-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
清晨被肠绞痛惊醒,聚餐后腹胀如鼓,皮肤莫名冒出红疹…这些现代人熟悉的困扰,根源可能都指向同一个问题——肠道炎症。外卖高油盐饮食、熬夜加班压力、抗生素滥用,正让我们的肠道炎症悄悄出现。
肠道炎症不仅是消化系统问题,更是影响全身健康。肠道是人体最大的免疫器官(70%免疫细胞位于肠道),肠道炎症的严重性远不止于表面症状,当它持续存在时可能导致炎症性肠病、糖尿病、关节炎、抑郁焦虑等神经系统疾病、免疫相关疾病(如过敏)等非常多慢性疾病。研究表明,慢性肠道炎症患者的结直肠癌风险提高,自身免疫疾病患者的肠道通透性标志物连蛋白(Zonulin)水平显著高于健康人群。
正因为它如此重要,肠道炎症已经成为现代医学关注的重要问题。现代医学通过多维度指标评估肠道炎症水平,例如,直接生化标志物,肠道屏障功能等。在谷禾肠道菌群检测报告中,也有“肠道炎症”这项指标。
<来源:谷禾肠道菌群检测数据库>
本文深入解析肠道炎症的成因链条——从麸质敏感、工业种子油到慢性压力的触发机制;揭示其如何通过”肠-脑轴“、”肠-皮肤轴“等方式引发全身性疾病;并提供相关干预方案,涵盖屏障修复、菌群重建及创新生物制剂应用等。
▸ 炎症:是什么?如何作用?
炎症是机体对有害刺激(如病原体、有毒化合物或受损细胞)的反应。它通过清除有害因子并启动修复过程发挥保护作用。
▸ 炎症的四个阶段
炎症过程包含四个不同阶段:
1.静息期,受损细胞释放介质启动炎症反应;
2.血管期,出现血管扩张和血浆外渗;
3.细胞期,中性粒细胞、单核细胞和巨噬细胞浸润,随后激活适应性免疫;
4.消退期,修复组织并清除碎片和炎症细胞。
因此,炎症本质上是一个具有明确起始、发展和结束阶段的生理过程。
慢性肠道炎症的各个阶段
Deraison C,et al.Annu Rev Pharmacol Toxicol.2025
急性炎症可能会发展成慢性炎症
然而,部分患者短期的炎症可能会发展为慢性炎症性疾病,炎症症状持续数月至数年。慢性炎症通常由于未能消除急性炎症的致病因子所致。这可能发生在病原体(如细菌、真菌、寄生虫)感染中,这些病原体能够抵抗宿主防御机制,或当刺激物持续存在且无法被内源性机制(如酶、炎症细胞吞噬作用)降解时。
自身免疫性疾病中也会出现慢性炎症,此时免疫系统错误地将自身蛋白质识别为外来抗原并引起组织破坏,如乳糜泻。正常情况下标志炎症过程结束的消退机制失调同样可导致慢性炎症。在肠道等黏膜表面,负责”处理”外来抗原和调节黏膜组织对微生物暴露反应的机制发生故障也可引起慢性炎症性疾病。这些故障机制包括屏障功能的各个层面——物理屏障(黏液)、细胞屏障(上皮细胞)和免疫屏障(常驻炎症细胞)。
▸ 与肠道炎症相关的疾病
急性回肠炎或结肠炎的发作通常与感染(病毒、细菌、真菌或寄生虫)相关。然而,在某些情况下,急性回肠炎或结肠炎可能是慢性炎症性疾病的最初表现,这些肠道慢性炎症性疾病包括炎症性肠病(IBD)、乳糜泻和肠易激综合征(IBS)。
▸ 炎症性肠病
炎症性肠病(IBD)是一种慢性肠道炎症性疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC)两个主要亚型,通常表现为腹痛、腹泻和血便。
IBD的病程特点是急性炎症发作(活动期)与缓解期和复发期交替出现。在病因方面,普遍认为IBD是遗传易感性和环境因素共同作用的结果,两者协同导致肠道微生物群落改变和免疫反应失控。
▸ 乳糜泻
乳糜泻是一种遗传性免疫疾病。遗传易感个体摄入含麸质食物后,会发生小肠黏膜炎症和绒毛萎缩。小麦面筋蛋白和麦胶蛋白富含谷氨酰胺和脯氨酸,使其对蛋白酶降解具有抗性,在小肠内形成免疫原性大肽。然而,这些肽的存在并不足以引发疾病;患者还必须携带位于DQ位点的特定HLA II类基因。这种遗传易感性使肠道组织更易受到食物诱发的炎症因子影响。
▸ 肠易激综合征
肠易激综合征是一种伴有排便习惯改变的慢性腹痛综合征,尚未发现明确的结构异常或炎症细胞浸润。多项研究探讨了炎症征象与该综合征的关联性。部分研究显示抗炎治疗(如美沙拉嗪)未能缓解肠易激综合征症状,提示炎症可能并非症状成因。
然而,大多数肠易激综合征患者存在免疫细胞激活增强的证据。这些免疫细胞包括在患者结肠组织中发生脱颗粒的肥大细胞,以及在结肠活检中上调的多种促炎介质(组胺、多不饱和脂肪酸代谢物、蛋白酶)。因此,充分证据表明肠易激综合征可视为一种低度慢性肠道炎症性疾病,虽然炎症细胞浸润并非显著特征,但可能存在组织功能紊乱和黏膜稳态改变。
▸ 肠道炎症涉及的分子机制
肠道黏膜炎症状态的共同特征包括微生物群生物膜失调、上皮功能障碍、先天免疫细胞浸润和适应性免疫激活。
肠道炎症患者存在微生物群失调
虽然IBD、乳糜泻或IBS中的微生物群失调可能呈现不同的分类特征,难以识别共同的微生物分子机制,但所有炎症状态均表现出微生物物种多样性和丰富性的减少。
紧密连接分子降解和黏液产生减少
屏障功能改变是另一共同特征。肠道上皮细胞紧密连接分子(如Zonulin和occludin)的降解以及杯状细胞黏液产生减少均与肠道炎症相关。潘氏细胞和肠上皮细胞表达分泌的抗菌肽是肠道屏障功能的重要组成部分,在炎症时功能下降。
α-和β-防御素、溶菌酶以及elafin和分泌型白细胞蛋白酶抑制剂等抗菌肽蛋白酶抑制剂在炎症组织中表达下调。因此,促进紧密连接分子、黏液蛋白和抗菌肽的表达和功能有助于增强肠道屏障功能,被视为治疗炎症的有效方法。
微生物群失调和屏障功能改变共同促进肠道慢性炎症
微生物群失调与屏障功能改变导致微生物对组织的异常暴露增加,引起先天免疫细胞深度激活。活化的巨噬细胞吞噬微生物成分,通过Toll样受体9、磷酸二酯酶4和Janus激酶(JAK)等信号机制释放肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-6、IL-12和IL-23,这些炎症介质和信号通路均被视为治疗慢性炎症的重要分子靶标。
组织损伤或侵袭激活后,肥大细胞、巨噬细胞和中性粒细胞共同释放储存在颗粒中的分子,包括炎症脂质介质(如前列腺素和白三烯)、活性氧(ROS)和蛋白酶,这些均构成炎症治疗的分子靶标。肠上皮细胞同样促进炎症性肠黏膜释放这些介质。
与慢性肠道炎症相关的机制
Deraison C,et al.Annu Rev Pharmacol Toxicol.2025
1
麸质——乳糜泻或麸质敏感人群的炎症
麸质蛋白是小麦、大麦、黑麦和燕麦的主要储能蛋白,位于谷物胚乳中,由麦谷蛋白和醇溶谷蛋白以1:1比例构成。
麸质会引起乳糜泻和麸质敏感患者炎症
麸质会导致乳糜泻和非乳糜泻麸质敏感性(NCGS)患者的炎症。乳糜泻是一种麸质自身免疫反应,表现为肠组织结构破坏、胃肠道不适及肠外症状(如皮疹和贫血)。
人群筛查显示乳糜泻为最常见的慢性胃肠道疾病之一,但因临床表现多样且模糊,绝大多数患者仍未被识别。虽然吸收不良和胃肠道症状较为人知,但多数患者实际表现为肠外症状,可累及神经系统、肝脏、皮肤、生殖和肌肉骨骼系统等全身器官,且可在不同年龄出现,更难确定诊断。
麸质会激活肠道肥大细胞并释放促炎分子
麸质与肠道CXCR3受体结合促进zonulin释放,引发易感个体肠道炎症。Zonulin分解上皮细胞间紧密连接蛋白,增加肠通透性和炎症。麸质还激活肠道肥大细胞释放组胺和类胰蛋白酶等促炎分子,使炎症持续存在。
需要注意的是,麸质并非对所有人都引起炎症。无乳糜泻或无非乳糜泻麸质敏感性(NCGS)的人通常能耐受饮食中的麸质。
注:多数晚期肠外表现可通过乳糜泻早期诊断预防。提高诊断率的方法是筛查高危人群,但无麸质饮食维持困难、社会限制且昂贵,可能降低生活质量,特别是症状轻微的患者。然而,证据表明即使无症状成年人也可能已有晚期组织学病变并从饮食治疗中获益,且诊断延迟会增加临床反应不良风险。
2
工业种子油
从大豆、玉米、油菜籽、棉籽和红花籽提取的高度加工工业籽油在标准饮食中占主要份额。这些油不到两个世纪前才引入人类饮食,与一些人体进化不匹配,会促进肠道炎症。
工业种子油烹饪会产生促炎产物
工业种子油富含ω-6脂肪酸,易受光和热损害。用其加工烹饪产生氧化炎症副产品,食用后引起肠道炎症。研究发现,富含工业种子油的饮食不仅会引起肠道炎症,还促进肠道病原体生长。
脂质饮食对肠道微生物群多样性的影响
doi: 10.3390/nu11020418.
脂质是哺乳动物正常发育和生存必需品,其化学性质细微差别影响生理和炎症反应。
不同的膳食脂质会影响肠道微生物群,可能促炎
研究显示饮食脂质对肠道微生物的影响:乳脂和玉米油饮食增加微生物多样性,橄榄油效果与低脂饮食相似;饮食脂质解释80.8%的微生物变异,形成三个不同聚类群;不同脂质类型特异性塑造肠道微生物群落。
总的来说,单不饱和脂肪酸消费与健康益处相关,包括降低消化系统癌症、2型糖尿病和炎症性肠病(IBD)发病率,橄榄油饮食可有效预防小鼠结肠炎。相比之下,虽然北美膳食指南推荐植物籽油中的ω-6多不饱和脂肪酸,但过量摄入是人类IBD风险因素,研究证实其加剧鼠结肠炎。
对于存在于乳制品和椰子油中的饱和脂肪酸,虽然数十年来被批评对健康不利,但欧洲前瞻性队列研究发现牛奶消费与IBD风险降低相关。然而,饲喂饱和脂肪酸通过与胆汁酸结合促进沃氏嗜胆菌(Bilophila wadsworthii)生长,增加IL-10-/-小鼠自发性结肠炎。但动物脂肪成分如丁酸具有抑制炎症、防止DSS-结肠炎和刺激结肠修复的作用。
3
非细胞碳水化合物
非细胞碳水化合物是指缺乏细胞壁的高碳水化合物密度食物,如面粉和糖,在饮食中大量存在并促进炎症性肠道微生物群。相比之下,细胞碳水化合物是含完整细胞的碳水化合物食物,如红薯和整个水果,通过促进抗炎肠道细菌生长来促进肠道健康。
doi: 10.2147/DMSO.S33473. Epub 2012 Jul 6.
现代食品中的无细胞致密碳水化合物从口腔开始产生炎症微生物群,最初引起牙周病。小肠暴露于口腔微生物群的脂多糖和其他病原体相关分子模式,并通过无细胞碳水化合物调节自身小细菌群的促炎性。膳食脂肪增强全身吸收后,炎症细菌化合物诱导瘦素抵抗和过度进食。
4
食品添加剂
超加工食品日益增多且含有大量食品添加剂。大多数添加剂缺乏长期安全性研究,而越来越多证据表明其对肠道炎症有害。
食品添加剂促进促炎细菌生长并增加肠道通透性
人造甜味剂三氯蔗糖刺激炎症肠道细菌的生长。海藻多糖角叉菜胶因其增稠和乳化特性被使用,但会加剧炎症性肠病。常见食品乳化剂羧甲基纤维素和聚山梨酯-80增加肠道通透性。增白剂二氧化钛在肠道引起炎症细胞因子反应。为防止肠道炎症,避免或减少这些普遍存在的食品添加剂应是首要任务。
5
剖腹产和配方奶喂养
剖腹产和奶粉喂养婴儿更易患肠道炎症
剖腹产深刻改变发育中婴儿肠道,用环境微生物而非母亲阴道有益微生物接种微生物组。剖腹产婴儿还通过胎盘循环暴露于预防术后感染的抗生素。这种早期抗生素暴露进一步扭曲婴儿肠道微生物群发育,使孩子易患肠道炎症和哮喘、肥胖等慢性炎症性疾病。
配方奶粉喂养对脆弱婴儿肠道同样可能有害。配方奶喂养的婴儿具有较高水平的促炎细菌类γ-变形菌门,增加肠道通透性和总细菌负荷。相反,母乳喂养增加婴儿肠道抗炎乳酸杆菌和双歧杆菌定植,降低肠道炎症和慢性炎症性疾病风险。
6
肠道感染
细菌、病毒、真菌和寄生虫等各类病原体引起的肠道感染会显著改变肠道微生物群的正常组成结构,从而创造出一个促进炎症反应的肠道内环境。
细菌和病原体感染会变相增加一些促炎细菌丰度
例如,甲型流感病毒感染过程中会通过多种机制减少具有保护作用的肠道有益细菌数量,这种保护性细菌的减少会瞬时性地增加机体对沙门氏菌属等致病菌的易感性,使患者更容易发生继发性细菌感染。
与此同时,幽门螺杆菌这种常见的胃部致病菌在感染过程中不仅会直接损害胃黏膜,还会通过复杂的相互作用机制增强普雷沃氏菌这种典型促炎细菌在肠道中的生长和繁殖能力。
食物中毒也会促进肠道炎症反应
此外,急性食物中毒事件除了造成胃肠道症状外,还可能通过刺激肠道免疫系统产生针对自身组织的炎症性自身抗体,这些异常的免疫反应不仅会引发持续性的肠道炎症状态,还可能进一步发展为肠易激综合征等功能性肠道疾病。
7
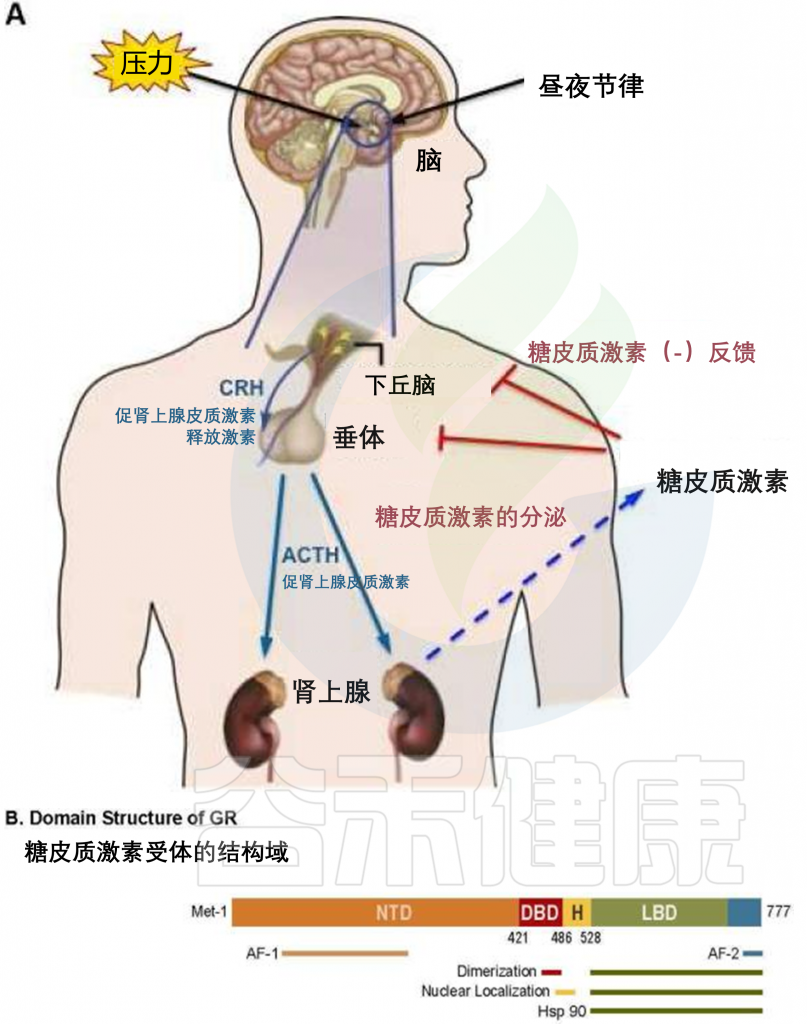
压力
人类的肠道对慢性压力非常敏感。糖皮质激素水平的长期升高驱动肠神经胶质细胞的炎症亚群的产生,通过集落刺激因子-1(CSF-1)促进单核细胞和TNF介导的炎症。此外,糖皮质激素通过TGF-β2引起肠神经元的转录不成熟、乙酰胆碱缺乏和运动障碍。
压力促使脂多糖进入血液导致炎症
慢性心理压力还会增加肠道通透性,并允许脂多糖(LPS),一种炎症细菌的副产物,进入血液循环;这会导致局部和全身炎症反应。应激还消耗保护性肠道粘膜层,并增加细菌粘附和渗透到肠上皮细胞中,引起肠道炎症。
不同居住条件下心理压力对肠道炎症的加剧作用
DOI: 10.1016/j.cell.2023.05.001
糖皮质激素治疗结肠炎的效果与心理压力相关
压力会导致炎症性疾病,而心理压力的典型全身介质——儿茶酚胺和糖皮质激素通常被认为具有抗炎作用。由于糖皮质激素受体激动剂泼尼松用于治疗IBD患者结肠炎,糖皮质激素信号传导诱导炎性肠神经胶质细胞和结肠炎恶化尤其令人困惑。
例如,长期压力或地塞米松治疗可能因负反馈抑制下丘脑-垂体-肾上腺轴而导致肾上腺皮质酮生产不足。然而,急性糖皮质激素受体抑制的有益作用与”肾上腺抑制”不符。或者,糖皮质激素抗炎和促炎作用间的平衡可能是暂时现象。
虽然急性糖皮质激素治疗改善DSS诱导的结肠炎,研究团队还发现持续升高的皮质酮水平有助于eGAPS的出现和产生TNF的单核细胞的积累。同样,临床观察已经证明,只有短期类固醇治疗才能在IBD中产生有益的结果。所以还是要强调了在炎症性疾病的临床管理中考虑患者心理健康的重要性,治疗效果可能因受影响个体的心理状态而异。
因此,心理状态的评估,结合减少压力,焦虑和抑郁的策略,可能是一个强大的和未充分利用的工具,以提高治疗的成功。
8
久坐不动的生活方式和过度训练
适量运动有助于促进抗炎细菌的生长
适度的运动可以促进有益的肠道细菌,包括产生抗炎性短链脂肪酸(SCFA)的细菌,如梭状芽孢杆菌属、罗氏菌属、毛螺菌属等,从而抑制肠道炎症。相反,久坐不动的生活方式与炎症分子向肠道的渗透增加有关。
然而,运动也并非越多越好。过度的体力活动会增加肠道通透性,对肠道微生物群产生负面影响。如果您患有慢性炎症性疾病或承受严重心理压力,应避免剧烈运动,专注于散步、瑜伽或游泳等温和活动。
9
昼夜节律紊乱和睡眠不足
昼夜节律是以约24小时为周期的内部生化过程,调节包括肠道健康和炎症在内的多项生理功能。当夜间蓝光照射和不规律睡眠等因素干扰昼夜节律时,会促进炎性肠道细菌生长,减少有益微生物,并增加肠道通透性和脂多糖向体循环的转运。
睡眠不足与昼夜节律紊乱促进炎性细菌增长
睡眠不足与昼夜节律紊乱密切相关,对肠道健康同样有害。仅两个晚上的部分睡眠剥夺就能改变肠道微生物群,增加促炎细菌种类,并加剧IBD的肠道炎症。因此,维持正常昼夜节律和充足睡眠对减少肠道炎症至关重要。
10
滥用抗生素
临床医生频繁开处抗生素会给患者带来虚假安全感,轻易就开抗生素已成为社会常态,但其对肠道健康的影响往往被低估。大量研究表明,抗生素可能对肠道微生物群产生长期有害影响,并诱导肠道炎症。
抗生素减少肠道菌群的多样性并导致肠道功能紊乱
抗生素会减少肠道共生细菌的多样性和丰度,使埃希氏菌和念珠菌等条件性致病菌过度生长,抗生素还增加了拟杆菌门/厚壁菌门的比率。抗生素对厌氧菌具有特异性,厌氧菌在人体肠道微生物群中占主导地位并发挥重要作用。克林霉素就是一个例子,这是一种相对广谱的抗生素,主要针对厌氧菌。克林霉素对肠道微生物群有很大的负面影响,表现为对病原体定植的抵抗力降低,导致艰难梭菌过度生长导致伪膜性结肠炎的高风险。克林霉素对肠道菌群的其他影响是胃炎和腹泻。正常肠道功能紊乱可导致腹胀和肠痛等症状。
抗生素可能导致长期的生态失调和肠道免疫下降
抗生素处理的微生物组释放岩藻糖和唾液酸等粘膜碳水化合物。这些物质水平的增加有利于机会性病原体鼠伤寒沙门氏菌和艰难梭菌在肠道内的扩张。肠出血性大肠埃希菌也被证明可以获取肠道微生物群从粘蛋白中释放的岩藻糖或唾液酸。
兵器抗生素导致的微生物的变化可以在停止使用抗生素后持续数月或数年。它们的不良影响在婴儿和幼儿中最为明显,他们正在经历肠道微生物群发育的关键时间窗口。
更令人担忧的是,耐药细菌在接触抗生素后会变得更具炎症性。抗生素还会增加肠道通透性,降低肠道天然免疫防御,从而间接促进肠道炎症。
11
非抗生素药物
除了抗生素会影响肠道微生态外,越来越多的证据表明普通常见药物也会对人体肠道健康产生影响。
胃肠道药物和抗抑郁药物对肠道微生态的影响尤为显著
质子泵抑制剂(PPI)用于治疗胃食管反流病和胃酸反流,通过减少胃酸产生来发挥作用。正常情况下,充足的胃酸能限制环境细菌进入肠道。PPI抑制胃酸产生后,更多细菌得以进入消化道并在小肠中增殖,导致细菌过度生长和肠道炎症,同时竞争资源减少产生抗炎短链脂肪酸的有益细菌生长。
选择性5-羟色胺再摄取抑制剂(SSRIs)除了引起便秘和食欲变化外,也会干扰正常的肠道微生物群结构。临床前研究表明氟西汀(百忧解)会抑制乳酸杆菌生长,同时显著增加Alistipes、各种Lachnospiraceae OTU、Lachnoclostridium和Anaerotruncus等菌属的丰度,从而加剧肠道菌群失调。
口服避孕药也会引发肠道炎症。事实上,它们的使用与克罗恩病(IBD的一种亚型)的风险增加有关。
12
环境毒素
工业界每年开发数千种新化学品,但现有环境化学品已造成的一系列健康危害。
环境毒素也会导致有害细菌增加并引发肠道炎症
肠道炎症是环境毒素暴露的最常见后果之一。双酚A(BPA)广泛存在于塑料水瓶、食品容器、儿童玩具和收银机收据中,通过增加有害肠道细菌和肠道通透性来促进肠道炎症。不含BPA产品中的替代增塑剂同样有害,甚至危害更大。
三氯生是洗手液和个人护理产品中使用的合成抗菌剂,也会加重肠道炎症。草甘膦作为农达除草剂的主要成分,能减少乳酸杆菌并促进耐除草剂大肠杆菌生长,表明其在肠道微生物组中发挥抗生素作用。
发炎的肠道会显著增加患多种慢性疾病的风险,包括炎症性肠病(IBD)和结肠癌等消化系统疾病,以及自闭症和阿尔茨海默病等神经系统疾病。肠道炎症作为一个关键的病理过程,与这些严重健康问题的发生和发展密切相关。
因此,积极阻止肠道炎症的发生和进展,对于有效预防这些慢性疾病的出现以及成功管理已有慢性疾病的症状和进程都具有至关重要的意义。通过控制肠道炎症,我们能够从根本上降低患病风险,改善整体健康状况。
1
过敏
促炎细胞因子会刺激诱导过敏性炎症
肠道炎症可能导致季节性过敏。有益和有害肠道微生物失衡会增加肠道促炎细胞因子的释放,这些细胞因子刺激肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞活性,诱导过敏性炎症。生态失调相关的肠道炎症还与特应性皮炎和食物过敏密切相关。
相反,健康的肠道通过释放抗炎短链脂肪酸和调节性T细胞来抑制过敏性致敏,维持免疫平衡。
肠道微生物群与免疫系统之间的相互作用
doi: 10.3389/fimmu.2018.01584.
2
自身免疫性疾病
肠道屏障受损在免疫性疾病中发挥重要作用
肠道炎症是自身免疫性疾病发展的先导因素。1型糖尿病患者的循环脂多糖水平更高。Zonulin是肠道屏障受损时释放的蛋白质,自身免疫性疾病患者的Zonulin水平明显高于健康对照组,表明肠漏在自身免疫性疾病中发挥重要作用。
麸质敏感性和慢性应激是肠道炎症的两个主要触发因素,通常在自身免疫疾病发生之前出现。
3
关节炎
口腔和肠道微生物群发生炎症性改变时,会对关节炎的发生和进展产生重要影响。这些微生物群的改变主要表现为致龋细菌牙龈卟啉单胞菌的异常过度生长,同时伴随着有益细菌数量的显著减少,这种微生物失衡状态与关节炎病情的恶化和进展密切相关。
生态失调引起促炎细胞因子释放,导致关节和肌肉病理性改变
当肠道出现生态失调和肠道屏障功能受损导致肠道渗漏时,会在体内诱导广泛的全身性炎症反应。这种炎症反应会触发多种促炎细胞因子的大量释放,这些细胞因子进入循环系统后会直接作用于肌肉骨骼系统,最终导致关节、肌肉和骨骼组织的退化性改变。
有益的抗炎细菌和短链脂肪酸有助于减轻关节炎
然而,与此形成鲜明对比的是,当肠道中存在充足的抗炎细菌和短链脂肪酸时,这些有益成分已被科学研究证实能够有效减轻关节炎症状的严重程度,并且具有预防和阻止骨质流失的保护作用。
4
胃肠道疾病
炎症性肠病(IBD)
肠道炎症是炎症性肠病(IBD)的一个关键特征,包括溃疡性结肠炎和克罗恩病。一系列有害的肠道变化,包括生态失调和肠道通透性增加,会促进IBD的进展。
肠易激综合征(IBS)
科学研究已经深入阐明了肥大细胞在肠易激综合征(IBS)发病机制中发挥的关键作用。肥大细胞作为一类重要的免疫细胞,能够释放多种刺激性化合物,其中组胺是最主要的介质之一。这些刺激性化合物的释放会引起肠道组织的炎症反应,而持续存在的低度炎症状态在IBS的病理过程中扮演着至关重要的角色,直接影响着疾病的发生和发展进程。
在临床表现为腹泻为主的IBS或者混合型IBS的患者群体中,自身免疫机制同样可能在肠道炎症的产生和维持过程中发挥重要作用。特别是在这些特定类型的IBS病例中,患者既往经历的食物中毒事件可能会成为一个重要的触发因素。这些食物中毒事件会刺激机体的免疫系统产生异常的免疫反应,最终导致机体产生能够直接损害和攻击胃肠道组织的自身抗体,从而加重肠道的炎症状态和功能紊乱。
长期的肠道炎症会增加结直肠癌风险
结直肠癌是一种严重威胁人类健康的恶性肿瘤,其发病率和死亡率都相当高。大量的科学研究证据清楚地表明,预先存在的胃肠道炎症状态往往在结直肠癌的发生和发展过程中起到先导作用,也就是说肠道炎症通常会在结直肠癌实际形成之前就已经出现。
通过深入的研究分析,科学家们已经成功确定了多种能够引发结直肠癌发生的炎症触发因素。包括各种有害的肠道病原体感染,肠道内负责产生丁酸盐的有益细菌数量处于异常低下的水平,以及长期摄入高度加工和精制的典型西方饮食模式,这些因素都会通过不同的机制促进肠道炎症的发生,进而增加结直肠癌的患病风险。
肠道炎症还会引发憩室炎
憩室炎是一种肠壁刺激,由肠道炎症引发。其特征在于结肠中的生态失调和粪便钙卫蛋白升高,这是当胃肠道中存在活动性炎症时由白细胞释放的蛋白质。
5
心血管疾病
心血管疾病(CVD)是全球死亡的主要原因,药物和手术是传统医疗的基石。然而,越来越多的证据表明肠道和心脏健康之间存在重要联系,肠道靶向治疗可能是未来CVD的治疗方法。
生态失调会促进斑块形成和高血压
肠道内多种炎症过程影响心血管疾病的病程。生态失调通过释放脂多糖和肽聚糖等革兰氏阴性和阳性细菌的炎性细胞壁成分,促进动脉粥样硬化斑块形成和高血压,从而导致心血管疾病。菌群失调还会影响胆汁酸代谢,损害胆固醇和甘油三酯等血脂的排泄。
6
抑郁和焦虑
最新的科学研究表明,免疫系统在抑郁症和焦虑症的发生和发展过程中起着至关重要的作用。考虑到人类肠道系统拥有约70%的免疫细胞和免疫组织,集中了机体免疫系统的绝大部分功能,因此肠道内发生的炎症反应会对心理健康状态产生显著而深远的影响也就完全不足为奇了。
肠道炎症通过肠-脑轴诱导大脑产生神经炎症反应
肠-脑轴是连接肠道肠神经系统和中枢神经系统之间的一个复杂的双向信号传递网络系统,这个重要的生理网络在介导和调节肠道炎症状态与心理健康水平之间的密切关系方面发挥着关键作用。
当肠道内出现各种炎症刺激时,这些炎症信号会通过肠-脑轴这一重要通道向大脑传送相关信息,从而在大脑组织内诱导产生神经炎症反应,并且显著改变和影响各种神经递质的正常合成和分泌过程。这些深层次生化变化所带来的直接后果就是大脑神经活动模式发生异常改变,最终表现为抑郁症和焦虑症等精神心理疾病的临床症状。
抑郁症和焦虑症患者对抗肠道炎症的能力减弱
这种具有炎症特征的肠-脑轴信号传导异常主要是由肠道微生物群的生态失调状态和肠道屏障功能的严重障碍所触发和维持的,而这两种病理状态在患有抑郁症和焦虑症的患者群体中表现得极为常见和普遍。同时,患有抑郁症和焦虑症的人群还表现出对抗肠道炎症能力的明显降低和减弱,这种抗炎能力的下降主要是由于肠道内具有抗炎作用的短链脂肪酸水平显著降低所导致的。
7
神经系统疾病
肠道炎症可能是神经退行性疾病的“驱动器”
肠-脑轴在神经退行性疾病中发挥关键作用。肠道炎症被认为是帕金森病的”沉默驱动器”,可在症状出现前持续长达二十年。研究还发现,肠源性炎症反应促进淀粉样蛋白-β斑块沉积,导致阿尔茨海默病中的神经元变性和认知功能障碍。
自闭症、多动症患者菌群多样性减少,存在肠道炎症
神经发育障碍在全球患病率急剧上升;自闭症患病率已达到每59名儿童中有1名,截至2016年,11%的儿童和青少年被诊断为注意力缺陷/多动障碍(ADHD)。小儿急性发作性神经精神综合征(PANS)和链球菌感染相关的小儿自身免疫性神经精神障碍(PANDAS)是以抽搐和强迫症突然发作为特征的新兴神经发育障碍。
研究表明,生态失调和肠道炎症是这些疾病的共同致病因素。ADHD儿童表现出肠道微生物α多样性降低,即肠道细菌种类减少;而较高的多样性通常与更好的健康结果相关。自闭症谱系儿童和PANS/PANDAS儿童同样表现出生态失调。这些炎症变化改变了肠-脑信号传导,最终导致神经行为缺陷。
8
骨质疏松
肠道炎症会影响维生素D、钙的吸收
几条证据表明肠道炎症通过破坏骨生成和骨吸收细胞之间的平衡,导致骨量净损失,从而促进骨质疏松症。肠道炎症也会减少对关键的骨骼构建营养素的吸收,包括维生素D,钙和镁。
9
皮肤健康
肠道及其微生物通过肠-皮肤轴影响皮肤健康
我们已经写了许多关于肠道和皮肤健康之间联系的文章,由肠道-皮肤轴介导。就像肠-脑轴一样,肠-皮肤轴是一个连接肠道及其微生物与皮肤的信号分子网络。
肠道的炎症变化,包括生态失调和肠道通透性增加,与一系列皮肤病有关,包括痤疮、牛皮癣、红斑痤疮和湿疹。
10
代谢性疾病
肠道炎症和代谢失调之间存在双向加剧作用
代谢综合征、2型糖尿病(T2D)、肥胖症和肠道炎症之间形成了一个复杂而有害的恶性循环机制:血糖调节失调状态和体内过量脂肪组织的积累会显著促进肠道内炎症反应的发生和发展,而肠道炎症状态反过来又会进一步加剧和恶化机体的代谢功能障碍,从而形成一个持续恶化的病理生理过程。
肠道微生态失调会促进胰岛素抵抗和瘦素抵抗
肠道微生物生态系统的失调状态以及循环系统中脂多糖水平的升高共同诱导和促进胰岛素抵抗和瘦素抵抗的发生,而这两种激素抵抗现象正是代谢综合征、2型糖尿病和肥胖症发病机制中的关键病理特征和核心环节。
日常饮食中摄入的非纤维性碳水化合物以及环境中存在的各种致肥胖环境毒素暴露(包括双酚A和多种邻苯二甲酸盐化合物)都会对肠道微生物群落的组成和结构产生显著的改变和影响。这些肠道微生物群落的变化和改变会直接引起肠道组织内炎症反应的激活和维持,并且对代谢功能障碍疾病的发生、发展和进展过程产生重要的推动和影响作用。
肠道菌群受损时会驱动非酒精性脂肪性肝病
非酒精性脂肪性肝病(NAFLD)是一种特定的肝脏疾病状态,主要是指在很少饮酒或完全不饮酒的个体中,肝脏组织内出现多余脂肪物质的异常积聚和沉积现象,这种疾病状态与代谢综合征、2型糖尿病(T2D)以及肥胖症等代谢性疾病之间存在着非常密切和重要的关联性。
当肠道微生物群落结构和功能受到损害和破坏时,这种受损的肠道微生物生态系统似乎会成为驱动和促进NAFLD相关炎症反应发生和发展的重要因素和机制。与此相对应的是,各种有益的、针对肠道环境的靶向治疗方法和干预措施,例如通过补充益生菌等方式来调节和改善肠道微生物群落,能够有效地缓解和减轻肝脏组织内的炎症反应以及由此导致的肝脏功能障碍和损害。
肠道炎症作为多种慢性疾病的核心病理机制,其有效治疗需要采用多元化、个体化的综合干预策略。当前的治疗方法主要围绕恢复肠道微生物平衡、修复肠道屏障功能、调节免疫反应以及减少促炎因子等核心目标展开。
这些治疗手段包括但不限于营养干预、益生菌和益生元补充、抗炎药物应用、生活方式调整以及新兴的微生物移植疗法等。通过系统性地结合这些不同的治疗模式,能够从多个层面同时作用于肠道炎症的发病机制,从而实现更加全面和持久的治疗效果,最终改善患者的整体健康状况和生活质量。
1
药物治疗
目前用于治疗慢性肠道炎症的大多数药物要么针对在炎症反应早期阶段(即静息期和血管期)释放的炎症介质,要么针对炎症细胞的招募。
①氨基水杨酸类药物
氨基水杨酸类药物(包括柳氮磺吡啶和5-氨基水杨酸)通过作用于花生四烯酸代谢,抑制前列腺素和白三烯等脂质炎症介质的释放。然而,该类药物还具有其他作用机制,包括清除活性氧、抑制白细胞产生细胞因子、通过芳香烃受体依赖途径诱导调节性T细胞招募,以及与过氧化物酶体增殖物激活受体γ结合。
5-氨基水杨酸用于治疗溃疡性结肠炎,有助于维持病情缓解,但在克罗恩病患者中的应用仍存争议。一项研究显示,5-氨基水杨酸能有效减少乳糜泻患者组织器官型培养中的氧化爆发和炎症,但尚无减少组织炎症的报道。在肠易激综合征患者的研究中,5-氨基水杨酸治疗未能改善症状。
②皮质类固醇
20世纪50年代,皮质类固醇成为治疗IBD的首个药理方法,至今仍能使许多患者获得有效缓解,但其维持缓解的效果尚未得到证实。因此,皮质类固醇用于终止炎症发作和诱导缓解,但不推荐长期使用。
皮质类固醇对所有炎症相关途径的多效性作用解释了其疗效。然而,尽管努力开发更安全、耐受性更好的皮质类固醇,但其使用可能产生显著副作用,包括机会性感染、糖尿病、高血压、静脉血栓栓塞和骨质疏松症。此外,部分患者对皮质类固醇治疗存在抵抗性,必须考虑其他免疫调节方法。
③免疫调节剂
用于治疗肠道炎症的免疫调节剂包括硫唑嘌呤、甲氨蝶呤、钙调磷酸酶抑制剂和Janus激酶抑制剂,所有这些药物都旨在降低T淋巴细胞的活化或增殖,并且在减少炎症发作方面非常有效。然而,它们也引起许多不良反应,包括肝损伤、骨髓抑制和传染病。
④生物制剂
许多治疗肠道炎症(特别是IBD)的生物制剂针对细胞因子或整合素。由于TNF-α、IL-12和IL-23在IBD发病机制中的重要作用,抗TNF-α和抗IL-12/23抗体是治疗IBD的主要生物制剂。
抗TNF-α抗体可抑制炎症反应和组织损伤,用于治疗对皮质类固醇无反应的中重度UC或CD患者。通过剂量递增可实现抗TNF-α抗体的长期缓解。然而,高达40%的患者对TNF-α抑制剂无反应,且在开始治疗后仅1年就有20%-45%的患者出现继发性疗效丧失。因此,抗IL-12和抗IL-23在生物制剂初治和既往治疗患者中均有效,常作为二线治疗使用。
整合素通过与组织特异性细胞黏附分子结合介导白细胞归巢,在炎症细胞向炎症组织招募和滞留中起关键作用。抗整合素治疗通过阻断整合素与白细胞内皮细胞黏附分子或上皮细胞表达的E-钙黏蛋白结合发挥作用。抗整合素生物制剂针对黏附分子的α4或β7整合素亚单位。
所有生物制剂对应答者的缓解诱导效果均很好。然而,尽管具有选择性高、特异性强等优点,仍有相当一部分IBD患者出现原发性无应答、继发性应答丧失和治疗不耐受,因此需要其他治疗选择。
2
微生物群靶向治疗
微生物群失调既是炎症相关肠道病变的常见特征,也是导致长期炎症的早期事件。因此,针对微生物群的治疗是治疗肠道炎症的有前景选择。
微生物干预能够有效改善肠道炎症
基于微生物组的疗法包括饮食干预、益生元补充、单一或多菌株益生菌制剂、噬菌体疗法、粪便微生物群移植(FMT)和微生物组模拟物。多项证据表明针对微生物组的疗法对炎症性肠病、肠易激综合征以及一定程度上的乳糜泻有益。微生物组治疗的作用模式可能是多模态的,涉及直接影响生物膜组成和代谢、控制屏障功能以及影响黏膜免疫。
①微生物群相关修复
多项研究显示益生菌、益生元和后益生元在IBD和IBS患者中的潜在作用。它们安全且耐受性良好,尽管效果有时相当有限。在CD患者中,大多数研究表明益生菌无显著效果,而在UC患者或IBS患者中,对临床症状和缓解有益。
粪菌移植治疗IBD的潜力正被积极研究。在UC患者中,FMT在实现临床缓解方面优于安慰剂,一项关于FMT在IBD患者中疗效的荟萃分析显示,无论CD还是UC,临床缓解率均显著。
②干细胞移植
干细胞作为所有细胞类型的起源,包括上皮细胞,因此用于修复受损肠道组织并恢复功能具有理论依据。在重度难治性克罗恩病患者中,自体造血干细胞移植或同种异体骨髓间充质干细胞治疗均显示出积极效果,约半数患者实现临床缓解。
尽管大多数接受自体造血干细胞移植的患者在术后5年内复发,但80%复发者在再次移植后可重新达到缓解。因此,干细胞移植对CD患者的黏膜修复具有潜力,但其临床应用尚未获批。此外,干细胞移植还可利用自体肠道干细胞,经体外培养和检测后移植,该方法已在动物模型中成功应用,但在人类中的临床条件尚未确定。
③加强屏障功能
屏障功能障碍与肠道炎症密切相关,这种障碍在炎症性肠病、乳糜泻和肠易激综合征患者中均有发现。研究表明,即使炎症消退,屏障功能在之后数周内仍可能受损。清除急性炎症后,屏障功能的恢复是组织修复的关键,涉及黏膜微生物生物膜、黏液层、上皮单层、黏膜免疫系统和神经支配。因此,屏障功能可通过多种方式恢复。一些IBD治疗手段部分通过改善上皮屏障起效,如抗TNF-α治疗对克罗恩病有效。
肠道粘膜表面的解决和修复参与者及介质
Deraison C,et al.Annu Rev Pharmacol Toxicol.2025
临床上,恢复肠道屏障功能主要依赖饮食干预,包括免疫调节营养物、益生菌和微生物代谢产物。局部应用丁酸可改善难治性溃疡性结肠炎患者的屏障功能。新的理论认为,具有细胞功能失常遗传背景者更易发生自身免疫反应,此类细胞对炎症触发因素更为敏感。肠腔内容物常为炎症的主要触发因素,难以完全避免。因此,针对遗传性功能障碍的干预为新型治疗途径。
3
生活方式改善
①吃营养丰富的未经加工的饮食
营养丰富、未经加工的饮食提供了底物(即,可发酵纤维,多酚和其他营养素),你的肠道细菌需要茁壮成长,创造一个抗炎的肠道生态系统。特别关注益生元食物可以提高你的抗炎SCFA产生细菌的水平。避免非细胞碳水化合物,包括精制面粉产品和工业种子油。
对于患有严重肠道炎症的人,如IBD,自身免疫方案饮食可以提供显著的缓解。
②管理压力
慢性压力确实会损害肠道健康,因此压力管理对于减轻肠道炎症至关重要。冥想有助于调节压力反应,维持肠道屏障功能和炎症平衡。规律锻炼和良好睡眠同样有助于管理压力并支持肠道健康。
③控制合理使用药物
为减少肠道炎症,应谨慎使用抗生素和其他药物。目前对非抗生素药物对肠道健康影响的了解有限,但已有初步担忧。相比之下,抗生素对肠道的负面影响证据充分。如果您正在使用PPI,请谨慎使用,并了解如何通过饮食和生活方式调整来减少或停用抑酸药物。
④尽量限制接触毒素
环境毒素无处不在,但通过以下简单措施可以降低暴露并预防肠道炎症:
-购物时避免使用收据,减少接触。
-选择不锈钢或玻璃水瓶和食物容器,避免塑料制品。
–避免在家中和院子里使用杀虫剂。
这些措施有助于减少环境毒素的累积暴露,促进肠道和整体健康。
肠道掌控着全身的健康。从消化吸收到免疫防线,从情绪调节到慢性病预防,你的身体几乎所有系统,都绕不开它的“号令”。一旦肠道炎症悄然来袭,打破屏障和菌群的平衡,导致各种慢性疾病,比如炎症性肠病、结肠癌、糖尿病、哮喘,甚至影响大脑、皮肤和骨骼健康。
不健康饮食(精制碳水、工业油、食品添加剂),还有滥用抗生素、环境毒素、过度压力、久坐、睡眠紊乱、剖腹产及配方喂养、反复肠道感染、甚至是某些常见药物等都会影响肠道炎症。
总之,肠道健康是你和慢病拉开距离的“第一道防线”。面对日常的饮食、作息和环境时,不妨从肠道微生物组学的角度审视:这些是否有利于维持肠道菌群的多样性与稳态?
从丰富多样、天然未加工的饮食入手,善用益生菌和益生元,科学运动,重视深度睡眠,减少压力,限用药物,远离环境毒素,肠道就会回馈你健康的身体和愉悦的心情。而现代医学的营养干预、生物制剂、微生态移植和干细胞等创新治疗,也在不断拓宽肠道炎症的管理边界。
肠道炎症,正走向现代医学的中心,未来,肠道炎症指标将如同血压、血糖一样成为常规监测项目,在疾病症状出现前数年就能识别风险并及时干预。谷禾肠道菌群检测为这一转变提供了强有力的技术支撑,通过分析肠道微生物组成和功能,基于大样本量数据库及最新的算法模型,评估肠道炎症水平。健康管理也正从症状出现后治疗向风险早期识别的根本转变。通过持续的肠道健康监测和精准干预,我们能够预防很多慢性疾病。
面对肠道炎症的复杂病理机制,未来的医疗模式将迎来跨学科融合,整合营养学、微生物学和免疫学等多学科知识,基于个体化检测结果制定多维度干预策略,为患者提供系统化解决方案。
主要参考文献
Pelaseyed T, Bergström JH, Gustafsson JK, Ermund A, Birchenough GM, Schütte A, van der Post S, Svensson F, Rodríguez-Piñeiro AM, Nyström EE, Wising C, Johansson ME, Hansson GC. The mucus and mucins of the goblet cells and enterocytes provide the first defense line of the gastrointestinal tract and interact with the immune system. Immunol Rev. 2014 Jul;260(1):8-20.
Ohno H. Intestinal M cells. J Biochem. 2016 Feb;159(2):151-60.
Gassler N. Paneth cells in intestinal physiology and pathophysiology. World J Gastrointest Pathophysiol. 2017 Nov 15;8(4):150-160.
Bäckhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI. Host-bacterial mutualism in the human intestine. Science. 2005 Mar 25;307(5717):1915-20.
Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, Gordon JI, Relman DA, Fraser-Liggett CM, Nelson KE. Metagenomic analysis of the human distal gut microbiome. Science. 2006 Jun 2;312(5778):1355-9.
Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T, Mende DR, Li J, Xu J, Li S, Li D, Cao J, Wang B, Liang H, Zheng H, Xie Y, Tap J, Lepage P, Bertalan M, Batto JM, Hansen T, Le Paslier D, Linneberg A, Nielsen HB, Pelletier E, Renault P, Sicheritz-Ponten T, Turner K, Zhu H, Yu C, Li S, Jian M, Zhou Y, Li Y, Zhang X, Li S, Qin N, Yang H, Wang J, Brunak S, Doré J, Guarner F, Kristiansen K, Pedersen O, Parkhill J, Weissenbach J; MetaHIT Consortium; Bork P, Ehrlich SD, Wang J. A human gut microbial gene catalogue established by metagenomic sequencing. Nature. 2010 Mar 4;464(7285):59-65.
Laurikka P, Nurminen S, Kivelä L, Kurppa K. Extraintestinal Manifestations of Celiac Disease: Early Detection for Better Long-Term Outcomes. Nutrients. 2018 Aug 3;10(8):1015.
Sturgeon C, Fasano A. Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases. Tissue Barriers. 2016 Oct 21;4(4):e1251384.
Frossi B, De Carli M, Calabrò A. Coeliac Disease and Mast Cells. Int J Mol Sci. 2019 Jul 11;20(14):3400.
Losurdo G, Piscitelli D, Pezzuto F, Fortarezza F, Covelli C, Marra A, Iannone A, Amoruso A, Principi M, Ierardi E, Di Leo A. T Helper Lymphocyte and Mast Cell Immunohistochemical Pattern in Nonceliac Gluten Sensitivity. Gastroenterol Res Pract. 2017;2017:5023680.
Abulizi N, Quin C, Brown K, Chan YK, Gill SK, Gibson DL. Gut Mucosal Proteins and Bacteriome Are Shaped by the Saturation Index of Dietary Lipids. Nutrients. 2019 Feb 16;11(2):418.
Spreadbury I. Comparison with ancestral diets suggests dense acellular carbohydrates promote an inflammatory microbiota, and may be the primary dietary cause of leptin resistance and obesity. Diabetes Metab Syndr Obes. 2012;5:175-89.
Martínez Steele E, Baraldi LG, Louzada ML, Moubarac JC, Mozaffarian D, Monteiro CA. Ultra-processed foods and added sugars in the US diet: evidence from a nationally representative cross-sectional study. BMJ Open. 2016 Mar 9;6(3):e009892.
Nickerson KP, McDonald C. Crohn’s disease-associated adherent-invasive Escherichia coli adhesion is enhanced by exposure to the ubiquitous dietary polysaccharide maltodextrin. PLoS One. 2012;7(12):e52132.
Rodriguez-Palacios A, Harding A, Menghini P, Himmelman C, Retuerto M, Nickerson KP, Lam M, Croniger CM, McLean MH, Durum SK, Pizarro TT, Ghannoum MA, Ilic S, McDonald C, Cominelli F. The Artificial Sweetener Splenda Promotes Gut Proteobacteria, Dysbiosis, and Myeloperoxidase Reactivity in Crohn’s Disease-Like Ileitis. Inflamm Bowel Dis. 2018 Apr 23;24(5):1005-1020.
Braniste V, Jouault A, Gaultier E, Polizzi A, Buisson-Brenac C, Leveque M, Martin PG, Theodorou V, Fioramonti J, Houdeau E. Impact of oral bisphenol A at reference doses on intestinal barrier function and sex differences after perinatal exposure in rats. Proc Natl Acad Sci U S A. 2010
JPascal M, Perez-Gordo M, Caballero T, Escribese MM, Lopez Longo MN, Luengo O, Manso L, Matheu V, Seoane E, Zamorano M, Labrador M, Mayorga C. Microbiome and Allergic Diseases. Front Immunol. 2018 Jul 17;9:1584. an 5;107(1):448-53.
Mao, Q., Manservisi, F., Panzacchi, S. et al. The Ramazzini Institute 13-week pilot study on glyphosate and Roundup administered at human-equivalent dose to Sprague Dawley rats: effects on the microbiome. Environ Health 17, 50 (2018).
Han H, Li Y, Fang J, Liu G, Yin J, Li T, Yin Y. Gut Microbiota and Type 1 Diabetes. Int J Mol Sci. 2018 Mar 27;19(4):995.
Chen, J., Chia, N., Kalari, K. et al. Multiple sclerosis patients have a distinct gut microbiota compared to healthy controls. Sci Rep 6, 28484 (2016).
谷禾健康
为什么在劳累一天后,我们的大脑会疯狂渴望一块巧克力蛋糕,而不是一盘清爽的西兰花?为什么明知奶茶不健康,那种甜腻的口感却能带来无与伦比的慰藉?
过去,我们总把这归结为“压力大”、“嘴馋”或是“意志力薄弱”。但科学的聚光灯正照向一个我们长期忽略的角落——我们的肠道。
你可能不知道,你的每一次口腹之欲,背后都可能是一场发生在肠道里的“生物战争”。你体内的微生物菌群,这些数量比我们自身细胞还多的微小生命体,它们有着自己的“生存法则”和“饮食偏好”。
你吃的每一口食物,都在“投票”:你选择高纤维的蔬菜,就是在为你体内的“有益菌”投票,它们会回报你稳定的情绪和清晰的饱腹感信号。而你选择高度加工的甜食,则是在为那些渴望糖分的“捣蛋菌”投票,它们会分泌出让你更加渴求垃圾食品的化学物质。
这不仅仅是关于消化:这些菌群产生的代谢产物,如短链脂肪酸、胆汁酸甚至神经递质,能像信使一样,顺着“肠-脑轴”这条信息高速公路直达大脑,直接影响你的心情、味觉乃至成瘾行为。
高度加工食品的特点是脂肪和糖含量升高、纤维含量降低,同时含有大量盐和食品添加剂,维生素等微量营养素减少。而饮食中膳食底物(纤维、糖、脂肪和蛋白质等)比例的改变会扰乱微生物组-肠道-大脑轴。
越来越多的证据表明,微生物群在调节饮食相关行为及代谢紊乱的行为合并症方面发挥至关重要作用。了解肠道微生物群影响宿主食欲和新陈代谢的机制,将有助于更好地理解肥胖等饮食失调和代谢失调情况,从而开发新的生物治疗策略。
本文将为你揭示,现代工业化饮食是如何通过扰乱我们体内的“微生态平衡”,来悄无声息地影响我们的行为的。理解了这场“肠脑对话”,你将找到一把全新的钥匙,去解锁困扰已久的饮食难题,并最终学会如何“喂养”出一个更健康、更快乐的自己。
现代化进程推动了人类生活方式的变革,饮食行为作为基本生存需求也随之发生复杂多样的演变。工业革命的食品加工技术、信息时代的个性化营养、全球化的饮食文化融合、城市化的快节奏生活、科技进步的精准营养指导,以及社交媒体对饮食观念的重塑,这些现代化力量共同催生了当代社会中数量庞大、类型繁多的饮食行为模式。
这些饮食行为呈现出鲜明的双重性特征:既有科学化营养管理、个性化健康需求满足等积极趋势,也存在高糖高脂成瘾性消费、不规律进食习惯、过度依赖加工食品等不健康倾向。深入理解这些饮食行为的成因、特征及健康影响,对构建科学合理可持续的现代饮食体系具有重要意义。
Part 01
不健康的饮食行为
以下列举了一些在当代社会中普遍存在的不健康饮食行为模式,这些行为可能正在悄悄影响着我们的身体健康,快来看看自己是否存在这些问题。
高糖高脂类
高脂肪高糖饮食:现代食品的发展使得高糖高脂食品变得极其便利和诱人。这类饮食方式不仅包括传统的高脂肪高糖饮食如奶茶、甜品、油炸食品和快餐组合,还延伸出了更加隐蔽的形式。
精制糖依赖:已成为现代人普遍面临的健康威胁。从早晨的含糖咖啡开始,到下午的甜点小憩,再到深夜的糖分慰藉,精制糖以各种形式渗透到日常生活的每一个角落。含糖饮料、糖果、精制糕点的过量摄入不仅导致血糖波动,还可能引发类似药物依赖的生理和心理反应。
反式脂肪摄入:人造奶油、酥饼、部分快餐食品中含有的反式脂肪酸,以其独特的口感和保存特性被广泛使用,但其对心血管健康的危害已被科学研究充分证实。
高盐高钠类
重口味饮食:现代人对味觉刺激的追求催生了重口味饮食的盛行。这种饮食方式表现为过度依赖调味料、腌制食品、咸菜等高钠食物,以及对麻辣、酸辣等强烈味觉刺激的偏好。
加工食品依赖:火腿肠、方便面、罐头等便利食品为了延长保质期和增强口感,往往含有超出日常所需的钠含量。这些”隐形盐”的大量摄入与高血压、心血管疾病的发生密切相关。
不规律进食类
现代生活节奏的加快导致了饮食时间的严重失调。这种失调不仅体现在进食时间的不规律,更表现为进食量和频率的极端化。
暴饮暴食:在工作压力、社交焦虑、情感困扰的驱动下,许多人选择通过短时间内大量进食来获得心理慰藉,这种压力性进食行为已成为现代都市生活的普遍现象。
过度节食:在追求”完美身材”的社会压力下,极端限制热量摄入、长期营养不均衡的节食行为不仅损害身体健康,还可能导致进食障碍等严重心理问题。
夜宵文化:深夜大量进食高热量食物不仅干扰正常的生物钟,还会增加消化系统负担,影响睡眠质量。
跳餐习惯:不吃早餐的现象在年轻人中非常普遍。这种习惯不仅影响一天的能量供应和代谢稳定,还可能导致午餐和晚餐的过度补偿性进食。
营养结构单一化饮食
碳水化合物过量:表现为主要以米面等精制谷物为主食,缺乏粗粮、杂粮的摄入。这种饮食模式不仅导致B族维生素和纤维素摄入不足,还可能引发血糖波动和胰岛素抵抗。
蛋白质缺乏:在一些盲目追求素食的人群中尤为明显。长期素食但营养搭配不当,特别是缺乏对植物蛋白互补性的理解,可能导致必需氨基酸摄入不足。
维生素矿物质不足:主要源于新鲜蔬果摄入不足。现代人对加工食品、外卖食品的依赖,使得天然维生素和矿物质的摄入量远低于推荐标准。
Part 02
较健康的饮食行为
与上述不健康的饮食行为形成鲜明对比的是,在现代社会中同时也涌现出了一些相对更加科学合理、对身体健康更为有益的健康饮食方式和饮食理念。
均衡营养类
地中海饮食:地中海饮食作为被广泛认可的健康饮食模式,以橄榄油、鱼类、坚果、全谷物、蔬果为主要构成,其对心血管健康的保护作用已被大量科学研究证实。
DASH饮食:通过低钠高钾的营养配比,强调蔬果、全谷物、瘦肉蛋白的摄入,不仅有助于控制血压,还能改善整体代谢健康。
彩虹饮食:鼓励人们每天摄入多种颜色的蔬果,通过颜色的多样性确保植物化学物质和营养素的全面摄入。
全食物饮食:强调选择未加工或轻加工的天然食物,避免过度加工食品中的添加剂和人工成分,回归食物的天然营养价值。
一些饮食对肠道微生物群和免疫的影响
doi: 10.3390/nu11102393.
植物性饮食类
素食主义:现代素食主义已经从单纯的不摄入动物产品,发展为注重营养搭配、科学规划的健康生活方式。
弹性素食:以植物性食物为主,适量摄入动物产品的饮食模式,既满足了营养需求,又减少了环境负担。
轻食主义:以低热量、低脂肪、高纤维的食物为主,追求营养均衡而非饱腹感。典型食物包括沙拉、轻汤、蒸煮食品等,强调”吃得少而精”。
功能性饮食类
抗炎饮食:通过富含抗氧化剂的食物,如浆果、绿叶蔬菜、深海鱼类等,帮助人体对抗慢性炎症,预防相关疾病。
益生菌饮食:强调发酵食品、酸奶、泡菜等有益菌群的摄入,促进肠道健康,这与现代医学对肠道微生物群重要性的认识高度一致。
低升糖指数饮食:通过选择血糖反应较低的食物,帮助维持血糖稳定,对糖尿病防治具有重要意义。
▸ 膳食成分影响微生物代谢和饮食行为
√ 膳食成分和加工程度会影响微生物和代谢
膳食成分组成而非热量负荷本身是微生物组结构和功能的主要驱动因素。人类队列和动物模型研究一致表明,不同的营养素特征会引起特定的微生物和代谢反应。
对照喂养研究显示,营养素比例相同但纤维含量和加工程度不同的等热量饮食会产生截然不同的微生物特征、发酵活性和宿主能量利用效率。工业化饮食减少了可发酵化合物的可用性,而这些化合物对维持多样化和有弹性的微生物群落至关重要。
由于肠道微生物组影响免疫、代谢、神经传递和内分泌等多种宿主过程,饮食的重大变化可能改变肠道微生物组的代谢输出,对宿主生理和行为产生重要影响。
√ 肠道微生物可以通过肠脑轴反向影响饮食行为
肠-脑轴对摄入的营养物质(纤维、糖、脂肪和蛋白质)进行差异感知,并将有关营养、能量和饱腹感的信息传递到大脑,以协调摄食行为。这些行为包括饥饿时觅食和饱腹时停止摄入。该系统通过专门的感觉途径整合来自胃肠道的化学和物理影响,从而维持能量稳态。
肠道微生物组作为对饮食敏感且高度可塑的微生物群落,在结肠中密度最高,通过将膳食底物代谢成生物活性化合物在宿主营养中发挥关键作用。由于肠道微生物组对饮食的反应和代谢能力远超人体自身,它能够显著影响肠脑信号传导和摄食行为。然而,这种饮食敏感性可能是双刃剑:在进化的低能量环境中发挥优势的机制,在现代工业化产生的高能量密集且易消化食物环境中可能带来危害。
饮食驱动的微生物组-肠-脑轴调节摄食行为
Liow YJ,et al.Trends Endocrinol Metab.2025
√ 现代饮食的大量加工会导致饮食行为改变
现代饮食改变了纤维、糖、脂肪和蛋白质的比例,并通过大量加工提高小肠营养物质消化率。这些变化增加了工业化饮食破坏微生物介导营养传感网络的可能性,导致饮食行为改变和能量失衡。这些饮食-微生物组相互作用可能为工业化生活方式相关的流行病(包括饮食失调和代谢疾病)提供了现有模型中基本未解释的隐藏信号层。
▸ 膳食常量营养素的化学感觉编码
√ 葡萄糖信号传感
葡萄糖传感发生在门静脉肠系膜系统内,代谢信号通过迷走神经和脊髓传入神经编码。门静脉葡萄糖代谢的迷走神经元通过结节神经节将信号传递至孤立道核,并通过调节纹状体多巴胺释放增强糖偏好。平行的门静脉-脊髓轴确保强大的营养信号编码,凸显了糖检测在摄食调节中的重要性。
然而,葡萄糖缺乏检测涉及非迷走神经机制。孤立道核后区是感知葡萄糖缺乏的中心枢纽,迷走神经切断术不能消除葡萄糖缺乏引起的摄食反应,而损伤该回路则能消除此反应,表明葡萄糖缺乏检测可能依赖中枢糖感受器或脊髓传入神经。此外,葡萄糖通过非迷走神经途径抑制刺鼠相关肽(AgRP)神经元,支持其他内感受机制的参与。
注:刺鼠基因相关蛋白——一种与食欲控制密切相关的神经肽。
√ 脂质信号传感
相比之下,脂质传感显示出对迷走神经传入神经的严格依赖。迷走神经切断术消除脂质摄食反应,表明脂质代谢信息必须通过肠-脑信号传导而非中枢直接检测传达。十二指肠脂肪需要迷走神经输入抑制AgRP神经元,强化了迷走神经信号的重要性。关键介质是油酰乙醇酰胺,这是近端肠道合成的脂质衍生分子,与PPARα受体结合并调节纹状体多巴胺信号,可能通过投射至孤立道核后区的迷走神经传入发挥作用。
长期高脂肪饮食会破坏油酰乙醇酰胺信号,削弱肠脑通讯和脂肪衍生的多巴胺释放,这种适应不良反应可能导致代偿性暴食。糖和脂肪信号参与重叠但不同的回路,同时出现时会放大多巴胺释放,促进超出热量需求的过度消耗。
√ 蛋白质信号传感
蛋白质衍生的信号参与迷走神经和非迷走神经途径,具体取决于蛋白质形式和生理环境。蛋白胨等水解蛋白激活肠道化学感受器并触发胆囊收缩素(CCK)释放,刺激迷走神经传入并激活食欲调节的肠脑信号。
迷走神经切断术或CCK1受体阻断可消除此效应,证实迷走神经依赖性。相反,完整蛋白质通过非迷走神经反馈调节摄食,可能通过血浆氨基酸传感或肝脏传入神经实现。肝门传感器以剂量依赖方式检测循环氨基酸,在氨基酸缺乏时迷走神经传感器敏感性增加约100倍,放大代偿驱动。这种肝脏中心机制能根据营养可用性动态调节蛋白质摄入。
▸ 胃胀的机械感觉编码
机械感觉提供独立于营养成分的肠脑信号传导层,传达胃扩张和进食量信息。表达催产素受体的迷走神经感觉神经元作为机械传感器,对胃和十二指肠牵拉做出反应,将机械信号传递至孤立道核。
√ 机械敏感传入神经影响饱腹感和能量平衡
这些机械敏感传入神经影响饱腹感和能量平衡控制回路,激活时抑制食物摄入并诱导昏睡样状态,表现为能量消耗减少和下丘脑-垂体-肾上腺轴活动增加。除迷走神经通路外,脊髓传入神经也传递机械感觉信号,背根神经节介导的通路将GLP-1介导的胃松弛信号传递至下丘脑外侧。
然而,机械感觉通路并非孤立运作,而是与肠内分泌细胞的化学感觉输入相互作用。产生5-羟色胺的肠嗜铬细胞既对管腔刺激物反应,也促进肠道蠕动并加速肠道转运以助毒素清除。此外,胰高血糖素样肽-1(GLP-1)和CCK释放细胞可减缓胃排空,可能与迷走神经机械传感器协同延长饱腹感。
√ 营养信号和机械信号共同调节进食行为
营养信号和机械信号间的相互作用精细调节进食行为,促进对不同膳食成分的适应性反应。
通过整合来自营养成分的化学感觉输入和编码胃扩张的机械感觉信号,肠脑轴传入分支确保摄食行为根据摄入食物的代谢和物理特性动态调节。脑干迷走神经和脊髓传入通路的汇聚实现对食欲和能量平衡的精细调节。肠内分泌细胞作为综合枢纽,将管腔营养信号转化为激素和神经输出,塑造肠道蠕动和摄食行为,进一步完善能量稳态的内感受控制。
饮食对肠道微生物组组成和功能的影响远超遗传因素。比较植物性与动物性饮食、地中海与西方饮食、非洲农村高纤维与欧洲城市饮食以及熟食与生食的研究中,均可观察到饮食对肠道微生物组的显著影响。
√ 肠道微生物组有助于评估生活方式的健康性
肠道微生物组对饮食的敏感性使其成为评估现代生活方式健康影响的重要标志和靶点。特别是向工业化饮食的转变可能对与饮食行为相关的肠道微生物组产生显著的组成和功能变化。
与传统饮食相比,工业化饮食的特征是纤维含量急剧减少,糖、脂肪和蛋白质含量增加。肠道微生物组代谢部分抵抗小肠消化的营养物质,产生多种生物活性小分子代谢物,使工业化饮食与其他饮食产生区别。在动物模型和人类研究中,饮食成为肠道微生物生态学的核心决定因素,不仅重塑群落组成,还重塑介导微生物-宿主相互作用的基因组、转录组和代谢组学程序。
√ 微生物代谢影响食欲和摄食行为
肠道微生物组在接触膳食底物时产生的代谢物包括短链脂肪酸(SCFA)、氨基酸代谢物、次级胆汁酸和神经递质,其产生取决于管腔中常量营养素的可用性。这些代谢物改变局部肠道环境、粪便和血浆代谢组特征以及全身能量调节,并对宿主生理学产生其他影响。
重要的是,这些代谢物与外周和中枢神经元相互作用,影响宿主进食行为。下图表概述了膳食底物的肠道微生物代谢如何产生影响食欲调节和摄食行为神经回路的生物活性代谢物。接下来我们将介绍微生物与各主要膳食成分的相互作用。
微生物代谢膳食底物及对宿主进食行为的影响
Liow YJ,et al.Trends Endocrinol Metab.2025
1
膳食纤维
工业化饮食的特征是纤维含量相对较低,精制碳水化合物含量较高。这种膳食底物模式促进了支持炎症和奖励敏感代谢途径的微生物环境,而抑制了促进饱腹感和代谢平衡的途径。
√ 能否发酵会影响宿主的饮食选择
膳食纤维对肠道微生物组的塑造程度取决于其可发酵性:可发酵纤维(如菊粉)更强烈地调节微生物组成和活性,而不可发酵纤维(如纤维素)代谢最少,对宿主能量贡献很小。
纤维素虽能诱导肠扩张,但代谢惰性相对较高,虽然它可激活迷走神经信号,但与脂肪和糖等代谢活性营养素相比作用较弱。有趣的是,微生物发酵能力可能影响宿主食物偏好:最近研究发现,小鼠更偏好其常驻微生物无法发酵的膳食纤维,而非可发酵纤维。因此,发酵性不仅控制微生物和代谢结果,还控制对膳食纤维的行为反应。
富含纤维的食物会诱导肠道蠕动、胃排空和肠内分泌信号传导的急性变化。在短期内,纤维消耗通过胃胀气和延迟营养吸收来增加饱腹感,从而减少膳食量。在数天至数周内,持续摄入纤维会重新配置微生物组组成和代谢信号通路,增强肠内分泌激素分泌,并导致食欲调节和能量稳态的持续改变。长期以来,高纤维饮食与较低的能量摄入和体重调节有关。
√ 膳食纤维代谢产生的短链脂肪酸是肠脑通讯的重要信号分子
膳食纤维发酵是短链脂肪酸(主要是丁酸盐、乙酸盐和丙酸盐)的主要来源。短链脂肪酸已成为肠脑通讯的重要调节剂。丁酸盐通过激活迷走神经传入神经元、降低孤立束核和背侧迷走神经复合体活性以及抑制下丘脑神经肽Y(NPY)表达的食欲神经元来抑制食物摄入。这种食欲抑制作用需要迷走神经完整性。
乙酸盐和丙酸盐腹腔注射也具有显著厌食作用。在禁食小鼠中,全身注射短链脂肪酸导致食物摄入量剂量依赖性减少,丁酸盐效果最强,其次是丙酸盐和乙酸盐。这种短链脂肪酸诱导的食欲抑制由迷走神经传入神经元介导,迷走神经传入神经元表达游离脂肪酸受体(FFAR2、FFAR3),为微生物代谢物提供了独立于经典肠内分泌信号通路调节宿主摄食行为的途径。
√ 短链脂肪酸影响肠内分泌激素进而影响饮食行为
短链脂肪酸不仅直接作用于迷走神经传入神经,还刺激肠内分泌细胞通过激活肠内分泌L细胞上的FFAR2释放激素,调节摄食行为和能量稳态。其中,CCK、GLP-1和PYY是肠脑信号传导和饱腹感的关键调节因子。
短链脂肪酸及其对宿主食欲和新陈代谢的影响
doi: 10.3945/jn.116.240481.
CCK通过迷走神经元影响摄食行为,迷走神经切开术消除其厌食作用。微生物来源的丙酸盐通过直接上调肠内分泌细胞中的Cck mRNA和肽水平刺激回肠和盲肠中CCK表达。CCK塑造营养特异性偏好,包括脂肪偏好发展。阻断CCK信号传导消除对糖、脂肪和氨基酸的迷走神经反应,表明CCK对营养驱动的食欲行为至关重要。膳食纤维摄入促进微生物发酵并促进CCK释放,通过微生物活动将膳食纤维与肠脑信号传导联系起来。
GLP-1是食欲和血糖控制的关键调节因子,通过表达GLP-1受体的迷走神经传入神经发挥作用。这些神经元密集支配胃肠道并投射到孤立道核,介导GLP-1的厌食和代谢作用。内源性GLP-1还通过替代的肠交感神经回路发挥作用。GLP-1和PYY都受微生物来源短链脂肪酸调节,后者通过结肠L细胞上的FFAR2急性刺激其分泌。长期暴露时,短链脂肪酸还通过FFAR2/PAX4依赖性分化扩大L细胞群来增强PYY输出。PYY3-36通过与迷走神经传入神经上的Y2受体结合发挥厌食作用。
√ 特定微生物代谢膳食纤维改变宿主的食物偏好
尽管微生物短链脂肪酸和肠内分泌激素相互作用影响饱腹感和能量稳态,但膳食纤维的微生物代谢也可能通过替代途径影响宿主食物偏好。菊粉补充剂研究表明其将食物偏好转向脂肪而非糖,这种变化与特定微生物特征相关。受控研究显示,用特定拟杆菌定植的小鼠选择性发酵果聚糖,使宿主偏好从可发酵果聚糖转向不可发酵果聚糖,当微生物代谢中断时这种效应消失。
人体研究提供初步证据表明肠道微生物对纤维的发酵影响食物相关线索的神经处理。超重成人补充菊粉型益生元纤维改变大脑对高热量食物刺激的激活模式,减少奖励评估相关脑区激活。尽管这些神经变化未直接转化为食物摄入或偏好改变,但提示微生物代谢物可能影响大脑对营养丰富食物的评估。
综上所述,低纤维的工业化饮食减少短链脂肪酸的微生物产生,通过迷走神经传入神经减弱饱腹感信号传导并减少CCK、GLP-1和PYY等饱腹感激素分泌,从而破坏肠脑通讯。因此,膳食纤维缺失可能导致饱腹感下降,促进过度摄入并损害能量平衡。
膳食底物的微生物代谢控制宿主的进食行为
Liow YJ,et al.Trends Endocrinol Metab.2025
2
膳食糖
膳食糖在现代工业化饮食体系中占据了相当大的比例,现代食品中,有相当多的食品类别都含有大量的糖分成分。
因为糖在小肠中易被消化,大大减少了到达结肠肠道微生物群的糖量。然而,在糖摄入过量的情况下——如某些工业化饮食所预期的,未吸收的糖会溢出到达结肠,引发微生物组、免疫和神经生理学变化的级联反应,间接影响宿主摄食行为。这些机制包括短链脂肪酸产生改变、免疫-微生物组相互作用和迷走神经重塑。
√ 过量的糖到达结肠可能会抑制拟杆菌等纤维降解菌
葡萄糖通常几乎完全在小肠中被吸收,而果糖代谢变化更大。当果糖到达结肠肠道微生物群落时,通过抑制编码关键定植因子的roc基因来抑制关键的纤维降解细菌,如多形拟杆菌(Bacteroides thetaiotaomicron)。
这种转变破坏微生物群落稳定性,可能导致短链脂肪酸产生减少。鉴于短链脂肪酸作为代谢信号分子,通过迷走神经通路和神经递质调节参与肠脑轴,其可用性降低会扰乱摄食行为和代谢稳态。
√ 膳食糖影响辅助性T17细胞进而影响饮食行为
与直接促进微生物代谢产生生物活性代谢物的膳食纤维不同,膳食糖对微生物组与免疫相互作用产生更间接影响。其中一种机制是通过消耗辅助性T17(Th17)细胞,这种免疫细胞群对肠道稳态至关重要。高糖饮食有利于适应糖的微生物扩张,而牺牲Th17诱导的共生体,导致肠黏膜中Th17细胞丢失。
Th17细胞破坏减少IL-17产生,这种细胞因子直接作用于下丘脑神经元,通过增加POMC表达和激活厌食信号通路抑制食物摄入,从而通过抑制这种免疫来源的饱腹感信号改变摄食行为。同时,Th17细胞通过IL-17调节肠道脂质吸收,并下调CD36(关键脂质转运蛋白)。这种免疫调节功能丧失增加脂质吸收,表明微生物组介导的糖摄入代谢后果与免疫抑制和微生物破坏交织。
这些发现共同强调了膳食糖塑造饮食行为的独特但未被充分认识的途径——不是通过作为微生物底物,而是通过以驱动代谢和神经生理学效应的方式重新编程宿主-微生物相互作用。
尽管膳食糖与微生物组结构变化、免疫调节和迷走神经重塑相关,但证明这些变化如何转化为摄食行为改变的直接实验证据仍然有限。然而,这一途径对现代饮食具有重要意义,因为长期摄入糖可能通过持续的微生物组-肠-脑改变强化失调的摄食行为。
3
膳食蛋白质
蛋白质杠杆理论假设生物体优先考虑蛋白质摄入而非总能量摄入,当膳食蛋白质被稀释时,会导致脂肪和碳水化合物的代偿性过度消耗。这种现象在包括人类在内的各物种中均可观察到,强调蛋白质食欲是摄食行为的重要驱动因素。尽管研究主要集中在宿主机制上,如氨基酸感觉检测、激素反馈回路和控制蛋白质食欲的中枢神经通路,但肠道微生物组在塑造蛋白质驱动摄食行为中的作用在很大程度上仍未探索。
√ 微生物氨基酸合成可抑制宿主代偿性摄食
越来越多证据表明肠脑信号传导在蛋白质稳态中起核心作用,新发现暗示微生物对这一调节网络的贡献。肠道微生物通过调节氨基酸可用性缓冲宿主对抗膳食蛋白质稀缺:用产生必需氨基酸的细菌Acetobacter pomorum定植的果蝇表现出减少的蛋白质寻找行为,表明微生物氨基酸合成可抑制宿主代偿性摄食。
相比之下,乳酸杆菌缺乏必需支链氨基酸(亮氨酸、异亮氨酸、缬氨酸)的生物合成途径,在必需氨基酸剥夺时不会抑制蛋白质食欲,这与该食欲调节作用需要必需氨基酸微生物生物合成的假设一致。这表明微生物对代偿性摄食反应的抑制取决于特定的生物合成能力。
√ 不同饮食下的微生物群落会影响宿主的摄食偏好
微生物组驱动的与必需氨基酸相互作用也可能影响更广泛的常量营养素偏好。在草食性供体肠道微生物中定植的小鼠表现出血浆色氨酸升高和对蛋白质的更大偏好,而在杂食性或肉食性供体肠道微生物中定植的小鼠消耗更多碳水化合物。其他一些研究已将犬尿氨酸途径与微生物组驱动的色氨酸代谢对摄食行为的影响联系起来。
色氨酸向犬尿酸的微生物代谢通过涉及迷走神经传入和中枢食欲通路的肠脑回路调节摄食行为。慢性压力和节食史改变肠道微生物组成并降低管腔犬尿酸水平。这种消耗抑制迷走神经末梢,通过孤束核和室旁核过度激活导致食物摄入量增加。通过补充益生菌或直接给药犬尿酸恢复其水平,使摄食行为正常化,证实犬尿氨酸途径是强迫性暴饮暴食的微生物代谢调节剂。
√ 肠脑轴信号和微生物代谢共同调节蛋白质摄入
蛋白质稳态依赖于肠道来源神经肽,这些神经肽参与肠道和中枢回路调整摄食行为以响应氨基酸可用性,肠道微生物组通过促进营养平衡进一步塑造这一过程。微生物合成必需氨基酸时,其生物合成抑制宿主因蛋白质稀缺而产生的代偿性摄食。这些机制共同证明宿主驱动的肠脑信号传导和微生物代谢都调节蛋白质摄入。
√ 不同蛋白质对肠道微生物群的影响存在差异
蛋白质对肠道微生物群组成的影响因类型而异。食用动物蛋白(特别是红肉和奶制品中的蛋白质)可能导致耐胆汁厌氧菌(如拟杆菌门、Alistipes和嗜胆菌门)丰度增加。这些肠道微生物群改变诱导氧化三甲胺(TMAO)增加。
TMAO是一种具有促动脉粥样硬化潜力的化合物,在心血管疾病中发挥重要作用。
另一项研究表明,硫酸盐还原菌从膳食中的无机硫和硫酸化氨基酸(即蛋氨酸、半胱氨酸、胱氨酸和牛磺酸)中产生硫化氢,可能增加炎症性肠病风险。此外,动物蛋白发酵降低了双歧杆菌丰度和短链脂肪酸产生,可能进一步增加炎症性肠病风险。
而食用植物蛋白(如豌豆蛋白)会增加肠道共生双歧杆菌和乳酸杆菌,并减少致病性脆弱拟杆菌和产气荚膜梭菌。在小鼠模型中,西式饮食3周后补充大豆浓缩蛋白导致双歧杆菌科、梭状芽胞杆菌科和递叶杆菌科丰度显著增加,拟杆菌门水平降低。植物蛋白的发酵与双歧杆菌和乳酸杆菌丰度增加相关,从而刺激短链脂肪酸产生。
√ 优化饮食中纤维和蛋白质的比例可能有助于改善代谢和微生物群
膳食纤维和蛋白质对肠道微生物组组成和微生物衍生代谢物的影响有据可查,突显它们对宿主饮食行为的重要性。尽管不可消化碳水化合物是微生物介导短链脂肪酸产生的主要底物,但结肠中未消化的膳食蛋白质和氨基酸也可作为短链脂肪酸合成前体。
纤维和蛋白质衍生代谢物间的相互作用可能抵消与西方饮食相关的一些不良代谢影响,西方饮食通常纤维含量低,脂肪和蛋白质含量高。饮食的代谢和微生物结果不仅取决于单个常量营养素存在,还取决于它们的相对比例和相互作用。
将可发酵纤维与优质蛋白质来源共同给药,可通过增加微生物对可发酵底物暴露来减少直接能量吸收并调节肠道微生物组组成。同时,降低高脂肪饮食中蛋白质与纤维比例可改善血糖控制和血脂状况,同时有利于产生短链脂肪酸的细菌类群扩张。
确定优化纤维与蛋白质比例是否可将微生物代谢转向增加短链脂肪酸产生和减少蛋白水解副产物,可能揭示抵消与纤维缺乏西方饮食相关饮食失调和代谢功能障碍的策略。
4
膳食脂肪
膳食脂肪通过热量负荷或感觉奖励以外的机制影响宿主摄食行为,新证据表明肠道来源代谢信号与脂肪偏好和饱腹感调节有关。工业化饮食的高脂肪和低纤维含量迅速使肠道微生物群落转向胆汁耐受生物,同时减少纤维发酵物种,导致包括胆汁酸代谢改变在内的功能变化。
√ 膳食脂肪改变微生物胆汁酸代谢影响脂肪感应
胆汁酸是微生物组衍生的关键代谢产物,将饮食与宿主代谢和摄食神经控制相结合。胆汁酸传统上因其在脂质乳化和吸收中的作用而受到认可,现在被认为是参与肠道激素通路、迷走神经传入神经元和中枢食欲回路的生物活性信号分子。
饮食、肠道微生物组组成、胆汁酸组成和摄食行为间的相互关系表明存在动态调节系统,其中膳食脂肪改变微生物胆汁酸代谢和胆汁酸组成,进而调节脂肪感应、饱腹感和食物摄入量。
高脂肪饮食通过重塑肠道微生物组和胆汁酸库破坏这种调节平衡,对肠脑信号传导产生下游影响。这些转变部分由微生物解偶联和初级胆汁酸脱羟基化为二级形式驱动,改变肠道和肝脏中的受体信号传导。例如,暴露于西方饮食的小鼠表现出胆汁酸组成变化,降低参与代谢调节的关键受体激活,包括法尼醇X受体和G蛋白偶联受体5,导致肠道激素分泌受损和代谢功能障碍。在人类中,不受控制的进食行为与扭链瘤胃球菌(Ruminococcus torques)和双歧杆菌属(Bifidobacterium spp)富集以及参与胆汁酸代谢和神经递质产生的基因表达减少有关。
高脂肪饮食对肠道微生物群和粘液屏障的影响
doi: 10.3390/nu11102393.
√ 胆汁酸可以充当肠道信号影响饱腹感和摄食行为
胆汁酸组成对摄食行为的影响是动态的,因为胆汁酸还影响膳食脂肪的感知和代谢方式。由关键胆汁酸产生酶CYP8B1破坏引起的小鼠12α-羟基化胆汁酸丢失会改变肠道脂质感应。这种变化增强GPR119介导的肠道激素分泌,从而增加饱腹感并减少高脂肪饮食消耗。
虽然胆汁酸主要通过肠道激素信号传导和迷走神经激活调节脂肪消化和饱腹感,但内源性大麻素通过直接参与奖励途径加强脂肪偏好来扩展这种调节功能。内源性大麻素系统通过CB1受体介导的抑制和兴奋性输入微调多巴胺和血清素信号传导,抑制奖励相关区域的多巴胺释放,同时以特定区域方式调节血清素传递——这些机制共同塑造包括摄食和强化学习在内的动机行为。
√ 肠道微生物群通过调节内源性大麻素水平诱导脂肪摄入
饮食引起的肠道微生物组组成变化通过调节生物活性内源性大麻素的合成和降解影响这些过程,导致回肠和血浆内源性大麻素水平平行变化。因此,限制和间歇性暴露于高脂肪饮食会改变大脑内源性大麻素信号传导并诱导暴饮暴食样行为。
内源性大麻素信号传导对膳食脂肪摄入的选择性反应。在受控喂养模型中,肠道内安非他命和2-花生四烯酰甘油水平对脂肪有反应但对碳水化合物或蛋白质无反应,迅速升高。直接给药这些内源性大麻素足以诱导脂肪偏好,迷走神经切断术消除了它们在空肠中脂肪诱导的积累和行为反应,加强了肠脑轴作为脂肪驱动奖励信号传导渠道的作用。
一个关键问题是肠道微生物组本身是否合成影响宿主食物摄入的生物活性脂质介质。肠道细菌可将膳食中的ω-3多不饱和脂肪酸转化为内源性大麻素样分子,表明微生物代谢可能至少扩展了宿主脂质信号传导的范围。
5
盐
世界卫生组织推荐盐的最大摄入量为5g/天。高盐饮食是高血压、肾损伤和心血管疾病发展的主要危险因素之一。高盐饮食还通过直接损害胃粘膜导致上皮增生,与胃癌风险增加相关。此外,考虑到幽门螺杆菌CagA阳性菌株是胃癌风险的标志物,当暴露于高盐饮食时,胃幽门螺杆菌通过诱导CagA表达来改变其毒力。
√ 高盐饮食会减少乳杆菌等有益菌并促进炎症
几项小鼠模型研究表明,高盐饮食与乳酸菌属、Oscillibacter、Pseudoflavonifractor、Clostridium XIVa、Johnsonella和Rothia的丰度降低相关,同时Parasutterella、Erwinia、Christensenellaceae、Corynebacteriaceae和瘤胃球菌属的丰度增加。
特别是,与高盐饮食相关的乳酸菌属减少会增加Th17细胞,这是许多炎症性疾病的促炎标志。进一步研究表明,高盐饮食诱导的小鼠结肠炎恶化与乳酸菌属减少有关,导致保护性短链脂肪酸产生改变,这些变化改变了肠道免疫稳态,增加了对炎症损伤的易感性。高盐饮食可能导致肠道菌群组成改变,厚壁菌门/拟杆菌门比率增加,从而改变与肠道通透性和免疫稳态变化相关的短链脂肪酸产生。
6
微量营养素
微量营养素在塑造肠道微生物群中起着重要作用,而肠道微生物群又是介导其保护性健康影响的有效参与者。
√ 许多拟杆菌和梭菌都能合成B族维生素
肠道微生物群可以合成多种维生素,包括硫胺素(VB1)、核黄素(VB2)、烟酸(VB3)、生物素(VB7)、泛酸(VB5)、叶酸(VB9)等B族维生素以及维生素K。拟杆菌门、梭菌门和变形菌门的细菌许多具备核黄素和生物素生物合成途径,大部分梭菌门都能产生维生素B12,而拟杆菌门是B族维生素的主要产生者。
√ 维生素会影响肠道菌群组成并可能对免疫和炎症性肠病有益
另一方面,研究表明维生素D等维生素会影响肠道微生物群组成。维生素D通过调节肠道微生物组和增加有益细菌菌株丰度,对炎症性肠病患者产生积极影响。在3-6个月大婴儿的研究中,维生素D与Lachnobacterium增加和乳球菌减少相关,这些变化可能对免疫系统调节和哮喘/过敏性疾病发病率产生长期影响。
其他抗氧化维生素,如负责许多水果和蔬菜黄色、橙色和红色的类胡萝卜素,也可能影响肠道微生物群组成。最近一项人类植物疗法研究确定叶黄素是黑醋栗提取物粉末的成分,并证明叶黄素显著促进双歧杆菌和乳酸杆菌生长,同时减少拟杆菌属和梭状芽胞杆菌属等其他细菌种群。
另一方面,血清类胡萝卜素水平可能受肠道微生物群组成影响。研究肠道宏基因组改变与动脉粥样硬化的关联,提出健康对照血清中高水平β-胡萝卜素可能由于肠道微生物群产生这种抗氧化剂。该研究表明β-胡萝卜素的抗炎作用由肠道微生物群介导。
7
食品添加剂
随着加工食品发展,食品添加剂(如非营养性甜味剂和乳化剂)数量飙升。人造甜味剂几乎被添加到所有加工食品中,通常有助于提高稳定性和保质期,并改善味道和质地。
√ 人造甜味剂可能改变肠道菌群并诱导不良反应
食用人造甜味剂会改变肠道菌群,并在宿主中诱导微生物群介导的不良反应(如葡萄糖耐受不良)。无热量人工甜味剂改变了微生物代谢途径,并将这些变化与宿主对代谢疾病的易感性联系起来。
几项研究证实,人工甜味剂摄入增加了拟杆菌属和一些梭菌属丰度,降低了梭状芽胞杆菌属、双歧杆菌属和乳酸菌属丰度,同时空腹血糖水平升高和胰岛素反应受损。
√ 膳食乳化剂可能促进全身炎症和菌群失调
除人造甜味剂外,膳食乳化剂(如卵磷脂、脂肪酸的甘油单酯和甘油二酯)可在体外增加细菌跨上皮细胞易位,促进全身炎症,改变微生物群定位和组成。乳化剂摄入降低了肠道微生物多样性和拟杆菌门丰度,增加了阿克曼菌(Akkermansia muciniphila)等粘液降解细菌的丰度。这些微生物群改变易导致菌群失调和慢性肠道炎症,促进结肠炎和代谢综合征发生。
感知和品尝营养物质的能力在维持营养平衡、食用有益食物以及识别变质食物方面起着至关重要的作用。动物模型已证明,特定信号机制会影响不同口味(甜、苦、咸、酸和鲜)的反应性。因此,肠道微生物对这些信号传导机制的调节可影响宿主摄取特定营养物质,从而增加它们的食物底物和存活率。
√ 饮食失调会导致对应的味觉反应改变
患有饮食失调的个体具有与其表型相对应的味觉反应性改变。事实上,肥胖与对甜味和脂肪味的反应性降低有关,导致人们转向偏好这些味道浓度较高的食物。此外,神经性厌食症患者的味觉受损,这已被证明会随着体重增加而改善。
舌头上的味觉受体细胞检测传递味觉的信号,随后通过孤立束传递到丘脑,向其他大脑区域发出信号。这些味觉受体细胞还表达厌食激素如GLP-1、PYY和胆囊收缩素,表明存在通过胃肠道激素分泌导致食欲下降的外周信号通路。
注:PYY敲除小鼠对脂肪和苦味化合物的行为反应降低。在这些小鼠中重建唾液PYY浓度会改善它们对脂肪的反应,但不会改善苦味反应。此外,在味觉反应性增加的个体中检测到较高浓度的循环TNF-α、胰岛素样生长因子1和瘦素,表明这些特定循环激素可能在味觉感知中发挥作用。
▸ 肠道微生物影响味觉
很少有研究调查肠道微生物群在宿主营养和味觉感应中的作用。最近的研究表明,使用选择性培育的西方低糖精和高糖精消耗大鼠模型,天生更易摄入糖精的大鼠具有与不易摄入糖精的大鼠不同的肠道微生物群组成。
√ 肠道微生物群通过影响味觉受体影响饮食偏好
此外,对无菌小鼠的研究表明,肠道微生物群能够影响味觉受体,从而影响味觉。例如,据报道小鼠中肠道甜味受体增加,蔗糖偏好增加。此外,小鼠对舌FA转位酶的口服偏好和表达增加,但FA受体的肠道表达降低,表明脂肪信号转导减少。
关于肠道微生物群对营养和味觉感应以及味觉功能影响的知识表明,这些影响可通过免疫系统调节分化味觉受体细胞的持续供应来实现。这些细胞在味觉化合物检测中必不可少,并通过味蕾细胞直接或间接传递后续信号,从而产生口腔味觉感知。
√ 肠道微生物可能通过调节免疫功能影响味觉
分化味觉受体细胞的持续供应对正常味觉功能至关重要,而这种供应的中断可能对味觉信号传导有害。免疫系统激活导致舌头上味觉受体和味蕾细胞的细胞更新和寿命缩短,这可能通过哺乳动物toll样受体以及I型和II型IFN受体介导,因为它们位于味觉细胞中。几项研究进一步指出免疫系统功能与味觉相关。例如,IL-10敲除小鼠的味蕾和味觉受体细胞数量减少,并且对脂多糖诱导的炎症反应增加。此外,TNF敲除小鼠对各种苦味化合物的反应降低,但对其他口味的反应也降低。
细菌衍生毒素脂多糖会导致舌头炎症反应,同时味觉细胞寿命缩短和味觉偏好降低。此外,小鼠长期口服脂多糖会导致甜味受体表达降低和对蔗糖的反应降低。
值得注意的是,脂多糖给药还会导致包括快感缺乏和焦虑成分的疾病行为,因此在研究体内行为时可能是混杂因素。然而,脂多糖给药降低了舌味上皮中c-Fos的表达,表明存在局部抑制的细胞活性。此外,将脂多糖皮下注射到舌腹表面会导致白细胞募集,并通过主要感觉传入神经鼓索抑制钠诱导的味觉信号传导。
综合来看,这些结果表明肠道微生物群可通过免疫系统调节影响宿主的营养和味觉信号传导,从而影响味觉功能,而脂多糖是其中的潜在介质。
▸ 肠道微生物影响其他饮食相关行为
除了味觉功能外,其他与饮食相关的行为很可能受到肠道微生物群及其代谢物的影响。尽管尚未广泛研究与肠道微生物群的直接联系,但嗅觉功能、与食物相关的认知加工、与食物相关的冲动和强迫性以及食物摄入的社会方面很可能容易受到微生物组调节。
√ 肠道微生物可能在食物成瘾中起关键作用
最近有假设肠道微生物群在成瘾中起关键作用,这可能与有争议的食物成瘾概念特别相关。肠道微生物群已经与小鼠的可卡因使用和人类的酒精依赖有关。同样地,大麻的主要精神活性成分Δ9-四氢大麻酚的给药缓解了高脂肪饮食诱导的与肠道微生物群改变相关的脂肪量和体重增加。
关于肠道微生物群在食物成瘾中的作用,特别是其他与饮食相关的行为,仍有很多未知数,因此需要进行更多研究,以更全面地了解肠道微生物群在饮食相关行为中的作用。
√ 微生物可能影响饮食紊乱导致焦虑和抑郁
饮食和代谢紊乱通常与焦虑和抑郁等其他行为合并症相关,因此这些行为可能存在很强的双向相互作用。影响这些食物相关行为的微生物或微生物衍生代谢物也有可能会改变宿主的食欲和新陈代谢。
微生物群-肠-脑轴的影响在焦虑和抑郁等行为中也越来越受到认可。因此,关于焦虑、压力、抑郁、社交和其他行为的发现对于全面了解饮食和代谢紊乱至关重要。
最近的一项研究表明,住院时神经性厌食症患者的肠道微生物群组成和多样性与抑郁、焦虑和饮食失调精神病理学水平相关。此外,许多与微生物群-肠-脑轴相关的食物相关行为发现通常通过肠道微生物群与宿主代谢和食欲相互作用的途径介导,包括免疫系统调节、迷走神经信号传导和神经化学物质产生。
▸ 工业化饮食塑造的不良饮食行为
工业化社会中饮食失调的患病率不断上升,反映出饮食行为与调节饱腹感的内部信号脱节。超加工食品作为工业化饮食的标志,可以通过增强奖励敏感性和鼓励超越生理饱腹感信号的摄入来发挥作用。
√ 超加工食品导致微生物多样性减少和氧化应激
微生物代谢被视为连接工业化饮食与适应不良饮食行为的潜在因素。工业化饮食通过提供高度加工的饮食底物,改变肠腔中的资源及其对宿主健康的广泛影响,从而塑造肠道微生物组及其代谢输出。
肠道微生物代谢物的下游变化既是饮食行为改变的潜在驱动因素,也是其强化因素,特别是通过对奖励途径和炎症过程的影响。由饮食和生活方式塑造的工业化微生物组表现出微生物多样性减少和氧化应激相关途径丰富,反映了生态脆弱和促炎状态。
通过这些级联效应,工业化饮食与微生物组-肠-脑轴之间的相互作用有可能形成一个生化反馈循环,从而促进食物成瘾和其他病态饮食行为。
√ 当代高糖低纤维的饮食改变了微生物组成及其代谢物
尽管在工业化和非工业化环境中人类饮食差异很大,但工业化饮食通常含有较少的纤维、较多的糖、蛋白质和脂肪,以及较高的总体热量。常量营养素平衡的这些变化预计将改变与宿主信号通路相互作用的微生物组衍生代谢物。
例如,膳食纤维减少会减少短链脂肪酸的微生物产生,而短链脂肪酸是饱腹感和代谢调节的关键信号。因此,短链脂肪酸信号传导受损可能会削弱控制饱腹感的肠脑通路,从而促进暴饮暴食和热量过剩。
膳食糖的增加驱动了适应糖的微生物丰度增加,牺牲了纤维发酵微生物,并通过短链脂肪酸的丢失直接损害了食欲调节。升高的膳食蛋白质驱动微生物代谢产生神经活性氨基酸代谢物,如犬尿酸和酪胺,这些代谢物能够破坏宿主营养感知并加强寻求蛋白质的摄食行为。
同样,高膳食脂肪摄入量会增加参与胆汁酸代谢的胆汁耐受生物的丰度,这些变化有可能激活奖励途径并促进针对脂肪食物的强迫性饮食行为。
随着全球肥胖症和代谢性疾病的流行,传统治疗方法面临疗效有限和副作用明显的挑战。近年来,肠道微生物群作为人体”第二基因组”的重要作用日益受到关注,在调节宿主代谢和食欲控制方面展现出巨大治疗潜力。
研究表明,肠道微生物群不仅参与食物消化和营养吸收,更通过产生短链脂肪酸、胆汁酸代谢产物和神经递质前体等生物活性代谢物,直接影响宿主的能量平衡、糖脂代谢和摄食行为。这些发现使肠道微生物群及其代谢物成为代谢和食欲控制领域极具前景的治疗靶点。
肠道微生物代谢物影响宿主食欲和新陈代谢
doi: 10.3945/jn.116.240481.
√ 益生元能增加饱腹感并降低餐后血糖水平
益生菌和益生元已被证明是显著改善超重和肥胖个体新陈代谢的有效策略。啮齿动物研究表明,补充益生菌可以促进饥饿的恢复,特定细菌菌株会影响体重或超重肥胖相关症状。
宿主难以消化的膳食纤维等益生元会增加饱腹感并影响餐后葡萄糖和胰岛素浓度。据报道,它们还与能量摄入、体重、胰岛素分泌、循环脂质和炎症标志物的减少相关。
√ 肠道菌群代谢物影响宿主代谢及食欲和摄入
微生物代谢物通过多种途径影响宿主代谢,包括与胃肠道和外周组织的直接相互作用。这些相互作用包括:通过表观遗传机制影响宿主基因表达、影响肠道神经系统并直接诱导迷走神经信号传导、改变胆汁酸信号传导,以及影响整合宿主能量状态的中枢食欲通路。
肠道微生物代谢物调节宿主食欲和新陈代谢控制。摄入的营养物质被肠道微生物利用,导致微生物群组成和功能改变。这些肠道微生物影响胆汁酸代谢,并产生各种代谢物,包括短链脂肪酸、神经活性物质、小蛋白序列和毒素。
部分肠道微生物代谢物通过与肠道中肠内分泌L细胞或迷走神经上的受体直接相互作用,或通过肠上皮转位到外周循环中发挥作用。胆汁酸或短链脂肪酸刺激L细胞导致厌食激素PYY和GLP-1的释放,并可增加胰岛素、瘦素和生长素释放肽等外周激素浓度。这些激素介导的信号转导受免疫球蛋白影响,而免疫球蛋白又可受到刺激或与肠道微生物衍生的小蛋白序列(如ClpB)相互作用。这种蛋白质序列以及肠道微生物衍生毒素(如LPS)的影响受肠道屏障完整性高度影响。
脂多糖还能够诱发免疫反应,可能导致味觉受体细胞分化减少和味觉检测降低。这些通路累积影响食欲和新陈代谢,受下丘脑中促阿片黑皮质素和可卡因苯丙胺调节转录物以及含有神经肽Y和刺豚鼠调节肽的神经元高度调控,最终影响进食行为、饮食相关行为(如认知和冲动)以及与食欲和代谢障碍相关的行为合并症功能失调(如焦虑和抑郁)。
▸ 作用机制
①微生物群-肠-脑轴的核心作用
肠道微生物群通过微生物群-肠-脑轴影响宿主代谢和食欲控制,主要通过以下途径:
-神经途径:通过迷走神经和肠神经系统直接信号传导;
-激素途径:调节GLP-1、PYY、瘦素、胰岛素等代谢激素分泌;
-免疫途径:调节慢性低度炎症和免疫反应;
-表观遗传机制:通过表观遗传修饰影响宿主基因表达。
②关键代谢物及其功能
–短链脂肪酸(SCFA)是最重要的微生物代谢物:
乙酸盐、丙酸盐、丁酸盐由纤维发酵产生,刺激肠内分泌L细胞释放厌食激素(PYY、GLP-1),可穿越血脑屏障直接调节下丘脑食欲中枢,激活迷走神经传入信号,抑制食物摄入。
-胆汁酸代谢产物:调节脂质代谢和能量平衡。
-GABA(γ-氨基丁酸)作为肠道微生物产生的多种神经活性物质之一,与以下物质共同调节宿主代谢和食欲:
组胺:影响食欲和代谢;
乙酰胆碱:调节胃肠道功能;
色胺:参与情绪和食欲调节;
儿茶酚胺(去甲肾上腺素、多巴胺):调节奖励机制和食欲;
血清素:调节情绪、饱腹感和胃肠道蠕动。
-小蛋白序列:如ClpB,影响激素信号传导。
√ 工业化饮食通过破坏微生物群-肠-脑轴造成了以下负面影响:
促进菌群失调:有益菌减少,有害菌增加;
损害饱腹感信号:影响GLP-1和PYY分泌;
增强奖励反应:激活大脑奖励回路,促进过度进食;
诱发慢性炎症:破坏肠道屏障,引起全身炎症;
形成恶性循环:代谢物谱改变强化不良饮食行为。
▸ 应对措施
针对现代高度加工食品对人体健康和肠道微生物群带来的各种负面影响,目前研究和临床实践中主要采用两大类应对策略:一类是通过益生菌、益生元等方式进行的直接微生物调节方法,另一类是通过调整膳食结构和营养成分的饮食干预策略。
√ 直接微生物调节方法
调节肠道菌群的主要方法有四种:
1)施用活的有益细菌菌株(益生菌);
2)施用宿主难消化的膳食纤维,这些纤维经细菌发酵后刺激特定细菌生长(益生元);
3)施用靶向抗生素;
4)粪便微生物群移植。
益生菌治疗:给予特定有益菌株(如Akkermansia muciniphila、Lactobacillus等);
分泌菌株特异性代谢物,改善代谢内毒素血症;
需要持续补充以维持效果。
益生元补充:提供宿主难消化的膳食纤维(如菊粉、低聚糖)选择性促进有益菌生长;
增加SCFA产生,改善饱腹感信号。
靶向抗生素:选择性清除有害菌群;
需要精准识别病原菌;
避免影响有益菌群。
粪菌移植:从健康供体移植微生物群;
适用于严重菌群失调病例;
需要严格的安全性评估。
√ 饮食干预策略
“去工业化”饮食模式
高纤维摄入:每日至少25-35g膳食纤维;
最小化加工:选择全谷物、新鲜蔬果;
低能量密度:减少高糖高脂食品;
植物为主:增加植物性食物比例。
增加发酵食品摄入(酸奶、发酵蔬菜等);
多样化膳食纤维来源(不同类型蔬果、谷物);
控制精制糖和加工食品摄入;
规律饮食,避免暴饮暴食。
想象一下,未来的减肥和健康管理将是什么样子?不再是千篇一律的节食食谱,也不是痛苦的意志力考验。你的医生或营养师可能会给你开一份特殊的“处方”:一份为你量身定制的“菌群优化”饮食方案。
·早餐:可能不再是简单的牛奶鸡蛋,而是一杯富含特定益生元的营养奶昔,专门用来唤醒你肠道中负责传递饱腹感信号的菌群。
·午餐:你的外卖软件可能会根据你上周的菌群报告,为你优先推荐富含短链脂肪酸前体的菜品。
·零食:你甚至可以享用专门设计的“益生菌软糖”,它不仅能解馋,还能精准地为你的肠道“盟友”补充能量。
通过精准调控肠道这个“第二大脑”,我们不仅能从根源上解决肥胖、糖尿病等代谢难题,更能彻底重塑我们与食物的关系——让吃饭回归健康与愉悦的本质。
现代饮食“高糖高脂低纤维”的组合拳,不仅喂饱了我们,更喂养出了一支会“胁迫”大脑、破坏代谢平衡的“叛逆”菌群。喂养你的“好菌”:别再只喂饱你自己,更要喂饱你体内的有益菌。多吃富含膳食纤维的食物,比如燕麦、豆类、全谷物和五颜六色的蔬菜水果。它们是益生菌最爱的“口粮”,能帮你产生更多有益的代谢物,向大脑发送“我饱了”的信号。
好消息是,我们已经找到了扭转战局的钥匙。未来的医学,将不再仅仅关注疾病本身,而是会深入到肠道以及肠道的亿万微生物,这意味着,我们有望从根本上告别“管不住嘴”的困扰,让身体自然而然地渴望健康食物。这一前沿领域不仅为攻克肥胖和代谢综合征带来了曙光,更将引领一场全民性的饮食观念升级:善待你的肠道菌群,就是善待你自己。
主要参考文献
Liow YJ, Sarkar A, Carmody RN. Industrialized diets modulate host eating behavior via the microbiome-gut-brain axis. Trends Endocrinol Metab. 2025 Jul 17:S1043-2760(25)00125-0.
Samulėnaitė S, García-Blanco A, Mayneris-Perxachs J, Domingo-Rodríguez L, Cabana-Domínguez J, Fernàndez-Castillo N, Gago-García E, Pineda-Cirera L, Burokas A, Espinosa-Carrasco J, Arboleya S, Latorre J, Stanton C, Hosomi K, Kunisawa J, Cormand B, Fernández-Real JM, Maldonado R, Martín-García E. Gut microbiota signatures of vulnerability to food addiction in mice and humans. Gut. 2024 Oct 7;73(11):1799-1815.
van de Wouw M, Schellekens H, Dinan TG, Cryan JF. Microbiota-Gut-Brain Axis: Modulator of Host Metabolism and Appetite. J Nutr. 2017 May;147(5):727-745.
Rinninella E, Cintoni M, Raoul P, Lopetuso LR, Scaldaferri F, Pulcini G, Miggiano GAD, Gasbarrini A, Mele MC. Food Components and Dietary Habits: Keys for a Healthy Gut Microbiota Composition. Nutrients. 2019 Oct 7;11(10):2393.
Medawar E, Haange SB, Rolle-Kampczyk U, Engelmann B, Dietrich A, Thieleking R, Wiegank C, Fries C, Horstmann A, Villringer A, von Bergen M, Fenske W, Veronica Witte A. Gut microbiota link dietary fiber intake and short-chain fatty acid metabolism with eating behavior. Transl Psychiatry. 2021 Oct 1;11(1):500.
McDougle M, de Araujo A, Singh A, Yang M, Braga I, Paille V, Mendez-Hernandez R, Vergara M, Woodie LN, Gour A, Sharma A, Urs N, Warren B, de Lartigue G. Separate gut-brain circuits for fat and sugar reinforcement combine to promote overeating. Cell Metab. 2024 Feb 6;36(2):393-407.e7.
Li M, Tan HE, Lu Z, Tsang KS, Chung AJ, Zuker CS. Gut-brain circuits for fat preference. Nature. 2022 Oct;610(7933):722-730.
Tan HE, Sisti AC, Jin H, Vignovich M, Villavicencio M, Tsang KS, Goffer Y, Zuker CS. The gut-brain axis mediates sugar preference. Nature. 2020 Apr;580(7804):511-516.
谷禾健康

随着生活方式的变化和环境压力的增加,慢性疾病的发病率正在全球范围内急剧上升。这些慢性疾病,包括心血管疾病、糖尿病、抑郁症和多种自身免疫性疾病,不仅对个人的健康和生活质量构成了严重威胁,也给全球卫生系统带来了前所未有的挑战。
我们知道抗生素对肠道菌群会产生很大影响,事实上,其他这些药物也被报告具有类似的改变肠道微生物群的效果。这引发了人们对药物通过影响肠道微生物群从而影响健康和疾病的关注。特别是,肠道微生物群与大脑之间的相互作用,也就是所谓的“肠-脑轴”,成为一个热点领域,这可能为一些神经系统疾病的新治疗方法提供线索。
另一方面,神经系统疾病的治疗面临着许多难点,其中包括疾病机制的复杂性、治疗效果的个体差异、长期药物治疗的副作用,缺乏针对疾病根本原因的治疗方法。这些难点突显了寻找新的治疗目标和策略的重要性。
本文我们来了解一下药物引起的生态失调,以及日常处方药包括二甲双胍、他汀类药物、质子泵抑制剂和非甾体抗炎药为什么以及如何可能通过微生物群改变肠脑轴,以抑郁症、多发性硬化症、帕金森病和阿尔茨海默病等神经系统疾病为例来说明。
关于药物和肠道菌群及其与神经系统疾病之间的关联研究,提供了一个全新的视角,对于开发新的神经系统疾病相关治疗方法具有重要意义。
不同的细菌种群在消化道的不同部位繁殖,这是由于不同的微环境所致。关于居住在胃和肠道中的肠道细菌组成的总结见下图:
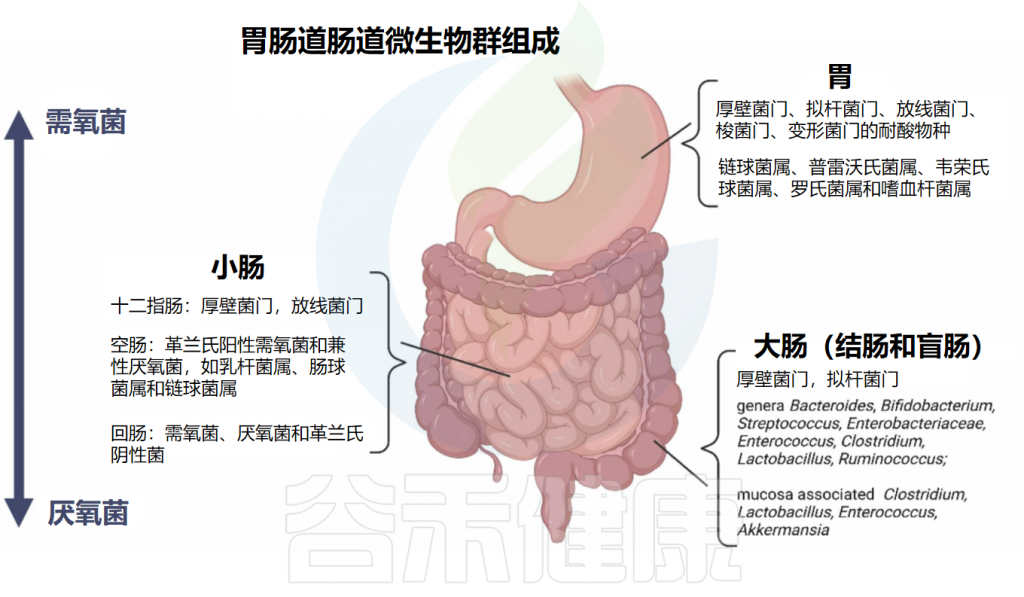
doi.org/10.1016/j.brainresbull.2024.110883
从上消化道到下消化道,细菌种类从需氧菌过渡到厌氧菌。
肠脑轴定义了肠神经系统(ENS)和中枢神经系统(CNS)之间的连接。随着研究的深入,微生物群在这一轴线中扮演着至关重要的角色。现已将肠脑轴扩展到了微生物群-肠-脑轴(MGBA)。
微生物群-肠-脑轴是肠道菌群和CNS之间的双向通信路径,肠道菌群可能通过细菌产生的神经递质和代谢物(所谓的化学信号)、迷走神经、免疫系统或包括下丘脑-垂体-肾上腺轴(HPAA)在内的神经内分泌系统影响大脑。
微生物群-肠-脑轴通信图
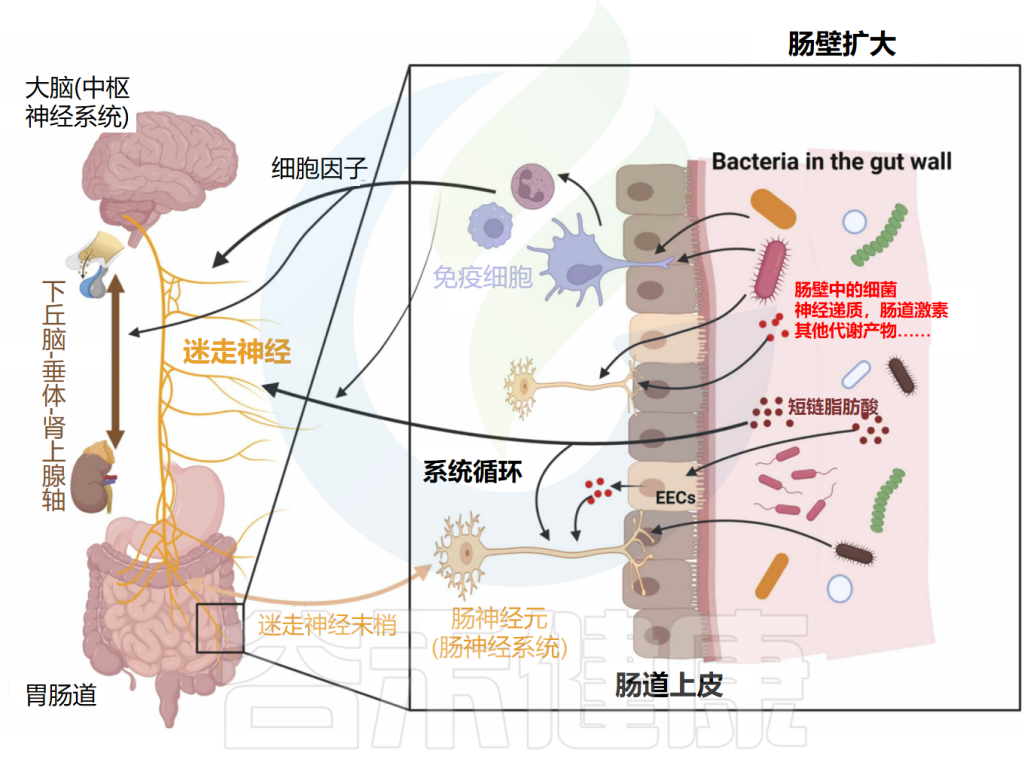
doi.org/10.1016/j.brainresbull.2024.110883
神经、免疫和内分泌介质,如神经递质、细胞因子和肠激素,是微生物群-肠-脑轴双向路径中的通信者。释放的细胞因子在免疫细胞识别细菌后可直接影响大脑。细胞因子和迷走神经也可以影响下丘脑-垂体-肾上腺轴(HPA轴)。细菌还可以通过其脂多糖(LPS)直接与肠神经元通信,触发肠神经元上的TLR4。
间接路径包括由肠道细菌产生的代谢物,如神经递质和短链脂肪酸(SCFAs)。这些代谢物可以进入全身血液循环,从而影响大脑。此外,这些代谢物可以刺激肠道中的肠内分泌细胞(EECs),然后它们在血液中释放肠激素。细菌代谢物和肠激素也可以通过属于迷走神经的肠神经元发送传入信号。
另一方面,大脑通过传出迷走神经纤维和其他肠神经系统(ENS)细胞进行通信。它因此在诸如粘液分泌和肠蠕动等重要方面影响肠生理。
关于微生物群-肠-脑轴在我们前面的文章已经详细阐述,详见:
最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用
抗糖尿病药物二甲双胍是 2 型糖尿病的一线治疗药物,已用于2 型糖尿病患者 60 多年。
口服后,二甲双胍在小肠吸收后的生物利用度约为40-60%。它在人肠道中的浓度比血浆中高 30-300 倍。
二甲双胍发挥什么作用?
二甲双胍通过改善胰岛素的作用、抑制肝脏糖异生、抑制肝脏中的胰高血糖素信号传导、增加骨骼肌中的葡萄糖摄取和降低体重来调节血糖水平,从而发挥其作用。新的研究表明,它通过抑制不同肿瘤类型的发作或进一步生长,具有抗癌作用。此外,二甲双胍已被证明通过与肠道菌群的相互作用降低葡萄糖水平。
二甲双胍对肠道微生物的影响
二甲双胍的肠道改变作用可能是由于对肠道微生物组的直接作用和/或通过其他代谢物的间接作用。高胰岛素血症也会改变肠道微生物群。因此,通过二甲双胍降低胰岛素会引起肠道微生物群的间接变化。
在接受二甲双胍治疗的患者中肠道菌群变化
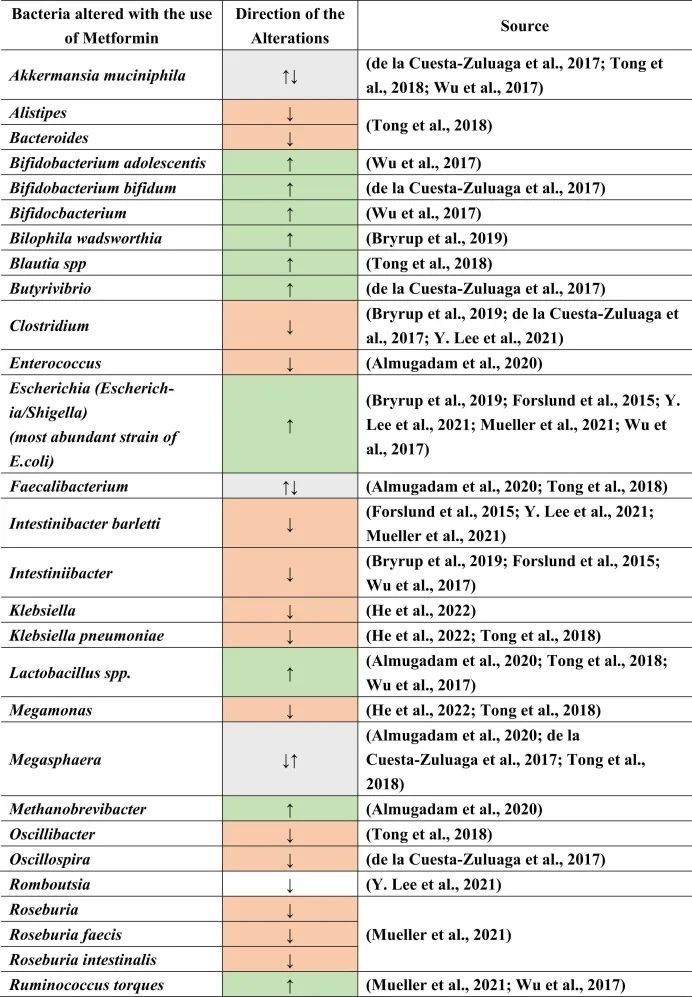
doi.org/10.1016/j.brainresbull.2024.110883
由于二甲双胍诱导的肠道菌群改变,该药物也正在研究用于治疗IBD、自身免疫病等,和/或用于恢复其他肠道改变药物的作用。
研究人员讨论了二甲双胍改善抗精神病药物引起的代谢功能障碍的可能性,代谢功能障碍主要通过各种途径引起体重增加,如胰岛素抵抗和高血糖,并影响神经活性物质(如神经递质和神经肽)。
二甲双胍→肠道菌群→改善抗精神病药物副作用
用抗精神病药物治疗的小鼠比微生物组耗尽的小鼠体重增加更大,这表明肠道菌群在体重管理中的作用。在抗精神病药物治疗的小鼠中,发现许多菌群减少,如乳酸杆菌和阿克曼菌。另一方面,大肠杆菌和双歧杆菌增加。特别是二甲双胍可以减少体重增加,A.muciniphila也显示了这一点。后者已被提议作为缓解全身炎症的益生菌治疗。因此,二甲双胍可以通过肠道微生物组改善抗精神病药物使用的副作用。
人体研究是在较小的队列规模(5-25名受试者)中进行的,还没有足够的数量。然而,对小鼠模型的研究充分证实了二甲双胍和肠道菌群之间的相互作用。
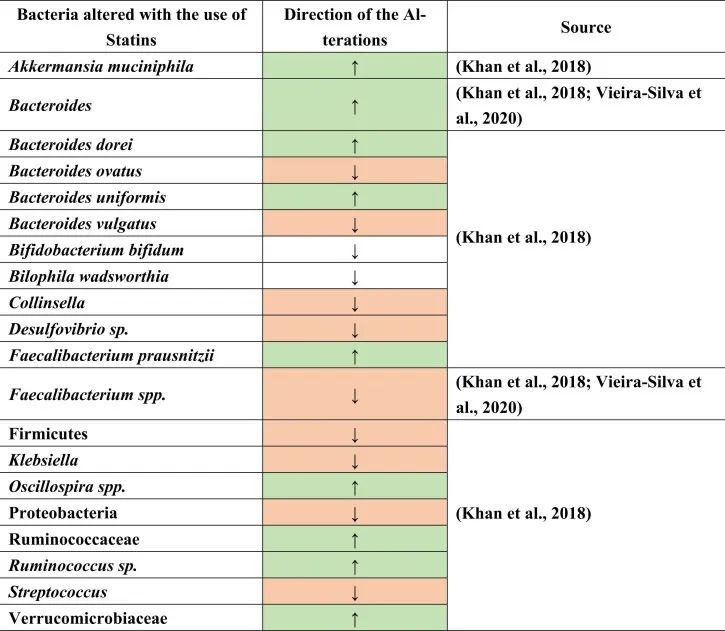
他汀类药物是预防心脏病和动脉粥样硬化最常用的心血管药物之一。超过2亿人单独或联合服用各种类型的他汀类药物。他汀类药物通过抑制HGM-CoA还原酶产生胆固醇的酶来降低低密度脂蛋白(LDL)。
在人类中进行的研究很少,以确定他汀类药物对肠道微生物群的影响,数据不一致。例如,瑞舒伐他汀在动力不足的人体试验中没有显示出显著变化。另一方面,它引起了肠道菌群功能潜力的显著改变,即细菌代谢物的水平。
他汀类药物治疗促炎菌降低
一项荟萃分析研究表明,他汀类药物通过降低Bact2肠型(Bacteroides 2)的发生率,而具有抗炎作用。
注:有研究人员根据在肠道占有优势地位的细菌种类将人的肠道微生物组成划分为4种“肠型”:拟杆菌1型(Bact1)、拟杆菌2型(Bact2)、瘤胃球菌型(Rum)和普氏菌型(Prev),其中拟杆菌2型可以被归类为“不健康肠型”,它与肥胖和系统性炎症水平高有关。
观察到接受他汀类药物治疗的患者Bact2较低,拟杆菌水平降低。这一结果可以进一步解释,在他汀类药物治疗下,粪杆菌属(Faecalibacterium)也可能增加,或者拟杆菌与粪杆菌属的比例较低,导致Bact2发生率降低。
他汀类药物治疗与产丁酸菌的增加有关
具体而言,与未治疗的高胆固醇血症患者相比,阿托伐他汀治疗的高胆固醇血症患者的下列菌群丰度增加:
促炎菌群减少,如:
与未经治疗的高胆固醇血症患者相比,在减少的共生菌中也测量到了Oscillospira(抗炎菌),Firmicutes,Proteobacteria,Desulfovibrio属和条件致病菌,包括克雷伯氏菌,链球菌和柯林斯菌属。
此外,在相同的比较中观察到Bilophila wadsworthia和双歧双歧杆菌(胆汁酸相关物种)的相对减少。他汀类药物治疗后,也观察到不同种类的拟杆菌如B.dorei和B.uniformis的丰度增加,同时B.vulgatus和B.ovatus的生长降低。这些结果表明他汀类药物引起的肠道菌群变化,可能通过肠道菌群进一步影响GBA。
doi.org/10.1016/j.brainresbull.2024.110883
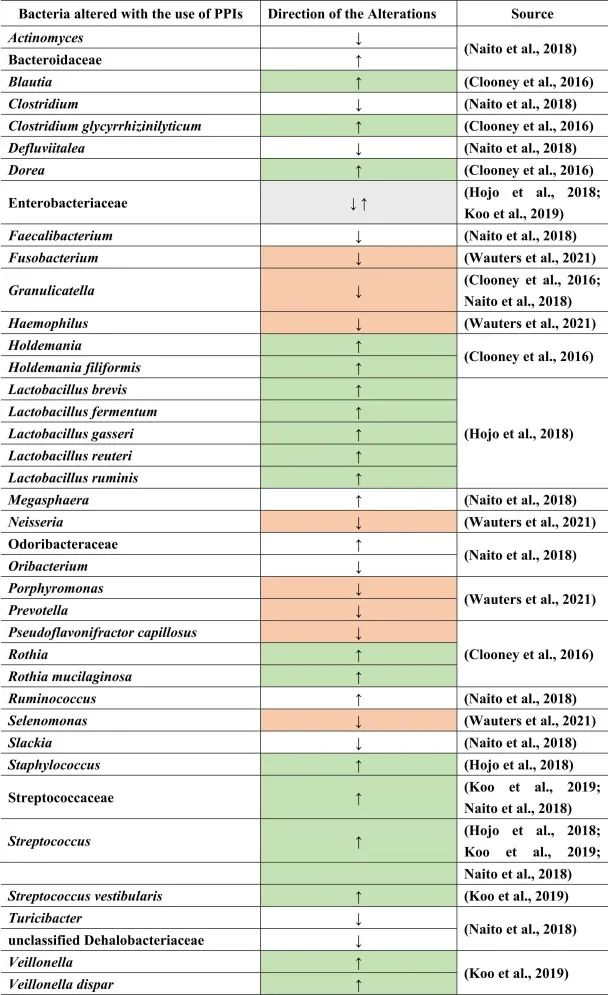
质子泵抑制剂(PPIs)用于预防胃病。很多患者尤其是老年人,会同时服用质子泵抑制剂和其他药物,如止痛药或抗抑郁药,以抵消后者对胃的副作用。
PPI对人体健康的影响
虽然说PPI的作用主要针对胃,但许多研究表明肠道微生物群发生了改变。PPI对微生物组诱导的人体代谢的影响还包括口腔,胃和小肠细菌过度生长(SIBO),肠道艰难梭菌的增加和沙门氏菌感染,肝性脑病,自发性细菌性腹膜炎,社区获得性肺炎,炎症性肠病的不良后果以及功能途径的变化。
PPI对肠道菌群的影响
许多这些疾病和改变是PPI使用后继发的生态失调的后果。一般来说,拟杆菌门丰度较低,厚壁菌门丰度较高。胃肠道中特定的菌群失调:
Naito等人总结了下列菌群丰度的相对增加:
而下列菌群减少:
功能性消化不良患者使用PPI的菌群变化
另一项研究得出结论,功能性消化不良与对照组相比,与粘液相关的细菌,如奈瑟氏菌(Neisseria)、卟啉单胞菌(Porphyromonas)、硒单胞菌(Selenomonas)、梭杆菌、嗜血杆菌(Haemophilus)的丰度较低。
使用PPI后对照组和功能性消化不良的普雷沃氏菌减少。停用PPI后,奈瑟氏菌仍然增加,表明药物使用后微生物变化持续存在。此外,其他细菌群如Holdemania和Blautia,Granulicatella,Rothia和Dorea,以及梭状芽孢杆菌簇XIVa和XIVb在PPI使用者中也有所增加。
在物种水平上:
反流性食管炎使用PPI治疗的菌群变化
由于PPI是给有胃病或反流问题的人服用的,因此一项研究仅检查了PPI治疗前后反流性食管炎患者的粪便微生物群组成。其中,在治疗的不同时间间隔中,乳杆菌(兼性厌氧菌)如加氏乳杆菌,罗伊氏乳杆菌和瘤胃乳杆菌,发酵乳杆菌,短乳杆菌的亚群在治疗后显著增加。
同样,对于链球菌属、肠杆菌科下的兼性厌氧菌计数以及葡萄球菌(也是兼性厌氧菌)也是如此。
有关于口服空肠弯曲菌或罗伊氏乳杆菌等研究显示,迷走神经传入信号发生变化,并在切除迷走神经的小鼠中恢复正常。
使用PPI后,细菌向下消化道区域的转移
在口腔,喉咙和鼻腔中发现了许多上述菌群,这表明由于使用PPI导致胃酸降低,细菌向下消化道区域的转移。通过PPI使用粪便样品显示远端肠道部分与上部胃肠道部分的定植,增加下列菌群:
减少下列菌群:
在一项健康双胞胎的研究中也观察到了同样的情况,结论是生态失调主要是由于咽部和口腔微生物群定殖到下肠道引起的,导致与上述文献相同的细菌改变。
PPI使用与肠道菌群多样性及SIBO相关影响
PPI的使用会导致细菌种群的进一步变化。例如,在PPI治疗后,远端肠道由上肠道的微生物群定殖。总体而言,微生物多样性较低,细菌种类减少,而上消化道中肠道共生菌的丰度较高。
小肠细菌过度生长(SIBO)是后一种情况的一个例子,导致链球菌,埃希氏菌,克雷伯菌,拟杆菌,乳酸杆菌,肠球菌,韦荣氏菌的丰度增加;双歧杆菌和放线菌科的减少。
与细菌转移相关联的是肠道的副交感神经刺激减少,如小肠细菌过度生长。下表总结了菌群的变化。
doi.org/10.1016/j.brainresbull.2024.110883
PPI使用增加链球菌,导致功能性消化不良等疾病患者消化不良症状持续
此外,在功能性消化不良,肝硬化,血液透析,类风湿性关节炎和癌症患者中观察到生态失调,这些患者表现出链球菌属的特异性增加。质子泵抑制剂用于缓解消化不良,尤其是幽门螺杆菌感染。然而,随着它增加链球菌的丰度,消化不良症状可能持续存在。来自胃窦胃炎患者的活检显示链球菌数量过多,证实了链球菌与消化不良的关系。
PPI引起肠道微生物失衡,增加肠道感染机会
总之,PPI用于预防其他药物(如NSAIDs)引起的消化不良,其作用是通过减少酸的产生。然而,它改变了肠道环境,使近端肠道细菌转移到肠道的远端。同时,它会导致一些菌群的丰度增加或减少。因此,这种生态失调导致更多的机会的肠道感染,涉及有害细菌,如艰难梭菌或沙门氏菌。
PPI治疗消化不良,影响肠道菌群,改变细菌丰度和细菌移位。主要影响链球菌丰度和艰难梭菌感染的高发病率。
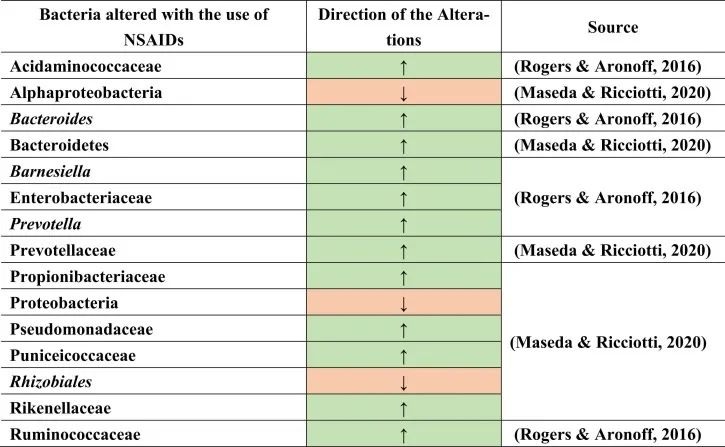
与上述其他药物组一样,非甾体抗炎药(NSAIDs)用于疼痛和抗炎,或低剂量阿司匹林作为心血管健康的血小板聚集抑制剂。NSAIDs也可能导致菌群失调及后果,如小肠细菌过度生长。大量使用NSAID诱导肠道病变。这是由于肠细胞死亡和免疫系统破坏导致肠道屏障受损的结果,从而导致革兰氏阴性细菌的增殖和革兰氏阳性细菌的减少。
PPIs和NSAIDs共同作用于肠道病变与微生物群失衡
PPIs和NSAIDs在由于生态失调引起的肠道肠病中发挥联合作用。NSAIDs可导致胃病,PPIs可减少其发生。NSAIDs和PPIs的联合摄入导致肠病,因为PPIs将微生物群从上胃肠道转移到远端肠道。
例如,用阿司匹林治疗会导致肠道微生物群组成的变化,增加普雷沃氏菌,拟杆菌,Ruminococcaceae,Barnesiella。
塞来昔布和布洛芬增加了酸性氨基球菌科(Acidaminococcaceae)和肠杆菌科的丰度。
与非使用者或萘普生使用者相比,布洛芬会导致丙酸杆菌科(Propionibacteriaceae),假单胞菌科,Puniciecoccaceae,Rikenellaceae的富集。
吲哚美辛诱导拟杆菌,普氏菌科的增加;变形菌门,α变形菌纲,根瘤目(Rhizobiales),假单胞菌科的减少。
同一项研究显示了性别特异性效应,因为女性肠道中的厚壁菌门较低,而男性肠道中的厚壁菌门较高。
一项比较研究表明,各种非甾体抗炎药诱导的生态失调增加了分类群,如肠杆菌科,酸性氨基球菌科,丙酸杆菌科,假单胞菌科,Punicecoccaceae,Rikenellaceae。
总结上述结果,在导致生态失调和NSAID肠病的不同细菌类群和物种中发现了明显的变化。
doi.org/10.1016/j.brainresbull.2024.110883
抗抑郁药(例如选择性5-羟色胺再摄取抑制剂SSRIs)是抑郁症的一线治疗方法。5-羟色胺是选择性5-羟色胺再摄取抑制剂(SSRIs)的靶标,增加了其在大脑中的可用性水平。
肠脑轴与抑郁症之间存在联系,但只有少数人体研究抗抑郁药对肠道菌群的影响。
抗抑郁药对肠道菌群的影响
艾司西酞普兰改变了肠道菌群,Christensenellaceae,Eubacterium ruminantium group,Fusobacterium显著增加,同时乳酸杆菌丰度相应降低,拟杆菌发生了显著变化。
注:艾司西酞普兰是一种用于治疗抑郁症和广泛性焦虑症的药物,通过增加大脑中神经递质5-羟色胺的水平来改善情绪。
Le Bastard等人的文章研究了非典型抗精神病药物治疗对双相情感障碍患者的影响,结果显示Lachnospiraceae的相对丰度增加(p=0.029),Akkermansia和Sutterella的相对丰度降低(p=0.0006)。
在荷兰队列的另一项研究中,B.dorei(p=0.051)和Coprococcus eutactus(p=0.041)与抗抑郁药呈正相关,而Eubacterium hallii与抗抑郁药呈负相关(p=0.055)。
在小鼠模型中存在许多关于SSRIs诱导的肠道改变的研究。常见的选择性5-羟色胺再摄取抑制剂(SSRI)舍曲林,氟西汀和帕罗西汀显示出对革兰氏阳性细菌如葡萄球菌和肠球菌的活性。
产毒肠杆菌随着SSRIs的使用而减少
其他潜在的产毒肠杆菌,如铜绿假单胞菌,肺炎克雷伯菌,柠檬酸杆菌属和摩根氏菌(M. morganii),产气荚膜梭菌和艰难梭菌也在一定程度上随着SSRIs的使用而减少。这些结果是在体外研究的基础上发现的。
服用某些抗抑郁药(如氟西汀)的抑郁成年人更容易发生艰难梭菌感染(CDI)。据报道,在小鼠中,艾司西酞普兰和锂在相似程度上增加了血清素水平。然而,这项研究没有讨论生态失调是根本原因。虽然SSRI对抑郁症的作用机制与这些药物的任何抗菌作用无关,但仍然可以看到微生物群落的潜在变化,并可能影响与情绪相关的其他炎症或生理参数。
抑郁症或重度抑郁症是最常见的神经精神疾病。它是导致残疾、发病率和死亡率的主要原因之一,导致生活质量低下。大约每五个人一生中就被诊断出一次。
抑郁症的基本症状
抑郁症是一种复杂的疾病,具有不同的症状和病理生理学。根据DSM-5,它被诊断出患有持续2周以上的一系列以下症状:持续的抑郁情绪,快感缺失,孤独感,动机降低,食欲和睡眠障碍,精神运动激动,注意力不集中,疲劳,内疚感或无价值感以及自杀念头。
抑郁症的病因
病因或病理生理学通过许多机制来解释,但整体上仍不清楚,可能有以下情况:
1) 血清素,去甲肾上腺素和多巴胺水平低,谷氨酸水平高;
2) HPA轴的改变;
3) 由于免疫介质的不平衡导致错误的免疫细胞通信,特别是微胶质细胞,引起系统性炎症;
4) 最后但同样重要的是与肠道微生物组-脑-肠轴有关的微生物群。
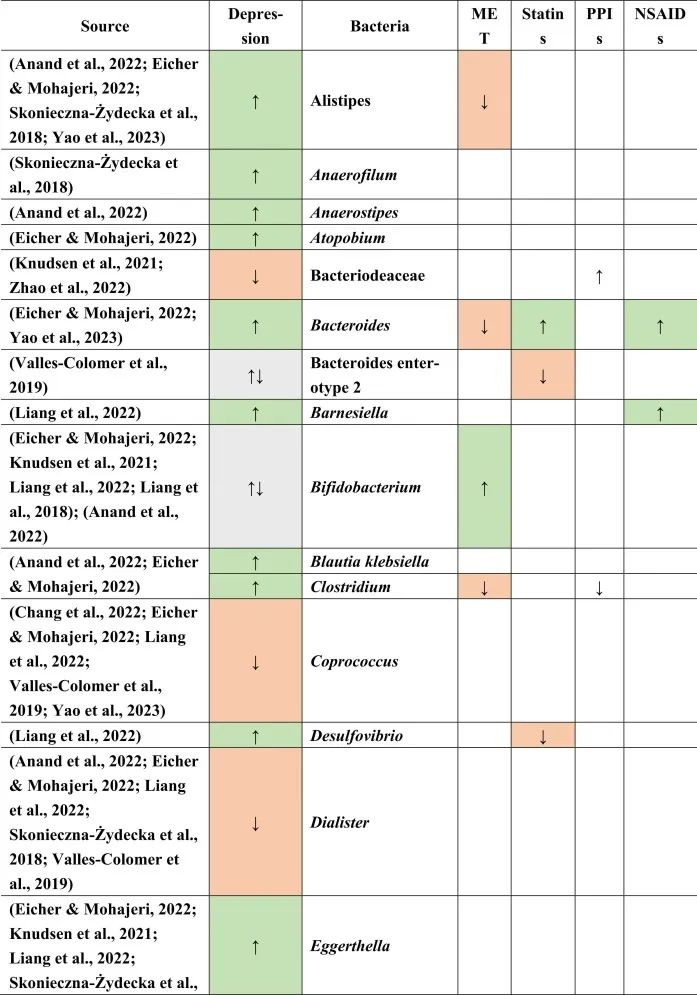
抑郁症的肠道菌群变化
迄今为止,研究发现,在门水平上,拟杆菌,变形杆菌,放线菌,放线菌增加,而抑郁症患者粪便中的厚壁菌减少。
在科的水平上,下列菌群有所增加:
下列菌群有所减少:
在属的层面上,提到了下列菌属减少:
下列菌属增加:
在少数细菌群体中,如Prevotellaceae,Prevotella,Bacteroides enterotype 2,双歧杆菌,Parasutterella,在不同的研究中发现了差异。
抑郁症患者菌群改变与二甲双胍,他汀类药物,
PPIs和NSAIDs使用者菌群改变有关
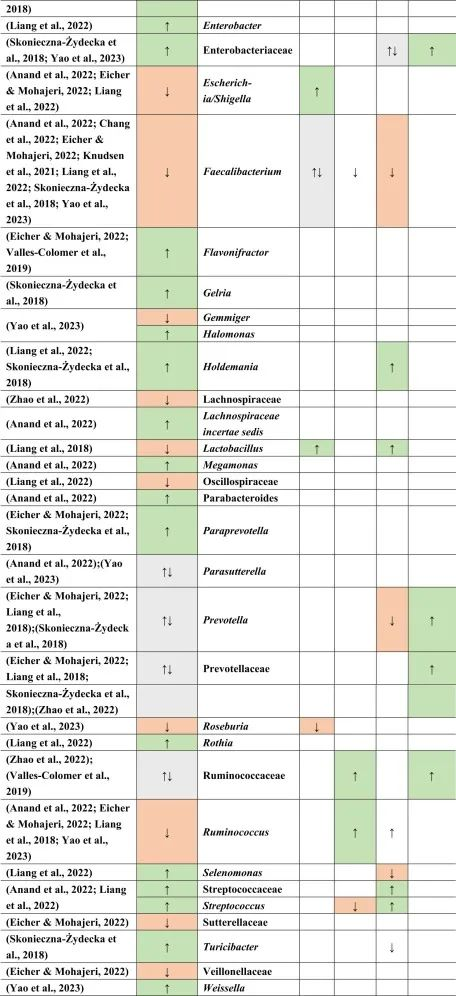
doi.org/10.1016/j.brainresbull.2024.110883
在比较抑郁症患者的肠道菌群与上述药物引起的生态失调时,可以观察到不同细菌分类群水平与一种或多种药物的相似性。
拟杆菌的增加可能对抑郁症有潜在益处
拟杆菌在使用他汀类药物和非甾体抗炎药(NSAIDs)以及抑郁症患者的肠道中都有所增加。拟杆菌是一种产生γ-氨基丁酸(GABA)的革兰氏阴性菌,具有免疫触发LPS和抗炎SCFAs,从而引发免疫反应。
抑郁症与血清素减少相关的系统性和神经炎症都有关联。然而,原本拟杆菌产生的短链脂肪酸和GABA在抑郁症患者体内的含量较低,那么拟杆菌的增加,也增加了GABA和短链脂肪酸,有助于缓解抑郁行为。
他汀类药物和PPIs → 瘤胃球菌↑
瘤胃球菌(Ruminococcus)是一种产短链脂肪酸菌,在他汀类药物和PPI的使用者中增加,再次抵消了短链脂肪酸的低含量。后者也可能是抑郁症患者在口服他汀类药物或PPIs后,粪杆菌属数量低下的原因,粪杆菌是已知的丁酸盐生产者,对肠道屏障稳态和抗炎作用很重要。
他汀类药物 → Bact2↓
特别是他汀类药物可以降低拟杆菌2型(Bact2),这反过来可能导致抑郁症状。
抑郁症可能与他汀类药物和PPI的使用呈负相关,因为抑郁症患者的瘤胃球菌较低,而他汀类药物和PPI使用者的瘤胃球菌较高。
二甲双胍和PPI → 梭菌↓
二甲双胍和PPI中可以降低梭菌丰度,但在抑郁症中没有,因此,二甲双胍和PPI可能有助于减少梭菌。
梭菌的过度生长可能带来的不利结果大于有利结果,例如,艰难梭菌具有毒性和传染性,而梭菌簇XIVa产生短链脂肪酸带来益处。
二甲双胍 → 大肠杆菌↑
血清素可能通过迷走神经影响体液肠-脑通路。大肠杆菌和链球菌与肠杆菌科物种参与血清素合成。在抑郁症患者中,大肠杆菌低丰度,链球菌高丰度,二甲双胍可以缓解低水平的大肠杆菌,因为在使用二甲双胍后大肠杆菌的丰度增加。
他汀类药物抵消PPIs
NSAIDs和PPIs可能分别对肠杆菌科和链球菌产生相同的作用,而他汀类药物可能抵消PPIs的作用,与链球菌数量减少呈正相关。
药物影响与谷氨酸途径的菌群
拟杆菌,乳酸杆菌,双歧杆菌,链球菌也可能参与谷氨酸途径。因此,它们的药物诱导影响可能在单独或通过彼此的相互作用提高谷氨酸能神经传递中发挥作用。
关于谷氨酸详见:兴奋神经递质——谷氨酸与大脑健康
因此,二甲双胍,他汀类药物,PPIs和NSAIDs药物诱导的菌群失调可能各自影响抑郁症的发展和进展,并且它们的作用可能相互抵消或加剧。
扩展阅读:
多发性硬化症是中枢神经系统中最丰富的自身免疫性疾病。全世界有250多万人受到影响,其中大多数是年轻人。它是一种慢性炎症性疾病,其特征是神经纤维脱髓鞘和轴突继发性破坏,表现为白质组织病变。
多发性硬化的症状
症状因受影响的组织区域而异。第一个最常见的症状是视神经炎引起的视觉障碍以及感觉障碍和疲劳。间歇性症状是运动障碍,疼痛,认知,心理和植物障碍,使疾病具有进行性或复发性。
多发性硬化的病因
炎症过程通过自身反应性外周T淋巴细胞侵入中枢神经系统来解释。然而,这种自身免疫反应的出现尚不清楚。脂肪因子和细胞因子水平之间的遗传不平衡,爱泼斯坦-巴尔病毒(EB病毒)感染引起的自身反应性,维生素D缺乏,吸烟以及改变微生物-肠-脑轴的细菌和病毒肠道生态失调,都与多发性硬化的病理生理学有关。
多发性硬化患者与健康对照组微生物群不同
移植了多发性硬化患者粪便物质的GF小鼠复制了自身免疫性脑脊髓炎(一种在动物中发现的脱髓鞘疾病)的表型。这些结果与具有健康对照粪便物质的GF小鼠形成对比。甚至疾病的严重程度和/或活动性似乎也与不同的微生物组成有关。一般来说,抗炎菌群丰度较低。
多发性硬化的微生物群特征
临床活跃的病例(即复发性发作)与临床非活跃的治疗前患者相比,具有更丰富的微生物组。
在比较细菌种类时,临床上不活跃的多发性硬化患者的普拉梭菌(Faecalibacterium prausnitzii)和Gordonibacter urolithinfaciens的丰度显著高于临床活跃的多发性硬化患者。
同一研究发现61种在微生物组成上有差异的物种。多发性硬化中富集的物种如下:
减少的菌群包括:
总体而言,多发性硬化患者的微生物组成丰富度低于健康对照组。这也与多发性硬化相关细菌物种相关的特定炎症生物标志物的丰度更高有关。
其他研究产生了类似的结果,下列菌群增加:
下列菌群减少:
总体而言,拟杆菌门减少,相应的物种也有所减少,例如B.coprocola,B.coprophilus,B.stercoris。
在Faecalibacterium,Slackia,Clostridium,Methanobrevibacter和Butyricimonas中观察到不一致的结果。
在所有引用的有关多发性硬化的文献中,阿克曼菌的增加和普雷沃氏菌的减少一直是菌群持续改变的原因之一。
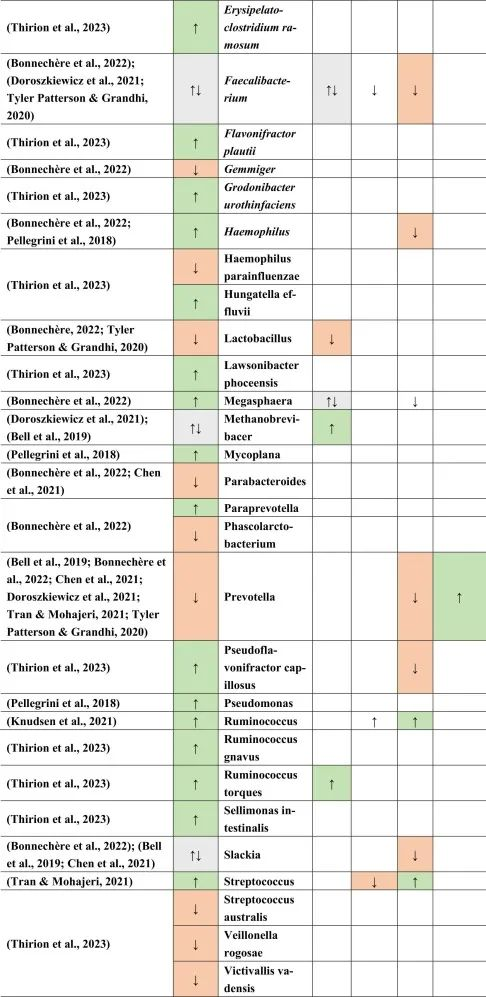
doi.org/10.1016/j.brainresbull.2024.110883
他汀类药物,NSAID → 拟杆菌↑
与多发性硬化患者相比,他汀类药物和非甾体抗炎药使用者的拟杆菌(一种革兰氏阴性细菌属和SCFA和GABA生产者)增加。
多发性硬化、二甲双胍→Bilophila wadsworthia↑
另一种革兰氏阴性物种Bilophila wadsworthia 在多发性硬化和二甲双胍中增加,但在他汀类药物中减少,这表明二甲双胍可能对多发性硬化患者不利,而他汀类药物对多发性硬化患者有利。革兰氏阴性细菌由于其细胞壁中存在LPS而诱导宿主免疫应答。
多发性硬化、PPI→链球菌↑ 他汀类→ 链球菌↓
链球菌属也是如此,在多发性硬化患者和PPI使用者中发现链球菌数量增加,而在他汀类药物使用者中发现链球菌数量减少。链球菌是一种条件致病菌,可产生神经毒素,乙酸盐和5-羟色胺(5-HT)。
多发性硬化、二甲双胍、PPI → Blautia↑
另一方面,Blautia 在多发性硬化,二甲双胍和PPI中增加。Blautia是丁酸盐生产者,这对于肠道屏障和血脑屏障等完整性以及小胶质细胞成熟和活化很重要。
二甲双胍和PPIs → 梭菌↓
然而,在多发性硬化症患者中,二甲双胍和PPIs使用者的梭状芽孢杆菌数量减少。梭菌产生SCFA,这可能影响Treg细胞,影响多发性硬化患者的自身免疫。
产短链脂肪酸菌Ruminococcus在多发性硬化和他汀类药物和PPI使用后增加。
Prevotella是LPS携带者和GABA生产者和丙酸生产者,NSAIDs增加,多发性硬化和PPIs减少。
双歧杆菌和乳酸杆菌,GABA和乙酸盐生产者在多发性硬化和摄入MET后分别增加和减少,表明这两个属可能影响多发性硬化疾病和进展。
从结果来看,多发性硬化与药物引起的生态失调之间可能存在许多关联。然而,需要更明确的研究结果来证明这些假设的关联。
扩展阅读:
帕金森病(PD)主要症状是运动症状,伴有运动障碍,僵硬,静息性震颤和姿势不稳,由多巴胺缺乏引起,多发生在黑质。路易体聚集体由错误折叠的蛋白质聚集体组成,即淀粉样蛋白,主要是α-突触核蛋白淀粉样蛋白,是多巴胺能神经元破坏的主要原因。
帕金森病的非运动前驱症状及其对疾病进展的影响
帕金森患者在很大程度上受到非运动症状的影响,其中许多症状在运动功能缺失发生前数十年就已出现。胃肠功能障碍,抑郁情绪,睡眠障碍,肌肉和关节疼痛是这些前驱症状中的一些。前者最常见的是便秘或胃排空延迟,流涎,吞咽困难,胃轻瘫和SIBO。患有这些前驱胃肠道疾病的患者帕金森进展更为严重。在ENS神经元中也观察到淀粉样蛋白的形成,特别是在小鼠和帕金森患者的早期。最近的研究表明,大脑中路易体的形成是由小鼠胃肠道中的淀粉样蛋白纤维诱导的,并且通过迷走神经干切断术大大降低了路易体形成的风险。
淀粉样蛋白的交叉形成与肠道微生物的潜在关联
淀粉样蛋白的形成不一定仅限于一种蛋白质。产生淀粉样蛋白的蛋白质可以相互交叉形成淀粉样蛋白。分子过程仍然未知,但可能发生在人类之间以及人类和非人类淀粉样蛋白之间。肠道微生物群中的多个物种能产生包含淀粉样蛋白的生物膜。有人提出,肠道淀粉样蛋白理论上可以通过迷走神经路径传输到大脑,并与α-突触核蛋白交叉促使形成淀粉样蛋白。
大肠杆菌、假单胞菌、链球菌、葡萄球菌、沙门氏菌、分枝杆菌、克雷伯菌、柠檬酸杆菌和芽孢杆菌是肠道中产生这种胞外淀粉样蛋白的候选细菌。Nuzum等人还指出产短链脂肪酸菌的总体丰度较低。因此,肠道微生物群可能既能启动也能调节帕金森病的发起。
帕金森患者的肠道菌群特征
当比较帕金森患者与健康对照组的微生物组成时,在帕金森患者中主要是下列菌群增多:
下列菌群减少:
乳杆菌科不一致,显示出较高和较低的丰度。
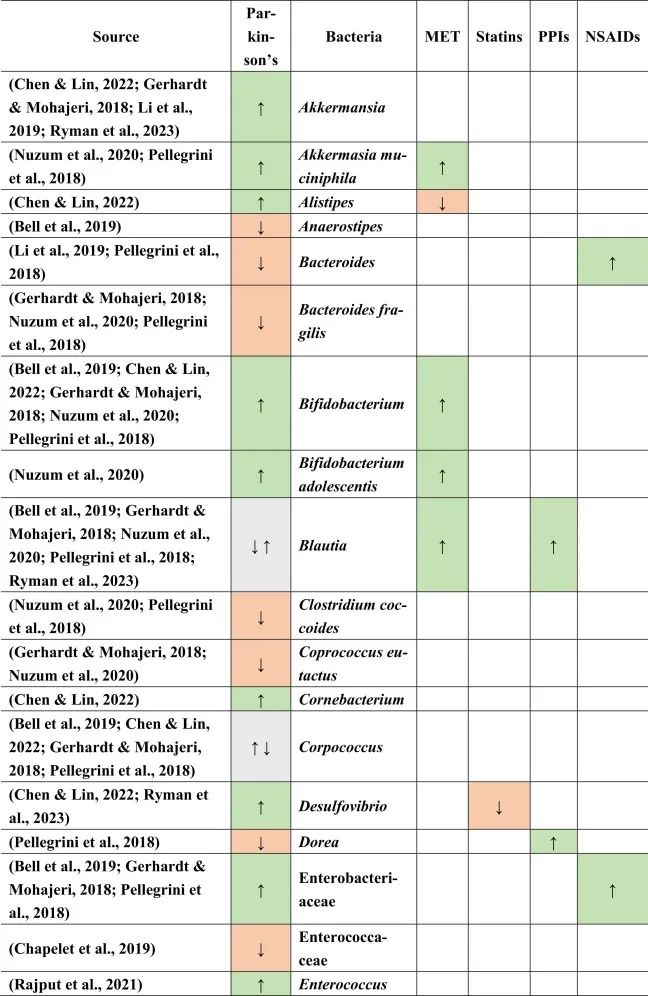
doi.org/10.1016/j.brainresbull.2024.110883
在比较帕金森的生态失调和药物引起的生态失调时,假设如下:PPI诱导小肠细菌过度生长,并增加沙门氏菌感染的风险。两者都可能影响帕金森,因为小肠细菌过度生长也在帕金森病患者中发现,沙门氏菌是细胞外淀粉样蛋白的产生者。然而,在PPI和帕金森中没有观察到沙门氏菌作为一个共同因素。
与多发性硬化类似,瘤胃球菌科在帕金森,他汀类药物和NSAIDs中增加。然而,已知短链脂肪酸可以增强BBB的完整性,因此可以降低炎症因子通过大脑从而形成细胞外淀粉样蛋白的风险。
帕金森,他汀类药物,PPI → 粪杆菌↓
另一方面,粪杆菌(Faecalibacterium)是一种已知的丁酸盐生产者,对肠道和BBB完整性以及抗炎菌群具有重要意义,在帕金森,他汀类药物和PPI中减少,这表明粪便杆菌可能是帕金森病患者屏障减弱和炎症过程加剧的原因之一。
二甲双胍和PPIs可能有助于逆转粪杆菌的不利影响
因为二甲双胍和PPIs增加了Blautia的存在,而帕金森患者则减少了Blautia。同样,由于他汀类药物和非甾体抗炎药,瘤胃球菌科的丰度增加,也可以补偿粪杆菌和其他不利菌的影响。这也表明,没有一种药物会产生所有负面或正面影响,例如,PPI会增加Blautia(一种有利的短链脂肪酸生产菌)并同时增加小肠细菌过度生长,这是人体的负面过程。
菌群之间的相互作用力量不可忽视
总体而言,与本文提到的其他药物相比,二甲双胍对微生物组产生的影响与帕金森病中所见的影响最相似。在帕金森患者和二甲双胍使用者中均观察到Akk菌(短链脂肪酸生产者和LPS携带者),青春双歧杆菌(GABA生产者)和大肠埃希氏菌(LPS携带者,5-HT-metabolsier)的丰度增加,其中第一种和后一种细菌是革兰氏阴性,其细胞壁中存在LPS,但也分别产生短链脂肪酸和5-HT。
同样,它们都传达了有利和不利的影响,这表明没有一种细菌是某种疾病发病机制的主要决定因素。菌群之间的相互作用和相对丰度似乎对疾病发作和进展的总体影响很重要。
阿尔茨海默病(AD)是老年痴呆症最常见的形式,约占全球痴呆症病例的50-70%。由于其患病率随着年龄的增长而增加,并且世界人口正在老龄化,阿尔茨海默的发病率在未来几年将更高。在大多数情况下,它始于新形成的记忆的丧失,神经认知和执行功能(如语言和视觉空间取向)进一步下降。
阿尔茨海默病的病理生理学
病理生理学是多方面的,导致不可逆的神经元细胞和突触丢失。除年龄外,阿尔茨海默的其他标志是不溶性淀粉样β斑块的积累,其次是Tau蛋白的神经原纤维缠结,神经递质的失衡和神经炎症。随着年龄的增长,肠道微生物组会发生实质性变化,因此,有人认为与年龄相关的肠道菌群失调也可能导致阿尔茨海默的发病。
扩展阅读:
老年人肠道菌群失衡与阿尔茨海默病发病
在老年人中,随着促炎细菌与抗炎细菌比例的增加以及产短链脂肪酸菌的减少,导致肠漏,BBB紊乱和小胶质细胞活化。后者在清除Aβ斑块方面很重要,当其清除能力因Abeta的过度产生或由于炎症性结构变化导致的能力丧失而受阻时,淀粉样斑块可能会在阿尔茨海默病患者的大脑中积累。
淀粉样蛋白的细菌来源与神经炎症加剧
据推测,淀粉样蛋白也被推测可能来自细菌源,类似于帕金森,要么在大脑中与其他淀粉样结构交叉播种,要么由于肠漏引起的系统性炎症而加剧神经炎症。此外,据报道,通过显著阳性的SIBO呼吸试验(p=0.025)报告细菌移位。阿尔茨海默患者的细菌移位和LPS水平升高都会加剧神经炎症。
主要发现表明促炎细菌埃希氏菌/志贺氏菌水平升高,抗炎直肠真杆菌水平降低。它们失衡可能是认知障碍和淀粉样蛋白合成的主要原因之一,因为在促炎细胞因子和抗炎细胞因子之间发现了各自的相关性,而且大肠杆菌也属于产生淀粉样蛋白的细菌。
阿尔茨海默患者的肠道菌群特征
据报道,阿尔茨海默患者中下列菌群增加:
下列菌群减少:
在厚壁菌门,乳酸杆菌,Lachnospiraceaea和拟杆菌科中发现了不一致的结果。
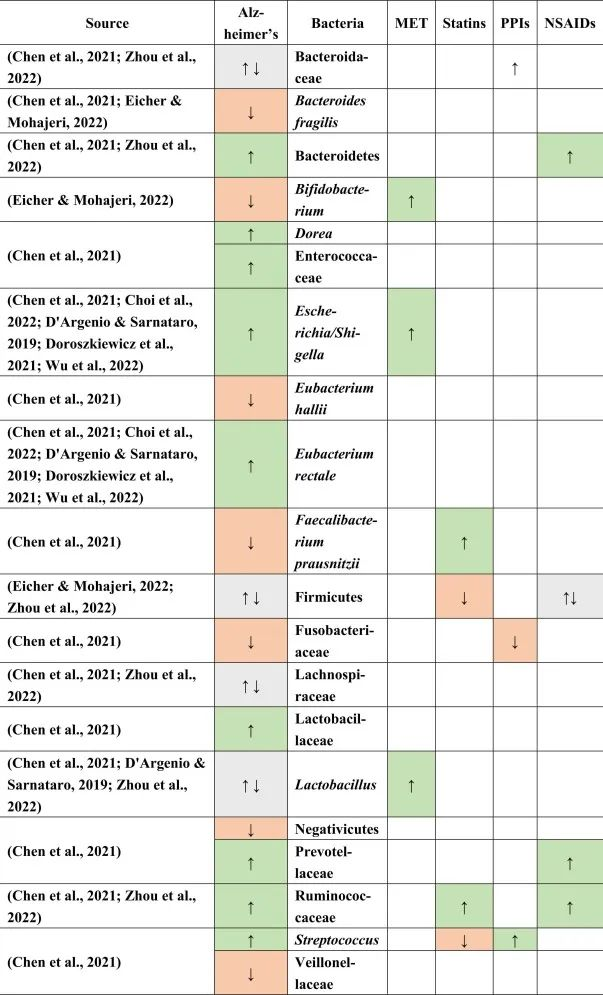
doi.org/10.1016/j.brainresbull.2024.110883
他汀类药物 → 普拉梭菌↑ → 抗炎
在上述药物和阿尔茨海默病患者中,他汀类药物的使用与改变的微生物群的关联最强。特别是,产丁酸菌普拉梭菌在他汀类药物使用者中增加,这可能有助于维持血脑屏障,因为丁酸盐在抗炎过程和小胶质细胞活化和成熟中起主要作用。
他汀类药物联合PPI → 抵消链球菌富集
他汀类药物与PPI一起使用,可能有助于抵消由于PPI使用而导致的链球菌富集,因为链球菌被认为会产生细胞外淀粉样蛋白。
瘤胃菌科是一种短链脂肪酸生产者,在他汀类药物以及NSAID使用者和阿尔茨海默患者中升高,可能具有与帕金森病相同的补偿作用,因为在阿尔茨海默患者中观察到短链脂肪酸丰度较低。
与帕金森一样,在阿尔茨海默患者中观察到阳性小肠细菌过度生长结果,PPI可能是其主要贡献者,无论是否口服NSAIDs。
扩展阅读:
有力的证据表明药物使用与肠脑轴之间、肠脑轴与神经系统疾病之间分别存在联系。由于药物和神经系统疾病,菌群失调环境中存在共同的细菌菌株。少数药物可以在特定疾病情况下缓解菌群失调,但也可能引起菌群失调。菌群彼此之间及其相互作用将影响肠脑轴,药物在共病患者中通经常联合使用。因此,它们的效果可能相互抵消或加剧细菌种群的相应变化,并与神经系统疾病中的菌群失调呈正面或负面关联。
由于肠道微生物群会因食物、环境、生活方式等各种因素而发生变化,因此在这类研究中也应考虑伴有共病的老年人。当老年人同时服用多种药物且因食欲不振而饮食不佳时,可能会预期其肠道微生物群发生不同的变化。然而,药物引起菌群失调及其通过肠脑轴对神经系统疾病影响的相关性仍是一个新领域。
本文中有些数据也是有限的,没有考虑原发病情况、其他药物的合并使用、药物剂量、药物暴露和服药时间、年龄、性别、患者饮食、共病等混杂因素,缺乏大队列数据支持,目前还没有足够的数据来得出建议性的结论。因此,还需要更多的工作来克服现有的局限性并提供更加坚实的证据基础,包括设计大型的、多中心的、随机对照试验,以收集高质量的数据来验证这些初步发现。
主要参考文献
Garg K, Mohajeri MH. Potential effects of the most prescribed drugs on the microbiota-gut-brain-axis: A review. Brain Res Bull. 2024 Jan 18;207:110883.
Garg K, Mohajeri MH. Potential effects of the most prescribed drugs on the microbiota-gut-brain-axis: A review. Brain Res Bull. 2024 Jan 18;207:110883.
Deng X, Zhang C, Wang P, et al., Cardiovascular Benefits of Empagliflozin Are Associated With Gut Microbiota and Plasma Metabolites in Type 2 Diabetes. J Clin Endocrinol Metab. 2022 Jun 16;107(7):1888-1896.
Epishina IV, Budanova EV. Rol’ mikrobioty cheloveka v razvitii neirodegenerativnykh zabolevanii [A role of human microbiota in the development of neurodegenerative diseases]. Zh Nevrol Psikhiatr Im S S Korsakova. 2022;122(10):57-65.
He D, Han H, Fu X, Liu A, Zhan Y, Qiu H, Ma L, Zhang X, Wang X. Metformin Reduces Blood Glucose in Treatment-Naive Type 2 Diabetes by Altering the Gut Microbiome. Can J Diabetes. 2022 Mar;46(2):150-156.
Knudsen JK, Bundgaard-Nielsen C, Hjerrild S, Nielsen RE, Leutscher P, Sørensen S. Gut microbiota variations in patients diagnosed with major depressive disorder-A systematic review. Brain Behav. 2021 Jul;11(7):e02177.

谷禾健康

“肚子里有蝴蝶”这句话的词源最早出现在弗洛伦斯·匡威(Florence Converse) 于 1908 年撰写的《祈祷之家》一书中。一百多年来,这句话一直被广泛用作成语,它描述了一个人面对压力或惊心动魄的事件时的不安感。
扑腾的蝴蝶不仅隐喻我们体内扑动的感觉,它也是一个术语,描述了一个巨大事件的一系列连锁反应中的最初动作。
特别令人迷惑和应该注意的是,人们将这种感觉描述为起源于肠道而不是其他地方的东西。二十多年来,科学家们一直在追寻这些“蝴蝶”及其起源,他们意识到这种成语可能与受胃肠道(GI)共生微生物影响的“感觉”有关。这些年科学家们在了解共生肠道微生物在人类生理学和病理生理学中的重要性方面取得了惊人的发现。

肠道中的共生微生物通过“肠-脑轴”对宿主行为产生各种影响。 “肠脑轴”是胃肠道系统和中枢神经系统之间的远端连接;它由跨越两个身体系统的复杂信号转导途径组成(这方面详细的文章可以翻看以往谷禾发的相关文章)。肠道细菌及其代谢物发挥“蝴蝶效应”,将信号传播到大脑,最终改变宿主的行为。
下丘脑-垂体-肾上腺 (HPA) 轴是压力调节的经典途径,是将共生肠道微生物、胃肠道、大脑和行为相互连接的最有前途的途径之一;这也反映了肠道内的颤动感。此外,压力信号可以通过迷走神经和传入/传出神经元连接传输到大脑。
面临威胁时通常会感到压力、紧张、担心和焦虑。最近的研究结果表明,应激反应和肠道微生物会相互影响宿主的许多行为结果。为了了解共生肠道微生物在应激调节和反应中的作用,许多研究使用限微生物动物、16S rRNA 测序、宏基因组测序、粪便微生物群移植、抗生素治疗和益生菌来揭示宿主-微生物之间相互交织的相互作用。
本文重点关注啮齿类动物作为模式生物,探索肠道微生物群、压力和行为之间的因果关系。还纳入了一些临床观察结果来深入说明问题。
✓
心理压力是一个全球性问题,影响着全世界至少三分之一的人口,并增加了患多种精神疾病的风险。这几年越来越多的证据表明,肠道及其栖息的微生物可以调节压力和与压力相关的行为异常。
当面临厌恶压力刺激时,压力感知、整合和应对是大脑的重要功能。压力相关信息被整合到感觉皮层,然后将信号发送到边缘系统、下丘脑和脑干,以激活 HPA 轴以及交感神经和副交感神经。
交感神经和副交感神经传播应激反应以引起体内各个系统的快速适应。检测来自外部环境的压力信号的大脑区域与参与情绪的大脑区域重叠,从而协调一致地协调动物或人类的压力反应。
下丘脑室旁核的核心作用:整合压力信号和调节应激反应
在参与调节应激反应的大脑区域中,下丘脑室旁核 (PVN) 在整合来自环境刺激的信号并进一步触发下游神经传递方面发挥着核心作用。 PVN 接受来自边缘系统和脑干的神经支配,调节 HPA 轴并整合应激后的反应。 PVN 中分布着各种类型的神经元。主要是,PVN 和其他相关大脑区域中的促肾上腺皮质激素释放激素 (CRH) 神经元对不同形式的压力做出反应。
注:促肾上腺皮质激素释放激素 (CRH) 是一种由下丘脑室旁核 (PVN) 产生的神经肽。它是下丘脑-垂体-肾上腺轴 (HPA轴) 中的关键调节因子之一。CRH的主要功能是刺激垂体前叶分泌促肾上腺皮质激素 (ACTH)。ACTH进而刺激肾上腺皮质分泌皮质醇和其他类固醇激素。CRH的释放通常受到多种刺激因素的调控,如应激、体内环境的变化和生物节律。CRH的异常释放与许多疾病和症状有关,如抑郁症、焦虑症和肾上腺皮质功能不全等。
在下图中,总结了PVN中的CRH神经元与终纹床核(BNST)和杏仁核细胞在应激反应中相互作用的发现。这些大脑区域对于确定循环皮质酮水平和动物行为输出至关重要。
下丘脑室旁核(PVN)与其他大脑区域对压力暴露的反应
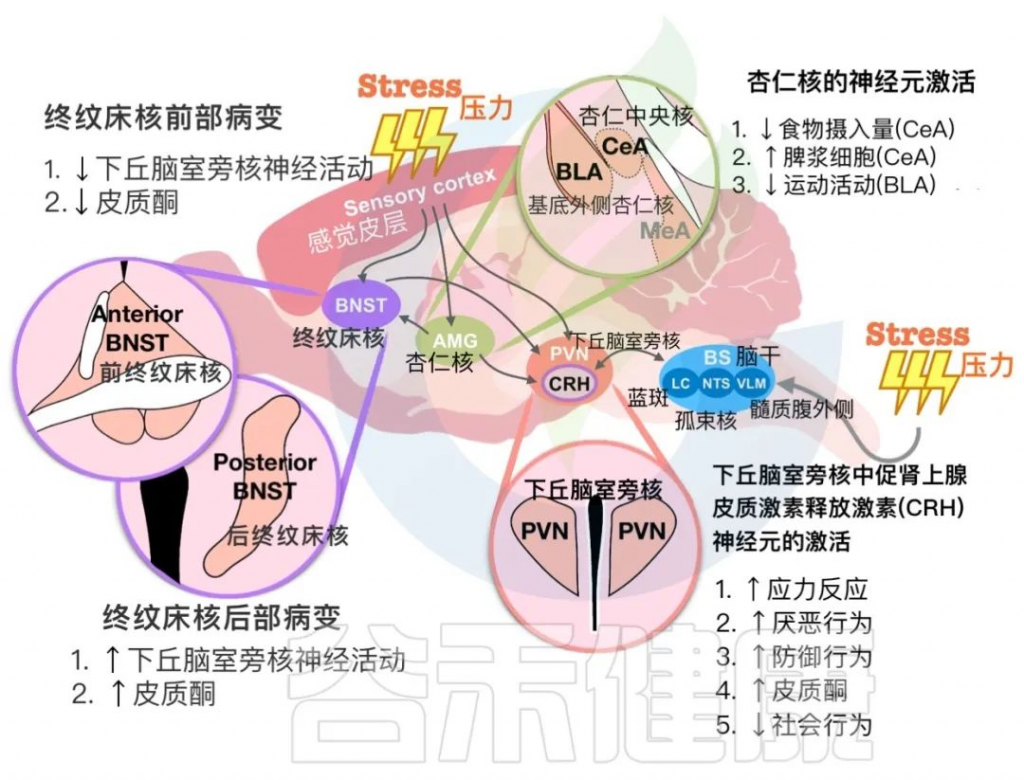
doi: 10.1186/s12929-023-00984-6
注:循环皮质酮是指在血液中循环的一种皮质酮激素,也被称为血浆皮质酮。皮质酮是由肾上腺皮质分泌的一种类固醇激素,它在机体的应激反应中起着重要的作用。循环皮质酮的水平在应激反应中通常会升高,它可以促进葡萄糖的产生、调节蛋白质和脂肪代谢,并参与免疫和炎症反应。
作为应激反应的中枢,PVN CRH 神经元可以被应激刺激触发,随后引发多种内在行为反应。
研究表明,在迫在眉睫的严峻任务中可以检测到 PVN 中 CRH 神经元活动的增加,这是一种模仿来自天空的捕食者威胁的方法,其中大多数小鼠表现出逃避行为,对迫在眉睫的阴影几乎没有冻结反应。
注:冻结反应是指在面对威胁或危险时,个体表现出明显的静止和冻结的反应。这种反应是动物和人类在面对潜在的威胁时的一种自我保护机制。当个体感知到威胁时,自主神经系统会释放肾上腺素等应激激素,导致身体进入一种高度警觉和紧张的状态。在这种状态下,个体可能会减少运动、停止呼吸、固定目光等,以最大程度地减少被威胁的可能性。这种反应在野生动物中常见,并且在人类中也可以观察到,尤其是在面对极端的恐惧、惊吓或创伤性事件时。增加冻结反应有助于个体在危险环境中保持相对安全,但在某些情况下也可能导致无助和无法应对的感觉。
PVN中的CRH神经元:与逃避行为和冻结反应的调节有关
沉默 PVN CRH 神经元会减少逃避行为,但会增加冻结反应。此外,PVN CRH 神经元预测迫在眉睫的威胁并编码压力可控性。同样,另一项研究表明,PVN 中的 CRH 神经元会对厌恶刺激做出反应,例如强迫游泳、尾巴约束、头顶物体、迫近,甚至腹腔注射。
PVN中的CRH神经元:与易感内脏疼痛的关联性
在一项研究中,与弹性小鼠相比,在小鼠经历母体分离后,易感内脏疼痛的小鼠在下丘脑室旁核(PVN)中显示出c-Fos阳性的促肾上腺皮质激素释放激素(CRH)神经元数量增加。
c-Fos是一种早期基因转录因子,它在神经元受到刺激后会被激活,并表达出来。因此,c-Fos的阳性表达可以作为神经元活动的标志。
在这种情况下,研究发现,在经历母体分离后易感内脏疼痛的小鼠中,PVN中的CRH神经元数量增加。这表明这些神经元在应激反应中被激活,并可能参与调节内脏疼痛的感受和处理。
PVN中的CRH神经元:在光遗传学刺激下对小鼠行为和压力信号传递的调控作用
研究发现,通过光遗传学刺激PVN 中的 CRH 神经元,可以增加小鼠的自我梳理行为,并改变其他家庭笼行为,类似于经历了足部电击的小鼠。通过增加环境的威胁水平,可以减弱刺激下丘脑下垂体后叶神经元的光遗传刺激对自我梳理行为的影响。研究还发现,从受压小鼠到未受压小鼠的压力信号传递需要激活两者的下丘脑下垂体后叶神经元。在社交互动测试中,刺激下丘脑下垂体后叶神经元会抑制社交行为并增加挖掘行为,同时导致皮质酮水平升高。
与此相反,并非所有的应激反应都与下丘脑下垂体后叶神经元有关。通过光遗传学激活下丘脑向腹外侧延髓的兴奋性投射,而不是下丘脑下垂体后叶神经元,可以在未经应激暴露的情况下在小鼠中重现应激诱导的高血糖现象。尽管如此,这些研究表明,当面临迫在眉睫的威胁时,下丘脑下垂体后叶神经元对于控制应激反应和行为至关重要。
BNST中CRH神经元:在应激反应调节中的作用
BNST(终纹床核)是连接与情绪有关的各个脑区的中继站。杏仁核-BNST和BNST-PVN回路参与应激反应调节。先前的研究表明,BNST由几个亚区组成,并向下丘脑下垂体发送不同的投射。在BNST回路中光遗传学激活基底侧杏仁核可以预防接受社交挫败应激的小鼠的焦虑行为。BNST的前部病变抑制了应激刺激后下丘脑和下丘脑-垂体-肾上腺轴的激活。
注:终纹床核是是应激反应神经回路中的关键节点,与身体的压力反应、焦虑和成瘾有关。BNST 损伤会改变与压力相关的皮质醇释放。
BNST后部损伤会增加急性束缚应激后下丘脑下垂体中的皮质酮水平和c-Fos阳性细胞数。应激暴露也会影响BNST的神经活动。捕食者应激、十字迷宫和束缚应激可增强BNST中CRH神经元的神经活动。然而,抑制BNST中的CRH神经元无法恢复应激引起的社交障碍,表明BNST可能受应激影响但不直接调节应激反应。
杏仁核:在压力和情绪调节中的作用
杏仁核是一个关键结构,与情绪处理和对压力的生理反应相关。杏仁核的各个子区域参与不同的机制来调节不同类型的压力源暴露。急性心理压力会增加内侧杏仁核 (MeA) 中 c-Fos 阳性细胞的数量,并增强中央核中的抑制性神经元活动杏仁核 (CeA)。
然而,杏仁核和 PVN 之间有限的直接连接可以调节应激反应。应激引起的免疫失调与 CeA 中不同的神经元群有关。确定了 CeA/PVN 和脾神经之间在应激相关免疫调节中的回路。人工激活 CeA 和 PVN 中的 CRH 神经元可增加脾浆细胞的形成。
将小鼠置于高架平台上不仅增加了CRH神经元活性,还促进了脾浆细胞形成,表明CeA和PVN参与了应激诱导的免疫反应。当小鼠暴露于捕食者气味时,抑制 mSTN 中的 CRH 神经元会增加冻结和隐现行为的潜伏期,并缩短适应捕食者威胁的快速眼动-睡眠反应的持续时间。
其他大脑区域的CRH神经元:在应激反应中发挥作用
捕食者刺激促进小鼠从快速眼动睡眠中快速唤醒。 最近的一项研究。研究表明,在快速动眼睡眠期间,内侧底丘脑核 (mSTN) 中的 CRH 神经元因外部刺激而被捕食者气味暴露所激活焦虑和抑郁样行为 和 BLA 中的神经活动,从而增加食物摄入量。
其他研究还表明,外周注射脂多糖 (LPS) 会增加 CeA 中的神经活动,从而减少食物摄入。CeA 病变在全身注射白细胞介素 (IL)-1 后阻止了 CRH 和促肾上腺皮质激素 (ACTH) 的释放。
总体而言,压力暴露会触发 PVN CRH 神经元与其他大脑区域对各种刺激做出反应。 PVN CRH 神经元似乎是连接其他大脑区域以启动压力反应和应对机制的中枢。了解应激反应的中心通路对于发现肠道微生物调节的信号通路非常重要。
✓
压力应对机制和适应对于生存至关重要。动物以多种方式应对压力,包括生理和行为的变化。有趣的是,科学家通过啮齿动物模型发现压力暴露会影响肠道微生物群(下表)。
急性和慢性应激条件下共生微生物组和行为的适应



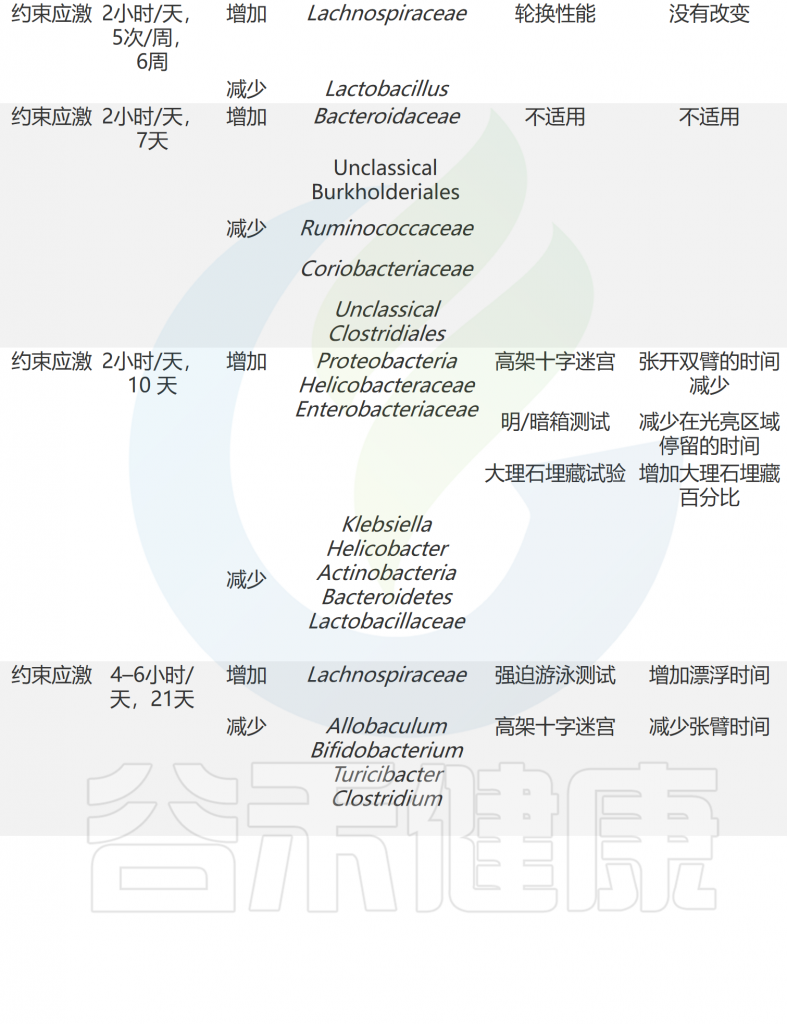
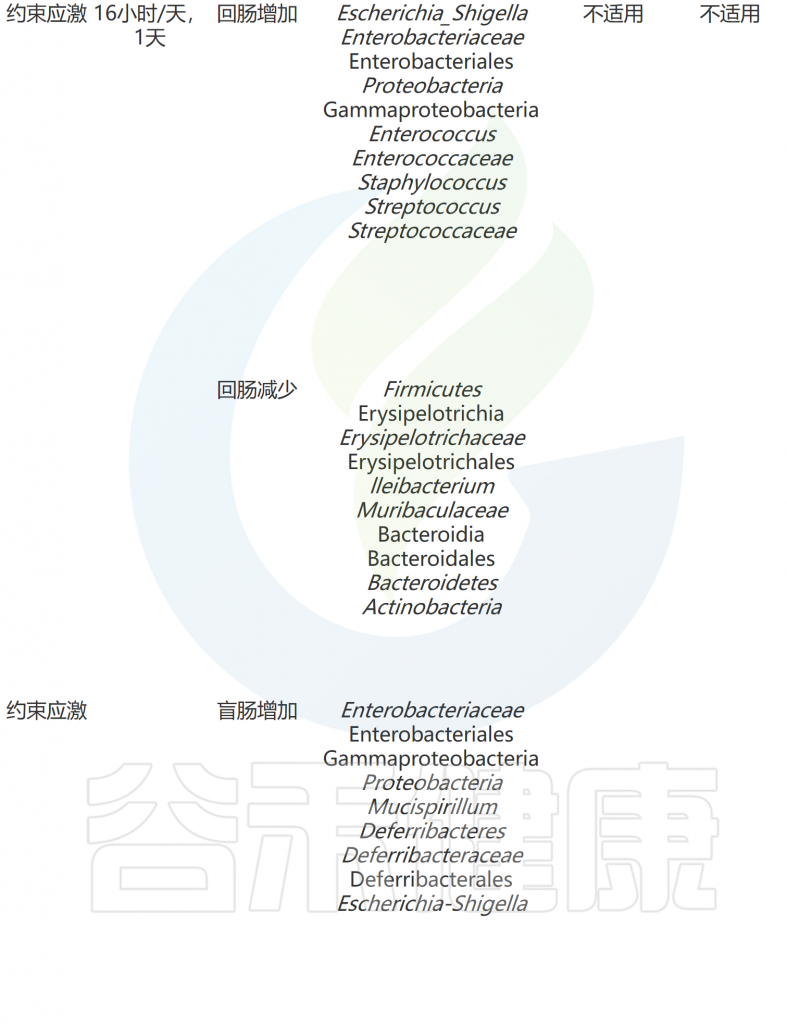


doi: 10.1186/s12929-023-00984-6
不可预测的慢性轻度应激
不可预测的慢性轻度应激 (UCMS) 是一种实验条件,会引起类似于慢性且未解决的应激暴露的生理和神经变化。该实验条件下的小鼠通常表现出抑郁样行为,与抑郁症患者相似,但焦虑样行为没有明显变化。
有趣的是,改变后的厚壁菌门和软壁菌门(Phylum Tenericutes)在 UCMS 动物中得到一致观察。
注:软壁菌门是细菌界下的一个门,典型物种如支原体。
值得注意的是,UCMS中乳杆菌科细菌减少了 。 而且肠道核心菌属-粪球菌属(Coprococcus)在 UCMS 小鼠和人类抑郁症队列中减少。
慢性社会挫败压力
慢性社会挫败压力(CSDS)是一种社会心理压力,具有非凡的面部、结构和预测有效性。CSDS后的行为结局很复杂,包括抑郁样行为、焦虑样行为增加,以及社交行为减少。同样,CSDS转移的微生物组分析比UCMS转移的微生物组分析更复杂。
慢性社交失败压力是一种实验动物模型,用于研究社交压力对动物行为和生理的影响。这个模型通常用于研究抑郁症和焦虑症等精神疾病的机制和治疗方法。
在CSDS模型中,实验动物(通常是小鼠)被暴露于反复的社交失败和攻击中,例如与更强壮的同种异性动物进行斗争。这种持续的社交失败经历会导致动物出现一系列的行为和生理改变,包括社交退缩、抑郁样行为、焦虑、食欲和睡眠紊乱等。
研究人员一般使用CSDS模型来研究社交压力对大脑神经回路、神经递质系统和免疫系统的影响,以及潜在的治疗策略,例如抗抑郁药物和行为疗法。这个模型有助于理解社交压力对心理健康的影响,并为精神疾病的研究提供了一个可靠的实验基础。
研究发现CSDS后的行为结果是复杂的,包括抑郁样行为、焦虑样行为的增加以及社交行为的减少。同样,CSDS引起的微生物组轮廓变化比UCMS引起的更为复杂。CSDS后,拟杆菌门和Helicobacteracea 的数量增加。相反,厚壁菌门中的一些细菌,如瘤胃菌科(Ruminococcaceae),在CSDS后发生了改变,唯独乳杆菌没有变化。
社交过度交叉
社交过度交叉(SOC)是一种模拟增加住房密度的方法。SOC对行为的影响很小。小鼠只在高架十字迷宫中显示出速度增加和进入光/暗盒中的黑暗室次数增加。然而,SOC后微生物组的变化更为显著。SOC增加了Akkermansia muciniphila和Anaerostipes的相对丰度,并减少了Erysipelotrichaceae家族、Lactobacillus和Bacteroides acidifaciens(产酸拟杆菌)物种的相对丰度。
约束压力
约束压力是限制啮齿动物运动的经典方法。啮齿类动物在受到约束压力后会出现类似焦虑和抑郁的行为。虽然肠道中的许多细菌类群发生了改变,但厚壁菌门似乎是最容易被慢性束缚应激改变的细菌,尤其是乳杆菌科、毛螺菌科(Lachnospiraceae)。
WAS小鼠是一种实验动物模型,用于研究自闭症和相关神经发育障碍。WAS代表”Wiskott-Aldrich syndrome”,是一种罕见的遗传性免疫缺陷病,患者通常表现出免疫功能异常、血小板减少和湿疹等症状。
WAS小鼠是通过基因突变技术,使小鼠的WAS基因发生突变,从而模拟人类WAS综合征。这些小鼠在行为和神经发育方面表现出与自闭症相关的特征,例如社交互动减少、沟通障碍、刻板行为和认知功能障碍等。
WAS是一种强烈的心理压力因素,会破坏肠道上皮紧密连接的完整性。与其他压力模型相比,单独的WAS对行为产生的影响不大。然而,WAS会影响粪便微生物组,导致拟杆菌门减少、厚壁菌门增加和变形菌门增加。当分析小肠和结肠的内容物时,WAS小鼠的乳杆菌科和未分类的拟杆菌门数量较低。
根据我们调查和总结,微生物组对压力的适应可能受到不同类型的压力、压力暴露时间、动物来源、饮食等因素的影响(下表)。在接受不同类型压力暴露后,已报道有几个细菌分类在不同研究中存在差异。
压力暴露会下会减少的细菌:
相反,压力暴露会增加的细菌:
注:研究人员观察到Anaerofustis菌与睡醒后30分钟内唾液皮质醇水平升高呈正相关
注:代表菌种幽门螺杆菌(Helicobacter pylori)
在这些研究中,Lactobacillus物种是在压力暴露后最一致减少的细菌分类。其余菌谷禾会逐步为大家科普。
✓
对小鼠的研究表明,压力暴露会改变肠道微生物组的组成并改变细菌分类群,这引出了另一个问题:肠道细菌是否在压力反应调节中发挥积极作用?
无菌和抗生素处理模型:揭示肠道微生物对应激反应的影响
为了解决这个问题,无菌和抗生素处理的啮齿动物是“敲除”共生菌群的理想模型,无论是持续性还是有条件的。令人惊讶的是,大多数研究表明,啮齿动物中的微生物群耗竭会增强应激反应并增加应激激素皮质酮。皮质酮是啮齿动物中的一种糖皮质激素(人类中的皮质醇),它是应激反应时分泌的重要类固醇激素。
然而,并非所有的研究都显示无菌啮齿动物在暴露于应激条件后会表现出过度的应激反应和更高水平的皮质酮。在测量无菌啮齿动物基线皮质酮水平时,尚未得出一致的结果。这些研究发现,下丘脑-垂体-肾上腺皮质轴(HPA)是肠道微生物改变宿主生理的重要调节因子;这引发了肠道微生物在应激抑制中可能发挥关键作用的可能性。
无菌啮齿动物明确表明肠道微生物的耗竭会导致异常的应激反应,包括皮质酮增加、与应激信号传导相关的基因表达改变以及异常的行为后果。虽然无菌模型是研究微生物对应激应对机制影响的宝贵工具,但需要注意下无菌模型的局限性。
无菌模型和抗生素给药模型:在研究应激反应时的局限性
无菌动物从出生开始就缺乏与微生物的接触,与常规饲养动物相比,它们可能表现出几个发育差异。这些差异包括肠道形态的改变、未成熟的黏膜免疫系统、口服耐受发育的延迟、上皮细胞周转减缓以及神经内分泌功能的改变,尤其是在早期生命阶段。对于这些差异的警告意识到了无菌模型在人体生理背景下的人为性质。
与无菌小鼠模型并行,广泛采用抗生素给药,以阐明肠道微生物在应激反应中扮演的角色。抗生素给药是一种控制共生微生物清除时间的有力工具。但是,年龄、治疗时间窗口、抗生素种类和剂量都是获得与无菌啮齿动物一致结果的关键因素。
此外,由于胃肠道不同区域对不同种类肠道细菌有地理选择性,完全清除肠道微生物还是一个挑战。只有少数研究能通过给予抗生素在无菌小鼠体内成功再现应激反应增强情况。
两项研究采用了类似的广谱抗生素药物组合(ABX),显示ABX的慢性治疗会导致小鼠基础皮质酮水平升高以及社交暴露后也会升高。
另外两项研究显示,口服单一抗生素的急性或慢性给药会导致小鼠在受到急性应激后,皮质酮水平升高。
皮质酮
皮质酮是一种 21-羟基类固醇,由在11和21位被羟基基团和氧代基团取代的孕 4-烯组成在位置3和20。皮质酮是在肾上腺皮质中产生的皮质类固醇类型的21碳类固醇激素。它具有人类代谢物和小鼠代谢物的作用。
糖皮质激素(人类为皮质醇,啮齿类动物为皮质酮)是类固醇激素,由肾上腺根据生理信号和压力以昼夜节律方式合成和释放。
肾上腺释放糖皮质激素的昼夜节律受下丘脑-垂体-肾上腺 (HPA) 轴调节。来自视交叉上核 (SCN) 的输入刺激下丘脑的室旁核 (PVN),释放促肾上腺皮质激素释放激素 (CRH) 和精氨酸加压素 (AVP)。
这些激素作用于垂体前叶,激活促肾上腺皮质激素细胞,将促肾上腺皮质激素 (ACTH) 分泌到体循环中。
随后,ACTH作用于肾上腺皮质,刺激糖皮质激素的合成和释放。一旦从肾上腺释放到血液循环中,糖皮质激素就会进入靶组织,调节多种生理过程,包括新陈代谢、免疫功能、骨骼生长、心血管功能、生殖和认知。
由于其亲脂性,糖皮质激素不能预先合成并储存在肾上腺中,但必须在 ACTH 刺激下快速合成(使用许多酶促反应)。 HPA 系统内的这种前馈机制通过作用于垂体前叶和下丘脑内的糖皮质激素的负反馈来平衡,以分别抑制 ACTH 和 CRH 的进一步释放。
因此,人类血清皮质醇浓度在早晨达到峰值,在夜间最低。 HPA 轴是中央应激反应系统,负责应激反应的适应部分,试图恢复体内平衡。应激反应的不当调节与多种疾病有关,包括自身免疫性疾病、高血压、情感障碍和重度抑郁症。全身血清糖皮质激素水平由肾上腺糖皮质激素合成维持,但糖皮质激素的可用性在组织或细胞水平上进一步调节。
有趣的是,用抗生素对小鼠进行发育期治疗在各种条件下降低了皮质酮水平。对大鼠进行抗生素治疗也会降低皮质酮水平,表明存在模型依赖效应。其他研究表明,抗生素对皮质酮水平没有影响。虽然抗生素给药是研究肠道菌群对大脑和行为影响的有效方法,但在实验设计中需要仔细考虑。
✓
小鼠大脑应激反应失调的现象在无共生微生物的小鼠中被广泛观察到。一些研究调查了肠道微生物耗竭小鼠中糖皮质激素受体(GR)、CRH及下游信号通路的基因表达水平。发现在应激暴露后,无菌小鼠海马CA1区和颗粒回(DG)中观察到皮质酮水平升高和GR mRNA水平降低。
无菌小鼠下丘脑中CRF表达水平较高。皮质中GR基因表达水平较低,但下丘脑和海马中未观察到这种情况。
在基线条件下,GF小鼠海马中的GR下游信号通路,包括Slc22a5、Aqp1、Stat5a、Ampd3、Plekhf1和Cyb561等基因表达上调。
在WAS后,与SPF小鼠相比,GF小鼠海马CA1区的神经活动减少。
最近的研究发现,肠道共生微生物对于抑制宿主的应激反应和增加社交行为至关重要。在与陌生老鼠进行短暂社交互动后,无菌小鼠的应激激素皮质酮水平升高。
与此同时,多个与应对应激有关的大脑区域的神经活动也得到了上调,包括下丘脑旁室核(PVN)、海马齿状回(DG)和肾上腺背侧床核(adBNST)。
在成年阶段接受抗生素治疗的小鼠中,这种应激激素和神经活动的上调现象也得到了重复。此外,这项研究还表明,GF小鼠的海马(Arc、Fos、cJun、JunB、Egr1、Egr2、Gadd45b、Gadd45g、Bdnf)和下丘脑(Arc、Fos、Egr1)中的即时早期基因表达上调,而脑干(cJun、JunB、Egr1、Gadd45b、Gadd45g、Bdnf)中的即时早期基因表达下调。
然而,在基线和应激条件下,接受抗生素治疗的小鼠中应激相关基因表达并没有发生改变。只有在社交互动后,ABX小鼠的Crh基因表达上调,而在暴露于新环境后,ABX小鼠的Ucn基因表达上调。
以上小编概括起来就是:
最新的研究发现,肠道微生物对于调节宿主的应激反应和社交行为非常重要。在实验中,当无菌的小鼠与陌生的老鼠进行短暂的社交互动后,它们的应激激素皮质酮水平会增加。
在接受抗生素治疗的成年小鼠中,这种应激激素和神经活动的增加现象也得到了重复。此外,研究还发现,没有微生物的小鼠的海马和下丘脑中的即时早期基因表达上调,而脑干中的即时早期基因表达下调。
然而,在接受抗生素治疗的小鼠中,无论是在正常状态还是应激条件下,与应激相关的基因表达并没有发生改变。只有在社交互动后,接受抗生素治疗的小鼠的某些基因表达会增加。这些研究结果表明,肠道微生物对于调节应激反应和社交行为起着重要作用。
应激反应神经元的干扰可以改变小鼠的社交行为和皮质酮水平
为了进一步研究神经元在脑回路中的干扰是否能够改变小鼠的应激激素和社交行为,采用了基因消除策略和化学遗传学方法来干扰接受抗生素治疗的小鼠中的应激反应神经元。
该研究通过对接受抗生素治疗的小鼠进行基因消除和化学遗传学方法的干预,发现破坏应激反应神经元可以恢复社交缺陷并抑制皮质酮水平。特别是在下丘脑中基因消除GR会降低社交行为,并在社交互动后增加皮质酮水平。沉默PVN CRH神经元可以抑制皮质酮水平的增加并阻止社交缺陷的发展(下图)。
肠道共生微生物是抑制宿主应激反应神经元增加社会行为所必需的
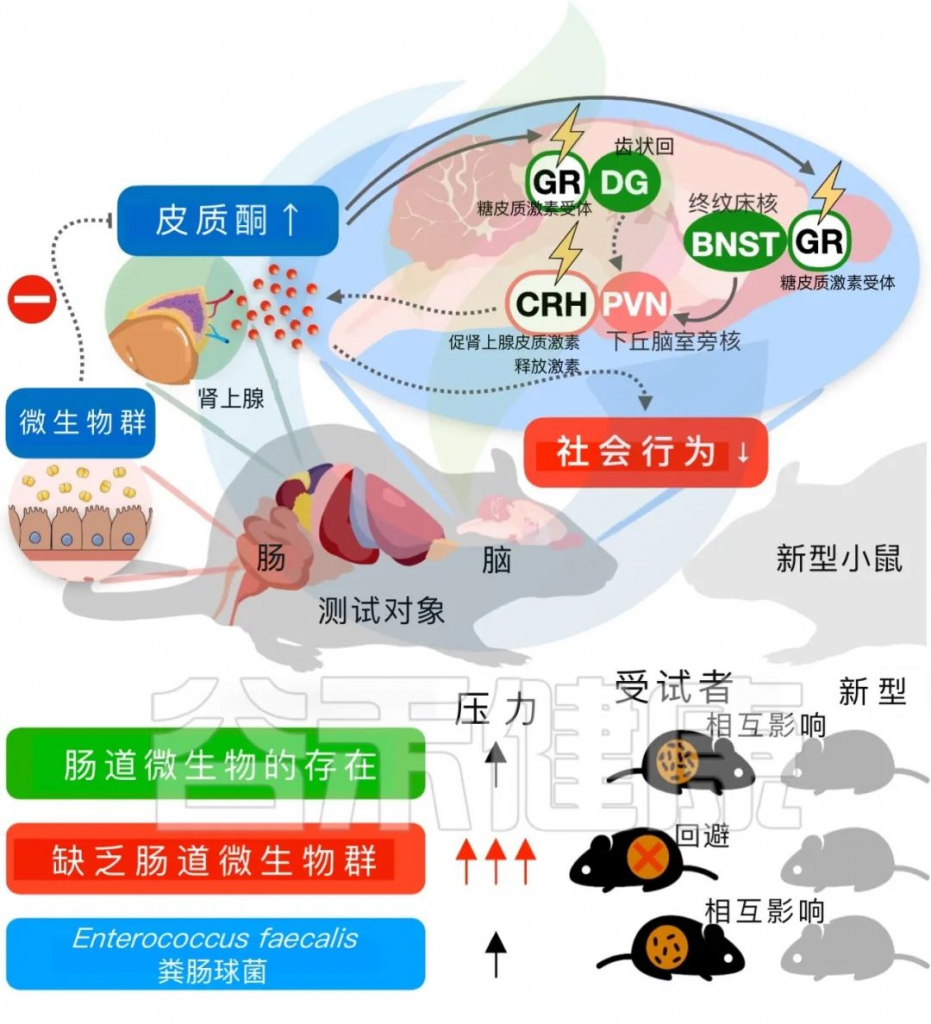
编辑
doi: 10.1186/s12929-023-00984-6
PVN中CRH神经元活动的改变,可能是社交行为和应激反应失调的原因
与此相反,adBNST CRH神经元的这些效应在ABX小鼠中未观察到。此外,去肾上腺和药物阻断GR以及皮质酮合成可以恢复微生物缺失小鼠的社交互动行为。因此,该研究认为,在没有微生物组的小鼠中,社交行为和应激反应的失调更可能是由于PVN CRH神经元的神经活动改变,而不是应激相关基因表达的改变或PVN相关神经回路的结构改变。这项研究为共生菌通过特定途径驱动宿主行为的应激应对提供了证据。
神经科学技术的进步使科学家能够精确地研究受微生物组调节的神经回路,并进一步发现微生物组介导的与应激相关的神经回路的机制。
✓
压力条件下大脑中的神经元已经得到了广泛的研究,但肠道源的压力信号尚未完全阐明。糖皮质激素是一类肾上腺皮质激素,主要由肾上腺分泌,部分由肾上腺外系统分泌。
尽管肾上腺糖皮质激素在应对压力中起着作用,但肠道中肾上腺外糖皮质激素的生理作用仍未被理解。
肾上腺中的糖皮质激素合成途径涉及线粒体中的一系列步骤:
基于合成皮质酮的生化过程的基本区别,肾上腺外糖皮质激素的生理作用被认为与应对压力无关。
肠道上皮细胞对肾上腺外糖皮质激素的合成贡献
肠道上皮细胞是肾上腺外糖皮质激素合成的主要产生者。小肠、大肠和阑尾中表达了参与类固醇合成的关键酶,包括Cyp11a1和Cyp11b1。肠道糖皮质激素被认为对肠道微环境有贡献。研究表明,系统免疫挑战会上调糖皮质激素合成,并与肠道免疫细胞相互作用。炎症因子肿瘤坏死因子α(TNFα)和脂多糖(LPS)诱导的免疫系统激活促进肠道糖皮质激素合成。然而,白细胞介素1β(IL-1β)在体外模型中抑制肠道上皮细胞的糖皮质激素信号传导。
糖皮质激素在肠道屏障功能和免疫调节中的作用
糖皮质激素激动剂地塞米松可增加上皮细胞的屏障功能,但与细胞因子联合处理可能影响屏障功能。长期使用地塞米松可能影响上皮细胞通透性和基因表达,从而改变细胞的结构和功能。细菌内毒素LPS注射后,肾上腺外组织产生的皮质酮水平显著增加。因此,肾上腺外糖皮质激素主要具有免疫调节功能,与典型的应激信号有所不同。
肠道糖皮质激素合成在IBD中的降低及其与疾病发展的关系
肠道糖皮质激素合成在炎症性肠病(IBD)患者中表达水平显著降低,暗示肠道糖皮质激素合成障碍可能参与了IBD的发展。肠道糖皮质激素在炎症期间起到抑制肿瘤发展和生长的关键作用。然而,在肿瘤期间,Cyp11b1介导的糖皮质激素合成抑制抗肿瘤免疫反应,促进免疫逃逸。这为肿瘤治疗提供了有希望的治疗靶点。这些发现突显了肠道糖皮质激素合成在调节胃肠道疾病中的重要作用。
通过对无菌小鼠的研究,了解到失去菌群会如何改变肠道的应激反应。在基线、免疫挑战和应激暴露条件下,无菌小鼠的肠道应激相关基因表达发生改变。
在社会挫败和急性束缚应激条件下,糖皮质激素合成基因表达差异
在社会挫败和急性束缚应激条件下,比较了SPF(无特定病原体动物)小鼠和无菌小鼠的垂体、肾上腺和肠道的糖皮质激素合成基因表达。简而言之,社会挫败应激后,SPF小鼠的结肠中的Crh和Ucn2基因表达上调,而GF小鼠中则保持不变,部分原因是GF小鼠基线水平的增加。
有趣的是,无论GF小鼠基线水平是否增加,在社会挫败应激后,Hsd11b1的下调在SPF小鼠和GF小鼠中都观察到。另一项研究调查了GF小鼠肠道中糖皮质激素合成的肠段特异性。急性束缚应激和菌群的存在改变了GF小鼠回肠和结肠中Nr5a2(编码LRH-1)和Hsd3b2的表达。然而,与回肠相比,结肠中的糖皮质激素合成基因的改变更为显著。
HPA轴对糖皮质激素分泌的调节
doi: 10.1016/j.rdc.2015.08.002
这些研究表明:肠道糖皮质激素合成可能是肠道细菌调节应激反应的关键途径。肠道细菌如何影响下丘脑-垂体-肾上腺轴(HPA轴)的精确机制尚不清楚。肠道外肾上腺糖皮质激素合成是一个值得研究的有希望的途径。
✓
乳杆菌(Lactobacillus)
鼠李糖乳杆菌 (L. rhamnosus GG)
鼠李糖乳杆菌作为益生菌已经使用了几十年。
鼠李糖乳杆菌GG减轻了母体分离大鼠和高脂饮食小鼠中急性约束应激诱导的皮质酮。
鼠李糖乳杆菌JB-1通过膈下迷走神经以应变依赖的方式降低急性约束应激诱导的皮质酮水平。母鼠分离后,幼鼠立即表现出高皮质酮水平。
口服鼠李糖乳杆菌R0011菌株(95%)和瑞士乳杆菌R0052菌株(5%)可以防止皮质酮水平增加。
除了鼠李糖物种外,副干酪乳杆菌、植物乳杆菌、干酪乳杆菌和其他物种已被证明在各种模型中调节应激。
副干酪乳杆菌 (L. paracasei )
副干酪乳杆菌Lpc-37的给药慢性降低了由慢性日常约束应激引起的皮质酮水平。
副干酪乳杆菌HT6有效地防止了早期生活压力社会经历引起的大脑GR表达变化。
副干酪乳杆菌PS23和植物乳杆菌PS128降低了早期生活压力诱导的皮质酮水平。
干酪乳杆菌(L. casei)
干酪乳杆菌Shirota菌株降低了大鼠WAS诱导的皮质酮水平和人类学业压力诱导的皮质醇水平。
干酪乳杆菌DKGF7抑制慢性约束应激诱导的皮质酮。
植物乳杆菌 (L. plantarum)
植物乳杆菌CCFM8610和干酪乳杆菌M2-01-R02-S01(M2S01)在WAS和柠檬酸杆菌诱导的肠易激综合征(IBS)模型中抑制皮质酮水平。
植物乳杆菌LRCC5310、植物乳杆菌LRCC5314和天然乳杆菌BNR17抑制了慢性冷应激和高脂饮食诱导的皮质酮升高。
路氏乳杆菌(L. reuteri)
路氏乳杆菌胞外多糖抑制氨苄青霉素诱导的皮质酮。路氏乳杆菌ATCC-PTA-6475在伤口愈合过程中下调皮质酮水平。
路氏乳杆菌NK33、约氏乳杆菌(L. johnsonii)分离株、约氏乳酸杆菌BS15和粘膜乳杆菌NK41抑制固定应激诱导的皮质酮升高。
其他乳杆菌
发酵乳杆菌(L. fermentum)CECT 5716减轻了WAS和母体分离诱导的皮质酮水平。用热灭活的发酵乳杆菌和德氏乳杆菌(ADR-159)治疗可降低皮质酮的基线水平并增加社交能力。
L.helveticus NS8可减少慢性约束应激诱导的皮质酮。用L.farciminis ML-7处理成功抑制了部分约束应力诱导的HPA轴的激活。
然而,并非所有乳杆菌物种都对应激反应产生下调作用,包括副干酪乳杆菌N1115、植物乳杆菌LP12407、植物乳菌LP12418,唾液乳杆菌UCC118、干酪乳杆菌CRL431、唾液乳杆菌HA113。此外,与安慰剂组相比,著名的益生菌鼠李糖乳杆菌JB-1不能改变皮质醇并释放压力。
双歧杆菌 (Bifidobacterium)
除了乳酸杆菌外,双歧杆菌是另一个已被广泛研究用于应激调节的细菌属。
B. subtilis在GF小鼠中的单克隆作用减弱了约束应激诱导的ACTH和皮质酮水平的增加。
青春双歧杆菌NK98、青春双歧杆菌IM38和长双歧杆菌NK46抑制固定应激诱导的皮质酮升高。
假链状双歧杆菌B. pseudocatenulatum CECT 7765和双歧双歧杆菌B.bifidum G9-1(BBG9-1)减轻了母体分离引起的皮质酮水平升高。
B.breve菌株M2CF22M7和CCFM1025减少了UCMS诱导的皮质酮产生。
在一项临床研究中,长双歧杆菌1714的给药降低了应激诱导事件后的应激激素水平。
同样,并非所有双歧杆菌物种都参与应激调节,包括婴儿双歧杆菌35624、短双歧杆菌UCC2003、长双歧杆菌1714、短芽孢杆菌1205。
益生菌混合物
结合乳酸杆菌和双歧杆菌的益生菌混合物也具有应激调节作用。L.helveticus R0052和B.longum R0175(Probio’Stick®)降低了WAS诱导的皮质酮升高。
用益生菌瑞士乳杆菌、鼠李糖乳杆菌、干酪乳杆菌和长双歧杆菌联合治疗可抑制UCMS大鼠的ACTH和皮质酮水平。
然而,不同细菌相互作用的机制可能很复杂。相反,母体使用B. animalis subsp. actis BB-12®和Propionibacterium jensenii 702可以增加新生儿皮质醇的水平。
其他不常见的益生菌
其他不常用作益生菌的细菌也在较小程度上调节应激诱导的激素。GF小鼠中大肠杆菌而非脆弱拟杆菌的单克隆作用降低了皮质酮的基础水平。给予克雷伯菌和大肠杆菌增加了皮质酮的基线水平。吴等人用抗生素(氨苄青霉素、万古霉素和甲硝唑;AVM)联合治疗小鼠,发现与全谱ABX治疗的小鼠相比,社交行为得到了保护,应激反应受到了抑制。当将AVM肠道微生物群移植到GF受体小鼠时,保留的社会行为和减少的应激反应被转移,表明AVM微生物群中的肠道细菌发挥了积极作用。
粪肠球菌——在社交活动中促进社交行为并抑制皮质酮水平升高的关键细菌
粪肠球菌(Enterococcus faecalis)是一种乳酸菌,对抗生素和许多其他压力源具有耐药性。粪肠球菌在宿主中的功能作用是多方面的,并且具有菌株特异性。
粪肠球菌是一种常见于尿路感染的常见病原体。另一方面,粪肠球菌已被广泛用作益生菌或食品添加剂。
粪肠球菌在ABX和GF小鼠中的定殖可以促进它们的社交行为,但只抑制ABX小鼠的皮质酮水平,而不是GF小鼠。
粪肠球菌可以调节神经系统和宿主行为
粪肠球菌EC-12菌株降低了焦虑反应,并改变了前额叶皮层中去甲肾上腺素和加压素的受体。
粪肠球菌SF3B菌株和EF-2001菌株已被证明可以缓解结肠炎诱导的肠道神经传递和病理。此外,粪肠球菌可以合成酪胺和苯乙胺,这两种神经活性分子被称为微量胺,能够调节宿主神经系统。
物质P刺激粪肠球菌V583菌株中酪胺和乳酸的产生,并增强肠道体外模型中的细胞毒性和细菌移位。
粪肠球菌AG5可增加宿主中的长链和短链脂肪酸,这可能通过间接方式间接影响神经系统。
一份报告发现,小鼠感染致病性粪肠球菌菌株K9和CP-1,会急性增加皮质酮,这表明粪肠球菌可以改变宿主中的糖皮质激素信号。临床上,粪肠球菌存在于89.3%的健康对照组中,而只存在于58.3%的神经发育障碍、58.3%的混合特异性发育障碍和55.6%的表达和接受语言障碍。
此外,粪肠球菌的给药对母体免疫激活的后代的重复行为和焦虑样行为没有产生任何影响。
总之,肠道细菌对宿主情绪和应激反应产生影响的分子和细胞机制将在未来进行研究。尽管在动物研究中微生物群对HPA轴有显著影响,但还需要更多的临床研究来支持使用益生菌缓解人类压力水平的概念。
✓
益生元是从食物中提取的不可消化成分,用于促进微生物(主要在胃肠道中)的生长。
合生元是将益生元和益生菌结合起来,对宿主产生协同作用。
先前的研究表明,益生元和合生元治疗都可以改变啮齿动物模型中的皮质酮水平。很少有研究调查益生元和压力暴露之间的相互作用及其对控制皮质酮水平的影响。
低聚果糖和低聚半乳糖
低聚果糖(FOS)和低聚半乳糖(GOS)治疗对成年小鼠产生抗焦虑和抗抑郁作用。
此外,GOS 和 FOS + GOS的组合可有效下调强迫游泳试验引起的急性应激诱发的皮质酮。有趣的是,FOS 和 GOS 处理中 Akkermansia、Bacteroides、Parabacteroides 的相对丰度有所增加,而脱硫弧菌、瘤胃球菌、Allobaculum、Turicibacter、乳酸杆菌、双歧杆菌的相对丰度降低。
然而,另外两项使用不同益生元化合物的研究并没有对不可避免的压力(GOS、聚葡萄糖和糖蛋白乳铁蛋白)或社会破坏压力(人乳低聚糖3 ‘唾液酰基乳糖或6 ‘唾液酰基乳糖)引起的皮质酮产生抑制作用。研究人员推测各种化合物、治疗持续时间和治疗开始时间都会影响益生元的效果。
低聚甘露糖
除了压力暴露之外,低聚甘露糖 (MOS) 的长期治疗降低了 5xFAD 转基因阿尔茨海默氏病小鼠模型血清中皮质酮和 CRH 的基线水平,但野生型小鼠没有这种情况。此外还发现 MOS 会增加血清和粪便中的丁酸盐水平,并与血清皮质酮呈负相关。然而,另一项研究结果表明,MOS 治疗降低了野生型 Whistar 大鼠成年期的血浆皮质酮水平。有趣的是,药物诱导的便秘大鼠模型表现出较高的 ACTH 和较低的皮质酮水平,而菊粉和低聚异麦芽糖可使其正常化。
其他益生菌和益生元联合治疗
益生元和益生菌的合生治疗很复杂,并且有多种组合。迄今为止,还没有研究使用相同的细菌菌株和益生元化合物配方来调节压力。
在暴露于慢性日常约束应激的大鼠中,将麦芽糊精L. paracasei DKGF1与仙人掌提取物相结合,以时间依赖的方式抑制约束应激诱导的皮质酮水平。
益生菌L.gasseri 505抑制UCMS诱导的皮质酮。添加柘树叶提取物不会对皮质酮产生额外影响。在急性应激中,在大鼠中,L. casei 54-2-33和菊粉的联合治疗可以降低加迷宫诱导的皮质酮升高。很少有研究采用合生元策略来缓解应激反应和皮质酮,这可能是因为缺乏关于益生菌和益生元的机制观点的基础。
✓
类固醇生成是在宿主体内将胆固醇转化为类固醇的生物合成过程。在糖皮质激素中,胆固醇通过几种关键酶(包括孕烯醇酮、黄体酮和脱氧皮质酮)经过几个步骤转化为皮质酮。然后皮质酮代谢为醛固酮。有趣的是,一些研究支持本地微生物直接调节宿主体内类固醇合成的假设。本节讨论从头细菌将胆固醇转化为类固醇的潜在候选细菌,这可能会干扰糖皮质激素类固醇的合成。
细菌中类固醇的生物合成——是直接影响类固醇激素水平的一种方式
在瘤胃球菌 (R.) gnavus、Bacteroides (B.) Acidifaciens 和 Clostridium (C.) scindens 培养物中发现孕烯醇酮治疗无氧条件下48小时可合成雄激素类固醇;研究人员使用液相色谱-串联质谱测量了类固醇途径中间体的水平。
在细菌条件培养基中检测到羟基孕烯醇酮、孕酮、脱氢表雄酮、睾酮。同样,相同的细菌菌株可以在体外将羟基孕烯醇酮代谢为黄体酮、脱氢表雄酮和睾酮。然而,R. gnavus 和 B. Acidifaciens 没有表现出任何胆固醇、皮质醇或醛固酮的代谢能力。
此外,孕烯醇酮和羟基孕烯醇酮在其他共生菌株中的处理,包括粪肠球菌、阴沟肠杆菌、肺炎克雷伯菌27、奇异变形杆菌、粘质沙雷氏菌、溶血葡萄球菌、大肠杆菌,产生了阴性结果,表明细菌在类固醇中间体代谢中的特异性。
类固醇激素代谢——可能是细菌影响宿主激素水平的另一种途径
从水甲虫的肠道中分离出两种芽孢杆菌菌株,HA-V6-3 和 HA-V6-11,并表明它们能够代谢孕烯醇酮。
其他证据表明,吲哚和粪臭素这两种肠道细菌衍生的色氨酸发酵代谢产物,可以抑制类固醇生成的限速酶CYP11A1,从而减少孕烯醇酮。
此外,睾酮缺乏与抑郁症状有关。最近发现从抑郁症患者中分离出的新金分枝杆菌(Mycobacterium neoaurum)可以将睾酮降解为雄烯二酮。
在新金分枝杆菌中鉴定出一个编码3β-羟基类固醇脱氢酶的基因,该基因可降解睾酮。将3β-羟基类固醇脱氢酶引入大肠杆菌中,产生3β-羟类固醇脱氢酶产生菌。产生3β-羟基类固醇脱氢酶的大肠杆菌在ABX小鼠中的定殖诱导了抑郁样行为。
最近进行的一项研究调查了给C57BL/6小鼠服用Thauera菌株GDN1的效果。GDN1是一种具有分解代谢睾酮能力的β变形菌。结果表明,GDN1菌株的给药导致血清雄激素水平显著降低,并在粪便提取物中检测到雄激素环切割代谢产物,这表明能够分解代谢雄激素的肠道细菌,可能调节宿主循环雄激素水平,并有可能作为益生菌用于高雄激素血症的替代治疗。
C. scindens细菌,通过侧链裂解将糖皮质激素皮质醇转化为雄激素
尽管没有研究表明特定细菌的能力可以直接影响皮质酮水平,但弗吉尼亚联邦大学的 Hylemon 实验室发现,C. scindens 是一种从人类粪便中分离出来的细菌,可以通过侧链裂解的机制将糖皮质激素皮质醇转化为雄激素。
C. scindens通过desD编码的钠依赖性皮质醇转运蛋白将皮质醇转运到细菌中。然后,皮质醇可以通过甾体-17,20-脱模酶(一种由desAB编码的假定转酮醇酶)代谢为11β-OHA(11β-氢-氰基甾-4-烯-3,17-二酮)。11βOHA可以通过ABC转运蛋白被泵出细胞。目前尚不清楚是否有细菌具有将皮质酮转化为其他类固醇的相似机制。
微生物参与皮质酮合成的新机制
Hylemon实验室的另一项研究在Eggerthella lenta(以前称为真杆菌)的细胞提取物中发现了一种皮质类固醇21-羟化酶。有趣的是,21羟化酶使用脱氧皮质酮、脱氧皮质醇、脱氢皮质酮和皮质酮作为底物。这可能是哺乳动物中微生物将类固醇转化为皮质酮的另一种机制。
然而,在压力暴露后的啮齿类动物中均未报告C.scindens和Eggertella lenta,也没有发现它们在微生物组缺乏的啮齿动物的肠道中定植。
从皮质酮的生物合成和代谢角度来看,一些细菌可以促进皮质酮前体,而另一些细菌则有相反的效果。因此,确定一种单一的途径来阐明在无菌和ABX(类似的广谱抗生素药物组合)治疗的小鼠中发现的高皮质酮仍然具有挑战性。该领域在肠道中面临着一种高度复杂的情况,这种情况会调节应激激素和应激诱导的行为异常。
✓
与压力相关的疾病,例如肠易激综合症(IBS),通常涉及微生物失调。 IBS 是一种胃肠道并发症,其特征是腹部不适、排便方式改变以及伴随的焦虑等症状,影响着 5-10% 的人口。尽管进行了广泛的研究,IBS 的确切病因仍然难以捉摸,公认的危险因素包括遗传、饮食、心理压力和肠道微生物组组成。
IBS患者中微生物代谢物的改变
研究表明,与健康对照相比,IBS 患者的 α 多样性降低,并且 21 种细菌种类的相对丰度存在显著差异。 IBS 亚型在肠道微生物群衍生的代谢物中表现出明显的改变:
微生物群在IBS患者中的作用
研究表明,IBS-D 中的特定细菌,如瘤胃球菌Ruminococcus gnavus,可以通过产生苯乙胺和色胺来刺激血清素生物合成,从而加速肠道蠕动。
研究发现,在一些 IBS 患者中发现的产气克雷伯菌(Klebsiella aerogenes)可增强组胺的产生,通过组胺 4 受体信号传导导致内脏痛觉过敏。
值得注意的是,可以通过人类 IBS 患者的粪便微生物群移植 (FMT) 到 GF 接受者来建立 IBS 动物模型。这种方法有效地复制了在人类 IBS 患者中的胃肠道和焦虑症状。
IBS 患者的应激反应激素水平
压力暴露是发生 IBS 的已知危险因素,通常影响肠道蠕动和 HPA 轴。 IBS 患者的应激反应激素水平与健康人不同。
研究表明,急性精神压力会导致 IBS 患者血浆 CRH 和 ACTH 显著升高。此外,Dinan组显示,CRH输注后,IBS患者的ACTH和皮质醇释放增加。
结肠扩张(CRD)是一种检测内脏敏感性的方法,在IBS动物模型中,导致PVN CRH神经元中c-Fos表达升高,血浆CRH、ACTH和皮质酮水平升高。
总之,这些发现表明,与健康受试者相比,患有IBS的个体表现出应激激素分泌增加和微生物群失调。
✓
应对压力是动物面对可能对身体有害的危及生命事件的重要策略。压力失调与情感性疾病密切相关。新冠肺炎大流行使压力相关疾病的全球流行率急剧上升,这对社会产生了深远影响。
最近的研究表明,肠道微生物群不仅出现在压力暴露的背景下,而且还起着“活性调节剂”的作用,调节神经和内分泌系统。这也就是我们开头提到的“胃里有蝴蝶”的扑腾感源于肠道微生物。
肠道微生物直接和局部调节类固醇生成,可能改变应激激素水平。然后,应激激素信号可以通过确定的途径、肾上腺外类固醇生成、自主神经系统和各种细菌成分传播到大脑。最终,大脑接收来自微生物的信息,并对PVN和其他大脑区域做出充分反应。
此外,大脑决定的应对和适应机制可以改变基于行为和内分泌功能的输出。然后,微生物可以进一步适应宿主在压力下的生理机能。这种从肠道微生物群开始的控制环路是基于目前对肠道微生物和压力之间相互作用的理解。
肠道微生物调节行为的分子和细胞机制、途径和回路在很大程度上尚未完全探索。识别导致和影响应激反应的关键细菌和细菌相关因素,将有利于使用基于微生物组的疗法进行替代医学创新。
随着对微生物与宿主交互作用机制的深入研究,肠-脑轴在心理疾病发生和治疗中的重要性将越来越受到重视。肠道菌群将成为预防和干预这类疾病的新靶点。
主要参考文献
Lai TT, Liou CW, Tsai YH, Lin YY, Wu WL. Butterflies in the gut: the interplay between intestinal microbiota and stress. J Biomed Sci. 2023 Nov 28;30(1):92.
Ramamoorthy S, Cidlowski JA. Corticosteroids: Mechanisms of Action in Health and Disease. Rheum Dis Clin North Am. 2016 Feb;42(1):15-31, vii.
Huang ST, Wu K, Guo MM, Shao S, Hua R, Zhang YM. Glutamatergic and GABAergic anteroventral BNST projections to PVN CRH neurons regulate maternal separation-induced visceral pain. Neuropsychopharmacology. 2023 Nov;48(12):1778-1788.
Avery S N, Clauss J A, Blackford J U. The human BNST: functional role in anxiety and addiction[J]. Neuropsychopharmacology, 2016, 41(1): 126-141.
谷禾健康

无论是什么社会阶层
无论以前的职业是什么
任何人都有可能患上阿尔兹海默症
这种疾病如同橡皮擦一般
逐渐抹掉一个人的记忆
…
在详细了解阿尔兹海默症之前,我们先来看一个动画短片(2020年奥斯卡最佳动画短片提名),该片讲述的是一位患有阿尔茨海默病的艺术家慢慢失去自己记忆的故事。
2020奥斯卡最佳动画短片提名——勿忘我(Mémorable)_腾讯视频
“ 他们彼此搂着对方在旋转中化作了记忆的露珠 ”
“你是我空白世界里最后一处的风景”
…
阿尔兹海默症正在呈指数级蔓延,目前却没有治愈的方法。
本文,我们在了解阿尔兹海默症的同时,也带来了关于阿尔兹海默症研究的新方向——结合肠道微生物群(“肠-脑轴”的阐述)来更深入了解该疾病。
阿尔茨海默氏病(AD)是一种神经退行性疾病,影响全世界超过5000万人,是最常见的痴呆症,临床表现为进行性认知功能减退和功能障碍。AD主要影响老年人(> 65岁),表明衰老是主要的危险因素之一,其中与衰老相关的AD进展被称为散发性AD
AD及其相关痴呆症的发病率在世界范围内呈上升趋势,以前,在高收入国家(西欧和北美),AD患病率最高。 然而,中低收入国家的痴呆症发病率开始增加,预计到2030年,所有病例中的63%发生在中低收入国家中,到2050年,占所有病例的71%。但其病因仍未解决,目前尚无有效的预防或改善治疗方法。
缩略词:

新的证据表明AD患者的肠道微生物群与认知正常的患者不同。肠道内的细菌强烈影响肠-脑轴,肠道微生物代谢物包括短链脂肪酸、促炎因子和神经递质也可能影响AD的发病机制和相关的认知能力下降。
饮食是肠道微生物群最强的调节剂之一,也强烈影响着大脑健康和AD病理学。例如,肥胖和2型糖尿病是AD的潜在危险因素,并且研究已将高脂饮食和高碳水化合物饮食与AD发生的风险联系在一起。 相反,地中海(MD)和生酮饮食与更健康的大脑衰老和较低的AD风险相关。 进一步证实了这一证据,在发展中国家,随着肥胖和糖尿病患者比例的增加,流行病学转变导致AD患病率增加。
因此,通过健康饮食来逆转肠道菌群异常可能有益于大脑并降低AD风险。
· 遗传
尽管尚不清楚AD的病理和影响因素,但仍存在一些遗传突变,例如淀粉样前体蛋白(APP)基因的额外拷贝和21号染色体三体等基因突变,这些突变增强了神经退行性β淀粉样蛋白(Aβ)的表达与家族性AD相关的蛋白质沉积。
· 病理
病理上,细胞外神经原纤维斑块和细胞内高磷酸化tau(pTau)缠结遍布AD大脑皮质实质,尤其是颞叶。深部脑萎缩也可能支持AD的诊断,这些明显的特征长期以来被认为是AD病理的主要因素。
新皮层中pTau的Aβ斑块和神经原纤维缠结的堆积会引起炎症,氧化应激和最终的神经退行性变。 这些症状也可以通过活性氧来介导,活性氧通常通过酶促抗氧化剂来控制。 然而,当抗氧化剂水平降低时,活性氧会引起氧化应激并导致神经退行性变。
大脑中的炎症也与AD患者常见的肠道渗漏有关,免疫系统因子如多形核中性粒细胞能够从肠壁漏出。来自肠道的持续炎症可开始降解血脑屏障,使这些炎症因子进入大脑并引起进一步的炎症。
用于AD诊断的生物标志物包括低Aβ-42和脑内高tau水平,PET上氟脱氧葡萄糖摄取减少,MRI上出现结构性脑萎缩。
AD的临床诊断因患者而异,很难用一系列规定的症状来描述。
需要关注的这10个方面
记忆退化/困难; 问题解决; 熟悉的任务完成; 时间/地点识别; 图像或空间关系的理解; 沟通; 追溯步骤; 判断/人际互动; 工作/社交活动; 情绪/认知
早期症状
记忆:丢钥匙,忘记朋友的名字或最近的一次谈话,在熟悉的地方迷路。
讲话:重复自己的话或努力跟上对话。
视觉:很难看到三维的东西和判断距离。
决策:难以做出决定、解决问题或完成多步骤任务,比如做饭。
方向:对自己的位置、时间和日期感到困惑。
情绪:感到焦虑、沮丧或易怒的。
晚期症状
错觉:
例如,毫无理由地相信有人在偷他们的东西
不寻常的行为:
表现出攻击性或躁动、喊叫或扰乱睡眠模式
行走和说话困难:
卧床不起或坐轮椅,需要24小时护理来帮助进食、饮水和上厕所
由于淀粉样蛋白级联假说的不可理解性,研究正在调查Aβ斑块和pTau作为一个系统的标志物,这个系统从许多末端被破坏。
研究假设β-淀粉样蛋白是一种抗菌肽,由于非有益微生物的大量携带,可能来自炎症导致的血脑屏障降解,因此可能会在AD大脑中积聚。这些淀粉样蛋白是由APP的裂解和toll样受体2激活的髓样分化主要反应途径形成的。
脑淀粉样变性外,肠道中还存在细菌淀粉样蛋白,其三级结构类似于中枢神经系统淀粉样蛋白,并可能在刺激大脑中的免疫系统中发挥作用,因为免疫系统学会了识别肠道中的淀粉样蛋白,然后 大脑中淀粉样蛋白的增强攻击,导致炎症。
饮食(例如高脂饮食)可进一步介导导致AD炎症和神经退行性变的肠道渗漏综合征。 因此,AD的可测量症状具有与肠道菌群相关的复杂原因。
Aβ 斑块和tau缠结假说是AD病理生理学的理想模型。然而,新的研究已经证实AD是系统性功能障碍的一个组成部分,至少部分由慢性、全身性和神经元炎症以及肠道微生物群介导。在这一点上,神经炎症假说建立在肠-脑轴上,它将肠道微生物群活动与神经元健康和功能障碍联系起来(下图)。
AD中肠道微生物群的作用是由微生物代谢物介导的,这些代谢物作用于肠道和周围组织中的局部神经元并向大脑发送信号,和/或从肠道吸收并通过循环到达大脑。例如:单胺类、短链脂肪酸(SCFA)、γ-氨基丁酸(GABA)、β-甲胺基-L-丙氨酸、脑源性神经营养因子、血清素和多巴胺。
Kincaid HJ, et al., Ann Nutr Metab,2021
MCI和AD患者中饮食与微生物组相互作用与大脑和认知健康之间的假定联系的示意图。
AD患者和/或患有轻度认知障碍(MCI)的受试者存在明显的微生物群模式。
随着自然衰老相关的肠道营养不良开始发展并削弱肠道上皮,已经存在的微生物群营养不良会进一步影响大脑的衰老,从而导致肠道渗漏和炎症。
全身性炎症的加剧促使免疫功能受损,使大脑中的β-淀粉样蛋白堆积。这表明,患者通常要到老年时发展为AD,即使在生命早期就存在存在危险因素,如基因突变。
患有MCI和AD的患者在脑脊液中还显示出较高水平的肠道微生物来源的三甲胺N-氧化物(TMAO),这与AD生物标志物(包括pTau,总Tau和Aβ42)相关。
TMAO治疗可通过改善神经元衰老和线粒体功能障碍来降低小鼠的认知功能和衰老迹象。尽管TMAO在AD中的作用机制尚不清楚,但TMAO及其前体是炎症生物标志物,可能与AD相关的肠道渗漏有关。
西方饮食由低纤维、高脂肪和高蛋白食物组成,通常吃富含TMA和胆碱的高脂肪红肉和鸡蛋,从而增加TMAO的产生。这可能部分解释了西方国家AD发病率较高的原因。
此外,TMAO相关的脑损伤和认知缺陷可能由氧化应激增加介导。因为大脑消耗大量的氧气,而且神经元的新陈代谢率很高,所以一般人大脑中的神经元面临更高的氧化应激风险。然而,氧化应激可能是AD病理的原因和后果。
炎症引发氧化应激,从而导致β pTau的积累;然而,在一个破坏性的循环中,反之亦然也是可能的。
此外,氧化应激可导致线粒体功能障碍,肠道微生物源性代谢产物影响线粒体功能。饮食可以调节氧化应激,如高果蔬饮食可以提高认知能力,这与老年人氧化应激的降低有关;而西方饮食不富含水果和蔬菜,这也可能解释了在西方国家AD患病率较高的原因。
肠道微生物群对我们的新陈代谢、免疫和大脑健康至关重要。在健康的稳态条件下,肠道微生物群与宿主保持共生关系,对宿主营养和代谢、对病原体的定植抗性、肠道屏障完整性和免疫调节发挥重要作用。
肠道微生物群对脑部疾病有影响,包括抑郁症、焦虑症、高血压和帕金森病。最近的研究也将肠道微生物群与AD联系起来;然而,值得注意的是,这些研究大多是横断面调查,因此,需要更多的纵向干预研究来确定微生物群和AD病理学之间的偶然联系。
美国北卡罗来纳州科学团队最近报道了MCI患者拟杆菌丰度较低,厚壁菌和变形杆菌(肠杆菌科)丰度较高,此外在属水平上也存在一些差异。其他研究也报道了AD受试者的多样性较低,厚壁菌与拟杆菌比率较低,痴呆患者的拟杆菌比率较低,而与MCI患者和正常受试者相比,AD患者的多样性较低,厚壁菌和变形杆菌比率较高。
一项研究表明,丁酸盐产生菌参与认知功能。有趣的是,该团队还发现MD生酮饮食改善了AD生物标志物,即。MCI患者脑脊液中的淀粉样蛋白和tau蛋白,其中这些变化与肠丁酸盐增加有关。
已经研究了Aβ积累与微生物群的关系。 例如,APP-PS1小鼠是使用最广泛的AD模型,它以年龄依赖的方式展示了Aβ在大脑中的蓄积; 然而,它的微生物群不同于野生型小鼠。 此外,移植有AD微生物群的小鼠倾向于具有更高的Aβ积累。 此外,Aβ聚集可以被微生物群衍生的戊酸酯和丁酸酯抑制。
此外,细菌内毒素也可能与AD-淀粉样变性相关的炎症有关。 例如,脂多糖(LPS)是革兰氏阴性细菌的外细胞壁成分,具有高度促炎性,可以增强大脑中Aβ的积累并引起认知功能障碍。
AD患者的血浆LPS水平较高,新皮质和海马较高。 LPS还可能导致慢性神经发炎,内嗅皮质神经细胞死亡以及海马神经元的突触可塑性受损。 特定的细菌,例如大肠杆菌(Escherichia coli),枯草芽孢杆菌(Bacillus subtilis),鼠伤寒沙门氏菌(Salmonella typhimurium)和肠沙门氏菌 (Salmonella enterica)也可以产生淀粉样蛋白。 然而,这些并不是人类肠道微生物的典型且一致的’居民’。
此外,AD相关淀粉样变性与细菌淀粉样变性之间的关系仍不清楚。 尽管如此,细菌淀粉样蛋白可能会激活与AD发病机制有关的特定信号通路,这提示肠道菌群可能会加剧与淀粉样变性病相关的炎症。 这些研究通过微生物细胞外成分,促炎因子,毒素,SCFA,淀粉样蛋白和神经递质将微生物群与淀粉样蛋白的积累联系起来。 考虑到迅速兴起的研究,可以预见的是,AD预防和治疗将绕不开针对微生物群的影响。
鉴于AD患者与健康受试者之间微生物群差异的新数据,研究人员已经开始探索调节微生物群的方法,希望能够改善AD病理学。
尽管肠道微生物群可以通过多种方法进行调控,包括使用益生菌、益生元、合生元和抗生素或改变饮食,但饮食是肠道微生物群的最高级调节剂。
以不饱和脂肪、水果和蔬菜以及全谷类为重点的饮食调节可以给AD相关的认知健康带来好处(上图)。例如,MD通过增加血浆类胡萝卜素和降低C-反应蛋白水平,与AD关键区域的脑萎缩减少相关(表明对AD病理学有积极影响)。
此外,炎症减少也是AD的主要症状。食用富含二十二碳六烯酸(一种n-3多不饱和脂肪酸)的鱼制品与降低AD风险有关。富含维生素D3的鱼和富含维生素D的奶制品促进神经生长因子蛋白的分泌,这种蛋白可以防止大脑发炎和衰老。
由于MD对AD的这些改善作用,一项人体试验研究了MD-DASH干预对神经退行性延迟(MIND)饮食的影响,该饮食是MD与DASH饮食(阻止高血压的饮食方法)的结合,富含 水果,蔬菜,全谷类,低脂乳制品和瘦肉蛋白证明,MIND饮食比单独使用MD或DASH更为有效,尽管所有3种饮食均显示出降低AD病理学的益处。
除了某些饮食生活方式外,个别食物还可以带来抗AD病理学的益处。 例如,在小鼠模型中,饮用红酒可防止Aβ肽生成并降低AD风险。具体而言,据报道,适度饮酒可减少轴突末端的GABA能发芽,这可能是AD中神经退行性变的部分原因。 富含类黄酮的食物,例如黑加仑子,葡萄,柑橘和绿茶,已显示出抑制Aβ沉积并防止tau蛋白过度磷酸化的作用,同时改善了AD的其他生物标志物。
具体而言,据报道,适量饮酒可减少轴突终末的GABA能发芽,这可能是AD中发现的神经退行性变的部分原因。富含类黄酮的食物,如黑加仑、葡萄、柑橘和绿茶,已被证明能抑制β 沉积和阻止tau蛋白的过度磷酸化,同时改善AD的其他生物标志物。
虽然大多数研究都在研究健康饮食对改善AD病理的影响,几项研究探讨了直接针对AD肠道细菌的补充剂的使用。
一项随机双盲对照人体试验,研究了12周食用嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei)、双歧杆菌 (Bifidobacterium bifidum)和发酵乳杆菌(Lactobacillus fermentum),的益生菌组合的效果,据报道,对认知功能有显著的积极影响,但对氧化应激或炎症没有影响。
一项小鼠实验研究了生物素丁酸钠对早期AD小鼠Aβ水平和行为症状的影响,发现补充丁酸钠12周后Aβ水平显着降低,行为反应增加。
益生菌和益生元的组合合生元也显示出对AD的益处。一项人类研究观察到,AD患者食用开菲尔谷物发酵的牛奶(形成共生物质)90天后,精神能力得到改善,炎症和氧化应激减少。
综上所述,目前有关饮食和补充剂影响肠道微生物群和改善AD是有希望的,但更多的研究是也非常需要。
此外,研究已经通过测试Tramiprosate(一种GABA的类似物)来靶向GABA,并发现它有望增加AD模型和临床试验中Aβ抑制的长期增强作用。5-羟色胺激动剂和再摄取抑制剂曲唑酮(trazodone)也表明,与延缓AD患者认知障碍的相关性是非曲唑酮使用者的2.6倍。
AD在世界范围内迅速增长,但是迄今为止尚无治愈方法,这强调了需要有效的策略,例如饮食因素来调节AD相关的神经炎症并预防或减慢AD的进展。
目前的证据表明,饮食成分的促炎和抗炎能力都可能在AD管理中发挥作用。
富含单糖,饱和/反式脂肪,高级糖基化终产物和加工肉的饮食可能对AD患者的大脑产生促炎性影响,同时可能加速肥胖症,高血压,血脂异常,动脉粥样硬化和2型糖尿病。
相反,富含蔬菜,水果,沙拉,坚果,豆类,浆果,多不饱和脂肪酸,维生素,类黄酮,多酚,益生菌/益生元和全谷物的复杂饮食模式(例如,MD,DASH和MIND)可能有助于预防或减缓认知能力下降和AD进展。
研究表明,肠道菌群通过肠脑轴参与了AD病理。饮食会强烈调节和塑造肠道菌群,这可能是这些饮食模式改善肠道脑轴与AD相关的摄动的潜在机制之一。 对生活方式因素与AD相互作用的机械理解可以阐明生活方式模式的改变与AD患病率增加之间的联系,同时包括微生物群等对于宿主生活方式与健康之间的相互作用至关重要的因素。
对饮食,微生物群,生活方式和痴呆症之间的联系进行解码,将有助于揭示AD病理的潜在机制,同时有助于发现预防/治疗AD和相关痴呆及认知能力下降的新策略。
虽然该疾病目前无法得到根治,也无法逆转,但如果在早期就介入治疗,是可以有效延缓疾病的进程。
音乐
有观察表明,音乐疗法可以极大地帮助许多患有阿尔茨海默氏病的人,2019年3月发表在《神经科学前沿》上的一篇评论发现,音乐疗法可以改善行为,认知和社交功能-帮助缓解焦虑症和抑郁症。
对于许多患有阿尔茨海默氏症的人来说,正确的音乐疗法可以在恐惧和孤独的时候提供安慰、快乐。
“以某种方式、形式对音乐做出反应,无论是身体反应、情感反应、社会反应,还是认知反应”,来自伯克利音乐学院音乐治疗系主任乔伊认为,“我们知道痴呆患者的大脑受损,但对音乐作出反应的那部分似乎是最后消失的部分。”
音乐的镇静作用可以减少日常生活中产生焦虑的事件中的躁动,并使阿尔茨海默症患者及其护理者的过渡不那么令人焦虑。
精油
梅奥诊所称,当吸入精油时,它会刺激嗅觉感受器,嗅觉感受器通过中枢神经系统向边缘系统传递正(或负)信息。边缘系统是大脑控制情绪的部分。
梅奥诊所的从业者不会将精油涂抹在患者身上,而是用于供阿尔茨海默患者吸入。
当然吸入太多也不好。如果周围有太多的气味,就像用扩散器一样,使嗅觉系统饱和,甚至再也认不出这种气味了。所以不能过量使用。
几项小型研究表明,薰衣草精油可帮助改善痴呆症患者的行为并改善睡眠。柠檬香脂可以按摩到皮肤或吸入,在减轻压力和焦虑方面显示出优势。生姜精油缓解恶心症状。
但不推荐使用薄荷精油,较刺激,许多人会对它产生不良反应。
瑜伽
关于瑜伽及其对阿尔茨海默氏病的影响的研究在某种程度上是有限的,还远没有定论,但在阿尔茨海默氏症的护理中加入诸如瑜伽之类的补充方法,可能会有助于缓解该疾病的某些症状。
2018年2月发表在《神经生物学的压力》杂志上的一项研究综述指出,越来越多的证据表明,压力可能会对像阿尔茨海默氏症这样的神经退行性疾病的发展产生有害影响。
瑜伽具有潜在的好处,可以帮助减轻压力,平息躁动并改善整体情绪。
大多数针对阿兹海默症患者的瑜伽都是以缓慢,轻松的方式进行轻柔运动。上课时间通常比一般的瑜伽课短,一般持续10至30分钟。根据个人体能定制,老师从不强迫运动,并鼓励参与者做自己想做的事情。
一篇文章发表在2019年的《大脑可塑性》杂志上,发现瑜伽似乎对负责记忆和信息处理以及情绪调节的大脑关键区域具有积极作用。
游戏
大多数专家似乎都同意游戏本身并不能真正改变疾病的生物学或阻止阿尔茨海默氏症对大脑的破坏性作用。
但有研究人员认为,这使他们增加了进行更多社交互动的机会,这比游戏本身更重要,可以提高生活质量,并可能减少认知能力下降。
发表在2019年8月6日《神经病学》上的一项研究发现,精神刺激活动(例如使用计算机,玩游戏,制作手工艺品和参加社交活动)与年龄相关的记忆力丧失的风险较低或延迟有关。
研究发现,在中老年人参加社交活动,例如去看电影或与朋友外出,或玩填字游戏或纸牌游戏等游戏,发展轻度认知障碍的风险降低了20%。
当然也可能是因为有轻度认知障碍的人没有能力经常降低参加这些活动的机会,因此,需要进一步的研究来调查这些发现。
不同人喜欢玩不同游戏,同一款游戏多次重复也会无聊,以下多款游戏可供参考:
填字、拼图、数独、西蒙、Risk、Azul、Lumosity等。
肠道菌群检测
定期进行肠道菌群健康检测,可以了解该疾病风险,如果能在非常早期的时候及时发现,结合肠道菌群进行多种方式针对性干预(如饮食,益生菌,生活方式的调整等),可能会大大延缓病程。
主要参考文献
Kincaid HJ, Nagpal R, Yadav H. Diet-Microbiota-Brain Axis in Alzheimer’s Disease. Ann Nutr Metab. 2021 Apr 27:1-7. doi: 10.1159/000515700. Epub ahead of print. PMID: 33906194.
Prince M, Bryce R, Albanese E, Wimo A, Ribeiro W, Ferri CP. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers Dement. 2013 Jan;9(1):63–e2.
Alonso R, Pisa D, Fernández-Fernández AM, Carrasco L. Infection of fungi and bacteria in brain tissue from elderly persons and patients with Alzheimer’s disease. Front Aging Neurosci. 2018;10:159.
Szczechowiak K, Diniz BS, Leszek J. Diet and Alzheimer’s dementia: nutritional approach to modulate inflammation. Pharmacol Biochem Behav. 2019 Sep;184:172743.
Blum S, Aviram M, Ben-Amotz A, Levy Y. Effect of a mediterranean meal on postprandial carotenoids, paraoxonase activity and C-reactive protein levels. Ann Nutr Metab. 2006;50(1):20–4.
Mosconi L, Murray J, Tsui WH, Li Y, Davies M, Williams S, et al. Mediterranean diet and magnetic resonance imaging-assessed brain atrophy in cognitively normal individuals at risk for Alzheimer’s disease. J Prev Alzheimers Dis. 2014 Jun;1(1):23–32.
Morris MC, Tangney CC, Wang Y, Sacks FM, Bennett DA, Aggarwal NT. MIND diet associated with reduced incidence of Alzheimer’s disease. Alzheimers Dement. 2015 Sep;11(9):1007–14.
Nagpal R, Neth BJ, Wang S, Craft S, Yadav H. Modified mediterranean-ketogenic diet modulates gut microbiome and short-chain fatty acids in association with Alzheimer’s disease markers in subjects with mild cognitive impairment. EBioMedicine. 2019 Sep;47:529–42.
Bhattacharjee S, Lukiw WJ. Alzheimer’s disease and the microbiome. Front Cell Neurosci. 2013;7:153.