-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
肠道屏障是将宿主与外界隔离的主要防御,具有多项关键生理功能,包括营养消化、吸收以及防止潜在有害的膳食抗原和致病微生物的侵害。然而,饮食、药物、昼夜节律紊乱、年龄、肠道微生物群、微生物代谢物和遗传易感性等多种因素都可能破坏肠道屏障。这种破坏可能导致细菌易位,进而引发肠肝和全身性炎症。
目前,肠道屏障受损已被认为与多种疾病的发病机制有关,包括炎症性肠病(克罗恩病和溃疡性结肠炎)、肠易激综合征和结直肠癌等肠道疾病。此外,肝病(如代谢功能障碍相关脂肪性肝病、酒精性肝病和原发性硬化性胆管炎)和全身性代谢疾病(如糖尿病和肥胖)也与肠道屏障受损有关。
然而,目前大多数临床数据仅显示相关性,尚无法明确肠道屏障损伤是这些疾病的原因还是结果。目前,全世界药监督管理局尚未批准专门用于修复肠道屏障损伤的药物。现有疗法主要侧重于疾病的预防和管理,并严重依赖免疫抑制剂来控制炎症。
不幸的是,持续的屏障损伤和延迟愈合会降低这些治疗的疗效,并可能导致治疗耐受甚至复发。因此,开发直接靶向肠道上皮屏障的治疗策略至关重要。
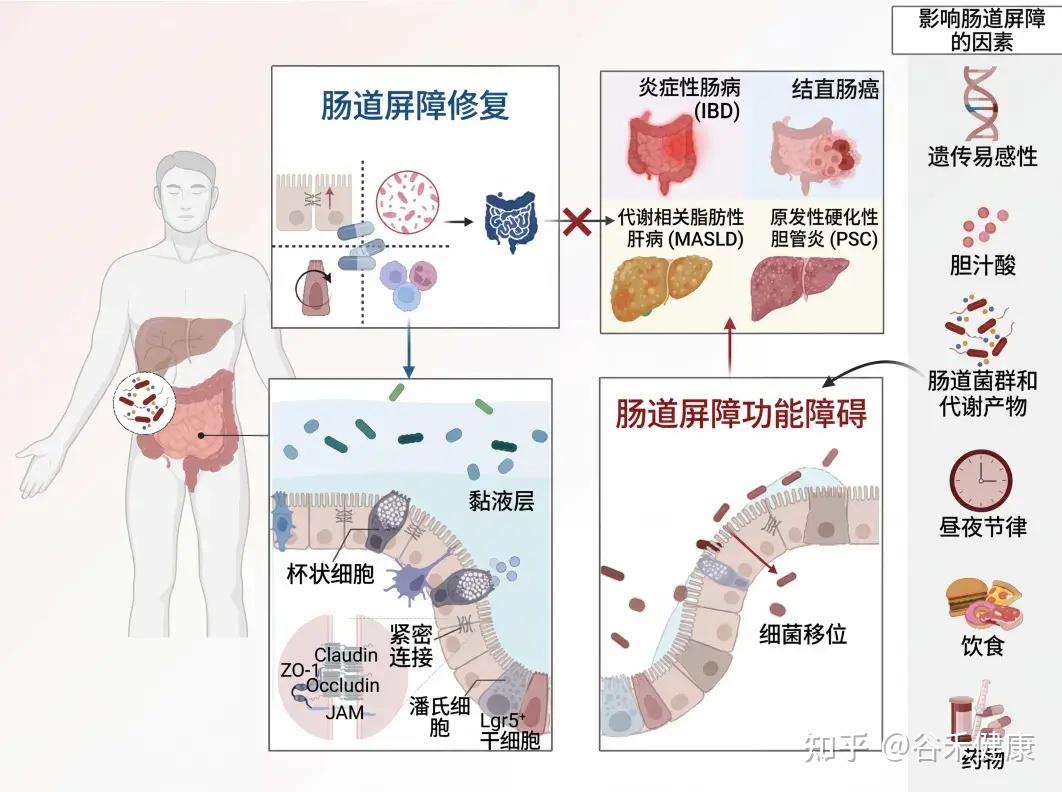
本文介绍肠道屏障的基本功能,生理结构和功能、影响其完整性的内外因素,重点介绍一些潜在的治疗策略,旨在恢复屏障完整性,改善和优化疾病管理。
肠道是一个独特的器官,在食物消化、营养吸收、动态的宿主与环境互动以及维持身体稳态方面发挥着关键作用。
为了保护宿主免受外部威胁,例如长期暴露于膳食抗原和病原微生物,肠道上皮细胞(IECs)形成了多种类型的屏障,包括机械屏障、富含共生微生物的粘液层,以及由免疫细胞及其活性物质组成的免疫屏障(下图)。

机械屏障:由紧密连接(TJs)形成的紧密排列的IECs层构成,确保肠道的结构完整性,调节肠道通透性,并控制水和大分子的运输。
粘液层:由杯状细胞分泌的粘蛋白组成,为共生细菌提供栖息地和营养。其独特的结构特征限制了病原体的渗透,进一步增强了TJs的物理隔离功能。
干细胞微环境:位于肠腺隐窝底部,由隐窝驻留肠道干细胞(ISCs)、间充质细胞、免疫细胞以及肠道分泌细胞(如杯状细胞和潘氏细胞)组成。这个微环境具有高度增殖性,因此负责组织更新和肠道屏障修复。它还介导抗原吞噬并释放抗菌肽(AMPs),通过清除潜在病原体来维持内部稳态。
这些元素共同构建了物理和生化屏障,保护宿主并调节内部和外部环境之间的交流。这种复杂的平衡对于胃肠系统的正常运作和维持身体整体平衡至关重要。
1
粘液层组成与免疫监测
粘液层的物理与生化屏障
粘液层是胃肠道的第一道防线,主要由90%-95%的水、1%-2%的脂质和1%-5%的粘蛋白组成。粘蛋白通过糖基转移酶高度糖基化,含有50%-80%的碳水化合物(w/w)。
粘蛋白聚糖多样而复杂的结构,为粘液相关细菌(如 R.torques、A.muciniphila、B.bifidum和R.gnavus)提供了理想的定植位点和营养来源。
动态防御:细菌即是住客,也是建筑师
MUC2是胃肠道中表达的主要粘蛋白。在细菌暴露后,杯状细胞通过meprin β介导的裂解机制分泌MUC2,形成保护性粘蛋白层。该结构允许共生微生物在外粘液层定植,并利用其多糖降解酶从粘蛋白O-聚糖中获取营养能量。这种宿主与微生物的相互作用,有助于调节近端结肠微生物群的结构和转录。
别让细菌吃肠壁:低纤维饮食的代价
研究表明,低纤维饮食会促进微生物群降解宿主粘蛋白,导致粘液层变薄,从而削弱屏障功能。Muc2缺陷小鼠表现出结肠组织学损伤增加、细菌易位至肝脏增多以及肠道紧密连接蛋白显著减少。此外,粘蛋白O-糖基化紊乱导致的粘液屏障完整性和功能受损与代谢疾病的发病机制有关。
粘液层的水龙头:谁在掌控肠道保护液的释放?
最近的研究发现,Gasdermin D (GSDMD) 是一种参与细胞凋亡的成孔效应蛋白,它通过scinderin介导的F-肌动蛋白解聚,促进钙依赖性胞吐作用,从而调节杯状细胞的粘蛋白分泌。GSDMD缺陷会破坏粘液屏障,使病原体粘附到上皮细胞,导致肠道疾病的发生。
严防细菌偷渡:一套保护肝脏的精密免疫系统
粘液层凭借其独特的粘弹性,能够有效滞留并扩散来自潘氏细胞和杯状细胞的抗菌物质及免疫细胞因子,形成化学屏障。
-抗菌肽 (AMPs) 与IgA的协同作用
潘氏细胞产生隐匿防御素、抗菌素和溶菌酶等AMPs。这些AMPs大量存在于肠道上皮表面,能够直接清除有害微生物。在新生非肥胖糖尿病小鼠模型中,生态失调导致的结肠AMPs缺乏会导致1型糖尿病中的胰腺自身免疫。
AMPs与微生物特异性免疫球蛋白IgA协调作用,在维持屏障稳定性和抑制炎症中发挥关键作用。
-IL-17和IL-22的调控
它们的调节受T辅助17(Th17)细胞和III型固有淋巴细胞(ILC3)产生的IL-17和IL-22的影响。
ILC3依赖于树突状细胞(DC)相关的Mincle信号通路,该通路与酪氨酸激酶偶联的C型凝集素受体有关。在Mincle缺失或酪氨酸激酶受损的情况下,肠道再生胰岛衍生III-γ(RegIIIγ)和IgA的合成会减少,从而导致肠道微生物群移位,进而引发肝脏炎症和脂质代谢失调。
这些发现表明粘液层完整性在维持肠肝稳态中的关键作用。
2
上皮连接:构筑肠壁防线的灰浆与砖块
微绒毛:不仅仅是吸收养分的地毯
功能:肠道上皮细胞顶端的微绒毛密集排列成刷状缘。它们既是营养吸收的高效界面(扩大表面积),又是阻止细菌附着的第一道物理防线。
脆弱性:在克罗恩病中,这些绒毛会变短、基因表达混乱。
破坏机制:就像拆除帐篷的支柱一样,肠出血性大肠杆菌的毒力因子通过CDK1-Formin信号轴,攻击支撑微绒毛的骨架蛋白(ACT-5),导致微绒毛坍塌消失,引发严重腹泻、出血性结肠炎等。
紧密连接(TJs):细胞间的拉链
在微绒毛下方,紧密连接(TJs)像拉链一样把相邻细胞的细胞膜紧紧锁死。
核心作用:这种吻合结构封堵了细胞间的空隙,相当于门控功能——只允许特定的物质通过,严防细菌和有害大分子渗透。
关键零件:谁在控制拉链的松紧?
病菌如何撬开防御?
紧密连接的稳定性高度依赖于细胞骨架的支撑,这成为了病原体的攻击目标:
3
动态防御机制:从干细胞再生到免疫感知
隐窝深处的生命源泉:肠道干细胞 (ISCs)
肠道屏障之所以能抵御消化道内持续的磨损与危害,归功于其惊人的自我更新能力。
核心机制: 位于肠道隐窝底部的肠道干细胞是这一过程的“总工程师”。它们通过持续增殖,不断分化补充受损的肠道上皮细胞(IECs),维持着组织的修复与动态平衡。
谁在调控修复?信号通路、压力与衰老
ISCs 的功能受到微环境信号的精密调控,同时也易受外部因素干扰:
-修复的加速器
当肠道受损时,IL-1R1 信号 和 Wnt 激动剂 RSPO3 会协同作用,强力促进 ISCs 的修复功能,加速伤口愈合。
-心理压力:让干细胞电量耗尽
心理压力不仅仅是情绪问题,它能产生实实在在的生理毒性。
心理压力会导致 ISCs 内部的 线粒体能量代谢 受损,进而干扰细胞分化。这种微观层面的能量危机削弱了宏观的肠道屏障,这科学地解释了为何精神疾病患者常伴有肠道问题。
-衰老的阻滞剂
随着年龄增长,ISCs 的数量和活性会下降,导致屏障完整性受损及菌群失衡。
关键原因:维持 ISCs 活性的关键信号——Wnt 信号通路随衰老而减弱,导致干细胞枯竭。
簇状细胞:不仅是免疫哨兵
簇状细胞是肠道屏障中一种重要的分泌型肠上皮细胞,与潘氏细胞和杯状细胞共同发挥作用。它们通过分泌IL-25来抵御病原体感染,激活2型免疫并清除病原体。簇状细胞还能感知病原体代谢物,并通过G蛋白偶联信号通路产生PGD2,从而刺激杯状细胞分泌粘液并促进自身增殖,进一步增强抗菌防御。此外,在肠道损伤时,簇状细胞可以充当储备肠道干细胞,协助屏障修复。
肠道屏障的健康受多种因素影响,包括遗传、饮食(如西式饮食)、药物(抗生素等)、疾病、生活习惯(昼夜节律)、心理状态(压力)和生理过程(衰老)。这些因素共同作用,可导致肠道微生物失衡,进而引发全身性代谢紊乱。这些代谢紊乱又会加剧炎症反应,进一步损害肠道屏障,形成一个恶性循环,持续破坏肠道健康。
下表总结了影响肠道和肝脏疾病的因素及机制与肠道屏障功能障碍相关的研究

1
遗传易感性
基因组关联研究(GWAS)的进展显著提升了疾病易感基因的识别和相关生物学通路的理解,这对临床转化具有重要价值。这些研究分析基因组中的遗传变异,以探索基因型和表型之间的关系。
免疫刹车失灵:IL-10 信号通路的遗传缺陷
尽管基因突变与肠道屏障功能障碍之间的直接联系有限,但GWAS已识别出许多与IBD(炎症性肠病)发展相关的基因座。例如,IL10基因突变是首批被发现能诱发IBD的突变之一。IL10基因敲除小鼠会自发发展结肠炎并增加肠道微生物易位。IL10受体(IL10R)的突变(由IL10RA和IL10RB基因编码的IL10R1和IL10R2蛋白组成)已与早发性小肠结肠炎相关联。这些突变损害了IL10诱导的信号传导,这可能增加TNF-α和其他促炎细胞因子的分泌,从而加剧炎症并削弱肠道耐受性。
离子转运障碍:SLC26A3 与物理屏障的松动
GWAS还显示SLC26A3基因(编码DRA蛋白,一种肠道氯离子转运蛋白)的显著下调。该基因在人类基因组中有害IBD变异中排名在前1%。SLC26A3表达的降低显著增加结肠旁细胞通透性,降低紧密连接(TJ)和黏附连接(AJ)蛋白的表达,从而增加对IBD的易感性。
黏液防线的溃败:ST6GALNAC1 与糖基化异常
糖蛋白组学分析揭示,先天性IBD(炎症性肠病)患者可能携带ST6GALNAC1(ST6)基因突变,该基因编码一种对维持黏液屏障稳态至关重要的唾液酸转移酶。该基因的突变会导致肠道黏膜层厚度减少,并破坏其保护功能。阐明这些调控机制对于理解先天性IBD的发病机制至关重要。此外,屏障功能还受到遗传易感性和环境因素相互作用的影响。DNA甲基转移酶编码基因DNMT3A的突变与IBD风险增加相关,已被证明能减少杯状细胞数量,缩短黏附连接(AJ)复合体,并增加肠道通透性。这些改变增加了对结肠炎的易感性,并阻碍了上皮再生和修复过程。
2
胆汁酸
胆汁酸(BAs)不仅是消化和脂质吸收的关键,还扮演着调节全身代谢和免疫的激素角色。它们通过激活FXR和TGR5等受体发挥作用。
修复的动力(次级胆汁酸)
最近研究发现,胆汁酸在维持肠道上皮屏障方面至关重要,能刺激Lgr5+肠道干细胞(ISCs)的自我更新,从而促进肠道修复。
修复的阻力(过量初级胆汁酸)
然而,过量的初级胆汁酸(如胆酸)会通过抑制脂肪酸氧化来减缓ISC的增殖,进而影响屏障修复。另一方面,TGR5在肠道代谢稳态中作用显著,其被次级胆汁酸(脱氧胆酸)激活后,会促进ISCs中YAP1和SRC等因子的转录,从而有效驱动肠道上皮的再生。
孕烷X受体 (PXR):抗炎与修复的化学感应器
孕烷X受体(PXR)是调节肠道上皮屏障稳态的关键核受体,它通过调控外源性物质代谢和先天免疫发挥作用。
溃疡性结肠炎患者中PXR及其靶基因的下调表明,PXR功能受损可能导致肠道损伤后屏障修复缺陷。PXR缺陷会加剧肠道上皮功能障碍,并增加对肠道损伤的易感性。
PXR的激活(例如通过石胆酸LCA)通过抑制NF-κB通路和炎症因子释放,以及维持紧密连接的完整性来发挥保护作用。
维生素 D 受体 (VDR):从抗菌防御到防癌屏障
胆汁酸也是维生素D受体(VDR)的内源性配体,对肠道稳态具有保护作用。VDR通过调节上皮分化和增强紧密连接表达来维护肠道屏障完整性,并支持潘氏细胞的抗菌功能。然而,在炎症性肠病(IBD)和结直肠癌(CRC)中,VDR的保护机制受损,其信号通路的失调与CRC的加速进展和不良预后密切相关。VDR激活不仅直接抑制肿瘤细胞增殖,还能通过增强黏膜屏障完整性来限制肿瘤进展,从而抑制CRC。
3
肠道微生物群及衍生代谢物
肠道微生物群通常与宿主共生,并被肠道上皮屏障限制在黏液层外。但有些微生物能突破屏障,损害胃肠道健康。抗生素虽看似能保护肠道,但实际上可能削弱屏障功能,增加新发炎症性肠病(IBD)的风险,这已在大量的研究中得到证实。与此相反,良好的肠道微生物结构对肠道屏障修复有积极作用。研究发现,肠道微生物群能通过激活巨噬细胞信号促进结肠上皮前体细胞生长,从而帮助修复受损的肠道上皮屏障。
色氨酸代谢物:PXR 与 AhR
肠道微生物群通过产生多种代谢物(如次级胆汁酸和色氨酸衍生物)来维护肠道屏障的完整性和整体健康。在IBD患者中,色氨酸水平显著降低,其代谢改变对疾病进程和预后有重要影响。
路径一:芳烃受体 (AhR) 的激活
色氨酸衍生物中的吲哚类物质是芳烃受体(AhR)的天然配体,AhR的激活能调节免疫细胞(如Tregs和Th17)及其细胞因子(特别是IL-22)的产生,从而促进肠道屏障的保护、修复和稳态。
路径二:孕烷 X 受体 (PXR) 的增强
除了AhR途径,这些代谢物还能通过孕烷X受体(PXR)增强屏障。例如,吲哚-3-丙酸(IPA)作为内源性PXR激动剂,通过TLR4信号通路减轻肠道通透性和炎症。PXR激活通过稳定紧密连接蛋白ZO-1、抑制MLCK表达和JNK1/2磷酸化来保护肠道屏障。
综上所述,色氨酸衍生的吲哚代谢物通过同时激活PXR和AhR信号通路,对肠道上皮发挥双重保护作用。
反面:犬尿氨酸 (Kyn) 途径
色氨酸代谢的犬尿氨酸(Kyn)途径与IBD进展密切相关,其限速酶IDO在炎症下促进Kyn途径,IDO的抑制或缺陷可减轻肠道炎症并增强屏障功能。
短链脂肪酸:能源与信号的结合
短链脂肪酸(SCFAs),包括丁酸、乙酸和丙酸,是肠道微生物分解膳食纤维等产生的关键代谢物,对肠道屏障功能至关重要。它们通过激活G蛋白偶联受体(如GPR43或FFAR2)来增强肠道屏障,并保护免疫细胞免受损伤,从而有助于预防结直肠癌(CRC)。
丁酸抑制组蛋白脱乙酰酶(HDACs)以调节基因转录,并通过调控紧密连接处的蛋白来促进屏障修复。GPCR信号和HDAC共同抑制维护上皮屏障完整性。此外,SCFAs还能刺激杯状细胞分泌黏蛋白,进而促进黏蛋白降解菌生长,通过消耗黏蛋白促进肠道干细胞分化,确保肠道上皮的再生能力。
4
昼夜节律
昼夜节律,常被称为生物钟,是代谢稳态的内部控制系统,旨在同步诸如光暗周期等周期性环境信号。该系统通过转录、转录后和翻译后修饰,在特定时间协调基因表达,以实现最佳代谢适应。
“什么时候吃”可能比“吃什么”更重要
多项研究表明,昼夜节律紊乱与代谢疾病之间存在密切关联。具体而言,不规律的进食时间会增加小肠暴露于膳食抗原和微生物刺激的风险,从而加重肠上皮细胞(IECs)主要组织相容性复合体II(MHC II)的负担。这种紊乱会削弱肠道微生态的调节功能,并减少IL-10的分泌。
神经免疫回路的失调:VIP 与 ILC3 的博弈
昼夜节律还会影响肠道中的神经免疫回路,这些回路受进食行为激活,并在饮食不规律时可能导致病理变化。食物摄入会触发肠道神经元分泌血管活性肠肽(VIP),该肽会上调与脂质吸收和转运相关的蛋白质。同时,VIP会降低IECs中的AMP水平,并减少ILC3产生的IL22。这种饮食节律的紊乱有助于病原体的肠道定植,尤其是在神经免疫回路的屏障功能受损时。
微生物振荡器:细菌也有生物钟
肠道微生物群自身也表现出丰度和功能的昼夜波动,被称为微生物振荡器,它们通过微生物代谢物或自身抗原影响宿主昼夜节律。肠道微生物群与宿主生物钟之间的这种相互作用显著影响屏障完整性和先天免疫反应。例如,短链脂肪酸通过抑制组蛋白脱乙酰酶(HDAC)活性,有助于调节小肠的昼夜节律相移。
肠道中的分节丝状细菌(SFB)驱动着与宿主节律同步的节律性ILC3回路振荡,从而通过时间依赖性地表达抗菌肽(AMPs)来介导感染抵抗力的昼夜变化。
5
饮食
高脂与快餐:胆汁酸的黑化与致癌风险
高脂肪和高糖、高加工饮食,与现代社会代谢疾病患病率的增加密切相关。饮食成分通过改变肠道微生物群以及主动参与宿主生理过程的次级代谢产物的产生,显著影响肠道微环境。
研究表明,现代快餐和西方饮食引起的肠道微生物群变化会提高脱氧胆酸(DCA)水平,这通过激活肠道FXR和I型干扰素(IFN)信号通路损害潘氏细胞。
动物研究进一步揭示,高脂肪饮食(HFD)在不同的结肠癌模型中,包括偶氮甲烷(AOM)-葡聚糖硫酸钠(DSS)诱导模型以及Apc突变诱导的自发模型,都会加剧肠道屏障损伤。HFD受损的肠道屏障允许更多病原体和衍生代谢物穿透上皮,从而加速结直肠癌(CRC)的发展。
糖衣炮弹:果糖与高血糖的双重打击
除了高脂肪摄入,过量的膳食果糖摄入也会损害上皮屏障。果糖水平升高会增加循环内毒素,从而激活巨噬细胞上的Toll样受体4(TLR4),引发全身性炎症反应。同时,葡萄糖代谢既对代谢综合征具有治疗潜力,也是肠道屏障功能的关键协调者。
在瘦素缺乏(ob/ob)和瘦素受体(LepR)缺乏(db/db)的2型糖尿病(T2DM)小鼠模型中,高血糖通过诱导肠上皮细胞(IECs)中葡萄糖转运蛋白2(GLUT2)依赖性转录重编程来破坏肠道屏障,这随后损害了紧密连接(TJ)和黏着连接(AJ)结构的完整性。
富含果糖的食物

6
药物
抗生素:精准打击与地毯式搜捕
抗菌素的使用对肠道微生物群落的丰度和结构有着深远的影响,进而影响肠道屏障的完整性。
例如,利福昔明-α (Rifaximin-α)常用来治疗小肠细菌过度生长:这种抗生素可以减少破坏粘膜的细菌,增加肠道内TNF-α和IL-17的水平,从而增强对病原体的抵抗力。它还能通过增加回肠中的乳杆菌水平来改善应激引起的肠道屏障功能障碍。
广谱抗生素会降低肠道微生物多样性,导致免疫失调,并增加感染的易感性。在健康成年小鼠中,广谱抗生素治疗会导致菌群失调,肠道上皮紧密连接(TJ)的完整性受损,表现为ZO-1表达减少和NLRP3炎症小体激活。
非抗生素药物:阿司匹林的隐形副作用
非抗生素药物也可能损害肠道屏障,例如阿司匹林,广泛用作消炎镇痛药,但会引起胃肠道损伤。
它会激活肠道FXR信号,并减少戈氏副拟杆菌(Parabacteroides goldsteinii)的数量。
戈氏副拟杆菌产生7-酮-LCA,这种物质能抑制肠道干细胞(ISC)的干性,从而减缓肠道屏障的修复。
化疗药物:再生能力的丧失
化疗药物:化疗是导致肠道屏障损伤的另一个主要原因。例如,5-氟尿嘧啶会加速黏膜细胞的死亡,而非再生。因此,超过40%的化疗患者会出现胃肠道损伤,表现为腹泻、便秘和消化不良等症状。
免疫检查点抑制剂:免疫激活的附带损伤
免疫检查点抑制剂(ICIs):靶向PD-1的ICIs彻底改变了抗肿瘤治疗。尽管这些抗体通过阻断PD-1通路来重建正常的免疫反应,但它们经常引起胃肠道毒性。
PD-1信号被发现对调节结肠淋巴组织诱导(LTi)细胞(ILC3的一个特定亚群,对维持免疫稳态至关重要)至关重要。
PD-1信号的缺失会导致LTi细胞中脂肪酸氧化过度激活,并反馈抑制LTi细胞的激活和IL-22的产生。这种失衡导致生态失调、肠道屏障损伤,并增加肠炎的易感性。
功能性测试:探针分子与 LMR 比值
乳果糖/甘露醇比值 (LMR) 是评估肠道通透性的重要生物标志物。
注:乳果糖(大分子)的尿液排泄量反映“肠漏”程度和上皮损伤。甘露醇(小分子)主要通过跨细胞途径吸收,代表非特异性上皮转运。
通过口服探针分子后检测尿液排泄来评估肠道通透性,这是最常用和直接的方法。
常用的探针分子包括不易代谢、吸收差的糖类(如甘露醇、鼠李糖、三氯蔗糖、乳果糖)或低分子量聚乙二醇(PEG)和乙二胺四乙酸(EDTA)。
为了避免饮食干扰,这些探针常使用同位素标记。
乳果糖-甘露醇测试 (LMT) 是临床广泛使用的评估方法。
在动物模型中,常用FITC标记的葡聚糖或铬-51标记的EDTA (51Cr-EDTA) 吸收到体循环的量来评估肠道屏障完整性。
其他方法:生物标志物的间接分析和多组学分析平台也是新兴的评估手段。
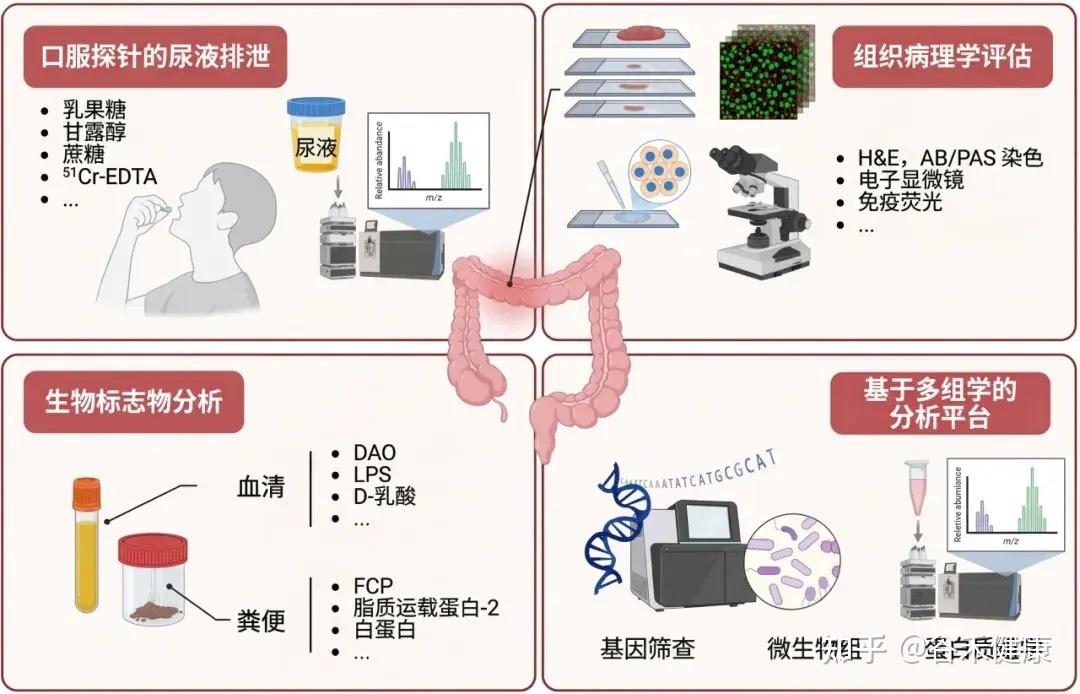
生物标志物:血液与粪便的线索
血清蛋白质组学和基因筛查技术:用于早期检测屏障功能障碍,并支持对其潜在原因的机制研究。
这些间接方法通过检测血液、粪便或分子水平上的特定物质,提供肠道屏障健康状况的重要信息。
组织病理学:屏障损伤的可视证据
内窥镜活检标本的组织病理学评估可以详细检查上皮绒毛形态和评估肠道屏障完整性。可以使用黏蛋白特异性阿尔辛蓝/过碘酸-希夫 (AB/PAS) 染色来评估黏液层,使用电子显微镜进行超微结构分析,以及使用免疫荧光技术精确定位和量化紧密连接 (TJ) 蛋白的表达,从而系统地分析黏膜成分的结构改变。
这些方法共同为评估肠道屏障完整性提供了全面的视角。
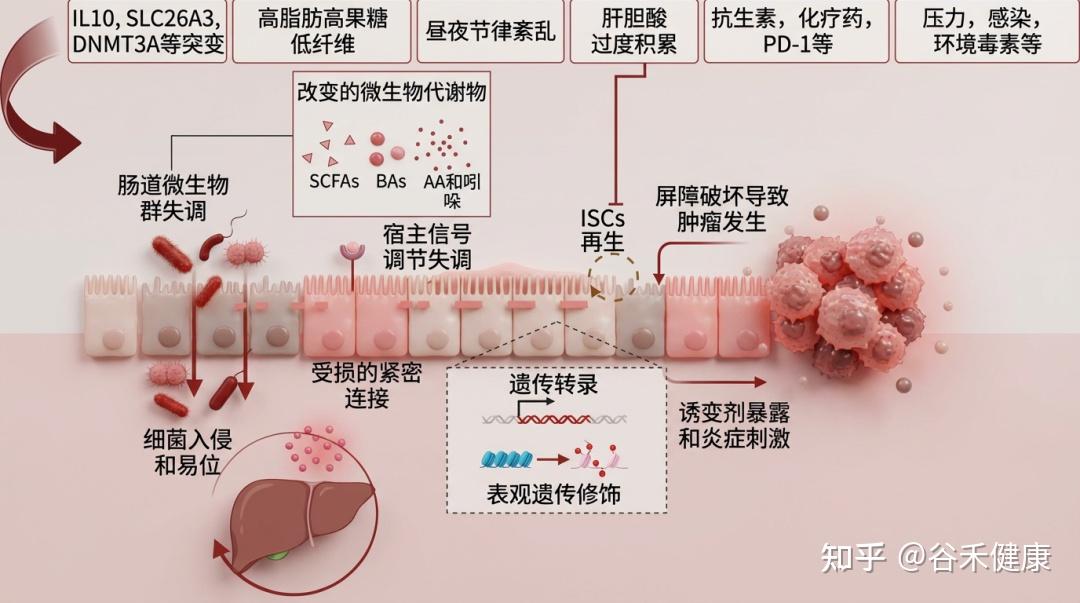
肠道上皮屏障的失调对多种肠道和肝脏疾病的发展和进展具有重要意义。肠道上皮的紧密连接功能障碍增加了通透性,促进细菌及其致病因子穿越屏障进入全身循环及其他组织。这种入侵会引发全身性炎症,破坏代谢稳态,而代谢稳态是肠道和肝脏疾病发生和进展的关键事件。虽然尚不确定肠道屏障的损伤是主要驱动因素还是偶然的病理特征,但越来越多的证据表明,肠道屏障的完整性在这些疾病的病因中起着关键作用。
1
炎症性肠病与结直肠癌
IBD 的病理核心:炎症因子的破坏机制
炎症性肠病 (IBD),包括克罗恩病 (CD) 和溃疡性结肠炎 (UC) 的特征是慢性胃肠道炎症。上皮屏障功能障碍是导致 IBD 发生和发展的关键因素。
临床研究表明,UC 和 CD 患者的肠道紧密连接 (TJ) 结构发生改变,导致肠道通透性增加。此外,黏膜免疫激活会引起TNF-α、IL-13、IL-17等细胞因子的产生。
屏障损伤是“因”而非“果”
进一步研究表明,由于 TJ 功能障碍和细胞骨架变化,细胞旁通透性增加可能在疾病发生前就已出现,例如 CD 患者亲属中早期肠屏障异常以及肠易激综合征 (IBS) 的较高患病率。同样,大规模队列研究已经发现 CD 诊断前三年内的屏障障碍标志物。这些发现支持屏障功能障碍是疾病进展的主要原因,而不是次要效应。
致癌风险:暴露于诱变环境
上皮屏障缺陷会使肠道内壁暴露于诱变化合物或长期炎症刺激,这可能通过氧化应激等机制启动并促进结直肠肿瘤的发生。在早期和晚期结直肠癌中,各种屏障相关蛋白的表达显著降低,这促进了微生物移位,引发炎症,并进一步加速肿瘤生长。然而,结直肠癌发生发展过程中上皮屏障成分异常表达的确切机制仍不清楚。
关键分子机制:GOLM1 与 NDRG2
事实上,实验模型表明,上皮屏障受损的小鼠更容易患结肠炎和炎症驱动的肿瘤。例如:
-GOLM1 缺失(细胞分化紊乱)
高尔基体膜蛋白 1 (GOLM1) 的缺失会过度激活 Notch 通路,从而破坏肠道稳态,改变肠上皮细胞 (IEC) 的分化和分泌细胞谱,并减少杯状细胞的数量,所有这些都会增加肠道通透性和促肿瘤炎症。机械屏障在预防结直肠癌发展中也至关重要。
-NDRG2(肿瘤抑制基因)
肿瘤抑制基因 N-myc 下游调节基因 2 (NDRG2) 已被证明可以增强 E3 连接酶 FBXO11 和 E-钙粘蛋白抑制剂 Snail 之间的相互作用,促进 Snail 泛素化。E-钙粘蛋白的这种稳定作用增强了黏附连接,从而限制了结肠炎相关肿瘤的发展。
2
慢性肝病
慢性肝病,包括 MASLD、ALD 和 PSC,常伴有肠道屏障受损和肠肝轴的失调。胃肠道物质,如营养素、分泌因子和微生物代谢物, 通过门静脉进入肝脏,并被代谢用于全身利用。这一过程使肝脏对病原体相关分子模式(PAMPs)极为敏感,成为肠道物质的主要靶点。
代谢功能障碍相关脂肪性肝病
代谢功能障碍相关脂肪性肝病 (MASLD, Metabolic dysfunction-associated steatotic liver disease):以前被称为NAFLD(非酒精性脂肪性肝病)。它是一种与代谢功能障碍相关的肝脏疾病,通常与肥胖、2型糖尿病、高血压和血脂异常有关。主要特征是肝脏中脂肪过度积聚,但与大量饮酒无关。
MASLD中,内毒素血症常见,提示肠屏障与肝炎症相关。DSS诱导小鼠肠屏障损伤加剧肝损伤。Il-10敲除鼠中,西方饮食+DSS处理降低BA水平,抑制肝脏FXR信号,加重MASLD。
肠道菌群失调是MASH早期驱动因素,宏基因组研究表明MASLD患者肝病发作前已存在肠道菌群失调。MASH患者粪外囊泡可能通过nmMLCK机制降低TJ表达,加剧肠屏障功能障碍。恢复肠屏障可逆转结肠炎引起的肝脂代谢失衡,特别是通过调节次级BA-TGR5/mTOR/氧化磷酸化通路。
酒精性肝病
酒精性肝病 (ALD, Alcoholic Liver Disease):是由于长期过度饮酒引起的肝脏损伤。 它可以表现为脂肪肝、酒精性肝炎和肝硬化等不同阶段。
酒精暴露破坏上皮连接,诱导肠屏障分解。ALDH2缺乏加剧酒精引起的肠道TJ/AJ蛋白降解,肠道ALDH2可能是酒精诱导的肠-肝轴损伤靶点。慢性酒精摄入减少肠道cDCs,导致AMP产量下降,保护性A. muciniphila丰度下降,AJs破坏,最终通过IL-12-IFNγ信号通路引起肝损伤。
原发性硬化性胆管炎 (PSC)
原发性硬化性胆管炎 (PSC, Primary Sclerosing Cholangitis):是一种慢性胆汁淤积性肝病,其特征是肝内外胆管的炎症和瘢痕形成。 最终可能导致胆管狭窄、肝硬化和肝功能衰竭。
PSC常与溃疡性结肠炎共病。PSC患者肠道微生物群与健康个体不同。门静脉中存在微生物提示肠屏障破坏,可能导致细菌易位。肺炎克雷伯菌等致病菌可通过接触依赖性细胞凋亡诱导上皮孔形成,加剧炎症和肝胆损伤。BDL诱导胆汁肝病小鼠模型中,肠道屏障破坏独立于菌群失调发生。敲除CHOP可缓解BDL小鼠肠屏障损伤、ISC干性丧失以及肝脏炎症和纤维化。
肠道屏障受损可刺激PSC中的保护性负反馈回路,LPS激活NF-κB通路抑制肝细胞BA代谢,减缓胆汁性肝病进展。抗生素或泛半胱天冬酶抑制剂能减弱菌群失调诱导的内毒素易位或NLRP3炎症小体激活,有望治疗PSC。
免疫靶向疗法,包括抗炎药、免疫抑制剂和生物制剂,已被证明在控制多种肠道疾病(如炎症性肠病)炎症方面有效。然而,这些治疗并不能直接解决肠道屏障的根本损伤。不幸的是,长期使用这些药物甚至可能增加感染、耐药性和疾病复发的风险,以及恶性肿瘤和死亡等严重不良反应。
确实,虽然减少炎症至关重要,但促进上皮屏障的愈合和恢复对于肠道疾病,尤其是炎症性肠病(IBD)的长期缓解至关重要。目前,没有临床批准的疗法专门针对肠道屏障的修复和维护。鉴于屏障功能障碍与肠道和肝脏疾病发病机制的密切联系,及时修复和恢复上皮屏障是一种有前景的治疗策略。与其仅关注症状管理,提升上皮愈合和健康完整性的治疗方法,可以减缓肠道和肝脏疾病的进展。
通过加强屏障,这类疗法还可能减少细菌易位、炎症以及肝损伤的加重。

1
紧密连接蛋白调节
靶向 MLCK:紧密连接稳态的核心调控
肠道屏障的维持在很大程度上依赖于多种 TJ 蛋白。肌球蛋白轻链激酶(MLCK)被视为开发炎症性肠病障碍疗法的有力候选目标,其在调节 TJs 及其分解中发挥核心作用,通过调节紧密连接(TJs)及其分解来保护屏障功能免受免疫诱导损伤。
对 MLCK 的缺失或抑制可以有效保护屏障功能免受免疫诱导损伤,但这些干预无法预防晚期结肠炎,后者涉及细胞凋亡和黏膜损伤,这些过程与 MLCK 介导的 TJ 分解无关。这些发现反映了 MLCK 抑制剂的治疗局限性。目前的 MLCK 抑制剂对上皮和平滑肌的催化域缺乏特异性,因此可能出现毒性副作用。
新机制发现:TCPTP 的双重保护
紧密连接 (TJ) 通过调节闭合蛋白 (occludin) 和封闭蛋白 (claudin) 来维持肠道完整性,而闭合蛋白和封闭蛋白是两种关键蛋白。
一项研究发现,上皮细胞中的蛋白酪氨酸磷酸酶 (TCPTP) 通过以下两种方式保护肠道屏障:
后者可以防止闭合蛋白 (occludin) 错位并降低上皮细胞的通透性。
目前尚无专门针对 TJ 蛋白的药物进入临床试验阶段,因此,需要在此领域进行深入研究和开发。
2
肠道微生物群的生态调控
益生菌疗法:从天然菌株到工程改造
益生菌已被发现通过多种机制调节屏障功能。例如,罗伊氏乳杆菌(Lactobacillus reuteri)激活Wnt/β-catenin信号通路,诱导Paneth细胞分化和AMP(抗菌肽)分泌,同时刺激Lgr5+肠道干细胞(ISCs)增殖以促进上皮修复。
此外,罗氏菌属(Roseburia)的鞭毛蛋白与Toll样受体5(TLR5)结合,可以上调occludin和MUC2,从而改善肠道屏障完整性,并增加IL-22和REG3γ水平,进一步调节肠道生态。
嗜黏蛋白阿克曼氏菌(AKK菌,Akkermansia muciniphila)也通过调节ISC程序来支持肠道上皮的修复、增殖、分化和稳定。因此,靶向肠道微生物失调成为恢复受损屏障功能的一种有前景的治疗策略。
最新的进展包括使用生物纳米材料包裹过表达人工酶的基因工程益生菌,这是一种用于黏膜修复和炎症治疗的新方法。长双歧杆菌(Bifidobacterium longum)经过修饰以表达过氧化氢酶和超氧化物歧化酶,表现出增强的肠道定植能力、强大的抗炎活性,促进肠道屏障重塑,并调节微生物平衡。这些进展有望减少传统抗炎药物的不良反应。
胆汁酸信号:FXR 激动剂的多重获益
胆汁酸在宿主与肠道菌群的交流以及肠道菌群的构成调节中起着关键作用。胆汁酸合成失调与多种疾病的发生密切相关。激活法尼酯X受体(FXR)能有效缓解胆汁酸过量带来的危害,它通过抑制胆固醇代谢、促进肝细胞将胆汁酸转运出去,从而减少胆汁淤积性肝损伤。
研究显示,FXR激动剂奥贝胆酸(OCA)能够:
此外,OCA治疗还能通过稳定内皮细胞内的β-连环蛋白来防止肠道血管屏障受损。
色氨酸代谢:AHR 通路与 IDO 的平衡
-AHR:屏障完整性的总开关
AHR(芳香烃受体)是一种色氨酸代谢物的受体,对维持肠道屏障的完整性至关重要。研究发现,Ahr−/−小鼠(即缺乏AHR的小鼠)的上皮屏障功能明显丧失,表现为肠道机械屏障受损以及细胞无法正常分化。缺乏AHR配体的小鼠也会出现类似的症状。
进一步研究表明,来自食物的AHR配体可以通过促进细胞内的锌离子(Zn2+)信号传导,从而提高紧密连接(TJ)蛋白的表达,有效预防损害肠道屏障功能的疾病。
-AHR 激动剂的治疗潜力:以尿石素 A 为例
其他AHR激动剂,例如微生物代谢产物尿石素A(UroA),也显示出保护肠道屏障功能的潜力。UroA具有抗炎作用,并且可以通过激活AhR–NrF2依赖性通路来上调TJ蛋白的表达,从而促进肠道屏障的修复。
这些研究表明,激活肠道AHR通路对于治疗酒精性肝病(ALD)具有重要意义,因为ALD与TJ屏障的丧失密切相关。因此,AHR可能成为修复肠道屏障的一个有价值的治疗靶点,尤其是在与肠道屏障功能障碍相关的慢性疾病中。
-IDO 抑制剂:代谢平衡与潜在毒性
正向:抑制 IDO -> 阻断色氨酸向犬尿氨酸转化 -> 迫使色氨酸转化为吲哚
抑制IDO(一种将色氨酸转化为犬尿氨酸的酶)可能有助于治疗肠道屏障功能障碍。IDO抑制剂通过促进色氨酸转化为吲哚,增加AHR配体的生成,从而改善肠道完整性。
虽然IDO抑制剂在癌症治疗中显示出潜力,但它们在治疗肠道屏障损伤方面的应用仍需更多研究。Indoximod是一种IDO抑制剂,已被证明能有效维持细胞间的紧密连接,并显著减轻DSS诱导的结肠损伤。
反向:过度抑制 IDO -> 减少犬尿酸生成 -> GPR35 失去激活 -> 削弱屏障保护
需要注意的是,IDO抑制也可能导致不良的肠道毒性反应。完全阻断犬尿氨酸通路可能会适得其反,损害上皮屏障的完整性。
研究表明,化疗药物引起的肠道损伤会激活色氨酸-犬尿氨酸-犬尿酸通路,增加肠道内犬尿酸的生成。犬尿酸随后激活GPR35,从而增强肠道完整性。这意味着,过度抑制犬尿氨酸通路可能会降低犬尿酸水平,削弱GPR35介导的保护作用,并可能延缓屏障修复。
综上所述,色氨酸代谢在肠道健康中扮演着复杂的角色。因此,在开发治疗肠道屏障功能障碍的新方法时,需要进行更深入的研究。
临床挑战:个体化差异
虽然大量研究表明直接调节肠道微生物群可以改善肠道屏障功能并缓解肠肝疾病,但基于微生物的疗法在临床应用上仍然受到限制。
肠道微生物群产生的有益代谢物,如吲哚-3-乳酸(ILA),其增强肠道屏障的特性取决于宿主特异性的微生物群调节。临床疗效主要取决于患者的初始肠道微生物群组成,这会影响微生物的定植情况。
此外,宿主的遗传变异也是治疗结果的关键因素。例如,携带CARD9风险基因的炎症性肠病(IBD)患者,其膳食色氨酸向芳香烃受体(AHR)激活代谢物的微生物转化能力受损。这些发现解释了微生物靶向疗法中个体差异显著的分子机制。
益生菌作为疾病状态下耗尽的共生微生物,需要稳定的宿主微环境才能定植和发挥作用。如果事先不恢复受损的肠道生态系统,微生物干预疗法往往无法建立持久的微生物平衡或实现有意义的临床结果。因此,未来的治疗策略应采用结合微生物调节和微环境恢复的双靶点方法。
3
肠道干细胞再生
Lgr5+ 肠道干细胞 (ISCs):修复的原动力
肠上皮细胞的更新、修复和再生在很大程度上依赖于位于隐窝底部的Lgr5+肠道干细胞(ISCs)。
Lgr5作为ISCs的特异性标记,编码一种受体,该受体能够响应Wnt等信号,从而触发ISCs重编程为上皮细胞谱系。ISC的活性受到细胞外信号和旁分泌信号的精密调控,以维持肠道稳态,并在损伤发生时启动适应性分化,从而保障肠道的基本生理功能。
调控胆汁酸水平,恢复干细胞活力
胆汁酸在介导肠肝轴通讯中扮演着关键角色,并整合了调控ISC功能的饮食和代谢信号。近期研究提示,通过减少病理条件下肠道内过量的胆汁酸累积,或可为治疗炎症性肠病(IBD)相关的肠道损伤提供新的干预策略。
例如,FXR激动剂治疗通过抑制肝脏中CYP8B1的表达,进而降低肠肝胆汁酸水平,从而减轻胆汁酸对Lgr5+ ISCs的相关毒性。上述发现提示,基于跨器官代谢调节靶向ISCs有望成为治疗IBD的新型目标。
4
免疫调节
传统抗炎疗法的局限性
传统的抗炎疗法,包括皮质类固醇、5-氨基水杨酸制剂以及新型TNF-α单克隆抗体,一直是炎症性肠病(IBD)和其他免疫介导疾病的标准治疗方法。
虽然这些疗法能有效减轻炎症并缓解症状,但它们在实现长期愈合方面往往力有不逮,尤其是在肠道屏障方面。许多患者随着时间推移出现疗效丧失和疾病复发。例如,尽管抗IL-6抗体疗法在临床试验中对中度至重度克罗恩病(CD)或溃疡性结肠炎(UC)有效,但在一些患者中仍持续发生脓肿和肠穿孔等严重不良反应。
这些疗法通常未能解决根本的上皮功能障碍问题,而这正是维持慢性肠道炎症的关键因素。
新兴策略:直接靶向屏障修复
为了解决这些局限性,人们对靶向更直接参与上皮屏障修复的免疫通路越来越感兴趣。IL-10是一种有效的抗炎和组织再生细胞因子,最近开发的IL-10制剂旨在通过靶向黏膜屏障来增强治疗效果。
另一个有前景的靶点是IL-22,其受体IL-22R在上皮细胞上表达,这使得IL-22和IL-22R成为旨在恢复上皮完整性和增强黏膜愈合疗法的潜在候选者。
IL-22通过刺激AMPs(抗菌肽)和粘蛋白的产生以及ISC(肠道干细胞)的再生,在维持肠道稳态中发挥关键作用。因此,IL-22被认为是屏障修复的潜在治疗方法。
IL-22 激动剂的临床与代谢获益
IL-22融合蛋白激动剂Efmarodocokin alfa (UTTR1147A) 目前正在研究中,用于活动性溃疡性结肠炎(UC)和克罗恩病(CD)的治疗(NCT02749630)。
临床试验表明,UTTR1147A在UC患者和健康个体中都能激活IL-22R信号通路,并改善UC相关的菌群失调。
此外,肠道中IL-22信号的特异性激活可以在代谢紊乱模型中以微生物依赖的方式增强肝脏和全身葡萄糖和脂质代谢稳态。此外,IL-22还对MASLD(代谢功能障碍相关脂肪性肝病)、ALD(酒精性肝病)和饮食诱导的肥胖表现出积极作用。
当外源性给药时,IL-22通过其在肠上皮细胞(IECs)而非肝细胞上的受体发挥治疗作用,然后激活STAT3并抑制WNT–β-catenin信号传导以减少吸收性肠上皮细胞的数量。
然而,IL-22在肠道屏障维持中的作用仍存在争议,人们担心可能产生致病性的免疫调节作用,例如在结肠组织中介导CXCR2+中性粒细胞的趋化作用,以及增加对IL-23单克隆抗体Ustekinumab的抵抗力。这些观察结果表明,IL-22靶向疗法可能并非总能达到预期的疗效,需要进一步研究以更好地了解IL-22激活的全部影响和潜在副作用。
5
肠道屏障功能增强相关的临床试验进展
前面介绍了目前针对肠道屏障完整性的多种创新疗法,包括药物、微生物疗法、吸附剂、饮食干预和工程益生菌,并同时也探讨了这些疗法在临床验证中的进展和未来面临的挑战。
其实核心要点如下:
创新疗法:多项创新疗法正在进行临床验证,以靶向肠道屏障完整性。
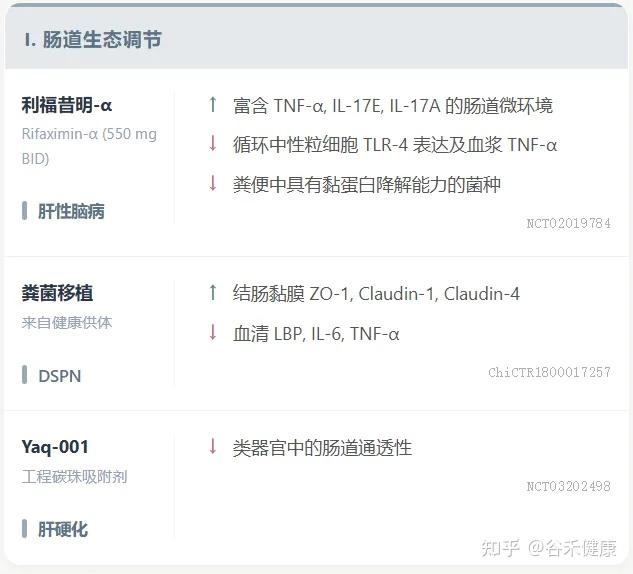
小分子创新 / 微生物疗法
ISM5411:一种新型肠道限制性选择性脯氨酰羟化酶结构域(PHD)抑制剂,通过AI平台开发,已完成I期临床试验。其在肠黏膜修复和免疫调节方面具有双重机制,在IBD模型中显示出显著疗效。
利福昔明-α (Rifaximin-α):通过上调粪便中的TNF-α和IL-17E来调节肠道微环境,增强抗菌防御,有效促进肠道屏屏障修复。
ZED1227:在乳糜泻中,作为转谷氨酰胺酶2抑制剂,显著改善十二指肠黏膜结构,减少上皮内淋巴细胞浸润,通过抑制免疫原性谷蛋白肽中谷氨酰胺残基的脱酰胺化来防止T细胞活化和黏膜损伤。
粪便菌群移植(FMT):健康供体FMT在恢复糖尿病远端对称性多发性神经病变(DSPN)患者肠道屏障功能和减轻全身炎症方面显示出治疗潜力。
工程益生菌:在恢复肠道屏障完整性和维持黏膜稳态方面具有显著治疗潜力,目前研究重点是结合其屏障增强和免疫调节作用,但仍在临床前阶段。
吸附剂:非吸收性、肠道限制性工程化碳珠吸附剂Yaq-001通过改善肠道屏障功能障碍和减少全身内毒素负荷,在肝硬化中显示出临床疗效。

饮食干预
临床研究证实,膳食干预在多种胃肠道疾病中有效。
谷氨酰胺补充剂:显著恢复肠道通透性并缓解感染后肠易激综合征的腹泻 (NCT01414244)。
在肠易激综合征-腹泻、代谢紊乱和轻中度克罗恩病中均显示出益处。

未来挑战
尽管这些进展显示了靶向屏障修复策略的广阔前景,但仍需要在人体试验中全面评估长期安全性和有效性,以推进临床应用。
肠道屏障功能障碍是多种胃肠和肠外疾病(如IBD、MASLD)的关键因素。传统免疫抑制疗法虽能改善症状,但无法根治屏障问题,且副作用明显。新型疗法应结合屏障修复策略,如干细胞再生、微生物疗法、胆汁酸调节、TJ调节剂等。
肠道屏障功能障碍与疾病互为因果,受遗传、环境等因素影响。屏障破坏可引发炎症和多器官功能障碍,导致MASH、IBD、CRC等。同时,疾病微环境反过来又损害屏障,形成恶性循环。
免疫抑制疗法可能抑制黏膜愈合,加剧微生物失衡。需深入研究肠道细胞间通讯,以确定有效治疗靶点。
独立于免疫抑制的屏障防御和修复是治疗肝肠疾病的重要目标。个性化治疗策略可能更有效。增强肠道屏障完整性在MASLD预防和逆转中潜力巨大。未来人体研究至关重要。
恢复肠道屏障是治疗肝肠疾病的重要机遇。新生物技术、再生医学和微生物组研究有望重塑胃肠道治疗格局。
主要参考文献:
Zhang Y, Liu Y, Liang X, Wen Y, Zhao J, He Y, Xie Q, Xie C. Intestinal barrier in chronic gut and liver diseases: Pathogenesis and therapeutic targets. Acta Pharm Sin B. 2025 Nov;15(11):5515-5536.
Macura B, Kiecka A, Szczepanik M. Intestinal permeability disturbances: causes, diseases and therapy. Clin Exp Med. 2024 Sep 28;24(1):232.
Farré R, Vicario M. Abnormal Barrier Function in Gastrointestinal Disorders. Handb Exp Pharmacol. 2017;239:193-217.
Brandl C, Bucci L, Schett G, Zaiss MM. Crossing the barriers: Revisiting the gut feeling in rheumatoid arthritis. Eur J Immunol. 2021;51(4):798–810.
Ramakrishna BS. Role of the gut microbiota in human nutrition and metabolism. J Gastroenterol Hepatol. 2013;28(Suppl 4):9–17.
Bäumler AJ, Sperandio V. Interactions between the microbiota and pathogenic bacteria in the gut. Nature. 2016;535(7610):85–93
谷禾健康
近年来,肠道屏障通透性异常增加(intestinal hyperpermeability)的临床诊断呈上升趋势,其病理生理机制涉及多个层面的复杂相互作用。
肠道屏障就像一堵城墙,一旦“城门大开”,各种“异类分子”如病原信号(PAMPs)、脂多糖(LPS)、未消化的蛋白碎片就会趁机溜进固有层和血液,掀起一场免疫风暴。
肠道固有层宛如“安检总站”,这里的树突状细胞和巨噬细胞负责利用“雷达”——比如Toll样受体——扫描入侵分子,然后拉响警报,释放大量炎症信号分子(TNF-α、IL-1β、IL-6)和趋化因子,引发局部炎症反应。
被激活的免疫细胞及其炎症介质通过门静脉循环和淋巴系统进入全身循环,触发远端器官的炎症反应,这种”肠-器官轴”的病理连接可能是类风湿关节炎、强直性脊柱炎、系统性红斑狼疮等自身免疫性疾病以及过敏性疾病、神经退行性疾病的潜在发病机制。
同时,肠道屏障功能受损导致肠道微环境稳态失调,有益共生菌群数量下降而潜在致病菌过度增殖,形成肠道菌群失调,进一步破坏肠道屏障功能并释放更多内毒素,加剧炎症反应,形成病理性正反馈循环。
造成肠道屏障告急的“罪魁祸首”很多:慢性压力、滥用抗生素、非甾体消炎药、高脂快餐、食品添加剂、各种感染和遗传易感性都可能“推波助澜”。理解这套复杂机制,有助于我们探索科学高效的“修复之路”。
本文介绍了目前肠道屏障受损的成因、健康影响和尝试干预改善过度渗透的肠屏障的一些方法。研究表明,预防肠道屏障受损以及在屏障受损时开发治疗方法至关重要。
肠上皮细胞是外界环境和体内环境之间最大的接触部位。胃肠道上皮屏障的功能是防止外来抗原和微生物进入,同时允许吸收必需的营养物质、水和电解质。
肠道屏障由物理屏障、生化屏障、免疫屏障和微生物屏障组成。
肠道屏障
Macura B,et al.Clin Exp Med.2024
▸ 物理屏障
物理(上皮)屏障是整个肠道屏障的重要组成部分。它由单层特化细胞组成:肠上皮细胞、杯状细胞(产生粘蛋白)、潘氏细胞(产生抗菌肽和蛋白质)、肠内分泌细胞、M细胞和肠干细胞。
这些细胞每3-5天更新一次。上皮细胞具有多种功能,并且紧密相连。
▸ 生化屏障
生化屏障由粘液构成,覆盖并保护上皮细胞免受病原体和有害物质侵害。
粘液是一种富含水分(90%–95%)、电解质、脂质(1%–2%)和蛋白质的稀薄分泌物,其中粘蛋白(1%–5%)为其主要结构和功能成分。
doi: 10.1007/164_2016_107.
上图展示了小肠和大肠粘液的生成与分布,包括内外粘液层的结构,并标示了杯状细胞从粘液产生到分泌和扩散的全过程(步骤1至7)。
粘液分泌是一个复杂的过程:杯状细胞在从隐窝底部迁移时用Muc2填充其分泌囊泡,并含有其他成分,例如IgG结合蛋白(FCGBP)的Fc片段、氯通道附件1(CLCA1)、酶原颗粒蛋白16(ZG16)和前梯度同源物2(AGR2)。这些囊泡与顶膜融合后,通过胞吐作用释放内容物,实现粘液分泌。
最后,粘蛋白可以分为两种不同的类型:跨膜粘蛋白和形成凝胶的粘蛋白。
▸ 免疫屏障
免疫屏障与肠道中淋巴组织的存在有关,称为肠道相关淋巴组织(GALT)。GALT系统分布于肠道粘膜及粘膜下层紧邻上皮细胞处,包括上皮内淋巴细胞、派伊尔集合淋巴结和淋巴细胞簇。
GALT系统含有抗原呈递细胞、T细胞、B细胞、浆细胞、巨噬细胞、肥大细胞和粒细胞,并且分泌型IgA(sIgA)主要在肠道中合成。
▸ 肠道屏障的功能-紧密连接调节通透性
大多数膳食蛋白质通过肠上皮细胞进行内吞作用。溶酶体降解导致蛋白质分解成更小的肽,从而避免激活免疫系统。液体和溶质在细胞之间运输。这种转运由紧密连接(TJ)调节。
紧密连接构建蛋白通过特殊的封闭小带蛋白(ZO)与肌动蛋白结合,肌动蛋白是细胞骨架的一部分。 这些蛋白质是调节紧密连接功能的分子的靶元件,因此负责调节肠屏障的通透性。
肠道屏障在外源性或内源性因素的作用下会受到损害,从而导致其正常功能被破坏。
▸ 饮食因素
不良饮食模式
高脂肪、高糖、高盐饮食
过度加工食品和快餐
缺乏膳食纤维的精制食品
过量饮酒
特定食物成分
人工添加剂、防腐剂
过量的乳化剂
某些人工甜味剂
过敏原食物(因人而异)
▸ 药物因素
抗生素:破坏肠道菌群平衡
非甾体抗炎药(NSAIDs):直接损伤肠粘膜
质子泵抑制剂:长期使用影响胃酸分泌
化疗药物:对肠道上皮细胞有毒性作用
▸ 生活方式因素
压力相关
慢性心理压力
睡眠不足或质量差
过度疲劳
运动相关
久坐不动的生活方式
过度剧烈运动(可能增加肠通透性)
▸ 环境因素
空气污染和化学毒素暴露
重金属污染
农药残留
吸烟
▸ 疾病和感染
肠道感染(细菌、病毒、寄生虫)
炎症性肠病
自身免疫疾病
糖尿病等代谢性疾病
▸ 年龄因素
衰老过程中肠道屏障功能自然下降
婴幼儿肠道屏障发育不完善
▸ 空气、水、食物污染等破坏了肠上皮屏障
近几十年来,城市化与全球化带来了巨大的环境变化,污染和气候变化,工业和家庭中常用的化学化合物,生态系统变化,不健康的饮食以及兴奋剂,主要是酒精,烟草和电子烟,可能会破坏皮肤和粘膜表面的上皮屏障。
空气、水、食物污染、微塑料、纳米颗粒、家用化学品和烟草烟雾是常见的上皮屏障破坏因素。这些因素复杂交互,但对生物体的影响取决于其组合及个体易感性。
▸ 微塑料和纳米颗粒会减少肠道粘液产生
近年来,食品和饮用水中的化学污染显著增加,即使是常用的食品添加剂、杀虫剂和饲料添加剂也在其中。最近,关于微塑料和纳米颗粒污染食品的报道越来越多。这些物质可以很容易地穿透组织并与细胞结构相互作用。
微塑料会改变蛋白质结构,与细胞膜脂质相互作用,诱导炎症基因转录,增加促炎细胞因子,导致内质网和线粒体功能障碍,甚至引发细胞因氧化应激而死亡。
纳米颗粒也能引起类似的蛋白结构变化和细胞膜相互作用。纳米塑料已被证明可以诱导炎症基因的转录,增加促炎细胞因子的水平,并改变某些蛋白质的表达。微塑料在胃肠道内吸收率高,可在体内外环境中积累。动物实验证实,聚苯乙烯微塑料会损伤肠道屏障并减少粘液分泌。
下表总结了被认为对肠道屏障状态具有有害影响的主要因素:微塑料,纳米颗粒,洗涤剂和乳化剂,肠道微生物群状态和饮食。
doi: 10.1007/s10238-024-01496-9
暴露于环境因素可以直接削弱肠道上皮屏障的完整性并改变微生物组结构。上皮屏障渗漏和肠道菌群失调常同时出现,促进炎症发生,部分原因是由于免疫细胞紧邻上皮层。
上皮屏障受损时,免疫系统被激活,引发局部炎症,炎症可通过免疫细胞及其分泌的细胞因子扩散至其他系统和器官。因此,多种疾病的发展与上皮屏障渗漏相关。肠上皮受损后,机会性病原体易定植,菌群多样性下降。微生物可移位至更深组织,导致微炎症。此外,化合物暴露还能诱导免疫系统表观遗传变化,促进某些疾病的发生。
▸ 生态失调→上皮损伤→慢性炎症
大量证据表明,微生物组对肠道上皮健康至关重要。正常微生物群调节紧密连接蛋白表达、血管生成、通透性和免疫功能。上皮屏障渗漏时,细菌和病原体穿透上皮,引发炎症并参与多种疾病。过敏性疾病的上升可能与菌群失调和多样性下降有关。
微生物群受到饮食、药物(特别是抗生素、精神药物、质子泵抑制剂)及遗传等影响。与人体共生的非致病性菌群有助于免疫调节,有利于预防慢性疾病并维持免疫平衡。
健康的微生物群通过调控屏障通透性、紧密连接和局部免疫,维持上皮屏障功能。缺乏免疫调节因子,如短链脂肪酸,可导致免疫系统过度激活、上皮炎症和疾病。这种反应主要由TH2细胞、ILC2和嗜酸性粒细胞介导,肥大细胞和巨噬细胞等也参与其中。而菌群失调、上皮损伤和慢性炎症会形成恶性循环,阻碍上皮再生。
同时损伤上皮中的炎症持续激活免疫细胞,可导致炎症扩散至其他器官。
微生物群变化、肠道屏障受损与疾病相互依存,但其因果关系仍有争议。尚不清楚是菌群失调导致屏障功能障碍和疾病,还是疾病先引发炎症和屏障损伤,进而加重细菌移位和器官损害。
因此,肠漏究竟是疾病的起因还是结果?此外,有研究表明,呼吸道或肠上皮屏障破坏以及其他屏障(如血脑屏障、血管内皮屏障)减弱,可能会促进代谢及自身免疫性疾病的发生。
▸ 胃食管反流病患者食管壁存在渗漏
胃食管反流病(GERD)最常见的症状是烧心和反酸,影响全球超过10%的成年人。胃镜检查显示,只有约30%的患者存在明显糜烂,其余70%(非糜烂性反流病,NERD)虽无可见损伤,但仍有症状。
GERD就像胃酸不断冲刷食管墙壁,表面虽完好但可能已“渗漏”,问题可能在于连接细胞的“水泥”。研究发现,GERD患者食管中即使无表面破损,其“水泥”成分也发生了变化:部分蛋白(如E-钙粘蛋白)减少,而其他蛋白(如CLDN-1和桥粒蛋白)则增加。
▸ 功能性消化不良存在十二指肠黏膜屏障渗漏
功能性消化不良(FD)是一种常见的胃肠道疾病,表现为早饱、腹胀、上腹痛或灼热,且常规检查无法发现明确病因。
最新研究发现,FD的核心问题在于十二指肠黏膜屏障渗漏,不仅离子,大分子也能穿透。该屏障损伤与肥大细胞和嗜酸性粒细胞增多,以及ZO-1和钙粘蛋白等紧密连接蛋白减少有关,说明低度炎症和屏障受损是FD的主要致病机制。
▸ 肠易激综合征与“肠漏”有关
肠易激综合征(IBS)是一种常见的功能性胃肠疾病,典型表现为反复腹痛和排便习惯改变(如腹泻、便秘或交替)。
尽管具体病因不明,但大量证据表明,其核心机制与“肠漏”有关。研究发现,几乎所有类型的IBS患者都存在肠道屏障通透性增加的问题。这具体表现为:肠道细胞间的“水泥”(即紧密连接蛋白ZO-1等)被破坏或减少,同时存在低度的黏膜炎症(如肥大细胞活化)。
这种屏障功能的损害,使得肠道内容物更容易“渗漏”过去,激活免疫系统,最终导致了IBS特有的腹痛和排便紊乱等一系列症状。
▸ 高血压患者肠道屏障功能障碍患病率较高
近年来,越来越多的研究关注肠道微生物群与高血压之间的关系。大量证据显示,肠道菌群的生态失调不仅可能促进高血压的发生和发展,还可能加重病情。
与此同时,高血压本身也会对肠道微生物群的组成产生影响,进一步加剧生态失调。研究表明,维持适当和健康的微生物群状态有助于血压的正常化,改善心血管系统的健康,而理想的血压水平同样有助于微生物群落的维持与恢复。
已有结果显示,高血压患者较非高血压患者更易出现肠屏障功能障碍,肠屏障的损伤被认为可能与高血压的发病机制密切相关。这一发现为进一步研究血压调控与肠道健康之间的复杂联系提供了新的思路,也提示改善肠道屏障功能或许有助于高血压的防治。
▸ 炎症性肠病患者即便无症状也会出现肠道通透性增加
炎症性肠病(IBD)患者的肠道微生物群特征主要表现为促炎细菌数量的明显增加,同时多种细胞因子的表达也发生了显著变化。这些变化会导致机体免疫反应失衡,加剧炎症进程。
值得注意的是,在患者尚未出现明显的临床症状之前,尽管处于无症状期,肠道的通透性实际上已经发生了异常改变。这表明肠道屏障功能的损伤可能早于症状表现,为疾病的早期诊断和干预提供了理论依据。
▸ 肠道屏障和菌群稳定影响肝脏健康
研究数据显示,肠上皮细胞和血管屏障的损伤在非酒精性脂肪肝的发展过程中起着关键和必要的作用。肠上皮屏障功能的破坏,使得肠道内容物更容易进入血液循环,进而促进肝脏炎症和脂肪堆积。
此外,肠道菌群的失调以及肠道菌群结构的破坏与这一过程密切相关。肠道菌群异常会导致有害菌数量增加,正常菌群比例下降,其产生的代谢产物也会对肠道细胞产生毒性作用,影响细胞功能和屏障完整性。
这些机制不仅涉及非酒精性脂肪肝的发生与发展,在酒精性肝病中同样存在。酒精摄入可加重肠上皮与血管屏障的损伤,进一步削弱肠道屏障功能,从而成为酒精性肝病患者肠上皮功能障碍的主要原因之一。由此可见,肠道屏障及菌群的稳定性对于肝脏健康至关重要。
▸ 免疫性疾病患者存在菌群失调和屏障渗漏
类风湿性关节炎患者表现为血清zonulin水平升高、肠道菌群失调和屏障渗漏,强直性脊柱炎患者可见亚临床肠道炎症。潘氏细胞对肠道菌群失调的激活可能是疾病早期症状的原因,并证实了脊椎-关节轴的存在。
▸ 帕金森、自闭症患者存在胃肠道症状
在帕金森病中,患者在诊断前数年就表现出胃肠道症状。α-突触核蛋白是帕金森病的典型蛋白质,在肠道中合成,然后通过迷走神经运送到中枢神经系统。相比之下,自闭症谱系障碍儿童会出现肠道症状,如便秘、腹痛和腹泻。对肠道微生物群的研究表明,微生物群多样性与神经系统疾病、拟杆菌减少以及肠粘膜中紧密连接蛋白表达减少之间存在负相关关系。
▸ 糖尿病患者的肠道通透性发生变化
研究显示,肠道通透性变化早于1型糖尿病的临床症状出现,并且与紧密连接蛋白和生态失调的改变,尤其是丁酸盐产生菌减少密切相关。2型糖尿病患者的肠道菌群失调加重了屏障损伤,并促进了炎症状态,导致胰岛素抵抗和β细胞功能障碍。
此外,2型糖尿病患者的高血糖有助于持续的促炎状态。肥胖则与慢性低度炎症密切相关,主要表现为脂肪组织中促炎巨噬细胞的活性增加。代谢紊乱在肥胖人群中也更为常见。
doi: 10.1007/s10238-024-01496-9
在间接或直接诊断试验中,可以评价肠屏障通透性水平。
▸ 口服物质测试
间接检测方法包括口服试剂后测定其在血液或尿液中的浓度,最常用的是糖。乳果糖/甘露醇(L/M)试验是评估小肠通透性的常用方法,通过测量尿中两者的排泄量进行判断。乳果糖为大分子,仅在细胞间连接受损时吸收,甘露醇为小分子能自由通过肠屏障。L/M试验非侵入性且灵敏度高,此外还可使用其他单一或多种糖类的检测方法。
▸ 测量内源物质水平
此外,还可以测量血液中内源性物质的水平。这样的生物标志物包括例如连蛋白、脂肪酸结合蛋白(FABP)、瓜氨酸、胰高血糖素样肽(GLP)-2、脂多糖、脂多糖结合蛋白(LBP)或粪便α1抗胰蛋白酶(AAT)。然而,这些测试不像糖测试那样敏感。
▸ 新型影像技术
新的成像技术,特别是共聚焦激光显微内镜,允许在体内评价静脉注射荧光素作为造影剂后肠屏障的完整性。共聚焦激光显微内镜目前用于诊断胃肠道癌症,以及肠易激综合征或乳糜泻。放大1000倍可以检测肠上皮内的病理变化。
▸ 肠道菌群检测
肠道菌群检测可以提供非常重要的间接线索和风险评估。肠道菌群与肠道屏障健康密切相关。菌群测序可以发现一些可能导致或指示肠道屏障通透性增加的风险因素,例如:嗜黏蛋白菌,AKK菌以及扭链瘤胃球菌等菌对的丰度,以及产丁酸菌减少,特定有害菌增多:某些细菌(如部分革兰氏阴性菌)会产生脂多糖(LPS),这是一种强烈的炎症触发物,会破坏肠道屏障。菌群多样性降低:通常一个多样性低、不稳定的菌群生态系统,其维护屏障功能的能力也会下降。
总之,肠道菌群检测可以揭示与肠道屏障功能受损相关的菌群失衡状态,提供有力的间接证据和风险预警。
功能性胃肠道疾病(FGID)在临床上发病率高、症状慢性且治疗效果有限,已成为重大公共卫生问题。多种病理机制被提出,其中屏障通透性受损是常见特征。局部免疫激活与屏障损伤的先后关系及其在症状发生中的作用仍需进一步研究。
目前的研究表明,治疗这些疾病的一个很有前景的策略,就是直接针对这道受损的屏障进行修复。
这主要包括两大类治疗方法:
一是直接使用药物来加固和修复肠道细胞间的连接,恢复屏障的完整性;
二是通过靶向调节局部的免疫反应,减轻炎症,从而间接保护和修复肠道屏障。
对屏障功能的直接影响
①谷氨酰胺可修复部分人群的肠道通透性
谷氨酰胺是一种非必需氨基酸,是肠细胞和结肠细胞的重要能量来源。谷氨酰胺在接受腔内禁食的Caco-2细胞中保持蛋白质合成和对离子和4 kDa葡聚糖分子的细胞旁渗透性。它还可降低大分子渗透性(40 kDa),其剥夺可促进TNF-α诱导的细菌易位,而不影响TEER。这些和其他体外研究表明,谷氨酰胺补充通过干扰泄漏途径恢复了对离子和小分子增加的细胞旁渗透性。
然而,在人身上的研究结果却不那么一致,有时甚至相互矛盾。这可能是因为补充谷氨酰胺的时机很关键——最好是在肠道屏障还没受损或者刚刚受损时就介入。
不过,最近一项针对腹泻型肠易激综合征(IBS-D)患者的研究带来了好消息:口服谷氨酰胺显著改善了患者的症状,并成功修复了他们受损的肠道通透性。这表明,对于特定人群,谷氨酰胺可能是一种修复“肠漏”的有效治疗选择。
②MLCK抑制剂有助于减轻肠漏
如前所述,通过肠上皮细胞的泄漏途径和细菌移位由肌球蛋白轻链激酶(MLCK)控制。因此,MLCK抑制剂可能是治疗或预防屏障功能改变的潜在药物。
MLCK的物质是控制肠道屏障“阀门”的关键开关。当它被激活时,肠道细胞间的连接就会松开,导致“肠漏”和细菌穿透。因此,开发能抑制MLCK的药物(即MLCK抑制剂)就成了一种非常有前景的治疗思路。
目前,这类药物在动物实验中已有效预防压力或毒素引起的肠道通透性增加及内脏高敏。如果能在人类中安全应用,MLCK抑制剂有望成为治疗“肠漏”相关胃肠疾病的新选择。
③Zonulin肽抑制剂可能修复通透性并预防肠炎
研究发现,Zonulin是一种调节肠道通透性的关键物质。当肠道受麸质或特定细菌等刺激时,Zonulin释放,可打开细胞间紧密连接,增加肠道通透性,导致“肠漏”。
基于此,科学家开发了Zonulin肽抑制剂(如醋酸拉唑肽),能有效阻断Zonulin作用,“锁上”肠道屏障。动物实验显示该药物可修复通透性并预防肠炎,但其在人类中的疗效尚需验证。
临床试验中,虽然乳糜泻患者用药后自觉症状改善,但肠道通透性并无明显下降。因此,Zonulin抑制剂是否能真正用于胃肠道疾病治疗,还需进一步研究确证。
对免疫激活的影响
研究发现,FGID中的炎症主要与肥大细胞、嗜酸性粒细胞和T细胞的轻度活化有关。因此,目前的治疗尝试大多集中在稳定“肥大细胞”上,因为它在肠易激综合征(IBS)等疾病中扮演了核心角色。
①药物治疗
一些药物已经显示出潜力:
-5-氨基水杨酸:可以减少炎症细胞的浸润。
-酮替芬和色甘酸二钠:作为肥大细胞稳定剂,它们在改善IBS和功能性消化不良(FD)的症状方面取得了良好效果,但其具体如何修复肠道屏障的机制还有待阐明。
此外,一些靶向神经调节和抑制肥大细胞的新型药物(如CRF拮抗剂、大麻素类物质)在动物实验中也表现不错,但它们在人体中的实际效果还需要进一步的临床研究来验证。
②缓解肠道炎症的药物
生物治疗主要包括促炎细胞因子抑制剂和整合素拮抗剂:抗TNF治疗、抗IL-12/23治疗、抗整合素治疗。生物疗法,尤其是抗TNF疗法是有效的治疗方法,但对TNF抑制剂的原发性无效或部分患者的继发性无效需要寻找新的治疗方案。
重要的是,炎症环境可能会对上皮干细胞的功能产生负面影响,因此可能会阻碍健康上皮的重建。 肠漏的治疗应该开始尝试确定肠屏障损伤的原因,然后消除这个因素。在肠道屏障恢复之前,使用缓解肠道炎症的药物似乎是合理的。
③恢复肠道微生物群
益生菌是活的微生物,对宿主的健康有有益的影响。益生菌管理减少肠渗漏,其中,影响肠道免疫调节和抗炎作用(例如,sIgA产生的增加)、抗炎作用、加强上皮屏障(例如,粘蛋白和短链脂肪酸(SCFA)的合成增加,以及限制病原微生物生长的细菌素(例如β防御素)的产生。
益生菌还可以增加构成紧密连接的蛋白质的合成。对肠道屏障状态具有保护作用的益生菌主要有鼠李糖乳杆菌GG、乳双歧杆菌BB-12、嗜酸乳杆菌、植物乳杆菌、双歧杆菌、大肠杆菌等。
恢复正常肠道微生物群的另一种方法是粪便微生物群移植(FMT)。该疗法涉及将从健康供体获得的胃肠道微生物群转移到受体的胃肠道。实施前需准确评估患者和供体的肠道及菌群状况,避免盲目移植导致免疫反应和屏障损伤。
④低FODMAP饮食并增加多酚摄入
FODMAP饮食以短链碳水化合物和多元醇为主,这些成分吸收不良且易发酵,因渗透性强会增加肠腔含水量。FODMAP对肠道微生物群和屏障功能有益,但IBS或IBD患者采用低FODMAP饮食更能减少气体和肠腔扩张,减轻症状。
研究显示,维生素A和D可多途径改善肠道屏障,充足摄入能提升微生物多样性、强化紧密连接、调节免疫反应。
膳食纤维通过发酵生成短链脂肪酸(如丁酸盐),有助于加强粘蛋白和紧密连接,调节免疫,防止屏障通透性增加。
多酚类物质有助于增强紧密连接和黏液分泌,提高抗氧化力,富含多酚的饮食有助于降低肠道屏障障碍风险。
部分草药如普洱茶、芙蓉、蒲公英、姜黄等具备调节微生物群、强化屏障和抗炎作用,但其机制和疗效尚不完全明确,需注意提取纯度。
蘑菇富含维生素D、多酚和多糖,是益生元来源,可通过调节儿茶酚胺及炎症反应影响肠道微生物群。
⑤适当体力活动可降低肠道屏障障碍风险
众所周知,体育活动或锻炼可以增加肠道微生物群的多样性,增强SCFA的产生并刺激抗炎机制,主要是有氧运动,如跑步,骑自行车,健身运动,可以降低肠道屏障功能障碍的风险。
研究结果表明,体力活动以依赖于运动强度的方式调节肠道屏障通透性水平。定期、中等强度的体育锻炼对肠道上皮状态和肠道屏障完整性有积极影响。运动增加了肠道微生物组的多样性,有助于维持肠道屏障的完整性,还显示出抗炎和抗氧化作用。适度的体力活动可能是治疗肠漏的一个有利因素。
但是,高强度的体力活动,典型的竞争性或极限运动,与胃肠道疾病和肠道通透性增加的症状的高发病率相关。这是身体的应激源,由于体内血液的重新分配,体温过高和脱水,导致肠细胞缺氧。
近几十年来,过敏性和自身免疫性疾病的发病率显著增加,例如哮喘、特应性皮炎、过敏性鼻炎、慢性鼻窦炎、食物过敏、乳糜泻和炎症性肠病。全身性和代谢性疾病,如糖尿病、肥胖症、多发性硬化症、类风湿性关节炎、红斑狼疮、强直性脊柱炎以及阿尔茨海默病、帕金森病、慢性抑郁症和自闭症谱系障碍也成为日益严重的健康问题。
现代生活中的食品添加剂、抗生素滥用、环境污染物、慢性压力和过度依赖加工食品等因素正是导致这一代人屏障功能普遍衰退的隐形杀手。面对这一挑战,当前的科学建议首先聚焦于预防屏障损伤,通过建立标准化检测体系、开发肠道友好型产品替代有害化学物质、推广个性化营养干预等手段来实现。
食品工业也将从”填饱肚子”向”滋养健康“转型、医疗健康从”治疗疾病”向”维护屏障”转变、营养保健从”营养补充”向”功能修复“升级等多个行业带来了前所未有的发展机遇。
通过将传统医疗手段与肠道屏障修复、微生物群调节相结合,不仅能显著提高疾病治疗效果,更重要的是实现从“治病”到”防病”的医疗模式转变。
主要参考文献:
Macura B, Kiecka A, Szczepanik M. Intestinal permeability disturbances: causes, diseases and therapy. Clin Exp Med. 2024 Sep 28;24(1):232.
Farré R, Vicario M. Abnormal Barrier Function in Gastrointestinal Disorders. Handb Exp Pharmacol. 2017;239:193-217.
Brandl C, Bucci L, Schett G, Zaiss MM. Crossing the barriers: Revisiting the gut feeling in rheumatoid arthritis. Eur J Immunol. 2021;51(4):798–810.
Ramakrishna BS. Role of the gut microbiota in human nutrition and metabolism. J Gastroenterol Hepatol. 2013;28(Suppl 4):9–17.
Bäumler AJ, Sperandio V. Interactions between the microbiota and pathogenic bacteria in the gut. Nature. 2016;535(7610):85–93.
Ostaff MJ, Stange EF, Wehkamp J. Antimicrobial peptides and gut microbiota in homeostasis and pathology. EMBO Mol Med. 2013;5(10):1465–83.
Hansson GC. Role of mucus layers in gut infection and inflammation. Curr Opin Microbiol. 2012;15(1):57–62.
Gerbe F, Legraverend C, Jay P. The intestinal epithelium tuft cells: specification and function. Cell Mol Life Sci. 2012;69(17):2907–17.
Anderson JM, Van Itallie CM. Physiology and function of the tight junction. Cold Spring Harb Perspect Biol. 2009;1(2):a002584.
Drąg J, Goździalska A, Knapik-Czajka M, Matuła A, Jaśkiewicz J. Nieszczelność jelit w chorobach autoimmunologicznych. Państwo i Społeczeństwo. 2017;17(4):133–46.
Camilleri M. Leaky gut: mechanisms, measurement and clinical implications in humans. Gut. 2019;68(8):1516–26.
Wood Heickman LK, DeBoer MD, Fasano A. Zonulin as a potential putative biomarker of risk for shared type 1 diabetes and celiac disease autoimmunity. Diabetes Metab Res Rev. 2020;36(5):e3309.
Chelakkot C, Ghim J, Ryu SH. Mechanisms regulating intestinal barrier integrity and its pathological implications. Exp Mol Med. 2018;50(8):1–9.
Wright SL, Kelly FJ. Plastic and human health: a micro issue? Environ Sci Technol. 2017;51(12):6634–47.
Yee M-L, Hii L-W, Looi CK, et al. Impact of microplastics and nanoplastics on human health. Nanomaterials.2021;11(2):496.
Holloczki O, Gehrke S. Can nanoplastics alter cell membranes? ChemPhysChem. 2020;21(1):9–12.
Holloczki O, Gehrke S. Nanoplastics can change the secondary structure of proteins. Sci Rep. 2019;9(1):16013.
Xu M, Halimu G, Zhang Q, Song Y, Fu X, Li Y, Li Y, Zhang H. Internalization and toxicity: a preliminary study of effects of nanoplastic particles on human lung epithelial cell. Sci Total Environ. 2019;694:133794.
Jin Y, Lu L, Tu W, Luo T, Fu Z. Impacts of polystyrene microplastic on the gut barrier, microbiota and metabolism of mice. Sci Total Environ. 2019;649:308–17.

谷禾健康

今年夏天的高温相信大家都有所感受,连续数十日的高温让我们感到非常炎热,但随着逐渐入秋,天气也渐渐变冷,我们需要适当地增添一些衣物。
环境温度不仅与我们的生活相关,对人体的健康也有重要影响。最近的研究将环境温度的变化与代谢、肠道微生物以及抗癌免疫反应联系起来。
谷禾将这些研究进行了一些整理归纳,主要讲述环境温度引起的全身代谢变化如何影响抗肿瘤免疫反应。我们还描述了温度变化期间肠道微生物组和免疫代谢之间的相互作用,并涵盖了环境温度调节肿瘤进展的已知机制。
帮助人们认识环境温度对身体的影响,有助于更好地对自己的健康进行管理。甚至可能有助于发现代谢疾病和癌症的治疗新方法。
本文主要分为以下四部分进行讲述
● 环境温度与脂肪代谢
● 不同温度下的免疫反应
● 环境温度对肠道微生物群的影响
● 环境温度与癌症及免疫治疗
环境温度的差异会影响生物体的物理需求、代谢活动和肠道微生物群。
脂肪组织
脂肪组织是指由大量群集的脂肪细胞构成,聚集成团的脂肪细胞由薄层疏松结缔组织分隔成小叶。
葡萄糖和脂质的摄取是癌细胞的基本能量来源,脂肪组织在环境温度变化期间调节能量平衡方面起着重要作用。
脂肪组织包含几种不同类型的细胞,主要分为白色脂肪组织(WAT)和棕色脂肪组织(BAT)。
●白色脂肪组织
白色脂肪组织(WAT)由单泡脂肪细胞构成,通常主要负责以甘油三酯的形式储存脂质,是我们人体最大的能量储存库。
单泡脂肪细胞,细胞中央有一大脂滴,胞质呈薄层,位于细胞边缘,包绕脂滴。
●棕色脂肪组织
棕色脂肪组织(BAT)是指动物体内呈棕色的脂肪组织。其中的脂肪细胞体积较小,胞质中有多个较小的脂滴,并有较多的线粒体。细胞核呈圆形,位于细胞中央。
在寒冷环境中,棕色脂肪组织消耗较快,能产生大量热量、温暖流经其周围的血流,有利于御寒。
利用葡萄糖和脂肪通过解偶联氧化磷酸化(主要由解偶联蛋白-1(UCP-1)介导)产生热量,这一过程称为非颤抖产热。
注:大量的研究表明棕色脂肪组织不仅具有御寒功能,而且还会燃烧多余脂肪和糖分,产生热量,防止体内储存过多的脂肪。
低温下脂肪组织会褐变
在长时间的冷暴露后,棕色脂肪细胞也会出现在白色脂肪细胞中,这一过程通常称为WAT褐变。
由于拥有大量UCP-1阳性线粒体,这些棕色脂肪细胞的产热能力高于白色脂肪细胞。
解偶联蛋白-1(UCP-1)是唯一在棕色脂肪组织(BAT)中表达的解偶联蛋白质,UCP-1的主要功能是参与棕色脂肪组织的产热调节和能量代谢来维持机体的能量代谢平衡。
✦促进WAT褐变的因素
一些因素可以促进WAT褐变,从冷暴露、耐力锻炼和饮食习惯,到通过β3-肾上腺素能受体激活的交感神经刺激,以及微生物群的改变。
冷暴露诱导β3-肾上腺素能受体信号的激活可促进葡萄糖、脂肪酸和富含甘油三酯的脂蛋白从内部贮存器摄取到棕色脂肪组织,然后将其用作非颤抖产热的能量来源。
温度影响下的脂肪组织
热中性区
什么是热中性区?
热中性区是指在环境温度的某一范围内,内温动物耗氧量最低,并且不随环境温度而变化,是代谢的稳定区。小鼠的热中性区在有光照期时为29°C,在黑暗时为33°C。
内温动物——通过自身体内氧化代谢产热来调节体温的动物
因此,20-22°C(室温,RT)的房屋温度对小鼠来说是一个较温和的寒冷环境,通过能量资源的比例分配,以实现产热。
✦热中性区下代谢减弱
由于交感神经活性受到抑制,耗氧量和产热率降低,与室温饲养的小鼠相比,热中性导致脂肪组织“变白”。
在没有解偶联蛋白-1的情况下,热中性会导致小鼠肥胖表型,很可能是由于在此温度下缺乏较高的代谢。
✦棕色脂肪组织比白色脂肪组织代谢更强
与白色脂肪组织相比,即使在温暖温度下处于基础状态,棕色脂肪组织也能增加葡萄糖摄取、乳酸释放和代谢活性。
值得注意的是,经过热中性处理的白色脂肪细胞在冷暴露后可以重新获得产热能力,这一过程部分由不同温度条件下的转录和表观遗传调控介导。
活体细胞类型特异性分析表明,白色脂肪细胞经历了白化诱导的染色质变化,从而能够保护其表观遗传记忆免受先前的寒冷影响。
不过还需要进行进一步研究,以充分了解导致脂肪组织温度驱动变化的细胞机制,以及特定皮下脂肪与内脏脂肪库在肿瘤生长过程中发生褐变的偏好。
温度变化影响的其他器官
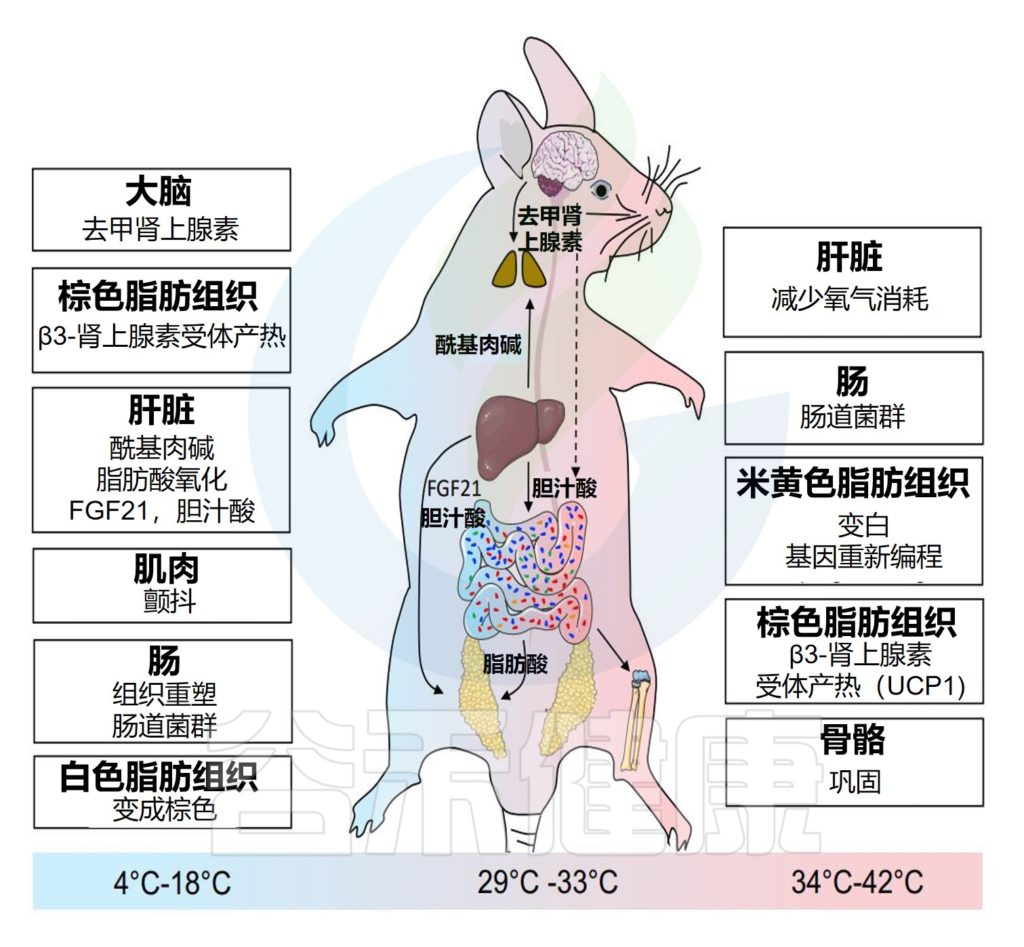
温度变化导致不同器官的代谢重编程
Wang H,et al.FEBS J.2022
生物体在不同环境温度下的生物物理需求,包括它们在不同组织和肠道微生物群中的代谢活动都不同。
▷寒冷环境
皮肤神经元感受到的冷刺激会激活交感神经系统,该系统负责棕色脂肪组织中去甲肾上腺素的局部生成。
交感神经系统(SNS)对整体生理功能具有调节意义: 在环境急剧变化时,交感神经系统可以动员机体许多器官的潜力以适应环境的变化。
去甲肾上腺素(NE),它既是一种神经递质,也是一种激素。
冷暴露也会引发肌肉颤抖,从而促进棕色脂肪组织产热。在长时间寒冷暴露期间,白色脂肪组织的褐变也通过各种机制参与生热,包括刺激肝脏FGF21和胆汁酸(BA)。肝脏酰基肉碱代谢的增加有助于肝脏和其他组织中的脂质氧化。
胆汁酸是胆汁的重要成分,在脂肪代谢中起着重要作用。
此外,寒冷诱导的食欲和代谢变化导致肠道微生物群落的厚壁菌/拟杆菌比率发生变化,厚壁菌的数量超过拟杆菌(从室温下的72.6%到低温下的35.2%),粪便和盲肠中几乎没有疣状杆菌门,影响到各种器官。
▷温暖环境
热暴露会导致微生物群发生相反的变化,通过增强多胺的产生,对骨重塑有显著的有益影响。肝脏热适应后,静息耗氧量降低。随着温度的升高,白色脂肪细胞可以经历表观基因重编程。
冷暴露(4oC-18oC);热中性温度(29°C-33°C);热暴露(≥34°C)。
建议
谷禾查阅到一项研究比较了温和与炎热环境下的运动脂肪的消耗率。结果显示,热环境显著降低了脂肪氧化率。
可以说,在相对适宜的温度下比高温下运动的减肥效率更好。对于那些试图在运动中增加脂肪氧化的人来说,不建议在高温下运动,同时也可以避免中暑。
免疫细胞监测并响应环境代谢线索以及各种内源性触发因素,导致其功能改变。人类和动物研究表明,不同的环境温度可以改变细胞和体液方面的免疫反应。
免疫系统和生物体的致热反应之间的相互作用可以在生命史理论的背景下进行观察,该理论认为生物程序之间资源的优先次序取决于环境。
在恶劣环境中,资源从增长和繁殖项目转移到维护项目。有趣的是,各种维护程序之间也存在资源竞争,其中对寒冷的代谢反应需要与其他耗能高的程序(如免疫反应)进行能量平衡。
不同温度下的免疫细胞
环境温度对小鼠和人类的代谢和免疫影响

Wang H,et al.FEBS J.2022
✦寒冷使活性降低,免疫反应受限
寒冷降低了单核细胞上的主要组织相容性复合物II类(MHCII)并使其活性降低,这反过来又抑制了自身免疫过程中致病性T细胞的启动。
这导致T细胞细胞因子表达减少,从而减轻神经炎症。这些数据表明,由于小鼠免疫系统的能量可用性降低,资源优先用于产热,导致免疫反应受限。
虽然这种竞争对自身免疫有明显的保护作用,但它也可以使寒冷期间对某些病毒感染的易感性增加,这值得进一步研究。
✦热中性环境下增强了免疫细胞
此外,热中性环境增强了免疫细胞在肿瘤微环境中的渗透。这与不断积累的证据一致,即反复寒冷暴露会抑制小鼠的免疫活动,而温暖会激发更大的抗病毒免疫反应。
有趣的是,处于热中性环境的小鼠在骨髓中积累LyG6+单核细胞,但在循环血液中减少,从而对动脉粥样硬化产生保护作用。
注意
虽然这些数据有力地支持了能量资源优先化会限制有利于增加产热的免疫反应的观点,但其作用还不能完全确定。
有证据表明,寒冷环境温度对免疫系统既有抑制作用,又有支持作用,这在一定程度上取决于寒冷暴露的时间长短。
几项研究表明,虽然短期冷刺激会降低人类淋巴增殖反应和Th1细胞因子的产生,但它也会引发炎症反应和免疫抑制特征基因。根据小鼠的数据,长期适应冷暴露会导致抗炎反应,这意味着冷适应期间免疫反应的变化可能具有普遍重要性。
免疫反应与脂肪组织的相互作用
免疫反应同时也会反过来调节瘦鼠和肥胖鼠的脂肪代谢。
抗炎信号的募集与脂肪中的白色脂肪生成密切相关。白色脂肪组织的低度炎症是肥胖的标志,与白色脂肪组织中促炎症(M1型)巨噬细胞的浸润和激活以及褐变能力的降低有关。
✦白色脂肪组织促使巨噬细胞极化
早期的报告表明,冷暴露后,白色脂肪组织被数量增加的嗜酸性粒细胞浸润,这可能会促使巨噬细胞极化,从促炎状态转变为抗炎状态。
白色脂肪组织驻留巨噬细胞可通过几种潜在机制发挥其褐变作用。M1型极化巨噬细胞通过结合整合素α4和血管细胞粘附分子1(VCAM-1)粘附到脂肪细胞,导致持续抑制。
✦巨噬细胞吸收并降解白色脂肪组织
一种称为交感神经元相关巨噬细胞的巨噬细胞亚群吸收并降解白色脂肪组织交感神经末梢网络释放的去甲肾上腺素。交感神经相关巨噬细胞在肥胖中增加,这些细胞摄取去甲肾上腺素的消融增加了褐变。
此外,在热中性状态下,小鼠棕色脂肪组织中巨噬细胞的浸润和相应的促炎细胞因子IFN-γ、TNF-α、IL-1β和IL-6增加。
不同温度下的免疫细胞数量
•冷暴露下免疫细胞数量变化暂不确定
在人类中,每日30–60分钟冷暴露(冷水游泳14°C-18°C)三周后,辅助T细胞(CD4+)和细胞毒性(CD8+)T细胞计数没有显著变化;然而,在同样的间歇性感冒六周后,T淋巴细胞增加。另一方面,短期(20–60分钟)冷暴露导致外周CD4+数量下降。
•室温下T细胞增殖受到抑制
与热中性温度相比,在室温条件下,髓源性抑制细胞(MDSC)通过上调β3-肾上腺素能受体,部分抑制T细胞增殖。
如上所述,冷暴露通过降低单核细胞MHCII的表达来减少T细胞启动。此外,据报道,急性热应激会增加自然杀伤细胞(NK细胞)的数量,;而慢性热应激抑制脾脏NK细胞的活性,并增加Th2与Th1的比值。
髓源性抑制细胞(MDSC)是一类未成熟的免疫细胞,有免疫抑制功能,可强力抑制T细胞
NK细胞是一种细胞毒性淋巴细胞,对先天免疫反应至关重要
✦全身热疗可能会增强免疫作用
小鼠和人类对高温(39°C-43°C)的免疫反应包括上调树突状细胞中的T细胞启动标记物,增强Toll样受体4(TLR4)+巨噬细胞,以及增强淋巴细胞向淋巴的转运。
这种免疫调节伴随着高温后热休克蛋白水平的增加及其与免疫细胞上热休克蛋白受体的相互作用。
热休克蛋白(HSP)是在从细菌到哺乳动物中广泛存在一类热应激蛋白质。当有机体暴露于高温的时候,就会由热激发合成此种蛋白,来保护有机体自身。
在人类癌症患者中,局部热疗不会改变细胞因子水平,然而,全身热疗会升高IL-1、IL-6或TNF-α,表明全身热疗可能对免疫治疗有益。
冷暴露下脂肪组织对免疫的影响
脂肪组织是一个高度代谢活性的器官,储存和释放脂质代谢产物。
•脂质总体成分变化
在对腹股沟白色脂肪组织进行的脂质组学/RNA序列组合分析中,短期(3天)冷暴露导致脂质成分的总体变化:特别是甘油磷脂和鞘脂的富集,以及产热机制、脂肪酸代谢、三酰甘油酯和甘油磷脂合成的转录组学变化。
•氨基酸大幅增加
然而,慢性(10天)冷暴露通过富集三羧酸循环中间产物,导致小鼠棕色脂肪组织和皮下白色脂肪组织中的线粒体葡萄糖氧化,这在内脏白色脂肪组织中未观察到。
短期冷暴露也会改变血浆氨基酸库,导致谷氨酰胺和支链氨基酸大幅增加,如谷氨酰胺含量、脯氨酸、色氨酸和苯丙氨酸,可以作为棕色脂肪组织产热的能源。
•有助于免疫细胞的激活
此外,研究还指出,其他代谢机制也参与其中,如脂肪酸、肌酸和钙的无效循环对冷适应产热的影响。脂肪组织中的生热诱导脂解可能有助于外周循环和重要代谢器官中免疫细胞的招募和激活。
在瘦个体中,脂肪组织相关巨噬细胞体积小,在脂肪细胞中稀疏分布,但在肥胖个体中,它们积累脂质并聚集。
其他潜在的代谢信号,如脂肪酸、氨基酸、缺氧和脂肪细胞应激,被认为有助于免疫细胞和脂肪细胞在不同温度下的相互作用;不过还需要更多的研究来更好地理解它们的重要性。
人体微生物群分布于身体的各个部位,包括呼吸道、皮肤以及肠胃。
肠道微生物
胃肠道微生物群落丰富多样,主要由放线菌、拟杆菌、厚壁菌、变形杆菌和疣状杆菌门的严格厌氧菌组成,肠道病毒和真菌种类繁多。
✦保护性免疫作用
肠道微生物群除了在食物消化和宿主生理调节中的作用外,越来越多的证据表明,它在增强癌症患者抗肿瘤免疫治疗中的保护性免疫作用。
环境因素对微生物的影响
一些环境因素,如营养素、盐和温度,影响微生物群的组成、定殖和代谢活动。
生命的组成部分天生对温度敏感。温度过高时,蛋白质变性,核酸失去碱基配对,质膜变得过于流动。温度太低时,一切都会变慢:酶工作效率低下,核酸形成不方便的二级结构,质膜变硬。
因此,微生物和其他有机体调整其细胞过程,使其在特定温度范围内生长,并在超出其最佳温度范围时作出响应。
✦环境温度会改变肠道微生物的功能
最近研究表明,环境温度变化会改变肠道微生物组的多种生物功能。反过来,肠道微生物群在多个层面上参与全身代谢。
一方面,适应低温的微生物群增加了营养素的吸收,从而影响从饮食和储存中获取能量,并调节免疫反应。另一方面,它通过调节棕色脂肪组织和白色脂肪组织褐变和产热来影响能量消耗。
✦肠道微生物对温度的适应能力如何?
•具有耐热性
大肠杆菌和其他肠杆菌科成员具有耐热性;该科中的许多物种在比宿主温度低和高的温度下都能较好地生存。
例如,耶尔森氏菌将在接近0°C的温度下继续生长,而实验室大肠杆菌菌株能从大约8°C生长到42°C,并很容易在高达48°C或更高的温度下生长。
•功能灵活
变形菌门被认为是功能灵活的,能对许多环境压力作出反应。此外,这一组的致病成员,如沙门氏菌, 耶尔森氏菌属, 假单胞菌和致病性大肠杆菌,明确响应宿主温度,将其作为上调毒力基因的环境线索。
这些温度响应基因在类似发烧的42℃温度下比在37℃温度下更容易上调,铜绿假单胞菌中的温度响应酶同样显示出在45°C的温度范围内提高效率。
艰难梭菌是另一种主要的人类肠道病原体,在37°C和41°C下在体外同样生长良好。总之,这些观察结果表明肠道病原体既能耐受也能利用宿主温度的变化。
不同温度下的肠道微生物
1
低温
一些实验研究了哺乳动物肠道微生物群对冷暴露和宿主体温过低的反应性。
•厚壁菌和短链脂肪酸增加
长期的寒冷暴露导致A.muciniphila几乎完全枯竭,同时增加了Lachnospiraceae、Clostridiaceae、Ruminococcaceae家族的丰度和短链脂肪酸的相对产量,使其不易受到高脂肪饮食诱导的肥胖的影响。
除了食物摄入量显著增加外,冷暴露还刺激棕色脂肪组织中的脂蛋白加工和胆固醇向胆汁酸的肝脏转化,这有助于微生物群重塑。
•新陈代谢良好
低温小鼠的新陈代谢健康状况也较好,不易受到高脂肪饮食诱导的肥胖的影响,这些特征可以通过将粪便微生物群移植到室温下保存的小鼠中来复制。
2
高温
•肠通透性增加
热应激(>40°C)可导致肠上皮损伤,导致细菌产生的脂多糖的肠通透性增加,从而引发局部和全身免疫反应,并与体重指数增加、胰岛素敏感性受损和脂肪褐变减少相关。
•厚壁菌和短链脂肪酸减少
与在哺乳动物冷应激期间观察到的厚壁菌和短链脂肪酸的丰度增加相反,多项研究表明,肠道厚壁菌随着热应激而减少,肠道微生物群的总体α多样性也随之减少。
令人惊讶的是,在多种宿主中都观察到了这种下降,包括放热动物和吸热动物。总之,这些数据表明,体温对肠壁厚菌的影响是一致的,这是由体温本身或宿主食欲或新陈代谢的保守变化引起的。
•影响随时间积累
此外,在反复的热应激循环后,沙鼠的微生物群落α多样性下降,表明热应激的后果可能会随着时间的推移而积累。
3
适宜温度
•肠道菌群组成发生变化
暴露在温和的温度(34°C)下也会引起肠道微生物群组成的变化。
以下的菌群数量会增加:
Turicibacter ↑↑↑
Akkermansia ↑↑↑
Parabacteroides ↑↑↑
以及下列菌属数量的减少:
Butyricococcus ↓↓↓
Peptococcaceae ↓↓↓
Ruminiclostridium ↓↓↓
•影响免疫反应和肠道稳态
在卵巢切除的老年雌性小鼠(绝经后骨质疏松症模型)中,温热条件下的微生物群移植均能逆转卵巢切除引起的胫骨转录组变化,并增加骨膜骨形成。
这种影响在一定程度上是由多胺的增加所介导的,多胺的产生可以影响骨重塑,但也可能具有免疫细胞功能。除了代谢调节的改变外,热应激诱导的热休克蛋白主要由肠道微生物群诱导,以响应细胞应激。
这些蛋白质作为肠道“看门人”,在免疫反应和肠道内稳态维持中具有若干关键功能,包括变性蛋白质的重折叠和从肠道中清除受损多肽。
免疫热应激和肠道微生物反应
✦体温升高有助于清除感染
为了应对感染和先天免疫刺激,大多数哺乳动物都会发烧:故意提高体温。发烧时,下丘脑通过触发棕色脂肪组织中的非颤动产热,对前列腺素水平升高(受刺激巨噬细胞释放的炎症脂质介质)作出反应,从而通过与低温时相同的基本机制产生代谢热。
即使是体温过高者也会改变他们的行为,在感染期间寻找更高的温度;事实上,感染后体温升高1.5至5°C在动物界非常普遍。核心体温升高的假定进化益处是通过直接抑制微生物生长或在更高温度下刺激免疫反应来限制病原微生物的活动。实验和观察证据都表明,发烧反应确实有助于更快地清除感染。
在抗生素开发之前,热疗甚至被用于治疗人类梅毒症状。
✦发烧会影响肠道微生物
尽管发烧对传染病有影响,但发烧对肠道微生物群的影响知之甚少。
一般来说,先天性炎症反应与肠道蛋白杆菌水平增加和α多样性降低有关,尤其是当炎症变为慢性时。然而,急性发热反应对哺乳动物微生物群的影响相对未知。
最近的一项研究发现,感染新型冠状病毒(SARS-Cov2)的患者的肠道微生物群出现发烧依赖性变化,包括细菌热休克蛋白的增加,这表明发烧温度确实会影响人体微生物群。
注意
虽然上述证据表明温度适应下的微生物群对宿主免疫调节有重要作用,但最近的研究强调,在物种层面上,人类和小鼠具有不同的肠道微生物群组成。在某些情况下,这些差异在家庭层面上也很明显。
例如,在人类中,拟杆菌门主要由拟杆菌科和瘤胃球菌科的厚壁菌门组成。相反,在小鼠中,拟杆菌主要由S24-7家族组成,而厚壁菌则由梭状芽孢杆菌目组成。
根据这些报告,可以设想不同的方法来克服使用小鼠微生物群作为人类替代物的挑战。例如,通过将人类肠道微生物群移植到无菌小鼠中来建立小鼠模型,以及发现小鼠物种和人类微生物群之间的功能同源物。
虽然在动物模型中的研究表明,微生物群在不同环境温度下调节免疫代谢方面起着关键作用,但人类肠道微生物群在这方面的重要性有待进一步研究。
自2008年以来,世界各地新发癌症病例的数量显著增加,但各国和世界各地不同类型癌症之间存在着相当大的异质性。
这些差异可归因于遗传差异、环境因素、寿命以及其他癌症诱因,包括社会行为、经济发展和医疗系统的进步。
环境温度与肿瘤存在联系
环境温度可能通过各种生理过程,如代谢和内分泌变化,以及免疫反应和肠道微生物群的变化,促进肿瘤的发生。
癌症和恶性细胞经历代谢改变,主要通过加速糖酵解代谢获得能量以促进其增殖、存活和迁移。然而,肿瘤微环境和宿主大环境中的葡萄糖缺乏也会导致癌细胞的代谢重编程,如脂质代谢的激活,从而改变肿瘤进展和耐药性。
•癌症中棕色脂肪组织活性较高
积累的证据表明棕色脂肪组织与癌症之间存在联系;然而,关于这是正相关还是负相关,有相互矛盾的证据。癌症患者在正电子发射断层扫描/计算机断层扫描中显示18F氟脱氧葡萄糖(18FFDG)摄取量较高,表明与健康对照组相比,棕色脂肪组织活性较高。
•温暖环境中免疫细胞渗透性更高
研究发现,由于免疫细胞在更温暖的环境中的渗透性更高,居住在室温中的小鼠的癌症生长速度比居住在热中性温度(大约30°C)下的小鼠更快、更具攻击性。
虽然对这些效应的分子解释有待进一步研究,但热疗是一种众所周知的癌症治疗替代策略,因为癌细胞在高达45°C的高温下死亡。然而,由于特殊的副作用(烧伤、水疱、腹泻和呕吐)和治疗效率的限制,这种方法在癌症患者中没有广泛应用。
•寒冷环境可能导致更高的癌症风险
相比之下,另一项研究报告,具有非典型强棕色脂肪组织活性的癌症患者预后更好。在动物研究中,在寒冷条件下饲养小鼠会导致脂肪组织褐变,以支持产热,并增加可能促进癌症的细胞因子分泌。
注意:小鼠在环境温度变化期间被广泛用于人类生物学建模,因为它们拥有与产热相关的一组相似的基因。
然而,人类和小鼠在生理体温调节方面存在差异,部分原因是不同的体型,以及生活温度的差异。人类通常倾向于在热中性区内进行活动,而大多数实验室啮齿动物居住在其热中性区以下,需要更多的能量来产生热量。
当试图将啮齿动物的数据转换为人类数据时,这可能会带来重大挑战,因为小鼠和人类的能量消耗差异反映在免疫系统的功能上。
因此,在试图将小鼠的临床前数据转化为人类的治疗药物时,需要仔细考虑环境温度作为可能有助于机体对抗肿瘤治疗反应的因素。
低环境温度有助于通过分泌谷氨酰胺的巨噬细胞促进肿瘤进展。在肝脏和脂肪组织中,慢性冷应激(>10天)触发转录激活物过氧化物酶体增殖物激活受体γ辅激活物和转录因子过氧化物酶体增殖物活化受体,这两种受体在调节肿瘤发生中都起着重要作用。
此外,冷适应导致的代谢活性增加与表观遗传改变有关,表观遗传变化可能导致更高的癌症风险。
与这些报告相反,最近的一项研究表明,冷暴露通过阻碍癌细胞中基于糖酵解的代谢来抑制各种类型的实体肿瘤的生长。具体来说,循环葡萄糖作为肿瘤生长、侵袭和转移的能量来源,对肿瘤糖酵解至关重要。因此,寒冷导致棕色脂肪组织中葡萄糖摄取量的增加,将使其不太适合肿瘤处理。
研究报告称,提供过量的葡萄糖,或删除UCP-1,可以消除冷诱导的肿瘤抑制。这项研究与上述研究之间不一致的原因值得进一步调查,可能部分取决于冷暴露的确切时间和强度、宿主微生物群以及饮食。
癌症的免疫治疗
✦不同温度下抗肿瘤免疫反应功效不同
与热中性的30℃相比,约22℃的标准室温下的慢性(轻度)冷应激会加速肿瘤生长;因此,抗肿瘤免疫反应的功效根据温度而显著不同。
在小鼠模型中,观察到肿瘤微环境和引流淋巴结中的抗肿瘤效应CD8+ T细胞显著增加,而调节性T细胞和免疫抑制细胞在30℃下均减少,这表明仅在22℃下饲养小鼠会导致抗肿瘤免疫反应的显著抑制。
我们还观察到,如果肿瘤在免疫缺陷小鼠中生长,这种作用就会消失,这暗示了适应性免疫反应的作用。
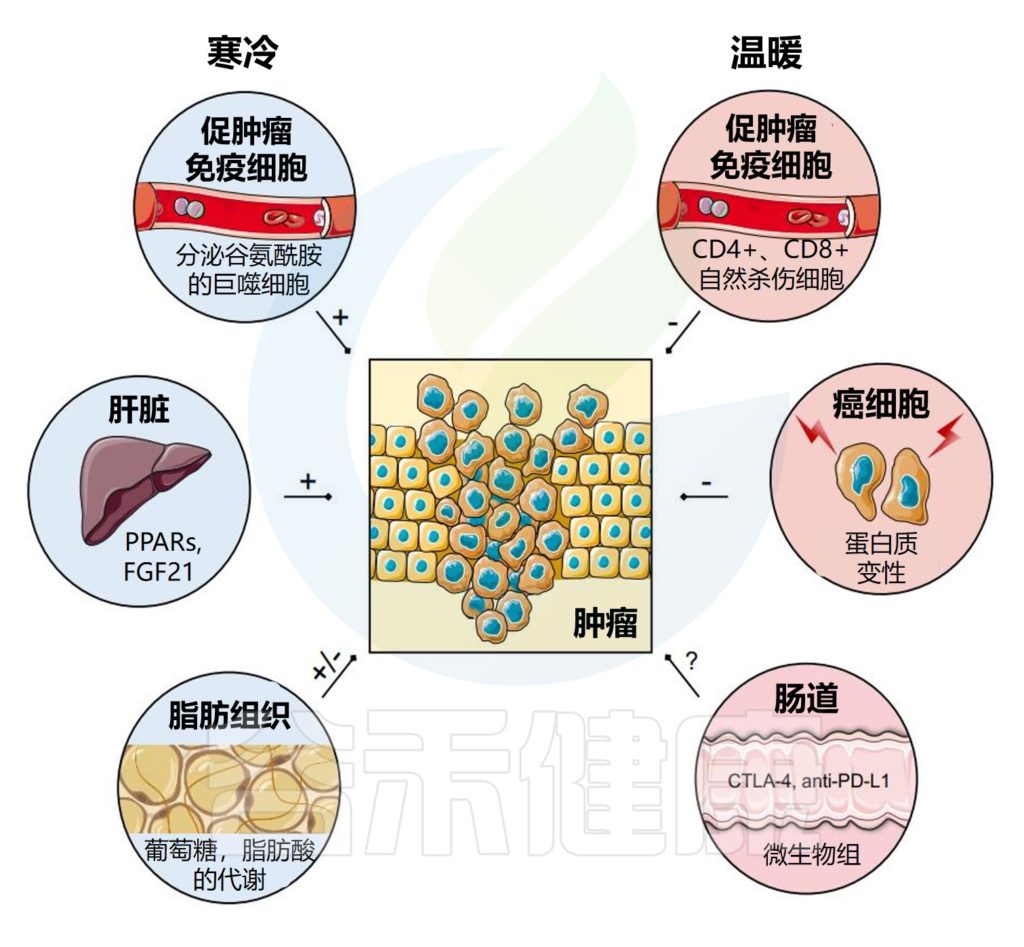
寒冷或温暖环境温度对肿瘤微环境的影响
Wang H,et al.FEBS J.2022
温度诱导的免疫系统重编程可能阻碍或有利于抗肿瘤免疫治疗。
免疫细胞
冷暴露会增加分泌谷氨酰胺的巨噬细胞和促肿瘤细胞因子向肿瘤微环境的渗透,而温暖会促进激活的免疫细胞向肿瘤微环境渗透,如辅助性T细胞、细胞毒性T细胞和NK细胞。
肝脏
在肝脏和脂肪组织中,慢性寒冷诱导的激素和代谢重编程既可以触发肿瘤生长,如FGF21和脂肪酸代谢;或与肿瘤竞争营养物质,如葡萄糖。
然而,在热疗过程中,可以通过野生蛋白变性和激活细胞凋亡选择性地杀死癌细胞。
肠道菌群
此外,温度引起的肠道菌群变化可能有利于抗肿瘤免疫疗法的疗效,例如CDLA-4或抗PD-L1。
✦肾上腺素能应激的程度取决于温度
我们发现房屋温度对免疫疗法(检查点抑制剂抗PD-1)的效果有显著影响。乳腺肿瘤和黑色素瘤在22℃时几乎没有反应,但在30℃时有显著反应。
我们继续证明,当用β-肾上腺素能受体拮抗剂(β-阻断剂)处理小鼠(在22℃时)时,这种差异也消失了,证实了肾上腺素能应激的程度取决于室温。
这些问题对于解释研究肾上腺素能应激作用的实验结果和开发克服应激的策略以改善小鼠对免疫或细胞毒性治疗的反应具有重要意义。
小结
改进免疫监测对于癌症免疫治疗至关重要,因为癌症免疫治疗可以提高免疫介导的癌细胞清除率。肠道微生物群产生多种小分子和代谢物,在人体免疫反应和代谢健康方面发挥着不可或缺的作用。
越来越多的证据支持肠道微生物群在肿瘤生长中的作用,影响抗肿瘤免疫和各种免疫检查点抑制剂抗癌免疫效果的效率,包括环磷酰胺、CTLA-4阻断抗PD-L1功效。
微生物分子,如丁酸盐和戊酸盐,通过增加其mTOR活性和表观遗传重编程,增强细胞毒性T细胞和嵌合抗原受体T细胞的活化。因此,了解由于环境温度变化引起的肠道微生物群变化在多大程度上参与了癌症免疫代谢非常重要。
环境温度变化会影响抗肿瘤免疫反应。温度变化期间肠道微生物组和免疫代谢之间的相互作用也会改变。
虽然最近已经清楚肠道微生物群的改变会导致免疫系统的失调,但这种相互作用的确切性质仍有待确定。
通过脂肪组织和微生物群之间温度介导的相互作用调节免疫反应的机制进行了深入研究,这可能有助于阐明代谢疾病和癌症的治疗方法。
主要参考文献:
Wang H, Ülgen M, Trajkovski M. Importance of temperature on immuno-metabolic regulation and cancer progression. FEBS J. 2022 Sep 24. doi: 10.1111/febs.16632. Epub ahead of print. PMID: 36152006.
Hylander BL, Gordon CJ, Repasky EA. Manipulation of Ambient Housing Temperature To Study the Impact of Chronic Stress on Immunity and Cancer in Mice. J Immunol. 2019 Feb 1;202(3):631-636. doi: 10.4049/jimmunol.1800621. PMID: 30670578; PMCID: PMC6352311.
Chevalier C, Stojanović O, Colin DJ, Suarez-Zamorano N, Tarallo V, Veyrat-Durebex C, Rigo D, Fabbiano S, Stevanović A, Hagemann S, Montet X, Seimbille Y, Zamboni N, Hapfelmeier S, Trajkovski M. Gut Microbiota Orchestrates Energy Homeostasis during Cold. Cell. 2015 Dec 3;163(6):1360-74. doi: 10.1016/j.cell.2015.11.004. PMID: 26638070.
Huus KE, Ley RE. Blowing Hot and Cold: Body Temperature and the Microbiome. mSystems. 2021 Oct 26;6(5):e0070721. doi: 10.1128/mSystems.00707-21. Epub 2021 Sep 28. PMID: 34581596; PMCID: PMC8552956.
Li, X. Y., Wenes, M., Romero, P., Huang, S. C. C., Fendt, S. M. & Ho, P. C. (2019) Navigating metabolic pathways to enhance antitumour immunity and immunotherapy, Nat Rev Clin Oncol. 16, 425-441.
谷禾健康
出于消化和吸收的目的,哺乳动物已经形成了一个非常复杂且高度专业化的胃肠系统,由粘膜屏障维持。
越来越多的数据强调了肠道屏障和肠道通透性对健康和疾病的重要作用。然而,这些术语定义不明确,其评估存在争议,临床意义也没有明确确定。
肠漏症正在成为一种流行病。虽然它尚未被医学界广泛认可,但全球数亿人可能患有与肠漏综合征相关的症状和疾病。
本文讨论的是关于粘膜屏障及其在疾病预防和治疗中的作用的知识。
首先,定义相关术语“肠到屏障”、 “肠道通透性”、“肠漏”。
其次,描述了影响肠道通透性的肠道屏障的关键要素。这个屏障代表了一个巨大的粘膜表面,数十亿细菌面对着身体最大的免疫系统。一方面,完整的肠道屏障保护人体免受微生物和毒素的侵袭,另一方面,这个屏障必须打开以吸收必需的液体和营养。这两个看起来矛盾的目标是通过肠道屏障组成的复杂解剖和功能结构来实现统一的,这正是我们常听说的“肠道通透性”。
第三,描述了饮食和细菌对肠道通透性的调节。特别是,必须考虑潜在的屏障破坏因素,例如肠道灌注不足、感染和毒素,还必须考虑选择过量的营养物质、药物和其他生活方式因素。
第四,讨论肠道菌群对肠道通透性的互相影响,以及与通透性增加相关的特定疾病,例如危重病、炎症性肠病、乳糜泻、食物过敏、肠易激综合征,以及肥胖和代谢疾病。所有这些疾病都以炎症为特征,炎症可能由管腔成分易位到宿主中引发。
最后,讨论了评估肠道通透性的方法。手段差异很大,可能评估屏障的不同功能组件。
“肠道屏障”和“肠道通透性”描述了同一解剖结构的两个不同方面。
“肠道通透性”是一个术语,主要由电生理学家使用动物或人类的组织外植体在 Ussing 室中研究上皮通透性而形成。
注:Ussing Chamber(尤斯室,也叫尤斯灌流室)是研究跨上皮转运的工具,可用于包括离子转运、营养物质转运及药物转运等的研究。通过跨上皮转运的研究,可以了解上皮的离子通道机制、营养成分及药物透过上皮的吸收、影响上皮屏障功能以及通透性的因素等等。来源:百度百科
“肠道屏障”用来描述将内部环境与管腔环境分开的复杂结构。物理屏障包括由血管内皮、上皮细胞和粘液层组成。除了这个物理屏障之外,化学物质也参与了屏障功能。它们由消化分泌物、免疫分子、细胞产物如细胞因子、炎症介质和抗菌肽组成,主要由小肠隐窝中的潘氏细胞(Paneth cell)产生。
肠道屏障基本上将肠道内容物与身体分开。它由单层细胞(上皮细胞、传感细胞以及产生酶和神经递质的细胞)组成。这些细胞通过紧密连接(TJ)蛋白连接起来。
肠道屏障是一个动态实体,由多个元素组成,与各种刺激相互作用并做出反应。
首先,在管腔中,细菌和抗原被胆汁、胃酸和胰液降解,共生细菌通过产生抗微生物物质来抑制病原体的定植。
屏障的另一个要素是由未搅拌的水层、糖萼和粘液层组成的小环境,它们通过免疫球蛋白 A (IgA) 分泌以及糖萼和粘液提供的物理屏障防止细菌粘附。由顶端连接复合物连接的上皮细胞具有运输管腔内容物的能力,但它们也通过分泌氯化物和抗菌肽对有害刺激作出反应。
▃ 上皮层

谷禾健康
中风是全球范围内最具破坏性的最严重的脑部疾病之一,治疗选择非常有限。中风和其他神经系统疾病与微生物群破坏有关。反过来,中风诱发的菌群失调会通过调节免疫反应而对疾病结果产生重大影响。
了解肠细菌-脑串扰的性质可能会导致基于微生物组的治疗方法,从而可以改善患者的康复。
本文主要介绍关于肠道微生物组在中风中的作用的最新知识,以及肠-免疫-脑串扰的潜在机制。
肠道微生物群和周围器官之间的信号传导是由微生物组相关分子模式(MAMP)和微生物组分泌的代谢产物介导的,这些代谢产物可以与粘膜上皮和肠道免疫细胞相互作用,刺激迷走神经或到达全身循环以向大脑发出信号和可能调节神经元和免疫应答。
反过来,支配肠壁的副交感神经和交感神经纤维会从大脑传递输入信号,从而影响肠蠕动,免疫细胞活性,并能诱导肠成分改变。
01
中风改变了微生物群的组成
我们知道,肠道微生物群稳态的破坏,就会容易患病。
实验和临床研究中越来越多的证据表明中风会改变肠道菌群的组成。对中风患者肠道菌群的分析显示,与健康个体相比,微生物组成发生了变化,而菌群失调程度与病变的严重程度相关。
同样,观察小鼠的粪便微生物丰度的变化,发现严重中风要比轻微中风更为明显。但是,在分析菌群多样性和特定菌群时,在临床和实验研究中有些不同结果。
为什么会出现不同结果?
Yin 等人发现与无症状对照组相比,中风患者粪便样本的多样性增加,Stanley等人发现假手术组和中风小鼠之间的微生物群多样性没有变化。相反,其他研究人员则在实验和临床环境中观察到某些菌减少和其他细菌的过度繁殖导致多样性降低,表明多样性程度不一定能预测中风的严重程度。
不同的研究发现,沙门氏菌总体上减少了,同时伴有拟杆菌的过度生长。然而,当在较低的生物分类等级上分析微生物群变化时,在临床和实验性中风中特定细菌变化方面缺乏一致性。
可能的混淆因素
粪便采样位置的差异(在小鼠的胃肠道和患者的粪便中),用于基因组DNA提取和16S rRNA基因分析的方法,中风模型的严重程度以及基线的差异微生物群组成(人类的小鼠起源或个体间和个体内变异)可能是造成矛盾结果的混淆因素。
影响肠道菌群组成的另一个混杂因素是饮食类型。
严重的中风病例总是住院治疗,他们将接受药物治疗并接受医院控制的饮食,而实验性中风后对小鼠的干预很少,这将以啮齿动物和人类的不同方式影响微生物群的组成。
总体而言,临床和实验数据表明中风后微生物群组成发生了变化。然而,迄今为止,尚不清楚哪种类型的肠道细菌参与中风的病理生物学机制。
年龄对微生物群状态的重要性
衰老会改变肠道菌群的组成,并与炎症和肠道通透性增加有关。中风后,与年轻小鼠相比,有高龄微生物群的小鼠具有更高的死亡率,运动功能受损和促炎性细胞因子反应。
粪便微生物群移植(FMT)可以在年轻和老年小鼠中恢复中风的结果。这些实验强调了年龄对微生物群状态的重要性及其对疾病发展的影响,以及微生物群的操纵如何能够导致非侵入性疗法以预防和改善中风预后。
虽然实验结果表明与年龄、肠道生物失调和中风结果相关,但其他风险因素(糖尿病、高血胆固醇水平、饮酒、高脂肪饮食、缺乏锻炼)和性别差异对肠道微生物群和中风结果的影响仍有待实验和临床研究解决。
脑损伤改变微生物组组成的机制
由于中风后自主神经系统(ANS)的失调而降低肠道运动性和粘膜屏障的完整性。脑损伤后,肠道内胆碱能活性下降,肾上腺素能信号传导增加,这与肠屏障的破坏有关。
因此,使用β受体阻滞剂抑制β肾上腺素能活性可显着恢复中风诱导的肠道通透性,并减少细菌向周围器官的扩散。
在这方面,Singh等人证明了回肠瘫痪本身就可以驱动微生物群变化,这是一种中枢神经系统介导的生态失调。
肠道细菌可以感觉到来自胃肠道的激素和神经递质,并且在体外培养中,在应激激素去甲肾上腺素(NE)存在下,某些条件致病菌能够增殖更多。
有趣的是,在实验性中风后,盲肠中的去甲肾上腺素释放增加,这可能是某些病原体或共生菌过度生长的原因。
另外,ANS调节肠粘液分泌,大脑对肠信号的扰动可能对肠粘液层的大小和质量产生重要影响。
Houlden等人观察到,中风后盲肠内,粘液蛋白产生的失调和产粘液的杯状细胞降低。中风后粘液层的形成受损可能使共生膜与上皮直接接触,转移并引发免疫反应,以及中风后感染。此外,还需要更多关于细菌移位导致实验性中风感染的直接影响的数据。
脑损伤触发肠道中胆碱能和肾上腺素能信号的失衡,增加释放的NE的浓度,降低肠道运动性,并改变与微生物群失调有关的肠脑屏障。所有这些事件都将影响肠道微生物的功能输出,并可能进一步扰乱肠道的免疫稳态。
02
中风的肠-免疫-脑轴
迄今为止,使用动物模型进行的研究提供了最有力的证据,并有助于阐明中风后肠-免疫-脑相互作用的潜在机制。
T淋巴细胞的关键作用
已知T淋巴细胞在脑损伤后继发的组织损伤中起关键作用。促炎性T辅助1细胞(Th1),T辅助17细胞(Th17)和γδT-IL-17+细胞与中风后神经毒性有关,而调节性T细胞(Treg)发挥作用抗炎和神经保护特性。
越来越多的证据,支持微生物群通过调节胃肠道中促炎Th17细胞与抗炎Treg细胞之间的平衡来维持免疫稳态。
通过诱导促炎Th1和Th17介导的反应,具有中风后遗症粪便含量的无菌(GF)小鼠的定殖导致中风结果的恶化,这表明中风诱导的微生物失调触发促炎性免疫反应,从而加剧脑损伤。
这组作者证明,来自派尔氏淋巴集结(Peyer’s patches)的T细胞会侵袭梗塞周围组织,并在中风的急性期产生免疫反应。
肠道菌群的免疫调节作用对于中风恢复至关重要
此外,通过健康捐献者的FMT恢复肠道微生物群的稳态,减少了损伤大小并增加了缺血性脑中Treg细胞的数量。
然而,单独存在的微生物群具有神经保护作用,因为与定殖小鼠相比,完全根除GF小鼠的肠道细菌导致更大的梗塞体积。
同样,这种微生物群介导的对中风的有益作用取决于淋巴细胞反应,表明肠道细菌的免疫调节作用对于中风恢复至关重要。通过显示在缺血性损伤之前使用抗生素对微生物群组成进行控制可减少梗塞体积并改善感觉运动功能,从而证明了肠-脑双向沟通在中风中的关键参与。
在这项研究中,他们表明神经保护作用是由微生物依赖性的肠道树突状细胞(DC)引发的,介导小肠Treg的扩增,通过抑制促炎性γδT-IL-17+细胞发挥作用。
此外,他们还认为IL-10是Treg细胞介导的γδT细胞增殖抑制的主要协调器,因为IL-10-/- 小鼠不受保护作用的影响。由于较少的促炎IL-17 +γδT细胞积聚在脑膜中,因此肠道中的这种抗炎环境会传导到大脑,这与较小的梗死面积有关。
有趣的是,肠道T细胞从肠道迁移到脑膜和脑实质中,表明中风有直接的肠脑沟通途径。
另外,肠道微生物群组成的修饰可通过致耐受性DC使肠道免疫应答偏向抗炎环境。
这些研究表明中风后微生物群受到影响,中风后细菌数量的变化会促进促炎性T细胞反应,肠道免疫细胞迁移至脑膜,这可能会参与继发性脑损伤并恶化中风结果。
也突显了通过肠道淋巴细胞从肠道运输到大脑的过程,沿着肠道-脑轴的直接联系,在那里它们调节了对中风的神经炎症反应。
当然,对于肠免疫细胞是否直接导致脑损伤或修复机制还不是很清楚。重要的是,这种肠道细菌-DC之间相互作用的分子途径仍然难以捉摸。
图 肠道代谢物——中风中的免疫系统干扰
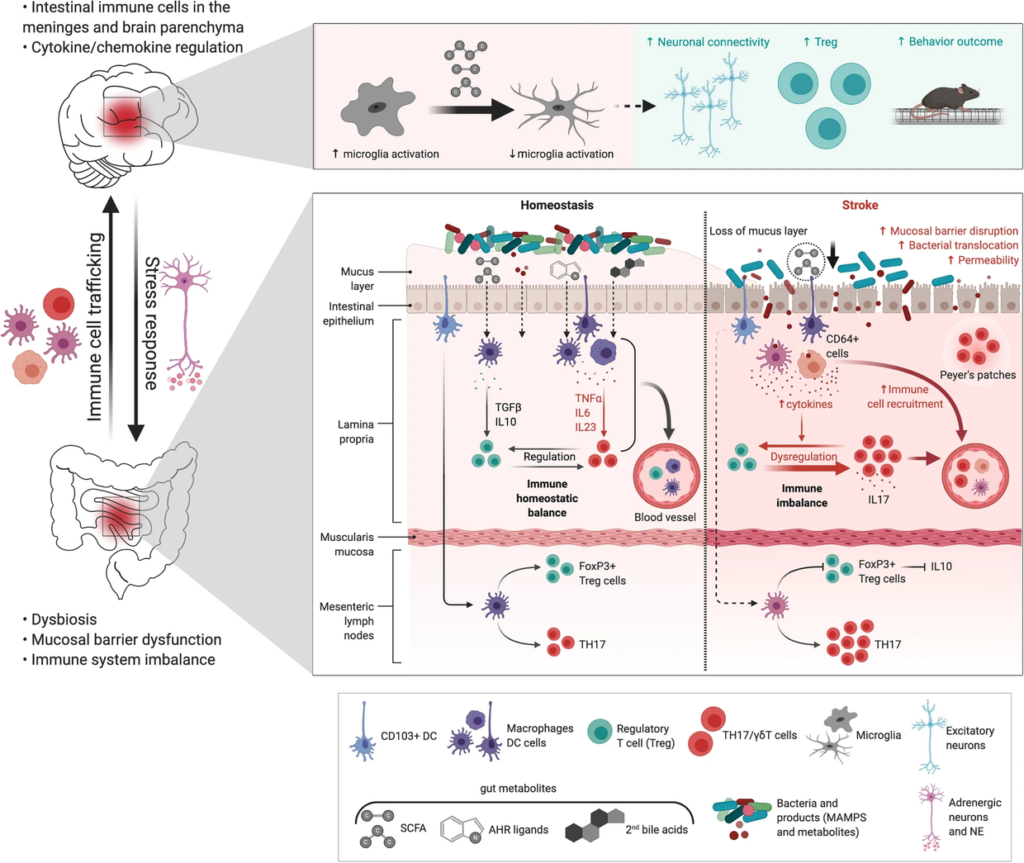
Delgado.et al., Neuromolecular Med, 2020.
中风后肠道微生物对免疫系统的调节。
下图:在肠道中,中风引起生物失调、粘膜屏障功能障碍、肠道通透性增加、细菌移位、中风后感染和通过树突细胞的促炎性T细胞反应(DC)。中风后,免疫细胞,特别是T细胞、CD64 +巨噬细胞和树突状细胞从肠道迁移到脑膜和大脑。肠道代谢物(AHR,次生胆汁酸,MAMPs)作为肠道免疫细胞免疫调节剂的作用尚未明确。中风后微生物来源的SCFA减少,可能引发γδT-IL-17 +细胞和调节性T细胞(Treg)的失衡。
上图:补充SCFA调节神经元活动和突触密度,并且与小胶质细胞激活减少和Tregs增加以及中风后更好的恢复相关。
03
中风肠道菌群的操纵
Benakis等人证明了在诱导缺血性损伤之前用氨苄西林或万古霉素治疗小鼠具有神经保护作用,而使用新霉素则不能保护小鼠免于中风。这种神经保护作用与微生物组组成中的抗生素特异性变化有关,变形菌和厚壁菌门增多,而拟杆菌属的减少。
此外,当他们分析与有益菌群变化相关的预测酶途径时,他们发现异种/芳香族化合物代谢可预测缺血性病变的大小。
微生物代谢产物是细菌-宿主串扰的主要沟通渠道之一
与中风的肠道免疫脑轴有关的一个可能的缺失环节可能是仅由细菌产生的代谢产物。
已知必需芳香族氨基酸色氨酸的代谢产物可通过在DC和T细胞中表达的芳烃受体(AHR)调节免疫细胞功能。一些菌群能够将肠道中的色氨酸分解为AHR的配体。
在小鼠中,微生物群衍生的吲哚激活AHR通过诱导免疫细胞中IL-22促进肠道稳态。在星形胶质细胞的AHR通过激活在多发性硬化的小鼠模型中色氨酸代谢物的神经保护作用的驱动器。
然而,保护作用是配体依赖,其他色氨酸代谢产物已报告加重病程。有趣的是,负责色氨酸分解代谢的内源性犬尿氨酸途径的活性被上调下列缺血性中风和已与炎性反应和恶化的结果。因此,AHR受体的药理和遗传阻断改善了中风恢复。
这些发现暗示了色氨酸衍生化合物在中风中的关键作用。尚不清楚微生物源性色氨酸代谢产物在缺血性损伤中的免疫调节作用。
短链脂肪酸(SCFA)是细菌发酵的生物产物,具有免疫调节作用:它们能够根据免疫情况直接诱导T细胞分化为效应细胞和调节细胞。
小鼠中风后血浆SCFA的水平显着降低,这与恶化的结果有关。
中风之前在小鼠中补充SCFA改善了行为恢复,改善了皮质网络的连通性,并改变了突触可塑性的组织学标志,这与改善中风的长期中风有关。这些作用与小胶质细胞形态向稳态状态的改变和侵袭性淋巴细胞的减少有关。
菊粉改善中风后神经功能缺损
在另一项研究中,他们观察到,与年幼小鼠相比,口服菊粉(产生SCFA的细菌和制造SCFA的细菌基质),可减少老年小鼠中风后的神经功能缺损和改善抑郁样行为。
此外,这些变化伴随着缺血性脑中IL-17 +γδT细胞百分比的降低,但SCFA是否直接影响T细胞极化和迁移尚未解决。出人意料的是,在两项研究中,梗死面积均不受SCFA干预的影响。
所有这些证据表明,微生物代谢产物SCFA在中风后恢复中起重要作用,并且可能参与中风后肠道菌群发挥的免疫调节作用。
04
结 语
本文总结了微生物群组成如何通过调节免疫反应影响中风预后的最新发现。肠道菌群的变化引起主要的促炎性T细胞反应,这与更大的梗塞体积和恶化的预后相关。
由于肠道菌群是一个非常复杂的生态系统,受环境和宿主的影响,具有冗余功能和协同关系,因此,研究微生物组代谢组学特征以将其转化为临床实验研究是一种更好的策略。
然而,尚无实验数据将特定微生物群合成的化合物与脑损伤后的免疫反应之间的因果关系联系起来。为了在中风患者中成功应用这些发现,有必要进一步研究中风后共生细菌和免疫系统之间相互作用的分子机制。
相关阅读:
参考文献:
Singh, V., Roth, S., Llovera, G., Sadler, R., Garzetti, D.,Stecher, B.,et al. (2016). Microbiota dysbiosis controls the neuroinflammatory response after stroke. Journal of Neuroscience, 36(28), 7428–7440.
Houlden, A., Goldrick, M., Brough, D., Vizi, E. S., Lénárt, N., Martinecz, B., et al. (2016). Brain injury induces specific changes in the caecal microbiota of mice via altered autonomic activity and mucoprotein production. Brain, Behavior, and Immunity, 57, 10–20.
Lee, J., d’ Aigle, J., Atadja, L., Quaicoe, V., Honarpisheh, P., Ganesh, B. P., et al. (2020). Gut microbiota-derived short-chain fatty acids promote poststroke recovery in aged mice. Circulation Research, 127(4), 453–465.
Delgado Jiménez Rosa,Benakis Corinne,The Gut Ecosystem: A Critical Player in Stroke.[J] .Neuromolecular Med, 2020.
Yin, J., Liao, S. X., He, Y., Wang, S., Xia, G. H., Liu, F. T., et al. (2015). Dysbiosis of gut microbiota with reduced trimethylamine-N-oxide level in patients with large-artery atherosclerotic stroke or transient ischemic attack. Journal of the American Heart Association.
Stanley, D., Mason, L. J., Mackin, K. E., Srikhanta, Y. N., Lyras, D., Prakash, M. D., et al. (2016). Translocation and dissemination of commensal bacteria in post-stroke infection. Nature Medicine.
Benakis, C., Brea, D., Caballero, S., Faraco, G., Moore, J., Murphy, M., et al. (2016). Commensal microbiota affects ischemic stroke outcome by regulating intestinal γδ T cells. Nature Medicine, 22(5), 516–523.
Lamas, B., Natividad, J. M., & Sokol, H. (2018). Aryl hydrocarbon receptor and intestinal immunity. Mucosal Immunology, 11(4), 1024–1038.