-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

癌症——这个困扰人类几个世纪的疾病,至今仍是全球死亡率最高的疾病之一。
国际癌症研究机构调查显示,2022年,全球有超过 1900 万新诊断的癌症病例和近1000 万癌症死亡病例,无数家庭因此经历痛苦。
癌症是一种复杂的多步骤慢性疾病,由活跃分裂细胞在 DNA 复制过程中获得的自发突变积累而成,环境也对癌症风险产生了相当大的影响。
传统的癌症治疗方法——手术切除、放射治疗和化学疗法,虽然在过去几十年中挽救了无数患者的生命,但它们的局限性也日益明显:手术无法完全清除微小转移灶;放疗和化疗的副作用严重,往往让患者雪上加霜;而且,即便是相同类型、相同分期的癌症患者,对同一治疗方案的反应也可能截然不同。
传统的癌症生物学理论难以完全解释这些差异。
这些问题引发了研究人员的深思:也许我们需要超越单纯关注癌细胞本身,将目光投向更广阔的“宿主环境”——患者的整体生理状态、免疫系统功能,以及体内的微生态系统。
从结直肠癌到肝癌,从乳腺癌到胰腺癌,微生物的”指纹”无处不在,它们通过复杂的代谢网络和免疫调节机制,参与肿瘤的发生、发展、转移和治疗反应全过程。
例如,肠道微生物群与宿主黏膜表面之间存在相互作用,后者在肿瘤发生中起着主要作用。微生物可能通过在胃黏膜中诱导氧化应激来损伤 DNA,增强上皮炎症并破坏黏膜屏障,从而增加肿瘤发生风险。
本文我们主要来了解微生物与癌症之间错综复杂的关系,探讨微生物如何成为癌症研究的新焦点,以及这一领域如何有可能彻底改变我们对癌症的认知和治疗方法。
随着年龄增长,我们的身体就像一台逐渐磨损的精密机器,各个部件的功能开始下滑。这种时间依赖性的细胞和生理功能退化过程,被称为”衰老“,它是多种重大疾病的主要风险因素之一,也包括癌症。
衰老的基本特征
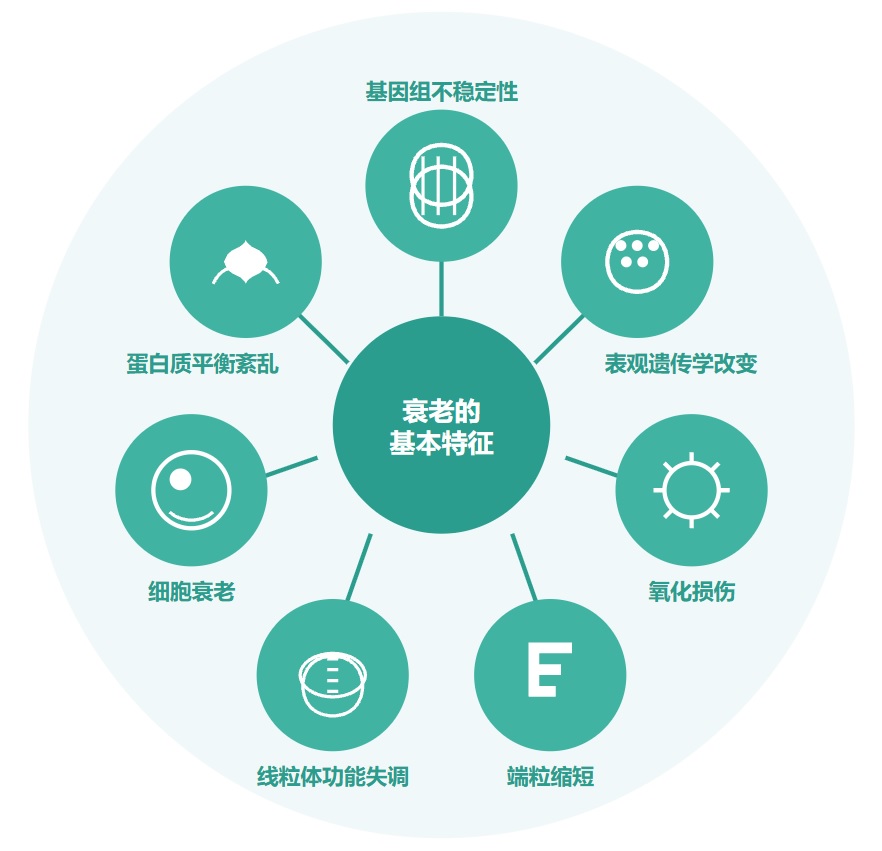
有人提出,尽管存在显著的个体间异质性和生活方式、饮食和治疗等外部因素的影响,但人类的肠道微生物组成在衰老过程中会逐渐变化。
多项报告表明,与有益菌相比,微生态失调在衰老过程中会增加,并导致促炎共生菌的大量存在,这些菌的富集,可以滋养生理性炎症。
对人类老龄化队列的研究表明,包括 Akkermansia、Anaerotruncus、Eggerthella、Bilophila 在内的一组属的丰度随着年龄的增长而显著增加,而 Faecalibacterium、Prevotella、Bacteroides 的丰度在老年人中相对较低。
衰老可能导致癌症,癌症治疗可能导致过早衰老

doi.org/10.1186/s12935-025-03787-x
微生物代谢物如何影响细胞衰老和健康?
短链脂肪酸,包括丁酸,可以帮助减缓细胞衰老。它们通过抑制组蛋白脱乙酰化酶来实现这一点,这调节代谢过程,增加胰岛素分泌,并调节免疫反应。
相比之下,致病菌的代谢产物,如脂多糖(LPS),通过加速炎症和增加氧化应激来增强细胞衰老,这是衰老的一个标志。
此外,铜绿假单胞菌和幽门螺杆菌产生的毒素会导致宿主 DNA 损伤并增加氧化应激。
因此,这加剧了 DNA 损伤反应、基因组不稳定性和细胞衰老。
菌群失调和细菌毒素促进衰老人群中衰老细胞的积累、DNA 损伤和促炎微环境的形成。这导致代谢紊乱,并创造一个促进肿瘤细胞生存和增殖的 肿瘤微环境,最终导致癌症。
癌症如何开始?
癌症起源于普通细胞中的遗传变化。当细胞DNA受到致癌物损伤时,会触发一系列变化。这些变化可能不会立即表现出来,但会逐渐积累。关键的基因突变会赋予细胞生长优势和抵抗死亡的能力,导致异常增殖,最终形成肿瘤。

癌细胞有什么特别之处?
癌细胞最显著的特征之一是它们的代谢方式发生了改变,也就是“代谢重编程”。正常细胞和癌细胞使用能量的方式完全不同。癌细胞即使在氧气充足的环境中也会进行糖酵解,这种现象称为”有氧糖酵解“。
此外,它们还进行大分子合成、维持氧化还原平衡,谷氨酰胺分解代谢,所有这些都有助于细胞快速增殖和生长。所有这些都有助于癌细胞快速分裂、扩散并侵入身体不同部位。
一个具体例子是D-2-羟基戊二酸的累积,这个代谢物抑制细胞分化,加速癌症发展。这是由于异柠檬酸脱氢酶-1/2 的连续突变。这表明通过抑制分化直接促进癌症的发生和进一步发展。
一个肿瘤内部并非完全一致,不同区域的细胞可能有不同的代谢特性,这种现象称为肿瘤异质性,这使得癌症治疗更加复杂。

肿瘤微环境:癌症的”生态系统”
肿瘤微环境(TME)是另一个在癌症发生和进展中发挥关键作用的组成部分。
肿瘤微环境是围绕癌细胞形成的高度组织化区域,就像一个小型社会,其中癌细胞只是众居民之一。其他成员如下图:

这个微环境如何影响癌症发展?
癌细胞能够改造邻居,使整个环境有利于肿瘤生长。
比如,癌细胞怎样获得养分和氧气?它们促使血管内皮细胞形成新血管。肿瘤相关巨噬细胞(TAMs)被招募后,会分泌生长因子和细胞因子,刺激血管生成和肿瘤侵袭。
癌细胞甚至能重新编程癌细胞相关成纤维细胞(CAFs),使它们分泌ECM蛋白和血管生成因子(如VEGF-A)。ECM则作为信号分子的储存库,增强细胞间通讯、粘附和迁移。
因此,TME 的不同组成部分通过影响各种细胞过程,有助于癌症的发生、进展和迁移。更深入地了解调节癌症进展和可塑性的分子机制,有助于开发精确和针对性的癌症治疗疗法,并预防复发。
微生物如何影响癌症发展?
最直接的联系是某些微生物直接致癌的能力:
动物研究显示,微生物可促进多种癌症的发展,包括:

doi.org/10.1186/s12935-025-03787-x
微生物群如何变化?
高通量DNA测序揭示了癌症相关的微生物群落变化:
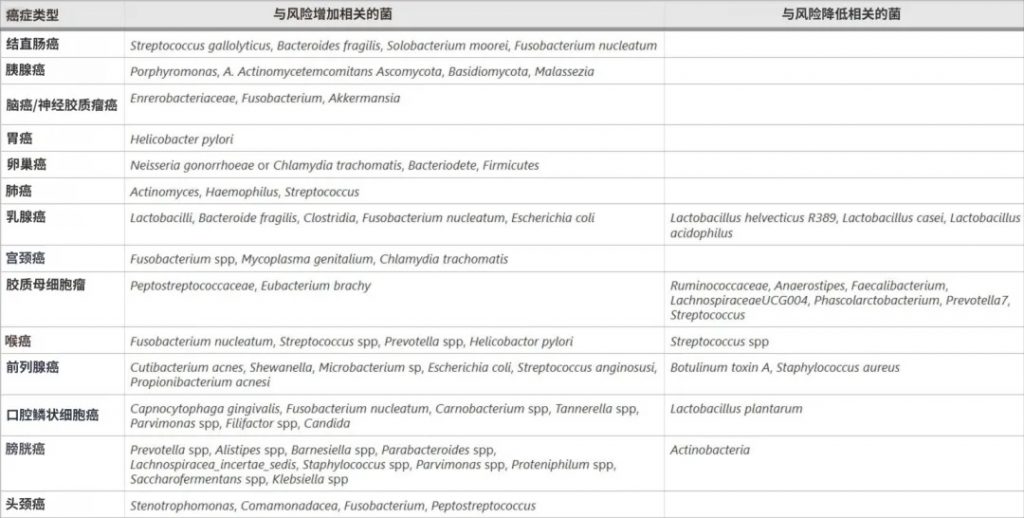
doi.org/10.1186/s12935-025-03787-x
微生物如何促进癌症?
微生物可能通过多种机制促进肿瘤发生:
了解微生物与癌症的关系,可能帮助我们开发新的癌症预防策略、提高治疗效果,甚至预测哪些患者可能对特定治疗产生耐药性。
实际上,微生物群可以同时扮演促进肿瘤发展和抑制肿瘤生长的双重角色,这取决于肿瘤进展的阶段以及微生物群的功能和分布位置,那么,哪些微生物会致癌?又是如何作用的?
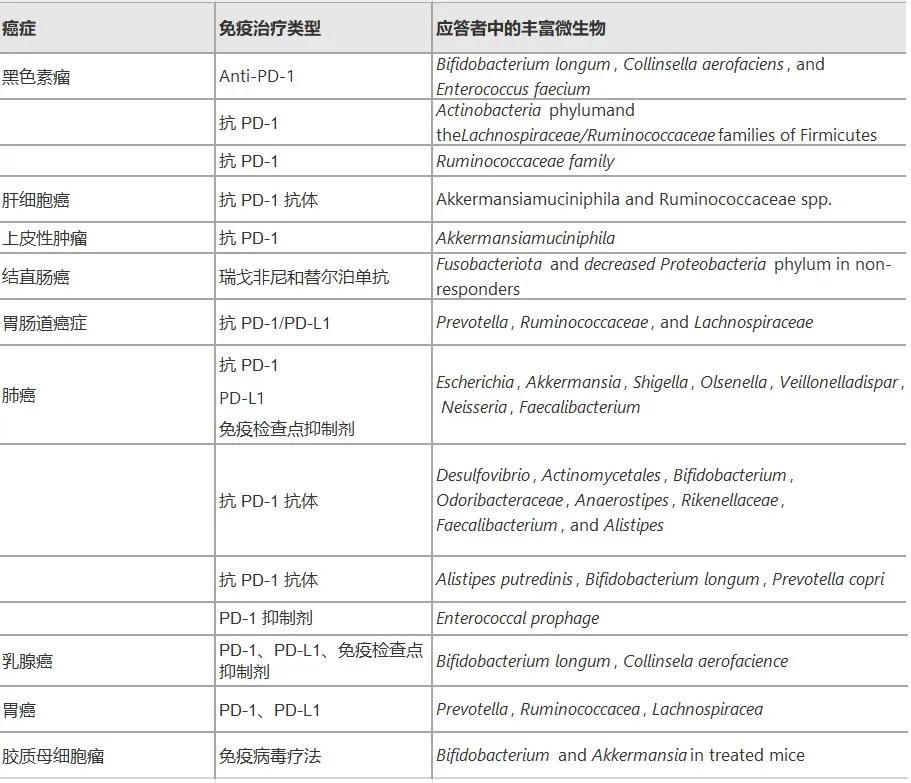
微生物的促癌作用
结直肠癌
脆弱拟杆菌、大肠杆菌、Streptococcus gallolyticus、Enterococcus faecalis、Fusobacterium nucleatum、Parvimonas micra等在结直肠癌患者肠道中大量存在,通过分泌短链脂肪酸等代谢物、DNA甲基化、组蛋白修饰等表观遗传机制影响肿瘤形成。
胰腺癌
牙龈卟啉单胞菌、奈瑟菌、放线菌、链球菌、双歧杆菌、拟杆菌、梭杆菌等与胰腺癌的发生有关,它们通过引起炎症和免疫抑制影响肿瘤生长。
口腔微生物群和幽门螺杆菌通过诱导炎症而成为胰腺癌症的危险因素。
乳腺癌
对人类乳腺癌症组织16S rRNA基因序列的分析显示,与早期乳腺肿瘤相比,晚期乳腺肿瘤中卟啉单胞菌、Lacibacter、Ezakiella、Fusobacterium的丰度更高。
具核梭杆菌(Fusobacterium nucleanum)和脆弱拟杆菌通过定植于乳腺肿瘤和促进癌症细胞的自我更新来加重乳腺癌症的生长和转移。
脑癌
Enterobacteriaceae、Fusobacterium、 Akkermansia是脑癌患者肠道中的主要菌群,它们可能通过免疫抑制、激活炎症、限制细胞死亡以及促进血管生成和侵袭性来影响胶质瘤。
微生物虽然不能穿过血脑屏障,但能释放具有穿透能力的细胞外囊泡,这些囊泡有能力穿过屏障进入大脑。
其他
其他癌症相关的微生物还包括:
这些菌在相应的癌症中大量存在,并通过改变代谢和免疫反应、增强炎症和毒性以及改变信号通路来提高肿瘤易感性。
微生物的抗癌作用
一些微生物如乳杆菌、双歧杆菌、Faecalibaculum rodentium、Streptococcus thermophiles等具有抗肿瘤特性,它们主要通过以下机制抑制肿瘤生长:
调节免疫系统
一组共生肠道细菌,如Paraprevotella xylaniphila、Bacteroides dorei、 Parabacteroides distasonis,可以诱导 CD8 T 细胞产生 IFNγ,抵抗单核细胞增生李斯特菌感染,并增强免疫检查点抑制剂在小鼠体内的疗效。
产生抑制性毒素
其他细菌,如铜绿假单胞菌、鼠伤寒沙门氏菌、艰难梭菌,分别在黑色素瘤、胰腺癌和乳腺癌癌症中表现出抗肿瘤特性。它们通过产生抑制增殖、使细胞停滞在G1-S期并诱导细胞凋亡的毒素来实现这一点,从而促进抗癌活性。
嗜热链球菌还抑制细胞增殖,引发细胞周期阻滞,增强体外结直肠细胞的凋亡,并减少结直肠癌异种移植物的生长。此外,肠道微生物群通过抑制结肠lncRNA Snhg9和上调p53表达来限制小鼠结直肠癌癌症的进展。
产生有益代谢物
– 微生物本身及其毒素能抗癌
科利毒素:赋予宿主抗肿瘤免疫力。
产气荚膜梭菌毒素(CPE)能识别乳腺癌、前列腺癌等细胞表面高表达的claudin-3/4蛋白,与这些蛋白结合后直接引发癌细胞死亡。
Akkermansia muciniphila在肝癌小鼠模型中减少免疫抑制细胞(单核MDSC、M2巨噬细胞),同时增强PD-1免疫治疗的疗效。
– 微生物代谢产物:短链脂肪酸抗癌
丁酸钠,在非小细胞肺癌中消除肿瘤细胞生长,诱导细胞周期阻滞,促进细胞凋亡,并改变免疫反应。
异丁酸,通过减少肿瘤体积来提高癌症结肠癌小鼠模型中抗PD-1免疫疗法的效率。
色氨酸,是人体必需氨基酸,其代谢途径包括:
拟杆菌、Clostridium sporogenes、 Eubacterium、Ruminococcus gnavus等菌群通过吲哚途径产生吲哚-3-乳酸、吲哚-3-丙酸、吲哚-3-乙酸等代谢物,这些物质既能抑制肿瘤免疫逃逸,也可能促进癌细胞生长,具体作用取决于代谢物种类和浓度。
吲哚代谢物可改善化疗和免疫治疗效果,但菌群失衡可能导致色氨酸代谢紊乱,反而加速癌症进展。
微生物与肿瘤微环境的相互作用
具核梭杆菌的Fap2蛋白可与抑制性受体TIGIT结合,抑制NK细胞和T细胞清除肿瘤的能力。
幽门螺杆菌与微环境中的巨噬细胞互动,诱导其极化为M2样巨噬细胞,促进胃癌进展。
肿瘤内微生物也参与肿瘤生成和进展,例如:
也有报道称,一些瘤内微生物可以增强抗肿瘤免疫反应,从而抑制肿瘤进展。
了解微生物在癌症中的双重作用,可能为开发新型抗癌疗法提供思路,包括调节微生物群落和利用微生物产物来增强现有治疗方法的效果。
转移是癌症细胞的一个关键标志,大多数癌症类型的晚期通常以转移开始为特征。
转移,是指癌症细胞通过血液循环从原发肿瘤转移到其他器官的继发部位。它涉及上皮间质转化(EMT)、迁移、侵袭、外渗和继发部位的定植。
转移过程包括哪些步骤,癌细胞面临哪些挑战?
这个过程对癌细胞来说充满了物理和化学挑战,包括需要穿越坚硬的细胞外基质、承受液体剪切应力、逃避免疫监视,并最终在可能与原发部位环境截然不同的部位建立殖民地。
微生物如何协助癌细胞转移?
– 乳腺癌:细菌随转移扩散
– 具核梭杆菌的多重促转移机制
有核梭杆菌可诱导乳腺癌、结直肠癌、喉癌的转移。它是口腔中常见的革兰氏阴性菌,通常与牙周病、口臭有关。
结直肠癌

doi.org/10.1186/s12935-025-03787-x
喉癌
– 抗生素治疗的启示
当然,微生物并不总是促进转移,已知许多微生物群也能抑制转移,从而为防止癌症进展提供了一种自然的方法。
微生物如何阻止转移?
– 抑制转移的菌群代谢物
– 调节肿瘤微环境
膀胱癌中的菌群关联:
– 抗癌微生物的鉴定
前列腺癌数据分析:
肿瘤内微生物种类在转移中的重要性在其他癌症中也得到了证实(下表)。

doi.org/10.1186/s12935-025-03787-x
这些研究表明,癌症中微生物的特异性靶向可以抑制肿瘤的转移,从而成为抗癌联合治疗的重要组成部分。未来需揭示菌群与宿主互作的具体机制,探索“以菌治癌”的精准策略,为癌症治疗提供新突破口。
微生物不仅参与癌症的发生和发展,还可能影响癌症治疗的效果。为什么有些患者对治疗产生耐药性?微生物可能是其中一个关键因素。
微生物如何影响抗癌疗效?
微生物群主要通过两种方式来影响抗癌疗效:
这样一来,药物的疗效和对癌细胞的毒性都会发生变化。
以环磷酰胺(CTX)为例,它是一种常用的抗癌药,用于治疗各种血液系统恶性肿瘤和实体瘤。
环磷酰胺不仅能杀伤癌细胞,还能调节肠道微生物的组成。它会促使一些特定的革兰氏阳性细菌从肠道转移到次级淋巴器官,而这些细菌到达那里后,会激活致病性 T 辅助细胞,从而增强环磷酰胺的抗癌活性。
但如果通过某种方式消除肠道微生物,比如用无菌小鼠或给小鼠喂食抗生素,特别是针对Barnesiella intestinihominis、Enterococcus hirae等特定菌群时,就会发现一个很棘手的问题:环磷酰胺的抗癌效果会变差,耐药性出现了。这说明肠道微生物群在化疗耐药性中扮演着重要的角色。
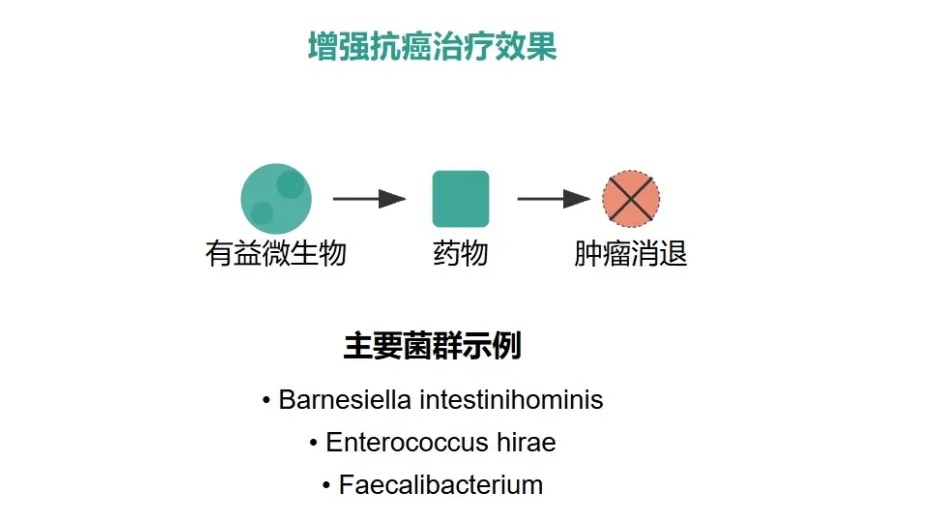
不过,这里又出现了一个违反我们直觉的情况。抗生素虽然可以杀菌,但用多了反而会导致细菌耐药性增加。
研究还在不断深入,科学家们发现:
微生物群调节有助于提高癌症治疗的效率,并通过改变代谢和免疫反应促进更好的预后。
比如,García-González 等人做了一项很有意思的研究,大肠杆菌可改变线虫体内代谢通路,增强5-氟尿嘧啶(FUDR)的疗效。
同样,在黑色素瘤患者的治疗中,研究发现粪杆菌Faecalibacterium能帮助增加免疫细胞和抗原呈递,从而让细胞毒性 CD8 + T 细胞在肿瘤床的浸润程度更高,引发大规模的免疫反应,这对抗 PD-1治疗很有帮助。
基于这些发现,有人提出一个大胆的想法:
肠道微生物群也可以用作生物标志物,来预测患者化疗和免疫治疗的治疗反应和疗效。
肝癌患者的肠道菌群失衡指数(Ddys) 反映了HCC患者粪便样本中的微生物干扰,可用于预测治疗效果。
失衡指数是根据HCC患者粪便样本中有益菌与有害菌的相对丰度计算的。
工程菌成为抗癌新武器
直接杀伤癌细胞:
靶向递送药物:
激活免疫:
现有研究揭示了微生物群在癌症治疗中的多重价值:增强药效、预测疗效、直接作为治疗载体。需深入解析不同癌症特异的菌群特征,明确特定菌种的作用机制,同时解决工程菌的生物安全性问题。
化疗不仅直接作用于肿瘤,同时也会对人体内的微生物群落产生显著影响。肠道微生物在应对化疗时,会通过代谢和免疫调节来影响化疗的疗效和毒性。
化疗如何破坏肠道菌群平衡?
化疗不仅攻击癌细胞,还会显著扰乱肠道微生物的组成。例如,在肠道中,化疗可能会破坏黏液层,使部分肠道微生物能够穿透黏膜层,引发免疫反应。
在结直肠癌患者中,化疗会降低肠道菌群的多样性,这种变化可能反向影响治疗效果——菌群结构越失衡,化疗耐药风险可能越高。
菌群网络的重构:竞争还是合作?
梭杆菌、拟杆菌、粪杆菌分别与肿瘤标志物CEA、CA724、CA242相关,但它们的丰度不受不同化疗阶段的影响。这提示特定菌群可能成为化疗反应的独立预测指标。
注:CEA是一种糖蛋白,最初在胚胎组织和结肠癌组织中发现。作为最早被应用于临床的肿瘤标志物之一,CEA主要用于消化系统肿瘤的辅助诊断和监测。
CA724是一种高分子量糖蛋白,是胃癌较为特异的肿瘤标志物。
CA242是一种新型的消化系统肿瘤标志物,主要用于胰腺癌和胆道系统肿瘤的辅助诊断。
菌群如何“对抗”化疗药物?
某些细菌通过代谢转化直接削弱药物活性:
菌群失衡是否会加剧化疗副作用?
5-氟尿嘧啶(5-FU)为例
5-氟尿嘧啶用于治疗乳腺癌、结直肠癌、胃癌、胰腺癌、胃癌等。其作用方式涉及DNA损伤,导致细胞凋亡或RNA合成抑制。
菌群也能增强化疗效果吗?
奥沙利铂和丁酸盐为例
奥沙利铂是晚期结直肠癌患者的一线化疗药物。
研究表明,肠道微生物产生的代谢物丁酸盐能增强奥沙利铂的抗癌效果。
丁酸盐通过依赖ID2的方式激活CD8 + T细胞。在结直肠癌患者中,对奥沙利铂有反应的患者血清丁酸盐水平高于无反应患者。这表明,肠道微生物产生的丁酸盐可能是决定患者对奥沙利铂反应的关键因素。
临床转化方向
预测性生物标志物
精准调控策略
化疗与肠道菌群存在双向影响:药物破坏菌群平衡,菌群则通过代谢和免疫调控反作用于药物疗效。未来研究需结合菌群检测,在分子机制与临床干预之间架起桥梁,最终实现精准治疗策略。
多项研究表明,放射治疗和微生物群之间存在相互交织的关系。虽然放射治疗可以杀死有益的微生物群,但某些微生物群也可以通过影响患者的免疫系统来提高放射治疗的敏感性。
例如,口腔中的具核梭杆菌会被转移到结直肠肿瘤部位,从而降低放疗的治疗效果。
而甲硝唑是一种针对具核梭杆菌的抗生素,研究发现,在结直肠癌小鼠模型中,甲硝唑可以作为一种放疗增敏剂,提高放疗的效果。
微生物群导致放疗抵抗
丁酸盐在肠道健康中通常被认为有益,为何在放疗中反而有害?
由Lachnospiraceae合成的丁酸盐与放疗抵抗有关
细菌和真菌对放疗的影响相反
小鼠模型(黑色素瘤、乳腺癌)研究发现:
关键分子:免疫受体Dectin-1(感知真菌感染)高表达的乳腺癌患者生存率较差。抑制Dectin-1可提升放疗疗效。
临床转化方向
精准菌群干预:
免疫微环境重塑:
传统癌症治疗方法存在很多局限性,例如对正常细胞的附带损伤、产生治疗耐药性的可能性以及无法完全穿透肿瘤等。因此,迫切需要开发新的、更好的癌症治疗方法。有文献表明,对癌症患者的肠道微生物群进行干预可以增强当前抗癌药物的疗效,如化疗和免疫疗法。
微生物群提高各种肿瘤免疫疗法的效率
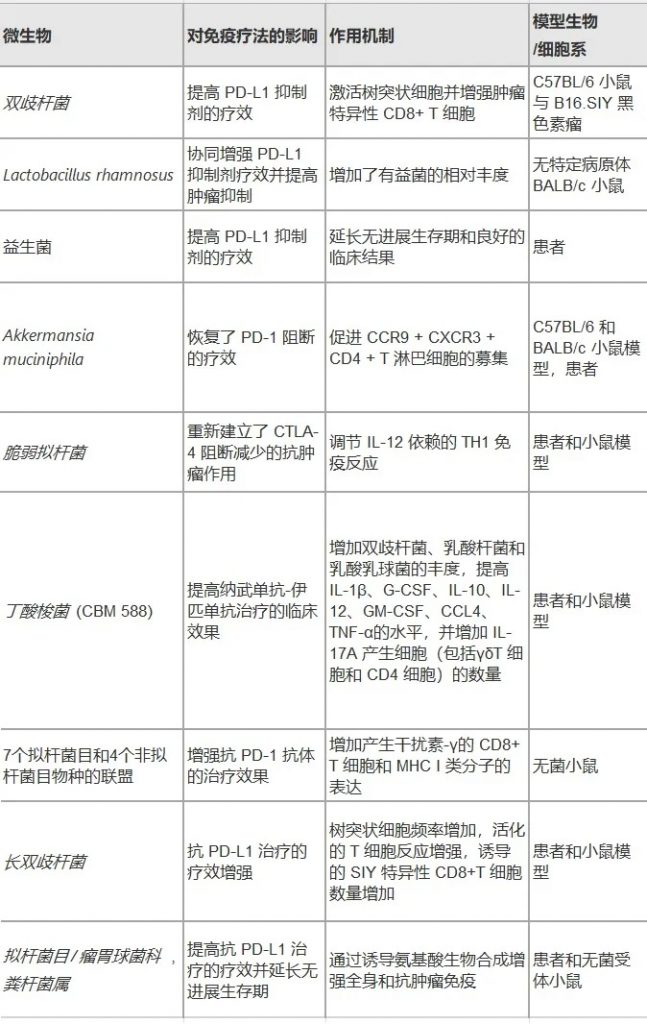
doi.org/10.1186/s12935-025-03787-x
细菌疗法
早在1868年,William Coley发现细菌感染可导致肿瘤消退,开创了细菌疗法的先河。现代研究揭示了细菌靶向肿瘤的独特机制:
研究人员改造了专性厌氧鼠伤寒沙门氏菌菌株YB1,并通过在神经母细胞瘤小鼠模型的肿瘤核心注射这种修饰的细菌观察到对肿瘤生长的抑制。
重组减毒沙门氏菌菌株SL7207被用作在黑色素瘤小鼠模型中递送工程肿瘤疫苗的载体。活细菌也可以与纳米粒子结合,形成有效的药物递送系统。
挑战:
细菌介导的抗癌疗法带来了一些挑战,包括半衰期短、DNA不稳定性和微生物的内在致病潜力。
基因工程有助于删除致病菌株的一些毒力基因,从而可以控制其抗肿瘤活性、特异性和定植。
目前,一些临床试验正在确定功能化鼠伤寒沙门氏菌菌株的效果。这些菌株要么通过各种遗传技术进行工程改造,要么通过纳米粒子或其他试剂进行表面修饰,以显示出所需的肿瘤靶向和定植。
粪菌移植 (FMT)
最近的研究表明,使用FMT重塑微生物群失调可以潜在地抑制癌症进展,特别是结直肠癌。
结直肠癌(CRC)
移植健康小鼠粪便至CRC模型,逆转菌群失衡,增加CD8+ T细胞浸润,减少促炎因子(IL-6、IL-17),抗炎细胞因子IL-10增加,抑制肿瘤进展。
临床试验进展

注:部分试验中FMT导致腹泻等副作用,提示需优化供体筛选。
宏基因组分析显示,在反应者中,FMT后Prevotella copri、Ruminoccocaceae、Eubacterium丰富。此外,与非反应者相比,反应者在FMT后一个月的粪便样本在小鼠模型中抑制肿瘤生长的能力更强。
涉及粪便微生物移植的临床试验

doi.org/10.1186/s12935-025-03787-x
关于 FMT的研究我们之前也写过,详见:
益生菌
益生菌如何帮助对抗癌症?
最近的一项队列研究中,发现益生菌的低等和中等摄入量与癌症死亡率的降低显著相关。
益生菌通过以下机制发挥作用:
鼠李糖乳杆菌(LGG)通过释放脂磷壁酸(LTA)激活TLR2信号,保护肠道干细胞免受放疗损伤。
另一种益生菌Prohep由鼠李糖乳杆菌GG(LGG)、具有活性的大肠杆菌Nissle 1917(EcN)和热灭活VSL3组成,用于在HCC小鼠模型中通过减少Th17细胞和IL-17细胞因子来减少肿瘤生长。
工程化益生菌有何突破?
益生菌要适量
益处:适量补充益生菌可降低癌症死亡率。
风险:过量可能干扰免疫治疗,如黑色素瘤模型中PD-1抑制剂疗效下降。
益生元
益生元——激活菌群抗癌潜能的“燃料”
益生元选择性地促进有益菌(如产丁酸菌)增殖,协同抗癌治疗。
益生元如何优化药物递送?
临床启示与风险管控
个体化菌群干预:
动态监测必要性:
风险提示:
免疫缺陷患者慎用活菌制剂,优先选择灭活益生菌或纯化代谢产物。
总的来说,益生菌双刃剑效应显著,需严格把控种类和剂量;而益生元通过调节菌群代谢,相对安全增强化疗/免疫疗效。
益生菌+益生元+传统疗法可能成为癌症治疗新方向,但需更多临床验证。
抗癌药物
为什么同种药物在不同患者中效果差异显著?
肠道微生物群还参与抗癌药物的生物转化和代谢,导致这些药物的差异吸收和生物利用度。在药物的生物转化过程中,微生物群采用各种机制,如脱氨基、水解、去甲基化、葡萄糖醛酸化和其他反应。
伊立替康(CPT11):
5-氟尿嘧啶(5-FU):
如何减轻菌群介导的副作用或耐药?
抑制特定酶活性:
调控菌群组成:
壳寡糖通过降低肠球菌、大肠杆菌-志贺氏菌、Turicibacter的密度以及促进丁酸产生菌的生长,对结直肠癌具有保护潜力。

临床潜在方向
未来,建立“菌群-药物代谢”数据库,结合人工智能预测个体化用药方案。例如,对高β-葡萄糖醛酸酶活性的患者,优先选择不受该酶影响的化疗药物(如奥沙利铂)。
关于常用药物和肠道菌群之间复杂的双向相互作用,我们之前的文章也写过,详见:
为什么药物对人效果不一?探索药物-微生物群相互作用对效果的影响
全球癌症治愈率依然不高,肠道微生物群在癌症发生、发展、转移和药物反应中的关键作用正逐渐成为研究热点,为精准抗癌策略提供了全新思路。
菌群在癌症治疗中的关键作用
微生物通过多种机制影响癌症治疗效果:
doi.org/10.1186/s12935-025-03787-x
当前挑战:从实验室到临床的鸿沟
– 研究方法的“碎片化”
样本收集(粪便 vs 肿瘤组织)、测序技术(16S rRNA vs 宏基因组)的差异导致结果难以比较;
解决方案:建立全球统一的微生物组分析标准。
– 个体化差异
年龄、饮食、地理因素使菌群组成差异巨大——同一疗法在不同人群中的响应率波动;
突破口:开发基于AI的个体化菌群图谱,预测治疗敏感性与毒性风险。
– 治疗复杂性的叠加
在现有化疗/免疫治疗基础上引入菌群调控,可能引发不可预见的药物-微生物相互作用;
未来方向:迈向精准菌群医学
– 精准菌群分层
通过多组学技术(宏基因组+代谢组)构建个体化菌群图谱,识别“促癌菌”与“抑癌菌”。
针对不同化疗方案调整菌群结构,丁酸水平低者优先使用奥沙利铂联合益生元。
– 联合干预策略
饮食-菌群协同:高纤维饮食联合特定益生元(如菊粉),可使MEK抑制剂疗效提升。
个性化膳食(如高纤维饮食)联合益生菌,改善肠道健康并增强治疗响应。
结合基因、饮食等多维度数据定制治疗方案。
工程菌开发:设计靶向降解耐药相关酶(如β-葡萄糖醛酸酶)的工程菌。
– 临床转化路径
推动大规模临床试验,验证菌群移植(FMT)、益生元/菌在特定癌种中的疗效。
探索菌群标志物(如丁酸盐水平)作为治疗响应预测指标。
开发微生物群-人工智能联合预测模型,优化治疗决策。
将菌群检测纳入癌症辅助诊疗,实现早筛与疗效监控。
总的来说,微生物组研究不仅扩展了我们对癌症发生发展的认知,更为癌症治疗提供了新的可能性。通过系统化的菌群检测与精准干预,跨学科协作与技术创新,未来有望实现真正的个体化治疗方案,提高抗癌疗效并改善患者生活质量。这一领域的进步,代表着癌症治疗从单一靶向向生态系统整体调控的深刻范式转变。
主要参考文献
Adlakha YK, Chhabra R. The human microbiome: redefining cancer pathogenesis and therapy. Cancer Cell Int. 2025 Apr 28;25(1):165.
Shi Z, Li Z, Zhang M. Emerging roles of intratumor microbiota in cancer: tumorigenesis and management strategies. J Transl Med. 2024 Sep 11;22(1):837.
Murayama M, Hosonuma M, Kuramasu A,et al., Isobutyric acid enhances the anti-tumour effect of anti-PD-1 antibody. Sci Rep. 2024 May 17;14(1):11325.
Jia D, Kuang Z, Wang L. The role of microbial indole metabolites in tumor. Gut Microbes. 2024 Jan-Dec;16(1):2409209.
Sun X, Shan X, Zhu B, Cai Y, et al., 5-Fluorouracil Loaded Prebiotic-Probiotic Liposomes Modulating Gut Microbiota for Improving Colorectal Cancer Chemotherapy. Adv Healthc Mater. 2025 Feb;14(4):e2403587.
Zhang H, Xu Z. Gut-lung axis: role of the gut microbiota in non-small cell lung cancer immunotherapy. Front Oncol. 2023 Nov 22;13:1257515.
Wang S, Yin F, Guo Z, Li R, Sun W, Wang Y, Geng Y, Sun C, Sun D. Association between gut microbiota and glioblastoma: a Mendelian randomization study. Front Genet. 2024 Jan 4;14:1308263.

谷禾健康

编辑在老龄化过程中,生理功能逐渐衰退,伴随着多种疾病的发生,对老年人的身心健康构成重大威胁。
衰老是一个渐进、持续的过程,受到多种因素的影响,包括遗传、饮食、运动、生活方式等生理因素,也有社会、文化等复杂因素的交互影响,目前,越来越多的证据支持肠道菌群在衰老过程中的作用。
自然或“健康”的衰老,伴随着普雷沃菌属、粪杆菌属和双歧杆菌属以及直肠真杆菌属等减少,被其他共生微生物群所取代,如Butyricimonas、Akkermansia、Odoribacter等,尤其Akk菌与百岁老人的健康有关。而不健康衰老,则意味着致病菌或条件致病菌增多,包括肠杆菌科、放线菌属等。
肠道菌群与衰老相关的变化与认知能力下降、肌肉质量下降、骨质减少、皮肤稳态、血管老化、免疫衰老、代谢改变、肺和肝功能下降等密切相关。这些身体机能的衰退往往伴随着心理健康的变化,尤其是晚年抑郁症的发病率增高,约4%的老年人被诊断患有晚年抑郁症。
与成年人抑郁症相比,晚年抑郁症更多表现为生理症状突出,认知功能损害更严重,晚年抑郁症可能是老年痴呆的先兆。
经常看我们文章的朋友都知道,肠-脑轴与神经精神疾病的发病机制密切相关。这一双向调节轴通过神经免疫、神经内分泌等通路,以及肠道屏障、微生物代谢物和血脑屏障等,影响大脑功能,当然也包括认知水平。
近期几项研究(包括纵向跨诊断研究,横截面研究等)表明,肠道菌群可以预测未来的认知能力下降和抑郁症状,未来认知功能下降与较低的Intestinibacter相对丰度、较低的谷氨酸降解以及较高的组胺合成水平相关。关于谷氨酸和组胺可以详见我们之前的文章:
晚年抑郁症中总游离脂肪酸部分介导了Akkermansia与认知功能之间的关系,IL-6、IFNγ、疣微菌门和Akkermansia水平与抑郁严重程度相关。
本文我们通过这几项研究,来更深入具体地了解肠道菌群对老年人认知能力下降和抑郁症状的当前和未来影响,同时也包括其他老年神经系统疾病相关合并症,营养不良住院老年人的肠道菌群紊乱和临床结果,以及针对衰老的相关干预措施的介绍。希望为大家提供更多关于肠道菌群在老年健康领域重要作用的见解。
doi.org/10.14336/AD.2024.0331
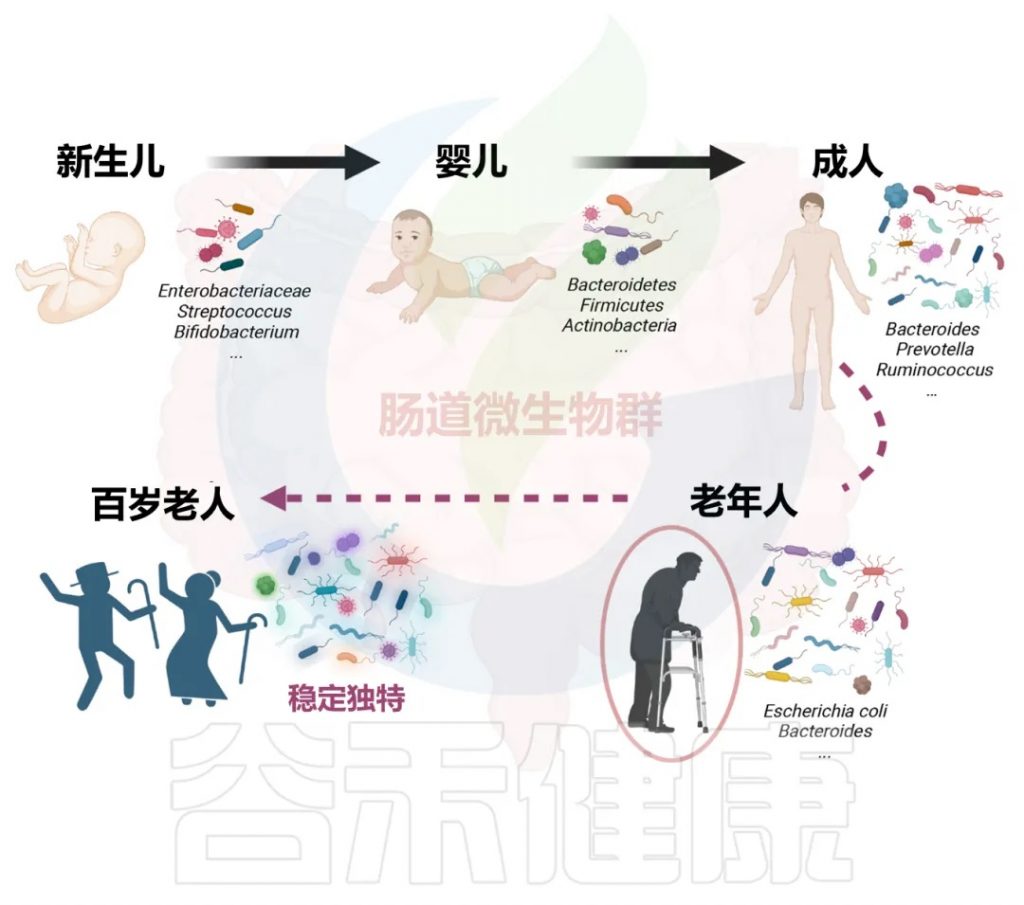
在人类的整个生命周期中,肠道微生物群的变化和转变伴随着衰老过程。
婴儿从出生起就接触各种环境微生物,导致肠道微生物群逐渐丰富和多样性增加。
新生儿肠道最初定植主要涉及兼性厌氧微生物,如肠杆菌科和链球菌,其次是专性厌氧微生物,如双歧杆菌、梭菌和拟杆菌。
Prausnitfaecali和喜爱粘蛋白的Akkermansia muciniphila等细菌在婴儿早期要么不存在,要么以非常低的水平存在,并在 1-2 岁左右增加到成人水平。
共生且稳定的肠道微生物群通常在9至36个月大的婴儿中形成,常见的分类群包括拟杆菌门、厚壁菌门和放线菌门。
3-5岁儿童的肠道菌群组成逐渐向成人趋同。一旦建立,肠道微生物群的组成在整个成年期保持相对稳定。
成年人的肠道菌群包括拟杆菌型、普雷沃氏菌型等几种常见肠型。个体间差异与饮食、生活方式、运动频率、种族、文化习惯等许多因素相关。
在中老年人中,肠道微生物群多样性下降。某些核心肠道微生物类群在老年人中也会发生变化。例如,拟杆菌属和大肠埃希氏菌的比例较高。
DOI: 10.14336/AD.2024.0331
自然或“健康”的衰老会导致肠道微生物组组成的特定变化,例如某些共生菌属的丧失,包括普雷沃菌属、粪杆菌属和双歧杆菌属以及直肠真杆菌属。在老年阶段,这些菌群被其他共生微生物所取代,如丁酸杆菌属(Butyricimonas)、Akkermansia、Odoribacter等。
特别是Akkermansia muciniphila,已知其有助于肠道中的粘蛋白降解。研究人员推测,AKK菌的水平可以指示健康状况,其相对丰度增加(高于健康老化时的水平)与百岁老人的极佳健康状况相关,而相对丰度降低则与肠道粘液层变薄和酰基甘油减少有关。
注:酰基甘油是一种调节肠道通透性和减少肠道炎症的内源性大麻素。
长寿人群的肠道菌群特征
研究发现,与100岁以下人群相比,百岁老人体内有益细菌(如拟杆菌属、Desulfovibrio suis、Pameliagodonibacterium pamelaeae、瘤胃球菌科、乳杆菌、Akkermansia、 甲烷短杆菌属)含量更高,而Faecalibacterium 、普雷沃特菌属、克雷伯氏菌属、链球菌属、肠杆菌属、肠球菌属含量较低。
百岁老人肠道菌群多样性有所增加。百岁老人肠道微生物群中有益细菌占主导地位,可能有助于抵消与年龄相关的健康问题和衰老。
长寿人群的肠道菌群功能分析
2019年,一项对百岁老人肠道微生物功能的分析显示,中枢代谢能力增强,特别是在产生短链脂肪酸的糖酵解和发酵途径中。此外,百岁老人还表现出更高水平的磷脂酰肌醇信号系统、鞘脂生物合成和不同水平的n-聚糖生物合成。
2020年,一项对肠道微生物组的功能研究揭示,随着年龄的增长,与异养降解代谢相关的途径增加,与碳水化合物代谢相关的通路减少。
2021年进行的一项研究,包括吲哚和苯乙酰谷氨酰胺在内的七种微生物代谢产物与百岁老人肠道微生物群的不同组成之间存在显著关联。这两种代谢产物先前被证明可以延长小鼠的寿命,在百岁老人的血液中发现了高水平的代谢产物。
总之,肠道微生物群不仅是衰老的标志,而且在维持人类健康和寿命方面发挥着至关重要的作用。
肠道微生物群与年龄相关的变化不仅影响肠道健康,而且还延伸到其他生理系统。
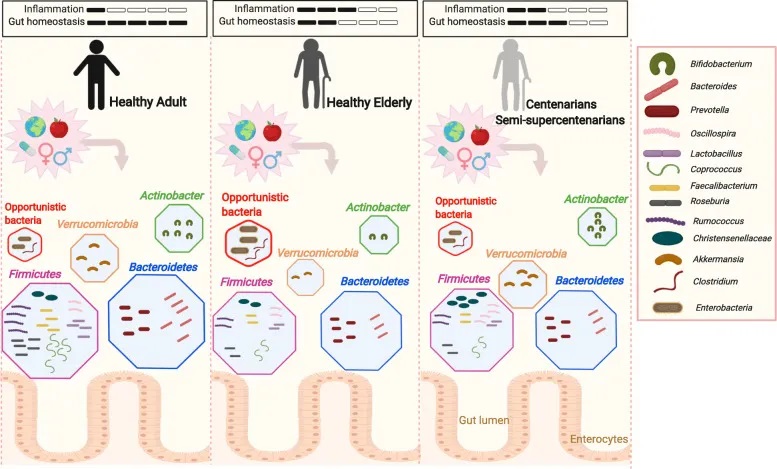
炎症衰老
早在20世纪60年代的研究就表明老年人的免疫功能有所下降,这一过程现在被称为免疫衰老,与免疫系统功能下降有关,从而导致促炎细胞因子的积累。
老年人群中炎症状态的增加现在通常被称为“炎症衰老”。促炎症状态使患者面临多种疾病的更高风险,例如自身免疫性疾病、心血管疾病、感染。
doi: 10.1186/s12979-020-00213-w
在胃肠道内,维持功能性上皮和粘液屏障对于预防感染和疾病至关重要。肠道通透性增加可导致微生物易位至宿主循环中,加剧促炎状态。
科学家还发现了几种在“不健康”衰老过程中会增加的致病生物或条件致病微生物,这一过程的特点是身体和精神迅速衰退,并与疾病进展和身体虚弱有关。其中一些病原体包括埃格特菌属(Eggerthella)、放线菌属、肠杆菌科,它们的存在和数量可以帮助预测寿命和疾病结果。
老龄化人群:微生物组本身的变化导致促炎状态
在无菌小鼠模型中进行的实验表明,老龄化人群中微生物组本身的变化导致了促炎状态,无菌小鼠的寿命比传统小鼠要长得多。此外,与灌胃其他年轻小鼠微生物组的小鼠相比,灌胃老年小鼠微生物组的年轻无菌小鼠表现出更大的肠道通透性和循环肿瘤坏死因子。
与各种器官和疾病相关的年龄相关肠道菌群
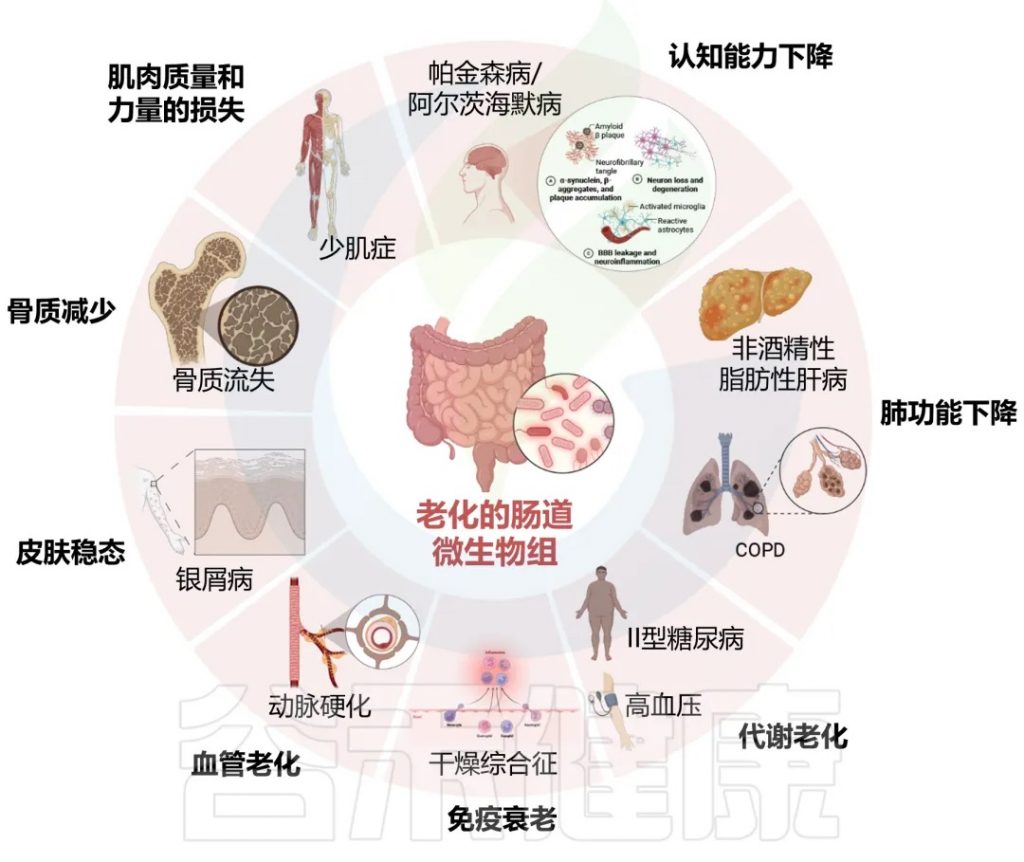
DOI: 10.14336/AD.2024.0331
肠道微生物群与年龄相关的变化与认知能力下降、肌肉质量和能力下降、骨质减少、皮肤稳态、血管老化、免疫衰老、代谢改变、肺和肝功能下降密切相关。
表1 不健康衰老过程中的肠道微生物组
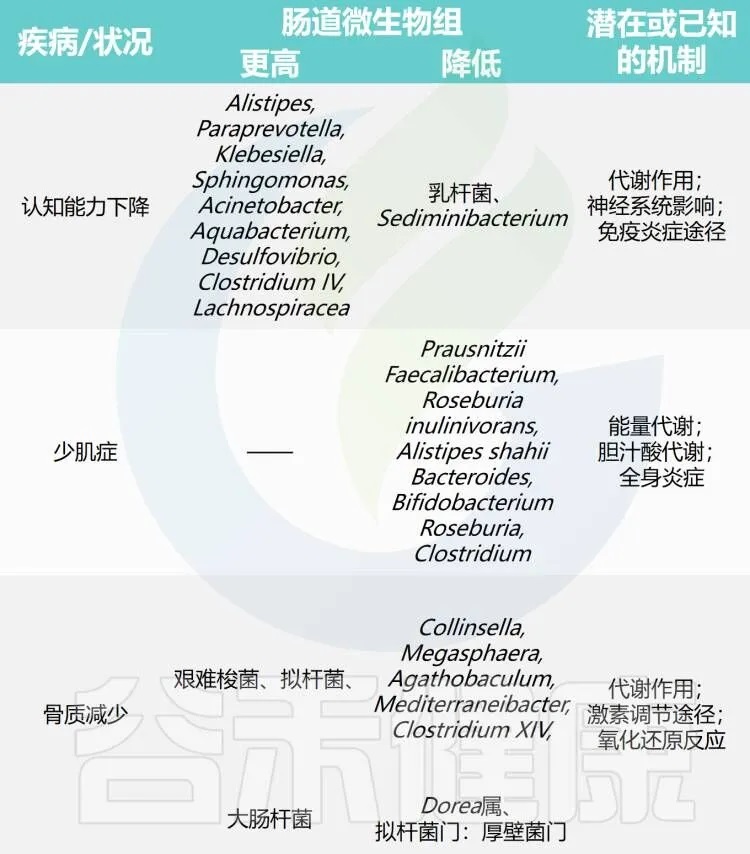

doi.org/10.14336/AD.2024.0331
一个越来越受关注的领域是通过可能影响认知功能的微生物群-肠-脑轴。神经精神疾病的病因复杂,肠道菌群和炎症可能是神经系统疾病发病机制的关键因素。接下来我们通过几项近期的研究队列,来了解老年人的肠道菌群与神经系统疾病关联。
随着全球人口预期寿命的增加,晚年抑郁症的患病率显著上升,约4%的老年人被诊断患有晚年抑郁症。晚年抑郁症更多表现为明显的躯体症状,而情感症状不突出,认知功能障碍也更严重。
有认知障碍的老年人抑郁会增加痴呆的进展。微生物群与当前的情绪和认知有关,近日,几项关于肠道菌群与老年抑郁、认知能力下降关联的研究发表,这些有助于我们更好地理解和应对老年抑郁和认知能力下降,一起来看一下:
literature 1
肠道菌群对老年人认知能力下降和抑郁症状的当前和未来影响

从268名有不同认知和抑郁症状的参与者中收集临床评估和粪便样本。
70名参与者接受了为期2年的随访。
肠道菌群多样性↑ 认知↓ 抑郁严重程度↑
更大的微生物群落多样性,表明群落中物种的数量更高,分布更均匀,与样本中当前认知功能更差以及未服用抗抑郁药的参与者抑郁严重程度更高有关。
认知功能差与双歧杆菌的相对丰度较低有关。
GABA↓ 抑郁症严重程度↑
在功能水平上,GABA 降解程度越高,基线抑郁症严重程度越高。
GABA 是一种主要的抑制性神经递质,抑郁症患者表现出较高的GABA降解和较低的 GABA 生物合成,GABA功能的减少在认知功能中起着至关重要的作用,影响抑郁和衰老过程中出现的症状,微生物衍生的GABA会影响全身的GABA 水平,并与行为和功能连接的变化相关。
未来认知能力下降 与下列因素有关:
未来抑郁症状的增加 与下列因素有关:
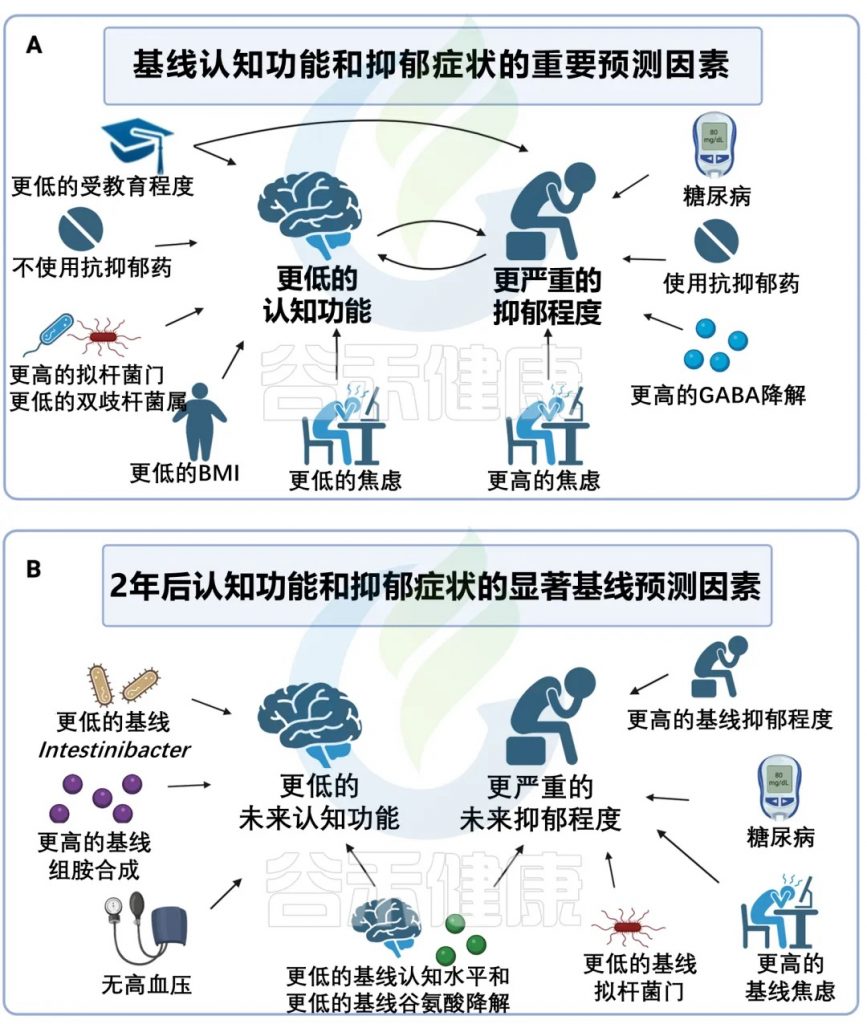
doi: 10.1038/s41380-024-02551-3
这是第一项纵向跨诊断研究,它代表着在精神病学、衰老和微生物组的交叉点上迈出了重要的一步。
微生物组可以预测未来的认知能力下降和抑郁症状,有可能为识别可能经历认知能力或情绪下降的人提供生物标志物。
literature 2
晚年抑郁中,总游离脂肪酸与肠道菌群组成和认知功能相关性的的中介分析
近日,来自浙江省人民医院精神病科康复医学中心廖峥娈团队的相关研究成果发表在《Lipids in Health and Disease》期刊上。这也是谷禾健康开放基金合作项目,一起来看一下。

晚年抑郁症是指60岁以上老年人出现的抑郁障碍,包括老年首发抑郁和老年复发的抑郁。该研究纳入来自老年抑郁认知结果队列研究的29名晚年抑郁症患者。
Spearman相关分析显示,Akkermansia丰度、总游离脂肪酸和MoCA评分之间存在显著相关性(P<0.05)。多元回归分析表明Akkermansia和总游离脂肪酸能显著预测MoCA评分(P<0.05)。
肠道微生物群、认知评估和脂质代谢指标之间的相关性
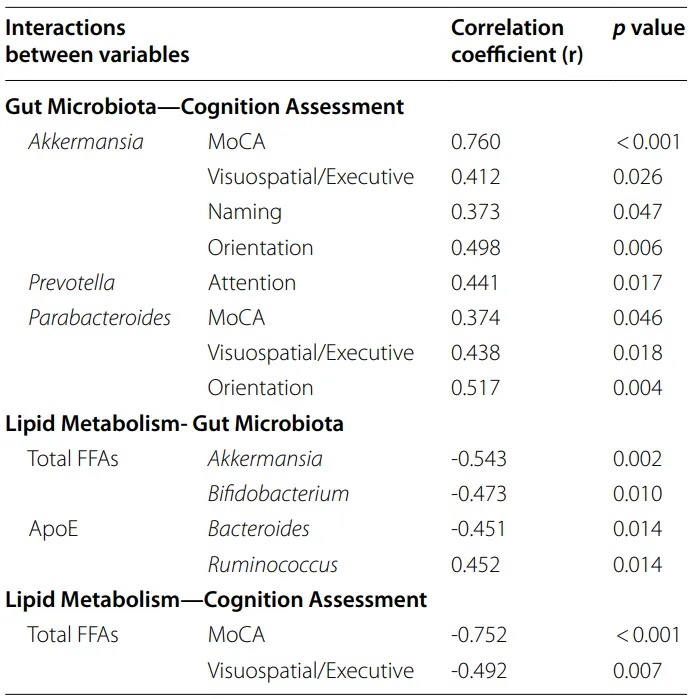
doi: 10.1186/s12944-024-02056-6.
调解分析显示,晚年抑郁症患者中Akkermansia相对丰度降低与认知功能下降的关系,部分由总游离脂肪酸介导(Bootstrap 95%CI: 0.023-0.557),占相对效应的43.0%。
肠道微生物群、脂质代谢产物和认知功能评分之间的相关性
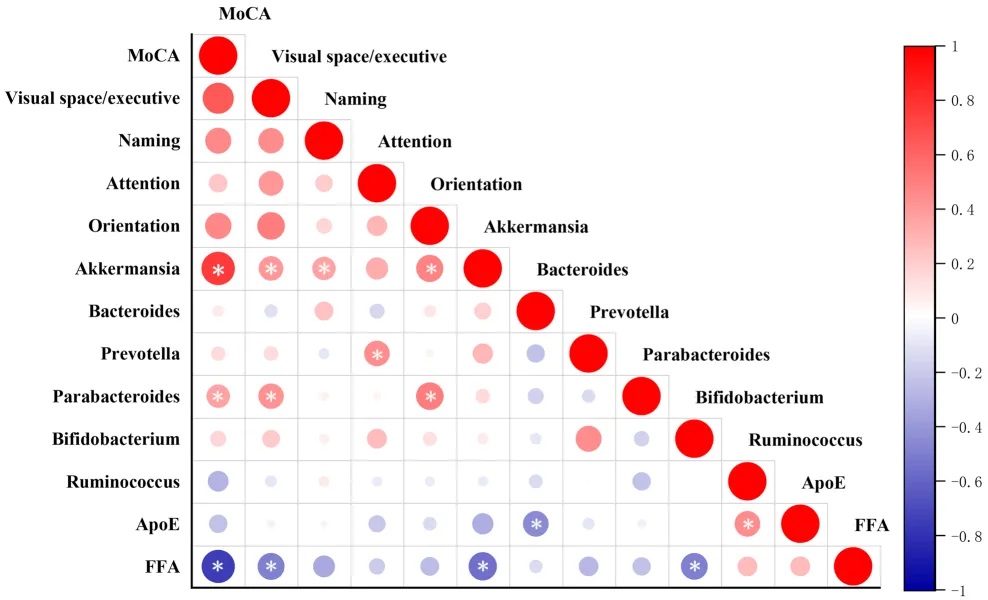
doi: 10.1186/s12944-024-02056-6.
这些发现表明,晚年抑郁症中认知功能与Akkermansia及总游离脂肪酸存在显著关系。总游离脂肪酸部分介导了Akkermansia与认知功能之间的关系。
晚年抑郁症患者的认知功能与总游离脂肪酸呈负相关,尤其是视觉空间/执行功能。
游离脂肪酸作为非酯化脂肪酸,是甘油三酯分解的产物,具有脂毒性,可通过被动转运或蛋白介导的内吞作用进入大脑,从而影响血管内皮功能。它们被认为可预示II型糖尿病(T2DM)患者阿尔茨海默的发生。有研究报告,在II型糖尿病合并轻度认知障碍的患者中,游离脂肪酸与注意力和执行功能呈负相关。另有研究发现,健康人群中游离脂肪酸水平升高与认知功能下降相关。这些发现揭示了游离脂肪酸对晚年抑郁症患者认知功能的影响。
总游离脂肪酸在阿克曼症和认知功能之间关系中作用的中介模型
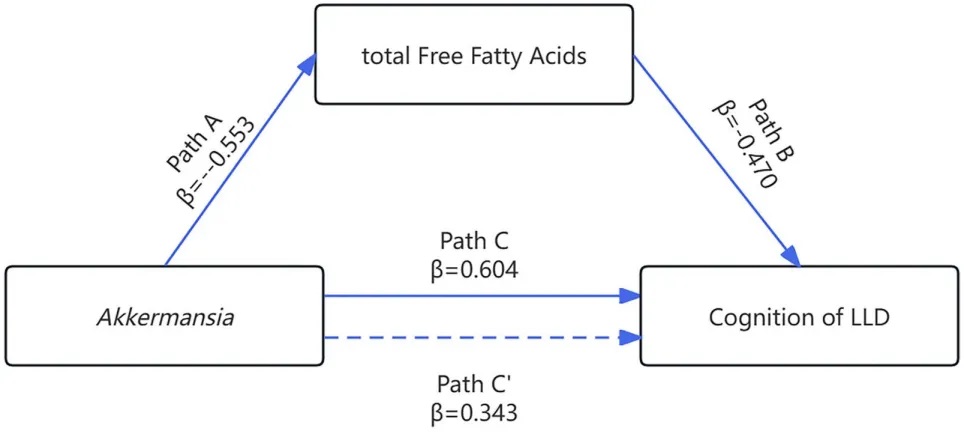
这是首次评估晚年抑郁症患者中认知功能、肠道菌群和脂质代谢关系的研究。这些结果有助于理解肠道微生物-宿主脂质代谢轴在晚年抑郁症认知功能中的作用。
literature 3
晚年抑郁症患者肠道微生物群失调和信息功能障碍的横断面观察分析
这项研究也是来自浙江省人民医院精神病科康复医学中心廖峥娈团队的,其相关研究成果已于近日发表在《Neuropsychiatric Disease and Treatment》期刊上。
这也是谷禾健康开放基金合作项目,该研究分析了晚年抑郁患者的肠道菌群特征和血清炎症细胞因子,探讨这两个因素在晚年抑郁潜在生物标志物中的联合作用。一起来看一下。

收集29名晚年抑郁患者和33名性别年龄匹配的健康对照(HC)的粪便样本和外周血,检测肠道菌群和12种炎症因子。
晚年抑郁症患者存在系统性炎症细胞因子水平升高和肠道菌群失调。
晚年抑郁症和健康对照的LEfSe分析
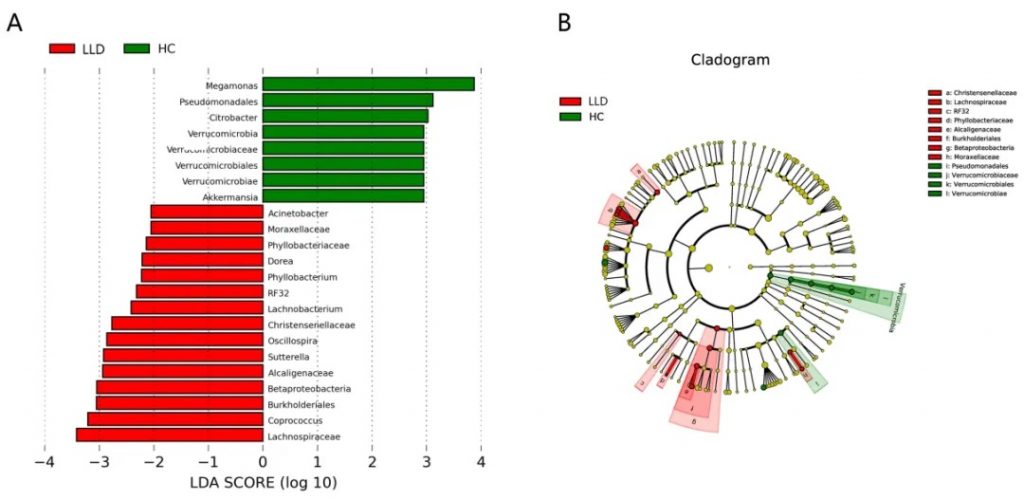
doi: 10.2147/NDT.S449224.
值得注意的是,IL-6、IFNγ、疣微菌门和Akkermansia水平与抑郁严重程度相关。
IL-6是神经元和胶质细胞表达的一种促炎症细胞因子,对免疫和急性期反应至关重要。有研究人员提出,高IL-6水平可促进5-羟色胺降解和减少5-羟色胺产生,从而损害神经可塑性,导致海马和前额叶萎缩等脑结构异常,这些异常已被证实与晚年抑郁症及其引起的认知障碍相关。与该研究一致。
IFNγ是一种参与中枢神经系统炎症的促炎因子,并激活大脑中的小胶质细胞以诱导促炎反应。研究表明,IFNγ激活的小胶质细胞改变了海马神经原生态位,抑制神经干细胞和祖细胞的增殖,并促进未成熟神经元的凋亡,从而导致小鼠的抑郁症状和认知障碍。该研究在临床上证实了这一观点,并证明IFNγ水平与晚年抑郁严重程度有关。简而言之,这项研究表明,晚年抑郁是一种促炎和抗炎细胞因子共存的炎症状态,IL-6和IFNγ与疾病严重程度有关。
既往研究发现,焦虑和抑郁患者中疣微菌门丰度降低,而Akkermansia丰度增加可降低焦虑,增强老年小鼠的认知功能。这与研究结果一致。回归分析显示,Akkermansia丰度是预测晚年抑郁概率的一个风险因素。但Akkermansia丰度与炎症因子水平无相关性,提示Akkermansia可能不通过炎症通路参与晚年抑郁的发病机制。
有趣的是,有研究发现,Akkermansia的外膜蛋白Amuc_1100可直接与TLR2结合,促进5-HT合成率限速酶Tph1的表达,并降低肠上皮细胞中5-HT转运体的表达,从而增加5-HT的生物合成和胞外可用性,这提示Akkermansia可能通过直接调节肠屏障的神经递质释放来影响晚年抑郁。
肠道菌群改变、临床变量和炎症因子之间的关联(Spearman相关分析)
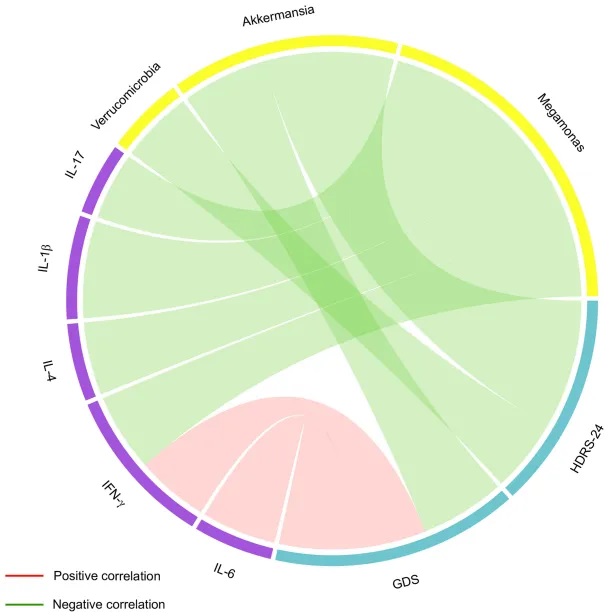
doi: 10.2147/NDT.S449224.
研究确定了IL-6、Akkermansia和Sutterella为晚年抑郁症的预测因子,它们的组合在区分晚年抑郁症患者和健康对照方面的曲线下面积为0.962。
通过回归分析,Sutterella可作为预测晚年抑郁的指标。Sutterella是一种重要的肠道共生菌。既往研究发现,Sutterella丰度在重度抑郁和广泛性焦虑障碍患者中显著增加。许多研究也发现Sutterella与肥胖以及体重和脂肪增加呈正相关。
肥胖和抑郁之间存在双向关系,研究表明,促使垂体肾上腺皮质轴(HPA轴)过度激活、导致皮质醇失调可能是两者的共同机制。因此推测Sutterella可能通过影响HPA轴,从而影响皮质醇的释放,进而触发晚年抑郁的发生。
利用差异丰度属作为晚年抑郁症诊断因子的灵敏度和特异性的ROC曲线分析
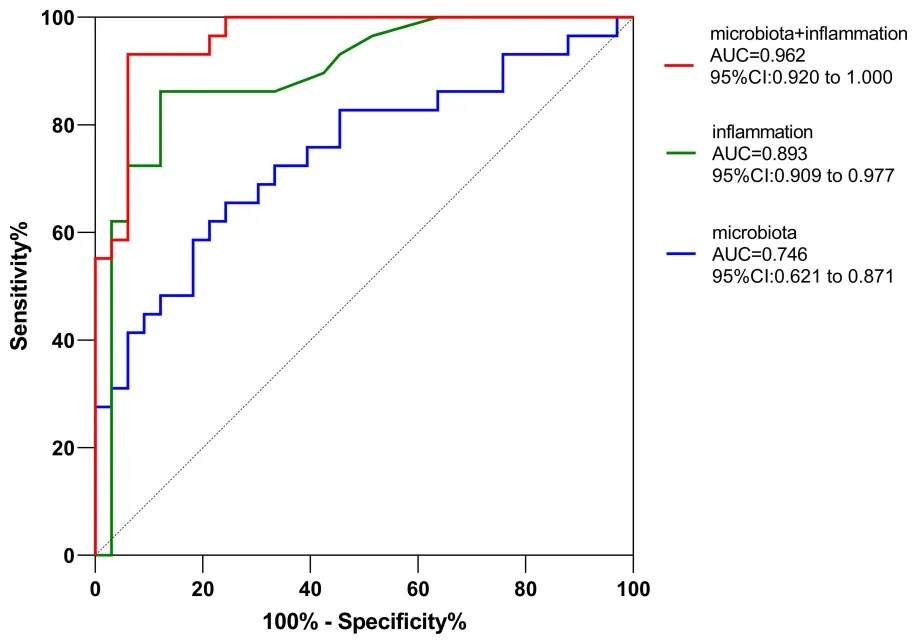
doi: 10.2147/NDT.S449224.
这是一项横断面观察研究。该研究提供了晚年抑郁中肠道菌群和系统性炎症变化的证据。重要的是,将肠道菌群和炎症标志物结合使用,可以增强其作为晚年抑郁症潜在生物标志物的预测能力。这些发现有助于阐明肠道菌群和系统性炎症在晚年抑郁发展中的作用,并为临床实践中晚年抑郁的生物标志物提供新思路。
其他合并症相关的研究:
轻度认知障碍(MCI)在老年人中高度普遍,影响了大约10%的70-74岁老人和25%的80-84岁老人。此外,轻度认知障碍患者更有可能进展为痴呆。迄今为止,药物治疗只能减缓轻度认知障碍的进展,但不能逆转它。
注:轻度认知障碍、阿尔茨海默虽然都涉及认知功能下降,但严重程度有所不同,轻度认知障碍是认知功能较正常人有轻微下降,但日常生活功能基本正常。阿尔茨海默是认知功能严重下降,严重影响日常生活。
虽然对微生物群改变是否会影响认知功能仍有分歧,但正在进行的长期项目,如MOTION(衰老肠道的微生物群及其对人类肠道健康和认知的影响),研究健康老龄化的认知和微生物群变化,为解释清楚这些相互作用提供了希望。
表2 选择随机对照试验和观察性研究(2019-2023)
评估老年人认知功能和肠道微生物组

DOI: 10.1007/s11894-024-00932-w
痴呆症:促炎菌增多
2019 年的一项鸟枪法宏基因组序列研究将 57 名患有痴呆症(包括阿尔茨海默病)的疗养院居民与 51 名未患有阿尔茨海默或其他形式痴呆症的老年人进行了比较,结果发现痴呆症患者体内的促炎性肠道细菌水平较高。
阿尔茨海默:产丁酸菌减少,α 多样性降低
作者还注意到,与没有痴呆症的受试者和患有阿尔茨海默病以外的其他痴呆症的受试者相比,阿尔茨海默组中丁酸合成细菌的种类(例如丁酸弧菌属Butyrivibrio和真细菌属Eubacteria)有所减少。
随后的系统回顾和荟萃分析同样发现,与健康对照者相比,阿尔茨海默患者肠道微生物组的 α 多样性有所降低,但轻度认知障碍 (MCI) 患者与健康对照者之间的差异并未降低。
阿尔茨海默病、轻度认知障碍和健康样本之间微生物组组成的差异(即β多样性)并没有一致改变。研究与痴呆症相关的肠道微生物组的一个挑战是缺乏明确、客观和非侵入性的测试来最终确定诊断和疾病阶段,从而使研究结果的解释进一步复杂化。虽然超出了肠道微生物组的范围,但阿尔茨海默病脑组织的尸检研究已经确定了大脑内存在微生物,这表明存在与神经退行性疾病相关的大脑微生物组。
促炎Collinsella菌和APOE风险的强相关性
一项大型全基因组关联研究确定了几个与载脂蛋白E ε4 (APOE ε4) 基因高风险等位基因相关的微生物组属,载脂蛋白E ε4 是阿尔茨海默的一个公认的危险因素。这项研究的一些最重要的发现包括促炎Collinsella菌和 APOE 风险等位基因之间的强相关性,以及提出对Eubacterium fissicatena的保护作用。
帕金森病 (PD) 是另一种神经系统疾病,在老年人中更为常见,人们越来越关注肠道微生物组作为其生物标志物或治疗方法。
帕金森:产丁酸菌如Roseburia、粪杆菌减少
2020 年对来自日本、美国、芬兰、俄罗斯和德国的 16S 测序数据进行荟萃分析发现,帕金森病患者的Roseburia和粪杆菌相对减少,这两者都是丁酸盐的重要生产者。
帕金森:普雷沃氏菌里的致病菌种增加
2022 年对 490 名帕金森病和 234 名健康对照者进行的鸟枪法测序研究证实了这些发现,并确定了帕金森病患者中发生改变的其他几个属,例如普雷沃氏菌里的致病菌种增加。
帕金森:阿克曼氏菌属增加
有趣的是,多项研究指出,帕金森病患者中阿克曼氏菌属(AKK菌)的数量有所增加,考虑到阿克曼氏菌通常与健康衰老相关,并且在超级百岁老人中尤其丰富,这一点令人惊讶。一些科学家推测阿克曼氏菌是健康衰老的重要组成部分,但数量的增加使患者面临神经认知疾病的风险。
进一步假设,阿克曼氏菌丰度的变化可能继发于便秘的发生,便秘是帕金森病的常见胃肠道并发症,并且在多项其他研究中与阿克曼氏菌增加独立相关。由于帕金森病和阿克曼氏菌之间的联系是一个不一致的发现,因此需要进一步的研究来确定该属在帕金森病和更广泛的衰老中的确切作用。
在过度表达 α-突触核蛋白聚集体(PD 患者大脑中常见的现象)的帕金森病小鼠模型中,与移植有健康供体微生物群的小鼠相比,移植有 6 名人类帕金森病患者肠道微生物组的小鼠的身体运动障碍和便秘有所增加。
粪菌移植改善帕金森病患者便秘和神经系统症状
基于帕金森病微生物群改变的这些早期发现,一项随机对照试验发现,健康捐赠者的粪便以冻干药丸形式每周两次服用,持续 12 周,可以改善便秘和肠道蠕动,并暂时提高轻度至中度帕金森病患者的客观运动技能。虽然仍需要大量的转化和临床数据开发,但这些初步发现表明肠道微生物组调节可能改善帕金森病的胃肠道和/或神经系统症状,并提供对疾病病理生理学的更深入了解的希望。
需要更多协助完成日常活动(ADL)的老年人,可能会从社区生活过渡到长期护理机构。这种迁移会由于环境、饮食和医疗因素的推测变化而导致微生物群的变化。
在一般成年人群研究中,家庭表面的微生物与肠道微生物群组成相关,这在过渡到长期护理环境时需要考虑。此外,老龄化和接触医疗机构(如长期护理机构)都与艰难梭菌感染(CDI)的风险增加有关,CDI是医疗相关性炎性腹泻的主要原因。
无论年龄如何,都有强有力的证据表明,特定的饮食可以引起微生物组的独特改变以及相应的血清和粪便代谢物的变化。
相对而言,高纤维受试者微生物组恢复能力最好
一项严格对照的研究跟踪了 30 名受试者,他们被随机分为纯素食(高纤维)、杂食(中纤维)和配方饮食(无纤维)。 6 天后,受试者接受口服抗生素和聚乙二醇的组合进行“肠道净化”。
研究人员发现,与其他群体相比,纯素食受试者的微生物组在“净化”后恢复得更快,在更短的时间内恢复了更大的多样性。另一方面,坚持配方饮食的受试者的恢复期最长。
不同生活方式下,微生物多样性的差异
在一项横断面研究中,将以前未接触过的亚诺马米美洲印第安人的肠道微生物组与居住在美国和和半跨文化人群的个体微生物组进行了比较,与美国人相比,亚诺马米人的肠道微生物群多样性明显更高,而半跨文化人群的多样性水平居中。然而,值得注意的是,不仅仅是饮食,其他社会和医学因素,也可能导致多样性增加。
从社区生活转向长期护理机构,饮食变化如何影响肠道菌群及功能?
微生物组中与年龄相关的变化的一个组成部分似乎与饮食和进食明确相关,特别是因为老年人在获取营养食物方面,出现牙列不良或咀嚼困难、食欲下降以及缺乏社会支持的风险增加。
例如,会导致微生物组改变的最显著的饮食变化之一,是从独立的社区生活转向长期护理机构内的辅助生活。
这种转变通常会导致从高纤维、低脂肪饮食向低纤维、高脂肪饮食的转变,与社区居民相比,长期护理居民的微生物组多样性较低。值得注意的是,这些长期护理居民和社区居民之间的差异与长期护理所花费的时间相关。
在消化过程中,纤维被代谢为短链脂肪酸,它可以作为保护性微生物群的能量来源,协助抗炎反应并维持肠道屏障完整性,从而为胃肠道带来许多好处。因此,转移到长期护理机构时因饮食改变而导致的短链脂肪酸缺乏,可能会间接导致肠道功能障碍。
营养不良住院老年人的肠道菌群紊乱和临床结果
营养不良是住院患者尤其是老年人中最普遍和最具威胁性的综合征之一。营养不良表现为身体成分改变和生物功能减弱,导致体力下降和恢复速度减慢。此外,它降低了对医疗干预的耐受和反应能力,使受影响的人容易出现并发症和预后较差。
一项研究对来自入院时和住院 72 小时评估的前瞻性队列中的 108 名急性重症老年患者进行了二次纵向分析。收集了临床、人口统计、营养和 16S rRNA 基因测序肠道微生物群数据。

严重营养不良患者α多样性较差
与住院期间营养良好的患者相比,营养不良患者 (51%) 的微生物群组成不同 (ANOSIM R = 0.079,P = 0.003)。
严重营养不良患者在入院时(Shannon P = 0.012,Simpson P = 0.018)和随访时(Shannon P = 0.023,Chao1 P = 0.008)表现出较差的α多样性。
营养不良与特定菌群的关联
Lachnospiraceae NK4A136组、Subdolilegum和普拉梭菌的差异丰度显着降低,与营养不良呈负相关,而棒状杆菌(Corynebacterium)、Ruminococcaceae Incertae Sedis和Fusobacter的差异丰度显着升高,与营养不良呈正相关。
棒状杆菌(Corynebacterium)、Ruminococcaceae Incertae Sedis及其总体组成是住院期间营养不良患者重症监护的重要预测因子。
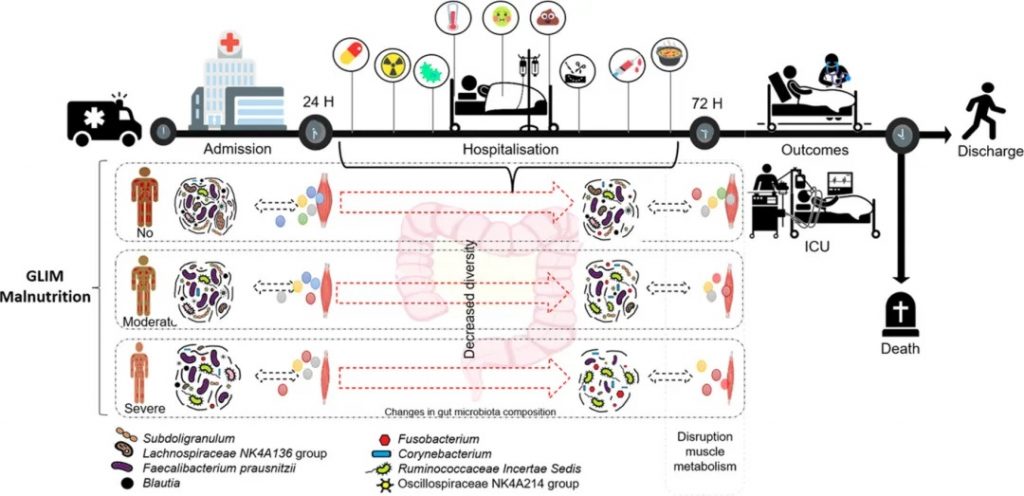
doi.org/10.1016/j.nut.2024.112369
总的来说,营养不良的老年急症患者肠道菌群组成不同,多样性较差,潜在有益菌丰度较低,住院期间机会致病菌增多。 “营养不良的肠道微生物群”可能能够预测不良的医院结果。为与疾病相关的营养不良进行更大规模的临床研究和临床前机制探索开辟了新的视角。
★ 地中海饮食
除了特定的补充剂外,某些饮食也与肠道健康有关。地中海饮食由植物性食品、全谷物和健康脂肪组成,已被证明可以预防所有年龄段的心血管疾病,这种饮食的影响可能是由肠道微生物组介导的。
一项研究发现,坚持地中海饮食至少一年,肠道内的普氏杆菌、人型杆菌、直肠杆菌、埃里根杆菌、嗜木杆菌、多形杆菌、普氏杆菌、哈德鲁斯杆菌相对增加。此外,坚持饮食还与认知功能的改善相关,以及高敏 C 反应蛋白 (hsCRP) 和IL-17水平等全身炎症标志物的降低。
饮食习惯(尤其是地中海饮食)与肠道菌群和衰老病理生理学方面的联系机制
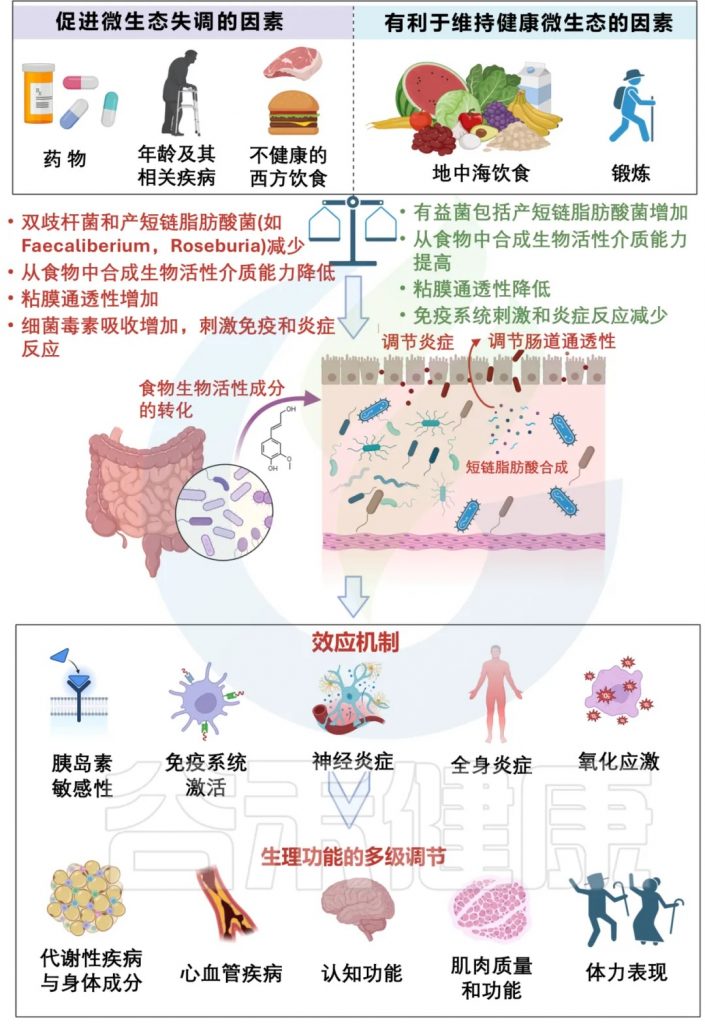
doi.org/10.1007/s40520-024-02707-9
如何理解肠道微生物群介导的地中海饮食抗衰老作用?
短链脂肪酸的微生物合成
患有虚弱、肌少症、认知能力下降的老年人肠道微生物组的一个关键特征,是产短链脂肪酸的菌减少,包括普拉梭菌、罗氏菌属、丁酸弧菌属(Butyrivibrio)、琥珀酸弧菌属(Succinivibrio)等。而身体健康的百岁老人粪便中短链脂肪酸水平通常高于 60-70 岁的受试者。
地中海饮食刺激短链脂肪酸合成细菌生长和提高短链脂肪酸的能力很重要,然而,肠道细菌有效释放短链脂肪酸的功能能力不仅取决于饮食中的纤维含量,还取决于细菌之间复杂的交叉喂养相互作用以及细菌与宿主之间的相互作用,例如,只有在肠道环境中存在大量双歧杆菌的情况下,普拉梭菌才能产生足够的丁酸。
注:丁酸可以促进肠道粘膜完整性;调节炎症反应;改善胰岛素抵抗,并具有整体促合成代谢功能。
降低肠粘膜通透性
衰老,即使具有健康的活动模式,也与肠通透性增加相关,血清生物标志物连蛋白水平升高就证明了这一点。荟萃分析表明,虚弱者的血清连蛋白水平平均高于健康老年受试者,反映出肠粘膜屏障功能的逐渐丧失。这种情况与健康或患有慢性阻塞性肺病和痴呆等慢性疾病的老年受试者的骨骼肌力量丧失、肌少症等有关。
肠粘膜通透性增加与细菌毒素(包括脂多糖LPS)增加有关,这些化合物激活先天免疫反应和适应性免疫的抗原刺激,最终导致典型的衰老和虚弱的持续性亚临床炎症,也就是炎症衰老。 LPS 毒素增加在与年龄相关的认知衰退和阿尔茨海默病的病理生理学中起着关键作用,并且被认为是肠-脑轴失调的主要原因之一。
在患有慢性疾病的成年受试者和老年人中,较高的地中海饮食依从性与胃肠粘膜通透性生物标志物和循环 LPS 水平呈负相关。
食品生物活性物质的生物转化
地中海饮食中通常建议大量摄入水果和蔬菜、全麦谷物、坚果、豆类和特级初榨橄榄油,这其中含有丰富的多酚或酚类化合物,膳食多酚和肠道微生物组之间的相互作用能够产生多种具有抗衰老作用的生物活性代谢物,特别是在骨骼肌和中枢神经系统水平上。
尿石素 A、异尿石素 A 和尿石素 B 是肠道微生物在摄入鞣花酸和鞣花单宁(核桃、石榴和草莓中常见的多酚)后释放的代谢物。
尿石素 A 的潜在抗衰老作用包括:改善肌肉力量和运动耐力、调节神经炎症和细胞凋亡并改善认知、促进胰岛素敏感性、调节脂质代谢和炎症反应。
地中海饮食与尿液中尿石素排泄的平均增加有关,即使分析没有考虑代谢型。同样,在两个不同的随机对照试验中,尿石素的尿液排泄与内脏脂肪减少和磁共振测量的海马占用评分显着相关,这些随机对照试验测试了长期地中海饮食干预的效果。
除鞣花单宁外,肠道微生物群衍生的多酚亚类代谢型鲜为人知。在饮食中摄入黄烷酮(一种特别以柑橘为代表的多酚亚类)后,已确定了橙皮苷的高排泄者和低排泄者。橙皮苷具有抗氧化、抗炎和促合成代谢作用,促进肌肉蛋白合成并减少阿尔茨海默病动物模型中的淀粉样蛋白沉积和神经炎症。
在一项测试地中海饮食对2型糖尿病受试者的影响的干预研究中,12周后检测到橙皮苷和其他黄烷酮衍生物的血浆水平增加,炎症生物标志物显著减少。
同样,雌马酚是大豆异黄酮大豆苷元肠道生物转化后释放的生物活性化合物,但它仅由一部分具有特定微生物特征的群体产生。雌马酚在体外表现出针对痴呆症发作的神经保护作用,但在体内,只有在存在雌马酚产生微生物组代谢型的情况下,它才与更好的认知表现相关。
多酚对衰老过程中肠道菌群的影响

doi.org/10.3390/nu16071066
扩展阅读:
★ 高脂肪和高钠的西方饮食
小鼠研究还表明,高脂肪和高钠的西方饮食会导致肠道微生物组的“预测年龄”增加,该模型基于对雄性 C57BL/6 J 小鼠进行贝叶斯模型训练,这些小鼠的微生物组从第 9 周起就已被表征到生命第 112 周。一旦小鼠恢复标准饮食,这些微生物组紊乱就会逆转。因此,鉴于老年人易受认知能力下降和不健康衰老的影响,评估老年人肠道微生物群和临床结果的干预性饮食研究很有意思。
★ 模拟禁食饮食
模拟禁食饮食(FMD)是一种日益流行的热量限制模式。研究人员发现模拟禁食饮食显著延长了过早衰老小鼠的寿命。在自然衰老的小鼠中,模拟禁食饮食改善了认知和肠道健康。
在肠道中,模拟禁食饮食循环增强了肠道屏障功能,减少了衰老标志物,并维持了固有层粘膜中 幼稚T细胞的记忆平衡。模拟禁食饮食重塑了肠道细菌组成,显著增加了约氏乳杆菌Lactobacillus johnsonii的丰度。模拟禁食饮食作为一种抗衰老干预手段,具有进一步研究的价值。
粪便菌群移植(FMT)是一种越来越多地被纳入复发性艰难梭菌治疗的疗法,并且还针对炎症性肠病和抗生素后菌群失调进行了研究。这使得研究人员猜测是否可以将来自年轻健康捐赠者的微生物组移植到老年人体内,以逆转不健康衰老的一些影响。
粪菌移植用于延缓衰老和改善认知功能
一项研究证明,“老年”微生物组从老年小鼠转移到年轻小鼠会导致多种与年龄相关的表型,包括晚期中枢神经系统恶化和视力缺陷。重要的是,在一组相关实验中,用年轻小鼠的粪便进行微生物组移植后,老年小鼠的年龄相关变化得到改善。这项工作提供了强有力的临床前证据,表明年轻和老年小鼠之间的微生物组特征不仅不同,而且这些微生物组的相关生理效应是可转移的。其他研究人员也重复了这些和类似的发现,证明将老年小鼠的微生物组转移给年轻小鼠可能会导致认知缺陷。
粪菌移植在早衰症模型研究中的应用
早衰症是一种特别独特的疾病,可以用来研究微生物组和衰老,因为受影响的个体携带编码层粘连蛋白 A 的基因突变,从而导致快速衰老。尽管出生时外观正常,受影响的个体通常会在青少年或成年早期出现致命的疾病并发症,主要是心血管疾病。
菌群移植延长小鼠寿命并逆转肠粘膜变薄
早衰症小鼠模型研究表明,在早衰小鼠模型中发现肠道微生物群中变形菌和Cyanobacteria丰度增加,疣微菌丰度减少。某些人类百岁老人富含的细菌菌株,例如Akkermansia muciniphila,可以通过移植来延长小鼠寿命并逆转肠粘膜变薄。
接受长寿菌群小鼠α多样性↑ 产短链脂肪酸菌↑
与普通老年组的小鼠相比,接受长寿个体肠道微生物群的小鼠表现出更长的小肠绒毛、更低的脂褐质和β-半乳糖苷酶(衰老标志)的积累;更高的α多样性,乳酸杆菌、双歧杆菌和产短链脂肪酸菌丰度更高。
恢复外周免疫,改善记忆、学习和行为缺陷
通过粪菌移植,老年小鼠部分恢复了外周免疫(尤其是肠系膜淋巴结免疫细胞)并改善了海马小胶质细胞的缺陷。小鼠海马代谢组(包括维生素 A、GABA、Neu5Gc、精氨酸和相关途径)和谷氨酰胺合成酶表达发生有益变化,从而改善与年龄相关的记忆、学习和行为缺陷。
尽管这些发现仍处于临床前阶段,但它们为使用年轻捐赠者的 FMT 或其治疗成分来逆转不健康衰老的某些方面带来了希望。
扩展阅读:
随着年龄的增长,老年人的饮食习惯通常会发生变化,这会导致微生物组的变化。与衰老相关的饮食变化中研究最多的一项是纤维摄入量的减少。然而,补充纤维的临床试验在微生物群组成和炎症状态的变化方面产生了相互矛盾的结果,一些研究人员假设饮食干预和补充剂的功效可能取决于宿主的初始微生物组特征。
阿拉伯木聚糖
在一项对 21 名 60 岁以上健康志愿者进行的双盲交叉试验中,他们补充了麦麸衍生的阿拉伯木聚糖,结果发现,所产生的微生物组组成因受试者最初的普雷沃氏菌丰度而异。尽管有限,但这些研究结果表明,需要采取个体化的方法来操纵微生物组,并且需要检测患者的初始微生物组,以调整实现预期结果所需的干预措施。
益生菌干预措施已在老年人中进行了专门研究。可惜,与一般人群的研究类似,临床可操作数据的生成因研究产品和结果的巨大异质性以及大量动力不足的研究而受到抑制。虽然尚未发现单一或组合的益生菌能够明确改善或逆转衰老迹象,但越来越多的研究正在评估特定的微生物菌株及其对客观生理效应的影响。
罗伊氏乳杆菌ATCC PTA 6475
在一项双盲、安慰剂对照研究中,骨矿物质密度较低的老年女性补充罗伊氏乳杆菌ATCC PTA 6475 可改善胫骨总体积 BMD (vBMD)。
干酪乳杆菌
在衰老加速SAMP8小鼠模型中,益生菌干酪乳杆菌代田株(Lactobacillus casei Shirota)的给药可减少与年龄相关的肌肉退化和线粒体功能障碍。
研究发现补充干酪乳杆菌 LC122或长双歧杆菌 BL986可改善小鼠外周组织氧化应激和炎症反应,增加海马神经变性和神经营养因子表达,并增强学习和记忆能力。
乳杆菌和双歧杆菌等细菌以光保护方式与真皮成纤维细胞结合,表现出抗衰老特性。
在人类中,一些小型但双盲随机对照试验已经确定了特定的益生菌改善老年人的认知功能,尤其是包括双歧杆菌和乳杆菌在内的益生菌。因此,随着对微生物组操纵和客观健康措施之间更加严格理解的发展,益生菌疗法可能需要定制微生物混合物,以针对个性化护理方法中的特定缺陷或状况。
扩展阅读:
多项研究报告了实施锻炼计划后肠道微生物组发生了变化,早期结果表明老年人群中也是如此。
2020 年的一项研究利用美国肠道项目的粪便样本,其中还包括患者报告的体重指数和运动习惯信息。该研究包括 1,589 名具有健康 BMI(18.5 ≤ BMI ≤ 25)的成年人(年龄 18-60 岁)和 897 名老年患者(年龄 > 60)的样本,他们根据 BMI 进一步分层为正常体重(n = 462),超重(BMI > 25,n = 413)和体重不足(BMI < 18.5,n = 22),并按运动频率分层。
研究人员发现,随着老年患者运动频率的增加,基于特定分类群和常见途径的相对丰度,老年患者的微生物组越来越接近健康BMI成年人的微生物组。例如,与不运动的老年人相比,运动的老年人中放线菌的相对丰度有所增加,并接近健康体重指数成年人的水平。此外,运动的老年患者的Cyanobacteria相对丰度有所下降,再次接近健康体重指数成人的水平。然而值得注意的是,Cyanobacteria产生的毒素如 β-N-甲基氨基-l-丙氨酸 (BMAA) 与阿尔茨海默病和渐冻症等神经退行性疾病有关。
一项小型研究中,招募了 15 名久坐的老年患者(50-75岁),参加一项为期 24 周、每周三次的心血管和阻力运动计划,干预前后收集粪便样本进行16S测序。研究人员观察到,经过 24 周的锻炼计划后,双歧杆菌的相对丰度有所增加,丁酸盐水平也有所增加。考虑到双歧杆菌在极端衰老和改善认知功能中的作用,这些研究结果表明,与运动相关的健康益处也可能是通过肠道微生物组介导的。
虽然有这些结果,但运动时的微生物组变化也存在显著的个体差异。此外,当前的许多研究没有对照组、缺乏严谨性和/或样本量较小。未来的研究需要确定运动与健康的衰老微生物群之间是否确实存在关系,以及可以影响肠道微生物群的体育活动类型。
扩展阅读:
一项研究观察艾灸“足三里”对亚急性衰老模型大鼠氧化应激和肠道菌群的影响,足三里组艾灸双侧“足三里”,每日 1 次,每次每穴 3 壮,连续 28天。
与模型组比较,足三里组大鼠Chao1、Shannon指数升高(P<0.01,P<0.05)。经艾灸干预后大鼠肠道菌群多样性改善。
与模型组比较,足三里组厚壁菌门、密螺旋体属_2相对丰度降低 (P<0.01),拟杆菌门、乳杆菌属、普雷沃氏菌科UCG-003相对丰度及B/F值升高 (P<0.05,P<0.01)。
注:
与模型组比较,足三里组大鼠血清SOD(血清超氧化物歧化酶)含量增加(P<0.01),MDA(丙二醛)含量减少(P<0.01)。
艾灸“足三里”可有效改善衰老大鼠氧化应激水平,调节肠道菌群结构,维持肠道菌群微生态平衡,从而起到延缓衰老的作用。
肠道菌群在预测及辅助治疗的应用
肠道微生物组可预测晚年的认知功能和抑郁症状;肠道微生物群和炎症标志物的组合,可能成为老年抑郁症的潜在生物标志物,具有更强的预测力。这些发现为老年认知下降和抑郁症的诊断和治疗提供了新的策略方向。
总游离脂肪酸在Akkermansia和认知功能之间的重要中介作用,为肠道微生物-脂质代谢轴在晚年抑郁症认知功能中的作用提供了新的视角。
营养不良的老年人肠道菌群可能能够预测不良的临床结果,肠道微生物群及其与宿主的相互作用,可能成为辅助个性化治疗/预防干预的新兴目标,有助于优化传统疗法的疗效。
基于肠道菌群的干预
益生菌、粪菌移植等方法,可能通过调节肠道菌群,改善免疫功能,为衰老提供新的解决方案。
地中海饮食中的多酚因其抗炎、抗氧化和免疫调节作用,与肠道微生物群的复杂互作也日益受到重视,多酚化合物可能是抵御这些与年龄相关表观遗传变化的关键。未来有望通过多酚化合物调节肠道菌群,利用生物活性化合物的功能属性,巧妙地调节和重新调整与衰老相关的过程。
随着对肠道菌群的研究不断深入,这些都可能成为未来抗衰老领域的突破口。
主要参考文献
Kolobaric A, Andreescu C, Jašarević E, Hong CH, Roh HW, Cheong JY, Kim YK, Shin TS, Kang CS, Kwon CO, Yoon SY, Hong SW, Aizenstein HJ, Karim HT, Son SJ. Gut microbiome predicts cognitive function and depressive symptoms in late life. Mol Psychiatry. 2024 Apr 25.
Chen Y, Li J, Le D, Zhang Y, Liao Z. A mediation analysis of the role of total free fatty acids on pertinence of gut microbiota composition and cognitive function in late life depression. Lipids Health Dis. 2024 Feb 29;23(1):64.
Chen Y, Le D, Xu J, Jin P, Zhang Y, Liao Z. Gut Microbiota Dysbiosis and Inflammation Dysfunction in Late-Life Depression: An Observational Cross-Sectional Analysis. Neuropsychiatr Dis Treat. 2024 Feb 27;20:399-414.
Chen LA, Boyle K. The Role of the Gut Microbiome in Health and Disease in the Elderly. Curr Gastroenterol Rep. 2024 Apr 20.
Muñoz-Fernandez SS, Garcez FB, Alencar JCG, Bastos AA, Morley JE, Cederholm T, Aprahamian I, de Souza HP, Avelino-Silva TJ, Bindels LB, Ribeiro SML. Gut microbiota disturbances in hospitalized older adults with malnutrition and clinical outcomes. Nutrition. 2024 Jun;122:112369.
Wu YL, Xu J, Rong XY, Wang F, Wang HJ, Zhao C. Gut microbiota alterations and health status in aging adults: From correlation to causation. Aging Med (Milton). 2021 Jun 24;4(3):206-213.
Pereira, Q.C.; Fortunato, I.M.; Oliveira, F.d.S.; Alvarez, M.C.; Santos, T.W.d.; Ribeiro, M.L. Polyphenolic Compounds: Orchestrating Intestinal Microbiota Harmony during Aging. Nutrients 2024, 16, 1066.
Wang XM, Fan L, Meng CC, Wang YJ, Deng LE, Yuan Z, Zhang JP, Li YY, Lv SC. Gut microbiota influence frailty syndrome in older adults: mechanisms and therapeutic strategies. Biogerontology. 2024 Feb;25(1):107-129.
Wang Q, Xu J, Luo M, Jiang Y, Gu Y, Wang Q, He J, Sun Y, Lin Y, Feng L, Chen S, Hou T. Fasting mimicking diet extends lifespan and improves intestinal and cognitive health. Food Funct. 2024 Apr 22;15(8):4503-4514.
Wang Y, Qu Z, Chu J, Hun S. Aging Gut Microbiome in Healthy and Unhealthy Aging. Aging Dis. 2024 Apr 9.

谷禾健康

现代的生活工作方式大多是久坐,户外运动少,导致与骨骼肌肉相关的亚健康症状越来越普遍,覆盖人群越来越广。
例如长时间的低头垂肩的姿势会让竖脊肌处在伸展的位置,进而导致竖脊肌的无力,产生受伤的状况。长时间久坐使得臀大肌萎缩无力,无力松弛的臀肌再结合无力的竖脊肌,导致腰背疼痛等症状。

老年人的肌肉骨骼疼痛,在我们生活的每一个角落悄然出现。这无声的挑战,让他们在岁月的长河中饱受苦楚。
随着全球老龄化的日益严重,与衰老相关的疾病,包括肌肉减少症、骨质疏松症和骨关节炎,变得越来越突出,影响着至少7-27%的世界人口。
肌肉减少症的发生率为 10% 至 27%。50岁以上女性骨质疏松患病率不低于20%,骨关节炎的患病率约为7%。
肌肉骨骼系统对于平衡代谢活动和保持健康非常重要。骨骼肌是机体最大的器官之一,其质量和功能的丧失或减退会导致一系列疾病。虽然临床上用了很多方式来治疗缓解这类疾病,但有效的治疗方法却较少。
最近的研究表明,肠道微生物群稳态的破坏与肌肉骨骼系统功能异常相关,甚至可能导致肌肉骨骼系统功能异常。生活中也发现,肠道菌群与骨质疏松症的发病相关。如果你肠胃不好,时不时就腹泻腹胀、消化不良,当心了,骨质疏松也可能已经“盯”上了。
研究还表明,肠道菌群及其次级代谢产物可以通过调节炎症、免疫和蛋白质合成代谢、能量、脂质、神经肌肉接头、氧化应激、线粒体功能、内分泌和胰岛素抵抗等多种机制来影响肌肉骨骼系统。
现有文献大多支持合理的营养干预有助于改善和维持肠道菌群的稳态,并可能对肌肉骨骼健康产生积极影响。即使已提出“肠道菌群-肌肉轴”,但其因果联系仍然是未知的。
本文对现有文献进行整理、总结和讨论的目的是探讨营养补充、适度运动等干预方法能否通过调节肠道菌群微生态来影响肌肉和骨骼健康。未来更深入的功效验证实验将有助于临床应用。
骨 骼 肌
无菌小鼠:肠道菌群存在对骨骼肌健康很重要
基于无菌 (GF) 小鼠的实验揭示了体内肠道微生物群的存在或缺失,通过调节营养和能量代谢途径对骨骼肌的健康至关重要。缺乏肠道微生物群的小鼠的骨骼肌质量显著降低,无菌 (GF) 小鼠中肌球蛋白重组基因和骨骼肌分化调节基因的表达显着低于正常携带细菌的小鼠,而肌肉的表达萎缩标志物明显升高。
肠道菌群→蛋白质合成/能量代谢→骨骼肌营养
蛋白质合成和降解是影响骨骼肌质量的重要因素。胰岛素样生长因子1(IGF-1)是促进蛋白质合成和增强肌肉功能的重要物质,无菌小鼠体内的IGF-1水平显着下降。此外,无菌小鼠中糖皮质激素诱导的支链氨基酸分解代谢显着增加。
肠道菌群还可以通过改变能量代谢模式来影响骨骼肌。无菌小鼠葡萄糖和胰岛素含量较低,线粒体功能明显扰乱,影响骨骼肌对葡萄糖的利用,减少肌肉合成的能量供应,最终影响骨骼肌的氧化代谢能力。
肠道菌群调控神经肌肉接头
无菌小鼠的胆碱水平下降,导致神经肌肉接头传递受损。肌钙蛋白与骨骼肌中的肌纤维收缩性和运动功能有关。
无菌小鼠骨骼肌中肌钙蛋白编码基因的表达显着降低,表明肌纤维收缩力可能受损。更重要的是,将肠道微生物群移植到无菌小鼠体内后,结果显示骨骼肌质量增加,肌肉萎缩标记物减少,肌肉氧化代谢改善,神经肌肉接头组装基因表达增加。证据表明肠道微生物群在维持正常骨骼肌功能方面发挥着关键作用。
骨
骨骼通过骨成骨细胞(OB)和破骨细胞(OCL)不断重建。这个过程的不平衡会导致骨质疏松症。
早期研究发现,肠道微生物群也是骨量的主要调节者,其对骨量的影响是通过其对免疫系统的影响来介导的,免疫系统反过来又调节破骨细胞的生成。
肠道微生物群缺失对维持骨量有负面影响
无菌小鼠骨髓中破骨细胞前体细胞和破骨细胞的数量减少。此外,无菌小鼠肠道来源的 5-羟色胺和炎症细胞因子的水平降低。值得注意的是,肠道微生物群定植可以恢复无菌小鼠损失的骨量。当然,不排除其他机制也可能参与其中。
然而,最近的一项研究表明,成年雄性 GF BALB/c 小鼠的骨骼生长速度比正常饲养的小鼠慢。粪便微生物群对无菌小鼠的长期定植会导致股骨长度惊人的增加和骨小梁微结构的改善。
维生素D改善肠道钙吸收促进骨代谢
无菌小鼠的维生素D 代谢存在缺陷,而被微生物群定植的无菌小鼠则表明 1, 25-二羟基维生素 D 和钙水平得到恢复。因此,肠道微生物群也对骨骼产生有益影响。
骨 关 节
越来越多的证据表明肠道微生物组在骨关节炎(OA)的病理学中发挥着关键作用。早期研究表明,在无菌条件下, 在TLR4(Toll 样受体 4)缺陷小鼠中,类风湿性关节炎(RA) 表现也受到显着抑制,肠道微生物群可作为抗原或佐剂来诱导或促进类风湿性关节炎产生。
注:Toll样受体(TLR)是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,也是连接非特异性免疫和特异性免疫的桥梁。当微生物突破机体的物理屏障,如皮肤、粘膜等时,TLR可以识别它们并激活机体产生免疫细胞应答(参考自百度百科)。
肠道微生物群对创伤性骨关节炎的发展产生影响
研究发现,无菌小鼠中内侧半月板不稳定手术引起的骨关节炎显着减少,表明肠道菌群促进了骨关节炎的发生。还发现肠道微生物组对小鼠模型中损伤引起的骨关节炎的严重程度有显着影响。
关节损伤后,无菌小鼠仅有轻微的骨关节炎症状,病理表现的严重程度最低。小鼠体内微生物组丰度与炎症生物标志物浓度、肠道通透性和骨关节炎严重程度呈正相关。这可能是因为在存在关节损伤的情况下,肠道微生物群(由更多的梭杆菌和粪球菌,以及更少的瘤胃球菌科)引起的免疫激活可能会加剧骨关节炎的病理过程。
以上无菌动物实验,主要是小鼠结果表明,肠道菌群的“存在与否”确实是影响和维持小鼠肌肉骨骼系统的关键因素。
无菌小鼠是通过无菌技术培育得到的。这里无菌小鼠既没有共生菌群,也没有致病菌等情况下,表现出不良的病理特征。这表明致病菌并非唯一的因素导致疾病发生。
疾病的发生通常是由多种因素共同作用引起的,包括宿主的遗传因素、环境因素和微生物因素等。致病菌可能需要与其他共生微生物或宿主因素相互作用才能引发疾病。在无菌小鼠中,缺乏这些相互作用,可能导致致病菌无法发挥其病原性。这刚好强调了微生物群落的复杂性和其与宿主的相互作用的重要性。
无菌小鼠试验的结果也需要与其他研究方法和模型相结合,例如体内试验、体外试验和临床研究,以获得更全面和准确的结论。综合多种研究方法的结果可以提供更可靠的科学依据,并有助于我们理解和解释无菌小鼠试验结果的适用性。
肠道微生物群失调一般主要指致病生物的大量繁殖、正常菌群的减少和微生物群组成多样性的减少。代谢、自身免疫、炎症和神经退行性疾病等多种因素与肠道菌群失调有关。微生物群失调对肌肉骨骼系统的影响引起了越来越多的关注。
扩展阅读:
骨 骼 肌
许多因素与肌少症的病理学相关,包括衰老、炎症、线粒体损伤和/或胰岛素抵抗。
注:肌少症是指因持续骨骼肌量流失、强度和功能下降而引起的综合症。患有肌肉减少症的老年人站立困难、步履缓慢、容易跌倒骨折。
几乎所有病理过程都会引发肠道微生物群的失调。反过来,微生物群失调也在骨骼肌质量和功能下降中发挥着至关重要的作用。由于肠道微生物组是导致肥胖或胰岛素抵抗等代谢失调表型的发生和加剧的原因,因此骨骼肌质量和功能可以部分受到肠道微生物组的调节。
老年人肠道菌群:促炎菌增多
健康肠道微生物群的主要门是厚壁菌门、拟杆菌门、放线菌门和疣微菌门,变形菌门的数量较少。在老年人和营养不良者中,都显示促炎症的变形计门增加,而产丁酸菌普拉梭菌,罗氏菌属减少。肠道菌群失调引起的循环促炎细胞因子的增加可以通过不同的机制(胰岛素抵抗、炎症和相关的氧化应激)诱导肌肉萎缩。
肠道菌群失调的两个最典型的例子:
炎症性肠病(IBD)和衰老引起的肌肉功能衰竭
接下来我们用这两个例子来具体阐述肠道菌群失调引起肌肉减少症的内在机制。
➤ IBD
IBD→肠道菌群失调→炎症→肌肉萎缩
IBD 的典型特征是肠道微生物群失调,肠道菌群失调往往伴随着肠道屏障损伤和肠道屏障通透性增加,内毒素和其他细菌代谢产物容易进入循环系统,从而增加LPS(脂多糖) 和其他炎症因子的水平,诱发体内的炎症反应。LPS 诱导的炎症的一个特征性表现是由于蛋白水解降解增加和蛋白质合成减少引起的严重肌肉萎缩。
肠道菌群失调→氧化应激→肌肉无力
肠道菌群的失调还可能导致肠道氧化应激、肠粘膜炎症和屏障功能障碍,从而引起免疫功能障碍。高水平的活性氧 (ROS) 引起的氧化应激可导致骨骼肌收缩障碍,导致肌肉无力和疲劳。因此,肠道微生物群失衡引起的炎症反应和氧化应激会对肌肉功能产生负面调节。
在结肠炎小鼠模型中,股四头肌和腓肠肌的骨骼肌质量和肌纤维横截面积减少,肌肉蛋白质含量减少。与此同时,肌肉功能障碍恶化,肌肉生长标志物 IGF-1 R(胰岛素样生长因子 1 受体) 和雷帕霉素磷酸化哺乳动物靶标 (mTOR) 下调。
研究人员认为,肠道微生物群失调引起的炎症可能是骨骼肌萎缩的触发因素。与肌原纤维分解相关的肌肉萎缩F-box(atrogin-1)和肌肉环指蛋白1(Murf-1)表达增强,介导肌原纤维加速分解。
IBD→炎症→肌肉合成和分解代谢→肌肉损伤
临床研究还发现,肌肉损伤是 IBD 等慢性胃肠道疾病的常见病理特征。42% 的 IBD 患者会出现肌肉减少症。
肠道微生物群刺激粘膜免疫细胞,促进促炎细胞因子(IL-6、IL-10、TNF-α等)的产生,产生一般状态慢性低度炎症,激活氧化应激损伤,进一步影响胰岛素敏感性、氨基酸生物合成、线粒体、生物生成、肌肉合成和分解代谢以及增加肌肉衰减相关分子途径。这可能导致肌肉骨骼损伤和虚弱。
➤ 衰 老
同样,体弱或活动能力差的老年人肠道微生物群的复杂组成也表现出不同程度的失调,物种丰富度降低以及机会性病原体和抗炎菌群之间的不平衡。
衰老→菌群多样性↓↓→代谢↓↓→炎症↑↑
肠道微生物群失调可能与肌肉萎缩的复杂机制有关。具体而言,肠道微生物群多样性因衰老而降低。同时,调节肠道环境的代谢能力也会下降,肠道屏障功能减弱,肠道粘膜通透性增加,从而导致包括脂多糖在内的细菌产物的吸收增加,并激活体内炎症反应。
与衰老相关的肠道微生物组会促进炎症,从而导致循环炎症介质的水平增加,而逆转这些与年龄相关的微生物组变化是减少与年龄相关的炎症和伴随发病率的潜在策略。
脂多糖促炎→代谢综合征→诱发骨骼肌衰老
脂多糖促进炎症信号传导,诱发骨骼肌炎症和胰岛素抵抗,从而促进代谢综合征的过程,进而诱发骨骼肌衰老。
研究表明,脂多糖相关细胞因子对蛋白质平衡(即合成和分解)的能力有决定性影响,并且随着衰老而增加的细胞因子可能会导致肌肉质量减少。
炎症反应增强会加剧骨骼肌质量损失
例如,在肌肉减少症患者中,IL-6 和 TNF-α 等促炎因子水平升高会导致肌肉质量减少。抗 TNF 治疗可以逆转微生物群中与年龄相关的变化,因此具有潜在的抗肌肉衰老作用。
肠道菌群变化与衰老中免疫稳态的紊乱有关
移植了年老小鼠肠道微生物群的年轻无菌小鼠的小肠,发现了与免疫相关的差异遗传特征,包括抗原呈递减少以及细胞因子和趋化因子产生的改变。这些基因可能在肠道微生物组老化过程中作为免疫紊乱的标志物发挥潜在作用。
肠道菌群失衡→肠漏→LPS释放到外周血
由于上述各种原因(炎症、营养不良、恶病质、衰老等)引起的肠道微生物生态系统组成的变化,可能导致肠漏和细菌内毒素(例如LPS)释放到外周血中。LPS可以通过TLR4受体触发巨噬细胞产生炎症细胞因子和ROS。
限制蛋白质合成,促进肌肉生长蛋白水解,肌肉萎缩
在骨骼肌中,TNF-α 激活参与NF-κB通路的基因表达,从而通过抑制肌细胞生成素和 myoD 来减少肌细胞分化和增殖。IL-6和IκB激酶可以抑制与诱导胰岛素抵抗相关的胰岛素受体底物1,限制mTORC1(雷帕霉素复合物1)肌肉靶标的激活,从而限制肌肉细胞中的蛋白质合成。
此外,由于蛋白激酶B受到抑制,叉头盒O的抑制作用不再发挥,导致泛素E3连接酶Atrogin-1和MuRF1表达增加,促进肌肉生长蛋白水解。
同样,不受 mTORC1 抑制的自噬激活激酶 1 进一步诱导骨骼肌细胞自噬。当肠道菌群失调引起的这些调节机制被激活时,蛋白质分解/合成之间就会出现不平衡,并最终导致肌肉萎缩。
其他机制:细菌群体感应,短链脂肪酸,胆汁酸
其他机制包括粪肠杆菌在细菌失调过程中产生的群体感应肽iAM373,下调了大多数骨骼肌发育和分化基因,降低了成肌细胞的代谢活性,并上调了肌管中的蛋白酶体降解途径,这是一种肌肉减少症新的诱导剂。
队列研究表明,肌肉减少症还与产生短链脂肪酸 的菌减少相关,从而导致肠道菌群失衡。
肠道菌群失调可能通过上调初级胆汁酸-法尼醇 X 受体途径导致骨骼肌萎缩。
骨
随着肠道微生物群在骨代谢稳态中的关键作用得到更好的了解,人们对肠道微生物群在调节骨骼健康中的重要作用越来越感兴趣(以前我们的文章专门介绍过肠道菌群与骨骼生长于骨代谢的关系,详见:肠道微生物如何影响骨骼发育和代谢 )。
肠道菌群失调与骨骼之间存在密切关系
研究发现,TLR5缺陷小鼠的肠道微生物群受损和微生物多样性较差会引起整体骨强度的变化;另外,长期使用抗菌药物引起的肠道菌群损伤(主要表现为拟杆菌、变形菌显著上调)导致小鼠骨性能受损,尤其是总骨量减少。卵巢切除术会导致小鼠肠道微生物群失调并导致骨质流失,这是由微生物依赖性 T 淋巴细胞(例如 Th17细胞)介导的。
骨密度低:
罗氏菌属、双歧杆菌属↓↓ 合成LPS的菌↑↑
在骨骼疾病患者中观察到肠道微生物群的变化。横断面研究表明,肠道微生物群与骨矿物质密度积累之间存在关联。最近,一项全基因组研究确定了与骨量变异相关的梭菌目和毛螺菌科。研究发现,与健康人相比,有害细菌过度生长的患者骨量较低,骨质流失率较高。
注:骨质流失加剧是 IBD 的常见并发症,肠道菌群失调也是IBD 的重要表现。
临床研究表明,骨矿物质密度低的个体肠道微生物群的组成和丰度显着下降。罗氏菌属(Roseburia)、双歧杆菌属和乳酸菌属等细菌群与骨密度呈正相关。然而,在骨矿物质密度较低的人群中,与LPS合成相关的微生物群更为丰富。
骨质疏松患者:多样性与骨密度呈负相关
研究发现,厚壁菌门/拟杆菌门的比例与骨量呈负相关,而放线菌和双歧杆菌与骨量呈正相关。使用 16sRNA 测序对骨质疏松症(OP)的肠道微生物群进行分析表明,肠道微生物群多样性估计值与骨矿物质密度呈负相关。
在骨质疏松患者中,如下菌属的丰度增加:
其他研究发现骨质疏松症患者Dialister和Faecalibacter显著增加。
菌群失调→营养素吸收能力下降→影响骨骼健康
微生物群对骨骼健康所需的营养素(例如钙和维生素 D)的运输和吸收具有必要的影响。肠道微生物群失调可能会损害营养物质和钙通过肠道进入循环系统的运输。随着年龄的增长,肠道对1, 25(OH) 2的吸收能力下降,这与肠道菌群失调密切相关。这也是微生物群失调影响骨骼健康的主要原因之一。
免疫系统干预肠道微生物群和骨代谢
生物多样性的变化和机会性病原体的定殖导致细菌内毒素的增加,例如脂多糖(LPS)、这与肠道炎症反应的增加有关,而炎症的增加与破骨细胞的激活有关。
肠道菌群失调会介导炎症
尤其是IL-1、TNF-α 和 IL-6,它们与骨质疏松症一样在破骨细胞激活中发挥着关键作用。
肠道微生物组依赖性Th17细胞和产生 TNF-α 的 T 细胞增殖产生大量促炎细胞因子(IL-17、TNF-α)、NF-κB 配体受体激活剂 (RANKL)、并减少RANKL拮抗剂的分泌(RANKL诱导破骨细胞功能,IL-17减少骨形成;TNF-α增强RANKL活性,诱导Th17细胞增殖和活化,是该过程中潜在的免疫调节机制。
注:Th17细胞是一类免疫细胞,主要参与调节免疫系统的炎症反应,并在自身免疫性疾病和炎症性疾病中发挥重要作用。
新生成的破骨细胞诱导了 Treg 细胞的生成。它抑制免疫反应,诱导和维持免疫耐受,通过多种途径减少炎症,并产生免疫抑制细胞因子,例如 TGF-β 和 IL-10。 Treg 细胞和 Th17 细胞之间微妙而复杂的关系会影响骨骼健康。重要的是,肠道细菌是控制这种平衡的关键。
注:破骨细胞是一种骨髓源性巨核细胞系的细胞,主要功能是吸收和降解骨组织。
Treg细胞是调节性T细胞(Regulatory T cells)的简称。它们是一类免疫细胞,主要功能是抑制免疫系统的活性,以维持免疫平衡和自身耐受。
肠道菌群→血清素下调→调节骨代谢
5-HT是5-羟色胺的缩写。它是一种神经递质,也称为血清素。根据合成部位分为两类:脑源性5-HT和肠源性5-HT。
有趣的是,这两种 5-HT 具有不同的功能:肠道来源的血清素对骨形成有负面影响,而大脑来源的血清素则具有相反的影响。近年来研究发现,肠道菌群不仅诱导细胞因子调节骨代谢,还通过减少血清素生物合成酶、增加血清素转运蛋白,下调肠源性血清素水平,从而调节骨代谢。
肠道菌群→改变 IGF-1→调节骨质量
IGF-1 在骨形成和生长的调节中也起着至关重要的作用。肠道微生物群可能通过改变 IGF-1 水平来调节整体骨质量。例如,传统特定肠道微生物群对成年 GF 小鼠的定植可以增加循环 IGF-1 并增加骨的形成和吸收。
菌群多样性↓↓→循环雌激素↓↓→影响骨钙沉积
肠道微生物群多样性减少也可能导致循环雌激素减少,进而影响正常骨钙沉积,因为肠道微生物群通过β-葡萄糖苷酶分泌调节雌激素,β-葡萄糖苷酶将雌激素分解为其活性形式。
注:IGF-1是胰岛素样生长因子-1(Insulin-like Growth Factor 1)的缩写。它是一种蛋白质激素,由肝脏和其他组织产生,并受到生长激素的调控。IGF-1促进细胞增殖和分化,对于骨骼和肌肉的生长和修复具有重要作用;也与肿瘤生长和代谢相关;较高的IGF-1水平与较长的寿命和较少的年龄相关疾病风险有关。
▸▹小结
根据上述研究结果提示,与肌肉健康类似,骨骼健康相关的肠道菌群紊乱主要表现为肠道优势菌群消失或减少,有害菌或衰老菌群的增殖导致LPS等产生过多或引起更多的炎症反应。机制主要涉及细胞因子以及Treg和Th17细胞的成骨/破骨平衡的微妙控制。
与肌肉健康不同,肠道菌群失调对钙离子有效吸收的影响以及肠道来源的 5-HT、IGF-1 和雌激素的调节作用也在此强调。这些机制是否也对肌肉健康发挥作用,可能是个有意义的探索方向。
骨 关 节
近年来,越来越多的证据表明肠道菌群失调与类风湿关节炎(RA)的发生和发展密切相关。在人类和动物研究中也观察到类风湿关节炎中肠道微生物群失调。
类风湿关节炎:拟杆菌↓↓,乳杆菌属、普雷沃氏菌属↑↑
在类风湿关节炎模型小鼠中,拟杆菌门减少、厚壁菌门和变形菌门增加。该模型还导致 14 种肠道细菌失衡,并对色氨酸、脂肪酸和次级胆汁酸等代谢物产生相当大的干扰。
在类风湿关节炎患者中,各种乳杆菌属(Lactobacillus)和普雷沃氏菌属( Prevotella)更加丰富;因此,普氏菌数量增加和肠道菌群失衡是 类风湿关节炎发展的潜在资源。
广古菌门(Euryarchaeota)与类风湿关节炎的严重程度直接相关,成为类风湿关节炎发病的独立危险因素。
拟杆菌丢失,普雷沃氏菌存在
在未经治疗的新发类风湿关节炎患者的粪便微生物群中,普雷沃氏菌(Prevotella)的存在同时拟杆菌的丧失(拟杆菌与普雷沃氏菌一般认为是拮抗菌)存在强烈相关性。
从类风湿关节炎患者的滑膜组织中分离出细菌 rRNA。类风湿关节炎患者肠道菌群中乳杆菌的数量和多样性显著增加,与报道胶原蛋白诱导性关节炎小鼠体内乳酸杆菌增加的数据一致。矛盾的是,嗜酸乳杆菌(Lactobacillus acidophilus)和干酪乳杆菌( Lactobacillus casei)似乎有利于类风湿关节炎的改善。
致病菌破坏屏障,促炎,诱导关节炎发生和维持
肠道机会致病菌,如普雷沃氏菌,可能通过增强细胞凋亡机制、破坏肠道屏障完整性,参与促炎免疫状态的形成,从而诱导关节病炎症的发生和维持。此外,Th17 细胞通过产生一系列炎症因子来促进破骨细胞分化,这些炎症因子是导致类风湿关节炎骨质破坏期的原因。拟杆菌的减少可能通过减少 Treg 细胞分化来促进局部炎症环境。
骨关节炎的发生可能是由于肠道菌群组成发生特异性变化,尤其是机会性促炎菌增多,具有抗炎特性的共生菌显著减少,肠道通透性增加,然后LPS引起炎症和免疫反应,诱导级联信号通路激活,导致关节病变甚至疼痛,但相关证据有限。而类风湿性关节炎与免疫炎症相关的研究相对深入,肠道菌群多样性较为丰富,但也导致机制更加复杂,需要进一步探索。
这里主要总结了益生菌及其次级代谢产物对肌肉骨骼系统的影响和机制。
骨 骼 肌
由于肠道微生物组的活性,肠道与骨骼肌相关,并通过调节全身/组织炎症、胰岛素敏感性等来调节肌肉功能。
益生菌通过改善肠道微生物群的多样性,来对抗肌肉质量和功能的损失。
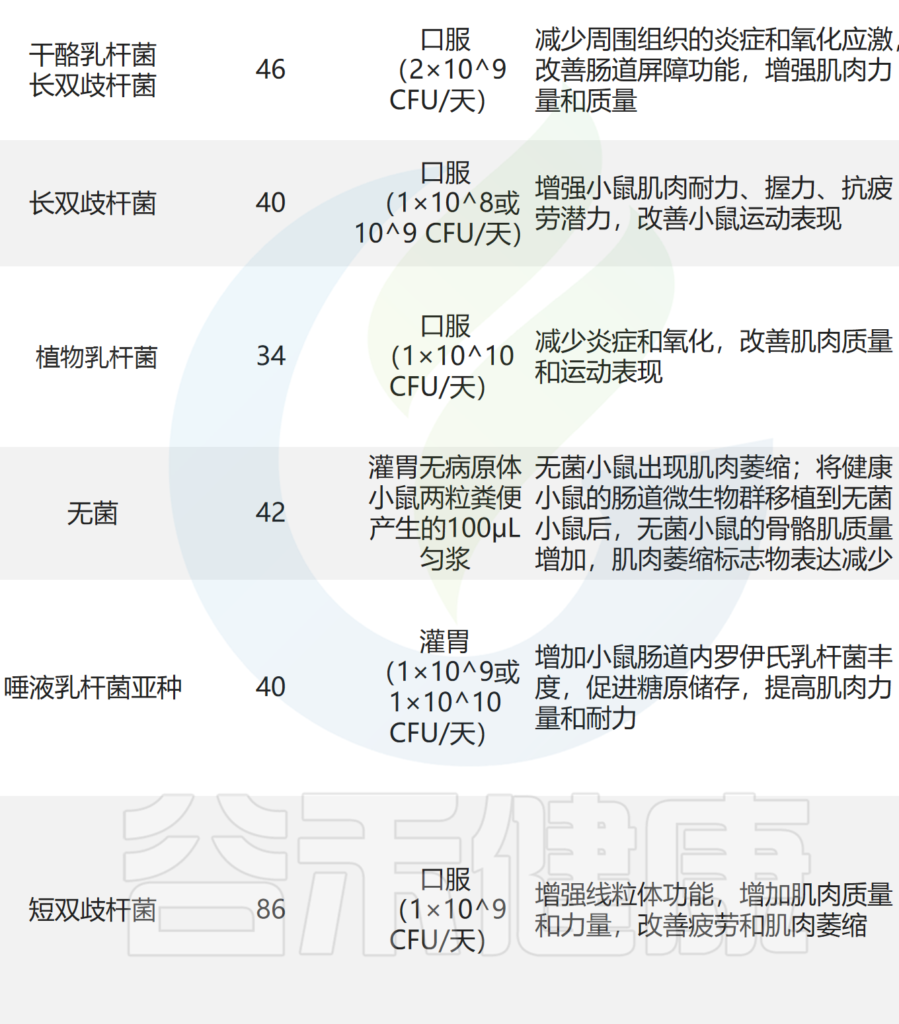
➤小鼠模型
在小鼠癌症模型中,罗伊氏乳杆菌能够抑制恶病质的发展,并与肌肉质量的保存有关。
植物乳杆菌HY7715通过改善老年 Balb/c 小鼠的骨骼肌质量和功能来改善肌肉减少症。
补充植物乳杆菌TWK10 可改善小鼠的运动表现并增加肌肉质量。
副干酪乳杆菌PS23 通过确保 SAMP8 小鼠的线粒体功能来减缓与年龄相关的肌肉损失。恢复特定乳酸杆菌水平可减少急性白血病小鼠模型中的炎症和肌肉萎缩标志物。
其他实验还表明,至少有七种益生菌对小鼠骨骼肌质量和强度有益:
其中,使用最广泛的菌株是乳杆菌和双歧杆菌,它们可以改善肌肉质量、力量和耐力损失。
益生菌有助于肌肉健康,提高蛋白质合成和力量,但益生菌的作用可能针对不同的信号或代谢途径和组织,例如降低炎症和压力、维持肌肉蛋白质合成、并提高了肌肉力量。然而也有研究表明,对肌肉质量和功能的影响几乎很小,仅观察到一定的抗炎作用。
➤人类
年轻人:益生菌可以改善运动耐力、增肌
在人类中,已经发现摄入特定的益生菌可以改变肠道微生物群,有利于增加骨骼肌质量。例如,摄入植物乳杆菌TWK10 六周可以提高年轻人在跑步测试中的耐力表现。补充植物乳杆菌表明,益生菌可以改善运动表现、耐力以及身体成分,减少脂肪量并增加肌肉量。
老年人:需进一步探索益生菌对肌肉的影响
不过,也有报道称,老年人补充益生菌在一定程度上可以导致肠道菌群发生有益变化,减少病原体,改善便秘,但对宿主健康的影响相对较小。
含有乳酸菌和双歧杆菌菌株以及干酪乳杆菌的对老年人的肌肉状况没有影响。这些发现表明益生菌的作用机制很复杂,需要进一步研究。
最近的一项荟萃分析表明,补充益生菌可以增强肌肉质量和力量,但在总去脂体重方面没有观察到有益效果。该研究表明,探索不同老龄化人群生理机制的差异,并探索补充合适的益生菌菌株以获得最佳肌肉质量和力量非常重要。
上述发现,研究的稀缺性、人群的变异性和重复性低,导致很难找到优化肌肉质量和功能的特定益生菌菌株,需要在更明确的人群中进行进一步研究设计个性化的益生菌干预措施。
— 改善血糖,提高肌肉质量和功能
益生菌可降低厚壁菌门与拟杆菌门的比例,从而提高小鼠的肌肉质量、耐力和力量。添加 植物乳杆菌 TWK10和 CP2998 可通过抑制糖皮质激素受体激活、改善血糖对肌肉发挥积极作用。
扩展阅读:
— 抑制炎症反应,改善肌肉合成
补充干酪乳杆菌LC122 和 长双歧杆菌BL986可降低炎症细胞因子 TNF-α、IL-6 和 IL-1β 的表达,并改善肌肉蛋白合成。
口服短双歧杆菌和鼠李糖乳杆菌可显着降低小鼠促炎细胞因子 IL-2、IL-4、IL-6 和 TNF-α 的水平,从而抑制炎症反应。还通过增加 IL-10 水平来减轻肌肉炎症。
还发现含有植物乳杆菌 TWK10 和罗伊氏乳杆菌的可以改善小鼠的肌肉质量,这与减少炎症和肌肉萎缩标记物表达有关。
— 抗氧化,或增加蛋白质吸收的方式
服用副干酪乳杆菌PS23的老年小鼠肌肉中抗氧化应激因子(例如超氧化物歧化酶和谷胱甘肽过氧化物酶)的表达较高。
罗伊氏乳杆菌可提高乳清蛋白中亮氨酸的吸收比例,从而增强蛋白质吸收,提高蛋白质利用率,最终促进肌肉合成,增加肌肉质量。
— 其他作用机制
益生菌的有益作用还通过多种机制产生,包括诱导免疫调节、抵抗生理应激、抑制病原体和改善肠上皮细胞的屏障功能。益生菌调节肌肉的潜在机制主要包括:
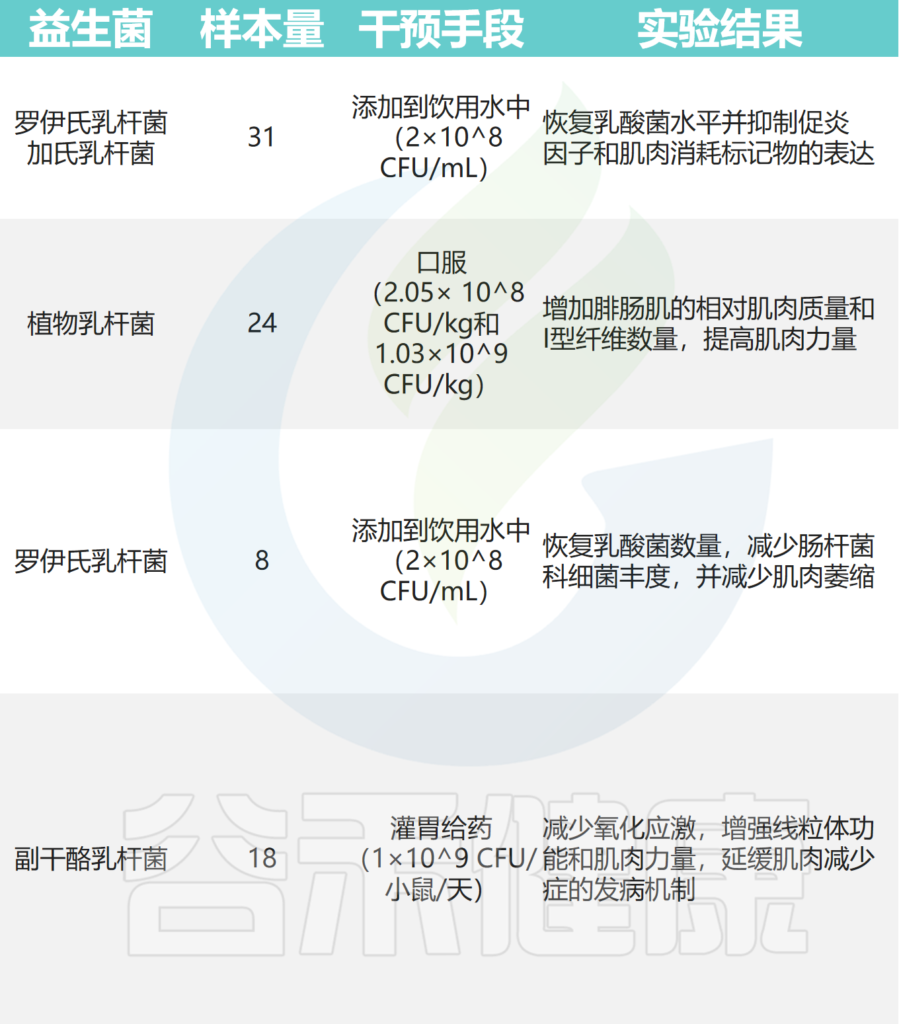
doi: 10.1080/19490976.2023.2263207
肠道益生菌限制胰岛素抵抗、调节代谢途径或抑制氧化应激和炎症。肠道菌群还可以通过不同的代谢途径将营养物质分解为次级代谢产物,调节肠道免疫和代谢稳态,维持宿主与肠道菌群之间的共生和寄生关系。
下面讨论这些代谢产物对骨骼肌代谢的主要影响和作用机制。
短链脂肪酸(SCFA)是肠道菌群对膳食纤维发酵产生的代谢产物,主要包括丁酸盐、丙酸盐和乙酸盐。SCFA 在葡萄糖和脂质稳态、炎症调节以及肠道与其他远端组织之间的连接中发挥着重要作用。
SCFA在调节肠道环境稳态、改善糖代谢、促进钙磷吸收、缓解氧化应激和炎症反应等方面发挥着重要作用,对调节骨骼肌功能具有重要意义。
无菌小鼠接受 SCFA 治疗后,骨骼肌损伤得到部分逆转(SCFA 降低了 atrogin-1 表达,增加了 MyoD 以及肌肉质量和功能),表明肠道菌群产生的 SCFA 在调节骨骼肌功能中发挥着关键作用。
丁酸盐:保持肌肉质量
在一项针对雌性 C57BL/6 小鼠的研究中,丁酸盐治疗后后肢肌肉萎缩得到完全或部分改善,而常规饮食喂养的老年 C57BL/6 雌性小鼠后肢肌肉质量显着降低。丁酸盐不仅能保持肌肉质量,还能改善小鼠的葡萄糖耐量,但对胰岛素耐量没有显着影响。
丁酸盐:改善线粒体功能,减少氧化应激,防止骨骼肌损伤
丁酸盐还能增加线粒体蛋白孔蛋白和线粒体转录因子 A 的水平,并显着改善骨骼肌细胞中的线粒体功能。
此外,丁酸盐治疗可减少小鼠氧化应激表达和细胞凋亡标记物,并改变抗氧化酶的活性,从而防止氧化应激引起的骨骼肌损伤。
丁酸盐:改善与年龄相关的肌肉损失
丁酸盐是一种重要的 SCFA 和组蛋白脱乙酰酶抑制剂,可调节与年龄相关的肌肉损失。丁酸盐已可以通过抑制组蛋白脱乙酰酶表达并改善老年小鼠的肌肉质量和横截面积来促进肌肉合成。
乙酸盐:促进葡萄糖吸收,减少肌内脂质生成
添加乙酸盐可以促进兔骨骼肌中的葡萄糖吸收和糖原生成,并通过增加脂肪酸和氧化来减少肌内脂质生成。
此外,SCFA 还可诱导 IGF-1 产生,从而促进肌肉合成代谢。SCFA 的这些代谢影响可能直接作用于骨骼肌,也可能通过刺激胰高血糖素样肽 1 (GLP-1) 分泌而间接产生。SCFA 对肌肉的其他间接影响包括加速血流效应。
分解色氨酸,产生吲哚代谢物:抗炎,增强肌肉蛋白合成
色氨酸是人体不可缺少的芳香氨基酸。肠道菌群分解色氨酸过程中产生的富含吲哚和吲哚衍生物的代谢物在维持肠道环境稳态和肠道菌群多样性方面发挥着关键作用。
来自肠道微生物群的吲哚代谢物可以增强体内IL-10水平,而IL-10在调节宿主炎症状态方面具有抗炎作用。
其他研究的证据表明,色氨酸代谢物吲哚丙烯酸可通过下调炎症和氧化应激相关基因表达来促进肠道屏障功能并抑制炎症反应。当机体处于慢性炎症状态、肌肉蛋白合成受到限制时,色氨酸代谢物的抗炎作用尤其重要。
肠道菌群→影响胆汁酸代谢→影响骨骼肌代谢
胆汁酸是肝脏产生并分泌到肠道的小代谢分子,参与膳食脂质吸收。肠道菌群可以改变胆汁酸的结构、生物利用度和生物活性,从而影响胆汁酸代谢和宿主代谢稳态。
肠道厌氧菌已被证明可以将初级胆汁酸转化为次级胆汁酸。毛螺菌科也可以产生 SCFA 并从初级胆汁酸转变为次级胆汁酸。
肠道菌群可能参与胆汁酸代谢和 FXR-FGF19 信号通路(有证据表明 FGF19 激活可以抑制肌肉萎缩标志物的蛋白表达,增强与生肌分化相关的分子,调节骨骼肌蛋白平衡,这反过来又影响骨骼肌代谢。次级胆汁酸还可以通过促进脂质和葡萄糖代谢来增强肌肉功能。
益生菌→促进维生素合成→影响骨骼肌功能
维生素是人体必需的微量营养素,大部分是人体无法合成的。实验证据证实,肠道益生菌促进体内维生素的合成,对骨骼肌功能有显著影响。例如,双歧杆菌和乳酸杆菌可以合成B族维生素 (包括叶酸、核黄素、维生素 B12)。B族维生素是直接参与能量代谢的水溶性维生素,它们的缺乏会导致心肌损伤和心力衰竭。维生素 B12缺乏会增加同型半胱氨酸水平并导致肌肉损伤。
骨
先前的研究表明,益生菌有利于肠道稳态,并在预防和治疗骨质流失中发挥关键作用。
益生菌
胃肠道中乳杆菌的上调可以产生有效的杀菌剂和有机酸,从而抑制致病性大肠杆菌。肠道菌群中乳酸杆菌和乳球菌丰度的增加。
罗伊氏乳杆菌补充剂可以显着改善肠道微生物群的不平衡,增强肠道屏障功能以防止骨质流失。
在一项随机对照试验中,75-80 岁骨量低的绝经后妇女每天服用罗伊氏乳杆菌,12个月后骨密度下降的比例明显低于对照组,这表明益生菌补充可以减少骨质流失。
补充普通双歧杆菌还可以降低 LPS 浓度,从而抑制炎症反应并防止骨质流失。
嗜酸乳杆菌和克劳氏芽孢杆菌(Bacillus Clausii)可以通过平衡炎症细胞因子的水平来维持骨稳态。
长双歧杆菌还可以预防和治疗骨质疏松症,通过增强成骨细胞活性和抑制破骨细胞形成来改善骨质流失。
此外,益生菌可以通过调节矿物质吸收来改善骨骼健康。例如,长双歧杆菌可以通过改善钙、磷酸盐和镁等矿物质的吸收来增强骨密度。罗伊氏乳杆菌可以通过抑制破骨细胞来减轻骨质流失。
益生菌促进维生素B12、维生素D、钙等吸收
维生素B12水平低还会抑制成骨细胞活性,从而增加骨质疏松风险,甚至诱发骨折。
益生菌如乳酸菌和双歧杆菌,在促进核黄素和叶酸的形成方面发挥着关键作用。核黄素和叶酸对于促进维生素合成和调节炎症反应很重要。研究表明,核黄素在一定程度上具有抗炎作用,其摄入可抑制大鼠白细胞中TNF-α的释放。
核黄素还作为抗氧化酶的辅助因子调节氧化应激。叶酸与调节胰岛素抵抗和抑制促炎细胞因子 IL-6、IL-8 和 TNF-α 有关。
不难发现,B族维生素的抗炎、抗氧化、参与能量代谢等功能对于维持骨骼健康是不可或缺的。钙和维生素 D 的吸收对于健康的骨骼维护尤为重要,益生菌可降低肠道PH值并改善钙吸收,从而增强骨骼功能。
多联益生菌→抗炎→减轻骨关节炎
在骨关节炎(OA)大鼠模型中,益生菌复合物通过抑制促炎细胞因子和软骨破坏来减轻骨关节炎的发展。
在一项人体试验中,537 名 骨关节炎(OA) 患者随机分配到干酪乳杆菌或安慰剂组,6 个月后,与对照组相比,干酪乳杆菌组的全身炎症显着降低。口服嗜热链球菌可改善骨关节炎变性。
口服丁酸梭菌(Clostridium butyricum)可有效保存 骨关节炎大鼠膝关节软骨和滑膜,显着减少纤维组织量,并显着降低骨和软骨各种炎症和代谢标志物的血清浓度。
干酪乳杆菌通过下调促炎细胞因子来减轻关节炎症损伤。益生菌最近添加到治疗关节炎症的药物清单中,因为干酪乳杆菌可以抑制关节肿胀、减少类风湿性关节炎,并防止关节炎症大鼠的骨质破坏。
嗜酸乳杆菌和干酪乳杆菌也常用于治疗类风湿性关节炎的缓解剂。还有人提出,用于缓解类风湿性关节炎相关后果的益生菌补充剂的可用性仍然很弱,而且益生菌对类风湿性关节炎的影响似乎是菌群特异性的。
肠道菌群代谢产物
短链脂肪酸:参与骨代谢,抑制骨吸收
短链脂肪酸(SCFA)参与骨代谢并影响骨形成和吸收。SCFA 对骨量的保护作用与抑制骨吸收有关。从潜在机制来看,丁酸盐和丙酸盐诱导破骨细胞代谢重编,增强糖酵解,下调关键破骨细胞基因,显着减少破骨细胞数量,从而抑制骨吸收。
因此,SCFAs是破骨细胞代谢和骨稳态的有效调节剂,在促进骨形成中发挥重要作用。
丁酸盐:促进骨合成代谢,维持骨代谢平衡
在一项小鼠研究中,发现丁酸盐可以通过调动成骨细胞中的 Wnt 信号通路来促进骨合成代谢并增加骨量。
此外,丁酸盐可以保护成骨细胞前体细胞免受过氧化氢诱导的损伤,并促进成骨细胞的矿化和分化。它主要通过增强细胞抗氧化酶的活性、促进ATP的产生、降低ROS水平来维持骨代谢的平衡。
短链脂肪酸还可诱导 IGF-1 的产生
IGF-1除了促进骨骼肌功能外,在骨代谢中起着至关重要的作用。IGF-1参与骨形成和吸收,调节骨代谢平衡。因此,SCFA 在维持骨代谢过程中的体内平衡中发挥着关键作用。
短链脂肪酸→调节IL-10→减轻关节炎
乳酸菌产生的丁酸通过控制软骨细胞自噬和炎症细胞死亡来抑制骨关节炎。益生菌衍生的丁酸盐可以通过影响 T 和 B 细胞的进展来抑制小鼠关节炎。
色氨酸代谢与骨代谢密切相关
犬尿氨酸是一种色氨酸代谢物,是色氨酸酶降解后形成的第一个稳定代谢物。
犬尿氨酸在骨代谢中的关键功能似乎是加速骨质流失并介导对骨骼的不利影响。犬尿氨酸含量随着衰老而增加,其对骨骼的不利影响可能是由于其对破骨细胞活化的影响,导致骨骼脆性增加和骨重塑失衡。
其他研究表明,犬尿氨酸水平升高会损害成骨细胞分化并增加破骨细胞吸收,从而加速骨骼老化。
次级胆汁酸调节骨稳态
次级胆汁酸还通过调节成骨细胞和破骨细胞之间的信号转导来调节骨稳态。此外,次级胆汁酸诱导 GLP-1 的产生,GLP-1 调节葡萄糖稳态并刺激成骨细胞分化并能进一步增强骨骼系统的功能。
对于益生菌及其次级代谢产物,其抗炎和免疫调节特性值得进一步研究,以确定其在肌肉骨骼系统中的作用和生物学机制。
小结
常见肠道微生物群对肌肉骨骼系统的影响
doi: 10.1080/19490976.2023.2263207
肠道微生物群及其产生的代谢物的重要作用:
然而,肠道微生物群的失衡还会引发一系列负面影响:
肠道菌群与肌肉骨骼系统的正常代谢密切相关。可以采取适当的干预措施,促进肠道益生菌发挥最佳调节作用。
doi: 10.1080/19490976.2023.2263207
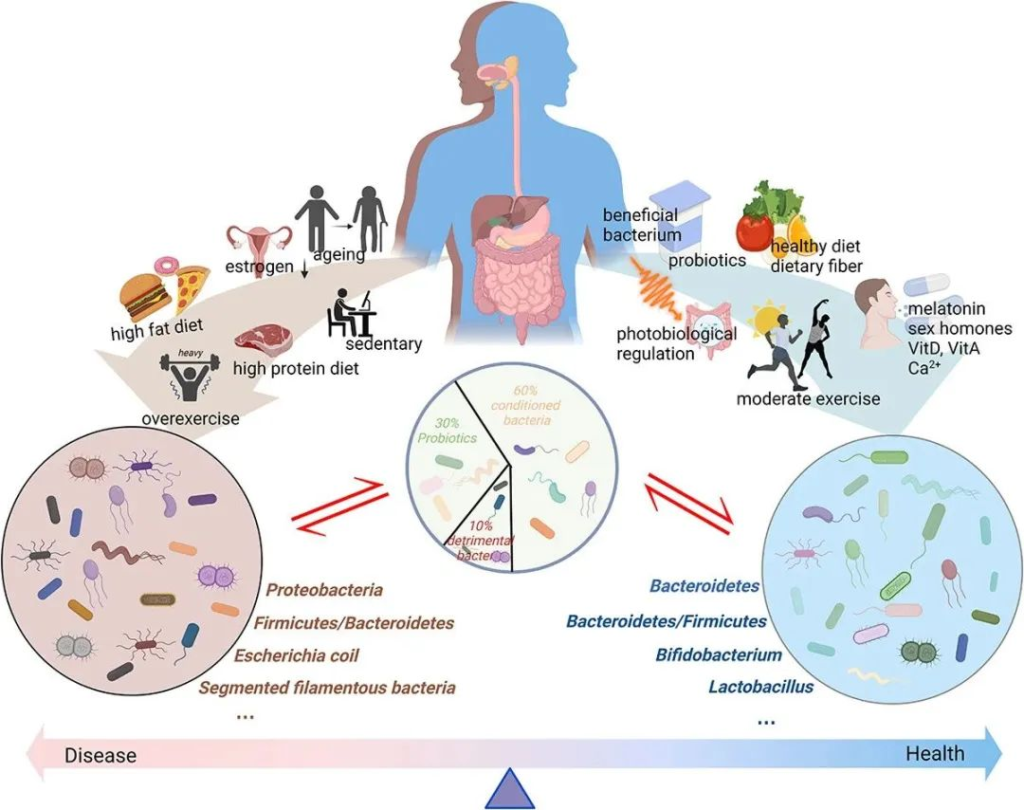
肠道微生物群一般分为三类:益生菌、有害菌和条件菌。
不同的生活方式对肠道微生物群产生不同的影响。衰老、性激素分泌减少、高脂肪饮食、高蛋白饮食以及久坐的生活方式或过度运动会对肠道微生物群产生负面影响。这些都会导致有害细菌比例增加,诱导粘膜通透性并引发一系列负面反应。同时,健康饮食、适度运动、光生物调节、补充益生元和益生菌、维生素、钙、性激素、褪黑素等可以促进肠道菌群的积极变化,从而增强肌肉骨骼系统功能。
促进肌肉骨骼系统健康
益生元通过选择性刺激某些肠道菌群的活性或生长,对宿主肌肉骨骼系统产生有益的生理作用。益生元有助于有益菌生长,比如乳杆菌和双歧杆菌等,常见的益生元有菊粉、低聚糖等。
益生元可改善肠道屏障功能和宿主免疫力,并减少梭菌等潜在致病菌的丰度。
益生元→炎症↓↓→肌肉质量↑↑
结果表明,喂食益生元纤维寡糖的小鼠的循环 LPS 水平和炎症降低,肌肉质量增加。此外,补充益生元可提高双歧杆菌、乳杆菌、拟杆菌门/厚壁菌门的比例。
同时,益生元作为膳食纤维的一种,也可以促进 短链脂肪酸的生成。
维生素D:有利于钙吸收、维持肠道屏障
维生素 D 是增加骨量的关键因素。除了直接影响钙吸收外,维生素 D 还通过维持肠道屏障的完整性来调节肠粘膜稳态,从而影响免疫系统功能和炎症反应。维生素D可以抑制促炎因子的水平,促进体内抗炎因子的分泌。
维生素D:改善肠道微生物稳态、促进肌肉合成
具体研究结果表明,维生素 D 补充剂可以调节女性肠道菌群并增加其多样性。维生素D补充后,AKK菌和双歧杆菌的相对丰度增加。
争议:维生素D能否改善肌少症,需要更多研究
维生素 A 在维持肠道屏障功能、调节免疫反应和细菌多样性以维持肠道稳态方面表现出类似的功能。但是同时有报道称,补充维生素 D 并不能改善社区老年人的任何肌肉减少症指数,并且可能会损害身体功能的某些方面。需要更多的实验证据来阐明维生素 D 的作用。
钙:菌群多样性↑↑ 有益菌↑↑ 保护肠道屏障
钙是体内最常见的矿物质,其摄入量关系到骨骼的健康发育。钙也是维持骨骼肌正常兴奋和收缩功能的最重要元素。膳食钙摄入量会引起肠道微生物群的变化。例如,用膳食钙喂养的小鼠肠道微生物群多样性显著增加,双歧杆菌、拟杆菌、瘤胃球菌科(Ruminococcaceae)和阿克曼氏菌(Akkermansia)丰度更高。
此外,膳食钙似乎对肠道屏障具有保护作用,通过增加宿主体内膳食钙的吸收来增加缓冲能力并促进骨量。总之,膳食钙可调节肠道微生物群,与宿主建立交叉对话,促进新陈代谢,并促进肌肉骨骼健康。
促进肌肉骨骼系统健康
肠道微生物群最近被定义为宿主营养信号的“传感器”。所消耗食物的类型和多样性与肠道微生物群的组成密切相关。
动物性饮食:拟杆菌门↑↑ 乙酸盐、丁酸盐↓↓
先前研究的证据表明,饮食模式的长期变化会引起肠道菌群的变化。短期饮食改变也会导致肠道微生物群的变化。例如,从植物性饮食转变为动物性饮食后,肠道中乙酸盐和丁酸盐的浓度显着降低。此外,以动物为基础的饮食增加了拟杆菌门的数量,并减少了厚壁菌门数量。
富含蛋白质的饮食:菌群多样性↑↑ 拟杆菌↑↑
骨骼肌质量受到肌肉蛋白质合成和分解的影响,肠道微生物群随年龄的变化也受到膳食蛋白质摄入量的影响。此外,摄入富含蛋白质的饮食与肠道微生物群的多样性呈正相关,可以提高肠道微生物群中拟杆菌。
长期高蛋白饮食:并不总是对肌肉产生积极影响
耐力运动员长期服用牛肉蛋白补充剂会减少双歧杆菌等有益肠道细菌的丰度。此外,结肠中未消化的蛋白质残留物发酵产生的化合物对肠道、免疫和代谢功能具有潜在的负面影响。
高脂肪饮食:炎症↑↑ 氧化应激、 变形菌↑↑
对高脂肪饮食小鼠的研究表明,这种饮食会增加体重和炎症标记物的表达,并降低葡萄糖耐量;更重要的是,高脂肪饮食喂养的小鼠体内LPS的循环水平增加了两到三倍,这导致肠道通透性增加,从而引发损害肌肉质量的炎症反应。
高脂饮食摄入引起的肥胖还可能导致体内 ROS 过量产生和氧化应激反应,并随之增加脂肪因子群和 TNF-α 表达,从而加重体内慢性炎症反应并影响骨骼肌肉功能。此外,高脂肪饮食可以减少 SCFA 的产生,并增加变形菌的比例。
地中海饮食:均衡蛋白质、碳水化合物、多酚,有益菌↑↑ 炎症↓↓
较高的碳水化合物摄入量与肠道菌群多样性下降密切相关。虽然双歧杆菌含量增加,但乳酸菌和链球菌含量减少。
咖啡、茶和红酒富含多酚,多酚与益生元丰度和双歧杆菌活性有关。膳食多酚可以增加产短链脂肪酸菌的繁殖并抑制产LPS菌的生长,从而调节肠道微生物群并影响肌肉骨骼系统健康。
地中海饮食的摄入有助于维持健康的肠道菌群,因为该饮食均衡摄入优质蛋白质和复合碳水化合物以及较高水平的纤维和多酚。因此,健康的饮食可以提高益生菌的相对比例并调节炎症,而不健康的饮食会导致肠道菌群失调、氧化应激、炎症等不良反应,最终损害肌肉骨骼系统的健康。
促进肌肉骨骼系统健康
运动改善效果大于营养补充剂
适度的运动可以改善肌肉、骨骼和关节。研究结果表明,运动干预可以有效改善60岁以上老年人的肌肉质量和功能,并且运动的效果明显大于营养补充剂。
运动还可以有效增加骨矿物质密度,提高骨强度,降低骨质流失风险以及跌倒和骨折的发生率。同样,运动可以缓解骨关节炎患者的疼痛、增强关节功能并提高生活质量。
运动:改善肠道菌群、改善肌肉骨骼健康(动物)
在人类和动物实验中,运动可以促进肠道微生物群的积极变化,从而改善肌肉骨骼功能。高强度训练可以防止高脂肪饮食诱导的肥胖小鼠中与肥胖相关的肠道微生物群失调,并维持肠道微生物群的多样性。非肥胖小鼠的拟杆菌与厚壁菌门的比例在运动后也会发生变化,并且拟杆菌的丰度在运动后显着增加。
在一项针对肥胖大鼠的运动和饮食研究中,随着时间的推移,运动对肠道微生物群产生更强、更稳定的影响,并能更有效地促进肠粘膜完整性和代谢功能。
运动员多样性高,肠道菌群有助于运动中乳酸转化为丙酸
关于运动与肠道微生物群之间关系的人体研究也获得了类似的结果。接受强化训练的精英运动员肠道微生物群的相对丰度明显高于久坐的成年人。
职业橄榄球运动员的肠道微生物群多样性高于非职业运动员。职业运动员的炎症细胞因子水平也低于非职业运动员。此外,研究表明,肠道微生物群菌群还可以通过将运动过程中产生的乳酸转化为丙酸,从而延长跑步时间,提高运动成绩。
扩展阅读:
肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?
有氧运动:拟杆菌↑↑ 改善心肺健康
有氧运动期间人体中拟杆菌门和厚壁菌门之间的平衡对于维持健康至关重要,肠道细菌定植平衡的破坏可能导致炎症和代谢或神经系统疾病。
日本一项关于有氧运动干预老年女性肠道微生物群的研究表明,为期 12 周的有氧运动计划不仅增加了拟杆菌,而且还改善了心肺健康。同时,快走时间增加超过 20 分钟的受试者中拟杆菌的丰度。
因此,适度运动可以通过改善肠道菌群组成、增强肠道粘膜功能、抑制炎症反应、维持多种肠道菌群来增强肌肉骨骼功能。
有氧运动+益生元:改善代谢紊乱,预防膝关节损伤
运动对肠道微生物群的潜在影响介导了骨关节炎的过程。在一项动物研究中,研究人员给高糖、高脂肪饮食的小鼠,同时进行有氧运动、益生元或两者的结合,发现两种干预措施的结合完全可以预防肥胖老鼠的膝关节损伤。
有趣的是,另一项研究表明,有氧运动和益生元的结合可以改善肥胖大鼠的代谢紊乱,但不能改善膝关节先前存在的骨关节炎损伤。因此,需要进一步研究进行更大样本的临床调查。
过度运动:促炎,限制肌肉形成、微生态失衡
过度运动可能会促进炎症、营养限制以及氧化和代谢应激,从而限制肌肉形成。过度训练的其他负面影响包括肠道缺血、肠道屏障通透性增加和氧化应激,从而导致肠道微生态失衡、炎症反应增加、分解代谢增加和肌肉功能恶化。
定期训练与更好的生物多样性和对肠道微生物群的有益影响有关。某些研究的证据支持这样的观点,即疲劳训练可能与有害的微生物后果有关。因此,运动对肠道菌群的影响可能取决于运动的强度和持续时间。
促进肌肉骨骼系统健康
肠道细菌与人体细胞的比例因性别而异,女性的比例高于男性。细菌与人体细胞的比例男性为1.3,女性为2.2 。
绝经后女性:厚壁菌门 / 拟杆菌门比例 ↓↓
女性肠道微生物的多样性也更高。Akkermansia muciniphila在女性中尤其丰富。绝经前女性的厚壁菌门/拟杆菌门比例高于绝经后女性。
绝经前女性中普雷沃菌属、毛螺菌属(Lachnospira)、嗜胆菌属( Bilophila)的相对丰度低于绝经后女性,同时炎症水平的 IL-6 和单核细胞趋化蛋白-1 血浆水平也较低。
这表明雌激素可能影响肠道微生物稳态和免疫的调节。与此同时,肠道菌群失衡也会影响雌激素活性。
绝经后雌激素水平下降,对肠道屏障和骨骼健康造成损害
如前所述,肠道微生物群通过分泌 β-葡萄糖苷酶来调节雌激素,当这一过程因肠道菌群失调(其特点是微生物多样性减少)而受到损害时,会导致循环雌激素减少,从而影响骨骼代谢。
非卵巢雌激素更多地受到肠道微生物组的影响,这可能是绝经后妇女更容易患骨质疏松的原因之一。因此,维持肠道稳态对于雌激素的正常分泌和骨代谢的平衡至关重要。
老年人睡眠障碍:与肠道菌群,肌少症相关
人们认为肌肉骨骼健康的丧失与睡眠障碍有关。同时,在老年人中,较短的睡眠时间与促炎细菌的增加有关,而睡眠质量的改善与Warts microbacteria、Flatcoccus有关。
年轻人睡眠中断:肠道菌群变化介导促炎状态
在年轻人中,睡眠中断对肠道微生物组成的影响,特别是有益的厚壁菌门与拟杆菌门的比例,仍然是矛盾且不清楚的。这项研究不仅将加深对肌肉减少症的多种影响因素的理解,而且还可以对这种复杂的情况提供更全面的看法。
当睡眠不佳时,肠道微生物群经常发生变化,这可能介导睡眠障碍和肌肉减少症之间的促炎症状态。
这些发现不仅表明肠道微生物群在睡眠质量和肌肉减少症之间的相关性中发挥着重要作用,而且还暗示调节睡眠的激素(例如褪黑激素)可能是有效的干预目标之一。
褪黑素:调节睡眠、抗炎抗氧化、保护骨骼肌
褪黑素是另一种调节睡眠和昼夜节律的内源性激素,具有抗衰老、抗炎和抗氧化特性,是一种用于疾病治疗和骨骼肌质量改善的安全膳食补充剂。褪黑素可减少氧化应激和炎症,并保护骨骼肌免受氧化损伤。
此外,它还可以改善衰老过程中的肌肉线粒体功能。对老年人的研究也表明褪黑激素水平与肌肉力量之间存在显著相关性。
褪黑素:逆转睡眠剥夺小鼠的肠道菌群失衡
有趣的是,睡眠剥夺小鼠的肠道菌群减弱,益生菌种类有限。有趣的是,褪黑素治疗逆转了这种异常的微生物组组成。褪黑激素可以改善动物和人类的肠道微生物群。口服褪黑激素补充剂可以减少脂质积累,逆转肠道微生物群失衡,并改善肠道菌群的多样性。
褪黑素:改善肠道生态失衡,恢复SCFA水平
高脂肪饮食喂养的小鼠肠道中SCFA水平显著降低,但在补充褪黑激素后恢复。此外,高脂饲料喂养的小鼠补充褪黑素可以有效改善肠道生态失衡,褪黑素可以改变厚壁菌门与拟杆菌门的比例,增强肥胖小鼠的肠粘膜功能。
褪黑素:减轻胰岛素抵抗,参与骨代谢
同时,补充褪黑激素减轻了小鼠因低度炎症和高脂肪饮食摄入引起的胰岛素抵抗。褪黑激素可以调节胰岛素敏感性,因此在维持葡萄糖稳态和调节葡萄糖代谢方面具有关键作用。
褪黑素还可通过激活核因子红细胞 2 相关因子 2 (Nrf2)/过氧化氢酶信号通路抑制破骨细胞形成,从而治疗炎症性骨溶解。
因此,我们可以推断,褪黑激素可以增强肠道粘膜功能,改善脂质和糖代谢,并通过调节肠道微生物群失调促进 SCFA 的产生,从而最终增强肌肉骨骼系统的功能。
促进肌肉骨骼系统健康
作为一种局部治疗,光生物调节在临床上用于治疗各种病症,包括肌肉疲劳、关节和肌腱炎症以及伤口和骨折愈合。
光生物调节:肠道菌群多样性↑↑
对健康小鼠腹部照射PBM后,小鼠肠道菌群发生显着变化,肠道菌群多样性也显着增加。这种效果在每周接受 3 次红光治疗的小鼠中最为明显,但在接受单次红光治疗的小鼠中则不明显。
近红外光比红光发挥更显着的效果
近红外照射后,小鼠肠道菌群中益生菌的比例显着增加,并且治疗还调节了与肠道菌群失衡相关的细菌丰度;这种作用可能归因于 PBM 对肠道微生物群的抗炎和氧化还原信号作用。
紫外线辐射:影响肠道菌群,维生素D和钙吸收,促进骨骼健康
紫外线辐射也会影响骨质流失大鼠模型中的肠道微生物群结构和功能。除了抗炎作用外,紫外线辐射还可以通过诱导维生素D合成和肠道钙吸收来调节骨代谢,从而促进骨形成、减少骨吸收、增强骨矿物质密度。该证据表明,尽管没有太多直接证据,但 PBM 仍然显示出通过调节肠道菌群失衡维持肌肉骨骼系统稳态的潜在作用。PBM 有潜力作为辅助疗法(与饮食和运动一起)来平衡微生物组并促进肌肉骨骼健康。
包括运动、电针和补充益生菌在内的生活方式干预措施对肠道微生物群有直接影响,改变其组成和功能,改善疼痛和生活质量,这为患有多种慢性疾病的患者开辟了新的治疗机会的创新途径。
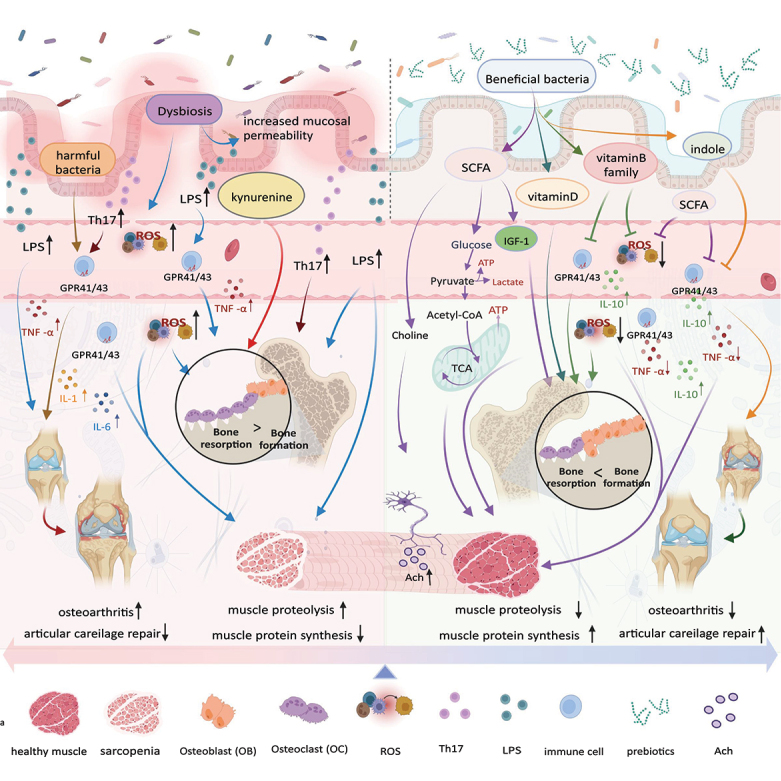
肠道和骨骼之间的跨学科作用越来越引起骨生物学领域的关注。肠道菌群调节肌肉骨骼健康的潜在机制包括蛋白质、能量、血脂、糖代谢、炎症水平、神经肌肉连接性和线粒体功能。
肠道菌群的组成和代谢变化可能会影响肌肉骨骼系统的功能。肠道菌群失衡增加促炎因子水平,激活氧化应激途径,减少肌肉质量,影响骨形成和吸收。
肠道菌群调节的个性化治疗对于肌肉骨骼系统疾病的治疗来说既困难又充满希望。
临床应用,还需深入研究
在粪便移植的临床研究中,现有的荟萃分析对粪便移植对85种疾病的治疗效果进行综述发现,大多数研究是在传染病和肠道疾病方面进行的,而与肌肉骨骼健康直接相关的研究很少。
不同人群的年龄、遗传背景、生活方式等背景下,肠道微生物群变化可能会汇聚成不同的病理微生物群模式,这些复杂的相互作用需要进行大规模的纵向研究才能解决。
临床应用刚刚开始,考虑到微生物菌群的复杂性和个体差异,是否适合筛选促进肌肉骨骼健康的细菌,或者基于人类粪便细菌移植的个体化治疗;无论是肠道微生态干预的手段和方法,还是肠道微生态干预的效果,都还需要大量的临床证据来支持,需要共同努力才能实现。
多种干预措施,组合探索
基于肠道菌群在肌肉骨骼系统中的作用机制,可以采用不同的干预措施,如益生菌、益生元、维生素和膳食钙等,改善肠道菌群的组成和代谢,增强肌肉骨骼系统功能。
此外补充雌激素和褪黑激素以及光生物调节等新兴方法已显示出调节肠道微生物群和促进肌肉骨骼健康的潜力,特别是联合使用时。各种合理干预方法的组合应用也是一种有意义的探索。
包括运动在内的生活方式干预措施对肠道微生物群有直接影响,改变其组成和功能,这为患有多种慢性疾病的患者开辟了新的治疗机会的创新途径。
主要参考文献:
Wang Y, Li Y, Bo L, Zhou E, Chen Y, Naranmandakh S, Xie W, Ru Q, Chen L, Zhu Z, Ding C, Wu Y. Progress of linking gut microbiota and musculoskeletal health: casualty, mechanisms, and translational values. Gut Microbes. 2023 Dec;15(2):2263207.
Sender R, Fuchs S, Milo R. Revised estimates for the number of human and bacteria cells in the body. PLoS Biol.2016;14(8):e1002533.
Petermann-Rocha F, Balntzi V, Gray SR, Lara J, Ho FK, Pell JP, Celis‐Morales C. Global prevalence of sarcopenia and severe sarcopenia: a systematic review and meta-analysis. J Cachexia Sarcopenia Muscle. 2022;13(1):86–35.
Ayers C, Kansagara D, Lazur B, Fu R, Kwon A, Harrod C. Effectiveness and safety of treatments to prevent fractures in people with low bone mass or primary osteoporosis: a living systematic review and network meta-analysis for the American college of physicians. Ann Intern Med. 2023;176(2):182–195.
Wei J, Zhang Y, Hunter D, Zeng C, Lei G. The gut microbiome-joint axis in osteoarthritis. Sci Bull (Beijing). 2023;68(8):759–762.
Dey P, Chaudhuri SR, Efferth T, Pal S. The intestinal 3M (microbiota, metabolism, metabolome) zeitgeist – from fundamentals to future challenges. Free Radic Biol Med. 2021;176:265–285.
Gilbert JA, Blaser MJ, Caporaso JG, Jansson JK, Lynch SV, Knight R. Current understanding of the human microbiome. Nat Med. 2018;24(4):392–400.
Turnbaugh PJ, Ley RE, Hamady M, Fraser-Liggett CM, Knight R, Gordon JI. The human microbiome project. Nature. 2007;449(7164):804–810.
Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol. 2021;19(1):55–71.
Delzenne NM, Neyrinck AM, Backhed F, Cani PD. Targeting gut microbiota in obesity: effects of prebiotics and probiotics. Nat Rev Endocrinol. 2011;7(11):639–646.
Ma Q, Li Y, Li P, Wang M, Wang J, Tang Z, Wang T, Luo L, Wang C, Wang T, et al. Research progress in the relationship between type 2 diabetes mellitus and intestinal flora. Biomed Pharmacother. 2019;117:109138.
Lynch SV, Pedersen O, Phimister EG. The human intestinal microbiome in health and disease. N Engl J Med. 2016;375(24):2369–2379.
Ridaura V, Belkaid Y. Gut microbiota: the link to your second brain. Cell. 2015;161(2):193–194.
Chen Y, Zhou J, Wang L. Role and mechanism of gut microbiota in human disease. Front Cell Infect Microbiol. 2021;11:625913.
Dinan TG, Cryan JF. Brain-gut-microbiota axis and mental health. Psychosom Med. 2017;79(8):920–926.
Hu X, Wang T, Jin F. Alzheimer’s disease and gut microbiota. Sci China Life Sci. 2016;59(10):1006–1023.
Witkowski M, Weeks TL, Hazen SL. Gut microbiota and cardiovascular disease. Circ Res. 2020;127(4):553–570.
Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, Liang S, Zhang W, Guan Y, Shen D, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature. 2012;490(7418):55–60.
Moludi J, Maleki V, Jafari-Vayghyan H, Vaghef-Mehrabany E, Alizadeh M. Metabolic endotoxemia and cardiovascular disease: a systematic review about potential roles of prebiotics and probiotics. Clin Exp Pharmacol Physiol. 2020;47(6):927–939.
Koh A, De Vadder F, Kovatcheva-Datchary P, Backhed F. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites. Cell. 2016;165(6):1332–1345.
Bana B, Cabreiro F. The microbiome and aging. Annu Rev Genet. 2019;53(1):239–261.
Strasser B, Wolters M, Weyh C, Kruger K, Ticinesi A. The effects of lifestyle and diet on gut microbiota composition, inflammation and muscle performance in our aging society. Nutrients. 2021;13(6):2045.

谷禾健康
衰老通常伴随着心血管、神经和免疫系统等一系列疾病的风险增加。
虽然在理解微生物组导致与衰老相关的个别疾病的细胞和分子机制方面取得了显著进展,我们在之前的文章也有这方面的阐述:
但微生物组对衰老过程的实际影响或操纵微生物组促进健康衰老的潜力仍不清楚。
这方面的研究因许多导致衰老和年龄相关表型的人口统计学因素而变得更加复杂。在世界各地几乎所有的人口中,女性的寿命都显著高于男性,世界卫生组织的大多数常见的与年龄相关的死亡原因都是性二型的,导致这些性二型表型的机制仍然知之甚少。
研究表明,人类微生物组在衰老个体中发生了改变,微生物组影响了模式生物的寿命。


本文重点介绍了最近在人类和模式生物中进行的研究,这些研究表明微生物组与多种年龄相关疾病有关,重点关注癌症、肥胖、2型糖尿病和帕金森氏病。同时解释了为什么性别是理解微生物组如何塑造衰老的关键差距。这些讨论共同强调了微生物组在整个生命周期中的广泛影响,以及在这一跨学科领域快速展开新发现的潜力。
通过微生物组预测年龄
人类微生物组与年龄之间的总体关联足够强,因此可以通过微生物组精确预测生物年龄。
在生命早期就证明了这一概念,在营养不良的情况下,在健康个体中建立的“微生物群成熟度指数”被推迟了。
最近,机器学习工具能够根据远端肠道宏基因组数据准确预测成年人的年龄,平均绝对误差为6至8岁。


其他部位菌群也与年龄相关
在其他身体部位发现的微生物群的组成也与年龄有关,包括皮肤和口腔在内。皮肤微生物群甚至在尸体解剖后被用于确定尸体的年龄,强调与人类微生物群的时间关系涵盖了整个生命周期以及生命周期结束后。
在法医学中有应用前景
这一领域的持续进展对法医学有着明确的影响,有助于采用新的方法来识别嫌疑人,甚至可能识别他们的年龄。微生物组特征也与老年人的生存有关,这进一步强调了了解微生物组如何在衰老中改变的重要性。
对百岁老人的研究促进健康衰老
对百岁老人(100岁以上的人)的研究为可能促进健康衰老的微生物组成分提供了有价值的见解。
健康的百岁老人和虚弱的老人
doi.org/10.1371/journal.pbio.3002087
百岁老人比年轻人表现出更高的细菌多样性,且Alistipes、Parabacteroides、Clostridium等丰度较高。
与这些分类变化一致的是,百岁老人体内也富含多种微生物代谢产物,包括肠道细菌产生的抗炎胆汁酸。
需要进行后续研究,测试特定细菌种类、基因和代谢产物在促进健康衰老中的因果作用;然而,这些数据清楚地表明,处于寿命极端的个体拥有独特的微生物类群和代谢最终产物。
虚弱老年人:肠道菌群多样性低,皮肤菌群中多种潜在的致病菌
虚弱也与人类肠道微生物组的个体间差异有关(图1)。经过年龄调整后,与不太虚弱的个体相比,虚弱的老年个体肠道细菌多样性降低。
对居住在社区和护理机构的老年人的纵向分析揭示了与虚弱相关的皮肤、口腔和肠道微生物群的差异。
在虚弱的老年人的皮肤上观察到多种潜在致病细菌,以及大量抗生素耐药性基因。与百岁老人一样,微生物群在导致虚弱中的因果作用仍有待确定,特别是考虑到许多可能解释人类微生物群中这些与虚弱相关的差异的混杂因素。
什么因素影响老年微生物组变化?
年龄与生活方式的多个方面和宿主生物学的变化有关,这些变化可以解释人类微生物群中观察到的许多或所有差异。
衰老伴随着宿主免疫受损,这可能导致以前被免疫系统控制的微生物的扩张,这可能解释了虚弱的老年人中潜在细菌病原体的富集。
饮食也是一个明显的混淆因素,因为疗养院居民更受限制的饮食可能是一些老年人肠道微生物群变化的关键驱动因素。
肠道运动通常也会随着年龄的增长而减慢,这可能会对肠道微生物群产生下游影响。
最后,老龄化健康的社会决定因素,如独居、住院护理的可能性增加、行动不便和人际关系的丧失,都可能影响微生物组。
考虑到可能起作用的众多因素,最近的一项研究采取了一种更为综合的方法,证明了肠道微生物组与整体生活史之间的联系,其中包括有关药物、体育活动、饮食和血液标志物的信息。因此,微生物组随年龄的变化似乎是由许多宿主和环境因素的净影响驱动的。
►▷
这些结果强调,人类微生物组是衰老过程中一个重要但研究不足的方面。鉴于这种微生物生态系统的复杂性,解开因果关系在人类中是难以解决的,这推动了我们在下一节中讨论的模式生物的新兴工作。
对无菌模式生物的研究,为微生物组在决定宿主寿命方面的因果作用提供了有力的支持,包括对蠕虫、苍蝇、鱼和小鼠的研究。
综合考虑,以下讨论的研究结果表明,人类微生物组在寿命中也起着因果作用;然而,将与衰老相关的人类微生物组的特定方面直接“反向翻译”为这些模式生物仍有待探索。
生命早期接触微生物组有利于延长寿命
跨多个模型系统的研究表明,在早期接触微生物组有利于延长寿命。这在斑马鱼中最为显著,由于表皮退化表型,可能是由于营养不足,斑马鱼在无菌条件下无法成熟。同样,胚胎发育过程中的细菌定植延长了黑腹果蝇的寿命。
然而,以上结果与来自无菌秀丽隐杆线虫、无菌小鼠和无菌大鼠的数据相冲突,这些动物的寿命都比传统饲养的对照动物更长。因此,微生物在生命早期定植的潜在好处可能会被生命后期的有害影响所抵消。
微生物组可能缩短老年动物的寿命
在秀丽隐杆线虫中,大肠杆菌的胃肠道积累会导致与年龄相关的死亡。将无菌条件下的无菌果蝇去除后,成年果蝇的寿命会缩短。
最近,人们用非洲绿松石溪鱼研究了微生物组对衰老动物的有害影响。使用抗生素治疗的中年鱼(9.5周龄)比未经治疗的鱼活得更长,这表明微生物群会损害老年鱼的寿命。
值得注意的是,6周大的溪鱼的胃肠道微生物群显著延长了中年溪鱼群体的寿命。
基于微生物组的干预措施延长寿命
这些发现也与哺乳动物有关。在2种早衰症小鼠模型中的研究,支持了基于微生物组的干预措施延长寿命的潜力。
早衰小鼠的肠道微生物群发生了改变,包括了LmnaG609G/G609G模型中的Akkermansia muciniphila的显著减少,该模型含有导致最常见的人类早衰综合征的核膜层粘连蛋白A/C点突变。
正如在鳉鱼中一样,野生型小鼠的粪便微生物群移植(FMT)显著增加了转基因过早衰老受体小鼠的寿命。
人类肠道微生物群的常见菌群疣微菌属(Verrucomicrobium) A.muciniphila足以延长小鼠的寿命。
这些结果为确定微生物群依赖性寿命变化的细胞和分子机制迈出了重要一步,也是将这些结果潜在地转化为人类的重要一步。
微生物增加膳食营养素的消化吸收
多种模式生物的研究结果支持的一种机制是,微生物组可能通过增加膳食营养素的可利用性来缩短寿命。因此,微生物组的差异可能会抵消甚至加剧热量限制的影响,从而延长多种物种的寿命。
简言之,微生物组对植物多糖的消化、脂质的吸收和氨基酸的吸收至关重要。关于肠道微生物组在营养中作用的我们也有多篇文章提及:
微生物定植激活多种被抑制途径,从而延长寿命
微生物定植还可以激活被热量限制抑制的多种途径(延长寿命),包括胰岛素样生长因子1和AMP活化蛋白激酶。值得注意的是,与传统饲养的对照动物小鼠相比,当热量受到限制时,无菌小鼠失去了寿命优势。
此外,最近对人类和小鼠模型的研究表明,热量限制会以促进减肥的方式扰乱人类肠道微生物组。大量数据也表明微生物组与营养不良有关。
►▷
需要做更多的工作来解开饮食和微生物组之间的这些复杂相互作用,以及它们对宿主健康和寿命的长期影响。
从前面了解的内容我们可以看到,微生物组可以通过影响疾病的风险和治疗来影响寿命。
最近的研究支持宿主年龄导致疾病相关微生物组和健康个体微生物组之间的差异。
鉴于涵盖多个疾病领域的大量文献,我们选择将以下部分重点放在3个年龄相关疾病领域:
这里讨论的研究强调了将机制和转化微生物组研究配对的潜力,以及这些方法对其他年龄相关疾病的可推广性。
研究人员认为,所有这些途径的净效应通过决定疾病的风险和治疗来决定寿命。
微生物组与3种不同的年龄相关疾病有关的一些机制

doi.org/10.1371/journal.pbio.3002087
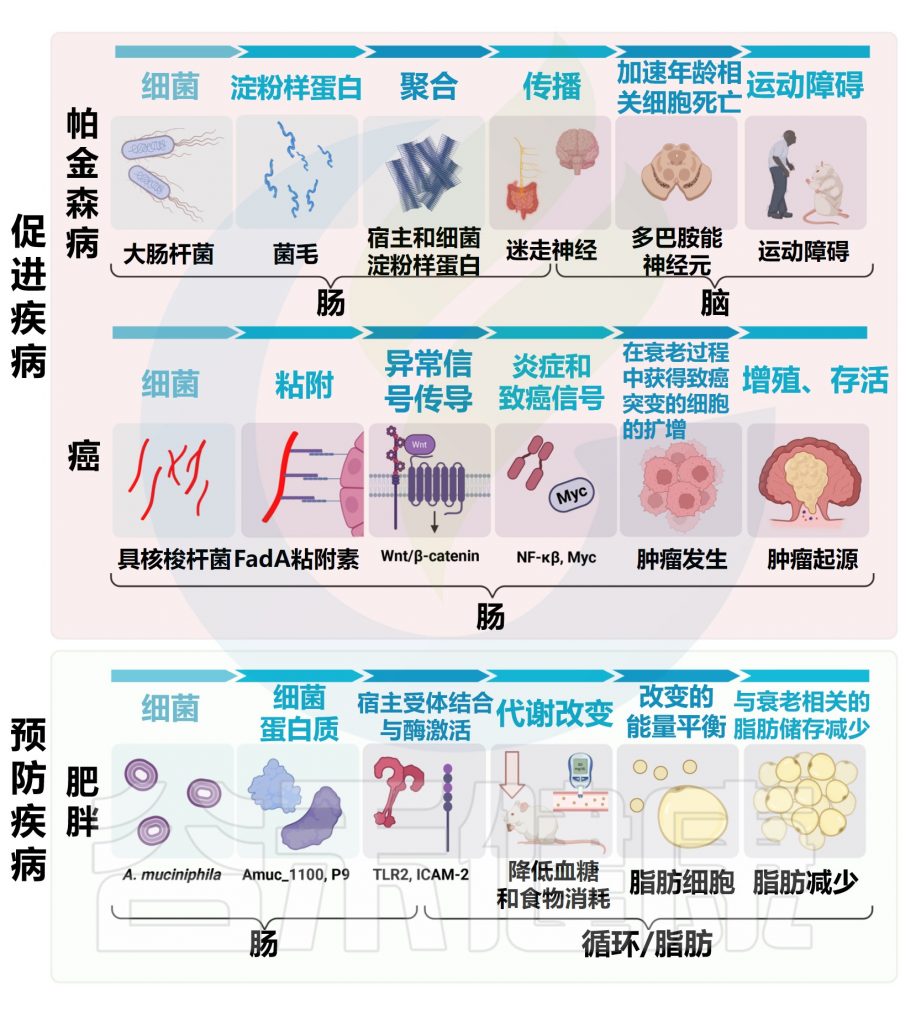
癌症与年龄有关:
20岁以下:每10万人中有25例以下
45至49岁:每10万人为350例
60岁及以上:每10万人中有1000例以上
大多数癌症类型,包括乳腺癌、前列腺癌和结肠直肠癌,都遵循这一趋势。


单个物种的影响:具核梭杆菌
最近,将结直肠癌肿瘤与邻近的非恶性粘膜进行比较,发现具核梭杆菌(Fusobacterium nucleatum)显著富集。
具核梭杆菌在结肠癌中因果作用的证据来自小鼠,在小鼠中,这种细菌激活信号通路,促进髓样细胞浸润,并表达促炎和致癌基因。
整体微生物组:评估疾病状态
除了具核梭杆菌等单个物种外,整个微生物组都可以作为疾病状态的有价值的生物标志物。使用肠道微生物组数据作为筛查工具可将结直肠腺瘤预测成功率提高50倍以上。
肠道微生物组也与其他器官中发现的癌症有关,包括肝脏、前列腺和乳腺。
扩展阅读:
此外,全身发现的肿瘤通常含有可检测的微生物,包括细菌和真菌,这表明微生物组可能对肿瘤进展具有局部和全身影响。
改变免疫力
癌症化疗和免疫治疗工作强调了微生物组在塑造癌症治疗结果中的广泛作用。从对免疫疗法反应良好的黑色素瘤患者通过粪菌移植到其他患者之后,一部分受试者的肿瘤大小减小。这些研究强调了肠道微生物组的变化如何改变宿主免疫力,从而改变对免疫检查点阻断的反应性。
代谢抗癌药物
除了免疫相互作用外,微生物组还可以通过将抗癌药物代谢为下游代谢产物,使其活性增加或降低,从而直接影响抗癌药物。
选择性抑制重新激活抗癌药物伊立替康(β-葡萄糖醛酸酶)的细菌酶可以挽救胃肠道毒性,而细菌前TA操纵子的高水平表达会干扰卡培他滨(抗癌药物5-氟尿嘧啶的口服形式)的疗效。
►▷
在了解微生物组如何影响癌症风险、治疗和生存方面取得的持续进展,对解决这一影响全球人口老龄化的毁灭性疾病具有深远的意义。
代谢性疾病的常见医疗干预措施对肠道菌群有深远的影响
肥胖和2型糖尿病都与年龄有关,并且与微生物组有着广泛的联系。在人类中,由于糖尿病药物二甲双胍、胃旁路手术和减肥饮食的混杂影响,与这些疾病的一致微生物组相关性一直难以实现。
扩展阅读:
种族之间的差异也可能起到一定作用,例如,在美国的一个队列中,在东亚个体中没有检测到与肥胖相关的白人肠道微生物群差异。
总之,这些结果强调,旨在改善代谢性疾病的常见医疗干预措施对肠道微生物组有着深远的影响,而肠道微生物组也可能与衰老过程有关。此外,所涉及的特定微生物物种、基因和途径可能因个体和队列而异,这促使人们努力实现基于微生物组的精准营养和医学。
微生物组可以通过多种途径影响与肥胖和2型糖尿病相关的表型
如上所述,微生物组可以通过帮助消化饮食中其他无法获得的成分来促进热量摄入,这与最近在人类中的数据一致。该数据显示,抗生素万古霉素治疗后,饮食能量收获显著减少。
反过来,微生物组也会影响宿主的能量消耗,部分是通过改变宿主基因表达和酶活性。
最近,对A.muciniphila的研究已经鉴定出一种细菌蛋白,该蛋白足以改善小鼠的糖耐量并挽救代谢性疾病表型。
额外的研究已经确定了一种单独的粘蛋白原蛋白,该蛋白足以改善小鼠的糖耐量并挽救代谢性疾病表型。这些发现与来自人类的数据一致,这些数据支持灭菌的A. muciniphila的安全性和益处。
►▷
未来重要的是,要了解微生物组对衰老个体宿主能量学的影响是如何变化的,特别是考虑到饮食摄入和药物使用的伴随变化。
微生物组也可能在多种神经系统疾病的病因和治疗中发挥因果作用,这些疾病的风险和/或严重程度随着年龄的增长而增加,包括阿尔茨海默病、多发性硬化症和帕金森病。
扩展阅读:
在这里,我们重点关注帕金森病,因为最近在理解其与肠道微生物组的关系以及与衰老的明确联系方面取得了进展。
95%以上的帕金森病病例发生在50岁以上的人群中;然而,人口老龄化不足以解释帕金森病发病率的上升,这涉及到微生物组等因素。
胃肠道与帕金森症有关
便秘是一种早期症状;淀粉样蛋白α-突触核蛋白在到达中枢神经系统之前在迷走神经(连接大脑和肠道)中发现;迷走神经干切断术(切除胃食管交界处的迷走神经)可降低近50%的帕金森病风险。
然而,尽管胃肠道和帕金森氏症之间有许多联系,但微生物组的作用直到最近才成为焦点。
肠道菌群与大脑沟通影响帕金森病的发病机制
帕金森病小鼠模型中的微生物群发生了改变,其中α-突触核蛋白过表达(ASO模型)。与对照组相比,ASO-无菌小鼠以及帕金森病的替代小鼠模型与受影响小鼠或人类的肠道微生物群的定殖会加剧大脑病理和运动功能障碍。
细菌淀粉样蛋白也可能引发疾病,如大肠杆菌制造的细胞表面淀粉样curli蛋白。
最近研究表明,肠道细菌也会影响宿主淀粉样蛋白的产生,因为细菌硝酸盐的减少会刺激α-突触核蛋白的肠道聚集。
再加上来自帕金森病患者和健康个体的越来越多的宏基因组数据,表明多种不同的微生物组依赖性细胞和分子机制可能共同驱动帕金森病患者的疾病。
肠道菌群也可能导致帕金森病治疗结果的个体间差异
帕金森病的治疗通常从小分子药物左旋多巴(L-多巴)开始,左旋多巴在中枢神经系统中转化为多巴胺,从而缓解神经元多巴胺耗竭引起的帕金森病症状。
左旋多巴通常与卡比多巴(一种脱羟基酶抑制剂)配对使用,可降低药物的外周代谢。然而,卡比多巴不会抑制肠道细菌酶酪氨酸脱羧酶(TyrDC),该酶催化肠道细菌在胃肠道内将左旋多巴代谢为间酪胺的第一步。相反,化合物(S)-α-氟甲基酪氨酸可用于特异性抑制细菌TyrDC,导致小鼠血清L-多巴增加。
值得注意的是,帕金森病患者的TyrDC水平随着时间的推移而增加,并与多种帕金森病药物治疗的胃肠道不良反应有关。
TyrDC可能只是肠道细菌代谢的多种途径之一;产孢梭菌也可以使左旋多巴脱氨化。
►▷
需要更多研究来了解这些和其他途径在模型生物和帕金森病患者中的相对贡献,以及它们对药物疗效和不良反应的下游影响。
这一概念也可以更广泛地应用于其他用于治疗神经疾病的药物;例如,阿尔茨海默病药物加兰他敏和美金刚,在体外生长过程中被人体肠道细菌分离株耗尽。
扩展阅读:
衰老在男性和女性中有着根本的区别,在寿命、虚弱和与年龄相关的疾病方面有着广泛的差异。女性的虚弱贯穿一生,晚年达到残疾高峰。然而,在世界上几乎所有的人口中,女性的寿命都比男性长。即使根据社会经济地位、种族和教育程度进行调整,这些数据仍然有效。
多种分子机制导致衰老过程中的两性异形,包括内分泌和宿主遗传差异。例如,尽管存在相互矛盾的发现,报告存在更温和甚至相反的影响,但一些报告表明,在人类和小鼠中,卵巢切除术会降低健康寿命。
男性性腺和激素会对寿命产生负面影响
一些证据支持男性性腺和激素会对寿命产生负面影响,虽然也是一个争论的话题。例如,对太监的研究表明,阉割可以延长男性的寿命,对啮齿动物的研究表明某些外源性雄激素会缩短寿命。此外,在小鼠身上进行的性腺交换实验支持了卵巢(以及可能的激素)可以显著延长寿命的结论。
大多数与衰老相关的疾病也是性二型的,包括上面强调的3个疾病领域。
癌症:
女人和女孩的癌症发病率和生存率较高,许多非生产性癌症在发病率上具有强烈的性别偏见,尤其是内分泌癌(女性偏见)和卡波西肉瘤(男性偏见)。
代谢性疾病:
与男性相比,女性肥胖的风险增加,但患2型糖尿病的风险相当。
神经退行性疾病:
神经退行性疾病的严重程度和风险与性别有关:例如,男性患帕金森病的风险更高,但女性表现出更严重的疾病。
初步数据表明,性激素是这种关系的重要介质。在人类中,从青春期到更年期的平均年龄,性别与肠道微生物群的差异有关,这与性激素是差异的重要驱动因素的假设一致。反过来,微生物组也可能在控制性激素水平方面发挥重要作用。
相对于CONV-R动物,无菌小鼠的性激素水平发生了变化:无菌雄性的睾酮和β-雌二醇较低,而无菌雌性的孕酮和β-雄二醇较低。
肠道细菌β-葡糖苷酸酶可以重新激活雌激素葡糖苷酸,这与人类的数据一致,这些数据将抗生素与血清性激素浓度降低和性激素偶联物粪便排泄增加联系起来。此外,循环性激素水平与肠道微生物群的多样性和组成有关。
虽然关于性别、微生物组和衰老交叉的文献仍然很少,但一些初步观察结果突出了这一研究方向的价值。
对无菌小鼠的研究表明,雌性的长寿优势需要微生物群。
一项针对1型糖尿病非肥胖糖尿病模型的开创性研究表明,微生物组的性别差异会影响自身免疫性疾病。雄性CONV-R小鼠免受糖尿病的影响,但由于睾酮水平下降,无菌雄性小鼠的这种差异消失了。
值得注意的是,将雄性相关肠道微生物群移植到雌性受体中足以预防疾病。这些影响可能与睾酮有关:最近一项关于小鼠饮食诱导肥胖的研究表明,雌激素诱导的肠道微生物组差异可能会保护其免受代谢疾病的影响。
微生物组与衰老研究中生物性别的考虑


编辑
doi.org/10.1371/journal.pbio.3002087
►▷
今后,至关重要的是要确定性别改变微生物组的机制,以及年龄相关疾病和整体寿命的下游后果。在这样做的过程中,研究人员应该考虑重要因素,以了解生物性别如何影响微生物组对衰老表型的影响。
本文讨论了新出现的证据支持微生物组在衰老和年龄相关疾病中的作用。这些发现对生物医学和其他生物学领域具有广泛的意义。
从事微生物组的研究人员最好在研究中控制或考虑年龄、性别和其他人口统计变量。反过来,衰老和许多年龄相关疾病领域的研究人员应该考虑微生物组在研究中的潜在作用;例如,收集用于微生物组分析的探索性样本;控制与微生物组相关的变量,如饮食起居;或使用无菌模型。
通过合作,这一跨学科研究领域有望迅速发展,并可能解决长期存在的问题,即控制微生物群落结构和功能的因素,以及年龄相关疾病风险和治疗结果个体间差异的驱动因素。
当然,我们需要的并不是在微生物组和衰老领域大肆宣传,而是优先考虑旨在理解基本生物过程的严谨、机制性和实验可处理的工作,这一点至关重要。
虽然说长生不老这个目标可能还有很长的路要走,但也许这条结合微生物组的研究路线,可以帮助我们实现活得更长,生命质量更高。
主要参考文献:
Rock RR, Turnbaugh PJ. Forging the microbiome to help us live long and prosper. PLoS Biol. 2023 Apr 5;21(4):e3002087. doi: 10.1371/journal.pbio.3002087. Epub ahead of print. PMID: 37018375.
Kim M, Benayoun BA. The microbiome: an emerging key player in aging and longevity. Transl Med Aging. 2020;4:103-116. Epub 2020 Jul 21. PMID: 32832742; PMCID: PMC7437988.
Glowacki RWP, Engelhart MJ, Ahern PP. Controlled Complexity: Optimized Systems to Study the Role of the Gut Microbiome in Host Physiology. Front Microbiol. 2021 Sep 27;12:735562. doi: 10.3389/fmicb.2021.735562. PMID: 34646255; PMCID: PMC8503645.
Chen Y, Wang H, Lu W, Wu T, Yuan W, Zhu J, Lee YK, Zhao J, Zhang H, Chen W. Human gut microbiome aging clocks based on taxonomic and functional signatures through multi-view learning. Gut Microbes. 2022 Jan-Dec;14(1):2025016. doi: 10.1080/19490976.2021.2025016. PMID: 35040752; PMCID: PMC8773134.
Baruch EN, Youngster I, Ben-Betzalel G, Ortenberg R, Lahat A, Katz L, Adler K, Dick-Necula D, Raskin S, Bloch N, Rotin D, Anafi L, Avivi C, Melnichenko J, Steinberg-Silman Y, Mamtani R, Harati H, Asher N, Shapira-Frommer R, Brosh-Nissimov T, Eshet Y, Ben-Simon S, Ziv O, Khan MAW, Amit M, Ajami NJ, Barshack I, Schachter J, Wargo JA, Koren O, Markel G, Boursi B. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science. 2021 Feb 5;371(6529):602-609. doi: 10.1126/science.abb5920. Epub 2020 Dec 10. PMID: 33303685.

谷禾健康

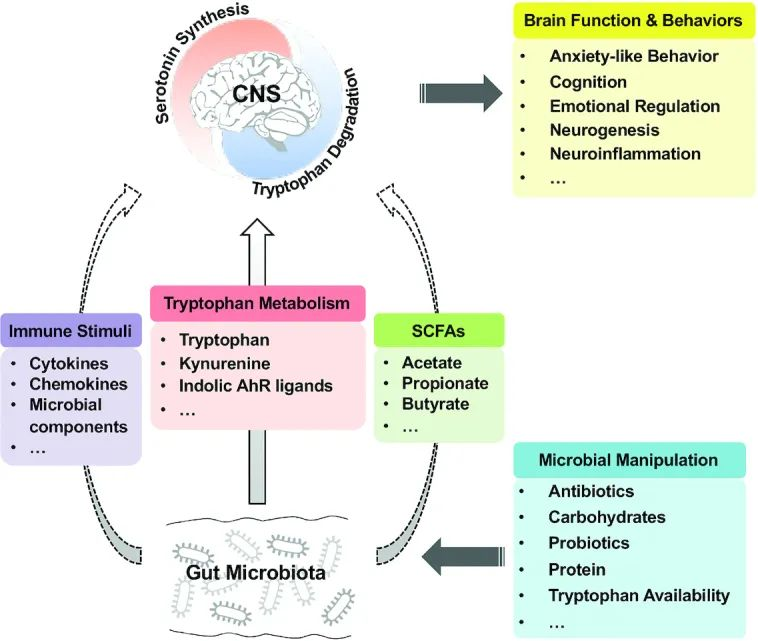
色氨酸(Tryptophan,简称 Try)是人体必需氨基酸,也是唯一含有吲哚结构的氨基酸,由食物尤其膳食蛋白质提供,是正常细胞稳态所必需的,是维持细胞生长和协调机体对环境和饮食线索的反应(其中色氨酸代谢物充当神经递质和信号分子)。
不同组织内的色氨酸代谢与许多生理功能有关:
在哺乳动物中,色氨酸是代谢物的生化前体,显著影响哺乳动物的生理机能,包括胃肠道功能、免疫力、新陈代谢和神经系统。色氨酸及其代谢物水平的失衡与广泛的人类病理学相关,包括抑郁症、精神分裂症、自身免疫、神经退化和癌症。同时它也是自身免疫、癌症、神经退行性或肠道疾病的一个非常有吸引力的治疗靶点。
本文将总结和讨论色氨酸及色氨酸代谢的生理和病理学作用,肠道中色氨酸代谢物的产生和调控、肠道菌群衍生的色氨酸代谢物在全身健康稳态中的作用、以及基于色氨酸代谢药物开发的巨大机遇和挑战。
/
/
▼
色氨酸是一种必需氨基酸,是体内许多重要分子的前体。
如果您读过我们很多文章,可能读到比较多是短链脂肪酸。短链脂肪酸(SCFA),尤其是丁酸盐,通常会在肠道菌群失调和慢性疾病的状态下耗尽。
但短链脂肪酸只是肠道代谢物的一大类之一。其他两类——色氨酸代谢物和胆汁酸,在维持肠道健康方面发挥着同样重要的作用。所以我们也将逐步关注和分享它们。
● 什么是色氨酸?
色氨酸是一种氨基酸——我们体内蛋白质的众多组成部分之一。
色氨酸是一种必需的芳香族氨基酸,由连接到吲哚基团 3 位的 β 碳组成。在 20 种常见的经典氨基酸中,色氨酸的分子量最大。
虽然色氨酸是蛋白质和细胞中含量最少的氨基酸,但它是大量微生物的生物合成前体和宿主代谢物。
大多数游离色氨酸通过犬尿氨酸 (Kyn) 途径 (KP) 或血清素途径降解为具有生物活性的化合物。
色氨酸分解代谢途径
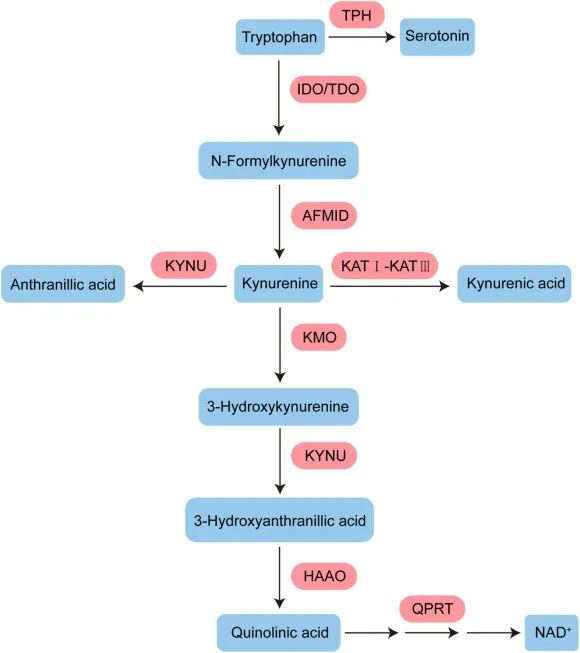
血清素途径产生血清素,可进一步转化为 N-乙酰血清素 (NAS) 和褪黑激素,后者对于昼夜节律调节和抗衰老至关重要。
肠道菌群对色氨酸的吸收很重要,限制和调节宿主细胞的使用。在此过程中生成吲哚衍生物,扩大了色氨酸分解代谢在不同组织器官中中的通讯作用。
色氨酸是体内许多其他化合物的重要前体,包括:
● 色氨酸 / 起源与生产
色氨酸是人体无法产生的必需氨基酸,必须通过饮食获取,主要来自动物或植物性蛋白质来源。
起源:酪蛋白分离
色氨酸是在 1900 年代初期从酪蛋白(一种在牛奶中发现的蛋白质)中分离出来后被发现的。几年后确定了它的分子结构。
释放:进入血液循环
小肠中膳食蛋白质的消化导致色氨酸的释放,色氨酸可以通过肠上皮细胞吸收并进入血液。色氨酸在血液中循环,主要与白蛋白结合,而在血液循环中只有 10-20% 的色氨酸是游离态。被吸收的色氨酸以其游离形式循环或与外周血流中的白蛋白结合。
据报道,健康献血者的总色氨酸平均血清水平为 73 ± 14.9 μmol/l 。
游离色氨酸的一个重要生理功能是对宿主蛋白质合成的贡献。
除了作为蛋白质合成的成分外,色氨酸还是生产多种重要生物活性物质的必需底物。例如,色氨酸是血清素合成(情绪相关)以及褪黑激素(睡眠相关)合成的底物。
全身和细胞色氨酸水平由食物摄入量、生物转化以及降解色氨酸的途径酶活性共同决定。
● 色氨酸的常见天然食物来源
乳制品、燕麦、香蕉、豆类、黑芝麻、李子干、金枪鱼、奶酪、面包、家禽、花生、黑巧克力、鱼肉、三文鱼、杏仁、南瓜和南瓜子等。
世界卫生组织将推荐的色氨酸摄入量设定为 4 毫克/千克/天,迄今为止,没有关于饮食中色氨酸过量的不良影响的报道。
注:含有色氨酸的食物对于制造激素血清素至关重要。但不应高估其影响。
一般来说,动物蛋白中的色氨酸含量往往高于植物蛋白。虽然色氨酸可以补充形式服用,但最好将其作为全食物中完整蛋白质的一部分。
● 为什么需要色氨酸?
色氨酸在体内的浓度是所有氨基酸中最低的,然而,色氨酸摄入量低与抑郁、焦虑、情绪低落、睡眠质量差、视觉认知能力下降以及学习和记忆受损有关。它还可能改变肠道微生物组并削弱肠道免疫力。
另一方面人们普遍认为色氨酸过量会导致困倦。比如在美国的感恩节食用大量火鸡,火鸡中的色氨酸含量很高,进食大餐会刺激胰岛素的产生,而胰岛素会清除血液中除色氨酸以外的所有氨基酸,会导致困倦。
/
/
▼
大量的数据表明色氨酸代谢的调节对环境条件很敏感,并且会影响生理和行为过程。
它因物种、细胞类型、诱导剂而异,并且可以通过组织之间的相互作用进行调节。
● 宿主色氨酸代谢
这里我们对色氨酸代谢先有个整体的认识:
色氨酸分解代谢主要两条通路:
▸犬尿氨酸通路占整体色氨酸降解的约95%
色氨酸 (TRP) 通过犬尿氨酸 (KYN) 通路 (KP) 的分解代谢,该通路占整体色氨酸降解的约 95%,形成主要最终产物 NAD+。
注:犬尿氨酸通路是炎症和免疫反应的重要参与者。
首先,色氨酸被转化为N-甲酰基-L-犬尿氨酸
该反应由三种限速酶之一催化:
注:这三种酶都是血红蛋白,并使用分子 O2作为共底物,这也使它们能够利用活性氧 (ROS) 并调节细胞内的氧化还原平衡。
IDO 和 TDO 酶在不同的组织中表达,暴露于不同的刺激物时被诱导,表明它们在健康和疾病中具有不同的功能。
TDO 在基础条件下催化色氨酸分解,而在免疫调节中具有关键作用的 IDO-1 受到多种刺激物的诱导和调节,例如炎症信号 。
进一步的,N-甲酰基-犬尿氨酸形式酰胺酶将 N-甲酰基-L-犬尿氨酸水解为 L-犬尿氨酸
成为三种具有不同氧化应激和器官毒性特性的替代代谢物:
最终在3-羟基邻氨基苯甲酸3,4-双加氧酶(3-HAAO)的催化下,进一步分解为喹啉酸、烟酰胺腺嘌呤二核苷酸(NAD+).
肝外色氨酸犬尿氨酸通路不提供所有必需的酶;因此,其中间代谢物及其特性在这些病症的发病机制和调节中变得至关重要(下图)。
注:在生理条件下,肝外通路仅占整体色氨酸降解的 5-10%.
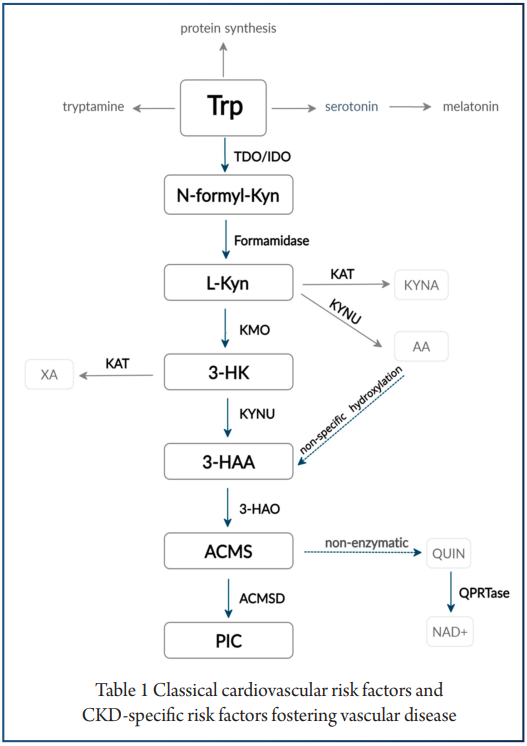
编辑
B 族维生素作为辅因子起着至关重要作用
KP 对B族维生素浓度的变化很敏感。维生素 B6(5′-磷酸吡哆醛,PLP)的活性形式影响犬尿氨酸酶 (KYNU) 和犬尿氨酸氨基转移酶 (KAT)。
维生素B6缺乏后,会影响色氨酸代谢。
▸ 大约不到5%的色氨酸会转化为5-羟色胺
通过色氨酸羟化酶(TPH)催化生成5-羟色胺(5-HT),也就是血清素。
doi.org/10.3389/fendo.2019.00158
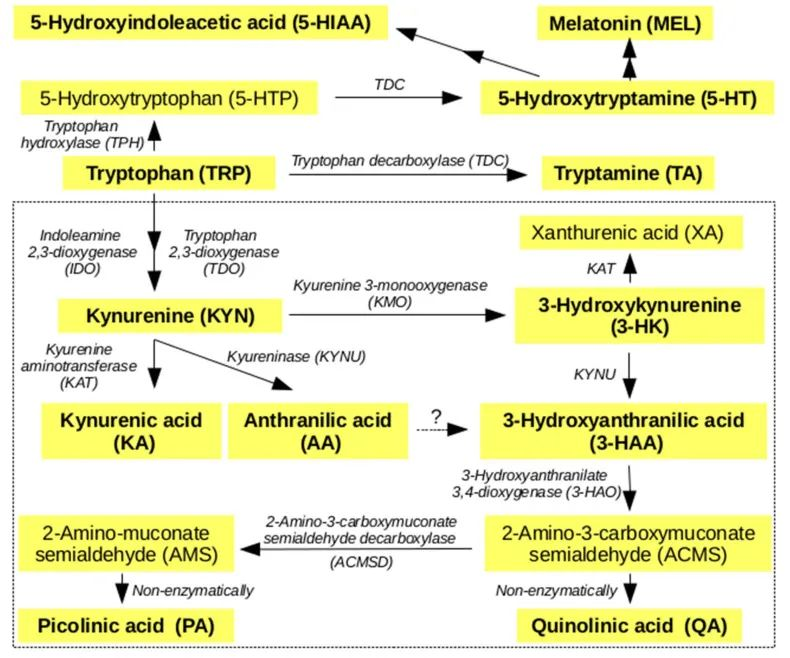
以上是色氨酸代谢的两种主要途径。感染、压力和肠道菌群的变化都可以将色氨酸代谢从 5-HT的产生分流到犬尿氨酸途径,因此如抑郁症之类的病理变化,与人类的营养因素、压力和免疫功能有关。
简化的人类色氨酸的主要代谢途径
doi: 10.3390/metabo10050208.
● 色氨酸微生物代谢
肠道微生物将未吸收的 L-色氨酸 代谢成几个分子,如吲哚衍生物 [indole-3-aldehyde (IAld)、indole-3-acetic acid (IAA)、indole-3-propionic acid (IPA)、indole-3-acetaldehyde (IAAld)、吲哚-3-乳酸 (ILA) 和吲哚丙烯酸],还有色胺和粪臭素。
最近表明,其中一些分子不仅由微生物群合成,而且还通过 L-氨基酸氧化酶 (IL-4I1) 的作用由肿瘤细胞合成,代谢 L -色氨酸 转化为吲哚-3-丙酮酸,随后转化为 IAA、IAld 和 ILA,从而以 AhR 依赖性方式逃避免疫系统、存活和肿瘤运动。
AhR 信号是免疫反应屏障位点的重要组成部分。它通过作用于上皮更新、屏障完整性和许多免疫细胞类型(如上皮内淋巴细胞、T 辅助 (Th)17 细胞、先天性淋巴样细胞、巨噬细胞树突状细胞和中。
肠道环境的细菌色氨酸代谢
由于不同的微生物拥有不同的催化酶,需要两种以上的细菌相互合作才能从色氨酸中产生一种代谢物。与动物内源性色氨酸代谢相对简单的背景不同,人类肠道环境在细菌色氨酸代谢方面相对复杂。
肠道菌群通过各种代谢途径产生多种色氨酸代谢产物,例如:
肠道中微生物群相关的色氨酸代谢
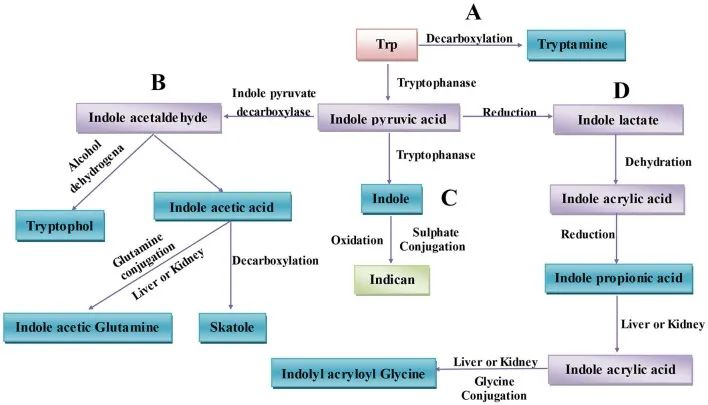
不同菌种可能存在相同代谢能力
比如:消化链球菌属的相同代谢功能可能是基于这些菌种拥有苯乳酸脱水酶基因簇,在下列菌群中也发现与它们产生IPA能力一致的同源基因簇:
不同菌种之间也存在一定代谢能力差异
比如:几种拟杆菌属和梭菌(Clostridium bartlettii)可以产生ILA和吲哚乙酸(IAA),而双歧杆菌属(Bifidobacterium spp.) 产生ILA 。
通过 5-HT、Kyn 和吲哚/AhR 途径的色氨酸代谢途径
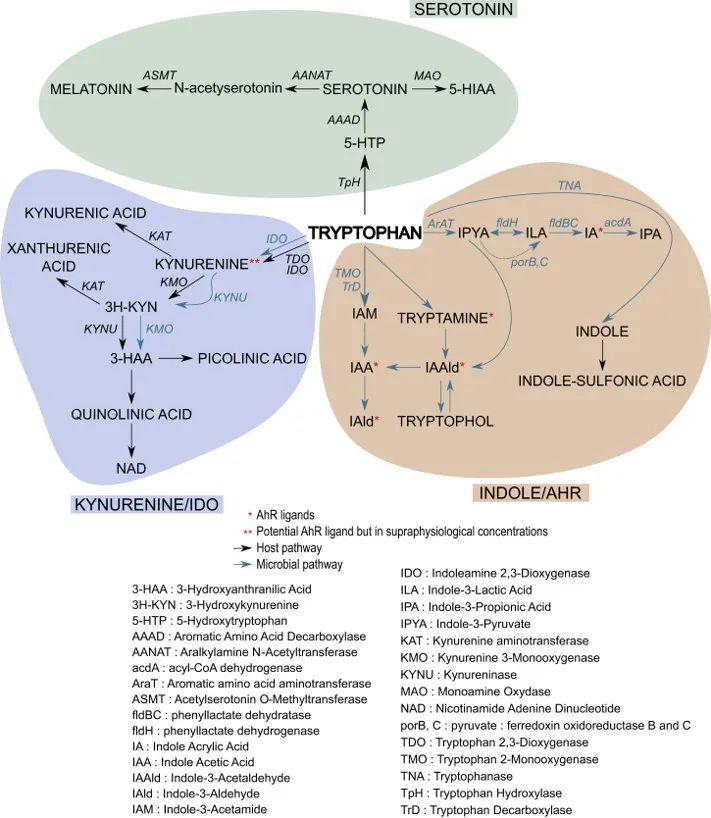
doi.org/10.1016/j.chom.2018.05.003
吲哚也是一种种间信号分子,能够控制细菌生理学的各个方面,例如抗生素抗性、孢子形成和生物膜形成。
在不产生吲哚的细菌中,吲哚及其衍生物显着抑制群体感应并调节毒力因子。然而,这些复杂现象在肠道生态系统中的重要性尚未得到具体解决。
微生物代谢的作用在肠道 AhR 活性中占主导地位。事实上,无菌或失调小鼠的肠道内容物缺乏 AhR 激动剂。只有少数共生物种能够产生 AhR 配体,例如Peptostreptococcus russellii罗氏消化链球菌和乳杆菌属已被表征,许多可能仍有待发现。
● 肠道色氨酸代谢平衡
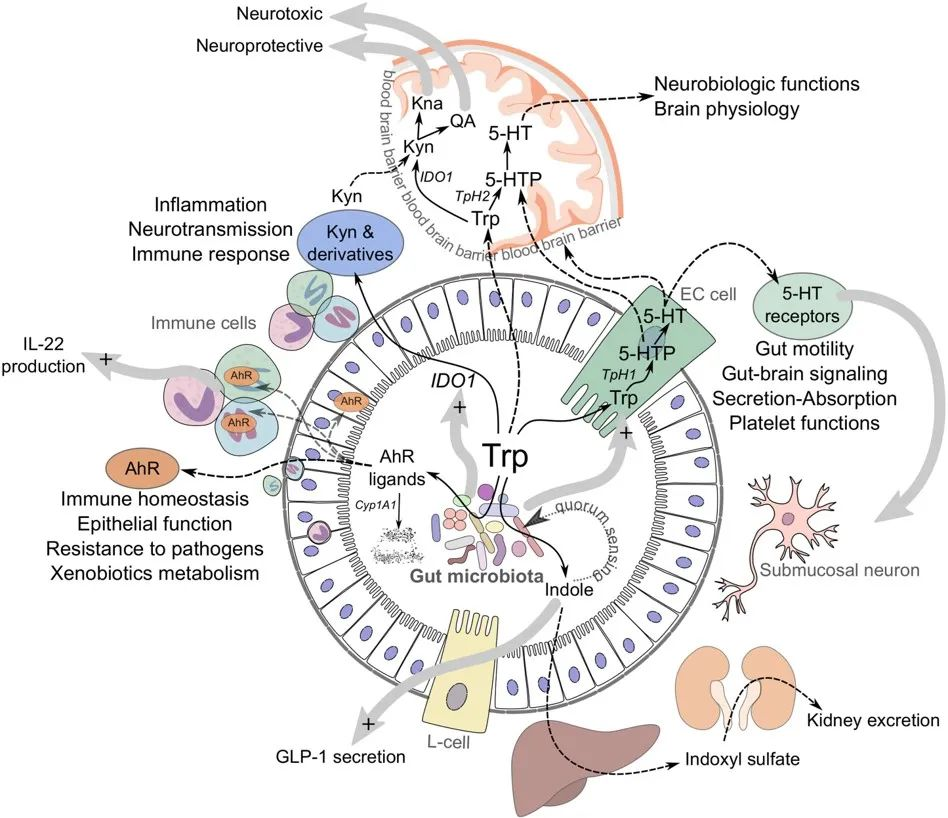
虽然大部分色氨酸被小肠吸收,但其中一些会继续进入大肠,在那里它可以被微生物和宿主细胞作用。从上一小节的阐述,我们可以看到色氨酸在肠道内的三个主要归宿:
1) 吲哚/AhR 通路
肠道细菌直接将色氨酸转化为吲哚和相关分子。就像锁和钥匙一样,其中一些吲哚分子与整个肠道和其他器官细胞表面的芳烃受体 (AhR)结合。这会引发广泛的反应,促进肠道稳态。该途径的活性取决于饮食和微生物群的组成。
2) 犬尿氨酸(KP)通路
一些色氨酸被肠道上皮细胞和免疫细胞吸收,在那里它被 IDO1 酶转化为犬尿氨酸。犬尿氨酸可以进一步代谢为其他分子,例如具有神经毒性作用的喹啉酸。应激、炎症或感染会增加该通路的活性。
3) 血清素途径
色氨酸也被吸收到肠道肠内分泌细胞中,然后通过酶 TpH1转化为神经递质血清素。肠道中的血清素调节肠道运动、分泌和吸收,并在肠-脑信号传导中发挥作用。该通路的活性受禁食、饮食、肠道感染和某些微生物的影响。
当然,关键是平衡。在健康的肠道中,这三种途径是平衡的,从而产生最佳的肠道屏障功能、动力、免疫力和神经功能。
宿主生理学中肠道菌群控制下的综合色氨酸代谢
doi.org/10.1016/j.chom.2018.05.003
▼
在慢性疾病中,上述三种途径的平衡似乎出现了偏差,导致肠道功能受损和系统性影响。
/
/
▼
色氨酸及其代谢物水平的失衡与广泛的人类病理学相关,包括肠道疾病、抑郁症、精神分裂症、自身免疫、神经退化、癌症、心血管疾病、过敏、代谢综合征、肥胖、衰老等。
本章节我们对这些疾病中的色氨酸代谢先做个大致了解,后面章节会对各类疾病一一展开阐述。
由于许多 KP 代谢物具有神经活性,因此通常由炎症损伤引起的 KP 酶功能障碍可引发或促进中枢神经系统 (CNS) 疾病。
对于中枢神经系统疾病,人们越来越关注通过靶向特定 KP 酶来纠正 KP 代谢物变阻器的变化以实现净神经保护作用,以及色氨酸及其代谢物在调节肠道微生物组和大脑之间的相互作用中的作用。
肠道微生物组对膳食色氨酸吸收和代谢的影响也越来越受到关注,并且与中枢神经系统疾病以及肠易激综合征、胰腺炎和糖尿病具有潜在相关性。
降低维生素 B2 浓度会导致依赖于黄素腺嘌呤二核苷酸的犬尿氨酸 3-单加氧酶 (KMO) 的活性降低。B 族维生素,包括核黄素 (RBF) 和吡哆醇 ,在预防中风和中风后恢复中发挥作用。据报道,异常 KP 与神经系统疾病、癌症、心血管疾病和中风有关。
色氨酸分解代谢——涉及的关键器官
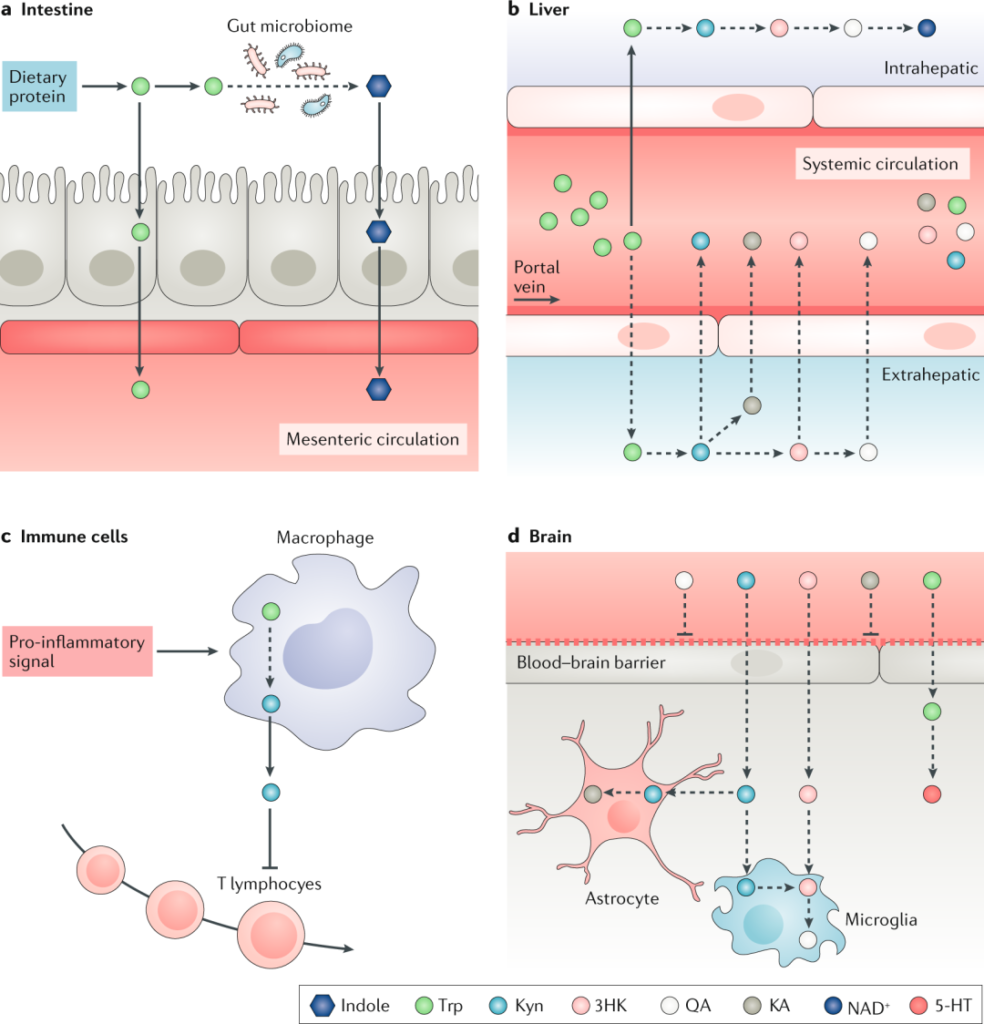
doi.org/10.1038/s41573-019-0016-5
a | 摄入膳食蛋白质后,肠上皮细胞将L-色氨酸转运穿过顶膜进入间质和肠系膜循环。或者,肠道微生物群合成色氨酸并将其代谢为吲哚并将其释放到体循环中。
b | 然后色氨进入肝脏,其中大部分被氧化为乙酰乙酰辅酶 A 并用于合成 NAD+。沿着犬尿氨酸 (Kyn) 途径 (KP) 代谢色氨酸 的肝外器官,包括肾脏、脾脏和免疫细胞,对 Kyn 和 KP 代谢物的循环水平贡献最大。
c | 在促炎性刺激后由骨髓细胞释放的 KP 代谢物抑制 T 细胞反应。
d | 色氨酸、Kyn 和 3-羟基犬尿氨酸 (3HK) 被转运穿过血脑屏障并被星形胶质细胞、小胶质细胞和神经元吸收。星形胶质细胞主要产生具有神经保护作用的犬尿酸 (KA),而小胶质细胞产生具有神经毒性的 KP 代谢物,例如喹啉酸 (QA)。
大约 5% 的色氨酸被代谢为血清素 (5-HT)、5-羟基吲哚乙酸 (5-HIAA)、褪黑激素 (MEL) 和色胺 (TA)。最近研究表明,5-HT除了在神经传递、血管收缩或血管舒张、止血控制和血小板功能中的作用外,还参与调节人体的能量平衡、食欲、肠道蠕动、免疫力、肝脏修复以及心血管和肺部生理学。
疾病中色氨酸代谢的扰动
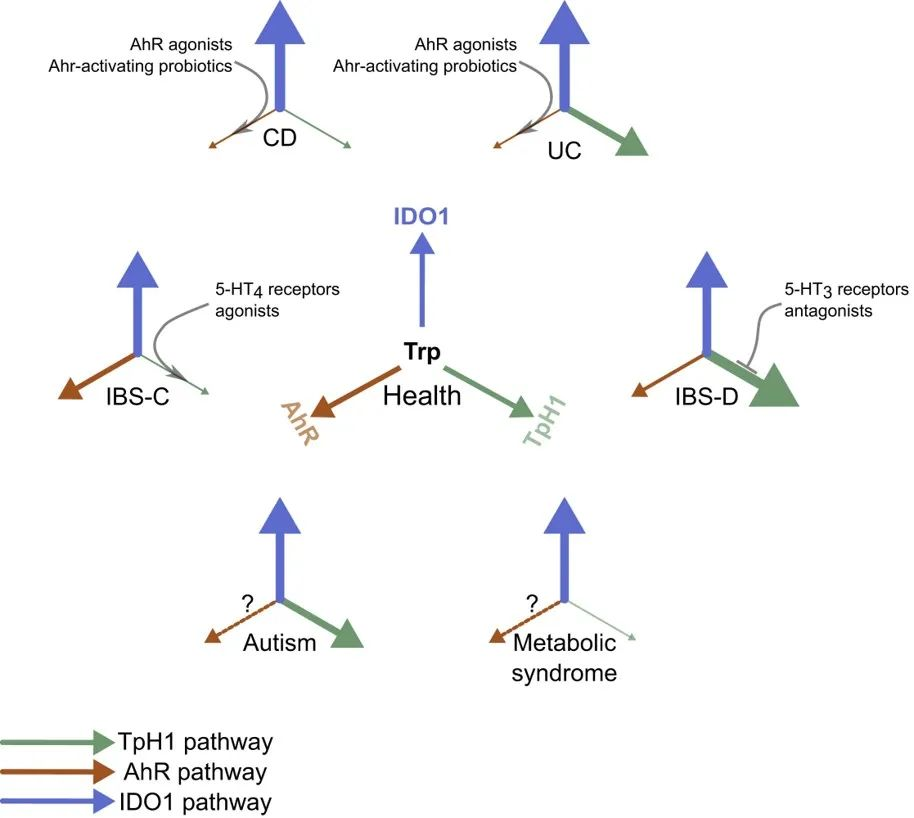
doi.org/10.1016/j.chom.2018.05.003
使用免疫组织化学监测 KP 代谢物的抗体的最新发展使得能够确定组织中 KP 代谢物的积累。
这些工具表明,犬尿氨酸通路在 IDO1 阳性癌症中积累,兴奋性毒性代谢物喹啉酸在脑肿瘤和神经退行性疾病的神经元中积累,而黄嘌呤酸 (XA) 是谷氨酸能突触传递的调节剂,定位于躯体和健康大脑中神经元的树突。
色氨酸代谢物与一系列疾病的联系导致人们在治疗上调节 KP 方面付出了巨大努力,特别是通过抑制所涉及的关键酶,包括 IDO1、TDO 和 KMO。
在癌症中,IDO1 和 TDO 的异常激活导致抗肿瘤免疫抑制。近年来 IDO1 抑制剂在癌症免疫治疗中得到了深入研究。
临床试验中有多种化合物,通常与免疫检查点抑制剂等其他药物联合使用。人们普遍预计领先的 IDO1 抑制剂将接近监管批准,但最近的 III 期试验终止引发了对该方法可行性的质疑,并强调需要更深入地了解 KP。
/
/
▼
● 神经退行性疾病中的色氨酸代谢
色氨酸代谢与多种神经退行性疾病有关,包括亨廷顿病 (HD)、阿尔茨海默病(AD)、肌萎缩侧索硬化 (ALS) 和帕金森病 (PD)。
尽管病理生理触发因素各不相同,但所有这些疾病的共同点是容易聚集的蛋白质引起神经元退化,从而导致细胞应激和有害的先天免疫反应。
基于人群的研究表明,就这些病理学特征而言,衰老和神经退行性疾病之间存在相当大的重叠,个体间差异很大。
虽然遗传和环境对色氨酸代谢的影响尚不完全清楚,但据信色氨酸代谢会导致衰老和神经退行性变,并且所涉及的机制即使不完全相同。这一观察得到了小鼠研究的支持,其中 TDO 的缺失已被证明会导致海马体和脑室下区的神经发生增强,可能抵消神经变性。
尽管生物标志物研究表明色氨酸代谢在神经退行性疾病患者中的活性不同,目前尚不清楚这是原发性倾向的结果还是神经变性或附带的先天免疫激活的结果。流行病学研究表明,KP 的激活与痴呆症风险增加有关。
然而,很难与生理老化明确区分。KP 对感染性和炎症性损伤的敏感性明显损害了其作为神经变性标志物的稳健性。另一方面,炎症对 KP 的激活可能在多发性硬化症等疾病中的神经炎症和神经变性之间建立联系。
由色氨酸代谢介导的神经变性的潜在机制包括:
➤ 阿尔茨海默氏病
色氨酸代谢物、肠道微生物和相关的神经炎症变化对阿尔茨海默病的病理生理学有显着影响。
阿尔茨海默患者的肠道微生物分类有显着差异,厚壁菌门和放线菌门减少,拟杆菌门增加。CSF 生物标志物升高与某些属的丰度相关,尤其是拟杆菌属和Blautia。
一项研究中,发现阿尔茨海默患者的循环色氨酸显著减少,犬尿氨酸/色氨酸比率升高,这反过来又与认知能力较差和促炎细胞因子升高相关。
几项临床前研究表明,在阿尔茨海默动物模型中具有保护作用。色氨酸代谢产物以芳基烃受体依赖的方式调节小胶质细胞和星形胶质细胞的活化。
此外,延缓阿尔茨海默进展的药物治疗的研究表明,肠道微生物和色氨酸代谢产物在阿尔茨海默的发展中可能发挥作用。
研究人员提供了犬尿氨酸代谢物在阿尔茨海默中的潜在毒性作用的间接证据,因为持续向小鼠腔内灌注犬尿氨酸会导致小鼠后代的学习和记忆缺陷。
吲哚途径代谢产物也可能介导阿尔茨海默病的发病。吲哚途径代谢物IPA在体外可抑制淀粉样蛋白-β诱导的神经毒性,并已被开发为治疗阿尔茨海默的神经保护剂。
➤ 帕金森病
帕金森病是一种进行性神经退行性疾病,其中α-突触核蛋白的聚集导致黑质神经毒性,导致多巴胺能神经传递不足。
大量数据表明肠道微生物组通过诱导炎性神经毒性参与帕金森发病机制。这些患者肠道拟杆菌属的丰度与运动症状严重程度和促炎性TNFα和IFNγ水平相关。尤其是疣微菌门(Verrucomicrobia)与循环中较高水平的IFNγ相关,说明了与IDO和色氨酸代谢产物的可能相互作用。
最近的研究还表明,帕金森病患者的色氨酸代谢紊乱,是潜在的治疗目标。帕金森患者血浆中3-HK显著升高,3-HANA降低。在这些患者中,犬尿酸显著降低,喹啉酸水平与疾病严重程度相关,表明色氨酸代谢产物在加重兴奋性毒性损伤中的潜在致病作用,尽管因果作用仍有待确定。
帕金森患者脑脊液和血浆中的犬尿氨酸/色氨酸比率升高,犬尿氨酸转氨酶活性降低。因此,犬尿酸合成类似物已成为治疗帕金森、亨廷顿病和阿尔茨海默病的神经保护药物。
➤ 其他神经退行性疾病
已知 NMDA 受体过度激活和随之而来的神经元兴奋性毒性在几种神经退行性疾病的发病机制中发挥作用。
——肌萎缩侧索硬化症
犬尿酸可能作为一种内源性神经保护剂发挥其拮抗 NMDA 受体过度激活的作用。临床数据表明了潜在的作用。晚期和延髓起病的肌萎缩侧索硬化症患者的 CSF 中 KA 水平显着升高。
——亨廷顿病
在亨廷顿病患者中,产生自由基的 3-HK 在早发性疾病中高度升高,同时纹状体和皮质喹啉酸也升高。然而,对于更晚期的疾病,这些浓度会降低。
虽然亨廷顿病患者的 CSF 中犬尿酸水平升高,对亨廷顿病大脑的尸检分析显示,与对照组相比,犬尿酸浓度降低,血清犬尿氨酸/色氨酸 比率升高。有趣的是,谷氨酰胺重复次数和疾病严重程度与循环色氨酸水平呈负相关。
亨廷顿病大鼠模型表明 3-HK 增强了神经兴奋性毒性,而自由基清除剂抑制了这种作用。
犬尿酸的合成类似物在原位产生神经保护和抗癫痫作用。鉴于IPA的抗氧化作用,研究人员还提出使用这种吲哚衍生物对亨廷顿病患者进行神经保护。
➤ 多发性硬化症
多发性硬化症是一种慢性、进行性和复发性中枢神经系统炎性脱髓鞘疾病。许多证据表明,这主要是由B和T细胞驱动的过程。最近,许多靶向B细胞和T细胞活化的药物被证明在预防复发方面具有临床疗效。
多发性硬化患者肠道菌群变化
多发性硬化患者粪便样本的微生物组分析显示,与对照组相比,多发性硬化患者中的Methanobrevibacter和Akkermansia增加,Butyricimonas 减少。
肠道微生物代谢产物参与多发性硬化发病
色氨酸代谢产物和I型IFN信号已显示在多发性硬化的实验性变态反应性脑脊髓炎(EAE)模型中激活星形胶质细胞AHR,从而抑制中枢神经系统炎症。
评估这种疾病中的犬尿氨酸途径的研究取得了有趣的结果。复发患者犬尿酸水平升高,而尸检样本显示犬尿氨酸转氨酶活性降低。
此外,喹啉酸可能诱导少突胶质细胞凋亡,导致脱髓鞘损伤。在其他EAE模型中,数据显示了有毒的犬尿氨酸代谢产物的集中聚集。
在这些模型中,肠道微生物也会影响中枢免疫,因为继发于微生物变化的免疫过度激活会加剧炎症损伤。
● 神经精神疾病中的色氨酸代谢
KP 的不平衡导致具有特定神经活性特性的代谢物过多,被认为是导致多种神经精神疾病的原因。
➤ 焦虑和抑郁
色氨酸代谢产物,尤其是血清素,与焦虑和抑郁的发病机制密切相关。
促进中枢5-羟色胺可用性的药物,特别是选择性5-羟色胺再摄取抑制剂(SSRIs)、MAO抑制剂(MAOIs)和三环类抗抑郁药(TCAs)已经彻底改变了这些疾病的治疗。
重度抑郁症、自杀倾向与喹啉酸水平升高相关
例如,重度抑郁症与 KP 的 3-羟基犬尿氨酸 (3HK) 分支下的新陈代谢增加有因果关系,导致大脑神经毒性喹啉酸水平高于神经保护性 KA。
同样,与 KA 和吡啶甲酸相比,喹啉酸水平升高也与自杀倾向相关。社会心理压力、感染或细胞因子治疗引起的免疫激活会导致抑郁症状。
系统性 IDO1 激活与抑郁症中 3HK 分支的激活有关
小鼠中的 IDO1 抑制或敲除可减轻抑郁样行为,细胞因子诱导的抑郁症易感性与 IDO1 基因的多态性有关。因此,系统性 IDO1 激活被认为与抑郁症中 3HK 分支的激活有关,但目前尚不清楚为什么 KA 和喹啉酸在对 IDO1 诱导的反应中没有同样上调。
随着对不同疾病过程中肠道微生物组组成的理解的增加,很明显,肠道微生物可能在这些疾病的起源和临床表型中发挥关键作用。
无菌小鼠表现出比常规饲养小鼠更焦虑的行为,这种行为在宿主断奶后不易随着微生物的重新繁殖而逆转,这表明肠道微生物组可能支持心理发育的关键时期。
一些益生菌在动物模型和人类中显示出减少焦虑和抑郁的功效。
补充色氨酸减少焦虑?仍然存在争议
瑞士乳杆菌R0052和长双歧杆菌R0175等物种的益生菌分别降低了小鼠和人类的焦虑、增强了情绪幸福感和抑郁症状。
患有抑郁症患者粪便微生物移植的小鼠表现出更严重的焦虑,这与更高的循环犬尿氨酸和犬尿氨酸/色氨酸比率有关。
有趣的是,已知慢性应激会增加循环色氨酸和皮质醇,由于糖皮质激素诱导的TDO表达增强,导致5-羟色胺代谢向犬尿氨酸及其代谢产物分流。
小鼠应激诱导的结果表明,外源性丁酸盐调节应激诱导的抑郁行为,降低海马血清素,增加海马脑源性神经营养因子(BDNF)。
肠道微生物群被抗生素耗尽的小鼠表现出类似焦虑的行为,循环的犬尿氨酸升高。在喂食高脂肪饮食的肥胖大鼠中,花青素可以防止神经炎症,并且循环色氨酸降低,犬尿酸增加。
➤ 精神分裂症
色氨酸向血清素的转换可能在精神分裂症的发病机制中受损,因为某些TPH1多态性增加了对精神分裂症和自杀的易感性。
精神分裂症患者 KA 的水平升高,与认知缺陷相关
精神分裂症和精神病似乎是由 NMDA 受体拮抗剂 KA 的形成增加引起的。在精神分裂症患者的死后大脑和脑脊髓液中测量到 KA 水平升高。KA 水平升高与在精神分裂症中观察到的认知缺陷相关、而KA 形成减少与认知功能改善相关。
同样,特别是在发育中的大脑中的神经炎症与精神分裂症的认知缺陷特征有关。KMO中的单核苷酸多态性基因与精神分裂症和双相情感障碍相关,这表明 KP 3HK分支下的流量减少可能使 Kyn 转向 KA 形成,KA 的积累与这些疾病有关。
脑脊液中低5-HIAA水平与自杀和攻击行为相关
由于精神分裂症患者皮质犬尿酸水平升高,犬尿氨酸代谢产物也可能起到致病作用。动物模型研究表明,色氨酸抑制攻击性行为,可能与增加中枢血清素的可用性有关。
小胶质细胞突触修剪过度激活
Sekar及其同事发表了一项具有里程碑意义的全基因组关联研究,该研究确定了与精神分裂症发病机制有关的基因位点,这涉及补体C4介导的小胶质细胞突触修剪过度激活。
肠道失调与免疫失调联系起来
鉴于肠道微生物组在介导中枢免疫中的既定作用,以及病例对照研究在精神分裂症患者中的优势,研究人员试图将肠道失调与免疫失调联系起来,导致大脑发育关键时期突触修剪过度活跃。
流行病学研究也支持这样的假设,即全身感染诱导的母体免疫激活是后代患精神分裂症的独立危险因素。
最近的一项研究表明,产前免疫暴露导致额叶皮质C4活性上调。母体微生物组向后代的垂直转移也可能导致持续的免疫功能障碍,增加突触过度修剪的风险。
需要进一步的机制研究来了解肠道微生物、色氨酸代谢产物和宿主免疫在精神分裂症和其他神经发育障碍发病机制中的相互作用。
➤ 自闭症
根据循环色氨酸的临床研究和排泄的犬尿氨酸代谢产物的检查,自闭症谱系障碍患者可能缺乏色氨酸。
自闭症患者来源的淋巴母细胞的代谢组学分析显示,当色氨酸是唯一可用的能量来源时,NADH生成减少,表明这些患者的喹啉酸降解途径可能受损。
某些微生物物种可能参与了自闭症的发病机制
几项评估自闭症患者肠道微生物丰度差异的研究将自闭症症状与Prevotella、Coprococcus、Veillonellaceae丰度较低联系起来。
脆弱拟杆菌(一种胰蛋白酶合成细菌),可能会降低自闭症患者的色氨酸可用性。非色氨酸衍生的微生物代谢产物也可能起到因果作用,一项观察自闭症小鼠母体免疫激活(MIA)模型中肠道微生物代谢产物的研究显示,微生物代谢产物4-乙基苯基硫酸盐增加了46倍,如果小鼠被脆弱拟杆菌定殖,则其正常化。
色氨酸代谢在肠道菌群-脑轴中的潜在作用
doi: 10.1093/advances/nmz127
通过各种方式(例如,抗生素和益生菌)对肠道微生物群组成和代谢的调控有助于在 5-羟色胺合成和色氨酸降解途径之间改变中枢色氨酸代谢,从而影响大脑功能和行为。
● 中枢神经系统疾病中靶向 KP 酶
尽管临床试验的重点(部分仍然是)补充或剥夺色氨酸或其代谢物以治疗神经精神疾病,但目前神经退行性和神经精神疾病药物开发的临床前工作主要集中在通过改变神经活性 KP 代谢物的变阻器抑制参与 喹啉酸或 KA 形成的酶。
从概念上讲,所有 KP 酶都代表潜在的治疗靶点,并且有几项研究调查了药理学抑制的影响。
例如,IDO1 抑制剂黄连碱已被证明可以减缓阿尔茨海默小鼠模型的认知障碍,尽管其对 IDO1 的特异性尚不清楚。
有趣的是,环氧合酶抑制通过抑制海马 TDO 表达,来防止类似阿尔茨海默模型中的行为下降。当使用 TDO 的药理学抑制剂时,观察到类似的神经保护作用。这些研究连同阿尔茨海默病和亨廷顿病患者中 KP 激活的证据, 表明抑制色氨酸降解中限速的第一个酶促步骤是一种潜在可行的治疗方法,可以抵消由淀粉样蛋白形成蛋白的积累引起的神经毒性。
尽管 IDO1 和 TDO 的抑制剂阻止了 KP 代谢物的产生,但这不会直接影响 KA/喹啉酸 喹啉酸变阻器,但会阻止两者的产生。这种治疗方法是可行的,因为它可以防止色氨酸的消耗,这可以减少在临床前模型中观察到的蛋白质毒性。
KAT 在辅助因子 pyridoxal-5-phosphate (PLP) 的帮助下催化 Kyn 转化为 KA。KATII 是哺乳动物大脑中最普遍的 KAT,并且正在寻求作为精神分裂症和认知障碍疾病的药物靶点。由于最近显示 KATII 也能催化 3HK 105形成 XA ,因此之前归因于 KA 的基于抑制 KATII 的效应也可能涉及 XA。
▸ KATII 抑制剂
KATII 的可逆抑制剂已经开发出来,包括 Kyn 类似物 (S)-4-(ethylsulfonyl)benzoylalalanine ( S -ESBA) ,它被证明可以降低大鼠大脑中的 KA 水平。
高效和选择性脑渗透不可逆抑制剂 PF-04859989 也报道了相同的抑制模式。然而,这些化合物都没有进入临床研究,这可能是由于它们与 KAT 同工酶和所有其他 PLP 依赖性酶所需的 PLP 辅因子发生不可逆相互作用而引起的毒性。
将 KATII 抑制剂推进临床试验的主要挑战包括由脑 KA 水平降低引起的潜在毒性、获得足够的效力和选择性以及 KATII 抑制剂效力的种间差异的发生。
▸ KMO 抑制剂
为了抑制 KP 的 喹啉酸分支和增加拮抗 KA 水平,KMO 抑制剂正在积极开发中。有关 KMO 晶体结构的信息有助于生成特异性更高的 KMO 抑制剂。众所周知的 KMO 抑制剂 Ro 61-8048已用于大量临床前研究,证明其作用范围从改善神经变性到减少大麻素滥用。
另一种广泛使用的工具化合物,UPF-648, 是一种不含氨基的 Kyn 类似物,在构象上受到环丙基环的限制。这种化合物,以及高效的恶唑烷酮 GSK180(在胰腺炎的背景下研究),是所谓的 I 型 KMO 抑制剂,它模仿 Kyn 并刺激有害的过氧化氢产生。
在一项基于结构的药物化学合作研究中,开发并评估了一种新的芳基嘧啶先导化合物 CHDI-340246,用于治疗 HD。然而,这种选择性 KMO 抑制剂的长期治疗并未显着改变 HD 小鼠模型的行为表型或自然进展,尽管它恢复了电生理学改变。
结构研究最近破译了 I 型和 II 型KMO抑制剂112、121之间的区别。II 型 KMO 抑制剂 GSK065 和 GSK366 显示出比 I 型 KMO 抑制剂更好的类药特性,因为它们具有皮摩尔亲和力、增加的停留时间和不产生过氧化物。
GSK065以GSK3335065(NCT03245619)的名称进入治疗胰腺炎的I期临床试验。有趣的是,KMO 抑制剂的外周给药足以影响 CNS KP 。然而,KMO 抑制剂是否需要穿透血脑屏障才能发挥作用,这仍然是一个有争议的问题。
最后,抑制初始限速 KP 酶 IDO1 和 TDO,它们分别在炎症条件或慢性社会心理压力下诱导,在神经退行性疾病和精神疾病中也可能值得探索。由于这些酶的抑制剂目前正在开发用于癌症治疗,因此可以使用多种化合物在临床环境中测试这些方法。
/
/
▼
● 感染中的色氨酸代谢
几条证据最近揭示了色氨酸代谢作为宿主-病原体相互作用和塑造宿主微生物群中免疫反应的重要调节因子的关键作用。
通过特定的色氨酸代谢酶,色氨酸代谢在细菌、病毒、真菌和寄生虫感染部位增加。通常以低基础水平表达,在抗原呈递细胞 (APC)中观察到 IDO1 增加,例如树突细胞 (DC) 和巨噬细胞,以响应多种微生物刺激,包括 Toll 样受体 (TLR) 配体(例如,脂多糖 (LPS) , CpG 寡核苷酸和聚肌胞苷酸 。
炎症刺激物诱导IDO1,IDO1 会耗尽色氨酸
此外,据报道,I 型和 II 型干扰素 、肿瘤坏死因子 (TNF)、前列腺素 和膜结合分子 等炎症刺激物可在特定APC类型中诱导IDO1。
在传染病中,IDO1 活性具有多效性,是一把双刃剑。实际上,IDO1 会耗尽色氨酸以饿死和重新编程营养缺陷型入侵者,同时有助于对在急性感染期间未清除的微生物产生 Kyn 依赖性免疫抑制状态或那些已经能够重新激活色氨酸生物合成的。
因此,已经表明色氨酸营养缺陷型病原体对 CD4 + T 细胞激活的巨噬细胞高度敏感。 在特定的环境条件下,色氨酸的微生物营养缺陷型可能会消失。
特定条件微生物重新获得合成必须氨基酸的能力
某些微生物可以在特定的胁迫条件下重新获得合成这种必需氨基酸的能力。此外,天然能够合成色氨酸的微生物群菌株可以在特定感染期间扩大,从而在色氨酸缺乏的条件下提供额外的这种必需氨基酸供应。
最近的研究结果表明,结核分枝杆菌等特定病原体可以在压力条件下重新获得合成色氨酸的能力,从而抵消 IDO1 饥饿驱动的抗菌作用。
此外,衣原体在由局部色氨酸剥夺引起的应激条件下进入非复制的持久状态。同样,IDO1 依赖性持久性已被记录在其他细菌物种中,包括肺炎积瘤。
除了调节病原体负荷外,通过 IDO1 活性进行的色氨酸代谢对于抑制最终阻止病原体根除的免疫病理也至关重要。
在这方面,最近对肠道微生物群的研究发现:
色氨酸代谢与通过充当特定 AHR 配体的微生物或细菌毒力因子在粘膜屏障表达的 AHR 激活之间存在重要联系。
值得注意的是,AHR +由于产生色氨酸代谢物(即吲哚 3 醛)的乳酸杆菌的选择性扩增,即使在 IDO1 缺乏的情况下,也会诱导产生IL-22 的第 3 组先天淋巴样细胞 (ILC3s)能够激活 AHR,从而在真菌感染模型中诱导保护性耐受状态。
TDO 在感染过程中的潜在作用
用 LPS 攻击的小鼠肝脏中 TDO 表达增加,而 TDO 缺陷小鼠更容易受到内毒素攻击。因此,在对弓形虫和金黄色葡萄球菌感染进行的体外研究中,已经报道了 TDO 依赖性抗菌和免疫调节作用。此外,代谢组分析揭示了原发性登革热感染患者 TDO 激活的变化。
因此,在宿主细胞中的三种不同色氨酸分解代谢酶中,IDO1 的影响已在几种临床前感染模型中得到解决。具体而言,据报道,IDO1 在体内抑制某些细胞内寄生虫和细菌的复制,例如弓形虫、衣原体和杜氏利什曼原虫。另一方面,弱 IDO1 抑制剂 1-甲基- L – Trp (L-1-MT) 增强了沙眼衣原体抗生素清除的功效,尽管可能涉及额外的 IDO1 独立机制。
IDO1活性还可以在体外抑制特定病毒的复制
例如人巨细胞病毒 (CMV)、2 型单纯疱疹病毒和痘苗病毒。然而,体内情况可能有所不同,因为病毒感染可能会诱导 IDO1 和 KP 逃避宿主免疫反应。
由于它们具有诱导 Treg细胞的能力 ,因此 IDO1 消耗色氨酸并产生 Kyn 是抑制抗菌 TH17 和 TH1 驱动的炎症的重要手段。
因此,病原体可能会劫持 IDO1 的免疫抑制作用,并利用它们来促进自身的生命周期。在这方面,尿道致病性大肠杆菌(UPEC) 在泌尿道的上皮细胞中诱导 IDO1 ,并且色氨酸分解代谢的免疫反应减弱使得 UPEC 能够成功定植。
HIV-1 等病毒利用 IDO1 的免疫抑制活性建立 HIV 慢性感染
KP 活性的增加也与丙型肝炎病毒感染患者的进行性肝硬化有关。
同样,小鼠感染甲型流感/PR/8/34 (PR8) 会刺激肺部和肺引流纵隔淋巴结中 IDO1 活性的快速升高,导致发病率增加、恢复减慢和肺部效应 T 细胞反应降低,尽管在原发性甲型流感病毒感染期间,IDO1 诱导不会影响病毒清除。在其他情况下,例如在真菌感染中,IDO1 可用作建立共生或慢性感染的逃避机制。
● 在传染病中靶向 KP 酶
在选定的微生物物种中调节特定的色氨酸生物合成途径并靶向宿主细胞中的 IDO1-AHR-微生物群轴可能代表了抗生素开发或补充抗病毒疗法的新颖有吸引力的策略。有必要更全面地了解特定感染期间色氨酸分解代谢酶或下游酶的作用,以便了解旨在调节色氨酸分解代谢以根除病原体同时保持与微生物群平衡的疗法的效用。
基于以上总结的证据,可以假设特定的 IDO1 阻断剂可能会发现潜在的应用作为辅助疗法来提高抗病毒药物的疗效,但可能证明对真菌感染有害,其中色氨酸分解代谢主要通过 IDO1 作用于维持免疫稳态和保护性耐受。
然而,这种作用可能构成使用 IDO1 抑制剂作为抗肿瘤药物的潜在缺点(下面讲)。实际上,在使用 IDO1 通路调节剂 1-甲基-D -Trp (D-1-MT)对转移性实体瘤患者进行的 I 期试验中,感染是最常见的不良事件。
有趣的是,最近的一项研究表明,KYNU 的靶向抑制会影响铜绿假单胞菌基因表达和群体感应,这表明一种新的潜在抗毒策略。具体而言,与 Kyn 具有结构相似性的S-苯基-L-半胱氨酸亚砜可抑制对铜绿假单胞菌毒力至关重要的邻氨基苯甲酸盐的产生。
/
/
▼
● 自身免疫中的色氨酸代谢
自身免疫是未能发展出对自身的中枢(胸腺)耐受性和外周耐受性维持不足的结果。免疫区室中的色氨酸代谢主要由 IDO1 启动,它代表主要促炎刺激的靶基因。
在这方面,IDO1 介导的色氨酸降解可被视为调节过度活跃的免疫反应的关键反馈机制,这是自身免疫性疾病的标志。
IDO1 在发炎组织中转录激活抑制适应性免疫反应的作用已经从最初在胎盘中观察到的维持胎儿耐受性扩展到多种自身免疫性疾病。
尽管 IDO1 缺陷不会导致与 Treg细胞重要检查点缺陷相关的整体自身免疫表型,但它与更微妙的炎症表型相关。这种关联可能部分是由于与其他双加氧酶共享的酶功能冗余。越来越多的证据表明,人类自身免疫性疾病是由免疫和/或基质细胞未能上调 IDO1 以响应炎症刺激驱动的。
然而,与自身免疫相关的上调 IDO 的结构性缺陷的潜在原因尚未阐明。连锁分析将IDO1和IDO2基因的多态性分别与克罗恩病的严重程度和风险相关联。需要进一步的研究来确定上调组织中色氨酸代谢的本构或诱导缺陷是否会导致组织特异性自身免疫。
许多针对多发性硬化症、类风湿性关节炎、狼疮和自身免疫性糖尿病的自身免疫性疾病小鼠模型的研究已经证明色氨酸代谢在调节疾病活动中的相关性。
综上所述,这些研究表明 IDO1 在组织驻留的骨髓细胞中表达,并限制对自身抗原和炎症病理学的先天性和适应性免疫。
然而,自相矛盾的是,在自发性类风湿性关节炎的动物模型中,使用 D/L-1-MT 对 IDO1 的药理学抑制减轻了疾病的严重程度,这可能是自身反应性 B 细胞活化减少的结果。
这一发现说明了 IDO1 在自身免疫中的复杂免疫调节功能,这取决于细胞区室。例如,B 细胞中免疫抑制细胞因子 IL-10 的表达依赖于 IDO1,这表明 IDO1 不仅会触发免疫抑制机制,还会协调对炎症的复杂免疫调节反应。
重要的是,转录激活和蛋白质表达不一定转化为人类 B 细胞中描述的酶活性。 在这方面,需要更多的研究来阐明 IDO1 的非酶功能。
此外,需要谨慎看待使用 D-1-MT 得出关于 IDO1 功能的关键结论的研究,因为 D-1-MT 不会抑制 IDO1 并显示出相当大的脱靶效应,从而导致 p38 MAPK 通路的激活。
对自身免疫性疾病模型的研究表明,与 IDO1 相比,IDO2 充当自身免疫的促进者,特别是由于体液免疫反应的调节。由于致病性自身抗体和抗体分泌细胞的减少,IDO2 缺陷小鼠表现出关节炎症减少。尽管与人类疾病的相关性仍不清楚, 这些研究突出了双加氧酶对色氨酸代谢的复杂和高度分隔的调节。
尽管 IDO1 介导的免疫调节的主要作用被认为是由组织炎症的局部微环境中的活动驱动的,但在患有自身免疫性疾病的患者中观察到色氨酸代谢的全身激活。在干燥综合征患者中,血清中色氨酸的降解增加,并与循环 Treg细胞频率增加有关。
相比之下,在多发性硬化症中,血清中的 IDO1 活性与健康对照相比没有显着差异,但抗炎治疗降低了 IDO1 活性。由于全身性 IDO1 活性会受到大量非特异性和难以控制的刺激的影响,包括感染、压力和营养,尝试通过循环色氨酸代谢物监测组织特异性自身免疫将具有挑战性。然而,对血清中 KP 代谢组的更详细分析不仅揭示了 KP 在多发性硬化症患者中的激活,而且还将 KP 活性的程度与疾病严重程度相关联。因此,KP 活性可以作为能够指导多发性硬化症治疗的预测性生物标志物。
● 靶向自身免疫性疾病中的色氨酸代谢
在治疗上针对色氨酸代谢的努力主要集中在开发具有 Kyn 样特性的药物上。
曲尼司特
曲尼司特是一种具有 AHR 激动特性的 AA 衍生物,能够在多发性硬化症和类风湿性关节炎的临床前模型中诱导免疫耐受和改善疾病活动。然而,一项针对类风湿性关节炎患者的 II 期临床试验(NCT00882024)因肝毒性而终止。
拉喹莫德
拉喹莫德是一种喹啉甲酰胺,在开发治疗多发性硬化症时显示出与 KA 的结构相似性,它以 AHR 依赖性方式抑制多发性硬化症临床前模型中的自身反应性 T 细胞免疫和疾病活动。
在针对复发和进行性多发性硬化症患者的一系列 II/III 期临床试验中,拉喹莫德未达到预先指定的主要终点,包括减少复发率和残疾进展,因此被终止 (NCT01707992)。
AHR 配体改善自身免疫神经炎症
AHR 的特定内源性配体足够稳定,可以在临床前疾病模型中进行肠胃外给药。2-(1’H-indole-3′-carbonyl)-thiazole-4-carboxylic acid methyl ester (ITE) 通过以 AHR 依赖性方式诱导致耐受性 DC,在实验性自身免疫性脑脊髓炎 (EAE) 模型中诱导 Treg细胞并改善自身免疫性神经炎症。
AHR 激活配体也可以与自身抗原偶联,从而导致 APC 的特异性靶向,然后耐受性抑制自身反应性 T 细胞反应,从而抑制系统性自身免疫。
从概念上讲,色氨酸代谢也可以通过全身给药色氨酸来增强,色氨酸在口服灌胃后会迅速代谢成 Kyn。尽管这种方法导致 TH17 免疫力的不同抑制,但这并不转化为实验性自身免疫性神经炎症的改善。
阻断IDO1降解,维持外周耐受性
认识到蛋白酶体降解是调节自身免疫中色氨酸代谢的免疫抑制活性的重要机制后,另一种治疗途径是阻断IDO1降解,从而维持外周耐受性。
硼替佐米是一种批准用于治疗多发性骨髓瘤的蛋白酶体抑制剂,可防止 IDO1 降解并以 IDO1 依赖性方式在临床前动物模型中改善自身免疫性糖尿病。
基于 IDO1 感受态细胞的疗法
尽管间充质干细胞的过继转移已被证明可以独立于IDO抑制自身免疫性神经炎症的临床疾病活动,但 IDO1 已被证明在其他自身免疫性体内疾病模型中与间充质干细胞的免疫抑制特性密切相关。
增强或诱导宿主 IDO 表达的另一种方法是通过局部基因治疗。例如,腺病毒将 IDO1 递送至移植器官可诱导免疫耐受并防止大鼠发生移植排斥反应。
IDO2 直到最近才成为潜在的治疗靶点
迄今为止,还没有对 IDO2 具有足够特异性的小分子。在自身免疫性关节炎的临床前模型中,一种通过内化靶向 IDO2 的抗体通过抑制自身反应性 T 细胞和 B 细胞减轻了疾病。
新开发的 IDO2 特异性测定系统和基于计算结构的研究可能有助于开发对 IDO1 没有交叉反应的 IDO2 抑制剂。
/
/
▼
● 肠 病
最近研究强调了肠道色氨酸代谢的改变与肠道微生物的潜在联系。发现 IBD 患者微生物群产生的 AhR 配体减少,这是受遗传因素的影响。与健康受试者相比, 肠道组织中 AhR 的表达降低。
IBD还与宿主和肠道细菌色氨酸代谢物的改变有关。IBD 患者的犬尿氨酸和 KA 血浆水平升高,血浆色氨酸浓度降低。
几种特定的肠道细菌色氨酸代谢物也参与 IBD 的病理生理学
在患有 IBD 的狗中,被认为在肠道中具有抗炎功能的细菌色氨酸代谢物(吲哚乙酸盐和吲哚丙酸盐)显着减少。在 IBD 患者中,粪便中 IAA(肠道抗炎功能)水平降低,表明细菌色氨酸代谢减少可能是 IBD 的病因。
此外,在 IBD 患者中,可利用 α-L-岩藻糖苷酶从肠粘蛋白中切割末端岩藻糖残基的细菌数量显着减少,这与来自色氨酸的吲哚丙烯酸和吲哚-3-丙酸产量减少有关。
IBD 患者的 IDO1 活性更高
据报道,IBD 患者外周血和结肠细胞中的 IDO1 活性增加。在 IBD 中,增加的促炎细胞因子,包括 IFN-γ、IL-1 和 IL-6,已被建议诱导色氨酸分解代谢途径以降低血浆色氨酸水平,并增加色氨酸分解代谢物水平。
此外,UC 患者血清中的 IPA 降低。在肠道局部观察到 IDO1 的过度激活和免疫系统过渡激活。与非活动性 IBD 患者相比,活动性 IBD 患者的 IDO1 活性更高,并且色氨酸和 C 反应蛋白血清水平呈负相关,这一假设得到了支持,C 反应蛋白是一种常用的生物标志物,对炎症反应增加。
IBD 中 5-HT 通路激活的状态存在争议。限速酶TpH1的表达增加在克罗恩病中已报道。
小鼠研究表明AhR 缺乏会增加实验性结肠炎的严重程度
这种结肠炎是由 T 细胞转移或通过施用葡聚糖硫酸钠 (DSS) 以化学方式驱动的。在这些模型中,AhR 缺陷部分通过改变白细胞介素 (IL)-22 的产生来驱动结肠炎,白细胞介素 (IL)-22 是一种对肠道稳态具有众所周知影响的细胞因子。
缺乏 caspase 募集域 9 (Card9)(一种 IBD 易感基因)的小鼠的肠道菌群失调无法将色氨酸催化成 AhR 配体,导致 IL-22 释放减少并最终导致Card9的易感性更高-/-小鼠对 DSS 诱导的结肠炎 。
在人类中也发现了一些功能相关性,因为 AhR 的药理学激活减少了促炎细胞因子干扰素 (IFN) γ 的产生,并增加了 IBD 患者固有层单核细胞中 IL-22 的产生。
此外,正如在患有 UC 的人类中观察到的那样,IPA 和吲哚在 DSS 诱导的结肠炎小鼠血清中减少,另外的证据表明口服 IPA 在该模型系统中具有保护特性。
KP 的改变也可能在机制上参与 IBD 发病机制
IDO1 -/-小鼠更易患结肠炎,表明 IDO1 是肠道炎症的负调节剂。与 IDO1 缺乏相关的病理损伤部分是由于促炎细胞因子的激活和结肠中 CD4+ Foxp3+ 调节性 T 细胞数量的减少。然而,所涉及的确切机制和代谢产物仍然未知。
众所周知,Kyn 是一种 AhR 激动剂,但在肝癌细胞系中引发报告基因 AhR 活性所需的浓度让人怀疑它在生理条件下作为 AhR 激活剂的相关性,可能涉及导致抗炎代谢物(如 Kna)缺乏的下游代谢途径的改变,但这仍有待证明。在 IBD 的背景下,来自失调微生物群的异常信号可能是 KP 的驱动因素。
5-HT 加重肠道炎症
化学诱导的结肠炎的严重程度在TpH1 −/−小鼠和用 5-HT 合成抑制剂对氯苯丙氨酸处理的小鼠中减弱,表明 5-HT 加重肠道炎症。此外,删除 SERT 会导致 5-HT 可用性增加,从而导致实验性结肠炎恶化。
这些促炎作用可能部分是由DC上 5-HT 7受体的激活驱动的。然而,新的线索表明 5-HT 还通过作用于 5-HT 4 发挥抗炎作用对肠上皮细胞屏障功能产生积极影响。
总之,这些数据表明在 IBD 中观察到的色氨酸代谢改变可能在疾病发病机制中发挥积极作用。就这些微生物产生 AhR 激动剂的能力受损而言,微生物群的参与是显而易见的,但也可能解释了在生理条件下微生物群的直接影响下发生的 IDO 和 TpH1 的局部激活加剧。
● 肠易激综合症
IBS 的病因在很大程度上是未知的,但可能与色氨酸代谢受损有关。IBS 患者血清中 Kyn 升高,外周 IDO1 活性与 IBS 严重程度呈正相关。
IBS 与通过 KP 增加的色氨酸代谢有关
犬尿氨酸:色氨酸比率与 IBS 症状严重程度呈正相关,IFN-γ 激活和随后的色氨酸 IDO1 氧化可能是 IBS 的致病机制。
此外,血清素能系统的功能障碍与 IBS 的病理生理学有关。与急性色氨酸耗竭治疗相比,IBS 患者通过急性色氨酸增加治疗进行的 5-羟色胺能调节导致更严重的胃肠道症状。
肠道运动的改变是 IBS 的关键特征之一,与 5-HT 代谢障碍有关
与健康对照组相比,IBS 患者的直肠活检组织中发现 TpH1 和 SERT 表达水平降低。
此外,5-HT 结肠内容物在便秘型和腹泻型 IBS 中分别减少和增加。5-HT 的多效性与其受体的多样性有关,这些受体能够触发特定器官的特定功能。
在胃肠道中表达最多的5-HT 3和 5-HT 4亚型将 5-HT 与内脏伤害感受和运动障碍联系起来。5-HT 的作用已经被开发为治疗靶点,使用 5-HT 3受体拮抗剂和 5-HT 4受体激动剂分别显示出对腹泻和便秘为主的 IBS 的一些疗效。
然而,受肠道微生物群调节的中枢血清素作用紊乱也可能参与 IBS 发病机制。肠道菌群对 5-HT 产生和肠道运动的影响已在小鼠身上得到证实,并表明 IBS 发病机制部分与微生物群对 5-HT 产生的功能失调控制有关。
● 与年龄有关的胃肠功能障碍
高龄增加了个体对胃肠道功能障碍的易感性,这归因于与年龄相关的神经元丢失。
5-HT4 激动剂刺激发育中的肠道中的神经突生长和网络形成,也已被证明可以防止神经元凋亡和炎症诱导的轴突变性和自噬。
此外,5-HT4 受体激动作用可促进成人肠道神经发生。相应地,其他方面健康的高龄个体表现出循环色氨酸减少,可能会限制血清素的可用性。
/
/
▼
● 衰 老
衰老与肠道微生物群的变化有关,这通常与胃肠道的生理变化有关,同时免疫系统功能下降可能导致感染、营养不良和其他功能缺陷的风险增加。
老年人菌群特征
老年人的肠道微生物群通常以细菌多样性降低、优势菌种改变、有益微生物减少和兼性厌氧菌增加为特征,所有这些都表明与衰老相关的微生物变化具有潜在的不利影响。微生物群组成的变化与老年人的免疫衰老和炎症有关。
色氨酸代谢受衰老影响
色氨酸在诱导免疫耐受和维持肠道菌群方面起着至关重要的作用。
对老年人和年轻人肠道核心微生物组直系同源基因的分析表明,丰度增加的年龄相关基因参与了色氨酸代谢途径 (ko00380),这与在百岁老人血清中发现的与年龄相关的色氨酸浓度降低一致。研究表明,肠道微生物群对色氨酸消耗的潜在增加可能会影响宿主对色氨酸的生物利用度。
最近的一项研究报告了血清色氨酸水平降低与免疫激活增加之间的关系。还推测微生物群依赖性色氨酸减少会增强百岁老人的炎症。
食物传感信号通路调节寿命,与色氨酸关联
几种食物传感信号通路,包括胰岛素/胰岛素样生长因子 (IIS) 通路和哺乳动物雷帕霉素靶标 (mTOR) 通路,已被证明可以调节模式生物的寿命,并且已经提出了类似的关联对于KP途径。
在人类中,表示该通路活性的 Kyn:色氨酸 比率随着年龄的增长而增加。这种增加与 65 岁以上人群的虚弱有关,并预示着 90 多岁人群的死亡率。
KP 的活性与衰老之间存在因果关系
此外,对成人个体外周血中年龄相关基因表达变化的荟萃分析将 KYNU 酶(犬尿氨酸酶,色氨酸降解途径关键酶)鉴定为表达差异最大的基因之一。在对秀丽隐杆线虫的后续研究中,通过 RNA 干扰 (RNAi) 敲低 KYNU 比敲低任何其他差异表达基因所达到的寿命更长,这表明 KYNU 对衰老有重要贡献。
连同独立发现,线虫和黑腹果蝇中 TDO 活性的遗传减少, 导致 Trp:Kyn 比率显着增加,延长寿命,这些研究表明 KP 的活性与衰老之间存在因果关系。
Kyn/Trp 分流在炎症中的后果
色氨酸代谢向肝外 Kyn 产生的炎症相关分流,可能影响衰老过程中一系列器官中色氨酸代谢物的功能。
编辑
doi.org/10.3389/fimmu.2019.02565
与年龄相关的组织稳态下降会导致生理上的低度慢性炎症表型,称为炎症。我们假设色氨酸向Kyn途径代谢,以控制与年龄相关的炎症。色氨酸和Kyn代谢产物的相应紊乱可能与年龄相关疾病和寿命缩短有关。
色氨酸参与调节寿命机制
KP 调节衰老的机制尚不清楚。已经针对不同的无脊椎动物和脊椎动物模型描述了氨基酸(包括色氨酸)在调节寿命方面的作用。在大多数情况下,色氨酸可用性的降低或细胞摄取的阻断可延长寿命。然而,这种机制与 TDO 抑制(增加色氨酸)延长寿命的发现相悖,除非这与细胞摄取减少有关。
此外,用 Kyn 喂养果蝇会缩短寿命,这表明该通路下游的代谢物水平也可能参与寿命的调节。TDO 耗尽对秀丽隐杆线虫延长寿命的影响取决于 FOXO 转录因子 DAF-16,它是寿命调节通路的介质,例如驱动细胞防御通路表达的 IIS 通路,表明它具有保护细胞免受细胞侵害的作用伤害。
有趣的是,防止与年龄相关的蛋白质毒性(这也是由秀丽隐杆线虫中的 TDO 耗尽引起的)不依赖于 DAF-16,并且独立于 KP 63中的下游酶。这一观察结果表明,延长寿命的效果要么是这种保护的结果,要么是由一种独立的机制引起的。
由于 NAD +正在成为一种潜在的延长寿命分子,KP 的改变可能通过 NAD +产生延长寿命的效果。然而,无脊椎动物的寿命更长是 KP 活性降低的结果,而通过外部供应其他 NAD +前体来延长寿命则表明 KP 活性的增加也是有益的。
需要更多的研究来理解这些看似矛盾的发现。由于 IDO1 或 TDO 的敲除小鼠是可行的,这些模型对于进一步研究 KP 中的寿命调节机制和潜在治疗靶点可能很有价值。KP 调节的寿命延长效应可能源于一般健康益处,而不是疾病特异性效应。
● 代谢综合征和肥胖
在患有代谢综合征的人类患者中,据报道 IDO1 过度激活会导致血清 Kyn 水平升高以及 Kyn/Trp 比率与肥胖、代谢综合征、BMI 和血液甘油三酯之间的相关性。
肥胖患者IDO1 的局部激活
IDO1和 KP 下游酶(如犬尿氨酸酶 (KYNU)、犬尿氨酸氨基转移酶 (KAT) 和犬尿氨酸 3-单加氧酶 (KMO))的基因表达增加已在肥胖患者的脂肪组织中观察到,表明 IDO1 的局部激活。
然而,循环 5-HT 水平在代谢综合征中降低,并且与 BMI 和体脂呈负相关。
色氨酸转化产物吲哚衍生物起作用
微生物群通过色氨酸转化产生的几种吲哚衍生物可能在代谢综合征的发病机制中起作用。
吲哚本身已被证明可以刺激肠内分泌 L 细胞产生胰高血糖素样肽-1 (GLP-1),这是一种刺激胰腺 β 细胞分泌胰岛素的肠降血糖素。这种机制涉及快速抑制刺激 GLP-1 分泌的电压门控 K+ 通道,但受 ATP 合成抑制的长期影响控制,减少 GLP-1 分泌。
硫酸吲哚酚促炎和氧化作用,与心血管和肾病等相关
吲哚也在肝脏中被吸收并代谢为硫酸吲哚酚。在肾衰竭期间,这种代谢物会积累,其促炎和氧化作用与动脉粥样硬化、动脉硬化、充血性心力衰竭和其他心血管并发症的发病机制有关,这些并发症在慢性肾衰竭患者中尤为突出。
硫酸吲哚酚在肾功能正常的受试者中的作用仍有待确定。KP 也与动脉粥样硬化有关。在小鼠模型中,IDO1 缺乏症通过 IL-10 产生失调减少了动脉粥样硬化病变的发展,这是一种通过施用 Kna 逆转的表型。在人类中,高 Kna 水平与不稳定的斑块表型相关。
低度慢性炎症可能有助于 IDO1 激活
KP 的过度激活也可能参与低度炎症情况下胰岛素抵抗的发生,例如肥胖、抑郁、丙型肝炎病毒感染和心血管疾病。人体和实验数据表明,黄嘌呤酸和 KP 的其他产物对胰岛素的产生和释放以及对靶组织的影响具有有害影响。
大脑中产生的血清素会引起饱腹感,但在微生物群的直接影响下产生的肠道来源的 5-HT 不会穿过血脑屏障。然而,色氨酸和直接 5-HT 前体 5-HTP 确实可以穿过血脑屏障,从而间接调节中枢 5-HT 的产生和功能。
外周 5-HT 独立于任何中枢效应影响宿主代谢
肠道来源的 5-HT 能够诱导食欲减退和饱腹感,其水平在禁食期间增加并刺激脂肪组织中的脂肪分解和肝细胞中的糖异生,有利于血糖控制。随后,通过一种涉及产热棕色脂肪组织消耗更多能量的机制,给予高脂肪饮食的 TpH1 基因或化学消融小鼠可免于肥胖、胰岛素抵抗和非酒精性脂肪肝疾病 (NAFLD)。
然而,这些结果可能不适用于棕色脂肪组织含量低且随年龄增长而减少的成年人。此外,人类肥胖与外周 5-HT 减少有关,表明其在发病机制中的复杂作用。
已经使用小鼠模型研究了 AhR 在代谢综合征中的作用,但尚未得出明确的结论。这可能与 AhR 的多重作用有关,AhR 在参与代谢综合征发病机制的各种细胞类型(肠细胞、肝细胞和免疫细胞)中表达。
/
/
▼
● 癌症中的色氨酸代谢
多项证据表明色氨酸代谢在癌症中具有重要作用,通过抑制抗肿瘤免疫反应和增加癌细胞的恶性特性来促进肿瘤进展。
首先,色氨酸降解酶在多种癌症中表达
IDO1 在大约 58% 的人类肿瘤中表达,其表达与多种癌症的不良临床结果相关,包括黑色素瘤、妇科癌症、结肠癌和血液系统恶性肿瘤。
IDO1 表达要么作为一种反调节机制被诱导,以响应从肿瘤浸润性免疫细胞释放的细胞因子,要么它的表达通过肿瘤固有的致癌信号传导维持。
TDO 催化与 IDO1 相同的反应,在神经胶质瘤、黑色素瘤、卵巢癌、肝癌、乳腺癌、非小细胞肺癌、肾细胞癌和膀胱癌中表达,并已被证明可促进肿瘤进展。
其次,各类癌症患者中全身色氨酸水平降低
已在成人 T 细胞白血病、结直肠癌 、妇科癌症、恶性黑色素瘤、肺癌和恶性神经胶质瘤患者中测量到全身色氨酸水平降低。在患有这些癌症的患者的血液中很少观察到 KP 代谢物浓度升高,这可能表明肿瘤微环境中 Kyn 和下游代谢物的局部变化受到更多限制。
第三,色氨酸降解在调节 Treg细胞和癌症中的免疫细胞浸润中发挥作用
FOXP3 + T reg细胞与宫颈癌引流淋巴结中表达 IDO1 的 DC 直接接触,IDO1 表达与转移性胰腺导管腺癌患者CD4 + CD25 + FOXP3 + T reg细胞增加有关,急性髓性白血病 (AML) 33和非霍奇金淋巴瘤。
此外,IDO1 表达与 CD3 + T 细胞、CD8的低肿瘤浸润相关+ T 细胞和 CD3 +和 CD8 + T 细胞以及 CD57 +自然杀伤细胞分别存在于结直肠癌、卵巢癌和子宫内膜癌患者中。
最近的一项研究表明,肿瘤再生细胞将 Kyn 转移到 CD8 + T 细胞,这反过来又以 AHR 依赖性方式上调程序性细胞死亡蛋白 1 (PD-1)。总而言之,这些观察结果为色氨酸代谢在肿瘤细胞免疫逃逸中的作用提供了机制解释。
第四,色氨酸代谢物可以有效促进癌细胞的运动和转移
例如,体外研究表明,TDO 在胶质母细胞瘤或乳腺癌细胞中的表达可促进肿瘤细胞迁移和侵袭。类似地,IDO1 的过表达增强了肺癌细胞的运动性,而敲除则降低了运动性。
这种促迁移表型也反映在临床前模型中由色氨酸降解引起的转移形成促进。药理学 TDO 抑制减少了肺癌小鼠模型肺部肿瘤结节的数量。
植入小鼠体内的人肺癌细胞中的 IDO1 过表达增加了大脑、肝脏和骨骼中的转移形成,而 IDO1 缺乏减少了转移负担并提高了乳腺癌衍生肺转移小鼠模型的存活率。
此外,TDO-AHR 信号轴促进了对贴壁依赖性细胞从周围细胞外基质分离时发生的程序性细胞死亡的抵抗,这是转移的关键步骤。最后,肿瘤内 IDO1 表达已被证明与结直肠癌肝转移、肝细胞癌远处转移和子宫内膜癌淋巴结转移的频率相关。
第五,NAD+ 在癌症生物学中通过色氨酸 de novo 途径产生的作用
在小鼠中,色氨酸代谢受损导致肝脏中从头合成 NAD+ 受到抑制,从而通过 DNA 损伤促进肝肿瘤发生。
在人类神经胶质瘤中,从色氨酸重新产生的 NAD+ 赋予对放化疗诱导的氧化应激的抗性。有趣的是,胶质瘤细胞和小胶质细胞合作产生 NAD+。
此外,在人类癌细胞中,IDO1 与通过产生 NAD +改善 DNA 修复和介导对治疗的抗性有关,例如 PARP 抑制剂奥拉帕尼、γ-辐射和化疗剂顺铂。因此,抑制色氨安代谢也可能通过从头形成 NAD +来防止治疗耐药性;然而,根据 NAD +合成所必需的 KP 酶的表达,这种效应可能是组织特异性或细胞特异性的,因此需要进一步研究。
● 靶向癌症中的 IDO1 和 TDO
基于 IDO1 和 TDO 的肿瘤促进功能,已经研究了这些酶的小分子抑制剂用于癌症治疗。临床阶段 IDO1 抑制剂 epacadostat (INCB024360)、navoximod (NLG-919/GDC919)等化学结构已被公开。未公开结构的化合物KHK2455、LY3381916和MK-7162也作为IDO1抑制剂进入临床评估。
TDO 抑制剂(最初被开发为抗抑郁药以提高全身色氨酸水平,从而提高大脑血清素浓度)也正在探索用于癌症治疗,但尚未进入临床试验阶段。
此外,indoximod 正在临床试验中进行研究,但与 L-1-MT 237不同,它们不是 IDO1抑制剂及其作用机制,尽管它似乎与 IDO1 表达有关,但仍存在争议。
然而,IDO1 抑制的最大治疗潜力预计是它与其他疗法的联合使用,这一直是大多数 II 期和 III 期研究的重点。
● 与免疫检查点抑制剂联合
IDO1 抑制剂的临床评估最先进的是它们与针对免疫系统检查点的单克隆抗体的组合,例如细胞毒性 T 淋巴细胞相关蛋白 4 (CTLA4)、PD-1 或其配体 (PD-L1),其中一些已被批准用于近年来治疗多种癌症的基础上部分患者出现前所未有的反应。
然而,由于相当大比例的患者无法从检查点抑制剂中获益,因此人们非常有兴趣确定缺乏治疗反应和治疗耐药性的分子基础,因为这些知识可能表明潜在的联合疗法可以改善反应。
有趣的是,在使用 PD-1 受体阻断剂 pembrolizumab 治疗期间,肉瘤患者的 Kyn:Trp 血浆比率增加,表明 IDO1 可能由免疫检查点封锁诱导。最有可能的是,这种 IDO1 的诱导,预计会抵消免疫检查点抑制的免疫刺激作用,是通过活化的 T 细胞产生的 IFNγ 介导的。
一项临床前研究表明,抑制 IDO1 会略微增强抗 CTLA4、抗 PD-1–PD-L1 和抗 GITR(糖皮质激素诱导的 TNFR 相关蛋白)疗法的疗效。
这些发现虽然不大,但引发了对 IDO1 抑制剂与免疫检查点抑制剂联合治疗的广泛临床研究。在 epacadostat 与 pembrolizumab 联合治疗的 I/II 期单臂试验获得令人鼓舞的数据后,在无法切除或转移性黑色素瘤患者中进行了 III 期试验。
尽管 ECHO-301 试验的阴性结果明显代表了 IDO1 抑制剂在癌症免疫治疗中的开发受挫,但它也激励人们利用临床试验来更多地了解 IDO1 抑制剂在癌症中的作用机制,以开发更复杂的生物标志物用于患者选择和治疗监测,并利用该途径中的新靶点,例如 AhR。
● 与免疫检查点抑制剂联合
目前已经计划在验证试验中继续研究 IDO1 抑制剂在联合免疫疗法中的潜力,包括不同于与 PD-1 和 PD-L1 拮抗剂组合的策略。
几项测试 IDO1 抑制剂 epacadostat 与抗肿瘤疫苗联合应用的临床试验正在进行中,可能会显示阻断 IDO1 是否会提高抗肿瘤疫苗接种的功效。这背后的基本原理是干扰素信号对 IDO1 的上调涉及多种免疫相关途径。例如,TLR 的激活通过干扰素诱导 IDO1 表达。
抑制抗肿瘤免疫反应的其他几种途径也与驱动色氨酸降解酶的肿瘤表达有关,包括 AhR 信号、TGFβ 信号和信号转导和转录激活因子 3 (STAT3)。
因此可以设想两种情况:
• 如果这些途径的抑制剂非常有效并且同时完全消除了色氨酸降解酶的表达,那么它们可能会使 IDO1 或 TDO 抑制剂在这种情况下变得可有可无。
• 相反,如果这些药物不能完全减轻 IDO1 和/或 TDO 的表达,它们可能与色氨酸代谢抑制剂协同作用。相比之下,其他治疗方法可能会诱导 IDO1 作为一种不良影响,这表明这些疗法与 IDO1 抑制剂的组合可能是有益的。
/
/
▼
前面概述了色氨酸及其在肠道中的三种命运。在这里主要谈论吲哚/AhR 通路,将深入探讨 AhR 信号的好处、为什么大多数人都缺乏这种途径、增加肠道中 AhR 活性的潜在策略,以及 AhR 可能被过度刺激的一些例外情况。
● 什么是AhR?
芳烃受体 (AhR)是一种转录因子——一种调节基因表达的蛋白质。结合并激活受体的分子称为激动剂。
AhR 的激动剂(即激活剂)主要分为三类分子:
AhR 最初因其在对二恶英和其他芳基碳氢化合物等环境毒素作出反应中的作用而被发现。这些污染物是 AhR 的非常强的激活剂。它们的结合增加了有助于促进其解毒的酶的表达。
肠道细菌,包括各种梭菌属、拟杆菌属、真杆菌属、乳杆菌属和双歧杆菌属,可以直接将色氨酸转化为称为吲哚的化合物,其中许多结合并激活 AhR。
近年来,膳食化合物也被证明可以激活 AhR。Indole-3-carbinol (I3C) 是一种源自十字花科蔬菜分解的化合物,可以结合并激活 AhR。
虽然环境污染物对 AhR 的慢性激活可能对健康产生负面影响,但肠道代谢物和膳食化合物对 AhR 的瞬时激活具有许多积极的下游影响。
● 肠道 AhR 激活的诸多好处
规律的、短暂的 AhR 信号在肠道和整体健康中起着许多重要作用。
1) 维持肠道屏障功能
AhR 刺激肠道中的先天免疫细胞产生细胞因子 IL-22,这是一种促进粘液产生和抗菌肽分泌的信号分子。在称为隐窝的肠道屏障口袋中,AhR 还支持干细胞增殖,这对于正常的肠道更新和修复至关重要。
2) 调节肠道菌群的组成
缺乏 AhR 刺激会导致促炎性肠杆菌科的扩张和产丁酸梭菌的减少,这是肠道菌群失调的常见特征。
3) 维持肠道免疫细胞群并减少炎症
AhR 支持肠道上皮细胞内足够数量的淋巴细胞。它还在将调节性 T 细胞引导至肠道并支持其抑制炎症的能力方面发挥关键作用。
4) 调节肠神经系统和肠蠕动
AhR 已被证明在调节蠕动方面发挥作用,蠕动是沿着胃肠道移动食物的肌肉收缩。AhR 也可能与损伤后肠神经的再生有关。
5) 防止念珠菌和其他肠道感染
AhR 激活通过支持 IL-22 信号传导在维持对酵母白色念珠菌和细菌病原体的定植抗性方面发挥重要作用。
6) 支持肺部的免疫防御
肠道 AhR 在防止其他粘膜表面(如肺)感染方面也起着重要作用。2019 年的一项研究发现,抗生素治疗后提高肠道中的 AhR 活性可显着减少肺部致病菌数量。
7) 促进健康的皮肤屏障功能
肠道 AhR 对于维持皮肤屏障的完整性至关重要。2016 年的一项研究发现,从饮食中去除 AhR 配体会损害皮肤屏障功能,而重新添加 AhR 激活剂吲哚-3-甲醇可挽救屏障缺陷,即使在老年小鼠中也是如此。
8) 激活解毒途径
AhR 在许多物质的解毒中发挥作用,包括多环芳烃、霉菌毒素、重金属和雌激素,激活整个身体的 解毒途径。
9) 保护肝肾功能
来自肠道色氨酸代谢的 AhR 信号也被证明可以预防非酒精性脂肪肝、酒精性肝损伤和肾纤维化。
10) 支持神经系统健康
星形胶质细胞中通过 AhR 发出的膳食色氨酸代谢物信号已被证明可以限制中枢神经系统的炎症。肠道 AhR 活性还促进成人神经发生,即新神经元的形成。
AhR 信号减少:许多慢性病的一个特征
在多种慢性疾病中观察到肠道 AhR 活性降低,包括炎症性肠病、肠易激综合征、结直肠癌、肥胖、代谢综合征、高血压、动脉粥样硬化、抑郁症、炎症性皮肤病、乳糜泻和多发性硬化症等疾病。
● 是什么导致 AhR 信号减少?
影响因素很多,包括:
改变的肠道微生物群组成通常无法产生已知可激活 AhR 的化合物,包括色氨酸衍生的吲哚和短链脂肪酸丁酸盐。
色氨酸(细菌吲哚形成的底物)的摄入量减少和/或植物性食物中 AhR 激动剂的摄入量减少都会减少 AhR 激动剂的总量。人造甜味剂的消费也被证明会减少 AhR 信号。
压力、炎症和某些类型的感染可以将色氨酸代谢从 AhR 转移到其他途径(后面我们会持续分享)。
解决这些根本原因始终是恢复 AhR 活动的第一步。
● 增加 AhR 活性的其他策略
以下是已知会暂时增加 AhR 活性的其他干预措施的总结。但是需要注意 AhR 激动剂具有物种特异性和组织特异性作用。它们的效果还取决于浓度,在存在多种化合物的情况下,它们甚至可能相互竞争——因此虽然这里列出了很多可能性,但“厨房水槽”方法并不一定是理想的。
希望在接下来的几年里,我们将看到更多的人体临床试验,以阐明这些疗法中的哪些可能对以 AhR 缺陷为特征的疾病状态最有帮助。以下信息不能视为医疗建议。
▸Indole-3-carbinol (I3C)
这种化合物由球芽甘蓝、卷心菜、西兰花、花椰菜和芥菜等十字花科蔬菜中的葡糖甘蓝素分解产生,是一种有效的 AhR 激活剂。
在动物模型中,I3C 已被证明可以诱导调节性 T 细胞的形成、抑制 Th17、保护粘液层、增加丁酸盐的产生、上调 PPAR-γ 并防止结肠炎。还对其潜在的抗癌和抗氧化作用进行了研究。虽然 I3C 或其衍生物二吲哚基甲烷 (DIM) 以补充剂形式提供,但较高剂量可能存在风险且人体研究有限,因此最好以整个食物形式食用 I3C。
注意:为了最大限度地提高膳食 I3C 的生物利用度,食用酸菜等生发酵形式的十字花科蔬菜,或在烹饪后加入芥末籽粉(含有黑芥子酶)。
▸丁酸盐
一种短链脂肪酸,是人肠上皮细胞中 AhR 的直接激活剂。在健康的肠道中,丁酸盐是由膳食纤维的发酵产生的,在较小程度上是蛋白质的发酵。它也以补充形式提供。一定情况下对结肠需要更有针对性。
▸尿石素 A
这种化合物由石榴、覆盆子和黑莓中的鞣花单宁分解产生,已被证明可以通过 AhR 增强肠道屏障功能。然而,估计只有 30-40% 的人拥有可以进行这种转化的细菌。尿石素 A也可以作为补充剂服用,并且作为食品成分已获得 FDA 公认的安全状态。
▸阳光照射
2019 年的一项研究发现,在小鼠身上,仅 15 分钟的 UV-B 照射就会诱导 AhR 靶基因在血液和外周组织(包括肠道)中的表达。
▸婴儿双歧杆菌(Bifidobacterium infantis)
该菌株在人乳低聚糖上生长后产生吲哚-3-乳酸,一种 AhR 的激活剂。它已在婴儿中得到充分研究,可用作婴儿益生菌。该菌株尚未在成人中进行研究。该配方确实含有大量的乳糖和残留量的大豆。
▸鼠李糖乳杆菌
某些乳杆菌菌株已被证明在色氨酸丰富时自然产生 AhR 激动剂。发现唯一已知可增加 AhR 活性且可商购的菌株是鼠李糖乳杆菌GG。
但是注意,不建议在使用抗生素期间或之后立即使用基于乳酸杆菌的益生菌,也不建议患有组胺不耐受/肥大细胞活化综合症的人服用。
▸Akkermansia muciniphila
至少在一项动物研究中,这种细菌或其外膜上的一种蛋白质增加了循环中的吲哚化合物并上调了 AhR 靶基因。
▸美沙拉嗪 (5-氨基水杨酸,5-ASA)
该药物是炎症性肠病 (IBD) 的一线治疗药物。这种药物上调 PPARgamma 和促细胞凋亡和抗增殖作用的能力。有趣的是,美沙拉嗪似乎也能激活 AhR。
▸咖啡
咖啡提取物,尤其是过滤较少的咖啡,如土耳其咖啡,已被证明可诱导肠上皮细胞中的 AhR 表达,并在啮齿动物模型中预防结肠炎。
▸萝卜硫素
虽然这种化合物的作用通常归因于 Nrf2 通路,但 AhR 似乎介导了它的许多保护作用。在喂食西方饮食的小鼠中,萝卜硫素增加了肠道中吲哚乙酸的产生,从而上调了 AhR 活性。
▸多酚
槲皮素、白藜芦醇和姜黄素都可以通过抑制控制 AhR 激动剂分解的 CYP1A1 酶来间接激活 AhR。其中,槲皮素在增强 AhR 信号传导方面最有效。
▸血清素
这种神经递质及其副产物 (5-HIAA) 也可以通过部分抑制 AhR 配体的清除来间接激活 AhR。这种效果取决于功能正常的血清素运输。
关于反馈调节而不是长期过度刺激 AhR 的重要性的说明:
这里不能忽略AhR 过度刺激的问题。虽然大多数慢性炎症性疾病都以 AhR 缺陷为特征,但在少数情况下,AhR 可能会过度激活,从而产生负面后果。这通常是由于污染物或霉菌暴露、严重病毒感染、或慢性肾病等引起的显着环境毒性。
这些条件的特点是持续的 AhR 激活,其对基因表达的影响与短暂的 AhR 激活截然不同。相反,由于某些解毒酶的上调,结合 AhR 的天然化合物在结合 AhR 时会被有效代谢。这种负反馈回路确保 AhR 信号是短暂的。
拥有足够的维生素,尤其B12 和叶酸可以防止慢性 AhR 过度刺激。尽管如此,在某些极端毒性或感染的情况下,短暂的 AhR 刺激是不提倡的。
/
/
▼
● 益 生 菌
益生菌,如属于乳杆菌属和双歧杆菌属的细菌,对色氨酸代谢产生有益影响。
益生菌促进血清素合成
一方面,益生菌,如乳杆菌和双歧杆菌中的物种,可以直接将色氨酸转化为血清素。
另一方面,一些益生菌乳杆菌菌株,如干酪乳杆菌327,可以通过增加TPH1表达间接促进结肠血清素合成。
益生菌与犬尿氨酸途径的调节密切相关
与血清5-羟色胺水平升高一致,大鼠口服约氏乳杆菌(Lactobacillus johnsonii) 无细胞上清液,也会导致血清中的犬尿氨酸水平降低,同时肠道IDO活性降低。口服约氏乳杆菌8周后,观察到人血清犬尿氨酸水平下降,色氨酸含量增加的明显趋势。
此前的一项研究还表明,大鼠服用益生菌婴儿双歧杆菌( Bifidobacteria infantis)会导致色氨酸水平升高,血液循环中的犬尿氨酸与色氨酸比率降低。
这些研究表明,一些属于乳杆菌和双歧杆菌的益生菌物种可能通过抑制犬尿氨酸途径改变宿主色氨酸代谢。
益生菌将色氨酸降解为吲哚化合物
此外,据报道,一些属于乳杆菌的细菌能够将色氨酸降解为吲哚化合物,如IAld、ILA和IAA。
向结肠炎易感小鼠口服3种色氨酸代谢乳杆菌菌株可促进微生物色氨酸新陈代谢芳基烃受体(Ah)依赖性信号传导,从而影响外周色氨酸的有效性。
尽管操纵肠道微生物群影响色氨酸代谢途径的机制尚未完全了解,但以肠道微生物群为靶点可能是调节色氨酸新陈代谢的一种有前途的方法。
● 抗 生 素
口服抗生素能够重塑肠道微生物群的组成和代谢。口服广谱抗生素会导致肠道微生物群耗竭,降低结肠血清素水平,进而延缓小鼠结肠运动。
正如结肠中关键合酶TPH1的下调所证明的,这项研究指出了共生微生物群在调节肠道血清素合成中的可能作用。
据报道,抗生素的微生物操纵会影响犬尿氨酸途径,因为抗生素诱导的微生物群耗竭会导致小鼠和猪的循环色氨酸可用性增加,并降低沿犬尿氨素途径的代谢。
此外,一些研究表明,抗生素诱导的肠道微生物改变也有利于猪体内的微生物色氨酸降解途径。随着循环色氨酸水平的增加,口服抗生素降低了空肠中色氨酸的可用性,并降低了猪大肠中的微生物色氨酸脱羧活性。
此外,口服抗生素会增加猪大肠中吲哚和吲哚化合物的含量。
有趣的是,最近的一项研究表明,回肠末端输注专门针对大肠微生物群的广谱抗生素会导致血液循环中的色氨酸水平降低,并增强微生物色氨酸降解,从而增加大肠中的吲哚水平。与之前的研究结果相反,该研究的发现表明,肠道微生物群在响应抗生素操作而调节色氨酸代谢方面发挥了独特的作用。
● 饮 食
饮食被认为是影响微生物色氨酸代谢的重要因素。
高脂肪饮食:抑制微生物从色氨酸向吲哚代谢物的转化,从而影响免疫调节
例如,最近的一项研究表明,高脂肪饮食会耗尽小鼠盲肠中的微生物代谢产物IAA和色胺,这表明在高脂肪饮食下,微生物色氨酸降解途径可以减弱。
高脂肪饮食增加了Alistipes和Bacteroides的丰度,同时减少了 Faecalibacterium。高脂肪饮食增加了致病菌属Alistipes,同时减少了有益菌 Parabacteroides distasonis ,导致小鼠肠道屏障功能受损。
高脂饮食显著增加小鼠肠道的IDO活性,促进色氨酸分解代谢为犬尿氨酸。
在暴露于高脂饮食的情况下,肠道微环境受到影响,随后抑制微生物从色氨酸向吲哚代谢物的转化,特别是吲哚-3-丙酸、吲哚-3-乳酸和吲哚乙酸盐。这些代谢物被认为是 AhR 激动剂,在免疫调节中起着关键作用。
配方奶:影响新生猪色氨酸代谢
母乳不仅是早期营养的唯一来源,而且有助于宿主肠道微生物群的成熟。有趣的是,之前的一项研究发现,配方奶引起的肠道微生物群的改变使新生猪结肠中的色氨酸代谢从血清素转变为色胺。
碳水化合物:影响色氨酸代谢速率
微生物色氨酸代谢的速率可能会受到管腔内营养物质(如碳水化合物)可用性变化的影响。
正如先前的体外研究所证明的,从仔猪粪便中分离出的一株利用色氨酸的细菌使用色氨酸进行细菌蛋白质合成,以可消化碳水化合物(葡萄糖)为底物,而不可消化碳水化合物(低聚果糖)是吲哚产生的底物。
此外,通过添加不可消化的碳水化合物,如低聚果糖和抗性淀粉,增加碳水化合物的可用性,促进碳水化合物代谢,从而增加短链脂肪酸的产量,同时减少色氨酸降解和仔猪大肠中的吲哚化合物。
事实证明,通过盲肠淀粉输注增加大肠碳水化合物的可用性可以抑制微生物色氨酸降解,从而导致大肠和血清中色氨酸水平的增加。
这些研究表明,增加碳水化合物的可用性抑制了肠道中的微生物色氨酸降解,这将进一步影响循环色氨酸库。
相比之下,增加碳水化合物的可用性促进了肠道血清素的合成,这与增加胃肠道传输有关,正如先前在口服多糖的小鼠中进行的一项研究所报告的那样。微生物短链脂肪酸的产生增强可以参与这一过程,因为它们已经被证明可以刺激结肠EC中的血清素释放。
腔内色氨酸可用性是影响微生物色氨酸代谢的另一个直接因素
IDO激活或饮食限制导致的宿主色氨酸耗竭可减少微生物增殖,尤其是乳酸杆菌中的细菌,据报道,其中一些细菌是利用色氨酸的细菌。通过饮食喂养选择性地恢复色氨酸水平导致乳杆菌的扩张,这进一步导致微生物色氨酸代谢的增强,IAld增加。
鉴于色氨酸也会被宿主直接吸收,肠道微生物群、管腔色氨酸可用性和宿主色氨酸代谢之间的复杂串扰需要进一步研究。
富含麦麸的饮食在调节色氨酸代谢物的合成和生物转化中的作用
富含麦麸的饮食有效地抑制了色氨酸向犬尿氨酸途径代谢物的转化,同时增加了褪黑激素和微生物分解代谢物,即吲哚-3-丙酸、吲哚-3-乙醛和 5-羟基-吲哚-3-乙酸。
麦麸增加了促进健康的细菌(例如,Akkermansia和Lactobacillus),它们与色氨酸衍生的吲哚类代谢物显著相关。
富含麦麸的饮食可有效调节与免疫功能相关的微生物转化和色氨酸合成(即增加 AhR 和 IL-22 的结肠表达),同时改善葡萄糖和脂质稳态,以及增加肠道健康促进菌的丰度。
/
/
色氨酸代谢调节炎症、肠道稳态和大脑功能等。色氨酸可用性和代谢的微生物调节对许多肠脑轴疾病具有重要意义,包括伴有精神疾病的胃肠道疾病,如IBS 、IBD,其他具有胃肠道功能障碍的中枢神经系统疾病,如自闭症等。
由于宿主色氨酸代谢直接或间接受肠道菌群调节,许多因素会影响肠道微生物群的组成和代谢,包括饮食、抗生素、益生菌等可以调节肠道微生物群,调节色氨酸的可用性,因此靶向肠道菌群干预是治疗肠脑轴疾病的有前途的方法。
色氨酸代谢可以作为与年龄相关的病理和寿命的调节剂。犬尿氨酸通路及其代谢产物可能成为预测衰老相关疾病的潜在风险标记物。
色氨酸主要经犬尿氨酸代谢,既促进肿瘤细胞固有的恶性特性,又限制肿瘤免疫,因此它是癌症免疫治疗的重要药物开发靶点。肿瘤中色氨酸代谢的改变常伴随色氨酸相关酶基因表达的异常,基于此,IDO抑制剂、TDO抑制剂及联合治疗被应用于大量的临床试验中。
随着这方面研究的不断深入,我们会持续关注和更新色氨酸代谢和全身健康稳态以及药物进展等。
主要参考文献
Le Floc’h N, Otten W, Merlot E. Tryptophan metabolism, from nutrition to potential therapeutic applications. Amino Acids. 2011 Nov;41(5):1195-205. doi: 10.1007/s00726-010-0752-7. Epub 2010 Sep 25. PMID: 20872026.
Gao K, Mu CL, Farzi A, Zhu WY. Tryptophan Metabolism: A Link Between the Gut Microbiota and Brain. Adv Nutr. 2020 May 1;11(3):709-723. doi: 10.1093/advances/nmz127. PMID: 31825083; PMCID: PMC7231603.
Sorgdrager FJH, Naudé PJW, Kema IP, Nollen EA, Deyn PP. Tryptophan Metabolism in Inflammaging: From Biomarker to Therapeutic Target. Front Immunol. 2019 Oct 30;10:2565. doi: 10.3389/fimmu.2019.02565. PMID: 31736978; PMCID: PMC6833926.
Richard DM, Dawes MA, Mathias CW, Acheson A, Hill-Kapturczak N, Dougherty DM. L-Tryptophan: Basic Metabolic Functions, Behavioral Research and Therapeutic Indications. Int J Tryptophan Res. 2009 Mar 23;2:45-60. doi: 10.4137/ijtr.s2129. PMID: 20651948; PMCID: PMC2908021.
Platten M, Nollen EAA, Röhrig UF, Fallarino F, Opitz CA. Tryptophan metabolism as a common therapeutic target in cancer, neurodegeneration and beyond. Nat Rev Drug Discov. 2019 May;18(5):379-401. doi: 10.1038/s41573-019-0016-5. PMID: 30760888.
Chen G, Zhou S, Chen Q, Liu M, Dong M, Hou J, Zhou B. Tryptophan-5-HT pathway disorder was uncovered in the olfactory bulb of a depression mice model by metabolomic analysis. Front Mol Neurosci. 2022 Oct 10;15:965697. doi: 10.3389/fnmol.2022.965697. PMID: 36299862; PMCID: PMC9589483.
Roth W, Zadeh K, Vekariya R, Ge Y, Mohamadzadeh M. Tryptophan Metabolism and Gut-Brain Homeostasis. Int J Mol Sci. 2021 Mar 15;22(6):2973. doi: 10.3390/ijms22062973. PMID: 33804088; PMCID: PMC8000752.
van der Goot AT, Nollen EA. Tryptophan metabolism: entering the field of aging and age-related pathologies. Trends Mol Med. 2013 Jun;19(6):336-44. doi: 10.1016/j.molmed.2013.02.007. Epub 2013 Apr 2. PMID: 23562344.
Yao K, Fang J, Yin YL, Feng ZM, Tang ZR, Wu G. Tryptophan metabolism in animals: important roles in nutrition and health. Front Biosci (Schol Ed). 2011 Jan 1;3(1):286-97. doi: 10.2741/s152. PMID: 21196377.
Höglund E, Øverli Ø, Winberg S. Tryptophan Metabolic Pathways and Brain Serotonergic Activity: A Comparative Review. Front Endocrinol (Lausanne). 2019 Apr 8;10:158. doi: 10.3389/fendo.2019.00158. PMID: 31024440; PMCID: PMC6463810.
Gibson EL. Tryptophan supplementation and serotonin function: genetic variations in behavioural effects. Proc Nutr Soc. 2018 May;77(2):174-188. doi: 10.1017/S0029665117004451. Epub 2018 Jan 25. PMID: 29368666.
Gostner JM, Becker K, Kofler H, Strasser B, Fuchs D. Tryptophan Metabolism in Allergic Disorders. Int Arch Allergy Immunol. 2016;169(4):203-15. doi: 10.1159/000445500. Epub 2016 May 4. PMID: 27161289; PMCID: PMC5433561.
Liu XH, Zhai XY. Role of tryptophan metabolism in cancers and therapeutic implications. Biochimie. 2021 Mar;182:131-139. doi: 10.1016/j.biochi.2021.01.005. Epub 2021 Jan 16. PMID: 33460767.
Yan T, Shi L, Liu T, Zhang X, Yang M, Peng W, Sun X, Yan L, Dai X, Yang X. Diet-rich in wheat bran modulates tryptophan metabolism and AhR/IL-22 signalling mediated metabolic health and gut dysbacteriosis: A novel prebiotic-like activity of wheat bran. Food Res Int. 2023 Jan;163:112179. doi: 10.1016/j.foodres.2022.112179. Epub 2022 Nov 19. PMID: 36596122.

谷禾健康


卵巢早衰
卵巢早衰(premature ovarian insufficiency,简称POI)在生殖系统疾病中位居首位,这些疾病可能会损害多个功能系统,降低生活质量,最终剥夺女性患者的生育能力。
目前的激素替代疗法不能改善受孕或降低全身并发症的发生率,可部分缓解症状。
日常食物中的营养成分包括碳水化合物、脂肪和脂蛋白、蛋白质和多肽、维生素以及含有植物雌激素的蔬菜或水果。这些是功能性营养素,在更年期期间具有增殖、抗炎、抗氧化和线粒体保护潜力。
除此之外,微生物相关营养物质,包括益生菌、益生元和合生元组合,在支持卵巢活力和调节其他重要生殖功能方面显示出很高的潜力。
本文主要介绍卵巢早衰的症状、发病率、风险因素,发病机制,与肠道菌群及阴道菌群的关联,后面着重介绍现有的关于卵巢早衰的膳食补充研究。
卵巢早衰,也称为原发性卵巢功能不全(简称POI)。


/ 卵巢早衰
健康女性的卵巢会产生雌激素。这种激素控制月经期并让人拥有生育能力(能够怀孕)。随着年龄的增长,卵巢最终会停止制造雌激素。有时,卵巢在预计绝经前很久就会停止工作。
注:绝经的平均年龄是 51 岁。
如果不到 40 岁,卵巢不再产卵,且月经停止,则可能是原发性卵巢功能不全,也就是我们通常所说的“卵巢早衰”。 甚至部分女性在青少年时期就开始了。
卵巢早衰不同于过早绝经。绝经是不可逆的;而有些卵巢早衰的女性,这种功能丧失是暂时的,也就是说,月经会在未来的某个阶段恢复。
对于大多数女性来说,最常见的症状是月经停止(或月经稀少)。
其他症状可能包括:
对于部分卵巢早衰的女性,月经变得不规律,卵巢可能会继续间歇性排卵并产生激素;这些女性可能会在卵巢完全关闭之前继续月经周期数月或数年。
对于大约十分之一的卵巢功能不全 (POI) 女性,她们的月经还没有开始,在很小的时候就出现了 POI,通常不到 20 岁。
什么时候应该怀疑自己可能有 POI?
POI可能在月经期突然停止时突然发生。或者,POI可以在月经停止前随着月经不规律的月份逐渐出现。
对一些人来说,怀孕困难可能是卵巢早衰的最早也是唯一的迹象。当症状被注意到时,通常是由于卵巢功能不良或功能不全导致雌激素分泌不足。
POI还会导致哪些问题?
在过去的几十年中,伴随着生活方式的快速改变和环境的恶化,POI 发病率的急剧上升。
在 40 岁以下的女性中,大约每 100 名女性中就有 1 名患有卵巢早衰。
在 30 岁以下的女性中,大约每 1000 名女性中就有 1 名会发生卵巢早衰。
在大约 90% 的情况下,POI 的确切原因是未知的。
研究表明,POI 与卵泡问题有关。卵泡是卵巢中的小囊,卵子在里面生长成熟。
一种卵泡问题是比正常情况更早地用完了工作卵泡。另一中问题是卵泡不能正常工作。
在大多数情况下,卵泡问题的原因是未知的。
某些因素会提高女性POI的风险:
注:
脆性 X 综合征,是常见的遗传性疾病,造成智力低下。
特纳综合征,指先天性卵巢发育不全。
艾迪生病,一般指肾上腺皮质功能减退症。
POI 的发生率逐渐增加,它与已知的致病基因高度异质,并影响多种生物活动,包括激素信号、代谢、发育、DNA 复制、DNA 修复和免疫功能。目前已知的 POI 基因只能解释一小部分患者。
细胞凋亡与 POI 密切相关,与卵母细胞在从原始卵泡到窦卵泡的成熟过程中丢失相关。
卵巢颗粒细胞凋亡是影响卵巢储备和功能下降的重要机制。女性一生当中只有0.1%卵泡可以发育成熟并完成排卵,其余卵泡在不同阶段发生闭锁,颗粒细胞凋亡是卵泡闭锁的重要因素之一。
正常卵巢与POI卵巢的卵泡生成受损
doi: 10.3389/fcell.2021.672890
在卵巢内因子和促性腺激素的调节下,初级卵泡发育成腔前卵泡和早期窦状卵泡,最容易发生闭锁或卵泡死亡。
然后,它们成为排卵前卵泡,导致卵母细胞释放和黄体形成。卵泡发生缺陷(如原始卵泡减少、闭锁增加和卵泡成熟度改变)导致POI。
涉及 DNA 损伤和修复、同源重组 (HR) 和减数分裂的基因中的大量基因突变。
这些基因包括基质抗原3(STAG3)、联会复合体中心元件1(SYCE1)、参与DNA修复的支架蛋白(SPIDR)、蛋白酶体26S亚基ATP酶3相互作用蛋白(PSMC3IP)、ATP依赖性DNA解旋酶同源物(HFM1)、mutS同源物(MSH)4、MSH5、MCM8、MCM9、cockayne综合征B-piggyBac 3(CSB-PGBD3)、核孔蛋白107(NUP107),以及乳腺癌易感基因(BRCA1和BRCA2).
内源性和外源性因素触发原始卵泡中DNA 双链断裂,由于细胞代谢的变化和氧化应激的升高,作为卵巢衰老的一部分,DNA损伤在原始卵泡中积累。在原始卵泡的氧化呼吸过程中,少量氧气首先在线粒体中转化为超氧化物,然后转化为羟基自由基。这些羟基自由基导致DNA单链断裂,如果双链断裂发生在多个相邻病变中,则会导致双链断裂和原始卵泡丢失。
线粒体是个多功能的细胞器,其异常与多种人类疾病相关,卵母细胞和颗粒细胞中的线粒体功能对卵巢的发育、功能维持都十分重要。
线粒体功能障碍可通过多种途径,如线粒体DNA 异常或逐渐积累的损伤、氧化应激、Ca2+ 对线粒体的直接损伤,导致卵子的发育潜能障碍,诱导卵子的凋亡而引起卵巢储备功能下降,进而发展成卵巢早衰。
▸TGF⁃β/ Smad 信号通路
TGF⁃β1/Smad 主要效应分子在卵巢组织中广泛表
达,参与病理性卵巢功能衰退,主要通过下调 TGF⁃β1/Smad3 信号通路因子表达,同时活化卵泡细胞质内 Smad2 表达;在生理性卵巢功能衰退中该信号通路的生物学效应可能与通过 Smad7 代偿性抑制通路的调节有关。
GDF-9 对窦状卵泡阶段的发育主要是通过减弱依赖 FSH的LH受体形成,防止卵泡过早发生黄素化和凋亡,直接决定卵泡池中卵泡数量,反映卵巢储备。
▸PI3-K / AKT 信号通路
磷酸酶和紧张素同系物(PTEN)/磷脂酰肌醇3激酶(PI3-K)/蛋白激酶B(AKT)/叉头转录因子3(FOXO3)信号通路在初级和进一步发育卵泡的卵母细胞的募集中起着重要作用。
PI3-K 和 AKT 过度激活可使原始卵泡过早发育及卵泡过快凋亡,进而发展成为卵巢早衰。
FOXO3a 是 PI3-K / AKT 信号通路下游的重要靶蛋白之一。FOXO3a的下调未能挽救颗粒细胞的凋亡死亡,导致卵母细胞丢失。卵母细胞特异性PTEN缺失导致全球原始卵泡激活,导致POI.
▸Wnt/ β⁃catenin 信号通路
合成类固醇激素是卵巢的重要功能之一。 目前现代医学认为卵巢 Wnt 信号通路可能是促性腺激素信号调节类固醇生成的重要信号途径之一。Wnt2 通过影响 β⁃catenin 的细胞定位来调节颗粒细胞增殖;β⁃catenin 参与合成卵巢甾体激素和黄体生成。
▸ SIRT 信号通路
SIRT1 通过调节氧化还原状态参与卵母细胞的成熟,以此减少氧化应激损伤导致的卵母细胞破坏和卵巢功能下降。
早发性卵巢功能不全患者存在系统性免疫失调,外周血T细胞亚群比例异常,Th1细胞占比显著升高,同时Treg细胞占比显著降低,提示细胞免疫参与早发性卵巢早衰发病。
注:Treg细胞是免疫抑制性淋巴细胞亚群,在维持免疫环境的稳定性和控制自身免疫疾病的发生中起重要作用。
免疫性卵巢早衰可能与辅助性Th17细胞过度活跃关系密切,E2水平低下时Th17细胞可过度激活,使机体免疫应答增强。
研究显示,卵巢早衰患者 Th17/Treg 水平较健康妇女明显增高,Th17和Treg 细胞表达失衡引发免疫调节紊乱,最终导致卵巢组织破坏和衰竭。
■ 为什么说肠道菌群与POI之间存在关联?
▸ 卵巢的自身免疫损伤
卵巢通过 T 细胞亚群的改变、T 细胞介导的损伤、产生自身抗体的 B 细胞的增加、效应抑制/细胞毒性淋巴细胞的减少以及自然杀伤细胞的减少而受到自身免疫的损害。
▸ 肠道菌群在自身免疫过程中发挥关键作用
肠道微生物群产生的肽可能会诱导免疫细胞产生自身反应和交叉激活。肠道微生物群的失调不仅会影响B淋巴细胞的激活和自身抗体的产生,还会诱导先天免疫细胞的异常激活,从而导致促炎细胞因子的上调。
▸ 肠道菌群在卵巢早衰中发挥重要作用
肠道微生物组在POI相关症状中发挥重要作用,包括自身免疫功能障碍、骨骼健康、认知、神经健康等。肠道微生物群及其代谢产物还具有调节炎症途径激活、脑肠肽分泌和胰岛β细胞破坏的能力。
我们具体来看相关的研究 ↓↓

2021年,深圳妇幼保健院检测了部分患者的肠道菌群,卵巢早衰女性(n = 35),健康女性( n = 18).
▸ POI患者中肠道菌群变化
下列菌群在POI女性中较少:
而下列菌群在POI女性中更丰富:
▸ 肠道菌群与自身免疫反应的关联
可以看到,拟杆菌属、双歧杆菌属和普氏菌属的相对丰度在该研究的POI组中均有所增加。这些菌群与自身免疫反应有何关联呢?
注:Th17细胞能够分泌产生IL-17A、IL-17F、IL-6以及TNF-α等,其功能主要就体现在它分泌的这些细胞因子集体动员、募集及活化中性粒细胞的能力上。
▸ 肠道菌群代谢产物诱导免疫调节活性
此外,双歧杆菌属、Blautia、Clostridium、Faecalibacterium、Roseburia和Ruminococcus可在人体肠道中产生短链脂肪酸,短链脂肪酸可以发挥什么作用呢?
综上,POI组肠道微生物组的所有这些变化可能通过某些细菌菌株及其代谢产物诱导免疫调节活性,这可能与自身免疫有关,进而影响POI的发展。
▸ POI肠道微生物群的改变与性激素有关
在这项研究中,在POI受试者中观察到显著较低的E2水平,通过调整BMI,E2水平与拟杆菌属、厚壁菌属和粪杆菌属的比例显著相关。FSH、LH和AMH水平也与某些微生物有关。
▸ 肠道菌群影响雌激素水平,雌激素调节的反应与POI相关
肠道微生物组通过分泌β-葡萄糖醛酸酶影响雌激素水平,使雌激素解凝,影响相关生理过程。
越来越多的研究表明,雌激素调节糖脂代谢、骨形成和炎症反应,其减少可损害雌激素依赖性过程,引发心血管疾病、骨质疏松等。这些症状都与POI有关。
肠道微生物群的失调与POI的发展有关,然而在进一步的研究中,还应考虑大样本量和多中心研究,来探索潜在的因果机制。
■ 为什么说阴道菌群与POI之间存在关联?
研究表明,细菌性阴道病与不孕有关。细菌性阴道病也被证明会改变阴道微生物组。
先前的一项研究表明,阴道微生物组在卵巢早衰的病理生理学中起着重要作用,卵巢早衰患者中乳杆菌属细菌的相对丰度显著低于健康对照组。因此,阴道微生物组和POI之间可能存在关系。
▸ POI患者中阴道菌群变化
下列菌群相对较少:
下列菌群显著增加:
我们具体来看相关的研究 ↓↓

2021年,深圳市妇幼保健院检测了部分患者的阴道菌群,卵巢早衰女性(n = 28),健康女性( n = 12).
▸ 阴道菌群与自身免疫反应的关联
可以看到,POI组中乳杆菌属、Odoribacter和Brevundimonas显著减少,链球菌属显著增加。这些菌群变化与自身免疫反应有何关联呢?
▸ 性激素水平会影响女性生殖道的防御能力和生殖期内的阴道微生物群
激素促进增生并增加糖原生成;糖原可以被阴道中的优势细菌乳酸杆菌转化为乳酸。这有助于保持阴道的酸性环境,抑制病原体的生长,并增强免疫系统。
在这项研究中,乳杆菌的比例与雌激素水平呈正相关,但与FSH水平呈负相关。POI患者的乳酸杆菌丰度和雌激素水平显著下降,FSH水平显著增加。
此外,AMH、FSH、LH、PRL、P和睾酮水平也与一些微生物有关,包括 Streptococcus, Odoribacter, Brevundimonas, Anaerococcus, Atopobium, Peptoniphilus, Prevotella, Veillonella,这增加了阴道微生物群改变与性激素相关的证据。
▸ 雌激素可以调节POI相关症状
越来越多的证据表明,雌激素可以调节POI相关症状,包括GLU和脂质代谢、骨形成和炎症反应。
在该研究中,GLU水平与Odoribacter和普雷沃氏菌属呈负相关。此外,PRL可以抑制FSH和促性腺激素释放激素以促进生育,这与厌氧球菌和嗜酸乳杆菌呈正相关。
▸POI患者阴道菌群的失调与卵巢功能密切相关
由于半乳糖和半乳糖代谢产物的积累,卵巢功能容易受损。先前的一项研究发现,半乳糖抑制了卵巢卵泡的数量和类固醇分泌。半乳糖代谢产物,包括1-磷酸半乳糖、半乳糖醇和尿苷二磷酸半乳糖,在干扰卵巢细胞凋亡和促性腺激素信号传导方面发挥重要作用。
患有POI的女性LACTOECAT-PWY通路的活性显著降低。这表明,患有POI的女性体内可能会积聚半乳糖,从而损害卵巢功能。患有POI的女性ARGONPROST-PWY通路显著富集。L-精氨酸与卵巢功能的调节相关。这可能对卵巢功能不利。
DNA损伤通过激活线粒体凋亡途径导致生殖功能障碍。
该研究结果表明,在POI患者中,许多与核糖核苷酸生物合成相关的途径发生了改变。
其他来自同济医院绝经与卵巢衰老专科门诊的研究数据发现:
双歧杆菌主要定殖在人体肠道中,在阴道中仅以低水平存在。作为一种益生菌,它具有抗炎作用、提高免疫功能和抵抗氧化损伤。临床研究发现,双歧杆菌可以改善绝经后妇女的新陈代谢和心血管功能。
Gardnerella和Atopobium均属于放线菌,在研究中发现 POI 患者显着富集,并且与卵巢储备下降、内分泌紊乱和围绝经期综合征症状显着相关。
阴道微生物组不仅反映了阴道的细菌组成,还反映了宿主的一般状况,包括激素和免疫状态等。阴道微生物群的失调与POI的发展有关,然而在进一步的研究中,还应考虑大样本量和多中心研究,来探索潜在的致病机制。
➔
这些测试可能帮助找到不孕的原因,找出排卵发生的时间,找出月经不规律或停止的原因,确认更年期或围绝经期的开始等。
➔
如果患有与POI相关的疾病,那么也必须对其进行治疗。治疗可能涉及药物和激素。
目前,没有经证实的治疗方法可以恢复女性卵巢的正常功能。但有一些治疗卵巢早衰症状的方法,或者可以降低其风险并解决POI可能导致的疾病:
激素替代疗法(HRT)
HRT是最常见的治疗方法。它给身体提供了卵巢无法产生的雌激素和其他激素。HRT可以改善性健康,降低患心脏病和骨质疏松症的风险。通常需要服用到50岁左右;这大约是更年期开始的年龄。
体外受精(IVF)
如果患有POI并且想怀孕,可以考虑尝试试管婴儿。
有规律的体育锻炼
有规律的体育锻炼,维持健康的体重,可以降低患骨质疏松症和心脏病的风险。
其他相关膳食补充方式,将在下一章节详细介绍。
除了那些遗传、免疫或医源性因素之外,日常饮食和生活方式中的营养摄入对于 POI 患者来说是最容易获得和改变的。
关于不良饮食习惯影响女性生育力和更年期的营养状况和调节的研究较少,这里初步提出了一些主要饮食因素和营养素:
Han Q, et al., Front Microbiol. 2022
碳水化合物为所有生物提供了最丰富的生命支持能源,通常分为单糖、寡糖和多糖。
Han Q, et al., Front Microbiol. 2022
半乳糖:毒性作用
半乳糖是卵巢早衰和相关不孕疾病中报道的一种常见单糖,它对卵巢产生了毒性作用。
半乳糖还可能抑制卵泡向性腺区域的迁移,并导致卵巢储备和雌二醇合成减少。因此,糖-半乳糖代谢异常与卵巢早衰的发生和发展有关。

铁皮石斛多糖:保护作用
铁皮石斛多糖(DO)对自然老化啮齿动物的卵巢早衰过程产生保护作用。
口服给药剂量为70 mg/kg,有助于这些大鼠恢复正常体重,减轻卵巢的病理变化,如血管增殖减少和卵泡减少。
DO导向的多糖通过调节NF-κB和p53/Bcl-2信号通路,提高谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)活性,降低血清中丙二醛(MDA)浓度,从而发挥抗氧化作用,从而减少卵巢组织的炎症损伤。同时还操纵了线粒体功能,恢复了卵巢细胞的活力。
碳水化合物对卵巢早衰发病或进展的重要性应进一步评估。
脂肪和体重高可能与卵巢早衰严重程度的控制有关。


Han Q, et al., Front Microbiol. 2022
一些研究报告称,绝经早期与低体重指数相关。具体机制尚不清楚。
脂蛋白是可运输的脂肪形式,积极参与人体内的代谢活动。
研究人员对卵巢早衰患者进行了血脂分析,发现血清中较高的甘油三酯(TG)浓度和较低的高密度脂蛋白(HDL)水平与游离雄激素指数增加和性激素结合球蛋白丢失相关。这些发现表明,TG升高可能导致胰岛素敏感性降低。
在另一项回顾性临床研究中同样发现,与具有密切流行病学特征的正常女性相比,出现卵巢早衰综合征且既往无激素摄入史的年轻女性患者血清中总胆固醇(TC)和低密度脂蛋白(LDL)浓度更高。结果表明,女性卵巢早衰患者在雌激素缺乏的情况下会引发脂质改变。
然而,不同研究中HDL的浓度水平非常不一致,一些研究报告HDL水平升高,另一些研究报告更年期妇女HDL水平降低。
至于脂肪摄入对更年期的影响,不同种类的脂肪可能会造成差异,包括多不饱和脂肪、总脂肪和饱和脂肪。
有研究认为,多不饱和脂肪的高消费与绝经较早有关;同时,总脂肪和饱和脂肪摄入量几乎不影响绝经期和年龄。
然而,尚不清楚日常饮食中的不同脂肪类型是否会以某种方式影响卵巢早衰的发病机制。
“
高蛋白摄入有助于推迟更年期的提前到来


Han Q, et al., Front Microbiol. 2022
研究发现,海鲜(每周约3天)和新鲜鸡蛋(每周超过4天)的消费与绝经晚期发病呈正相关。其他几项研究也支持类似的结论。研究人员认为,高蛋白摄入有助于推迟绝经并延长生殖功能。欧洲癌症与营养前瞻性调查(EPIC)还进行了一项队列研究,其中早期绝经的发生与蛋白质摄入量呈负相关。
除了直接摄入蛋白质外,多肽对保护卵巢功能和延缓卵巢衰老也很重要。
通过酶解从牡蛎中纯化的牡蛎多肽,由于其DPPH(2,2-二苯基-1-苦酰肼基)自由基清除剂能力,能够保护其免受氧化应激和炎症,从而对卵巢早衰产生治疗作用。
牡蛎多肽可以纠正异常的发情周期,提高血清卵泡刺激素(FSH)和黄体生成素(LH)浓度。此外还增加了原始卵泡计数和分布,并通过模拟SOD清除显著减轻了卵巢细胞死亡。牡蛎多肽支持的卵巢细胞保护和存活在调节死亡受体BCL-2依赖性信号通路时被激活。因此,适当的蛋白质和肽摄入可能是影响卵巢早衰进展和严重程度的潜在途径。
维生素是一类仅来自食物的微量有机物质,在人体内维持一些重要的生理活动和功能。它们不提供能量,但调节代谢过程。许多维生素在支持女性健康方面发挥着关键作用,如维生素B、C、D、E和一些辅酶。


Han Q, et al., Front Microbiol. 2022
烟酸:改善卵泡发育,保护卵巢
烟酸属于维生素B家族,代谢细胞能量,并直接影响正常生理。除了许多神经和皮炎疾病外,烟酸还通过抑制氧化应激来改善卵泡发育,从而减少卵巢细胞死亡。
有趣的是,烟酸还能够改变卵巢早衰表型并恢复化疗或辐射刺激诱导的雌性卵巢早衰小鼠。作者进一步证实,添加10 Mmol烟酸可以降低卵泡阻滞标记FOXO3的表达水平,并增加卵母细胞标记DDX4的表达水平以发挥卵巢保护作用。
叶酸:妊娠率更高,提高卵母细胞的质量和成熟度
叶酸是一种水溶性维生素B,对蛋白质合成、红细胞分裂和生长很重要。
一项基于小样本的临床研究报告称,与安慰剂治疗相比,低生育率女性在接受400μg叶酸治疗12周后的妊娠率更高。叶酸的摄入缩短了健康女性的备孕时间,并提高了卵母细胞的质量和成熟度。
MTHFR可以强烈影响叶酸循环,并帮助同时患有非霍奇金淋巴瘤和重复妊娠损失的卵巢早衰患者成功分娩出健康的男婴。
维生素C:显著刺激卵巢标志物的表达
维生素C是一种天然抗氧化剂,并积极参与干细胞调节。
据报道,维生素C修饰人羊膜上皮细胞(hAECs)的生物学特性,并显著刺激移植POI小鼠卵巢组织中卵巢标志物的表达。
注:羊膜细胞通俗地说就是包裹羊水的那层透明薄膜上的细胞。
可能的影响机制是维生素C依赖的几种重要生长因子的旁分泌,如肝细胞生长因子和表皮生长因子。
维生素D:有争议
维生素D属于脂溶性维生素,通过调节钙和磷酸盐代谢对维持生命至关重要。其活性形式1,25-二羟基维生素D3定位于许多器官,如肾脏、肝脏、大脑和卵巢。在女性生殖系统中,维生素D可以调节颗粒细胞中的抗苗勒氏激素(AMH)分泌,从而影响FSH水平。
然而,它在卵巢早衰发病机制中的作用是有争议的,因为一些人声称它不影响卵巢早衰的病理生理过程。
而另一些人则报告维生素D缺乏与凝血相关,是由于卵泡发育不良和芳香化酶水平降低而导致卵巢早衰的主要因素。
先前的研究也没有报告任何关于补充维生素D治疗卵巢早衰的证实性发现。研究发现,在约2个月内,每周摄入50000 IU的维生素D与临床上的妊娠改善无关。提高卵子受体患者的血清维生素D水平也不能改善IVF结局。
因此,维生素D对卵巢早衰患者的意义的解释仍然模糊,仍需进一步调查。
维生素E:增加卵巢体积并刺激初级卵泡的增殖
维生素E主要由生育酚和生育三烯醇组成,它们在生理和病理条件下对清除自由基很重要。维生素E缺乏可能导致雌性啮齿动物模型中的卵巢细胞死亡和发育异常。
在一项临床研究中,在40名患者中,维生素E与卵巢早衰的发病有关。在月经正常的女性中,维生素E-α生育酚的活性形式浓度显著高于卵巢早衰患者。进一步分析表明,这可能与AMH表达水平降低有关,并表明卵巢储备能力在卵巢早衰发病机制中受到损害。
在另一项随机对照试验研究中,向卵巢早衰患者服用400IU的维生素E 3个月,除改善AMH水平外,还显著增加了窦卵泡数和平均卵巢体积。
补充维生素E可能有助于缓解卵巢早衰过程,几乎不会产生副作用。
植物雌激素确实不是雌激素的一部分,但通过提供高亲和力的雌激素受体β作为激素补充剂,其功能类似。


Han Q, et al., Front Microbiol. 2022
它们通常包括大豆异黄酮和芝麻木脂素,这两种都是我们日常饮食中重要和普通的食物类型。几项研究证实了植物雌激素消耗对绝经后女性TC、LDL和血脂的降低作用。
大豆异黄酮摄入也显著缓解了髂动脉动脉粥样硬化,绝经前后5年内食用大豆食物的女性减少了冠状动脉斑块的大小。对于绝经后开始以大豆食品作为日常饮食的人来说,这种有益效果并不明显。
研究人员指出,大豆异黄酮可以通过卵巢切除术减少更年期啮齿动物的潮热。该效应基于肠道微生物群和雌激素样机制产生的异丙戊酸雌马。
芝麻籽木脂素(芝麻籽油中的一种成分)在小鼠模型中增加了脂肪酸的β-氧化,并抑制了胆固醇的吸收。芝麻酚是一种强抗氧化剂,也是芝麻的主要成分。它可以改善记忆,减轻焦虑情绪,减少中枢神经系统中的氧化剂损伤。同时,与卵巢切除后的绝经大鼠相比,芝麻酚还通过降低血清中肿瘤坏死因子-α(TNF-α)浓度来调节血清中的脂质成分,并降低炎症效应。
益生菌、益生元和合生元


Han Q, et al., Front Microbiol. 2022
益生菌促进营养物质的消化和吸收,提高免疫功能,维持肠道菌群的结构平衡,并增强人体的抗氧化水平。许多益生菌应用于食品补充剂和医疗。对于女性健康,激素水平与肠道或阴道微生物群之间存在密切相关性。
在平滑肌瘤和乳腺癌患者中,肠道微生物群被视为雌激素的替代代谢供应商,主要富含大肠杆菌、梭状芽孢杆菌、乳酸杆菌和拟杆菌。
考虑到这些现象,益生菌的调节作用也可以通过改变几种具有雌激素或抗雌激素性质的蔬菜成分(称为植物雌激素,如大豆异黄酮、木脂素等)的代谢活性和效率以间接方式调节肠道微生物群来发挥。
益生菌参与调节经前综合征、泌尿生殖道感染和骨质疏松症。雌激素缺乏是与卵巢早衰后骨炎症和吸收相关的骨质疏松症的主要原因。
先前的研究表明,肠道微生物群对骨形成和代谢有潜在影响。在接受益生元治疗的小鼠、大鼠和鸟类中发现骨骼增加。
在体外和去卵巢的啮齿类动物研究中,益生菌罗伊氏乳杆菌抑制了骨髓CD4+T淋巴细胞的上调和随后的破骨细胞活化。研究人员假设罗伊氏乳杆菌可以直接使T细胞失活并抑制TNF-α的产生,并通过T细胞间接使基质细胞失活以减少破骨细胞因子的形成,从而增加骨代谢活性并减少骨损失。
在一项由60名40至60岁绝经后妇女组成的随机对照试验中,益生菌还增强了异黄酮的代谢活性,以缓解泌尿生殖系统问题,如阴道干燥和绝经后的不良性体验,连续治疗16周。该效果与低剂量阴道雌激素相当,后者是治疗更年期泌尿生殖系统综合征的金标准疗法。
研究人员在一项为期12周的随机临床试验中报告,1×1010菌落形成单位(CFU)浓度的多菌益生菌影响肠道通透性和心脏代谢参数,如脂多糖水平、胰岛素、葡萄糖、尿酸、脂肪质量、皮下脂肪和胰岛素抵抗指数。
研究人员在一项试点临床研究中发现,乳酸杆菌和蔓越莓提取物复合物可以防止女性患者在绝经前或绝经前后连续26周反复发生尿路感染。
益生元是发酵的膳食纤维,其在肠道微生物群的成分和/或生物活性方面都含有一定的修饰,对人体健康状况产生有益影响。目前,益生元主要包括双歧杆菌、不易消化的低聚糖(尤其是低聚半乳糖、菊粉及其水解产物低聚果糖)。
大量的营养益生元可能有助于钙的生物吸收,如酪蛋白磷酸肽(CPP),酪蛋白的蛋白水解产物,与钙一起构建可溶性复合物。此外,一些复杂的有机酸,如苹果酸或柠檬酸,可以增加肠道中生物可吸收钙的可溶性复合物的百分比。
益生元依赖性钙代谢的潜在机制包括来自结肠中细菌发酵碳水化合物的酸代谢产物,如乳酸、乙酸和丙酸,降低了pH值,以提高钙离子的管腔水平,并增加钙的被动生物吸收。此外,电荷可以通过Ca2+-H+复合物进行修饰。因此,益生元在女性绝经后骨质疏松症的预防和抑制中发挥了保护作用。
研究人员表明,壳聚糖和柑橘果胶这两种益生元增强了葡萄糖耐量,降低了血脂异常,并提高了血清精氨酸、丙酸、亮氨酸和丁酸水平。此外,壳聚糖更有助于调节肠道微生物群,从而影响绝经后症状。
还尝试将益生菌和益生素结合起来生产合生元。研究人员表明,副干酪乳杆菌和菊粉增强了异黄酮的生物活性可用性,有助于缓解更年期问题。
使用由发酵乳杆菌和花椰菜蘑菇中的β-葡聚糖组成的合生元作为益生菌和益生元,可以降低啮齿动物尾巴的皮肤温度,并保持血清和子宫指数中的17β-雌二醇水平。合生元依赖性机制进一步得到验证,因为它们激活了肝脏胰岛素信号,随后在雌激素缺乏大鼠中激活了AMPK磷酸化。
这些研究初步反映了益生菌、益生元和合生元在调节更年期综合征及其主要病理生理过程中的有益作用。这些发现对于研究卵巢早衰的发病机制和通过微生物营养策略治疗卵巢早衰至关重要。
营养对女性一生的健康至关重要,膳食营养素可以通过影响各个方面来延缓更年期,从直接提高卵巢活力和功能到抵消氧化应激、炎症、衰老和系统性内分泌失调。
越来越多的证据表明肠道菌群的改变与卵巢早衰相关,可能通过影响一些重要代谢物影响卵巢疾病进展,至于是否会导致血清代谢物失衡,进而导致更年期表现和相关健康问题,仍有待进一步验证。
从目前的研究来看,膳食和微生物营养素对于调节卵巢早衰等女性生殖障碍很重要且很有前途,因此,通过合理饮食、最佳生活方式对菌群进行干预是有希望的,值得更多研究人员的关注,希望为广大女性带来更健康的生活。
主要参考文献:
Han Q, Chen ZJ, Du Y. Dietary supplementation for female infertility: Recent advances in the nutritional therapy for premature ovarian insufficiency. Front Microbiol. 2022 Nov 17;13:1001209. doi: 10.3389/fmicb.2022.1001209. PMID: 36466679; PMCID: PMC9712792.
Chon SJ, Umair Z, Yoon MS. Premature Ovarian Insufficiency: Past, Present, and Future. Front Cell Dev Biol. 2021 May 10;9:672890. doi: 10.3389/fcell.2021.672890. PMID: 34041247; PMCID: PMC8141617.
Zhang X, Lu Y, Wu S, Zhao X, Li S, Zhang S, Tan J. Estimates of global research productivity in primary ovarian insufficiency from 2000 to 2021: Bibliometric analysis. Front Endocrinol (Lausanne). 2022 Oct 26;13:959905. doi: 10.3389/fendo.2022.959905. PMID: 36387882; PMCID: PMC9645456.
Wu J, Zhuo Y, Liu Y, Chen Y, Ning Y, Yao J. Association between premature ovarian insufficiency and gut microbiota. BMC Pregnancy Childbirth. 2021 Jun 5;21(1):418. doi: 10.1186/s12884-021-03855-w. PMID: 34090383; PMCID: PMC8180047.
Takahashi A, Yousif A, Hong L, Chefetz I. Premature ovarian insufficiency: pathogenesis and therapeutic potential of mesenchymal stem cell. J Mol Med (Berl). 2021 May;99(5):637-650. doi: 10.1007/s00109-021-02055-5. Epub 2021 Feb 27. PMID: 33641066.
Kim S, Lee SH, Min KJ, Lee S, Hong JH, Song JY, Lee JK, Lee NW, Lee E. Females with impaired ovarian function could be vulnerable to environmental pollutants: identification via next-generation sequencing of the vaginal microbiome. J Obstet Gynaecol. 2022 Jul;42(5):1482-1488. doi: 10.1080/01443615.2021.2006162. Epub 2022 Jan 7. PMID: 34996320.
Wu J, Ning Y, Tan L, Chen Y, Huang X, Zhuo Y. Characteristics of the vaginal microbiome in women with premature ovarian insufficiency. J Ovarian Res. 2021 Dec 8;14(1):172. doi: 10.1186/s13048-021-00923-9. PMID: 34879874; PMCID: PMC8655991.
Wen J, Feng Y, Yan W, Yuan S, Zhang J, Luo A, Wang S. Vaginal Microbiota Changes in Patients With Premature Ovarian Insufficiency and Its Correlation With Ovarian Function. Front Endocrinol (Lausanne). 2022 Feb 22;13:824282. doi: 10.3389/fendo.2022.824282. PMID: 35273569; PMCID: PMC8902819.
谷禾健康
你知道肠道和大脑之间的秘密吗?
大脑自闭了,为什么是肠道的锅?
肠道真的会影响大脑嘛,原理是啥?
……
已经有越来越多人开始好奇肠道和大脑之间的联系,关于这方面的前沿研究也在不断更新,人们开始逐渐深入了解相关机制。

中枢神经系统功能与肠道微生物之间存在关联,即大脑和肠道之间的串扰,与迷走神经、肠神经系统、免疫系统和循环相互作用。胃肠道微生物群可以影响神经系统,无论是通过迷走神经直接输入大脑,还是通过间接激活整个胃肠道的肠神经系统。
以下是我们整理过相对较全面的关于肠道和神经系统相关的文章:
深度解读 | 肠道菌群和中枢神经系统的关系
肠道微生物群在神经系统疾病中的作用
本文在这个基础上,结合最新研究进展,再次阐述人类肠道微生物组在神经系统疾病发病机制中的潜在作用,讨论了精神药物、益生菌、益生元、合生元、后生元、粪菌移植等方式治疗神经系统疾病的潜在作用。

大家越来越有这样的认知:胃肠道微生物群的不平衡会影响大脑的生理、认知和行为。
肠道微生物群通过神经、免疫、体液和内分泌联系参与肠-脑双向相互作用。我们先来了解一下以下它们之间几种“交流方式”:
肠道主要通过两条神经解剖学途径与大脑进行沟通。
首先,大脑和肠道直接通过迷走神经(VN)和脊髓中的自主神经系统(ANS)进行沟通。
其次,细菌通过迷走神经和肠神经系统传入神经元的刺激在大脑和胃肠道微生物群之间建立直接的神经联系。
此外,迷走神经激活表现出抗炎作用,迷走神经活动对肠道微生物群及有益菌的产生积极影响。
迷走神经可以将胃肠道中的内分泌、神经元和微生物改变转移到大脑。
几项临床前研究表明,肠道疾病的病理生理学和发病机制,包括炎症性肠病(IBD)和肠易激综合征(IBS),以及神经系统疾病和精神疾病,包括焦虑、抑郁、自闭症、阿尔茨海默、多发性硬化和帕金森病,与肠道微生物群失衡有关。
由于微生物群-肠-脑轴(MGBA)内存在多种相互作用机制,胃肠道微生物组主要通过免疫相关、神经、内分泌和代谢信号通路与中枢神经系统进行通信。
肠道微生物可通过在肠腔中产生大量代谢物与宿主交换感官信息,包括神经递质、GABA、血清素、多巴胺和去甲肾上腺素,激素(如下丘脑-垂体-肾上腺轴中促肾上腺皮质激素释放激素的分泌)、组胺、乙酰胆碱、儿茶酚胺,以及几种维生素和短链脂肪酸。其中一些分子可以通过血脑屏障进入大脑,并影响神经回路。在这些代谢物中,短链脂肪酸是结肠细菌发酵膳食纤维产生的主要代谢物,在调节神经免疫内分泌、代谢稳态、感染和炎症方面发挥着关键作用。
许多种类的乳酸杆菌和双歧杆菌产生γ-氨基丁酸(GABA),这是大脑中主要的抑制性神经递质。
念珠菌、大肠杆菌和肠球菌会产生神经递质5-羟色胺,而一些芽孢杆菌会产生多巴胺。
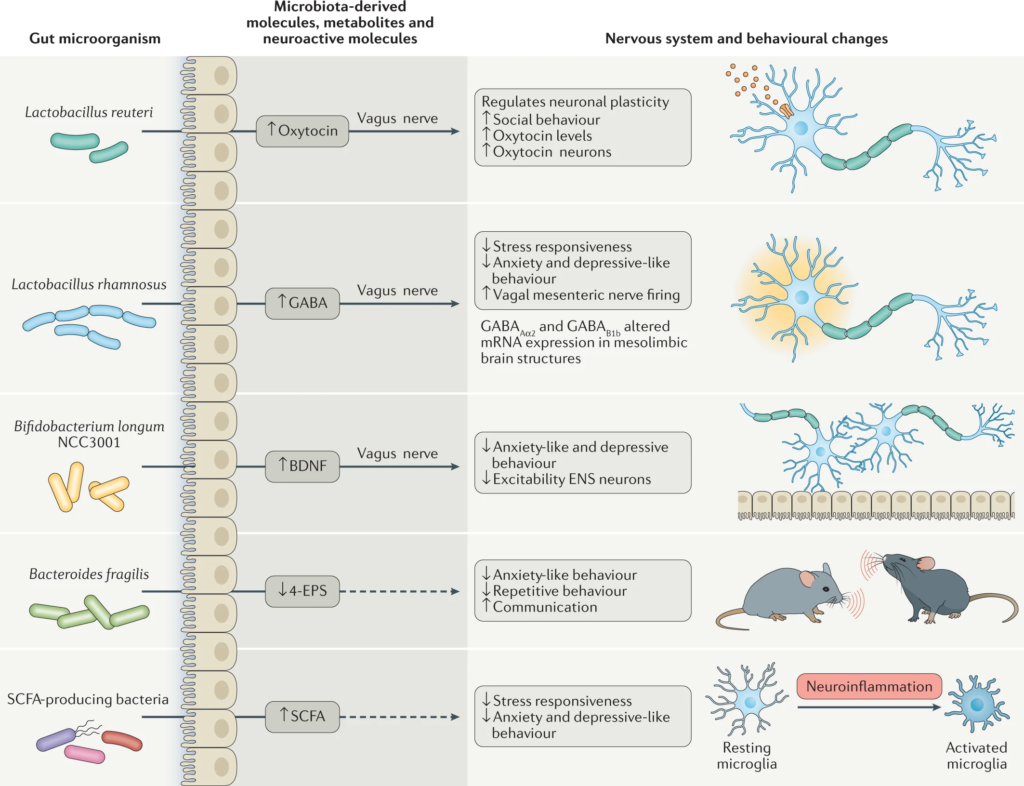
Morais LH, et al. Nat Rev Microbiol. 2021.
微生物群代谢产物,包括维生素、神经活性代谢物(如短链脂肪酸)和神经递质,介导双向微生物群-肠-脑轴相互作用以调节宿主神经生理学和免疫。
微生物代谢产物——短链脂肪酸,如乙酸、丙酸、丁酸,也可以通过进入体循环影响中枢神经系统。
短链脂肪酸能够刺激交感神经系统,粘膜血清素的释放,从而影响大脑的记忆或学习过程。
大约95%血清素(5-羟色胺)由肠粘膜嗜铬细胞产生。在外周,5-羟色胺参与Gl分泌、运动(平滑肌收缩和放松)和疼痛感知的调节,而在大脑中,5-羟色胺参与情绪和认知的调节。
肠道微生物群在色氨酸代谢中也起着重要作用,色氨酸代谢是产生5-羟色胺的前体。例如,婴儿双歧杆菌通过增加血浆色氨酸影响中枢5-羟色胺的传递。
我们知道了以上化学信使,那么它们通过什么途径去发挥作用?
细菌神经活性代谢物和饮食分子可以通过多种方式改变大脑和行为,例如影响上皮细胞以影响上皮屏障的功能,肠内分泌细胞释放激素,通过树突状细胞调节小胶质细胞和免疫细胞的功能。
代谢产物在通过血脑屏障运输后直接影响,或通过神经内分泌、免疫或迷走神经途径间接影响。
血脑屏障
细菌可以直接将因子释放到体循环中或可以转移到血液中。一旦进入血液,微生物组及其因子可以改变外周免疫细胞,促进与血脑屏障的相互作用,并最终与神经血管单元的其他元素相互作用。菌群代谢产物,例如短链脂肪酸,可穿过血脑屏障以影响脑功能。
肠道屏障
肠道微生物群还可以影响肠道屏障的完整性,控制信号分子从肠腔到固有层(包含免疫细胞和ENS神经元末端)或门静脉循环的通道。肠道屏障的完整性在某些神经精神疾病中会被破坏,如焦虑症、自闭症谱系障碍和抑郁症。
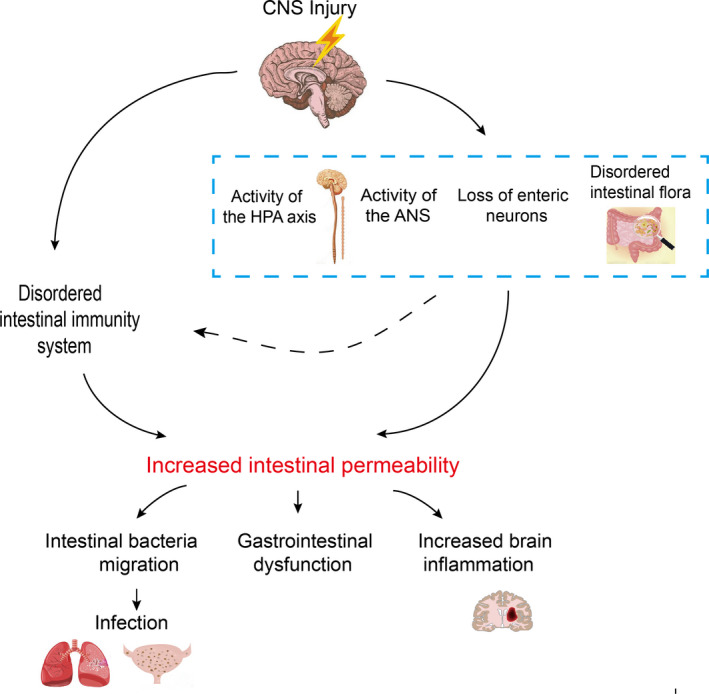
Li XJ,et al., CNS Neurosci Ther. 2020
肠道通透性
慢性应激可改变肠道通透性(肠漏综合征),这与低度炎症有关,在功能上与抑郁症等精神疾病有关。
在许多情况下,循环中细菌内毒素(脂多糖,LPS)的增加是导致疾病的基本危险因素。
肠道屏障和肠道通透性区别:
肠屏障
是将肠腔与内部宿主分开的功能实体,由机械元件(粘液、上皮层)、体液元件(防御素、IgA)、免疫元件(淋巴细胞、先天免疫细胞)、肌肉和神经元件组成
肠道通透性
指给定部位肠道屏障的功能特征,可通过分析整个肠壁或跨壁成分的定义分子的通量率进行测量
神经内分泌(HPA轴)
在神经系统内,应激是如何激活HPA轴反应?
该反应涉及下丘脑神经元,该神经元向大脑或门静脉循环分泌激素,如促肾上腺皮质激素受体激素(CRH),触发促肾上腺皮质激素(ACTH)的释放,然后启动皮质醇的合成和释放。
皮质醇调节神经免疫信号反应,进而影响肠屏障的完整性。
肠道渗漏导致促炎状态,循环中TNF-A、干扰素-y和IL-6水平升高。已知IL-6激活HPA轴。
随着时间的推移,它也下调糖皮质激素受体。这些受体是抑制HPA轴的反馈机制,然而,它们的下调导致HPA轴过度活跃和过度敏感。
有研究表明,这些变化导致海马5-羟色胺的减少以及BDNF表达的减少。BDNF表达降低是抑郁症发病的危险因素。
应激激素、免疫介质和CNS神经递质可激活肠神经系统的神经细胞和迷走神经的传入通路,从而改变肠道环境和微生物群组成。
目前,已经表明胃肠道微生物群在发展大脑免疫和神经发育中起着核心作用。
大脑并非免疫“特权”器官
免疫系统和中枢神经系统都是复杂而有组织的系统,在运作模式和发育过程中具有共同的特征。大脑中可以产生参与先天免疫的分子,如Toll样受体(TLR)、细胞因子、以及适应性免疫相关分子,如抗体受体和主要组织相容性复合体(MHC),这些分子在脑发育中起着关键的调节作用。
脑膜淋巴细胞和血脑屏障
尽管以前认为大脑是一个免疫特权器官,但它包含脑膜淋巴管。脑膜中淋巴管的存在使我们能够深入了解中枢神经外周免疫系统之间的可能联系,从而影响自身免疫。
此外,淋巴细胞和小胶质细胞可以调节认知,对神经元回路的正确连接也是必不可少的。小胶质细胞是巨噬细胞,占所有神经细胞的10%。它们负责中枢神经系统主动免疫防御的基本作用。而且大脑大部分区域的血管系统发展出选择性血脑屏障的组织特异性,允许所需分子进入大脑,并限制潜在有毒物质或细胞的渗透。
免疫影响大脑和神经
免疫细胞具有渗透大脑的能力。浸润性免疫细胞或小胶质细胞能够与中枢神经系统有效地相互作用,并影响大脑功能和病理学。
小胶质细胞从胚胎祖细胞中出现,并可在中枢神经系统中经历自我更新的过程。它们不仅参与典型的免疫功能,如吞噬和抗原递呈,还参与一些大脑生理活动。
免疫细胞如中性粒细胞、巨噬细胞、T细胞和自然杀伤(NK)细胞从大脑的外周循环血液进入。小胶质细胞对行为和某些神经系统疾病有着巨大的影响,如神经退行性疾病。
通常,成人大脑神经发生受宿主肠道微生物群的影响。成年小鼠的抗生素治疗影响肠道微生物群的多样性和海马的神经发生,而且益生菌具有重建肠道微生物群的能力并显示神经发生改善。
菌群与免疫
最近的许多研究表明肠道微生物组与大脑以及肠道微生物组与免疫系统调节之间存在联系。对无菌和对照啮齿动物的研究表明,肠道微生物组的缺失会加剧焦虑样行为。此外,如果肠道微生物群在生命早期恢复,这种行为完全可以治愈。微生物代谢产物可通过血液循环转移到大脑,并影响迷走神经或免疫系统和炎症反应,这表明由于生态失调引起的微生物代谢紊乱可对焦虑相关疾病产生巨大影响。
菌群招募免疫细胞
肠道微生物群落通过在各种免疫条件下招募不同的免疫细胞,直接或间接调节肠道内的免疫反应。胃肠道微生物的动态和异质性特征是宿主体内平衡的基础。据报道,与野生型小鼠相比,以胃肠道淋巴细胞水平降低为特征的免疫系统发育不平衡减少了无菌小鼠中免疫球蛋白a(IgA)、抗菌肽(AMP)和未成熟肠道相关淋巴组织(GALT)的数量,强调胃肠道微生物组在宿主免疫形成中的重要作用。
病原识别和抗体反应
此外,肠道免疫系统在区分共生动物和病原体以及确定导致免疫耐受的因素方面至关重要。因此,肠道菌群可以调节免疫系统的发育和功能,形成肠道微生物群落并调节肠道粘膜表面的病原体。例如,据报道,无菌小鼠中辅助性T细胞1(Th1)和Th17细胞数量的减少,以及IL-22和IL-17的减少,导致固有层数量减少。
影响T和B细胞发育和反应
肠道微生物组影响肠道T和B细胞反应的诱导和发展。肠道微生物群在肠道CD81 T淋巴细胞的激活中起着重要作用。
胃肠道微生物组影响固有层处肠道驻留B淋巴细胞的发育,因为无菌小鼠的固有层处B细胞计数较低。此外,这种类型的细胞也能够产生IgA,作为微生物成分的强调节因子。这表明在促进对共生微生物的免疫耐受以及在固有层中实现IgA的广泛多样化方面具有突出作用。
菌群代谢物参与免疫
对短链脂肪酸的研究表明,除了增强肠道系统中调节性T淋巴细胞的功能和数量外,它们还可以通过抑制转录因子NF-kB和HDAC活性来促进抗炎作用和肠道屏障功能。微生物肠道菌群与芳香烃受体(AhR)结合产生的色氨酸衍生物影响肠道免疫系统的功能。肠道菌群可产生精氨酸衍生物,包括二胺、精胺、亚精胺和多胺,通过增强常驻免疫细胞和肠粘膜的内环境平衡来调节免疫反应 。
微生物群与大脑之间通过肠脑轴的分子通讯途径
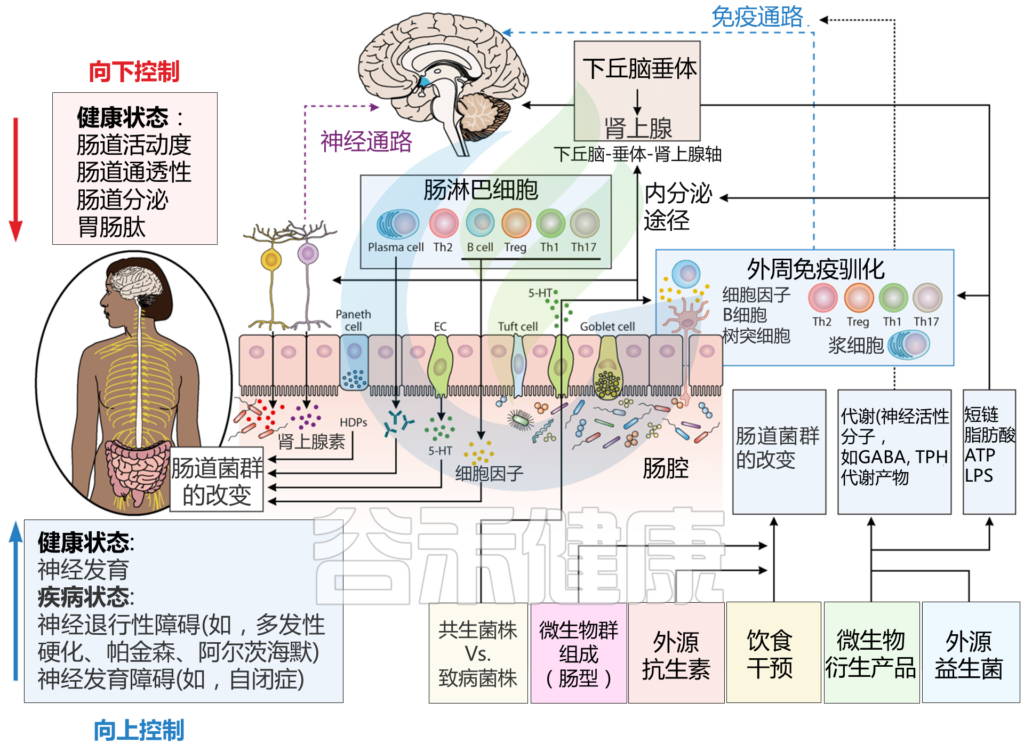
Sorboni SG, et al.,Clin Microbiol Rev. 2022
肠神经系统在人的一生中经历了一个巨大的发育变化,同时在病理生理功能方面保持了灵活性。因此,随着年龄的增长,肠神经系统开始衰弱,宿主微生物群、免疫系统和生理学也开始衰弱。
注:肠道神经系统是周围神经系统中最复杂、最重要的部分之一,由小神经节和神经元组成。这些神经元分布在整个胃肠道膜。
在了解菌群与神经衰退之前,首先看一下菌群与神经发育的关系。
大脑发育是一个复杂的过程,通常从妊娠第三周开始,一直持续到青春期晚期,生命的前3年被认为是胃肠道微生物群和脑突触形成的中心时期。
对无菌(GF)小鼠模型的研究表明,胃肠道微生物群、行为表现和大脑功能之间存在相关性。应激反应比无特定病原体(SPF)小鼠强烈得多。据报道,无菌小鼠模型中突触形成标记物水平的降低,包括分别负责突触成熟的突触素和PSD95,突出了共生细菌在大脑发育中的重要性。基于这些结果,肠道菌群似乎在大脑发育过程中对神经网络的形成起着核心作用。
部分自闭症患者表现出慢性便秘、肠道通透性增高、腹痛和肠道微生物群紊乱的症状,从而提供了生态失调和神经发育障碍之间的可能联系。微生物从母亲转移到胎儿、分娩方式、抗生素暴露和饮食习惯都会改变婴儿微生物群的定植和成熟。
怀孕期间补充抗生素会导致母体和新生儿肠道菌群的破坏,随后运动活动的减少,以及新生儿行为的改变。因此,临床证据支持抗生素诱导的失调与几种神经发育障碍的发展相关,包括精神分裂症、抑郁症和双相障碍。
尽管需要更多的研究来阐明上述因素与神经发育障碍之间的分子联系,但操纵早期生命微生物群可以被认为是预防自闭症和其他神经疾病的有益手段。
肠神经系统是否随年龄增长而变化?
一些研究认为随着年龄的增长,肌间神经元的数量和功能都会减少,而其他研究则没有报道这种后果。因此,肠神经系统是否会随着年龄的增长而发生变化仍在激烈争论中。
肠神经系统随年龄变化的研究表明,肠神经节的形态发生了变化,变性神经纤维的识别,α-突触核蛋白(α-syn)和脂褐素积累。这些报告表明老化和肠神经系统退化之间存在相关性。
肠神经系统在肠道细胞活动、营养吸收和肠道激素分泌中具有重要作用。针对肠神经系统的研究虽多,但机制不明确。根据以上研究证据,有理由假设肠神经系统发生了退化性变化,与宿主生理学、代谢、微生物群以及与衰老相关的免疫系统的变化相一致。
考虑到肠神经系统细胞不同的功能和形态特征,不同的细胞类型在年龄相关疾病的易感性中起主要作用。代谢活跃的神经细胞中氧化DNA损伤和活性氧(ROS)产生的负担可能是肠神经系统衰老的另一个潜在因素。
根据强调在老年动物模型中降低钙结合蛋白表达的重要性的研究,钙失调也可被认为与肠神经系统衰老有关。也有报道称,在衰老过程中,肠神经细胞中的钠通道基因表达显著改变。
对肠神经系统的年龄相关影响的额外研究是必要的,可能有助于对这些复杂的衰老和胃肠道关联的新理解,也可能带来新机会,发现治疗各种年龄相关神经疾病的新治疗方法,以及改善老年人的生活质量。
肠道微生物群与肠神经系统
考虑到胃肠道肠道神经元附近定植的微生物,肠神经系统似乎与肠道微生物群高度相关或可能受其影响。
几项研究表明,新生儿肠神经系统的发育是由早期暴露于肠道常驻微生物形成的。此外,肠道微生物群可以调节神经胶质细胞对固有层的初始定植以及稳态。
随着年龄的增长,拟杆菌和变形杆菌(尤其是Gammaproteobacteria)数量增加,厚壁菌和双歧杆菌数量显著减少。
与衰老过程中肠道微生物群的实质性变化类似,成人肠道神经元对年龄相关损伤的敏感性更高。肠道微生物群平衡的改变,包括条件致病菌的增加和有益菌或共生菌的减少,可导致胃肠道的不同微生物代谢产物谱。
因此,由肠道菌群的年龄相关改变引起的肠道炎症水平升高会影响肠神经系统,并导致肠道神经元不同生理和神经化学功能的损害或丧失,从而导致年龄相关疾病的发生。
肠神经系统还可以调节肠道微生物群落组成,维持和促进肠道健康。此外,肠道微生物群落的缺失可导致肠神经系统功能的异常和改变。
也有研究表明,肠道失调和肠道病理的发展与胃肠动力紊乱相关,表明肠神经系统在肠道微生物群维持和预防可导致宿主疾病的病原菌过度生长中的重要作用。
尽管确切的机制仍需澄清,但从肠-脑轴和老年人群神经病变的角度来看,肠道微生物群、粘膜免疫系统、肠道神经元和肠上皮细胞之间复杂的相互作用和相互作用强调了该领域研究的重要性,并强调了进一步研究的必要性。
胃肠道菌群和神经-肠内分泌系统中与年龄相关的变化可能通过肠-脑信号通路功能障碍影响大脑健康的分子通路图如下。
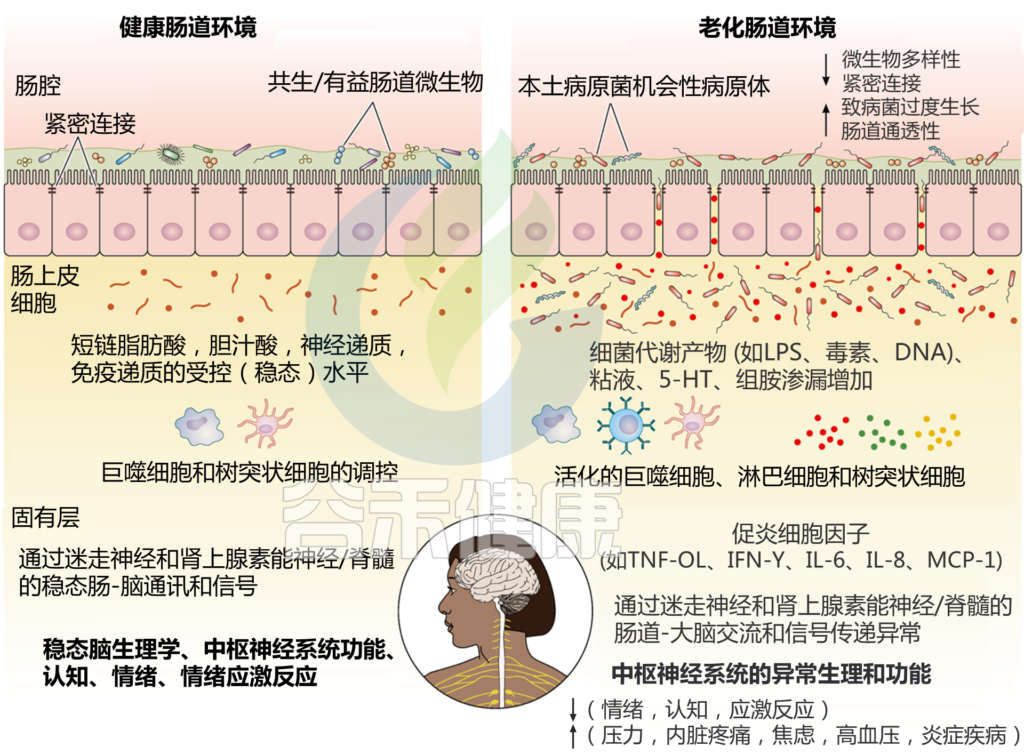
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在健康成人中,平衡的肠道菌群和肠道屏障完整性有助于维持平衡的微生物群落及其代谢产物,包括短链脂肪酸。胃肠道中神经递质的适当产生有助于通过巨噬细胞和树突状细胞的平衡增殖维持受控的肠道炎症和免疫系统,最终导致受控的肠脑通讯和中枢神经系统的适当功能。
然而,在衰老宿主中,胃肠道微生物群落多样性的改变和肠道屏障完整性的破坏,通过短链脂肪酸、LPS、5-羟色胺、组胺、葡萄糖和葡萄糖水平的不平衡,导致胃肠道上皮细胞衬里的生化和微生物微环境发生扰动,分泌性免疫球蛋白(sIgA)等。因此,在肠道环境中诱导过度激活的炎症环境导致健康肠道-大脑沟通中断。
老化的微生物组本身足以导致认知障碍
微生物群移植研究表明,老化的肠道微生物群可导致年轻受体发病。从老年供体小鼠到无菌受体小鼠的肠道微生物群移植有助于促进肠道炎症和增加通透性,这表明与较高水平的变形菌和TM7细菌相关。
最近的一项研究表明,来自老年供体小鼠的粪便微生物群移植导致年轻受体小鼠的空间学习和记忆障碍,产短链脂肪酸菌显著减少,包括Faecalibaculum、毛螺菌科和瘤胃菌科。
从老龄小鼠模型到无菌小鼠的粪菌移植导致粪便短链脂肪酸生成减少、促进抑郁样行为和短期记忆障碍,表明老龄肠道微生物组能够降低宿主的短链脂肪酸水平和随后的认知能力下降。
从老龄供体到年轻受体大鼠的粪菌移植导致受体小鼠的认知行为损伤、突触结构改变、糖基化终产物水平升高以及炎症和氧化应激增加。
自闭症谱系障碍
精神分裂症
抑郁症
自闭症谱系障碍(ASD) 包括一系列复杂的神经发育障碍症状,包括社交和交流障碍,以及限制性和重复性行为模式。
谷禾参与组织的一项多中心合作的自闭症谱系发育障碍与肠道菌群研究,该项目共包括 773 名自闭症受试者(16 个月至 19 岁)和 429 名神经典型 (NT) 发育受试者(11 个月至 15 岁)。该研究已发表的在《GUT》。【实际上这个研究仍在继续,目前我们已经构建了超过3000例的自闭症样本队列】
这项研究详细分析了不同年龄发育阶段自闭症儿童的菌群与正常儿童的差异和变化,并揭示了临床症状相关的自闭症儿童肠道微生物组发育动态特征。
研究显示多种菌、菌群代谢功能的改变与自闭症儿童的行为、睡眠和胃肠道症状的严重程度有关。
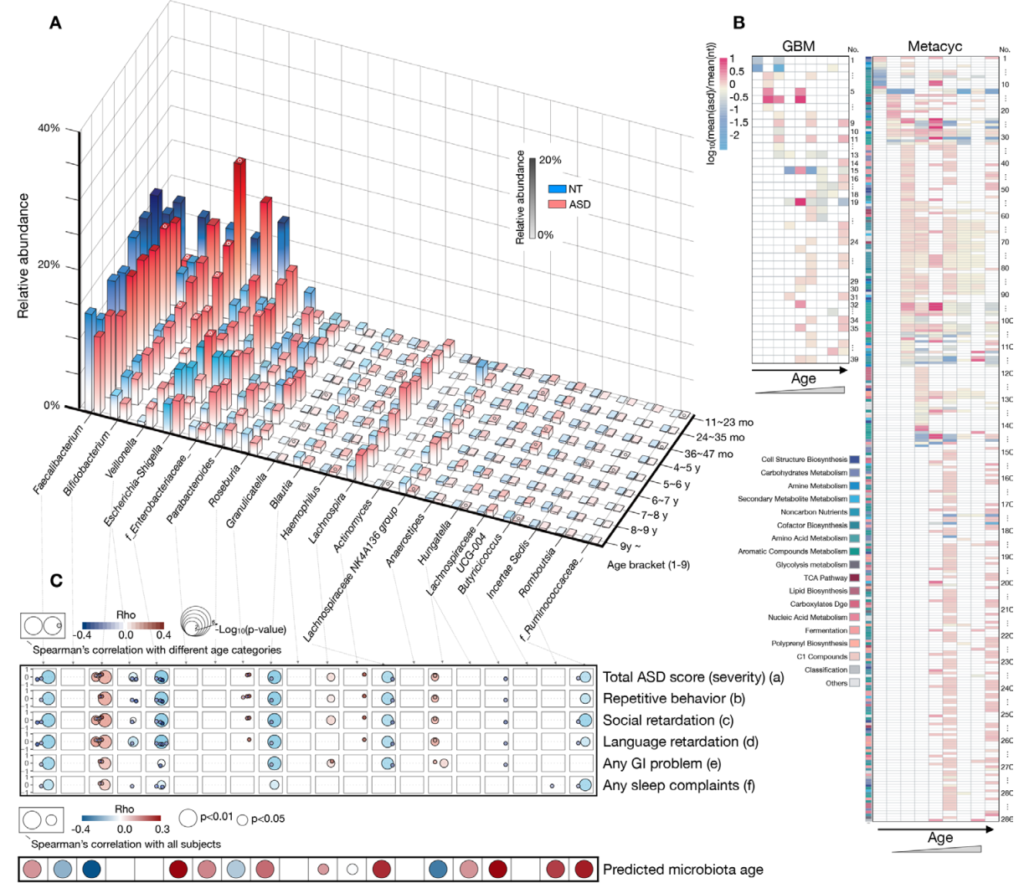
Lou M, et al., Gut. 2021
为了更好的应用于临床,我们尝试并给出了基于微生物群的疾病诊断模型,并在不同年龄和地区显示出很好的模型效果。
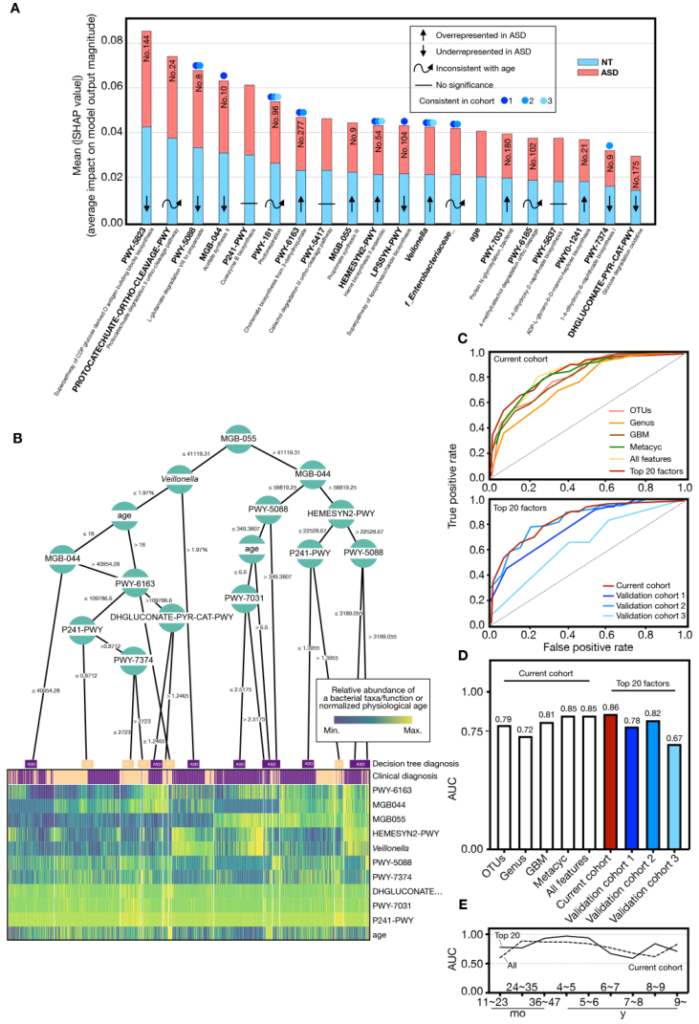
Lou M, et al., Gut. 2021
尤其是在早期,基于肠道菌群的模型对于临床鉴别和评估有更大价值。因为很难对低龄幼儿进行行为学评估,而错误的评估很容易错过早期干预的黄金时机,肠道菌群模型可以更加量化的评估,而不依赖问询或行为学,可以很好的对现有临床诊疗进行补充。
遗传和环境因素
自闭症的确切病因尚不确定。然而,有大量的临床证据表明,遗传和环境因素在该病的发病中起着至关重要的作用。已经确定了100多个影响中枢神经系统发育的基因和基因组区域,这些基因和基因组区域可能与自闭症的发展有关。
环境因素,如营养不良、病毒和婴儿期发育错误,特别是发育中大脑中七种蛋白质的母体自身抗体,也与自闭症有关。这些环境因素现在已经被证明对自闭症有着比以前认为的更重要的作用。
微生物群-大脑重要作用
大约40%的自闭症患者经历更多的胃肠功能障碍,包括肠功能改变和腹部痉挛(疼痛)、腹泻、反流和呕吐。
胃肠道症状与自闭症严重程度之间的相关性表明了肠道与大脑之间联系的重要性。
人们逐渐发现肠道中的微生物群和大脑相互作用在自闭症等神经精神疾病中起着关键作用。
肠道微生物群的组成与年龄有关。肠道微生物群正常组成的改变会增加致病菌的数量,从而导致感染。
Sorboni SG, et al.,Clin Microbiol Rev. 2022
肠道失调 -> 炎症
自闭症患者的胃肠道紊乱和中枢神经系统症状可能与肠道失调引起的炎症状态有关。
根据最新研究,自闭症儿童的肠道微生物群组成发生了显著变化,胃肠道症状可能代表了炎症过程。炎症与肠粘膜屏障对细菌神经毒性肽(如脂多糖)的通透性增加和炎性细胞因子的产生有关。细菌代谢产物在肠-脑轴中起着至关重要的作用;因此,肠脑信号中断可能与自闭症和帕金森等神经精神疾病有关。
最近关于微生物干预预防和治疗自闭症的潜力的研究
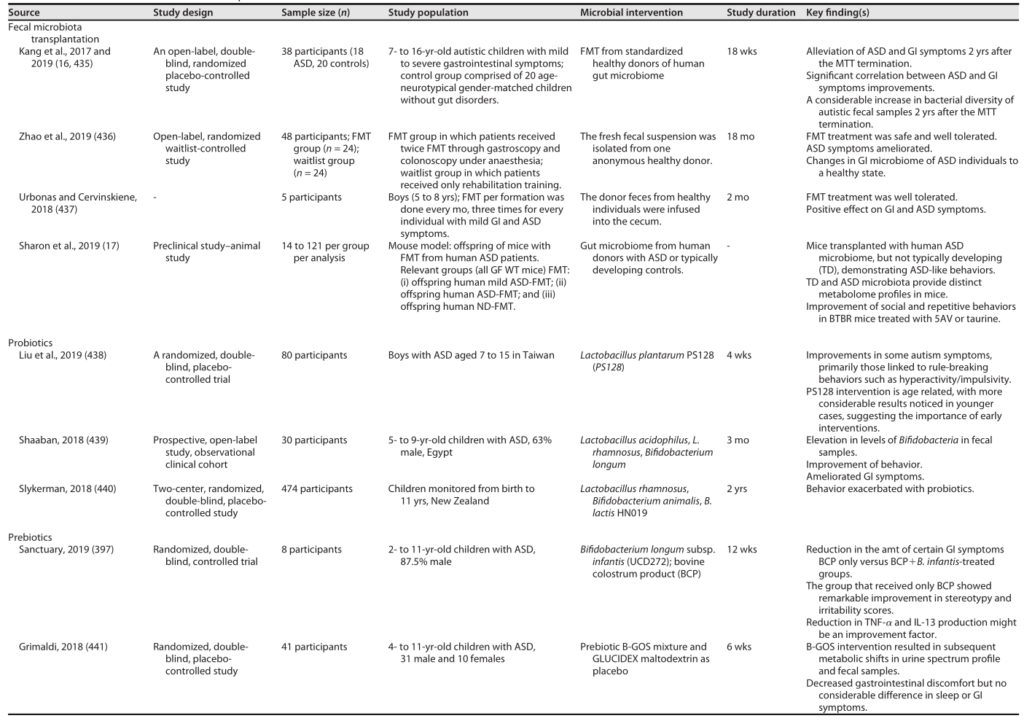
Sorboni SG, et al.,Clin Microbiol Rev. 2022
自闭症患者肠道菌群变化
自闭症儿童甚至成人的肠道微生物群与健康对照组完全不同。
对自闭症儿童粪便样本的调查表明,由于拟杆菌数量减少,拟杆菌/厚壁菌比例降低。
在患有自闭症的儿童中,乳酸杆菌、梭状芽孢杆菌、脱硫弧菌、Caloramator、Alistipes、Sarcina、Akkermansia、Sutterellaceae、肠杆菌科的水平升高。
许多研究人员已经评估了梭菌的丰度及其作为危险因素的作用。对自闭症儿童每周使用万古霉素治疗可显著改善神经行为和胃肠道症状。
发送信号 -> 控制肠通透性
除了肠道微生物群在免疫系统发育中的作用外,梭状芽孢杆菌通过肠上皮或迷走神经的传入纤维向大脑发送信号,并控制肠道通透性。
代谢
据报道,肠道微生物可通过产生酚类、短链脂肪酸和游离氨基酸等代谢物在肠道通透性中发挥重要作用。自闭症儿童丙酸和乙酸的比率较高,但丁酸的比率较低。非消化性碳水化合物的最终产物可能与自闭症发病机制有关。
详见:如何通过喂养菌群产生丁酸调节人体健康
自闭症儿童和正常发育儿童的粪便和血浆代谢组比较显示线粒体功能障碍;自闭症儿童中不同水平的酚类微生物代谢产物、脂质、氨基酸和外源性代谢可能被用作自闭症的分子生物标记物。
在另一项研究中对患有自闭症的儿童的血浆代谢物进行精确评估后,血浆代谢物的水平,包括烟酰胺核糖苷、IMP、亚氨基二乙酸、甲基琥珀酸、半乳酸、丙氨酸甘氨酸、肌氨酸和亮氨酸甘氨酸,明显较低。
然而,在微生物群转移疗法(MTT)后,这些代谢物发生了实质性变化,使其中一些与典型发育中儿童的代谢产物相似。
干预(饮食、微生物等)
已经证明,影响孕妇胎儿微生物群的高脂肪饮食也可能与自闭症有关。此外,母乳喂养6个月降低了自闭症表现的机会,而配方奶粉喂养与肠道艰难梭菌数量增加相关。
《cell》发表的关于自闭症的文章显示,与自闭症相关的行为与饮食多样性的减少有关。并提示在对精神疾病患者的微生物组分析时,应考虑饮食相关因素。
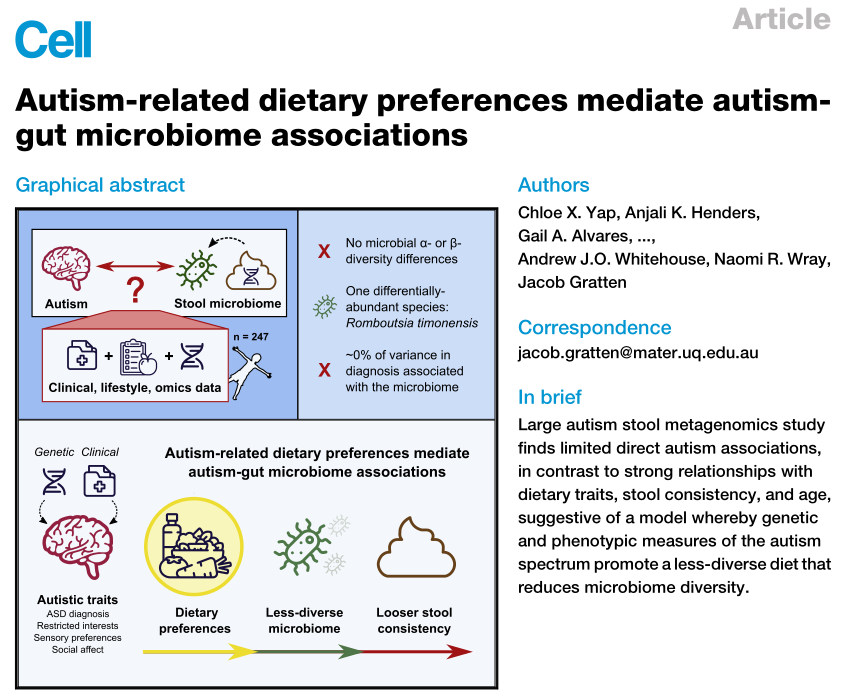
由于益生菌可以发挥抗炎作用并减轻IBD受试者的胃肠道症状,据报道微生物干预,如益生菌,可有助于减少自闭症患者的社会行为症状和炎症水平。
总的来说,自闭症患者肠道微生物群改变已得到证实。然而,考虑到参与患者的异质性和几个相互矛盾的结果,很难建立自闭症的独特特征。考虑到肠道功能障碍与自闭症患者社会行为障碍严重程度的不一致,这些数据提示我们应该考虑两种不同类型的自闭症,这些炎症类型与胃肠道并发症相关。
在各种治疗自闭症的方法中,益生菌治疗的结果很有潜力,同时也应考虑耐受性和安全性评估。鉴于微生物群分析方法的局限性,有必要进一步使用随机、安慰剂对照临床试验,以验证益生菌治疗自闭症的有效性。
精神分裂症(SCZ) 是一种严重的精神疾病,与幻听、妄想、思维和行为紊乱有关,损害日常功能和社会交往。
精神分裂症的生理病理学尚未得到解释,但最近的研究表明,环境因素增加了可能具有该疾病遗传易感性的个体发生精神分裂症的风险。
神经递质在多个系统中的功能障碍已被广泛研究,特别强调了信号异常的重要性,包括多巴胺、5-羟色胺、谷氨酸和GABA。
此外,炎症的重要性以及胃肠系统在精神分裂症病因中的可能作用正在考虑之中。
肠道菌群及其代谢物的影响
胃肠道微生物群在神经生成途径和肠道微生物组中起着至关重要的作用,微生物代谢物扰动已被证明会影响情绪和行为。
肠道微生物组的改变与几种神经发育和神经系统疾病相关。最近有研究表明,来自精神分裂症受试者的粪便移植到无菌受体小鼠,可诱发精神分裂症相关的行为症状。这与海马中GABA、谷氨酰胺和谷氨酸水平的改变有关。这表明精神分裂症患者的微生物群可能对神经化学产生影响,这可能与这些人类条件有关。
目前还没有报告可以促进受试小鼠模型行为改变的特定细菌功能。根据各种研究显示,放线菌、变形菌、拟杆菌和厚壁菌群在精神分裂症患者中的差异最大。
抗生素或许发挥作用
有趣的是,在一项体外研究中,补充抗生素减少了小胶质细胞对突触的吞噬。小胶质细胞降低了中枢神经系统突触的密度,这被认为是精神分裂症发育的一个重要步骤。
在对一组青少年的电子健康记录进行检查后,服用二甲胺四环素与精神分裂症的发病率略有降低有关,这意味着需要更多的研究来调查精神分裂症中微生物群的相关性。
益生菌缓解精神分裂症的消化障碍
根据SCZ的严重性和复杂性,尚未有研究证实精神分裂症患者通过补充益生菌来缓解任何行为症状。然而,一些研究认为,服用益生菌至少可以缓解与精神分裂症相关的消化障碍。
精神分裂症的微生物干预
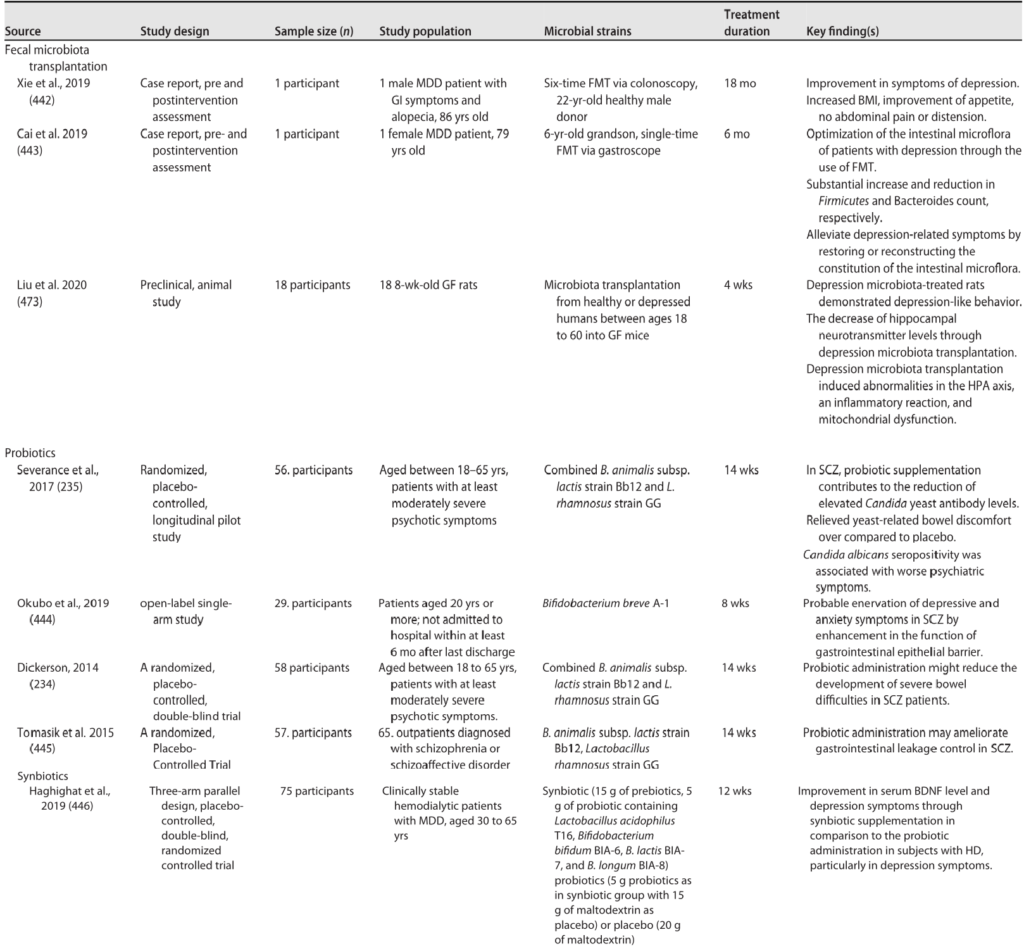
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在一项人类临床试验中,严重的胃肠道问题减少了,精神分裂症患者的精神症状没有任何改变。
另一项人体试验证明了白色念珠菌与胃肠道问题之间的相关性,在服用特定益生菌补充剂(包括鼠李糖乳杆菌GG和动物乳双歧杆菌Bb12)的男性患者中,精神症状有所改善,且白色念珠菌血清阴性。
已经发现了一整套针对严重精神病性疾病的新颖、可能的治疗干预措施,包括考虑肠道舒适性。需要进行更多的研究,通过纵向数据分析和更大的样本量来提高我们对胃肠道微生物群参与精神分裂症的理解。胃肠道微生物的功能和分类对于全面精神分裂症至关重要。
抑郁症是世界范围内导致严重残疾的一种常见的异质性疾病,其特征是情绪低落,经常伴随着对个人通常认为是愉快的活动失去兴趣。其严重形式为重度抑郁症,被归类为心境障碍。抑郁症对人们的健康有着更大的负面影响,并且它带来了与吸烟、血压和饮酒类似的死亡风险。它是癫痫和主要神经退行性疾病(下节内容)的相关共病,其病因包括代谢、神经内分泌和神经免疫因子。
抑郁症主要是一种脑部疾病,但大脑并不是孤立存在的,它存在于包括肠道在内的整个身体生理系统中。如果说成年健康个体的肠道菌群主要由拟杆菌和厚壁菌门组成(90%),那么重度抑郁症患者的肠道菌群在拟杆菌门、厚壁菌门、变形菌门和放线菌门的不同属的丰度上表现出显著变化。
在人类和动物模型中研究发现,临床抑郁症与肠道微生物群丰富度和多样性降低有关。来自抑郁症患者或对照组的粪便微生物群样本移植到微生物群缺陷大鼠模型中,诱发了抑郁症的行为和生理特征,包括快感丧失和焦虑样行为。
慢性炎症可能在重度抑郁症(MDD)的发病机制中发挥重要作用,肠道菌群的内环境平衡失调可能导致此类炎症,这表明胃肠道菌群在影响大脑发育、情绪和行为方面起着中心作用。
这些作者得出结论,生理和情绪压力会影响肠道微生物组的组成。
抑郁症通常与肠易激综合征共存,肠易激综合征的特征是肠道功能的改变,从动物研究中获得的数据表明,肠道微生物群可能影响抑郁症的神经生物学特征。
利用小鼠双侧嗅球切除术(已知会诱发抑郁样行为)来研究其是否会导致微生物群组成的变化:球切除术诱导的慢性抑郁导致肠道微生物谱改变,同时结肠运动、c-Fos活性和5-羟色胺水平增加。
由于抑郁症是肥胖患者的常见症状,研究人员从肥胖小鼠(表现出抑郁症样行为)移植到非肥胖对照小鼠体内的微生物组,观察发现在体重无显著差异的情况下,对照组非肥胖小鼠中肥胖衍生的微生物群重新定植导致探索、认知和定型行为的中断。
抑郁样行为也可以通过应激模型在小鼠中诱导,例如慢性社会挫败应激(CSDS)范式,在该范式中,小鼠反复遭受更大、更具攻击性的小鼠的社会挫败。应激小鼠表现出抑郁样行为,并表现出微生物多样性的变化,其中脱硫弧菌科、Rikenellaceae、毛螺菌科的数量增加,Allobaculum、Mucispirillum的数量减少。
现有证据表明,肠道微生物群可能在抑郁症的发展中起到因果作用,并且可能被认为是治疗/预防这种疾病的一个有价值的靶点。
神经退行性疾病是一类复杂疾病,脑和脊髓的神经元随时间发展而损害逐渐加剧,以特异性神经元的大量丢失为主要特征。这里介绍几种常见的神经退行性疾病及其与肠道微生物群的关系:
多发性硬化
帕金森病
阿尔茨海默
癫痫症
中风和脑损伤
多发性硬化
多发性硬化症(MS)是一种免疫介导的慢性中枢神经系统疾病,涉及受损轴突和脱髓鞘,影响全球约230万人,女性发病率较高。
多发性硬化的致病特征
在中枢神经系统中形成炎性局灶性脱髓鞘斑块,包括脊髓和大脑的灰质或白质,并触发神经炎症反应,导致包括少突胶质细胞在内的特殊细胞脱髓鞘,并导致神经退行性变。
脱髓鞘如何形成?
由于血脑屏障的异常通透性,免疫系统的各种细胞渗入中枢神经系统,导致脱髓鞘的发生。髓鞘抗原特异性T细胞(CD81和CD41 T细胞)穿过这一屏障,导致一系列事件导致脱髓鞘病变的形成。
多发性硬化发病的免疫机制
最近对多发性硬化小鼠模型(包括实验性自身免疫性脑脊髓炎模型)的研究表明,CD41 T淋巴细胞在多发性硬化发病机制中起主要作用。尤其是,CD41Th17和Th1淋巴细胞在多发性硬化发病中具有最突出的作用。
Th1有助于分泌δ干扰素(IFN-d),在活化后促进巨噬细胞酶的产生。此外,IFN-d刺激活性氮和活性氧的产生,分别导致细胞结构的亚硝化和氧化损伤。Th1细胞还能够产生IL-12,从而诱导肿瘤坏死因子(TNF-a)和IFN-d的分泌,导致慢性炎症反应和进一步的组织损伤。
由Th17细胞介导的特定细胞因子(包括IL-22、IL-21和IL-17)的产生导致慢性炎症进展。识别中枢神经系统自身抗原(如Th1和Th17)的CD41 T淋巴细胞参与多发性硬化的病理生理学。
除了CD81和CD41细胞外,其他免疫细胞也与多发性硬化发病有关,包括NK细胞、小胶质细胞和巨噬细胞。这些细胞与其细胞因子之间的分子相互作用维持了中枢神经系统内的炎症级联反应。
多发性硬化的几种临床变异
包括最常见的复发缓解型多发性硬化和进行性复发型多发性硬化,以及原发性进行性多发性硬化和继发性进行性多发性硬化(SPMS)。
遗传易感性和环境因素在多发性硬化症的病因中都起着重要作用。
肠道微生物群参与免疫调节
最近的研究表明,肠道共生微生物群落也与多种免疫介导的疾病(如多发性硬化)有关,可以认为是一种新的环境风险因素。换句话说,肠道微生物群负责免疫调节,改变血脑屏障的完整性和功能,刺激自身免疫脱髓鞘过程,并与中枢神经系统中存在的各种细胞类型直接相互作用。
与肠道微生物群α或β多样性的广泛差异不同,横断面调查主要揭示了多发性硬化儿童与健康个体相比在分类上的明显改变。
一些研究评估了多发性硬化患者微生物移植到两种不同的实验性自身免疫性脑脊髓炎(EAE)模型中的效果;这些研究强调了产生IL-10的CD1 T细胞在胃肠道微生物群介导的免疫调节中的重要性。
此外,胃肠道中SFB的存在,可能在Th17细胞活化中起作用 ,显著影响EAE小鼠的多发性硬化样症状。根据多发性硬化作为脱髓鞘疾病的定义,临床前抗菌研究表明,在汇集来自无菌小鼠模型的数据后,胃肠道微生物群可以调节小鼠模型前额叶皮质髓鞘的生成。
肠道菌群在血脑屏障调节中的基本作用
无菌小鼠研究表明,作为多发性硬化的一个主要标志,微生物组与血脑屏障完整性的丧失之间可能存在关联。
研究还表明,在膳食中补充短链脂肪酸或产短链脂肪酸的菌,可以逆转血脑屏障完整性的丧失。此外,饮食诱导的肠道微生物群落结构变化也参与了EAE的表现。
有证据表明,肠道微生物群可以调节大量的神经炎症途径。然而,补充研究对于理解多发性硬化病因的确切作用机制至关重要。动物和人类研究表明,肠道菌群可能与多发性硬化生理病理学的许多方面有关。
干预措施
关于如何有效地控制肠道微生物组作为一种干预措施,以最大程度地阻止复发和缓解症状,问题仍然悬而未决。
在一项试点实验中,补充一种特定的益生菌制剂(含有双歧杆菌、乳酸杆菌和链球菌)可以逆转微生物群的改变并调节炎症反应,这表明这种微生物群靶向治疗是有希望的(下表),尽管需要进一步调查以确认这些结果。
多发性硬化的微生物干预
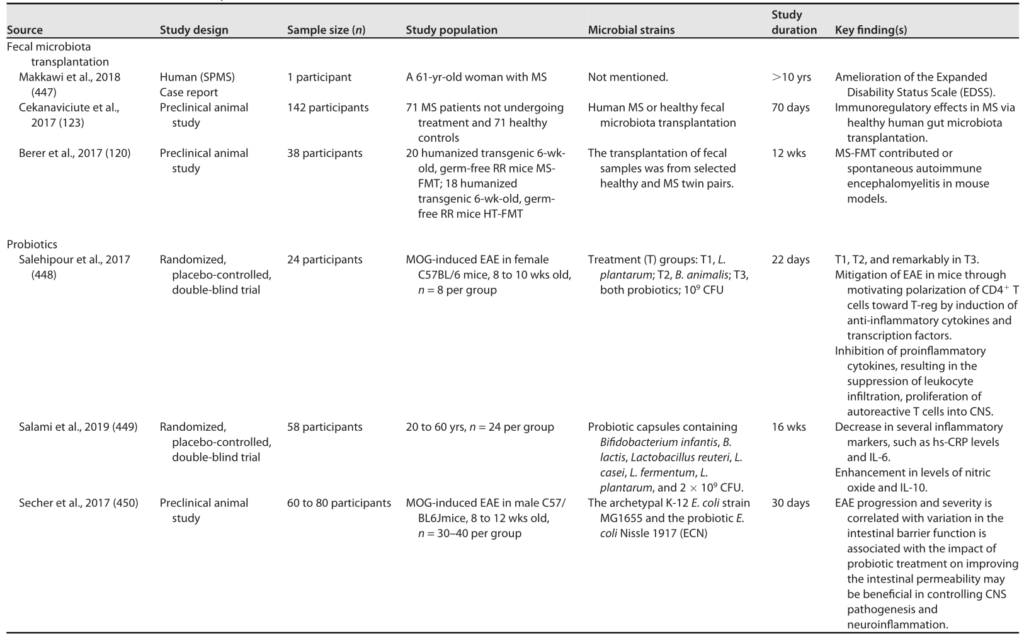
Sorboni SG, et al.,Clin Microbiol Rev. 2022
帕金森病
帕金森病(PD)是一种进行性多中心神经退行性疾病,由α-突触核蛋白(α-syn)沉积在部分大脑中心黑质的多巴胺能神经细胞中引起。这些过程促进了圆形片状嗜酸性细胞质内含物的逐渐聚集,称为Lewy小体。
然而,帕金森发病机制的确切机制仍不明确,它可能是一种多因素疾病,在这方面引入了各种理论。
衰老是帕金森发展和进展的重要风险因素
影响多种细胞途径,导致这些过程受损,并导致神经退行性变。可以想象,年轻神经元可以容忍的相同分子扰动在老年神经元中显示出一些灾难性后果。
帕金森病的临床症状主要表现为运动障碍症状,包括肌肉僵硬、静止性震颤、运动迟缓和姿势不稳 。帕金森病在50岁之前很少见,但随着年龄的增长,发病率会增加5到10倍。它主要发生在男性,每年每100000人中有5-35例新病例。
多巴胺能神经元逐渐退化,非运动和运动症状如抑郁症、痴呆症和胃肠道问题(包括便秘、唾液分泌异常、排便功能障碍、恶心和吞咽困难)之间存在着强相关。帕金森症状因个体而异。
几项研究表明,帕金森受试者的胃肠道异常与肠神经系统中的肠道失调和α-突触核蛋白沉积有关。
肠道菌群如何影响帕金森?
由于最初的胃肠道参与帕金森,并且宿主微生物组之间的生理相互作用潜力很大,因此有人认为胃肠道菌群可能影响帕金森。胃肠道功能异常,尤其是便秘,影响多达80%的帕金森病患者,并且可能在出现运动症状前几年发生。
特发性便秘是帕金森的主要相关因素,与肠神经系统的神经退行性改变有关。肠神经系统中的α-syn神经退行性变可能是帕金森的运动前临床症状之一。它与慢性便秘和胃肠道壁的生理改变有关。
肠道微生物群可能影响参与α-syn分泌的肠道神经元。这些变化在运动症状出现之前的帕金森开始时就已出现,可认为是运动前生物标记物。
——Prevotellaceae减少
对肠道微生物组与帕金森患者之间的相关性进行了不同的研究。一项研究观察到帕金森病患者粪便样本中Prevotellaceae种类显著减少。与对照组相比,Prevotellaceae的丰度显著降低(77.6%)。
Prevotellaceae通过膳食纤维发酵和肠道中的粘蛋白率先产生短链脂肪酸。Prevotellaceae减少引起的细菌内毒素全身暴露和肠道通透性的增强可触发α-syn结肠的不受控制的表达和错误折叠。
这种肠型负责硫胺素、叶酸和神经活性短链脂肪酸的生物合成。因此,补充这些维生素和短链脂肪酸可能有助于治疗帕金森。
最近的研究首次承认,帕金森病患者的机会性病原体数量显著增加。
——肠杆菌科丰度增加
步态困难姿势不稳的严重程度与肠道内肠杆菌科丰度呈正相关。肠杆菌科细菌在肠道中的过度生长导致作为血清中革兰氏阴性细菌细胞壁一部分的LPS滴定增强 。因此,研究表明,由于帕金森患者血液样本中LPS的吸收增加,LPS结合蛋白的全身浓度异常高。
——乳酸杆菌科的丰度增加
与Prevotellaceae一样,乳酸杆菌科与胃肠激素ghrelin有关。也有报道称帕金森患者的ghrelin分泌减少。
总的来说,研究结果揭示了胃肠道微生物群和帕金森作用之间的联系。进一步的微生物组学分析可能会提高准确性,澄清关系以及机制。
帕金森患者中菌群失衡可能会影响炎症,因为菌群失调会损害肠道屏障功能并触发免疫激活和全身炎症反应。
帕金森的持续存在会影响微生物群,肠道菌群可能在一些腹部症状中起作用,如便秘和炎症。
肠道屏障破坏
简而言之,LPS和其他细菌神经毒素在穿过肠壁后进入血液,导致肠上皮屏障的破坏。血液中细菌LPS的存在导致通过核因子kB(NF-kB)和TLR4产生炎症细胞因子,导致全身炎症。细菌LPS和炎性细胞因子(包括TNF-a、IL-1b和IL-6)诱导的血脑屏障破坏触发α-syn的积累。位于黑质的多巴胺能神经元丢失可能是血脑屏障分解的结果。由于帕金森的肠屏障破坏导致微生物易位升高和促炎症基因谱升高,结肠活检标本显示TLR4或细菌内毒素特异性配体、CD31 T 细胞和其他细胞因子的表达增强。
产短链脂肪酸的细菌减少
帕金森病患者在肠道失调期间产短链脂肪酸的细菌减少。TLR4介导的炎症在脑或肠道炎症中发挥重要作用,这可能是导致帕金森神经退行性变的重要因素之一。因此,增强肠道内肠杆菌科后LPS的相对增强与帕金森的发生相关。
闭塞和其他紧密连接蛋白对肠屏障结构至关重要。肠道生态失调,使闭塞素降解,导致肠道通透性增强。
促炎细胞因子升高
另一项针对帕金森病患者的研究调查了其粘膜中Ralstonia、肠球菌和变形菌浓度的增加,导致促炎细胞因子的升高。
帕金森受试者粪便样本中被认为具有抗炎作用的产丁酸菌(如布氏杆菌、粪球菌、粪杆菌和罗氏菌)数量显著减少。
此外,据报道,帕金森患者粪便样本的微生物群中LPS生物合成基因表达增加。有趣的是,幽门螺杆菌感染可被认为是帕金森发病机制中的一个重要触发因素。
小肠细菌过度生长(SIBO),与运动功能障碍有关,尤其是在帕金森患者中。
牙龈假单胞菌感染在帕金森的病因/危险因素中的重要作用
牙龈卟啉单胞菌的牙龈蛋白酶和LPS导致帕金森样本中出现异常血凝块。研究发现只有帕金森样本的凝块中观察到了牙龈蛋白酶抗体信号,这证实了这种细菌在帕金森病理学中的潜力。他们进一步指出,据报道,牙龈假单胞菌诱导的外周炎症导致肠道微生物群失衡,黑质多巴胺能神经元减少,肠道通透性增加,以及富含亮氨酸重复激酶2(LRRK2)相关帕金森病理生理学中小胶质细胞活化增强。
益生菌缓解症状
益生菌,包括乳酸杆菌和双歧杆菌,已被证明可以缓解帕金森样症状。
帕金森的微生物干预

Sorboni SG, et al.,Clin Microbiol Rev. 2022
芽孢杆菌作为一种益生菌,能够将L-酪氨酸转化为L-多巴,L-多巴是多巴胺的重要前体分子,其转化为多巴胺是通过多巴脱羧酶进行的。
据报道,定期服用含有干酪乳杆菌shirota的发酵乳饮料可通过减少帕金森患者粪便中葡萄球菌的数量促进排便。
肠道微生物群从二芳基黄烷醇中积极产生多酚,干扰α-突触核蛋白的错误折叠和毒性,是帕金森和其他α-突触核蛋白病的基本病理机制。
对口服富含拉法诺制剂(FRP)的异源性人源化侏儒小鼠的研究表明,FRP衍生代谢物的产生存在特殊差异,影响α-突触核蛋白的错误折叠或炎症。
对果蝇α-突触核蛋白病模型的研究表明,它对运动功能障碍有影响,从而导致其发病和进展的调节。
体外研究表明,在细菌发酵过程中,特定的细菌可以产生这些具有生物活性的酚酸。
总之,已经得出结论,个体间异质肠道微生物群诱导的二芳基黄烷醇的变化证明了益生菌、益生元和共生策略在调节帕金森和其他共核病变进展中的潜力。
目前,关于微生物组与帕金森病之间的相关性的不同研究结果并不一致。微生物组的结果产生了有价值的信息。帕金森患者使用的药物与肠道微生物之间存在联系,因为肠道微生物群在处方药物代谢中发挥作用,甚至药物对微生物组成产生影响。
对胃肠道微生物组和肠-脑轴的相互作用有一个完整的认识,可能阐明帕金森的病因和进展因素,以提供新的治疗视野和手段。例如,FMT和肠道微生物组作为帕金森临床诊断的新生物标记物的评估可能揭示传统治疗方法的替代治疗。
肠道不适可发生在帕金森的初始阶段;这有助于在出现震颤和强直等运动症状之前对该疾病进行早期诊断。微生物组学研究可以提供关于帕金森病的有用信息,但目前,我们不能依赖它们作为生物标志物。
阿尔茨海默病是一种慢性不可逆的大脑疾病,脑细胞的进行性退化导致记忆障碍、认知能力下降。它是老年人最常见的痴呆类型。阿尔茨海默患者表现出严重的学习、行为和记忆障碍,严重到足以影响日常活动。
阿尔茨海默的特征
阿尔茨海默患者的大脑中的神经元细胞死亡和进行性突触衰竭,伴随着神经元周围或外部的β淀粉样蛋白(amyloid-β,简称Aβ)沉积,伴随着皮质神经元树突和轴突中微管相关蛋白tau异常磷酸化的聚集。Aβ的积累和tau蛋白的聚集有助于微管稳定性的降低、突触失效和神经元钙稳态的紊乱,最终导致神经元凋亡。
尽管已经对阿尔茨海默的病因进行了大量研究,但阿尔茨海默的潜在机制尚不完全明确,目前的Aβ疗法对症状的缓解作用有限。据报道,淀粉样蛋白可能在大脑中充当AMP。
与中枢神经系统炎症有关
最近的研究发现阿尔茨海默的发病机制与周围感染引起的中枢神经系统炎症有关。在感染单纯疱疹病毒1型(HSV-1)的小鼠中,可以看到阿尔茨海默受试者中tau和Aβ沉积的共同特征。病毒感染诱导的高细胞内胆固醇25羟化酶(CH25H)水平对于调节Aβ产生和阿尔茨海默易感性至关重要。
阿尔茨海默 & 微生物群
此外,先前的研究已经证明阿尔茨海默与其他微生物感染(包括真菌、肺炎衣原体和螺旋体感染)之间存在潜在联系。阿尔茨海默患者脑脊液中肠道菌群微生物驱动代谢物的测定与阿尔茨海默生物标记物(如磷酸化tau和tau/Aβ42)相关,表明肠道微生物群在阿尔茨海默发病中的意义。
一项研究报告,根据Aβ前体蛋白转基因小鼠(APP)粪便样本的细菌16S rRNA序列分析,与野生型小鼠模型对照组相比,肠道微生物组成存在显著差异。研究还表明,具有阿尔茨海默表型的转基因小鼠模型具有多种肠道微生物。
对无菌小鼠的研究表明,在没有微生物的情况下,不会出现淀粉样斑块和神经炎症症状。
根据横断面研究结果,与健康对照组相比,阿尔茨海默患者粪便样本中参与炎症反应的两种细菌大肠杆菌和志贺菌的丰度显著增加。在患有认知障碍和脑淀粉样变性的患者中,可能与外周炎症状态有关的两种主要情况包括促炎性大肠杆菌和志贺菌的增加以及抗炎性直肠真杆菌的降低。
菌群失调 & 全身炎症
肠道微生物群失调和全身炎症之间存在联系,这可能是阿尔茨海默患者大脑中发生的神经退行性变的一个促成因素。
这些观察结果基于小规模研究,需要更多具有较大统计组的研究来评估肠道微生物群与阿尔茨海默进展的关系。一些科学家指出,在阿尔茨海默患者大脑中发现的感染因子可能与该疾病的发展有关,但在这方面,强有力的证据是必不可少的。
牙龈卟啉单胞菌在患者大脑中定植
在最近的一项阿尔茨海默治疗研究中,使用合成的神经毒性抑制剂是有益的。在这项研究中,牙龈卟啉单胞菌与慢性牙周炎有关,在阿尔茨海默患者的大脑中被发现。这些细菌在大脑中的定植导致Aβ1-42的产生增加。此外,神经毒性姜黄素对tau蛋白Aβ1-42有破坏性影响。
NLRP3炎症小体与阿尔茨海默
肠道微生物群失调与阿尔茨海默相关神经炎症之间的潜在关联。肠道NLRP3异常表达的增加与外周炎性体的激活呈正相关,后者随着阿尔茨海默的进展而增强神经炎症。因此,观察到,与年龄匹配的对照组小鼠相比,年轻和老年5xFAD小鼠模型的肠道微生物群组成发生了相当大的变化。
与非转基因小鼠相比,com 5xFAD小鼠由于粘附蛋白和紧密连接蛋白的丢失而表现出肠道屏障功能受损。此外,已经证明肠道微生物炎症体蛋白的高表达可能是激活下游细胞毒性和炎症介质的重要主导因素。因此,NLRP3炎症体介导的神经炎症可能通过胃肠道NLRP3促进。因此,肠道微生物群调节可能是治疗遗传易感个体阿尔茨海默相关神经系统疾病的一种可能策略。
将Tg2576小鼠阿尔茨海默模型(包括症状前和症状中转基因)与野生型进行比较,研究人员观察到肠上皮屏障(IEB)中血管A β肽的沉积破坏了IEB,并且吸收失调发生在其脑聚集之前。得出结论,肠-脑轴的改变与较高水平的炎症血浆细胞因子(如IL-9、IP-10和VEGF)相关。
考虑到阿尔茨海默患者的肠道功能障碍,阿尔茨海默治疗的未来治疗策略可能涉及肠道微生物群的早期调理。根据肠道微生物群参与阿尔茨海默Aβ病理学的发展,研究人员开发了一个新的框架,通过肠-脑轴确定阿尔茨海默的潜在机制,并将肠道微生物群的操作转化为临床实践。
抗生素疗法
用接受来自老年(16个月)APPSWE/PS1DE9小鼠的粪便供体移植的APPSWE/PS1DE9小鼠进行短期抗生素鸡尾酒疗法,收集粪便颗粒进行进一步分析。
抗生素治疗前小鼠的FMT重建主要归因于供者来源,如梭状芽孢杆菌和Coriobacteriae,有助于Aβ斑块的更高沉积。有趣的是,在微生物群植入后,Aβ斑块周围星形胶质细胞的激活受到抑制,而不是小胶质细胞。
在阿尔茨海默小鼠模型中,长期服用广谱抗生素也可以减少Aβ积累并调节影响Aβ淀粉样变的先天免疫反应。此外,在转基因小鼠中,通过定期使用抗生素鸡尾酒疗法,海马淀粉样斑块周围的小胶质细胞和星形胶质细胞聚集以及不溶性Aβ斑块减少 。
也有报道称,通过比较不同年龄的野生型和阿尔茨海默小鼠模型之间的粪便短链脂肪酸和微生物组成,观察到具有阿尔茨海默表型的小鼠中的丁酸球菌和瘤胃球菌数量显著减少,变形菌和疣状菌数量增加,提供改变的微生物组成和多样性。短链脂肪酸水平的下降表明至少有30条代谢途径受到干扰。
先前的一项研究也表明,小胶质细胞激活抑制Aβ清除和降解,Aβ的进一步积累导致阿尔茨海默的病理学。此外,Aβ沉积水平的升高有助于小胶质细胞内几种促炎介质的释放,如ROS、iNOS、NF-kB和COX2,从而促进阿尔茨海默患者的神经炎症。
阿尔茨海默的微生物干预
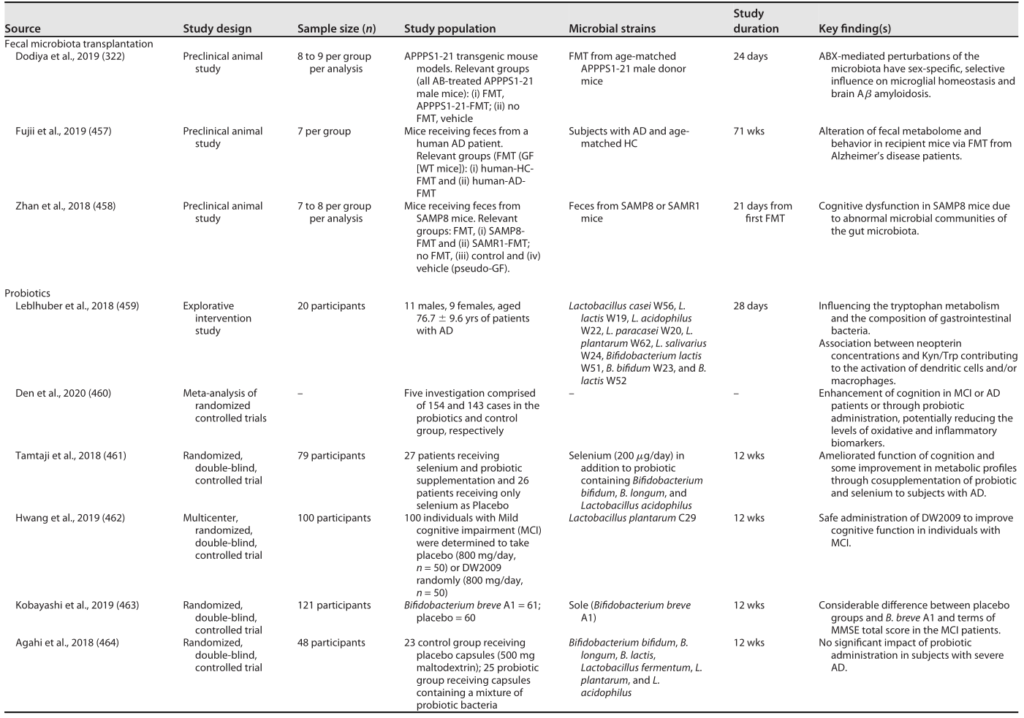
Sorboni SG, et al.,Clin Microbiol Rev. 2022
这些研究表明,某些种类的肠道微生物可激活Aβ信号通路,参与阿尔茨海默的发病机制,并在阿尔茨海默的分子调节中发挥关键作用。益生菌补充和营养干预可能成为阻碍阿尔茨海默进展的一种有希望的治疗方法。
癫痫是一种使人衰弱的神经系统疾病,影响全世界约6500万人。尽管医学上有许多新的进展,但确切的病因仍需完全阐明。大约一半的癫痫患者病因不明。据报道,癫痫患者的医疗费用是正常人的13倍。癫痫显著的社会经济影响是由于其死亡率和致残率高于正常人群。尽管正在使用抗癫痫药物(AEDs)进行药物治疗,但只有70%的癫痫患者能够完全控制癫痫发作。因此,大约三分之一的癫痫患者会出现难治性癫痫,影响他们的日常生活活动。
环境和遗传因素都决定癫痫的易感性。
此外,一些研究表明肠道细菌种类与癫痫的病理生理学之间存在关联。肠道微生物组失调与癫痫等神经精神疾病的发生有关。平衡的肠道微生物群与健康的大脑和免疫系统之间存在相关性。
最近的研究表明,慢性炎症在癫痫的发病和进展中起着重要作用。研究还表明,肠道菌群可以调节免疫和炎症反应。因此,操纵肠道微生物组作为癫痫的治疗策略具有潜力。
腹腔注射LPS诱导大鼠更易发生癫痫发作,同时增加血脑屏障的通透性和大脑中更高水平的促炎细胞因子。
未控制癫痫的替代治疗策略包括迷走神经刺激和生酮饮食。因此,控制肠道微生物群的多样性可以被认为是一种潜在的治疗方法。
癫痫患者肠道菌群变化
在几项研究中发现,与健康人群相比,采用各种治疗方法的癫痫患者的肠道微生物特征存在差异。
所有这些研究表明,在未控制的癫痫中,厚壁菌/拟杆菌比率增加。一些属于厚壁菌门的细菌能够调节神经递质水平。对肠道微生物群(包括α-多样性)的进一步分析表明,结果存在显著差异。在另一项研究中,与拟杆菌相比,厚壁菌的数量增加。
此外,与药物反应性患者相比,耐药患者的α-多样性测量结果与健康受试者相似。实质上,更高水平的α-多样性与罕见肠道细菌种类的异常增加有关。此外,在属水平上,报告了显著差异。根据这些结果,可以认为细菌在癫痫的有效治疗中起作用。
有趣的是,肠道微生物群可以调节唑尼沙胺代谢,唑尼沙胺是一种抗癫痫药物。此外,乳酸杆菌和双歧杆菌数量的增加与每年较少的癫痫发作相关。
在临床前和临床研究中,关于抗生素给药是否能诱导或预防癫痫发作,也有争议的发现。值得注意的是,潜在传染病在治疗过程中可能产生的促癫痫作用或抗生素直接引起的神经毒性副作用可能更为重要。
生酮饮食降低癫痫发作率
据报道,癫痫患者的生酮饮食可降低癫痫发作率,并与肠道菌群组成和功能的改变有关。
生酮饮食在颞叶癫痫的无菌小鼠模型中介导抗癫痫作用。事实上,这些研究人员发现,SPF小鼠在移植生酮饮食的微生物群或长期治疗细菌后癫痫发作阈值升高(长期治疗细菌包括Akkermansia muciniphila, Parabacteroides distasonis, Parabacteroides merdae)。
一些研究表明补充益生菌对癫痫有积极作用。
癫痫的微生物干预
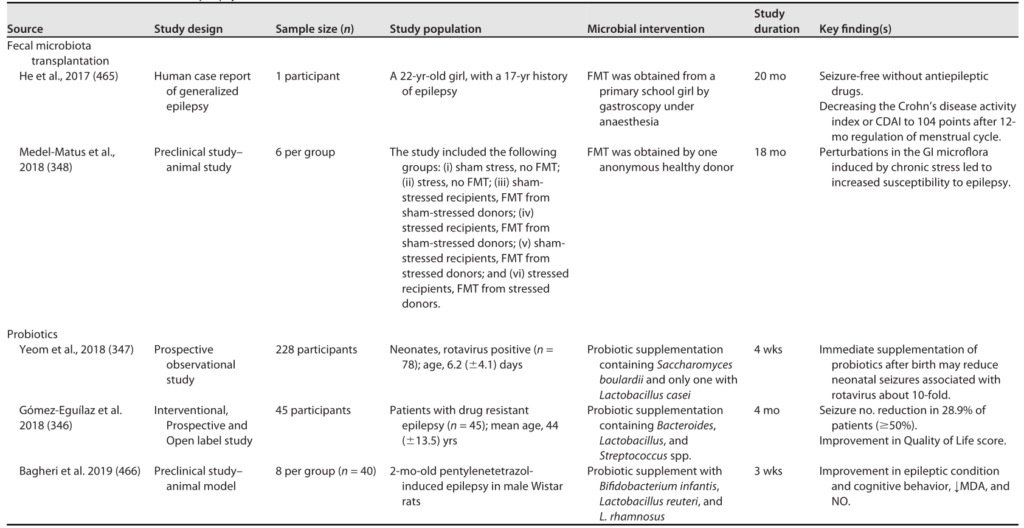
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在全球范围内,中风和脑损伤是发病率和死亡率的重要原因。肠道菌群中的共生细菌可能通过调节多种脑血管疾病的危险因素(包括动脉粥样硬化、糖尿病、血脂异常和动脉高血压),与中风的发生有关。饮食也是一个重要的危险因素。
将动脉粥样硬化和失调联系起来会直接影响微生物组的组成和多样性。然而,越来越多的证据表明,肠道微生物群可能在脑血管疾病和中风中发挥更直接的作用。
三甲胺n-氧化物(TMAO)升高
三甲胺n-氧化物(TMAO)作为微生物群衍生的代谢物,可以从膳食胆碱中合成,可在体液和组织中检测到。最近的研究表明,TMAO与脑血管和心血管疾病的风险增加有关,这表明可能通过这种代谢物的治疗潜力调节肠道微生物群。
横断面调查表明,与健康对照组相比,中风患者的肠道微生物群组成不平衡。在一项对4000多例患者的纵向研究中,血浆样本中TMAO水平升高与卒中和心血管事件的高风险呈剂量依赖性相关。
抗生素补充引起的TMAO水平降低突出了肠道细菌在该化合物合成中的重要性。
同时,与无症状动脉粥样硬化患者相比,中风和短暂性脑缺血发作患者的TMAO水平相对较低。
磷脂酰胆碱代谢物
临床前研究表明,服用磷脂酰胆碱代谢物(如胆碱和TMAO)可上调参与动脉粥样硬化的巨噬细胞清除受体的表达,这可能是由于肠道中存在的细菌物种所致。
对无菌小鼠的研究表明,胆碱的服用与较高的动脉粥样硬化率无关,并且有助于减少主动脉斑块的体积。然而,关于饮食对TMAO和胆碱的影响以及肠道微生物群在动脉粥样硬化发病和进展中的有害和保护作用,重要的是不要过度解释临床前研究的结果。
健康的微生物组在动脉粥样硬化病变的恢复中起着重要作用。
大脑中动脉闭塞后补充广谱抗生素与小鼠存活率降低相关。抗生素诱导的胃肠道菌群改变也导致IL-17相关趋化因子表达下调和促炎性IL-17gd T细胞迁移减少。
因此,肠道细菌通过调节肠道T细胞向大脑的浸润来调节中风后的神经炎症。
卒中后含有短链脂肪酸产生菌的粪菌移植,包括发酵乳杆菌、长双歧杆菌、Faecalibacterium prausnitzii、Clostridium symbiosum,可缓解卒中后的认知障碍和炎症,还可增加血浆、肠道和大脑短链脂肪酸浓度,促进老年模型卒中后恢复。也有报道称,将中风患者粪菌移植到抗生素给药的小鼠,以及从中风模型转移到无菌小鼠,会增加缺血性脑损伤和相关功能损伤的大小。
中风和脑损伤的微生物干预
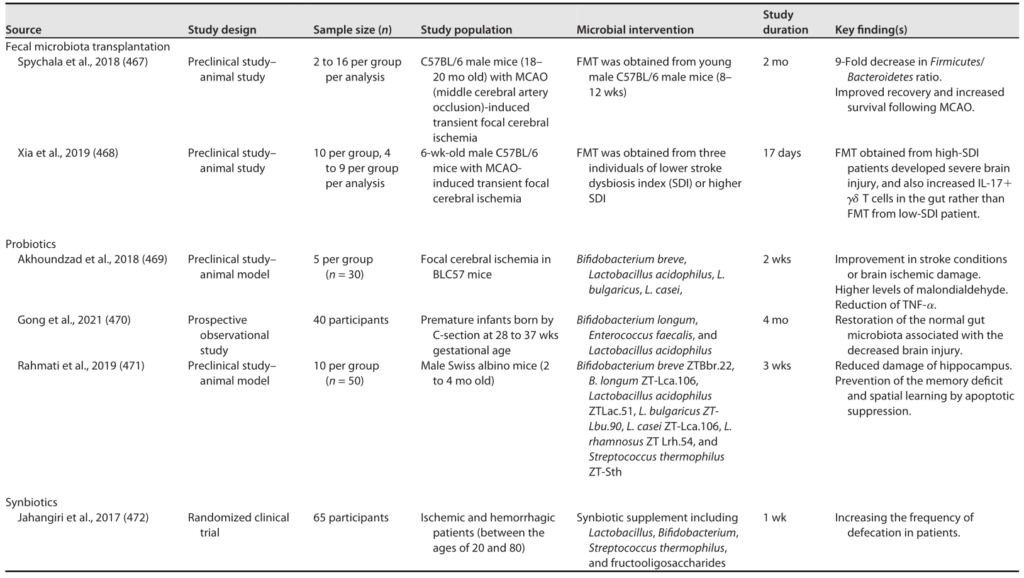
Sorboni SG, et al.,Clin Microbiol Rev. 2022
据报道,中风后拟杆菌的数量和多样性减少。另一项研究表明,短暂性脑缺血发作和中风患者的机会性病原体数量较多,包括脱硫弧菌、肠杆菌、巨球形杆菌和Osicillibacter,有益或共生菌属的数量较少,如拟杆菌、粪杆菌和Prevotella。此外,Prevotellaceae和Peptococcaceae的丰度增加与中风严重程度相关。
用一种特殊的细菌菌株,即丁酸梭菌进行治疗,可改善缺血/再灌注小鼠模型的认知功能,并减少神经元损伤。
根据这些解释,肠道微生物群在中风和脑损伤发病和进展中的作用尚不完全清楚。虽然临床前和临床研究提供了有趣的结果(表7),但还需要进一步的研究。有人建议在饮食中补充精神生物素,以减少创伤性脑损伤后的精神后果和共病。然而,需要更多的临床研究来阐明这种微生物治疗干预的潜力。
药物
益生元
益生菌
合生元
后生元
粪菌移植
其他
越来越多的证据表明,人们越来越认识到肠道微生物组在调节不同药物(如精神药物)的疗效和副作用方面的重要性。
抗生素
抗生素是影响胃肠道菌群的最有效和最直接的方法。
对1135名个体的肠道微生物组的深度测序表明,肠道微生物组与各种药物组之间存在关联。抗生素与胃肠道微生物组的改变密切相关。
值得注意的是,作者提供了其他几种治疗药物对胃肠道微生物群影响的证据,如二甲双胍、泻药、他汀类药物和质子泵抑制剂(PPI)。
多药疗法
同时使用多种药物治疗患者,也与肠道微生物群的改变有关。一项调查显示,服用药物的数量与微生物多样性之间存在显著的负相关。尤其是抗抑郁药、PPI和抗精神病药与分类单元丰度的相关性最大。
非抗生素药物
同时,新证据表明,除了药物药代动力学的调节外,非抗生素药物还可以改变肠道微生物组结构,对情绪和行为产生潜在影响。
另一方面,人们越来越重视肠道微生物组与药物之间的相互作用,这支持了肠道菌群可影响药物代谢和吸收的观点。在一项大规模队列研究发现,包括抗生素、抗抑郁剂、苯二氮卓类药物等在内的医疗干预可以改变肠道微生物组的组成。
精神药物
此外,研究了精神药物对40名焦虑症和/或重度抑郁症患者胃肠道菌群的影响。在其队列研究中,研究人员得出结论,抗精神病药物降低了胃肠道微生物组α多样性。这些研究人员确定抗精神病药物的剂量与这些患者的α-多样性呈负相关。
已经进行了多项体外研究,以评估非抗生素药物的抗菌活性,所有这些药物都具有抗菌活性,可能通过与特殊分子靶相互作用影响中枢神经系统功能。
其他报告显示抗抑郁药选择性5-羟色胺再摄取抑制剂(SSRIs)、氟西汀、舍曲林、西酞普兰和帕罗西汀对芽孢杆菌、梭状芽孢杆菌、肠球菌、假单胞菌和葡萄球菌菌株具有抗菌活性。
在最近的一项研究中,作者测试了不同类别的抗抑郁药对12种肠道菌群共生细菌菌株的抗菌活性。大多数被检查的抗抑郁药对被检查菌株的生长具有相当大的浓度依赖性抑制作用。此外,在对雄性BALB/c小鼠肠道微生物群的体内研究中,作者发现与对照组相比,地昔帕明可增加β-多样性并降低丰富度。
这些作者还发现,在补充了地昔帕明的小鼠模型中,Adlercreutzia、瘤胃球菌和未分类的α-变形杆菌的数量减少。三环类抗抑郁药,包括阿米替林,也被证明对致病细菌菌株,如芽孢杆菌属、葡萄球菌属和霍乱弧菌具有体外抗菌活性,而丙咪嗪分别对小肠结肠炎耶尔森菌和大肠杆菌具有生长抑制作用。
在一项老年住院患者队列研究中,研究了精神药物对肠道微生物群组成的影响。在受试药物中,与PPI和抗抑郁药相比,抗精神病药物与微生物群落α多样性的负相关性最高。
在另一项对双相情感疾病受试者的调查中,非典型抗精神病药物(APP)治疗与女性的微生物多样性降低相关,但与APP治疗的男性患者无关。在这一队列中,服用APPs的患者,其衣原体科和阿克曼氏菌的数量分别显著增加和减少。
在针对40种肠道共生菌代表的1000多种药物的大规模体外筛选研究中,据报道,24%的受试药物对至少一种细菌菌株表现出生长抑制。这些药物对相当相似的物种模式具有抗菌活性,表明直接抗菌活性可能是其药理作用的一部分,不应将其视为副作用。因此,迫切需要评估精神药物对胃肠道菌群的潜在影响。
阿片类药物
肠-脑轴的双向方面也反映在这样一个事实,即肠道神经胶质细胞的 GDNF 等分泌因子也通过粘膜免疫系统的成熟以及通过加强上皮紧密连接功能来调节微生物稳态。阿片类药物介导的 GDNF 表达降低也与肠道通透性增加和肠粘膜表面免疫监视改变有关。这些因素有助于维持阿片类药物治疗观察到的促炎环境,导致下游阿片类药物相关的合并症,如阿片类药物耐受、依赖和戒断。

Jalodia R, et al., J Neuroimmune Pharmacol. 2022
此外,来自肠神经元的神经元介质(例如,VIP、ACh、NO)的阿片类药物抑制释放会导致胃肠道分泌减少、水和电解质吸收增加、蠕动减少,从而导致阿片类药物诱导的便秘,进一步导致微生物群失调。总之,虽然 OUD 的药物治疗是可用的,但它们并非对所有患者都有效。
根据国际益生菌和益生元科学协会(ISAPP)的说法,“益生元是指宿主微生物群体专门利用的、对健康有益的非活性食品成分。”作为益生菌补充的替代品,益生元可用于调节肠道菌群。
这组化合物通过其影响胃肠道健康的能力进行鉴定,包括不可消化低聚糖(NDO)、母乳低聚糖(HMO)和可溶性可发酵纤维。尽管益生元疗法在增强有益细菌(如双歧杆菌和乳酸杆菌)方面具有潜力,但只有少数研究检测了这些化合物对人类和动物肠道菌群的有益影响。对低聚半乳糖和低聚果糖或其组合对雄性小鼠的作用的研究表明,这些化合物具有抗抑郁、抗焦虑作用,并逆转慢性应激的作用。
在一项安慰剂对照临床试验中,服用N-乙酰半胱氨酸8周后,自闭症婴儿的易怒性和重复行为有所下降。此外,补充商业益生元药物B GOS(Bimuno)和限制性饮食可改善自闭症儿童的行为,这可能是由于乳酸杆菌和双歧杆菌含量较高。
最近的一项研究还表明,益生元乳果糖可以通过自噬和抗炎途径改善阿尔茨海默小鼠模型的认知缺陷。因此,这些发现似乎表明益生菌和益生元是神经系统疾病的有效治疗选择。然而,考虑到仅仅是相关性并不一定表明因果关系,需要进行额外的调查以详细了解潜在的机制。
健康个体和患者肠道微生物群组成和功能的变化已被确定为各种神经系统疾病。人们已经认识到,饮食可以影响微生物组成,改变肠-脑轴的功能。多种治疗干预措施已用于治疗肠道微生物群落失调,恢复肠道微生物群落平衡,改善神经系统疾病的临床结果,包括使用益生菌。
益生菌在普通食品和药片中的应用越来越流行。益生菌主要由双歧杆菌和乳酸产生菌组成,例如乳酸杆菌。越来越多的证据表明,益生菌合成的代谢物是饮食诱导的宿主-微生物相互作用的基本介质。此外,一些肠道细菌种类,如拟杆菌、梭菌、双歧杆菌、消化链球菌、乳酸杆菌和瘤胃球菌,可产生多种色氨酸分解代谢产物,包括吲哚、3-甲基吲哚、吲哚乙酸(IAA)、色胺等。
新出现的数据表明,微生物组衍生的色氨酸分解代谢影响宿主健康。已经证明,这些代谢物可与AhR结合,从而激活免疫系统,改善肠道屏障功能,刺激胃运动活动(以及胃肠激素的分泌),发挥全身或局部抗氧化、抗炎作用,并可能调节肠道微生物组和代谢组。
据报道,由共生微生物群合成的色氨酸分解代谢物可诱导小胶质细胞AhR激活,抑制NF-kB信号、VEGF-B和TGF-α的激活。此外,AhR在树突状细胞中高度表达,控制分化和功能。树突状细胞中维甲酸、犬尿氨酸和AhR驱动的细胞因子的产生增强T-reg细胞的分化,抑制EAE作为多发性硬化动物模型的发展。
AhR信号在肠道和大脑中的作用
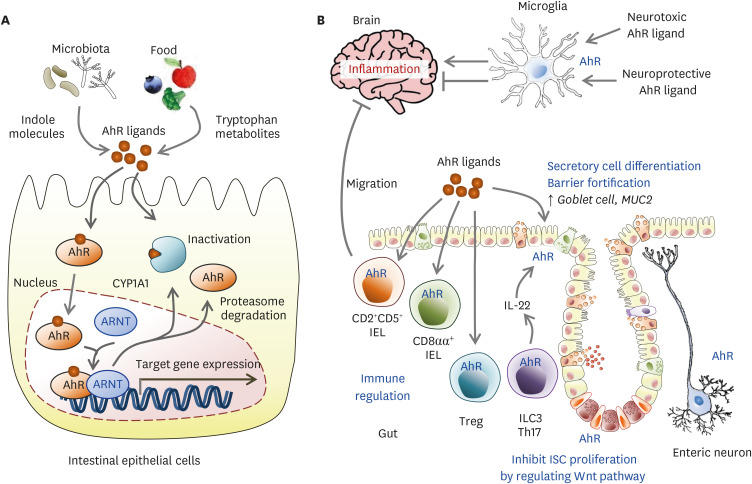
Gwak MG, et al., Immune Netw. 2021
星形胶质细胞在炎症介导的神经退行性变中发挥关键作用,发挥神经毒性作用,激活和招募与中枢神经系统发病机制有关的其他细胞。据报道,在EAE和多发性硬化动物模型中,星形胶质细胞的转录谱显示AhR表达上调。
最近的研究得到了几种神经系统疾病相关临床证据的支持,证明越来越重视使用益生菌和益生元来调节胃肠道微生物群。
使用小鼠模型进行的几项研究表明,益生菌的施用可有益于几种神经系统疾病(如自闭症、癫痫和阿尔茨海默),从而改善认知结果。然而,关于益生菌给药对人类神经功能障碍的有效性,临床证据仍然很少。
对几名患有焦虑和胃肠道症状的3-12岁自闭症儿童进行的调查发现,使用名为Visbome的特殊配方,包括八种不同的益生菌菌株,主要是乳酸杆菌,是安全的,并导致保留乳酸菌患者的自闭症和胃肠道症状的健康改善。
此外,当使用益生菌治疗人类神经退行性疾病(包括阿尔茨海默)时,已经发现了有希望的结果。首先,据报道,植物乳杆菌能够改善阿尔茨海默小鼠模型的认知能力并增加大脑中乙酰胆碱酯酶的水平。在患有阿尔茨海默的啮齿动物散发模型中,用嗜酸乳杆菌、发酵乳杆菌、乳酸双歧杆菌和长双歧杆菌进行Ab注射也发现类似结果。另一项随机临床研究表明,益生菌与鼠李糖乳杆菌GG(ATCC 53103)合用可能减少75名自闭症婴儿的多动症发展,并可能减少神经精神疾病的发展。
证据还表明益生菌对帕金森病患者的影响。最近的一项研究表明,长期服用由六种细菌组成的益生菌可减轻帕金森病遗传小鼠模型的运动损伤,并对多巴胺能神经元具有神经保护作用。
合生元是指益生元和益生菌的混合物,其中益生元有利于益生菌微生物的生长和代谢,提高其生存能力和效益,通过增加胃肠道中有益微生物的丰度来影响宿主。
合生元中使用的组合必须适当,以支持益生菌微生物在胃肠道中的存活。研究表明,使用合生元比单独使用益生菌或益生元更有效。结果表明,由GOS和包括瑞士乳杆菌和长双歧杆菌在内的多序列益生菌组成的合生元制剂可减少抑郁症症状,并改善重度抑郁症中的色氨酸信号。
随机对照试验中使用含合生元的多序列益生菌和益生元治疗的结果导致帕金森队列中功能性胃肠道症状的改善。婴儿双歧杆菌和低聚糖作为合生元被证明对缓解自闭症中的肠道相关疾病有效。然而,合生元对微生物群-肠-脑轴的影响还需要更多的研究 。
后生元,也称为代谢、生物原或CFSs(无细胞上清液),由细菌发酵代谢产物和从活细菌中获得或在细菌细胞裂解后释放的可溶性因子组成,如短链脂肪酸、酶、AMP、磷壁酸、胞内和胞外多糖、细胞表面蛋白、维生素、血浆素和有机酸。
非活性益生菌paraprobiotics被定义为不可存活或失活的微生物细胞,而一些研究人员将其作为后生物的一个亚组。非活性益生菌是一种结构成分,若给予适量,可能会触发宿主的生物活性。
灭活可通过各种方法实现,如物理(热灭活益生菌、紫外线照射或超声波)或化学方法。生物活性化合物,如肠道肽,是细菌与宿主相互作用的结果,被认为是益生元。热灭活副干酪乳杆菌PS23缓解了皮质酮诱导的焦虑样表型,改善了海马和前额叶皮质中的多巴胺水平。
关于大脑健康,对患有心理社会应激的小鼠进行短链脂肪酸组合(乙酸盐、丙酸盐和丁酸盐)治疗的研究显示了抗焦虑作用。
根据最近发现的微生物干预在调节肠道失调引起的神经系统疾病方面的潜力,粪便微生物群移植(FMT)似乎是一种有希望的治疗策略。
这种相对较新的治疗方法包括从健康粪便样本捐赠者及其微生物和代谢物转移到接受者。这种方法目前被用于治疗艰难梭菌感染,与抗生素治疗一起使用。
通过FMT,健康微生物群通过繁殖自我替换,并产生生物活性代谢物。口蹄疫是通过使用内窥镜、灌肠和冷冻干燥材料口服喂养来完成的。该方法的潜力已被用于治疗帕金森病、自闭症和多发性硬化症等神经系统疾病。这种方法的优点之一是没有明显的副作用报告,即使在高危患者中也被认为是安全的。
在最近一项关于自闭症小鼠的研究中,评估了体外培养的肠道微生物移植(GMT)的效果,该移植显著减轻了小鼠的焦虑样行为。在另一项研究中,对接受FMT的自闭症患者进行了结肠镜检查,结果证明自闭症相关症状显著改善,他们的肠道微生物群改变为健康状态。然而,需要更多的研究来进一步阐明FMT对自闭症患者的影响。
在动物模型中对阿尔茨海默进行了大量研究,但没有对人类患者进行具体研究。对阿尔茨海默小鼠模型的研究结果表明,认知功能障碍与肠道微生物群组成的变化有关;因此,通过FMT对该微生物群进行修饰被证明能有效缓解阿尔茨海默患者的认知功能障碍。许多关于FMT的神经系统疾病的研究已经完成,许多试验正在进行中。因此,很快就会有大量证据。
通过治疗性微生物干预调节肠道微生物群
Sorboni SG, et al.,Clin Microbiol Rev. 2022
其他(食物及补充剂)
改善肠脑轴的食物
食物已被证明可以改善肠脑功能。其中许多含有精神生物化合物,包括:
Omega-3 脂肪
存在于油性鱼类和亚麻籽中,已被证明可以改善青春期和成年期的微生物群多样性。这可以降低患精神分裂症和抑郁症等脑部疾病的风险。
发酵乳制品
如酸奶和奶酪中发现的各种益生菌菌株。这些已被证明可以调节大脑活动。
富含纤维的食物
如水果和蔬菜、全谷物和坚果。这些含有益生元纤维,可降低皮质醇水平并改变情绪偏见。
富含多酚的食物
肠道菌群失调导致肠上皮黏膜屏障和血脑屏障通透性增高,并通过肠-脑轴的免疫、内分泌和肠神经途径影响阿尔茨海默的发生发展。多酚类化合物可能通过上述机制发挥防治阿尔茨海默的作用。
详见:肠道微生物群与膳食多酚互作对人体健康的影响
食用蘑菇类
香菇含有大量的维生素B6。因为维生素 B6 会影响血清素和神经递质的产生,所以健康的 B6 水平与积极的情绪和自然地减轻压力有关。
在动物研究中,它也被证明可以有效治疗抑郁症等情绪障碍。
坚果
如杏仁、腰果、核桃和巴西坚果。研究表明,食用这些会提高血清素的水平,血清素是一种让人感觉良好的化学物质,血清素降低,人会感到沮丧。
富含酪氨酸的食物
如杏仁、蛋鱼和鸡肉,富含酪氨酸,酪氨酸是一种能提高大脑多巴胺水平的氨基酸。
其他:
L-苏糖酸镁
镁对大脑至关重要,它是制造许多参与大脑功能的酶的必要辅助因子。它对于维持和发展突触之间的联系也至关重要,突触是学习和记忆的核心任务。大脑和脑脊液中高水平的镁与阿尔茨海默病和大脑衰老的发病率降低有关。补充剂 L-苏糖酸镁比其他镁形式更有效地通过血脑屏障,并且不会引起消化不良。
维生素 D3 和 维生素 K2
血清维生素 D 高水平对于维持大脑健康和降低阿尔茨海默病和其他神经退行性疾病导致的认知障碍风险极为重要。维生素 D 的抗炎和抗氧化特性也很重要。
相反,低维生素 D 会导致大脑中的钙含量增加,这与抑郁症有关,并且会导致表征痴呆的淀粉样蛋白斑块增加。
维生素 D 与维生素 K 协同作用以调节钙并防止其在软组织中积累,例如滋养大脑的血管。
补充剂应包括最易吸收的胆钙化醇(维生素 D3)形式的维生素 D,以及甲基萘醌(维生素 K2)形式的维生素 K,以帮助调理肠道。这种组合对预防血管钙化最有效。
姜黄素
姜黄根中的活性化合物姜黄素使咖喱粉呈现鲜艳的黄色。姜黄素激活 Nrf2 抗氧化信号通路,开启参与解毒和消除自由基的基因。
在大脑中,姜黄素补充剂具有强大的抗炎和抗氧化特性。姜黄素还通过抑制淀粉样蛋白的形成来帮助预防痴呆。姜黄素补充剂可以显著提高 BDNF(脑源性神经营养因子)的血清水平。BDNF 在保护现有神经元和刺激新神经元生长方面发挥着重要作用。
高水平可以帮助预防认知障碍,并有助于从脑震荡和脑损伤中恢复。
肠道微生物群不仅与消化吸收相关,还与大脑密切相关,从而影响各类神经系统疾病,如常见的自闭症、抑郁症、精神分裂症等。改善肠道健康后,通过肠脑轴的连接减少全身炎症,同时也改善心理健康。在现代社会普遍压力较大的情况下,注意减压的同时更不能忽视肠道健康。
主要参考文献:
Li XJ, You XY, Wang CY, et al. Bidirectional Brain-gut-microbiota Axis in increased intestinal permeability induced by central nervous system injury. CNS Neurosci Ther. 2020;26(8):783-790. doi:10.1111/cns.13401
Deidda G, Biazzo M. Gut and Brain: Investigating Physiological and Pathological Interactions Between Microbiota and Brain to Gain New Therapeutic Avenues for Brain Diseases. Front Neurosci. 2021;15:753915. Published 2021 Oct 12. doi:10.3389/fnins.2021.753915
Gwak MG, Chang SY. Gut-Brain Connection: Microbiome, Gut Barrier, and Environmental Sensors. Immune Netw. 2021;21(3):e20. Published 2021 Jun 16. doi:10.4110/in.2021.21.e20
Sorboni SG, Moghaddam HS, Jafarzadeh-Esfehani R, Soleimanpour S. A Comprehensive Review on the Role of the Gut Microbiome in Human Neurological Disorders. Clin Microbiol Rev. 2022 Jan 5;35(1):e0033820. doi: 10.1128/CMR.00338-20. Epub ahead of print. PMID: 34985325; PMCID: PMC8729913.
Suganya K, Koo BS. Gut-Brain Axis: Role of Gut Microbiota on Neurological Disorders and How Probiotics/Prebiotics Beneficially Modulate Microbial and Immune Pathways to Improve Brain Functions. Int J Mol Sci. 2020;21(20):7551. Published 2020 Oct 13. doi:10.3390/ijms21207551
Jalodia R, Abu YF, Oppenheimer MR, Herlihy B, Meng J, Chupikova I, Tao J, Ghosh N, Dutta RK, Kolli U, Yan Y, Valdes E, Sharma M, Sharma U, Moidunny S, Roy S. Opioid Use, Gut Dysbiosis, Inflammation, and the Nervous System. J Neuroimmune Pharmacol. 2022 Jan 7. doi: 10.1007/s11481-021-10046-z. Epub ahead of print. PMID: 34993905.
Morais LH, Schreiber HL 4th, Mazmanian SK. The gut microbiota-brain axis in behaviour and brain disorders. Nat Rev Microbiol. 2021 Apr;19(4):241-255. doi: 10.1038/s41579-020-00460-0. Epub 2020 Oct 22. PMID: 33093662.

谷禾健康

Oscillospira,颤螺菌属,是一种神秘的细菌属,从未培养过,但通过人类微生物组的 16S rRNA 基因调查不断检测到,是人类肠道菌群的谜一样的组件,广泛存在于动物和人类肠道中。大人群水平上, 其与肥胖,消瘦,和胆结石和慢性便秘等相关,并显示出与其病程中的积极或消极变化有一定的相关性。能够产生丁酸盐等短链脂肪酸(SCFAs)的菌属,由于丁酸盐是筛选“下一代益生菌”的重要参考指标,该菌也被列为下一代益生菌的候选者。
颤螺菌属(Oscillospira)是梭菌群中的一个未被充分研究的厌氧细菌属,属于厚壁菌门,瘤胃球菌科。
一个世纪前,Chatton 和 Pérard在豚鼠盲肠内容物中发现了Oscillospira guilliermondii,这是Oscillospira属中唯一已知的物种,这才第一次出现了有关Oscillospira 的记录。然而,由于尚未获得纯培养物,因此对其在肠道中的生态作用和生理特性知之甚少。
由于O. guilliermondii 体型大且形态独特,便于其 DNA 分离和 16S rRNA 基因扩增和测序,因此基于流式细胞术对Oscillospira属进行分类,并通过 16S rRNA 系统发育分析确定为Ruminococcaceae(瘤胃球菌科)的成员。
Oscillospira属的通常是杆状或椭圆形,细胞非常大(大约5-7微米的宽度,70 毫米长),在透射电子显微镜下可以看到细胞内紧密间隔的横向隔膜。一些颤螺菌属有内生孢子(2.5×4 μm),呈棒状纵向排列,具折射性,数量可变,通常含有大量多糖,遇碘呈淡红色或淡紫色。
由于在颤螺菌中观察到孢子样结构,推测这组微生物可能含有孢子相关基因。一些Oscillospira成员基因水平的分析揭示了小酸溶孢子蛋白的存在,孢子成熟蛋白A和B,六种III阶段孢子形成蛋白,以及孢子形成转录调节SpoIIID 和 SpoVT。
然而,一些没有SpoVT 和其他相关的孢子蛋白,表明孢子形成可能是Oscillibacter进化枝中的零星分布特征。有趣的是,产孢基因也存在于一些非产孢菌中,例如Oscillibacter valericigenes,它含有产孢基因但不产生孢子,而这些产孢基因可能起其他作用,如调控基因。
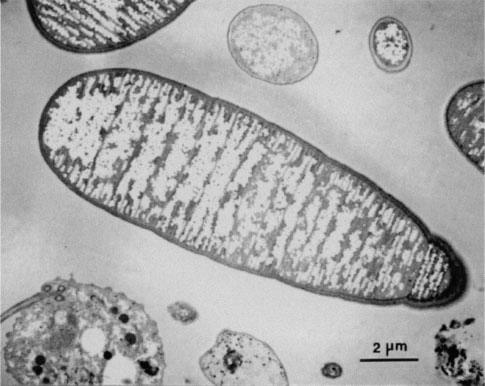
图源:by Takahiro Kanagawa
Oscillospira是一种革兰氏阳性细菌,其 G + C 含量低,序列与从肉鸡盲肠和奶牛瘤胃内容物中获得的梭菌簇 IV(柯林斯命名法)内的未培养细菌克隆的序列接近。有趣的是,来自人类粪便样本的克隆序列也属于这一簇,这表明该簇中的微生物不仅广泛存在于草食动物的消化道中,而且还广泛存在于杂食动物的消化道中。
从宏基因组和代谢特征的发现该生物体具有丁酸激酶介导的通路,从而它被推断Oscillospira是丁酸生产者,并且至少其中的一些物种可以利用葡萄糖酸盐,这是一种常见的动物源性糖,既由人类宿主产生,又由宿主通过富含动物产品的饮食摄入。
另一方面,进一步证明了颤螺菌可以发酵复杂的植物碳水化合物。特定的碳源对其生长也是必不可少的,例如颤螺菌在含有葡萄糖、乙醇和乳酸的培养基中生长良好,尤其是葡萄糖显著促进其生长。
已经表明,颤螺菌难以培养且生长缓慢,这可能与较长的结肠转运时间有关。快速的结肠运输时间选择快速生长的微生物,同样,较慢的运输条件允许较慢的微生物留在管腔中并避免被洗脱,缓慢生长的颤螺菌的特性很合适。
另一方面,基因组中 tRNA 基因的数量可以作为微生物世代的强预测因子。绝大多数快速生长的微生物在其基因组中都有更多的 tRNA 基因拷贝,反之亦然。先前的研究已经表明,有少于40个tRNA基因Oscillospira,和相对于其他快速增长的肠微生物如脆弱拟杆菌(72-73 tRNA基因,产生时间0.63 h)比,Oscillospira是一种生长非常缓慢的生物。
近年来,基于人体肠道菌群的多个16S rRNA扩增子测序数据表明,颤螺菌是人体肠道和粪便菌群的丰富成分,其基因序列量有时占整个肠道菌群的10%以上,同时,Oscillospira可以产生丁酸盐,表明这种生物可能在人体功能和健康的各个方面发挥重要作用。
为了深入了解Oscillospira与人体相关健康状况,广东肠道微生物组计划 (GGMP) 分析了来自中国广东省 14 个区的6000多名参与者,并记录调查了这些参与者的社会人口学和人体测量学参数、饮食、药物、疾病和生活方式的详细信息。发现Oscillospira与人类健康密切相关,因为它的丰度与微生物多样性、高密度脂蛋白和睡眠时间呈正相关。
多种因素影响着颤螺菌的丰度,主要是外源性因素。从一系列文献中得知,饮食、益生菌益生元、重金属、天然活性产品、药理干预、运动和饮食以及其他因素都会影响肠道中Oscillospira的丰度。
益生菌
养殖家禽,益生菌芽孢杆菌通常与饲料混合,以达到保证个人健康和获得高品质的肉的最终目标。
研究发现枯草芽孢杆菌29784显著提高肉鸡增重,提高他们的肠道健康状况,同时增加了肠道中Oscillospira丰度。添加枯草芽孢杆菌对母鸡的饮食,这是能够提高生长性能和肠道功能,诱导Oscillospira逐渐成为在肠道中的优势种。
同样,在新生肉鸡饲养过程中,添加益生菌制剂(解淀粉芽孢杆菌加枯草芽孢杆菌)增加了Oscillospira丰度和显著减少致病的大肠杆菌水平传输,并减轻感染的严重程度。
凝结芽孢杆菌添加可以减轻环磷酰胺诱导的小鼠肠损伤和显着增加有益菌的丰度如Oscillospira。
短双歧杆菌ATCC 15700 (BB) 治疗酒精性肝病 (ALD) 后,症状得到缓解,并显着增加了Oscillospira的丰度。
从Leuconostoc pseudomesenteroides XG5 (XG5-EPS) 中分离出的胞外多糖显着增加了小鼠盲肠微生物群的丰富度,尤其是增加了Oscillospira的相对丰度。
乳酸菌和酵母共同发酵的西藏开菲尔奶 (TKM) 对喂食含有人源菌群相关 (HFA) 的高脂肪饮食的大鼠脂肪沉积的影响,发现TKM减少腹部脂肪沉积和通过调节血清中甘油三酯(TG)水平,同时增加Oscillospira丰度。
然而,并非所有益生菌都可以直接或间接增加颤螺菌的丰度。
研究指出长期补充鼠李糖乳杆菌降低了雌性 Sprague Dawley 大鼠的体重,改善了血清细胞因子,降低了血清脂蛋白谱,而它们的肠道颤螺旋体丰度显着下调。同样,丁酸梭菌能够产生丁酸,丁酸已被证明可以限制肝脏中的脂质沉积,恢复肠道屏障功能,并改善肝脏炎症,并具有益生菌潜力。丁酸梭菌缓解了结肠炎小鼠肠道炎症并伴随Oscillospira丰度降低。
益生元
除了益生菌,益生元对肠道菌群也有重要影响。
低聚果糖(FOS)显著增加的丰度Oscillospira在小鼠肠,特别是当FOS与益生菌组合的进一步能够抑制许多有害肠道微生物。
褐藻糖胶 (FUC) 和低聚半乳糖 (GOS) 改善了高脂饮食大鼠的血清血脂异常、胆盐水解酶 (BSH) 活性和胆汁酸相关代谢水平,并促进了Oscillospira guilliermondii的丰度。
人乳寡糖非常重要,具有独特多样的结构,可以通过不同的机制影响婴幼儿肠道菌群的发育和组成。使用婴儿粪便移植的人类小鼠模型来研究岩藻糖基-α1,3-GlcNAc (3FN)、岩藻糖基-α1,6-GlcNAc、乳-N-二糖 (LNB) 和半乳-N-二糖的作用。关于粪便微生物群和宿主-细菌相互作用,发现所有这些二糖都显着上调了颤螺菌的丰度。
发现豌豆纤维改善了超重个体的健康状况并增加了他们的肠道颤螺菌丰度,同时他们发现增加的Oscillospira与降低的脱氧胆酸(DCA)和粪便中的石胆酸(ISO-LCA)显著关联。
马铃薯纤维是淀粉生产的副产品,富含果胶、纤维素、半纤维素和抗性淀粉等膳食纤维,可被肠道微生物群利用和代谢以产生短链脂肪酸。
其中一个代表产品是 FiberBind 400,是一种市售的马铃薯纤维产品。在胃肠模型(TIM)-2结肠模型测定中,FiberBind 400的摄取增加外源性的肠内存活发酵乳杆菌PCC®,鼠李糖乳杆菌LGG®,罗伊氏乳杆菌RC-14®,副干酪乳杆菌F-19®和也被发现促进肠道的生长Oscillospira。
然而,也有研究发现燕麦 β-葡聚糖 (OG)、燕麦抗性淀粉 (ORS) 和全燕麦食品 (WO) 显着改善了 II 型糖尿病大鼠的症状并降低了它们的肠道颤螺菌丰度。海洋动物来源的Cereus sinensis多糖 (CSP-1) 显着增加了小鼠胸腺、脾脏指数和总 SCFAs 的产生,并降低了Oscillopira丰度,他们假设 CSP-1 可能是一种潜在的益生元。
总之,益生菌和益生元通常在家禽养殖以及特定疾病相关的动物模型中表现出促进健康的作用,其中绝大多数益生菌或益生元摄入可以直接或间接增加宿主肠道中颤螺菌的丰度,而少数人则相反,颤螺菌丰度的上调或下调似乎与特定菌株或特定益生元有关。
重金属
越来越多的流行病学证据表明,重金属可能促成和影响各种代谢疾病的进展,这些疾病的病因和进展部分是由于重金属引起的肠道微生物群紊乱。
通过对不同剂量的铅对肠道菌群和肠屏障在小鼠,发现随着铅剂量的增加,对小鼠结肠组织的损害增加,Coprococcus和Oscillostira的相对丰度呈线性下降。
铅和镉 (Cd) 暴露可以通过改变产生 SCFA 的相关微生物的丰度来影响 SCFA 的浓度,例如瘤胃球菌、拟杆菌、颤螺菌。
一项研究表明,Oscillospira产生丁酸盐和丙酸盐,增加杯状细胞和粘液的产生,保持肠上皮的完整性,减少铅的吸收,从而减少结肠组织的损伤和炎症。

4周龄C57BL / 6雌性小鼠摄取含有100ppb的砷(As)的饮用水13周显示出在一个显著下降Oscillospira丰度,但这是伴随着增加Akkermansia和双歧杆菌丰度。该结果在其他小鼠研究中一致。
此外,Oscillospira似乎对其他重金属同样敏感,例如铜和银,这些重金属可以显着影响大鼠肠道中颤螺菌的比例。然而,也有一些重金属与颤螺菌丰度呈正相关,例如汞暴露会导致小鼠肠道损伤并增加其肠道颤螺菌丰度,这一现象在另一项研究中得到进一步证实。
值得注意的是,研究表明,儿童自闭症谱系障碍 (ASD) 人群中较高浓度的铅、砷、铜、锌、汞、钙和镁,尤其是砷和汞浓度,与肠道中的颤螺菌丰度高度相关。
不同重金属对肠道中颤螺菌丰度的影响各不相同。仅颤螺菌丰度的上调或下调似乎并不能表明特定重金属对宿主健康是否具有积极或消极影响。因此,不同重金属暴露下的颤螺菌丰度模式有待进一步探索,该属也有可能作为评估重金属污染程度的指标之一。
天然产物
天然产物对肠道微生物群的影响已被更频繁地研究。其中,多酚似乎能够对宿主微生物群发挥重要作用。
从谷壳中提取的小米壳多酚(MSP)在体外具有抗动脉粥样硬化作用。以高脂饮食的 ApoE-/- 小鼠为实验对象,研究 MSPs在体内的抗动脉粥样硬化活性发现MSPs有效抑制动脉粥样硬化斑块的发展,降低相关炎症因子的水平,并显着上调紧密连接蛋白(ocludin、zona occludens-1和claudin 1),肠道菌群中Oscillospira和瘤胃球菌进行显著富集。
一种富含多酚的植物提取物,可对高脂饮食 (HFD) 小鼠的体重和胰岛素抵抗产生有益影响。将高强度间歇训练 (HIIT) 和 富含多酚的植物提取物的组合应用于西方饮食诱导的肥胖大鼠模型,发现这种组合方式显着限制了大鼠的体重增加并改善了血糖水平,而它们的颤螺菌丰度也显着增加。
绿茶多酚(GTP),也可以提高雌性SD大鼠的肠道内Oscillospira。然而,多酚也并非都与颤螺菌呈正相关。
研究表明,青砖茶(QZT)具有显着的抗肥胖、清除自由基、抗氧化、抑制脂肪细胞增殖等保健作用。发现QZT提取物改善肠道微生物介导的在高脂肪小鼠代谢紊乱并降低的丰度Oscillospira,其显著正与代谢综合征关联。
除了多酚,其他一些活性产品也有类似的效果。

辣椒素 (CAP) 是辣椒中的一种活性成分,具有多种药理活性和对精神疾病的潜在影响。
发现 CAP 可改善脂多糖 (LPS) 诱导的抑郁样行为小鼠的抑郁和血清 5-羟色胺 (5-HT) 和肿瘤坏死因子-α (TNF-α) 水平,并显着上调小鼠的Oscillospira相对丰度。
蔓越莓渣 (CBP) 富含多酚、复合碳水化合物、纤维和营养矿物质。肉鸡饲养过程中持续增加CBP的最终显著促进了鸡肠道内的Oscillospira丰度。
蓝莓二甲花翠素-3-半乳糖苷(蓝莓M3G)也增加了在小鼠中的肠道微生物的多样性和显著增加的丰度Oscillospira和瘤胃球菌。
多糖是从葛根(PPL)衍生不仅减少了异戊酸浓度在正常小鼠,也显著增加Oscillospira丰度和最终减轻抗生素相关性腹泻(AAD)诱导的结肠病理状况和小鼠肠道菌群的生态失调。
肠道微生物群在改善认知和塑造行为方面也发挥着重要作用。发现 5% 的果胶与 5% 的纤维素混合可改善小鼠的学习和记忆力,并显着增加其肠道颤螺菌的丰度。
同样,肠道微生物群在食物过敏中起着至关重要的作用。在小麦依赖性运动诱发过敏反应(WDEIA)在肠道菌群的变化的患者的研究中,Oscillospira与ω-5醇溶蛋白-特异性免疫球蛋白E(IgE)呈正相关,而双歧杆菌与总 IgE 水平呈显著负相关。
然而,一些天然产物与颤螺菌之间存在负相关关系。
苦豆子(豆科)衍生的生物碱改善抑郁样在慢性应激行为和抑郁有关的指标(CUMS)诱导的抑郁症模型小鼠和降低Oscillospira丰度。

发现用亚麻籽多糖(FSP)处理的高脂肪饮食喂养的小鼠已经显著降低他们的血清空腹血糖,总甘油三酯和总胆固醇水平和显著增加有益的比例Akkermansia和双歧杆菌比,同时降低的比例Oscillospira。
芥末粉显着改善了饮食诱导的肥胖大鼠的健康状况,并下调了它们的肠道Oscillospira丰度。
综上所述,以多酚、纤维为代表的天然产物能够显著改善特定疾病动物模型的健康状况,尤其是高脂饮食引起的肥胖等代谢性疾病,并伴随肠道颤螺菌丰度的显著上调。此外,其他天然活性产品总体上表现出对宿主健康的有益作用,但不同产品作用下的颤螺菌丰度差异很大。
药理干预
药物干预对肠道菌群有重要影响。年龄相关性黄斑变性 (AMD) 是老年人视力障碍的主要原因。AMD小鼠艾替伏辛etifoxine治疗后肠道内的Oscillospira显著降低。
53羟氯喹 (HCQ) 是一种广泛使用的抗疟疾药物,推荐用于治疗 COVID-19。对小鼠进行短期高剂量 HCQ 刺激会改变其肠道微生物群的结构,尤其是Oscillospira的丰度,但不会影响其肠道完整性和免疫反应。
发现杀菌剂福美双使鸡的肠道菌群紊乱,引起脂质代谢的破坏和显著减少Oscillospira。
然而,一些药物的干预可以增加颤螺菌的相对丰度。例如,三氟甲磺酸(TFMS)处理的小鼠显示增加的丰度Oscillospira。
在药物干预过程中,肠道和肠道菌群是药物代谢和药效的中心部位,不同药物的代谢过程可能有不同肠道微生物的参与,而颤螺菌的丰度也可能因药物而异。
运动和饮食
饮食结构和运动模式已被证明会影响宿主健康和肠道微生物组成。
发现高强度间歇训练 (HIIT) 对 Wistar 大鼠的肠道微生物多样性有显著影响,单独的 HIIT 仅对其体脂肪量有显著影响,但当 HIIT 与亚麻籽油 (LO) 结合使用时,α亚麻酸(ALA),以二十二碳六烯酸(DHA)转化率增加,同时结肠菌群的Oscillospira显著增加。
值得注意的是,单独使用 HIIT 和 LO 都不会导致肠粘膜相关菌群发生显着变化,但当联合使用时,它会显着增加Oscillospira丰度。该研究的结果与之前的研究结果相似,因为颤螺菌与体重指数 (BMI) 呈负相关,与瘦度呈正相关。
其他研究也指出显著增加运动后小鼠的Oscillospira上升,伴随短链脂肪酸的水平显著上升。
两项动物实验表明,Oscillospira丰度、乳酸水平和运动强度之间存在很强的相关性。
在一项基于人群的试验中发现,肥胖的人坚持一年的地中海饮食后,普雷沃氏菌减少,而Oscillospira增加。因此,Oscillospira被认为是一种可能的用于减肥和减脂的下一代益生菌候选物。

在一项随机对照试验中,短期食用杏仁也增加了健康成年人的颤螺菌丰度。
高脂肪饮食被认为是不健康的饮食。高脂肪饮食会增加大鼠肠道中的颤螺菌丰度,然而,在 另一项动物试验中看到了相反的结果。发现高脂肪饮食的雌性小鼠肠道中的颤螺菌丰度显着降低,并且尚不清楚这是否是由于物种差异造成的。此外,该研究发现禁食会降低人体肠道中颤螺菌的相对丰度,这表明热量限制可能对颤螺菌具有负面调节作用。
总体而言,适当的运动模式和适度的运动水平似乎增加了颤螺菌的相对丰度在人类和动物中,虽然公认的健康饮食结构也正向调节Oscillopira丰度的增加。
Oscillospira的健康特性
在肠道菌群及其相关疾病的研究中,颤螺菌经常出现在高通量测序数据中,尤其值得注意的是,在某些特定疾病中,颤螺菌的丰度波动较大。在这里,我们总结了与颤螺菌正相关或负相关的疾病。
2 型糖尿病
2 型糖尿病 (T2DM) 大鼠肠道中的颤螺菌丰度与糖尿病和炎症的发展呈正相关。
神经障碍或退化
中枢神经和退行性疾病与颤螺菌之间也存在密切关联。帕金森病 (PD) 患者也有高丰度的颤螺菌,但这一结果在另一项研究中显示出相反的趋势。
测序和分析自闭症儿童的肠道菌群,发现Oscillospira显着增加。
在另一项研究中CUMS诱发抑郁症小鼠,CUMS感应造成的大量增加Oscillospira,治疗后该属下降。
胆病
可以确定的是,Oscillospira与胆结石直接相关,这种生物可用作有症状胆结石形成的生物标志物。胆结石患者有较高的总粪便胆汁酸(BAS)的浓度,微生物多样性降低,伴有的Oscillospira丰度增加, 进一步分析发现与次级 BA 呈正相关,与初级 BA 呈负相关。
便秘
肠道菌群失调被认为是便秘症状的原因之一。发现Oscillospira可能是便秘的生物指标。一个可能的原因是颤螺菌生长缓慢,并参与结肠运输。在广东6000多人队列和 1126 名成年欧洲人的研究中,Oscillospira与胆结石有关,慢运输是已知的危险因素。
此外,埃希氏菌属和克雷伯氏菌属被认为是快速生长的细菌,它们占据空间并消耗营养。从另一个角度来看,Oscillospira被推断能够产生丁酸盐,一种短链脂肪酸。动物研究表明,短链脂肪酸抑制平滑肌收缩性和由此产生的结肠中的液体转运,从而导致便秘的发展。因此,颤螺可能起到加重便秘的作用。然而,这一假设需要通过代谢组学研究进一步验证,因为 SCFA 在结肠转运中的作用存在争议。
因此,颤螺菌与便秘呈正相关,特别是在慢性便秘的女性人群中,这种相关性非常强。
体重
最近的几项研究发现,Oscillospira与儿童和成人的瘦身或较低体重指数(BMI)相关,包括最近的两项双胞胎研究。
最值得注意的是,其中一项研究表明,Oscillospira菌属的成员具有高度遗传性,在瘦人中富集,并且与促进瘦肉型细菌物种Christensenella minuta高度正相关。

肠道微生物群的组成由长期饮食习惯决定,但短期营养干预会迅速影响肠道微生物群。
在一项研究中,志愿者(21-33岁,体重指数19-32)被转换为植物性饮食(平均纤维含量比基线高出近三倍,脂肪和蛋白质含量比基线低约30%)或动物性饮食。随着转向以动物为基础的饮食,Oscillospira相对丰度大大增加,而在以植物为基础的饮食中,Oscillospira的相对丰度减少(更温和)。因此,Oscillospira物种可能具有双抗性。
此外,这项研究表明,Oscillospira不太可能是复杂的纤维降解物,而是依赖于其他物种分泌的发酵产物,例如在转向动物饮食期间也增加的拟杆菌成员,或者依赖于从宿主粘蛋白释放的糖。
在该研究中,Oscillospira是鸟类、鱼类和哺乳动物(小鼠)禁食期间盲肠中唯一增加的属,所以推测Oscillospira也能够降解宿主聚糖(如岩藻糖、唾液酸和葡萄糖醛酸)。这可以部分解释为什么颤螺菌与瘦身有关,因为宿主不得不花费代谢能量来再生降解的糖蛋白,这些糖蛋白包括如肠粘蛋白。
肠炎
炎症性肠病中的颤螺菌大量减少。对炎症性肠病(主要影响肠道、引起疼痛、腹泻和其他表现的免疫失调疾病)患者的五项微生物群研究的荟萃分析表明,克罗恩病患者中的颤螺菌显著减少。
鉴于没有在培养基中培养出颤螺菌分离物(尽管最近可能使用一种新的培养方法获得了一个分离物),并且没有可用的参考基因组,因此很容易理解为什么它仍然是肠道微生物群研究中的一个难题。
如上所述,Oscillospira可能利用哺乳动物衍生的聚糖,来源于宿主或富含动物糖蛋白的饮食。根据Oscillospira分泌的代谢物,基于其与炎症性疾病和BMI的负相关性,我们推测,与其他表现出类似趋势的属(如Roseburia和Faecalibacterium)类似。
目前,多项研究表明炎症与颤螺菌密切相关,且大多呈负相关。
肠炎和肠病
Oscillospira丰度与溃疡性结肠炎(UC)患者的疾病严重程度呈负相关。
在患有炎症性肠病 (IBD) 的儿童的肠道中发现了较低丰度的颤螺菌。显著低丰度Oscillospira也在克罗恩病(CD)患者和儿童非酒精性脂肪性肝病(NALD)患者的肠道中发现。
衰老
衰老是一种以炎症介质循环水平升高为特征的低度慢性炎症。老年人的许多炎症标志物和介质的循环浓度高于青年人。
越来越多的文献表明,与年龄相关的肠道微生物群失调会导致老年人的整体炎症状态。其中,Oscillospira与促炎性单核细胞趋化蛋白 1 (MCP-1) 呈强负相关。
肥胖
发现超重儿童肠道中颤螺菌的丰度显着减少。同样,发现肥胖相关糖尿病患者肠道中的Oscillopira丰度显著降低,而患有局部和全身炎症的肥胖患者的O.guillermondii显着降低。
脆性 X 综合征 (FXS)
是一种神经发育障碍,被认为是遗传性智力障碍的最常见原因,也是自闭症的主要诱发因素之一。发现在 FXS 小鼠模型的肠道中,Oscillospira丰度显着下调。
抑郁症
颤螺菌与几个抑郁症相关指标之间的强相关性先前也在另一项试验中得到证实。这种关系似乎得到了基于人群的实验数据的进一步支持,发现,社交能力(参与者的外向性,社交能力,沟通能力,综合衡量)呈高度正相关Akkermansia,乳酸和Oscillospira,其中,Oscillospira在社会性得分较高的个体中更为丰富。
肝病
临床上,Oscillospira丰度也与肝脏脂肪呈负相关;Oscillospira丰度在非酒精性脂肪肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)的患者中减少。目前,减少的颤螺菌伴随着增加的 2-丁酮已被确定为 NAFLD 发病的肠道微生物群特征。
肺癌
肺癌发病伴随着在Oscillospira丰度显著下降,在两者之间存在负相关。
粪便硬度
一项关于欧洲成年人肠道微生物群和粪便软/硬的研究表明,颤螺菌的丰度与较硬的粪便呈正相关,与稀便呈负相关。
Oscillospira目前纯培养物没有获得,因此,实际的生物学功能和特定的作用与人体健康机理还没有完全确定。
目前对颤螺菌的描述主要体现在其在不同环境中的丰度变化。通过多项研究总结发现颤螺菌与肥胖和肥胖相关的慢性炎症和代谢疾病高度相关,并且在这类疾病中,颤螺菌的丰度显着降低。
此外,一些研究已经证实,Oscillospira与消瘦强相关,并显示出较低的体重指数高度的遗传性。大量证据表明,Oscillospira丰度在与人类肥胖相关的代谢活动中起重要作用。颤螺菌可能是具有减肥、降脂、缓解代谢综合征等作用的下一代益生菌候选物,具有巨大的健康应用潜力。
此外,Oscillospira与中枢神经系统疾病和退行性疾病之间存在关联,但由于证据稀缺且因果关系尚未得到证实,还需要更多的研究来揭示其潜在机制。
外部干预措施,如益生菌,益生元,多酚类物质,饮食和运动,可以显著影响Oscillospira在肠道的丰度,有助于治疗特定肠道菌群介导的如肥胖和肥胖相关的糖尿病。未来,以颤螺菌为核心的微生态制剂可能为食用或药用的食品、保健品和生物制药带来新的选择。
未来,还需要更多的临床前和临床研究来证实颤螺菌在不同疾病中的疗效,那时如果能够攻克这种生物的纯培养技术,将大大加快其开发和应用进程。
主要参考文献:
Konikoff T, Gophna U. Oscillospira: a Central, Enigmatic Component of the Human Gut Microbiota. Trends Microbiol. 2016 Jul;24(7):523-524. doi: 10.1016/j.tim.2016.02.015. Epub 2016 Mar 17. PMID: 26996766.
Feng W, Liu J, Ao H, Yue S, Peng C. Targeting gut microbiota for precision medicine: Focusing on the efficacy and toxicity of drugs. Theranostics. 2020;10(24):11278-11301. Published 2020 Sep 14. doi:10.7150/thno.47289

谷禾健康
虽然每个人都会老去,但是衰老的速度却不一定相同。生理年龄是每个人的遗传,环境和生活方式的影响。
人的一生,从出生到成年到老年,微生物组在免疫系统成熟,功能和调节中起着基本作用。免疫系统和微生物组形成一种互惠关系。
随着年龄的增长,免疫系统和肠道微生物组的组成和功能都会发生重大变化,这与对传染病的易感性增加有关。
导读
01)免疫衰老的一般标志
02)衰老和肠道微生物组
03)微生物老化的衡量指标
04)微生物老化加快免疫衰老和虚弱
05)肠道微生物组对疫苗反应的影响
06)对抗与年龄相关宿主免疫力下降的营养策略
07)恢复肠道微生物稳态、减少炎症和免疫衰老
08)健康长寿的普适方式
免疫衰老
“免疫衰老”是指在老年人中观察到的功能障碍,免疫反应有缺陷或异常。
与年龄相关的免疫反应的质量和数量的变化导致触发有效抗体和细胞反应抵御感染和疫苗的能力逐渐下降。
衰老的T淋巴细胞生物学研究十分突出,但所有造血源性细胞都显示出衰老的特征,包括功能失调的抗体产生B细胞、抗原呈递细胞、自然杀伤细胞和中性粒细胞。最早的造血祖细胞中也报告了表观遗传学改变,这可能解释了观察到的年龄相关的髓样细胞偏斜。
主要淋巴器官的老化(骨髓和胸腺磨损)、慢性抗原过载(如CMV)、肠道失调或炎症是免疫衰老的驱动因素,这些因素与遗传缺陷、细胞应激和/或细胞衰竭的累积一起,会导致免疫适应度随着年龄的增长而下降。
炎症
炎症是一种高度控制的生理过程,对对抗病原体、清除碎屑和愈合损伤至关重要。
随着年龄的增长,由于基因、环境和生活方式因素的复杂和不断变化的相互作用,促炎和抗炎之间的动态平衡下降。
慢性炎症状态是发病和死亡的一个重要危险因素。包括慢性感染、缺乏运动、内脏肥胖、饮食、心理压力、睡眠不足或肠道失调等多种因素都会引发和维持炎症。
长期暴露于应激源会加速细胞衰老和先天免疫失调,这是炎症的一个主要特征,反映在局部和全身炎症介质与白细胞介素-6(IL-6)、肿瘤坏死因子TNF-α 水平持续升高,IL-1β,C-反应蛋白(CRP)在老年人中普遍存在。
尽管先天性单核-巨噬细胞网络的失调可能是炎症的中心,但新的证据表明衰老细胞(包括T细胞和B细胞)通过其衰老相关的分泌表型参与慢性低度炎症的关键作用。
而慢性表达或暴露于炎症刺激可能使预先激活的免疫细胞对进一步的刺激难以耐受,从而导致观察到的老年人感染性疾病的频率和严重程度增加。
因此,先前存在的炎症已被证明是疫苗反应性的一个重要决定因素。
此外,炎症可能通过助长年龄相关疾病(包括代谢综合征、心血管疾病、肌细胞减少症、癌症和神经退行性疾病)而产生多种健康后果,因为大多数(如果不是所有)年龄相关疾病都具有炎症特征。
尽管衰老、炎症和慢性病之间存在着共同性,但生物医学研究继续巨额花费来单独解决这些疾病状态。这就提出了一个具有挑战性的问题,即:
针对慢性低度炎症或引起炎症的机制是否可能减缓衰老及其相关疾病?
虽然临床前研究表明炎症是导致年龄相关疾病和免疫反应性降低的一个因素,但证实这一假设的人类数据在很大程度上是缺失的。
而最近一项CANTOS的研究(Canakinumab Anti-inflammatory Thrombosis Outcomes Study)为老年人带来了巨大的希望。
对10000多名既往有心肌梗死史的稳定患者进行卡那单抗(Canakinumab,一种针对白细胞介素-1β的人单克隆抗体)治疗,可显著降低参与者的全身低度炎症。
重要的是,治疗方案可以预防复发性血管事件和肺癌的发生。虽然这些研究唤起了人们对有效抗衰老疗法的希望,但通过靶向阻断关键炎症介质来减少全身炎症需要在对传染病的易感性方面谨慎平衡。
这些免疫指标包括基于炎症年龄评分的iAGE、依赖于免疫球蛋白糖基化的聚糖生长或南丁格尔健康指数,其中糖蛋白乙酰化的全身炎症预测呼吸道感染、心血管疾病和全因死亡率的长期风险。
随着老龄化社会的健康管理成为一个日益增长的经济负担,这种免疫指标代表了有希望的工具,以确定风险个人的早期药物或营养干预。
为了应对不断变化的环境,肠道微生物通过菌种组成和代谢功能的变化动态响应。这个过程受到宿主免疫系统的严格调控,想象宿主免疫系统是一位建筑师,通过允许共生细菌生长和占据粘膜生态位,同时选择性地消除或中和有害微生物,从而塑造肠道微生物群。
随着年龄的增长,免疫适应度逐渐下降,宿主与微生物动态信号交换的监测受到损害,从而对宿主健康和免疫造成广泛的功能后果(图1)。
图1 模型:微生物老化及其对宿主免疫的相关影响
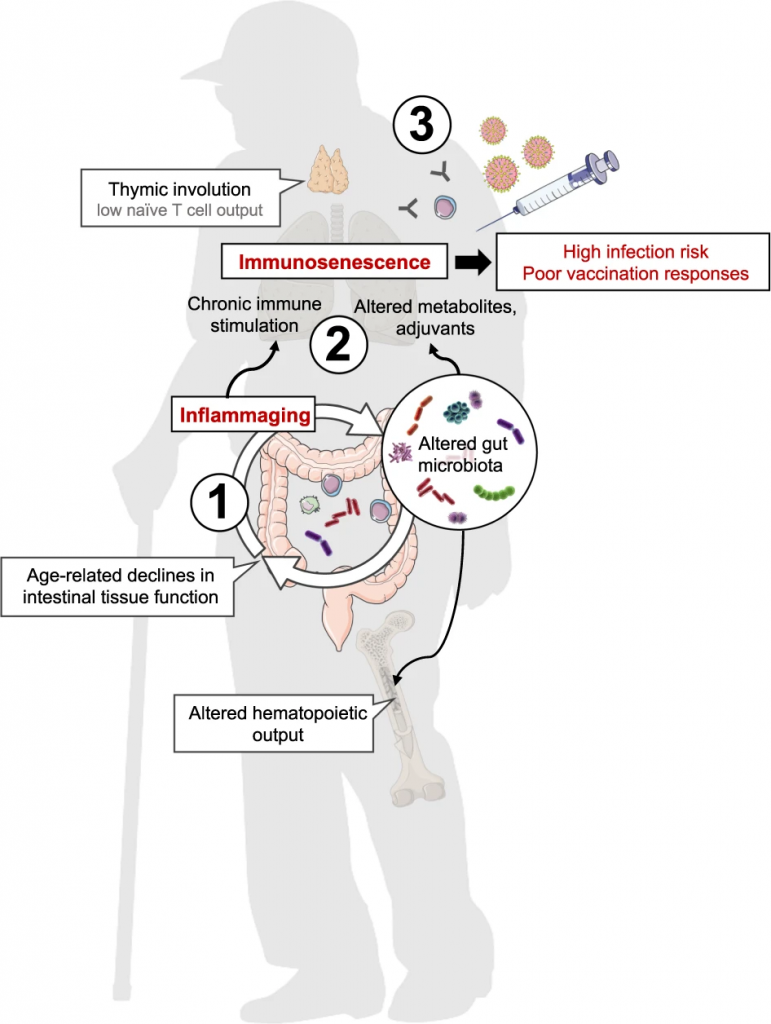

Nabil Bosco & Mario Noti,Genes & Immunity, 2021
(1) 年龄相关的肠道微生物群落变化和相关的肠道组织功能下降可能加剧炎症
(2) 由全身低度炎症引起的慢性免疫刺激、代谢组和微生物刺激的变化导致免疫衰老
(3) 免疫功能受损(如胸腺退化、造血功能改变),导致老年人感染风险增加,老年人接种疫苗反应差
在人类中,年龄相关的菌群失调(微生物老化)特征是梭状芽孢杆菌和双歧杆菌数量减少,变形菌门以及肠杆菌科等病原菌数量过多。
肠道微生物群落结构的组装也可能取决于宿主器官的功能。考虑到肠道的组织功能和完整性受到与年龄相关的显著变化,如再生能力、上皮屏障形成、黏液层组成和蠕动的改变,随着我们年龄的增长,粘膜生态位的变化很可能导致了失调状态。
这种肠道完整性的亚临床改变可能会促进微生物向全身部位渗出,全身性低度炎症,慢性炎症的发生和过早死亡。然而,确定人类的因果关系仍然具有挑战性,下文将进行讨论。
虽然,我们已经开始了解细菌的分类组成和多样性是如何随着年龄的变化而变化的,但我们对细菌进化和与宿主适应性相关的功能后果的了解仍然有限。有两种可能的情况:
1 肠道微生物群落结构中与年龄相关的变化是宿主衰老过程中发生的生理组织适应的简单结果
2 与年龄相关的失调是细菌进化的产物,通过使特定菌群逃避免疫监视,直接触发宿主衰老
因此,更好地了解老化的宿主微生物群,对于推进以微生物组为基础的治疗方法来对抗老化和与年龄相关的疾病至关重要。
我们需要先了解这样的概念。
生理年龄:指人达到某一时序年龄时生理和其功能所反映出来的水平,是从医学、生物学角度来衡量的。
肠道年龄:是基于健康人群每个年龄段样本的菌群构成使用深度神经网络模型提取特征菌属并构建的预测模型。
谷禾健康-肠道年龄预测模型图

注: 谷禾报告中的肠道年龄是基于超过6万人群队列的深度学习模型构建的,伴随年龄的变化肠道菌群也会相应的改变。对于0~2岁的儿童,肠道年龄通常偏差小于3个月,3~5岁偏差在6个月以内,6~15岁偏差在1岁左右,16~50岁人群正常肠道年龄的偏差在3岁以内,50岁以上正常偏差在5岁以内。在正常偏差内年龄差异可以理解为年轻或衰老,超出正常偏差的年龄无论是超过或低于都可能是菌群异常或健康状况不佳。
真实年龄与肠道预测年龄在范围内的差异可以反映其肠道菌群的发育和衰老状况。
以下情况可能会导致肠道预测年龄完全偏离真实年龄,包括:肠道菌群紊乱,菌群结构过于单一,近期服用包括抗生素等可能严重干扰肠道菌群的药物,病原菌感染或者处于疾病状态。
肠道菌群失调可以触发先天性免疫反应和慢性低度炎症,导致许多与年龄有关的退化性疾病和不健康的衰老。肠道菌群通过各种生物分子,营养素信号独立途径和表观遗传机制与宿主进行交流。与年龄有关的肠道菌群失调会干扰这些交流,从而影响宿主的健康和寿命。
与年龄相关的肠道微生物组成的改变不仅发生在人类身上,也发生在实验室模型生物身上。这些控制遗传、年龄、饮食和微生物组本身的模型系统提供了强有力的科学证据,表明宿主生理或微生物进化的内在改变足以促进一种失调状态。
这些模式生物已经证明肠道微生物群有潜力有益地调节衰老过程,以促进宿主的健康和寿命。
黑腹果蝇
对黑腹果蝇的研究(一个经常被用来研究微生物动力学、肠道生理中与年龄相关的变化和生物体健康之间相互作用的衰老模型)——已经完美地证明了肠道生态失调不仅是年龄相关肠道屏障功能障碍、系统免疫激活和机体死亡的前兆,而且还预测了这些疾病的发生。
结果表明,在整个生命过程中保持在无菌条件下的果蝇显示出较低的衰老率,这表明在这些模型设置中防止与年龄相关的菌群失调可以限制炎症,改善免疫稳态,促进健康。
非洲绿松石鳉鱼
利用自然短命的脊椎动物非洲绿松石鳉鱼(Nothobranchius furzeri)进一步证实了肠道微生物群在调节衰老过程中的影响。年轻的微生物群的慢性定植在中年鱼,诱导了长期有益的系统效应,导致脊椎动物的寿命延长。将年轻的供体微生物群定植在年老的鱼,与已知产生代谢产物的关键细菌属的存在有关,这些代谢产物既能维持免疫系统健康,又有抗炎作用。
小鼠
年轻小鼠菌群 → 早衰小鼠:特定菌发挥作用
将年轻供体的粪便微生物群移植到早衰小鼠中,可改善后者的健康状况和寿命,并将疣微菌门verrucomicrobia,Akkermansia muciniphila移植到早衰小鼠中,从而充分发挥有益作用。
此外,与年龄相关的Akkermansia muciniphila缺失与肠道完整性受损和胰岛素抵抗相关——这是一个通过微生物组-单核细胞-B细胞轴介导的过程。
除了对宿主代谢的影响,Akkermansia muciniphila还参与了调节抗原特异性T细胞反应和抗体产生来调节宿主免疫功能。
小鼠菌群 → 无菌小鼠:T细胞活化增加
用年轻或年老小鼠的肠道微生物群定植无菌(GF)小鼠。将老年供体微生物组移植给年轻小鼠足以促进肠道炎症、微生物产物向循环的渗漏和慢性低级别炎症的发生。作为全身低度炎症的结果,全身免疫区的T细胞活化增加。
年老菌群→年轻小鼠:巨噬细胞功能失调
另一项研究报告了类似的发现,在年轻的GF接受者中,移植一种老年微生物组可促进全身低度炎症。这些情况下的炎症进一步与巨噬细胞功能失调相关,巨噬细胞是炎症细胞因子的有力来源,其细菌杀灭活性较差。此外,基因或抗体介导的肿瘤坏死因子α(低度炎症的标志性细胞因子)的减少,可以预防年龄相关的肠道失调和相关的全身低度炎症。
年龄相关肠道免疫力下降:增加M细胞可恢复
最近的一项研究强调,年龄相关肠道免疫力下降可以通过操纵肠道微生物组增加M细胞数量来恢复。年老小鼠暴露于年轻的微生物群或鞭毛蛋白刺激都足以观察到这种效应:Peyer’s补丁中的M细胞成熟恢复,增强抗原摄取,年老小鼠肠道IgA反应增加。基于微生物组干预的M细胞修复确实依赖于肠道干细胞功能的改善,这表明修复老年肠道的再生能力可能对提高肠道免疫力有额外的好处。这些发现可能与改善口服疫苗应答或预防老年人胃肠道感染有关。
年龄相关肠道菌群改变影响造血
除了局部免疫调节外,年龄相关的肠道群落结构变化也可能对造血产生直接影响。对小鼠的研究表明,肠道微生物组的改变与造血系统的多谱系改变和多能祖细胞的抑制有关。
鉴于肠道微生物群通过促进造血功能密切参与了细菌感染的控制,与年龄相关的肠道微生物群平衡和多样性的变化可能导致老年人造血功能受损、更易感染和减少疫苗接种应答。然而,为了更好地理解年龄相关的生态失调对造血系统调节的影响,还需要更多的研究来支持这一假设。
总的来说,这些临床前模型系统的发现表明,校正与年龄相关的肠道菌群失调是有益的,为基于微生物组的治疗方法改善免疫系统功能、对抗衰老及相关疾病提供了理论依据。
虽然粪便微生物群移植(FMT)在动物模型中具有抗衰老特性(见上文),并且FMT已成功用于治疗男性复发性艰难梭菌感染,但在临床环境中提出FMT作为抗衰老策略仍存在一些障碍。更好地了解健康微生物组的特征(包括病毒组和真菌组)对于确保接受者的长期安全至关重要。
尽管我们对整个生命中肠道微生物群的理解取得了很大进步,但在疫苗学上的潜力尚未实现。鉴于微生物组严格调控免疫细胞的发育和功能,它可能最终影响疫苗的疗效。因此,由环境、社会经济、营养或卫生条件引起的肠道微生物群落结构的变化可以解释疫苗应答中的地理异质性。
对微生物群如何促进疫苗应答的机制更好地理解,可能有助于制定新的策略,以减少老年人感染性死亡。
直到最近,表明肠道微生物组影响疫苗接种反应的最佳证据来自使用无菌或缺乏微生物的小鼠的临床前模型系统。
研究人员探讨不同抗生素方案对抗原特异性体液免疫应答的影响,研究了克拉霉素、强力霉素和氨苄西林对小鼠破伤风类毒素(TT)、肺炎球菌多糖疫苗(PPV)、乙型肝炎病毒表面抗原(HBsAg)疫苗和减毒沙门氏菌活疫苗(Ty21a)的一级和二级抗体应答的影响。
有趣的是,抗原和抗生素的特异性反应都受到了影响。
克拉霉素和强力霉素抑制典型的T细胞依赖性和T细胞非依赖性抗体反应,而氨苄西林的效果较差或无效果。
此外,所有三种抗生素,特别是氨苄西林增强了对Ty21a-a减毒细菌粘膜疫苗模型的体液反应。在GF小鼠中进行疫苗接种实验的进一步工作证实了这些初步发现。
到目前为止,现有的研究主要集中在细菌,以及包括病毒、真菌、原生动物和古生菌在内的微生物群的其他组成部分。然而,仍然存在两个重要问题:
(一) 微生物群参与宿主免疫反应(特别是疫苗反应)的机制是什么?
(二) 这些发现对人类的影响是什么?
迄今为止,最令人信服的数据表明,肠道微生物群提供了佐剂的天然来源,能够调节宿主的系统和黏膜疫苗反应。
这一观点最初是在Nakaya等人的系统生物学报告中提出的,他们描述了在非佐剂流感疫苗接种三价灭活疫苗(TIV)后,人类toll样受体-5 (TLR5)的早期(第3天)和瞬时基因上调。TLR5的表达与TIV诱导的血凝抑制(HAI)滴度(滴度是稀释度的倒数)呈正相关。
随后,该研究小组证实TLR5对小鼠肠道微生物分泌的鞭毛蛋白的感应与TIV介导的应答有关。虽然直接给予鞭毛蛋白或有鞭毛的细菌移植可以提供天然佐剂来改善非佐剂流感疫苗的应答,但它不能与其他佐剂或活疫苗如破伤风-白喉-百日咳(Tdap)、黄热病(YF-17D)或重组乙型肝炎抗原(Recombivax HB)配合使用。
除TLR5外,另一种模式识别受体核苷酸结合寡聚结构域2 (NOD2)的特异性贡献,人血清白蛋白(HSA)抗原和霍乱毒素(CTX)佐剂鼻内刺激诱导的粘膜疫苗应答小鼠模型。在GF小鼠、抗生素处理小鼠或基因修饰缺乏NOD2信号的突变小鼠中,HSA特异性IgG反应持续下降。当这些动物接受一种被NOD2或表达MDP的细菌识别的肽聚糖MDP(muramyl dipeptide, MDP)时,HSA特异性IgG反应恢复。
虽然尚未使用人体相关疫苗,但这第二项工作表明,常驻微生物也可以增强用于粘膜疫苗接种方案的CTX的佐剂效果。需要进一步研究揭示肠道微生物群、其细胞壁成分或代谢物作为内源性疫苗佐剂的免疫能力,以放大对特定病原体的适应性免疫应答。
临床前和临床报告均观察到膳食纤维对功能免疫参数的积极影响,包括疫苗应答(表1),进一步支持基于其组成(细菌的性质)和或活性(分泌的代谢物的性质)的肠道微生物群的重要免疫调节潜力。
表1 益生元和/或益生菌临床干预试验探讨老年人免疫相关结果


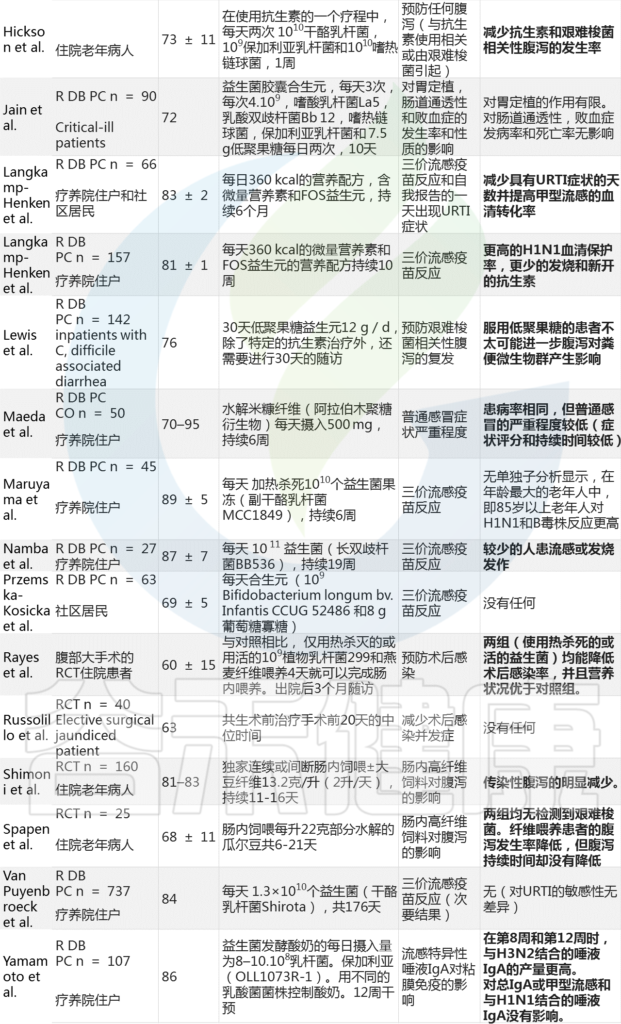
Nabil Bosco & Mario Noti,Genes & Immunity, 2021
关于纤维消化产生的短链脂肪酸(SCFAs)免疫调节活性的大量文献证明了这一点。这些代谢物在局部或全身释放,参与宿主的一般生理过程。
肠道微生物组组成和功能的动态变化也可以解释疫苗应答中观察到的地理异质性。研究人员还报道了成人和老年人接种流感疫苗后体液免疫反应的显著差异(超过100倍)。
宿主遗传、营养状况、母乳喂养习惯以及卫生条件和/或之前接触过病原体,被提出用来解释疫苗免疫原性的差异。然而,近年来研究宿主微生物群的技术进步为这一领域提供了新的思路。
粪便微生物群特征研究表明,肠道菌群组成可能影响口服脊髓灰质炎、卡介苗、破伤风类毒素和乙肝病毒的疫苗接种效果。
此外,在某些国家的儿童中,小肠细菌过度生长(SIBO)的流行率高。SIBO还可能限制疫苗的性能,因为相关的吸收不良、肠道微生物群和宿主免疫细胞之间争夺关键营养物质以及或通过渗漏的肠道系统释放微生物分子。从南非收集的样本中观察到反应迟钝的全血细胞(标准TLR刺激试验),并将来自北美和欧洲儿童的年龄匹配样本进行了比较。
上述人体研究仅存在相关性。
最近进行了三项研究,以确定婴儿和成人肠道微生物群失调和疫苗应答之间的因果关系。
在第一个大型(n = 754)和良好对照的研究中,广谱抗生素治疗(阿奇霉素)减少了致病性肠道细菌的流行,但没有改善印度婴儿的口服脊髓灰质炎疫苗接种。
接下来,Harris等人在开放标签试验中使用广谱抗生素(万古霉素)或广谱抗生素(万古霉素、环丙沙星和甲硝唑)治疗66名荷兰健康成人,并研究TT、口服轮状病毒(RV)和多糖肺炎球菌(Pneumo23)疫苗的应答。虽然RV疫苗观察到一些积极的效果,抗生素治疗没有改善TT或肺炎23价反应。
最后,Hagan和他的同事进行了一项研究,22名年轻的成年人接受广谱抗生素(万古霉素、新霉素和甲硝唑)治疗,然后接受TIV疫苗。虽然这种治疗对以前接种过流感疫苗的成年人影响有限,但在11名以前没有接触过流感(接种疫苗或自然感染)的健康个体中进行的第二次试验提供了突破性的发现。那些首次接受抗生素治疗的人的体液免疫反应,特别是对H1N1流感毒株的免疫反应大大减弱。
这些数据证实了早期的小鼠研究,并证明抗生素驱动的生态失调导致了非佐剂TIV引起的疫苗应答的显著改变。用系统生物学方法进行的更深层次的分子图谱也揭示了一种特定的炎症基因特征,即与抗生素治疗相关的更活化的髓系树突状细胞。
合理设计以微生物为内源性佐剂的疫苗在疫苗学领域具有广阔前景。这些方法可能需要个性化和工程可逆性来管理脆弱个体的疗效和潜在并发症。鉴于饮食是塑造肠道微生物群的最有力因素之一,营养干预与益生菌和益生元促进多样化的微生物群来维持健康受到了相当大的关注。
食品的发展是为了促进健康或减少疾病风险,1980年代中期,出现了“功能食品”一词:希望支持以营养为基础的预防性方法,以提高生活质量,减少与老龄化人口相关的医疗成本。
由于肠道微生物与宿主免疫系统的密切相互作用,临床试验研究的提高老年人免疫力的功能食品主要包括益生元(如纤维)、益生菌、两者的结合(即共生)或分泌可溶性代谢物(也称为后生元,如短链脂肪酸)。
随着年龄的增长,免疫适应能力下降,老年人无力抵抗感染,无力对抗原挑战作出反应,大多数这些试验探讨了感染流行程度、严重程度和持续时间或特定的疫苗接种结果。
在已确定的400项临床研究中,研究人员根据其相关性(免疫读数和目标人群为60岁的老年人)保留了31项研究,并将其总结在表1中。
这些研究是在社区居民、疗养院居民或住院患者中进行,这些患者可以服用口服补充剂或需要管饲。
大多数研究(20项研究)是随机双盲安慰剂对照组,考虑经典的混杂因素,如年龄、性别,有时还有医疗条件、营养状况、感染史或疫苗接种史。
预防感染性并发症,特别是危重症或选择性手术患者中艰难梭菌相关腹泻是第二个有意思的领域。
在对老年人进行的13项研究中,6项呈阳性。它们积极的性质也可能表明,疾病预防可以通过人体免疫系统的不同方面来实现。
疫苗挑战研究通常测试适应性免疫系统的功能,但没有解决某些细菌感染中与年龄相关的先天免疫下降的后果。然而,最近在英国23家养老院进行的规模最大的研究,即“益生菌减少养老院居民感染”试验,LGG和BB12胶囊每天服用长达1年,对预防感染没有效果。在感染症状、抗生素使用、住院或死亡率方面没有发现差异。
总的来说,可能有多种原因,研究之间缺乏一致性,如菌株特定差异或剂量,以及益生元性质和数量,或受试者的年龄和医疗条件。
这些研究中没有一项对干预前和干预后的患者微生物群进行了广泛的分析。虽然这些数据可能作为独立报告存在,以描述成分的特性,在未来,对干预前后的人体微生物群和免疫参数进行系统的平行评估是至关重要的,以揭示相关的相互作用或因果关系。
虽然实际年龄是不可逆转的,但随着年龄的增长,与肠道微生物群、炎症和免疫衰老相关的衰老变化是免疫介导的慢性疾病的共同帮凶,这可能是维持免疫和健康的目标。
当消炎药和衰老疗法选择性地消除衰老细胞(衰老抑制剂)或抑制衰老相关分泌表型(衰老表型)时,作为抗衰老疗法的临床试验正在迅速发展(图2),它们的长期使用需要谨慎地平衡对传染病的易感性和潜在的其他副作用。
为什么减少全身低度炎症可以促进疫苗应答,而疫苗学的主流观点是佐剂通过促进局部炎症来改善疫苗应答,这一悖论还需要进一步的研究来解释。
图2 恢复肠道微生物稳态、减少炎症和免疫衰老以支持老年人免疫功能的方法
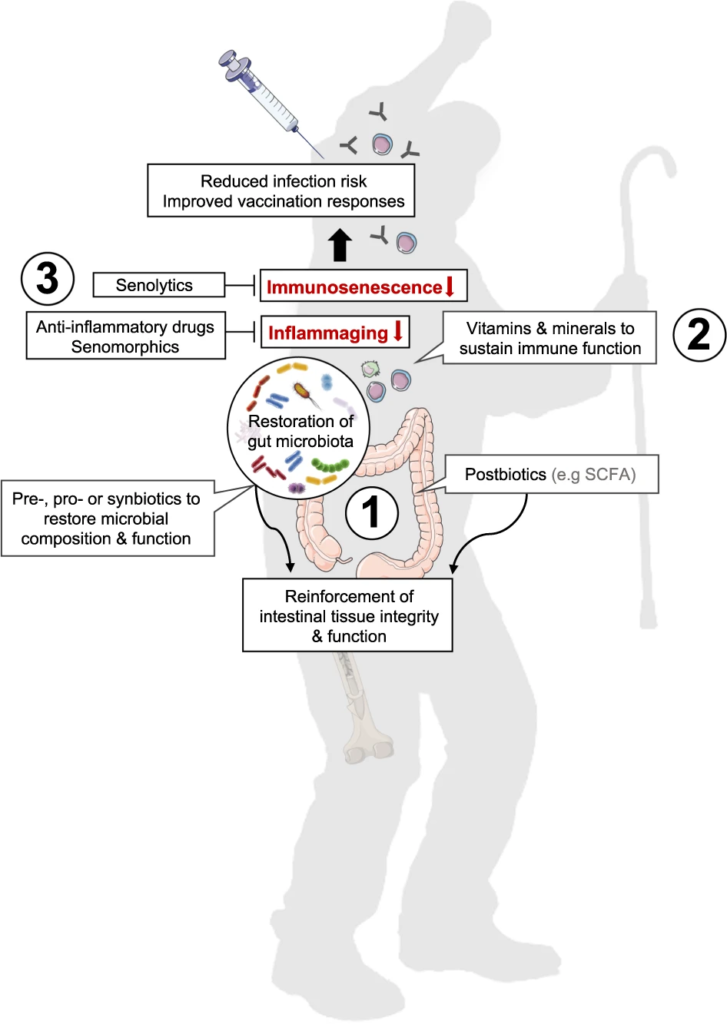
Nabil Bosco & Mario Noti,Genes & Immunity, 2021
(1)益生菌或益生元或合生元、后生元(如SCFAs)等进行干预可能有助于恢复与年龄相关的肠道微生物组成和功能下降
(2) 补充维生素和矿物质有助于正常的免疫细胞功能。
(3) 消炎药或老年药可能有助于减少炎症,而老年药直接消除老化细胞,燃料炎症。
单独或联合使用可能有助于增强宿主免疫,更好地控制感染,并随着我们年龄的增长产生适当的疫苗接种反应。
鉴于肠道微生物对宿主免疫系统的影响越来越大,可以合理推测,通过个性化营养或补充,恢复与年龄相关的肠道微生物丰富度和功能的下降,可能是一种对抗免疫适应性功能下降的预防措施。
在这种情况下,已在临床环境中测试了能够通过支持肠道屏障完整性或调节炎症过程来增强免疫力的益生菌、益生元、后生元或合生元(表1)。
然而,由于研究、菌株特异性差异或剂量、益生元的性质和数量或受试者的年龄和医疗条件之间缺乏一致性,因此很难验证这种方法在增强与年龄相关的宿主免疫适应性下降方面的有效性。
肠道微生物群是一个有待挖掘的宝藏,衰老学也不例外。正如许多临床前研究所证明的那样,恢复年轻的微生物群可以通过维持免疫和健康跨度来恢复老年宿主的活力。
因此,更好地了解肠道微生物群落结构和相关代谢组的动态变化,这些改变如何影响细胞免疫网络,以及这些通路如何被治疗靶向,将对未来加强甚至恢复老化免疫系统的策略产生广泛的影响。随着人口老龄化的加剧,迫切需要这样的解决方案来支持健康老龄化,减缓不断增长的医疗费用。
健康饮食
Omega-3脂肪酸
随着年龄的增长,神经细胞萎缩,向大脑提供的营养丰富的血液供应减少,Omega-3脂肪酸,尤其是二十二碳六烯酸(DHA)可以促进神经细胞之间的有效电信号传递,减少炎症,甚至可以改善精神集中度并与记忆力丧失作斗争。
较小的脑体积与阿尔茨海默氏症以及正常衰老有关。研究人员发现,血液中omega-3脂肪酸EPA和DHA水平较高的绝经后妇女的脑体积也更大。
富含Omega-3脂肪酸的食物:
鱼类:鲱鱼,沙丁鱼,鲭鱼,鲑鱼,大比目鱼,鳟鱼
绿叶蔬菜: 抱子甘蓝,菠菜,芝麻菜,薄荷,羽衣甘蓝和豆瓣菜
油: 亚麻籽油,正大籽油,鳕鱼肝油和磷虾油
其他:蛋、核桃等
黄酮类化合物
几乎所有的水果,蔬菜都含有类黄酮,具有许多健康益处,包括减少炎症,降低心脏病风险和湿疹症状,对衰老的大脑有益。有研究发现,食用大量浆果(类黄酮含量较高)的老年妇女将记忆力下降的时间推迟了两年以上。
类黄酮含量高的食物:
浆果: 蓝莓,草莓和黑莓
绿叶蔬菜: 菠菜,羽衣甘蓝和豆瓣菜
彩色农产品:胡桃南瓜,牛油果,李子,红葡萄
其他:咖啡,黑巧克力,红酒
维生素E
防止细胞损伤。已有几项研究发现,维生素E可以延缓轻度到中度阿尔茨海默病的进展
富含维生素E的食物:
坚果和种子:杏仁,山核桃,花生酱,花生,榛子,松子和葵花籽
油:小麦胚芽油,葵花籽油,红花油,玉米油,大豆油
绿叶蔬菜:菠菜,蒲公英嫩叶,唐莴苣,萝卜叶
运动
走楼梯:
瑞士一项研究发现,久坐不动的人把乘电梯换成走楼梯,过早死亡的风险可以降低15%。哈佛早期的研究显示,与每周爬楼梯少于10层的人相比,每周能爬35层或更多的楼梯能显著提高寿命。
骑车:
骑自行车上班是一种环保又健康的方式,在一天中挤出锻炼时间在户外,还能节省点油钱。
游泳:
一项数据发现,经常游泳的男性比久坐不动的男性死亡率低50%,游泳者的死亡率也比运动时走路或跑步的男性低。
每天锻炼15分钟:
2011年的一项研究发现,与久坐不动的人相比,每天15分钟锻炼可以平均延长3年的寿命。
保护牙齿
如果牙齿一直很敏感,那么随着年龄的增长,牙齿会越来越容易脱落,这会影响老年生活品质。请保持日常牙科护理的最佳状态,防止蛀牙。
保持良好的生活习惯
保证充足的睡眠:
NIH的数据显示,每晚持续睡眠少于7个小时的成年人患高血压,心脏病,肥胖,糖尿病和抑郁症的风险更高。另外,晚上睡不好会抑制重要激素的释放,这些激素可以修复细胞和组织,抵抗疾病和感染,睡不好会使身体无法自然康复。
尽可能避免吸烟:
戒烟可以减少许多疾病风险。
适当缓解压力:
压力容易让人变老。尝试放弃明显的压力源,适当安排休息时间,
经常锻炼记忆力
记忆就像肌肉一样可以训练;如果充分利用自己的记忆并定期使用它,记忆力可以磨练到老。比如每天尝试做一个填字游戏,以帮助建立和维护词汇量和记忆力。
《阿尔茨海默氏病杂志》上的一项研究显示,吃蓝莓可以增强记忆力和学习能力,喝苹果汁可以通过防止重要的神经递质的衰退来改善记忆力。
选择适宜的养老居住地
可以选择气候宜人的地方居住,良好的空气质量有助于保持健康,环境条件佳也有利于保持好心情。此外尽量选择拥有良好的经济和医疗体系的地方,帮助维持积极长寿的生活。
做好健康管理
定期进行肠道菌群健康检测或其他检查,及时了解自身健康状况,包括哪些风险,需要注意事项等,做好健康管理,享受健康幸福的晚年生活。
相关阅读:
主要参考文献:
Hägg S, Jylhävä J, Wang Y, Xu H, Metzner C, Annetorp M, et al. Age, frailty, and comorbidity as prognostic factors for short-term outcomes in patients with coronavirus disease 2019 in geriatric care. J Am Med Dir Assoc. 2020;21:1555–9.e2.
Khan SS, Singer BD, Vaughan DE. Molecular and physiological manifestations and measurement of aging in humans. Aging Cell. 2017;16:624–33.
Crooke SN, Ovsyannikova IG, Poland GA, Kennedy RB. Immunosenescence and human vaccine immune responses. Immun Ageing. 2019;16:25–16.
Butler CC, Lau M, Gillespie D, Owen-Jones E, Lown M, Wootton M, et al. Effect of probiotic use on antibiotic administration among care home residents: a randomized clinical trial. Jama. 2020;324:47–56.
Bosco Nabil,Noti Mario,The aging gut microbiome and its impact on host immunity.[J] .Genes Immun, 2021
Book: Mayo Clinic Family Health Book, 5th Edition
Wang J, Varghese M, Ono K, Yamada M, Levine S, Tzavaras N, Gong B, Hurst WJ, Blitzer RD, Pasinetti GM. Cocoa extracts reduce oligomerization of amyloid-β: implications for cognitive improvement in Alzheimer’s disease. J Alzheimers Dis. 2014;41(2):643-50.
James V. Pottala, Kristine Yaffe, Jennifer G. Robinson, Mark A. Espeland, Robert Wallace, William S. Harris Neurology Feb 2014, 82 (5) 435-442
Dysken MW, Sano M, Asthana S, et al. Effect of Vitamin E and Memantine on Functional Decline in Alzheimer Disease: The TEAM-AD VA Cooperative Randomized Trial. JAMA. 2014;311(1):33–44.
Berryman CE, West SG, Fleming JA, et al. Effects of Daily Almond Consumption on Cardiometabolic Risk and Abdominal Adiposity in Healthy Adults With Elevated LDL-Cholesterol: A Randomized Controlled Trial. Journal of the American Heart Association. January 2015.

谷禾健康
过完今天,这个魔幻的2020就要过去了。面临工作、学习、出行等方方面面一而再地按下暂停键,很多人都希望这一年能够重启。
这一年发生了太多故事
每一个都足以让人痛惜
“活着”、“健康”这样的字眼在这一年显得尤为珍贵。简单的道理往往在经历重大的事件后才会尤为深刻。
古有求仙药,今有各种医疗技术的不断革新,大家对于长寿有着一致的追求。当基本的生活有了一定的保障后,人们不仅想要活得长久,还要健健康康地活着。
我们可以看到,人类的预期寿命已开始延长,并且仍在继续提高。“健康长寿”不再停留于一句祝福语,而是可行的人生目标。
长寿是多种变量复杂组合的结果。由于不同地区自然环境、社会制度、社会经济发展状况和人口构成等因素千差万别。
根据相关研究,影响人类寿命的因素至少包括:
遗传因素如线粒体状态、染色体稳定性、端粒长短、疾病、干细胞活性;
环境因素如肠道微生物、饮食、运动、空气质量以及生活环境;
其他因素如情绪压力、社交爱情、目标成就、投入预防等等。
人们在迈向健康长寿的过程中处于不同的阶段和水平。若干年后,也许有相当多的人进入百岁人生。
在2020年的最后一天,我们就来聊聊肠道菌群和长寿的故事。

伊卡里亚岛
伊卡里亚岛
该岛位于萨摩斯岛西南约10海里,这是爱琴海的一个小岛,是世界上寿命最长的地区之一。他们是90岁以上人群中世界上人口最多的国家,百岁老人在岛上已有400多年的历史了。科学家将那里长寿的机会与空气,水,社区精神,饮食习惯和遗传倾向等因素相关联。

意大利
提起意大利,你想到的是足球还是意大利面,其实这个国家还盛产长寿老人,根据欧盟统计,意大利为欧洲第一长寿国,女性平均寿命为84岁,男性平均寿命为78.3岁。
研究发现100岁意大利老人的肠道菌群种类分布与30岁意大利人相比,出现了较明显的变化,厚壁菌门中的拟杆菌XIVa明显减少,而芽孢杆菌上升,身体的炎症反应状况高,因此科学家得出长寿的关键因素:菌群种类的改变,更好的应对和调节炎症反应。

中国 新疆和田,广西巴马,四川都江堰青城山等
中国新疆和田,广西巴马以及四川都江堰市青城山等地区都很大比例的长寿健康老人。动物遗传育种研究所李英团队在《Current Biology》发表的一项关于寿老人和年轻人群肠道菌群研究发现长寿老人肠道菌群多样性和菌群丰度显著高于年轻组,这一结论在意大利相应人群中也得到了证实,提示更多有益菌群以及更丰富的菌群多样性可能是人类健康长寿的重要原因之一。
对长寿的研究可能有助于我们理解人类是如何延缓衰老,如何战胜与年龄相关的疾病。
肠道微生物群被认为是监测和可能支持健康衰老的变量之一。事实上,宿主-肠道微生物体内平衡的破坏与炎症和肠道通透性以及骨骼和认知健康的普遍下降有关。肠道微生物群作为健康衰老可能的介质,通过对抗炎症、肠道通透性以及认知和骨骼健康的恶化来保持宿主环境的稳态。
健康老年人的肠道菌群如何定义?
考虑到大多数老年人都患有肠道相关合并症,因此在该人群中定义健康的肠道微生物组极具挑战性。肠道环境的变化,例如炎症,肠道渗漏,活性氧的产生以及药物的使用,都可能影响肠道微生物组。在这方面,健康百岁老人一直被用作健康老龄化的典范,因为他们有能力推迟或避免慢性疾病。因此,该队列中的肠道微生物组可用于定义健康的肠道微生物组。
长寿者肠道菌群多样性水平高
一般认为,随着年龄增长时,肠道微生物多样性通常会降低。可能是由于生理,饮食,药物和生活方式的变化所致。
是不是所有老人的肠道菌群多样性都会降低?
研究人员检测了一群健康的长寿老人的肠道微生物组,来自中国四川都江堰市的长寿老人,包括“90-99岁”和“≥100岁”两个年龄段。
他们发现长寿人群的肠道菌群比年轻成年人的肠道菌群更多样化,这与传统观点相矛盾。
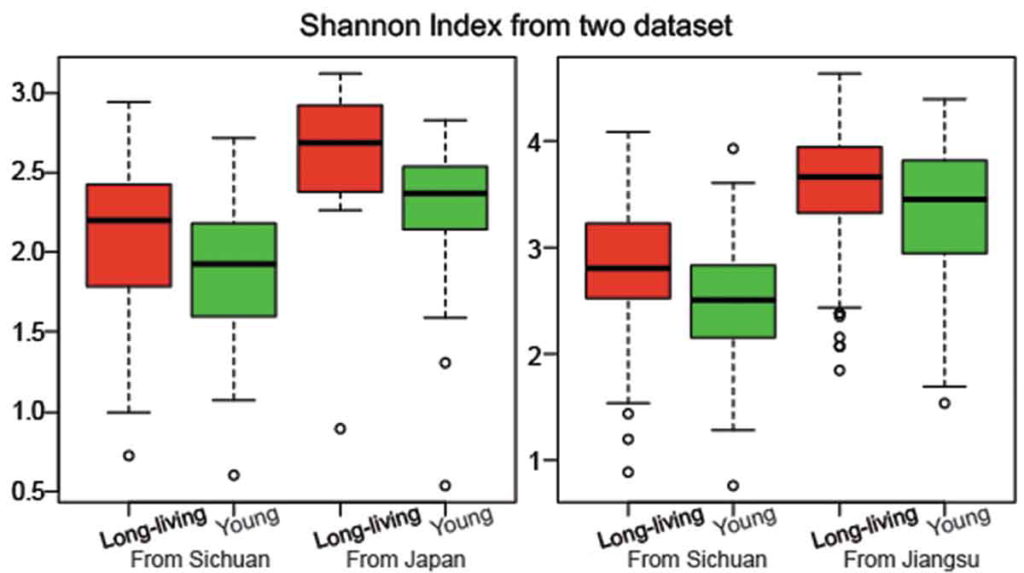
他们还发现了产短链脂肪酸菌在长寿老人中开始增加,例如梭状芽胞杆菌XIVa。
国内外研究结果一致
为了验证他们的发现,他们分析了来自一个意大利小组的独立数据集。
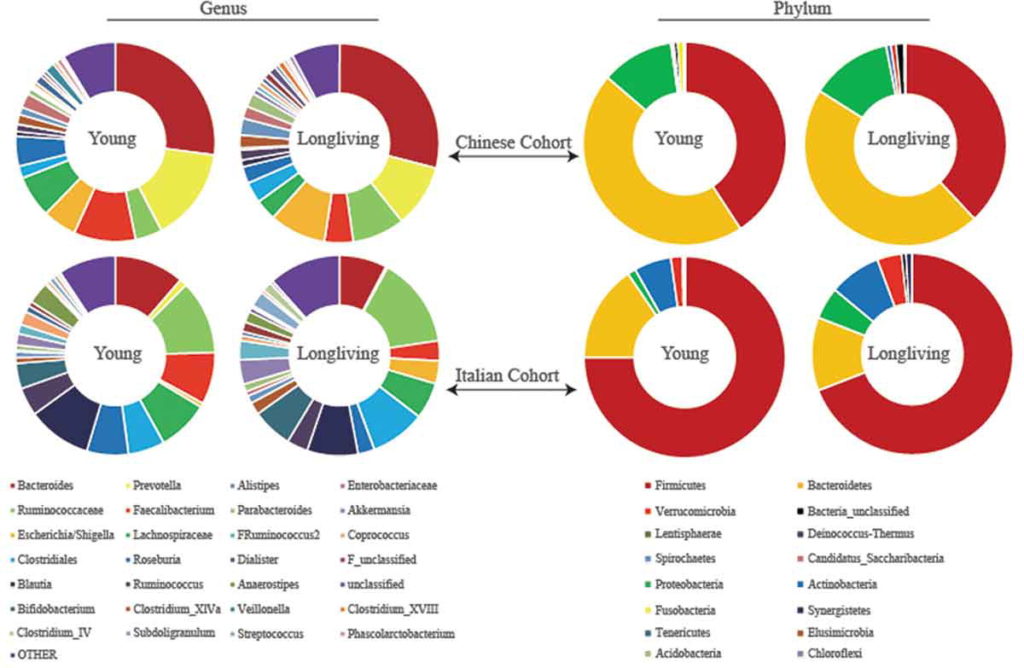
出现一致的结果:长寿的意大利人也比年轻的人群的肠道菌群多样化水平更高 。
庆幸的是,谷禾肠道菌群数据库中也有比较长寿的老人肠道菌群数据。
我们抽取其中一例相对较为健康的长寿老人的数据:
编号:083*****97 ,98岁(谷禾肠道菌群数据库)
谷禾健康数据库
可以看到肠道菌群多样性水平也是明显增高,与文献报道相符。大部分指标都处于正常水平。
长寿者产短链脂肪酸菌增多
结合意大利和中国的数据集,发现尽管肠道微生物群结构存在显著差异(可能是由于饮食、基因和环境的差异),但区分长寿个体和年轻群体的前50种细菌特征中,有11种特征是相同的。同样,这些特征包括肠道菌群多样性水平更高和几个产短链脂肪酸菌丰度更高。
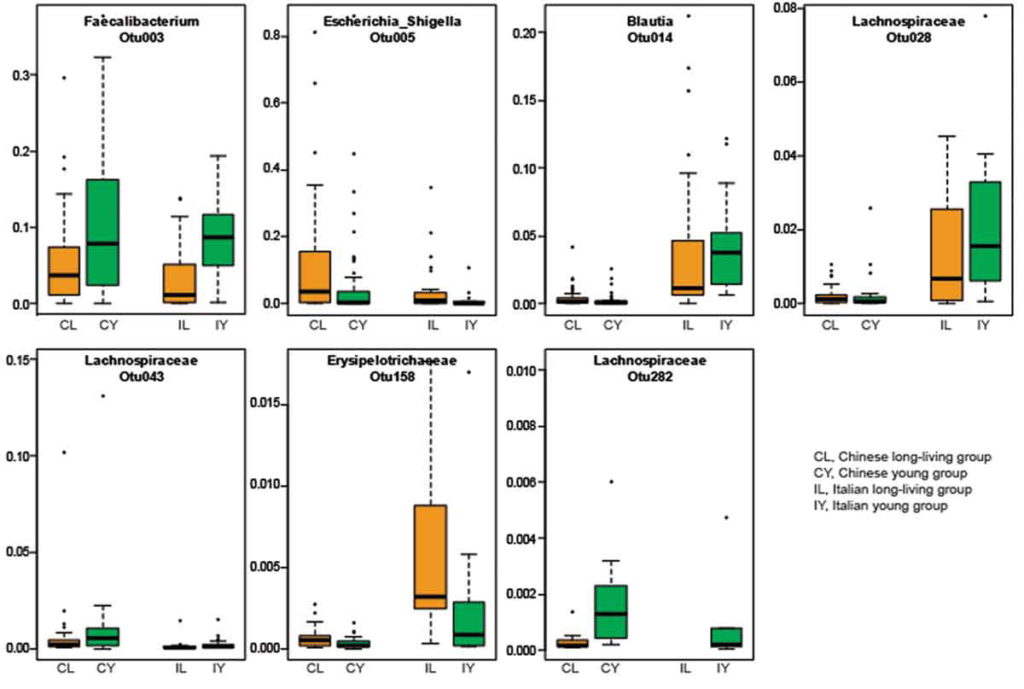
一项后续研究中,另外两个独立的队列中也观察到了长寿人群中更大的肠道微生物组多样性:一个来自中国江苏省,另一个来自日本。
以上这些研究都清楚地表明,健康长寿的人存在更多样化且平衡的肠道菌群,而在患有不同合并症的老年人中观察到肠道菌群紊乱。
因此,研究人员假设调节肠道微生物组(如通过饮食、益生菌)来维持健康的肠道微生物组将有利于健康地衰老。
进一步假设,在患有慢性疾病的老年人中,将紊乱的肠道菌群调节为健康的肠道菌群将减轻他们的症状,提高他们的生活质量。
肠道微生物组和健康衰老的有效假设
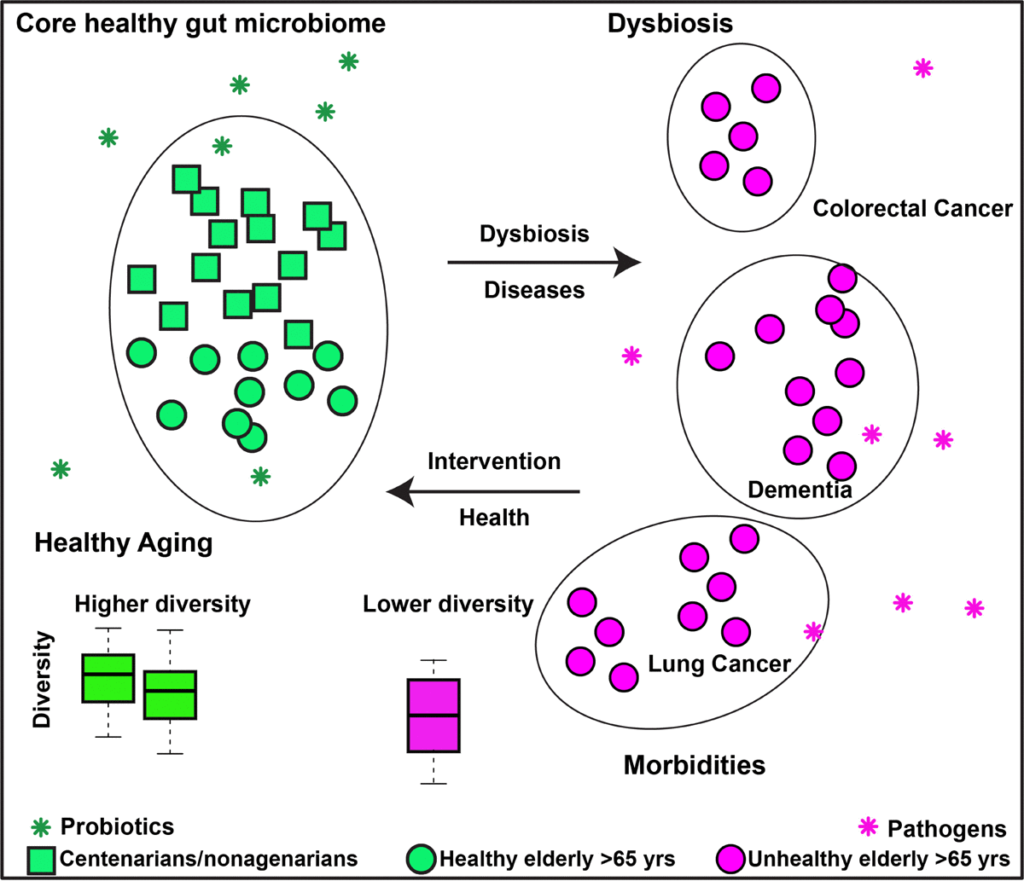
该假设背后的一个基本原理是慢性炎症,即老年人中慢性低度炎症的增加,这与不同的慢性疾病有关。
短链脂肪酸对维持肠道止血很重要。短链脂肪酸为结肠上皮细胞提供主要能量,并具有抗炎特性。这些产短链脂肪酸菌在长寿老人中的富集表明,这些细菌可能会减轻炎症及由此造成的损害,这可能是他们能够健康衰老的原因。
以上我们知道长寿老人的产短链脂肪酸菌增多,那么其他菌群会有什么样的变化?
在门类水平上,大多数研究都证明了变形菌丰度的增加。
长寿者菌群变化,潜在有益菌较多
· 不同地区比较:
一项研究分析并比较了长寿村庄中百岁老人与同一地区和城市化城镇中的老年人和成年人的肠道菌群。采集长寿村的百岁老人、老年人和年轻人的粪便样本,以及来自韩国城市城镇的老年人和年轻人的公共数据库获得肠道菌群数据。
与城镇化老年人相比,长寿村老人:
康复医院百岁老人的肠道菌群也不同于居家。这些差异可能是由于饮食方式和生活环境的差异。
· 不同年龄比较:
我们来看一项研究,对62个人的粪便微生物组进行宏基因组测序,年龄从22岁至109岁不等。
下图可以看到,随着年龄的增长,肠道微生物群发生了变化。
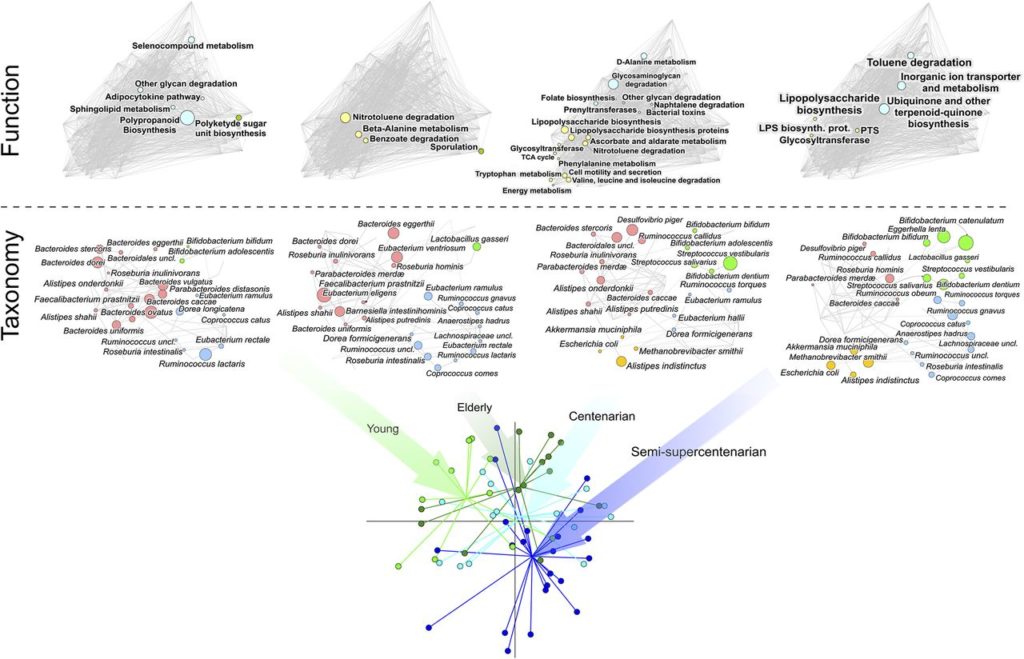
注:4个年龄组的肠道微生物组:
11个年轻人 (22 – 48岁,young);
中年13人 (65 – 75岁,elderly);
15名百岁老人 (99至104岁, centenarian);
23名半超百岁(105至109岁,semisupercentenarian)
研究人员发现与年轻人相比,长寿者菌群变化如下:

编号:083*****97 ,98岁(谷禾肠道菌群数据库)
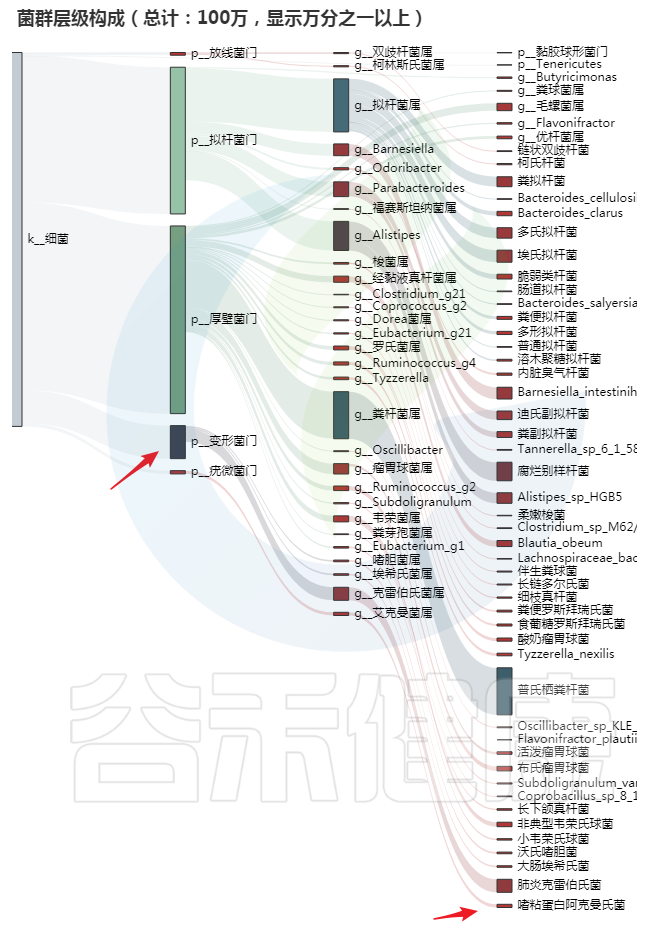
我们发现同样,变形菌门增加,另外有益菌如阿克曼菌增多。
长寿者碳水化合物代谢相关基因减少
有趣的是,当研究人员将分析集中在功能规模上时,发现与碳水化合物代谢有关的基因减少。
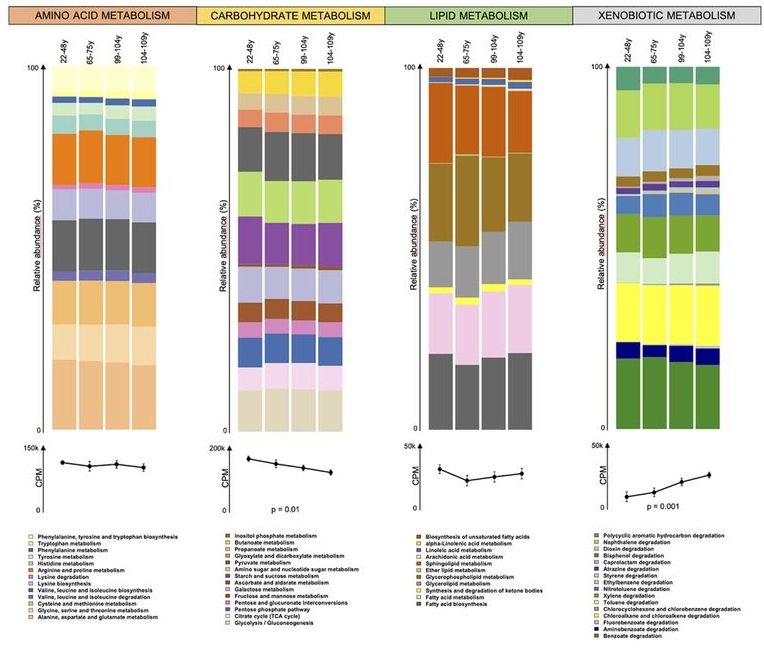
这种功能重塑在百岁老人和半超百岁老人的肠道微生物组中更为明显,研究人员观察到淀粉和蔗糖(KEGG途径编号ko00500),磷酸戊糖(ko00030)以及氨基糖和核苷酸糖(ko00520)途径的贡献减少。
异种生物降解有关的基因数量增加
同时,研究人员发现了和甲苯(ko00623),乙苯(ko00642),己内酰胺(ko00930)以及氯环己烷和氯苯(ko00361)降解途径的随之增加。
乙苯,氯苯,氯环己烷,甲苯是主要来源于工业生产和城市排放的普遍化学物质,由于其毒性作用,是世界各地监测的主要环境污染物之一。这些分子的主要人造来源实际上是汽车和废气汽车的排放,以及香烟烟雾。
此外,众所周知,它们是在加工精制石油产品(如塑料)的过程中产生的,并包含在普通消费产品(如油漆和漆、稀释剂和橡胶产品)中。
己内酰胺是尼龙的原料,用于生产合成纤维、树脂、合成皮革、增塑剂等多种室内产品。先前的研究表明,这些分子在室内的负担比在室外环境中更高,并强调了室内暴露对人类健康的特殊重要性。
生活在强人为下的环境中,例如意大利的艾米利亚-罗马涅区(工业发达),导致持续不断地暴露于这些普遍的异生物质中,促进它们在身体组织(包括肠道)中的维持和累积。
研究人员认为,这可以为人类宿主创造合适的条件,以选择能够解毒此类化合物的肠道微生物组成分,就微生物组和宿主在人类环境中的适应性而言互惠互利。
百岁和半百岁的人都是长寿的人,他们接触异生生物刺激的时间更长,他们的微生物群更适合降解这些异生生物。
脂质代谢基因变化
除了异物降解基因和糖代谢相关基因外,我们还发现了其他代谢途径中与年龄相关的差异,包括与脂质代谢有关的差异。
百岁老人和半超百岁老人显示出更多的α-亚油酸(KEGG途径编号ko00592)和甘油脂(ko00561)代谢的信息。另一方面,年轻人显示鞘脂(ko00600)和甘油磷脂(ko00564)代谢相关基因的贡献更大。
鉴于已知甘油磷脂和鞘脂在动物源性食品中更为丰富,而α-亚油酸主要来自植物源食物,这些特征可能与饮食习惯有关,特别是长寿者的植物源性脂肪摄入量高于年轻人的动物脂肪摄入量。
氨基酸代谢基因变化
此外,涉及氨基酸代谢的功能途径:
色氨酸(ko00380),酪氨酸(ko00350),甘氨酸,丝氨酸和苏氨酸(ko00260)的代谢基因随着年龄的增长而逐渐增加。
另一方面,发现年轻人中丙氨酸,天冬氨酸和谷氨酸代谢的基因(ko00250)更为丰富。色氨酸和酪氨酸的代谢被认为是蛋白水解代谢增强的指标。
此外,血清中色氨酸的生物利用度降低,以及尿液中酪氨酸代谢引起的酚类代谢产物水平升高。
慢性炎症水平低
研究人员发现随着衰老,脂多糖生物合成基因(ko00540)逐渐增加,这可能与病原菌(即肠杆菌科的成员)的存在和慢性炎症的水平低有关。
然而,更长的寿命并不一定等于健康的衰老。随着年龄的增长,人们更有可能患上各种疾病,如心脏病、中风、高血压、认知障碍、癌症等。
前面章节有一项研究(长寿村老人与城镇化老人肠道菌群)提到,来自不同地区的老人,虽然都是长寿,但菌群情况不尽相同。
因此,我们想更具体地了解,同样是长寿老人,健康长寿和不健康长寿具体到个人,在哪些方面会有区别。我们抽取谷禾肠道菌群数据库中两例报告来进行直接比较分析。
以上只是数据库中的两个案例,在经过谷禾肠道菌群数据库筛查后,我们总结了一些关于长寿老人(90岁以上)的肠道菌群的趋势,分享关于报告中的一些指标判断,供大家参考。
健康总分
健康总分能很好的反映一个人的总体健康水平,有慢病或其他问题的老人一般低于55分。
菌群多样性
菌群多样性健康长寿老人的菌群多样性水平最好能高于50,菌种数量在1000~1800左右较好,超过2000则可能会伴有病原菌感染的情况。
慢病情况
主要是心脑血管及糖尿病和部分消化道疾病,涉及慢性炎症和代谢疾病。
病原菌
病原菌感染是老人中最常出现的问题,包括呼吸道和肠道病原菌,随着衰老,肠杆菌科的部分机会致病菌比例会上升,需要注意饮食健康,以及呼吸道健康和口腔健康。
肠道屏障及炎症水平
长寿老年人中Akk菌水平普遍较中年人群较高,Akk菌有助于降低肥胖等代谢疾病,但是Akk菌丰度过高会导致肠粘膜黏蛋白降解,破坏肠道屏障,也是需要注意的指标。
短链脂肪酸水平
短链脂肪酸生成的菌的水平与短链脂肪酸和炎症水平密切相关,短链脂肪酸缺乏通常是慢性炎症的推手。
益生菌水平
在谷禾检测的90岁以上人群中,益生菌水平普遍较高,基本超过人群平均水平。
06 长寿者避雷专区——谣言粉碎机
信息爆炸的时代,我们可以轻易获得大量关于营养保健的信息,然而其中大多数可能是不正确或者过时的观念。
1. 减肥仅靠控制热量?
我们都知道,减肥需要燃烧比摄入更多的能量,但这不是唯一。那些遵循“卡路里摄入,卡路里消耗”方法的人通常只专注于食物的卡路里值,而不是其营养价值。这对于整体健康而言,并非最佳选择。
如果出现体内激素失调,甲状腺功能低下,代谢状况,药物使用等健康问题,可能即使在严格饮食下也难以减轻体重。
2. 高脂食物不健康?
许多人仍然担心高脂肪的食物并遵循低脂肪的饮食习惯,认为减少脂肪的摄入有益于整体健康。
膳食脂肪对于保持最佳健康至关重要。另外,低脂饮食与包括代谢综合征在内的健康风险更高有关,并且可能导致胰岛素抵抗和甘油三酸酯水平升高,这是已知的心脏病危险因素。
而且,在鼓励减肥方面,高脂肪饮食已被证明比低脂肪饮食有效(甚至更高)。
当然,无论是低脂还是高脂饮食,任何一种极端情况都可能危害健康。尽可能遵循“中庸之道”。
3.非营养性甜味剂是健康的?
市场上出现越来越多的非营养性甜味剂(NNS)的产品有所增加。显然,高糖饮食会大大增加疾病的风险,但摄入NNS也会导致不良的健康后果。
例如,摄入NNS可能会引起肠道菌群产生负面变化并促进血糖失调,从而增加2型糖尿病的发病率。
该领域的研究仍正在进行中,未来需要高质量研究来确认这些潜在的联系。
4. 你必须很瘦才能健康?
我们知道,肥胖与许多健康状况相关,包括2型糖尿病,心脏病,抑郁症,某些癌症等。
尽管如此,降低疾病风险并不是说要你必须要达到模特身材。最重要的是营养饮食并保持积极的生活方式,因为这些行为通常会改善体重和体内脂肪百分比。
5. 所有食物都用低脂和减肥食品来代替?
去超市你会发现各种标有“清淡”,“低脂”,“无脂”的产品。虽然这些产品对那些想要减少体内多余脂肪的人来说很诱人,但它们通常是不健康的选择。
研究表明,许多低脂和减肥食品所含的糖和盐要比普通脂肪食品多得多。最好不要经常食用这些产品,有时候也可以享受一下正常食物,例如全脂酸奶,奶酪和坚果黄油。
6. 钙补充剂对骨骼健康必不可少?
很多人听说添加钙补充剂以保持骨骼系统健康。但是,目前的研究表明,补充钙可能弊大于利。
例如,一些研究已将钙补充剂与心脏病风险增加联系起来。此外,研究表明,它们不会降低骨折或骨质疏松症的风险。
当然,如果你担心缺钙,最好注意下钙的饮食来源,例如全脂酸奶,沙丁鱼,豆类和种子食物等。
7.所有果汁和果汁都是健康的 ?
某些果汁营养丰富。例如,主要由非淀粉类蔬菜制成的新鲜果汁可以是增加维生素,矿物质和抗氧化剂摄入量的好方法。
然而,要知道外面买到的大多数果汁中都含有糖和卡路里。如果过量食用,会促进体重增加和其他健康问题,例如蛀牙和血糖失调。

8. 每个人都需要补充益生菌?
益生菌的概念现在越来越火。但是,研究表明,不是所有人补充益生菌都有用,搞不好有副作用。
某些人的消化系统对益生菌的定殖有抵抗力,而且通过补充剂引入益生菌可能会导致肠道细菌产生负面变化。另外,与益生菌使用相关的小肠细菌过度生长会导致腹胀,气体和其他不良副作用。
益生菌不应作为千篇一律的补充剂,而应更加个性化,最好在做完肠道菌群检测之后再确定是否需要补充益生菌,补充哪一类益生菌,这样才能真正让身体恢复健康。
9. 减肥很容易?
你可能看过很多生动的减肥前后的图片,甚至还有传奇的故事,几乎不费吹灰之力就可以迅速减肥的故事,不要随意相信。
减肥其实并不容易。它需要坚持不懈,自律,努力和耐心。另外,由于遗传或其他药物因素使某些人的减肥困难很大,我们需要正视这一切,面对它,慢慢来,给自己多一点耐心,找到一种对你有效的可持续的模式最重要。

10. 纤维补充剂是高纤维食品的良好替代品?
许多人缺乏足够的膳食纤维,这就是为什么纤维补充剂如此受欢迎的原因。尽管纤维补充剂可以改善肠蠕动和血糖控制,从而有益于健康,但它们不应代替真正的食物。
高纤维全食(例如蔬菜,豆类和水果)包含营养物质和植物化合物,它们可以协同工作以促进您的健康,并且不能完全由纤维补充剂替代。
LONGEVITY
随着时代的不断发展,旧的观念也在不断更新。曾经的认知也许是“七十古来稀”,而现如今更多的是百岁人生。
我们的追求也会越来越高,不仅是长寿,更是健康的长寿。可以预见,长寿时代将促使健康产业结构升级。
是的,微生物产业作为健康领域的其中一块,发展迅速。值得庆幸的是,在应对突如其来的疫情下,肠道微生态也在被应用于治疗,技术的革新为提高健康水平提供有力支撑,各个制度完善也在为健康领域的可持续发展构建强大保障,人类命运共同体正彰显其感召力。

而谷禾健康作为微生物产业的一员,自2012年创立起,对于科研事业一直贡献着自己的力量,与此同时,这么多年来,谷禾一直希望将科研真正服务于大众,将科研成果带给每一个人,这是我们的使命。
现如今,我们也已经看到阶段性硕果。曾经,“肠道菌群”还只是一个概念,谷禾健康从肠道菌群的研究构思,到取样专利的落地,肠道菌群检测报告逐步完善,再到样品运输的细节管理,我们都在经历从0到1的过程,勇于创新,不断摸索,在微生物产业的道路上,迈着坚定的步伐。
令我们感到欣慰的是,“肠道菌群”现已逐渐从研究过渡到临床甚至普通人群,并且从模糊的健康概念走向精准检测甚至个性化辅助治疗。
2021寄语
愿你所有努力都有回报
所有的美好都如期而至
参考文献:
Kong F, Deng F, Li Y, Zhao J. Identification of gut microbiome signatures associated with longevity provides a promising modulation target for healthy aging. Gut Microbes.
2019;10(2):210-215. doi: 10.1080/19490976.2018.1494102. Epub 2018 Aug 24. PMID: 30142010; PMCID: PMC6546316.
Rampelli S, Soverini M, D’Amico F, Barone M, Tavella T, Monti D, Capri M, Astolfi A, Brigidi P, Biagi E, Franceschi C, Turroni S, Candela M. Shotgun Metagenomics of Gut Microbiota in Humans with up to Extreme Longevity and the Increasing Role of Xenobiotic Degradation. mSystems. 2020 Mar 24;5(2):e00124-20. doi: 10.1128/mSystems.00124-20. PMID: 32209716; PMCID: PMC7093822.
Deng F, Li Y, Zhao J. The gut microbiome of healthy long-living people. Aging (Albany NY). 2019 Jan 15;11(2):289-290. doi: 10.18632/aging.101771. PMID: 30648974; PMCID: PMC6366966.
Kim BS, Choi CW, Shin H, Jin SP, Bae JS, Han M, Seo EY, Chun J, Chung JH. Comparison of the Gut Microbiota of Centenarians in Longevity Villages of South Korea with Those of Other Age Groups. J Microbiol Biotechnol. 2019 Mar 28;29(3):429-440. doi: 10.4014/jmb.1811.11023. PMID: 30661321.