-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
阴道微生物组在女性阴道健康方面起着重要作用。使用高通量宏基因组和16S rRNA 测序,已在人类阴道中鉴定出250多种细菌。其中,乳杆菌是健康阴道中最常检测到的微生物,其中包括卷曲乳杆菌(Lactobacillus crispatus)、惰性乳杆菌(Lactobacillus iners)、詹氏乳杆菌(Lactobacillus jensenii)和格氏乳杆菌(Lactobacillus gasseri)。
乳杆菌被认为通过产生有机酸、过氧化氢 (H2O2)、细菌素和其他抗菌化合物来防止病原体入侵,从而对阴道生态有益。月经、怀孕、性行为、阴道冲洗和不受控制地使用抗生素等因素会迅速改变微生物群落。阴道生态系统的破坏的特征是乳杆菌物种的枯竭和非乳杆菌微生物的过度生长。
如果把阴道微生态比作一座城市,惰性乳杆菌(Lactobacillus iners)就像那位“随时上线的值班员”:它无处不在、反应灵敏,却不总是最强的守护者。与经典的“稳定派”L.crispatus不同,L.iners 更像过渡期的掌舵者——在月经、性行为、抗生素、妊娠激素等因素影响时占据主导地位,帮助群落从一种状态向另一种状态转变。
但这份灵活也带来代价:它产酸与抑菌能力较弱,黏附与免疫调控独具一格,因而既能伴随健康,也常与生态失调、细菌性阴道病、性传播感染、妊娠不良风险相伴。认识并理解这位“双刃剑”角色,或许是我们走向更精准的女性生殖健康管理、重塑“好菌优势”的关键一步。
惰性乳杆菌(Lactobacillus iners)是阴道微生物群中最普遍的成员,然而,其在复杂的阴道微环境中的作用尚不完全清楚。鉴于其在乳杆菌中具有独特属性,且对多种不良生殖结局的影响差异明显,了解其基本特征有助于更全面地认识其在女性健康中的作用。
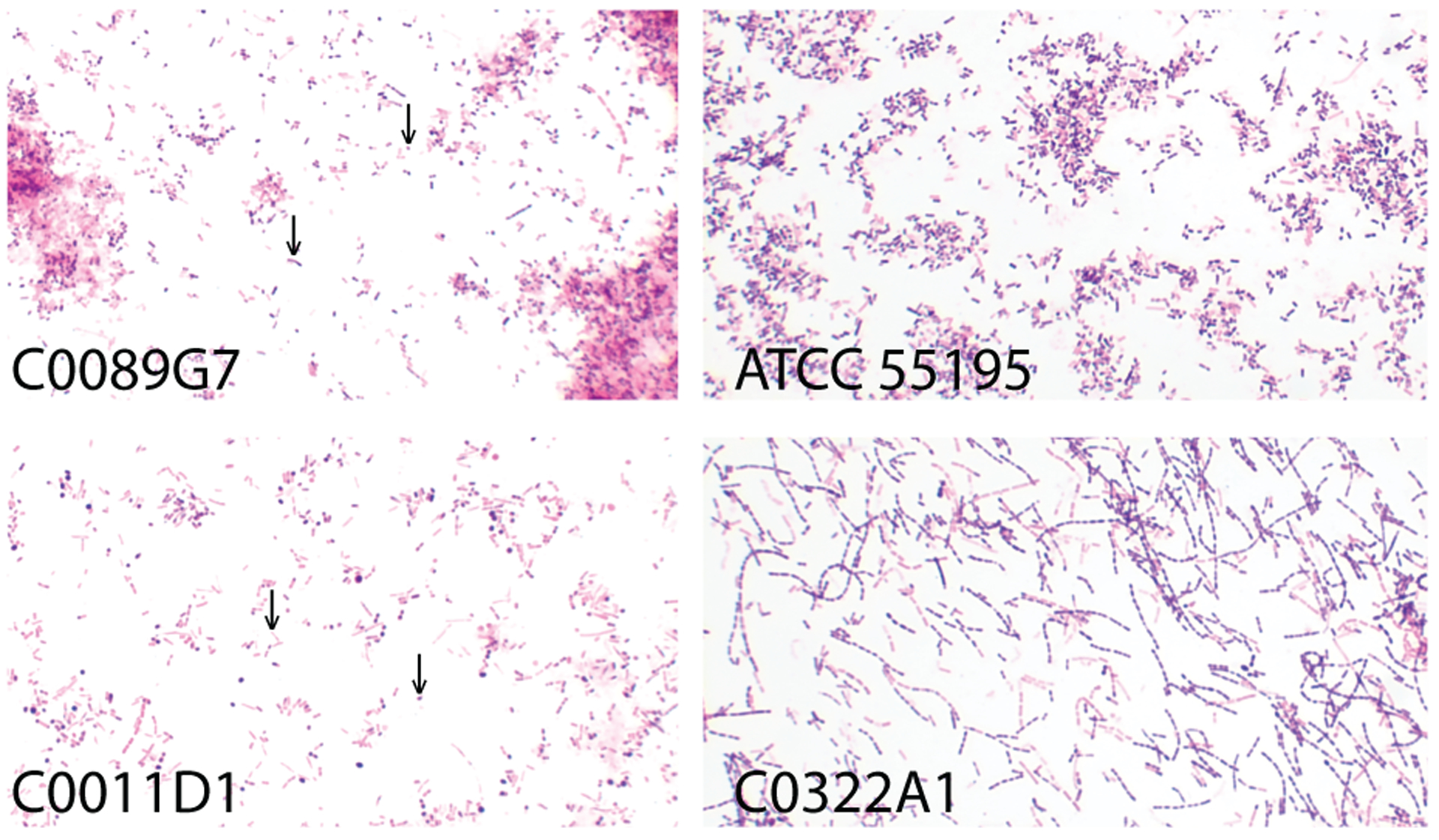
惰性乳杆菌(L.iners)于1999年才首次在阴道和泌尿道标本中被发现;因无法在常规MRS琼脂的标准条件下像其他乳杆菌那样生长而长期被忽视。
1
形态特征
• 革兰氏染色具有可变性
惰性乳杆菌(L.iners)起初被归为革兰氏阳性、杆状、非孢子形成的兼性厌氧菌,但多项研究表明其并非总呈典型的革兰氏阳性染色,形态亦常似球杆菌。一些报道其多呈革兰氏阴性、短小杆状,耐酸性弱(在pH3培养基中不可存活),这或致其早期在培养与显微观察中被忽视。
L. iners 出现“时而革兰氏阳性、时而革兰氏阴性(或变异性)”主要有以下原因:
–细胞壁肽聚糖层很薄:电镜研究显示其PG层显著薄于典型乳杆菌,导致在革兰染色中难以稳定保留结晶紫,呈现革兰阴性或“变异性”外观(可见杆菌或球菌样形态)。
-形态可塑性与菌株差异:同一菌株内及不同分离株之间均可见细胞形态与染色表现的变动,提示菌株层面的结构与功能差异会影响染色结果。
-环境与基因表达的影响:在不同阴道微环境(如细菌性阴道病样环境 vs. 乳杆菌占优势环境)中,L.iners 的基因表达(如调控细胞形态的rodZ等)会改变细胞形态与壁性质,从而影响革兰染色表现。
-方法学与判读偏差:Nugent评分依赖革兰染色形态计分,而L. iners 的“革兰阴性样”表型易被误判为加德纳菌等阴性形态,导致分类偏差,放大了其“阴性”出现的频率。
L. iners 培养分离株的革兰氏染色
Holm JB,et al.Curr Infect Dis Rep.2023
• 厌氧条件下生长能力显著强于其他乳杆菌
该菌在血琼脂上厌氧孵育 24 小时可形成小而光滑、圆形、半透明、无色素的菌落;在添加1–5%绵羊或人血的MRS琼脂上多数分离株亦可生长。
研究证实,L. iners 在厌氧条件下可在MRS琼脂上持续生长至少7天,显著长于其他乳杆菌。
2
基因组和功能
• 较小的基因组对环境波动适应能力较差
惰性乳杆菌(L.iners)的基因组很小,平均为1.28 Mbp,而L.crispatus为2.25 Mbp,这已经处于乳杆菌属的较低基因组大小范围内。相应地,L.crispatus泛基因组计数4300个基因,而L.iners的基因组为2300个基因,平均GC含量为 ~33.3%。
如此低的基因组大小强烈表明一种寄生性、宿主依赖性的生活方式。此外,人们认为较小的基因组预示着对环境波动的脆弱性更高。
• 碳水化合物和氨基酸代谢基因减少
基因组分析表明,L. iners碳水化合物和氨基酸代谢相关的基因数量严重减少,而它维持了主要核心代谢蛋白的保守基因和来自宿主或群落的必需化合物的膜转运基因。确定了三个潜在的核心基因(inerolysin、ZnuA 和 hsdR)与L.iners对阴道环境的特异性适应密切相关。
inerolysin是一种异常的成孔型胆固醇依赖溶素,在酸性环境中活性高,能在膜上形成孔洞,或为稳定获取宿主营养所必需;高亲和力锌摄取蛋白 ZnuA 维持金属离子稳态,可能介导对阴道上皮的强黏附;I 型限制性内切酶亚基 hsdR 被认为在细菌性阴道病期间参与抗噬菌体防御。
• 独特的肽聚糖层可能有助于吸收营养
此外,L. iners 携带完整的肽聚糖(PG)合成与水解酶基因。与其他乳杆菌物种相比,惰性乳杆菌细胞膜独特而薄的肽聚糖(PG)层可能更容易吸收营养或分泌蛋白质,从而提供必需的营养物质或应对阴道环境的快速变化。
3
产酸和过氧化氢能力较弱
• 相较其他乳杆菌抵抗病原体能力较弱
乳杆菌是阴道主要产酸者,能降低pH并抑制潜在致病菌。但不同物种的产酸能力存在差异:L.crispatus、L.gasseri、L.jensenii可由糖原发酵生成D-乳酸与L-乳酸;而L.iners缺乏D-乳酸脱氢酶,仅产L-乳酸,因此其L/D比值最高。
乳酸异构体对宿主免疫的影响不同;较高的L/D比值可上调 EMMPRIN 并激活 MMP-8,促进细胞外基质分解,利于细菌穿越宫颈并诱发上行感染。此外,D-乳酸对外源细菌的抑制强于L-乳酸,说明L.iners在防御病原入侵方面较弱。
• L.iners为主时阴道pH值偏高
研究发现,L.crispatus优势时阴道pH持续偏低;而 L.iners过度生长并不能维持低 pH,且在低 pH 环境中表现较弱。细菌性阴道病常伴随 pH 升高,此时多见加德纳菌与L.iners共存而少见其他乳杆菌。
L.iners 亦缺乏通过丙酮酸氧化产生 H2O2 的机制,而 H2O2 被认为有助于抑制厌氧菌定植。因此,当病原菌挑战阴道环境时,L.iners无法抵抗病原菌的过度生长和pH值的升高,而它可能会持续存在生态失调。
4
营养需求
L. iners基因组异常小、代谢受限,却有更复杂的营养需求,使其能适应多样阴道生态位。激素和其他因素的波动可能会影响阴道环境,导致粘液和糖原产生、pH 值和微生物种类发生变化,这可能为L.iners提供必需的营养。
• 主要对葡萄糖、麦芽糖进行糖酵解
基因组分析表明,除能从葡萄糖、麦芽糖、海藻糖和甘露糖产生酸外,这些菌株不能从L-阿拉伯糖、D-阿拉伯糖醇、环糊精、糖原、N-乙酰葡糖胺、乳糖、甘露醇、松三糖、蜜二糖、甲基β-D-吡喃葡萄糖苷、普鲁兰、棉子糖、核糖、鼠李糖、山梨糖醇、蔗糖、塔格糖、海藻糖或D-木糖产生酸。
• 编码inerolysin使其在失调环境下更具竞争优势
惰性乳杆菌(L.iners)对外源氨基酸的依赖性更高。并且L.iners已被证明是迄今为止已知的唯一编码一种形成孔的溶细胞毒素 inerolysin 的乳杆菌物种。
L.iners产生 inerolysin 的能力可能是影响其从阴道环境中获取营养能力的最重要因素之一。与在平衡的微生物环境中相比,超过10%的编码L.iners中 inerolysin 的基因在生态失调中的表达更高。该毒素可直接从宿主组织/细胞释放资源,使L.iners在营养匮乏和不利条件(如细菌性阴道病,其他乳酸杆菌难以定植)下具竞争优势。
注:尽管在乳杆菌中没有发现铁摄取系统,但在乳杆菌中检测到了能够催化亚铁离子并结合原卟啉IX形成血红素的铁螯合酶。
5
粘附能力
惰性乳杆菌(L.iners)对宿主细胞的粘附被认为通过阻断病原微生物在阴道上皮细胞的结合位点的机制在排除病原微生物方面发挥作用。
• 中性pH值下L.iners与人纤连蛋白的结合强于其他乳杆菌
尽管L.iners缺乏乳杆菌属的大部分主要粘附分子,但它仍然对阴道上皮细胞表现出很强的粘附能力。纤连蛋白是阴道上皮细胞外基质中的一种不溶性糖蛋白。L.iners基因组编码一种纤连蛋白结合蛋白,该蛋白含有金黄色葡萄球菌致病菌株共有的基序(纤连蛋白结合蛋白 A),从而介导金黄色葡萄球菌对宿主细胞的粘附和侵袭。研究证明,在更中性的 pH 值下,L.iners与人纤连蛋白的结合明显强于其他乳杆菌物种,这可能导致L.iners在阴道中持续存在,尽管存在病原体或用抗生素治疗。
• L.iners独特的粘附能力会影响其保护作用
一项体外研究报告说,L.iners可能会增加引起细菌性阴道病(BV)的G.vaginalis的粘附。研究还证明,L.iners产生溶孔素,这是一种常见于病原菌中的成孔蛋白,可以增强粘附能力。这些发现表明,L.iners独特的粘附功能降低了对健康阴道微生物组免受病原菌侵害的保护。
6
抗菌和免疫特性
L.iners是最常见且持久的阴道共生乳杆菌,能高度适应复杂且动态的阴道环境。环境波动时,其他乳酸杆菌或难以存活,而 L.iners 借助基因组层面的灵活调控——如特异性碳水化合物摄取、纤连蛋白结合、噬菌体防御与惰性溶血素合成——维持稳定丰度。其在多种条件下的生存优势使其在微生物组过渡期常成优势种。
• L.iners在不同环境下可能存在免疫保护也可能扰乱稳态
多项研究已证实 L.iners 具备多种免疫特性,其细胞因子调控、外源营养摄取和噬菌体防御等特性,有助于在不利条件(包括 BV)下生存。L.iners还能限制有害菌获取铁等关键营养,并通过激活上皮先天免疫抑制其生长;此外,通过阴道上皮细胞之间的特定分子相互作用观察到 L.iners 的抗炎作用。
以 L.iners 为主的阴道微生物组与上皮应激反应的诱导相关。研究发现,L. iners(而非 L. crispatus)显著上调人原代阴道上皮的模式识别受体通路并提升 TNF mRNA,显示其对宿主免疫的物种特异调节。有人提出,L. iners 在压力下可激活 TLR 信号、提高 HSP70、抑制自噬,从而扰乱上皮稳态并削弱对潜在病原的识别与应答。相反,多种参与上皮抗菌防御的分子(如 NGAL、钙卫蛋白、透明质酸)又更易被其诱导。
综上,L.iners 既能对抗非生理威胁、促进恢复至更健康状态,又表现促炎特性,且在不同环境下并不总是共生角色。
阴道微生物群在维持女性健康的阴道微环境方面起着重要作用,其组成受种族、年龄、妊娠、阴道疾病等多种因素的影响。作为全球育龄女性阴道微生物组中最常见的乳杆菌成员,Lactobacillus iners兼具“普遍性”与“复杂性”。
一方面,乳杆菌总体被视为女性阴道健康的关键守护者,通过乳酸与抗菌物质产生抑制病原体、维持低pH与生态稳态;另一方面,L.iners又与经典的有益乳杆菌(如L.crispatus、L.jensenii、L.gasseri)显著不同:其基因组较小、代谢能力相对受限、主要产生L-乳酸、能在高低pH及BV阳/阴性环境中存活,因而常被视为生态扰动后的“过渡型”定植者。
流行病学与多组学研究提示,L. iners主导的微生物群(CST III型)在多个人群中广泛存在,较缺乏乳杆菌的多样化菌群仍具一定保护性,但与L.crispatus主导状态相比,其对病原体(包括念珠菌)定植与部分不良结局(如阴道生态失调、性传播感染及妊娠不良)的防护可能次优;同时,行为与社会学因素(如无保护性行为、性伴数增加)可能与其主导状态相关。
阐明L.iners在阴道健康与疾病中的双刃剑角色,并识别可干预的致病特征与潜在生物标志物,至关重要且紧迫。
1
L.iners与阴道生态失调
证据强度:较高
与肠道菌群相比,健康个体阴道微生物环境的一个典型特征是其细菌多样性极低。健康绝经前妇女有五种主要的群落状态类型(CST),即L.crispatus 主导的 CST I、L. gasseri 主导的 CST II、L.iners 主导的 CST III 和 L. jensenii 主导的 CST V,而 CST IV 的特征是缺乏乳杆菌属。阴道生态失调以细菌多样性高和厌氧菌混合物为特征,经常与多种妇科疾病有关。
• L.iners在孕妇中占比均较高,但健康孕妇中更多
一项研究从中国广州中山大学附属第六医院招募了一组 95 名孕妇。该队列包括 34 名健康孕妇(健康)和 61 名患有至少一种疾病的孕妇。
参与者患有的疾病也被分为妊娠糖尿病(GDM)(n=21)、母体相关不良妊娠结局(MAPO, n=29)、胎儿相关不良妊娠结局 (FAPO, n=13)、阴道感染(n=6)、肝脏或肾脏异常(n=14)、贫血(n=8)、血栓形成倾向(n=4)和辅助受孕(n=11)。
中国孕晚期孕妇阴道微生物组组成及结构
Wang X,et al.NPJ Biofilms Microbiomes.2025
研究发现,在物种层面,健康孕妇的阴道微生物组呈现出独特的分布模式,其中L.iners主导的CST-III型占比高达50%,显著高于疾病组的31.15%,但在所有组中,L.iners所主导的分型占比均不低。
• L.iners为主的阴道菌群保护性不及L.crispatus
L.iners常见于健康女性、阴道生态失调(如 BV)患者,甚至抗菌治疗者。多项研究表明,L.crispatus与健康相关,而以L.iners为主的群落有时难以提供足够保护以预防失调。
L.iners的存在与较高水平的促炎因子有关,例如白细胞介素1α、白细胞介素18、巨噬细胞迁移抑制因子和肿瘤坏死因子α,它们负责激活阴道炎症反应。
• L.iners适应能力较强,BV患者丰度可能也不低
尽管L.iners的作用仍有争议,但其丰度相对稳定,不易被病原体替代。细菌性阴道炎时,L.iners常与潜在有害菌共存,而L.crispatus则很难做到。
其基因组支持对失调环境的适应,可能与代谢、细胞溶解及抗噬菌体防御基因随阴道环境变化而调控有关。其在多种条件下的强生存力提示其既是宿主防御的重要成员,也是可维持与恢复阴道微生物组的持久共生乳杆菌。
2
L.iners与细菌性阴道病
证据强度:较高
细菌性阴道病(BV)是育龄妇女中最常见的阴道炎类型。它的特点是乳杆菌属显著减少或消失,伴随着以厌氧菌和兼性细菌为主的更多样化的微生物群的出现,如加德纳菌属、普雷沃氏菌属和阴道曲霉属。
• L.iners是能在细菌性阴道病中存在的乳杆菌
L.iners通常是唯一可以在细菌性阴道病(BV)期间检测到的与BV相关细菌共存的阴道乳杆菌物种。凭借对基因组功能的动态调控,它能在剧变的阴道环境中持续存在;L.iners基因表达的增加可能导致琥珀酸和其他短链脂肪酸的产生以及 BV 环境中 pH 值的增加。
为了适应BV环境,L.iners可以增加inerolysin和粘蛋白的表达,促进甘油的产生和相关代谢酶的表达,从而保证其从外源获取营养物质。此外,噬菌体是导致 BV 期间乳杆菌种类突然减少的原因之一,而 L.iners 可以上调I型 RM 系统和 CRISPR 等防御系统,以及其特异性 hsdR 基因,以抵抗 BV 期间噬菌体的入侵。
最近的一项研究发现了三种由名为Lactobacillus paragasseri的人类肠道菌株产生的细菌素活性肽。这些细菌素对乳杆菌具有很强的选择性抑制活性,而L. crispatus、L. jensenii和L. gasseri仅受到轻微抑制,表明这些乳杆菌衍生的抑制剂可以与甲硝唑联合使用,以改善目前的BV治疗。
• L.iners有助于预测细菌性阴道病的状态
由于 L.iners 在 BV 中的共存与其他乳杆菌物种不同,因此L.iners的流行率可以作为微生物指标来预测BV的发作或中间状态。此外,L.iners对甲硝唑具有耐药性,并且被发现它是主要的乳杆菌物种,即使在用甲硝唑处理BV后也是如此。
与BV期间几乎缺失的保护性乳杆菌相比,L.iners竞争力更强,能在失衡微生物组中共存。有人认为它促成 BV 与非 BV 状态的过渡。值得注意的是,治疗后微生物组常仍以L.iners为主,而未转为L.crispatus优势。因此,L.iners持续存在或致长期阴道失调,尤见于反复治疗后。但仍需研究其究竟是转化生物标志物,还是 BV 的促成因素。
3
L.iners与早产
证据强度:一般,存在矛盾结果
在怀孕期间维持阴道微生物组中乳杆菌属的自然健康平衡尤为重要。早期的研究证实,怀孕期间阴道内的高雌二醇水平和随之而来的高糖原水平导致更强的阴道酸化,从而随着妊娠的进展促进乳杆菌物种的流行。
• L.iners的丰度在孕中期和晚期显著下降
许多研究表明,以惰性乳杆菌(L.iners)为主的阴道微生物组更有可能在怀孕期间转向生态失调。在之前的研究中,发现健康孕妇的L.iners丰度在妊娠中期和晚期显著下降,而 L.crispatus 的丰度在妊娠中期与孕早期相比有所增加。
此外,研究发现,阴道清洁度和白细胞酯酶活性阳性的升高与 L.iners 而非 L.crispatus 的丰度增加相关。
• L.iners的丰度与早产之间存在一定联系
越来越多证据表明,细菌性阴道病(BV)是不良妊娠结局的重要病因,尤以早产(PTB)为甚。以L.iners占优势的“中间微生物群”被视为 PTB 的潜在风险因素。
有研究人员认为,在怀孕早期健康女性的阴道涂片中检测到的L.iners可能与早产(PTB)有关。另有研究也证明了这一点,报告说,妊娠16周时以L.iners为主的阴道微生物组是短宫颈和早期 PTB(<34 周)的危险因素,而 L.crispatus 优势在种族更多样化的队列中对 PTB 具有保护作用。
来自不同国家的最新研究表明,L. iners 与早产患病率增加之间存在关联。L. iners也被证明是黑人孕妇中最丰富的乳杆菌物种。然而,大多数研究并未确定乳杆菌占主导地位的阴道微生物组与黑人孕妇的 PTB 之间存在显著关系。
相反,三项研究报告说,L.iners与降低 PTB 风险有关。因此,L. iners 与 PTB 风险之间的关联还存在争议(表1)。此外,有限的样本量、样本采集时间、PTB 定义的差异、种族和地理差异、菌株鉴定方法的差异,以及遗传异常或 PTB 病史等复杂的临床条件,都是影响结果的混杂因素。
L.iners和早产的研究主要结果
Zheng N,et al.Front Cell Infect Microbiol.2021
基于L.iners的特性及其在作为唯一乳杆菌时对病原体保护不足,一些研究者认为它并不直接致孕期感染。事实上,L.iners优势的阴道微生物组较不稳定,孕期易向与BV相关的CST-IV转变;其还可能通过调节局部炎症与影响宫颈完整性,削弱化学与机械黏膜屏障,从而增加早产风险。但仍需进一步研究阐明二者的潜在机制。
4
L.iners与生物膜形成
证据强度:一般
生物膜是紧密附着在表面上的细菌结构,已知它们比浮游细胞对宿主免疫反应和抗生素治疗更具抵抗力。阴道上皮的生物膜与感染密切相关;大量证据显示BV伴随致密的多菌生物膜,其中加德纳菌(G.vaginalis)为主导菌。一般认为,加德纳菌启动生物膜形成并促进其他 BV 相关菌附着,进而增厚生物膜;其生物膜还能阻挡抗生素渗透,保护其他菌株。BV 的高复发被广泛归因于此类生物膜既能保护细菌免受抗生素治疗,甚至作为病原体再生的宿主。
• L.iners对病原菌的粘附抑制不如其他乳杆菌
阴道本土乳杆菌被认为可以通过空间位阻或粘膜中的受体掩蔽来防止病原菌的定植。先前的研究使用乳杆菌益生菌方法试图清除多微生物生物膜,从根本上阻止细菌毒力并抑制人体阴道感染。
据报道,植物乳杆菌(Lactobacillus plantarum)可显著降低 HT-29 细胞系中大肠杆菌、鼠伤寒沙门氏菌、金黄色葡萄球菌和铜绿假单胞菌的粘附,这使其成为治疗 BV 的潜在抗生物膜剂。体外生长的阴道加德纳菌生物膜被罗伊氏乳杆菌RC-14取代,并在有限程度上被L.iners取代。
研究发现,L.crispatus大大降低了G.vaginalis菌株对宫颈上皮细胞的粘附,包括来自健康女性和患有BV的女性。有趣的是,L.iners显著降低了健康女性对G.vaginalis菌株的粘附,但却增强了致病性G.vaginalis的粘附,表明L.iners可能可以与BV相关的G.vaginalis共存,并可能有助于G.vaginalis主导的生物膜形成。
此外,众所周知,念珠菌属,主要是白色念珠菌,可以形成厚而坚韧的生物膜,这大大增加了治疗复发性外阴阴道念珠菌病期间对抗真菌药物的耐受性。有研究报道了各种乳杆菌在共培养时抑制白色念珠菌生物膜形成和生物膜相关基因表达的能力。鼠李糖乳杆菌可下调白色念珠菌生物膜相关基因表达。相反,与 L.iners 共培养导致生物膜相关基因表达(ALS3 和 ECE1)上调,表明 L.iners 的存在可能表明阴道生态失调的转变;因此,它不应用作白色念珠菌感染的益生菌干预措施。
进一步了解阴道共生乳杆菌与生物膜结构和功能之间的相互作用对于确定生物膜相关感染的新治疗方法极为重要。
5
L.iners与性传播感染
证据强度:低
先前的研究报告称,以L. crispatus为主的阴道微生物组与较低的性传播感染患病率有关,而细菌性阴道病与性传播感染风险升高有关,例如沙眼衣原体、人类免疫缺陷病毒(HIV)、淋病奈瑟菌、巨细胞病毒和单纯疱疹病毒2型感染。
• 以L.iners为主的阴道微生物群受病原体感染风险更高
有研究报告说,基线时以L.iners为主的阴道微生物组显著增加了一年后感染沙眼衣原体的风险。以乳杆菌为主的阴道微生物组中缺乏D-乳酸可能会通过调节宫颈完整性来增加 HIV 横贯宫颈阴道粘液的能力。
许多研究报告称,HPV阳性女性的阴道微生物多样性较高,乳杆菌种类丰度较低。与L.crispatus相比,以L.iners为主的阴道微生物组与高危 HPV 感染相关。可以推测,阴道生态失调可能会影响宿主对 HPV 感染的先天免疫力,导致发育不良/宫颈癌。
这些发现表明,L.iners可能表现出类似于BV的阴道微生物组组成的快速变化,并且可能是性传播感染下动态阴道环境的有价值的生物标志物。
6
L.iners与不孕症
证据强度:较低
阴道生态失调,包括pH值升高、菌群多样性增加、细菌性阴道病、外阴阴道念珠菌病和滴虫性阴道炎,被认为是不孕症的危险因素。还有研究报告说,L.iners的丰度与不孕率增加有关。
• L.iners丰度可能对怀孕率存在影响
近期有研究报道,以L.iners为主的阴道微生物组与输卵管性不孕和沙眼衣原体感染相关。作为过渡物种,L.iners可能在治疗或体外受精(IVF)所致的高雌激素环境下,促使异常与正常微生物组相互转换。
7
L.iners与月经周期
证据强度:一般
人类微生物组项目显示,包括阴道在内的各部位微生物群在同一受试者内的时间变化小于个体间差异。月经周期是扰动阴道微生物多样性的关键因素。L.crispatus通常在育龄妇女的阴道中占主导地位,而 L.iners 在月经周期中过度生长并取代L.crispatus。
• L.iners在月经期间明显增加,有助于判断月经时间点
最近的一项研究报告说,L. iners是卵泡期复发最频繁的微生物;L.iners和CST IV型在围排卵期占主导地位;在黄体期,最常见的类型是 CST IV。事实上,L.iners的丰度在月经期间显著增加,通常与G.vaginalis或Atopobium vaginae的增加同时;然而,在没有干预的情况下,它们随后在月经后减少。
由于阴道生态的动态变化是在同一个体月经周期的不同时间点表征的,因此相对于月经周期的采样时刻对于阴道微生态分析非常重要。
L.iners作为改善生殖健康的靶点
鉴于L. iners在阴道微生物组中的高检出率、其在多种阴道环境状态中的存在以及其功能可塑性(无论是通过遗传多样性、维持多菌株、差异基因表达还是两者兼有),特定的L. iners菌株、基因或产物可能成为治疗或预防性调节阴道微生物群的广泛适用靶点。
在关于阴道乳杆菌对半胱氨酸依赖性的报告中证明,L.iners缺乏L.crispatus、L.gasseri和L.jensenii中存在的外源性半胱氨酸摄取转运系统。相反,L.iners依赖于摄取外源性L-胱氨酸,然后在细胞内将其转化为半胱氨酸。在模拟细菌性阴道病(BV)样菌群的体外实验中,使用胱氨酸摄取抑制剂和甲硝唑处理促进了L.crispatus的生长,而单独使用甲硝唑处理则导致L.iners的扩增。因此,胱氨酸摄取抑制剂或其他特异性抑制L.iners的试剂未来可能作为细菌性阴道病治疗方案的补充,以调节微生物群组成,促进非L.crispatus乳杆菌属的扩增。
总的来说,卷曲乳杆菌(L.crispatus)与最佳阴道健康状况相关,部分原因在于其全球普遍存在以及与积极健康结果的相关性。然而,由于宿主生理或免疫学原因,卷曲乳杆菌的优势状态可能并非某些个体能够合理实现的状态。确实存在稳定的以无害乳杆菌(L.iners)为主的微生物群,这些微生物群可能具有特定的菌株水平特征,即宏基因组亚种,并且可能对某些个体而言是最优的。
一种新的干预措施可能是将与细菌性阴道病(BV)风险增加相关的不稳定乳杆菌微生物群调节为由对变异有抵抗力的无害乳杆菌菌株组成的稳定微生物群。
本文涵盖了L. iners的主要特性、健康影响及其在未来女性健康中的潜在作用:
一、L.iners的主要特性
普遍性与过渡性:是育龄女性阴道中最常见的乳杆菌之一,常出现在生态扰动后的过渡阶段,可在健康与失调状态(如BV)中共存。
基因组与代谢:基因组最小(约1.28 Mbp),代谢能力受限,依赖宿主营养;缺乏D-乳酸脱氢酶,仅产L-乳酸,产酸与过氧化氢能力弱于L.crispatus。
特异功能基因:携带inerolysin(成孔毒素)、ZnuA(高亲和锌摄取)和hsdR(I型限制性内切酶亚基)等,有利于在酸性、营养匮乏和噬菌体压力下生存。
免疫调控:可上调上皮PRR通路与炎症因子(如TNF),在不同环境下呈现抗炎与促炎双重效应。
二、对女性健康的影响
阴道生态:以L.iners为主(CST III型)的群落相较L.crispatus主导状态保护性较弱;在细菌性阴道病中常与厌氧菌共存,能耐受甲硝唑并在治疗后持续占优,或与生物膜形成、复发相关。
生物膜与病原体黏附:对G.vaginalis的黏附抑制弱,甚至增强致病株黏附;与白色念珠菌共培养可上调ALS3/ECE1,提示其不宜作为念珠菌感染的益生菌干预。
妊娠与早产:孕期以L.iners为主的群落较不稳定,易向BV相关CST-IV转变;可能通过局部炎症与宫颈完整性影响,增加早产风险(证据存在异质性)。
性传播感染(STI)与HPV:L. iners主导与较高的STI风险和高危HPV相关;多样性升高、乳酸杆菌减少的状态或削弱对HPV的先天免疫。
月经周期动态:卵泡期与围排卵期更易见L.iners增多,提示其对激素与环境波动高度敏感。
三、未来在女性健康中的作用与方向
风险分层与生物标志物:作为生态扰动与STI动态环境的指示菌,用于BV“中间状态”、治疗后复发风险及HPV/早产风险的预测与监测。
精准干预靶点:围绕其特征通路(inerolysin、金属离子摄取、CRISPR/限制修饰系统、黏附因子)设计干预,限制致病性而非简单清除。
益生策略优化:更倾向于重建L. crispatus优势的“功能性益生”与微生态移植;避免在念珠菌感染等场景使用L. iners相关干预。
个体化管理:结合月经周期、妊娠阶段、性行为模式与种族/地域差异,动态评估菌群状态,制定个体化预防与治疗方案。
总而言之,惰性乳杆菌(Lactobacillus iners)在波动环境中具生存与一定保护能力,但其较弱的产酸/抗菌功能与独特黏附、免疫调控特性,关联BV、STI、HPV风险升高以及妊娠不良与不孕。未来应将其作为风险标志与精准干预靶点,聚焦功能替代与群落重建,推动女性生殖健康的个体化管理与预防治疗升级。
主要参考文献
Wang X, Jiang Q, Tian X, Chen W, Mai J, Lin G, Huo Y, Zheng H, Yan D, Wang X, Li T, Gao Y, Mou X, Zhao W. Metagenomic analysis reveals the novel role of vaginal Lactobacillus iners in Chinese healthy pregnant women. NPJ Biofilms Microbiomes. 2025 May 30;11(1):92.
Zheng N, Guo R, Wang J, Zhou W, Ling Z. Contribution of Lactobacillus iners to Vaginal Health and Diseases: A Systematic Review. Front Cell Infect Microbiol. 2021 Nov 22;11:792787.
Holm JB, Carter KA, Ravel J, Brotman RM. Lactobacillus iners and genital health: molecular clues to an enigmatic vaginal species. Curr Infect Dis Rep. 2023 Apr;25(4):67-75.
Kim H, Kim T, Kang J, Kim Y, Kim H. Is Lactobacillus Gram-Positive? A Case Study of Lactobacillus iners. Microorganisms. 2020 Jun 29;8(7):969.
Novak J, Ravel J, Ma B, Ferreira CST, Tristão ADR, Silva MG, Marconi C. Characteristics associated with Lactobacillus iners-dominated vaginal microbiota. Sex Transm Infect. 2022 Aug;98(5):353-359.
Bautista C. T., Wurapa E., Sateren W. B., Morris S., Hollingsworth B., Sanchez J. L. (2016). Bacterial Vaginosis: A Synthesis of the Literature on Etiology, Prevalence, Risk Factors, and Relationship With Chlamydia and Gonorrhea Infections. Mil. Med. Res. 3, 4.
Alonzo Martinez M. C., Cazorla E., Canovas E., Martinez-Blanch J. F., Chenoll E., Climent E., et al. (2021). Study of the Vaginal Microbiota in Healthy Women of Reproductive Age. Microorganisms 9 (5):1069.
Borgdorff H., Armstrong S. D., Tytgat H. L., Xia D., Ndayisaba G. F., Wastling J. M., et al. (2016). Unique Insights in the Cervicovaginal Lactobacillus Iners and L. Crispatus Proteomes and Their Associations With Microbiota Dysbiosis. PloS One 11 (3), e0150767.
Campisciano G., Florian F., D’Eustacchio A., Stankovic D., Ricci G., De Seta F., et al. (2017). Subclinical Alteration of the Cervical-Vaginal Microbiome in Women With Idiopathic Infertility. J. Cell Physiol. 232 (7), 1681–1688.

谷禾健康
在肠道菌群检测系列产品成熟之后,谷禾健康将深耕多年的微生物组学技术平台,延伸至关乎女性全生命周期健康的另一核心领域——阴道微生态。
还包括子宫颈沙眼衣原体、HPV、HSV、EB病毒、巨细胞病毒等。
谷禾阴道菌群检测报告引入科学前沿的菌群状态分型(CST)概念,将复杂的菌群构成归纳为几种易于理解的健康状态类型。
例如,以卷曲乳杆菌为主的CST-I型代表健康的稳定状态,而以加德纳菌等多种厌氧菌为主的CST-IV型则与细菌性阴道病高度相关。这为临床判断和干预效果评估提供了科学支持。
谷禾阴道菌群检测报告中包括阴道菌群总体评估、CST分型、致病菌表(细菌性阴道病,需氧菌性阴道炎,外阴念珠菌病等)、列出异常菌群及相关说明,菌群详细构成等(注:仅用于菌群科学研究和辅助参考,不直接用于临床诊断)。
…
…
…
…
阴道菌群检测让我们能够更全面地了解阴道微生物组的组成及其变化,以及它是如何随着时间的推移或对各种因素(如环境、激素变化、性活动和抗生素使用等)的反应而变化的。
注:本产品可辅助评估和筛查,不用作临床诊断。
05

谷禾健康
乳杆菌属(Lactobacillus)是厚壁菌门乳杆菌科下的一类革兰氏阳性菌,最早于19世纪在酸奶中发现。
乳杆菌在自然界中分布很广,在植物体表、乳制品、肉制品、葡萄酒、发酵面团、污水以及人畜粪便中,均可分离到。在人类中,乳杆菌属成员定植于胃肠道、口腔和女性泌尿生殖道。
★ 乳杆菌的特性
• 消化和代谢蛋白质和碳水化合物
• 合成B族维生素和维生素K
• 分解代谢胆汁盐
• 增强先天性和获得性免疫力
• 抑制促炎介质
• 对一系列病原体具有抗菌活性
✦乳杆菌的应用
乳杆菌被广泛应用于各种领域中:
•食品工业
乳杆菌被广泛应用于食品工业中,如酸奶、奶酪的制作中。乳杆菌能够发酵乳糖产生乳酸,使得食品呈现出酸味和口感。
•医药领域
乳杆菌被用于制作口服制剂、肠内营养制剂、抗生素辅助治疗等药物。能够调节肠道微生物群落的平衡,促进食物消化和营养吸收,缓解肠道炎症和感染。
•保健品领域
乳杆菌被应用于保健品领域,如乳酸菌饮料、乳酸菌片等。乳杆菌能够改善肠道菌群平衡,增强免疫力,促进身体健康。
•环境领域
乳杆菌被应用于环境领域,如土壤修复、废水处理等。乳杆菌能够分解有机物质,促进土壤肥力和水质净化。
★ 乳杆菌对人体健康非常重要
随着对微生物群落的研究逐渐深入,乳杆菌的作用也逐渐被人们所认识。
乳杆菌对人体有着重要的作用,在肠道健康及女性阴道健康中扮演不可或缺的角色。具有多种生理功能,能够维护菌群平衡、改善消化功能、提高免疫力,除此之外还会影响一些疾病的进展。
本文主要讨论和介绍乳杆菌的菌属特性,生态代谢特征,对人体肠道健康、阴道健康以及一些疾病的影响,在最后还介绍了一些补充乳杆菌的方法。
目录/contents
Part1:认识乳杆菌
Part2:乳杆菌与肠道健康
Part3:乳杆菌与阴道健康
Part4:乳杆菌与其他疾病
Part5:如何补充乳杆菌
Part6:结语
▸ 乳杆菌、乳酸杆菌和乳酸菌
乳杆菌属(Lactobacillus),有时也会翻译成乳酸杆菌,是革兰氏阳性兼性厌氧或微需氧的棒状细菌,通常是乳酸菌的一种。
乳杆菌属包括多种菌种,如乳酸杆菌、嗜酸乳杆菌、肠道乳杆菌等。它们通常是革兰氏阳性、非芽孢杆菌,能够在无氧或微氧条件下进行发酵,产生乳酸等有益物质。
乳酸菌包括多种菌属,如乳杆菌属、双歧杆菌属、嗜酸乳球菌属等。它们能够在无氧或微氧条件下进行发酵,产生乳酸等有益物质。乳酸菌在人体内具有多种功能,如维护肠道菌群平衡、增强免疫力、促进营养物质吸收等。
因此,乳杆菌属(乳酸杆菌)是乳酸菌的一种,而乳酸菌则是一个更广泛的概念,包括多种菌属。
▸ 形态特征
乳杆菌属于革兰氏阳性菌,呈细长的杆状,但无分枝,无芽孢,一般大小约为0.5-1.5μm×2-10μm(某些大杆菌如保加利亚乳杆菌可能更大)。菌落呈圆形、白色(有时黄色)、半透明。
细胞壁:乳杆菌的细胞壁主要由肽聚糖和多糖组成,具有较强的抗菌作用。
运动性:乳杆菌通常是非运动性的,即不具有鞭毛或纤毛。菌毛首先在鼠李糖乳杆菌(Lactobacillus rhamnosus GG)中观察到,它从细菌细胞中突出,在粘附到上皮细胞中起主要作用。
乳杆菌菌落


Talib N,et al.Molecules.2019
注:a是在MRS培养基上从开菲尔样品中分离的乳酸杆菌菌落; b是在MRS培养基上从开菲尔样品中单筛选分离的乳酸杆菌
▸ 分类及主要种群
乳杆菌属是乳杆菌科中最大的一个属。该属的成员已经有超过200种。具体见附录一。
主要有德氏乳杆菌保加利亚亚种(保加利亚乳杆菌)、嗜酸乳杆菌、干酪乳杆菌、罗伊氏乳杆菌、惰性乳杆菌等。
此外卫生部公布可用于生产普通食品的乳杆菌还有卷曲乳杆菌、德氏乳杆菌乳亚种、发酵乳杆菌、格氏乳杆菌、瑞士乳杆菌、约氏乳杆菌、副干酪乳杆菌、植物乳杆菌、唾液乳杆菌等。
乳杆菌属中最具代表性的物种以其在食品发酵中的应用而闻名,并且特定菌株已被认为具有益生菌特性。乳酸杆菌的健康方面促使许多研究人员积极筛选这些细菌的许多潜在来源。因此,在过去 15 年中观察到新物种的爆炸式增长。
尽管许多早期描述的物种被转移到新创建的属(Atopobium、Carnobacterium、Eggerthia、 Weissella 、Fructobacillus等)该属在系统发育和表型标记方面仍然存在异质性。Pediococcus属、Paralactobacillus 属与Lactobacillus 混合在一起,表明对该属进行进一步的分类学细分很可能甚至是必要的。
▸ 生长环境和条件
乳杆菌广泛存在于自然界中,包括土壤、水体、植物、动物等环境中。乳杆菌作为一种常见的益生菌,也存在于人体的口腔、肠道、阴道等部位。
乳杆菌的生长环境主要包括以下几个方面:
pH值:乳杆菌适宜生长的pH范围一般在4.5-6.5之间(某些耐酸种群可能在3.8仍能生长),其中以5.5-6.0最为适宜。
温度:乳杆菌的生长温度一般在20-45℃之间,其中以30-40℃最为适宜。
氧气需求:乳杆菌是一种厌氧菌,不需要氧气就能生长。
营养物质:乳杆菌需要一定的营养物质才能生长,主要包括碳源、氮源、矿物质、维生素等。
注:不同种类的乳杆菌对营养物质的需求可能会有所不同
▸ 乳杆菌的代谢
乳杆菌是过氧化氢酶阴性革兰氏阳性微生物,主要产生乳酸作为碳水化合物发酵的主要代谢终产物。
参与的KEGG途径具体见附录二。
▸ 乳杆菌的作用
乳杆菌是一种益生菌,对人体健康有着重要的作用。以下是乳杆菌的主要作用:
维护肠道菌群平衡:乳杆菌能够抑制有害菌的生长,维护肠道菌群平衡,防止肠道感染和炎症。
改善消化功能:乳杆菌能够分解食物中的纤维素和其他难以消化的物质,促进食物消化和营养吸收。
提高免疫力:乳杆菌能够增强肠道黏膜屏障的功能,防止有害物质进入血液循环,提高免疫力。
缓解过敏反应:乳杆菌能够调节免疫系统的反应,减轻过敏反应的症状。
降低胆固醇:乳杆菌能够降低血液中的胆固醇水平,预防心血管疾病。
改善口腔健康:乳杆菌能够抑制口腔中有害菌的生长,预防龋齿和口臭。
总之,乳杆菌对人体健康有着多方面的益处,是一种非常重要的益生菌。
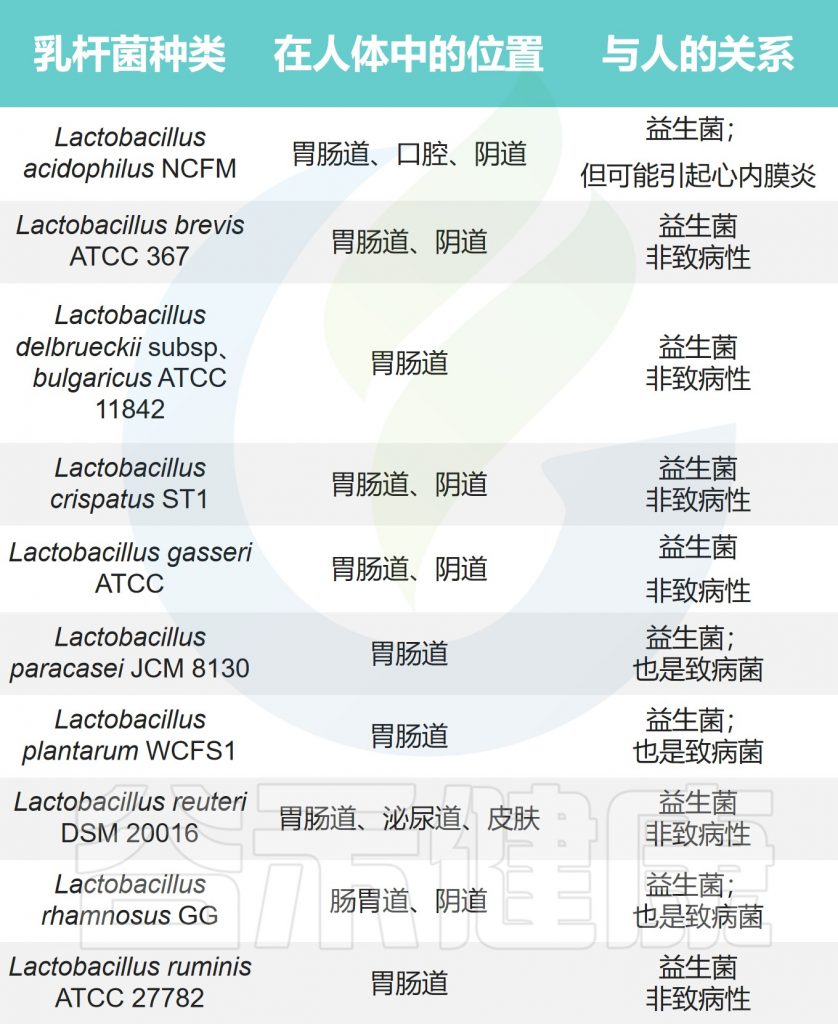
• 乳杆菌也有可能是机会性病原体
乳杆菌中主要的病原菌或致病菌包括:
它们也有可能是机会性病原体,可引起脓肿、菌血症、心内膜炎、肺部感染和新生儿脑膜炎等多种感染。
注:大多数由乳酸杆菌引起的疾病都发生在免疫功能低下的人或那些有糖尿病等易感病症的人身上。
乳杆菌在人体的位置及与人体的关系

Zafar H,et al.Genes (Basel).2020
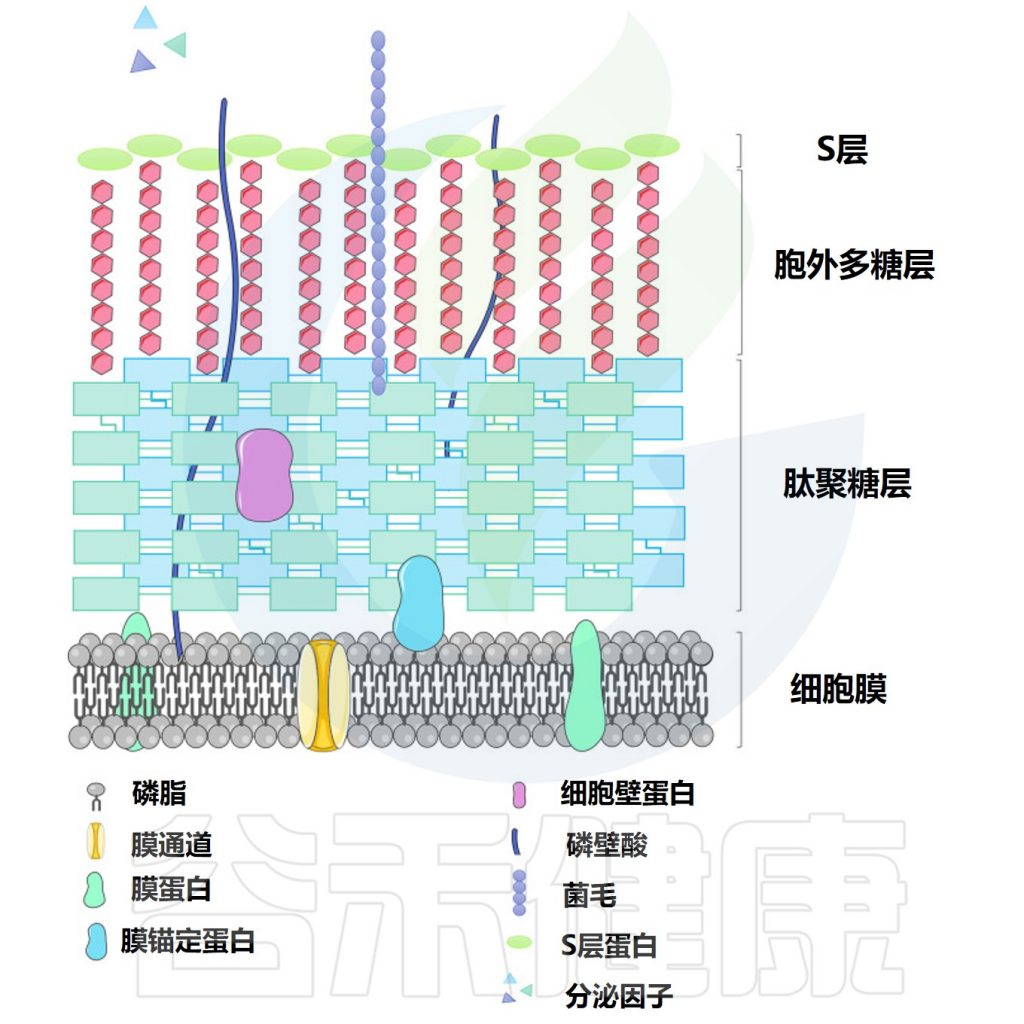
▸ 乳杆菌的表面活性分子
乳杆菌的益生菌特性被认为是由乳杆菌表面活性分子 (SAM) 贡献的。据报道,支持益生菌作用的表面活性分子包括肽聚糖、细菌多糖和磷壁酸等。
乳杆菌细胞表面结构

Dempsey E,et al.Front Immunol.2022
通常,乳杆菌的细胞质膜被肽聚糖和其他生物聚合物包围,即磷壁酸、S层蛋白和多糖。
• 肽聚糖
肽聚糖(PG)是一种生物聚合物,包含由N-乙酰氨基葡萄糖(GlcNAc)和N-乙酰胞壁酸(MurNAc)侧链连接的聚糖链,形成革兰氏阳性菌(如乳杆菌和双歧杆菌)的细胞表面。
改善宿主先天免疫
乳杆菌肽聚糖在改善宿主先天免疫反应方面表现出出色的免疫调节活性。例如,干酪乳杆菌(L.casei)肽聚糖能够通过toll样受体2和核苷酸结合寡聚化结构域2(NOD2)诱导小鼠腹腔巨噬细胞产生白细胞介素12。
此外,植物乳杆菌(L. plantarum CAU1055)肽聚糖通过抑制一氧化氮合酶、环氧合酶-2(COX-2)和细胞因子(TNF-α和白细胞介素-6),显示出改善小鼠巨噬细胞中一氧化氮诱导的炎症的能力。
• 脂磷壁酸
乳杆菌肽聚糖通常用磷壁酸或脂磷壁酸修饰。脂磷壁酸由磷酸甘油的聚合产生,并与细胞质膜结合。
调节宿主的信号通路
脂磷壁酸与其他表面活性分子一起调节宿主模式识别受体和宿主的几种信号通路,这些信号通路是乳杆菌的益生菌和抗病原体作用的原因。
植物乳杆菌脂磷壁酸显著抑制粪便大肠杆菌生物膜的形成,并在人类牙本质切片上形成生物膜,这表明脂磷壁酸可以作为粪便大肠杆菌感染的预防和治疗措施。
• 细菌多糖
细菌在细胞表面形成紧密连接的聚合物,并将其作为胞外多糖(EPS)(松散未附着的黏液)释放到环境中。
细菌分泌的胞外多糖对于宿主-微生物相互作用过程中的粘附和细胞识别至关重要。乳杆菌的胞外多糖还能抑制蜡样芽孢杆菌(Bacillus cereus)产生的细菌毒素。
▸ 影响乳杆菌的因素
乳杆菌对人体健康有着重要的作用。然而乳杆菌的数量和种类受到多种因素的影响,包括以下几方面:
饮食因素:饮食中富含益生元的食物,如蔬菜、水果、全麦面包等,可以促进乳杆菌的生长。相反,高脂肪、高糖、高盐等不健康的饮食习惯会抑制乳杆菌的生长。
药物因素:长期使用抗生素、非甾体抗炎药等药物会破坏肠道菌群平衡,抑制乳杆菌的生长。
生活方式因素:缺乏运动、长期处于压力状态等生活方式因素也会影响肠道菌群的平衡,抑制乳杆菌的生长。
年龄因素:婴幼儿期肠道菌群构成不稳定,乳杆菌数量较少,随着年龄的增长,乳杆菌数量逐渐增加。
综上所述,保持健康的饮食习惯、合理使用药物、积极的生活方式等都有助于促进乳杆菌的生长。
乳杆菌已被证明对改善胃肠道健康具有重要作用,本章节将具体展开讲述。
胃肠道粘膜是机体最大也是最关键的屏障部位之一,外来抗原、微生物和潜在病原体都在这里与宿主的免疫系统密切接触。
它是一种半透性屏障,允许吸收营养和免疫感应,同时限制潜在有害抗原或微生物的流入。
胃肠道屏障由四个主要元素组成:共生微生物群、粘液层——含有分泌型免疫球蛋白A(sIgA)和抗微生物肽、肠上皮细胞单层和肠道相关淋巴组织(GALT)构成胃肠道隔室中的各种免疫细胞群。
肠道屏障破坏与多种疾病相关
肠道屏障功能的丧失被认为是各种胃肠道疾病发病机制的早期事件,例如乳糜泻和炎症性肠病,以及包括I型糖尿病、肥胖症和多发性硬化症在内的全身性疾病。所以肠道屏障的完整性对于健康至关重要。
★ 乳杆菌可以增强肠道屏障
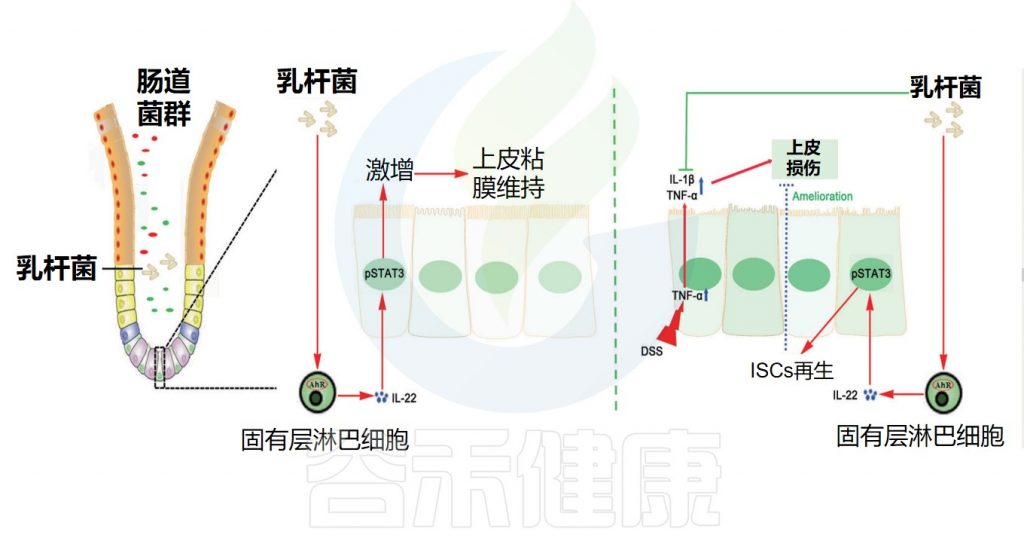
肠道屏障功能可以通过摄入非致病微生物来增强,这些微生物可以增强粘液层的物理屏障,增强对病原体的先天防御并降低肠上皮细胞的细胞旁通透性。
作为益生菌食用的乳杆菌被认为可以通过多种作用机制调节天然肠道微生物群并改善健康。如图所,益生菌通过增加粘液的产生、刺激抗微生物肽的释放和分泌性免疫球蛋白A的产生来增强肠道屏障功能,增加肠上皮细胞的紧密连接完整性并提供对病原体的抵抗力。
乳杆菌增强肠道屏障的机制
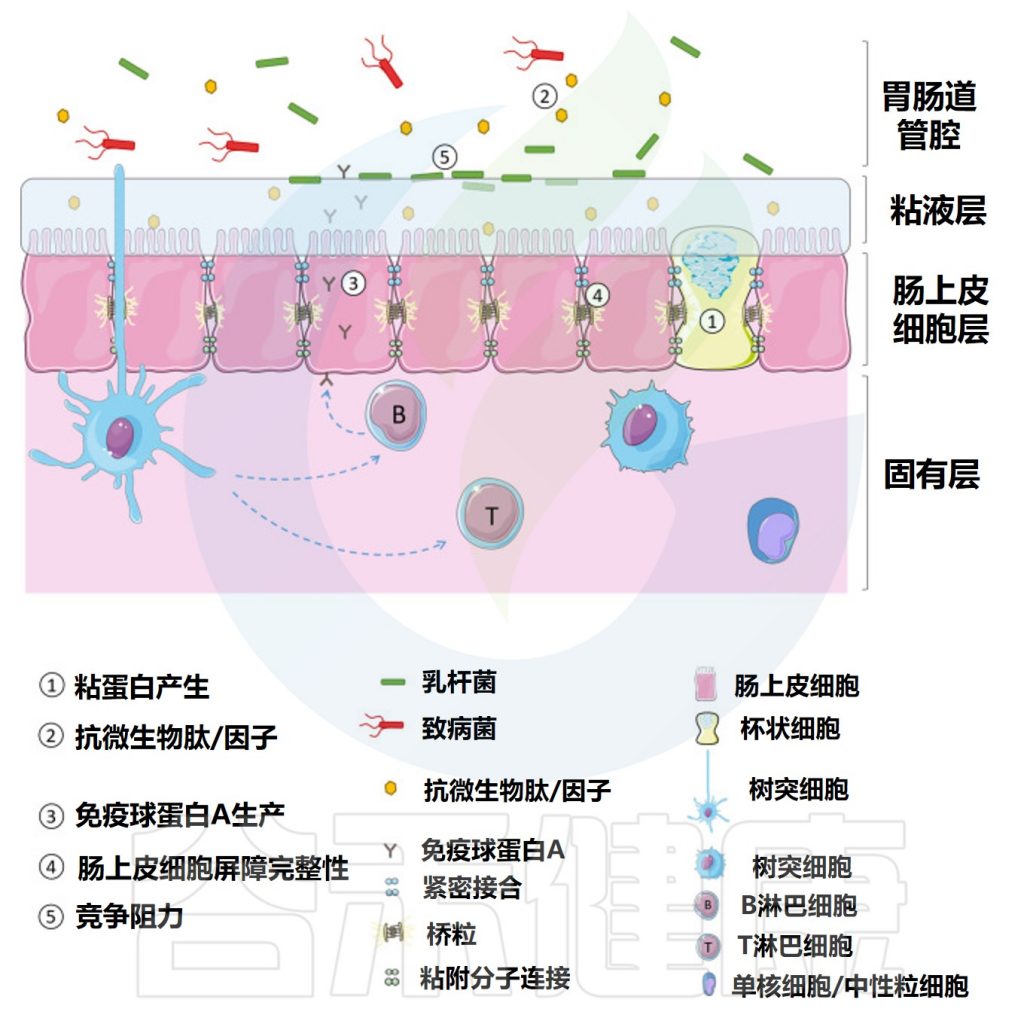

Dempsey E,et al.Front Immunol.2022
1 粘液分泌
胃肠道的杯状细胞表达杆状粘蛋白,这些粘蛋白要么粘附在上皮细胞上,要么释放到胃肠道腔中。这些粘蛋白高度糖基化并通过二硫键连接在一起形成糖蛋白基质,保护肠上皮免受肠腔内容物(含有消化酶)的影响,防止致病抗原/细菌与上皮单层之间的相互作用,并有助于胃肠道运动。
粘液层的厚度通常在50-800µm之间,在健康个体中,最靠近上皮表面的前30µm应该没有微生物。
乳杆菌通过促进粘液分泌增强胃肠道屏障
乳酸菌种被认为通过促进粘液分泌来增强肠道屏障防御。体外研究表明,来自干酪乳杆菌(L.casei T21)的条件培养基可以上调受到艰难梭菌攻击的结肠上皮细胞中的粘膜保护性基因。
在体内研究方面, L. rhamnosus CNCM I-3690 最近被证明可以保护或恢复杯状细胞种群并保护小鼠在低度结肠炎症后的粘液层厚度。
类似地,施用两种罗伊氏乳杆菌(L. reuteri R2LC 或4659)菌株之一并暴露于结肠炎的小鼠表现出降低的结肠炎严重程度,归因于给予益生菌的小鼠粘液厚度增加。
2 抗菌肽、抗菌因子
宿主产生的胃肠道抗菌肽通常分为导管素和防御素。抗菌肽可以被丁酸盐激活。
丁酸盐由肠道微生物群产生,但很少有研究检查益生菌对导管素表达的影响。
防御素进一步分为β-防御素,由整个肠道的上皮细胞产生,以及α-防御素,在小肠中表达。防御素在胃肠道中组成型表达,对许多细菌、真菌和一些病毒显示出抗微生物活性。
乳杆菌诱导抗菌肽表达
嗜酸乳杆菌(L. acidophilus PZ1138)和发酵乳杆菌(L. fermentum PZ1162)显示可通过促炎机制在细胞中诱导人β-防御素-2基因的表达。除了上调促炎介质外,给肉鸡施用罗伊氏乳杆菌(L.reuteri)还与盲肠和回肠中的抗菌肽调节相关。
除了宿主衍生的抗菌肽刺激外,共生细菌还产生抗菌因子以帮助宿主屏障防御。这些因素包括短链脂肪酸、过氧化氢和细菌素。
短链脂肪酸刺激紧密连接的形成
乳杆菌产生包括乙酸盐、丙酸盐和丁酸盐在内的短链脂肪酸,这些短链脂肪酸已被证明在体外通过抑制NLRP3炎症小体和自噬来增加跨上皮电阻并刺激肠上皮细胞中紧密连接的形成。
细菌素抑制或杀死其他细菌
细菌素是由多种细菌产生的核糖体合成的热稳定肽,其功能是抑制或杀死其他细菌的生长。
革兰氏阳性菌产生的细菌素通常通过破坏膜功能发挥其抗生素作用,通常针对其他革兰氏阳性菌,但一些革兰氏阴性菌也可能易感。
植物乳杆菌产生多种细菌素,这些细菌素对食源性病原体(如李斯特菌)和食品腐败菌具有抗微生物活性,可用于食品生产以减少化学防腐剂的使用。
3 免疫球蛋白A
免疫球蛋白A的产生是胃肠道在非炎症模式下产生免疫保护的重要方式。IgA二聚体(由位于淋巴结或固有层的肠道B细胞分泌)与上皮细胞基底外侧表面的受体相互作用,转移到上皮细胞表面并作为分泌型免疫球蛋白A(sIgA)释放。
分泌型免疫球蛋白A(sIgA)是一种非常重要的抗体分子,在人体抵抗疾病的第一道防线起决定性作用。
sIgA主要通过结合饮食抗原和粘液中的潜在病原体并下调共生细菌上促炎细菌表位的表达来促进肠道中合适的共生细菌群落的维持。
此外,sIgA通过阻断参与上皮粘附的微生物成分增强肠道屏障,促进上皮内防御病原体和微生物产物。
乳杆菌可以增加小肠中slgA水平
已知包括副干酪乳杆菌(L.paracasei MCC1849)、加氏乳杆菌(L.gasseri SBT2055)和植物乳杆菌在内的各种乳杆菌菌株可增加小肠中的sIgA水平。
在一项针对12至24个月大儿童的临床试验中,补充植物乳杆菌增加了sIgA粪便滴度,并且观察到这与TGF-β1/TNF-α比率之间存在显著正相关。
4 上皮细胞屏障
如前所述,肠上皮细胞形成单层细胞,充当肠腔外部环境和宿主免疫系统之间的物理屏障。该屏障的完整性由紧密连接确保,紧密连接是将细胞紧密结合在一起的多蛋白复合物以及粘附连接、间隙连接和桥粒。
紧密连接位于上皮细胞的顶端侧。它们由跨膜蛋白组成,这些蛋白在细胞外与邻近细胞中紧密连接的类似蛋白质相互作用,在细胞内通过封闭小带蛋白和丝状肌动蛋白与细胞自身的细胞骨架相互作用。
病原菌感染会破坏紧密紧密连接蛋白
在慢性炎症性疾病中观察到紧密连接完整性的丧失,在肠道病原体如艰难梭菌、大肠杆菌、鼠伤寒沙门氏菌、霍乱弧菌等的感染中观察到破坏紧密连接蛋白以突破胃肠道屏障的机制。
乳杆菌增强紧密连接蛋白和闭合蛋白表达
已证明鼠李糖乳杆菌上调Caco-2细胞中的紧密连接蛋白1(ZO-1)的表达。这种益生菌菌株可提高ZO-1的表达水平并增强闭合蛋白(claudin-1)的分布,作为对抗肠出血性大肠杆菌感染的保护机制。
使用各种植物乳杆菌菌株(L. plantarum WCSF1、L. plantarum CGMCC 1258和L. plantarum MB 452)也观察到紧密连接蛋白和闭合蛋白的表达增加。
乳杆菌增强肠上皮屏障保护作用

Hou Q,et al.Cell Death Differ.2018
增加E-钙粘蛋白表达,稳定粘附连接
乳杆菌还可以通过增加E-钙粘蛋白的表达,以及通过增强β-连环蛋白的磷酸化来加强E-钙粘蛋白/β-连环蛋白复合物(将粘附连接到细胞骨架)来稳定粘附连接。
钙黏蛋白E——又名上皮细胞钙粘素和CD324,是一种钙依赖性的细胞粘附分子。
在小肠屏障功能的临床研究中,活检样本表明植物乳杆菌(L. plantarum strain TIFN101)和较小程度上L. plantarum WCFS1和CIP104448调节紧密连接和粘附连接蛋白基因表达的增加。
5 竞争结合位点抵抗病原体
乳杆菌还通过竞争肠上皮细胞、粘液层中的糖蛋白或细胞外基质的纤溶酶原上的结合位点来帮助肠道屏障抵抗入侵病原体。
为了促进与宿主细胞的相互作用,乳杆菌属物种在其外表面展示各种不同的成分。这些可能包括细胞壁蛋白、S层蛋白、菌毛蛋白和月光蛋白。
这些表面蛋白促进乳杆菌与宿主的粘附,例如在几种乳杆菌菌株中发现的LPXTG蛋白是与肽聚糖层共价结合的细胞表面蛋白,可以结合粘液和上皮细胞。
通过阻断病原体与位点结合显示抗病毒活性
嗜酸乳杆菌(L. acidophilus ATCC)的S层蛋白通过阻断病原体与C型凝集素受体(DC-SIGN)的粘附而显示出抗病毒活性
C型凝集素受体(DC-SIGN)是一种强烈促进病毒感染的附着因子
如前文所述,乳杆菌通过促进粘液产生和屏障相关蛋白,分泌抗微生物物质(如短链脂肪酸、细菌素)抑制病原体的生长或杀死病原体,来保护肠道屏障免受感染,并通过调节宿主对病原体的免疫反应,防止病原体粘附和竞争结合位点。
★ 乳杆菌可以抑制病原菌感染
因此,乳杆菌能够预防某些细菌感染引起的肠道损伤。乳杆菌已被证明可以抑制病原菌感染的发展,例如艰难梭菌和产气荚膜梭菌、空肠弯曲杆菌、肠炎沙门氏菌、大肠杆菌、金黄色葡萄球菌和耶尔森氏菌等。
由感染引起的两种主要胃肠道疾病,幽门螺杆菌感染和抗生素相关性腹泻,已被证明可以极大地受益于乳杆菌,概述如下。
幽门螺杆菌感染与乳杆菌
幽门螺杆菌感染是世界上最常见的细菌感染之一,全球一半以上的人口受到感染。幽门螺杆菌感染胃的上皮细胞内壁,导致消化性溃疡病、慢性胃炎和胃癌等疾病。
许多感染者没有症状,20%的感染患者会出现胃炎症状、胃或十二指肠溃疡或非霍奇金胃淋巴瘤。
目前推荐的幽门螺杆菌感染治疗方法包括多种抗生素药物和质子泵抑制剂,但随着幽门螺杆菌抗生素耐药性的上升,这种治疗的有效性正在下降。
在各种随机对照试验中,添加乳杆菌(分别为干酪乳杆菌DN-114 001和干酪乳杆菌Shirota)和嗜酸乳杆菌后生元已被证明可以提高该疗法的疗效。
√使幽门螺杆菌活力丧失
来源于干酪乳杆菌(Lactobacillus caseistrain Shirota)的无细胞废培养上清液在体外表现出对幽门螺杆菌的杀菌活性。约氏乳杆菌(L. johnsonii NCC533)和嗜酸乳杆菌均导致幽门螺杆菌活力丧失。
此外,来自这三种乳杆菌菌株的培养物上清液导致幽门螺杆菌的形态改变为U形或球形体,这是细菌的休眠形式,而球形体定植和诱导炎症的能力较低。
已知约氏乳杆菌NCC 533和干酪乳杆菌Shirota也能产生对幽门螺杆菌有活性的细菌素。
√影响幽门螺杆菌运动
幽门螺杆菌是一种螺旋形细菌,具有多个鞭毛,使其能够在胃粘液层中游动并与上皮细胞相互作用,这是在胃中定植所需的能力。
干酪乳杆菌已被证明会导致幽门螺杆菌失去鞭毛运动,这是由于其转化为没有鞭毛的休眠形式,以及通过分泌抑制游泳能力的小型抗微生物化合物。
类似地,约氏乳杆菌(L. johnsonii NCC533)也分泌抑制幽门螺杆菌游泳能力的化合物。
√阻止幽门螺杆菌粘附
为了在胃的低pH中生存,幽门螺杆菌将脲酶表达为一种表面蛋白,以中和周围的酸性环境。嗜酸乳杆菌和约氏乳杆菌的培养物上清液已被证明可降低幽门螺杆菌的脲酶活性。
就粘附性而言,嗜酸乳杆菌阻止了幽门螺杆菌粘附到人HT-29细胞上,导致粘附细胞死亡,并降低了导致其裂解的剩余粘附细胞的脲酶活性。
HT-29细胞——人结直肠腺癌细胞
抗生素相关性腹泻与乳杆菌
抗生素相关性腹泻 (AAD) 是由抗生素破坏肠道正常微生物群引起的,其症状从轻度腹泻到更严重的疾病,如伪膜性结肠炎 (PMC) 。
抗生素相关性腹泻发生在5-30%接受抗生素治疗的患者中,无论是在抗生素治疗期间还是在治疗停止后长达2个月内。
与抗生素相关性腹泻相关的主要病原体之一是艰难梭菌,它导致10-30%的轻症病例和90-100%的重症病例。
注:尽管产气荚膜梭菌、金黄色葡萄球菌和催产克雷伯氏菌等其他微生物与这种疾病有关,但它们并不常见。
√乳杆菌治疗是预防抗生素相关性腹泻的有效措施
虽然在这种情况下益生菌的作用机制尚不清楚,但它们的功效似乎是维持肠道菌群、战胜病原菌、保护肠道屏障功能和潜在的免疫调节。用包括鼠李糖乳杆菌和格氏乳杆菌(L. gasseri)在内的几种乳杆菌菌株治疗已被证明是治疗抗生素相关性腹泻的有效预防措施。
一项分析总结了51项随机对照试验,发现鼠李糖乳杆菌比其他益生菌更有效,但干酪乳杆菌对艰难梭菌感染最有效。另一项研究显示了类似的结果,得出结论认为安全地给予鼠李糖乳杆菌以预防抗生素相关性腹泻并另外控制急性胃肠炎的症状。
前文中有提到乳杆菌在宿主的胃肠道中发挥免疫作用,可增强肠道屏障并保护免受潜在病原体的侵害。
✦乳杆菌的免疫调节作用
乳杆菌的免疫调节作用是通过释放细胞因子实现的,包括白介素、肿瘤坏死因子、干扰素、转化生长因子和来自免疫细胞的趋化因子。
炎症过程取决于促炎细胞因子与抗炎细胞因子,益生菌可以通过这种方式以免疫调节或免疫刺激的方式发挥作用。
降低炎症反应
免疫调节益生菌可降低炎症反应,保护宿主免受自身免疫性疾病、炎症性肠病和过敏的侵害,其特点是产生白细胞介素-10和调节性T细胞。
白细胞介素-10是由单核细胞、T细胞、B细胞、巨噬细胞、NK细胞产生的抗炎细胞因子,可抑制促炎细胞因子、趋化因子和趋化因子受体,从而防止肠道炎症。
免疫刺激性益生菌通过产生白细胞介素-12来激活NK细胞和发育Th1细胞,保护宿主免受感染和癌症发展,并通过平衡Th1和Th2的产生来保护宿主免受过敏。
越来越多的证据表明,乳杆菌有可能预防或治疗某些炎症性疾病:
下调白细胞介素12的产生
L.casei Shirota、L.johnsonii JCM 2012 和L.plantarum ATCC 14917的肽聚糖已被证明可通过Toll样受体2下调白细胞介素-12的产生。
增强了免疫反应
来自鼠李糖乳杆菌(L.rhamnosus CRL1505)的肽聚糖在小鼠鼻腔给药时表现出先天性和适应性免疫反应的增强,改善了Th2型免疫反应。
引发抗炎反应
植物乳杆菌的脂磷壁酸已被显示通过抑制 白细胞介素-8在人和猪肠上皮细胞中引发抗炎反应。
鼠李糖乳杆菌的菌毛的敲除突变体表明,这些菌毛不仅对粘附至关重要,而且具有免疫调节作用。
在小鼠中,源自德氏乳杆菌保加利亚亚种发酵酸奶的胞外多糖具有免疫刺激作用,激活自然杀伤细胞并诱导脾脏产生γ干扰素。
✦乳杆菌代谢物的免疫调剂作用
短链脂肪酸的抗炎作用
一些免疫调节作用是由乳杆菌的代谢物介导的,例如短链脂肪酸,特别是丙酸盐、乙酸盐和丁酸盐。这些后生元与肠上皮细胞上的特定受体结合,以抑制嗜中性粒细胞和巨噬细胞的促炎活性和Treg抑制作用。
丁酸盐灌肠剂已被证明有效并成为转移性结肠炎的公认治疗方法,尽管这被认为是由于对平滑肌的松弛作用。
减少氧化应激作用
乳酸杆菌还能够产生抗氧化剂,如谷胱甘肽 (GSH),并能减少氧化应激。在结肠炎大鼠模型中,保加利亚乳杆菌的两个菌株已被证明可以减少脂质过氧化,增加抗氧化酶的测量值,并减少氧化应激。
在胃损伤小鼠模型中,发酵乳杆菌(L.fermentum Suo)显著降低了丙二醛(一种氧化损伤的量度)浓度和IL-6、IL-12、TNF-α 和IFN-γ的血清浓度。
在健康的人类受试者中,干酪乳杆菌与益生元菊粉一起服用,显著降低了丙二醛和谷胱甘肽二硫化物(另一种氧化测量)的浓度,并增加了抗氧化指标的浓度。
✦分泌蛋白化合物调节免疫
乳杆菌还可以通过分泌蛋白质化合物来调节免疫系统。从鼠李糖乳杆菌(L. rhamnosus GG ATCC 53103)释放的蛋白质p40和p75都激活了Akt信号通路,抑制了肿瘤坏死因子诱导的人和小鼠结肠上皮细胞和小鼠结肠外植体细胞凋亡。
减少炎症损伤
在诱导小鼠结肠炎之前用鼠李糖乳杆菌进行预处理可显著减少结肠炎症和损伤,抑制细胞因子诱导的细胞凋亡并减少过氧化氢诱导的紧密连接破坏。
在鼠李糖乳中发现的两种可溶性蛋白质p40和p75的消耗消除了这些抗炎作用。鼠李糖乳杆菌通过分泌可溶性肽增加小鼠结肠细胞中热休克蛋白HSP25和 HSP72 的产生,这些肽通过激活MAPK信号转导途径发挥作用。
乳杆菌属不仅在人体肠道健康中起着重要作用,在女性阴道健康与相关疾病中的作用也不容忽视。
阴道微生物组在人类阴道健康方面起着重要作用。使用高通量宏基因组和16S rRNA测序,已在人类阴道中鉴定出超过250种细菌。
其中,乳杆菌是健康阴道中最常检测到的微生物,包括卷曲乳杆菌、惰性乳杆菌、詹氏乳杆菌和格氏乳杆菌。
几十年来,乳杆菌通过产生有机酸、细菌素和其他抗菌化合物来防止病原体入侵,被认为对阴道生态有益。
健康阴道中主要乳杆菌的相对丰度决定了细菌群落群的类型,称为群落状态类型(CST)。群落状态类型分为CST I、II、III、IV、V五种。
每个群落均由卷曲乳杆菌(L. crispatus)、加氏乳杆菌(L. gasseri)、惰性乳杆菌(L. iners)、包括乳杆菌和细菌性阴道病相关细菌(BVAB)在内的多种微生物群落占主导地位。
✦阴道微生物群会随时间和外因变化
人类阴道微生物群组成在不同的生命阶段会发生变化,包括婴儿、青春期、怀孕和更年期。
荷尔蒙的变化、抗生素的不受控制的使用、月经和阴道冲洗是导致人类阴道微生物群暂时变化的常见因素。
阴道生态系统破坏的特征是乳杆菌种类的枯竭和非乳杆菌微生物的过度生长。通常,厌氧菌的过度生长会导致异常情况,例如细菌性阴道病以及妊娠相关并发症。
与肠道菌群相比,健康个体阴道微生物环境的一个典型特征是较低的细菌多样性。阴道生态失调的定义是细菌多样性高和厌氧菌混合,通常与多种妇科疾病有关。
惰性乳杆菌(L. iners)存在于健康女性的阴道中,或者存在于阴道生态失调的女性中,例如细菌性阴道病,甚至在接受抗菌治疗的女性中。
▷乳杆菌的丰度与阴道健康有关
许多研究报告说,卷曲乳杆菌(L. crispatus)在阴道中的存在与身体健康有关,而以惰性乳杆菌(L. iners)为主的群落无法提供足够的保护以防止阴道生态失调。
惰性乳杆菌与炎症反应有关
惰性乳杆菌的存在与较高水平的促炎因子有关,例如白细胞介素-1α、白细胞介素-18、巨噬细胞迁移抑制因子和肿瘤坏死因子,它们负责激活阴道中的炎症反应。
惰性乳杆菌甚至被认为在阴道生态失调中起作用,尽管惰性乳杆菌的确切作用仍有争议。然而,惰性乳杆菌的丰度似乎保持相对恒定,惰性乳杆菌不易被病原体或感染条件取代。
惰性乳杆菌在各种条件下的卓越生存能力表明该物种可能是宿主防御的重要成员,并且可能是一种持久的共生乳杆菌可以维持和恢复阴道微生物组的物种。
细菌性阴道病是育龄妇女最常见的阴道炎类型。它的特点是乳杆菌种类显著减少或消失,伴随着以厌氧和兼性厌氧细菌为主的更多样化的微生物群的出现,例如加德纳菌属、普雷沃氏菌属和阴道曲霉。
注:惰性乳杆菌通常是唯一可以在细菌性阴道病期间检测到的与细菌性阴道病相关细菌共存的阴道乳杆菌。由于其能够响应和调节其基因组功能,它可以在细菌性阴道病急剧变化的阴道环境下持续存在。
▷惰性乳杆菌作为微生物指标
由于惰性乳杆菌在细菌性阴道病中共存,惰性乳杆菌的流行可以作为预测细菌性阴道病发病或中期状态的微生物指标。
此外,惰性乳杆菌对甲硝唑具有抗性,即使在用甲硝唑处理后也是阴道中主要的乳杆菌属物种。惰性乳杆菌显示出更强的竞争优势并共存于被破坏的微生物组中。
因此,惰性乳杆菌的持久性可能会导致长期的阴道生态失调,尤其是在重复治疗周期后。需要进一步的研究来阐明该物种是否只是阴道微生物群转变的生物标志物或细菌性阴道病的促成因素。
尽管如此,最近的一项研究发现了一种名为副格氏乳杆菌(Lactobacillus paragasseri)的人类肠道菌株产生的三种细菌素活性肽。
这些细菌素对惰性乳杆菌具有很强的选择性抑制活性,而卷曲乳杆菌(L. crispatus)、加氏乳杆菌(L. gasseri)和詹氏乳杆菌(L. jensenii)仅受到轻微抑制,表明这些乳杆菌衍生的惰性乳杆菌有效抑制剂可以与甲硝唑联合使用,以改善目前的治疗
▷抗生素和乳杆菌组合可显著降低复发率
传统的治疗方法是使用甲硝唑等抗生素。事实上,口服甲硝唑治疗后的复发率非常高,全身使用抗生素有很大的副作用。在这种情况下,急需新的治疗策略。
益生菌的使用可以改善阴道菌群,增加有益菌,减少有害菌的数量,进一步维持阴道菌群环境的稳定。如今,越来越多的证据表明益生菌可有效治疗 细菌性阴道病。
在对30项研究的荟萃分析中,发现益生菌干预降低了复发率,提高了治愈率。
在另一项荟萃分析中,发现与单独使用抗生素相比,抗生素和益生菌的组合使用可显著降低细菌性阴道病的复发率。
乳杆菌在治疗细菌性阴道病的临床研究


Mei Z,et al.Front Cell Infect Microbiol.2022
生物膜是紧密附着在细菌表面的结构,已知它们比一般细胞对宿主免疫反应和抗生素治疗更具抵抗力。
▷生物膜与阴道感染相关
已经表明,阴道上皮细胞上的生物膜形成与阴道感染密切相关。有足够的证据表明细菌性阴道病与多种微生物生物膜的存在有关。
据推测,加德纳菌属(Gardnerella spp.)启动了生物膜的形成,这支持其他细菌性阴道病相关细菌(BVAB)附着在阴道上皮上,进一步增强了生物膜厚度。
此外,加德纳菌生物膜是抗生素的屏障,通过阻止抗生素的渗透来保护其他其他细菌性阴道病相关细菌。人们普遍认为,细菌性阴道病的高复发率是由于生物膜的形成,生物膜可以保护细菌免受抗生素治疗。
▷乳杆菌可以在一定程度上清除生物膜
先前的研究使用了乳杆菌,试图清除多微生物生物膜,并抑制人类阴道中的感染。
据报道,植物乳杆菌可显著降低HT-29细胞系中大肠杆菌、鼠伤寒沙门氏菌、金黄色葡萄球菌和铜绿假单胞菌的粘附,这使其成为治疗细菌性阴道病的潜在抗生物膜剂。
卷曲乳杆菌(L.crispatus)大大降低了来自健康女性和患有细菌性阴道病女性的阴道加特纳菌(G.vaginalis)对宫颈上皮细胞的粘附。
需要注意的是,惰性乳酸杆菌(L. iners)显著降低了健康女性阴道加特纳菌的粘附力,但增强了致病性阴道加特纳菌的粘附。表明惰性乳酸杆菌可以与细菌性阴道病相关的加特纳菌共存,并可能有助于阴道加特纳菌主导的生物膜形成。
进一步了解阴道共生乳杆菌与生物膜的结构和功能之间的相互作用,对于确定生物膜相关感染的新治疗方法至关重要。
宫颈癌是女性生殖道的恶性肿瘤,每年约有30万人死于宫颈癌。
▷感染人乳头瘤病毒后破坏阴道微生态
感染人乳头瘤病毒(HPV)后,可破坏阴道微生态平衡,使乳杆菌数量减少,增加异常菌群的粘附定植。这进一步导致人乳头瘤病毒蛋白表达上调,促进宫颈上皮内瘤变(CIN)的发展,甚至导致宫颈癌的发生。
研究发现HPV阳性女性的阴道细菌多样性更为复杂,阴道微生物群的组成也不同。持续的高危型HPV感染和宫颈微环境的改变加快了宫颈癌前病变的发生发展。
▷乳杆菌对抵抗宫颈癌具有抵抗作用
一项研究首次证明口服卷曲乳杆菌(Lactobacillus curlicus)可以改变阴道群落状态类型并增加HPV清除率。
乳杆菌作为一种阴道益生菌,不仅可以酸化阴道环境,稳定阴道菌群,增强阴道上皮细胞功能,还可以杀灭宫颈癌细胞。增加益生菌摄入量与减缓癌症进展之间存在重要联系。
乳酸菌激活免疫系统,通过分泌多种抗肿瘤代谢物,包括磷酸化多糖和细胞外多糖,抑制恶性肿瘤的增殖。
抑制癌细胞增殖
乳杆菌吸附并占据阴道上皮,防止引起恶性肿瘤的侵袭性病原菌的粘附。乳酸菌可以通过分泌肽聚糖和胞外多糖来抑制癌细胞增殖。
促进细胞因子产生
乳杆菌主要是增强机体的免疫过程,促进细胞因子的产生,抑制单核细胞的增殖。最近的研究表明,乳杆菌如干酪乳杆菌和鼠李糖乳杆菌通过激活自然杀伤细胞和树突状细胞的成熟发挥抗癌作用。
影响体液免疫和细胞免疫
乳杆菌还能影响细胞免疫和体液免疫,促进胸腺源性细胞的增殖和分化,进一步促进骨髓源性细胞的免疫识别和增殖。
对宫颈癌细胞具有细胞毒性
此外,乳杆菌代谢物对宫颈癌细胞也有细胞毒作用。乳酸杆菌的增加属与高危亚型HPV感染、宫颈上皮内瘤变和癌检出率下降有关。
微生物群在癌症的治疗中发挥着越来越重要的作用。乳酸菌作为一种很有前途的非化疗替代疗法,在恢复和维持正常阴道菌群和治疗宫颈癌方面引起了广泛关注。下面总结了一些乳杆菌对宫颈癌细胞的作用:
乳杆菌在宫颈癌中的作用研究


编辑
Mei Z,et al.Front Cell Infect Microbiol.2022
月经周期是扰乱阴道微生物组多样性的最重要因素之一。卷曲乳杆菌(L.crispatus)通常在育龄妇女的阴道中占据主导地位,而惰性乳杆菌(L.iners)在月经周期期间过度生长并取代卷曲乳杆菌。
▷月经期间阴道微生物变化显著
最近的一项研究报告说,惰性乳杆菌(L.iners)是卵泡期最常见的微生物;惰性乳杆菌和CST IV类型(微生物多样性)在排卵期占主导地位;在黄体期,最常见的类型也是CST IV。
事实上,惰性乳杆菌的丰度在月经期间显著增加,通常与阴道加特纳菌或阴道阿托波氏菌(Atopobium vaginae)的增加有关;然而,在没有干预的情况下,它们随后会在月经后减少。
▷感染人乳头瘤病毒后破坏阴道微生态
由于阴道微生物的动态变化,在同一个体月经周期的不同时间具有不同特征,因此月经周期的采样时刻对于阴道群落分析非常重要。
在怀孕期间保持阴道微生物群中乳杆菌的自然和健康平衡尤为重要。早期的研究证实,怀孕期间阴道中的高雌二醇水平和随之而来的高糖原水平会导致阴道酸化更强,从而随着妊娠的进展促进乳杆菌属的流行。
▷怀孕期间阴道微生物可能存在失调
许多研究表明,以惰性乳杆菌(L.iners)为主的阴道微生物组在怀孕期间更有可能转向生态失调。研究发现,在健康孕妇的孕中期和孕晚期,惰性乳杆菌的丰度显著下降,而卷曲乳杆菌(L.crispatus)的丰度在孕中期与孕早期相比有所增加。
▷乳杆菌丰度与早产直接存在关联
越来越多的证据表明细菌性阴道病是导致不良妊娠结局的主要原因之一,尤其是早产。惰性乳杆菌占主导地位的阴道微生物组,被推测是早产的危险因素。
怀孕早期健康女性的阴道涂片中检测到的惰性乳杆菌可能与早产有关。一项研究报告称,在妊娠16周时,由惰性乳杆菌主导的阴道微生物组是短宫颈和早产(<34周)的一个风险因素。
在更具种族多样性的队列中,卷曲乳杆菌的主导地位对早产具有保护作用。来自不同国家的最新研究也表明,乳杆菌与早产发病率增加之间存在显著关联。


先前的研究报告称,在体外受精辅助生殖失败的患者中,高达40%的患者有异常的生殖道微生物组。
阴道生态失调,包括pH值升高、菌群多样性增加、细菌性阴道病、外阴阴道念珠菌病和滴虫性阴道炎,被认为是不孕的危险因素。
▷惰性乳杆菌丰度与不孕相关
一项研究报告称,惰性乳杆菌的丰度与不孕率的增加有关。最近还报道了以惰性乳杆菌为主的阴道微生物组与输卵管性不孕症和沙眼衣原体感染有关。人们认为,以惰性乳杆菌(L. iners)为主的阴道微生物组是怀孕的不利因素。
乳杆菌属作为人体数量最多的细菌之一,不仅仅只是影响了肠道和阴道健康,在全身其他疾病中也有一定作用。
特应性皮炎(AD)是一种慢性炎症性皮肤病,患者经常会因并发过敏性疾病而出现并发症。
尽管特应性皮炎的发病机制尚不清楚,但数十年的研究表明,特应性皮炎的发病机制可能与遗传因素、环境暴露、皮肤屏障受损、免疫功能异常和微生物失衡有关。
•乳杆菌在预防和治疗特应性皮炎中发挥作用
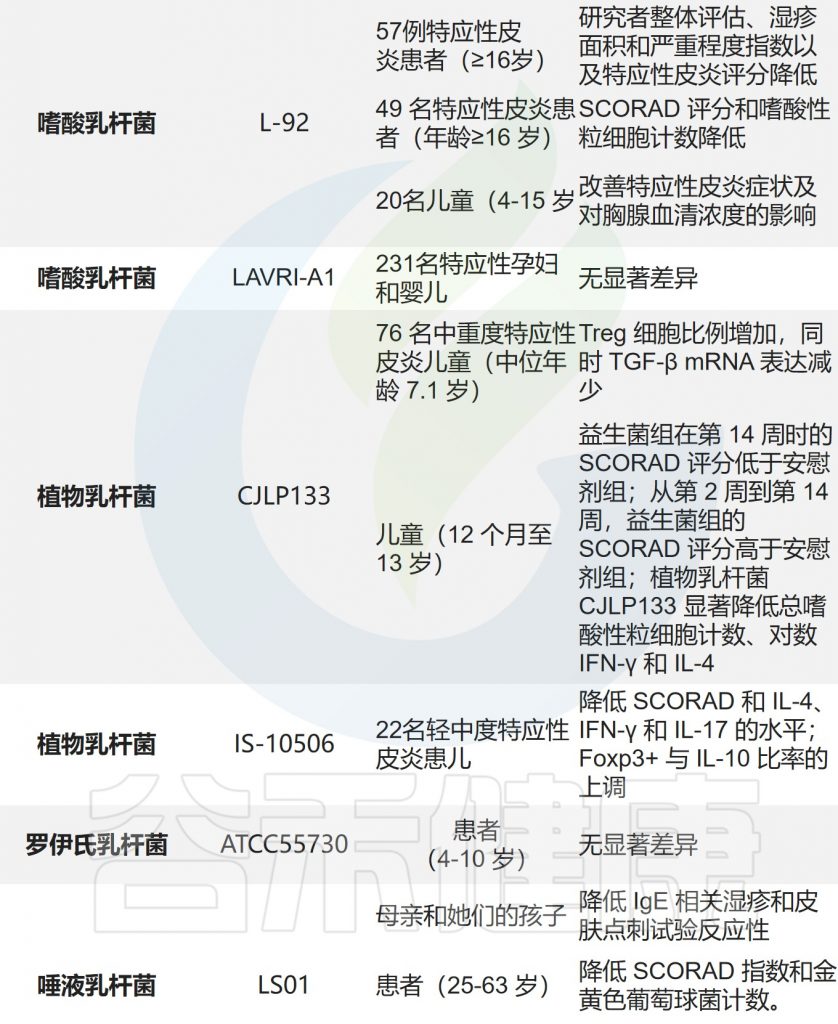
肠道在免疫反应中起着重要作用。乳杆菌是应用最广泛的益生菌。已经研究了几种乳杆菌用特应性皮炎预防和治疗。
乳杆菌通过对致病菌的竞争性排斥和抗菌活性,刺激先天免疫,促进微生物群落平衡。
据报道,这些乳杆菌可以产生多种物质,如有机酸、过氧化氢、低分子量抗菌剂、细菌素和粘附抑制剂。
乳杆菌的给药降低了免疫球蛋白E(IgE)的血清水平,并实现了Th1/Th2的平衡。乳杆菌加速免疫系统的成熟,维持肠道稳态,改善肠道微生物群,最终改善特应性皮炎症状。
用于治疗和预防特应性皮炎的乳杆菌


Xie A,et al.Front Cell Infect Microbiol.2023
肠道屏障、免疫功能和皮肤屏障在给予乳杆菌后得到了改善。下面列出了一些乳杆菌的作用机制。乳杆菌对患有特应性皮炎的动物和人类都显示出一定的作用。
乳杆菌治疗特应性皮炎的作用





编辑
Xie A,et al.Front Cell Infect Microbiol.2023
肠道微生物群在调节影响全身健康的宿主代谢中起着关键作用。迄今为止,多项研究证实了微生物群与宿主相互作用、调节免疫、控制稳态环境和维持全身状况。
据报道,植物乳杆菌(L. plantarum)具有将亚油酸转化为共轭亚油酸的潜力。根据分子和化学结构,乳杆菌通过多不饱和脂肪酸过程产生的代谢物为10-羟基-顺式-12-十八烯酸(HYA)、10-羟基-十八烯酸(HYB)、10-羟基-反式-11-十八烯酸 (HYC)、10-氧代-顺式-12-十八碳烯酸(KetoA)、10-氧代-十八烷酸(KetoB)和10-氧代-反式 -11-十八碳烯酸 KetoC )。
•乳杆菌代谢物有益于牙周稳态
乳杆菌衍生的生物活性代谢物能带来牙周稳态。HYA和KetoC具有抗氧化、抗炎、抗菌和上皮屏障连接改善剂的作用。
乳杆菌的生物活性代谢物有助于牙周稳态
Sulijaya B,et al.Molecules.2020
• 乳杆菌也可能引起龋齿
虽然链球菌家族细菌(例如变形链球菌)是蛀牙的最常见原因,其他种类的微生物也会引起龋齿。例如,一些乳杆菌属物种与龋齿病例有关。乳酸具有腐蚀牙齿的能力,唾液中的乳杆菌数多年来一直被用作“龋齿测试”。
这是支持在牙膏中使用氟化物的论据之一。乳杆菌的特征是导致现有的龋齿病变进展,尤其是那些在冠状龋齿中的病变。
然而,这个问题很复杂,因为最近的研究表明益生菌可以让有益的乳酸杆菌在牙齿上生长,防止链球菌病原体占据并导致蛀牙。
乳酸菌与口腔健康相关的科学研究是一个新领域,目前发表的研究和结果还很少,需要更多研究。
呼吸道感染是世界上发病率和死亡率最高的疾病之一。尽管许多呼吸道感染具有轻微和自限性,但它们每年在全世界造成400万人死亡。
最近几年严重急性呼吸系统综合症冠状病毒2(也称新型冠状病毒) 在全球肆虐。许多呼吸道病原体没有有效的疫苗,耐药微生物的增加使得呼吸道感染的有效治疗极具挑战性。因此,找到一种安全有效的方法来降低呼吸道感染的风险是很重要的。
•乳杆菌通过肠肺轴影响呼吸系统健康
近年来,许多研究报道肠和肺之间存在串扰,这种被描述为肠-肺轴的联系似乎是双向的 。口服一些益生菌,尤其是乳杆菌,可以通过肠肺轴促进呼吸系统健康。
乳酸杆菌通过肠肺轴调节呼吸免疫的潜在机制
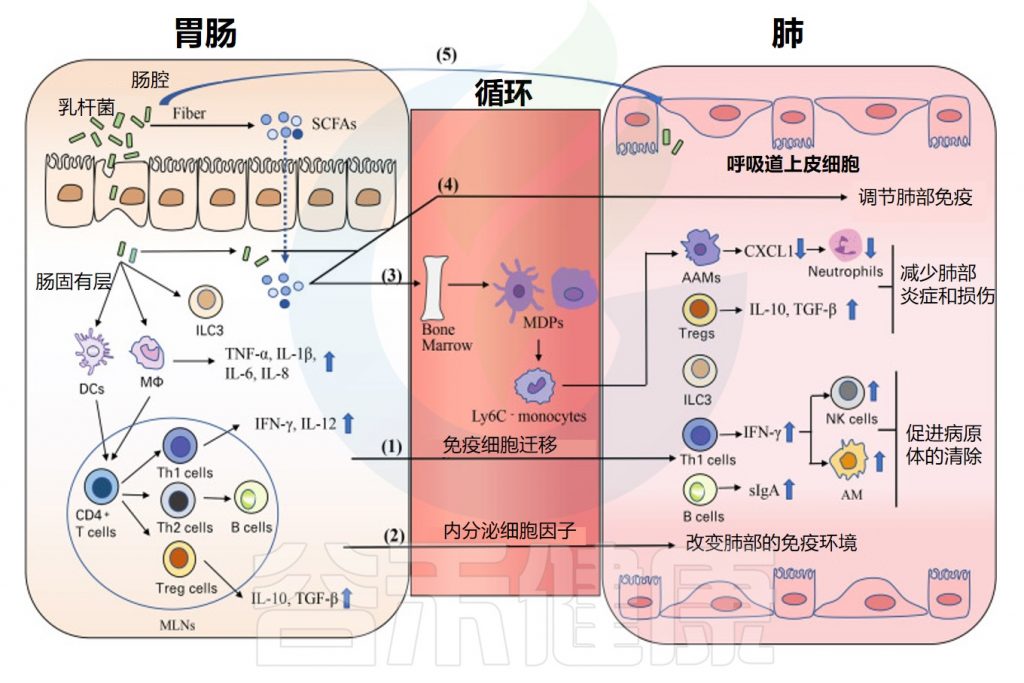

Du T,et al.Front Immunol.2022
最近,乳杆菌已被用于对抗各种呼吸道感染,包括病毒和细菌感染。许多乳杆菌显示可以预防流感病毒感染,包括以下菌株:
L. rhamnosus GG、
L.casei Shirota、
L. plantarum DK119、
L. paracasei MCC1849、
L. gasseri SBT2055、
L. fermentum CJl-112、
L. kunkeei YB38。
此外,乳酸菌由于其安全性和生物技术优势,作为疫苗或佐剂在预防流感病毒感染方面也具有出色的作用。
值得注意的是,补充相同乳杆菌菌株(如鼠李糖乳杆菌CRL1505)的活菌和灭活菌通常具有相似的效果, 表明活力对于乳酸菌达到保护性免疫调节作用不是必需的。
下面是一些通过施用乳杆菌来预防细菌或病毒性呼吸道感染的研究:
乳杆菌预防细菌和病毒性呼吸道感染的研究






Du T,et al.Front Immunol.2022
系统性红斑狼疮是一种慢性自身免疫性疾病,影响大约一半患者的肾脏。狼疮性肾炎(LN)是系统性红斑狼疮发病和死亡的重要危险因素。
狼疮性肾炎与肠壁充血、代谢性酸中毒、频繁使用抗生素有关,所有这些都会对肠道紧密连接产生影响,并导致穿过肠道屏障的细菌代谢产物增加。此外,胃肠道尿素输出增加导致肠道微生物失调。
•乳杆菌混合物有助于恢复黏膜屏障减少肾脏病变
研究发现,5种乳杆菌的混合物(Lactobacillus oris、Lactobacillus rhamnosus、Lactobacillus reuteri、Lactobacillus johnsonii和Lactobacillus gasseri) 通过增加调节性T细胞和抑制致病性Th17细胞来恢复粘膜屏障功能并减少肾脏病变。
表明乳杆菌和乳杆菌衍生的生物活性代谢物在治疗系统性红斑狼疮中具有潜在有益功能。
乳杆菌及其代谢物在系统性红斑狼疮中的有益作用


Wang W,et al.Front Immunol.2022

doi.org/10.1016/j.foodres.2022.111809
乳杆菌在人体健康以及一些疾病中起着重要的作用,作为人体不可缺少的一种细菌,我们应该如何补充呢?以下是一些补充乳杆菌的方法:
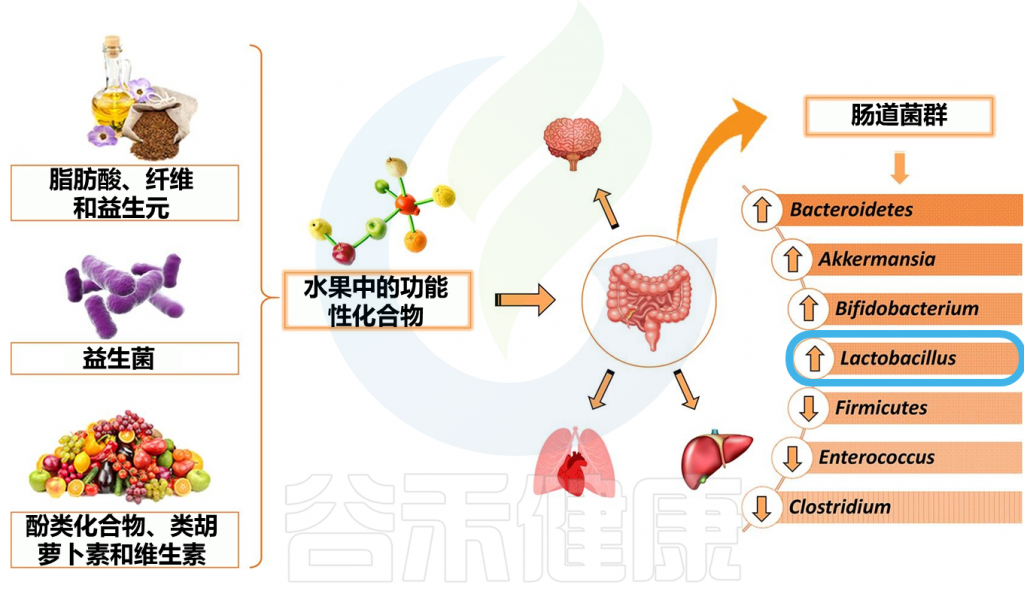
常见水果
水果中的生物活性物质,包括如胡萝卜素、多酚化合物、维生素和纤维素等,富含这些生物活性物质的水果如香蕉、木莓(树莓)、苹果、芒果、柠檬、石榴、木瓜、猕猴桃等,可以促进乳杆菌属的生长。


食用发酵食品
酸奶、奶酪、酸菜、泡菜、开菲尔、味噌、豆豉等发酵食品中含有丰富的乳杆菌,可以通过食用这些食品来补充乳杆菌。
益生菌
市面上有很多乳杆菌制剂,如乳杆菌素、乳酸菌片等,可以通过口服来补充乳杆菌。
由于补充剂含有不同数量的细菌,因此请阅读包装上的说明。根据补充剂中微生物的数量适量补充。
如果正在服用抗生素,请在抗生素服用2小时之前或者2小时之后服用乳杆菌制剂。
益生元
益生元是一种可以促进肠道内有益菌生长的物质,可以通过食用含有益生元的食品来促进乳杆菌的生长。例如低聚半乳糖(GOS)、低聚果糖(FOS)和母乳低聚糖(HMO)等。
从牛蒡中提取的菊粉促进了有益细菌的生长。菊粉显着增加了小鼠中的乳酸杆菌和双歧杆菌。
将龙舌兰中菊粉等果聚糖添加到正常小鼠饮食中,发现小鼠体内乳酸菌、双歧杆菌数量增加。
全麦谷物可以增加双歧杆菌和乳酸杆菌的相对数量。
一项临床试验(NCT02227602),10名参与者连续8周每天服用200-400克芒果果肉,显著增加乳杆菌、植物乳杆菌、罗伊氏乳杆菌和乳酸乳杆菌的丰度。
还包括其他一些常见食物,例如大蒜、洋葱、韭菜、芦笋、全谷物等,都有助于促进肠道中乳杆菌的生长。


合生元
一项临床试验(NCT 编号:03123510),20 名受试者在接受合生元3个月后,乳杆菌和双歧杆菌显著增加。
注:该研究中的合生元:益生菌成分含有嗜酸乳杆菌DDS-1、乳酸双歧杆菌UABla-12、长双歧杆菌UABl-14和两歧双歧杆菌UABb-10的专利菌株的混合物,益生元成分是一种反式低聚半乳糖混合物。
其他补充剂
乳清和豌豆蛋白的摄入可以增加双歧杆菌和乳酸杆菌的丰度。
灵芝孢子油具有很强的免疫增强活性,有助于肠乳杆菌丰度升高。
绿茶与异麦芽低聚糖联合使用,通过预防小鼠肠道生态失调来对抗高脂肪饮食诱导的代谢改变,双歧杆菌、乳杆菌、罗氏菌属丰度升高。
补充维生素A、维生素C都可以使乳酸杆菌增加。
姜黄素、白藜芦醇、杏仁/杏仁皮可以增加乳酸杆菌。
膳食褐藻糖胶可以增加乳酸杆菌和瘤胃球菌科的丰度。
补充2周葡萄多酚显著提高了断奶后小鼠的乳酸杆菌和Akkermansia的丰度。


中医
对溃疡性结肠炎的患者应用益阳愈溃汤结合针刺治疗,对照组仅给予益阳愈溃汤,治疗后实验组双歧杆菌、乳酸杆菌等均高于对照组。
在连续给药3周后,黄芩促进大鼠结肠的乳酸菌的生长。栀子对乳酸菌双向调节。
黄柏对大鼠肠道乳酸菌的影响:整体表现为促进。
黄连提取物显著促进乳酸菌、双歧杆菌的生长。
吴茱萸碱(EVO)是从吴茱萸中分离出的喹诺酮类生物碱,通过增加嗜酸乳杆菌水平和乙酸盐产生对溃疡性结肠炎具有治疗效果。
山药多糖灌胃健康小鼠一段时间后,发现小鼠盲结肠内的双歧杆菌、乳酸菌均增殖。
马齿苋多糖可使衰老小鼠肠道双歧杆菌及乳酸杆菌数量增加。
蒲公英多糖、黄芪多糖能改善小鼠菌群失调,显著增加双歧杆菌和乳酸杆菌数量。
麦冬多糖 MDG-1 对膳食诱导型肥胖小鼠肠道益生菌群有增殖作用,尤其是一些鼠乳杆菌和台湾乳杆菌。
魔芋低聚糖对三硝基苯磺酸 (TNBS) 诱导溃疡性结肠炎大鼠有保护机制,结肠内乳酸杆菌和双歧杆菌数量增多。
泰山蛹虫草多糖对环磷酰胺 (CY) 免疫抑制小鼠的作用,发现多糖组双歧杆菌、乳酸菌数量均较 CY 模型组增加。
七味白术散能促进小鼠肠道乳酸菌和双歧杆菌的增殖(P<0.05),恢复肠道菌群平衡。
肺癌患者放射治疗后服用养阴清肺汤,治疗12周后,乳酸菌和双歧杆菌含量较对照组均上升(P<0.05)。


辣椒素可降低2型糖尿病小鼠体内乳酸杆菌的丰度。
高盐饮食会使乳酸杆菌的丰度降低。
一些疾病的存在可能与乳杆菌降低相关:
包括阿尔茨海默症、自闭症、炎症性肠病、慢性肝病、过敏疾病、肿瘤、肥胖、牙周病、免疫缺陷病、干燥综合征、系统性红斑狼疮、类风湿关节炎、肾脏疾病等。
注意
虽然乳杆菌在大部分情况下对人体都是有益的,但是过量补充也是不可取的。那么我们如何知道自己体内的乳杆菌含量以及补充是否足够呢?
✔肠道菌群检测可以直观地反映体内乳杆菌丰度
肠道菌群检测是目前较为直观地反映补充剂和食物对肠道乳杆菌影响的方法,通过使用高通量测序技术评估肠道中乳杆菌的菌群丰度。
如果通过检测发现乳杆菌处于正常水平,则不需要额外补充,过高的乳杆菌水平并不一定代表更健康;如果发现乳杆菌缺乏,那么可以通过前文所讲的方法进行补充,有助于营造更健康的身体。
补充乳杆菌并不是一劳永逸的事情,需要长期坚持。同时,对于某些人群,如免疫力低下、肠道疾病患者等,应在医生的指导下进行补充。
总之,乳杆菌是一类非常重要的益生菌,它们能够帮助我们维护肠道和阴道的健康、提高免疫力、改善消化功能,并且可有效治疗各种疾病,包括细菌性阴道病、特应性皮炎和呼吸道感染,对人体健康有着重要的作用。
我们可以通过食用富含乳杆菌的食物或者补充乳杆菌制剂来增加体内乳杆菌的数量,从而更好地保护我们的健康。
此外,乳杆菌对于食品、化工业、保健品和医药行业也都具有重要价值。有必要进一步研究乳杆菌,在未来发掘它更深层的价值。
附录一:乳杆菌种类
· Lactobacillus acetotolerans
· Lactobacillus acidifarinae
· Lactobacillus acidipiscis
· Lactobacillus acidophilus
· Lactobacillus agilis
· Lactobacillus algidus
· Lactobacillus alimentarius
· Lactobacillus alvei
· Lactobacillus alvi
· Lactobacillus amylolyticus
· Lactobacillus amylophilus
· Lactobacillus amylotrophicus
· Lactobacillus amylovorus
· Lactobacillus animalis
· Lactobacillus animata
· Lactobacillus antri
· Lactobacillus apinorum
· Lactobacillus apis
· Lactobacillus apodemi
· Lactobacillus aquaticus
· Lactobacillus aviarius
· Lactobacillus backii
· Lactobacillus bifermentans
· Lactobacillus bombi
· Lactobacillus bombicola
· Lactobacillus brantae
· Lactobacillus brevis
· Lactobacillus brevisimilis
· Lactobacillus buchneri
· Lactobacillus cacaonum
· Lactobacillus camelliae
· Lactobacillus capillatus
· Lactobacillus casei group
· Lactobacillus catenefornis
· Lactobacillus ceti
· Lactobacillus coleohominis
· Lactobacillus collinoides
· Lactobacillus composti
· Lactobacillus concavus
· Lactobacillus coryniformis
· Lactobacillus crispatus
· Lactobacillus crustorum
· Lactobacillus curieae
· Lactobacillus curvatus
· Lactobacillus delbrueckii
· Lactobacillus dextrinicus
· Lactobacillus diolivorans
· Lactobacillus equi
· Lactobacillus equicursoris
· Lactobacillus equigenerosi
· Lactobacillus fabifermentans
· Lactobacillus faecis
· Lactobacillus faeni
· Lactobacillus farciminis
· Lactobacillus farraginis
· Lactobacillus fermentum
· Lactobacillus floricola
· Lactobacillus florum
· Lactobacillus formosensis
· Lactobacillus fornicalis
· Lactobacillus fructivorans
· Lactobacillus frumenti
· Lactobacillus fuchuensis
· Lactobacillus furfuricola
· Lactobacillus futsaii
· Lactobacillus gallinarum
· Lactobacillus gasseri
· Lactobacillus gastricus
· Lactobacillus ghanensis
· Lactobacillus gigeriorum
· Lactobacillus ginsenosidimutans
· Lactobacillus gorillae
· Lactobacillus graminis
· Lactobacillus guizhouensis
· Lactobacillus halophilus
· Lactobacillus hammesii
· Lactobacillus hamsteri
· Lactobacillus harbinensis
· Lactobacillus hayakitensis
· Lactobacillus heilongjiangensis
· Lactobacillus helsingborgensis
· Lactobacillus helveticus
· Lactobacillus herbarum
· Lactobacillus heterohiochii
· Lactobacillus hilgardii
· Lactobacillus hokkaidonensis
· Lactobacillus hominis
· Lactobacillus homohiochii
· Lactobacillus hordei
· Lactobacillus iatae
· Lactobacillus iners
· Lactobacillus ingluviei
· Lactobacillus insectis
· Lactobacillus insicii
· Lactobacillus intermedius
· Lactobacillus intestinalis
· Lactobacillus iwatensis
· Lactobacillus japonicus
· Lactobacillus jensenii
· Lactobacillus johnsonii
· Lactobacillus kalixensis
· Lactobacillus kefiranofaciens
· Lactobacillus kefiri
· Lactobacillus kimbladii
· Lactobacillus kimchicus
· Lactobacillus kimchiensis
· Lactobacillus kisonensis
· Lactobacillus kitasatonis
· Lactobacillus koreensis
· Lactobacillus kullabergensis
· Lactobacillus kunkeei
· Lactobacillus larvae
· Lactobacillus leichmannii
· Lactobacillus letivazi
· Lactobacillus lindneri
· Lactobacillus malefermentans
· Lactobacillus mali
· Lactobacillus manihotivorans
· Lactobacillus mellifer
· Lactobacillus mellis
· Lactobacillus melliventris
· Lactobacillus mindensis
· Lactobacillus mixtipabuli
· Lactobacillus mobilis
· Lactobacillus mucosae
· Lactobacillus mudanjiangensis
· Lactobacillus murinus
· Lactobacillus nagelii
· Lactobacillus namurensis
· Lactobacillus nantensis
· Lactobacillus nasuensis
· Lactobacillus nenjiangensis
· Lactobacillus nodensis
· Lactobacillus odoratitofui
· Lactobacillus oeni
· Lactobacillus oligofermentans
· Lactobacillus oris
· Lactobacillus oryzae
· Lactobacillus otakiensis
· Lactobacillus ozensis
· Lactobacillus panis
· Lactobacillus pantheris
· Lactobacillus parabrevis
· Lactobacillus parabuchneri
· Lactobacillus paracasei
· Lactobacillus paracollinoides
· Lactobacillus parafarraginis
· Lactobacillus parakefiri
· Lactobacillus paralimentarius
· Lactobacillus paraplantarum
· Lactobacillus pasteurii
· Lactobacillus paucivorans
· Lactobacillus pentosus
· Lactobacillus perolens
· Lactobacillus plantarum
· Lactobacillus pobuzihii
· Lactobacillus pontis
· Lactobacillus porcinae
· Lactobacillus psittaci
· Lactobacillus rapi
· Lactobacillus rennanquilfy
· Lactobacillus rennini
· Lactobacillus reuteri
· Lactobacillus reuterii
· Lactobacillus rhamnosus
· Lactobacillus rodentium
· Lactobacillus rogosae
· Lactobacillus rossiae
· Lactobacillus ruminis
· Lactobacillus saerimneri
· Lactobacillus sakei
· Lactobacillus salivarius
· Lactobacillus sanfranciscensis
· Lactobacillus saniviri
· Lactobacillus satsumensis
· Lactobacillus secaliphilus
· Lactobacillus selangorensis
· Lactobacillus senioris
· Lactobacillus senmaizukei
· Lactobacillus sharpeae
· Lactobacillus shenzhenensis
· Lactobacillus sicerae
· Lactobacillus silagei
· Lactobacillus siliginis
· Lactobacillus similis
· Lactobacillus songhuajiangensis
· Lactobacillus sp.
· Lactobacillus sp. 66c
· Lactobacillus sp. 7_1_47FAA
· Lactobacillus sp. Akhmro1
· Lactobacillus sp. BL302
· Lactobacillus sp. C30An8
· Lactobacillus sp. C4I18
· Lactobacillus sp. C4I5
· Lactobacillus sp. CR-609S
· Lactobacillus sp. NRCT-KU 1
· Lactobacillus sp. S16
· Lactobacillus sp. TAB-22
· Lactobacillus sp. TAB-26
· Lactobacillus sp. TAB-30
· Lactobacillus sp. Thmro2
· Lactobacillus sp. oral taxon 052
· Lactobacillus sp. oral taxon 461
· Lactobacillus sp.A A18
· Lactobacillus sp.A A21
· Lactobacillus sp.A A25
· Lactobacillus sp.A A29
· Lactobacillus sp.A A35
· Lactobacillus sp.A A44
· Lactobacillus sp.A A45
· Lactobacillus sp.A A48
· Lactobacillus sp.A A49
· Lactobacillus sp.A A85
· Lactobacillus sp.A A96
· Lactobacillus sp.B A100
· Lactobacillus sp.B A101
· Lactobacillus sp.B A102
· Lactobacillus sp.B A103
· Lactobacillus sp.B A12
· Lactobacillus sp.B A13
· Lactobacillus sp.B A14
· Lactobacillus sp.B A16
· Lactobacillus sp.B A19
· Lactobacillus sp.B A20
· Lactobacillus sp.B A23
· Lactobacillus sp.B A31
· Lactobacillus sp.B A33
· Lactobacillus sp.B A34
· Lactobacillus sp.B A36
· Lactobacillus sp.B A37
· Lactobacillus sp.B A41
· Lactobacillus sp.B A42
· Lactobacillus sp.B A52
· Lactobacillus sp.B A53
· Lactobacillus sp.B A64
· Lactobacillus sp.B A65
· Lactobacillus sp.B A76
· Lactobacillus sp.B A78
· Lactobacillus sp.B A81
· Lactobacillus sp.B A86
· Lactobacillus sp.B A87
· Lactobacillus sp.B A89
· Lactobacillus sp.B A90
· Lactobacillus sp.B A91
· Lactobacillus sp.B A95
· Lactobacillus sp.B A97
· Lactobacillus sp.B A98
· Lactobacillus sp.B AB1
· Lactobacillus sp.B CG1
· Lactobacillus sp.B CG3
· Lactobacillus sp.B CG53
· Lactobacillus sp.B CG63
· Lactobacillus sp.B CG71
· Lactobacillus sp.B CG76
· Lactobacillus spicheri
· Lactobacillus sucicola
· Lactobacillus suebicus
· Lactobacillus sunkii
· Lactobacillus taiwanensis
· Lactobacillus thailandensis
· Lactobacillus tucceti
· Lactobacillus ultunensis
· Lactobacillus uvarum
· Lactobacillus vaccinostercus
· Lactobacillus vaginalis
· Lactobacillus vermiforme
· Lactobacillus versmoldensis
· Lactobacillus vini
· Lactobacillus wasatchensis
· Lactobacillus xiangfangensis
· Lactobacillus yonginensis
· Lactobacillus zymae
附录二:参与的KEGG途径
主要参考文献
Chee WJY, Chew SY, Than LTL. Vaginal microbiota and the potential of Lactobacillus derivatives in maintaining vaginal health. Microb Cell Fact. 2020 Nov 7;19(1):203. doi: 10.1186/s12934-020-01464-4. PMID: 33160356; PMCID: PMC7648308.
Zheng N, Guo R, Wang J, Zhou W, Ling Z. Contribution of Lactobacillus iners to Vaginal Health and Diseases: A Systematic Review. Front Cell Infect Microbiol. 2021 Nov 22;11:792787. doi: 10.3389/fcimb.2021.792787. PMID: 34881196; PMCID: PMC8645935.
Dempsey E, Corr SC. Lactobacillus spp. for Gastrointestinal Health: Current and Future Perspectives. Front Immunol. 2022 Apr 6;13:840245. doi: 10.3389/fimmu.2022.840245. PMID: 35464397; PMCID: PMC9019120.
Mei Z, Li D. The role of probiotics in vaginal health. Front Cell Infect Microbiol. 2022 Jul 28;12:963868. doi: 10.3389/fcimb.2022.963868. PMID: 35967876; PMCID: PMC9366906.
Chen CM, Wu CC, Huang CL, Chang MY, Cheng SH, Lin CT, Tsai YC. Lactobacillus plantarum PS128 Promotes Intestinal Motility, Mucin Production, and Serotonin Signaling in Mice. Probiotics Antimicrob Proteins. 2022 Jun;14(3):535-545. doi: 10.1007/s12602-021-09814-3. Epub 2021 Jul 29. PMID: 34327633; PMCID: PMC9076750.
Sulijaya B, Takahashi N, Yamazaki K. Lactobacillus-Derived Bioactive Metabolites for the Regulation of Periodontal Health: Evidences to Clinical Setting. Molecules. 2020 Apr 29;25(9):2088. doi: 10.3390/molecules25092088. PMID: 32365716; PMCID: PMC7248875.
Xie A, Chen A, Chen Y, Luo Z, Jiang S, Chen D, Yu R. Lactobacillus for the treatment and prevention of atopic dermatitis: Clinical and experimental evidence. Front Cell Infect Microbiol. 2023 Feb 16;13:1137275. doi: 10.3389/fcimb.2023.1137275. PMID: 36875529; PMCID: PMC9978199.
Wang W, Fan Y, Wang X. Lactobacillus: Friend or Foe for Systemic Lupus Erythematosus? Front Immunol. 2022 May 23;13:883747. doi: 10.3389/fimmu.2022.883747. PMID: 35677055; PMCID: PMC9168270.
Du T, Lei A, Zhang N, Zhu C. The Beneficial Role of Probiotic Lactobacillus in Respiratory Diseases. Front Immunol. 2022 May 31;13:908010. doi: 10.3389/fimmu.2022.908010. PMID: 35711436; PMCID: PMC9194447.
Sergeev IN, Aljutaily T, Walton G, Huarte E. Effects of Synbiotic Supplement on Human Gut Microbiota, Body Composition and Weight Loss in Obesity. Nutrients. 2020 Jan 15;12(1):222. doi: 10.3390/nu12010222. PMID: 31952249; PMCID: PMC7019807.
Kim H, Venancio VP, Fang C, Dupont AW, Talcott ST, Mertens-Talcott SU. Mango (Mangifera indica L.) polyphenols reduce IL-8, GRO, and GM-SCF plasma levels and increase Lactobacillus species in a pilot study in patients with inflammatory bowel disease. Nutr Res. 2020 Mar;75:85-94. doi: 10.1016/j.nutres.2020.01.002. Epub 2020 Jan 10. PMID: 32109839.
Wang MX, Lin L, Chen YD, Zhong YP, Lin YX, Li P, Tian X, Han B, Xie ZY, Liao QF. Evodiamine has therapeutic efficacy in ulcerative colitis by increasing Lactobacillus acidophilus levels and acetate production. Pharmacol Res. 2020 Sep;159:104978. doi: 10.1016/j.phrs.2020.104978. Epub 2020 May 30. PMID: 32485282.
Lu F, Li Y, Wang X, Hu X, Liao X, Zhang Y. Early-life polyphenol intake promotes Akkermansia growth and increase of host goblet cells in association with the potential synergistic effect of Lactobacillus. Food Res Int. 2021 Nov;149:110648. doi: 10.1016/j.foodres.2021.110648. Epub 2021 Aug 20. PMID: 34600650.
Borgonovi TF, Virgolin LB, Janzantti NS, Casarotti SN, Penna ALB. Fruit bioactive compounds: Effect on lactic acid bacteria and on intestinal microbiota. Food Res Int. 2022 Nov;161:111809. doi: 10.1016/j.foodres.2022.111809. Epub 2022 Aug 27. PMID: 36192952.
朱晨,段学清,段智璇,谢鑫,张其,田维毅.清热解毒中药黄芩和栀子对大鼠不同肠段菌群的影响[J].中华中医药学刊,2023,42(03):52-57.DOI:10.13193/j.issn.1673-7717.2023.03.012.
朱晨,陈瑞,谢鑫,张其,瞿慧琴,段学清,田维毅.黄柏对大鼠不同肠段主要菌群的影响[J].时珍国医国药,2021,32(12):2851-2855.
崔祥,陶金华,江曙,魏晓燕,徐君,钱大玮,段金廒.黄连提取物与肠道菌群的相互作用研究[J].中草药,2018,49(09):2103-2107.
周欣,付志飞,谢燕,王晓明,李楠,张鹏.中药多糖对肠道菌群作用的研究进展[J].中成药,2019,41(03):623-627.
谭周进,吴海,刘富林,蔡莹,蔡光先,张华玲,曾奥.超微七味白术散对肠道微生物及酶活性的影响[J].生态学报,2012,32(21):6856-6863.
潘婷婷,张爱琴.养阴清肺汤对肺癌患者放疗后皮肤损伤和肠道菌群的影响[J].辽宁中医杂志,2023,50(01):97-100.DOI:10.13192/j.issn.1000-1719.2023.01.028.
谷禾健康
阴道微生物组是一个复杂而动态的微生态系统,在女性月经周期和女性的一生中不断发生波动。
在过去几年中,对阴道微生物群关注随着测序技术的发展和应用逐渐广泛和突出,有关以往传统正常和异常阴道微生物组的知识也发生了变化。培养技术可能不再适用于确定正常或异常的阴道微生物群。以非培养为基础的分析生物技术揭示了一个动态且主要由乳酸杆菌主导的复杂动态系统。
该生态系统受基因、种族背景、发育以及环境和行为因素的影响。每个个体都有几种乳酸杆菌在健康的阴道中占主导地位。它们与抗菌物质、细胞因子、防御素和其他物质一起支持防御系统,以对抗菌群失调、感染和早产以及不孕不育等问题。
在这里,我们主要讨论和介绍女性生命周期不同阶段阴道区域微生物群落的变化,哪些因素会影响阴道菌群,及阴道菌群对性健康和病理状况的影响。
育龄女性产生约 1 至 4 mL 的阴道液,每 mL 含有 108至 109 个细菌细胞。阴道微生物从女性出生的最初几个小时开始就开始定居,并伴随她的一生一直存在到死亡。
这些细菌群落在个体之间和随着时间的推移可能会有产生差异。
• 阴道微生物群被定义为在阴道内定殖的共生和病原微生物群;
• 阴道微生物群从女性出生的最初几个小时开始就开始定居,伴宿女性一生;
• 随着年龄的变化,从青春期前的厌氧微生物过渡到生殖年龄时富含乳酸杆菌的阴道。
• 在大多数健康育龄妇女中,阴道微生物群以乳酸杆菌为主。
+
阴道菌群中 70%是乳杆菌
阴道拥有自己的原生微生物群落,这是抵御病原体的主要防线。
最主要的阴道种群是乳酸菌,占细菌群落的近 70%。这些包括下列菌群等:
此外,其他细菌种类如下列菌群等也存在于健康个体的阴道中:
研究人员通过16s技术等在研究中将阴道微生物群分为编号为 I-V 的进化枝。其中,Clades I、II、III、V以乳酸杆菌为主,Clade IV无优势群,是微生物的混合体。
注:CST I、II、III 和 V 以L. crispatus 、L. gasseri、L. iners、L. jensenii 为主,而 CST IV 是指以专性厌氧菌为特征的微生物群落的高度多样性。
每个女性体内的原生微生物群数量因种族、地理、生活方式、卫生和冲洗方法而异。
注:已经发现,在疾病进展期间,乳杆菌种群发生了从L. crispatus 到 L. iners 的转变。这种转变的原因尚不清楚。有人提出,与L. iners 产生的L-乳酸相比, L . crispatus 产生的d-乳酸可能提供更好的保护,防止病原体定植。
因此,许多其他细菌在健康的阴道菌群中的浓度较低,例如消化链球菌(Peptostreptococcus)、拟杆菌(Bacteroides)、棒状杆菌(Corynebacterium)、链球菌(Streptococcus)和消化球菌(Peptococcus)。
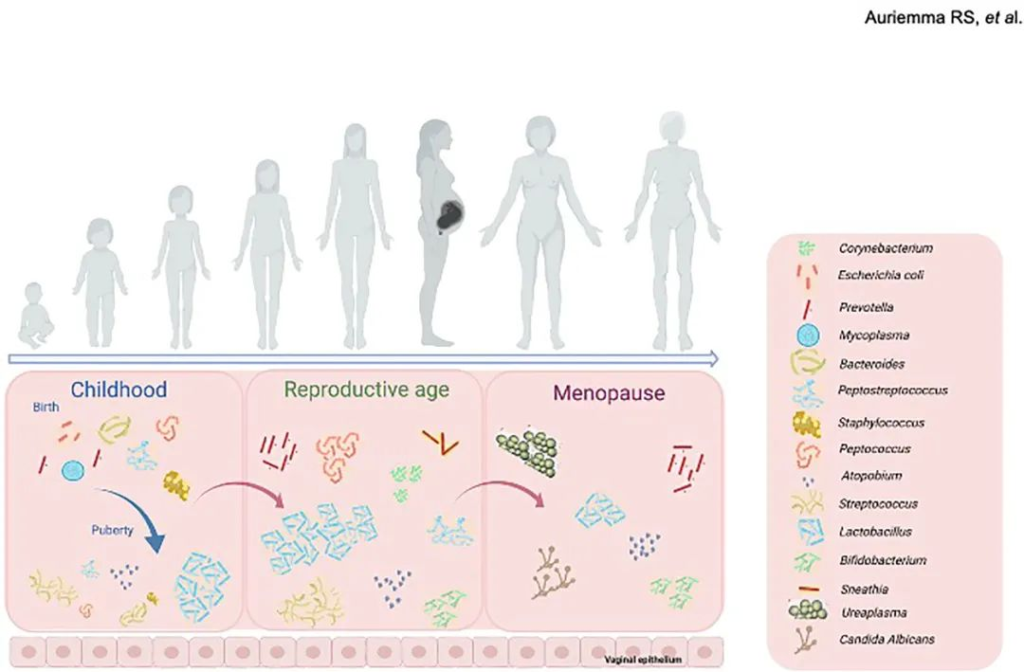
阴道微生物群的组成在女性的一生中不断演变。在女性生命的这些不同阶段,阴道菌群会发生各种生理和荷尔蒙变化(下图)。
健康的阴道微生物群通常由乳杆菌属控制,乳杆菌属对阴道失调或感染具有保护作用。尽管这种保护作用的确切机制尚不清楚,但新出现的研究表明,阴道菌群产生多种分子来维持阴道内稳态并防止感染。
例如,健康的阴道环境的特征是阴道乳杆菌产生乳酸,这在消除入侵病原体方面发挥着重要作用。此外,Lactobacilius还产生许多化合物,如细菌素和H2O2,以选择性地抑制入侵病原体并保持阴道内稳态。
阴道微生物失调的特点是乳酸杆菌属的丰度较低,而CST IV微生物群的水平较高,如厌氧链球菌、阴道加德纳菌、阴道阿托波菌、莫比伦氏菌属、斯内氏菌属(Sneathia)、普雷沃氏菌属、支原体,这会对阴道和生殖健康产生不利影响,并导致对各种阴道感染(如细菌性阴道病和念珠菌病)的易感性,甚至可能导致不良妊娠结局,如早产、先兆子痫、妊娠高血压等。
世界范围内进行的大量研究已确定乳酸杆菌是育龄健康女性阴道微生物群的主要成分。阴道微生物组因种族和地区而异。目前尚不清楚种族因素是否单独或结合行为和环境变量可以解释这些差异。
▸ 不同地区的阴道菌群存在差异:
来自不同国家的女性在其阴道微生物群中有一定程度的差异,不过差异不大。
在中国育龄健康女性的生殖微生物群落中以 L. gasseri, L. crispatus 和 L. iners为主要。
欧洲女性有一个独特的阴道微生物群,包括L. crispatus, L. jensenii, L. gasseri, L. iners.
而非洲研究表明,植物乳杆菌是阴道微生物群中的主要物种,其次是:
L. gasseri
Lactobacillus rhamnosus
L. crispatus
Lactobacillus plantarum
上述发现表明,来自世界各地的健康女性的阴道微生物组存在物种水平的差异。这些差异也可以用所研究社区内的种族差异来解释。
▸ 同一地区不同种族的阴道菌群存在差异:
育龄妇女的阴道细菌群落在不同地区的妇女之间可能存在差异,但在生活在同一地理区域的不同种族的妇女之间也可能存在差异。
2011 年的一项研究对无症状北美女性的阴道微生物群进行表征,表明亚裔和美国白人女性的阴道菌群以乳酸杆菌为主,这与西班牙裔和非裔美国女性不同,后者只有 60% 的阴道菌群以乳酸菌为主。
此外,与非洲女性相比,白种人和亚洲女性的L. crispatus含量较高,而 L. iners 含量较低。
在另一项使用 16S rRNA 基因测序的研究中,表明欧洲血统女性的阴道微生物群以乳酸杆菌为主,而非裔美国女性则相反,后者呈现出混合的阴道群落,其中包括人型支原体、气球菌、惰性乳杆菌和许多严格的厌氧菌,包括:革兰氏-阳性厌氧球菌、细菌性阴道炎相关细菌、Sneathia、Prevotella amnii、Megasphaera、Atopobium、Gardnerella vaginalis。
阴道 pH 值也因种族而异。非裔美国人和西班牙裔女性的阴道 pH 值(分别为 4.7 和 5.0)高于标准值(<4.5)。
阴道及其微生物群形成了一个生态系统,随着时间的推移,从婴儿期到儿童期再到青春期和成年期,影响这些变化的主要力量是雌激素水平的波动和性活动的出现,卫生实践和药物,包括口服避孕药和抗菌剂,也会影响阴道中存在的各种菌群之间的复杂相互作用。
下面我们来看每个时期阴道菌群的特点及相关影响因素:
出生后或出生后不久,婴儿的阴道微生物群从母亲身上吸收细菌时开始繁殖。
许多研究表明,怀孕期间的母体微生物组对妊娠结局和分娩方式(阴道或剖宫产)有很大影响,这会显著影响婴儿的微生物组。
出生后,微生物群需要数年的时间才能充分发展和多样化,这是一个动态过程,并受到多种外部因素的严重影响。例如,早期喂养方式或接触抗生素会影响婴儿的微生物群。
▸分娩方式不同影响菌群定植
在阴道分娩时,新生儿暴露于母亲的阴道和粪便微生物群,这些微生物群中含有大量乳酸杆菌、普雷沃氏菌、斯奈氏菌和双歧杆菌;
然而,剖腹产婴儿从母亲的皮肤或周围医院环境中接受了不同的微生物接种物,这些接种物通常主要由棒状杆菌、葡萄球菌和丙酸杆菌居住,有时还含有传染性微生物制剂,如梭状芽孢杆菌、肠球菌和克雷伯菌。
胎盘和羊水的微生物组在成功分娩和新生儿微生物组发育中起着重要作用。最初的胎粪显示胎盘和羊水中的细菌占优势。
▸阴道菌群与激素调节相关
在怀孕和产后阶段,身体经历了许多变化,通常由雌激素等各种激素调节。
阴道雌激素水平高,有助于维持较高水平的阴道糖原,乳酸杆菌通常将其用作维持阴道酸性环境的食物。
此外,新生儿还通过母乳接触母体雌激素,这有助于维持健康的新生儿菌群。相反,阴道雌激素水平随着年龄的增长而降低,这反过来导致阴道乳杆菌和中性阴道pH值的降低。
▸乳酸杆菌是大多数女孩的主要菌群
在完成如厕训练之前,婴儿和学步儿童通常会遇到革兰氏阴性肠道细菌和肠球菌,但之后会较少遇到。
在儿童中,乳酸杆菌在 2 岁以下的女孩中比在青春期前年龄较大的女孩中更常见,并且可能在限制其他菌群过度生长方面发挥保护作用。
在儿童早期,阴道的 pH 值是中性或微碱性。
几个内在和外在因素可以显著影响女性一生中的阴道微生物群。
青少年时期的厌氧菌流行率更高。从青春期开始,有氧定植随着年龄、性活动的开始和胎次而增加。
在月经初潮前,低雌激素水平通常与由需氧、厌氧和肠道微生物组成的多种阴道微生物群落有关,微生物多样性增加的梭杆菌属、普雷沃氏菌属和Ezakiella属(普雷沃氏菌为主);在生命的这一阶段,阴道pH值呈微碱性(pH 7.5–8)或中性(pH 7.0)(下图)。
给父母的重要提示:
青春期前的儿童可能会出现阴道感染,这通常是由于高香味的沐浴产品造成的。鼓励孩子在上厕所时从前到后擦拭,洗澡时不要使用香皂等产品洗,尤其是直接进入阴道区域。
青少年时期对年轻人来说是一个充满挑战的时期,他们的身体在进入青春期时会发生变化。此时阴道微生物组也发生了很大变化。
从青春期初期到生殖阶段,阴道微生物组成不断变化:
青春期早期通常由Finegoldia、Anaerococcus、Prevotella、Dialister、Peptoniphilus和乳杆菌属组成,而后期主要由乳杆菌属和较低丰度的Sneathia、Prevotela、嗜血杆菌属、Atopobium、Gardnerella组成。
不断增加的雌激素水平导致高水平的糖原存在于阴道内膜中。乳酸杆菌家族的细菌发酵糖原,从而产生乳酸。这有助于保护阴道。
在这个阶段,乳酸杆菌的丰度降低会导致阴道生物失调和细菌性阴道病。
在生殖阶段的初始阶段,一系列因素有助于阴道微生物组的动态。青春期初期女性性腺激素水平的增加导致阴道微生物多样性的增加,这是通过诱导阴道壁中糖原沉积的增加,较低的阴道性腺水平和激素刺激的糖原支持乳酸杆菌的生长。
月经期的阴道微生物组成似乎与青春期早期观察到的相似:两个属(消化链球菌Peptostreptococcus和链球菌属Streptococcus)通常占主导地位,而不是乳杆菌属,这可以通过测定期间阴道pH值的变化来解释。
新的研究表明,在月经期间,月经液与阴道壁的相互作用中和了酸性阴道微环境,导致pH值升高(7.2–7.4)。乳杆菌属的下降导致许多其他厌氧菌上升。
尽管在月经周期中阴道菌群发生这些实质性变化的确切原因尚不清楚,但过去的结果表明,这一阶段的一些生理事件可能会影响阴道微环境。
例如,黄体期(月经前)被认为以子宫壁增厚为特征,特别是子宫内膜和阴道上皮增厚,导致阴道区域糖原沉积增加,而缺乏受精导致性激素水平突然下降,以及子宫内膜衬里脱落和中性pH,为许多微生物的增殖创造了理想的栖息地。
在随后的卵泡期,月经流量的减少再次降低了阴道pH值,增强了糖原降解和乳酸生产(通过乳酸杆菌),从而抑制了其他厌氧微生物的生长。
月经与阴道微生物群落的动态变化有关。一些女性有强健的阴道微生物群落,在月经期间群落状态之间有简单和可预测的过渡,而其他女性在整个月经期间表现出相对稳定的微生物群落。
在生殖阶段,阴道微生物群落通常以脆乳杆菌为主,而在月经期间观察到阴道微生物群失衡,其特征是脆乳杆菌减少,混合厌氧菌增加,如Gardnerella、Atopobium、Prevotella、Megasphaera sp.、L.iners、链球菌等。因此,CST从CST I转移到CST III或CST IV,有时在整个月经周期中,社区保持稳定和相同。
新的研究表明,阴道微生物环境是由宿主因素(种族、遗传和免疫介质)和微生物生物学在整个生殖周期中的微妙相互作用维持的。虽然在月经期间已描述了改变的阴道细胞因子模式,但其与阴道微生物群和生殖健康的关系尚未完全确定。此外,女性阴道微生物群落的个体间差异也很高。
一旦我们度过了青春期,我们就达到了生育年龄。性活动可能会随之而来,并伴随着怀孕的机会。在怀孕期间,阴道菌群会发生变化,并且在乳酸杆菌中变得更加占优势。人们认为,由于荷尔蒙的变化,乳酸杆菌的这种增加的优势是为了防止感染,这种感染可能在这个脆弱的时期被触发。
怀孕的特点是各种生理变化,这些变化有助于胎儿适应母亲身体的微生物群,反之亦然。这种多样化的状态受到激素和生理变化的调节,这些变化导致免疫调节、行为、粘膜理化、代谢和生殖道变化,从而导致微生物组的结构和功能被调节,这与非怀孕女性的不同。
怀孕是一个“形成期”,由各种相互关联的生理和分子过程控制,以支持胎儿的生长和发育。
在怀孕过程中,身体经历了大量的激素、免疫和微生物变化,以促进母体内稳态并支持胎儿生长。阴道菌群在怀孕过程中也会发生实质性变化,并随着怀孕的进行而变得更加均匀。在妊娠早期,胎盘为支持胎儿而增加的雌激素和孕激素分泌。
实际上触发了总体微生物多样性的丰富;然而,怀孕期间持续升高的激素水平和阴道乳杆菌的拮抗反应导致稳定和健康的阴道菌群。另一方面,不断变化的阴道环境也会导致几种氨基酸(例如,苯丙氨酸、丝氨酸、天冬氨酸、异亮氨酸、色氨酸、苏氨酸、甘氨酸、谷氨酸、亮氨酸)和乳酸水平升高,同时耗尽有机酸(乙酸盐、丙酸盐)、葡萄糖和生物胺(腐胺、酪胺、甲胺)以支持胎儿。
与怀孕期间阴道微生物的变化类似,母体免疫反应也发生了从促炎反应到抗炎细胞因子的实质性变化,以接受胎儿同种异体移植,同时性腺激素水平升高。阴道免疫系统在稳定阴道微生物群和防止上行生殖道感染中起着至关重要的作用。
产后阶段的阴道菌群显著不同,其特征通常是乳酸杆菌的丰度较低,而其他菌群的丰度相对较高,如阴道加德纳菌、无乳链球菌和普雷沃氏菌,导致阴道微生物群落更加多样。
怀孕后雌激素(雌二醇和雌二醇)水平的降低是一个显著影响阴道微环境的因素,包括菌群,这对于非怀孕阶段、恢复自然生理状态和为连续怀孕准备阴道微环境非常重要。未能在1年内恢复自然生理和免疫阴道微环境或随后的妊娠可能会严重影响妊娠结局。
产后抗生素预防是决定产后阴道微生物组成的另一个重要因素。与未经治疗的女性相比,分娩时使用抗生素预防的女性。
与雌激素水平降低同时,与分娩和分娩相关的自然生理变化会刺激炎症反应,以促进子宫收缩、宫颈扩张和胎膜破裂,这可能会显著导致阴道微生物成分的变化。
除雌激素外,其他分泌化合物如透明质酸和Hsp70在重塑阴道微环境中发挥着重要作用,因为它们在分娩期间的水平调节子宫颈并为分娩做好准备,而分娩后它们有助于重塑子宫颈,包括阴道上皮衬里和阴道液体成分。
更年期是女性停止月经周期的时候。在这个阶段,卵巢停止释放雌激素和卵子,这导致生殖周期结束,性腺激素和阴道壁糖原水平降低。随后,雌激素水平的降低也导致阴道微环境的变化,包括乳酸杆菌和乳酸的丰度降低以及中性pH值,这促进了潜在致病微生物的定植,并增加了对泌尿生殖道感染的易感性。
绝经后妇女不仅阴道感染风险增加,而且还会出现其他血管舒缩症状,如潮热、失眠、抑郁等。这些症状是更年期雌激素缺乏的结果,对女性的健康和生活质量产生负面影响。
阴道微生物组极其重要,对绝经后妇女的整体生活质量有重大影响,包括性健康、阴道干燥和外阴阴道萎缩等。不幸的是,新出现的结果表明,大约25-50%的女性在绝经后阶段经历了外阴阴道萎缩,这包括外阴阴道症状,如疼痛的性活动、性交后出血、小便时灼热、疼痛、瘙痒和带有难闻气味的阴道分泌物。
尽管医生已经尝试了不同的治疗方法来改善妇女的绝经后生活,包括使用雌激素的激素替代疗法,这种疗法导致乳酸杆菌数量和糖原水平的增加,从而导致泌尿生殖道感染的减少。
然而,这种疗法未能在不同人群中显示出一致的效果,特别是在有肝病、冠心病、心脏病或乳腺癌病史的患者中。在这些患者中,治疗会导致严重的不良反应,如乳房疼痛或持续阴道出血。
用益生菌鼠李糖乳杆菌GR-1和罗伊氏乳杆菌RC-14 进行的另一种阴道治疗已经证明,这显示出对阴道菌群的有益影响,有助于避免绝经后女性的阴道感染。有限的科学证据和不适当的数据阻止了此类益生菌的使用。
阴道微生物群在保护阴道上皮免受病原微生物污染方面发挥着重要作用。这种保护机制基于三种机制:
1)天然微生物群与病原体的竞争
乳酸杆菌粘附到阴道上皮,通过竞争性占领过程形成抵抗病原微生物的保护层。
2)针对这些不良微生物的抗微生物物质的生产
生产三种不同类型的物质:乳酸、过氧化氢和细菌素。
乳酸:维持阴道的 pH 值在酸性,抑制病原微生物的生长。
过氧化氢:由于其氧化能力而具有抗菌作用。
细菌素:是蛋白质来源的毒素,具有抗菌功能,因此它们可以抑制其他可能致病的微生物的生长。它们的作用是通过在细菌的细胞质膜中产生孔来溶解或破坏细菌的细胞质膜。
3)病原物种的共聚集能力以提高抗微生物能力
病原微生物被来自天然阴道微生物群的细菌包围的机制。
这些形成阴道菌群的微生物与其他微生物群在共生或稳态的情况下生活在一起,也就是说,在阴道中存在的所有物种之间保持平衡。
然而,当由于某种原因阴道中乳酸杆菌的浓度降低时,我们就会进入一种生态失调的情况,其中体内平衡被破坏,因此对粘膜的保护作用降低。
导致乳酸菌减少的原因是多种多样的:
在这种低保护的情况下,病原体会引起感染,包括细菌性阴道病、念珠菌属阴道炎(念珠菌病)、滴虫病或尿路感染等,其他包括早产,不孕不育等也与阴道菌群变化相关,接下来章节我们来详细了解一下相关妇科疾病。
早产(PTL)是指怀孕37周之前的分娩,影响15-30%的妊娠,是导致产前死亡的主要原因。尽管早产的确切病因仍不明确,但胎膜早破、阴道上升感染、羊膜内感染、压力、宫颈功能不全和血管疾病是关键的促成因素;其中,某些细菌引起的宫内感染或上行尿路感染是不良妊娠结局或PTL的影响关键因素。
越来越多的证据表明阴道微生物组与自发性早产风险有关。
阴道微生物群在妊娠健康和结局中起着重要作用,阴道失调的增加(通常以CST IV菌群的丰度较高和乳酸杆菌的丰度较低为特征)导致妊娠并发症和早产风险增加。
足月分娩中,阴道菌群以厚壁菌为主
足月分娩妇女的阴道微生物群落通常是稳定的,在怀孕早期以乳杆菌为主;而经历早产的女性通常阴道菌群以厌氧菌为主。
在大多数足月分娩中,阴道微生物群的特点是厚壁菌门成员占优势,放线菌门、变形菌门、拟杆菌门和细杆菌门成员的丰度较低,而在早产的情况下,厚壁菌的数量减少。
饮食对阴道微生物群有重要影响
在怀孕期间,几种维生素和小分子是必不可少的,每一种都在不同的代谢和生理变化以及胎儿的整体发育中发挥作用。
据指出,女性的饮食中缺乏铁、钙、叶酸、核黄素、钾和维生素D,更容易早产。
维生素D在怀孕期间会对阴道微生物群产生影响,因为它可以加强、保护和维持阴道的上皮衬里;诱导抗微生物肽(LL-37)的表达、增加胰岛素合成;并且通过抑制糖原合成酶激酶最显著地模拟糖原合成。
低丰度的乳酸菌与早产风险最高相关
对至少三种不同CST中的阴道微生物组进行分类以评估早产风险的纵向研究。所有17项研究均在2014年至2021期间发表,包括38-539例妊娠和8-107例早产。与脆乳杆菌占优势的女性相比,具有“低乳杆菌”阴道微生物组的女性早产风险增加(OR 1.69,95%CI 1.15–2.49).
网络荟萃分析支持微生物组可以预测早产,其中低丰度的乳酸菌与最高的风险相关,而L. crispatus优势菌群的早产风险最低。
不孕症对社会、经济以及夫妻双方的心理健康都有严重的不良影响。全球育龄夫妇的患病率为 8–12%.导致不孕的因素复杂且范围广泛。
年龄是导致女性生育力下降的关键影响因素,其他例如卵巢早衰、多囊卵巢综合征和子宫内膜异位症都是公认的导致女性不孕的原因。
越来越多的证据表明,每个女性独有的阴道微生物群在决定生殖健康许多方面起着重要作用。
之前的研究还表明, L. iners 、L . crispatus、L. gasseri可以区分特发性不孕女性与健康女性或阴道病患者。
乳杆菌主导的阴道菌群通常被视为正常的标志。然而,许多研究表明,并非所有类型的乳酸菌都是有益菌,例如,L . crispatus似乎具有有益特性,而L. iners 则没有。
患有特发性不孕的女性似乎更容易出现阴道菌群失调。
研究人员将阴道微生物群分为两类:低乳酸杆菌阴道微生物群 (LL-VMB) 和高乳酸杆菌阴道微生物群 (HL-VMB)。研究人员开始评估女性不育与阴道微生物群之间的统计关联,结果如下:
高乳酸菌阴道微生物群与不孕症之间呈负相关
DOI: 10.1007/s00404-020-05675-3
数据显示,细菌性阴道炎与女性不孕症呈正相关,并且细菌性阴道炎阳性者的影响大于细菌性阴道炎中间值者。
女性不孕症可根据不同的标准分为不同的类型,其中与阴道微生物群的关联可能有所不同。从病因学的角度来看,输卵管性不孕症是与阴道微生物群相关的最常见疾病。
由细菌性阴道炎引起的慢性炎症反应也可能是输卵管粘连的原因,至少是部分原因。
低乳酸杆菌阴道微生物群 或 细菌性阴道病 如何对受精过程产生影响?
通过回顾文献,研究人员确定了三种可能的途径。
第一个:慢性炎症假说
已知一部分女性不孕症可归因于亚临床盆腔炎。此外,细菌性阴道病常伴有 pH 值升高、粘膜细胞损伤和局部炎症反应。虽然阴道炎症不会直接影响卵子,但微生物群仍有可能发挥作用。
最近的一项研究还表明,女性生殖道存在微生物群连续体,包括宫颈管、子宫、输卵管和腹膜液。由于一些盆腔炎是慢性的,没有临床症状,许多女性在诊断出不孕症后才意识到这些问题。
第二个:对性传播感染 (STI) 的易感性
最近的一项荟萃分析提供了高乳酸杆菌阴道微生物群对 HPV 和沙眼衣原体的保护作用的证据。 此外,许多研究表明,细菌性阴道病是感染 STI/HIV 的危险因素。
第三个:指非因果关联
多囊卵巢综合征是女性不孕症的一个非常常见的原因,代表了以高雄激素血症、少排卵/无排卵和卵巢囊肿为特征的内分泌疾病综合症。
已知雌激素或下丘脑-垂体-卵巢轴的变化与 多囊卵巢综合征和阴道微生物群相关,但所涉及的机制仍不清楚。有一些证据表明肠道微生物群与多囊卵巢综合征有关。
需要进一步的研究来系统地探索阴道微生物群、不孕症和其他混杂/中介因素之间的因果关系。
总的来说研究结果表明,健康的阴道微生物群与较低的不孕风险相关。
健康的阴道微生物组以产生各种抗菌化合物的乳杆菌为主。细菌性阴道病(BV)的特征是乳酸杆菌总数的减少或急剧下降,以及相应的厌氧微生物浓度显着增加。
细菌性阴道病是一种在全球育龄妇女中非常普遍的阴道微生物群疾病。全世界23%–29%的女性患有此病。细菌性阴道病已被证实与妇科和产科不良结局有关,例如性传播感染、盆腔炎和早产。
BV的特征是:
乳酸杆菌总数的减少或急剧下降,同时兼性或专性厌氧微生物的浓度相应增加100–1000倍,如Gardnerella、Prevotella、Atopobium、Mobiluncus、双歧杆菌、Sneahia、Leptotrichia,以及梭状芽胞杆菌目中的一些新细菌,称为BV相关细菌(BVAB)1–3.
加德纳菌是从患有 BV 的女性阴道样本中鉴定出的最常见的微生物。
健康或无症状的女性也可能携带G. vaginalis. 这表明阴道中存在G. vaginalis并不一定导致 BV。因此,正确理解G. vaginalis的作用非常重要。
G. vaginalis 含有多种与致病潜力相关的毒力因子,其中唾液酸酶和阴道溶血素是研究最广泛的因子。唾液酸酶A基因与BV和生物膜的存在有关。
G. vaginalis 利用唾液酸酶水解阴道内粘液唾液聚糖中的唾液酸残基,然后分解代谢游离碳水化合物,从而促进阴道粘液屏障的降解。
至于阴道溶解素,它是一种属于胆固醇依赖性溶细胞素家族的成孔毒性化合物,有助于靶细胞(如阴道上皮细胞)的裂解。
细菌性阴道病的发病机制和益生菌对抗BV的作用机制
doi: 10.3390/antibiotics10060719
生物膜是一个附着在非生物或生物表面的结构化微生物群落,镶嵌在其自身分泌的聚合物基质中,包括碳水化合物、蛋白质和核酸。生物膜的形成是一个复杂、动态和相互作用的过程,与活动的浮游微生物和微生物聚集体有关。
多种细菌和真菌微生物,如加德纳菌属和念珠菌属,可以形成生物膜。
阴道上皮上形成的多微生物生物膜在BV的发病机制中起着关键作用。G. vaginalis是主要的定植体,它可以为其他BV相关微生物的附着建立支架,从而能够开发多微生物生物膜。
Atopobium vaginae 是多微生物生物膜的第二个定殖者之一,是一种严格的厌氧微生物,对BV具有很大的预测性。
G. vaginalis 生物膜对两种常见的健康阴道分泌物(即乳酸和H2O2)的耐受性高于浮游细胞。这可以保护阴道毛滴虫和其他BV相关微生物免受不利环境的影响。
BV被认为是一种生物失调,通常表现出临床症状,可由大量具有促炎特征的微生物以及宿主免疫反应引起。
据报道,BV女性的阴道样本中含有高水平的免疫介质,如白介素(IL)-8、IL-6、IL-1α、IL-1β、IL-12p70和TNFα。
不同物种可能采用不同的免疫因子。例如,脆乳杆菌与γ诱导蛋白10(IP-10)的显著增加以及IL-12(p70)、IL-8、IL-1β和IL-1α的显著下降相关。
然而,根据阴道拭子的分析,G. vaginalis与IP-10的下降和IL-12(p70)、IL-8、IL-1β和IL-1α的增加相关。G. vaginalis也与相同因素的增加和减少有关。
在携带大量Prevotella spp.的女性中观察到了更高水平的IL-1β、IL-8和干扰素(IFN-γ)。
IL-36G对BV女性的关键作用得到了验证。因此,BV患者阴道样本中IL-36G水平升高。IL-36G可能在BV和其他疾病的免疫应答中发挥重要作用。
通过阴道菌群的检测,可以了解更多相关疾病风险。
谷禾阴道菌群检测数据库
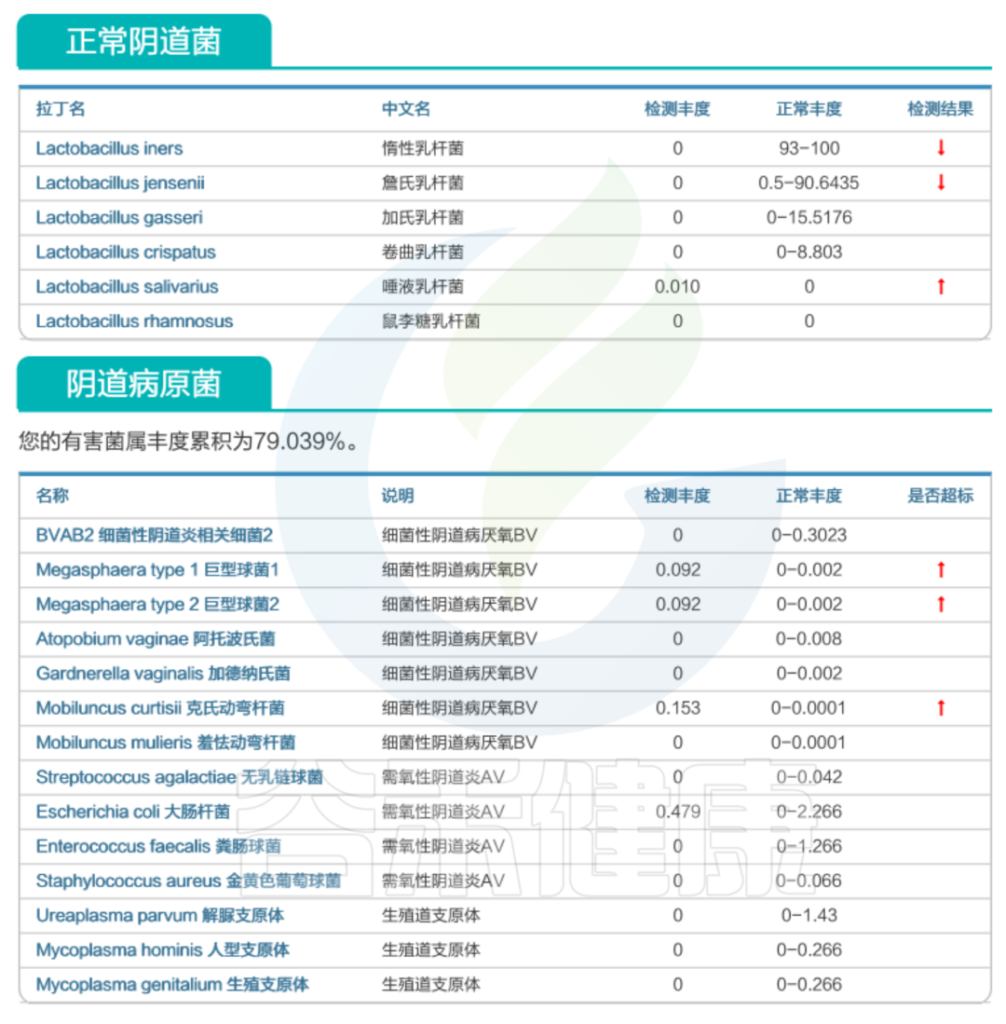
该案例选自谷禾阴道菌群检测数据库,相关菌群检测结果的异常对细菌性阴道病的风险具有提示作用。
盆腔炎是由上生殖道炎症引起的感染。细菌性阴道病被认为是盆腔炎的一个危险因素,可导致不良的生殖后遗症,如不孕、慢性骨盆疼痛和异位妊娠。
据报道,细菌性阴道病相关微生物与盆腔炎发病风险升高有关,而非细菌性阴道病相关微生物对盆腔炎发病风险没有影响。
急性子宫内膜炎患者更有可能细菌性阴道病,而携带乳酸杆菌的可能性较小。与阴道微生物群正常的女性相比,细菌性阴道病患者亚临床盆腔炎的检出率是正常女性的2.7倍。
A. vaginae, S. amnionii, BVAB1, S. sanguinegens的存在与盆腔炎及其后遗症相关,包括复发性盆腔炎和不孕。
在最近一项针对性传播感染高危女性的研究中,阴道中存在BV相关微生物,如A. vaginae, Megasphaera spp., Sneathia spp., Prevotella amnii, Eggerthella-like bacterium,可增加盆腔炎发生的可能性。
此外,BV相关微生物的更大细菌负荷预测了盆腔炎。盆腔炎中BV相关微生物的鉴定表明,生殖道上升的程度从低到高。
这一发现可能是由于BV相关微生物产生的酶。这些酶,如粘蛋白酶和唾液酸酶,可以降解粘蛋白屏障,促进上升感染,从而导致盆腔炎。
其他相关妇科疾病与阴道菌群详见:
阴道中有益和有害细菌之间的平衡非常脆弱,如果阴道 pH 值不够酸性,就会出现不平衡。阴道酸碱度应该在 3.8 到 4.5 之间,以保持健康的阴道酸度。
如果由于缺乏乳酸杆菌而导致阴道酸度不足,那么真菌和“坏”细菌的繁殖能力就会比平时更多。
可能增加阴道菌群失衡并因此感染的生理或外部风险因素包括:
帮助恢复阴道菌群平衡的措施:
益生菌是体内天然存在的细菌,通常被推荐用于治疗阴道菌群失衡。益生菌有助于恢复健康的乳酸杆菌水平。通过保持阴道菌群的健康平衡,身体对感染的防御能力得以恢复。
益生菌的开发和临床应用的最新进展为治疗开辟了新途径。极大地克服了因抗生素的适宜性、用量、给药方式等使用不当而导致病原体耐药性增强的现象。
有些益生菌例如鼠李糖乳杆菌、罗伊氏乳杆菌、植物乳杆菌、长双歧杆菌等,已被证明可以改善整体阴道健康。
每天口服一次或两次胶囊化鼠李糖乳杆菌GR-1和发酵乳杆菌RC-14菌株可将细菌性阴道病相关微生物群转化为以乳杆菌优势为标志的正常微生物群。
益生菌在外阴阴道念珠菌病(VVC)的阴道微生物组改变的治疗中也很有效。研究人员调查了7918名VVC孕妇阴道菌群的变化,发现外阴阴道念珠菌病阴道菌群可以在正常(以乳酸菌为主)和异常(乳酸菌减少)之间振荡。
临床试验表明,嗜酸乳杆菌、鼠李糖乳杆菌GR-1和发酵乳杆菌RC-14在恢复以乳酸杆菌为主的阴道菌群方面具有有效性。
它会对阴道健康产生负面影响。对于更容易受到阴道酵母菌感染的女性,建议采用均衡且高纤维的低糖饮食。摄入大量糖会促进肠道中致病性酵母菌的生长。如果这些在上厕所时进入阴道,可能会导致阴道酵母菌感染。
高热量和高脂肪消耗的女性患细菌性阴道病的风险增加。
一些研究已经确定微量营养素摄入不足,尤其是维生素 A、C、E 和 D 以及 β-胡萝卜素、叶酸、钙的不足,会增加细菌性阴道病的风险。
各种疾病所需的抗生素疗程会扰乱健康的阴道菌群。这使得病原体和酵母菌很容易传播。
有香味的卫生用品或其他物品,如用含有合成香料的洗衣粉洗涤的内衣,会破坏阴道微生物组。阴道有一种自然的气味。如果闻到比平时更刺鼻的气味,则可能表明阴道微生物组失衡。
冲洗会破坏阴道的天然微生物组,使其容易受到感染。肥皂和化学女性卫生用品会改变 pH 值的酸度,也可能杀死或去除有益细菌,还会引入新的细菌,从而降低抵御潜在感染的防御屏障。
有些女性认为所有的内衣都是一样的。但是紧贴生殖器区域皮肤穿的衣服会有所不同。“穿白色棉质内衣,不要染色”,研究人员表示,“而且阴道需要呼吸空间,所以不要穿紧身牛仔裤。”
膳食糖会滋养阴道中的酵母菌和其他有害细菌。“避免在饮食中加糖——不要吃小麦,不要吃甜食,”一些研究人员提倡“绿色”饮食,富含健康脂肪和低糖食物、富含微量营养素的植物性食物,如鳄梨、坚果、种子和十字花科蔬菜。
吸烟可以改变阴道内的雌激素和 pH 值;同时研究发现宫颈/阴道分泌物中含有微量尼古丁,可能会促进炎症。
如果低雌激素或阴道干燥影响阴道 pH 值,外用雌激素乳膏可能会有所帮助。 外用雌激素乳膏仅供处方使用,因此如果怀疑低雌激素(或雌激素波动不稳定)导致阴道生态系统失衡,请咨询医生。“如果女性处于围绝经期或绝经后,阴道雌激素治疗是降低阴道 pH 值的最有效方法。”
拥有健康的阴道菌群对孕妇尤为重要。怀孕对身体来说是一个非常特殊的条件。它还会改变荷尔蒙平衡。伴随的高水平雌激素也会影响阴道菌群。由于免疫系统更敏感,孕妇也更容易受到感染。
孕妇阴道菌群紊乱可能导致病原体传播。在细菌性阴道病的情况下,早产或流产的风险会增加。注意到阴道分泌物(外观和气味)发生变化的孕妇应咨询妇科医生。
阴道微生物组与人类宿主形成稳态和互惠关系,并在阴道健康和疾病中发挥重要作用。内部和/或外部因素的变化导致平衡的生态系统崩溃,这也称为生态失调。
乳酸杆菌似乎在维持健康的阴道微环境中起着核心作用。阴道菌群失调涉及微生物多样性或丰度的变化,特别是乳酸杆菌或某些厌氧细菌,这会导致炎症。这些相关微生物会影响免疫介质,而免疫介质可作为阴道环境中生态失调的预测性生物标志物。
基于调节阴道菌群平衡的研究,可用于了解阴道微生物组如何影响怀孕和分娩;同时可能成为细菌性阴道病、早产、不孕等疾病的新的靶点,深入了解相关作用机制,有助于更多改进的和准确的诊断和治疗策略的开发。

主要参考文献:
Gudnadottir U, Debelius JW, Du J, Hugerth LW, Danielsson H, Schuppe-Koistinen I, Fransson E, Brusselaers N. The vaginal microbiome and the risk of preterm birth: a systematic review and network meta-analysis. Sci Rep. 2022 May 13;12(1):7926. doi: 10.1038/s41598-022-12007-9. PMID: 35562576; PMCID: PMC9106729.
Hong X, Ma J, Yin J, Fang S, Geng J, Zhao H, Zhu M, Ye M, Zhu X, Xuan Y, Wang B. The association between vaginal microbiota and female infertility: a systematic review and meta-analysis. Arch Gynecol Obstet. 2020 Sep;302(3):569-578. doi: 10.1007/s00404-020-05675-3. Epub 2020 Jul 8. PMID: 32638096.
Joseph RJ, Ser HL, Kuai YH, Tan LT, Arasoo VJT, Letchumanan V, Wang L, Pusparajah P, Goh BH, Ab Mutalib NS, Chan KG, Lee LH. Finding a Balance in the Vaginal Microbiome: How Do We Treat and Prevent the Occurrence of Bacterial Vaginosis? Antibiotics (Basel). 2021 Jun 15;10(6):719. doi: 10.3390/antibiotics10060719. PMID: 34203908; PMCID: PMC8232816.
Chen X, Lu Y, Chen T, Li R. The Female Vaginal Microbiome in Health and Bacterial Vaginosis. Front Cell Infect Microbiol. 2021 Apr 7;11:631972. doi: 10.3389/fcimb.2021.631972. PMID: 33898328; PMCID: PMC8058480.
Zheng N, Guo R, Wang J, Zhou W, Ling Z. Contribution of Lactobacillus iners to Vaginal Health and Diseases: A Systematic Review. Front Cell Infect Microbiol. 2021 Nov 22;11:792787. doi: 10.3389/fcimb.2021.792787. PMID: 34881196; PMCID: PMC8645935.
Bastianelli C, Farris M, Bianchi P, Benagiano G. The effect of different contraceptive methods on the vaginal microbiome. Expert Rev Clin Pharmacol. 2021 Jul;14(7):821-836. doi: 10.1080/17512433.2021.1917373. Epub 2021 Apr 23. PMID: 33863265.
Saraf VS, Sheikh SA, Ahmad A, Gillevet PM, Bokhari H, Javed S. Vaginal microbiome: normalcy vs dysbiosis. Arch Microbiol. 2021 Sep;203(7):3793-3802. doi: 10.1007/s00203-021-02414-3. Epub 2021 Jun 13. PMID: 34120200.
Auriemma RS, Scairati R, Del Vecchio G, Liccardi A, Verde N, Pirchio R, Pivonello R, Ercolini D, Colao A. The Vaginal Microbiome: A Long Urogenital Colonization Throughout Woman Life. Front Cell Infect Microbiol. 2021 Jul 6;11:686167. doi: 10.3389/fcimb.2021.686167. PMID: 34295836; PMCID: PMC8290858.

谷禾健康


卵巢早衰
卵巢早衰(premature ovarian insufficiency,简称POI)在生殖系统疾病中位居首位,这些疾病可能会损害多个功能系统,降低生活质量,最终剥夺女性患者的生育能力。
目前的激素替代疗法不能改善受孕或降低全身并发症的发生率,可部分缓解症状。
日常食物中的营养成分包括碳水化合物、脂肪和脂蛋白、蛋白质和多肽、维生素以及含有植物雌激素的蔬菜或水果。这些是功能性营养素,在更年期期间具有增殖、抗炎、抗氧化和线粒体保护潜力。
除此之外,微生物相关营养物质,包括益生菌、益生元和合生元组合,在支持卵巢活力和调节其他重要生殖功能方面显示出很高的潜力。
本文主要介绍卵巢早衰的症状、发病率、风险因素,发病机制,与肠道菌群及阴道菌群的关联,后面着重介绍现有的关于卵巢早衰的膳食补充研究。
卵巢早衰,也称为原发性卵巢功能不全(简称POI)。


/ 卵巢早衰
健康女性的卵巢会产生雌激素。这种激素控制月经期并让人拥有生育能力(能够怀孕)。随着年龄的增长,卵巢最终会停止制造雌激素。有时,卵巢在预计绝经前很久就会停止工作。
注:绝经的平均年龄是 51 岁。
如果不到 40 岁,卵巢不再产卵,且月经停止,则可能是原发性卵巢功能不全,也就是我们通常所说的“卵巢早衰”。 甚至部分女性在青少年时期就开始了。
卵巢早衰不同于过早绝经。绝经是不可逆的;而有些卵巢早衰的女性,这种功能丧失是暂时的,也就是说,月经会在未来的某个阶段恢复。
对于大多数女性来说,最常见的症状是月经停止(或月经稀少)。
其他症状可能包括:
对于部分卵巢早衰的女性,月经变得不规律,卵巢可能会继续间歇性排卵并产生激素;这些女性可能会在卵巢完全关闭之前继续月经周期数月或数年。
对于大约十分之一的卵巢功能不全 (POI) 女性,她们的月经还没有开始,在很小的时候就出现了 POI,通常不到 20 岁。
什么时候应该怀疑自己可能有 POI?
POI可能在月经期突然停止时突然发生。或者,POI可以在月经停止前随着月经不规律的月份逐渐出现。
对一些人来说,怀孕困难可能是卵巢早衰的最早也是唯一的迹象。当症状被注意到时,通常是由于卵巢功能不良或功能不全导致雌激素分泌不足。
POI还会导致哪些问题?
在过去的几十年中,伴随着生活方式的快速改变和环境的恶化,POI 发病率的急剧上升。
在 40 岁以下的女性中,大约每 100 名女性中就有 1 名患有卵巢早衰。
在 30 岁以下的女性中,大约每 1000 名女性中就有 1 名会发生卵巢早衰。
在大约 90% 的情况下,POI 的确切原因是未知的。
研究表明,POI 与卵泡问题有关。卵泡是卵巢中的小囊,卵子在里面生长成熟。
一种卵泡问题是比正常情况更早地用完了工作卵泡。另一中问题是卵泡不能正常工作。
在大多数情况下,卵泡问题的原因是未知的。
某些因素会提高女性POI的风险:
注:
脆性 X 综合征,是常见的遗传性疾病,造成智力低下。
特纳综合征,指先天性卵巢发育不全。
艾迪生病,一般指肾上腺皮质功能减退症。
POI 的发生率逐渐增加,它与已知的致病基因高度异质,并影响多种生物活动,包括激素信号、代谢、发育、DNA 复制、DNA 修复和免疫功能。目前已知的 POI 基因只能解释一小部分患者。
细胞凋亡与 POI 密切相关,与卵母细胞在从原始卵泡到窦卵泡的成熟过程中丢失相关。
卵巢颗粒细胞凋亡是影响卵巢储备和功能下降的重要机制。女性一生当中只有0.1%卵泡可以发育成熟并完成排卵,其余卵泡在不同阶段发生闭锁,颗粒细胞凋亡是卵泡闭锁的重要因素之一。
正常卵巢与POI卵巢的卵泡生成受损
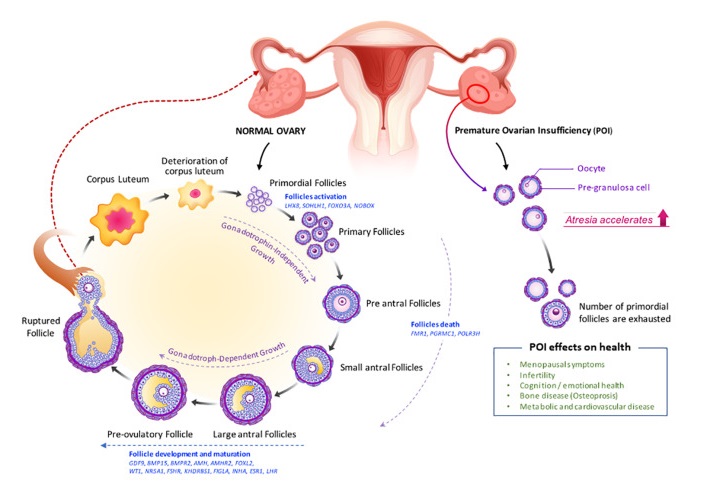
doi: 10.3389/fcell.2021.672890
在卵巢内因子和促性腺激素的调节下,初级卵泡发育成腔前卵泡和早期窦状卵泡,最容易发生闭锁或卵泡死亡。
然后,它们成为排卵前卵泡,导致卵母细胞释放和黄体形成。卵泡发生缺陷(如原始卵泡减少、闭锁增加和卵泡成熟度改变)导致POI。
涉及 DNA 损伤和修复、同源重组 (HR) 和减数分裂的基因中的大量基因突变。
这些基因包括基质抗原3(STAG3)、联会复合体中心元件1(SYCE1)、参与DNA修复的支架蛋白(SPIDR)、蛋白酶体26S亚基ATP酶3相互作用蛋白(PSMC3IP)、ATP依赖性DNA解旋酶同源物(HFM1)、mutS同源物(MSH)4、MSH5、MCM8、MCM9、cockayne综合征B-piggyBac 3(CSB-PGBD3)、核孔蛋白107(NUP107),以及乳腺癌易感基因(BRCA1和BRCA2).
内源性和外源性因素触发原始卵泡中DNA 双链断裂,由于细胞代谢的变化和氧化应激的升高,作为卵巢衰老的一部分,DNA损伤在原始卵泡中积累。在原始卵泡的氧化呼吸过程中,少量氧气首先在线粒体中转化为超氧化物,然后转化为羟基自由基。这些羟基自由基导致DNA单链断裂,如果双链断裂发生在多个相邻病变中,则会导致双链断裂和原始卵泡丢失。
线粒体是个多功能的细胞器,其异常与多种人类疾病相关,卵母细胞和颗粒细胞中的线粒体功能对卵巢的发育、功能维持都十分重要。
线粒体功能障碍可通过多种途径,如线粒体DNA 异常或逐渐积累的损伤、氧化应激、Ca2+ 对线粒体的直接损伤,导致卵子的发育潜能障碍,诱导卵子的凋亡而引起卵巢储备功能下降,进而发展成卵巢早衰。
▸TGF⁃β/ Smad 信号通路
TGF⁃β1/Smad 主要效应分子在卵巢组织中广泛表
达,参与病理性卵巢功能衰退,主要通过下调 TGF⁃β1/Smad3 信号通路因子表达,同时活化卵泡细胞质内 Smad2 表达;在生理性卵巢功能衰退中该信号通路的生物学效应可能与通过 Smad7 代偿性抑制通路的调节有关。
GDF-9 对窦状卵泡阶段的发育主要是通过减弱依赖 FSH的LH受体形成,防止卵泡过早发生黄素化和凋亡,直接决定卵泡池中卵泡数量,反映卵巢储备。
▸PI3-K / AKT 信号通路
磷酸酶和紧张素同系物(PTEN)/磷脂酰肌醇3激酶(PI3-K)/蛋白激酶B(AKT)/叉头转录因子3(FOXO3)信号通路在初级和进一步发育卵泡的卵母细胞的募集中起着重要作用。
PI3-K 和 AKT 过度激活可使原始卵泡过早发育及卵泡过快凋亡,进而发展成为卵巢早衰。
FOXO3a 是 PI3-K / AKT 信号通路下游的重要靶蛋白之一。FOXO3a的下调未能挽救颗粒细胞的凋亡死亡,导致卵母细胞丢失。卵母细胞特异性PTEN缺失导致全球原始卵泡激活,导致POI.
▸Wnt/ β⁃catenin 信号通路
合成类固醇激素是卵巢的重要功能之一。 目前现代医学认为卵巢 Wnt 信号通路可能是促性腺激素信号调节类固醇生成的重要信号途径之一。Wnt2 通过影响 β⁃catenin 的细胞定位来调节颗粒细胞增殖;β⁃catenin 参与合成卵巢甾体激素和黄体生成。
▸ SIRT 信号通路
SIRT1 通过调节氧化还原状态参与卵母细胞的成熟,以此减少氧化应激损伤导致的卵母细胞破坏和卵巢功能下降。
早发性卵巢功能不全患者存在系统性免疫失调,外周血T细胞亚群比例异常,Th1细胞占比显著升高,同时Treg细胞占比显著降低,提示细胞免疫参与早发性卵巢早衰发病。
注:Treg细胞是免疫抑制性淋巴细胞亚群,在维持免疫环境的稳定性和控制自身免疫疾病的发生中起重要作用。
免疫性卵巢早衰可能与辅助性Th17细胞过度活跃关系密切,E2水平低下时Th17细胞可过度激活,使机体免疫应答增强。
研究显示,卵巢早衰患者 Th17/Treg 水平较健康妇女明显增高,Th17和Treg 细胞表达失衡引发免疫调节紊乱,最终导致卵巢组织破坏和衰竭。
■ 为什么说肠道菌群与POI之间存在关联?
▸ 卵巢的自身免疫损伤
卵巢通过 T 细胞亚群的改变、T 细胞介导的损伤、产生自身抗体的 B 细胞的增加、效应抑制/细胞毒性淋巴细胞的减少以及自然杀伤细胞的减少而受到自身免疫的损害。
▸ 肠道菌群在自身免疫过程中发挥关键作用
肠道微生物群产生的肽可能会诱导免疫细胞产生自身反应和交叉激活。肠道微生物群的失调不仅会影响B淋巴细胞的激活和自身抗体的产生,还会诱导先天免疫细胞的异常激活,从而导致促炎细胞因子的上调。
▸ 肠道菌群在卵巢早衰中发挥重要作用
肠道微生物组在POI相关症状中发挥重要作用,包括自身免疫功能障碍、骨骼健康、认知、神经健康等。肠道微生物群及其代谢产物还具有调节炎症途径激活、脑肠肽分泌和胰岛β细胞破坏的能力。
我们具体来看相关的研究 ↓↓

2021年,深圳妇幼保健院检测了部分患者的肠道菌群,卵巢早衰女性(n = 35),健康女性( n = 18).
▸ POI患者中肠道菌群变化
下列菌群在POI女性中较少:
而下列菌群在POI女性中更丰富:
▸ 肠道菌群与自身免疫反应的关联
可以看到,拟杆菌属、双歧杆菌属和普氏菌属的相对丰度在该研究的POI组中均有所增加。这些菌群与自身免疫反应有何关联呢?
注:Th17细胞能够分泌产生IL-17A、IL-17F、IL-6以及TNF-α等,其功能主要就体现在它分泌的这些细胞因子集体动员、募集及活化中性粒细胞的能力上。
▸ 肠道菌群代谢产物诱导免疫调节活性
此外,双歧杆菌属、Blautia、Clostridium、Faecalibacterium、Roseburia和Ruminococcus可在人体肠道中产生短链脂肪酸,短链脂肪酸可以发挥什么作用呢?
综上,POI组肠道微生物组的所有这些变化可能通过某些细菌菌株及其代谢产物诱导免疫调节活性,这可能与自身免疫有关,进而影响POI的发展。
▸ POI肠道微生物群的改变与性激素有关
在这项研究中,在POI受试者中观察到显著较低的E2水平,通过调整BMI,E2水平与拟杆菌属、厚壁菌属和粪杆菌属的比例显著相关。FSH、LH和AMH水平也与某些微生物有关。
▸ 肠道菌群影响雌激素水平,雌激素调节的反应与POI相关
肠道微生物组通过分泌β-葡萄糖醛酸酶影响雌激素水平,使雌激素解凝,影响相关生理过程。
越来越多的研究表明,雌激素调节糖脂代谢、骨形成和炎症反应,其减少可损害雌激素依赖性过程,引发心血管疾病、骨质疏松等。这些症状都与POI有关。
肠道微生物群的失调与POI的发展有关,然而在进一步的研究中,还应考虑大样本量和多中心研究,来探索潜在的因果机制。
■ 为什么说阴道菌群与POI之间存在关联?
研究表明,细菌性阴道病与不孕有关。细菌性阴道病也被证明会改变阴道微生物组。
先前的一项研究表明,阴道微生物组在卵巢早衰的病理生理学中起着重要作用,卵巢早衰患者中乳杆菌属细菌的相对丰度显著低于健康对照组。因此,阴道微生物组和POI之间可能存在关系。
▸ POI患者中阴道菌群变化
下列菌群相对较少:
下列菌群显著增加:
我们具体来看相关的研究 ↓↓

2021年,深圳市妇幼保健院检测了部分患者的阴道菌群,卵巢早衰女性(n = 28),健康女性( n = 12).
▸ 阴道菌群与自身免疫反应的关联
可以看到,POI组中乳杆菌属、Odoribacter和Brevundimonas显著减少,链球菌属显著增加。这些菌群变化与自身免疫反应有何关联呢?
▸ 性激素水平会影响女性生殖道的防御能力和生殖期内的阴道微生物群
激素促进增生并增加糖原生成;糖原可以被阴道中的优势细菌乳酸杆菌转化为乳酸。这有助于保持阴道的酸性环境,抑制病原体的生长,并增强免疫系统。
在这项研究中,乳杆菌的比例与雌激素水平呈正相关,但与FSH水平呈负相关。POI患者的乳酸杆菌丰度和雌激素水平显著下降,FSH水平显著增加。
此外,AMH、FSH、LH、PRL、P和睾酮水平也与一些微生物有关,包括 Streptococcus, Odoribacter, Brevundimonas, Anaerococcus, Atopobium, Peptoniphilus, Prevotella, Veillonella,这增加了阴道微生物群改变与性激素相关的证据。
▸ 雌激素可以调节POI相关症状
越来越多的证据表明,雌激素可以调节POI相关症状,包括GLU和脂质代谢、骨形成和炎症反应。
在该研究中,GLU水平与Odoribacter和普雷沃氏菌属呈负相关。此外,PRL可以抑制FSH和促性腺激素释放激素以促进生育,这与厌氧球菌和嗜酸乳杆菌呈正相关。
▸POI患者阴道菌群的失调与卵巢功能密切相关
由于半乳糖和半乳糖代谢产物的积累,卵巢功能容易受损。先前的一项研究发现,半乳糖抑制了卵巢卵泡的数量和类固醇分泌。半乳糖代谢产物,包括1-磷酸半乳糖、半乳糖醇和尿苷二磷酸半乳糖,在干扰卵巢细胞凋亡和促性腺激素信号传导方面发挥重要作用。
患有POI的女性LACTOECAT-PWY通路的活性显著降低。这表明,患有POI的女性体内可能会积聚半乳糖,从而损害卵巢功能。患有POI的女性ARGONPROST-PWY通路显著富集。L-精氨酸与卵巢功能的调节相关。这可能对卵巢功能不利。
DNA损伤通过激活线粒体凋亡途径导致生殖功能障碍。
该研究结果表明,在POI患者中,许多与核糖核苷酸生物合成相关的途径发生了改变。
其他来自同济医院绝经与卵巢衰老专科门诊的研究数据发现:
双歧杆菌主要定殖在人体肠道中,在阴道中仅以低水平存在。作为一种益生菌,它具有抗炎作用、提高免疫功能和抵抗氧化损伤。临床研究发现,双歧杆菌可以改善绝经后妇女的新陈代谢和心血管功能。
Gardnerella和Atopobium均属于放线菌,在研究中发现 POI 患者显着富集,并且与卵巢储备下降、内分泌紊乱和围绝经期综合征症状显着相关。
阴道微生物组不仅反映了阴道的细菌组成,还反映了宿主的一般状况,包括激素和免疫状态等。阴道微生物群的失调与POI的发展有关,然而在进一步的研究中,还应考虑大样本量和多中心研究,来探索潜在的致病机制。
➔
这些测试可能帮助找到不孕的原因,找出排卵发生的时间,找出月经不规律或停止的原因,确认更年期或围绝经期的开始等。
➔
如果患有与POI相关的疾病,那么也必须对其进行治疗。治疗可能涉及药物和激素。
目前,没有经证实的治疗方法可以恢复女性卵巢的正常功能。但有一些治疗卵巢早衰症状的方法,或者可以降低其风险并解决POI可能导致的疾病:
激素替代疗法(HRT)
HRT是最常见的治疗方法。它给身体提供了卵巢无法产生的雌激素和其他激素。HRT可以改善性健康,降低患心脏病和骨质疏松症的风险。通常需要服用到50岁左右;这大约是更年期开始的年龄。
体外受精(IVF)
如果患有POI并且想怀孕,可以考虑尝试试管婴儿。
有规律的体育锻炼
有规律的体育锻炼,维持健康的体重,可以降低患骨质疏松症和心脏病的风险。
其他相关膳食补充方式,将在下一章节详细介绍。
除了那些遗传、免疫或医源性因素之外,日常饮食和生活方式中的营养摄入对于 POI 患者来说是最容易获得和改变的。
关于不良饮食习惯影响女性生育力和更年期的营养状况和调节的研究较少,这里初步提出了一些主要饮食因素和营养素:
Han Q, et al., Front Microbiol. 2022
碳水化合物为所有生物提供了最丰富的生命支持能源,通常分为单糖、寡糖和多糖。
Han Q, et al., Front Microbiol. 2022
半乳糖:毒性作用
半乳糖是卵巢早衰和相关不孕疾病中报道的一种常见单糖,它对卵巢产生了毒性作用。
半乳糖还可能抑制卵泡向性腺区域的迁移,并导致卵巢储备和雌二醇合成减少。因此,糖-半乳糖代谢异常与卵巢早衰的发生和发展有关。

铁皮石斛多糖:保护作用
铁皮石斛多糖(DO)对自然老化啮齿动物的卵巢早衰过程产生保护作用。
口服给药剂量为70 mg/kg,有助于这些大鼠恢复正常体重,减轻卵巢的病理变化,如血管增殖减少和卵泡减少。
DO导向的多糖通过调节NF-κB和p53/Bcl-2信号通路,提高谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)活性,降低血清中丙二醛(MDA)浓度,从而发挥抗氧化作用,从而减少卵巢组织的炎症损伤。同时还操纵了线粒体功能,恢复了卵巢细胞的活力。
碳水化合物对卵巢早衰发病或进展的重要性应进一步评估。
脂肪和体重高可能与卵巢早衰严重程度的控制有关。


Han Q, et al., Front Microbiol. 2022
一些研究报告称,绝经早期与低体重指数相关。具体机制尚不清楚。
脂蛋白是可运输的脂肪形式,积极参与人体内的代谢活动。
研究人员对卵巢早衰患者进行了血脂分析,发现血清中较高的甘油三酯(TG)浓度和较低的高密度脂蛋白(HDL)水平与游离雄激素指数增加和性激素结合球蛋白丢失相关。这些发现表明,TG升高可能导致胰岛素敏感性降低。
在另一项回顾性临床研究中同样发现,与具有密切流行病学特征的正常女性相比,出现卵巢早衰综合征且既往无激素摄入史的年轻女性患者血清中总胆固醇(TC)和低密度脂蛋白(LDL)浓度更高。结果表明,女性卵巢早衰患者在雌激素缺乏的情况下会引发脂质改变。
然而,不同研究中HDL的浓度水平非常不一致,一些研究报告HDL水平升高,另一些研究报告更年期妇女HDL水平降低。
至于脂肪摄入对更年期的影响,不同种类的脂肪可能会造成差异,包括多不饱和脂肪、总脂肪和饱和脂肪。
有研究认为,多不饱和脂肪的高消费与绝经较早有关;同时,总脂肪和饱和脂肪摄入量几乎不影响绝经期和年龄。
然而,尚不清楚日常饮食中的不同脂肪类型是否会以某种方式影响卵巢早衰的发病机制。
“
高蛋白摄入有助于推迟更年期的提前到来


Han Q, et al., Front Microbiol. 2022
研究发现,海鲜(每周约3天)和新鲜鸡蛋(每周超过4天)的消费与绝经晚期发病呈正相关。其他几项研究也支持类似的结论。研究人员认为,高蛋白摄入有助于推迟绝经并延长生殖功能。欧洲癌症与营养前瞻性调查(EPIC)还进行了一项队列研究,其中早期绝经的发生与蛋白质摄入量呈负相关。
除了直接摄入蛋白质外,多肽对保护卵巢功能和延缓卵巢衰老也很重要。
通过酶解从牡蛎中纯化的牡蛎多肽,由于其DPPH(2,2-二苯基-1-苦酰肼基)自由基清除剂能力,能够保护其免受氧化应激和炎症,从而对卵巢早衰产生治疗作用。
牡蛎多肽可以纠正异常的发情周期,提高血清卵泡刺激素(FSH)和黄体生成素(LH)浓度。此外还增加了原始卵泡计数和分布,并通过模拟SOD清除显著减轻了卵巢细胞死亡。牡蛎多肽支持的卵巢细胞保护和存活在调节死亡受体BCL-2依赖性信号通路时被激活。因此,适当的蛋白质和肽摄入可能是影响卵巢早衰进展和严重程度的潜在途径。
维生素是一类仅来自食物的微量有机物质,在人体内维持一些重要的生理活动和功能。它们不提供能量,但调节代谢过程。许多维生素在支持女性健康方面发挥着关键作用,如维生素B、C、D、E和一些辅酶。


Han Q, et al., Front Microbiol. 2022
烟酸:改善卵泡发育,保护卵巢
烟酸属于维生素B家族,代谢细胞能量,并直接影响正常生理。除了许多神经和皮炎疾病外,烟酸还通过抑制氧化应激来改善卵泡发育,从而减少卵巢细胞死亡。
有趣的是,烟酸还能够改变卵巢早衰表型并恢复化疗或辐射刺激诱导的雌性卵巢早衰小鼠。作者进一步证实,添加10 Mmol烟酸可以降低卵泡阻滞标记FOXO3的表达水平,并增加卵母细胞标记DDX4的表达水平以发挥卵巢保护作用。
叶酸:妊娠率更高,提高卵母细胞的质量和成熟度
叶酸是一种水溶性维生素B,对蛋白质合成、红细胞分裂和生长很重要。
一项基于小样本的临床研究报告称,与安慰剂治疗相比,低生育率女性在接受400μg叶酸治疗12周后的妊娠率更高。叶酸的摄入缩短了健康女性的备孕时间,并提高了卵母细胞的质量和成熟度。
MTHFR可以强烈影响叶酸循环,并帮助同时患有非霍奇金淋巴瘤和重复妊娠损失的卵巢早衰患者成功分娩出健康的男婴。
维生素C:显著刺激卵巢标志物的表达
维生素C是一种天然抗氧化剂,并积极参与干细胞调节。
据报道,维生素C修饰人羊膜上皮细胞(hAECs)的生物学特性,并显著刺激移植POI小鼠卵巢组织中卵巢标志物的表达。
注:羊膜细胞通俗地说就是包裹羊水的那层透明薄膜上的细胞。
可能的影响机制是维生素C依赖的几种重要生长因子的旁分泌,如肝细胞生长因子和表皮生长因子。
维生素D:有争议
维生素D属于脂溶性维生素,通过调节钙和磷酸盐代谢对维持生命至关重要。其活性形式1,25-二羟基维生素D3定位于许多器官,如肾脏、肝脏、大脑和卵巢。在女性生殖系统中,维生素D可以调节颗粒细胞中的抗苗勒氏激素(AMH)分泌,从而影响FSH水平。
然而,它在卵巢早衰发病机制中的作用是有争议的,因为一些人声称它不影响卵巢早衰的病理生理过程。
而另一些人则报告维生素D缺乏与凝血相关,是由于卵泡发育不良和芳香化酶水平降低而导致卵巢早衰的主要因素。
先前的研究也没有报告任何关于补充维生素D治疗卵巢早衰的证实性发现。研究发现,在约2个月内,每周摄入50000 IU的维生素D与临床上的妊娠改善无关。提高卵子受体患者的血清维生素D水平也不能改善IVF结局。
因此,维生素D对卵巢早衰患者的意义的解释仍然模糊,仍需进一步调查。
维生素E:增加卵巢体积并刺激初级卵泡的增殖
维生素E主要由生育酚和生育三烯醇组成,它们在生理和病理条件下对清除自由基很重要。维生素E缺乏可能导致雌性啮齿动物模型中的卵巢细胞死亡和发育异常。
在一项临床研究中,在40名患者中,维生素E与卵巢早衰的发病有关。在月经正常的女性中,维生素E-α生育酚的活性形式浓度显著高于卵巢早衰患者。进一步分析表明,这可能与AMH表达水平降低有关,并表明卵巢储备能力在卵巢早衰发病机制中受到损害。
在另一项随机对照试验研究中,向卵巢早衰患者服用400IU的维生素E 3个月,除改善AMH水平外,还显著增加了窦卵泡数和平均卵巢体积。
补充维生素E可能有助于缓解卵巢早衰过程,几乎不会产生副作用。
植物雌激素确实不是雌激素的一部分,但通过提供高亲和力的雌激素受体β作为激素补充剂,其功能类似。


Han Q, et al., Front Microbiol. 2022
它们通常包括大豆异黄酮和芝麻木脂素,这两种都是我们日常饮食中重要和普通的食物类型。几项研究证实了植物雌激素消耗对绝经后女性TC、LDL和血脂的降低作用。
大豆异黄酮摄入也显著缓解了髂动脉动脉粥样硬化,绝经前后5年内食用大豆食物的女性减少了冠状动脉斑块的大小。对于绝经后开始以大豆食品作为日常饮食的人来说,这种有益效果并不明显。
研究人员指出,大豆异黄酮可以通过卵巢切除术减少更年期啮齿动物的潮热。该效应基于肠道微生物群和雌激素样机制产生的异丙戊酸雌马。
芝麻籽木脂素(芝麻籽油中的一种成分)在小鼠模型中增加了脂肪酸的β-氧化,并抑制了胆固醇的吸收。芝麻酚是一种强抗氧化剂,也是芝麻的主要成分。它可以改善记忆,减轻焦虑情绪,减少中枢神经系统中的氧化剂损伤。同时,与卵巢切除后的绝经大鼠相比,芝麻酚还通过降低血清中肿瘤坏死因子-α(TNF-α)浓度来调节血清中的脂质成分,并降低炎症效应。
益生菌、益生元和合生元


Han Q, et al., Front Microbiol. 2022
益生菌促进营养物质的消化和吸收,提高免疫功能,维持肠道菌群的结构平衡,并增强人体的抗氧化水平。许多益生菌应用于食品补充剂和医疗。对于女性健康,激素水平与肠道或阴道微生物群之间存在密切相关性。
在平滑肌瘤和乳腺癌患者中,肠道微生物群被视为雌激素的替代代谢供应商,主要富含大肠杆菌、梭状芽孢杆菌、乳酸杆菌和拟杆菌。
考虑到这些现象,益生菌的调节作用也可以通过改变几种具有雌激素或抗雌激素性质的蔬菜成分(称为植物雌激素,如大豆异黄酮、木脂素等)的代谢活性和效率以间接方式调节肠道微生物群来发挥。
益生菌参与调节经前综合征、泌尿生殖道感染和骨质疏松症。雌激素缺乏是与卵巢早衰后骨炎症和吸收相关的骨质疏松症的主要原因。
先前的研究表明,肠道微生物群对骨形成和代谢有潜在影响。在接受益生元治疗的小鼠、大鼠和鸟类中发现骨骼增加。
在体外和去卵巢的啮齿类动物研究中,益生菌罗伊氏乳杆菌抑制了骨髓CD4+T淋巴细胞的上调和随后的破骨细胞活化。研究人员假设罗伊氏乳杆菌可以直接使T细胞失活并抑制TNF-α的产生,并通过T细胞间接使基质细胞失活以减少破骨细胞因子的形成,从而增加骨代谢活性并减少骨损失。
在一项由60名40至60岁绝经后妇女组成的随机对照试验中,益生菌还增强了异黄酮的代谢活性,以缓解泌尿生殖系统问题,如阴道干燥和绝经后的不良性体验,连续治疗16周。该效果与低剂量阴道雌激素相当,后者是治疗更年期泌尿生殖系统综合征的金标准疗法。
研究人员在一项为期12周的随机临床试验中报告,1×1010菌落形成单位(CFU)浓度的多菌益生菌影响肠道通透性和心脏代谢参数,如脂多糖水平、胰岛素、葡萄糖、尿酸、脂肪质量、皮下脂肪和胰岛素抵抗指数。
研究人员在一项试点临床研究中发现,乳酸杆菌和蔓越莓提取物复合物可以防止女性患者在绝经前或绝经前后连续26周反复发生尿路感染。
益生元是发酵的膳食纤维,其在肠道微生物群的成分和/或生物活性方面都含有一定的修饰,对人体健康状况产生有益影响。目前,益生元主要包括双歧杆菌、不易消化的低聚糖(尤其是低聚半乳糖、菊粉及其水解产物低聚果糖)。
大量的营养益生元可能有助于钙的生物吸收,如酪蛋白磷酸肽(CPP),酪蛋白的蛋白水解产物,与钙一起构建可溶性复合物。此外,一些复杂的有机酸,如苹果酸或柠檬酸,可以增加肠道中生物可吸收钙的可溶性复合物的百分比。
益生元依赖性钙代谢的潜在机制包括来自结肠中细菌发酵碳水化合物的酸代谢产物,如乳酸、乙酸和丙酸,降低了pH值,以提高钙离子的管腔水平,并增加钙的被动生物吸收。此外,电荷可以通过Ca2+-H+复合物进行修饰。因此,益生元在女性绝经后骨质疏松症的预防和抑制中发挥了保护作用。
研究人员表明,壳聚糖和柑橘果胶这两种益生元增强了葡萄糖耐量,降低了血脂异常,并提高了血清精氨酸、丙酸、亮氨酸和丁酸水平。此外,壳聚糖更有助于调节肠道微生物群,从而影响绝经后症状。
还尝试将益生菌和益生素结合起来生产合生元。研究人员表明,副干酪乳杆菌和菊粉增强了异黄酮的生物活性可用性,有助于缓解更年期问题。
使用由发酵乳杆菌和花椰菜蘑菇中的β-葡聚糖组成的合生元作为益生菌和益生元,可以降低啮齿动物尾巴的皮肤温度,并保持血清和子宫指数中的17β-雌二醇水平。合生元依赖性机制进一步得到验证,因为它们激活了肝脏胰岛素信号,随后在雌激素缺乏大鼠中激活了AMPK磷酸化。
这些研究初步反映了益生菌、益生元和合生元在调节更年期综合征及其主要病理生理过程中的有益作用。这些发现对于研究卵巢早衰的发病机制和通过微生物营养策略治疗卵巢早衰至关重要。
营养对女性一生的健康至关重要,膳食营养素可以通过影响各个方面来延缓更年期,从直接提高卵巢活力和功能到抵消氧化应激、炎症、衰老和系统性内分泌失调。
越来越多的证据表明肠道菌群的改变与卵巢早衰相关,可能通过影响一些重要代谢物影响卵巢疾病进展,至于是否会导致血清代谢物失衡,进而导致更年期表现和相关健康问题,仍有待进一步验证。
从目前的研究来看,膳食和微生物营养素对于调节卵巢早衰等女性生殖障碍很重要且很有前途,因此,通过合理饮食、最佳生活方式对菌群进行干预是有希望的,值得更多研究人员的关注,希望为广大女性带来更健康的生活。
主要参考文献:
Han Q, Chen ZJ, Du Y. Dietary supplementation for female infertility: Recent advances in the nutritional therapy for premature ovarian insufficiency. Front Microbiol. 2022 Nov 17;13:1001209. doi: 10.3389/fmicb.2022.1001209. PMID: 36466679; PMCID: PMC9712792.
Chon SJ, Umair Z, Yoon MS. Premature Ovarian Insufficiency: Past, Present, and Future. Front Cell Dev Biol. 2021 May 10;9:672890. doi: 10.3389/fcell.2021.672890. PMID: 34041247; PMCID: PMC8141617.
Zhang X, Lu Y, Wu S, Zhao X, Li S, Zhang S, Tan J. Estimates of global research productivity in primary ovarian insufficiency from 2000 to 2021: Bibliometric analysis. Front Endocrinol (Lausanne). 2022 Oct 26;13:959905. doi: 10.3389/fendo.2022.959905. PMID: 36387882; PMCID: PMC9645456.
Wu J, Zhuo Y, Liu Y, Chen Y, Ning Y, Yao J. Association between premature ovarian insufficiency and gut microbiota. BMC Pregnancy Childbirth. 2021 Jun 5;21(1):418. doi: 10.1186/s12884-021-03855-w. PMID: 34090383; PMCID: PMC8180047.
Takahashi A, Yousif A, Hong L, Chefetz I. Premature ovarian insufficiency: pathogenesis and therapeutic potential of mesenchymal stem cell. J Mol Med (Berl). 2021 May;99(5):637-650. doi: 10.1007/s00109-021-02055-5. Epub 2021 Feb 27. PMID: 33641066.
Kim S, Lee SH, Min KJ, Lee S, Hong JH, Song JY, Lee JK, Lee NW, Lee E. Females with impaired ovarian function could be vulnerable to environmental pollutants: identification via next-generation sequencing of the vaginal microbiome. J Obstet Gynaecol. 2022 Jul;42(5):1482-1488. doi: 10.1080/01443615.2021.2006162. Epub 2022 Jan 7. PMID: 34996320.
Wu J, Ning Y, Tan L, Chen Y, Huang X, Zhuo Y. Characteristics of the vaginal microbiome in women with premature ovarian insufficiency. J Ovarian Res. 2021 Dec 8;14(1):172. doi: 10.1186/s13048-021-00923-9. PMID: 34879874; PMCID: PMC8655991.
Wen J, Feng Y, Yan W, Yuan S, Zhang J, Luo A, Wang S. Vaginal Microbiota Changes in Patients With Premature Ovarian Insufficiency and Its Correlation With Ovarian Function. Front Endocrinol (Lausanne). 2022 Feb 22;13:824282. doi: 10.3389/fendo.2022.824282. PMID: 35273569; PMCID: PMC8902819.