-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

更年期标志着女性衰老的一个关键里程碑,引发激素,组织学和微生物组的变化。
随着卵巢功能衰退,雌激素与孕激素的断崖式下降,不仅重塑了女性体内的激素图谱,更改变了口腔、肠道、阴道等关键部位的微生物群落平衡。
最新研究揭示,更年期的症状,从反复的腹胀、顽固的牙周炎到阴道感染,其背后与微生物组的“失控”密切相关:肠道菌群的多样性降低可能加剧骨质流失,而口腔微生物的代谢紊乱甚至与心血管风险形成隐秘联动。
激素波动在塑造这些微生物群落方面发挥关键作用,对疾病易感性有影响。雌激素影响微生物群落,而微生物可以代谢并影响雌激素水平。因此,激素与微生物组之间的相互作用是复杂且双向的。
联合国大会已将2021-2030年期间定为”健康老龄化十年“。联合国“健康老龄化十年”计划强调,尽管女性寿命更长,但更年期带来的独特健康挑战,如骨质疏松、心血管疾病和泌尿生殖系统感染,正威胁着她们的晚年生活质量。
社会经济因素和文化规范(如生活方式和营养习惯)也影响她们的健康和老龄化体验。因此,关注性别特定的健康需求并推广定制化的健康老龄化策略,对于提高老年女性的健康和生活质量至关重要。
本文系统阐述了更年期女性激素波动与微生物组(口腔、肠道、阴道)的动态互作机制,揭示了雌激素下降引发的菌群失衡如何加剧骨质疏松、心血管疾病、牙周病等健康风险,这为更年期健康管理从“症状缓解”转向“精准干预”提供了科学依据。
理解更年期转变包括激素变化、环境因素和微生物动态如何影响更年期症状和女性健康。这一见解可能推动精确疗法的开发,以缓解症状并最小化相关健康问题的风险,最终提高更年期女性的生活质量。
更年期是由于卵巢滤泡活动减少导致的连续12个月自然停经的永久现象,通常发生在50岁左右,但自然变化范围在40~59岁之间。
更年期女性有哪些症状?
常见症状
大多数情况下,更年期会随着时间的推移而发生。导致绝经的几个月或几年称为围绝经期或绝经过渡期。
在过渡期间,卵巢产生的激素量会有所不同。围绝经期可持续 2~8 年。平均约为 4 年。
激素变化会引起以下症状:
此外,更年期时口腔健康会因雌激素水平下降和口腔组织老化而受到影响。
不同的人有不同的更年期症状。大多数情况下,月经在结束之前并不规律。
围绝经期,通常,月经周期跳过一个月并返回。或者跳过几个月,然后再次开始每月一次的周期,持续几个月。围绝经期早期的月经周期往往会变短,随着更年期的临近,月经间隔会越来越远,直到结束。
需要注意的是,随着年龄增长,老化过程以及系统性疾病或药物对口腔变化的影响会增加。口干感、颞下颌关节功能障碍和心理生理障碍引起的并发症是一些更年期女性出现饮食障碍的多种原因之一。
另外,由于老化或雌激素下降导致的免疫功能受损可能会显著影响口腔感染的发生。
并发症
绝经后患某些疾病的风险会增加。比如:
更年期与什么因素有关?
30 多岁时,卵巢开始减少控制经期的激素,如雌激素和黄体酮。如果这些激素水平低,较难怀孕。
在 40 多岁时,月经期可能会变长或变短、变重或变轻,并且发生频率更高或更低。随着时间的推移,卵巢会停止释放卵子。那么就没有更多的月经了。这种情况平均发生在 51 岁左右。
卵巢产生控制月经周期的激素,包括雌激素、黄体酮。切除卵巢的手术会导致立即绝经。
月经停止,可能会出现潮热和其他绝经症状。症状可能严重,因为手术会导致激素立即下降,而不是在几年内缓慢下降。
切除子宫但不切除卵巢的手术称为子宫切除术,通常不会立即绝经。卵巢在一段时间内仍然会释放卵子并产生雌激素和黄体酮。
这些癌症疗法可导致更年期。它们会在治疗期间或治疗后不久引起潮热等症状。化疗后月经有时会恢复,仍然可以怀孕。
针对骨盆、腹部和下脊柱的放射疗法可导致绝经。用于干细胞移植的全身放疗也可能导致绝经。对身体其他部位(如乳房组织或头部和颈部)进行放射疗法可能不会影响绝经。
大约 1% 的更年期患者在 40 岁之前过早绝经。过早绝经可能是由于卵巢没有产生通常的激素水平造成的,也就是原发性卵巢功能不全,它可能由基因变化或自身免疫性疾病引起。
更年期期间,激素水平变化会影响肠道菌群组成和功能。研究发现某些肠道菌群能直接代谢雌激素和孕激素,形成双向关系:激素影响菌群,菌群也参与激素代谢。这种微生物变化可能加剧更年期症状。
具体我们将在下一章节详细阐述。
更年期时,体内激素变化会改变口腔、肠道、阴道和皮肤的微生物环境。研究发现某些肠道菌群能直接代谢雌激素和孕激素,当女性进入更年期时,激素水平下降导致的生理变化也会影响微生物群的组成和功能。
因此,探索微生物组与更年期之间的复杂相互关系揭示了缓解更年期症状和改善整体健康的有前景途径。通过调整饮食、使用益生菌和个性化微生物干预等方法,有望改善更年期女性的健康状况。
doi.org/10.1038/s44294-024-00050-y
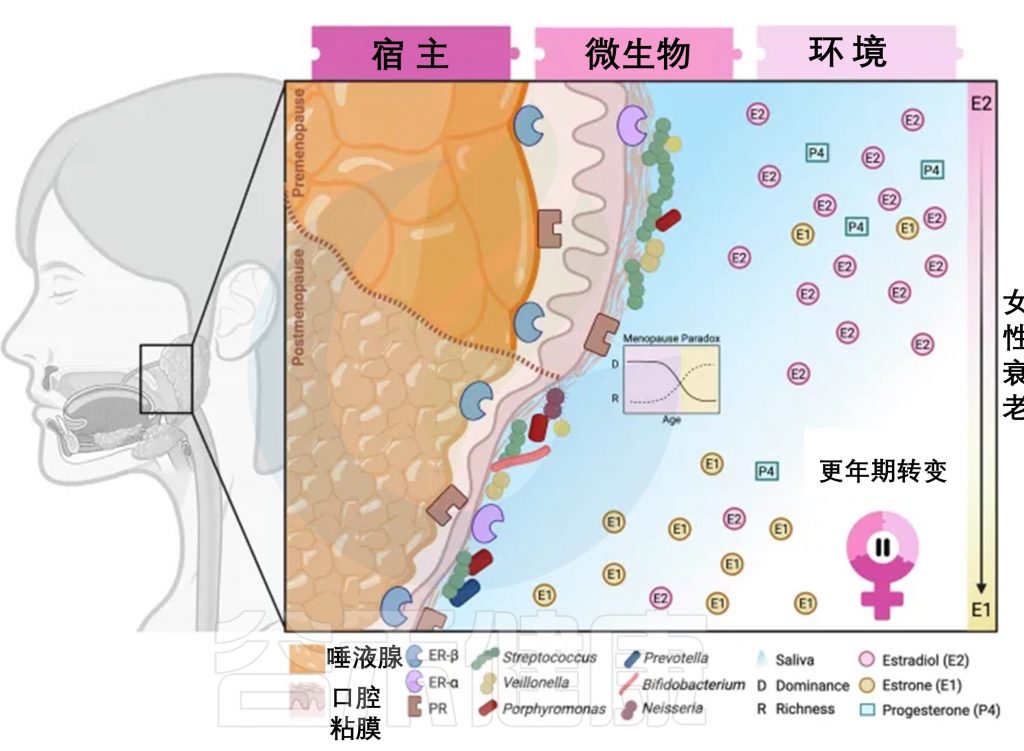
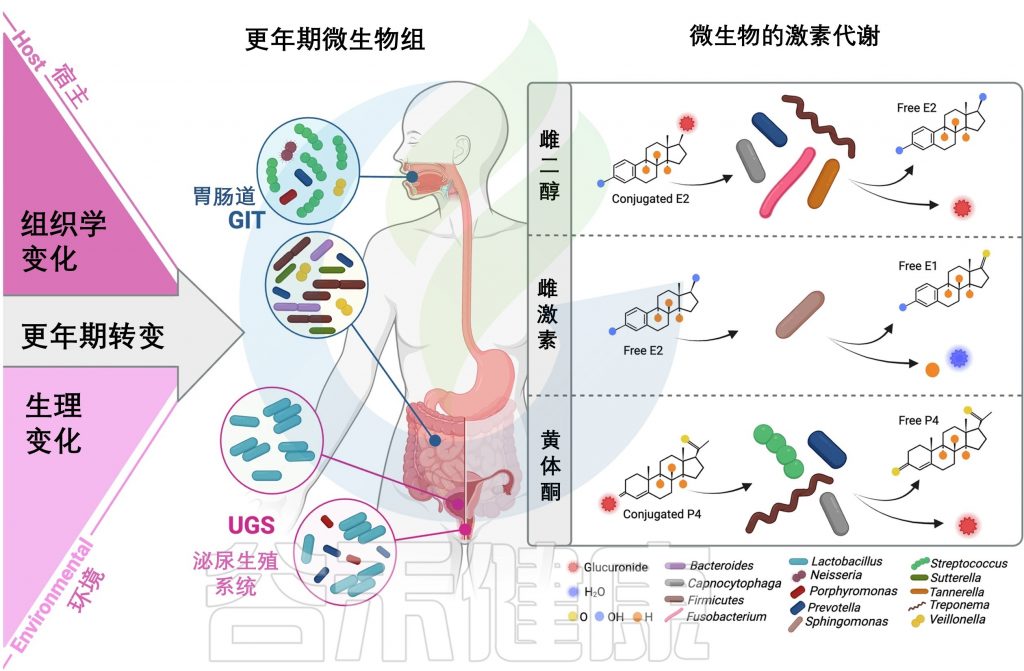
宿主、微生物、环境在更年期的变化
宿主变化
更年期期间,女性的身体会发生一系列改变。例如,唾液腺和口腔黏膜(如牙龈、舌头表面)会逐渐变薄甚至萎缩。类似的变化也可能出现在肠道、阴道等对激素敏感的部位,因为这些地方的组织里存在能接收雌激素、孕激素信号的“接收器”(激素受体)。
微生物变化
更年期期间,微生物组多样性(微生物种类分布)和丰富度(种类数量)会发生变化,这些变化受到宿主组织互动、激素代谢和环境变化的影响。
口腔细菌不仅局限于黏膜生态环境,还存在于牙龈或舌头等其他口腔部位。它们被视为能够代谢性类固醇激素的常驻口腔微生物群的一部分。
更年期悖论表现为阴道环境中微生物优势度降低但丰富度增加,这种现象可能适用于微生物群体中的其他身体部位。从临床角度看,微生物适应能力的变化可能导致感染等健康问题。
环境变化
唾液减少:唾液分泌减少,导致口腔干燥,细菌更容易滋生。
雌激素类型转换:卵巢不再生产强效的雌二醇,转而依赖脂肪组织合成的雌酮(效果较弱)。
孕激素“断崖式下降”:这种激素的减少可能削弱身体对炎症的控制能力。
雌激素与微生物组的双向互动
雌激素是与女性内分泌转变相关的主要性激素,包括青春期、妊娠期、更年期。雌激素就像是调节女性身体的总开关,特别在这些重要时期起作用:
在更年期过渡期间,女性的粘膜组织变薄变干,导致阴道和口腔细菌失调,这可以通过更年期激素治疗来缓解。
微生物组和性激素之间存在动态的双向相互作用,随着一些因素如衰老而变化。
▸雌激素存在两种形式:
人体内的雌激素水平通过以上两种形式的平衡来调节。
▸微生物的特殊能力:
肠道里的某些细菌有一种特殊”钥匙”(β-葡萄糖醛酸苷酶),这把”钥匙”能打开储备形式的雌激素,让它变成活跃形式,这些特殊细菌群体被称为”雌激素组”细菌。
游离雌激素可以被运输到许多部位,如阴道,并促进微生物组中乳杆菌的优势地位。因此,代谢性激素的微生物可以改变宿主对可用性的控制,从而影响与激素相关的生理过程。
▸互相影响的循环
雌激素水平影响微生物群落的组成,微生物又能影响体内实际可用的雌激素量;循环关系会随着年龄增长而改变。在更年期,这种平衡被打破。
因此了解这种关系很重要,因为通过调整微生物群(比如益生菌),可能有助于缓解一些更年期症状。
雌激素:从全身健康到口腔微生态的塑造
雌激素变化如何塑造女性一生的健康轨迹
雌激素,主要以雌二醇和雌酮形式存在,在女性从青春期到更年期的不同生命阶段经历显著变化。
在生育年龄,雌二醇是最强效且普遍的雌激素形式,随月经周期呈现周期性波动,在排卵期达到峰值。这种激素在生殖功能中扮演关键角色,影响全身健康,维持骨密度、心血管健康、性健康、情绪调节和认知健康。
然而,随着更年期的到来,雌激素动态发生明显转变。卵巢功能下降导致雌二醇产量减少,使雌酮成为主要雌激素形式。与雌二醇不同,雌酮在脂肪组织中合成,在排卵停止后维持某些雌激素活动。不过,在绝经后,整体雌激素活性降低。
在谷禾的检测实践中,也发现部分的45岁以上女性雌激素水平缺乏或偏低。
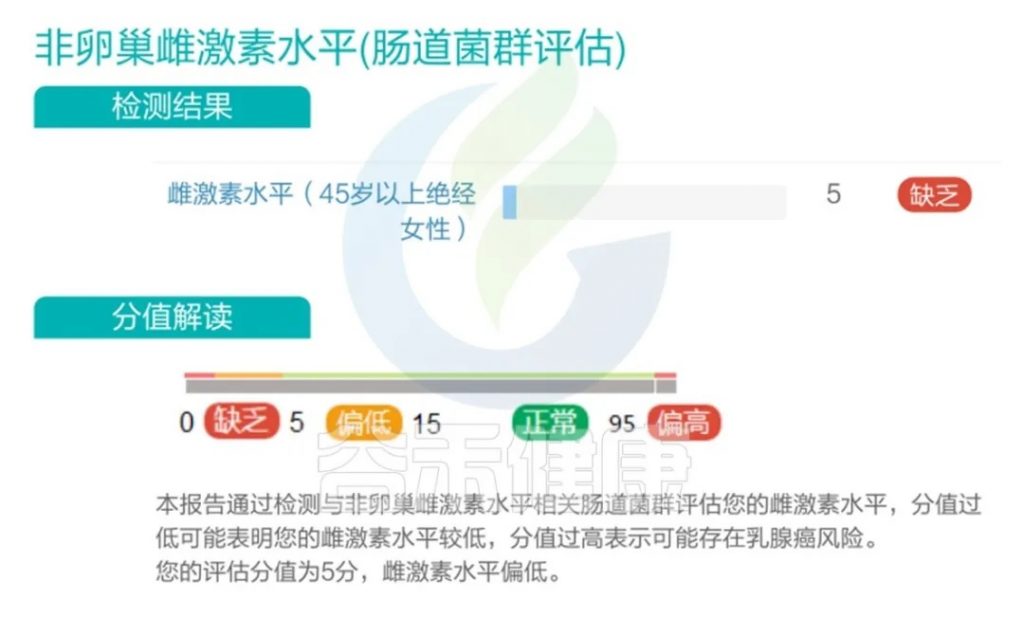
<来源:谷禾健康肠道菌群检测数据库>
多项研究将这种下降与骨质疏松、心血管疾病、认知障碍风险增加相关联。这一时期反映了雌激素在女性一生中的复杂相互作用,雌酮在雌二醇水平降低的情况下提供残留但不足的雌激素效应。这些女性激素水平的波动可能是女性在更年期过渡期间经历的影响其健康的身体和心理症状的原因。
雌激素循环途径
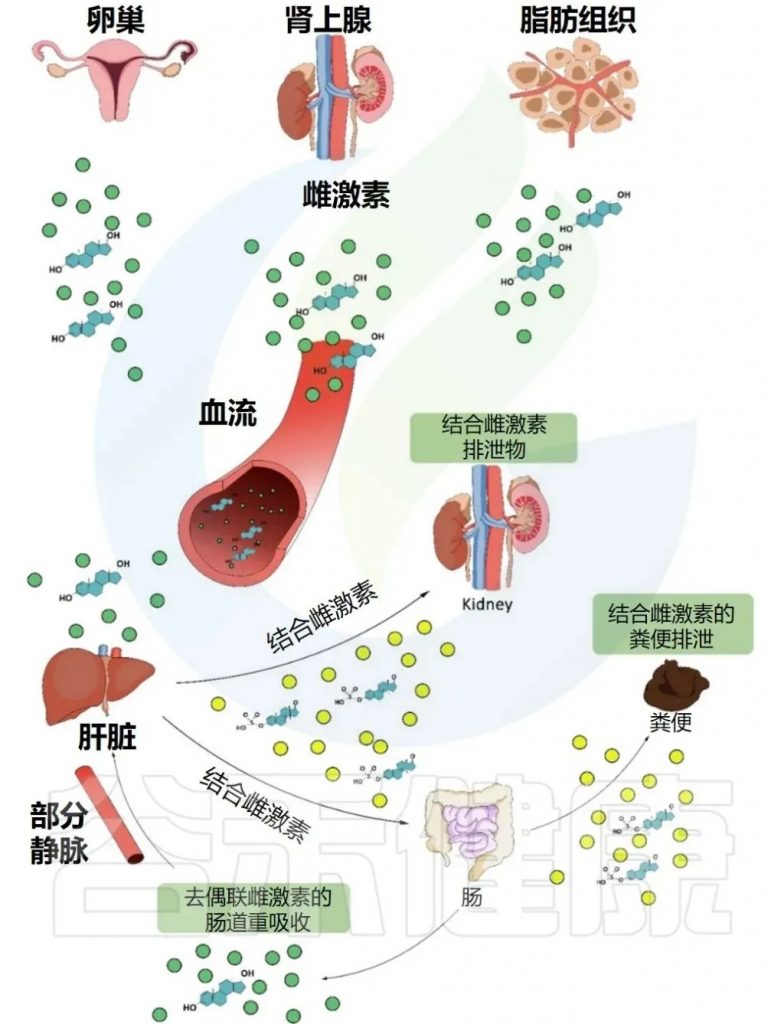
Valeri F,et al.Front Neuroendocrinol.2021
激素如何影响口腔健康?
口腔液体自然含有激素。在口腔中,唾液和牙龈沟液对维持健康完整性起着重要作用。唾液和牙龈沟液共享一些代谢物和途径,但也有各自独特的成分。
唾液主要由水、矿物质、电解质、激素、酶、免疫球蛋白和细胞因子组成。唾液的生理水平对口腔健康至关重要,因为它影响口腔中的各种因素,如防止龋齿、免疫过程、消化。唾液中含有卵巢分泌的高活性天然雌激素17β-雌二醇、孕激素、雌酮。
在唾液腺腺泡和导管细胞中发现雌激素-β受体,表明雌激素缺乏可能是更年期女性唾液分泌和无机成分变化的病因。唾液的成分和流量也可能受某些药物影响,如抗抑郁药、降压药、口腔消毒剂和癌症治疗药物。
更年期唾液变化:酸性环境与口腔健康风险的隐秘关联
激素缺乏可能导致唾液在数量和质量上发生变化,破坏口腔内环境平衡,影响口腔微生物群并导致细菌定植。绝经后女性唾液pH值和流量的变化直接导致口腔疾病增加。
唾液pH值与年龄之间的关系存在争议
患者体内的氢离子浓度随年龄增长而增加,使他们处于更酸性的环境中。有研究报告显示,与绝经前女性相比,绝经后女性的唾液pH值较低,而其他研究则发现不同组别之间的唾液pH值没有显著变化。
2018年发表的一项病例对照研究(n=80)显示,与对照组(n=40)相比,绝经后女性(n=40)的唾液流量和pH值降低。因此,更年期的激素变化可能导致女性体内pH值更酸性,增加口腔组织与老化相关的损伤风险。然而,身体其他部位的pH值却会增加,从而导致细菌感染。
激素波动如何破坏牙龈健康?微生物与炎症
相比之下,牙龈沟含有血清衍生的牙龈沟液。牙龈液中含有雌二醇和孕激素,其波动影响牙龈组织。雌激素降低角质化程度,增加上皮糖原,并影响成纤维细胞增殖和蛋白质生成。
孕激素增强血管通透性,减少糖胺聚糖合成,改变胶原蛋白生成速率和模式,并抑制IL-6生成。女性类固醇激素对牙龈产生促炎作用。
存在牙龈炎等牙龈炎症期,这与微观解剖结构改变以及牙龈和龈下细菌群落增加相关。尽管雌二醇水平在更年期期间急剧下降,但雌酮等其他形式的雌激素可能影响牙龈组织。
由于牙龈环境中有常驻微生物生物膜群落,而唾液中含有暂时性浮游微生物群,这两种口腔环境都能在激素波动期间影响宿主-微生物相互作用。因此,研究口腔液体是否含有各种浓度的激素以及微生物群可获取的形式至关重要。
更年期女性的身体“改造”:从皮肤到骨骼
激素撤退的连锁反应:黏膜屏障弱化与阴道健康警报
卵巢激素受体存在于鼻咽黏膜、胃肠道和女性泌尿生殖系统中。性激素的作用影响口腔黏膜、牙龈和唾液腺组织。更年期发生的激素变化产生血管运动改变,导致血管通透性和炎症介质发生变化。
雌激素和孕激素调节女性生殖道的黏膜屏障和免疫反应,若它们的水平改变可能引起阴道症状。与更年期相关的最常见阴道症状是因雌激素缺乏导致的阴道干燥以及阴道上皮变薄、失去防御元素。
一些最常见的病理状况包括外阴阴道萎缩、复发性尿路感染、细菌性阴道病和阴道念珠菌病。结果,阴道区域出现灼热感、瘙痒和刺痛。
口腔与阴道的”镜像变化”
更年期女性常惊讶于口腔干燥与阴道灼痛的同时出现,这背后暗藏黏膜系统的深层关联。在微观层面,口腔和阴道上皮在超微结构、角蛋白丝分布、水渗透性和化学成分方面表现出相似性。这一点特别值得注意,因为阴道上皮在更年期期间及之后会经历各种变化,这暗示着对口腔上皮可能的影响。
多项研究发现,两种黏膜的上皮细胞层数没有显著差异。同样,角质化模式和细胞间隙的脂质层分布也很相似。所有这些表明,鉴于它们的微观相似性,绝经后女性阴道黏膜因缺乏激素刺激而观察到的变化也可能以相同方式影响口腔上皮。
有研究表明,口腔、阴道和肠道微生物群的组成可能受雌激素水平调节。因此,性激素的减少被发现会引起宿主的炎症反应增加,可能导致口腔微生物平衡失调。这可能导致各种牙龈病理,其中更年期龈口炎尤为突出。
口腔里的激素“接收器”与更年期连锁反应
我们的口腔中藏着一些特殊的“激素接收器”——牙龈和唾液腺里分布着能感应雌激素、孕激素的受体。就像乳腺组织一样,唾液腺里主要存在雌激素受体α(ERα),而牙龈中则富含另一种“接收器”雌激素受体β(ERβ)。这些受体像开关一样,帮助激素调控口腔组织的健康状态。
此外,唾液腺和牙龈细胞里还发现了孕激素受体(PR),协同调节激素对口腔的影响。
更年期为何容易“口干”?
唾液腺中的腺泡和导管细胞(尤其是腮腺、颌下腺)密布激素受体。当更年期雌激素断崖式下降,这些“接收器”失去信号,唾液分泌可能减少,导致口干、黏膜干燥等问题。
激素撤退的全身风暴
更年期后性激素水平的急剧下降,尤其是雌激素水平,对神经系统、心血管系统、风湿性疾病、内分泌系统、胃肠道和泌尿生殖道有众多影响。在绝经前女性中,性类固醇激素通过其受体展示直接血管扩张作用,表明其心血管益处。在年轻女性中,雌激素有助于心脏保护,这一功能在更年期后减弱。
骨质疏松症是更年期另一种常见疾病,尽管其病因复杂。在这一阶段,激素波动和钙代谢改变可能导致骨吸收水平增加,使该疾病在更年期后更为普遍。
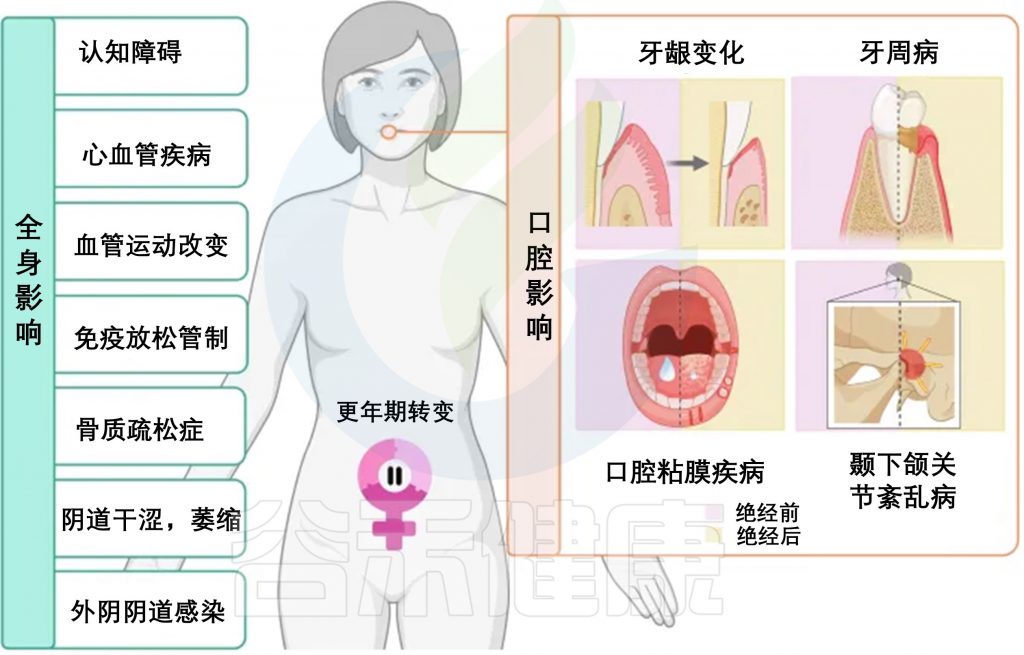
doi.org/10.1038/s44294-024-00050-y
更年期转变对口腔的影响
在更年期,由于女性生殖衰老导致的雌激素下降,会发生一系列生理变化。这种明显的低雌激素状态影响口腔颌面系统和其他系统,产生各种全身和口腔临床表现,影响女性的健康。
多项研究探索了更年期口腔状况与全身表现之间的关联,发现了积极的相关性。
更年期如何悄然影响牙周健康?
牙周病是一种慢性细菌源性炎症疾病,破坏牙齿支持组织,最终导致牙齿脱落。这是一种多因素病因学病理,由必要但不充分的主要病因因素、易感宿主以及影响两者的环境因素相互作用引起。
性激素被认为是重要的修饰因素,可以增加宿主对牙周病原体的易感性,因此影响牙周病的患病率、进展和严重程度。性激素水平的显著波动以及更年期特有的骨质疏松症已导致多项研究将更年期与牙周病联系起来。
骨质疏松症可能导致单位体积内牙槽嵴骨密度降低,这会加速牙周感染引起的骨吸收刺激下的骨质流失。基于这一假设,一项针对绝经后女性的研究未能将较低的系统性矿物质密度与对口腔感染反应中更大的牙周附着丧失相关联,尽管观察到随着患者年龄增长,这种关联变得显著。
更年期激素治疗:牙周健康的潜在保护因素
后续研究报告显示,绝经后女性的牙周病患病率高于绝经前女性,而绝经前女性与接受更年期激素治疗(MHT)的绝经后女性的牙周状况相似。一些研究甚至指出MHT是减轻牙痛、改善牙齿活动度和降低牙周袋探测深度的保护因素。
最近有研究探讨了绝经后女性牙齿脱落的主要原因是口腔卫生不良和骨矿物质密度低,低雌激素水平-骨质疏松症与牙齿脱落呈正相关,但需要更多研究来明确更年期与牙周病之间的关系,考虑到与两种状况相关的混杂因素,如高龄、教育程度、慢性疾病、烟草和酒精消费,特别是口腔卫生和饮食。
颞下颌关节紊乱与更年期的关系
颞下颌关节紊乱(TMD)是一组影响咀嚼肌和颞下颌关节(TMJ)的肌肉骨骼疾病。女性TMD发病率高于男性,以及在TMJ盘中检测到雌激素和孕激素受体,使研究者考虑女性性激素在这种关节紊乱的多因素病因学中的作用。
一些作者观察到绝经后女性的TMD患病率和严重程度高于绝经前女性。相关研究中,对不同月经周期状态下患有TMD的女性进行的研究得出结论,当雌激素水平较低时,TMD相关慢性疼痛程度、咀嚼功能障碍、抑郁症状和躯体化症状更为严重。
然而,其他研究者评估了绝经后女性TMD的存在及其与疼痛和更年期激素治疗(MHT)使用的关系,发现TMD与绝经后期之间没有关系,MHT使用与TMD疼痛之间也没有关系。这些相互矛盾的结果需要进一步研究,以了解更年期对TMJ的影响。
更年期唾液危机:口腔干燥与健康变化的激素关联
雌激素缺乏可能与更年期女性唾液分泌变化有关,这是由于唾液组织改变所致。唾液减少与口腔变化相关,如口腔黏膜光泽丧失、黏膜干燥、舌背裂纹、口角炎、唾液变稠、口腔感染频率增加、非典型位置出现龋齿以及主要唾液腺体积增大。
绝经后女性常见口腔症状包括干燥、灼热感、口腔疼痛、味觉改变、牙齿脱落,通常伴有吞咽困难、发音问题和口臭。
口干或口腔干燥症是围绝经期和绝经后期的主要口腔症状,大多数患者报告唾液流量减少。唾液中孕激素水平与更年期口腔干燥感直接相关。
然而,目前尚不清楚干燥是否仅与激素下降有关,因为药物或衰老等其他因素也会影响唾液分泌率。
更年期口腔干燥与相关综合征
口腔干燥感通常伴随着口腔灼烧综合征(BMS),这也与绝经后期的真菌感染如口腔念珠菌病有关。情绪不稳定,特别在表现为口腔黏膜疼痛和灼热的BMS患者中明显,与抑郁或焦虑等心理障碍相关,突显了更年期口腔健康问题的多方面性质。
此外,面部、牙齿和颞下颌关节紊乱以及溃疡也有所增加。总体而言,唾液流量减少会导致其他症状,如口味差或异常、吞咽困难、唾液粘稠、口腔黏膜炎、扁平苔藓、口炎和类天疱疮。
因此,通过制定预防性口腔护理计划和针对更年期的特定治疗干预措施,解决老龄女性的口腔疾病非常重要。
口腔微生物组是由宿主-微生物互动及环境条件共同塑造的复杂生态系统,分布于口腔软硬组织中。激素波动可直接影响该系统的平衡,例如改变唾液成分(如流量、pH值及抗菌物质含量),从而调控微生物群落的结构与功能。
研究表明,激素水平变化(如青春期、妊娠期及更年期)会通过唾液特性改变,促进特定致病菌增殖或抑制有益菌定植。以更年期为例,雌激素锐减引发的唾液酸化与黏稠度增加,可显著改变微生物群落的组成,加剧龋齿及牙周病风险。此外,分析口腔微生物组的动态变化,可能成为监测系统性激素波动的潜在生物标志物。
口腔微生物组与激素变化的关系
更年期时,女性体内的雌激素水平会随着卵巢功能衰退而逐渐降低。但有意思的是,在更年期初期(过渡期),某些性激素可能会暂时升高,这种波动会刺激口腔组织发炎,并扰乱牙龈部位的微生物平衡,导致有害细菌过度繁殖。与此同时,肠道内的雌激素水平变化也会打破人体和肠道微生物之间的平衡,影响消化和免疫健康。
口腔-肠道-雌激素组轴提示全身雌激素和口腔健康之间存在联系。比如,口腔里的某些细菌能分解雌激素、孕激素等激素,甚至反过来调节它们的水平。这意味着,如果雌激素代谢出了问题,最早可能在口腔菌群失衡中表现出来,比如牙龈出血、口臭等症状,都可能成为身体发出的预警信号。
具体来说:
孕激素能“压制”有害菌:研究发现,像奈瑟菌(Neisseria)、葡萄球菌这类容易引发口腔感染的有害菌,遇到孕激素时生长会被抑制,这种效果和激素浓度有关。
“吃激素”的细菌更危险:密螺旋体等细菌会“偷吃”人体产生的类固醇(如雌激素)作为营养,这可能让它们变得更活跃,甚至加重牙周疾病。
维生素K的替代来源:
一些口腔细菌如Prevotella intermedia、Prevotella nigrecens、 Capnocytophaga等需要维生素K才能存活,而雌激素和孕激素可以替代这种营养。这些细菌在牙龈组织中随着雌二醇和孕酮周期而同步增加。
最近的一项研究调查了雌二醇、雌三醇、孕激素或睾酮对体外口腔生物膜诱导毒力因子表达的影响。研究显示对生物膜形成、微生物组成和蛋白水解活性的影响很小。在口腔牙龈组织中,牙龈含有能够特异性结合雌激素的受体,其微生物组具有β-葡萄糖醛酸苷酶(GUS)作为雌激素代谢酶。
源自人类口腔微生物组的GUS图谱与53种独特的GUS酶相关。许多这些酶在常与牙周病相关的属中被鉴定,如Tannerella, Treponema、普雷沃菌属、梭杆菌属。特别是,口腔微生物组中发现的GUS蛋白与胃肠道中发现的不同。性激素影响口腔生态位的确切机制仍在持续探索中。
内源性类固醇与口腔微生物代谢的关联
内源性类固醇能够直接触发正常微生物群改变的能力的发现,为类固醇水平波动标记的口腔和一般健康之间的联系提供了新见解。类固醇脱氢酶已在多个细菌属中被鉴定,包括梭菌属、棒状杆菌属(Corynebacterium)、芽胞杆菌属(Bacillus)、分枝杆菌属(Mycobacterium)、Nocardia、假单胞菌属(Pseudomonas)和链霉菌属(Streptomyces)。这突显了口腔微生物细胞的居民可以通过微生物酶代谢孕激素和睾酮。
变形链球菌(Streptococcus mutans)同时拥有5α-和5β-类固醇还原酶,以及3α-、17β-和20α-羟类固醇脱氢酶,促进孕激素和睾酮的代谢。
此外,牙龈沟中发现的其他口腔细菌已知含有参与类固醇转化的细菌酶。例如,密螺旋体通过5α-还原酶、3β-和17β-羟类固醇脱氢酶代谢胆固醇、孕激素和睾酮。
因此,关注更年期过渡期间微生物在激素代谢中的作用,强调了有针对性干预的潜力,并为更年期症状管理的先前未探索的途径提供了启示。
唾液皮质醇如何影响微生物与更年期相关疾病
唾液皮质醇是用于检查人类应激反应的生物标志物。
心身性头颈部疾病如口疮性口炎、非典型面部疼痛、口腔扁平苔藓、口腔灼烧综合征(BMS)和口干症与更年期阶段相关。
在一项包括200名绝经后女性的临床试验中,唾液皮质醇水平显示出统计学显著性,证明患有心身疾病的绝经后女性具有更高水平的皮质醇。
最近一项关于应激相关皮质醇对口腔微生物组影响的宏转录组功能分析发现,在皮质醇存在的情况下,梭菌门成员变得更加活跃。有趣的是,之前与牙龈炎相关的Leptotrichia goodfellowii活性显著增强。总体而言,口腔微生物组暴露于皮质醇可改变整个细菌群落的活动。
这些变化包括宿主对口腔细菌的免疫应答过度表达,以及细菌方面蛋白质水解、寡肽转运、铁代谢和鞭毛组装的增加。这些活动先前已与功能性菌群失调和口腔疾病(如牙周病)的进展相关。这提出了一个有趣的可能性,即口腔微生物可能直接响应应激激素的存在。
更年期对唾液与口腔微生物的隐秘影响:争议与新发现
唾液流量和成分与更年期的关联存在争议。
AMICA项目比较了20名绝经后女性与对照组(19名生育年龄女性)的唾液口腔微生物组。该研究未发现更年期女性与有规律月经周期女性之间唾液口腔微生物组成分存在显著差异。
最丰富的细菌属是已知在健康个体中占主导地位的,如链球菌、奈瑟菌、卟啉单胞菌、普雷沃菌和韦荣球菌。
相比之下,研究人群中占主导地位的细菌科是普雷沃菌科和链球菌科。具体而言,绝经后普雷沃氏菌显著增加,而Veillonella tobetsuensis减少。此外,经历严重唾液分泌减少的女性与唾液流量正常的女性相比,细菌谱相似。
研究在绝经后女性唾液中发现了显著的代谢物变化,雌二醇水平与非刺激性唾液流量呈正相关。
另一项研究确定了老年女性唾液分泌减少相关的唾液成分差异,特别关注口腔微生物组。研究结果表明,由于唾液流量减少导致的雌二醇水平下降可能导致更年期口腔问题并改变某些口腔细菌。
进一步的大规模人群和纵向研究将阐明更年期转变对唾液环境的影响。
更年期女性的牙周疾病与口腔微生物组
生物膜相关牙周疾病是老年和更年期女性常见的口腔疾病。绝经后女性的龈下微生物组与牙周疾病的存在和严重程度相关。与这种疾病相关的一些最具特征性的病原体属于拟杆菌属、牙龈卟啉单胞菌、螺旋体、牙形螺旋体、拟杆菌目和梭杆菌属。
厚壁菌门和拟杆菌属之间的相互作用可以作为老年患者微生物栖息地的良好指标。研究描述了更年期女性厚壁菌门与拟杆菌属的比例趋向更高。
特定物种在更年期女性的龈下微生物组中存活,不受牙周疾病存在或严重程度的影响。特别是,这些包括Veillonella dispar、Veillonella parvula、口腔链球菌(Streptococcus oralis)和齿双歧杆菌(Bifidobacterium dentium)。
研究表明,齿双歧杆菌的存在可抑制牙周疾病中的显著病原体牙龈卟啉单胞菌的增殖。这一观察可能解释了为什么在没有牙周疾病的老年女性群体中检测到的牙龈卟啉单胞菌水平相对较低。
更年期期间口腔微生物组发生变化,特定病原体促进了老年女性的牙周疾病。尽管如此,某些物种在更年期女性的龈下微生物组中持续存在,可能影响牙周健康。
龈沟液与激素变化对牙周健康的影响
龈沟液是一种牙周渗出物,由含有各种与牙周定植微生物群相互作用的代谢物的血清组成。从临床上看,牙周炎症增加与激素调节失调的情况如妊娠期和雌激素依赖性疾病如子宫内膜异位症相关。
因此,老年女性牙周疾病相关的许多龈下微生物与年轻牙周病患者研究中观察到的龈下微生物群相似。一个显著的例外是缺乏伴随侵袭性牙周炎的聚集性放线杆菌(A. actinomycetemcomitans),这在老年人中很少见。
这些发现表明口腔微生物组与更年期之间存在复杂的动态关系,对研究和治疗具有重要意义。
更年期激素失衡与真菌失调
虽然先前的研究主要关注细菌物种,但认识共生真菌群落在口腔微生物复杂性中的作用至关重要。在更年期,由于衰老和激素失衡,真菌繁殖增加,导致菌群失调和机会性物种如白色念珠菌(Candida albicans)的增殖,特别是在绝经后阶段。
以下因素会促进念珠菌病的发展:
更年期慢性念珠菌病与口腔灼烧综合征
慢性念珠菌病可引起口腔灼烧感,这是口腔灼烧综合征(BMS)的特征症状,这两种情况都与长期服药和佩戴活动假牙有关。
虽然在45.16%患有BMS的绝经后女性中检测到白色念珠菌(C. albicans),但其与该综合征病因的关联尚无定论。
口腔环境的酸碱度和唾液分泌量对白色念珠菌的存在似乎没有明显影响,这表明念珠菌在口腔中的定植受到多种因素的复杂影响。虽然更年期的生理变化可能有利于真菌生长,但研究表明更年期本身并不直接增加口腔念珠菌感染的风险。
虽然在绝经后女性中未观察到唾液流量与白色念珠菌侵袭之间的关联,但以往文献表明可能存在潜在联系,特别是在那些使用质子泵抑制剂(可能影响口腔微生物平衡)的女性中。
最近研究已确定光滑念珠菌(Candida glabrata)是一种机会性病原体,负责黏膜和全身感染,通常见于老年人、免疫功能低下者和医疗机构环境中。
性激素对多部位微生物组的系统性调节
卵巢激素受体已在脑部、口腔、鼻咽部、胃肠道和女性泌尿生殖系统的黏膜中被发现。这表明神经系统、口腔、肠道、阴道和膀胱微生物组的组成可能受到性激素水平的系统性调节。
尽管我们体内的不同部位(如口腔、肠道和生殖系统)拥有各自独特的微生物环境,但研究发现某些对激素变化敏感的细菌能同时在多个区域生存。例如,某些乳杆菌不仅能在口腔中找到,也能在阴道和直肠中繁衍,有时甚至能通过腹部组织从肠道迁移到阴道。
当女性进入更年期后,体内激素水平的变化会对不同身体部位的微生物群落产生不同影响,改变人体与这些微生物之间的相互关系。这种变化可能是更年期女性在不同身体系统中出现各种症状的原因之一。
性类固醇激素影响的微生物-宿主相互作用
doi.org/10.1038/s44294-024-00050-y
最新研究显示,肠道中的微生物群落可能在女性衰老过程中扮演重要角色,特别是对更年期期间体内激素变化有显著影响。由于从口腔到肛门的整个消化系统被视为一个连续的环境,肠道中的细菌可能与口腔中的微生物有关联,反之亦然。
性激素和肠道菌群之间的相互关系
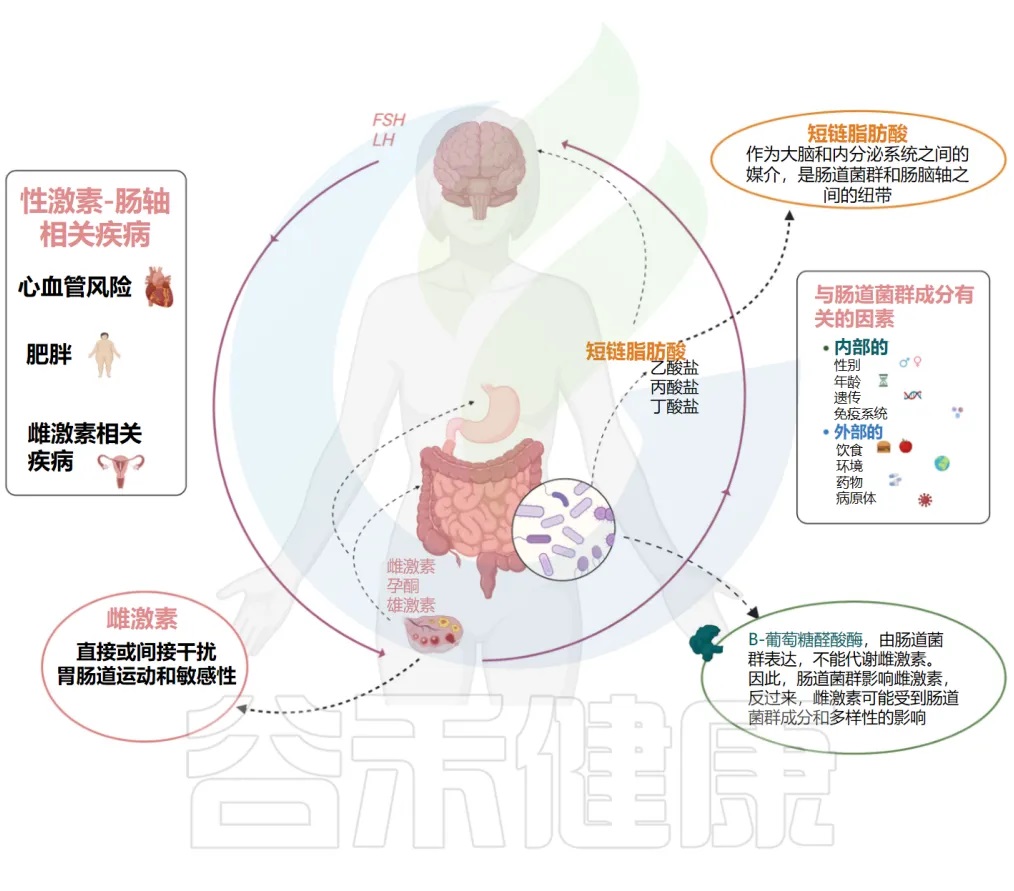
Calcaterra V, et al., Front Endocrinol (Lausanne). 2022
微生物群的α多样性由样本内微生物分布决定,包括存在的分类群的数量和相对丰度。研究表明,由于激素水平下降,更年期与胃肠道微生物群多样性的改变相关。
不过,科学界对此并未达成共识。一些相反的研究结果表明,绝经前和绝经后女性之间没有明显差异。
这些矛盾的发现表明更年期对肠道微生物组的影响可能比预期的更为复杂,受到多种因素影响。
更年期女性肠道微生物组的变化
研究者们正日益关注女性衰老过程中肠道微生物组所经历的变化。一项纵向研究发现,绝经后女性(n=1027)的肠道微生物组比绝经前女性(n=295)的多样性更低。
绝经后女性体内以下菌群丰度更高:
绝经后女性以下微生物丰度降低:
Prevotella和Sutterella 在其他研究中曾与肥胖相关。同样,肠道拟杆菌可能产生有益或有害影响,这取决于它与其他微生物组和宿主因素的关系。能在口腔中找到适宜条件的微生物,如普氏菌属、拟杆菌属和厚壁菌门,在胃肠道水平产生不同类型的群落。
更年期女性 Odoribacter 的增加导致短链脂肪酸、氢和硫化氢水平升高。短链脂肪酸增加脂肪酸氧化和能量代谢,参与血清素的合成和稳定神经元,并增加刺激成骨的循环胰岛素样生长因子-1。因此,更年期女性中短链脂肪酸 的Odoribacter 相关增加可能会降低肥胖、高脂血症、抑郁症和骨质疏松症的风险。相反,硫化氢产生增加会导致炎症反应。因此,Odoribacter 既有积极影响,也有不良反应(类似于绝经后综合征的影响)。
Biophila 产生的硫化氢可以放松回肠平滑肌,增加胃肠黏膜的血液供应。更年期妇女体内嗜胆汁细胞增多会导致硫化氢产生增加,引发局部炎症和粘膜损伤,血清内毒素浓度增加,以及几种组织的炎症反应。炎症因子引起的细胞内炎症反应通过干扰胰岛素信号转导导致胰岛素抵抗。在骨骼中,炎症因子(如肿瘤坏死因子-α、白细胞介素(IL-1和IL-6)增强破骨细胞的功能,导致骨质减少。外周血中的炎症因子穿过血脑屏障,激活中枢神经系统的小胶质细胞,导致神经元炎症,加剧神经纤维缠结和β-淀粉样蛋白的聚集和积累,从而导致阿尔茨海默病。
目前尚不清楚更年期过渡期间激素水平的变化是否会影响肠道微生物群的平衡,可能导致菌群失调。
性别&肠道菌群:从青春期差异到绝经后趋同
肠道微生物组的性别二态性指男性和女性在微生物组成和多样性方面的差异。研究发现:
值得注意的是,绝经后女性的肠道微生物群与男性的相似度高于绝经前女性。
2022 年 4 月发表在《mSystems》上的一项研究研究了近 1,000 名西班牙裔男性、1,000 名绝经后的西班牙裔女性和近 300 名绝经前西班牙裔女性的肠道微生物。研究发现,绝经后女性的微生物组与男性相比,与男性更相似。
这表明性激素水平可能在调节肠道微生物组成方面发挥重要作用。
然而,普氏菌属对人类健康的影响存在矛盾,其效果因涉及的特定菌株而异。有些菌株可能有益,而其他菌株可能与某些健康问题相关,这取决于具体条件和宿主因素。
肠道微生物群功能与更年期健康关系
居住在消化道中的微生物群体执行多种功能:
一些激素与肠道菌群的已知关系
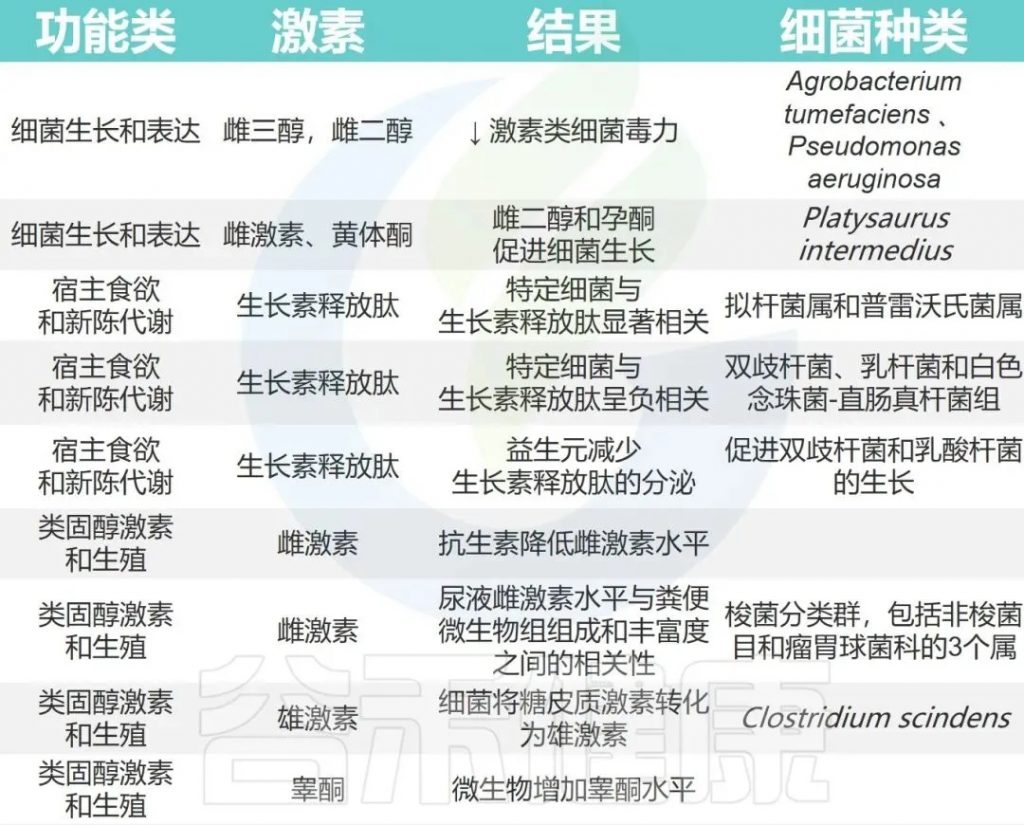
Hussain T,et al.Anim Nutr.2021
研究发现,绝经后自身免疫疾病的发病率增加。这可能与肠道微生物组的变化有关。
瘤胃球菌属(Ruminococci),属于梭菌目,是短链脂肪酸的生产者。这些短链脂肪酸具有神经活性特性,能够促进脑-肠轴的通信,这是一种有益功能。在克罗恩病和系统性红斑狼疮患者中,已观察到某些瘤胃球菌种类的丰度降低。
值得强调的是,与绝经前女性相比,绝经后女性体内瘤胃球菌的丰度较低。这一发现表明,更年期激素变化可能通过影响这些有益菌的丰度,对免疫功能和炎症过程产生影响。
肠道微生物组与雌激素及相关疾病的关系
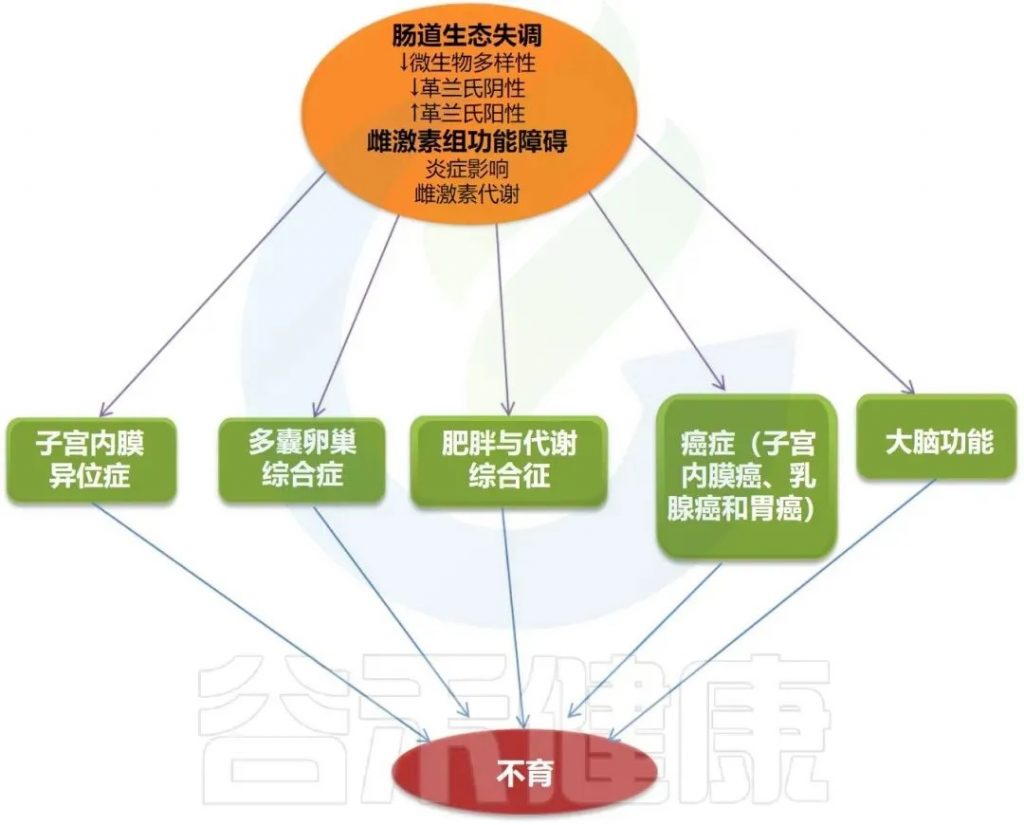
Hussain T,et al.Anim Nutr.2021
骨健康状态
关于通常影响更年期妇女的骨质疏松症,研究报告了与骨质疏松症严重程度相关的肠道微生物组的显着差异。
那些没有骨质疏松症的人有大量的 Romboutsia、unclassified_Mollicutes 、Weissella。
相比之下,骨质疏松症患者下列菌群丰富:
在骨质疏松症的不同严重程度中,肠道微生物组的变化比阴道微生物组的变化更明显,这表明女性的肠道微生物组可能会影响骨骼代谢。
更年期心血管健康
由于心血管疾病是老年女性的主要疾病之一,近期研究评估了肠道微生物组在激素相关心血管保护中的作用。
一项大型绝经后女性队列研究收集了粪便样本和15种性激素的血清水平,发现雌激素与以下微生物的多样性和丰度增加相关:
有趣的是,研究者提出肠道微生物组可能影响雌酮与颈动脉斑块之间的联系。然而,该研究中81%的女性患有艾滋病毒(HIV),这可能干扰性激素与微生物组之间的直接相关性。
另一方面,孕酮降低免疫系统活性,导致对病原体的易感性增加。绝经后,孕酮水平与雌激素同时下降。研究发现,绝经后女性的血浆孕酮浓度可根据肠道微生物组的组成预测循环孕酮水平。
由于缺乏机制研究,确定这些细菌在肠道微生物组中的具体作用及其与更年期的关系具有挑战性。因此,肠道微生物组在女性衰老中的具体健康影响尚未被充分理解。
更年期阴道微生物组变化及健康影响
阴道微生物组在更年期经历深刻变化,影响女性健康和对各种感染的易感性。
具体而言,在阴道水平,微生物失衡可触发慢性炎症,这可能导致某些感染性疾病风险升高,包括:
持续的炎症状态和相关感染还可能增加恶性转化的可能性,从而提高致癌风险。
这强调了更年期激素变化对阴道健康和相关风险的潜在影响。激素水平的下降改变了阴道环境,影响了保护性微生物的生存条件,可能导致更易感染和炎症反应增强,形成一个可能危及女性晚年健康的复杂互动网络。
更年期生殖微生物组变化与子宫内膜癌风险
近期研究表明,更年期期间生殖微生物组的变化与子宫内膜癌(EC)风险增加有关。
Walsh等人的研究发现,绝经后女性的微生物组多样性增加,这可能提高疾病风险。具体而言:
这表明卟啉单胞菌属(Porphyromonas)可能在更年期疾病发展中发挥作用。这些发现突显了女性更年期期间生殖道微生物组变化与癌症风险之间的重要联系,为未来预防和治疗策略提供了潜在目标。
微生物组健康与女性生殖道健康
微生物组健康度指特定环境(如肠道或口腔)中微生物群落的健康状态和恢复力。健康的微生物组具有多样性,由支持宿主健康的有益微生物组成,而失衡的微生物组可能导致疾病。
在健康的阴道微生物组中,乳杆菌属(Lactobacillus)通常是占主导地位的细菌,乳杆菌属可以:
乳杆菌的这种优势对维持阴道健康和预防感染至关重要。
它们形成一种保护性屏障,通过多种机制(包括pH调节、抗菌物质产生和竞争性排斥)抵抗病原体。
在更年期过渡期间,激素水平的变化可能会影响这种微生物平衡,导致乳杆菌减少和有害菌增加,从而增加感染和其他健康问题的风险。
更年期悖论:阴道微生物组变化的双面性
更年期悖论描述了绝经前和绝经后女性阴道微生物组之间观察到的相互矛盾趋势。这一现象的特征是:
因此,绝经后女性的阴道微生物组可能变得更加多样化,适应生态位内更广泛的微生物物种谱。这似乎违反了通常认为的微生物多样性对健康有益的观点。
导致更年期女性优势度和丰富度之间这种悖论关系的因素包括:
从临床角度看,这种悖论可能导致健康问题,如由于微生物适应性变化引起的感染,强调了在更年期女性医疗保健中解决这些微生物组变化的重要性。
这表明阴道微生物组的最佳状态在生命不同阶段可能有所不同,而不仅仅是追求最大的多样性。
更年期荷尔蒙变化对阴道微生物生态的影响
首先,与更年期相关的荷尔蒙变化会改变阴道环境,从而影响微生物群落。绝经期间雌激素水平的下降导致阴道pH值和湿度水平发生变化,创造了一个不太有利于某些微生物物种生长的环境,特别是在绝经前女性中占主导地位的乳杆菌。
阴道微生物组被分为五种群落状态类型(CST),其分类取决于乳杆菌物种的存在和丰度:
编辑
随着绝经的发生,许多女性从乳杆菌占优势的状态转变为CST IV状态,这种变化可能增加对某些感染和健康问题的易感性。这种转变反映了荷尔蒙调节对维持健康阴道微生物组的重要性。
绝经后阴道微生物组变化及健康影响
绝经后女性经历乳杆菌水平降低,导致微生物多样性增加。然而,这可能增加厌氧菌定植的易感性,与多种感染相关。
当细菌多样性增加时,检测到的物种包括:
其中一些与特定阴道感染相关,如细菌性阴道病(BV)。临床研究表明,BV的特征性厌氧菌过度生长与绝经后女性的微生物组相关,与绝经前女性相比有明显差异。
此外,研究已发现非乳杆菌占优势的阴道菌群与阴道干燥之间存在相关性。阴道干燥、性交疼痛和阴道疼痛症状更严重的女性往往具有更大的阴道微生物多样性,且不以乳杆菌为主。
普雷沃氏菌菌和卟啉单胞菌是女性生殖道和口腔的组成部分,它们参与细菌性阴道病和口腔牙周炎等多微生物感染。这表明微生物组变化可能在多个身体系统中产生广泛影响。
绝经前后免疫功能与阴道健康差异
绝经前后女性在免疫功能和阴道健康方面的差异也可能导致微生物多样性与丰富度的悖论。免疫反应和阴道上皮完整性的变化能够影响微生物定植模式和群落结构。
乳杆菌的保护作用
乳杆菌通过乳酸发酵保护女性免受侵入性病原体的侵害,促进阴道和膀胱健康。绝经前后最显著的差异是乳杆菌水平的降低。乳杆菌的主要代谢途径是乳酸和糖原。乳杆菌通过乳酸(一种主要的抗菌剂)消灭失调的微生物和各种病原体,从而维持微生物平衡。
乳酸水平变化
绝经前:乳酸含量占总量的98%
绝经后:乳酸浓度显著降至94.2%,阴道液pH值升高
雌激素与糖原关系
较高水平的雌激素促进阴道上皮中糖原的积累,有利于乳杆菌的优势地位。增加的游离糖原水平促进更厚的复层鳞状上皮和保护性粘液层形成,这也与较高的乳杆菌水平相关。
绝经前:阴道粘膜中游离糖原水平显著高于绝经后
绝经后:雌激素水平急剧下降,阴道微生物组和上皮受到影响
绝经后女性乳杆菌水平较低,可能是由于雌激素依赖性糖原可及性降低。此外,在患有阴道萎缩的女性中,细菌微生物组缺失。
这些变化说明了激素、上皮环境和微生物组之间复杂的相互作用,解释了为什么绝经可能导致微生物多样性增加但并不总是有益健康。
阴道与泌尿生殖系统微生物组的相互关系
泌尿生殖系统与阴道密切相关。阴道微生物组与泌尿系统和胃肠道系统中的其他微生物群落相互作用。阴道乳杆菌可能对泌尿道起保护作用。此外,泌尿道可能作为阴道乳杆菌的储存库,并可能帮助在因更年期相关代谢变化或病理引起的菌群失调后重新定植。
在乳杆菌物种中,詹森乳杆菌(L. jensenii)也常见于尿道,与惰性乳杆菌(L. iners)和卷曲乳杆菌(L. crispatus)一起,是阴道中最常分离出的菌种。阴道中乳杆菌丰度与其在尿道中存在显著的相关性。因此,促进乳杆菌在阴道中的定植可以积极影响其在泌尿系统中的存在,从而在女性健康中发挥重要作用,尤其是在绝经后。
这一发现具有重要的临床意义,表明针对阴道微生物组的干预可能会对整个泌尿生殖系统健康产生连锁效应。绝经后这种微生物生态系统的变化可能解释了为什么许多女性在更年期后容易出现泌尿道感染和其他泌尿系统问题,强调了在更年期医疗保健中考虑整个泌尿生殖轴的重要性。
更年期泌尿生殖系统并发症影响50岁或以上女性的三分之一
泌尿系统也可能因粘膜干燥而受到影响。可能出现的泌尿生殖系统症状包括性交疼痛、排尿困难和复发性尿路感染(UTI)。存在一种称为更年期泌尿生殖综合征(GSM)的病理状态,影响约50%的更年期女性,同样影响女性的性健康和功能健康。更年期引起阴道微生物组的变化,导致阴道症状。
2021年的一项研究确定普雷沃氏菌和卟啉单胞菌(经典的牙周病原体)是与接受抗生素治疗的尿路感染相关的微生物。
2013年的一项横断面研究(n=87)表明,轻度或中度外阴阴道萎缩表现出更大的微生物组多样性,缺乏乳杆菌,而没有外阴阴道萎缩的女性则表现出以卷曲乳杆菌为主的微生物组。因此,阴道微生物组动态的复杂性需要多方面的方法来阐明潜在机制。
未来研究应采用纵向研究和先进的组学技术,揭示宿主生理、微生物组成和环境因素在更年期阴道微生物组塑造中的复杂相互作用。通过更多地了解这些动态,可以开发有针对性的干预措施,促进阴道健康并减轻更年期女性感染的风险。
更年期常见的肠道健康问题
随着更年期荷尔蒙的变化,消化通常会变得更加不可预测。许多女性会出现腹胀、便秘、胃酸倒流和食物敏感,这些在过去从来都不是问题。这些问题与消化缓慢、胃酸降低和肠道细菌的变化密切相关。了解这些症状发生的原因以及如何管理它们可以帮助更好地控制自己的肠道健康。
腹胀和胀气
随着消化速度减慢,食物在肠道中停留的时间会更长,从而导致发酵和气体积聚。激素波动会进一步影响食物在消化系统中移动的效率,从而引起不适。此外,肠道细菌的变化会破坏正常的消化,使腹胀更加频繁和明显。
通过肠道菌群检测可识别甲烷菌、硫化氢代谢菌等特定菌群的丰度,从而制定针对性策略。若检测j结果显示产甲烷菌丰度高,需减少豆类、十字花科蔬菜摄入;若硫化氢菌为主,则限制红肉和含硫食物。
如何干预?
便秘和消化迟缓
当雌激素水平下降时,消化系统会减慢,导致食物在肠道中停留的时间更长。随着胃酸和酶的产生降低,分解食物变得更加困难,导致消化缓慢。此外,肠道肌肉收缩减弱会使排便不那么规律,从而导致不适。
肠道菌群检测报告中,一些产丁酸菌可能辅助判断菌群代谢能力,若丁酸菌不足,补充菊粉或抗性淀粉(如青香蕉);若普氏菌属丰度高,也可以改用其他例如低聚半乳糖。
如何干预?
食物敏感和炎症增加
肠道通透性增加引起的肠漏,使未消化的食物颗粒进入血液,引发免疫反应。肠道细菌的变化会改变身体处理某些食物的方式,使其更容易产生敏感性。较高的炎症水平也会使身体对乳制品、麸质和加工食品更敏感,导致消化不适和不耐受。
如何干预?
支持更年期肠道健康的食物
吃合适的食物可以在平衡肠道菌群、减少腹胀、改善消化和支持更年期的整体健康方面产生巨大影响。由于激素变化会影响肠道功能,因此专注于富含纤维、益生菌、抗炎和营养丰富的食物有助于维持消化平衡。
减少肠道炎症的健康脂肪
Omega-3 脂肪酸和健康脂肪支持肠道内壁的完整性并减少消化道的炎症。
《营养生物化学杂志》发表的一项研究发现,Omega-3 脂肪酸补充可以改善绝经后妇女的肠道微生物群健康并减少炎症。
建议每天摄入约250-500毫克Omega-3脂肪酸。
健康脂肪的最佳来源:
如果经历持续的肠道炎症,健康的脂肪会有所帮助,但它们本身并不总是足够的。有针对性的抗炎营养计划可以进一步减轻更年期与肠道相关的症状。
舒缓肠道的抗炎食物
慢性炎症会削弱消化并导致食物敏感。抗炎食物有助于修复肠道内壁并减少腹胀。
最好的抗炎食物:
如果炎症导致持续腹胀或肠道不适,可以考虑进行功能医学肠道健康咨询,确定食物触发因素和解决方案。
《营养学杂志》发表的一项研究发现,大豆补充可以改善绝经后妇女的雌激素水平。
骨汤和胶原蛋白用于肠道内壁修复
更年期会削弱肠道内壁,增加肠漏和炎症的风险。骨汤和胶原蛋白含有谷氨酰胺等氨基酸,有助于增强肠壁。
最佳来源:
如果怀疑肠漏导致了食物敏感性,可以考虑优先解决肠漏方案来帮助治愈和恢复消化。
多补充水分
保持水分可以保持消化顺畅并防止便秘。除了喝水,吃补水食物也会有所帮助。
最佳保湿食物:
益生菌
益生菌是发酵食品中的活性微生物,存在于酸奶、酸菜和酸面包,也可以在膳食补充剂中找到。摄入益生菌可以改善消化、增强免疫系统并调节雌激素水平。
改善肠道健康
它们被认为通过恢复有益菌和抑制肠道有害菌的生长来改善肠道健康。肠道微生物平衡的转变可以导致改善雌激素代谢,有助于维持健康的雌激素水平。
一项研究发现,连续六周每天食用益生菌补充剂的女性肠道健康显著改善。
改善雌激素水平
研究表明,益生菌对雌激素水平有积极影响,通过增加β-葡萄糖醛酸酶的产生,这是一种促进体内雌激素排泄的酶。
根据《临床胃肠病学杂志》发表的一项研究,益生菌补充可以改善代谢综合征的绝经后妇女的雌激素水平。
益生元
益生元是人体无法消化但肠道微生物组可以消耗的纤维素类型。
益生元可以在许多食物中找到,最佳益生元来源:
改善肠道健康、调节雌激素水平
摄入益生元促进肠道中有益菌的生长,减少有害菌的数量,有助于改善肠道健康并调节雌激素水平。
研究表明,益生元对雌激素水平有积极影响,通过增加短链脂肪酸的产生,这可以帮助调节雌激素水平。
《营养学杂志》发表的一项研究发现,益生元补充可以改善绝经后妇女的雌激素水平。
此外,益生菌和益生元还可能对与激素失衡有关的疾病,如多囊卵巢综合症产生积极影响。
《功能性食品杂志》发表的一项研究发现,连续12周食用益生菌补充剂的多囊卵巢综合症女性,睾酮水平下降,胰岛素敏感性改善,这两个指标与多囊卵巢综合症密切相关。
总之,益生菌和益生元对肠道健康和激素平衡,特别是在女性中有积极影响。将这些补充剂纳入饮食中可能对与激素失衡有关的疾病有益,如多囊卵巢综合症。
然而,需要进行更多的研究来全面了解它们的影响机制,也可以借助肠道菌群检测了解自身需求,确定最佳的剂量和补充时间。
维生素D
这种维生素在维持肠道健康和免疫功能方面起着至关重要的作用。一些富含维生素D的食物包括富含脂肪的鱼类、蛋黄和强化的乳制品。
《妇女健康杂志》发表的一项研究发现,维生素D补充可以改善绝经后妇女的肠道微生物群组成并减少炎症。
缓解压力
压力是我们日常生活中常见的现象,它可以对肠道微生物组产生深远的影响。
压力改变肠道菌群组成
几项研究表明,慢性压力可以改变肠道细菌的组成,导致有益菌的减少和有害菌的增加。
例如,发表在《大脑、行为和免疫》杂志上的一项研究发现,压力诱导的肠道微生物组变化与炎症性肠病的风险增加有关。
压力影响激素的产生和代谢
此外,压力还可以影响激素的产生和代谢,包括雌激素。下丘脑-垂体-肾上腺(HPA)轴是压力反应系统的关键组成部分,已知与下丘脑-垂体-性腺(HPG)轴相互作用,后者调节雌激素的产生。
研究表明,慢性压力可以破坏这些轴的调节,导致雌激素水平的改变。
因此,减少压力水平可以是改善肠道健康和恢复雌激素水平的有效策略。一些减压的方式包括冥想、深呼吸练习、瑜伽、定期运动。
一项研究发现,定期运动可以改善绝经后妇女的雌激素水平,运动还可以降低患乳腺癌等雌激素相关疾病的风险。
– 每天练习10-15分钟的正念冥想或深呼吸练习
– 每天进行至少30分钟的有氧运动,如快走、慢跑或骑车
– 将力量训练融入每周的运动计划中
– 减少暴露于压力因素,如过度的工作负担或负面关系
– 参与有趣的活动,如兴趣爱好或与亲人共度时光,以减轻压力水平
然而,肠道健康并不是一刀切的。每个女性的身体对激素变化的反应都不同,对一个人有效的方法可能对另一个人不起作用。这种个体差异与肠道菌群的独特组成密切相关。例如,部分女性因产甲烷菌丰度过高而对豆类敏感,而另一些人可能因丁酸菌不足而需针对性补充抗性淀粉。
通过肠道菌群健康检测可通过解析菌群结构,明确优势菌群(如普氏菌、双歧杆菌)及致病菌定植状态,指导膳食调整方向。了解功能基因及代谢物水平(如短链脂肪酸、硫化氢等),判断炎症风险与营养吸收能力,从而制定个性化干预方案;通过定期复测评估益生菌定植率或益生元/饮食干预后的菌群重塑效果,避免盲目补充。
更年期作为女性生命周期的关键转折点,其健康管理已从传统的症状缓解转向基于微生物组学的精准干预。肠道菌群与雌激素代谢的双向调控机制、菌群失衡与更年期综合征的关联性研究,为健康老龄化提供了全新的科学视角。
然而,现有研究过度依赖西方人群样本,地理与生活方式差异(如饮食结构、环境暴露)导致微生物组数据缺乏多样性,限制结论的普适性。例如,非洲或亚洲女性因饮食差异可能具有独特的菌群特征。
解决这一差距至关重要。包括来自非洲、亚洲和拉丁美洲等更多样化人群的研究,可以提供对更年期如何全球性影响微生物组的更全面理解。更具地理包容性的方法将有助于揭示微生物群落的变异,从而开发更个性化的干预措施,更好地满足不同群体更年期女性的需求。
随着研究的深入,未来将围绕以下方向展开:
检测技术的革新与普及
精准医疗的核心在于“检测先行”。宏基因组测序、代谢组学及AI驱动的数据分析技术将推动肠道菌群检测的标准化。
唾液、阴道分泌物等多部位微生物组联合检测技术的开发,将揭示“口腔-肠道-生殖道”微生物轴的联动机制,为系统性干预提供依据。
个性化益生菌/益生元产品的迭代
基于菌群检测结果的靶向菌株筛选与定制化产品研发将成为主流。例如,针对绝经后女性双歧杆菌丰度下降、产甲烷菌过度增殖等问题,开发含特定菌株的益生菌组合,或设计差异化的益生元配方。
同时,微生物代谢工程技术的应用,可人工合成具有抗炎、调节雌激素功能的代谢产物,为药物开发开辟新路径。
数据驱动的健康管理平台
整合肠道菌群数据、激素水平、临床表型及生活方式的多组学数据库将构建更年期健康管理的智能中枢。AI算法可通过分析大规模队列数据(如中国更年期女性队列),预测骨质疏松、心血管疾病等风险,并推荐个性化干预方案,同时联动医疗机构进行动态跟踪。
跨学科研究与产业协同
微生物组学与内分泌学、免疫学、营养学的交叉融合,将催生“微生物-激素”共调控疗法。例如,通过靶向调控肠道菌群的β-葡萄糖醛酸酶活性,促进雌激素再循环以缓解阴道萎缩;或利用益生菌代谢产物调节骨吸收相关通路,降低骨质疏松风险。此外,中医药与微生物组研究的结合有望挖掘传统疗法的现代科学价值。
未来,随着技术的突破与产业链协同,女性将不再被动应对更年期挑战,而是通过“检测-干预-监测”的全周期管理,实现从激素平衡到全身健康的精准调控。通过整合肠道菌群检测、激素水平分析与临床表型数据,可构建预测模型,为女性提供从症状缓解到疾病预防的全周期方案。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Nieto M R, Rus M J, Areal-Quecuty V, et al. Menopausal shift on women’s health and microbial niches[J]. npj Women’s Health, 2025, 3(1): 3.
Tatullo M, Nor J, Orrù G, Piattelli A, Cascardi E, Spagnuolo G. Oral-Gut-Estrobolome Axis May Exert a Selective Impact on Oral Cancer. J Dent Res. 2024 May;103(5):461-466.
Park MG, Cho S, Oh MM. Menopausal Changes in the Microbiome-A Review Focused on the Genitourinary Microbiome. Diagnostics (Basel). 2023 Mar 21;13(6):1193.
Shen X, Wang C, Zhou X, Zhou W, Hornburg D, Wu S, Snyder MP. Nonlinear dynamics of multi-omics profiles during human aging. Nat Aging. 2024 Nov;4(11):1619-1634.
Hu S, Ding Q, Zhang W, Kang M, Ma J, Zhao L. Gut microbial beta-glucuronidase: a vital regulator in female estrogen metabolism. Gut Microbes. 2023 Jan-Dec;15(1):2236749.
Peters BA, Santoro N, Kaplan RC, Qi Q. Spotlight on the Gut Microbiome in Menopause: Current Insights. Int J Womens Health. 2022 Aug 10;14:1059-1072.
Łaniewski P, Herbst-Kralovetz MM. Connecting microbiome and menopause for healthy ageing. Nat Microbiol. 2022 Mar;7(3):354-358.

谷禾健康

现代的生活工作方式大多是久坐,户外运动少,导致与骨骼肌肉相关的亚健康症状越来越普遍,覆盖人群越来越广。
例如长时间的低头垂肩的姿势会让竖脊肌处在伸展的位置,进而导致竖脊肌的无力,产生受伤的状况。长时间久坐使得臀大肌萎缩无力,无力松弛的臀肌再结合无力的竖脊肌,导致腰背疼痛等症状。

老年人的肌肉骨骼疼痛,在我们生活的每一个角落悄然出现。这无声的挑战,让他们在岁月的长河中饱受苦楚。
随着全球老龄化的日益严重,与衰老相关的疾病,包括肌肉减少症、骨质疏松症和骨关节炎,变得越来越突出,影响着至少7-27%的世界人口。
肌肉减少症的发生率为 10% 至 27%。50岁以上女性骨质疏松患病率不低于20%,骨关节炎的患病率约为7%。
肌肉骨骼系统对于平衡代谢活动和保持健康非常重要。骨骼肌是机体最大的器官之一,其质量和功能的丧失或减退会导致一系列疾病。虽然临床上用了很多方式来治疗缓解这类疾病,但有效的治疗方法却较少。
最近的研究表明,肠道微生物群稳态的破坏与肌肉骨骼系统功能异常相关,甚至可能导致肌肉骨骼系统功能异常。生活中也发现,肠道菌群与骨质疏松症的发病相关。如果你肠胃不好,时不时就腹泻腹胀、消化不良,当心了,骨质疏松也可能已经“盯”上了。
研究还表明,肠道菌群及其次级代谢产物可以通过调节炎症、免疫和蛋白质合成代谢、能量、脂质、神经肌肉接头、氧化应激、线粒体功能、内分泌和胰岛素抵抗等多种机制来影响肌肉骨骼系统。
现有文献大多支持合理的营养干预有助于改善和维持肠道菌群的稳态,并可能对肌肉骨骼健康产生积极影响。即使已提出“肠道菌群-肌肉轴”,但其因果联系仍然是未知的。
本文对现有文献进行整理、总结和讨论的目的是探讨营养补充、适度运动等干预方法能否通过调节肠道菌群微生态来影响肌肉和骨骼健康。未来更深入的功效验证实验将有助于临床应用。
骨 骼 肌
无菌小鼠:肠道菌群存在对骨骼肌健康很重要
基于无菌 (GF) 小鼠的实验揭示了体内肠道微生物群的存在或缺失,通过调节营养和能量代谢途径对骨骼肌的健康至关重要。缺乏肠道微生物群的小鼠的骨骼肌质量显著降低,无菌 (GF) 小鼠中肌球蛋白重组基因和骨骼肌分化调节基因的表达显着低于正常携带细菌的小鼠,而肌肉的表达萎缩标志物明显升高。
肠道菌群→蛋白质合成/能量代谢→骨骼肌营养
蛋白质合成和降解是影响骨骼肌质量的重要因素。胰岛素样生长因子1(IGF-1)是促进蛋白质合成和增强肌肉功能的重要物质,无菌小鼠体内的IGF-1水平显着下降。此外,无菌小鼠中糖皮质激素诱导的支链氨基酸分解代谢显着增加。
肠道菌群还可以通过改变能量代谢模式来影响骨骼肌。无菌小鼠葡萄糖和胰岛素含量较低,线粒体功能明显扰乱,影响骨骼肌对葡萄糖的利用,减少肌肉合成的能量供应,最终影响骨骼肌的氧化代谢能力。
肠道菌群调控神经肌肉接头
无菌小鼠的胆碱水平下降,导致神经肌肉接头传递受损。肌钙蛋白与骨骼肌中的肌纤维收缩性和运动功能有关。
无菌小鼠骨骼肌中肌钙蛋白编码基因的表达显着降低,表明肌纤维收缩力可能受损。更重要的是,将肠道微生物群移植到无菌小鼠体内后,结果显示骨骼肌质量增加,肌肉萎缩标记物减少,肌肉氧化代谢改善,神经肌肉接头组装基因表达增加。证据表明肠道微生物群在维持正常骨骼肌功能方面发挥着关键作用。
骨
骨骼通过骨成骨细胞(OB)和破骨细胞(OCL)不断重建。这个过程的不平衡会导致骨质疏松症。
早期研究发现,肠道微生物群也是骨量的主要调节者,其对骨量的影响是通过其对免疫系统的影响来介导的,免疫系统反过来又调节破骨细胞的生成。
肠道微生物群缺失对维持骨量有负面影响
无菌小鼠骨髓中破骨细胞前体细胞和破骨细胞的数量减少。此外,无菌小鼠肠道来源的 5-羟色胺和炎症细胞因子的水平降低。值得注意的是,肠道微生物群定植可以恢复无菌小鼠损失的骨量。当然,不排除其他机制也可能参与其中。
然而,最近的一项研究表明,成年雄性 GF BALB/c 小鼠的骨骼生长速度比正常饲养的小鼠慢。粪便微生物群对无菌小鼠的长期定植会导致股骨长度惊人的增加和骨小梁微结构的改善。
维生素D改善肠道钙吸收促进骨代谢
无菌小鼠的维生素D 代谢存在缺陷,而被微生物群定植的无菌小鼠则表明 1, 25-二羟基维生素 D 和钙水平得到恢复。因此,肠道微生物群也对骨骼产生有益影响。
骨 关 节
越来越多的证据表明肠道微生物组在骨关节炎(OA)的病理学中发挥着关键作用。早期研究表明,在无菌条件下, 在TLR4(Toll 样受体 4)缺陷小鼠中,类风湿性关节炎(RA) 表现也受到显着抑制,肠道微生物群可作为抗原或佐剂来诱导或促进类风湿性关节炎产生。
注:Toll样受体(TLR)是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,也是连接非特异性免疫和特异性免疫的桥梁。当微生物突破机体的物理屏障,如皮肤、粘膜等时,TLR可以识别它们并激活机体产生免疫细胞应答(参考自百度百科)。
肠道微生物群对创伤性骨关节炎的发展产生影响
研究发现,无菌小鼠中内侧半月板不稳定手术引起的骨关节炎显着减少,表明肠道菌群促进了骨关节炎的发生。还发现肠道微生物组对小鼠模型中损伤引起的骨关节炎的严重程度有显着影响。
关节损伤后,无菌小鼠仅有轻微的骨关节炎症状,病理表现的严重程度最低。小鼠体内微生物组丰度与炎症生物标志物浓度、肠道通透性和骨关节炎严重程度呈正相关。这可能是因为在存在关节损伤的情况下,肠道微生物群(由更多的梭杆菌和粪球菌,以及更少的瘤胃球菌科)引起的免疫激活可能会加剧骨关节炎的病理过程。
以上无菌动物实验,主要是小鼠结果表明,肠道菌群的“存在与否”确实是影响和维持小鼠肌肉骨骼系统的关键因素。
无菌小鼠是通过无菌技术培育得到的。这里无菌小鼠既没有共生菌群,也没有致病菌等情况下,表现出不良的病理特征。这表明致病菌并非唯一的因素导致疾病发生。
疾病的发生通常是由多种因素共同作用引起的,包括宿主的遗传因素、环境因素和微生物因素等。致病菌可能需要与其他共生微生物或宿主因素相互作用才能引发疾病。在无菌小鼠中,缺乏这些相互作用,可能导致致病菌无法发挥其病原性。这刚好强调了微生物群落的复杂性和其与宿主的相互作用的重要性。
无菌小鼠试验的结果也需要与其他研究方法和模型相结合,例如体内试验、体外试验和临床研究,以获得更全面和准确的结论。综合多种研究方法的结果可以提供更可靠的科学依据,并有助于我们理解和解释无菌小鼠试验结果的适用性。
肠道微生物群失调一般主要指致病生物的大量繁殖、正常菌群的减少和微生物群组成多样性的减少。代谢、自身免疫、炎症和神经退行性疾病等多种因素与肠道菌群失调有关。微生物群失调对肌肉骨骼系统的影响引起了越来越多的关注。
扩展阅读:
骨 骼 肌
许多因素与肌少症的病理学相关,包括衰老、炎症、线粒体损伤和/或胰岛素抵抗。
注:肌少症是指因持续骨骼肌量流失、强度和功能下降而引起的综合症。患有肌肉减少症的老年人站立困难、步履缓慢、容易跌倒骨折。
几乎所有病理过程都会引发肠道微生物群的失调。反过来,微生物群失调也在骨骼肌质量和功能下降中发挥着至关重要的作用。由于肠道微生物组是导致肥胖或胰岛素抵抗等代谢失调表型的发生和加剧的原因,因此骨骼肌质量和功能可以部分受到肠道微生物组的调节。
老年人肠道菌群:促炎菌增多
健康肠道微生物群的主要门是厚壁菌门、拟杆菌门、放线菌门和疣微菌门,变形菌门的数量较少。在老年人和营养不良者中,都显示促炎症的变形计门增加,而产丁酸菌普拉梭菌,罗氏菌属减少。肠道菌群失调引起的循环促炎细胞因子的增加可以通过不同的机制(胰岛素抵抗、炎症和相关的氧化应激)诱导肌肉萎缩。
肠道菌群失调的两个最典型的例子:
炎症性肠病(IBD)和衰老引起的肌肉功能衰竭
接下来我们用这两个例子来具体阐述肠道菌群失调引起肌肉减少症的内在机制。
➤ IBD
IBD→肠道菌群失调→炎症→肌肉萎缩
IBD 的典型特征是肠道微生物群失调,肠道菌群失调往往伴随着肠道屏障损伤和肠道屏障通透性增加,内毒素和其他细菌代谢产物容易进入循环系统,从而增加LPS(脂多糖) 和其他炎症因子的水平,诱发体内的炎症反应。LPS 诱导的炎症的一个特征性表现是由于蛋白水解降解增加和蛋白质合成减少引起的严重肌肉萎缩。
肠道菌群失调→氧化应激→肌肉无力
肠道菌群的失调还可能导致肠道氧化应激、肠粘膜炎症和屏障功能障碍,从而引起免疫功能障碍。高水平的活性氧 (ROS) 引起的氧化应激可导致骨骼肌收缩障碍,导致肌肉无力和疲劳。因此,肠道微生物群失衡引起的炎症反应和氧化应激会对肌肉功能产生负面调节。
在结肠炎小鼠模型中,股四头肌和腓肠肌的骨骼肌质量和肌纤维横截面积减少,肌肉蛋白质含量减少。与此同时,肌肉功能障碍恶化,肌肉生长标志物 IGF-1 R(胰岛素样生长因子 1 受体) 和雷帕霉素磷酸化哺乳动物靶标 (mTOR) 下调。
研究人员认为,肠道微生物群失调引起的炎症可能是骨骼肌萎缩的触发因素。与肌原纤维分解相关的肌肉萎缩F-box(atrogin-1)和肌肉环指蛋白1(Murf-1)表达增强,介导肌原纤维加速分解。
IBD→炎症→肌肉合成和分解代谢→肌肉损伤
临床研究还发现,肌肉损伤是 IBD 等慢性胃肠道疾病的常见病理特征。42% 的 IBD 患者会出现肌肉减少症。
肠道微生物群刺激粘膜免疫细胞,促进促炎细胞因子(IL-6、IL-10、TNF-α等)的产生,产生一般状态慢性低度炎症,激活氧化应激损伤,进一步影响胰岛素敏感性、氨基酸生物合成、线粒体、生物生成、肌肉合成和分解代谢以及增加肌肉衰减相关分子途径。这可能导致肌肉骨骼损伤和虚弱。
➤ 衰 老
同样,体弱或活动能力差的老年人肠道微生物群的复杂组成也表现出不同程度的失调,物种丰富度降低以及机会性病原体和抗炎菌群之间的不平衡。
衰老→菌群多样性↓↓→代谢↓↓→炎症↑↑
肠道微生物群失调可能与肌肉萎缩的复杂机制有关。具体而言,肠道微生物群多样性因衰老而降低。同时,调节肠道环境的代谢能力也会下降,肠道屏障功能减弱,肠道粘膜通透性增加,从而导致包括脂多糖在内的细菌产物的吸收增加,并激活体内炎症反应。
与衰老相关的肠道微生物组会促进炎症,从而导致循环炎症介质的水平增加,而逆转这些与年龄相关的微生物组变化是减少与年龄相关的炎症和伴随发病率的潜在策略。
脂多糖促炎→代谢综合征→诱发骨骼肌衰老
脂多糖促进炎症信号传导,诱发骨骼肌炎症和胰岛素抵抗,从而促进代谢综合征的过程,进而诱发骨骼肌衰老。
研究表明,脂多糖相关细胞因子对蛋白质平衡(即合成和分解)的能力有决定性影响,并且随着衰老而增加的细胞因子可能会导致肌肉质量减少。
炎症反应增强会加剧骨骼肌质量损失
例如,在肌肉减少症患者中,IL-6 和 TNF-α 等促炎因子水平升高会导致肌肉质量减少。抗 TNF 治疗可以逆转微生物群中与年龄相关的变化,因此具有潜在的抗肌肉衰老作用。
肠道菌群变化与衰老中免疫稳态的紊乱有关
移植了年老小鼠肠道微生物群的年轻无菌小鼠的小肠,发现了与免疫相关的差异遗传特征,包括抗原呈递减少以及细胞因子和趋化因子产生的改变。这些基因可能在肠道微生物组老化过程中作为免疫紊乱的标志物发挥潜在作用。
肠道菌群失衡→肠漏→LPS释放到外周血
由于上述各种原因(炎症、营养不良、恶病质、衰老等)引起的肠道微生物生态系统组成的变化,可能导致肠漏和细菌内毒素(例如LPS)释放到外周血中。LPS可以通过TLR4受体触发巨噬细胞产生炎症细胞因子和ROS。
限制蛋白质合成,促进肌肉生长蛋白水解,肌肉萎缩
在骨骼肌中,TNF-α 激活参与NF-κB通路的基因表达,从而通过抑制肌细胞生成素和 myoD 来减少肌细胞分化和增殖。IL-6和IκB激酶可以抑制与诱导胰岛素抵抗相关的胰岛素受体底物1,限制mTORC1(雷帕霉素复合物1)肌肉靶标的激活,从而限制肌肉细胞中的蛋白质合成。
此外,由于蛋白激酶B受到抑制,叉头盒O的抑制作用不再发挥,导致泛素E3连接酶Atrogin-1和MuRF1表达增加,促进肌肉生长蛋白水解。
同样,不受 mTORC1 抑制的自噬激活激酶 1 进一步诱导骨骼肌细胞自噬。当肠道菌群失调引起的这些调节机制被激活时,蛋白质分解/合成之间就会出现不平衡,并最终导致肌肉萎缩。
其他机制:细菌群体感应,短链脂肪酸,胆汁酸
其他机制包括粪肠杆菌在细菌失调过程中产生的群体感应肽iAM373,下调了大多数骨骼肌发育和分化基因,降低了成肌细胞的代谢活性,并上调了肌管中的蛋白酶体降解途径,这是一种肌肉减少症新的诱导剂。
队列研究表明,肌肉减少症还与产生短链脂肪酸 的菌减少相关,从而导致肠道菌群失衡。
肠道菌群失调可能通过上调初级胆汁酸-法尼醇 X 受体途径导致骨骼肌萎缩。
骨
随着肠道微生物群在骨代谢稳态中的关键作用得到更好的了解,人们对肠道微生物群在调节骨骼健康中的重要作用越来越感兴趣(以前我们的文章专门介绍过肠道菌群与骨骼生长于骨代谢的关系,详见:肠道微生物如何影响骨骼发育和代谢 )。
肠道菌群失调与骨骼之间存在密切关系
研究发现,TLR5缺陷小鼠的肠道微生物群受损和微生物多样性较差会引起整体骨强度的变化;另外,长期使用抗菌药物引起的肠道菌群损伤(主要表现为拟杆菌、变形菌显著上调)导致小鼠骨性能受损,尤其是总骨量减少。卵巢切除术会导致小鼠肠道微生物群失调并导致骨质流失,这是由微生物依赖性 T 淋巴细胞(例如 Th17细胞)介导的。
骨密度低:
罗氏菌属、双歧杆菌属↓↓ 合成LPS的菌↑↑
在骨骼疾病患者中观察到肠道微生物群的变化。横断面研究表明,肠道微生物群与骨矿物质密度积累之间存在关联。最近,一项全基因组研究确定了与骨量变异相关的梭菌目和毛螺菌科。研究发现,与健康人相比,有害细菌过度生长的患者骨量较低,骨质流失率较高。
注:骨质流失加剧是 IBD 的常见并发症,肠道菌群失调也是IBD 的重要表现。
临床研究表明,骨矿物质密度低的个体肠道微生物群的组成和丰度显着下降。罗氏菌属(Roseburia)、双歧杆菌属和乳酸菌属等细菌群与骨密度呈正相关。然而,在骨矿物质密度较低的人群中,与LPS合成相关的微生物群更为丰富。
骨质疏松患者:多样性与骨密度呈负相关
研究发现,厚壁菌门/拟杆菌门的比例与骨量呈负相关,而放线菌和双歧杆菌与骨量呈正相关。使用 16sRNA 测序对骨质疏松症(OP)的肠道微生物群进行分析表明,肠道微生物群多样性估计值与骨矿物质密度呈负相关。
在骨质疏松患者中,如下菌属的丰度增加:
其他研究发现骨质疏松症患者Dialister和Faecalibacter显著增加。
菌群失调→营养素吸收能力下降→影响骨骼健康
微生物群对骨骼健康所需的营养素(例如钙和维生素 D)的运输和吸收具有必要的影响。肠道微生物群失调可能会损害营养物质和钙通过肠道进入循环系统的运输。随着年龄的增长,肠道对1, 25(OH) 2的吸收能力下降,这与肠道菌群失调密切相关。这也是微生物群失调影响骨骼健康的主要原因之一。
免疫系统干预肠道微生物群和骨代谢
生物多样性的变化和机会性病原体的定殖导致细菌内毒素的增加,例如脂多糖(LPS)、这与肠道炎症反应的增加有关,而炎症的增加与破骨细胞的激活有关。
肠道菌群失调会介导炎症
尤其是IL-1、TNF-α 和 IL-6,它们与骨质疏松症一样在破骨细胞激活中发挥着关键作用。
肠道微生物组依赖性Th17细胞和产生 TNF-α 的 T 细胞增殖产生大量促炎细胞因子(IL-17、TNF-α)、NF-κB 配体受体激活剂 (RANKL)、并减少RANKL拮抗剂的分泌(RANKL诱导破骨细胞功能,IL-17减少骨形成;TNF-α增强RANKL活性,诱导Th17细胞增殖和活化,是该过程中潜在的免疫调节机制。
注:Th17细胞是一类免疫细胞,主要参与调节免疫系统的炎症反应,并在自身免疫性疾病和炎症性疾病中发挥重要作用。
新生成的破骨细胞诱导了 Treg 细胞的生成。它抑制免疫反应,诱导和维持免疫耐受,通过多种途径减少炎症,并产生免疫抑制细胞因子,例如 TGF-β 和 IL-10。 Treg 细胞和 Th17 细胞之间微妙而复杂的关系会影响骨骼健康。重要的是,肠道细菌是控制这种平衡的关键。
注:破骨细胞是一种骨髓源性巨核细胞系的细胞,主要功能是吸收和降解骨组织。
Treg细胞是调节性T细胞(Regulatory T cells)的简称。它们是一类免疫细胞,主要功能是抑制免疫系统的活性,以维持免疫平衡和自身耐受。
肠道菌群→血清素下调→调节骨代谢
5-HT是5-羟色胺的缩写。它是一种神经递质,也称为血清素。根据合成部位分为两类:脑源性5-HT和肠源性5-HT。
有趣的是,这两种 5-HT 具有不同的功能:肠道来源的血清素对骨形成有负面影响,而大脑来源的血清素则具有相反的影响。近年来研究发现,肠道菌群不仅诱导细胞因子调节骨代谢,还通过减少血清素生物合成酶、增加血清素转运蛋白,下调肠源性血清素水平,从而调节骨代谢。
肠道菌群→改变 IGF-1→调节骨质量
IGF-1 在骨形成和生长的调节中也起着至关重要的作用。肠道微生物群可能通过改变 IGF-1 水平来调节整体骨质量。例如,传统特定肠道微生物群对成年 GF 小鼠的定植可以增加循环 IGF-1 并增加骨的形成和吸收。
菌群多样性↓↓→循环雌激素↓↓→影响骨钙沉积
肠道微生物群多样性减少也可能导致循环雌激素减少,进而影响正常骨钙沉积,因为肠道微生物群通过β-葡萄糖苷酶分泌调节雌激素,β-葡萄糖苷酶将雌激素分解为其活性形式。
注:IGF-1是胰岛素样生长因子-1(Insulin-like Growth Factor 1)的缩写。它是一种蛋白质激素,由肝脏和其他组织产生,并受到生长激素的调控。IGF-1促进细胞增殖和分化,对于骨骼和肌肉的生长和修复具有重要作用;也与肿瘤生长和代谢相关;较高的IGF-1水平与较长的寿命和较少的年龄相关疾病风险有关。
▸▹小结
根据上述研究结果提示,与肌肉健康类似,骨骼健康相关的肠道菌群紊乱主要表现为肠道优势菌群消失或减少,有害菌或衰老菌群的增殖导致LPS等产生过多或引起更多的炎症反应。机制主要涉及细胞因子以及Treg和Th17细胞的成骨/破骨平衡的微妙控制。
与肌肉健康不同,肠道菌群失调对钙离子有效吸收的影响以及肠道来源的 5-HT、IGF-1 和雌激素的调节作用也在此强调。这些机制是否也对肌肉健康发挥作用,可能是个有意义的探索方向。
骨 关 节
近年来,越来越多的证据表明肠道菌群失调与类风湿关节炎(RA)的发生和发展密切相关。在人类和动物研究中也观察到类风湿关节炎中肠道微生物群失调。
类风湿关节炎:拟杆菌↓↓,乳杆菌属、普雷沃氏菌属↑↑
在类风湿关节炎模型小鼠中,拟杆菌门减少、厚壁菌门和变形菌门增加。该模型还导致 14 种肠道细菌失衡,并对色氨酸、脂肪酸和次级胆汁酸等代谢物产生相当大的干扰。
在类风湿关节炎患者中,各种乳杆菌属(Lactobacillus)和普雷沃氏菌属( Prevotella)更加丰富;因此,普氏菌数量增加和肠道菌群失衡是 类风湿关节炎发展的潜在资源。
广古菌门(Euryarchaeota)与类风湿关节炎的严重程度直接相关,成为类风湿关节炎发病的独立危险因素。
拟杆菌丢失,普雷沃氏菌存在
在未经治疗的新发类风湿关节炎患者的粪便微生物群中,普雷沃氏菌(Prevotella)的存在同时拟杆菌的丧失(拟杆菌与普雷沃氏菌一般认为是拮抗菌)存在强烈相关性。
从类风湿关节炎患者的滑膜组织中分离出细菌 rRNA。类风湿关节炎患者肠道菌群中乳杆菌的数量和多样性显著增加,与报道胶原蛋白诱导性关节炎小鼠体内乳酸杆菌增加的数据一致。矛盾的是,嗜酸乳杆菌(Lactobacillus acidophilus)和干酪乳杆菌( Lactobacillus casei)似乎有利于类风湿关节炎的改善。
致病菌破坏屏障,促炎,诱导关节炎发生和维持
肠道机会致病菌,如普雷沃氏菌,可能通过增强细胞凋亡机制、破坏肠道屏障完整性,参与促炎免疫状态的形成,从而诱导关节病炎症的发生和维持。此外,Th17 细胞通过产生一系列炎症因子来促进破骨细胞分化,这些炎症因子是导致类风湿关节炎骨质破坏期的原因。拟杆菌的减少可能通过减少 Treg 细胞分化来促进局部炎症环境。
骨关节炎的发生可能是由于肠道菌群组成发生特异性变化,尤其是机会性促炎菌增多,具有抗炎特性的共生菌显著减少,肠道通透性增加,然后LPS引起炎症和免疫反应,诱导级联信号通路激活,导致关节病变甚至疼痛,但相关证据有限。而类风湿性关节炎与免疫炎症相关的研究相对深入,肠道菌群多样性较为丰富,但也导致机制更加复杂,需要进一步探索。
这里主要总结了益生菌及其次级代谢产物对肌肉骨骼系统的影响和机制。
骨 骼 肌
由于肠道微生物组的活性,肠道与骨骼肌相关,并通过调节全身/组织炎症、胰岛素敏感性等来调节肌肉功能。
益生菌通过改善肠道微生物群的多样性,来对抗肌肉质量和功能的损失。
➤小鼠模型
在小鼠癌症模型中,罗伊氏乳杆菌能够抑制恶病质的发展,并与肌肉质量的保存有关。
植物乳杆菌HY7715通过改善老年 Balb/c 小鼠的骨骼肌质量和功能来改善肌肉减少症。
补充植物乳杆菌TWK10 可改善小鼠的运动表现并增加肌肉质量。
副干酪乳杆菌PS23 通过确保 SAMP8 小鼠的线粒体功能来减缓与年龄相关的肌肉损失。恢复特定乳酸杆菌水平可减少急性白血病小鼠模型中的炎症和肌肉萎缩标志物。
其他实验还表明,至少有七种益生菌对小鼠骨骼肌质量和强度有益:
其中,使用最广泛的菌株是乳杆菌和双歧杆菌,它们可以改善肌肉质量、力量和耐力损失。
益生菌有助于肌肉健康,提高蛋白质合成和力量,但益生菌的作用可能针对不同的信号或代谢途径和组织,例如降低炎症和压力、维持肌肉蛋白质合成、并提高了肌肉力量。然而也有研究表明,对肌肉质量和功能的影响几乎很小,仅观察到一定的抗炎作用。
➤人类
年轻人:益生菌可以改善运动耐力、增肌
在人类中,已经发现摄入特定的益生菌可以改变肠道微生物群,有利于增加骨骼肌质量。例如,摄入植物乳杆菌TWK10 六周可以提高年轻人在跑步测试中的耐力表现。补充植物乳杆菌表明,益生菌可以改善运动表现、耐力以及身体成分,减少脂肪量并增加肌肉量。
老年人:需进一步探索益生菌对肌肉的影响
不过,也有报道称,老年人补充益生菌在一定程度上可以导致肠道菌群发生有益变化,减少病原体,改善便秘,但对宿主健康的影响相对较小。
含有乳酸菌和双歧杆菌菌株以及干酪乳杆菌的对老年人的肌肉状况没有影响。这些发现表明益生菌的作用机制很复杂,需要进一步研究。
最近的一项荟萃分析表明,补充益生菌可以增强肌肉质量和力量,但在总去脂体重方面没有观察到有益效果。该研究表明,探索不同老龄化人群生理机制的差异,并探索补充合适的益生菌菌株以获得最佳肌肉质量和力量非常重要。
上述发现,研究的稀缺性、人群的变异性和重复性低,导致很难找到优化肌肉质量和功能的特定益生菌菌株,需要在更明确的人群中进行进一步研究设计个性化的益生菌干预措施。
— 改善血糖,提高肌肉质量和功能
益生菌可降低厚壁菌门与拟杆菌门的比例,从而提高小鼠的肌肉质量、耐力和力量。添加 植物乳杆菌 TWK10和 CP2998 可通过抑制糖皮质激素受体激活、改善血糖对肌肉发挥积极作用。
扩展阅读:
— 抑制炎症反应,改善肌肉合成
补充干酪乳杆菌LC122 和 长双歧杆菌BL986可降低炎症细胞因子 TNF-α、IL-6 和 IL-1β 的表达,并改善肌肉蛋白合成。
口服短双歧杆菌和鼠李糖乳杆菌可显着降低小鼠促炎细胞因子 IL-2、IL-4、IL-6 和 TNF-α 的水平,从而抑制炎症反应。还通过增加 IL-10 水平来减轻肌肉炎症。
还发现含有植物乳杆菌 TWK10 和罗伊氏乳杆菌的可以改善小鼠的肌肉质量,这与减少炎症和肌肉萎缩标记物表达有关。
— 抗氧化,或增加蛋白质吸收的方式
服用副干酪乳杆菌PS23的老年小鼠肌肉中抗氧化应激因子(例如超氧化物歧化酶和谷胱甘肽过氧化物酶)的表达较高。
罗伊氏乳杆菌可提高乳清蛋白中亮氨酸的吸收比例,从而增强蛋白质吸收,提高蛋白质利用率,最终促进肌肉合成,增加肌肉质量。
— 其他作用机制
益生菌的有益作用还通过多种机制产生,包括诱导免疫调节、抵抗生理应激、抑制病原体和改善肠上皮细胞的屏障功能。益生菌调节肌肉的潜在机制主要包括:
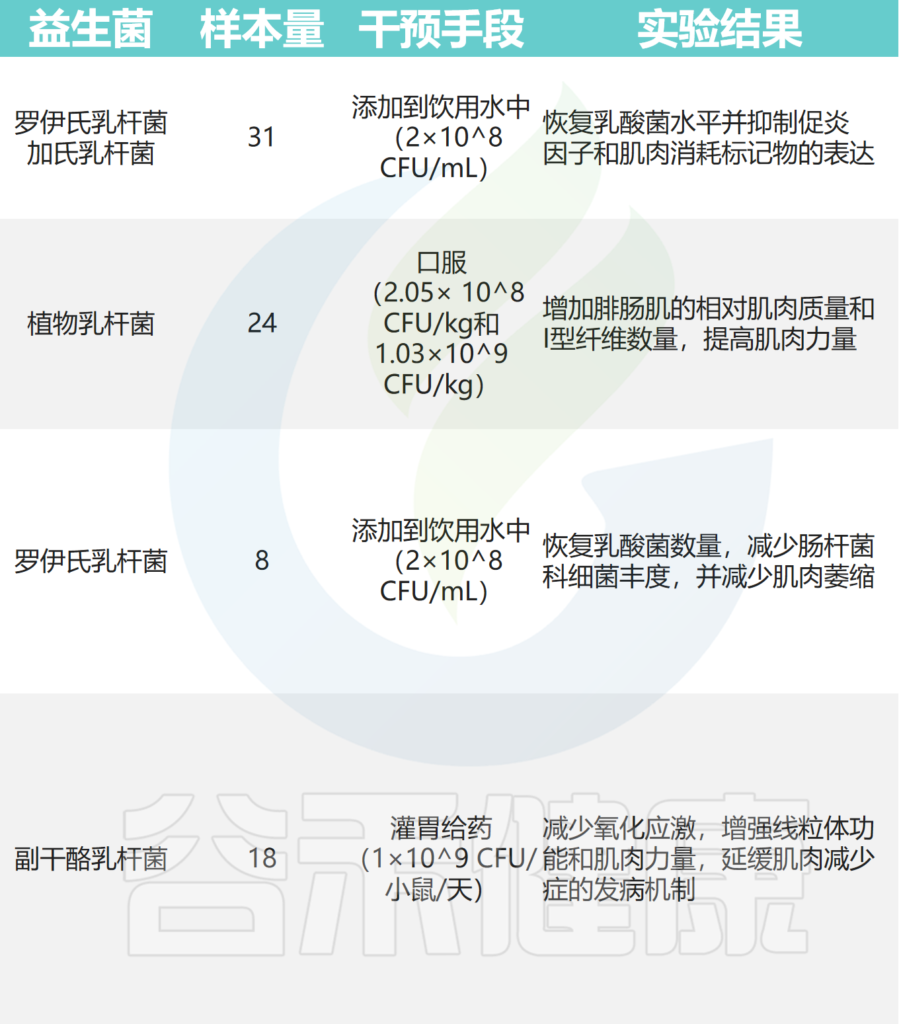
doi: 10.1080/19490976.2023.2263207
肠道益生菌限制胰岛素抵抗、调节代谢途径或抑制氧化应激和炎症。肠道菌群还可以通过不同的代谢途径将营养物质分解为次级代谢产物,调节肠道免疫和代谢稳态,维持宿主与肠道菌群之间的共生和寄生关系。
下面讨论这些代谢产物对骨骼肌代谢的主要影响和作用机制。
短链脂肪酸(SCFA)是肠道菌群对膳食纤维发酵产生的代谢产物,主要包括丁酸盐、丙酸盐和乙酸盐。SCFA 在葡萄糖和脂质稳态、炎症调节以及肠道与其他远端组织之间的连接中发挥着重要作用。
SCFA在调节肠道环境稳态、改善糖代谢、促进钙磷吸收、缓解氧化应激和炎症反应等方面发挥着重要作用,对调节骨骼肌功能具有重要意义。
无菌小鼠接受 SCFA 治疗后,骨骼肌损伤得到部分逆转(SCFA 降低了 atrogin-1 表达,增加了 MyoD 以及肌肉质量和功能),表明肠道菌群产生的 SCFA 在调节骨骼肌功能中发挥着关键作用。
丁酸盐:保持肌肉质量
在一项针对雌性 C57BL/6 小鼠的研究中,丁酸盐治疗后后肢肌肉萎缩得到完全或部分改善,而常规饮食喂养的老年 C57BL/6 雌性小鼠后肢肌肉质量显着降低。丁酸盐不仅能保持肌肉质量,还能改善小鼠的葡萄糖耐量,但对胰岛素耐量没有显着影响。
丁酸盐:改善线粒体功能,减少氧化应激,防止骨骼肌损伤
丁酸盐还能增加线粒体蛋白孔蛋白和线粒体转录因子 A 的水平,并显着改善骨骼肌细胞中的线粒体功能。
此外,丁酸盐治疗可减少小鼠氧化应激表达和细胞凋亡标记物,并改变抗氧化酶的活性,从而防止氧化应激引起的骨骼肌损伤。
丁酸盐:改善与年龄相关的肌肉损失
丁酸盐是一种重要的 SCFA 和组蛋白脱乙酰酶抑制剂,可调节与年龄相关的肌肉损失。丁酸盐已可以通过抑制组蛋白脱乙酰酶表达并改善老年小鼠的肌肉质量和横截面积来促进肌肉合成。
乙酸盐:促进葡萄糖吸收,减少肌内脂质生成
添加乙酸盐可以促进兔骨骼肌中的葡萄糖吸收和糖原生成,并通过增加脂肪酸和氧化来减少肌内脂质生成。
此外,SCFA 还可诱导 IGF-1 产生,从而促进肌肉合成代谢。SCFA 的这些代谢影响可能直接作用于骨骼肌,也可能通过刺激胰高血糖素样肽 1 (GLP-1) 分泌而间接产生。SCFA 对肌肉的其他间接影响包括加速血流效应。
分解色氨酸,产生吲哚代谢物:抗炎,增强肌肉蛋白合成
色氨酸是人体不可缺少的芳香氨基酸。肠道菌群分解色氨酸过程中产生的富含吲哚和吲哚衍生物的代谢物在维持肠道环境稳态和肠道菌群多样性方面发挥着关键作用。
来自肠道微生物群的吲哚代谢物可以增强体内IL-10水平,而IL-10在调节宿主炎症状态方面具有抗炎作用。
其他研究的证据表明,色氨酸代谢物吲哚丙烯酸可通过下调炎症和氧化应激相关基因表达来促进肠道屏障功能并抑制炎症反应。当机体处于慢性炎症状态、肌肉蛋白合成受到限制时,色氨酸代谢物的抗炎作用尤其重要。
肠道菌群→影响胆汁酸代谢→影响骨骼肌代谢
胆汁酸是肝脏产生并分泌到肠道的小代谢分子,参与膳食脂质吸收。肠道菌群可以改变胆汁酸的结构、生物利用度和生物活性,从而影响胆汁酸代谢和宿主代谢稳态。
肠道厌氧菌已被证明可以将初级胆汁酸转化为次级胆汁酸。毛螺菌科也可以产生 SCFA 并从初级胆汁酸转变为次级胆汁酸。
肠道菌群可能参与胆汁酸代谢和 FXR-FGF19 信号通路(有证据表明 FGF19 激活可以抑制肌肉萎缩标志物的蛋白表达,增强与生肌分化相关的分子,调节骨骼肌蛋白平衡,这反过来又影响骨骼肌代谢。次级胆汁酸还可以通过促进脂质和葡萄糖代谢来增强肌肉功能。
益生菌→促进维生素合成→影响骨骼肌功能
维生素是人体必需的微量营养素,大部分是人体无法合成的。实验证据证实,肠道益生菌促进体内维生素的合成,对骨骼肌功能有显著影响。例如,双歧杆菌和乳酸杆菌可以合成B族维生素 (包括叶酸、核黄素、维生素 B12)。B族维生素是直接参与能量代谢的水溶性维生素,它们的缺乏会导致心肌损伤和心力衰竭。维生素 B12缺乏会增加同型半胱氨酸水平并导致肌肉损伤。
骨
先前的研究表明,益生菌有利于肠道稳态,并在预防和治疗骨质流失中发挥关键作用。
益生菌
胃肠道中乳杆菌的上调可以产生有效的杀菌剂和有机酸,从而抑制致病性大肠杆菌。肠道菌群中乳酸杆菌和乳球菌丰度的增加。
罗伊氏乳杆菌补充剂可以显着改善肠道微生物群的不平衡,增强肠道屏障功能以防止骨质流失。
在一项随机对照试验中,75-80 岁骨量低的绝经后妇女每天服用罗伊氏乳杆菌,12个月后骨密度下降的比例明显低于对照组,这表明益生菌补充可以减少骨质流失。
补充普通双歧杆菌还可以降低 LPS 浓度,从而抑制炎症反应并防止骨质流失。
嗜酸乳杆菌和克劳氏芽孢杆菌(Bacillus Clausii)可以通过平衡炎症细胞因子的水平来维持骨稳态。
长双歧杆菌还可以预防和治疗骨质疏松症,通过增强成骨细胞活性和抑制破骨细胞形成来改善骨质流失。
此外,益生菌可以通过调节矿物质吸收来改善骨骼健康。例如,长双歧杆菌可以通过改善钙、磷酸盐和镁等矿物质的吸收来增强骨密度。罗伊氏乳杆菌可以通过抑制破骨细胞来减轻骨质流失。
益生菌促进维生素B12、维生素D、钙等吸收
维生素B12水平低还会抑制成骨细胞活性,从而增加骨质疏松风险,甚至诱发骨折。
益生菌如乳酸菌和双歧杆菌,在促进核黄素和叶酸的形成方面发挥着关键作用。核黄素和叶酸对于促进维生素合成和调节炎症反应很重要。研究表明,核黄素在一定程度上具有抗炎作用,其摄入可抑制大鼠白细胞中TNF-α的释放。
核黄素还作为抗氧化酶的辅助因子调节氧化应激。叶酸与调节胰岛素抵抗和抑制促炎细胞因子 IL-6、IL-8 和 TNF-α 有关。
不难发现,B族维生素的抗炎、抗氧化、参与能量代谢等功能对于维持骨骼健康是不可或缺的。钙和维生素 D 的吸收对于健康的骨骼维护尤为重要,益生菌可降低肠道PH值并改善钙吸收,从而增强骨骼功能。
多联益生菌→抗炎→减轻骨关节炎
在骨关节炎(OA)大鼠模型中,益生菌复合物通过抑制促炎细胞因子和软骨破坏来减轻骨关节炎的发展。
在一项人体试验中,537 名 骨关节炎(OA) 患者随机分配到干酪乳杆菌或安慰剂组,6 个月后,与对照组相比,干酪乳杆菌组的全身炎症显着降低。口服嗜热链球菌可改善骨关节炎变性。
口服丁酸梭菌(Clostridium butyricum)可有效保存 骨关节炎大鼠膝关节软骨和滑膜,显着减少纤维组织量,并显着降低骨和软骨各种炎症和代谢标志物的血清浓度。
干酪乳杆菌通过下调促炎细胞因子来减轻关节炎症损伤。益生菌最近添加到治疗关节炎症的药物清单中,因为干酪乳杆菌可以抑制关节肿胀、减少类风湿性关节炎,并防止关节炎症大鼠的骨质破坏。
嗜酸乳杆菌和干酪乳杆菌也常用于治疗类风湿性关节炎的缓解剂。还有人提出,用于缓解类风湿性关节炎相关后果的益生菌补充剂的可用性仍然很弱,而且益生菌对类风湿性关节炎的影响似乎是菌群特异性的。
肠道菌群代谢产物
短链脂肪酸:参与骨代谢,抑制骨吸收
短链脂肪酸(SCFA)参与骨代谢并影响骨形成和吸收。SCFA 对骨量的保护作用与抑制骨吸收有关。从潜在机制来看,丁酸盐和丙酸盐诱导破骨细胞代谢重编,增强糖酵解,下调关键破骨细胞基因,显着减少破骨细胞数量,从而抑制骨吸收。
因此,SCFAs是破骨细胞代谢和骨稳态的有效调节剂,在促进骨形成中发挥重要作用。
丁酸盐:促进骨合成代谢,维持骨代谢平衡
在一项小鼠研究中,发现丁酸盐可以通过调动成骨细胞中的 Wnt 信号通路来促进骨合成代谢并增加骨量。
此外,丁酸盐可以保护成骨细胞前体细胞免受过氧化氢诱导的损伤,并促进成骨细胞的矿化和分化。它主要通过增强细胞抗氧化酶的活性、促进ATP的产生、降低ROS水平来维持骨代谢的平衡。
短链脂肪酸还可诱导 IGF-1 的产生
IGF-1除了促进骨骼肌功能外,在骨代谢中起着至关重要的作用。IGF-1参与骨形成和吸收,调节骨代谢平衡。因此,SCFA 在维持骨代谢过程中的体内平衡中发挥着关键作用。
短链脂肪酸→调节IL-10→减轻关节炎
乳酸菌产生的丁酸通过控制软骨细胞自噬和炎症细胞死亡来抑制骨关节炎。益生菌衍生的丁酸盐可以通过影响 T 和 B 细胞的进展来抑制小鼠关节炎。
色氨酸代谢与骨代谢密切相关
犬尿氨酸是一种色氨酸代谢物,是色氨酸酶降解后形成的第一个稳定代谢物。
犬尿氨酸在骨代谢中的关键功能似乎是加速骨质流失并介导对骨骼的不利影响。犬尿氨酸含量随着衰老而增加,其对骨骼的不利影响可能是由于其对破骨细胞活化的影响,导致骨骼脆性增加和骨重塑失衡。
其他研究表明,犬尿氨酸水平升高会损害成骨细胞分化并增加破骨细胞吸收,从而加速骨骼老化。
次级胆汁酸调节骨稳态
次级胆汁酸还通过调节成骨细胞和破骨细胞之间的信号转导来调节骨稳态。此外,次级胆汁酸诱导 GLP-1 的产生,GLP-1 调节葡萄糖稳态并刺激成骨细胞分化并能进一步增强骨骼系统的功能。
对于益生菌及其次级代谢产物,其抗炎和免疫调节特性值得进一步研究,以确定其在肌肉骨骼系统中的作用和生物学机制。
小结
常见肠道微生物群对肌肉骨骼系统的影响
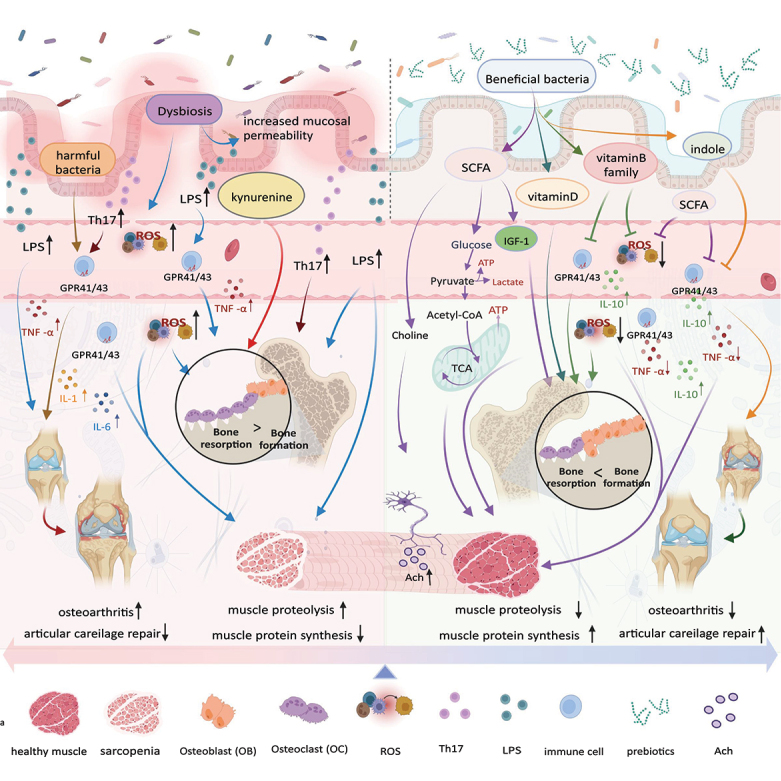
doi: 10.1080/19490976.2023.2263207
肠道微生物群及其产生的代谢物的重要作用:
然而,肠道微生物群的失衡还会引发一系列负面影响:
肠道菌群与肌肉骨骼系统的正常代谢密切相关。可以采取适当的干预措施,促进肠道益生菌发挥最佳调节作用。
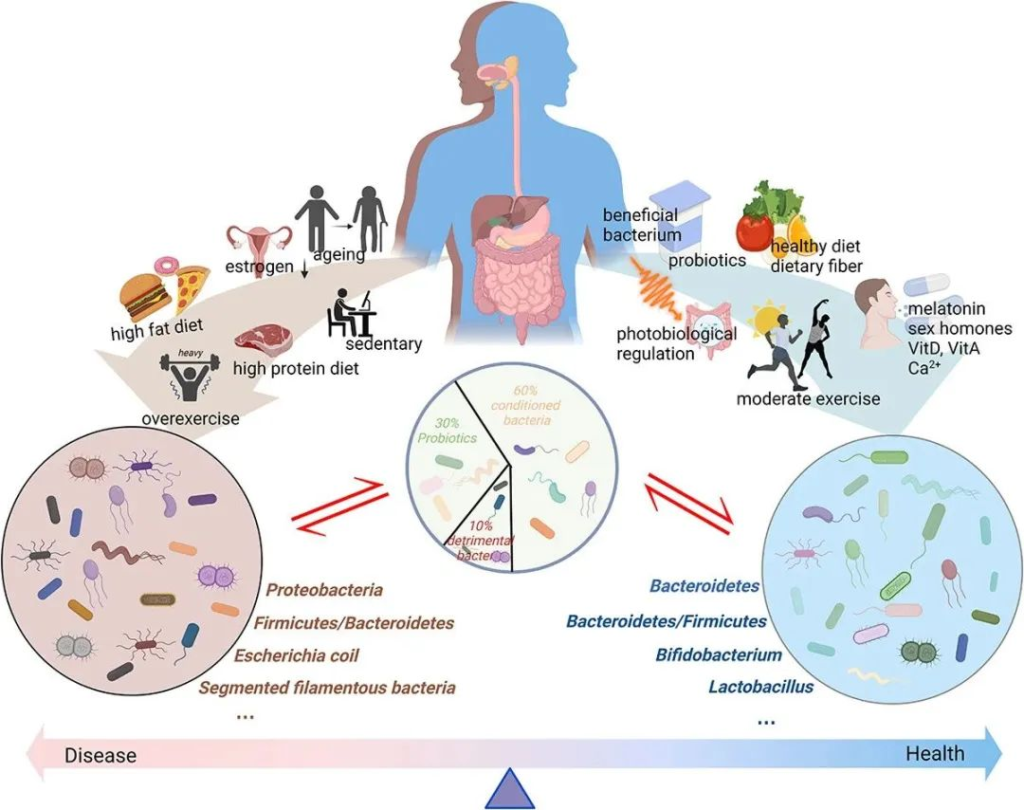
doi: 10.1080/19490976.2023.2263207
肠道微生物群一般分为三类:益生菌、有害菌和条件菌。
不同的生活方式对肠道微生物群产生不同的影响。衰老、性激素分泌减少、高脂肪饮食、高蛋白饮食以及久坐的生活方式或过度运动会对肠道微生物群产生负面影响。这些都会导致有害细菌比例增加,诱导粘膜通透性并引发一系列负面反应。同时,健康饮食、适度运动、光生物调节、补充益生元和益生菌、维生素、钙、性激素、褪黑素等可以促进肠道菌群的积极变化,从而增强肌肉骨骼系统功能。
促进肌肉骨骼系统健康
益生元通过选择性刺激某些肠道菌群的活性或生长,对宿主肌肉骨骼系统产生有益的生理作用。益生元有助于有益菌生长,比如乳杆菌和双歧杆菌等,常见的益生元有菊粉、低聚糖等。
益生元可改善肠道屏障功能和宿主免疫力,并减少梭菌等潜在致病菌的丰度。
益生元→炎症↓↓→肌肉质量↑↑
结果表明,喂食益生元纤维寡糖的小鼠的循环 LPS 水平和炎症降低,肌肉质量增加。此外,补充益生元可提高双歧杆菌、乳杆菌、拟杆菌门/厚壁菌门的比例。
同时,益生元作为膳食纤维的一种,也可以促进 短链脂肪酸的生成。
维生素D:有利于钙吸收、维持肠道屏障
维生素 D 是增加骨量的关键因素。除了直接影响钙吸收外,维生素 D 还通过维持肠道屏障的完整性来调节肠粘膜稳态,从而影响免疫系统功能和炎症反应。维生素D可以抑制促炎因子的水平,促进体内抗炎因子的分泌。
维生素D:改善肠道微生物稳态、促进肌肉合成
具体研究结果表明,维生素 D 补充剂可以调节女性肠道菌群并增加其多样性。维生素D补充后,AKK菌和双歧杆菌的相对丰度增加。
争议:维生素D能否改善肌少症,需要更多研究
维生素 A 在维持肠道屏障功能、调节免疫反应和细菌多样性以维持肠道稳态方面表现出类似的功能。但是同时有报道称,补充维生素 D 并不能改善社区老年人的任何肌肉减少症指数,并且可能会损害身体功能的某些方面。需要更多的实验证据来阐明维生素 D 的作用。
钙:菌群多样性↑↑ 有益菌↑↑ 保护肠道屏障
钙是体内最常见的矿物质,其摄入量关系到骨骼的健康发育。钙也是维持骨骼肌正常兴奋和收缩功能的最重要元素。膳食钙摄入量会引起肠道微生物群的变化。例如,用膳食钙喂养的小鼠肠道微生物群多样性显著增加,双歧杆菌、拟杆菌、瘤胃球菌科(Ruminococcaceae)和阿克曼氏菌(Akkermansia)丰度更高。
此外,膳食钙似乎对肠道屏障具有保护作用,通过增加宿主体内膳食钙的吸收来增加缓冲能力并促进骨量。总之,膳食钙可调节肠道微生物群,与宿主建立交叉对话,促进新陈代谢,并促进肌肉骨骼健康。
促进肌肉骨骼系统健康
肠道微生物群最近被定义为宿主营养信号的“传感器”。所消耗食物的类型和多样性与肠道微生物群的组成密切相关。
动物性饮食:拟杆菌门↑↑ 乙酸盐、丁酸盐↓↓
先前研究的证据表明,饮食模式的长期变化会引起肠道菌群的变化。短期饮食改变也会导致肠道微生物群的变化。例如,从植物性饮食转变为动物性饮食后,肠道中乙酸盐和丁酸盐的浓度显着降低。此外,以动物为基础的饮食增加了拟杆菌门的数量,并减少了厚壁菌门数量。
富含蛋白质的饮食:菌群多样性↑↑ 拟杆菌↑↑
骨骼肌质量受到肌肉蛋白质合成和分解的影响,肠道微生物群随年龄的变化也受到膳食蛋白质摄入量的影响。此外,摄入富含蛋白质的饮食与肠道微生物群的多样性呈正相关,可以提高肠道微生物群中拟杆菌。
长期高蛋白饮食:并不总是对肌肉产生积极影响
耐力运动员长期服用牛肉蛋白补充剂会减少双歧杆菌等有益肠道细菌的丰度。此外,结肠中未消化的蛋白质残留物发酵产生的化合物对肠道、免疫和代谢功能具有潜在的负面影响。
高脂肪饮食:炎症↑↑ 氧化应激、 变形菌↑↑
对高脂肪饮食小鼠的研究表明,这种饮食会增加体重和炎症标记物的表达,并降低葡萄糖耐量;更重要的是,高脂肪饮食喂养的小鼠体内LPS的循环水平增加了两到三倍,这导致肠道通透性增加,从而引发损害肌肉质量的炎症反应。
高脂饮食摄入引起的肥胖还可能导致体内 ROS 过量产生和氧化应激反应,并随之增加脂肪因子群和 TNF-α 表达,从而加重体内慢性炎症反应并影响骨骼肌肉功能。此外,高脂肪饮食可以减少 SCFA 的产生,并增加变形菌的比例。
地中海饮食:均衡蛋白质、碳水化合物、多酚,有益菌↑↑ 炎症↓↓
较高的碳水化合物摄入量与肠道菌群多样性下降密切相关。虽然双歧杆菌含量增加,但乳酸菌和链球菌含量减少。
咖啡、茶和红酒富含多酚,多酚与益生元丰度和双歧杆菌活性有关。膳食多酚可以增加产短链脂肪酸菌的繁殖并抑制产LPS菌的生长,从而调节肠道微生物群并影响肌肉骨骼系统健康。
地中海饮食的摄入有助于维持健康的肠道菌群,因为该饮食均衡摄入优质蛋白质和复合碳水化合物以及较高水平的纤维和多酚。因此,健康的饮食可以提高益生菌的相对比例并调节炎症,而不健康的饮食会导致肠道菌群失调、氧化应激、炎症等不良反应,最终损害肌肉骨骼系统的健康。
促进肌肉骨骼系统健康
运动改善效果大于营养补充剂
适度的运动可以改善肌肉、骨骼和关节。研究结果表明,运动干预可以有效改善60岁以上老年人的肌肉质量和功能,并且运动的效果明显大于营养补充剂。
运动还可以有效增加骨矿物质密度,提高骨强度,降低骨质流失风险以及跌倒和骨折的发生率。同样,运动可以缓解骨关节炎患者的疼痛、增强关节功能并提高生活质量。
运动:改善肠道菌群、改善肌肉骨骼健康(动物)
在人类和动物实验中,运动可以促进肠道微生物群的积极变化,从而改善肌肉骨骼功能。高强度训练可以防止高脂肪饮食诱导的肥胖小鼠中与肥胖相关的肠道微生物群失调,并维持肠道微生物群的多样性。非肥胖小鼠的拟杆菌与厚壁菌门的比例在运动后也会发生变化,并且拟杆菌的丰度在运动后显着增加。
在一项针对肥胖大鼠的运动和饮食研究中,随着时间的推移,运动对肠道微生物群产生更强、更稳定的影响,并能更有效地促进肠粘膜完整性和代谢功能。
运动员多样性高,肠道菌群有助于运动中乳酸转化为丙酸
关于运动与肠道微生物群之间关系的人体研究也获得了类似的结果。接受强化训练的精英运动员肠道微生物群的相对丰度明显高于久坐的成年人。
职业橄榄球运动员的肠道微生物群多样性高于非职业运动员。职业运动员的炎症细胞因子水平也低于非职业运动员。此外,研究表明,肠道微生物群菌群还可以通过将运动过程中产生的乳酸转化为丙酸,从而延长跑步时间,提高运动成绩。
扩展阅读:
肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?
有氧运动:拟杆菌↑↑ 改善心肺健康
有氧运动期间人体中拟杆菌门和厚壁菌门之间的平衡对于维持健康至关重要,肠道细菌定植平衡的破坏可能导致炎症和代谢或神经系统疾病。
日本一项关于有氧运动干预老年女性肠道微生物群的研究表明,为期 12 周的有氧运动计划不仅增加了拟杆菌,而且还改善了心肺健康。同时,快走时间增加超过 20 分钟的受试者中拟杆菌的丰度。
因此,适度运动可以通过改善肠道菌群组成、增强肠道粘膜功能、抑制炎症反应、维持多种肠道菌群来增强肌肉骨骼功能。
有氧运动+益生元:改善代谢紊乱,预防膝关节损伤
运动对肠道微生物群的潜在影响介导了骨关节炎的过程。在一项动物研究中,研究人员给高糖、高脂肪饮食的小鼠,同时进行有氧运动、益生元或两者的结合,发现两种干预措施的结合完全可以预防肥胖老鼠的膝关节损伤。
有趣的是,另一项研究表明,有氧运动和益生元的结合可以改善肥胖大鼠的代谢紊乱,但不能改善膝关节先前存在的骨关节炎损伤。因此,需要进一步研究进行更大样本的临床调查。
过度运动:促炎,限制肌肉形成、微生态失衡
过度运动可能会促进炎症、营养限制以及氧化和代谢应激,从而限制肌肉形成。过度训练的其他负面影响包括肠道缺血、肠道屏障通透性增加和氧化应激,从而导致肠道微生态失衡、炎症反应增加、分解代谢增加和肌肉功能恶化。
定期训练与更好的生物多样性和对肠道微生物群的有益影响有关。某些研究的证据支持这样的观点,即疲劳训练可能与有害的微生物后果有关。因此,运动对肠道菌群的影响可能取决于运动的强度和持续时间。
促进肌肉骨骼系统健康
肠道细菌与人体细胞的比例因性别而异,女性的比例高于男性。细菌与人体细胞的比例男性为1.3,女性为2.2 。
绝经后女性:厚壁菌门 / 拟杆菌门比例 ↓↓
女性肠道微生物的多样性也更高。Akkermansia muciniphila在女性中尤其丰富。绝经前女性的厚壁菌门/拟杆菌门比例高于绝经后女性。
绝经前女性中普雷沃菌属、毛螺菌属(Lachnospira)、嗜胆菌属( Bilophila)的相对丰度低于绝经后女性,同时炎症水平的 IL-6 和单核细胞趋化蛋白-1 血浆水平也较低。
这表明雌激素可能影响肠道微生物稳态和免疫的调节。与此同时,肠道菌群失衡也会影响雌激素活性。
绝经后雌激素水平下降,对肠道屏障和骨骼健康造成损害
如前所述,肠道微生物群通过分泌 β-葡萄糖苷酶来调节雌激素,当这一过程因肠道菌群失调(其特点是微生物多样性减少)而受到损害时,会导致循环雌激素减少,从而影响骨骼代谢。
非卵巢雌激素更多地受到肠道微生物组的影响,这可能是绝经后妇女更容易患骨质疏松的原因之一。因此,维持肠道稳态对于雌激素的正常分泌和骨代谢的平衡至关重要。
老年人睡眠障碍:与肠道菌群,肌少症相关
人们认为肌肉骨骼健康的丧失与睡眠障碍有关。同时,在老年人中,较短的睡眠时间与促炎细菌的增加有关,而睡眠质量的改善与Warts microbacteria、Flatcoccus有关。
年轻人睡眠中断:肠道菌群变化介导促炎状态
在年轻人中,睡眠中断对肠道微生物组成的影响,特别是有益的厚壁菌门与拟杆菌门的比例,仍然是矛盾且不清楚的。这项研究不仅将加深对肌肉减少症的多种影响因素的理解,而且还可以对这种复杂的情况提供更全面的看法。
当睡眠不佳时,肠道微生物群经常发生变化,这可能介导睡眠障碍和肌肉减少症之间的促炎症状态。
这些发现不仅表明肠道微生物群在睡眠质量和肌肉减少症之间的相关性中发挥着重要作用,而且还暗示调节睡眠的激素(例如褪黑激素)可能是有效的干预目标之一。
褪黑素:调节睡眠、抗炎抗氧化、保护骨骼肌
褪黑素是另一种调节睡眠和昼夜节律的内源性激素,具有抗衰老、抗炎和抗氧化特性,是一种用于疾病治疗和骨骼肌质量改善的安全膳食补充剂。褪黑素可减少氧化应激和炎症,并保护骨骼肌免受氧化损伤。
此外,它还可以改善衰老过程中的肌肉线粒体功能。对老年人的研究也表明褪黑激素水平与肌肉力量之间存在显著相关性。
褪黑素:逆转睡眠剥夺小鼠的肠道菌群失衡
有趣的是,睡眠剥夺小鼠的肠道菌群减弱,益生菌种类有限。有趣的是,褪黑素治疗逆转了这种异常的微生物组组成。褪黑激素可以改善动物和人类的肠道微生物群。口服褪黑激素补充剂可以减少脂质积累,逆转肠道微生物群失衡,并改善肠道菌群的多样性。
褪黑素:改善肠道生态失衡,恢复SCFA水平
高脂肪饮食喂养的小鼠肠道中SCFA水平显著降低,但在补充褪黑激素后恢复。此外,高脂饲料喂养的小鼠补充褪黑素可以有效改善肠道生态失衡,褪黑素可以改变厚壁菌门与拟杆菌门的比例,增强肥胖小鼠的肠粘膜功能。
褪黑素:减轻胰岛素抵抗,参与骨代谢
同时,补充褪黑激素减轻了小鼠因低度炎症和高脂肪饮食摄入引起的胰岛素抵抗。褪黑激素可以调节胰岛素敏感性,因此在维持葡萄糖稳态和调节葡萄糖代谢方面具有关键作用。
褪黑素还可通过激活核因子红细胞 2 相关因子 2 (Nrf2)/过氧化氢酶信号通路抑制破骨细胞形成,从而治疗炎症性骨溶解。
因此,我们可以推断,褪黑激素可以增强肠道粘膜功能,改善脂质和糖代谢,并通过调节肠道微生物群失调促进 SCFA 的产生,从而最终增强肌肉骨骼系统的功能。
促进肌肉骨骼系统健康
作为一种局部治疗,光生物调节在临床上用于治疗各种病症,包括肌肉疲劳、关节和肌腱炎症以及伤口和骨折愈合。
光生物调节:肠道菌群多样性↑↑
对健康小鼠腹部照射PBM后,小鼠肠道菌群发生显着变化,肠道菌群多样性也显着增加。这种效果在每周接受 3 次红光治疗的小鼠中最为明显,但在接受单次红光治疗的小鼠中则不明显。
近红外光比红光发挥更显着的效果
近红外照射后,小鼠肠道菌群中益生菌的比例显着增加,并且治疗还调节了与肠道菌群失衡相关的细菌丰度;这种作用可能归因于 PBM 对肠道微生物群的抗炎和氧化还原信号作用。
紫外线辐射:影响肠道菌群,维生素D和钙吸收,促进骨骼健康
紫外线辐射也会影响骨质流失大鼠模型中的肠道微生物群结构和功能。除了抗炎作用外,紫外线辐射还可以通过诱导维生素D合成和肠道钙吸收来调节骨代谢,从而促进骨形成、减少骨吸收、增强骨矿物质密度。该证据表明,尽管没有太多直接证据,但 PBM 仍然显示出通过调节肠道菌群失衡维持肌肉骨骼系统稳态的潜在作用。PBM 有潜力作为辅助疗法(与饮食和运动一起)来平衡微生物组并促进肌肉骨骼健康。
包括运动、电针和补充益生菌在内的生活方式干预措施对肠道微生物群有直接影响,改变其组成和功能,改善疼痛和生活质量,这为患有多种慢性疾病的患者开辟了新的治疗机会的创新途径。
肠道和骨骼之间的跨学科作用越来越引起骨生物学领域的关注。肠道菌群调节肌肉骨骼健康的潜在机制包括蛋白质、能量、血脂、糖代谢、炎症水平、神经肌肉连接性和线粒体功能。
肠道菌群的组成和代谢变化可能会影响肌肉骨骼系统的功能。肠道菌群失衡增加促炎因子水平,激活氧化应激途径,减少肌肉质量,影响骨形成和吸收。
肠道菌群调节的个性化治疗对于肌肉骨骼系统疾病的治疗来说既困难又充满希望。
临床应用,还需深入研究
在粪便移植的临床研究中,现有的荟萃分析对粪便移植对85种疾病的治疗效果进行综述发现,大多数研究是在传染病和肠道疾病方面进行的,而与肌肉骨骼健康直接相关的研究很少。
不同人群的年龄、遗传背景、生活方式等背景下,肠道微生物群变化可能会汇聚成不同的病理微生物群模式,这些复杂的相互作用需要进行大规模的纵向研究才能解决。
临床应用刚刚开始,考虑到微生物菌群的复杂性和个体差异,是否适合筛选促进肌肉骨骼健康的细菌,或者基于人类粪便细菌移植的个体化治疗;无论是肠道微生态干预的手段和方法,还是肠道微生态干预的效果,都还需要大量的临床证据来支持,需要共同努力才能实现。
多种干预措施,组合探索
基于肠道菌群在肌肉骨骼系统中的作用机制,可以采用不同的干预措施,如益生菌、益生元、维生素和膳食钙等,改善肠道菌群的组成和代谢,增强肌肉骨骼系统功能。
此外补充雌激素和褪黑激素以及光生物调节等新兴方法已显示出调节肠道微生物群和促进肌肉骨骼健康的潜力,特别是联合使用时。各种合理干预方法的组合应用也是一种有意义的探索。
包括运动在内的生活方式干预措施对肠道微生物群有直接影响,改变其组成和功能,这为患有多种慢性疾病的患者开辟了新的治疗机会的创新途径。
主要参考文献:
Wang Y, Li Y, Bo L, Zhou E, Chen Y, Naranmandakh S, Xie W, Ru Q, Chen L, Zhu Z, Ding C, Wu Y. Progress of linking gut microbiota and musculoskeletal health: casualty, mechanisms, and translational values. Gut Microbes. 2023 Dec;15(2):2263207.
Sender R, Fuchs S, Milo R. Revised estimates for the number of human and bacteria cells in the body. PLoS Biol.2016;14(8):e1002533.
Petermann-Rocha F, Balntzi V, Gray SR, Lara J, Ho FK, Pell JP, Celis‐Morales C. Global prevalence of sarcopenia and severe sarcopenia: a systematic review and meta-analysis. J Cachexia Sarcopenia Muscle. 2022;13(1):86–35.
Ayers C, Kansagara D, Lazur B, Fu R, Kwon A, Harrod C. Effectiveness and safety of treatments to prevent fractures in people with low bone mass or primary osteoporosis: a living systematic review and network meta-analysis for the American college of physicians. Ann Intern Med. 2023;176(2):182–195.
Wei J, Zhang Y, Hunter D, Zeng C, Lei G. The gut microbiome-joint axis in osteoarthritis. Sci Bull (Beijing). 2023;68(8):759–762.
Dey P, Chaudhuri SR, Efferth T, Pal S. The intestinal 3M (microbiota, metabolism, metabolome) zeitgeist – from fundamentals to future challenges. Free Radic Biol Med. 2021;176:265–285.
Gilbert JA, Blaser MJ, Caporaso JG, Jansson JK, Lynch SV, Knight R. Current understanding of the human microbiome. Nat Med. 2018;24(4):392–400.
Turnbaugh PJ, Ley RE, Hamady M, Fraser-Liggett CM, Knight R, Gordon JI. The human microbiome project. Nature. 2007;449(7164):804–810.
Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol. 2021;19(1):55–71.
Delzenne NM, Neyrinck AM, Backhed F, Cani PD. Targeting gut microbiota in obesity: effects of prebiotics and probiotics. Nat Rev Endocrinol. 2011;7(11):639–646.
Ma Q, Li Y, Li P, Wang M, Wang J, Tang Z, Wang T, Luo L, Wang C, Wang T, et al. Research progress in the relationship between type 2 diabetes mellitus and intestinal flora. Biomed Pharmacother. 2019;117:109138.
Lynch SV, Pedersen O, Phimister EG. The human intestinal microbiome in health and disease. N Engl J Med. 2016;375(24):2369–2379.
Ridaura V, Belkaid Y. Gut microbiota: the link to your second brain. Cell. 2015;161(2):193–194.
Chen Y, Zhou J, Wang L. Role and mechanism of gut microbiota in human disease. Front Cell Infect Microbiol. 2021;11:625913.
Dinan TG, Cryan JF. Brain-gut-microbiota axis and mental health. Psychosom Med. 2017;79(8):920–926.
Hu X, Wang T, Jin F. Alzheimer’s disease and gut microbiota. Sci China Life Sci. 2016;59(10):1006–1023.
Witkowski M, Weeks TL, Hazen SL. Gut microbiota and cardiovascular disease. Circ Res. 2020;127(4):553–570.
Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, Liang S, Zhang W, Guan Y, Shen D, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature. 2012;490(7418):55–60.
Moludi J, Maleki V, Jafari-Vayghyan H, Vaghef-Mehrabany E, Alizadeh M. Metabolic endotoxemia and cardiovascular disease: a systematic review about potential roles of prebiotics and probiotics. Clin Exp Pharmacol Physiol. 2020;47(6):927–939.
Koh A, De Vadder F, Kovatcheva-Datchary P, Backhed F. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites. Cell. 2016;165(6):1332–1345.
Bana B, Cabreiro F. The microbiome and aging. Annu Rev Genet. 2019;53(1):239–261.
Strasser B, Wolters M, Weyh C, Kruger K, Ticinesi A. The effects of lifestyle and diet on gut microbiota composition, inflammation and muscle performance in our aging society. Nutrients. 2021;13(6):2045.

谷禾健康


卵巢早衰
卵巢早衰(premature ovarian insufficiency,简称POI)在生殖系统疾病中位居首位,这些疾病可能会损害多个功能系统,降低生活质量,最终剥夺女性患者的生育能力。
目前的激素替代疗法不能改善受孕或降低全身并发症的发生率,可部分缓解症状。
日常食物中的营养成分包括碳水化合物、脂肪和脂蛋白、蛋白质和多肽、维生素以及含有植物雌激素的蔬菜或水果。这些是功能性营养素,在更年期期间具有增殖、抗炎、抗氧化和线粒体保护潜力。
除此之外,微生物相关营养物质,包括益生菌、益生元和合生元组合,在支持卵巢活力和调节其他重要生殖功能方面显示出很高的潜力。
本文主要介绍卵巢早衰的症状、发病率、风险因素,发病机制,与肠道菌群及阴道菌群的关联,后面着重介绍现有的关于卵巢早衰的膳食补充研究。
卵巢早衰,也称为原发性卵巢功能不全(简称POI)。


/ 卵巢早衰
健康女性的卵巢会产生雌激素。这种激素控制月经期并让人拥有生育能力(能够怀孕)。随着年龄的增长,卵巢最终会停止制造雌激素。有时,卵巢在预计绝经前很久就会停止工作。
注:绝经的平均年龄是 51 岁。
如果不到 40 岁,卵巢不再产卵,且月经停止,则可能是原发性卵巢功能不全,也就是我们通常所说的“卵巢早衰”。 甚至部分女性在青少年时期就开始了。
卵巢早衰不同于过早绝经。绝经是不可逆的;而有些卵巢早衰的女性,这种功能丧失是暂时的,也就是说,月经会在未来的某个阶段恢复。
对于大多数女性来说,最常见的症状是月经停止(或月经稀少)。
其他症状可能包括:
对于部分卵巢早衰的女性,月经变得不规律,卵巢可能会继续间歇性排卵并产生激素;这些女性可能会在卵巢完全关闭之前继续月经周期数月或数年。
对于大约十分之一的卵巢功能不全 (POI) 女性,她们的月经还没有开始,在很小的时候就出现了 POI,通常不到 20 岁。
什么时候应该怀疑自己可能有 POI?
POI可能在月经期突然停止时突然发生。或者,POI可以在月经停止前随着月经不规律的月份逐渐出现。
对一些人来说,怀孕困难可能是卵巢早衰的最早也是唯一的迹象。当症状被注意到时,通常是由于卵巢功能不良或功能不全导致雌激素分泌不足。
POI还会导致哪些问题?
在过去的几十年中,伴随着生活方式的快速改变和环境的恶化,POI 发病率的急剧上升。
在 40 岁以下的女性中,大约每 100 名女性中就有 1 名患有卵巢早衰。
在 30 岁以下的女性中,大约每 1000 名女性中就有 1 名会发生卵巢早衰。
在大约 90% 的情况下,POI 的确切原因是未知的。
研究表明,POI 与卵泡问题有关。卵泡是卵巢中的小囊,卵子在里面生长成熟。
一种卵泡问题是比正常情况更早地用完了工作卵泡。另一中问题是卵泡不能正常工作。
在大多数情况下,卵泡问题的原因是未知的。
某些因素会提高女性POI的风险:
注:
脆性 X 综合征,是常见的遗传性疾病,造成智力低下。
特纳综合征,指先天性卵巢发育不全。
艾迪生病,一般指肾上腺皮质功能减退症。
POI 的发生率逐渐增加,它与已知的致病基因高度异质,并影响多种生物活动,包括激素信号、代谢、发育、DNA 复制、DNA 修复和免疫功能。目前已知的 POI 基因只能解释一小部分患者。
细胞凋亡与 POI 密切相关,与卵母细胞在从原始卵泡到窦卵泡的成熟过程中丢失相关。
卵巢颗粒细胞凋亡是影响卵巢储备和功能下降的重要机制。女性一生当中只有0.1%卵泡可以发育成熟并完成排卵,其余卵泡在不同阶段发生闭锁,颗粒细胞凋亡是卵泡闭锁的重要因素之一。
正常卵巢与POI卵巢的卵泡生成受损
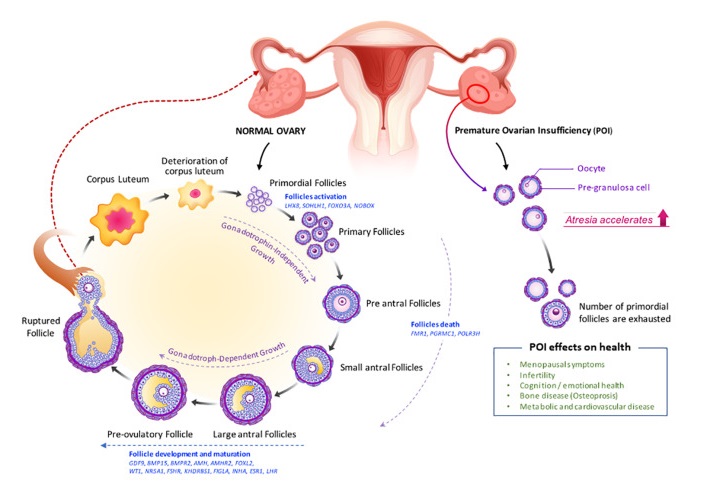
doi: 10.3389/fcell.2021.672890
在卵巢内因子和促性腺激素的调节下,初级卵泡发育成腔前卵泡和早期窦状卵泡,最容易发生闭锁或卵泡死亡。
然后,它们成为排卵前卵泡,导致卵母细胞释放和黄体形成。卵泡发生缺陷(如原始卵泡减少、闭锁增加和卵泡成熟度改变)导致POI。
涉及 DNA 损伤和修复、同源重组 (HR) 和减数分裂的基因中的大量基因突变。
这些基因包括基质抗原3(STAG3)、联会复合体中心元件1(SYCE1)、参与DNA修复的支架蛋白(SPIDR)、蛋白酶体26S亚基ATP酶3相互作用蛋白(PSMC3IP)、ATP依赖性DNA解旋酶同源物(HFM1)、mutS同源物(MSH)4、MSH5、MCM8、MCM9、cockayne综合征B-piggyBac 3(CSB-PGBD3)、核孔蛋白107(NUP107),以及乳腺癌易感基因(BRCA1和BRCA2).
内源性和外源性因素触发原始卵泡中DNA 双链断裂,由于细胞代谢的变化和氧化应激的升高,作为卵巢衰老的一部分,DNA损伤在原始卵泡中积累。在原始卵泡的氧化呼吸过程中,少量氧气首先在线粒体中转化为超氧化物,然后转化为羟基自由基。这些羟基自由基导致DNA单链断裂,如果双链断裂发生在多个相邻病变中,则会导致双链断裂和原始卵泡丢失。
线粒体是个多功能的细胞器,其异常与多种人类疾病相关,卵母细胞和颗粒细胞中的线粒体功能对卵巢的发育、功能维持都十分重要。
线粒体功能障碍可通过多种途径,如线粒体DNA 异常或逐渐积累的损伤、氧化应激、Ca2+ 对线粒体的直接损伤,导致卵子的发育潜能障碍,诱导卵子的凋亡而引起卵巢储备功能下降,进而发展成卵巢早衰。
▸TGF⁃β/ Smad 信号通路
TGF⁃β1/Smad 主要效应分子在卵巢组织中广泛表
达,参与病理性卵巢功能衰退,主要通过下调 TGF⁃β1/Smad3 信号通路因子表达,同时活化卵泡细胞质内 Smad2 表达;在生理性卵巢功能衰退中该信号通路的生物学效应可能与通过 Smad7 代偿性抑制通路的调节有关。
GDF-9 对窦状卵泡阶段的发育主要是通过减弱依赖 FSH的LH受体形成,防止卵泡过早发生黄素化和凋亡,直接决定卵泡池中卵泡数量,反映卵巢储备。
▸PI3-K / AKT 信号通路
磷酸酶和紧张素同系物(PTEN)/磷脂酰肌醇3激酶(PI3-K)/蛋白激酶B(AKT)/叉头转录因子3(FOXO3)信号通路在初级和进一步发育卵泡的卵母细胞的募集中起着重要作用。
PI3-K 和 AKT 过度激活可使原始卵泡过早发育及卵泡过快凋亡,进而发展成为卵巢早衰。
FOXO3a 是 PI3-K / AKT 信号通路下游的重要靶蛋白之一。FOXO3a的下调未能挽救颗粒细胞的凋亡死亡,导致卵母细胞丢失。卵母细胞特异性PTEN缺失导致全球原始卵泡激活,导致POI.
▸Wnt/ β⁃catenin 信号通路
合成类固醇激素是卵巢的重要功能之一。 目前现代医学认为卵巢 Wnt 信号通路可能是促性腺激素信号调节类固醇生成的重要信号途径之一。Wnt2 通过影响 β⁃catenin 的细胞定位来调节颗粒细胞增殖;β⁃catenin 参与合成卵巢甾体激素和黄体生成。
▸ SIRT 信号通路
SIRT1 通过调节氧化还原状态参与卵母细胞的成熟,以此减少氧化应激损伤导致的卵母细胞破坏和卵巢功能下降。
早发性卵巢功能不全患者存在系统性免疫失调,外周血T细胞亚群比例异常,Th1细胞占比显著升高,同时Treg细胞占比显著降低,提示细胞免疫参与早发性卵巢早衰发病。
注:Treg细胞是免疫抑制性淋巴细胞亚群,在维持免疫环境的稳定性和控制自身免疫疾病的发生中起重要作用。
免疫性卵巢早衰可能与辅助性Th17细胞过度活跃关系密切,E2水平低下时Th17细胞可过度激活,使机体免疫应答增强。
研究显示,卵巢早衰患者 Th17/Treg 水平较健康妇女明显增高,Th17和Treg 细胞表达失衡引发免疫调节紊乱,最终导致卵巢组织破坏和衰竭。
■ 为什么说肠道菌群与POI之间存在关联?
▸ 卵巢的自身免疫损伤
卵巢通过 T 细胞亚群的改变、T 细胞介导的损伤、产生自身抗体的 B 细胞的增加、效应抑制/细胞毒性淋巴细胞的减少以及自然杀伤细胞的减少而受到自身免疫的损害。
▸ 肠道菌群在自身免疫过程中发挥关键作用
肠道微生物群产生的肽可能会诱导免疫细胞产生自身反应和交叉激活。肠道微生物群的失调不仅会影响B淋巴细胞的激活和自身抗体的产生,还会诱导先天免疫细胞的异常激活,从而导致促炎细胞因子的上调。
▸ 肠道菌群在卵巢早衰中发挥重要作用
肠道微生物组在POI相关症状中发挥重要作用,包括自身免疫功能障碍、骨骼健康、认知、神经健康等。肠道微生物群及其代谢产物还具有调节炎症途径激活、脑肠肽分泌和胰岛β细胞破坏的能力。
我们具体来看相关的研究 ↓↓

2021年,深圳妇幼保健院检测了部分患者的肠道菌群,卵巢早衰女性(n = 35),健康女性( n = 18).
▸ POI患者中肠道菌群变化
下列菌群在POI女性中较少:
而下列菌群在POI女性中更丰富:
▸ 肠道菌群与自身免疫反应的关联
可以看到,拟杆菌属、双歧杆菌属和普氏菌属的相对丰度在该研究的POI组中均有所增加。这些菌群与自身免疫反应有何关联呢?
注:Th17细胞能够分泌产生IL-17A、IL-17F、IL-6以及TNF-α等,其功能主要就体现在它分泌的这些细胞因子集体动员、募集及活化中性粒细胞的能力上。
▸ 肠道菌群代谢产物诱导免疫调节活性
此外,双歧杆菌属、Blautia、Clostridium、Faecalibacterium、Roseburia和Ruminococcus可在人体肠道中产生短链脂肪酸,短链脂肪酸可以发挥什么作用呢?
综上,POI组肠道微生物组的所有这些变化可能通过某些细菌菌株及其代谢产物诱导免疫调节活性,这可能与自身免疫有关,进而影响POI的发展。
▸ POI肠道微生物群的改变与性激素有关
在这项研究中,在POI受试者中观察到显著较低的E2水平,通过调整BMI,E2水平与拟杆菌属、厚壁菌属和粪杆菌属的比例显著相关。FSH、LH和AMH水平也与某些微生物有关。
▸ 肠道菌群影响雌激素水平,雌激素调节的反应与POI相关
肠道微生物组通过分泌β-葡萄糖醛酸酶影响雌激素水平,使雌激素解凝,影响相关生理过程。
越来越多的研究表明,雌激素调节糖脂代谢、骨形成和炎症反应,其减少可损害雌激素依赖性过程,引发心血管疾病、骨质疏松等。这些症状都与POI有关。
肠道微生物群的失调与POI的发展有关,然而在进一步的研究中,还应考虑大样本量和多中心研究,来探索潜在的因果机制。
■ 为什么说阴道菌群与POI之间存在关联?
研究表明,细菌性阴道病与不孕有关。细菌性阴道病也被证明会改变阴道微生物组。
先前的一项研究表明,阴道微生物组在卵巢早衰的病理生理学中起着重要作用,卵巢早衰患者中乳杆菌属细菌的相对丰度显著低于健康对照组。因此,阴道微生物组和POI之间可能存在关系。
▸ POI患者中阴道菌群变化
下列菌群相对较少:
下列菌群显著增加:
我们具体来看相关的研究 ↓↓

2021年,深圳市妇幼保健院检测了部分患者的阴道菌群,卵巢早衰女性(n = 28),健康女性( n = 12).
▸ 阴道菌群与自身免疫反应的关联
可以看到,POI组中乳杆菌属、Odoribacter和Brevundimonas显著减少,链球菌属显著增加。这些菌群变化与自身免疫反应有何关联呢?
▸ 性激素水平会影响女性生殖道的防御能力和生殖期内的阴道微生物群
激素促进增生并增加糖原生成;糖原可以被阴道中的优势细菌乳酸杆菌转化为乳酸。这有助于保持阴道的酸性环境,抑制病原体的生长,并增强免疫系统。
在这项研究中,乳杆菌的比例与雌激素水平呈正相关,但与FSH水平呈负相关。POI患者的乳酸杆菌丰度和雌激素水平显著下降,FSH水平显著增加。
此外,AMH、FSH、LH、PRL、P和睾酮水平也与一些微生物有关,包括 Streptococcus, Odoribacter, Brevundimonas, Anaerococcus, Atopobium, Peptoniphilus, Prevotella, Veillonella,这增加了阴道微生物群改变与性激素相关的证据。
▸ 雌激素可以调节POI相关症状
越来越多的证据表明,雌激素可以调节POI相关症状,包括GLU和脂质代谢、骨形成和炎症反应。
在该研究中,GLU水平与Odoribacter和普雷沃氏菌属呈负相关。此外,PRL可以抑制FSH和促性腺激素释放激素以促进生育,这与厌氧球菌和嗜酸乳杆菌呈正相关。
▸POI患者阴道菌群的失调与卵巢功能密切相关
由于半乳糖和半乳糖代谢产物的积累,卵巢功能容易受损。先前的一项研究发现,半乳糖抑制了卵巢卵泡的数量和类固醇分泌。半乳糖代谢产物,包括1-磷酸半乳糖、半乳糖醇和尿苷二磷酸半乳糖,在干扰卵巢细胞凋亡和促性腺激素信号传导方面发挥重要作用。
患有POI的女性LACTOECAT-PWY通路的活性显著降低。这表明,患有POI的女性体内可能会积聚半乳糖,从而损害卵巢功能。患有POI的女性ARGONPROST-PWY通路显著富集。L-精氨酸与卵巢功能的调节相关。这可能对卵巢功能不利。
DNA损伤通过激活线粒体凋亡途径导致生殖功能障碍。
该研究结果表明,在POI患者中,许多与核糖核苷酸生物合成相关的途径发生了改变。
其他来自同济医院绝经与卵巢衰老专科门诊的研究数据发现:
双歧杆菌主要定殖在人体肠道中,在阴道中仅以低水平存在。作为一种益生菌,它具有抗炎作用、提高免疫功能和抵抗氧化损伤。临床研究发现,双歧杆菌可以改善绝经后妇女的新陈代谢和心血管功能。
Gardnerella和Atopobium均属于放线菌,在研究中发现 POI 患者显着富集,并且与卵巢储备下降、内分泌紊乱和围绝经期综合征症状显着相关。
阴道微生物组不仅反映了阴道的细菌组成,还反映了宿主的一般状况,包括激素和免疫状态等。阴道微生物群的失调与POI的发展有关,然而在进一步的研究中,还应考虑大样本量和多中心研究,来探索潜在的致病机制。
➔
这些测试可能帮助找到不孕的原因,找出排卵发生的时间,找出月经不规律或停止的原因,确认更年期或围绝经期的开始等。
➔
如果患有与POI相关的疾病,那么也必须对其进行治疗。治疗可能涉及药物和激素。
目前,没有经证实的治疗方法可以恢复女性卵巢的正常功能。但有一些治疗卵巢早衰症状的方法,或者可以降低其风险并解决POI可能导致的疾病:
激素替代疗法(HRT)
HRT是最常见的治疗方法。它给身体提供了卵巢无法产生的雌激素和其他激素。HRT可以改善性健康,降低患心脏病和骨质疏松症的风险。通常需要服用到50岁左右;这大约是更年期开始的年龄。
体外受精(IVF)
如果患有POI并且想怀孕,可以考虑尝试试管婴儿。
有规律的体育锻炼
有规律的体育锻炼,维持健康的体重,可以降低患骨质疏松症和心脏病的风险。
其他相关膳食补充方式,将在下一章节详细介绍。
除了那些遗传、免疫或医源性因素之外,日常饮食和生活方式中的营养摄入对于 POI 患者来说是最容易获得和改变的。
关于不良饮食习惯影响女性生育力和更年期的营养状况和调节的研究较少,这里初步提出了一些主要饮食因素和营养素:
Han Q, et al., Front Microbiol. 2022
碳水化合物为所有生物提供了最丰富的生命支持能源,通常分为单糖、寡糖和多糖。
Han Q, et al., Front Microbiol. 2022
半乳糖:毒性作用
半乳糖是卵巢早衰和相关不孕疾病中报道的一种常见单糖,它对卵巢产生了毒性作用。
半乳糖还可能抑制卵泡向性腺区域的迁移,并导致卵巢储备和雌二醇合成减少。因此,糖-半乳糖代谢异常与卵巢早衰的发生和发展有关。

铁皮石斛多糖:保护作用
铁皮石斛多糖(DO)对自然老化啮齿动物的卵巢早衰过程产生保护作用。
口服给药剂量为70 mg/kg,有助于这些大鼠恢复正常体重,减轻卵巢的病理变化,如血管增殖减少和卵泡减少。
DO导向的多糖通过调节NF-κB和p53/Bcl-2信号通路,提高谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)活性,降低血清中丙二醛(MDA)浓度,从而发挥抗氧化作用,从而减少卵巢组织的炎症损伤。同时还操纵了线粒体功能,恢复了卵巢细胞的活力。
碳水化合物对卵巢早衰发病或进展的重要性应进一步评估。
脂肪和体重高可能与卵巢早衰严重程度的控制有关。


Han Q, et al., Front Microbiol. 2022
一些研究报告称,绝经早期与低体重指数相关。具体机制尚不清楚。
脂蛋白是可运输的脂肪形式,积极参与人体内的代谢活动。
研究人员对卵巢早衰患者进行了血脂分析,发现血清中较高的甘油三酯(TG)浓度和较低的高密度脂蛋白(HDL)水平与游离雄激素指数增加和性激素结合球蛋白丢失相关。这些发现表明,TG升高可能导致胰岛素敏感性降低。
在另一项回顾性临床研究中同样发现,与具有密切流行病学特征的正常女性相比,出现卵巢早衰综合征且既往无激素摄入史的年轻女性患者血清中总胆固醇(TC)和低密度脂蛋白(LDL)浓度更高。结果表明,女性卵巢早衰患者在雌激素缺乏的情况下会引发脂质改变。
然而,不同研究中HDL的浓度水平非常不一致,一些研究报告HDL水平升高,另一些研究报告更年期妇女HDL水平降低。
至于脂肪摄入对更年期的影响,不同种类的脂肪可能会造成差异,包括多不饱和脂肪、总脂肪和饱和脂肪。
有研究认为,多不饱和脂肪的高消费与绝经较早有关;同时,总脂肪和饱和脂肪摄入量几乎不影响绝经期和年龄。
然而,尚不清楚日常饮食中的不同脂肪类型是否会以某种方式影响卵巢早衰的发病机制。
“
高蛋白摄入有助于推迟更年期的提前到来


Han Q, et al., Front Microbiol. 2022
研究发现,海鲜(每周约3天)和新鲜鸡蛋(每周超过4天)的消费与绝经晚期发病呈正相关。其他几项研究也支持类似的结论。研究人员认为,高蛋白摄入有助于推迟绝经并延长生殖功能。欧洲癌症与营养前瞻性调查(EPIC)还进行了一项队列研究,其中早期绝经的发生与蛋白质摄入量呈负相关。
除了直接摄入蛋白质外,多肽对保护卵巢功能和延缓卵巢衰老也很重要。
通过酶解从牡蛎中纯化的牡蛎多肽,由于其DPPH(2,2-二苯基-1-苦酰肼基)自由基清除剂能力,能够保护其免受氧化应激和炎症,从而对卵巢早衰产生治疗作用。
牡蛎多肽可以纠正异常的发情周期,提高血清卵泡刺激素(FSH)和黄体生成素(LH)浓度。此外还增加了原始卵泡计数和分布,并通过模拟SOD清除显著减轻了卵巢细胞死亡。牡蛎多肽支持的卵巢细胞保护和存活在调节死亡受体BCL-2依赖性信号通路时被激活。因此,适当的蛋白质和肽摄入可能是影响卵巢早衰进展和严重程度的潜在途径。
维生素是一类仅来自食物的微量有机物质,在人体内维持一些重要的生理活动和功能。它们不提供能量,但调节代谢过程。许多维生素在支持女性健康方面发挥着关键作用,如维生素B、C、D、E和一些辅酶。


Han Q, et al., Front Microbiol. 2022
烟酸:改善卵泡发育,保护卵巢
烟酸属于维生素B家族,代谢细胞能量,并直接影响正常生理。除了许多神经和皮炎疾病外,烟酸还通过抑制氧化应激来改善卵泡发育,从而减少卵巢细胞死亡。
有趣的是,烟酸还能够改变卵巢早衰表型并恢复化疗或辐射刺激诱导的雌性卵巢早衰小鼠。作者进一步证实,添加10 Mmol烟酸可以降低卵泡阻滞标记FOXO3的表达水平,并增加卵母细胞标记DDX4的表达水平以发挥卵巢保护作用。
叶酸:妊娠率更高,提高卵母细胞的质量和成熟度
叶酸是一种水溶性维生素B,对蛋白质合成、红细胞分裂和生长很重要。
一项基于小样本的临床研究报告称,与安慰剂治疗相比,低生育率女性在接受400μg叶酸治疗12周后的妊娠率更高。叶酸的摄入缩短了健康女性的备孕时间,并提高了卵母细胞的质量和成熟度。
MTHFR可以强烈影响叶酸循环,并帮助同时患有非霍奇金淋巴瘤和重复妊娠损失的卵巢早衰患者成功分娩出健康的男婴。
维生素C:显著刺激卵巢标志物的表达
维生素C是一种天然抗氧化剂,并积极参与干细胞调节。
据报道,维生素C修饰人羊膜上皮细胞(hAECs)的生物学特性,并显著刺激移植POI小鼠卵巢组织中卵巢标志物的表达。
注:羊膜细胞通俗地说就是包裹羊水的那层透明薄膜上的细胞。
可能的影响机制是维生素C依赖的几种重要生长因子的旁分泌,如肝细胞生长因子和表皮生长因子。
维生素D:有争议
维生素D属于脂溶性维生素,通过调节钙和磷酸盐代谢对维持生命至关重要。其活性形式1,25-二羟基维生素D3定位于许多器官,如肾脏、肝脏、大脑和卵巢。在女性生殖系统中,维生素D可以调节颗粒细胞中的抗苗勒氏激素(AMH)分泌,从而影响FSH水平。
然而,它在卵巢早衰发病机制中的作用是有争议的,因为一些人声称它不影响卵巢早衰的病理生理过程。
而另一些人则报告维生素D缺乏与凝血相关,是由于卵泡发育不良和芳香化酶水平降低而导致卵巢早衰的主要因素。
先前的研究也没有报告任何关于补充维生素D治疗卵巢早衰的证实性发现。研究发现,在约2个月内,每周摄入50000 IU的维生素D与临床上的妊娠改善无关。提高卵子受体患者的血清维生素D水平也不能改善IVF结局。
因此,维生素D对卵巢早衰患者的意义的解释仍然模糊,仍需进一步调查。
维生素E:增加卵巢体积并刺激初级卵泡的增殖
维生素E主要由生育酚和生育三烯醇组成,它们在生理和病理条件下对清除自由基很重要。维生素E缺乏可能导致雌性啮齿动物模型中的卵巢细胞死亡和发育异常。
在一项临床研究中,在40名患者中,维生素E与卵巢早衰的发病有关。在月经正常的女性中,维生素E-α生育酚的活性形式浓度显著高于卵巢早衰患者。进一步分析表明,这可能与AMH表达水平降低有关,并表明卵巢储备能力在卵巢早衰发病机制中受到损害。
在另一项随机对照试验研究中,向卵巢早衰患者服用400IU的维生素E 3个月,除改善AMH水平外,还显著增加了窦卵泡数和平均卵巢体积。
补充维生素E可能有助于缓解卵巢早衰过程,几乎不会产生副作用。
植物雌激素确实不是雌激素的一部分,但通过提供高亲和力的雌激素受体β作为激素补充剂,其功能类似。


Han Q, et al., Front Microbiol. 2022
它们通常包括大豆异黄酮和芝麻木脂素,这两种都是我们日常饮食中重要和普通的食物类型。几项研究证实了植物雌激素消耗对绝经后女性TC、LDL和血脂的降低作用。
大豆异黄酮摄入也显著缓解了髂动脉动脉粥样硬化,绝经前后5年内食用大豆食物的女性减少了冠状动脉斑块的大小。对于绝经后开始以大豆食品作为日常饮食的人来说,这种有益效果并不明显。
研究人员指出,大豆异黄酮可以通过卵巢切除术减少更年期啮齿动物的潮热。该效应基于肠道微生物群和雌激素样机制产生的异丙戊酸雌马。
芝麻籽木脂素(芝麻籽油中的一种成分)在小鼠模型中增加了脂肪酸的β-氧化,并抑制了胆固醇的吸收。芝麻酚是一种强抗氧化剂,也是芝麻的主要成分。它可以改善记忆,减轻焦虑情绪,减少中枢神经系统中的氧化剂损伤。同时,与卵巢切除后的绝经大鼠相比,芝麻酚还通过降低血清中肿瘤坏死因子-α(TNF-α)浓度来调节血清中的脂质成分,并降低炎症效应。
益生菌、益生元和合生元


Han Q, et al., Front Microbiol. 2022
益生菌促进营养物质的消化和吸收,提高免疫功能,维持肠道菌群的结构平衡,并增强人体的抗氧化水平。许多益生菌应用于食品补充剂和医疗。对于女性健康,激素水平与肠道或阴道微生物群之间存在密切相关性。
在平滑肌瘤和乳腺癌患者中,肠道微生物群被视为雌激素的替代代谢供应商,主要富含大肠杆菌、梭状芽孢杆菌、乳酸杆菌和拟杆菌。
考虑到这些现象,益生菌的调节作用也可以通过改变几种具有雌激素或抗雌激素性质的蔬菜成分(称为植物雌激素,如大豆异黄酮、木脂素等)的代谢活性和效率以间接方式调节肠道微生物群来发挥。
益生菌参与调节经前综合征、泌尿生殖道感染和骨质疏松症。雌激素缺乏是与卵巢早衰后骨炎症和吸收相关的骨质疏松症的主要原因。
先前的研究表明,肠道微生物群对骨形成和代谢有潜在影响。在接受益生元治疗的小鼠、大鼠和鸟类中发现骨骼增加。
在体外和去卵巢的啮齿类动物研究中,益生菌罗伊氏乳杆菌抑制了骨髓CD4+T淋巴细胞的上调和随后的破骨细胞活化。研究人员假设罗伊氏乳杆菌可以直接使T细胞失活并抑制TNF-α的产生,并通过T细胞间接使基质细胞失活以减少破骨细胞因子的形成,从而增加骨代谢活性并减少骨损失。
在一项由60名40至60岁绝经后妇女组成的随机对照试验中,益生菌还增强了异黄酮的代谢活性,以缓解泌尿生殖系统问题,如阴道干燥和绝经后的不良性体验,连续治疗16周。该效果与低剂量阴道雌激素相当,后者是治疗更年期泌尿生殖系统综合征的金标准疗法。
研究人员在一项为期12周的随机临床试验中报告,1×1010菌落形成单位(CFU)浓度的多菌益生菌影响肠道通透性和心脏代谢参数,如脂多糖水平、胰岛素、葡萄糖、尿酸、脂肪质量、皮下脂肪和胰岛素抵抗指数。
研究人员在一项试点临床研究中发现,乳酸杆菌和蔓越莓提取物复合物可以防止女性患者在绝经前或绝经前后连续26周反复发生尿路感染。
益生元是发酵的膳食纤维,其在肠道微生物群的成分和/或生物活性方面都含有一定的修饰,对人体健康状况产生有益影响。目前,益生元主要包括双歧杆菌、不易消化的低聚糖(尤其是低聚半乳糖、菊粉及其水解产物低聚果糖)。
大量的营养益生元可能有助于钙的生物吸收,如酪蛋白磷酸肽(CPP),酪蛋白的蛋白水解产物,与钙一起构建可溶性复合物。此外,一些复杂的有机酸,如苹果酸或柠檬酸,可以增加肠道中生物可吸收钙的可溶性复合物的百分比。
益生元依赖性钙代谢的潜在机制包括来自结肠中细菌发酵碳水化合物的酸代谢产物,如乳酸、乙酸和丙酸,降低了pH值,以提高钙离子的管腔水平,并增加钙的被动生物吸收。此外,电荷可以通过Ca2+-H+复合物进行修饰。因此,益生元在女性绝经后骨质疏松症的预防和抑制中发挥了保护作用。
研究人员表明,壳聚糖和柑橘果胶这两种益生元增强了葡萄糖耐量,降低了血脂异常,并提高了血清精氨酸、丙酸、亮氨酸和丁酸水平。此外,壳聚糖更有助于调节肠道微生物群,从而影响绝经后症状。
还尝试将益生菌和益生素结合起来生产合生元。研究人员表明,副干酪乳杆菌和菊粉增强了异黄酮的生物活性可用性,有助于缓解更年期问题。
使用由发酵乳杆菌和花椰菜蘑菇中的β-葡聚糖组成的合生元作为益生菌和益生元,可以降低啮齿动物尾巴的皮肤温度,并保持血清和子宫指数中的17β-雌二醇水平。合生元依赖性机制进一步得到验证,因为它们激活了肝脏胰岛素信号,随后在雌激素缺乏大鼠中激活了AMPK磷酸化。
这些研究初步反映了益生菌、益生元和合生元在调节更年期综合征及其主要病理生理过程中的有益作用。这些发现对于研究卵巢早衰的发病机制和通过微生物营养策略治疗卵巢早衰至关重要。
营养对女性一生的健康至关重要,膳食营养素可以通过影响各个方面来延缓更年期,从直接提高卵巢活力和功能到抵消氧化应激、炎症、衰老和系统性内分泌失调。
越来越多的证据表明肠道菌群的改变与卵巢早衰相关,可能通过影响一些重要代谢物影响卵巢疾病进展,至于是否会导致血清代谢物失衡,进而导致更年期表现和相关健康问题,仍有待进一步验证。
从目前的研究来看,膳食和微生物营养素对于调节卵巢早衰等女性生殖障碍很重要且很有前途,因此,通过合理饮食、最佳生活方式对菌群进行干预是有希望的,值得更多研究人员的关注,希望为广大女性带来更健康的生活。
主要参考文献:
Han Q, Chen ZJ, Du Y. Dietary supplementation for female infertility: Recent advances in the nutritional therapy for premature ovarian insufficiency. Front Microbiol. 2022 Nov 17;13:1001209. doi: 10.3389/fmicb.2022.1001209. PMID: 36466679; PMCID: PMC9712792.
Chon SJ, Umair Z, Yoon MS. Premature Ovarian Insufficiency: Past, Present, and Future. Front Cell Dev Biol. 2021 May 10;9:672890. doi: 10.3389/fcell.2021.672890. PMID: 34041247; PMCID: PMC8141617.
Zhang X, Lu Y, Wu S, Zhao X, Li S, Zhang S, Tan J. Estimates of global research productivity in primary ovarian insufficiency from 2000 to 2021: Bibliometric analysis. Front Endocrinol (Lausanne). 2022 Oct 26;13:959905. doi: 10.3389/fendo.2022.959905. PMID: 36387882; PMCID: PMC9645456.
Wu J, Zhuo Y, Liu Y, Chen Y, Ning Y, Yao J. Association between premature ovarian insufficiency and gut microbiota. BMC Pregnancy Childbirth. 2021 Jun 5;21(1):418. doi: 10.1186/s12884-021-03855-w. PMID: 34090383; PMCID: PMC8180047.
Takahashi A, Yousif A, Hong L, Chefetz I. Premature ovarian insufficiency: pathogenesis and therapeutic potential of mesenchymal stem cell. J Mol Med (Berl). 2021 May;99(5):637-650. doi: 10.1007/s00109-021-02055-5. Epub 2021 Feb 27. PMID: 33641066.
Kim S, Lee SH, Min KJ, Lee S, Hong JH, Song JY, Lee JK, Lee NW, Lee E. Females with impaired ovarian function could be vulnerable to environmental pollutants: identification via next-generation sequencing of the vaginal microbiome. J Obstet Gynaecol. 2022 Jul;42(5):1482-1488. doi: 10.1080/01443615.2021.2006162. Epub 2022 Jan 7. PMID: 34996320.
Wu J, Ning Y, Tan L, Chen Y, Huang X, Zhuo Y. Characteristics of the vaginal microbiome in women with premature ovarian insufficiency. J Ovarian Res. 2021 Dec 8;14(1):172. doi: 10.1186/s13048-021-00923-9. PMID: 34879874; PMCID: PMC8655991.
Wen J, Feng Y, Yan W, Yuan S, Zhang J, Luo A, Wang S. Vaginal Microbiota Changes in Patients With Premature Ovarian Insufficiency and Its Correlation With Ovarian Function. Front Endocrinol (Lausanne). 2022 Feb 22;13:824282. doi: 10.3389/fendo.2022.824282. PMID: 35273569; PMCID: PMC8902819.

谷禾健康
肠道菌群 & 性激素
青春期是生命的一个关键阶段,与性成熟相关的生理变化有关,是一个受多种内分泌和遗传控制调控的复杂过程。
青春期发育可以在适当的时候,早熟或延迟。
青春期发育异常会给患者带来痛苦,也可能是潜在病理的征兆。

青春期是由激素驱动的,它会影响肠道微生物群。性别之间的肠道微生物群差异出现在青春期开始时,证实了微生物群和性激素之间的关系。在不同的研究中已经提出了肠道微生物群和性激素之间的双向相互作用。
本文介绍了性早熟发育,以及性早熟中肠道微生物群的变化,便于从儿科内分泌学的角度考虑性激素-肠道菌群轴的作用。
肠道菌群的改变可能发生在患有中枢性早熟的女孩身上的证据,为预测和预防性早熟提供了一个有趣的发现。
加深对性激素与微生物群变化作用之间联系的理解,可以通过提供儿科内分泌学的视角,在青春期疾病中实施微生物群靶向治疗。
在了解性早熟与肠道菌群的关系之前,我们先了解一下青春期发育的相关生理过程,以及关于性早熟的基本知识。
青春期特征是:
正常的青春期是由于下丘脑-垂体-性腺轴(HPG)的长期成熟活动所致。
下丘脑以脉动的方式将促性腺激素释放激素释放到垂体门静脉系统,在那里它刺激LH和FSH分泌(也是脉动的)。
注:
LH(促黄体生成素):主要刺激睾丸中的间质细胞和卵巢中的卵泡膜细胞分泌雄激素。
FSH(卵泡刺激素):主要刺激卵泡或生精小管形成雌激素、抑制素、卵子或精子。
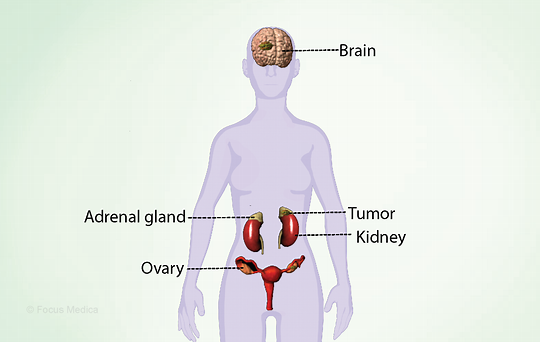
间质、管状和卵泡隔室通过旁分泌过程共同作用,产生雌激素,并调节性类固醇的产生和配子的发育。类固醇激素对促性腺激素释放激素和促性腺素分泌有内分泌负反馈作用。
FSH分泌被抑制素、孕酮和雌二醇的负反馈抑制。在成年女性受试者中,临界雌二醇浓度刺激LH激增,从而启动排卵。
HPG轴出生时短暂激活,青春期完全重新激活
出生时,由于缺乏抑制HPG轴的胎盘类固醇,这一轴会被激活,从而导致类固醇激素的产生增加,这是青春期继续进行的第一步。这种短暂的激活大约在出生后一周开始,几个月(大约6个月)后停止。
HPG轴在整个儿童期并不完全休眠,尤其是女性,其FSH浓度略高于男性。有时,也可以用超声波检查卵巢卵泡。在青春期,HPG轴经历完全重新激活。
最重要的GnRH抑制系统是γ-氨基丁酸能神经元(产生γ-氨基丁酸的神经元)和阿片受体;吻肽、神经激肽B和强啡肽A这三种存在于弓状核(ARC)中的神经肽被认为是影响GnRH释放的基本生成物,因为它们对男孩和女孩的青春期生理学有重要贡献。
厌食因子——瘦素:在青春期发挥重要作用
瘦素是一种主要由脂肪细胞产生的细胞因子,它作为一种厌食因子,通过抑制下丘脑神经肽Y(NPY),从而抑制食欲,在控制体重、食物摄入和能量平衡方面发挥重要作用。儿童时期必须达到正常的体重和组成,以避免青春期功能障碍。
除了瘦素与NPY的相互作用外,一些研究表明瘦素通过与KiSS-1基因直接相互作用而影响青春期和生殖功能。GnRH神经元缺乏瘦素受体,但KiSS-1神经元表达瘦素受体。瘦素直接刺激kisspeptin释放并介导GnRH的脉动释放。
青春期是一个复杂的过程,具有广泛的生理变化。调节青春期开始的机制涉及遗传、营养和环境相互作用。
胎儿营养异常以及内分泌系统可能导致发育改变,从而永久影响结构、生理和代谢。
生长关键时期激素和营养之间的相互作用对于代谢适应反应控制和青春期发育预期至关重要。
越来越多的证据表明,产前和产后早期是青春期开始规划的重要时期。各种研究表明,产前暴露于不利环境因素,如导致儿童出生SGA(小于胎龄)和/或IUGR(宫内生长受限)的因素,会影响青春期时机。儿童出生的SGA可能会经历几次青春期改变,如性早熟。
➡ 性早熟如何定义?
性早熟(PP)定义为女性青少年在8岁之前和男性在9岁之前出现变化:
性早熟患者表现出性和身体生长加快,同时出现生长突增。如果不治疗,骨骺生长加快可能会导致骨骺过早闭合,导致成年后身材矮小。
➡ 性早熟分类
根据潜在的生理病理过程,病理性性早熟分类如下:
• 中枢性性早熟
中枢性性早熟是最常见的性早熟形式,女孩多于男孩。一般异常位于大脑。
由于先天性或后天性中枢神经系统(CNS)损伤或单基因缺陷导致的HPG轴过早成熟,从而导致的中枢性性早熟(CPP)或促性腺激素依赖性性早熟(或真正的性早熟),也可能是特发性的。
• 外周性性早熟
一般异常不在大脑中,而是在睾丸、卵巢或肾上腺中。
外周性性早熟(PPP)或促性腺激素非依赖性性早熟(或假性早熟),由于遗传或肿瘤病因、分泌hCG的生殖细胞肿瘤(仅适用于男孩的人绒毛膜促性腺素)或外源性来源导致的性腺性激素或肾上腺激素分泌过多。
➡ 中枢性性早熟病例男女有别
据评估,每5000-10000名儿童中就有1名患有中枢性性早熟,女性的发病率是男性的10倍。
大多数女性中枢性性早熟病例似乎是特发性的,而男性中枢性性早熟患病率较高似乎通常是由病理性脑损伤引起的。特别是,下丘脑错构瘤是引起中枢性性早熟的最常见的脑损伤。
注:下丘脑错构瘤,是临床极为罕见的先天性脑组织发育异常性病变。
➡ 性早熟的临床检查评估
准确的个人和熟悉的病史、完整的体检、荷尔蒙和放射检查对性早熟诊断至关重要。
——青春期体征
临床检查应侧重于发育学数据、根据Marshall和Tanner分类对青春期体征的评估、过去6-12个月的生长模式,青春期体征(女孩的乳腺芽、男孩的睾丸体积、两者的阴毛)和其他青春期体征(痤疮、油性皮肤、勃起、男孩夜间排泄物、女孩阴道分泌物和月经出血)的进展率。
——基线LH水平
基线LH水平是诊断中枢性性早熟的有希望的生物标志物;基础晨LH值超过0.2 mUI/ml通常被认为是青春期的标志。在成瘾中,LH与FSH的比值高于0.6与中枢性性早熟有关。
——GnRH刺激试验
GnRH刺激试验仍然是鉴别中枢性性早熟的金标准,大于5 IU/L的LH截止峰值水平被广泛用于诊断中枢性性早熟。
——其他激素评估
其他激素评估应包括甲状腺测试、睾酮、雌二醇、17-羟基孕酮(17-OHP)、癌胚抗原(CEA)、癌抗原125(CA125)、甲胎蛋白和β-hCG,具体取决于患者的病史。
——骨龄
为了确定孩子的生物年龄,需要对非优势(左手)手和手腕进行骨龄X光检查。超过2.5标准差(SD)或超过2年的晚期骨龄更可能与病理性性早熟相关。
——盆腔超声
在女孩中,盆腔超声是评估卵巢早熟发育和排除卵巢囊肿或肿瘤的有用工具。
——脑部MRI检查
建议对患有中枢性性早熟的患者进行脑部MRI检查,以排除CNS损伤,应在男孩(<6岁)中进行常规检查。
性激素和肠道菌群之间的关系在最近的研究中得到了广泛的探讨,并且是一个不断扩大的研究领域,可能会为各种与性有关的疾病带来新的治疗选择。
20世纪80年代,最早的研究之一是在细胞水平上进行的,其中发现孕酮促进了拟杆菌和中间普氏杆菌的生长。
2012年一项研究在对91名女性的粪便样本进行测序时发现,无论健康状况如何,在怀孕期间,尤其是在孕晚期,当雌激素达到峰值时,肠道微生物组明显改变。
2015年,一项欧洲研究表明,健康男性的普氏拟杆菌丰度高于生育女性,而绝经后女性的微生物群与男性没有差异。
这两项研究都证明了雌激素和相关的雌性激素在调节肠道微生物组的组成方面是至关重要的。
因此,微生物群会影响雌激素水平,反过来,雌激素水平可能会受到微生物群组成和多样性的影响。
➤ 微生物群对雌激素的影响
微生物组能够通过表达B-葡萄糖醛酸酶(一种介导膳食和非膳食雌激素解偶联的酶)代谢雌激素。
未结合的雌激素可以通过作用于α和β雌激素受体而进入全身血流并具有代谢活性,这些受体在多种器官和组织中表达;雌激素活性不仅对生殖健康有影响,而且对心血管风险、代谢和骨稳态以及中枢神经系统也有影响。
微生物群多样性与绝经后妇女和男性的尿雌激素水平较高有关,而绝经前妇女的雌激素水平似乎不受微生物群组成的影响,这表明微生物群主要影响非卵巢雌激素水平。
►►
补充植物雌激素能够促进特定细菌的肠道定植,富含植物雌激素的饮食可能与亚洲绝经后妇女代谢综合征的风险降低有关。
➤ 反过来,性激素水平也可能影响微生物组的组成
雄激素过量,如多囊卵巢综合征患者,也可能导致生物失调和细菌多样性降低。多囊卵巢综合征(PCOS)是一种内分泌疾病,其特征是雄激素水平较高,雌激素水平较低,几项研究表明,多囊卵巢综合症患者的肠道失调与细菌多样性较低有关,导致丁酸生成减少,BMI升高,睾酮血清浓度升高。
此外,肠道微生物组通过产生有助于减少炎症反应的短链脂肪酸在决定胰岛素分泌方面发挥重要作用;菌群失调可能导致胰岛素抵抗和糖代谢改变,如多囊卵巢综合征;较高的胰岛素水平刺激卵巢产生雄激素,从而使多囊卵巢综合征的发病机制永久化。
➤ 微生物群及其代谢产物也可能影响肠道菌群定植
微生物群及其代谢产物也可能通过定殖阴道,以及一些作者认为的子宫内膜和胎盘,影响女性生育、怀孕、胚胎发育和分娩的各个阶段。微生物群的改变与促炎细胞因子的分泌和早产有关。剖宫产新生儿肠道菌群多样性较低,可能是因为他们没有通过阴道被母体肠道菌群定植。
➤ 性激素信号和脑-肠轴功能中的应激反应之间存在复杂的相互作用
我们知道,肠道和中枢神经系统之间的双向沟通途径,根据肠道细菌是大脑和内分泌系统之间的重要媒介。肠道菌群是调节脑-肠轴的中枢,肠道屏障短链脂肪酸,除了是能够调节肠道运动和伤口愈合的炎症调节剂外,还代表了微生物组和肠-脑轴之间的联系。
功能性胃肠疾病的发生率,如功能性消化不良和肠易激综合征,导致运动能力受损和/或敏感性改变,在女性中明显更高,这可能是因为性激素信号和脑-肠轴功能中的应激反应之间存在复杂的相互作用。
▸ 雌激素激活脑-肠轴的受体,间接干扰胃肠动力
具体而言,已观察到雌激素通过直接激活位于脑-肠轴的受体,并通过调节其他受体系统间接干扰胃肠动力和敏感性。在卵巢周期的卵泡期,当雌激素水平较高时,女性的胃肠动力降低。
此外,支持循环雌激素在胃排空延迟中起重要作用的假设,绝经前和绝经后女性接受激素替代疗法与未接受激素治疗的绝经后妇女相比,胃排空速度较慢,而绝经后的女性与同龄男性相类似。相比之下,睾酮或雄激素似乎对胃动力或胃超敏反应没有影响。
性激素和肠道菌群之间的相互关系
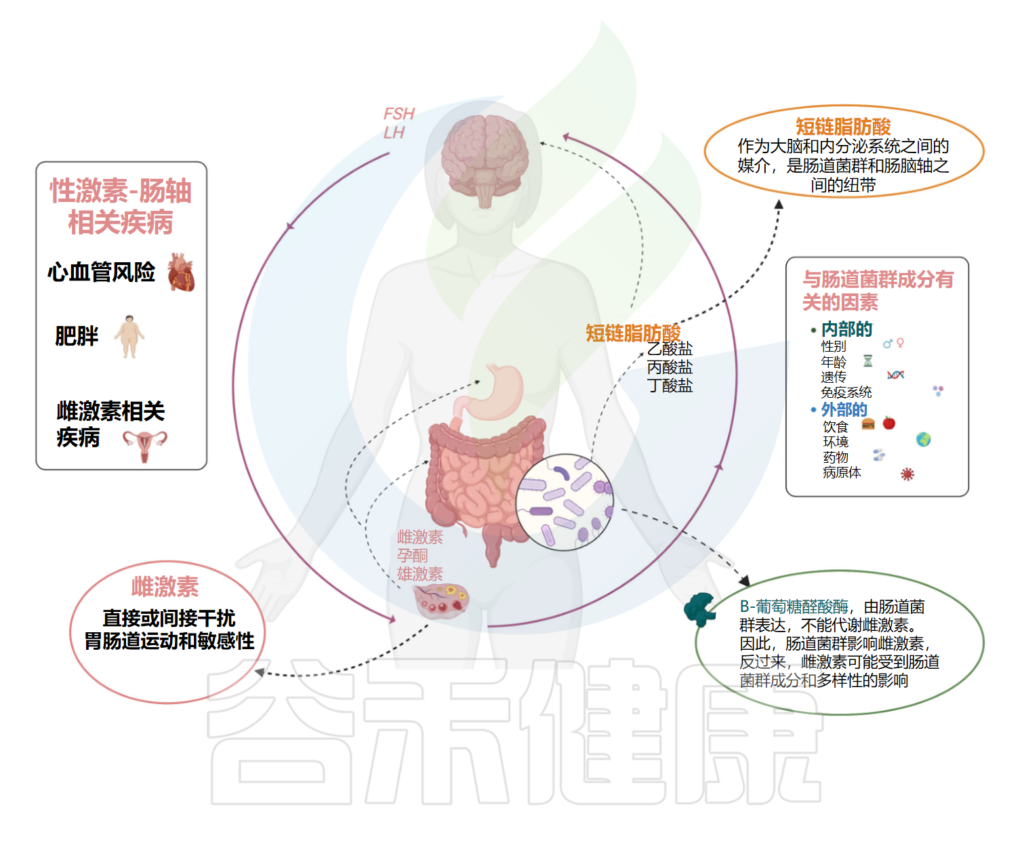
Calcaterra V, et al., Front Endocrinol (Lausanne). 2022
雌激素通过对核受体的作用,以及通过与膜G蛋白偶联的雌激素受体1 (ER 1)受体的激活,实现其快速、非基因组的作用机制。
▸ 雌激素干扰疼痛调节
雌激素受体在中枢神经系统和涉及内脏疼痛感知的通路中广泛表达,包括下丘脑、杏仁核和中脑,所有这些都已被证明向参与胃肠功能调节的迷走神经细胞发送广泛的投射。
具体而言,在外周内脏传入中,雌激素似乎通过改变离子通道的开放和受体表达的调节来调节伤害感受,以及激活胆酸速激肽-神经激肽1受体并诱导P物质的释放。
最后,除了干扰疼痛调节外,雌激素还参与中枢神经系统的内脏信息处理。
脑成像研究发现,与患有IBS的男性相比,患有IBS女性在对不良内脏刺激的反应中表现出更大的情绪回路激活,包括杏仁核和蓝斑。
众所周知,随着年龄的增长,微生物群的组成逐渐发生变化,需氧菌和兼性厌氧菌的数量普遍减少,专性厌氧菌种群数量增加。
传统上,普遍的观点是,在1-2岁之间,人类肠道菌群开始类似于成年人,主要由厚壁菌门、拟杆菌门、变形杆菌门和放线菌门的物种组成。然而,青少年和成人粪便微生物群在属水平上观察到许多差异。
非青春期和青春期菌群类别存在差异
一项研究评估青春期儿童的远端肠道菌群表明,双歧杆菌属和梭状芽孢杆菌属(已知定植于新生儿肠道并在2至18岁之间逐渐减少的物种)成员的丰度在青春期儿童中显著高于成年人。这些属的流行率以前在青春期前和青春期年龄组中没有被认识到。
2020年的一项横断面研究,通过16S rRNA测序分析了不同青春期阶段(5-15岁)的肠道菌群生物多样性。非青春期和青春期受试者之间的α或β多样性没有发现差异,但研究证明两组之间的细菌类群存在差异。
特别是,非青春期受试者的特征主要以下菌群:
另一方面,青春期组以β变形菌纲(Burkhollderiales)的流行率较高。
进一步分析血清性激素与菌群丰度之间的关系,结果表明:
睾酮水平与Adlercreutzia、Dorea、Clostridium和拟副杆菌属的丰度有关。作者假设这些细菌可能受到性激素的影响。
几项研究已经调查了肠道微生物与性类固醇激素之间的关系。Shin等人证明了肠道菌群特征与人类睾酮/雌激素状态之间的关系:
不动杆菌、多利亚菌、瘤胃球菌和巨单胞菌与睾酮水平显著相关,而Slackia菌和丁酸单胞菌则与雌二醇水平显著相关。
青春期两性之间的肠道菌群差异更加明显
据报道,肠道菌群似乎不受儿童性别的影响,但在青春期开始时就出现了差异。微生物门相关疾病也表现出性别偏见,支持肠道细菌与性别之间的关系可能是双重的。
最近的一项横断面调查发现,在青春期,两性之间的肠道菌群差异更加明显。
比较青少年和成年人的微生物群,发现双歧杆菌的数量,特别是在一些研究中,随着年龄的增长而减少,也报道了与拟杆菌门和厚壁菌门的年龄相关的联系。
Hollister等人比较了青春期和成人的肠道菌群组成,指出在青春期发育期间,女孩的肠道菌群逐渐发生变化,越来越像成年女性的肠道菌群,与她们的青春期发育程度成正比。
在雄性和雌性中,优势类群都是梭状芽孢杆菌和拟杆菌,表明微生物群成熟的要素是:
梭状芽胞菌和拟杆菌类菌群优势的变化
事实上,在青春期,梭状芽孢杆菌的相对丰度逐渐增加,拟杆菌的相对减少,逐渐类似于成人微生物群的组成。就门而言,随着青春期的进展,厚壁菌门的数量增加,而拟杆菌门的数量减少。
然而,尽管Hollister等人观察到男孩和女孩的肠道菌群变化,但由于男性青春期发育较晚,仅在女性青少年中获得了具有统计学意义的数据。
青春期,肠道菌群组成和预测的代谢谱存在性别显著差异
Yuan等人证实了这些数据,他们确定了不同青春期状态下两种性别的肠道菌群特征。对89名5-15岁的中国参与者进行了肠道菌群分析。参与者被分为青春期前和青春期组,男性(n=49)和女性(n=40)。
这项横断面研究表明,在青春期之前,肠道菌群组成和预测的代谢谱存在性别差异,在青春期变得更为显著。
实验结果表明,Dorea、Megamonas、Bilophila、Parabacteries、Phascolactobacterium属代表青春期受试者的微生物标记。
他们认为,性别依赖的肠道菌群多样性部分是由于性激素,部分是由于其他非激素影响因素。
“
以上是肠道菌群在生理性青春期发育中的作用的证据。而肠道菌群在病理性青春期中的作用越来越受到关注。
青春期到来的时间可能受到肠道菌群的影响,特别是某些梭菌属物种,包括调节宿主性激素水平的瘤胃球菌科、粪杆菌属和瘤胃球菌属。
肠道菌群影响雌激素代谢
Ruminococcus和Faecalibacterium的β-葡糖醛酸酶能够裂解雌酮和雌二醇,而拟杆菌物种只能代谢雌酮。
因此,尿液中雌激素-雌激素代谢物比率与瘤胃球菌的相对丰度呈正相关,与拟杆菌的相对丰量呈负相关。
根据这些数据,肠道菌群可能通过其雌激素代谢部分调节青春期的开始。
肠道菌群通过能够代谢雌激素的特定肠道微生物似乎能够调节青春期,但反过来也可能。性激素可以通过引导肠道菌群的成熟,直接影响特定菌群的生长。
肠道菌群代谢物影响内分泌系统
最近的研究发现,肠道菌群产生的代谢物可以影响人体内分泌系统,激活肠道神经系统。
一些关于微生物群功能的最佳研究强调了肠道微生物通过产生短链脂肪酸为宿主提供能量,包括丁酸和丙酸,这两种物质都参与胆汁盐代谢,并在脑肠轴中发挥重要作用。
已经证明,内源性受体游离脂肪酸受体(FFAR)2和FFAR3与短链脂肪酸相互作用,并在肠内分泌细胞中表达,肠内分泌细胞产生肽YY(一种厌食激素),从而参与调节宿主能量、食欲、脂肪组织储存和荷尔蒙平衡,影响青春期时间。
肥胖 & 青春期 & 肠道菌群失调
肥胖和青春期之间有着密切的联系;尤其是性早熟与体重指数(BMI)呈正相关。基于这一信息,并考虑到受性早熟影响的儿童往往肥胖,已假设肠道菌群可能参与性早熟的发病机制。
一项研究阐明了特发性中枢性性早熟(ICPP)患者(n=25)和健康女孩(n=23)之间肠道菌群的差异。
特发性中枢性性早熟肠道菌群与肥胖菌属相似
作者应用16S rDNA测序来比较两组之间的肠道菌群,观察到,特发性中枢性性早熟中鉴定的肠道属与肥胖相关的肠道属相似,特别是吉米格瘤胃杆菌属、示波杆菌属和XIVb梭状芽孢杆菌属。
考虑到微生物种类水平,患有特发性中枢性性早熟的女孩富含Rumicoccus bromii, Ruminococcus gnavus, Ruminococcus leptum,前两种是在肥胖人群中发现的;它们可以促进脂肪组织的能量吸收和增生,而据报道,Ruminococcus leptum会影响人体体重变化。
这些结果突出了肥胖、特发性中枢性性早熟和肠道菌群失调之间的关联。作者假设,肠道菌群失调会导致青春期前女孩发生类似于肥胖患者的过程,脂肪细胞的增殖和沉积会引发性早熟。
然而,肠道失调也可能导致下丘脑-垂体-性腺轴(HPGA)的早期激活。
不同的研究已经研究了肠道菌群在雌激素、FSH和LH分泌机制中的作用,但仍不清楚。
三种临床生物标志物(FSH、LH和胰岛素抵抗)与肠道菌群之间的关系
考虑到特发性中枢性性早熟女孩,作者证明了FSH与梭杆菌、LH与Gemmiger之间的正相关,LH与Romboutsia之间的负相关。此外,胰岛素抵抗与吉米格菌、瘤胃球菌、巨单胞菌和双歧杆菌呈正相关。
特发性中枢性性早熟:部分菌群高产短链脂肪酸
肠道菌群、激素分泌和肥胖之间的密切联系激发了对肠道菌群触发特发性中枢性性早熟机制的研究。
研究人员在工作中调查的特发性中枢性性早熟女孩的特征是与产短链脂肪酸相关的菌群:
短链脂肪酸诱导瘦素基因表达,激活HPGA轴
瘦素在女性青春期发病中的重要作用众所周知。瘦素是一种脂肪细胞代谢肽,参与其表达的基因与短链脂肪酸相关。
短链脂肪酸产生与特发性中枢性性早熟之间的关系可以通过高浓度短链脂肪酸诱导瘦素基因表达的机制来解释,瘦素基因激活下丘脑-垂体-性腺轴,从而导致青春期的开始。
Li等人招募了27名中枢性性早熟女孩、24名超重女孩和22名健康对照,以探讨肥胖与中枢性性早熟之间的关系。
肠道菌群代谢物激活HPGA轴
这项研究表明,中枢性性早熟患者表现出过多的Alistipes、Klebsiella、Sutterella,这通常出现在神经系统疾病患者中。这些微生物产生具有神经递质活性的代谢物(血清素和多巴胺),这些代谢物会引发早熟,激活下丘脑-垂体-性腺轴。
肠道菌群代谢物促进胰岛素抵抗
作者在中枢性性早熟和超重组中都发现了普雷沃氏菌;支链氨基酸的产生可促进胰岛素抵抗。这一机制可以解释中枢性性早熟患者肥胖的高发生率。
此外,在两组中,均观察到一氧化氮合成升高,这是一种重要的气体神经递质,可刺激促性腺激素释放激素的分泌并促进胰岛素抵抗。
这些情况,肠道菌群表达的改变,可以解释中枢性性早熟和肥胖之间的联系,如下图所示。
性早熟 – 肠道微生物组和肥胖:密切相关
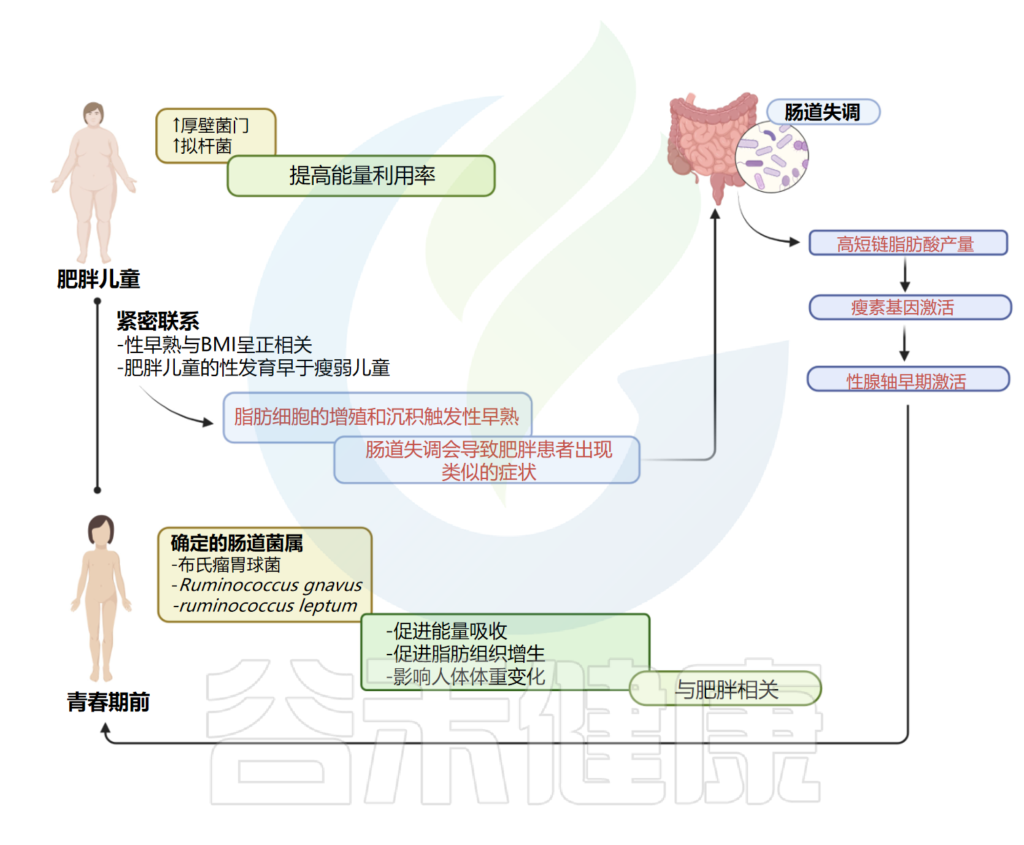
Calcaterra V, et al., Front Endocrinol (Lausanne). 2022
高脂饮食:过早激活HPG轴,诱导性早熟
大量营养素食物含量,如高脂肪摄入,可能会调节HPG轴的过早激活,诱导青春期的性早熟。
最近,在实验模型中,研究人员表明,高脂饮食对性早熟的影响受肠道微生物群和激素的相互作用调节。
断奶后的高脂饮食导致性早熟,下丘脑中的血清雌二醇、瘦素、脱氧胆酸和GnRH增加。特别是,GnRH与脱硫弧菌、Lachnoclostridium、GCA-900066575、链球菌、厌氧菌、双歧杆菌呈正相关,这表明这些细菌可能在促进性发育方面发挥作用。
此外,作者报道,“高脂饮食微生物群”移植促进了小鼠的性早熟,支持肠道菌群调节促进性早熟的局部和全身性类固醇水平。
性早熟治疗的最重要目标是保持成人身高并减少相关的心理社会压力。
促性腺激素释放激素激动剂,1个月或3个月储存制剂,是中枢性性早熟的标准护理。GnRH激动剂治疗被广泛认为是安全的。
最常见的不良反应包括局部皮肤反应和绝经后症状。需要定期验证青春期进展、生长速度和骨骼成熟。
PPP的治疗因发病机制而异,治疗的主要目的是消除性类固醇的内源性或外源性来源。
肾上腺和性腺肿瘤需要手术治疗。
其他生活中的注意事项如下,供参考。
生活方式
消除外源性雌激素(塑料、食品添加剂和杀虫剂)和其他内分泌干扰物(例如美容产品中的邻苯二甲酸盐)。薰衣草油和茶树油与乳突有关,尤其是男孩的男性乳房发育症。
营养
消除添加激素的乳制品、鸡蛋和肉类。考虑消除大豆、亚麻和芝麻,因为它们是植物雌激素,年轻组可能对这些非常敏感。
缺乏维生素 D 的 5-12 岁女孩面临青春期提前的风险是维生素 D 水平较高的女孩的两倍。
晒太阳是增加维生素 D 摄入量以预防和减缓青春期提前的一种方法。
其他食物补充包括:金枪鱼和鲑鱼等多脂鱼、橙汁、豆浆等。
肝脏解毒支持减少外源性激素作用。
食物
深色绿叶蔬菜、西兰花、甜菜、朝鲜蓟、姜黄、柠檬、蒲公英根等。
减少肾上腺激素输出的植物药:
刺五加 ;睡茄;红景天
父母的反应会影响孩子的应对能力
当孩子的家庭氛围不好,他们的病情无法得到家人的支持,会增加孩子的负面心理情绪和父母的养育压力。加强家庭成员之间的沟通至关重要。
一些导致性早熟的风险因素(例如性别和种族)无法避免。但是,有一些措施可以降低孩子出现性早熟的风险,包括:
不同的研究都提出了肠道菌群与性激素之间的双向相互作用。青春期期间,身体发育变化主要由激素驱动;因此,这一动态和过渡期是评估潜在激素对肠道菌群影响的机会。
不同青春期阶段的肠道菌群存在多样性,并且患有中枢性性早熟的女孩肠道菌群可能改变,这是预测和预防性早熟发育的一个有趣的发现。通过提供儿科内分泌学的观点,加深对性激素和微生物群变化作用之间的联系的理解,可以在青春期疾病中实施微生物群靶向治疗。
主要参考文献:
Calcaterra V, Rossi V, Massini G, Regalbuto C, Hruby C, Panelli S, Bandi C, Zuccotti G. Precocious puberty and microbiota: The role of the sex hormone-gut microbiome axis. Front Endocrinol (Lausanne). 2022 Oct 21;13:1000919. doi: 10.3389/fendo.2022.1000919. PMID: 36339428; PMCID: PMC9634744.
Li Y, Shen L, Huang C, Li X, Chen J, Li SC, Shen B. Altered nitric oxide induced by gut microbiota reveals the connection between central precocious puberty and obesity. Clin Transl Med. 2021 Feb;11(2):e299. doi: 10.1002/ctm2.299. PMID: 33634977; PMCID: PMC7842634.
Dong G, Zhang J, Yang Z, Feng X, Li J, Li D, Huang M, Li Y, Qiu M, Lu X, Liu P, Zeng Y, Xu X, Luo X, Dai W, Gong S. The Association of Gut Microbiota With Idiopathic Central Precocious Puberty in Girls. Front Endocrinol (Lausanne). 2020 Jan 22;10:941. doi: 10.3389/fendo.2019.00941. PMID: 32038493; PMCID: PMC6987398.