-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
ResistoXplorer基于Web的耐药基因组数据可视化,统计和探索性新分析工具。
对宏基因组测序后的数据进行抗生素耐药性基因组的注释与分析,逐渐成为一条必经之路。过去,人们需要自己下载相关数据库再用比对工具进行比对,然后去冗余,再进行下游分析。这通常需要学习编程并熟练应用,对于一些临床医生或科研人员是一个很大的挑战。
最近有一款新的工具,用于对耐药基因组数据的成分分析,功能分析和比较分析。
ResistoXplorer,一款Web程序,地址:http://www.resistoxplorer.no
ResistoXplorer的主要功能包括:
1.支持多种常用和先进的方法,用于成分分析、可视化和探索性数据分析
2.全面支持各种数据归一化方法,包括标准的和最新的统计和机器学习算法
3.支持对配对数据集进行垂直数据综合分析的多种方法
4. ARG功能注释及其微生物和表型关联,基于10多个参考数据库的对比结果
5.功能强大且齐全的网络可视化,直观展现ARG于微生物的关联
打开网址后的界面:

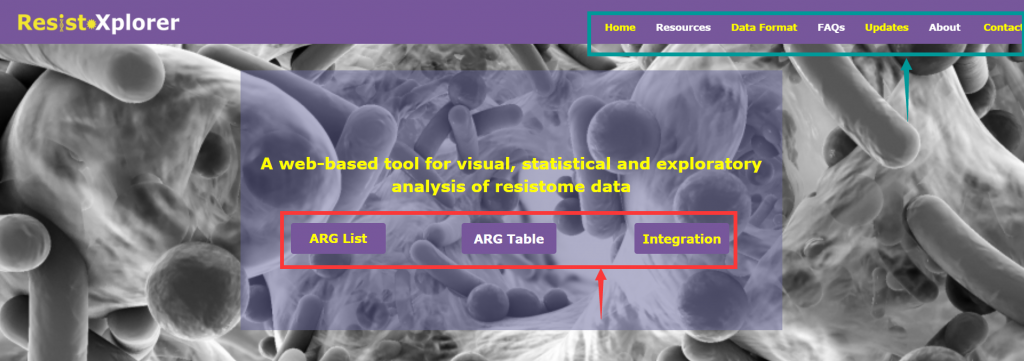
由三个主要分析模块组成(上图红色箭头所指框内):
“ARG List”:探索给定的ARG信息的功能和微生物宿主的关联,可视化网络。
“ARG Table”:对从宏基因组组学研究中获得的耐药基因组丰度文件进行功能分析,α多样性分析,排序分析,差异丰度分析等。
“Intergration”:综合分析,进一步探索潜在的联系,并结合新的生物学见解和假说,相似性分析,成对微生物-ARG相关分析等
上图绿色箭头所指框内:
“DataFormat”和“About”: 提供了关于注释表的格式、结构和数据库统计信息的详细描述
“FAQs”:提供了一些问题的答疑
“Resources”:分为“Manuals”和“Downloads”两个模块
Manuals是使用手册,对用户进行操作指导,建议仔细阅读。

Downloads,提供了示例上传文件和单个数据库的下载
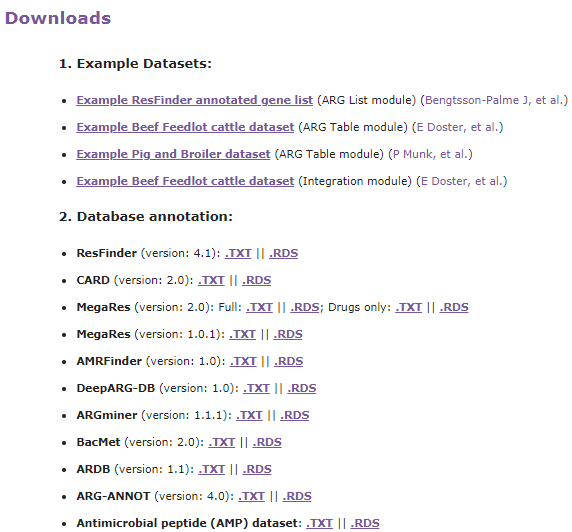
分析流程
ResistoXplorer接受抗性基因列表和ARG/taxa丰度表作为输入数据。然后是数据处理、数据分析和结果输出三个步骤。数据处理包括数据过滤和标准化,数据分析包括成分分析,比较分析和综合分析。结果输出以可视化图形,表格或html格式输出。
ResistoXplorer的功能注释使用的参考数据库来自9个通用的AMR数据库,CARD、ResFinder、MEGARes、AMRFinder、SARG、DeepARG-DB、ARGminer、ARDB和ARG-ANNOT。
此外,研究人员还从BacMet数据库和抗菌肽(AMP)耐药基因数据集中手动构建了功能注释信息,使用户能够对抗菌药物/金属和AMP抗性基因进行功能分析和下游分析。
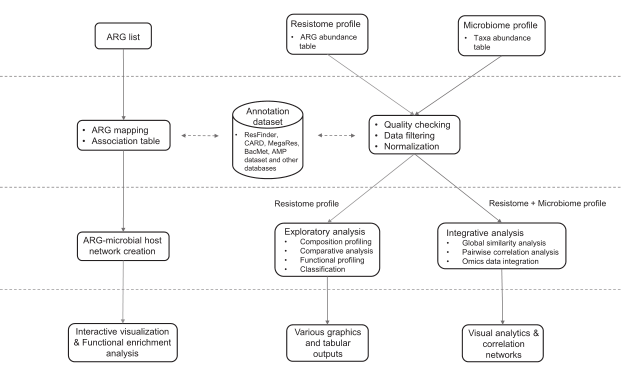
数据处理、分析及结果
数据过滤和标准化
默认情况下,低质量的特征会根据样本流行度及其丰度水平进行过滤。默认值是其他工具所使用的值,大多数在文献中可以找到。用户可以根据分位数间范围、标准差或变异系数排除这些低变异特征。
除alpha多样性和稀疏性分析外,过滤后的数据大多数用于下游分析。在综合分析的情况下,用户还可以对分类注释和耐药基因组丰度数据选择不同的数据筛选标准。
过滤后的数据还需要normalization(归一化)。ResistoXplorer提供了三种数据归一化方法,rarefying, scaling和transformation(稀疏、缩放和转换)。此外还支持其他归一化方法,如中心对数(CLR)和加性对数比(ALR)变换,以便于成分数据分析。方法的选择取决于要执行的分析类型。归一化后的数据用于探索性数据分析,包括排序、聚类和综合分析。用户可以自行探索适合的参数。
成分分析
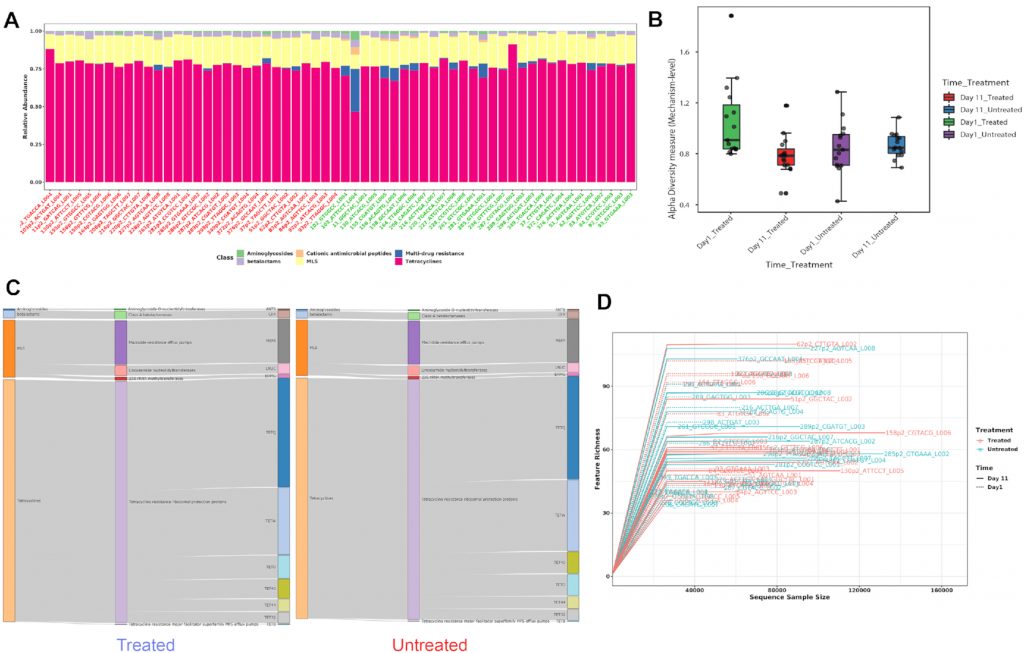
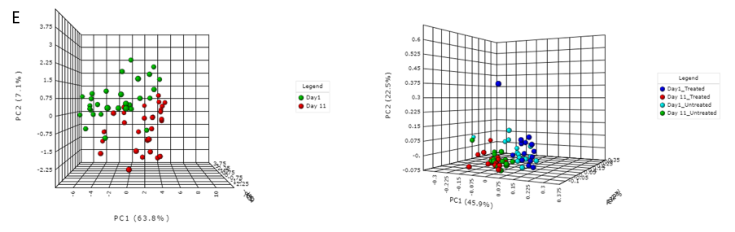


A) 显示各样本在不同分类水平下的ARG丰度。
B) Shannon多样性指数
C) 桑基图。显示了各组内的包括类别,机制和分组的ARG丰度分布。
D) 稀疏曲线。评估样本中估计的多样性的可靠性,在稀疏曲线中,识别的唯一特征(ARG)的数量与序列样本大小相对应。
E) 排序分析。左边是基于时间点的带有样本颜色的3D PCA图。右边是根据不同的治疗组和时间点绘制3D PCoA图。目前,支持三种通用的排序方法, PCoA、NMDS和 PCA。结果表示为2D和3D样本图。
比较分析
差异丰度分析
使用DESeq2、Edger、metagenomeSeq、Lefse,以及单变量分析方法,比如ALDEx2和ANCOM。DESeq2和Edger说明计数数据的特征,相比之下metagenomeSeq使用推荐的CSS规范化,在更大的分组规模下具有更高的性能。
Lefse使用标准的非参数检验统计显著性,结合线性判别分析来评估差异丰富特征的效应大小。
ALDEx2对来自数据的模型化概率分布的对数比值执行参数或非参数统计测试,并返回统计测试的期望值以及效应大小估计。
ANCOM使用非参数统计检验来检验所有特征对的对数比丰度,以找出均值差异。结果以表格样式展现。
基于机器学习的分类
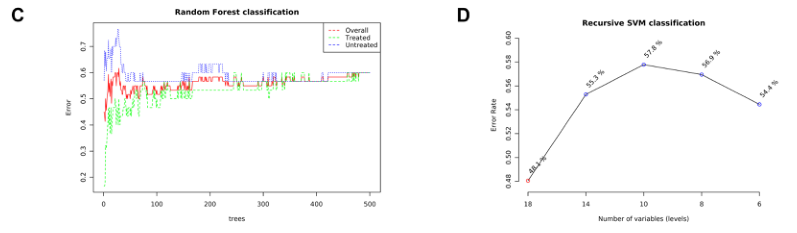
提供了两种功能强大的监督分类方法–随机森林和支持向量机(SVM),以识别潜在的生物标志物。
C)随机森林
D)展示了SVM在特征(变量)数量减少的情况下的分类性能
其他的一些可视化分析

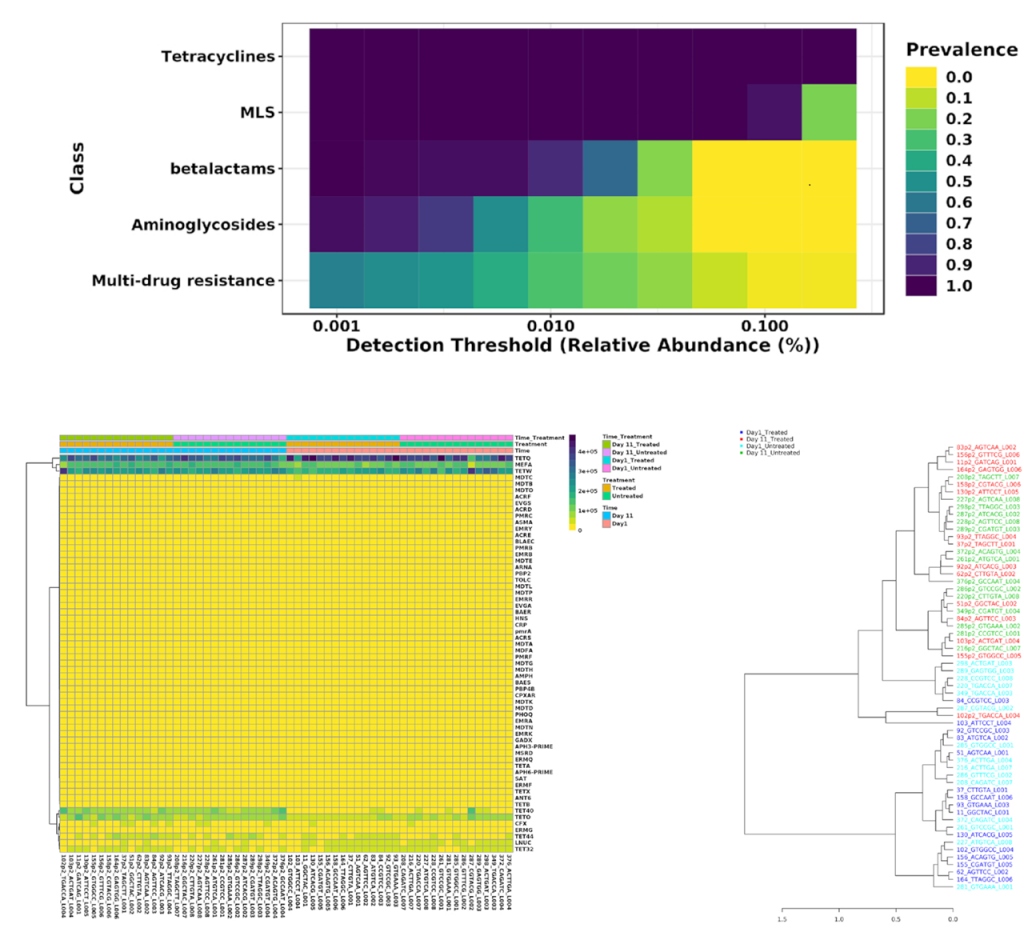
用户可以根据样本的丰度和流行程度,执行核心抗性分析来检测样本或样本组中存在的核心特征集,以热图的形式展现;以及关联分析和层次聚类,使用热图或者树状图可视化。
综合分析
使用各种综合数据分析方法来探索和揭示微生物群和抗性群之间潜在的潜在关联,这种分析大多用于探索不同环境中细菌和ARGs之间的联系。目前,为数据集成和相关分析提供了几种领先的、常用的单变量和多变量统计方法。所有这些分析都是在过滤和归一化数据集上执行的。
全局相似性分析
用两种基于多变量相关性的方法来确定微生物组和AMR数据集之间的总体相似性,分别为普鲁克分析(PA)和协惯量分析(CIA),在各种功能和分类级别上执行分析。相似系数和P值用于评估两个数据集之间的关联的强度和显著性,相似性系数在0到1之间,0表示两个数据集之间的完全相似,而1表示两个数据集之间的完全不相似。可视化结果用2D和3D排序图表示,如下图

A) 来自普鲁克分析的3D NMDS图,包含与数据集相关的样本、形状和颜色。
B) 来自协惯量分析的3D PCoA图,其中连接两点的线的长度表示两个数据集之间的样本的相似性。
组学数据集成方法
基于多变量投影的探索性方法,如正则化典型相关分析(RCCA)和稀疏偏最小二乘法(SPLS),用于微生物组和AMR数据的集成。这些方法旨在突出高维“组学”数据集之间的相关性。
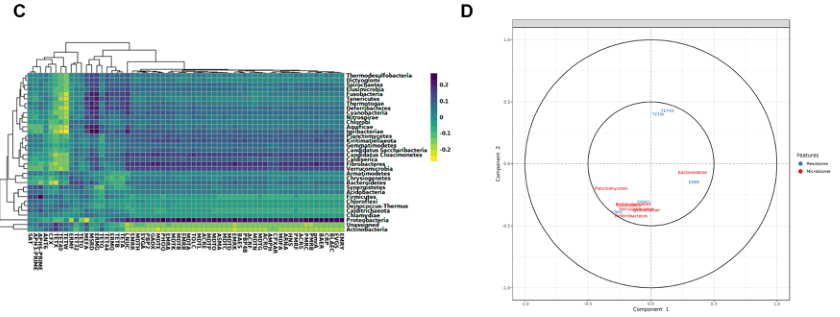
A 门水平微生物群落与ARGs(组水平)之间的聚类图像热图
B 显示存在于两个数据集中的特征(分类群/参数)的相关结构的相关圆图
成对微生物-ARG相关分析
使用单变量相关分析来确定单个菌群和ARGs(耐药基因组)之间是否存在强相关。使用Spearman、Pearson、CCLasso和最大信息系数(Maximal Information Coefficient)四种方法。用户可以使用绝对相关系数和调整p值的组合来选择强且显著的成对相关性。结果如下图,每个节点表示一个菌或ARG。用户可以双击一个节点,以突出显示网络中相应的相关节点。边缘的宽度和颜色表示两个节点之间相关性的强度和方向。
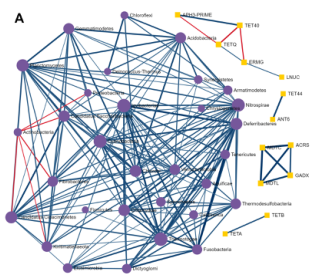
探索ARGs-微生物宿主网络
基于网络的可视化分析系统,提供了解ARGs和微生物宿主之间复杂的“多对多”关系的可能性。例如,通过查找在多个微生物中发现的ARGs或通过识别同时包含多个感兴趣的ARGs的微生物,可以直接从网络的角度找到承上启下的关键点。
从ResistoXplorer程序中涵盖的数据库中搜集ARGs-微生物宿主信息,构建的关联表用于网络可视化和功能分析。如下图,它由三个主要组件组成:中央网络可视化区、左侧的网络定制和功能分析面板,包含节点表的右侧面板。
用户可以使用带滚轮的鼠标直观地查看和操作中心区域的网络。例如,可以滚动滚轮来放大和缩小网络,将鼠标悬停在任何节点上以查看其名称,单击节点以在右下角显示其详细信息,或双击节点以将其选中。
顶部的水平工具栏显示了操纵网络的基本功能。第一个是颜色选择器,能够为下一次选择选择高亮颜色。还可以使用工具栏中的虚线方形图标选择并拖动多个节点。对当前网络中存在的ARGs进行功能富集分析,使用超几何测试方法,这种方法与网络可视化系统相结合,在解释AMR耐药机制和提供ARGs的可能传播路径信息可能会有更好的效果。
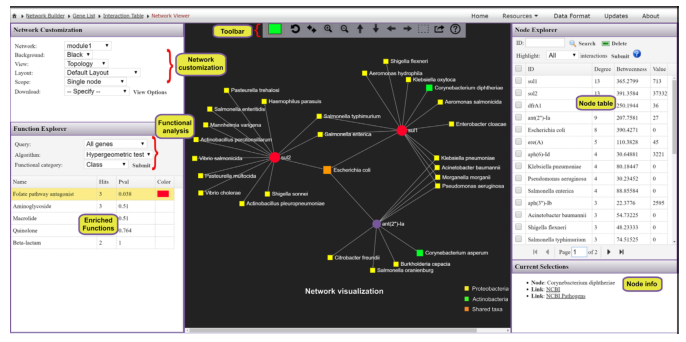
文章中为了展示该工具的可用性,在已发表的一些研究中,选择了1个研究进行抗性分析,“利用商业饲养牛检验图拉霉素(抗菌药物)对肠道微生物组和耐药性的影响”,分析的内容就如同上面展示的那样,这里就不多加赘述。
与其他工具的比较,文章中也列举了一个表格,分别与AMR++Shiny、resistomeAnalusis、WHAM!在分析模块上进行了比较。实际上大同小异,主要的分析模块以及使用的数据库都是相似的,只是谁的数据库更强大,搭载的分析模块更多的区别。
哪款软件的算法和统计分析匹配你的实验数据,或者它能为你提供更多的数据信息,就是适合你的。
这款在线分析抗生素耐药性基因组的程序值得探索一下,统计分析方法和数据库内容都挺强大的,交互式的使用也免去了对编程语言的探索,并且开发人员也表示会持续更新和精选数据库以达到更准确的下游分析。
参考文献
Dhariwal A, Junges R, Chen T, Petersen FC. ResistoXplorer: a web-based tool for visual, statistical and exploratory data analysis of resistome data. NAR Genom Bioinform. 2021 Mar 24;3(1): lqab018.
Interagency Coordination Group on Antimicrobial Resistance No time to wait–securing the future from drug-resistant infections. Rep. Secret. Gen. Nations. 2019.
Simonsen G.S., Tapsall J.W., Allegranzi B., Talbot E.A., Lazzari S. The antimicrobial resistance containment and surveillance approach-a public health tool. Bull. World Health Organ. 2004; 82:928–934.
Cecchini M., Langer J., Slawomirski L. Antimicrobial Resistance in G7 Countries and Beyond: Economic Issues, Policies and Options for Action. Paris: Organization for Economic Co-operation and Development. 2015; 1–75.
Xia Y., Zhu Y., Li Q., Lu J. Human gut resistome can be country-specific. PeerJ. 2019; 7:e6389.
Forslund K., Sunagawa S., Kultima J.R., Mende D.R., Arumugam M., Typas A., Bork P. Country-specific antibiotic use practices impact the human gut resistome. Genome Res. 2013; 23:1163–1169.

谷禾健康
链读测序(Linked-read sequencing)通过将相同的barcode与长DNA片段(10-100kb)的序列连接在一起,能够消除其中的一些错读,从而改进宏基因组组装。但目前还不清楚在使用链读测序时参数的选择对组装的质量的影响如何。
近日,香港浸会大学研究人员发表文章 “通过链读测序对宏基因组组装全面研究”。


模拟数据和模拟菌群中的分析结果表明,模拟数据(simulated data)中读取深度(C)与组装序列的长度呈正相关,但对组装序列的质量影响不大,模拟菌群的研究中读取深度(C) 对组装序列的质量以及被注释为基因组草图的bin的比例有轻微影响。
另一方面,宏基因组组装质量受CR(每个短读长片段的平均深度)和CF(由长DNA片段计算的基因组的平均物理深度)的影响。对于相同的读取深度,较深的CR 会产生更多的基因组草图,而较深的CF 会提高基因组草图的质量。
还发现μFL(未加权的DNA片段的平均长度)对组装有边际效应,而NF/P(每个分区的片段数)对局部组装涉及到的偏离目标读数(off-target reads)有影响,即较低的NF/P值会通过减少off-target序列的错读而有更好的组装效果。
总体而言,与Illumina的短读长相比,使用链读改善了组装中重叠群的N50,但与PacBio CCS的长读长相比则没有改善。
人体微生物群是一个复杂的系统,在生理活动和疾病中起着重要的作用。对微生物群中的微生物基因组进行测序可以帮助我们研究其功能。
然而,微生物基因组序列很难获得,微生物群中的绝大多数微生物不能被分离出来进行单个测序。目前的宏基因组项目中使用短读长测序对混合的微生物基因组进行测序。
这些结果在基因组组装过程中是有错读的,导致微生物基因组的完整性和重叠群的连续性结果不理想。长读长测序已经被用来尝试减轻这些问题,如Nicholls等人和Sevim等人的研究。特别是Moss等人的研究,其成果优化了纳米孔测序的长读长文库制备方案,并获得了更完整的细菌基因组。
但实际应用中,长读长测序是昂贵的。虽然链读序列(linked-reads)的基因组组装的质量无法与PacBio CCS的长读长相提并论,但其低成本和高碱基质量的优点是值得去使用的。
01 三组链读序列数据集的来源及构成:
模拟数据(simulated data):
从MBARC-26数据集中下载了23个细菌和3个古细菌菌株,按丰度分类,L-sim,低丰度微生物,摩尔浓度<10-15;M-sim,中等丰度微生物,10-15 < 摩尔浓度 < 10-14;H-sim,高丰度微生物,摩尔浓度 > 10-14
模拟菌群(mock community):
(ATCC MSA-1003)是一个由20个菌株组成的池,同样按丰度分类,L-mock,低丰度微生物;M-mock,中等丰度微生物;H-mock,高丰度微生物;UH-mock,超高丰度微生物。
人类肠道菌群:
一份来自健康的中国人粪便样本
02 DNA提取、文库制备和测序:
对于模拟菌群,从ATCC 20菌株交错的混合基因组材料中提取DNA,不进行大小选择。
对于人类肠道菌群,用Qiagen QiAaMP粪便迷你试剂盒提取DNA,去掉5kb以下的DNA片段。
脉冲场凝胶电泳后,按照厂商的说明制备10x Chromium文库。使用Illumina XTen双端2x150bp测序。人类肠道微生物组的DNA也被用于标准的Illumina XTen短序列测序。
03 DNA长片段重建和链读序列二次抽样:
Long Ranger v2.2.1用于纠正barcode碱基错误,计算PCR重复率,并完成barcode感知的链读序列比对。
使用BWA-MEM v0.7.17比对短序列和没有barcode的链读序列。根据映射得到的具有共同的barcode的短序列的坐标重建DNA长片段。
链接序列首先按barcode排序,然后按它们的映射坐标排序。如果最近的barcode序列大于50kb,则终止延伸长DNA片段。每个片段必须包括至少两个具有共同barcode的成对序列,并且最小长度为2kb。
04 宏基因组组装:
对于链读序列的组装,没有 barcode 的链读序列首先由 metaSPAdes v3.11.1使用默认参数组装为“seed”重叠群,并通过BWA-MEM v0.7.17与重叠群比对。
最后使用 Athena-meta v1.3 通过汇集在 scaffold 中的两个“seed”重叠群里共享相同 barcode 的序列进行局部组装。
05 组装效果评估:
MaxBin v2.2.4将长于1kb的重叠群分组到bins中,并通过CheckM v1.0.12评估其完整性和污染率。
Quast v5.0.0统计了基础信息,如重叠群的N50、NG50、NGA50、总比对长度(total aligned length)和基因组覆盖率(genomic coverage)。
Kraken v0.10.6基于内置数据库MiniKrakenDB为bins做物种注释。每个bins都作为一个基因组草图,被分类为高质量的(完整性>90%,污染率<5%),中等质量的(完整性≥50%,污染率<10%),低质量的(完整性<50%,污染率<10%)
来自人类肠道菌群和Illumina短序列链读序列二次抽样的组装效果统计
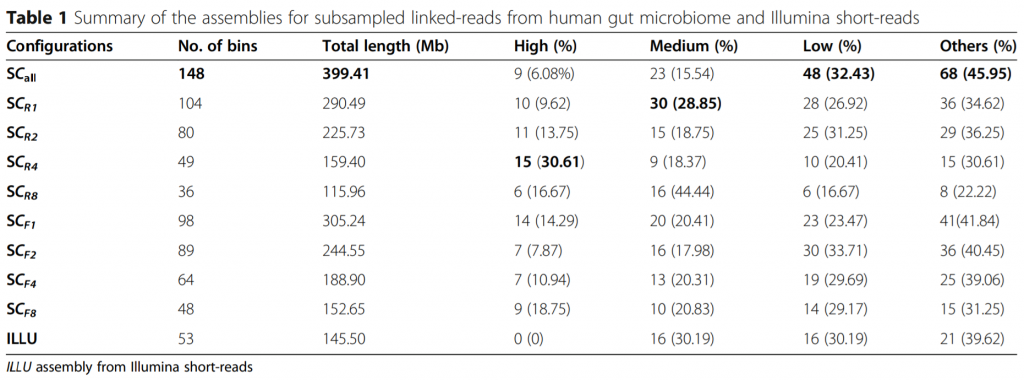

ILLU,Illumina短序列的组装
SC-all,模拟菌群和人类肠道菌群总共的两个测序lane链读序列
在链读测序中,有四个关键参数可能会影响宏基因组组装,如下图。
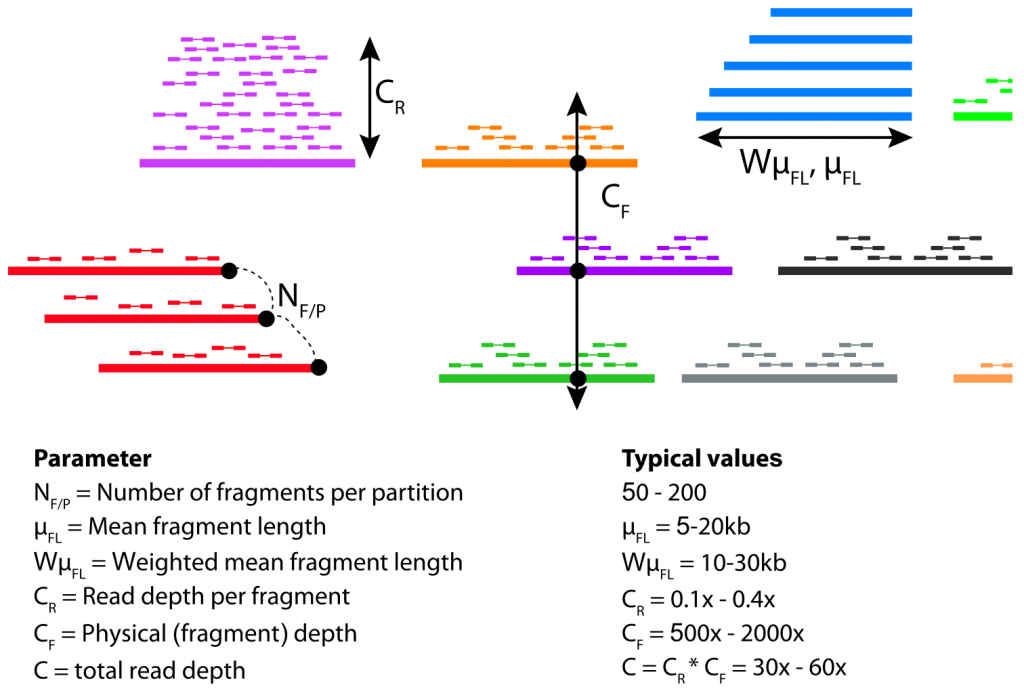

这些参数中有几个是相互依赖的。例如,输入DNA的量越大,CF和NF/P都会增加,CR就会降低;CF和CR的绝对值是由总读取深度(C)增加多少来设置的,因为CR×CF=C。
L-sim,模拟数据中的低丰度微生物,青色
M-sim,模拟数据中的中等丰度微生物,蓝色
H-sim,模拟数据中的高丰度微生物,红色
L-mock,模拟菌群中的低丰度微生物
M-mock,模拟菌群中的中等丰度微生物
H-mock,模拟菌群中的高丰度微生物
UH-mock,模拟菌群中的超高丰度微生物
“-”表示测序lane的倒数,例如MSCR4/MSCF4表示四分之一测序lane的序列被二次采样
MSCR-,模拟菌群中的短序列
MSCF-,模拟菌群中的长DNA片段
MSC-1,模拟菌群和人类肠道菌群总共的一个测序lane链读序列
SC-all,模拟菌群和人类肠道菌群总共的两个测序lane链读序列
相关阅读:
参考文献:
Zhang L, Fang X, Liao H, Zhang Z, Zhou X, Han L, Chen Y, Qiu Q, Li SC. A comprehensive investigation of metagenome assembly by linked-read sequencing. Microbiome. 2020 Nov 11;8(1):156. doi: 10.1186/s40168-020-00929-3. PMID: 33176883; PMCID: PMC7659138.
He S, Chandler M, Varani AM, Hickman AB, Dekker JP, Dyda F: Mechanisms of evolution in high-consequence drug resistance plasmids. MBio 2016;7(6): e01987–16.
Peng Y, Leung HC, Yiu SM, Chin FY. IDBA-UD: a de novo assembler for single-cell and metagenomic sequencing data with highly uneven depth.Bioinformatics. 2012;28(11):1420–8.
Li D, Liu CM, Luo R, Sadakane K, Lam TW. MEGAHIT: an ultra-fast singlenode solution for large and complex metagenomics assembly via succinct de Bruijn graph. Bioinformatics. 2015;31(10):1674–6.
Nurk S, Meleshko D, Korobeynikov A. Pevzner PA: metaSPAdes: a new versatile metagenomic assembler. Genome Res. 2017;27(5):824–34.
Nicholls SM, Quick JC, Tang S, Loman NJ. Ultra-deep, long-read nanopore sequencing of mock microbial community standards. Gigascience. 2019;8(5): 1–9.
Sevim V, Lee J, Egan R, Clum A, Hundley H, Lee J, Everroad RC, Detweiler AM, Bebout BM, Pett-Ridge J, et al. Shotgun metagenome data of a defined mock community using Oxford Nanopore, PacBio and Illumina technologies. Sci Data. 2019;6(1):285.