 国家高新企业 | ISO9001认证
国家高新企业 | ISO9001认证 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

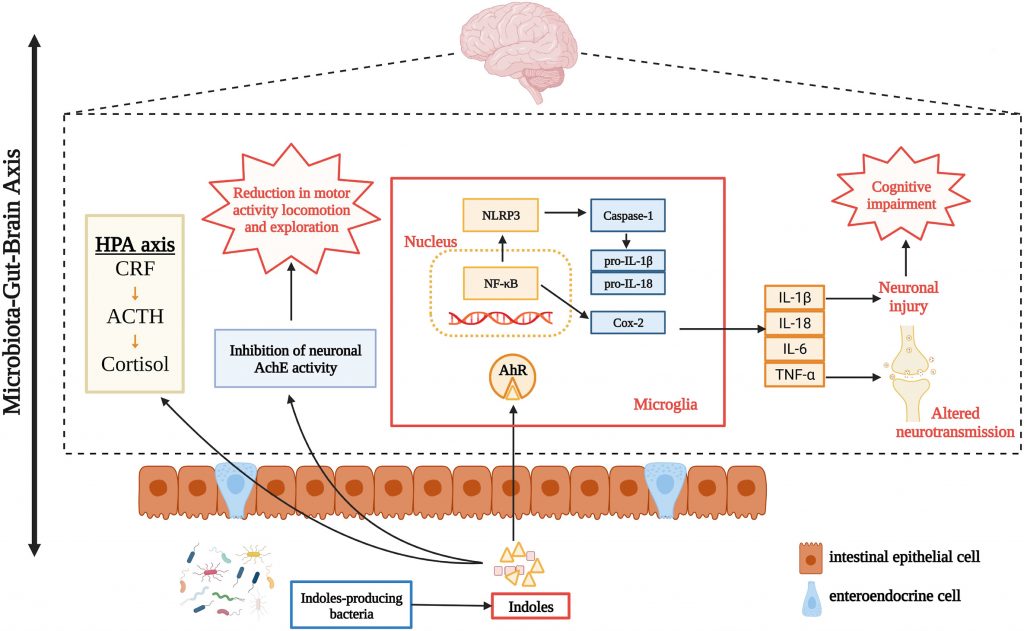
肠道微生物群在食物消化、免疫激活和肠道内分泌信号通路的调节中扮演关键角色。同时,它们通过产生特定的代谢化合物与中枢神经系统(CNS)及身体其他部位进行密切交流。
这些代谢物包括次级胆汁酸、短链脂肪酸(SCFAs)、谷氨酸(Glu)、γ-氨基丁酸(GABA)、多巴胺(DA)、肾上腺素、吲哚、血清素(5-HT)和组胺等神经递质以及其他重要信号分子。
这些神经递质和主要菌群代谢物对肠道微生物及人体健康有着深远的影响。肠道细菌主要利用GABA、多巴胺、谷氨酸、血清素和组胺等神经递质,以及短链脂肪酸、色氨酸和次级胆汁酸等菌群代谢产物,与中枢神经系统进行双向通讯。这些信号分子通过传入迷走神经纤维传输到大脑,大脑则通过传出的迷走神经纤维将信号发送回肠壁中的肠神经细胞和粘膜免疫系统。下丘脑-垂体-肾上腺轴(HPA轴)也参与了这一复杂的信号调控网络。
这些神经递质和菌群代谢物的协调作用,对维持肠道生态平衡和免疫稳态至关重要。一旦出现失衡,就可能导致主要胃肠道疾病,甚至影响神经系统功能,引发神经退行性疾病。
相应的,通过对肠道菌群的分析和前期构建的研发数据队列,我们可以评估出血清中神经递质和菌群代谢产物的水平情况。因为肠道这些指标可以反映肠道微生物在神经递质代谢和信号传递中的作用,从而为评估个体的神经功能和代谢状态提供重要线索。
谷禾健康肠道菌群检测报告新增了这方面的相关指标,本文总结和解读这些神经递质及肠道菌群代谢物,并总结了含量过高和过低对人体健康的影响和一些饮食生活和药物干预措施。

编辑
细菌具有许多不同的代谢方式。一些细菌只需要二氧化碳作为它们的碳源,被称作自养生物。另外一些细菌依靠有机物形式的碳作为碳源,称为异养生物。而人体的肠道微生物群主要就是异养生物,他们通过消化膳食成分和其他人体内的物质来获取营养,从而维持它们的生存和繁殖。这些微生物对于人体健康至关重要。
肠道菌群是宿主消化的关键组成部分,分解复杂的碳水化合物,蛋白质,并且在较小程度上分解到达下胃肠道的脂肪。该过程产生大量微生物代谢物,其可以局部和全身起作用(在被吸收到血流中之后)。这些途径都可以产生潜在有益和潜在毒性的代谢物。
// 肠道菌群将膳食成分转化为各种代谢物
例如细菌可以将多糖、蛋白质、脂肪等大分子营养物质分解为单糖、小肽或氨基酸等,进而产生短链脂肪酸、次级胆汁酸、吲哚、苯酚、硫化氢、谷氨酸、组胺等物质。
细菌除了在分解和合成代谢中能产生多种代谢产物,还被证明可以产生或消耗多种神经递质,包括多巴胺、去甲肾上腺素、血清素或γ-氨基丁酸 (GABA)等。多项的研究证据表明,细菌对这些神经递质的操纵会对宿主的生理及健康产生影响。
注:初步的人体研究还表明,基于微生物群的干预也可以改变神经递质水平。
那么胃肠道与大脑、神经系统甚至全身其他器官是如何相互联系的呢?肠脑轴(Gut-Brain Axis)被称为肠-脑轴或肠道-大脑轴,指的是肠道和大脑之间存在着复杂的相互关系和通讯机制。
// 大部分信号通过双向迷走神经传递
大多数进出肠道的信号都通过双向迷走神经传输,该双向迷走神经在延髓处离开大脑,并在颈静脉孔处离开头骨。颈部迷走神经与控制吞咽和言语的咽喉肌肉通信,胸部迷走神经可降低心率。迷走神经通向胃肠道的分支放松和收缩平滑肌并控制腺体组织的分泌。迷走神经的的腹腔分支与十二指肠相连,其余部分与结肠的远端相连。
髓质迷走神经的节前神经元与固有层和外肌层的肌肉层和粘膜层通信。神经节中的感觉细胞向孤束核(NTS)发送信号,从孤束核向蓝斑(LC)、杏仁核、丘脑和延髓头端腹外侧发送信息。
胃肠道通过迷走神经与中枢神经系统连接
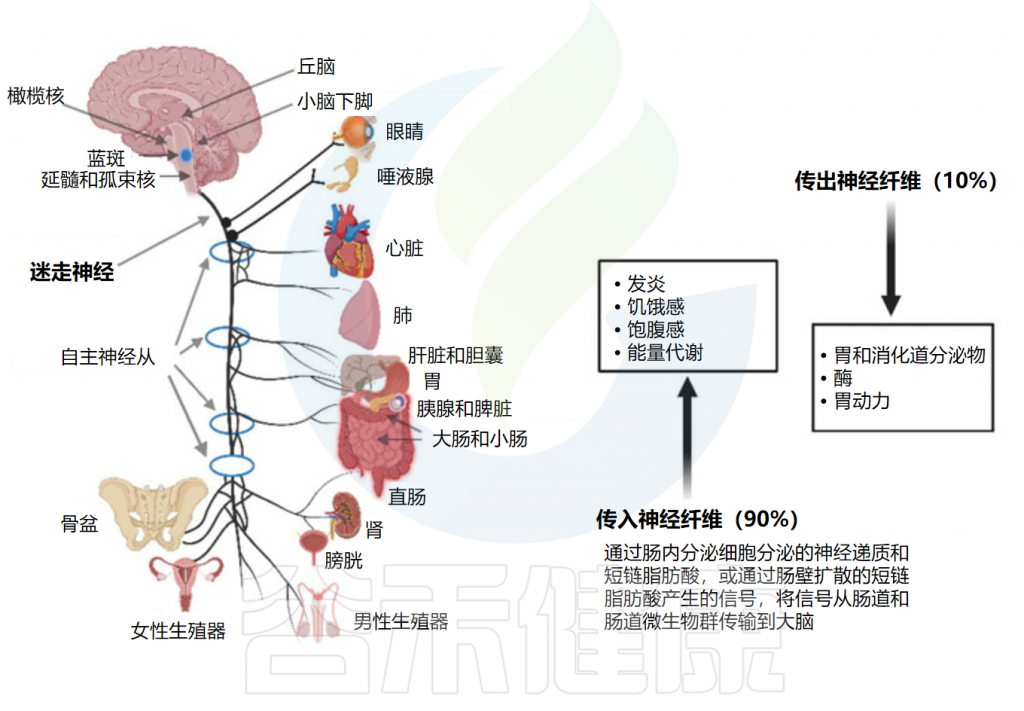
Dicks LMT.Microorganisms.2022
传入神经也与食道、肝脏和胰腺中的受体相连。尽管迷走神经与肠壁的所有层接触,但神经不穿过肠壁,因此不与肠道微生物群直接接触。信号一般通过肠壁粘膜下层和肌间神经丛的肠神经系统(ENS)中的1亿至5亿个神经元到达肠道微生物群。
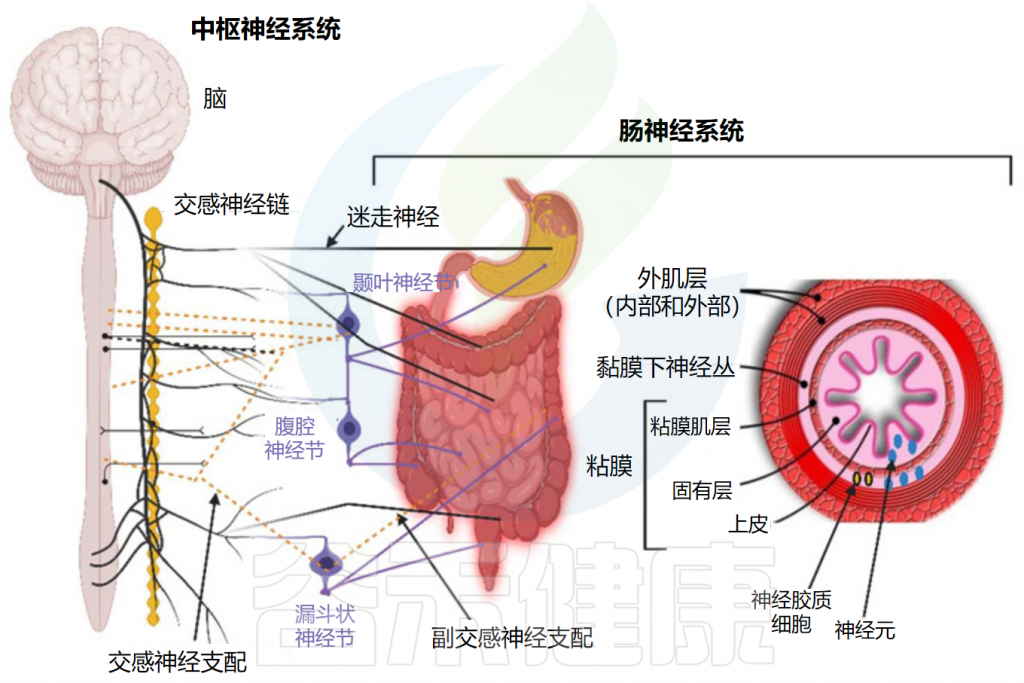
Dicks LMT.Microorganisms.2022
// 肠神经系统功能下降会导致便秘、排便障碍
尽管与迷走神经相关,但小肠和大肠中的部分功能独立于迷走神经。这可能是由于独立的感觉和运动神经元,能够调节肌肉活动、肠壁运动、液体分泌、粘膜层血流和粘膜屏障功能。
与肠神经系统相关的功能下降通常表现为便秘、失禁和排便障碍。这通常发生在老年人身上,被称为先天性巨结肠或肠假性梗阻。最近的研究表明,肠神经系统是动态的,并且不断变化,由细胞凋亡和神经发生过程维持。
与胃肠道相连的神经元有许多受体,它们与肠内分泌细胞(EECs)释放的激素或其他激素相互作用,在维持肠道稳态方面发挥着重要作用。
到目前为止,已经对十多种不同类型的EEC进行了表征。它们作为感觉细胞,协调血清素(5-HT)、神经肽Y(NPY)、血管活性肠肽(VIP)、胆囊收缩素(CCK)、γ-氨基丁酸(GABA)、生长抑素、胰高血糖素样肽(GLP)-1/2、胃饥饿素等的分泌变化。这些感觉细胞上的受体通常由肠道神经元表达,也由迷走传入神经、脑干和下丘脑表达。
// 胆囊收缩素、胰高糖素样肽-1等带来饱腹感
胆囊收缩素、胰高血糖素样肽-1(GLP-1)和肽YY(PYY)水平在餐后长达6小时内保持较高水平。富含蛋白质的饮食会刺激CCK的产生。CCK与胰腺中的特定受体(CCK-A受体)、大脑中的受体(CCK-B受体)以及中枢神经系统中的其他受体结合,这会带来饱腹感。
同时,胰腺释放脂肪分解酶、蛋白分解酶和碳代谢酶。当CCK与胰腺中的钙调神经磷酸酶相互作用时,转录因子NFAT 1-3被激活,刺激胰腺细胞肥大和增殖。
注:高CCK水平会增加焦虑,而生长抑素和胰腺肽可防止CCK的过度释放。
// 胃饥饿素、生长激素释放肽促进食欲
胃饥饿素(ghrelin)在禁食期间由胃释放,进入循环系统并穿过血脑屏障。胃饥饿素通过与位于迷走神经节上的Ghrelin受体(GHSR)的相互作用刺激食欲。
较高的ghrelin水平与升高的多巴胺(DA)水平相关,而多巴胺水平反过来又向中枢神经系统发送饱腹感信号。
一旦进入大脑,生长激素释放肽就会激活弓状核神经元上的受体,导致神经肽Y(NPY)和刺鼠关联蛋白(AgRP)的产生增加。
大脑和脊髓中高水平的NPY与其他神经递质(如GABA和谷氨酸)一起分泌。NPY刺激食欲,以脂肪的形式调节能量的储存,但也能减轻焦虑、压力和疼痛。NPY还调节睡眠模式并保持低血压。
富含低聚果糖和菊粉的饮食会抑制生长素释放肽的产生,并增加肠上皮内分泌L细胞GLP-1的产生。
// 胃饥饿素的产生受到一些肠道菌群的影响
一项研究总结了肠道微生物群对激素释放的影响。胃饥饿素的产生受到拟杆菌某些物种(Bacteroides)、Coriobacteriaceae、韦荣氏菌属(Veillonella)、普雷沃氏菌(Prevotella)、双歧杆菌某些种类(Bifidobacterium)、乳酸杆菌某些品种、粪球菌属(Coprococcus)和瘤胃球菌(Ruminococcus)的刺激,但受到双歧杆菌、链球菌、乳酸杆菌、粪杆菌、拟杆菌、埃希氏菌、志贺菌(Shigella)和链球菌(Streptococcus)的抑制。
这清楚地表明,激素水平的调节是物种特异性的,需要更多的研究来确定所涉及的特定因素。
// 拟杆菌等细菌还影响其他激素的作用
拟杆菌产生与胰岛素、神经肽Y和黑色细胞刺激素(α-MSH)同源的分子。这些分子诱导与循环系统中的免疫球蛋白发生交叉反应,直接对抗生长素释放肽、瘦素、胰岛素、肽YY和神经肽Y。
Rikenellaceae和梭菌科(Clostridiaceae)的一些菌株产生酪蛋白分解酶B(ClpB),可模拟α-MSH水平增加时产生的饱腹感。与ClpB相互作用产生的免疫球蛋白可对抗α-MSH并减少其厌食作用,导致饱腹感降低。
肠嗜铬细胞(EC)控制反射和胃酸分泌,但也产生血清素(5-HT)。D、G、I、K和L型细胞控制酶分泌,单核细胞启动肌电迁移,N细胞调节收缩,S细胞(位于小肠)调节酸度水平,A细胞分泌胃促生长素和内脂素-1,P细胞分泌瘦素。
胃肠道除了通过各种激素使大脑形成不同的感觉和反应外,神经递质也对胃肠道健康及其中的微生物群产生重要影响。谷禾最新的报告中已将神经递质作为健康的重要指标,让我们一起来了解一些重要神经递质对健康的影响。
神经递质一般可分为氨基酸(例如,谷氨酸、天冬氨酸、D-丝氨酸、GABA和甘氨酸)、单胺(多巴胺、去甲肾上腺素、肾上腺素、组胺和血清素)、微量胺(例如,苯乙胺、酪胺、章鱼胺、色胺)、肽(催产素、生长抑素、P物质、可卡因和阿片肽)、气体递质(一氧化氮、一氧化碳和硫化氢)、嘌呤(三磷酸腺苷和腺苷)等。
其中,血清素(5-HT)、γ-氨基丁酸(GABA)、谷氨酸、多巴胺、组胺和一氧化氮被认为是关键的神经递质,将进行更深入的讨论。

血清素又名5-羟色胺(5-HT),主要存在于中枢神经系统和肠道,是一种抑制性神经递质。在中枢神经系统中,血清素充当神经递质,参与调节情绪、睡眠和食欲。它有助于幸福感,有助于调节对压力和焦虑的反应。此外,血清素负责介导多种非神经元过程和功能,例如膀胱调节、止血、呼吸驱动、免疫反应、血管张力和肠道炎症。
血清素作为神经递质发挥着关键作用,但是大脑仅含有大约5%的血清素,而胃肠道系统中的肠嗜铬细胞(ECC)负责产生约90%的人体总血清素。血清素主要由色氨酸合成,而色氨酸则是一种必需氨基酸,必须通过饮食摄入。肠道血清素水平受色氨酸羟化酶TPH1和TPH2调节。
▸ 血清素的合成受到肠道微生物群的调节
肠道微生物群可以影响血清素的产生。研究表明,肠道菌群可以影响血清素的前体物质如色氨酸的代谢,促进血清素的产生。肠嗜铬细胞受到肠道微生物群(特别是短链脂肪酸)的刺激,产生血清素。短链脂肪酸会增加肠嗜铬细胞中的TPH1表达和血清素合成,从而导致循环血清素浓度升高。
一项研究表明乙酸钠(10-50 mM)显著增加人体中TPH1 mRNA 的表达。然而,较高水平的丁酸盐(8.0和16.0mM)分别抑制TPH1表达13.5和15.7倍。
另一项单独的研究表明,无菌小鼠的神经元功能障碍可以通过肠道微生物群的重新定植来逆转。多项研究证实了这一点,并提供了明确的证据表明5-HT的合成受到肠道微生物群的调节。
过高或过低的血清素含量都不利于人体健康
▸ 血清素含量过高的危害
血压异常、心血管问题:5-羟色胺是一种强血管收缩剂和平滑肌收缩刺激剂。高血清素水平可能导致血管过度收缩,增加血压和心血管疾病风险。
神经功能异常:5-羟色胺过高时,由于其抑制植物神经功能,使得交感神经过于兴奋,此时可导致植物神经功能发生紊乱。引起神经功能异常的表现,比如手抖、乏力、出汗、头晕、失眠、胸闷、心悸等。
与炎症性肠病有关:在对患有结肠炎的小鼠进行的研究中,观察到5-HT产量增加。随着5-HT水平的增加,固有层树突状细胞(DC)上7型血清素(5-HT7)受体的表达被激活,并触发促炎免疫反应。而抑制5-HT7受体可减轻肠道炎症。
注:5-HT4受体的激活在成人神经系统的成熟中起着重要作用,因为它调节神经元的形成并保护细胞。
▸ 血清素含量过低的危害
情绪低落、抑郁:5-羟色胺在大脑皮层及神经突触中的含量较高,是一种能产生愉悦情绪的信使。如果该物质的含量偏低,容易影响大脑活动,可能对患者的情绪造成影响,使患者处于较为低落的状态中,常伴有悲观、失落、忧愁等负面情绪。可能导致抑郁、焦虑和情绪波动等心理健康问题。
睡眠障碍:5-羟色胺是一种抑制性神经递质,如果其含量比较低,可能导致中枢神经系统持续处于较为兴奋的状态中,可能导致患者出现睡眠障碍的情况,常有入睡困难、早醒、多梦等表现。
记忆力衰退:在一定程度上,5-羟色胺通常能保护神经元,使其免受兴奋性神经毒素的影响。如果5-羟色胺的含量比较低,可能导致神经元受损,进而影响患者的记忆力。
消化问题:血清素在肠道中也扮演重要角色,过低的血清素含量可能导致消化问题,如胃肠道不适、食欲不振和胃肠道功能紊乱。
最近的一份报告表明一些神经递质可能作为肠道细菌的生长底物。高水平的血清素(5-HT)可能会降低肠壁通透性,而低水平的5-HT会降低人紧密连接蛋白(Occludin)的表达并削弱肠壁,导致通透性增加和肠漏的形成。
▸ 提高血清素水平的方法
一些精神疾病,例如抑郁症与大脑中异常的血清素水平有关。那么血清素过低时可以通过哪些方法来提高呢?
饮食调理:要想补充血清素,要多吃一些富含蛋白质的食物,如鸡蛋、坚果、瘦肉、鱼、虾等,其色氨酸含量较高,进入体内能够促进血清素的合成,升高血清素。
药物补充:血清素低一般可以在医生指导下通过口服药物辅助补充,如选择性血清素再摄取抑制剂(SSRI)、血清素-去甲肾上腺素再摄取抑制剂、三环类抗抑郁药等,可以抑制血清素再摄取,减缓血清素的分解,从而增加血清素的含量。
多晒太阳:阳光照射与血清素水平升高有关,色氨酸的光捕获对于血清素的合成有重要影响。吸收蓝光波会激发色氨酸的吲哚结构,使其失去吲哚环结构中的一个电子,从而被氧化。阳光对人类的血清素水平以及情绪、睡眠和自杀意念都有影响。
锻炼:锻炼对生理和心理健康有多种显著益处,包括提高血清素水平和对整体情绪产生积极影响。例如,一些人类研究报告称,从事有氧运动会导致大脑血清素水平增加,并且如果保持良好的运动习惯,这种增加可能会持久。
积极情绪诱导:正如低血清素水平可能会对我们的情绪产生负面影响一样,消极情绪也会导致血清素水平下降。一些证据表明,使用认知和行为策略积极诱导积极情绪可能有助于维持健康的血清素水平。血清素水平和情绪之间的这种“双向影响”可能会影响一系列身心健康问题。
使用补充剂:在体内,血清素是由5-HTP制成的,而5-HTP是由L-色氨酸制成的。因此,从理论上讲,增加这些“组成部分”(代谢前体)中的任何一个的水平都可以导致血清素总体水平的增加。
维生素D有助于身体(包括大脑)制造、释放和使用血清素。维生素D会激活一种酶,将色氨酸转化为血清素。如果维生素D水平较低,我们的大脑就会产生较少的血清素。因此,增加维生素D的摄入量可能会增加血清素水平,从而有可能支持心理健康。
▸ 血清素过高一般补充药物或补剂需注意
当人的系统中血清素过多时,就会出现血清素综合症。血清素综合征是由于药物、补充剂或草药的组合导致血清素升高至不安全水平而引起的。
最常与血清素综合征相关的抗抑郁药和抗焦虑药包括:
偏头痛药物(曲普坦类药物):曲坦类药物通常是医生为中度至重度偏头痛患者开出的第一种药物。曲普坦类药物还会激活大脑中的血清素受体,并存在发生血清素综合征的风险,特别是与阿片类药物或抗抑郁药联合使用时。
他们包括:
除此之外单胺氧化酶抑制剂、阿片类药物、丁螺环酮 (Buspar)、恶心药物、右美沙芬、迷幻剂,可卡因,以及一些草药和补品如圣约翰草、人参、姜黄、藏红花在使用时也需特别注意,可能会引起血清素综合症。
γ-氨基丁酸(GABA)是一种非蛋白氨基酸,于1950年首次在大脑中被发现,主要在中枢神经系统中发挥作用,是哺乳动物大脑中最主要的抑制性神经递质。GABA的作用是减缓神经系统的活动,帮助维持神经系统的平衡,防止过度兴奋导致的不良反应。
研究发现 , GABA具有激活脑内葡萄糖代谢、促进乙酰胆碱合成、降血氨、抗惊厥、降血压、改善脑机能、精神安定、促进生长激素分泌等多种生理功能。多项研究还证明GABA与一些神经系统疾病如
焦虑、抑郁、癫痫、自闭症谱系障碍(ASD)和注意力缺陷多动障碍存在关联。

▸ 人体肠道内的一些菌群也可以产生GABA
GABA可由多种生物体合成,包括人类、植物和细菌。在合成过程中,GABA由谷氨酸通过谷氨酸脱羧酶(GAD)产生。在人类微生物群中,几种胃肠道细菌含有编码GAD的基因,该基因负责GABA的产生。
双歧杆菌、乳酸杆菌和拟杆菌是最著名的GABA产生菌,尤其是脆弱拟杆菌(b.fragilis)。人们还描述了一种新的“吃GABA”物种,瘤胃球菌科中的Evtepia gabavorous。E.gabavorous对GABA的依赖性很明显,因为菌株只有在产生GABA的情况下才能生长。
▸ 一些微生物可以改变GABA受体的功能
已经描述了三类γ-氨基丁酸受体(GABAR),即GABAR A、GABAR B和GABAR C。GABAR B将从激素、神经递质和信息素接收到的信号转移到信号转移途径。
已知少数微生物可以改变GABAR的功能。鼠李糖乳杆菌JB-1改变大脑中GABAR的表达,从而减少焦虑和抑郁。因此,很可能某些乳酸杆菌在焦虑和抑郁的调节中起着关键作用。乳酸杆菌治疗可提高海马和前额叶皮层的GABA水平。结肠中微生物群产生的乙酸盐通过血脑屏障转移到下丘脑,并进入GABA神经胶质细胞循环途径。
▸ GABA含量过高的危害
神经系统抑制过度:GABA作为一种抑制性神经递质,过高的GABA水平可能导致神经系统抑制过度,影响神经传导和神经元活动,引发头晕、嗜睡和思维迟钝等症状。
肌无力、运动障碍:GABA可以影响肌肉的收缩和松弛,过高的GABA含量可能导致肌肉过度松弛,引起肌无力和运动障碍。
心律失常、血压下降:GABA的过高水平可能导致心血管系统的抑制,影响心脏的收缩力和心率,引起心律失常和血压下降。
情绪低落:神经系统受到GABA调节,过高的GABA含量可能导致情绪低落、注意力不集中和记忆力减退等情绪和认知问题。
呼吸困难:GABA过高可能影响呼吸中枢的功能,导致呼吸抑制,引起呼吸困难和缺氧症状。
▸GABA含量过低的危害
神经系统问题:GABA是一种重要的神经递质,含量过低可能导致神经传导异常,引发焦虑、抑郁和神经紊乱等问题。
睡眠障碍:GABA参与调节睡眠过程,GABA含量过低大脑容易兴奋,从而可能导致失眠、睡眠质量下降和睡眠障碍。
情绪不稳定:GABA也是一种帮助平静和放松的神经递质,是身体自产的一种有效的抗应激化学物质。GABA不足可能影响情绪调节功能,导致情绪波动大、易怒和情绪不稳定。
肌肉紧张:GABA参与肌肉松弛,含量过低可能导致肌肉紧张、痉挛和纤维肌痛。
▸ 调整GABA水平的方法
饮食:有些食物成分可以增加GABA水平,比如:燕麦、茶叶、核桃、香蕉、杏仁、菠菜和鱼类。还有矿物质镁,和维生素B6也可能增加GABA水平。
运动:瑜伽可以提高GABA水平,还有其他一些运动方式,也可以适当提高GABA水平。冥想的人会增加 GABA 水平,并降低皮质醇和去甲肾上腺素水平。
药物:调整体内GABA水平的药物和途径包括苯二氮䓬类药物(如苯巴比妥)和催眠药物(如扎来普隐)。此外,通过调整神经元GABA受体的活性和GABA转运体的功能也可以影响GABA水平。
草药类:
卡瓦对 GABA 的影响很复杂,因为该植物含有 6 种精神活性化合物。卡瓦主要的精神活性化合物之一是卡瓦因,在人类研究中,卡瓦改善了焦虑、失眠、抑郁、睡眠质量、认知、紧张和不安的症状
注:卡瓦与许多细胞色素酶有复杂的相互作用,这可能会影响肝脏。
厚朴在中药中被广泛应用,具有多种功效,可在动物和试管研究中,厚朴显示出抗氧化性能。还可保护大脑、心脏、肝脏,并具有抗癌和抗炎特性。
缬草中的活性成分主要存在于其根中,戊酸似乎是最有效的活性成分,戊酸通过多个 GABAA 受体亚基正向调节 GABA ,可以促进放松、减轻压力和改善睡眠。
黄芩,含有生物活性黄酮类化合物,可作为有效的抗氧化剂,不仅具有抗焦虑和抗惊厥作用,还可以改善认知、神经元再生。
柠檬香蜂草,具有复杂的药理学特征,含有许多精神活性有机化学物质,从多酚到萜烯。其中迷迭香酸是其最有效的精神活性化合物。迷迭香酸通过间接抑制将 GABA 转化为 L-谷氨酸的酶来增加 GABA 水平。
黑籽油,其提取物可改善炎症、血压和焦虑。
南非醉茄提取物与其他 GABA 正变构调节剂结合显示出协同效应,并且当 GABA 含量较低时似乎会增加 GABA 活性。
薰衣草,安全可靠地改善了焦虑和睡眠质量。
茶氨酸,可以减少心理和生理压力反应,同时改善情绪和放松,可以轻微增加大脑中的单胺水平,例如血清素、多巴胺、甘氨酸、GABA(增加约 20%)。
芹菜素,存在于许多传统使用的草药中,包括洋甘菊、小白菊、芹菜、金光菊、西番莲等。芹菜素通过其对苯二氮卓受体的活性增强 GABA 传输。它具有抗癌和抗氧化特性,甚至可以减少 tau 蛋白和β淀粉样蛋白的沉积和积累,这可能会降低患阿尔茨海默病和神经炎症的风险。它还会抑制谷氨酸家族的 NMDA 受体。
绿茶,EGCG(表没食子儿茶素没食子酸酯)是一种绿茶化合物,通过正向调节苯二氮卓受体来增加 GABA活性。
牛磺酸,一种与心脏和大脑健康有关的氨基酸,存在于许多饮食来源中,可以与 GABAA 和 GABAB 受体结合,每天摄入量少于 3 克其补充剂,不会产生副作用。
GABA 拮抗剂或“负调节剂”可阻断 GABA 的作用。
以下是可能阻断 GABA 的物质列表:
谷氨酸(Glu)是大脑中最丰富的游离氨基酸,也是大脑主要的兴奋性神经递质。在记忆存储中发挥着关键作用,它还可以帮助我们说话、处理信息、思考、运动、学习新事物和集中注意力学习等。
注:谷氨酸也是γ-氨基丁酸(GABA)的前体,这二者之间的平衡对于我们大脑健康非常重要。
谷氨酸被归类为非必需氨基酸,这意味着它可以在体内以足够的数量合成。对各种动物肠道进行仔细平衡研究的结果,结果表明膳食谷氨酸几乎在肠道内定量代谢,主要是通过肠细胞。
谷氨酸可以以两种不同的方式合成:首先,它可以通过谷氨酸脱氢酶或多种转氨酶从α-酮戊二酸合成。其次,谷氨酸可以由其他氨基酸合成;氨基酸的“谷氨酸家族”包括谷氨酰胺、精氨酸、脯氨酸和组氨酸。
▸ 谷氨酸的作用
化学信使:谷氨酸将信息从一个神经细胞传递到另一个神经细胞。作为主要的兴奋性神经递质,它向大脑和全身发送信号。它有助于认知功能、记忆、学习和其他大脑功能 。
脑细胞的能量来源:当细胞的主要能量来源葡萄糖储备低时,可以使用谷氨酸。
学习和记忆的调节:谷氨酸有助于随着时间的推移增强或减弱神经元之间的信号,以塑造学习和记忆。
疼痛传递器:较高水平的谷氨酸与增加的疼痛感有关。
影响免疫:谷氨酸受体存在于免疫细胞(T细胞、B细胞、巨噬细胞和树突状细胞)上,这表明谷氨酸在先天免疫系统和适应性免疫系统中均发挥作用。
保护肠道:谷氨酸是肠细胞的主要营养素之一。谷氨酸还可以通过帮助产生抗氧化剂谷胱甘肽来保护肠壁。一项动物研究发现,补充 L-谷氨酸有助于改善仔猪的肠道完整性,这有利于营养物质的消化和吸收。
注:谷氨酸还可以预防由于幽门螺杆菌和长期使用阿司匹林等非甾体抗炎药引起的胃肠道损伤。
睡眠和清醒的介质:大鼠模型研究表明,当我们清醒或快速眼动(REM)睡眠期间,谷氨酸水平最高。丘脑是个例外,在非快速眼动睡眠期间谷氨酸水平最高。
在过去的30年中,越来越多的研究进展还揭示了谷氨酸及其受体在神经退行性疾病疾病(阿尔茨海默氏症、肌萎缩侧索硬化症、多发性硬化症、癫痫、帕金森等)以及肠道疾病如克罗恩病和溃疡性结肠炎的病因中起核心作用。
▸ 谷氨酸含量过高的危害
谷氨酸是大脑中必不可少的(也是主要的兴奋性)神经递质。然而,谷氨酸在某些情况下会变得有害——这一过程称为谷氨酸兴奋性毒性 (GE)
由于谷氨酸是神经元的兴奋剂,过多会导致神经元过度激活并死亡,从而破坏神经元。
神经系统疾病:谷氨酸作为兴奋性毒素的作用,与多种神经退行性疾病有关,例如多发性硬化症、 阿尔茨海默病和肌萎缩性侧索硬化症。谷氨酸失调也被认为是纤维肌痛和慢性疲劳综合征的原因之一。
心理健康障碍:谷氨酸过多(或过少)也与抑郁症和精神分裂症等心理健康障碍有关。大量研究发现,在患有重度抑郁症的人中经常发现高水平的谷氨酸或过度活跃的谷氨酸受体。
偏头痛:高浓度的谷氨酸盐和偏头痛之间也有密切的联系。一项研究发现,偏头痛患者的血浆谷氨酸水平显著升高。另一项研究得出结论,GABA能药物(那些改变 GABA 作用的药物)可能有助于治疗偏头痛。
糖尿病:有一些证据表明,随着时间的推移,高水平的谷氨酸会导致1型和2型糖尿病的发生。一项研究发现,谷氨酸水平对两种类型的糖尿病中β细胞的损失都有直接和间接的影响。
▸ 谷氨酸含量过低的危害
注意力不集中:如果谷氨酸太少,我们无法对进入大脑的刺激做出快速反应,无法很好地记住事物,难以集中注意力,学习会更加困难。
情绪障碍:谷氨酸是大脑里需求量比较大的一种氨基酸,主要是参与脑内蛋白质或者是脂肪酸等的合成和代谢,过低可能影响人的精神状态,也可能诱发神经衰弱。研究人员发现,阻止大鼠吸收谷氨酸会导致类似抑郁的效果,这可能反映了快感缺失。
▸ 降低谷氨酸水平的方法
在饮食中降低:最好限制或避免使用富含谷氨酸的食物包括:酱油、硬奶酪、腌肉、谷物(尤其是含有麸质的)、骨汤,快餐、方便面、沙拉酱等。
PPAR -γ激活剂:PPAR -γ激活剂可能是对抗GE(谷氨酸兴奋性毒性)的最佳方法之一。许多食物和草药具有降低谷氨酸兴奋性毒性的能力。例如:黄芪、绿茶、紫锥菊、棕榈油、大豆、厚朴、奶蓟草、甘草、牛至、百里香油、高丽参、姜黄素、黑籽油、槲皮素 。
补充维生素:维生素B6有助于减少谷氨酸过量,因为参与将谷氨酸转化为GABA。维生素B6缺乏可能是谷氨酸过量积累并且不能正确转化为 GABA 的一个原因。辅酶Q10-也可以改善谷氨酸兴奋性毒性、线粒体功能和氧化应激 。
▸ 提高谷氨酸水平的方法
运动:锻炼的参与者的谷氨酸或GABA水平增加。即使在停止运动后效果仍然存在,这表明谷氨酸水平会随着运动而发生更持久的变化。
饮食:天然高谷氨酸食物包括:发酵、陈化、腌制、压力烹制的食品。其中包括:陈年奶酪、慢煮肉类和家禽、蛋、酱油、大豆蛋白、鱼露,某些蔬菜,如蘑菇、成熟的西红柿、西兰花和豌豆、核桃、大麦麦芽。
补充剂:身体将谷氨酰胺转化为谷氨酸。谷氨酰胺可以作为补充剂使用,也可以在肉类、鱼类、鸡蛋、奶制品、小麦和一些蔬菜中找到。
扩展阅读:
作为耳熟能详的一种神经递质,你真的了解多巴胺的全部作用以及利与弊吗?下面由谷禾带你一起了解下。
多巴胺(DA)主要在黑质、腹侧被盖区和下丘脑中产生,并释放到大脑的伏隔核和前额皮质中。它通常被称为奖励神经递质,在认知、奖励、饱腹感、运动、愉悦和动机等重要功能中发挥着重要的外周和中枢作用,影响睡眠、情绪、注意力、工作记忆和学习等。
▸ 肠道微生物群能够影响多巴胺的代谢
肠道微生物群是肠道和中枢神经系统中多巴胺生物利用度的主要贡献者。一些肠道微生物已被证明对多巴胺能神经元发挥神经保护作用,以减少多巴胺损失。另一方面,其他微生物可以通过内毒素刺激炎症反应,进一步降低多巴胺浓度,从而产生负面影响。
帕金森病肠道中的有益微生物群往往会减少,而诱发病理过程的微生物水平则会升高。
左旋多巴是多巴胺的天然前体,外周给药时可穿过血脑屏障,增加大脑中多巴胺的水平。然而,肠道微生物代谢的左旋多巴会降低其利用率,而外周产生的多巴胺会导致不良副作用。
将来,肠道微生物群的筛查或肠道微生物群的绘图可能对于选择用于精神治疗的药物变得重要。随着测序、克隆、基因操作、病毒(包括噬菌体)靶向、成像技术的最新进展,这将成为可能。
▸ 多巴胺的作用
调节情绪、影响认知:多巴胺参与调节情绪和情感反应,特别是与愉悦和奖赏感有关。多巴胺水平的变化可以影响人的情绪状态,使人感到快乐、满足或兴奋。
多巴胺还可以影响认知功能,包括记忆、学习、决策和注意力等。它促进神经元之间的连接和信息传递,有助于提高认知能力。
影响躯体运动:多巴胺是锥体系统中的重要递质,与躯体运动功能有密切关系。多巴胺在大脑基底神经元中起着关键作用,参与调节运动控制和协调。多巴胺的不足会导致运动障碍,如帕金森病。
调节体内激素水平:多巴胺也参与调节内分泌系统的功能,影响激素的分泌和调节身体的代谢。它与垂体前叶的调节密切相关,影响生长激素、泌乳素等激素的分泌。多巴胺还通过负反馈机制调节腺垂体激素的合成和释放,维持体内激素水平的稳定。
调节心血管活动:多巴胺的作用可以导致心率的增加,这是由于多巴胺通过激活β1-肾上腺素能受体增加心脏的兴奋性和传导速度,从而加快心率。然而,在高剂量下,多巴胺也可以通过抑制交感神经系统来降低心率。
多巴胺还通过激活β2-肾上腺素能受体来引起血管舒张,特别是在冠状动脉和周围血管中。这种血管扩张的作用有助于降低外周阻力,减少心脏的负担。
影响胃肠道功能:多巴胺在胃肠道系统中也扮演着重要的角色,调节胃酸、胃蛋白酶、胰腺碱性物和酶的分泌,影响十二指肠溃疡的病理演变。当中枢多巴胺功能缺损时易出现溃疡症,如帕金森病患者常患有溃疡症。而多巴胺功能亢进的精神分裂症患者很少有溃疡症。
多巴胺还可以影响胃肠道的消化和吸收功能。它可以调节肠道的血流和肠道蠕动,促进营养物质的吸收和利用。
与成瘾性相关:多巴胺与大脑中的奖赏系统密切相关。当个体接触到有奖赏性的刺激时,多巴胺会被释放,产生愉悦感和满足感。这种奖赏性体验会强化行为,促使个体不断追求这种奖赏。脑内奖赏效应可能是产生精神依赖性和强迫性觅药行为的主要原因。
▸ 多巴胺含量过高的危害
多巴胺过高可能会导致一系列健康问题和危害,包括但不限于:
情绪不稳定:多巴胺有兴奋的作用,含量过高会使得患者脾气暴躁,情绪波动过大,容易生气,对外界也过于敏感。可能导致焦虑、紧张和不安情绪,影响个体的心理健康。
血压、心律失常:多巴胺过多使得神经过度兴奋,出现血压增高,同时伴有头晕、头痛、阵发性颜面潮红以及恶心、呕吐等高血压的表现。还引起患者心率增快,心率增快可引起窦性心动过速,甚至引起心律失常的情况发生。
睡眠问题:多巴胺过高可能干扰睡眠,导致失眠或睡眠质量下降。使睡眠不深、易醒、睡眠中断等现象更为频繁,以及睡眠中的惊醒、噩梦等情况。
可能引起一些精神疾病:多巴胺过高与精神疾病之间存在密切的关系,特别是在以下几种精神疾病中:精神分裂症、躁郁症、药物成瘾、帕金森病。总的来说,多巴胺过高与多种精神疾病之间存在复杂的相互作用关系,多巴胺系统的异常可能是某些精神疾病发病机制的重要因素之一。
▸ 多巴胺含量过低的危害
抑郁和情绪低落:多巴胺是调节情绪的神经递质之一,多巴胺不足会影响大脑中与情绪调节相关的区域,导致情绪不稳定、抑郁和情绪低落等问题。
帕金森病:缺乏多巴胺会导致帕金森病,患者可出现静止性震颤、肌肉强直、运动迟缓,以及尿频、便秘、体位性低血压、不安腿综合征等症状,多巴胺严重缺乏时患者可出现全身肌肉僵硬、生活不能自理等。
精神疾病风险增加:多巴胺与精神疾病如精神分裂症等有关,多巴胺含量过低可能增加患上精神疾病的风险。
▸ 提高多巴胺水平的方法
饮食:在饮食方面有一些食物可以促进多巴胺的分泌,应该多吃富含酪氨酸的食物来促进多巴胺的分泌,建议患者多吃香蕉、橘子,以及巧克力等等这样的食物来促进多巴胺分泌。
体育锻炼:想要促进多巴胺的分泌,也可以通过参加体育锻炼来达到这样的目的。因为人在体育锻炼的时候血压升高、心率增快,这种情况会促进多巴胺分泌。
保持心情愉悦:观看有趣的事物、听音乐会提高身体的快感和愉悦感,可以刺激多巴胺的释放。
增加多巴胺的药物:增加多巴胺的药主要左旋多巴、普拉克索,另外还要配合抗胆碱药物金刚烷胺等药治疗。
多晒太阳:当皮肤暴露于阳光下时,身体会产生维生素D,同时也会促进多巴胺的释放。
▸ 降低多巴胺水平的方法
服用药物:多巴胺是一种神经递质,当多巴胺分泌过多时,会导致精神兴奋。患者可以在医生的指导下服用抗精神病药物进行治疗,如利培酮片、奥氮平片等,可以有效改善症状。
调整饮食结构:食用含色氨酸的食物可增加多巴胺分泌,减少摄入可降低多巴胺分泌。
心理调整:如果精神过于紧张或兴奋,多巴胺分泌会增多,建议及时调整心态,通过心理治疗、暗示治疗等方式来缓解情绪,从而能使多巴胺迅速下降。
组胺是人体内的一种生物胺,最为熟知的作用是作为过敏反应的介质,但也是神经系统、肠道、皮肤和免疫系统中重要的信号分子。
组胺还是肠道稳态的重要调节剂。通过增强分泌和蠕动,组胺促进潜在有毒物质的快速清除。这种生物胺对于肠道细菌的生存也至关重要。与健康个体相比,组胺不耐受患者的肠道菌群失衡或失调。
组胺主要由肥大细胞和嗜碱性粒细胞等免疫细胞产生和释放。一些细胞如树突状细胞或T细胞可以表达组氨酸脱羧酶,这是一种在刺激后合成组胺的酶。
尽管如此,一些食物中的微生物群和部分人体肠道微生物群也可以分泌组胺。
产生组胺的细菌包括乳杆菌属、乳酸乳球菌(Lactococcus lactis)、酒类酒球菌(Oenococcus oeni)、小片球菌、嗜热链球菌、摩根氏菌、肺炎克雷伯菌、肠杆菌属、弗氏柠檬酸杆菌和哈夫尼菌属(Hafnia alvei)。
▸ 组胺的作用
信号传导:在中枢神经系统中,组胺作为一种神经递质,参与睡眠调节和体温调节等生理过程。组胺对感觉神经末梢有强烈的刺激作用,尤其对调节痛和痒的神经,该效应由H1受体所调节。
除此之外,有研究发现组胺还会影响伤口愈合、食欲和情绪等方面。
介导过敏反应:当免疫系统对过敏原产生过度反应时,免疫细胞(如肥大细胞和嗜酸性粒细胞)会释放存储在细胞内的组胺。释放的组胺会结合到特定的受体上,引发一系列生理反应,例如瘙痒、肿胀、打喷嚏等。
扩张血管,影响血压:组胺对人心血管系统最突出的作用是扩张小血管。血管扩张使外周阻力降低,血压下降,并伴有潮红、头痛等症状。
组胺还增加毛细血管的通透性,使渗出增加,引起水肿,严重时甚至导致循环血量减少,可能引起休克。组胺对心脏的直接作用包括增强心肌收缩力、加快心率和减慢房室传导。
刺激胃酸分泌:首先,组胺可以刺激胃黏膜细胞中的H2受体,当组胺与H2受体结合时,会激活细胞内的信号转导通路,导致胃壁上的壁细胞释放胃酸。
其次,组胺还可以通过刺激嗜酸性细胞(胃窦细胞)来促进胃酸的分泌。嗜酸性细胞是胃黏膜中的一种细胞类型,它们包含大量的组胺。当胃黏膜受到刺激时,嗜酸性细胞会释放存储的组胺。释放的组胺通过与H2受体结合,刺激壁细胞分泌胃酸。
影响排便:一项研究中,发现细菌产生的组胺与小鼠结肠运动和粪便排出量增加有关,并且组胺受体拮抗剂治疗在很大程度上阻断了细菌组胺对结肠运动的影响。
收缩平滑肌:此外,组胺会诱导平滑肌细胞(包括支气管和肠道)收缩,哮喘患者对组胺比正常人敏感100~1000倍,组胺可引起支气管痉挛导致呼吸困难。组胺收缩胃肠平滑肌和子宫平滑肌还会引起痉挛性腹痛。
▸ 组胺含量过高的危害
组胺中毒:在健康人体内,会因摄入组胺含量高的食物(例如鲭鱼)导致血液中组胺浓度升高而出现严重症状——组胺中毒。
组胺中毒症状多种多样,可能包括口腔麻木、头痛、头晕、心悸、低血压、吞咽困难、脉搏微弱、荨麻疹、面部肿胀、潮红、呕吐、恶心和腹泻等。
组胺中毒的症状可能持续数小时或一天,但在极少数情况下,症状可能会持续数天。
过敏反应:组胺是一种重要的组织胺,过高的组胺浓度可能引发过敏反应,包括皮肤瘙痒、荨麻疹、呼吸困难等症状。
胃肠道反应:组胺过高可能引起胃肠道症状,如胃灼热、胃痛、腹泻和恶心和消化不良等问题。
肠道肥大细胞过度增生和过度活跃,使组胺浓度较高,还会导致粘膜炎症性疾病,产生腹泻和腹痛。
皮肤和呼吸道症状:组胺过高可能导致皮肤血管扩张和炎症反应,引发红肿、瘙痒和刺痛等皮肤问题。
除此之外,还会引起呼吸道症状,如喉咙发痒、喉咙肿胀、咳嗽和哮喘等呼吸系统问题。
▸ 降低谷氨酸水平的方法
低组胺饮食:组胺过高的基础是基于低组胺含量食物的消除饮食。一般来说,公认的饮食指南尚未制定;但是,建议避免食用富含组胺的食物如奶酪、油性鱼类和贝类,以及生发酵肉制品、腌菜、发酵豆制品、葡萄酒和啤酒、鸡蛋、巧克力和蘑菇。
此外,应避免食用会刺激内源性组胺释放的蔬菜和水果(如菠菜、西红柿、柑橘类水果、草莓、茄子、鳄梨、木瓜、香蕉、猕猴桃、菠萝和李子)。
施用抗组胺药物:纠正组胺不耐受的药物方案基于使用组胺受体阻滞剂、肥大细胞膜稳定剂和其他具有抗组胺活性的药物。在这方面,H1R拮抗剂是最有效的,特别是依巴斯汀。每天服用20毫克该药物,持续12周,46%的患者出现临床缓解。
补充生物活性物质:维生素C被用作纠正组胺不耐受的佐剂。每日剂量300-500毫克可增强组胺降解并抑制肥大细胞脱颗粒。
天然类黄酮(非瑟酮、山奈酚、槲皮素、芦丁和木犀草素)和活性生物碱小檗碱在体外抑制肥大细胞脱颗粒。这些都有助于减轻组胺不耐受。
▸ 组胺含量过低的危害
虽然组胺含量过低的情况相对较少见,但也可能会对身体产生一些影响,包括:
伤口愈合缓慢:组胺在人体中起着重要的调节作用,其能够帮助调节纤维细胞生长因子的生成,该成分可以加速局部肉芽的生长,帮助促进伤口的愈合。因此组胺含量较低时,伤口愈合能力也会减弱,速度会随之减慢。
消化不良:组胺可以通过刺激胃部,进而起到促进胃酸分泌的效果。若身体中没有组胺,则会导致胃酸减少,无法有效消化分解食物,进而引起消化不良的问题。
情绪问题:组胺还可以作为神经递质帮助调节中枢神经系统,而一旦没有组胺或缺少组胺,则会影响中枢神经系统稳定性,引起睡眠异常、激素水平紊乱等情况,进而导致情绪不良、抑郁和焦虑等心理问题。
血管扩张问题:组胺在血管平滑肌收缩和扩张中起到调节作用。组胺含量过低可能导致血管扩张不足,影响血液循环和血压调节。
免疫力下降:组胺对免疫细胞,如吞噬细胞、T细胞、B细胞等,起到增强活性的功效,因此组胺还具有增强免疫功能的作用。若人体缺少该物质,则人体免疫力会下降,无法有效抵抗细菌、真菌等有害物质的侵入。
扩展阅读:

一氧化氮(NO)是一种无色气体,是一种半衰期很短(平均5s后即失活)的神经递质。在人体内扮演着重要的生物学角色,一氧化氮具有以下作用:
▸ 一氧化氮的作用
神经信号传递:一氧化氮与传统的神经递质不同,它不是在突触前膜释放后通过突触间隙传递信号,而是可以直接穿透细胞膜,影响邻近的细胞。这种特性使得NO可以快速地在神经元之间传递信号,参与短期和长期的神经调节过程。
记忆和学习:一氧化氮在大脑的学习和记忆形成过程中发挥关键作用。研究表明,NO参与调节长时程增强(LTP)的过程,这是一种与学习和记忆形成密切相关的神经突触强化机制。
血管扩张:虽然这不是直接作为神经递质的功能,但一氧化氮在调节血管舒张中的作用也影响到大脑的功能。NO可以促进血管扩张,从而增加血流量,改善大脑的血液供应。这对于维持大脑健康和功能至关重要。
神经保护作用:一氧化氮在一定条件下可以发挥神经保护作用,帮助减轻神经损伤和促进神经修复。然而,NO的过量产生也可能导致神经毒性,因此其在神经保护中的作用是把双刃剑。
疼痛调节:一氧化氮在调节疼痛感知中也起着作用。它参与了疼痛信号的传递过程,可能通过调节疼痛相关神经递质的释放来影响疼痛感知。
提高运动表现:一氧化氮通过增强流向肌肉的血液、增加氧气和营养物质的输送以及减少运动过程中代谢废物的积累来提高运动表现。这可以提高耐力、力量和恢复时间。
▸ 一氧化氮含量过高的危害
一氧化氮(NO)作为一种神经递质,在适量情况下对人体具有重要的调节作用。然而,一氧化氮含量过高可能会对人体产生一些不良影响。
神经毒性:过高的一氧化氮含量可能对神经系统产生毒性作用,损害神经元的结构和功能,导致神经元凋亡和神经退行性疾病的发生。
过高的一氧化氮含量还可能干扰神经元之间的正常传导,影响神经信号的传递和神经网络的功能,导致神经系统失调和功能障碍。
氧化应激:过高的一氧化氮含量可能导致氧化应激反应的增加,引发细胞损伤和炎症反应,加速细胞老化和疾病的发展。
血管扩张过度:一氧化氮是一种强效的血管舒张因子,过高的一氧化氮含量可能导致血管扩张过度,造成血压下降和循环血容量不足,甚至引发休克。
免疫抑制:过高的一氧化氮含量可能抑制免疫系统的正常功能,降低机体对抗病原体的能力,增加感染和疾病的风险。
▸ 降低一氧化氮水平的方法
一氧化氮测定值过高,需要根据引起的原因进行处理,多考虑是慢性支气管炎引起的,但也不排除是支气管哮喘、阻塞性睡眠呼吸暂停低通气综合征等疾病导致的。
慢性支气管炎:多考虑是细菌感染引起的,但也不排除是长期吸烟或吸入有害的物质导致的,进而会导致气管、支气管黏膜等组织出现慢性非特异性炎症的情况,在临床通常会出现气促等症状。建议患者在医生的指导下服用盐酸溴己新片、硫酸沙丁胺醇片等药物治疗。
支气管哮喘:多考虑是遗传因素引起的,但也不排除是环境因素导致的,进而会出现气道慢性炎症的情况,在临床通常会出现呼吸急促等症状。建议患者在医生的指导下使用硫酸特布他林气雾剂、布地奈德气雾剂等药物治疗,必要时通过支气管热成形手术等方式缓解。
改善生活方式:降低体内一氧化氮水平的措施和药物包括改变饮食习惯、减少摄入高脂肪食物、增加运动量、避免暴饮暴食等。药物方面可以使用一氧化氮合成酶抑制剂或其他降低一氧化氮水平的药物。
▸ 一氧化氮含量过低的危害
神经传导障碍:一氧化氮作为神经递质在神经元之间传递信号,调节神经传导。一氧化氮含量过低可能导致神经传导障碍,影响神经网络的功能和神经元的正常活动。
情绪和认知问题:一氧化氮参与调节情绪和认知功能,影响大脑的神经传导。一氧化氮含量过低可能导致情绪波动、注意力不集中和认知功能下降。
勃起功能障碍: 有研究表明,NO是阴茎神经元(自主神经支配海绵体并穿透腺海绵体组织)和阴茎血管外膜层神经网络中勃起功能的生理促进剂。而一氧化氮含量过低可能会引起男性性功能障碍,使阴茎无法勃起。
炎症反应增加:一氧化氮在炎症过程中发挥重要作用,可以调节炎症反应和免疫反应。一氧化氮含量过低可能导致炎症反应增加,影响炎症的调节和细胞修复过程。
▸ 提高一氧化氮水平的方法
补充L-精氨酸或者L-胍氨酸:补充NO的途径第一种办法,最直接的方法是增加NO合酶原料L-精氨酸或者L-胍氨酸。大部分蛋白质都含有这两种氨基酸,比如,鱼类、瘦肉、牛羊肉、鸡鸭、蛋类、鱼虾、豆制品、坚果类、巧克力、芝麻、核桃、乳制品等。

适当运动:运动可以调节机体血管内一氧化氮合成酶,使其合成酶含量增加,可以较多地产生一氧化氮,并且运动时由于血液循环加速,也可使其辅助产生一氧化氮,达到较好的补充作用。
补充硝酸盐和亚硝酸盐:亚硝酸盐还原酶在生理条件下发挥功能,催化硝酸盐和亚硝酸盐生成NO增加。补充硝酸盐和亚硝酸盐最容易的是食用水果和蔬菜,其中含有大量硝酸盐和亚硝酸盐,在体内就可以转化为NO。而且我们平常吃的新鲜蔬菜和水果都含有大量天然抗氧化剂,可以防止补充硝酸盐和亚硝酸盐产生亚硝胺。例如茶叶和巧克力中的多酚类,葡萄里的白藜芦醇和原花青素,胡萝卜里的胡萝卜素,番茄里的番茄红素,核桃油和胡麻油中Ω3等。
除了神经递质,肠道菌群代谢物在人体健康中也扮演着重要角色。肠道菌群代谢物是由肠道微生物产生的化合物,可以影响人体的免疫系统、新陈代谢和神经系统等。

研究表明,肠道菌群代谢物与多种疾病的发展密切相关,包括肥胖、糖尿病和炎症性肠病。因此,了解和维护良好的肠道菌群代谢物平衡对于维持人体健康至关重要。
短链脂肪酸(SCFAs)是一类由1~6个碳原子组成的有机脂肪酸,主要包括乙酸、丙酸和丁酸,结肠是其主要产生部位,多由未消化吸收的碳水化合物经结肠内厌氧菌酵解产生。
在结肠中存在的总短链脂肪酸中,健康人体内的90%-95%是乙酸盐、丙酸盐和丁酸盐。
短链脂肪酸主要由双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)、毛螺菌科(Lachnospiraceae)、经黏液真杆菌属(Blautia)、粪球菌属(Coprococcus)、罗氏菌属(Roseburia)和粪杆菌属(Faecalibacterium)在结肠中产生,并为结肠上皮细胞提供能量。
这些短链脂肪酸粘附于游离脂肪酸受体(FFAR),例如位于肠上皮细胞表面的GPR43(FFAR2)和GPR41(FFAR3)。
• 降低肠道pH,减少有害菌生长
短链脂肪酸的存在会使回肠(小肠末端)到盲肠(大肠起点)的肠道pH值降低,从而防止有害细菌(如肠杆菌科和梭状芽胞杆菌)过度生长。
• 防止肠漏,保护肠道健康
短链脂肪酸有助于修复“肠漏”,通过增加粘蛋白2(MUC-2)的分泌来加强肠壁,丁酸盐通过上调紧密连接蛋白claudin-1来保护肠道屏障功能从而防止脂多糖穿过屏障。
患有炎症性肠病的个体粪便短链脂肪酸水平较低,伴随着厚壁菌门和拟杆菌门的减少。
• 为结肠细胞提供能量
丁酸盐是结肠细胞的主要能量来源,结肠细胞是构成肠道内壁的细胞。与身体中使用糖(葡萄糖)作为主要能量来源的大多数其他细胞不同,肠道内壁细胞(结肠细胞)主要使用丁酸盐。如果没有丁酸盐,这些细胞就无法正确执行其功能。
• 抗炎、抗癌特性
丁酸盐也是一种组蛋白脱乙酰酶抑制剂(HDAC抑制剂),通过诱导细胞凋亡(细胞自然死亡)来帮助预防结肠癌及癌症并发症,并在上皮细胞的氧消耗中发挥重要作用,氧气的平衡状态可以防止生态失调。
丁酸盐的抗炎特性,部分原因是其抑制核转录因子(NF-κB)的激活,通过下调NF-κB信号通路,丁酸盐可以调节促炎细胞因子的产生。
• 影响宿主食欲,调节体重
乙酸盐通过刺激生长素释放肽的分泌来降低食欲。与此相一致的是,丙酸盐喂养会诱导脑干、下丘脑和脊髓的背侧迷走神经复合体中FOS(fos原癌基因,AP-1 转录因子亚基)的表达,这引发了一个问题,即短链脂肪酸诱导的外周感觉神经元活动的刺激是否可以介导对宿主饮食行为的影响。
• 短链脂肪酸的其他生理功能
短链脂肪酸调节体内的其他几种生理功能,例如中枢神经系统中小胶质细胞的成熟和功能,血清素、GABA和多巴胺产生的信号向神经元的传输,以及结肠中阴离子的分泌。后者是由于刺激结肠中的烟碱类Ach受体,导致Ach产生增加,并刺激杯状细胞分泌更多粘液。
在免疫细胞中,短链脂肪酸调节T细胞的分化。在肠内分泌细胞中,短链脂肪酸刺激肠道激素的释放。胆汁盐与短链脂肪酸结合,在肠肝循环中发挥着不可或缺的作用,在神经元通路和中枢神经系统信号传导的调节中同样重要。
肠道微生物群产生的短链脂肪酸通过血管转运至大脑,调节神经元、小胶质细胞和星形胶质细胞的功能,并影响血脑屏障。
微生物产生的短链脂肪酸在微生物群-肠-脑轴通讯、保护肠道屏障和炎症反应中发挥着关键作用。特别需要注意的是,过量的短链脂肪酸和缺乏短链脂肪酸对人体健康都是不利的。例如丁酸并不总是越多越好,低浓度丁酸促进细胞增殖和生长,高浓度丁酸反而抑制细胞增殖和生长,增加肠道的通透性。

▸ 调整短链脂肪酸水平的方法
补充直接含有短链脂肪酸的食物:主要来源是乳制品,黄油等,其中含有丁酸盐。例如,黄油大约含有3%至4%的丁酸。这听起来可能不多,但它比大多数其他食物都多。
通过菌群调节增加短链脂肪酸的食物:吃大量富含纤维和抗性淀粉类的食物,例如水果、蔬菜和豆类,与短链脂肪酸的增加有关。
以下类型的食物最适合在结肠中产生短链脂肪酸:菊粉、低聚果糖、抗性淀粉、果胶、阿拉伯木聚糖、阿拉伯半乳聚糖。
扩展阅读:
脂多糖是革兰氏阴性细菌细胞壁外壁的组成成分,是由脂质和多糖构成的物质(糖脂质)。
脂多糖是一种内毒素(Endotoxin),当其作用于人类或动物等其他生物细胞时,就会表现出多种的生物活性。脂多糖的生理作用主要是通过存在于宿主细胞的细胞膜表面的Toll样受体(TLR4)而体现的。
▸ 脂多糖含量过高的危害
然而,高浓度的脂多糖在人体内可能会引发一系列潜在危害和不良影响。
引发炎症:在血液中,脂多糖与单核细胞、树突细胞、巨噬细胞和B细胞(这些都是白细胞)结合,并引导它们产生转录因子NF-κB和AP-1。然后,这些转录因子,刺激炎症细胞因子TNF-a、IL-1b、IL-6的产生。
脂多糖还可以增加一氧化氮,超氧化物(一种自由基)和类二十烷酸(增加炎症的脂肪分解产物,如PGE2)的产生。
内毒素作用:脂多糖中的脂蛋白部分即内毒素,具有毒性作用,如果血液中的脂多糖水平过高,还会引发脓毒血症,这是一种致命的毒素反应,可造成发热、组织功能损伤、器官衰竭甚至死亡。
因此,要注意控制脂多糖含量,避免过高的脂多糖摄入,保持身体的免疫平衡和健康状态,有助于预防上述危害的发生。及时监测和调节脂多糖水平,是维护身体健康的重要措施。
▸ 降低脂多糖水平的方法
首先,低密度脂蛋白胆固醇LDL可以和他结合,通过新的表位来降低脂多糖。
其次,研究显示,在小鼠中,益生菌双歧杆菌,可以通过改善肠道屏障功能,来降低LPS水平。即补充益生元和益生菌,有助于矫正肠道菌群失衡。最常用的益生菌,乳酸杆菌属和双歧杆菌属,是革兰氏阳性菌,因此不含LPS。
最后,许多植物营养素,如槲皮素和小檗碱,都通过作用于肠壁的紧密连接,来抑制肠道对内毒素的吸收。乙酰胆碱刺激迷走神经,可降低巨噬细胞中炎症细胞因子(TNF-a、IL-6等)的释放。
除此之外,Omega-3脂肪酸和乳铁蛋白,也有助于降低LPS的产生,适当的运动也是有益的。
在肠道中,结合的初级胆汁酸受微生物群作用并转化为次级胆汁酸,从而进一步增加胆汁酸库的多样性和整体疏水性。
主要通过胆汁酸水解酶进行的微生物去结合是肠道环境中微生物进一步修饰胆汁酸的关键一步。
胆汁酸水解酶编码基因已在各种肠道微生物中检测到并表征,包括双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)、肠球菌(Enterococcus)、梭菌(Clostridium)、拟杆菌(Bacteroides)等。
▸ 次级胆汁酸的作用
影响脂肪、胆固醇的消化吸收:次级胆汁酸在肠道中有助于脂肪的消化和吸收。它们可以促进脂肪乳化和吸收,帮助机体获取必要的营养。
次级胆汁酸还在胆固醇代谢中起着重要作用。它们参与胆固醇的代谢和排泄,有助于维持胆固醇的平衡。
影响肠道菌群的结构、多样性:胆汁酸是微生物群丰度、多样性和代谢活性的重要决定因素。在人体中,牛磺-β-鼠胆酸和牛磺酸胆酸对多种微生物的发展至关重要。
研究发现小鼠肠道微生物群落过度增殖和细菌易位,通过使用口服胆汁酸,以诱导法尼醇X受体激活,从而抑制细菌过度生长。
肠道微生物群和胆汁酸之间存在双向相互作用。肠道微生物群可以调节胆汁酸的合成和代谢,相反,胆汁酸可以改变肠道菌群的组成。
调节肝胆功能:次级胆汁酸可以影响胆囊的收缩和胆汁的排放,调节胆囊功能,维持胆汁的正常分泌和排泄。
次级胆汁酸还有助于肝脏代谢废物及药物,还可以刺激肝细胞的再生,有利于肝脏功能的恢复。
影响肠道屏障功能、调节免疫:微生物群和胆汁酸之间的相互作用会影响肠道屏障功能的维持,调节先天免疫和适应性免疫,并调节定植抵抗力。
胆汁酸也限制炎症小体的激活。FXR和SHP通过与NLRP3炎症小体和胱天蛋白酶-1的物理相互作用来抑制炎症小体的组装,而TGR5环磷酸腺苷(cAMP)途径的激活通过诱导其泛素化来阻断NLRP3炎性小体的激活,这最终限制了白细胞介素-1β和白细胞介素-18的产生。
▸ 次级胆汁酸含量过高的危害
胆汁反流:次级胆汁酸过高可能导致胆汁反流,即胆汁逆流到胃或食管中,引起胃灼热、食管炎等消化道问题。
胆囊结石、肝脏损伤:过高的次级胆汁酸水平可能导致胆囊内胆固醇结晶形成,增加胆囊结石的风险,引起胆囊疾病和疼痛。
过量的次级胆汁酸可能对肝脏产生负担,导致肝脏功能异常,容易形成肝硬化,还可能会导致肝炎的出现。
消化问题:高水平的次级胆汁酸可能干扰消化系统的正常功能,导致消化不良、腹泻等问题。
免疫系统异常:异常的次级胆汁酸水平可能影响免疫系统的平衡,导致免疫功能异常,增加感染和疾病的风险。
▸ 降低次级胆汁酸水平的方法
饮食调整:胆汁酸高的患者在饮食上应注意清淡,减少摄入高胆固醇、高脂肪食物和辛辣的食物,以减少胆汁酸的产生。增加膳食纤维摄入,有助于降低次级胆汁酸的含量。
药物治疗:医生可能会考虑使用胆汁酸螯合剂来帮助降低体内次级胆汁酸的含量。这些药物可以帮助排出多余的胆汁酸,从而减少其在体内的积累。
控制体重:肥胖会增加肝脏负担,导致脂肪肝等肝病,进而影响胆汁酸的代谢。通过合理饮食和适度运动,保持健康的体重,一定程度上可以达到降低总胆汁酸的效果。
治疗原发病:某些肝脏疾病,如肝炎、肝硬化等,可能会导致总胆汁酸升高。建议在医生指导下积极治疗原发病,如服用复方甘草酸苷片、消炎利胆片等药物,可以降低总胆汁酸。
▸ 次级胆汁酸含量过低的危害
消化问题、营养不良:次级胆汁酸的不足可能导致脂肪的消化和吸收受阻,影响脂肪和脂溶性维生素的吸收,可能导致营养不良。
增加脂肪肝风险:次级胆汁酸不足可能影响胆固醇的代谢和排泄,导致胆固醇积聚在体内,增加动脉粥样硬化等心血管疾病的风险。
次级胆汁酸不足还会增加脂肪肝的风险,影响肝脏功能和健康。
胆汁淤积:次级胆汁酸含量过少时,可能影响胆汁的流动性和排泄功能,导致胆汁在胆道中积聚和凝结,从而增加胆汁淤积的风险。
此外,次级胆汁酸的不足也可能影响胆汁的化学成分和性质,使其更容易形成胆固醇结晶或胆结石,进一步加剧胆汁淤积的情况。
▸ 提高次级胆汁酸水平的方法
饮食调整:增加摄入富含胆汁酸的食物,如动物肝脏、蛋黄、牛奶和奶制品等。此外,适量摄入脂肪和胆固醇也有助于促进胆汁酸的合成。
药物治疗:医生可能会考虑使用胆汁酸补充剂来增加体内次级胆汁酸的含量。包括亮菌甲素(胆汁分泌促进剂)、去氢胆酸、抑氨酚、利胆醇(苯丙醇)、鹅去氧胆酸、胆宁等等。这些补充剂可以帮助增加胆汁酸的合成和释放,从而提高其含量。
营养补充:一些营养素如维生素B12和叶酸被认为对胆汁酸的合成有益,可以通过补充来帮助提高次级胆汁酸的含量。
适当运动:适量的体育锻炼有助于促进胆汁分泌。有氧运动,如快走、跑步、跳舞,能够提高胆囊收缩力和肠蠕动,促进胆汁分泌与排泄。
扩展阅读:
对甲酚(p-Cresol)是人体肠道菌群的代谢产物之一,可由肠道中的一些厌氧菌代谢食物中的特定化合物如酪氨酸产生。因分子量极小极易通过肠道屏障和血脑屏障。
目前人类肠道菌群中至少有55种细菌可以产生“对甲酚”,包括双歧杆菌科、肠杆菌科、Coriobacteriae、拟杆菌科、梭杆菌科、乳杆菌科和梭状芽孢杆菌科等。
▸ 对甲酚含量过高的危害
虽然对甲酚是人体肠道菌群的代谢产物,但过多的对甲酚在肠道内积聚可能对人体健康产生不利影响。
可能导致孤独症:目前已在孤独症患者的血、尿、粪便样本中发现对甲酚和对乙酚水平明显异常升高,并发现孤独症患者的重复刻板行为、交流与认知障碍症状的加重与尿液中对甲酚升高密切相关。
器官损伤:对甲酚在一定浓度下可能对肠道黏膜有刺激作用,影响肠道的正常功能。此外,高浓度的对甲酚也可能对肾脏和其他器官产生毒性影响。
神经损伤:对甲酚极易穿过血脑屏障,过量的对甲酚可能对中枢神经系统产生影响,引起头晕、头痛、恶心、呕吐等神经系统症状。长期暴露还可能导致神经系统损伤和功能障碍。
其他问题:过量的甲酚还会导致便秘,以及可能对呼吸系统、循环系统、免疫系统等产生影响,引起呼吸困难、心血管问题、免疫功能异常等。
一些研究表明,高浓度的甲酚还可能对人体具有致癌作用,增加患结直肠癌的风险。
▸ 降低对甲酚水平的方法
增加膳食纤维摄入有助于促进肠道蠕动,减少有害代谢产物的积累,摄入益生菌和益生元可以减少有害菌的生长,降低对甲酚的产生。适量摄入蛋白质,避免过度摄入。此外过度加热食物可能会破坏其中营养成分增加有害代谢物产生。
内源性吲哚及其衍生物是来源于肠道菌群的色氨酸代谢物,具有一系列生物活性。
吲哚衍生物可以影响胃肠道的蠕动,会影响便秘或腹泻等状况;吲哚及其衍生物已被证明可以加强肠道屏障功能,有助于防止病原体和有害物质进入血液。
最近的研究表明,吲哚主要通过激活AhR和PXR受体来发挥抗炎活性,从而影响免疫系统的功能,显著改善肠道健康(炎症性肠病、出血性结肠炎、癌症结直肠癌),并进一步促进人类健康(糖尿病、中枢系统炎症和血管调节)。
吲哚在人体内可以作为一种信号分子,参与调节细胞生长、分化和凋亡等生物学过程。吲哚还可能对神经系统产生影响,包括调节神经传导、神经元活性和神经递质释放等。吲哚在神经系统中的作用与情绪调节、认知功能等有关。
吲哚还具有一定的抗氧化性质,可以帮助清除自由基和减轻氧化应激对细胞的损伤。吲哚可能在一定程度上保护细胞免受氧化损伤的影响。
▸ 吲哚含量过高的危害
尽管吲哚对于改善肠道甚至全身疾病至关重要,但过高的吲哚含量可能对健康造成一些危害,包括但不限于以下几个方面:
影响情绪:越来越多的证据表明吲哚和吲哚化合物对大脑代谢、生理和宿主行为有影响。在拥有产生吲哚的大肠杆菌的大鼠中,吲哚的慢性过量产生已被证明会增强焦虑样行为和抑郁。
导致肠道损伤:硫酸吲哚酚(IS)是吲哚的衍生物之一,而过量的硫酸吲哚酚会诱导肠上皮细胞(IEC)损伤。在IEC-6细胞中,硫酸吲哚酚处理可显著增加TNF-α的释放、环氧合酶-2和诱导型一氧化氮合酶的产生以及硝基酪氨酸的合成,表明肠上皮细胞是硫酸吲哚酚诱导的肠道炎症的靶点。
与硫酸吲哚酚一起培养的结肠显示出收缩性降低,这表明该毒素可能对结肠平滑肌细胞产生有害影响并导致肠道蠕动受损。
影响神经系统:其次,硫酸吲哚酚可损伤神经元和神经干细胞,损害神经营养因子和神经递质,诱发氧化应激和神经炎症。例如,通过作用于中枢神经系统胶质细胞,硫酸吲哚酚促进神经炎症并表现出促炎作用。
与肾病相关:并且强有力的证据表明,硫酸吲哚酚在肾功能不全的情况下积累时是有害的。硫酸吲哚酚会损害近端肾小管细胞并诱导炎症和纤维化发展。肾脏通过肾小管分泌实现硫酸吲哚酚的高清除率,而硫酸吲哚酚与血浆蛋白结合超过90%,受到蛋白结合的限制,并且血液透析患者的血浆水平相对较高,这也表明与肾脏疾病密切相关。
免疫抑制:吲哚含量可能影响免疫细胞的活性和功能。高浓度的吲哚可能抑制免疫细胞的功能,如抑制T细胞的活性、影响免疫细胞的增殖和分化等,从而降低机体对病原体的抵抗能力。
▸ 降低吲哚水平的方法
放松身心:高度紧张和某些精神疾病会导致体内吲哚水平过高,多洗热水澡,调节好神经和心理,改善睡眠有助于降低吲哚水平。
食用发酵食品:通过对14名健康男性进行随机交叉研究设计,探讨了发酵乳制品对人类血清代谢组的影响。与牛奶组相比,酸奶摄入组餐后血中吲哚-3-丙酸和吲哚乙酸浓度较低。
同样,C反应蛋白水平轻度升高的健康超重男性在接受抗炎膳食混合物后,饮用500mL餐后奶昔(由300mL蛋奶冻、150mL奶油干酪和50mL鲜奶油组成)。受试者在后期表现出吲哚-3-丙酸血浆浓度降低。
使用药物:一些药物可能影响吲哚类物质的生成。例如,一些抗生素和非甾体抗炎药物被发现可以改变肠道微生物群的组成和功能,从而影响吲哚类物质的生成。
此外,一些药物可能直接干扰色氨酸代谢途径,从而影响吲哚类物质的生成。
减少高蛋白饮食:吲哚是蛋白质的代谢产物,减少高蛋白饮食,尤其是富含色氨酸的食物,有助于降低体内的吲哚含量。
▸ 吲哚含量过低的危害
免疫失调:吲哚在一定浓度下可以调节免疫系统的功能,过低的吲哚含量可能导致免疫系统功能下降,增加感染、致病菌定植、炎症的风险。
神经系统问题:吲哚在神经系统中具有调节作用,过低的吲哚含量可能影响神经传导、神经递质释放等,导致神经系统功能异常,如情绪不稳定、认知功能下降等问题。
代谢紊乱、抗氧化能力下降:吲哚在人体内参与多种代谢过程,过低的吲哚含量可能导致代谢紊乱,影响体内物质的合成和代谢平衡。
吲哚具有一定的抗氧化性质,过低的吲哚含量可能导致机体抗氧化能力下降,增加氧化应激对细胞的损伤风险。
▸提高吲哚水平的方法
补充益生菌、益生元:临床试验表明,益生菌可以抵消肠道微生物失衡造成的负面影响,并可导致吲哚产生属及其衍生物的富集,如乳杆菌(Lactobacillus)。
益生元(包括菊粉和低聚半乳糖)已被证明可以显著提高产生吲哚的益生菌(例如双歧杆菌和乳酸杆菌)的丰度。在对肠道微生物失衡进行一定纠正后,吲哚作为具有调节作用的配体,对炎症反应具有抑制作用。
调节饮食:肠道微生物通过色氨酸调节吲哚水平。色氨酸是人体必需氨基酸之一,需要完全依赖饮食摄入。
以下是一些富含色氨酸的常见食物:肉类(牛肉、猪肉、鸡肉、火鸡)、鱼类(鳕鱼、鲑鱼、金枪鱼)、贝类(蛤蜊、扇贝)、蛋(鸡蛋、鸭蛋)、豆类(大豆、黑豆、红豆)、奶制品(牛奶、乳制品)。菠菜、花椰菜、蘑菇、芝麻、松子、香蕉、菠萝、樱桃、草莓、蓝莓。燕麦、大麦、小麦、黑米、糙米。核桃、杏仁、腰果、葵花子、南瓜子、亚麻籽。
粪菌移植:通过粪菌移植(FMT)将产生吲哚的益生菌(乳酸杆菌、双歧杆菌等)移植到患者的肠道中,可以改善肠道微生物群。据观察,肠道中产生吲哚的微生物群的丰度增加,吲哚及其衍生物的水平受到间接影响。
扩展阅读:
苯酚(Phenol)是一种常见的有机化合物,也是人体肠道微生物的代谢产物之一。在人体的肠道中,肠道微生物通过代谢食物中的复杂碳水化合物和蛋白质等产生苯酚。苯酚的生成通常是通过肠道微生物对酪氨酸(一种氨基酸)的代谢产生的。
苯酚在人体内具有一定的生理作用,苯酚在肠道内可以被吸收到血液循环中,进而影响全身的代谢和生理功能。
抗氧化作用:苯酚具有一定的抗氧化性质,可以帮助清除体内的自由基,减少氧化应激对细胞的损伤,有助于维护细胞健康。
免疫调节:苯酚可能对免疫系统产生一定调节作用,有助于平衡免疫反应,调节免疫细胞的活性,提高机体的抵抗力。
维护肠道健康:适量的苯酚可以促进肠道微生物的平衡,维持肠道健康,有利于消化吸收和排泄功能的正常进行。
▸ 苯酚含量过高的危害
但过高的苯酚含量可能对健康产生不利影响。过高的苯酚含量可能导致肠道菌群失衡、肠道炎症、毒素积累等问题,从而影响整体健康。
肠道健康问题:过高的苯酚含量可能导致肠道微生物失衡,影响肠道菌群的稳定性,进而引发肠道炎症、肠道细菌感染等肠道健康问题。
毒性作用:苯酚具有一定的毒性,过高的苯酚含量可能对肠道黏膜和组织造成损害,导致肠道溃疡、出血等严重问题。
神经系统问题:苯酚可能穿过血脑屏障影响神经系统功能,过高的苯酚含量可能导致神经系统问题,如头晕、头痛、神经炎症等。
代谢紊乱、肝脏负担增加:过高的苯酚含量会影响人体的代谢平衡,导致代谢紊乱,影响体内物质的合成和代谢过程。
苯酚在体内主要通过肝脏代谢,过高的苯酚含量会增加肝脏的负担,可能导致肝脏损伤和功能异常。
免疫系统问题:过高的苯酚含量可能影响免疫系统的功能,导致免疫调节失衡,增加感染和炎症的风险。
▸ 降低苯酚水平的方法
增加膳食纤维摄入,促进肠道健康减少苯酚产生。多摄入新鲜水果和蔬菜等富含维生素和矿物质,适量控制蛋白质摄入,避免添加剂和防腐剂的加工食品。增加饮食多样化。
肠道微生物可从鸟氨酸、精氨酸、赖氨酸、酪氨酸和组氨酸等氨基酸前体产生腐胺、胍胺、尸胺、酪胺和组胺等多胺。
腐胺具有一定的生理作用,如调节肠道运动,但是高浓度的腐胺可能与肠炎、癌症和神经退行性疾病的发展有关。
▸ 腐胺含量过高的危害
臭味问题:腐胺是一种具有刺鼻臭味的化合物,其在胃肠道中含量过高可能导致口臭等问题,影响个人的生活质量。
导致胃肠道疾病:高浓度的腐胺会对人体产生毒性作用,影响肠道黏膜的健康,导致肠道炎症,肠道通透性增加。从而易患结肠炎、炎症性肠病、结直肠癌。
致癌风险:一些研究表明,腐胺被认为是潜在的致癌物质,过高的腐胺含量可能通过诱发DNA损伤、促进细胞增殖、影响基因表达等途径参与致癌过程。
影响认知功能:过高的含量可能导致神经系统问题,如情绪不稳定、认知功能下降等。
▸ 调整腐胺水平的方法
腐胺主要来自于肠道菌群代谢转化,发酵食品,如豆腐、豆酱、酸奶奶酪,以及高蛋白特别是动物蛋白,加工肉类以及硝酸盐含量高的食物会促进腐胺转化。
想要降低体内腐胺水平,需要减少高蛋白摄入,适量控制动物蛋白摄入量,减少发酵食品以及高硝酸盐食物如加工肉类、腌制食品等,增加膳食纤维摄入,新鲜水果和蔬菜富维生素和矿物质有助于维持肠道菌群平衡减少腐胺转化。
硫化氢(H2S)是蛋氨酸、半胱氨酸等含硫氨基酸通过一些肠道微生物(如沙门氏菌、埃希氏菌、梭杆菌等)发酵产生的一种微生物代谢物。H2S也来源于无机硫酸盐和亚硫酸盐添加剂的还原,以及肠道磺胺类物质的分解代谢。
越来越多的研究发现它在哺乳动物体内广泛存在,微生物产生的H2S可能反过来塑造肠道微生物群落本身的组成。这对宿主的健康有很多影响,包括帮助训练和调节免疫系统,而且具有重要的细胞保护作用。它已经称为继一氧化氮和一氧化碳之后,被发现的第3种气体信号分子,具有舒张血管、调节血压等多种生理功能。其代谢异常与心脏病和高血压等多种心血管疾病有关。
▸ 硫化氢浓度过高的危害
虽然硫化氢在一定程度上也具有抗菌作用,但过量的硫化氢对人体健康可能造成负面影响。
中枢神经系统损害:硫化氢在高浓度下可能对神经元产生毒性作用,导致神经元损伤和神经元死亡,还会影响血脑屏障的功能,使得有害物质更容易进入大脑,从而引发神经系统疾病(如帕金森病、阿尔茨海默病)。
胃肠道疾病:高浓度的硫化氢会引发肠道阻塞、炎症反应,以及可以使覆盖在肠道上的保护性黏液层变性,出现黏膜损伤等问题。此外,一些研究还发现高水平的肠道内硫化氢与某些疾病如慢性炎症性肠病、结直肠癌等相关联。
胃胀气:硫化氢作为一种气体,如果在肠道中积累过多,可能会引起胃肠道胀气。
影响消化功能:硫化氢可抑制胃酸分泌,影响消化酶活性,导致消化不良、腹胀和腹泻。硫化氢还可能影响肝脏功能,导致转氨酶升高、出现黄疽等症状。
▸ 降低硫化氢水平的方法
减少高硫蛋白食物的摄入,比如蛋类、肉类、鱼类以及大豆制品等。多摄入富含维生素B6的食物,如香蕉等,此外高纤维食物也可减少硫化氢的转化产生。
扩展阅读:
谷禾肠道菌群检测基于大规模匹配血清代谢组和肠道菌群检测,构建了基于肠道菌群的神经递质和菌群代谢物评估。通过上文对各项指标的解读,我们可以了解其具体意义,以及对健康的影响机制。借助肠道菌群这一重要工具,让我们可以探知自身的情绪、神经系统以及免疫和重要代谢毒素的变化与异常。
此外通过调整肠道微生物群落的结构,可以影响神经递质的水平,调节免疫系统的功能,改善肠道黏膜屏障的完整性,从而减少炎症反应,改善疾病症状。因此,我们可以借此进行更加个性化和有效的干预。
主要参考文献
Dicks LMT. Gut Bacteria and Neurotransmitters. Microorganisms. 2022 Sep 14;10(9):1838.
Braga JD, Thongngam M, Kumrungsee T. Gamma-aminobutyric acid as a potential postbiotic mediator in the gut-brain axis. NPJ Sci Food. 2024 Apr 2;8(1):16.
Guzel T, Mirowska-Guzel D. The Role of Serotonin Neurotransmission in Gastrointestinal Tract and Pharmacotherapy. Molecules. 2022 Mar 3;27(5):1680.
Dicks L.M.T., Hurn D., Hermanus D. Gut Bacteria and Neuropsychiatric Disorders. Microorganisms. 2021;9:2583.
Yang X., Lou J., Shan W., Ding J., Jin Z., Hu Y., Du Q., Liao Q., Xie R., Xu J. Pathophysiologic Role of Neurotransmitters in Digestive Diseases. Front. Physiol. 2021;12:567650.
Strandwitz P. Neurotransmitter modulation by the gut microbiota. Brain Res. 2018;1693:128–133.
Van De Wouw M., Boehme M., Lyte J.M., Wiley N., Strain C., O’Sullivan O., Clarke G., Stanton C., Dinan T.G., Cryan J.F. Short-chain fatty acids: Microbial metabolites that alleviate stress-induced brain-gut axis alterations. J. Physiol. 2018;596:4923–4944.发文助手Hi,欢迎使用一点号发文助手,一 键检测为您提供优化建议,帮您获 得更多曝光机会。了解更多>开始检测封面:单图三图(仅在wifi下显示)默认
编辑清晰美观的封面有利于推荐,建议分辨率不低于1920*1080设为封面图设为封面图设为封面图设为封面图设为封面图设为封面图设为封面图设为封面图设为封面图设为封面图
温馨提示:开通原创功能可提升内容推荐量,还能享受收益加权哦~
您可前往一点号管理平台“设置 > 账号功能 > 原创声明”申请开通原创功能。
若开通账号关联可加速开通原创和点金功能,还能开启同步功能!添加评论内容声明:无需声明内容自行拍摄内容取材网络内容由AI生成虚构情节内容

谷禾健康
你敢相信吗?从粪便中提取出具有强烈粪臭味的物质,当用酒精稀释上千倍后,脱胎换骨变成了一种香味。这就是一种吲哚衍生物——3-甲基吲哚(又名粪臭素)
吲哚,是所有花香类原精的关键成分,这种物质在低剂量1-3%浓度时,具有放松的作用,协同苯基酯,能强效抗痉挛,增添感官愉悦和魅力。然而,如果简单将吲哚等同于香水,未免太少看它的功效。
在谷禾特定肠道菌群检测报告中炎症部分或毒素部分有吲哚这个指标。
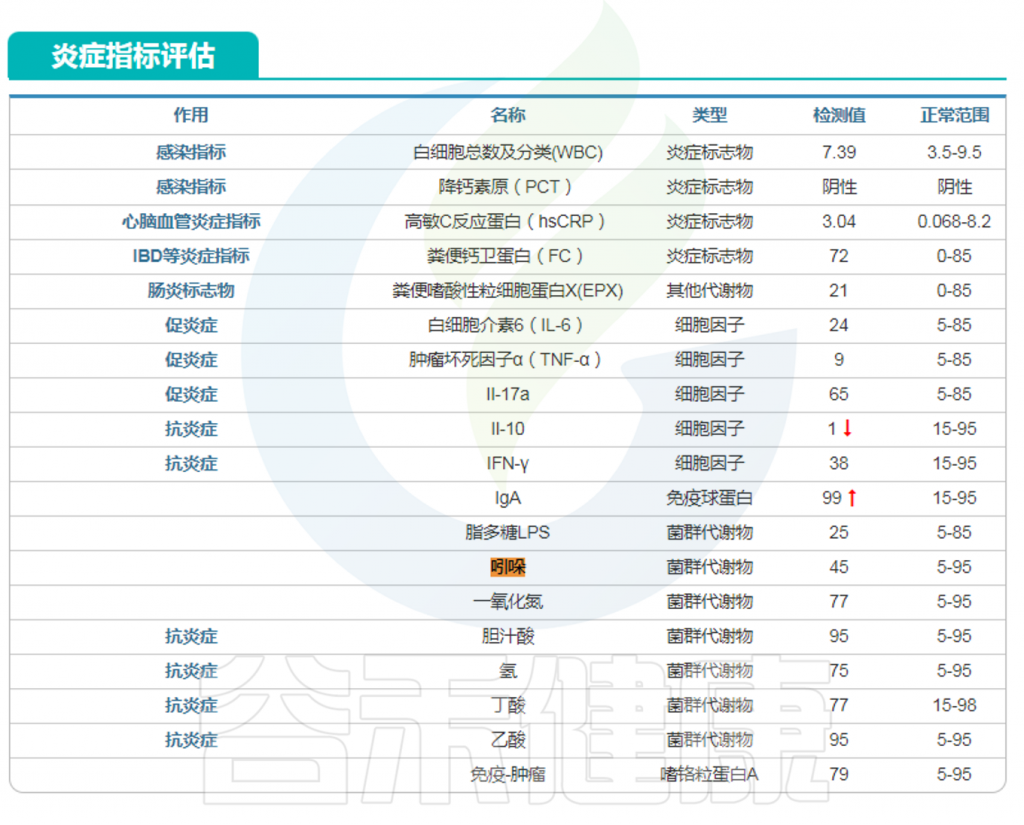
<来源:谷禾肠道菌群检测数据库>

<来源:谷禾肠道菌群检测数据库>
很多人可能对与菌群和健康相关的血清素,色氨酸,脂多糖,组胺等指标比较熟悉,但是对吲哚还是比较陌生,实际上吲哚与肠道微生物群和人类健康和生活关系密切,例如,吲哚衍生物可以影响胃肠道的蠕动,可能会影响便秘或腹泻等状况;吲哚及其衍生物已被证明可以加强肠道屏障功能,有助于防止病原体和有害物质进入血液。
事实上,由吲哚衍生而来的各种化学物质,对人体神经调节和抗病原微生物,有极为积极的作用。在人体中存在着许多这样神奇的吲哚类物质。内源性吲哚及其衍生物是源自肠道微生物群的色氨酸代谢物,具有一系列生物活性。
最近的研究表明,吲哚有助于维持人体肠道的生物屏障,主要通过激活AhR和PXR受体来发挥抗炎活性,从而影响免疫系统的功能,显著改善肠道健康(炎症性肠病、出血性结肠炎、癌症结直肠癌),并进一步促进人类健康(糖尿病、中枢系统炎症和血管调节)。
作为细胞间信号分子,吲哚还控制细菌生理学的各个方面,例如产吲哚细菌的孢子形成、质粒稳定性、耐药性、生物膜形成和毒力。相比之下,许多不产生吲哚的细菌、植物和动物产生多种加氧酶,可能会干扰吲哚信号传导。
吲哚还是身体神经系统与内分泌系统正常与否的风向标。所谓的体臭,其实就是人体内吲哚含量增高的表现。吲哚在细菌生理学、生态平衡以及人体健康中发挥着重要作用。
然而,吲哚的毒性影响也不容忽视。过量的吲哚会对情绪和行为产生不利影响,硫酸吲哚酚是一种吲哚衍生物,具有肾毒性和心血管毒性。羟吲哚还可能降低神经元兴奋性。
吲哚与肠道微生物群之间的相互作用以及吲哚对人类健康的影响是一把双刃剑。本文主要讲述了内源性吲哚的生物合成、吲哚对肠道功能及微生物群的影响,为吲哚与疾病的相关性提供了科学依据。
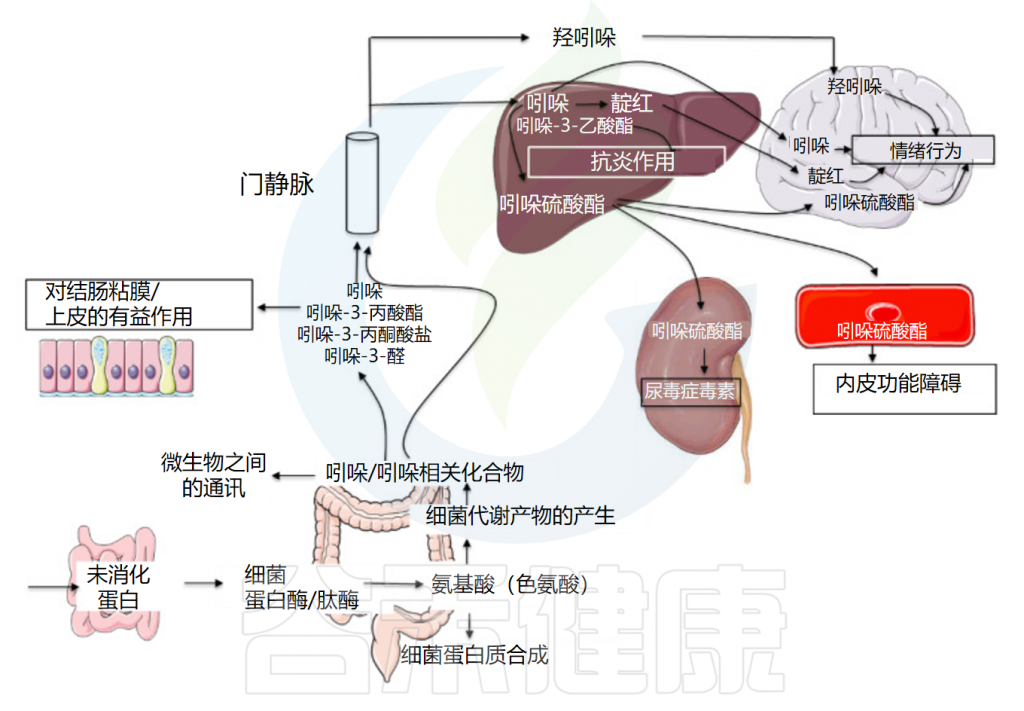
Tennoune N,et al., Microorganisms.2022
吲哚(Indole)是一种有机化合物,是吡咯与苯并联的化合物,又称苯并吡咯。吲哚及其同系物和衍生物广泛存在于自然界,主要存在于天然花油,如茉莉花、苦橙花、水仙花、香罗兰等。
而内源性吲哚及其衍生物是来源于肠道菌群的色氨酸代谢物,具有一系列生物活性。内源性吲哚类物质包括吲哚本身以及吲哚的代谢产物,如吲哚-3-甲酸、吲哚-3-丙酸、硫酸吲哚酚等。
吲哚相关化合物的结构
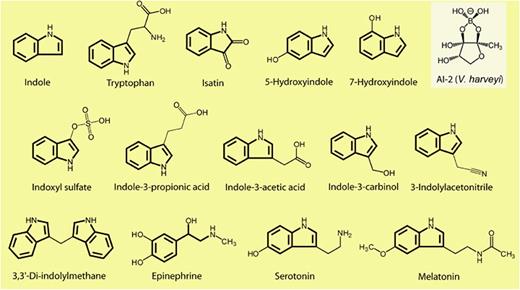
Lee JH, Lee J.FEMS Microbiol Rev.2010
肠道菌群产生吲哚类物质
细菌蛋白酶和肽酶从可用的膳食中释放氨基酸,包括色氨酸。而色氨酸是吲哚的主要前体。大部分色氨酸在小肠中被吸收,约4%~6%的色氨酸在结肠中被肠道菌群分解代谢为吲哚。
色氨酸作为一种必需氨基酸,主要从富含蛋白质的食物中获取,是唯一含有吲哚的氨基酸。
肠道中的色氨酸通过三个主要途径进行代谢:1) 犬尿氨酸途径(摄入的色氨酸的95%);2)细菌色氨酸代谢(4-6%);
3) 血清素途径 (1-2%)
✦ 肠道菌群主要通过色氨酸酶将色氨酸转化为吲哚
肠道细菌主要通过色氨酸酶(TnaA)的作用将色氨酸转化为吲哚;色氨酸酶TnaA可逆地将色氨酸降解为吲哚、丙酮酸和氨。
值得注意的是,在哺乳动物中,吲哚完全来源于细菌代谢活动,因为宿主细胞不具有产生这种化合物的代谢能力。
色氨酸也可以通过肠道微生物群直接或间接转化为几种吲哚相关化合物,包括吲哚-3-丙酮酸、吲哚-3-乳酸、吲哚-3-丙酸、吲哚-3-乙酰胺、吲哚-3-丙烯酸、吲哚乙醛、吲哚-3-乙酸、3-甲基吲哚(粪臭素)等。
✦ 内源性吲哚产生的机制
大肠杆菌(E. coli)是研究最广泛的吲哚合成生物体,它可以使用多种机制(抑制、转录衰减和反馈抑制)来调节色氨酸代谢中的色氨酸操纵子(Trp operon)和tna操纵子的表达。
在色氨酸缺乏的条件下, trp操纵子的表达升高,而由TnaC(24个氨基酸前导肽,以前称为TnaL)、TnaA(色氨酸酶)和TnaB(通透酶)组成的tna操纵子的表达受到抑制,因为转录终止因子(Rho)依赖性终止发生在tna操纵子中。
结果,当色氨酸水平较低时,TnaA和TnaB的表达以及吲哚的产生受到抑制。在富含色氨酸的条件下,转录终止因子依赖性转录终止被消除,因此吲哚产量增加。
因此,细胞外色氨酸和其他氨基酸直接影响吲哚的产生。
// 拓展:渗透酶通过转运也会影响吲哚水平
此外,三种渗透酶(Mtr、TnaB和AroP)在不同环境的色氨酸转运中发挥不同的作用,因此可以直接影响吲哚的水平。
Mtr通透酶主要负责转运吲哚,而TnaB通透酶对于色氨酸的摄取至关重要。尽管色氨酸的生产成本高昂,但细胞仍然利用色氨酸途径大量生产和分泌吲哚。
由色氨酸产生的吲哚可以通过细胞膜蛋白进行转运。例如,大肠杆菌和霍乱弧菌在丰富的培养基中可以分泌高达0.6 mM的吲哚。
在大肠杆菌中,外排蛋白AcrEF部分负责吲哚的输出,因为AcrEF突变体的吲哚排泄低于其野生型菌株。Mtr通透酶主要负责输入吲哚,因为吲哚不被mtr突变体吸收。
然而,最近有人提出,吲哚由于其疏水性,可能可以直接扩散通过细胞膜。因此,有必要清楚地了解吲哚的进出口情况。
大肠杆菌中吲哚生物合成和吲哚信号传导
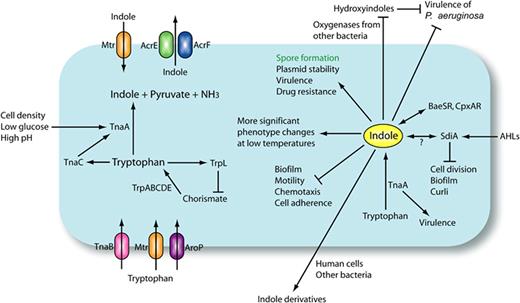
Lee JH, Lee J.FEMS Microbiol Rev.2010
人体粪便中吲哚的浓度较高,通常范围为0.25毫摩尔浓度~1.1毫摩尔浓度,但可能由于人群之间肠道微生物群组成的差异以及膳食蛋白质消耗水平不同而存在差异区别。
注:由于吲哚似乎是通过结肠上皮吸收的,结肠中吲哚的浓度可能高于粪便中记录的浓度,远端大肠的浓度高于近端部分的浓度。
尽管大多数生物体都含有色氨酸代谢途径,但只有能编码tnaA的细菌才能合成吲哚。表达色氨酸酶(tnaA)的细菌,例如大肠杆菌(E. coli)、梭菌属(Clostridium spp.)、拟杆菌属(Bacteroides spp.)和普通变形杆菌(Proteus Vulgaris),可催化色氨酸直接转化为吲哚。
✦ 梭状芽孢杆菌代谢产生吲哚-3-丙酸
已经证明吲哚-3-丙酸是由梭状芽孢杆菌(Clostridium sporogenes)产生的。粪臭素(3-甲基吲哚)是由梭菌属和拟杆菌属产生的。
此外,产孢梭菌(C. sporogene)可以将色氨酸转化为吲哚-3-丙酮酸(IPyA),并在吲哚-3-丙酮酸脱羧酶的催化下产生吲哚-3-乙醛(IAAld)。然后,IAAld 被厚壁菌门、变形菌门、拟杆菌门和放线菌门的成员脱羧,产生吲哚乙酸 (IAA)。
✦ 一些病原菌也可以产生吲哚
色氨酸代谢很复杂,许多菌株参与吲哚衍生物的制造。总的来说,数据支持迄今为止有至少85种细菌已被证明可以产生吲哚。
这些细菌包括许多病原菌,例如创伤弧菌、流感嗜血杆菌、多杀巴氏杆菌(pasteurella multocida)、四种志贺氏菌菌株、植物克雷伯菌(Klebsiella planticola)和普通变形杆菌。值得注意的是,一些革兰氏阳性菌株,包括B.alvei和粪肠球菌(E.faecalis)也产生吲哚。
✦ 一些拥有tnaA基因的细菌却无法产生吲哚
有趣的是,一些细菌,如杀鲑气单胞菌(Aeromonas salmonicida)、宋氏志贺氏菌(Shigella sonnei)、克氏耶尔森氏菌(Yersinia kristensenii)和Seudovibrio spp.,已经失去了合成吲哚的能力,尽管这些菌株的染色体上有一个tnaA基因同源物。
例如,与正常志贺氏菌菌株不同,一些在tna操纵子中具有点突变、插入或缺失的志贺氏菌不产生吲哚,这可能是由于某些适应性优势。虽然只是推测,但一些个体可能通过利用当地细菌群体的信号来避免产生吲哚的成本。
其他可以产生吲哚的细菌:
Alkaliphilus metalliredigens
Bacillus alvei
Clostridium novyi
Clostridium limosum
Clostridium tetani
Corynebacterium acnes
Desulfitobacterium hafniense
Nocardioidessp.
Oribacterium sinus
Propionibacterium acnes
Enterococcus faecalis
Symbiobacterium thermophilum
Aeromonas hydrophila
Aeromonas liquefaciens
Aeromonas punctata
Bacteroides thetaiotaomicron
Bacteroides sp.
Brachyspira hyodysenteriae
Burkholderiasp.
Chromobacterium violaceum
Chryseobacterium gleum
Citrobactersp.
Citrobacter intermedius
Citrobacter koseri
Desulfovibrio vulgaris
Edwardsiella tarda
Enterobacter liquefaciens
Escherichia coli
Escherichia fergusonii
Flavobacteria bacterium
Flavobacteriumsp.
Fusobacterium nucleatum
Fusobacterium polymorphum
Haemophilus influenzae
Haemophilus somnus
Haloarcula marismortui
Halogeometricum borinquense
Hyphomonas neptunium
Klebsiella ornithinolytica
Klebsiella planticola
Micrococcus aerogenes
Morganella morganii
Paracolobactrum coliforme
Pasturella multocida
Pasturella pneumotropica
Photobacterium harveyi
Porphyromonas asaccharolytica
Porphyromonas endodontalis
Porphyromonas gingivalis
Prevotella intermedia
Proteus inconstans
Proteus vulgaris
Providencia alcalifaciens
Providencia rettgeri
Providencia rustigianii
Providencia stuartii
Rhizobium leguminosarumbv.trifolii
Saccharomonospora viridis
Shigella boydii
Shigella dysenteriae
Shigella flexneri
Sphaerophorus varius
Stigmatella aurantiaca
Treponema denticola
Vibrio alginolyticus
Vibrio cholerae
Vibrio fluvialis
Vibrio harveyi
Vibrio hollisae
Vibrio mediterranei
Vibrio nigripulchritudo
Vibrio orientalis
Vibrio parahaemolyticus
Vibrio splendidus
Vibrio tapetis
Vibrio tubiashii
Yersinia frederiksenii
Yersinia intermedia
吲哚类物质的生成可能受到环境因素的严重影响,例如膳食成分、肠道微生物群、碳源、温度、pH值以及生理状态。
★ 肠道微生物群和饮食对吲哚生成有重要影响
吲哚类物质是肠道微生物群产生的膳食色氨酸的代谢产物。因此,肠道微生物组成以及饮食模式的变化会影响其产生。
研究发现吲哚-3-丙酸(IPA)与肠道微生物群的α多样性呈正相关,肠道微生物组的组成可以解释大约20%的IPA循环水平的变化。
高纤维和富含多酚的饮食可以提高吲哚含量
多项研究发现,吲哚-3-丙酸的循环水平与纤维摄入量相关,这可能是通过肠道微生物群的变化来解释的。
此外,富含多酚的饮食会导致肾功能正常受试者的血清IPA显著增加,但肾功能受损的受试者不会显著增加。与此相一致的是,饲喂菊粉60天的猪的盲肠和结肠中微生物组组成的β多样性显著增加,同时IPA含量也显著增加。
地中海饮食会导致吲哚-3-丙酸水平升高
不同的饮食结构也会改变吲哚的水平。例如,地中海饮食仅治疗4天后就导致吲哚-3-丙酸水平升高,而快餐(即薯条和汉堡)则引起相反的结果。
此外,正常饮食喂养的同窝小鼠的血浆IPA水平显著高于生酮饮食喂养的小鼠。一项针对117名超重成年人的研究发现,摄入炸肉会降低肠道微生物群落的丰富度,并导致IPA浓度下降。
发酵食品可能会降低吲哚含量
通过对14名健康男性进行随机交叉研究设计,探讨了发酵乳制品对人类血清代谢组的影响。与牛奶组相比,酸奶摄入组餐后血中吲哚-3-丙酸和吲哚乙酸浓度较低。
同样,C反应蛋白水平轻度升高的健康超重男性在接受抗炎膳食混合物后,饮用500mL餐后奶昔(由300mL蛋奶冻、150mL奶油干酪和50mL鲜奶油组成)。受试者在后期表现出吲哚-3-丙酸血浆浓度降低。
总之,我们推测不同的饮食结构会改变肠道微生物的组成,从而导致吲哚类物质产生的个体差异。
• 细胞群体密度影响吲哚分泌
细胞外吲哚浓度取决于细胞群体密度,其中大肠杆菌和霍乱弧菌在指数早期开始产生吲哚。浓度在固定相中达到最高水平(在富集培养基中高达0.6mM吲哚),并在固定相期间稳定维持。
• 碳源影响吲哚产量
其次,有报道称葡萄糖抑制吲哚生物合成。TnaA的分解代谢抑制得到证实,因为tnaA基因的转录在碳限制期间受到抑制。
此外,tnaAB操纵子被大肠杆菌中的分解代谢调节蛋白环AMP复合物激活。因此,当大肠杆菌数量较多且碳源减少时,会产生相对大量的吲哚。
• 温度和pH影响吲哚生物合成
温度和pH也是影响大肠杆菌吲哚生物合成的重要环境因素。温度从30°C转变到43°C会诱导大肠杆菌中tnaAB基因的表达,但大肠杆菌在44.5°C时失去吲哚生物合成的能力。
注:与37°C相比,吲哚信号传导在较低温度(30°C)下对大肠杆菌基因表达、生物膜形成和抗生素耐药性的控制作用更为显著。
此外,低pH值会抑制大肠杆菌中吲哚的产生,而TnaA是pH9.0时最容易诱导的蛋白质之一。
• 生理状态影响吲哚生成
例如年龄、性别以及个体的生理状态都可能影响内源性吲哚的产生。睡眠模式、压力水平和运动习惯等生活方式因素都可能对内源性吲哚的产生产生影响。
此外,特定的健康状况和疾病,如肠道炎症、肝脏疾病等,可能会改变内源性吲哚的生成或代谢。
• 药物的使用也会影响吲哚生成
一些药物可能影响吲哚类物质的生成。例如,一些抗生素和非甾体抗炎药物被发现可以改变肠道微生物群的组成和功能,从而影响吲哚类物质的生成。
此外,一些药物可能直接干扰色氨酸代谢途径,从而影响吲哚类物质的生成。
小结
因此,细胞群密度、碳源、温度和pH等环境条件直接会影响吲哚的浓度;而饮食、药物的使用以及生活方式可能通过影响肠道微生物群或其他器官间接影响吲哚的生成。
肠道屏障的功能与肠道健康密切相关,在健康中发挥着至关重要的作用。肠道屏障将宿主与肠腔中的微生物隔离,并限制微生物和分子从肠腔的运动。
一旦肠道屏障受损,肠道通透性增加,细菌及其产物(如内毒素)将跨膜并激活单核巨噬细胞系统,促进大量炎症因子的产生,如白细胞介素6和肿瘤坏死因子-α(TNF-α),导致慢性微炎症状态。
吲哚对于控制肠道屏障功效至关重要,包括调节炎症和免疫反应、影响上皮通透性、粘液产生和紧密连接(TJ)形成。
▼
✦ 吲哚减轻非甾体抗炎药引起的肠道炎症
研究了使用吲哚作为非甾体抗炎药肠病的治疗方法。吲哚降低粪便钙卫蛋白浓度以及吲哚美辛诱导的脾和肠系膜淋巴结中中性粒细胞的浸润。
吲哚与吲哚美辛联合使用可减少非甾体抗炎诱导的粘膜转录组变化。粪便钙卫蛋白是肠道炎症的中性粒细胞特异性生物标志物。而中性粒细胞被认为是非甾体抗炎肠病发病的关键因素,可通过释放多种炎症介质引起炎症和组织损伤。
这就说明吲哚能够减轻吲哚美辛引起的小鼠肠道炎症,对非甾体抗炎药肠病具有潜在的免疫调节作用。
此外还发现吲哚减少促炎细胞因子IL-8的产生和趋化因子TNF-α激活的核因子κB(NF-κB)的表达,并诱导抗炎细胞因子IL-10的分泌。
研究表明,共生菌可以限制鼠伤寒沙门氏菌诱导的NF-κB激活,减轻小鼠炎症。因此,吲哚可能是益生菌减少肠道炎症的信号。
✦ 细菌产生的吲哚衍生物增强免疫屏障
吲哚乙酸
卵形拟杆菌(Bacteroides ovatus)产生的吲哚乙酸(IAA)增加了CD103+ /CD11c+免疫群体的丰度,而 CD103+ /CD11c+免疫细胞对于维持肠道免疫稳态和诱导耐受性免疫反应至关重要。
此外,吲哚乙酸与树突状细胞上的芳基氢受体结合并驱动IL-22的产生。在炎症性肠病个体中,IL-22 刺激上皮再生并减少炎症,并且在肠道炎症的调节中发挥关键作用。
注:除卵形拟杆菌外,其他拟杆菌产生的吲哚也可以激活免疫细胞上的AhR,从而产生IL-22。
在脂多糖存在的情况下,肠上皮细胞中表达的Reg4通过增加乳酸菌及其代谢物吲哚乙酸的比例来维持免疫稳态,从而促进肠组织中IL-35 +B调节细胞的产生和积累。这些结果表明吲哚乙酸可以调节IL-35 的产生,并影响肠道免疫屏障。
吲哚-3-乳酸
罗伊氏乳杆菌(Lactobacillus reuteri)产生吲哚-3-乳酸(ILA),ILA是Trp的吲哚衍生物,可激活CD4+ T细胞中的AhR并下调转录因子ThpoK,使CD4 + T细胞分化为具有免疫调节功能的CD4+ CD8αα +双阳性上皮内T淋巴细胞(DPIELs)。通过这些机制,吲哚-3-乳酸可以促进肠道屏障功能并减少炎症。
生活在母乳喂养婴儿胃肠道中的婴儿长双歧杆菌亚种也可产生吲哚-3-乳酸,从而显著减弱TNF-α和脂多糖诱导的肠上皮细胞中促炎细胞因子IL-8的增加。吲哚-3-乳酸还增加AhR靶基因CYP1A1和NRF2靶向基因谷胱甘肽还原酶2、超氧化物歧化酶2和NAD(P) H脱氢酶的 mRNA 表达,这可能是母乳喂养婴儿肠道炎症的重要调节剂。
此外,另一项研究表明,婴儿双歧杆菌分泌的吲哚-3-乳酸对未成熟肠道具有抗炎作用。这些数据为生产吲哚-3-乳酸益生菌的生产和饮食建议提供了重要的见解。
吲哚-3-丙酸
吲哚-3-丙酸(IPA)下调肠上皮细胞介导的炎症细胞因子TNF-α,同时上调配体蛋白编码mRNA,从而调节肠道屏障功能,缓解肠道炎症。
吲哚-3-丙酸还通过激活AhR显著诱导肠上皮细胞上的IL-10受体配体结合亚基(IL-10R1)来调节肠道免疫稳态。
IL-10R1是抗炎细胞因子IL-10的受体,IL-10通过IL-10R1发送抗炎信号,抑制多种细胞(包括肠上皮细胞)过度释放促炎介质。这进一步说明了吲哚-3-丙酸对肠道免疫屏障的保护作用。
吲哚-3-醛
乳杆菌(Lactobacillus)产生的吲哚-3-醛(IAld)有助于AhR依赖性IL22转录,IL-22产生者抑制炎症并保护粘膜表面的免疫生理学。吲哚-3-醛可以替代益生菌,在感染或化学损伤期间保护和维持粘膜完整性。
吲哚-3-醛可用作菌群处理和肠道菌群失调期间的支持疗法。乳酸菌还通过IAld诱导的AhR刺激LPL分泌IL-22,从而激活pSTAT3通路并抑制IL-1β和TNF-α分泌,以保护粘膜免疫屏障.
吲哚对肠道免疫的影响

Ye X,et al.Front Immunol.2022
服用非甾体抗炎药时,肠道微生物组以革兰氏阴性菌为主,这种转变会导致肠道损伤。吲哚和吲哚美辛的共同给药可以维持甚至增加厚壁菌门的重要成员,特别是对肠道稳态至关重要的C. cluster XIVa和C. cluster IV。似乎它可以防止拟杆菌的任何增加,这种变化可以减少肠粘膜损伤。
吲哚可通过增殖MUC基因的表达来增加HCT-8细胞对去甲肾上腺素介导的肠出血性大肠杆菌(EHEC)沉降的抵抗力。
吲哚-3-醛(IAld)激活AhR以产生IL-22,IL-22调节粘膜反应,使混合微生物群落存活并抑制白色念珠菌(Candida albicans)定植
✦ 减轻克雷伯菌属的细胞毒性
吲哚调节多种肠道细菌的毒力因子。吲哚增强替利霉素向替利伐林的转化。两者均由克雷伯菌属(Klebsiella spp.)产生,不同之处在于替利伐林是一种细胞毒性降低的吲哚类似物,并且替利伐林与上调孕酮X受体(PXR)反应性解毒基因结合并抑制微管蛋白定向毒性。因此,吲哚以多种方式减轻克雷伯菌属的细胞毒性。
✦ 调节霍乱弧菌和大肠杆菌的毒力基因表达
肠道益生菌代谢产生的吲哚在肠腔内浓度较高,减少了肠道大肠杆菌和啮齿类柠檬酸杆菌(Citrobacter rodentium)致病基因的表达。
吲哚还用作ToxR激动剂,调节肠道内霍乱弧菌(Vibrio cholerae)的毒力基因表达和生物膜产生。吲哚、吲哚甲酸和吲哚乙酸还可下调致病性大肠杆菌菌株的毒力和志贺氏毒素的产生。
此外,吲哚和7-羟基吲哚显著改变铜绿假单胞菌(Pseudomonas aeruginosa)的毒力基因表达,从而降低毒力因子并降低集群运动性。
铜绿假单胞菌用7-羟基吲哚治疗后,胃肠道中有更好的清除率。因此,吲哚可能有助于作为针对肠出血性大肠杆菌等病原体的治疗剂。
✦ 增强肠道机械屏障
吲哚通过诱导许多涉及内皮细胞的基因的表达,包括紧密连接、粘附分子连接(AJ)、肌动蛋白细胞骨架和黏蛋白形成,在体外增强内皮细胞的屏障功能。
将人肠上皮细胞系HCT-8暴露于吲哚以测量其基因表达的变化。结果显示,高剂量的吲哚增强了肠上皮细胞HCT-8中与黏蛋白产生、粘膜屏障增强和上皮间抵抗相关的分子谱。因此,吲哚加强了机械屏障。
✦ 增强肠道粘液屏障
吲哚-3-丙酸通过增加MUC2和MUC4以及杯状细胞分泌产物(TFF3和RELMβ)来增强粘液屏障功能。
吲哚-3-丙酸还促进IL-10释放,IL-10的信号转导增强粘液屏障功能并维持上皮细胞的稳态。
细菌中的吲哚-3-丙烯酸(IA)可增强IL-10的产生和MUC基因的表达,而IL-10对于维持杯状细胞中MUC的产生至关重要。因此,吲哚-3-丙烯酸通过 IL-10间接影响粘液屏障。
吲哚通过AhR或PXR调节肠道屏障
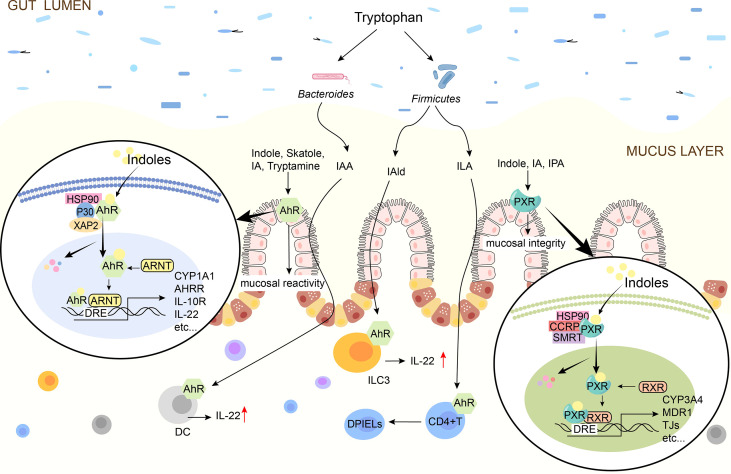
Ye X,et al.Front Immunol.2022
研究发现吲哚在细菌中发挥多种生物学作用,包括孢子形成、耐药性、毒力因子、质粒稳定性和生物膜形成等。
吲哚可以作为细菌间的信号分子
事实上,吲哚可以作为一种细菌信号,参与同一物种内以及不同物种之间的通讯。它在细菌生态系统中充当细胞间和细胞内信号。
注:吲哚还诱导了S. aurantiaca的孢子形成。
通过遗传筛选,在大肠杆菌中研究了吲哚作为细胞外信号分子的可能。结果,四个基因(astD、cysK、gabT和tnaB)被证明在稳定期通过自身产生的细胞外信号的积累而被激活。
在后续研究中,吲哚被证实是astD、gabT和tnaB激活所需的细胞外信号分子。
吲哚作为细胞间信号分子存在哪些争议?
吲哚是否是细胞间信号分子一直存在争议。已经提出了对群体感应信号分子要求的许多标准,如下所示:
1.假定的信号必须在特定阶段产生,吲哚主要在固定相中产生。
2.假定的信号必须在细胞外积累并被特定受体识别。吲哚的化学性质是众所周知的,并且在大多数吲哚调节情况下,化学互补被证明,其中吲哚在稳定期积累并且是已知的细胞外信号。该受体由AcrEF输出并由Mtr输入。
3.假定的信号必须累积并产生一致的响应,吲哚已被证明可以控制孢子和生物膜的形成。
4.重要的是,假定的信号必须引起超出信号代谢或解毒所需的生理变化的反应。吲哚已被证明可以控制毒力、生物膜和质粒稳定性,这些与吲哚无关代谢。
因此,根据这些标准,吲哚有可能成为群体感应分子。
由于上述四个标准仅适合规范的群体感应信号,例如AHL,Monds&O’Toole又添加了两个更普遍适用且具有实用价值的标准:
1.表型变化所需的生理相关信号浓度对细胞无毒。大肠杆菌和霍乱弧菌产生高达0.6mM的吲哚,对细胞无毒,并在该生理浓度下控制许多表型。
2.信号网络在社区层面是自适应的。尽管由于进化实验的困难而难以证明,但我们假设细胞间信号吲哚可能对微生物群落有益,尽管吲哚的生产对个体来说成本高昂。
例如,吲哚在产生吲哚的细菌大肠杆菌和霍乱弧菌中增加了质粒稳定性、耐药性。相反,在不产生吲哚的细菌中,吲哚通过干扰群体感应系统,降低了真菌的细胞生长和铜绿假单胞菌的毒力。因此,我们推测产生吲哚的细菌可能利用吲哚来对抗其他细菌和真核生物。
吲哚和tnaA基因也影响病原菌的毒力。色氨酸酶活性与致病性大肠杆菌有关,因为色氨酸酶活性是LEE1启动子完全激活所必需的。
吲哚会增加肠出血性大肠杆菌中毒力相关的EspA和EspB蛋白(LEE4基因产物)的分泌以及附着和消除病变的形成。
在霍乱弧菌中,吲哚和tnaA基因可能通过诱导毒力相关的分泌蛋白来增加对盘基网柄菌(Dictyostelium discoideum)的抗性。
此外,在流感嗜血杆菌分离株中,大多数血清型 (94-100%)呈吲哚阳性,而无害分离株中只有70-75%呈吲哚阳性。结果表明,吲哚的产生是必要的,但不足以对该菌株产生毒力。
值得注意的是,吲哚通过抑制毒素的产生来减轻克雷伯菌属(Klebsiella spp)的细胞毒性,还通过降低细胞运动性和聚集性来减少李斯特菌(L. monocytogenes)的相关毒力。
吲哚还通过改变基因表达来减少铜绿假单胞菌(不产生吲哚的细菌)中毒力因子的产生。
吲哚降低毒力基因的表达
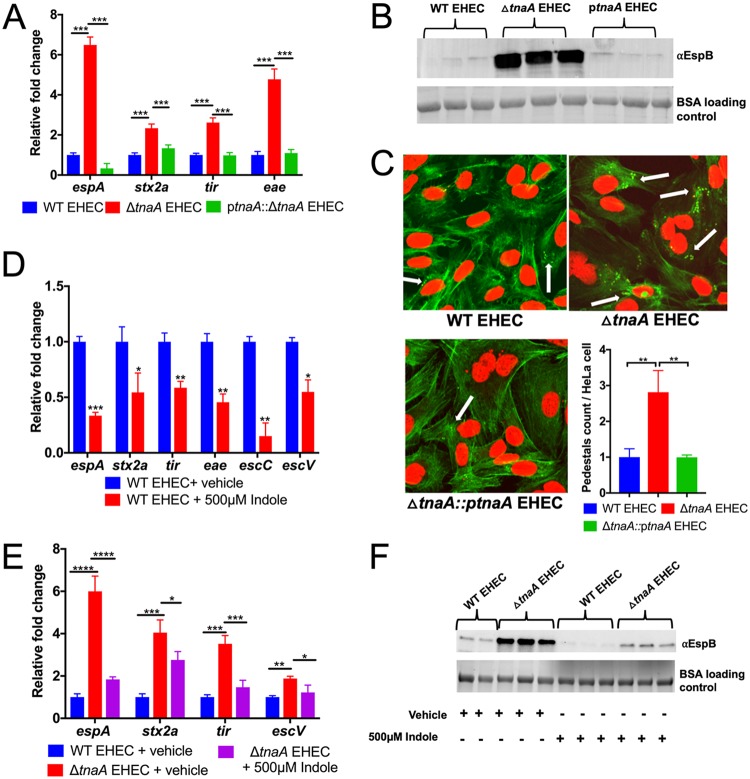
Kumar A,et al.mBio.2019
研究表明,吲哚通过在大肠杆菌中诱导输出基因(mdtEF和acrD)来增加耐药性,其中吲哚通过双组分信号转导系统(BaeSR和CpxAR)发挥作用。
这些双组分信号系统可以用作吲哚传感器。该结果证实了另一项研究,其中吲哚通过BaeSR和CpxAR诱导spy(球形体蛋白Y)基因的表达。
此外,有人认为GadX(AraC型转录因子)、Hfq(sRNA功能的全局调节因子)和RpoS(应激和固定相西格玛S)对吲哚诱导的mdtEF表达是必需的。因此,吲哚可能与多种调节因子相互作用。
增强大肠杆菌的质粒稳定性
吲哚增强大肠杆菌中的质粒稳定性。研究表明,来自大肠杆菌质粒ColE1的小非编码RNA与TnaA结合,有助于防止质粒丢失,而吲哚则延迟细胞分裂。
大肠杆菌中的吲哚还通过抑制gadABCEX、hdeABD和ymgB等耐酸基因来降低耐酸性。大肠杆菌可能会在弱碱性肠道菌群中存在吲哚的情况下关闭耐酸性基因,因为在通过酸性胃存活后不再需要耐酸性蛋白。
降低了运动性
此外,吲哚是一种化学排斥剂,会降低运动性,可能是由于细胞分裂干扰,而肾上腺素和去甲肾上腺素是一种化学引诱剂,会增加大肠杆菌O157: H7的运动性。
此外,吲哚降低细胞对上皮细胞的粘附,而肾上腺素和去甲肾上腺素增加细胞粘附。由于细菌粘附和定植到上皮细胞对于感染很重要,因此假设这也会对细菌毒力产生不同的影响。
吲哚对其他微生物的影响如下所示:

Lee JH, Lee J.FEMS Microbiol Rev.2010
吲哚类物质被肠上皮细胞吸收并扩散到血液中,从而循环到全身并影响各个系统,例如肠道及相关疾病的调节。
谷禾在这里总结了它们对炎症性肠病、出血性结肠炎、结直肠癌、糖尿病、中枢神经系统炎症和血管调节的影响。
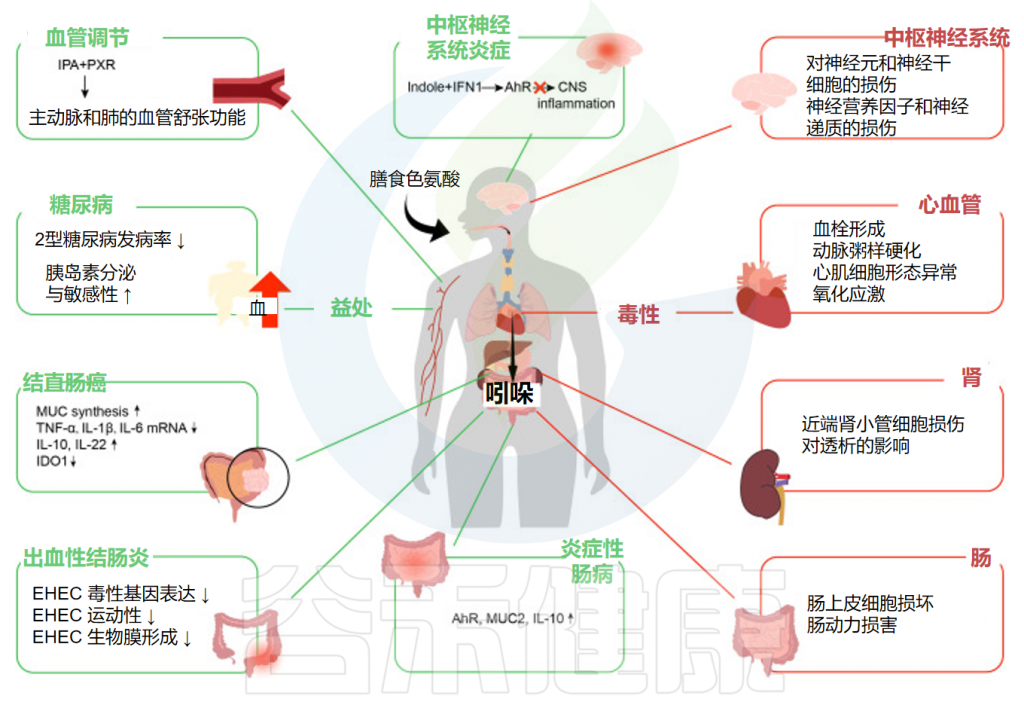
Ye X,et al.Front Immunol.2022
炎症性肠病是克罗恩病、溃疡性结肠炎等一组疾病的总称,是临床上重要的慢性胃肠道炎症性疾病。大量研究表明,吲哚对缓解炎症性肠病症状有一定的作用。
✦ 吲哚类物质增加了抗炎细胞因子
炎症性肠病与粘液层有关,炎症性肠病患者的内部粘液层较薄,MUC2糖基化较低。结果表明,吲哚-3-丙烯酸甲酯(IA)处理小鼠结肠球体可显著增加AhR激活和MUC2基因表达。
即使在脂多糖刺激的共培养物存在下,IA仍能保持其对MUC2基因表达的影响并增加IL-10的产生。杯状细胞产生MUC依赖于IL-10。因此,细菌产生的 IA 有可能增加IL-10的产生和MUC基因的表达,这可能对炎症性肠病患者有利。
吲哚对于肠出血性大肠杆菌的发病机制至关重要。出血性结肠炎是一种出血性腹泻,可导致溶血性尿毒症综合征,由人类病原体大肠杆菌O157:H7引起。
✦ 吲哚减少了肠出血性大肠杆菌的定值
根据表面相关EHEC的DNA微阵列研究,吲哚降低了EHEC中与表面定植和致病性有关的基因表达。
吲哚可以被加氧酶氧化,产生新的种间生物膜信号,从而以多种方式影响相同的表型(生物膜产生)。大肠杆菌K-12和肠道内其他共生菌产生的吲哚可能会限制大肠杆菌K-12生物膜的产生,并通过改变SdiA的表达来降低非致病性大肠杆菌的运动性,从而影响EHEC趋化性和粘附力。粘附测定证实,吲哚可在体外减少EHEC与上皮细胞的附着。
总之,吲哚通过改变肠出血性大肠杆菌毒性基因的表达、减少其运动性和生物膜形成以及减少粘附来减轻肠出血性大肠杆菌感染并改善出血性结肠炎。
根据越来越多的数据,肠道吲哚,特别是色氨酸代谢物,似乎在结直肠癌中发挥着重要作用。吲哚刺激AhR,它可以直接作用于肠道干细胞,维持MUC合成并改善肠道屏障功能。
然而,在炎症相关结直肠癌发生模型中,阻断吲哚-AhR信号通路会显著增加TNF-α、IL-1β和IL-6 mRNA水平。
此外,吲哚衍生物色胺会抑制吲哚胺2,3-双加氧酶(IDO1),该酶参与肿瘤免疫耐受。这些发现表明肠道菌群产生的吲哚可能会减缓结直肠癌的进展。
与健康个体相比,结直肠癌患者的吲哚/色氨酸比率较低,犬尿氨酸(kyn)/色氨酸比率较高。在结直肠癌患者中,犬尿氨酸和IDO1的表达增加,吲哚的产生减少。
吲哚产生的下降削弱了对结肠癌的抑制作用。总体而言,有证据表明微生物色氨酸-吲哚代谢途径的改变在结直肠癌的发病机制中发挥着重要作用。
较高的吲哚-3-丙酸血清浓度可降低患2型糖尿病的可能性,并增强胰岛素分泌和敏感性。
研究发现,与喂食对照饮食的大鼠相比,喂食吲哚-3-丙酸饮食的大鼠的空腹血糖水平显著降低。根据其他研究,吲哚可以调节小鼠结肠成纤维细胞释放胰高血糖素样肽-1(GLP-1)。
✦ 吲哚调节胰高血糖素样肽-1的释放
吲哚在短时间内增加GLP-1的释放,在较长时间内减少其分泌。这些作用结果的产生是因为吲哚可以影响L细胞的两个关键化学途径。
在某种程度上,吲哚可以抑制电压门控K+通道,增加L细胞诱导的动作电位持续时间,并导致Ca2+进入大量增加,从而快速促进GLP-1的分泌。吲哚抑制了NADH脱氢酶,随着时间的推移减缓ATP的生成并降低GLP-1的释放。
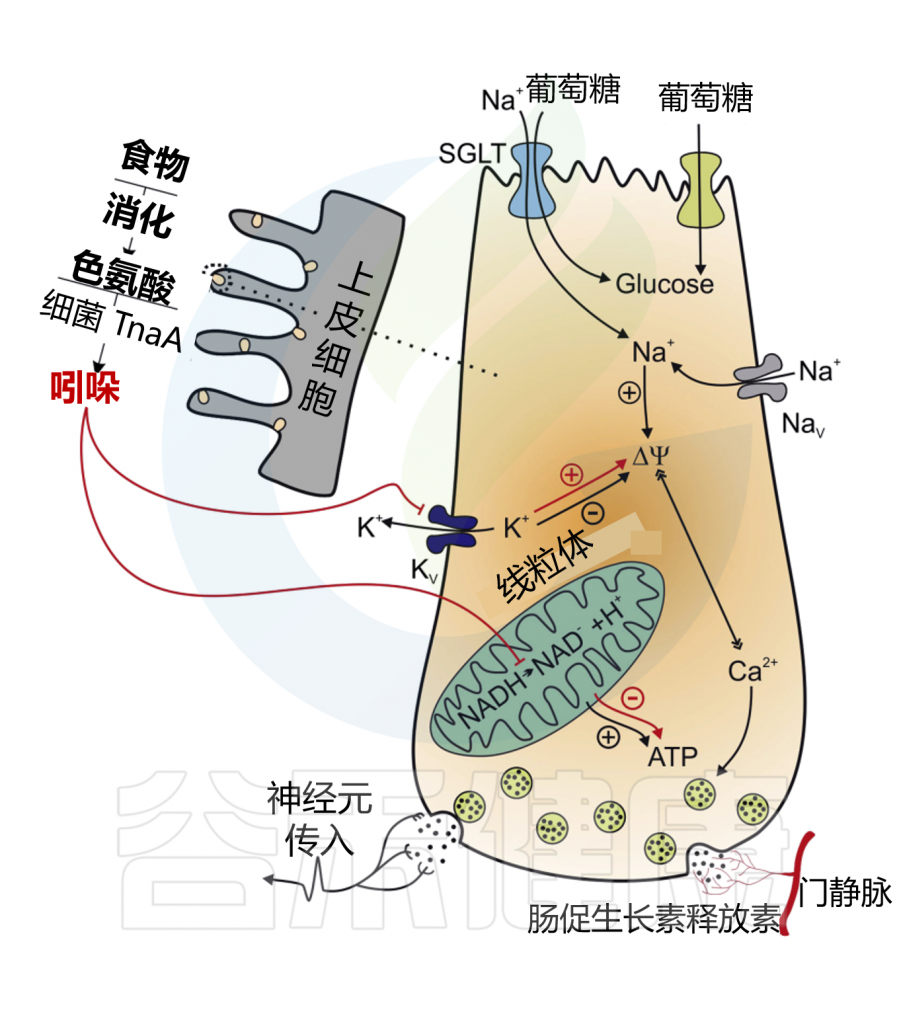
Chimerel C,et al.Cell Rep.2014
肠道内的吲哚可能还会影响食欲,同时,吲哚-3-丙酸具有强大的抵抗氧化应激的能力,这表明这种代谢物可以保护β细胞免受代谢和氧化应激相关的损伤以及淀粉样蛋白积累。因此,肠道微生物群代谢产生的吲哚-3-丙酸对2型糖尿病具有保护作用。
体外实验发现,吲哚丙酸也是嗜肺军团菌(Legionella pneumophila)生长的强效抑制剂,且抑菌效果随着吲哚丙酸浓度和暴露时间的增加而增强。因此,吲哚丙酸可以抑制细菌引起的肺部炎症。
HIV阳性患者通常更容易感染结核病,这是死亡率增加的重要因素,两种疾病的共同感染可能会因抗逆转录病毒药物和抗结核药物之间的相互作用而使治疗复杂化。
值得注意的是,吲哚丙酸可能是此类治疗中潜在的药物成分。有研究发现,接受抗逆转录病毒治疗的HIV患者体内吲哚丙酸含量显著下降,这是区分HIV感染者与健康人的重要标志物。
这种作用的机制尚不清楚,但部分原因是肠道屏障受损导致脂多糖和脂多糖结合蛋白易位,从而加剧全身炎症反应。此外,接受抗逆转录病毒治疗的HIV患者也容易出现非酒精性脂肪性肝病/非酒精性脂肪性肝炎,进一步说明了吲哚丙酸在各种疾病中的多种治疗潜力。
相比之下,吲哚丙酸是一种小分子代谢产物,具有良好的药代动力学特性,很容易被宿主吸收,充分发挥治疗作用。
未来,吲哚丙酸有望通过其作为抗结核病和抗逆转录病毒药物的补充的潜力来改善某些疾病的现有治疗选择。
吲哚丙酸可以触发孕烷X受体(PXR),一种生物量激活的核受体,存在于包括血管内皮在内的各种组织中,以调节内皮功能。
吲哚丙酸通过PXR调节主动脉和肺动脉导管中激动剂诱导的内皮依赖性松弛。这种调节主要是由于内皮一氧化氮合酶产生的一氧化氮的改变,而内皮一氧化氮合酶受到吲哚丙酸介导的PXR激活的抑制。
然而,破坏肠道微生物群并降低吲哚丙酸丰度的抗生素治疗会通过改变内皮PXR途径来改变吲哚丙酸的血管舒张作用。
而微生物代谢的吲哚丙酸补充可以提高全身吲哚丙酸水平并刺激PXR表达,从而逆转抗生素治疗引起的主动脉和肺动脉中激动剂诱导的内皮依赖性血管舒张的增强。
注:吲哚与血管的相互作用可能会显著改变传统传染病或结肠手术相关的抗生素治疗,导致微生物群落紊乱。
尽管吲哚对于改善肠道甚至全身疾病至关重要,但它们中的一些仍然会产生负面影响,例如硫酸吲哚酚(IS)、吲哚基-β-d-葡萄糖苷和吲哚乙酸。
硫酸吲哚酚是最重要的肾毒性代谢产物之一,其肾毒性已在临床研究中得到广泛证实。此外,一些吲哚类物质还会对胃肠系统、神经系统和心血管系统产生毒性。
越来越多的证据表明吲哚和吲哚化合物对大脑代谢、生理和宿主行为有影响。在拥有产生吲哚的大肠杆菌的大鼠中,吲哚的慢性过量产生已被证明会增强焦虑样行为和抑郁。
另一项研究还发现,给予常规大鼠肠道内吲哚可以激活一个称为迷走神经背侧复合体的大脑核。通过比较与非吲哚产生大肠杆菌菌株或吲哚产生大肠菌菌株单体相关的小鼠,发现肠道微生物群的长期高吲哚产生增加了慢性压力对整体情绪行为不利影响的敏感性。
✦ 可能影响儿童自闭症的发病率
在人类中,一项研究发现,患有自闭症谱系障碍的儿童在大便样本中吲哚水平较健康儿童低,而3-甲基吲哚水平升高。 这两种吲哚与患者中更常见的梭菌属细菌有关。
肠道微生物代谢活性产生的血浆吲哚升高与肝性脑病有关,这是由肝功能障碍引起的神经精神障碍,以及个体意识、行为和个性的变化。
此外,NutriNet-Santé观察性前瞻性研究的结果表明,尿液中吲哚和吲哚化合物浓度与反复发作的抑郁症状呈正相关。这种相关性提出了这样一个假设:肠道微生物过度产生这些化合物可能在人类情绪障碍的出现中起到作用。
硫酸吲哚酚由肠道菌群和宿主共同代谢。肠道菌群用酶分解食物中的色氨酸生成吲哚,然后由门静脉携带至肝脏,在细胞色素P450酶和磺基转移酶的作用下转化为硫酸吲哚酚。
硫酸吲哚酚通过上调IRF1表达、抑制动力相关蛋白1表达并干扰线粒体自噬通量来诱导肠上皮细胞(IEC)损伤。硫酸吲哚酚通过以浓度依赖的方式增加活性氧的释放,在IEC-6细胞中引起氧化应激。
硫酸吲哚酚还抑制NRF2激活,降低抗氧化防御细胞系统并抑制血红素加氧酶-1、NAD(P)H 脱氢酶和超氧化物歧化酶的表达。
在IEC-6细胞中,硫酸吲哚酚处理可显著增加TNF-α的释放、环氧合酶-2和诱导型一氧化氮合酶的产生以及硝基酪氨酸的合成,表明肠上皮细胞是硫酸吲哚酚诱导的肠道炎症的靶点。
与硫酸吲哚酚一起培养的结肠显示出收缩性降低,这表明该毒素可能对结肠平滑肌细胞产生有害影响并导致肠道蠕动受损。
微生物群代谢物硫酸吲哚酚在中枢神经系统疾病的发生中也具有致病作用。众所周知,慢性肾病和心血管疾病常常是由硫酸吲哚酚引起的。此外,肾功能不全会导致尿毒症毒素在大脑中积聚,导致中枢神经系统功能异常。
✦ 损伤神经元和神经干细胞
其次,硫酸吲哚酚可损伤神经元和神经干细胞,损害神经营养因子和神经递质,诱发氧化应激和神经炎症。例如,通过作用于中枢神经系统胶质细胞,硫酸吲哚酚促进神经炎症并表现出促炎作用。
小鼠表现出情绪障碍和神经元退化的行为证据,如焦虑、抑郁和认知功能障碍。这些相应的器质性病变伴随着这些行为变化。这也表明硫酸吲哚酚和中枢神经系统疾病之间似乎存在病理联系。
吲哚对神经和神经精神疾病的影响
编辑
Zhou Y,et al.Neuropharmacology.2023
硫酸吲哚酚对大脑产生有益或有害的影响取决于含量:
通过比较患有抑郁症的志愿者和健康参与者,鉴定出了22种尿液代谢物,并且两组受试者之间的丰度存在差异。患有严重抑郁症的个体尿液中硫酸吲哚酚浓度低于健康人。在志愿者中,血清硫酸吲哚酚浓度与精神焦虑和相关的基于功能磁共振成像的神经特征有关。
在实验性自身免疫性脑脊髓炎的小鼠模型中,每日腹腔注射硫酸吲哚酚(10mg/kg)可调节星形胶质细胞活性,并通过芳基烃受体对中枢神经系统发挥抗炎作用。相反,当大鼠口服较高剂量(100和200mg/kg)的硫酸吲哚酚时,观察到空间记忆受损以及运动和探索活动减少。
另一项研究发现,单次腹腔注射更大剂量(800mg/kg)的硫酸吲哚酚会引起与神经元坏死相一致的大脑组织学变化。硫酸吲哚酚在15-60微摩尔范围内使用时,会诱导原代星形胶质细胞产生自由基氧,并导致海马神经元细胞死亡。在10微摩尔浓度下,硫酸吲哚酚通过氧化应激诱导人星形胶质细胞凋亡。
在慢性肾病(CKD)患者中,硫酸吲哚酚与心血管健康和全因死亡率相关。硫酸吲哚酚是血液透析患者发生心血管疾病的重要因素。在血液透析中,发现游离形式硫酸吲哚酚水平与成纤维细胞生长因子23呈正相关,与C-C基序趋化因子15、补体成分C1q受体、串珠素(Perlecan)、博来霉素水解酶、分化簇166抗原和信号淋巴细胞活化分子家族成员5呈负相关。
这些蛋白质在血管修复和内皮生长中发挥着至关重要的作用。硫酸吲哚酚还可以通过增加血小板过度活跃、提高血浆促凝血水平和产生促凝血颗粒来导致血栓形成和动脉粥样硬化。硫酸吲哚酚通过增加炎症、心脏纤维化、心肌细胞增殖来影响心脏组织。
并且强有力的证据表明,硫酸吲哚酚在肾功能不全的情况下积累时是有害的。硫酸吲哚酚会损害近端肾小管细胞并诱导炎症和纤维化发展。肾脏通过肾小管分泌实现硫酸吲哚酚的高清除率,而硫酸吲哚酚与血浆蛋白结合超过90%,受到蛋白结合的限制,并且血液透析患者的血浆水平相对较高,这也表明与肾脏疾病密切相关。
啮齿动物口服新霉素(一种广谱抗生素)会降低脑内羟吲哚含量,因此表明羟吲哚至少部分源自肠道微生物群代谢活动。
有趣的是,最近在人类粪便样本中发现了羟吲哚,从而证实肠道微生物是这种代谢物的来源。在人类粪便中存在的细菌代谢物中,羟吲哚被发现是主要的芳基烃受体激活剂之一。
大鼠海马切片的体外实验表明,羟吲哚可能与电压门控钠通道相互作用,增加产生动作电位的阈值,从而大大降低神经元的兴奋性。
大胆推测
这些结果说明羟吲哚可能与已知的神经抑制化合物具有一些共同特征,从而能够降低神经元的兴奋性
吲哚及其衍生物可以影响肠道健康甚至是全身其他器官的健康,而过高或过低的水平都可能带来不利影响,导致一些疾病的发生。
调节人体内吲哚水平的机制主要有3种:首先,它可以通过调节与吲哚产生相关的肠道微生物群的丰度来影响吲哚的水平。
先前的研究发现,特定的肠道微生物群成员在色氨酸转化为吲哚的过程中发挥着不可或缺的作用,例如产孢梭菌(Clostridium sporogenes),它已被证明可以通过氧化和还原途径产生吲哚乙酸和吲哚-3-丙酸。在大肠杆菌中也发现了吲哚活性转运蛋白,在乳杆菌中也发现了色氨酸酶的表达,并有助于将色氨酸转化为吲哚。
其次,饮食调整可以增加或减少色氨酸的摄入量,从而间接影响体内的吲哚水平。
最后,直接作用于AHR受体激动剂的药物可能会发挥与吲哚类似的作用。
益生菌可以通过多种机制与体内微生物群相互作用,对宿主健康产生有益影响。
临床试验表明,益生菌可以抵消肠道微生物失衡造成的负面影响,并可导致吲哚产生属及其衍生物的富集,如乳杆菌(Lactobacillus)。在另一项临床试验中,具有抗炎作用的双歧杆菌属在益生菌治疗后的丰度也显著增加。
益生菌还有可能成为神经和精神疾病的治疗辅助药物。在一项针对抑郁症和海马体功能变化的研究中,接受益生菌治疗的小鼠表现出肠道微生物生态失调的显著缓解,以及较低的肠道炎症介质如IL-1β、TNF-α和iNOS的表达水平。此外,情感行为也被检测到与肠道微生物群组成变化相关的显著改善。
益生元是宿主细菌可以选择性利用并提供健康益处的底物。常见的益生元包括低分子量碳水化合物、多酚和多不饱和脂肪酸。
在实验室和临床试验中,益生元(包括菊粉和低聚半乳糖)已被证明可以显著提高产生吲哚的益生菌(例如双歧杆菌和乳酸杆菌)的丰度。在对肠道微生物失衡进行一定纠正后,吲哚作为具有调节作用的配体,对炎症反应具有抑制作用。
合生元是益生菌和益生元的混合物。在大鼠实验中,合生元治疗逆转了肠道微生物特定菌群丰度的变化。
经过合生元(乳杆菌、双歧杆菌、链球菌和菊粉的组合)治疗的患有慢性肾病的大鼠中,肠道中产生吲哚的产气荚膜梭菌的丰度降低至正常水平。此外,合生元治疗可通过改变肠道微生物丰度来有效调节粪便中吲哚及其衍生物的水平。
合生元治疗由于其对吲哚水平的间接影响,可能成为许多神经系统和神经精神疾病的辅助治疗。最近一项针对阿尔茨海默病患者的临床实验表明,在使用合生元后,神经炎症有所减轻。
值得注意的是,合生元干预的改善效果优于单独的益生元或益生菌干预,这表明复合干预的组合更有可能成为临床治疗的实际应用。
粪便微生物移植(FMT)在先前的几项研究中已被证明对缓解胃肠道微生物失调具有不可否认的作用。通过FMT将产生吲哚的益生菌(乳酸杆菌、双歧杆菌等)移植到患者的肠道中,可以改善肠道微生物群。据观察,肠道中产生吲哚的微生物群的丰度增加,吲哚及其衍生物的水平受到间接影响。
吲哚是色氨酸代谢途径上的关键配体,可以调节和抑制神经和精神疾病的炎症。粪菌移植已被证明在各种疾病和临床治疗中对改善患者的肠道生态起着至关重要的作用,它可以通过吲哚在中枢神经系统疾病治疗中间接发挥作用,并被认为是一种潜在的辅助疗法。
肠道微生物通过色氨酸调节吲哚水平。色氨酸是人体必需氨基酸之一,需要完全依赖饮食摄入。
以下是一些富含色氨酸的常见食物:
蛋白质食物:肉类(牛肉、猪肉、鸡肉、火鸡)、鱼类(鳕鱼、鲑鱼、金枪鱼)、贝类(蛤蜊、扇贝)、蛋(鸡蛋、鸭蛋)、豆类(大豆、黑豆、红豆)、奶制品(牛奶、乳制品)等。
蔬菜和水果:菠菜、花椰菜、蘑菇、芝麻、松子、香蕉、菠萝、樱桃、草莓、蓝莓等。
谷物和豆类:燕麦、大麦、小麦、黑米、糙米等。
坚果和种子:核桃、杏仁、腰果、葵花子、南瓜子、亚麻籽等。
研究表明,0.4%膳食色氨酸可显著减少衰老小鼠的神经退行性病变和神经炎症。在此过程中,补充色氨酸可以通过改变肠道微生物组成并增加阿克曼氏菌等有益细菌的丰度来增强肠粘膜屏障功能。肠道菌群产生的吲哚类物质(如吲哚乙酸、吲哚-3-丙酸)显著升高,可以激活AHR,从而抑制神经炎症。
通过血清靶向代谢组学分析和16s rRNA测序对全身色氨酸代谢和肠道微生物组进行了分析,进一步证实了微生物群-肠-脑轴在调节色氨酸饮食产生吲哚的潜在作用。
虽然色氨酸饮食是一种可能的治疗策略,但过多的色氨酸摄入也被证明具有有害作用,应注意适量摄入。
此外,据报道,间歇性禁食还可能通过调节肠道微生物组成来影响血浆吲哚,从而对神经和神经精神疾病的预后产生有益影响。饮食调节可能是改善吲哚含量的一种简单但有效的方法。
最近的综合研究表明,吲哚通过作用于靶细胞来调节炎症反应和细胞生理。近年来,开发吲哚类作用靶点的药物一直是一个重要的研究热点。
吲哚及其衍生物充当AHR的配体,并通过AHR间接调节星形胶质细胞和小胶质细胞的炎症。因此,直接作用于AHR的激动剂也可以作为内源性AHR配体(如吲哚)的替代品,并参与色氨酸AHR介导的炎症抑制途径。
体外合成的AHR配体2-(1′H-吲哚-3′-羰基)-噻唑-4-羧酸甲酯在一项临床研究中被证明具有抑制自身免疫性脑脊髓炎进展的能力。对AHR具有激动作用的药物有可能取代色氨酸代谢产物,并作为外源性AHR配体激活自限制途径和修复神经和神经精神疾病。
除了靶向AHR,影响吲哚作用途径中其他靶点的药物也可能具有治疗作用,这需要在未来进行更多的研究。
由于吲哚是肠道细菌常见的代谢产物,其重要的生物学作用不容忽视。吲哚与肠道菌群的稳态和肠道健康直接相关,吲哚还可以间接影响其他系统和人体的整体健康。
吲哚对人类健康具有有益影响,通过激活免疫细胞释放抗炎因子如IL-22来调节肠道屏障并帮助维持肠道稳态,抑制包括肠出血性大肠杆菌在内的病原菌的定植,以及增加MUC表达以增强粘液屏障功能。
此外,吲哚在调节肠道微生态方面也起着关键作用。它们抑制有害菌株,并以影响基因表达的方式改变肠道致病菌的毒力,这有助于缓解出血性结肠炎等疾病。同时,吲哚及其衍生物在激活AhR和PXR介导的抗炎途径中至关重要。例如吲哚-3-丙酸通过PXR介导肠细胞TNF-α的下调,并上调编码生长抑素的mRNA,以调节炎症中的肠道通透性和肠道屏障功能。这意味着吲哚及其衍生物有前景的治疗途径。
尽管如此,吲哚也是一把双刃剑,少数衍生物也存在一定的缺点。例如,吲哚肝脏代谢产生的硫酸吲哚酚在高浓度时具有肾毒性和心血管毒性,可通过促进氧化应激、炎症等病理变化而导致多系统功能障碍。
吲哚在肠道稳态和人类健康中发挥着至关重要的作用。许多肠道细菌被鉴定为将色氨酸代谢为吲哚。尽管如此,仍可能存在未鉴定的细菌,因此未来需要使用代谢组学和宏基因组学来进一步表征未知的吲哚产生细菌及其相关代谢途径。
不同浓度的吲哚发挥着不同的生理功能。健康成年人的粪便吲哚浓度是已知的,而人类肠道和血液中许多吲哚衍生物的浓度仍然未知。缺乏在不同环境中测定吲哚及其衍生物浓度的定量方法,未来需要开发简单快速的测定方法。
未来仍需进一步研究吲哚与人类健康之间的关系。需要研究多种吲哚组合对宿主生理学的影响,并将这些发现与临床环境相结合,以开发相关疾病的新疗法。
主要参考文献
Zhou Y, Chen Y, He H, Peng M, Zeng M, Sun H. The role of the indoles in microbiota-gut-brain axis and potential therapeutic targets: A focus on human neurological and neuropsychiatric diseases. Neuropharmacology. 2023 Nov 15;239:109690.
Tennoune N, Andriamihaja M, Blachier F. Production of Indole and Indole-Related Compounds by the Intestinal Microbiota and Consequences for the Host: The Good, the Bad, and the Ugly. Microorganisms. 2022 Apr 28;10(5):930.
Ye X, Li H, Anjum K, Zhong X, Miao S, Zheng G, Liu W, Li L. Dual Role of Indoles Derived From Intestinal Microbiota on Human Health. Front Immunol. 2022 Jun 17;13:903526.
Lee JH, Lee J. Indole as an intercellular signal in microbial communities. FEMS Microbiol Rev. 2010 Jul;34(4):426-44.
Jiang H, Chen C, Gao J. Extensive Summary of the Important Roles of Indole Propionic Acid, a Gut Microbial Metabolite in Host Health and Disease. Nutrients. 2022 Dec 28;15(1):151.
Kumar A, Sperandio V. Indole Signaling at the Host-Microbiota-Pathogen Interface. mBio. 2019 Jun 4;10(3):e01031-19.
Chimerel C, Emery E, Summers DK, Keyser U, Gribble FM, Reimann F. Bacterial metabolite indole modulates incretin secretion from intestinal enteroendocrine L cells. Cell Rep. 2014 Nov 20;9(4):1202-8.
Lu Y, Yang W, Qi Z, Gao R, Tong J, Gao T, Zhang Y, Sun A, Zhang S, Ge J. Gut microbe-derived metabolite indole-3-carboxaldehyde alleviates atherosclerosis. Signal Transduct Target Ther. 2023 Oct 4;8(1):378.

谷禾健康

在过去的几十年里,肥胖患病率的持续快速增长。成为了许多国家的主要医疗保健问题,尤其是在2019年新冠状病毒时代以来。
肥胖是包括心血管疾病在内的一系列疾病不断扩大的风险因素。2型糖尿病、慢性肾病、非酒精性脂肪肝病, 负重过大导致的关节炎,甚至许多癌症都与肥胖有关。
▸ 肥胖的定义
肥胖定义为身体脂肪过度积累到可能对健康产生不利影响的程度。
一般使用体重指数(BMI;体重(千克)除以身高(米)的平方)进行评估。
我国规定的BMI正常范围在18.5-23.9之间,24-27.9为超重,超过28则为肥胖。
肥胖不是单纯的体重增加,而是体内脂肪组织积蓄过剩的状态。肥胖是指一定程度的明显超重与脂肪层过厚,是体内脂肪,尤其是甘油三酯积聚过多而导致的一种状态。
主要原因是由于能量摄入过多或机体代谢的改变而导致体内脂肪积聚过多造成体重过度增长并引起人体病理、生理改变或潜伏。
▸ 引起肥胖的因素
肥胖是一个多因素问题,不仅限于饮食或缺乏运动的原因,还包括遗传、环境和心理社会因素,这些因素通过能量摄入和消耗的生理介质起作用。
肠道微生物组是这些环境因素之一;大约 20年前,在小鼠研究中已经确定了脂肪储存和肠道微生物组之间的联系。粪便微生物群移植研究提供了更切实的证据。
本文结合了最新的学术研究和谷禾健康数据库,涵盖了不同的角度,既关注单个细菌的作用,也特别强调整个微生物组的组成,以试图解开肠道微生物组与肥胖的关系。
让人们更好地了解肥胖以及其发病机制,在此基础上提出一些预防和治疗肥胖的建议,使人们拥有更健康的生活。
本文主要从以下几个方面讲述
●肠道微生物对肥胖发病机制的影响
●菌群代谢物对肥胖的影响
●健康与肥胖人群中的细菌比例
●肥胖与肠道微生物的研究分类
●微生物多样性与人体健康有关
●肥胖与肠道微生物的未来研究方向
●预防和治疗肥胖的一些建议
学术专业用词缩写
PRR—模式识别受体
NOD2—核苷酸结合寡聚化结构域2
FXR—法尼醇X受体
TLR5—TOLL样受体5重组蛋白CDI—复发性艰难梭菌感染
BSH—胆盐水解酶
GLP1—胰高血糖素样肽-1
GPR—G蛋白偶联受体
01
肠道微生物对肥胖发病机制的影响
研究肥胖的发病机制,有助于我们更好地了解肥胖,并以此制定相应的治疗方案。实验研究发现肠道微生物对肥胖的发病机制存在一定的影响。
许多研究已经确定了肠道微生物群与宿主免疫系统之间的关联。其中一个发现是肥胖与肠道微生物引起的慢性低度炎症有关。
肠道微生物群和肠道细胞之间的密切接触是由微生物相关分子模式介导的,这些分子模式可以与上皮细胞和免疫细胞中的模式识别受体 (PRR) 结合。
这些识别受体属于先天免疫系统,控制炎症和免疫反应。PRR还可以检测宿主细胞释放的损伤相关分子模式。
✦革兰氏阴性菌中的脂多糖易引起炎症
脂多糖 (LPS)是革兰氏阴性菌外膜的一种特有成分,由脂质和多糖构成,似乎会引起小鼠的低度炎症。
在这里列举了一些常见的革兰氏阴性菌:
大肠杆菌、变形杆菌、痢疾杆菌
肺炎杆菌、布氏杆菌
需要注意的是,大部分革兰氏阴性菌对人体都有害
在一项人体研究中进行了类似的观察,其中能量摄入与内毒素血症和伴随的炎症有关。
事实上,与健康对照组相比,在患有2型糖尿病的受试者中,革兰氏阴性菌的数量明显更多。
脂多糖通过脂多糖分化受体14(CD14)和辅助受体 toll样受体 (TLR4)引起炎症,这反过来又导致脂肪细胞产生的促炎细胞因子增加。
●饮食在脂多糖中起重要作用
果胶可抑制脂多糖诱导的单核细胞或树突状细胞中的TLR4活化,而果糖或高脂肪饮食导致含有脂多糖的变形菌增加,瘦素信号与饱腹感和能量平衡紊乱有关,因此失调。
在此列举了一些高果糖高脂食物:
1.蜂蜜和市面上一些甜的饮料果糖含量较高;
2.淀粉类:经油炸加工的馅饼、油条、葱油饼、油糕等食物中,含有大量脂肪与糖分;
2、肉类:用糖汁、糖煎、糖烧的方法进行烹调的红烧肉、炸鸡等,也为高糖高脂食物;
3、奶油制品食物:如奶油蛋糕、奶茶、泡芙等甜品,主要原材料为淀粉与黄油等物质,所以也有较高的糖分与脂肪。
同时还表明,分泌型脂蛋白脂肪酶(LPL)抑制剂血管生成素样蛋白4(一种禁食诱导的脂肪因子)可被微生物群抑制,进而导致分泌型脂蛋白脂肪酶活性增加和白色脂肪组织中的脂肪储存。
✦肽聚糖影响体内平衡
另一个例子是肽聚糖,它是细菌细胞壁的一种成分,对人体内平衡很重要。
核苷酸结合寡聚化结构域2 (NOD2) 是肽聚糖的产物,是一种位于上皮细胞和免疫细胞内的胞质 ,能够感知胞壁酰二肽。
这种胞质对于病原体入侵和几种炎症性疾病期间的免疫反应至关重要,从而调节粘膜细菌定植。
// 一些关于NOD2的研究案例
NOD2缺乏的小鼠在高脂饮食期间显示出脂肪组织、肝脏炎症和胰岛素抵抗增加。因此经常用于糖尿病研究。
在具有功能性NOD2受体的肥胖小鼠中,胞壁酰二肽识别显示可减少脂肪炎症和胰岛素抵抗,而不会减轻体重或改变肠道微生物群组成。
上述案例在一定程度上可以说明NOD2对于减轻肥胖和肠道微生物群稳定具有一定作用。
✦Toll样蛋白受体影响免疫
——Toll样受体5(TLR5)重组蛋白是免疫系统的关键成分,还是单体鞭毛蛋白的传感器,可以检测细菌感染并启动宿主抗菌的防卫反应。
肠道微生物群也通过位于上皮细胞上的TLR5与免疫系统相关联。
免疫系统通过TLR5感知肠道微生物群的组成和肠道微生物群的定位,以避免共生肠道微生物群传播到肠外器官、产毒成员的过度生长以及机会性病原体的过度生长和入侵。TLR5检测鞭毛蛋白会导致白细胞介素-22的产生,从而预防与肠道炎症相关的疾病。
// 关于TLR5影响免疫在小鼠中的研究
与野生型无菌小鼠相比,TLR5缺陷小鼠的胰岛素抵抗和肥胖水平增加。肠道微生物群从这些TLR5缺陷小鼠转移到野生型无菌小鼠也导致这些野生型小鼠代谢综合征的相似特征转移。
一项调查缺乏TLR5受体的小鼠的研究,观察到鞭毛蛋白特异性免疫球蛋白的丢失导致鞭毛细菌增加,包括许多变形杆菌,以及粘膜屏障破坏和炎症增加。
肠道微生物影响宿主免疫的推定机制
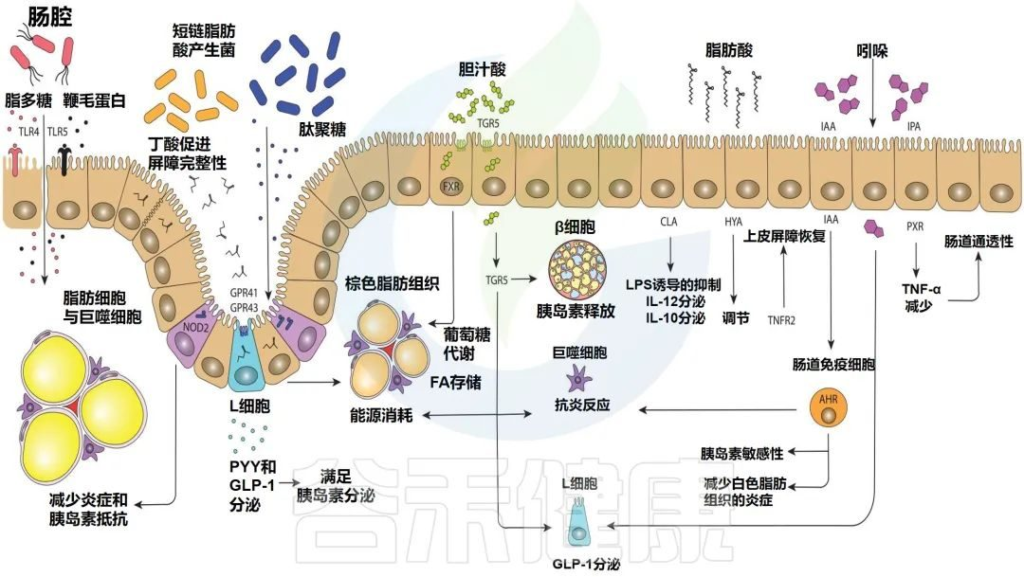
Levin E,et al.Therap Adv Gastroenterol.2022
部分肠道微生物群的鞭毛蛋白和脂多糖可以与toll样受体重组蛋白结合,而细胞内NOD2感知肽聚糖。几种短链脂肪酸的产生可以与GPR41和GPR43(2种特异性短链脂肪酸受体)结合,导致PYY(肽YY(一种新的胃肠道激素,具有抑制胃肠运动和胃酸分泌等作用))和GLP-1(胰高血糖素样肽-1)的表达增加。
胆汁酸激活TGR5和FXR(一种胆汁酸的受体)),影响脂质和葡萄糖代谢。脂肪酸,如HYA,调节TNFR2,参与上皮屏障恢复。吲哚通过GLP-1调节和AHR的激活以及与PXR 的结合影响宿主。
注意
事实上,与瘦的人相比,肥胖的人往往有的粪便鞭毛蛋白、更少的粪便抗鞭毛蛋白IgA和更高水平的慢性肠道炎症。
02
菌群代谢物对肥胖的影响
短链脂肪酸
短链脂肪酸(SCFA)主要是微生物厌氧发酵的衍生终产物,对宿主具有多种影响。它是一组少于六个碳的羧酸,包括乙酸盐、丙酸盐和丁酸盐。这些短链脂肪酸及其比例在几种不同的组织中具有多种有益的作用。
✦短链脂肪酸有利于肠道环境的稳态
短链脂肪酸被认为是人类宿主的能量来源和能量调节剂,但它们也有助于维持肠道环境的稳态。短链脂肪酸的细胞外活性主要由G蛋白偶联受体(GPRs)介导。
这些受体在多种细胞上表达,包括肠上皮细胞、脂肪细胞、肠内分泌L细胞、先天免疫细胞和体细胞感觉神经节的神经元。
✦短链脂肪酸会影响饱腹感
短链脂肪酸参与L细胞产生的肽YY和胰高血糖素样肽1(GLP1) 激素的调节。这两种激素都调节神经系统的饱腹感,GLP1在葡萄糖刺激的胰岛素敏感性和分泌中也起作用。
饱腹感也由丙酸盐通过激活脂肪细胞中的游离脂肪酸受体3(FFAR3)来控制,因为这些脂肪细胞会产生瘦素。微生物衍生的丁酸盐和丙酸盐都会诱导肠道糖异生,进而诱导对葡萄糖和能量稳态的有益影响。
✦短链脂肪酸促进能量消耗
研究显示丁酸盐通过游离脂肪酸受体2(FFAR2)的活化刺激棕色脂肪组织的活化,从而显著促进能量消耗。并且脂肪积累被丁酸盐诱导的白色脂肪组织中的游离脂肪酸受体2活化抑制。最后,丁酸盐通过降低肠屏障的通透性来减少上皮细胞中的细菌易位。
在肠道内,短链脂肪酸的产生通过各种中间体发生。不同的物种,在产生这些中间体和最终产物的每个步骤中使用不同的酶,都参与了这个过程。
●2型糖尿病中产丁酸盐菌丰度较低
在2型糖尿病中,许多研究看到的一个共同趋势是,糖尿病患者的丁酸盐生产者(如Roseburia和Faecalibacterium)的丰度低于对照组,这可能取决于饮食。
在肥胖症中也可能如此,短链脂肪酸的过量生产可能会导致更高的能量可用性和摄入量。
事实上,一项比较肥胖与瘦的受试者的研究表明,肥胖者的总短链脂肪酸水平较高,但必须指出,肥胖与丙酸盐水平特别相关。
胆汁酸
胆汁酸是胆汁的重要成分,在脂肪代谢中起着重要作用。 胆汁酸主要存在于肠肝循环系统并通过再循环起一定的保护作用。
许多研究报告了肠道微生物组、胆汁酸和肥胖或肥胖相关疾病之间存在联系。
初级胆汁酸通过两种途径在肝细胞中产生:
产生大部分胆汁酸的经典途径是由细胞色素P450中的胆固醇7α-羟化酶启动的。
替代途径由细胞色素P450中的27α-羟化酶启动。
注:细胞色素P450——一个很大的可自身氧化的亚铁血红素蛋白家族,属于单氧酶的一类,因其在450纳米有特异吸收峰而得名。它参与内源性物质和包括药物、环境化合物在内的外源性物质的代谢。
7α-羟化酶和27α-羟化酶都属于细胞色素P450中的成员。
经典途径中的一种中间体胆固醇7α-羟化酶与总血浆甘油三酯浓度相关,表明肝胆汁酸合成对于调节肥胖者的血浆甘油三酯水平很重要。
胆汁酸的作用途径
产生的初级胆汁酸是胆酸、鹅去氧胆酸和猪胆酸。这些初级胆汁酸与甘氨酸或牛磺酸结合。餐后,这些结合物被分泌到胆汁中并释放以促进膳食脂肪的溶解和吸收。
此后,肠道微生物群使用胆盐水解酶(BSHs)去结合初级胆汁酸。
Bifidobacterium spp., Lactobacillus spp., Enterococcus spp.和Methanobrevibacter spp.,这些细菌中都含有这些胆盐水解酶。
接下来,这些去结合的初级胆汁酸随后被转化为次级胆汁酸。
注:这是通过肠道微生物群的脱氨基作用和7α-羟化酶的脱羟基化来完成的。
在最后阶段,胆汁酸被回肠远端吸收,完成肠肝循环。产生的次级胆汁酸是脱氧胆酸和石胆酸。这些胆汁酸参与调节能量消耗,以及炎症和葡萄糖代谢和脂质代谢。
这表明这些胆汁酸在肥胖的病理生理学中非常重要,因为与肥胖相关的肠道微生物群的改变包括胆汁酸池大小和组成的变化。
✦不同胆汁酸具有不同的作用
不同的胆汁酸对各种肠道受体具有不同的亲和力,例如与膜结合的蛋白偶联受体(TGR)以及法尼醇X受体(FXR) 。
注:TGR5—是一种G蛋白偶联受体,不仅是胆汁酸的受体,也是多种选择性合成激动剂的受体。
法尼醇X受体(FXR):一种胆汁酸受体,被特定胆汁酸代谢物激活后发挥转录因子作用,参与调控胆汁酸的合成和肠肝循环,影响机体的糖脂代谢。
在小鼠中,已经表明肠道菌群通过FXR受体促进饮食诱导的肥胖。
在脂肪组织中,脂肪细胞分化受FXR通过促进过氧化物酶体增殖物激活受体γ活性,进而调节脂肪酸储存和葡萄糖代谢。
在棕色脂肪组织中,能量消耗因胆汁酸与TGR5结合而增加,随后产生的环磷酸腺苷会增加参与能量稳态的甲状腺激素活化。
在巨噬细胞中,胆汁酸激活TGR5会导致抗炎反应,因为抑制了NF-κb通路和NLRP3依赖性炎症小体活性。FXR和TGR5受体都存在于相似的细胞中,例如胰岛β细胞和肠内分泌L细胞。
在胰岛β细胞中,正向调节合成和葡萄糖诱导的胰岛素分泌。在肠内分泌L细胞中,观察到相反的效果。FXR的激活导致GLP-1分泌的抑制,而TGR5的激活诱导GLP-1的分泌。
✦饮食会影响胆汁酸的含量
几项研究已经将特定的肠道微生物群改变以及胆汁酸成分的改变与肥胖联系起来,同时考虑到饮食的类型。
与富含精制谷物的饮食相比,富含全谷物的饮食导致血浆胆汁酸含量显著增加,包括牛磺鹅去氧胆酸、甘胆酸和牛磺石胆酸。
这被假设为激活FXR和TGR5受体并影响葡萄糖稳态。事实上,高膳食纤维的纯素饮食与Prevotella丰度较高相关被证明可以增强法尼醇X受体的信号通路
与杂食动物相比,纯素食者的粪便胆汁酸含量也显著降低。当杂食动物的饮食中膳食纤维增加时,观察到粪便胆汁酸显著减少。
//研究证明高脂饮食胆汁酸水平升高
在小鼠中,高脂饮食引起的肥胖导致粪便中脱氧胆酸水平升高。此外,高脂肪饮食略微增加总胆汁酸池,特别是增加肝脏和血浆中的脱氧胆酸和牛磺脱氧胆酸水平。
这些变化与以下菌群的丰度增加相关:
Blautia ↑↑↑
Coprococcus ↑↑↑
Intestinimonas ↑↑↑
Lactococcus ↑↑↑
Roseburia ↑↑↑
Ruminococcus ↑↑↑
另一项小鼠研究调查了胆盐水解酶对法尼醇X受体胆汁酸拮抗剂牛磺-β-鼠胆酸的影响,因为法尼醇X受体抑制会导致对肥胖的抵抗。他们发现,乳酸杆菌水平降低与BSH水平降低相关,因此与牛磺酸-β-鼠胆酸水平升高相关。
事实上,从小鼠盲肠中分离出的L.johnsonii被发现表达产生胆盐水解酶的基因,这些基因专门针对牛磺-β-鼠胆酸,提供了肠道微生物群变化与调节法尼醇X受体和胆盐水解酶基因表达之间的机制联系。
然而,与其他产生类似胆盐水解酶的肠道微生物相比,乳酸杆菌对法尼醇X受体拮抗剂浓度的贡献仍不清楚。
一项调查肥胖受试者的人体研究发现了毛螺菌科的瘤胃球菌家族与甘氨脱氧胆酸的比例和血浆中次级胆汁酸与初级胆汁酸的比例呈正相关。
除此之外,Faecalibacterium prausnitzii与粪便中的异石胆酸水平呈负相关。
一项调查肥胖受试者的研究发现,该组的非12-OH胆汁酸比例降低。在同一项研究中,高脂饮食抗肥胖小鼠的这些非12-OH胆汁酸水平升高。
在高脂饮食易肥胖的小鼠中,这些胆汁酸减少并与肠道微生物群的改变有关。在这里,梭状芽孢杆菌减少的很明显,肥胖与肠道微生物群通过胆汁酸池的大小和组成有关,但在单个细菌、特定胆汁酸剖面和肥胖表型之间还没有明确的联系。
因此,还需要进行更多的研究,以将肥胖与胆汁酸谱和胆汁酸池大小与特定细菌组成谱联系起来。
脂肪酸
除了产生胆汁酸外,一些细菌,包括Lactobacilli和Bifidobacteria,还通过多不饱和脂肪酸的饱和代谢产生代谢物。这会产生中间脂肪酸,如羟基、氧代、共轭和部分饱和反式脂肪酸。
结果表明,与无菌小鼠相比,无特定病原体小鼠的羟基脂肪酸水平要高得多,这表明肠道微生物组的脂质代谢会影响宿主体内的脂肪酸组成,因此会影响宿主的健康。
✦增强抗炎能力,促进屏障恢复
此外,共轭脂肪酸组中的一些脂肪酸对健康有益。体外对树突状细胞的实验表明,共轭亚油酸的异构体抑制脂多糖诱导的白细胞介素12产生并增强抗炎细胞因子白细胞介素10的产生。
一个例子是10-hydroxy-cis-12-octadecenoic acid(HYA),因为它部分调节肿瘤坏死因子受体2 (TNFR2),从而促进上皮屏障恢复作用。
注:HYA是不饱和脂肪酸的代谢过程中,肠道微生物产生的中间体游离脂肪酸。HYA能够改善与一些细胞中成熟标志物表达相关的抗氧化/解毒防御能力。
✦保护宿主,减少肥胖
另一项研究展示了HYA如何通过G蛋白偶联受体40(GRP40)和G蛋白偶联受体120(GRP120)分泌胰高血糖素样肽-1来减轻高脂饮食诱导的小鼠肥胖。
此外,他们还证实了几种乳酸杆菌属,如
Lactobacillus salivarius和
Lactobacillus gasseri,能够产生相似水平的 HYA,保护宿主免受高脂饮食引起的肥胖。
吲哚
吲哚是吡咯与苯并联的化合物,细菌产生吲哚对人体健康具有重要意义。
✦饮食类型影响吲哚的产生
吲哚是通过降解肠中芳香族氨基酸如酪氨酸、苯丙氨酸和色氨酸的分解代谢产生的。因此,肠道吲哚水平取决于饮食类型。
富含蛋白质的饮食会促进吲哚的产生。然而,富含糖的饮食可能会降低吲哚合成,因为过度消耗糖可能会导致小肠饱和,从而导致更多剩余的糖进入大肠。
由于碳水化合物发酵优于蛋白水解活性,因此抑制色氨酸酶活性导致吲哚合成速率降低。吲哚通过以下途径影响宿主代谢L细胞对GLP-1分泌的调节,表明在2型糖尿病等代谢疾病中发挥作用。
吲哚丙酸(3-Indolepropionic acid)由Clostridium sporogenes产生,它与膳食纤维摄入量呈正相关。
•2型糖尿病会影响吲哚水平
事实上,一项研究发现较高的血浆吲哚丙酸水平与降低患2型糖尿病的风险之间存在关联。
另一项研究发现,与瘦对照相比,患有2型糖尿病的肥胖受试者的吲哚丙酸水平降低。吲哚丙酸显示通过与孕烷X受体结合并随后下调肿瘤坏死因子α来调节炎症。
✦吲哚具有抗肥胖等特性
研究显示吲哚丙酸可降低饮食诱导的肥胖小鼠的肠道通透性。吲哚丙酸也被证明在小鼠中具有抗肥胖活性。
在肠道中,色氨酸可以被肠道菌群用作底物来产生吲哚,但也可以被宿主代谢。在低度肠道炎症(肥胖的一种慢性症状)期间,巨噬细胞中的吲哚胺2,3-双加氧酶活性增加,导致犬尿氨酸的产生水平升高,从而将生产从微生物衍生的吲哚转移。
注:吲哚胺2,3-双加氧酶是人体内色氨酸代谢中的关键酶,可通过介导色氨酸耗竭及其代谢产物调节机体抗肿瘤免疫。
与正常饮食的小鼠相比,高脂肪饮食的小鼠显示出吲哚胺2,3-双加氧酶活性增加。然而,与高脂饮食的野生型小鼠相比,在这种酶被敲低的小鼠中观察到胰岛素耐受性有所改善。
微生物衍生的吲哚,如吲哚乙酸激活芳烃受体,但犬尿氨酸抑制其激活。微生物衍生的吲哚乙酸进一步限制了巨噬细胞中脂肪酸的积累和炎症标志物的产生。
谷氨酸
除了吲哚,谷氨酸也可以影响人体。
——谷氨酸是一种多功能氨基酸,谷氨酸在生物体内的蛋白质代谢过程中占重要地位。除此之外,谷氨酸也是人体兴奋神经递质,不仅参与消化系统和免疫系统,还是大脑健康密切相关。现在强有力的证据表明肠道微生物产生神经活性分子,如神经递质(即去甲肾上腺素、多巴胺、血清素、GABA 和谷氨酸)和代谢物(即,色氨酸代谢物,短链脂肪酸等)维持宿主和细菌之间跨界跨区域交流。谷氨酸代表了在这种跨界交流中活跃的众多神经活性分子之一。
根据对肥胖和瘦受试者的队列进行的全基因组关联分析显示,谷氨酸盐具有潜在危害。
通过进行途径分析,谷氨酰胺/谷氨酸转运系统在肥胖个体中高度富集。这与拟杆菌属(包括B.thetaiotaomicron)的物种呈负相关。事实上,与瘦受试者相比,肥胖者体内这种细菌的数量减少。因此谷氨酸与人体之间也存在一定联系。
•拟杆菌的在高脂饮食中的研究
对多形拟杆菌(B.thetaiotaomicron)在高脂饮食小鼠中的作用的研究表明,编码参与脂肪生成的蛋白质的基因表达较低,而编码参与脂肪酸氧化和脂肪分解的蛋白的基因表达较高。此外,炎症相关标志物的表达也降低。
关于发现与肥胖相关的B.thetaiotaomicron,其效应可能是由于与某些其他物种的相互作用,例如B. uniformis,已知其部分恢复了高脂肪饮食诱导的肥胖效应。
03
健康与肥胖人群中的细菌比例
有研究发现,健康人群和肥胖人群中的拟杆菌门和厚壁菌门比例存在不同。但是将健康受试者与肥胖受试者用拟杆菌与厚壁菌的比例区分开来的一个有争议的话题。
•支持的证据
一项研究调查了遗传易感肥胖小鼠及其接受相同多糖饮食的正常野生型同胞的盲肠微生物群之间的差异。
在肥胖小鼠中,拟杆菌数量减少,而厚壁菌的相对丰度较高。一年后,在比较肥胖和正常时发现了类似的结果。
•反对的证据
然而,同一组在比较正常人和肥胖人双胞胎时观察到了有争议的结果。然而,此处观察到拟杆菌显著减少,与厚壁菌没有关联。
除此之外,使用16s rRNA基因的类似管道和区域重新分析前面提到的文章的数据集和其他公开可用的数据也导致了与拟杆菌与厚壁菌比率相关的矛盾结果。
鉴于人类肠道中这两个门所代表的目、科、属的物种众多,这些门水平上相互矛盾的肠道微生物群结果并不令人惊讶。
另一方面,厚壁菌门是如此广泛,以至于说某个菌属于厚壁菌门,但是不同菌的功能差别很大。
此外,这些门中分类上不同的细菌具有截然不同的属性。拟杆菌门中最重要的例子是普氏杆菌属和拟杆菌属,它们往往相互排斥。当比较多个研究时,将每个门的细菌汇集在一起时,预计会出现相互矛盾的结果。
因此,目前还不鼓励使用拟杆菌与厚壁菌的比例来区分健康人群与肥胖人群。我们在检测实践中也发现部分肥胖人群拟杆菌比例较高。
Prevotella与Bacteroides的比例
在引入肠型后,在拟杆菌门内做出了更合适的区分,即Prevotella和Bacteroides的比率。
与Bacteroides相比,Prevotella个体在食用左旋肉碱时血浆氧化三甲胺浓度较高。
以Prevotella为主的肠道微生物群往往与素食主义或非工业化的富含膳食纤维的饮食有关。这些例子可以在非洲、南美洲或者东南亚狩猎采集者或农村人口进行的几项研究中找到。
✦Prevotella与Bacteroides更利于减肥
研究很好地说明了饮食和环境导致的从普氏杆菌向更为拟杆菌主导的肠道微生物群的转变,来自泰国农村的人移民到了美国。不出所料,这种转变也伴随着体重的增加。
关于减肥方案,这一比例很重要,因为普氏杆菌与拟杆菌比例较高的受试者在膳食纤维含量较高的情况下更容易减肥。
研究发现,给予辣椒素时,拟杆菌量较多的受试者体重减轻更多,在此强调了个性化营养的必要性。
04
肥胖与肠道微生物的研究分类
为了更好更有条理地研究肥胖与肠道微生物之间的关系,需要将微生物进行研究分类。
大多数关于肥胖与肠道微生物群之间关系的研究通常将个体分类群与病理生理途径联系起来,以建立与肥胖的联系。
影响微生物的因素
细菌并不存在于真空中,所以它们的生长速度以及它们能够进行的代谢活动取决于外部环境因素。
这些外部因素包括pH、胆汁酸和底物可用性。所有这些反过来又取决于微生物组分本身;这意味着一种细菌的功能受其周围所有其他细菌的影响。
更直接地说,各种细菌种类依赖于其他细菌种类为它们提供中间底物(其他细菌的废物),并且反过来,依赖于将消耗其自身废物(发酵产物)的其他细菌,以使其从中获得能量的生化转化在能量上有利。
同一物种的不同菌株可能存在很大差异
通常使用不同的分类水平(门/科/属/种)来归因特定的特征和关联,而物种的功能甚至在同一属内,甚至是目前被认为属于不同菌株的细菌。相同的物种,可以有很大的不同。
因此,旨在通过查看更高的分类级别来限制分类组数量的降维策略通常应该优选地限制在类属级别。
同一物种的不同菌株可能具有也可能不具有归因于它们的特定功能,正如在碳水化合物活性酶中观察到的那样。如果高度相似的基因存在于多种细菌中,则可能还会出现冲突模式。
越来越多的研究人员在过去几十年中得出结论,与肥胖相关的有益影响应归因于肠道微生物群中的多个参与者协同工作。而这种关联的紊乱可以被视为生态失调的一种形式。
微生物成员分组
——由于上述个体分类群分析的缺陷使得难以找到特定于健康结果的具有生物学意义的模式,因此创造了两个不同的术语来将个体微生物组成员分组。
▸ 微生物“聚类”
应用了“guild”这个术语,这在宏观生态学中已经众所周知。它包括“以类似方式利用同一类环境资源的一组物种”,后来成为“功能组”的同义词。
通过构建基于微生物丰度协变的共丰度组,给出了一个框架,以更生态有意义的方式解开肠道微生物组与人类健康之间的关系。这将克服目前对基于分类单元的分析和以基因为中心的分析存在问题的各种缺点。
▸ 营养网络
另一个术语称为“营养网络”,营养网络被定义为微生物种群形成代谢相互依赖的生物体的食物网,随着时间的推移以相关的方式稳定地建立。
小结
通过观察微生物聚类或特定的营养网络,可以实现对与健康和肥胖相关的肠道生态学的更有意义的解释。
此外,将数百个分类群聚集到有限数量的微生物聚类或营养网络中将有助于降低维度,从而有可能应用经典统计数据来限制与校正多重测试相关的问题。
尽管基于微生物聚类的方法似乎是一种有前途的方法,在了解肥胖儿童的体重调节方面观察到了附加价值,但与肥胖本身的相关性仍有待阐明。
05
微生物多样性与人体健康有关
α多样性与疾病状态有关
——在区分肥胖受试者和健康受试者时,一个常见的观察结果是他们平均较低的α-多样性。
在许多其他疾病中也观察到相同的情况,例如克罗恩病、肠易激综合征和结肠直肠癌。因此,微生物多样性的丧失通常与各种疾病状态有关。可以说,断奶后肠道α多样性降低是与各种人类状况相关的普遍特征。
在成年人中,较高丰度的细菌(如Akkermansia muciniphila和F. prausnitzii)通常与较高的α多样性相关。
丰富的A. muciniphila与BMI、炎症标志物、脂质合成和总脂肪组织重量呈负相关。
▸ α多样性是什么?
α多样性主要关注局域均匀生境下的物种数目,因此也被称为生境内的多样性。α-多样性是由扩散、局部多样化、环境选择和生态漂移共同形成的。
多样性本身不仅仅是健康的指标,因为多种高丰度的病原体持续存在一般不会让肠道感觉 “幸福”。
相反,更高的α多样性应该被视为存在发育良好和扩展的微生物营养网络,它们共同导致发酵能力的提高。
✦低α多样性下的肠道微生物
富含拟杆菌的微生物群倾向于具有较低的α-多样性值、较简单的营养网络,并且更容易下降。
这种低α-多样性组合物通常富含诸如肠杆菌科、梭杆菌属、链球菌属、瘤胃球菌属和各种拟杆菌属物种的物种。
这种益生菌组合物在肠型方面与拟杆菌2肠型最为相似,最终会是肥胖和2型糖尿病的危险因素。
营养网络被破坏导致α多样性减低
研究表明营养网络的彻底破坏以及由此导致的α-多样性、基因丰富度和肠道发酵能力的极大降低。
调查了(抗生素治疗)危重儿童的肠道微生物群、粪便短链脂肪酸和胆汁酸谱。由于缺乏代谢和发酵能力,这些儿童的初级胆汁酸与次级胆汁酸的比例较高,但短链脂肪酸的产量极低,而碳水化合物发酵的中间产物,如乳酸盐和琥珀酸盐与健康对照儿童相比含量增加。
后一项发现,加上剩余的未发酵糖组分、较高水平的未接触蛋白质和更松散的粪便,突出了肠道中剩余的发酵仍然处于糖分解阶段。
Christensenellaceae营养网络
——一个与高α-多样性和健康相关的特定营养网络
与肥胖受试者相比,体重指数正常的健康受试者的Christensenellaceae水平更高。
Christensenellaceae和寄主BMI之间的关联被认为是最稳健的关联之一。在无菌小鼠体内移植来自人类供体的富含菊苣科植物的粪便可减少肥胖。在富含瘤胃球菌科或厚壁菌的肠型的人中,Christensenellaceae通常很丰富。
如上所述,不应将Christensenellaceae视为一个独特的独立实体,因为它始终与其他细菌和古细菌形成营养网络。
✦Christensenellaceae与古细菌的关联
Christensenellaceae与一种古细菌——Methanobrevibacter smithii 的关联可能是这一营养网络最典型的部分。
M.smithii 从微小梭菌产生的氢气中产生甲烷。如果这种营养网络与低BMI之间存在因果关系,则仍然相当不确定。
除了M. smithii是这一营养网络的一部分外,一项比较意大利瘦弱和肥胖老年人的研究发现,Christensenellaceae、Rikenellaceae和Porphyromonadaceae之间存在相关性。
在日本的一个队列中,调查了不同地区健康成年人的粪便样本,Christensenellaceae与各种其他细菌也与BMI呈负相关。
注意
鉴于α-多样性、瘦弱性和Christensenellaceae细菌营养网络之间的紧密联系,未来将继续从机制上研究这种联系。还应注意的是,该营养网络对于短链脂肪酸生产的重要性尚未确定。
虽然Christensenellaceae和Methanobrevibacter可能仅占总微生物群的一小部分,但它们所代表的核心指示物种的营养网络在不同种族中绝不是一个小角色。这种营养网络,其中各种物种彼此之间非常密切相关,具有肠型定义潜力。
Prevotella stercorea营养网络
另一个营养网络,通常在工业化国家的人们中代表性不足,是Prevotella stercorea营养网络,它可以被视为Prevotella肠型组成中的一个重要因素。
这个营养网络的建立首先是通过观察冈比亚儿童正在发育的肠道微生物群来广泛描述的。P. stercorea与Succinivibrio dextinosolvens和Paraprevotella xylaniphila等形成一个大型营养网络,并且类似地与高α-多样性相关。
✦肠道Prevotella的特征
肠道普雷沃氏菌是一个完美的例子来展示微生物“聚类”和营养网络之间的区别。
在人群范围内的研究中,例如使用多民族队列研究的数据,被定义为肠型普氏杆菌的人通常具有非常高的P. stercorea水平和与P.stercorea营养网络相关的高水平物种。
当在分层聚集的热图中可视化时,P.copri和P.stercorea营养网络中的物种聚集在一起。然而,这种共同发生主要是由于粪便中的Prevotella(包括P.copri、P.stercorea和其他许多普氏杆菌属)和Bacteroides/Phocaeicola.之间的强烈拮抗作用。
P.copri和P.stercorea营养网络在同一环境中表现良好(Bacteroides贫乏),但P.copri的高丰度完全独立于P.stercorea营养网络发展,这可以通过跟踪儿童在前3个年的肠道微生物群成熟情况看出多年生活在一个每个人都会发展出富含Prevotella的肠道微生物群的环境中。
12个月后,P.copri成为优势种并保持优势,而与P.stercorea营养网络相关的物种丰度在生命的前30个月以相互依赖的方式缓慢增加,直到达到稳定水平。推测在P. stercorea的营养网络中存在着各种代谢产物的交换,值得进一步研究,特别是与Prevotella肠型生产短链脂肪酸的能力增加有关。
✦Prevotella与健康相关
与肥胖率上升最快的工业化国家相比,肠型拟杆菌相关的拟杆菌和种类在冈比亚并不多见。
肠道中的Prevotella本身也与较低的BMI相关,并且已观察到低密度脂蛋白胆固醇与肠道Prevotella呈负相关,这表明在非工业化国家,肠道Prevotella与健康有关。
06
肥胖与肠道微生物的未来研究方向
尽管使用大型队列的关联研究对于试图解开与肥胖相关的肠道微生物组的极端复杂性至关重要,但其他几种研究途径也具有潜力,其中一种是粪菌移植。
粪菌移植
▸ 定义
粪菌移植,是将粪便从瘦供体转移到受体。也称为“人类肠道微生物群转移”、“粪便移植”和“粪便细菌疗法”。
✦粪菌移植的作用
粪菌移植已被证明是比抗生素更有效的复发性艰难梭菌感染 (CDI) 治疗方法。然而,与肥胖不同,从病理学的角度来看,CDI是一种相对简单的疾病,其中肠道微生物群的因果关系是明确的。
在一项对患有胰岛素抵抗的肥胖受试者进行的粪菌移植试验中。受试者接受自己的粪便(自体)或瘦供者粪便(同种异体)。短期内在接受瘦供体粪菌移植的受试者中观察到对胰岛素敏感性的有益影响。
进一步研究表明基线肠道菌群有利于粪菌移植的成功。在这里,当接受同种异体粪菌移植时,在α-多样性降低的受试者中,粪菌移植成功率更高。
总的来说,与那些肠道微生物组组成尚未严重恶化的受试者相比,那些α-多样性较低的受试者有更大的改进空间。
✦其他影响粪菌移植的因素
一项研究,其中包括几个调查不同疾病的粪菌移植队列,显示生态变量(如低α-多样性)与临床变量(如抗生素治疗和灌洗)一起在植入成功中发挥作用。
他们进一步表明,通过合并供体样本来增加α-多样性预计不会增加供体菌株的植入,这表明合并供体样本在功能上并不等同于单个高α-多样性供体样本。
对队列进行的分析表明,P.copri对接受同种异体粪菌移植的受试者具有有益的影响。P.copri与BMI、C反应蛋白和空腹胰岛素水平进一步呈负相关。
此外,肠道微生物群的变化可能与特定血浆代谢物水平和血浆单核细胞中DNA甲基化的变化有关,为肠道微生物群影响肥胖相关疾病的机制提供了额外线索。
验证细菌植入的生物学工具
最近开发了几种工具来帮助解开粪菌移植中肠道微生物组与肥胖之间的关系。
为了验证来自瘦供体的菌株是否已移植到受体中,需要进行菌株跟踪分析。比较了七种不同的生物信息学工具,用于在数据集上进行应变跟踪。
减轻肥胖和相关疾病负担有前景的方法
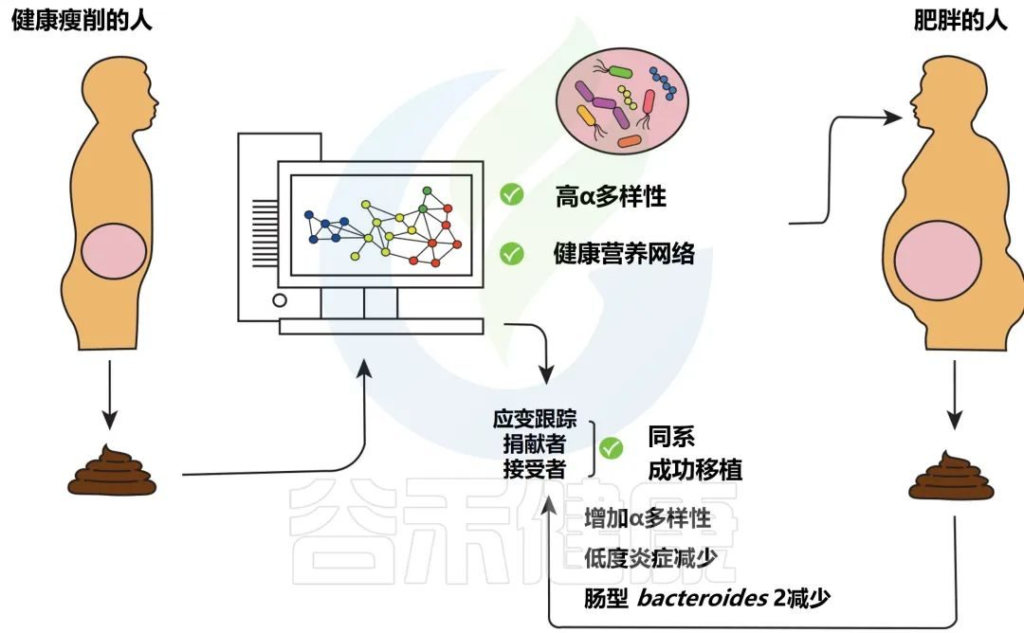
Levin E,et al.Therap Adv Gastroenterol.2022
分析健康瘦供体粪便的微生物组成,以选择具有高 α 多样性(以及其他)的供体,这可以被视为存在复杂的健康相关营养网络的标志。
如果合适,然后将高α多样性供体的粪便转移到肥胖的接受者身上,这可能会减轻低度炎症。在粪菌移植之后,使用菌株追踪在接受者的粪便中追踪肠道微生物群基因组中特定位置的特定SNP的供体菌株验证。
在这里,观察到概率工具在宏基因组测序数据上表现最好。然而,随着最近开发的两种新的应变跟踪工具,这一技术领域仍在快速发展。
其中一个工具是基于物种特异性标记基因中的单核苷酸变体跟踪菌株,另一个是先前发布和改进的进一步构建工具,应用应变跟踪方法。
在接受粪菌移植后调查了受体中的菌株植入,观察到供体和受体特异性菌株可以共存。与此同时,发现肥胖受试者的粪菌移植胶囊会导致微生物群落组成发生变化,从而导致受试者从一种肠型转变为另一种肠型。这随后改变了菌群的代谢潜力。微生物组向供体的转变与α多样性呈正相关。
此外,肠道微生物群组成的变化在治疗后持续26周。本研究结合了多个供体的粪便,并表明一些供体具有用于移植的高效微生物群,这意味着供体粪便的组成和整个营养网络的转移,而不是添加单个分类群的重要作用。
07
预防和治疗肥胖的建议
预防肥胖
——鉴于肥胖症如此普遍,并且考虑到治疗的难度,预防尤为重要。
为预防超重和肥胖,人们应该根据自己的营养需求进食和饮水,定期锻炼,定期检查体重。
•少吃高热量食物
就营养而言,他们应该少吃高能量密度的食物,多吃低能量密度的食物。由于水分或纤维含量高而能量密度低的食物,如全麦制品、水果和蔬菜,相对来说更能饱腹,能量含量也较低。地中海饮食有助于预防超重和肥胖。
还应减少酒精、快餐和含糖饮料的消费。快餐通常含有高比例的脂肪和糖,因此能量很高。不仅是加糖的饮料,还有果汁和果汁饮料,含糖量也很高。
•避免久坐或不活动
经常坐着看电视或上网和类似活动的不活跃生活方式会促进体重增加。在日常活动和休闲活动中进行锻炼具有预防作用。这个目标最好通过每周2小时以上的以耐力为重点的体育锻炼(使用大肌肉群)来实现。
肥胖的治疗方法
✦饮食疗法
为了减轻体重,目标应该是遵循减量饮食,这将产生约500kcal/天的热量缺口,或在个别情况下更多。
每天500至600kcal的能量缺口将使体重减轻,以约0.5kg/周的速度发生,持续12周最多24周。
低碳水化合物饮食在开始时会比其他饮食导致更剧烈的体重减轻,但一年后就看不到差异了。过去几年的几项大型研究表明,常量营养素组成(脂肪、碳水化合物和蛋白质的比例)与减肥无关。各种减脂饮食可在1至2年内减掉约4公斤。个人经验、知识和资源比营养关系更重要。
✦益生菌帮助减肥
已经证明几种益生菌,单独使用或以共生混合物的形式使用,能够通过物种和菌株特异性机制(例如,肠道微生物群调节、降低胰岛素抵抗、更强的饱腹感)来治疗肥胖。
更具体地说,乳酸杆菌和双歧杆菌物种由于其低致病性和低水平的抗生素耐药性而已成功用于成熟的肥胖动物模型。
益生菌对减肥作用的一些实验
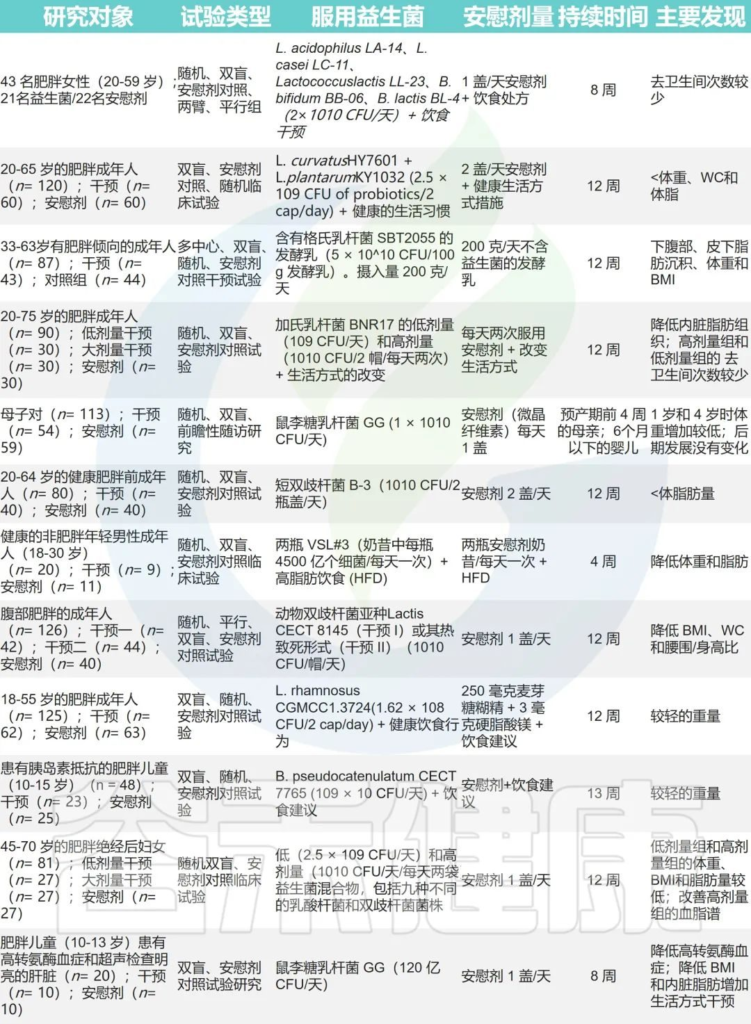
Abenavoli L, et al. Nutrients.2019
与安慰剂组相比,这些治疗导致不同程度的体重增加减少和脂肪累积减少。
所以在一些时候,我们可以利用例如乳酸杆菌等益生菌来帮助我们减肥。
✦增加运动
有效的减肥需要>150分钟/周的运动,能量消耗率为1200至1800kcal/周。单独的力量训练对于减轻体重作用不大。
运动中消耗的能量常常被高估。当使用大肌肉群,强度适中到高,运动时间长时,体重减轻是可以预期的。对照良好的研究和荟萃分析显示,在6至12个月内体重减轻了约2公斤,腹部脂肪减少了约6%.
应该向超重和肥胖的人解释运动的健康益处(代谢、心血管和社会心理),无论体重减轻如何,这些益处都会产生。即使在肥胖个体中,增加运动的健康价值也不仅仅体现在体重减轻上。
✦行为矫正干预
在团体或个人中,基于行为方法的干预应成为减重计划的一部分。
干预的主要目的是改变营养和运动方面的生活方式,并且可以由合格的非心理治疗师进行。如果伴随超重或肥胖的症状更严重,精神科医生或心理治疗师应参与患者管理,并应支持患者进行饮食治疗和锻炼。
08
结语
肥胖和肠道微生物群以多种方式交织在一起。饮食的类型及其数量会影响能量的可用性并因此影响肥胖,但也会强烈影响肠道微生物组,这反过来又可以放大饮食的致肥胖特性,或另一方面提供各种保护性益处。
许多微生物衍生的代谢物,包括短链脂肪酸、胆汁酸、吲哚和其他氨基酸,对健康同样至关重要。过量或缺乏这些,或者更具体地说,在任何这些方式中改变的整体组成,都可能是致肥胖的。
通过本文更好地了解肥胖以及其发病机制与微生物组之间的关系,有助于在日后的生活中更好地应对肥胖,使人人都有一个健康的身体。
主要参考文献
van der Vossen EWJ, de Goffau MC, Levin E, Nieuwdorp M. Recent insights into the role of microbiome in the pathogenesis of obesity. Therap Adv Gastroenterol. 2022 Aug 9;15:17562848221115320. doi: 10.1177/17562848221115320. PMID: 35967920; PMCID: PMC9373125.
Canfora, EE, Meex, RCR, Venema, K, et al. Gut microbial metabolites in obesity, NAFLD and T2DM. Nat Rev Endocrinol 2019; 15: 261–273.
Abenavoli L, Scarpellini E, Colica C, Boccuto L, Salehi B, Sharifi-Rad J, Aiello V, Romano B, De Lorenzo A, Izzo AA, Capasso R. Gut Microbiota and Obesity: A Role for Probiotics. Nutrients. 2019 Nov 7;11(11):2690. doi: 10.3390/nu11112690. PMID: 31703257; PMCID: PMC6893459.
GBD 2015 Obesity Collaborators . Health effects of overweight and obesity in 195 countries over 25 Years. N Engl J Med 2017; 377: 13–27.
Chauhan, S, Jena, KK, Mehto, S, et al. Innate immunity and inflammophagy: balancing the defence and immune homeostasis. FEBS J. Epub ahead of print 26 November 2021.
Beukema, M, Faas, MM, de Vos, P. The effects of different dietary fiber pectin structures on the gastrointestinal immune barrier: impact via gut microbiota and direct effects on immune cells. Exp Mol Med 2020; 52(9): 1364–1376.
谷禾健康
慢性肾病 (CKD) 影响着全球约 13.4% 的人口,是一个日益严重的全球健康负担。成人中,高血压和糖尿病是慢性肾病的主要原因,而先天性肾脏和泌尿生殖道异常占儿童慢性肾病病因的大部分。慢性肾病与心血管疾病、神经系统并发症、不良妊娠结局和高钾血症等严重健康状况的发展有关。在儿童中,慢性肾病会影响神经认知能力、学校表现、成长、生活质量等。
而许多研究已证明,慢性疾病过程与人类肠道微生物群及其代谢物之间存在关联。
那么慢性肾病与肠道微生物群之间存在什么关系?
肠道菌群代谢产物在慢性肾病中起着什么样的作用?
肠道失调是如何启动炎症过程并导致菌群代谢产物泄漏到血液中的?
哪些饮食方式可以对其进行干预?
本文一起来了解一下。
概 要
· 慢性肾病与菌群关系是双向的;肠源性代谢物和毒素影响慢性肾病的进展,尿毒症环境影响微生物群。
· 微生物代谢物和毒素的积累与肾功能丧失和死亡风险增加有关,但短链脂肪酸和胆汁酸等肾脏保护代谢物有助于恢复肾功能和提高慢性肾病患者的存活率。
· 改变肠道微生物组的特定饮食干预可改善慢性肾病患者的临床结果。
·低蛋白和高纤维饮食增加了产生短链脂肪酸和抗炎菌的丰度。
· 尿液微生物组的波动与感染易感性和抗生素耐药性的增加有关。
01
慢性肾病是什么
肾脏的存在好处多多。肾可以帮助调控血液稳态,维持电解质平衡,调控全身水平衡,甚至可以产生激素。
慢性肾病是一个泛指,包含多种肾功能轻微下降的症状,且肾功能下降和微结构改变持续时间超过3个月,而小于3个月的肾功能恶化则是急性肾损伤。
慢性肾病的病理生理学
慢性肾病包括一系列与肾功能异常和肾小球滤过率(GFR)逐渐下降相关的病理生理过程。
注:单位时间内两肾生成滤液的量称为肾小球滤过率,正常成人为100-125ml/min/1.73㎡。
但是呢,由于GFR的测量麻烦、经济与时间成本较高,临床实践中相对较少使用。于是就出现了eGFR(Estimated Glomerular filtering Rate,即估算的肾小球滤过率),临床上一般用这个指标来衡量肾脏的工作情况。可以对慢性肾病患者的疾病严重程度进行分级,分级越高,滤过率越低,病情越严重。

慢性肾病的潜在病因因年龄、合并症、急性肾损伤反复发生和蛋白尿水平而异。
无论潜在的病因如何,剩余肾单位的过度过滤和肥大、肾小管间质纤维化、肾素-血管紧张素-醛固酮系统的激活以及内皮屏障的破坏都很常见,并导致肾排泄功效和eGFR下降。
从一个等级到下一个等级的转变通常伴随着肾脏内分泌功能的丧失。特别是,患有心血管病的慢性肾病患者表现出肾功能恶化和严重炎症。
肾小管间质间隙中免疫细胞的浸润和免疫衍生成分的积累促进慢性肾病的进展。
慢性肾病治疗的一个关键目标是防止患者进展到疾病的下一阶段。
02
慢性肾病中的肠道菌群失调
最近的研究表明,肠道微生物群失调在慢性肾病的病理生理学中起着关键作用,并导致严重的慢性肾病。
慢性肾病中的菌群变化
双歧杆菌和乳酸杆菌与慢性肾病进展和长期生存率呈负相关。
一项对223名终末期肾病患者的研究表明,与对照组相比,慢性肾病患者的次级胆汁酸和尿毒症毒素水平升高与Eggerthella lenta、Fusobacterium nucleatum、Alistipes shahii呈正相关。在这项研究中,作者表明,Faecalibacterium prausnitzii(普拉梭菌)、Roseburia、Prevotella(产短链脂肪酸菌)的存在与疾病进展和尿毒症毒素积累呈负相关。
另一项对92例慢性肾病患者的研究报告称:
慢性肾病队列中的Paraprevotella,Pseudobutyrivibrio(假丁酸弧菌属),Collinsella数量增加;这一发现使作者提出,这个特征可以用来区分慢性肾病患者(甚至是处于疾病早期的患者)和健康人。
肠道菌群失调引发慢性肾病的两种机制
其一:影响肠道屏障
微生物群组成的变化增强了肠道氨的产生,从而提高了肠腔的生理 pH 值,导致粘膜刺激并破坏了结肠上皮屏障。这导致肠道通透性增加,通常称为“肠漏”。
因此,内毒素和细菌产物易位进入循环并诱导局部炎症,由免疫细胞激活和促炎细胞因子和趋化因子的释放引起,以及慢性全身炎症,加剧肾功能的恶化。
其二:影响血压变化
肠道菌群失调可能促进慢性肾病进展的另一个机制是通过肠道生态失调在内皮功能障碍、血管收缩反应和随后的高血压发展中的作用。
肠道中乳酸杆菌的较低丰度与高血压和肾脏疾病的发生有关。与正常饮食的小鼠相比,高盐饮食的小鼠具有异常的微生物群;这些变化与T淋巴细胞活化和血压升高有关。
肠道微生物群的变化可能是慢性肾病通过一系列免疫反应改变、血压改变、代谢变化和长期炎症进展的起点。
上述是菌群失调影响慢性肾病,反过来,慢性肾病也影响菌群失调。
肠道菌群 ⇋ 慢性肾病
菌群失调与慢性肾病的发病机制之间存在双向关系。
吃进去的营养物质被分解代谢最终产物中的氨,通过肝脏代谢转化为尿素,并释放到循环中。尿素主要通过肾脏排出,部分通过结肠排出。
肾功能的恶化将主要排泄部位从肾脏转移到结肠。结肠中尿素的持续存在会触发产脲酶菌的增殖,导致肠道生态失调。
肠道微生物组与慢性肾脏病之间的关系是双向的
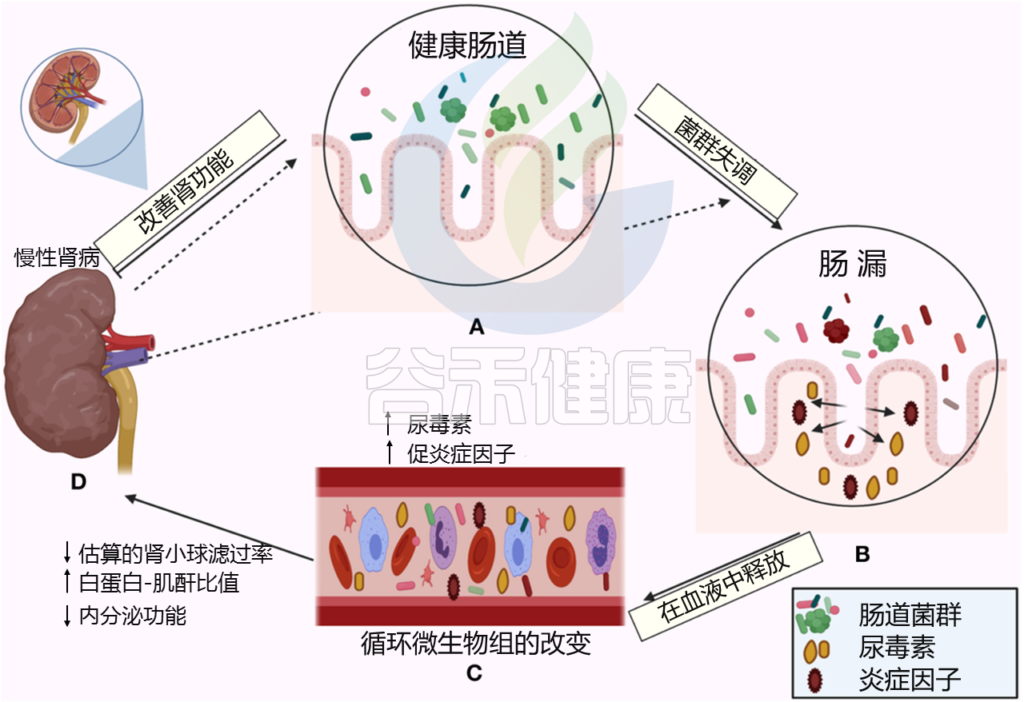
Al Khodor D, et al., Frontiers in Medicine,2022
← 在一个方向上,肠道菌群影响肾脏:
(A)健康的肠道
(B)肠道微生物失调和破坏粘膜层
(C)释放血液中炎性因子和炎症级联的开始,尿毒症毒素积累
(D)估计的肾小球滤过率下降(eGFR),白蛋白肌酐比值(ACR)升高,肾脏内分泌功能丧失
→ 在另一个方向,慢性肾病驱动肠道内的生态失调(虚线箭头所示),并引发炎症级联
03
慢性肾病中的微生物代谢物
一般来说,与慢性肾病相关的微生物代谢物分为两类;有害和肾脏保护代谢产物。
一方面,有害代谢物的水平增加,包括三甲胺 N-氧化物 (TAMO)、硫酸吲哚酚和对甲酚硫酸盐与肾纤维化、内皮功能障碍、估计肾小球滤过率 (eGFR) 下降、心血管并发症以及慢性肾病死亡率和发病率增加有关。此外,5-甲氧基色氨酸和硫酸吲哚酚的血清水平与慢性肾病进展呈正相关。
另一方面,包括短链脂肪酸在内的肾脏保护代谢物通过抑制上皮屏障的破坏和调节抗炎反应来预防慢性肾病的进展。来自肠道菌群的吲哚丙酸水平与慢性肾病患者的对甲酚硫酸酯和吲哚硫酸酯浓度呈负相关。
菌群代谢产物和慢性肾病的关系
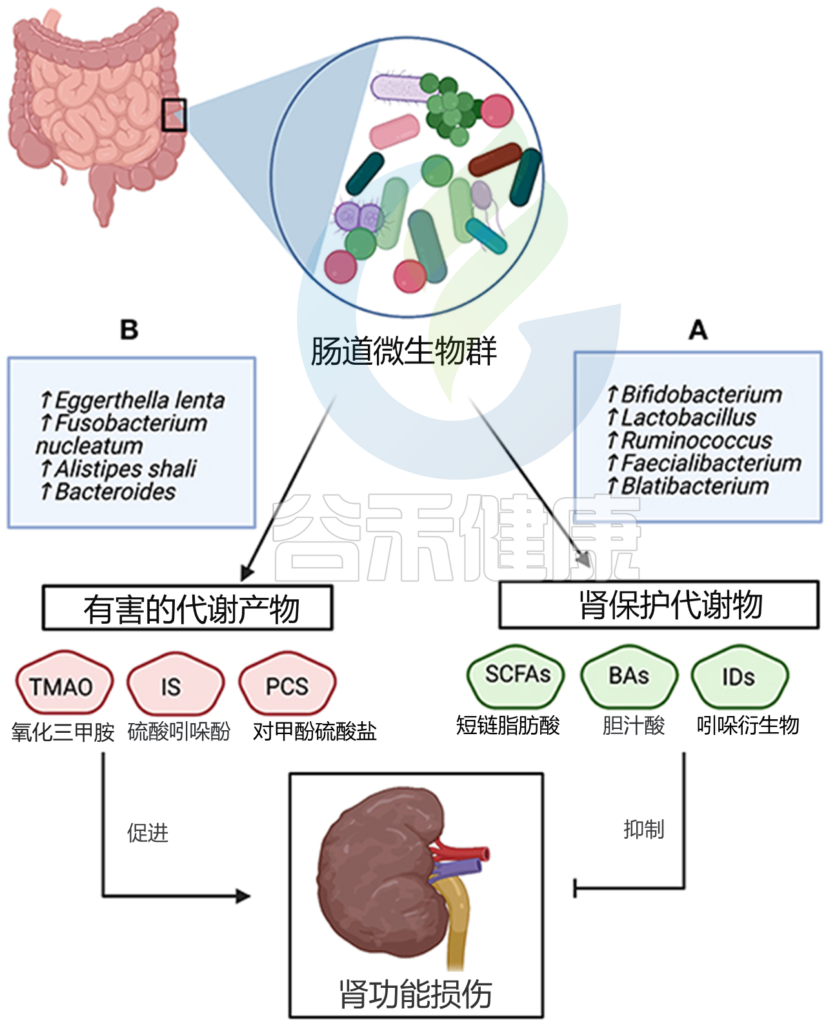
Al Khodor D, et al., Frontiers in Medicine,2022
一些人类和动物研究已经证明了TAMO对肾脏的有害影响,表现为肾间质纤维化、eGFR下降、内皮功能障碍和心血管疾病风险增加。
我们知道,肾脏的功能就是代谢身体废物,它的功能类似一个“清洁工”,肾脏生病也就是清洁工罢工,那么代谢废物就清除不出去了,于是在血浆中累积。
慢性肾病患者死亡率和发病率的增加归因于毒素的积累:硫酸吲哚酚和硫酸对甲酚。这些毒素与血浆蛋白具有很高的亲和力,从而减轻了它们通过透析膜的清除。
TAMO、硫酸吲哚氧基和硫酸对甲酚分别参与SMAD信号传导、色氨酸代谢和酪氨酸途径。
广泛的尿毒症毒素和其他微生物代谢物积聚在慢性肾病患者的生物样本中,包括血浆、粪便和尿液等常见生物样本中的毒素和其他微生物代谢物,也包括呼出气中的挥发性代谢物和粪便培养物中收集的气体。例如,慢性肾病患者体内会积聚气体代谢物,包括异戊二烯、醛、二甲基二硫、二甲基三硫和硫酯。
04
慢性肾病中的饮食干预
慢性肾病患者存在微生物失调和肠道代谢物积累。
益生菌
对慢性肾病患者进行的随机对照临床试验表明,益生元和益生菌治疗后肠道微生物群组成的变化改善了疾病结果,并降低了尿毒症毒素水平。
双歧杆菌和乳酸杆菌含量高的患者血清中尿毒症毒素水平较低,炎症环境减轻,肾功能改善。
益生元
益生元是不易消化的膳食成分,如膳食纤维和耐消化淀粉。它们存在于谷物、水果、牛奶、蜂蜜和蔬菜中,或者可以作为膳食补充剂。益生元发酵通过增加双歧杆菌和乳酸杆菌的丰度,降低类杆菌、梭状芽孢杆菌和肠杆菌的水平,有益地改善肠道细菌。
不利肾脏的食物:
摄入富含胆碱和 L-claritin的食物(TMAO的前体),如蛋黄、内脏、肉类和牛奶,与尿毒症毒素的大量积累和肾小球滤过率的下降相关。
低蛋白饮食减少炎症菌
一项前瞻性交叉临床试验将60例慢性肾病患者随机分为不同的饮食干预组;与常规饮食组相比,极低蛋白饮食组的肠道放线菌丰度增加,炎性变形菌减少。
膳食纤维降低慢性肾病风险
在慢性肾病患者中,膳食纤维摄入可降低循环中促炎细胞因子的水平,减缓eGFR的下降,降低尿毒症毒素的血浆水平,并将慢性肾病相关的心血管风险降至最低。
抗性淀粉降低血浆毒素
研究人员研究了补充抗性淀粉(16克/天)对慢性肾病患者的影响;他们观察到尿毒症毒素(硫酸吲哚氧基和硫酸对甲酚)、IL-6和硫代巴比妥酸反应物质的血浆水平降低。
乳果糖糖浆降低血清肌酐
这些结果与另一项将32例慢性肾病患者随机分为两组的研究一致;接受乳果糖糖浆治疗8周的组,肠道微生物群中双歧杆菌和乳酸杆菌的含量更高,血清肌酐水平降低。
虽然这些研究表明益生菌和益生元对慢性肾病有有益的作用,但也有其他研究表明循环肠道菌群代谢物或慢性肾病结果没有显著变化。
重要的是要指出,现有的研究是异质的;他们使用不同的膳食补充剂,有不同的干预持续时间,并对其他共病患者、肾病严重程度和潜在病因不同的患者进行管理。这种异质性使得从这些研究中得出结论非常困难。这就是说,在儿童饮食干预研究中可能会获得更好的结果,因为其他共同因素是最小的。
总之,这些研究表明,饮食干预疗法有可能调节微生物组组成及其代谢产物,从而改善慢性肾病并发症和慢性肾病进展率。然而,需要进一步设计良好的前瞻性研究来明确证明营养疗法对慢性肾病的益处。
05
尿和血液微生物群在慢性肾病中的作用
微生物组学领域的大部分注意力集中在肠道微生物组及其代谢产物上;然而,尿液微生物组正受到更多的关注。
新一代测序技术的发展使研究表明,健康个体的尿路由不同种类的微生物控制,这些微生物的分布模式影响尿路健康。
泌尿系微生物组的波动发生在泌尿系感染中,并与抗生素耐药性有关。肾移植后,尿液微生物组发生变化,这些改变被认为是导致同种异体移植功能障碍和增加感染易感性的原因。此外,慢性肾病患者尿液微生物多样性与eGFR值相关。
健康个体的循环微生物群包含多种细菌类群,其中以变形菌门为主。血液中循环的肠源性内毒素可改变血液微生物组。
一项研究调查了399名参与者的血液代谢组与肠道微生物群α多样性之间的相关性,结果表明,对甲酚和TAMO等肠道菌群代谢物反映了肠道细菌的香农多样性,可能是反映肠道健康的生物标记物。
使用16S rRNA靶序列对血液样本进行的病例对照研究表明,与对照组相比,慢性肾病患者的肠杆菌科和假单胞菌科的多样性较高,这也与较低的eGFR相关。
因此,肠道微生物群通过不同途径对慢性肾病的结局产生最终影响。
06
结 语
双歧杆菌、乳酸杆菌和胆汁酸成分水平较低与慢性肾病患者的不良后果有关。TAMO、硫酸吲哚氧基、硫酸对甲酚和其他有害微生物代谢产物在慢性肾病患者体内积累,这些代谢产物的水平与疾病进展相关。
肠道、泌尿道和血液微生物群以及相关代谢物之间的复杂相互作用可能协调慢性肾病发病机制中的亚临床变化,并促进疾病的发生。
通过饮食干预调节肠道微生物群可以改善慢性肾病患者的临床结果。
随着肠道微生物群的深入研究,可为慢性肾病的病因、代谢途径和潜在治疗提供线索。
未来可在以下方面深入开展研究:
主要参考文献:
Al Khodor D, Wehedy E, Shatat I F. The human microbiome in chronic kidney disease: a double-edged sword[J]. Frontiers in Medicine, 2986.
Mertowska P, Mertowski S, Wojnicka J, et al. A Link between Chronic Kidney Disease and Gut Microbiota in Immunological and Nutritional Aspects. Nutrients. 2021;13(10):3637. Published 2021 Oct 17. doi:10.3390/nu13103637
Feng Z, Wang T, Dong S, et al. Association between gut dysbiosis and chronic kidney disease: a narrative review of the literature. J Int Med Res. 2021;49(10):3000605211053276.
Giordano L, Mihaila SM, Eslami Amirabadi H, Masereeuw R. Microphysiological Systems to Recapitulate the Gut-Kidney Axis. Trends Biotechnol. 2021 Aug;39(8):811-823. doi: 10.1016/j.tibtech.2020.12.001. Epub 2021 Jan 6. PMID: 33419585.

谷禾健康
每个人身上都有“独特的味道”。有些人身上的味道几乎感受不到,而有些人身上却会出现令人尴尬的“体臭”。
慢性体臭可能带来许多不便,焦虑,自尊降低和生活质量下降,社交困难,甚至导致严重的心理问题。

人体会通过呼吸,唾液,汗水(皮肤),尿液或生殖器官液体释放出有气味的物质,主要的气味物质是小的挥发性化合物。
越来越多的证据表明,微生物群在人类的生理过程中起着至关重要的作用。它可能通过产生大量有气味的分子(例如氨,挥发性硫化合物或三甲胺)来加剧人体臭味。
本文我们来讨论下关于体臭最常见的原因,以及潜在的治疗选择。
化合物的过度积累会产生难闻的气味。与体液中细菌代谢物积聚相关的体臭可能由以下一种或多种原因引起:

主要的细菌气味物质及其散发部位
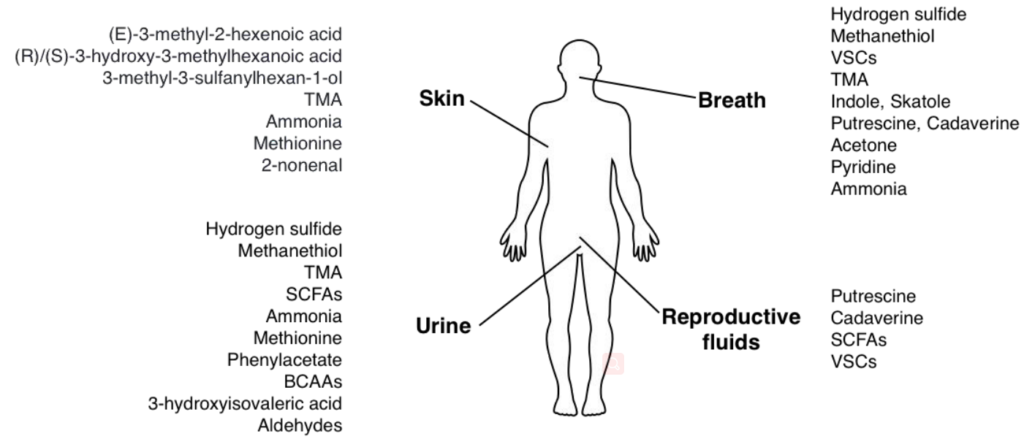
Mogilnickaet al., Int J Mol Sci, 2020
接下来,我们针对身体各个部位气味及其原因逐一解读。
口臭(口腔之味或呼吸之味)是一种以口腔内或口腔外的口臭为特征的疾病。全世界约有20-50%的成人或青少年患有口臭。[更精确的数字,为31.8%(95%可信区间24.6–39.0%)]

在绝大多数(80-90%)持续口臭的患者中,口臭的原因是口腔原因,其中舌苔和牙周病最为普遍。
在口臭的口外(非口)原因中,还包括糖尿病酮症酸中毒,先天性代谢性疾病,胃肠道或呼吸疾病等。
当然,尽管口臭可能是一些严重疾病的征兆,但食用洋葱或大蒜等几种食物以及吸烟也可能导致口臭。
口臭患者呼吸中存在的主要物质是挥发性硫化合物,如硫化氢(H2S)、乙硫醇、硫代乙酸乙酯、二乙基二硫化物、二甲基硫化物((CH3)2S) 和甲硫醇(CH3SH或甲硫醇)。
一些革兰氏阴性菌与食物或唾液中含硫底物产生挥发性硫化合物有关,如:
福赛拟杆菌Bacteroides forsythus、牙龈卟啉单胞菌Porphyromonas gingivalis、放线共生放线杆菌Actinobacillus actinomycetemcomitans 、中间普雷沃氏菌Prevotella intermedia.
最常见的细菌气味
Mogilnickaet al., Int J Mol Sci, 2020
与恶臭相关的疾病
Mogilnickaet al., Int J Mol Sci, 2020
H2S——臭鸡蛋的气味
在低浓度下,硫化氢(H2S)是一种重要的生物介质,类似于其他气体递质,如一氧化氮或一氧化碳。然而,在较高的浓度下,H2S最出名的是它的毒性作用和特殊的臭味,经常被比作臭鸡蛋的气味。H2S即使浓度很低,也会产生明显的气味。
众所周知,口腔中存在的厌氧菌(龈下微生物群)可能会将含有氨基磺酸半胱氨酸的脱硫物质降解为有气味的挥发性硫化合物,而H2S是难闻呼吸气味的重要来源。
几十年前,已经报道了产生硫化氢的菌属,如:
多齿拟杆菌Treponema denticola 和中间拟杆菌Bacteroides intermedius,以及其他属如消化链球菌Peptostreptococcus、真细菌Eubacterium和梭杆菌Fusobacterium。
多年后确定,口腔异味患者以韦荣氏球菌属Veillonella、放线菌属Actinomyces、普雷沃氏菌属 Prevotella 为主。
另一方面有研究认为,在呼出高浓度H2S的患者口腔中占优势的菌:奈瑟氏球菌属 Neisseria、梭杆菌属Fusobacterium、卟啉单胞菌属 Porphyromonas.
而以CH3SH为主的患者口腔中以韦荣氏球菌属Veilonella和普雷沃氏菌属Prevotella为主。
在某些食品中,可能存在由细菌还原酶生产H2S的底物。例如,洋葱,大蒜,葡萄酒,卷心菜,花椰菜,蘑菇,坚果,土豆和干果含有硫化物和亚硫酸盐(用作抗菌和抗氧化剂)。
甲硫醇(CH3SH/MT/MeSH) ——腐败、霉味
在口臭患者的呼吸中检测到的另一种分子是甲硫醇。研究表明CH3SH是口腔内口臭的主要致病因素。MT的气味常被形容为腐臭、霉味,可比作谷仓气味。
事实上,口臭患者的恶臭通常更类似于臭鸡蛋的气味(H2S的特征)。客观存在的阈值为0.5 nM (12 ppb) 。与H2S类似,口外(血源性)口臭患者的口腔空气中也检测不到甲基叔丁基醚,而其他口腔鳞状细胞癌在其中起着至关重要的作用。
研究人员报告说,在口臭患者唾液中,普雷沃氏菌 Prevotella、韦荣氏球菌Veillonella、阿托波毕姆菌Atopobium、巨形球菌Megasphaera和硒单胞菌Selenomonas的丰度很高,并怀疑这些菌群参与CH3SH的产生。
对口腔恶臭患者口腔气体中的金属硫蛋白含量测量,发现在患有牙周病的个体中显著增加的浓度。
其他挥发性硫化合物——熟洋葱的甜味和霉味
口臭患者的呼吸和唾液中检测到的其他挥发性含硫化合物包括乙硫醇、硫代乙酸乙酯、二乙基二硫化物和二甲基硫化物。这些化合物与蔬菜独特的、甜的、发霉的气味有关,通常类似于熟洋葱的气味。
二甲基硫(DMS,CH3SCH3)是血液传播(口外)臭味的主要来源。相比之下,口腔内口臭患者口腔和鼻子呼吸中的二甲基硫浓度在正常范围内,未达到气味阈值。
血液中存在二甲基硫的可能原因是代谢紊乱。文献中报道的其他原因包括肝衰竭、高硫氨酸血症(一种主要与甲硫氨酸水平升高相关的遗传性甲基化障碍)和治疗性摄入二甲亚砜或半胱胺。
三甲胺——鱼腥味
三甲胺(TMA)是一种挥发性的脂肪族叔胺,因其腐烂鱼的特有气味和高浓度的毒性作用而闻名。它是由肠道细菌产生的过量胆碱和其他含TMA的膳食营养素形成的。
已经表明,许多肠道中的共生细菌通过代谢膳食中含有TMA的物质来产生TMA,
例如,厌氧球菌属Anaerococcus、普罗维登夏氏菌属Providencia、爱德华氏菌属Edwardsiella、梭菌属Clostridium、柯林塞拉氏菌属Collinsella、脱硫弧菌属Desulfovibrio、乳杆菌属Lactobacillus 和 变形杆菌属Proteus.
从肠道吸收后,TMA被肝脏氧化成几乎无味的三甲胺氧化物(TMAO)。在三甲基胺尿症(也叫TMAu或“鱼味综合征”)中,由于缺乏含鸟苷的单加氧酶3 (FMO3),一种氧化TMA的肝酶,TMA积累并排泄到体液中。
继发性(获得性)TMau在患有严重肝脏或肾脏疾病患者中。文献中还描述了儿童(与含胆碱的食物补充剂摄入有关)和妇女(与月经有关)的短暂形式。这种代谢障碍导致底物超载和独特的体臭,可以在包括呼吸在内的多个身体部位检测到。
吲哚和甲基吲哚——粪便的气味
吲哚代表一组微生物来源的化合物,由色氨酸产生,色氨酸是一种必需氨基酸,是色胺、血清素和褪黑激素内源性合成的前体。
被怀疑导致口臭的吲哚包括吲哚和甲基吲哚,它们是由口腔内厌氧革兰氏阴性菌产生的,如:
中间卟啉单胞菌Porphyromonas intermedia、具核梭杆菌Fusobacterium nucleatum和牙龈卟啉单胞菌Porphyromonas gingivalis.
它们的气味可以等同于粪便的气味,而这两种化合物的气味更浓。与挥发性含硫化合物相比,吲哚和甲基吲哚的挥发性要低得多,因此,它们对口臭的影响相当小。
然而,有些口臭患者呼吸中可能存在无法检测到的VSCs浓度以及高水平的吲哚,在这样一组患者中,常用的用于测定口气气味的工具(如检测VSCs的口臭计)可能不够充分并延误诊断。
腐胺和尸胺——腐肉或鱼的气味
腐胺和尸胺这两种二胺一直被怀疑是造成口臭的原因,都与牙菌斑中的细菌引起的食物腐败有关。
它们在唾液中通过氨基酸脱羧(分别是赖氨酸和鸟氨酸)或转氨作用产生。
腐胺的气味常被比作变质的鱼或腐肉的气味,而尸胺的气味除了上述气味之外,还可能会让人联想到尿液或精液的气味。口臭和唾液中存在尸胺有强相关性。
丙酮——水果味
丙酮是一种三碳挥发性酮,来源于乙酰乙酸酯(通过脱羧或酶促转化)。长期以来,它的水果味(常被比作烂苹果的味道)一直与糖尿病(DM)有关。
高浓度的呼吸丙酮与糖尿病酮症酸中毒有关。它也随着禁食、高脂肪或生酮饮食而增加。
吡啶——鱼腥味、汗味
吡啶是一种芳香的含氮挥发性化合物,有一种鱼腥味和汗味,可能会导致口臭。在中度和重度牙周病患者的培养唾液中发现了吡啶及其类似物(2-,3-和4-甲基吡啶)。相比之下,这些分子在口腔健康患者的样本中是不存在的。
氨——类似尿液的气味
氨(NH3)以铵离子(NH4+)的形式存在于所有体液中,但其高浓度是有毒的,因此它由尿素循环精确调节。氨在肝脏和肾脏疾病以及口臭中作为生物标志物发挥着重要作用。
去除舌苔和牙菌斑后呼吸中氨水平的降低,这可能表明口腔中存在的一些微生物是口腔内口臭中氨产生的原因。
在患有终末期肾病(ESRD)的患者中,尿毒症呼吸气味是由唾液中的高浓度尿素引起的,尿素被分解成氨。多达34.1%的ESRD患者主诉尿毒症恶臭。
肝衰竭历来与尿样胎儿肝性脑病(肝性呼吸)有关。比较肝硬化患者和非肝硬化患者的血氨和呼吸氨水平,患有肝性脑病的患者的呼吸氨水平明显高于对照组。此外,呼吸和血氨随着高氨血症的治疗而降低。
肠道细菌是哺乳动物体内氨形成的重要因素。胃肠道细菌(主要是革兰氏阴性肠杆菌科)产生脲酶,将尿素水解成二氧化碳和氨。其他细菌菌株,例如大肠杆菌和肠道沙门氏菌,能够通过半胱氨酸脱硫酶从半胱氨酸形成氨。
此外,大肠杆菌还可以将硝酸盐还原成氨。源自肠道的氨被肠道细菌用于蛋白质再合成,通过GBB(肠道-血液屏障)被吸收到循环中,或者随粪便排出体外。在正常情况下,肠道中产生的氨在肝脏中代谢。然而,在肝衰竭状态下,它不能转化为无毒衍生物,如尿素或谷氨酰胺。
因为氨也是在蛋白质分解代谢过程中形成的,所以可以假设富含蛋白质的饮食可能会增加其血液水平,并导致更多的口呼出氨。研究表明,蛋白质的摄入导致血清和唾液尿素增加,从而导致呼吸氨浓度增加。这一点需要认识到,尤其是因为许多流行的、不健康的时尚饮食是基于高蛋白的摄入。
尿液成分受身体新陈代谢的影响,但也受消耗的食物和饮料的影响。因此,需要强调的是,并不是尿液中发现的每一种气味都是不好的。
例如,在摄入芦笋后不久,有些人的尿液可能会有明显的硫磺味(想象煮熟的卷心菜)。虽然导致这种气味的确切分子还没有被明确地鉴定出来,但是一些类似甲硫醇或二甲基硫醚的挥发性物质是可疑的。
尿液中特殊气味化合物的鉴定可能有助于诊断苯丙酮尿症,高硫氨酸血症或枫糖尿症。值得一提的是,多种有气味的物质是由肠道菌群产生的,它们可以在从肠道吸收到循环系统后出现在尿液中。
下面将介绍几种影响尿液气味的物质。
H2S ——臭鸡蛋的味道
在尿失禁(UI,不自觉的尿液泄漏,显著影响生活质量)患者中,出现难闻的气味,也是造成社会尴尬的重要原因。
研究尿液和吸收性失禁垫主要挥发性气味物质,与甲硫醇和醛类等其他分子一起,硫化氢被检测到高于气味阈值。此外,在尿路感染中,大肠杆菌是恶臭硫化氢的常见产生者。
甲硫醇 ——腐败、霉味
健康人尿液中的气态甲硫醇低于检测阈值。在用半胱胺治疗的患者,肝甲硫氨酸腺苷转移酶缺乏症和UI 中发现水平升高。甲硫醇产生的主要因素是肠道细菌群,如大肠杆菌、柠檬酸杆菌和变形杆菌。甲硫醇从肠道吸收,进入循环,然后可以随尿液排出。
三甲胺——鱼腥味
在三甲胺尿中,过量的三甲胺不能被氧化成无味的TMAO,分泌到包括尿液在内的多种体液中。需要强调的是,一些患者只有间歇性TMAu,这使得建立正确的诊断更加困难,因为尿液测试可能在气味不明显的期间呈阴性,必须重复进行。
例如,来月经的女性应该在月经期间或之前进行测试,以最大限度地增加检测TMAu的机会,因为在此期间TMA的排泄会增加。
尿中TMA的另一个来源可能是肠道菌群,主要是
厌氧球菌Anaerococcus,普罗维登夏氏菌 Providencia, 爱德华氏菌Edwardsiella,梭状芽孢杆菌Clostridium, 柯林塞拉氏菌Collinsella, 脱硫弧菌Desulfovibrio,乳杆菌Lactobacillus,变形杆菌Proteus.
短链脂肪酸——干酪味
异戊酸血症(IA)通常与“汗脚”或人体呕吐物的特殊干酪样体臭有关,这在代谢危机期间可以注意到。这种疾病是异戊酰辅酶a脱氢酶(IVD)缺乏导致亮氨酸代谢异常的结果。在IA患者的尿液中可以检测到的病理物质是异戊酰甘氨酸。
氨——类似尿液的气味
氨是第一批被认为会在尿失禁患者周围引起恶臭的分子之一。根据这一概念,细菌尿素酶(主要是大肠杆菌、奇异变形杆菌Proteus mirabilis和粪肠球菌 Enterococcus faecalis)会将尿素分解成难闻的氨。然而,也有研究人员对这一假设提出质疑。
蛋氨酸及其代谢物——腐臭黄油或煮卷心菜的气味
甲硫氨酸腺苷转移酶(MAT) I/III缺乏是甲硫氨酸代谢的遗传性错误,主要在新生儿筛查中发现。它是由导致蛋氨酸及其代谢物积累的MAT1A基因突变引起的。是持续性孤立性高硫血症最常见的原因。
苯乙酸盐——霉味、鼠味
另一个导致尿液有独特的类似老鼠气味的原因是苯丙酮尿症(PKU)。
支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)及其酮酸——焦糖或枫糖浆的气味
枫糖浆尿病(MSUD,亮氨酸病)是另一种代谢紊乱,其症状之一是有明显的尿气味。
3-羟基异戊酸——雄性猫尿的气味
在3-甲基巴豆酰辅酶a羧化酶(3-MCC)缺乏的其他症状中,一些研究人员报告了尿液的特殊气味。
醛类(乙醛、丁醛、异戊醛)——类似尿液的气味
在尿失禁患者的尿液样本和尿失禁卫生垫中检测到少量有气味的醛类物质。据报道,乙醛、丁醛、异戊醛(具有恶臭、类似尿液的气味)的浓度高于检测阈值,可以假设它们有效地增加了UI患者的气味强度。尿醛的来源至少部分是肠道及其微生物群。
从皮肤表面散发出的气味分子大多来自汗液,汗液是汗腺分泌的产物。人体汗腺主要分三种类型:大汗腺、小汗腺和大小汗腺(混合型)。
小汗腺产生大量的汗液,主要含有水和电解质,它们几乎分布在整个身体表面。
大汗腺大多位于腋窝、会阴、生殖器区域和乳头周围。它们在青春期后变得活跃,分泌的汗液比外分泌腺少。
大汗腺分泌的汗液类似于小汗腺产生的汗液,但其分泌速率较高,尤其出现在腋窝部位。这些特征使得大汗腺成为腋窝出汗的重要原因。
顶泌汗液是无味的,它只有被皮肤表面的微生物分解后才会变得有气味,如微球菌科Micrococcaceae、好氧类白喉菌aerobic diphtheroids 和丙酸杆菌Propionibacteria。
激素平衡的变化、消耗的食物和新陈代谢的变化可能会对汗水的数量和质量构成产生影响。
皮肤微生物群的任何变化以及细菌感染都可能改变汗液的成分,通常会产生独特的气味,因为人类有机体与几种能够转化汗液化合物的微生物物种保持共生关系。
据报道,在链球菌性皮炎中,患者皮肤有一种独特的臭味。
此外,许多代谢疾病的特征是皮肤散发出各种气味。其中一些疾病包括苯丙酮尿症,甲硫氨酸吸收不良综合征,高硫氨酸血症,或TMAu。
下面将讨论已知会导致皮肤散发气味的物质。
E3M2H,HMHA,MSH——发臭、发臭的汗味
体臭,是一种令人尴尬痛苦的疾病,特别是在腋窝、生殖器或脚等部位。
这三种类型的汗腺都在这种疾病的发病机制中起作用。过度出汗后,细菌分解汗液成分,会产生难闻的汗味。与小汗腺腋臭相反,大汗腺腋臭在青春期后出现,是这种疾病最常见的形式。
细菌将顶泌汗液分解成许多挥发性分子,如氨和短链脂肪酸,例如(E)-3-甲基-2-己烯酸(E3M2H) ,这是一种C7支链和不饱和酸。它有一种非常强烈的刺鼻气味。
Natsch等人报道了有气味的E3M2H及其水合类似物,(R)/(S)-3-羟基-3-甲基己酸((R)/(S)-HMHA)是由位于腋窝皮肤上的共生棒状杆菌物种的特定锌依赖性N-α-酰基-谷氨酰胺氨酰酶(N-AGA)从谷氨酰胺缀合物(存在于腋窝分泌物中)中释放出来的。
HMHA(以腐臭、奶酪味为特征)是最丰富的。3-甲基-3-磺酰己-1-醇的(S)-异构体((R)/(S)-MSH)及其洋葱味和类似鼠尾草的气味是引起腋臭的另一种颗粒。
此外,多种因素与小汗腺腋臭有关。这些包括摄入某些食物产品,如大蒜或洋葱,角蛋白的细菌降解,代谢紊乱和多汗症。
三甲胺——鱼腥味
在TMAu患者中,过量的未代谢的三甲胺也会从皮肤表面渗出(伴有汗液),引起特有的鱼腥味体臭,无论患者的个人卫生状况如何,都会有这种体臭。
在对患有特发性恶臭的患者进行的一项研究中,约三分之一的患者三甲基胺尿检测呈阳性。在这些个体中,自我识别的体臭是主要症状(29.9%),其次是体臭和口臭(21.4%)。
然而,只有5%的TMAu阳性患者确实在手掌上检测到明显的恶臭,并且他们中没有人在社交距离处发出明显的体臭。在摄入胆碱(合成TMA的一种底物)后,多达10%受试者在社交距离内有明显的体臭。
氨——类似尿液的气味
研究表明,汗液中含有氨。然而,汗液中的氨来源尚未得到证实。一些研究人员认为它是从血浆中运输的,而其他人则认为它直接来自汗腺。
比较呼吸和汗液中氨浓度的研究结果也没有定论。一项研究表明,有气味的氨的皮肤释放量高于呼气。另一项研究则认为,皮肤气体中的氨含量比呼吸中的低。
蛋氨酸及其代谢物——腐臭黄油或煮卷心菜的气味
在新生儿筛查中未确诊的蛋氨酸腺苷转移酶I/III缺乏症(导致高蛋氨酸血症)患者,不仅在呼吸或尿液中,而且在汗液中可能会发现类似水煮卷心菜或腐臭黄油的特殊气味。这种独特的气味很可能是由蛋氨酸形成的有气味的二甲基硫引起的。
2-壬烯醛–油腻、青草味
自然身体气味的化学成分、强度和宜人性在一生中都会发生变化。众所周知,老年人有一种特殊的体臭,有时称“老人气味”。
研究人员对与衰老相关的体臭变化进行研究,发现了一种特殊的粒子,2-壬烯醛,它是老年人和中年人身体气味的特征。
这种不饱和醛具有独特的油腻和青草气味,是由皮肤表面脂质中的ω-7单不饱和脂肪酸降解产生的。

正常阴道分泌物:几乎无气味或有类似酸奶的气味。
与生殖液体一起释放的干酪味或鱼腥味可能是位于生殖器区域的感染(例如,细菌性阴道病、滴虫病或念珠菌病)以及非感染疾病(例如尿失禁、恶性溃疡、三甲基铵尿症或慢性便秘)的症状。
细菌性阴道病是阴道气味最常见的原因。其他症状包括阴道分泌物、瘙痒和刺激。这种情况下阴道液的异常腥味是由阴道加德纳氏菌Gardnerella vaginalis 等细菌产生的挥发性胺(腐胺、尸胺、TMA)引起的。在大多数情况下,细菌性阴道病可以用抗生素迅速治愈。然而,在大约三分之一的患者中,常规治疗并不能改善症状。
阴道气味的非感染性原因比感染性原因更不常见,因此它们构成了更大的临床挑战。医生也应该认识到,阴道的气味可能有不同的来源,如肛管或尿道。生殖器汗味的难闻气味也可能被误认为是阴道气味。
胃肠疾病,如慢性便秘和大便失禁,也应被视为肛门生殖器区域散发恶臭的可能原因。在这些状态下,挥发性有气味的化合物包括硫化氢、甲硫醇和二甲基硫化物,它们是造成屁和粪便气味的原因。这些患者的阴道检查不会显示任何异常。
最后,一些妇科肿瘤和病变患者抱怨阴道分泌物带有恶臭。例如,伴有坏死的外阴恶性溃疡可能导致腐烂气味,这可能是由于细菌形成腐胺、尸胺、短链脂肪酸(异戊酸和丁酸)和含硫化合物。
遗憾的是,缺乏管理体臭的循证指南,也没有普遍的治疗方法。医学文献中已经讨论了几种临时解决方案,如刷牙、漱口、嚼口香糖或经常用抗菌肥皂洗澡和使用除臭剂。然而,这些方法不能解决潜在的问题,而是掩盖或减少不愉快的气味到可接受的水平。只有把原因考虑进去,才能取得令人满意的结果。
一般来说,与体液中细菌代谢物积累相关的恶臭是由气味物质的合成和排泄之间的不平衡引起的。
可能是由以下一个或多个因素引起的:
(1) 含有气味物质或其产生底物的饮食
(2) “前气味”细菌组成和细菌的代谢活性
(3) 增加从肠道对气味物质或其前体的吸收(增加肠道转运时间,增加肠道-血液屏障通透性)
(4) 减少气味物质的肝脏代谢
(5) 减少尿排泄
基于以上所述,除了标准的卫生程序之外,还可以建议一些一般的但不是基于证据的预防措施。
1. 减少产生气味的食物基质。
2. 经常排便以减少通过时间(缩短肠道细菌代谢时间和细菌代谢物吸收时间),治疗便秘。
3. 益生菌和益生元治疗(尝试改变肠道细菌组成)。
4. 多喝水,以增加代谢物随尿液的排泄。
下表总结了与细菌气味剂有关体味的治疗选择。根据气味类型进行管理:

Mogilnickaet al., Int J Mol Sci, 2020
目前为止,已经确定了几种导致体臭的化合物,其中大多数是细菌来源的。虽然没有基于证据的管理身体恶臭的指南,一些针对饮食、肠道菌群组成的治疗措施可能会减轻症状。需要提高临床认识以及进一步的研究来解决体臭问题。
相关阅读:
肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?
参考文献:
Li, M.; Al-Sarraf, A.; Sinclair, G.; Frohlich, J. Fish odour syndrome. CMAJ 2011, 183, 929–931.
Rath, S.; Heidrich, B.; Pieper, D.H.; Vital, M. Uncovering the trimethylamine-producing bacteria of the human gut microbiota. Microbiome 2017, 5, 54
Piotr, K.; Marcin, U. Indoles – Gut Bacteria Metabolites of Tryptophan with Pharmacotherapeutic Potential.Curr. Drug Metab. 2018, 19, 883–890
Mogilnicka Izabella,Bogucki Pawel,Ufnal Marcin,Microbiota and Malodor-Etiology and Management.[J] .Int J Mol Sci, 2020, 21.
Bielinska, K.; Radkowski, M.; Grochowska, M.; Perlejewski, K.; Huc, T.; Jaworska, K.; Motooka, D.; Nakamura, S.; Ufnal, M. High salt intake increases plasma trimethylamine N-oxide (TMAO) concentration and produces gut dysbiosis in rats. Nutrition 2018, 54, 33–39
Suzuki, N.; Nakano, Y .; Watanabe, T.; Yoneda, M.; Hirofuji, T.; Hanioka, T. Two mechanisms of oral malodorinhibition by zinc ions. J. Appl. Oral Sci. 2018, 26, e20170161