-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

当地时间12月19日,微软联合创始人、亿万富翁比尔·盖茨发布了对来年的年度预测,称 2024 年将是一个“转折点”。
在这封长达 10 页的信中他展示了对人工智能领域的更多创新、婴儿营养不良问题的突破、气候变化谈判的进展等多方面的期待。
人工智能可以让世界变得更加公平。盖茨对人工智能的预测超越了去年的超声波预测,他断言人工智能的进步将广泛改善全球健康,同时促进创新。
人工智能可以帮助世界各地对抗抗生素耐药性疾病,识别高风险妊娠并估计孕龄等,他预计人工智能在开发新药、诊断疾病和增强教育资源方面将发挥至关重要的作用。
盖茨表示,世界在利用肠道微生物补充剂来解决儿童营养不良方面即将取得突破。
本文我们来看看盖茨眼中的儿童营养不良问题及解法,盖茨预计,随着对微生物组的深入研究,人们将能够开发出以微生物为基础的新型营养治疗方案,这将给解决全球儿童营养危机带来重要进展。
期待已久的营养不良问题的突破即将到来
在盖茨基金会,我们愿意下大赌注。我们知道每一次冒险都可能没有回报,但这没关系。我们的目标不仅仅是逐步取得进展。我们的目标是将我们的努力和资源投入到重大项目中,这些项目一旦成功,就能拯救和改善生命。
当你下一个大赌注时,你往往要等待很长时间才能看到它是否有回报。当你终于意识到它会成功时,那种感觉是难以置信的。我最兴奋的一次豪赌就接近了这一时刻:利用我们对肠道微生物群的了解来预防和治疗营养不良。
经常有人问我,如果只能解决一个问题,我会选择什么。我的答案不变:营养不良。这是世界上最严重的健康不平等现象,大约每四个儿童中就有一个受到影响。如果在生命的头两年得不到足够的营养,身体和智力都无法正常发育。通过解决营养不良问题,我们可以减少导致儿童死亡的最大因素之一。
营养不良的原因远比没有得到足够的食物要复杂得多。大约15年前,研究人员注意到脊髓灰质炎等口服儿童疫苗在营养不良率高的地区效果不佳,他们开始怀疑生活在肠道中的微生物群可能在其中发挥了作用。很明显,有什么东西妨碍了它们被正常吸收。
这种怀疑在2013年得到了证实,当时生物学家杰夫·戈登(Jeff Gordon)发表了一项有里程碑意义的研究,关于马拉维一对双胞胎婴儿的微生物群。微生物群不仅是健康的副产物,还是健康的决定因素。这是第一条重要线索,表明我们或许可以通过改变肠道微生物群来减少营养不良问题。
经常有人问我,如果只能解决一个问题,我会选择什么。我的答案不变:营养不良
在过去的十年里,我们对肠道微生物群的了解比之前的1000年还要多。我们发现,生活在肠道中的细菌可能处于功能失调状态,从而导致炎症,使人无法吸收营养。我们发现,如果及早干预,就能最大程度地改善肠道微生物群。
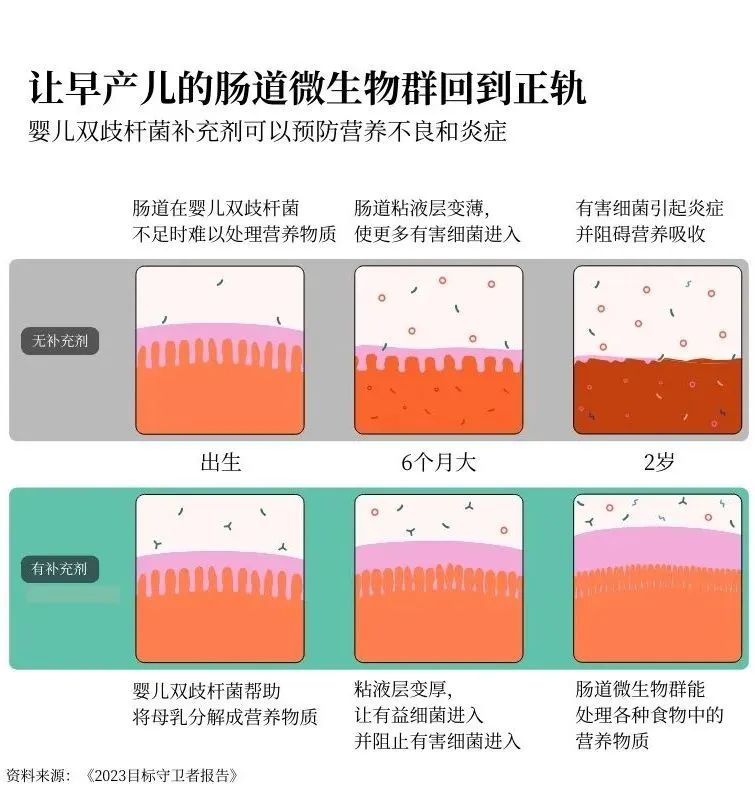
在人类发育过程中最先出现的肠道细菌之一叫做婴儿双歧杆菌。它能帮助将母乳中的糖分分解成人体生长所需的营养物质。反过来,母乳又为婴儿双歧杆菌和整个肠道微生物群提供食物。这是一个良性循环。但是,如果婴儿一开始没有足够的婴儿双歧杆菌,他们就可能无法从母乳中吸收足够的营养来支持其他必要的肠道细菌的生长。
要克服这种缺陷几乎是不可能的。你可以获得世界上所有富含营养的食物,但这并不管用。如果你的肠道生长路径过早被打乱,你可能永远无法吸收到所需的全部营养。
但是,如果我们能给高危婴儿服用婴儿双歧杆菌作为益生菌补充剂呢?我们能否及早干预,让他们正常发育?
这正是基金会合作伙伴多年来一直在研究的问题——我们终于找到了答案。我们正在对一种可添加到母乳中的婴儿双歧杆菌粉末补充剂进行三期临床。来自5个国家的16000名婴儿参与了试验,研究人员正在对每个婴儿进行跟踪,以确保益生菌既安全又有效。
目前的研究结果令人惊叹:通过给婴儿喂食这种益生菌,可以帮助他们的微生物群进入积极状态,从而使他们能够长大并充分发挥潜力。这对预防营养不良大有裨益。
在婴儿出生前就能改善肠道微生物群,这也让我感到兴奋。新的研究发现,婴儿的微生物群与母亲的微生物群息息相关。解决子宫内的炎症问题会给产妇、胎盘和发育中的胎儿带来更多益处。
如果我们能给准妈妈提供一种益生菌补充剂,让她的孩子从出生第一天起肠道就正常发育,那会怎么样呢?目前还不清楚这些活体生物药到底是什么样的,也不清楚如何给药,这还只是非常早期的研究。但研究表明,健康的微生物群可帮助婴儿在妊娠晚期每天增加5克体重。
在过去十年里,儿童健康领域发展速度超出了我一生中的预期。看到微生物群从一个完全看不见的东西变成解决世界上最大健康不平等之一的关键策略,真是令人惊叹。我迫不及待地期待在接下来一年里我们将学到多少新知识,以及我们将如何运用这些知识来拯救生命…
——比尔·盖茨
儿童营养不良问题的现状如何?带来什么问题?
儿童营养不良问题给全球健康带来巨大挑战,据世界卫生组织和联合国儿童基金会的数据统计,到 2020 年,估计有1.49亿 5岁以下儿童生长发育迟缓(年龄身高低),而 4500万儿童出现消瘦(WLZ 低)。
营养不良及其长期后遗症是该年龄段人群发病和死亡的主要原因。后遗症包括线性生长、免疫和代谢功能以及神经发育的持续损害——所有这些都对当前的干预措施有很大的抵抗力。
从比尔·盖茨的年度总结我们也可以看到,他十分重视肠道微生物对健康的影响,总的来说,微生物方面的研究给儿童健康带来了很大希望。
从肠道微生物组的角度入手,对营养不良儿童进行基于微生物群的相关干预措施,比尔及梅琳达·盖茨基金会已支持多项相关研究。我们来看近期得到该基金会支持的两篇研究文献。
在健康儿童中,肠道微生物组在分类和功能多样性方面稳步增长,直到3岁,其中最明显的变化发生在断奶期间。相比之下,营养不良儿童的肠道微生物组是年龄倒退的,即肠道微生物组与年幼儿童相似。
抗生素是严重急性营养不良的标准治疗方法,因为即使儿童没有出现明显的疾病,他们也可能因急性感染而突然恶化。
在马拉维和尼日尔,与安慰剂相比,短期(即7天)阿莫西林给药已被证明在降低全因死亡率、住院率、腹泻病和改善人体测量方面具有益处。
然而,抗生素治疗对严重急性营养不良儿童的潜在后果(如抗生素耐药性的发展和微生物组破坏)仍存在不确定性。
研究设计
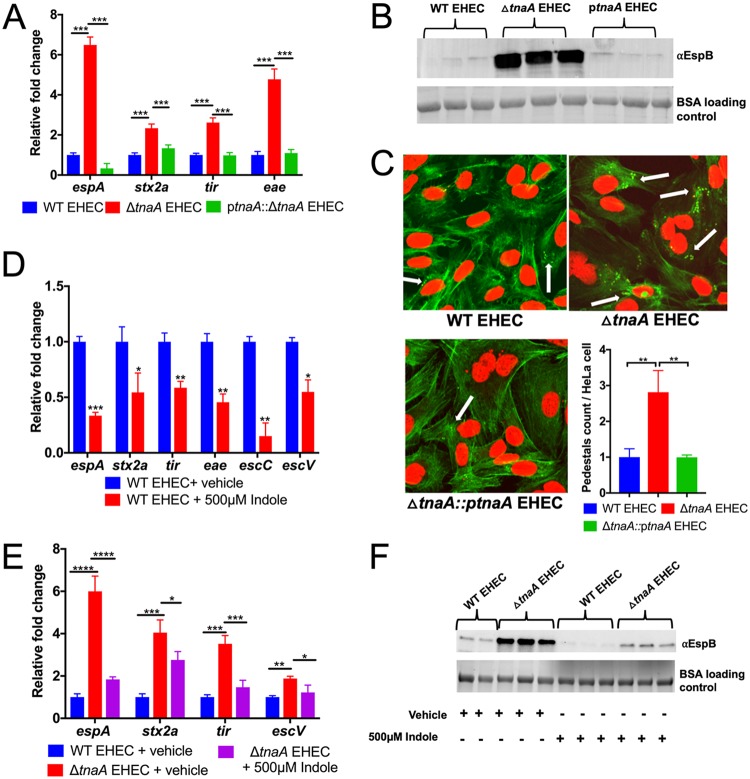
研究人员想要确定 7 天的阿莫西林治疗,对接受严重急性营养不良治疗的儿童肠道微生物组和抗生素耐药组的急性和长期变化的影响。该成果发表在《Lancet Microbe》。

研究人员对尼日尔门诊治疗的严重急性营养不良儿童(6-59 个月)的阿莫西林随机、双盲、安慰剂对照试验 (NCT01613547) 进行了二次分析。从2013年9月23日至2014年2月3日从整个队列中随机选择了161名儿童(n = 2399)进行最初12周的随访。
根据人体测量结果从这161名儿童中选择了一个方便样本,2年后(2015年9月28日至10月27日)进行随访。儿童在基线、第 1 周、第 4 周、第 8 周、第 12 周以及 2 年随访队列中的第 104 周提供了粪便样本。研究人员进行了宏基因组测序,然后对粪便样本进行了微生物组和耐药组分析。38 名无严重急性营养不良的儿童和 6 名与原始队列基线年龄相匹配的严重急性营养不良儿童被用作参考对照。
研究结果
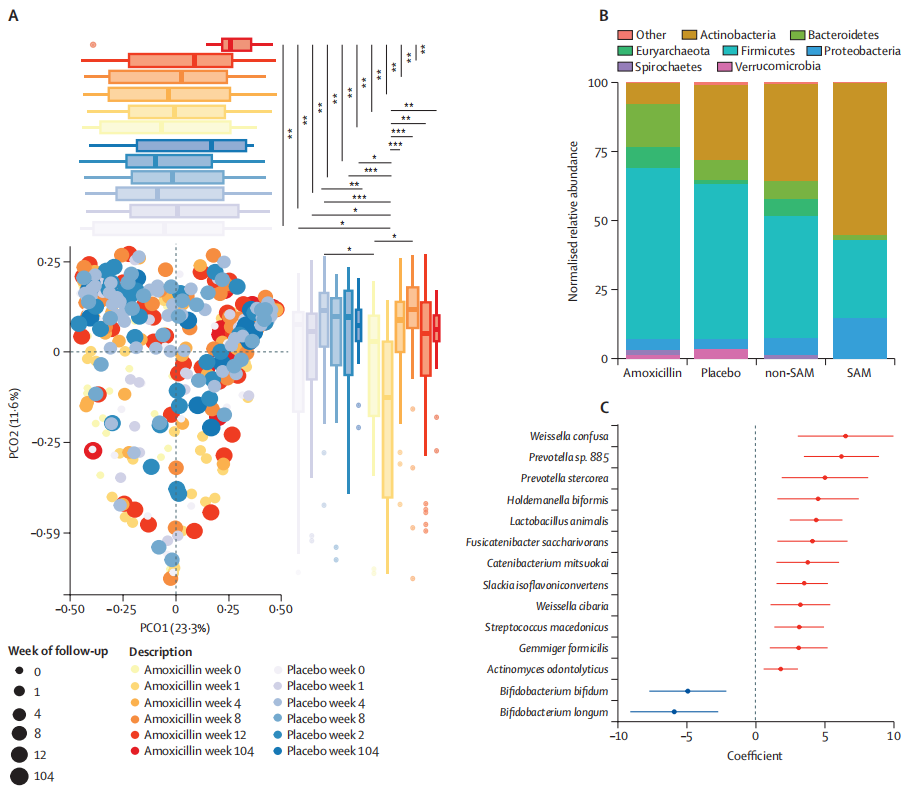
结果表明,营养不良的尼日尔儿童在接受抗生素治疗后,虽然发现克雷伯氏菌属、埃希氏菌属等增加,这些菌可能与更严重的感染相关,但是,微生物组和耐药组扰动的负面影响似乎是短暂的,在三周内完全消失。
进一步观察到阿莫西林治疗的一些意想不到的长期益处,包括改善长期微生物组丰富度,多样性和成熟度。
阿莫西林对长期微生物组成熟的影响
doi.org/10.1016/S2666-5247(23)00213-6
生命头三年肠道微生物组急剧成熟的一些关键驱动因素包括婴儿在出生期间和出生后接触母体微生物、加入牛奶、奶粉以及向固体食物的过渡。在营养不良的儿童中,肠道微生物组的成熟过程和生长都受到阻碍。但在治疗计划中加入抗生素改善了他们的身体测量和微生物组发育。
抗生素可能起到重置的作用,使有助于固体食物消化的微生物群在肠道生态系统中繁衍生息。
“
接受抗生素治疗的效果,对严重营养不良儿童来说算是个好消息,对于这一特定人群,抗生素治疗的益处似乎大于风险,但风险确实存在。研究人员警告说,儿童中已知的耐药细菌和耐药基因的增加不应被忽视。
营养干预措施,如即食治疗性食品,已被证明可以暂时改善肠道微生物组的成熟度和人体测量得分;然而,这种改善并不总是持续的。
在过去的5年里,合理设计的以微生物群为导向的治疗性食品在中度和重度急性营养不良儿童的微生物组恢复和人体测量得分方面显示出了希望。
接下来我们来看对于微生物群为导向的治疗性食品研究的最新进展。
生命头两年,肠道微生物群的发育需要与身体其他部分、其他器官系统的发育同步。当这个微生物群不完全形成时,仅仅增加热量是无法修复的。研究人员试图寻找特定的食物成分,以滋养健康的肠道微生物群,希望修复营养不良儿童肠道微生物群的功能失调。
使用传统食疗食品治疗可减少死亡,但并不能实质性改善营养不良的其他长期影响,包括新陈代谢、骨骼生长、免疫功能和大脑发育问题。
近日,来自华盛顿大学医学院的一项研究,已经确定了一种新型治疗食品中天然存在的关键生化成分,以及处理这些成分的重要细菌菌株。
该研究表明,识别这些成分以及作为其治疗靶标的关键促生长肠道细菌菌株,研究强调了了解细菌菌株如何加工特定食物成分的重要性,可以帮助指导当前食品配方的治疗,并可以在未来创造新的、更有效的配方。该研究成果于2023年12月13日发表在《Nature》杂志。
研究人员从试验参与者的粪便微生物群中重建了1000个细菌基因组(宏基因组组装基因组,简称MAG),确定了75个丰度与体重生长(体重长度Z评分变化,简称WLZ)正相关的MAGs。将MAG基因表达的变化表征为治疗类型和WLZ反应的函数,并定量MDCF-2和粪便中的碳水化合物结构。
结果表明,两个与WLZ呈正相关的普雷沃氏菌MAG是MDCF-2诱导的代谢途径表达的主要贡献者,这些代谢途径涉及利用MDCF-2的组分聚糖。
结果强调了微生物组反应的显著菌株特异性,并指出两种普氏菌菌株(MAG Bg0018 和 MAG Bg0019)是 MDCF-2 聚糖代谢和宿主体重生长反应的关键介质。
在生长相关细菌分类群代谢的MDCF中鉴定生物活性聚糖结构,有助于指导关于其在急性营养不良儿童中使用的建议,并有助于开发其他制剂。
在这项工作的基础上,世界卫生组织与比尔及梅琳达·盖茨基金会正在支持一项大型多站点临床试验,研究这种新的治疗性食品——MDCF-2,或微生物组导向的补充食品。
MDCF-2 治疗性食品包括哪些食物成分?
在 2021 年的临床试验中,MDCF-2 治疗性食品作为膳食补充剂提供,以提供儿童每日能量需求的约 20%。
Prevotella copri 两个菌株对MDCF-2干预改善营养不良的关键作用
研究人员发现:普雷沃氏菌Prevotella copri与儿童的生长发育呈正相关。
P. copri是拟杆菌门的成员,该门的成员含有一组叫多糖利用基因座(PUL)的基因,这些基因介导特定聚糖或一组聚糖的检测、导入和代谢。
它们在利用MDCF-2治疗食品中有益的生物活性碳水化合物结构的代谢途径中表现出活性的增加。
与接受传统治疗性食物的儿童相比,接受MDCF-2的儿童血液中支持肌肉骨骼生长和神经发育的某些蛋白质水平较高,与炎症有关的蛋白质水平较低。也表明,微生物群修复的作用远不止于肠道。
研究人员对这些儿童的粪便样本进行了广泛的基因组分析,了解对这些食物成分有反应的细菌,以及这些细菌对治疗的反应所具有和表达的代谢能力。事实证明,许多与儿童生长密切相关的细菌富含碳水化合物代谢的途径。
分析不同食物中的关键有效成分
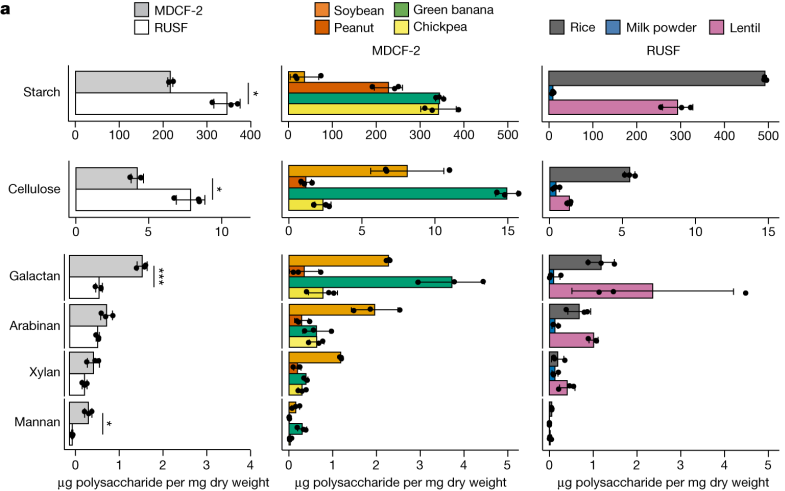
在该研究中,通过质谱分析MDCF-2和RUSF两类食品,确定其组成成分。
MDCF-2、RUSF 及其食品成分中的多糖
DOI: 10.1038/s41586-023-06838-3
对这些食物详细分析表明,MDCF-2食物中L-阿拉伯糖、D-木糖、L-岩藻糖、D-甘露糖和D-半乳糖醛酸 (GalA) 显著更丰富(P < 0.05)。
也就是说,MDCF-2含有更多的多糖,即半乳聚糖和甘露聚糖。而传统的治疗性食物RUSF含有更多的淀粉和纤维素。
MDCF-2 有效提高营养不良儿童生长
尽管MDCF-2的热量密度比高热量食物低15%,但与接受传统补充食物的儿童相比,接受MDCF-2治疗的儿童表现出更高的生长速度。
与MDCF-2治疗相关的生长增加与儿童微生物群中某些普氏菌菌株中存在的代谢途径的表达增加有关,这些途径与生物体利用MDCF-2中存在的多糖有关。
“来自食物频率问卷的信息表明,对MDCF-2反应最大的儿童也食用了更多的坚果和豆类作为他们日常饮食的一部分” ,研究人员表示,“这些坚果和豆类具有一些与MDCF-2相同的多糖。这表明可能有机会调整MDCF-2的成分和剂量,以进一步增强其治疗效果”。
营养不良儿童“微生物组修复”的一个定义是,重新平衡有益菌的表现和表达功能,使其呈现出更有利于健康微生物组-宿主共同发育的构型。
以这种方式将膳食聚糖和微生物代谢联系起来,为基于培养的计划提供了一个起点,这些计划旨在检索这些“效应”类群的分离物,用作潜在的益生菌制剂,或者如果与他们渴望的关键营养素相结合,修复对单独基于食物的干预反应不足紊乱的微生物群,提供合生元配方。
当然,P.copri菌株和MDCF-2聚糖之间的关系并不排除其他宏量或微量营养素对MDCF-2在增重方面优于RUSF的贡献。
总之,为改善微生物群的营养干预提供了一种新的见解。
这些和其他研究的结果有助于加深我们对微生物如何与人类细胞和器官合作,从而影响发育生物学的理解,帮助相关产业科研人员开发微生物组导向疗法的方法,帮助开发构建儿童营养健康的新策略,以确保在出生后的头几年形成健康的微生物组,尽可能规避儿童营养不良风险。
同时,随着人工智能技术及高通量测序等先进技术的不断发展,整合食物-微生物-人体交互作用研究,通过对婴幼儿的肠道菌群进行定期检测,可以帮助家长更好地监测儿童肠道菌群的变化,及时发现异常,采取相应的纠正措施,有利于促进儿童的身心健康发育。

谷禾健康

“肚子里有蝴蝶”这句话的词源最早出现在弗洛伦斯·匡威(Florence Converse) 于 1908 年撰写的《祈祷之家》一书中。一百多年来,这句话一直被广泛用作成语,它描述了一个人面对压力或惊心动魄的事件时的不安感。
扑腾的蝴蝶不仅隐喻我们体内扑动的感觉,它也是一个术语,描述了一个巨大事件的一系列连锁反应中的最初动作。
特别令人迷惑和应该注意的是,人们将这种感觉描述为起源于肠道而不是其他地方的东西。二十多年来,科学家们一直在追寻这些“蝴蝶”及其起源,他们意识到这种成语可能与受胃肠道(GI)共生微生物影响的“感觉”有关。这些年科学家们在了解共生肠道微生物在人类生理学和病理生理学中的重要性方面取得了惊人的发现。

肠道中的共生微生物通过“肠-脑轴”对宿主行为产生各种影响。 “肠脑轴”是胃肠道系统和中枢神经系统之间的远端连接;它由跨越两个身体系统的复杂信号转导途径组成(这方面详细的文章可以翻看以往谷禾发的相关文章)。肠道细菌及其代谢物发挥“蝴蝶效应”,将信号传播到大脑,最终改变宿主的行为。
下丘脑-垂体-肾上腺 (HPA) 轴是压力调节的经典途径,是将共生肠道微生物、胃肠道、大脑和行为相互连接的最有前途的途径之一;这也反映了肠道内的颤动感。此外,压力信号可以通过迷走神经和传入/传出神经元连接传输到大脑。
面临威胁时通常会感到压力、紧张、担心和焦虑。最近的研究结果表明,应激反应和肠道微生物会相互影响宿主的许多行为结果。为了了解共生肠道微生物在应激调节和反应中的作用,许多研究使用限微生物动物、16S rRNA 测序、宏基因组测序、粪便微生物群移植、抗生素治疗和益生菌来揭示宿主-微生物之间相互交织的相互作用。
本文重点关注啮齿类动物作为模式生物,探索肠道微生物群、压力和行为之间的因果关系。还纳入了一些临床观察结果来深入说明问题。
✓
心理压力是一个全球性问题,影响着全世界至少三分之一的人口,并增加了患多种精神疾病的风险。这几年越来越多的证据表明,肠道及其栖息的微生物可以调节压力和与压力相关的行为异常。
当面临厌恶压力刺激时,压力感知、整合和应对是大脑的重要功能。压力相关信息被整合到感觉皮层,然后将信号发送到边缘系统、下丘脑和脑干,以激活 HPA 轴以及交感神经和副交感神经。
交感神经和副交感神经传播应激反应以引起体内各个系统的快速适应。检测来自外部环境的压力信号的大脑区域与参与情绪的大脑区域重叠,从而协调一致地协调动物或人类的压力反应。
下丘脑室旁核的核心作用:整合压力信号和调节应激反应
在参与调节应激反应的大脑区域中,下丘脑室旁核 (PVN) 在整合来自环境刺激的信号并进一步触发下游神经传递方面发挥着核心作用。 PVN 接受来自边缘系统和脑干的神经支配,调节 HPA 轴并整合应激后的反应。 PVN 中分布着各种类型的神经元。主要是,PVN 和其他相关大脑区域中的促肾上腺皮质激素释放激素 (CRH) 神经元对不同形式的压力做出反应。
注:促肾上腺皮质激素释放激素 (CRH) 是一种由下丘脑室旁核 (PVN) 产生的神经肽。它是下丘脑-垂体-肾上腺轴 (HPA轴) 中的关键调节因子之一。CRH的主要功能是刺激垂体前叶分泌促肾上腺皮质激素 (ACTH)。ACTH进而刺激肾上腺皮质分泌皮质醇和其他类固醇激素。CRH的释放通常受到多种刺激因素的调控,如应激、体内环境的变化和生物节律。CRH的异常释放与许多疾病和症状有关,如抑郁症、焦虑症和肾上腺皮质功能不全等。
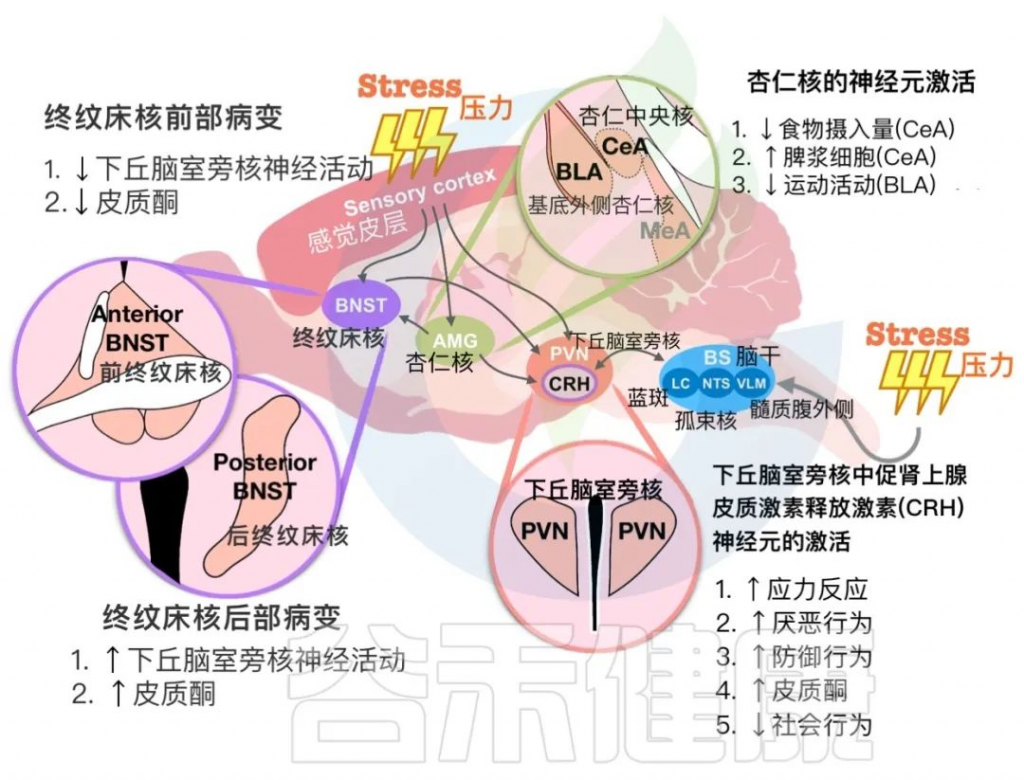
在下图中,总结了PVN中的CRH神经元与终纹床核(BNST)和杏仁核细胞在应激反应中相互作用的发现。这些大脑区域对于确定循环皮质酮水平和动物行为输出至关重要。
下丘脑室旁核(PVN)与其他大脑区域对压力暴露的反应
doi: 10.1186/s12929-023-00984-6
注:循环皮质酮是指在血液中循环的一种皮质酮激素,也被称为血浆皮质酮。皮质酮是由肾上腺皮质分泌的一种类固醇激素,它在机体的应激反应中起着重要的作用。循环皮质酮的水平在应激反应中通常会升高,它可以促进葡萄糖的产生、调节蛋白质和脂肪代谢,并参与免疫和炎症反应。
作为应激反应的中枢,PVN CRH 神经元可以被应激刺激触发,随后引发多种内在行为反应。
研究表明,在迫在眉睫的严峻任务中可以检测到 PVN 中 CRH 神经元活动的增加,这是一种模仿来自天空的捕食者威胁的方法,其中大多数小鼠表现出逃避行为,对迫在眉睫的阴影几乎没有冻结反应。
注:冻结反应是指在面对威胁或危险时,个体表现出明显的静止和冻结的反应。这种反应是动物和人类在面对潜在的威胁时的一种自我保护机制。当个体感知到威胁时,自主神经系统会释放肾上腺素等应激激素,导致身体进入一种高度警觉和紧张的状态。在这种状态下,个体可能会减少运动、停止呼吸、固定目光等,以最大程度地减少被威胁的可能性。这种反应在野生动物中常见,并且在人类中也可以观察到,尤其是在面对极端的恐惧、惊吓或创伤性事件时。增加冻结反应有助于个体在危险环境中保持相对安全,但在某些情况下也可能导致无助和无法应对的感觉。
PVN中的CRH神经元:与逃避行为和冻结反应的调节有关
沉默 PVN CRH 神经元会减少逃避行为,但会增加冻结反应。此外,PVN CRH 神经元预测迫在眉睫的威胁并编码压力可控性。同样,另一项研究表明,PVN 中的 CRH 神经元会对厌恶刺激做出反应,例如强迫游泳、尾巴约束、头顶物体、迫近,甚至腹腔注射。
PVN中的CRH神经元:与易感内脏疼痛的关联性
在一项研究中,与弹性小鼠相比,在小鼠经历母体分离后,易感内脏疼痛的小鼠在下丘脑室旁核(PVN)中显示出c-Fos阳性的促肾上腺皮质激素释放激素(CRH)神经元数量增加。
c-Fos是一种早期基因转录因子,它在神经元受到刺激后会被激活,并表达出来。因此,c-Fos的阳性表达可以作为神经元活动的标志。
在这种情况下,研究发现,在经历母体分离后易感内脏疼痛的小鼠中,PVN中的CRH神经元数量增加。这表明这些神经元在应激反应中被激活,并可能参与调节内脏疼痛的感受和处理。
PVN中的CRH神经元:在光遗传学刺激下对小鼠行为和压力信号传递的调控作用
研究发现,通过光遗传学刺激PVN 中的 CRH 神经元,可以增加小鼠的自我梳理行为,并改变其他家庭笼行为,类似于经历了足部电击的小鼠。通过增加环境的威胁水平,可以减弱刺激下丘脑下垂体后叶神经元的光遗传刺激对自我梳理行为的影响。研究还发现,从受压小鼠到未受压小鼠的压力信号传递需要激活两者的下丘脑下垂体后叶神经元。在社交互动测试中,刺激下丘脑下垂体后叶神经元会抑制社交行为并增加挖掘行为,同时导致皮质酮水平升高。
与此相反,并非所有的应激反应都与下丘脑下垂体后叶神经元有关。通过光遗传学激活下丘脑向腹外侧延髓的兴奋性投射,而不是下丘脑下垂体后叶神经元,可以在未经应激暴露的情况下在小鼠中重现应激诱导的高血糖现象。尽管如此,这些研究表明,当面临迫在眉睫的威胁时,下丘脑下垂体后叶神经元对于控制应激反应和行为至关重要。
BNST中CRH神经元:在应激反应调节中的作用
BNST(终纹床核)是连接与情绪有关的各个脑区的中继站。杏仁核-BNST和BNST-PVN回路参与应激反应调节。先前的研究表明,BNST由几个亚区组成,并向下丘脑下垂体发送不同的投射。在BNST回路中光遗传学激活基底侧杏仁核可以预防接受社交挫败应激的小鼠的焦虑行为。BNST的前部病变抑制了应激刺激后下丘脑和下丘脑-垂体-肾上腺轴的激活。
注:终纹床核是是应激反应神经回路中的关键节点,与身体的压力反应、焦虑和成瘾有关。BNST 损伤会改变与压力相关的皮质醇释放。
BNST后部损伤会增加急性束缚应激后下丘脑下垂体中的皮质酮水平和c-Fos阳性细胞数。应激暴露也会影响BNST的神经活动。捕食者应激、十字迷宫和束缚应激可增强BNST中CRH神经元的神经活动。然而,抑制BNST中的CRH神经元无法恢复应激引起的社交障碍,表明BNST可能受应激影响但不直接调节应激反应。
杏仁核:在压力和情绪调节中的作用
杏仁核是一个关键结构,与情绪处理和对压力的生理反应相关。杏仁核的各个子区域参与不同的机制来调节不同类型的压力源暴露。急性心理压力会增加内侧杏仁核 (MeA) 中 c-Fos 阳性细胞的数量,并增强中央核中的抑制性神经元活动杏仁核 (CeA)。
然而,杏仁核和 PVN 之间有限的直接连接可以调节应激反应。应激引起的免疫失调与 CeA 中不同的神经元群有关。确定了 CeA/PVN 和脾神经之间在应激相关免疫调节中的回路。人工激活 CeA 和 PVN 中的 CRH 神经元可增加脾浆细胞的形成。
将小鼠置于高架平台上不仅增加了CRH神经元活性,还促进了脾浆细胞形成,表明CeA和PVN参与了应激诱导的免疫反应。当小鼠暴露于捕食者气味时,抑制 mSTN 中的 CRH 神经元会增加冻结和隐现行为的潜伏期,并缩短适应捕食者威胁的快速眼动-睡眠反应的持续时间。
其他大脑区域的CRH神经元:在应激反应中发挥作用
捕食者刺激促进小鼠从快速眼动睡眠中快速唤醒。 最近的一项研究。研究表明,在快速动眼睡眠期间,内侧底丘脑核 (mSTN) 中的 CRH 神经元因外部刺激而被捕食者气味暴露所激活焦虑和抑郁样行为 和 BLA 中的神经活动,从而增加食物摄入量。
其他研究还表明,外周注射脂多糖 (LPS) 会增加 CeA 中的神经活动,从而减少食物摄入。CeA 病变在全身注射白细胞介素 (IL)-1 后阻止了 CRH 和促肾上腺皮质激素 (ACTH) 的释放。
总体而言,压力暴露会触发 PVN CRH 神经元与其他大脑区域对各种刺激做出反应。 PVN CRH 神经元似乎是连接其他大脑区域以启动压力反应和应对机制的中枢。了解应激反应的中心通路对于发现肠道微生物调节的信号通路非常重要。
✓
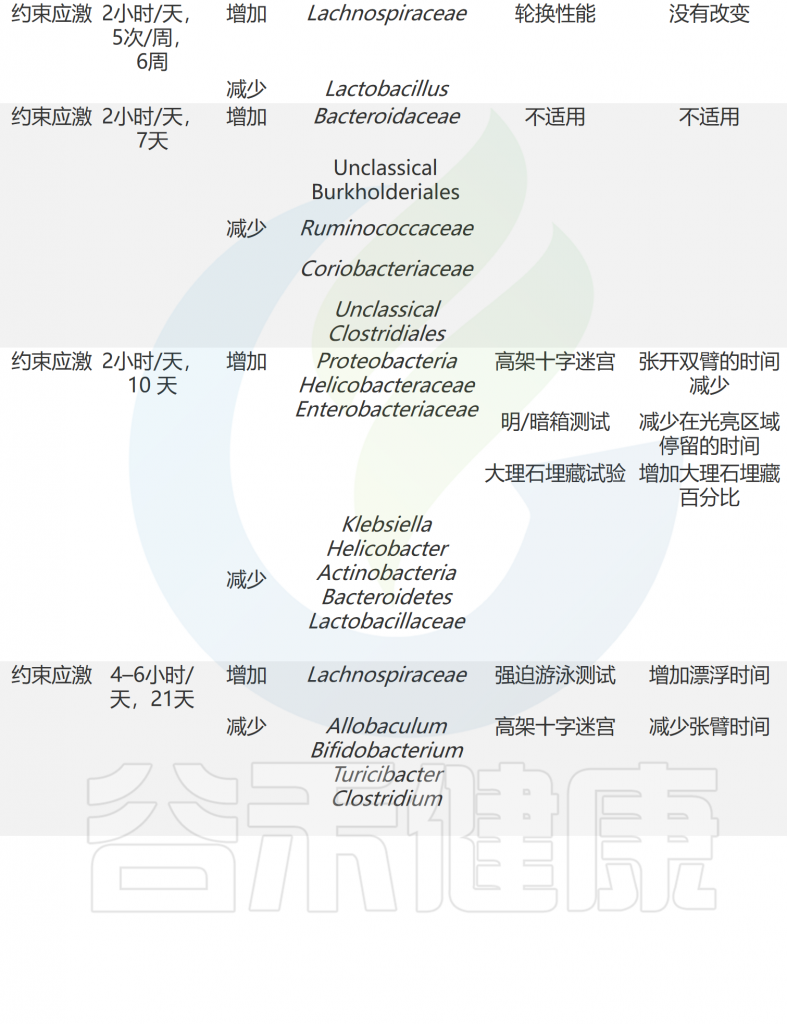
压力应对机制和适应对于生存至关重要。动物以多种方式应对压力,包括生理和行为的变化。有趣的是,科学家通过啮齿动物模型发现压力暴露会影响肠道微生物群(下表)。
急性和慢性应激条件下共生微生物组和行为的适应





doi: 10.1186/s12929-023-00984-6
不可预测的慢性轻度应激
不可预测的慢性轻度应激 (UCMS) 是一种实验条件,会引起类似于慢性且未解决的应激暴露的生理和神经变化。该实验条件下的小鼠通常表现出抑郁样行为,与抑郁症患者相似,但焦虑样行为没有明显变化。
有趣的是,改变后的厚壁菌门和软壁菌门(Phylum Tenericutes)在 UCMS 动物中得到一致观察。
注:软壁菌门是细菌界下的一个门,典型物种如支原体。
值得注意的是,UCMS中乳杆菌科细菌减少了 。 而且肠道核心菌属-粪球菌属(Coprococcus)在 UCMS 小鼠和人类抑郁症队列中减少。
慢性社会挫败压力
慢性社会挫败压力(CSDS)是一种社会心理压力,具有非凡的面部、结构和预测有效性。CSDS后的行为结局很复杂,包括抑郁样行为、焦虑样行为增加,以及社交行为减少。同样,CSDS转移的微生物组分析比UCMS转移的微生物组分析更复杂。
慢性社交失败压力是一种实验动物模型,用于研究社交压力对动物行为和生理的影响。这个模型通常用于研究抑郁症和焦虑症等精神疾病的机制和治疗方法。
在CSDS模型中,实验动物(通常是小鼠)被暴露于反复的社交失败和攻击中,例如与更强壮的同种异性动物进行斗争。这种持续的社交失败经历会导致动物出现一系列的行为和生理改变,包括社交退缩、抑郁样行为、焦虑、食欲和睡眠紊乱等。
研究人员一般使用CSDS模型来研究社交压力对大脑神经回路、神经递质系统和免疫系统的影响,以及潜在的治疗策略,例如抗抑郁药物和行为疗法。这个模型有助于理解社交压力对心理健康的影响,并为精神疾病的研究提供了一个可靠的实验基础。
研究发现CSDS后的行为结果是复杂的,包括抑郁样行为、焦虑样行为的增加以及社交行为的减少。同样,CSDS引起的微生物组轮廓变化比UCMS引起的更为复杂。CSDS后,拟杆菌门和Helicobacteracea 的数量增加。相反,厚壁菌门中的一些细菌,如瘤胃菌科(Ruminococcaceae),在CSDS后发生了改变,唯独乳杆菌没有变化。
社交过度交叉
社交过度交叉(SOC)是一种模拟增加住房密度的方法。SOC对行为的影响很小。小鼠只在高架十字迷宫中显示出速度增加和进入光/暗盒中的黑暗室次数增加。然而,SOC后微生物组的变化更为显著。SOC增加了Akkermansia muciniphila和Anaerostipes的相对丰度,并减少了Erysipelotrichaceae家族、Lactobacillus和Bacteroides acidifaciens(产酸拟杆菌)物种的相对丰度。
约束压力
约束压力是限制啮齿动物运动的经典方法。啮齿类动物在受到约束压力后会出现类似焦虑和抑郁的行为。虽然肠道中的许多细菌类群发生了改变,但厚壁菌门似乎是最容易被慢性束缚应激改变的细菌,尤其是乳杆菌科、毛螺菌科(Lachnospiraceae)。
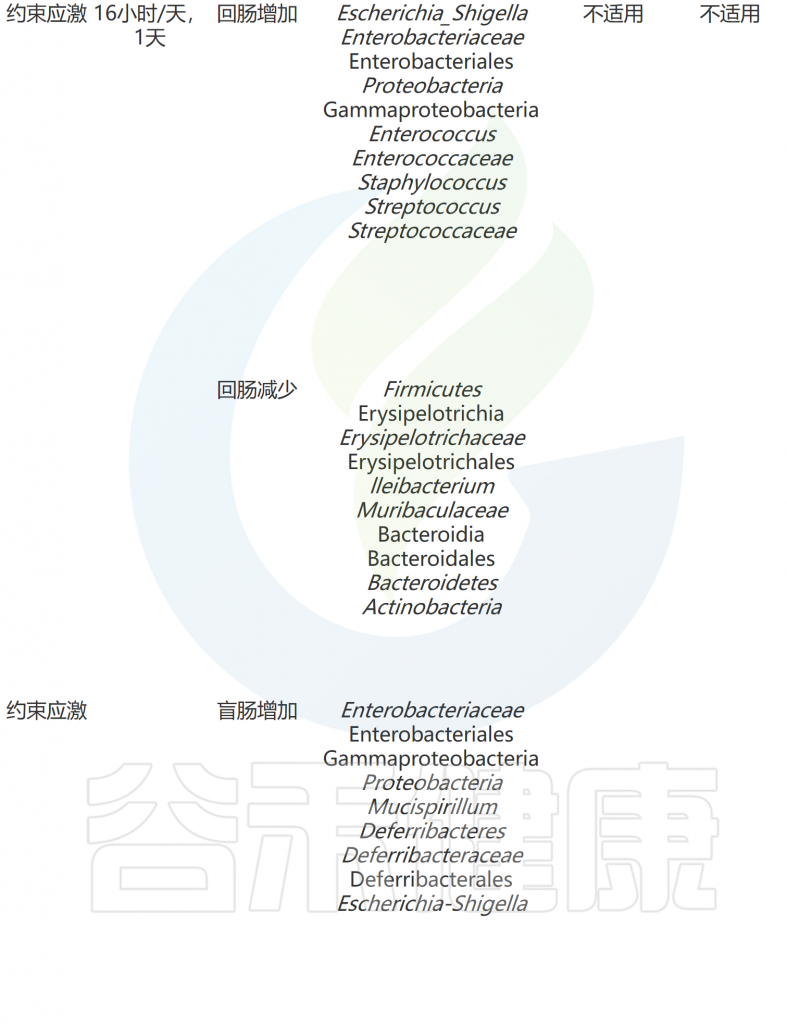
WAS小鼠是一种实验动物模型,用于研究自闭症和相关神经发育障碍。WAS代表”Wiskott-Aldrich syndrome”,是一种罕见的遗传性免疫缺陷病,患者通常表现出免疫功能异常、血小板减少和湿疹等症状。
WAS小鼠是通过基因突变技术,使小鼠的WAS基因发生突变,从而模拟人类WAS综合征。这些小鼠在行为和神经发育方面表现出与自闭症相关的特征,例如社交互动减少、沟通障碍、刻板行为和认知功能障碍等。
WAS是一种强烈的心理压力因素,会破坏肠道上皮紧密连接的完整性。与其他压力模型相比,单独的WAS对行为产生的影响不大。然而,WAS会影响粪便微生物组,导致拟杆菌门减少、厚壁菌门增加和变形菌门增加。当分析小肠和结肠的内容物时,WAS小鼠的乳杆菌科和未分类的拟杆菌门数量较低。
根据我们调查和总结,微生物组对压力的适应可能受到不同类型的压力、压力暴露时间、动物来源、饮食等因素的影响(下表)。在接受不同类型压力暴露后,已报道有几个细菌分类在不同研究中存在差异。
压力暴露会下会减少的细菌:
相反,压力暴露会增加的细菌:
注:研究人员观察到Anaerofustis菌与睡醒后30分钟内唾液皮质醇水平升高呈正相关
注:代表菌种幽门螺杆菌(Helicobacter pylori)
在这些研究中,Lactobacillus物种是在压力暴露后最一致减少的细菌分类。其余菌谷禾会逐步为大家科普。
✓
对小鼠的研究表明,压力暴露会改变肠道微生物组的组成并改变细菌分类群,这引出了另一个问题:肠道细菌是否在压力反应调节中发挥积极作用?
无菌和抗生素处理模型:揭示肠道微生物对应激反应的影响
为了解决这个问题,无菌和抗生素处理的啮齿动物是“敲除”共生菌群的理想模型,无论是持续性还是有条件的。令人惊讶的是,大多数研究表明,啮齿动物中的微生物群耗竭会增强应激反应并增加应激激素皮质酮。皮质酮是啮齿动物中的一种糖皮质激素(人类中的皮质醇),它是应激反应时分泌的重要类固醇激素。
然而,并非所有的研究都显示无菌啮齿动物在暴露于应激条件后会表现出过度的应激反应和更高水平的皮质酮。在测量无菌啮齿动物基线皮质酮水平时,尚未得出一致的结果。这些研究发现,下丘脑-垂体-肾上腺皮质轴(HPA)是肠道微生物改变宿主生理的重要调节因子;这引发了肠道微生物在应激抑制中可能发挥关键作用的可能性。
无菌啮齿动物明确表明肠道微生物的耗竭会导致异常的应激反应,包括皮质酮增加、与应激信号传导相关的基因表达改变以及异常的行为后果。虽然无菌模型是研究微生物对应激应对机制影响的宝贵工具,但需要注意下无菌模型的局限性。
无菌模型和抗生素给药模型:在研究应激反应时的局限性
无菌动物从出生开始就缺乏与微生物的接触,与常规饲养动物相比,它们可能表现出几个发育差异。这些差异包括肠道形态的改变、未成熟的黏膜免疫系统、口服耐受发育的延迟、上皮细胞周转减缓以及神经内分泌功能的改变,尤其是在早期生命阶段。对于这些差异的警告意识到了无菌模型在人体生理背景下的人为性质。
与无菌小鼠模型并行,广泛采用抗生素给药,以阐明肠道微生物在应激反应中扮演的角色。抗生素给药是一种控制共生微生物清除时间的有力工具。但是,年龄、治疗时间窗口、抗生素种类和剂量都是获得与无菌啮齿动物一致结果的关键因素。
此外,由于胃肠道不同区域对不同种类肠道细菌有地理选择性,完全清除肠道微生物还是一个挑战。只有少数研究能通过给予抗生素在无菌小鼠体内成功再现应激反应增强情况。
两项研究采用了类似的广谱抗生素药物组合(ABX),显示ABX的慢性治疗会导致小鼠基础皮质酮水平升高以及社交暴露后也会升高。
另外两项研究显示,口服单一抗生素的急性或慢性给药会导致小鼠在受到急性应激后,皮质酮水平升高。
皮质酮
皮质酮是一种 21-羟基类固醇,由在11和21位被羟基基团和氧代基团取代的孕 4-烯组成在位置3和20。皮质酮是在肾上腺皮质中产生的皮质类固醇类型的21碳类固醇激素。它具有人类代谢物和小鼠代谢物的作用。
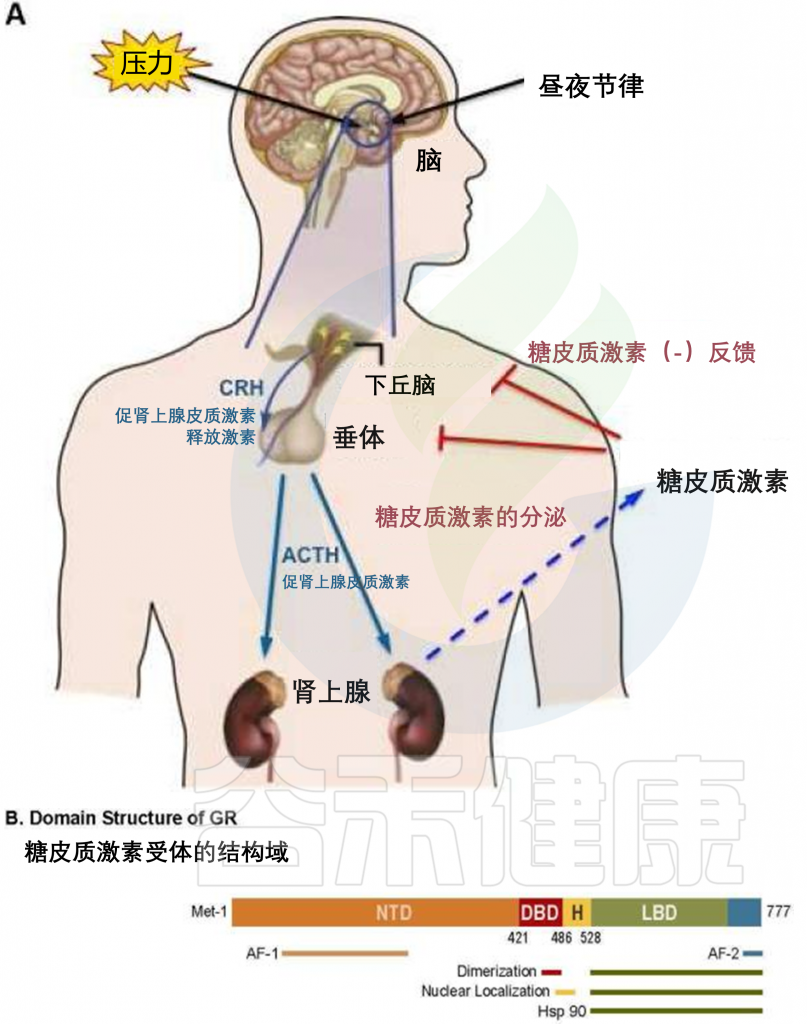
糖皮质激素(人类为皮质醇,啮齿类动物为皮质酮)是类固醇激素,由肾上腺根据生理信号和压力以昼夜节律方式合成和释放。
肾上腺释放糖皮质激素的昼夜节律受下丘脑-垂体-肾上腺 (HPA) 轴调节。来自视交叉上核 (SCN) 的输入刺激下丘脑的室旁核 (PVN),释放促肾上腺皮质激素释放激素 (CRH) 和精氨酸加压素 (AVP)。
这些激素作用于垂体前叶,激活促肾上腺皮质激素细胞,将促肾上腺皮质激素 (ACTH) 分泌到体循环中。
随后,ACTH作用于肾上腺皮质,刺激糖皮质激素的合成和释放。一旦从肾上腺释放到血液循环中,糖皮质激素就会进入靶组织,调节多种生理过程,包括新陈代谢、免疫功能、骨骼生长、心血管功能、生殖和认知。
由于其亲脂性,糖皮质激素不能预先合成并储存在肾上腺中,但必须在 ACTH 刺激下快速合成(使用许多酶促反应)。 HPA 系统内的这种前馈机制通过作用于垂体前叶和下丘脑内的糖皮质激素的负反馈来平衡,以分别抑制 ACTH 和 CRH 的进一步释放。
因此,人类血清皮质醇浓度在早晨达到峰值,在夜间最低。 HPA 轴是中央应激反应系统,负责应激反应的适应部分,试图恢复体内平衡。应激反应的不当调节与多种疾病有关,包括自身免疫性疾病、高血压、情感障碍和重度抑郁症。全身血清糖皮质激素水平由肾上腺糖皮质激素合成维持,但糖皮质激素的可用性在组织或细胞水平上进一步调节。
有趣的是,用抗生素对小鼠进行发育期治疗在各种条件下降低了皮质酮水平。对大鼠进行抗生素治疗也会降低皮质酮水平,表明存在模型依赖效应。其他研究表明,抗生素对皮质酮水平没有影响。虽然抗生素给药是研究肠道菌群对大脑和行为影响的有效方法,但在实验设计中需要仔细考虑。
✓
小鼠大脑应激反应失调的现象在无共生微生物的小鼠中被广泛观察到。一些研究调查了肠道微生物耗竭小鼠中糖皮质激素受体(GR)、CRH及下游信号通路的基因表达水平。发现在应激暴露后,无菌小鼠海马CA1区和颗粒回(DG)中观察到皮质酮水平升高和GR mRNA水平降低。
无菌小鼠下丘脑中CRF表达水平较高。皮质中GR基因表达水平较低,但下丘脑和海马中未观察到这种情况。
在基线条件下,GF小鼠海马中的GR下游信号通路,包括Slc22a5、Aqp1、Stat5a、Ampd3、Plekhf1和Cyb561等基因表达上调。
在WAS后,与SPF小鼠相比,GF小鼠海马CA1区的神经活动减少。
最近的研究发现,肠道共生微生物对于抑制宿主的应激反应和增加社交行为至关重要。在与陌生老鼠进行短暂社交互动后,无菌小鼠的应激激素皮质酮水平升高。
与此同时,多个与应对应激有关的大脑区域的神经活动也得到了上调,包括下丘脑旁室核(PVN)、海马齿状回(DG)和肾上腺背侧床核(adBNST)。
在成年阶段接受抗生素治疗的小鼠中,这种应激激素和神经活动的上调现象也得到了重复。此外,这项研究还表明,GF小鼠的海马(Arc、Fos、cJun、JunB、Egr1、Egr2、Gadd45b、Gadd45g、Bdnf)和下丘脑(Arc、Fos、Egr1)中的即时早期基因表达上调,而脑干(cJun、JunB、Egr1、Gadd45b、Gadd45g、Bdnf)中的即时早期基因表达下调。
然而,在基线和应激条件下,接受抗生素治疗的小鼠中应激相关基因表达并没有发生改变。只有在社交互动后,ABX小鼠的Crh基因表达上调,而在暴露于新环境后,ABX小鼠的Ucn基因表达上调。
以上小编概括起来就是:
最新的研究发现,肠道微生物对于调节宿主的应激反应和社交行为非常重要。在实验中,当无菌的小鼠与陌生的老鼠进行短暂的社交互动后,它们的应激激素皮质酮水平会增加。
在接受抗生素治疗的成年小鼠中,这种应激激素和神经活动的增加现象也得到了重复。此外,研究还发现,没有微生物的小鼠的海马和下丘脑中的即时早期基因表达上调,而脑干中的即时早期基因表达下调。
然而,在接受抗生素治疗的小鼠中,无论是在正常状态还是应激条件下,与应激相关的基因表达并没有发生改变。只有在社交互动后,接受抗生素治疗的小鼠的某些基因表达会增加。这些研究结果表明,肠道微生物对于调节应激反应和社交行为起着重要作用。
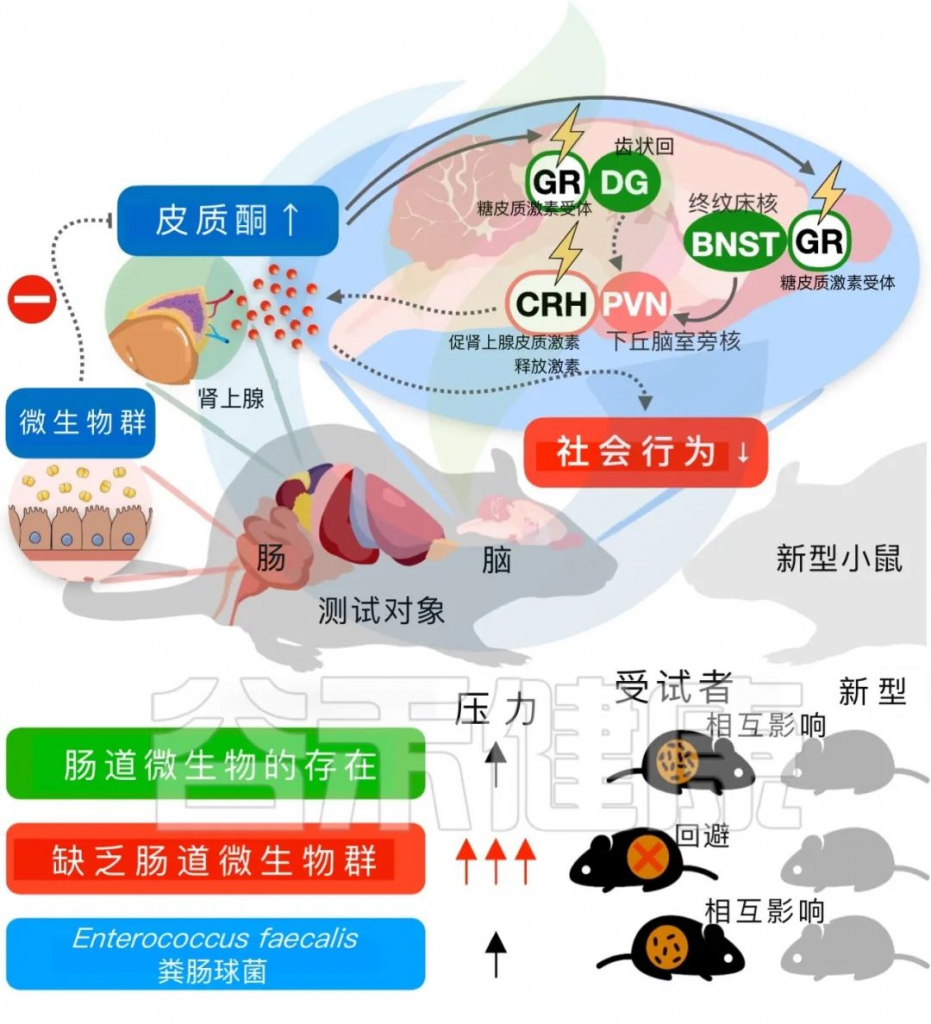
应激反应神经元的干扰可以改变小鼠的社交行为和皮质酮水平
为了进一步研究神经元在脑回路中的干扰是否能够改变小鼠的应激激素和社交行为,采用了基因消除策略和化学遗传学方法来干扰接受抗生素治疗的小鼠中的应激反应神经元。
该研究通过对接受抗生素治疗的小鼠进行基因消除和化学遗传学方法的干预,发现破坏应激反应神经元可以恢复社交缺陷并抑制皮质酮水平。特别是在下丘脑中基因消除GR会降低社交行为,并在社交互动后增加皮质酮水平。沉默PVN CRH神经元可以抑制皮质酮水平的增加并阻止社交缺陷的发展(下图)。
肠道共生微生物是抑制宿主应激反应神经元增加社会行为所必需的
编辑
doi: 10.1186/s12929-023-00984-6
PVN中CRH神经元活动的改变,可能是社交行为和应激反应失调的原因
与此相反,adBNST CRH神经元的这些效应在ABX小鼠中未观察到。此外,去肾上腺和药物阻断GR以及皮质酮合成可以恢复微生物缺失小鼠的社交互动行为。因此,该研究认为,在没有微生物组的小鼠中,社交行为和应激反应的失调更可能是由于PVN CRH神经元的神经活动改变,而不是应激相关基因表达的改变或PVN相关神经回路的结构改变。这项研究为共生菌通过特定途径驱动宿主行为的应激应对提供了证据。
神经科学技术的进步使科学家能够精确地研究受微生物组调节的神经回路,并进一步发现微生物组介导的与应激相关的神经回路的机制。
✓
压力条件下大脑中的神经元已经得到了广泛的研究,但肠道源的压力信号尚未完全阐明。糖皮质激素是一类肾上腺皮质激素,主要由肾上腺分泌,部分由肾上腺外系统分泌。
尽管肾上腺糖皮质激素在应对压力中起着作用,但肠道中肾上腺外糖皮质激素的生理作用仍未被理解。
肾上腺中的糖皮质激素合成途径涉及线粒体中的一系列步骤:
基于合成皮质酮的生化过程的基本区别,肾上腺外糖皮质激素的生理作用被认为与应对压力无关。
肠道上皮细胞对肾上腺外糖皮质激素的合成贡献
肠道上皮细胞是肾上腺外糖皮质激素合成的主要产生者。小肠、大肠和阑尾中表达了参与类固醇合成的关键酶,包括Cyp11a1和Cyp11b1。肠道糖皮质激素被认为对肠道微环境有贡献。研究表明,系统免疫挑战会上调糖皮质激素合成,并与肠道免疫细胞相互作用。炎症因子肿瘤坏死因子α(TNFα)和脂多糖(LPS)诱导的免疫系统激活促进肠道糖皮质激素合成。然而,白细胞介素1β(IL-1β)在体外模型中抑制肠道上皮细胞的糖皮质激素信号传导。
糖皮质激素在肠道屏障功能和免疫调节中的作用
糖皮质激素激动剂地塞米松可增加上皮细胞的屏障功能,但与细胞因子联合处理可能影响屏障功能。长期使用地塞米松可能影响上皮细胞通透性和基因表达,从而改变细胞的结构和功能。细菌内毒素LPS注射后,肾上腺外组织产生的皮质酮水平显著增加。因此,肾上腺外糖皮质激素主要具有免疫调节功能,与典型的应激信号有所不同。
肠道糖皮质激素合成在IBD中的降低及其与疾病发展的关系
肠道糖皮质激素合成在炎症性肠病(IBD)患者中表达水平显著降低,暗示肠道糖皮质激素合成障碍可能参与了IBD的发展。肠道糖皮质激素在炎症期间起到抑制肿瘤发展和生长的关键作用。然而,在肿瘤期间,Cyp11b1介导的糖皮质激素合成抑制抗肿瘤免疫反应,促进免疫逃逸。这为肿瘤治疗提供了有希望的治疗靶点。这些发现突显了肠道糖皮质激素合成在调节胃肠道疾病中的重要作用。
通过对无菌小鼠的研究,了解到失去菌群会如何改变肠道的应激反应。在基线、免疫挑战和应激暴露条件下,无菌小鼠的肠道应激相关基因表达发生改变。
在社会挫败和急性束缚应激条件下,糖皮质激素合成基因表达差异
在社会挫败和急性束缚应激条件下,比较了SPF(无特定病原体动物)小鼠和无菌小鼠的垂体、肾上腺和肠道的糖皮质激素合成基因表达。简而言之,社会挫败应激后,SPF小鼠的结肠中的Crh和Ucn2基因表达上调,而GF小鼠中则保持不变,部分原因是GF小鼠基线水平的增加。
有趣的是,无论GF小鼠基线水平是否增加,在社会挫败应激后,Hsd11b1的下调在SPF小鼠和GF小鼠中都观察到。另一项研究调查了GF小鼠肠道中糖皮质激素合成的肠段特异性。急性束缚应激和菌群的存在改变了GF小鼠回肠和结肠中Nr5a2(编码LRH-1)和Hsd3b2的表达。然而,与回肠相比,结肠中的糖皮质激素合成基因的改变更为显著。
HPA轴对糖皮质激素分泌的调节
doi: 10.1016/j.rdc.2015.08.002
这些研究表明:肠道糖皮质激素合成可能是肠道细菌调节应激反应的关键途径。肠道细菌如何影响下丘脑-垂体-肾上腺轴(HPA轴)的精确机制尚不清楚。肠道外肾上腺糖皮质激素合成是一个值得研究的有希望的途径。
✓
乳杆菌(Lactobacillus)
鼠李糖乳杆菌 (L. rhamnosus GG)
鼠李糖乳杆菌作为益生菌已经使用了几十年。
鼠李糖乳杆菌GG减轻了母体分离大鼠和高脂饮食小鼠中急性约束应激诱导的皮质酮。
鼠李糖乳杆菌JB-1通过膈下迷走神经以应变依赖的方式降低急性约束应激诱导的皮质酮水平。母鼠分离后,幼鼠立即表现出高皮质酮水平。
口服鼠李糖乳杆菌R0011菌株(95%)和瑞士乳杆菌R0052菌株(5%)可以防止皮质酮水平增加。
除了鼠李糖物种外,副干酪乳杆菌、植物乳杆菌、干酪乳杆菌和其他物种已被证明在各种模型中调节应激。
副干酪乳杆菌 (L. paracasei )
副干酪乳杆菌Lpc-37的给药慢性降低了由慢性日常约束应激引起的皮质酮水平。
副干酪乳杆菌HT6有效地防止了早期生活压力社会经历引起的大脑GR表达变化。
副干酪乳杆菌PS23和植物乳杆菌PS128降低了早期生活压力诱导的皮质酮水平。
干酪乳杆菌(L. casei)
干酪乳杆菌Shirota菌株降低了大鼠WAS诱导的皮质酮水平和人类学业压力诱导的皮质醇水平。
干酪乳杆菌DKGF7抑制慢性约束应激诱导的皮质酮。
植物乳杆菌 (L. plantarum)
植物乳杆菌CCFM8610和干酪乳杆菌M2-01-R02-S01(M2S01)在WAS和柠檬酸杆菌诱导的肠易激综合征(IBS)模型中抑制皮质酮水平。
植物乳杆菌LRCC5310、植物乳杆菌LRCC5314和天然乳杆菌BNR17抑制了慢性冷应激和高脂饮食诱导的皮质酮升高。
路氏乳杆菌(L. reuteri)
路氏乳杆菌胞外多糖抑制氨苄青霉素诱导的皮质酮。路氏乳杆菌ATCC-PTA-6475在伤口愈合过程中下调皮质酮水平。
路氏乳杆菌NK33、约氏乳杆菌(L. johnsonii)分离株、约氏乳酸杆菌BS15和粘膜乳杆菌NK41抑制固定应激诱导的皮质酮升高。
其他乳杆菌
发酵乳杆菌(L. fermentum)CECT 5716减轻了WAS和母体分离诱导的皮质酮水平。用热灭活的发酵乳杆菌和德氏乳杆菌(ADR-159)治疗可降低皮质酮的基线水平并增加社交能力。
L.helveticus NS8可减少慢性约束应激诱导的皮质酮。用L.farciminis ML-7处理成功抑制了部分约束应力诱导的HPA轴的激活。
然而,并非所有乳杆菌物种都对应激反应产生下调作用,包括副干酪乳杆菌N1115、植物乳杆菌LP12407、植物乳菌LP12418,唾液乳杆菌UCC118、干酪乳杆菌CRL431、唾液乳杆菌HA113。此外,与安慰剂组相比,著名的益生菌鼠李糖乳杆菌JB-1不能改变皮质醇并释放压力。
双歧杆菌 (Bifidobacterium)
除了乳酸杆菌外,双歧杆菌是另一个已被广泛研究用于应激调节的细菌属。
B. subtilis在GF小鼠中的单克隆作用减弱了约束应激诱导的ACTH和皮质酮水平的增加。
青春双歧杆菌NK98、青春双歧杆菌IM38和长双歧杆菌NK46抑制固定应激诱导的皮质酮升高。
假链状双歧杆菌B. pseudocatenulatum CECT 7765和双歧双歧杆菌B.bifidum G9-1(BBG9-1)减轻了母体分离引起的皮质酮水平升高。
B.breve菌株M2CF22M7和CCFM1025减少了UCMS诱导的皮质酮产生。
在一项临床研究中,长双歧杆菌1714的给药降低了应激诱导事件后的应激激素水平。
同样,并非所有双歧杆菌物种都参与应激调节,包括婴儿双歧杆菌35624、短双歧杆菌UCC2003、长双歧杆菌1714、短芽孢杆菌1205。
益生菌混合物
结合乳酸杆菌和双歧杆菌的益生菌混合物也具有应激调节作用。L.helveticus R0052和B.longum R0175(Probio’Stick®)降低了WAS诱导的皮质酮升高。
用益生菌瑞士乳杆菌、鼠李糖乳杆菌、干酪乳杆菌和长双歧杆菌联合治疗可抑制UCMS大鼠的ACTH和皮质酮水平。
然而,不同细菌相互作用的机制可能很复杂。相反,母体使用B. animalis subsp. actis BB-12®和Propionibacterium jensenii 702可以增加新生儿皮质醇的水平。
其他不常见的益生菌
其他不常用作益生菌的细菌也在较小程度上调节应激诱导的激素。GF小鼠中大肠杆菌而非脆弱拟杆菌的单克隆作用降低了皮质酮的基础水平。给予克雷伯菌和大肠杆菌增加了皮质酮的基线水平。吴等人用抗生素(氨苄青霉素、万古霉素和甲硝唑;AVM)联合治疗小鼠,发现与全谱ABX治疗的小鼠相比,社交行为得到了保护,应激反应受到了抑制。当将AVM肠道微生物群移植到GF受体小鼠时,保留的社会行为和减少的应激反应被转移,表明AVM微生物群中的肠道细菌发挥了积极作用。
粪肠球菌——在社交活动中促进社交行为并抑制皮质酮水平升高的关键细菌
粪肠球菌(Enterococcus faecalis)是一种乳酸菌,对抗生素和许多其他压力源具有耐药性。粪肠球菌在宿主中的功能作用是多方面的,并且具有菌株特异性。
粪肠球菌是一种常见于尿路感染的常见病原体。另一方面,粪肠球菌已被广泛用作益生菌或食品添加剂。
粪肠球菌在ABX和GF小鼠中的定殖可以促进它们的社交行为,但只抑制ABX小鼠的皮质酮水平,而不是GF小鼠。
粪肠球菌可以调节神经系统和宿主行为
粪肠球菌EC-12菌株降低了焦虑反应,并改变了前额叶皮层中去甲肾上腺素和加压素的受体。
粪肠球菌SF3B菌株和EF-2001菌株已被证明可以缓解结肠炎诱导的肠道神经传递和病理。此外,粪肠球菌可以合成酪胺和苯乙胺,这两种神经活性分子被称为微量胺,能够调节宿主神经系统。
物质P刺激粪肠球菌V583菌株中酪胺和乳酸的产生,并增强肠道体外模型中的细胞毒性和细菌移位。
粪肠球菌AG5可增加宿主中的长链和短链脂肪酸,这可能通过间接方式间接影响神经系统。
一份报告发现,小鼠感染致病性粪肠球菌菌株K9和CP-1,会急性增加皮质酮,这表明粪肠球菌可以改变宿主中的糖皮质激素信号。临床上,粪肠球菌存在于89.3%的健康对照组中,而只存在于58.3%的神经发育障碍、58.3%的混合特异性发育障碍和55.6%的表达和接受语言障碍。
此外,粪肠球菌的给药对母体免疫激活的后代的重复行为和焦虑样行为没有产生任何影响。
总之,肠道细菌对宿主情绪和应激反应产生影响的分子和细胞机制将在未来进行研究。尽管在动物研究中微生物群对HPA轴有显著影响,但还需要更多的临床研究来支持使用益生菌缓解人类压力水平的概念。
✓
益生元是从食物中提取的不可消化成分,用于促进微生物(主要在胃肠道中)的生长。
合生元是将益生元和益生菌结合起来,对宿主产生协同作用。
先前的研究表明,益生元和合生元治疗都可以改变啮齿动物模型中的皮质酮水平。很少有研究调查益生元和压力暴露之间的相互作用及其对控制皮质酮水平的影响。
低聚果糖和低聚半乳糖
低聚果糖(FOS)和低聚半乳糖(GOS)治疗对成年小鼠产生抗焦虑和抗抑郁作用。
此外,GOS 和 FOS + GOS的组合可有效下调强迫游泳试验引起的急性应激诱发的皮质酮。有趣的是,FOS 和 GOS 处理中 Akkermansia、Bacteroides、Parabacteroides 的相对丰度有所增加,而脱硫弧菌、瘤胃球菌、Allobaculum、Turicibacter、乳酸杆菌、双歧杆菌的相对丰度降低。
然而,另外两项使用不同益生元化合物的研究并没有对不可避免的压力(GOS、聚葡萄糖和糖蛋白乳铁蛋白)或社会破坏压力(人乳低聚糖3 ‘唾液酰基乳糖或6 ‘唾液酰基乳糖)引起的皮质酮产生抑制作用。研究人员推测各种化合物、治疗持续时间和治疗开始时间都会影响益生元的效果。
低聚甘露糖
除了压力暴露之外,低聚甘露糖 (MOS) 的长期治疗降低了 5xFAD 转基因阿尔茨海默氏病小鼠模型血清中皮质酮和 CRH 的基线水平,但野生型小鼠没有这种情况。此外还发现 MOS 会增加血清和粪便中的丁酸盐水平,并与血清皮质酮呈负相关。然而,另一项研究结果表明,MOS 治疗降低了野生型 Whistar 大鼠成年期的血浆皮质酮水平。有趣的是,药物诱导的便秘大鼠模型表现出较高的 ACTH 和较低的皮质酮水平,而菊粉和低聚异麦芽糖可使其正常化。
其他益生菌和益生元联合治疗
益生元和益生菌的合生治疗很复杂,并且有多种组合。迄今为止,还没有研究使用相同的细菌菌株和益生元化合物配方来调节压力。
在暴露于慢性日常约束应激的大鼠中,将麦芽糊精L. paracasei DKGF1与仙人掌提取物相结合,以时间依赖的方式抑制约束应激诱导的皮质酮水平。
益生菌L.gasseri 505抑制UCMS诱导的皮质酮。添加柘树叶提取物不会对皮质酮产生额外影响。在急性应激中,在大鼠中,L. casei 54-2-33和菊粉的联合治疗可以降低加迷宫诱导的皮质酮升高。很少有研究采用合生元策略来缓解应激反应和皮质酮,这可能是因为缺乏关于益生菌和益生元的机制观点的基础。
✓
类固醇生成是在宿主体内将胆固醇转化为类固醇的生物合成过程。在糖皮质激素中,胆固醇通过几种关键酶(包括孕烯醇酮、黄体酮和脱氧皮质酮)经过几个步骤转化为皮质酮。然后皮质酮代谢为醛固酮。有趣的是,一些研究支持本地微生物直接调节宿主体内类固醇合成的假设。本节讨论从头细菌将胆固醇转化为类固醇的潜在候选细菌,这可能会干扰糖皮质激素类固醇的合成。
细菌中类固醇的生物合成——是直接影响类固醇激素水平的一种方式
在瘤胃球菌 (R.) gnavus、Bacteroides (B.) Acidifaciens 和 Clostridium (C.) scindens 培养物中发现孕烯醇酮治疗无氧条件下48小时可合成雄激素类固醇;研究人员使用液相色谱-串联质谱测量了类固醇途径中间体的水平。
在细菌条件培养基中检测到羟基孕烯醇酮、孕酮、脱氢表雄酮、睾酮。同样,相同的细菌菌株可以在体外将羟基孕烯醇酮代谢为黄体酮、脱氢表雄酮和睾酮。然而,R. gnavus 和 B. Acidifaciens 没有表现出任何胆固醇、皮质醇或醛固酮的代谢能力。
此外,孕烯醇酮和羟基孕烯醇酮在其他共生菌株中的处理,包括粪肠球菌、阴沟肠杆菌、肺炎克雷伯菌27、奇异变形杆菌、粘质沙雷氏菌、溶血葡萄球菌、大肠杆菌,产生了阴性结果,表明细菌在类固醇中间体代谢中的特异性。
类固醇激素代谢——可能是细菌影响宿主激素水平的另一种途径
从水甲虫的肠道中分离出两种芽孢杆菌菌株,HA-V6-3 和 HA-V6-11,并表明它们能够代谢孕烯醇酮。
其他证据表明,吲哚和粪臭素这两种肠道细菌衍生的色氨酸发酵代谢产物,可以抑制类固醇生成的限速酶CYP11A1,从而减少孕烯醇酮。
此外,睾酮缺乏与抑郁症状有关。最近发现从抑郁症患者中分离出的新金分枝杆菌(Mycobacterium neoaurum)可以将睾酮降解为雄烯二酮。
在新金分枝杆菌中鉴定出一个编码3β-羟基类固醇脱氢酶的基因,该基因可降解睾酮。将3β-羟基类固醇脱氢酶引入大肠杆菌中,产生3β-羟类固醇脱氢酶产生菌。产生3β-羟基类固醇脱氢酶的大肠杆菌在ABX小鼠中的定殖诱导了抑郁样行为。
最近进行的一项研究调查了给C57BL/6小鼠服用Thauera菌株GDN1的效果。GDN1是一种具有分解代谢睾酮能力的β变形菌。结果表明,GDN1菌株的给药导致血清雄激素水平显著降低,并在粪便提取物中检测到雄激素环切割代谢产物,这表明能够分解代谢雄激素的肠道细菌,可能调节宿主循环雄激素水平,并有可能作为益生菌用于高雄激素血症的替代治疗。
C. scindens细菌,通过侧链裂解将糖皮质激素皮质醇转化为雄激素
尽管没有研究表明特定细菌的能力可以直接影响皮质酮水平,但弗吉尼亚联邦大学的 Hylemon 实验室发现,C. scindens 是一种从人类粪便中分离出来的细菌,可以通过侧链裂解的机制将糖皮质激素皮质醇转化为雄激素。
C. scindens通过desD编码的钠依赖性皮质醇转运蛋白将皮质醇转运到细菌中。然后,皮质醇可以通过甾体-17,20-脱模酶(一种由desAB编码的假定转酮醇酶)代谢为11β-OHA(11β-氢-氰基甾-4-烯-3,17-二酮)。11βOHA可以通过ABC转运蛋白被泵出细胞。目前尚不清楚是否有细菌具有将皮质酮转化为其他类固醇的相似机制。
微生物参与皮质酮合成的新机制
Hylemon实验室的另一项研究在Eggerthella lenta(以前称为真杆菌)的细胞提取物中发现了一种皮质类固醇21-羟化酶。有趣的是,21羟化酶使用脱氧皮质酮、脱氧皮质醇、脱氢皮质酮和皮质酮作为底物。这可能是哺乳动物中微生物将类固醇转化为皮质酮的另一种机制。
然而,在压力暴露后的啮齿类动物中均未报告C.scindens和Eggertella lenta,也没有发现它们在微生物组缺乏的啮齿动物的肠道中定植。
从皮质酮的生物合成和代谢角度来看,一些细菌可以促进皮质酮前体,而另一些细菌则有相反的效果。因此,确定一种单一的途径来阐明在无菌和ABX(类似的广谱抗生素药物组合)治疗的小鼠中发现的高皮质酮仍然具有挑战性。该领域在肠道中面临着一种高度复杂的情况,这种情况会调节应激激素和应激诱导的行为异常。
✓
与压力相关的疾病,例如肠易激综合症(IBS),通常涉及微生物失调。 IBS 是一种胃肠道并发症,其特征是腹部不适、排便方式改变以及伴随的焦虑等症状,影响着 5-10% 的人口。尽管进行了广泛的研究,IBS 的确切病因仍然难以捉摸,公认的危险因素包括遗传、饮食、心理压力和肠道微生物组组成。
IBS患者中微生物代谢物的改变
研究表明,与健康对照相比,IBS 患者的 α 多样性降低,并且 21 种细菌种类的相对丰度存在显著差异。 IBS 亚型在肠道微生物群衍生的代谢物中表现出明显的改变:
微生物群在IBS患者中的作用
研究表明,IBS-D 中的特定细菌,如瘤胃球菌Ruminococcus gnavus,可以通过产生苯乙胺和色胺来刺激血清素生物合成,从而加速肠道蠕动。
研究发现,在一些 IBS 患者中发现的产气克雷伯菌(Klebsiella aerogenes)可增强组胺的产生,通过组胺 4 受体信号传导导致内脏痛觉过敏。
值得注意的是,可以通过人类 IBS 患者的粪便微生物群移植 (FMT) 到 GF 接受者来建立 IBS 动物模型。这种方法有效地复制了在人类 IBS 患者中的胃肠道和焦虑症状。
IBS 患者的应激反应激素水平
压力暴露是发生 IBS 的已知危险因素,通常影响肠道蠕动和 HPA 轴。 IBS 患者的应激反应激素水平与健康人不同。
研究表明,急性精神压力会导致 IBS 患者血浆 CRH 和 ACTH 显著升高。此外,Dinan组显示,CRH输注后,IBS患者的ACTH和皮质醇释放增加。
结肠扩张(CRD)是一种检测内脏敏感性的方法,在IBS动物模型中,导致PVN CRH神经元中c-Fos表达升高,血浆CRH、ACTH和皮质酮水平升高。
总之,这些发现表明,与健康受试者相比,患有IBS的个体表现出应激激素分泌增加和微生物群失调。
✓
应对压力是动物面对可能对身体有害的危及生命事件的重要策略。压力失调与情感性疾病密切相关。新冠肺炎大流行使压力相关疾病的全球流行率急剧上升,这对社会产生了深远影响。
最近的研究表明,肠道微生物群不仅出现在压力暴露的背景下,而且还起着“活性调节剂”的作用,调节神经和内分泌系统。这也就是我们开头提到的“胃里有蝴蝶”的扑腾感源于肠道微生物。
肠道微生物直接和局部调节类固醇生成,可能改变应激激素水平。然后,应激激素信号可以通过确定的途径、肾上腺外类固醇生成、自主神经系统和各种细菌成分传播到大脑。最终,大脑接收来自微生物的信息,并对PVN和其他大脑区域做出充分反应。
此外,大脑决定的应对和适应机制可以改变基于行为和内分泌功能的输出。然后,微生物可以进一步适应宿主在压力下的生理机能。这种从肠道微生物群开始的控制环路是基于目前对肠道微生物和压力之间相互作用的理解。
肠道微生物调节行为的分子和细胞机制、途径和回路在很大程度上尚未完全探索。识别导致和影响应激反应的关键细菌和细菌相关因素,将有利于使用基于微生物组的疗法进行替代医学创新。
随着对微生物与宿主交互作用机制的深入研究,肠-脑轴在心理疾病发生和治疗中的重要性将越来越受到重视。肠道菌群将成为预防和干预这类疾病的新靶点。
主要参考文献
Lai TT, Liou CW, Tsai YH, Lin YY, Wu WL. Butterflies in the gut: the interplay between intestinal microbiota and stress. J Biomed Sci. 2023 Nov 28;30(1):92.
Ramamoorthy S, Cidlowski JA. Corticosteroids: Mechanisms of Action in Health and Disease. Rheum Dis Clin North Am. 2016 Feb;42(1):15-31, vii.
Huang ST, Wu K, Guo MM, Shao S, Hua R, Zhang YM. Glutamatergic and GABAergic anteroventral BNST projections to PVN CRH neurons regulate maternal separation-induced visceral pain. Neuropsychopharmacology. 2023 Nov;48(12):1778-1788.
Avery S N, Clauss J A, Blackford J U. The human BNST: functional role in anxiety and addiction[J]. Neuropsychopharmacology, 2016, 41(1): 126-141.
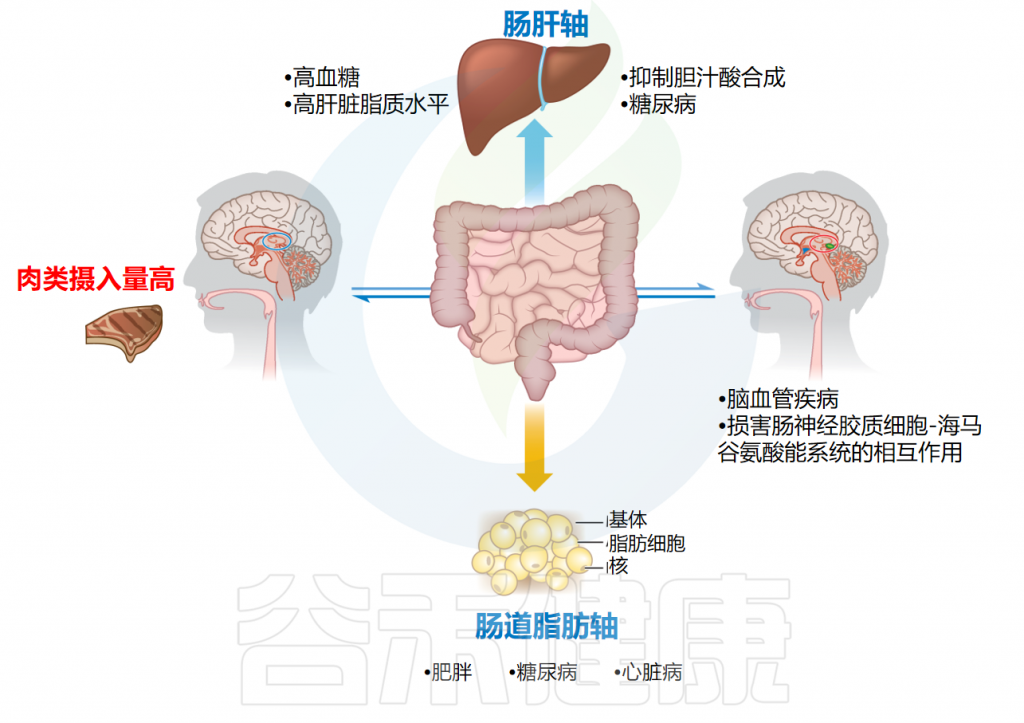
谷禾健康
由于肉类和肉制品含有丰富的脂质和蛋白质,因此易于发生氧化反应。脂质氧化会产生一系列氧化衍生物,主要影响食物的颜色和风味,同时也会导致肌肉蛋白质的功能和稳定性丧失。同样,蛋白质容易被活性氧化物质(ROS)和氧化应激的次级副产物氧化。蛋白质氧化是一个会导致构象和结构改变、聚集和断裂的过程,从而损害蛋白质的功能特性,进而影响肉品的质量。
脂质氧化-蛋白质氧化在肉类中是密不可分的,因为脂质氧化可能会诱发蛋白质氧化。这些积累的氧化蛋白质和脂质,包括它们的次级产物,被认为在食用肉制品和随后的消化时对人类构成健康风险。因此,控制肉类和肉制品中的蛋白质氧化非常重要。
已经进行了许多消化率试验和相关研究,以揭示与肉类蛋白质相关的分子变化和潜在风险。蛋白质消化是一种复杂的过程,涉及消化酶对膳食蛋白质的集体作用。这个过程受多种因素的影响,包括蛋白质的饮食来源、消化酶的活性、胃肠道菌群,pH值、肠道蠕动和内源性分泌物等。通过动物模型的研究,已经证明摄入过多的加工肉类可能会促进与非酒精性脂肪肝和肥胖相关的蛋白水解细菌的增殖。
另外,大量摄入红肉后会刺激结肠中的氧化反应。过多摄入肉类氧化产物可能会导致肠道菌群失调,损害结肠的代谢能力,并对结肠粘膜产生有害影响。
前不久南京农业大学食品科技学院李春保教授等人发表了题为“Molecular Changes of Meat Proteins During Processing and Their Impact on Quality and Nutritional Values”的综述论文。重点介绍了肉类蛋白质的分子变化、对新鲜肉类和加工肉类营养价值的影响、肉类蛋白质的消化和吸收、与高肉类摄入量相关的健康风险以及为改善这些情况而采取的预防策略。希望能够对生活中肉类的食用有一定帮助。

编辑
肉质通常会受到理化和代谢变化的影响。这些变化主要包括pH值下降、肌原纤维蛋白降解、蛋白质氧化和蛋白质翻译后修饰。
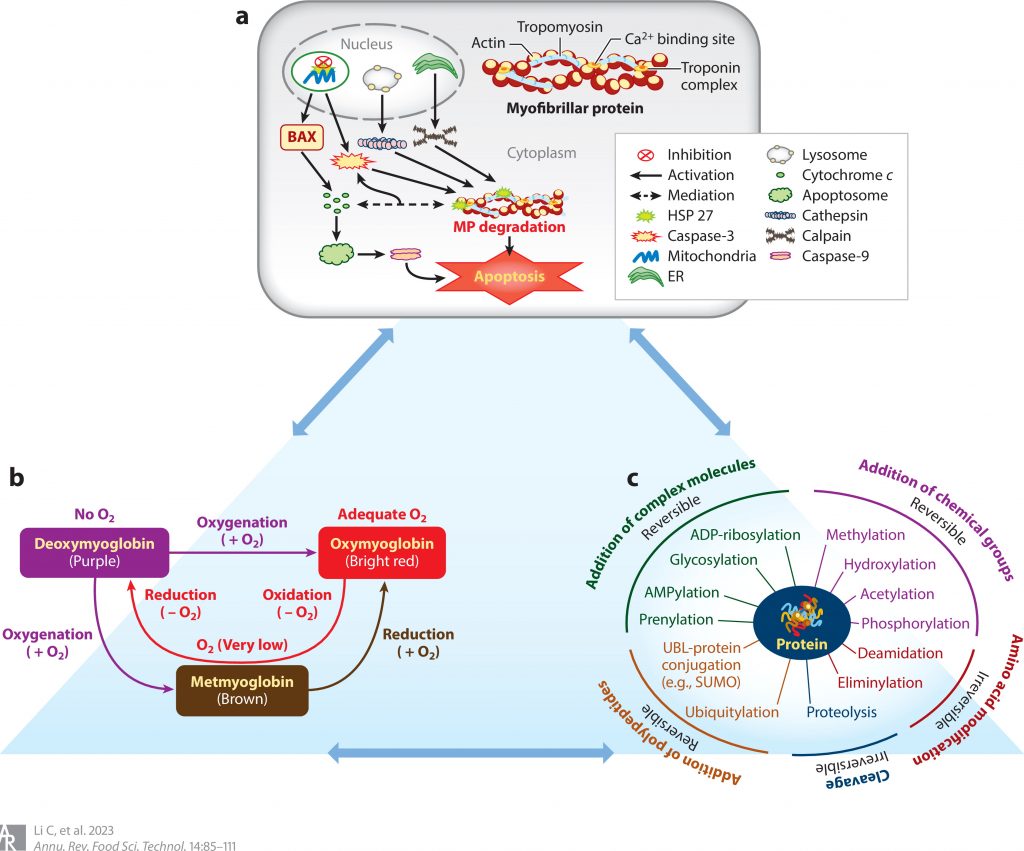
Li C,et al.Annu Rev Food Sci Technol.2023
肉的颜色是一个不可或缺的质量属性,也是消费者的第一判断点,其变化与购买的可能性密切相关。
鲜肉颜色通常由着色剂的浓度和所需颜色在储存期间或零售展示期间的稳定性为特征。色调和色度由肌红蛋白主导,其变化取决于其生化状态,特别是氧化或还原程度。
注:肌红蛋白是肌肉中主要的携氧血红素蛋白,而血红蛋白则在血液中输送氧气。肌红蛋白比血红蛋白具有更高的氧亲和力。
•在空气中暴露不同的时间导致产生不同颜色
肌红蛋白与空气中的氧气接触后,随着时间的推移,新鲜肉呈紫红色;暴露在空气中30~40min后,颜色变为鲜红色;最后肉类自身存在的耗氧酶会消耗掉渗入肉中的氧气使肉质产生褐变。
颜色变化的具体机制
最近,已经进行了生化研究来阐明肉的颜色机制。利用从深色牛肉中分离的线粒体(肌肉pH>6)注意到,深色牛肉的电子损失高于对照(即从正常牛肉肌肉中分离出的线粒体,pH=5.6)。
这表明线粒体较多的肌肉,如腰大肌,可以产生活性氧并发生氧化变化。在大腰肌中检测到高丰度的次黄嘌呤和肌苷,而在腰最长肌中观察到腺苷、肌肽和l-组氨酸,表明不同肌肉类型之间的嘌呤代谢率不同。
另一项研究同样报道了深色牛肉中较高的线粒体蛋白质和DNA含量。这一发现也证实了最近的一项蛋白质组学研究,该研究表明,与线粒体电子传输和糖原分解相关的蛋白质的变化分别促进了高氧摄入和pH值的增加,从而抑制了深色肉中的肌红蛋白氧化。
肌原纤维蛋白占肌肉总蛋白的60-70%,肌原纤维蛋白的分子内和分子间相互作用,例如氢键和疏水性、离子性和范德华相互作用,极大地影响肉的质地、结构和品质。
胶原蛋白浓度和溶解度、肉收缩的程度以及肌原纤维蛋白在死后老化过程中的蛋白水解变化是与肉嫩度相关的整体因素。老化最初提供了对机械应力的缓冲。它通过肌肉组织的酶促结构降解和随后的肌肉细胞肿胀来冷冻。肌纤维中的大部分水分被限制在肌原纤维中,肌原纤维蛋白降解可能与水分减少有关。
最近研究报道,溶酶体Fe2+促进脂质过氧化和线粒体肿胀,导致线粒体功能障碍,随后促进细胞色素c氧化和线粒体Ca2+积累,从而诱导肌原纤维蛋白变性。
线粒体是最初因死后变化而受损的主要细胞器,并且是进一步细胞反应和最终死后肉嫩化不可或缺的一部分。活性氧在死后衰老过程中不可避免地产生,并通过多不饱和脂肪酸的过氧化进一步侵入线粒体膜,导致线粒体损伤。
此外,离子强度和pH值可能会导致蛋白质结构发生改变,使疏水残基暴露于表面并影响表面疏水性。研究表明,在冷冻过程中,未冷冻水中的pH值降低,离子强度增加,导致肌球蛋白丝的内部结构破坏,并有助于其构象变化以及随后的溶解和变性。
氧气损失导致死后早期从有氧代谢转变为无氧代谢。伴随着这样的过程,会发生以下复杂的变化。
磷酸化是一种蛋白质翻译后修饰,在死后肌肉质量属性中发挥着不可或缺的作用。特别是,蛋白质磷酸化是苏氨酸、丝氨酸和酪氨酸残基的主要蛋白质翻译后修饰,调节信号转导、代谢和其他重要的生物过程,例如分化和增殖。它通过调节肌动球蛋白解离、蛋白质变性和宰后μ-钙蛋白酶活性来影响肉质。
先前的研究表明,肌浆蛋白和肌原纤维蛋白的磷酸化状态会在死后发生变化,这种变化与肉质有关。在一项磷酸蛋白质组学研究报告中称,季节也会导致肉质变化,包括pH值和保水能力下降。季节转换期间的温度变化可能会通过某些伴侣蛋白的过度表达导致猪的冷应激或热应激,从而导致肉质苍白、柔软、渗出性缺陷。
酶在肉类的生化变化中至关重要,例如碳水化合物降解、蛋白水解、氨基酸降解反应(脱氨、转氨基、脱羧)、Strecker 降解、美拉德反应、脂肪分解和 脂质氧化。在死后老化过程中,通过内源性蛋白水解作用使肉中的细胞骨架肌原纤维蛋白变性,可显著提高质量,例如多汁性、风味或嫩度。
钙蛋白酶和组织蛋白酶是参与死后蛋白水解的酶系统。钙蛋白酶系统的两种μ/m同工型在死后老化过程中均被激活,并且通过降解结蛋白和肌钙蛋白-T对肉嫩化至关重要。
另一方面,随着死后肌肉pH值降低,溶酶体膜减弱,组织蛋白酶从溶酶体中释放出来,使它们能够水解肌原纤维蛋白。因此,与死后肌肉储存过程中发生的肌原纤维蛋白相比,组织蛋白酶处理的肌原纤维蛋白具有不同的变性模式。
•热休克蛋白可以抑制肉的老化
热休克蛋白(HSP)家族以其在细胞保护中的重要性而闻名。高丰度的热休克蛋白是肌肉抗细胞凋亡不可或缺的一部分,并可能抑制肉的老化,影响肉的嫩度。
据报道,小热休克蛋白可以保护死后肌肉中的细胞骨架结构,例如肌联蛋白、肌动蛋白和肌钙蛋白。它们可以模拟肌动蛋白单体并与肌动蛋白-肌动蛋白结合位点结合,有效阻碍肌动蛋白聚合。μ-钙蛋白酶的蛋白水解活性通过小热休克蛋白的抑制调节而受到最终肉类pH值的影响。
HSP27是一种分子伴侣蛋白,大量存在于骨骼肌中,与肉品质相关。研究发现HSP27似乎抑制蛋白水解的启动,但随着肉在屠宰后7至14天的老化过程中,HSP27的存在有助于肉的嫩化。HSP27可能通过与酶、底物或两者的相互作用来调节蛋白水解活性。
在肉类加工过程中,根据叠加的时间温度条件和工艺流程,不同程度地发生多种结构变化。肌肉细胞在机械变化过程中被氧气降解和包裹,从而增加了脂质氧化-蛋白质氧化的可能性。
热处理会导致主要蛋白质成分发生严重变化,这是由蛋白质变性、氨基酸氧化和聚集过程引起的。
谷禾将不同加工方法及其对肉品质影响的优缺点简单总结在了下表:

Li C,et al.Annu Rev Food Sci Technol.2023
1
加热
加热引起构象变化,称为蛋白质变性。它还诱导蛋白质之间相互作用,导致蛋白质聚集。熟肉中蛋白质聚集体的形成主要影响产品的技术和营养特性。
粉碎产品和非粉碎产品的差异很大。例如,与煮熟的火腿相比,乳化香肠含有更多的不溶性蛋白质残留物。胶原蛋白的存在意味着高分子量蛋白质聚集体,可能是热处理和不同工艺过程的结果。这些聚集体的特征是肌原纤维与肌浆的比例很高,这表明肌原纤维蛋白,特别是肌动蛋白,在构建热诱导的超分子蛋白质组装过程中相互作用。
在研究烹饪对肉类蛋白质的影响时,观察到氨基酸氧化变化呈上升趋势,特别是在可溶性胶原蛋白中,而不溶性部分中的肌球蛋白最容易受到其他热诱导的修饰(例如美拉德反应)的影响。
注:最近发现范德华力和氢键产生肌球蛋白-醛结合相互作用,从而为维持/控制肉味的机制提供了新的见解。
•胶原蛋白在长时间加热后有更好的提取性
一项蛋白质组学研究表明,干燥加热有助于一些三维结构显著变化的肉类蛋白质的聚集,例如肌酸激酶M型和肌球蛋白重链。
尽管在尿素-硫脲溶液中检测到总蛋白质可提取性显著损失,但与其他蛋白质相比,骨骼肌中的主要胶原蛋白(I型和III型)在长时间烹饪后表现出相对更好的可提取性。
•低温加热可能拥有更好的抗氧化特性
据报道,在较低温度下热诱导的I型胶原蛋白部分解折叠或氧化可能会暴露出更多胃蛋白酶消化的活性位点,而过热会导致蛋白质聚集、聚合、交联和氧化,从而诱导对酶降解的抵抗。
真空低温烹调12小时增加了抗氧化活性肽的数量,这可以显著减少脂质氧化和蛋白质氧化的发生。这表明具有潜在抗氧化特性和生物活性、可穿透细胞的肽可能在低温和短时间下产生。
2
烘干
干肉和肉制品通常通过热风干燥技术来实现。一般来说,肉类蛋白质的连续和密集加工会因必需氨基酸的损失和消化率受损而导致营养变化。
•烘干会导致蛋白质消化率下降
为了揭示脂质氧化、肌原纤维氧化和蛋白质消化率的变化,研究发现风干牦牛肉蛋白质消化率的下降归因于氧化诱导的蛋白质交联和羰基化,影响了底物与胃蛋白酶的结合。
•冷干燥可以减少氧化,延长保质期
另外,据报道,冷干燥可以通过降低温度来减少热敏食品的快速氧化过程,从而延长保质期。冷风干鱼的蛋白质降解和脂肪酸氧化下降。
注:在4°C下冷干燥的凤尾鱼和鳟鱼样品比在恒定气流下在10°C、15°C和20°C下干燥的样品具有更高的功效。
3
加盐
盐是加工产品中不可或缺的成分。它促进肉类蛋白质的溶解,并充当肉类和脂肪之间的粘合剂,改善质地、嫩度、香气和适口性。
感知到的咸味主要归因于Na+阳离子,风味强度取决于盐含量。盐水平在肌动球蛋白的氧化、结构和消化中发挥着重要作用,表明对肉类营养和蛋白质消化率有很大影响。
•施用盐影响了蛋白质的消化率
由于肌红蛋白的刚性和消化效率低,氯化钠处理降低了蛋白质结合能力,导致肌红蛋白被胃蛋白酶快速消化。尽管如此,过量的氯化钠会损害蛋白质功能,因为肌原纤维蛋白具有高度盐溶性。
最近有报道称,氯化钠处理会改变血红素结构和肌红蛋白疏水腔,降低蛋白质消化率。因此,氯化钠减少对蛋白质氧化的影响各不相同,这与氯离子与蛋白质残留、蛋白水解和肌原纤维状况之间的关联有关。
•盐类物质可能改变了蛋白质的结构
人们对各种氯化物盐如氯化钙、氯化钾和氯化镁进行了研究,以确定它们作为肉制品中氯化钠替代品的效力。因此,观察到一价(钾)和二价阳离子(镁和钙)在凝胶化过程中增强了肉蛋白的功能。
为了评估用KCl、MgCl2或CaCl2部分替代NaCl对肌原纤维蛋白的影响,证明NaCl能够展开肌原纤维蛋白结构并增强凝胶质量,而25%KCl增加肌原纤维蛋白疏水性和粒径、二硫化物和羰基含量,在类似离子下比其他盐组合更好地增强凝胶结构和凝胶强度力量。尽管MgCl2或CaCl2导致蛋白质不溶和聚合,但前者极大地影响凝胶性质。
4
包装
人们开发了各种包装技术,以减少氧化过程并提高肉质。
•低氧浓度抑制蛋白质氧化,利于保持肉的嫩度
数据发现低氧浓度(10%O2/90%N2)抑制蛋白质氧化,而高氧包装增加了肉的损失并降低了肉的嫩度。
在高氧浓度(80%O2/20%CO2)包装牛肉中,揭示了高分子量蛋白质聚合物的生成,表明高氧化和交联导致高氧包装肉中的肌球蛋白聚合。
•富含天然抗氧化性的物质对健康有益
通过将食品、保鲜和包装系统纳入可食用、可生物降解和防潮薄膜中,可食用薄膜或涂层显著改善了包装。这种包装可以防止颜色退化、氧化变化和异味,延长保质期,并赋予肉类及其衍生物功能。
据报道,富含天然抗氧化剂的提取物、多糖和精油的不同涂层可增强膜的机械性能,并抑制肉制品中高铁肌红蛋白的形成和脂质氧化–蛋白质氧化过程的形成。
注:先前关于天然抗氧化剂在肉类工业中应用的研究也进行了综述。这些生物活性物质一旦摄入,也会对消费者的健康有益。
5
其他处理方法
最近,消费者的注意力已逐渐从营养转向对身体产生积极生理反应的食品。超声波处理、高压处理和脉冲电场(PEF)等创新工具已被证明可以增强肉类和肉制品的基本生化和功能特性。
•高压处理可以降低烹饪损失,改善消化
人们发现高压处理可以通过形成丝状网状网络(甚至在肌肉纤维内)来改善肉糊的质量,从而降低烹饪损失。
在一项蛋白质组学研究中,揭示高压处理加速蛋白水解,表明肌动蛋白与肌球蛋白不同,存在差异性变性。他们还证实,高压处理对直链醛(己醛、壬醛、庚醛和戊醛)的形成有积极影响,从而改善干腌火腿的味道和香气。高压处理和脉冲电场也被证明对消化过程中肉蛋白的酶水解产生积极影响。
•超声辅助可以改善肉的质地和结构
最近还发现,超声辅助的表没食子儿茶素没食子酸酯共价反应基团表现出更高的消化率,这与消化蛋白酶的可及性和减少肌原纤维蛋白聚集有关。证明集成超声波和低温短时加热(40kHz,0.2W/cm2,55°C,15分钟)协同促进必需肉类蛋白酶(组织蛋白酶 B、钙蛋白酶和总蛋白酶)的失活。这显著减少了肉类蛋白质的降解,改善了肉的质地和微观结构。
同样,液相色谱与串联质谱联用(LC-MS/MS)的结果表明,超声处理可促进小分子量肽的生成,这可能与线粒体能量代谢的上升趋势有关。
肉类是膳食蛋白质的重要来源,是具有良好平衡性和高生物利用度的必需氨基酸。然而,蛋白质氧化和肉类结构的变化会影响蛋白质的水解速率,从而影响蛋白质的生物利用度。
•烹饪程度影响蛋白酶的敏感性
虽然轻度蛋白质氧化可能诱导部分解折叠,促进蛋白水解酶与蛋白质底物的结合,但严重的蛋白质氧化条件会改变蛋白质与蛋白水解酶的结合位点,并通过聚合使蛋白质结构变得紧凑,从而降低蛋白酶敏感性。
一个例子如美洲鸵鸟肉,烹饪抑制了肌原纤维蛋白对胃蛋白酶活性的敏感性。烹饪后胰酶的蛋白水解率增加支持了蛋白质聚集在肉类蛋白质营养特性中的重要性。
•肉的类型影响蛋白质成分和消化敏感性
肉的营养质量取决于多种因素,从动物和肌肉类型到成熟度和烹饪条件。在蛋白质组研究中,证明猪肉中的股二头肌对消化的敏感性最高,相互作用分析表明差异蛋白主要与糖酵解和肌肉收缩有关。
因此,蛋白质成分和消化敏感性的变化可能归因于肉质类型。然而,营养质量还必须考虑肉的脂肪酸组成和可能产生有害物质的过氧化过程。
加工过程中生肉和预煮肉制品中蛋白质氧化衍生物含量较高可能归因于高脂肪-蛋白质比率、低蛋白质水平或强烈的切碎和烹饪方法。烹饪过程中蛋白质氧化的发生以及进一步消化过程中氧化序列的释放导致生物活性变化,主要来自胶原蛋白和肌联蛋白检测到的肽以及消化过程中新产生的肽。最近证明,蛋白质来源和脂肪含量影响食品基质的流变特性和微观状态,进一步影响蛋白质水解程度和消化率。
•低消化率会降低蛋白质的生物利用度
还有研究证明肌动球蛋白在100°C下持续加热会导致二硫键的形成、聚集和残基氧化,从而通过破坏部分切割位点导致消化率降低,很大程度上改变了蛋白质消化物中的肽组成。肌红蛋白在胰酶和胃蛋白酶消化中的水解程度也相对较低。
低消化效率可能会抑制蛋白质的生物利用度及其在盲肠和结肠中的积累,蛋白质或其片段在盲肠和结肠中由肠道微生物群发酵。
评估了胃肠道消化对肉和肉制品产生的生物活性肽的影响。胃肠道中生物活性肽的模拟研究表明,肉蛋白是抗二肽基肽酶活性、血管紧张素转换酶抑制和一定程度抗氧化活性的来源。
因此,为了使肉释放生物活性肽并表现出生理效应,肽必须完整地通过胃肠道。
饮食成分和饮食习惯对肠道健康很重要,包括肠道微生物成分和平衡。在消化和吸收过程中,胃肠道从食物中提取营养物质,以提供基本营养和健康。虽然有些食物富含抗炎生物活性化合物,但其他食物则含有促炎化合物。
定期摄入富含抗炎生物活性化合物的食物有益于肠道微生物的流行,将食物成分降解为代谢物以维持体内平衡。相比之下,摄入富含促炎化合物的饮食可能导致生态失调,产生可能对健康构成风险的致病代谢产物。
过量摄入高脂肪肉类带来的不利影响
Li C,et al.Annu Rev Food Sci Technol.2023
•合理的肉类摄入有助于平衡肠道微生物以及抗氧化作用
在均衡饮食中,摄入肉类蛋白质已被证明可以对肠道微生物成分、能量代谢和抗氧化产生积极影响。报道称,在长期食用蛋白质来源(酪蛋白、牛肉、鸡肉和大豆等)的过程中,肉类蛋白质保持了更平衡的肠道微生物成分,并降低了肠道微生物对宿主的抗原负荷和炎症反应。
有研究称,与大豆相比,肉类蛋白质有利于新陈代谢和生长。最近声称,与牛肉、猪肉和大豆蛋白相比,鸡肉和鱼肉蛋白显著诱导肝脏抗氧化应激。因此,在推荐剂量下,肉类蛋白质可以促进甘油三酯分解和胆固醇降解,并将能量平衡维持在健康水平。
不同肉类摄入对健康的影响


Li C,et al.Annu Rev Food Sci Technol.2023
•膳食酪蛋白有助于减少肥胖
此外,由于氧化应激是肥胖、糖尿病等慢性疾病的主要推动因素,在不损害营养价值的情况下合理摄入肉类可以改善健康风险。
几项研究证明了积极的发现。在一项研究中与膳食鸡肉相比,膳食酪蛋白增加了实验动物盲肠中乳酸乳球菌(Lactococcus lactis)的丰度,并上调了与肥胖抑制相关的基因表达。
一致地,在喂养小鼠的膳食蛋白质来源(大豆、牛肉、去皮鸡肉、酪蛋白、鳕鱼片或猪肉)中,与其他饮食相比,酪蛋白饮食大大减少了脂肪量并防止了肥胖的发展。
富含酪蛋白的食物:酪蛋白是一种乳清蛋白,主要存在于乳制品中。例如牛奶、酸奶、奶酪、奶粉,以及一些鱼类、豆类。
•天然益生元通过肠道菌群有利于健康
在喂食富含菊粉的加工猪肉产品(发酵香肠和煮熟的火腿)的两种结直肠癌动物模型中,息肉减少,抗炎和纤维发酵微生物群呈上升趋势。
值得注意的是,与淀粉不同,菊粉等果聚糖在到达结肠之前不会在人类胃肠道中发生改变,在结肠中它们被双歧杆菌、乳酸杆菌和其他短链脂肪酸产生物种等益生菌用作能量和碳源。
富含角豆果提取物的肉制品还被发现可以在晚期2型糖尿病模型中提供预防和治疗作用,例如诱导更高的肠道微生物丰富度、增强结肠屏障完整性、促进足够的短链脂肪酸水平以及在远端结肠粘膜。
丁酸盐是结肠细胞的首选能量来源,具有促进结肠健康和抗肿瘤的功效,支持粘膜完整性,并通过其对表观遗传调节、免疫和基因表达的影响来预防炎症和癌变。
需要注意的是,过量地摄入肉类也不利于人体健康。
•高肉高脂肪饮食会损害神经递质平衡
报道称,高猪肉或高鸡肉饮食(40%或以上)和高脂肪含量会损害谷氨酸能系统和神经递质平衡,并对海马谷氨酸能系统和肠胶质细胞之间的关联产生巨大影响。
同样,高脂饮食中过量的肉类蛋白摄入可能会促进代谢紊乱、全身炎症、中枢神经系统功能的改变,并最终导致神经退行性疾病的发展。
•高肉类饮食影响肠道微生物组成
高脂饮食中的蛋白质显著影响肠道微生物组成、肝脏代谢特征、肠道炎症基因表达和血清内毒素水平,其中许多代谢物影响血清内毒素、炎症和肠道通透性。
研究表明,肠道炎症通过高脂饮食引起的肠道血管屏障功能障碍诱导肝损伤,强调了肠道微生物、肠道屏障和非酒精性脂肪性肝病发展的饮食之间的关系。
特定的肠道微生物可能通过调节宿主消化蛋白的分泌来影响蛋白质的消化和吸收,特别是在长期食用肉类蛋白之后。研究表明,与替代品相比,高膳食肉类蛋白会降低肝脏中吲哚和粪臭素代谢酶的活性。
还报道了饮食蛋白质喂养的大鼠盲肠微生物群组成的快速变化。说明了肉类摄入量与肠道微生物之间的关联,表明过量肉类消费会增加心血管疾病风险和动脉硬化。
•高肉饮食会导致糖代谢紊乱
最近评估了不同氧化损伤程度的熟猪肉对小鼠葡萄糖代谢的影响,并得出结论,摄入高氧化损伤猪肉饮食会损害葡萄糖耐受性,并导致低胰岛素血症和高血糖,表明葡萄糖代谢紊乱。
•高肉饮食影响胆汁酸的分泌与合成
肠道微生物还会在肉类和其他膳食来源中产生三甲胺。三甲胺被肝脏含黄素单加氧酶氧化为氧化三甲胺,可能抑制胆汁酸的合成和分泌,还会促进动脉粥样硬化。
胆汁酸对于宿主改变肠道微生物组成至关重要,因为它与左旋肉碱有很强的相互作用,次级胆汁酸(如石胆酸和脱氧胆酸)的升高归因于摄入高脂饮食,这可能会引发结直肠癌风险。
研究发现肉类诱导的氧化三甲胺形成受到肝脏基因表达水平变化以外的机制的调节,可能涉及肠道微生物改变。重要的是,该研究表明,将富含红肉的饮食改为白肉或非肉类蛋白质来源(但保持相同的卡路里和膳食蛋白质比例)会导致氧化三甲胺水平在几周内大幅下降。
研究了膳食蛋白质来源与血浆氧化三甲胺水平的相互作用,以及通过饮食改变降低氧化三甲胺水平所需的时间,强调除了数量之外,饮食成分(与蛋白质来源有关,但与饱和脂肪含量无关)影响氧化三甲胺的整体代谢。
推荐剂量的肉类蛋白质可以增强胆固醇降解和甘油三酯分解,并保持能量合成处于健康状态。
以下几点可以使肉类在保存和加工过程中保持较好的营养价值和肉质:
采用低温保存,控制温度在0-4°C范围内,可以减缓肌红蛋白的氧化程度,保持肉类颜色。
选择肌肉类型含有较高线粒体的肉类,如鸡肉,可以减少肌红蛋白的氧化程度。
适度使用盐可以改善肉质,但不要过量,以免损害蛋白质。
避免高温长时间加工,如不必要的高温煮熟,可以防止蛋白质变性和聚集。
选择加工方法温和的肉制品,如熏肉比烤肉更易保留营养。
适量食用肉类,可以促进肠道微生物平衡,但过量可能影响健康。
食用肉类时搭配蔬菜水果等食物,可以提供抗氧化营养成分,共同保护肉类免受氧化损害。
总体来说,低温保存、温和加工和适量食用,可以最大限度地保留肉类的营养价值和肉质质量。
主要参考文献:
Li C, Bassey AP, Zhou G. Molecular Changes of Meat Proteins During Processing and Their Impact on Quality and Nutritional Values. Annu Rev Food Sci Technol. 2023 Mar 27;14:85-111.
谷禾健康
支原体:小而隐蔽
支原体(Mycoplasmas)是一种特殊且独特的细菌,是地球上已知的最小的自由生活的生物体。由于其体积较小,早些时候被误解为病毒。它小到用普通显微镜无法定位。事实上,大约 4000 个支原体可以轻松容纳在红细胞内。
支原体既作为膜表面寄生虫存在于细胞外,也存在于细胞内,作为“沉默的寄生虫”成为细胞内的居民。
支原体与其他细菌之间的主要区别在于:
当我们使用抗生素治疗某些细菌感染时,是通过破坏细菌细胞的外壁来起作用的。由于支原体没有外壁,所以大多数抗生素如青霉素等对它不起作用。因此支原体是小且隐形的病原体。
支原体首次被描述于 100 年前。迄今为止,已鉴定出 210 多种广泛分布于人类、动物、昆虫和植物中的物种。其中23种可以感染人类;一般免疫系统健康的人不会受到支原体细菌的影响,但免疫力低下的人很容易被感染,并可能出现严重的健康问题。支原体可以通过飞沫感染、昆虫叮咬、性接触、口腔摄入、吸入以及开放性伤口转移到另一个身体。
主要致病支原体包括:
• 肺炎支原体(Mycoplasma pneumoniae)
• 生殖支原体(Mycoplasma genitalium)
• 发酵支原体(Mycoplasma fermentation)
• 人型支原体(Mycoplasma hominis)
• 穿透支原体(Mycoplasma penetrans)
• 梨支原体(Mycoplasma pirum)
• 解脲支原体(Ureaplasma urealyticum)
这些支原体被确定与人类和动物的呼吸道和泌尿生殖系统疾病有关。
支原体是操纵和战胜宿主免疫系统的大师。它的一半基因组成专门用于这一独特目的。虽然它几乎没有能力造成直接伤害,但它可以利用宿主的免疫功能来发挥其优势:支原体产生慢性低度炎症并从体内窃取重要的营养物质。
事实上,这种隐形微生物生存所需的一切——维生素、矿物质、脂肪、碳水化合物和氨基酸,包括胆固醇、氨基酸、脂肪酸都要从宿主身上获取。它们尤其在富含胆固醇和精氨酸的环境中茁壮成长。支原体为什么大部分存在于呼吸道粘膜中,因为它们需要胆固醇来维持细胞膜的功能和生长,并且呼吸道的支气管中含有丰富的胆固醇。
广泛感染的很大程度上可能受宿主免疫功能状态的影响。如果免疫功能最佳,初次感染后微生物就会被遏制,不会发生长期危害。大约 30-70% 的人携带至少一种支原体,但没有症状。
截止2023年6月柳叶刀在全球范围内的统计显示,在COVID-19之前,肺炎支原体是呼吸道感染的常见原因,通过直接测试方法测得,2017年至2020年全球发病率为8.61%(Lancet Microbe. 2023 Oct;4(10):e763)。
然而,针对 COVID-19 的非药物干预措施大大降低了肺炎支原体的传播。短期内,2020-2021 年间,发病率下降至 1.69%。当时还观察到其他病原体的传播率较低。
然而,柳叶刀刚刚12月又发表统计结果表明:肺炎支原体:COVID-19 大流行限制后延迟重新出现。文章指出:
2023年4月1日至9月30日(6个月期间),前瞻性监测数据是从欧洲、亚洲、美洲和大洋洲这四个联合国区域的 24 个国家的 45 个地点获得的。在所有四个联合国区域均通过 PCR 检测到肺炎支原体。通过 PCR 检测,6 个月内肺炎支原体的平均发病率为4.12%,较COVID-19期间显著上升,推测可能出先新的亚型。也表明该病原菌容易逃脱免疫系统。
与病毒不同,支原体可以在组织液(血液、关节液、心脏、胸腔和脊髓液)中生长,并且可以在任何活组织细胞内生长而不杀死细胞,就像大多数正常细菌和病毒一样。
实际上,大多数支原体物种都不是正常菌群,它们只是在等待立足的机会。如果免疫功能由于某种原因而下降,慢性、全身性感染就可能发生。有些支原体种类还具有完全逃避免疫系统的独特能力。
一旦它们附着在体内的宿主细胞上,它们独特的血浆和蛋白质涂层就可以模仿宿主细胞的细胞壁,并且免疫系统无法将支原体与人体自身的宿主细胞区分开来。然后慢慢的,支原体开始窃取重要的营养物质,并引起一系列与最初感染无关的症状。支原体等隐形微生物对组织的普遍破坏会加速衰老过程,并且可能是少数慢性退行性疾病的主要因素。
据《国际免疫学评论》和《英国医学从业者杂志》等出版物分别报道,几种支原体与许多慢性退行性疾病(如多发性硬化症和阿尔茨海默病)密切相关。
每年关于肺炎支原体疾病期间“肺外症状”的报告数量一直在增加。临床和流行病学数据表明,症状来自皮肤和粘膜、中枢神经系统、心脏。
在患有脑膜炎和脑炎、癫痫、肌萎缩侧索硬化(ALS)、阿尔茨海默病和其他中枢神经系统感染、疾病和紊乱的患者的脑脊液中发现了它。
而且,肺炎支原体以及至少 7 种其他支原体现已被认为是许多慢性疾病的直接原因或重要辅助因素,包括类风湿性关节炎、阿尔茨海默病、多发性硬化症、纤维肌痛、慢性疲劳、糖尿病、克罗恩病、ALS、非淋菌性尿道炎、哮喘、狼疮、不孕症、艾滋病以及某些癌症和白血病。
在肺炎支原体大流行的情况下,本文汇编查阅了许多研究资料,带大家了解下关于支原体这个神秘的细菌,菌属特性,致病性以及传播和防御等。
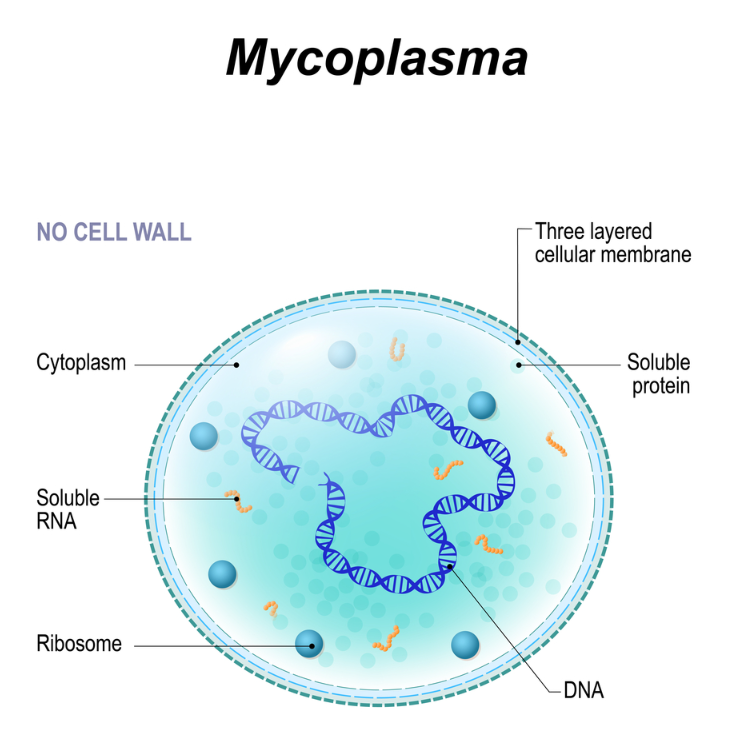
支原体(Mycoplasmas)是最小、最简单的自我复制细菌。支原体细胞含有生长和复制所必需的最小细胞器:质膜、核糖体和由双链环状DNA分子组成的基因组。与所有其他原核生物不同,支原体没有细胞壁,因此它们被归类为单独的。
支原体细胞薄片的电子显微照片
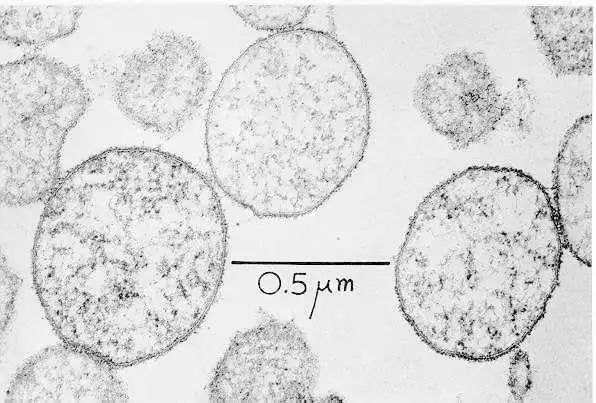
Baron S, editor. Medical Microbiology Chapter 37, Mycoplasmas
细胞以单层膜为界,在剖面上显示出特征性的三层形状。细胞质包含代表染色体切片的细线和代表核糖体的深色颗粒。
支原体的快速增殖,可以作为污染物抢占空间
支原体可以作为污染物出现在细胞培养中,支原体在细胞培养物中也会快速增殖,并与培养的细胞竞争营养和空间,从而导致培养失败或研究结果的偏差。
支原体:微小无细胞壁
支原体直径为 0.1-0.3 μm,长度可达 98 μm。它们在自然界中无处不在,广泛存在于人类、哺乳动物、爬行动物、鱼类、节肢动物和植物中。它们生活在呼吸道和泌尿生殖道的粘膜表面、眼睛、消化道、乳腺和关节中,通常表现出器官和组织特异。支原体属于 Mollicutes 类(拉丁语中 mollis = 软,cutis = 皮肤),它们体积小且没有细胞壁,这有助于将它们与其他细菌区分开来。
进化假设:寄生生活方式导致细胞壁的退化
一种假设(还原进化或退化进化)指出,支原体通过采用寄生生活方式而失去了细胞壁和其他生物合成途径。根据这一假设,寄生生活方式使得细胞壁的存在变得一次性。因此,支原体逐渐失去了合成构建细胞壁所需的聚合物所需的基因。
通过在宿主环境中作为寄生虫生活,这种发展并没有导致进化劣势。作为一种权衡,支原体依赖于其宿主来满足许多基本营养需求,这阻碍了它们在培养物中的生长,从而阻碍了对其致病决定因素的详细研究。
支原体具有较小的环状双链基因组
同一物种的菌株之间存在差异,范围从小于600 kb到2200 kb,并且它们合成的蛋白质数量相对较少;因此,代谢能力有限。
支原体膜简单坚固,复制存活依赖宿主或培养基
支原体的膜非常简单、坚硬、薄而坚固,由甾醇(脂肪酸、胆固醇或复合脂质)组成。这些分子是从周围环境中吸收的,而不是由这些微生物合成的;它们的复制和存活取决于宿主产生的因子或生长培养基吸收的因子。
支原体可寄生于细胞外或内
支原体物种既存在于细胞外作为膜表面寄生虫,也存在于细胞内,在细胞内它们成为细胞内居民作为“沉默的寄生虫”。其他数据显示艾滋病患者细胞样本中发酵支原体的细胞内定位,并且支原体(名为穿透支原体)能够在体内和体外进入许多不同的人类细胞。
最近,共聚焦显微照片证明了肺炎支原体结合和内化的能力,具体取决于细胞类型。
支原体是多种疾病的病原体和辅助因子
通常引起慢性感染,其大多数致病决定因素的身份和作用机制尚未完全了解。由于粘膜表面破坏、局部创伤、手术、组织坏死和无菌部位清除受损,支原体倾向于定殖、损伤和侵入深层组织。由于它们可以在厌氧环境中生长,这可能会导致局部感染。
支原体常作为局部感染的病原体,RT-PCR提高了检测效率
事实上,在许多情况下,支原体是这些局部感染的病原体,并且通过实验室实践对其进行分离和鉴定的困难可能导致这些关联被低估。最近添加的带有特异性引物的实时聚合酶链反应(RT-PCR)可以特异性确定感兴趣位点中是否存在支原体。例如,RT-PCR 是生殖支原体的首选诊断方法,但由于生长极慢,在常规培养中无法检测到支原体。在其他情况下,例如解脲脲原体和人型支原体,它们的快速生长允许使用常规培养来确定它们的存在,在这种情况下,RT-PCR 可以用作确认性和更快的检测方法。
蛋白质序列技术的进步,已经能够鉴定人类(例如肺炎支原体、生殖支原体和发酵支原体)和动物(鱼类中的移动支原体、猪肺炎支原体和猪中的絮状支原体)支原体致病性的潜在决定因素。
因此,一些数据表明,支原体膜上存在的脂质蛋白与单核细胞/巨噬细胞相互作用,调节免疫反应,有时导致免疫系统逃避。
std-gov
支原体的基因组特征和形态多样性
支原体基因组的鸟嘌呤-胞嘧啶(G + C)含量较低,并且相应地优先使用含有腺嘌呤和尿嘧啶的密码子,特别是在第三位。最有趣的是在许多支原体中使用通用终止密码子 UGA 作为色氨酸密码子,这是迄今为止仅在支原体和非植物线粒体中发现的罕见特性。
其变异性是由于重复元件(由大小和数量不同的基因片段组成)或插入序列元件(IS)造成的。它们的形状由细胞骨架的存在控制,细胞骨架也有助于细胞分裂(通过二元裂变进行繁殖)和支原体的运动。支原体的主要形状是球形,但它们可以有小的球虫体、肿胀的环状形式和长度可变的丝状分支形式。
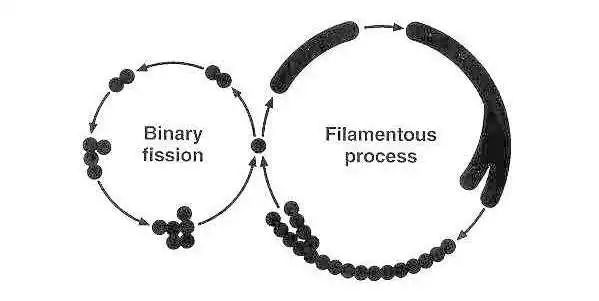
支原体的繁殖方式和生长特点
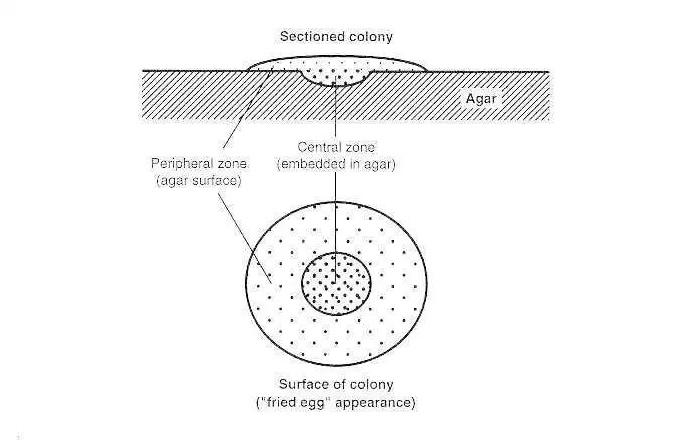
支原体通过细胞出芽和二元横向裂变进行繁殖。支原体没有鞭毛,不产生孢子,并且是革兰氏阴性。几乎所有寄生在人类和动物身上的支原体以及所有腐生支原体都可以在或多或少复杂的人工营养培养基上生长,在其中它们产生微小的菌落,通常具有特征性的“煎蛋”外观。
支原体繁殖模式的示意图
细胞可以通过二元裂变分裂或首先伸长为多核丝,随后分裂为球状体。
支原体附着细胞器
一些支原体具有独特的附着细胞器,在肺炎支原体和生殖支原体中形状为锥形尖端。肺炎支原体是呼吸道病原体,主要通过附着细胞器粘附在呼吸道上皮上。有趣的是,这两种人类支原体在液体覆盖的表面上表现出滑动运动。尖端结构始终领先,再次表明其在附着中的重要性。
煎蛋菌落形状
支原体最有用的显着特征之一是其独特的煎蛋菌落形状,由嵌入琼脂的中心生长区和琼脂表面的外围生长区组成(下图)。
典型“煎蛋”支原体菌落的形态
支原体膜的组成和特点
缺乏细胞壁和胞质内膜有利于以相对纯净的形式分离支原体膜。分离的支原体膜与其他原核生物的膜相似,由大约三分之二的蛋白质和三分之一的脂质组成。除了需要甾醇的支原体中含有大量胆固醇之外,支原体脂质与其他细菌的脂质相似。
支原体的抗原决定簇和血清学测试
暴露在细胞表面的膜蛋白、糖脂和脂聚糖是支原体的主要抗原决定簇。含有针对这些成分的抗体的抗血清抑制支原体的生长和代谢,并且在补体存在的情况下引起生物体裂解。这些特性用于区分支原体种类和血清型的各种血清学测试,并检测患者血清中的支原体抗体。
支原体的来源和对抗生素的敏感性
支原体主要从健康和/或患病动物以及患有呼吸道和泌尿生殖道疾病的人类中分离出来;它们与动物的一些关节炎和神经疾病有关;有些被发现以腐生菌的形式存在。
大多数支原体对青霉素完全耐药;支原体RNA聚合酶对利福平的抗性是支原体区别于传统真细菌的另一个特性。然而,它们对四环素和氯霉素敏感,有些对红霉素和某些其他抗生素敏感。
支原体的系统发育
作为最小和最简单的自我复制原核生物,支原体提出了一个有趣的问题:它们是否代表了在基于肽聚糖的细胞壁发育之前就存在的极其原始的细菌的后代,或者它们是否代表了已经失去其原始特征的进化退化的真细菌形式。
分子进化研究主要依靠核糖体RNA(rRNA)序列,特别是16S rRNA序列的比较。rRNA序列高度保守,比较结果支持支原体从其他细菌进化而来的假说。根据科学家的研究,支原体是从低鸟嘌呤加胞嘧啶革兰氏阳性菌分化出来的一个分支。支原体与两种梭状芽胞杆菌Clostridium. innocuum和Clostridium ramosum的关系最为紧密。也有科学家认为支原体的起源是单系的,并通过该群体的快速进化过程来解释支原体的多样性。
在大多数情况下,体内可能存在的 200 多种不同种类的支原体是完全无害的。然而,有五种特定形式可能导致感染和严重的健康问题:
这些细菌生活宿主呼吸系统中,可能导致肺部感染。通常也被称为“行走性肺炎”。
大多数感染这种细菌的人都会患上轻度肺炎。症状包括疲劳、喉咙痛、头痛和慢性咳嗽。在某些情况下,可能会出现支原体皮疹(类似于荨麻疹的红色皮疹)。
注:“行走性肺炎”是一种肺部感染,约三分之一的支原体感染者受到影响。这种感染也被称为行走性肺炎,在儿童中,它被称为支气管炎。
症状
肺炎支原体可引起上呼吸系统感染,也可模仿常见的肺炎支原体感染。与这种感染相关的一些常见症状包括干咳、不适、持续发烧和轻度呼吸急促。在极少数情况下,这种感染还可以通过损害中枢神经系统和心脏而达到临界水平。
与这种感染相关的一些常见疾病包括溶血性贫血、肾衰竭、关节炎、心包炎、中毒性表皮坏死松解症和格林巴利综合征。
常见的治疗方案
大多数时候,专家建议使用抗生素治疗这种感染。对于儿童,阿奇霉素、红霉素、克拉霉素足够有效,而对于成人,专家建议四环素、强力霉素、莫西沙星等。
当抗生素无法控制疾病时,专业人士可能还会建议使用泼尼松龙等皮质类固醇来治疗支原体。
预防肺炎支原体的小贴士
这种感染的风险在冬季和秋季会增加。这种感染可以在人与人之间传播,因此最好避免去拥挤的地方。一些预防技巧包括:保证充足的睡眠,每晚至少 6-8 小时,均衡饮食。最好避免与已经感染肺炎支原体的人接触。与人互动后和吃饭前切勿忘记洗手。
这些细菌生活在宿主的尿道和生殖器内及其周围。如果与已感染细菌的人发生性行为,就会发生这种细菌感染。
症状
可怕的事实是,生殖支原体并不总是伴随症状。许多报告表明,即使一个人根本没有感觉到任何症状,这种疾病也存在。症状因性别而异。
一般来说,女性的症状包括:
如果是男性,症状可能是:
研究表明,百分之一的成年人可能患有这种性病。有些人还尝试将支原体和衣原体联系起来;然而,它们是两种不同的性传播疾病,几乎没有共同的症状,但原因和治疗方法却不同。
常见的诊断治疗
医疗卫生专家认为,生殖支原体是一个严重的问题,诊断也很棘手。几种可能的选项是:
医生可能会推荐阿奇霉素,但如果没有任何改善,那么可能需要服用莫西沙星。继续服用该药物至少一个月后,需要再接受一次医学检查,看看感染是否消失。但都需要根据症状和感染程度采取特定的治疗。
这些细菌主要影响女性并生活在女性的生殖系统和泌尿道中。对于大多数健康人来说,这些细菌从未被注意到,而且几乎没有症状。这种细菌感染的迹象通常只出现在怀孕和分娩期间,因为细菌可以从感染该细菌的母亲那里传染给新生儿。它可能导致流产或早产,以及新生儿发烧。
症状
常见的诊断、治疗、预防
➤ 4
解脲支原体
(Ureaplasma Urealyticum)
小脲原体(Ureaplasma parvum)
这些细菌生活在男性的尿道和女性的子宫颈或阴道中。几乎所有健康的成年人都有这种细菌,但如果它导致感染,就会造成健康问题。
很少有男性携带这种细菌,但大多数健康女性都有。细菌在性交过程中传播,并可能导致阴茎或阴道分泌物、腹痛和生殖器异味等症状。
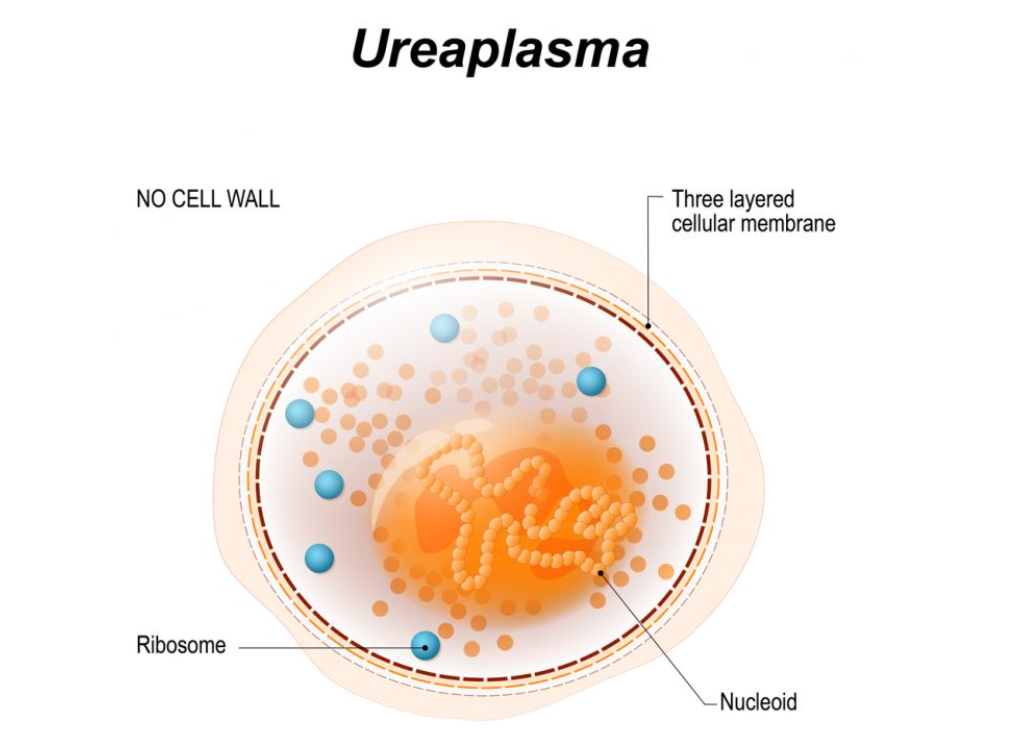
健康女性也可能感染解脲支原体和微小解脲支原体。虽然它们不会对你的身体产生任何重大影响,但几乎观察不到基本的疼痛和分泌物症状。支原体和解脲支原体之间有一个共同的关系,即它们都存在于男性和女性的生殖道中。如果出现一些疾病症状,最好就医。
大多数人类和动物软体动物属于支原体科的解脲支原体属。支原体是由革兰氏阳性细菌进化而来的,这些细菌经历了显着的基因组缩减;因此,该属的大多数成员表现出宿主和组织特异性,并且复制和生存的代谢选择有限,迫使它们适应从宿主获取代谢前体。
支原体的入侵
为了完成这一致病过程,支原体必须首先克服几个障碍才能成功侵入宿主的防御并达到完整的生命周期。
支原体的侵袭性是由表面粘附素及其辅助蛋白、荚膜多糖、侵袭酶和生物膜介导的,所有这些都确保了支原体在体内的建立、繁殖和传播。
在寄生周期中,支原体吸收宿主细胞的营养物质并释放大量代谢物,如过氧化氢(H2O2)、氨(NH3)和硫化氢(H2S),造成局部组织损伤。
支原体分泌毒素,表达多种致病酶
某些支原体还可以分泌一些外毒素,包括社区获得性呼吸窘迫综合征毒素(CARDS TX)和溶血素。这些毒素具有不同的功能,可以通过多种方式影响宿主细胞功能。
支原体还可以表达多种致病酶,如脂肪分解酶、肽酶、磷酸酶、胞外ATP酶、细胞毒性核酸酶和核苷酸酶,被认为是重要的支原体致病因子。
此外,支原体细胞膜上的一些固有成分,例如脂质、膜脂蛋白,甚至关节炎支原体产生的超抗原,都可以通过各种策略引发炎症反应。
支原体毒力因子示意图
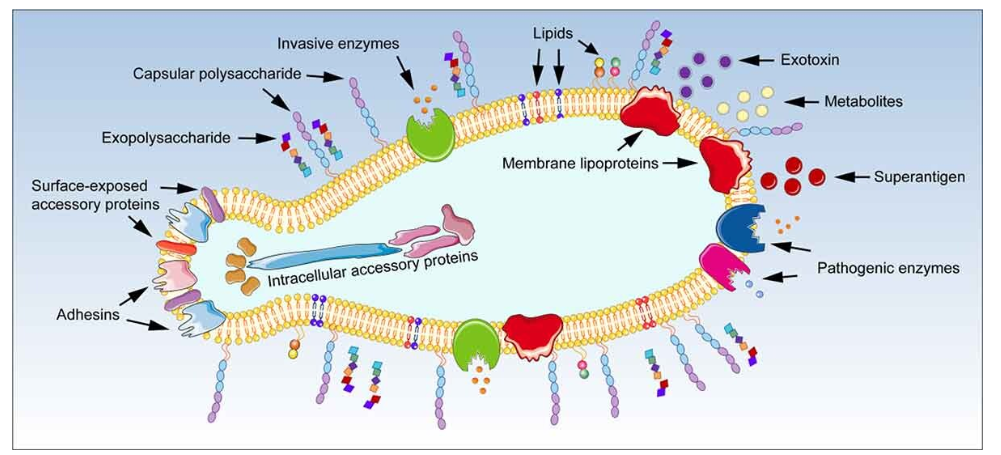
doi: 10.1080/21505594.2021.1889813
支原体的毒力因素包括侵袭性、类毒素物质、外毒素、致病酶和一些膜成分。
注:类毒素物质主要包括增殖过程中产生的代谢产物,如H2O2、NH3、 H2S等。
支原体附着的受体位点(宿主细胞膜)
肺炎支原体和生殖支原体的附着受到神经氨酸酶预处理宿主细胞的影响,宿主细胞膜的唾液酸糖蛋白和/或唾液酸糖脂似乎是这些支原体的受体位点。
有证据表明,几种肺炎支原体膜蛋白充当粘附素,并且它们对宿主细胞上肺炎支原体的特异性受体具有高亲和力。其中一种蛋白质,即蛋白质 P1的单克隆抗体可抑制支原体的附着。抗体的铁蛋白标记表明 P1 集中在支原体的尖端结构上,这一发现进一步支持了尖端作为附着细胞器的观点。
支原体粘附蛋白P1和MgPa
对肺炎支原体(P1) 和生殖支原体(MgPa)主要粘附素的基因进行了克隆和测序,从而能够表征这些蛋白质。这两种粘附素在许多方面都很相似,并且实际上包含广泛的同源性区域,这也通过共享表位来表达。这两种蛋白质可能是经历水平基因转移事件的祖先基因的产物。
支原体代谢产物过氧化氢对宿主细胞的损伤
损害支原体感染粘膜表面的毒性因子的性质仍不清楚。因此,研究人员考虑支原体代谢的终产物是否导致组织损伤。过氧化氢(H2O2)是支原体呼吸的最终产物,自从在体外被证明它能导致支原体裂解红细胞以来,它就被认为是主要的致病因素。
然而,H2O2的产生本身并不能决定致病性,因为肺炎支原体毒力的丧失并不伴随着H2O2产生的减少。为了使 H2O2发挥其毒性作用,支原体必须足够紧密地粘附在宿主细胞表面,以维持有毒的稳态 H2O2浓度,足以对宿主细胞造成直接损害,例如脂质过氧化。
粘附肺炎支原体对宿主细胞造成氧化损伤的机制
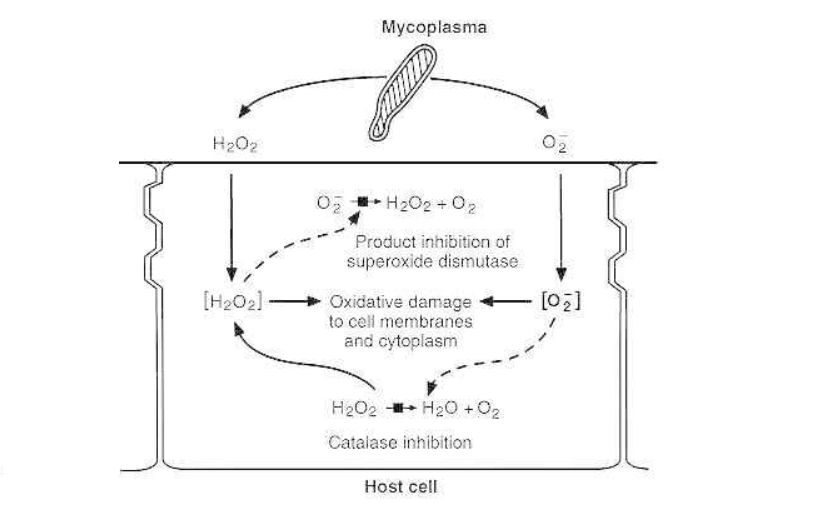
Medical Microbiology. Chapter 37, Mycoplasmas
生物体相关因素和宿主相关因素均参与支原体感染的发病机制
支原体激活巨噬细胞,诱导细胞因子产生和淋巴细胞增殖;大鼠病原体关节炎支原体可产生有效的超抗原。因此,就肺炎支原体而言,宿主可能通过对支原体产生局部免疫反应而对肺炎负有主要责任。
鼻内接种肺炎支原体的仓鼠显示出由单核细胞浸润组成的斑片状支气管肺炎病变。实验感染前胸腺功能的消融可防止特征性肺部浸润的发展,但会延长微生物从肺部分离的时间。当胸腺动物恢复并再次感染时,就会发生夸大和加速的肺炎过程。
流行病学数据还表明,在出现症状性疾病之前,需要在人类中反复感染:大多数 2 至 5 岁的儿童中都可以发现肺炎支原体的血清抗体,尽管这种疾病在 5 至 15 岁的个体中发生的频率最高。
免疫病理学机制可解释一些肺炎支原体并发症
免疫病理学机制也可以解释一些感染肺炎支原体的患者出现影响远离呼吸道的器官的并发症。在许多此类患者的血清中检测到了各种自身抗体,包括与红细胞 I 抗原反应的冷凝集素,以及与淋巴细胞、平滑肌细胞以及脑和肺抗原反应的抗体。
肺炎支原体与脑和肺抗原之间的血清学交叉反应已被证明,这些抗原可能与肺炎支原体膜的糖脂有关,这种糖脂也存在于大多数植物和许多细菌中。显然,宿主反应差异很大,因为只有大约一半的患者出现冷凝集素,并且即使在具有抗组织球蛋白的个体中,并发症也很少见。
肺炎支原体肺炎最令人费解的特征之一是患者的年龄分布。1964年至1975年间对西雅图地区10万多人进行的一项调查显示,5岁至9岁儿童的特定年龄发病率最高。最年轻年龄组(0至4岁)的肺炎支原体肺炎发病率约为学龄儿童的一半,但明显高于成人。
肺炎支原体肺炎在6个月以下的婴儿中很少观察到,这表明母体赋予了免疫力(下图)。肺炎支原体占学龄儿童所有肺炎的 8% 至 15%(科研统计数据,只做参考)。在年龄较大的儿童和年轻人中,约 15% 至 50% 的肺炎是由这种微生物引起的。
肺炎支原体感染全年都会在世界范围内发生,但在较冷的月份中更容易发生,这显然是因为通过飞沫感染传播的机会更大。肺炎支原体似乎需要密切的个人接触才能传播;成功的传播通常发生在家庭、学校和机构中。潜伏期为2至3周。
传播途径
风险因素
对于大多数人来说,这些细菌是他们日常生活中无害且始终存在的一部分。然而,如果有以下风险因素,那么发生感染的风险就会增加:
支原体脂蛋白与宿主细胞相互作用
支原体附着在外部细胞膜上,一方面导致某些细菌蛋白(脂蛋白LP/脂肽或特定附着细胞器)与靶细胞表面上的特定细胞受体之间的相互作用手。为此,许多研究已经鉴定出几种支原体的脂蛋白可以与宿主生物体的上皮细胞和白细胞相互作用。
免疫细胞的炎症反应与支原体脂蛋白结合的关系
当这些细菌蛋白与免疫细胞中表达的特定受体(模式识别受体PRR)结合时,就会发生炎症反应。更详细地说,病原体相关分子模式 (PAMP) 通过与专门的 PRR——Toll 样受体 (TLR) 和核苷酸结合寡聚化结构域蛋白 (NOD) 样受体相互作用,被先天免疫系统的细胞识别。
支原体的脂蛋白可以通过与TLRs 1、2、4和6结合来引发炎症反应。其中第一个被鉴定的脂肽是支原体的巨噬细胞活化脂肽-2(MALP-2),它可以通过与TLRs结合来激活细胞和表达NF-κB。
三酰基或二酰基脂肽分别与TLR 1/2或TLR 2/6异二聚体结合。TLR2基因敲除小鼠无法通过MALP-2来激活信号通路,这进一步证实了该信号通路的重要性。支原体感染可引发乳腺炎、输卵管炎、尿道炎、非典型肺炎等发炎性疾病。
支原体影响参与炎症和细胞转化的细胞途径
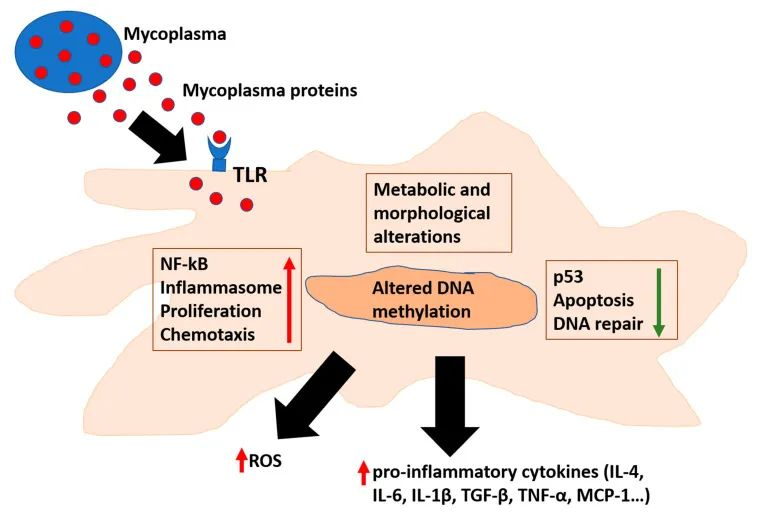
Benedetti F et al. 2020. Microorganisms
支原体的蛋白质与 TLR 相互作用或进入细胞,在那里它们可以改变负责炎症和 DNA 修复的多种途径。此外,影响细胞 DNA 甲基化会导致细胞表观遗传景观的改变。TLR:Toll 样受体;ROS:活性氧。TGF:转化生长因子;TNF:肿瘤坏死因子;和MCP-单核细胞趋化蛋白。
支原体感染引起的炎症反应和免疫细胞迁移
这些炎症反应是由支原体感染后上皮细胞和白细胞分泌的免疫因子所致,其后会激活NF-κB和多种细胞因子,从而引起粒细胞、巨噬细胞和淋巴细胞的迁移,使它们集中到感染部位。
个别脂肽如三酰基脂肽也能在没有完整支原体的情况下促进白细胞浸润。TLRs与NF-κB的结合可能会启动细胞的抗凋亡程序,最终产生促癌作用。
总而言之,研究数据表明支原体配体在进化上具有保守性,能够引发相同的细胞信号传导反应。值得注意的是,支原体中的单个脂肽可以诱导炎症,与整个微生物分离,这表明可能对细胞产生旁分泌作用。
慢性阻塞性肺病(COPD)可能与支原体有关
虽然支原体水平高和炎症水平升高可以很容易地解释其致病性,但在某些情况下,其负面影响的机制尚不清楚。
一个例子是慢性阻塞性肺病 (COPD),其两种病理表现(慢性支气管炎和肺气肿)是发病率和死亡率日益增加的原因(全世界有 130,000 人死亡)。
COPD病因和症状
长期接触刺激物(主要是吸烟和空气污染物)会引发肺部炎症反应,导致小气道狭窄、肺组织破裂和进行性肺泡破坏(肺气肿),并出现呼吸困难、咳嗽等症状和痰液产生。
尽管呼吸道症状是慢性阻塞性肺病的标志,但非肺部症状也经常出现。因此,心血管、内分泌和肌肉骨骼合并症的风险增加。
炎症对COPD患者的全身影响
这些非肺部表现很可能是由炎症过程引发的免疫功能障碍介导的,炎症过程最初在肺部触发,并在全身传播,导致并加重合并症。
在这方面,在 COPD 患者中观察到的循环炎症生物标志物水平升高是这些全身效应的潜在介质。此外,COPD 患者的循环功能性 T 调节细胞 (Treg)、骨髓源性抑制细胞 (MDSC) 和衰竭性程序性死亡 (PD) 1 + 细胞的水平也显着升高,这些细胞会导致效应 T 细胞功能障碍和降低他们抵抗感染的能力。
COPD患者肺部微生物变化
与健康人中观察到的微生物群相比,肺部微生物群的特征发现多样性显着减少。特别是,在慢性阻塞性肺病患者中,微生物群的组成似乎仅限于包括潜在致病微生物的门,例如肺炎支原体,它也与急性加重有关。
包括支原体在内的许多细菌的病原体与癌症的精确关系在很大程度上仍然难以捉摸。
我们特别注意到,一些细菌能够通过侵入宿主细胞并在很长一段时间内不被免疫系统检测到来建立持续的慢性感染。它们产生的蛋白质会干扰和改变重要细胞途径的功能,如细胞周期控制、细胞凋亡、DNA 修复。这与这些病原体诱导能够增加 DNA 损伤的物质的能力有关,可能会增加异常细胞的生长和转化。
▼
许多研究已经在慢性炎症、肿瘤进展和 p53 之间建立了牢固的联系,鉴于 p53 在保持基因组稳定性方面的核心作用,p53 无疑是人类最重要的肿瘤抑制蛋白。支原体感染细胞后,由于p53功能受损无法适当修复DNA损伤,从而潜在增加癌症发生和发展风险。
注:p53是一种蛋白质,也被称为肿瘤蛋白53。它在细胞中起着关键的调控作用,主要参与细胞周期的调控、DNA修复和细胞凋亡等过程。p53蛋白质的功能异常与多种癌症的发生和发展有关。正常情况下,p53可以抑制异常细胞的生长和分裂,促进DNA修复,或引导细胞进入凋亡途径。当细胞受到DNA损伤或其他应激刺激时,p53蛋白质会累积并激活一系列的反应,维护基因组的稳定性。然而,当p53基因发生突变或其他异常时,p53功能可能受到抑制或失调,导致异常细胞的增殖和存活,从而增加患癌风险。p53是癌症研究中的重要研究对象,也是潜在的治疗靶点。
慢性炎症通过NF-κB降低p53的活性:细胞命运的关键决定因素之一
NF-κB 降低 p53 的活性,抗凋亡 NF-κB 和促凋亡 p53 之间的相互调节是细胞命运的主要决定因素之一。事实上,在不同肿瘤细胞系中对持续活化的 NF-κB 进行遗传或药理学抑制会导致 p53 功能激活,并通过 p53 依赖性细胞凋亡导致肿瘤细胞死亡。
鉴于炎症可以降低 p53 的活性,慢性炎症可能通过 NF-κB 的激活降低 p53 的活性;因此,促进细胞转化。
p53参与DNA损伤响应和细胞周期调控
DNA 损伤和其他应激信号后,细胞 p53 蛋白的低水平增加,导致生长停滞、DNA 修复或细胞凋亡。细胞周期的中断可防止受损 DNA 的复制,从而使 p53 能够激活参与 DNA 修复的蛋白质的转录。
另一方面,当该途径受到损害时,细胞会激活导致细胞凋亡的途径,这是避免含有异常 DNA 的细胞增殖的选择机制。
p53活性受严格调控
由于这些原因,p53的细胞浓度和活性必须受到严格调节,p53的主要调节因子是Mdm2,它通过将p53保留在细胞质中并通过泛素系统激活其降解来发挥作用。
Mdm2 通过反馈机制受到 p53 以及参与生长停滞、DNA 修复和凋亡的基因(例如 p21、Gadd45、BAX 和 PUMA)的调节。
▼
骨形态发生蛋白 2 (BMP2) 是一种重要的生长因子和形态发生素,与癌症的促进和生长有关。
事实上,已经表明,穿透支原体、发酵支原体和人型支原体的感染会在通常不表达此类蛋白的细胞,包括 BEAS-2B 细胞(永生化细胞)中诱导 BMP2 RNA 表达以及成熟 BMP2 蛋白的分泌。
人支气管上皮细胞、A549 细胞(肺腺癌细胞)以及其他几种不同来源的细胞系(间质细胞、上皮细胞和骨髓细胞)。
支原体感染细胞中 BMP2 表达的增加,主要是通过调节 RNA 稳定性来实现的,而不是影响转录水平。此外,研究表明,BMP2 刺激慢性支原体感染转化的 BEAS-2B 细胞的增殖,表明支原体感染对 BMP2 调节途径的深远影响,包括参与细胞增殖、分化和凋亡的途径。
▼
将支原体与致癌作用联系起来的进一步研究通过其参与 DNA 甲基化模式的变化来说明。DNA 甲基化(即胞嘧啶向 5-甲基胞嘧啶的转化)是转录调控的重要元素,也是主要的表观遗传机制之一。
许多应激或 DNA 损伤实际上会干扰 DNA 被 DNA 甲基转移酶 (DNA-MTase) 在 CpG 二核苷酸处甲基化的能力。当特定支原体MTase 在人类细胞系中表达时,已观察到它们易位至细胞核。结果是人类基因组甲基化格局发生了变化,因为这些细菌酶使人类基因组 DNA 中各自 CG 和 GATC 位点内的胞嘧啶甲基化,从而刺激促癌途径。
▼
其他报告强烈表明支原体在细胞转化中的作用,目前正在积极研究支原体与癌症之间的联系。为此,许多研究证明支原体对细胞系的影响,表明支原体可能促进肿瘤发生,例如在口腔组织中、在人前列腺细胞、胃癌细胞和宫颈细胞中两者都是体外的。
在体内,一些研究报道了在各种肿瘤组织和体液中分离出支原体,特别是在癌前病变以及胃癌、结肠癌、卵巢癌、肺癌和肝细胞癌患者的恶性组织中发现了支原体,尽管迄今为止尚未证明与细胞转化有直接的因果关系。尽管如此,所有概述的研究和支原体的特性都强烈表明这些物质是癌症促进因素。
▼
将患者痰液、脓液等样本接种到适当的细胞培养基中,观察是否有支原体在细胞内生长繁殖。这是一种传统的诊断方法。
采用聚合酶链反应(RT-PCR)技术检测支原体DNA特异序列。PCR检测灵敏度高,能快速检出病原体。
高通量测序技术可以应用于支原体的检测和鉴定。支原体是一类细菌,通过对其基因组进行测序分析,可以确定其物种、亚型和耐药性等信息。
ELISA法检测患者血清中支原体特异性抗体IgM和IgG。这种方法操作简单、成本低。
采用荧光标记的抗支原体抗体对病理切片或细胞培养物进行染色,观察荧光信号判断是否感染。
HE染色下观察支原体在组织中的形态和位置。电镜下可以直接观察到支原体细胞内的结构。
检测CRP、ESR等炎症标志物升高情况,辅助支持支原体感染的诊断。
这是一种传统的方法,通过细胞形态学特征判断是否感染支原体。
▼
不建议对支原体感染进行化学预防,并且没有可用的疫苗。先前的自然感染似乎提供了最有效的抵抗力;然而,有证据表明肺炎支原体感染每隔几年就会复发。这些观察结果表明,对单一自然感染的免疫力相对较短。
以下方式可能有助于预防,仅供参考:
▼
支原体感染的治疗通常采用抗生素进行,具体的药物选择和治疗方案会根据支原体的种类、临床症状和耐药性等因素进行确定。
常用的治疗支原体感染的药物:
• 大环内酯类抗生素
如红霉素、四环素、阿奇霉素等,常用于治疗肺炎支原体感染。
• 四环素类抗生素
如多西环素、米诺环素等,常用于治疗衣原体感染。
• 喹诺酮类抗生素
如氧氟沙星、左氧氟沙星等,常用于治疗衣原体、肺炎支原体感染。
• β-内酰胺类抗生素
如头孢菌素、阿莫西林-克拉维酸等,常用于治疗鸡眼支原体感染。
• 大环内酯类和四环素类联合治疗
对于一些耐药性较强的支原体感染,联合使用大环内酯类和四环素类抗生素可能会提高疗效。
需要注意的是,抗生素的使用应该根据医生的建议和具体情况来确定,遵循药物的使用指南和剂量要求。
此外,抗生素治疗支原体感染时,应严格按照疗程完成,以避免耐药性的产生。
除了抗生素治疗外,还可以辅助应用一些支持疗法,如充分休息、保持良好的营养状态、健康胃肠道生态、增强免疫力等,以帮助更快地康复。最终的治疗方案应根据临床情况和医生的建议来确定。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Bajantri B, Venkatram S, Diaz-Fuentes G. Mycoplasma pneumoniae: A Potentially Severe Infection. J Clin Med Res. 2018 Jul;10(7):535-544.
Meyer Sauteur PM, Beeton ML; ESGMAC the ESGMAC MAPS study group. Mycoplasma pneumoniae: gone forever? Lancet Microbe. 2023 Oct;4(10):e763.
Meyer Sauteur PM, Beeton ML; European Society of Clinical Microbiology and Infectious Diseases (ESCMID) Study Group for Mycoplasma and Chlamydia Infections (ESGMAC), and the ESGMAC Mycoplasma pneumoniae Surveillance (MAPS) study group. Mycoplasma pneumoniae: delayed re-emergence after COVID-19 pandemic restrictions. Lancet Microbe. 2023 Nov 23:S2666-5247(23)00344-0.
Kashyap S, Sarkar M. Mycoplasma pneumonia: Clinical features and management. Lung India. 2010 Apr;27(2):75
Siles-Guerrero V, Cardona-Benavides I, Liébana-Martos C, Vázquez-Alonso F, Expósito-Ruiz M, Navarro-Marí JM, Gutiérrez-Fernández J. Recent clinical relevance of mono-genital colonization/infection by Ureaplasma parvum. Eur J Clin Microbiol Infect Dis. 2020 Oct;39(10):1899-1905.
sciencedirect.com/topics/medicine-and-dentistry/mycoplasmataceae
Yiwen C, Yueyue W, Lianmei Q, Cuiming Z, Xiaoxing Y. Infection strategies of mycoplasmas: Unraveling the panoply of virulence factors. Virulence. 2021 Dec;12(1):788-817.
Benedetti F, Curreli S, Zella D. Mycoplasmas-Host Interaction: Mechanisms of Inflammation and Association with Cellular Transformation. Microorganisms. 2020 Sep 4;8(9):1351.

谷禾健康


DNA 测序是测量各种生命形式主要特性的基础。自20世纪50年代发现DNA双螺旋结构后,全世界科学家们就开始致力于确定不同物种基因组的原始序列。这一任务被称为基因组测序,旨在揭示不同生物的基因组组成和基因的排列顺序。
现代基因组研究标志之一是生成大量原始序列数据。这项工作的重要性在于,基因组序列的破译可以提供关于生物的遗传信息,包括基因功能、遗传变异和进化关系等方面重要线索。
在过去的几十年里,随着测序技术的不断发展和突破,测序的速度和精度都得到了显著提高。早期的测序方法主要依赖于Sanger测序技术,该技术基于DNA链延伸的原理,通过测量DNA链延伸反应中释放的荧光标记物来确定DNA序列。然而,由于其低通量和高成本的限制,Sanger测序逐渐被新一代测序技术(NGS)所取代。
随着新一代测序技术的兴起,如Illumina的高通量测序和454 Life Sciences的Roche测序平台以及华大基因(BGI)DNBSEQ-T7等测序平台,基因组测序进入了一个全新的时代。这些技术利用并行测序的原理,可以同时测序数百万个DNA片段,大大提高了测序的速度和效率。同时,这些技术也在成本和准确性方面取得了显著的突破,使得大规模基因组测序成为可能。
随着测序技术的不断进步,越来越多的原核和真核基因组序列被测序出来,并存储在公共数据库中,目前四个主要的数据库是:
它们目前拥有丰度的实验以及样本核苷酸序列原始数据,此外还有蛋白质序列或大分子结构数据。这些数据库为科学家们提供了宝贵的资源,可以用于研究和比较不同物种的基因组,从而增进对生物多样性、进化和基因功能的理解。
除了基因组序列的分析,还需要开发各种生物信息学工具和数据库,以帮助解释和注释基因组数据。这些工具可以用于预测基因的功能、识别调控元件、比较不同物种之间的基因组差异等。
随着计算机技术的不断进步,测序数据也逐渐借助人工智能和机器学习等技术。这些技术可以辅助人们更快速、准确地分析和解释基因组数据,发现隐藏在数据中的模式和关联。机器学习算法可以用于预测基因的功能、识别基因组中的重要调控区域或精确区分相近物种等。
例如谷禾肠道菌群16S数据库,是谷禾健康从几十万人肠道菌群检测数据中提取的16S序列库,通过宏基因组匹配数据和模型构建,重新完成到种的物种注释。进一步通过基因组数据研究和分析,为您提供深度个性化的健康检测方案。
目前测序技术已经在许多应用领域产生了广泛的影响。例如,基因组测序为研究人类遗传疾病的发病机制提供了重要线索,短读长、高测量通量和低成本为个体化医学和精准治疗奠定了基础。此外,测序还广泛应用于农业、环境科学和生物工程等领域,为改良作物、保护环境和生产高效生物工艺提供了有力支持。
因此本文和大家分享DNA测序相关的知识以及测序技术的发展和测序的注意事项等。
DNA(脱氧核糖核酸)是遗传物质,存在于所有生物的细胞中,以双螺旋结构存在,由核苷酸组成,包括磷酸基团、脱氧核糖和四种氮含基(腺嘌呤A、胸腺嘧啶T、胞嘧啶C和鸟嘌呤G)。DNA负责存储遗传信息,指导蛋白质合成,并在细胞分裂时复制自身,确保遗传信息传递给子代。
不同物种的DNA在结构上非常相似,但在序列和组织上存在差异
人类DNA包含约30亿个碱基对,组成大约2万到2万5千个基因,这些基因分布在23对染色体上。人类DNA中的遗传信息决定了我们的外貌、生理功能和健康状况。人类的遗传多样性虽然存在,但所有人类的DNA序列大致相似,约有99.9%的相似度。个体基因组有 3-400 万个碱基对位置存在差异。这些变异可在单核苷酸多态性(SNP)中捕获 ,但也存在一些称为结构变异(SV) 的较大变异。

大多数病毒基因组有 10000 个 bp;某些植物的基因组长达数千亿个碱基对。细菌,通常具有较小的基因组,可以从几百万到几千万碱基对不等。细菌的DNA通常是单个环状染色体,而不是多条线性染色体。此外,许多细菌还含有质粒,这些是小型的DNA分子,可以在细菌之间进行转移,促进基因的水平传播,这是细菌适应环境和抗药性发展的重要机制。
总之,不同物种的DNA在功能上都是遗传信息的载体,但是在大小、形态和序列上存在差异,这些差异导致了物种之间的多样性。
不同物种个体基因组差异的产生有两个原因:
➼ 随机突变,在进化过程中发生,因为自然选择有利于某些表型。这些主要是由于细胞分裂期间 DNA 复制过程中的“错误”造成的。大多数突变都是有害的,会导致有害的表型变化并导致细胞死亡。有时,自然选择有利于某些突变,而这些突变会保留在种群中。
➼ 重组,发生在哺乳动物等高等生物的繁殖过程中。在重组过程中,亲本生物体传递给子代的遗传物质是来自亲本生物体的遗传物质的混合物。
DNA双链碱基互补
DNA 是双链的,并以双螺旋形式构建,其中核苷酸对作为螺旋的“横档”(因此称为“碱基对”)。腺嘌呤总是与胸腺嘧啶发生化学结合,而胞嘧啶总是与鸟嘌呤发生化学结合。换句话说,A 与 T互补,类似地 C 与 G 互补。AT 和 CG 对称为互补对。
DNA的结构如下所示:
图源:medlineplus
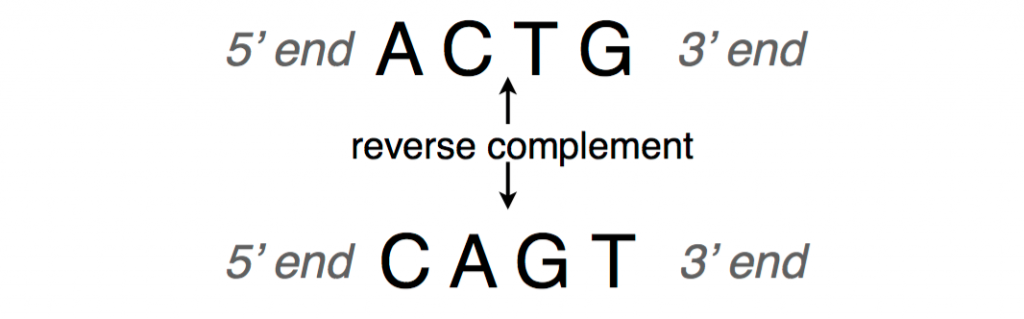
DNA序列通常以5’端(头部)到3’端(尾部)的方向展示或写入。当我们有一条 DNA 链时,由于知道互补对,所以可以推断出另一条链是第一条链的反向互补链。
为了获得反向互补,可以反转原始字符串中核苷酸的顺序,然后互补核苷酸(即,将 A 与 T 互换,将 C 与 G 互换)。
下图显示了 DNA 片段及其反向互补链的示例。
DNA 补体
DNA复制
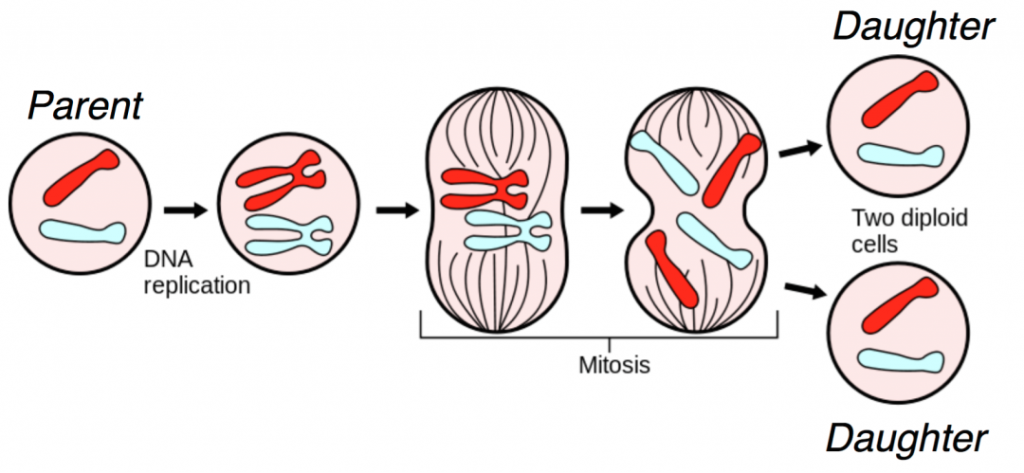
DNA 是细胞复制的基础。当细胞进行细胞分裂(也称为有丝分裂)时,细胞核中的 DNA 会被复制,并通过下图所示的一系列步骤,一个亲代细胞产生两个相同的子细胞。
有丝分裂的图
图源:wikipedia
有丝分裂过程中涉及多种生物分子,我们在这里对有丝分裂过程进行了高度简化的解释。
在图中,我们从两条染色体开始:红色和蓝色。
首先,DNA 被复制,产生更熟悉的 X 形染色体。通过生物分子信号的复杂级联和细胞内重组,(现已复制的)染色体在细胞中部排列。对于每条染色体,两半被拉开,两个子细胞中的每一个都会收到原始染色体的副本。这会产生两个与原始亲本细胞在遗传上相同的子细胞。
DNA 复制是这张图中最重要的部分;这是用来进行测序的基础过程。DNA复制如下图所示:
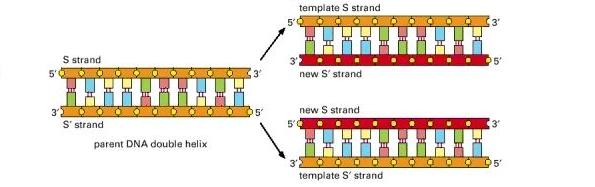
在 DNA 复制过程中,两条 DNA 链首先被解压缩,产生两条单链,每条链都充当复制的模板。然后将短 RNA 引物附着到 DNA 上的特定位点;引物中的碱基与位点中的碱基互补。酶促进(或“催化”)化学反应,而DNA 聚合酶是催化新核苷酸与延伸结合引物的模板 DNA 互补配对的酶。
DNA 聚合酶用来延伸链的核苷酸称为dNTP(脱氧核苷酸三磷酸)。从生物化学角度来看,它们与核苷酸略有不同,因为它们在 DNA 复制过程中更容易使用。对应于A、C、G和T的dNTP分别是dATP、dCTP、dGTP和dTTP。
获取DNA序列主要依赖于测序技术。常用的测序技术有桑格测序法和下一代测序法。下一章节会详细介绍。
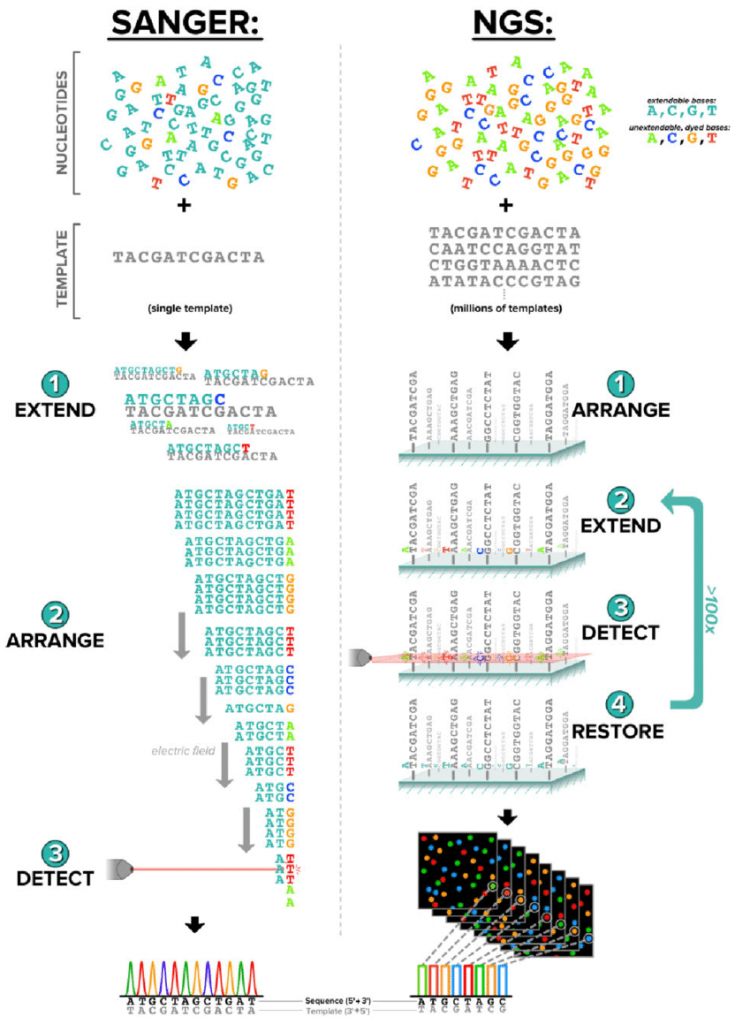
图源:praxilabs
桑格测序法准确度高但通量低。下一代测序法代表了高通量测序技术,它实现了并行化操作,大大提高了序列通量,降低了测序成本和时间,因此适合进行整个基因组或transcript组的测序。这些技术使大规模、高精度的DNA测序分析成为可能。
DNA 测序方法的发展在 2000 年左右达到顶峰,主要基于四位研究人员的贡献。
➛
Allan Maxam 和 Walter Gilbert 在 70 年代开发了一种 DNA 测序的化学方法,其中末端用放射性磷标记的 DNA 片段经过碱基特异性化学切割,并通过凝胶电泳分离反应产物。
➛
1977 年,Frederick Sanger采用另一种方法,通过使用链终止双脱氧核苷酸类似物完善了测序方法,该类似物导致引物DNA合成的碱基特异性终止。在这种方法中,引物通常用放射性磷标记。
➛
Leroy Hood 与他的同事 Michael Hunkapiller 和 Lloyd Smith 在1986年通过使用荧光标记的双脱氧核苷酸将 Sanger 方法修改为更高的通量配置。这种方法可避免使用寿命有限的放射性化合物,而是使用稳定的荧光探针。此外,所有核酸碱基的分析可通过仅读取一个而不是四个电泳泳道来完成,并且读取过程可以自动化。
这种高通量配置用于第一个人类基因组的测序,该测序于 2003 年通过人类基因组计划完成,该计划历时 13 年。

由于方法的改进和自动化,2008 年,另一个人类基因组在 5 个月的时间内完成了测序。第一份人类基因组草图的完成只是现代 DNA 测序时代的开始,它带来了更多的发明和新的、先进的高通量 DNA 测序策略,即所谓的下一代测序 (NGS)。
NGS 策略的发展正在满足我们对测序通量和成本的需求,从而在基因组研究中实现多种当前和未来的应用。这些先进方法需要开发新的生物信息学工具,作为分析过程中产生的大量数据的必要先决条件。
第一代测序——桑格测序
Fred Sanger 及其同事开发了一种基于放射性标记部分消化片段检测的相关技术。
著名的桑格测序起源于 20 世纪 70 年代末,当时桑格开发了一种基于凝胶的方法,将 DNA 聚合酶与标准核苷酸和链终止核苷酸 (ddNTP) 的混合物结合起来。将 dNTPS 与 ddNTP 混合会导致 PCR 期间测序反应随机提前终止。四个反应并行进行,每个反应包含一种版本的链终止核苷酸。使用凝胶电泳可视化该过程使得能够逐个碱基读取序列。在当时,这项技术是革命性的。它能够对 500-1,000bp 片段进行测序。
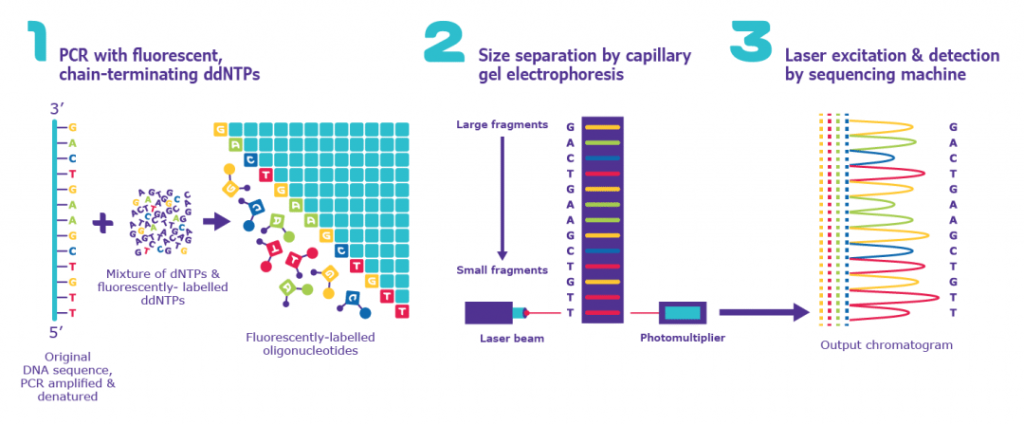
图源:praxilabs
桑格方法的一种变体——加减法,由桑格和艾伦·科尔森开发,于1977年获得了第一个DNA基因组序列,即噬菌体φX174。
图源:pixels
两年后,艾伦·麦克萨姆和沃尔特·吉尔伯特发表了他们的化学裂解技术,该技术成为第一个广泛采用的 DNA 测序方法。

到了 20 世纪 80 年代,桑格最初的方法已经自动化(毛细管电泳)。大块凝胶被更细的丙烯酸毛细管取代,结果可以在电泳图上查看。这项技术对于 2003 年人类基因组计划的完成至关重要。尽管如此,即使在人类基因组计划之后,毛细管电泳的成本仍然过高,无法实现大规模测序项目。
到 2000 年代中期,人们做出了一些努力来降低测序成本。世界各地的实验室正在测试用于更高通量筛选的新方法和技术。
第二代测序技术
第二代测序,也称为下一代测序(NGS)。简单来说,二代测序是依靠PCR文库构建和激光探针荧光信号读取的短读长测序。
目前最常见的平台有Illumina和华大基因(BGI)。
Illumina测序平台
由 illumina 等公司开发的第二代 NGS 技术可分为两大类:杂交测序或合成测序。
华大测序平台
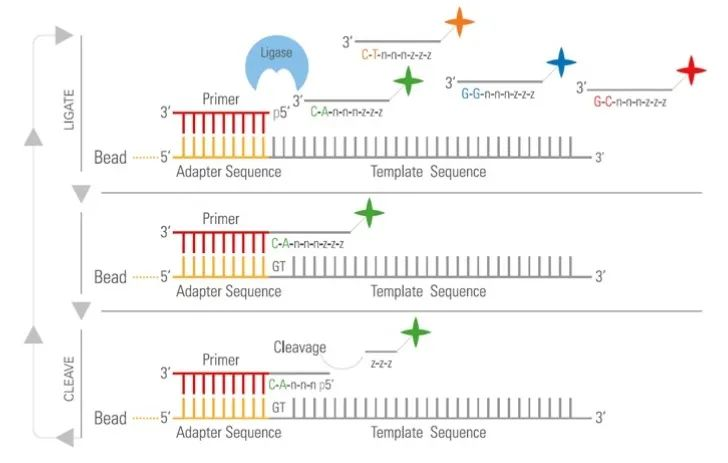
华大基因测序化学方法被称为组合探针锚定合成(cPAS)。它采用Phi 29 DNA聚合酶进行滚动圆环复制,合成一条长的单链DNA,自组装成约300纳米大小的纳米球。然后进行鉴定以确定 DNA 序列。
随着大规模双脱氧测序技术的进步,一项新技术的出现奠定了下一代测序(NGS)技术的基础。这项名为焦磷酸测序的方法,利用DNA合成过程中焦磷酸盐产生的光信号来确定核苷酸序列。在这个过程中,模板DNA被固定在一个固相表面上,随着每个核苷酸的加入,通过检测焦磷酸释放的光信号来推断DNA的序列。此技术后续还引入了珠子,以便更有效地附着DNA分子。
焦磷酸测序技术被454 Life Sciences公司所开发,并最终被罗氏公司收购,成为市场上第一个取得重大成功的商业化NGS平台。
乳液PCR
在这一平台中,DNA文库通过油包水乳液PCR技术附着在微小珠子上。在测序过程中,当较小的珠联酶和dNTPs被引入到反应板上时,便可进行焦磷酸测序。这种高度并行化的方法显著提高了测序的吞吐量,实现了数量级的提升。
桥式放大
继454测序技术取得成功之后,许多新的并行测序技术相继出现。其中最显著的是Solexa测序技术,该技术后来被illumina公司收购。
Illumina测序平台因此成为了第一个实现商业化的高通量并行测序技术。

其他
随着时间的推移,新技术不断涌现,其中包括:
图源:slideserve
这些创新技术已经成为下一代测序(NGS)技术领域的一部分。NGS平台目前是主流的测序技术,它们可以以相对较低的成本进行高通量的测序工作。然而,这些平台的读长通常有限,一般产生的读长在50到500碱基对(bp)之间。
本文我们主要介绍Illumina和华大这两个平台的测序原理。其他的简单说明一下。
Illumina测序平台介绍
Illumina 的首个测序平台是通过收购Solexa公司获得的,被命名为基因组分析仪,并于2007年开始商业化运作。这台设备能够在每个测序通道中对600万个扩增的DNA片段进行测序,最初每个片段的读取长度大约是30个碱基。Illumina 不久后提升了这一读取长度,增至100多个碱基对。同时,流动池中扩增片段的数量也得到了提升,使得基因组分析仪的输出能力达到了80吉字节的碱基信息。
注:吉字节(GigaByte),又称千兆字节,是计算机存储容量单位,简称GB。
2010年,Illumina 推出了其第二代NGS设备——HiSeq。这款设备配备了两个流动池:
紧接着,Illumina 又发布了HiSeq X10,该设备通过使用图案化的流动池凹坑(代替了传统的随机扩增簇),进一步提高了可分析片段的数量。
目前,Illumina 提供了多种测序设备,包括NextSeq 和 NovaSeq 系列,以及适用于不同规模需求的台式测序仪,如iSeq100和 MiniSeq。

NextSeq
NextSeq 500 于 2014 年推出,采用两种染料测序技术,而不是其前代产品使用的四种染料测序技术。仅拍摄红色和绿色图像,从而显着缩短周期和数据处理时间。该仪器能够在大约 30 小时的运行时间内读取4亿个碱基对。
NextSeq 1000 和 2000 机器于2020年发布,旨在通过提供机载信息学和基于云的技术来简化工作流程。P3 流动池扩展了 NextSeq 2000 仪器的范围,在单次测序运行中提供 11 亿次读取。
NovaSeq6000
NovaSeq 6000于2017年发布。它能够运行三种不同的芯片,并且可以生成100 GB的序列输出,价格仅为375美元——这个价格仅适用于测序,不包括DNA分离、文库制备、测序分析或数据贮存。
本质上,该机器每次运行能够对多达 48 个完整人类基因组进行测序,这可能需要长达 44 小时。其他关键应用包括单细胞分析、转录组测序和宏基因组分析。

HiSeq X 系列
HiSeq X Ten 测序仪是一种高性能的测序系统,它能够在单次运行中产生高达16 Tb的序列输出。使用该系统,可以以不到1000美元的价格对人类基因组进行30倍或更高倍数的测序,并且每年可以提供超过18,000个人类基因组的测序数据。每个流动池可以生成多达520亿次的读取,最长运行时间为48小时。
该系统具有超越人类物种的全基因组测序能力,并且还可以用于全外显子组测序、转录组测序、单细胞分析和多组学研究。
华大测序平台(BGI) 介绍
华大基因集团成立于1999年、参与人类基因组计划的中国公司。华大基因于2012年收购了Complete Genomics,其产品由子公司(华大智造)销售。
DNBSEQ-T7
DNBSEQ-T7于2019年推出,旨在支持健康项目和临床研究的一系列大规模测序应用。据报道,与百万基因组整体解决方案软件和硬件一起,DNBSEQ-T7 每年可以对多达 800,000 个样本进行测序。

硬件解决方案包括自动化文库制备系统,这意味着测序机可以24小时运行,无需人工干预,每天可以完成60个人类全基因组测序。其商业化预计将把个人全基因组测序的成本降低至 500 美元以下,从而改变测序格局。
华大基因测序化学
BGI的测序化学方法被称为组合探针锚定合成(cPAS)。它采用Phi 29 DNA聚合酶进行滚动圆环复制,合成一条长的单链DNA,自组装成约300纳米大小的纳米球。荧光探针被结合在其中,纳米球被连接到硅片流动池上,选择性地与带正电的材料高度有序地结合。然后,荧光发射被成像和测量,以记录碱基位置。
与所有短读取测序方法一样,BGI平台主要缺点是无法获得长的DNA序列。然而,基于cPAS的测序的一个重要优势是Phi 29 DNA聚合酶的高准确性,确保了环状模板的准确扩增。此外,由于DNA纳米球在流动池上保持不动,它们不会产生光学重复,并且不会干扰相邻的DNA。
DNBSEQ-G99(G99)
DNBSEQ-G99(以下简称“G99”)基因测序仪采用的是基于聚合酶链式反应(PCR)原理的测序技术。测序过程中,首先使用特定的引物引导 DNA 序列进行体外扩增,然后添加一种含有测序所需的四种不同颜色的 dNTP(脱氧核苷酸)和荧光标记物。当引物与待测序列结合后,聚合酶开始合成新的链,同时荧光标记物被激活并发出不同颜色的荧光。通过记录这些荧光信号,并使用计算机进行数据分析和解码,最终确定每个碱基的序列。

G99突破性地实现了12小时可完成PE150测序,从用户需求出发,在提供高质量的测序数据的同时,做到快速、简单、灵活,能为测序工作带来更好的体验,应用场景大大扩展了。
而且DNBSEQ-G99获批国家药品监督管理局(NMPA)医疗器械注册证(国械注准20233221289)。此次获批意味着,中小通量测序仪中的“速度王者”DNBSEQ-G99被准许在国内市场应用于临床,将能够充分发挥其快速、灵活的优势,服务于临床方向的应用需求。
第三代测序技术
第三代测序技术的原理主要基于单分子测序或合成测序方法,通过直接读取DNA分子的序列来进行测序。
单分子测序:通过将DNA固定在表面上,并使用荧光染料或其它探针进行测序。
单分子实时测序(SMRT):使用PacBio公司的SMRT技术,通过监测DNA聚合酶在DNA模板上的荧光信号来进行测序。
纳米孔测序(Nanopore):使用Oxford Nanopore Technologies(ONT)的纳米孔测序技术,通过将DNA分子通过纳米孔,测量通过纳米孔的电流变化来进行测序。

合成测序:通过在反应体系中逐步合成DNA序列,并使用荧光标记的核苷酸来标记每个碱基。第三代测序技术通常具有较长的读取长度,可以读取数千到数百万个碱基。
第三代测序技术的不断发展和改进,为基因组学研究提供了更多的可能性,可以更好地解析复杂的基因组结构和功能。适用于长片段的测序,如全基因组测序、长读段转录组测序、甲基化测序等。然而,第三代测序技术也面临一些挑战,如测序错误率、数据处理和分析等方面的问题,需要进一步的研究和改进。
市场上的其他三代测序平台:
MinION:MinION设备是一种便携式的纳米孔测序仪器,可以实现实时测序,并且具有较小的体积和较低的成本。
GridION:GridION设备是一种高通量的纳米孔测序仪器,可以同时进行多个样品的测序。
PromethION:PromethION设备是一种高产量的纳米孔测序仪器,可以进行大规模的基因组测序。
此外国内目前也有多家公司已推出或正在开发三代测序仪,包括真迈生物,齐碳科技等。
测序将继续变得越来越高效和经济实惠,彻底改变与基因组学相关的多个领域。目前,所有高通量测序(NGS )方法都需要文库制备。该方案发生在 DNA 片段化之后,其中接头连接到每个片段的末端。接下来通常是 DNA 扩增步骤,以产生一个文库,然后可以通过 NGS 平台进行测序。
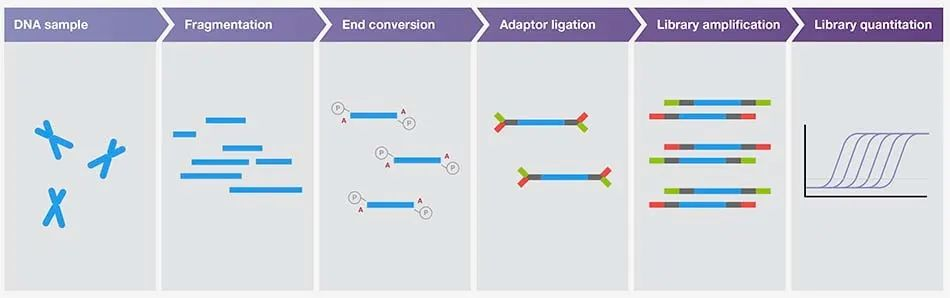
➦1
样品制备的本质是将生物样品中的核酸混合物转化为不同类型的文库,以准备进行NGS技术所需的测序步骤。如果未正确遵循方案,测序将会受到影响。每个准备步骤都是基础性的,并且根据样本和NGS平台的类型有不同的考虑因素。因此,在开始实验之前,考虑如何执行最有效的方案以确保最高质量的结果非常重要。
样品制备的一般步骤如下:
步骤1:提取遗传物质
这是每个样品制备方案的第一步。从各种生物样品中提取核酸(DNA 或 RNA)。
步骤2:文库准备
生成文库需要一系列步骤,最终目标是将提取的核酸转换成适合所选测序技术的格式。这是通过将目标序列片段化至所需长度,然后将特定的接头序列连接到这些目标片段的末端来完成的。
适配器还可以包括条形码,识别特定样品并允许多重分析。片段化可以通过物理或酶促方法完成。
步骤3:放大
这是一个可选步骤,但通常也是必需的。这取决于 NGS 的应用和样本量。扩增对于获得足够的覆盖范围以对含有少量起始材料的样品进行可靠测序至关重要。聚合酶链式反应(PCR) 是增加 DNA 量的常用方法。有关可实现小样本核酸检测的 PCR 方法出现的更多信息。
步骤4:纯化和质量控制
此步骤是必要的,以去除可能阻碍测序的任何不需要的材料。一些NGS平台可能对尺寸要求较窄,因此丢弃太大或太小的片段可以提高测序效率。最佳文库大小由测序应用决定。这种“清理”通常通过基于磁珠的清理或琼脂糖凝胶来完成。
质量控制是进行测序之前的最后一个过程。确认 DNA 的质量和数量可以提高测序数据的可信度。后续的实验既耗时又昂贵,因此需要严格的质量控制步骤以确保所有样品都适合其应用。
➦2
挑战 1
许多样本是从有限数量的样本或甚至单个细胞中提取的。它们本身并不能提供足够的遗传物质,因此需要进行 PCR。然而,该扩增步骤很容易给样品引入偏差。PCR 重复是指存在完全相同的 DNA 片段的多个拷贝。太多的 PCR 重复会导致实验的测序覆盖率不均匀。
解决方案 1:消除所有偏差来源有些不可能,但了解偏差发生的位置并采取所有实际步骤将其最小化非常重要。高 PCR 重复率表明文库制备需要进行一些修改,可能需要提高 NGS 文库的复杂性。
许多程序都可以删除 PCR 重复项,最常用的是 Picard MarkDuplicates 和 SAMTools。此外,特定的PCR 酶已被证明可以最大限度地减少扩增偏差。最终,文库制备的目标是最大限度地提高样品的复杂性,并最大限度地减少扩增造成的偏差。
挑战 2
建库效率低下是样品制备过程中面临的问题。具有正确适配器的片段比例较低反映了这一点。其后果是获得的测序数据量减少,嵌合片段数量增加。嵌合读数源自基因组中彼此不相邻的部分,并且是测序期间错误的来源。
解决方案 2:据报道,PCR 产物的有效A 加尾可防止嵌合体形成,该程序是通用的,可应用于多种不同的文库构建技术。此外,链分割伪影读数 (SSAR) 已被建议减少样本中嵌合伪影的数量,并且嵌合体检测程序可用于过滤原始序列,以实现仅 1% 的总体嵌合率。
挑战 3
样品污染是一个固有的问题,因为单独的文库通常是并行制备的。最可能的主要污染源是预扩增,这是一种在 PCR 之前增加核苷酸序列量的方法。
解决方案 3:可以通过质控,阴性对照,设置重复等步骤识别污染,确保在样品制备过程中使用无菌技术和无菌实验条件,以防止外源性污染的引入。
此外使用独特的条码和标签对样品进行标识(谷禾所有样本全程唯一条形码溯源识别管理),以避免混淆和交叉污染。最后,做好定期清洁和消毒:定期清洁和消毒实验室设备和工作区域,以减少污染的积累和传播。
挑战 4
文库制备的巨大成本主要归因于实验室设备、需要经过培训的人员和试剂成本。
解决方案 4:通过优化实验步骤和条件,可以减少试剂的使用量和浪费,从而降低成本。确保实验室人员接受适当的培训和技术支持,以提高实验的效率和准确性。与其他实验室或研究团队合作,共享设备和资源,共同承担成本和实验负担。随着自动化技术变得越来越流行,样品制备的准确性和效率可能会提高。
什么是碱基平衡?
测序中一个不可忽视的原则就是碱基平衡,是指测序过程中,每个循环中A、C、G和T四种碱基,比较均匀地存在。需要兼顾的平衡度与复杂度。在测序过程中,保持碱基平衡是非常重要的,可以确保测序结果的准确性和可靠性。
什么是碱基不平衡文库?
就是扩增子产生的文库,扩增子的特点是有特定的起始位点的。反应到测序图像上,就会呈现一张照片特别亮,光点很多,而其他三张照片就特别暗。这时软件做空间上比对就比较难。结果是判断的可靠性比较差,导致对于碱基的判读就会出现错误,从而导致测序质量值大幅度下降。一般添加诸如基因组DNA文库,或掺入大量的平衡碱基文库,包括phix文库等。同时,也可以尽量多掺入不同类型的扩增子文库。
此外,碱基平衡还涉及到检测和纠正测序过程中的碱基偏差。在测序过程中,可能会出现碱基的插入、缺失或错误,这些错误会影响测序结果的准确性。为了纠正这些错误,开发了各种生物信息学工具和算法,例如质量控制和碱基校正等。
文库长度含两侧测序接头和插入目标片段,整个文库的长度范围不能过宽,一般建议在250bp-450bp之间比较好,超过600bp以上就会造成一些不利影响。
过长的文库长度会降低测序效率
在Illumina测序等高通量测序平台上,测序片段长度会影响测序的质量和效率。过长的文库长度会增加测序过程中的错误率,并且会导致测序片段的读取长度变短。这会降低测序的可靠性和准确性,影响后续的生物信息学分析和数据解读。但是如果文库片段过短的话,该短片段测序到后期,就是要测接头序列了,有的时候连接头序列都测完了,那就没有信号了,后续会读取一些假信号,降低测序质量值。
过长的文库长度会降低簇密度
簇密度是基于单次只测一个碱基的边合成边测序原理,要求对各个分子簇的反应时间要求一致。也就是各个分子簇必须同时进行反应。理想状态当然是如此,但是实际PCR反应过程中,各个分子的反应时间还是不尽相同的(一般体系和酶要控制好)。因此,会产生有的分子簇内的分子反应的快,有的慢的情况过长的文库长度会降低簇密度。在Illumina测序中,DNA片段会被固定在测序芯片上的聚合酶链反应(PCR)产物中,形成簇。过长的文库长度会导致PCR扩增效率降低,从而降低簇密度。低簇密度会减少每个簇中的测序片段数量,进而降低测序的覆盖度和深度,影响后续的数据分析和解读。
过长的文库长度可能导致碱基偏移
在测序过程中,由于DNA聚合酶的滑动等原因,长片段的文库容易出现碱基偏移的情况。
数据量(yield)
数据量指一次测序所获得的PF数据的总量。注意,是PF数据(PF数据是指通过滤波后的有效测序数据,即通过质量控制筛选后的测序片段),而不是原始数据。数据量当然越多越好,实际成绩与测序仪型号有关,不同的机器,产量不一样。
PF数据的总量是衡量测序深度和测序质量的一个重要指标。较高的PF数据总量表示测序过程中得到了更多的有效测序片段,可以提供更高的测序覆盖度和深度,从而提高后续数据分析的可靠性和准确性。
Q30
Q30是指在测序过程中,质量值(Quality Value,QV)大于或等于30的碱基。质量值是根据测序仪器对每个碱基的测量结果和信号峰值计算得出的,用来表示该碱基的质量好坏。Q30值越高,表示测序数据中高质量的碱基比例越高。
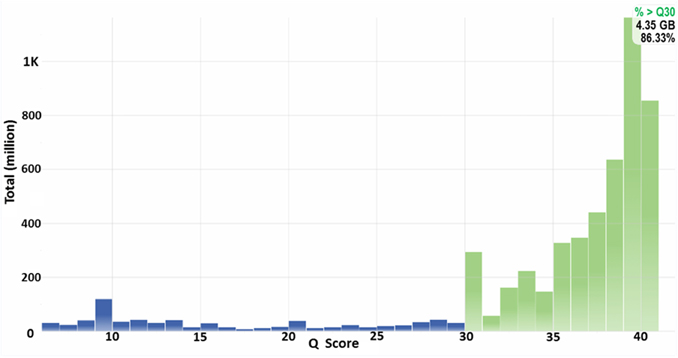
by:Alexander William Eastman
需要注意的是,Q30的大小与测序片段(read)的读长有关。如果读长较长,即测序片段包含的碱基数较多,那么要求每个碱基的质量值都达到或超过30就更加困难,因此平均%Q30可能会降低。相反,如果读长较短,即测序片段包含的碱基数较少,那么要求每个碱基的质量值达到或超过30就相对容易,平均%Q30可能会提高。
比对率(mappingrate)
将测序数据与参考序列(reference)进行比对,是测序数据分析中的一项重要步骤。比对率是指在比对过程中,测序数据与参考序列完全一致的碱基占测序数据总碱基数的比例。比对率越高,表示测序数据的准确性和可靠性越高。在细菌16S测序中,可以根据具体的需求选择适合的比对工具。
常用的比对工具是基于Smith-Waterman算法的BLAST(Basic Local Alignment Search Tool)和基于Burrows-Wheeler变换的Bowtie、BWA等工具。高比对率是测序数据质量好的重要指标之一。它表示测序数据的准确性和可靠性较高,能够提供更准确的基因组信息和变异位点等重要信息(在谷禾16s测序中,尤其粪便样本约超过 70%能比对到种)。在后续的数据分析和解读中,高比对率的测序数据更有助于准确地进行变异检测、基因表达分析、功能分析等。
需要注意的是,比对率受到多种因素的影响,包括测序数据质量、参考序列的准确性、数据库以及比对算法的选择等。在进行测序数据分析时,需要综合考虑比对率、测序数据质量和其他相关指标,以获得准确可靠的分析结果。
覆盖度(coverage)
由于测序数据的生成过程中存在一些技术和生物学上的随机性,导致不同区域的测序数据的覆盖深度(coverage depth)是不一样的。
覆盖深度是指在某个特定位置的测序数据的读段数目或测序碱基数目。覆盖深度越高,表示该位置的测序数据越丰富,测序结果的准确性和可靠性越高。
需要注意的是,覆盖深度的均匀性和高低受到多种因素的影响,包括测序深度、测序技术、样本质量等。
重复率(duplicationrate)
在二代测序文库的构建过程中,除了无PCR流程(PCR-free approach),其他方法都需要进行PCR扩增。PCR扩增会导致染色体的不同区域放大程度不一致,有部分序列被过度放大。这是一种人为引入的偏差。重复率与文库构建试剂的质量有关,对于人类全基因组测序来说,通常<10%。
捕获率(capturerate)
杂交捕获建库是通过探针杂交捕获来从基因组文库中富集相应序列的,探针杂交捕获存在着捕获效率高低的问题,因此考察、评价这一步骤成败、好坏的参数就是捕获率,越高越好。捕获率与所用的捕获试剂有关,不同的试剂,捕获率不同。
高通量测序操作包括样品准备、文库构建、PCR扩增、测序仪器运行等。只有按照标准SOP规范操作,才能保证实验的准确性和可重复性。新测序仪平台和技术的不断出现和改进,使得高通量测序无论通量、质量、速度和成本都在快速进步,高通量测序的应用范围也大大得到拓展,不久的将来有望以低成本随时随地的开展高通量测序应用。
谷禾健康
你敢相信吗?从粪便中提取出具有强烈粪臭味的物质,当用酒精稀释上千倍后,脱胎换骨变成了一种香味。这就是一种吲哚衍生物——3-甲基吲哚(又名粪臭素)
吲哚,是所有花香类原精的关键成分,这种物质在低剂量1-3%浓度时,具有放松的作用,协同苯基酯,能强效抗痉挛,增添感官愉悦和魅力。然而,如果简单将吲哚等同于香水,未免太少看它的功效。
在谷禾特定肠道菌群检测报告中炎症部分或毒素部分有吲哚这个指标。
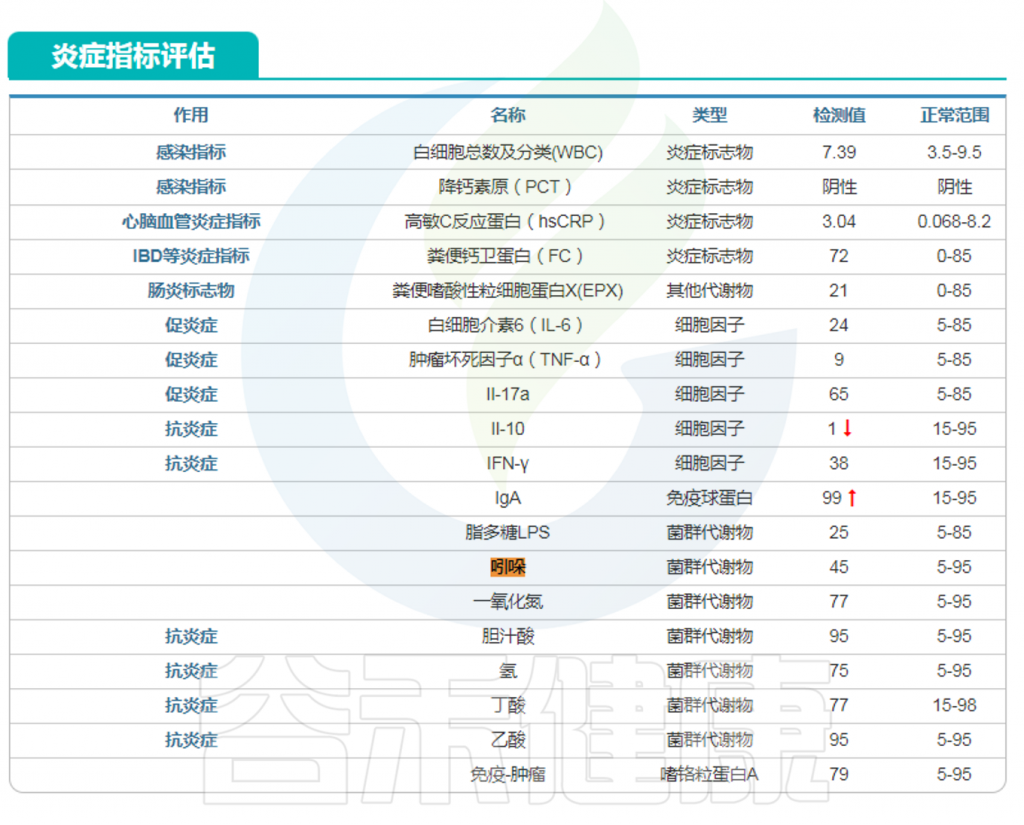
<来源:谷禾肠道菌群检测数据库>

<来源:谷禾肠道菌群检测数据库>
很多人可能对与菌群和健康相关的血清素,色氨酸,脂多糖,组胺等指标比较熟悉,但是对吲哚还是比较陌生,实际上吲哚与肠道微生物群和人类健康和生活关系密切,例如,吲哚衍生物可以影响胃肠道的蠕动,可能会影响便秘或腹泻等状况;吲哚及其衍生物已被证明可以加强肠道屏障功能,有助于防止病原体和有害物质进入血液。
事实上,由吲哚衍生而来的各种化学物质,对人体神经调节和抗病原微生物,有极为积极的作用。在人体中存在着许多这样神奇的吲哚类物质。内源性吲哚及其衍生物是源自肠道微生物群的色氨酸代谢物,具有一系列生物活性。
最近的研究表明,吲哚有助于维持人体肠道的生物屏障,主要通过激活AhR和PXR受体来发挥抗炎活性,从而影响免疫系统的功能,显著改善肠道健康(炎症性肠病、出血性结肠炎、癌症结直肠癌),并进一步促进人类健康(糖尿病、中枢系统炎症和血管调节)。
作为细胞间信号分子,吲哚还控制细菌生理学的各个方面,例如产吲哚细菌的孢子形成、质粒稳定性、耐药性、生物膜形成和毒力。相比之下,许多不产生吲哚的细菌、植物和动物产生多种加氧酶,可能会干扰吲哚信号传导。
吲哚还是身体神经系统与内分泌系统正常与否的风向标。所谓的体臭,其实就是人体内吲哚含量增高的表现。吲哚在细菌生理学、生态平衡以及人体健康中发挥着重要作用。
然而,吲哚的毒性影响也不容忽视。过量的吲哚会对情绪和行为产生不利影响,硫酸吲哚酚是一种吲哚衍生物,具有肾毒性和心血管毒性。羟吲哚还可能降低神经元兴奋性。
吲哚与肠道微生物群之间的相互作用以及吲哚对人类健康的影响是一把双刃剑。本文主要讲述了内源性吲哚的生物合成、吲哚对肠道功能及微生物群的影响,为吲哚与疾病的相关性提供了科学依据。
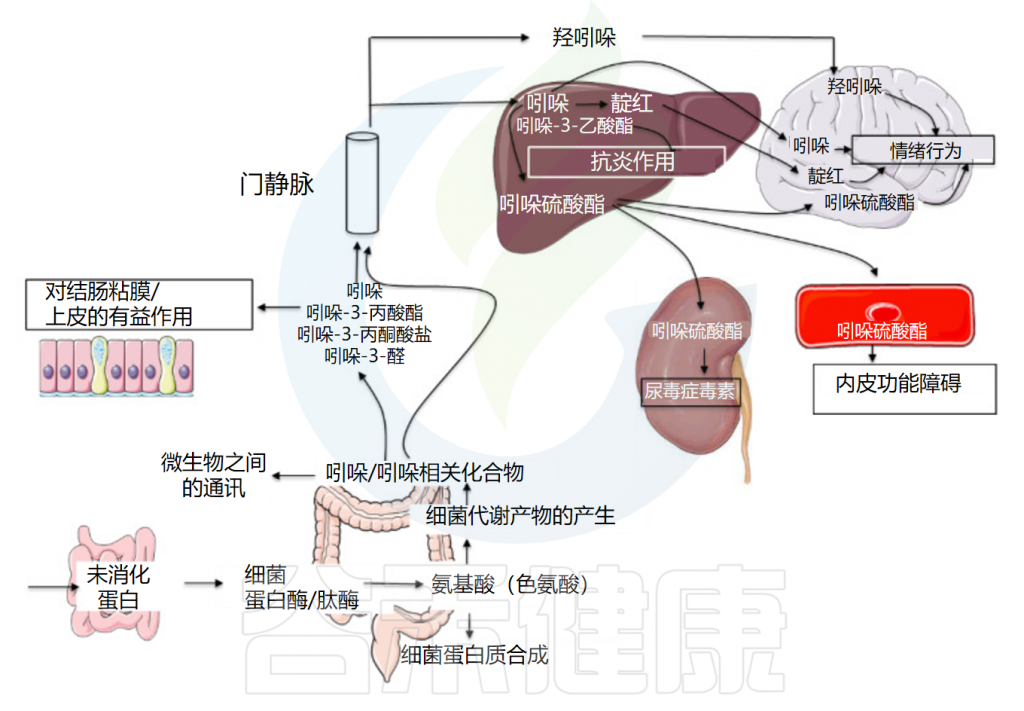
Tennoune N,et al., Microorganisms.2022
吲哚(Indole)是一种有机化合物,是吡咯与苯并联的化合物,又称苯并吡咯。吲哚及其同系物和衍生物广泛存在于自然界,主要存在于天然花油,如茉莉花、苦橙花、水仙花、香罗兰等。
而内源性吲哚及其衍生物是来源于肠道菌群的色氨酸代谢物,具有一系列生物活性。内源性吲哚类物质包括吲哚本身以及吲哚的代谢产物,如吲哚-3-甲酸、吲哚-3-丙酸、硫酸吲哚酚等。
吲哚相关化合物的结构
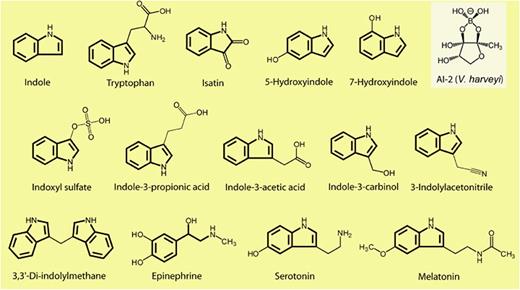
Lee JH, Lee J.FEMS Microbiol Rev.2010
肠道菌群产生吲哚类物质
细菌蛋白酶和肽酶从可用的膳食中释放氨基酸,包括色氨酸。而色氨酸是吲哚的主要前体。大部分色氨酸在小肠中被吸收,约4%~6%的色氨酸在结肠中被肠道菌群分解代谢为吲哚。
色氨酸作为一种必需氨基酸,主要从富含蛋白质的食物中获取,是唯一含有吲哚的氨基酸。
肠道中的色氨酸通过三个主要途径进行代谢:1) 犬尿氨酸途径(摄入的色氨酸的95%);2)细菌色氨酸代谢(4-6%);
3) 血清素途径 (1-2%)
✦ 肠道菌群主要通过色氨酸酶将色氨酸转化为吲哚
肠道细菌主要通过色氨酸酶(TnaA)的作用将色氨酸转化为吲哚;色氨酸酶TnaA可逆地将色氨酸降解为吲哚、丙酮酸和氨。
值得注意的是,在哺乳动物中,吲哚完全来源于细菌代谢活动,因为宿主细胞不具有产生这种化合物的代谢能力。
色氨酸也可以通过肠道微生物群直接或间接转化为几种吲哚相关化合物,包括吲哚-3-丙酮酸、吲哚-3-乳酸、吲哚-3-丙酸、吲哚-3-乙酰胺、吲哚-3-丙烯酸、吲哚乙醛、吲哚-3-乙酸、3-甲基吲哚(粪臭素)等。
✦ 内源性吲哚产生的机制
大肠杆菌(E. coli)是研究最广泛的吲哚合成生物体,它可以使用多种机制(抑制、转录衰减和反馈抑制)来调节色氨酸代谢中的色氨酸操纵子(Trp operon)和tna操纵子的表达。
在色氨酸缺乏的条件下, trp操纵子的表达升高,而由TnaC(24个氨基酸前导肽,以前称为TnaL)、TnaA(色氨酸酶)和TnaB(通透酶)组成的tna操纵子的表达受到抑制,因为转录终止因子(Rho)依赖性终止发生在tna操纵子中。
结果,当色氨酸水平较低时,TnaA和TnaB的表达以及吲哚的产生受到抑制。在富含色氨酸的条件下,转录终止因子依赖性转录终止被消除,因此吲哚产量增加。
因此,细胞外色氨酸和其他氨基酸直接影响吲哚的产生。
// 拓展:渗透酶通过转运也会影响吲哚水平
此外,三种渗透酶(Mtr、TnaB和AroP)在不同环境的色氨酸转运中发挥不同的作用,因此可以直接影响吲哚的水平。
Mtr通透酶主要负责转运吲哚,而TnaB通透酶对于色氨酸的摄取至关重要。尽管色氨酸的生产成本高昂,但细胞仍然利用色氨酸途径大量生产和分泌吲哚。
由色氨酸产生的吲哚可以通过细胞膜蛋白进行转运。例如,大肠杆菌和霍乱弧菌在丰富的培养基中可以分泌高达0.6 mM的吲哚。
在大肠杆菌中,外排蛋白AcrEF部分负责吲哚的输出,因为AcrEF突变体的吲哚排泄低于其野生型菌株。Mtr通透酶主要负责输入吲哚,因为吲哚不被mtr突变体吸收。
然而,最近有人提出,吲哚由于其疏水性,可能可以直接扩散通过细胞膜。因此,有必要清楚地了解吲哚的进出口情况。
大肠杆菌中吲哚生物合成和吲哚信号传导
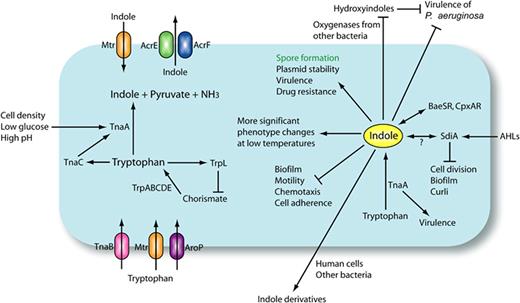
Lee JH, Lee J.FEMS Microbiol Rev.2010
人体粪便中吲哚的浓度较高,通常范围为0.25毫摩尔浓度~1.1毫摩尔浓度,但可能由于人群之间肠道微生物群组成的差异以及膳食蛋白质消耗水平不同而存在差异区别。
注:由于吲哚似乎是通过结肠上皮吸收的,结肠中吲哚的浓度可能高于粪便中记录的浓度,远端大肠的浓度高于近端部分的浓度。
尽管大多数生物体都含有色氨酸代谢途径,但只有能编码tnaA的细菌才能合成吲哚。表达色氨酸酶(tnaA)的细菌,例如大肠杆菌(E. coli)、梭菌属(Clostridium spp.)、拟杆菌属(Bacteroides spp.)和普通变形杆菌(Proteus Vulgaris),可催化色氨酸直接转化为吲哚。
✦ 梭状芽孢杆菌代谢产生吲哚-3-丙酸
已经证明吲哚-3-丙酸是由梭状芽孢杆菌(Clostridium sporogenes)产生的。粪臭素(3-甲基吲哚)是由梭菌属和拟杆菌属产生的。
此外,产孢梭菌(C. sporogene)可以将色氨酸转化为吲哚-3-丙酮酸(IPyA),并在吲哚-3-丙酮酸脱羧酶的催化下产生吲哚-3-乙醛(IAAld)。然后,IAAld 被厚壁菌门、变形菌门、拟杆菌门和放线菌门的成员脱羧,产生吲哚乙酸 (IAA)。
✦ 一些病原菌也可以产生吲哚
色氨酸代谢很复杂,许多菌株参与吲哚衍生物的制造。总的来说,数据支持迄今为止有至少85种细菌已被证明可以产生吲哚。
这些细菌包括许多病原菌,例如创伤弧菌、流感嗜血杆菌、多杀巴氏杆菌(pasteurella multocida)、四种志贺氏菌菌株、植物克雷伯菌(Klebsiella planticola)和普通变形杆菌。值得注意的是,一些革兰氏阳性菌株,包括B.alvei和粪肠球菌(E.faecalis)也产生吲哚。
✦ 一些拥有tnaA基因的细菌却无法产生吲哚
有趣的是,一些细菌,如杀鲑气单胞菌(Aeromonas salmonicida)、宋氏志贺氏菌(Shigella sonnei)、克氏耶尔森氏菌(Yersinia kristensenii)和Seudovibrio spp.,已经失去了合成吲哚的能力,尽管这些菌株的染色体上有一个tnaA基因同源物。
例如,与正常志贺氏菌菌株不同,一些在tna操纵子中具有点突变、插入或缺失的志贺氏菌不产生吲哚,这可能是由于某些适应性优势。虽然只是推测,但一些个体可能通过利用当地细菌群体的信号来避免产生吲哚的成本。
其他可以产生吲哚的细菌:
Alkaliphilus metalliredigens
Bacillus alvei
Clostridium novyi
Clostridium limosum
Clostridium tetani
Corynebacterium acnes
Desulfitobacterium hafniense
Nocardioidessp.
Oribacterium sinus
Propionibacterium acnes
Enterococcus faecalis
Symbiobacterium thermophilum
Aeromonas hydrophila
Aeromonas liquefaciens
Aeromonas punctata
Bacteroides thetaiotaomicron
Bacteroides sp.
Brachyspira hyodysenteriae
Burkholderiasp.
Chromobacterium violaceum
Chryseobacterium gleum
Citrobactersp.
Citrobacter intermedius
Citrobacter koseri
Desulfovibrio vulgaris
Edwardsiella tarda
Enterobacter liquefaciens
Escherichia coli
Escherichia fergusonii
Flavobacteria bacterium
Flavobacteriumsp.
Fusobacterium nucleatum
Fusobacterium polymorphum
Haemophilus influenzae
Haemophilus somnus
Haloarcula marismortui
Halogeometricum borinquense
Hyphomonas neptunium
Klebsiella ornithinolytica
Klebsiella planticola
Micrococcus aerogenes
Morganella morganii
Paracolobactrum coliforme
Pasturella multocida
Pasturella pneumotropica
Photobacterium harveyi
Porphyromonas asaccharolytica
Porphyromonas endodontalis
Porphyromonas gingivalis
Prevotella intermedia
Proteus inconstans
Proteus vulgaris
Providencia alcalifaciens
Providencia rettgeri
Providencia rustigianii
Providencia stuartii
Rhizobium leguminosarumbv.trifolii
Saccharomonospora viridis
Shigella boydii
Shigella dysenteriae
Shigella flexneri
Sphaerophorus varius
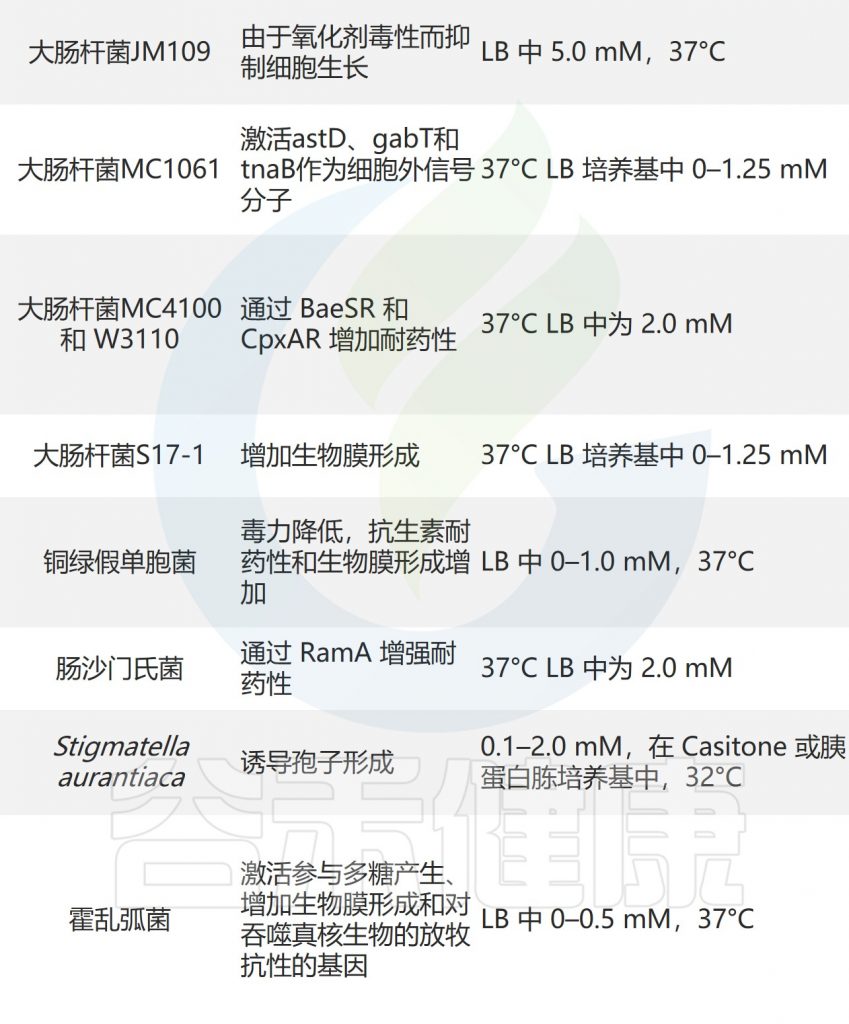
Stigmatella aurantiaca
Treponema denticola
Vibrio alginolyticus
Vibrio cholerae
Vibrio fluvialis
Vibrio harveyi
Vibrio hollisae
Vibrio mediterranei
Vibrio nigripulchritudo
Vibrio orientalis
Vibrio parahaemolyticus
Vibrio splendidus
Vibrio tapetis
Vibrio tubiashii
Yersinia frederiksenii
Yersinia intermedia
吲哚类物质的生成可能受到环境因素的严重影响,例如膳食成分、肠道微生物群、碳源、温度、pH值以及生理状态。
★ 肠道微生物群和饮食对吲哚生成有重要影响
吲哚类物质是肠道微生物群产生的膳食色氨酸的代谢产物。因此,肠道微生物组成以及饮食模式的变化会影响其产生。
研究发现吲哚-3-丙酸(IPA)与肠道微生物群的α多样性呈正相关,肠道微生物组的组成可以解释大约20%的IPA循环水平的变化。
高纤维和富含多酚的饮食可以提高吲哚含量
多项研究发现,吲哚-3-丙酸的循环水平与纤维摄入量相关,这可能是通过肠道微生物群的变化来解释的。
此外,富含多酚的饮食会导致肾功能正常受试者的血清IPA显著增加,但肾功能受损的受试者不会显著增加。与此相一致的是,饲喂菊粉60天的猪的盲肠和结肠中微生物组组成的β多样性显著增加,同时IPA含量也显著增加。
地中海饮食会导致吲哚-3-丙酸水平升高
不同的饮食结构也会改变吲哚的水平。例如,地中海饮食仅治疗4天后就导致吲哚-3-丙酸水平升高,而快餐(即薯条和汉堡)则引起相反的结果。
此外,正常饮食喂养的同窝小鼠的血浆IPA水平显著高于生酮饮食喂养的小鼠。一项针对117名超重成年人的研究发现,摄入炸肉会降低肠道微生物群落的丰富度,并导致IPA浓度下降。
发酵食品可能会降低吲哚含量
通过对14名健康男性进行随机交叉研究设计,探讨了发酵乳制品对人类血清代谢组的影响。与牛奶组相比,酸奶摄入组餐后血中吲哚-3-丙酸和吲哚乙酸浓度较低。
同样,C反应蛋白水平轻度升高的健康超重男性在接受抗炎膳食混合物后,饮用500mL餐后奶昔(由300mL蛋奶冻、150mL奶油干酪和50mL鲜奶油组成)。受试者在后期表现出吲哚-3-丙酸血浆浓度降低。
总之,我们推测不同的饮食结构会改变肠道微生物的组成,从而导致吲哚类物质产生的个体差异。
• 细胞群体密度影响吲哚分泌
细胞外吲哚浓度取决于细胞群体密度,其中大肠杆菌和霍乱弧菌在指数早期开始产生吲哚。浓度在固定相中达到最高水平(在富集培养基中高达0.6mM吲哚),并在固定相期间稳定维持。
• 碳源影响吲哚产量
其次,有报道称葡萄糖抑制吲哚生物合成。TnaA的分解代谢抑制得到证实,因为tnaA基因的转录在碳限制期间受到抑制。
此外,tnaAB操纵子被大肠杆菌中的分解代谢调节蛋白环AMP复合物激活。因此,当大肠杆菌数量较多且碳源减少时,会产生相对大量的吲哚。
• 温度和pH影响吲哚生物合成
温度和pH也是影响大肠杆菌吲哚生物合成的重要环境因素。温度从30°C转变到43°C会诱导大肠杆菌中tnaAB基因的表达,但大肠杆菌在44.5°C时失去吲哚生物合成的能力。
注:与37°C相比,吲哚信号传导在较低温度(30°C)下对大肠杆菌基因表达、生物膜形成和抗生素耐药性的控制作用更为显著。
此外,低pH值会抑制大肠杆菌中吲哚的产生,而TnaA是pH9.0时最容易诱导的蛋白质之一。
• 生理状态影响吲哚生成
例如年龄、性别以及个体的生理状态都可能影响内源性吲哚的产生。睡眠模式、压力水平和运动习惯等生活方式因素都可能对内源性吲哚的产生产生影响。
此外,特定的健康状况和疾病,如肠道炎症、肝脏疾病等,可能会改变内源性吲哚的生成或代谢。
• 药物的使用也会影响吲哚生成
一些药物可能影响吲哚类物质的生成。例如,一些抗生素和非甾体抗炎药物被发现可以改变肠道微生物群的组成和功能,从而影响吲哚类物质的生成。
此外,一些药物可能直接干扰色氨酸代谢途径,从而影响吲哚类物质的生成。
小结
因此,细胞群密度、碳源、温度和pH等环境条件直接会影响吲哚的浓度;而饮食、药物的使用以及生活方式可能通过影响肠道微生物群或其他器官间接影响吲哚的生成。
肠道屏障的功能与肠道健康密切相关,在健康中发挥着至关重要的作用。肠道屏障将宿主与肠腔中的微生物隔离,并限制微生物和分子从肠腔的运动。
一旦肠道屏障受损,肠道通透性增加,细菌及其产物(如内毒素)将跨膜并激活单核巨噬细胞系统,促进大量炎症因子的产生,如白细胞介素6和肿瘤坏死因子-α(TNF-α),导致慢性微炎症状态。
吲哚对于控制肠道屏障功效至关重要,包括调节炎症和免疫反应、影响上皮通透性、粘液产生和紧密连接(TJ)形成。
▼
✦ 吲哚减轻非甾体抗炎药引起的肠道炎症
研究了使用吲哚作为非甾体抗炎药肠病的治疗方法。吲哚降低粪便钙卫蛋白浓度以及吲哚美辛诱导的脾和肠系膜淋巴结中中性粒细胞的浸润。
吲哚与吲哚美辛联合使用可减少非甾体抗炎诱导的粘膜转录组变化。粪便钙卫蛋白是肠道炎症的中性粒细胞特异性生物标志物。而中性粒细胞被认为是非甾体抗炎肠病发病的关键因素,可通过释放多种炎症介质引起炎症和组织损伤。
这就说明吲哚能够减轻吲哚美辛引起的小鼠肠道炎症,对非甾体抗炎药肠病具有潜在的免疫调节作用。
此外还发现吲哚减少促炎细胞因子IL-8的产生和趋化因子TNF-α激活的核因子κB(NF-κB)的表达,并诱导抗炎细胞因子IL-10的分泌。
研究表明,共生菌可以限制鼠伤寒沙门氏菌诱导的NF-κB激活,减轻小鼠炎症。因此,吲哚可能是益生菌减少肠道炎症的信号。
✦ 细菌产生的吲哚衍生物增强免疫屏障
吲哚乙酸
卵形拟杆菌(Bacteroides ovatus)产生的吲哚乙酸(IAA)增加了CD103+ /CD11c+免疫群体的丰度,而 CD103+ /CD11c+免疫细胞对于维持肠道免疫稳态和诱导耐受性免疫反应至关重要。
此外,吲哚乙酸与树突状细胞上的芳基氢受体结合并驱动IL-22的产生。在炎症性肠病个体中,IL-22 刺激上皮再生并减少炎症,并且在肠道炎症的调节中发挥关键作用。
注:除卵形拟杆菌外,其他拟杆菌产生的吲哚也可以激活免疫细胞上的AhR,从而产生IL-22。
在脂多糖存在的情况下,肠上皮细胞中表达的Reg4通过增加乳酸菌及其代谢物吲哚乙酸的比例来维持免疫稳态,从而促进肠组织中IL-35 +B调节细胞的产生和积累。这些结果表明吲哚乙酸可以调节IL-35 的产生,并影响肠道免疫屏障。
吲哚-3-乳酸
罗伊氏乳杆菌(Lactobacillus reuteri)产生吲哚-3-乳酸(ILA),ILA是Trp的吲哚衍生物,可激活CD4+ T细胞中的AhR并下调转录因子ThpoK,使CD4 + T细胞分化为具有免疫调节功能的CD4+ CD8αα +双阳性上皮内T淋巴细胞(DPIELs)。通过这些机制,吲哚-3-乳酸可以促进肠道屏障功能并减少炎症。
生活在母乳喂养婴儿胃肠道中的婴儿长双歧杆菌亚种也可产生吲哚-3-乳酸,从而显著减弱TNF-α和脂多糖诱导的肠上皮细胞中促炎细胞因子IL-8的增加。吲哚-3-乳酸还增加AhR靶基因CYP1A1和NRF2靶向基因谷胱甘肽还原酶2、超氧化物歧化酶2和NAD(P) H脱氢酶的 mRNA 表达,这可能是母乳喂养婴儿肠道炎症的重要调节剂。
此外,另一项研究表明,婴儿双歧杆菌分泌的吲哚-3-乳酸对未成熟肠道具有抗炎作用。这些数据为生产吲哚-3-乳酸益生菌的生产和饮食建议提供了重要的见解。
吲哚-3-丙酸
吲哚-3-丙酸(IPA)下调肠上皮细胞介导的炎症细胞因子TNF-α,同时上调配体蛋白编码mRNA,从而调节肠道屏障功能,缓解肠道炎症。
吲哚-3-丙酸还通过激活AhR显著诱导肠上皮细胞上的IL-10受体配体结合亚基(IL-10R1)来调节肠道免疫稳态。
IL-10R1是抗炎细胞因子IL-10的受体,IL-10通过IL-10R1发送抗炎信号,抑制多种细胞(包括肠上皮细胞)过度释放促炎介质。这进一步说明了吲哚-3-丙酸对肠道免疫屏障的保护作用。
吲哚-3-醛
乳杆菌(Lactobacillus)产生的吲哚-3-醛(IAld)有助于AhR依赖性IL22转录,IL-22产生者抑制炎症并保护粘膜表面的免疫生理学。吲哚-3-醛可以替代益生菌,在感染或化学损伤期间保护和维持粘膜完整性。
吲哚-3-醛可用作菌群处理和肠道菌群失调期间的支持疗法。乳酸菌还通过IAld诱导的AhR刺激LPL分泌IL-22,从而激活pSTAT3通路并抑制IL-1β和TNF-α分泌,以保护粘膜免疫屏障.
吲哚对肠道免疫的影响

Ye X,et al.Front Immunol.2022
服用非甾体抗炎药时,肠道微生物组以革兰氏阴性菌为主,这种转变会导致肠道损伤。吲哚和吲哚美辛的共同给药可以维持甚至增加厚壁菌门的重要成员,特别是对肠道稳态至关重要的C. cluster XIVa和C. cluster IV。似乎它可以防止拟杆菌的任何增加,这种变化可以减少肠粘膜损伤。
吲哚可通过增殖MUC基因的表达来增加HCT-8细胞对去甲肾上腺素介导的肠出血性大肠杆菌(EHEC)沉降的抵抗力。
吲哚-3-醛(IAld)激活AhR以产生IL-22,IL-22调节粘膜反应,使混合微生物群落存活并抑制白色念珠菌(Candida albicans)定植
✦ 减轻克雷伯菌属的细胞毒性
吲哚调节多种肠道细菌的毒力因子。吲哚增强替利霉素向替利伐林的转化。两者均由克雷伯菌属(Klebsiella spp.)产生,不同之处在于替利伐林是一种细胞毒性降低的吲哚类似物,并且替利伐林与上调孕酮X受体(PXR)反应性解毒基因结合并抑制微管蛋白定向毒性。因此,吲哚以多种方式减轻克雷伯菌属的细胞毒性。
✦ 调节霍乱弧菌和大肠杆菌的毒力基因表达
肠道益生菌代谢产生的吲哚在肠腔内浓度较高,减少了肠道大肠杆菌和啮齿类柠檬酸杆菌(Citrobacter rodentium)致病基因的表达。
吲哚还用作ToxR激动剂,调节肠道内霍乱弧菌(Vibrio cholerae)的毒力基因表达和生物膜产生。吲哚、吲哚甲酸和吲哚乙酸还可下调致病性大肠杆菌菌株的毒力和志贺氏毒素的产生。
此外,吲哚和7-羟基吲哚显著改变铜绿假单胞菌(Pseudomonas aeruginosa)的毒力基因表达,从而降低毒力因子并降低集群运动性。
铜绿假单胞菌用7-羟基吲哚治疗后,胃肠道中有更好的清除率。因此,吲哚可能有助于作为针对肠出血性大肠杆菌等病原体的治疗剂。
✦ 增强肠道机械屏障
吲哚通过诱导许多涉及内皮细胞的基因的表达,包括紧密连接、粘附分子连接(AJ)、肌动蛋白细胞骨架和黏蛋白形成,在体外增强内皮细胞的屏障功能。
将人肠上皮细胞系HCT-8暴露于吲哚以测量其基因表达的变化。结果显示,高剂量的吲哚增强了肠上皮细胞HCT-8中与黏蛋白产生、粘膜屏障增强和上皮间抵抗相关的分子谱。因此,吲哚加强了机械屏障。
✦ 增强肠道粘液屏障
吲哚-3-丙酸通过增加MUC2和MUC4以及杯状细胞分泌产物(TFF3和RELMβ)来增强粘液屏障功能。
吲哚-3-丙酸还促进IL-10释放,IL-10的信号转导增强粘液屏障功能并维持上皮细胞的稳态。
细菌中的吲哚-3-丙烯酸(IA)可增强IL-10的产生和MUC基因的表达,而IL-10对于维持杯状细胞中MUC的产生至关重要。因此,吲哚-3-丙烯酸通过 IL-10间接影响粘液屏障。
吲哚通过AhR或PXR调节肠道屏障
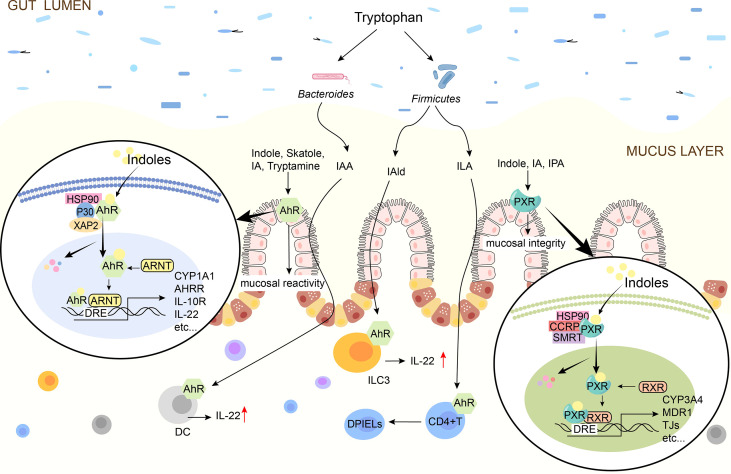
Ye X,et al.Front Immunol.2022
研究发现吲哚在细菌中发挥多种生物学作用,包括孢子形成、耐药性、毒力因子、质粒稳定性和生物膜形成等。
吲哚可以作为细菌间的信号分子
事实上,吲哚可以作为一种细菌信号,参与同一物种内以及不同物种之间的通讯。它在细菌生态系统中充当细胞间和细胞内信号。
注:吲哚还诱导了S. aurantiaca的孢子形成。
通过遗传筛选,在大肠杆菌中研究了吲哚作为细胞外信号分子的可能。结果,四个基因(astD、cysK、gabT和tnaB)被证明在稳定期通过自身产生的细胞外信号的积累而被激活。
在后续研究中,吲哚被证实是astD、gabT和tnaB激活所需的细胞外信号分子。
吲哚作为细胞间信号分子存在哪些争议?
吲哚是否是细胞间信号分子一直存在争议。已经提出了对群体感应信号分子要求的许多标准,如下所示:
1.假定的信号必须在特定阶段产生,吲哚主要在固定相中产生。
2.假定的信号必须在细胞外积累并被特定受体识别。吲哚的化学性质是众所周知的,并且在大多数吲哚调节情况下,化学互补被证明,其中吲哚在稳定期积累并且是已知的细胞外信号。该受体由AcrEF输出并由Mtr输入。
3.假定的信号必须累积并产生一致的响应,吲哚已被证明可以控制孢子和生物膜的形成。
4.重要的是,假定的信号必须引起超出信号代谢或解毒所需的生理变化的反应。吲哚已被证明可以控制毒力、生物膜和质粒稳定性,这些与吲哚无关代谢。
因此,根据这些标准,吲哚有可能成为群体感应分子。
由于上述四个标准仅适合规范的群体感应信号,例如AHL,Monds&O’Toole又添加了两个更普遍适用且具有实用价值的标准:
1.表型变化所需的生理相关信号浓度对细胞无毒。大肠杆菌和霍乱弧菌产生高达0.6mM的吲哚,对细胞无毒,并在该生理浓度下控制许多表型。
2.信号网络在社区层面是自适应的。尽管由于进化实验的困难而难以证明,但我们假设细胞间信号吲哚可能对微生物群落有益,尽管吲哚的生产对个体来说成本高昂。
例如,吲哚在产生吲哚的细菌大肠杆菌和霍乱弧菌中增加了质粒稳定性、耐药性。相反,在不产生吲哚的细菌中,吲哚通过干扰群体感应系统,降低了真菌的细胞生长和铜绿假单胞菌的毒力。因此,我们推测产生吲哚的细菌可能利用吲哚来对抗其他细菌和真核生物。
吲哚和tnaA基因也影响病原菌的毒力。色氨酸酶活性与致病性大肠杆菌有关,因为色氨酸酶活性是LEE1启动子完全激活所必需的。
吲哚会增加肠出血性大肠杆菌中毒力相关的EspA和EspB蛋白(LEE4基因产物)的分泌以及附着和消除病变的形成。
在霍乱弧菌中,吲哚和tnaA基因可能通过诱导毒力相关的分泌蛋白来增加对盘基网柄菌(Dictyostelium discoideum)的抗性。
此外,在流感嗜血杆菌分离株中,大多数血清型 (94-100%)呈吲哚阳性,而无害分离株中只有70-75%呈吲哚阳性。结果表明,吲哚的产生是必要的,但不足以对该菌株产生毒力。
值得注意的是,吲哚通过抑制毒素的产生来减轻克雷伯菌属(Klebsiella spp)的细胞毒性,还通过降低细胞运动性和聚集性来减少李斯特菌(L. monocytogenes)的相关毒力。
吲哚还通过改变基因表达来减少铜绿假单胞菌(不产生吲哚的细菌)中毒力因子的产生。
吲哚降低毒力基因的表达
Kumar A,et al.mBio.2019
研究表明,吲哚通过在大肠杆菌中诱导输出基因(mdtEF和acrD)来增加耐药性,其中吲哚通过双组分信号转导系统(BaeSR和CpxAR)发挥作用。
这些双组分信号系统可以用作吲哚传感器。该结果证实了另一项研究,其中吲哚通过BaeSR和CpxAR诱导spy(球形体蛋白Y)基因的表达。
此外,有人认为GadX(AraC型转录因子)、Hfq(sRNA功能的全局调节因子)和RpoS(应激和固定相西格玛S)对吲哚诱导的mdtEF表达是必需的。因此,吲哚可能与多种调节因子相互作用。
增强大肠杆菌的质粒稳定性
吲哚增强大肠杆菌中的质粒稳定性。研究表明,来自大肠杆菌质粒ColE1的小非编码RNA与TnaA结合,有助于防止质粒丢失,而吲哚则延迟细胞分裂。
大肠杆菌中的吲哚还通过抑制gadABCEX、hdeABD和ymgB等耐酸基因来降低耐酸性。大肠杆菌可能会在弱碱性肠道菌群中存在吲哚的情况下关闭耐酸性基因,因为在通过酸性胃存活后不再需要耐酸性蛋白。
降低了运动性
此外,吲哚是一种化学排斥剂,会降低运动性,可能是由于细胞分裂干扰,而肾上腺素和去甲肾上腺素是一种化学引诱剂,会增加大肠杆菌O157: H7的运动性。
此外,吲哚降低细胞对上皮细胞的粘附,而肾上腺素和去甲肾上腺素增加细胞粘附。由于细菌粘附和定植到上皮细胞对于感染很重要,因此假设这也会对细菌毒力产生不同的影响。
吲哚对其他微生物的影响如下所示:

Lee JH, Lee J.FEMS Microbiol Rev.2010
吲哚类物质被肠上皮细胞吸收并扩散到血液中,从而循环到全身并影响各个系统,例如肠道及相关疾病的调节。
谷禾在这里总结了它们对炎症性肠病、出血性结肠炎、结直肠癌、糖尿病、中枢神经系统炎症和血管调节的影响。
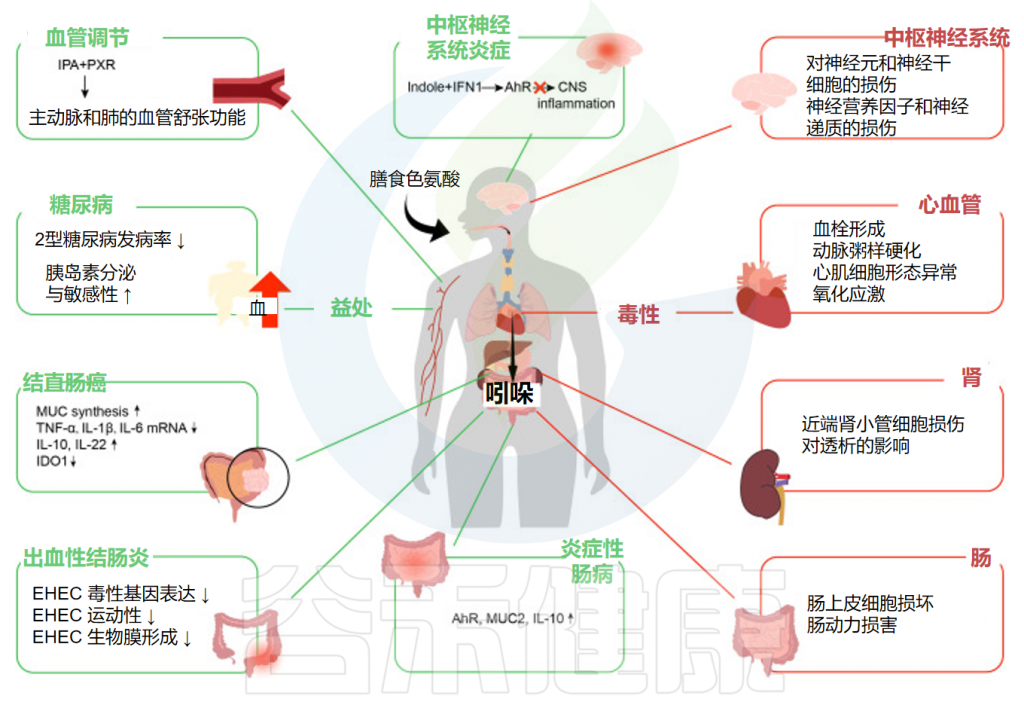
Ye X,et al.Front Immunol.2022
炎症性肠病是克罗恩病、溃疡性结肠炎等一组疾病的总称,是临床上重要的慢性胃肠道炎症性疾病。大量研究表明,吲哚对缓解炎症性肠病症状有一定的作用。
✦ 吲哚类物质增加了抗炎细胞因子
炎症性肠病与粘液层有关,炎症性肠病患者的内部粘液层较薄,MUC2糖基化较低。结果表明,吲哚-3-丙烯酸甲酯(IA)处理小鼠结肠球体可显著增加AhR激活和MUC2基因表达。
即使在脂多糖刺激的共培养物存在下,IA仍能保持其对MUC2基因表达的影响并增加IL-10的产生。杯状细胞产生MUC依赖于IL-10。因此,细菌产生的 IA 有可能增加IL-10的产生和MUC基因的表达,这可能对炎症性肠病患者有利。
吲哚对于肠出血性大肠杆菌的发病机制至关重要。出血性结肠炎是一种出血性腹泻,可导致溶血性尿毒症综合征,由人类病原体大肠杆菌O157:H7引起。
✦ 吲哚减少了肠出血性大肠杆菌的定值
根据表面相关EHEC的DNA微阵列研究,吲哚降低了EHEC中与表面定植和致病性有关的基因表达。
吲哚可以被加氧酶氧化,产生新的种间生物膜信号,从而以多种方式影响相同的表型(生物膜产生)。大肠杆菌K-12和肠道内其他共生菌产生的吲哚可能会限制大肠杆菌K-12生物膜的产生,并通过改变SdiA的表达来降低非致病性大肠杆菌的运动性,从而影响EHEC趋化性和粘附力。粘附测定证实,吲哚可在体外减少EHEC与上皮细胞的附着。
总之,吲哚通过改变肠出血性大肠杆菌毒性基因的表达、减少其运动性和生物膜形成以及减少粘附来减轻肠出血性大肠杆菌感染并改善出血性结肠炎。
根据越来越多的数据,肠道吲哚,特别是色氨酸代谢物,似乎在结直肠癌中发挥着重要作用。吲哚刺激AhR,它可以直接作用于肠道干细胞,维持MUC合成并改善肠道屏障功能。
然而,在炎症相关结直肠癌发生模型中,阻断吲哚-AhR信号通路会显著增加TNF-α、IL-1β和IL-6 mRNA水平。
此外,吲哚衍生物色胺会抑制吲哚胺2,3-双加氧酶(IDO1),该酶参与肿瘤免疫耐受。这些发现表明肠道菌群产生的吲哚可能会减缓结直肠癌的进展。
与健康个体相比,结直肠癌患者的吲哚/色氨酸比率较低,犬尿氨酸(kyn)/色氨酸比率较高。在结直肠癌患者中,犬尿氨酸和IDO1的表达增加,吲哚的产生减少。
吲哚产生的下降削弱了对结肠癌的抑制作用。总体而言,有证据表明微生物色氨酸-吲哚代谢途径的改变在结直肠癌的发病机制中发挥着重要作用。
较高的吲哚-3-丙酸血清浓度可降低患2型糖尿病的可能性,并增强胰岛素分泌和敏感性。
研究发现,与喂食对照饮食的大鼠相比,喂食吲哚-3-丙酸饮食的大鼠的空腹血糖水平显著降低。根据其他研究,吲哚可以调节小鼠结肠成纤维细胞释放胰高血糖素样肽-1(GLP-1)。
✦ 吲哚调节胰高血糖素样肽-1的释放
吲哚在短时间内增加GLP-1的释放,在较长时间内减少其分泌。这些作用结果的产生是因为吲哚可以影响L细胞的两个关键化学途径。
在某种程度上,吲哚可以抑制电压门控K+通道,增加L细胞诱导的动作电位持续时间,并导致Ca2+进入大量增加,从而快速促进GLP-1的分泌。吲哚抑制了NADH脱氢酶,随着时间的推移减缓ATP的生成并降低GLP-1的释放。
Chimerel C,et al.Cell Rep.2014
肠道内的吲哚可能还会影响食欲,同时,吲哚-3-丙酸具有强大的抵抗氧化应激的能力,这表明这种代谢物可以保护β细胞免受代谢和氧化应激相关的损伤以及淀粉样蛋白积累。因此,肠道微生物群代谢产生的吲哚-3-丙酸对2型糖尿病具有保护作用。
体外实验发现,吲哚丙酸也是嗜肺军团菌(Legionella pneumophila)生长的强效抑制剂,且抑菌效果随着吲哚丙酸浓度和暴露时间的增加而增强。因此,吲哚丙酸可以抑制细菌引起的肺部炎症。
HIV阳性患者通常更容易感染结核病,这是死亡率增加的重要因素,两种疾病的共同感染可能会因抗逆转录病毒药物和抗结核药物之间的相互作用而使治疗复杂化。
值得注意的是,吲哚丙酸可能是此类治疗中潜在的药物成分。有研究发现,接受抗逆转录病毒治疗的HIV患者体内吲哚丙酸含量显著下降,这是区分HIV感染者与健康人的重要标志物。
这种作用的机制尚不清楚,但部分原因是肠道屏障受损导致脂多糖和脂多糖结合蛋白易位,从而加剧全身炎症反应。此外,接受抗逆转录病毒治疗的HIV患者也容易出现非酒精性脂肪性肝病/非酒精性脂肪性肝炎,进一步说明了吲哚丙酸在各种疾病中的多种治疗潜力。
相比之下,吲哚丙酸是一种小分子代谢产物,具有良好的药代动力学特性,很容易被宿主吸收,充分发挥治疗作用。
未来,吲哚丙酸有望通过其作为抗结核病和抗逆转录病毒药物的补充的潜力来改善某些疾病的现有治疗选择。
吲哚丙酸可以触发孕烷X受体(PXR),一种生物量激活的核受体,存在于包括血管内皮在内的各种组织中,以调节内皮功能。
吲哚丙酸通过PXR调节主动脉和肺动脉导管中激动剂诱导的内皮依赖性松弛。这种调节主要是由于内皮一氧化氮合酶产生的一氧化氮的改变,而内皮一氧化氮合酶受到吲哚丙酸介导的PXR激活的抑制。
然而,破坏肠道微生物群并降低吲哚丙酸丰度的抗生素治疗会通过改变内皮PXR途径来改变吲哚丙酸的血管舒张作用。
而微生物代谢的吲哚丙酸补充可以提高全身吲哚丙酸水平并刺激PXR表达,从而逆转抗生素治疗引起的主动脉和肺动脉中激动剂诱导的内皮依赖性血管舒张的增强。
注:吲哚与血管的相互作用可能会显著改变传统传染病或结肠手术相关的抗生素治疗,导致微生物群落紊乱。
尽管吲哚对于改善肠道甚至全身疾病至关重要,但它们中的一些仍然会产生负面影响,例如硫酸吲哚酚(IS)、吲哚基-β-d-葡萄糖苷和吲哚乙酸。
硫酸吲哚酚是最重要的肾毒性代谢产物之一,其肾毒性已在临床研究中得到广泛证实。此外,一些吲哚类物质还会对胃肠系统、神经系统和心血管系统产生毒性。
越来越多的证据表明吲哚和吲哚化合物对大脑代谢、生理和宿主行为有影响。在拥有产生吲哚的大肠杆菌的大鼠中,吲哚的慢性过量产生已被证明会增强焦虑样行为和抑郁。
另一项研究还发现,给予常规大鼠肠道内吲哚可以激活一个称为迷走神经背侧复合体的大脑核。通过比较与非吲哚产生大肠杆菌菌株或吲哚产生大肠菌菌株单体相关的小鼠,发现肠道微生物群的长期高吲哚产生增加了慢性压力对整体情绪行为不利影响的敏感性。
✦ 可能影响儿童自闭症的发病率
在人类中,一项研究发现,患有自闭症谱系障碍的儿童在大便样本中吲哚水平较健康儿童低,而3-甲基吲哚水平升高。 这两种吲哚与患者中更常见的梭菌属细菌有关。
肠道微生物代谢活性产生的血浆吲哚升高与肝性脑病有关,这是由肝功能障碍引起的神经精神障碍,以及个体意识、行为和个性的变化。
此外,NutriNet-Santé观察性前瞻性研究的结果表明,尿液中吲哚和吲哚化合物浓度与反复发作的抑郁症状呈正相关。这种相关性提出了这样一个假设:肠道微生物过度产生这些化合物可能在人类情绪障碍的出现中起到作用。
硫酸吲哚酚由肠道菌群和宿主共同代谢。肠道菌群用酶分解食物中的色氨酸生成吲哚,然后由门静脉携带至肝脏,在细胞色素P450酶和磺基转移酶的作用下转化为硫酸吲哚酚。
硫酸吲哚酚通过上调IRF1表达、抑制动力相关蛋白1表达并干扰线粒体自噬通量来诱导肠上皮细胞(IEC)损伤。硫酸吲哚酚通过以浓度依赖的方式增加活性氧的释放,在IEC-6细胞中引起氧化应激。
硫酸吲哚酚还抑制NRF2激活,降低抗氧化防御细胞系统并抑制血红素加氧酶-1、NAD(P)H 脱氢酶和超氧化物歧化酶的表达。
在IEC-6细胞中,硫酸吲哚酚处理可显著增加TNF-α的释放、环氧合酶-2和诱导型一氧化氮合酶的产生以及硝基酪氨酸的合成,表明肠上皮细胞是硫酸吲哚酚诱导的肠道炎症的靶点。
与硫酸吲哚酚一起培养的结肠显示出收缩性降低,这表明该毒素可能对结肠平滑肌细胞产生有害影响并导致肠道蠕动受损。
微生物群代谢物硫酸吲哚酚在中枢神经系统疾病的发生中也具有致病作用。众所周知,慢性肾病和心血管疾病常常是由硫酸吲哚酚引起的。此外,肾功能不全会导致尿毒症毒素在大脑中积聚,导致中枢神经系统功能异常。
✦ 损伤神经元和神经干细胞
其次,硫酸吲哚酚可损伤神经元和神经干细胞,损害神经营养因子和神经递质,诱发氧化应激和神经炎症。例如,通过作用于中枢神经系统胶质细胞,硫酸吲哚酚促进神经炎症并表现出促炎作用。
小鼠表现出情绪障碍和神经元退化的行为证据,如焦虑、抑郁和认知功能障碍。这些相应的器质性病变伴随着这些行为变化。这也表明硫酸吲哚酚和中枢神经系统疾病之间似乎存在病理联系。
吲哚对神经和神经精神疾病的影响
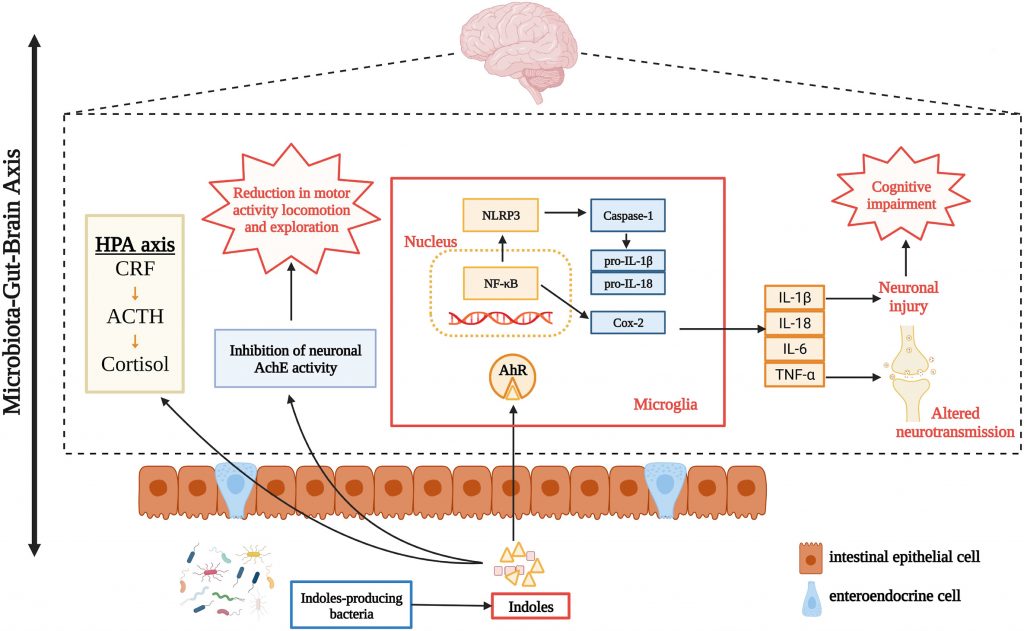
编辑
Zhou Y,et al.Neuropharmacology.2023
硫酸吲哚酚对大脑产生有益或有害的影响取决于含量:
通过比较患有抑郁症的志愿者和健康参与者,鉴定出了22种尿液代谢物,并且两组受试者之间的丰度存在差异。患有严重抑郁症的个体尿液中硫酸吲哚酚浓度低于健康人。在志愿者中,血清硫酸吲哚酚浓度与精神焦虑和相关的基于功能磁共振成像的神经特征有关。
在实验性自身免疫性脑脊髓炎的小鼠模型中,每日腹腔注射硫酸吲哚酚(10mg/kg)可调节星形胶质细胞活性,并通过芳基烃受体对中枢神经系统发挥抗炎作用。相反,当大鼠口服较高剂量(100和200mg/kg)的硫酸吲哚酚时,观察到空间记忆受损以及运动和探索活动减少。
另一项研究发现,单次腹腔注射更大剂量(800mg/kg)的硫酸吲哚酚会引起与神经元坏死相一致的大脑组织学变化。硫酸吲哚酚在15-60微摩尔范围内使用时,会诱导原代星形胶质细胞产生自由基氧,并导致海马神经元细胞死亡。在10微摩尔浓度下,硫酸吲哚酚通过氧化应激诱导人星形胶质细胞凋亡。
在慢性肾病(CKD)患者中,硫酸吲哚酚与心血管健康和全因死亡率相关。硫酸吲哚酚是血液透析患者发生心血管疾病的重要因素。在血液透析中,发现游离形式硫酸吲哚酚水平与成纤维细胞生长因子23呈正相关,与C-C基序趋化因子15、补体成分C1q受体、串珠素(Perlecan)、博来霉素水解酶、分化簇166抗原和信号淋巴细胞活化分子家族成员5呈负相关。
这些蛋白质在血管修复和内皮生长中发挥着至关重要的作用。硫酸吲哚酚还可以通过增加血小板过度活跃、提高血浆促凝血水平和产生促凝血颗粒来导致血栓形成和动脉粥样硬化。硫酸吲哚酚通过增加炎症、心脏纤维化、心肌细胞增殖来影响心脏组织。
并且强有力的证据表明,硫酸吲哚酚在肾功能不全的情况下积累时是有害的。硫酸吲哚酚会损害近端肾小管细胞并诱导炎症和纤维化发展。肾脏通过肾小管分泌实现硫酸吲哚酚的高清除率,而硫酸吲哚酚与血浆蛋白结合超过90%,受到蛋白结合的限制,并且血液透析患者的血浆水平相对较高,这也表明与肾脏疾病密切相关。
啮齿动物口服新霉素(一种广谱抗生素)会降低脑内羟吲哚含量,因此表明羟吲哚至少部分源自肠道微生物群代谢活动。
有趣的是,最近在人类粪便样本中发现了羟吲哚,从而证实肠道微生物是这种代谢物的来源。在人类粪便中存在的细菌代谢物中,羟吲哚被发现是主要的芳基烃受体激活剂之一。
大鼠海马切片的体外实验表明,羟吲哚可能与电压门控钠通道相互作用,增加产生动作电位的阈值,从而大大降低神经元的兴奋性。
大胆推测
这些结果说明羟吲哚可能与已知的神经抑制化合物具有一些共同特征,从而能够降低神经元的兴奋性
吲哚及其衍生物可以影响肠道健康甚至是全身其他器官的健康,而过高或过低的水平都可能带来不利影响,导致一些疾病的发生。
调节人体内吲哚水平的机制主要有3种:首先,它可以通过调节与吲哚产生相关的肠道微生物群的丰度来影响吲哚的水平。
先前的研究发现,特定的肠道微生物群成员在色氨酸转化为吲哚的过程中发挥着不可或缺的作用,例如产孢梭菌(Clostridium sporogenes),它已被证明可以通过氧化和还原途径产生吲哚乙酸和吲哚-3-丙酸。在大肠杆菌中也发现了吲哚活性转运蛋白,在乳杆菌中也发现了色氨酸酶的表达,并有助于将色氨酸转化为吲哚。
其次,饮食调整可以增加或减少色氨酸的摄入量,从而间接影响体内的吲哚水平。
最后,直接作用于AHR受体激动剂的药物可能会发挥与吲哚类似的作用。
益生菌可以通过多种机制与体内微生物群相互作用,对宿主健康产生有益影响。
临床试验表明,益生菌可以抵消肠道微生物失衡造成的负面影响,并可导致吲哚产生属及其衍生物的富集,如乳杆菌(Lactobacillus)。在另一项临床试验中,具有抗炎作用的双歧杆菌属在益生菌治疗后的丰度也显著增加。
益生菌还有可能成为神经和精神疾病的治疗辅助药物。在一项针对抑郁症和海马体功能变化的研究中,接受益生菌治疗的小鼠表现出肠道微生物生态失调的显著缓解,以及较低的肠道炎症介质如IL-1β、TNF-α和iNOS的表达水平。此外,情感行为也被检测到与肠道微生物群组成变化相关的显著改善。
益生元是宿主细菌可以选择性利用并提供健康益处的底物。常见的益生元包括低分子量碳水化合物、多酚和多不饱和脂肪酸。
在实验室和临床试验中,益生元(包括菊粉和低聚半乳糖)已被证明可以显著提高产生吲哚的益生菌(例如双歧杆菌和乳酸杆菌)的丰度。在对肠道微生物失衡进行一定纠正后,吲哚作为具有调节作用的配体,对炎症反应具有抑制作用。
合生元是益生菌和益生元的混合物。在大鼠实验中,合生元治疗逆转了肠道微生物特定菌群丰度的变化。
经过合生元(乳杆菌、双歧杆菌、链球菌和菊粉的组合)治疗的患有慢性肾病的大鼠中,肠道中产生吲哚的产气荚膜梭菌的丰度降低至正常水平。此外,合生元治疗可通过改变肠道微生物丰度来有效调节粪便中吲哚及其衍生物的水平。
合生元治疗由于其对吲哚水平的间接影响,可能成为许多神经系统和神经精神疾病的辅助治疗。最近一项针对阿尔茨海默病患者的临床实验表明,在使用合生元后,神经炎症有所减轻。
值得注意的是,合生元干预的改善效果优于单独的益生元或益生菌干预,这表明复合干预的组合更有可能成为临床治疗的实际应用。
粪便微生物移植(FMT)在先前的几项研究中已被证明对缓解胃肠道微生物失调具有不可否认的作用。通过FMT将产生吲哚的益生菌(乳酸杆菌、双歧杆菌等)移植到患者的肠道中,可以改善肠道微生物群。据观察,肠道中产生吲哚的微生物群的丰度增加,吲哚及其衍生物的水平受到间接影响。
吲哚是色氨酸代谢途径上的关键配体,可以调节和抑制神经和精神疾病的炎症。粪菌移植已被证明在各种疾病和临床治疗中对改善患者的肠道生态起着至关重要的作用,它可以通过吲哚在中枢神经系统疾病治疗中间接发挥作用,并被认为是一种潜在的辅助疗法。
肠道微生物通过色氨酸调节吲哚水平。色氨酸是人体必需氨基酸之一,需要完全依赖饮食摄入。
以下是一些富含色氨酸的常见食物:
蛋白质食物:肉类(牛肉、猪肉、鸡肉、火鸡)、鱼类(鳕鱼、鲑鱼、金枪鱼)、贝类(蛤蜊、扇贝)、蛋(鸡蛋、鸭蛋)、豆类(大豆、黑豆、红豆)、奶制品(牛奶、乳制品)等。
蔬菜和水果:菠菜、花椰菜、蘑菇、芝麻、松子、香蕉、菠萝、樱桃、草莓、蓝莓等。
谷物和豆类:燕麦、大麦、小麦、黑米、糙米等。
坚果和种子:核桃、杏仁、腰果、葵花子、南瓜子、亚麻籽等。
研究表明,0.4%膳食色氨酸可显著减少衰老小鼠的神经退行性病变和神经炎症。在此过程中,补充色氨酸可以通过改变肠道微生物组成并增加阿克曼氏菌等有益细菌的丰度来增强肠粘膜屏障功能。肠道菌群产生的吲哚类物质(如吲哚乙酸、吲哚-3-丙酸)显著升高,可以激活AHR,从而抑制神经炎症。
通过血清靶向代谢组学分析和16s rRNA测序对全身色氨酸代谢和肠道微生物组进行了分析,进一步证实了微生物群-肠-脑轴在调节色氨酸饮食产生吲哚的潜在作用。
虽然色氨酸饮食是一种可能的治疗策略,但过多的色氨酸摄入也被证明具有有害作用,应注意适量摄入。
此外,据报道,间歇性禁食还可能通过调节肠道微生物组成来影响血浆吲哚,从而对神经和神经精神疾病的预后产生有益影响。饮食调节可能是改善吲哚含量的一种简单但有效的方法。
最近的综合研究表明,吲哚通过作用于靶细胞来调节炎症反应和细胞生理。近年来,开发吲哚类作用靶点的药物一直是一个重要的研究热点。
吲哚及其衍生物充当AHR的配体,并通过AHR间接调节星形胶质细胞和小胶质细胞的炎症。因此,直接作用于AHR的激动剂也可以作为内源性AHR配体(如吲哚)的替代品,并参与色氨酸AHR介导的炎症抑制途径。
体外合成的AHR配体2-(1′H-吲哚-3′-羰基)-噻唑-4-羧酸甲酯在一项临床研究中被证明具有抑制自身免疫性脑脊髓炎进展的能力。对AHR具有激动作用的药物有可能取代色氨酸代谢产物,并作为外源性AHR配体激活自限制途径和修复神经和神经精神疾病。
除了靶向AHR,影响吲哚作用途径中其他靶点的药物也可能具有治疗作用,这需要在未来进行更多的研究。
由于吲哚是肠道细菌常见的代谢产物,其重要的生物学作用不容忽视。吲哚与肠道菌群的稳态和肠道健康直接相关,吲哚还可以间接影响其他系统和人体的整体健康。
吲哚对人类健康具有有益影响,通过激活免疫细胞释放抗炎因子如IL-22来调节肠道屏障并帮助维持肠道稳态,抑制包括肠出血性大肠杆菌在内的病原菌的定植,以及增加MUC表达以增强粘液屏障功能。
此外,吲哚在调节肠道微生态方面也起着关键作用。它们抑制有害菌株,并以影响基因表达的方式改变肠道致病菌的毒力,这有助于缓解出血性结肠炎等疾病。同时,吲哚及其衍生物在激活AhR和PXR介导的抗炎途径中至关重要。例如吲哚-3-丙酸通过PXR介导肠细胞TNF-α的下调,并上调编码生长抑素的mRNA,以调节炎症中的肠道通透性和肠道屏障功能。这意味着吲哚及其衍生物有前景的治疗途径。
尽管如此,吲哚也是一把双刃剑,少数衍生物也存在一定的缺点。例如,吲哚肝脏代谢产生的硫酸吲哚酚在高浓度时具有肾毒性和心血管毒性,可通过促进氧化应激、炎症等病理变化而导致多系统功能障碍。
吲哚在肠道稳态和人类健康中发挥着至关重要的作用。许多肠道细菌被鉴定为将色氨酸代谢为吲哚。尽管如此,仍可能存在未鉴定的细菌,因此未来需要使用代谢组学和宏基因组学来进一步表征未知的吲哚产生细菌及其相关代谢途径。
不同浓度的吲哚发挥着不同的生理功能。健康成年人的粪便吲哚浓度是已知的,而人类肠道和血液中许多吲哚衍生物的浓度仍然未知。缺乏在不同环境中测定吲哚及其衍生物浓度的定量方法,未来需要开发简单快速的测定方法。
未来仍需进一步研究吲哚与人类健康之间的关系。需要研究多种吲哚组合对宿主生理学的影响,并将这些发现与临床环境相结合,以开发相关疾病的新疗法。
主要参考文献
Zhou Y, Chen Y, He H, Peng M, Zeng M, Sun H. The role of the indoles in microbiota-gut-brain axis and potential therapeutic targets: A focus on human neurological and neuropsychiatric diseases. Neuropharmacology. 2023 Nov 15;239:109690.
Tennoune N, Andriamihaja M, Blachier F. Production of Indole and Indole-Related Compounds by the Intestinal Microbiota and Consequences for the Host: The Good, the Bad, and the Ugly. Microorganisms. 2022 Apr 28;10(5):930.
Ye X, Li H, Anjum K, Zhong X, Miao S, Zheng G, Liu W, Li L. Dual Role of Indoles Derived From Intestinal Microbiota on Human Health. Front Immunol. 2022 Jun 17;13:903526.
Lee JH, Lee J. Indole as an intercellular signal in microbial communities. FEMS Microbiol Rev. 2010 Jul;34(4):426-44.
Jiang H, Chen C, Gao J. Extensive Summary of the Important Roles of Indole Propionic Acid, a Gut Microbial Metabolite in Host Health and Disease. Nutrients. 2022 Dec 28;15(1):151.
Kumar A, Sperandio V. Indole Signaling at the Host-Microbiota-Pathogen Interface. mBio. 2019 Jun 4;10(3):e01031-19.
Chimerel C, Emery E, Summers DK, Keyser U, Gribble FM, Reimann F. Bacterial metabolite indole modulates incretin secretion from intestinal enteroendocrine L cells. Cell Rep. 2014 Nov 20;9(4):1202-8.
Lu Y, Yang W, Qi Z, Gao R, Tong J, Gao T, Zhang Y, Sun A, Zhang S, Ge J. Gut microbe-derived metabolite indole-3-carboxaldehyde alleviates atherosclerosis. Signal Transduct Target Ther. 2023 Oct 4;8(1):378.

谷禾健康
发酵食品被定义为“通过受控微生物生长以及通过酶作用转化食品成分而生产的食品或饮料。许多食物历史上都经历过发酵,包括肉和鱼、乳制品、蔬菜、大豆、其他豆类、谷物和水果。

发酵过程中存在多种变量,包括微生物、营养成分和环境条件,从而产生了数千种不同的发酵食品。历史上,食品发酵被用作一种保存方法,因为抗菌代谢物(例如有机酸、乙醇和细菌素)的产生降低了病原微生物污染的风险。
发酵还用于增强感官特性(例如,味道和质地),一些食物,例如橄榄,如果不经过发酵去除苦味酚类化合物,就无法食用。
近年来,发酵食品越来越受欢迎,发酵食品在世界上几乎所有文化的美食中都占有一席之地。发酵食品越来越受欢迎,主要原因包括发酵食品对健康的益处以及人们对胃肠健康的兴趣高涨。发酵食品可以通过多种机制对健康和疾病发挥有益作用。
首先,在肠道中,发酵食品所含的共生微生物主要通过与病原菌竞争资源,以及产生具有调节免疫和神经功能的发酵副产物来发挥其生理作用。
其次,发酵产生的代谢物可能对健康有益。例如,乳酸菌(与乳制品和非乳制品发酵食品相关)产生生物活性肽和多胺,对心血管、免疫和代谢健康具有潜在影响。
第三,发酵可以将某些化合物转化为生物活性代谢物。例如,乳酸菌可以将酚类化合物(如类黄酮)转化为具有生物活性的代谢物。
第四,发酵食品中的食品成分,如益生元和维生素,也可能对健康产生益处。
最后,发酵可以减少毒素和抗营养物质,例如,大豆发酵可以降低植酸浓度,酸面团发酵可以减少可发酵碳水化合物(例如,可发酵低聚糖、二糖、单糖和多元醇、FODMAP)的含量,这可能会增加肠易激综合征等功能性肠道疾病患者对这些产品的耐受性。
本文带大家一起了解发酵食物/食品的来源,方法,种类,包括的微生物以及对人体健康的益处和作用机制。
虽然人们已经食用发酵食品有数千年,在公元前 7000 年的陶器中,发现了有意应用发酵的最早证据,这些陶器用于发酵大米、蜂蜜和水果。但最近在了解肠道微生物组(肠道中细菌、病毒和真菌的组成)方面取得的进展,重新燃起了人们对发酵食品消费的兴趣。传统上,食品被发酵作为一种保存手段,用来提高保质期、食品安全性和可及性。
发酵还用于改善食物的消化耐受性、味道和质地。发酵食品在文化饮食模式中的突出地位和悠久的使用历史,让消费者和研究人员想知道发酵食品如何适应当前的饮食建议、个人应该多久食用它们以及有什么好处。
为了更好地了解它们的健康益处,首先了解发酵食品的构成非常重要。国际益生菌和益生元科学协会(ISAPP)专家共识将发酵食品和饮料定义为“通过所需的微生物生长和食品成分的酶促转化而制成的食品”。
尽管微生物对于发酵过程至关重要,但由于加热和加工的原因,微生物在食用时可能存在也可能不存在(下表)。


Dimidi E, et al., Nutrients. 2019
不是所有酸菜都是发酵食品
值得注意的是,一些食品需要发酵才能通过其通用名称来识别,例如酸奶;其他食品则可能不需要,例如,酸菜可以腌制或发酵,因此并非所有酸菜都是发酵食品。
注:腌制食品通常是通过浸泡制成的,不一定需要微生物或符合发酵食品的定义。
发酵食品和益生菌有什么区别?
发酵食品和饮料有时被定性或标记为“益生菌食品”或“含有益生菌”。然而:
由于以上这些原因,术语“发酵食品”和“益生菌”不能互换使用。
大多数发酵食品不符合益生菌的定义,因为它们的菌株尚未定义,并且不能保证在整个保质期内维持足够的菌落形成单位 (CFU)。
许多发酵食品含有具有益生菌潜力的细菌
这些细菌要么是在制造过程中添加的,要么是外来细菌,例如奶酪中发现的非发酵剂乳酸菌 (NSLAB),它们能够在发酵食品中生长和繁殖。
一般来说,大多数发酵产品含有足够多的微生物,其浓度根据产品的地区、年龄、消费时间等多个变量而变化。周围的食物基质似乎通过其针对肠道条件(例如低 pH 值、胆汁酸)的缓冲和保护作用,在益生菌菌株的存活中发挥着重要作用。
事实上,许多研究表明,发酵食品中的微生物可以到达胃肠道,这可能因产品而异。
发酵食品影响肠道微生物组的方式
食品发酵有两种主要方法
首先,食物可以自然发酵,通常被称为“野生发酵”或“自发发酵”,其中微生物天然存在于生食或加工环境中,例如酸菜、奶酪和某些发酵豆制品。
其次,食物可以通过添加发酵剂进行发酵,称为“依赖于培养物的发酵”,例如开菲尔、康普茶和纳豆。进行依赖于培养物的发酵的一种方法是“backslopping”,其中将少量先前发酵的批次添加到生食品中,例如酵母面包,用于启动发酵的发酵剂可以是天然的,也可以是精选的商业发酵剂,以标准化最终产品的感官特征。
注:backslopping是一种发酵过程中的一种方法,指的是将之前发酵批次中的一小部分加入到新的原始食物中,以启动新的发酵过程(有点类似于以前和面用的“醒子”)。
上面“野生发酵”或“自发发酵”利用空气中恰好存在的微生物或发酵原料上的微生物,而发酵剂则用于最初接种食物以启动发酵。在使用发酵剂时,微生物可能会经历产品标准化的选择过程。在研究发酵食品的健康益处时,由于生产方法而导致的食品成分和微生物的变化导致文献中存在显着的异质性。
发酵食品和饮料作为“功能性食品”的一部分,在传统和现代饮食中占有重要地位,对食物链价值有显著贡献,并具有额外的健康促进或疾病预防效果。
发酵过程及其与肠道健康的关联
发酵过程在无氧条件下将糖转化为有机酸、气体、醇和二氧化碳,带来多种益处,如新的口感和质地、营养增强、有毒或不良成分的去除、益生菌的传递以及食源性病原体的抑制。
发酵食品有助于提供益生菌,以维持健康的微生物群,对免疫系统和代谢功能影响显著。发酵食品的处理涉及人类、动物、环境、食品和微生物群之间的联系,这些联系影响食品的感官和理化特性以及人类健康。肠道控制并处理我们健康的各个方面,如消化方式、食物敏感性与情绪、行为、能量、体重、食欲、激素平衡和免疫力等均有关联。
营养与微生物群的协同效应
营养物质与微生物群的相互作用决定了整体健康。食用和饮用发酵食品和饮料,尤其是有机未削皮和未经巴氏消毒的水果和蔬菜,能提高食物生物活性成分的生物可及性和生物利用度,提供膳食纤维和必需的微量元素、植物化学物质以及酶、乳酸菌和有机酸,这些对健康至关重要。
发酵能增强各种食品的好处
包括乳制品、草药和饮料,影响它们次生代谢产物和化学元素的吸收和活性。尽管难以区分微生物内容和食物基质的潜在贡献,但消费者对发酵食品和饮料的健康益处有着明显的认知,这不仅仅是因为它们对胃肠功能障碍的影响,而且还与肠道微生物群、人类健康以及多种传染性、炎症性和肿瘤性疾病进程以及大脑功能有关。
发酵食品在精神健康和慢性疾病中扮演重要角色
尤其是与糖尿病和心血管疾病相关的肠道微生物组的变化。发酵和食物消化过程中产生的生理活性肽具有多种功能,能够作为促进健康的营养素配方。
尽管对于精神障碍的病因、分类和医疗护理存在分歧,但当前关于发酵食品、微生物组及其对人类健康影响的研究,特别是全球精神健康流行病,描述了与现代生活方式和高糖高饱和脂肪的西方饮食有关的问题。肠道黏膜的退化削弱了对有害物质入侵的紧密屏障,以及对无处不在的无害化合物的反应保护,是多种疾病的主要原因。
摄入活性益生菌,尤其是在发酵食品中,对平衡肠道通透性和屏障功能有显著积极改善,对代谢综合征、动脉粥样硬化、炎症性肠病和结肠癌有直接影响,并对抑郁、愤怒、焦虑和压力激素水平有间接影响。
酸奶与降低慢性疾病风险相关
酸奶是倍受认可的发酵食品之一。在流行病学研究中,饮用酸奶与降低 II 型糖尿病、心脏病和癌症的风险有关。此外,它还与改善骨骼健康和体重管理有关。
酸奶可提高乳糖不耐受者的乳糖消化率
牛奶发酵通过降低生产中的乳糖含量,以及通过活微生物表达 B-半乳糖苷酶的消化过程中的乳糖含量来提高乳糖的消化率。
虽然一些研究表明,饮用酸奶有助于减少抗生素相关性腹泻,但结果并不一致。虽然所有酸奶都是发酵的,但只有部分酸奶同时符合发酵食品和益生菌食品的标准,这意味着它们的菌株具有足够的特异性,具有治疗剂量,并且已针对特定的健康益处进行了研究。

酸奶可能含有特定的益生菌菌株,对身体有益处
这可以支持特定的治疗效果,包括改善便秘、减轻肠易激综合征 (IBS) 的症状,降低艰难梭菌 (C. difficile) 和抗生素相关性腹泻的发病率。值得注意的是,这些发现不能推广到酸奶本身,而是涉及到存在的益生菌菌株。除了乳糖消化不良和添加益生菌的酸奶具有特定菌株的治疗作用之外,支持饮用酸奶改善特定消化系统疾病的研究尚未阐明。
食用发酵牛奶、奶酪后对肠道菌群的影响
有八项研究分析了在食用发酵乳制品后的肠道菌群,包括发酵牛奶、酸奶和奶酪。发酵乳制品通常由乳酸菌(LAB)发酵,特别是嗜热链球菌(Streptococcus thermophilus)和乳杆菌属,此外还有双歧杆菌属。卡蒙贝尔奶酪还会使用明串珠菌属(Leuconostoc spp.)、Hafnia alvei、Geotrichum fungi 进行发酵。这些额外的奶酪发酵剂可能是导致其对肠道菌群影响多样化的原因。
食用酸奶对肠道菌群影响的研究
一项研究中,6名健康参与者连续6周食用酸奶,未发现与肠道细菌丰度存在任何统计学上显著的变化。
相反,也有报告显示,含有益生菌的酸奶进行4周干预,与对照组相比,能降低感染幽门螺杆菌儿童肠道大肠杆菌与双歧杆菌的比例(研究开始前1个月内使用抗生素为排除标准)。这种干预还降低了感染儿童体内的幽门螺杆菌,提高了血清IgA浓度,这为用酸奶治疗该感染提供了一条途径。
►
虽然测试的发酵乳和酸奶是用相似的细菌发酵的,但每种产品中特定的乳酸菌和乳酸菌的含量并不相同。这些差异可能是发酵奶和酸奶干预研究结果差异的原因。
为了进一步阐明食用酸奶产品的潜在益处,有必要开展更大样本量的研究,可能还需要开展干预时间更长的研究,来测试酸奶对肠道菌群的影响。
传统的开菲尔起源于高加索山脉,是一种具有奶油般质地、酸味和微妙气泡感的发酵乳饮料。通过向牛奶中添加一种名为“开菲尔粒”的发酵剂来生产开菲尔。
开菲尔粒由共生的乳糖发酵酵母(如Kluyveromyces marxianus)和非乳糖发酵酵母(如Saccharomyces cerevisiae、Saccharomyces unisporus),以及产乳酸和乙酸的细菌组成,它们位于称为开菲尔兰的多糖和蛋白质基质中。乳酸、风味生成成分(如乙醛)、乙醇和二氧化碳都是发酵的副产品,它们共同决定了开菲尔的感官特性。
在开菲尔粒中已经鉴定出多种微生物物种
常见的包括乳杆菌属:
链球菌属:
醋杆菌属:
酵母菌属:
假丝酵母菌属:
克鲁维酵母属:
乳杆菌科:
注: 如Leuconostoc mesenteroides 常见于蔬菜、乳制品和其他发酵食品中。它们在食品工业中扮演重要的角色,尤其是在发酵过程中,例如在制作泡菜、某些奶酪和腌制蔬菜等食品的过程中。这种细菌可以发酵糖类产生乳酸,有助于食品的保存和发酵过程中特定风味的形成。
它也能产生多种有益的代谢产物,如二乙酰(diacetyl),这是一种具有奶油味的化合物,常用于增强奶制品的风味。此外,这种细菌还能产生一种被称为白藜芦醇的多糖,这种物质具有良好的稳定剂和增稠剂特性,可以用于食品工业。
发酵过程中开菲尔的微生物组成可能会变化
例如,虽然在开菲尔粒的初级培养中L. kefiri并不是最主要的乳杆菌种类,但在最终发酵饮料中L. kefiri可以占所有乳杆菌种类的80%。
联合国粮食及农业组织(FAO)和世界卫生组织(WHO)建议开菲尔粒中至少应含有107个形成菌落单位(CFU)/克的微生物,最终产品中至少应含有10^4 CFU/克的酵母。
还有一种不含乳制品的开菲尔版本,称为水开菲尔,它是由水、糖和水开菲尔粒发酵而成的饮料,含有细菌和酵母,与传统开菲尔的发酵剂不同。

开菲尔抵抗病原菌,有益健康
多项体外研究已探究开菲尔的抗菌活性,这种活性归因于与病原体竞争可用营养物质,以及产生有机酸、细菌素、二氧化碳、过氧化氢、乙醇和乙酰乳酸等物质。
体外研究显示c对多种微生物如白色念珠菌、伤寒沙门氏菌、肠炎沙门氏菌、志贺氏菌、大肠杆菌、枯草杆菌、粪肠球菌和金黄色葡萄球菌表现出抗菌活性。
发酵衍生的生物活性肽已在动物模型中显示出刺激免疫系统的能力,而开菲兰则减少了小鼠哮喘模型中由卵清蛋白诱导的细胞因子产生。体外和动物研究还表明开菲尔可能具有抗氧化、降血压、抗癌以及降低胆固醇和血糖的潜在效果。
开菲尔有潜力在人类肠道中定植
多项体外、动物及人体研究已探讨开菲尔及其组成微生物对肠道菌群的影响。虽然尚未在体内得到证实,但从开菲尔中分离出的几种菌株已显示能够粘附于类人肠上皮Caco-2细胞,表明其有潜力在人类肠道中定植。
开菲尔或其组成菌株对肠道菌群有相当大影响
大量动物研究表明,它会增加乳杆菌、乳球菌和双歧杆菌的浓度,并降低变形菌和肠杆菌的浓度。此外,一项研究发现,与对照组相比,给予开菲尔乳杆菌(开菲尔乳杆菌本身不是开菲尔本身)(开菲尔谷物中常见的菌株)的小鼠体内,厚壁菌门、拟杆菌门和普雷沃氏菌浓度更高,粪便重量和粪便水分也更高。
食用开菲尔后,胃肠道中真菌丰度也会变化
一项针对高脂肪饮食诱导的肥胖小鼠模型的研究表明,与对照小鼠相比,摄入 0.2 mL 开菲尔的小鼠粪便总酵母菌和念珠菌随菲尔数量显着增加。
开菲尔在炎症性肠病中的应用
在人类中,一项针对 45 名炎症性肠病患者的研究表明,在每天摄入 800 毫升开菲尔的 4 周后,大多数参与者的粪便中都发现了一种开菲尔特有的菌株,即开菲尔乳杆菌,并且粪便中总乳酸杆菌丰度显着增加。与对照(无开菲尔)相比,克罗恩病患者发现了这一结果。
乳酸杆菌是一类益生菌,它们对维持肠道微生物平衡和促进肠道健康具有重要作用。这些菌株可以帮助改善肠道屏障功能,减少炎症,以及可能对免疫系统产生有益的调节效应。
在这项研究中,与未摄入开菲尔的对照组相比,克罗恩病患者在摄入开菲尔后的这些变化,可能表明开菲尔对改善他们的肠道微生物群和肠道健康有积极作用。这可能是由于开菲尔中的益生菌和发酵产物对肠道环境产生了积极影响。
开菲尔改善乳糖吸收不良
开菲尔对乳糖吸收不良的人具有良好的耐受性,因为它含有表达β-半乳糖苷酶的细菌(例如Kluyveromyces marxianus),可以水解乳糖,从而降低饮料中的乳糖浓度。
注:酵母全身是“宝”,无论酵母形式是农场生产的酵母醪糟,啤酒或白酒企业生产的酵母副产物,或专门生产用于饲喂动物的酵母产品。其中马克斯克鲁维酵母(Kluyveromyces marxianus)。这种酵母又叫“乳清酵母”,可以利用牛奶糖或乳糖作为底物,通过代谢过程将其分解,从而生长和繁殖。
这个特性使得Kluyveromyces marxianus特别适合用于乳制品工业的副产品,例如乳清。乳清含有乳糖和其他营养素,而乳清酵母可以将这些乳糖转化为酒精和二氧化碳(在发酵过程中),同时还能产生一些有益的副产品,如维生素和酶。
开菲尔含有比原味酸奶多 60% 的 β-半乳糖苷酶,而与未发酵奶相比,开菲尔的乳糖含量降低了 30% 。与牛奶相比,开菲尔还导致肠胃胀气严重程度显着降低,但肠胃气胀频率、腹痛和腹泻没有差异。总体而言,这项研究表明,对于乳糖吸收不良的人来说,食用开菲尔的胀气严重程度比牛奶低,并且与酸奶一样具有良好的耐受性。
开菲尔有助于根除幽门螺杆菌
另一项双盲随机对照试验研究了每天500毫升开菲尔与每天250毫升牛奶相比,在消化不良且幽门螺杆菌感染的患者中,对于配合2周三联抗生素疗法的幽门螺杆菌根除率的影响。研究发现:
这表明在治疗幽门螺杆菌感染期间,开菲尔可能是有益的辅助疗法。
然而,开菲尔研究的一个重要限制是每批可能包含不同的微生物。这可以解释一些异质性。需要进一步的高质量随机对照试验来确定开菲尔对肠道微生物群的影响及其对便秘等其他胃肠道疾病的影响。
开菲尔有助于改善便秘
几项非随机研究也探讨了开菲尔对便秘的影响。


doi: 10.3390/nu11081806
一项针对42名住院患者(这些患者有便秘问题以及精神和身体障碍)的非随机交叉研究显示,与对照组的粉状牛奶相比,6克冻干开菲尔对使用泻药的频率、大便的一致性和体积没有影响,然而在开菲尔干预12周后,不需要任何泻药的患者数量比基线时更高。
另一项小型非随机、无对照试验包括了20名功能性便秘患者,研究显示连续4周每天摄入500毫升开菲尔显著增加了大便频率,改善了肠道满意度评分,并且与基线相比,缩短了肠道传输时间。
考虑到样本小和研究设计的局限性(开菲尔的形式不同,没有随机化,无对照,验证程序的使用有限),需要进一步的高质量试验来确定开菲尔对便秘的影响。
康普茶(Kombucha) 是一种古老的发酵茶,康普茶距今已经有上千年的历史,起源于中国,后随丝绸之路引入亚洲和欧洲各国。
康普茶的发酵
传统的康普茶是通过细菌和酵母的组合对红茶(也可能使用绿茶)和白糖进行有氧发酵而生产的,称为细菌和酵母的共生培养物(SCOBY)。
酵母将蔗糖转化为乙醇(除了有机酸和二氧化碳),乙酸细菌将蔗糖转化为乙醛和乙酸。康普茶的微生物和代谢物组成根据 SCOBY 的具体组成、茶和糖的类型和浓度、氧气浓度、发酵时间、温度和储存时间而变化。

红茶菌的低pH值,主要是由于高浓度乙酸的产生,能够阻止幽门螺杆菌、大肠杆菌、鼠伤寒沙门氏菌和空肠弯曲菌等致病菌的生长。即使在中性pH值和经过热变性处理后,红茶菌在体外也能抑制病原体的生长,这表明除了乙酸以外的其他化合物也具有抗菌效果。
SCOBY是用于制作康普茶的一种共生菌群
它主要由乙酸细菌(例如乙酸杆菌属和葡萄糖酸杆菌属)、乳酸细菌(例如乳杆菌属和乳球菌属)以及酵母(例如酿酒酵母属Saccharomyces,和接合酵母属Zygosaccharomyces)组成。
高通量测序分析的研究表明,在康普茶发酵过程之后,假丝酵母属(Candida)和接合酵母属(Zygosaccharomyces)的酵母变得占主导地位,而在细菌中,则是酿酒酵母属(Komagataeibacter)、鱼腥藻属(Lyngbya)、葡萄糖酸杆菌属(Gluconobacter)、乳杆菌属和双歧杆菌属的数量最多。
在动物研究中:
康普茶对血糖水平、氧化应激、糖尿病引起的体重减轻、化学物质引发的肾脏毒性、高胆固醇血症、胃溃疡有影响。
研究假设在这些有益效果中起作用的化合物包括D-葡萄糖酸-1,4-内酯(DSL),这是在发酵过程中由葡萄糖酸杆菌产生的,在大鼠中它能够抑制氧化应激和糖尿病引起的肾损伤以及对乙酰氨基酚引起的肝损伤。尽管如此,目前还没有人类数据来证实这一作用机制。
茶中的多酚和黄酮类物质的含量会随着发酵的进行而增加。此外,康普茶发酵过程中,体外超氧阴离子清除能力、还原能力和总酚类化合物浓度也会增加。
虽然说康普茶是乙酸、乳酸菌和酵母的丰富来源,但目前还没有公开发表的研究探讨食用康普茶对动物或人类肠道微生物群落组成或功能的影响。有趣的是,康普茶在体外已显示出抗菌效果。
酸菜起源于中国,最早可以追溯到东汉,西周时期。酸菜是一种利用蔬菜经过发酵而制成的食品,可以延长保存时间并增加风味。酸菜在中国各地都有不同的制作方法和口味,是中国传统的发酵食品之一。
发酵酸菜的方法
古籍中记载的酸菜关于“酸菜”的形成历史。“请君伐菹薪,煮沸水为盐”;而《释名》中对“菹”的解释更为透彻,“菹,阻也。生酿之,遂使阻于寒温之闲,不得烂也”,这其实也写出了发酵酸菜的具体方法。

酸菜是最常见的腌制卷心菜形式之一,由切碎的卷心菜和2.3%至3.0%的盐混合制成的,然后让其自然发酵,通常涉及的菌种包括:
最终产品的低pH值使得卷心菜得以保存。
酸菜中的菌群
目前,通过培养依赖的技术,研究表明自制和商店购买的酸菜中含有多种细菌,一般包括:
当添加一种鼠李糖乳杆菌11MZ-5-1的启动培养物时,所制作的酸菜主要包含乳杆菌属和乳酸链球菌属(Lactococcus),这与自然发酵的酸菜相比,除了含有乳酸链球菌和乳杆菌外,自然发酵酸菜还含有显著数量的肠杆菌(Enterobacter)和假单胞菌(Pseudomonas),并且在微生物组成上更为多变。酸菜主要含有明串珠菌属和乳杆菌属。
从酸菜中分离出的某些乳杆菌种显示出益生菌潜力,它们能够耐受低pH环境,在Caco-2细胞上附着,并且在体外可以对抗病原体。常见于酸菜中的副干酪乳杆菌HD1.7(Lactobacillus paracasei HD1.7),能够产生一种广谱细菌素,这可能在酸菜的保存过程中发挥作用。
酸菜的健康益处,抗氧化,解毒,抗病原菌
在Wistar大鼠中口服酸菜汁导致谷胱甘肽S-转移酶(GST)、NAD(P)H:醌氧化还原酶1(NQO1)活性增加,这两种酶是肝脏和肾脏解毒过程中的关键酶。酸菜中含有的某些乳酸菌能够产生共轭亚油酸,关于共轭亚油酸,在动物实验中有证据表明它具有抗癌和抗动脉粥样硬化的活性。
从酸菜中分离出的植物乳杆菌P2(Lactobacillus plantarum P2)显著诱导TNF-α和IL-12的表达,并防止沙门氏菌肠炎亚种(Salmonella enteritidis)附着和侵入Caco-2细胞。
酸菜含有硫代葡萄糖苷分解产物,包括山奈酚(一种黄酮类化合物)、异硫氰酸酯、吲哚-3-甲醇、硫代甘蓝素、烯丙基腈和腈类化合物。尽管这些植物化学物质对人类健康的具体影响尚不明确,但山奈酚具有清除自由基的活性,能够保护机体免受氧化损伤,并在体外减轻细胞因子诱导的活性氧物种。
异硫氰酸酯已被证明具有抗菌特性,可以防止包括大肠杆菌、艰难梭菌、空肠弯曲菌(C. jejuni)和产气荚膜梭菌(C. perfringens)在内的多种物种的生长。
酸菜改善了肠易激综合征
酸菜是为数不多的几种发酵食品之一,其在功能性肠道疾病方面进行了临床试验。
一项随机双盲试验,比较了含有活性乳酸菌(LAB)的酸菜,对58名符合罗马III标准诊断的任何亚型肠易激综合症(IBS)患者的胃肠症状和微生物群的影响。
患者被随机分配每天食用75克的巴氏杀菌(对照)或未经巴氏杀菌(干预)含有LAB的酸菜,持续6周。在两个研究组中,从试验开始到结束,肠易激综合症严重性评分系统(IBS-SSS)得分都显著降低,但是饮食组之间的症状没有差异;
16S rRNA测序显示两个研究组之间或者在任一组的开始和结束时的微生物群组成没有差异。这可能表明,人们感知到的酸菜的健康益处与活微生物无关。这项研究的一个局限性是按方案分析,即只有完成研究的患者(n=34)被纳入主要结果的分析。此外,因为没有生卷心菜对照组,所以无法确定胃肠症状的改善是与发酵产物还是卷心菜本身有关。
酸菜可能与胃肠道癌症关联
在中国参与者中进行的另一项研究表明,大量食用酸菜实际上可能与胃肠癌症的不良健康结果有关。具体来说,这项病例对照研究显示,酸菜摄入量最高的人群与喉癌的风险增加有显著关联,比值比高达7.27。虽然这可能与酸菜中的高盐分有关,但在我国进行的另一项关于喉癌风险因素的研究并未发现与腌制蔬菜的摄入有关联。此外,酸菜中的高钾含量可能有助于抵消盐分可能引起的高血压效应。
尽管存在这些潜在的风险,一项试验发现,无论是经过巴氏杀菌处理的还是未经处理的酸菜,都能降低肠易激综合症(IBS)的严重程度,但这种效果似乎并非由改变胃肠道微生物群引起的。这意味着酸菜可能通过其他未知机制影响胃肠道症状。然而,目前关于酸菜对其他健康状况影响的证据还很有限。
最早已知的发酵大豆制品起源于中国和日本,包括发酵黑豆和腐乳。亚洲不同地区有许多发酵大豆制品,包括豆饼,豆豉(tempeh)、日本纳豆(natto)、日本味噌(miso)、中国腐乳(sufu)、豆腐乳(douche)、酱油以及韩国的豆瓣酱(doenjang)等。
豆 豉
豆豉是中国传统特色发酵豆制品调味料。豆豉(Glycine max)以黑豆或黄豆为主要原料,利用毛霉、曲霉或者细菌蛋白酶的作用,分解大豆蛋白质,达到一定程度时,用加盐、加酒、干燥等方法,抑制酶的活力,延缓发酵过程而制成。

在豆豉的制作过程中,主要的微生物包括:
豆豉霉(Aspergillus oryzae)或豆豉曲霉(Aspergillus sojae):这些霉菌负责初期的发酵过程,它们会分解大豆中的蛋白质和淀粉,产生一系列风味物质。
酵母:在发酵过程中,酵母也会参与作用,它们可以产生酒精和其他香气化合物。
乳酸菌:在某些豆豉的发酵过程中,乳酸菌可能会参与,有助于发酵过程的进行,并增加产品的酸味。
不同地区和不同生产商的豆豉可能会有所差异,微生物的种类和比例也可能会有所不同,这也是导致各种豆豉风味差异的原因之一。
豆 饼
豆饼是一种传统的印尼食品,通过在室温下用根霉Rhizopus oligoporus菌种发酵煮熟并去壳的大豆35-37小时来生产。这样可以制作出质地柔软、口感有嚼劲且带有类似蘑菇风味的白色豆饼。豆饼的微生物组成因生产工艺的不同而有所变化。
豆饼中含有乳酸菌、粪肠球菌,以及根霉属的丝状真菌(Rhizopus filamentous fungi)。研究表明,大豆的发酵能够降低蛋白酶抑制剂、植酸和酚类这些在生大豆中含量较高的抗营养因子,这可能与豆饼中根霉属表达的植酸酶有关。

在Sprague-Dawley大鼠中,与食用未发酵大豆的大鼠相比,补充豆饼后大鼠粪便中的拟杆菌门、厚壁菌门、艰难梭菌和脆弱拟杆菌的丰度增加。
在体外肠道模拟器模型中,应用大豆和豆饼对人类微生物群,可以增加双歧杆菌、乳酸杆菌、大肠杆菌和肠球菌的丰度。在一项对10名健康志愿者进行的开放标签非对照研究中,食用豆饼导致粪便中AKK菌的丰度和免疫球蛋白A浓度增加,这表明豆饼可能会影响人类的肠道微生物群。
在体外实验中,豆饼比未发酵的大豆显示出更强的自由基和超氧化物清除能,这可能与发酵后大豆中多酚含量和可消化性的变化有关。
但是迄今为止,关于豆饼消费对人类影响的随机对照试验(RCTs)还不存在。对人体的健康效果需要在人类试验中进行研究。
纳豆(Natto)
纳豆是一种传统的日本发酵大豆食品。纳豆是通过用枯草芽孢杆菌(一种益生菌)发酵煮熟的黄大豆制成的。这样制作出来的食品粘稠,有独特的风味和强烈的气味。
纳豆的特性根据大豆的蒸煮时间、相对湿度、发酵时间和温度而有所不同。纳豆发酵产生许多生物活性因子,包括纳豆激酶、杆菌肽酶F、维生素K2和吡啶二羧酸。
纳豆含槲皮素,对代谢、炎症、癌症预防有益
与未发酵的豆制品相比,纳豆中异黄酮槲皮素的含量更高,这些与代谢和炎症性疾病以及致癌预防有关。一种对肺炎链球菌和枯草芽孢杆菌具有抗菌活性的肽已从纳豆中分离出来,尽管尚未在人体中进行研究,但它在治疗肺炎链球菌感染方面具有潜在的临床重要性。
注:异黄酮类化合物是一类存在于豆类食物中的天然植物化学物质,具有类似于雌激素的生物活性,因此也被称为植物雌激素。
槲皮素(Genistein)是一种特定的异黄酮化合物,主要存在于大豆及其制品中。槲皮素因其多种生物学功能而受到关注,包括其抗氧化、抗炎、抗肿瘤的潜在效果,以及对骨密度和心血管健康的积极影响。

纳豆激酶由枯草芽孢杆菌变种产生。纳豆激酶除了增加组织纤溶酶原激活剂和减少血小板聚集外,还具有直接的体外和体内纤溶活性。纳豆激酶的抗血栓和抗高血压活性已在人体小型随机对照试验中得到证实。
食用含纳豆味噌汤:芽孢杆菌和双歧杆菌增加
关于纳豆对人类胃肠道微生物群影响的证据有限。关于纳豆对人类肠道微生物的影响,证据有限。有研究显示,8名健康志愿者连续两周食用含纳豆的味噌汤后,其粪便中的芽孢杆菌和双歧杆菌增加,而梭菌和肠杆菌科细菌减少。此外,粪便中的短链脂肪酸增加,氨和硫化物下降。然而,无法区分味噌汤(也是一种发酵大豆产品)的效应和纳豆的可能效应。
在每周排便3-5次的个体中,连续两周每天食用含有枯草芽孢杆菌K-2的50克纳豆,与每天食用50克煮豆相比,可以增加粪便频率和粪便中双歧杆菌的比例,尽管没有提供样本量。
味噌(Miso)
味噌是一种传统的日本发酵大豆酱,用于制作味噌汤。制作味噌的过程中,会用到一种名为“麴”的发酵剂,它是由霉菌Aspergillus oryzae(即麴菌)产生的,尽管有时也会使用酿酒酵母(Saccharomyces cerevisiae)和乳酸菌。与其他发酵大豆食品一样,味噌的生产在原料、温度和发酵时间、盐浓度以及使用的A. oryzae菌株方面都有很大差异。
味噌的微生物分析
对不同时间点的味噌进行微生物分析,发现在发酵过程中存在:
但在最终产品中只剩下枯草芽孢杆菌的细菌,关于枯草芽孢杆菌,详见:
此外,一系列味噌样本还含有乳球菌属的GM005菌株,它能产生一种具有强大抗菌活性的细菌素,能够抑制包括枯草芽孢杆菌、乳酸乳球菌(Pediococcus acidilactici)和植物乳杆菌在内的多种细菌的生长。

中国和日本的高大豆摄入量历史上一直被假设为相对较低的结肠癌和前列腺癌发病率的原因。支持这一假设的一个可能机制是在大豆中发现的异黄酮类化合物和大豆苷元的高浓度。异黄酮类在结构上与雌激素相似,可能通过与雌激素受体结合影响乳腺癌风险,这在体外实验中已得到证明。
进一步的体外研究表明,槲皮素可能通过促进细胞周期停滞、诱导凋亡和减少癌细胞迁移对癌症风险产生影响。如前面讨论过的,与未发酵的大豆制品如豆浆和豆腐相比,发酵大豆制品如味噌和纳豆中的槲皮素和大豆苷元含量可能更高。
味噌与癌症之间的关联,研究不一致
许多日本队列研究已经调查了味噌摄入量与癌症风险之间的关联。这些研究在饮食摄入评估(食物频率问卷,通常反应有限的摄入量)和可能存在的大量混杂因素方面是有限的。考虑到这些方法学局限性,队列研究观察到日本男性频繁摄入味噌汤与胃癌风险呈反向关联。相反,队列和病例对照研究显示频繁摄入味噌汤与日本成年人的单发和多发胃癌之间呈正相关。此外,一些队列研究显示味噌汤的摄入量与各种类型癌症的风险之间没有关联。
味噌对胃肠道疾病和肠道菌群的影响
目前还没有随机对照试验(RCTs)研究味噌对功能性肠道疾病的影响。因此,关于味噌对胃肠疾病和肠道菌群影响的证据是有限的。有几项观察性研究显示味噌的摄入与胃癌风险之间存在关联,然而这些关联的强度和方向仍然不明确。
酸菜、豆制品和泡菜对胃肠道健康和疾病影响的干预研究

doi: 10.3390/nu11081806
泡菜是一组腌制和发酵蔬菜的术语。它主要由大白菜或萝卜组成,并加入各种调味料(例如,辣椒、胡椒、大蒜、洋葱、生姜)、调味品(例如,盐、酱油、芝麻)以及其他辅助食材(例如,胡萝卜、苹果、梨、虾)。
泡菜的制作发酵
制作泡菜的过程中,首先将大白菜腌制并排水,然后添加剩余的调味品、香料和食品,与大白菜混合,最后进行发酵。发酵是由大白菜和混合物中食物自然存在的微生物发生的,尽管发酵剂培养物可用于泡菜的商业生产,但大白菜菜和混合物中天然存在的微生物会自发地进行发酵。
发酵前后的菌群变化
在发酵前,泡菜混合物中包含了来自明串珠菌属(Leuconostoc)、乳酸杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)、泛菌属(Pantoea)和魏斯氏菌属(Weissella)等多个不同细菌属的各种细菌物种。
然而,一旦开始发酵,细菌多样性就会下降,并在发酵后仅3天内迅速被明串珠菌属(Leuconostoc)主导。在这个属中,柠檬明串珠菌(Leuconostoc citreum)是发酵前最丰富的物种,但在发酵3天后其比例就很低,此时伴气明串珠菌(Leuconostoc gasicomitatum)和冷明串珠菌(Leuconostoc gelidum)变得占主导地位。
泡菜与其他食物的联合效应
由于泡菜可以包含各种各样的食材,其微生物组成会根据所含食物的类型和数量而有所不同。例如,当泡菜中含更多大蒜时,发现乳酸杆菌的浓度更高; 而添加红辣椒粉会导致魏斯氏菌(Weissella)比例增高,明串珠菌属和乳酸杆菌属比例降低。
一项动物研究显示,含有肠膜明串珠菌(Leuconostoc mesenteroides) DRC 0211的泡菜摄入可通过降低小鼠肝脏脂肪生成相关基因的mRNA表达和降低附睾脂肪组织中与炎症相关的单核细胞趋化蛋白-1和IL-6,展现出潜在的体重控制作用。
在大鼠身上,摄入由泡菜乳酸菌(Leuconostoc kimchi) GJ2发酵的泡菜后,血清总胆固醇、三酰甘油、低密度脂蛋白胆固醇水平以及动脉粥样硬化指数也显示出降低。
一项人体研究表明,摄入发酵8周的泡菜可导致与代谢途径和免疫相关的基因表达发生变化。在一种小鼠结肠炎模型中,从泡菜中分离出的嗜酸乳杆菌(Lactobacillus paracasei) LS2菌株可减少细胞因子产生、髓过氧化物酶活性以及固有层淋巴细胞中的巨噬细胞和中性粒细胞数量,提示其具有潜在的抗炎作用。

泡菜具有抗癌特性
一项体外研究显示泡菜可抑制胃癌细胞生长。值得注意的是,由于泡菜包含多种成分,其对肠道菌群和健康的影响被认为是其所含微生物以及食物制备过程中使用的食材营养成分(如植物化学物、纤维、维生素)的协同效应结果。例如,泡菜中的食物成分如红辣椒籽和大蒜也被认为具有抗菌和抗氧化效果。
小鼠实验:泡菜增加Adlercreutzia的比例
一项针对饮食诱导的肥胖小鼠模型的研究显示,从泡菜中分离出的植物乳杆菌(Lactobacillus plantarum) HAC01可以增加Adlercreutzia的比例,并降低拟杆菌属、Mucispirillum和瘤胃菌属(Ruminococcus)的比例,与对照组小鼠相比。
人体实验:泡菜增加乳杆菌,普雷沃氏菌属,明串珠菌,降低经黏液真杆菌属
在人体研究中,一项非随机对照研究纳入了6名韩国参与者,结果显示每天摄入300克泡菜4周,与每天摄入60克泡菜相比,可以增加粪便中的乳杆菌和明串珠菌的浓度,并降低粪便pH值。
其他几项非随机对照的人体研究也发现了类似的结果。在一项随机对照试验中,比较了24名肥胖女性摄入发酵泡菜和新鲜(未发酵)泡菜的影响,随机分配每天摄入180克发酵泡菜8周的女性显示,与基线相比,肠道核心菌属——经黏液真杆菌属(Blautia)的丰度降低,而普雷沃氏菌属(Prevotella)和拟杆菌属的丰度增加,但两组(发酵和未发酵泡菜)变形菌门和放线菌门的丰度都有所增加。
扩展阅读:
肠道核心菌属——经黏液真杆菌属(Blautia),炎症肥胖相关的潜力菌
不同成分的泡菜都增加产短链脂肪酸菌
另一项随机对照试验则比较了两种不同成分和数量制作的泡菜:
泡菜I 包含了白菜、萝卜、辣椒粉、大葱、大蒜、生姜、鳀鱼汁和糖;
而泡菜II 包含有机白菜、萝卜等多种成分,以及每克106个菌落形成单位的植物乳杆菌。
两组泡菜的摄入都导致产生短链脂肪酸的细菌,如粪肠球菌属(Faecalibacterium)、罗氏菌属(Roseburia)和考拉杆菌属(Phascolactobacterium)的丰度增加,同时降低了梭状芽孢杆菌属(Clostridium)和大肠杆菌(Escherichia coli)的丰度。
扩展阅读:
尽管没有直接比较两组泡菜的效果,但泡菜I被显示出与基线相比,放线菌门(Actinobacteria)的相对丰度增加,而变形菌门(Proteobacteria)的相对丰度减少。相比之下,泡菜II则产生了相反的效果,这表明泡菜中不同类型和数量的成分可能会以不同的方式影响肠道菌群。
酸面包发酵种是通过面粉中的乳酸菌和酵母发酵产生的,这些乳酸菌和酵母来源于面粉本身以及周围环境。
酸面包发酵
制作酸面包发酵种平均需要7天,过程中需要每天用新鲜面粉和水重新喂养微生物。一旦发酵种准备好,会取出一小部分加入酸面包的基本配料中,以启动酸面包的发酵过程——这种方法通常被称为“回种法”。与仅通过快速酵母发酵生产的标准面包不同,酸面包的共生发酵同时包含细菌和酵母,这被认为可以改善面包质量,包括质地、风味、营养含量和保质期,并且替代添加剂。
在发酵过程中,会发生微生物和酶引导的谷物碳水化合物、蛋白质、脂肪和酚类化合物的转化。微生物和酶的活性是相互关联的,例如,乳酸菌会导致pH值降低,调节谷物酶的活性和底物的溶解性(如麸质),反过来酶可以提供底物支持微生物的生长。

酵母发酵剂的微生物含量取决于所使用的传统做法,因此,最终产品的味道和质地以及营养成分都可能有很大差异。
酸面团发酵剂的微生物:乳杆菌常见
一般来说,酸面团发酵剂中已鉴定出乳杆菌属、明串珠菌属、魏斯氏菌属、片球菌属(Pediococcus)和链球菌属的几种菌种。
乳杆菌属是最常见的,而Lactobacillus sanfransiscensis是从大多数发酵剂中分离出来的关键细菌。酿酒酵母 (Saccharomyces cerevisiae)是最丰富的酵母菌种,其次是Candida milleri、 Candida humilis、小酒酵母 ( Saccharomyces exigious )和东方伊萨酵母 (Issatchenkia orientalis )。
酸面包带来健康益处,主要是通过其制作过程对面包营养成分的影响
例如,酸面团工艺可以降低面包中不可消化的低聚糖果聚糖和棉子糖(FODMAP 的类型)的含量,从而使 IBS 患者对面包的耐受性更好 。这种变化是由于酵母微生物,特别是如酿酒酵母和克鲁维酵母对寡糖的降解而发生的。
酸面团及其组成微生物也具有抗菌、抗高血压和降低胆固醇的特性,但这些都是基于体外研究,检查酸面团提取的细菌的影响,而不是烘烤的酸面团面包的影响。
酵母面包对肠道微生物群的影响:变形菌减少
与未发酵的面包相比,添加发酵 8 小时的酸面包后,健康对照样品中的双歧杆菌显着增加。与基线(接种前)相比,IBS 患者和健康捐赠者接种酵母面包发酵 8 小时后,δ-变形菌和 Gemmatimonadetes 显着减少。
此外,与未发酵面包和用酵母发酵16小时的面包相比,发酵8小时的酸面包在IBS样品接种15小时后产生的气体显着降低。作者认为这可能表明肠道微生物群发酵这种酵母面包的速度更慢。
然而,在体内,一项在20名健康成人中进行的随机交叉研究显示,每天摄入145克全麦酸面包1周,与每天摄入110克白小麦面包相比,在粪便微生物群组成上没有显著差异,整个两种面包干预期间,微生物群保持稳定。
酵母牛角面包:腹部不适、腹胀和恶心明显减轻
在一项双盲、交叉随机对照试验中,17 名健康成年人被随机分配吃一顿 2 个酵母牛角面包或 2 个啤酒酵母牛角面包,然后对胃排空进行磁共振成像分析。与啤酒酵母牛角面包相比,食用酵母牛角面包后胃总体积显着减少 11%,氢气产量显着减少 30%。腹部不适、腹胀和恶心明显减轻,表明酵母牛角面包比啤酒酵母牛角面包的耐受性更好。
此外,一项非常小的随机交叉试验包括7名报告轻微胃肠症状的参与者,结果显示食用酸面包黑麦面包后呼出的挥发性有机化合物(VOC)剖面与富含生物处理黑麦麸的小麦面包相比有显著不同,然而并未测量对胃肠症状的影响。这表明酸面包黑麦面包的潜在健康效果可能确实是通过肠道微生物群介导的。

编辑

doi: 10.3390/nu11081806
奶酪
奶酪的制作过程涉及到牛奶中的乳糖被乳酸菌等微生物发酵转化为乳酸的步骤。这个过程不仅使得奶酪产生独特的酸味,还有助于凝固奶蛋白,形成奶酪的固体结构。
在不同类型的奶酪生产中,可能会使用不同种类的发酵微生物,包括乳酸菌(如嗜热链球菌、乳酸乳球菌等)、霉菌(如青霉菌、白霉菌等)和其他发酵剂。
发酵橄榄
橄榄本身含有苦味物质,通常不能直接食用,需要通过发酵或其他处理方法来去除苦味并增加风味。
发酵橄榄的过程通常涉及将橄榄浸泡在盐水溶液中,有时还会添加其他调味料,如香料、柠檬酸、醋等。在这个环境中,有益的乳酸菌会繁殖并开始发酵过程,这些微生物会消耗橄榄中的糖分,产生乳酸,从而降低溶液的pH值。这个酸性环境有助于防止有害微生物的生长,并且随着发酵的进行,橄榄的苦味会逐渐减少,风味也会得到改善。

发酵橄榄的过程可能需要几周到几个月的时间,取决于所使用的具体方法和所需达到的风味强度。这个过程不仅增加了橄榄的可食性和风味,还提高了其保质期。发酵完成后的橄榄可以作为小吃、沙拉配料、披萨配料或其他菜肴的一部分来食用。
发酵辣酱
发酵辣酱是一种发酵食品。发酵辣酱的制作过程通常涉及将辣椒与盐混合,有时还会加入其他成分,如蒜、姜、蔬菜等。这些原料混合后会放置在适当的条件下进行自然发酵或控制发酵。这些是益生菌的良好来源。
在发酵过程中,盐水溶液(盐溶于辣椒释放的水分中)为乳酸菌等有益微生物提供了生长环境。这些微生物会消耗混合物中的糖分,产生乳酸,从而降低辣酱的pH值,形成酸性环境。这个环境有助于抑制有害微生物的生长,并且使辣酱具有独特的酸味和复杂的风味。
鱼露
鱼露是东亚和东南亚美食中的主食,是一种由发酵小鱼(通常是凤尾鱼)和盐制成的调味液,所得酱汁是咸鱼的液体副产品。在发酵过程中,鱼类和盐的混合物会自然分解,其中的蛋白质被酶和微生物分解成氨基酸,产生独特的强烈风味和鲜味。这个过程中产生的液体就是鱼露,它通常具有咸味和鱼的鲜味,是许多东南亚菜肴不可或缺的风味增强剂。鱼可以发酵几个月或长达几年,发酵过程中会出现活细菌,除非鱼露经过巴氏灭菌。
醋
醋是一种通过发酵过程制成的食品。醋的生产通常涉及两个基本的发酵步骤:

不同类型的醋使用不同的原料和发酵方法。例如,白醋通常由谷物酒精发酵而成,苹果醋来自苹果或苹果汁,而葡萄酒醋则是由葡萄酒发酵制成。每种醋都有独特的风味特点,这些特点取决于原料、发酵过程、成熟时间以及是否有其他调味成分的添加。
生姜啤酒
传统酿造生姜或根汁啤酒的制备方法与康普茶类似;酵母和乳酸菌的共生菌落有助于将生姜、糖和水发酵成美味的碳酸饮料。
生姜作为缓解消化不良的天然家庭疗法已经被世世代代使用,并且由于现代科学研究,我们现在知道生姜具有多种治疗作用。生姜含有抗氧化、抗炎和免疫支持化合物。
发酵啤酒的制作过程涉及到使用特定的微生物——酵母,来将麦芽中的糖分转化为酒精和二氧化碳。酵母是一种单细胞真菌,能够进行有氧或厌氧代谢。在啤酒的发酵过程中,酵母主要进行的是厌氧代谢,即酒精发酵。
因此,这种富含益生菌的饮料可能是比其他替代甜碳酸饮料更好的选择。话虽如此,需要知道即使是姜汁啤酒也可能含有多余的糖分。
客观的说,发酵食品的健康益处目前还是常常被夸大了。虽然发酵食品确实与健康益处有关,但是其他像治疗“渗漏性肠炎”或替代抗生素疗法的声明却缺乏足够的证据。
发酵食品确定的健康益处
包括:食品保存、提高营养的生物利用度、改善消化耐受性。利用发酵作为食品保存的手段可以提高食品安全性、可获得性,并保留营养成分。
通过发酵过程,食物成分的转化还可以通过降低抗营养因子(如植酸和单宁)的含量来提高营养的生物利用度。通过降低这些抗营养因子的含量,钙、铁和镁等微量元素的生物利用度就会提高。
发酵食品微生物的短暂性
当前的研究表明,来自发酵食品的微生物是短暂存在的。个体的微生物组已经建立并且对于定植有抵抗力;没有可以定植的生态位,因此它们的益处是可能短暂的。由于这些微生物的短暂性,我们可以推断,发酵食品的益处也可能只在个体食用的期间存在。
通常食用发酵食品的影响是短暂的,但某些影响,例如微生物群组成变化,可能会持续存在
活菌的摄入与肠道菌群和免疫系统积极互动,抑制病原菌,降低疾病风险
许多流行病学研究表明,随着发酵食品摄入量的增加,慢性疾病(如糖尿病和心血管疾病)的患病风险往往会降低。目前的理论是活菌的摄入会与我们自身的肠道微生物和先天免疫系统产生积极互动,有助于抑制病原菌的生长,并提供发酵代谢产物,从而对我们的健康有益。虽然一些益处已经被广泛研究,但其他一些益处更多是理论假设,还需要进一步的研究证实。
发酵食品摄入量逐步增加:炎症细胞因子下降,菌群多样性提高
一个最近的研究探讨了总体发酵食品摄入量对人体免疫系统的调节作用。该随机前瞻性研究纳入36名患者,要么接受高纤维饮食,要么增加发酵食品的摄入。研究监测了患者干预前3周的状况,然后进行为期4周的“逐步增加”阶段,参与者逐步增加高纤维或高发酵食品的饮食,维持6周饮食,以及4周的“自选饮食”,参与者在这期间根据自己的意愿维持饮食。
研究人员发现,在发酵食品组中,每天摄入约6份发酵食品的人(基线时每天仅摄入0.4份发酵食品)的炎症性细胞因子有所下降。
此外,随着发酵食品摄入量的增加,微生物多样性也有所提高。这是首个评估总体发酵食品摄入量及其对免疫功能影响的研究。虽然还需要进一步研究,但它开始探索膳食建议如何转变为包含总体发酵食品目标,以积极影响人类健康。
在世界各地,每种文化都有其独特的食品文化和传统,其中包括发酵食品。在发展中国家,生活在贫困中的人们的主要优先事项并非食品卫生、安全和营养因素,他们消费的食物中可能含有化学、微生物、人畜共患病以及其他危害,可能对健康构成风险。
非洲:大量食用乳酸发酵产品的地方,精神障碍和抑郁症的率比较低
非洲的传统发酵食品和饮料自古以来就被使用,整个大陆上有多种多样的发酵食品和饮料,主要是酸性粥和饮料。
在发展环境中,乳酸发酵和酒精发酵是最受欢迎的发酵类型,约80%的人口仍然寻求传统医治者的帮助,他们会开具本土产品。
在非洲,大量食用乳酸发酵产品的地方,精神障碍和抑郁症的率比较低,但疾病的发生率并不低于发达社会,除了饮食以外还有其他可能加剧疾病的因素,如社会经济变化、城市化、饮食习惯的改变,以及最近青年中的久坐行为。
撒哈拉以南非洲的人民常常遭受内战、干旱、洪水、饥荒和疾病的困扰,但拥有巨大的植物和草药生物多样性,他们倾向于依赖传统医治者,后者通常将精神疾病解释为附身或诅咒,并通过仪式以及推荐传统植物、草药、发酵食品和饮料来处理精神健康问题。
非洲的许多农村社区完全依赖传统发酵食品作为营养的主要来源
同时也用于文化传统实践。在莫桑比克和津巴布韦,传统发酵食品用于四个月大的婴儿断奶。最常见的发酵食品是mahewu,这是一种传统的、发酵的、麦芽的、酸的、非酒精性的玉米或木薯稀粥,酸奶和酸粥。
坦桑尼亚的发酵糊状食品togwa,可以在卫生条件较差的地区防止食源性疾病。但每个人在需求和营养上都是独一无二的。我们大多数人在想到过敏时只会想到组胺,但实际上作为潜在益生菌来源的本土发酵食品和饮料对一些人可能有治疗作用,而其他人可能对组胺不耐受,因为没有无组胺饮食,而这种胺在身体中有许多功能,自然发生,是中枢神经系统中的一种神经递质。
在非洲,水果和蔬菜由于其高水活性和营养价值而容易腐烂。这一现象在热带和亚热带国家更为严重,这些国家的气候有利于腐败微生物的生长。在非洲、亚洲和拉丁美洲的发展环境中,可能对益生菌和发酵食品的需求最大,因此许多发酵果蔬食品被开发出来。
食品发酵的主要目的是增加食品或饮料的保质期,并因此提高其安全性以供消费。发酵通过多种方式达到这个目的,包括通过产生有机酸来降低水分活性和pH值。
用于发酵的微生物是非致病性的,被认为是安全的。尽管对大多数人来说是安全的,但应该注意,发酵的一些副产品可能对健康产生负面影响,最值得注意的是酒精和生物胺。例如组胺和酪胺等生物胺的产生,可能对被诊断有肥大细胞疾病的患者或正在使用单胺氧化酶抑制剂(MAOIs)的患者产生负面影响。
通过发酵,氨基酸被脱羧释放出生物胺,这些生物胺在发酵的肉类和鱼类产品、奶酪、葡萄酒和啤酒中含量较高。对于那些服用单胺氧化酶抑制剂的人来说,限制生物胺和发酵食品的摄入可能是明智的,对于那些有组胺不耐症或肥大细胞激活症的人来说,这样做可能也有帮助。
发酵是一种古老的实践,用于保存食物和饮料,以提供更好的口味,改善营养和食品安全,有机保存食品,并促进健康属性。
食物和饮料的发酵可以改善产品的储存时间、安全性、功能性、感官品质和营养品质。发酵不仅有助于延长货架寿命,还可以安全有效地增强营养属性。
多种食物包括乳制品、蔬菜、豆类、谷物、淀粉根类和水果以及肉类和鱼类,都可以发酵。
在某些人群中,发酵食品和饮料可能占人类饮食的5-40%。
肠道微生物群可能会接触到多种逃避肠道消化的饮食成分,并可能受到植物化学物的影响。植物化学物质是存在于水果、蔬菜、全谷物、豆类、豆科植物、草药、香料、坚果和种子中的非营养性天然化学物,负责产生生理属性,并保护植物作物免受各种环境压力的侵害。
关于发酵食品和饮料与益生菌概念之间存在相当的混淆,重要的是要澄清发酵食品并不等同于益生菌的常见误解。尽管发酵食品可能包含益生菌,但它们的活性微生物含量是未定义的。
益生菌能够通过有益微生物更新、修复和生长消化道内衬组织,中和有害微生物。有用的活性微生物能够正确发酵我们的食物,从而改善我们的健康。尽管发酵食品和饮料对胃肠健康和疾病有影响,但它们的健康益处或推荐消费量尚未广泛纳入全球食品指南。
当发酵食品和饮料补充了益生菌细菌时,它们提供了许多额外的营养和健康特性。发酵食品和饮料比以往任何时候都更受欢迎,而对其健康益处的研究相对较新。并非所有发酵食品都含有活性微生物;例如,啤酒和葡萄酒在生产过程中经历了去除微生物的步骤,其他如面包的发酵食品则经过热处理,微生物被灭活。

目前消费者越来越频繁问到 “我应该食用发酵食品吗,或食用哪些发酵食物比较好?”或者遇到试图利用发酵食品来治疗他们消化症状的患者。
发酵食品通常被认为对健康有益,特别是对肠道健康。但是正如前面上面提到的,目前关于发酵食品对胃肠道健康有效性的科学证据仍然有限,且研究质量参差不齐。因此,当推荐消费者食用发酵食品时,应该提供以下建议:
逐量添加:如果消费者不习惯食用发酵食品,建议他们逐渐添加到饮食中。这样可以帮助肠道微生物群逐步适应,并减少可能出现的消化不适,如胀气或腹泻。
个体化选择:由于每个人的身体和健康状况不同,建议消费者选择适合自己的发酵食品。例如,乳糖不耐受的人可能需要避免含乳糖的发酵乳制品,转而选择非乳制的发酵食品,如泡菜或豆豉。
了解发酵食品:不同的发酵食品具有不同的营养和健康益处。例如,酸奶和开菲尔富含益生菌,有助于维持肠道微生物平衡;泡菜和酸菜含有丰富的维生素C和纤维,可以促进消化;而味噌和天然酿造的酱油则提供了丰富的氨基酸。
注意食品来源:推荐消费者选择自然发酵且未经高度加工的食品,这些食品更有可能含有活性的益生菌。选择未经过度加工和含有活性微生物的发酵食品。市场上的一些产品可能经过巴氏杀菌处理,这会杀死有益的微生物。因此,查看标签并选择含有“活性微生物”或“活性益生菌”的产品。
监测身体反应:建议消费者在尝试新的发酵食品时,留意身体的反应。如果发现消化不适或其他不良反应,应该减少摄入量或停止食用,并咨询医生。
谨慎治疗性使用:如果消费者试图通过食用发酵食品来治疗消化症状,应该提醒这种做法的证据基础不足。鼓励寻求专业医疗建议,并将发酵食品作为整体治疗计划的一部分,而不是唯一的治疗手段。
整体饮食模式:发酵食品应该作为均衡饮食的一部分。确保饮食中还包含了丰富的蔬菜、水果、全谷物、蛋白质和健康脂肪,以支持整体健康。
通过这些建议,可以更好地将发酵食品融入你的饮食中,同时确保这些食品对自己的健康带来积极的影响。
主要参考文献
Dimidi E, Cox SR, Rossi M, Whelan K. Fermented Foods: Definitions and Characteristics, Impact on the Gut Microbiota and Effects on Gastrointestinal Health and Disease. Nutrients. 2019 Aug 5;11(8):1806.
Leeuwendaal NK, Stanton C, O’Toole PW, Beresford TP. Fermented Foods, Health and the Gut Microbiome. Nutrients. 2022 Apr 6;14(7):1527.
Marco ML, Sanders ME, Gänzle M, et al. The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on fermented foods. Nature Reviews Gastroenterology & Hepatology. 2021;18(3):196-208.
Dimidi E, Cox SR, Rossi M, Whelan K. Fermented foods: definitions and characteristics, impact on the gut microbiota and effects on gastrointestinal health and disease. Nutrients. 2019;11(8):1806.
Rul F, Béra-Maillet C, Champomier-Vergès M, et al. Underlying evidence for the health benefits of fermented foods in humans. Food & Function. 2022;13(9):4804-4824.
Wastyk HC, Fragiadakis GK, Perelman D, et al. Gutmicrobiota-targeted diets modulate human immune status. Cell. 2021;184(16):4137-4153.
Gardini F, Özogul Y, Suzzi G, Tabanelli G, Özogul F. Technological factors affecting biogenic amine content in foods: A review. Frontiers in microbiology. 2016;7:1218.
Maintz L, Novak N. Histamine and histamine intolerance. The American journal of clinical nutrition. 2007;85(5):11851196.
Weinstock LB, Pace LA, Rezaie A, Afrin LB, Molderings GJ. Mast cell activation syndrome: a primer for the gastroenterologist. Digestive Diseases and Sciences. 2021;66(4):965982.
Savaiano DA, Hutkins RW. Yogurt, cultured fermented milk, and health: A systematic review. Nutrition reviews. 2021;79(5):599-614.
Patro-Golab B, Shamir R, Szajewska H. Yogurt for treating antibiotic-associated diarrhea: systematic review and metaanalysis. Nutrition. 2015;31(6):796-800.
Skokovic-Sunjic D. Clinical Guide to Probiotic Products Available in Canada. probioticchart.ca. Accessed September 14, 2022.
Turan İ, Dedeli O, Bor S, İlter T. Effects of a kefir supplement on symptoms, colonic transit, and bowel satisfaction score in patients with chronic constipation: a pilot study. Turk J Gastroenterol. 2014;25(6):650-656.
Bekar O, Yilmaz Y, Gulten M. Kefir improves the efficacy and tolerability of triple therapy in eradicating Helicobacter pylori. Journal of medicinal food. 2011;14(4):344-347.
Nielsen ES, Garnås E, Jensen KJ, et al. Lacto-fermented sauerkraut improves symptoms in IBS patients independent of product pasteurisation–a pilot study. Food & function. 2018;9(10):5323-5335.
Fujisawa T, Shinohara K, Kishimoto Y, Terada A. Effect of miso soup containing Natto on the composition and metabolic activity of the human faecal flora. Microbial ecology in health and disease. 2006;18(2):79-84.
Altobelli E, Del Negro V, Angeletti PM, Latella G. LowFODMAP diet improves irritable bowel syndrome symptoms: a meta-analysis. Nutrients. 2017;9(9):940.
Loponen J, Gänzle MG. Use of sourdough in low FODMAP baking. Foods. 2018;7(7):96.

谷禾健康

今年的天气,如此的奇怪:
短袖和羽绒服之间,只差了一个降温
忽冷忽热,气温仿佛过山车…
11月初多地气温破纪录,冬天集体迟到…
早穿皮袄午穿纱,每天不知道穿啥…
再不冷都不好意思过圣诞了…
好在前几天,冷空气又开始冲业绩了!
当我们以为无限接近冬天的时候,
本周四温度又会飙升到20多度温暖如春…
之后又开启从二十多度到零下,断崖式下跌…


<截止发文前12月12日12:00 杭州天气预报>
气候变化改变了许多生态系统,对全球生物多样性产生了不利影响。有时候我们看到的表面上只是温度的变化,而在这背后,气候变化可能是多维的,超出了单一因素的变化。
这些因素包括气候变化和降水模式的改变、极端天气事件的强度和持续时间的增加以及季节性的变化。这些影响可以组合作用或产生涉及间接途径的级联反应,例如改变环境、食物供应等,从而影响人体健康。由此,人们越来越能感受到,异常天气直接或间接对胃肠道、肝脏、神经系统等疾病的影响。
而人体内和动物身上的微生物群,也可以受到一系列环境变量的影响。微生物群的变化会影响宿主的健康和生理机能。
注:微生物群可以代谢食物产生能量,支持免疫系统的发展和病原体的排除,并介导内分泌和神经功能。
气候驱动的宿主相关微生物群的变化可能会加剧气候变化对宿主的负面影响,或者可能通过增强宿主可塑性来缓冲气候变化的影响。
本文我们来了解一下,气候变化与人体健康之间的关联,包括胃肠道、肝病、心理健康等,其中一些联系是推测性的,需要研究来确认因果关系,了解这些可能有助于开发一些潜在的适应和缓解策略。
气候变化对身体、心理健康的影响
dx.doi.org/10.1136/gutjnl-2023-331187
我们知道人体是恒温动物,体温维持在一定范围内,环境温度的变化不会影响体温。但人体需忍受环境温度的变化才能确保自身的生存和繁殖。为此会作出一系列的应激响应:
生命的组成部分本质上都对温度敏感。当温度太高时,蛋白质会变性,核酸会失去碱基配对,质膜会过于流动。当天气太冷时,一切都会变慢:酶的工作效率低下,质膜变得僵硬。
同样,温度变化会影响肠道各组分的生理功能,从而导致肠道功能紊乱。例如,低温可能减弱肠道蠕动,影响粪便排泄;极端高低温可能降低肠道黏膜的免疫功能。
天气较冷的时候,有些对冰凉的食物很敏感,可能一不小心就会腹泻、便秘或腹痛等情况发生,但并非每个人都这样。同样的环境同样的饮食,部分人容易出现肠道症状,而另一部分人没有不适,这可能与肠道菌群相关。
从某种角度来说,温度也会影响肠道菌群。

Getty Images; iStock
微生物和其他生物体会在特定温度范围内生长,并对超出其最佳状态的温度做出响应。
大肠杆菌和其他肠杆菌科成员具有耐热性;这个科中的许多物种在比典型吸热宿主更冷和更温暖的温度下都能很好地生存。例如,肠道致病性耶尔森氏菌将在接近 0°C 的温度下继续生长,而实验室中的大肠杆菌菌株将从大约 8°C 生长到 42°C,并且很容易进化到在高达 48°C 或更高的温度下生长。
事实上,变形菌门的成员在响应许多环境压力时具有功能灵活性。此外,该组的致病成员(如沙门氏菌、耶尔森氏菌、假单胞菌和致病性大肠杆菌)明确响应宿主温度,将其用作上调毒力基因的环境线索。
这些温度响应基因在 42°C 的发烧样温度下往往比在 37°C 时更强烈地上调;铜绿假单胞菌中的温度响应酶同样显示出高达 45°C 的效率增加。艰难梭菌是另一种主要的人类肠道病原体,在 37°C 和 41°C 的体外生长同样良好。
总之,这些观察结果表明,肠道病原体既能耐受又能利用宿主温度变化。
天气冷起来了,人们往往会选择一些高热量的食物,饮食中可能会选择一些高脂肪类的食物,如牛肉、羊肉、猪肉等,但不一定很快长胖。
一篇文献探讨了哺乳动物肠道微生物群对寒冷暴露和宿主体温过低的反应性。啮齿动物和人类中,Lachnospiraceae 的丰度和多样性以及短链脂肪酸的产生随着体温下降而持续增加。体温过低的小鼠也具有更好的代谢健康,并且不太容易受到高脂肪饮食诱导的肥胖。
微生物群通过影响宿主产热,帮助维持体温
有大量证据表明微生物群不仅对低温有反应,而且还会影响宿主的产热作用。在冷应激期间,哺乳动物主要通过非颤抖产生体热,这是棕色脂肪组织中发生的代谢过程。
在寒冷暴露中,动物能够通过激活棕色脂肪组织(BAT)来产生热量,同时通过促进白色脂肪组织“褐变”的方式来维持体温。
在非颤抖产热过程中,宿主线粒体蛋白 UCP1(解偶联蛋白 1)将质子运输与 ATP 合成解偶联,从而产生热量。
微生物群改善饮食中的能量获取
缺乏微生物群的哺乳动物在基线时体温较低,暴露在寒冷环境中会经历更严重的体温过低。这可能是因为当微生物群存在时,可以改善饮食中的能量获取,促进产热。
暴露于寒冷环境 1-6 天的小鼠肠道微生物群表现出群落多样性下降、厚壁菌门:拟杆菌门比例下降、疣微菌相对丰度降低。
寒冷应激的传统饲养动物中短链脂肪酸产量的增加,似乎是食物摄入量增加的结果,从而为微生物代谢并最终为宿主产热提供了更多燃料。
当粪便从体温过低的啮齿类动物移植到健康啮齿类动物时,短链脂肪酸的产生和体温调节能力也得到改善。
微生物发酵纤维也会直接产生代谢热
人类肠道微生物群在发酵过程中产生 60 kcal/h 的热量,约占个体静息时产生的总热量的 70%。
这些发现共同表明,微生物群的代谢活动有助于促进宿主产热。
以上是寒冷也就是气温下降后,人体及肠道微生物群的变化。气候变化同时也意味着极端高温事件的出现,那么炎热的天气又会对人体及肠道菌群带来什么影响呢?
环境温度升高与肠病、肾病、胆病之间存在关联
热浪与炎症性肠病(IBD)患者急性发作的风险增加有关。在热浪期间,热浪期间每增加一天,IBD发作的风险增加4.6%(95%置信区间(CI):1.6-7.4%,P=0.0035),传染性胃肠炎发作的风险增加4.7%(95%CI:1.8-7.4%,P=0.0020)。
环境温度升高与胆道疾病入院之间也存在潜在联系;潜在的机制仍有待阐明。
一项研究汇编了 1999 年至 2009 年加利福尼亚州肝胆和肾脏系统疾病的每日住院人数数据,并将其与气象数据相匹配。温暖季节较高的平均温度与尿路感染[每10°F变化百分比:7.3,95% CI:5.6,9.1]、败血症[增加百分比:2.9;95% CI: 1.5,4.3]、尿路结石[增加百分比:15.2;95% CI:10.3,20.4]和复合性肾病的入院率显著增加有关。此外,温度升高与胆道疾病入院人数增加有关。
极端高温会影响哺乳动物的生理功能
患有慢性疾病(例如慢性肝病)的人更容易受到过热的影响。
注:过热定义为体温调节失效导致核心温度高于36℃-37.5℃的正常范围。过热与发热这一更常见的体征不同,后者由炎症反应时细胞因子激活所致,受下丘脑水平调控。
极端高温对人体的影响包括:
以上我们是从直接的角度来了解温度变化对人体的影响,从更宏观的角度来说,温度改变也意味着气候的变化,这可以从土壤、空气等环境来间接影响人体健康。
气候变化→土壤菌群→肠道菌群→慢病
气候变化相关的温度升高会对土壤微生物的生长产生负面影响,导致土壤微生物组成的改变。研究表明,全球变暖可以通过减少土壤不稳定的碳、增加寡营养细菌(Oligotrophic bacteria),减少真菌和放线菌来改变生态系统。土壤微生物组组成的改变可能会影响土壤中磷、硫和氮的循环。
土壤微生物组组成的退化直接影响生产农产品的土壤质量下降。土壤中有机物含量低,会降低作物微量营养素的质量和数量,人类严重依赖农产品和畜牧业来满足食物需求。肥沃的土壤会创造出优质、有益健康的食物,对身体健康产生积极影响。然而,土壤中营养物质和养分的缺乏,会降低食物的营养价值,进而损害肠道菌群的正常功能和新陈代谢。
粮食作物质量的降低可以通过增加变形菌丰度和减少拟杆菌来改变肠道微生物群的组成。这些变化会通过改变体内必需微量和大量营养素的产生来进一步影响人类健康状况。
气候变化→农作物歉收、化学品→肠道菌群→慢病
由于气候变化,农作物歉收现象日益严重;用于作物生长的化学品和杀虫剂可能会改变肠道微生物组的组成,降低肠道菌群多样性。
由此产生的肠道菌群失调可能会影响肠易激综合征、炎症性肠病 (IBD) 和结直肠癌的病理生理学,以及从肥胖到神经退行性疾病的非胃肠道疾病。
doi: 10.3390/ijerph18115510
空气污染→炎症、氧化应激、肠道菌群→慢病
空气污染和颗粒物 (PM) 水平上升现在也与人类许多器官系统疾病的发展有关,并可通过炎症、胰岛素抵抗和氧化应激产生影响。空气污染与脂肪肝病、慢性肝损伤和肝硬化的发生有关,但具体机制仍有待确定。
颗粒物与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
代谢功能障碍相关的脂肪肝病 (MASLD) 与气候危机有关
因为农业破坏和粮食不安全的加剧,导致对超加工食品的依赖以及随后出现的营养不良和/或肥胖,空气质量差,导致缺乏户外运动和积极旅行,久坐不动的生活方式和肥胖。许多医生担心气候变化、肥胖和营养不良的协同流行正在导致 MASLD 的流行。
微囊藻毒素(蓝绿藻的一种肝毒性副产品,由于气候变化而增加,会污染饮用水和游泳场所)可导致进行性 MASLD,并通过其对微生物组的影响增加炎症性肠道病理学和实验模型中的恶性肿瘤。
气候可以改变肠道微生物群组成
并通过直接和间接途径影响宿主的健康
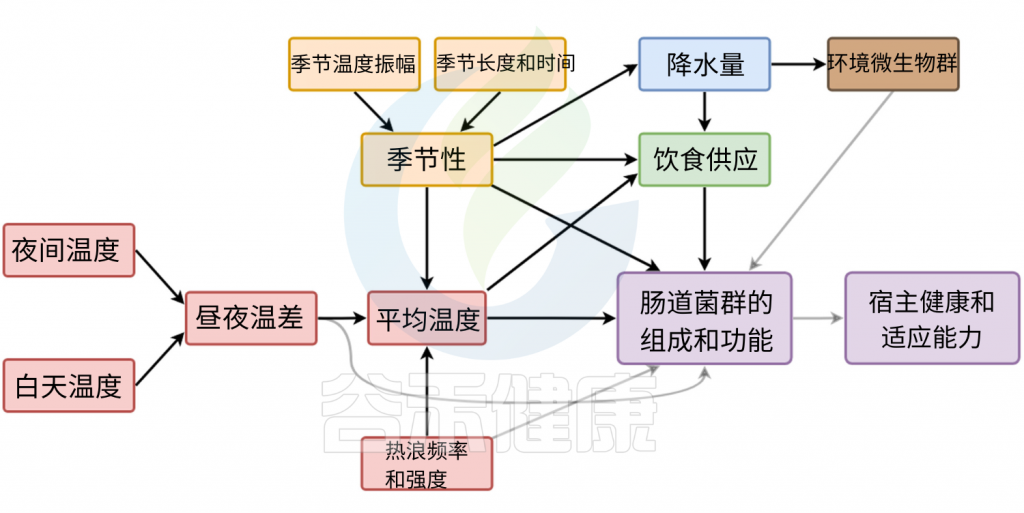
doi.org/10.1111/1751-7915.14276
气候变暖下的冰川融化,传染病增加
人类遇到的超过 50% 的传染病因气候变化而加剧,预计到 2030 年,腹泻病发病率将增加 10%,主要影响幼儿。
与气候变化相关的洪水导致饮用水污染和甲型肝炎和戊型肝炎等水源/肠道感染的爆发。人们发现冰川中肠道病毒含量丰富,由于全球变暖加剧,冰川融化时,这些冰川和永久冻土中处于休眠状态的病毒和细菌病原体可能会被唤醒,并在周边现有和新的动物群之间传播。大量新型病毒颗粒会释放到相连的水体中。海水温度上升也为肠道病毒提供了更适宜的环境。
气温升高,细菌性疾病风险增加,部分病毒病原体风险降低
某些细菌的生长;胃肠道细菌感染(包括弧菌感染)已有报道,甚至远至波罗的海和北海附近的地区。平均气温每升高 1°C,非伤寒沙门氏菌病、志贺氏菌病、弯曲菌病、霍乱、大肠杆菌肠炎和伤寒病的发病风险就会增加。由于气候变化引起的洪水,带来钩端螺旋体病、弯曲杆菌和隐孢子虫病的爆发。
另一方面,轮状病毒和诺如病毒在全球变暖的环境中可能会减少,因为这些病毒在较温暖的温度下生存能力较差。在 4°C 下观察到的轮状病毒感染性高于 20°C 下的轮状病毒感染性。
以上,我们了解了气候变化通过土壤微生物群、农用化学品、空气污染物、冰川融化等方面来影响肠道菌群,从而影响人体健康。
据报道,气候危机对心理健康产生负面影响,进而影响胃肠道健康。粮食不安全和生活成本都受到影响。
doi.org/10.1016/j.hnm.2022.200165
生态焦虑和压力与物质滥用有关
这可能与酒精相关的胃肠道疾病和病毒性肝炎的发展有关。北极的升温速度大约是全球变暖平均速度的四倍,越来越多的文献记录了这些变化对人们心理健康和药物使用脆弱性的影响。
气候变化与物质使用增加联系起来的途径
doi.org/10.1177/17456916221132739
气候变化正在增加急性和慢性环境压力源的频率和严重程度 (a)。这些压力源的影响因个人脆弱性和接触严重程度而异 (b),并通过五个独立途径增加有害物质使用风险 (c)。这些途径会引发与增加有害物质使用 (d) 相关的适应不良应对措施,需要采取缓解和适应行动 (e)。这五种途径中的每一种都可以单独、并行或交互地操作以增加风险。
气候变化引发恐惧、内疚、焦虑、悲伤等情绪
世界各国调查显示,气候变化会引发强烈而复杂的情绪反应,包括担忧、恐惧、愤怒、内疚、焦虑、悲伤、绝望等情绪,尤其是在年轻人中。
一项针对 10 个国家 10000 名 16-25 岁人士的调查发现,超过 45% 的受访者表示,他们对气候变化的想法和感受损害了他们的日常生活和功能,年轻人感到“没有未来”,“人类注定要灭亡”等。
当我们感到压力或焦虑时,由于大脑向肠道发送的信号,我们最终可能会感到胃部或肠道不适。另一方面,肠道通路的破坏可能会影响我们身体的压力反应、情绪唤醒、情绪、动机,甚至更高层次的认知功能,如决策。
微生物群-肠-脑轴 (MGB) 的双向交流
Singh S,et al., Microorganisms.2022
一些研究表明,精神疾病患者有“肠漏”,这使得肠道微生物能够通过肠道屏障进入血液。循环中的白细胞可以感知这些微生物,并通过释放一些细胞因子引起炎症反应,这些物质能够穿过血脑屏障并直接作用于大脑。这种不健康的炎症级联反应也与抑郁和焦虑有关。
肠-脑相互作用障碍的负担也可能随着酒精的增加而增加。
尽管这些负面情绪状态不应与精神病学诊断混为一谈,但对自然环境的破坏可能导致情绪困扰,并且情绪状态会影响物质使用。例如,负面情绪状态与吸烟者对尼古丁的渴望有关,并且在药物滥用复发中发挥重要作用。悲伤(但并非所有负面情绪状态)与长期烟草成瘾的风险增加有关。
➤1
温度影响骨骼疾病
外部温度是影响生理各个方面的环境参数,需要生物体不断适应其波动。骨质疏松症是最常见的代谢性骨病,其特征是骨量低和微结构恶化,导致骨骼脆弱并增加骨折风险。宿主对寒冷的适应部分是由肠道微生物群组成的改变介导的。
一项研究发现,温暖暴露(34°C)可以通过增加骨小梁体积、连接密度和厚度来防止卵巢切除引起的骨质流失,从而提高成年雌性和年轻雄性小鼠的生物力学骨强度。
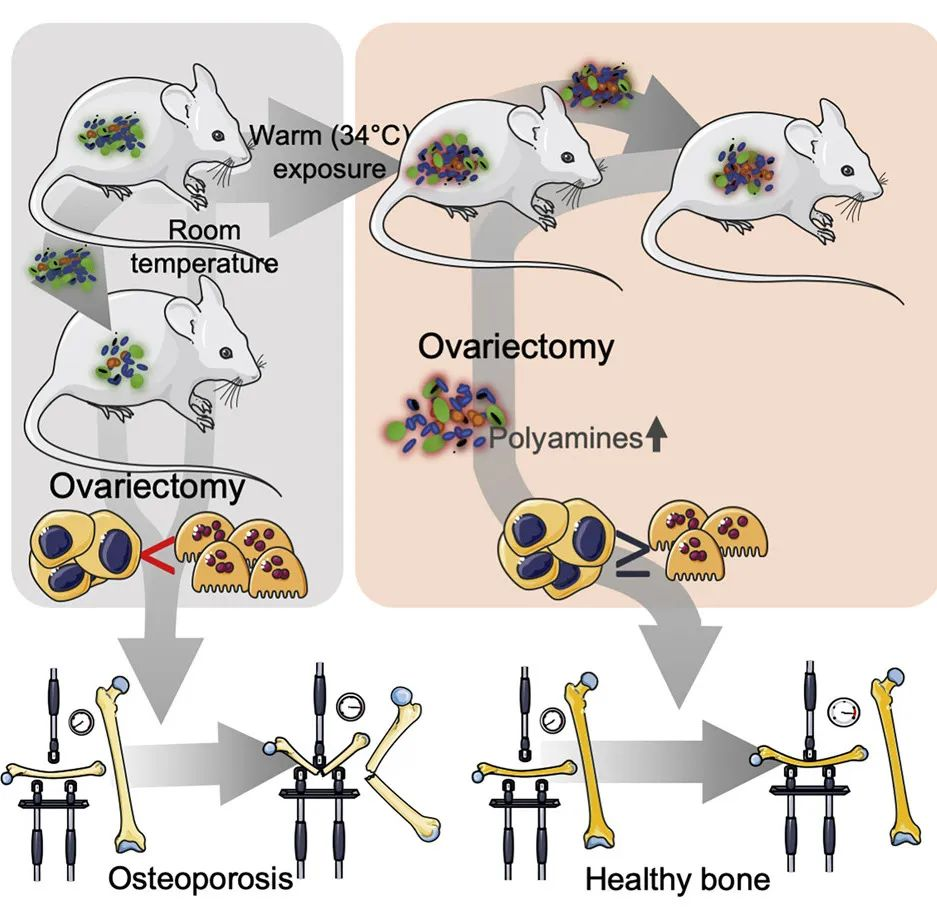
doi.org/10.1016/j.cmet.2020.08.012
温暖会改变肠道微生物群的组成,温暖暴露后, Akkermansia muciniphila 的丰度显着增加。移植适应温暖的微生物群表型可复制温暖对骨质流失的保护作用。组合宏基因组学/代谢组学分析表明,温暖可增强细菌多胺生物合成,导致体内总多胺水平更高,从而增强骨骼强度。
人们普遍认为地球正在以前所未有的速度变暖,作物的地理分布和产量以及作物的叶际微生物群预计将受到气候变化的强烈影响。例如,产真菌毒素的黄曲霉能够在高温和干旱条件下生长。黄曲霉在极端炎热和干燥条件下的恢复生长是一个预期的和正在出现的困境。
摄入受污染的食物后,胃肠道尤其容易受到霉菌毒素的影响。一般来说,胃肠道中的肠道屏障起到过滤有害霉菌毒素的作用。然而,一些霉菌毒素对胃肠道产生有害影响,霉菌毒素可以改变正常的肠道功能,例如屏障功能、营养吸收,甚至影响肠道的组织形态。
黄曲霉毒素AFB1——肝致癌物
在气候变暖的情况下,真菌产生的黄曲霉毒素预计与原发性肝癌发病率增加有关。在人类食品和动物饲料中发现的最常见的霉菌毒素是AFB1。AFB1是公认的有效的肝癌物,并被国际癌症研究机构列为I类致癌物。肝脏是AFB1的主要靶点。AFB1和肝细胞癌之间存在很强的联系。同时,急性黄曲霉毒素中毒会引起腹痛、呕吐、水肿和死亡。
赭曲霉毒素OTA——肾致癌物
赭曲霉毒素主要由曲霉属和青霉属产生,赭曲霉毒素A(OTA)是该组中最普遍和最相关的真菌毒素。OTA的主要靶点是肾脏。先前的动物研究结果表明,OTA是一种有效的肾致癌物,国际癌症研究机构将 OTA 归类为可能对人类致癌的 2B 组致癌物。除此之外,OTA 是一种免疫抑制、致畸和肾毒性化合物。
室外空气污染、PM2.5——食道癌、肝癌
室外空气污染和PM(<2.5 μm)被认为是与气候密切相关的致癌物质改变。人们推测 PM 暴露与食道癌的发生之间存在联系。
一项对我国成年人的大型前瞻性队列研究发现,长期接触 PM 2.5与食道癌风险升高相关。
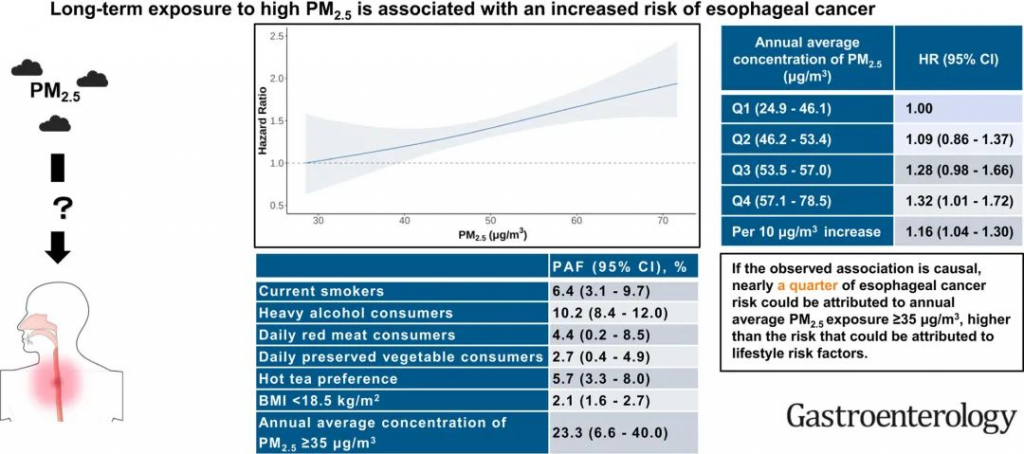
doi.org/10.1053/j.gastro.2023.03.233
对于每增加10μg/m3的PM2.5,食管癌发病率的风险比(HR)为1.16(95% CI,1.04–1.30)。
最近的一项系统评价提供了 PM 与结直肠癌和肝癌之间关联的证据,其中肝癌的证据最为有力。
据报道,塑料废物(由化石燃料制成)也具有致癌性,尽管日益严重的内部微塑料污染(目前通过受污染的海鲜和其他来源影响到世界各地的大多数人)对胃肠道疾病的影响尚不清楚。值得注意的是,在人类肝脏中检测到了微塑料。
人体组织样本中发现的 MP 颗粒示例
doi.org/10.1016/j.ebiom.2022.104147
气候变化是一个全球性的问题,气候变化与肠道菌群之间存在密切的关联,进而影响免疫调节和炎症过程。正在发育的免疫系统很容易受到气候变化的影响,从而改变个体对感染、特应性和自身免疫性疾病的易感性。这种影响可能导致胃肠道疾病的发展和加重。
因此,了解气候变化通过肠道菌群影响胃肠道疾病的途径,对于预防和治疗这些疾病至关重要。
考虑到未来随着全球气候变暖,环境温度的升高,细菌性肠道病原体引起的肠道感染可能会增加。一些风险可能在出生前就开始了,并在整个发育过程中产生叠加、交互和累积效应。
除了传统的感染后吃药等手段治疗之外,我们需要更多的监测方式,例如肠道菌群检测,提前预测潜在的肠道感染风险,并采取针对性的预防措施。
建立更强大的肠道菌群对于缓解极端气候变化带来的心理压力,减少细菌性肠道病原体的传播和感染风险是必要的。同时,我们也可以从个人做起,加强对环境问题的重视,共同为健康的未来努力。
主要参考文献:
Chua PLC, Ng CFS, Tobias A, Seposo XT, Hashizume M. Associations between ambient temperature and enteric infections by pathogen: a systematic review and meta-analysis. Lancet Planet Health. 2022 Mar;6(3):e202-e218. doi: 10.1016/S2542-5196(22)00003-1. PMID: 35278387.
Donnelly MC, Talley NJ. Effects of climate change on digestive health and preventative measures. Gut. 2023 Nov 24;72(12):2199-2201. doi: 10.1136/gutjnl-2023-331187. PMID: 37977585.
Fontaine SS, Novarro AJ, Kohl KD. Environmental temperature alters the digestive performance and gut microbiota of a terrestrial amphibian. J Exp Biol. 2018 Oct 19;221(Pt 20):jeb187559. doi: 10.1242/jeb.187559. PMID: 30171093.
Zhang XY, Sukhchuluun G, Bo TB, Chi QS, Yang JJ, Chen B, Zhang L, Wang DH. Huddling remodels gut microbiota to reduce energy requirements in a small mammal species during cold exposure. Microbiome. 2018 Jun 8;6(1):103. doi: 10.1186/s40168-018-0473-9. Erratum in: Microbiome. 2018 Jul 9;6(1):126. PMID: 29884232; PMCID: PMC5994089.
Hylander BL, Repasky EA. Temperature as a modulator of the gut microbiome: what are the implications and opportunities for thermal medicine? Int J Hyperthermia. 2019 Nov;36(sup1):83-89. doi: 10.1080/02656736.2019.1647356. PMID: 31795833; PMCID: PMC6897310.
Huus KE, Ley RE. Blowing Hot and Cold: Body Temperature and the Microbiome. mSystems. 2021 Oct 26;6(5):e0070721. doi: 10.1128/mSystems.00707-21. Epub 2021 Sep 28. PMID: 34581596; PMCID: PMC8552956.
Liew WP, Mohd-Redzwan S. Mycotoxin: Its Impact on Gut Health and Microbiota. Front Cell Infect Microbiol. 2018 Feb 26;8:60. doi: 10.3389/fcimb.2018.00060. PMID: 29535978; PMCID: PMC5834427.
Chevalier C, Kieser S, Çolakoğlu M, Hadadi N, Brun J, Rigo D, Suárez-Zamorano N, Spiljar M, Fabbiano S, Busse B, Ivanišević J, Macpherson A, Bonnet N, Trajkovski M. Warmth Prevents Bone Loss Through the Gut Microbiota. Cell Metab. 2020 Oct 6;32(4):575-590.e7. doi: 10.1016/j.cmet.2020.08.012. Epub 2020 Sep 10. PMID: 32916104; PMCID: PMC7116155.
Li B, Li L, Li M, Lam SM, Wang G, Wu Y, Zhang H, Niu C, Zhang X, Liu X, Hambly C, Jin W, Shui G, Speakman JR. Microbiota Depletion Impairs Thermogenesis of Brown Adipose Tissue and Browning of White Adipose Tissue. Cell Rep. 2019 Mar 5;26(10):2720-2737.e5. doi: 10.1016/j.celrep.2019.02.015. PMID: 30840893.
Williams CE, Williams CL, Logan ML. Climate change is not just global warming: Multidimensional impacts on animal gut microbiota. Microb Biotechnol. 2023 Sep;16(9):1736-1744. doi: 10.1111/1751-7915.14276. Epub 2023 May 29. PMID: 37247194; PMCID: PMC10443335.
Vergunst F, Berry HL, Minor K, Chadi N. Climate Change and Substance-Use Behaviors: A Risk-Pathways Framework. Perspect Psychol Sci. 2023 Jul;18(4):936-954. doi: 10.1177/17456916221132739. Epub 2022 Nov 28. PMID: 36441663; PMCID: PMC10336608.
Varghese R, Patel P, Kumar D, Sharma R. Climate change and glacier melting: risks for unusual outbreaks? J Travel Med. 2023 Jun 23;30(4):taad015. doi: 10.1093/jtm/taad015. PMID: 36721991.
Sepulveda J, Moeller AH. The Effects of Temperature on Animal Gut Microbiomes. Front Microbiol. 2020 Mar 10;11:384. doi: 10.3389/fmicb.2020.00384. PMID: 32210948; PMCID: PMC7076155.

谷禾健康

成人每年大约会患上两到三次普通感冒,儿童每年可能会患上多达八次。而今年尤为显著,各大医院的儿科还是爆满状态,甚至是一号难求。
肺炎支原体感染还没彻底过去,紧接着流感和其他呼吸道病原体感染又跟来了,医院爆满某种程度上又增加了交叉感染的风险…

“孩子又发烧了”
“还在不停地咳嗽…”
“什么时候可以好?”
“还要请假很多天!”
“今晚又不能好好睡了”
…
国家卫生健康委新闻发言人介绍,当前,随着各地陆续入冬,呼吸道疾病进入高发时期。
监测显示近期,呼吸道感染性疾病以流感为主,此外还有鼻病毒、肺炎支原体、呼吸道合胞病毒、腺病毒等引起。分析认为,近期我国急性呼吸道疾病持续上升与多种呼吸道病原体叠加有关。
呼吸道感染是指任何影响我们呼吸系统的病原体引起的感染,这包括鼻腔、咽喉、气管、支气管以及肺部。这些感染可以分为上呼吸道感染(如普通感冒、咽炎、鼻窦炎等)和下呼吸道感染(如支气管炎、肺炎);上呼吸道感染是门诊中排名前三位。
从感冒到肺炎,都属于呼吸道感染的范围。秋季是鼻病毒引起的普通感冒的发病高峰。
不同年龄群流行的主要病原体不同
中国疾控中心免疫规划首席专家王华庆表示,多病源监测结果显示,近期呼吸道感染性疾病不同年龄群体流行的主要病原体不同:
甲型流感是最常见的亚型,每年导致 3 至 500 万人严重感染,并导致 25 万至 50 万人死亡。传统上认为疫苗接种是预防甲型流感的最佳方法,但由于甲流病毒极易发生抗原漂移和抗原转变,疫苗生产又有滞后性问题,抗病毒药物的耐药性问题等,因此有必要从其他各种方面寻找治疗的可能性。
近年来,肠道菌群在调节呼吸道感染风险中的作用越来越受到关注。肠-肺轴可以塑造免疫反应并干扰呼吸系统疾病的进程。
肠肺轴是双向的,允许内毒素、微生物代谢物、细胞因子和趋化因子通过。这些成分被释放到血液中,从而连接肠道和肺部微生物群。在肠-肺轴中,相互作用的关键可能是肠道菌群代谢物,这些代谢物具有免疫系统的调节功能。
例如,短链脂肪酸可以通过I型干扰素激活NLRP3炎症小体,从而增强宿主对甲型流感病毒的防御能力。短链脂肪酸是关键的信号分子,全身和局部短链脂肪酸的浓度很大程度上取决于我们饮食中的纤维摄入量以及能够代谢这些纤维的肠道菌群。
本文帮助大家了解一下关于呼吸道感染的原因、症状等相关知识。
结合呼吸道感染和肠道菌群的研究成果,肺和肠道微生物群如何相互影响,并可能影响呼吸系统疾病,便于大家从更新更全的视角去看待呼吸道感染。
了解“肠-肺轴”在呼吸道感染中的作用,有助于开发新的预防和治疗策略,比如通过饮食、益生菌益生元、功能性食品、中药等方式调节肠道微生物群,减少呼吸道感染的风险或减轻严重程度。
呼吸道感染涉及上呼吸道、下呼吸道或两者。它们可能由病毒、细菌和真菌引起,包括普通感冒、鼻窦炎、肺炎或支气管炎。一般来说,上呼吸道感染比下呼吸道感染更常见。
呼吸道感染包括但不限于:普通感冒、流感、鼻窦炎、扁桃体炎、喉炎、支气管炎、肺炎等。
什么是上呼吸道感染?与下呼吸道感染有什么区别?
上呼吸道感染会影响呼吸系统的上部,包括:普通感冒、会厌炎、喉炎、咽炎、鼻窦炎等;
症状如:咳嗽,鼻塞,流鼻涕,打喷嚏,喉咙痛,头痛,发热,肌肉痛等各种不适都可能发生。
症状通常在暴露后 1-3 天开始,持续 7-10 天,可持续长达 3 周。
下呼吸道感染会影响气道和肺部。一般来说,下呼吸道感染持续时间更长且更严重。这些感染包括:
流感可以是上呼吸道感染或下呼吸道感染。
肺炎支原体感染 ≠ 支原体肺炎
肺炎支原体感染是指肺炎支原体这种细菌进入人体并开始繁殖,但这并不一定导致肺炎。肺炎支原体可以引起多种呼吸道疾病,包括轻微的上呼吸道感染(如感冒)和更为严重的下呼吸道感染。
支原体肺炎是指肺炎支原体感染引起的一种特定类型的肺炎。这种情况下,感染已经扩散到肺部,导致肺组织发炎,是更严重的疾病。支原体肺炎通常表现为干咳、胸痛、发热和乏力等症状,可能需要专门的治疗。
你是否出现咳嗽、打喷嚏、喉咙发痒或疼痛、呼吸困难、发烧、有痰,但不知道自己是感冒了还是流感还是其他?下表可以作为参考。

编辑

只过了3天就又叠加另外一种感染?
首都医科大学附属北京中医医院院长刘清泉表示,“从中医角度来看,叠加感染是合病或并病。比如发烧7天好了,发现是流感。10天左右又发烧了,这次是支原体。这其实不是叠加,而是养护不好,后续发病的情况。”
测出来好几种病原体感染,是不是很严重?
北京市呼吸疾病研究所所长童朝晖表示,“尽管测出来了很多病原体,但并不代表每一种都是致病的。医生会结合病人的临床情况,综合分析哪一种是病人的致病菌。”
关于混合感染,我们在后面章节也会详细讲到。
支原体肺炎是新冠的变异?
支原体肺炎是由支原体引起的呼吸道感染。支原体是一类特殊的细菌,它们没有细胞壁,这使得它们对许多常见抗生素(如青霉素类药物)具有天然的抗药性。感染通常发生在冬季,潜伏期为 2-3 周。不是说感染了支原体就会成为支原体肺炎,事实上,感染支原体的人中只有 5%-10%会发展为肺炎。许多肺炎支原体感染是无症状的。
支原体肺炎是渐进的,患者最初会头痛、不适和低烧。持续不断的咳嗽通常是最突出的呼吸道特征。咳嗽引起的胸部疼痛很常见。也可能出现喘息。其他呼吸道症状包括咽炎、鼻漏、耳痛等。
童朝晖表示,“人类在20世纪初就发现了支原体,直到20世纪末期才确定它是一种病原体,而新冠病毒在2019年末才被大家知晓,两者毫无关系。”
为什么孩子特别容易感染?今年的儿童呼吸道疾病发病率为什么高?
童朝晖表示,“儿童的免疫力系统发育不健全,抵抗力不如成人,因此更容易被感染”。
其他例如环境问题,孩子们在学校和其他孩子密切接触,这些环境促进了病原体的传播。
一位三甲医院儿科主任认为,“一是新冠期间全民佩戴口罩,也隔离了其他呼吸道疾病,所以前三年其他病毒处于相对低流行的状态。
二是这种隔离也使得微生物刺激儿童免疫系统的作用被削弱,所以解除口罩限制后,儿童感染就显得更多一些。”
一旦感冒发烧就得赶紧输液?
童朝晖表示,“感冒发烧输液好得快,这其实是一个误区。
与流感相比,感冒发烧的温度更低,症状也更轻,往往是上呼吸道的症状。如果感冒后出现发烧或者咳嗽,在家服用退烧或止咳的药物即可,要注意多休息、多喝水、补充营养。
而对于流感来说,部分流感可能引起肺炎,甚至出现重症肺炎,这个时候住院医生会判断是否需要输液。”
张文宏也表示,“一般输液只限于住院的重症病人,或者有些药物无法口服,只能通过输液。对于普通感冒来说,口服药物效果更好。”
据《柳叶刀传染病》统计,2019 年全球发生了 4.89 亿起下呼吸道感染事件,总共导致 2500 万人死亡。不过好消息是,以 1990 年为基准,所有年龄组和性别的发病率和死亡率均呈下降趋势。这表明通过有针对性的干预措施,在减少幼儿下呼吸道感染方面取得了进展。

细菌
常见的引起呼吸道疾病的细菌包括:
贝氏柯克斯体(Coxiella burnetii)和嗜肺军团菌可引起呼吸道疾病的暴发和散发病例。
病毒
包括腺病毒、冠状病毒(例如SARS-CoV-2、COVID-19和常见的人类冠状病毒,包括229E、NL63、OC43和HKU1型)、人类偏肺病毒、流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒等。
常见病毒主要特征对比表

doi: 10.1016/B978-0-12-801238-3.66161-5
注:包膜病毒可持续感染,非包膜病毒通常不会引起反复感染
旅行者特别关注的其他病毒包括中东呼吸综合征冠状病毒和高致病性禽流感病毒。在中东或靠近阿拉伯半岛的国家旅行后,如果旅行者出现14天内的发热和肺炎症状,请将中东呼吸综合征纳入鉴别诊断。
在国际旅行后,如果旅行者出现上呼吸道或下呼吸道症状的证据、嗅觉丧失、腹泻、发热、肌肉疼痛等症状,应将COVID-19纳入鉴别诊断。旅行者可以成为新型SARS-CoV-2变体从一个地理区域传播到另一个地理区域的源头。
当排除其他原因时,对于出现新发的严重急性呼吸道病例需要住院治疗的患者,应考虑高致病性禽流感病毒,例如:H5N1、H7N9等。最近曾前往有人类或动物感染病例的国家(≤10天),特别是接触家禽或患病或死亡的禽鸟的旅行者,其患病诊断的可能性增加。
真菌
与旅行有关的真菌病原体包括:
一旦病原体侵入呼吸道,它们会开始破坏呼吸道的上皮细胞,引起红肿、水肿、出血,有时还会产生渗出物。这些病变的发生会导致呼吸道的正常功能受损,从而出现感染的症状,如咳嗽、喉咙痛或鼻塞。
这些症状通常是机体对病原体侵袭的自然反应,旨在清除病原体并修复受损的组织。
当讨论呼吸道健康时,我们往往会专注于直接影响呼吸系统的因素,但事实上,我们的身体是一个整体,不同系统之间是相互联系的。肠道菌群就扮演了一个重要的角色。
尽管肠道和呼吸道是身体中两个不同的系统,但肠道菌群的平衡与整体健康,呼吸道健康之间存在着密切的联系。
健康的肠道菌群可以支持免疫系统的正常运作,而免疫系统的效能对于抵御呼吸道感染至关重要。后面章节,我们来了解一下呼吸道感染机制,以及肠道菌群如何影响呼吸道健康,这有助于我们更全面地理解和预防呼吸道感染。
我们知道,正常人每天吸入大量空气,其中灰尘、毒物、病原体是多种疾病的高危因素。肺部拥有强大的防御系统,包括粘液、结构细胞、免疫细胞和细胞外基质,可清除或灭活病原体。
大部分呼吸道感染是由病毒引起的。因此本章节我们主要以病毒感染为例来说明,但临床上可能会存在细菌合并病毒感染的情况,这个我们在后面阐述。
常见的呼吸道病毒感染包括流感病毒、腺病毒、呼吸道合胞病毒、人偏肺病毒等。
呼吸道感染中的病毒感染的机制比较复杂,主要涉及以下几个方面:
如果说身体是一座城市,那么细胞是城市里的居民,而病毒就是入侵者。病毒通过与宿主细胞表面受体结合,相当于钥匙打开了门,跑进了居民家里,也就是细胞内,开始为非作歹。利用宿主系统表达病毒蛋白并复制病毒基因组,产生大量子代病毒颗粒。
宿主会激活先天和获得性免疫应答,相当于警报响起,释放细胞因子、炎性因子,召集免疫细胞来抓捕这些入侵者。但混战之下也会带来伤害,过度炎症会损害组织。
这些入侵的病毒很狡猾,会通过各种机制逃逸、抑制、甚至假扮好人来躲避追捕。
呼吸道正常微生物群会帮助维护城市的秩序,建立坚固的围墙(物理屏障),并在有需要时可以支援,刺激免疫应答。但病毒入侵后感染可破坏城墙,打破微生物群平衡,减弱它们对病毒的抵抗力。
在城市的另一边——肠道,那里的微生物是盟友,它们也可通过看不见的秘密通道——“肠-肺轴”影响,输送代谢物,从而间接帮助呼吸道抵抗入侵者。
看起来这两者之间相差很远,但呼吸道和胃肠道具有相同的胚胎起源和共同结构,这表明它们的相互作用可能是多方面的。
它们之间能够相互交流,得益于以下方面:
● 共同黏膜免疫系统
这两个器官都有自己的黏膜免疫系统,它们都是抵御外来病原体入侵的第一道防线,能够对病原体作出快速反应,并在先天性和适应性免疫中发挥重要作用,由于这种共享的免疫特性,它们可以通过相似的免疫细胞和分子进行交流。
● 微生物群的影响
肠道含有丰富的微生物群,这些微生物通过其代谢产物(如短链脂肪酸)可以影响远处的器官,包括肺部。
● 免疫细胞的迁移
免疫细胞可以在身体的不同部位之间迁移。例如,肠道中的树突状细胞或其他免疫细胞可以在接触到肠道微生物后,通过血液循环迁移到肺部,并在那里调节免疫反应。
● 炎症的系统性影响
如果肠道发生炎症,它可以通过释放炎症介质到血液中而产生全身性的影响。这些炎症分子可以到达肺部,引发或加剧肺部的炎症反应。
● 共同的病理反应
肠道和肺部在感染或其他疾病状态下可能都会表现出病理反应。例如,感染呼吸道流感病毒的患者一旦出现肺损伤,往往会出现胃肠道样症状。
● 环境因素的影响
吸入的空气和摄入的食物是与外界环境直接接触的两种途径。环境因素,如烟草烟雾、污染物或饮食中的特定成分,可能会同时影响肠道和肺部的健康。
我们来了解一下肠-肺轴。
肠道和肺部维持着双向交流
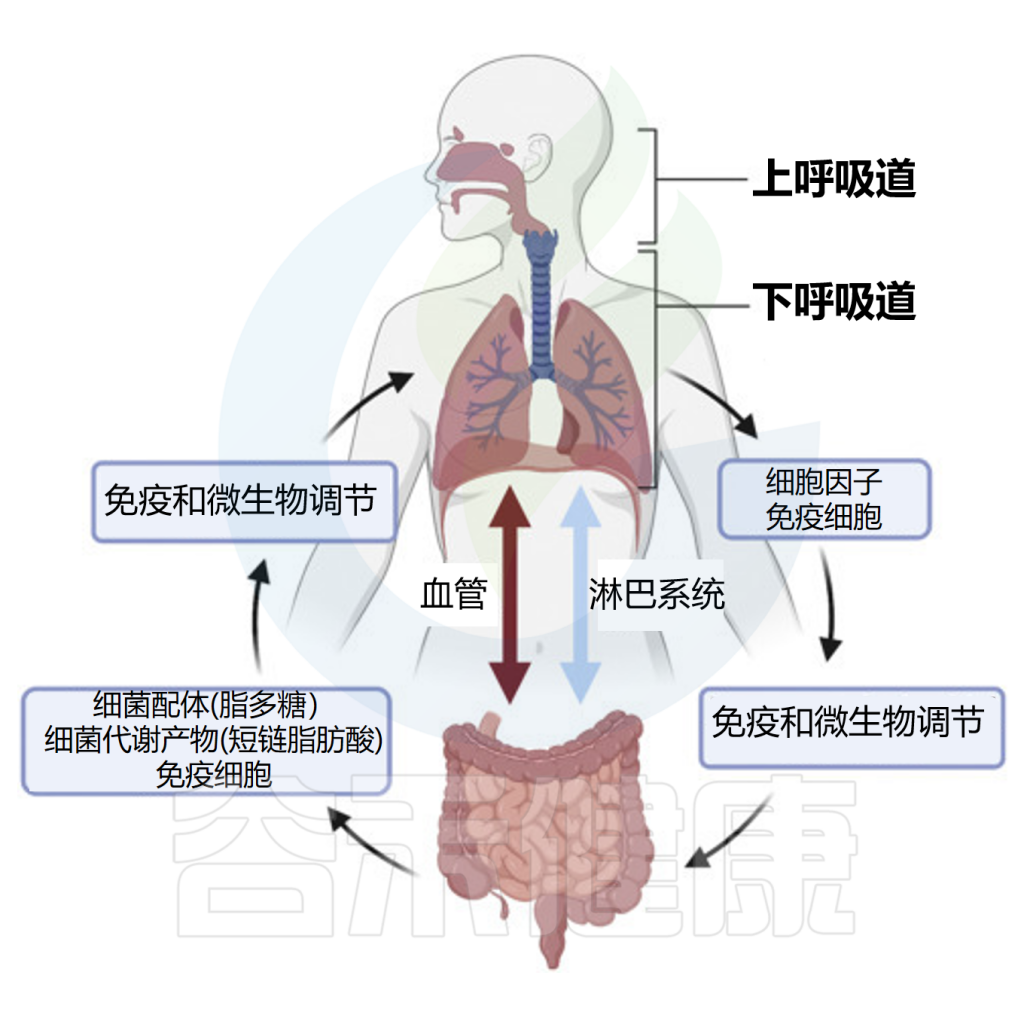
doi:10.1016/B978-0-12-819265-8.00048-6
肠-肺轴是指肠道和肺部之间微生物和/或其代谢物和免疫调节信号的相互交换。这是一个涉及肠道和肺部之间双向对话的特定轴线,包括微生物和免疫互动。
研究表明,肠道微生物群组成的改变可导致呼吸道急性感染和慢性肺部疾病的易感性增加。相反,呼吸道菌群的改变会通过血液影响肠道菌群。
肺→肠
呼吸道由上呼吸道(UTR)和下呼吸道(LTR)组成,气道微生物群通过作用于居住的免疫细胞和调节细胞因子水平来维持肺部的稳态。肺部感染或炎症会激活局部和全身的免疫反应,产生的炎症介质,如细胞因子可能进入血液,随后影响肠道的微生物群。
在某些情况下,呼吸道的分泌物或内容物可能会被吞入肠道,携带病原体或其他物质,从而影响肠道。
肠→肺
来自肠道的细菌配体(脂多糖;LPS)和细菌代谢物(短链脂肪酸;SCFAs)进入血液,并运输到肺部,在那里它们调节免疫反应和肺部微生物。肠道的肠上皮细胞与微生物群相互作用,以刺激免疫反应。肠道来源的短链脂肪酸可以启动骨髓中的骨髓细胞,这些细胞在迁移到肺部后可能会促进抗炎环境。
肠道微生物群对病毒和肺部感染起着保护作用,部分原因是它在调节先天和适应性免疫反应中的作用。比如,生命早期使用抗生素会增加患哮喘和过敏的风险,这与抗生素治疗后胃肠道细菌数量变化从而影响呼吸道有关。
举例来说,缺乏分段丝状细菌(SFB)的小鼠比用SFB定植的小鼠对肺部炎症的易感性增加,死亡率更高。
在SFB定植后,即使在缺乏SFB的小鼠中,Th17免疫反应增加,BALF中IL-22的水平以及T细胞受体β(TCRβ)细胞和中性粒细胞的数量增加,表明肠道菌群可以调节肺部免疫反应,缓解严重的肺部感染。
在人类肠肺轴的背景下肠道和肺之间的串扰
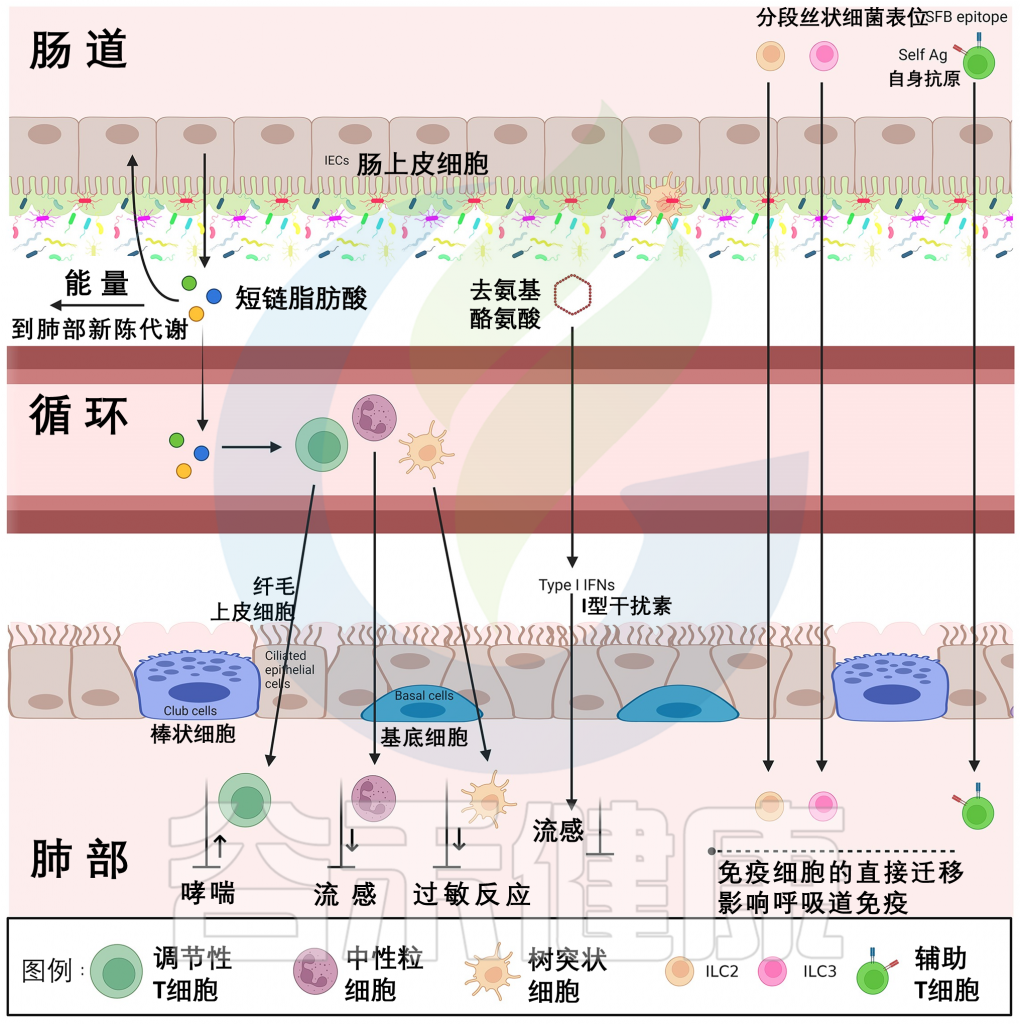
上图用于直观地展示这些系统之间的通信和交互。该图突出了肠道和肺之间的相互作用以及它们对彼此微生物组的潜在影响。为了清晰展示,空间关系和解剖细节是简化后的。
肠道和肺都与血液循环和淋巴系统相连,通过将免疫细胞、细胞因子、趋化因子和微生物代谢物从一个器官双向转移到另一个器官,从而实现两个系统之间的串扰。
肠-肺轴内的主要影响途径

doi.org/10.1111/crj.13622
以上我们了解了肠-肺之间双向串扰的基本知识,这种复杂的相互作用揭示了肠道和肺部健康之间的深刻联系,接下来,我们来了解肠道菌群及其代谢产物在呼吸道感染中的作用,以及它们是如何影响宿主的免疫反应和疾病的临床结果。
胃肠道症状如恶心、呕吐、腹泻和腹痛,是呼吸道感染的常见伴随症状,尤其是在儿童中,肠道菌群占据了重要原因,比如大肠杆菌的异常增殖,就可能与这些症状相关。
呼吸道感染对肠道微生物群有何影响?
我们尚未完全了解呼吸道感染期间胃肠道症状的原因。它们可能是呼吸道炎症增加的直接结果,也可能源于呼吸道感染期间免疫反应的变化,导致肠道微生物组发生变化。
一些研究表明,呼吸道感染会导致肠道微生物组失调。
▸甲流病毒感染
肠道菌群多样性增加,同时下列菌群增殖较为明显:
而一些有益菌的丰度则降低:
一项双向双样本孟德尔随机化研究确定:
放线菌和梭状芽胞杆菌具有潜在的预防流感感染的作用
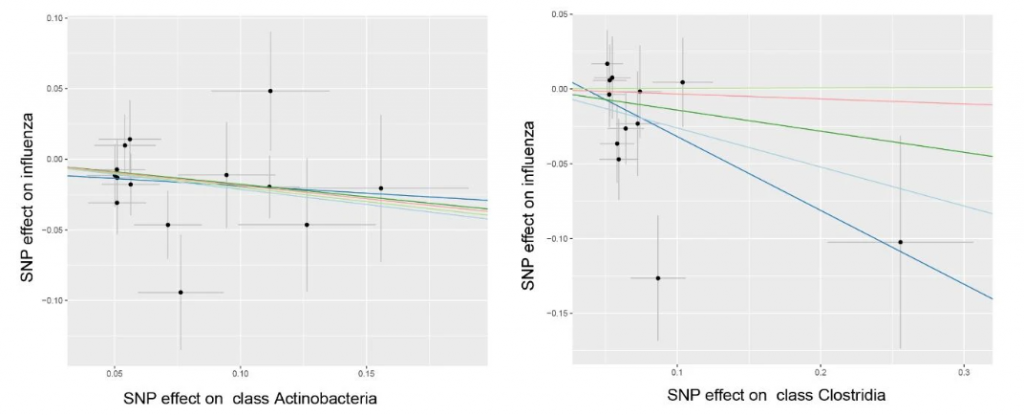
梭状芽孢杆菌不仅可以预防流感,还可以抑制严重流感向肺炎的进展。
杆菌的大量存在可能作为识别流感感染的指标
该研究还发现,杆菌(Bacilli)的大量存在,可能作为肠道中识别流感和其他感染的指标:
未感染:链球菌增加→不易感染
感染后:链球菌增加→继发性链球菌肺炎
MR分析表明,链球菌与流感之间存在双向因果关系,与其他研究一致:
真菌:
曲霉菌诱导的C反应蛋白水平升高与真菌诱导的降钙素水平降低之间存在相关性,从而导致临床症状。
注:目前,大多数研究关注的是流感感染后某个时间点(主要是在第 7-14 天)细菌的变化。
总体而言,甲流感染引起的肠道菌群变化主要表现为有益菌(如产丁酸菌)水平降低,而条件致病菌水平升高。
▸呼吸道合胞病毒感染
呼吸道合胞病毒是 2 岁以下儿童毛细支气管炎和肺炎的最常见病因。它占小儿下呼吸道感染的 80% 以上。这种病原体也是老年人呼吸道疾病的重要原因。呼吸道合胞病毒会诱发季节性暴发。
在小鼠模型中,呼吸道合胞病毒在感染后第 7 天导致肠道微生物群多样性(但不是丰度和 α 多样性)的显着改变,拟杆菌门增加,厚壁菌门减少。拟杆菌门增加主要是由于拟杆菌科和S24-7增加,而厚壁菌门丰度减少主要与其中的Lachnospiraceae和Lactobacillaceae科的减少有关。
呼吸道感染下的肠道菌群变化
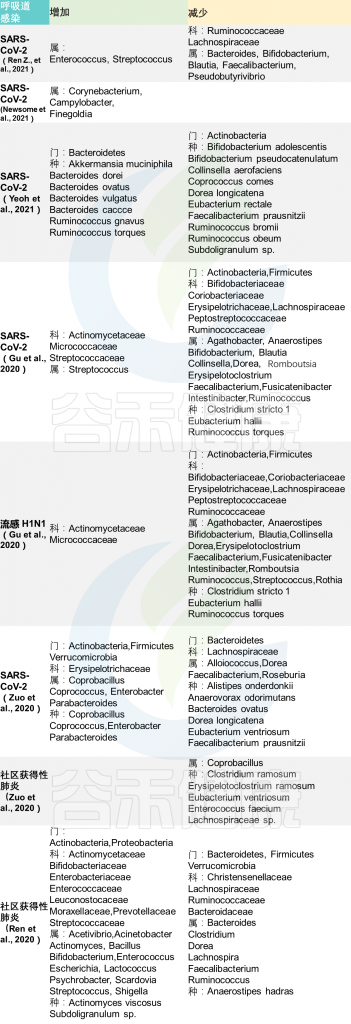
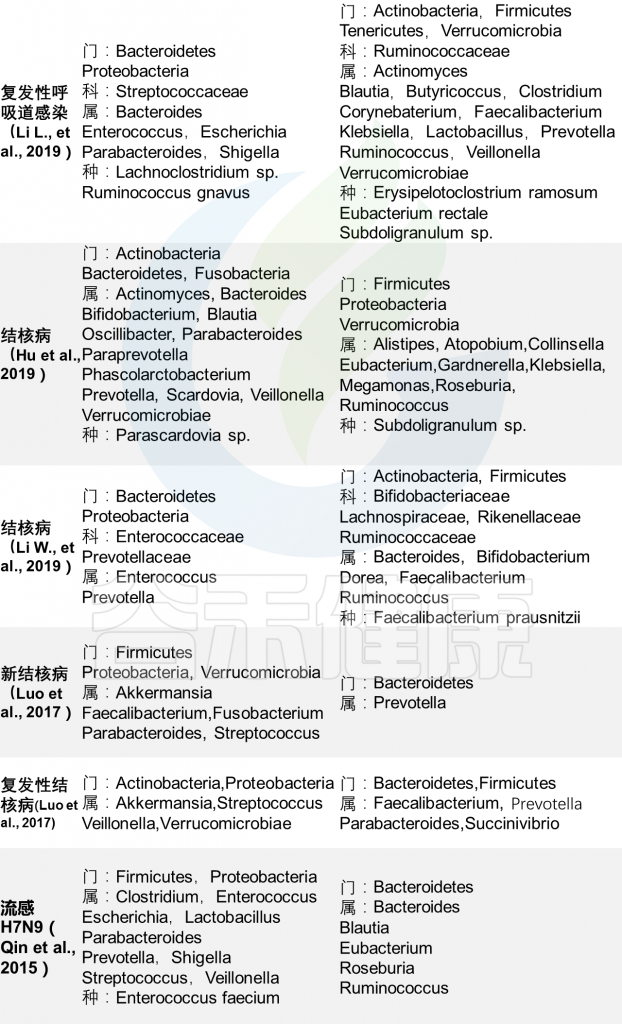
doi.org/10.1371/journal.pone.0262057
病毒性呼吸道感染期间如何引起肠道菌群失调?
主要原因有两个,一是食物摄入减少,二是细胞因子的刺激。I型和II型干扰素是免疫细胞为抵抗病原体而分泌的主要炎症因子,在流感期间可能会严重破坏肠道微生物群。TNF-α分泌过多是食欲不振的病程之一。
肠道菌群的变化会如何影响病毒的易感性?
甲流感染诱导的肠道菌群失调不仅导致肠道细菌过度生长,还为原本存在于呼吸道中的细菌创造了有利条件,最终削弱了对肺部病原体入侵的防御阈值。
甲流感染条件下小鼠的肠道菌群失调损害了它们对肺炎链球菌感染的抵抗力,最终增加了肺部细菌复发的发生率。这些研究表明,肠道菌群和甲流感染相互影响,并显著影响甲流感染后的疾病发展和预后。
肠道菌群产生的代谢产物可以引起对宿主急性免疫激活的反应,从而影响宿主对疾病的易感性和抵抗力。
肠系膜淋巴系统在肺和肠道之间提供了一条直接的高速公路,完整的细菌、其碎片或其代谢物可以通过这条高速公路传播。这里介绍两种代谢物,去氨基酪氨酸和短链脂肪酸,主要是后者。
去氨基酪氨酸(DAT)
去氨基酪氨酸是一种肠道代谢物,可通过提高I型干扰素(IFN)的水平来增强人体对流感病毒的抵抗力,从而降低流感感染小鼠的体重减轻和死亡率。
短链脂肪酸(SCFA)
短链脂肪酸,主要由细菌代谢膳食纤维时产生,特别是在高纤维饮食的情况下。乙酸、丙酸、丁酸约占所有短链脂肪酸的 95% ,其比例可能因年龄、饮食和特定疾病的存在而异。
短链脂肪酸:能量供给
大部分的短链脂肪酸会被结肠细胞用作能量,或者被肠道上皮细胞用来调节肠道内的免疫功能。剩下的短链脂肪酸会通过血液运输到身体其他部位,比如肝脏。如果有没有被代谢的短链脂肪酸,则会重新分布到其他组织中。
肠道中的短链脂肪酸如何与肺部发生关联,从而增强抗病毒免疫力?
短链脂肪酸,在肺部作为常驻抗原呈递细胞上的信号分子起作用,以减弱炎症和过敏反应,也可以帮助减轻哮喘的症状。
肠道菌群代谢产物短链脂肪酸,被肠道粘膜吸收并附着在肺道中的免疫细胞受体上,从而通过调节粘膜免疫来增强肺部的抗病毒反应。
短链脂肪酸要么通过循环直接迁移到肺组织并调节肺免疫,要么促进免疫细胞的分化和活化以产生细胞因子和IgA。在肺部,IgA促进病原体的清除,Treg细胞减少肺部炎症和损伤,某些细胞因子(如TNF-α、IL-4等)改变免疫环境。
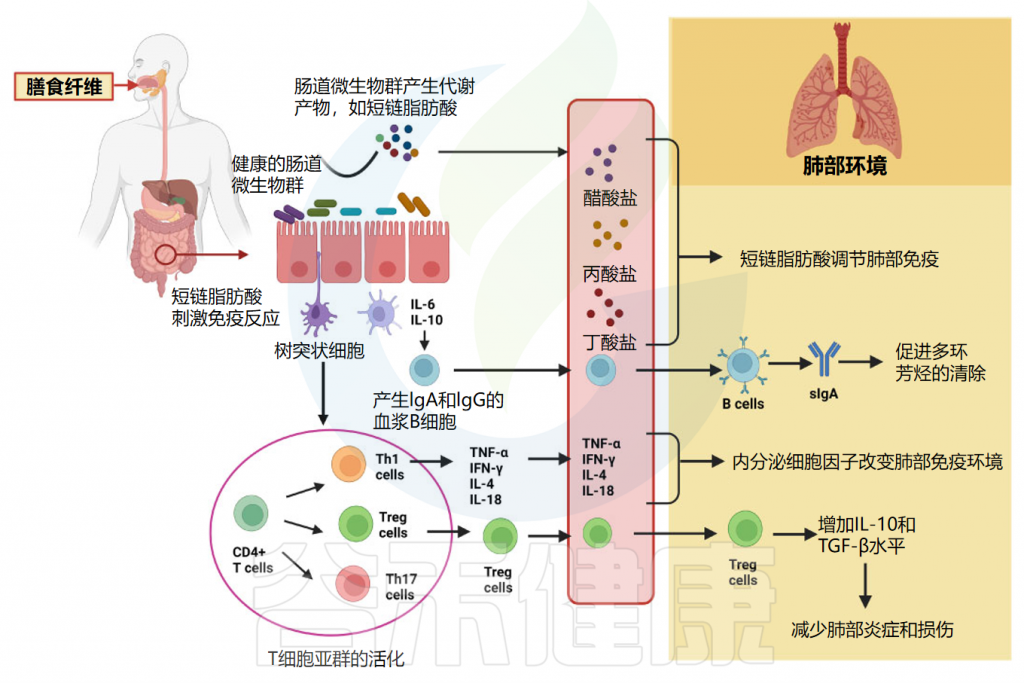
doi:10.3389/fimmu.2022.954339
短链脂肪酸:抑制促炎因子来抗炎
短链脂肪酸通过激活先天免疫中性粒细胞、巨噬细胞和树突状细胞来调节促炎细胞因子(如 TNF-α、IL-12 和 IL-10)的形成。它们还通过抑制 B 细胞中的 NF-κB 并促进胸腺外调节性 T 细胞的产生,增强了CD8+ T细胞的功能,来促进抗炎环境的形成,从而限制炎症过程。
注:CD8+ T细胞显示出杀死病毒感染细胞的能力增强。
短链脂肪酸:激活炎症小体来抗炎
短链脂肪酸参与G蛋白偶联受体(GPR40-43)的激活,这是消退炎症反应所必需的。
短链脂肪酸通过炎症小体复合物调节免疫应答。短链脂肪酸配体 GPR109A 和 GPR43 以及信号蛋白激活 LRR、NACHT 和 PYD 结构域蛋白 3 (NLRP3) 炎症小体激活,从而支持细胞修复机制。
短链脂肪酸:调节干扰素产生
越来越多的证据表明肠道营养不良会影响肺部的免疫反应,肺部感染可导致炎症细胞浸润以及肠道 IFN-γ 和IL-17 水平升高。
短链脂肪酸可以增加干扰素的产生,干扰素有什么用呢?它的产生增加,可以增强机体预防呼吸道病毒感染和清除病毒的能力,从而减少病毒引起的哮喘发作。
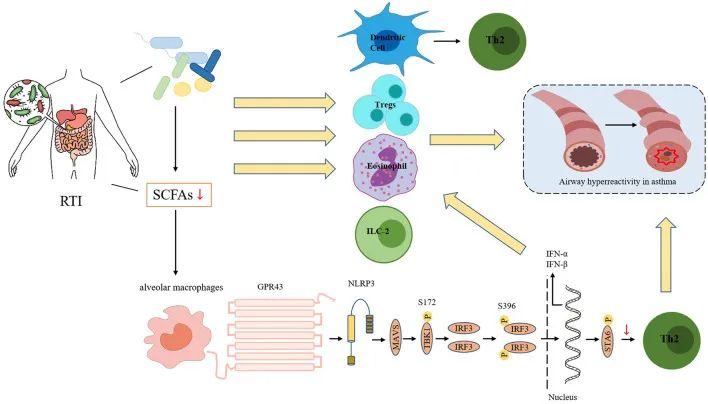
doi: 10.3389/fmicb.2023.1219942
短链脂肪酸:加强屏障防入侵
短链脂肪酸有助于加强肺部和其他呼吸道组织的屏障功能,这可以防止病原体侵入引起的感染。
短链脂肪酸还可以调节粘液产生、IgA分泌和抗菌肽的表达,强化物理屏障,维持粘膜免疫平衡。
我们知道,微生物组调节宿主免疫应答,健康的微生物组对免疫稳态至关重要。 微生物组-免疫细胞相互作用非常复杂。
肠道感染可以增加肺部感染的风险,反之亦然。例如,流感病毒感染可以影响肠道的微生物群,从而影响肠道免疫反应,并可能增加细菌性肺炎的风险。
人类的免疫系统进化为包含先天性和适应性系统,可以保护和防御潜在的病原体。
病毒对微生物组-先天免疫相互作用的影响
简而言之,微生物组组成与保护性和有害免疫反应有关。 微生物组的失调可诱发异常免疫应答,这与肠道内和肠外部位对慢性疾病和感染的易感性增加有关。
肠道菌群失调由I型干扰素驱动
研究流感和鼠伤寒沙门氏菌血清型感染的研究发现,流感诱导的干扰素(IFN) 产生导致肠道微生物组失调,并导致鼠伤寒沙门氏菌的生长。具体而言,肺部的 I 型 IFN 信号转导导致粪便微生物组中肠杆菌科的丰度增加,并增加了肠道中继发性鼠伤寒沙门氏菌感染的易感性。
这些研究表明,先前的呼吸道感染可以调节微生物组与先天免疫的相互作用,从而促进继发性细菌感染。
与甲型流感相关的肠-肺症状及其机制
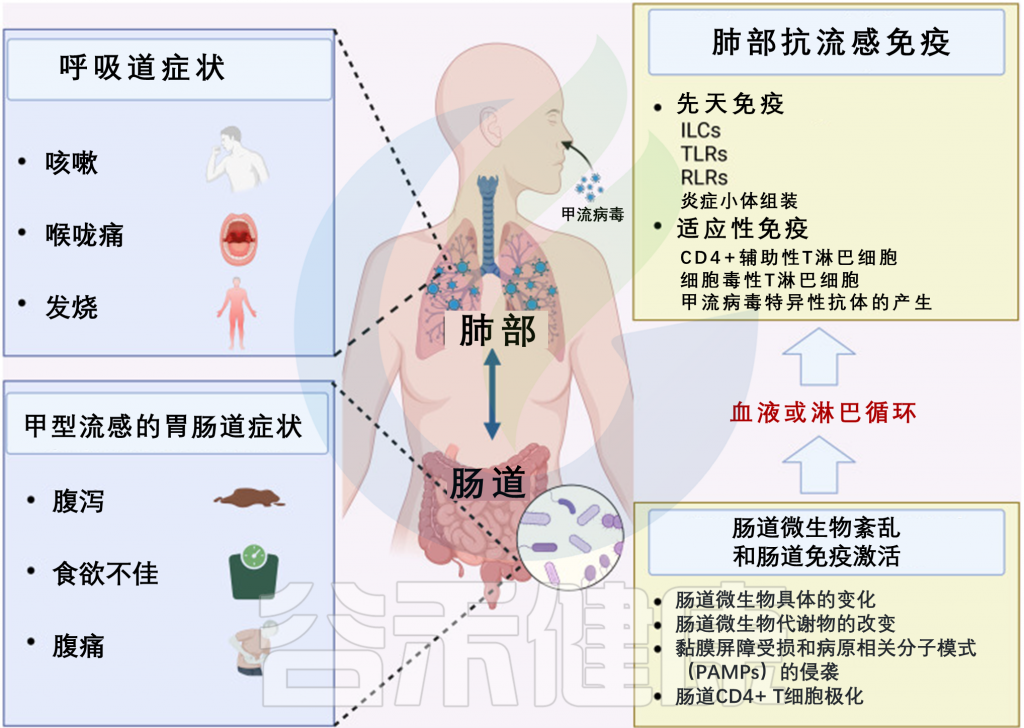
doi: 10.3389/fimmu.2023.1147724
病毒对先天免疫失调及感染的影响
由抗病毒反应引起的免疫失调是继发性细菌感染发展的重要因素。这里讨论该领域的主要概念,重点关注呼吸道感染期间的先天性免疫失调及其对随后的肺部细菌感染和胃肠道功能障碍的影响。
上皮细胞是许多呼吸道病毒的主要靶标,与定植在气道粘膜表面的细菌密切相互作用。病原体通过模式识别受体(PRR)进行检测,导致分泌介质的产生,以直接攻击病原体或将免疫细胞募集到感染部位。
机制研究表明,呼吸道感染以三种主要方式改变上皮免疫防御机制以促进细菌感染:
i) 破坏屏障完整性,与病毒病原体的直接相互作用会损害上皮完整性以促进细菌感染,病毒诱导的免疫信号转导也会损害屏障完整性。
ii) 促进细菌粘附
iii) 免疫信号失调,其中一种成分通常会影响另一种成分。
流感病毒感染后,CCR9+ CD4+ T细胞(源自肺部的效应细胞)被募集到小肠,在那里它们分泌干扰素-γ(IFN-γ),这导致肠道菌群失衡,促进小肠中的Th17细胞极化。最终,这会导致IL-17 A分泌,介导免疫损伤。
因此,流感病毒感染所引起的上述机制改变,对宿主的免疫防御产生了显著影响,增加了继发性细菌感染的风险。
IFN在抗病毒反应中的双刃剑作用
在呼吸道感染期间,上皮细胞是 I 型和 III 型 IFN 的主要产生者,IFN 是抗病毒反应的关键组成部分。所以这个IFN 分泌适度至关重要,IFN 信号转导的不当幅度和/或时间会损害感染控制。
研究表明,IFN 促进上皮细胞凋亡,并且在合并感染期间是有害的,因为一些研究表明,气道上皮细胞中 I 型和 III 型 IFN 的信号转导会减少上皮细胞增殖,降低屏障完整性,并延迟上皮重塑,导致对继发性细菌感染的易感性增加。
免疫反应与继发性细菌感染的易感性增加
TNF和TRAIL通路促进先前病毒感染期间的上皮损伤,增加对继发性细菌感染的易感性。病毒诱导的免疫反应驱动了细菌粘附的增加。流感感染导致TGF-β信号转导增加链球菌粘附。AMP分泌减少和营养免疫改变也促进细菌感染。
流感感染抑制金黄色葡萄球菌感染时炎性细胞因子的产生。呼吸道合胞病毒感染导致铁分泌增加,并促进铜绿假单胞菌感染。细菌在病毒合并感染期间调节上皮细胞信号转导以促进感染。金黄色葡萄球菌通过损伤气道上皮中的I型IFN信号转导促进流感病毒复制。
理解这些复杂的免疫机制,可以帮助我们更好地理解身体是如何抵抗疾病,也有助于抗病毒药物、免疫调节剂的开发,来优化宿主的免疫反应。
感染病毒后,肠道屏障受损,肠道菌群易位,可能加剧感染
感染甲型流感病毒后,肠黏膜屏障功能障碍与感染的严重程度密切相关。
肠黏膜屏障由肠上皮细胞构成,分泌多种免疫因子并传递细菌抗原,在维持肠道菌群与宿主的共生关系中发挥着重要作用,并作为维持肠道菌群稳定性和生态平衡的控制开关。
流感病毒感染通过破坏肠上皮细胞中紧密连接蛋白和粘附蛋白的功能来影响肠道屏障,这些蛋白调节肠道屏障功能,阻止肠腔内大分子(如细菌和毒素)进入血液。
这些蛋白表达的降低可导致屏障功能受损,从而增加甲型流感病毒的疾病进展和危重症的发生。研究发现,小鼠感染H1N1导致肺和结肠中紧密连接蛋白的表达显著降低。这种减少导致这些器官的屏障结构受损,从而允许肠道细菌易位。随后,通过体液循环发生继发性细菌感染。
仍需进一步的研究来明确最有效的治疗策略。
直觉上我们会认为,一个人体内有不止一种致病病毒会导致更严重的症状和后遗症,事实上真的如此吗?
部分研究:合并感染中重度疾病风险增加
一项研究确实支持了这一结论,作者观察了所有呼吸道病毒检测的儿科患者,合并感染患者中重度疾病风险增加。
对细支气管炎进行了超过 3 年的多中心评估,发现 RSV/RV 混合感染患者的住院时间更长。
部分研究:合并感染临床结果无差异
针对游客的研究没有发现病毒合并感染与出现症状或出现更严重症状的可能性之间有任何关联。
一项针对住院儿科患者的研究发现,携带多种病毒的患者入住 ICU 的风险并未增加。
部分研究:患有多种病毒感染的患者的严重程度较轻
对荷兰患有细支气管炎的儿童进行了评估,发现那些双重感染的患者在 3 个月以下的严重程度没有差异,但在 3 个月以上的患者中病情严重程度明显减轻;荷兰的另一项研究关注的是儿科患者的平均住院时间较短。
另一项研究发现,病毒合并感染的患者入住住院病房(OR 0.55)、入住 ICU(OR 0.32)、需要补充氧气(OR 0.55)或住院时间超过 3 天(OR 0.32)的可能性显著降低。
实际上病毒和病毒之间也存在相互作用。
RSV vs. 鼻病毒
鼻病毒是一种快速复制的病毒,可以干扰其他病毒的复制,而PIV(副流感病毒)是一种极其缓慢的复制病毒,其复制可能会因其他病毒的存在而中断。
鉴于 RSV 和鼻病毒感染率很高,因此在多项研究中,它们是合并感染患者中最常见的病毒。
然而,一项研究表明,当存在 RSV 时,检测到鼻病毒的几率较低,而接受 RSV 免疫预防的患者检测到鼻病毒的几率明显更高 。这表明尽管这些病毒合并感染的发生率很高,但仍然存在病毒干扰的情况。
RSV 和 流感 之间存在病毒竞争
一项研究发现,无论合并感染状态如何(例如 RSV、甲型流感和 HMPV),病毒载量始终较高,但其他研究的病毒载量根据合并感染状态(例如 PIV1 和腺病毒)而变化。
在这些病毒中,甲流在共感染患者中被检测到的可能性最小。在数学建模中,资源竞争的概念可以解释为什么繁殖速度较快的病毒会通过消耗所有资源而战胜繁殖速度较慢的病毒。在这个模型中,甲流的繁殖速度比呼吸道合胞病毒(RSV)快,因此它会使RSV的病毒载量低于检测水平。
简单来说,就病毒竞争而言,RSV感染率高时,流感感染率低,反之亦然。
从病毒-病毒合并感染的角度来看,无论儿童是否检测到一种或多种病毒,RSV 似乎最终都是感染严重程度的主要决定因素。
病毒-细菌联合感染对疾病严重程度的评估是一个不断发展的领域,但没有研究报告病毒-细菌共同感染的严重程度降低。
合并感染与疾病严重相关
一项研究评估患有细支气管炎的儿童,除肺炎链球菌、卡他莫拉菌和流感嗜血杆菌外,还使用鼻拭子鉴定了过量的病毒。这项研究回归分析中,呼吸道合胞病毒和肺炎链球菌的联合检测与严重疾病显著相关。
在一项针对急性呼吸道疾病患儿的队列研究中,细菌叠加感染与较高的疾病严重程度评分(OR = 2.12),更严重的呼吸窘迫(OR = 4.4),需要更多的呼吸支持(OR=3.4),住院时间更长。
呼吸道病毒-细菌混合感染常常导致严重的下呼吸道并发症,并导致极高的死亡率。其中,甲流与肺炎链球菌和流感嗜血杆菌合并尤为常见。
病毒和细菌双重感染及相关并发症
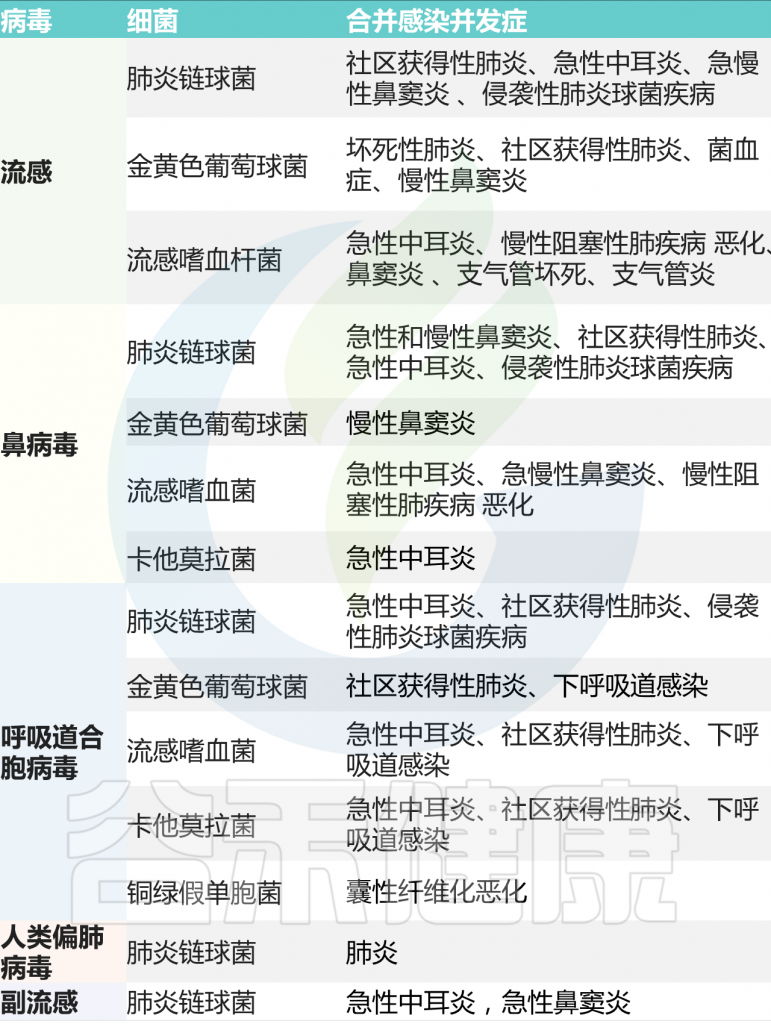
doi: 10.1007/s11908-020-0711-8
流感感染引起的宿主免疫系统和上皮结构的变化,使个体更容易受到肺炎球菌感染。
这些机制可能包括:
i)呼吸道上皮细胞的破坏和基底膜的暴露
ii)细菌用作受体的分子上调(特别是由于病毒神经氨酸酶活性)
以上两者都增加了细菌对呼吸道上皮细胞的粘附
iii)免疫细胞(包括中性粒细胞和巨噬细胞)的功能受损,后者受到T细胞反应期间产生的干扰素-γ释放的影响。流感损害肺泡巨噬细胞对肺部肺炎球菌的清除。
通过上述机制,甲流病毒感染会促进肺炎球菌的定植、传播和活动性疾病。
甲流病毒清除后,高度促炎状态引起的粘膜屏障损伤,是晚期流感与细菌合并感染的重要触发因素。
肺炎链球菌与流感、鼻病毒或 RSV 合并感染会增加急性中耳炎的风险。鼻咽部的肺炎链球菌定植会增加幼儿 RSV 感染的临床严重程度。
要引起呼吸道疾病,细菌病原体首先需要在鼻咽腔定植。
病毒-细菌合并感染破坏了黏膜免疫的许多方面,其最终结果是无法控制细菌复制。该领域很复杂,这里来了解一些重要的点:
▸病毒对细菌粘附的易感性
在病毒感染期间和病毒性疾病完全康复后,宿主呼吸道上皮的改变,导致细菌定植的易感性增加。
▸破坏上皮屏障
病毒可以在细胞内扰乱细胞过程或通过代谢耗竭或裂解来破坏受感染的细胞。细胞的破坏导致上皮层剥脱,暴露基底膜;因此,导致细菌侵入。
举例来说:
▸粘附蛋白的上调
病毒感染的细胞可能通过改变呼吸道粘膜分泌的抗菌肽(防御素)的表达来降低先天免疫反应。在病毒感染期间,会发生级联的促炎症反应,导致上皮细胞上发现的粘附蛋白上调,从而导致病原生物的细胞入侵。例如:
▸病毒因子的产生
病毒成分的产生,如神经氨酸酶 (NA)、流感和副流感产生的一种糖蛋白,以及 RSV 细胞上表达的 G 蛋白,会破坏受感染细胞的完整性。这种破坏暴露了细菌受体并有助于细菌合并感染。
▸免疫系统成分功能障碍
呼吸道病毒可能通过损害中性粒细胞功能、减少氧化爆发、增强中性粒细胞凋亡等方式影响免疫系统,从而增加细菌重复感染的易感性。
病毒会使自然杀伤细胞(NK)的募集和激活无效,从而导致细菌叠加感染,这在流感和肺炎链球菌中可见。
病毒还会改变单核细胞功能,降低细胞因子的产生和活性,并阻止适当的免疫反应途径,导致细菌定植增强和死亡风险增加。
总的来说,病毒-细菌混合感染通常会导致更严重的疾病。
如果幸运的你,此刻还没有感染上流感等呼吸道病毒,那么可以通过调理微生物群,维持一个相对比较健康的状态来预防可能的发生感染:
一、优化饮食结构,增加膳食纤维的摄入
膳食纤维是益生菌的良好营养源,增加膳食纤维的摄入,可以促进益生菌的生长。蔬菜、水果、全谷物都是良好的膳食纤维来源。可以在日常饮食中有意识地多摄入膳食纤维。同时保持适量优质蛋白质的摄入。
二、维持良好的生活习惯
三、维持良好的心态
我们在前面的文章中已经知道,精神压力会导致肠道微生物群失衡。可以通过冥想、音乐等方式控制压力,维持肠道微生物的稳定。
四、定期检测肠道微生物
了解自己的肠道微生物组成,菌群是否平衡,如果本身有害菌偏多,或者多样性较低等情况下,肠道菌群构筑的整体抵抗力薄弱,那么当外来病原体入侵之后,就会给身体带来一系列问题。
在肠道菌群检测报告中,我们可以看到哪些疾病风险较高,哪些症状相关菌超标,营养指标有什么不均衡情况等,针对这些情况按照一些相关建议地调整饮食、生活方式,将原有的肠道微生物进行优化,从而提高机体免疫力,为呼吸道健康提供重要保障。这是基于微生物组进行呼吸道感染防控的重要新策略。
上呼吸道感染在冬季很常见,在大多数情况下是可以恢复的,但可能会在几周内严重影响生活质量。少数人可能会发展为肺炎、脑膜炎、败血症和支气管炎等。
早期鉴别诊断很重要。最好进行相关检测,判别是流感病毒、新冠病毒、支原体等哪种病原体引起的。
治疗方法则取决于感染的类型和严重程度。轻微的上呼吸道感染通常是自限性的,就是说,不需要特殊治疗。
对大多数患者而言,遵医嘱居家规范服用药物,可以配合休息和充足的水分,在病情发展到一定程度之后,能够依靠自身免疫力控制病情发展以及逐步痊愈。一般来说病情可在1-2周得到缓解。
随着抗生素的滥用和不合理使用,抗生素耐药性的问题日渐严重。
呼吸道感染是否需要服用抗生素取决于感染的病原体类型,以下资料供参考:
病毒性感染:大多数上呼吸道感染,如普通感冒和大部分流感,是由病毒引起的。病毒性感染不需要抗生素来治疗,因为抗生素对病毒无效。对于这些病毒性感染,治疗通常包括休息、充足的水分摄入、以及可能的对症治疗(如退烧药、止咳药)等。
细菌性感染:如果呼吸道感染是由细菌引起的,如某些类型的肺炎、急性细菌性支气管炎、咽炎等,抗生素可能是必要的。
混合感染:有时,一个最初由病毒引起的感染可能会导致细菌的继发性感染。例如,流感后可能会发展成细菌性肺炎。在这种情况下,可能需要抗生素治疗。
● 流感病毒
充分休息有助于身体恢复,保持足够的水分摄入。
对症治疗,使用解热镇痛药物(如对乙酰氨基酚或布洛芬)来缓解发热、疼痛和不适。
在某些比较严重的情况下,医生可能会开特定的抗病毒药物,如奥司他韦或扎那米韦,应在医生指导下使用。
● 支原体肺炎
一线治疗药物是大环内酯类抗菌药物,包括阿奇霉素、红霉素、克拉霉素等。青霉素、头孢类抗生素对支原体肺炎治疗无效。
对于大环内酯类药物治疗无效、8岁以上儿童可以使用四环素类药物,如多西环素、米诺环素。注意,一定要在专业医生指导下用药。
● 呼吸道合胞病毒
目前国内还没有针对呼吸道合胞病毒感染者的特异抗病毒药物和治疗方法。一般使用常规抗病毒药物以及止咳化痰类药物等对症治疗即可好转,但如果出现咳嗽、呼吸急促和呼吸困难等症状应及时就医治疗。
● 腺病毒、鼻病毒、副流感病毒
这些病毒感染没有特效治疗药物,以观察病情变化和对症治疗为主。
一般来说就像普通感冒一样,只要正规的护理、对症用药、适当多喝水、多休息就可能安然度过感染阶段。
▸遵医嘱,服用适合自身的抗生素
最好在医生的指导下服用抗生素。医生会根据感染的类型和严重程度开具适当的抗生素处方。
临床上,对于抗生素的选择,基于可能的致病菌、患者的过敏史、地区的耐药性模式以及患者的个人健康状况及抗生素耐药情况,综合判断,个人抗生素耐药性的问题可以参考肠道菌群检测报告,如果某些抗生素耐药指标已经较高的情况下,可以选择一些替代抗生素。
▸完整的疗程,避免滥用或不规范使用抗生素
同时,患者也应该配合医生的建议,按照规定的剂量和时间完成抗生素治疗,不要自行增加或减少剂量,不要自行服用一天就停药,以免耐药菌株的产生。
如果在服用抗生素期间出现副作用,应及时与医生联系。抗生素的正确使用对于个人和公共卫生都至关重要。
国家儿童医学中心,北京儿童医院主任医师王荃表示,“我们吃退烧药的目的不是把体温降到正常,而是增加我们孩子的舒适度,让孩子能够安全舒适地度过发热期,但是我们想要比如说今天你来了医院,吃完药我就想让体温正常孩子都好,这是不可能的,因为所有的疾病它都是有一个过程的。尤其是对于我们呼吸道病毒感染的这种疾病来说,一定是要有一个病程,通常情况下需要3-5天恢复期,不管是您吃什么样的药,都是需要有一个这样正常的病程转归。”
专家表示,咳嗽属于人体保护性反射,孩子因为咽部不舒服或者呼吸道有分泌物,通过咳嗽把它排出来,对缓解孩子病情是有好处的。
童朝晖表示,“大多数情况下,不管是病毒还是支原体,如果局限在上呼吸道,大部分可以自愈,一小部分可能会发展到肺炎。”
张文宏表示,“一般来说,支原体肺炎在家用一些对症药物就能好转,但需要注意有没有向重症的方向发展。比如,孩子用药后情况好转,就可以在家观察;如果吃了退烧药仍高烧不退,状态萎靡不愿吃东西,这种情况应尽早就医。”
成年人:如果发热持续时间超过72个小时或体温超过40℃,或频繁咳嗽以致影响正常生活,或出现胸痛、喘憋、咯血、呼吸急促或呼吸困难、精神差、频繁呕吐等症状时,要及时去医院就诊。
孩子出现超高热或持续发热超过三天、频繁咳嗽影响正常生活、精神状态不好甚至出现嗜睡、呼吸频率增快或呼吸困难、频繁呕吐、皮疹、头痛或抽搐等,应及时带孩子就医。
而对于更严重的感染,如肺炎,则可能需要医生开具的抗生素或其他相关入院治疗。
因此,在感染还未发展到严重状态时,及时加以干预,在可控制范围内帮助缓解疾病。改善肠道微生态可以降低病毒载量,增加IFN-α、IFN-γ和IL-1β的表达,减少TNF-α。

doi: 10.2147/IJGM.S361001
维生素C
维生素 C 具有重要的抗炎、免疫调节、抗氧化、抗血栓和抗病毒特性。诺贝尔奖获得者莱纳斯·鲍林从随机对照试验中得出结论,维生素 C 可以预防和缓解感冒。
一项针对儿童上呼吸道感染的荟萃分析发现,维生素C的补充能够减少感染持续时间约1.6天。
口服维生素 C(2-8 克/天)可以减少呼吸道感染的发生率和持续时间。
英国安慰剂对照试验由 168 名志愿者组成,他们在 60 天的冬季期间随机接受安慰剂或维生素 C(每天 2 × 500 毫克)。
维生素 C 组的感冒次数较少(37次 vs.50次,p=0.05)
病毒感染的“感冒”天数更少(85次 vs.178次,p=0.03)
严重症状持续时间较短(1.8天 vs.3.1天,p=0.03)。
试验期间患过两次感冒的参与者人数显着减少(维生素 C 组为 2/84,安慰剂组为 16/84;p=0.04)
维生素D
维生素D缺乏会影响呼吸道感染的发生和哮喘的恶化。
维生素D和肠道微生物组以多种类似的方式影响呼吸道疾病中的免疫系统。它们之间可能存在一些相互作用和/或协同作用。
肠道微生物组可以改变肠道维生素D代谢,1,25(OH)2D (维生素D的活性形式)水平较高的人更有可能拥有有利的肠道微生物群,尤其是更多的产丁酸菌。
维生素D->抗病毒感染->降低哮喘发生和恶化的风险
一项涉及不同国家儿童的队列研究发现,补充维生素D 与 RV感染呈负相关。此外,患有下呼吸道感染的儿童的平均维生素 D 水平明显低于对照组。下呼吸道感染的发生率和严重程度也与维生素 D 水平相关。
维生素D可以双向调节肠道微生物群
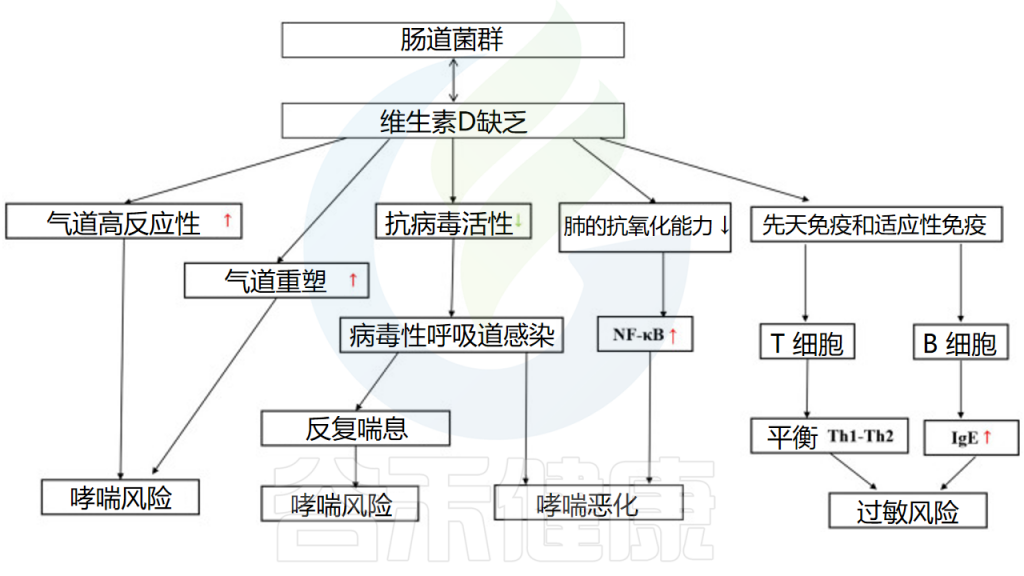
doi: 10.3389/fmicb.2023.1219942
维生素D通过多种途径影响哮喘的发生
因此,保持足够的维生素D水平对于预防和管理哮喘以及呼吸道感染至关重要。
研究发现,摄入豆类、谷物、海鲜、坚果、水果、蔬菜、油性鱼类与机会性细菌群、内毒素生成和粪便中的炎症标志物下降相关,也与某些有益菌增加相关。
• 姜黄素
姜黄素是姜黄中存在的生物活性化合物,具有多机制作用模式。它可以抑制病毒进入细胞,包裹病毒和病毒蛋白酶。
——见效快
在呼吸道感染的研究中,姜黄素组的大多数症状,包括发烧和发冷、呼吸急促、肌痛和咳嗽,消退速度明显更快。
——在肺部疾病中的抗炎作用
姜黄素可以通过抑制 NF-κB 来减轻甲流病毒在肺部引起的炎症反应。姜黄素具有多效性,可细胞因子(如IL-6、TNF-α)、粘附分子(如 ICAM-1)和酶(如 MMP),在炎症中发挥重要作用,例如哮喘或慢性阻塞性肺病、急性呼吸窘迫综合征、肺纤维化和急性肺损伤等。
——作为新型抗生素的来源
姜黄素对耐甲氧西林金黄色葡萄葡萄球菌(MRSA)、粪肠球菌、枯草芽孢杆菌、铜绿假单胞菌、大肠杆菌具有体外抗菌活性。
姜黄素和常见抗生素对 60 种产生革兰氏阳性和革兰氏阴性生物膜的细菌(包括之前介绍的常见肺炎病原体)具有协同作用,有望有效抑制多种多重耐药细菌的发展。
• 白藜芦醇
白藜芦醇是一种天然多酚化合物,源自葡萄、红酒、桑葚、花生、浆果、坚果和其他植物来源。白藜芦醇具有抗氧化、抗癌、抗病毒和自由基清除活性。白藜芦醇的抗病毒活性可能与其对 IFN-a、IL-2 和 IL-12 的免疫调节作用有关。
用白藜芦醇后,慢性阻塞性肺病引起的肺部炎症和氧化应激有所减少。
它与β-葡聚糖的组合提高了白藜芦醇的稳定性。含有白藜芦醇和羧甲基-β-葡聚糖的溶液可以减轻患有普通感冒的婴儿的一些呼吸道症状。
• 槲皮素
槲皮素有抗炎、抗氧化和免疫调节特性。
槲皮素可以从一些水果和蔬菜中获得,如浆果、芦笋,红叶生菜、洋葱、苹果、莳萝、萝卜、刺山柑、香菜、银杏叶、葡萄、葱、西红柿、西兰花、青椒、豌豆等。也可以从含有槲皮素或其一些合成衍生物的补充片剂中补充。
一项随机、双盲、安慰剂对照试验显示,补充每天1000毫克的槲皮素持续12周,显著增加了血浆槲皮素水平,每天摄入 1000 毫克槲皮素的受试者的上呼吸道感染患病天数和严重程度减少了三分之一。
• 大蒜中的大蒜素和二烯丙基三硫化物 (DATS)
大蒜可以通过抑制促炎细胞因子并通过调节免疫细胞来调节瘦素表达,从而发挥针对 COVID-19 的治疗作用,大蒜对 SARS-CoV 和其他几种病毒,如单纯疱疹病毒(HSV-1 型和 2 型)、乙型流感和 HIV等具有抗病毒特性。
• 从褐藻中提取的褐藻糖胶(硫酸化多糖)
海藻的代谢物是预防儿童流感感染的潜在药物。来自褐藻的岩藻糖胶通过结合并阻断甲型流感病毒中的神经氨酸酶活性,从而抑制病毒的释放。
• 卡拉胶(Carrageenan)
在感染普通感冒病毒的儿童中,通过鼻腔喷雾剂直接施用卡拉胶可减轻感冒症状。
• 硫酸半乳聚糖化合物
硫酸化半乳聚糖的来源是红藻,通过用水提取,然后用乙醇沉淀多糖,从藻类中分离半乳聚糖。硫酸化半乳聚糖作为儿童抗菌剂和抗病毒剂也具有重要用途。
• 从胡椒中提取的胡椒碱
胡椒碱抑制 IL-6 和 MMP-13 以减少 PGE。胡椒碱促进吞噬细胞的活性以支持免疫,具有抗炎和抗病毒特性。
• 肉桂醛
肉桂醛是一种具有潜在抗炎活性的生物活性化合物,可用于减轻 SARS-Cov-2 引起的肺部过度炎症。通过抑制 NF-B、内毒素介导的炎症小体(例如 NLRP3、TLR4 和 NOD)来抑制 TNF 诱导的炎症。
益生菌对病原微生物的保护作用主要基于三个生物过程:
i)抗菌活性
ii)支持上皮屏障特性
iii)免疫调节
益生菌调节粘膜免疫功能,特别是通过影响诱导部位(如Peyer斑块和肠系膜淋巴结)的树突状细胞极化。这些树突状细胞反过来影响T细胞和B细胞的反应。一旦这些T细胞和B细胞进入循环系统,它们就会迁移到肠外部位,例如呼吸道。
各种研究表明,益生菌可以有效降低肺部的病毒滴度并抑制多种呼吸道病毒的复制,包括流感病毒和呼吸道合胞病毒。
下列益生菌显示出鼻病毒诱发疾病的潜在减少:
植物乳杆菌 CECT 7315/7316,具有免疫刺激特性,可以提高老年人流感疫苗的有效性。
长双歧杆菌BB 536菌株作为佐剂来增强对流感疫苗的免疫反应,这导致老年人接种时抗体滴度和细胞介导的免疫增强。
动物乳芽孢杆菌亚种BB-12和副干酪乳杆菌亚种副干酪乳杆菌431的2种益生菌菌株的免疫益处的评估表明,与安慰剂组相比,两个益生菌组的特异性IgG增加明显更多。
注:IgG抗感染防御,中和病原体,促进吞噬作用,激活补体系统,增强抗体对病原体的清除作用。
口服短双歧杆菌、鼠李糖乳杆菌和乳双歧杆菌可以诱导抗原特异性反应,从而有助于以抑制过敏反应。同样,粪肠球菌FK-23 可以通过减少Th 17反应来抑制过敏性气道炎症。
总的来说,益生菌可以帮助加强肠道和呼吸道的免疫功能,减少病毒感染的风险,并缓解症状的严重程度。
自史前时代以来,人们就开始食用发酵食品(例如黄油、奶酪、酸奶、牛奶、扁豆、肉、鱼和酸面包)。发酵食品的好处在古代文献中已经提到。
发酵食品,例如:
饮料,例如:
多酚,如花青素、类黄酮和黄烷酮,通过促进有益细菌的生长和调节肠道细菌的多样性来充当益生元。地中海饮食中存在的主要酚类化合物作为呼吸道感染预防/治疗剂的潜在用途,基于其抗氧化和抗炎作用。
表没食子儿茶素 (EGCG) 显示出抗病毒活性,包括抑制 SARS-COV-2。EGCG(一种在绿茶中发现的化合物)、绿茶提取物和泡菜(韩国发酵食品)已被发现在抑制 SARS-CoV-2 方面具有潜在益处。这是通过抑制主要蛋白酶(MPro,也称为 3C 样蛋白酶)来实现的,这对病毒的生命周期至关重要。
此外,这些物质通过抑制促氧化酶提供线粒体保护,激活称为NrF2的细胞保护性转录因子通路,并下调 ACE2 和TMPRSS2。通过减少氧化应激和细胞因子风暴,它们可以降低 COVID-19 患者患肺纤维化、血栓形成和败血症的风险。
发酵蔬菜和芸苔科蔬菜含有萝卜硫素,可激活 NrF2 途径,因此已显示出病毒保护和对早期氧化应激的保护作用,因此可以帮助减轻 COVID-19 的严重程度。
合生元是添加到可发酵食品中的活微生物的组合,可以对健康产生协同作用。
由植物乳杆菌、嗜酸乳杆菌、乳杆菌和益生元纤维菊粉和低聚果糖组成的合生元制剂,已被证明可以消耗与代谢综合征和几种心血管危险因素相关的胰岛素抵抗标志物。
为了进一步研究微生物组调节作为 COVID-19 治疗策略的潜力,利用新型共生配方 (SIM01) 进行了一项临床研究。该配方含有双歧杆菌菌株、低聚半乳糖、低聚木糖和抗性糊精,用于住院的 COVID-19 患者。结果显示炎症标志物显着减少,针对 SARS-CoV-2 的抗体形成得到改善,鼻咽病毒载量降低。
此外,共生配方可有效恢复这些患者的肠道菌群失调,表明微生物组靶向疗法在治疗 COVID-19 方面的潜力。因此,合生元等功能性食品的创新和开发可以为呼吸道感染患者的健康促进和健康提供有益的方法。
FMT刺激肠道会激活肺部免疫反应,肠道和上呼吸道微生物组恢复可以通过增强初级肺泡巨噬细胞功能的机制,重新建立针对细菌和病毒感染的肺部免疫防御。FMT 可以恢复针对多重耐药细菌院内感染的保护能力。
FMT可能成为治疗肺部疾病的一种潜在策略,尤其是针对那些与肠道微生物组失衡相关的疾病。
中药在临床应用已有一千多年的历史,最近研究表明,中药在减轻甲流患者肺部炎症、改善临床症状、缩短治疗时间、促进康复等方面具有功效。
感染肺部后,甲流病毒可以改变肠道微生物群的组成和代谢,导致肠粘膜屏障受损、免疫功能受损和炎症因子水平升高。尽管如此,中药干预具有调节肠道微生物群、恢复体内平衡、保持肠粘膜屏障完整性、增强免疫功能和调节炎症反应的潜力。
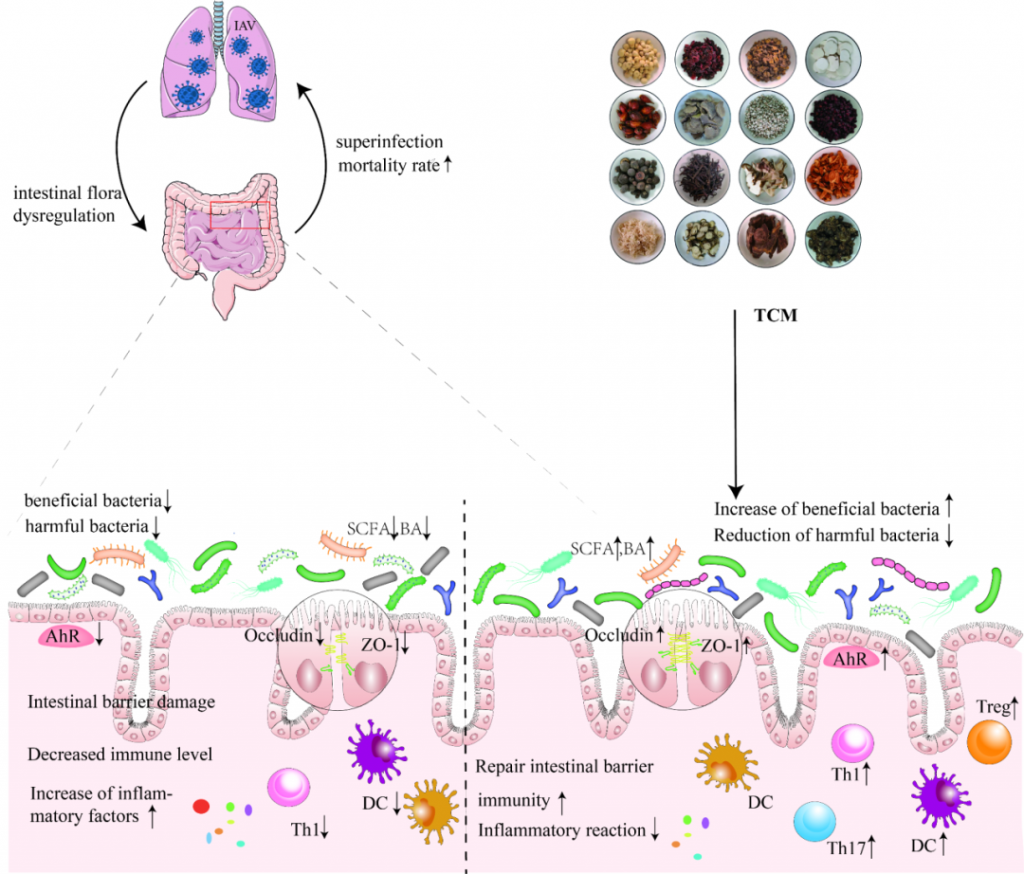
doi: 10.1186/s12985-023-02228-3.
宣肺败毒汤调节肠道微生物群多样性,并与拟杆菌、志贺氏菌、Eubacterium nodatum、Turicibacter、Clostridium sensu stricto 1 的变化呈正相关,而这些变化与 TNF-α 水平相关。
升麻素苷(Prim-O-glucosylcimifugin,POG)是中药防风的提取物,可以通过上调紧密连接蛋白Occludin、Claudin-3和ZO-1的表达水平来调节肠道菌群结构并修复肠道免疫屏障。
999 小儿感冒颗粒可以缓解H1N1感染小鼠的体重减轻,降低IL-6和IL-1β等炎性细胞因子的水平。降低肺指数和病理损伤,通过维持结肠杯状细胞的数量来保护肠道屏障,降低结肠组织中IL-17 A的表达。
大黄中蒽醌类成分不仅增加了大鼠肠道中一些益生菌和产短链脂肪酸菌的丰度,而且通过上调ZO-1和闭塞素的表达水平来增强肠道屏障功能,从而抑制炎症。
其他中药对菌群及免疫的影响
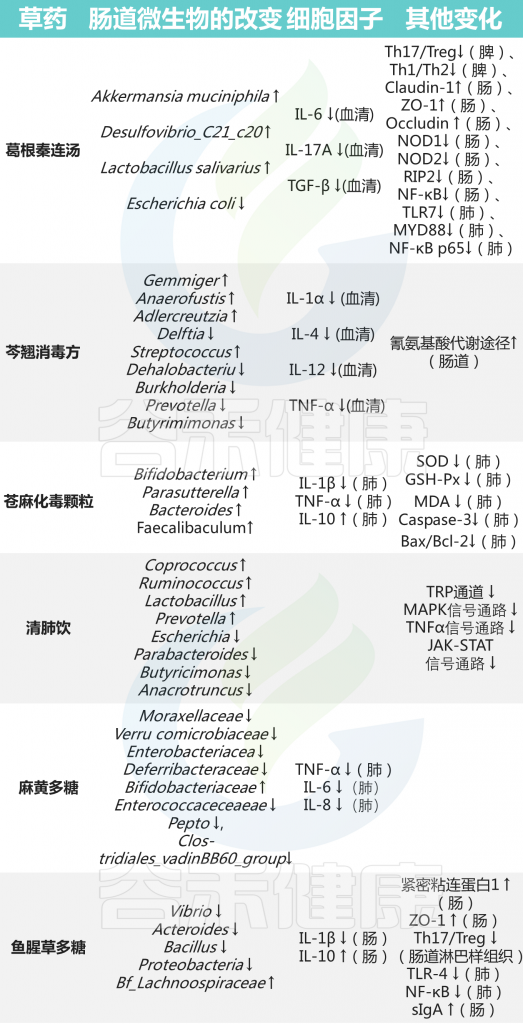
doi: 10.3389/fimmu.2023.1147724
我们需要维持一定的运动量,来保持良好的免疫力和身体状态,但凡事过犹不及,需把握一个度:“微微出汗”。
冬季增大运动量,发场大汗就可以提高免疫力?
刘清泉表示,从中医的角度来讲,过分出汗会伤人的阳气。冬季运动身上微微发热,微微出汗就可以。大汗淋漓地运动也没问题,但不用天天如此。
其他帮助孩子缓解不适的简单方式:
揉迎香穴
迎香穴位于人体面部鼻唇沟中,鼻翼外缘中点旁,用食指罗纹面置于迎香穴,做旋转揉搓。揉迎香有通经活络、通利鼻窍的作用。
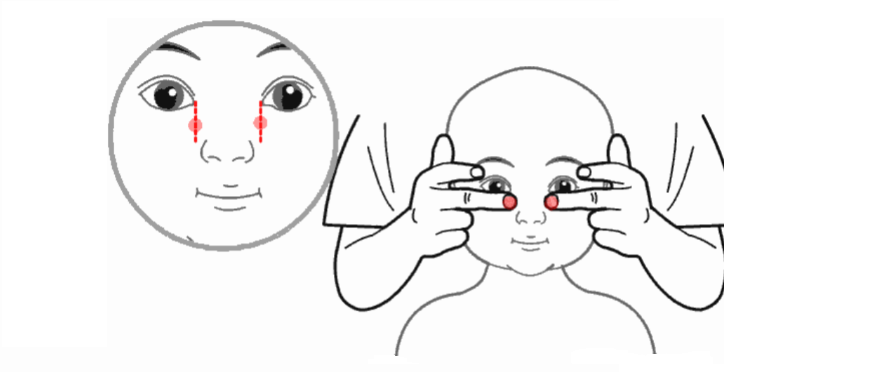
清天河水
清天河水,自下而上推左手,有退热、镇静、安眠的作用,对于孩子发烧、心烦、口渴等有很好的疗效。

清肺经
用拇指螺纹面,从无名指的指尖向指根方向直推,针对扁桃体炎有较好的效果。
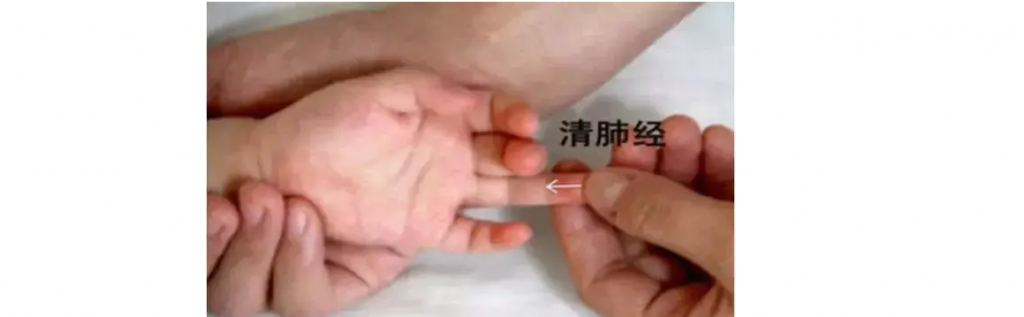
推揉足三里
在外膝眼下三寸胫骨前脊外开一横指处。推揉足三里可调理脾胃,增强抗病能力。
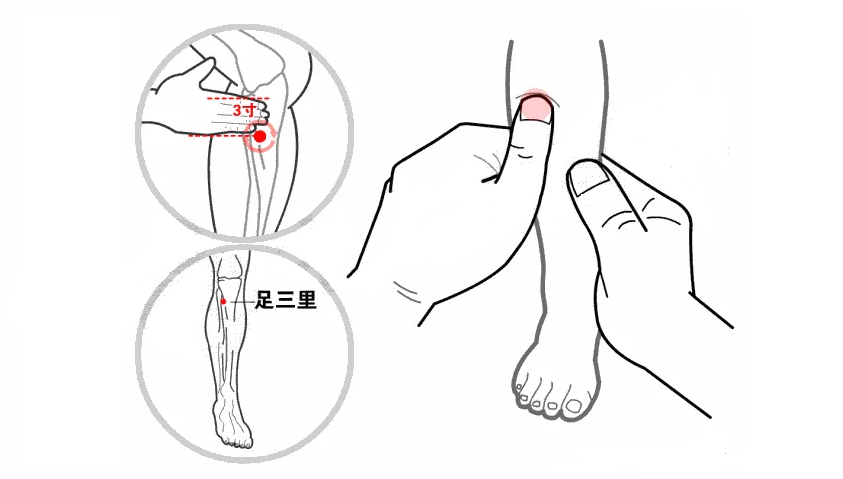
清大肠经
肺与大肠相表里,肺热,大肠也会有热。大肠经位于食指桡侧缘,由食指指尖至虎口,成一直线处。可以帮助清热解毒、调理胃肠。
“肺与大肠相表里”是中医的一个概念,指两个脏腑之间存在着密切的生理联系,相互影响和制约。肺主宣发和下行,掌管呼吸,而大肠主传导,负责排泄。肺的清肃功能与大肠的泄下功能相互协调,保证了人体的正常气机运行。
现代医学研究中,“肠-肺轴”也认为肠道和肺部之间存在的相互沟通机制,包括免疫系统、内分泌系统、神经系统等,与中医的“肺与大肠相表里”概念有着相似之处,例如肠道菌群通过代谢产物如短链脂肪酸等可以影响远处的肺部免疫反应。
需要重视病后康复阶段,在用各种方式调理肠道菌群的同时,可以配合以上小儿推拿,扶正驱邪,增强免疫力。
肠道菌群失调不仅调节胃肠道的免疫反应,还影响肺和呼吸道等远端器官。肠道微生物通过产生代谢产物、调节免疫反应以及与宿主细胞相互作用,可以影响呼吸道的病原体防御和炎症反应。肠道菌群失调可能削弱宿主的免疫反应,使个体更容易受到呼吸道感染的侵袭。
肠道微生物群与呼吸道健康之间的相互作用是一个多层次、多维度的领域。肠道菌群作为肠道健康的关键因素,其在“肠-肺轴”中的作用为“肺与大肠相表里”这一古老的中医理论提供了新的科学依据。
监测肠道菌群组成,准确改善肠道,可以降低呼吸道疾病的易感性,远离病原体的困扰。当感染发生时,第一时间进行饮食等相关调整,逐步优化肠道菌群健康,可帮助恢复,减少复发风险。
相关阅读:
阳康后是否会二次感染,长新冠与肠道菌群的关联,多种潜在的相关干预措施
主要参考文献
Bosch AA, Biesbroek G, Trzcinski K, Sanders EA, Bogaert D. Viral and bacterial interactions in the upper respiratory tract. PLoS Pathog. 2013 Jan;9(1):e1003057
Ou G, Xu H, Wu J, Wang S, Chen Y, Deng L, Chen X. The gut-lung axis in influenza A: the role of gut microbiota in immune balance. Front Immunol. 2023 Oct 20;14:1147724.
Zhu W, Wu Y, Liu H, Jiang C, Huo L. Gut-Lung Axis: Microbial Crosstalk in Pediatric Respiratory Tract Infections. Front Immunol. 2021 Nov 18;12:741233.
Lane S, Hilliam Y, Bomberger JM. Microbial and Immune Regulation of the Gut-Lung Axis during Viral-Bacterial Coinfection. J Bacteriol. 2023 Jan 26;205(1):e0029522.
Huang S, Li J, Zhu Z, Liu X, Shen T, Wang Y, Ma Q, Wang X, Yang G, Guo G, Zhu F. Gut Microbiota and Respiratory Infections: Insights from Mendelian Randomization. Microorganisms. 2023 Aug 18;11(8):2108.
Zama D, Totaro C, Biscardi L, Rocca A, Turroni S, Brigidi P, Lanari M. The Relationship between Gut Microbiota and Respiratory Tract Infections in Childhood: A Narrative Review. Nutrients. 2022 Jul 21;14(14):2992.
Haldar S, Jadhav SR, Gulati V, Beale DJ, Balkrishna A, Varshney A, Palombo EA, Karpe AV, Shah RM. Unravelling the gut-lung axis: insights into microbiome interactions and Traditional Indian Medicine’s perspective on optimal health. FEMS Microbiol Ecol. 2023 Sep 19;99(10):fiad103.
Enaud R, Prevel R, Ciarlo E, Beaufils F, Wieërs G, Guery B, Delhaes L. The Gut-Lung Axis in Health and Respiratory Diseases: A Place for Inter-Organ and Inter-Kingdom Crosstalks. Front Cell Infect Microbiol. 2020 Feb 19;10:9.
Sencio V, Machado MG, Trottein F. The lung-gut axis during viral respiratory infections: the impact of gut dysbiosis on secondary disease outcomes. Mucosal Immunol. 2021 Mar;14(2):296-304.
Zhou B, Pang X, Wu J, Liu T, Wang B, Cao H. Gut microbiota in COVID-19: new insights from inside. Gut Microbes. 2023 Jan-Dec;15(1):2201157.
Keulers L, Dehghani A, Knippels L, Garssen J, Papadopoulos N, Folkerts G, Braber S, van Bergenhenegouwen J. Probiotics, prebiotics, and synbiotics to prevent or combat air pollution consequences: The gut-lung axis. Environ Pollut. 2022 Jun 1;302:119066.
Bulanda E, Wypych TP. Bypassing the Gut-Lung Axis via Microbial Metabolites: Implications for Chronic Respiratory Diseases. Front Microbiol. 2022 May 3;13:857418.
Ma L, Ji L, Wang T, Zhai Z, Su P, Zhang Y, Wang Y, Zhao W, Wu Z, Yu H, Zhao H. Research progress on the mechanism of traditional Chinese medicine regulating intestinal microbiota to combat influenza a virus infection. Virol J. 2023 Nov 13;20(1):260.
Weston S, Frieman MB. Respiratory Viruses. Encyclopedia of Microbiology. 2019:85–101.
Liu Y, Ling L, Wong SH, Wang MH, Fitzgerald JR, Zou X, Fang S, Liu X, Wang X, Hu W, Chan H, Wang Y, Huang D, Li Q, Wong WT, Choi G, Zou H, Hui DS, Yu J, Tse G, Gin T, Wu WK, Chan MT, Zhang L. Outcomes of respiratory viral-bacterial co-infection in adult hospitalized patients. EClinicalMedicine. 2021 Jun 10;37:100955.
Zhao X, Hu M, Zhou H, Yang Y, Shen S, You Y, Xue Z. The role of gut microbiome in the complex relationship between respiratory tract infection and asthma. Front Microbiol. 2023 Jul 27;14:1219942.
Thottarath Prasanthan A, Damodaran A, Kumar NS, Viswanad V. Deducing the Interplay Between Gut Flora and Respiratory Diseases: A New Therapeutic Strategy? Indian J Microbiol. 2023 Mar;63(1):1-17.
Valverde-Molina J, García-Marcos L. Microbiome and Asthma: Microbial Dysbiosis and the Origins, Phenotypes, Persistence, and Severity of Asthma. Nutrients. 2023 Jan 17;15(3):486.
Holford P, Carr AC, Jovic TH, Ali SR, Whitaker IS, Marik PE, Smith AD. Vitamin C-An Adjunctive Therapy for Respiratory Infection, Sepsis and COVID-19. Nutrients. 2020 Dec 7;12(12):3760.
Omer AK, Khorshidi S, Mortazavi N, Rahman HS. A Review on the Antiviral Activity of Functional Foods Against COVID-19 and Viral Respiratory Tract Infections. Int J Gen Med. 2022 May 10;15:4817-4835.
Suresh MV, Francis S, Aktay S, Kralovich G, Raghavendran K. Therapeutic potential of curcumin in ARDS and COVID-19. Clin Exp Pharmacol Physiol. 2023 Apr;50(4):267-276.

谷禾健康

芽孢杆菌属(Bacillus)是革兰氏阳性、杆状、芽孢杆菌科细菌的一个属,属于厚壁菌门。
芽孢杆菌属物种可以是专性需氧微生物(依赖氧气)或兼性厌氧微生物(具有需氧或厌氧的能力)。当使用或存在氧气时,它们的过氧化氢酶检测呈阳性。
▸ 芽孢杆菌分布广泛
芽孢杆菌在自然界中无处不在,包括自由生活(非寄生)和寄生致病菌种。在压力环境条件下,细菌可以产生椭圆形内生孢子,这不是真正的“孢子”,但细菌可以将自身缩小到内生孢子,并在很长一段时间内保持休眠状态,正是由于这些特征最初定义了该属。
芽孢杆菌属主要栖息地是土壤,但它广泛分布在环境中。这些生物通常存在于腐烂的有机物、灰尘、蔬菜、水中,农作物、食物以及有些物种是人体正常菌群的一部分。它们形成的孢子对热、冷和普通消毒剂具有抵抗力,使它们经常从院内污染物中分离出来。
▸ 小部分芽孢杆菌可能是机会性病原体
芽孢杆菌属大多没有致病潜力,并且很少与人类或其他动物的疾病相关;但是也有几个例外,炭疽杆菌是炭疽病的病原体;蜡状芽孢杆菌,通常会引起食源性中毒,也会引起局部和全身感染,是人类和牲畜的病原体,特别影响免疫抑制个体、新生儿和术后患者。此外,偶尔也从食物相关疾病病例中分离出地衣芽孢杆菌、枯草芽孢杆菌和短小芽孢杆菌。幼虫芽孢杆菌、慢孢芽孢杆菌、蒺藜芽孢杆菌、球形芽孢杆菌和苏云金芽孢杆菌是特定昆虫类群的病原体。
芽孢杆菌引起的感染临床谱包括自限性食物中毒、与外伤有关的局部感染(如眼部感染)、深部软组织感染和全身感染(如脑膜炎、心内膜炎、骨髓炎和菌血症)。暴发性眼部感染被广泛认为是非炭疽芽孢杆菌感染的并发症,最常见的是蜡状芽孢杆菌。
目前芽孢杆菌属尚未被认为是主要的人类病原体,随着医疗技术的最新进步和免疫抑制患者数量的增加,它们越来越多地被认为是住院患者中的机会病原体。大多数临床实验室无法鉴定芽孢杆菌属。
▸ 一些芽孢杆菌可作为益生菌
但是,一些芽孢杆菌属物种可用作益生菌,包括凝结芽孢杆菌和枯草芽孢杆菌。研究结果显示摄入这种细菌的可以缓解肠易激综合症的症状,还可以缓解类风湿性关节炎和胀气的症状以及肠道炎症和泌尿生殖感染以及停止腹泻等。
芽孢杆菌属的益生菌比较特殊,因为它们多一个厚厚的“保护衣”——芽孢,跟直接裸露的孢子相比,被保护得好好的芽孢存活率更高。凝结芽孢杆菌有很强的耐受性,耐高温,耐胃酸和耐胆盐,因此可以顺利通过肠道,达到他们的目的地,起到很好的益生效果,这也是芽孢杆菌益生菌的不同之处,因此也被称为“菌中之王”。此外,芽孢杆菌属还参与肠道微生物组的各个方面,例如色氨酸代谢、维持肠道屏障完整性和影响宿主免疫反应,而它们的丰度可能受到雌激素缺乏和宿主遗传学等因素的影响。
芽孢杆菌的孢子经常被动物和人类无意中通过食物和饮料以及一些发酵食品摄入。但是注意该属细菌的许多作用不仅取决于物种,还取决于菌株,但该属细菌的一个重要共性是它们可以刺激免疫系统,这可能是好是坏,取决于具体肠道整齐情况。
已知芽孢杆菌属能够从环境中的其他细菌获取质粒。这些质粒可能是无害的,也可能包含抗生素耐药性或毒素产生的信息。此外,某些用作益生菌的芽孢杆菌具有抗生素耐药性,因此如果正在服用它们,需要谨慎。
此外,芽孢杆菌的孢子穿过胃形成营养细胞,一旦环境条件不利,营养细胞就会重新形成孢子从肠道转移肠外,在许多情况下,人体的免疫系统会消灭它们,但可能会发生感染。
该属的成员具有重要的微生物用途。许多酶、抗生素和其他代谢物具有医疗、农业、制药和其他工业应用。由芽孢杆菌属形成的抗生素的例子,包括地衣芽孢杆菌或枯草芽孢杆菌产生的杆菌肽、多粘芽孢杆菌产生的多粘菌素以及短芽孢杆菌产生的短杆菌肽。某些芽孢杆菌菌株已被用作抗生素和其他测定中的生物对照。
本文将从属层面介绍芽孢杆菌,包括其历史,分类,代谢属性以及代表性的益生菌种和致病菌种。
1 历史
对芽孢杆菌属的兴趣可以追溯到19世纪,因为通过对枯草芽孢杆菌及其孢子的观察,费迪南德·科恩 (Ferdinand Cohn, 1876)最终能够质疑自然发生理论;以及罗伯特·科赫(Robert Koch, 1876)对炭疽芽孢杆菌的发现标志着临床细菌学的起源。
罗伯特·科赫发现了炭疽杆菌的显微照片。死于炭疽病的动物血液中始终存在这种细菌,为炭疽杆菌(炭疽芽胞杆菌),首次证明特定细菌是特定疾病的病因。
芽孢杆菌(Bacillus),意思是“棍子”,是一类杆状革兰氏阳性细菌,属于厚壁菌门,已鉴定出超过270个菌种,细菌类的复数名称是Bacilli。
• 形态
它们呈棒状,直或稍弯曲,可以单独或成对出现,有时也成串出现。通常具有圆形末端,尽管一些细胞被描述为方形(例如蜡样芽孢杆菌)。由于周鞭毛的存在,它们中的绝大多数是可移动的,也就是说,它们向各个方向伸出。然而,炭疽杆菌缺乏鞭毛。
细胞的直径为0.4至1.8微米,长度为0.9至10.0微米。每个物种和每个菌株内的细胞尺寸通常几乎没有变化。
当通过相差显微镜观察时,培养物似乎由单个细胞和成对的分裂细胞组成。在其他情况下,子细胞可能仍然相互附着,因此可以看到细胞链。
• 可产生芽孢
长期以来,在有氧存在的情况下产生抗性内生孢子一直是其定义特征。
该属的成员可能是需氧的或兼性厌氧的,并且它们也有望具有革兰氏阳性细胞壁结构(尽管它们的染色反应,也可能是革兰氏可变的或坦率地说是革兰氏阴性的)。
细胞壁由多层肽聚糖组成,肽聚糖之间交联,形成坚固的支架,维持细胞形状,并含有磷壁酸和脂磷壁酸。
大约75年来,这些特征一直是该属定义的一部分,但自1995年以来,已提出了三种严格厌氧芽孢杆菌。这种对定义的破坏是因为16S rRNA基因序列分析允许识别属边界,而属之前是通过表型来定义的,作为共享关键(即诊断)特征的物种的实用集合。此外,在单一可用的盐芽孢杆菌菌株中仅观察到球状细胞,因此芽孢杆菌不再仅仅是杆状细胞属。
• 具有良好的适应能力
该属的许多物种表现出广泛的生理能力,使它们能够生活在各种自然环境中。每个细胞仅形成一个内生孢子,孢子耐热、耐寒、耐辐射、耐干燥和耐消毒剂。
孢子形态是一种分类学特征,尽管特定菌株内可能存在一些变异。最常见的孢子形状为椭圆形或卵形,但形状范围从圆柱形到椭圆形、球形或不规则形状。
炭疽杆菌需要氧气才能形成孢子;这一限制对流行病学和控制具有重要影响。在体内,炭疽芽孢杆菌产生一种多肽(聚谷氨酸)胶囊,可保护其免受吞噬。
内生孢子对热、辐射、消毒剂和干燥的抵抗力以及特定孢子的粘附特性促进它们附着在加工设备上并抵抗清洁导致这些生物体成为临床环境、生物技术过程和食品生产中的污染物。香料、奶粉和谷物产品等干燥食品通常受到孢子的严重污染,在食品制备过程中如果有水,这些孢子可能会发芽,导致腐败或食物中毒。
• 流行病学
虽然芽孢杆菌的主要栖息地是土壤,但它广泛分布在环境中。这些生物通常存在于腐烂的有机物、灰尘、蔬菜、水中,有些物种是正常菌群的一部分。
健康无症状个体粪便中蜡状芽孢杆菌的携带率在0-43%之间。在医院环境中,疫情和流行病可追溯到受污染的呼吸机设备、含酒精的消毒湿巾、消毒剂和透析设备。
食源性疫情中蜡样芽胞杆菌的来源包括大米、肉饼、面包、肉类和植物等。
尽管芽孢杆菌分布广泛,但它们很少与实际感染有关,更常见的是作为培养物的污染物被分离出来。仔细的临床评估对于确定芽孢杆菌分离的意义非常重要。
原料乳容易受到污染
据报道,芽孢杆菌属在原料乳中污染最严重。农场中的饲料、土壤和粪便等易受芽孢杆菌污染,牛舍周围也广泛存在芽孢杆菌,这些菌易污染奶牛乳头表面,使芽孢杆菌污染原料乳。当原料奶中有较多的芽孢时,加工后贮存过程中芽孢转化为营养体,随着贮存期的延长会出现酸包、胀包现象。
• 临床感染
芽孢杆菌引起的感染临床谱包括自限性食物中毒、与外伤有关的局部感染(如眼部感染)、深部软组织感染和全身感染(如脑膜炎、心内膜炎、骨髓炎和菌血症)。
暴发性眼部感染被广泛认为是非炭疽芽孢杆菌感染的并发症,最常见的是蜡状芽孢杆菌 。
与严重感染有关的各种物种包括蜡状芽孢杆菌、枯草芽孢杆菌、球形芽孢杆菌、蜂房芽孢杆菌、侧孢芽孢杆菌、地衣芽孢杆菌、巨大芽孢杆菌和短小芽孢杆菌 。
• 实验室诊断
芽孢杆菌属物种分类的早期尝试基于两个特征:需氧生长和内生孢子形成。这导致许多具有不同生理机能并占据不同栖息地的细菌聚集在一起。因此,生理学、生态学和遗传学的异质性使得芽孢杆菌属鉴定变得困难。
大多数临床实验室无法鉴定芽孢杆菌属。许多芽孢杆菌属物种很容易在营养琼脂或蛋白胨培养基上生长。有时葡萄糖也可以促进生长,但血液或血清则不能。最适生长温度为25°C至37°C。在营养状态下,55°C的湿热可在1小时内杀死芽孢杆菌。
注:枯草芽孢杆菌的孢子可以承受煮沸数小时。
传统上,对未知芽孢杆菌菌株的可靠诊断采用多相方法,其中包括基本表征、16S rRNA的部分序列分析、宏基因组等分析以及区分个体表型测试。
早在1981年,就有人指出,根据rRNA序列,芽孢杆菌属的遗传多样性与肠杆菌科和弧菌科的联合科一样高。根据rRNA 序列,(1993)区分了六个不同的群体。今天,只有rRNA 第1组的代表,其中包含B.subtilis、B.pumilus、B.licheniformis、B.simplex、B.megaterium、B. cereus、B.smithii、B.firmus、B.coagulans等物种,以及B.alcalophilus仍被归入芽孢杆菌属,而其他类群的代表现在被归入其他几个属。
该系统图基于16S rRNA序列包含273个芽孢杆菌属物种,并在命名法中具有最新地位。
(http://www.bacterio.net/bacillus.html)
尽管系统图反映了不同物种之间的分类学差异,但在许多情况下它对于不同物种的分类学分辨率还远远不能令人满意且不足。通常,不同物种之间的 16S rRNA相似性超过物种谱系的97%,人们普遍认为,超过97%的序列相似性支持归入一个物种。然而,随着全基因组DNA序列的可用性不断增加,分类学越来越依赖于核心基因组序列。
芽孢杆菌属和梭菌属构成芽孢杆菌科。革兰氏阳性需氧杆菌以越来越多的不同属和科为代表。伯杰手册的最新版本列出了属于芽孢杆菌科的19个不同属,例如芽孢杆菌属、碱杆菌属、盐杆菌属、慢杆菌属、海洋杆菌属和维吉杆菌属。许多物种最初被描述为芽孢杆菌属的成员,现在被重新分类为不同属和科的代表。
随着16S rRNA基因序列数据的积累,芽孢杆菌属已被划分。芽孢杆菌有160多个物种,获得的新物种数量比它因新属而失去的数量还要多。此外,还描述了42个含有需氧内生孢子形成物种的属,这些物种最初不属于芽孢杆菌属。
对细菌多样性认识的爆炸性增长和细菌类群数量的巨大扩张(不限于需氧内生孢子形成菌)是由来自新的、通常是外来环境的菌株的发现推动的。许多新物种的描述主要是基于16S rRNA 基因序列相似性和DNA-DNA相关性;它们的表型描述可能很简短——通常仅限于对单个分离株的观察,因此用于区分其中一些的常规表型特征的数量可能很少且几乎没有实用价值。
自1990年以来提出的一百三十或更多芽孢杆菌属物种中的许多都是基于对单一分离株的研究。其他几个物种的描述仅基于两个品系,因此该属中近40%的物种(以及自1990年以来出版的物种中约50%)的代表性较差,而且我们对它们内部的信息很少或根本没有——物种变异。
缺乏对物种品系间变异的了解几乎总是会导致识别困难,进一步的分离通常会导致描述的修正,并且经常导致分类学和命名法的变化。然而,由于许多新生物体是从外源或极端环境中分离出来的,不必太担心这种分类学的扩展;对于与其利益相关的物种来说,这并不代表分类学的剧变。
芽孢杆菌属仍然是最大的属,并且继续包含大多数最著名的名称,例如枯草芽孢杆菌(模式种)、蜡状芽孢杆菌、地衣芽孢杆菌、短小芽孢杆菌和苏云金芽孢杆菌;很少有其他熟悉的名称(其中一些具有潜在的临床意义)被转移到较新的属中。
例如短芽孢杆菌、球形赖氨酸芽孢杆菌、多粘类芽孢杆菌和浸软芽孢杆菌,并且在此基础上提出了几种新的芽孢杆菌和类芽孢杆菌物种临床来源中未知意义的单一分离株。
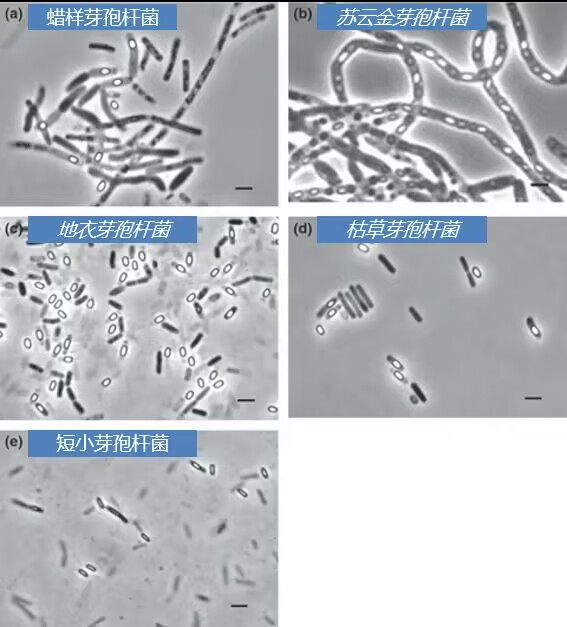
Logan NA. J Appl Microbiol. 2012
芽孢杆菌属已知的物种分类,详见附录一。
它们的共同特征包括降解大多数植物和动物来源的底物,例如纤维素、淀粉、果胶、蛋白质、琼脂、碳氢化合物等;此外还有抗生素生产;硝化作用;反硝化作用;固氮作用;自养;嗜酸;嗜碱性;嗜冷;嗜热和寄生等。
• 产生多种细胞外产物
不同种类的芽孢杆菌产生多种细胞外产物,包括少数种类的抗菌物质、酶、色素和毒素。
培养物中存在的酶包括淀粉酶、胶原酶、卵磷脂酶、磷脂酶、蛋白酶和脲酶。
蜡状芽孢杆菌在指数生长过程中会产生两种不同类型的肠毒素:引起腹泻的肠毒素和催吐毒素。
最近对蜡状芽孢杆菌毒力因子的研究表明,溶血素、一种三重皮肤坏死渗透因子和体内粗外毒素制剂在接种后4小时内引起生物体眼内炎。
蜡状芽孢杆菌可能具有与卵磷脂酶样活性相关的三种不同形式的酶活性;磷脂酰胆碱水解酶是研究最多的形式,通常称为磷脂酶C。这种酶可能通过破坏因其他毒素的作用而暴露的宿主细胞膜磷脂,从而在眼部感染中发挥次要作用。
根据KEGG,芽孢杆菌属代谢通路详见附录二。
• 体外和体内敏感性
治疗严重芽孢杆菌感染时,需要根据体外药敏情况选择抗生素。最近有关于芽孢杆菌属体外敏感性的研究已被报道 。
最常见的具有临床意义的分离株是蜡状芽孢杆菌(Bacillus cereus)。其他分离的菌株包括巨大芽孢杆菌、多粘芽孢杆菌、短小芽孢杆菌、枯草芽孢杆菌、环状芽孢杆菌、解淀粉芽孢杆菌和地衣芽孢杆菌。
使用微量稀释药敏法,所有蜡状芽孢杆菌菌株对亚胺培南、万古霉素、氯霉素、庆大霉素和环丙沙星敏感。大多数菌株对克林霉素、头孢唑啉和头孢噻肟耐药。
纸片扩散敏感性显示, 蜡样芽孢杆菌菌株对所有青霉素、苯唑西林和头孢菌素(美洛西林除外)具有耐药性。而许多非蜡状芽孢杆菌菌株对青霉素、头孢菌素和甲氧苄氨嘧啶-磺胺甲恶唑敏感。
许多菌株对红霉素和四环素敏感。超过95%的非蜡状芽孢杆菌菌株对亚胺培南、万古霉素、达托霉素和环丙沙星敏感。
75%至90%的菌株对青霉素、苯唑西林、头孢唑啉、头孢噻肟和氯霉素敏感。环状芽孢杆菌和多粘芽孢杆菌比其他非蜡状芽孢杆菌更有可能对青霉素、苯唑西林、头孢唑林和头孢噻肟产生耐药性。
体外协同研究显示,克林霉素-庆大霉素组合比万古霉素-庆大霉素组合拥有更高的杀菌协同率(60%vs40%)。这种杀菌作用可能在临床上很重要,例如眼内炎,其中宿主对感染的免疫反应导致终末器官损伤,以及免疫功能低下的宿主已被证明处于发生蜡样芽孢杆菌感染的风险中。
体内研究仅限于动物模型中的眼部感染。在由蜡状芽孢杆菌引起的外伤后眼内炎实验模型中, 玻璃体内注射100ug环丙沙星,在外伤和接种后1小时和6小时给药可预防疾病的发展。
在实验性外伤后蜡状芽孢杆菌眼内炎猪模型中,比较了环丙沙星、万古霉素和亚胺培南的玻璃体内注射效果。万古霉素和亚胺培南治疗的动物比对照动物有更少的炎症和组织破坏。而环丙沙星治疗的动物表现出明显更多的眼内破坏,并且与对照组没有区别。
• 抗菌疗法
芽孢杆菌的分离需要仔细的临床评估以确定发现的意义。某些危险因素与显著的芽孢杆菌感染有关,包括静脉内药物滥用、恶性肿瘤引起的镰状细胞病、中性粒细胞减少症和皮质类固醇治疗以及外来装置,包括留置血管内导管、中枢神经系统分流器、乳房植入物和起搏器。
首选药物为万古霉素或克林霉素
根据体外数据,治疗芽孢杆菌引起的严重感染的首选药物是万古霉素 ,因为蜡样芽孢杆菌是最常见的分离株。而根据临床数据,万古霉素和克林霉素均已成功使用。
单一疗法是否足够或联合疗法是否更好尚未在体外模型或临床试验中得到解决。其他高活性且可能具有杀菌作用的药物包括伊米培南、环丙沙星和庆大霉素。四环素、氯霉素、克林霉素和红霉素也对芽孢杆菌有活性。
大多数芽孢杆菌对头孢菌素具有耐药性
大多数芽孢杆菌菌株对广谱头孢菌素和替卡西林-克拉维酸具有耐药性。在进行药敏试验之前,应避免对血培养结果为革兰氏阳性需氧芽孢杆菌的免疫功能低下患者进行经验性覆盖后一种药物。
由芽孢杆菌引起的严重感染,包括眼部感染、心内膜炎、菌血症和败血症、肺炎、脑膜炎、肌肉骨骼感染等,通常需要全身抗生素治疗。
蜡状芽孢杆菌引起的食物中毒是一种自限性疾病,无需抗菌治疗。治疗通常是对症治疗,对于严重脱水的患者可能需要补充体液。
枯草芽孢杆菌是一种普遍存在的革兰氏阳性细菌,存在于水、土壤、空气、植物残渣以及山羊、绵羊和牛等反刍动物的胃肠道中,也存在于人类胃肠道中。
该名称于1872年由费迪南德·科恩(Ferdinand Cohn)命名,他还展示了枯草芽孢杆菌形成耐热孢子的能力。
枯草芽孢杆菌是一种友好且有益的细菌,因为它不具有引起疾病的特征。
尽管在20世纪50年代(抗生素出现的时期)之后,这种好细菌失去了人们的青睐——在人们开始使用抗生素之前,不同培养物的枯草芽孢杆菌在全世界都很流行。当时,人们使用这种友好的细菌作为免疫刺激剂来帮助治疗泌尿道和胃肠道疾病。
枯草芽孢杆菌也被广泛用作农场动物和家禽业中抗生素的替代品。它还用于食品比如日本纳豆和韩国清国酱的生产。
✦ 枯草芽孢杆菌的特点
由于枯草芽孢杆菌产生内生孢子(一种在某些细菌细胞内发育的抗性无性孢子),因此这种细菌可以在环境的极端高温和干燥条件下生存。
例如,如果其孢子被灰尘覆盖以保护其免受太阳紫外线的伤害,它可以在太空中存活长达六年。枯草芽孢杆菌还产生一系列蛋白酶和其他酶,这使其能够降解多种天然基质并促进养分循环。
低GC革兰氏阳性菌(低G+C革兰氏阳性菌DNA中鸟嘌呤和胞嘧啶核苷酸含量低于50%,而高G+C革兰氏阳性菌DNA中鸟嘌呤和胞嘧啶核苷酸含量超过50%)。
低GC革兰氏阳性菌中特征最明显的:
-棒状
-形成耐热、休眠的孢子
-具有单个环状基因组(染色体)
-有细胞质膜和厚的细胞壁,但没有外膜
-枯草芽孢杆菌的基因组测序包含4214630个碱基对
枯草芽孢杆菌基因组很容易进行遗传操作,生产各种重要的商业产品,特别是蛋白酶和淀粉酶。由于其商业重要性和易于基因操作,已被深入研究。
枯草芽孢杆菌是一种益生菌,通过平衡肠道微生物群,可能具有许多健康益处。在此,我们为您带来基于科学的枯草芽孢杆菌的一些健康益处清单。
• 枯草芽孢杆菌对减肥有益
动物研究表明,枯草芽孢杆菌(枯草芽孢杆菌 B10 菌株)可以通过减少氧化应激以及改善脂质代谢来减少肥胖小鼠的体重增加。
• 枯草芽孢杆菌具有抗氧化特性
枯草芽孢杆菌(菌株 B. subtilis BMB 44)已被证明具有高抗氧化和DNA保护活性。抗氧化剂对于保护细胞免受自由基及其有害作用至关重要。
• 枯草芽孢杆菌对胃肠道很有价值,因为它可以积极调节肠道微生物群
益生菌,例如不同种类的乳酸菌和双歧杆菌,对健康有许多益处。它们甚至可能对您的心理健康产生积极影响并减轻抑郁症状。
然而,有时肠道内的平衡会发生变化,有害细菌开始占主导地位,从而引发胃肠道问题、菌群失调,进而引发其他严重疾病。
幸运的是,枯草芽孢杆菌可以有益地改变肠道微生物群,因为它可以促进乳杆菌和双歧杆菌的生长,并减少大肠杆菌。
• 枯草芽孢杆菌有助于减少胆固醇
研究结果表明,通过改变肠道微生物群的组成(枯草芽孢杆菌R-179 和屎肠球菌R-026 的组合菌株)可以通过降低胆固醇水平来改善宿主健康。
• 枯草芽孢杆菌可能对糖尿病有帮助
一项研究表明,枯草芽孢杆菌 SPB1 生物表面活性剂所表现出的降血糖(降低血糖)和抗血脂(促进血液中脂质水平降低)活性足以有效缓解大鼠的糖尿病。
因此,根据研究结果,枯草芽孢杆菌 SPB1 生物表面活性剂可被认为是预防和治疗糖尿病的潜在有力候选物。
生物表面活性剂是由微生物产生的活性化合物(在细胞外合成,即在微生物细胞表面产生或分泌),可以降低表面张力和界面张力。
已知许多微生物能够产生相对大量的生物表面活性剂。已发现生物表面活性剂可用于多种用途。例如,在食品工业中,生物表面活性剂用于改善味道和质地、稳定性和延长保质期。
• 枯草芽孢杆菌可以缓解便秘
枯草芽孢杆菌可能有助于缓解健康人偶尔出现的便秘。例如,在一项研究中,服用枯草芽孢杆菌(枯草芽孢杆菌 DE111 菌株)的人报告称,与服用安慰剂的人相比,正常粪便的丰度有所增加。
因此,每天10亿CFU的枯草芽孢杆菌 DE111 剂量可以改善偶发性便秘,同时有助于维持胃肠道健康。
• 枯草芽孢杆菌可能有助于治疗腹泻
一项研究结果表明,枯草芽孢杆菌(枯草芽孢杆菌 CU1 菌株)预防性治疗可能具有有效的止泻活性。并且可以增强结肠在腹泻情况下吸收水分的能力。此外,枯草芽孢杆菌可以改善肠道的蠕动功能。
• 枯草芽孢杆菌可能对腹泻型或交替型 IBS 有益
尽管还需要更多的研究,但来自亚洲的一项研究表明,与安慰剂相比,枯草芽孢杆菌和屎链球菌等益生菌可成功减少腹泻为主型或交替型肠易激综合征(IBS)中腹痛的频率和严重程度。
• 枯草芽孢杆菌可能有助于治疗炎症性肠病
在一项亚洲动物研究中,研究人员发现,在缓解期间长期(6周)持续口服枯草芽孢杆菌,可以通过调节上皮细胞增殖、保护肠道完整性、调整微生物结构和功能来促进炎症性肠病的缓解。
此外,肠道微生物结构明显改善,大肠杆菌、志贺氏菌、肠球菌等有害菌显著减少,有益菌及相应的微生物增多。
• 枯草芽孢杆菌可能有助于对抗幽门螺杆菌感染
幽门螺杆菌是一种引起胃部感染的有害细菌。这种细菌是消化性溃疡的首要原因,也可能导致胃炎和胃癌。
遗憾的是,只有有限数量的抗生素可用于对抗幽门螺杆菌感染,因此抗生素耐药性威胁着治疗的成功。科学家试图寻找有效治疗幽门螺杆菌感染的新方案。
幸运的是,一项研究结果表明,枯草芽孢杆菌(枯草芽孢杆菌3号菌株的无细胞上清液)可以抑制幽门螺杆菌的生长,而且这种抑制作用并不是像最初想象的那样是由于有机酸的产生,而是由于抗菌物质的生产。
• 枯草芽孢杆菌可以刺激免疫系统
一项针对健康老年人(60-74岁)的研究表明,尽管在整个人群中对常见传染病没有显著的效果,但食用枯草芽孢杆菌(枯草芽孢杆菌 CU1 菌株)显著刺激了老年人的全身免疫反应,增加血清IFN-γ水平。
尽管仍需要进一步研究,但这些发现表明,冬季每日施用枯草芽孢杆菌 CU1 可能是增强老年人粘膜和全身免疫反应的安全有效方法。
• 枯草芽孢杆菌可能有助于对抗感染
枯草芽孢杆菌和解淀粉芽孢杆菌都是有害细菌最著名的敌人,因为它们可以产生不同的抗真菌代谢物。
例如,枯草芽孢杆菌可以不断产生和分泌大量潜在的抗真菌剂,这些抗真菌剂可以直接与真菌细胞表面相关蛋白结合,对细胞膜造成终末损伤,从而避免耐药性。一些枯草芽孢杆菌菌株还用作食品工业中的商业生物防治剂。
您甚至可以说枯草芽孢杆菌菌株是一种抗生素,因为它们产生多种抗生素,包括核糖体和非核糖体肽抗生素,以及杆菌溶菌素和新海藻糖二胺。
枯草芽孢杆菌还被证明对从烧伤感染中分离出的一些多重耐药细菌病原体具有治疗作用。
• 枯草芽孢杆菌可能有助于治疗肝脏疾病
动物研究表明,摄入枯草芽孢杆菌可能会减轻酒精引起的肝损伤,减轻肝脏和肠道损伤,并协调肠道微生物群和调节基因表达谱(同时测量数千个基因的活性)。
这里提供质量极高的枯草芽孢杆菌补充剂,可抵抗消化酸并帮助建立腹部平衡。
• 枯草芽孢杆菌可能具有皮肤愈合特性
动物研究表明,口服枯草芽孢杆菌可以减轻特应性皮炎皮肤病变的发展。
此外,由细菌纤维素凝胶膜和枯草芽孢杆菌细胞组成的生物复合材料可能具有很强的伤口愈合作用。
• 枯草芽孢杆菌可能有助于治疗牙周炎
一项研究结果表明,枯草芽孢杆菌可能对牙周炎患者有帮助,因为与日本常用的漱口液 Neosteline Green 相比,使用 Extraction 300E(含有枯草芽孢杆菌 E-300)漱口可显著减少牙周病原体。
• 来自枯草芽孢杆菌的多糖可能有助于降低糖尿病患者的心血管疾病风险
糖尿病是一种可能引发白内障、视网膜病变、肾病、多发性神经病以及心血管损害等并发症的疾病。
一项动物研究表明,来自枯草芽孢杆菌的胞外多糖,可能会改善糖尿病大鼠的高血糖、血脂异常和心血管疾病风险。
• 枯草芽孢杆菌可能有助于对抗白色念珠菌感染
研究表明,枯草芽孢杆菌可能是一种有效对抗白色念珠菌的益生菌,并且对不同的人类致病性白色念珠菌物种具有抗菌活性。此外,它还可以防止念珠菌感染期间的组织损伤。
★ 含有枯草芽孢杆菌的食物
含有枯草芽孢杆菌的食物主要包括一些发酵食品:
发酵乳制品:部分酸奶产品会添加枯草芽孢杆菌作为益生菌,奶酪中可能也含有这种菌株;
发酵蔬菜:如泡菜、酸菜等自然发酵过程中可能产生枯草芽孢杆菌;
发酵豆制品:如豆豉、天然发酵的豆腐乳等;
益生菌补充剂:市面上有些益生菌胶囊或粉剂中含有枯草芽孢杆菌。
蜡样芽孢杆菌(Bacillus cereus)最近被认为是眼部感染的主要病原体,可引起眼内炎。眼内炎是一种严重疾病,可在接种后12-48小时内导致视力受损。
1.4µm革兰氏阳性杆状细菌,通常成对和短链出现。
蜡样芽孢杆菌是兼性厌氧菌,具有能动性并能够形成内生孢子,具有直径约2-7毫米的菌落形态,并具有白色颗粒状结构。
蜡样芽孢杆菌生长温度高于10-20°C,低于35-45°C,最适温度约为37°C。这些细菌能够产生六种类型的毒素:五种肠毒素和一种催吐毒素,根据菌株的不同,这些毒素可以是热稳定的或热不稳定。
• 致病性/毒性
蜡样芽孢杆菌可以引起自限性(24-48小时)食物中毒综合征(腹泻型和呕吐型)、机会性感染,并与眼内炎和其他眼部感染等临床感染有关。
蜡样芽孢杆菌食物中毒的腹泻形式特点是腹部绞痛、大量水样腹泻和直肠里急后重,偶尔还会出现发烧和呕吐。蜡状芽孢杆菌食物中毒的呕吐形式的特点是恶心、呕吐和不适,偶尔伴有腹泻。
蜡样芽孢杆菌可引起伤口感染、菌血症、败血症、脑膜炎、肺炎、中枢神经系统感染、心内膜炎、心包炎、呼吸道感染和外周感染。
免疫功能低下个体的感染可能危及生命。蜡样芽孢杆菌菌株还含有携带炭疽芽孢杆菌样毒力因子的质粒,可在免疫功能正常的人群中引起严重肺炎。
• 感染剂量
在腹泻疾病中,毒素是由小肠中的生物体产生的,感染剂量为每克食物10^4 -10^9个细胞。催吐毒素在食物中预先形成且不消化(每克约10^5 -10^8 个细胞才能产生足够的毒素)。
• 传播方式
主要传播方式是通过摄入被蜡样芽孢杆菌污染的食物:呕吐型食物中毒主要与食用大米和面食有关,而腹泻型食物中毒主要通过奶制品、蔬菜和肉类传播。它形成孢子并容易传播。在医院中,蜡状芽孢杆菌可通过受污染的物品等传播。
注:蜡样芽孢杆菌不会在人与人之间传播
• 潜伏期
蜡样芽胞杆菌腹泻形式的发病期为8-16小时,而呕吐形式的发病期为1-6小时。恢复通常在24小时内完成。
注:腹泻或呕吐会导致大量体液流失,这可能会引起脱水。如果不及时补充水分和电解质,可能会对身体健康造成严重影响。因此,在出现腹泻或呕吐时,应该注意及时补充液体,并且如果情况严重或持续不止,应该寻求医疗帮助。
• 对化学药物的敏感性
蜡样芽孢杆菌产生大量β内酰胺酶,对青霉素、氨苄西林、头孢菌素、甲氧苄啶耐药。
戊二醛是一种用于对受芽孢杆菌污染的材料进行灭菌的化学试剂。1%次氯酸钠、过氧乙酸、活性过氧化氢、二氧化氯可杀死孢子、甲醛、碘、酸、碱。这些化学试剂应该是高度浓缩的,并且需要更长的接触时间才能杀死孢子。恶唑烷酮也是蜡状芽孢杆菌的有效抗菌剂。
注:每当在具有感染临床症状的免疫功能低下患者的血液或脑脊液中发现革兰氏阳性杆状细胞时,经验性抗生素治疗应涵盖蜡样芽胞杆菌(蜡样芽胞杆菌通常对克林霉素、氨基糖苷类、万古霉素、氯霉素和红霉素敏感)。
• 物理灭活
蜡样芽孢杆菌在土壤和植被中生存,通常具有耐热性,因此可以在食品热加工过程中存活,无论是否对细胞造成损伤。
0.15%NaCl溶液中的脉冲电场可灭活蜡样芽孢杆菌。蜡样芽孢杆菌孢子可以耐热和辐射,但在100°C下加热5分钟会导致细胞膜和核糖体受损。此外2-5 kGy的伽马射线照射才能灭活蜡样芽胞杆菌细胞。
• 预防
目前暂无针对蜡样芽孢杆菌的疫苗。在急性非炎症性感染性腹泻的情况下,使用次水杨酸铋进行药物预防可能有用,每次两片,每日四次,随餐和睡前服用。使用时间不应超过3周。
• 风险食品
蜡样芽孢杆菌是一种产生毒素的细菌,是食物中毒最常见的原因之一,也称为“炒饭综合症”。根据《微生物学前沿》杂志2019年发表的一篇文章,美国每年发生约63000起由蜡样芽孢杆菌引起的食物中毒病例。然而,绝大多数病例都没有报告,因为症状通常很轻微,通过休息和补水会自行消退。
纽约大学兰格尼健康中心的微生物学家兼临床教授菲利普·蒂尔诺说,剩下的炒饭是罪魁祸首。米饭煮熟后,通常会在室温下放置两个多小时,待冷却后再与其他配料一起炒。冷却米饭可确保成品炒饭不会结块或变湿。但重新加热并不能消除细菌已经产生的毒素。
第一种毒素在细菌被摄入后在小肠中释放,引起腹泻、痉挛,偶尔恶心,但很少呕吐。症状通常在食用受污染的食物(包括各种肉类、牛奶、蔬菜或鱼类)后6至15小时开始出现,大约24小时后消退。
第二种毒素是食物中的细菌在食用前释放的。大米等淀粉类食物是受影响的最常见食物来源。食用受污染的食物后30分钟至6小时内,毒素会导致呕吐和恶心,大约24小时后症状消退。
• 疾病所需的蜡样芽孢杆菌最少数量
蜡样芽孢杆菌食物中毒并不简单地与摄入蜡样芽孢杆菌的量有关。例如,饮用250–450 mL的牛奶,其中自然污染了多达10^8 CFU mL耐冷蜡状芽孢杆菌,但没有引起胃肠道不适;而三名老年人在食用蔬菜泥后死亡,其中每克含有3.2 × 10^5 CFU蜡样芽孢杆菌。
根据食物中毒病例的流行病学数据,估计疾病所需的蜡样芽胞杆菌数量为10^5至10^8个活蜡样芽胞杆菌。
注:由于食用、食物中毒症状的发展和食物样本分析之间的时间延迟,阻碍了获得有关剂量反应的可靠数据。此外,食物中毒事件中相关且妥善储存的食物样本很少可用于微生物分析。
特别提醒
由于蜡样芽胞杆菌菌株、宿主生理学和食品异常大的变异性,腹泻性食物中毒的确切“感染剂量”的确定变得复杂,这极大地影响了疾病的发展和严重程度。
首先,蜡状芽胞杆菌可以拥有多种不同组合和不同表达水平的毒素基因。与高温下的嗜温菌株相比,耐冷菌株的发芽、生长和肠毒素产生通常降低。
此外,细胞类型非常重要,营养细胞缺乏孢子的耐酸和耐胆汁能力。因此,与孢子相比,营养细胞在胃肠道中存活的能力非常低,这可能导致引起疾病所需的数量增加。
其次,几乎所有宿主方面都高度可变。每个人都有特定的肠道微生物群、健康状况和用药史。人们在饮食习惯、胃排空以及胃酸和胆汁的分泌方面表现出很大的差异。这些特征主要因年龄和性别而异,免疫系统以及药物和抗生素的使用也有显著影响。
同时在我们的标准化体外实验中,食物颗粒的存在对蜡样芽孢杆菌的胃肠道存活和肠毒素产生没有直接影响。
然而,食物预计会发挥一些间接作用。食物类型决定了可用的营养物质和竞争性微生物群的组成。此外,储存温度(和温度滥用)决定蜡样芽胞杆菌是否可以繁殖,如果可以,则主要是耐冷菌株或嗜温菌株。最后,食物类型、膳食量和食用时间影响许多消化过程的动力学,这反过来又影响胃肠道期间细菌的存活。
益生菌潜力:芽孢杆菌属中的某些物种,例如凝结芽孢杆菌和枯草芽孢杆菌,已对其益生菌特性进行了研究。益生菌是活的微生物,当摄入足够量时,可以为宿主带来健康益处。这些芽孢杆菌种类与促进消化健康、支持免疫功能并可能减轻某些胃肠道疾病有关。
抗生素生产:一些芽孢杆菌属产生抗生素,例如杆菌肽和多粘菌素,已在医学上用于治疗细菌感染。这些抗生素可有效对抗某些革兰氏阳性细菌。然而,值得注意的是,抗生素的使用应在医疗保健专业人员的指导下进行,以确保适当的治疗并最大程度地降低抗生素耐药性的风险。
孢子形成能力:芽孢杆菌以其形成孢子的能力而闻名,孢子是高度抵抗的结构,可以承受恶劣的条件。这一特性使得芽孢杆菌能够在包括人体在内的各种环境中生存。在某些情况下,形成孢子的芽孢杆菌属物种可能会引起感染,特别是对于免疫系统受损的个体。
食品安全和保存:一些芽孢杆菌属物种,例如蜡样芽孢杆菌,与食源性疾病有关。这些细菌会产生毒素,引起胃肠道症状,包括恶心、呕吐和腹泻。正确的食品处理、储存和烹饪方法对于预防芽孢杆菌相关的食源性疾病至关重要。
工业和环境应用:芽孢杆菌属物种在农业、生物技术和废物管理等领域具有工业应用。它们用于生产酶、生物农药和生物肥料等应用。此外,某些芽孢杆菌物种具有降解污染物并有助于环境修复的能力。
值得注意的是,虽然某些芽孢杆菌具有有益作用,但其他芽孢杆菌却可能引起感染或食源性疾病。对人类健康的具体影响取决于所涉及的物种、它们的特征以及它们遇到的环境。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
Bacillus abyssalis
Bacillus acidiceler
Bacillus acidicola
Bacillus acidiproducens
Bacillus acidopullulyticus
Bacillus acidovorans
Bacillus aeolius
Bacillus aeris
Bacillus aerius
Bacillus aestuarii
Bacillus aidingensis
Bacillus akibai
Bacillus alcaliinulinus
Bacillus alcalophilus
Bacillus algicola
Bacillus alkalinitrilicus
Bacillus alkalisediminis
Bacillus alkalitelluris
Bacillus alkalitolerans
Bacillus alkalogaya
Bacillus altitudinis complex
Bacillus alveayuensis
Bacillus amiliensis
Bacillus andreesenii
Bacillus aporrhoeus
Bacillus aquimaris
Bacillus arbutinivorans
Bacillus aryabhattai
Bacillus asahii
Bacillus aurantiacus
Bacillus azotoformans
Bacillus badius
Bacillus baekryungensis
Bacillus bataviensis
Bacillus benzoevorans
Bacillus beringensis
Bacillus berkeleyi
Bacillus beveridgei
Bacillus bogoriensis
Bacillus bombysepticus
Bacillus borbori
Bacillus boroniphilus
Bacillus butanolivorans
Bacillus canaveralius
Bacillus carboniphilus
Bacillus casamancensis
Bacillus caseinilyticus
Bacillus catenulatus
Bacillus cavernae
Bacillus cecembensis
Bacillus cellulosilyticus
Bacillus cereus group
Bacillus cf. pumilus SG2
Bacillus chagannorensis
Bacillus chandigarhensis
Bacillus chungangensis
Bacillus cibi
Bacillus cihuensis
Bacillus circulans
Bacillus clausii
Bacillus coagulans
Bacillus coahuilensis
Bacillus cohnii
Bacillus composti
Bacillus coniferum
Bacillus crassostreae
Bacillus cucumis
Bacillus daliensis
Bacillus danangensis
Bacillus decisifrondis
Bacillus decolorationis
Bacillus deramificans
Bacillus deserti
Bacillus djibelorensis
Bacillus drentensis
Bacillus ectoiniformans
Bacillus eiseniae
Bacillus encimensis
Bacillus enclensis
Bacillus endophyticus
Bacillus endoradicis
Bacillus farraginis
Bacillus fastidiosus
Bacillus fengqiuensis
Bacillus ferrariarum
Bacillus filamentosus
Bacillus firmis
Bacillus firmus
Bacillus flavocaldarius
Bacillus flexus
Bacillus foraminis
Bacillus fordii
Bacillus fortis
Bacillus freudenreichii
Bacillus fucosivorans
Bacillus fumarioli
Bacillus funiculus
Bacillus galactosidilyticus
Bacillus galliciensis
Bacillus gibsonii
Bacillus ginsenggisoli
Bacillus ginsengihumi
Bacillus ginsengisoli
Bacillus glycinifermentans
Bacillus gobiensis
Bacillus gottheilii
Bacillus graminis
Bacillus granadensis
Bacillus hackensackii
Bacillus halmapalus
Bacillus halochares
Bacillus halodurans
Bacillus halosaccharovorans
Bacillus hemicellulosilyticus
Bacillus hemicentroti
Bacillus herbersteinensis
Bacillus horikoshii
Bacillus horneckiae
Bacillus horti
Bacillus huizhouensis
Bacillus humi
Bacillus hunanensis
Bacillus hwajinpoensis
Bacillus idriensis
Bacillus indicus
Bacillus infantis
Bacillus infernus
Bacillus intermedius
Bacillus iranensis
Bacillus isabeliae
Bacillus israeli
Bacillus jeotgali
Bacillus kochii
Bacillus kokeshiiformis
Bacillus koreensis
Bacillus korlensis
Bacillus kribbensis
Bacillus krulwichiae
Bacillus kyonggiensis
Bacillus lehensis
Bacillus lentus
Bacillus ligniniphilus
Bacillus litoralis
Bacillus locisalis
Bacillus lonarensis
Bacillus longiquaesitum
Bacillus longisporus
Bacillus luciferensis
Bacillus luteolus
Bacillus luteus
Bacillus malikii
Bacillus mangrovensis
Bacillus mannanilyticus
Bacillus marcorestinctum
Bacillus marisflavi
Bacillus marmarensis
Bacillus massilioanorexius
Bacillus massiliogorillae
Bacillus massiliosenegalensis
Bacillus megaterium
Bacillus meqaterium
Bacillus mesonae
Bacillus methanolicus
Bacillus muralis
Bacillus murimartini
Bacillus nanhaiisediminis
Bacillus nealsonii
Bacillus neizhouensis
Bacillus nematocida
Bacillus niabensis
Bacillus niacini
Bacillus niameyensis
Bacillus nitritophilus
Bacillus novalis
Bacillus oceani
Bacillus oceanisediminis
Bacillus ohbensis
Bacillus okhensis
Bacillus okuhidensis
Bacillus oleivorans
Bacillus oleronius
Bacillus olivae
Bacillus oryzae
Bacillus oryzaecorticis
Bacillus oshimensis
Bacillus pakistanensis
Bacillus panacisoli
Bacillus panaciterrae
Bacillus paraflexus
Bacillus patagoniensis
Bacillus persicus
Bacillus pervagus
Bacillus pichinotyi
Bacillus piscicola
Bacillus plakortidis
Bacillus pocheonensis
Bacillus polyfermenticus
Bacillus polygoni
Bacillus polymachus
Bacillus pseudalcaliphilus
Bacillus pseudofirmus
Bacillus pseudomegaterium
Bacillus pseudomycoides
Bacillus psychrosaccharolyticus
Bacillus pumilus
Bacillus purgationiresistens
Bacillus qingdaonensis
Bacillus qingshengii
Bacillus racemilacticus
Bacillus rhizosphaerae
Bacillus rigiliprofundi
Bacillus rubiinfantis
Bacillus ruris
Bacillus safensis
Bacillus salarius
Bacillus saliphilus
Bacillus salmalaya
Bacillus salsus
Bacillus sediminis
Bacillus selenatarsenatis
Bacillus senegalensis
Bacillus seohaeanensis
Bacillus shacheensis
Bacillus shackletonii
Bacillus shandongensis
Bacillus siamensis
Bacillus similis
Bacillus simplex
Bacillus siralis
Bacillus smithii
Bacillus soli
Bacillus solimangrovi
Bacillus songklensis
Bacillus sp.
Bacillus sp. 2+3
Bacillus sp. 3EC3A1
Bacillus sp. CBMAI 1158
Bacillus sp. DHT-33
Bacillus sp. HC10.2Y2
Bacillus sp. HC15
Bacillus sp. N-16
Bacillus sp. T41
Bacillus sp.10 SA10
Bacillus sp.20R2
Bacillus sp.20R7
Bacillus sp.3.5R*5
Bacillus sp.7RP2-26
Bacillus sp.H-46
Bacillus sp.LW-10
Bacillus sp.LW-14
Bacillus sp.RP8
Bacillus sp.U0684
Bacillus sporothermodurans
Bacillus stamsii
Bacillus subterraneus
Bacillus subtilis group
Bacillus taeanensis
Bacillus taiwanensis
Bacillus tequilensi
Bacillus thaonhiensis
Bacillus thermoalkalophilus
Bacillus thermoamyloliquefaciens
Bacillus thermoamylovorans
Bacillus thermocopriae
Bacillus thermolactis
Bacillus thermophilus
Bacillus thermoproteolyticus
Bacillus thermoterrestris
Bacillus thermotolerans
Bacillus thermozeamaize
Bacillus thioparans
Bacillus tianmuensis
Bacillus tianshenii
Bacillus timonensis
Bacillus tipchiralis
Bacillus trypoxylicola
Bacillus vanillea
Bacillus vietnamensis
Bacillus vireti
Bacillus viscosus
Bacillus vitellinus
Bacillus wakoensis
Bacillus xiamenensis
Bacillus xiaoxiensis
Bacillus zhanjiangensis
丙氨酸、天冬氨酸和谷氨酸代谢
氨基糖和核苷酸糖代谢
氨酰-tRNA生物合成
氨基苯甲酸酯降解
花生四烯酸代谢
精氨酸和脯氨酸代谢
精氨酸生物合成
抗坏血酸和丙二酸代谢
碱基切除修复
苯甲酸酯降解
抗生素的生物合成
次生代谢物的生物合成
不饱和脂肪酸的生物合成
生物素代谢
丁酸代谢
C5-支链二元酸代谢
碳青霉烯生物合成
碳代谢
阳离子抗菌肽 (CAMP) 耐药性
氯烷和氯烯烃降解
柠檬酸循环(TCA循环)
氰基氨基酸代谢
半胱氨酸和蛋氨酸代谢
D-丙氨酸代谢
D-精氨酸和D-鸟氨酸代谢
D-谷氨酰胺和 D-谷氨酸代谢
DNA复制
芳香族化合物的降解
脂肪酸生物合成
脂肪酸降解
脂肪酸代谢
叶酸生物合成
果糖和甘露糖代谢
半乳糖代谢
香叶醇降解
谷胱甘肽代谢
甘油脂代谢
甘油磷脂代谢
糖酵解/糖异生
乙醛酸和二羧酸代谢
组氨酸代谢
同源重组
磷酸肌醇代谢
胰岛素抵抗
硫辛酸代谢
脂多糖生物合成
甲烷代谢
不同环境下的微生物代谢
单菌素生物合成
萘降解
烟酸和烟酰胺代谢
氮代谢
非同源末端连接
新生霉素生物合成
核苷酸切除修复
氧化磷酸化
泛酸和 CoA 生物合成
戊糖和葡萄糖醛酸相互转化
磷酸戊糖途径
肽聚糖生物合成
苯丙氨酸、酪氨酸和色氨酸生物合成
聚酮糖单元生物合成
卟啉和叶绿素代谢
丙酸代谢
嘌呤代谢
嘧啶代谢
丙酮酸代谢
RNA降解
RNA聚合酶
核黄素代谢
硒化合物代谢
淀粉和蔗糖代谢
链霉素生物合成
苯乙烯降解
硫代谢
酮体的合成和降解
牛磺酸和亚牛磺酸代谢
萜类骨架生物合成
硫胺素代谢
泛醌和其他萜醌生物合成
缬氨酸、亮氨酸和异亮氨酸生物合成
缬氨酸、亮氨酸和异亮氨酸降解
万古霉素耐药性
维生素B6代谢
α-亚麻酸代谢
β-丙氨酸代谢
β-内酰胺抗性
主要参考文献:
Logan NA. Bacillus and relatives in foodborne illness. J Appl Microbiol. 2012 Mar;112(3):417-29.
Weber DJ, Rutala WA. Bacillus species. Infect Control Hosp Epidemiol. 1988 Aug;9(8):368-73.
Ehling-Schulz M, Lereclus D, Koehler TM. The Bacillus cereus Group: Bacillus Species with Pathogenic Potential. Microbiol Spectr. 2019 May;7(3):10.1128/microbiolspec.GPP3-0032-2018.
Ceuppens S, Boon N, Uyttendaele M. Diversity of Bacillus cereus group strains is reflected in their broad range of pathogenicity and diverse ecological lifestyles. FEMS Microbiol Ecol. 2013 Jun;84(3):433-50.
Mongkolthanaruk W. Classification of Bacillus beneficial substances related to plants, humans and animals. J Microbiol Biotechnol. 2012 Dec;22(12):1597-604.
Kaneda T. Fatty acids of the genus Bacillus: an example of branched-chain preference. Bacteriol Rev. 1977 Jun;41(2):391-418.
Setlow P. Small, acid-soluble spore proteins of Bacillus species: structure, synthesis, genetics, function, and degradation. Annu Rev Microbiol. 1988;42:319-38.