-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

感染是人类面临的健康威胁之一。各种病原体,如细菌、病毒、真菌、寄生虫等,存在于我们日常接触的环境、物品、食物等中。一些常见的感染病例包括感冒、流感、腹泻、组织器官或血液感染等,在全球范围内广泛传播。这些疾病的传播方式多样,可能通过空气、水源、接触和食物等途径传播。
感染的症状包括发热、头痛、咳嗽、呕吐、腹泻等,严重感染可能导致器官衰竭、败血症等并发症。感染的原因包括接触感染源、免疫力下降、不良生活习惯等,易感人群有免疫力低下者、老年人、慢性疾病患者等。
研究发现,肠道菌群与感染也有密切关系。肠道菌群有助于消化、吸收营养物质,同时还调节人体免疫系统的功能。但如果肠道菌群失衡,会导致多种疾病,包括感染。
本文我们来了解一下关于感染的种类,症状,致病途径,易感因素,免疫系统应对病原体的三大防线,肠道菌群失衡与免疫系统的关联,以及肠道菌群检测在临床感染案例中的应用。
▼
感染可以按多种不同方式分类。
按影响部位分为局部和全身的:
按影响持续时间分为急性和慢性的:
按病原体类型划分:
病毒、细菌、真菌、寄生虫等都是导致感染的不同类型的病原体。
► 细菌感染
细菌感染是由体内过量的有害细菌引起的。正常情况下,人体的免疫系统能够通过白细胞和吞噬细胞等机制对抗细菌感染。但如果人体的免疫系统出现异常或受到外界因素干扰,细菌就可能趁虚而入,导致细菌感染的发生。
常见的细菌感染包括:肺炎、腹泻、皮肤感染、脑膜炎、膀胱炎、中耳炎等。
► 真菌感染
真菌感染多为继发性感染,由机会致病性真菌引起,特别是深部真菌感染多是由于各种诱因使机体免疫功能显著下降所致。
真菌是一类与细菌和病毒不同的微生物,它们包括霉菌、酵母菌等,常见的真菌感染有白色念珠菌感染、曲霉菌感染等。
► 病毒感染
病毒感染与细菌感染不同,因为病毒本身并不能独立存在,只有当它侵入人体细胞后才能产生病毒性病变。当病毒进入细胞时,它会留下迫使细胞复制的遗传物质。
当细胞死亡时,它会释放新的病毒感染其他细胞。并非所有的病毒都会破坏细胞——有些病毒会改变细胞的功能。
病毒会导致多种疾病,包括普通感冒、流感、登革热、水痘、艾滋病等。
► 寄生虫感染
寄生虫是需要以其他生物为食才能生存的生物。有些寄生虫不会对人产生明显影响,而有些寄生虫会生长、复制并侵入器官系统。
常见的寄生虫感染有阿米巴病、血吸虫病、肠道蠕虫感染等。
▼
无论何时发生感染,身体的一线反应都是炎症性的。
炎症是身体抵御疾病的方式,同时促进受影响组织的愈合。炎症的主要症状:红、肿、热、痛、组织功能的暂时丧失。
在感染期间,由于潜在的炎症反应,人们通常会出现非特异性的全身症状。症状和严重程度可能因受影响的器官系统而异,但可能包括:
▼
► 病史采集
询问患者或病人家属发病情况、既往病史、服药史、过敏史、流行病学史等。
► 体格检查
体温、呼吸、心率、血压、身体部位肿胀、红肿、局域性压痛、淋巴结肿大等都是感染体征,可以作为诊断和判断感染病情严重程度的参考指标。
► 实验室检查(抽血、尿检等)
通过血液、尿液、呼吸道分泌物、伤口分泌物等样本的化验检查可以更直接地确定病原体的种类和数量,以及感染程度的严重程度。
► 影像学检查(做CT等)
如X射线、CT、MRI等技术,可以帮助医生了解感染的程度以及可能受影响的部位,从而确定感染的类型和严重程度。影像学检查为临床医生在明确诊断之前的经验性治疗提供线索。
► 快速诊断测试(做核酸等)
如血清学检测、ELISA试剂盒、PCR技术等,可以在短时间内快速准确地检测出患者血清中的病原体抗体、抗原以及核酸等,提供对感染病原体的敏感性和特异性的快速诊断。
▼
呼 吸 道
普通感冒的另一个名称是上呼吸道感染。鼻病毒是引起感冒的最常见病毒。其他通过空气传播的传染病也以这种方式感染。
感冒和流感通常不会直接影响肺部,但它们可能会导致继发性细菌感染——肺炎。
消 化 道
如果不小心吃了被细菌或病毒感染的食物、饮料或水、或是农产品在种植或运输过程中接触了污染物,或者过期变质的食物等,病原体也一并被吞入,感染胃部或肠道,有时表现为腹泻和/或呕吐。一个常见的例子是细菌性肠胃炎,也称为食物中毒。
泌尿生殖系统
病原体也可以通过泌尿系统进入人体,如尿路感染,或生殖系统,如性传播疾病。传染源可能停留在局部,也可能进入血液。例如,性传播疾病最常感染生殖器,而艾滋病毒通过体液携带,也可以通过唾液、精液或血液传播。
皮 肤 接 触
皮肤的功能之一是充当抵御感染的屏障。但如果有割伤、抓伤、虫咬或任何类型的开放性伤口,皮肤阻挡不住,病原体可能会进入血液。如:蜂窝组织炎、脓疱疮等都是通过皮肤接触开始的常见感染。
▼
无论来源如何,任何人都可能感染。但有些人更容易感染,或感染并发症的风险增加,例如:
以上我们可以看到,那些免疫系统功能低下的人更容易发生感染。那么当病原体入侵时,免疫系统正常运作会发生什么呢?
下一章节我们来了解一下,默默帮助我们抵抗病原体的——免疫系统。
前面章节我们知道感染是微生物进入人体并造成伤害的结果。引起感染的生物体很多,包括病毒、细菌、真菌、寄生虫等。
当它们试图攻击的时候,免疫系统是如何运作的?
第一道防线——物理屏障
正常情况下,皮肤、呼吸道等组成的物理屏障在保护你,一般只有水分、气体等小分子物质进出,细菌、病毒难以入侵。
然而,也许你只是摔了一跤擦破了皮,也许只是水果刀不小心划伤了…皮肤作为免疫系统的第一道防线破了。
这时候细菌就开始争先恐后进入体内,不断繁殖,增强武力值。
第二道防线——先天性免疫防线
(广泛执行任务)
巨噬细胞——以吞制敌
巨噬细胞开始介入这场搏斗,它往往通过吞噬的方式以一敌百,不管三七二十一先吞下将其困在膜泡里,利用酶等物质分解杀敌,如果细菌还来不及生长繁殖就被吞完了,这场搏斗也就随之终止了。该过程可能引发局部的炎症,表现为红,肿,痛,热等。

但如果一直持续下去,巨噬细胞也可能累了,它开始发出紧急信号,召集后援团…
中性粒细胞——不分敌我直接干
中性粒细胞出现了,它离开了原本在血液中巡逻的路线,第一时间冲过来加入,武力值开始飙升,健康细胞也会被它误杀,它也会给细菌设置障碍,从而困住细菌将其干掉。
它们也会“适可而止、功成身退”,几天后自杀,不带来更多伤害。
如果这还不足以击退,发出的求救信号越来越多,当中枢神经检测到,下丘脑便会开始调节体温上升,也就是发烧。较高的体温可以抑制病原体的活性与繁殖。
以上就是人体免疫系统的第二道防线,也就是先天性免疫(非特异性免疫)。
如果第二道防线没有阻止入侵者呢?
最终对抗会发生在第三道防线,也就是后天性免疫。
第三道防线——后天性免疫防线
(形成记忆,长期保护)
后天性免疫系统是一个成长、学习和经验的累积,学习和记忆着病原体的模式,进而识别并产生特异性的免疫应答。具有极强的打击和防守能力,可以持续有效地保护我们的身体。

这时候,树突状细胞登场了。
树突状细胞——先天性免疫和后天性免疫之间的桥梁
树突状细胞开始手撕敌军,把病原体碎片暴露在自己的细胞膜上,带着病原体的信息去淋巴结,这里有很多T细胞待激活,当T细胞出生时会经过一个训练,之后会配备一个装备。
树突状细胞要寻找的正是可以和病原体表面特征蛋白结合的那个T细胞。
T细胞——等待激活,加入战斗
找到后该T细胞会被瞬间激活,然后开始分裂复制,并分化出三种T细胞,分别为:
B细胞——产生抗体,继续奋斗
当辅助T细胞过去找到B细胞识别结合之后,B细胞瞬间激活,大量复制,产生抗体。
抗体的出现意味着胜利的曙光,抗体表面有多个结合点,可以把多个病原体结合在一起,病原体捆在一起行动不便,失去活力。其他免疫细胞过来可以轻松把它们干掉。
抗体还可以拉着病原体连接杀伤细胞,将其消灭。
记忆T细胞和B细胞——学会对付,默默守护
在清除病原体后,分化出来的大量免疫细胞完成任务,会程序性自杀,防止继续占用资源。会有一小部分留下来,也就是记忆T细胞和记忆B细胞,等待病原体下次来的时候直接杀敌。
以上就是免疫系统的三大防线,它们的存在为人体提供了多重保护。正是因为它们的不懈努力,在感染发生后我们也会挺过来。
研究发现肠道菌群与人体免疫功能以及许多疾病的发生密切相关。
肠道菌群失衡如何与感染相关?肠道菌群与免疫系统之间存在怎样的关联?
下一章节我们继续来看。
肠道菌群中某些微生物和宿主的免疫系统之间存在相互作用,肠道菌群能够影响和调节上述第三大防线中B细胞和T细胞的活性,通过调节免疫细胞的行为,促进抗原递呈细胞的活化和作用,影响细胞因子及其受体的表达等。
肠道微生物代谢产物能够影响免疫平衡。例如,肠道菌群可以通过代谢产生短链脂肪酸、色氨酸胆汁酸等代谢产物,这些代谢产物能够通过激活特定的神经元和免疫细胞来调节免疫反应,从而维持肠道黏膜的免疫稳态。
短链脂肪酸可能具有抗炎和免疫调节作用,当然短链脂肪酸只是一部分,因为除了产生的酶和其他代谢物之外,细菌本身的成分,包括脂多糖、细胞囊碳水化合物和其他内毒素,也可能被释放并对宿主产生二次影响。
肠道微生物群衍生的代谢物丙酸盐(一种短链脂肪酸)水平降低可能导致 Th17/Treg 细胞分化的病理失衡。
一些菌群代谢物,如 4-甲基苯甲酸、3,4-二甲基苯甲酸、己酸和庚酸等,已被证明会加剧结肠上皮细胞的损伤,从而影响免疫。
在肠道菌群失调的情况下,某些有益菌可能会缺乏消化酶等必要的代谢产物和物质,使机体免疫系统无法及时有效地对病原体进行攻击。
许多致病菌与肠道屏障的特定元素相互作用。一些有益的菌群可以激活上皮细胞,加强它们的黏附能力和抗病原性,从而提高肠黏膜的免疫防御能力。
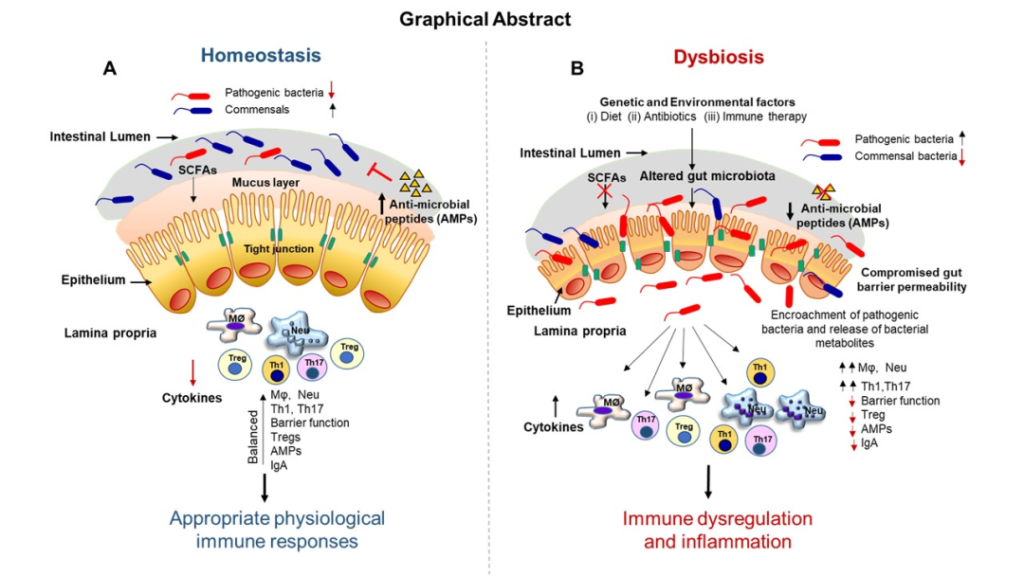
致病菌和抗生素的使用可能会通过增强黏液降解,或抑制正常的共生黏液生成触发器来扰乱肠道黏液层,从而破坏肠道屏障,也就是我们常说的“肠漏”。
肠道屏障的破坏也会诱发体内炎症:与微生物相关的代谢物离开肠道并进入血液。作为回应,身体会产生细胞因子和其他介质,有效地启动炎症反应。
肠道上皮组织内的细胞将细菌代谢物传递给免疫细胞,从而在局部和全身范围内促进炎症。这种情况的持续存在可能导致亚急性或慢性炎症,随后可能会导致炎症性肠病、糖尿病或心血管疾病等疾病的发展。
doi.org/10.3390/biomedicines11020294
C 反应蛋白 (CRP) 是一种下游炎症标志物,可以通过特定肠道微生物的抗炎代谢产物的作用下调。当巨噬细胞和 T 细胞分泌白细胞介素 IL-6 时,该分子随后以高水平释放到循环中。我们在肠道菌群检测报告中也可以用CRP来辅助判断炎症状况。
炎症标志物是复杂的双向调节机制的组成部分,并且参与多个重叠过程,与感染和体内稳态的维持有关。
由此,肠道菌群变化对于免疫功能强弱具有重要指示作用,那么我们可以结合肠道菌群检测中的实际案例,来了解更多关于肠道菌群和感染的关联。
在谷禾肠道菌群健康检测中,有许多关于感染的病例,我们选取一例来详细看一下。
年初,一名7岁女孩入院,经诊断后发现患有:
菌血症是一种严重的感染症状,通常由细菌或真菌等微生物感染引起。菌血症分为原发性和继发性。
只有大约20%病例是原发性菌血症,也就是说病原体最初进入血液系统并引起血流感染,例如创伤、手术、注射等导致血管受损直接感染。
其余大多数都是继发性菌血症,也就是在其他部位先感染,未能及时处理,致使病原菌进入血液系统引起继发性菌血症。
常见的菌血症类型包括葡萄球菌菌血症,肺炎链球菌菌血症,鲍曼不动杆菌菌血症,克雷伯菌菌血症,真菌菌血症等,都是相应的致病菌感染引起的。
入ICU后,出现腹胀问题,且愈发严重 ⇊
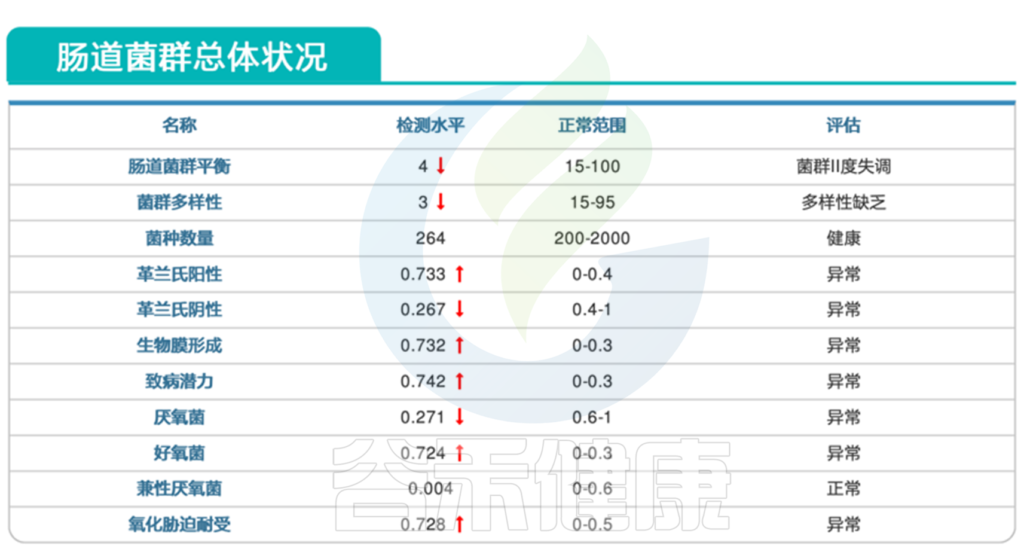
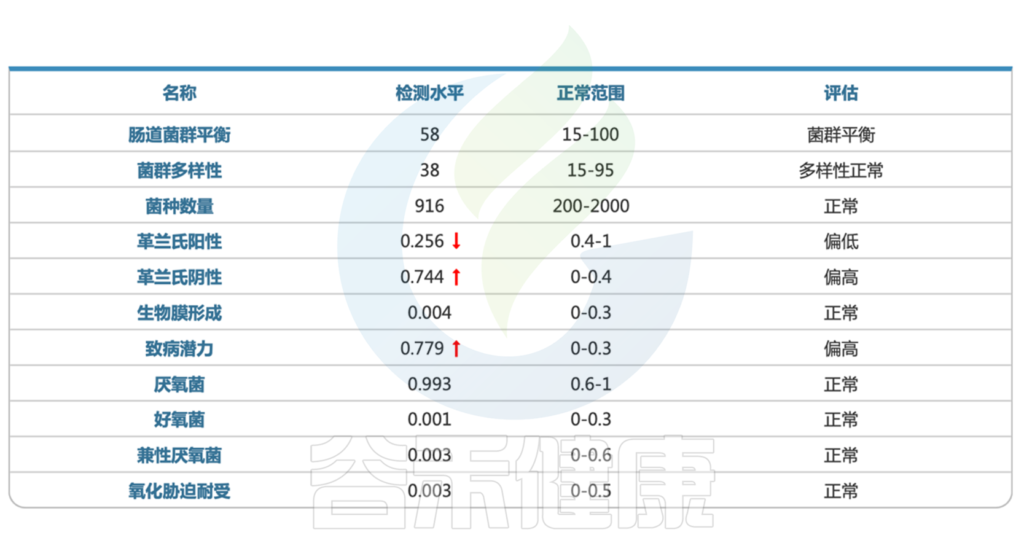
肠道菌群检测结果显示:
1. 患儿肠道菌群严重失调
<来源:谷禾健康肠道菌群检测数据库>
显然,该患者的肠道菌群失调,多项指标均显示异常。
从报告的肠道菌群总体状况这部分,我们可以看到,菌群多样性下降,其中革兰氏阳性菌明显偏高,革兰氏阳性菌包括葡萄球菌,链球菌,梭菌等,可能与多种感染相关。同时报告中致病潜力这项指标也是大幅上升。
2. 存在艰难梭菌携带超标、酵母菌感染、不动杆菌超标严重(感染)情况
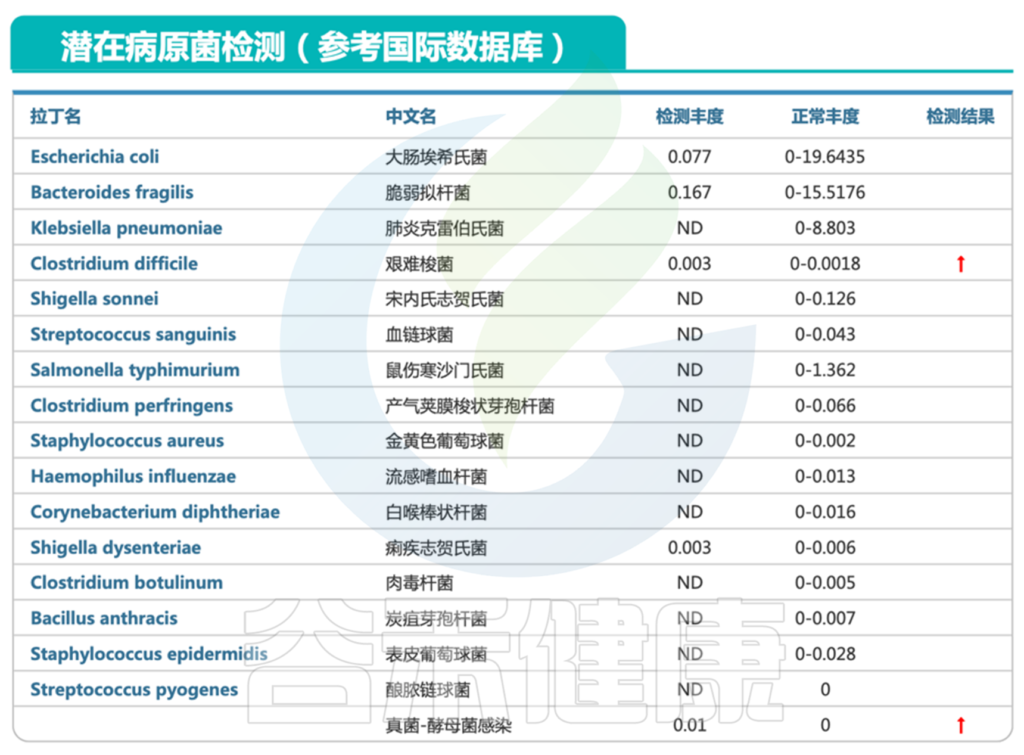
<来源:谷禾健康肠道菌群检测数据库>
艰难梭菌超标 ↑
艰难梭菌是一种常见的肠道病原菌。它可以引起广泛感染,症状最常见的是腹泻,伴随着腹部疼痛,刺痛,腹胀等不适,有些人还可能会出现发热,发冷,胃部压痛或疼痛,恶心呕吐的症状。
更严重的可能出现水样腹泻,心跳加快、体温升高、腹部绞痛、体重下降、腹部肿胀、肾功能衰竭等。
这与患儿的某些症状相符,从肠道菌群检测中可以发现艰难梭菌感染。
艰难梭菌感染与免疫功能有怎样的关联?
艰难梭菌毒素通过炎症小体和TLR4、TLR5和含有核苷酸结合寡聚结构域的蛋白1(NOD1)信号通路刺激先天免疫细胞,随后产生大量促炎细胞因子(如IL-12、IL-1β、IL-18、IFN-γ和TNFα)和趋化因子(MIP-1a、MIP-2、IL-8),导致粘膜通透性增加、肥大细胞脱颗粒、上皮细胞死亡和中性粒细胞浸润,引发免疫功能低下。
这与患者一开始诊断中中性粒细胞功能低下相符。
艰难梭菌感染通常与抗生素使用相关
通过某些抗生素,特别是克林霉素,可能会去除大量肠道中的有益细菌,使艰难梭菌得以繁殖,导致结肠炎和随后的腹泻。
真菌——酵母菌感染 ↑
报告中可以看到酵母菌超标,存在感染。这与入院时的粪便培养中的真菌感染相吻合。
真菌感染可能通过影响肠道微生物群和免疫反应,促进病原体的定殖和发展。
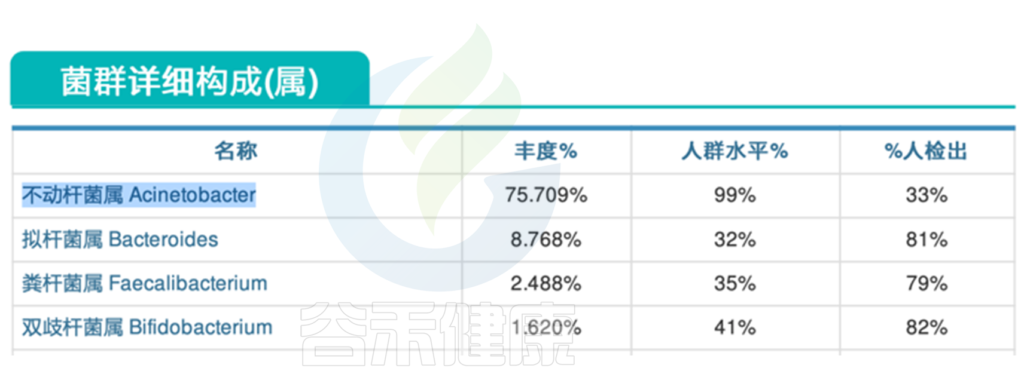
<来源:谷禾健康肠道菌群检测数据库>
不动杆菌属(75.709%)占比过多 ↑
从报告中的菌群详细构成这部分可以看到,不动杆菌属的丰度竟然超过75%,严重超标。
这种情况下,不动杆菌属严重挤压了其他肠道核心菌属的生存空间,有益菌生长受限,菌群多样性下降,肠道菌群整体失调。
不动杆菌属Acinetobacter是一类革兰氏阴性菌,该菌属于常见的医院感染病原体之一。不动杆菌属感染常见的病症包括呼吸道感染、泌尿道感染、创伤感染等,严重情况下还可能导致败血症。
不动杆菌属对常见抗生素经常会产生抗药性。这里不动杆菌属丰度较高可能与抗生素使用较多相关。
结合该患者的情况,一开始入院时的组合抗生素一周未见好转,可能与不动杆菌属占比过多相关,对许多常见的抗生素已经产生耐药性,且免疫功能低下,因此难以好转。
针对上述情况,临床考虑口服抗生素,针对消化道微生物进行抗感染治疗。
初步选定:口服利福昔明 + 甲硝唑治疗。2天未见明显改善。
后改为:口服万古霉素 + 阿莫西林治疗。当天腹胀症状明显缓解,3天治疗腹胀明显改善。
同时辅助康复新液+B族维生素+谷氨酰胺治疗。
用药两周后,患儿整体情况平稳,仍存在轻微腹胀⇊

肠道菌群复查提示菌群结构基本恢复正常。
<来源:谷禾健康肠道菌群检测数据库>
一年后随访,该儿童身体已经好转,生活正常。
备注:临床中还有其它治疗药物等没有全部分享,主要分享了与菌群相关的治疗,仅做交流,不能作为治疗参考。
宿主感染与肠道菌群之间存在复杂的相互作用,免疫系统有两个分支,即先天性和适应性,它们协同工作以保护身体免受外部和内部威胁。这两个免疫系统分支都受到严格调节,肠道微生物群是其中的一个重要因素。
要揭开这其中的机制关联可能需要依靠营养学、流行病学、医学、免疫学和微生物学等多学科研究人员的共同努力。
不过从以上案例我们可以看到,肠道菌群健康检测在感染治疗中发挥重要价值。
辅助判别
在传统诊断中得知患者存在菌血症,真菌感染,但通过肠道菌群健康检测可以了解更多具体的感染信息,比如说艰难梭菌感染可能引起的腹胀等问题,不动杆菌属占比过大形成的抗生素耐药性。
除了致病菌超标等直观的信息之外,我们还可以判断整个肠道微生态的健康状况。肠道微生物群的失调可能导致肠道易感性增加,使得易感性疾病如艰难梭菌感染更容易发生。
辅助用药
针对这些具体信息可以使用药更加精确,而不是直接使用常见的组合抗生素。
用对抗生素对于恢复速度有很大提升,同时也避免了患者因使用不必要的抗生素产生耐药性。

谷禾健康

5月29日,是世界肠道健康日。肠道是人体最重要的消化系统之一,与人体健康紧密相关。而肠道菌群作为肠道重要组成部分,在肠道健康中发挥着重要的作用。
编辑
由于基因、环境、饮食、药物等因素的影响,每个人的肠道菌群都有所不同,因此我们常常说每个人的肠道菌群都是独一无二的。
然而在不同年龄段不同人群中,有一类菌群却普遍存在,它们在人体的健康和稳定性方面发挥着重要的作用,这就是“肠道核心菌属”。
在这个世界肠道健康日,我们一起来聊聊关于“肠道核心菌属”。结合肠道菌群检测报告的部分案例,我们可以更深入直观地了解肠道核心菌属,这对于我们保持肠道健康和整体健康有重要意义。
谷禾在多年的肠道菌群检测中,发现大批量的肠道菌群检测报告中有那么一些菌群在大多数人群中普通存在,这些菌群的存及其丰度构成在肠道健康中起着至关重要的作用。一些科研文献中也有关于肠道核心菌属的相关研究。
一项大规模研究,利用微生物扩增子变异体精确作图 (RExMap)对来自全球 16 个地区的 29,349 名个体的现有 16S 数据进行重新分析,RExMap 的重新分析来自 10 项人口规模研究的现有 16S 微生物组数据绘制了来自世界各地 29,349 名个体的 17,786 个 OSU。
在此荟萃分析中,平均 122 个 OSU 占单个人微生物组丰度的 99%,平均 2000 个 OSU 占一个地理区域内 95% 的微生物组丰度。揭示了不同人群和地理区域的肠道微生物物种的详细景观。表明人类确实存在共享肠道核心微生物组。
这些核心菌属在不同的人群中,核心微生物之间的相对比例高度保守,这可能表明存在稳定的生态或功能关系。
我们的数据和这篇大规模荟萃分析表明这些核心微生物群对于其它菌群的定植,营养代谢,体重指数以及整个微生态健康起非常关键的作用。
目前,对于核心菌属的定义还没有统一的标准,但一般认为,核心菌属应该具备以下特征:
1. 在不同人群中普遍存在:核心菌属应该在不同人群中都能够被检测到,而不是仅存在于某些特定人群中。
2. 数量相对较高:核心菌属应该在肠道菌群中占据较高的比例,而不是仅占据极小的比例。
3. 对人体健康具有重要作用:核心菌属应该对人体健康具有重要作用,如参与食物消化、维持肠道屏障功能、调节免疫系统等。
谷禾健康基于超过60万人肠道菌群检测样本数据,这些样本包括了来自全球各大洲不同人种、地区饮食习惯和所有年龄段人群,给出了人体肠道菌群核心菌属的标准:
在90%人群检出,人群平均丰度1%以上的菌属为核心菌属(双歧杆菌和乳杆菌作为益生菌相对丰度低于1%但是重要性很高)。
核心菌属及有益菌累加占总肠道菌群比例低于60%就可能出现肠道菌群紊乱,菌群是一种生态系统,健康的核心菌属占据菌群构成的绝大部分后,其他可能导致感染、免疫反应以及无法有效代谢食物的异常菌的比例就会被抑制。
核心菌属缺乏就给了病原菌或非肠道菌群生存空间,导致肠道健康问题。
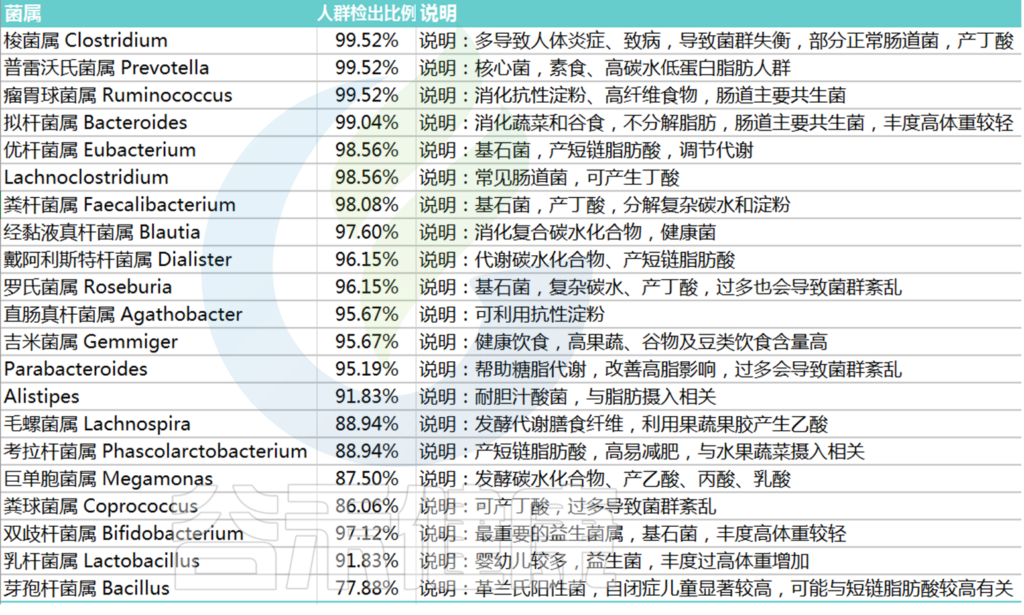
<来源:谷禾肠道菌群检测数据库>
上述这些核心菌属比如:
1. 拟杆菌 Bacteroides
Bacteroides是人体肠道中最常见的菌属之一,能够分解多糖类物质,产生短链脂肪酸,维持肠道屏障功能,调节免疫系统等。
2. 普雷沃氏菌属 Prevotella
Prevotella是一种厌氧菌,能够分解多糖类物质,产生短链脂肪酸,参与肠道免疫调节等。
3. 粪杆菌属 Faecalibacterium
Faecalibacterium是一种产生丰富的丁酸和丙酸的梭菌,能够维持肠道屏障功能,调节免疫系统等。
4.瘤胃球菌属Ruminococcus
Ruminococcus是一种产生丰富的丙酸和丁酸的菌属,能够参与食物消化、维持肠道屏障功能等。
虽然都属于核心菌属,且广泛存在于各类人群的肠道中,但每个人各个菌属的相对丰度却存在很大差异,不同的饮食习惯、母体传递以及生活地区都会导致这些核心菌属构成的偏好。
由于使用相对丰度来评估,其中一类菌丰度占比更高通常会导致其他菌属的相对丰度占比下降,因此早期肠道菌群研究中根据占据最主要丰度的菌属来将肠道菌群构成划分为多个肠型,常见的有拟杆菌、普氏菌、罗氏菌型三种。
不过肠型的划分相对比较粗放,也忽略了其他菌属的构成,那么:
这么多菌属怎么样的比例才是最健康的呢?
是不是都在范围内就都正常了,可是这些范围看着都好大,有的是从0.001~36%,都一样吗?
针对这些问题,我们给出了另一个指标:
该菌属丰度处于人群%水平
对于核心菌属我们评估较为:
因此评估菌群总体状况时较简单的方法,就是看过高和过低的核心菌属数量,超标越多菌群问题越大。当绝大部分菌属都处于正常范围之后我们就可以优化我们的核心菌属构成,使其尽量处于50~70%的水平。
下图其中第4列就给出了这个指标,意思是这个核心菌属现有丰度超过了人群中%的人。
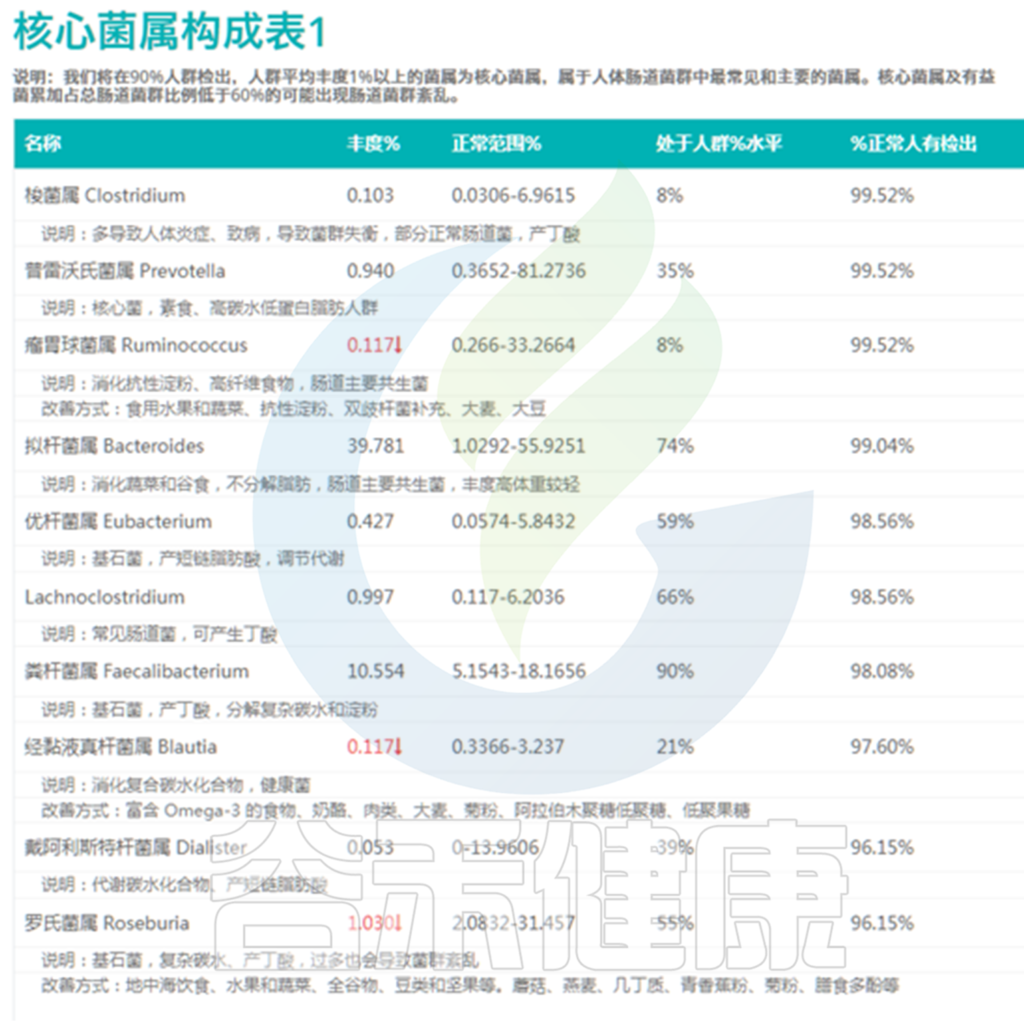
<来源:谷禾肠道菌群检测数据库>
其中瘤胃球菌属的丰度水平是0.117%,并给出了红色向下箭头,表明其丰度水平过低,超标了,对应的人群水平是8%,也就是这个丰度仅比8%的人要高。
除了箭头标示的过低菌属之外,其实像普雷沃氏菌属的35%人群水平也属于偏低,而粪杆菌属的90%人群水平就偏高了。
这样通过饮食和补剂定向干预可以使菌群中占比最主要的核心菌属达到更加稳定和合理的水平,整体肠道菌群的健康状况也会得到极大改善。
作为核心菌属,它们对于人体肠道菌群的作用主要包括:
1
参与食物消化
核心菌属能够分解多糖类物质,产生短链脂肪酸等,帮助人体消化食物
2
维持肠道屏障功能
核心菌属能够维持肠道黏膜屏障的完整性,防止有害物质进入血液循环。
3
调节免疫系统
核心菌属能够调节肠道免疫系统的功能,维持肠道微生物群落的稳定性。
4
构建稳定的肠道菌群生态
经过长期的共同进化和适应,核心菌属中的大部分能够有效代谢和利用人类饮食并消化进入结直肠部位的物质。这些菌属通过代谢途径的互补相互之间构建起一个菌群代谢网络,并维持稳定的菌群结构。
类似于我们常见的生态系统,一次抗生素的使用或某次感染后免疫系统的清理重建,相当于大草原或森林的一场大火,会摧毁大部分的生态成员,但一旦雨季来临生态又会重新开始建立。最底层的食物和能量来源就相当于雨水,最早能利用这些食物和能量来源的菌群构成了肠道菌群的基石。
研究发现上述核心菌属中的大部分都属于能代谢特定碳水化合物的降解和能量产生途径,包括拟杆菌(Bacteroides thetaiotaomicron)和青春双歧杆菌(Bifidobacterium adolescentis),以及Ruminococcus torques、Bacteroides coprocola、Faecalibacterium prausnitzii、Coprococcus catus、Parabacteroides johnsonii、Alistipes shahii等。
当上述这些核心菌属含量较高且构成合理时,肠道菌群的整体生态环境就会非常稳定,从最初代谢碳水化合物产生短链脂肪酸,进一步维持肠道内下游菌群的生长,同时调节肠道屏障,供给肠道黏膜细胞养分,维持免疫系统的均衡。
总之,核心菌属在人体肠道菌群中具有重要作用,对于人体健康具有重要意义。
谷禾肠道菌群检测数据库中显示,肠道核心菌属的异常与以下66种疾病相关:
以下是与每种核心菌属相关的疾病数量:
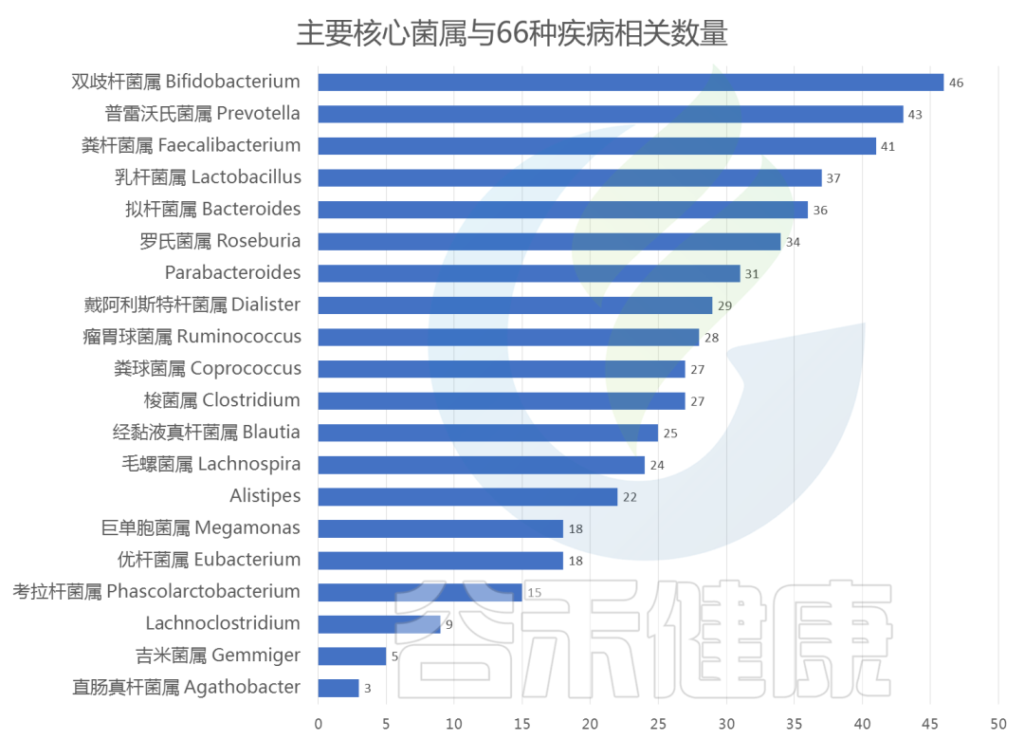
<来源:谷禾肠道菌群检测数据库>
★
结合谷禾肠道菌群检测报告案例,我们来看看一些慢性疾病患者的肠道核心菌属构成情况。
一般来说,他们的核心菌属异常分为两种情况:
这里我们来看关于慢性腹泻和便秘患者的两个案例。
➤➤ 慢性腹泻患者:
该慢性腹泻患者的肠道菌群检测报告中,许多核心菌属均处于低丰度的情况。
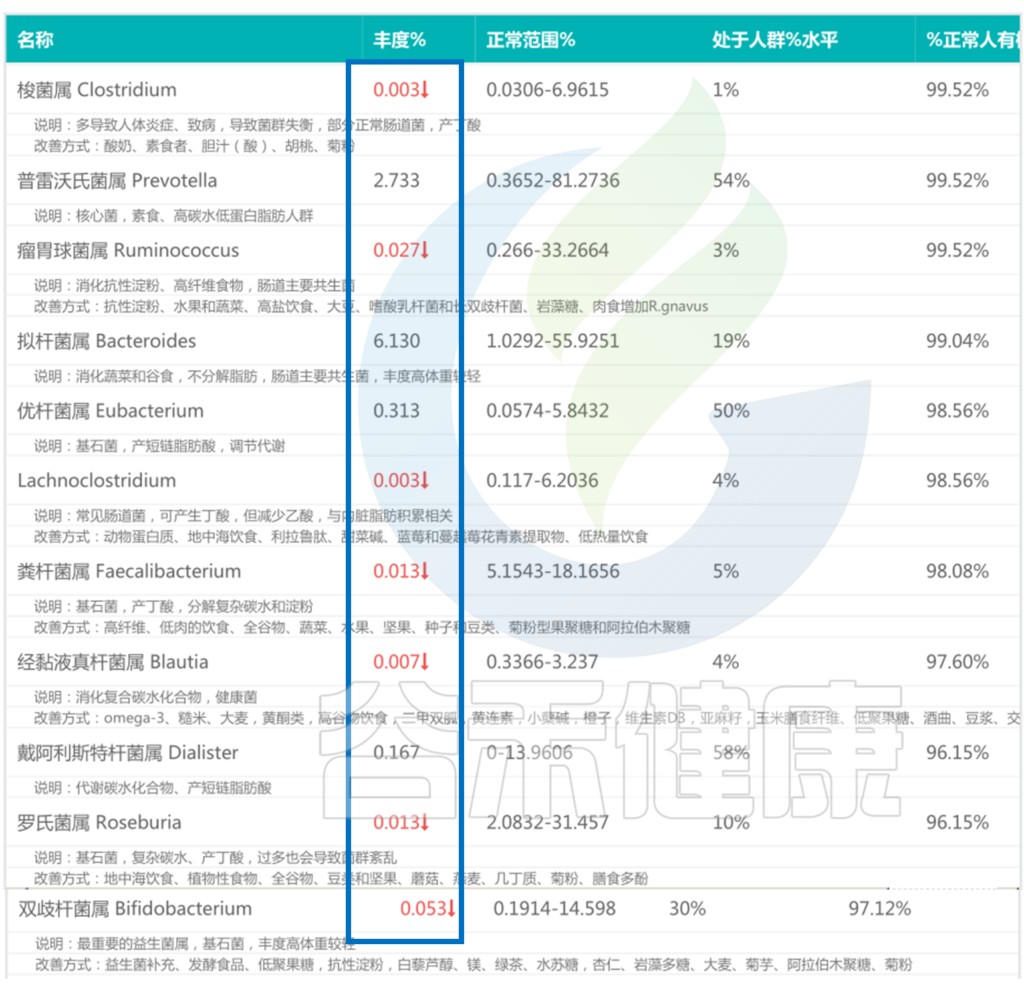
<来源:谷禾肠道菌群检测数据库>
当多数核心菌属丰度较低处于劣势的情况下,肠道有害菌逐渐开始占上风:
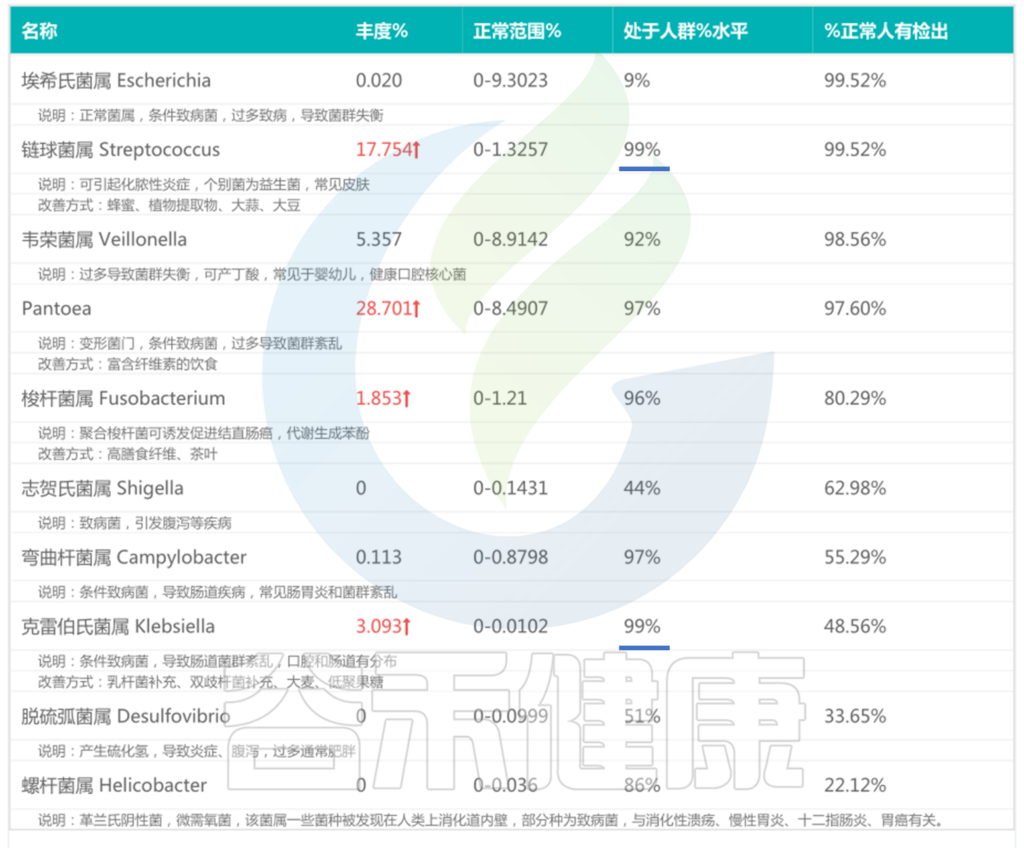
<来源:谷禾肠道菌群检测数据库>
可以看到,链球菌属、Pantoea、克雷伯氏菌属等有害菌远高于正常水平。
链球菌通常是存在于人体正常的口腔、鼻咽、肠道等部位的常见菌群,一些链球菌感染可以引起喉咙痛、扁桃体肿胀等症状。
肠道中检出的过量链球菌,可能是由呼吸道感染后通过体循环进入肠道,链球菌到了肠道可能会影响肠道的健康和功能,导致一些症状,包括腹泻、腹痛、消化不良等。
链球菌在自身免疫性疾病中也会富集,和免疫相关疾病中自身抗体的产生或Th17细胞的激活有关。
Pantoea是肠杆菌科内一个高度多样化和多变的人类机会性人类病原菌,一般由伤口或医院获得性感染引起,主要发生在免疫功能低下的个体中。在我们的肠道菌群检测实践中也发现许多健康状况不良的人群,尤其幼儿和老年患者中检出高丰度的Pantoea菌。
只有大约 20% 的病例能够在培养中分离出泛菌属物种。大多数关于Pantoea 物种可以通过适当的抗生素和支持性管理进行治疗。
克雷伯氏菌可以自然存在于健康个体的肠道和呼吸道中,具有健康免疫系统的人很少发生感染疾病。一旦克雷伯氏菌属进入体内并在免疫系统的防御中幸存下来,它们就会影响各种器官。疾病的症状通常取决于感染开始的位置。
当克雷伯氏菌属感染肠道后,由于克雷伯氏菌通过肠道分泌毒素,导致肠道蠕动加快,从而引起腹泻,同时患者可能出现腹部不适的症状。有时会伴随发热等全身反应,这可能是由于克雷伯氏菌在肠道内繁殖并释放炎症介质所致。具体症状和严重程度因人而异。
而拟杆菌的存在可以阻止肺炎克雷伯菌的肠道定殖。上述报告中拟杆菌丰度并不高,对克雷伯菌的抑制程度有限。
易感因素包括营养不良,接触程度,不卫生的环境、酒精、年龄(衰老)、遗传易感性、药物、慢性肝病、糖尿病、大型手术等。
以上我们可以看到仅这三种有害菌的丰度加起来已经占一半了,那么核心菌属自然就没有生长空间,肠道菌群整体趋于失调。
有害菌过多会影响肠道内环境,如pH值,含氧量,肠道内毒素等,可能会导致出现一些机会感染和机会致病菌入侵,进而诱发肠道炎症和相关疾病。

➤➤ 便秘患者:
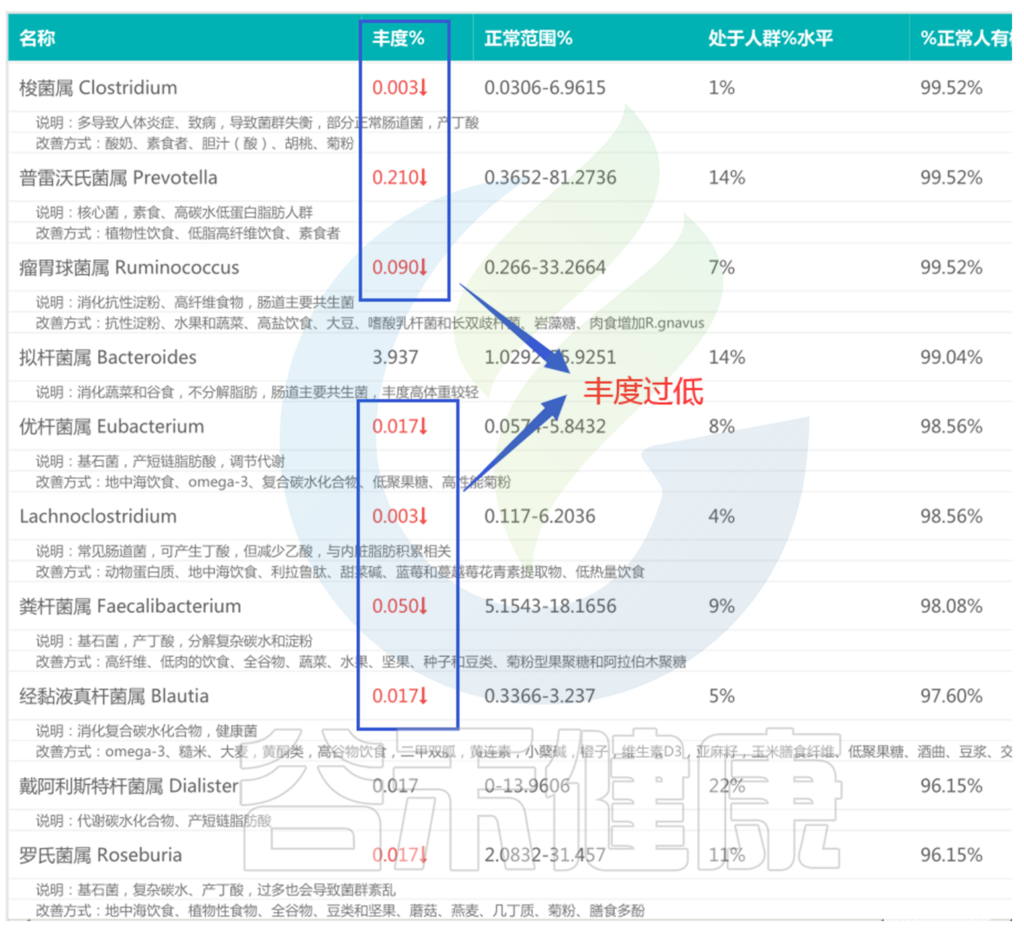
<来源:谷禾肠道菌群检测数据库>
同样,在便秘患者的肠道菌群检测报告中,部分核心菌属丰度是过低的。
上述报告中,与产丁酸相关的核心菌属丰度较低。有研究表明,便秘患者可能出现肠道菌群和丁酸代谢失调。
核心菌属丰度低,伴随着部分有害菌的丰度大幅上升,肠道菌群多样性下降。
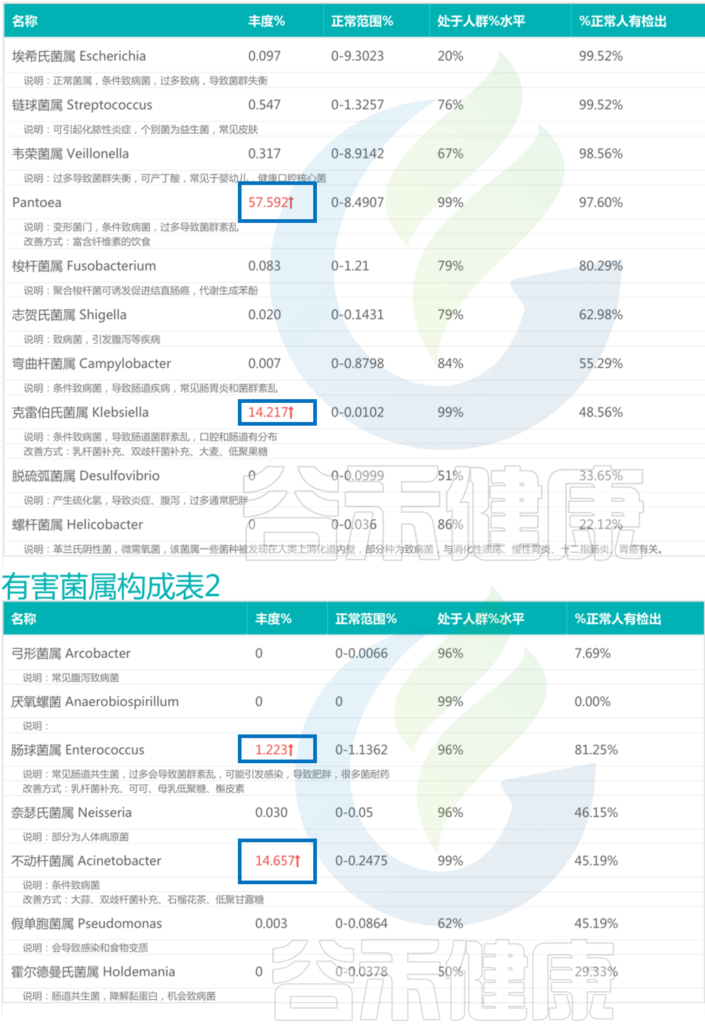
<来源:谷禾肠道菌群检测数据库>
不动杆菌属Acinetobacter是一类革兰氏阴性菌,该菌属于常见的医院感染病原体之一。不动杆菌属感染常见的病症包括呼吸道感染、泌尿道感染、创伤感染等,严重情况下还可能导致败血症。
不动杆菌属对常见抗生素经常会产生抗药性。这里不动杆菌属丰度较高可能与抗生素使用较多相关。
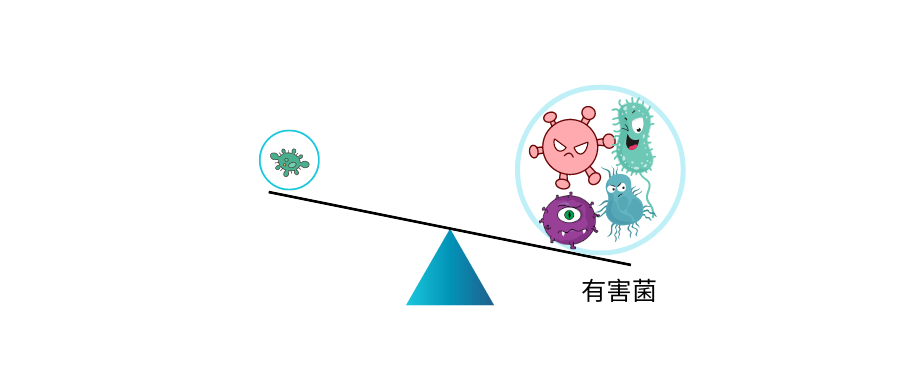
泛菌属Pantoea:57.592%
克雷伯氏菌属:14.217%
肠球菌属:1.223%
不动杆菌属:14.657%
以上四种有害菌加起来已经超过85%,核心菌属的生存空间受到严重影响,整体丰度很低,肠道多样性下降,这可能与便秘相关。
以上是核心菌属低,有害菌大量入侵的情况,那么如果核心菌属丰度整体很高,是不是意味着健康的肠道菌群?
不一定。也有可能出现核心菌属内部不平衡,个别核心菌属疯长的情况。
肠易激综合征、消化不良患者:
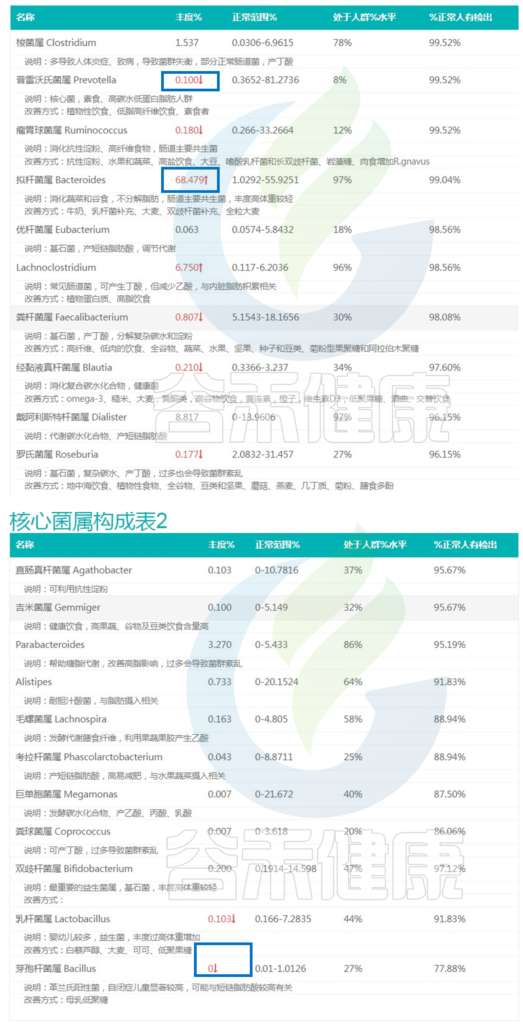
<来源:谷禾肠道菌群检测数据库>
可以看到虽然核心菌属整体占比较高,但是个别核心菌属丰度过高,例如:拟杆菌、Lachnoclostridium菌群丰度属于过高,那么其他核心菌属的生存空间就会受到影响,这就导致菌群单一化,多样性下降,肠道菌群稳定性较差。
多项研究表明拟杆菌、普拉梭菌、瘤胃球菌属和双歧杆菌与肠易激综合征相关。其中拟杆菌的过度生长可能与肠易激综合征的症状加重相关。
研究表明,肠易激综合征患者中短链脂肪酸水平降低,尤其是丁酸盐,上述报告中与产丁酸相关的核心菌属如粪杆菌属,罗氏菌属等都有所下降。
同时,与消化复合碳水化合物相关的经黏液真杆菌属丰度也较低,可能与患者的消化不良有关。
以上是核心菌属异常的情况,健康人的肠道菌群检测报告中核心菌属具体如何?
这里从谷禾肠道菌群检测数据库选取一例健康人的报告,健康总分在89分。
注:在谷禾肠道菌群检测报告评分机制中,超过80分已经算很健康的状态。

其核心菌属丰度如下:
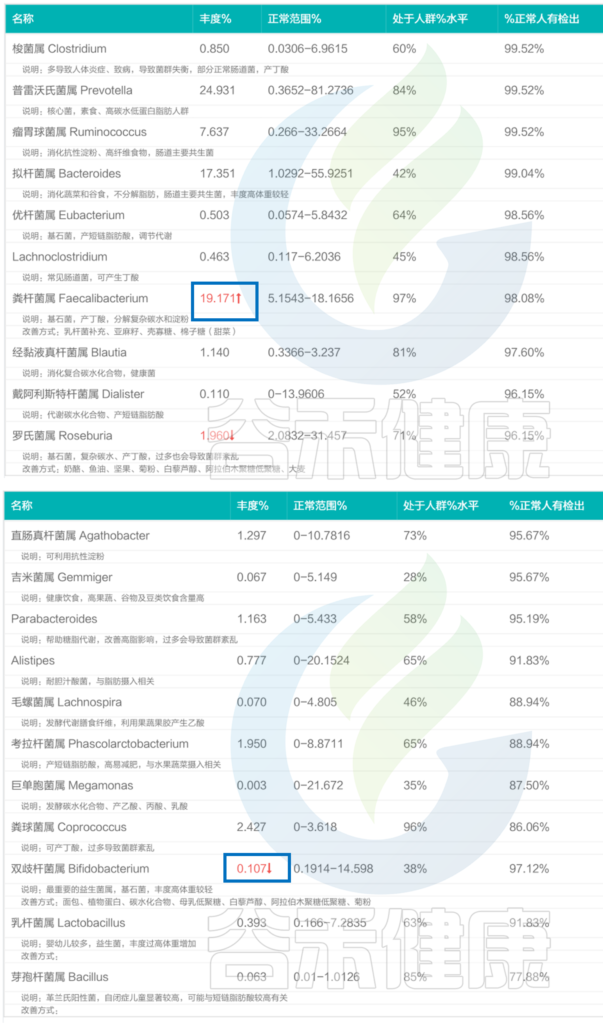
<来源:谷禾肠道菌群检测数据库>
可以看到,健康人的核心菌属绝大部分都在正常范围内,其肠道菌群结构非常稳定。
当然也有个别菌群超标。其中粪杆菌属丰度为19.171%,比正常范围的上限略高一点点,而粪杆菌属,可以帮助分解膳食纤维,产短链脂肪酸,有助于维持肠黏膜健康、增强免疫系统功能,维持肠道内长期的稳定状态。
其他像罗氏菌属的丰度在1.960%,双歧杆菌属丰度在0.107%,略微低于正常水平,对整体健康基本不构成威胁。
还有像芽孢杆菌属在一些亚健康人群中有很多未检出或者极低,而该报告中芽孢杆菌属能检测到且丰度属于正常水平,有助于提升其整体肠道菌群结构的稳定性。
我们需要关注肠道菌群中的核心菌属,因为这些菌属在整个人体肠道菌群中扮演着网络节点或基础菌群的角色。核心菌属及其重要菌属的紊乱会直接影响营养物质的吸收、代谢产物的合理构成以及维持肠道正常生理环境的稳定性等。
如何保持这些核心菌属的健康水平呢?
一方面要坚持通过健康的饮食和生活状态来实现。尽量选择多样化新鲜卫生的食物、富含含欧米伽-3的不饱和脂肪酸,平衡动物和植物蛋白,更多的十字花科蔬菜、富含多酚的水果、根茎类蔬菜以及合理的脂肪。
另外一方面,了解肠道健康和菌群状态,针对性的调整异常菌属和菌群结构,保持核心菌属的平衡和喂养,才能构筑一个强大的菌群网络结构,维护正常的免疫状态和身体健康。
世界肠道健康日,希望每个人都拥有更健康的肠道和更好的身体~

谷禾健康

Dorea菌属于厚壁菌门毛螺菌科,广泛存在于人体肠道内,谷禾数据显示该菌在人群的检出率超89%。该菌最早也是从人体粪便中分离出来。
“Dorea” 目前没有一个确定的译名,Dorea是以法国微生物学家 Joel Doré 的名字命名,以表彰他对肠道微生物学的诸多贡献。
该菌是一类革兰氏阳性厌氧菌,主要存在于人类和动物的肠道中,可以利用多种底物进行发酵代谢,包括葡萄糖、果糖、乳糖和芳香族化合物等。
它可能通过诱导Treg并抑制Th17细胞的分化和功能,从而调节肠道免疫反应,维持肠道黏膜屏障的完整性和稳定性。
编辑
图源:microbiomology
Dorea菌在肠道微生态系统中的丰度和分布受到多种因素的影响,如年龄、饮食、生活方式、疾病等。在不同年龄段、不同饮食类型和不同疾病状态下存在差异,这可能与其在肠道内的营养代谢、免疫调节和菌群相互作用等方面的作用有关。
在多发性硬化症、炎症性肠病患者,甚至结直肠癌、自闭症谱系障碍以及肥胖人群中的Dorea菌高丰度富集,被认为具有促炎作用。
多数研究证实Dorea与体重指数 (BMI)、腰围和舒张压呈正相关。基线肠道内富含高丰度的Dorea菌的人群,在减重方面更困难。
然而Dorea菌在抑郁患者和患有食物过敏人群中减少,研究还表明Dorea菌可以预防或治疗过敏性鼻炎。
相较于其他的肠道重要菌属,关于Dorea 的研究资料相对有限,本文将根据该菌相关的研究结果以及检测实践数据来综合分享该菌的相关信息和健康特性及其干预措施。
该菌是不形成孢子、革兰氏染色阳性、不运动、专性厌氧的菌。葡萄糖代谢的主要终产物是乙醇、甲酸盐、乙酸盐、H2 和 CO2。不产生丁酸盐。DNA G+C 含量 (mol%):40–45.6 (Tm)。
该属的代表菌种是Dorea formicigenerans,是肠道中主要的产气菌,能够利用碳水化合物,这也是一些肠病和部分肥胖患者会伴随腹胀气的原因之一。另外还有Dorea longicatena也比较常见。
该菌属包括目前已经鉴定的常见种包括以下:
Dorea菌与肠道微生态系统中的其他菌群之间也存在着复杂的相互作用。一些研究表明,Dorea菌与Bacteroides、Faecalibacterium等菌群之间存在着协同关系,可以相互促进代谢产物的生成和利用,从而维持肠道微生态系统的平衡和稳定性。
此外,青春双歧杆菌和长双歧杆菌可以降低或抑制Dorea的丰度。
该菌作为肠道重要菌属,其与其它肠道菌群互作如下,仅供参考:
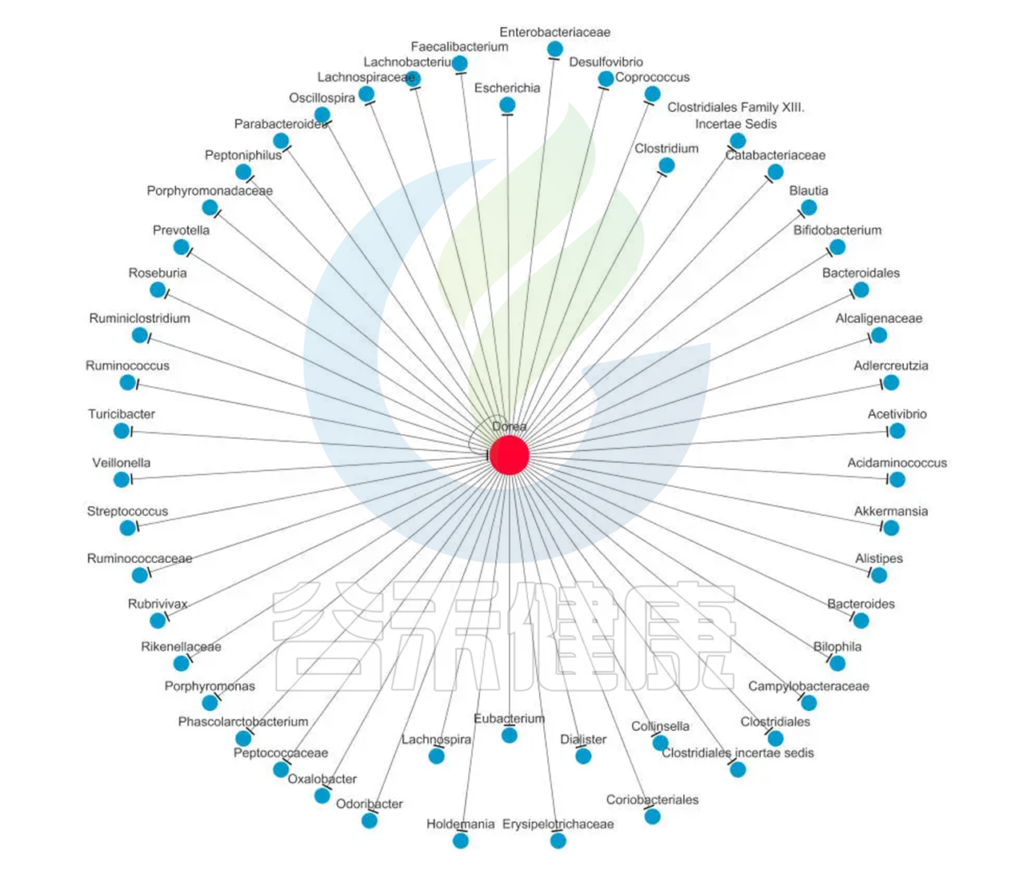
<来源:谷禾健康数据库>
➩ 非酒精性脂肪型肝炎
患有脂肪变性或非酒精性脂肪型肝炎(NASH)的儿童伴随着更高丰度的Dorea和Ruminococcus 菌属。
线粒体功能障碍,连同氧化应激和肠道菌群改变据信能够促进非酒精性脂肪型肝炎的进展。
证据表明非酒精性脂肪性肝病(NAFLD)会破坏肠-肝轴,将野生型和甲基化控制的J蛋白敲除(MCJ-KO)小鼠喂食6周的高脂饮食 (CDA-HFD),小鼠的Dorea属及Oscillospira属较WT小鼠高;研究结果阐明了MCJ-KO的特定菌群谱,表现为Dorea和Oscillopira菌属的粪便相对丰度增加,以及Allboaculum和Ruminococcus菌属的减少。
这些菌通过增强短链脂肪酸、烟酰胺腺嘌呤二核苷酸(NAD+)代谢和sirtuin(长寿蛋白)的活性,增加了无菌小鼠的脂肪酸氧化来发挥肝脏保护作用。值得注意的是,该研究强调Dorea菌属及其相关代谢产物是这种菌群依赖性保护表型的主要调节剂。
研究者进一步利用公共数据库进行分析:通过一组肝硬化患者的数据,将患者根据体重指数(BMI)分为肥胖(BMI≥30;n=71)和非肥胖(BMI<30;n=121),有趣的是,在非肥胖受试者的子集中,粪便Dorea的丰度显著降低(p=0.026),而在肥胖患者中未观察到显著差异(p=0.636)。
这些发现可能表明瘦型非酒精性脂肪型肝炎患者的肠道菌群组成发生了特定变化,特征表现为Dorea菌属的减少。
➩ 超重和肥胖
肠道菌群被认为在超重和肥胖的发展中发挥重要作用,但能量限制(特别是长期)对超重和肥胖成年人肠道微生物群的影响。发表于Genome Medicine的一项研究发现,基线时Dorea菌属丰度较高可能与随后难以减掉体重有关。
宏基因组研究也表明,Blautia,Dorea和Mediterraneibacter属的增加可能促成宿主肥胖。
Dorea formicigenans 和 Dorea longicatena 在超重/肥胖人群中的丰度更高。
基线Dorea的丰富对随后的体重减轻有适度的预测作用。
Dorea丰度与肥胖呈正相关,在糖尿病前期患者中发现其丰度增加。Dorea丰度的变化与粪中戊酸水平的变化呈负相关。Dorea高丰度可以降低产短链脂肪酸菌的丰度,导致粪便中包括戊酸在内的短链脂肪酸水平降低。
➩ 2型糖尿病
2型糖尿病患者肠道菌群中产丁酸菌减少,而潜在致病菌增多。糖尿病前期患者肠道菌群也有相应的变化:梭菌属和黏蛋白降解菌AKKermansia显著减少。此外,Dorea菌属、瘤胃球菌属和链球菌属增多。
➩ 肠易激综合征
在肠易激综合征受试者中,与健康对照组相比,观察到肠道微生物群,肠杆菌科、瘤胃球菌、梭菌、Dorea物种增加。
➩ 肿瘤息肉
肠道微生态系统组成变化与大肠肿瘤密切相关:与无腺瘤性息肉患者相比,腺瘤性息肉患者肠道微生态中拟杆菌比例相对降低,而变形菌比例相对较高,Dorea菌属及志贺菌属比例升高。
➩ 结直肠癌
结直肠癌患者中Dorea和Porphyromonas增加同时Catenibacterium和Prevotella减少的细菌属被证明产生了最准确的预测效果。Dorea在结直肠癌患者的粪便样本中比在健康对照者的粪便样本中更丰富。Dorea菌具有粘附癌细胞的能力,这可能赋予Dorea在癌性结直肠环境中的竞争优势。Dorea菌的机会主义能力带来潜在致癌作用。
➩ 牛皮癣
牛皮癣患者肠道菌群中的Ruminoccocus gnavus, Dorea formicigenerans, Collinsella aerofaciens丰度显著增加。
➩ 自闭症
与健康对照组相比,自闭症孤独症谱系障碍儿童中毛螺菌科的数量有所增加。毛螺菌科由大约几十个异质属组成。
众所周知,毛螺菌科成员中的许多属甚至可以主宰肠道微生物群,包括Dorea、Blautia、Lachnospira、Coprococcus、Roseburia和Ruminococcus。毛螺菌科成员具有广泛的代谢功能,包括合成短链脂肪酸(包括丁酸盐)、粘蛋白降解以及糖和芳香族氨基酸代谢。他们的生态失调与许多其他慢性疾病有关,例如炎症性肠病、肾脏疾病、肝脏疾病和神经行为疾病等。
➩ 过敏性鼻炎
过敏性鼻炎 (Allergic rhinitis,AR)是特应性个体接触环境中变应原后,通过IgE介导的多种细胞因子及炎性介质参与的鼻腔黏膜慢性非感染性炎症。发现过敏性鼻炎患儿的粪便Dorea菌、Dialister菌和组氨酸水平显著降低,而其差异代谢物与差异菌群无明显关联。
进一步研究发现Dorea和Ralstonia与淋巴细胞模式(Th2/Treg 比率)密切相关。有趣的是,Dorea和Ralstonia与淋巴细胞模式呈负相关:Th2/Treg 比率与Dorea呈负相关, 但与Ralstonia呈正相关。
在儿童早期,Dorea菌与屋尘螨特异性 IgE 水平呈负相关,并且似乎对过敏性鼻炎更具特异性。由于Dorea属与过敏的持续关联,因此Dorea菌丰度的改变可能通过改变对屋尘螨的过敏性致敏作用的发展,来预防或治疗过敏性鼻炎。
➩ 食物过敏
厚壁菌门的Dorea属与婴儿期的食物致敏和食物过敏呈负相关。
研究表明提出婴儿双歧杆菌(Bifidobacterium Infantis)可能通过增加Dorea和减少Ralstonia来减轻 Tm 引起的过敏反应。Dorea可能有助于诱导 Treg 并抑制 Tm 诱导的过敏反应。
注:Tm 是指过敏原(allergen)或致敏物质(sensitizing agent)。
另外一项为期 3 年的后续研究表明,Dorea在后来发生食物致敏或食物过敏的婴儿的肠道微生物群中减少,因此表明Dorea可以防止食物致敏和食物过敏。
➩ 与肠道内肠道辅酶NAD正相关
Dorea相对丰度与肠道NAD总水平呈正相关。肠道NAD指的是肠道内的辅酶NAD(nicotinamide adenine dinucleotide)分子。NAD是一种重要的辅酶,在细胞中发挥着多种重要的生物学功能,包括能量代谢、DNA修复、信号转导等等。肠道内的NAD含量和代谢状态对肠道黏膜屏障的维护、肠道免疫和菌群平衡等方面都有着重要的影响。最近的研究表明,肠道NAD水平的改变可能与多种肠道相关疾病的发生和发展有关。
➩ 心力衰竭
此外,个别研究发现直肠真杆菌和Dorea longicatena在心力衰竭患者肠道微生物群中的含量低于健康受试者。
➩ 抑郁、睡眠
重度抑郁症是一种常见的精神疾病。研究结果显示属水平上,Dorea菌与抑郁和睡眠质量同时相关。压力诱导 Dorea, Coprococcus等菌群显著变化。
Dorea在抑郁症患者中减少,患有睡眠障碍的重度抑郁症患者的Dorea formicgenerans减少。
在属水平上,摄入 3 g/d HMW β-葡聚糖会增加拟杆菌,但会减少 Dorea (P < 0.1)。
大麦干预具有更高丰度的 Akkermansia、Blautia 和 Bilophila,同时减少 Parabacteroides和 Dorea。
属于厚壁菌门的 Dialister、 Dorea 、Pseudobutyrivibrio 和 Veillonella 在使用L-谷氨酰胺后显着减少。
补充维生素D,肠道内Dorea相对丰度降低。
补充硫酸铁(口服)导致 Dorea菌物种的丰度降低。
低聚半乳糖 (GOS) 补充显示Dorea减少。
补充益生元(低聚果糖FOS 和菊粉混合物)显示 Dorea 丰度较低。
Bifidobacterium longum 增加Dorea菌。
喂食鼠李糖乳杆菌hsryfm 1301或其发酵乳28天后,大鼠的肠道微生物群和血脂得到改善。血脂与瘤胃球菌、Dorea、Enterococcus呈正相关(P<0.05)。
刺梨(RRT)的果实可食用,被认为是具有降脂作用的药用果实。12 周刺梨降低 Dorea和Coprobacillus 丰度,并促进双歧杆菌和Roseburia 丰度,来逆转高脂饮食诱导的肠道生态失调。
芒果 ( Mangifera indica L.) 果皮是工业加工获取果汁和浓缩物的副产品,富含多酚和膳食纤维。将预先消化的芒果皮提交给人类结肠的动态体外模型。Dorea属在芒果果皮发酵中的含量为 6.69%。
在抗生素(阿莫西林、四环素和甲硝唑)治疗 2 周后,Dorea formicgenerans,Eubacterium rectale的丰度下降。
白藜芦醇有效降低了Akkermansia、Dorea、Sutterella和Bilophila菌属的丰度 。
在高蛋白饮食后,Dorea会随着 BMI 的降低而降低。
Dorea菌属可以利用多种底物进行发酵代谢,包括葡萄糖、果糖、乳糖和芳香族化合物等。因此,调节饮食结构可以影响Dorea菌属的生长和代谢。
摄入动物性饮食五天后,肠球菌科、肠球菌属和 Dorea属的细菌在蠕虫感染中表现出丰度增加的趋势。
高纤维、低脂肪的饮食有利于增加Dorea菌属的丰度和多样性。
富含可发酵碳水化合物的饮食支持相对丰富的双歧杆菌、普雷沃氏菌属、瘤胃球菌属、Dorea 、 Roseburia 等。
果胶是一种水果蔬菜中发现的复杂的膳食纤维和益生元。果胶摄入增加Lachnospira、Dorea和Clostridium,其中Lachnospira的增幅最大。
中等强度的运动干预持续 3 个月后,亚阈值抑郁症的年轻青少年的肠道菌群发生变化,在属水平上增加了Coprococcus、Blautia、Dorea、Tyzzerella 、Tyzzerella nexilis 的相对丰度。
注:中等强度的运动,包括每天跑步 30 分钟,每周 4 天。
结 语
当谈到Dorea菌时,虽然仍有许多未知的领域,但我们已经取得了一些重要的研究进展。Dorea菌在肠道微生物组中扮演着重要的角色,与人类健康密切相关。它们能够帮助维持肠道菌群的平衡,支持营养物质的吸收和消化,并且可能对肥胖、炎症性肠病、自身免疫疾病等疾病的发生和发展起到重要作用。
然而,关于Dorea菌的研究仍然处于起步阶段。我们需要研究更多的样本、更多的群体,并使用更多的技术手段来深入了解这些菌属的作用机制。相信随着微生物组研究的不断深入,我们将能够更好地理解Dorea菌和其他肠道菌属对人类健康的影响,并开发更加个性化的干预管理方案。
主要参考文献:
Chaput N,Lepage P,Coutzac C et al. Baseline gut microbiota predicts clinical response and colitis in metastatic melanoma patients treated with ipilimumab.[J] .Ann Oncol, 2019, 30: 2012.
Sowah SA, Milanese A, et al., Calorie restriction improves metabolic state independently of gut microbiome composition: a randomized dietary intervention trial. Genome Med. 2022 Mar 14;14(1):30
Juárez-Fernández M, Goikoetxea-Usandizaga N, Porras D, García-Mediavilla MV, Bravo M, Serrano-Maciá M, Simón J, Delgado TC, Lachiondo-Ortega S, Martínez-Flórez S, Lorenzo Ó, Rincón M, Varela-Rey M, Abecia L, Rodríguez H, Anguita J, Nistal E, Martínez-Chantar ML, Sánchez-Campos S. Enhanced mitochondrial activity reshapes a gut microbiota profile that delays NASH progression. Hepatology. 2023 May 1;77(5):1654-1669.
Zhang Q, Yun Y, An H, Zhao W, Ma T, Wang Z, Yang F. Gut Microbiome Composition Associated With Major Depressive Disorder and Sleep Quality. Front Psychiatry. 2021 May 21;12:645045.
Dahl WJ, Rivero Mendoza D, Lambert JM. Diet, nutrients and the microbiome. Prog Mol Biol Transl Sci. 2020;171:237-263.
Chen D, Yang Z, Chen X, Huang Y, Yin B, Guo F, Zhao H, Zhao T, Qu H, Huang J, Wu Y, Gu R. The effect of Lactobacillus rhamnosus hsryfm 1301 on the intestinal microbiota of a hyperlipidemic rat model. BMC Complement Altern Med. 2014 Oct 10;14:386.
Tangestani H, Boroujeni HK, Djafarian K, Emamat H, Shab-Bidar S. Vitamin D and The Gut Microbiota: a Narrative Literature Review. Clin Nutr Res. 2021 Jul 20;10(3):181-191.
Wang R, Cai Y, Lu W, Zhang R, Shao R, Yau SY, Stubbs B, McIntyre RS, Su KP, Xu G, Qi L, So KF, Lin K. Exercise effect on the gut microbiota in young adolescents with subthreshold depression: A randomized psychoeducation-controlled Trial. Psychiatry Res. 2023 Jan;319:115005.

谷禾健康

微生物组的纵向研究是一种长期跟踪微生物组变化的研究方法。在这类研究中,样本从同一人群或个人中多次采集,通过检测样本中微生物群落丰度的变化(如不同菌群的比例和种类),来了解微生物组随时间的变化趋势和特征。
根据微生物组不同菌群的变化,可以发现一些与健康或疾病相关的特征,从而为疾病预防和治疗提供参考。
但是,由于不同研究对象在纵向时间轴上的时间点分布不均匀且数量不同,难以进行有效的综合分析,一些时间点上的样本缺失导致大量数据无法利用。
为此,研究人员提出了一种名为DeepMicroGen的双向循环神经网络-生成对抗网络(GAN)模型,该模型根据观测值之间的时间关系进行训练,从而在时间序列数据中填补缺失值。
本文介绍了DeepMicroGen模型的算法、并在性能评估上使用模拟和真实数据集与几种标准基线方法进行了比较,结果都表示DeepMicroGen模型无疑是优秀的。

如图中所示,DeepMicroGen模型主要分为两部分,生成器(Generator)和判别器(Discriminator)。
•生成器
生成器的目标是产生更真实的伪造数据,用于填补缺失值。
•辨别器
判别器的目标是辨别真实的数据和伪造的数据,促使生成器不断地生成更加真实的虚假数据。
两者通过反复训练来相互对抗和优化,最终达到生成器生成的数据足以欺骗判别器的效果,从而提高模型的生成和预测能力。
在进入模型训练前,要对输入的微生物组数据进行预处理,使用clr方法进行了归一化,同时,为了避免某些物种在所有样本中完全缺失的情况,即数据中不会出现零值,计算了伪计数(最小相对丰度除以2)。
▷DeepMicroGen模型中的生成器(Generator)训练
先判断每个时间点上是否存在该物种,0表示数据缺失,1表示数据存在。

然后计算出时间差δf,一个向量,用于表示前一个观测值与当前时间点之间的时间差。δb,与δf定义类似,但计算方向相反,这反映了下一个观测值的时间与当前时间点之间的差异。
这些变量的计算有助于更准确地捕捉时间序列数据中的时间相关性。
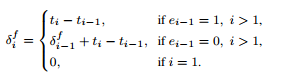
接着将x(观测值)、e、δf和δb变量值输入至DeepMicroGen模型的生成器中,使用CNN模块提取捕捉系统发育关系的特征。
计算门水平的OTUs之间的Spearman相关性,得到相关性系数矩阵(一个p×p矩阵,其中p个OTUs在一个聚类中),利用下面的公式将矩阵中的每一行简化为相关系数的几何平均值,其中ρOTUjp是OTUj和OTUp之间的Spearman相关性。
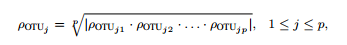
然后OTUs按照几何平均值从大到小进行排序,进一步强化门水平OTU之间的关联。之后,将CNN模块分别应用于每个聚类并提取特征,该模块由两个1D-CNN层组成,卷积核大小为3,分别具有16和8个滤波器,每个滤波器后接一个Leaky ReLU激活函数和一个max-pooling层。
从每个聚类中提取的特征被连接并传递到biRNN模块。通过这种方式,DeepMicroGen模型可以同时利用门聚类和时间序列数据的相关性,提高对微生物组数据中缺失值的填充精度。
为了训练模型,需要捕捉时间序列之间的关系,以便填充缺失值。因此,在模型中增加了一层具有tanh激活函数的单层biRNN模块,用于捕捉正向和反向的时间关系。
RNN(循环神经网络)单元的定义如下:其中,Wh是权重矩阵,bh是bias,hi−1是前一个时间点的隐藏状态(hidden state)
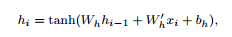
在biRNN 模块中的生成器应用中,前向(forward)和反向(backward)RNN单元都会产生一个生成的输出,分别用 x˜f和x˜b指示。
然后,每个生成的输出将与其对应的权重系数λf和λb相乘,λf和λb是根据时间差分计算出来的,bias向量bλf和bλb是模型通过训练学习得到的参数,最终的插补值 ˜x是由输入数据和生成数据按一定比例加权组合而成,如果输入数据中存在真实值,那么生成值就会被真实值替代。
其中,1是一个全1矩阵,xe是一个矩阵,其中第i列是x乘以一个单位向量ei(即只有第i个位置是x,其他位置均为0)。

▷ DeepMicroGen模型中的判别器与生成器之间的对抗训练
判别器由一个带有LSTM单元的一层RNN模块构成,判别器的训练过程旨在最小化两个不同的损失函数lossD和lossT,以此优化判别器的性能,从而提供准确的反馈信息给生成器,改进生成器的生成结果。
其中,lossD用于评估判别器的鉴别能力,即判断一个样本是真实值还是生成值的能力;lossT用于评估判别器对时间点的预测准确性。

在生成器的训练过程中,会分别计算lossG、lossR和lossC。使得生成器产生更准确、一致且真实的填充值。
lossG表示生成器的损失函数(Generator Loss),表示生成器在生成伪造数据过程中的误差;lossR表示真实数据损失函数(Real Data Loss),表示判别器对真实数据分类的误差;lossC表示伪造数据损失函数(Fake Data Loss),表示判别器对伪造数据分类的误差。
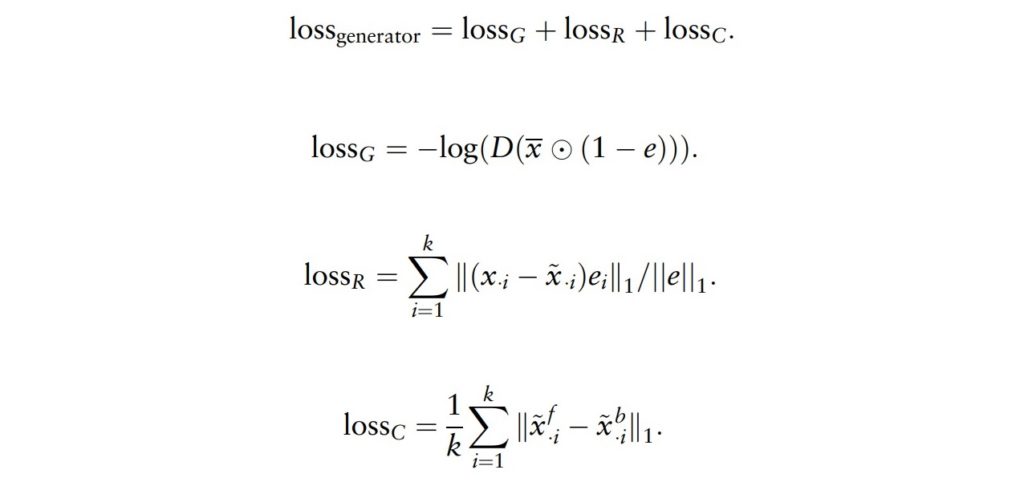
最终,通过相互对抗和共同优化,判别器和生成器可以同时得到优化,并且生成器可以生成具有真实样本类似但又与数据集不完全相同的新数据。
DeepMicroGen是基于Tensorflow库(v1.8.0)构建的。在训练中使用了Adam优化算法,Adam的学习率被设置为0.001。
每一轮训练,生成器会在判别器经过5次迭代之后进行一次训练。当生成器的损失函数连续1000轮训练没有降低时,训练就会被结束。同时使用了Dropout(CNN层中的0.7比率)来缓解过拟合的问题。
下图为训练过程的损失函数曲线:

实验设计
使用的测试数据集包括1个模拟数据集和2个真实数据集(DIABIMMUNE和BONUS-CF数据集)。
DIABIMMUNE数据集内含从三个国家(芬兰、爱沙尼亚和俄罗斯)招募的婴儿粪便样本,这些国家在1型糖尿病和过敏的发病率方面存在很大差异。
根据16s rRNA扩增子测序,选择了133名受试者的1064份粪便样本(时间点为第4、7、10、13、16、19、22和28个月),其中包含115个种水平的OTUs。BONUS-CF数据集内含231个婴儿的粪便样本,这些婴儿中,有一部分存在囊性纤维化(CF)或高风险发展成囊性纤维化的情况。
研究人员选择了113名受试者的452份在5个月、6个月、8个月和10个月时的粪便样本,使用WGS测序。模拟数据是基于DIABIMMUNE数据集模拟了200名受试者。
使用了三种不同类型的缺失值填补方法进行性能评估。采用简单的方法(平均值和中位数)进行插补,然后比较了线性曲线拟合、三次曲线拟合和基于移动窗口(window-size = 3)的缺失值填补方法。
还使用了广泛用于纵向数据集的缺失值填补方法:基于链式方程的多重插补(MICE)和最后一次观测值向前插补(LOCF)。使用平均绝对误差(MAE)来衡量不同缺失值填补方法的性能。
★ 实验结果表明DeepMicroGen模型优于其他方法
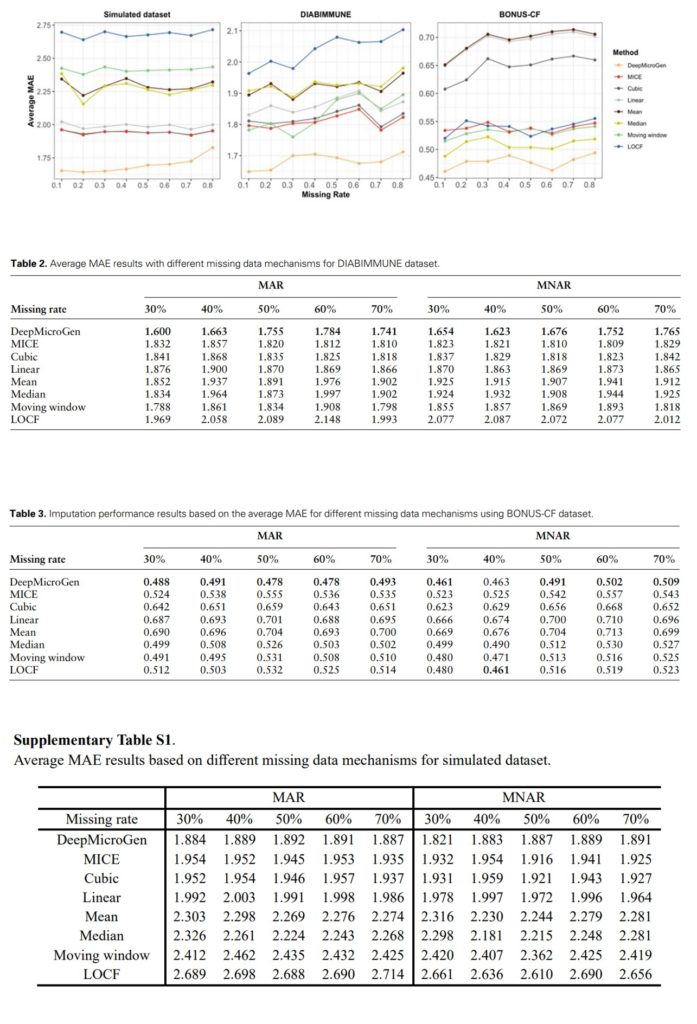
DeepMicroGen模型在模拟数据集上的MAE为1.866,优于其他方法,其中MICE的表现次之,为1.942。其他方法的MAE分别为:三次曲线拟合(1.943)、线性曲线拟合(1.990)、Median(2.277)、Mean(2.298)、Moving window(2.452)、LOCF(2.698)。DeepMicroGen在真实数据集上也取得了最好的成绩,MAE分别为1.609和0.486。
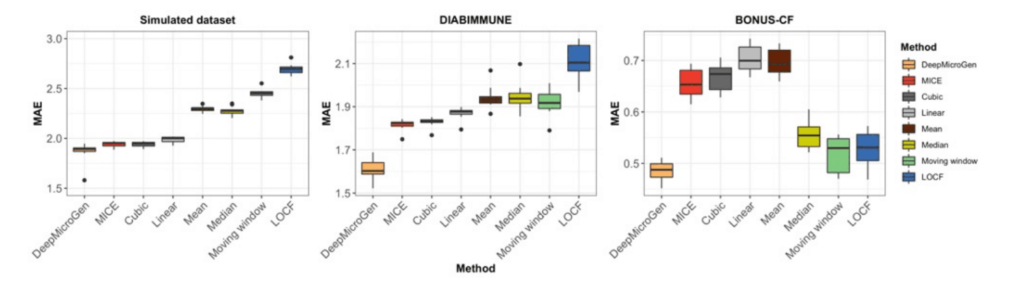
DeepMicroGen模型利用GAN与CNN结合提取OTU特征来推算微生物组数据。研究人员为了观察不同组件对imputation性能的影响,通过移除或改变模型中的组件设计了四种变体DeepMicroGen模型。然后分别使用DIABIMMUNE数据集进行10倍交叉验证,并计算MAE进行性能评估。
如下图所示,与所有四种变体模型相比,DeepMicroGen表现出最佳性能。

评估DeepMicroGen模型在不同数据缺失率下的表现。随机(MAR)或非随机(MNAR)删除10%到80%的数据,使用DeepMicroGen模型进行缺失值填补,实验重复5次,计算MAE。结果表示除MNAR缺失率为40%外,DeepMicroGen模型在大多数情况下的MAE仍然是最低的。
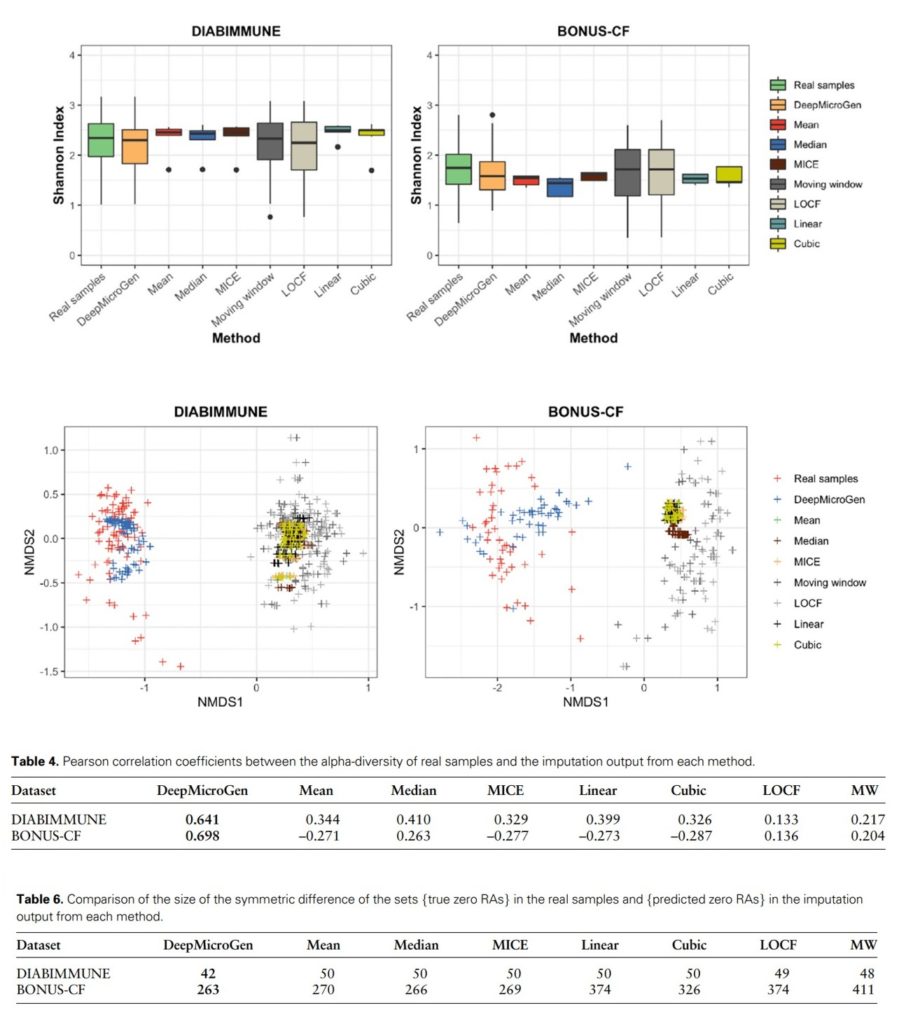
评估DeepMicroGen模型生成的插补值是否能够与原始数据保持相似性。研究人员随机丢弃10%-80%的数据,并使用DeepMicroGen和其他方法进行填补。
对于每种方法,分别比较了Shannon指数结果,NMDS分析结果。还计算量真实值和插补值分别与这两者间的pearson相关系数。
结果表示mean、median、MICE、linear和cubic方法的插补值与真实值的alpha多样性存在显著差异(P<0.05)。
MW和LOCF方法进行插补得到的数据,其alpha多样性与真实数据较为接近,但它们与真实数据的相关性较低。
★ DeepMicroGen模型的到的插补值与真实数据相似,相关性最高
而通过DeepMicroGen模型得到的插补值,其alpha多样性与真实数据相似,并且相关性最高。在比较beta多样性时,还可以看到DeepMicroGen模型生成的插补值与真实数据之间有重叠,而其他方法却几乎没有重叠。
此外,研究人员还测试了是否能够识别真实数据中相对丰度值(RA)为0的,并准确预测。准备了两个数据集合,分别是{true zero RAs}和{predicting zero RAs},分别表示真实数据集中RA=0的OTU集合和生成插补值数据集中RA=0的OTU集合。依次比较这两个集合之间的对称差,预测准确率和MAE值。
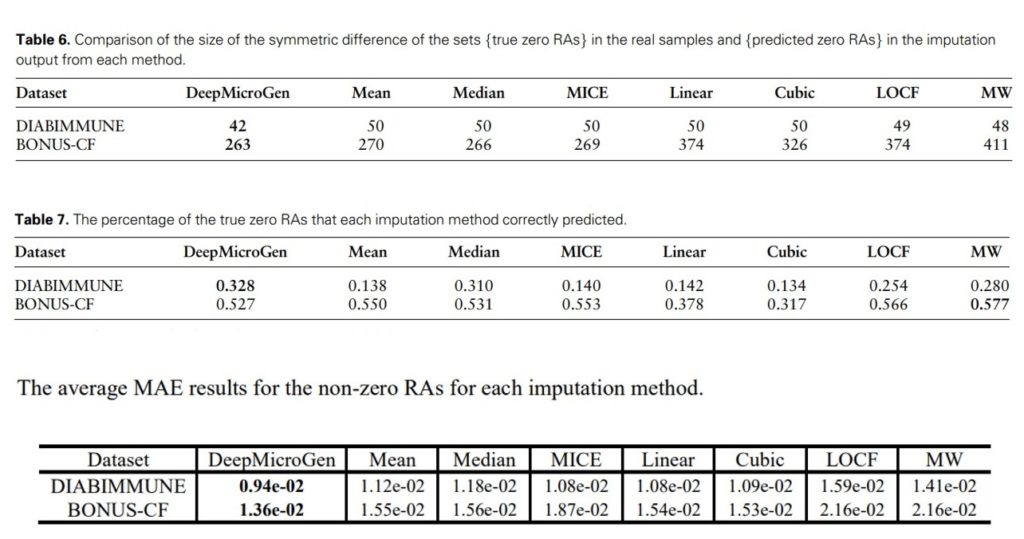
★ 能够有效保留原始数据特征,利于下游分析
这些结果都表明DeepMicroGen模型生成的插补值能够有效地保留原始数据的特征,更有助于下游分析。
评估DeepMicroGen模型是否可以提高疾病预测能力。在DIABIMMUNE数据集中,141名婴儿有鸡蛋、牛奶和花生过敏结果的临床信息,其中117名婴儿有8个时间点的所有样本,而其他25名受试者没有样本。
研究人员利用LSTM神经网络分类器对蛋、牛奶和花生过敏等疾病进行了预测,使用clr转换后的相对丰度数据作为DeepMicroGen模型数据输入,比较经重复5次5-fold交叉验证计算 的平均AUC值,与其他插补值生成方法相比,DeepMicroGen模型在所有过敏疾病的预测表现中实现了最高的改善效果,其中花生过敏的预测表现提高了19.5%。
编辑
由于DeepMicroGen模型较好的结果表现是假定样本是在相同的时间间隔下生成的,如果样本的时间间隔不规律,那么DeepMicroGen模型的表现可能不太好。
因此,最好有一定数量的样本在每个时间点上。当然,对于这类数据,DeepMicroGen模型也能训练并生成插补值,只是精确度可能会降低。
DeepMicroGen 模型为微生物组数据缺失值填补提供了一种有效的方法,并且在实验中表现出了良好的性能,在疾病预测方面的潜力也不逊色。
据文中介绍,基于深度学习的纵向数据填补方法已经被用于特定的研究领域,如用于阿尔茨海默病进展的MRI特征插补,患者管理的电子健康记录插补,以及肺癌风险评估的CT图像插补。
这为利用不完整的纵向数据集进行微生物组研究的科学家们提供了支持。
参考文献
Choi JM, Ji M, Watson LT, Zhang L. DeepMicroGen: a generative adversarial network based method for longitudinal microbiome data imputation. Bioinformatics. 2023 Apr 26:btad286.

谷禾健康

音乐对身心的影响
近年来,环境和动物生理及心理的相关研究越来越多。环境因素的丰富性和多样性是改善动物生理和心理状态的重要研究参数。
环境因素指的是正常环境,在这种环境中,动物通过获得环境激励以做出有益的增强,使它们能够正常表达其行为和心理活动,从而改善健康状况和生长性能。
★ 音乐对人体健康具有益处

音乐这种声波刺激,影响着动物的生理和心理。以前的研究表明,伴随音乐喂养动物会影响它们的生长性能和动物生产。音乐的节奏鼓励肌肉活动并激发机体的活力。当音乐的节奏接近机体的心律时,会刺激机体分泌调节荷尔蒙。
美国开展的一项音乐疗法研究表明,它可以缓解情绪、改善消化、平衡心理状态并促进疾病康复。
★ 音乐可以辅助调节肠道菌群
中国在先秦时期就将五行音乐疗法(FEMT)引入医学领域。中国的五行音乐疗法有着悠久的历史和完整的体系。科学家观察到五行音乐疗法可以缓解焦虑症状、改善空间认知、调节肠道菌群和辅助药物治疗。
五行音乐疗法——中医理论描述了五种音乐音调、五种器官和五种元素之间的相互联系,五音分属五行,通肝、心、肺、脾、肾五脏。用角、徵、宫、商、羽五种不同的音调的音乐来治疗相对应的疾病。
虽然目前音乐疗法治疗疾病存在一定的局限性,但音乐疗法已成为临床常用的辅助治疗手段。
然而,关于喂食过程中听音乐对肠道微生物影响的报道较少。本文通过最新的研究评估喂养时伴随音乐对小鼠肠道微生物和生长性能的影响,为音乐治疗提供理论支持。
•实验选用生长状况良好、健康的小鼠
在整个研究过程中,没有动物患抑郁症、疾病或死亡,尸检和电子显微镜成像均未显示宏观和微观病理。
整个实验期间的小鼠体重
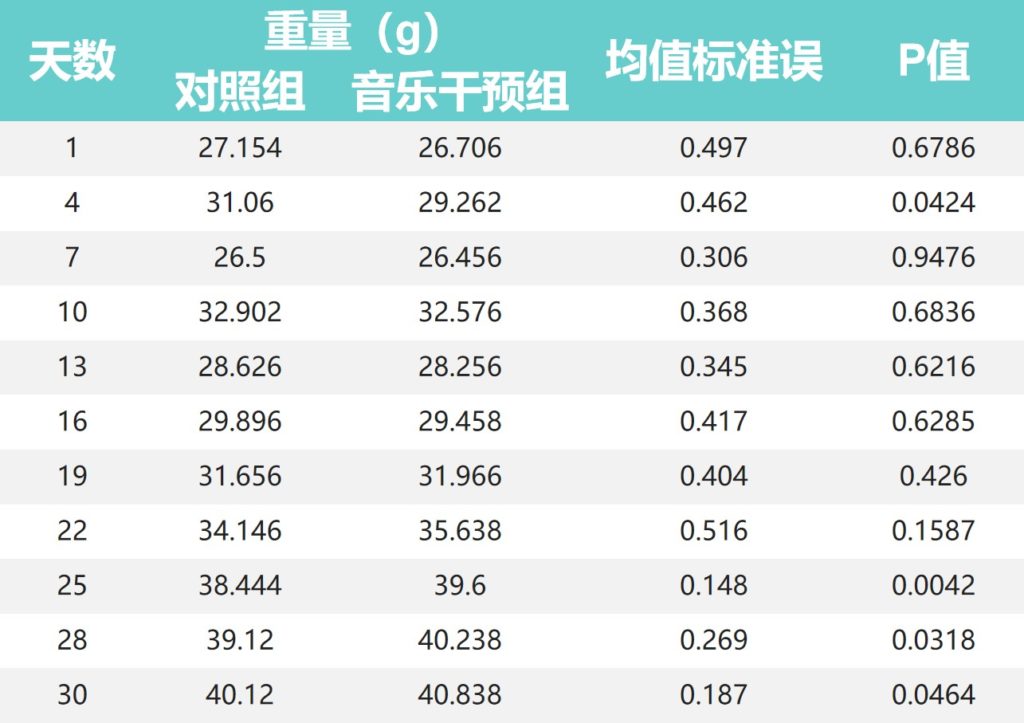
•对照组小鼠体重在前16天高于音乐干预组
对照组小鼠体重在30天喂养期的最初16天高于音乐干预组,第4天两组差异显著(P<0.05)。
•19天后音乐干预组体重开始高于对照组
然而,在第19天后,两组之间的小鼠体重发生了翻天覆地的变化,音乐干预组的体重在第19-30天高于对照组。
其中,第25天(38.444:39.600)、第28天(39.120:40.238)和第30天(40.120:40.838)组间差异有统计学意义(P<0.01;P<0.05;P < 0.05)。
•音乐干预组小鼠情绪和状态更活跃
值得注意的是,在喂食期间,我们发现音乐干预后的小鼠在情绪状况和活动状态方面比对照小鼠更活跃。
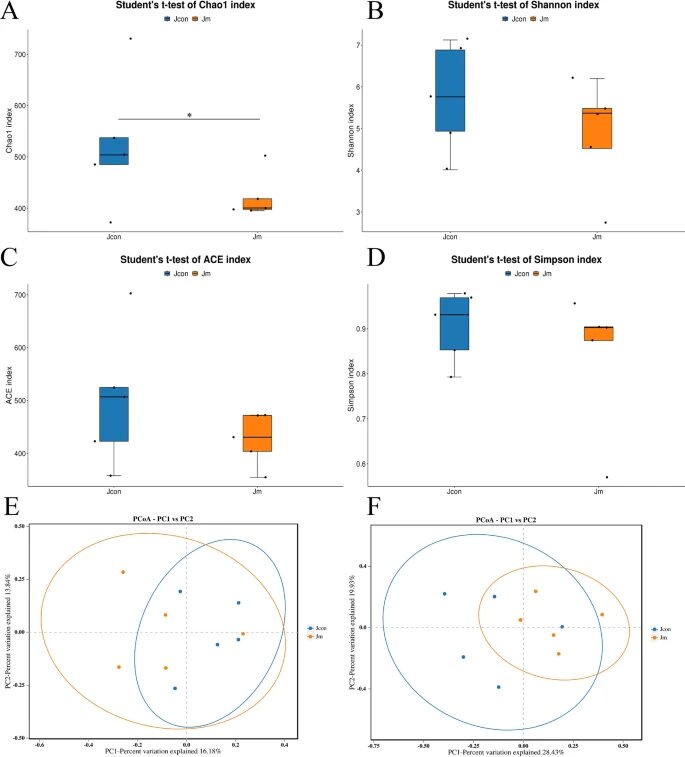
匹配了获得的合格序列,并进行了α-多样性分析,以评估对照组和音乐干预组之间肠道菌群多样性和丰度的差异。
✦伴随音乐的喂养降低了肠道菌群丰度
结果表明,对照组的微生物多样性和丰度高于音乐干预组,两组间chao1指数差异显著(P<0.05)。其他三个指数(Shannon指数、ACE指数和Simpson指数)没有显示出统计差异。
注:chao1指数——又称Chao1丰富度指数或Chao1多样性指数,是一种用于衡量群落物种多样性的指标。
综上所述,可以看出伴随音乐的喂养过程降低了肠道菌群的丰度。
✦β多样性较低
利用QIIME软件计算β多样性分析,比较样本间物种多样性的相似性。
PCoA分析基于未加权的二进制 jaccard(P>0.05)和加权的 bray curtis(P>0.05)显示两组之间没有统计学差异,表明两组之间具有高相似性和低物种多样性。
α和β多样性分析
▼
通过使用 QIIME2 软件对来自不同物种的微生物类群进行分类,评估了门和属水平上优势样本的相对比例。
✦两组中都以厚壁菌和变形菌为主
结果表明,对照组中门水平的优势菌为厚壁菌门(Firmicutes)占42.19%,变形菌门(Proteobacteria)占19.57%,蓝藻(Cyanobacteria)占13.05%和拟杆菌门(Bacteroidetes)占9.85%,占总肠道菌群的84.66%。
在音乐干预组中,门水平的优势细菌为厚壁菌门(Firmicutes)占61.42%,变形菌门(Proteobacteria)占16.00%、蓝藻占7.07%和拟杆菌门(Bacteroidetes)占4.46%,占微生物总数的88.94%。两组的微生物组成(属水平)均显示乳杆菌(Lactobacillus)为优势群落。
此外,uncultured_bacterium_f_Enterobacteriaceae(3.97%比5.83%)和uncultured_bacterium_f_Muribaculaceae(3.47%比1.62%)是两组中的优势菌株。
小结
从以上结果可以得出结论,在小鼠喂食过程中进行音乐干预可以改变肠道微生物的组成。
热图通过色带和接近程度表明多个样品的肠道微生物种群的异同。
结果表明,无论细菌门水平还是在属水平,两组样品之间的微生物丰度相似性较低,但组内样品之间的差异较小,微生物丰度相似。
小鼠肠道微生物组成分布和热图
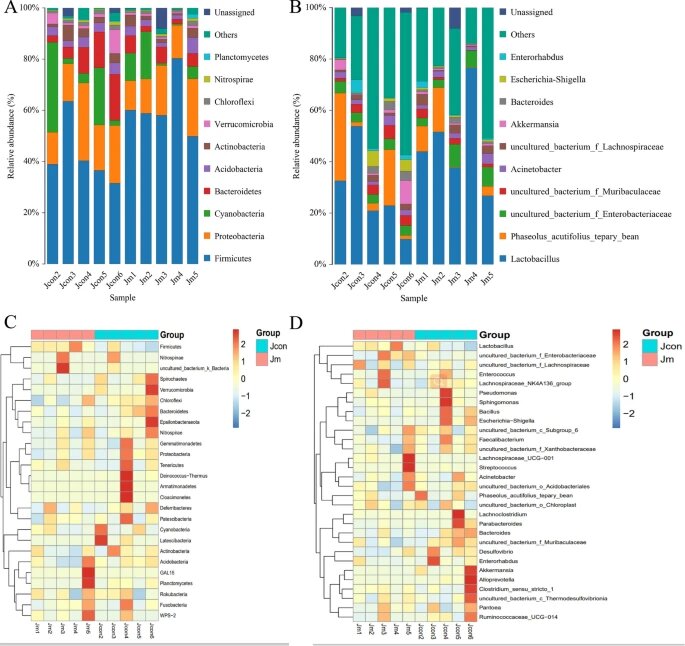
注:(A) 门级的优势细菌种类和丰度;(B) 属级的优势细菌种类和丰度;(C) 门级样品间微生物相似性热图;(D) 属级样品间微生物相似性热图。
▼
✦两组之间厚壁菌丰度存在显著差异
使用 Metastats 分析,研究了两组微生物的门和属水平组成的统计学差异。结果显示厚壁菌门的相对丰度存在显著差异(对照组0.422 ± 0.056与音乐干预组0.614 ± 0051,P < 0.05)。
Metastats分析——组间群落显著性差异分析,用于寻找组间差异物种
✦对照组丰度高于音乐干预组的菌群
在属水平上发现了11个具有统计学意义的分类群,而对照组在以下菌种丰度高于音乐干预组
uncultured_bacterium_o_Microtrichales
(P<0.0001);uncultured_bacterium_f_Micromonosporaceae
(P<0.05);
Pseudolabrys (P<0.05);
Methylobacterium (P<0.05);
uncultured_bacterium_f_Muribaculaceae
(P<0.05);
Ruminococcaceae_UCG-005 (P<0.05) 。
✦音乐干预组丰度高于对照组的菌群
与此相反,以下菌种丰度音乐干预组高于对照组:
uncultured_bacterium_f_Atopobiaceae(P<0.01);Ileibacterium(P<0.01);Lachnospiraceae_FCS020_group(P<0.05);Serratia(P<0.05);
Dietzia (P<0.05)。
门和属水平肠道细菌丰度的统计差异
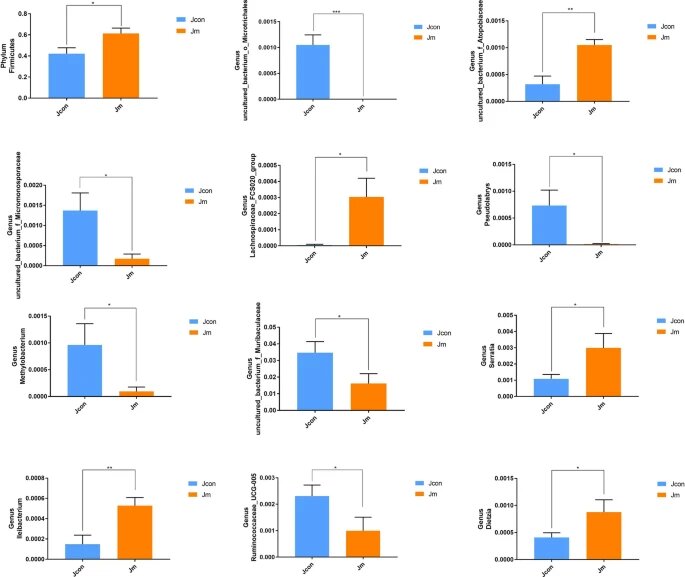
注:所有数据均表示平均值±SD(*P<0.05;**P<0.01;***P<0.001)
▼
考虑到 Metastats 分析对两组间细菌相对丰度差异的局限性,进行了 LEfSe 分析以寻找对照组和音乐干预组之间具有统计学差异的生物标志物。
LEfSe分析是一种将非参数的Kruskal-Wallis以及Wilcoxon秩和检验,与线性判别分析效应量相结合的分析手段, 能够在不同组间寻找具有统计学差异的Biomarker,其要求组内样本数≥3。
结果表明,除了上述显著差异的细菌外,还回收了15个具有统计学差异的生物标志物,对照组中最主要的群体是疣微菌门(Verrucomicrobia)、δ-变形菌(Deltaproteobacteria)和酸微菌(Acidimicrobiia),而Lleibacterium和大洋芽孢杆菌(Oceanobacillus)在音乐干预组中显著表达。
LEfSe分析和LDA评分揭示了细菌丰度的显著差异
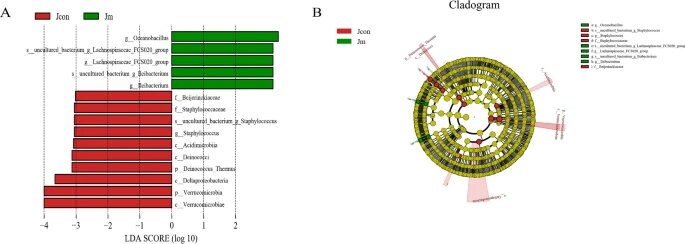
注:(A) LDA分数>3.0被认为具有统计学意义。(B) 分支图描绘了与对照组和音乐干预组相关的肠道微生物群的系统发育分布。
▼
在生态学领域,相关性通常用于构建可用于分析物种群落数据(共现模式)或组合多个数据集进行分析的网络模型。以python为基础,使用前50个属来创建基于网络的关联,该关联表示78个节点、237个边和6个社区。
✦乳杆菌是两组中最丰富的菌
我们发现,在基于网络的相关性分析中,乳杆菌(Lactobacillus)是两组中最丰富的细菌。
此外,音乐干预后小鼠(Jm组)体内乳杆菌丰度高于对照组(47.34%比28.03%),而Phaseolus_acutifolius_tepary_bean丰度低于对照组(6.24% 比 12.36%)。
✦乳杆菌与其他菌属的关联性
乳杆菌与Parabacteroides(0.6364)、Faecalibacterium(0.7455)、幽门螺杆菌(0.7720)、RB41(0.6485)呈负相关。
Phaseolus_acutifolius_tepary_bean与Candidatus_Koribacter(0.7173)和Breznakia(0.7195)呈正相关,与泛菌属(0.66060)、肠球菌属(0.6809)和Ruminococcacee_UCG-014(0.6606)呈负相关。
物种间相关性分析
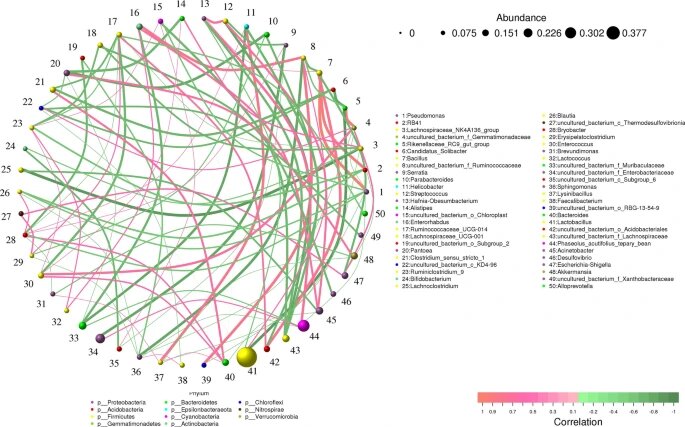
线条描绘了两个物种之间的相关性,线条粗细描绘了相关性的强度。根据线条的颜色,橙色表示正相关,绿色表示负相关。
已发现音乐对身体有积极的影响,引起协调的共振,促进器官节奏的和谐,以及一系列内分泌转变。
▼
✦提高动物的生长性能
先前的研究表明,音乐和检查声音的混合会显著提高小猪生长性能(同样的饲料量下长了更多的肉)。然而,有些音乐(例如重金属,频率<20赫兹,95–105分贝)具有相反的效果。
注:这项研究是在 El Condor Pasa 音乐上进行的,该音乐风格自然且没有过度分层。
在为期30天的喂养实验(有音乐干预)中,发现小鼠的体重在第25天时明显高于对照组。此外还显示,在音乐干预后,动物消耗了更多的食物,体重明显增加。
✦促进对营养的吸收
一些研究发现,音乐可以促进免疫系统和肠道微生物对营养的吸收,同时还可以减轻噪音的负面影响。总的来说,表明音乐可以改善体重,促进小鼠的生长和身体发育。
▼
✦增强肠道菌群的活性
先前的研究表明,音乐疗法可以减少抑郁症,它还会影响消化系统的协调共振、生长激素的分泌并增强肠道菌群的活性和多样性。
肠道微生物群是动物肠道中的微生物群落,在微生物学、医学和遗传学等肠道微生物群相关领域中观察到越来越多的研究趋势。
小鼠胃肠道α-多样性和PCoA分析表明,与对照组相比,音乐干预组肠道微生物发生了变化。有趣的是,整个多样性分析揭示了音乐组中组内样本的高度聚集和组内相似性的显著增强。
✦有助于肠道菌群的相对稳定
我们发现喂食期间的音乐干预从统计学上增加了厚壁菌和乳杆菌的丰富度,同时成倍减少了蓝藻、拟杆菌、肠道微生物中的Phaseolus_acutifolius_tepary_bean和uncultured_bacterium_f_Muribaculaceae。
厚壁菌门是数量最多的细菌,大多数为革兰氏阳性菌,呈球形或杆状,厚壁菌门的许多成员是有益菌,如乳杆菌、芽孢杆菌、双歧杆菌、丁酸梭菌等。
表明肠道微生物多样性的减少与特定细菌的减少或个别菌株的过度生长有关。这表明喂养期间的音乐干预可以减少离散的微生物群并有助于相对稳定性。
✦肠道微生物的稳态有助于防止其他疾病
肠道微生物群的稳态被发现是外部病原体入侵和定植的重要障碍,肠道微生物群的改变可能与多种疾病有关。
除了胃肠道疾病和代谢疾病,肠道菌群还与多种全身性疾病有关,例如神经系统疾病、呼吸系统疾病、心血管疾病和肿瘤疾病。
研究表明,乳杆菌等微生物可以产生乙酸盐、乳酸和抗菌物质,可以防止病原体干扰健康。 此外,它们还有助于维持肠道微生态平衡,预防和抑制肿瘤的发生,增强动物免疫力,促进消化,合成氨基酸和维生素。
总体而言,本研究描述了小鼠在进食期间听音乐情况下肠道微生物群的变化。
结果表明,音乐干预后肠道微生物群发生了显著变化,其特征是肠道细菌多样性下降和小鼠肠道微生物群组成发生变化。此外,在伴随音乐喂养小鼠期间,有益菌的数量增加,而致病菌或条件致病菌减少。
这些结果有助于理解音乐与肠道微生物群之间的关系,以及肠道微生物群会根据不同的喂养环境发生变化。本研究也为音乐疗法改善动物生长环境提高动物生理及心理状态提供了理论依据。

关于肠道菌群干预的相关措施有很多,比如说饮食、睡眠、运动、益生菌、粪菌移植、天然产物、抗生素等,这些在我们之前写过的相关主题的文章都有涉及;而关于音乐对肠道菌群的干预的研究较少,本文对此做一个详细介绍,为音乐疗法的有效性提供了理论依据。
音乐是我们日常生活中轻而易举就能接触到的,可以说是一种非常便捷的治疗方式,因为它不需要使用任何药物或器械,无需去医院等特殊的场所。通过本文的研究可以窥见音乐疗法对于干预人类肠道菌群的潜力。
对于研究人员而言,未来可以更深入了解音乐疗法的作用机制,通过研究不同类型的音乐、不同的音乐治疗对象,探索更多有效的个性化的音乐调节肠道菌群的方案,从而更好地应用于临床实践中,让大众有机会感受音乐疗法带来的不可思议的力量。
参考文献
Niu J, Xu H, Zeng G, Wang P, Raciheon B, Nawaz S, Zeng Z, Zhao J. Music-based interventions in the feeding environment on the gut microbiota of mice. Sci Rep. 2023 Apr 18;13(1):6313.

谷禾健康

目前,原核生物的系统发育分类依赖于16S rRNA基因序列,这种序列在细菌中广泛存在且高度保守,但即使16S rDNA测序的结果显示某些细菌间序列相似性≥99%,但它们仍然不能被归为同一物种。因为基因序列中的一些保守区域并不一定代表真正的进化历史,水平基因转移也可能会影响分析结果。
为此研究人员开发了一种方法,并为该方法创建了一个web应用程序Phy5,以及它的命令行版本Phy5cli。
该方法旨在对任何物种或亚种进行系统发育评估,包括与已知物种的基因序列相似性非常低的非致病菌株,可以轻松地进行系统发育树分析。
文中以E.coli、Shigella、Yersinia、Klebsiella和Neisseria spp.的系统发育关系为例进行了应用与验证。
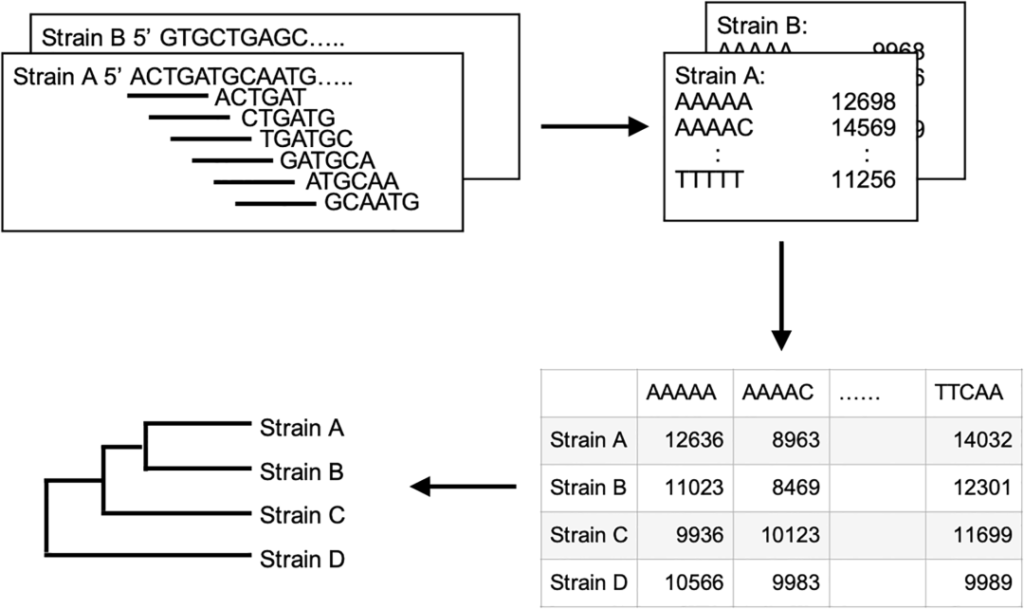
通过分析短核苷酸的频率差异来区分高度相似物种,划分成不同的类群,从而推断它们在系统发育上的关系。
研究使用R v4.12和Biostrings软件包分别对每个细菌样品的三核苷酸、四核苷酸、五核苷酸和六核苷酸频率进行了测定。
这些K-mer(由k个连续核苷酸组成的单元)频率是构建系统发育树的重要信息。通过测定K-mer频率,可以使用层次聚类分析(hierarchical cluster analysis)将样品细菌基因组的相似性进行比较。
在此过程中,使用曼哈顿距离(Manhattan)估计样本间的差异程度,并使用沃德算法(Ward’s)来判断样本间的相似性和关联性。
在该方法中,将互补的K-mer对(例如AAA vs TTT)视为相同的核苷酸序列,以降低这种互补配对对结果的影响。如下图,就是基于五核苷酸频率的系统发育树构建方案。
1
分别基于五核苷酸频率分析和MLST构建的110个Yersinia菌株的系统发育树
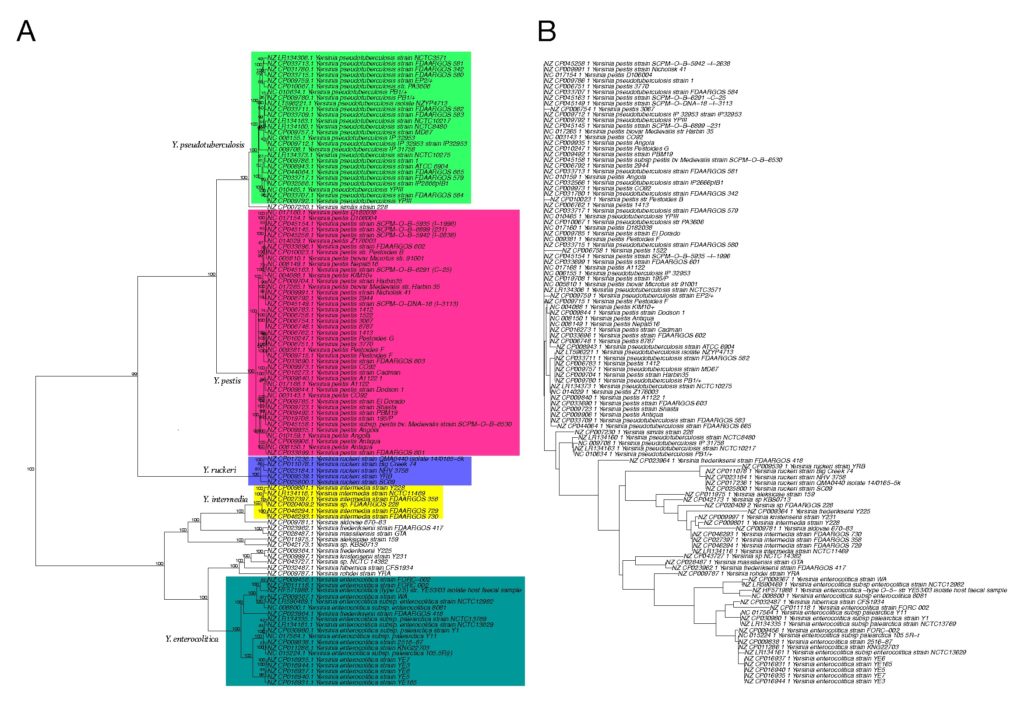
如下图所示,图A为基于五核苷酸频率分析所构建的系统发育树,采用曼哈顿距离和Ward算法。
图B是采用neighbor-joining方法的多重位点序列分型(MLST) 分析所构建的系统发育树。
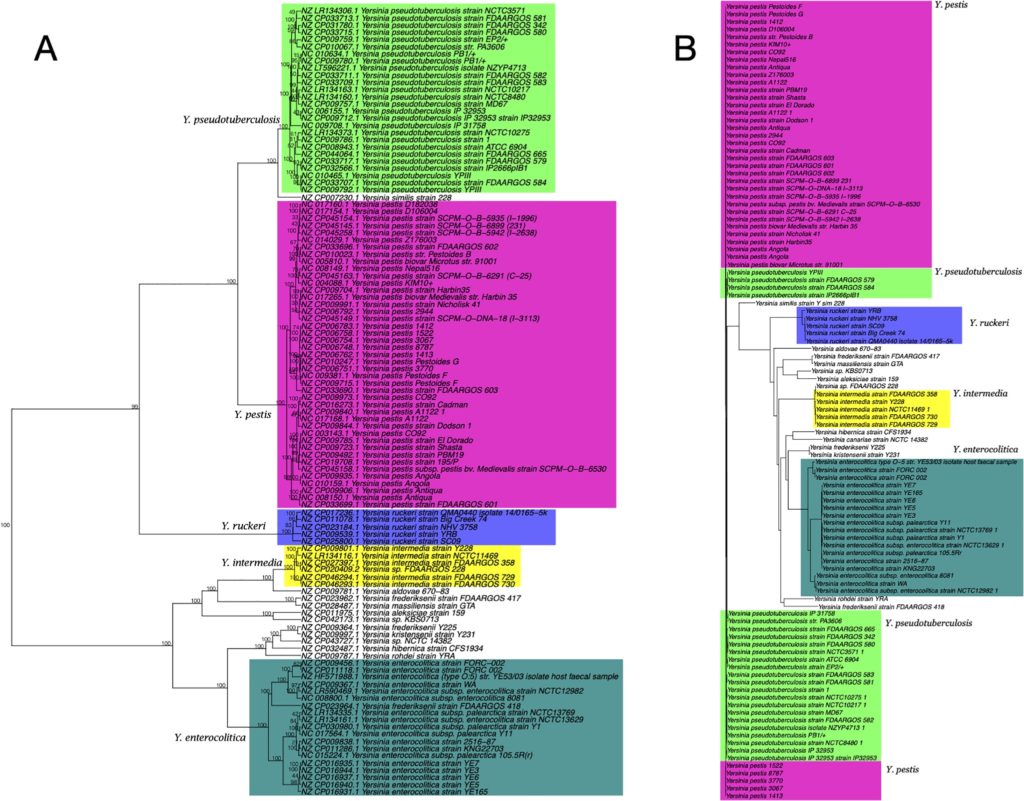
节点上的数字表示在1000个bootstrap值中出现的百分比。颜色区分不同种水平分类。
结果表示两种方法在这个特定的数据集上所产生的系统发育树是高度相似的,它们都可以很好地区分Yersinia和其他物种。
而基于16S rRNA基因序列分析所构建的系统发育树(MAFFT工具)无法区分这些物种,如下图所示,下图B为基于16S rRNA基因序列分析所构建的系统发育树。
2
基于五核苷酸频率分析方法构建系统发育树可以应用于任何物种,且仅需要通过高通量测序技术获取的短链
如下图,根据五核苷酸频率构建了E. albertii、E. coli和Shigella的系统发育树。

发现E. albertii 和致肠出血性大肠杆菌菌株(包括O157、O121和O111等)密切相关,并与Shigella和非致病性E. coli(如K-12菌株)分开排列。
Shigella菌株与肠侵袭性大肠杆菌(EIEC)可以区分开来,并与其他大肠杆菌菌株形成一个分支。
3
基于五核苷酸频率分析方法构建的系统发育树仅适用于近亲物种
研究人员从GenBank序列数据库下载了24个Ipomoea属植物的30个叶绿体基因组的核苷酸序列,并使用五核苷酸频率分析方法构建系统发育树,结果如下图,只构建出来与Ipomoea相关的物种。
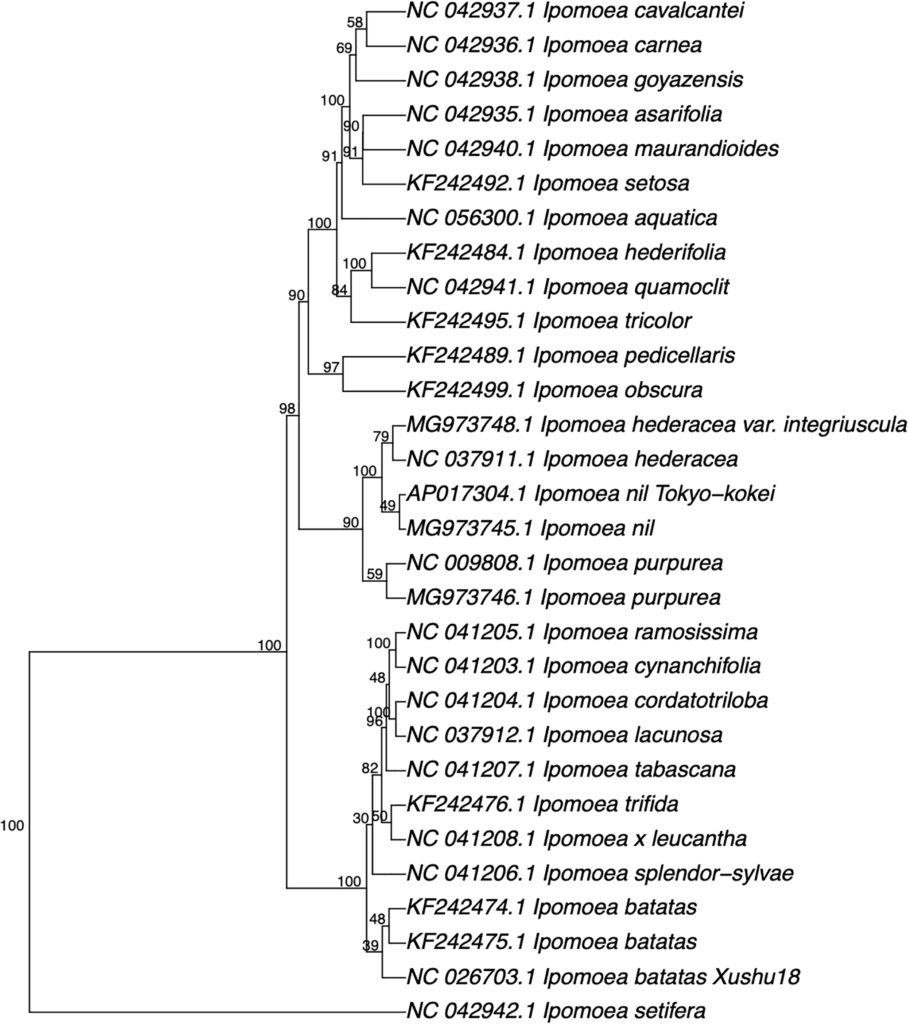
如其它隶属于Ipomoea的物种并没有被发现。
研究人员还测试了使用五核苷酸频率分析方法构建各种远亲物种的系统发育树,包括嗜热古菌和细菌。
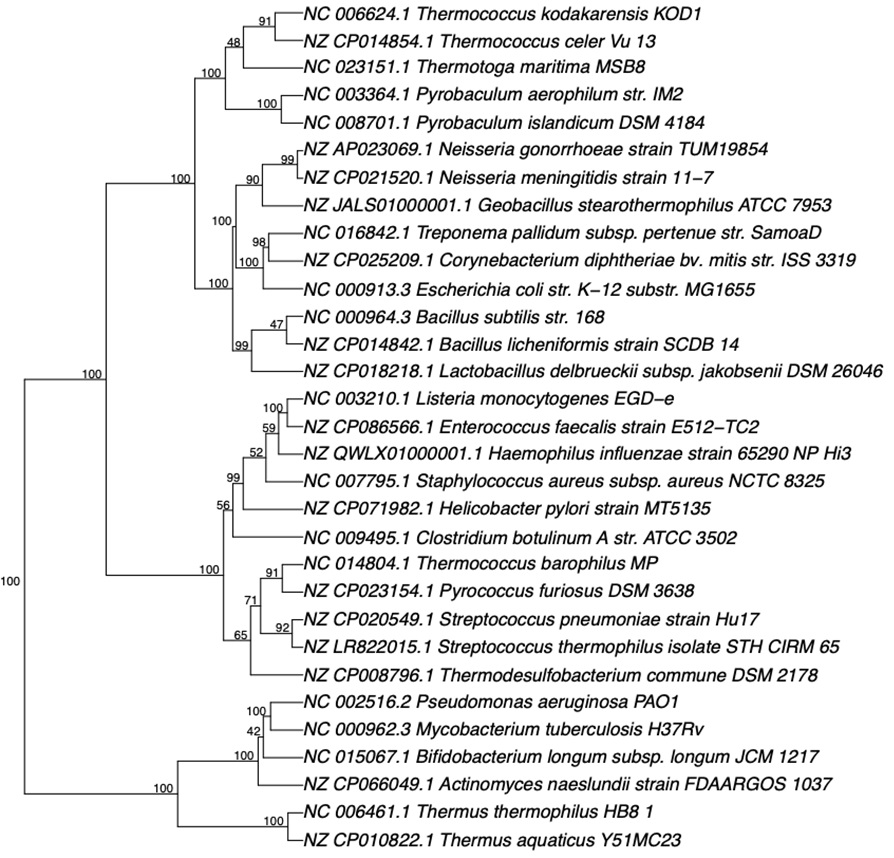
但结论与上面一致。这个方法无法准确地反映远亲物种之间的亲缘关系。
基于五核苷酸频率分析的系统发育分析是一个具有潜力的微生物系统发育分析的方法。该方法对于近亲物种表现良好,对于远亲物种,能力还不够。
研究人员将该方法制作成了Phy5的R包,工具小巧,运行速度也快,可在这里获得:
也可以访问在线版本:
参考文献:
Nakano Y, Domon Y, Yamagishi K. Phylogenetic trees of closely related bacterial species and subspecies based on frequencies of short nucleotide sequences. PLoS One. 2023 Apr 20;18(4):e0268847. doi: 10.1371/journal.pone.0268847. PMID: 37079522; PMCID: PMC10118083.
谷禾健康
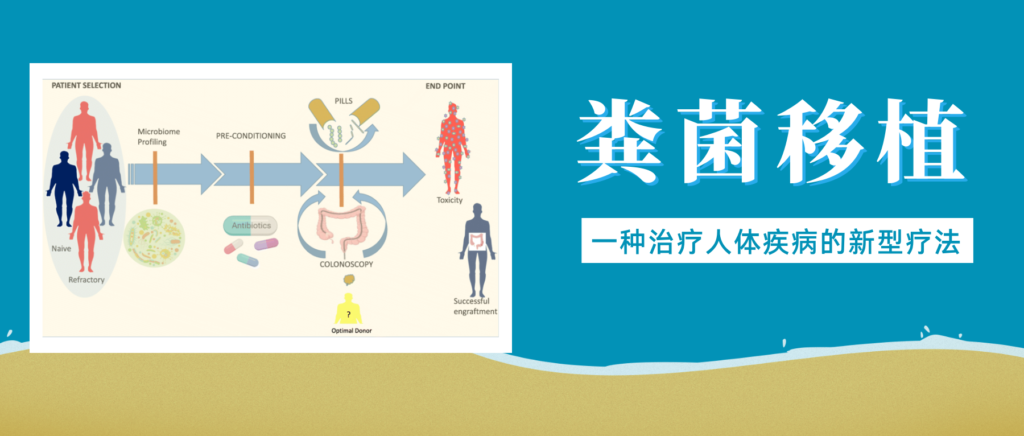
粪菌移植是一项近年来备受关注的医疗技术,它涉及将健康捐赠者的粪便物质转移至患有疾病或障碍患者的胃肠道。

简单来说就是选择健康合适的人粪便,通过科学方法提取出有用的微生物,去除有害与无用的部分,然后制成制剂,给病人口服或者直接注入肠道,目的是恢复健康的肠道微生物群并改善整体健康状况。
粪菌移植的历史悠久
粪菌移植在传统中医中已有数百年的应用,粪菌移植的第一个记录可以追溯到四世纪的中国,当时人类粪便被称为黄汤,用于治疗严重腹泻的患者。
15到16世纪的中国明朝,有关于将新鲜或发酵的粪便悬浮液用于治疗腹泻、便秘和腹痛等胃肠道疾病的记载。
但直到20世纪50年代晚期,它才首次用于现代医学,以治疗由抗生素耐药菌引起的严重腹泻。
在20世纪80年代和90年代,粪菌移植主要用于治疗反复发作的艰难梭菌感染。然而,随着肠道微生物群的发现及其在健康和疾病中的作用,粪菌移植开始被探索作为治疗其他疾病的潜在方法,包括炎症性肠病、肠易激综合征甚至神经系统疾病等。

粪菌移植在未来拥有巨大前景
近年来,粪菌移植受到医学界和公众越来越多的关注,许多临床试验和研究正在进行,以评估其疗效和安全性。
粪菌移植的疗效已经在多种肠道疾病中得到证实,如艰难梭菌感染、肠炎、炎症性肠病等。粪菌移植的出现,为肠道微生物失调带来了新的治疗思路和方法,也为人类健康提供了新的希望。
随着我们对肠道微生物群研究的不断发展,粪菌移植很可能成为治疗其他疾病越来越重要的工具。谷禾在本文中将为大家介绍粪菌移植。
粪便微生物群移植 (粪菌移植) 是一种医疗程序,涉及将粪便从健康供体转移到受体的胃肠道中。已发现粪菌移植可有效治疗各种胃肠道疾病,包括艰难梭菌感染、炎症性肠病和肠易激综合征。
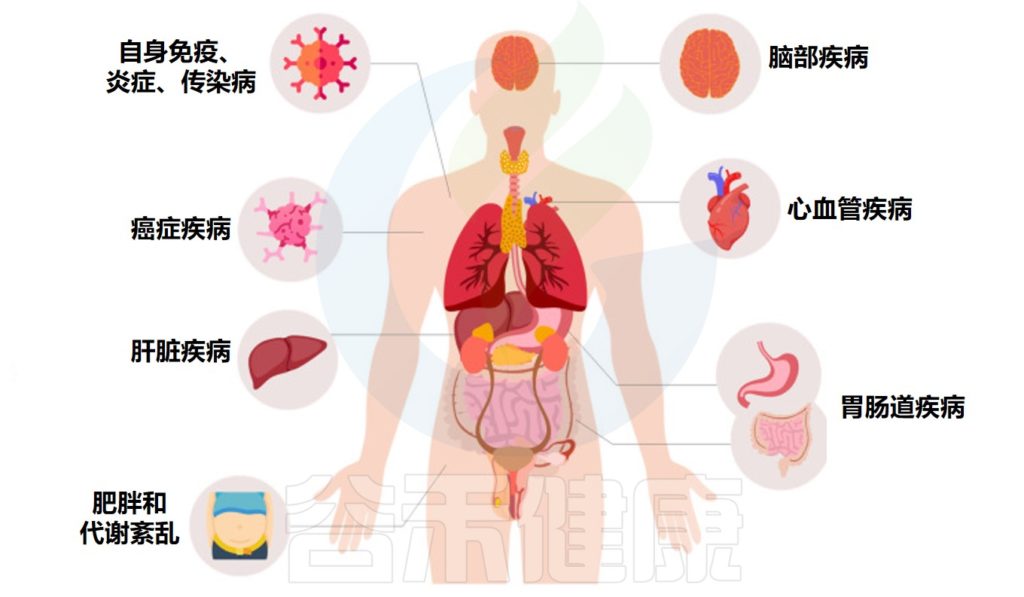
来自大量临床试验的数据表明,粪菌移植也可能对许多其他疾病具有治疗潜力,从胃肠道到肝脏疾病,神经系统疾病、自身免疫性疾病、皮肤疾病、心血管疾病、脑部疾病、肥胖和代谢综合征。
根据这些相关研究,谷禾带大家了解粪菌移植在治疗人体疾病中的作用。
人类疾病中的粪菌移植
Biazzo M,et al.J Clin Med.2022
▼
粪菌移植主要用于治疗反复发作的艰难梭菌感染(CDI),这是一种细菌感染,会引起严重的腹泻和结肠炎症。
√粪菌移植对治疗艰难梭菌感染特别有效
研究表明,粪菌移植在治疗复发性艰难梭菌感染方面特别有效,已发现粪菌移植在治疗艰难梭菌感染方面的成功率超过90%,而且几乎没有副作用。
▼
粪菌移植已被证明是治疗多种胃肠道疾病的有效方法,包括炎症性肠病(IBD)、肠易激综合征(IBS)。
炎症性肠病是一种复杂的炎症和慢性疾病,其特征是免疫失调,最终导致消化道免疫介导的损伤,包括溃疡性结肠炎(UC)和克罗恩病(CD)。肠道微生物群失调被认为是炎症性肠病发展中的关键调节事件,因此粪菌移植代表了一种可能的治疗策略。
√缓解溃疡性结肠炎患者症状
最近一项随机对照试验的荟萃分析发现,粪菌移植可有效诱导溃疡性结肠炎患者症状缓解,缓解率为36%,而对照组仅为9%。对核糖体 16S RNA 的分析表明,粪菌移植后微生物多样性增加并持续存在。
对活动期溃疡性结肠炎的儿科患者(4至17岁)进行了随机临床试验。粪菌移植组中92%的患者在第6周实现了小儿溃疡性结肠炎活动指数的改善(与安慰剂组的50%相比)。
√短期内改善了克罗恩病患者症状
评估了25名患有腹腔内炎症性肿块的克罗恩病患者使用多种新鲜粪菌移植(初始粪菌移植随后每三个月重复粪菌移植)的疗效和安全性。
超过一半的患者在第一次粪菌移植后三个月表现出临床反应的缓解,这一比例在12个月和18个月时有所下降。
注:这表明尽管粪菌移植在短期内缓解了临床症状,但未能产生持久的临床效果。
√对肠易激综合征有积极影响
六项不同的临床试验发现粪菌移植对肠易激综合征症状有积极影响:
(1) 在一项只有10名患者入组的小型临床试验中,在粪菌移植后4周,6 名患者有所改善;有趣的是,作者发现报告改善的患者接受了来自双歧杆菌含量高于无效供体的粪菌移植,这表明富含双歧杆菌的粪便供体可能是粪菌移植成功的预测因素。
(2)观察到65%的患者在通过结肠镜检查接受粪菌移植治疗三个月后症状缓解以及粪菌移植之后微生物特征向供体特征的转变,包括增加的α和β多样性。
(3)报告了腹泻型肠易激综合征患者的症状和生活质量的改善,这些患者通过胃镜接受新鲜粪便,并且(在连续分析中)增加了短链脂肪酸。
(4)报告显示,在接受来自健康供体(同种异体移植)或来自他们自己(自体移植)的粪便材料的患者中,肠易激综合征症状出现短暂改善;接受同种异体移植的患者抑郁评分有所下降。
(5)使用仅从一名健康、特征良好的供体获得的粪便样本通过胃镜粪菌移植治疗肠易激综合征患者,发现了疲劳和生活质量的改善以及细菌微生物群概况的变化、粪便短链脂肪酸的变化。
(6)在最近的一项临床试验中,招募了难治性肠易激综合征患者,主要是腹胀,并通过鼻空肠给药接受一次粪菌移植治疗;粪菌移植一年后,56%的患者报告肠易激综合征症状和生活质量有所改善。
▼
复发性肝性脑病是肝硬化的并发症(与饮酒无关),由肝功能衰竭和肠-肝-脑轴受损引起,可导致意识障碍和昏迷 。
√粪菌移植改善肝性脑病患者认知和微生态失调
粪菌移植最近被研究为一种可能的新治疗工具。第一项试验描述,通过灌肠递送的单一粪菌移植在短期内减少了肝性脑病患者的住院时间,改善了他们的认知和微生态失调。
粪菌移植治疗后一年内,与对照组相比,降低了住院率并改善了认知功能。
√粪菌移植展现出肝病的治疗潜力
广泛的研究支持粪菌移植作为一种控制肝病的疗法。粪菌移植改善了高脂肪饮食引起的肝损伤和脂质代谢,同时增加了小鼠肠道微生物群的多样性。来自对酒精性肝病有抵抗力的供体小鼠的粪菌移植可以预防酒精性肝损伤。
此外,粪菌移植已经用于慢性肝病患者。最近一项针对严重酒精性肝炎患者的初步研究表明,粪菌移植与存活率提高和腹水消退有关。
▼
多项研究探索了粪菌移植在治疗神经系统疾病方面的潜在益处,例如帕金森病、多发性硬化症和自闭症谱系障碍。
√改善帕金森病患者症状
发表在《神经病学》杂志上的一项研究发现,粪菌移植改善了帕金森病患者的症状,如便秘和睡眠障碍。
在帕金森病小鼠模型中,来自正常小鼠的粪菌移植可以减少黑质的病理特征并减轻身体损伤。
√改善多发性硬化症患者症状
发表在《神经炎症杂志》上的另一项研究发现,粪菌移植改善了多发性硬化症患者的症状,例如疲劳和抑郁。
√影响抑郁症、阿尔兹海默症状态
此外,来自重度抑郁症患者的粪菌移植在正常小鼠中诱导了抑郁症的行为/生理特征。
最后,在阿尔茨海默病小鼠模型中,源自正常对照小鼠的粪菌移植改善了认知功能。
▼
除神经系统疾病外,粪菌移植在治疗其他非胃肠道疾病(如肥胖、糖尿病和代谢综合征)方面也显示出前景。
√改善代谢综合征患者胰岛素敏感性
几项临床试验研究了粪菌移植对代谢综合征患者的的影响,显示出改善:报告说,患有代谢综合征的男性参与者接受了来自健康人群的肠道微生物群输注六周后胰岛素敏感性增加。
研究人员概括了关于胰岛素抵抗增加的发现,并补充说它取决于粪菌移植后肠道微生物群的变化。
最后,与移植正常供体粪便的受试者相比,使用代谢综合征供体粪便移植肥胖和胰岛素抵抗的男性受试者时,胰岛素敏感性降低,从而显示代谢综合征中胰岛素敏感性和微生物群之间的因果关系。
发表在《胃肠病学》杂志上的一项研究也发现,粪菌移植改善了代谢综合征患者的胰岛素敏感性。
注:代谢综合征是糖尿病的前兆。
除了这些已经确定的应用,粪菌移植还有一些新兴的用途。例如,粪菌移植被探索作为治疗肥胖和2型糖尿病的潜在方法。
▼
在过去的几年中,肠道微生物群在致癌过程中的作用已得到越来越多的认可。肠道微生物失调和个别细菌可以通过激活致瘤途径、诱发炎症和破坏宿主DNA来诱发癌症或影响癌症进程。
细菌影响癌症的具体机制
几种细菌拥有或产生促进β-连环蛋白与E-钙粘蛋白分离的蛋白质,激活参与癌发生的β-连环蛋白信号通路。
肠道生态失调导致细菌衍生的短链脂肪酸的产生减少。肠道生态失调通过Toll 样受体 (TLR) 的微生物相关分子模式发挥促炎作用,增加细胞产生促炎因子,从而增加致癌作用。
除了诱发炎症外,许多细菌还能够通过释放特定代谢物来破坏DNA,从而促进癌症进展。
β-连环蛋白(β-catenin)是一种细胞骨架蛋白,主要位于细胞膜,在乳腺上皮中,β-catenin游离量较少,通过介导与E-cadherin的相互作用,将细胞外黏附因子与细胞质内细胞骨架相互连接,以保持质膜的完整性,并参与细胞的黏附、迁徙与转移等过程。
β-catenin异常表达时脱离细胞间连接进入细胞质或细胞核,将失去介导细胞间链接、黏附的功能,并引起某些癌基因的表达,导致细胞癌变、转移。
β-catenin还是介导Wnt信号传导的关键分子,其在细胞核中决定着Wnt信号通路的开放或关闭,通过调节基因表达过程,在乳腺发育以及肿瘤发生的调控中起到了重要的作用。
细胞膜中β-catenin的丢失以及细胞质、细胞核中β-catenin的高表达都可以经过不同的调节途径独立发生,诱导乳腺癌的发生,并影响乳腺癌的预后。
E-钙粘蛋白(E-cadherin)是钙黏蛋白家族成员,在上皮细胞中连接细胞骨架与细胞外环境,参与细胞信号传导。在正常乳腺组织中,E-cadherin在肌上皮中呈颗粒状膜阳性,在腺上皮细胞中呈细胞膜强阳性,是区分DCIS和小叶原位癌的标志物;E-cadherin几乎在所有的DCIS细胞上呈线状膜染色,而小叶原位癌的细胞膜大多不表达E-cadherin。
令人惊讶的是,特定的微生物群物种具有调节癌症治疗的功效,显著影响癌症患者的临床预后。
√粪菌移植有助于治疗黑色素瘤
黑色素瘤是一种皮肤癌,涉及产生黑色素的黑色素细胞。最近,新工具利用免疫检查点抑制剂来增强患者对肿瘤的免疫反应(这种治疗方法称为“癌症免疫疗法”),并且有趣地发现肠道微生物组调节这种反应。
注:谷禾前面的文章中也有讲过癌症免疫疗法。
在两个具有不同肠道微生物组成的小鼠中,黑色素瘤的生长及其对抗程序性死亡配体1(PD-L1)免疫疗法的反应显著不同。
如果将来自对抗PD-1治疗有积极反应的黑色素瘤患者的粪便样本移植到无菌小鼠体内,则PD-1阻断的抗肿瘤作用会得到改善。
粪菌移植似乎有望通过转移有利的肠道微生物群来增强黑色素瘤患者的抗肿瘤免疫力。
通过粪便微生物群移植治疗癌症
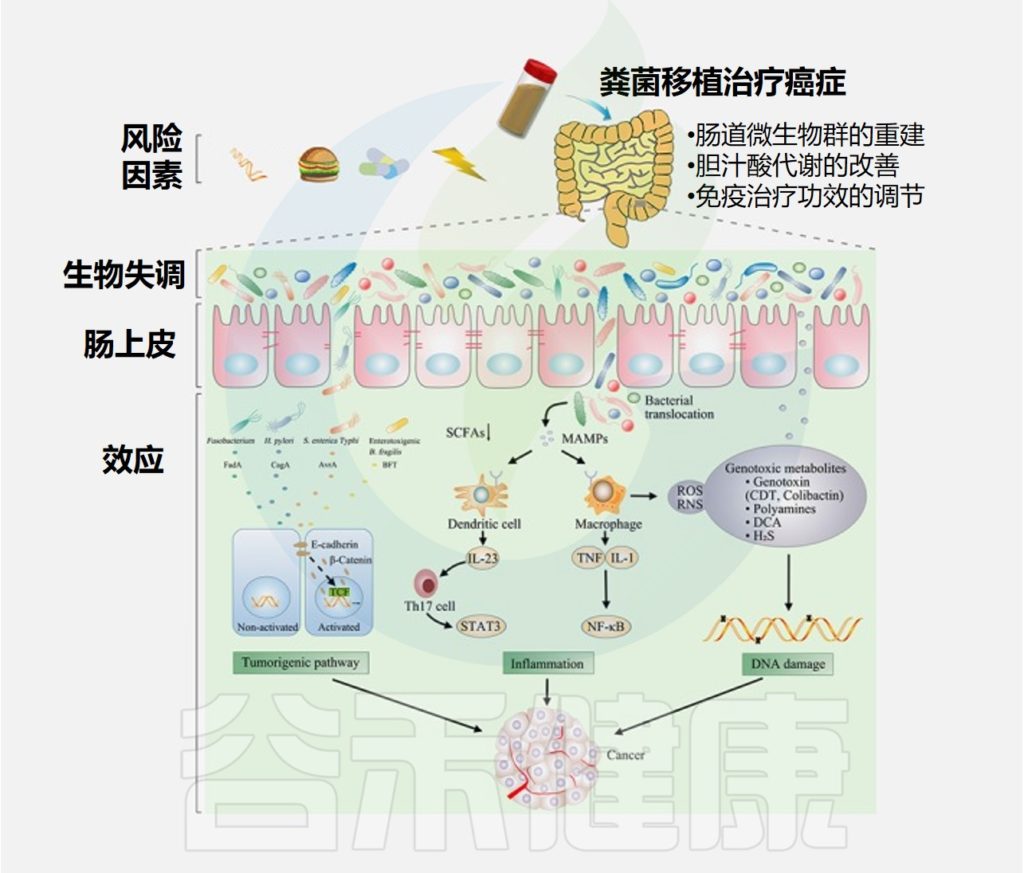
Chen D,et al.Int J Cancer.2019
▼
根据最近的研究,粪菌移植可能是治疗各种皮肤病症(包括湿疹和牛皮癣)的潜在治疗选择。人体肠道微生物群在免疫调节中起着至关重要的作用,肠道微生物群的改变与各种皮肤病有关。
一些案例报告了湿疹和牛皮癣患者经粪菌移植后成功治疗。
√改善了牛皮癣患者的严重程度
在研究皮肤病学杂志上发表的一项研究中,研究人员发现粪菌移植改善了四分之三的牛皮癣患者的严重程度。
√湿疹症状有了显著改善
此外,发表在美国皮肤病学会杂志上的一项研究报告说,粪菌移植使三分之二的患者的湿疹症状有了显著改善。
总之,粪菌移植显示出作为治疗湿疹等皮肤病的巨大潜力。同样重要的是要注意粪菌移植具有潜在的风险,包括感染和不良反应。
需要更多的研究来确定粪菌移植治疗皮肤病的最佳频率和剂量。因此,在考虑将其作为皮肤病的治疗选择之前,必须彻底评估粪菌移植的潜在益处和风险。
▼
关于微生物群和粪菌移植干预在心血管疾病中的作用,只有有限的证据可用,而且大多是在动物模型中获得的。
√菌群影响房颤的易感性
最近提出了老年人肠道菌群失调在房颤发病机制中的因果作用。研究表明,将患有心房颤动的老年大鼠粪菌移植移植到年轻大鼠体内会导致更高水平的脂多糖和更高的疾病易感性。
√菌群移植改善了心肌损伤
仍然在动物模型中,实验性自身免疫性心肌炎(EAM)小鼠模型中对照小鼠的粪菌移植增加了微生物的丰富度,包括厚壁菌门/拟杆菌门的比例增加,并且由于炎症减轻而改善了心肌损伤。
尽管科学文献中很少有证据表明粪菌移植策略在心血管疾病中有治疗价值,但在动物模型和人类中获得的这些数据肯定会为进一步研究提供坚实的基础。
本章小结
未来,粪菌移植也可能用于治疗自身免疫性疾病,如类风湿性关节炎和红斑狼疮,以及精神健康状况,如抑郁症和焦虑症。
值得注意的是,这些新兴应用仍处于研究的早期阶段,需要进一步的研究来确定它们的疗效和安全性。
总的来说,目前粪菌移植主要用于治疗反复发作的艰难梭菌感染和一部分胃肠道疾病,但它在治疗其他疾病和障碍方面具有巨大的潜力,正在进行研究探索其在各个医学领域的潜在应用。
▼
移植所需的粪菌来自经过严格筛查的供体,供体捐赠样本后,用一套全自动化的机器进行分离,经过注水、搅拌、过滤、离心、沉淀等步骤,得到纯化的细菌。
粪便菌群移植过程示意图
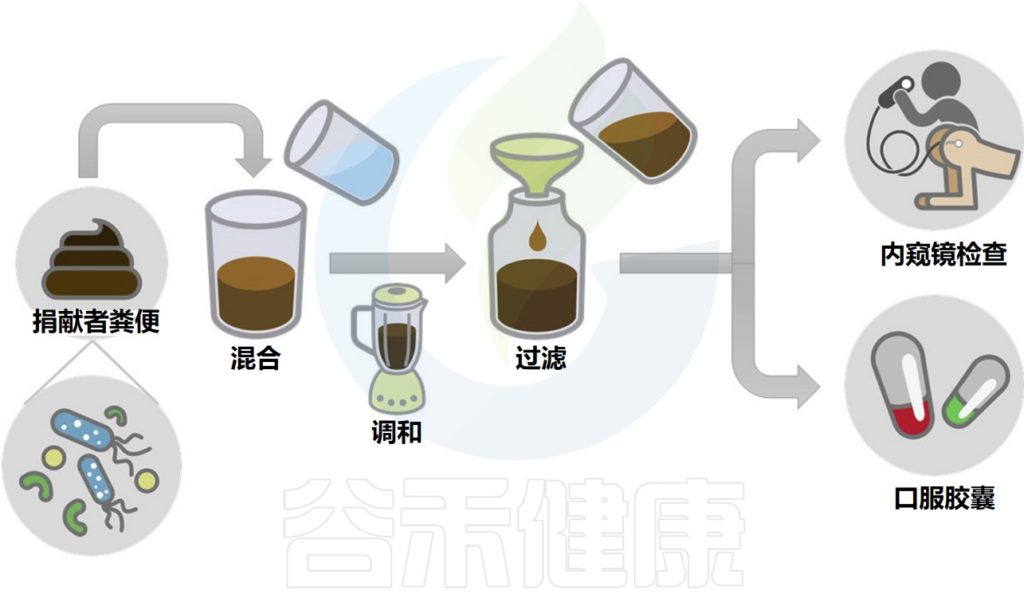
Wang JW,et al.J Formos Med Assoc.2019
其中单单过滤的步骤就要重复数次,每一道过滤用的滤网孔径都比前一道滤网的孔径更小,最后一道滤网的孔径只有0.07毫米,基本上可以把所有的杂质去除,只剩下细菌这些微生物。
分离出来的粪菌再用生理盐水制成混悬液供移植使用。
▼
“移植”过程不是简单粗暴的将一个人的粪便直接注入患者的肠道,主要是将健康供体的粪便离心纯化,获得功能菌,然后通过上消化道、中消化道和下消化道转移至受体肠道。从而重建稳定的肠道微生态环境,缓解相关症状,治疗疾病。
★ 粪菌移植的途径与治疗目的有相关性
例如,想要治疗溃疡性结肠炎可以采取经结肠镜灌肠。要治疗慢性乙型肝炎,则是经上消化道,可以采取:经麻醉胃镜、普通胃镜、经鼻饲管,或者用粪菌胶囊,经典方式是通过麻醉胃镜。
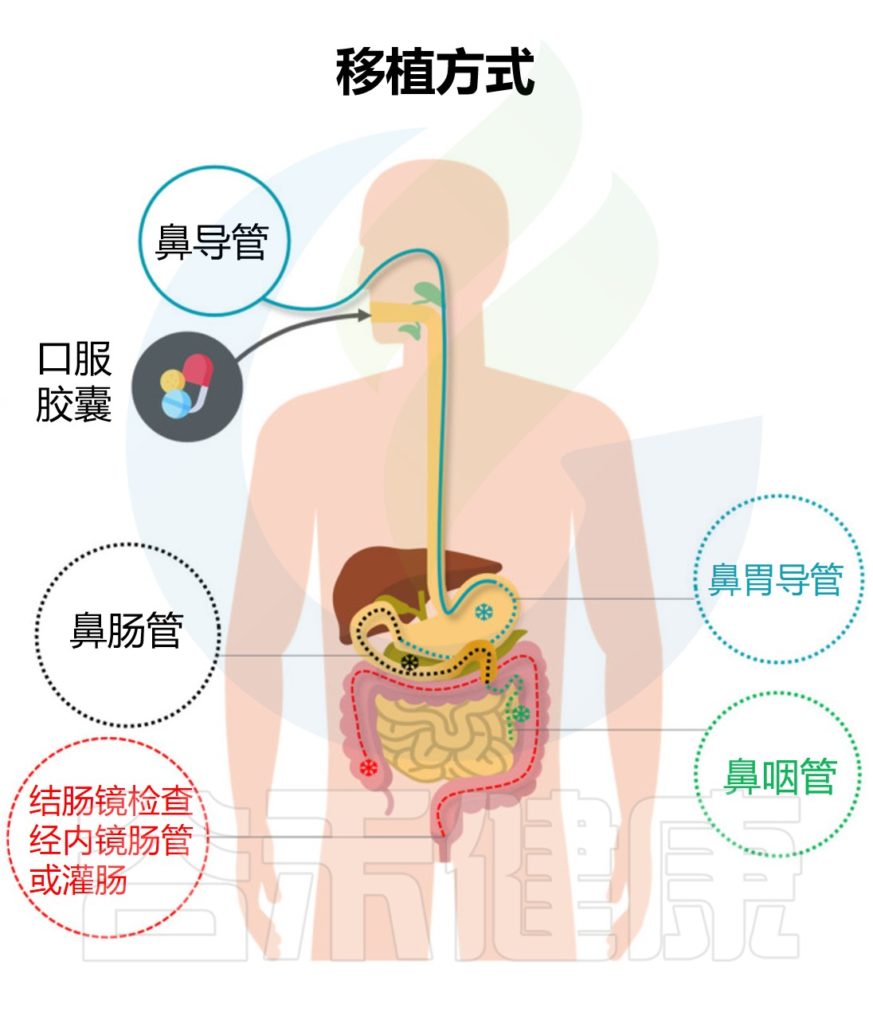
粪便微生物群移植的方法
Biazzo M,et al.J Clin Med.2022
不同的粪菌移植方式具有各自的优缺点,下面谷禾具体来讲述经不同部位消化道进行粪菌移植的特点。
▸ 上消化道
操作简单,总体风险较低
上消化道途径中,口服给药和鼻胃管应用广泛,操作简单,总体风险较低。但在此过程中,可能会因菌液反流或吸出而导致窒息,如果机体本身存在梗阻,则移植的菌液可能无法准确到达肠道。
其中,口服途径主要指包封粪菌材料,通过将提取的粪菌与冷冻保护剂(主要是甘油)混合制备,然后进行多重包装以保护粪菌移植材料免受胃肠道环境的影响。同时,操作人员可以根据预期的释放位置进一步选择胶囊壳的材料。目前,市售的胶囊壳通常针对胃或结肠的释放,并被配制以确保细菌的存活率和定植。
降低潜在疾病传播的概率
此外,在制作胶囊的过程中,也可以去除无症状供体中可能存在的真菌、寄生虫、病毒和部分炎症介质,以降低潜在的疾病传播概率。
总的来说,通过上消化道途径的粪菌移植具有无需昂贵器械、重复使用对患者损伤小、患者耐受性好等优点。该途径适用于不能耐受鼻肠管和胃镜移植的患者,以及需要口服定制菌的患者。
▸ 中消化道
减少移植时的细菌位移
中消化道途径主要是指鼻肠移植和经内镜肠道植管术,能够实现全肠道给药。其中鼻肠管通过导丝拉伸拉直,在胃肠蠕动正常的情况下自动通过幽门,进一步减少粪菌移植时的细菌移位。
在一项随机对照试验中报道,通过鼻肠管的粪菌移植优于单独使用万古霉素治疗艰难梭菌感染,但粪菌移植组患者也出现了腹泻、痉挛和便秘等不良事件。
什么是经内镜肠道植管术?
经内镜肠道植管术(TET)具体指的是在内镜下辅助植入固定管并固定在肠道深处,同时外端沿肠道与外部相通。TET主要包括结肠途径介导的TET和中胃肠道途径介导TET。
结肠通路介导的TET需要应用结肠镜检查,并且使用这种途径进行重复粪菌移植是昂贵的。相比之下,中胃肠道途径介导的TET更方便,更容易维持。
由于中胃肠道介导的TET不需要在内镜手术后通过X射线或其他医疗仪器进一步确认肠道位置,对于无法进行结肠镜检查肠道准备的患者,或需要重复粪菌移植的患者,中胃肠道中介导的经内镜肠道植管术也是主要选择。
▸下消化道
下消化道通路主要指灌肠、结肠镜检查、结肠通路介导的经内镜肠道植管术等操作。
灌肠侵入性较小且相对简单
其中,灌肠是一种侵入性较小且相对简单的操作。灌肠法患者耐受性好,不需要昂贵的器械,有效降低了手术风险。但这种方法需要将输注的粪悬液保留较长时间,患者保持仰卧位以减少粪便排泄,同时反复灌肠易于被患者接受。
注意:粪菌移植的细菌是否可以通过灌肠的方式保留在肠段的命题尚不明确,而且这种方式也伴随着无法到达结肠和脾曲的风险,需要多次灌注才能获得疗效和更长的手术时间,以弥补肠道菌群保留率低的缺陷。同时,由于细菌液的滞留,这种方法可能不适用于肛门括约肌松弛或尿失禁的患者。
此外,在结肠镜检查和结肠通路介导的经内镜肠道植管术方面,它具有多种优势,主要包括:
(1)能够完整显示结肠和活检可疑组织的情况,有利于疾病的诊断、识别和分期;
(2) 允许操作人员直接评估肠道炎症,并在适当的部位注入足量的供体粪便细菌;
(3) 可将肠道菌群准确移植到受影响的肠段,并进一步将细菌保留在目标肠段;
(4)可以准确地输入足量的供体粪便菌,可以在一定程度上提高治疗效率。
然而,这些手术也伴随着部分不良事件,包括加重肠道反应。
粪菌移植的主要操作方式及优缺点


Zhang YW,et al.J Bone Miner Metab.2022
▼
粪菌移植的安全性主要与两方面因素有关,即供体的生物安全性、移植的操作安全性。
•供体的生物安全性
供体不仅要筛查排除乙肝、丙肝、梅毒、艾滋病、这些已知传染病,还要排除寄生虫、条件致病菌感染,甚至连饮食习惯、排便习惯、情绪状态、肿瘤家族史都要进行调查,不符合要求的都要排除。
供体的筛查可以说是“百里挑一”,要成为一个合格的供体是非常困难的。所有这些筛查工作都是为了保证供体的生物安全性。
•移植的操作安全性
移植的操作安全性主要与移植的方式有关。经胃镜、结肠镜的移植操作风险与常规胃镜、结肠镜检查的风险基本一致。
注:在后面的章节我们会详细讲述粪菌移植操作的具体要求。

为了评估粪菌移植的安全性,上海同济粪菌移植工作组主任等研究人员对8547名采用过粪菌移植的患者进行跟踪研究,得出以下结论:
1、回顾性分析数据表明,粪菌移植的短期和长期(从2周到5年)安全性都是比较好的,患者不要担心;
2、短期不良事件与粪菌移植给药方法有关,多为轻中度、较短暂,包括恶心、呕吐、腹泻等,只有42名(0.5%左右,很低比例)患者发生胃肠症状恶化;
3、长期随访期间的新发疾病主要是胃肠道和呼吸道疾病,发病率与一般人群无异;
4、 随访期间无粪菌移植相关感染传播事件,11例死亡与粪菌移植无关;
5、通过规范适应症和给药时机后,短期安全性和患者满意度升高。
所以,粪菌移植还是比较安全的。
粪菌移植已被证明是治疗多种胃肠道疾病的有效方法,然而,粪菌移植的潜在长期影响以及粪菌移植的最佳频率和剂量仍未得到很好的了解。
本章节旨在回顾有关粪菌移植潜在长期影响的现有文献,并为未来的研究和临床实践提供建议。
▼
虽然粪菌移植已被证明在短期内有效,但对粪菌移植长期影响的研究有限,粪菌移植对肠道微生物组和整体健康的长期影响仍不清楚。
✦可能导致抗生素抗性基因的转移
粪菌移植是一种医疗程序,它将健康捐赠者粪便中的微生物移植到受体的肠道中,以恢复或改善肠道微生物平衡。虽然粪菌移植已被证明在治疗某些疾病方面非常有效,但它的使用也存在一定争议。
一些研究表明,粪菌移植可能会产生意想不到的后果,例如抗生素抗性基因的转移或致病菌的引入。
✦病毒或其他感染因子可能通过粪菌移植传播
此外,人们还担心病毒或其他感染因子可能通过粪菌移植传播。需要更多的研究来充分了解粪菌移植的长期影响,并制定安全有效地使用该程序的指南。
▼
✦粪菌移植的监管
粪菌移植的监管因国家而异,一些国家如美国对其使用采取更为严格的方法。在美国,粪菌移植被美国食品药品监督管理局作为生物制品进行监管,只批准用于治疗未对其他治疗方法产生反应的复发性艰难梭菌感染。
在欧洲,粪菌移植通常被视为医疗程序,并由国家卫生部门进行监管。
✦粪菌移植的伦理问题
粪菌移植的伦理考虑包括知情同意、捐赠者选择以及对捐赠者和受体的潜在风险。捐赠者必须接受广泛的筛查,以确保他们健康且没有传染病,并且必须同意他们的粪便用于粪菌移植。
受体也必须提供知情同意,并且必须完全了解该程序的潜在风险和好处。粪菌移植的主要争议之一是该程序缺乏标准化。目前没有粪菌移植的标准化方案,粪便成分在捐赠者之间可能会有很大的差异。
▼
✦粪菌移植的剂量会影响其疗效
目前,粪菌移植的最佳频率和剂量仍不确定。一些研究表明,粪菌移植的剂量可能会影响其疗效,但目前还没有确定最佳剂量的标准。
✦一般需要多次粪菌移植
关于粪菌移植的频次,目前尚无明确的建议。一些研究表明,单次粪菌移植可能无法完全恢复肠道微生物群的平衡,需要多次粪菌移植才能达到最佳疗效。
单次粪菌移植可以有效治疗某些疾病,如复发性艰难梭菌感染。然而,对于其他疾病,可能需要多次粪菌移植才能获得最佳效果。
但是,多次粪菌移植也可能增加感染和其他不良反应的风险。因此,粪菌移植的频次应根据患者的具体情况和病情进行个体化的决策。
总之,粪菌移植的最佳频次和剂量应根据患者的具体情况和病情进行个体化的决策,同时应注意监测和预防不良反应的发生。
需要更多的研究来确定粪菌移植的最佳频率和剂量,以便在临床实践中更好地使用该程序。
根据《上海市菌群移植技术管理规范(2021年版)》,以下是部分粪菌移植操作要求:
▼
(一)严格遵守粪菌移植治疗操作规范和诊疗指南,严格掌握粪菌移植治疗适应证和禁忌证。
▷粪菌移植适用于治疗以下消化系统疾病
(1)艰难梭状芽胞杆菌感染:复发性/难治性艰难梭状芽胞杆菌感染。
(2)其他消化系统疾病:溃疡性结肠炎、克罗恩病、功能性便秘、肠易激综合征、菌群紊乱相关腹泻等。
▷粪菌移植治疗的其他疾病
(1)神经系统疾病:帕金森病、阿尔兹海默症、癫痫等。
(2)精神疾病:自闭症、情绪障碍、多动症、抽动症等。
(3)代谢相关疾病:代谢综合征、糖尿病等。
(4)肿瘤相关疾病:免疫治疗及放化疗所致肠炎等。
(二)除复发性/难治性艰难梭状芽胞杆菌感染外,出于其他治疗目的使用粪菌移植治疗均须以临床研究形式开展,并通过本机构伦理审查与备案。
(三)实施粪菌移植治疗前应当向患者及其家属告知治疗目的、风险、注意事项及可能发生的并发症等,并签署知情同意书。
(四)医疗机构应当建立完整的电子化临床数据库及严格的术后随访制度,在完成每例粪菌移植治疗后应当按照有关规定将治疗相关信息上报卫生健康行政部门。
▼
(1)有明确与肠道菌群紊乱有关的肠道内疾病,如肠功能障碍性疾病、肠道感染性疾病(复发性艰难梭菌感染)、肠道炎症性疾病及假性和麻痹性肠梗阻等;
(2)有明确与肠道疾病或者肠道菌群紊乱有关的肠道外疾病,如便秘合并帕金森病、便秘或腹泻合并自闭症、便秘或腹泻合并过敏性皮炎;
(3)患者需充分理解粪菌移植治疗过程及机制,并签署知情同意书。
!
出现以下情况之一不宜进行粪菌移植:
(1)肠道大面积溃疡、出血;
(2)移植通道梗阻;
(3)移植操作本身(内镜、置管、灌肠、经口饮食)的禁忌证;
(4)未通过伦理审核的临床试验或患者拒绝接受粪菌移植。
(5)生命体征(体温、心率、血压、呼吸)不稳定;
(6)严重免疫系统紊乱;
(7)孕妇或哺乳期妇女;
(8)代偿或者失代偿肝功能障碍。
▼
(1)个人情况:作息规律,饮食健康,家庭和睦,无不良性交,无吸烟、饮酒、吸毒等嗜好,无药物成瘾,近6个月未接种过疫苗或参加药物试验,近6个月未接受纹身或出现皮肤破损,近6个月无热带地区旅居史;无胃肠道病变家族史,无恶性肿瘤家族史,无传染病家族史;非孕期,非经期。
(2)开展病史和身体检查,评估供体的健康状况和是否符合粪菌移植的供体资格;选择无传染病史、无抗生素使用史、无消化系统疾病等方面的供体。
身体状态:年龄18-30周岁,体重指数(BMI)18.5-23.9 kg/m2,儿童医院开展粪菌移植,供体要求可放宽至15-30周岁。
心理状态:心理科医师或心理咨询师访谈认定心理状态良好;抑郁自评量表(SDS)、焦虑自评量表(SAS)、匹兹堡睡眠质量指数(PSQI)等评分正常。
(3)进行多项检测,如血液化验、粪便检测、病原菌检测、URTI检测等,确保找到适合的健康供体;以确保其不携带有害微生物和多重耐药菌。同时,需要考虑供体的肠道微生物组成和短链脂肪酸水平,以选择最适合的供体。
血液学检测:包括血常规、肝肾功能、电解质、C反应蛋白正常,肝炎病毒、HIV、梅毒、EB病毒、巨细胞病毒、COVID-19抗体、线虫、阿米巴等病原检测阴性;
粪便检测:粪便常规检查正常,隐血实验阴性,艰难梭菌、弯曲菌、沙门菌、志贺菌、产志贺毒素大肠杆菌及虫卵、小肠结肠耶尔森菌、致病性弧菌(副溶血弧菌、霍乱弧菌)、气单胞菌、阿米巴、孢子、诺如病毒、轮状病毒和新型冠状病毒(COVID-19)等病原学检测阴性。
(4)评估供体的肠道微生物组成,多样性和稳定性,包括菌群、真菌群和病毒群,并建立数据库;在选择供体时,除了肠道微生物群的总体多样性外,还应考虑到益生菌的丰富度,如乳酸菌、双歧杆菌等,选择粪便丁酸浓度高的供体微生物组。
(5)根据评估结果选择合适的供体,注意进行家族成员偏向,判别成熟度和完整性,同时避免与患者组群共同优势菌种重合等;一些研究表明,供体微生物组成与受体的微生物组成相似,可以提高移植成功率。
(6)移植前需对受体进行评估和准备,包括清洁肠道和停用抗生素等;为了提高移植效果,一些研究还使用抗生素预处理和肠道灌洗等方法来增强供体菌株的移植。
限食耐受性:通过限食实验完成。部分受体存在食物过敏及食物不耐受(如鸡蛋、牛奶等),根据受体要求,供体需在捐赠粪便前5天限制食物种类,如该供体不可耐受,则不可作为本次移植的捐赠者。
(7)进行移植后,对受体的微生物组成进行多次采样和分析,以评估移植效果和持续时间;
①每2个月复查以上条目,仍然符合上述要求;
②每次捐赠的粪便均留样行宏基因或者16s rDNA测序(根据各自单位检测能力),保证菌群组成及多样性稳定;
③每次捐献粪便应留样行代谢组学检测。
(8)监测受体的生理状况和不良反应,及时采取措施进行处理。
▼
(1)粪便采集:应采用无菌容器采集,粪便重量不少于100g,性状为Bristol评分标准中3-5分方为合格,立即进入菌液制作流程,或立即密封后2-8℃保存。
(2)制作流程:每次需取不少于50g粪便与无菌生理盐水以1∶3比例混合,充分搅拌混匀后过滤,从粪便排出体外至菌液制作完成应保证在2小时以内,整个处理过程应在无菌环境下操作。
注:为了避免感染窗口期的问题,菌液或胶囊制备后应待21 天后经过病毒细菌等检验合格后出库,每批产品留样至少6个月以供追溯。
(3)冻存与复融:菌液制备完成后置于-80℃保存,6个月之内使用不影响疗效;如置于-20℃保存,应在1-4周内使用。使用前置于室温复融,6小时内输注;如使用水浴锅复融,则水温不得超过37℃。
(4)质控标准:每次制作完成的菌液应随机抽样,进行致病菌监测、细胞计数及宏基因或16s rDNA菌群测序。
每50mL菌液中活细胞数应不小于2.5×10^12个,同供体同批次样本应达到菌群组成一致,6个月内同供体不同批次样本应达到菌群组成差异无统计学意义。
制作完成的菌液应有独立包装与标签。如制作胶囊,还应取胶囊内容物进行细菌活性监测与活细胞计数,其中细菌活性应不低于85%,每克内容物包含活菌数不小于10^9CFU。
▼
(1)菌液输注前需结合患者自身情况及疾病种类行肠道准备。
(2)应根据指南及操作规范选择上消化道或下消化道进行菌液输注。
(3)操作时应观察患者耐受情况,并及时处理不良反应。
▼
(1)管理原则:医疗安全(不良)事件的管理,遵循预防为主、紧急处理、合理控制、防微杜渐、持续改进的原则。
(2)上报要求:凡科室职工均有权上报医疗安全(不良)事件,可通过网络、书面、电话上报,上报时限要求在不良事件发生后24小时之内。
(3)审核、处置要求:科室负责人24小时内审核、处置科室发生的不良事件,并呈报至相关职能部门。
注意:主管职能部门自接报之日起,24小时内审核、处置不良事件;对于接报的Ⅱ级及以上不良事件,应呈报至主管院领导。
主管院领导对于接报的Ⅱ级及以上不良事件,必要时组织委员会进行讨论分析,并提交院务会。
▼
(1)每次菌液输注后密切观察患者耐受情况24小时,如有不良反应立刻处理并及时上报。
(2)1个疗程治疗结束后4周内应对患者症状学和肠道菌群改善情况进行评估,粪菌移植治疗疾病的随访及疗效判断指标主要遵循原发疾病的治疗指南。移植前后重复检测粪便及血液中传染病相关指标,有条件者可行免疫相关检测。
注意:如第1个疗程结束3周后病情无改善,可尝试更换供体,重新给予1个疗程粪菌移植,若有效可继续治疗,若仍无效则应视为粪菌移植无反应性,此时不应继续给予粪菌移植,以免耽误病情;如患者接受粪菌移植治疗后症状明显改善,可重复3-5次粪菌移植后结束治疗。
随访至末次粪菌移植结束后至少8周,有条件者应进行大于1年甚至5年以上的长期随访。
随着对微生物与宿主相互作用的了解不断加深,肠道微生物群的参与已成为一种新颖、巧妙且不可忽视的调节宿主健康的方式。
粪菌移植是一种治疗胃肠道疾病的有效方法,还有望治疗其他更多疾病。未来的研究应该重点关注粪菌移植对肠道微生物组和整体健康的长期影响,并制定安全有效地使用该程序的指南。
此外,需要进一步研究如何提高粪菌移植的改善效果,供体和受体的配型以及移植肠道菌群的定植和效果的长期性,以便在临床实践中更好地使用。
主要参考文献:
Zhang YW, Cao MM, Li YJ, Zhang RL, Wu MT, Yu Q, Rui YF. Fecal microbiota transplantation as a promising treatment option for osteoporosis. J Bone Miner Metab. 2022 Nov;40(6):874-889.
Biazzo M, Deidda G. Fecal Microbiota Transplantation as New Therapeutic Avenue for Human Diseases. J Clin Med. 2022 Jul 15;11(14):4119.
Quaranta G, Guarnaccia A, Fancello G, Agrillo C, Iannarelli F, Sanguinetti M, Masucci L. Fecal Microbiota Transplantation and Other Gut Microbiota Manipulation Strategies. Microorganisms. 2022 Dec 7;10(12):2424.
Vendrik KEW, Ooijevaar RE, de Jong PRC, Laman JD, van Oosten BW, van Hilten JJ, Ducarmon QR, Keller JJ, Kuijper EJ, Contarino MF. Fecal Microbiota Transplantation in Neurological Disorders. Front Cell Infect Microbiol. 2020 Mar 24;10:98.
Wang JW, Kuo CH, Kuo FC, Wang YK, Hsu WH, Yu FJ, Hu HM, Hsu PI, Wang JY, Wu DC. Fecal microbiota transplantation: Review and update. J Formos Med Assoc. 2019 Mar;118 Suppl 1:S23-S31.
Chen D, Wu J, Jin D, Wang B, Cao H. Fecal microbiota transplantation in cancer management: Current status and perspectives. Int J Cancer. 2019 Oct 15;145(8):2021-2031.
Stallmach A, Steube A, Stallhofer J, Grunert PC, Merkel U, Hartmann M. Fäkaler Mikrobiomtransfer – Indikationen, Risiken und Chancen [Fecal microbiota transplantation: indications, risks and opportunities]. Inn Med (Heidelb). 2022 Oct;63(10):1036-1042. German.

谷禾健康

如果你是一名科研人员,在研究的过程中需要用到代码,那么你可能不需要像专业码农那样从头到尾一句一句去写完整的,而是可以将网上的一段符合应用场景的现成代码拿过来直接用。
这听起来是不是很简单?然而实际上…
目前,虽然学术界有资源可以用来编写更好的代码,但很少关注使用他人的代码可能遇到的问题,比如:有时候看着别人的代码过于繁琐、晦涩难懂;又或者绕进去,反而忘了自己一开始要干什么;或者添油加醋最后一团乱麻;甚至即便是费了九牛二虎之力搞懂了,deadline却已经在眼前了…
学会使用他人的代码是现代学术生活的重要组成部分。
本文主要在将行业、现有文献和一些科研人员自己的经验结合起来,为学术研究人员提供相对实用的十条规则。
这10条规则可以分为计划、理解、更改和发布类别。
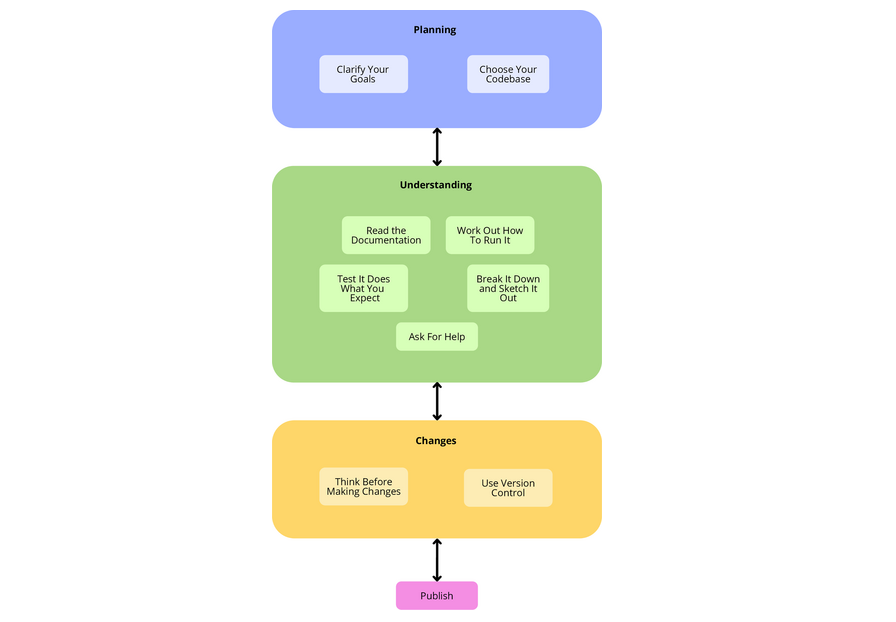
doi.org/10.1371/journal.pcbi.1011031.g002
下面我们就来详细看一下。
在正式开始动手写之前,先想一想,你真正想要实现的目标是什么?
是需要计算一些东西吗?
还是需要添加一些代码中当前不存在的功能?

不同的目标需要对应不同的方法。
如果需要计算,那么关键的要求是确信计算是正确的;而如果要添加某些功能,那么可能需要更多地理解代码。
试想一下,是不是每次都需要通过浏览整个代码库,理解每一行代码来实现呢?
明确目标会防止你做无用功,提升效率。这是一个有用的练习。
当你建立对代码的理解时,你的目标可能会改变,这会影响到你如何改变以及是否做出改变。
在学习或者写代码的过程中,要记住这个一开始就已明确的目标,一旦发现行动走偏的时候不断把自己拉回来,不断回到问题,从而以轻松高效的方式完成。
如果要使用别人写好的程序,你需要在网上搜索,选择一个合适的代码库。那么问题来了,所谓的“合适的代码库”怎么选呢?
几个要点:
当然,其他还可以考虑:
代码库的可访问性、代码的可读性。
也可以考虑选择其他熟悉的编程语言。
有时候别人的代码看不懂,自己的又跑不通,很容易把它全部扔掉,然后重新开始。
到底是否需要重新写一遍代码?
重新写一遍代码也是一种选择。
➪ 好处是可以让你更深入地理解代码的功能和运作方式,也就是说可以学到深度知识,这些知识在使用他人代码时很难挖掘到。
一位计算机科学博士说,他们更喜欢编写自己版本的算法来完全理解它们,一旦完成,他们就会使用现有的库。
➪ 主要缺点是复制已经完成的工作,这可能很耗时,也不必要。
当然,可以阅读现有的代码和文档,了解如何构建自己的版本。也可以使用旧代码来测试新代码,并检查是否正常。
同时也别忘了第一条,明确目标,从而确定是不是要重新写一遍。
►►
使用哪种代码库以及是否重新开始可能都是艰难的选择。重要的是,不要急于做决定,花时间了解别人的代码,再考虑该怎么做。
阅读文档有什么用?
文档,就像是代码的翻译官,可以帮你理解它们。虽然不需要像看小说一样读完整个文档,但是拿来当参考还是蛮重要的。刚开始接触他人的代码时,简单地浏览一下文档可以帮助你大概了解它们的结构。
文档里有哪些内容?
如果卡在了某个问题上,也可以去文档里找答案。文档通常会包含一些重要、难懂的部分,这些部分我们读了以后会更清楚。即使文档不太好或者太少,也应该去看一看。如果文档实在少得可怜,那么这说明代码可能不太靠谱,不是遵循最佳实践编写的。
文档不仅包括README文件或在线API,还包括代码注释、文档字符串、变量和函数名,以及任何写下来的测试。好的项目通常会有在线文档,里面可能包含“入门教程”,对你上手很有帮助。
如果文档不存在(或不正确),自己加文档
这不仅对你自己很有帮助,而且还能帮助未来其他使用代码的人。文档不一定要多么正式或完美,它就是你对代码的注释。在探索代码时,你可能会记录很多笔记,把它们保存成文档,过个几周或几个月后可以更容易回到代码中学习或修改。
如何加文档?
加文档可以简单地创建一个README文件,该文件通常从较高的层次解释功能,但也可能包括安装步骤或强调如何通过API调用特定函数。另外,你也可以在代码本身中添加或更改注释,解释特定部分是如何工作的。
一个很好的建议是:
想象你下一年回到这段代码时已经忘记了所有内容,这时候你添加文档就相当于在帮助未来的自己。
使用他人代码时的一个基本问题是首先得让它跑的通。这看起来很简单,但实际上却是非常困难的一步。
很多因素导致别人的代码不一定能跑通
不同的代码需要不同的操作系统、编程语言、数据库甚至是硬件,在一台计算机上跑通的代码在另一台计算机可能不行。如果环境不匹配,代码就无法正常运行。
对于旧代码来说,这尤其是个问题——《Nature》最近的一篇文章向研究人员提出了一个问题,即他们是否可以运行10年后的研究代码,发现了与过时的环境以及不完整的文档相关的问题。
通常,运行他人代码的主要问题是使用正确版本的编程语言和代码依赖关系。编程语言和单个软件包经常更新,有时这些更改是在考虑向后兼容性的情况下进行的,因此旧代码在新版本中仍然可以工作,但有时情况并非如此。
除了编程语言和依赖性之外,使用特定的操作系统、安装特定的数据库或图形卡、传感器等硬件,甚至需要软盘驱动器等。
发现跑不通的时候应该怎么办?
——看error提示
为了弄清楚如何运行代码,最好的第一步是简单地尝试在当前环境中按原样运行它。如果不行,计算机可能会发出一个error ,让你知道出了什么问题。
——查看文档
好的文档会清楚地说明预期的环境,包括所需的编程语言和软件包版本。不幸的是,并不是所有的文档都包括这些。
——使用互联网搜索
找出编写代码时软件的最新版本,并从那里往回推。
——创建虚拟环境来运行
当你确定代码需要运行的特定环境时,可以开始在计算机上复制该环境。如果不想更改计算机上的环境,我们可以创建一个虚拟环境来运行代码。虚拟环境允许使用特定版本的编程语言和程序包运行代码。
除此之外,虚拟机可以模拟整个计算机系统(例如,在Mac上运行虚拟Windows实例)。虚拟化有很多选项,最佳选项取决于当前的计算机和要虚拟化的系统。
——目前已有的配置虚拟环境工具
可能是其他人已经制定了运行代码的虚拟化设置。例如:
Conda和DockerHub都是社区驱动的平台,你也可以贡献自己的虚拟化设置来帮助他人(以及未来的自己)。
——利用调试工具深入挖掘代码
可能你遇到的问题不仅仅是寻找合适的环境。例如,可能不清楚需要什么样的输入。当代码的其他部分出现错误时,某些功能可能会正常工作。混淆这些问题,错误信息本身可能无法为问题提供很好的线索。在这些情况下,你可能需要更深入地挖掘代码的各个部分,并尝试弄清楚它是如何工作的。这可能很耗时,需要耐心和毅力。
调试工具可以在这里提供帮助,一步一步地跟踪代码的执行,并查看正在使用的资源和数据类型。当然,代码的某些部分是有可能被破坏的,可能需要进行更严格的测试或进行更改。
为什么要做测试?
一个警示故事:
2006年,Geoffrey Chang因软件bug撤回了《科学》杂志上的几篇引人注目的论文。在这些论文中,Chang使用了一些代码来计算蛋白质的结构。
不幸的是,这个从另一个实验室继承的代码包含了一个小错误,这意味着由此产生的蛋白质结构是不正确的。如果进行更好的软件测试,这个问题可能会更早发现。
当使用他人的代码时,测试是一个好方法,可以检查代码做了什么(或没做什么),并验证它是否真的有效。
运行现有的测试
通常,一个项目已经有了测试,找到并运行这些测试应该是起点。这些通常可以在一个叫“tests”或类似的文件夹中找到,理想情况下,文档将包括运行这些测试的说明。
运行测试你会进一步熟悉代码库,也是一种衡量他人代码质量的方法。你甚至可能会发现测试失败,在这种情况下,可以考虑进行更改来修复代码。
编写自己的测试
除了现有的测试之外,你可能还想编写自己的测试。一个好的起点是健全性检查,这可以检验代码是否给出了期待的正确答案。
注:健全性检查是一种数据完整性检查方法,用于确保数据的准确性和一致性,是数据管理的重要组成部分。
健全性检查是值得的,不过自动化测试更彻底。这可以简单到通过编写测试来检查函数的输出是否正确,从而自动进行健全性检查。
——单元测试
通常,这是通过使用“assert”语句来实现的,如果输出不是预期的,则该语句会引发错误。这是一种单元测试的形式,它检查软件的特定单元,在这种情况下是一个功能,是否按预期工作。大多数编程语言都包括单元测试功能或库,其中包括断言语句以及快速轻松地运行许多测试的方法。
——功能测试
另一种常见的测试类型是功能测试,可以检查整个软件是否符合期望。
例如,你可能打算从论文中复制一个图形,这将作为对用于生成图形分析的软件的一种测试。功能测试可以是一种很好的方法,可以检查代码是否做了它应该做的事情,而不必太了解代码是如何工作的。
对于单元测试和功能测试,需要一些数据来检查结果
代码库可能已经包括了一些演示数据,这是一个很好的起点,也是代码所需数据格式的一个好例子。你可能需要添加自己的测试数据,这些数据可能是真实数据,例如在复制图形的情况下。
或者可以模拟数据,例如,可以模拟具有已知参数的数据,以检查拟合算法是否给出合理的结果。
对于真实或模拟的数据集,你可能不知道“正确”的答案,因此在可能的情况下,通常使用另一种现有工具来验证结果。
►►
总的来说,需要的测试的深度和类型将取决于你的具体目标。在许多情况下,一些简单的健全性检查就足以验证代码是否按预期工作。当对代码的质量有疑问时,以及当代码的正确性能至关重要时,需要进行更严格的测试。
一种很好的策略:
将问题分解为较小的单元或模块,然后将这些单元放在一起解决复杂的问题。
同样的事情也适用于使用其他人的代码。拆解代码并弄清楚代码的每一部分做什么,这通常比一次完成要容易得多。
这种方法的具体操作之一是:
绘制代码是如何工作的以及各部分是如何交互的。
这不需要完美,可以简单地用纸笔或黑板快速绘制草图。你可能想可视化代码的结构、数据的传递方式、哪些函数调用其他函数等。只要把一些东西写在纸上就可以帮助可视化系统。
doi.org/10.1371/journal.pcbi.1011031.g002
根据项目和目标,你可能会决定通过使用可视化软件设计图形来正式化这些图纸。
可以将其包含在项目的编写中,也可以将其添加到代码库的文档中。对于那些感兴趣的人,你甚至可以使用统一建模语言,这是一种可视化软件系统的通用方法。
研究有时候也是需要合作努力。协作在处理代码时尤其有用,因为每个人在各种编程语言和范式中具有不同的知识和技能水平。利用现有知识是提高自己研究效率的一个很好的策略。
获得帮助的途径有很多:
➤ 谷歌(或其他搜索引擎)
可以依靠搜索引擎来帮助写代码,一项研究发现,开发人员花费了大约20%的时间搜索网络。当涉及到使用他人的代码时,包括项目名称在内的谷歌搜索可以显示在线资源,如代码库、教程、论坛等。谷歌是一个查找代码片段、简短解释和诊断错误的好资源。
-小tips:
一个好的搜索策略是:直接把错误消息复制粘贴到谷歌中。
➤ StackOverflow
StackOverflow是一个有用的资源,经常出现在谷歌搜索结果中。该在线门户允许用户询问和回答特定的编码问题。
一般来说,你的问题已经有人问过并回答过问题。如果你无法通过搜索找到解决方案,那么也可以自己问,基本上会很快得到答案。
也有可能你正在处理的代码库过于模糊,无法直接引用。就算这样,也可以发布代码块或提出更一般的问题并获得帮助。
其他有用的门户网站包括W3Schools和Quora,还有专门研究特定研究领域的论坛,如生物信息学的BioStars。
➤ github
许多项目都会在GitHub上托管代码,这是托管和共享代码库的行业和学术标准。
如果你对代码有问题,比如bug、建议的新功能,或者只是一个问题,那么你可以在GitHub Issues中提出这个问题,项目开发人员会回答或解决这个问题。这是最佳实践,也是许多开发人员提出问题的首选方式。
在提出问题之前,可以浏览你过去的问题,看看是否得到了解决。
➤ 其他项目门户网站
正在进行的软件项目通常有各种在线资源来获得帮助。这可能包括Slack、Gitter、Discord和论坛等平台。这些可以从GitHub页面链接,也可以通过谷歌搜索找到。
➤ 合作者
如果你有合作者,可以问他们。他们可能愿意提供帮助,甚至可能在过去使用过该代码。
➤ 其他研究人员
很有可能其他人以前也使用过该代码。你可以查看引用该软件或相关研究文章的论文。
如果代码托管在GitHub上,可以在存储库页面上检查问题,或者查看它是否已被分叉。或者在GitHub中搜索存储库名称并查找其他版本。
如果运气好的话,可能已经有人熟悉了这个代码库,他们可能会愿意为你提供资源,甚至成为你的合作伙伴。
➤ 原作者
值得与原作者联系,他们应该愿意回答特定的问题,甚至提供一些在网上找不到的文档,或者他们可能也想合作。你用他们的代码,他们也会高兴。如果你们合作起来,说不定他们会为你增加一些新功能或修复一些bug呢。
➤ 研究软件工程师
根据你所在的机构,你可能会获得研究软件工程师团队的帮助。这可以是一般性建议或支持的形式,也可以是他们愿意承担与代码库相关的项目并跟你合作。

当我们想要使用别人的代码时,总是想着要去写代码,改进代码。但是有没有想过:
我们真的需要去改变它吗?
其实,完成任务的最有效方法是:意识到你根本不需要去做它。当然,有时候改变是必要的,但在动手之前,先花点时间思考一下。

改变代码可能会带来很多意想不到的麻烦,特别是当你不太了解代码的运作方式或者理解不到位时,这种后果就更加可能发生。有些你看起来垃圾的代码可能是出于某种重要的原因而写成这样的。一旦你改变了代码,你就改变了代码的本质,不能确定它是按预期的,还是因为你的改变引起的。
关于修改代码,有本书叫《代码修改的艺术(Working Effectively with Legacy Code)》

改代码的目的不是要破坏原有功能,而是尽可能有效地完成改动。所以,我们需要明确改动的目的,只做必要的改动。
比如,你在修复bug时发现一个循环可以优化,但是要忍住不要掉入这种陷阱!这个循环的效率可能并不重要,每一次改动都可能引发严重问题。就像计算机科学家Donald Knuth说的,在大多数情况下,我们不应该过于关注代码的小细节,过早地优化是所有问题的根源。
改代码的最佳实践应该是什么样的?
在你做任何改动之前,最好先写一些单元测试,覆盖现有的功能,以及覆盖你想要添加的新功能。一旦做出改变,你可以运行这些测试来检查是否破坏了任何东西,更改是否生效。这个过程相对简单。
比如,如果你要重构一个特定的函数,你可以先写一些自动化测试,基于当前函数的输出(也就是特征测试)。改了代码后,你可以运行这些测试,确保重构没有改变功能。另外,记得把改过的地方记录在文档中,包括更改的内容,为什么要更改等。
版本控制是备份、共享、协作和跟踪代码的最佳方式。
很多人会通过电子邮件、共享文件夹来传输代码,或者根本不备份,如果你不经常使用版本控制,那么这条很重要。
当我们谈到版本控制时,通常会想到Git和GitHub。GitHub提供免费账户,其中包括无限的代码存储库,可以是私有的,也可以是公共的。
还有其他选择,比如BitBucket。如果代码(或数据)是敏感的,不能发送到GitHub的服务器上,那么还有像GitLab这样的选择,可以让你运行自己的私人的Git服务器。
学习使用Git难不难?有哪些资源推荐?
学习使用Git实际上入门很简单。你不需要成为专家,只要能够推动和拉动更改就足够了。在这里,我们不会重复介绍如何使用Git的指南,已经有很多现成的资源了。
对于初学者建议阅读PLOS文章《使用Git和GitHub进行版本控制的快速介绍》。
对于更感兴趣的人,Pro Git书籍是一个有用的资源,还有许多其他的在线指南和教程。
如果你拿来的代码没有存储在版本控制的存储库中怎么办?
遇到这样的情况,你可以开始将现有代码移动到一个Git存储库中,并创建一个起始提交,将所有文件添加进去。你自己所做的任何更改都可以像往常一样进行跟踪,使用后续的提交。这样做可以确保始终可以将代码恢复到以前的状态,即使引入了错误,也不用担心继承的原始版本代码丢失。
Git还有什么其他功能?
对于高级用户,Git还提供了一系列有用的工具,例如GitHub Actions,可以自动化工作流程的某些部分。这可以包括自动化测试,检查代码更改是否破坏了任何东西,并且项目中的测试是否仍然能通过。
Git还允许轻松对代码进行版本控制,便于你可以将代码库回溯到特定版本或时间,这对于研究的可重复性非常重要。

根据你的目标,你可能已经对代码和/或文档进行了更改。可以考虑分享这些更改。
为什么要在网上发布代码?有什么好处?
——为研究社区做出贡献
很多人可能和你一样,也有着相同的目标,你的更改可以为他们节省大量时间和困难。
——帮助你的职业发展
在线发布代码将建立你的在线个人资料和声誉,这在申请工作或其他机会时非常有帮助。
——优化代码、书写更加规范
可能有其他人帮你的代码库做出贡献和改进,或者只是发现你忽略的bug。
发布代码是一个好习惯。通常,如果我们知道代码将被发布,那就会有意识地写得更加规范,避免那些可能带来问题的懒惰捷径。
在研究项目的同时发布代码的趋势越来越明显,如果你已经养成了这个习惯,就会变得更加容易。
——增加合作机会
其他研究人员看到你的代码,可能会联系你进行合作。发布代码还将使其他人或者你自己在未来更容易地复制你的工作。
有研究人员讲述了这么一个故事:
在他们发布了几年后有人联系他们合作一个类似的项目,这是一个很好的机会,但他们差点拒绝了——因为他们找不到代码,之前写在一台旧笔记本电脑上的,现在已经无法访问了。幸运的是,他们意识到当时已经在GitHub上发布了代码,因此才有可能达成合作。

GitHub是共享代码的标准平台
在研究和工业领域,共享代码的标准是GitHub。如果代码已经作为现有的GitHub存储库发布,那么你可以“fork”创建一个包含更改的存储库副本。根据这些更改的内容,你甚至可以向现有存储库发起“pull request”,将你的更改合并到原始代码库中。
发布更改前需检查软件许可证
如果没有现有的存储库,那么你可以创建一个新的存储库。但是,在发布更改之前,需要注意一点:最好检查一下软件许可证是否允许这样做。
许可证通常在主项目目录中,命名为“LICENSE.txt”或类似的名称。虽然许多研究软件都是在宽松的开源许可证下发布的,但并不是每一个都这样,需要进行检查。即使是开源许可证也可能有一些条件,例如必须注明原作者。
以上总结了使用他人的代码的一些经验,供大家参考交流。学会用好他人的代码,对于自身代码水平的提升也有帮助。毕竟在接触不同的编码实践、设计模式、工具的过程中,你的编程知识和视野都在拓宽。
希望本文的一些驾驭源代码的技巧和心法,能帮你在科研的路上走得更稳,更加高效地得到想要的结果。当然你也可能有自己的心得体会,欢迎分享。
参考文献
Pilgrim C, Kent P, Hosseini K, Chalstrey E. Ten simple rules for working with other people’s code. PLoS Comput Biol. 2023 Apr 20;19(4):e1011031.

谷禾健康
酒精与健康

饮酒作为一种特殊的文化形式,在我们国家有其独特的地位,在几千年的发展中,酒几乎渗透到日常生活、社会经济、文化活动之中。
据2018年发表的《中国饮酒人群适量饮酒状况》白皮书数据显示,中国饮酒人群高达6亿。酒精暴露是一种环境刺激,可显著改变许多生理、心理以及周围和中枢神经系统过程。从心脏和肝功能,到对肠道微生物组和内分泌途径的影响,酒精对全身和大脑都有广泛的影响。
众多的研究表明酒精本身可以产生双重效果,当然,这取决于饮酒量和酒的生产方式。
▸ 低-中剂量
低度至中度酒精对肠道微生物组、肠道代谢物和免疫相关疾病甚至一些癌症似乎起保护和有益作用。
▸ 高剂量
高剂量酒精或长期酗酒对胃肠道、肠道微生物组、免疫细胞和营养物质起破坏和损害作用。
目前的证据还表明,不同剂量的酒精在体内不同组织部位发挥不同的作用。
总体来说,过度饮酒,尤其在青少年和部分职业人群中占比越来越高,带来的伤害和健康风险不容忽视。过度饮酒会导致许多不良的病理健康影响和沉重的医疗保健负担。
根据世界卫生组织最新的通报指出,全球每年大约有超过300万人因过量饮酒而被夺去生命,其死亡人数已经超过爱滋病、暴力和交通事故死亡人数的总和。在饮酒所造成的直接或间接的死亡事件中,男性饮酒带来的风险尤为突出。

酒精引起的胃肠道功能以及微生物群组成和代谢的变化,内毒素血症的肠道通透性与全身性炎症和组织损伤/器官病变相关。
在过去的十年中,肠道,特别是肠道微生物群与酒精性肝病之间的关联引起了研究人员的关注。酒精与消化系统密不可分。它通过肠道吸收,并在肝脏内被肝细胞代谢。过量饮酒会导致肠道微生物组和肠道上皮完整性发生改变。它会导致重要的微量营养素缺乏症,包括短链脂肪酸和微量元素,这些元素会影响免疫功能并导致肝和其它器官损伤。
而且,酒精引起的微生物组改变和肠道屏障完整性下降会对中枢神经系统产生深远影响,导致抑郁、焦虑和对酒精的渴望增加,从而增加酗酒行为,造成恶心循环。
目前,酒精的治疗干预措施主要包括药物治疗、心理治疗、社会支持等方面。然而,这些干预措施都存在着一定的局限性,例如药物治疗可能会产生副作用,心理治疗需要长时间的治疗过程,社会支持需要家庭、朋友等的积极配合。
因此,寻找一种更加有效、安全、方便的治疗方法成为了当前治疗酒精成瘾和酒精使用障碍的研究重点。近年来,越来越多的研究表明,肠道菌群可能成为新的治疗酒精成瘾和酒精使用障碍的途径。新兴研究表明,通过调节肠道菌群可以减轻酒精成瘾的症状,例如减少饮酒量、降低戒断症状等。
本文将介绍酒精摄入或饮酒与肠道菌群及其代谢,肠内外健康的关系。
↘
本文目录
01 饮酒如何影响健康
酒精进入人体过程
酒精和肠道
酒精带来的有害影响
适量酒精带来的益处
02 轻中剂量酒精对自身免疫性疾病的保护作用
短链脂肪酸
多不饱和脂肪酸
自身免疫性糖尿病
自身免疫性甲状腺疾病
系统性红斑狼疮
类风湿关节炎
多发性硬化症
03 高剂量酒精对肠道菌群及其代谢物和营养物质的促炎作用
高剂量酒精对肠道菌群组成的影响
高剂量酒精对肠道屏障功能的影响
高剂量酒精对肠道微生物代谢物的影响
长期饮酒对营养状况的影响
高剂量酒精对肠道炎症和黏膜免疫的影响
04 酒精对相关疾病的影响
酒精与肠-肝轴和肝病
-酒精代谢
-酒精相关性脂肪变性
-酒精性脂肪性肝炎
-酒精引起的纤维化和肝硬化
-肝癌
酒精与胃肠道疾病
酒精和营养不良&肥胖
-营养不良
-肥胖
酒精和心血管疾病
-血脂概括
-高血压
05 酒精与肠脑轴和酒精成瘾
06 干预措施
酒精(乙醇)是一种水溶性小分子,通过胃和近端小肠进入血流,然后分布到全身。它首先进入门静脉,门静脉直接排入肝脏,这是接触酒精最多的地方。肝脏消除了大部分酒精 (90%),而 2–5% 以原形通过尿液、汗液和呼吸排出。
身体第一个直接接触酒精的器官系统是消化系统;因此,从口腔到直肠,几乎消化系统的每个部分都会受到酒精的影响。
酒精对消化系统的病理影响部分取决于肠-肝轴。这种由肠肝循环促进的双向关系涉及消化和细菌产物从肠道到肝脏的运输,以及胆汁、抗体和细胞因子返回肠道。
过量酒精摄入已被证明会通过破坏肠道微生物组成、代谢组和肠道上皮屏障来改变这一轴。这些干扰最终会对营养吸收产生连锁反应。
酒精对肠道的影响
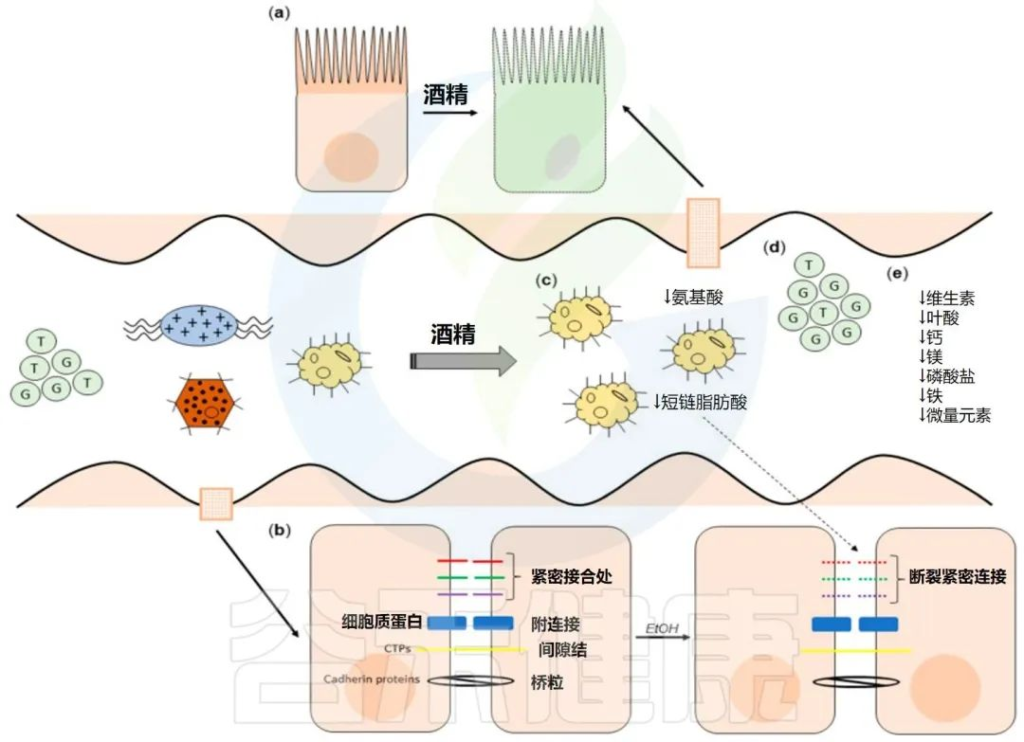
Pohl K et al. Nutrients. 2021,13(9):3170.
CTP:连接蛋白跨膜蛋白;JAM:连接粘附分子;EtOH:酒精。
( a ) 酒精对肠粘膜的组织学影响(细胞死亡、粘膜侵蚀和绒毛尖端上皮细胞丢失)。
( b ) 酒精引起的紧密连接破坏,因管腔短链脂肪酸浓度降低而加剧。
( c ) 酒精引起的生态失调导致短链脂肪酸和氨基酸浓度降低。
( d ) 次级胆汁酸浓度增加,与甘氨酸结合的比例增加。
( e ) ( a – d ) 导致的营养缺乏。
酒精对人体的影响是双重的,既有正面的作用,也有负面的作用。
▼
过量饮酒对人体各部位可能引起的有害影响
– 嘴
饮酒会刺激口腔和喉咙,这会增加患口腔癌的风险。
– 食管
酒精从口腔进入胃部时会引起刺激,从而增加患食道癌的风险。
– 胃
酒精会引起胃壁刺激和随后的炎症,这种情况也称为胃炎。胃壁过度刺激或发炎会导致受影响区域出血和溃疡。
此外,饮酒会导致营养吸收不良,从而使个人患上一系列其他疾病的风险更高。
– 大/小肠
饮酒会抑制大肠和小肠内的营养吸收。肠道蠕动也会受到影响并导致腹泻。
– 胰腺
酒精会导致胰腺发炎,也称为胰腺炎。酒精还会影响胰腺产生胰岛素的方式,如果不停止饮酒,最终会导致个体患上糖尿病。
– 肝脏
酒精是通过 ADH 和 CYP2E1 代谢的,这两种酶都是肝脏的重要功能酶。
通过干扰这些酶的正常功能并产生有害的副产物,对肝脏的影响可能包括肝脏炎症或肝炎、肝硬化、黄疸。
饮酒过多的人可能的直接有害影响
长期酗酒的危害
长期饮酒是全世界最常见的死亡原因之一。根据世界卫生组织的数据,全世界有 23 亿人饮酒,其中约 7500 万人被归类为患有酒精障碍。
酒精滥用会对多个终末器官造成损害,主要是肝脏、肠道和大脑,从而引发多系统损伤。
酒精中毒对全球发病率和死亡率有显著影响,每年约有 5.3% 的死亡是由有害饮酒造成的(世卫组织,2018 年)。一项针对印度南部农村 167,343 名成年受试者的研究发现,每天饮酒 30 年或更长时间会增加癌症相关死亡率的总体水平。
大量饮酒通常与患癌症的风险增加有关;然而,具体的剂量反应关系因癌症部位而异。
——饮酒量越多,肝癌风险越高
最近对涉及 19 组肝癌(即肝细胞癌)受试者的 16 篇文章进行的荟萃分析发现,与不饮酒者相比,饮酒量与肝癌风险之间存在线性关系。
因此,每天饮用 3 杯酒精饮料与风险增加相关,而每天饮用约 7 杯酒精饮料则风险增加高达 66%。
——不同种类乳腺癌,饮酒风险不同
乳腺癌风险也存在类似的线性关系。虽然饮酒总体上与女性患乳腺癌的风险较高有关,但这种关联并不适用于所有类型的乳腺癌。
在参加妇女健康倡议的女性中,饮酒者患雌激素阳性乳腺癌的风险增加。
而与从未饮酒的女性相比,饮酒者患三阴性乳腺癌的风险降低。
注:三阴性乳腺癌,孕激素、雌激素受体以及Her-2即表皮上皮生长因子,都是阴性,叫三阴性乳腺癌。
总之,饮酒和滥用酒精与多种癌症有关,并且这些关联的数量还在不断增加。与此同时,现在越来越清楚的是,酒精对某些慢病和癌症具有预防作用。此外,尽管酒精在预防某些癌症方面具有潜在的有益作用,但重要的是要记住,不能忽视长期酗酒的有害影响。
可能会增加以下疾病的易感性:
酒精引起的肠道菌群和代谢功能的变化可能导致
虽然酒精的新陈代谢看起来相当简单,但酒精的有害影响最常与新陈代谢过程相关,而新陈代谢过程通常会导致烟酰胺腺嘌呤二核苷酸加氢 (NADH) 的过量产生。
大量的 NADH 会导致乳酸,从而导致体内酸中毒,以及葡萄糖合成不足,从而导致低血糖。
▼
虽然大多时候我们都认为饮酒会带来许多有害影响,但过去几年进行的几项临床研究表明,适度饮酒实际上可以促进许多健康益处,例如:可能有助于降低患心脏病和死亡、缺血性中风、糖尿病的风险。这些益处的前提是要适度饮酒,那么什么是适度饮酒?
根据疾病预防控制中心的说法:
轻度饮酒:每周喝三杯或更少的酒精饮料。
适度饮酒:女性每天喝一杯酒精饮料,男性每天喝两杯。
大量饮酒:女性每天喝四杯或更多酒,男性每天喝五杯或更多酒。
注:这个定义在不同的研究中存在差异。由于参与者的主观记忆和准确的报告,准确的人类消费量很难量化。
适度饮酒具体是如何带来益处的?
适量的酒精已被证明可以提高高密度脂蛋白 (HDL) 的水平,这是一种“好”胆固醇,实际上这已经从你的身体中去除了有害的胆固醇。
当一个人的 HDL 水平较高时,它们就能更好地保护自己免受心脏病的侵害。
适度摄入不含酒精的啤酒,可以通过补充生物活性多酚和酚酸,以及通过有益菌丰富肠道微生物群多样性,对人体健康产生积极影响。
——适量饮酒与血癌发病率较低相关
有趣的是,饮酒还与几种血癌的发病率较低有关,包括非霍奇金淋巴瘤 (NHL) 和多发性骨髓瘤。对与瑞典癌症登记处相关的 420489 名被诊断患有酒精使用障碍 (AUD) 的人进行的分析还发现,他们患白血病、多发性骨髓瘤和霍奇金病的风险较低。
最近的另一项研究还表明,饮酒与白血病风险增加无关,事实上,少量饮酒(每天少于或等于一杯)与白血病发病率降低 10% 有关。
——适量饮酒与甲状腺癌和肾细胞癌风险降低有关
在肾细胞癌的案例中,男性和女性的饮酒量低至每天 1 杯,风险也会降低,而更高的酒精摄入量并没有带来进一步的好处。
——适度饮酒与直肠腺癌呈负相关
一项针对结肠和直肠腺癌的回顾性观察性研究表明,适度饮酒(每天少于 14 克)与直肠癌的发病率呈负相关。研究人员还发现,适度摄入啤酒,尤其是葡萄酒与远端结直肠癌呈负相关。
酒精在体内具有多效性
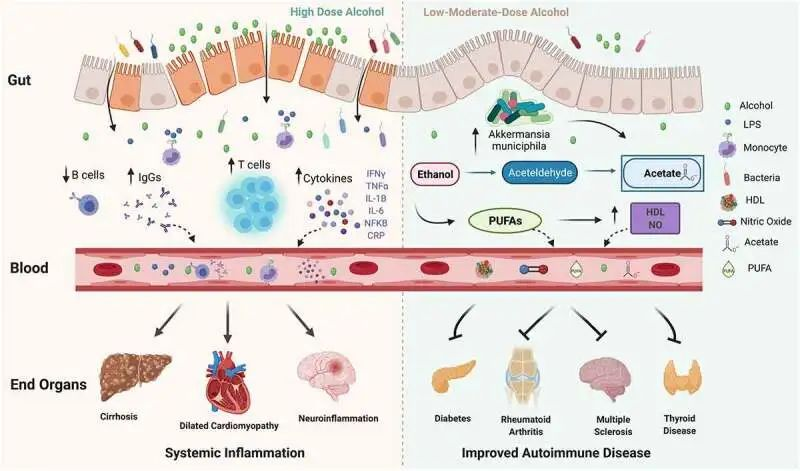
10.1080/19490976.2021.1916278
在高剂量下,酒精会破坏肠道屏障的稳定性,并可能导致肠道微生态失调、细菌壁产物、脂多糖 (LPS) 增加,后者会刺激免疫细胞上的 Toll 样受体 (TLR),并导致单核细胞、T 细胞、细胞因子和免疫球蛋白 (IgG) 水平以及 B 细胞减少。反过来,循环的炎性细胞因子、IgG 和免疫细胞会导致终末器官损伤。
在中低剂量下,酒精已被证明可以改善自身免疫性疾病的风险和进展。
低剂量酒精可能通过增加Akkermansia muciniphila对炎症产生积极影响和其他保护性肠道微生物,并有助于增加乙酸盐、多不饱和脂肪酸 (PUFA)、高密度脂蛋白 (HDL) 和一氧化氮 (NO)。
接下来展开讨论低-中剂量酒精对自身免疫性疾病的保护作用,以及高剂量酒精带来的健康危害,包括免疫系统、肠道菌群及其代谢产物、营养物质等多方面。
酒精可能对自身免疫性炎症产生有益影响的一个重要方式是通过其对肠道中脂肪酸代谢的影响。
众所周知,高剂量酒精会导致脂肪酸失调和发展为脂肪肝疾病,而在低剂量时,酒精可能有助于产生肠道衍生的抗炎脂肪酸,例如短链脂肪酸(SCFAs) 和多不饱和脂肪酸 (PUFAs)。
短链脂肪酸
低度至中度饮酒可以通过两种方式调节短链脂肪酸的产生:
1、通过改变肠道中产短链脂肪酸菌
低度至中度酒精会改变肠道中产生短链脂肪酸的微生物群,例如Akkermansia muciniphila。
短期饮酒(5 天 0.8 g/kg 胃内)会升高小鼠的Akkermansia muciniphila水平,而在消耗同等酒精强度的发酵米酒 (FRL) 的组中未观察到升高。
2、通过乙酸盐产生
酒精本身会代谢成短链脂肪酸、乙酸盐,并且喂食 Lieber-DeCarli 饮食 8 周的动物与对照组相比显示乙酸水平升高。
Lieber-DeCarli 饮食
Lieber-DeCarli 饮食是一种常用于动物实验中的饮食方案。它是由两位科学家 Lieber 和 DeCarli 在 1980 年代开发的,旨在为动物提供一种高度可控的饮食,也就是说可以根据实验需要增加或减少某种营养素的含量,以便研究不同营养素对健康和疾病的影响。
Lieber-DeCarli 饮食的特点是含有高浓度的葡萄糖和脂肪,而蛋白质含量相对较低。这种饮食的能量密度非常高,因此可以使动物快速增重。
Lieber-DeCarli 饮食在动物实验中应用广泛,特别是在研究肝脏疾病、肿瘤、代谢疾病等方面。由于该饮食的成分非常可控,可以帮助研究人员更准确地评估不同营养素对健康的影响,因此被广泛应用于基础医学和临床研究中。
需要注意的是,Lieber-DeCarli 饮食虽然在动物实验中应用广泛,但并不适合人类长期食用。这是因为该饮食的成分并不符合人类的膳食建议,长期食用可能会导致营养不良和健康问题。
多不饱和脂肪酸
低度至中度酒精保护自身免疫性疾病的另一个潜在机制,可能依赖于酒精在必需多不饱和脂肪酸代谢中的重要作用,如二十二碳六烯酸 (DHA) 和二十碳五烯酸 (EPA)。这些多不饱和脂肪酸(PUFA)可以减少活性氧的形成并充当抗炎分子。
低至中等剂量的酒精已被证明会增加多不饱和脂肪酸的产生,而在高剂量酒精下,由于脂肪酸分解代谢增加,多不饱和脂肪酸浓度会降低。
值得注意的是,多不饱和脂肪酸和多不饱和脂肪酸衍生物,如分解素、脂氧素和与自身免疫性疾病的缓解有关。
此外,多项研究还表明,多不饱和脂肪酸的增加具有心脏保护作用。由于心血管健康正在成为自身免疫性疾病结果的一个重要因素,这可能是另一种由低度至中度酒精介导的保护机制。
鉴于促炎特性,饮酒可能会导致自身免疫性疾病的风险增加或恶化。事实上,在某些炎症性疾病中,例如肠易激综合征 (IBS) 和常年性过敏,大量饮酒与疾病发作之间存在直接相关性。然而,适度饮酒似乎可以降低疾病风险、严重程度和进展。
这里介绍几种酒精相关的自身免疫性疾病,包括自身免疫性糖尿病、自身免疫性甲状腺疾病、系统性红斑狼疮、类风湿关节炎、多发性硬化症等,适度饮酒可降低其风险。
自身免疫性糖尿病
适度饮酒的有益作用已在成人非自身免疫性2 型糖尿病和自身免疫性 1 型糖尿病 (LADA) 中得到证实。
每天摄入 2–7 g 的患者风险降低了 60%
在一项自身免疫性 1 型糖尿病研究中,与每天摄入 0.01–2 g 的患者相比,每天摄入 2–7 g 的患者风险降低了 60%。这项研究还指出,与饮酒者相比,戒酒者的抗谷氨酸脱羧酶抗体 (GAD Ab) 水平更高,C 肽水平更低,对男性的影响更为明显。
注:抗谷氨酸脱羧酶抗体 (GAD-Ab) 在1型糖尿病发病前期和发病时多为阳性,而在正常人群及2型糖尿病患者中多为阴性。
葡萄酒的效果显著,可能与葡萄酒中的多酚类抗氧化物质相关
在另一项自身免疫性 1 型糖尿病研究中,发现摄入量超过 25 克/天的男性和女性的风险降低了 46%。这种效果似乎在抗 GAD 抗体水平低的患者中最强,并且与啤酒或白酒消费者相比仅限于葡萄酒饮用者。作者推测,抗 GAD 抗体水平较低的患者可能与 2 型糖尿病患者最相似,可能是葡萄酒中的多酚和羟基二苯乙烯类物质促进了酒精在自身免疫中的抗氧化或抗炎作用。
自身免疫性甲状腺疾病
与糖尿病类似,适度饮酒已被证明对自身免疫性甲状腺功能减退症和甲状腺功能亢进症均有保护作用。
例如,与对照组相比,适度饮酒与甲状腺功能减退症和格雷夫氏病的风险降低呈剂量依赖关系,无论性别或饮酒类型如何。
几项研究还发现,适度饮酒 >10 单位/周或每天至少饮酒 35 克,与自身免疫性甲状腺疾病和甲状腺过氧化物酶抗体阳性的发生概率较低有关。
系统性红斑狼疮(SLE)
多个病例对照、队列和横断面研究已经确定适度饮酒与系统性红斑狼疮风险之间存在显著的剂量依赖性关联。
在一项荟萃分析中,适度饮酒的保护作用与系统性红斑狼疮的持续时间有关,与治疗少于 5 年的患者相比,治疗少于 10 年的患者具有显著性。
另一项研究得出结论,适度饮酒可能会降低 ANA 阳性患者进展为系统性红斑狼疮的概率。
注:系统性红斑狼疮(SLE)是临床上最为常见的自身免疫性疾病之一。SLE的实验室检查包括多种项目,抗核抗体(ANA)是其中较为经常检测的项目之一。ANA阳性尤其是ANA核型为核均质性的结果往往与SLE具有较高的相关性,故临床上往往以此结果联合其他检查并结合患者症状作为诊断SLE的依据。
类风湿关节炎
与甲状腺疾病、糖尿病和系统性红斑狼疮类似,多项流行病学研究和几项机制研究支持轻度至中度酒精以 J 型或 U型剂量依赖方式在类风湿关节炎中发挥保护作用。
适度饮酒女性:较低的风险,较高的生活质量
在一项荟萃分析研究中,男性和女性的类风湿关节炎风险在10年内均有所降低,其中女性的风险降低幅度最大。
在其他研究中,与男性相比,适度饮酒的女性报告了较低的疾病活动和较高的生活质量。
然而,也有文献记载:酒精可能会阻止男性的放射学进展,并增加女性的放射学进展。与不饮酒的患者相比,中度饮酒的类风湿关节炎患者的改良健康评估问卷得分(提示功能状态改善)也显著降低。这种影响在HLA-DRB1共享表位阳性的患者中更强。
因此,类风湿关节炎患者的酒精、性别和基因构成之间可能存在有益但复杂的关系。
在类风湿关节炎中,适度饮酒与CRP 水平、IL-6水平的关联
在类风湿关节炎(RA)中,已注意到 CRP 水平呈 J 型关联:每周饮用 1-7 杯酒的患者 CRP 水平最低。
51 名适度饮酒的类风湿关节炎患者在症状出现前与 IL-6 水平呈 U 型关联,饮酒与可溶性肿瘤坏死因子受体 2 (TNFR2) 水平呈负相关。
适度饮酒:ACPA阳性患者类风湿关节炎风险降低
由于酒精会导致肝损伤,一项评估饮酒与肝脏炎症之间关系的研究报告称,每周饮酒量大于 21 单位与转氨酶相关,而每周饮酒量小于 14 单位则没有。适度饮酒还与抗瓜氨酸化蛋白抗体 (ACPA) 阳性患者的类风湿关节炎风险降低 50% 相关,并且与 ACPA 阴性类风湿关节炎患者的疾病风险降低 30% 呈反比剂量反应关系。
在类风湿关节炎小鼠模型中也注意到酒精对免疫系统的剂量依赖性影响。
适度饮酒:胶原性关节炎发病率下降
在胶原性关节炎 (CIA) 模型中,与非酒精对照组相比,适度饮酒的小鼠的 CIA 发病率降低了 40%,放射疾病严重程度降低了 50% 以上。
饮酒小鼠的 IL-21 和 IL-17A、中性粒细胞、单核细胞、浆 B 细胞和 IgG 水平也较低。酒精和乙酸盐都会影响体外和体内T 滤泡辅助 (TFH ) 细胞的功能状态,从而抑制 IL-21 的分泌。
这些发现很有趣,因为 TFH细胞通常存在于类风湿关节炎患者的滑膜关节中,也是肠道免疫的重要介质,表明肠道免疫过程与类风湿关节炎之间可能存在联系。
在另一项 CIA 研究中,适度饮酒(10% 乙醇水溶液)通过增加内源性睾酮、抑制核因子 B 活化和下调白细胞迁移来延缓 CIA 的发作并改善其进展。
多发性硬化症(MS)
同样,在多发性硬化症中,也有证据表明,适度饮酒在降低疾病风险和/或疾病进展方面具有保护作用。几项大型人口研究表明:
酒精与男女多发性硬化症风险之间存在剂量依赖性负相关
适度饮用红酒似乎与较低的扩展残疾状态量表评分相关,这表明功能有所改善,尽管适度饮酒的患者在脑部 MRI 上表现出 T2 病变体积增加。
相反,大量饮酒可能会增加患多发性硬化症的风险,尤其是男性。
也有研究认为剂量和多发性硬化症风险之间没有关联,性别可能是一个变量
一些研究指出,不同剂量的酒精与患多发性硬化症的风险之间没有关联。在这些研究中,性别可能是一个变量,可以解释酒精对多发性硬化症的影响。
例如,在一项女性护士健康研究(NHS)I和II中,不同类型的酒精与多发性麻痹症的风险没有关联。尽管这是一项针对英国国家医疗服务体系两项研究中超过90000名女性的大型研究,但258例多发性硬化症患者的队列相对较小,与男性相比,女性可能没有经历到酒精的保护作用。
例如,在多发性硬化症的动物模型,即实验性自身免疫性脑脊髓炎(EAE)中,最近的研究表明,主要是雄性小鼠在适度饮酒后疾病评分有所改善。
以上是低-中剂量酒精带来的健康益处,“凡事皆有度,过犹不及”。接下来章节来看过量饮酒可能带来哪些不利影响。
酒精与消化系统密不可分。它通过肠道吸收,并在肝脏内被肝细胞代谢。过量饮酒会导致肠道微生物组和肠道上皮完整性发生改变。它会导致重要的微量营养素缺乏症,包括短链脂肪酸和微量元素,这些元素会影响免疫功能并导致肝损伤。在某些人中,长期酗酒会导致肝病从脂肪肝发展为肝硬化和肝细胞癌。
持续酗酒会改变肠腔pH 值,促进病原体过度生长,并且还与肠道微生物群功能的改变有关,因为它会改变与肠屏障功能障碍有关的特定代谢物分泌物。酒精使用障碍患者通常表现出血浆细胞因子水平升高,例如 TNF-α、IL-10 和 CRP,这表明慢性、低度、全身性炎症。
几项研究调查了饮酒对动物和人体模型的影响,并一致表明过量饮酒与肠道微生态失调的发展有关。
简而言之,酒精已被证明可以增加变形杆菌、肠杆菌和链球菌的相对丰度,并降低拟杆菌、阿克曼氏菌和粪杆菌的丰度。其他还包括抗炎细菌(如Faecalibacterium prausnitzii和双歧杆菌等)水平下降。
在人类酒精使用障碍 (AUD) 研究中,生态失调的特征是:
扩展阅读:
肠道细菌四大“门派”——拟杆菌门,厚壁菌门,变形菌门,放线菌门
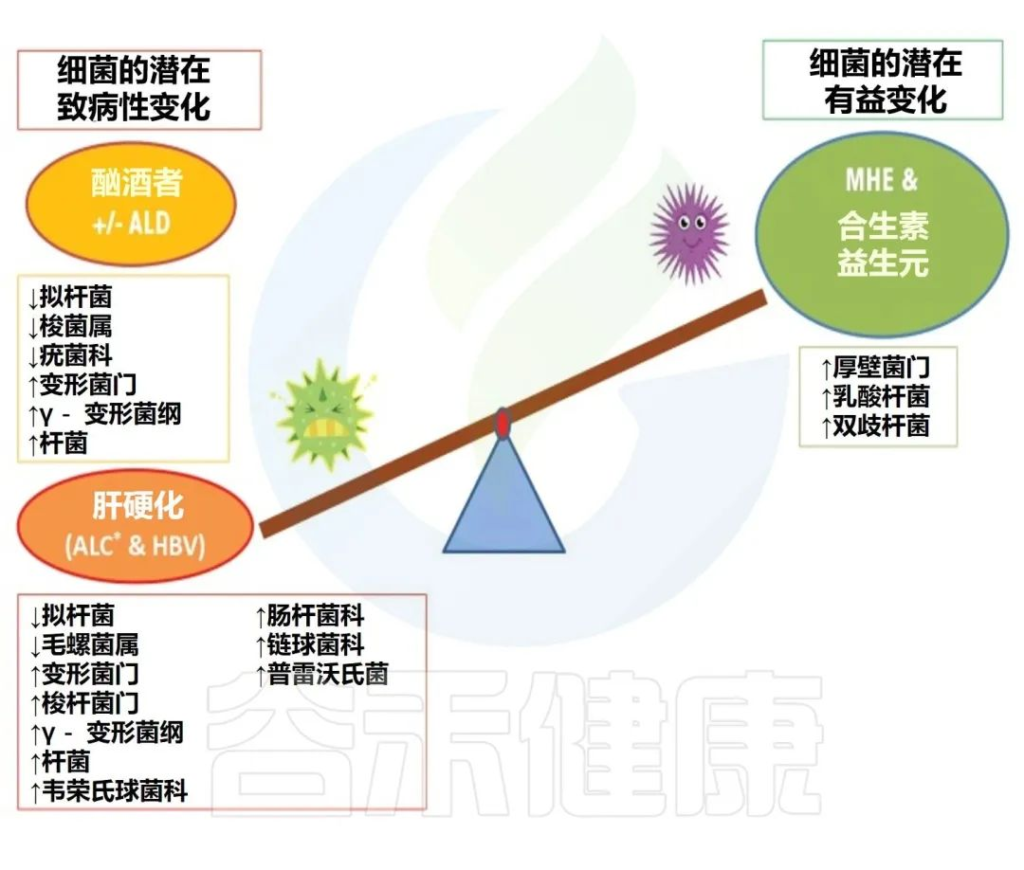
然而,并非所有研究都注意到厚壁菌门对高剂量酒精的反应有所减少。例如,在猕猴中自愿自我给予慢性高剂量酒精会导致拟杆菌减少、厚壁菌门升高,并且在饮酒期间完全没有Akkermansia muciniphila,而戒酒则恢复了基线细菌种类。
肠道微生物群稳态的破坏与这些疾病有关
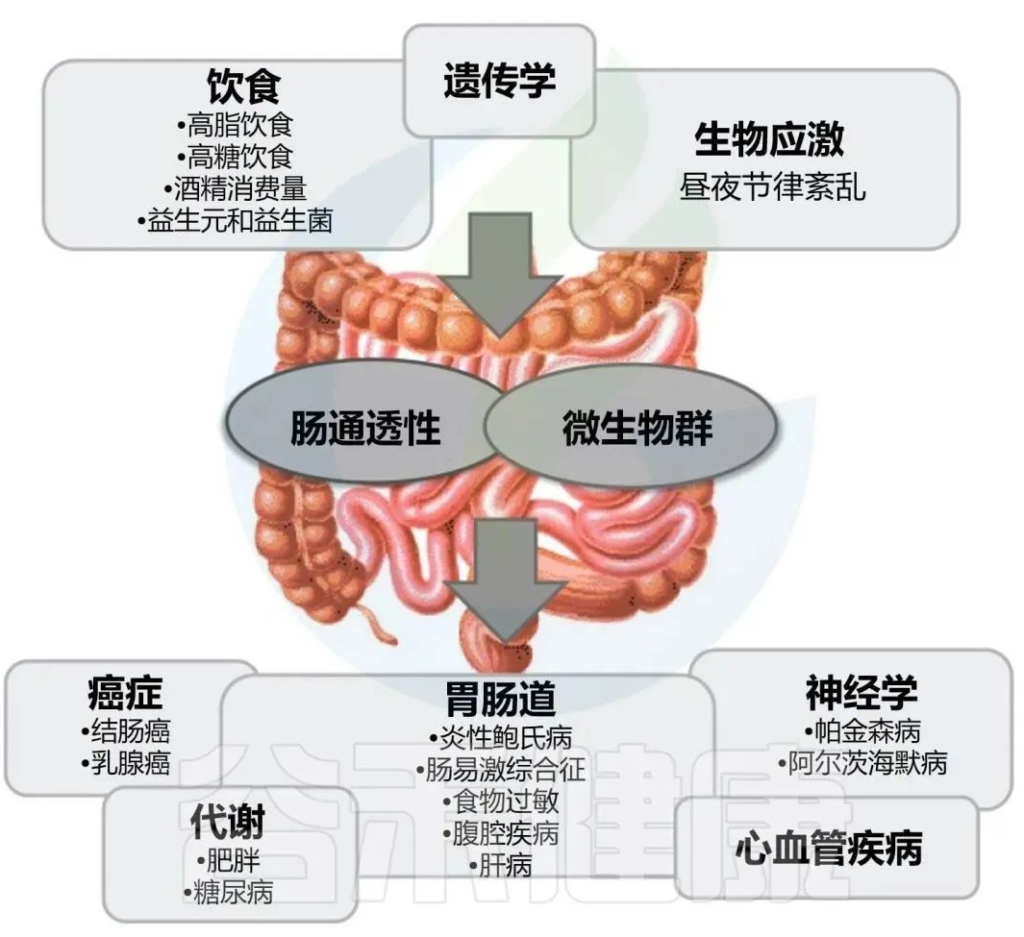
Engen PA et al., Alcohol Res. 2015;37(2):223-36.
此外,生态失调可能是由西方社会常见的环境因素引起的,包括饮食、遗传、昼夜节律紊乱和酒精饮料消费。
在酒精成瘾者中,饮酒会破坏肠道屏障功能,也称为肠漏症。肠道屏障由肠细胞、杯状细胞和影响粘液层内肠道微生物组的抗菌物质以及固有层中的众多免疫细胞组成。
酒精引起的生态失调通过其对肠道完整性的病理影响促进急性(例如,酒精性肝炎)和慢性(例如,酒精相关性肝硬化)肝病的发展。
肠粘液屏障在肠道的免疫功能中起着至关重要的作用,它的破坏会导致这些疾病状态。在这个屏障中,相邻的肠细胞被顶端“紧密连接”蛋白 claudins、occludin 和 zona occludens 结合在一起,防止病原体相关分子颗粒 (PAMP) 和细菌内毒素等管腔内容物意外转移到门脉循环中。
饮酒引起的生态失调与这些紧密连接的破坏有关。因此,随后的免疫功能障碍和循环促炎细胞因子(如肿瘤坏死因子 (TNF)-α 和IL-1β)的增加进一步破坏了肠道屏障。
扩展阅读:什么是肠漏综合征,它如何影响健康?
酒精相关的微生态失调不可避免地会影响肠道代谢,包括短链脂肪酸 (SCFA)、氨基酸和胆汁酸的显著变化。
短链脂肪酸
短链脂肪酸在维持紧密连接方面的作用越来越明显。短链脂肪酸是肠道菌群对难消化膳食纤维进行厌氧发酵的产物。
对酒精使用障碍患者的粪便代谢组分析显示,短链脂肪酸减少,这可能部分是由于生态失调对粪杆菌等产短链脂肪酸菌产生负面影响。一些小鼠模型表明,以高纤维饮食、益生菌或饮食调整形式补充短链脂肪酸,可增强肠道上皮完整性,并减少酒精模型中的肝损伤。
氨基酸
从饮食中获得的必需氨基酸(例如赖氨酸)和非必需氨基酸(例如谷氨酸)都会受到酒精影响。据推测,这是由于生态失调导致微生物-宿主共同代谢紊乱的结果。
虽然管腔氨基酸浓度会随着饮酒而下降,但一些氨基酸(如酪氨酸和苯丙氨酸)的血清水平会升高,这表明失调微生物组的代谢和吸收特征发生了改变。这种代谢失衡可能在活性氧 (ROS) 和有毒中间体水平升高的过程中发挥作用。
胆汁酸
胆汁酸已被证明在人类和大鼠饮酒后的血清和管腔内容物中都会发生变化。初级(由肝脏合成)和次级(来自细菌代谢)胆汁酸主要在小肠中发挥多种功能,并通过其类固醇结构在脂质吸收、胆固醇稳态以及激素作用中发挥关键作用。
在健康的肠肝循环中,初级胆汁酸与牛磺酸或甘氨酸结合形成分泌到肠腔中的胆汁盐。然后肠道微生物群将这些代谢为次级胆汁酸,在将它们循环回肝脏之前去除牛磺酸/甘氨酸基团。饮酒通过增加次级胆汁酸的比例和胆汁酸的总浓度,以及增加与甘氨酸而非牛磺酸结合的比例来破坏这一点。
这是由于生态失调降低了牛磺酸的生物利用度和肠肝循环率增加所致。这种破坏的后果尚不完全清楚;然而,在饮酒过程中更普遍的甘氨酸结合酸可能毒性相对更大,尽管管腔浓度高但胆汁酸的合成增加导致肝脂肪变性。
长期饮酒会减少营养吸收并导致营养不良。肠道通透性、胆汁酸概况和微生物组的改变都促成了这一点,此外,酒精代谢过程中释放的有毒代谢物和 ROS 会对肠道造成结构损伤。
特别是,长期饮酒已被证明会导致细胞死亡、粘膜侵蚀和绒毛尖端上皮细胞丢失。其后果是维生素 A、B1(硫胺素)、B2(核黄素)、B6(吡哆醇)、C、D、E 和 K 以及叶酸、钙、镁、磷酸盐、铁和微量元素锌和硒的不同程度的缺乏。
扩展阅读:如何解读肠道菌群检测报告中的维生素指标?
所有患有慢性酒精使用障碍的患者都要接受全面的营养评估,因为这些缺乏症因人而异,例如铁可能缺乏或过量。
除了上述机制外,重度饮酒者每天从营养不良的酒精饮料中获取高达 50% 的热量摄入 。此外,应该注意的是,除了慢性酒精滥用的症状影响(例如,呕吐、厌食和腹痛)之外,该群体中的社会因素(例如贫困和获得营养“完整”的饮食)也可能导致营养不良。
微生物组从高剂量酒精喂养的小鼠,转移到未接触酒精的无菌小鼠,已被证明会在受体小鼠中诱发肠道炎症。
酒精通过影响肠粘膜免疫诱发炎症
肠道炎症是由免疫系统对酒精及其代谢物产生的炎症反应引起的。酒精通过多种机制影响肠粘膜免疫。特别是,它可能首先降低粘膜中的先天免疫反应,导致对肠道病原体的易感性增加。
随后,正如在细胞培养研究中发现的那样,酒精可能会触发免疫系统反应和促进炎症反应的分子上调,包括释放炎症免疫细胞,例如白细胞和肥大细胞。
研究还表明,酒精可以直接调节先天免疫和适应性免疫,进一步促进肠道和肠道源性炎症。例如,一项针对小鼠的研究发现酒精会抑制肠道清除有害细菌的免疫反应,而其他研究发现酒精会抑制肠道粘膜免疫细胞的活性。
酒精通过引起肠道菌群失调诱发炎症
酒精相关的细菌过度生长和生态失调可能导致肠道内毒素产生增加,内毒素可与肠粘膜上的细胞结合,引起局部炎症,并易位至肠外部位,引起全身炎症。
微生物群失调可导致肠道通透性受损,并通过肠道细菌内毒素、LPS 的系统易位、免疫细胞上 TLR 和NF-kB 的激活以及炎症 iNOS 的诱导促进炎症。
酒精通过肝毒性诱发炎症
肝毒性会干扰肝脏解毒物质的能力,从而导致酒精的有毒代谢物乙醛在全身蓄积。此外,LPS 介导的肝脏驻留巨噬细胞 Kupffer 细胞的激活进一步促进了促炎细胞因子的释放和全身炎症的传播。
其他研究发现酒精影响粘膜免疫的多种方式,包括:
酒精对先天免疫系统和适应性免疫系统的影响具有剂量依赖性。
酒精对小胶质细胞(中枢神经系统的先天免疫细胞)具有显著的剂量依赖性影响
在急性酒精滥用的小鼠模型中:
酒精还以剂量依赖的方式调节适应性免疫系统
长期适度饮酒会导致 T 细胞和 B 细胞活化和增殖,而长期大量饮酒则与 T 细胞和 B 细胞耗竭和凋亡以及免疫球蛋白增加有关。
此外,长期酗酒会改变 T 细胞表型,导致幼稚 T 淋巴细胞百分比下降和记忆 T 细胞百分比升高。相反,适度饮酒与滤泡辅助性 T (T FH )细胞的调节有关。
细胞因子和炎症标志物也以剂量依赖的方式受到酒精的影响。例如,C 反应蛋白 (CRP) 和白细胞介素 6 (IL-6) 在人类重度饮酒者中升高,但与不饮酒者相比,在适度饮酒者中相对降低。
CRP 效应也可能是性别二态的,一些研究表明酒精引起的 CRP 降低是女性特有的,也有其他研究表明适度饮酒会以 U 形模式降低 CRP,而与性别无关。
以上是高剂量酒精对肠道屏障、肠道菌群及其代谢产物、营养状况、免疫系统等方面的影响。接下来章节我们具体来了解一下酒精相关疾病,包括肝病、胃肠道疾病、营养不良、肥胖、心血管疾病等。
►►►
酒精代谢
肝肠微生物轴在营养吸收和肝毒性中起着重要作用,其中肝脏是营养物质、毒素和肠道血液供应的细菌代谢产物的第一道过滤器。
酒精性肝病 (ALD) 是一种由过量饮酒引起的疾病,是全球医疗保健的负担。酒精性肝病涵盖范围广泛的肝损伤,包括无症状脂肪变性、酒精性脂肪性肝炎 (ASH)、纤维化、肝硬化和肝细胞癌 (HCC)。
酗酒患者发展为酒精性肝病的易感性是高度可变的,并且其向更晚期的进展受若干因素(即酒精滥用的量和持续时间)的强烈影响。
其中,肠道微生物群及其代谢物最近被确定为酒精性肝病病理生理学中最重要的。
酒精滥用会引发肠道菌群分类组成、粘膜炎症和肠道屏障紊乱的定性和定量改变。肠道通透性过高导致活致病菌、革兰氏阴性微生物产物和促炎性内腔代谢物转移到血液中,进一步证实了酒精引起的肝损伤。
酒精在肝脏中的代谢
酒精在肝脏中的代谢是了解其在酒精相关肝病发病机制中的作用的关键。酒精在肝细胞中主要通过乙醇脱氢酶代谢为乙醛,然后通过乙醛脱氢酶代谢为乙酸。
乙醛是一种高反应性蛋白质,会导致肝损伤。它与脂质、蛋白质和 DNA 结合形成潜在的免疫原性加合物。这些加合物可产生适应性免疫反应,导致肝细胞损伤和炎症。
线粒体结构改变可导致功能障碍,包括 ATP 生成减少、ROS 生成和乙醛脱氢酶活性降低。乙醛也是肝纤维化进程中的关键代谢物。它可以促进肝星状细胞 (hepatic stellate cells, HSCs) 中胶原 I 的合成,乙醛加合物刺激炎性细胞因子和趋化因子的释放。
乙醇脱氢酶途径可有效代谢少量酒精,但在长期接触酒精时,该途径会变得饱和,并且会显著诱导 CYP2E1。向 CYP 途径的转变导致 ROS 的产生,从而导致氧化应激。
ROS 与蛋白质结合,改变它们的结构和功能特性,并可能充当新抗原。ROS 还可以直接与 DNA 结合,造成损伤,或导致脂质过氧化产物,如 4-羟基壬烯醛 (4-HNE) 和丙二醛 (MDA),从而产生高度致癌的 DNA 加合物。
此外,在慢性重度酒精摄入中,由于乙醛介导的谷胱甘肽减少,肝脏的抗氧化清除系统受损。氧化应激的结果是诱导肝细胞凋亡和坏死。
酒精性肝损伤
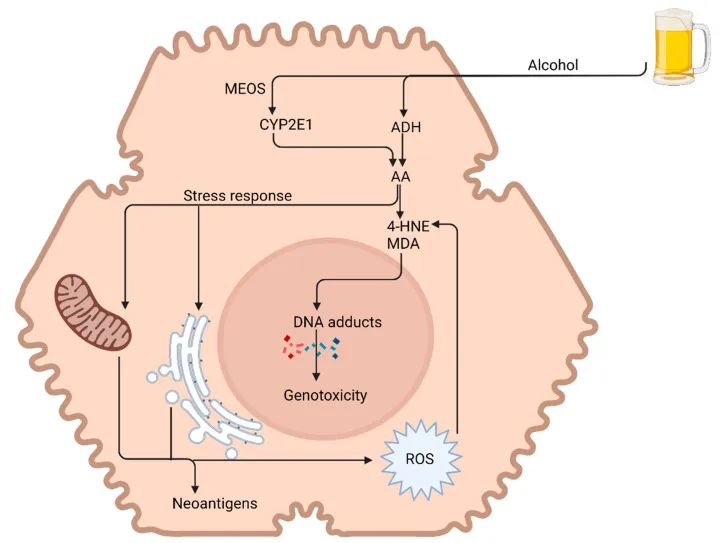
编辑
图源:biorender
乙醛 (AA) 是造成酒精对肝脏的大部分毒性作用的原因。乙醛极度亲脂,导致形成乙醛加合物——丙二醛 (MDA) 和 4-羟基壬烯醛 (4-HNE)。这与活性氧 (ROS) 一起导致 DNA 损伤和遗传毒性。
乙醛还会诱导各种细胞器(例如线粒体和内质网)的功能和结构改变。
MEOS:线粒体酶氧化系统;ADH:乙醇脱氢酶。
酒精相关性脂肪变性
脂肪变性的特征是肝细胞中脂肪(甘油三酯、磷脂和胆固醇酯)的积累,是肝脏对长期饮酒的最早反应,几乎普遍存在于慢性重度饮酒者中。
虽然它在减少饮酒后是完全可逆的,但它的存在与酒精相关肝病的进展有关,最近的一项荟萃分析发现肝硬化的年进展率为 3%。 肝脂肪变性可能通过更大的脂质过氧化和氧化应激增加肝脏炎症(脂肪性肝炎)、纤维化和肝硬化的风险。
然而,进展不仅受饮酒量的影响,还受其他因素的影响,包括性别、共存的肝病、吸烟和遗传。
慢性酒精摄入通过增加肝脂肪生成和减少肝脂肪分解导致肝脂肪变性
酒精通过多种机制诱导肝脂肪变性
图源:biorender
↑:增加;↓:减少;HSC:肝星状细胞。
酒精性脂肪性肝炎
肝脏炎症强烈影响纤维化、肝硬化和最终肝细胞癌的发展
酒精引起的肠漏症导致病原体相关分子模式(PAMP) 输送到肝脏。PAMP 与受损细胞释放的损伤相关分子模式一起激活单核细胞、巨噬细胞、枯否细胞和肝实质细胞上的先天受体【Toll 样受体 (TLR) 和 NOD 样受体 (NLR)】。
通过这些受体发出的信号导致包括 NF-κB 在内的促炎转录因子的转录增加以及促炎趋化因子和细胞因子的产生。
净效应是单核细胞、中性粒细胞和 T 细胞的流入,导致细胞死亡和肝星状细胞 (HSC) 激活的可溶性介质的释放。
除了对酒精激活的促炎性免疫反应外,酒精性肝炎患者还有免疫功能障碍的证据。肠道来源的 PAMP 对单核细胞的激活导致 T 细胞耗竭,同时产生抗炎 IL-10 的 T 细胞数量减少,单核细胞和中性粒细胞功能受损 。
酒精引起的炎症
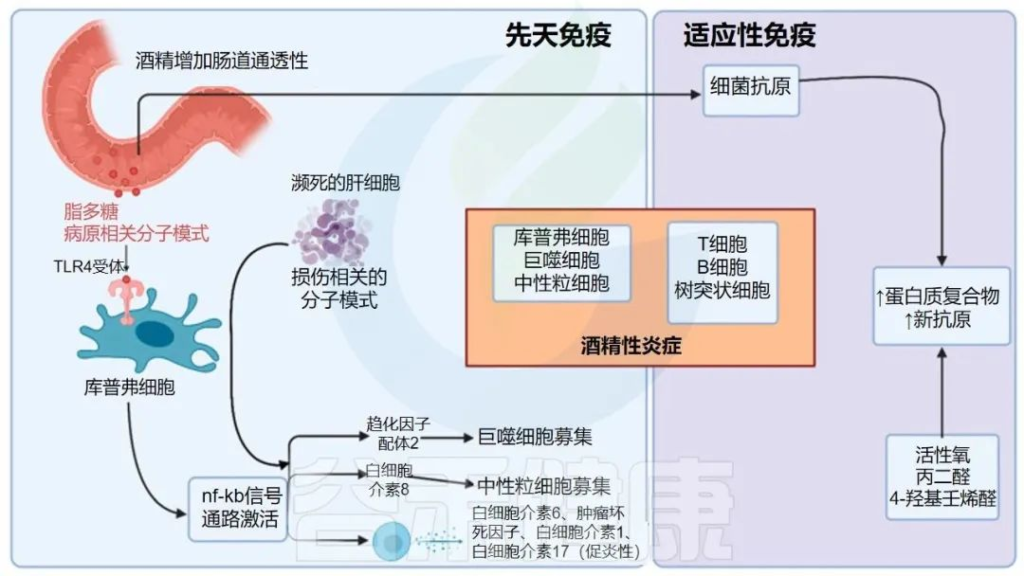
酒精对先天免疫和适应性免疫均有影响。酒精不仅会诱发肠道菌群失调,还会增加肠道通透性。病原体相关分子模式 (PAMP) 如脂多糖与 Kupffer 细胞上的 TLR4 受体相互作用,并通过 NF-κB 途径产生促炎细胞因子和趋化因子,导致肝脏炎症。
乙醛诱导各种蛋白质的结构变化并产生新抗原,从而引发适应性免疫反应并导致肝脏炎症。
CCL2:CC基序趋化因子配体2;DAMPs:损伤相关分子模式;4-HNE:4-羟基壬烯醛;IL:白细胞介素;MDA:丙二醛;NF-κB:核因子 kappa B;ROS:活性氧;TLR4:toll 样受体 4;TNFα:肿瘤坏死因子α;↑: 增加; ↓:减少。
肝细胞死亡通过多种机制发生
包括细胞凋亡、细胞焦亡、坏死和坏死性凋亡。
细胞凋亡是由直接酒精介导的肝毒性、氧化应激的诱导、存活基因 ( C-met ) 的抑制和促细胞凋亡信号分子(TNF-α 和 Fas 配体)的诱导引起的。
坏死、细胞肿胀和膜破裂也可以通过称为坏死性凋亡的程序化途径发生。
而细胞焦亡是一种依赖于 caspase-1 的程序性细胞死亡。
细胞死亡的模式可能受疾病状态的影响,早期酒精相关肝病中细胞凋亡占主导地位,但酒精性肝炎中炎性体激活驱动细胞焦亡和肝损伤扩散。
长期饮酒通过多种机制影响肝脏
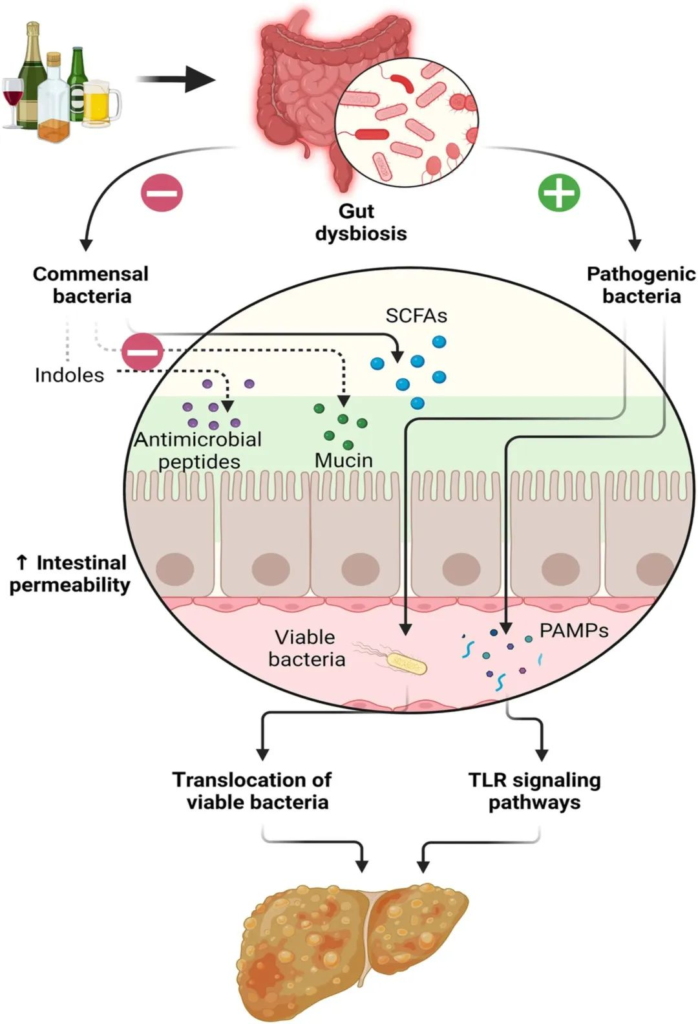
doi.org/10.1111/jgh.16199
长期饮酒会导致肠道生态失调,从而导致肠道通透性增加、肠道细菌易位和病原体相关分子模式 (PAMP),并通过 Toll 样受体 (TLR) 信号通路增加肝脏炎症和纤维化。
为什么有些人不喝酒也有可能得脂肪肝?
脂肪肝的发生与多种因素有关,包括肥胖、高血压、高血脂、糖尿病等,也与外源性酒精和内源性酒精相关。这些因素会影响肝脏的代谢功能,导致脂肪在肝脏内积累,从而引起脂肪肝。
我们一般认为的酒精摄入是指外源性酒精,是通过饮酒等途径摄入的酒精。而内源性酒精则是由人体自身产生的一种酒精,主要产生于肠道中的细菌代谢过程中。这两种酒精对人体的影响有所不同。
内源性酒精对人体的影响相对较小,因为它的产生量较少。但是,如果肠道细菌失衡,导致内源性酒精产生过多,就可能会对人体健康产生负面影响,如肝脏疾病、代谢紊乱等。
酒精引起的纤维化和肝硬化
纤维化是肝脏对破坏性刺激的伤口愈合反应,在去除刺激后可逆。在长期大量饮酒的情况下,会发生慢性炎症和纤维化,导致宽频带纤维组织沉积,扭曲肝脏结构并改变肝脏血流,导致门脉高压及其相关并发症。
当肝纤维化发展到扭曲肝脏结构并形成结节时,患者会发展为肝硬化。
活化的星形细胞 (HSC) 引起的细胞外基质沉积是肝纤维化发生和发展的关键事件。其他细胞(门静脉成纤维细胞和肌成纤维细胞)的贡献较小。HSC 被炎性细胞因子和直接被酒精及其代谢物和 ROS 激活。活化的 HSC 通过分泌趋化因子和表达粘附分子来吸引和刺激循环免疫细胞,从而使炎症反应持续存在,进而激活静止的 HSC。
肝癌
肝硬化是一种癌前状态,会增加原发性肝癌的风险,最常见的是肝细胞癌(HCC)。在全球范围内,大约 30% 的肝细胞癌是由酒精引起的。
酒精本身是一种致癌物,在肝细胞癌的背景下,通过 ROS 诱导的损伤、炎症机制及其反应性代谢物乙醛,酒精在其发展中起着特定的作用。
在大量饮酒者中,CYP 通路活性增加会产生 ROS,导致 DNA 损伤,导致细胞周期停滞和细胞凋亡并破坏基因功能,从而增加癌发生。
酒精相关性肝病患者炎症通路的激活与癌症风险增加相关
尽管机制尚未完全阐明,但可能涉及促炎细胞因子促进 ROS 积累(关于ROS平衡与健康我们准备专门搞一个主题讲下)。细胞因子的产生也与血管生成和转移发展的上调有关。此外,酒精会抑制 CD8+ T 细胞的抗肿瘤反应。
乙醛具有高反应性,并与 DNA 和蛋白质形成加合物,导致线粒体损伤和 DNA 修复机制的破坏。在具有遗传变异的人群中发现的乙醛水平升高会导致酒精脱氢酶和乙醛脱氢酶的活性改变,这与重度饮酒者患肝细胞癌的风险较高有关。
扩展阅读:深度解析 | 肠道菌群与慢性肝病,肝癌
►►►
胃肠道 (GI) 是与摄入体内任何物质的第一道接触线,特别容易受到毒素的损害。越来越多的研究表明,胃肠道健康状况不佳对身体的整体健康起着重要作用。任何可能导致胃肠道损伤的事情,其后果可能远远超出肠道。事实上,研究人员已经开始发现酒精,特别是如果长期大量饮酒,会引发肠道内启动的过程,从而促进全身炎症。
酒精使用障碍患者肠道通透性增加
对人类的研究表明,一部分酒精使用障碍 (AUD) 患者的肠道通透性实际上有所增加,这是使用称为 Cr-EDTA 的方法测量的,该方法检查口服铬的排泄。此外,那些患有酒精使用障碍且通透性增加的人更容易患肝病,表明肠道通透性可能是某些酒精使用障碍患者器官损伤的介质。
另一项研究表明,患有酒精使用障碍的人不仅肠道通透性增加,而且增加到足以让大分子通过肠道屏障。内毒素 – 也称为脂多糖 (LPS),是大分子,同一项研究发现血浆内毒素水平随着肠道通透性的增加而增加。
酒精是如何诱导肠道通透性的呢?
简短的回答是通过破坏上皮细胞本身(跨上皮通透性)和破坏上皮细胞之间的空间(细胞旁通透性),它由紧密连接、细胞骨架和一些相关蛋白组成。
跨上皮渗透性是由直接细胞损伤引起的。例如:
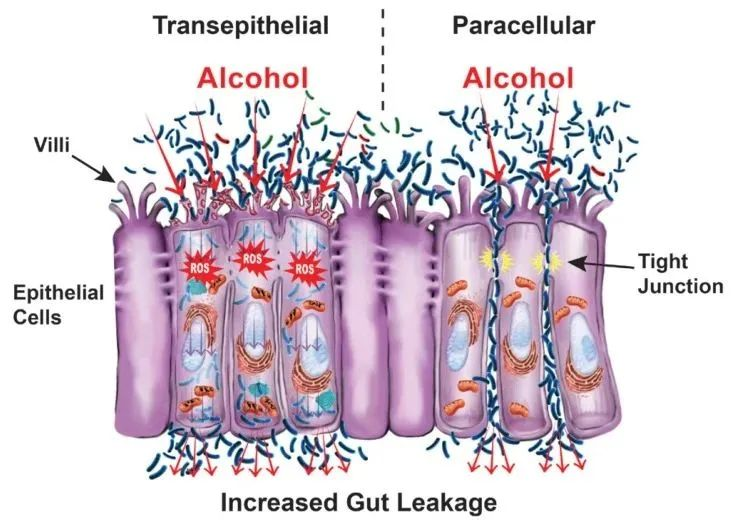
肠道屏障调节肠道内部(食物和饮料流经的地方)和肠道内部上皮细胞层另一侧的细胞和血管之间的物质通道,包括微生物产物。
破坏肠道屏障有两种方式:
肠道屏障通透性增加,使细菌及其产生的毒素离开肠道,并通过血液渗入其他器官。
酒精及代谢物如何通过触发以上两种机制?
— 酒精及其代谢物通过直接破坏细胞和通过活性氧 (ROS) 引起的氧化应激等多种机制削弱细胞膜来触发跨上皮机制。
酒精会导致细胞死亡,从而导致肠道发生变化,包括粘膜溃疡、糜烂和主要位于绒毛尖端的上皮细胞丢失;乙醛形成导致直接细胞损伤的 DNA 加合物;和酒精代谢过程中释放的活性氧 (ROS) 通过氧化应激导致直接细胞损伤。
— 酒精的代谢物通过破坏产生连接细胞和稳定细胞骨架的蛋白质的紧密连接的蛋白质,来触发细胞旁路机制。
酒精及其代谢物通过作用于将两个相邻细胞融合在一起的紧密连接复合物而引起细胞旁通透性。例如,乙醛通过重新分配蛋白质来破坏紧密连接的稳定性;酒精及其代谢物改变紧密连接蛋白的表达;和酒精的非氧化代谢物导致紧密连接再分布,破坏其屏障功能。
此外,研究表明酒精会破坏细胞的细胞骨架,即赋予它们结构的细胞边界。还有越来越多的证据表明,酒精会导致 microRNA (miRNA) 的过度表达,这些小片段的非编码 RNA 会沉默基因表达。具体而言,酒精会导致 miRNA 过度表达,从而影响与肠道屏障完整性相关的基因。
酒精和胃肠道癌症
长期饮酒会增加患主要胃肠道癌症的风险,包括食道癌、胃癌和结肠癌(结直肠癌)。这种风险通常随着饮酒量的增加以及与其他生活方式相关因素(如吸烟或代谢综合征)的增加而增加。虽然酒精最初被认为是一种直接致癌物,但研究表明酒精引起的肠道炎症可能是罪魁祸首。
代谢综合征和肥胖中出现的全身性炎症会增加多种上皮癌的风险,包括胃肠道癌,这表明酒精引起的肠道炎症造成的全身性炎症状态,也可能导致酒精引起的胃肠道和其他器官癌症发生。这个过程像滚雪球,因为随着细胞转变为癌变状态,ADH 活性会增加,而 ALDH 活性可能会降低 。
这导致氧化速率增加和清除酒精代谢物的能力降低,这反过来又可以通过对 DNA、氧化应激和肠道炎症的直接影响进一步促进癌变。
►►►
营养不良
酒精的能量价值及其对营养状况的影响
酒精是唯一提供能量 (7.1 kcal/g) 的精神药物。然而,它的卡路里被认为是“空的”,因为酒精摄入不能提供维生素和矿物质,并且它的过量摄入会导致营养状况的改变。
由于酒精的高能量值,人们普遍认为,过量饮酒会增加体重和肥胖的风险。尽管酒精密度高,但与不饮酒者相比,饮酒者的体重似乎并未增加。
当酒精摄入热量占总热量摄入的 50% 或更多时,由于微粒体乙醇氧化系统 (MEOS) 的激活,身体系统可能无法有效利用乙醇摄入提供的能量。以能量浪费为代价,MEOS 是乙醇氧化的主要肝脏途径。其诱导在戒酒后是可逆的。
饮酒与体重的关系及戒酒对营养状况的改善
在对 181 名每天消耗超过 80 克乙醇的住院男性进行观察性研究期间观察到,63.1% 的人患有厌食症,58.7% 的人体重减轻,17.8% 的人的 BMI 低于 20 kg/m2。经过三个月的戒酒期后,酗酒者的热量使用正常化,体重指数 (BMI) 和腰臀比 (WHP) 也有所增加。
作者认为,戒酒期间营养状况的改善可能是由于 MEOS 活性较低,从而减少了热量的浪费。
少量或中等程度饮酒的女性肥胖风险较低
酗酒患者因饮酒而出现代谢和营养障碍,并表现出在静息状态下大量使用能量,优先使用脂质作为能量来源,并且与对照组相比,脂肪组织比健康对照减少了 19%。
队列研究表明,与戒酒的女性相比,少量或中等程度饮酒(最多 30 克/天)的女性体重增加和肥胖的风险较低,而其他研究已经达到无论受试者的性别如何,都得出相同的结论。
研究评估了酗酒者脂肪和肌肉组织长期变化的预后价值以及戒酒对这些变化的影响。结果表明,在第一次评估后的头六个月内,原来体重较轻与较差的预后相关,无论患者是否在同一时期戒酒。然而,不禁欲与瘦体重的减少相关性更大。
低剂量饮酒是热量的重要来源
身体对酒精热量的利用可能与酒精的用量有关。酒精消耗量低于每日卡路里的 25-35% 可用作能量来源;然而,在更高的消耗量下,利用可能不完整。
在人类中,热量营养不良是世界各地数以百万计死于饥饿的人所面临的现实,并且由于价格低廉且可用性高,乙醇被摄入以代替食物。一些研究创建动物模型是为了阐明当营养不良的生物体暴露于乙醇时会发生什么。然而,结果并不是人们所期望的。
事实上,低剂量饮酒是热量的重要来源,可减轻营养不良的影响。动物研究表明,摄入低至中等剂量的酒精(最多占总热量摄入的 20%)会导致营养不良的大鼠体重增加,这表明有效利用了酒精的能量含量。然而,当酒精中的能量含量占总卡路里摄入量的 10% 或更多时,富营养化大鼠的体重就会减轻。
肥胖
个人的营养状况可能会影响酒精饮料中能量的利用。在人类中,瘦个体对酒精卡路里的利用效率可能较低,而在肥胖个体中,卡路里有助于增加体重。
酒精对体重的影响仍然是一个有争议的话题
一项长达10年的前瞻性研究表明,饮酒者的体重比不饮酒者更稳定,这表明饮酒不是肥胖的危险因素。每月长期适度饮用啤酒不会改变成年人的体重或身体成分。
一些研究表明,身体和腹部脂肪的增加与适度和频繁饮酒有关。还有证据表明,不同的饮酒方式会导致体重增加。每天摄入 ≥ 30 克酒精可能会改变能量稳态的平衡,促使食欲增加,从而导致体重增加和肥胖,无论摄入哪种类型的酒精。
为什么有可能增加肥胖的风险?
在短期内,饮酒被认为是一种食欲兴奋剂,影响用于控制食欲的神经化学和外周系统,如瘦素抑制、胰高血糖素样肽-1 和血清素,并增强γ-氨基丁酸的作用,内源性阿片类药物和神经肽 Y。因此,在没有依赖性的情况下大量饮酒以及酗酒可能会增加肥胖的风险。
饮酒与体重变化及发展为肥胖的关联因性别而异
男性将酒精添加到日常摄入的卡路里中,而女性则倾向于使用酒精替代其他能源,例如减少碳水化合物的消耗而不会增加总卡路里摄取。在考虑能量平衡时必须包括这些差异,因为它们可能会产生关于体重的不同结果。
多种肥胖风险因素与饮酒有关
例如腹部脂肪增加 、脂质氧化能力下降、高热量饮食消耗和皮质醇分泌增加。有人可能会说,与酗酒者和饮食富含脂肪的人相比,超重或肥胖的人和非日常适度饮酒者更多地利用酒精中的卡路里。
女性、饮酒者、大学生的身体、腹部和外周脂肪值也较高,表明 AUDIT 问卷中较高的分数与 BMI、体脂百分比、腰围、三头肌皮褶,手臂周长呈正相关。
喝得量少,频率高 ⇒ BMI 较低
喝得量多,频率低 ⇒ BMI 较高
一项基于 1997 – 2001 年全国健康采访调查数据的研究表明,与 BMI 相关的饮酒量和频率之间存在强烈的相反影响。喝得频率更高但喝得少(即每天喝一杯)的人 BMI 较低。另一方面,饮酒频率较低但饮酒量较大(暴饮暴食)的个体 BMI 较高。那些每天摄入 ≥ 50 g 的人的腹部肥胖风险因素增加。
与这一发现一致的是,在对英国人进行的一项研究中,有人指出,摄入 30 克或更多的酒精会增高 BMI 和体重增加的风险。
肥胖风险:当前适度饮酒者<戒酒者<酗酒者
同样,在对第三次全国健康和营养检查数据进行研究后提供的结果显示,与戒酒者相比,当前饮酒者肥胖的可能性较低,而酗酒者(一天四剂或更多剂饮酒者)肥胖的可能性更大。在报告经常饮酒但每周饮酒量少于 5 剂的人群中,肥胖风险因素显著降低。
扩展阅读:体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
►►►
血脂概况
每周饮酒三到四天与患心肌梗塞的风险较低有关
据估计,酒精的心脏保护作用可能归因于 50% 的 HDL 升高。适量饮酒(30 克乙醇/天)可使 HDL-c 浓度增加约 4 mg/dL,apoA-I 浓度增加 8.82 mg/dL,心脏病风险估计降低 24.7%。
不管饮用的饮料(葡萄酒、烈酒或啤酒)的数量或类型如何,这种改变都可能发生。此外,酒精促进 HDL (好胆固醇)的较少降解和 LDL(坏胆固醇)的更大肝脏代谢。
重度饮酒者中风风险较高
尽管饮酒会改变血脂水平并减少心血管事件,但已证明重度饮酒者中脑出血和蛛网膜下腔出血等中风的发生率高于不饮酒者 。此外,由于大量饮酒,如糖尿病、高血压性心脏病、缺血性心脏病、缺血性和出血性中风等疾病逐渐增加。
酒精的风险和益处之间的差异因人而异,科学家呼吁不应将其用作保护心血管的工具作为一项公共卫生措施加以鼓励。
在一项荟萃分析研究中描述了酒精对预防冠心病的益处的减少,其中节制和轻度和中度饮酒者显示出相同的冠心病死亡风险。
发现每天饮酒 10 克的人甘油三酯水平较高。摄入量大于 50 克/天可显著降低发生低水平 HDL-c 的风险,但会增加发生高水平胆固醇的风险。
在餐后时期,酒精会导致甘油三酯升高,并抑制游离脂肪酸 (FFA) 的氧化 。重要的是要强调,对于患有冠心病的个体,餐后高甘油三酯血症更大、持续时间更长。高甘油三酯血症或 FFA 增加与正常个体和胰岛素抵抗者的内皮血管舒张减少有关。
扩展阅读:
高血压
酒精摄入会以剂量依赖性反应升高动脉压
每天摄入超过两次的剂量是最常见的可逆性高血压原因之一 。肾素-血管紧张素系统可能参与了酒精诱发高血压的机制。
一项研究表明,急性酒精中毒改变了肾素-醛固酮系统,使人体具有正常的氢和钠平衡。血浆肾素的增加可能是由于乙醇利尿或乙醇对醛固酮分泌的抑制作用引起的脱水。渗透压、动脉压和心脏频率没有发现显著变化。后来,证实适度饮酒时肾素活性会急剧增加,从而引起液体和电解质平衡以及动脉血压的变化。
少量和适度饮酒的影响可能因性别而异
文献对这个问题的描述并不一致。在一项由女性健康研究对 28,848 名女性开展的前瞻性研究和由医生健康研究开展的另一项对 13,455 名女性开展的前瞻性研究中,少量和适度饮酒降低了女性患高血压的风险,并增加了男性患高血压的风险。
酒精成为高血压危险因素的阈值在女性中等于或大于每天 4 剂,而男性的中等水平等于或大于每天 1 剂。 然而,一些研究在考虑男性和女性的动脉血压对酒精的敏感性是否不同时存在争议。
饮酒推荐量因体重而异
由于习惯性饮酒不同,动脉血压升高在低体重个体中比在高体重个体中更为显著。因此,低体重女性预防高血压的推荐饮酒限度必须低于高体重女性。
对于重度饮酒者而言,少喝可以预防治疗高血压
在没有其他心血管疾病的健康男性和女性中调查了饮酒和当前饮酒标准与高血压风险之间的关联。与节制的人相比,那些饮酒且饮酒量很大的人患高血压的风险更高。
重度饮酒者酒精摄入量的减少显著降低了动脉收缩压和舒张压。因此,必须推荐减少饮酒作为生活方式调整措施,以预防和治疗重度饮酒者的高血压。
扩展阅读:认识肠道微生物及其与高血压的关系
以上是酒精对相关疾病的影响。长期大量饮酒后,人体对酒精容易产生依赖性,出现无法自主控制饮酒行为,也就是戒不掉、戒断症状等现象,我们通常说酒精成瘾。他们需要往往更多的酒精来获得同样的愉悦感。接下来章节,我们来看一下酒精成瘾的相关因素。
肠道和大脑是两个器官,它们在解剖学上相距甚远,但在其他方面却如此接近。我们过去的文章写过,肠道微生物组和大脑之间的代谢和神经串扰对大脑功能、情绪和行为具有重要意义。
详见:
在过去十年中,多项研究表明,全身性炎症与精神疾病(包括抑郁症和自闭症)之间存在关联。然而,全身炎症与酒精成瘾、抑郁症和自闭症等精神疾病之间相互作用的机制尚不完全清楚,肠道菌群可能是一个很好的研究目标。
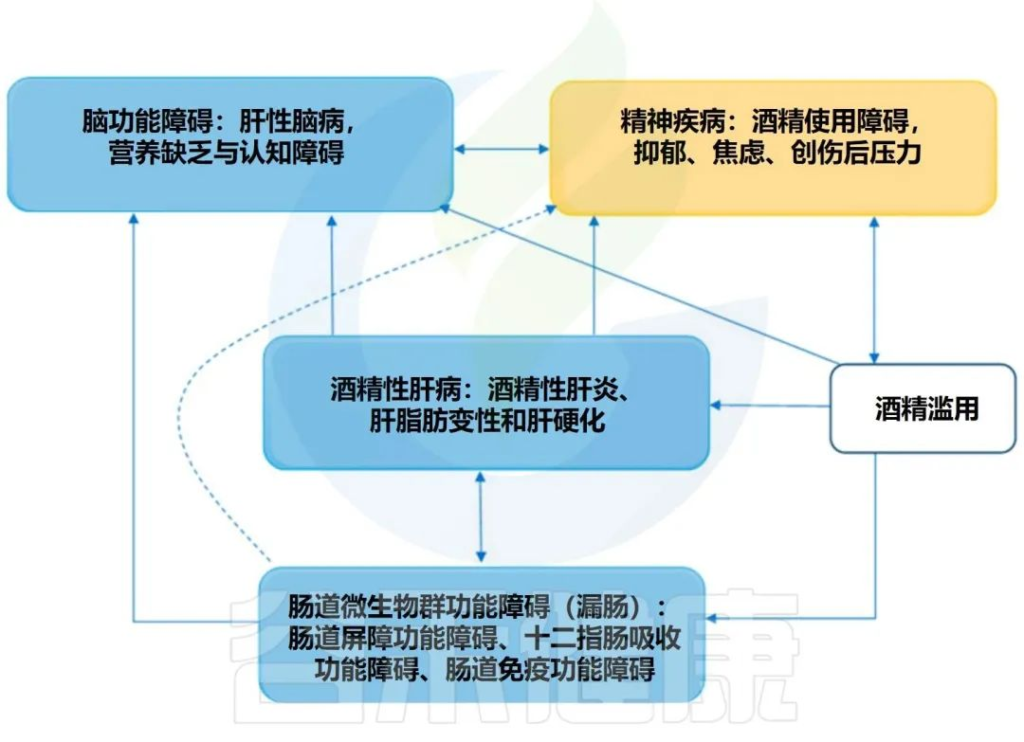
全身性炎症和酒精成瘾的一个可能机制是肠道细菌产物激活外周血单核细胞,诱导细胞因子进入血流,在酒精依赖者中引起低度全身性炎症 。
肠道炎症还可以将内毒素和细胞因子传播到血液中,在那里它们可以进入中枢神经系统 (CNS),引起神经炎症。
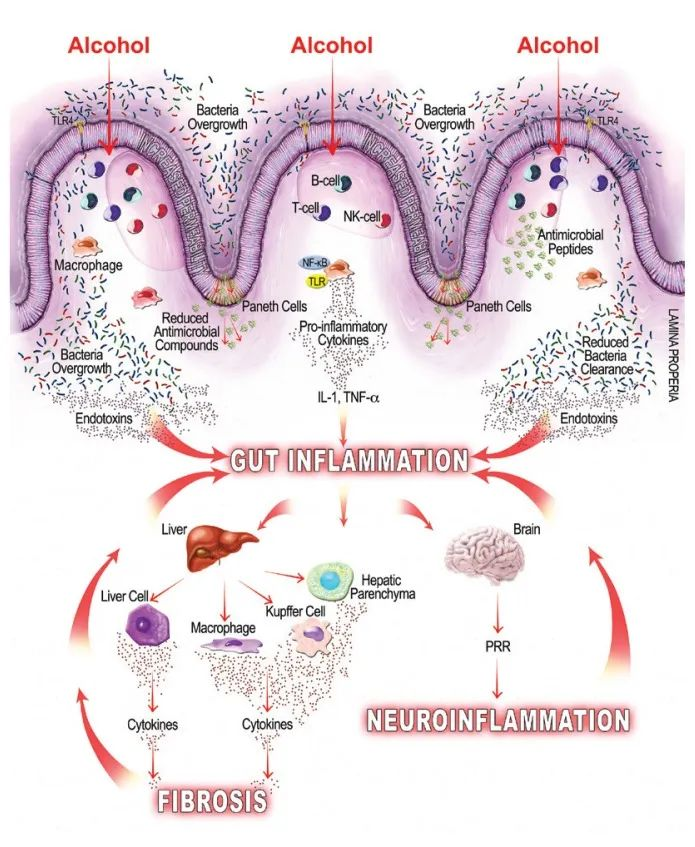
酒精成瘾与十二指肠的吸收障碍有关,导致营养不良和硫胺素的肝脏储存受损。
酒精成瘾与其他精神疾病高度相关,包括重度抑郁症、双相情感障碍以及焦虑症。重度抑郁症等情绪障碍通常先于酒瘾发作;例如,有人使用酒精来应对情绪低落。
酒精成瘾的严重程度与其渴望、认知功能障碍、焦虑和抑郁症状的强度相关
正如我们上面提到的,全身炎症可能在酒精成瘾的发展中起重要作用;肠道和肝脏的肠屏障功能障碍和炎症可能导致外周炎症并引起脑部炎症,从而诱发小胶质细胞或星形胶质细胞等脑细胞的炎症。
疾病行为理论可能将全身性炎症与酒精成瘾和情绪障碍联系起来。该理论支持外周炎症,如肠漏症,激活免疫系统并产生可到达大脑的细胞因子,导致发烧、疲劳、疲倦、无法集中注意力和退出社交;当上述行为持续存在时,可能会出现抑郁症状。
越来越多的研究将肠道微生物组的组成和功能与物质使用障碍 (SUD) 联系起来。
肠脑轴和物质使用障碍(SUD)
SUD 的特征是:尽管知道会对精神、身体和社会造成负面影响,但仍对某种物质(例如,酒精、阿片类药物和/或其他药物)长期依赖。
它们具有社会经济、生物化学、遗传以及越来越多的微生物学基础。众所周知,大脑是调节成瘾参数的重要器官,然而,通过微生物角度研究成瘾提供了一种思考:与身体相关的其他因素如何与大脑携手合作,以调解获得滥用药物的动机的新方法。
肠道和大脑通过双向、生化和神经高速公路(肠-脑轴)进行交流。肠上皮细胞下方的神经末梢接收来自肠道微生物群的代谢信号,这可能会影响行为,例如压力或焦虑。
除了与中枢神经系统发育和大脑功能有关的其他代谢物,如短链脂肪酸,肠道微生物还有助于产生一系列与情绪、认知和奖赏相关的神经递质(例如血清素和多巴胺)。
肠脑轴
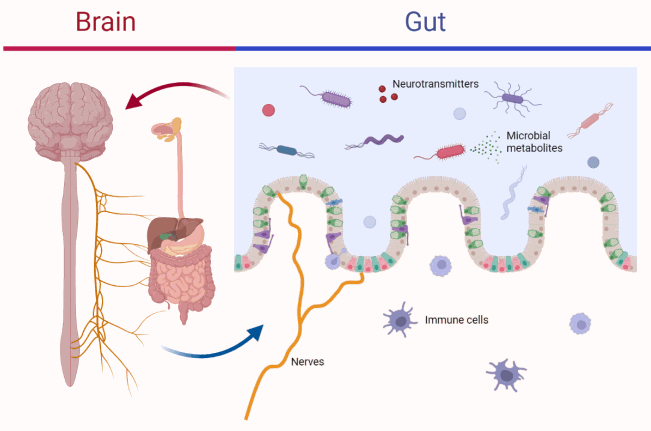
图源:BioRender
这些神经递质在 SUD 的情况下特别相关;许多滥用物质通过触发大量多巴胺进入奖励途径来劫持大脑的奖励系统。这种多巴胺泛滥带来的愉悦感最终会减弱,个人可能会反复服用该物质以再次体验这些感觉。研究表明,肠道微生物参与自然(例如食物)和人工奖励(包括药物)的奖励感知,这表明 SUD 的发展/进展与肠道微生物组组成之间存在联系。
事实上,滥用酒精或药物与微生物组组成的变化有关。尽管这些改变的具体情况因物质而异,但与“健康”相关的微生物通常会减少,而具有促炎作用的微生物会增加,例如变形杆菌。这些变化伴随着关键微生物代谢物(如短链脂肪酸)的减少,具有各种全身和局部效应(例如,肠道屏障完整性的破坏)。
通常,SUD 的特征是肠道炎症增加,部分原因是这种渗漏的肠道屏障允许微生物及其产物与底层免疫细胞相互作用。激活后,这些免疫细胞会产生细胞因子,这些细胞因子不仅会引发局部炎症,还会进入循环并穿过血脑屏障。由此产生的神经炎症会改变神经元活动,包括在大脑的奖励通路内,并可能影响对物质本身的反应和耐受性。
管理物质使用障碍——肠道微生物
治疗 SUD 的策略因人和物质而异,但可能涉及药物(如阿片类拮抗剂)、咨询和行为护理。然而,这些策略可能并不总是奏效,并且可能会复发。目前药物成瘾治疗干预的成功率很低,大约40-60% 接受治疗的人最终会复发并重新使用滥用药物。
鉴于肠道微生物群和 SUD 之间出现的交叉点,发现用某些细菌补充肠道微生物群,它们的发酵产物(如短链脂肪酸)可能会减少滥用物质的影响。
例如,一项研究发现富含双歧杆菌的益生菌和Lactobacillaeae 可逆转小鼠对吗啡的耐受性。
粪便微生物群移植 (FMT) 也可能是一种选择,或许未来可以用于干预酒精成瘾或使用障碍。一项 1 期临床试验表明,与安慰剂组相比,接受富含毛螺菌科和瘤胃球菌科 FMT 的酒精使用障碍患者在 15 天后 对酒精的渴望有所减少(分别减少 90% 和 30%)。在吗啡依赖小鼠中,FMT减轻了戒断症状由阿片拮抗剂触发。由于阿片类药物耐受性容易导致剂量增加和用药过量,这些发现表明微生物可以延长药物的疗效。
以上表明肠道微生物组的未来及其对健康和福祉的影响有很大的应用,尤其是与 SUD 相关的情况。这是一个有前景的领域。
目前,酒精摄入过量的治疗干预措施主要包括药物治疗、心理治疗、社会支持等方面。以下是一些应对过度饮酒的可行性计划:
这里再介绍一些关于过量饮酒的饮食干预。
1. 豆腐
豆腐中所含的半脱氨酸是一种氨基酸,其重要性在于能解除乙醇的毒性,食用后能促进酒中乙醇的排出,从而达到解酒的目的。
2. 香蕉
香蕉还有解酒作用,因为香蕉中含有丰富的果糖,进入人体后可以稀释酒精,所以可以解酒。

3. 糖水
适量白糖和开水混合,甜度视醉度而定,稍凉片刻即可饮用。糖分进入人体后,会增加体内血糖浓度,降低血液中酒精浓度,加速体内酒精的排出,从而达到醒酒的目的。
4. 蜂蜜水
其实酒后喝点蜂蜜水可以有效减轻酒后头痛的症状,蜂蜜可以促进人体对酒精的吸收从而减轻酒后头痛的症状,此外,蜂蜜还有镇静催眠的作用. 多吃蜂蜜对皮肤和胃都有好处。

5.葛根水
葛根泡水喝,不管是喝前还是喝后,都有很好的效果。饮酒前先喝葛根水,可预防酒精对肝脏的损害。酒后饮用可起到醒酒作用。
6.番茄
番茄中的果糖、葡萄糖和维生素对肝脏和心脏都有保健作用,而且果糖还是解酒醒酒的好味道。酒后吃几个西红柿,可使头晕逐渐消失。
7.红薯
将生红薯磨碎,加入适量白糖,搅拌均匀后服用。
8.绿豆
绿豆适量,用温水冲净,捣烂,用沸水冲净或熬汤食用。
9.甘蔗
1 根甘蔗,去皮并榨汁。
10.盐水
在开水中加少许盐,喝下醒酒。
11.柑橘皮(陈皮)
将陈皮烘熟,研末,加食盐1.5克煮汤。
12.白萝卜
白萝卜1公斤,捣成泥取汁,分次服用。也可以在白萝卜汁中加入适量的红糖饮用,也可以生吃萝卜。

编辑
这些用食物解酒的方法虽然看似简单,但是却能够起到解酒作用。如果你也喜欢喝酒,经常喝醉,那么学习一些有效的解酒方法就显得非常重要了。对于喜欢喝酒的朋友而言,为了整体健康,请根据自身情况适度饮酒,尽可能避免过量饮酒。
总的来说,适量酒精可能给人体带来好处,尤其对自身免疫性疾病具有保护作用。低剂量酒精可能通过增加Akk菌等保护性肠道微生物,并有助于增加乙酸盐、多不饱和脂肪酸等,间接产生积极影响。
而高剂量酒精则可能带来不利影响,破坏肠道屏障的稳定性,增加肠道通透性,导致微生物成分进入循环系统,引发肝脏和其他器官的炎症反应;并可能导致肠道微生态失调、肠道菌群产物、脂多糖增加;导致单核细胞、T 细胞、细胞因子、IgG 水平以及 B 细胞减少;进而影响酒精性肝病、肥胖、胃肠道疾病、心血管疾病等发生和发展。
此外,饮酒还会影响肠道微生物组影响社交行为和精神障碍。因此,保持健康的肠道微生物组对于预防和治疗与饮酒相关的疾病具有重要意义。
未来的研究应该进一步探讨肠道菌群与酒精代谢和酒精成瘾之间的因果关系,肠道菌群的调节可能成为预防和治疗酒精成瘾的新靶点。
主要参考文献:
Jew MH, Hsu CL. Alcohol, the gut microbiome, and liver disease. J Gastroenterol Hepatol. 2023 Apr 25. doi: 10.1111/jgh.16199. Epub ahead of print. PMID: 37096652.
Meroni M, Longo M, Dongiovanni P. Alcohol or Gut Microbiota: Who Is the Guilty? Int J Mol Sci. 2019 Sep 14;20(18):4568.
Caslin B, Mohler K, Thiagarajan S, Melamed E. Alcohol as friend or foe in autoimmune diseases: a role for gut microbiome? Gut Microbes. 2021 Jan-Dec;13(1):1916278.
Zugravu CA, Medar C, Manolescu LSC, Constantin C. Beer and Microbiota: Pathways for a Positive and Healthy Interaction. Nutrients. 2023 Feb 7;15(4):844.
Engen PA, Green SJ, Voigt RM, Forsyth CB, Keshavarzian A. The Gastrointestinal Microbiome: Alcohol Effects on the Composition of Intestinal Microbiota. Alcohol Res. 2015;37(2):223-36.
González-Zancada N, Redondo-Useros N, Díaz LE, Gómez-Martínez S, Marcos A, Nova E. Association of Moderate Beer Consumption with the Gut Microbiota and SCFA of Healthy Adults. Molecules. 2020 Oct 17;25(20):4772
Crews FT, Sarkar DK, Qin L, Zou J, Boyadjieva N, Vetreno RP. Neuroimmune Function and the Consequences of Alcohol Exposure. Alcohol Res. 2015;37(2):331-41, 344-51.
González-Zancada N, Redondo-Useros N, Díaz LE, Gómez-Martínez S, Marcos A, Nova E. Association of Moderate Beer Consumption with the Gut Microbiota and SCFA of Healthy Adults. Molecules. 2020 Oct 17;25(20):4772.
Hernández-Quiroz F, Nirmalkar K, Villalobos-Flores LE, Murugesan S, Cruz-Narváez Y, Rico-Arzate E, Hoyo-Vadillo C, Chavez-Carbajal A, Pizano-Zárate ML, García-Mena J. Influence of moderate beer consumption on human gut microbiota and its impact on fasting glucose and β-cell function. Alcohol. 2020 Jun;85:77-94.
Doremus-Fitzwater TL, Deak T. Adolescent neuroimmune function and its interaction with alcohol. Int Rev Neurobiol. 2022;161:167-208.
Tirado-Kulieva VA, Hernández-Martínez E, Minchán-Velayarce HH, Pasapera-Campos SE, Luque-Vilca OM. A comprehensive review of the benefits of drinking craft beer: Role of phenolic content in health and possible potential of the alcoholic fraction. Curr Res Food Sci. 2023 Mar 4;6:100477.
Caslin B, Mohler K, Thiagarajan S, Melamed E. Alcohol as friend or foe in autoimmune diseases: a role for gut microbiome? Gut Microbes. 2021 Jan-Dec;13(1):1916278.

谷禾健康
胆汁酸是一种代谢胆固醇的物质,它具有两个亲和性不同的区域,即一部分能够与水分子相互作用(亲水),而另一部分则不能与水分子相互作用(疏水)。
由于拥有这种两亲性质,胆汁酸能够在生物体内与胆固醇等脂类物质结合并形成混合物,从而起到降低血液中胆固醇水平的作用。
胆汁酸不仅是代谢胆固醇的物质,还有其他重要的功能。胆汁酸可以通过激活肝脏和肠道中的受体,调节血糖水平、胆固醇代谢和免疫信号等。
其中,初级胆汁酸是由肝细胞合成并储存在胆囊中的,而次级胆汁酸则是由肠道中的微生物代谢初级胆汁酸形成的。
随着研究的深入,发现肠道菌群和胆汁酸在人体健康和疾病中发挥着重要的作用。肠道菌群可以代谢胆汁酸,影响其在体内的水平和作用,从而影响脂质代谢、肝胆功能和肠道健康等方面。
同时,胆汁酸也可以影响肠道菌群的组成和功能,维持肠道微生物的平衡和多样性。因此,肠道菌群和胆汁酸之间的相互作用关系对于人体健康和疾病的发生、发展和治疗具有重要的意义。
肠道微生物主要的代谢产物包括:短链脂肪酸、色氨酸、胆汁酸等。
以往我们写过短链脂肪酸(详见:你吃的膳食纤维对你有帮助吗?)、
色氨酸(详见:色氨酸代谢与肠内外健康稳态 )。
本文我们主要阐述胆汁酸及其代谢,与肠道微生物群之间的关联及其在疾病中的作用。
本文目录/contents
Part1:胆汁酸及其代谢
Part2:影响胆汁酸代谢的因素
Part3:肠道菌群与胆汁酸之间的相互作用
Part4:微生物群-胆汁酸相互作用的影响
Part5:微生物与胆汁酸在疾病中的作用
Part6:调节胆汁酸代谢的方法
Part7:结语
本文提及的专业名词缩写
FXR——法尼醇X受体,胆汁酸是FXR的天然配体,因此FXR又称为胆汁酸受体。
SHP——是LRH-1(肝脏受体同源物-1)在肝细胞激活的主要靶基因,胆汁酸通过LRH-1诱导SHP的表达,表达的SHP结合并失活LRH-1,从而抑制胆汁酸合成相关基因及SHP自身的表达。
TGR5——又称G蛋白偶联胆汁酸受体,是一种胆汁酸受体。在外周组织器官如肝、脾、肾、脂肪等多种组织中表达水平较高,能调控脂类和葡萄糖代谢。
GLP-1——胰高血糖素样肽-1是一种由肠道细胞所分泌的激素,属于一种肠促胰岛素。
FXR-Fgf15轴——回肠肠细胞中FXR的激活释放Fgf15(FGF19是人的同源基因),Fgf15通过门静脉循环到达肝细胞,与FGFR4结合并抑制CYP7A1,从而抑制肝细胞胆汁酸的合成。
当胆固醇在肝细胞内代谢时,会产生一种叫做胆汁酸的化合物。胆汁酸可以溶解脂肪,促进脂肪消化和吸收,同时还能帮助排泄体内多余的胆固醇。
胆汁酸一般可分为初级胆汁酸和次级胆汁酸
初级胆汁酸(primary bile acids):
初级胆汁酸是由肝细胞合成并储存在胆汁中的胆汁酸,它是胆汁中最主要的成分。初级胆汁酸的结构比较简单,含有羟基(-OH)和羧基(-COOH)等官能团,因此具有良好的水溶性。初级胆汁酸可以在肠道中与脂肪结合成胆汁酸盐,参与脂肪的乳化和吸收过程。
初级胆汁酸包括胆酸、鹅去氧胆酸、甘氨胆酸、牛磺胆酸、甘氨鹅去氧胆酸、牛磺鹅去氧胆酸。
次级胆汁酸(secondary bile acids):
次级胆汁酸是由肠道中的微生物代谢初级胆汁酸生成的,也称为微生物代谢产物。次级胆汁酸的结构更加复杂,它经过羟化、氧化、甲基化等反应后形成。次级胆汁酸相对于初级胆汁酸来说,具有更强的亲脂性和生物活性。
次级胆汁酸主要有去氧胆酸、石胆酸、甘氨去氧胆酸、牛磺去氧胆酸、甘氨石胆酸、牛磺石胆酸。
胆汁酸的结构有助于它们的功能。胆汁酸一般由一个甾醇核心组成,该核心由三个六元碳环和一个五元碳环组成,通常具有5β-氢和沿前两个稠合环平面的顺式结构。
一般胆汁酸的结构
Collins SL,et al.Nat Rev Microbiol.2023
胆汁酸的种类由与其结合的羟基、羧基、硫酸根和氨基酸基团的数量和位置决定。羟基和羰基面向甾醇核心的同一侧,而甲基面向相反的一侧。这使得胆汁酸具有两亲特性,因为一侧是疏水的,而另一侧是亲水的。
胆汁酸的不同种类

Poland JC,et al.Physiology (Bethesda).2021
胆汁酸的疏水性取决于甾醇环上羟基和硫酸根的数量和位置,以及胆汁酸是否与氨基酸结合,在小鼠中主要是牛磺酸,在人类中主要是甘氨酸。
胆汁酸的肠肝循环是一个精细调节的过程。
初级胆汁酸由肝脏中的胆固醇通过胆固醇7α-羟化酶(CYP7A1)介导途径或固醇27-羟化酶(CYP27A1)介导途径合成。
然后初级胆汁酸与牛磺酸或甘氨酸结合,储存在胆囊中,然后在摄入食物后分泌到十二指肠中,以促进膳食脂质和脂溶性维生素的吸收。
95%以上的胆汁酸会被重吸收
排入肠道的各种胆汁酸约95%以上要被重吸收。回肠部的重吸收是主动重吸收,其余肠段为被动重吸收,并运回肝脏进行代谢回收。
注:虽然少量初级胆汁酸可以通过被动扩散吸收,但有效吸收需要由回肠上皮细胞中表达的顶端胆汁酸转运蛋白 (ASBT) 介导的主动转运。结合的初级胆汁酸主要由回肠胆汁酸结合蛋白 (IBABP) 通过肠细胞转运。
这个过程在人体中每天发生4到12次,并确保维持胆汁酸稳态。
人体胆汁酸的肠肝循环
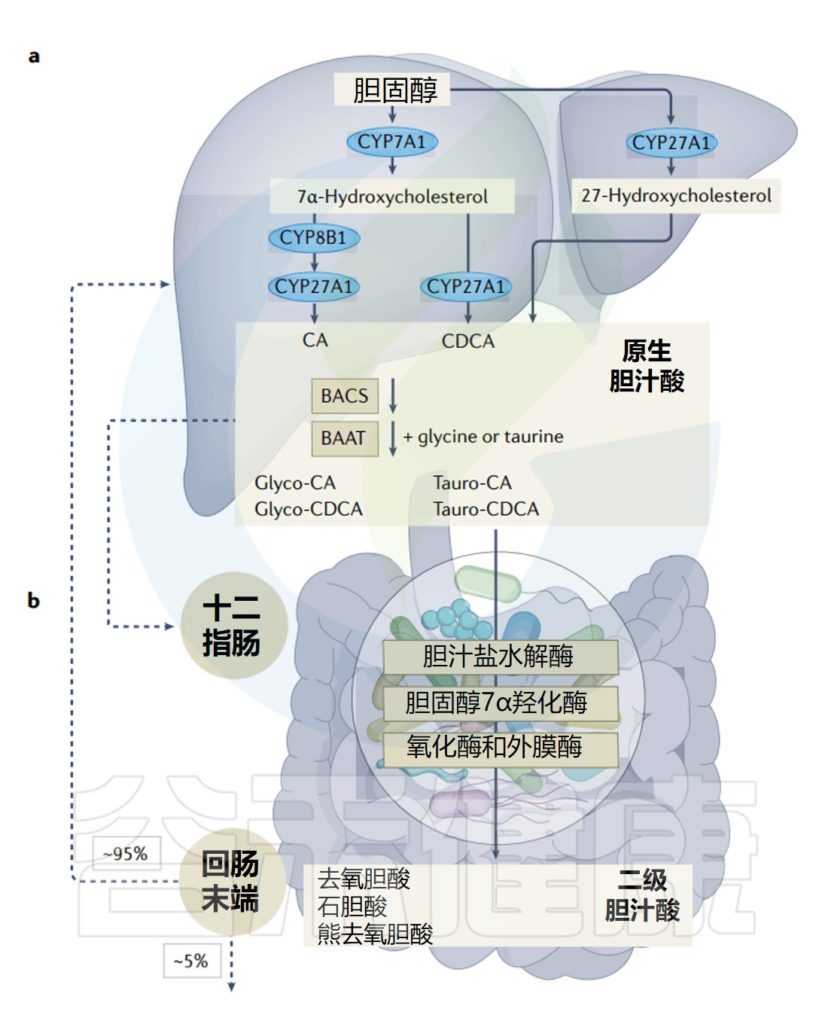
Collins SL,et al.Nat Rev Microbiol.2023
在肠道中,结合的初级胆汁酸受微生物群作用并转化为次级胆汁酸,从而进一步增加胆汁酸库的多样性和整体疏水性。
次级胆汁酸代谢的第一步是通过胆汁盐水解酶(BSH)水解氨基酸部分。胆汁盐水解酶在所有主要的肠道微生物(拟杆菌(Bacteroidetes)、厚壁菌(Firmicutes)和放线菌(Actinobacteria))中都是高度保守的,但由于它们对甘氨酸偶联或牛磺酸偶联的胆汁酸具有优先活性,因此在细菌之间是不同的。
✦细菌对胆汁酸的代谢一般是有益的
细菌胆汁酸去偶联对一般细菌有益,因为它们从氨基酸和宿主那里获得能量,它降低了胆汁酸的毒性。然而,对于胆汁盐水解酶是否对细菌有益存在一些争论。
细菌其他的作用包括氧化,脱硫,酯化和偶联。将在本文后面的章节具体展开描述。
从分类上看,多种细菌都能在体外将氨基酸与胆汁酸结合,其中双歧杆菌(Bifidobacterium)、拟杆菌(Bacteroides)和肠球菌(Enterococcus)的结合量最大。
微生物生产者的胆汁酸代谢

Cai J,et al.Cell Host Microbe.2022
药物、运动、饮食或其他不良状态导致肠道菌群组成或活性的改变都会扰乱胆汁酸代谢。
影响细菌转化胆汁酸的因素
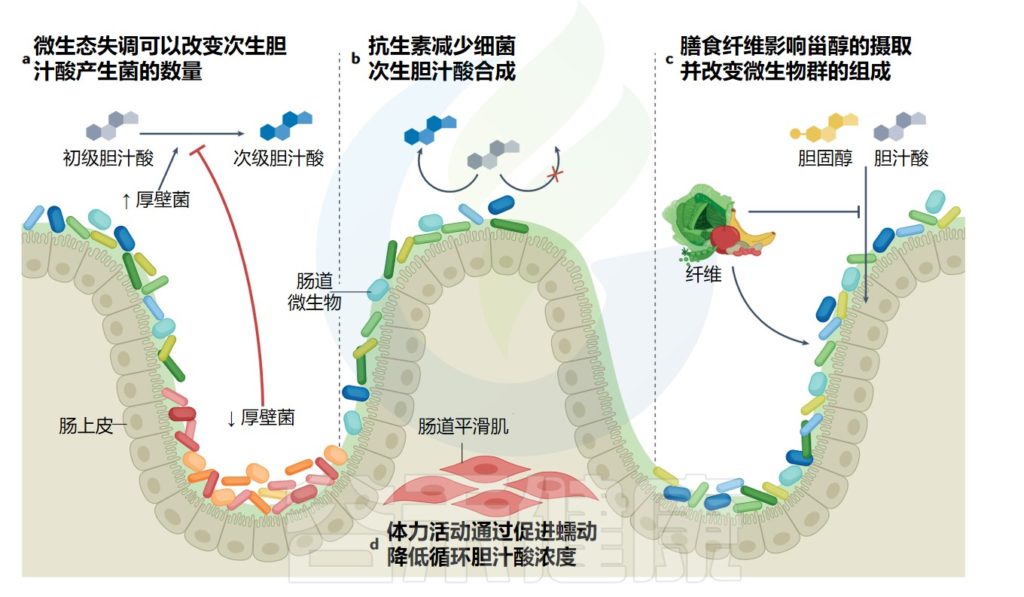
Collins SL,et al.Nat Rev Microbiol.2023
肠道微生物可以代谢胆汁酸,影响其在体内的水平和作用。肠道微生物失调可能会导致胆汁酸代谢紊乱,从而影响脂质代谢、肝胆功能和肠道健康等方面。
具体来说,肠道微生物失调可能会导致以下影响:
•胆汁酸合成减少:肠道微生物可以参与胆汁酸的合成过程,肠道微生物失调可能会导致胆汁酸合成减少,从而影响胆汁酸代谢。
•胆汁酸代谢紊乱:肠道微生物可以代谢胆汁酸,影响其在体内的水平和作用。肠道微生物失调可能会导致胆汁酸代谢紊乱,从而影响脂质代谢、肝胆功能和肠道健康等方面。
•肠道屏障功能受损:肠道微生物失调可能会导致肠道屏障功能受损,从而影响肠道对胆汁酸的吸收和代谢。
•炎症反应增加:肠道微生物失调可能会导致肠道炎症反应增加,从而影响胆汁酸代谢和肠道健康。
因此,保持肠道微生物的平衡和稳定,对于维持胆汁酸代谢的正常和健康具有重要的意义。
抗生素等药物对胆汁酸有着巨大的影响。抗生素治疗对宿主破坏最严重的代谢途径之一是胆汁酸代谢。
•影响次生胆汁酸的水平
随着细菌的耗竭,可用于解除宿主胆汁酸结合的胆汁盐水解酶减少,次级胆汁酸也不再产生。因此,使用抗生素,可观察到共轭胆汁酸和一些次生胆汁酸水平下降。
其他药物,如抗抑郁药物帕罗西汀,也可以扰乱胆汁酸水平。
次级胆汁酸的损失进一步加剧了胆汁酸的失调,因为胆汁酸的生物合成被上调,导致初级胆汁酸库更大。
几项研究将锻炼与不同的胆汁酸联系起来,但结果存在一些矛盾。
•适度运动可增加胆汁酸的排泄
啮齿类动物研究发现,由于胃肠运动或胆固醇摄取增加,适度运动可增加胆汁酸排泄。然而,令人惊讶的是,这些啮齿动物的胆汁酸合成和信号传导不受运动的影响。
•运动可使循环胆汁酸总体减少
在人类中,持续时间的增加和运动的一致性导致血清和粪便胆汁酸的总体减少。这对结直肠癌和非酒精性脂肪性肝病具有意义,其中循环胆汁酸增加与负面结果相关。
注:除了宿主胆汁代谢外,体育活动还可以逆转非酒精性脂肪性肝患者的微生物群失调,这可能导致不同的次生胆汁酸水平。
此外,对运动训练有生理适应的长跑运动员具有较少的诱变性次生胆汁酸。需要更多的研究来阐明体育活动对肠道和肝脏中胆汁酸的影响。
人们早就知道,饮食,尤其是脂肪和纤维的摄入,可以极大地改变微生物群和胆汁酸代谢。
•胆固醇摄入多会提高胆汁酸总体水平
摄入胆固醇会提高人体内胆汁酸的总体水平,因为胆固醇是胆汁酸的前体,并上调胆汁酸的合成途径。
在高脂肪饮食的人群中,由于表达7α-去羟化酶和表达胆汁酸水解酶的细菌数量的增加,次生胆汁酸和非共轭胆汁酸水平特别高。
•纤维诱导胆汁酸的排泄、抑制其吸收
相比之下,膳食纤维可以在胃肠道消化过程中通过吸附作用促进胆汁酸的排泄以及抑制胆汁酸在肠道的吸收。
高脂肪、低纤维饮食的胆汁酸特性与结肠癌患者有关。最近的一篇文章表明,小鼠的热量限制减少了总胆汁酸,包括石胆酸和去氧胆酸,也减少了总微生物群的含量。
•肝胆系统疾病会导致胆汁酸代谢紊乱
肝胆系统疾病如肝硬化、胆囊疾病等可能会影响胆汁酸的合成和代谢,导致胆汁酸代谢紊乱和相关疾病的发生。
肝细胞受到了损伤,就会出现代谢问题,导致患者的总胆汁酸偏高。
•孕妇的总胆汁酸会偏高
怀孕期间孕妇体内的孕激素水平改变会引起胆汁酸代谢异常,从而使得孕妇总胆汁酸偏高
一些遗传因素也可能会影响胆汁酸代谢,特定的宿主基因变异会影响胆汁酸代谢和肠腔内的胆汁酸含量,导致相关疾病的发生。
▼
人类与微生物群的交流部分依赖于宿主受体对微生物代谢物的反应。微生物群通过几种关键的宿主胆汁酸受体调节胆汁酸的代谢和转运。
肠道菌群调节胆汁酸主要体现在生物转化、生物合成和胆汁酸的运输。
胆汁酸信号传导和网络
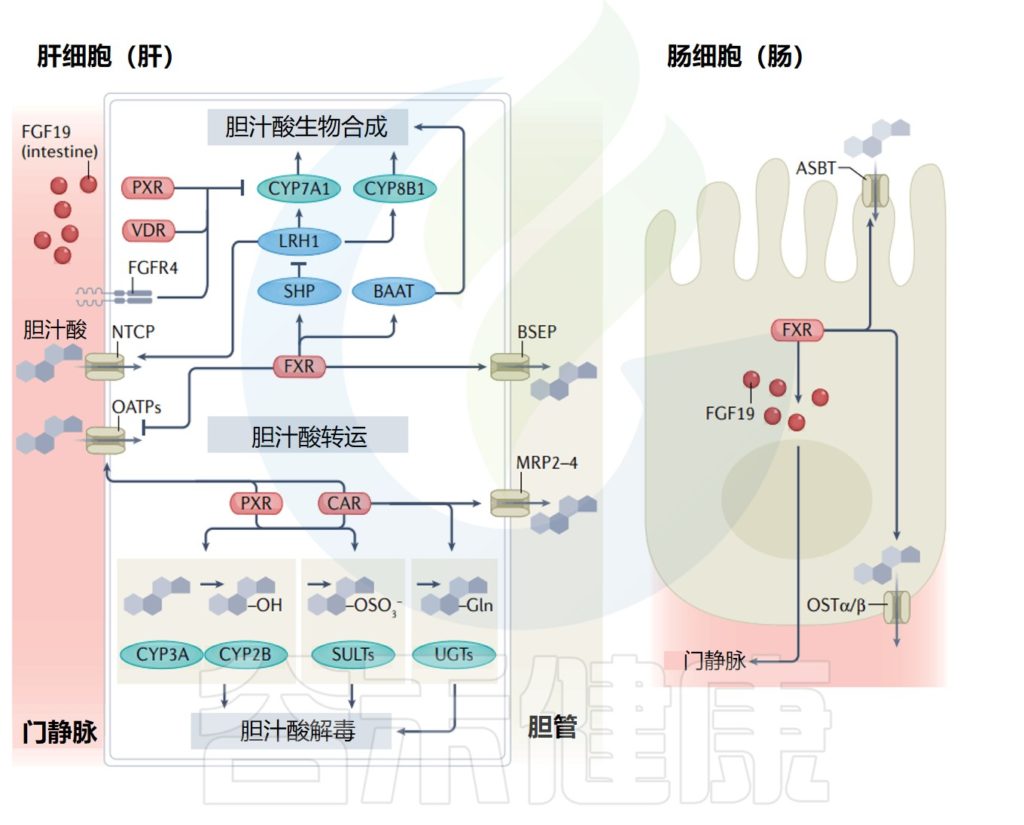
Collins SL,et al.Nat Rev Microbiol.2023
1
肠道菌群调节胆汁酸的生物转化
胆汁酸在肝脏中合成并通过胆道系统释放到肠道,部分释放到远端回肠或结肠,在那里它们被肠道菌群进一步代谢。
✦影响胆汁酸生物毒性和肠道吸收
肠道微生物可以改变胆汁酸,因为它们具有不同的 胆汁酸代谢酶。肠道微生物群通过去结合、7ɑ-脱羟基、异构化、氧化、脱硫和酯化来调节胆汁酸的化学多样性,进而影响其生物毒性和肠道吸收。
去共轭和7ɑ-脱羟基是两个值得注意的反应。
主要通过胆汁酸水解酶进行的微生物去结合是肠道环境中微生物进一步修饰胆汁酸的关键一步。
胆汁酸水解酶编码基因已在各种肠道微生物中检测到并表征,包括双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)、肠球菌(Enterococcus)、梭菌(Clostridium)、拟杆菌(Bacteroides)等。
✦小部分细菌通过脱羟基作用转化胆汁酸
已经表明,怀孕期间分泌胆汁酸水解酶的拟杆菌丰度增加会促进胆汁酸解偶联,从而减少肠细胞胆汁酸的摄取。
胆盐水解酶去结合的胆汁酸随后通过肠道菌群产生的7ɑ-脱羟基作用脱水,并最终转化为次级和三级胆汁酸。
然而,7α-脱羟基作用仅由少数厌氧物种进行,目前的估计表明,只有大约0.0001%的结肠细菌可以进行这种反应,占肠道微生物群总数的不到0.025%。
16S rRNA 序列分析表明,这些细菌主要是梭菌属,包括C.hiranonis、C.scindens、C.hylemonae(簇 XIVa)和C.sordelli(簇 XI)。
在大肠中,梭菌属物种可以通过7α-脱羟基作用将胆酸和鹅去氧胆酸分别转化为去氧胆酸和石胆酸。
✦氧化反应导致差向异构化
氧化和环氧化在胆汁酸的微生物修饰和代谢反应中也受到特别关注,一些肠道微生物合成能够进行可逆氧化还原反应和羟基环氧化的羟基类固醇脱氢酶 (HSDH)。
羟基类固醇脱氢酶(HSDH)活性存在于肠道微生物群的四个主要类别中:
放线菌门(Actinobacteria);
变形菌门(Proteobacteria);
厚壁菌门(Firmicutes);
拟杆菌门(Bacteroidetes)。
这些氧化反应最终会导致差向异构化。然而,由于缺乏合适的分析方法,人们对微生物通过羟基类固醇脱氢酶调节胆汁酸异构化反应的机制知之甚少,但这些反应性胆汁酸的疏水性和毒性是无可辩驳的。
✦肠道微生物的破坏导致胆汁酸代谢紊乱
2019年进行的一项研究支持肠道微生物群的破坏会导致胆汁酸代谢紊乱。这项研究发现,在接受各种抗生素治疗的大鼠的血浆和粪便中,牛磺酸结合的胆汁酸显著增加,而游离胆汁酸减少,胆汁酸的多样性也显著降低。
一项较早的研究还指出,肠道微生物群对胆汁酸有显著影响。无菌小鼠胆汁酸的多样性减少,并且缺乏未结合的和次级胆汁酸。
注:与正常小鼠相比,盲肠、结肠和粪便中的胆汁酸水平降低,但胆囊和小肠中的胆汁酸水平升高。
✦微生物群影响胆汁酸受体信号
实验研究进一步证明了微生物群影响FXR信号。当用tempol处理小鼠时,减少了乳酸杆菌属。及其胆汁酸水解酶改变肠道微生物群的活性,导致厚壁菌门:拟杆菌门比率降低,次级胆汁酸降低,以及牛磺酸-β-鼠胆酸 (T-β-MCA) 积累。
Tempol是一种超氧化物歧化酶(SOD)类似物,可有效中和活性氧。
虽然次级胆汁酸是有效的FXR激动剂,而T-β-MCA是FXR拮抗剂,但抑制胆汁酸受体信号会导致胆汁酸合成增加和胆汁酸库大小增加。
但由于参与胆汁酸脱氢的梭状芽孢杆菌簇XI和XVIa的减少,胆汁酸多样性下降。脱硫弧菌(Desulfovibrionales)也可以逆转这一过程,脱硫弧菌负责从饮食和宿主来源代谢含硫化合物。富含脱硫弧菌的肠道微生物群可以调节胆汁酸的代谢,从而使肠道产生更多的次生胆汁酸。
2
肠道菌群影响胆汁酸的生物合成
✦影响关键酶的表达从而调节胆汁酸的合成
肠道微生物群对胆汁酸形成的调节是复杂的,包括由至少17种不同酶催化的几个反应步骤。然而,更重要的是,肠道微生物群对胆汁酸的代谢会影响许多参与胆汁酸从头合成的关键酶的表达,包括CYP7A1、CYP7B1、CYP8B1和CYP27A1。
在厚壁菌中,可以通过FXR-FGF15/19 反馈机制调节胆汁酸的合成。在肝细胞中,通过来自 SHP/LRH-1/LXRα 的负反馈调节胆汁酸合成。
SHP是LRH-1在肝细胞激活的主要靶基因,胆汁酸通过LRH-1诱导SHP的表达,表达的SHP结合并失活LRH-1,从而抑制胆汁酸合成相关基因及SHP自身的表达。
抑制过程
一旦肝脏FXR被激活,SHP就会立即被触发以抑制LRH转录,从而抑制CYP7A1和CYP8B1转录。在肠道细胞中,FXR通过FXR/FGF19/FGFR4通路抑制胆汁酸合成,其中FXR诱导FGF19/FGF15,后者又与FGFR4和β-klotho复合物结合,触发 MAPK/ERK1/2 通路并最终抑制该基因CYP7A1在肝脏中的表达。
✦没有细菌的情况下无法产生胆汁酸受体激活剂
研究证实肠道在没有细菌的情况下无法产生胆汁酸受体激活剂。肠道微生物群可以通过降低T-MCA水平和促进回肠中FXR依赖性FGF15的表达来抑制CYP7A1和胆汁酸的合成,从而表明肠道微生物群通过FXR-FGF15/19反馈机制调节胆汁酸的合成。
注:正如已经提到的,脱硫弧菌(Desulfovibrionales)衍生的硫化氢除了有利于含7α-脱羟基细菌的生长外,还可以诱导肝脏 FXR 并抑制CYP7A1表达和胆汁酸合成。
3
肠道菌群调节胆汁酸的运输
微生物群还可以通过法尼醇X受体(FXR)反馈机制调节胆汁酸运输。
✦通过影响法尼醇X受体调节胆汁酸的重吸收
肝脏中FXR的激活诱导胆盐输出泵(BSEP)、MRP、OSTα和OSTβ复合物以增强胆汁酸的肝脏消除,同时通过抑制Na+/牛磺胆酸盐对肝细胞中基底外侧NTCP和OATP1B1和OATP1B3的下调来减少胆汁酸重吸收。
肠道中的法尼醇X受体激活上调肠道胆汁酸结合蛋白 ,以促进胆汁盐通过回肠肠细胞,并增强OSTα和 OSTβ表达以帮助胆汁酸从肠道进入门脉循环。
OSTα/β——有机溶质转运蛋白,一种表达在肠上皮细胞基底膜的异二聚体蛋白,主要负责转运胆汁酸入静脉血。
此外,法尼醇X受体可以通过下调ASBT,通过SHP和FGF15/19通路调节肠细胞和胆管细胞对胆汁酸的重吸收。
ASBT——顶端膜钠依赖性胆汁酸转运蛋白
▼
肠道中的胆汁酸被微生物群进一步代谢,进而影响微生物组成。胆汁酸已被证明对肠道微生物群有直接和间接的影响。
胆汁酸是微生物群丰度、多样性和代谢活性的重要决定因素。
1
破坏了胆汁酸不耐受细菌的结构
研究表明,较高的胆汁酸浓度表现出抗菌活性,当胆汁酸不耐受细菌暴露于高浓度胆汁酸时,胆汁酸 会溶解磷脂并分离内在的膜蛋白,导致细胞膜被完全破坏,导致细胞内物质溢出。
除了膜损伤外,胆汁酸还通过干扰RNA二级结构、破坏大分子的稳定性、引起DNA损伤和促进蛋白质错误折叠,从而破坏肠道微生物的组成,从而表现出直接的抗菌活性。
在胆汁酸喂养的大鼠中,厚壁菌门的丰度显著增加,丹毒丝菌(Erysipelotrichi)和梭状芽胞杆菌(Clostridia)中的一些微生物也增加了。
✦胆汁酸的含量对不同细菌作用不同
一般来说,胆汁酸池的减少似乎有利于革兰氏阴性细菌的生长,这些细菌能够产生脂多糖,其中一些具有致病潜力。
相比之下,随着胆汁酸池的增加,观察到革兰氏阳性厚壁菌门的生长,从而促进了次级胆汁酸的产生。
2
影响微生物群的多样性及功能
尽管它们具有毒性作用,但胆汁酸也支持微生物群的多样性。在人体中,牛磺-β-鼠胆酸和牛磺酸胆酸对多种微生物的发展至关重要。
✦胆汁酸的分泌可以提供能量支持微生物多样性
虽然尚未证实其机制,但胆汁酸的分泌可能提供足够的能量来支持大量微生物的多样性。除了成分的改变,胆汁酸还改变了微生物群的功能能力。
例如,去氧胆酸、牛磺胆酸和牛磺酰脱氧胆酸会破坏小鼠中细菌的核苷酸和碳水化合物代谢。
3
抑制细菌的过度生长
研究发现小鼠肠道微生物群落过度增殖和细菌易位,通过使用口服胆汁酸,以诱导法尼醇X受体激活,从而抑制细菌过度生长。
✦胆汁酸受体诱导抗菌肽和宿主免疫反应
这是因为法尼醇X受体可以诱导参与肠道保护的基因,法尼醇X受体诱导抗菌肽产生和宿主免疫反应调节来塑造微生物组。
在回肠中缺乏法尼醇X受体受体表达细胞的小鼠也表现出肠道微生物数量的变化,拟杆菌和厚壁菌的数量分别增加和减少。其主要原因是法尼醇X受体敲低后胆汁酸的合成增加,这表明胆汁酸可以抵消法尼醇X受体信号通路,从而影响肠道微生物的组成。
小结
一般来说,肠道微生物群和胆汁酸之间存在双向相互作用。
肠道微生物群可以调节胆汁酸的合成和代谢,相反,胆汁酸可以改变肠道菌群的组成。
因此,维持胆汁稳态对肠道微生态非常重要。然而,还需要更多的研究来了解胆汁酸对肠道微生物群的功能操作如何影响宿主-微生物群的交流。
微生物群和胆汁酸之间的相互作用会影响肠道屏障功能的维持,调节先天免疫和适应性免疫,并调节定植抵抗力。
胆汁酸对宿主细胞的影响主要由膜相关和胆汁酸受体介导,包括法尼醇X受体(FXR)、G蛋白偶联受体5(TGR5)、孕烷X受体(PXR)和维生素D受体(VDR)。
FXR和TGR5在肝脏、回肠远端和结肠、上皮细胞、内皮细胞和免疫细胞中高度表达。除了在调节胆汁酸合成中的作用外,这两种受体对于维持肠道屏障完整性和限制炎症都是必不可少的。
注:胆汁酸激活TGR5的能力不同,顺序为石胆酸>去氧胆酸>鹅去氧胆酸>熊去氧胆酸>胆酸。
肠上皮细胞形成紧密连接的能力对于肠屏障的形成和维持至关重要。几项研究支持胆汁酸在调节紧密连接功能中的作用。
胆汁酸介导的肠道屏障功能调节
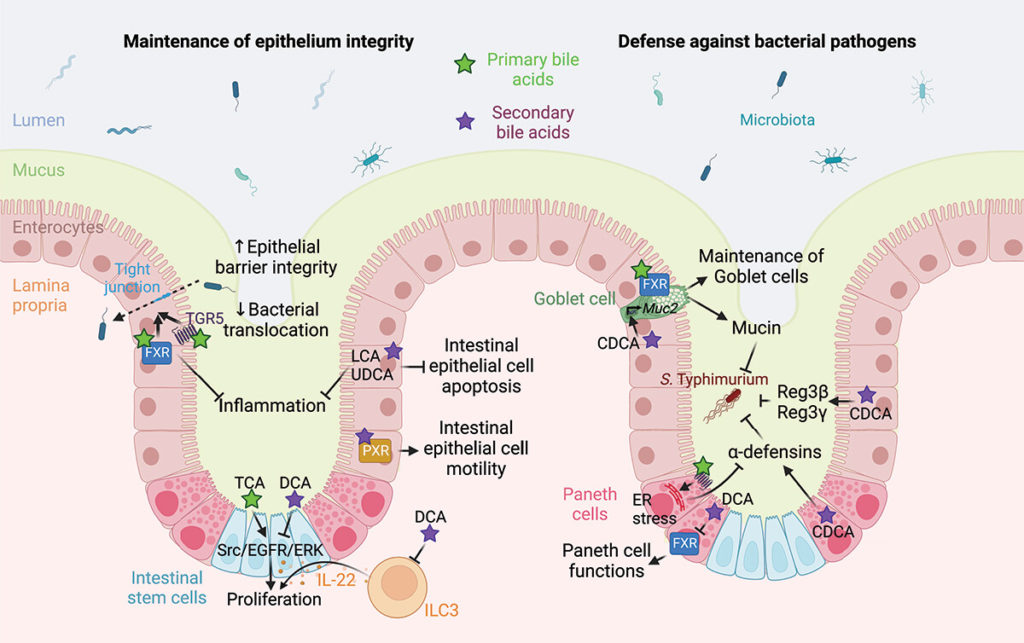
Larabi AB,et al.Gut Microbes.2023
▷肠道通透性与胆汁酸浓度有关
在喂食高脂肪饮食的小鼠和大鼠中,肠道通透性增加和紧密连接蛋白表达减少与盲肠和血浆胆汁酸浓度的改变有关,总胆汁酸库和次级胆汁酸增加。
法尼醇X受体缺失会增加肠道通透性
胆汁酸对肠上皮完整性的调节是由其激活受体的能力介导的。在小鼠和大鼠胆管结扎胆汁流阻塞模型中,法尼醇X受体的缺失增加了肠道通透性和细菌移位,并降低了紧密连接蛋白的表达。
同样,在化学诱导的结肠炎小鼠模型中,法尼醇X受体的激活限制了上皮屏障的通透性并防止了肠道炎症。
法尼醇X受体在肠上皮稳态中的作用是通过FGF蛋白介导的。补充喂食去氧胆酸的小鼠会出现生态失调,这会减少胆汁酸去结合,从而限制FXR-FGF15轴的激活并损害粘膜屏障功能。
G蛋白偶联受体5缺陷小鼠肠道通透性增加
此外,与野生型小鼠相比,G蛋白偶联受体5缺陷小鼠表现出紧密连接的表达改变、肠道通透性增加并且更易患化学诱导的结肠炎,表明这种胆汁酸受体在维持肠道屏障中的作用。
▷诱导上皮细胞增殖
胆汁酸还诱导肠上皮细胞增殖并限制细胞凋亡。在小鼠中,次级胆汁酸石胆酸和熊去氧胆酸可防止肠道炎症并限制上皮细胞凋亡。胆汁酸通过作用于肠道干细胞中的G蛋白偶联受体5受体来促进上皮再生。
牛磺胆酸诱导肠上皮细胞增殖
在体外,化学激动剂对法尼醇X受体的刺激增加了肠上皮细胞的运动和伤口闭合。牛磺胆酸通过表皮生长因子受体(EGFR)和胞外调节蛋白激酶(ERK)激活在体外诱导肠上皮细胞增殖,而去氧胆酸通过法尼醇X受体依赖性机制抑制细胞增殖。
最后,高脂肪饮食诱导的去氧胆酸增加通过减少3型先天淋巴细胞的数量来减少肠道干细胞的增殖和分化,从而减少潘氏细胞和杯状细胞。
▷调节粘液层的形成和组成
胆汁酸还调节粘液层的形成和组成,粘液层由浸泡在抗菌药物(如防御素)中的粘蛋白组成。
补充鹅去氧胆酸粘蛋白转录增加
在化学诱导的结肠炎小鼠模型中,法尼醇X受体的激活可防止产生粘蛋白的杯状细胞的损失。补充鹅去氧胆酸饮食的小鼠表现出潘氏细胞α-防御素的表达增加,杯状细胞Muc2(粘蛋白2-编码基因)的转录增加,回肠上皮C型凝集素Reg3β和Reg3γ的合成增强。
次级胆汁酸去氧胆酸具有刺激作用,而熊去氧胆酸在体外抑制人β-防御素-1和β-防御素-2的表达和分泌,这可能对维持肠道稳态也有影响。
微生物群产生的胆汁酸调节免疫的不同方面,包括诱导炎症基因募集先天性和适应性免疫细胞。
微生物衍生的胆汁酸调节肠道先天性和适应性免疫
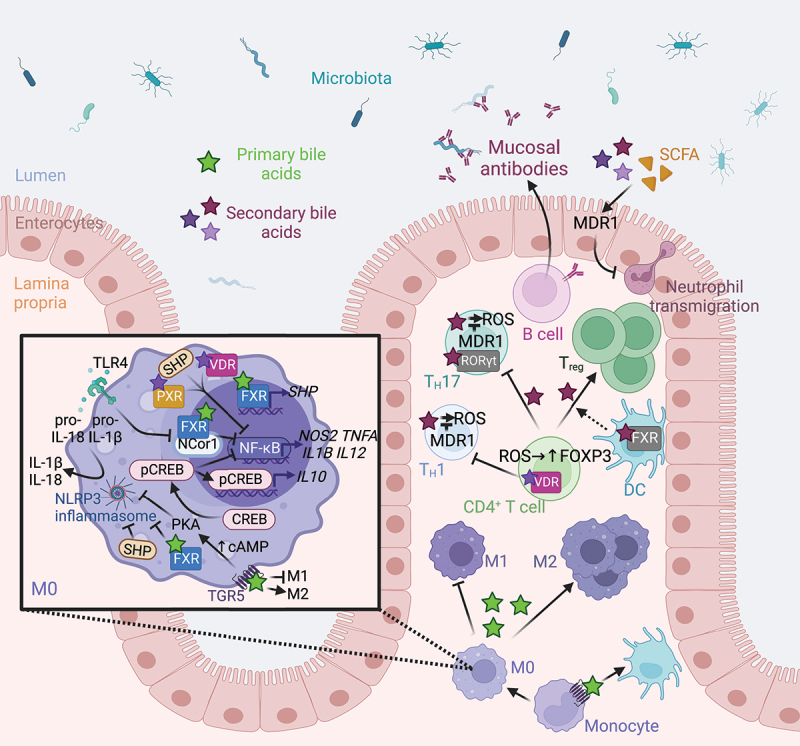
Larabi AB,et al.Gut Microbes.2023
▷调节促炎基因表达
胆汁酸受体FXR、TGR5和PXR调节促炎基因表达。在化学诱导的结肠炎小鼠模型中,FXR缺陷恶化,而FXR激动剂奥贝胆酸治疗可防止粘膜炎症并促进抗菌基因的表达。
胆汁酸受体影响促炎基因的表达
此外,法尼醇X受体可以通过直接结合促炎基因的启动子,以不依赖于SHP的方式调节促炎基因的表达。
病原体相关分子模式激活Toll样受体4会导致促炎基因启动子释放NCor1,从而激活其转录。最后,孕烷X受体和维生素D受体直接抑制NF-κB信号,从而减少促炎反应。
▷限制炎性体的产生
胆汁酸也限制炎症小体的激活。FXR和SHP通过与NLRP3炎症小体和胱天蛋白酶-1的物理相互作用来抑制炎症小体的组装,而TGR5环磷酸腺苷(cAMP)途径的激活通过诱导其泛素化来阻断NLRP3炎性小体的激活,这最终限制了白细胞介素-1β和白细胞介素-18的产生。
施用胆汁酸可减轻部分炎症
将去氧胆酸和石胆酸直肠给药于各种小鼠结肠炎模型可减轻炎症,部分是通过作用于TGR5受体。因此,溃疡性结肠炎患者体内菌群失调引起的次级胆汁酸缺乏可能会促进炎症,而炎症可以通过恢复次级胆汁酸水平得到缓解。
相反,另一项研究报告称,结肠中的去氧胆酸给药可部分通过刺激组织蛋白酶B释放来激活 NLRP3 炎性体,这会增加巨噬细胞分泌白细胞介素-1β并加剧结肠炎。
鉴于结肠炎模型中次级胆汁酸的相反作用,需要进一步的研究来更好地了解其在肠道炎症中的作用。
▷影响免疫细胞的募集和分化
胆汁酸还指导各种免疫细胞的募集和分化。与野生型小鼠相比,法尼醇X受体缺陷小鼠在结肠炎期间表现出炎症细胞募集减少。
接受鹅去氧胆酸补充剂的小鼠表现出向肠粘膜募集的单核细胞、巨噬细胞和嗜中性粒细胞减少,其中鼠伤寒沙门菌(S.Typhimurium)和柠檬酸杆菌(C.rodentium)感染期间B细胞的相对数量增加。
最近的研究表明,次级胆汁酸的氧代、异代和同种异体调节T细胞分化。
在体内,微生物群衍生的IsoDCA通过限制法尼醇X受体活性增加树突状细胞的免疫刺激特性,从而间接促进结肠调节性T细胞的分化。
▷通过抑制中性粒细胞迁移限制肠道炎症
暴露于固有层中的胆汁酸会驱动效应细胞TH1和TH17中的氧化应激。效应T细胞在迁移到回肠时通过上调外源性转运蛋白多药耐药蛋白1(MDR1,也称为P-糖蛋白)的表达来适应,以限制胆汁酸驱动的氧化应激。
胆汁酸与短链脂肪酸协同作用限制了肠道炎症
胆汁酸和微生物群衍生的短链脂肪酸协同作用,调节MDR1的表达,抑制中性粒细胞迁移,从而限制肠道炎症。
总之,肠道微生物组产生次级胆汁酸的能力是调节炎症以及先天和适应性免疫细胞募集、分化和激活的重要因素。
相反,适应性免疫调节微生物群和次级胆汁酸的产生。因此,维持这些因素之间的平衡对于维持肠道稳态是必要的。
微生物群通过竞争资源和产生限制细菌生长的代谢产物,如短链脂肪酸,来保护细菌免受机会性感染。
微生物群衍生的限制细菌生长的代谢产物可以被视为选择最适合环境的代谢特征的栖息地过滤器。微生物群通过与宿主合作来防止机会病原体在肠道定植。
微生物群介导的胆汁酸代谢和对病原体的防御
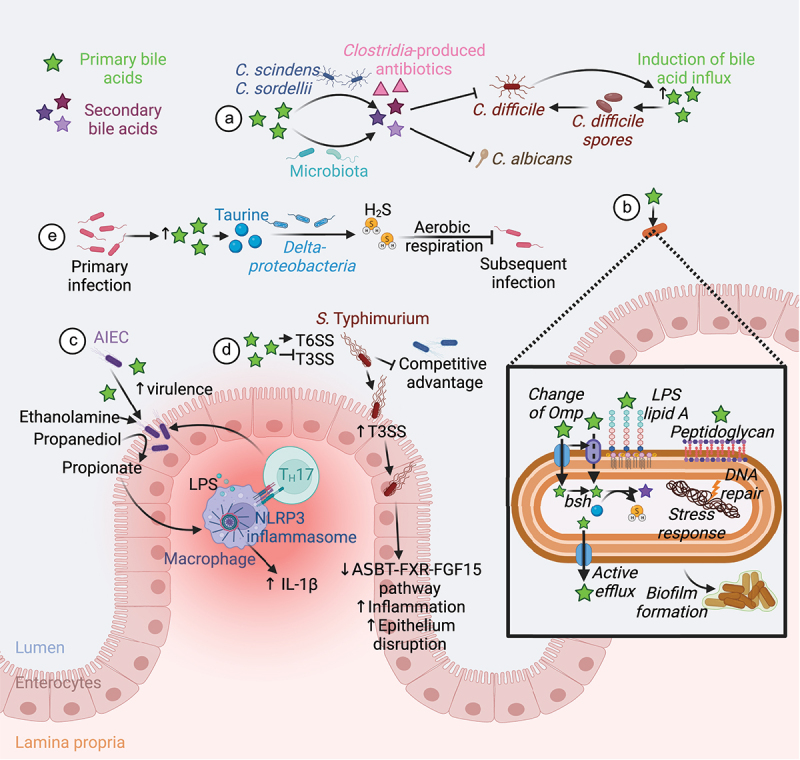
Larabi AB,et al.Gut Microbes.2023
▷增强了对病原体的防御
微生物群对胆汁酸的调节在保护宿主免受致病性感染方面发挥作用。
在人类中,肠道微生物群中胆汁酸水解酶的丰度和活性越高,通过降解激活病原体毒力基因表达的牛磺胆酸,对霍乱弧菌(Vibrio cholerae)感染的抵抗力就越强。
次级胆汁酸对艰难梭菌具有定值抗性
将初级胆汁酸转化为次级胆汁酸的共生细菌提供了对艰难梭菌(C. difficile)的定植抗性。初级胆汁酸可诱导艰难梭菌孢子萌发,而次级胆汁酸对营养细胞有毒。
编码操纵子的共生梭菌通过产生抑制艰难梭菌萌发、生长和毒素产生的次级胆汁酸来保护艰难梭菌不受感染。
石胆酸和去氧胆酸对白色念珠菌具有抵抗性
在体外,次级胆汁酸石胆酸和去氧胆酸对白色念珠菌具有直接的抗真菌活性。相反,通过改变微生物群组成和减少肠道单核吞噬细胞和TH17细胞的数量,向抗生素治疗的小鼠施用牛磺胆酸会加剧白色念珠菌的定植和传播。
因此,微生物群对胆汁酸的作用调节了定植抗性,直接通过抑制病原体生长或间接通过调节粘膜固有和适应性反应。
▷作为致病菌和病原体的环境信号
由于胆汁酸及其代谢产物是肠道环境的关键特征,许多机会性病原体利用这些线索来调节肠道定植所需的毒力因子的表达。
粘附侵袭性大肠杆菌(AIEC) 是一种独特的常驻粘膜相关病理细菌,克罗恩病患者中富含这种细菌。利用特定的肠道环境来增加它们的复制并诱发炎症。
在管腔中,胆汁酸促进AIEC毒力基因的表达,例如有利于细菌在肠道中持久存在的鞭毛蛋白FliC,以及促进细菌与潘氏斑相互作用和生长的长极性菌毛LpF。
此外,胆汁盐的存在激活了次级代谢途径,使AIEC能够使用乙醇胺作为氮源,使用丙二醇作为碳源,从而赋予这些菌株相对于其他共生细菌的竞争优势。但也与脂多糖协同作用,触发白细胞介素-1β的产生和TH17细胞的激活,从而促进T细胞依赖性肠道炎症。
影响病原菌的毒力和运动性
鼠伤寒杆菌(S.Typhimurium)暴露于胆汁会增加其VI型蛋白分泌系统(T6SS)的活性,将具有抗菌活性的效应蛋白输送到邻近细胞,从而杀死共生细菌并成功地在肠道定植。
在霍乱弧菌(V. cholerae)中,初级胆汁酸增加了毒力和运动性。艰难梭菌(C. difficile)在宿主定植过程中诱导胆汁酸快速流入肠道,这有助于孢子萌发和生长。
▷会记住过去的感染,以便在未来更好地抵抗
肠道病原体感染会破坏胆汁酸的回肠吸收和胆汁酸产生的内分泌调节。
表现出更强的定值抗性
实验小鼠在感染假结核耶尔森菌(Y.pseudotuberculosis)数周后,表现出对肺炎克雷伯菌(Klebsiella pneumoniae)更强的定植抗性。
潜在的机制是感染假结核耶尔森菌(Y.pseudotuberculosis),一种侵入回肠派尔氏斑块的肠道病原体,增加了肠道微生物群中Deltaproteobacteria的丰度。
注:Deltaprotoebacteria是一类代谢胆汁酸衍生的牛磺酸的细菌。
Deltaproterobacteria摄入牛磺酸会导致硫化氢的释放,可以通过有氧呼吸抑制肺炎克雷伯菌生长。
Deltaproteobacteria丰度的增加也增强了对柠檬酸杆菌(C.rodentium)的定殖抗性,是一种需要氧气才能在肠道环境中生长的病原体。
这些研究表明微生物群衍生的硫化氢限制了兼性厌氧机会性病原体的生长。
注意
尽管结肠中胆汁酸浓度的增加可能有利于增强定植抵抗力,但胆汁酸浓度过高与炎症性疾病和结直肠癌有关。
因此,需要对胆汁酸代谢进行精细调节,以增强定植抵抗力,同时限制对宿主的有害影响。
肠道菌群和胆汁酸在人体健康和疾病中发挥着重要的作用。肠道菌群可以代谢胆汁酸,影响其在体内的水平和作用,从而影响脂质代谢、肝胆功能和肠道健康等方面。
同时,胆汁酸也会影响艰难梭菌感染、癌变与细胞周期失调。下面谷禾列举了胆汁酸在影响人类疾病中的一些例子。
宿主和微生物群依赖性胆汁酸对人类疾病的影响
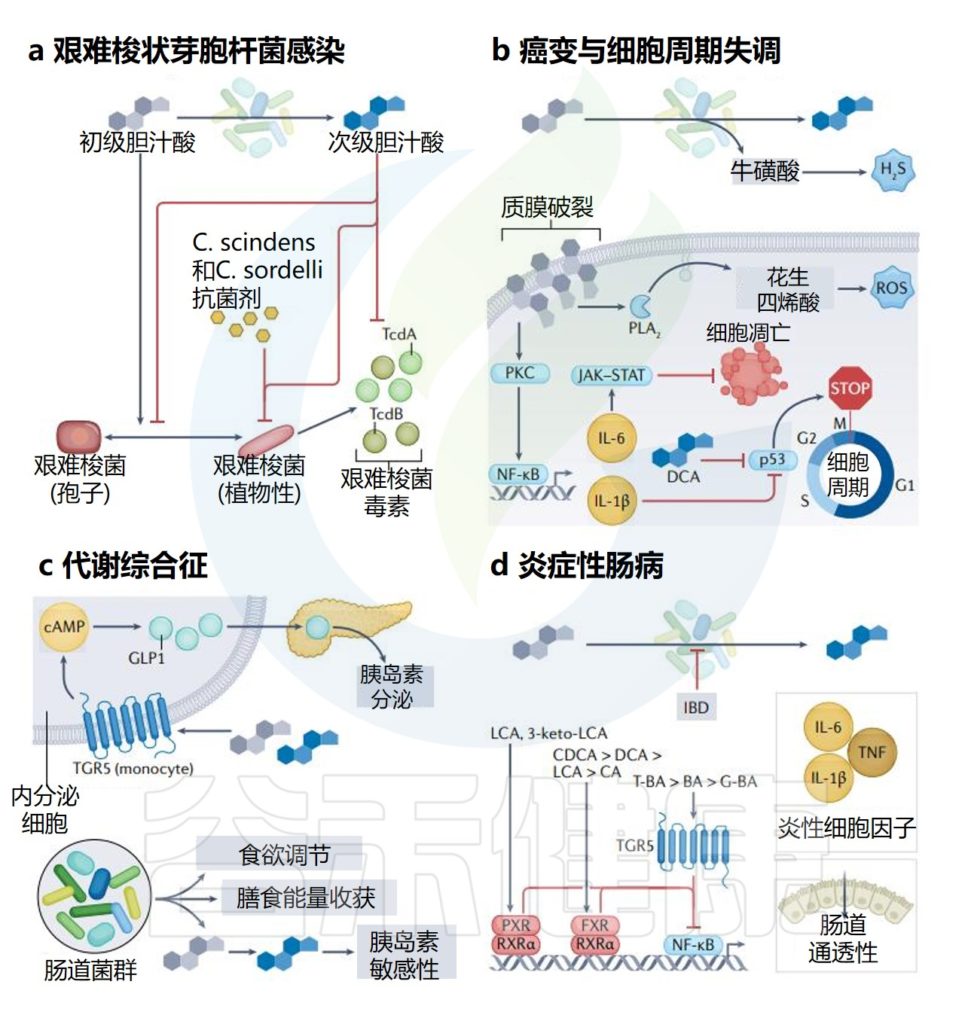
编辑
Collins SL,et al.Nat Rev Microbiol.2023
代谢综合征是指至少有以下三种体征的个体:高血压、肥胖、血液甘油三酯水平升高或血糖水平升高。
患有代谢综合征的人有多种疾病的风险,包括糖尿病、中风、心脏病和结直肠癌。
√肠道菌群改变胆汁酸对代谢稳态非常重要
遗传、饮食和环境都在代谢性疾病中起作用,其中包括微生物群和胆汁酸组成。微生物群通过增加膳食能量收获、调节食欲和改变胆汁酸池对代谢稳态至关重要。
√次级胆汁酸与非酒精性脂肪肝相关
抗生素相关的厚壁菌门细菌丰度减少和次级胆汁酸的消耗与代谢综合征患者胰岛素敏感性降低相一致,而微生物群依赖的次级胆汁酸水平增加与非酒精性脂肪肝相关,强调了微生物群相关胆汁酸对代谢健康的重要性。
√次级胆汁酸影响脂质和葡萄糖稳态
虽然次级胆汁酸可能有助于缓解代谢综合征,但其机制尚不清楚。胆汁酸受体如FXR和TGR5维持脂质(胆固醇和甘油三酯)和葡萄糖稳态。
被胆汁酸激活的受体增加胰岛素敏感性
被胆汁酸激活的TGR5通过诱导胰高血糖素样肽-1(GLP1)的分泌而增加胰岛素敏感性。虽然FXR的激活也会增加GLP1的分泌,但它在代谢性疾病中的作用是复杂的,似乎是特定于环境的。
在一些研究中,激活FXR对胆固醇、甘油三酯和葡萄糖水平有有益的影响。例如,肝脏FXR激活通过抑制SREBP1c脂质生成途径来抑制甘油三酯的产生。
√胆汁酸通过法尼醇X受体活性影响代谢
包括奥贝胆酸在内的强效合成FXR激动剂的临床试验显示,非酒精性脂肪肝患者体重减轻,可能是通过刺激棕色脂肪分化和代谢。
然而,关于奥贝胆酸对非酒精性脂肪肝患者胰岛素抵抗的影响,有相互矛盾的报道。此外,在一些研究中,敲除小鼠体内的法尼醇X受体与激活法尼醇X受体有相似的效果(防止体重增加和增加胰岛素敏感性)。
FXR基因敲除小鼠的益处依赖于微生物群,因为微生物群从这些小鼠转移到无菌小鼠可以减轻体重,降低体脂率和胰岛素敏感性。
因此,在检查胆汁酸对肥胖和代谢性疾病的影响时,应仔细考虑肠道和肝脏FXR活性。
艰难梭菌感染(CDI)是全世界范围内最常见的感染之一,一部分感染者为无症状携带者,严重的患者可能出现腹泻、发烧,甚至会死亡。
当正常的微生物群被抗生素耗尽时,就会出现艰难梭菌感染。抗生素消耗的常驻微生物群减少了分泌抗菌肽的梭状芽胞杆菌(Clostridium spp.)的数量,而梭状芽胞杆菌通常控制艰难梭菌的数量。
√微生物胆汁酸代谢对预防艰难梭菌感染有益
此外,原生微生物群将原发性胆汁酸转化为继发性胆汁酸对于预防艰难梭菌感染至关重要。事实上,抗生素相关的原发性胆汁酸升高和继发性胆汁酸水平降低与复发性艰难梭状芽胞杆菌感染有关。
一些初级胆汁酸会诱导艰难梭菌到产毒状态
微生物胆汁酸代谢对预防艰难梭菌感染的益处是多方面的。某些初级胆汁酸,包括胆酸、牛磺胆酸和甘氨胆酸,可诱导艰难梭菌从孢子萌发到活跃的产毒状态。
次级胆汁酸能直接抑制艰难梭菌的生长
相反,去氧胆酸和石胆酸已被证明能直接抑制艰难梭菌的萌发和生长。这部分解释了为什么编码胆汁酸的梭状芽胞杆菌(如C. scindens)产生次生胆汁酸可以保护艰难梭菌感染。
注:C.scindens和Clostridium也分泌抗艰难梭菌的抗菌剂,与去氧胆酸和石胆酸结合使用更有效。
次级胆汁酸可以降低艰难梭菌毒性
次级胆汁酸也直接结合并隔离艰难梭菌毒素B(TcdB)以降低其毒性。细菌胆汁酸代谢对预防艰难梭菌感染很重要,这一认识可能会提供新的治疗选择。
粪菌移植作为抗生素的替代方法已被证明可以通过恢复次级胆汁酸来成功减轻艰难梭菌感染。
肠道菌群相关的胆汁酸会影响胃肠道炎症和肿瘤的发展。
早在20世纪30年代,去氧胆酸就被证明会引起小鼠注射部位的肿瘤。特别是与高脂肪饮食相结合,两种主要的次级胆汁酸(去氧胆酸和石胆酸)长期以来都与胃肠道癌症有关,特别是结直肠癌和肝细胞癌。
√胆汁酸影响致癌作用
微生物群的组成和胆汁酸合成潜力对炎症和癌症的进展至关重要。
高脂肪饮食更容易发生肝细胞癌
高脂肪饮食喂养的小鼠更容易发生肝细胞癌,部分原因是革兰氏阳性群体增加,它们通过7α-去羟基化酶产生去氧胆酸。
由于其疏水性,次级胆汁酸如去氧胆酸和石胆酸比初级胆汁酸更具有致癌性。在肝细胞癌和结直肠癌中,疏水性胆汁酸的癌症加速是基于它们损伤细胞和诱导炎症的能力。
未结合的疏水性去氧胆酸和石胆酸更容易作为清洁剂破坏细胞膜并诱导细胞损伤反应。
抑制法尼醇X受体活性进一步加剧了次级胆汁酸的致癌潜力。许多研究已经观察到人类结直肠癌中法尼醇X受体激活降低,法尼醇X受体敲除小鼠易患结肠和肝脏肿瘤。
作为胆汁酸的受体,法尼醇X受体是癌症进展过程中脂质代谢和细胞信号中断事件之间的重要联系。
炎症会降低法尼醇X受体的激活从而影响癌变
炎症,特别是通过NF- κB信号通路分泌肿瘤坏死因子和白细胞介素-1β,降低了法尼醇X受体的激活。因此,上述细胞对去氧胆酸和石胆酸的促炎反应会促进癌变。
法尼醇X受体失活还会增加胆汁酸的合成并减少肝细胞的胆汁酸输出,进一步加剧胆汁酸积累介导的损伤和炎症。
细菌水解的牛磺酸偶联胆汁酸的促癌作用的另一种机制已被提出。去偶联释放的牛磺酸最终通过磺酸代谢为硫化氢,这是一种强效致癌物。
√炎症性肠病中胆汁酸代谢失调
炎症性肠病是胃肠道慢性炎症性疾病的集合,最常见的是克罗恩病和溃疡性结肠炎。溃疡性结肠炎只影响结肠,而克罗恩病可以同时影响小肠和结肠。
在炎症性肠病发作期间,肠上皮发炎并失去屏障的完整性。虽然炎症性肠病的病因尚不完全清楚,但与肠道菌群的大规模变化有关。
炎症性肠病中胆汁酸代谢明显失调,特别是当微生物群被破坏时。活动性炎症性肠病患者粪便中共轭胆汁酸水平升高,次级胆汁酸水平降低。
注:一项利用计算预测炎症性肠病患者和健康人微生物群的解偶联和修饰潜能的研究发现,炎症性肠病患者微生物群的胆汁酸代谢潜能受到干扰。
次级胆汁酸受体促进肠上皮再生并预防肠道炎症
次级胆汁酸激活G蛋白偶联受体5(TGR5)可促进肠上皮细胞再生并预防肠道炎症。胆汁酸受体FXR和 TGR5被胆汁酸衍生物或其他激动剂激活,刺激靶向通路以调节肠道稳态,预防炎症和肿瘤发生。
炎症性肠病和结直肠癌中的胆汁酸受体
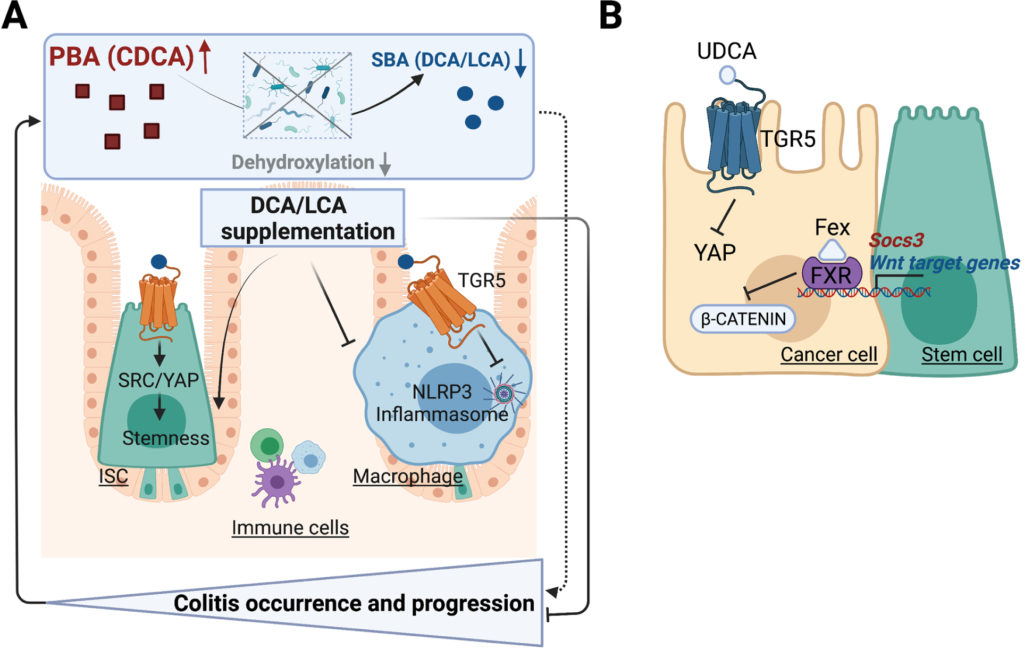
Cai J,et al.Cell Host Microbe.2022
然而,一些因素使胆汁酸、微生物群和炎症性肠病之间的关系复杂化。特别是,活动性炎症性肠病患者肠道转运率的增加减少了总微生物群数量,限制了代谢胆汁酸的足够反应时间。
胆汁酸能预测炎症性肠病的早期缓解
胆汁酸不仅与疾病发生高度相关,而且能够预测炎症性肠病的早期缓解。在最近发表的一项研究中,进行了粪便宏基因组学、血清代谢组学和蛋白质组学,以揭示预测炎症性肠病中抗细胞因子和抗整合素治疗的不同反应的微生物决定因素。
血清胆汁酸,如甘氨石胆酸钠、甘氨脱氧胆酸和熊去氧胆酸的富集可预测接受抗细胞因子治疗的炎症性肠病患者的早期病情缓解。
此外,微生物种类的多样性与与抗细胞因子反应相关的缓解可能性呈正相关,这表明微生物特征可能有利于炎症性肠病的生物治疗反应。
√胆汁酸与结直肠癌发病相关
根据2020年美国癌症协会的统计数据,在美国,结直肠癌是男性和女性癌症死亡的第三大原因。炎症性肠病和结直肠癌密切相关,炎症性肠病被认为是结直肠癌的主要风险因素。
与炎症性肠病类似,结直肠癌也是一种与肠道菌群密切相关的异质性疾病。鉴于肠道微生物群与结肠肿瘤发生之间的联系以及结直肠癌的异质性,多组学技术已被应用于了解疾病的病因学、发现预后或预测性生物标志物以及开发治疗或预防药物。
人体炎症性肠病和结直肠癌中的胆汁酸
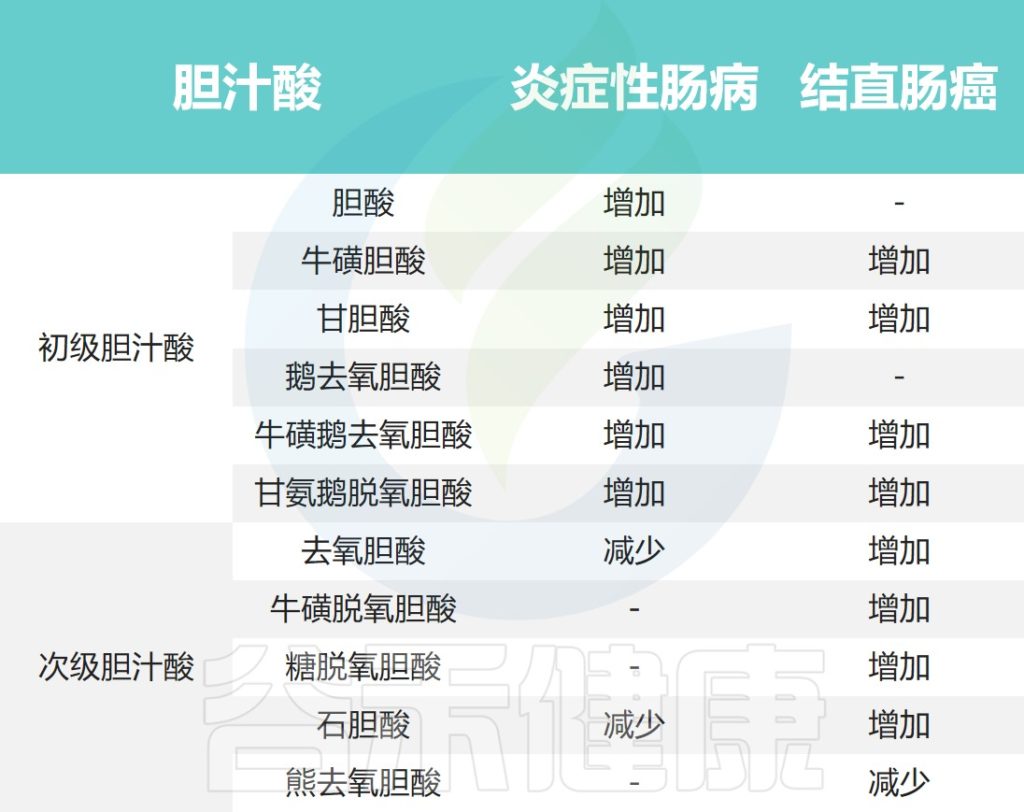
Cai J,et al.Cell Host Microbe.2022
胆汁酸合成基因与结直肠癌显著相关
研究发现胆汁酸合成相关基因的丰度与人类结直肠癌显著相关。
在对来自七个不同国家的八项结直肠癌研究进行的无偏倚荟萃分析中,胆汁酸基因在基因组和转录组水平上都在结直肠癌患者的粪便中高度富集,这可能被用作结直肠癌诊断的替代微生物组标志物。
胆盐水解酶与结直肠癌存在联系
在另一项关于人类微生物组的全球宏基因组研究中,主要来自厚壁菌门的胆汁酸水解酶基因的丰度与结直肠癌呈负相关,这与之前显示结直肠癌患者中厚壁菌门减少的研究一致, 表明胆盐水解酶丰度与人类结直肠癌之间的关系。
胆汁酸含量与肿瘤风险相关的研究:
在一项全基因组鸟枪法宏基因组学和代谢组学研究中,粪便样本取自结直肠肿瘤不同阶段的患者,研究了多步肿瘤发生过程中的微生物组和代谢组学变化。多发性息肉样腺瘤患者的去氧胆酸显著增加。
在欧洲癌症与营养前瞻性调查队列中的一项病例对照研究中,七种血浆胆汁酸的水平,包括甘氨胆酸、牛磺胆酸、牛磺去氧胆酸和甘胆酸等与结肠癌风险呈正相关,而未结合的胆汁酸和三级胆汁酸与癌症风险无关。
其他研究发现,在粪便代谢组学研究中,血清胆汁酸在腺瘤组中升高,并与拟杆菌(Bacteroides)呈正相关而与健康对照相比,结直肠癌患者粪便样本中的熊去氧胆酸有所减少。
一些研究表明去氧胆酸可能有助于结直肠癌的发病机制,不过还需要更多的研究来确定其他胆汁酸,尤其是原发性胆汁酸在人类结直肠癌中的作用。
胆固醇结石病 (GS) 是一种世界范围内流行的疾病,尤其是在西方国家。最近的调查发现,它在中国上海的发病率超过12%。
√胆汁酸分泌异常与胆结石形成相关
导致胆结石的先决生化障碍是胆囊中胆固醇过饱和胆汁的形成。研究中,我们发现胆固醇结石患者和胆结石易感小鼠的粪便中富含脱硫弧菌(Desulfovibrio),诱导胆结石形成。
肝脏胆固醇积聚和胆汁胆固醇分泌增强
我们进一步证明,携带脱硫弧菌与肠道微生物群活化胆汁酸脱羟基作用导致的次级胆汁酸产生增加有关,导致胆汁酸疏水性增加,从而促进肠道胆固醇吸收,导致肝脏胆固醇积聚和胆汁胆固醇分泌增强。
微生物群促进胆固醇结石形成的潜在机制
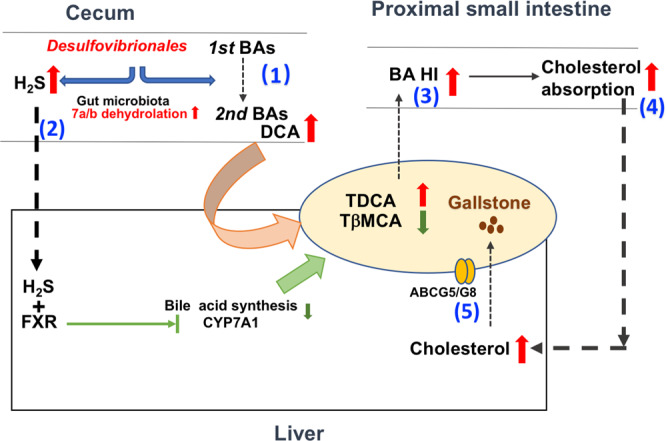
Hu H,et al.Nat Commun.2022
√易患胆结石的微生物群调节胆汁酸的方式:
易患胆结石的微生物群(富含脱硫弧菌)通过以下方式调节肝胆汁酸代谢:
(1) 增加7α-脱羟基细菌在盲肠中产生更多的次级胆汁酸;
(2) 产生硫化氢并调节肝FXR-CYP7A表达,这些物质影响胆汁酸的合成以及在肝脏中的重吸收;
(3) 导致去氧胆酸增加,进而提高胆汁酸的疏水性指数,抑制肝胆汁酸合成;
(4) 促进肠道胆固醇吸收,导致肝脏胆固醇超载;(5) 促进小管胆固醇分泌到胆汁中并诱导胆固醇胆结石形成。
通过改变微生物群的组成或微生物群代谢某些胆汁酸的能力,或通过施用次生胆汁酸,来控制微生物胆汁酸代谢,具有提供健康益处的潜力。
随着研究阐明了特定胆汁酸对健康的确切影响,治疗可以从更普遍的改变微生物群的方法(例如,粪便移植、益生菌和益生元)转向专门针对单个胆汁酸。
粪便微生物群移植是将健康供体的粪便微生物转移到受体患者,最初是为了恢复完整的微生物群而开发的。
•粪菌移植可以治疗艰难梭菌感染
粪菌移植治疗艰难梭菌感染的成功可能部分是由于恢复了依赖胆汁酸水解酶的次级胆汁酸生产。
尽管一些初级胆汁酸,如牛磺胆酸,促进艰难梭菌孢子萌发,但次级胆汁酸去氧胆酸和石胆酸抑制艰难梭菌生长和艰难梭菌孢子发芽,并且它们的水平在艰难梭菌感染抗性个体中升高。
•减轻肠道炎症等相关疾病
虽然粪菌移植在治疗溃疡性结肠炎方面的效果不一,但石胆酸的衍生物3-oxo LCA的恢复与粪菌移植相关,并表明次级胆汁酸在减轻疾病方面的作用。
减少产生胆汁酸水解酶的细菌缓解肠易激综合征
粪菌移植可以通过减少胆汁酸水解酶活性细菌的数量来缓解与腹泻型肠易激综合征相关的次级胆汁酸过量产生。
•粪菌移植也可用于治疗生态失调
粪菌移植也在小鼠身上进行了研究,以治疗观察到微生态失调的各种其他情况(例如衰老)。
粪菌移植缺乏特异性
粪菌移植广泛应用的主要限制之一是其在调节微生物群方面缺乏特异性,这可能导致意想不到的不良反应。
在完整的细菌群落及其对人类健康的影响尚不清楚的情况下,设计一种成功的粪菌移植治疗方法仍然具有挑战性。
具有明确胆汁酸代谢特性的活微生物可用于改变生态失调和疾病中的胆汁酸库。
•使用益生菌更具针对性
与粪菌移植相比,益生菌的优势在于它们更具针对性,具有明确的作用机制。具有7α-去羟基化活性的梭状芽胞杆菌(Clostridium spp.),特别是C.scindens,被证明可以通过产生抑制性的次级胆汁酸来消除艰难梭菌。
注:通过基因工程,来自具有7α-脱羟基活性的细菌的操纵子已被移植,以将这些益处赋予共生产孢梭菌菌株。这种方法可以将胆汁酸合成归因于各种共生细菌,并精确地生成需要的胆汁酸。
生孢梭菌——能够成为具有发展前景的癌症治疗手段
•益生菌可以调节胆汁酸受体
益生菌的使用可以调节胆汁酸受体如法尼醇X受体、维生素D受体的激活。
•益生菌通过调节胆汁酸降低胆固醇水平
益生菌混合物VSL#3可以治疗肠易激综合征和溃疡性结肠炎,但也含有表达胆汁酸水解酶的细菌,可以增加胆汁酸的解结和排泄。
VSL#3通过抑制FXR-FGF15途径上调肝脏胆汁酸生物合成。这种作用可能有利于降低循环中的胆固醇水平。
•益生菌还可以减少肠道炎症和肿瘤形成
然而,同样的益生菌混合物在结直肠癌患者中可能具有相反的恢复法尼醇X受体激活的效果。事实上,施用VSL#3可防止结直肠癌相关的胆汁酸下调,并减少炎症和肿瘤形成。
另一种活性益生菌,罗伊氏乳杆菌NCIMB 30242,在人类中具有类似的抗炎和降胆固醇作用,这表明这些细菌的有益作用依赖于将共轭胆汁酸转化为次级胆汁酸。
与其给药产生胆汁酸的细菌,不如直接给药具有生物活性的次级胆汁酸,因为它们具有相似的预期效果。
•施用熊去氧胆酸可以抑制胃肠道癌症
熊去氧胆酸主要用作抗胆汁淤积剂,是原发性胆道自身免疫性疾病(如原发性胆道胆管炎)患者的主要治疗选择,但也可能抑制胃肠道癌症(如结直肠癌和肝细胞癌)的进展。
注:熊去氧胆酸减轻结直肠癌的发生是由胆汁酸膜受体TGR5介导的。
•施用次级胆汁酸降低了结肠炎的严重程度
胆汁酸也可能有助于结肠炎患者的症状缓解。石胆酸代谢物通过调节转录因子RORγt和产生线粒体活性氧,支持T细胞分化为调节性T细胞而不是促炎性T辅助17细胞。
这种次级胆汁酸介导的对调节性T细胞分化的促进降低了结肠炎的严重程度,并且部分地解释了细菌联合治疗小鼠结肠炎的益处。
•改善肥胖患者胆固醇及甘油三酯含量
熊去氧胆酸和石胆酸均为法尼醇X受体激动剂,可通过FXR-FGF15途径减轻代谢综合征。由于FXR-FGF15的激活,肥胖小鼠在接受熊去氧胆酸和石胆酸治疗后,胆固醇、血浆甘油三酯和血浆脂肪酸水平降低了。
因此,产生这些次生胆汁酸的细菌,如狄氏副拟杆菌(Parabacteroides distasonis),有助于降低高脂血症。
注:合成的FXR激动剂奥贝胆酸是一种被批准用于治疗原发性胆道胆管炎的药物,并且在治疗非酒精性脂肪性肝炎和肥胖症方面也取得了成功。
提示
虽然直接补充胆汁酸可以产生对致癌、结肠炎和代谢综合征有益的结果,但这些效果可能只在治疗期间持续。相反,改变微生物群以增加胆汁代谢可能有助于延长效果。因此调节肠道微生物群的平衡十分重要。
细菌转化胆汁酸的失衡是代谢性、炎症性、感染性和肿瘤性疾病的重要因素,主要通过胆汁酸受体的失调来实现。
由于许多胆汁酸受体在胃肠道以外的组织中表达(例如,脑,T细胞和平滑肌),因此值得进一步研究胆汁酸在其他部位的影响。
随着对肠道菌群和胆汁酸的深入研究,我们将更好地了解它们在人类健康中的作用机制,以及它们与人类疾病的关系。
同时,我们也将探索更多的方法来维护肠道菌群和胆汁酸的平衡,如饮食、运动、药物等。这些研究将为预防和治疗相关疾病提供新的思路和方法,为人类健康事业做出更大的贡献。
主要参考文献
Collins SL, Stine JG, Bisanz JE, Okafor CD, Patterson AD. Bile acids and the gut microbiota: metabolic interactions and impacts on disease. Nat Rev Microbiol. 2023 Apr;21(4):236-247. doi: 10.1038/s41579-022-00805-x. Epub 2022 Oct 17. PMID: 36253479.
Yu L, Liu Y, Wang S, Zhang Q, Zhao J, Zhang H, Narbad A, Tian F, Zhai Q, Chen W. Cholestasis: exploring the triangular relationship of gut microbiota-bile acid-cholestasis and the potential probiotic strategies. Gut Microbes. 2023 Jan-Dec;15(1):2181930. doi: 10.1080/19490976.2023.2181930. PMID: 36864554; PMCID: PMC9988349.
Cai J, Sun L, Gonzalez FJ. Gut microbiota-derived bile acids in intestinal immunity, inflammation, and tumorigenesis. Cell Host Microbe. 2022 Mar 9;30(3):289-300. doi: 10.1016/j.chom.2022.02.004. PMID: 35271802; PMCID: PMC8923532.
Hu H, Shao W, Liu Q, Liu N, Wang Q, Xu J, Zhang X, Weng Z, Lu Q, Jiao L, Chen C, Sun H, Jiang Z, Zhang X, Gu A. Gut microbiota promotes cholesterol gallstone formation by modulating bile acid composition and biliary cholesterol secretion. Nat Commun. 2022 Jan 11;13(1):252. doi: 10.1038/s41467-021-27758-8. PMID: 35017486; PMCID: PMC8752841.
Poland JC, Flynn CR. Bile Acids, Their Receptors, and the Gut Microbiota. Physiology (Bethesda). 2021 Jul 1;36(4):235-245. doi: 10.1152/physiol.00028.2020. PMID: 34159805; PMCID: PMC8526331.
Larabi AB, Masson HLP, Bäumler AJ. Bile acids as modulators of gut microbiota composition and function. Gut Microbes. 2023 Jan-Dec;15(1):2172671. doi: 10.1080/19490976.2023.2172671. PMID: 36740850; PMCID: PMC9904317.
McCarville JL, Chen GY, Cuevas VD, Troha K, Ayres JS. Microbiota metabolites in health and disease. Annu Rev Immunol [Internet] 2020; 38:147–170.