-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

腹泻是常见的健康问题,相信绝大多数人在生活中都曾遭受过腹泻的困扰。
根据2016年柳叶刀期刊统计,慢性腹泻影响全世界 3%-20% 的成年人。全球每年有17亿儿童腹泻病例,腹泻是五岁以下儿童死亡的第五大原因,每年约有52.5万儿童死亡。儿童时期腹泻还可能与营养不良相关,甚至对健康带来终生影响(后面文中会提到)。

全球对所有腹泻原因中特定类型细菌性腹泻患病率的估计包括大肠杆菌10%-25%、志贺氏菌10%、沙门氏菌3%、弯曲杆菌3%-6%。
我国是15个腹泻高发国家之一。十年纵向监测研究显示,主要病毒病原体来自A型轮状病毒和诺如病毒,主要的细菌病原体来自腹泻性大肠杆菌、非伤寒沙门氏菌。
腹泻的种类多、原因复杂,有病原体感染引起的急性腹泻,也有胃肠道疾病、神经系统疾病、食物过敏等伴随的慢性腹泻。
在腹泻期间肠道环境的短暂氧化,专性厌氧肠道菌群急剧消失,肠道菌群可能出现短暂失调。实际上,每次腹泻对肠道引起的波动不容小觑,人体内的肠道菌群相当于“历了个劫”。
DOI: 10.1016/bs.pmbts.2022.08.002
针对腹泻问题的处理,一般人可能认为偶尔腹泻一两天就过去了没什么,甚至有人还觉得拉肚子有助于减肥…
实际上如果不引起重视没有及时干预,或者说身体免疫系统没有将病原体彻底清除,一些病原体残留在体内,可能引起多次腹泻,反复多次后可能逐渐形成慢性腹泻,甚至悄悄延伸到其他慢性疾病。
我们也有时候会看到这样的现象:
– 有些人在腹泻后疲倦了好一阵恢复不过来…
– 在几次腹泻的一段时间后,突然对某些食物开始过敏了…
– 甚至某一天不明所以地出现了自身免疫疾病…
– 也有人在腹泻后突然爆发了一些大面积的皮肤状况…
本文我们就来详细了解一下关于腹泻的病因,腹泻后的肠道菌群有哪些变化,这些变化会不会与其他疾病相关,在与腹泻相关的疾病中肠道微生物群发挥的作用,以及实际应用中的干预措施。

腹泻一般会出现以下症状:
可能还会伴随着:
腹泻可能引起脱水,如果不及时治疗,有可能危及生命。脱水对儿童、老年人和免疫系统功能低下者来说尤其危险。
成人脱水症状:
婴幼儿脱水症状:
★ 感染
感染可能是由于食用了被某种致病菌污染的食物,或饮用受污染的水,其中可能含有细菌、寄生虫等。
常见的感染有:细菌、病毒、真菌、寄生虫等。
★ 旅行者腹泻
旅行者腹泻是由食用被细菌、病毒或寄生虫污染的食物或饮用水引起的。旅行者腹泻最常见的是急性腹泻。然而,一些寄生虫会引起持续时间更长的腹泻。
部分地方可能很难将废水和污水与烹饪、饮用和洗澡的水分开,就比较容易出现腹泻。
★ 药物
许多药物都可能引起腹泻,包括抗生素、抗酸剂(含镁)、口服糖尿病药物、抗癌药物、降胆固醇药、秋水仙碱等。
★ 食物问题
食物过敏:对牛奶、大豆、谷物、鸡蛋、海鲜等食物过敏可能会导致慢性腹泻。
乳糖不耐受:很多人有这个问题。乳糖是存在于奶类和其他乳制品中的一种糖。有乳糖消化障碍的人在食用奶制品后会出现腹泻。
有些人小时候喝牛奶没事,长大后慢慢出现腹泻的情况了。由于人体内帮助消化代谢乳糖的酶会随着年龄的增长有所减少,乳糖不耐受症的情况也会随着年龄的增长而增多。
其他比如说果糖,天然存在于水果和蜂蜜中,有时,也作为甜味剂添加到一些饮料中。对于有果糖消化障碍的人来说,果糖可引起腹泻。
有些人可能吃含糖、辛辣、高脂肪或油炸食品,也会腹泻。食物中成分刺激胃黏膜和肠道,引起胃肠道炎症和蠕动加快,从而导致腹泻。
★ 慢性疾病
★ 手术
许多人在腹部手术后可能会出现腹泻。腹部手术包括对阑尾、胆囊、大肠、肝脏、胰腺、小肠、脾脏或胃的手术。消化道可能需要一段时间才能恢复从吃的食物中正常吸收营养。
关于围手术期相关知识详见我们之前的文章:
★ 营养不良
腹泻是五岁以下儿童营养不良的主要原因。每一次腹泻都会使他们的营养不良更加严重。
对于大多数感染来说,营养不良和腹泻之间的相互作用是双向的。也就是说,营养状态改变宿主对感染的反应,营养不良会导致对肠道病原体的抵抗力下降,增加腹泻的风险;而反复腹泻则会改变营养状态。当感染频繁时,尤其是复发性腹泻病,宿主营养状况也在相应变化且逐渐恶化,导致营养不良,免疫力下降,发育矮小。
关于儿童营养不良我们之前的文章写过,详见:全球队列显示儿童营养不良关键在肠道菌群
▸ 急性腹泻
持续一到两天的稀稀水样腹泻。这是最常见的类型,通常无需治疗,在几天内自行消失。
大多数急性腹泻病例都有感染性病因。
急性腹泻有没有可能发展为其他疾病?
急性感染性腹泻会导致原有的肠道微生态失调恶化,如果这种情况发生在儿童身上,从长远来看,粘膜免疫系统的发育和成熟以及肠道屏障的完整性可能会受到影响,使儿童更有可能因肠漏而患上自身免疫性疾病。(我们在后面会详细讲到)。
▸ 持续性腹泻
持续约两到四个星期的腹泻。
▸ 慢性腹泻
持续超过四个星期或在很长一段时间内有规律地发作和发作。
慢性腹泻通常是腹腔疾病、慢性胰腺炎、病理性胆汁吸收、慢性炎症性疾病的症状,或是药物、进食、肠道手术、放疗的副作用。慢性腹泻也可能继发于肠易激综合征,其特征是与腹痛相关的排便习惯改变(腹泻和/或便秘)。
功能性腹泻是一种特殊类型的慢性腹泻,根据Roma IV临床标准定义为腹泻性大便,发生时间超过25%,在诊断前3至6个月的时间范围内,肠壁没有任何结构异常。
全球每年有17亿儿童腹泻病例,腹泻是五岁以下儿童死亡的第二大原因,每年约有52.5万儿童死亡。
慢性腹泻影响全世界 3%-20% 的成年人。
全球对所有腹泻原因中特定类型细菌性腹泻患病率的估计包括大肠杆菌10%-25%、志贺氏菌10%、沙门氏菌3%、弯曲杆菌3%-6%。
美国细菌性腹泻约占所有腹泻的31%。 导致食源性腹泻的细菌病原体比例为:沙门氏菌15.4%,弯曲杆菌11.8%,志贺菌4.6%,产志贺毒素的大肠杆菌(STEC)约3%。
我国是15个腹泻高发国家之一。以下是一项对我国长达十年(2009-2018年)的纵向监测研究。

▸在患者中检测到的两种主要病毒病原体:
其次是腺病毒和星状病毒。
▸两种主要的细菌病原体:
其次是志贺氏菌和副溶血性弧菌。
▸年龄对病原体检测的影响:
以上我们了解了关于腹泻的一些基本信息,腹泻作为一种常见的消化系统症状,与肠道微生物群的平衡之间有什么关联呢?下一章节我们详细了解一下。
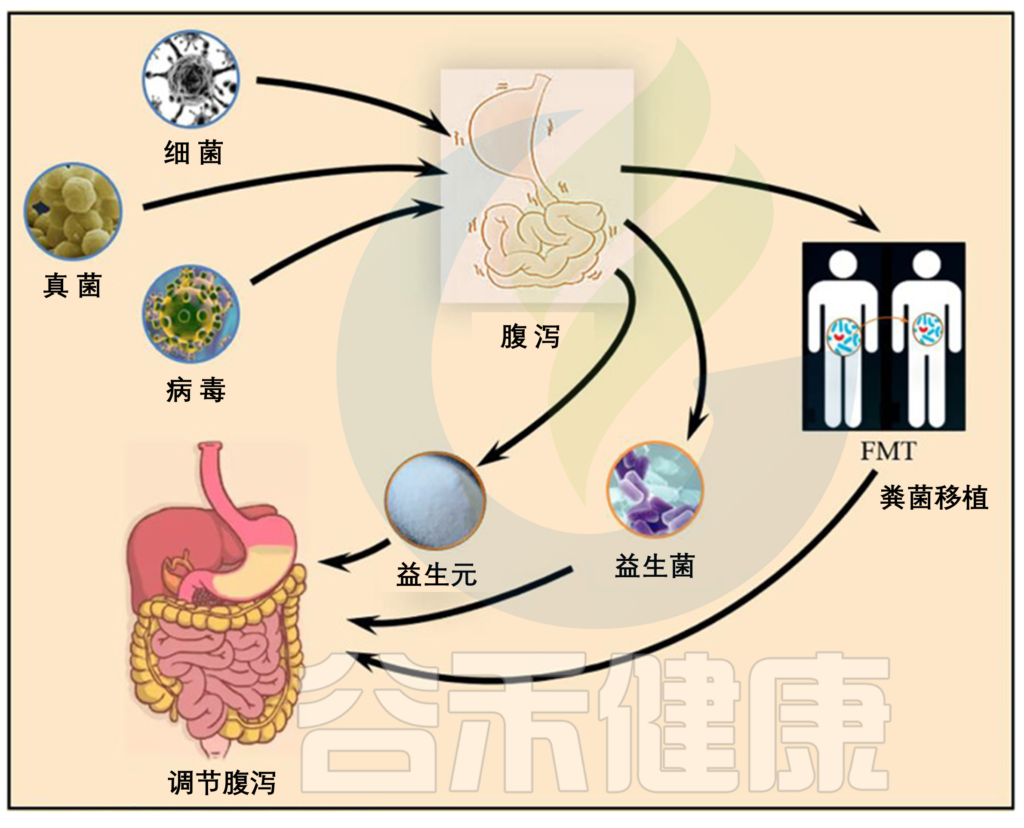
这里我们从两个方面来了解:
下面要介绍的菌群,如果在肠道菌群检测报告中发现超出正常范围,那么腹泻的发生与这些菌群密切相关,在食物卫生方面需要格外留意。
■气单胞菌属 (Aeromonas)
气单胞菌属细菌更常见于海鲜、肉类,有时也存在于蔬菜中。症状往往在食用受污染食品后不久出现,可以持续几天到2周。除了腹泻,一般没有腹痛,呕吐和发烧可能存在,也可能不存在。
■ 蜡样芽孢杆菌(Bacillus cereus)
“炒饭综合征”,即蜡样芽孢杆菌引起的食源性疾病,具有明显的季节性,多发生在6月到10月;蜡样芽孢杆菌污染的食品,外观一般无明显变化,看不到腐败变质现象。潜伏期在1至16小时之间,在这段时间之后,症状才会变得明显,总体短暂仅持续约1至2天。除了大量腹泻,还有呕吐和腹痛。发烧通常不会发生在由蜡样芽孢杆菌引起的细菌性肠胃炎中。
■ 弯曲菌属(Campylobacter)
弯曲菌常见于乳制品、不同肉类和家禽中。潜伏期为2至4天,之后出现症状。整个病程在5至7天之间。呕吐通常不会发生。不过,腹泻时伴有发热、腹痛。
■ 梭菌属(Clostridium)
通常与食源性感染相关的是艰难梭菌和产气荚膜梭菌。
艰难梭菌感染的潜伏期是可变的。艰难梭菌引起的腹泻症状通常在用抗生素后 5-10 天开始,但也可能在第一天或长达 2个月后出现;艰难梭菌的病程也有很大差异。
艰难梭菌轻中度感染症状:
严重感染时通常会脱水,需要住院治疗。
(关于艰难梭菌感染我们在后面还会详细讲)
产气荚膜梭菌感染的潜伏期通常不超过1天,可以短至几个小时,病程大概仅持续约1天。呕吐一般较轻,通常不发烧,但腹泻时确实会出现腹痛。
■大肠杆菌(E.coli)
虽然我们说大肠杆菌自然存在于人类的肠道中,但一些菌株可能会导致严重的疾病。
不同的腹泻大肠杆菌菌株表现出不同的流行病学,并分为肠致病性大肠杆菌(EPEC,婴儿腹泻的主要原因)、肠出血性大肠杆菌,根据病理类型、定植部位、毒力机制和临床症状,可分为肠毒素性大肠杆菌(ETEC,旅行者腹泻和婴儿腹泻的主要原因)和肠侵袭性大肠杆菌。
在食品中,它通常来源于碎牛肉,但也可能在蔬菜中找到,尤其是当灌溉水被人或动物粪便污染时。肠出血性大肠杆菌潜伏期为1至8天,通常持续约3至6天。
通常不呕吐,可能发烧,也可能不发烧,但腹痛伴有腹泻。产肠毒素大肠杆菌的潜伏期为1至3天,疾病持续约3至5天。低烧伴呕吐、腹痛、腹泻。
■ 李斯特菌属(Listeria)
李斯特菌属细菌常见于牛奶和乳制品中。潜伏期约1天,期间无症状。这种疾病往往会持续3天左右。有些人确实会呕吐,但通常并不常见。出现发烧,腹痛可能也可能不会与腹泻同时发生。
■ 邻单胞菌属(Plesiomonas)
邻单胞菌更常见于海鲜中,食用受污染的牡蛎后容易感染。这种疾病往往在食用受污染的食物后很短一段时间内开始,并可持续2周。除腹泻外,呕吐、发热和腹痛等其他症状可能存在,也可能不存在。
■沙门氏菌属(Salmonella)
沙门氏菌是一种革兰氏阴性兼性厌氧细菌,存在于许多不同的食品中,包括乳制品、鸡蛋、肉类、豆芽、黄瓜等。潜伏期可以是几小时到3天。这种被称为沙门氏菌病的疾病可以持续约2至7天。除了腹泻(水样腹泻),还有呕吐、发烧、腹痛、胃痉挛。粪便颜色可能出现绿色。
大多数沙门氏菌引起的腹泻患者可以完全康复。一些沙门氏菌感染者在感染结束后会出现关节疼痛,称为反应性关节炎。一些患有反应性关节炎的人在排尿时会出现眼睛刺激和疼痛。
■志贺氏菌属(Shigella)
志贺氏菌一般分四类:
志贺菌属引起志贺菌病,这是常见的细菌性痢疾类型之一。痢疾志贺氏菌产生志贺毒素,引起细菌性痢疾。宋内氏志贺氏菌毒性不如其他志贺氏菌,但容易暴发和流行。
如果由患病且不保持良好卫生的人处理,任何食品中都会发现这种病毒。用受污染的水烹制的生鲜食品或用受污水污染的水灌溉的蔬菜也可能是一个问题。
潜伏期最长可达2天。志贺菌病通常持续2至7天。表现为高烧、腹痛伴腹泻,即使肠子空了也感觉还需要排便。呕吐通常不会发生。5 岁以下的儿童最容易患志贺氏菌病,但所有年龄段的人都可能患上这种疾病。志贺氏菌感染中约有 5% 具有广泛耐药性。
志贺氏菌等感染后伴随发烧症状,可能是一些人群的肠道屏障薄弱,致病菌就容易进入到血液,引起发烧。大多数志贺氏菌感染是自限性的。
■葡萄球菌属(Staphylococcus)
食品中的葡萄球菌可能存在于乳制品和肉类中。它也可能出现在蛋黄酱等食品中。潜伏期很短,约2至6小时。这种疾病是短暂的,持续时间仅为1天左右。通常不会发烧。出现呕吐、腹痛和腹泻。
■ 弧菌属(Vibrio)
弧菌属细菌通常存在于牡蛎等海鲜中。较为知名的弧菌种类是霍乱弧菌,它是霍乱的病因。它通常通过受污染的水传播。弧菌感染的潜伏期非常短,最多1天左右。这种病最长可以持续5年。
■ 小肠结肠炎耶尔森菌(Yersinia enterocolitica)
小肠结肠炎耶尔森菌通过未充分煮熟的猪肉传播给人类。它也可能通过受污染的水传播。潜伏期可以持续数小时到6天不等。这种疾病最短可持续1天,最长可达45天。通常症状包括发烧、呕吐、腹痛伴腹泻。
如果在这种急性腹泻的时候进行肠道菌群检测,可以对应相关症状,辅助判别引起本次腹泻的病原菌。如果某些菌群超标,则与腹泻相关。
谷禾长期的肠道菌群检测实践发现,很多的健康人或者是说非腹泻人群的肠道菌群检测报告中,也可能会携带以上这些菌群,这是为什么呢?
有些致病菌可能是一过性的,最近旅行,或者吃的不干净的食物中把这些菌带进去了,但是它在健康的肠道中没有定植成功,又从粪便排出体外,因此肠道菌群检测就检出了这些菌。
致病菌也可能悄悄潜伏在身体内,正常情况下没有反应,但当有时候没睡好太累了免疫力低下的时候,或者其他病理炎症感染的时候,或者服用抗生素之后正常菌群一定程度存在失调,这些致病菌趁虚而入,定植成功,就到了它们发挥作用的时候,腹泻也就随之而来。
以上所提及的菌群与腹泻有直接联系,那么在腹泻期间,整体肠道菌群是否会受到影响呢?
一些菌群的变化是否与细菌性感染或病毒性感染相关呢?
我们接着看。
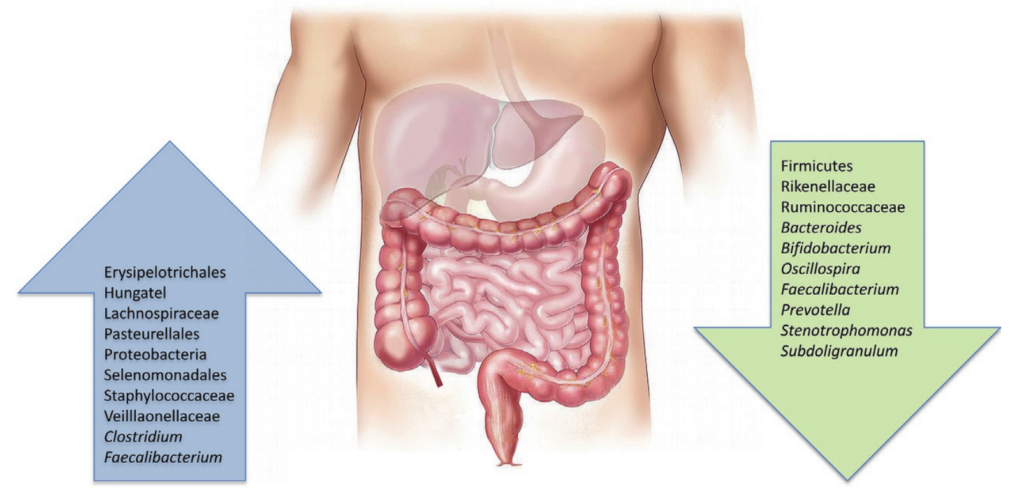
腹泻早期肠道菌群失调
这里将疾病的早期定义为腹泻症状没有消退的时期,通常是在疾病发作或出现在医院后的前三到五天内。
与年龄、位置匹配的健康个体相比,腹泻导致分类丰富度和多样性显著降低。重复冲洗可能会极大地侵蚀微生物群,腹泻粪便中较高的含水量(较低的排便时间)与较低的α多样性有关。
腹泻发作后,兼性厌氧菌的增殖
腹泻发作后,肠道微生物组发生了显著的分类变化,有利于快速生长的兼性厌氧菌的增殖。变形杆菌(主要是肠杆菌科/大肠杆菌)和链球菌(主要是唾液链球菌和Streptococcus gallolyticus)在早期阶段富集最为显著,在粪便微生物群中的相对丰度可能高达80%。
肠道短暂氧化,专性厌氧肠道共生菌的急剧消失
腹泻期间肠道环境的短暂氧化,促进了这些细菌的繁殖,编码低亲和力细胞色素氧化酶的基因相应升高证明了这一点。这种丰度的增加伴随着专性厌氧肠道共生菌的急剧消失(Blautia、Prevotella、Faecalibacterium、Lachnospiraceae、Ruminococceae等),导致相关代谢产物如短链脂肪酸耗竭。
然而,腹泻细菌通常是短暂的和/或低丰度的(第一天的霍乱弧菌除外)。
并不是在所有腹泻患者中都发生菌群失调
部分感染患者的粪便微生物群与健康对照组的粪便微生物组非常相似。特别是,腹泻儿童的肠道微生物组可以分为四种肠道类型,每种类型都以一个分类单元为主:双歧杆菌、拟杆菌、链球菌或大肠杆菌。
目前尚不清楚这些不同的初始配置如何影响临床结果和恢复,但链球菌的相对丰度较高与住院时间或腹泻持续时间呈正相关。
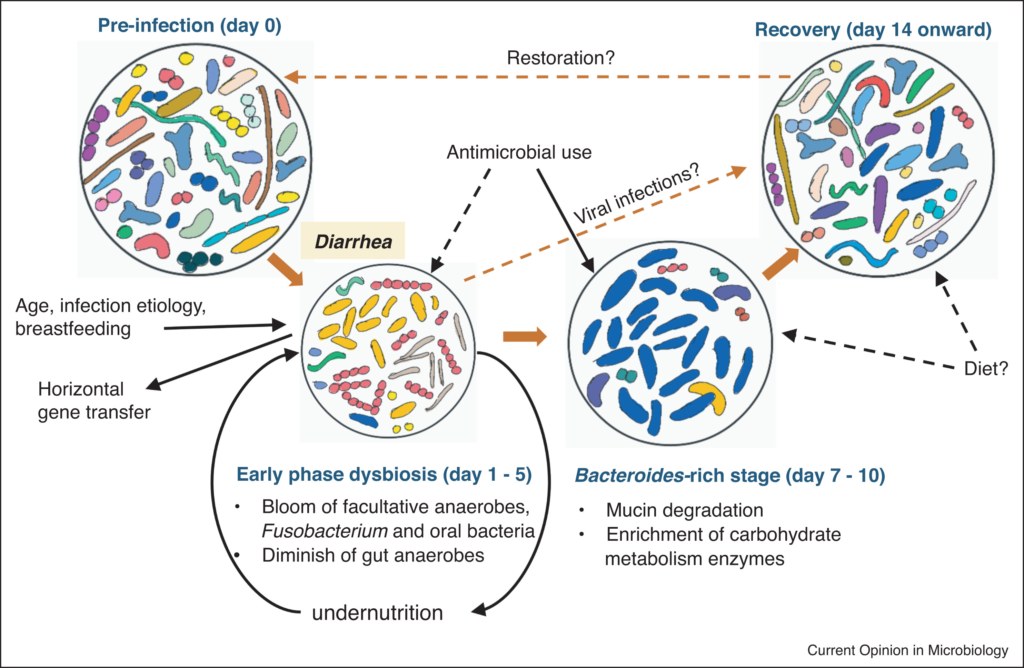
感染性腹泻下的肠道微生物组演替
doi: 10.1016/j.mib.2022.01.006
F. mortiferum过多可能是肠道失调的一般标志
除了埃希氏菌和链球菌,腹泻粪便微生物群中也发现了其他细菌过多,即使在整个肠道微生态没有失调的情况下也是如此。
在越南的研究强调,其中包括 Fusobacterium mortiferum,以及人类口腔微生物群的几个菌(Granulicatella、Gemella、放线菌、Rothia、具核梭杆菌等)。
厌氧F. mortiferum通常在中国人的胃肠道定植(虽然丰度较低),但在西方人群中没有定植,最近在大肠息肉患者中注意到其增殖。
这些结果表明,F. mortiferum过多可能是肠道失调的一般标志,尤其是在亚洲人群中。
口腔细菌与腹泻肠道微生物群的紧密联系
计算分析表明,根据分类群共丰度模式推断,口腔细菌可能在腹泻肠道微生物群中形成紧密的相关网络。这表明它们可能共存于多微生物生物膜中,与口腔中存在的类似,但它们在腹泻病中的意义目前尚未研究。
对健康个体来说,微生物在口腔-肠道轴上的移位是频繁发生的,而腹泻所产生的生态贫瘠环境可能是这些口腔菌群临时定居的理想条件。
不同腹泻病因的菌群存在一些细微的差异
虽然整体的生态失调模式与不同的腹泻病因无关,但存在一些细微的差异。
这可能表明,病毒感染导致厌氧肠道共生菌减少的程度较低,可能是因为大多数病毒(轮状病毒、诺如病毒)感染的是小肠内壁的细胞,而不是结肠。在小鼠模型中,轮状病毒感染仅在回肠微生物群中导致拟杆菌和阿克曼菌群(均具有粘蛋白降解能力)增加,但这两个分类群在人类轮状病毒感染中过度生长的证据尚不确定。
另一方面,贾第虫引起的腹泻,始终与γ变形菌减少和普雷沃氏菌属富集有关。
痢疾(粘液性/血性腹泻)是一种严重的感染性腹泻,肠道炎症加剧,需要抗菌治疗和更长的住院时间。痢疾腹泻中存在过多的兼性厌氧菌(大肠杆菌、链球菌、肠球菌等),同时具有免疫调节作用的细菌(Lactobacillus ruminis, Bifidobacterium pseudocatenulatum)减少。
这些发现表明,细菌感染和痢疾通常伴随着与健康状况进一步不同的失调状态,这可能是病原体引发的炎症和/或频繁使用抗菌药物的影响。
腹泻后恢复阶段
腹泻后恢复期患者的肠道菌群与疾病早期不同,并向健康人群的肠道菌群趋同。恢复阶段标志着肠道微生物群的分类丰富度和多样性逐渐增加,但微生物群落演替在感染个体中显示出较高的时间变异性。
中期:拟杆菌↑↑,晚期:普雷沃氏菌属,产短链脂肪酸菌↑↑
通过对感染了霍乱弧菌和产肠毒素大肠杆菌的孟加拉国患者的研究,研究人员提出了肠道菌群恢复的逐步(中晚期)演替模型。大肠杆菌/链球菌的扩张最终耗尽肠道环境中的氧气,导致其种群在恢复阶段下降。
中期的特征是拟杆菌数量相当丰富(最早出现在发病后的第7天),而晚期则含有更丰富、更多样的普雷沃氏菌属和产短链脂肪酸的厚壁菌。碳水化合物代谢基因(主要为拟杆菌属)在中期富集最显著,使这些细菌能够灵活地从饮食来源和宿主来源的碳水化合物(分别富含纤维和粘蛋白)中提取能量。
这种按时间顺序排列的微生物组合,类似于服用抗生素后肠道微生物组恢复的情况。大量研究指出,经过抗生素治疗后,拟杆菌大量增殖,而厚壁菌和放线菌则减少了。
拟杆菌成为结肠生态恢复的关键物种
类似地,等渗性腹泻诱发短暂的肠道扰动,冲洗后立即出现明显的拟杆菌繁殖。拟杆菌属,如单形拟杆菌(Bacteroides uniformis),多形拟杆菌(Bacteroides thetaiotaomicron),因其粘蛋白降解能力被确定为初级恢复相关类群。通过利用宿主衍生的营养物质,拟杆菌成为结肠生态恢复的关键物种。
这随后启动了一个复杂的交叉喂食网络,以加快其他厌氧菌和产短链脂肪酸的菌(双歧杆菌、玫瑰杆菌、粪便杆菌等)的重新繁殖,从而建立一个分类学和功能多样性的群落。
患者恢复的微生物群是否恢复到感染前状态?
由于缺乏腹泻队列研究,此类数据有限。一项弯曲杆菌人类挑战研究结果表明,在比较恢复期和感染前的微生物组,显著的成分差异仍然存在,恢复期拟杆菌的丰度归因于抗菌药物的使用。
相比之下,在病毒性肠胃炎的康复过程中,拟杆菌富集期的存在并不突出,这可能是由于其不太严重的失调状态和很少使用抗菌药物。
儿童腹泻带来的长期影响
虽然腹泻大多是急性的,但反复腹泻可能会对儿童健康产生终身影响。长期以来,研究表明,腹泻和营养不良相互影响,使儿童在成年后容易发育迟缓、认知障碍和葡萄糖不耐受。
腹泻→多样性↓↓,与发育迟缓相关
秘鲁儿童的纵向微生物组跟踪表明,腹泻频率的增加,大大降低了肠道微生物组的多样性和丰富度,而发育迟缓儿童的这种影响更为严重。发育迟缓还与微生物群恢复速度较慢有关,而长期的扰动反过来又降低了对随后肠道感染的适应能力,形成了腹泻和营养不良的恶性循环。
口腔菌群→肠道定植,可能引发炎症
非洲发育迟缓的儿童的小肠和结肠中口腔细菌过度生长,口腔细菌占优势,如唾液乳杆菌和链球菌。研究人员推测,反复腹泻增加了移位口腔细菌适应紊乱肠道环境的机会,口腔菌群稳定定植可能会引发炎症并改变微生物组的功能。
无症状携带的肠道病原体也会重塑肠道微生物组
感染弯曲杆菌、诺如病毒或肠聚集性大肠杆菌的儿童具有显著更高丰度的Ruminococcus gnavus,它与克罗恩病密切相关,并产生促炎多糖。与腹泻类似,弯曲杆菌的无症状感染与发育迟缓有关,突出了菌群失调在腹泻之外的重要性。
腹泻:耐药基因水平转移,促进新的耐药性表型
肠杆菌科在腹泻早期的扩张,大大增加了它与攻击性病原体的接触,从而增加了水平基因转移的可能性。实验模型已经证实,由于结肠炎诱导的肠杆菌科细菌增多,质粒很容易从沙门氏菌转移到大肠杆菌。
越南的研究发现,共生大肠杆菌和致病性Shigella sonnei中存在相同的多药耐药质粒,这两种质粒都是从一名腹泻儿童身上分离出来的。这表明,一旦病原体进入肠道感染发生率和抗菌药物使用率高的环境,肠道的肠杆菌科可以成为促进新的多药耐药性表型出现的有效宿主。
腹泻后的肠道微生态失调是短暂且可逆的,但其负面影响在脆弱人群中会被放大。
以上是关于感染性腹泻与肠道菌群之间的关联,实际上研究表明,肠道菌群的失调与慢性腹泻之间也存在密切的联系。接下来,我们从具体疾病中一一来看它们之间的关联机制。
腹泻可能是许多疾病的症状。这里我们介绍一些常见的与肠道菌群相关的包括腹泻症状的疾病,例如肠易激综合征、胆汁酸腹泻、乳糜泻、炎症性肠病、抗生素治疗腹泻、放射性腹泻、酮症腹泻等。
IBS的特征是慢性腹痛或不适以及排便习惯改变,其诊断是根据罗马 IV 标准在临床上确定的,该标准将 IBS 定义为过去三个月内平均每周至少一天发生的复发性腹痛,涉及以下两种或多种相关症状:排便、大便频率的变化或大便外观的变化。
IBS的亚类包括:
什么人群更易出现IBS?
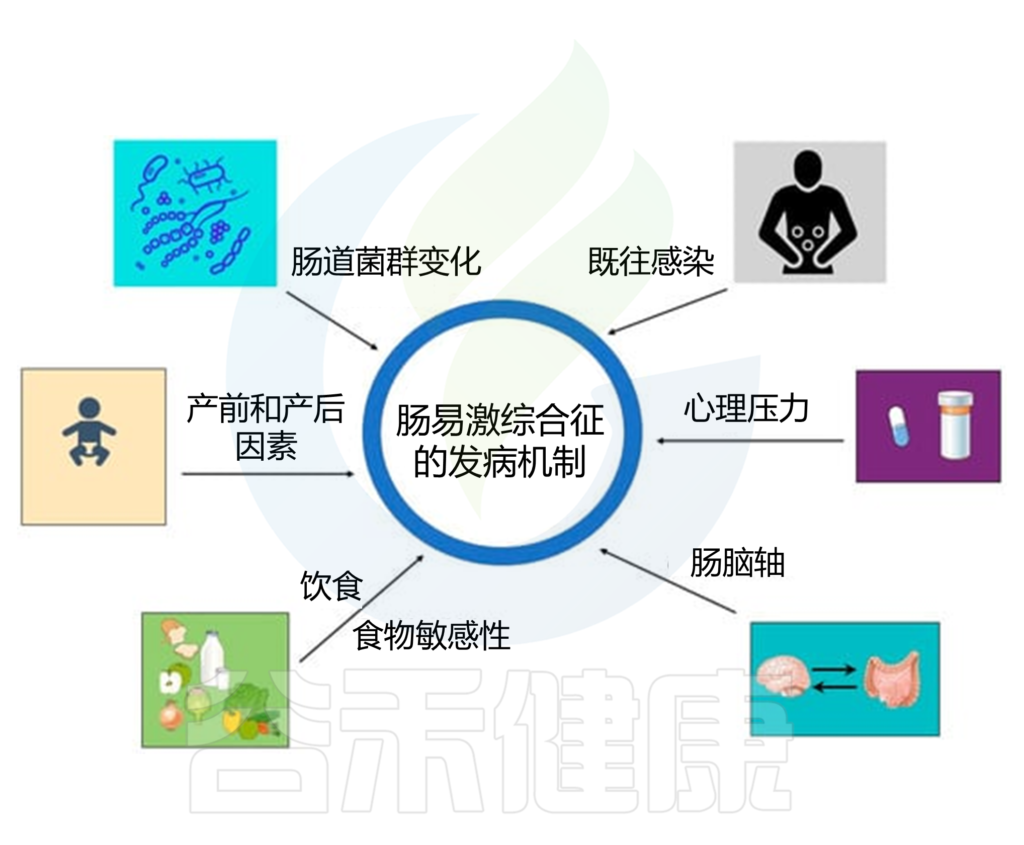
IBS的多种病理生理机制
如运动能力改变、屏障功能受损、免疫激活、内脏过敏和中枢神经系统异常,并可能与个人和环境风险因素有关,包括遗传易感性、压力、抗生素使用、肠道感染、心理困扰、饮食等。
doi.org/10.3390/jcm12072558
脑-肠轴的失调会改变胃肠道系统的运动、感觉、自主和分泌功能,进而改变肠道蠕动、肠道通透性、内脏敏感性和肠道微生物群组成,所有这些都与 IBS 的发病机制有关。
关于内脏敏感详见我们之前的文章:
腹胀、腹痛、肠胃不明原因疼痛?–可能是内脏高敏感,详细了解内脏高敏的原因后果
IBS 中常见的肠道蠕动变化是由血清素代谢改变介导的。肠神经系统的肠嗜铬细胞释放血清素,刺激肠道蠕动并调节分泌和血管舒张功能。肠神经系统失调可导致血清素分泌增加或减少,分别表现为腹泻或便秘。
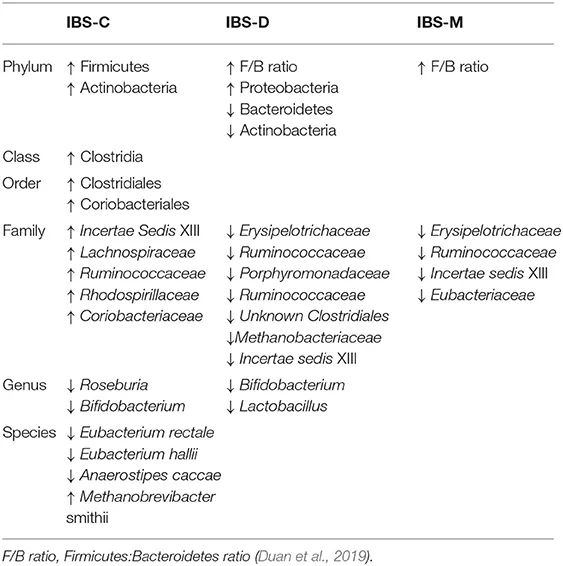
IBS的肠道菌群变化
IBS-D 的特点是粪便微生物群的微生物多样性总体下降,厚壁菌门显著减少,拟杆菌门增加。

多种类型IBS的菌群变化:
低度炎症和免疫功能障碍在 IBS 中发挥作用
研究发现 IBS 患者的促炎细胞因子水平升高,部分原因可能是压力所致。
10%的IBS病例是在最近患有胃肠道疾病的情况下感染后发生的,这通常会导致粘膜和全身炎症。
IBS症状与心理、生理和神经胃肠道因素有关
肠道微生物组的改变也会导致一些炎症和免疫学变化,这些变化可能会通过增加肠道通透性来损害胃肠粘膜屏障。这反过来可能会干扰胃肠道稳态,并使脑-肠伤害感受通路失调,导致内脏过敏或胃肠道疼痛感增强。
IBS相关干预措施
IBS患者饮食方面要注意,豆类、含乳糖食品和人工甜味剂中存在的可发酵低聚糖、单糖、二糖和多元醇 (FODMAP) 由于其发酵和渗透作用,可能会加剧部分患者的症状。
注:FODMAP 在小肠中吸收不良,导致大结肠中的水分吸收增加和发酵产生气体,这可能会导致与 IBS 相关的几种症状,包括腹痛和腹胀。摄入 FODMAP 的渗透效应也可能导致胃肠道系统扩张,并在肠道蠕动异常中发挥作用。
消除 FODMAP饮食 可以改善 IBS 整体症状,消除饮食涉及短时间(即几天到几周)而不是永久地禁食各种食物。
IBS基于病理生理学的分类和治疗建议

四分之一的 IBS-D 患者实际上患有特发性胆汁酸腹泻,接下来我们来看看胆汁酸腹泻。
胆汁酸腹泻
胆汁酸腹泻(BAD)是一种常见的疾病,其起因是原发性胆汁酸流失增加,并可导致微生物群变化,同时与腹泻型肠易激综合征(IBS-D)有重叠之处。
胆汁酸腹泻患者报告的最常见症状是爆发性腹泻、难闻的气味或水样腹泻(80%)、尿急 (85%) 以及腹胀或肿胀 (54%)。
实际上,25-33%的慢性腹泻患者患有原发性胆汁酸腹泻。继发性胆汁酸腹泻继发于终末期回肠切除或发生在克罗恩病或放射线后。
胆汁酸腹泻是怎么回事?
胆汁酸由肝脏产生并储存在胆囊中。吃脂肪食物时,胆汁酸会释放到小肠中分解脂肪,之后胆汁酸被重新吸收并送回肝脏重新利用。通常,只有很少的胆汁酸最终进入大肠。
胆汁酸的正常肝肠循环
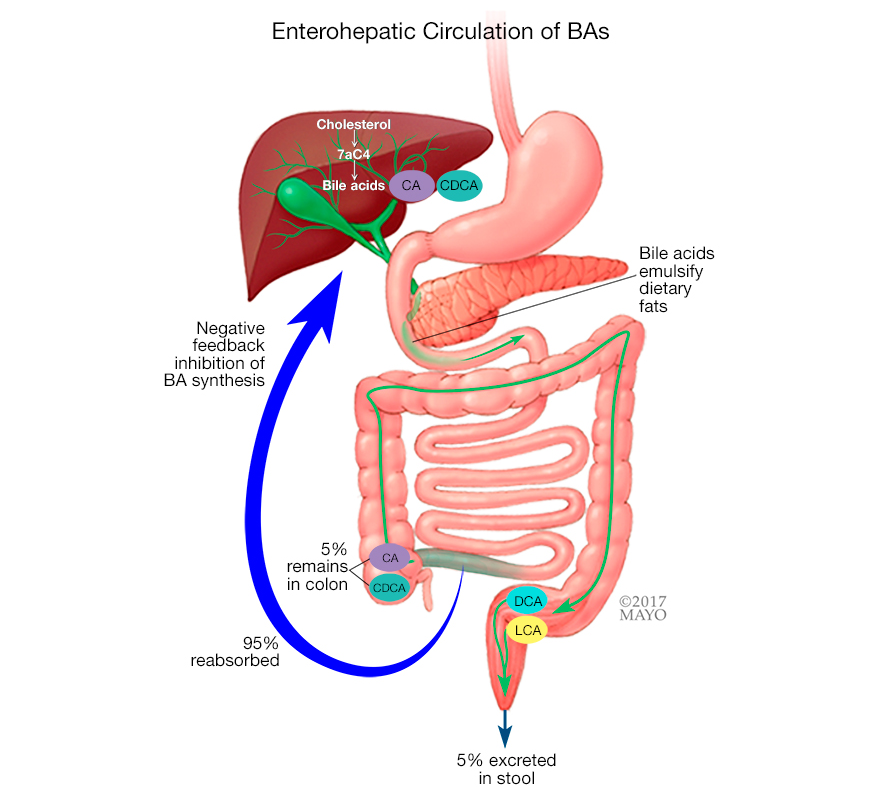
对于 BAD 患者,大量胆汁酸会被冲入大肠。这会导致肠道内液体增加。液体通过肠道的运动速度加快,结果是水样大便。
胆汁酸合成由与肠肝循环相关的负反馈回路调节,该负反馈回路依赖于法尼素X受体和成纤维细胞生长因子。这些反馈回路的中断会导致胆汁酸的过量产生,从而导致胆汁酸腹泻。
低脂饮食可能有助于改善与胆汁酸腹泻相关的症状。
与肠道菌群有什么关联?
由于电解质失衡,胆汁酸的吸收不良或过量产生会导致肠道菌群失调和腹泻。
肠道菌群负责初级胆汁酸的去结合、脱氢、7α脱氢和差向异构化,在胃肠腔产生次级胆汁酸,并介导胆汁酸合成的反馈控制。肠道菌群是胆汁酸的主要调节者,反过来又调节微生物群的组成和丰富度及其特征。
在一组胆汁酸排泄过多的IBS-D患者(BA+IBS-D)中,一种以胆汁酸转化梭菌物种富集为特征的特定肠道菌群能够增强胆汁酸总排泄量,这与粪便胆汁酸和血清7-羟-4-胆甾酮(C4)水平较高有关。
另一项最新研究显示,BAD患者粪便细菌多样性降低,其他菌群变化如下:
BAD患者的初级粪便胆汁酸比例也较高,可能是由于肠道微生物群中双歧杆菌和Leptum减少,大肠杆菌增加所致。这可能会改变胆汁酸对FXR和TGR5的亲和力,从而导致FXR活性降低,胆汁酸向结肠的输送增加。
另有研究表明,双歧杆菌丰度增加的同时,次级粪便胆汁酸减少,从而导致乙酸盐和丙酸盐水平升高。
乳糜泻 (CD) 是一种常见的全身性疾病,是由于人体免疫力对麸质摄入的异常反应而导致的。
注:麸质是一种存在于小麦、大麦、黑麦等谷物中的蛋白质,可溶于酒精。
乳糜泻的发病机制涉及遗传和环境因素的复杂相互作用。肠道微生物群在乳糜泻的发病机制中发挥着复杂的作用。
与乳糜泻相关的微生物群的变化
包括有益菌丰度降低,特别是以其抗炎和免疫调节特性而闻名的双歧杆菌。
还有乳杆菌通过多种机制,包括分泌抗炎细胞因子和改变Th1免疫反应。
某些细菌的过度生长与肠道通透性增加有关,这是乳糜泻的一个标志。具体来说:
肠道微生物群导致乳糜泻的可能发病机制
这里从环境因素的作用、微生物群本身的作用、遗传学因素、围产期因素等几个方面来说。
环境因素的作用:
一种假设是,一些肠道细菌表达模仿麦醇溶蛋白(麸质的一种成分)的表位,可以引发宿主免疫反应。这种反应导致免疫系统激活并产生攻击肠道内壁的抗体。
另一个假设与脂多糖有关,脂多糖是革兰氏阴性细菌外膜中发现的分子。脂多糖可以通过产生IL-15在先天性和适应性免疫系统中发挥相关作用,IL-15可以引发肠道炎症。
一些细菌,例如铜绿假单胞菌,与麸质结合可导致粘膜炎症加剧。这两个因素的结合可能会导致肠道内壁进一步受损,并加剧乳糜泻症状。
最后,病毒感染也可以触发先天免疫系统的激活。具体来说,TLR3是一种可以识别病毒感染并做出反应的受体,导致先天免疫系统激活和肠道炎症。
微生物群本身的作用:
– 通过产生特异性免疫原性或耐受性面筋肽
– 释放影响肠道通透性的连蛋白(zonulin)
– 通过促进上皮粘膜成熟,改变麸质的消化,从而促进乳糜泻发病
– 肠道菌群产生的促炎或抗炎肽和细胞因子也可能通过调节免疫系统发挥作用
微生物群代谢产物的作用:
肠道细菌还可以通过释放短链脂肪酸来调节,具体来说,短链脂肪酸通过促进紧密连接形成、抑制促炎细胞因子的产生以及促进调节性T细胞分化,参与维持肠上皮屏障的完整性。通过这种方式,肠道细菌及其产物的平衡可能会影响宿主对包括麸质在内的膳食抗原的耐受能力,可能导致乳糜泻的发生。
遗传学的作用:
– 乳糜泻家族风险婴儿的基因型(携带HLA-DQ2单倍型的),影响早期肠道菌群的组成
– 有乳糜泻遗传易感性的婴儿肠道菌群组成不同(即拟杆菌比例)
– 出生后前6个月微生物群变化增加了包括乳糜泻在内的自身免疫性疾病的发病风险
患有乳糜泻一级亲属的婴儿的大规模前瞻性出生队列研究,在引入食物(包括麸质)之前,4-6个月大的婴儿中几种链球菌和粪球菌的丰度减少与患乳糜泻的遗传风险有关。发生乳糜泻的标准遗传风险和高遗传风险与拟杆菌和肠球菌种类增加有关。出生后4-6个月时,下列菌群丰度下降:
围产期因素的作用:
剖腹产:由于粪肠球菌增加,拟杆菌属和副拟杆菌属数量减少,导致乳糜泻的风险更高。
喂食类型:婴儿配方奶粉喂养可能是发生乳糜泻的危险因素,但结果不一致。
任何的配方奶粉(无论是纯配方奶粉喂养还是与母乳混合喂养的儿童)都与短双歧杆菌数量减少相关。
抗生素使用:与乳糜泻之间存在关系,这可能是剂量依赖性的。
胃肠道感染:出生后 6-18 个月内的胃肠道感染会因肠道通透性增强而增加患乳糜泻的风险。
肠病毒、腺病毒12型、正呼肠病毒和白色念珠菌也与乳糜泻风险增加有关。
以上所有这些机制凸显了肠道微生物组、麸质和免疫系统在乳糜泻发展过程中复杂的相互作用。
炎症性肠病(IBD)常见症状是腹痛、腹泻和体重减轻。炎症性肠病主要包括:克罗恩病(CD)和溃疡性结肠炎(UC)。
IBD 类型通常通过炎症位置和胃肠道的组织病理学特征来区分。临床上:
这两种情况均源于遗传易感宿主对微生物和/或环境因素的不适当免疫反应。
炎症性肠病患者肠道菌群变化
炎症性肠病患者肠道菌群多样性较低,对大多数炎症性肠病患者的报告了厚壁菌门、拟杆菌门和变形菌门内特定细菌类群的丰度变化,具有攻击性的菌群的增多,如变形杆菌、梭杆菌属、瘤胃球菌,同时具有保护性的菌群的减少,例如Faecalibacterium、罗氏菌属 、毛螺菌科、双歧杆菌属。
当粘蛋白降解细菌(如瘤胃球菌)过度生长时,粘液层开始变薄,肠壁更容易受到肠道微生物的促炎信号的影响。
当这种情况变成慢性时,肠壁中的异常炎症反应似乎成为常态,导致我们在 IBD 中看到的肠壁损伤以及特征性的高粪便钙卫蛋白和FIT。慢性炎症会使肠道菌群失调和肠道屏障功能障碍长期存在,形成恶性循环。
肠道中高水平的具核梭杆菌(一种来自口腔的共生细菌),与炎症性肠病的进展有关。
其他例如普拉梭菌等一些产丁酸菌也减少,丁酸盐有助于肠壁修复和调节炎症。如果肠道丁酸生成量低,肠壁可能会变得渗透性过高,并由于这种微生物介导的愈合机制的丧失而出现慢性炎症。
关于IBD在我们之前的文章有详细阐述其机制,以及肠道微生物群与IBD之间的密切关联,详见:肠道菌群失调与炎症性肠病的关联
抗生素相关性腹泻(AAD)通常是指与服用抗生素相关且无法以其他方式解释的腹泻。腹泻可发生在抗生素治疗期间和治疗停止后长达8周。
发病率:
AAD的临床病程因是否涉及艰难梭菌而异,大多数非艰难梭菌发作。艰难梭菌AAD严重程度轻微,自限性强,仅持续几天。
一项对住院患者抗生素相关性腹泻相关细菌的荟萃分析显示,艰难梭菌、产气荚膜梭菌、产酸克雷伯菌(Klebsiella oxytoca)、金黄色葡萄球菌是全球AAD住院患者中最常见的细菌。
AAD组动物模型中变形菌门和放线菌门丰度较高。更重要的是,模型组乳杆菌的丰度明显低于对照组,而肠球菌的丰度明显高于对照组。
抗生素治疗还增加了柠檬酸杆菌(Citrobacter)、窄养单胞菌(Stenotrophomonas)和谷氨酸杆菌(Glutamicibacter)的丰度,而抗生素降低了支原体和幽门螺杆菌的丰度。
■ 艰难梭菌感染
艰难梭菌是一种革兰氏阳性厌氧芽孢杆菌,是一种重要的医院病原体。艰难梭菌是属于厚壁菌门的正常微生物群的一部分,正常在特定范围内。
近年来,由于抗生素过量使用,艰难梭菌相关性腹泻(CDAD)的发病率有所增加。
艰难梭菌相关性腹泻发展的关键风险因素:
艰难梭菌感染的临床表现各不相同,从无症状或非常轻微的腹泻到严重的伪膜性结肠炎。艰难梭菌感染的发病机制似乎与正常肠道微生物群的破坏有关,主要来自抗生素治疗,如阿莫西林、氟喹诺酮、氨苄青霉素、克林霉素和头孢菌素,这些药物可能导致肠道微生态失调。
注:健康微生物组的共生菌群通过定植抗性控制艰难梭菌等病原体的定植。在抗生素和抗肿瘤或免疫抑制药物对正常肠道菌群产生破坏性影响后,肠道易被艰难梭菌定殖,或者这种影响可能导致肠道环境中预先存在的微生物种群过度生长,从而导致CDAD。
病原体通过粪口途径和孢子传播,一旦摄入,可以在胃酸中存活并定植于结肠,释放肠毒素A和细胞毒素B,这在很大程度上是造成临床严重程度的原因。
与未发生艰难梭菌感染的患者相比,抗生素治疗后艰难梭菌感染患者的微生物群多样性较低。与对照艰难梭菌抗性小鼠相比,发现数量显著增加的初级胆汁酸和某些碳水化合物有利于艰难梭菌的生长。
对于复发性艰难梭菌感染,可以使用粪菌移植FMT治疗,目前临床上有较好的反馈,随着研究的深入和技术的成熟,成功率也越来越高,关于FMT我们在后面章节也会讲到。
有时候常常将食物过敏与食物不耐受混为一谈。虽然这两种情况可能会导致类似的症状,但它们是由不同的机制触发的。
食物过敏是由于免疫系统对特定食物物质的过度反应引起的。食物过敏的主要原因是蛋白质。
蛋白质存在于花生、坚果、鸡蛋、乳制品、鱼、小麦、大豆和虾等贝类中。
牛奶过敏是婴幼儿期常见的食物过敏,牛奶蛋白质分为两大类:酪蛋白和乳清蛋白,所有蛋白质都可能是潜在的过敏原,并且可以诱导IgE 和非 IgE 介导的免疫反应,从而导致广泛的临床表现和不同的表型。
非 IgE 介导的牛奶过敏涵盖多种疾病,包括食物蛋白诱发的过敏性直肠结肠炎、食物蛋白诱发的小肠结肠炎综合征和食物蛋白诱发的肠病。
当身体遇到少量的有害食物时,它都会释放组胺,肠道内布满了具有组胺受体的细胞。当组胺与这些受体结合时,会引起消化系统的肌肉收缩,导致腹部痉挛和腹泻。
患有慢性小肠结肠炎综合征的婴儿表现出更多的慢性症状,如呕吐、慢性腹泻和生长发育不良。
案
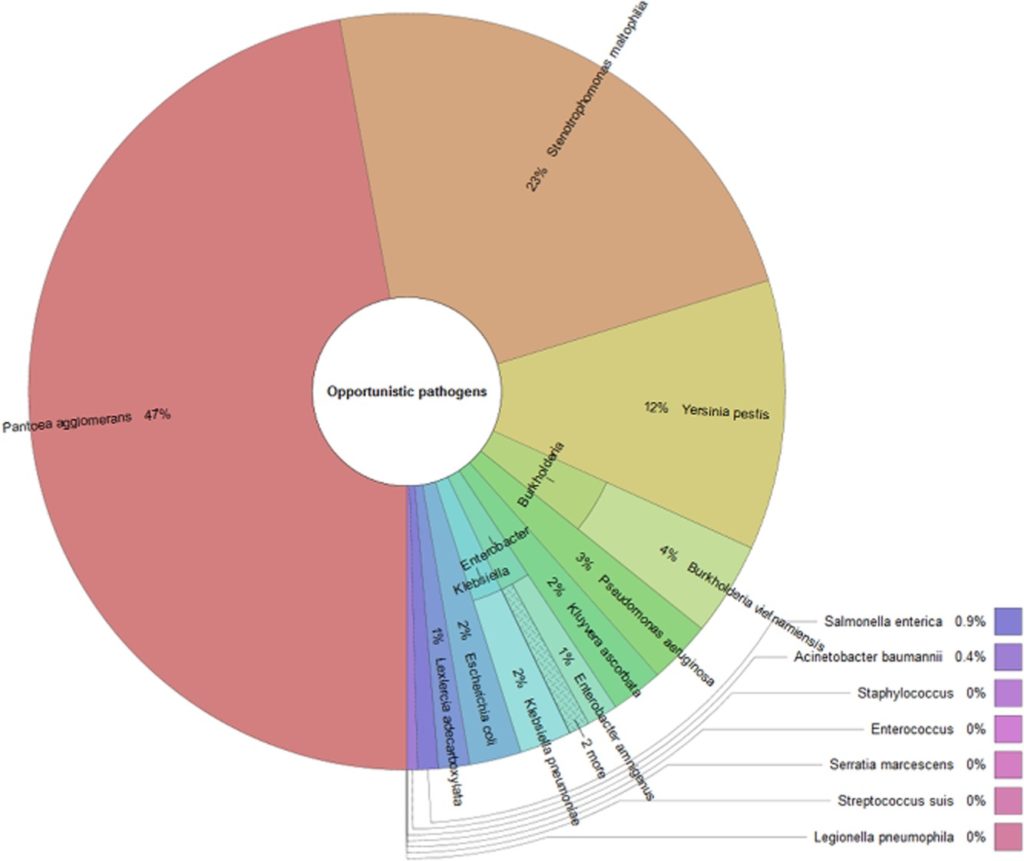
例
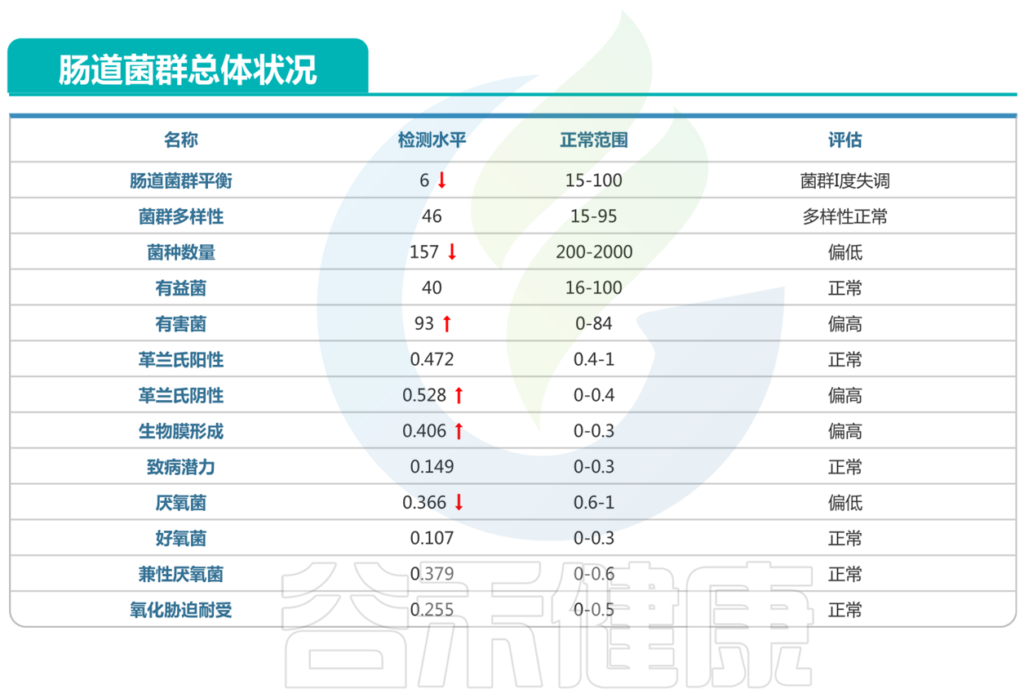
一名6个月的患者,基本情况:中度营养不良,牛奶蛋白过敏,每日腹泻较多。
肠道菌群检测报告如下:
<来源:谷禾健康肠道菌群数据库>
以上我们可以看到:
病原菌中:
对应的菌属中:链球菌属,志贺氏菌属,梭菌属这几类有害菌较多的菌属属于人群中较高。
<来源:谷禾健康肠道菌群数据库>
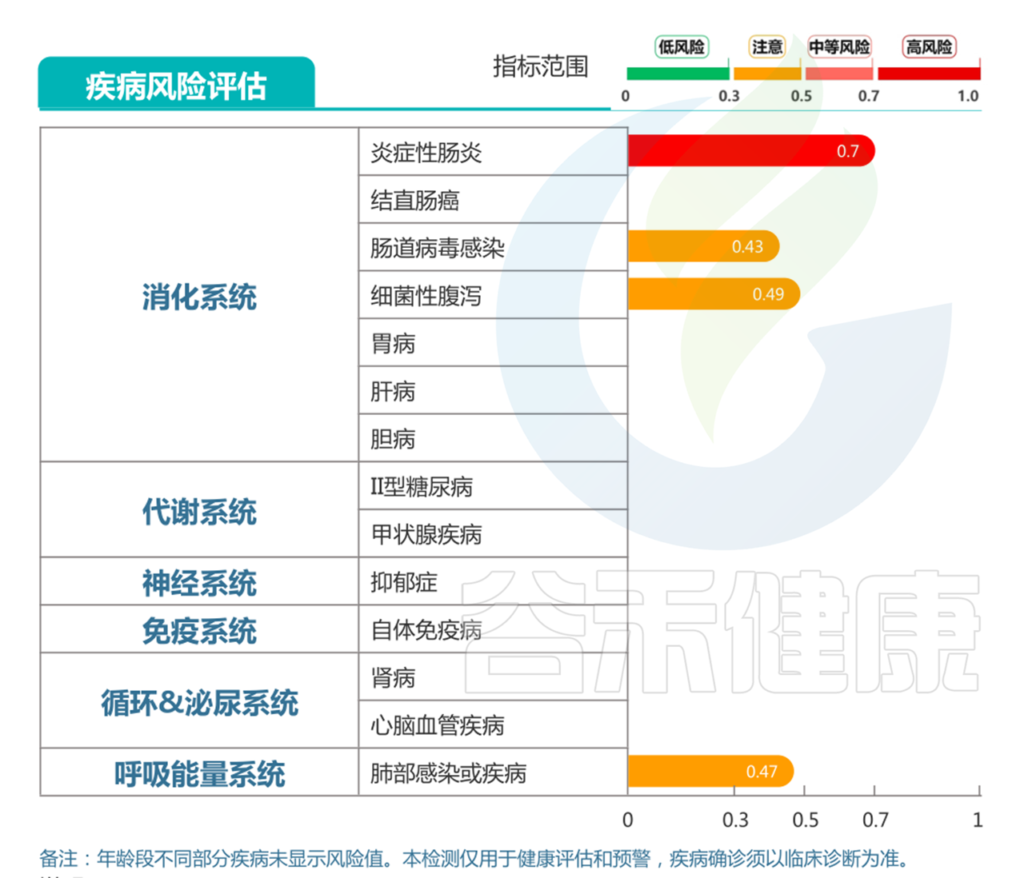
针对牛奶蛋白过敏,以及出现中度营养不良和腹泻的情况,对应报告中:
消化道疾病部分的显示的,肠炎高风险,细菌性腹泻、病毒性腹泻和过敏性腹泻均提示注意。
结合前面病原菌的超标和每日腹泻症状,判断较大可能存在细菌性腹泻的可能。较大可能存在肠炎的情况,并引发肠道屏障损伤,导致乳蛋白过敏的情况。
干预建议:
牛奶过敏暂时可以使用深度水解的奶粉减少过敏。另外可以适当开始摄入米粉等辅食,补充碳水化合物。
基于肠道炎症的情况,可以考虑少量服用姜黄素,并补充益生菌。
扩展阅读:生命早期微生物接触和过敏风险:如何预防
放射性腹泻患者的肠道微生物群落变化比非放射性腹泻患者的肠道微生物群落变化更大,因此,肠道微生物群对于预防放射性腹泻至关重要。
腹泻患者的拟杆菌、Dialister、Veillonella和未分类细菌种类增加,梭菌XI和XVIII、Faecalibacterium、Oscillobacter、Prevotella、Parabacteroides减少。
一些证据还表明,接受放射治疗的患者艰难梭菌感染的发生率很高,这与高死亡率有关。研究表明,肠道微生物群组成可作为放射治疗引起的腹泻和疲劳发展的预测标志。
肠道微生物组对辐射诱导的胃肠道粘膜炎发病机制的影响,是通过调节氧化应激和炎症过程、肠道通透性、粘液层组成、上皮修复和抵抗有害刺激的能力,以及免疫效应分子在肠道中的表达和释放介导的。
肠道微生物组可以通过两种机制影响辐射诱导的胃肠道粘膜炎:易位和微生态失调。
辐射破坏肠道屏障和粘液层,导致细菌移位,从而激活炎症反应。生物失调,无论是由辐射还是其他因素引起,都会影响局部和全身免疫反应。
TLR 具有抗辐射保护作用的另一个潜在机制是激活 NF-κB 信号传导,这对于保护肠道免受辐射诱导的细胞凋亡至关重要。也就是说 TLR 可能通过 NF-κB 途径影响肠道对辐射诱导的上皮损伤的反应。
由于缺乏纤维,便秘往往是生酮饮食的最大问题,但事实上,生酮饮食也会导致腹泻。酮症腹泻可能只是比平时更多的水样大便和/或更频繁地排便。
酮症腹泻的原因可能如下:
脂肪很难消化
一般来说,身体消化脂肪需要更长的时间。在像酮这样的高脂肪饮食中,你会突然比平常吃更多的鳄梨、坚果、种子、肉类、橄榄油和其他脂肪,这会扰乱消化。当你改用这种高脂肪饮食时,可能会导致腹泻。
人工甜味剂和糖醇可能会对胃造成伤害
在生酮饮食中经常摄入更多的糖醇和其他人造甜味剂。这些甜味剂虽然碳水化合物含量低且通常是安全的,但过量食用可能会导致腹胀和腹泻。因此,如果有人食用大量糖醇含量高的酮类产品,他们可能会患酮类腹泻。
破坏肠道菌群
一些小型研究发现,在进行生酮饮食三个月后,肠道菌群发生了很大变化,这可能会导致一些人腹泻。与基线相比,3个月时,脱硫弧菌属统计显着增加(p = 0.025)。脱硫弧菌属与食用动物源性脂肪相关的肠道粘膜炎症状况恶化有关。还需要做更多的研究。
酮症腹泻持续多久?
酮症腹泻并不是一个永久性的问题。通常是暂时的,一般会发生在一开始改变饮食的时候,可能是在身体能够调整之前的第一到四周。
然而,如果高脂肪饮食对一个人的身体来说不容易消化,或者肠道微生物群确实发生了变化,腹泻可能是一个长期的副作用。
如果酮类腹泻持续存在,就值得重新考虑饮食计划。一种饮食计划不太可能适合所有人,其他可能考虑地中海饮食等饮食方式。
关于腹泻相关的干预,我们分三步走:
▼
1. 腹泻未发生 → 预防
预防腹泻相关措施
勤洗手:可以预防感染性腹泻的传播,比如准备食物前后,如厕、换尿布、打喷嚏、咳嗽、擦鼻涕等之后都要洗手。
正确储存食物:在正确的温度下储存食物,并烹饪所有食物直至达到建议的温度。不要冒险食用过期的食物或饮料。
预防旅行者腹泻:到卫生条件不完善的地区旅行时,需要注意食品安全。吃完全煮熟的热食,吃水果要吃可以去皮的,喝原包装的瓶装水,包括刷牙也用瓶装水。避开未经高温消毒的牛奶或果汁产品。合理摄入一些益生元,降低旅行者腹泻的风险。
保持肠道菌群平衡:当我们肠道菌群在一个良好的状态时,可以提高我们的免疫力,甚至能抵抗病原菌的定植,通过均衡饮食、保持良好的作息规律、适度运动、减少压力等各个方面,维持肠道菌群平衡。
当腹泻发生时,首先要判别感染源和感染原因。
如果是急性腹泻,很可能是因为病原体引起的,进行常规的病原物判别,医院可以进行相关检测,当然也可以结合肠道菌群检测,找出感染的原因,进行针对性治疗。
在处理优先级上,首先要解决感染问题
细菌性感染
如果是细菌性感染腹泻,就需要用到相关抗生素治疗。比如说大肠埃希氏菌、沙门氏菌、志贺氏菌等感染,可以考虑β-内酰胺类抗生素,如头孢曲松、拉氧头孢等。
不过需要注意的是,使用抗生素的时候尽量遵医嘱一次性吃到位,如果吃了一天感觉好了就不吃了,没有起到彻底杀菌的作用,则可能出现病情反复,那么这时候也会带来抗生素耐药性问题,即便吃了抗生素药也不一定很快好转。
因此关于抗生素用药需要谨慎,要么不用,要么用到位,尽量避免形成抗生素耐药性问题。如果有进行肠道菌群检测,也可以看到有没有抗生素耐药性问题,如果存在某种抗生素耐药,则可以避免该药物,改用其他抗生素代替。
病毒性感染
如果主要症状是腹泻+呕吐,也可能伴随出现一些腹痛、头痛、发烧、畏寒、肌肉酸痛等情况,则考虑可能是病毒性感染。一般病毒性感染具有自限性。
病毒性感染则需要避免使用抗生素。配合一些补液及益生菌,辅助治疗。
研究表明,鼠李糖乳杆菌GG可减少病毒性腹泻持续时间和每天排便次数。其他包括嗜酸乳杆菌NCFM,可有效增强轮状病毒疫苗效果。
其次,考虑其他功能性问题
肠道感染也是IBS的危险因素,如果是IBS患者,饮食因素可诱发或加重IBS症状。
短期使用利福昔明可以改善IBS的腹痛、腹泻、腹胀症状。洛哌丁胺的随机双盲安慰剂对照研究证实其可以显著降低IBS排便频率。
一些不确定病因的腹泻,比如说腹部绞痛、头痛、持续排出恶臭气体,进食后马上又腹泻,怀疑是否是因为胆汁酸吸收不良引起的腹泻,这时候可能需要配合进行SeHCAT测试、或血清7αC4检测、或粪便胆汁测试等进行相关诊断。一般来说,胆汁酸腹泻在克罗恩病和肠易激综合征患者中比较常见。
医生可能会开出胆汁酸螯合剂来减少胆汁的循环。通常为10-14天。
有些不明原因的腹痛、腹胀、腹泻、各种不适,在进行肠道菌群健康检测后,如果发现存在失调的情况,比如说肠道菌群多样性过低,有益菌缺乏,一些其他有害菌超标,那么需要结合相应的指标去综合判别,纠正可能的诱发因素。
案
例
我们来看一个案例:一名患者50岁,主诉腹泻。

<来源:谷禾健康肠道菌群数据库>
可以看到肠道菌群多样性明显缺乏,且埃希氏菌属明显超标。大肠埃希氏菌在正常情况下对人体无害,但某些菌株也可能引起感染和疾病,导致胃肠道症状,如腹泻、腹痛等。
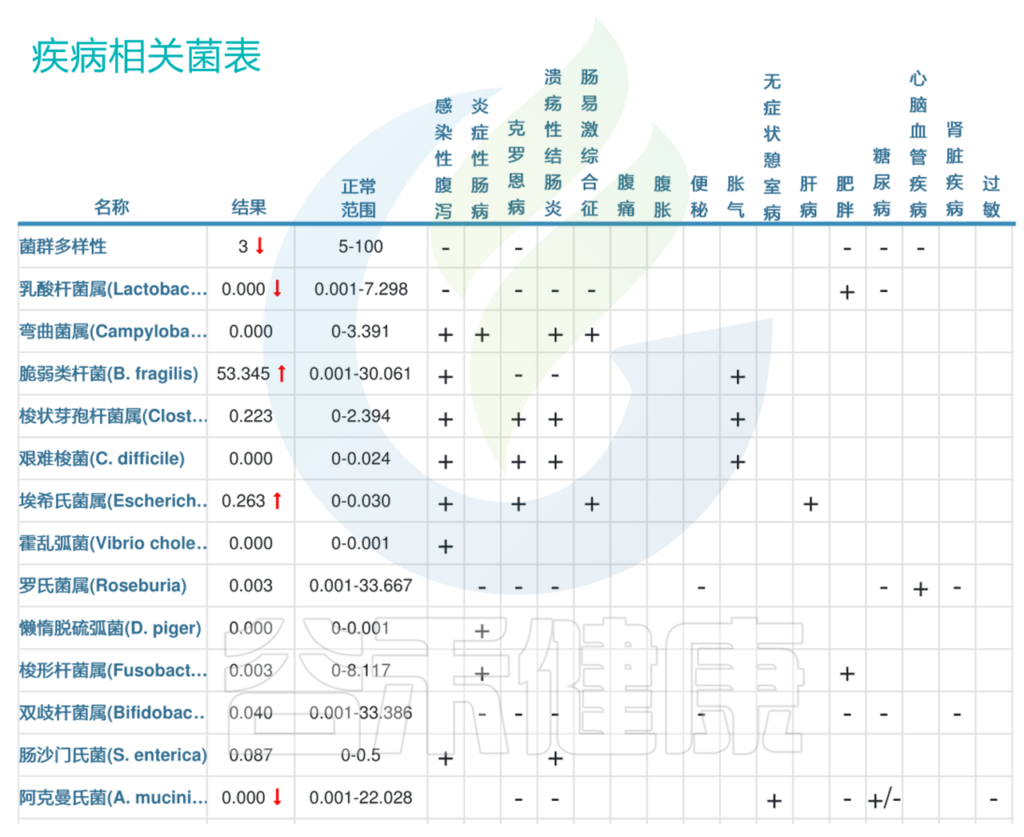
<来源:谷禾健康肠道菌群数据库>
以上我们可以看到最明显的,脆弱拟杆菌53.345,明显超标,脆弱拟杆菌这一行右边第一格显示“+”,说明脆弱拟杆菌丰度与“感染性腹泻”呈正相关,那么脆弱拟杆菌超标也就意味着该患者很有可能存在感染性腹泻。
其他菌群例如第二行乳酸杆菌属,结果0.000,也就是没有检出,低于正常范围。而乳酸杆菌属与“感染性腹泻”、“克罗恩病”、“溃疡性结肠炎”、“肠易激综合征”都呈负相关(都显示“–”)。患者刚好低于正常范围,也就是说乳酸杆菌属低,提示该患者很有可能存在以上这些肠道类疾病。
整体肠道菌群检测结果也与该患者“腹泻”的症状吻合,可以作为临床上的参考。
比如说过敏性腹泻,则应识别过敏源,在过敏源不明确的情况下,应该短期采用限制性食物疗法,排除蛋奶等可能引发过敏的食物,如果在这段时间内症状消失,则可定期有计划地引入单一食物,对于过敏食物进行回避。
在纠正诱发因素后,可以采取措施进行调理,提升免疫力,合理应用微生态制剂,也就到了接下来第三步。
一次腹泻,对于我们肠道来说,就好比打了一场仗,各大菌群忙着争夺领地、占据优势地位,肠道菌群的平衡却遭受了巨大的打击,有益菌可能被削弱,而有害菌则可能过度繁殖,甚至肠粘膜都受损。因此,腹泻后的肠道养护很重要。
我们从两个方面进行养护肠道,营养和菌群。
营 养
腹泻后可以吃什么?
土豆(不带皮),含有维生素B6、维生素C、烟酸和微量矿物质碘等营养成分。不要加黄油那些会刺激肠道的添加物,可以直接吃。
生吃蔬菜可能很难消化。可以通过剥皮、去除种子和彻底煮熟吃更好。
面食,提供膳食纤维和碳水化合物。
燕麦片,很容易消化,并且富含具有治疗作用的抗氧化剂。它还含有维生素 B1、硒和锰,也是可溶性纤维的良好来源。
香蕉,较温和,容易消化,是治疗腹泻的好选择。它们也是钾的良好来源,钾是一种可能因腹泻而流失的重要电解质。
苹果酱,比生苹果更好,因为水果的皮含有不溶性纤维。苹果酱还含有果胶,可以帮助粪便凝固。
腹泻后避免吃什么?
以上只是关于腹泻期间饮食的普适性建议,临床上病人腹泻情况复杂,可能需要根据不同类别的腹泻进行分层管理。
对于 IBS 患者来说,则需额外避免:
对于 胆汁酸腹泻患者来说,其他干预包括:
对于炎症性肠病患者来说,一些干预措施包括:
每个人的身体状况,肠道菌群特征各不相同,并不适用于所有人。比如说有些人吃香蕉后腹泻会更严重,这个就需要避免,根据自身情况而定。
扩展阅读:深度解析 | 炎症,肠道菌群以及抗炎饮食
菌 群
除了上述营养之外,也可以通过对肠道菌群的调理,促进有益菌生长,抑制有害菌过度生长,优化菌群组成;增强肠道屏障功能,加强抵抗病原体入侵后的定植;从根本上改善人体免疫力。
▼ 益生菌
普遍认为,益生菌的功能在于:
一项研究表明,益生菌大肠杆菌抑制其他大肠杆菌菌株,以及病原菌金黄色葡萄球菌和表皮葡萄球菌的生物膜形成。
小鼠研究表明,短双歧杆菌和Bifidobacterium pseudocantenulatum DSM20439 可以抑制肠出血性大肠杆菌产生的志贺毒素的表达。
益生菌的摄入也可以降低住院患者中艰难梭菌相关腹泻和抗生素诱导腹泻的发生率。含益生菌的嗜酸乳杆菌(L.acidophilus)和干酪乳杆菌(L.casei)菌株在预防艰难梭菌相关腹泻方面取得了良好的效果,没有严重的不良反应报告。布拉氏酵母菌也为治疗艰难梭菌相关腹泻提供了很好的前景。
罗伊氏乳杆菌DSM 17938 可能有助于调节肠道微生物群、消除感染以及减轻结肠炎、抗生素相关的胃肠道症状。无论是儿童还是成人,罗伊氏乳杆菌都能缩短急性感染性腹泻的持续时间,并改善结肠炎或炎症性肠病患者的腹痛。
益生菌似乎也能有效治疗痢疾;在接受乳杆菌和双歧杆菌菌株以及一种链球菌菌株组合治疗的患者中,腹泻的血液持续时间和住院时间都显著缩短。
益生菌也可以减轻与抗生素使用有关的肠道微生物群的改变,并可能抑制抗生素耐药性细菌的生长。
▼ 益生元
益生元也可以对腹泻患者产生积极影响。益生元的主要靶标是乳酸杆菌和双歧杆菌。益生元的摄入会增加短链脂肪酸的产生,这对维持肠道屏障的完整性很重要。由于丁酸盐在促进正常细胞增殖和分化方面的作用,它是被认为对肠道健康最有益的短链脂肪酸。
一些益生元,如低聚半乳糖、低聚果糖、菊粉、乳果糖和果胶低聚糖,可以拮抗病原体对上皮细胞的粘附,从而抑制定植并促进肠道病原体的清除。此前的研究表明,益生元可以缩短急性水样腹泻的持续时间,对腹泻有良好的治疗作用。
白术挥发油通过调节肠道菌群缓解急性溃疡性结肠炎。白术挥发油可以有效缓解溃疡性结肠炎小鼠的出血性腹泻、结肠组织损伤和结肠炎症。白术挥发油抑制了潜在的有害细菌(Turicibacter、Parasuterella、Erysipelatoclosstridium)的生长,富集了潜在有益菌(Enterorhabdus、Parvibacter、Akkermansia)。综上,白术挥发油可能作为一种新型益生元缓解溃疡性结肠炎。
doi.org/10.3389/fcimb.2021.625210
▼ 粪菌移植(FMT)
我们知道一般腹泻用抗生素治疗可见明显好转,但也有些用了抗生素,病情没有好转,反而产生耐药性,形成慢性腹泻,反反复复,那这样的情况就可能需要用到FMT。
在腹泻患者中使用FMT的好处是基于这样一种观点,即通过FMT引入的健康微生物群可以战胜病原体,并将恢复健康肠道微生物组的组成。
在许多研究中,FMT已成功用于治疗难治性艰难梭菌诱导的腹泻。现有文献支持FMT的使用,并将其作为复发性艰难梭菌相关腹泻的安全有效的治疗方法。
此外,FMT在4 周后, IBS患者的生活质量方面显著优于安慰剂(平均差 [MD] = 7.47,95% 置信区间 [CI]:2.05-12.89,p = 0.04)
单臂分析显示,IBS 症状改善的发生率为 57.8%(45.6%-69.9%),IBS-SSS 减少(MD = -74,95% CI:-101.7 至 -46.3)。
一项临床研究表明,FMT可能安全有效地改善慢性放射性肠炎患者的肠道症状和粘膜损伤。此外,FMT 也是缓解急性放射综合症的有效疗法。
扩展阅读:粪菌移植——一种治疗人体疾病的新型疗法
▼ 中 药
越来越多的研究支持:中草药配方通过调节肠道菌群缓解腹泻症状。传统中药方剂,如“四君子汤、痛泻要方、补中益气汤、参苓白术汤”等,广泛用于治疗慢性腹泻。
升姜泻心汤通过改变肠道菌群和肠道代谢稳态来改善抗生素相关性腹泻。升姜泻心汤可以显著提高肠道菌群多样性,显著增加了拟杆菌属的相对丰度(p < 0.01),并降低了埃希氏杆菌属-志贺氏杆菌的相对丰度(p < 0.001)。
升姜泻心汤可以有效预防人类伊立替康引起的迟发性腹泻的发生。增强肠道屏障功能并减轻小鼠结肠炎。改善胆汁酸代谢和氨基酸代谢。
七味白术散(QWBZP)是一种治疗各种原因引起的腹泻的中药配方。七味白术散煎剂和七味白术散总苷,在抗生素相关性腹泻小鼠中,促进乳杆菌的增殖,抑制变形杆菌、梭状芽胞杆菌、真杆菌、Facklamia、埃希氏菌的生长。还增加了脱氧胆酸和 β-鼠胆酸的水平,并降低了牛磺胆酸、牛磺-α-鼠胆酸和牛磺-β-鼠胆酸的水平。乳杆菌是响应七味白术散总苷的关键细菌属。
清化止泻汤可调节肠道微生物群,减少5-羟色胺和血管活性肠多肽,改善腹泻症状。葛根芩连汤具有止泻作用和肠道微生物调节功能。香连丸可能通过恢复肠道菌群和减轻黏膜损伤来治疗抗生素相关性腹泻。经典中草药复方参苓白术可以通过调节结肠腔和粘膜微生物群,恢复肠道离子转运,缓解乳糖诱导的腹泻。
肠安Ⅰ号方治疗IBS-D临床能够明显降低IBS-SSS积分,提高AR应答率,疗效优于安慰剂,临床未发现明确不良反应。
在一项为期28天的双盲、随机、对照初步研究中,香沙六君子汤(XSLJZT)对IBS患者的腹泻(定义为频繁排便)有改善,但对稀便或急便没有改善。
除了中药配方,越来越多的证据表明,中国单一草药,如生姜、人参发酵物、苍术、小檗碱、黄柏提取物还具有止泻特性,恢复不平衡的肠道微生物群。
一项荟萃分析报告称,肠溶薄荷油可改善整体 IBS 症状。
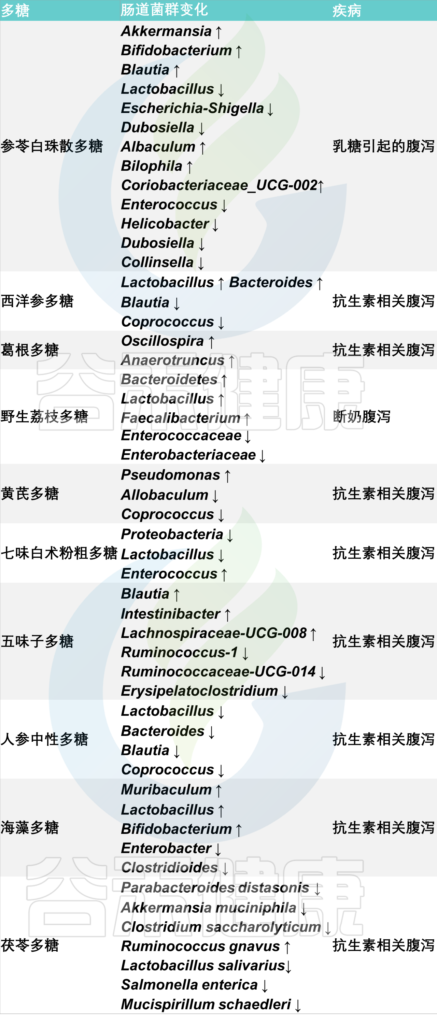
中草药多糖是由单糖组成的天然聚合物,广泛存在于中草药中,是重要的活性成分,作为肠道微生物群的重要能量来源,具有止泻作用。
中草药多糖对慢性腹泻患者肠道微生物群的影响
以上这些都是关于腹泻的相关干预措施。
一次看似偶然的腹泻,实际上可能是我们肠道菌群平衡打破的一声警钟。平衡的肠道菌群可以帮助我们抵抗腹泻病原菌的定植。
当腹泻发生后,我们首先应该去寻找腹泻的原因,传统的医学检查往往需要繁琐的流程和耗时的等待以及不确定的结果,而依托于高通量测序和人工智能等技术的肠道菌群检测,则极大地提高了效率和精确性,在医疗手段飞速发展的时代,“快检、便检”已经逐渐开始成为获得关键医学信息的刚需,便于临床医生能够快速判断疾病类型和严重程度,有针对性地制定治疗方案。
结合个体差异,深入分析肠道菌群变化和疾病发展的关联,更好地了解每个人的疾病风险和治疗响应,可以提升治疗效果,缩短治疗时间,提高生活质量,减轻医疗负担,从而有助于将个性化医学推向前沿。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
相关阅读:
关 于 谷 禾
杭州谷禾健康专注于利用高通量测序技术进行肠道菌群和精准健康检测,是国家高新技术企业。
公司于2012年成立于浙江大学校内,核心创始团队主要来自浙江大学。谷禾在高通量基因测序领域独立研发大量独有技术,已授权包括采样,提取和数据库相关国家发明专利6项,此外还有9项软件和作品著作权。并通过ISO19001认证,并建有II级病原微生物P2实验室,并正在申请更全面的资质。公司为150多家国内顶级医院和医疗以及健康相关机构提供科研和检测服务。
经过多年的积累,已完成检测并构建了超过70万例各类人群样本数据库。自主构建了肠道菌群参考注释数据库,同时建立了基于近7万人群的肠道菌群人群分布及正常范围。在Nature Communications,Gut,PNAS等国际顶级学术期刊发表多项研究论文。支持合作50多项目临床开放基金项目,已发表研究成果20多项。
谷禾更大的数据和人工智能平台意味着可以更可靠和准确地反应您当前的菌群和健康状况。
主要参考文献:
Li Y, Xia S, Jiang X, Feng C, Gong S, Ma J, Fang Z, Yin J, Yin Y. Gut Microbiota and Diarrhea: An Updated Review. Front Cell Infect Microbiol. 2021 Apr 15;11:625210.
GBD 2016 Diarrhoeal Disease Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of diarrhoea in 195 countries: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis. 2018 Nov;18(11):1211-1228.
Chung The H, Le SH. Dynamic of the human gut microbiome under infectious diarrhea. Curr Opin Microbiol. 2022 Apr;66:79-85.
Ramamurthy T, Kumari S, Ghosh A. Diarrheal disease and gut microbiome. Prog Mol Biol Transl Sci. 2022;192(1):149-177.
Moshiree B, Heidelbaugh JJ, Sayuk GS. A Narrative Review of Irritable Bowel Syndrome with Diarrhea: A Primer for Primary Care Providers. Adv Ther. 2022 Sep;39(9):4003-4020.
Xue H, Mei C F, Wang F Y, et al. Relationship among Chinese herb polysaccharide (CHP), gut microbiota, and chronic diarrhea and impact of CHP on chronic diarrhea[J]. Food Science & Nutrition, 2023, 11(10): 5837-5855.
抗菌药物临床应用指导原则修订工作组. 抗菌药物临床应用指导原则[M]. 2015: 21-39
Mada PK, Alam MU. Clostridioides difficile Infection. 2023 Jan 23. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 28613708.
Shaikh SD, Sun N, Canakis A, Park WY, Weber HC. Irritable Bowel Syndrome and the Gut Microbiome: A Comprehensive Review. J Clin Med. 2023 Mar 28;12(7):2558.
Holtmann G J, Ford A C, Talley N J. Pathophysiology of irritable bowel syndrome[J]. The lancet Gastroenterology & hepatology, 2016, 1(2): 133-146.
Farrugia A, Arasaradnam R. Bile acid diarrhoea: pathophysiology, diagnosis and management. Frontline Gastroenterol. 2020 Sep 22;12(6):500-507.
Piovezani Ramos G, Camilleri M. Current and Future Therapeutic Options for Irritable Bowel Syndrome with Diarrhea and Functional Diarrhea. Dig Dis Sci. 2023 May;68(5):1677-1690.
Jay P. Sanford. 桑德福抗微生物治疗指南[M]. 范洪伟译. 北北京: 中国协和医科大学出版社. 2013: 71-76
Camilleri M, Boeckxstaens G. Irritable bowel syndrome: treatment based on pathophysiology and biomarkers. Gut. 2023 Mar;72(3):590-599.
Cheng H, Zhang D, Wu J, Liu J, Tan Y, Feng W, Peng C. Atractylodes macrocephala Koidz. volatile oil relieves acute ulcerative colitis via regulating gut microbiota and gut microbiota metabolism. Front Immunol. 2023 May 2;14:1127785.
Wellens J, Vissers E, Matthys C, Vermeire S, Sabino J. Personalized Dietary Regimens for Inflammatory Bowel Disease: Current Knowledge and Future Perspectives. Pharmgenomics Pers Med. 2023 Jan 12;16:15-27.
何礼贤. 国家抗微生物治疗指南[M]. 北北京: 人民卫生出版社. 2012: 196-210
Elhusein AM, Fadlalmola HA. Efficacy of Fecal Microbiota Transplantation in Irritable Bowel Syndrome Patients: An Updated Systematic Review and Meta-Analysis. Gastroenterol Nurs. 2022 Jan-Feb 01;45(1):11-20.
Altomare A, Di Rosa C, Imperia E, Emerenziani S, Cicala M, Guarino MPL. Diarrhea Predominant-Irritable Bowel Syndrome (IBS-D): Effects of Different Nutritional Patterns on Intestinal Dysbiosis and Symptoms. Nutrients. 2021 Apr 29;13(5):1506.
Saviano A, Brigida M, Migneco A, Gunawardena G, Zanza C, Candelli M, Franceschi F, Ojetti V. Lactobacillus Reuteri DSM 17938 (Limosilactobacillus reuteri) in Diarrhea and Constipation: Two Sides of the Same Coin? Medicina (Kaunas). 2021 Jun 23;57(7):643.

谷禾健康

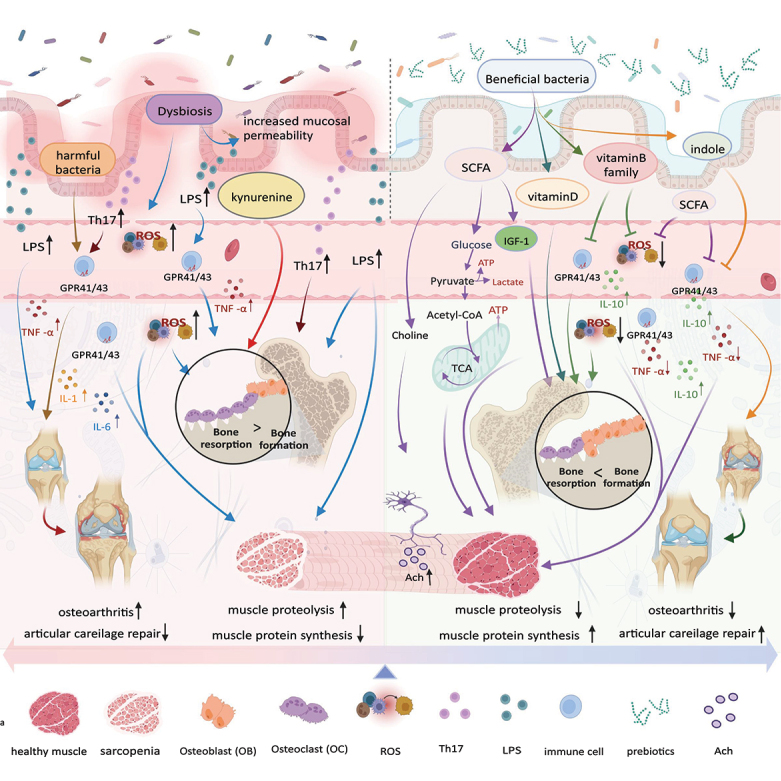
现代的生活工作方式大多是久坐,户外运动少,导致与骨骼肌肉相关的亚健康症状越来越普遍,覆盖人群越来越广。
例如长时间的低头垂肩的姿势会让竖脊肌处在伸展的位置,进而导致竖脊肌的无力,产生受伤的状况。长时间久坐使得臀大肌萎缩无力,无力松弛的臀肌再结合无力的竖脊肌,导致腰背疼痛等症状。

老年人的肌肉骨骼疼痛,在我们生活的每一个角落悄然出现。这无声的挑战,让他们在岁月的长河中饱受苦楚。
随着全球老龄化的日益严重,与衰老相关的疾病,包括肌肉减少症、骨质疏松症和骨关节炎,变得越来越突出,影响着至少7-27%的世界人口。
肌肉减少症的发生率为 10% 至 27%。50岁以上女性骨质疏松患病率不低于20%,骨关节炎的患病率约为7%。
肌肉骨骼系统对于平衡代谢活动和保持健康非常重要。骨骼肌是机体最大的器官之一,其质量和功能的丧失或减退会导致一系列疾病。虽然临床上用了很多方式来治疗缓解这类疾病,但有效的治疗方法却较少。
最近的研究表明,肠道微生物群稳态的破坏与肌肉骨骼系统功能异常相关,甚至可能导致肌肉骨骼系统功能异常。生活中也发现,肠道菌群与骨质疏松症的发病相关。如果你肠胃不好,时不时就腹泻腹胀、消化不良,当心了,骨质疏松也可能已经“盯”上了。
研究还表明,肠道菌群及其次级代谢产物可以通过调节炎症、免疫和蛋白质合成代谢、能量、脂质、神经肌肉接头、氧化应激、线粒体功能、内分泌和胰岛素抵抗等多种机制来影响肌肉骨骼系统。
现有文献大多支持合理的营养干预有助于改善和维持肠道菌群的稳态,并可能对肌肉骨骼健康产生积极影响。即使已提出“肠道菌群-肌肉轴”,但其因果联系仍然是未知的。
本文对现有文献进行整理、总结和讨论的目的是探讨营养补充、适度运动等干预方法能否通过调节肠道菌群微生态来影响肌肉和骨骼健康。未来更深入的功效验证实验将有助于临床应用。
骨 骼 肌
无菌小鼠:肠道菌群存在对骨骼肌健康很重要
基于无菌 (GF) 小鼠的实验揭示了体内肠道微生物群的存在或缺失,通过调节营养和能量代谢途径对骨骼肌的健康至关重要。缺乏肠道微生物群的小鼠的骨骼肌质量显著降低,无菌 (GF) 小鼠中肌球蛋白重组基因和骨骼肌分化调节基因的表达显着低于正常携带细菌的小鼠,而肌肉的表达萎缩标志物明显升高。
肠道菌群→蛋白质合成/能量代谢→骨骼肌营养
蛋白质合成和降解是影响骨骼肌质量的重要因素。胰岛素样生长因子1(IGF-1)是促进蛋白质合成和增强肌肉功能的重要物质,无菌小鼠体内的IGF-1水平显着下降。此外,无菌小鼠中糖皮质激素诱导的支链氨基酸分解代谢显着增加。
肠道菌群还可以通过改变能量代谢模式来影响骨骼肌。无菌小鼠葡萄糖和胰岛素含量较低,线粒体功能明显扰乱,影响骨骼肌对葡萄糖的利用,减少肌肉合成的能量供应,最终影响骨骼肌的氧化代谢能力。
肠道菌群调控神经肌肉接头
无菌小鼠的胆碱水平下降,导致神经肌肉接头传递受损。肌钙蛋白与骨骼肌中的肌纤维收缩性和运动功能有关。
无菌小鼠骨骼肌中肌钙蛋白编码基因的表达显着降低,表明肌纤维收缩力可能受损。更重要的是,将肠道微生物群移植到无菌小鼠体内后,结果显示骨骼肌质量增加,肌肉萎缩标记物减少,肌肉氧化代谢改善,神经肌肉接头组装基因表达增加。证据表明肠道微生物群在维持正常骨骼肌功能方面发挥着关键作用。
骨
骨骼通过骨成骨细胞(OB)和破骨细胞(OCL)不断重建。这个过程的不平衡会导致骨质疏松症。
早期研究发现,肠道微生物群也是骨量的主要调节者,其对骨量的影响是通过其对免疫系统的影响来介导的,免疫系统反过来又调节破骨细胞的生成。
肠道微生物群缺失对维持骨量有负面影响
无菌小鼠骨髓中破骨细胞前体细胞和破骨细胞的数量减少。此外,无菌小鼠肠道来源的 5-羟色胺和炎症细胞因子的水平降低。值得注意的是,肠道微生物群定植可以恢复无菌小鼠损失的骨量。当然,不排除其他机制也可能参与其中。
然而,最近的一项研究表明,成年雄性 GF BALB/c 小鼠的骨骼生长速度比正常饲养的小鼠慢。粪便微生物群对无菌小鼠的长期定植会导致股骨长度惊人的增加和骨小梁微结构的改善。
维生素D改善肠道钙吸收促进骨代谢
无菌小鼠的维生素D 代谢存在缺陷,而被微生物群定植的无菌小鼠则表明 1, 25-二羟基维生素 D 和钙水平得到恢复。因此,肠道微生物群也对骨骼产生有益影响。
骨 关 节
越来越多的证据表明肠道微生物组在骨关节炎(OA)的病理学中发挥着关键作用。早期研究表明,在无菌条件下, 在TLR4(Toll 样受体 4)缺陷小鼠中,类风湿性关节炎(RA) 表现也受到显着抑制,肠道微生物群可作为抗原或佐剂来诱导或促进类风湿性关节炎产生。
注:Toll样受体(TLR)是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,也是连接非特异性免疫和特异性免疫的桥梁。当微生物突破机体的物理屏障,如皮肤、粘膜等时,TLR可以识别它们并激活机体产生免疫细胞应答(参考自百度百科)。
肠道微生物群对创伤性骨关节炎的发展产生影响
研究发现,无菌小鼠中内侧半月板不稳定手术引起的骨关节炎显着减少,表明肠道菌群促进了骨关节炎的发生。还发现肠道微生物组对小鼠模型中损伤引起的骨关节炎的严重程度有显着影响。
关节损伤后,无菌小鼠仅有轻微的骨关节炎症状,病理表现的严重程度最低。小鼠体内微生物组丰度与炎症生物标志物浓度、肠道通透性和骨关节炎严重程度呈正相关。这可能是因为在存在关节损伤的情况下,肠道微生物群(由更多的梭杆菌和粪球菌,以及更少的瘤胃球菌科)引起的免疫激活可能会加剧骨关节炎的病理过程。
以上无菌动物实验,主要是小鼠结果表明,肠道菌群的“存在与否”确实是影响和维持小鼠肌肉骨骼系统的关键因素。
无菌小鼠是通过无菌技术培育得到的。这里无菌小鼠既没有共生菌群,也没有致病菌等情况下,表现出不良的病理特征。这表明致病菌并非唯一的因素导致疾病发生。
疾病的发生通常是由多种因素共同作用引起的,包括宿主的遗传因素、环境因素和微生物因素等。致病菌可能需要与其他共生微生物或宿主因素相互作用才能引发疾病。在无菌小鼠中,缺乏这些相互作用,可能导致致病菌无法发挥其病原性。这刚好强调了微生物群落的复杂性和其与宿主的相互作用的重要性。
无菌小鼠试验的结果也需要与其他研究方法和模型相结合,例如体内试验、体外试验和临床研究,以获得更全面和准确的结论。综合多种研究方法的结果可以提供更可靠的科学依据,并有助于我们理解和解释无菌小鼠试验结果的适用性。
肠道微生物群失调一般主要指致病生物的大量繁殖、正常菌群的减少和微生物群组成多样性的减少。代谢、自身免疫、炎症和神经退行性疾病等多种因素与肠道菌群失调有关。微生物群失调对肌肉骨骼系统的影响引起了越来越多的关注。
扩展阅读:
骨 骼 肌
许多因素与肌少症的病理学相关,包括衰老、炎症、线粒体损伤和/或胰岛素抵抗。
注:肌少症是指因持续骨骼肌量流失、强度和功能下降而引起的综合症。患有肌肉减少症的老年人站立困难、步履缓慢、容易跌倒骨折。
几乎所有病理过程都会引发肠道微生物群的失调。反过来,微生物群失调也在骨骼肌质量和功能下降中发挥着至关重要的作用。由于肠道微生物组是导致肥胖或胰岛素抵抗等代谢失调表型的发生和加剧的原因,因此骨骼肌质量和功能可以部分受到肠道微生物组的调节。
老年人肠道菌群:促炎菌增多
健康肠道微生物群的主要门是厚壁菌门、拟杆菌门、放线菌门和疣微菌门,变形菌门的数量较少。在老年人和营养不良者中,都显示促炎症的变形计门增加,而产丁酸菌普拉梭菌,罗氏菌属减少。肠道菌群失调引起的循环促炎细胞因子的增加可以通过不同的机制(胰岛素抵抗、炎症和相关的氧化应激)诱导肌肉萎缩。
肠道菌群失调的两个最典型的例子:
炎症性肠病(IBD)和衰老引起的肌肉功能衰竭
接下来我们用这两个例子来具体阐述肠道菌群失调引起肌肉减少症的内在机制。
➤ IBD
IBD→肠道菌群失调→炎症→肌肉萎缩
IBD 的典型特征是肠道微生物群失调,肠道菌群失调往往伴随着肠道屏障损伤和肠道屏障通透性增加,内毒素和其他细菌代谢产物容易进入循环系统,从而增加LPS(脂多糖) 和其他炎症因子的水平,诱发体内的炎症反应。LPS 诱导的炎症的一个特征性表现是由于蛋白水解降解增加和蛋白质合成减少引起的严重肌肉萎缩。
肠道菌群失调→氧化应激→肌肉无力
肠道菌群的失调还可能导致肠道氧化应激、肠粘膜炎症和屏障功能障碍,从而引起免疫功能障碍。高水平的活性氧 (ROS) 引起的氧化应激可导致骨骼肌收缩障碍,导致肌肉无力和疲劳。因此,肠道微生物群失衡引起的炎症反应和氧化应激会对肌肉功能产生负面调节。
在结肠炎小鼠模型中,股四头肌和腓肠肌的骨骼肌质量和肌纤维横截面积减少,肌肉蛋白质含量减少。与此同时,肌肉功能障碍恶化,肌肉生长标志物 IGF-1 R(胰岛素样生长因子 1 受体) 和雷帕霉素磷酸化哺乳动物靶标 (mTOR) 下调。
研究人员认为,肠道微生物群失调引起的炎症可能是骨骼肌萎缩的触发因素。与肌原纤维分解相关的肌肉萎缩F-box(atrogin-1)和肌肉环指蛋白1(Murf-1)表达增强,介导肌原纤维加速分解。
IBD→炎症→肌肉合成和分解代谢→肌肉损伤
临床研究还发现,肌肉损伤是 IBD 等慢性胃肠道疾病的常见病理特征。42% 的 IBD 患者会出现肌肉减少症。
肠道微生物群刺激粘膜免疫细胞,促进促炎细胞因子(IL-6、IL-10、TNF-α等)的产生,产生一般状态慢性低度炎症,激活氧化应激损伤,进一步影响胰岛素敏感性、氨基酸生物合成、线粒体、生物生成、肌肉合成和分解代谢以及增加肌肉衰减相关分子途径。这可能导致肌肉骨骼损伤和虚弱。
➤ 衰 老
同样,体弱或活动能力差的老年人肠道微生物群的复杂组成也表现出不同程度的失调,物种丰富度降低以及机会性病原体和抗炎菌群之间的不平衡。
衰老→菌群多样性↓↓→代谢↓↓→炎症↑↑
肠道微生物群失调可能与肌肉萎缩的复杂机制有关。具体而言,肠道微生物群多样性因衰老而降低。同时,调节肠道环境的代谢能力也会下降,肠道屏障功能减弱,肠道粘膜通透性增加,从而导致包括脂多糖在内的细菌产物的吸收增加,并激活体内炎症反应。
与衰老相关的肠道微生物组会促进炎症,从而导致循环炎症介质的水平增加,而逆转这些与年龄相关的微生物组变化是减少与年龄相关的炎症和伴随发病率的潜在策略。
脂多糖促炎→代谢综合征→诱发骨骼肌衰老
脂多糖促进炎症信号传导,诱发骨骼肌炎症和胰岛素抵抗,从而促进代谢综合征的过程,进而诱发骨骼肌衰老。
研究表明,脂多糖相关细胞因子对蛋白质平衡(即合成和分解)的能力有决定性影响,并且随着衰老而增加的细胞因子可能会导致肌肉质量减少。
炎症反应增强会加剧骨骼肌质量损失
例如,在肌肉减少症患者中,IL-6 和 TNF-α 等促炎因子水平升高会导致肌肉质量减少。抗 TNF 治疗可以逆转微生物群中与年龄相关的变化,因此具有潜在的抗肌肉衰老作用。
肠道菌群变化与衰老中免疫稳态的紊乱有关
移植了年老小鼠肠道微生物群的年轻无菌小鼠的小肠,发现了与免疫相关的差异遗传特征,包括抗原呈递减少以及细胞因子和趋化因子产生的改变。这些基因可能在肠道微生物组老化过程中作为免疫紊乱的标志物发挥潜在作用。
肠道菌群失衡→肠漏→LPS释放到外周血
由于上述各种原因(炎症、营养不良、恶病质、衰老等)引起的肠道微生物生态系统组成的变化,可能导致肠漏和细菌内毒素(例如LPS)释放到外周血中。LPS可以通过TLR4受体触发巨噬细胞产生炎症细胞因子和ROS。
限制蛋白质合成,促进肌肉生长蛋白水解,肌肉萎缩
在骨骼肌中,TNF-α 激活参与NF-κB通路的基因表达,从而通过抑制肌细胞生成素和 myoD 来减少肌细胞分化和增殖。IL-6和IκB激酶可以抑制与诱导胰岛素抵抗相关的胰岛素受体底物1,限制mTORC1(雷帕霉素复合物1)肌肉靶标的激活,从而限制肌肉细胞中的蛋白质合成。
此外,由于蛋白激酶B受到抑制,叉头盒O的抑制作用不再发挥,导致泛素E3连接酶Atrogin-1和MuRF1表达增加,促进肌肉生长蛋白水解。
同样,不受 mTORC1 抑制的自噬激活激酶 1 进一步诱导骨骼肌细胞自噬。当肠道菌群失调引起的这些调节机制被激活时,蛋白质分解/合成之间就会出现不平衡,并最终导致肌肉萎缩。
其他机制:细菌群体感应,短链脂肪酸,胆汁酸
其他机制包括粪肠杆菌在细菌失调过程中产生的群体感应肽iAM373,下调了大多数骨骼肌发育和分化基因,降低了成肌细胞的代谢活性,并上调了肌管中的蛋白酶体降解途径,这是一种肌肉减少症新的诱导剂。
队列研究表明,肌肉减少症还与产生短链脂肪酸 的菌减少相关,从而导致肠道菌群失衡。
肠道菌群失调可能通过上调初级胆汁酸-法尼醇 X 受体途径导致骨骼肌萎缩。
骨
随着肠道微生物群在骨代谢稳态中的关键作用得到更好的了解,人们对肠道微生物群在调节骨骼健康中的重要作用越来越感兴趣(以前我们的文章专门介绍过肠道菌群与骨骼生长于骨代谢的关系,详见:肠道微生物如何影响骨骼发育和代谢 )。
肠道菌群失调与骨骼之间存在密切关系
研究发现,TLR5缺陷小鼠的肠道微生物群受损和微生物多样性较差会引起整体骨强度的变化;另外,长期使用抗菌药物引起的肠道菌群损伤(主要表现为拟杆菌、变形菌显著上调)导致小鼠骨性能受损,尤其是总骨量减少。卵巢切除术会导致小鼠肠道微生物群失调并导致骨质流失,这是由微生物依赖性 T 淋巴细胞(例如 Th17细胞)介导的。
骨密度低:
罗氏菌属、双歧杆菌属↓↓ 合成LPS的菌↑↑
在骨骼疾病患者中观察到肠道微生物群的变化。横断面研究表明,肠道微生物群与骨矿物质密度积累之间存在关联。最近,一项全基因组研究确定了与骨量变异相关的梭菌目和毛螺菌科。研究发现,与健康人相比,有害细菌过度生长的患者骨量较低,骨质流失率较高。
注:骨质流失加剧是 IBD 的常见并发症,肠道菌群失调也是IBD 的重要表现。
临床研究表明,骨矿物质密度低的个体肠道微生物群的组成和丰度显着下降。罗氏菌属(Roseburia)、双歧杆菌属和乳酸菌属等细菌群与骨密度呈正相关。然而,在骨矿物质密度较低的人群中,与LPS合成相关的微生物群更为丰富。
骨质疏松患者:多样性与骨密度呈负相关
研究发现,厚壁菌门/拟杆菌门的比例与骨量呈负相关,而放线菌和双歧杆菌与骨量呈正相关。使用 16sRNA 测序对骨质疏松症(OP)的肠道微生物群进行分析表明,肠道微生物群多样性估计值与骨矿物质密度呈负相关。
在骨质疏松患者中,如下菌属的丰度增加:
其他研究发现骨质疏松症患者Dialister和Faecalibacter显著增加。
菌群失调→营养素吸收能力下降→影响骨骼健康
微生物群对骨骼健康所需的营养素(例如钙和维生素 D)的运输和吸收具有必要的影响。肠道微生物群失调可能会损害营养物质和钙通过肠道进入循环系统的运输。随着年龄的增长,肠道对1, 25(OH) 2的吸收能力下降,这与肠道菌群失调密切相关。这也是微生物群失调影响骨骼健康的主要原因之一。
免疫系统干预肠道微生物群和骨代谢
生物多样性的变化和机会性病原体的定殖导致细菌内毒素的增加,例如脂多糖(LPS)、这与肠道炎症反应的增加有关,而炎症的增加与破骨细胞的激活有关。
肠道菌群失调会介导炎症
尤其是IL-1、TNF-α 和 IL-6,它们与骨质疏松症一样在破骨细胞激活中发挥着关键作用。
肠道微生物组依赖性Th17细胞和产生 TNF-α 的 T 细胞增殖产生大量促炎细胞因子(IL-17、TNF-α)、NF-κB 配体受体激活剂 (RANKL)、并减少RANKL拮抗剂的分泌(RANKL诱导破骨细胞功能,IL-17减少骨形成;TNF-α增强RANKL活性,诱导Th17细胞增殖和活化,是该过程中潜在的免疫调节机制。
注:Th17细胞是一类免疫细胞,主要参与调节免疫系统的炎症反应,并在自身免疫性疾病和炎症性疾病中发挥重要作用。
新生成的破骨细胞诱导了 Treg 细胞的生成。它抑制免疫反应,诱导和维持免疫耐受,通过多种途径减少炎症,并产生免疫抑制细胞因子,例如 TGF-β 和 IL-10。 Treg 细胞和 Th17 细胞之间微妙而复杂的关系会影响骨骼健康。重要的是,肠道细菌是控制这种平衡的关键。
注:破骨细胞是一种骨髓源性巨核细胞系的细胞,主要功能是吸收和降解骨组织。
Treg细胞是调节性T细胞(Regulatory T cells)的简称。它们是一类免疫细胞,主要功能是抑制免疫系统的活性,以维持免疫平衡和自身耐受。
肠道菌群→血清素下调→调节骨代谢
5-HT是5-羟色胺的缩写。它是一种神经递质,也称为血清素。根据合成部位分为两类:脑源性5-HT和肠源性5-HT。
有趣的是,这两种 5-HT 具有不同的功能:肠道来源的血清素对骨形成有负面影响,而大脑来源的血清素则具有相反的影响。近年来研究发现,肠道菌群不仅诱导细胞因子调节骨代谢,还通过减少血清素生物合成酶、增加血清素转运蛋白,下调肠源性血清素水平,从而调节骨代谢。
肠道菌群→改变 IGF-1→调节骨质量
IGF-1 在骨形成和生长的调节中也起着至关重要的作用。肠道微生物群可能通过改变 IGF-1 水平来调节整体骨质量。例如,传统特定肠道微生物群对成年 GF 小鼠的定植可以增加循环 IGF-1 并增加骨的形成和吸收。
菌群多样性↓↓→循环雌激素↓↓→影响骨钙沉积
肠道微生物群多样性减少也可能导致循环雌激素减少,进而影响正常骨钙沉积,因为肠道微生物群通过β-葡萄糖苷酶分泌调节雌激素,β-葡萄糖苷酶将雌激素分解为其活性形式。
注:IGF-1是胰岛素样生长因子-1(Insulin-like Growth Factor 1)的缩写。它是一种蛋白质激素,由肝脏和其他组织产生,并受到生长激素的调控。IGF-1促进细胞增殖和分化,对于骨骼和肌肉的生长和修复具有重要作用;也与肿瘤生长和代谢相关;较高的IGF-1水平与较长的寿命和较少的年龄相关疾病风险有关。
▸▹小结
根据上述研究结果提示,与肌肉健康类似,骨骼健康相关的肠道菌群紊乱主要表现为肠道优势菌群消失或减少,有害菌或衰老菌群的增殖导致LPS等产生过多或引起更多的炎症反应。机制主要涉及细胞因子以及Treg和Th17细胞的成骨/破骨平衡的微妙控制。
与肌肉健康不同,肠道菌群失调对钙离子有效吸收的影响以及肠道来源的 5-HT、IGF-1 和雌激素的调节作用也在此强调。这些机制是否也对肌肉健康发挥作用,可能是个有意义的探索方向。
骨 关 节
近年来,越来越多的证据表明肠道菌群失调与类风湿关节炎(RA)的发生和发展密切相关。在人类和动物研究中也观察到类风湿关节炎中肠道微生物群失调。
类风湿关节炎:拟杆菌↓↓,乳杆菌属、普雷沃氏菌属↑↑
在类风湿关节炎模型小鼠中,拟杆菌门减少、厚壁菌门和变形菌门增加。该模型还导致 14 种肠道细菌失衡,并对色氨酸、脂肪酸和次级胆汁酸等代谢物产生相当大的干扰。
在类风湿关节炎患者中,各种乳杆菌属(Lactobacillus)和普雷沃氏菌属( Prevotella)更加丰富;因此,普氏菌数量增加和肠道菌群失衡是 类风湿关节炎发展的潜在资源。
广古菌门(Euryarchaeota)与类风湿关节炎的严重程度直接相关,成为类风湿关节炎发病的独立危险因素。
拟杆菌丢失,普雷沃氏菌存在
在未经治疗的新发类风湿关节炎患者的粪便微生物群中,普雷沃氏菌(Prevotella)的存在同时拟杆菌的丧失(拟杆菌与普雷沃氏菌一般认为是拮抗菌)存在强烈相关性。
从类风湿关节炎患者的滑膜组织中分离出细菌 rRNA。类风湿关节炎患者肠道菌群中乳杆菌的数量和多样性显著增加,与报道胶原蛋白诱导性关节炎小鼠体内乳酸杆菌增加的数据一致。矛盾的是,嗜酸乳杆菌(Lactobacillus acidophilus)和干酪乳杆菌( Lactobacillus casei)似乎有利于类风湿关节炎的改善。
致病菌破坏屏障,促炎,诱导关节炎发生和维持
肠道机会致病菌,如普雷沃氏菌,可能通过增强细胞凋亡机制、破坏肠道屏障完整性,参与促炎免疫状态的形成,从而诱导关节病炎症的发生和维持。此外,Th17 细胞通过产生一系列炎症因子来促进破骨细胞分化,这些炎症因子是导致类风湿关节炎骨质破坏期的原因。拟杆菌的减少可能通过减少 Treg 细胞分化来促进局部炎症环境。
骨关节炎的发生可能是由于肠道菌群组成发生特异性变化,尤其是机会性促炎菌增多,具有抗炎特性的共生菌显著减少,肠道通透性增加,然后LPS引起炎症和免疫反应,诱导级联信号通路激活,导致关节病变甚至疼痛,但相关证据有限。而类风湿性关节炎与免疫炎症相关的研究相对深入,肠道菌群多样性较为丰富,但也导致机制更加复杂,需要进一步探索。
这里主要总结了益生菌及其次级代谢产物对肌肉骨骼系统的影响和机制。
骨 骼 肌
由于肠道微生物组的活性,肠道与骨骼肌相关,并通过调节全身/组织炎症、胰岛素敏感性等来调节肌肉功能。
益生菌通过改善肠道微生物群的多样性,来对抗肌肉质量和功能的损失。
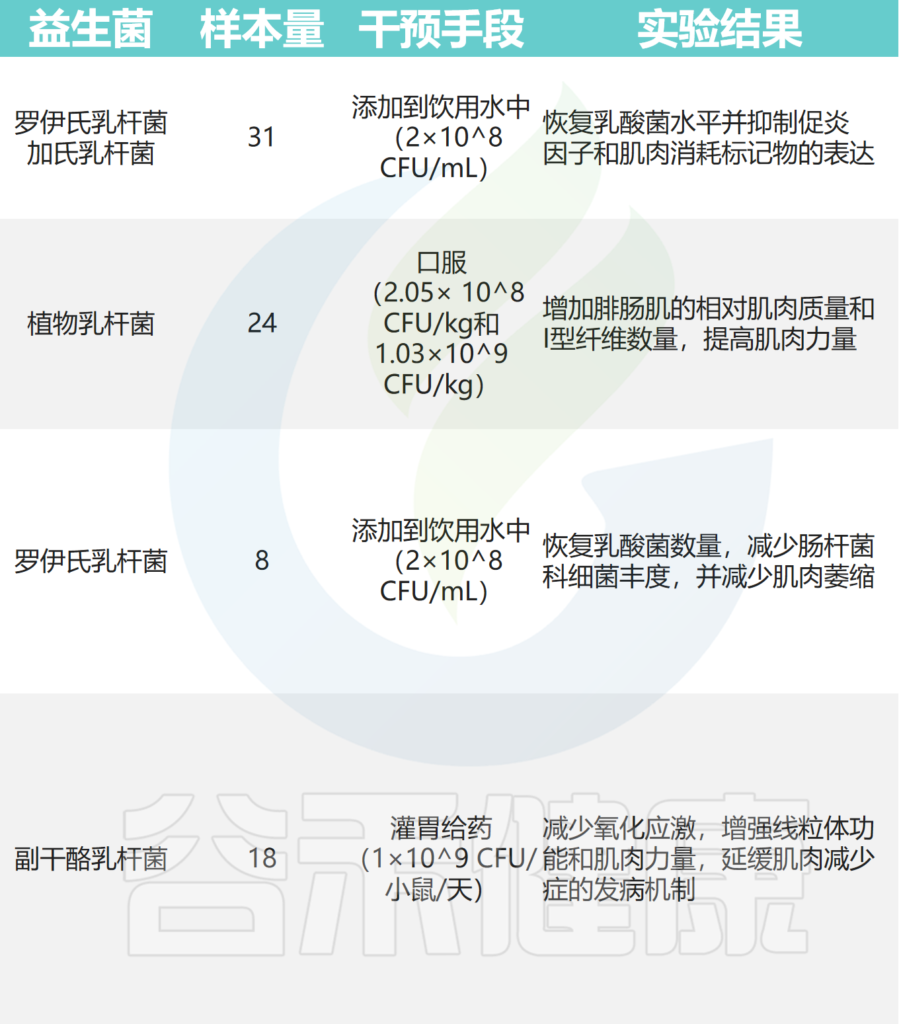
➤小鼠模型
在小鼠癌症模型中,罗伊氏乳杆菌能够抑制恶病质的发展,并与肌肉质量的保存有关。
植物乳杆菌HY7715通过改善老年 Balb/c 小鼠的骨骼肌质量和功能来改善肌肉减少症。
补充植物乳杆菌TWK10 可改善小鼠的运动表现并增加肌肉质量。
副干酪乳杆菌PS23 通过确保 SAMP8 小鼠的线粒体功能来减缓与年龄相关的肌肉损失。恢复特定乳酸杆菌水平可减少急性白血病小鼠模型中的炎症和肌肉萎缩标志物。
其他实验还表明,至少有七种益生菌对小鼠骨骼肌质量和强度有益:
其中,使用最广泛的菌株是乳杆菌和双歧杆菌,它们可以改善肌肉质量、力量和耐力损失。
益生菌有助于肌肉健康,提高蛋白质合成和力量,但益生菌的作用可能针对不同的信号或代谢途径和组织,例如降低炎症和压力、维持肌肉蛋白质合成、并提高了肌肉力量。然而也有研究表明,对肌肉质量和功能的影响几乎很小,仅观察到一定的抗炎作用。
➤人类
年轻人:益生菌可以改善运动耐力、增肌
在人类中,已经发现摄入特定的益生菌可以改变肠道微生物群,有利于增加骨骼肌质量。例如,摄入植物乳杆菌TWK10 六周可以提高年轻人在跑步测试中的耐力表现。补充植物乳杆菌表明,益生菌可以改善运动表现、耐力以及身体成分,减少脂肪量并增加肌肉量。
老年人:需进一步探索益生菌对肌肉的影响
不过,也有报道称,老年人补充益生菌在一定程度上可以导致肠道菌群发生有益变化,减少病原体,改善便秘,但对宿主健康的影响相对较小。
含有乳酸菌和双歧杆菌菌株以及干酪乳杆菌的对老年人的肌肉状况没有影响。这些发现表明益生菌的作用机制很复杂,需要进一步研究。
最近的一项荟萃分析表明,补充益生菌可以增强肌肉质量和力量,但在总去脂体重方面没有观察到有益效果。该研究表明,探索不同老龄化人群生理机制的差异,并探索补充合适的益生菌菌株以获得最佳肌肉质量和力量非常重要。
上述发现,研究的稀缺性、人群的变异性和重复性低,导致很难找到优化肌肉质量和功能的特定益生菌菌株,需要在更明确的人群中进行进一步研究设计个性化的益生菌干预措施。
— 改善血糖,提高肌肉质量和功能
益生菌可降低厚壁菌门与拟杆菌门的比例,从而提高小鼠的肌肉质量、耐力和力量。添加 植物乳杆菌 TWK10和 CP2998 可通过抑制糖皮质激素受体激活、改善血糖对肌肉发挥积极作用。
扩展阅读:
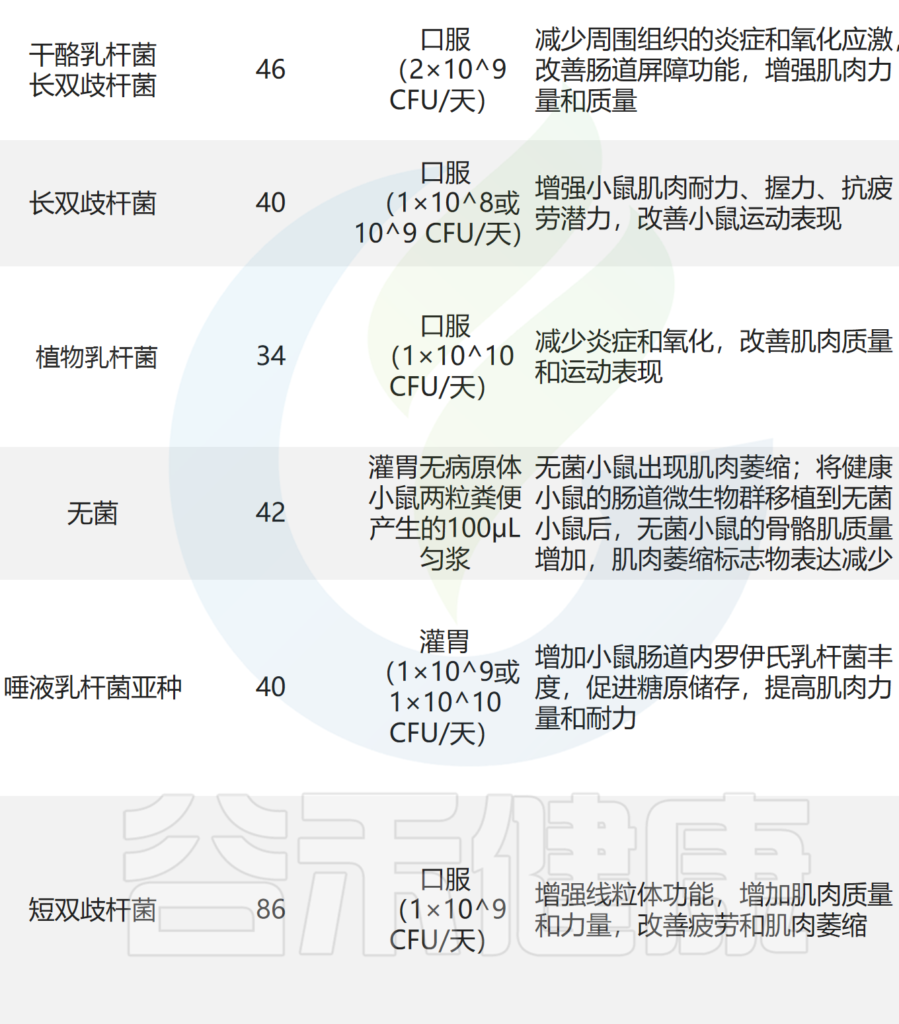
— 抑制炎症反应,改善肌肉合成
补充干酪乳杆菌LC122 和 长双歧杆菌BL986可降低炎症细胞因子 TNF-α、IL-6 和 IL-1β 的表达,并改善肌肉蛋白合成。
口服短双歧杆菌和鼠李糖乳杆菌可显着降低小鼠促炎细胞因子 IL-2、IL-4、IL-6 和 TNF-α 的水平,从而抑制炎症反应。还通过增加 IL-10 水平来减轻肌肉炎症。
还发现含有植物乳杆菌 TWK10 和罗伊氏乳杆菌的可以改善小鼠的肌肉质量,这与减少炎症和肌肉萎缩标记物表达有关。
— 抗氧化,或增加蛋白质吸收的方式
服用副干酪乳杆菌PS23的老年小鼠肌肉中抗氧化应激因子(例如超氧化物歧化酶和谷胱甘肽过氧化物酶)的表达较高。
罗伊氏乳杆菌可提高乳清蛋白中亮氨酸的吸收比例,从而增强蛋白质吸收,提高蛋白质利用率,最终促进肌肉合成,增加肌肉质量。
— 其他作用机制
益生菌的有益作用还通过多种机制产生,包括诱导免疫调节、抵抗生理应激、抑制病原体和改善肠上皮细胞的屏障功能。益生菌调节肌肉的潜在机制主要包括:
doi: 10.1080/19490976.2023.2263207
肠道益生菌限制胰岛素抵抗、调节代谢途径或抑制氧化应激和炎症。肠道菌群还可以通过不同的代谢途径将营养物质分解为次级代谢产物,调节肠道免疫和代谢稳态,维持宿主与肠道菌群之间的共生和寄生关系。
下面讨论这些代谢产物对骨骼肌代谢的主要影响和作用机制。
短链脂肪酸(SCFA)是肠道菌群对膳食纤维发酵产生的代谢产物,主要包括丁酸盐、丙酸盐和乙酸盐。SCFA 在葡萄糖和脂质稳态、炎症调节以及肠道与其他远端组织之间的连接中发挥着重要作用。
SCFA在调节肠道环境稳态、改善糖代谢、促进钙磷吸收、缓解氧化应激和炎症反应等方面发挥着重要作用,对调节骨骼肌功能具有重要意义。
无菌小鼠接受 SCFA 治疗后,骨骼肌损伤得到部分逆转(SCFA 降低了 atrogin-1 表达,增加了 MyoD 以及肌肉质量和功能),表明肠道菌群产生的 SCFA 在调节骨骼肌功能中发挥着关键作用。
丁酸盐:保持肌肉质量
在一项针对雌性 C57BL/6 小鼠的研究中,丁酸盐治疗后后肢肌肉萎缩得到完全或部分改善,而常规饮食喂养的老年 C57BL/6 雌性小鼠后肢肌肉质量显着降低。丁酸盐不仅能保持肌肉质量,还能改善小鼠的葡萄糖耐量,但对胰岛素耐量没有显着影响。
丁酸盐:改善线粒体功能,减少氧化应激,防止骨骼肌损伤
丁酸盐还能增加线粒体蛋白孔蛋白和线粒体转录因子 A 的水平,并显着改善骨骼肌细胞中的线粒体功能。
此外,丁酸盐治疗可减少小鼠氧化应激表达和细胞凋亡标记物,并改变抗氧化酶的活性,从而防止氧化应激引起的骨骼肌损伤。
丁酸盐:改善与年龄相关的肌肉损失
丁酸盐是一种重要的 SCFA 和组蛋白脱乙酰酶抑制剂,可调节与年龄相关的肌肉损失。丁酸盐已可以通过抑制组蛋白脱乙酰酶表达并改善老年小鼠的肌肉质量和横截面积来促进肌肉合成。
乙酸盐:促进葡萄糖吸收,减少肌内脂质生成
添加乙酸盐可以促进兔骨骼肌中的葡萄糖吸收和糖原生成,并通过增加脂肪酸和氧化来减少肌内脂质生成。
此外,SCFA 还可诱导 IGF-1 产生,从而促进肌肉合成代谢。SCFA 的这些代谢影响可能直接作用于骨骼肌,也可能通过刺激胰高血糖素样肽 1 (GLP-1) 分泌而间接产生。SCFA 对肌肉的其他间接影响包括加速血流效应。
分解色氨酸,产生吲哚代谢物:抗炎,增强肌肉蛋白合成
色氨酸是人体不可缺少的芳香氨基酸。肠道菌群分解色氨酸过程中产生的富含吲哚和吲哚衍生物的代谢物在维持肠道环境稳态和肠道菌群多样性方面发挥着关键作用。
来自肠道微生物群的吲哚代谢物可以增强体内IL-10水平,而IL-10在调节宿主炎症状态方面具有抗炎作用。
其他研究的证据表明,色氨酸代谢物吲哚丙烯酸可通过下调炎症和氧化应激相关基因表达来促进肠道屏障功能并抑制炎症反应。当机体处于慢性炎症状态、肌肉蛋白合成受到限制时,色氨酸代谢物的抗炎作用尤其重要。
肠道菌群→影响胆汁酸代谢→影响骨骼肌代谢
胆汁酸是肝脏产生并分泌到肠道的小代谢分子,参与膳食脂质吸收。肠道菌群可以改变胆汁酸的结构、生物利用度和生物活性,从而影响胆汁酸代谢和宿主代谢稳态。
肠道厌氧菌已被证明可以将初级胆汁酸转化为次级胆汁酸。毛螺菌科也可以产生 SCFA 并从初级胆汁酸转变为次级胆汁酸。
肠道菌群可能参与胆汁酸代谢和 FXR-FGF19 信号通路(有证据表明 FGF19 激活可以抑制肌肉萎缩标志物的蛋白表达,增强与生肌分化相关的分子,调节骨骼肌蛋白平衡,这反过来又影响骨骼肌代谢。次级胆汁酸还可以通过促进脂质和葡萄糖代谢来增强肌肉功能。
益生菌→促进维生素合成→影响骨骼肌功能
维生素是人体必需的微量营养素,大部分是人体无法合成的。实验证据证实,肠道益生菌促进体内维生素的合成,对骨骼肌功能有显著影响。例如,双歧杆菌和乳酸杆菌可以合成B族维生素 (包括叶酸、核黄素、维生素 B12)。B族维生素是直接参与能量代谢的水溶性维生素,它们的缺乏会导致心肌损伤和心力衰竭。维生素 B12缺乏会增加同型半胱氨酸水平并导致肌肉损伤。
骨
先前的研究表明,益生菌有利于肠道稳态,并在预防和治疗骨质流失中发挥关键作用。
益生菌
胃肠道中乳杆菌的上调可以产生有效的杀菌剂和有机酸,从而抑制致病性大肠杆菌。肠道菌群中乳酸杆菌和乳球菌丰度的增加。
罗伊氏乳杆菌补充剂可以显着改善肠道微生物群的不平衡,增强肠道屏障功能以防止骨质流失。
在一项随机对照试验中,75-80 岁骨量低的绝经后妇女每天服用罗伊氏乳杆菌,12个月后骨密度下降的比例明显低于对照组,这表明益生菌补充可以减少骨质流失。
补充普通双歧杆菌还可以降低 LPS 浓度,从而抑制炎症反应并防止骨质流失。
嗜酸乳杆菌和克劳氏芽孢杆菌(Bacillus Clausii)可以通过平衡炎症细胞因子的水平来维持骨稳态。
长双歧杆菌还可以预防和治疗骨质疏松症,通过增强成骨细胞活性和抑制破骨细胞形成来改善骨质流失。
此外,益生菌可以通过调节矿物质吸收来改善骨骼健康。例如,长双歧杆菌可以通过改善钙、磷酸盐和镁等矿物质的吸收来增强骨密度。罗伊氏乳杆菌可以通过抑制破骨细胞来减轻骨质流失。
益生菌促进维生素B12、维生素D、钙等吸收
维生素B12水平低还会抑制成骨细胞活性,从而增加骨质疏松风险,甚至诱发骨折。
益生菌如乳酸菌和双歧杆菌,在促进核黄素和叶酸的形成方面发挥着关键作用。核黄素和叶酸对于促进维生素合成和调节炎症反应很重要。研究表明,核黄素在一定程度上具有抗炎作用,其摄入可抑制大鼠白细胞中TNF-α的释放。
核黄素还作为抗氧化酶的辅助因子调节氧化应激。叶酸与调节胰岛素抵抗和抑制促炎细胞因子 IL-6、IL-8 和 TNF-α 有关。
不难发现,B族维生素的抗炎、抗氧化、参与能量代谢等功能对于维持骨骼健康是不可或缺的。钙和维生素 D 的吸收对于健康的骨骼维护尤为重要,益生菌可降低肠道PH值并改善钙吸收,从而增强骨骼功能。
多联益生菌→抗炎→减轻骨关节炎
在骨关节炎(OA)大鼠模型中,益生菌复合物通过抑制促炎细胞因子和软骨破坏来减轻骨关节炎的发展。
在一项人体试验中,537 名 骨关节炎(OA) 患者随机分配到干酪乳杆菌或安慰剂组,6 个月后,与对照组相比,干酪乳杆菌组的全身炎症显着降低。口服嗜热链球菌可改善骨关节炎变性。
口服丁酸梭菌(Clostridium butyricum)可有效保存 骨关节炎大鼠膝关节软骨和滑膜,显着减少纤维组织量,并显着降低骨和软骨各种炎症和代谢标志物的血清浓度。
干酪乳杆菌通过下调促炎细胞因子来减轻关节炎症损伤。益生菌最近添加到治疗关节炎症的药物清单中,因为干酪乳杆菌可以抑制关节肿胀、减少类风湿性关节炎,并防止关节炎症大鼠的骨质破坏。
嗜酸乳杆菌和干酪乳杆菌也常用于治疗类风湿性关节炎的缓解剂。还有人提出,用于缓解类风湿性关节炎相关后果的益生菌补充剂的可用性仍然很弱,而且益生菌对类风湿性关节炎的影响似乎是菌群特异性的。
肠道菌群代谢产物
短链脂肪酸:参与骨代谢,抑制骨吸收
短链脂肪酸(SCFA)参与骨代谢并影响骨形成和吸收。SCFA 对骨量的保护作用与抑制骨吸收有关。从潜在机制来看,丁酸盐和丙酸盐诱导破骨细胞代谢重编,增强糖酵解,下调关键破骨细胞基因,显着减少破骨细胞数量,从而抑制骨吸收。
因此,SCFAs是破骨细胞代谢和骨稳态的有效调节剂,在促进骨形成中发挥重要作用。
丁酸盐:促进骨合成代谢,维持骨代谢平衡
在一项小鼠研究中,发现丁酸盐可以通过调动成骨细胞中的 Wnt 信号通路来促进骨合成代谢并增加骨量。
此外,丁酸盐可以保护成骨细胞前体细胞免受过氧化氢诱导的损伤,并促进成骨细胞的矿化和分化。它主要通过增强细胞抗氧化酶的活性、促进ATP的产生、降低ROS水平来维持骨代谢的平衡。
短链脂肪酸还可诱导 IGF-1 的产生
IGF-1除了促进骨骼肌功能外,在骨代谢中起着至关重要的作用。IGF-1参与骨形成和吸收,调节骨代谢平衡。因此,SCFA 在维持骨代谢过程中的体内平衡中发挥着关键作用。
短链脂肪酸→调节IL-10→减轻关节炎
乳酸菌产生的丁酸通过控制软骨细胞自噬和炎症细胞死亡来抑制骨关节炎。益生菌衍生的丁酸盐可以通过影响 T 和 B 细胞的进展来抑制小鼠关节炎。
色氨酸代谢与骨代谢密切相关
犬尿氨酸是一种色氨酸代谢物,是色氨酸酶降解后形成的第一个稳定代谢物。
犬尿氨酸在骨代谢中的关键功能似乎是加速骨质流失并介导对骨骼的不利影响。犬尿氨酸含量随着衰老而增加,其对骨骼的不利影响可能是由于其对破骨细胞活化的影响,导致骨骼脆性增加和骨重塑失衡。
其他研究表明,犬尿氨酸水平升高会损害成骨细胞分化并增加破骨细胞吸收,从而加速骨骼老化。
次级胆汁酸调节骨稳态
次级胆汁酸还通过调节成骨细胞和破骨细胞之间的信号转导来调节骨稳态。此外,次级胆汁酸诱导 GLP-1 的产生,GLP-1 调节葡萄糖稳态并刺激成骨细胞分化并能进一步增强骨骼系统的功能。
对于益生菌及其次级代谢产物,其抗炎和免疫调节特性值得进一步研究,以确定其在肌肉骨骼系统中的作用和生物学机制。
小结
常见肠道微生物群对肌肉骨骼系统的影响
doi: 10.1080/19490976.2023.2263207
肠道微生物群及其产生的代谢物的重要作用:
然而,肠道微生物群的失衡还会引发一系列负面影响:
肠道菌群与肌肉骨骼系统的正常代谢密切相关。可以采取适当的干预措施,促进肠道益生菌发挥最佳调节作用。
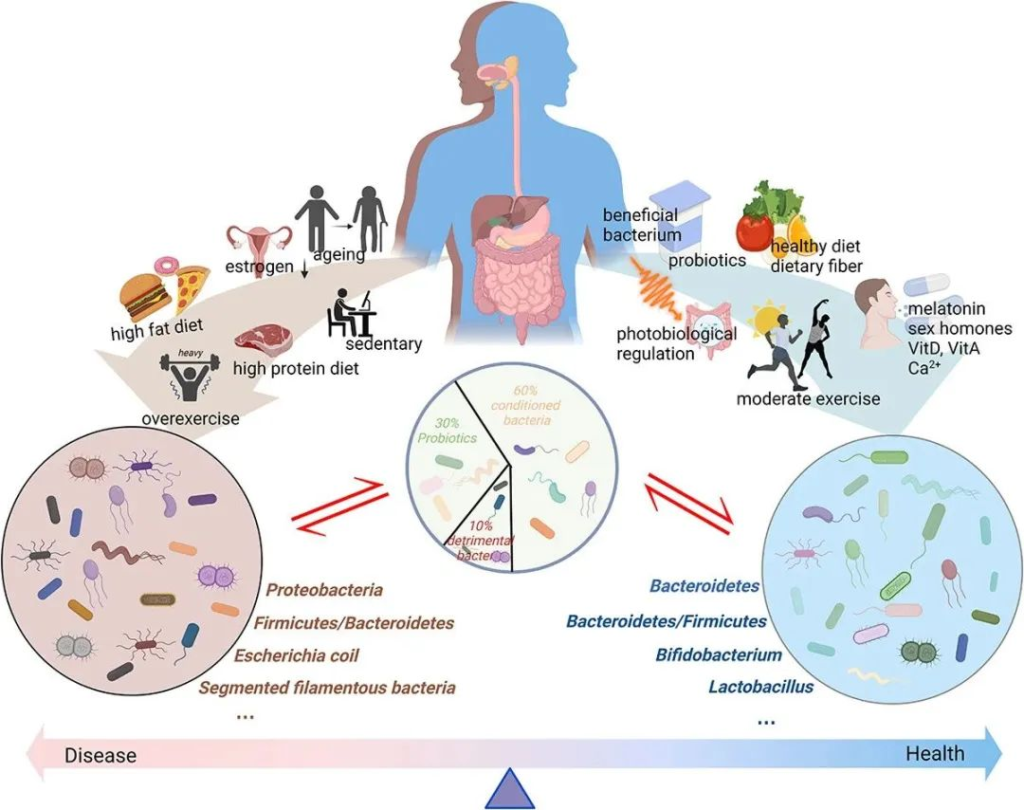
doi: 10.1080/19490976.2023.2263207
肠道微生物群一般分为三类:益生菌、有害菌和条件菌。
不同的生活方式对肠道微生物群产生不同的影响。衰老、性激素分泌减少、高脂肪饮食、高蛋白饮食以及久坐的生活方式或过度运动会对肠道微生物群产生负面影响。这些都会导致有害细菌比例增加,诱导粘膜通透性并引发一系列负面反应。同时,健康饮食、适度运动、光生物调节、补充益生元和益生菌、维生素、钙、性激素、褪黑素等可以促进肠道菌群的积极变化,从而增强肌肉骨骼系统功能。
促进肌肉骨骼系统健康
益生元通过选择性刺激某些肠道菌群的活性或生长,对宿主肌肉骨骼系统产生有益的生理作用。益生元有助于有益菌生长,比如乳杆菌和双歧杆菌等,常见的益生元有菊粉、低聚糖等。
益生元可改善肠道屏障功能和宿主免疫力,并减少梭菌等潜在致病菌的丰度。
益生元→炎症↓↓→肌肉质量↑↑
结果表明,喂食益生元纤维寡糖的小鼠的循环 LPS 水平和炎症降低,肌肉质量增加。此外,补充益生元可提高双歧杆菌、乳杆菌、拟杆菌门/厚壁菌门的比例。
同时,益生元作为膳食纤维的一种,也可以促进 短链脂肪酸的生成。
维生素D:有利于钙吸收、维持肠道屏障
维生素 D 是增加骨量的关键因素。除了直接影响钙吸收外,维生素 D 还通过维持肠道屏障的完整性来调节肠粘膜稳态,从而影响免疫系统功能和炎症反应。维生素D可以抑制促炎因子的水平,促进体内抗炎因子的分泌。
维生素D:改善肠道微生物稳态、促进肌肉合成
具体研究结果表明,维生素 D 补充剂可以调节女性肠道菌群并增加其多样性。维生素D补充后,AKK菌和双歧杆菌的相对丰度增加。
争议:维生素D能否改善肌少症,需要更多研究
维生素 A 在维持肠道屏障功能、调节免疫反应和细菌多样性以维持肠道稳态方面表现出类似的功能。但是同时有报道称,补充维生素 D 并不能改善社区老年人的任何肌肉减少症指数,并且可能会损害身体功能的某些方面。需要更多的实验证据来阐明维生素 D 的作用。
钙:菌群多样性↑↑ 有益菌↑↑ 保护肠道屏障
钙是体内最常见的矿物质,其摄入量关系到骨骼的健康发育。钙也是维持骨骼肌正常兴奋和收缩功能的最重要元素。膳食钙摄入量会引起肠道微生物群的变化。例如,用膳食钙喂养的小鼠肠道微生物群多样性显著增加,双歧杆菌、拟杆菌、瘤胃球菌科(Ruminococcaceae)和阿克曼氏菌(Akkermansia)丰度更高。
此外,膳食钙似乎对肠道屏障具有保护作用,通过增加宿主体内膳食钙的吸收来增加缓冲能力并促进骨量。总之,膳食钙可调节肠道微生物群,与宿主建立交叉对话,促进新陈代谢,并促进肌肉骨骼健康。
促进肌肉骨骼系统健康
肠道微生物群最近被定义为宿主营养信号的“传感器”。所消耗食物的类型和多样性与肠道微生物群的组成密切相关。
动物性饮食:拟杆菌门↑↑ 乙酸盐、丁酸盐↓↓
先前研究的证据表明,饮食模式的长期变化会引起肠道菌群的变化。短期饮食改变也会导致肠道微生物群的变化。例如,从植物性饮食转变为动物性饮食后,肠道中乙酸盐和丁酸盐的浓度显着降低。此外,以动物为基础的饮食增加了拟杆菌门的数量,并减少了厚壁菌门数量。
富含蛋白质的饮食:菌群多样性↑↑ 拟杆菌↑↑
骨骼肌质量受到肌肉蛋白质合成和分解的影响,肠道微生物群随年龄的变化也受到膳食蛋白质摄入量的影响。此外,摄入富含蛋白质的饮食与肠道微生物群的多样性呈正相关,可以提高肠道微生物群中拟杆菌。
长期高蛋白饮食:并不总是对肌肉产生积极影响
耐力运动员长期服用牛肉蛋白补充剂会减少双歧杆菌等有益肠道细菌的丰度。此外,结肠中未消化的蛋白质残留物发酵产生的化合物对肠道、免疫和代谢功能具有潜在的负面影响。
高脂肪饮食:炎症↑↑ 氧化应激、 变形菌↑↑
对高脂肪饮食小鼠的研究表明,这种饮食会增加体重和炎症标记物的表达,并降低葡萄糖耐量;更重要的是,高脂肪饮食喂养的小鼠体内LPS的循环水平增加了两到三倍,这导致肠道通透性增加,从而引发损害肌肉质量的炎症反应。
高脂饮食摄入引起的肥胖还可能导致体内 ROS 过量产生和氧化应激反应,并随之增加脂肪因子群和 TNF-α 表达,从而加重体内慢性炎症反应并影响骨骼肌肉功能。此外,高脂肪饮食可以减少 SCFA 的产生,并增加变形菌的比例。
地中海饮食:均衡蛋白质、碳水化合物、多酚,有益菌↑↑ 炎症↓↓
较高的碳水化合物摄入量与肠道菌群多样性下降密切相关。虽然双歧杆菌含量增加,但乳酸菌和链球菌含量减少。
咖啡、茶和红酒富含多酚,多酚与益生元丰度和双歧杆菌活性有关。膳食多酚可以增加产短链脂肪酸菌的繁殖并抑制产LPS菌的生长,从而调节肠道微生物群并影响肌肉骨骼系统健康。
地中海饮食的摄入有助于维持健康的肠道菌群,因为该饮食均衡摄入优质蛋白质和复合碳水化合物以及较高水平的纤维和多酚。因此,健康的饮食可以提高益生菌的相对比例并调节炎症,而不健康的饮食会导致肠道菌群失调、氧化应激、炎症等不良反应,最终损害肌肉骨骼系统的健康。
促进肌肉骨骼系统健康
运动改善效果大于营养补充剂
适度的运动可以改善肌肉、骨骼和关节。研究结果表明,运动干预可以有效改善60岁以上老年人的肌肉质量和功能,并且运动的效果明显大于营养补充剂。
运动还可以有效增加骨矿物质密度,提高骨强度,降低骨质流失风险以及跌倒和骨折的发生率。同样,运动可以缓解骨关节炎患者的疼痛、增强关节功能并提高生活质量。
运动:改善肠道菌群、改善肌肉骨骼健康(动物)
在人类和动物实验中,运动可以促进肠道微生物群的积极变化,从而改善肌肉骨骼功能。高强度训练可以防止高脂肪饮食诱导的肥胖小鼠中与肥胖相关的肠道微生物群失调,并维持肠道微生物群的多样性。非肥胖小鼠的拟杆菌与厚壁菌门的比例在运动后也会发生变化,并且拟杆菌的丰度在运动后显着增加。
在一项针对肥胖大鼠的运动和饮食研究中,随着时间的推移,运动对肠道微生物群产生更强、更稳定的影响,并能更有效地促进肠粘膜完整性和代谢功能。
运动员多样性高,肠道菌群有助于运动中乳酸转化为丙酸
关于运动与肠道微生物群之间关系的人体研究也获得了类似的结果。接受强化训练的精英运动员肠道微生物群的相对丰度明显高于久坐的成年人。
职业橄榄球运动员的肠道微生物群多样性高于非职业运动员。职业运动员的炎症细胞因子水平也低于非职业运动员。此外,研究表明,肠道微生物群菌群还可以通过将运动过程中产生的乳酸转化为丙酸,从而延长跑步时间,提高运动成绩。
扩展阅读:
肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?
有氧运动:拟杆菌↑↑ 改善心肺健康
有氧运动期间人体中拟杆菌门和厚壁菌门之间的平衡对于维持健康至关重要,肠道细菌定植平衡的破坏可能导致炎症和代谢或神经系统疾病。
日本一项关于有氧运动干预老年女性肠道微生物群的研究表明,为期 12 周的有氧运动计划不仅增加了拟杆菌,而且还改善了心肺健康。同时,快走时间增加超过 20 分钟的受试者中拟杆菌的丰度。
因此,适度运动可以通过改善肠道菌群组成、增强肠道粘膜功能、抑制炎症反应、维持多种肠道菌群来增强肌肉骨骼功能。
有氧运动+益生元:改善代谢紊乱,预防膝关节损伤
运动对肠道微生物群的潜在影响介导了骨关节炎的过程。在一项动物研究中,研究人员给高糖、高脂肪饮食的小鼠,同时进行有氧运动、益生元或两者的结合,发现两种干预措施的结合完全可以预防肥胖老鼠的膝关节损伤。
有趣的是,另一项研究表明,有氧运动和益生元的结合可以改善肥胖大鼠的代谢紊乱,但不能改善膝关节先前存在的骨关节炎损伤。因此,需要进一步研究进行更大样本的临床调查。
过度运动:促炎,限制肌肉形成、微生态失衡
过度运动可能会促进炎症、营养限制以及氧化和代谢应激,从而限制肌肉形成。过度训练的其他负面影响包括肠道缺血、肠道屏障通透性增加和氧化应激,从而导致肠道微生态失衡、炎症反应增加、分解代谢增加和肌肉功能恶化。
定期训练与更好的生物多样性和对肠道微生物群的有益影响有关。某些研究的证据支持这样的观点,即疲劳训练可能与有害的微生物后果有关。因此,运动对肠道菌群的影响可能取决于运动的强度和持续时间。
促进肌肉骨骼系统健康
肠道细菌与人体细胞的比例因性别而异,女性的比例高于男性。细菌与人体细胞的比例男性为1.3,女性为2.2 。
绝经后女性:厚壁菌门 / 拟杆菌门比例 ↓↓
女性肠道微生物的多样性也更高。Akkermansia muciniphila在女性中尤其丰富。绝经前女性的厚壁菌门/拟杆菌门比例高于绝经后女性。
绝经前女性中普雷沃菌属、毛螺菌属(Lachnospira)、嗜胆菌属( Bilophila)的相对丰度低于绝经后女性,同时炎症水平的 IL-6 和单核细胞趋化蛋白-1 血浆水平也较低。
这表明雌激素可能影响肠道微生物稳态和免疫的调节。与此同时,肠道菌群失衡也会影响雌激素活性。
绝经后雌激素水平下降,对肠道屏障和骨骼健康造成损害
如前所述,肠道微生物群通过分泌 β-葡萄糖苷酶来调节雌激素,当这一过程因肠道菌群失调(其特点是微生物多样性减少)而受到损害时,会导致循环雌激素减少,从而影响骨骼代谢。
非卵巢雌激素更多地受到肠道微生物组的影响,这可能是绝经后妇女更容易患骨质疏松的原因之一。因此,维持肠道稳态对于雌激素的正常分泌和骨代谢的平衡至关重要。
老年人睡眠障碍:与肠道菌群,肌少症相关
人们认为肌肉骨骼健康的丧失与睡眠障碍有关。同时,在老年人中,较短的睡眠时间与促炎细菌的增加有关,而睡眠质量的改善与Warts microbacteria、Flatcoccus有关。
年轻人睡眠中断:肠道菌群变化介导促炎状态
在年轻人中,睡眠中断对肠道微生物组成的影响,特别是有益的厚壁菌门与拟杆菌门的比例,仍然是矛盾且不清楚的。这项研究不仅将加深对肌肉减少症的多种影响因素的理解,而且还可以对这种复杂的情况提供更全面的看法。
当睡眠不佳时,肠道微生物群经常发生变化,这可能介导睡眠障碍和肌肉减少症之间的促炎症状态。
这些发现不仅表明肠道微生物群在睡眠质量和肌肉减少症之间的相关性中发挥着重要作用,而且还暗示调节睡眠的激素(例如褪黑激素)可能是有效的干预目标之一。
褪黑素:调节睡眠、抗炎抗氧化、保护骨骼肌
褪黑素是另一种调节睡眠和昼夜节律的内源性激素,具有抗衰老、抗炎和抗氧化特性,是一种用于疾病治疗和骨骼肌质量改善的安全膳食补充剂。褪黑素可减少氧化应激和炎症,并保护骨骼肌免受氧化损伤。
此外,它还可以改善衰老过程中的肌肉线粒体功能。对老年人的研究也表明褪黑激素水平与肌肉力量之间存在显著相关性。
褪黑素:逆转睡眠剥夺小鼠的肠道菌群失衡
有趣的是,睡眠剥夺小鼠的肠道菌群减弱,益生菌种类有限。有趣的是,褪黑素治疗逆转了这种异常的微生物组组成。褪黑激素可以改善动物和人类的肠道微生物群。口服褪黑激素补充剂可以减少脂质积累,逆转肠道微生物群失衡,并改善肠道菌群的多样性。
褪黑素:改善肠道生态失衡,恢复SCFA水平
高脂肪饮食喂养的小鼠肠道中SCFA水平显著降低,但在补充褪黑激素后恢复。此外,高脂饲料喂养的小鼠补充褪黑素可以有效改善肠道生态失衡,褪黑素可以改变厚壁菌门与拟杆菌门的比例,增强肥胖小鼠的肠粘膜功能。
褪黑素:减轻胰岛素抵抗,参与骨代谢
同时,补充褪黑激素减轻了小鼠因低度炎症和高脂肪饮食摄入引起的胰岛素抵抗。褪黑激素可以调节胰岛素敏感性,因此在维持葡萄糖稳态和调节葡萄糖代谢方面具有关键作用。
褪黑素还可通过激活核因子红细胞 2 相关因子 2 (Nrf2)/过氧化氢酶信号通路抑制破骨细胞形成,从而治疗炎症性骨溶解。
因此,我们可以推断,褪黑激素可以增强肠道粘膜功能,改善脂质和糖代谢,并通过调节肠道微生物群失调促进 SCFA 的产生,从而最终增强肌肉骨骼系统的功能。
促进肌肉骨骼系统健康
作为一种局部治疗,光生物调节在临床上用于治疗各种病症,包括肌肉疲劳、关节和肌腱炎症以及伤口和骨折愈合。
光生物调节:肠道菌群多样性↑↑
对健康小鼠腹部照射PBM后,小鼠肠道菌群发生显着变化,肠道菌群多样性也显着增加。这种效果在每周接受 3 次红光治疗的小鼠中最为明显,但在接受单次红光治疗的小鼠中则不明显。
近红外光比红光发挥更显着的效果
近红外照射后,小鼠肠道菌群中益生菌的比例显着增加,并且治疗还调节了与肠道菌群失衡相关的细菌丰度;这种作用可能归因于 PBM 对肠道微生物群的抗炎和氧化还原信号作用。
紫外线辐射:影响肠道菌群,维生素D和钙吸收,促进骨骼健康
紫外线辐射也会影响骨质流失大鼠模型中的肠道微生物群结构和功能。除了抗炎作用外,紫外线辐射还可以通过诱导维生素D合成和肠道钙吸收来调节骨代谢,从而促进骨形成、减少骨吸收、增强骨矿物质密度。该证据表明,尽管没有太多直接证据,但 PBM 仍然显示出通过调节肠道菌群失衡维持肌肉骨骼系统稳态的潜在作用。PBM 有潜力作为辅助疗法(与饮食和运动一起)来平衡微生物组并促进肌肉骨骼健康。
包括运动、电针和补充益生菌在内的生活方式干预措施对肠道微生物群有直接影响,改变其组成和功能,改善疼痛和生活质量,这为患有多种慢性疾病的患者开辟了新的治疗机会的创新途径。
肠道和骨骼之间的跨学科作用越来越引起骨生物学领域的关注。肠道菌群调节肌肉骨骼健康的潜在机制包括蛋白质、能量、血脂、糖代谢、炎症水平、神经肌肉连接性和线粒体功能。
肠道菌群的组成和代谢变化可能会影响肌肉骨骼系统的功能。肠道菌群失衡增加促炎因子水平,激活氧化应激途径,减少肌肉质量,影响骨形成和吸收。
肠道菌群调节的个性化治疗对于肌肉骨骼系统疾病的治疗来说既困难又充满希望。
临床应用,还需深入研究
在粪便移植的临床研究中,现有的荟萃分析对粪便移植对85种疾病的治疗效果进行综述发现,大多数研究是在传染病和肠道疾病方面进行的,而与肌肉骨骼健康直接相关的研究很少。
不同人群的年龄、遗传背景、生活方式等背景下,肠道微生物群变化可能会汇聚成不同的病理微生物群模式,这些复杂的相互作用需要进行大规模的纵向研究才能解决。
临床应用刚刚开始,考虑到微生物菌群的复杂性和个体差异,是否适合筛选促进肌肉骨骼健康的细菌,或者基于人类粪便细菌移植的个体化治疗;无论是肠道微生态干预的手段和方法,还是肠道微生态干预的效果,都还需要大量的临床证据来支持,需要共同努力才能实现。
多种干预措施,组合探索
基于肠道菌群在肌肉骨骼系统中的作用机制,可以采用不同的干预措施,如益生菌、益生元、维生素和膳食钙等,改善肠道菌群的组成和代谢,增强肌肉骨骼系统功能。
此外补充雌激素和褪黑激素以及光生物调节等新兴方法已显示出调节肠道微生物群和促进肌肉骨骼健康的潜力,特别是联合使用时。各种合理干预方法的组合应用也是一种有意义的探索。
包括运动在内的生活方式干预措施对肠道微生物群有直接影响,改变其组成和功能,这为患有多种慢性疾病的患者开辟了新的治疗机会的创新途径。
主要参考文献:
Wang Y, Li Y, Bo L, Zhou E, Chen Y, Naranmandakh S, Xie W, Ru Q, Chen L, Zhu Z, Ding C, Wu Y. Progress of linking gut microbiota and musculoskeletal health: casualty, mechanisms, and translational values. Gut Microbes. 2023 Dec;15(2):2263207.
Sender R, Fuchs S, Milo R. Revised estimates for the number of human and bacteria cells in the body. PLoS Biol.2016;14(8):e1002533.
Petermann-Rocha F, Balntzi V, Gray SR, Lara J, Ho FK, Pell JP, Celis‐Morales C. Global prevalence of sarcopenia and severe sarcopenia: a systematic review and meta-analysis. J Cachexia Sarcopenia Muscle. 2022;13(1):86–35.
Ayers C, Kansagara D, Lazur B, Fu R, Kwon A, Harrod C. Effectiveness and safety of treatments to prevent fractures in people with low bone mass or primary osteoporosis: a living systematic review and network meta-analysis for the American college of physicians. Ann Intern Med. 2023;176(2):182–195.
Wei J, Zhang Y, Hunter D, Zeng C, Lei G. The gut microbiome-joint axis in osteoarthritis. Sci Bull (Beijing). 2023;68(8):759–762.
Dey P, Chaudhuri SR, Efferth T, Pal S. The intestinal 3M (microbiota, metabolism, metabolome) zeitgeist – from fundamentals to future challenges. Free Radic Biol Med. 2021;176:265–285.
Gilbert JA, Blaser MJ, Caporaso JG, Jansson JK, Lynch SV, Knight R. Current understanding of the human microbiome. Nat Med. 2018;24(4):392–400.
Turnbaugh PJ, Ley RE, Hamady M, Fraser-Liggett CM, Knight R, Gordon JI. The human microbiome project. Nature. 2007;449(7164):804–810.
Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol. 2021;19(1):55–71.
Delzenne NM, Neyrinck AM, Backhed F, Cani PD. Targeting gut microbiota in obesity: effects of prebiotics and probiotics. Nat Rev Endocrinol. 2011;7(11):639–646.
Ma Q, Li Y, Li P, Wang M, Wang J, Tang Z, Wang T, Luo L, Wang C, Wang T, et al. Research progress in the relationship between type 2 diabetes mellitus and intestinal flora. Biomed Pharmacother. 2019;117:109138.
Lynch SV, Pedersen O, Phimister EG. The human intestinal microbiome in health and disease. N Engl J Med. 2016;375(24):2369–2379.
Ridaura V, Belkaid Y. Gut microbiota: the link to your second brain. Cell. 2015;161(2):193–194.
Chen Y, Zhou J, Wang L. Role and mechanism of gut microbiota in human disease. Front Cell Infect Microbiol. 2021;11:625913.
Dinan TG, Cryan JF. Brain-gut-microbiota axis and mental health. Psychosom Med. 2017;79(8):920–926.
Hu X, Wang T, Jin F. Alzheimer’s disease and gut microbiota. Sci China Life Sci. 2016;59(10):1006–1023.
Witkowski M, Weeks TL, Hazen SL. Gut microbiota and cardiovascular disease. Circ Res. 2020;127(4):553–570.
Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, Liang S, Zhang W, Guan Y, Shen D, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature. 2012;490(7418):55–60.
Moludi J, Maleki V, Jafari-Vayghyan H, Vaghef-Mehrabany E, Alizadeh M. Metabolic endotoxemia and cardiovascular disease: a systematic review about potential roles of prebiotics and probiotics. Clin Exp Pharmacol Physiol. 2020;47(6):927–939.
Koh A, De Vadder F, Kovatcheva-Datchary P, Backhed F. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites. Cell. 2016;165(6):1332–1345.
Bana B, Cabreiro F. The microbiome and aging. Annu Rev Genet. 2019;53(1):239–261.
Strasser B, Wolters M, Weyh C, Kruger K, Ticinesi A. The effects of lifestyle and diet on gut microbiota composition, inflammation and muscle performance in our aging society. Nutrients. 2021;13(6):2045.

谷禾健康

为什么一种药物对一位患者反应良好,但对另一位患者反应不佳,甚至在某些情况下会导致严重的药物不良反应?
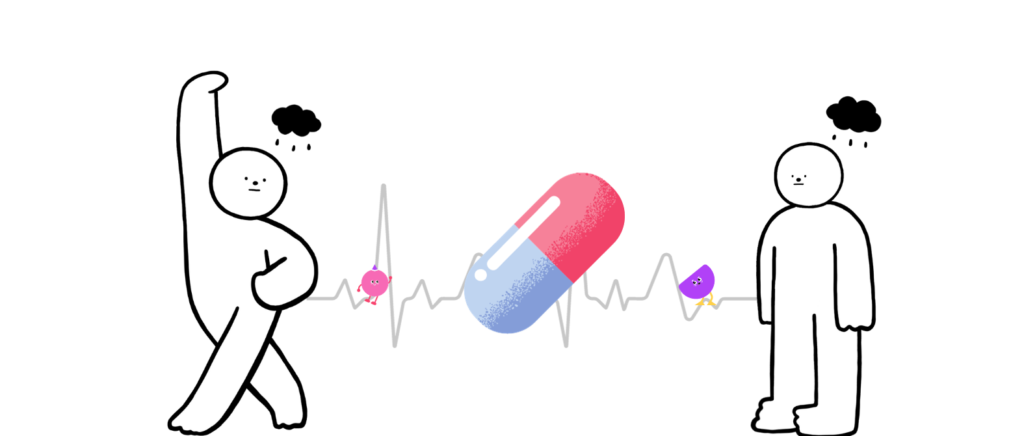
研究表明,一些药物的反应率在50%-75%,也就是说很多人服用药物后其实没有得到实际的改善,这并不代表该药物没用,可能只是对一些人效果不大,这是什么原因导致的呢?
这其实与药物反应个体差异(简称IVDR)相关。这种差异归因于多种因素,包括遗传、年龄、性别、生活方式、疾病状态、周围环境、肠道微生物群和药物相互作用等。
在精准医学正在加速来临的时代,根据个人的遗传、环境和生活方式因素制定量身定制的医疗干预措施成为可能,然而,药物反应的个体差异是实施精准医疗的主要障碍。因此,需要更好地了解药物反应的个体差异,以提高药物疗效或预防不良反应。
研究表明,在肠道中,药物和微生物群之间存在复杂的相互作用:
▸ 一方面,药物可以导致肠道微生物群的组成和功能的改变,导致微生物代谢和免疫反应的变化。
例如,二甲双胍可以减少肠道中的脆弱拟杆菌,降低该菌的胆盐水解酶活性,使GUDCA水平升高,以不依赖于肠道AMPK的方式,抑制肠道FXR信号,发挥改善代谢的作用。
▸ 另一方面,肠道微生物群可能改变药物,包括产生催化或降解药物分子的酶、改变药物在宿主体内的代谢水平以及与药物分子竞争代谢酶等方式,直接或间接地改变药物的吸收、分布、代谢和排泄,从而影响药物疗效。
例如,同样使用华法林的心血管疾病患者,有些人对该药物反应较低,这部分患者的肠道中拟杆菌、志贺氏菌、克雷伯氏菌较多,华法林是一种抗凝血药物,通过抑制维生素K的活性来减少血液凝块的形成。志贺氏菌有助于产生维生素K。因此,如果肠道中的志贺氏菌数量较多,它们可能会提供足够的维生素K,从而减少华法林的抗凝血效果。
本文我们来了解一下,常用药物和肠道微生物组之间复杂的双向相互作用,通过人体各个系统中的不同例子来阐述具体的机制。对这方面的逐步了解,有助于改善药物的效果,同时最大程度地减少不良反应,也有助于推动精准医疗的发展。
药物反应的个体差异(IVDR)是指不同个体在使用相同药物时表现出的不同反应情况。这种差异可以涉及药物的吸收、分布、代谢、排泄等方面。
了解个体差异可以帮助医生更好地调整药物剂量和选择合适的药物,以最大程度地提高治疗效果并减少不良反应的发生。
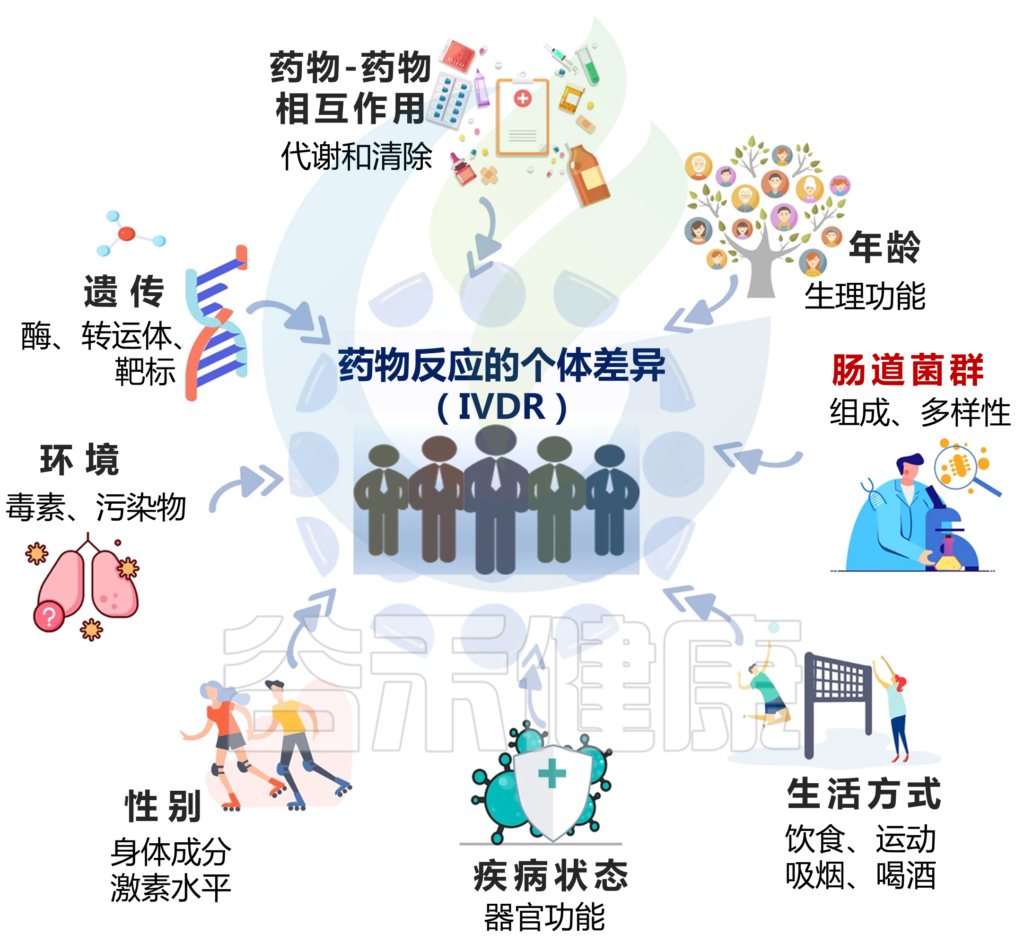
Zhao Q, et al., Signal Transduct Target Ther. 2023
IVDR是多种因素共同作用的结果,包括:
1)遗传学
编码药物代谢酶、转运蛋白和靶标的单个基因的变异会影响其代谢和对药物的反应,导致IVDR。
2)年龄
由于生理功能的差异,如肝肾功能、身体成分和激素水平的变化,年轻和老年患者可能会经历不同的药物反应。例如,老年患者可能肾功能和肝代谢降低,导致PK改变。
3)性别
男性和女性之间的生物差异会影响药物反应。由于身体成分和激素水平的差异,女性可能有更高的药物浓度,这将影响药物代谢和清除。
4)生活方式
饮食、运动、吸烟等因素,酒精摄入可以通过改变药物代谢和从体内清除的方式来影响药物反应。
5)疾病状态
患有某些疾病或病症的患者可能会因器官功能变化、药物代谢改变或药物受体表达改变而经历IVDR。例如,肝病患者的药物代谢可能会降低,肾病患者的药物清除率可能会降低。
6)药物-药物相互作用
同时使用多种药物可能会导致药物-药物的相互作用,从而改变药物的吸收、分布、代谢、排泄。
7)环境因素
暴露于环境毒素和污染物会影响药物代谢和清除,可能导致IVDR.
8)肠道微生物群
肠道微生物群也可能影响药物药代动力学(PK)和药效学(PD),个体之间肠道微生物群组成的变化会导致IVDR。
肠道微生物群与药物治疗之间的关联
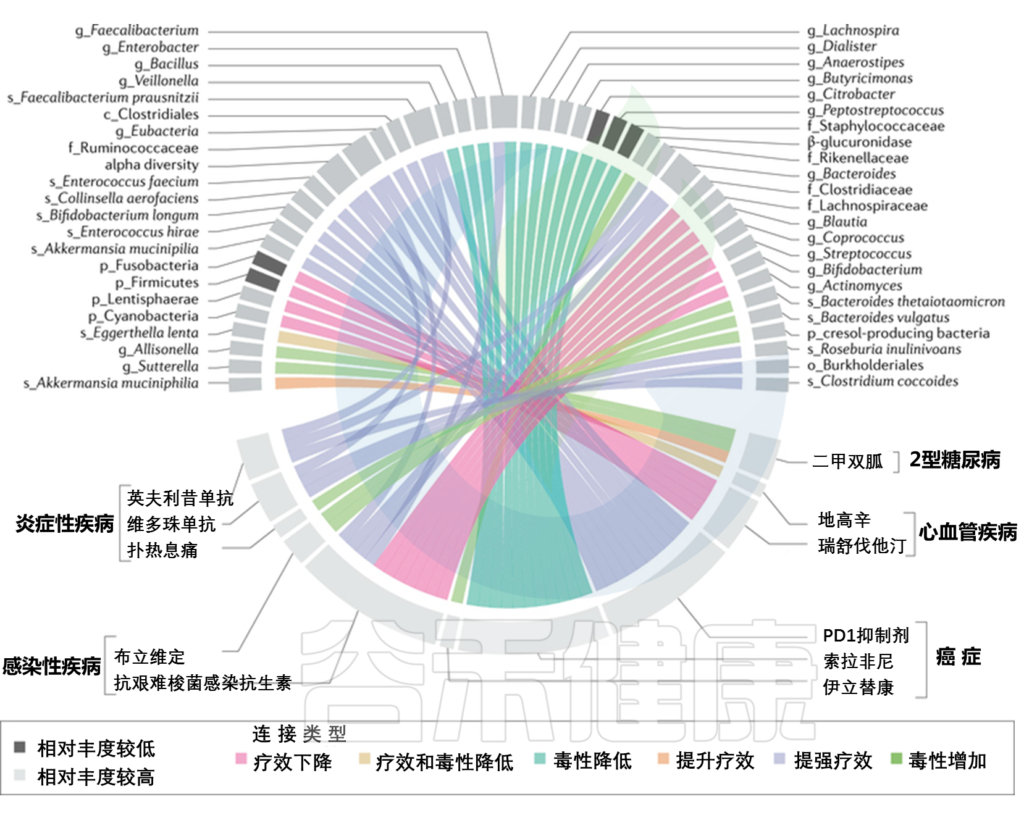
doi: 10.1038/s41575-021-00499-1
总体而言,了解这些因素对于优化药物治疗和将药物不良反应风险降至最低至关重要。
药物遗传学专注于识别影响药物代谢、转运、药效学 (PD) 等的遗传变异。
药物基因组学是一个更广泛的领域,考虑整个基因组及其对药物反应的影响。
尽管药物遗传学和药物基因组学取得了进展,人类基因组贡献的变异性可能在20%-95%,因此,仅遗传因素不足以解释药物反应的个体差异,其他因素,例如肠道微生物群也很重要。
肠道微生物群可以通过直接转化药物或调节宿主的代谢或免疫系统,来改变药物的药效学和药代动力学。
药物微生物组学一词,用来描述肠道微生物群和药物反应之间的相互作用,这些相互作用可以改变药效学(即药物吸收、分布、代谢、排泄及其血浆药物浓度动态的变化)或药代动力学(即药物靶点或生物途径的变化,导致生物体对药物作用的不同易感性)。
接下来,我们就从人体八大系统的具体疾病中来一一了解,微生物群与药物之间的相互作用。了解这种相互作用有助于开发针对微生物群的方法,以提高药物疗效并减少不良反应。
现代医疗体系下的药物种类很多,我们按照以下几大类来介绍常见的药物:心血管系统、内分泌系统、消化系统、神经系统、运动系统、泌尿生殖系统、呼吸系统、癌症。
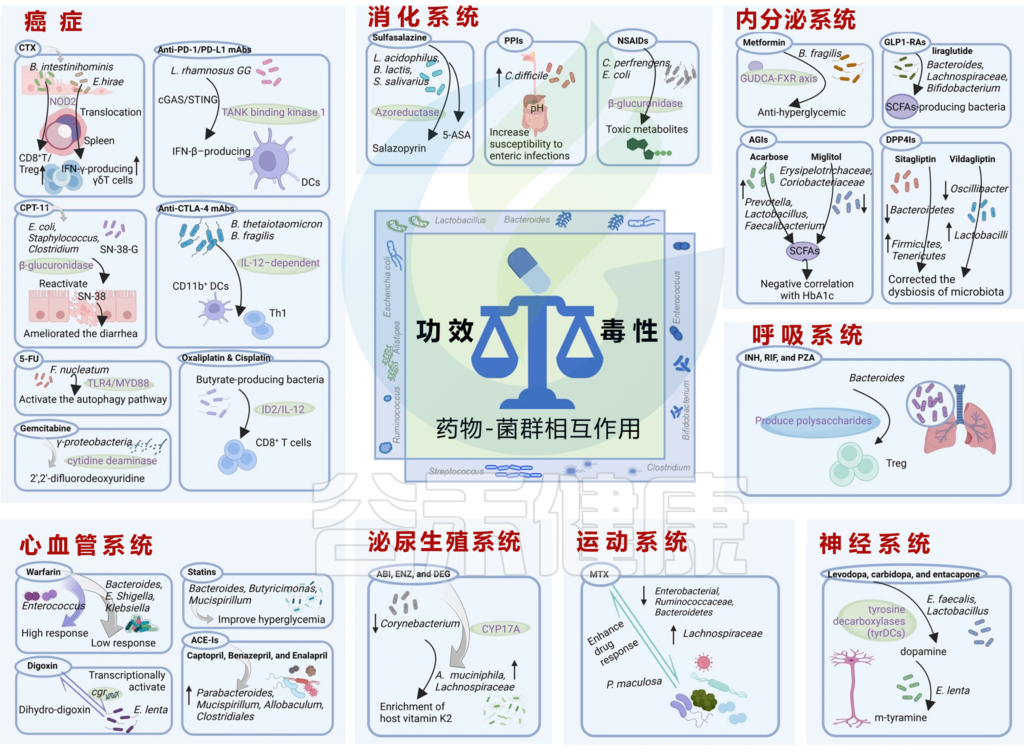
Zhao Q, et al., Signal Transduct Target Ther. 2023
华 法 林
华法林:防治血栓,但治疗窗口有限
华法林是一种维生素K拮抗剂,用于预防和治疗血栓形成和栓塞的疾病,然而,其治疗窗口有限,IVDR明显,促使许多研究确定影响治疗结果的遗传因素。
对华法林低反应者,志贺氏菌等菌群较多
已知肠道微生物群和维生素K代谢之间有联系。一项研究首次建立了肠道微生物群和IVDR与华法林之间的联系。针对200名对华法林有不同程度反应的患者的试验表明,拟杆菌、志贺氏菌、克雷伯氏菌在低反应者中表现突出。
华法林是通过抑制维生素K的作用,来防止血液凝结,维生素K参与合成凝血因子,在血液凝固过程中起着重要的角色,而志贺氏菌具有产生维生素K所必需的酶,可能出现一边抑制一边合成的情况,这可能是患者对华法林反应较弱的原因。相比之下,肠球菌与对华法林的反应增加有关。
▸
还需要更多的研究来证实和完善结果。
他汀类药物
他汀类药物:降胆固醇、抗炎、抗血栓
他汀类药物通常用于降低“坏”胆固醇,治疗心血管疾病。通过抑制HMG-CoA,减少肝脏中胆固醇的从头合成。
注:“坏”胆固醇,是指低密度脂蛋白胆固醇,简称LDL-C。
HMG-CoA,3-羟基-3-甲基戊二酰辅酶A,是一种参与胆固醇和同化代谢的重要酶。
近几十年的研究表明,他汀类药物具有许多多效性作用,包括抗炎、抗血栓形成和抗氧化,这可能与其心血管保护特性有关。他汀类药物可抑制Rho激酶和Rac1蛋白的功能,这两种蛋白与动脉粥样硬化的进展有关,动脉粥样硬化是心血管疾病的主要危险因素。他汀类药物还激活PPAR-γ.
注:PPAR-γ,过氧化物酶体增殖物激活受体γ,这是一种有助于调节炎症、脂肪代谢和糖代谢的核受体。
他汀类药物可以改变肠道微生物群的结构
一项研究发现,他汀类药物治疗显著增加了某些抗炎相关菌(如拟杆菌、Butyricimonas、 Mucispirillum),这可能有助于改善高血糖。
另一项研究表明,他汀类药可能通过PXR(孕酮X受体)介导的机制改变胆汁酸的复杂性,从而导致肠道失调,带来不良影响。
他汀类药物→改变胆汁酸→菌群失调
胆汁酸是在肝脏中从胆固醇合成的,对膳食脂肪的消化和吸收至关重要。他汀类药物通过直接抑制新生胆固醇的合成,可以抑制肝脏中的胆汁酸合成,从而改变人体肠道中的胆汁酸。肠道中胆汁酸的数量和结构的改变,可能通过改变肠道菌群直接或间接诱导出复杂而显著的生理反应。
▸
要更多的研究了解他汀类药物治疗对肠道微生物组的长期影响,以及这些变化是否始终对心血管疾病有益。此外,评估他汀类药物治疗和IVDR的可能风险和益处至关重要。
地高辛
地高辛:提高心脏泵送效率,但对10%患者无效
地高辛,是一种可以提高受损或虚弱心脏泵送效率的药物,从而提高临床稳定性和运动能力。然而,在低流量充血性心力衰竭中,由于特定菌株的失活,地高辛可能对10%的患者无效,这突出了IVDR对人类和微生物群的重要性。地高辛的失活是通过Eggerthella lenta将地高辛转化为失活状态二氢地高辛介导的。
E. lenta:可能成为地高辛失活的微生物标志物
在另一项开创性研究中,发现一个编码E. lenta细胞色素、心脏甙还原酶(cgr)的操纵子,被鉴定为地高辛转录激活,表明这可能是地高辛失活的可预测的微生物组生物标志物。
精氨酸增加→调节E.lenta→抑制地高辛失活
研究人员还探索了内源性地高辛相关物质可能被选择失活的可能性,并确定了合理的饮食干预是否可以调节体内地高辛的灭活。如前所述,E.lenta的增殖与精氨酸有关,精氨酸不仅能改善增殖,还能防止地高辛失活。因此,无论是饮食还是微生物群产生的精氨酸浓度的增加,都可能抑制这种不需要的微生物群功能。
饮食中增加蛋白质→提高地高辛水平
为了验证这一假设,研究人员使用两种不同饮食的小鼠进行了一项体内实验:一种不含任何蛋白质,另一种含有蛋白质总热量摄入的20%。结果表明,蛋白质摄入的增加显著提高了血液和尿液中的地高辛水平,但仅在携带地高辛减少菌株的小鼠中。
▸
总之,这些发现对受益于地高辛治疗的心力衰竭患者,具有重要的临床应用价值。此外,鉴定药物失活的预测性微生物群标志物,可能有助于制定个体微生物群落为基础的个性化治疗指南。
血管紧张素转换酶抑制剂(ACE-Is)
一代ACE-Is药:卡托普利,降压
卡托普利是第一代ACE-Is药物,通过抑制中枢和外周部位的肾素-血管紧张素系统(RAS)用于治疗高血压。除了其抗高血压作用外,卡托普利也会影响肠道微生物群的组成。研究表明,卡托普利在停药后保持其抗高血压活性。
一项用卡托普利治疗大鼠的实验中,下列菌群丰度增加:
此外,卡托普利可减少自身区域的神经元炎症,并减少交感神经驱动,它平衡了肠道微生物群。
最近的研究结果还表明,接受卡托普利治疗的母亲通过重建肠道微生物群、改善肠道病理和通透性以及恢复雄性后代失调的肠脑轴,具有持续的降压作用。
卡托普利治疗的怀孕大鼠中,梭菌属和梭菌目的存在率较高
与没有治疗的怀孕大鼠相比,用卡托普利治疗的怀孕大鼠在肠道微生物群中下列梭菌目平均丰度更高,例如:
因此,卡托普利可能会影响人类肠道微生物群的生长和组成,从而改变药物的有效性。
二代ACE-Is药:贝那普利和依那普利,治疗心血管疾病
贝那普利和依那普利是第二代血管紧张素转换酶抑制剂,主要用于治疗心血管疾病,如动脉高血压、充血性心力衰竭。这些药物通过抑制ACE的活性发挥作用,导致血管紧张素II生成减少。
注:ACE,血管紧张素转化酶,参与调节血管张力、血压以及体液平衡等生理过程。
血管紧张素Ⅱ,是一种使血管变窄并升高压力的激素。
最近研究表明,贝那普利和依那普利都有能力对肠道微生物群产生积极影响。
贝那普利治疗:促进肠道微生物群结构的恢复
贝那普利主要在肝脏中代谢,并转化为二酸贝那普利的形式,这会影响肠道微生物群。
依那普利治疗:改变肠道菌群,降低TMAO
依那普利可以降低血液中TMAO的水平。高浓度的TMAO与心血管疾病的高发病率有关。依那普利通过改变肠道微生物群的组成和控制尿液中甲胺的排泄,来影响血浆TMAO水平。
注:TMAO,三甲胺N-氧化物,一种由肠道微生物群代谢某些营养物质产生的化合物
心血管系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
▸
这些发现表明,ACE-Is可能在改善肠道微生物群组成和心血管健康方面有效。通过促进肠道微生物群结构的恢复和降低TMAO水平,贝那普利和依那普利可能有助于降低心血管疾病的风险。
其他降血压药物:药物-微生物相互作用
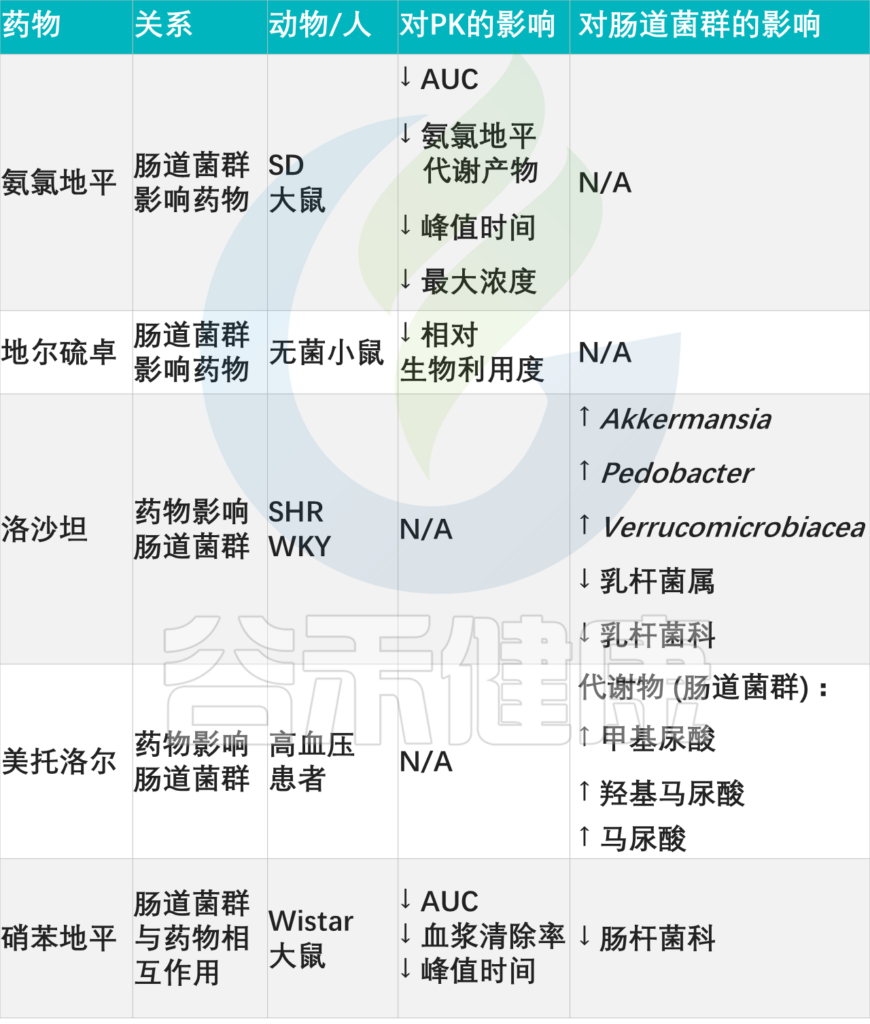
doi: 10.3389/fmed.2021.742394
内分泌系统是一个复杂的腺体系统,产生激素,负责调节各种身体功能,目前的证据表明,微生物群在内分泌系统的调节中发挥着重要作用,并可影响内分泌疾病的IVDR。
下面列出抗糖尿病药物和肠道微生物群之间相互作用的几个案例。
二甲双胍
二甲双胍是一种常见的抗糖尿病药物,也可以减少肥胖、降低心血管疾病和癌症的发病率等。
研究逐步发现,肠道微生物群调节葡萄糖代谢和能量平衡的机制,特别是可能参与IVDR的机制。
肠道菌群如何影响二甲双胍的抗高血糖作用
将未经治疗的2型糖尿病患者的粪便,移植到无菌小鼠身上,与对照小鼠相比,葡萄糖耐量显著改善。确定A.muciniphila及其金属结合蛋白的表达,是二甲双胍-微生物群相互作用的关键因素。
另一项研究表明,二甲双胍的抗高血糖作用涉及一种新的机制——脆弱拟杆菌-GUDCA-FXR轴。该途径依赖于肠道微生物群,并涉及肠道FXR信号的激活,以改善代谢功能障碍。发现二甲双胍可减少脆弱拟杆菌,防止GUDCA降解。
注:GUDCA,甘氨熊脱氧胆酸,一种FXR的拮抗剂
二甲双胍→抗炎→对心血管疾病的保护作用
包括激活AMPK途径和抑制NF-κB途径。越来越多的证据表明,微生物群介导的途径可能与二甲双胍的治疗作用有关。例如,二甲双胍治疗引起的肠道微生物群结构变化可能导致葡萄糖、激素、胆汁酸、短链脂肪酸和免疫的改变。
二甲双胍→调节肠道菌群→改善认知功能
二甲双胍不仅具有抗炎和抗氧化作用,还与神经保护有关,有研究表明二甲双胍的使用与2型糖尿病患者患痴呆症的风险降低有关,轻度认知障碍得到改善。这其中部分有益作用通过肠道微生物群的组成和功能来调节,从而增加短链脂肪酸和胆汁酸的产生。
二甲双胍对肠道菌群的影响

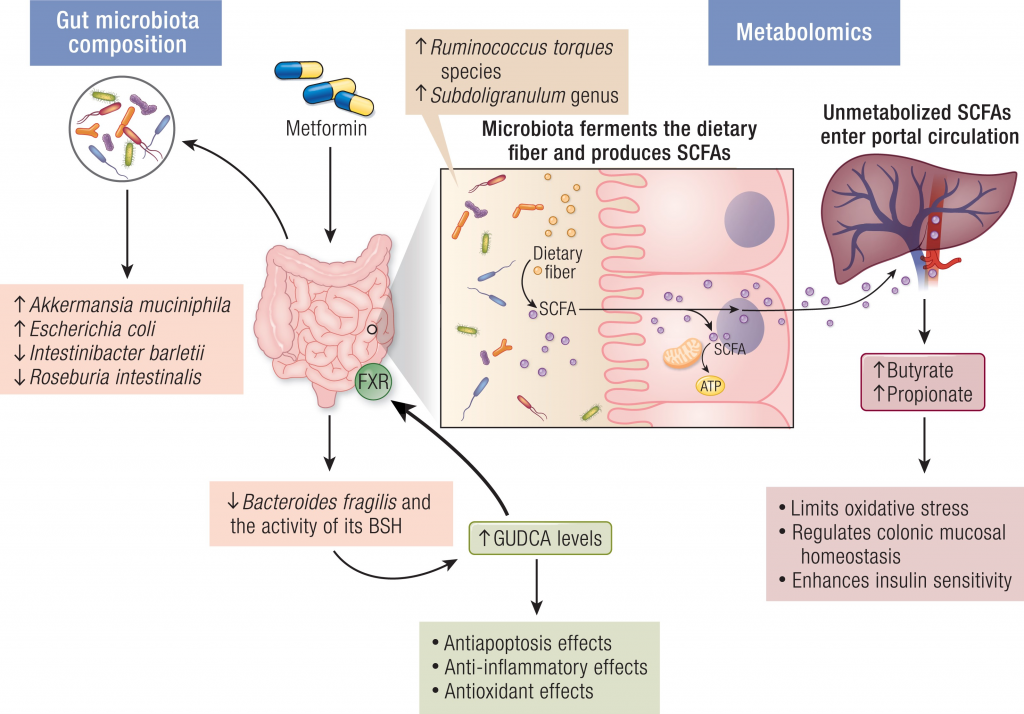
doi.org/10.1210/endrev/bnad029
▸
总的来说,新出现的证据表明,微生物群介导的肠道微生物群结构变化机制,可能是其多效性作用的原因。这对开发针对肠道微生物群及其与IVDR相互作用的新疗法具有重要意义。
α-葡萄糖苷酶抑制剂(AGI)
AGI是一类改变小肠中碳水化合物吸收和代谢的药物。这些药物会显著影响肠道微生物群的结构和变异性,这可能对管理代谢疾病(如2型糖尿病)有重要意义。阿卡波糖和米格列醇是两种常用的AGI。
阿卡波糖:产短链脂肪酸菌,乳杆菌 ↑↑
拟杆菌科、肠杆菌科、部分梭菌属 ↓↓
在体外,实验表明,阿卡波糖通过抑制麦芽糖导入物选择性地抑制大肠杆菌的生长,而临床试验表明,阿卡波糖增强了产短链脂肪酸菌的丰度,例如普雷沃氏菌属、乳杆菌属、粪杆菌属(Faecalibacterium)。短链脂肪酸对代谢健康有益,用乳杆菌治疗可以降低血糖。
此外,一项研究表明,在肠道微生物群中发现的Dialister在阿卡波糖治疗后增强,并与HbA1c呈负相关,这表明它可能在控制葡萄糖代谢中发挥作用。阿卡波糖也被证明可以增加双歧杆菌和乳杆菌,并减少高脂血症或2型糖尿病患者粪便中有害的拟杆菌科、肠杆菌科和卵磷脂酶阳性梭菌。
注:HbA1c在医学中指糖化血红蛋白,以反映最近两到三个月内的平均血糖水平
米格列醇:抗炎,逆转高能量饮食引起的菌群变化
米格列醇在小鼠中具有抗炎特性,可以抑制炎症反应的组织学和分子指标,并减少高脂肪高糖饮食产生的肠道转运时间。摄入高能量饮食会增加Erysipelotrichaceae和Coriobacteriaceae,但米格列醇可以逆转这种作用。据推测,肠道炎症的减少与肠道微生物群的这些变化有关。
▸
总的来说,AGI特别是阿卡波糖,可能有助于重建2型糖尿病患者的肠道微生物群平衡。通过增加产短链脂肪酸菌和减少潜在的有害菌,这些药物可能会对代谢健康产生积极影响。需要更多的研究来充分阐明其影响。
胰高血糖素样肽-1受体激动剂
GLP-1(胰高血糖素样肽-1)是肠内分泌细胞通过饮食产生的一种肠内激素,GLP-1在增强葡萄糖诱导的胰岛素分泌、抑制胰高血糖素分泌、抑制食欲和胃排空方面的作用,使其成为治疗糖尿病和超重的有力靶点。
最近的研究强调了肠道微生物群通过诱导GLP-1分泌来调节饱腹感和葡萄糖稳态的功能,GLP-1受体激动剂(如利拉鲁肽)作为一类新兴的抗糖尿病药物,已被证明可以调节肠道微环境,并改变肠道微生物群组成。
利拉鲁肽:改变厚壁菌门/拟杆菌门比例,有争议
通常,厚壁菌门与拟杆菌门的比例是肠道微生物群结构的重要指标。这在我们之前的一篇文章有讲述这方面内容,详见:
研究表明,利拉鲁肽可以使正常体重的糖尿病小鼠的肠道菌群比例向瘦体比例转变,从而使厚壁菌门与拟杆菌门的比例更高。
有趣的是,另一项研究表明,利拉鲁肽降低了厚壁菌门与拟杆菌门的比例,以降低单纯超重和糖尿病超重个体的体重,而与血糖状况无关。
这种差异可能归因于不同水平的高血糖和使用的不同模型系统。
GLP1受体激动剂已被证明可极大改变糖尿病雄性大鼠的肠道微生物群结构。这些变化包括选择性增强几种产短链脂肪酸菌,如拟杆菌、毛螺菌科和双歧杆菌。此外,GLP1受体激动剂可至少部分重建肠道微生物群的稳态。
二肽基肽酶-4抑制剂(DPP4Is)
DPP4Is(例如西格列汀和维达格利汀)是用于2型糖尿病的一线抗2型糖尿病药物。DPP4Is主要通过抑制GLP-1降解来降低血糖。先前的研究表明,肠道微生物群与DPP-4相关功能可能是DPP4Is的目标,可能为DPP4Is调节肠道微生物群不一致性开辟新的治疗应用。
研究表明,DPP4Is可以通过增加拟杆菌门来改善血糖控制,从而大大恢复高脂饮食诱导的肠道微生物群改变。
西格列汀:产短链脂肪酸菌↑↑适度恢复菌群失调
西格列汀对肠道微生物群影响的研究表明,拟杆菌门减少,厚壁菌门和软壁菌门(Tenericutes)增加。然而,西格列汀适度恢复了2型糖尿病大鼠的微生物群失衡,并改变了产短链脂肪酸菌的丰度。
维达利汀:乳杆菌↑↑ Oscillibacter↓↓
类似地,维达利汀给药与糖尿病大鼠的拟杆菌门增加和厚壁菌门减少,厚壁菌与拟杆菌门比例降低有关。此外,维达利汀通过调节肠道微生物群产生益处,导致乳杆菌增加和Oscillibacter减少。为了阐明变异机制,研究人员通过实验证实,维达利汀抑制盲肠内容物中的TLR配体,并恢复抗菌肽水平和回肠隐窝深度。研究还表明,DPP4Is可能通过对肠道微生物群的影响,间接减少肝脏中促炎细胞因子的分泌。
▸
总的来说,这些研究强调了DPP4Is对肠道微生物群的重要性,并揭示了改善葡萄糖稳态和IVDR的有希望的策略。
内分泌系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
消化系统是药物微生物组学最广泛的领域之一,对药物代谢和疗效至关重要。肠道微生物群会影响用于治疗各种消化系统疾病的药物的结果,例如,炎症性肠病(IBD)和肠易激综合征(IBS)。IBD患者的肠道微生物群组成和功能发生了改变,这可能会影响IVDR。
柳氮磺吡啶(SAS)
SAS是一种最初开发的药物,旨在治疗细菌感染引起的炎症。后来发现它在治疗溃疡性结肠炎方面有效。该药物由氨基水杨酸盐和磺胺吡啶组成,它们通过偶氮键连接在一起。SAS的一个独特特性是它不会在上游胃肠道中快速吸收。相反,它被结肠中的肠道微生物群分解为其各个组成部分。
随后,磺胺吡啶被吸收到血液中,而美沙拉秦(5-氨基水杨酸,5-ASA)可以在结肠中失活。
SAS+益生菌:5-ASA和磺胺嘧啶恢复
一项针对健康受试者的PK研究表明,肠道微生物群对激活SAS至关重要。这一发现或许可以解释为何该药物在治疗溃疡性结肠炎(UC)方面比克罗恩病(CD)更为有效。
通过给予益生菌菌株(例如嗜酸乳杆菌L10、乳酸双歧杆菌B94、唾液链球菌K12),可以增强肠道菌群SAS的功能。
在一项体外试验中,研究人员在厌氧条件下将大鼠结肠的内容物与SAS单独或SAS与益生菌联合孵育。发现益生菌具有偶氮还原酶活性,使其能够代谢SAS。经与SAS和益生菌共同培养后,样本中的5-ASA和磺胺嘧啶含量得到了更大程度的恢复。
尽管SAS是一种有效且廉价的溃疡性结肠炎治疗方法,但一些患者在使用时报告了不良反应,如恶心、皮疹和厌食症。这可能是由SAS通过肠道微生物群代谢引起的。因此,SAS不如其他溃疡性结肠炎治疗方法受欢迎。
质子泵抑制剂
PPIs是广泛用于治疗酸性疾病的药物,包括消化性溃疡、胃食管反流、消化不良、胃十二指肠病、出血。
PPI 有效,但长期使用可能存在不良反应
基于其疗效和安全性特点,质子泵抑制剂治疗在近几十年快速扩大。然而,与长期使用PPIs相关的安全性和可能的不良反应仍存在争议。据估计,高达70%的PPIs处方被认为是不必要的。一旦开始使用,很少重新评估PPIs的原始适应症,试图停药后不必要的长期使用也随之产生。
PPI:肠道菌群多样性↓↓ 部分口腔菌群增加↑↑
荷兰一项基于患者的大规模临床试验表明,PPI与肠道微生物群多样性减少和分类学变化之间存在很大相关性。
分析来自不同队列的16S数据发现,PPI的使用导致部分肠道微生物群丰度下降,口腔微生物群增加。

例如,肠杆菌科、肠球菌科和乳杆菌科增加,瘤胃球菌科和双歧杆菌科减少。而典型口腔微生物群的改变表现为下列菌群增加:
此外,观察到的变化似乎是PPI的一类功效,剂量的增加与微生物群的更大变化有关。
PPI的使用与可预测的功能变化
最近的研究表明,PPI的使用与24个分类群和133个途径高度相关,具有可预测的功能变化,包括脂肪酸生物合成、脂质生物合成和L-精氨酸的生物合成增加,嘌呤脱氧核糖核酸的降解。
PPI→胃酸↓↓→增加肠道感染的易感性
另一项受流行药物直接影响肠道微生物群的体外实验表明,生长速度发生了显著变化,这意味着PPIs与细菌H+/K+ATP酶的结合可能介导直接影响。 PPIs引起的胃酸减少,使口腔微生物群能够定植肠道微生物群,导致分类稳态改变,并可能增加对肠道感染的易感性,例如艰难梭菌、弯曲杆菌和沙门氏菌。
儿童期使用PPI,可能与日后肥胖相关
此外,PPI的启动和停用可能导致肠道微生物群的改变,可能加剧肝硬化。长期使用PPI,特别是在儿童时期,会导致肠道微生物群的永久性改变,可能导致日后的肥胖。
▸
虽然PPI被广泛认为是无害和有效的,但临床上应该重新评估其广泛、长期的影响和OTC的可及性。PPI使用的快速而广泛的转变导致了肠道微生物群的变化,影响了多达五分之一的人群。仔细评估PPIs诱导的肠道微生物群改变带来的长期影响,特别是在早期发育过程中,以及对晚年健康和疾病的潜在影响,这一点很重要。
非甾体抗炎药
非甾体抗炎药通常用于缓解疼痛和炎症,但它们的使用会导致不良反应,如胃溃疡和小肠粘膜损伤。
这是由于细菌葡萄糖醛酸酶在肠道中代谢非甾体类抗炎药,类似于CPT-11的情况,它将药物转化为损害肠道粘膜的有毒代谢产物。肝脏中产生的非甾体抗炎药的葡萄糖醛酸苷通过胆汁到达肠道,在胆汁中细菌GUSs将其水解为苷元。这些苷元随后被细胞色素P450重吸收并转化为潜在的细胞毒性中间体,从而引起肠道毒性。
注:CPT-11属于盐酸伊立替康注射液
与CPT-11一样,最近的一项研究表明,Inh1(抑制剂1)是一种新型的微生物特异性GUSs抑制剂,可以减少双氯芬酸的肠道药物不良反应。这表明抑制GUSs是减少某些药物不良反应的一种很有前途的方法。
虽然肠道微生物群产生对生物体具有有益功能的GUS,但条件致病菌或肠道致病菌,如产气荚膜梭菌和大肠杆菌,负责对药物进行去葡萄糖醛酸化反应,产生有害代谢产物。这是由于GUSs的细胞内变化,包括构象、疏水性和迁移率的变化。细菌GUSs诱导的ADR的增强潜力,尤其是肠道损伤,并非NSAIDs和CPT-11独有。
其他药物,包括抗肿瘤酪氨酸激酶抑制剂,瑞格菲尼和静脉补剂类黄酮,是GUSs 的底物。这些证据强调了了解细菌酶在IVDR中的重要性,以制定减少药物不良反应的策略的价值。
消化系统:药物-微生物相互作用
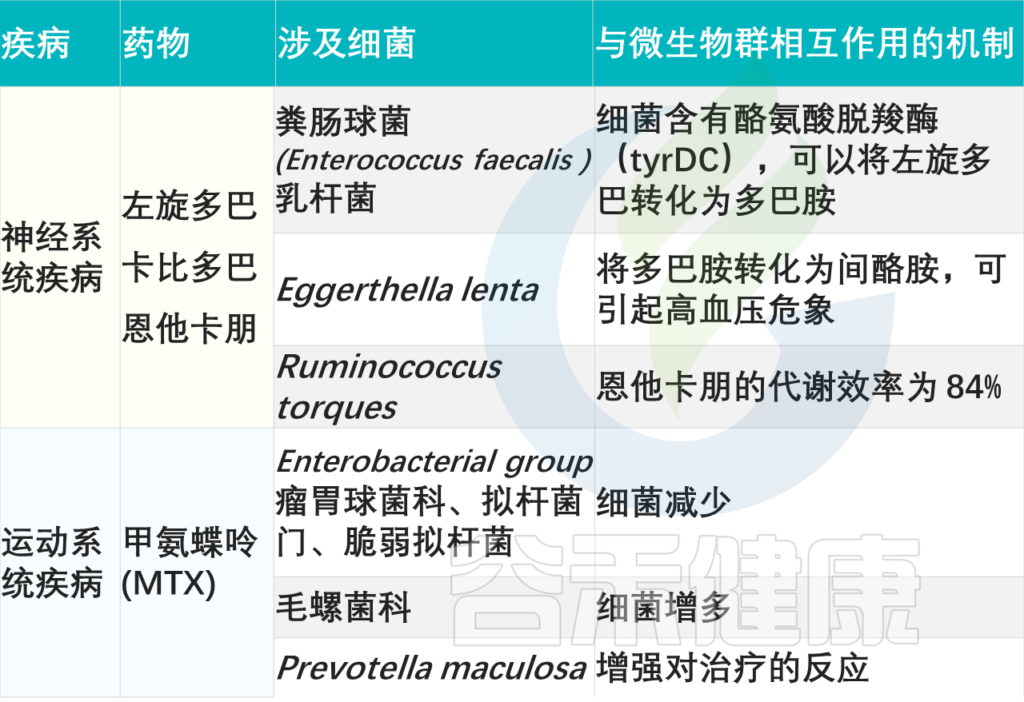
Zhao Q, et al., Signal Transduct Target Ther. 2023
初步研究表明,微生物群可能在调节神经系统IVDR中发挥关键作用。其中一个例子是使用益生菌来提高抗抑郁药物的有效性。多项研究表明,某些肠道微生物群菌株可以产生神经递质,如血清素和γ-氨基丁酸(GABA),可以调节情绪和焦虑。
通过补充益生菌,研究人员希望增加这些神经递质的可用性,改善对抗抑郁药治疗的反应。另一个领域是微生物群对神经退行性疾病的影响,例如帕金森病,常用的治疗药物是左旋多巴。
左旋多巴、卡比多巴和恩他卡朋
左旋多巴是一种治疗帕金森病的药物,帕金森病是一种神经系统疾病,表现为震颤、僵硬和行动困难。左旋多巴口服,必须通过小肠重新吸收才能到达大脑,在那里它被酪氨酸脱羧酶(tyrDC)转化为多巴胺。该药物的有效性取决于大脑的生物利用度,该药物通常与儿茶酚胺代谢抑制剂(如卡比多巴和戊卡彭)一起使用,以抑制脑外代谢。
E.lenta 代谢左旋多巴,可能与高血压风险相关
新出现的证据表明,肠道微生物群可以代谢左旋多巴。某些物种,如粪肠球菌(E.faecalis)和乳杆菌含有酪氨酸脱羧酶。然而,这种微生物群代谢减少了大脑中可获得的左旋多巴的量,导致药效降低。此外,左旋多巴的微生物群代谢也会导致药物不良反应,因为E.lenta和其他十个物种可以进一步将多巴胺转化为间酪胺,从而导致高血压危机。
残留左旋多巴也可以与微生物群相互作用
绝大多数左旋多巴通过肠道氨基酸转运载体输送到循环系统,还有10%左右残留,也可以与微生物群相互作用,通过其代谢产物影响肠道稳态。Clostridium sporogenes 能够将L-多巴胺脱氨化为3-(3,4-二羟基苯基)丙酸,后者可以体外抑制回肠运动。
粪肠球菌:98.9%效率代谢左旋多巴和恩他卡朋
肠道微生物群也可以直接代谢卡比多巴和恩他卡朋。例如,粪肠球菌能以98.9%的效率代谢左旋多巴和恩他卡朋。反过来,恩他卡朋会减少一些物种,例如Ruminococcus torques,后者仍能以84%的效率代谢恩他卡朋。
▸
这些发现说明了肠道微生物群和IVDR之间的复杂相互作用,这可能会影响药物的疗效和安全性。这些有利于拓宽我们对药物-微生物群相互作用的了解,并探索神经和精神疾病的新治疗策略。
运动系统的健康可能受到各种疾病的影响,例如骨关节炎、类风湿性关节炎和骨质疏松症,这些疾病会导致疼痛、僵硬和活动能力下降。近年来,人们越来越关注肠道微生物群在这些疾病的病理学和治疗中的影响,如甲氨蝶呤、非甾体抗炎药等。
甲氨蝶呤(MTX)
甲氨蝶呤是一种用于治疗自身免疫性疾病(如类风湿关节炎)的强效细胞毒性药物。其潜在作用基于抑制二氢叶酸还原酶和胸苷酸合成酶,从而防止嘧啶和嘌呤的从头合成。虽然甲氨蝶呤是有效的,但它也有很高的不良反应发生率,包括胃肠道、血液学、肾毒性和肝毒性。
甲氨蝶呤:E.faecium↓↓ Lachnospiraceae↑↑
可能影响对甲氨蝶呤反应的一个潜在因素是肠道微生物群。研究表明,甲氨蝶呤治疗可以改变肠道微生物群的组成,降低肠道细菌的丰度,尤其是粪肠球菌(E.faecium)的丰度,并增加Lachnospiraceae的丰度。然而,部分有益菌(如瘤胃球菌科、拟杆菌科、脆弱拟杆菌)的减少可能会加剧胃肠道药物不良反应,特别是肠道粘膜炎。
甲氨蝶呤和肠道微生物群之间的联系是双向的
肠道微生物群的变异性可能会影响甲氨蝶呤的治疗反应。研究发现,肠道微生物群多样性较高的患者,具有丰富的Prevotella maculosa,对甲氨蝶呤的反应更好。尽管看起来不错,但甲氨蝶呤的应答率极其不稳定,介于10%-80%之间,只有40%的患者能够达到治疗所需的药物浓度,并且不良反应显著。
▸
已经探索了遗传因素来预测甲氨蝶呤的IVDR,但尚未达到临床相关性。需要更多的研究来评估。肠道微生物群可能在甲氨蝶呤的PD中发挥重要作用,进一步的探索可能有助于患者个性化治疗。
神经、运动系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
泌尿生殖系统的微生物群会影响几种药物的疗效和毒性,导致该系统出现了药物微生物组学领域。特别是,泌尿生殖微生物群会影响雄激素剥夺治疗(ADT)的有效性,这是癌症的常见治疗方法。ADT通常涉及使用雄激素合成抑制剂(如醋酸阿比特龙),或雄激素受体拮抗剂(如恩扎鲁胺、醋酸德格雷)。
醋酸阿比特龙、恩扎鲁胺、醋酸地加瑞克
最近的研究揭示了ADT对免疫系统和肠道微生物群的影响,以及这如何影响前列腺癌症的进展。
醋酸阿比特龙是ADT中广泛使用的药物,研究强调了胸腺依赖性T细胞在调节前列腺癌进展中的关键作用,由于CD4+和CD8+T细胞的消耗,导致IVDR控制的肿瘤发展的部分减少。
醋酸阿比特龙→ A.muciniphila ↑↑ → 维生素K2 ↑↑
前列腺癌患者接受醋酸阿比特龙治疗后,重塑肠道微生物群并促进抗炎菌A.muciniphila的增殖,从而提高微生物群产生维生素K2。
此外,研究表明,具有较高α-多样性的微生物群和特定的肠道微生物群,如A.muciniphila,与更好的疗效相关。
进一步研究发现,接受口服雄激素靶向治疗(ATT)的男性的泌尿生殖微生物群组成,与接受促性腺激素释放激素(GnRH)激动剂或拮抗剂单一治疗或不接受ADT的男性有所不同。例如,A. muciniphila、瘤胃菌科等能够合成类固醇的菌,在接受口服ATT治疗的男性的微生物群中丰富,这可能会影响疾病进展和免疫疗法。
肠道菌群→调节循环性激素→促进ADT耐药性
另一项研究表明,肠道微生物群可以通过对人体细胞的影响,也可以通过直接的生物转化或合成来调节循环性激素的水平,从而促进ADT耐药性。前列腺癌患者表现出更高水平的菌株,如A. muciniphila、瘤胃菌科,它们能够通过CYP17A1样细菌酶合成类固醇激素。使用CYP17A1抑制剂醋酸阿比特龙培养细菌可抑制雄激素生物合成。然而,微生物群对雄激素水平降低的反应导致能够合成雄激素的菌株的扩增,尚待阐明。
▸
总之,微生物群调节循环性激素的能力和能够合成雄激素的细菌的扩张,可以驱动对ADT的耐药性。未来的研究有必要澄清肠道微生物群、前列腺癌和治疗之间的复杂相互作用。
药物可能会影响呼吸微生物群的组成和功能,相反,微生物群可能会影响药物代谢和反应。例如,抗生素可以减少微生物群的多样性,并促进可能导致慢性呼吸道疾病的机会性病原体的生长。吸入皮质类固醇可以增加微生物群的多样性,降低致病菌的丰度,这可能有助于其治疗效果。
此外,呼吸道微生物群会影响药物向肺部的输送。最著名的例子之一是使用抗生素异烟肼(INH)、利福平(RIF)和吡嗪酰胺(PZA)进行抗结核治疗。
异烟肼、利福平、吡嗪酰胺
研究抗结核抗生素对结核分枝杆菌感染小鼠肠道微生物群结构的影响,发现在小鼠模型中,异烟肼、利福平、吡嗪酰胺治疗三个月会导致显著和持久的生态失调。肠道微生物群的组成发生了改变:
研究进一步表明,单剂量利福平降低了微生物群的多样性,而与未用抗生物治疗的小鼠的肠道微生物群相比,单独使用异烟肼或吡嗪酰胺会导致微生物群组成的改变。
具体而言,异烟肼富集Gordonibacter,而吡嗪酰胺富集Marvinbryanti。 结核病感染不会显著改变肠道微生物群组成,但它被发现可以调节粘膜免疫反应。
在人类中,一线抗结核药物治疗似乎对肠道微生物群的影响很小。然而,一些菌株可以调节宿主的免疫反应,如:
研究还发现,抗结核病药物可以减少肠道稳态所需的微生物群,增加复发结核病的风险。与无结核病患者相比,先前治疗的患者的T细胞对2型表位的识别能力也较差。人类肠道中的2型表位与分枝杆菌(mycobacteria)有关。
▸
抗结核病治疗的多年试验有助于更深入地了解微生物群在结核病进展中的重要性。抗结核抗生素和宿主调节剂的组合,可以缩短结核病的治疗时间,减轻严重程度,减少再次感染的风险。对宿主-病原体相关性、宿主免疫学和宿主靶向治疗的研究表明,这种方法可能对结核病的治疗有益。
呼吸系统:药物-微生物相互作用

Zhao Q, et al., Signal Transduct Target Ther. 2023
在癌症方面,肠道微生物群对于几种癌症的发病机制、进展和 IVDR 至关重要。这里介绍几种代表性药物和肠道微生物群在癌症患者中相互作用的机制,见下表。
Zhao Q, et al., Signal Transduct Target Ther. 2023
关于癌症药物与微生物群之间的相互作用,在我们之前的文章也有介绍,详见:
肠道微生物群通过酶修饰结构和生物活性或毒性的改变来影响药物的有效性和可接受性。肠道微生物群可以通过多种方式影响IVDR,包括以下:
1) 药物代谢的改变
微生物群可以影响体内代谢药物的酶的活性,从而影响药物的疗效和副作用。
2) 产生耐药性
随着时间的推移,微生物群会对药物产生耐药性,使其在治疗感染方面的效力降低。这种耐药性可能是由于微生物群DNA突变或从他人那里获得耐药性基因所致。
3) 药物靶点的修饰
微生物群可以修饰体内的药物靶点,使其不易受药物影响。如微生物群可以修饰氟喹诺酮类抗生素的靶位点,从而降低其结合和抑制酶的能力。
4) 与药代动力学相互作用
微生物群影响药代动力学,影响药物的疗效和安全性。例如,肠道微生物群可以改变药物的吸收、分布、代谢、排泄,从而改变其治疗效果和毒性。
5) 宿主微生物群的破坏
使用抗生素会干扰宿主微生物群中的自然生态系统,导致致病菌(如艰难梭菌)过度生长。这会导致感染和其他不良反应,从而影响药物安全。
6) 宿主免疫反应的调节
肠道微生物群可以调节宿主的免疫功能,这可能会影响靶向免疫系统的药物的活性和毒性。例如,肠道微生物群可以通过调节宿主免疫反应来调节免疫疗法在肿瘤治疗中的有效性。
7) 肠道屏障功能的调节
肠道微生物群可能影响肠道屏障的完整性,从而影响药物吸收和肠道-宿主相互作用。例如,肠道微生物群可以调节肠道中紧密连接蛋白的表达水平,从而影响药物的吸收。
肠道菌群编码的一些酶及其对药物的影响

Zhao Q, et al., Signal Transduct Target Ther. 2023
在一项重要全面的研究中,作者评估了1000多种药物的抗微生物特性,其中835种是影响人体细胞的靶向药物。其中,24%表现出抗菌作用,影响了至少50%的受试菌株的增殖。
药物影响肠道微生物群的机制有几个:
1) 直接抗生素效应
抗生素可以杀死包括有害菌和有益菌,可能导致肠道微生物群失衡,对人类健康产生负面影响。
2) 肠道运动能力改变
食物通过肠道的速度,会影响肠道微生物群的增殖和功能。某些药物,如阿片类止痛药,会减缓肠道运动,从而导致有害细菌过度生长。这可能会导致便秘和腹胀等胃肠道症状,在某些情况下还会导致感染(如艰难梭菌)。
3) 免疫功能的调节
肠道微生物群在调节肠道免疫方面具有关键功能。几种药物,如免疫检查点抑制剂,会影响肠道免疫,进而影响肠道微生物群。
4) pH值的变化
肠道的pH值会影响不同类型细菌的生长和存活。一些药物,如用于治疗胃酸倒流的质子泵抑制剂,可以改变肠道的pH值,从而影响不同微生物群的增殖,从而影响肠道微生物群的整体组成。
5) 干扰微生物代谢
肠道微生物群在代谢肠道中的化合物方面具有重要功能。一些药物,如非甾体抗炎药,会干扰微生物代谢,这可能会对肠道微生物群产生影响。特别是,非甾体抗炎药会干扰胆汁酸的肠道微生物群代谢,导致肠道微生物群的变化。
6) 饮食变化
某些药物,如泻药或抗腹泻药,会改变肠道的饮食环境。这可能会通过改变肠道微生物群生长和生存所需的营养素和其他化合物的可用性来影响肠道微生物群。
▸
药物对肠道微生物群的影响可能是积极的,也可能是消极的。例如,某些益生菌或益生元能够调节肠道微生物群,这可能对个体的健康产生积极影响。然而,服用对肠道微生物群产生负面影响的抗生素或其他药物可能导致微生态失调,对人类健康产生负面影响。
因此,必须仔细评估药物对肠道微生物群的潜在影响,并开发考虑个体肠道微生物群组成和功能的个性化药物治疗方法。
以上我们了解到微生物群和常见药物之间复杂的相互作用对药物效果的影响,肠道微生物群在药物治疗中的重要性意味着,肠道微生物群驱动的精准医疗,明确靶向肠道微生物群或将提高临床疗效。
未来多元化应用
通过测定肠道微生物群的组成、数量及代谢产物相对丰度,可以预测药物在体内的疗效和毒性。肠道微生物特征可作为非侵入性辅助诊断方法或提供预后评估。因此,开发能够预测药物疗效和毒性的改进生物标志物,对于成功实施精准医疗至关重要。
设计小分子抑制体内与药物生物转化为有毒代谢物相关的微生物代谢活性。
可以通过引入益生菌、益生元、粪菌移植等方式来调节微生物群的组成和比例,提高药物的生物利用度,减少不良反应。
药物微生物组学领域正在兴起
整合多个高通量多组学数据集,提供药物反应的个体差异的全面概况。这些将辅助全面揭示药物与微生物之间相互作用背后的决定因素,可以有效地满足对患者进行聚类和预测以及发现新生物标志物的需求。
多组学策略促进药物微生物组学走向人类精准医学

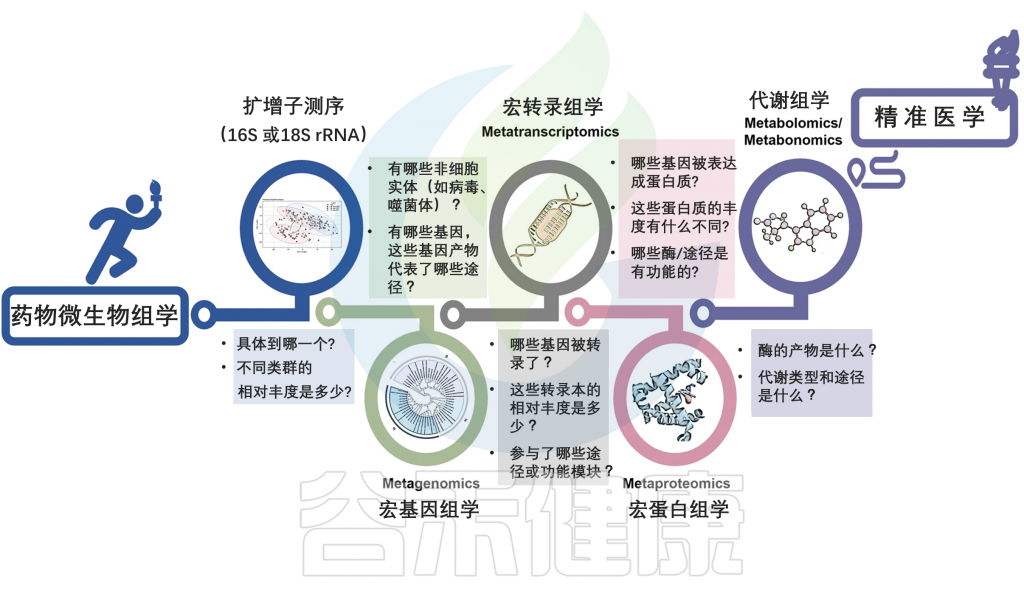
Zhao Q, et al., Signal Transduct Target Ther. 2023
高通量数据需要使用先进的计算技术通过人工智能算法进行建模。开发模拟药物与微生物相互作用的预测模型和软件对于减少研究时间和成本至关重要。
仍然存在一些挑战
——研究还需更加深入
对药物-微生物之间相互作用背后的机制仍然缺乏全面的了解。肠道菌群是一个复杂且不断变化的生态系统,受到饮食、年龄、性别、生活方式、宿主遗传学等多种因素的影响。很难将这些因素的影响与药物引起的微生物群变化分开。
——临床转化需要克服的障碍
例如,开发基于微生物群的药物反应生物标志物将需要大规模的验证研究和监管部门的批准。
许多药物微生物组学研究的样本量通常有限,可能限制其统计能力和概括研究结果的能力。需要更大规模的研究来确认和扩展初步结果。
应对这些挑战需要研究人员、临床医生和行业合作伙伴之间的合作,加深我们对药物-微生物相互作用机制的理解,并确保研究结果转化为安全有效的临床实践,为患者提供更好的治疗策略,共同推动精准医学领域的进步。
主要参考文献
Zhao Q, Chen Y, Huang W, Zhou H, Zhang W. Drug-microbiota interactions: an emerging priority for precision medicine. Signal Transduct Target Ther. 2023 Oct 9;8(1):386.
Rosell-Díaz M, Fernández-Real JM. Metformin, cognitive function, and changes in the gut microbiome. Endocr Rev. 2023 Aug 21:bnad029.
Weersma RK, Zhernakova A, Fu J. Interaction between drugs and the gut microbiome. Gut. 2020 Aug;69(8):1510-1519.
Schupack DA, Mars RAT, Voelker DH, Abeykoon JP, Kashyap PC. The promise of the gut microbiome as part of individualized treatment strategies. Nat Rev Gastroenterol Hepatol. 2022 Jan;19(1):7-25.
Chen HQ, Gong JY, Xing K, Liu MZ, Ren H, Luo JQ. Pharmacomicrobiomics: Exploiting the Drug-Microbiota Interactions in Antihypertensive Treatment. Front Med (Lausanne). 2022 Jan 19;8:742394.
Daisley BA, Chanyi RM, Abdur-Rashid K, Al KF, Gibbons S, Chmiel JA, Wilcox H, Reid G, Anderson A, Dewar M, Nair SM, Chin J, Burton JP. Abiraterone acetate preferentially enriches for the gut commensal Akkermansia muciniphila in castrate-resistant prostate cancer patients. Nat Commun. 2020 Sep 24;11(1):4822.
Jia L, Huang S, Sun B, Shang Y, Zhu C. Pharmacomicrobiomics and type 2 diabetes mellitus: A novel perspective towards possible treatment. Front Endocrinol (Lausanne). 2023 Mar 23;14:1149256.
Khan I. Drugs and gut microbiome interactions-an emerging field of tailored medicine. BMC Pharmacol Toxicol. 2023 Aug 30;24(1):43.
Pant A, Maiti TK, Mahajan D, Das B. Human Gut Microbiota and Drug Metabolism. Microb Ecol. 2023 Jul;86(1):97-111.

谷禾健康

俗话说病从口入,饮食对人体具有重要的影响,蔬菜和水果作为每日饮食中必不可少的成分,为人类提供了重要的营养物质,包括各种必需的维生素和矿物质。
此外,蔬菜和水果上栖息着数量惊人的微生物,高度多样化的微生物组是机会性病原体和益生菌的重要储存库。新鲜蔬菜和水果可能成为一些食源性病原微生物的重要来源。
许多研究还发现,食用新鲜蔬菜和水果会影响肠道微生物的组成,同时对人体健康和相关代谢也存在一些有益的影响,例如可以增加碳水化合物活性酶的丰度,影响短链脂肪酸和维生素的生成。
除了新鲜的蔬菜和水果外,牛奶也是人们生活中重要的饮食,牛奶富含蛋白质、维生素、矿物质、必需氨基酸等多种营养,但同时非常容易滋养微生物。不当的保存方法会促进微生物的生长和繁殖,从而对食品质量和食品安全产生负面影响。
本文从食品中的微生物角度,主要阐述了蔬果中存在的一些微生物群对肠道微生物群结构和人类健康的影响。此外还介绍了一些影响食物中微生物生长的因素,以及导致牛奶及奶制品腐败的微生物。
人们对动物体内的微生物研究较多,有时可能忽略了植物中的微生物,你可能想象不到,一个普通的苹果就含有约1亿个细菌。
★ 蔬果中的微生物会影响人体健康
蔬果中高度多样化的微生物群是机会性病原体和益生菌的储存库。其中很少细菌是致病的,大多数是无害的,有些甚至是有益的。
随着饮食的摄入,定植于植物组织内部和外部的微生物可以在人类营养和健康中发挥作用,例如十字花科蔬菜的微生物群,研究表明它们为人类宿主提供了抵御真菌病原体和针对抗癌分子的保护。
此外,一些植物微生物与植物激素协同作用产生的代谢物,也可能与人类肠道微生物甚至整体健康相关。
研究发现蔬菜含有以放线菌门、拟杆菌门、厚壁菌门和变形菌门为主的多种细菌群落,但每种蔬菜物种的组成显著不同。
★ 肠杆菌是蔬菜微生物中的重要组成部分
这些差异通常可归因于肠杆菌科(Enterobacteriaceae)相对丰度的差异。这个革兰氏阴性菌大家族除了许多无害的共生体之外,还包括许多熟悉的机会性病原体,例如大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella)、克雷伯菌(Klebsiella)。然而,肠杆菌科是蔬菜微生物组的重要组成部分。
★ 发酵的蔬菜中含有大量的乳酸菌
除了新鲜蔬菜外,发酵的蔬菜也是全世界饮食的重要组成部分,并且不同地区存在特定的传统产品,例如韩国的“泡菜”或中国的“酸菜”。
通过使用本土细菌或发酵剂进行乳酸发酵会引起细菌群落的转变。它们携带内源性乳酸菌群落,这些群落在发酵过程中变得丰富。例如,腌制橄榄含有大量乳杆菌(Lactobacillus),可能具有益生菌作用。
另一类发酵食品以奶酪和其他乳制品为代表,将在本文后面的章节讲述。
★ 不同蔬果中的微生物组成存在差异
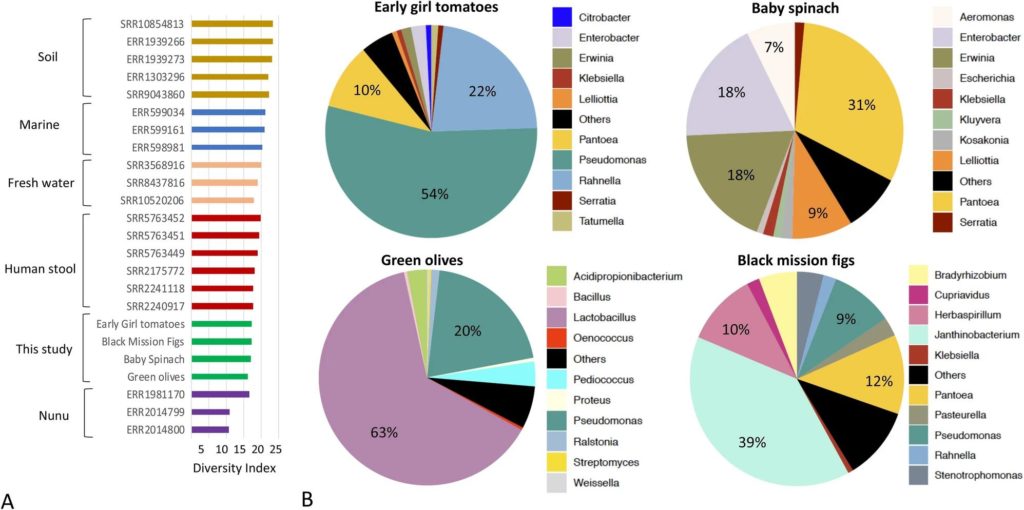
基于宏基因组读数的分类注释表明,大部分样品中的微生物群落均以变形菌门为主,但绿橄榄除外,其中最丰富的门是厚壁菌门(占总数的69.7%)。
与其他样品相比,绿橄榄中的放线菌含量也高出10 倍(平均为4.2%对0.4%)。在属水平上,蔬菜和水果中含有不同的微生物成员(上图B所示)。
番茄中假单胞菌非常丰富
例如,假单胞菌属(Pseudomonas)是番茄中最丰富的分类群(54%),其次是拉恩氏菌属(rahnella)(22%)和泛菌属(Pantoea)(9%)。
小菠菜以泛菌属(Pantoea)(30%)为主,其次是欧文氏菌属(Erwinia)(20%)和肠杆菌属(19%)。
绿橄榄以乳杆菌(62%)为主,其次是假单胞菌(21%)、丙酸杆菌(3%)和片球菌(3%)。
黑无花果中有较高丰度的真菌
黑无花果中的细菌以紫色杆菌属(Janthinobacterium)(38%)为主,其次是泛菌属(12%)和草螺菌属(12%)。
基于从宏基因组中恢复的 16S 和 18S rRNA 基因序列的分类学图谱表明,黑无花果拥有属于真菌的最高比例的测序读数,主要分为曲霉属(30%)、未分类的散囊菌目(Eurotiales)(29%)和未分类的Trichocomaceae属(26%) 属。
注:在任何宏基因组中均未检测到古菌序列。
小结
蔬菜微生物组高度多样化,不同品种蔬菜的物种组成各不相同,并受到地理方面以及农业和食品加工的强烈影响,肠杆菌科是关键物种。
★ 蔬菜中具有潜在有益细菌和病原体
生菜在蔬菜中有着特殊的地位。它是最受欢迎的生吃蔬菜之一,并为特定微生物提供了栖息地。
研究发现,在田间种植的长叶生菜的叶际中,存在高丰度10^5–10^6菌落形成单位(cfu)g和肠杆菌科细菌比例较高的多样性。肠杆菌科分类群不仅包含潜在的有益细菌,而且还存在潜在的病原体。
在德国病原体监测系统中,在所调查的生菜样本中,1.3%发现了产维罗细胞毒素的大肠杆菌,3.8%发现了大肠杆菌。
植物,特别是其内层和根茎,是新出现机会性病原体的重要储存库。
★ 多种病原体能够在蔬菜中定值
近年来,记录在案与食用生蔬菜有关的人类感染的数量有所增加。多种人类病原体能够在蔬菜中定殖,包括大肠杆菌等致病菌。
下图显示了细菌处理后大肠杆菌通过气孔侵入生菜叶片。
大肠杆菌在生菜叶片上的定值
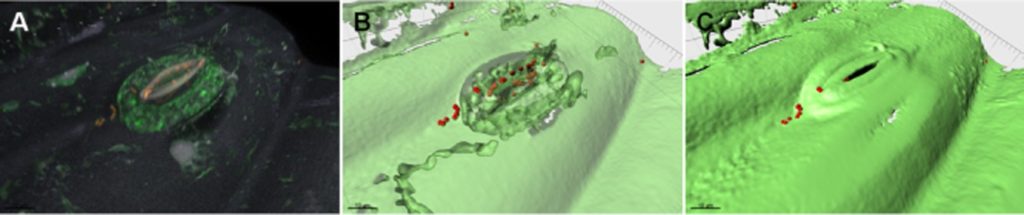
Berg G,et al.Microb Biotechnol.2014
A.共聚焦Z堆栈体积的渲染。
B和C.显示造口内细菌的A的等表面模型。
★ 植物中的一些菌属和人体存在相互作用
有许多与植物相关的菌属,包括伯克霍尔德菌属(Burkholderia)、肠杆菌属、假单胞菌属、罗尔斯通氏菌属(Ralstonia)、沙雷氏菌属、葡萄球菌属和寡养单胞菌属(Stenotrophomonas),它们与植物和人类之间相互作用。
这些属的一些成员表现出促进植物生长以及对抗植物病原体的优异拮抗特性;然而,许多菌株也会定植于人体器官和组织,从而引起疾病。一个原因是相似或通常相同的因素允许识别、粘附和入侵植物和人类宿主。
机会致病菌在芝麻菜叶层中的分类结构
Berg G,et al.Microb Biotechnol.2014
这一群体中研究得很好的例子是革兰氏阴性,通常具有多重耐药性的铜绿假单胞菌和嗜麦芽窄食单胞菌。两者都是植物微生物群中丰富的成员,属于这些物种的菌株在基因型和表型水平上具有高度的多样性。
铜绿假单胞菌分布较广,会引起人体感染
令人惊讶的是,铜绿假单胞菌的泛基因组比人类基因组具有更大的遗传库,这解释了铜绿假单胞菌广泛的代谢能力及其在栖息地中的普遍分布。
此外,流行的植物模型拟南芥已被用于成功鉴定与毒力相关的新铜绿假单胞菌基因。
铜绿假单胞菌感染人体后,可引起病人的血液感染、肺炎、心内膜炎、尿路感染等;对植物亦是机会性感染的,感染后会流出绿色的脓汁和渗出液。
当人体自身微生物群减少时,可能被嗜麦芽窄食单胞菌感染
嗜麦芽窄食单胞菌菌株表现出相似程度的多样性。临床和环境嗜麦芽窄食单胞菌种群的多态性突变频率解释了对新生态位的适应,与植物相关的种群具有更广泛的多样性,只有突变频率高的种群(超突变者)才能适应临床环境和人类宿主。
尽管嗜麦芽窄食单胞菌菌株引起大量感染,但仅鉴定出非特异性毒力因子,例如蛋白酶和铁载体。属于该物种的菌株持续存在并表现出多重抗性;只有本土微生物群减少,病原体才有机会感染人类。
在自然栖息地中,嗜麦芽窄食单胞菌菌株定植于双子叶植物中,这些植物能够产生多种次生抗菌代谢物。
为了在这样的植物中生存,需要使用外排泵,这也是它们对临床使用的抗生素具有多重耐药性的原因。然而,研究表明,菌株水平上的基因组和表观基因组具有高度可塑性和特异性,这可能有助于强毒菌株的发展。
农业技术和加工对植物相关微生物群落的组成有重要影响。在过去的二十年里,更大规模的生产和更有效的新鲜蔬菜分配导致了疾病爆发数量的增加。
有机农业实践可能与传统农业实践不同,包括使用的肥料和农药的类型,这些差异有可能影响与蔬菜相关的微生物群落结构;它们通常具有较高的微生物多样性的特点。
★ 抗生素和农药的使用增加了相关耐药基因
在过去的几十年中,抗生素在畜牧业中的使用极大地促进了农场环境中抗生素耐药性的发展和丰富。特别是,粪便是耐药细菌和抗生素化合物的储存库,其应用于农业土壤被认为会显著增加抗生素耐药基因和土壤中耐药细菌种群的选择。
这些种群可以从根际侵入植物的内部,并进入人类的食物链。新鲜产品的病原体污染可能起源于收获之前或之后,一旦被污染,产品就很难消毒。
★ 动物粪便中携带的病原体可能增加了蔬菜中的病原体
食品加工也会对蔬菜微生物组的结构和食品安全产生重要影响。例如,中等干扰(例如轻微的生物或非生物影响)可以增加肠杆菌科细菌的相对丰度。
与志贺氏菌(一种以人类为主要宿主的有机体)收获前污染相关的爆发相对较少,而与沙门氏菌或产生志贺毒素的大肠杆菌相关的爆发相对较高,以动物为主要宿主的生物体,强调了家养动物和野生动物作为沙拉等蔬菜收获前污染的主要来源的作用。
既然植物中存在如此丰富的微生物组,那么其在植物生长的时候是否存在一定的作用,当人类将其作为食物摄入时又是否会对人体健康产生影响?在这一章节谷禾将具体讲述植物中微生物的相关作用。
植物微生物组对植物生长和健康起着重要作用,取决于植物种类、栽培品种和土壤类型等因素。
▷ 植物中的微生物会促进营养吸收
植物中的一些微生物可以支持营养吸收并产生多种植物激素。
例如根瘤菌和固氮菌,能够与植物共生,将大气中的氮转化为植物可利用的氮化合物。这种共生关系使植物能够吸收到更多的氮,从而促进其生长。
溶磷细菌和真菌,能够分解土壤中的有机磷化合物,将其转化为可溶性的无机磷,为植物提供营养。
一些微生物能够产生植物生长激素,如生长素和激动素,这些激素可以促进植物的生长和发育。微生物通过与植物根系接触,释放这些激素,从而影响植物根系的吸收能力。
注:激动素是一种内源的细胞分裂素,除具有促进细胞分裂的作用外,还具有延缓离体叶片和切花衰老,诱导芽分化和发育及增加气孔开度的作用。
▷ 一些植物中的病原菌会影响产量
许多病原体会对植物产生负面影响,特别是真菌、卵菌和线虫;据估计,全球三分之一以上的产量损失是由它们造成的。
病原菌会直接侵害植物的组织,破坏植物的生长和发育过程。例如,霉菌和真菌可以感染植物的叶片、茎和根部,这会削弱植物的光合作用和养分吸收能力。
此外,病原菌还可以分泌毒素,对植物产生毒害作用。这些毒素会破坏植物的细胞结构和功能,干扰植物的正常代谢过程,使植物受到氧化应激和细胞死亡的影响。
最终导致叶片枯萎、果实腐烂、凋萎和死亡等症状,从而降低产量。
植物微生物可能还通过刺激人体的免疫系统和增强肠道微生物组的多样性对人类健康发挥积极作用。
最近,通过与肠杆菌科细菌的显著相互作用证明了细菌多样性与特应性之间的相关性。研究发现健康人外周血单核细胞中不动杆菌(Acinetobacter)的丰度与白细胞介素10的表达呈正相关。
白细胞介素10是一种抗炎细胞因子,在维持对无害物质的免疫耐受性方面发挥着核心作用。
▷ 植物相关微生物可能成为“天然疫苗”
已知源自革兰氏阴性菌(例如肠杆菌科)的内毒素具有过敏保护和免疫调节潜力。如果植物是肠杆菌科细菌的天然储存库,那么这些细菌一定长期以来一直是我们饮食的“天然”组成部分。
考虑到全世界人们食用的蔬菜和水果量,植物相关微生物组可能可以作为免疫刺激剂或“天然疫苗”。
▷ 植物相关细菌影响肠道微生物的多样性
在人体肠道中可检测到水果和蔬菜相关细菌
有趣的是,植物和人类肠道微生物组在物种组成和功能方面存在重叠。最近的研究表明,胃并不像以前认为的那样对微生物通道构成严格的屏障。它栖息着许多物种。
最近还提供了食源性微生物(包括动物性和植物性饮食)在通过消化系统后仍能存活的证据,并且食源性菌株可能在肠道中具有代谢活性。
植物和人类相关细菌的分类及其在人类肠道中的丰度
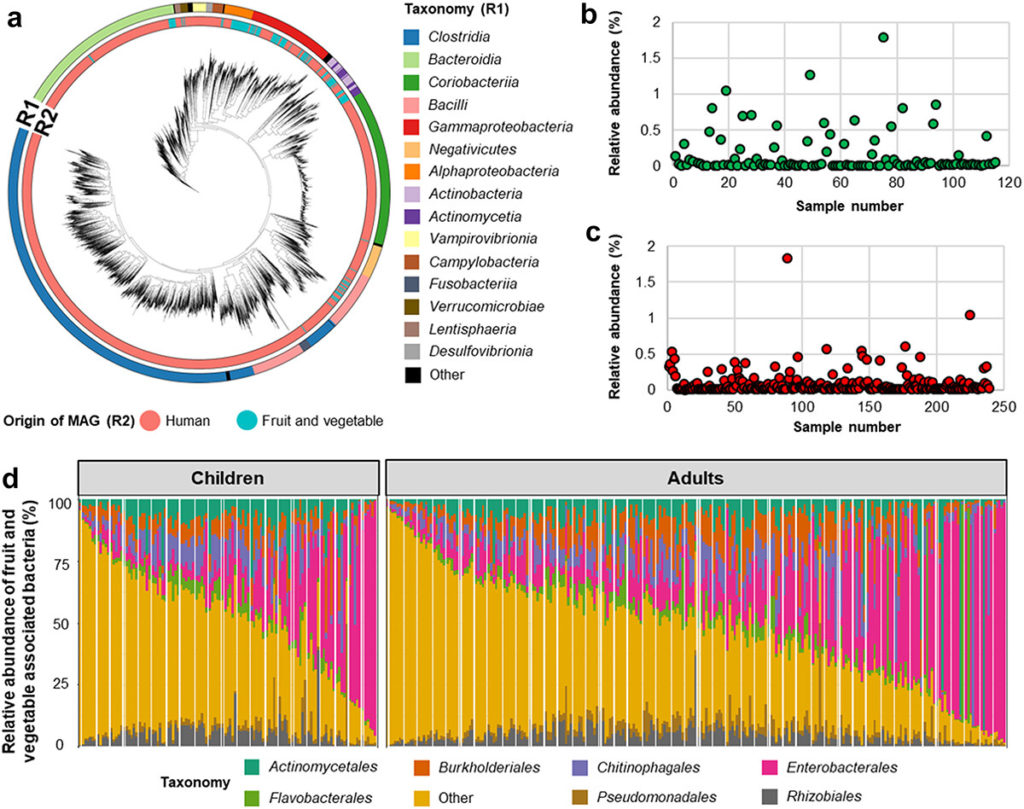
Wicaksono WA,et al.Gut Microbes.2023
(a)R1中的不同颜色表示细菌分类,R2表示MAG(宏基因组组装基因组)的起源。
水果和蔬菜相关细菌的相对丰度及其在儿童(b)和成人(c)中的丰度。条形图显示了人类肠道中与水果和蔬菜相关的细菌组成在目水平上的相对丰度。
(d)水果和蔬菜相关细菌的相对丰度是通过使用包含仅映射到水果和蔬菜相关细菌基因组读数的数据集获得的。不同的颜色代表不同的级别分类,不太丰富的细菌目包括在“其他”中。
通过基于每月粪便样本鸟枪宏基因组测序(对儿童肠道微生物组进行纵向研究,进一步尝试确定水果和蔬菜相关细菌对人类肠道整体微生物多样性的贡献。
婴儿时期喂养蔬果有助于肠道微生物的发育
有趣的是,水果和蔬菜相关细菌的多样性从1个月大到12个月大的受试者有所增加,但从此时开始下降,在24个月以上的受试者中达到最低水平。
除了母乳喂养之外,引入固体食物(即水果和蔬菜)是生命早期的事件,有助于肠道微生物组的变化和发育。
在队列中,一些儿童在前4个月内已经接触了根类蔬菜(n=269中的71名)、水果(n=269中的81名)和蔬菜。此外,制备自制婴儿食品的常见烹饪方法可能无法完全消除植物微生物群。
由于食源性微生物可以在消化道中生存,我们推测,儿童肠道宏基因组中检测到的植物相关细菌数量的增加是由于断奶早期食用的自制或生水果或蔬菜中的植物微生物群的转移和定植所致。
水果和蔬菜相关细菌平均占2.2%(最小值:0.8%,最大值:13.6%)
▷ 植物微生物随着时间的推移在体内持续存在
人类肠道中与水果和蔬菜相关的细菌群落随着宿主年龄的变化而变化,根据图中的年龄梯度,可以看到清晰的聚类。评估表明,宿主年龄影响水果和蔬菜相关的细菌群落结构(P=0.001),但只能解释5.3%的细菌变异。
有趣的是,婴儿的国籍也对水果和蔬菜相关的细菌群落结构产生了较小程度的影响(P=0.001,R2=2.2%)。这一结果可能是由于不同国家的婴儿之间的辅食喂养模式不同所致。
沿梯度富集的细菌类群主要是革兰氏阳性菌,尤其是布氏乳杆菌、乳杆菌属和乳球菌属,它们取代了早期占主导地位的泛菌属、欧文菌属和不动杆菌属。
注:与临床菌株相比,源自植物的聚集泛菌菌株同样能够定植于人类宿主。
肠道微生物的变化可能由于氧气浓度和食物种类
我们假设,由于新生儿肠道中存在氧气,来源于水果和蔬菜的兼性厌氧γ-变形菌,即泛球菌、欧文氏菌和不动杆菌,可以在断奶早期的婴儿肠道中定植。然后,由于氧气浓度降低,厌氧细菌,即布氏乳杆菌和乳杆菌属,在第8-12个月出现。
在婴儿期,肠道微生物群的生态演替是一个动态过程,然后在儿童期达到稳定阶段。随着宿主年龄的增加,人类肠道中与水果和蔬菜相关的细菌组成变得更加异质(即相对于中位数分布的差异更大)。这可能是由于通常随着婴儿年龄的增加而提供的食物种类更加多样化,也可能因个体而异,导致观察到与宿主年龄相关的异质性。
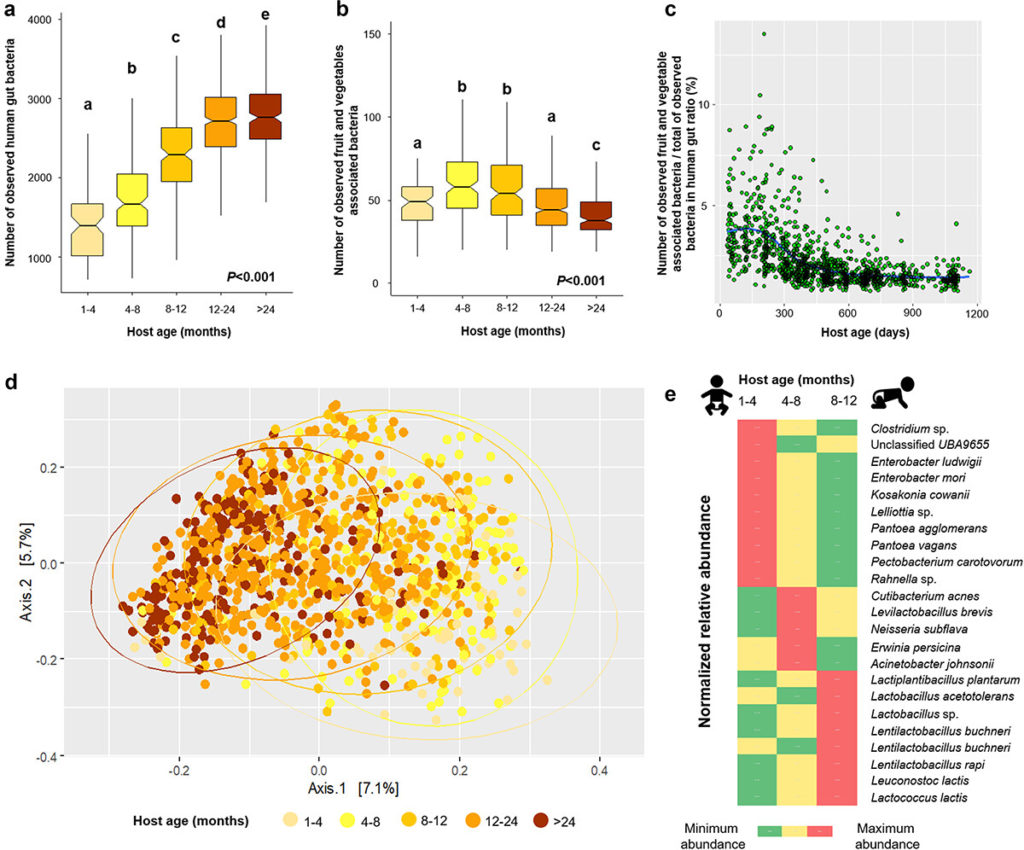
Wicaksono WA,et al.Gut Microbes.2023
箱线图包括基于观察到的肠道宏基因组观察到的人类肠道相关细菌(a)和水果和蔬菜相关细菌(b)。
箱形图上方的不同字母表示不同宿主年龄内的Kruskal-Wallis检验,然后进行成对比较(P<0.05)。散点图显示了观察到的水果和蔬菜相关以及人类肠道相关细菌宏基因组组装基因组沿年龄梯度的比率(c)。使用二维PCoA图并基于 Bray-Curtis 相异矩阵(d)显示了人类肠道中水果和蔬菜相关细菌的群落聚类。
LEfSe分析表明,水果和蔬菜相关的细菌宏基因组组装基因组在不同年龄组中富集(e)。
▷ 蔬果消费频率和多样性会影响人类肠道中与水果和蔬菜相关的细菌丰富度
食用水果和蔬菜的频率和多样性可能会影响人类肠道中与水果和蔬菜相关的细菌丰富度。
为了检验这一假设,研究人员使用了美国肠道项目的数据集,这是一项大型公民科学开放平台研究,收集了自我报告的饮食数据和粪便样本。
使用Kraken2,总共746个样本的读数超过500000个,这些读数被指定为细菌。保留这些样本进行进一步分析,以检查肠道微生物多样性与植物消费频率和多样性之间的关联。
分析表明,人类肠道中水果和蔬菜相关细菌的丰富度与受试者食用蔬菜的频率和多样性有关。
食用蔬菜更丰富的人群肠道微生物多样性更高
对于α多样性分析,将数据集二次采样至500000个读数后,计算了人类肠道中检测到的水果和蔬菜相关宏基因组组装基因组(MAG)的数量。
与其他组相比,经常食用蔬菜和每周食用超过10种植物的受试者中检测到的与水果和蔬菜相关的宏基因组组装基因组数量更高。然而,水果消费频率对检测到的相关宏基因组组装基因组的数量没有显著影响。
蔬菜消费频率的增加和所消费植物的多样性也增加了人类肠道中水果和蔬菜相关细菌的相对丰度。
Wicaksono WA,et al.Gut Microbes.2023
一周内蔬菜消费频率、水果消费频率和消费植物多样性对观察到的水果和蔬菜相关细菌数量以及水果和蔬菜细菌群落组成总体异质性的影响。
箱线图显示了肠道(ac)中观察到的与水果和蔬菜相关的宏基因组组装基因组。其他图显示了肠道中水果和蔬菜相关宏基因组组装基因组组成的总体异质性(df)。
与研究结果一致,经常食用蔬菜、水果和自制发酵乳制品的农村贝都因人的细菌多样性明显高于城市沙特人,城市沙特人每周只吃1-2次蔬菜和水果。
另一组研究人员也提出了类似的观点,患者因每天食用帕尔马干酪而在人类肠道中发现了与奶牛相关的细菌定植。
基因本体论(GO)生物学过程的预测表明,宏基因组读数的很大一部分与代谢功能有关,如核酸代谢、蛋白质代谢和碳水化合物代谢。
★ 植物中不同的微生物组成导致代谢存在差异
对四个样本中注释基因的比较表明,并非所有生物代谢过程都是均匀分布的。在新鲜菠菜中,与其他样品相比,我们发现分配给果胶分解代谢、甘油醚代谢、海藻糖生物合成、L-苏氨酸分解代谢为甘氨酸和L-丝氨酸生物合成过程等过程的高频读取。
在无花果中,我们发现木葡聚糖代谢和聚羟基丁酸酯生物合成更加频繁。与其他样品相比,番茄中的乙醛酸分解代谢更为频繁。
此外还确定了与人类肠道微生物组稳态相关的代谢途径的存在,包括谷氨酸、萜类化合物、核黄素(VB2)、硫胺素(VB1)、叶酸、谷氨酰胺和生物素的生物合成。
除绿橄榄外,所有样品中都存在类胡萝卜素生物合成过程,而对氧化还原状态、乳糖代谢过程以及脂磷壁酸、磷壁酸和异戊烯基二磷酸生物合成过程的响应仅在绿橄榄中被发现。
总体而言,这些数据揭示了食用植物微生物组具有多样化的基因组库,且不同样本之间存在差异。
▷增加碳水化合物活性酶的丰度
为了进一步了解这些植物微生物组的功能,我们研究了碳水化合物活性酶 (CAZymes) 的丰度,这是一组参与植物细胞壁分解的酶,有可能进一步转化为人体肠道中的有益代谢物。
碳水化合物活性酶根据蛋白质序列和结构相似性进行分类,包括糖基转移酶(GTs)、糖苷水解酶(GHs)、碳水化合物酯酶(CE)、多糖裂解酶(PL)、辅助活性酶(AA)和碳水化合物结合模块(CBM)。
本研究中所表征的植物相关微生物群中的假定碳水化合物活性酶是使用来自宏基因组和碳水化合物活性酶数据库的预测开放阅读框进行鉴定的。
糖基转移酶和糖苷水解酶是宏基因组中预测最丰富的碳水化合物活性酶(约占总数的30%至57%)。样品中鉴定出较少百分比的辅助活性酶(约1-6%)、碳水化合物结合模块(2-5%)、碳水化合物酯酶(3-9%)和多糖裂解酶(1-4%)。
具体而言,碳水化合物活性酶数据库中的133个糖苷水解酶家族中有79个在样本中被检测到,其中 GH13、GH23和GH1是最常见的家族。GH13是人类肠道微生物组中最常见的家族之一,其特点是分解淀粉。
部分糖苷水解酶与人类肠道的有益作用相关
研究还观察到糖苷水解酶明显分布在特定样本中,并且与人类肠道的有益作用相关。
例如,番茄酶与木聚糖酶一起是GH10的成员。番茄红素酶促进抗真菌番茄红素降解为非致癌底物。
黑无花果中真菌的存在可能与GH10酶的存在有关,GH10酶使真菌毒素呈惰性。
GH1包含参与纤维素降解的β-葡萄糖苷酶,纤维素是叶类蔬菜中最丰富的纤维之一。肠道微生物利用GH1酶将聚糖水解成葡萄糖和糖酵解前体葡萄糖-6-磷酸。
含有海藻糖磷酸化酶的GH65在绿橄榄样品中含量最高。海藻糖是一种二糖,可以防止植物干燥,存在于橄榄叶中。海藻糖酶也存在于脊椎动物的小肠中,肠球菌等细菌已被证明可以代谢海藻糖。
GH28家族含有与果胶降解相关的酶。果胶被认为是一种益生元,番茄中存在的欧文氏菌属(Erwinia)和假单胞菌属(Pseudomonas)是常见的果胶分解酶生产者。
总之,这些数据进一步支持了这样一种观点,即植物中存在的微生物在作为饮食的一部分食用时可以为人类提供代谢益处,因为它们含有大量碳水化合物活性酶,对人类健康和植物细胞壁中存在的底物起着至关重要的作用。
▷ 影响短链脂肪酸产生的代谢途径
与人类健康相关之一的微生物代谢物是短链脂肪酸。短链脂肪酸源自复杂碳水化合物的微生物发酵,既可作为重要的调节信号分子,又可作为宿主的额外燃料来源。
所分析的四个样品中最普遍的短链脂肪酸途径是乳酸氧化和L-赖氨酸分解代谢过程为乙酸。在新鲜菠菜和绿橄榄的宏基因组中也发现了乳酸代谢过程。最不常见的途径是丁酸代谢过程,因为宏基因组包含的丁酸激酶读数最少。
蔬果中的微生物组有助于产生乙酸和丙酸
有趣的是,研究中具有最广泛短链脂肪酸代谢潜力的样品是腌制的绿橄榄,这表明腌制过程可能会选择具有广泛短链脂肪酸生产能力的微生物。样品中最具代表性的酶是与乙酸(乙酸激酶)和乳酸(D-乳酸脱氢酶)生产相关的酶。
这些数据表明,水果和蔬菜的微生物组含有产生乙酸和丙酸(与人类健康相关的微生物代谢物家族)所需的基因和途径,但缺少丁酸生物合成,因为它主要与样品中未见的严格厌氧菌有关。
▷ 与维生素合成相关
众所周知,微生物可以合成维生素,这对于各自宿主的多种代谢反应至关重要。
本研究的宏基因组中参与维生素生物合成和摄取转运蛋白酶的鉴定是基于先前在人类粪便宏基因组和益生菌菌株克劳氏芽孢杆菌(Bacillus clausii)中鉴定的KEGG同源物(KOs)注释基因。
植物微生物中存在编码维生素合成的基因
研究结果表明,植物相关宏基因组中存在编码酶的基因,这些酶是钴胺素(维生素B12)、生物素(维生素H)和泛酸(维生素B5)生物合成途径的一部分,叶酸(维生素B9)、甲基萘醌(维生素K2)和烟酸(维生素B3)生物合成的基因簇较少。
此外,在宏基因组中检测到了很高比例的与钴胺素代谢相关的基因,并且在早期番茄和绿橄榄中发现了略高丰度的钴胺素代谢基因。
钴胺素(维生素B12)是人类必需的辅助因子,由一些细菌和古细菌合成,参与介导微生物-微生物相互作用和宿主-微生物作用。钴胺素缺乏会导致贫血、神经系统疾病等。
植物和动物来源的食物都在微生物生长中发挥着重要作用。微生物在食品中生长或繁殖的能力取决于食品环境。
食品的内在因素、外在因素、隐性因素包括各种食品加工方法分别对微生物的生长产生作用。这些因素决定了食物中微生物的生长以及它们用来产生能量和代谢产物的特定途径。
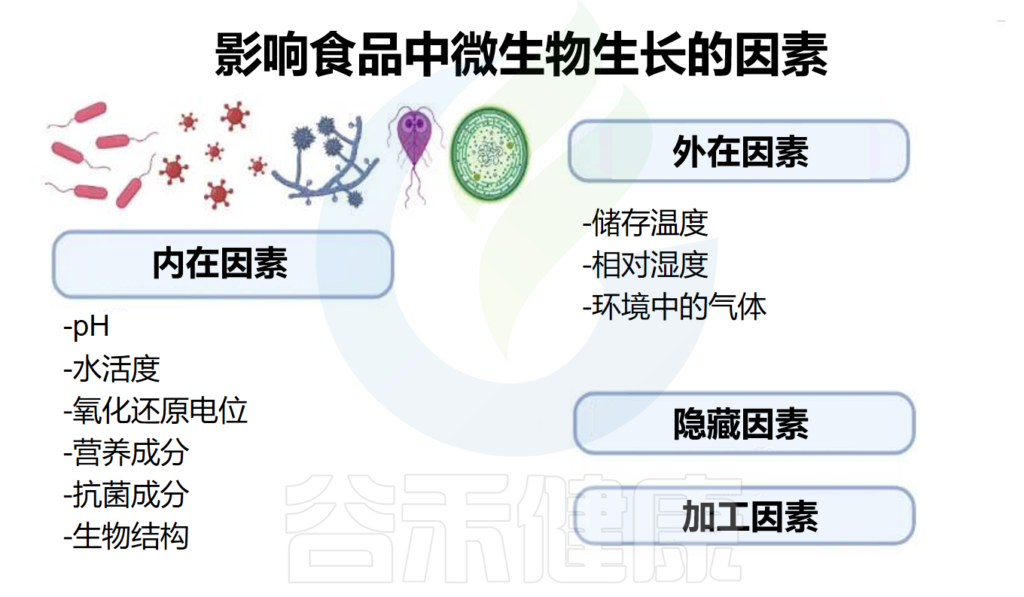
Part 01
内在因素
1
酸碱度
一般来说,与细菌相比,霉菌和酵母菌可以在较低的pH值下生长,并且革兰氏阴性菌比革兰氏阳性菌对低pH值更敏感。
霉菌生长的pH范围为1.5至9.0;对于酵母生长的pH范围为2.0至8.5;革兰氏阳性菌生长的pH范围为4.0至8.5;革兰氏阴性菌生长的pH范围为4.5至9.0。
根据 pH 范围,微生物可分为:
中性菌在pH值5至8范围内生长最佳;
嗜酸菌在pH值低于5.5时生长最佳;
嗜碱菌在pH值高于8.5时生长最佳。
以下是一些常见微生物生长所需的pH值:
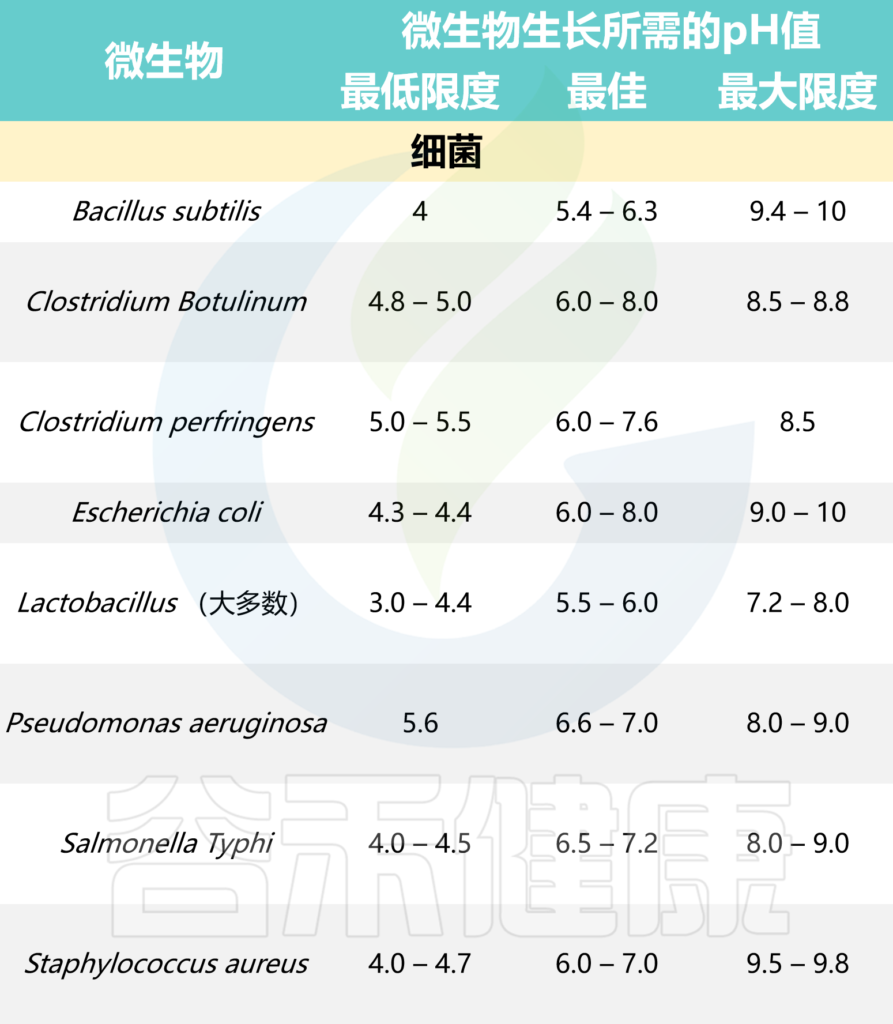
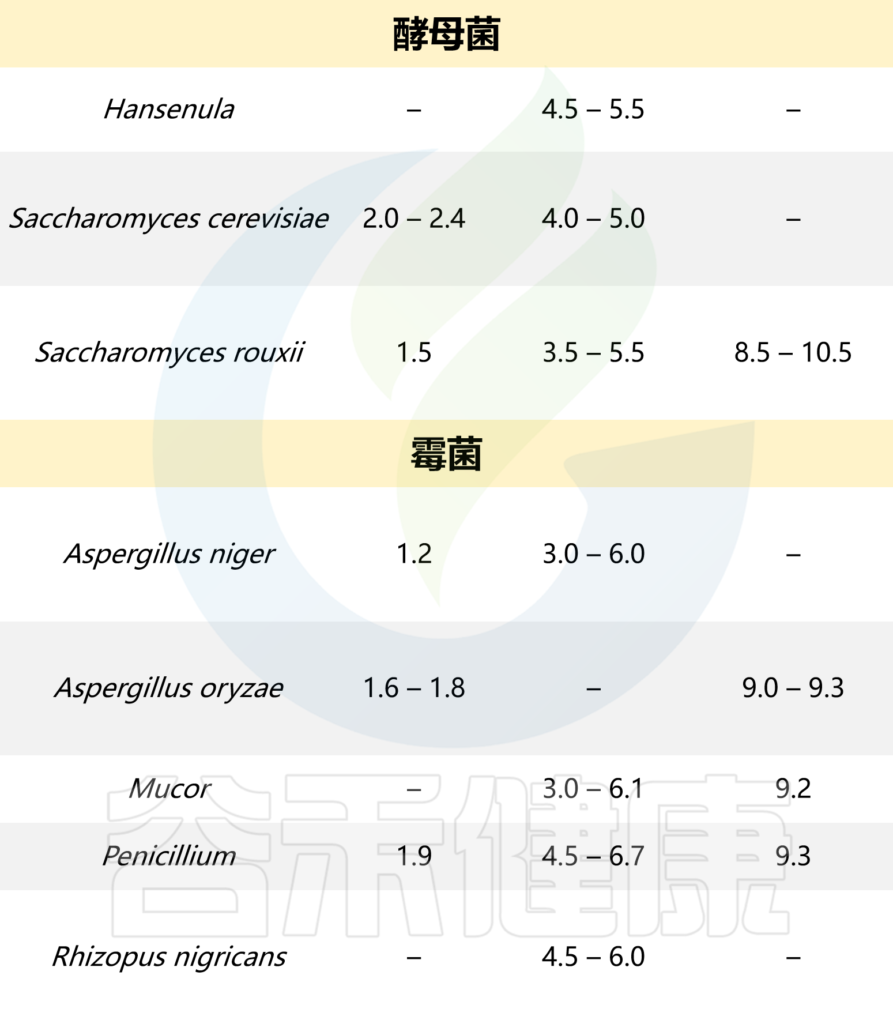
根据pH值,食物一般可分为以下几类:
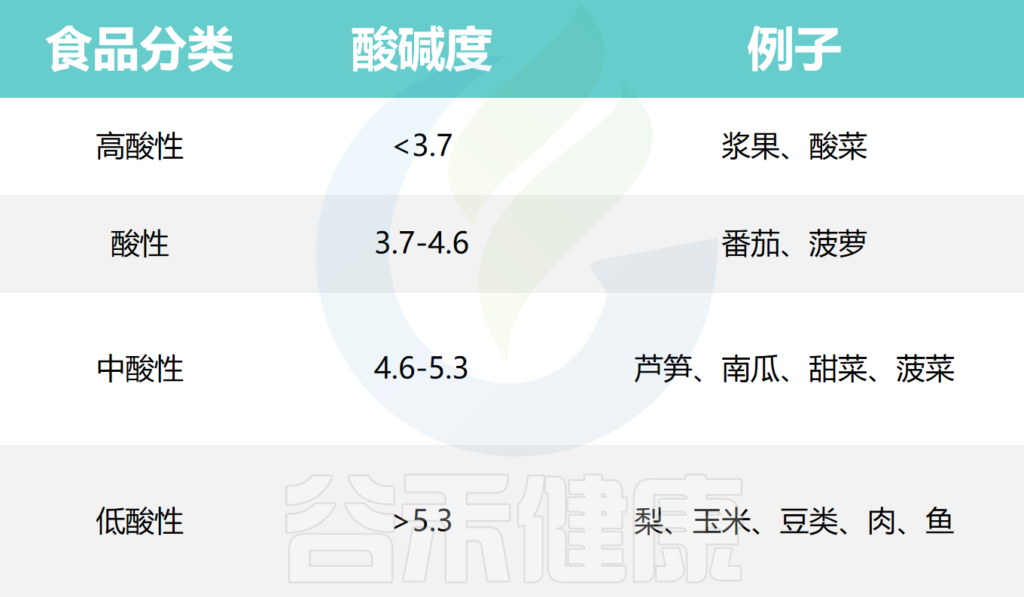
2
水分活度
水分活度(aw)是可用于生物功能的水量,可因渗透效应而减少。微生物需要可用形式的水才能在食物中生长。
食物的水分活度可以用相同温度下食物的水蒸汽压与纯水的水蒸汽压力的比值来表示,0<它的范围是<1。
与真菌相比,细菌的生长需要更高的水分活度。细菌不会在低于0.91的水平生长,霉菌可以在低至0.80的水平生长。革兰氏阴性菌比革兰氏阳性菌对低水分活度更敏感。
3
氧化还原电位
物质的氧化还原或氧化还原电位被定义为原子或分子之间电子转移的测量值。氧化还原电位通常写为Eh,并以毫伏(mV)为单位进行测量。
不同类群微生物生长所需的Eh范围如下:
需氧菌在+500至+300mV下生长最佳,如霉菌、酵母、芽孢杆菌、假单胞菌、卡他莫拉菌和微球菌;
兼性厌氧菌在+300至+100mV下生长最佳,例如乳酸菌和肠杆菌科细菌;
厌氧菌在+100至–250mV或更低的电压下生长最佳,例如梭菌属。
4
营养成分
微生物的生长和代谢功能需要蛋白质、碳水化合物、维生素、脂质、水、以及硫、磷、氮等矿物质。
人们的食物是微生物生长的最佳营养来源,但食品中常见的微生物对营养的需求差异很大,能够大量利用现有营养的微生物通常在食品中占主导地位。
首先利用简单的碳水化合物和氨基酸,然后是这些营养素的更复杂形式。革兰氏阳性菌的营养需求高于酵母菌,其次是革兰氏阴性菌,霉菌的营养需求最低。
因此许多食物中都会出现霉菌
5
抗菌成分
部分食品具有天然的抗菌成分,这些成分可以抑制微生物的生长和繁殖。因此其中一些可以用作天然的保存剂。
下面罗列了一些常见食物中的抗菌成分:


6
生物结构
有些食物具有防止微生物进入的生物结构,天然覆盖物可防止损坏并减少微生物腐败的机会。
例如水果的外壳、坚果壳、蛋壳、肉类具有筋膜和皮肤等结构,可以防止食源性病原体和腐败微生物的进入。
Part 02
外部因素
受外部条件控制的因素称为外在因素,这些因素包括温度,相对湿度等。
1
储存温度
酶促反应和微生物生长受到环境温度的影响。例如酵母菌和霉菌的生长温度范围很广,为10–35°C。
根据温度,细菌通常可分为以下几类:
–嗜冷菌可以在0-20°C的温度范围内生长,例如假单胞菌属(Pseudomonas)和肠球菌属(Enterococcus)。
–嗜温菌是可以在25°C-40°C之间生长的微生物,最适生长温度接近37°C。 这些包括沙门氏菌、葡萄球菌、梭菌、志贺氏菌。
–嗜热菌是在45°C以上高温下生长的微生物,最适生长温度在50°C-70°C之间。其中包括芽孢杆菌属、梭菌属和地热芽孢杆菌(Geobacillus)。
注:病原菌一般均为嗜温菌,最适温度为人体的体温,即37℃,故实验室一般采用37℃培养细菌。
2
相对湿度
相对湿度是大气或食品环境中的水分含量。相对湿度会影响食品的水分活度水平,从而影响微生物的生长。
低湿环境(相对湿度低于30%):低湿环境会导致细菌细胞失水,从而抑制其生长和繁殖。细菌在干燥环境中往往处于休眠状态,无法进行正常的代谢活动。因此,低湿环境对于细菌的生长是不利的。
中等湿度(相对湿度在30%至70%之间):中等湿度是细菌生长的最适宜条件之一。在适度湿润的环境中,细菌可以获得足够的水分来维持其细胞活动,并且可以更好地利用营养物质进行生长和繁殖。因此,中等湿度下的细菌生长速度较快。
储存在较高湿度环境中的干燥谷物会吸收水分并发生霉变。
3
气体浓度
气体浓度可以对微生物的生长产生影响。不同的微生物对气体浓度有不同的适应能力和偏好,因此气体浓度的变化可能会对微生物的生长速率和代谢活性产生影响。
以下是一些常见气体对微生物生长的影响:
-氧气:氧气是许多微生物生长所必需的,被称为好氧微生物。它们需要氧气进行呼吸作用,以产生能量和完成生物化学反应。然而,有些微生物是厌氧微生物,它们在缺氧或无氧条件下生长。氧气浓度过高会抑制厌氧菌的生长甚至导致其死亡。
-氮气:氮气在大气中的浓度很高,但大多数微生物无法直接利用氮气。一些微生物具有固氮能力,能够将氮气转化为可利用的氨或亚硝酸盐,从而为其他微生物提供可用的氮源。
-甲烷:甲烷是一种重要的温室气体,也是一些微生物的产物。产甲烷菌(Methanogenus)是一类厌氧微生物,它们能够利用无机或有机化合物产生甲烷。这类微生物对甲烷浓度的变化非常敏感。
Part 03
隐性因素
第三个因素被称为隐性因素。该因素包含了生物体本身的特性以及一些食品加工手段对微生物生长的影响。
•一种微生物对其他微生物可能存在抑制作用
微生物可以抑制或刺激另一种微生物的生长。一些微生物可能会产生对其他生物体具有抑制性或致命性的物质,例如抗生素、细菌素、过氧化氢和有机酸。
•食品加工
在食品加工过程中,微生物会受到各种物理或化学压力。这些加工因素包括加热、冷冻、干燥、减少气压、辐射和各种化学物质:
加热通过破坏细胞质膜、改变代谢和酶活性来帮助降低食物中的微生物水平。
冷冻通过降低pH值和增加水分活度的抑制作用来减少微生物的生长。
干燥会减少微生物的生长,因为它会导致代谢损伤,从而损害细胞的增殖。
牛奶被称为均衡食品和高营养食品,富含蛋白质、脂肪、碳水化合物、维生素、矿物质、必需氨基酸等。是许多人日常生活中常摄入的食品之一。
但牛奶的高水分活度、适中的pH值(6.4–6.6)和高营养含量,也成为许多微生物(即细菌、病毒、真菌和原生动物)的极佳生长培养基。
★ 牛奶及奶制品非常容易受微生物的影响
牛奶及其制品,如酸奶、黄油、奶油和奶酪都很容易受到微生物的影响而腐败。
生奶和巴氏奶中都含有多种微生物,它们都是冷藏保存的,但保质期有限。
在巴氏灭菌前的冷藏(奶牛场和加工厂)期间,只有耐冷菌可以在冷藏奶中生长,例如假单胞菌(Pseudomonas)、黄杆菌(Flavobacterium)、产碱杆菌属(Alcaligenes)、单核细胞增生李斯特氏菌、小肠结肠炎耶尔森氏菌、某些大肠菌群和芽孢杆菌。
其中一部分是致病菌,会引起食物中毒,使人出现呕吐、腹泻、头晕等症状,严重时甚至可导致死亡,建议大家避免直接食用生奶。
在巴氏灭菌中存活下来的是一些耐热微生物,如微球菌、一些肠球菌、链球菌、一些乳杆菌以及梭状芽胞杆菌。霉菌和酵母菌通常在巴氏灭菌过程中被消除。
在较小程度上,原生动物病原体如隐孢子虫和贾第鞭毛虫也已被发现污染牛奶。
★ 微生物引起的牛奶变化
一些微生物可能引起牛奶出现以下变化:
-出现异味
-变色
-产生气体
-脂肪分解并发生酸败
-蛋白水解
-在低酸度下凝结
谷禾在下表列出了一些微生物对应的牛奶变化:

人们可能觉得乳制品经过加工后,不太容易变质,但事实上,在常温下许多乳制品还是会被相关微生物污染并引起腐败。
乳制品的微生物量主要取决于:
•使用的奶和奶制品的类型(生奶、炼乳、奶粉、奶油、黄油等);
•用于增强其功效的产品,如明胶、水果、糖、巧克力、着色剂等;
•各类设备的卫生水平、巴氏灭菌的效率、生产和包装过程中的卫生水平。
接下来为大家简单介绍一下引起乳制品变质的相关微生物。
•奶油变质
奶油是由均匀化前沉积在牛奶顶部的乳脂层制成的。
冷却牛奶用于生产奶油,因此嗜冷菌是腐败的主要原因,包括假单胞菌属、产碱杆菌属、不动杆菌属、气单胞菌属和无色杆菌属。
在室温下,引起奶油腐败的微生物是棒状杆菌(Corynebacterium)、芽孢杆菌(Bacillus)、微球菌(Micrococcus)、乳杆菌(Lactobacillus)和葡萄球菌(Staphylococcus)。
奶油对大肠杆菌、鼠伤寒沙门氏菌和单核细胞增生李斯特氏菌等病原微生物高度敏感。

•黄油变质
黄油是通过牛奶分离和随后的奶油搅拌制成的奶制品。奶油是黄油的原材料,因此黄油中发现的微生物主要来源是奶油。
引起黄油腐败的主要微生物是霉菌,例如Thamnidium、Cladosporium和Aspergillus。
此外,引起黄油变质的病原微生物有李斯特菌、布鲁氏菌、分枝杆菌、弯曲杆菌、小肠结肠炎耶尔森氏菌、鼠伤寒沙门氏菌等。
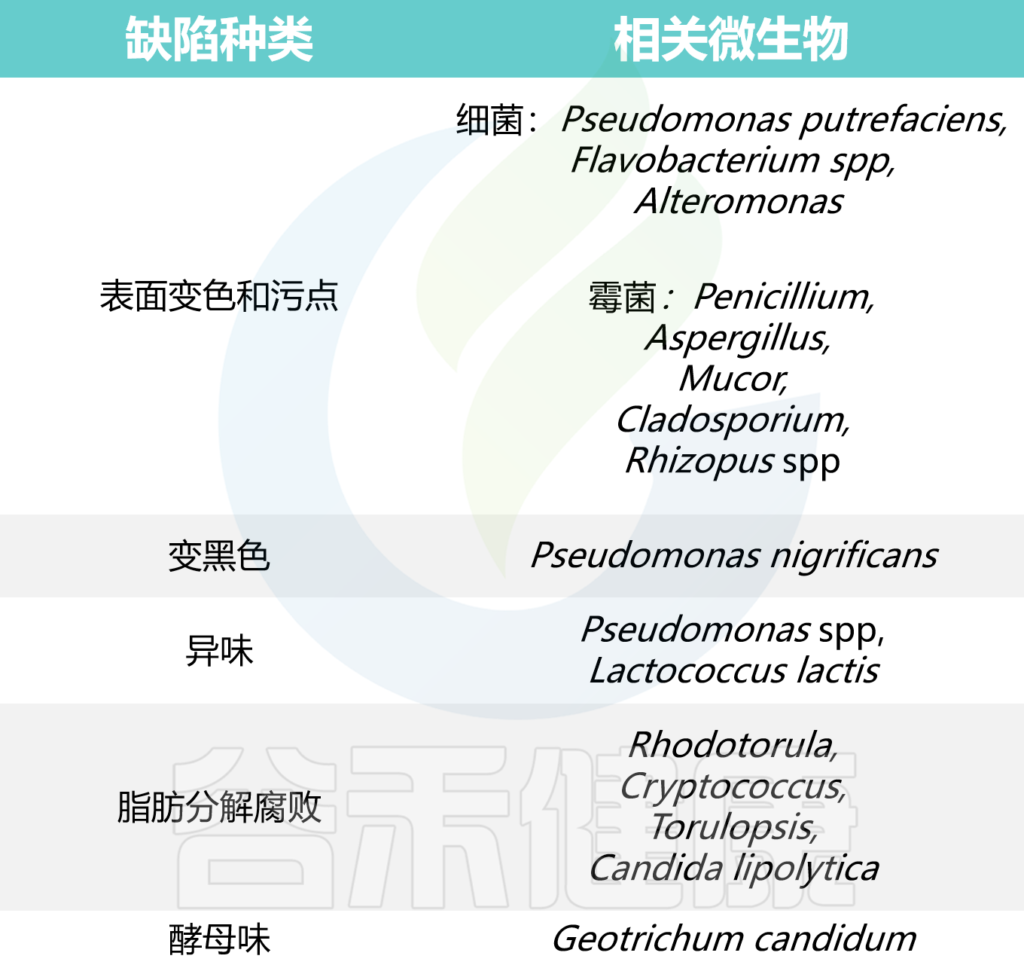
•奶酪变质
奶酪是一种发酵乳制品,是通过使用凝乳酶凝固牛奶中的酪蛋白而制成的。奶酪的成熟是各种微生物的蛋白水解和脂肪分解活性而实现的。
新鲜的软奶酪由于pH值较高、水分含量较高且盐度较低,因此很容易变质;硬质和半硬质成熟奶酪的水分含量较低,与细菌相比,更容易受到真菌的侵害。
细菌引起的奶酪变质
细菌性奶酪变质是由梭菌属(尤其是C.pasteurianum,C.butyricum,C.sporogenes和C.tyrobutyricum)、多粘芽孢杆菌(Bacillus polymyxa)、黄杆菌、假单胞菌、产碱杆菌和无色杆菌引起的。
真菌引起的奶酪变质
酵母菌也是引起奶酪腐败微生物之一,例如念珠菌属、汉斯德巴氏酵母菌、白地霉和毕赤酵母。由霉菌引起的腐败主要是青霉菌和枝孢菌。
奶酪中发现的主要致病菌是李斯特菌、沙门氏菌和大肠杆菌。

•酸奶变质
酸奶是牛奶经过巴氏杀菌后再添加有益菌(主要是嗜热链球菌和保加利亚乳杆菌)发酵后制成的。
霉菌和酵母菌是酸奶中的主要污染物
导致酸奶腐败的常见霉菌是曲霉属、青霉属、根霉属、镰刀菌属和木霉属。
导致酸奶腐败的常见酵母菌是念珠菌属、汉斯德巴氏酵母菌、克鲁维酵母菌、球拟酵母属。
霉菌和酵母使酸度下降,导致细菌蛋白水解和腐败,产生气体、异味和变色等。
据报道,酸奶中常见的食源性病原体有大肠杆菌、金黄色葡萄球菌、李斯特菌和小肠结肠炎耶尔森菌。
食物中的微生物对于食品的口感、可消化性和安全性都起着重要作用,伴随饮食摄入的微生物可以调节肠道微生物结构甚至影响人体健康。
例如新鲜水果和蔬菜中的微生物具有大量的分类学和功能多样性,可以增加人体肠道微生物的多样性,调节碳水化合物、短链脂肪酸及维生素的相关代谢。
与此同时,蔬果微生物组是机会性病原体的储存库。在免疫功能低下的个体中,机会性病原体可引起严重感染。这些感染包括肺炎、血液感染、尿路感染、手术部位感染和腹泻等。
在免疫能力强的宿主中,植物相关微生物可能成为“天然疫苗”,刺激免疫系统并增强微生物多样性以维持我们的健康。
生活中对于食品的保存也至关重要,不当的保存方法会导致有害微生物大量繁殖,影响食物的风味及安全,进而影响人体健康。
了解食品微生物的组成和功能及其相互作用对于人体微生物多样性和系统健康非常重要。微生物检测、多组学整合可以提供技术解决方案,而益生菌、益生元和合生元可以提供改善方案。
主要参考文献
Wicaksono WA, Cernava T, Wassermann B, Abdelfattah A, Soto-Giron MJ, Toledo GV, Virtanen SM, Knip M, Hyöty H, Berg G. The edible plant microbiome: evidence for the occurrence of fruit and vegetable bacteria in the human gut. Gut Microbes. 2023 Dec;15(2):2258565.
Soto-Giron MJ, Kim JN, Schott E, Tahmin C, Ishoey T, Mincer TJ, DeWalt J, Toledo G. The Edible Plant Microbiome represents a diverse genetic reservoir with functional potential in the human host. Sci Rep. 2021 Dec 15;11(1):24017.
Berg G, Erlacher A, Smalla K, Krause R. Vegetable microbiomes: is there a connection among opportunistic infections, human health and our ‘gut feeling’? Microb Biotechnol. 2014 Nov;7(6):487-95.
Abdelfattah A, Tack AJM, Lobato C, Wassermann B, Berg G. From seed to seed: the role of microbial inheritance in the assembly of the plant microbiome. Trends Microbiol. 2023 Apr;31(4):346-355.
Abdelfattah A, Freilich S, Bartuv R, Zhimo VY, Kumar A, Biasi A, Salim S, Feygenberg O, Burchard E, Dardick C, Liu J, Khan A, Ellouze W, Ali S, Spadaro D, Torres R, Teixido N, Ozkaya O, Buehlmann A, Vero S, Mondino P, Berg G, Wisniewski M, Droby S. Global analysis of the apple fruit microbiome: are all apples the same? Environ Microbiol. 2021 Oct;23(10):6038-6055.
Mendes R, Garbeva P, Raaijmakers JM. The rhizosphere microbiome: significance of plant beneficial, plant pathogenic, and human pathogenic microorganisms. FEMS Microbiol Rev. 2013 Sep;37(5):634-63.
Li J, Wang Z, Karim MR, Zhang L. Detection of human intestinal protozoan parasites in vegetables and fruits: a review. Parasit Vectors. 2020 Jul 29;13(1):380.

谷禾健康

肠道微生物除了在肿瘤发生过程有重要作用,在抗癌治疗过程中也有着不可忽视的价值。
现有的癌症疗法很多,化疗、放疗等方式虽然有效,但副作用较多;免疫疗法有其局限性,有效率低且针对癌症类型有限。研究表明,肠道微生物群的调节不仅有助于增强机体免疫力,抑制肿瘤细胞的增殖和侵袭,还可以改善治疗的耐受性和减轻不良反应。
例如,研究发现化疗中伊立替康的毒性取决于肠道微生物群的组成;
毛螺菌科、肠球菌科通过产生短链脂肪酸减轻放疗毒性;
在晚期黑色素瘤患者中,双歧杆菌科、瘤胃球菌科、毛螺菌科等关键细菌与抗PD1治疗后的良好结果有关。
因此,如何通过将肠道微生物群结合现有的癌症治疗方式,更好地促进肿瘤患者的康复和疗效,值得深入挖掘和探讨。
本文我们就来详细了解一下,微生物群与各类癌症疗法,最主要是免疫疗法及其与免疫相关的不良反应。根据患者微生物群组成训练的机器学习方法,可以准确预测患者对免疫疗法的反应能力。
粪菌移植或饮食、益生元等干预可在临床上用于提高癌症患者免疫治疗的成功率,这里讨论了基于微生物群的癌症治疗的新策略。
理解肠道微生物群与肿瘤治疗之间的相互关系,可以为创新的治疗方法提供有力的支持,并为肿瘤治疗领域带来新的突破。
化疗是指使用药物来杀死或控制癌细胞的生长。这些药物可以通过静脉注射、口服或局部应用的方式给予患者。
缺点
由于化疗中使用的药物可能对癌症没有特异性,无法区分细胞好的坏的,会影响身体的其他健康组织,引起副作用,比如脱发、口腔溃疡、恶心、精疲力竭等。
肠道菌群影响化疗药代动力学、疗效和毒性
一个代表性的例子是:伊立替康的毒性取决于肠道微生物群的组成。
注:伊立替康用于治疗结直肠癌的拓扑异构酶 I 抑制剂。
肝脏中:
葡萄糖醛酸转移酶将活性形式的伊立替康 SN-38 解毒成无活性的 SN-38-G。
肠道中:
许多表达 β-葡萄糖醛酸酶的细菌将 SN-38-G 转化回 SN-38,从而引发腹泻。
这种毒性可以通过广谱抗生素或 β-葡萄糖醛酸酶抑制剂来预防。
肠道菌群可优化肿瘤治疗、增强免疫抗癌效果
肠道微生物群可以通过提供有利于药物对癌症细胞毒性作用的肿瘤微环境,并在药物诱导的免疫原性细胞死亡后维持抗癌适应性免疫,从而调节化疗效果。
奥沙利铂、顺铂
无菌或抗生素处理的小鼠中,铂基化合物奥沙利铂和顺铂显示出降低抗肿瘤功效。这些药物仍然可以在微生物群耗尽的小鼠的肿瘤中形成铂-DNA加合物,但没有观察到DNA损伤。肠道微生物群通过NOX2(NADPH氧化酶2)启动肿瘤中的髓细胞产生活性氧(ROS),这是铂治疗诱导的DNA损伤所需的。
肠道微生物发酵的膳食纤维产物——丁酸盐,可以通过 IL-12 信号传导调节 TME 中 CD8+ T 细胞的功能,从而增强奥沙利铂的抗癌作用。
烷化剂环磷酰胺(CTX)
同样,烷化剂环磷酰胺疗效也取决于肠道菌群。
注:烷化剂环磷酰胺既是一种化疗剂,也是一种免疫抑制剂。
CTX减少了小肠中厚壁菌门和螺旋体门,同时增加了其他细菌类群的丰度,其中一些细菌转移到肠系膜淋巴结。CTX诱导免疫原性肿瘤细胞死亡,这依赖于微生物群调节的致病性辅助T细胞17(TH17)和记忆性TH1细胞。
CTX治疗后, Enterococcus hirae移位至淋巴结和Barnesiella intestinihominis在结肠中的积聚促进了癌症免疫。
此外,接受化疗免疫治疗的癌症或卵巢癌患者的存活率与E. hirae和B. intestinihominis特异性TH1反应相关。
吉西他滨
吉西他滨是胰腺导管腺癌常用的化疗药物。肠道微生物参与化疗药物的药代动力学,吉西他滨治疗胰腺导管腺癌的疗效可能受到肠道微生物的影响。
γ-变形菌能够代谢吉西他滨并将其转化为无活性的2′,2′-二氟脱氧尿嘧啶。因此,未来有可能通过将抗γ-变形菌的抗生素与化疗相结合来提高吉西他滨的抗癌效果。
除了负面影响外,肠道微生物代谢产物丁酸盐,还可以通过诱导细胞凋亡来增强吉西他滨对抗癌症细胞的功效。
除了肠道微生物群,肿瘤内细菌促进肿瘤生长并干扰化疗效果,这表明:
肿瘤内微生物群可能是癌症治疗的靶向菌
肿瘤内微生物群已显示在人类乳腺癌、骨癌、胰腺癌、卵巢癌、肺癌、黑色素瘤、胶质母细胞瘤以及原发性和转移性结直肠癌中。肿瘤微生物群可能在肿瘤发生、肿瘤进展和治疗反应中发挥着重要作用。
肿瘤相关γ-变形菌表达细菌胞苷脱氨酶,该脱氨酶使细胞毒性药物吉西他滨失活;使用抗生素环丙沙星可以清除细菌,恢复对吉西他滨的敏感性。然而,吉西他滨治疗也通过增加变形杆菌的丰度来改变肠道微生物群。
↓↓↓
因此,抗生素治疗是否通过对肿瘤相关的γ-变形菌或其他与肠道或肿瘤相关的微生物成分的特异性影响来影响肿瘤生长,目前没有确切的证据。
*************************************************************************
小鼠乳腺癌模型:
通过循环肿瘤细胞携带的肿瘤内细菌,重组了细胞骨架,促进了宿主细胞的存活。通过肿瘤微生物群落中分离的菌株直接注入肿瘤,增强了转移形成。
在原发性人类结肠癌和远处转移中检测到:
——梭杆菌门(Fusobacteria)
使用甲硝唑抗生素治疗可以消除梭杆菌,并减小肿瘤生长速度。
肝癌和肝硬化患者:
肝脏中Stenotrophomonas maltophilia丰度的增加诱导了肝星状细胞的细胞衰老相关的分泌表型(SASP),从而促进了肝癌发生。
↓↓↓
这些数据表明,抗生素有可能靶向肿瘤微生物群,但抗生素治疗的全身效应与肿瘤局部效应可能是拮抗的,特别是考虑到抗生素对免疫检查点阻断的有害影响。
*************************************************************************
细胞内细菌可能逃避RAB11介导的吞噬作用,并寄居于稳定的含有细菌的液泡中,使其对抗生素无效。
↓↓↓
因此,使用细胞穿透肽和核酸可能会最大限度地增强抗生素对肿瘤相关细菌的效力。
肠道微生物群调节癌症治疗,可以有针对性地提高治疗效果并预防不良反应
doi: 10.1038/s41568-022-00513-x
放射治疗在于缩小或破坏肿瘤,但过程不同。
辐射是一种高能不可见光波,可以针对癌细胞破坏其遗传物质,最终杀死它们。辐射波会损害癌细胞,癌细胞会随着时间的推移而死亡并被身体清除,从而导致肿瘤缩小。
与化疗不同,放疗通常是一种局部治疗,也就是说一般不会传播到全身。
缺点
如果附近的健康组织在治疗过程中受损,局部放射可能会产生副作用,比如恶心、口腔溃疡、喉咙问题导致进食困难、皮肤干燥、精疲力竭等。
不同癌症类型在毒性和敏感性方面存在差异,这是影响电离放射治疗安全性和有效性的主要障碍。
肠道微生物群的细菌和真菌成分都可能导致患者间的异质性
在实验动物中,对革兰氏阳性细菌有选择性的抗生素万古霉素通过消耗产短链脂肪酸的肠道细菌,提高RTX的有效性,并增强树突状细胞抗原呈递和癌症免疫。
向万古霉素处理的小鼠施用丁酸盐,部分通过抑制树突状细胞功能,包括它们产生IL-12的能力,消除了这种作用。
使用广谱抗生素治疗肠道微生物群会导致酵母菌类真菌肠道扩张,通过β-葡聚糖受体Dectin 1的信号传导抑制肿瘤免疫,从而降低RTX有效性。使用抗真菌药物治疗可提高未经治疗小鼠的RTX有效性,尤其在抗生素治疗的对RTX反应较差的小鼠中。
在乳腺癌患者中,肿瘤内髓细胞中Dectin1的表达与生存率呈负相关,这一观察结果表明真菌免疫抑制作用可能与临床相关。
短链脂肪酸在癌症治疗中的复杂功能:对抗毒性 与 免疫调节
传统饲养的小鼠比无菌小鼠更容易受到全身照射(TBI)毒性的影响,因为微生物群抑制ANGPTL4的表达。
注:ANGPTL4,血管生成素样4,也称为FIAF,是一种支持组织修复的脂蛋白脂肪酶抑制剂。
然而,产短链脂肪酸菌通过诱导ANGPTL4,来保护接受RTX治疗的患者免受结肠炎和粘膜炎的侵袭。
毛螺菌科、肠球菌科→产丙酸→减轻毒性
在全身照射存活的小鼠中,产生色氨酸代谢产物和短链脂肪酸(特别是丙酸盐)的细菌,毛螺菌科(Lachnospiraceae)和肠球菌科(Enterococcaceae)大量存在,并且可以将对TBI毒性的耐药性转移到其他小鼠。
在进行异基因造血干细胞移植(allo-HSCT)预处理过程中,观察到患有白血病的患者的粪便样本中存在着毛螺菌科(Lachnospiraceae)和肠球菌科(Enterococcaceae)。这些患者在接受全身放疗治疗(TBI)时出现的肠道毒性较轻。
这些发现可以解释为什么产生短链脂肪酸的益生菌,如乳酸杆菌和双歧杆菌,可以预防TBI毒性。
总体而言,几项研究表明,不同的短链脂肪酸可能对癌症免疫和治疗毒性产生复杂影响,包括粘膜保护作用,部分由ANGPTL4、IL-18和IL-22的诱导介导,以及通过Treg细胞诱导和抑制树突状细胞功能介导的对立的免疫调节效应。
因此,短链脂肪酸在放疗和其他癌症治疗中的功能似乎很复杂,需要进一步研究。
最新的癌症疗法利用宿主免疫系统来对抗癌症。免疫细胞通过识别和消灭癌细胞来抑制肿瘤的发生。
CTLA-4充当淋巴结中 T 细胞激活的“关闭”开关,而 PD-L1/PD-1降低肿瘤部位的晚期免疫反应。
免疫检查点抑制剂(ICI) 是一种单克隆阻断抗体,可以释放免疫系统的“刹车”,使免疫细胞能够更有效地识别和攻击癌细胞。
这种方法给一些难治癌症患者带来了显著的持久缓解,如晚期和转移性黑色素瘤、肾细胞癌、非小细胞肺癌等。目前用于超过25种不同的肿瘤类型。
缺点
免疫治疗(ICI)每年每个患者的费用超过10万元,成功率仅为20%-40%,同时许多患者会出现与免疫相关的不良事件。
因此,迅速发展的需求突显了将免疫疗法的有效性扩展到所有癌症患者的必要性。
微生物群维持对病原体的抵抗力和疾病耐受性,防止对无害抗原的过度炎症反应。
饮食、生活方式、抗生素和其他药物使用的变化可能会改变这种健康保护生态平衡。与对急性感染的抗原特异性耐药性不同,肿瘤通过劫持疾病耐受机制抑制癌症免疫。因此,肠道微生物群的改变,可能会影响患者对免疫疗法的反应和免疫相关不良事件(irAE)的程度。
过继性T细胞疗法(ACT):万古霉素增强ACT抗肿瘤,其他抗生素降低抗肿瘤
万古霉素的治疗增加了肠道中变形杆菌门的丰度,但耗尽了厚壁菌门和拟杆菌门的大多数物种,增强了ACT在小鼠中的抗肿瘤作用。
而其他抗生素,特别是新霉素和甲硝唑,分别消耗革兰氏阴性需氧菌和厌氧菌,降低了ACT的抗肿瘤作用。
万古霉素修饰的微生物群诱导产生刺激T细胞的IL-12,维持过继转移的细胞毒性T细胞。
Toll样受体激动剂:CpG-ODN、ICB疗法
革兰氏阴性菌与诱导坏死的CpG-ODN的有利先天反应,以及维持适应性CD8+T细胞介导的抗癌免疫的肿瘤微环境的重定向有关。
ICB 疗法增强的适应性免疫(如后面所讨论的)与几种革兰氏阳性细菌的存在相关,包括:
在这种情况下,革兰氏阴性菌与免疫抑制性局部和全身炎症状态有关。
在一项临床试验(NCT03618641)中,证明了 CpG-ODN和ICB组合的功效,抗PD1治疗下,初始CpG-ODN诱导的坏死和维持无复发生存,与革兰氏阴性细菌(变形菌门、拟杆菌门和革兰氏阴性Oscillospiraceae)的粪便丰度相关。
免疫检查点阻断
一般来说,只有20-40%的患者对ICB有反应,因此需要确定响应标志物并开发克服耐药性的治疗方法。
而肠道微生物群已成为预测ICB响应的肿瘤外部生物标志物。
CTLA4
➦ 无菌小鼠对抗CTLA4治疗反应不佳。
➥ 向微生物群耗尽的小鼠注射多形拟杆菌(Bacteroides thetaiotaomicron)或脆弱拟杆菌(Bacteroides fragilis),通过诱导肿瘤中的DC成熟和引流淋巴结中的TH1反应,恢复抗CTLA4反应。
PDL1
相反,小鼠对肿瘤生长的抵抗力和对抗PDL1的反应性与几种双歧杆菌的粪便丰度有关。
在晚期黑色素瘤患者中,放线菌门(双歧杆菌科和Coriobacteriaceae)和厚壁菌门(瘤胃球菌科和毛螺菌科)的关键细菌种类的粪便丰度与抗PD1治疗后的良好结果有关。
在肺癌、肾细胞癌或肝细胞癌患者中,粘蛋白降解的Akkermansia muciniphila在抗PD1治疗中发挥抗肿瘤作用。然而,在一些接受抗生素治疗的患者中,粪便中A. muciniphila的高丰度与抗PD1治疗的耐药性有关,这可能表明AKK菌在抗PD1疗法反应中具有双峰效应。
在抗PD1治疗无反应的患者粪便中,溶血性葡萄球菌和Corynebacterium aurimucosum的更高,在有反应的肾癌和肺癌患者中,E. hirae菌的粪便频率更高。
研究中发现的细菌种类的一致性有限,可能是由于ICB介导的免疫机制的变化。
TIM3
抗生素治疗对抗TIM3癌症治疗的损害,也表明了肠道微生物群在维持这种类型的ICB的疗效中的作用。
肠道菌群、血液相关菌群和肿瘤相关菌群的组成不同,对不同类型的癌症具有特异性,导致不同的细菌种类对免疫治疗的反应产生影响。
对相同类型肿瘤和相同ICB治疗的患者队列的研究,即使仍然受到队列内微生物群异质性的影响,也报告了更一致的结果。
事实上,复杂微生物群落中的未知变异阻碍了稳健的特征识别。未来的研究依赖于细菌亚种和菌株的新特征,并分析单个细菌基因或途径的关联,将更好地识别特定细菌与治疗反应的关联及其作用机制。
肠道菌群对抗PD1免疫检查点阻断反应的调节
doi: 10.1038/s41568-022-00513-x
在大多数接受抗PD1治疗的癌症患者的研究和荟萃分析中,与有利或不利治疗反应普遍相关的细菌已得到一致定义。
在对抗PD1治疗有反应的患者中观察到一种健康、无炎症的肠粘膜,其特征是编码抗炎载脂蛋白和跨膜粘蛋白的转录物。在这些患者的血液中,参与T细胞和B细胞募集的细胞因子和趋化因子升高,这对抗肿瘤免疫很重要。左上角列出了与抗PD1治疗的有利反应相关的确定细菌种类及其在调节抗肿瘤免疫中的作用机制。
在对抗PD1治疗没有反应的患者中,观察到肠粘膜发炎和炎症细胞脱落,而在他们的血液中,通常存在全身炎症的生物标志物。所列的肠道革兰氏阴性菌群与抗PD1治疗的不良反应以及局部和全身炎症的生物标志物有关,可能反映了免疫抑制肿瘤微环境。
早期临床反应取决于肿瘤内在因素或宿主因素;而肠道菌群的调节作用在治疗开始约1年后更具影响力
一项针对黑色素瘤患者的抗PD1治疗研究报告称,较高的肠道微生物群α多样性与良好反应之间存在关联。但没有更多研究证实,α多样性用于区分健康个体和癌症患者,它不能预测对免疫疗法的反应性。
对已发表的接受抗PD1治疗的黑色素瘤患者队列的数据进行的荟萃分析显示,不仅在单个物种水平上,而且在更大的分类分支中,识别出的细菌之间存在共性。
大多数研究认为有利的微生物群特征,包括放线菌门的多个成员,以及在厚壁菌门中,瘤胃球菌科和Lachnospiraceae科。
而一个不利的特征包括拟杆菌门和变形菌门。
对黑色素瘤患者的免疫治疗反应进行的两项荟萃分析使用了大队列,研究发现,肠道微生物群的基线组成在3个月时进行放射学评估时,区分有反应的患者和没有反应的患者的能力有限,但它可以更好地区分在治疗开始后约1年有进展或没有进展的患者。此外,长期无进展生存期患者在开始抗PD1治疗后数年保持良好的微生物群。
为什么没有在队列中一致地识别出某些菌作为生物标志物?
一项研究的样本来自三个欧洲国家和一些公开的数据集,并包括用抗CTLA4、抗PD1或两者联合治疗的黑色素瘤患者。这里涉及到,地理和治疗类型的异质性。
即使同卵双胞胎,每个个体的肠道微生物组都是独特的,并且这种独特性的很大一部分是在单个菌株水平上编码的。需要分析方法更深入探索这种个体特异性的微生物多样性。
不同地理区域的肠道微生物类型不同,因为人类肠道微生物组受到种族和地理起源的影响。利用美国肠道项目的7000多个样本,对微生物类型进行了地理测绘,揭示了美国各地理区域的分布不均。
接受抗PD1治疗的黑色素瘤患者队列中的微生物类型代表性也不一样,并反映了他们的地理环境。此外,对抗PD1治疗有反应的概率与肠道微生物类型相关。
因此,通过微生物类型视角分析肠道微生物群与免疫疗法反应之间的关系,为先前研究的不一致性提供了可能的解释,并可作为纠正地理和临床中心特异性偏见的工具。
肠道菌群中的肽聚糖酶介导的抗癌
一些肠球菌在小鼠中维持ICB作用的能力是由一簇肽聚糖水解酶介导的,包括分泌抗原a(SagA),它产生NOD2激活的胞壁肽(muropeptides),增强抗PDL1诱导的肿瘤免疫。
当给予小鼠时,SagA转染的乳酸乳球菌抑制肿瘤生长并提高抗PD1反应性。某些与小鼠抗PD1和奥沙利铂癌症治疗协同作用的双歧双歧杆菌菌株富集了肽聚糖合成基因,通过TLR2刺激癌症免疫。
肠道菌群调控干扰素
肠道菌群维持I型干扰素表达,增强肿瘤免疫
在微生物群耗尽的小鼠中,肿瘤内先天免疫细胞中的干扰素信号减弱,改变巨噬细胞极化、树突状细胞分化和DC-自然杀伤(NK)细胞串扰,并使肿瘤微环境从抗肿瘤变为促肿瘤。
肠道微生物通过诱导免疫细胞产生干扰素,通过一系列的受体和信号通路来增强免疫应答。
注:一些列受体如TLR3、TLR4、TLR7、TLR9、Dectin 1、干扰素基因刺激因子(STING)、DDX41、RIG-I等。
微生物群诱导的细胞和基因表达特征激活了小鼠的STING-干扰素途径,并与黑色素瘤患者的良好ICB反应有关。
某些共生菌如AKK菌、双歧杆菌、鼠李糖乳杆菌,通过激活干扰素途径来抑制肿瘤进展,并增强免疫治疗的效果。
干扰素的作用也与肿瘤类型和治疗阶段有关
I型干扰素信号传导并不总是与抑制肿瘤生长有关。肝脏中持续的I型干扰素信号传导,分别通过诱导一氧化氮或改变尿素循环,诱导对抗PD1治疗的耐药性或抑制抗病毒T细胞反应。
不同刺激产生的干扰素还会对肿瘤生长和免疫反应产生不同的影响。在肿瘤治疗中,详细了解干扰素在不同时间点对不同细胞的作用,以及如何影响肿瘤环境和免疫治疗效果,还需深入研究。
肠道促炎:预测ICB疗效不佳
系统性炎症的许多外周血生物标志物,如高中性粒细胞与淋巴细胞比率(NLR)和C反应蛋白(CRP)、IL-8和血清淀粉样蛋白a(SAA)水平升高,是对ICB反应不佳的预测因素。
黑色素瘤患者粪便微生物群中,高NLR与革兰氏阴性拟杆菌门的丰度增加有关。人类粪便转录组分析显示,对抗PD1治疗没有反应的患者肠道中存在促炎特征,主要由脱落的中性粒细胞和其他髓细胞引起,这与LPS和NF-κB信号传导有关,导致产生促炎细胞因子,如TNF、IL-1和IL-8。
革兰氏阴性菌:阻碍ICB反应
总体而言,这些数据表明,肠道微生物群中的革兰氏阴性菌可能通过LPS产生和TLR4信号传导,诱导免疫抑制性局部肠道和全身炎症,从而阻碍ICB反应。
实验诱导的小鼠胆汁淤积诱导革兰氏阴性菌从肠道转移到肝脏,导致TLR4依赖性炎症反应,产生CXCL1,募集免疫抑制性中性粒细胞,抑制抗肿瘤免疫,导致胆管癌生长增强。此外,革兰氏阴性菌Fusobacterium nucleanum与原发性和转移性结直肠癌癌症的关联,通过吸引髓细胞而具有免疫抑制性。
自身抗原和微生物异种抗原之间交叉反应
自身抗原和微生物异种抗原之间的交叉反应在自身免疫性疾病中很常见,可能与癌症免疫有关。身体不仅对病原体产生免疫反应,而且对共生微生物产生免疫反应。尽管这种反应得到了很好的控制,但失调可能会引发免疫病理,并可能在接受ICB治疗的患者中被重新激活,导致免疫相关不良反应,并可能与肿瘤新抗原发生交叉反应。
ICB治疗的患者中鉴定的一些肿瘤新抗原,可能与微生物抗原具有交叉反应
在抗CTLA4处理的小鼠中,通过过继转移B.thetaiotaomin特异性或B.fragilis特异性T细胞导致其活化,进而抑制MCA-205肉瘤肿瘤生长,支持肿瘤和微生物抗原之间分子模拟的观点。
小鼠细菌共生体E.hirae与对环磷酰胺和ICB的有利反应相关的,E.hirae携带表达肽的原噬菌体,针对该肽引发主要组织相容性复合物(MHC)I类反应,并与癌症细胞中过表达的非突变蛋白酶体组分中的表位交叉反应。
在人类中,相同的原噬菌体在肠球菌属中表达。除毛滴虫外,其MHC限制性表位与甘油-3-磷酸脱氢酶1-样蛋白(GPD1L)中的表位发生交叉反应,后者也在肿瘤中过表达。
在人类黑色素瘤转移中,表达人类白细胞抗原(HLA)I类和II类限制性肽的细菌物种存在于造血细胞和肿瘤细胞中。当对表达肿瘤匹配HLA等位基因的EB病毒转化的B细胞进行脉冲时,其中一些肽能够特异性激活肿瘤浸润淋巴细胞。
因此可以推测,在患者中,这些肽通过传统抗原呈递细胞或黑色素瘤细胞的呈递,引发了可能影响抗癌免疫的T细胞免疫反应。
有望成为预测免疫疗法反应的生物标志物
前面第二章节有提到短链脂肪酸与放疗,这里我们主要看短链脂肪酸对接受 ICI 的癌症患者的预测作用。
在日本进行的一项研究中,52名接受抗PD-1抗体治疗的实体瘤患者的粪便短链脂肪酸与良好的临床结果相关。高浓度的粪便乙酸盐、丙酸盐、丁酸盐和戊酸盐以及血清异戊酸盐与PFS的延长有关。
相比之下,另有研究发现,高血清丁酸盐和丙酸盐水平与黑色素瘤患者对抗CTLA4抗体的耐药性和Treg细胞数量的增加有关。
鉴于临床前肿瘤模型也揭示了短链脂肪酸对抗CTLA4抗体或放射治疗的疗效的负面影响,在利用血液或粪便中的任何短链脂肪酸作为ICI疗效的生物标志物之前,需要进一步的研究来验证不同地理位置的大型队列中短链脂肪酸的预测价值。
不同的细菌种类,包括假长双歧杆菌、约氏乳杆菌和粘球菌,产生肌苷及其代谢产物次黄嘌呤。这些分子结合腺苷受体A2a(A2aR),激活抗肿瘤T细胞并提高小鼠的ICB效率,特别是抗CTLA4疗法。
肌苷增强抗PD1治疗效果
除了A2aR介导的T细胞活化外,肌苷是葡萄糖限制下CD8+T细胞的替代碳源,并增强了对不能利用肌苷作为能量来源的肿瘤的抗PD1治疗功效。表明肌苷活性增强了ICB疗效,并且像腺苷一样激活了A2aR,在临床癌症治疗的试验中,A2aR是一个免疫抑制的检查点,增强ICB效果。
肌苷也可能抑制自身免疫
罗伊氏乳杆菌(Lactobacillus reuteri)可以预防ICB诱导的结肠炎,但不会影响ICB在小鼠中的抗肿瘤功效,它通过增强作用于A2aR110的肌苷的产生,来抑制Treg细胞缺陷的Scurfy小鼠的自身免疫。
这些高度矛盾的结果可能可以通过肌苷对T细胞的直接刺激效应与上下文相关的事实来加以解释;在无菌动物中或在没有共生细菌提供的促炎启动的体外,肌苷需要在这些实验条件下分别由CpG-ODN或IFNγ提供的炎症刺激。由于缺乏这种炎症刺激,肌苷确实会抑制T细胞。
因此,在癌症免疫疗法中靶向肌苷依赖性途径需要更好地理解肌苷的这些对比效应,同时考虑到腺苷和肌苷通过A2aR的信号可能不相同,并且肌苷通过A2aR或A3R影响不同的全身炎症模型。
两项研究调查了接受ICIs的晚期癌症患者的犬尿氨酸与色氨酸(Kyn与Trp)比率的临床意义。
Kyn/Trp比率高,与总生存期缩短有关
第一项研究中,早期疾病进展患者(3个月内)的Kyn/Trp比率显著高于有反应者(P = 0.017)。
第二项研究中,在接受nivolumab治疗的黑色素瘤和肾细胞癌患者中,开始治疗4-6周后Kyn与Trp比率的增加(>50%)与中位总生存期的缩短密切相关(P ≤ 0.026)。
有争议的发现
鉴于代谢适应在癌症免疫疗法中的重要性,以及在黑素瘤患者中选择性IDO1抑制剂与ICI联合治疗的疗效不佳(在ECHO-301/KEYNOTE-252第三期试验中),这些发现不仅对未来试验中基于血清肾上腺素/色氨酸比率监测而进行患者分层的必要性提出了质疑,还对ICI治疗期间肠道菌群动态调节的分析提出了质疑。
事实上,色氨酸不仅由肿瘤和髓系细胞代谢,而且由肠道菌群中的不同种类代谢成吲哚和吲哚衍生物,包括吲哚乙酸、吲哚-3-醛(I3A)和吲哚丙酸等,这些物质能够与芳香烃受体结合。
可能支持富含色氨酸的饮食,或基于I3A或3-IAA 的益生元与ICI的组合
当罗伊氏乳杆菌与ICI联合给小鼠口服时,它可以从回肠转位到黑素瘤部位,释放I3A,激活CD8阳性T细胞的TCR信号通路,促进IFNγ的释放和抗肿瘤效应。
这些实验发现的临床意义已在一项涉及接受ICI治疗的黑素瘤患者的研究中得到证实,为基于色氨酸的饮食干预在癌症患者中的应用开辟了道路。
细胞内L-精氨酸浓度也直接影响T细胞的代谢适应度和存活率,从而影响它们在小鼠模型中介导有效抗肿瘤免疫反应的能力。
L-精氨酸水平升高诱导了整体代谢变化,包括活化T细胞从糖酵解向氧化磷酸化的转变,并促进了中枢记忆样T细胞的产生。
在发现组和验证组中,低血清L-精氨酸水平(<42 µM)与减少的临床获益率、无进展生存期和总生存期显著独立相关(P = 0.004)。此外,低血清L-精氨酸水平与髓系细胞中PD-L1的表达增加相关。因此,血浆L-精氨酸监测可能成为ICI疗效的适宜预测生物标志物。

doi: 10.1038/s41571-023-00785-8.
尽管广谱抗生素可能会导致真菌过度生长,从而降低放疗效率
万古霉素消耗产短链脂肪酸菌,提高放疗效果
一项正在进行的临床试验(NCT03546829),测试在接受立体定向身体放射治疗的非小细胞癌症(NSCLC)患者中,通过IFNγ的产生评估,万古霉素是否增加抗肿瘤免疫力。
万古霉素还通过增强自然杀伤T细胞(NKT)在肝脏中的迁移和IFNγ的产生,削弱小鼠原发性和转移性癌症的生长。
万古霉素耗尽革兰氏阳性菌,调控胆汁酸
万古霉素耗尽革兰氏阳性菌,特别是Clostridium scindens,它将初级胆汁酸转化为次级胆汁酸。微生物群衍生的胆汁酸影响炎症、免疫和致癌物的许多方面。初级胆汁酸,如鹅去氧胆酸,通过肝窦内皮细胞诱导趋化因子CXCL16的产生,该细胞通过CXCR6吸引NKT细胞,而次级胆汁酸,特别是ω-鼠胆酸,抑制CXCL16产生。
还计划进行临床试验(NCT03785210),测试万古霉素是否改善原发性肝癌或转移患者对抗PD1治疗的反应。然而,即使是特定的抗生素也会引起肠道微生物群组成的广泛变化,这可能会对癌症治疗产生相反的影响。
胆汁酸对免疫反应的调节也是复杂的
黑色素瘤患者FMT后,次级胆汁酸水平与抗PD1治疗的良好临床反应有关。
然而在小鼠中,拟杆菌属部分地将抑制TH17细胞的次级胆汁酸3-oxoLCA,转化为激活Treg细胞的isoalloLCA,从而限制自身免疫和癌症免疫。
万古霉素提高ADT疗效
去势抵抗性前列腺癌与促癌的肠道菌群变化有关,使用含有万古霉素的抗生素混合物来消耗小鼠体内产生雄激素的细菌,这种抗生素可以专门减少厚壁菌门的细菌,包括产生雄激素的梭菌属,从而提高ADT(雄激素剥夺疗法)的效果。因此,如果抗生素与ADT一起使用,它们的性质应该是选择性地消耗产生雄激素的细菌,而不是免疫刺激物种。
抗生素治疗仍有挑战,更特异性的方法有待探索
一般来说,在ICB期间或之前使用抗生素对临床反应产生不利影响,很可能是因为它们改变了肠道生态以及有利和不利细菌之间的平衡。尽管通过抗生素来靶向肠道菌群可能具有益处(如上面例子所述),但总体而言,这面临着大部分抗生素的广泛反应性以及可能诱导抗生素耐药性的挑战。
除了抗生素,其他更具特异性的方法,如噬菌体治疗以及更有效、更具特异性的噬菌体介导的CRISPR-Cas3抗微生物药物,可以在我们对直接影响抗肿瘤反应的细菌种类以及由其消除引起的生态变化的认识更加精确之后使用。
FMT可解决80-90%的抗生素耐药性艰难梭菌感染,其他包括各种机会性感染、炎症性肠病等也在研究中。
对免疫疗法后的结肠炎,FMT效果好
抗CTLA4治疗免疫相关不良反应中常见的有结肠炎,这类结肠炎可能比较严重,皮质类固醇或TNF拮抗剂的治疗难以治愈。
两名癌症患者在接受ICB治疗后出现结肠炎,经健康捐赠者FMT治疗后,病情迅速恢复。供体菌群确实发生了定植,厚壁菌门和变形菌门的丰度降低,拟杆菌门和Verrumicrobiae的丰度增加。随后的一份初步报告显示,在FMT治疗的15名癌症患者中,有11人从ICB诱导的结肠炎中恢复。
FMT:提高黑色素瘤患者的抗PD1治疗效果
两项临床试验证明,FMT可以靶向微生物群,以提高黑色素瘤患者的抗PD1治疗效果。由于预测微生物群组成尚不可行,这可能支持抗PD1治疗反应,以选择健康的粪便微生物群供体,两项试验都使用了黑色素瘤患者和对抗PD1疗法有持久反应的患者作为供体。
*****************************************************************************
第一项试验
10名进展中的黑色素瘤患者接受了抗生素治疗(其中6人之前对ICB有阳性反应),并通过结肠镜检查。这10个人做了FMT,供体是两名对抗PD1治疗有反应的捐赠者中的其中一人,随后重复胶囊形式的FMT和抗PD1疗法。
● 在从供体1接受移植的5名患者中,一个完全反应和两个部分反应;
● 在从供体2接受移植的五名患者没有反应。
两个供体的微生物群都包含有利于抗PD1治疗反应的菌群,供体1在梭菌属和放线菌属中更富集。FMT后,供体1受体的微生物组成变化比供体2受体更一致,人类粪便转录组中炎症和抗原呈递特征的表达增加。治疗后,三名有反应的患者表现出更显著的肿瘤排斥反应,其特征是I型干扰素反应和单核细胞、DC、NK细胞和T细胞浸润。
*****************************************
第二项试验
15名对抗PD1治疗原发性无反应的黑色素瘤患者在结肠清洗后(没有抗生素治疗),接受了来自6名抗PD1疗法有反应的供体中的1名,随后接受了持续的抗PD1治疗;1名患者完全缓解,2名患者部分缓解,3名患者病情稳定超过18个月。
这些反应良好的患者的菌群怎么样了?
在反应良好的患者中,FMT后的粪便微生物群变得更像供体,并且针对供体菌群的IgG抗体更显著诱导。有益菌的丰度增加,如毛螺菌科、瘤胃球菌科和双歧杆菌科,有害菌如拟杆菌属减少。
其他指标有什么变化?
在这些有反应的患者的血液中,IL-8水平下降,而CXCR13和IL-21水平上升,表明T卵泡辅助细胞(TFH)有反应。
初级和次级胆汁酸的水平以及苯甲酸盐降解的产物都增加了,苯甲酸盐是微生物群多样性,与抗PD1治疗反应相关的某些菌群的存在的标志。
******************************************************************************
尽管规模小且单臂试验,但这两项初步研究中的整体临床反应率为36%,高于其他联合治疗方案在难治性抗PD-1治疗患者中的反应率,且没有额外严重毒副作用。
FMT后菌群有效定植,干扰时长超1年
总的来说,即使没有抗生素调理,单次结肠镜进行FMT,也会干扰微生物群组成超过1年。宏基因组分析表明,大多数存在于供体而不在受体患者身上的菌属(和微生物基因),可以有效且持久地定植,除非受体接受了抗生素治疗。
供体菌株定植与治疗效果之间可能存在不一致?
事实上,FMT后的微生物群组成不仅反映了供体特异性菌群的定植情况,还反映了FMT引起的肠道生态变化,改变了来自供体或接受者的不同菌群的丰度。
对抗PD1治疗无效的黑色素瘤患者来说,FMT可能只有当患者存在针对肿瘤的免疫反应,但受到免疫抑制或微生物组成不利的影响,导致缺乏免疫促进的微环境时,才会产生对继续抗PD1治疗的反应。FMT可以纠正这种不利的微生物组成。
自体FMT,重建肠道微生物群
供体可以提供更健康、更多样的微生物群,能够重建受体微生物群的多样性。然而,将病原体或抗生素耐药性病原体转移到免疫抑制受体中存在风险,这也说明了患者自体微生物群的储存是合理的。
接受自体FMT的患者每种白细胞谱系的数量都更高,这表明FMT是有利的。Faecaliberium、Ruminococcus、Akkermansia与白细胞数量增加有因果关系的是通过自体FMT重建的。
癌症患者对抗PD1治疗产生抗药性的原因各不相同,可能导致FMT治疗失败
其中原因包括:
1)由于免疫抑制或肿瘤可能缺乏新抗原,无论微生物群组成如何,都无法对肿瘤做出反应
2)FMT供体可能缺乏对抗-PD4治疗做出反应所需的菌群
3)由于供体与受体微生物群的不相容性,FMT不能使微生物群扰动足够大
4)FMT模式的递送方法和频率可能不是最佳的
FMT在癌症免疫治疗中的未来发展
需要重点评估患者预处理和微生物群转移的最佳方案,确定最有可能受益于FMT的患者和合适的供体。
许多计划中以及正在进行的试验将通过评估FMT在不同肿瘤类型中的有效性,以及将FMT与其他方法(如益生菌、饮食和益生元)进行比较或结合,调节肠道微生物群的组成,来确定FMT是否成为治疗对ICB无反应患者的常规方法。
益生菌制剂含有具有抗炎和粘膜保护能力的菌群,如乳酸杆菌属和双歧杆菌属,用于预防化疗和放疗引起的毒性。
临床和小鼠研究,都确定了可能对特定机会性感染产生耐药性的细菌,以及可能纠正微生物群失衡的潜在益生菌。
乳杆菌属:抑制肿瘤生长,改善对ICIs的反应
鼠李糖乳杆菌、嗜酸乳杆菌和发酵乳杆菌对结肠癌发展的缓解作用已在小鼠模型中得到证实。
鼠李糖乳酸杆菌GG可通过cGAS/STING信号传导途径刺激I型干扰素,从而改善对ICIs的反应。
乳酸菌(LAB)可有效减少结直肠癌的发生,这可能归因于炎症因子的减少。此外,LAB还影响肠道微生物群落,其特征是拟杆菌丰度的降低。因此,LAB有利于抑制癌症的发生和发展。
罗伊氏乳杆菌能促进肠上皮的更新和修复,刺激宿主免疫。它能将上皮内CD4+T细胞转化为CD4+CD8αα双阳性上皮内淋巴细胞,从而缓解炎症性肠病,预防部分消化道癌症的发生。
罗伊氏乳杆菌抑制 ICI相关结肠炎的能力,与第 3 组先天淋巴细胞分布的减少有关。
罗伊氏乳杆菌通过产生三种色氨酸降解产物,抑制黑色素瘤、肝癌和结直肠癌的生长:
双歧杆菌属:增强抗PDL1疗效
对无特定病原体或微生物群耗尽的小鼠,给予与ICB反应相关的各种菌群可提高治疗反应。
为了验证双歧杆菌属支持小鼠抗PDL1治疗,施用含有四种双歧杆菌属菌株的非处方商业益生菌制剂可提高对抗PDL1疗法的反应。在对抗PD1治疗有反应的患者中,双歧杆菌也会增加。
只有一些双歧杆菌菌株能够在小鼠中与抗PD1治疗协同作用。这些协同菌株表达参与合成肽聚糖途径的基因,表明它们有助于产生免疫刺激分子。
Faecalibaculum rodentium: 抑制肿瘤生长
F.rodentium和Holdemanella biformis(人类同源物)在肿瘤发生过程中缺失或丢失,这两者都可以产生短链脂肪酸,通过抑制钙调神经磷酸酶和NFATc3激活来控制肿瘤细胞的增殖和蛋白质乙酰化。
当将F.rodentium应用于ApcMin/+小鼠时,80%以上的结直肠癌中会发生结肠腺瘤样息肉(APC)基因突变,或者用偶氮甲烷和右旋糖酐硫酸钠治疗可以减轻小鼠的肿瘤生长。同样,在ApcMin/+模型中,H.biformis在通过丁酸盐抑制肿瘤生长方面似乎与F.rodentium相似。因此,H.biformis可以应用于癌症治疗的设计。
嗜热链球菌:分泌β-半乳糖苷酶,释放叶酸
嗜热链球菌(Streptococcus thermophiles)是一种强大的益生菌,具有消化和免疫益处,通常在结直肠癌患者中被耗尽。更重要的是,嗜热链球菌对肿瘤发生有抑制作用。
具体而言,在结直肠癌小鼠中经口灌胃嗜热链球菌将显著减少肿瘤形成。嗜热链球菌分泌的β-半乳糖苷酶是抑制结直肠癌生长的活性成分;β-半乳糖苷酶可以增加另外两种益生菌乳酸杆菌和双歧杆菌的丰富性,这表明了协同作用。
嗜热链球菌通过释放叶酸来影响肿瘤生长。叶酸是一种主要的膳食元素,在细胞代谢和DNA复制、修复、甲基化和核苷酸合成中发挥重要作用。研究表明,叶酸缺乏在人类中相当普遍,嗜热链球菌释放的叶酸可能与肿瘤抑制有关。此外,嗜热链球菌对淋巴细胞特征、结肠炎的严重程度和调节性T细胞反应有影响。
大肠杆菌Nissle 1917: 减少并发症
大肠杆菌Nissle 1917 菌株可以调节肠道屏障上皮功能,缓解肠道菌群失调,最终减少伊立替康引起的肠道并发症。
丁酸梭菌588菌株:改善抗PD1治疗后患者生存率
相反,在一项回顾性分析中,一种单一的益生菌制剂,在日本和中国广泛用于治疗与胃肠道病理学相关的微生态失调的丁酸梭菌(CBM)588菌株,显著改善了接受抗PD1治疗的小细胞肺癌癌症患者的客观反应、PFS和总生存率。丁酸梭菌通过增加乳酸杆菌和双歧杆菌来改善微生态失调。
然而,一项对接受联合ICB治疗的肾细胞癌症患者的随机试验证实,接受丁酸梭菌治疗的患者临床反应有所改善,但未能检测到双歧杆菌的增加。
多种菌组合,效果 1+1>2
虽然单一益生菌菌株显示出前景,但细菌群落可能更好地维持肠道微生物群内的生态平衡。人类和小鼠种,某些种类的梭状芽孢杆菌与对结肠癌的耐药性有关。
小鼠口服下列四种梭菌菌株:
诱导了激活的CD8+T细胞在肿瘤内的积聚,并成功治疗了化学诱导的结肠癌和可移植结肠癌。
该联合体作为一种独立的治疗方法以及单个物种,在小鼠中比单独的抗PD1治疗更有效。所有四个菌株都产生短链脂肪酸,包括丁酸盐;然而,它们的免疫刺激作用独立于丁酸盐。
鉴定免疫激活细菌群落的另一种方法涉及鉴定罕见的人类共生菌株,该菌株可以激活小鼠肠道中产生IFNγ的CD8+T细胞。一个由11个物种组成的群落在无菌小鼠中对单核细胞增多性李斯特菌感染保持耐药性,并具有与抗PD1治疗相加的抗肿瘤作用。值得注意的是,7种本身没有抗癌活性的拟杆菌目物种确实对该群落的总活性有贡献,这支持了多物种细菌生态学在重建肠道微生物群中的重要性。因此,使用单一菌株和联合体的试验正在进行中。
免疫治疗期间,益生菌的服用也需谨慎
与不服用益生菌的患者相比,服用非处方益生菌的黑色素瘤患者对抗PD1治疗的反应并没有改善,反而有所下降。
这些结果,再加上商业益生菌的配方是异质的,缺乏严格的成分和生存能力质量标准,表明在免疫治疗期间使用这些产品时应谨慎。
饮食的变化会迅速改变肠道微生物群的组成,以及食物发酵衍生的细菌代谢产物的产生,从而产生代谢和免疫后果。
不同的饮食策略,包括热量限制、间歇性禁食、模拟禁食饮食、高纤维饮食、生酮饮食、发酵食物,都已在小鼠或患者中提出或测试,以改善癌症的治疗,至少在某些情况下,显示出通过改变肠道微生物群的组成来影响免疫力。
在T细胞过继转移模型中,小鼠的饮食热量限制促进了记忆性T细胞在骨髓中的积累,并增强了T细胞对细菌感染和肿瘤的免疫力。
发酵食品饮食持续增加了微生物组的多样性,并通过整体抗炎作用改变了其组成。
高纤维饮食对微生物组多样性和组成的影响更为温和,对免疫细胞的频率和细胞因子的表达没有显著影响,但对免疫细胞中的内源性信号传导产生了不同的影响,在一组具有高炎症指数的个体中,内源性信号传导增加,而在另外两组具有低炎症指数特征的个体中则减少炎症指数。
饮食可能通过改变菌群影响抗癌免疫
接受抗PD1治疗的黑色素瘤患者,在纤维充足的饮食超过20g/天时有更好的反应和存活率 ,每5 g纤维的增加相当于进展或死亡风险降低30%。
与另一项研究一致,不同纤维摄入量的人类肠道微生物群在组成或细菌丰富度方面没有显示出重大变化,但从小鼠食物中去除大部分纤维含量导致微生物群迅速变化,双歧杆菌属减少,AKK菌增加。低纤维饮食的小鼠对抗PD1癌症治疗反应较差,与临床结果相似。因此,在无菌小鼠中,高纤维和低纤维饮食不会影响对抗PD1治疗的反应,这表明该饮食可能通过改变微生物群影响抗癌免疫。
跨物种网络分析表明,小鼠的高纤维饮食通过扩大发酵纤维的瘤胃球菌属来维持有效的肿瘤免疫。瘤胃球菌属诱导T细胞的激活和肿瘤浸润,包括表达诱导型T细胞共刺激因子(ICOS)的CD8+和CD4+T细胞。
模拟禁食饮食(FMD)可降低癌症患者的毒性,并改善其对化疗的反应,但大多数关于这种饮食干预的研究尚未解决肠道微生物群改变的作用。
禁食对化疗的积极作用体现在四个方面:
二甲双胍、维生素 C、铂和曲美替尼与禁食联合使用可以增强化疗的效果。
对于三阴性乳腺癌,模拟禁食饮食激活癌细胞中的饥饿逃逸途径,并减少癌症干细胞的表面标志物,从而导致化疗药物的识别增加。
生酮饮食在小鼠中通过诱导由酮体3-羟基丁酸介导的T细胞癌症免疫,来增强抗PD1治疗的抗肿瘤作用。在小鼠和人类中,尽管在低碳水化合物饮食在增加Eisenbergiella massiliensis等细菌种类的丰度方面与抗癌效应相一致,但饮食对肿瘤免疫的影响是由3-羟基丁酸盐的增加介导的,并不依赖于肠道微生物群的改变。
菊粉和果胶是许多蔬菜和水果中天然存在的可溶性纤维,不能被胃肠道酶消化,但可以被细菌发酵。因此,它们通过改变肠道微生物群的组成、增强粘膜屏障、增强上皮完整性以及激活或抑制先天免疫细胞来发挥益生元的作用。
菊粉→产短链脂肪酸菌→增强抗PD1疗效
在小鼠中,菊粉凝胶的口服治疗增加了产短链脂肪酸菌的丰度,并增强了抗PD1疗法的抗肿瘤活性。
↘
果胶增强抗肿瘤免疫,有两种不同的机制。
果胶→产短链脂肪酸菌→增强抗PD1疗效
果胶喂养增强了移植有癌症患者粪便微生物群的小鼠对抗PD1治疗的反应能力,通过扩大纤维喂养和产生短链脂肪酸的Lachnospiraceae和Ruminococceae,通过丁酸盐激活肿瘤免疫。
果胶→AKK菌→激活STING→提高肿瘤免疫
果胶喂养也可以通过导致AKK菌的扩张来提高肿瘤免疫力,从而产生环状二磷酸腺苷(cyclic-di-AMP)并激活STING;由此产生的I型干扰素依赖性免疫肿瘤微环境特征,与小鼠和黑色素瘤患者的免疫介导的肿瘤抵抗相关。
卡姆果→增加多样性,有益菌→增强抗PD1疗效
小鼠研究中,从卡姆果(camu camu)中分离的多酚——栗木鞣花素(castalagin,一种可水解的单宁)的口服给药具有抗肿瘤作用,并通过增加肠道微生物群的多样性,增加有望对抗PD1治疗有益的菌(如瘤胃菌科,颤螺旋菌科Oscillospiraceae和AKK菌)来改变其组成,从而增强小鼠的抗PD1治疗效果。
栗木鞣花素通过影响肠道微生物群组成,重新编程肿瘤免疫微环境,并在一定程度上通过直接结合而不内化于共生细菌(如Ruminococcus bromii)来促进抗癌反应,这可能有助于扩大这种细菌和其他有益细菌的种类,促进抗PD1治疗反应。这表明,栗木鞣花素和其他传统食品添加剂或其成分可能是益生元的来源,通过靶向微生物群来提高免疫疗法的反应性。
人参多糖→增加戊酸→增强抗PD1疗效
人参多糖是一种来源于人参的益生元,可以通过降低犬尿氨酸/色氨酸的比例,增加微生物代谢产物戊酸来增强癌症对PD1抑制剂的反应,从而促进Teff细胞的诱导和调节T细胞的抑制。
肠道微生物群在癌症治疗中,可以通过多种机制影响肿瘤的发展和治疗效果。
研究表明,肠道微生物群可能成为多种癌症类型的预后和预测标记。肠道微生物群有望增强抗癌力,改善放疗化疗效果和增强免疫治疗效果,以降低死亡率和提高生活质量。初步临床试验表明,对抗PD1治疗有反应的患者的FMT可以克服对ICB治疗的原发性和获得性耐药性,这证明可以靶向微生物群增强治疗反应。
然而,在这些临床治疗研究的进展中存在许多障碍和局限性。个体生物学差异可能会阻碍微生物策略的应用。该领域的挑战包括需要在不同的癌症类型、分期、地理区域、年龄、遗传、性别、生活方式、伴随疾病、治疗和合并症中进行前瞻性验证。将小鼠的结果推广到人类也应该谨慎。
虽然存在挑战,但相应的解决方案也在不断研究中。目前应用机器学习方法分析,在考虑了不同群体和地理差异的患者肠道菌群的组成方面取得了进展,这可能很快使肠道菌群成为一个可靠的生物标志物,用于预测患者对治疗的反应,从而实现个性化选择最适合的治疗方法。
将肠道微生物群与独立调节 ICI 功效的其他生物标志物(例如 PD-L1、TMB、IL-8 或某些代谢物等)结合起来,预测免疫疗法效果的能力可能会提高。
未来的临床进展需要更精确地鉴定细菌分类单元对癌症治疗具有积极和负面效应的因果关系,并了解其作用机制,因此需要进行更广泛的试验。
改进的细菌或许可以作为抗癌治疗药物,甚至可以被改造成指导性的“微型机器人”用于药物传递。
总的来说,这一领域的发展为癌症患者提供了新的治疗选择和希望,但同时也需要谨慎评估和监测,确保安全性和有效性。
肠道微生物群对于开发新的抗癌策略的重要性和潜力值得强调,并且有必要探索一种将微生物调节疗法纳入当前癌症管理的整体方法系统。未来我们有望实现更加精准和个性化的肠道菌群调节策略,为癌症治疗带来更大的突破和进展。
主要参考文献
Thomas AM, Fidelle M, Routy B, Kroemer G, Wargo JA, Segata N, Zitvogel L. Gut OncoMicrobiome Signatures (GOMS) as next-generation biomarkers for cancer immunotherapy. Nat Rev Clin Oncol. 2023 Sep;20(9):583-603.
Fernandes MR, Aggarwal P, Costa RGF, Cole AM, Trinchieri G. Targeting the gut microbiota for cancer therapy. Nat Rev Cancer. 2022 Dec;22(12):703-722.
Lee KA, Thomas AM, Bolte LA, Björk JR, de Ruijter LK, Armanini F, Asnicar F, Blanco-Miguez A, Board R, Segata N et al., Cross-cohort gut microbiome associations with immune checkpoint inhibitor response in advanced melanoma. Nat Med. 2022 Mar;28(3):535-544.
Zhao LY, Mei JX, Yu G, Lei L, Zhang WH, Liu K, Chen XL, Kołat D, Yang K, Hu JK. Role of the gut microbiota in anticancer therapy: from molecular mechanisms to clinical applications. Signal Transduct Target Ther. 2023 May 13;8(1):201.
Liu L, Shah K. The Potential of the Gut Microbiome to Reshape the Cancer Therapy Paradigm: A Review. JAMA Oncol. 2022 Jul 1;8(7):1059-1067.
McCulloch JA, Davar D, Rodrigues RR, Badger JH, Fang JR, Cole AM, Balaji AK, Vetizou M, Prescott SM, Fernandes MR, Costa RGF, Yuan W, Salcedo R, Bahadiroglu E, Roy S, DeBlasio RN, Morrison RM, Chauvin JM, Ding Q, Zidi B, Lowin A, Chakka S, Gao W, Pagliano O, Ernst SJ, Rose A, Newman NK, Morgun A, Zarour HM, Trinchieri G, Dzutsev AK. Intestinal microbiota signatures of clinical response and immune-related adverse events in melanoma patients treated with anti-PD-1. Nat Med. 2022 Mar;28(3):545-556.
Guillot N, Roméo B, Manesh SS, Milano G, Brest P, Zitvogel L, Hofman P, Mograbi B. Manipulating the gut and tumor microbiota for immune checkpoint inhibitor therapy: from dream to reality. Trends Mol Med. 2023 Nov;29(11):897-911.

谷禾健康

在研究肠道菌群或复杂微生物样本构成时,“门”(Phylum)是细菌分类的高级分类单位之一。
细菌分类依次为门纲目科属种亚种,最大的分类层面是门,以前写过人群肠道菌群构成主要是以拟杆菌门和厚壁菌门为主,大部分人群占比超90%(个别的变形菌门或放线菌门占比也很高),作为两大“细菌王国”,这两大王国有着不同的生态和代谢属性,又有着相似的营养和生存需求,它们如同天平的两端的砝码,不同的人有着不同倾斜,即使同一个人不同时期不同身体状态下天平的倾斜都不一样。
拟杆菌门被比喻为肠道微生物群落的“多面手”,有超过7000种不同的革兰氏阴性菌组成,主要来自拟杆菌属、副拟杆菌属、普氏菌属和卟啉单胞菌属。它们的脂多糖和鞭毛蛋白与细胞受体相互作用,并通过细胞因子合成增强免疫反应。
拟杆菌门作为多糖降解联盟的成员,尤其是拟杆菌属和普雷沃氏菌属,具有多种可以利用多糖的聚糖和糖苷酶。它们有助于分解膳食纤维和淀粉释放能量,并且它们可能是丙酸盐的主要来源。
拟杆菌门一些细菌的功能还包括胆汁酸的解离。肠道微生物群,特别是肠道拟杆菌,一定程度上也具有使初级胆汁酸解离和脱水并将其转化为人结肠中次级胆汁酸的能力。它们也参与蛋白质分解过程中有毒产物的释放。比如氨,组胺,硫化氢等,这些高浓度的产物会对肠黏膜产生毒性。
该群体的成员具有一些可能有助于抑制炎症的活动,但它们也有可能促进炎症,其中一些已知是机会病原体。
厚壁菌门细菌大多为革兰氏阳性菌,通过短链脂肪酸合成在宿主的营养和代谢中发挥关键作用。
通过其代谢产物,厚壁菌门细菌与其他组织和器官间接连接并调节饥饿和饱腹感。厚壁菌门由大量功能更加多样化的核心细菌组成。从代谢的角度来看,共生梭菌簇 XIVa 和 IV 通过产生短链脂肪酸在宿主和肠道稳态中发挥着重要作用,使肠道通透性正常化,参与脑肠轴调节。许多厚壁菌门的能力与宿主的体重有关。
F/B比率升高或降低被视为生态失调,前者通常与肥胖,代谢障碍相关,这可能与从食物中提取热量增加、脂肪沉积和脂肪生成、胰岛素敏感性受损有关;而后者则与炎症性肠病,抑郁,阿尔茨海默病等相关,这可能与短链脂肪酸尤其丁酸的生成减少,蛋白代谢物组胺,脂多糖累积等相关诱导的免疫炎症反应相关。
目前许多研究工作都集中在识别特定的微生物特征,特别是与肥胖、2型糖尿病和炎症相关的微生物特征。
我们从谷禾肠道菌群检测数据库中随机抽取5万例样本,统计的人群厚壁菌门/拟杆菌门(F/B)比率如下:
可以看出大部分人群的厚壁菌/拟杆菌比率在0.30-1.0之间(谷禾健康数据库随机抽样5万例样本),表明国人大部分人群肠道菌群的构成中拟杆菌占比多一点;同时抽样人群中1/10人厚壁菌/拟杆菌比率大于2.9,表明也有相当一部分人群厚壁菌门占比较高。
一般而言,从出生到成年,厚壁菌门/拟杆菌门的比例不断增加,并随着年龄的增长而进一步改变。该比率在婴儿、成人和老年人之间存在差异。它可能与生命不同阶段细菌谱的整体变化有关。
厚壁菌门/拟杆菌门比率是一个考虑高水平分类等级(即门)的指数,同一群体的受试者之间厚壁菌门和拟杆菌门的相对丰度差异很大。这可能是由于许多与生活方式相关的因素造成的,包括饮食、疾病状态、食品添加剂和污染物、抗生素消耗、体力活动等影响胃肠道微生物群组成的因素。
由于菌群是一个复杂的生态体系,门层面的简单划分只能提供一个最简单的线索,想要了解肠道菌群需要从最主要的核心菌属,常见的有害菌属以及大量功能菌属的构成来更加准确的分析,此外菌群的代谢通路也提供了不同角度的信息。
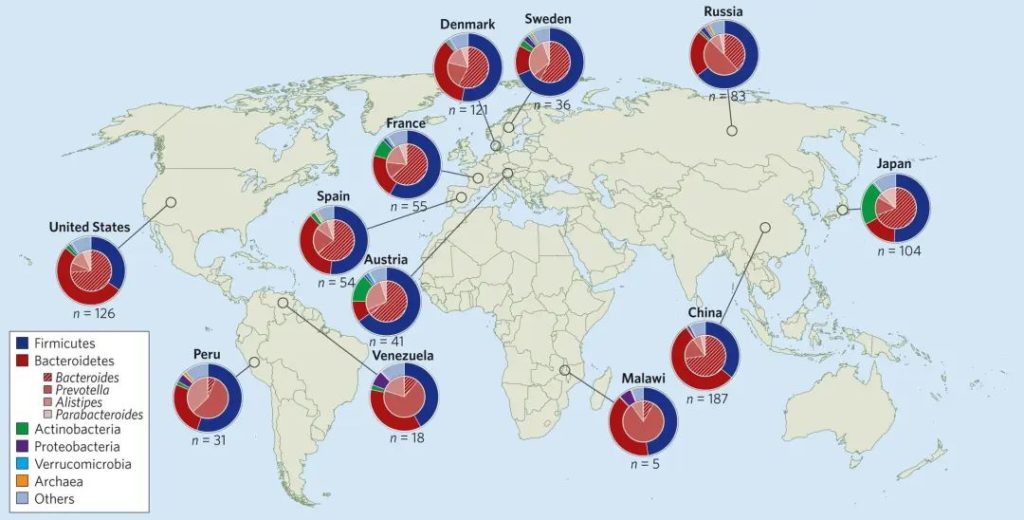
Wexler AG,et al.Nat Microbiol.2017
大多数健康成人微生物群仅由两个细菌门控制——革兰氏阳性厚壁菌门(许多属)和革兰氏阴性拟杆菌门(主要是拟杆菌属、另枝菌属、副拟杆菌属和普氏菌属)——它们共同构成了微生物中的大多数细菌分类群。
此外还有其他分类群包括变形菌门、放线菌门、梭杆菌门、疣微菌门、产甲烷古菌、真核生物(原生生物和真菌)和其他更短暂的定植者。
健康个体中发现的类群在家庭成员(例如父母及其子女)之间往往最相似,而在不同文化和地理空间(例如西方社会与非西方社会)之间则最不相似。
厚壁菌门(Phylum Firmicutes)是细菌的一个门,大多数具有革兰氏阳性细胞壁结构。然而,一些细菌,如巨球菌属、梳状菌属、月单胞菌属和嗜发酵菌属,具有多孔的假外膜,导致它们被染成革兰氏阴性。
科学家们曾经将厚壁菌门分类为包括所有革兰氏阳性细菌,但最近将它们定义为相关形式的核心组,称为低 G+C 组。与放线菌相反。它们有圆形细胞,称为球菌(单球菌),或杆状细胞(芽孢杆菌)。厚壁菌门缺乏脂多糖,而是向宿主呈现厚厚的肽聚糖层;研究人员已经发现了200多种不同类型的属于厚壁菌门的细菌。
★ 厚壁菌门中有许多有益的菌
厚壁菌门的成员包括许多有益的菌。比如乳酸菌是一种常见于酸奶和其他发酵乳制品中的益生菌,属于该门。这些微生物会产生醋酸盐(另一种促进健康的短链脂肪酸)以及乳酸和抗菌物质,以防止病原体定植。
又比如普氏栖粪杆菌(Faecalibacterium prausnitzii),又名:普拉梭菌,是人类肠道菌群中最重要的细菌之一,占健康人粪便样本中检测到的细菌总数的5-15%,是丁酸的重要生产者之一,具有抗炎作用,维持细菌酶的活性,保护消化系统免受肠道病原体的侵害。
★ 厚壁菌门中也存在一些致病菌
但是一些致病菌也属于该门。例如,产气荚膜梭菌是一种引起胃肠道感染的细菌。还有金黄色葡萄球菌,它是一些严重感染的常见原因。
丁酸盐是研究最深入的短链脂肪酸之一,是肠道上皮细胞营养的主要来源。丁酸盐的消耗与肠道屏障完整性受损有关。
注:研究支持,长寿、健康的老年人肠道内的丁酸细菌含量明显较高。
人类肠道包含一个非常密集的代谢活跃微生物群落。然而,只有有限数量的肠道细菌为丁酸生产者。人类肠道中大多数丁酸合成细菌分布于厚壁菌门。在厚壁菌门中,毛螺菌科、瘤胃球菌科、真杆菌科和梭状芽孢杆菌科是四个重要的丁酸合成科。
梭菌目的簇 IV、XIVa、XVI 和 I 包含大多数丁酸盐生产菌种。其中两个重要的物种,直肠真杆菌和普拉梭菌分别属于梭菌簇 XIVa 和梭菌簇 IV,占健康成人粪便样本中肠道菌群总数的12-14% 。此外,还有罗氏菌属,粪球菌属,瘤胃球菌属, Anaerostipes ,丁酸弧菌属和梭菌属。
分布在XIVa 簇中的Butyricicoccus pullicaecorum、Subdolicapsulu variabile、Anaaerotruncus colihominis和分布在 IV 簇中的Papillibacter cinnamivorans是其他产丁酸菌种。
据报道,属于韦荣氏球菌科、热厌氧杆菌科 III 的Megasphaera elsdenii和Caldocellum saccharolyticum也能合成丁酸盐。
最近,对人类样本的高通量宏基因组测序表明,Rawsonibactera saccharolyticus是瘤胃球菌科中的一个新物种,并且肠单胞菌AF211编码丁酰辅酶A:用于合成丁酸的乙酰辅酶A转移酶。
许多厚壁菌门细菌可以产生内生孢子,其耐干燥并且可以在极端条件下生存。孢子在细菌生长中起着重要的作用。细菌的孢子是一种休眠状态,可以在不利环境下存活,并在适宜条件下重新发芽成为活跃的细菌。这种休眠状态使得细菌能够在恶劣条件下存活并传播。
★ 内生孢子可以帮助细菌在恶劣条件下存活
内生孢子由细菌的DNA和部分细胞质组成,周围有一层非常坚韧的外层。它们可以在没有营养的情况下生存,并且能够抵抗紫外线、干燥、高温、极端冷冻和化学消毒剂。
厚壁菌门的代谢偏好
科学家发现,人类肠道微生物群虽然独特,但都可以按照几个分类划分下,称为肠型。第三种肠道型,被称为“谷物爱好者” ,通常以瘤胃球菌(厚壁菌门的成员)为主。
肠型往往可以追溯到长期的饮食习惯。顾名思义,具有“谷物爱好者”微生物组类型的人倾向于消耗更多全谷物中的抗性淀粉和膳食纤维。
✦ 高纤维饮食的人体内厚壁菌更丰富
高纤维饮食可以增加厚壁菌门的丰度并减少拟杆菌的丰度 ,从而增加肠道内短链脂肪酸的浓度。
而葡萄籽原花青素显著降低了肥胖大鼠肠道菌群中厚壁菌门的含量,提高了拟杆菌门的含量,显著降低了厚壁菌门与拟杆菌门比值。
✦厚壁菌偏向从膳食蛋白和循环尿素中获取氮
在厚壁菌门成员中,偏好尿素氮的属往往是菊粉的疯狂使用者,即使用菊粉和尿素合成自己的氨基酸。这包括一些脲酶阴性菌属,它们可能通过交叉喂养获得尿素氮。
此外,在厚壁菌中也看到了一些属更喜欢从膳食蛋白质中获得氮,而其他菌属更喜欢循环尿素。
静脉注射尿素以提高循环尿素浓度后,偏好尿素的厚壁菌以及阿克曼菌的丰度大幅增加。
膳食蛋白质和循环尿素是厚壁菌的主要氮原料,而分泌的宿主蛋白质为拟杆菌提供氮。
!
如果厚壁菌门过高意味着什么?
可能的原因:
– 不良的饮食习惯
– 生态失调
– 消化不良
– 胃酸过少
– 代谢疾病
可能的治疗方法和注意事项:
– 平衡共生细菌
– 当厚壁菌门含量较高时,考虑主要使用双歧杆菌益生菌和布拉氏酵母菌
– 乳杆菌属和芽孢杆菌属(益生菌中发现)可以提高厚壁菌门的数量
– 优化饮食结构:低脂肪饮食可能有助于厚壁菌门水平正常化
滋养肠道内厚壁菌门的食物
纤维和淀粉,是这些细菌的能量来源。富含水果、蔬菜、豆类和全谷物的饮食也是理想的。
研究表明,地中海饮食与更丰富的厚壁菌门有关,包括普拉梭菌。另一方面,富含动物蛋白、脂肪和糖的西方饮食会对有益的这些细菌产生负面影响。
如果想增加肠道中厚壁菌门的丰度,那么应该多吃高纤维食物。以下是一些可以添加到饮食中的食物,以支持您的肠道微生物组并促进厚壁菌门和丁酸盐的产生:
-苹果
-蒜
-大麦
-菊苣根
-燕麦
-亚麻籽
-洋葱
拟杆菌是肠道生态系统中非常成功的竞争者,表现出相当大的营养灵活性以及对宿主和肠道环境施加的压力做出反应的能力。很难权衡肠道拟杆菌对宿主是否产生负面或正面影响。
拟杆菌是复杂碳水化合物的主要降解者,迄今为止调查的所有生态系统中都普遍发现该属,在土壤以及人类和动物肠道中尤其占主导地位。大多数已测序的拟杆菌基因组编码大量多糖降解酶(CAZymes),表明代谢重点是聚糖降解。
CAZymes 在碳水化合物活性酶数据库中分为类别和家族,其中降解酶存在于糖苷水解酶(GH)、多糖裂解酶(PL)、碳水化合物酯酶(CE)和辅助活性酶 (AA) 类别中。
拟杆菌还通过与免疫系统的相互作用,在激活T细胞介导的反应中发挥作用,从而有助于宿主的整体健康。
✦ 防止特定炎症反应
基于多项研究,发现脆弱拟杆菌通过产生称为两性离子多糖的多糖来激活CD4+ T细胞。CD4+ T细胞的产生会刺激白细胞介素10的释放,从而防止特定的炎症反应和脓肿形成。
肠道免疫保护取决于拟杆菌、白细胞介素36信号和巨噬细胞的发育。拟杆菌的这种作用需要其保守的共生定植因子的多糖利用位点。
✦ 抑制胃肠道中的病原体
与胃肠道中发现的其他一些细菌相比,研究表明拟杆菌门的一些成员对各种抗生素和胆汁等物质具有耐药性,这给了他们竞争优势。
除了这种竞争优势之外,这些细菌还被证明在调节胃肠道中其他正常菌群和病原体的数量方面发挥着重要作用。
拟杆菌可以积极改善肠道环境,使其更适合自身和其他微生物。
✦降低肠道内氧水平从而促进厌氧菌生长
例如,许多编码细胞色素bd氧化酶,据推测该酶可以降低细胞内氧水平,进而降低肠道氧水平,从而允许严格厌氧菌生长,否则这些厌氧菌会被氧气的存在杀死。
这种耐受和降低氧气水平的能力可能有助于拟杆菌传播到新宿主,这可能是它们在哺乳动物中如此广泛传播的主要原因。
✦改变肠道的营养状况
它们还可以通过促进宿主的生理变化来诱导某些食物来源(例如岩藻糖基化糖蛋白)的产生,或通过从糖蛋白中释放岩藻糖和唾液酸残基来改变肠道的营养状况,这些残基可以被其他微生物消耗,包括病原体。
通过比较缺乏自身微生物的无菌动物和与单个拟杆菌属菌株和突变体单相关的无菌动物(出生时无菌但后来被微生物定殖),已经鉴定了许多这些拟杆菌属依赖性的肠道环境变化。
✦拟杆菌拥有多糖利用位点有助于代谢
尽管人们可能会想象肠道中的生命充满了微生物的过多食物选择,但在结肠(细菌密度最高的地方),简单、容易获得的糖大部分已经被消耗或吸收。其中的残留物是复杂的长链多糖,它们不能自由吸收,也不能被人类酶促消化。对于许多细菌来说,这些复杂的多糖同样难以处理,并且无法跨膜运输。
然而,早期研究证实拟杆菌是熟练的聚糖降解剂,具有识别和代谢十多种植物和宿主来源的多糖的不同寻常的能力。拟杆菌属物种通过基因簇来实现这一点,这似乎是拟杆菌特有的,称为多糖利用位点(PUL)。
多糖利用位点可以确定拟杆菌可以占据哪些代谢生态位,甚至可以确定它们在肠道内的生物地理位置。多糖利用位点被如此分类是因为它们的susC和susD的同系物,以及其他成分(糖苷水解酶、多糖裂解酶、糖基转移酶、碳水化合物酯酶),它们对于分解多种植物或宿主来源的聚糖很重要。
肠道细菌的其他谱系,包括革兰氏阳性放线菌,降解和输入膳食多糖的途径远不那么复杂,这在很大程度上是由于缺乏外膜屏障。例如,短双歧杆菌使用多结构域、细胞表面锚定酶(而不是一系列单独的酶),可以结合并降解聚合物,例如淀粉、支链淀粉和糖原。
拓展
比较基因组分析已在每个拟杆菌属中鉴定出数十种不同的多糖利用位点。例如,Bacteroides thetaiotaomicron是第一个对其基因组进行测序的拟杆菌属成员,将其 6.26 Mbp 基因组的近五分之一专用于88个不同的多糖利用位点。
拟杆菌不是同时表达所有多糖利用位点以捕获周围环境中可能存在的任何多糖,而是通过大量SusR样调节因子、混合双组分系统和涉及胞质外 σ/抗的跨包膜信号通路来严格调节其表达。
也许是由于在跨外膜运输之前需要部分降解长多糖链,B. thetaiotaomicron和其他肠道拟杆菌已经成功地将适当的多糖利用位点转录与其相应多糖分解中间体的丰度(而不是丰度)耦合起来。
这使得肠道细菌能够快速适应营养可用性的变化。糖分解物质形成甲酸盐、乙酸盐、乳酸盐、丙酸盐和琥珀酸盐作为主要发酵产物。拟杆菌可能是结肠中丙酸盐形成的主要贡献者。
由于多糖利用位点激活是肠道环境的产物,富含植物源性多糖和糖蛋白的饮食将导致多糖利用位点暂时上调,从而降解这些膳食营养素。然而,当这些底物稀缺时,例如在禁食期间或某些低纤维饮食期间(如高糖、高脂肪的西方饮食),亲糖拟杆菌会改变其转录谱以消耗宿主衍生的聚糖,这些暂时的转换可能是导致某些细菌在婴儿期最初在肠道定殖并在我们一生中持续存在的主要因素。
根据最近使用动物模型的研究,拟杆菌属可以在相对较短的宿主婴儿期主要依靠宿主聚糖生存,但当在多个宿主世代的时间内被迫以低纤维饮食为生时,它们最终可能会灭绝。
有的菌会通过破坏中性粒细胞趋化性等机制帮助逃避免疫系统(例如,伤寒沙门氏菌)和逃避宿主补体系统(例如肺炎克雷伯菌)。
相比之下,拟杆菌使用一种称为相变的过程,以开/关方式控制其荚膜多糖生物合成位点的表达。例如,脆弱拟杆菌从八个生物合成位点产生不同的荚膜多糖,其表达受到可逆启动子区域和反式位点抑制剂的严格调控,限制多个位点的同时表达,从而使脆弱拟杆菌的同基因群体共同表现出广泛的多样性。当脆弱拟杆菌漏入通常无菌的腹膜腔时,可能会发生腹膜炎。
注:绝大多数人类腹膜炎病例都是由脆弱拟杆菌引起的。
目前,拟杆菌门中研究的最充分的,包括拟杆菌属和普氏菌属以及卟啉单胞菌属。
✦ 卟啉单胞菌属可导致急性坏死溃疡性牙龈炎
卟啉单胞菌属的成员作为共生体或机会性病原体生活在人类口腔中。牙龈卟啉单胞菌引起临床上侵袭性牙龈炎,可导致急性坏死溃疡性牙龈炎或扩展到口腔和面部组织,这种情况称为坏疽性口炎或口腔癌。
✦ 普雷沃氏菌也是一种条件性致病菌
普氏菌属是一个大属,包括50多个不同的物种。大多数可以从口腔和肠道中分离出来。普雷沃氏菌属存在于人类中,帮助分解蛋白质和碳水化合物食物。也可作为条件致病菌,引起牙周和牙齿、肠道炎症、类风湿性关节炎、细菌性阴道炎等问题。
大型基因组计划,包括美国国立卫生研究院(NIH)资助的人类微生物组项目(http://nihroadmap.nih.gov/hmp/)和欧盟资助的 MetaHIT 项目 (http://www.metahit.eu)对50多种人类来源的拟杆菌门的拟杆菌和普氏菌分离株进行了测序。
基因组草图可从 Genbank 公开获得,并揭示这些物种拥有多种糖苷酶,这些糖苷酶具有预测的对抗植物和宿主来源的多糖的活性,以及维生素和辅因子合成的许多途径。
拟杆菌门的基因组大小相对较大,例如B.thetaiotaomicron 为 6.26 Mb。迄今为止在拟杆菌属中发现的16S rRNA基因的最高拷贝数为7个(在普通拟杆菌中)。
✦ 拟杆菌的组成和代谢受到饮食调节
在全基因组水平上,拟杆菌属与副拟杆菌属共享超过1000个蛋白质家族的核心,但与卟啉单胞菌属和普雷沃菌属共享较少数量的核心家族蛋白质家族。它们的组成和代谢活动在很大程度上受饮食调节。
拟杆菌与高脂肪和蛋白质的摄入量有关,而普雷沃氏菌与富含植物的饮食(高水平的复合碳水化合物和水果和蔬菜的摄入量)有关。因此,拟杆菌属和普雷沃氏菌属物种在人体内具有其特定的栖息地,因为它们大多数是拮抗的。
厚壁菌门与拟杆菌门之间的比率(F/B)与维持体内平衡有关,该比率的变化可能导致各种病理。
例如,特定厚壁菌门或拟杆菌门物种丰度的增加分别导致肥胖和肠道炎症。尽管人们非常关注 F/B 比率,但应该记住,这一比率可能会受到其他门的增加的影响,但是其他门的菌群失调增加或减少并不一定会改变 F/B 比率。
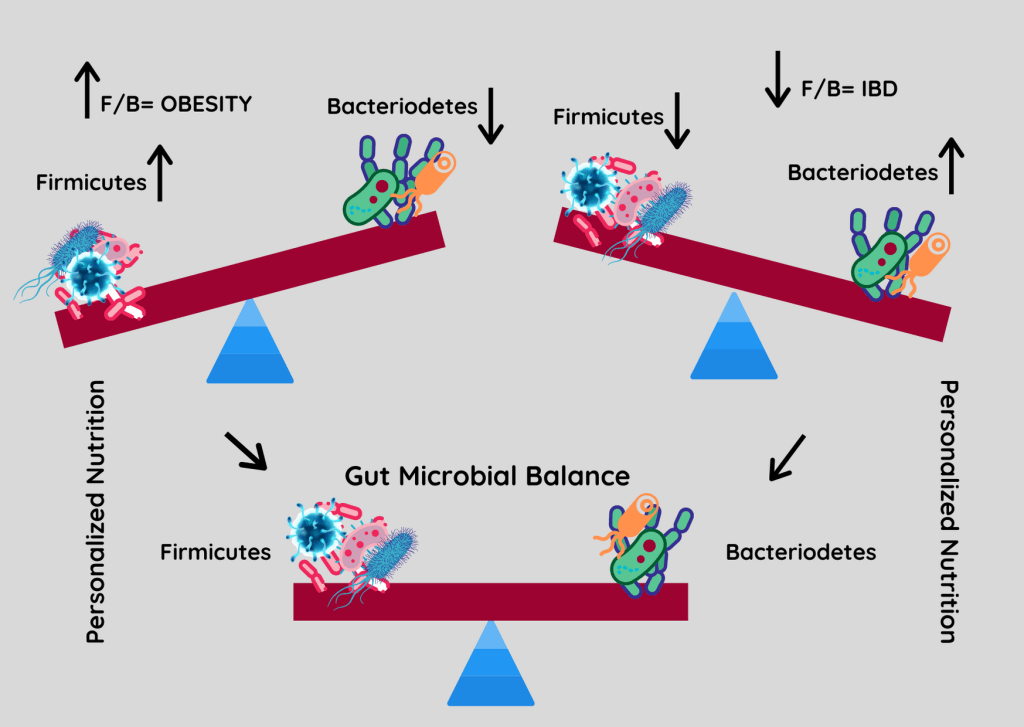
Stojanov S,et al.Microorganisms.2020
肥胖是一种复杂的、多因素的疾病,其原因包括宿主遗传背景、体力活动减少和食物摄入过多等多种因素。在过去的几十年里,肠道微生物群被认为是有利于脂肪储存、体重增加和胰岛素抵抗的额外因素。
世界范围内的研究正在不断寻找其致病因素。厚壁菌门和拟杆菌门的改变首先在肥胖动物和受试者中被描述,这些动物和受试者表现出厚壁菌门丰度增加,而拟杆菌门却减少了。
✦ F/B 比率较高时相同食物会吸收更多能量
当F与B的比例较高或体重增加和肥胖状态时,这两个细菌门影响我们体重的原因是它们调节我们吸收的脂肪量。想象一下两个人都消耗2000卡路里,但F与B的比例不同。F/B 比率较高的一种会吸收更多的卡路里,因此会比另一种增加更多的体重。因此,重点应该是平衡F与B的比例,一方面防止肥胖,另一方面预防炎症性肠病的发生。
当受试者接受热量限制饮食一年后,他们的拟杆菌门丰度增加,厚壁菌门/拟杆菌门比例正常化,同时体重减轻。这些研究得到了对喂食高脂肪或高纤维饮食的动物的研究的支持,这些研究显示厚壁菌门和拟杆菌门的丰度分别较高。
基于这些结果以及从肥胖动物和人类身上获得的其他结果,有人提出厚壁菌门比拟杆菌更能有效地从食物中提取能量,从而促进有效吸收热量和随后的体重增加。
肥胖双胞胎的微生物组富含编码营养转运蛋白的基因,而瘦双胞胎的微生物组富含编码与碳水化合物代谢相关的酶的基因。
最近发表的一项系统综述显示,大多数研究都支持 F/B 比率增加与肥胖之间的关系。
对肥胖和非肥胖日本受试者的粪便样本进行的一项研究显示,他们的 F/B 比率存在显著差异。厚壁菌门的百分比为 37.0 ± 9.1%(非肥胖者)和 40.8 ± 15.0%(肥胖者),而拟杆菌门的百分比为 44.0 ± 9.8%(非肥胖者)和 37.0 ± 14.0%(肥胖者)。
在61名乌克兰成年人中也报告了类似的结果,其中 F/B 比率与体重指数(BMI)显著相关。F/B 比率≥ 1 的个体超重的可能性比F/B 比率<1 的个体高出23%。
同样,卡塔尔受试者(37名肥胖者和36名瘦者)表现出肠道微生物群的改变;肥胖和瘦受试者的 F/B 比率分别为 2.25 ± 1.83 和 1.76 ± 0.58。在哈萨克族和比利时学童中,肥胖组的F/B比值显著高于对照组。
✦ 肥胖人群与正常人群拟杆菌存在差异
然而,两个拟杆菌属的存在差异:与肥胖组相比,正常组中拟杆菌属的高出20%,而肥胖组中普雷沃氏菌属比正常组高出19%。拟杆菌属和普雷沃氏菌属都属于拟杆菌门。
同一群体的受试者之间厚壁菌门和拟杆菌门的相对丰度差异很大。这可能是由于许多与生活方式相关的因素造成的,包括饮食、体力活动、食品添加剂和污染物、抗生素消耗等影响胃肠道微生物群组成的因素。
这种高度变异性可能解释了在比较正常体重和肥胖受试者之间的微生物群时观察到的矛盾结果,使得很难将厚壁菌门/拟杆菌门比率与确定健康状况联系起来。
重要的是要观察肠道微生物种群结构的整体组成,将其作为肥胖和肥胖相关病理(例如GSD)的指标,而不仅仅是厚壁菌门/拟杆菌门的比率。然而,在我们看来,可以修改这个比率,例如引入表征拟杆菌门底下的拟杆菌属或普氏菌属与梭状芽胞杆菌 XIVa 簇菌的比例。
!
F/B 比改变导致肥胖的争议
然而,与这些结果相反,许多研究没有观察到该参数的任何改变,甚至报告肥胖动物和人类中厚壁菌门/拟杆菌门的比例降低。
事实上,在大多数研究中,肥胖患者比瘦受试者表现出更少的细菌多样性,这表明在科、属或种水平上存在其他组成变化,这可能比厚壁菌门/拟杆菌门比率更相关。
✦肥胖增加可能与长期暴露脂多糖有关
关于这一点,代谢性内毒素血症的假说提出,肥胖增加和全身炎症的发展可能是由于长期暴露于脂多糖所致,脂多糖是一种源自革兰氏阴性细菌的促炎分子,它会通过肠腔进入血液。
这一假设与肥胖症中所报道的拟杆菌门丰度下降的情况并不相符,因为该门是肠道微生物群中革兰氏阴性菌的主要群体。
这种差异可以通过这样的事实来解释:来自拟杆菌门细菌的脂多糖的内毒素活性被认为低于来自其他革兰氏阴性细菌(例如属于变形菌门的细菌)的内毒素活性。有趣的是,在肥胖受试者或动物中也观察到变形菌门的增加,并且在无菌小鼠中施用变形菌门成员肠杆菌会导致这些动物出现肥胖和胰岛素抵抗。
✦ F/B比率增加与短链脂肪酸产生无关
另一方面,厚壁菌门/拟杆菌门比例的增加与肥胖个体中观察到的短链脂肪酸产生无关。事实上,据报道,拟杆菌门主要产生乙酸和丙酸,而厚壁菌门则产生更多的丁酸。丁酸盐被认为是一种促进健康的分子,因为它具有增加胰岛素敏感性、发挥抗炎活性、调节能量代谢和增加瘦素基因表达的能力。
结肠中的丙酸盐刺激L-肠内分泌细胞释放GLP-1和 PYY,从而抑制食欲。它还可能到达门静脉循环,主要被肝脏捕获,参与肝糖异生并减少参与脂肪酸和胆固醇从头合成的酶的表达。
乙酸也被吸收并到达全身循环和周围器官,包括脂肪组织、肌肉和大脑。在肝脏中,与丙酸盐相反,它刺激肝脏合成脂质,导致血脂异常。在大脑中,它激活副交感神经系统,分别促进胰腺和胃粘膜分泌胰岛素和生长素释放肽。
这些事件会导致脂肪储存和食欲增加,从而导致肥胖。根据这些结果,醋酸盐通常被认为更容易导致肥胖。肥胖个体中厚壁菌门/拟杆菌门比例的增加意味着这些受试者中丁酸盐的产量较高,丙酸盐和乙酸盐的产量较低,这一发现与这些短链脂肪酸各自的抗肥胖和致肥胖作用部分矛盾。一种解释是,肥胖个体中产生丁酸的细菌减少,并逐渐被属于同一门的其他细菌取代,导致结肠腔中丁酸的产生量降低。例如,葡萄球菌属和罗伊氏乳杆菌的丰度增加(均来自厚壁菌门)
肥胖状态还与A. muciniphila (疣微菌门)丰度较低有关,这是一种粘蛋白降解细菌,有助于稳定肠道屏障功能、分泌抗菌肽和控制炎症。
✦生理及病理状况都会影响肠道微生物群
另一方面,性别、年龄、宿主遗传学的差异。男性和女性的肠道微生物群存在差异,例如男性中拟杆菌-普雷沃氏菌群的水平较高,而女性中厚壁菌门的比例较高。然而,个别研究也发现女性中拟杆菌门的丰度最高。
此外,存在病理状况(糖尿病、心血管疾病、炎症性肠病等)。例如,Oddi括约肌松弛与胆管结石有关,可能是由于肠内容物回流增强改变了微环境所致。
治疗(抗生素、二甲双胍等)通过富集Akkermansia muciniphila以及几种产生短链脂肪酸的微生物群(丁酸弧菌、两歧双歧杆菌等)来改变肠道微生物群组成。
总之,这些导致厚壁菌门/拟杆菌门比率并不是与肥胖相关的微生物群失调的有力标志。
我们建议与肥胖相关的肠道微生物组研究不应该研究肥胖本身的分类标志物,而应侧重于确定用于将患者分层为亚组的分类标志物。引入微生物组患者分层将通过直接操纵患者微生物组来制定个性化治疗决策,从而改善肥胖的管理。
炎症性肠病代表小肠和大肠炎症反应引起的肠道疾病,由两种疾病组成:克罗恩病(CD)和溃疡性结肠炎(UC)。
溃疡性结肠炎是由结肠和直肠(从大肠末端开始到肛门结束的腔室)的长期炎症引起的,而克罗恩病是由结肠或回肠(小肠的最后部分)或两者的长期炎症引起的。
✦ 炎症性肠病患者厚壁菌门丰度下降
肠道微生物群会导致这些疾病。具体来说,当厚壁菌门减少或拟杆菌门相对于厚壁菌门增加时(两种情况下肠道菌群失调),就会导致慢性炎症和消化系统疾病,如克罗恩病和溃疡性结肠炎。
一项研究检查了克罗恩病和溃疡性结肠炎患者以及健康对照活检组织中的微生物多样性。观察到厚壁菌门丰度下降;更准确地说,克罗恩病患者中梭状芽胞杆菌类细菌减少,但溃疡性结肠炎患者或健康个体中则没有减少。
相反,与溃疡性结肠炎患者和健康个体相比,克罗恩病患者的拟杆菌丰度显著增加(分别为74.97%、64.31%和67.41%)。
✦肠道微生物变化与炎症性肠病严重程度相关
肠道微生物群的变化也与克罗恩病和溃疡性结肠炎的疾病活动度和严重程度相关。例如,与患有非活动性疾病的患者相比,患有活动性疾病的溃疡性结肠炎患者中厚壁菌门的含量较低。同样,与患有非侵袭性疾病的克罗恩病患者相比,患有侵袭性疾病的克罗恩病患者的厚壁菌门丰度显著降低。
具有抗炎作用的普氏粪杆菌减少
普氏粪杆菌(F. prausnitzii)是一种厚壁菌门物种,在炎症性肠病患者中减少,其减少与克罗恩病术后六个月复发相关。
普氏粪杆菌在体内和体外均表现出抗炎作用。在患有诱导性结肠炎的小鼠中,活普氏粪杆菌(或其上清液)降低了结肠炎的严重程度并纠正了生态失调。此外,普氏粪杆菌对血液单核细胞的体外刺激导致IL-10分泌增加以及IL-12和干扰素-γ(IFN-γ)分泌减少。
拟杆菌在炎症性肠病中增加
相比之下,拟杆菌在炎症性肠病中通常会增加,并与其进展和发展相关。对炎症性肠病患者和健康个体肠道炎症和非炎症区域的粘膜活检显示,炎症性肠病样本中厚壁菌门减少,拟杆菌门丰度增加,而肠杆菌科仅在克罗恩病患者中增加。活检还显示,与非发炎区域相比,发炎区域的细菌失调程度更高。
另一项对克罗恩病和溃疡性结肠炎患者进行粘膜活检和粪便菌群构成的研究证明了肠道微生物群和 F/B 比率的改变。克罗恩病和溃疡性结肠炎患者的F/B比值均较对照组显著降低。
此外,种、属和科的组成也发生了变化。与克罗恩病患者和对照组相比,溃疡性结肠炎患者中拟杆菌和乳酸菌的丰度较高;与对照组相比,溃疡性结肠炎患者中大肠杆菌的丰度也有所增加。相反,克罗恩病患者中球状梭菌减少。
✦ 不同拟杆菌种类与不同炎症性肠病程度相关
不同的拟杆菌与不同程度的炎症性肠病相关。在经过抗生素预处理且存在转化生长因子(TGF)βRII和IL-10R2信号传导缺陷的小鼠系中,在用普通拟杆菌和多形拟杆菌灌胃后观察到严重的溃疡性疾病。
与显示 F/B 比率对肥胖影响不大的研究类似,并不是在所有炎症性肠病病例中都观察到 F/B 比率降低。炎症性肠病患者粪便微生物分析显示,拟杆菌门、厚壁菌门和疣微菌门的丰度下降,而变形菌门、放线菌门和梭杆菌门的丰度增加。在48名克罗恩病患者中,粪便样本中的拟杆菌细菌丰度不到健康个体的10%,梭菌亚群 XIVab(厚壁菌门)也显著降低。
然而,大多数研究表明,拟杆菌因内毒素而表现出促炎特性,并影响细胞因子的产生,从而导致炎症性肠病。此外,厚壁菌门细菌具有抗炎作用,可以缓解炎症性肠病的进展。
2型糖尿病(T2DM)是一种代谢性疾病,其主要原因是与肥胖相关的胰岛素抵抗。然而,其他一些因素,如精神压力、感染和遗传倾向也可能导致糖尿病。
肥胖和糖尿病的特征都是慢性低度炎症状态,并伴有多种炎症介质(例如肿瘤坏死因子和白细胞介素)的异常表达和产生。
最近的研究基于大规模16S rRNA 基因测序、定量实时PCR (qPCR) 和荧光原位杂交 (FISH),显示了肠道微生物群组成与糖尿病等代谢疾病之间的关系。
有人提出,肠道微生物群引导增加肠道对单糖的摄取,并指示宿主增加肝脏产生与胰岛素抵抗相关的甘油三酯。
✦ 2型糖尿病患者中产丁酸厚壁菌门丰度降低
权威研究显示主要的丁酸盐合成菌厚壁菌门在2型糖尿病患者中显著减少。多项人体研究支持这样一个事实:与健康受试者相比,2型糖尿病受试者中合成丁酸的厚壁菌门丰度显著降低。
对这些患者的粪便微生物群分析显示,与正常耐糖受试者相比,新诊断或长期患有糖尿病的受试者中瘤胃球菌科和毛螺菌科等科的丰度有所下降。
还报告了罗氏菌属(Roseburia)和普拉梭菌(Faecalibacter prausnitzii)的丰度在健康对照中比2型或1型糖尿病患者更高。
对粪便样本进行深入的宏基因组学和宏蛋白质组学分析证实,在患有糖尿病前期 (Pre-DM) 或初治2型糖尿病 (TN-T2D) 的个体中,产生丁酸盐的菌含量显著降低。与正常耐糖个体相比, 患有糖尿病前期个体中的普拉梭菌的水平低于正常耐糖个体和初治2型糖尿病个体。
肠道微生物组可以反映整个身体的健康状况。厚壁菌门和拟杆菌门是结肠的主要门,可以影响与肥胖相关的疾病,这些疾病也是乳腺癌的危险因素。
✦ 乳腺癌患者F/B比值比健康人群低很多
因此,研究对乳腺癌患者和健康对照者的血清中提取细菌细胞外囊泡,使用微生物组测序分析厚壁菌门和拟杆菌门。分析乳腺癌的预后因素和血清学检测结果与 F/B 比值的相关性。发现乳腺癌患者的 F/B 比值比健康对照者低三倍。
此外,乳腺癌的危险因素,如空腹血糖,被发现与F/B比值有关。F/B比值可以作为乳腺癌的危险因素,并可能作为解释影响乳腺癌发生的潜在机制的线索之一。
健康对照者和乳腺癌患者中 F/B 的比率
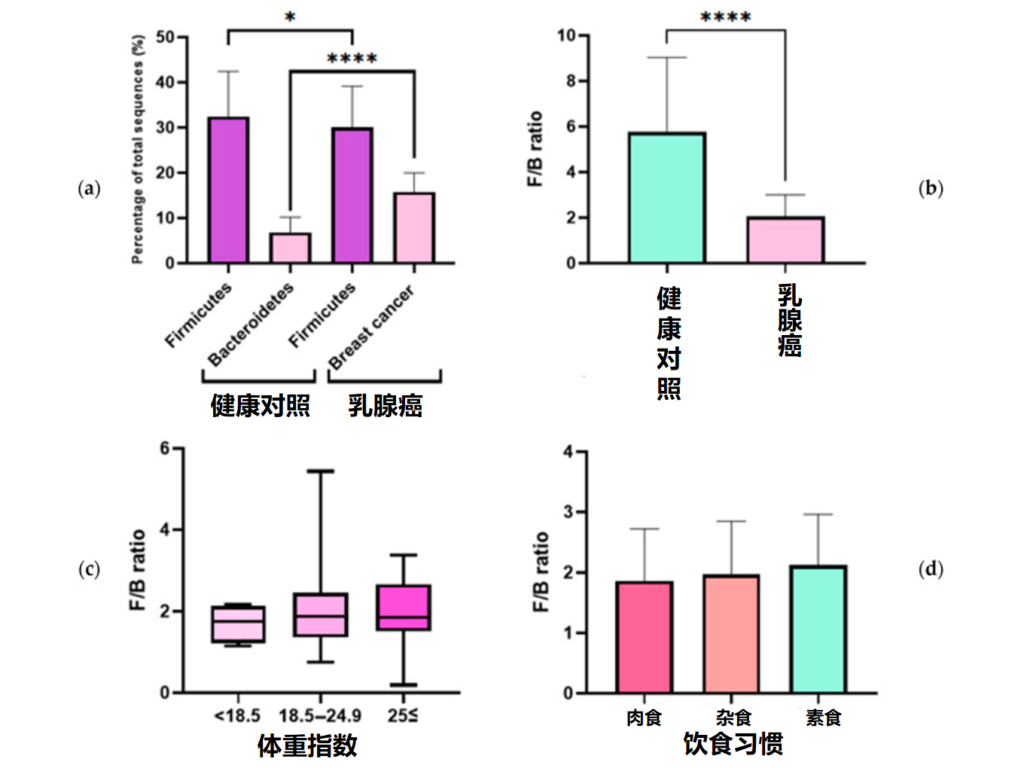
An J,et al.J Clin Med.2023
(a)健康对照组和乳腺癌患者中厚壁菌门和拟杆菌门占总微生物群的比例;(b)健康对照者和乳腺癌患者的F/B比率;(c)F/B比与体重指数之间的关系;(d)F/B比与饮食习惯的关系(*p≤0.05,**** p≤0.0001)。
调查研究发现中国饮食中的动物脂肪和蛋白质含量高于印度饮食中的全谷物和植物性素食。而印度参与者微生物组中拟杆菌的比例几乎是中国参与者的四倍,分别为16.39%和4.27%(p=0.001)。
✦ 动物产品食用较少与拟杆菌数量较多有关
据推测,印度人体内拟杆菌门的丰度较高是由于他们对动物产品的消耗较少;表明饮食中动物产品含量较低与拟杆菌数量较多有关。
对欧洲儿童和布基纳法索儿童的微生物群的比较也显示了由于饮食习惯不同而导致的微生物群组成的差异,欧洲儿童的饮食富含动物蛋白、糖、淀粉和脂肪,纤维含量低。以素食为主的饮食主要由碳水化合物、纤维和非动物蛋白组成。欧洲儿童微生物组富含厚壁菌门和变形菌门,而放线菌门和拟杆菌门在非洲儿童中较多。
✦ 营养不良儿童的肠道微生物多样性较低
研究发现,与同一地区中高收入家庭的健康儿童相比,孟加拉国贫困社会经济地位家庭的营养不良儿童的肠道微生物群多样性较低,其特点是拟杆菌门的相对丰度较低,变形菌门占主导地位。
注:拟杆菌门的存在率较低众所周知,它们可以消化复杂的膳食材料,从而提高从各种食物中提取能量,而潜在致病性变形菌的较高含量可能有助于解释营养不良儿童的健康状况不佳。
✦ 增加纤维摄入量可以增加厚壁菌门的数量
一项研究将西方饮食的美国儿童与食用大米、面包和扁豆等植物性饮食的孟加拉国儿童进行了比较。在食用西方饮食的美国儿童中,厚壁菌门/拟杆菌门的比例减少了三倍。
另一项研究要求参与者增加纤维摄入量并避免西方减肥食品。研究表明厚壁菌门:拟杆菌门比率增加了。
通过分析三名健康受试者6-12个月的肠道宏蛋白质组,进一步证实了这些结果。在这项研究中,参与碳水化合物运输和代谢的蛋白质占检测到的蛋白质的10%以上,构成了所有测试对象中发现的核心宏蛋白质组的一部分。
糖酵解途径尤其引人注目,并鉴定出几种相关酶。在为每个门的每个COG功能类别分配光谱命中后,很明显,厚壁菌门和放线菌门负责活跃的碳水化合物代谢,而拟杆菌门则显示出更多的混合功能。
这些例子反映了将某些门与特定饮食广泛联系起来主要挑战是需要考虑涵盖整个微生物组的微生物的状态和相互作用动态。
✦ 当F/B比率增加时
即更多厚壁菌门,拟杆菌较少。或两者兼而有之,厚壁菌门增长更快。可能导致以下疾病:
-肥胖(BMI较高)
-高血压中的肠道菌群失调
-自闭症谱系障碍
-慢性疲劳综合症
-肠易激综合症
-干燥综合症
-类风湿性关节炎
✦当F/B比率下降时
即厚壁菌门较少,更多拟杆菌。或两者兼而有之,厚壁菌门减少得更快。可能导致以下疾病:
-系统性红斑狼疮
-乳糜泻
-克罗恩病
-老龄化
我们审查评估了饮食干预如何影响微生物组成的相关文章。总体而言得出以下建议供参考:
✦ 增加植物蛋白摄入,避免摄入过量动物蛋白
总体而言,蛋白质摄入量,尤其植物蛋白的摄入与肠道拟杆菌门,细菌多样性呈正相关。乳清和豌豆蛋白可以增加双歧杆菌和乳酸菌的数量,而乳清还可以减少脆弱拟杆菌和产气荚膜梭菌的数量,这两种细菌都是致病性的。
此外,豌豆蛋白被发现可以增加短链脂肪酸水平,短链脂肪酸被认为具有抗炎作用,并在粘膜完整性中发挥作用。然而,一项研究发现,高动物蛋白/低碳水化合物饮食会导致罗氏菌属和直肠真杆菌(这两种有益细菌)减少。动物蛋白可能含有大量脂肪,而脂肪也会影响肠道微生物群。
✦ 尽量摄入不饱和脂肪
当研究人员观察脂肪时,发现并不是所有的脂肪都是平等产生的。在一项研究中,小鼠被喂食猪油或鱼的脂肪。喂猪油的小鼠中拟杆菌属和嗜胆菌属(Bilophila)增加,而双歧杆菌和Adlercreutzia、乳酸菌(乳杆菌和链球菌)和疣微菌属(Akkermansia muciniphila)在鱼油喂养的小鼠中增加。
猪油喂养的小鼠还出现白色脂肪组织炎症和胰岛素敏感性受损。喂食鱼油的小鼠总体表现更好,研究人员得出结论,肠道微生物群促进了高饱和脂肪饮食的整体炎症反应。
✦ 高纤维的饮食可以减少炎症
碳水化合物,包括可消化的(淀粉和糖)和不可消化的(纤维),可能是研究最多的常量营养素,因为它们具有改变肠道微生物组的能力。
人类喂食大量葡萄糖、果糖和蔗糖,双歧杆菌水平增加,拟杆菌减少。相反,当喂食糖精(一种人工甜味剂)时,拟杆菌丰度增加,罗伊氏乳杆菌减少,微生物发生与天然糖完全相反的变化。
纤维被认为是一种不易消化的膳食成分,有时被称为益生元,因为它通过刺激有益肠道细菌的生长而对宿主有益。
来源包括大豆、菊粉、未精制的小麦和大麦、生燕麦和不可消化的低聚糖,例如果聚糖、聚葡萄糖、低聚果糖 (FOS)、低聚半乳糖 (GOS)、低聚木糖 (XOS) 和阿拉伯低聚糖 (AOS)。
低纤维饮食与较低的细菌丰度有关,而富含这些不易消化的碳水化合物的饮食会增加双歧杆菌和乳酸杆菌。较高的纤维摄入量导致促炎细胞因子IL-6和胰岛素抵抗减少。
✦ 发酵食品可以增加双歧杆菌和乳杆菌水平
除了常量营养素和纤维对肠道细菌的影响外,含有乳酸菌的发酵食品(例如发酵乳制品)也被发现可以增加双歧杆菌和乳酸杆菌的水平。
✦ 多酚具有抗氧化活性能够减少一些致病菌
最后但并非最不重要的是多酚,包括儿茶素、黄酮醇、黄酮、花青素、原花青素和酚酸(存在于水果、种子、蔬菜、茶、可可制品和葡萄酒等食品中),被发现可以增加拟杆菌,减少金黄色葡萄球菌、鼠伤寒沙门氏菌和梭菌等致病菌。
拟杆菌门的成员被假设可以降低细胞内的氧水平,从而有利于厌氧菌的生长,从而促进肠道平衡的维持,并且它们被认为是关键的聚糖降解细菌比厚壁菌门等其他类群更能代谢多酚。
多酚可以改变肠道环境,它们可以被肠道细菌分解代谢,将它们转化为多种化合物比原始化合物具有更强的抗氧化活性。
厚壁菌门/拟杆菌门(F/B比率)作为一个指标在很多关于肠道菌群的研究中被提及和表征,从疾病发生进展,到药物饮食干预,涉及肠道菌群的研究,首先会描述细菌门水平的变化,而人类或动物肠道细菌约90%都属于厚壁菌门与拟杆菌门,而它们的比率也被认为是肠道菌群动态平衡的标志。
拟杆菌门主要为革兰氏阴性菌,能激活T细胞介导的免疫反应,降解多糖保护肠道和其他病原菌,厚壁菌门主要为革兰氏阳性菌,尤其产丁酸的菌,但是更容易吸收能量。
但是肠道菌群受到抗生素,药物,年龄以及分析注释数据库等的影响,此外随着肠道菌群研究队列的扩大,以及对菌群构成与不同疾病状态和药物饮食等因素的相关性研究的深入,F/B比率作为一个相对粗放的指标已经无法准确反映复杂的肠道菌群状况。我们需要更加深入和全面的通过菌属甚至菌种的构成变化来解释和分析肠道菌群特征,并进而更准确的解释肠道菌群和健康及生活方式的关联。
主要参考文献
Stojanov S, Berlec A, Štrukelj B. The Influence of Probiotics on the Firmicutes/Bacteroidetes Ratio in the Treatment of Obesity and Inflammatory Bowel disease. Microorganisms. 2020 Nov 1;8(11):1715.
Mariat D, Firmesse O, Levenez F, Guimarăes V, Sokol H, Doré J, Corthier G, Furet JP. The Firmicutes/Bacteroidetes ratio of the human microbiota changes with age. BMC Microbiol. 2009 Jun 9;9:123.
Gui X, Yang Z, Li MD. Effect of Cigarette Smoke on Gut Microbiota: State of Knowledge. Front Physiol. 2021 Jun 17;12:673341.
Grigor’eva IN. Gallstone Disease, Obesity and the Firmicutes/Bacteroidetes Ratio as a Possible Biomarker of Gut Dysbiosis. J Pers Med. 2020 Dec 25;11(1):13.
Vaiserman A, Romanenko M, Piven L, Moseiko V, Lushchak O, Kryzhanovska N, Guryanov V, Koliada A. Differences in the gut Firmicutes to Bacteroidetes ratio across age groups in healthy Ukrainian population. BMC Microbiol. 2020 Jul 22;20(1):221.
Indiani CMDSP, Rizzardi KF, Castelo PM, Ferraz LFC, Darrieux M, Parisotto TM. Childhood Obesity and Firmicutes/Bacteroidetes Ratio in the Gut Microbiota: A Systematic Review. Child Obes. 2018 Nov/Dec;14(8):501-509.
Hidalgo-Cantabrana C, Delgado S, Ruiz L, Ruas-Madiedo P, Sánchez B, Margolles A. Bifidobacteria and Their Health-Promoting Effects. Microbiol Spectr. 2017 Jun;5(3).
An J, Kwon H, Kim YJ. The Firmicutes/Bacteroidetes Ratio as a Risk Factor of Breast Cancer. J Clin Med. 2023 Mar 13;12(6):2216.

谷禾健康

就在前不久,世界卫生组织将阿斯巴甜列为可能致癌物,引发了人们不小的热议。阿斯巴甜作为人工甜味剂的一种,不提供任何卡路里,就可以提供蔗糖几百倍的甜度。
人工甜味剂几乎不提供热量,或只提供极少的热量,所以深受健身人士及减肥人群的喜爱。人工甜味剂相关产业发展迅速,许多无糖饮料、无糖冰淇淋、巧克力等食品中都有其身影。
除了人工甜味剂外,乳化剂、着色剂、防腐剂等食品添加剂也是现代食品产业的重要组成部分,用于维持或提高食品的口味、安全性、新鲜度和外观。
但随着食品中的添加剂越来越多,其对健康的影响正引起人们的担忧。在此背景下,食品添加剂对微生物群的影响受到广泛研究。
事实上许多国家允许的食品添加剂并不会直接对人产生有害影响,但是会改变肠道微生物及其代谢。近年来出现的证据表明食品添加剂和微生物群之间存在相互作用,这可能会间接影响宿主健康。
例如盐是用于食品保鲜的最常见天然添加剂之一。高盐摄入会改变肠道微生物群组成和粪便短链脂肪酸的产生,通过调节辅助T细胞17影响肠道免疫轴并促进局部和全身组织炎症,可能导致高血压和肥胖。
此外,人工甜味剂有可能引起糖代谢障碍。随着人工甜味剂摄入量的增加,患心血管疾病的风险上升,尤其是阿斯巴甜与脑血管疾病,安赛蜜和三氯蔗糖与冠动脉性心脏病的风险有关。
本文主要总结了食品添加剂中的人工甜味剂、多元醇、乳化剂、色素、防腐剂对人体肠道微生物的影响,并间接导致了一些宿主代谢的变化,已有研究发现过量摄入食品添加剂与肠道炎症之间存在关联。在最后,我们提出了一些有助于减轻食品添加剂对身体的损害的小建议。
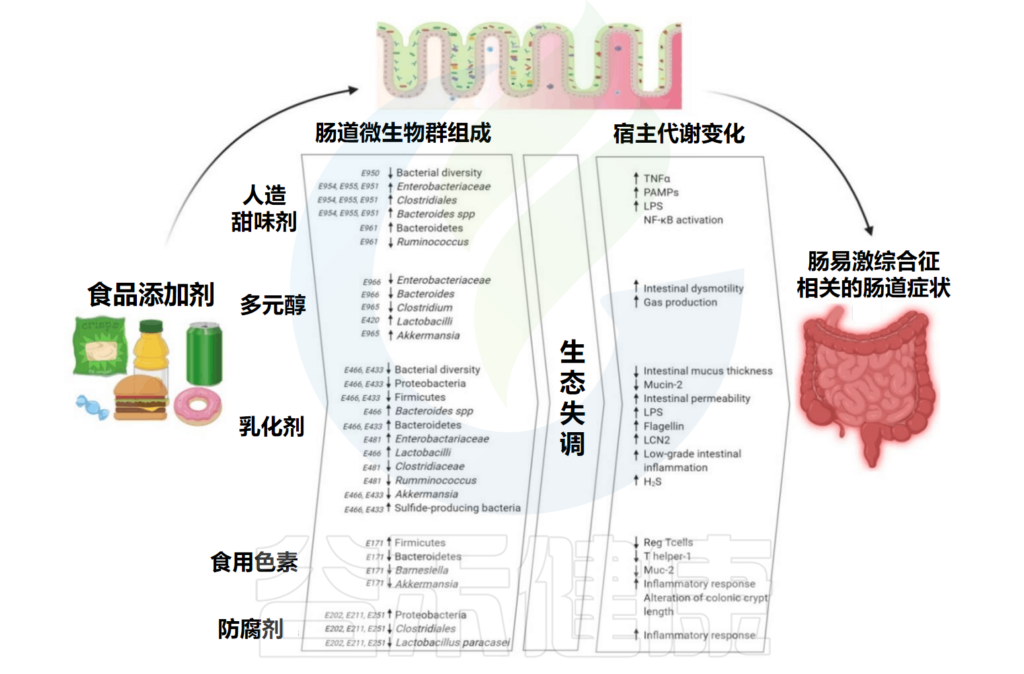
Rinninella E,et al.Int J Environ Res Public Health.2020
甜味剂与食品风味和人体健康密切相关,由于现在许多人们重视对身材的管理,无热量人工甜味剂逐渐兴起,其是蔗糖的替代品,特点是能够在不增加热量摄入的情况下具有更高的甜味强度,不会增加热量或引发血糖反应。
其中包括阿斯巴甜、安赛蜜、三氯蔗糖、糖精、纽甜和相应的化合物,主要存在于无糖饮料、无糖糖果和乳制品中。目前的研究已观察到人工甜味剂引起的肠道微生物群和代谢物的改变。
阿斯巴甜是一种低热量、强效的人造甜味剂。
•阿斯巴甜会改变人体肠道微生物的多样性
在人类中,阿斯巴甜可能不会改变粪便微生物群的丰度,但会改变其多样性。产生短链脂肪酸的细菌(例如双歧杆菌和另一项研究中检测到Blautia coccoides和拟杆菌/普雷沃氏菌比例下降。
•阿斯巴甜会影响短链脂肪酸浓度
在动物实验中,经阿斯巴甜处理后,厚壁菌门和柔嫩梭菌属(Clostridiumleptum)的丰度较高,肠球菌和副萨特氏菌 (Parasutterella)的丰度较低。
注:厚壁菌门和柔嫩梭菌都是重要的产丁酸菌属。
而在另一项人体研究中,随着阿斯巴甜的摄入,血清、粪便和盲肠内容物中的短链脂肪酸(包括丙酸和丁酸)浓度有所增加。
鉴于阿斯巴甜在不同动物和体外研究中存在一定的差异,阿斯巴甜对人体短链脂肪酸的影响还需要更多的实验研究,但目前可以确定的是,阿斯巴甜的摄入对人体短链脂肪酸的含量有影响。
阿斯巴甜存在一定的安全隐患!
需要注意的是,苯丙酮尿症患者苯丙氨酸代谢困难,应控制阿斯巴甜的摄入量。并且在此之前,美国一项研究发现,阿斯巴甜还会导致小鼠产生焦虑行为,这种影响还会跨代遗传。
阿斯巴甜对革兰氏阴性菌N-酰基高丝氨酸内酯(AHL)具有显著的抑制作用,通过群体感应抑制影响肠道微生物群落的平衡,从而促进消化系统疾病的进展。
此外,法国一项大规模前瞻性队列研究的结果表明,较高的人工甜味剂消耗量(尤其是阿斯巴甜)与心血管疾病风险增加之间存在潜在的直接关联。

安赛蜜,又称AK糖,是一种常用的人造甜味剂,也适合1-3岁儿童用于特殊医疗项目。
安赛蜜的可接受每日摄入量为9毫克/公斤体重
•安赛蜜在改变肠道微生物时具有性别特异性
在一项研究中,安赛蜜的摄入量在改变肠道微生物及其代谢物方面表现出高度的性别特异性。
在女性中,观察到乳杆菌属(Lactobacillus)和梭菌属(Clostridium)的丰度较低,Mucispirillum的丰度较高;而在男性中,拟杆菌属、萨特氏菌(Sutterella)、Anaerostipes有所增加。
•过量的安赛蜜会引起肠道炎症
在怀孕和哺乳期间将小鼠暴露于三氯蔗糖和安赛蜜会改变其后代肠道微生物群的α和β多样性,厚壁菌门增加和潜在抗炎细菌Akkermansia muciniphila的极度减少。
抗生素治疗后施用安赛蜜还会诱导硫酸盐还原菌脱硫弧菌的扩增以及结肠中促炎细胞因子的较高表达。
在炎症性肠病患者的粪便样本中,安赛蜜治疗后抗炎细菌减少,并伴有一些细菌功能改变,如脂多糖和胆汁酸合成。这表明安赛蜜诱导的肠道微生物组和代谢物扰动可能是破坏肠道稳态的因素,这可能会增加炎症性肠病的风险。
此外,安赛蜜可能会通过菌群失调引起吲哚美辛诱导的肠道损伤。
三氯蔗糖又名三氯半乳蔗糖,其甜度是蔗糖的600-650倍。
•长期摄入三氯蔗糖会改变肠道菌群并影响胰岛素水平
在人类研究中,摄入三氯蔗糖并不会在短期中影响肠道微生物,而年轻人摄入十周可能会导致Blautia coccoides增加和嗜酸乳杆菌减少,并改变肠道菌群和血清中的胰岛素和葡萄糖水平。
注:B. coccoides是一种参与促炎途径的细菌。
•三氯蔗糖的摄入导致体内多种代谢物改变
三氯蔗糖的摄入导致了多种代谢物的改变。酪氨酸水平升高,而对羟基苯乙酸和肉桂酸水平降低。这些化合物可以抑制参与色氨酸代谢的活性氧的产生。
此外,胆汁酸含量受损,盲肠内容物中胆酸浓度较高,胆酸/鹅去氧胆酸比率较高。研究人员认为这些代谢物的变化将导致引发和维持肝脏炎症。
▷大胆推测:三氯蔗糖会增加结肠炎的易感性
根据现有证据,我们认为三氯蔗糖对结肠炎有害,会增加促炎细菌的丰度。
三氯蔗糖会增加2,4,6,三硝基苯磺酸诱发的结肠炎易感性,并导致拟杆菌门和变形菌门的水平升高,厚壁菌门和放线菌门的数量减少。
最近的一项调查还发现,三氯蔗糖可能会增加患结肠炎相关结直肠癌的风险。
邻苯甲酰磺酰亚胺,俗称糖精。是一种热量为0的甜味剂,其甜度为蔗糖的300~500倍,但吃起来会有轻微的苦味和金属味。大部分糖精会被吸收并最终通过尿液排出,而未被吸收的糖精则通过粪便排出体外。
•糖精的消耗导致黏膜炎症细胞富集并改变肠道通透性
最近的一项研究发现,糖精的消耗会导致粘膜炎症细胞的富集并改变小鼠的肠道通透性。
此外,用抗生素预处理的糖精暴露小鼠可诱导较低水平的粘膜炎症和肠道屏障功能障碍。这些发现表明肠道菌群失调被认为是介导这些异常的原因。
•大量食用糖精会导致菌群失调
盲肠内容物中糖精的高含量与需氧菌群的增加有关。糖精暴露会导致严重的菌群失调,从而导致葡萄糖不耐受。许多增加的类群属于拟杆菌门和梭菌目,但厚壁菌门和蓝藻门减少了。
在无菌小鼠中无法诱导代谢变化,但在移植肠道微生物群后却发生了代谢变化。糖精还会导致肝脏炎症,导致阿克曼氏菌、棒状杆菌(Corynebacterium)和Turicibacter增加,并减少Anaerostipes、瘤胃球菌(Ruminococcus)和Dorea。
纽甜的味道比蔗糖甜7000-13000倍。纽甜的摄入降低了粪便微生物组的α多样性并改变了β多样性。
观察到厚壁菌门数量急剧下降。拟杆菌门,尤其是拟杆菌属的丰度增加。值得注意的是,毛螺菌科和瘤胃球菌科的多种成分显著减少,包括Blautia、Dorea、Oscillospira和瘤胃球菌属。
•纽甜的摄入改变了丁酸等物质的代谢
纽甜的摄入还改变了肠道微生物组的两种丁酸发酵途径。其中一条途径包括编码t4-羟基丁酰辅酶A脱水酶、丁酰辅酶A脱氢酶和乙酸辅酶A转移酶的三个基因的减少。这些基因参与了琥珀酸发酵为丁酸的过程。
另一方面,有关丙酮酸发酵丁酸的上游基因也被下调。此外,氨基酸代谢、脂多糖生物合成和抗生素生物合成增强,而脂肪酸和碳水化合物代谢途径减少。
为了方便大家观看,谷禾将一些食品添加剂与肠道微生物群之间的相互作用整理在了下表:




Liu C,et al.Nutrients.2022
人工甜味剂对肠道功能和代谢的影响
多项研究探讨了人工甜味剂对肠道微生物群和宿主生理功能的影响。他们证明人工甜味剂消耗与胰岛素抵抗和葡萄糖耐受不良增加之间的关联。
•富含人工甜味剂的饮食可能导致病态肥胖
研究表明,与对照小鼠相比,食用糖精的小鼠的聚糖降解显著增加。鉴于肠道细菌将聚糖发酵成短链脂肪酸,接触糖精可能会减少短链脂肪酸的产生。
丁酸盐通过肠-脑神经回路降低食欲和激活棕色脂肪组织而具有关键的抗肥胖作用。因此富含人工甜味剂的饮食可能与成年人的病态肥胖有关。
这些结果强调了一些人工甜味剂对聚糖发酵和短链脂肪酸产生的潜在不利影响,从而导致代谢紊乱。
•长期食用人工甜味剂会诱导炎症反应
此外,分析了给予糖精6个月后的小鼠肝脏,报告显示,与对照组相比,糖精处理的小鼠肝脏出现明显的肝脏炎症,且TNF-α基因表达升高。
注:TNF-α是炎症中的关键细胞因子,TNF-α的表达可以激活NFκB通路并诱导细胞损伤和炎症反应。
如前所述,在动物模型中,人工甜味剂的摄入可能会增加拟杆菌和肠杆菌科。肠杆菌科,如大肠杆菌、克雷伯菌属和变形杆菌属,位于粘膜上皮附近。
病原体感染、化学诱导的结肠炎或宿主免疫力不足可能导致肠道炎症,并刺激肠杆菌科的生长。因此,人工甜味剂似乎与肠道微生态失调、肠道炎症以及肠易激综合征相关的症状有关。
谷禾在下图中汇总了各种食品添加剂对肠道代谢产物的影响:



Liu C,et al.Nutrients.2022
多元醇,也叫糖醇,是一种有机物。主要种类有赤藓糖醇、异麦芽酮糖醇、山梨糖醇和木糖醇。它们天然存在于一些水果、蔬菜和蘑菇中。
其热量约为白糖的一半,并且只会导致血糖轻微变化。它们中的大多数在宿主中不能被很好地吸收或代谢,并且一部分会被结肠中的微生物群发酵。
糖醇对肠道微生物和代谢物的影响
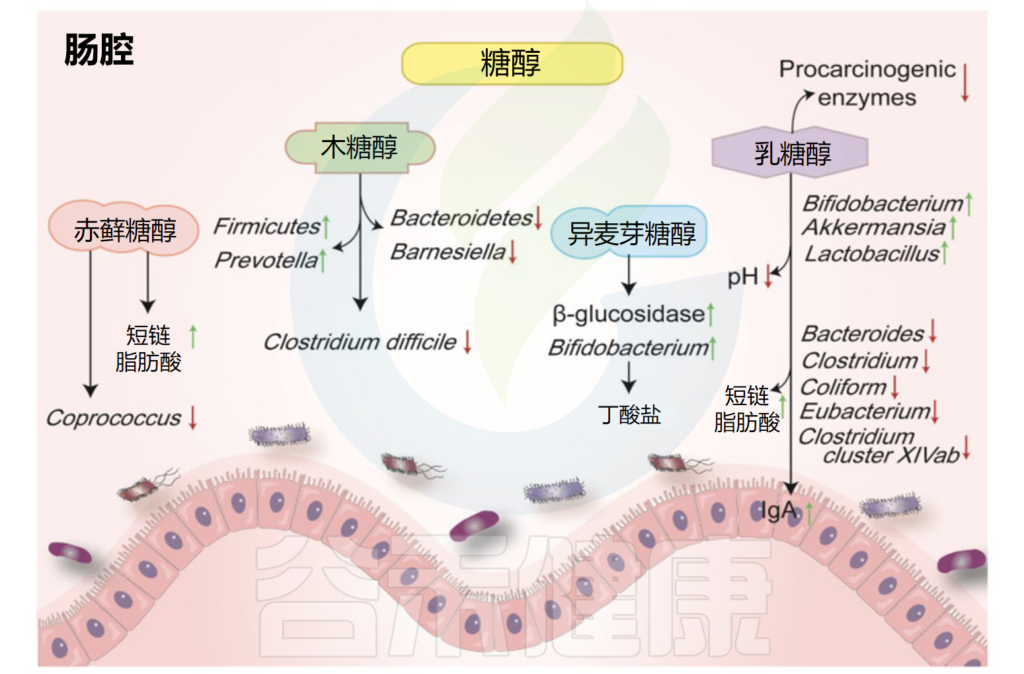
Liu C,et al.Nutrients.2022
赤藓糖醇在自然界中广泛存在,葡萄、梨、蘑菇、地衣中都有赤藓糖醇。摄入赤藓糖醇后,约90%可被小肠吸收,但代谢率很低,并主要以原形通过尿液排出体外。
•摄入赤藓糖醇增加了体内短链脂肪酸含量
在结肠中,肠道菌群可以代谢未吸收的部分。研究证明,摄入赤藓糖醇会导致丁酸和戊酸增加。考虑到到达大肠的赤藓糖醇数量有限,该化合物仅对肠道微生物群的组成产生轻微影响。
然而,赤藓糖醇会增强肠道微生物群以产生短链脂肪酸,从而减轻肠道炎症。赤藓糖醇被发现可以改善高脂肪饮食中的小肠炎症,并诱导粪球菌属丰度降低。
注:研究发现摄入赤藓糖醇后血清、粪便和白色脂肪组织中短链脂肪酸的浓度明显升高。
▷目前认为赤藓糖醇是一种对肠道稳定有利的物质
尽管缺乏赤藓糖醇对炎症性肠病的直接证据,但它被认为是一种对细菌友好的多元醇,可以稳定肠道微环境,并且可以降解为对炎症性肠病友好的代谢物。
异麦芽酮糖醇长期以来一直在食品和制药工业中用作甜味剂。微生物可以很容易地降解结肠中未吸收的异麦芽酮糖醇。
•异麦芽酮糖醇提高双歧杆菌的丰度
最近的研究认为它是一种益生元。在人类肠道中发酵的异麦芽酮糖醇可提高双歧杆菌的丰度并抑制致病菌,此外还降低了细菌β-葡萄糖苷酶的活性。
粪便中的短链脂肪酸、乳酸、胆汁酸、中性甾醇、苯酚和对甲酚也发生了变化。一些双歧杆菌菌株可以在体外发酵异麦芽,产生更高含量的丁酸盐。然而,暴露于异麦芽后没有发现不同的基因表达。
尽管很少有临床试验探讨异麦芽酮糖醇对肠道炎症的影响,但异麦芽酮糖醇可能被认为是一种双歧多元醇,是肠道稳态和微环境的“亲密朋友”。
木糖醇是是从白桦树、橡树、玉米芯、甘蔗渣等植物原料中提取出来的一种天然甜味剂。木糖醇被认为是一种非致龋性甜味剂,常被应用于口香糖中。
•木糖醇有一定的抗炎作用并能抑制变型链球菌
据报道,木糖醇会影响肠道菌群,并对脂多糖诱导的炎症细胞因子表达具有抑制作用。在一项人体研究中,摄入包括木糖醇在内的低消化性碳水化合物会导致Anaerostipes spp和粪便中的丁酸盐显著升高。
木糖醇降低了粪便拟杆菌(Bacteroidetes)和Barnesiella属的水平,而厚壁菌门和普雷沃氏菌(Prevotella)的丰度增加。较低的木糖醇浓度还可以抑制有害的变形链球菌。
注:变型链球菌是口腔天然菌群中占比例最大的链球菌属中的一种,是龋病的主要致病菌。
因此,我们认为木糖醇可能有利于肠道菌群的生长和代谢,而不会对肠道产生低有害刺激。
其他食品添加剂对肠道菌群及其功能的影响

编辑
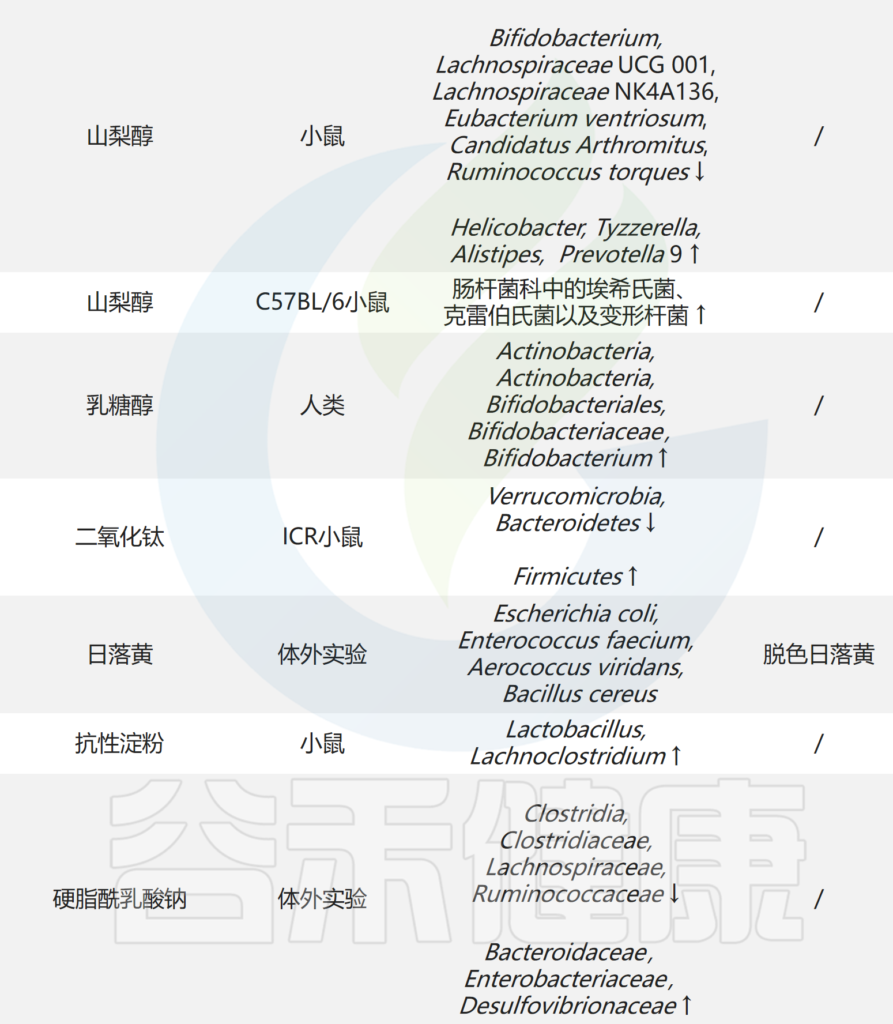
Zhou X,et al.Molecules.2023
多元醇引起的菌群变化对肠道健康有益
多元醇属于所谓的“FODMAP”(可发酵低聚糖、二糖和单糖以及多元醇)饮食类别。近年来,FODMAP饮食已成为肠易激综合征患者的宝贵治疗选择,对其限制将改善肠易激综合征治疗的结果。
“FODMAP”一词于2004年创建,用于定义高度可发酵的碳水化合物和多元醇。
乳化剂在日常生活中被广泛应用,因为它们能够稳定乳液并通过防止储存期间分离来延长保质期。它们还可以通过食品中的脂肪分子充当胶凝剂和表面活性剂。
常见的乳化剂包括羧甲基纤维素、聚山梨酯、卡拉胶等。它们存在于各种加工食品中,如酱汁、布丁、人造黄油和冰淇淋,在西方饮食中非常普遍。研究发现乳化剂会通过肠道微生物影响人体健康。
乳化剂通过肠道微生物诱发结肠炎的机制
编辑
Liu C,et al.Nutrients.2022
羧甲基纤维素(CMC)和聚山梨酯80(P80)常见于食用油、冰淇淋、蛋糕粉、糖霜和巧克力糖浆中。然而,接触乳化剂CMC和P80会对肠道微生物群产生负面影响。
•可能通过微生物群驱动肠道炎症
有益菌如短链脂肪酸的生产菌减少
聚山梨酯80的施用引起了与炎症性肠病类似的人类肠道微生物群的改变,导致有益的双歧杆菌属、重要的短链脂肪酸生产者如粪杆菌属和罕见小球菌属 (Subdoligranulum)以及Clostridium leptum的减少。
炎症性肠病相关病原菌增长显著
在小鼠中,摄入P80会加剧吲哚美辛诱发的回肠炎,从而降低肠道微生物群的α多样性。包括肠杆菌科在内的硫化物生产者的生长和炎症性肠病相关物种奇异变形杆菌的群集行为得到显著促进。
群集是一种鞭毛介导的运动,需要营养细胞分化成一种称为群集细胞的特殊细胞类型。奇异变形杆菌的群集能力与其在炎症性肠病中的发病机制高度相关。
增加病原菌的入侵
研究发现长期摄入羧甲基纤维素或聚山梨酯80会诱发低度肠道炎症,并促进易患这种疾病的小鼠出现严重结肠炎,最终导致细菌入侵增加。
卡拉胶,又名角叉菜胶,是从麒麟菜、石花菜、鹿角菜等红藻类海草中提炼出来的亲水性胶体。它们常见于调味牛奶、冰咖啡、乳制品冰淇淋和冷冻甜点中。
卡拉胶的代谢主要由宿主肠道微生物群进行。因此,肠道微生物直接与卡拉胶相互作用,影响肠道稳态。有趣的是,不同种类和分子量的卡拉胶对宿主有不同的影响。
卡拉胶可分为低分子量或高分子量、降解或未降解卡拉胶。
•低分子量的卡拉胶会增加肠道通透性并与结肠炎相关
低分子量卡拉胶已被证明可以增加肠道通透性并与结肠炎的发生有关。据报道,角叉菜胶会诱发和加重肠道炎症,改变肠道微生物群组成。
卡拉胶的摄入导致变形菌门和脱铁杆菌门(Deferribacteres)的增加,以及厚壁菌门、放线菌门和拟杆菌门的减少。
卡拉胶的不同异构体均被认为会对肠道生态产生有害影响。对于人类肠道微生物群,每种异构体都会诱导α-多样性的变化并增加微生物群的促炎潜力。
κ-卡拉胶和λ-卡拉胶显著富集了拟杆菌,而ι-卡拉胶减少了Faecaliberium,处理后鞭毛蛋白含量更高。κ-卡拉胶在高脂饮食模型中诱导了结肠炎,显著增加了志贺菌并减少了双歧杆菌。两种炎症相关细菌Alistipes finegoldii和Bacteroides acidifaciens的丰度也显著增加。
然而,高分子量卡拉胶可能具有良好的抗肿瘤和抗氧化活性。此外,之前的研究认为,肠道微生物组的改变仅在饮用水中添加卡拉胶时观察到,而在补充卡拉胶的饮食中则未观察到,这表明与蛋白质等其他食物成分的结合可能改变其构象并消除其对某些细菌的生物利用度。
▷推测:食用卡拉胶不利于肠道炎症患者恢复
在一项研究中,两种协同菌株:Bacteroides xylanisolvens 38F6A4和E. coli 38F6C1是从健康人的粪便中获得的,并给予无菌小鼠,与卡拉胶一起食用时会加剧肠道炎症。
对于缓解期的溃疡性结肠炎患者,在含卡拉胶的饮食治疗后复发率较高。鉴于卡拉胶对炎症性肠病患者和肠道菌群的直接有害作用,我们推测卡拉胶可能由于肠道菌群和肠道稳态紊乱而对炎症性肠病患者产生有害影响。
!
乳化剂可能通过肠道微生物影响宿主心理
研究结果表明,膳食乳化剂也可能对肠脑轴产生影响,并通过微生物群依赖机制诱导暴露者的心理/行为障碍。
肠道微生物群中聚山梨酯80和羧甲基纤维素依赖性的变化也是小鼠性别特异性行为和神经改变的原因。特别是,雌性获得了反社会行为,而雄性表现出更高的焦虑水平。
这两种变化都与微生物群特征和α-黑素细胞刺激素水平的明显变化相关,这两个神经肽参与调节焦虑相关行为、食欲和能量。
小结
乳化剂中羧甲基纤维素和聚山梨酯80过量食用会导致生态失调,粘液降解细菌过度生长,以及白细胞介素10或Toll样受体5进一步缺乏。
乳化剂可能还会增加肠上皮屏障中病原微生物的易位,引起肠道炎症,从而导致炎症性肠病发病率增加。
除此之外,乳化剂等胶体还会通过肠脑轴、肠肝轴、肠道与骨骼、心血管之间的联系进一步影响人体代谢和健康。
其他乳化剂在体内的生理影响



Tan H,Nie S.FEMS Microbiol Rev.2021
乳化剂和相关微生物代谢对人体的影响
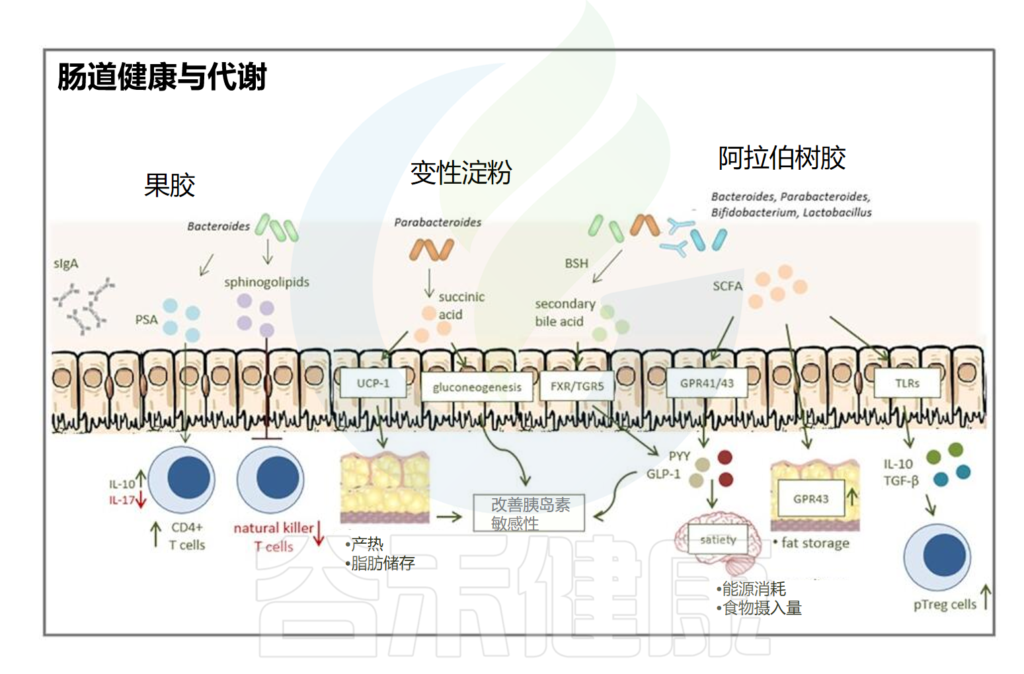
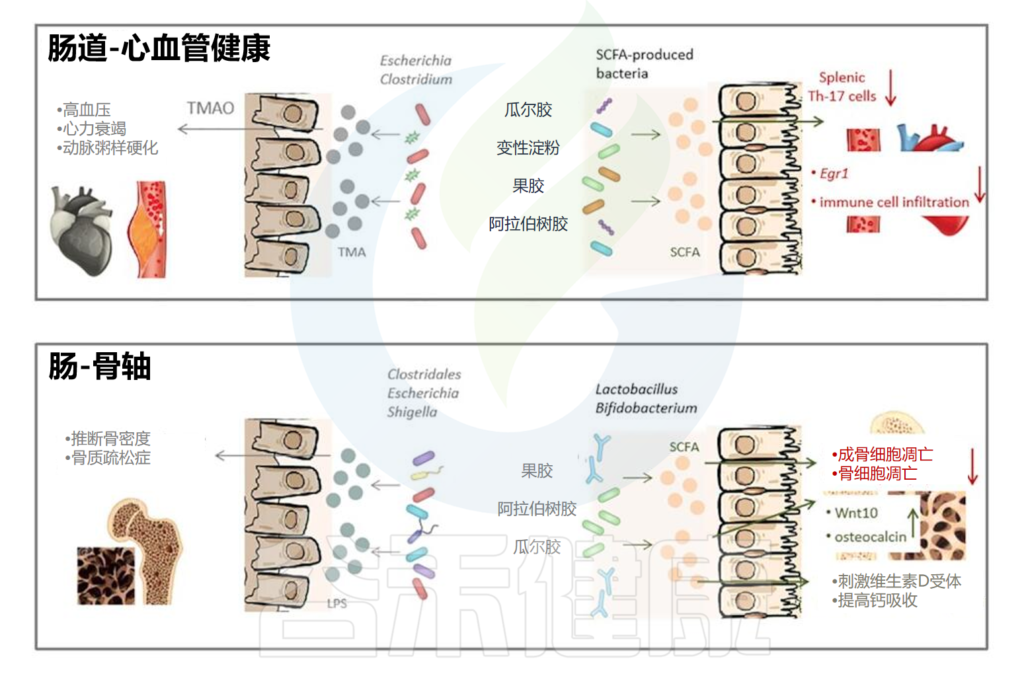
编辑
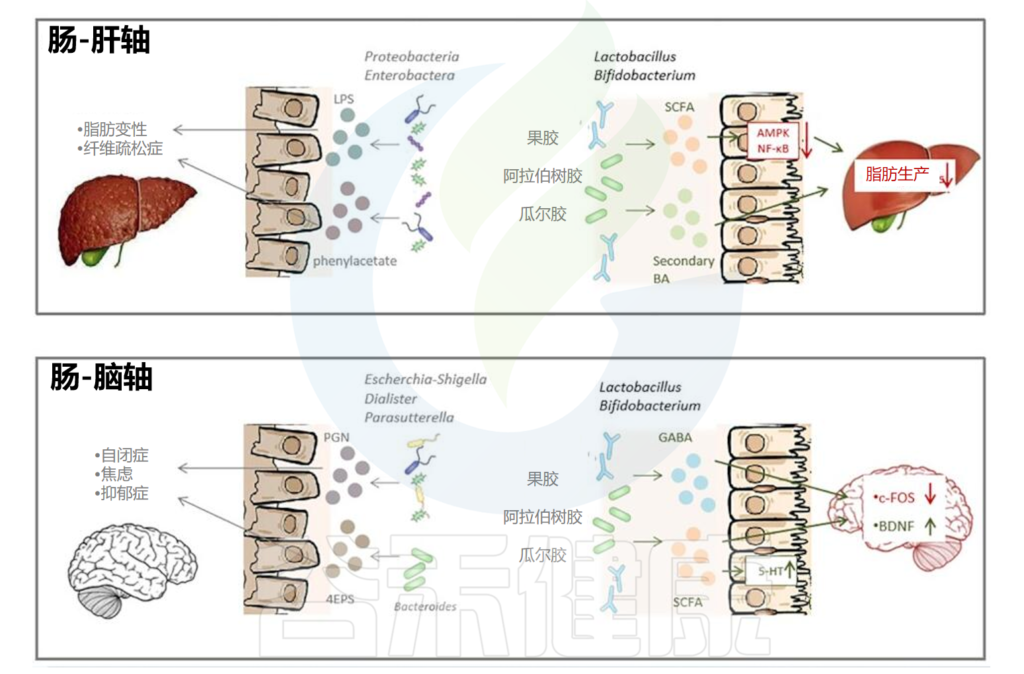
Tan H,Nie S.FEMS Microbiol Rev.2021
食品着色剂又称食品色素,是以食品着色为主要目的,赋予食品色泽和改善食品色泽的物质。
食品着色剂主要添加到奶酪、酱汁、冰淇淋、糕点、糖果、巧克力和口香糖中。
二氧化钛(TiO2)是我国常用的食品着色剂,通常用作食品中的增白剂或增亮剂。
•二氧化钛影响肠道保护细菌的丰度
近年来,各种研究试图确定口服二氧化钛对小鼠和人类肠道微生物群组成的影响。在用二氧化钛处理的小鼠中,与对照组相比,观察到厚壁菌门显著增加,拟杆菌门减少。特别是,巴恩斯氏菌(Barnesiella),一种关键的保护性肠道细菌,其丰度受到二氧化钛暴露(160mg/kg/天,持续28天)的显著影响。
巴恩斯氏菌(Barnesiella)可以清除肠道中的有害细菌。消除对万古霉素耐药的肠球菌的定植,并抑制抗生素耐药细菌的传播。它还可以改善环磷酰胺等抗癌化合物的性能。
巴恩斯氏菌(Barnesiella)的减少可能与炎症性肠病的发病机制有关。此外,它们导致结肠中的炎症浸润和线粒体异常,粪便中Turicibacter属和格氏乳杆菌(Lactobacillus gasseri)和Lactobacillus NK4A136_group的增加。
•高剂量的二氧化钛会诱导肠道炎症加剧
在人类中,添加二氧化钛会导致肠道微生物群多样性适度下降,并导致卵形拟杆菌(Bacteroides ovatus)和Clostridium cocleatum减少。
卵形拟杆菌(Bacteroides ovatus)被誉为新一代益生菌,在肠道免疫、肿瘤治疗、膳食纤维代谢方面发挥重要作用。
剂量反应实验表明,单独使用微量二氧化钛对两组巨噬细胞的吞噬作用没有影响。然而,高剂量的二氧化钛与细菌抗原协同作用,可促进巨噬细胞产生 IL-8、肿瘤坏死因子-α和IL-10,并损害其转化生长因子-β分泌/吞噬细胞活性。
据报道,喂食富含二氧化钛饮食的小鼠肠道炎症加剧。特别是,微生物群组成发生了显著变化,活性氧释放增强,NLRP3炎症小体激活。
!
食品着色剂会影响肠道稳态
二氧化钛等食品着色剂可能会影响肠道稳态。事实上,各种研究已经证明了二氧化钛暴露与对肠道微生物群功能性不利影响之间的潜在关联。
炎症反应加剧
在口服二氧化钛一周(10mg/kg体重/天)的大鼠中,在派尔贴片的免疫细胞和参与炎症反应的调节性T细胞中检测到二氧化钛。具体而言,在二氧化钛暴露后,从Peyer贴片中分离的免疫细胞的刺激显示辅助性T细胞减少,IFN-γ分泌增加,Th1/Th17炎症反应增加。
注:更进一步研究表明二氧化钛暴露与啮齿动物肠道疾病和结直肠癌的发展之间可能存在关联。
短链脂肪酸水平降低
研究了小鼠体内不同剂量的二氧化钛(2、10、50 mg/kg体重/天),并报告了高剂量暴露后短链脂肪酸水平的降低、粘液相关基因表达的降低、炎症反应的增加和结肠隐窝长度的改变。
不同食品着色剂对粘膜屏障和肠道微生态的影响
Liu C,et al.Nutrients.2022
所有这些发现表明,由于暴露于二氧化钛等食品着色剂而导致的菌群失调可能导致微生物群失调,其中特定科和属细菌的变异可能参与炎症性肠病的发病机制。
食品防腐剂可以延缓食品的降解,延长食品的保质期,限制微生物的生长,抑制食品的氧化。
防腐剂的益处和安全性存在争议,许多常见的防腐剂,如苯甲酸、山梨酸钾、亚硝酸钠和亚硫酸钠以及银纳米颗粒被报道可以诱导肠道微生物群的改变。
美国儿科学会警告说,防腐剂可能与恶化的多动行为或致癌风险有关。
苯甲酸和苯甲酸钠均可作为食品防腐剂,因为它们能够限制病原微生物的生长。所有吸收的苯甲酸均可完全降解为马尿酸。
•适量的苯甲酸会提高有益微生物的水平
最近的研究发现苯甲酸和苯甲酸钠通过调节氧化状态和免疫状态对肠道屏障功能和肠道微生物群的有益影响。
苯甲酸处理增强了回肠微生物群的生物多样性,以剂量依赖性方式降低了总需氧细菌的丰度。它还会减少十二指肠中革兰氏阴性菌的丰富度。在小猪中,苯甲酸处理增加了肠绒毛的高度,提高了有益微生物(例如双歧杆菌和乳杆菌)的水平,并减少了有害微生物的数量。
•过量摄入可能会破坏肠道屏障
然而,过量摄入苯甲酸可能会通过氧化还原状态破坏肠道屏障。
最近的研究报告称,苯甲酸增加了小鼠中诱导变形菌失调的易感性。值得注意的是,变形菌的增殖被认为是生态失调的潜在诊断标志物,并且与炎症性肠病等疾病的风险相关。
虽然现有的研究对苯甲酸表现出相互矛盾的观点,仍需要更多的研究来阐明其对肠道菌群和肠道炎症的影响。
山梨酸钾是一种低毒防腐剂,能强烈抑制腐败细菌和霉菌,其对感官特性影响轻微。
•山梨酸钾会降低肠道微生物多样性
先前的研究报道,山梨酸钾通过改变宿主免疫来抑制肠道微生物群的生存能力。暴露于山梨酸钾显著降低了斑马鱼肠道中IgG、IL-1β和TNF-α的含量,并激活了免疫系统。
在属水平上,有益菌粪杆菌(Faecalibacterium)以及病原菌气单胞菌(Aeromonas)和甲基杆菌(Methylobacterium)的含量呈现显著下降趋势。在体外,施用山梨酸钾后,普氏粪杆菌的生长也显著下降。
•革兰氏阳性菌可能阻碍山梨酸钾的传递
值得注意的是,山梨酸钾的亲脂性在调节不同类型的肠道微生物群中发挥着重要作用。革兰氏阴性细菌细胞壁中含有大量脂质,从而抑制转录和碳水化合物代谢途径。然而,革兰氏阳性菌含有较高的肽聚糖含量,可能会阻碍山梨酸钾的传递。大肠杆菌已被证明通过其外排泵机制对山梨酸钾具有抗性。
亚硫酸钠是常见的食品防腐剂之一。
•亚硫酸钠对人体有一定的危害
它强烈抑制普拉梭菌(Faecalibacterium prausnitzii)的生长。干酪乳杆菌、鼠李糖乳杆菌和植物乳杆菌因具有产生乳酸的能力而被认为是有益的肠道细菌,但它们也减少了。
在另一项研究中,亚硫酸钠持续降低奇异变形杆菌、Escherichia fergusonii、摩氏摩根菌(Morganellamorganii)的活力。亚硫酸钠对肠道有益菌较强的抗菌能力,可能诱发肠道疾病。
•具有抗炎特性的细菌可能对防腐剂更敏感
在一项体外研究中,发现人类肠道微生物对亚硝酸钠、苯甲酸钠和山梨酸钾高度敏感,尤其是酪丁酸梭菌(Clostridium tyrobutyricum)或副干酪乳杆菌(Lactobacillus paracasei),具有已知的抗炎特性,与具有促炎或致大肠杆菌特性的粪肠球菌或多形拟杆菌相比,对这三种防腐剂更敏感。
减轻食品添加剂对身体损害的一些建议
•选择天然食物:尽量选择天然食物,例如新鲜水果、蔬菜、全谷物和未经加工的肉类。这些食物通常不含添加剂。
•阅读食品标签:在购买加工食品时,仔细阅读食品标签。避免购买添加剂含量较高的食品,特别是那些含有大量人工色素和防腐剂的食品。
•自制食物:尽量选择自制食物,这样可以控制所使用的成分和添加剂的量。自制食物可以使用新鲜的食材,并尝试使用天然的调味料来增添风味。
•限制加工食品摄入量:减少加工食品的摄入量,特别是那些高度加工和包装的食品。这些食品通常含有更多的添加剂。
•多样化饮食:保持饮食的多样性,摄入各种不同类型的食物。这样可以减少对某一种食品及其潜在添加剂的过度依赖。
需要注意的是,并非所有的食品添加剂都对每个人都会产生负面影响。食品添加剂经过严格的监管和安全评估,以确保在合理摄入量下的安全性。
然而,对于敏感人群来说,或在过量摄入的情况下,某些食品添加剂可能会引起问题。因此,适度和平衡地摄入食品添加剂是很重要的。
越来越多的研究调查肠道微生物群与食品添加剂之间的相互作用,在总结当前研究中收集的信息后,我们得出结论:食品添加剂对肠道微生物群和肠道稳态产生多种影响,这可能与肠道炎症的发病和进展有关。
食品添加剂显著介导细菌功能的改变。总而言之,安赛蜜、三氯蔗糖和糖精等甜味剂可能通过提高细菌炎症潜力而诱发或加剧结肠炎。
羧甲基纤维素和聚山梨酯80等乳化剂被认为会改变肠道微生物群的多样性并增加细菌的侵入,从而对肠道健康有害。
食品着色剂的安全性应重新评估,因为其会引发肠道紊乱和菌群失调;然而,多元醇似乎通过改善肠道微生物的结构和功能而对肠道微生物群有益。
根据目前的证据和法规,必须谨慎考虑对炎症性肠病患者不利的食品添加剂,例如食品着色剂和乳化剂,包括羧甲基纤维素和聚山梨酯80。
尽管研究显示食品添加剂对肠道微生物组和肠道炎症有不同的影响,但将体外或动物模型中获得的相同结果归因于人类是不可行的。因此,未来的研究应该基于生物相关模型来复制人类的生理条件。
总之,需要更多的研究来阐明食品添加剂、肠道微生物群和人体健康之间的关系,并了解后代由于当代人的消费习惯而可能面临的炎症性肠病风险。
相关阅读:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
主要参考文献
Zhou X, Qiao K, Wu H, Zhang Y. The Impact of Food Additives on the Abundance and Composition of Gut Microbiota. Molecules. 2023 Jan 7;28(2):631.
Rinninella E, Cintoni M, Raoul P, Gasbarrini A, Mele MC. Food Additives, Gut Microbiota, and Irritable Bowel Syndrome: A Hidden Track. Int J Environ Res Public Health. 2020 Nov 27;17(23):8816.
Tan H, Nie S. Functional hydrocolloids, gut microbiota and health: picking food additives for personalized nutrition. FEMS Microbiol Rev. 2021 Aug 17;45(4):fuaa065.
Liu C, Zhan S, Tian Z, Li N, Li T, Wu D, Zeng Z, Zhuang X. Food Additives Associated with Gut Microbiota Alterations in Inflammatory Bowel Disease: Friends or Enemies? Nutrients. 2022 Jul 25;14(15):3049.
Del Pozo S, Gómez-Martínez S, Díaz LE, Nova E, Urrialde R, Marcos A. Potential Effects of Sucralose and Saccharin on Gut Microbiota: A Review. Nutrients. 2022 Apr 18;14(8):1682.
Ravash N, Peighambardoust SH, Soltanzadeh M, Pateiro M, Lorenzo JM. Impact of high-pressure treatment on casein micelles, whey proteins, fat globules and enzymes activity in dairy products: a review. Crit Rev Food Sci Nutr. 2022;62(11):2888-2908.
Laudisi F, Stolfi C, Monteleone G. Impact of Food Additives on Gut Homeostasis. Nutrients. 2019 Oct 1;11(10):2334.
Abiega-Franyutti P, Freyre-Fonseca V. Chronic consumption of food-additives lead to changes via microbiota gut-brain axis. Toxicology. 2021 Dec;464:153001.

谷禾健康

营养不良的微生物 Malnourished Microbes
儿童营养不良是全球主要的健康负担,营养干预措施只能部分解决这一问题。儿童营养不良的慢性和急性形式均以多种生物系统紊乱为特征,包括新陈代谢、免疫和内分泌系统。
越来越多的证据支持肠道微生物组在调节这些影响早期生命生长的途径中的作用。观察性研究报告了营养不良儿童肠道微生物组的变化,而临床前研究表明,这可能引发肠病,改变宿主代谢,并破坏免疫介导的针对肠道病原体的抵抗力,这些都会导致早期生命生长不良。
肠道微生物组在健康和疾病中发挥着不可或缺的作用,而饮食是其组成、多样性和功能的主要驱动因素。鉴于婴儿和儿童肠道微生物组的动态发育,解决两个主要问题至关重要:
a) 饮食能否改变肠道微生物组的组成、多样性或功能
b) 这种修改是否会影响功能/临床结果,包括免疫功能、认知发展和整体健康?
本文汇编了临床前和临床研究的证据,包括生命早期肠道微生物组影响宿主代谢、免疫、肠道功能、内分泌调节和其他导致儿童营养不良的途径的新兴病理生理学途径。
我们综合了儿童青少年的营养、营养干预措施和肠道微生物群之间联系的最新研究,该年龄段儿童是一个生长阶段,对疾病的易感性各不相同。还讨论了营养素如何单独或组合如何影响肠道微生物组的机制。
同时综合并讨论了新兴的微生物组导向疗法,并考虑未来的研究方向,以确定和针对儿童营养不良的微生物组治疗目标。
2013年发表在《柳叶刀》上文章统计,儿童营养不良导致全球儿童死亡人数的 45%,并对健康产生终生影响。全世界超过五分之一的5岁以下儿童至少表现出一种形式的慢性或急性营养不良。
首先我们来了解一下发育迟缓、消瘦的定义。
发育迟缓[定义为年龄别身长 Z 得分 (LAZ) < −2],影响着全球 22% 的儿童,与认知发展较差、终身综合能力下降以及成年后慢性病风险增加有关。
消瘦[定义为身高体重 Z 得分 (WHZ) < –2] 影响着全世界近 7% 的儿童,除了长期认知和健康缺陷不佳之外,还与高死亡率相关。
▸ 目前的治疗方法无法完全解决这一问题
营养疗法不足以完全恢复生长缺陷和营养不良的相关病理生理后果。标准生命早期营养补充剂仅可将发育迟缓降低 12-14%。
而严重消瘦后会出现高死亡率、再入院和长期生长缺陷。因此,存在与儿童营养不良相关的隐藏的病理生理学负担,目前的治疗方法无法完全解决这一问题。
▸ 儿童营养不良与多个生命早期生物系统紊乱有关
发育迟缓和消瘦儿童的肠道功能受到环境肠道功能障碍(EED)的影响。这种肠道病理学损害营养吸收,并可能导致全身炎症,从而损害早期生命生长。
在营养不良的儿童中宿主免疫力广泛缺陷,导致抵抗感染能力受损,特别是病原体密集的环境。
营养良好和营养不良的儿童之间存在激素差异,尤其是与生长 [生长激素 (GH) 和胰岛素样生长因子1 (IGF-1)] 和食欲调节(瘦素和生长素释放肽)相关的荷尔蒙差异。
营养不良时宿主代谢发生改变,氨基酸、脂质和能量代谢受到干扰。这些受到干扰的生理系统表明,儿童营养不良背后存在复杂的病理生理学,涉及相互关联的生物系统。
▸ 微生物群影响生命早期的生长发育
生命早期接触微生物也可能导致儿童营养不良中这些扰动途径。肠道病原体携带量高与线性生长和体重生长下降以及 EED 相关,而腹泻和呼吸道感染也与儿童营养不良密切相关。
除了病原体之外,共生肠道微生物群也会影响早期生命的生长。生命早期复杂微生物组的组装对于免疫训练、对病原体的定植抵抗、母乳寡糖(HMO) 和其他营养物质的代谢、肠道结构和内分泌信号传导至关重要。
因此,儿童时期肠道微生物组的破坏可能会损害这些有助于儿童健康成长的途径。
▸ 儿童在出生时就获得了一些的微生物组
除了环境获得的微生物外,这些微生物组主要源自母体肠道、阴道、口腔和皮肤微生物组。
在纯母乳喂养的儿童中,最初的婴儿肠道微生物群的多样性仍然很低,主要由大肠杆菌、双歧杆菌和拟杆菌组成物种。
在接下来2-3 年里,肠道微生物群会经历一种模式化的组装,这种组装主要是由纯母乳喂养和随后的补充食品的引入所形成的,这导致肠道微生物群的快速扩张和多样化。
▸ 许多环境因素会影响微生物,从而影响生长
包括地理位置、分娩方式、抗生素暴露、胎龄以及其他母亲和家庭因素。这些微生物群在出生后在胃肠道内的积累,除了肠道结构和对病原体的定植抵抗力之外,还推动了免疫、代谢和内分泌途径的成熟,这些都有助于儿童的正常生长。
如果微生物演替因营养不足、卫生或抗生素暴露而受到干扰,这些生长决定途径可能会受到损害。很少有研究纵向研究在营养匮乏的环境中保持良好营养的儿童与消瘦或发育迟缓的儿童的肠道微生物群的演替和组装情况。
因此,这种依赖高收入环境的微生物组数据库的现象,限制了低收入和中等收入国家中个体所产生的营养不良微生物组的解释性(这也是构建本地数据库和谷禾长期追踪重点人群纵向数据的主要原因),这些国家的肠道微生物组特征不太明确。
来自中低收入国家的横断面和短期纵向研究的越来越多的证据揭示了微生物组的差异,这些差异将营养不良与健康生长区分开来。
▸ 发育迟缓——多因素驱动
“发育迟缓”是一种慢性营养不良的形式,由多种遗传和环境因素共同驱动。高达30%的发育迟缓发生在子宫内,这可以通过出生体重对发育迟缓风险的强烈影响来证明。
之后一系列环境因素有助于产后线性生长。很少有研究纵向研究健康婴儿与发育不良婴儿肠道微生物组的获取和组装情况。
▸ 横断面研究:肠道菌群特征破坏导致发育迟缓
对马拉维和孟加拉国队列的二次分析发现,微生物组多样性减少和Acidaminococcus(氨基酸球菌)丰度增加分别与发育迟缓严重程度和未来线性生长缺陷相关。
其他一些小型横断面研究已经发现,在一系列中低收入国家队列中,发育不良儿童与健康儿童的粪便微生物组组成存在不同差异。来自中非共和国和马达加斯加的一项更大规模的多点横断面分析发现,发育不良儿童的粪便微生物群中大肠杆菌/志贺氏菌和弯曲杆菌种类丰富,而产生丁酸的种类较少。
▸ 发育迟缓的儿童:小肠细菌过度生长
在发育迟缓的儿童中观察到小肠细菌过度生长的比率较高,其特征是十二指肠中口咽微生物的富集。发现一群来自孟加拉国的发育迟缓儿童的小肠细菌载量与 LAZ 之间呈负相关。韦荣球菌属、链球菌属和Rothia mucilaginosa的十二指肠丰度也与 LAZ 呈负相关。
▸ 肠道菌群的功能潜力——预测儿童生长的指标
对 335 名津巴布韦农村的 1 至 18 个月大儿童的肠道微生物组的组成和功能发育的跟踪发现,肠道微生物组的功能宏基因组组成(而非分类组成),可以预测孩子已达到的线性生长和未来的生长速度,其中 B 族维生素和核苷酸生物合成途径是最具预测性的特征之一。这些数据表明,肠道微生物组的功能潜力是儿童生长的更强大的指标。
来自马拉维的一个纵向队列发现了类似的结果,即 16S 测序无法识别成分多样性、成熟度或物种丰度与 LAZ 之间的关联。秘鲁对 6-24 个月大的儿童(作为营养不良和肠道疾病队列的一部分)进行的一项纵向研究表明,成分多样性与线性生长之间存在一定关联,仅针对出生时发育迟缓的儿童。
该研究组另外一项研究究表明,肠道微生物组可能介导腹泻和弯曲杆菌感染对线性生长的影响。除了肠道微生物组细菌成分的影响之外,发育迟缓婴儿与非发育迟缓婴儿中噬菌体(可以调节微生物组组成的病毒)的丰度也有所不同。
总的来说,发育不良儿童的肠道微生物群与营养良好的儿童不同。然而,这因地理群体而异。因此,目前不存在一致的发育迟缓的组成或功能微生物组特征。
▸ 儿童口腔微生物组与发育迟缓有关
发育迟缓的儿童在十二指肠和粪便中表现出更丰富的口咽微生物,包括唾液乳杆菌,这表明胃肠道的隔室化可能导致营养不良儿童中肠道菌群变化,并通过减少营养吸收而导致生长不良或口腔微生物在其生态位之外的炎症作用。
▸ 怀孕期间母亲的口腔微生物组预测儿童营养不良
牙周炎是一种口腔生态失调疾病,会导致局部免疫反应功能失调,并与低出生体重呈负相关。在怀孕期间的母亲口腔中,Actinomyces naeslundii(内氏放线菌)的相对丰度与出生体重和妊娠持续时间呈负相关,而Lactobacillus casei(干酪乳杆菌)则呈正相关,两者都强烈预测儿童营养不良。
▸ 早产的阴道微生物组,与新生儿低出生体重和随后的发育迟缓密切相关
高度多样化、缺乏乳杆菌的阴道微生物群与西方地区的早产以及撒哈拉以南非洲地区新生儿 LAZ 的减少密切相关。阴道微生物组的改变很可能与早产的经典感染触发因素同时发生,包括绒毛膜羊膜炎、细菌性阴道病和泌尿生殖感染,从而导致泌尿生殖环境炎症,这些共同可能限制胎儿生长或引发早产。
▸ 消瘦及其分类:营养不良形式的反映
消瘦是营养不良的一种形式,可以反映慢性营养缺乏和急性疾病,通常与发育迟缓同时发生。
消瘦可分为中度[中度急性营养不良(MAM)]或重度[严重急性营养不良(SAM)],取决于 WHZ 阈值、中上臂围 (MUAC) 和/或水肿的存在。
▸ 水肿性SAM、非水肿性SAM、复杂SAM
SAM 还以两种主要形式存在:
如果出现急性感染、食欲不振、休克或水肿(也称为复杂 SAM)。
患有水肿性和非水肿性 SAM 的儿童具有不同的临床结果,其中非水肿性 SAM 儿童在某些情况下接受 SAM 住院治疗后表现出更高的死亡率和再入院率。
尽管治疗 SAM 的营养疗法有所改进,但需要住院治疗的复杂 SAM 的死亡率在 10% 至 40% 之间,而生长缺陷可能会持续长达7年,此外,日后认知缺陷和慢性病风险也会增加。
▸ 在SAM 儿童肠道中肠道微生物组具有影响力
患有 SAM 的儿童肠道微生物多样性降低,肠杆菌科细菌增多,而与健康生长一致的双胞胎相比,SAM不一致的双胞胎肠道病毒组受到干扰。
▸ 年龄微生物群Z评分——微生物群成熟度指标
2014 年,孟加拉国的一项具有里程碑意义的研究创建了微生物群成熟度指标,称为年龄微生物群Z评分(MAZ),该评分在 SAM 儿童中显着降低,并且与术后营养恢复的人体测量指标高度相关。这项研究和最近的后续研究使得所谓的微生物组生态群得以细化,该生态群由 15 种细菌类群组成,这些细菌类群在不同地理环境中在生命的头 2 年中表现出一致的共变,可用作微生物群落的指标。
不成熟的微生物组发育并衡量MAM 或 SAM 后微生物组的恢复程度。根据 MAZ 的评估,标准治疗性往往只能暂时恢复微生物组的成熟度,表明 MAZ 可能有潜力作为未来 MAM/SAM 复发的指标,或者针对肠道微生物组的营养疗法可能有助于营养恢复。
事实上,这些微生物群成熟度指标为 MAM 中新的微生物群导向营养干预措施提供了信息,在试点研究中,与标准治疗食品相比,这些干预措施在更大程度上改善了营养恢复。
▸ 在水肿性SAM 和非水肿性 SAM 儿童差异
这可能部分解释了他们营养恢复的差异。与水肿性SAM儿童相比,非水肿性 SAM 儿童的α多样性显著降低,并且与普雷沃氏菌科(Prevotellaceae)、毛螺菌科 (Lachnospiraceae) 、瘤胃菌科(Ruminoccoaceae)相对丰度的减少有关。
总的来说,与健康成长的儿童相比,SAM 儿童的微生物组始终不成熟且多样性降低。这种失调的微生物组可能是急性营养状态以及与治疗相关的合并症和抗生素治疗的结果。
如上所述,越来越多的人类观察研究证据表明,营养良好和营养不良的儿童之间的微生物组组成存在差异。
临床前和临床研究已开始揭示,生命早期肠道微生物群紊乱可能导致儿童生长不良的病理生理机制。其中包括肠道微生物组对免疫、新陈代谢、肠道功能和内分泌信号传导等途径的影响(如下图)。
doi.org/10.1146/annurev-nutr-061121-091234
下面我们逐一来了解营养不良的微生物群带来的多方面影响。
共生肠道微生物群的存在,对于生命早期肠道屏障的正常结构、功能和转录发育至关重要。临床前研究的大量证据表明,无菌小鼠幼崽表现出肠道屏障成熟延迟,这与自发性结肠炎、更容易肠道感染和营养吸收不良有关。
生命早期长期接触肠道病原体会破坏肠道结构和功能。环境肠道功能障碍(EED)是一种胃肠道现象,在营养匮乏的环境中很常见,并且经常在营养不良的儿童中观察到(我们以前也专门写过儿童EED的文章)。
▸ 什么是环境肠道功能障碍(EED)?
EED 通常是亚临床的,局限于小肠,其特征是肠道通透性增加、绒毛萎缩和变钝、粘膜屏障变化、吸收不良、局部炎症和隐窝伸长。屏障功能的丧失还导致微生物及其产物(最常研究的是脂多糖)从肠道转移到体循环中,从而刺激全身炎症。据推测,营养吸收不良、肠道炎症和慢性全身炎症的结合会阻碍儿童的健康成长。
▸ 环境肠道功能障碍(EED)与什么相关?
EED 通常归因于在水、环境卫生和个人卫生 (WASH) 较差的环境中长期接触肠道病原体。然而,在此类环境中改善怀孕期间和早期生活中的 WASH 的大型随机试验未能减少幼儿 EED 的常见生物标志物,这可能是由于同时未能减少其肠道病原体携带。
除了病原体携带之外,共生微生物组的破坏也可能导致 EED。对611 名儿童( 6、18 和 30 个月大)大型分析发现,微生物群多样性/成熟度与 EED 的三种生物标志物之间存在负相关:
表明肠道微生物群的不成熟可能会导致肠道炎症和屏障功能障碍。特定菌群的丰度升高,包括Megasphaera、Mitsuokella、Sutterella也与 EED 有关。
注:REG1B,Regenerating family member 1 beta 是一种蛋白质,它是一种由胰腺细胞产生的蛋白质,在胰岛细胞再生和胰岛功能调节中起着重要作用。
REG1B在胰腺细胞再生过程中被表达,且参与了胰岛细胞增殖和分化,对胰岛细胞的生长和修复有促进作用,在胰岛素分泌和血糖调节中发挥一定的调节作用。
EED 动物模型有助于深入了解可能驱动该疾病表型的机制。一些模型能够通过应用低蛋白饮食和 LPS 或吲哚美辛等肠道损伤来复制 EED 的某些方面。
注:吲哚美辛:用于治疗关节炎,癌性疼痛,痛风,滑囊炎、肌腱炎及肩周炎等非关节软组织炎症;可用于高热的对症解热,恶性肿瘤引起的发热或其他难以控制的发热。
▸ 肠道微生物对 EED 的潜在贡献
利用异常微生物状态和改变的营养环境之间相互作用的新模型已经成功地概括了几种 EED 表型。例如,肠道生理学和微生物组通过血管紧张素 I 转换 2 酶 (ACE2) 的表达联系起来。
注:ACE2是一种在分化上皮细胞的管腔表面表达的蛋白质。
与野生型小鼠相比,缺乏 ACE2 的小鼠在受到DSS攻击时,表现出类似 EED 的病理学、氨基酸代谢紊乱和肠道微生物组紊乱。DSS 攻击期间的 EED 表型可以在从 ACE2 缺陷小鼠进行粪便移植后转移到野生型动物中,这表明微生物群被破坏。
注:DSS,右旋糖酐硫酸钠,一种破坏肠上皮屏障并导致结肠炎的刺激物
膳食色氨酸及其代谢物烟酰胺可以通过哺乳动物雷帕霉素靶点 (mTOR) 活性刺激抗菌肽的产生,从而挽救 ACE2 缺陷小鼠的表型,从而维持微生物组稳态。
▸ 微生物结合营养物质影响EED
低蛋白、低脂肪饮食会导致小鼠小肠微生物群遭到破坏,其特点是小肠内物种丰富度升高,此外拟杆菌门和变形菌门也会扩张。
将营养不良的饮食与拟杆菌和大肠杆菌结合起来作者产生了 EED 的表型,包括肠道通透性、绒毛和隐窝萎缩增加、空肠细胞因子 (IL-6 和 MCP-1)释放到腔内增加,以及细菌对小肠上皮细胞的粘附增加。这种表型依赖于微生物组的改变和营养不良的饮食,这表明 EED 表型是复杂的微生物与营养物质相互作用的结果。
总体表明,肠道微生物群破坏在营养不良相关肠道功能障碍的病理学中具有潜在的因果作用。
▸ 腹泻和有症状的呼吸道感染与发育迟缓和消瘦有关
关于腹泻和儿童营养不良的大型多中心研究的有力证据表明,肠道病原体的高负担与生命早期生长不良有关。
健康且多样化的肠道微生物群通过生态位排除提供针对肠道病原体的定植抵抗力。因此,受损的肠道微生物组可能为病原体定植提供了环境。
肠道微生物组也可能介导远处部位的感染易感性,包括肺部。因此,生命早期健康肠道微生物组可能有助于在卫生条件差的环境中抵抗病原体的定植,从而防止感染负担和相关的生长不良。
▸ 发育迟缓:肠道菌群多样性减少——预示腹泻发病率的增加
来自秘鲁的发育不良儿童在生命的前两年表现出肠道微生物组多样化轨迹受损。在此期间,发育迟缓的儿童的微生物多样性显着减少,腹泻后多样性的恢复也较慢。因此,肠道微生物组的组装受损可能会加剧感染-发育迟缓的循环。
来自同一队列的一项研究发现,弯曲杆菌的携带与肠道微生物群的改变有关。此外,肠道微生物组内与弯曲杆菌携带相关的物种与 LAZ 的减少独立相关,这表明肠道微生物组组成受损会促进病原体定植和并发生长缺陷。
▸ 营养不良:微生物组对病原体定植产生影响
与营养良好的小鼠相比,由营养不良饮食和肠道微生物群紊乱引起的 EED 小鼠模型对感染的敏感性更高,这表明与营养不良相关的微生物群破坏可能会导致病原体定植和感染负担。
蓝氏贾第鞭毛虫感染后生长缺陷的易感性也取决于动物模型中的肠道微生物组。人类研究报告称,贾第鞭毛虫和相关的肠侵袭性病原体,除了那些涉及粘膜破坏的病原体外,对全身炎症、肠道炎症和生长受损具有最深远的影响。
在小鼠中,贾第鞭毛虫与小肠中的肠杆菌科细菌相互作用,以限制蛋白质营养不良期间的生长,这种作用在用没有抗贾第鞭毛虫活性的抗菌药物治疗后消失,表明失调的微生物群在此过程中发挥着关键作用。
这种相互作用表明特定的病原体或病原体依赖于共生肠道微生物群的成员来定殖和增殖。这在人类发育迟缓研究中很明显,即肠杆菌科细菌和拟杆菌目细菌之间的交叉喂养与儿童发育迟缓有关。
▸ 在体外,肠杆菌科和拟杆菌目之间协同生长
特别是在蛋白质和铁含量低的营养不良条件下。在这种情况下拟杆菌属利用饮食和粘蛋白衍生的糖和肠杆菌科细菌提高铁的生物利用度,铁是特定病原体增殖所必需的微量营养素。
拟杆菌科和肠杆菌科在营养不良的儿童中具有很强的相关性,但在营养良好的儿童中则没有。另一种拟杆菌属的脆弱拟杆菌,还依赖周围的微生物群来诱导小鼠的生长效应。含有bft毒素的脆弱拟杆菌的产肠毒素菌株会导致无菌小鼠体重减轻和能量代谢受损,这些小鼠被来自发育迟缓儿童的微生物群定植,但对于那些被来自营养良好儿童的微生物群定植的小鼠则不会。
这些数据表明,病原体和感染对儿童营养不良的影响可能依赖于共生肠道微生物群的组成和功能,在儿童营养不良患病率高的环境中减少病原体负担的策略除了考虑病原体负担外,还必须考虑共生微生物群。
营养不良儿童的宿主蛋白质、脂肪和能量代谢紊乱早已有报道。然而,肠道微生物组的代谢能力大大扩展了哺乳动物宿主的生物转化能力,扩大了可加工底物的多样性,并增加了宿主接触的分子范围。
许多微生物衍生的代谢物可以在肠道和肠壁中发挥局部作用,并且在吸收后还可以影响周围组织中的宿主过程。因此,儿童早期肠道微生物组的变化可能会通过改变提供给儿童的代谢副产物和宿主代谢途径本身来影响代谢表型,从而影响生长。
▸ 成熟度与微生物代谢
与用于绘制儿童微生物组成熟度的MAZ评分类似,代谢成熟度模型,称为年龄表组 Z 评分 (PAZ),是根据秘鲁、坦桑尼亚和孟加拉国儿童的尿液样本构建的,并用于追踪生化年龄及其与生长的关系。用于计算 PAZ 的八种代谢物中的三种——对甲酚硫酸盐 (pCS)、苯乙酰谷氨酰胺 (PAG) 和马尿酸,与肠道微生物代谢相关。
有趣的是,与未生长受限的婴儿相比,生长受限的婴儿早在出生后 3 个月就出现生化不成熟(即,其生化年龄低于实际年龄)。这凸显了微生物群在宿主整体代谢能力发展及其对生长的后续影响中的重要性。
健康肠道微生物群的一个主要功能是发酵宿主无法消化的膳食底物。在母乳喂养期间,这主要涉及HMO的微生物消化。患有发育不良婴儿的母亲的母乳中 HMO 含量明显较低,结构相似的牛乳低聚糖可以恢复营养不良模型中小鼠的生长。
然而,这种效果取决于微生物群,因此补充乳寡糖后,无菌小鼠的生长不会恢复。断奶后,肠道微生物群转向不可消化的碳水化合物、抗性淀粉、粘蛋白和蛋白质的代谢。
▸ 糖分解产生短链脂肪酸,满足能量需求
糖分解活性(即碳水化合物的分解)的主要最终产物是短链脂肪酸。这些都有助于宿主日常的能量需求。丁酸盐是结肠细胞的主要能量来源,提供其所需能量的 80%,而乙酸盐在肌肉等全身区域代谢,丙酸盐在肝脏中用于产生 ATP。
这种微生物活动提供了一种从饮食中释放能量的机制,可用于支持生长。此外,短链脂肪酸还具有其他有益作用,例如降低结肠 pH 值以增强对潜在病原体的定植抵抗力并提高矿物质吸收。此外,丁酸盐已被证明可以通过增加 AMP 激活蛋白激酶 (AMPK) 活性和紧密连接蛋白的组装来促进肠道屏障的发育。
▸ 营养不良:从碳水化合物发酵和短链脂肪酸生产转向蛋白水解代谢
例如,与营养良好的儿童相比,印度尼西亚中度营养不良儿童的粪便丙酸盐和丁酸盐含量较低,粪便 pH 值较高。
在营养不良的猪模型中,肠道微生物组产生的丁酸盐较少,并且与肝脏脂肪酸代谢(β-氧化)减少有因果关系。同样,在对巴西东北部儿童进行的代谢组学研究中,发育不良的婴儿排出了更多由微生物降解氨基酸而产生的微生物-宿主共代谢物。
其中包括 pCS 和 PAG,它们分别源自酪氨酸和苯丙氨酸的微生物分解。营养不良病原体相关的EED导致肠道吸收不良可能会推动这一观察。这增加了小肠中氨基酸的可用性,从而导致发育不良儿童中的小肠细菌过度生长,并增加到达结肠进行细菌代谢的氨基酸。
▸ 营养不良:微生物群与发育中的宿主竞争氨基酸
有趣的是,虽然 SCFA 促进上皮屏障完整性,但 pCS 被发现会损害它,可能导致营养不良个体中观察到的肠漏表型。
此外,pCS由艰难梭菌和其他病原体产生,限制肠道微生物群的生物多样性。可能导致营养不良婴儿中观察到的微生物群失调。另外两种氨基酸代谢物,吲哚乳酸和N-乙酰谷氨酸,分别源自色氨酸和谷氨酸代谢,在来自孟加拉国的一组儿童中,它们与 2-24 个月龄之间的线性和体重生长指标呈正相关。长双歧杆菌也与生长呈正相关,它编码了参与这些化合物生产的大部分微生物代谢途径,这些化合物可能有助于支持早期生命的生长。
▸ 膳食胆碱的微生物分解增加还导致蛋白质营养不良和发育迟缓
在蛋白质缺乏的小鼠模型中,尿胆碱减少,而胆碱代谢的微生物产物三甲胺和二甲胺增加。
同样,在马拉维儿童中,血清中三甲胺-N-氧化物(TMAO)与胆碱的比率与线性生长障碍呈正相关。
胆碱和甜菜碱排泄量降低与巴西婴儿发育迟缓有关。胆碱的可用性不仅对于肌肉获得很重要,对于S-腺苷甲硫氨酸 (SAMe)的生成也是必要的,而 S-腺苷甲硫氨酸 (SAMe) 是 DNA 甲基化和发育的关键。
重要的是,胆碱是骨骼肌的必需营养素以及神经发育和大脑功能。胆汁酸是宿主肝脏和肠道微生物群组合代谢产生的代谢物的一个例子,在消化中发挥重要作用。
初级胆汁酸,例如胆酸和鹅去氧胆酸,在肝脏中合成,然后通常与甘氨酸或牛磺酸结合,并分泌到胆汁中。释放到肠道后,一小部分胆汁酸可以到达结肠,在那里微生物群将它们分解并转化为次级胆汁酸,例如脱氧胆酸。这些修饰的胆汁酸可以通过粪便排出或再循环回肝脏。
与没有 EED 的儿童相比,患有 EED 的儿童的血清总胆汁酸含量较低,其中牛磺鹅去氧胆酸、牛磺鼠胆酸和甘氨酰去氧胆酸存在特定差异。除了消化之外,胆汁酸在代谢调节中也发挥着重要作用。通过充当全身表达的受体(例如 FXR、PXR、VDR 和 TGR5)的配体,胆汁酸可以调节多种宿主途径和功能的表达,例如能量稳态、葡萄糖和脂质代谢。
▸ 这些细菌相关代谢物还具有抗菌特性,既能抑制又能促进特定病原体的生长
例如,胆汁酸代谢的变化,特别是细菌胆汁盐水解酶活性,被认为是隐孢子虫卵囊排泄的重要触发因素。此外,观察到未患阿米巴病的儿童粪便中次级胆汁酸、脱氧胆酸的含量较低。研究表明,给小鼠注射这种胆汁酸足以增加粒细胞-单核细胞祖细胞的数量,并提供针对阿米巴病的保护。这表明胆汁酸可能在预防营养不良环境中常见的不同肠道感染和对这些感染的易感性方面发挥潜在作用。
▸ 从微生物代谢,到宿主代谢的改变
除了微生物代谢的改变外,在营养不良的儿童中还观察到宿主代谢的改变,这可能部分是由菌群失调引起的。例如,从发育迟缓儿童的小肠中分离出的口腔微生物在体外和体内模型中会损害脂质吸收,从而提供小肠微生物组和小肠细菌过度生长在营养不良中的潜在因果作用。
肠道屏障功能的丧失会导致微生物群及其产物(包括脂多糖)从肠道进入体循环的易位增加。LPS 易位可导致慢性全身炎症,从而通过吲哚胺 2,3-双加氧酶诱导激活色氨酸-犬尿氨酸途径。事实上,秘鲁和坦桑尼亚儿童的血浆犬尿氨酸与色氨酸 (K:T) 比率与血浆 LPS 和 LPS 结合蛋白 (LBP) 相关,并且还与线性增长缺陷相关。
扩展阅读:
犬尿氨酸途径的激活可以抑制炎症并促进耐受性,但可能会失调色氨酸途径,而色氨酸途径对于血清素的产生以及 NAD +和烟酰胺的生成非常重要,而后者是生长的关键。免疫耐受性的增加也可能对增强对病原体的有效反应产生影响,这也可能受到色氨酸剥夺的影响,并可能导致此类感染在营养不良的肠道中持续存在。
儿童营养不良与内分泌信号中断有关,包括介导食欲和能量代谢的瘦素和生长素释放肽,以及共同构成生长轴的GH 和IGF-1 。
发育迟缓儿童与非发育迟缓儿童相比,在童年后期血浆 IGF-1 较低以及生命的前 18 个月,一种与慢性炎症相关的现象。
▸ 瘦素水平低可预测SAM儿童的死亡率
新数据表明,肠道微生物组直接和间接影响肠道局部激素的产生,例如胰高血糖素样肽-1 (GLP-1),并通过介导瘦素、生长素释放肽和 IGF-1 的产生来系统地进行,每一个都调节新陈代谢和营养状况。
▸ 微生物组→产生SCFA→GLP-1 的产生→抑制胰高血糖素原的表达
GLP-1 是一种肠道源性激素,负责刺激胰岛素分泌、减少胃排空和增加饱腹感,从而影响新陈代谢和营养状况。
在没有微生物组的情况下,在无菌小鼠中,GLP-1 的产生在一种假设的适应性机制中升高,当微生物组被破坏或不存在时,GLP-1 的产生会增加营养物质的吸收,而 SCFA 给药可以逆转这种效应。
▸ 微生物衍生的SCFA也会影响 IGF-1 的产生
IGF-1 在肝脏和脂肪组织中产生,影响骨形成、骨量和骨骼生长,尤其是在生命早期。当无菌小鼠被微生物定植时,血浆中血清 IGF-1 的浓度会增加。
同样,抗生素的使用会降低 IGF-1 浓度,而补充 SCFA 可恢复抗生素治疗期间 IGF-1 的浓度。不产生短链脂肪酸的细菌种类也可以通过刺激生长轴来刺激实验动物的生长。植物乳杆菌的特定菌株可恢复果蝇和小鼠的线性生长、股骨长度、IGF-1 产生和活性以及外周组织对 GH 的敏感性。
植物乳杆菌WJL ( Lp WJL ) 菌株对 IGF-1 产生和生长的活性取决于肠上皮细胞中含有核苷酸结合寡聚化结构域的蛋白 2 (NOD2) 的刺激。
▸ 肠道共生细菌还可以防止感染时的肌肉萎缩
共生大肠杆菌在骨骼肌中维持 IGF-1 信号传导,独立于宿主代谢、热量吸收或炎症,从而防止肠道或肺部感染后肌肉萎缩。
▸ 与饱腹感和新陈代谢有关的激素与特定共生菌群丰度相关
在动物模型中,双歧杆菌和乳酸菌丰度与瘦素浓度呈正相关,而生长素释放肽则与拟杆菌和普雷沃氏菌丰度呈正相关。
在营养不良模型中,生长素释放肽水平还与双歧杆菌、乳酸菌和球状球菌-直肠真杆菌呈负相关。一项针对 6 至 24 个月大的冈比亚儿童( n = 60)的横断面观察队列研究发现,严重营养不良儿童的肠道微生物群与代谢激素浓度之间存在许多密切相关性,使用网络分析模拟肠道微生物组和激素相互作用。埃希氏菌/志贺氏菌通过其与生长素释放肽和生长素释放肽受体的相互作用,在区分健康对照和营养不良患者方面具有高度预测性,而粘膜乳杆菌与瘦素/瘦素受体之间的相互作用也对营养不良和营养良好的儿童具有高度区分性。肠杆菌科细菌和 IGF-1 的相互作用也区分了 MAM 和 SAM。
这些相互作用可能是双向的,瘦素可以刺激粘蛋白的产生并改变肠道微生物组的组成,而特定的产生脂多糖的肠杆菌科细菌的炎症活性可能会损害 IGF-1 和 GH 信号传导。
微生物群在整个生命过程中与宿主免疫系统保持着相互的、动态的沟通,而这种沟通会因营养不良而被破坏。
越来越多的证据表明,营养不良的儿童在免疫学上与营养充足的同龄人不同,胸腺较小,免疫细胞组成和分布在质量和数量上不同,全身和肠道环境中的促炎介质长期升高,以及由不利因素驱动的免疫基因上的表观遗传标记。
产前和产后暴露。迄今为止,大多数营养不良儿童的免疫表型都是在感染和病原体携带的背景下进行研究的。然而,新出现的数据表明,肠道微生物组内共生和条件致病微生物的多样性可能会驱动营养不良儿童的独特免疫表型,而与病原体无关。
▸ 营养不良引起的肠道炎症的特征——EED生物标志物
例如钙卫蛋白和髓过氧化物酶,这些生物标志物是由肠道组织中微生物激活的先天免疫细胞产生的,这些细胞可能会被破坏的肠道微生物组激活。
EED 动物模型表明,营养缺乏的小鼠与营养充足的小鼠相比,肠道菌群失调会导致小肠上皮内淋巴细胞数量增加和促炎细胞因子分泌增加。尽管空肠免疫激活增加,但营养缺乏的动物在肠道内抑制鼠伤寒沙门氏菌感染的能力较差,导致细菌传播到脾脏和肝脏,并导致肝脏分泌促炎介质。
▸ 儿童营养不良还与慢性全身炎症有关
尽管反复出现症状的感染可以引发全身炎症表型,但小鼠模型表明,在没有明显感染的情况下,肠道微生物群和/或其成分系统性扩散到功能失调的肠道屏障进入循环也可能发生这种情况,如 EED 中观察到的那样。
与营养充足的幼鼠相比,断奶后采用缺乏蛋白质、铁、锌的饮食的健康小鼠出现了微生物群失调和体重减轻,这与向结肠给药时未能含有脂多糖有关;全身、盲肠和结肠(但不包括回肠)促炎细胞因子升高;在没有感染的情况下,LPS 攻击后促炎细胞因子的分泌增多。
在该模型中,通过针对革兰氏阴性(LPS 阳性)而非革兰氏阳性(LPS 阴性)共生体的抗生素治疗,使体重增加和促炎性免疫反应的差异正常化。
该模型中抗生素治疗效果的选择性支持了对革兰氏阴性微生物群成分的播散性促炎性免疫反应的作用,这些微生物群成分从肠道转移到循环系统中,从而导致营养不良的体重和身高缺陷。
由微生物易位驱动的慢性全身炎症可能影响人体测量的一种方式是通过抑制生长因子信号传导和骨/骨骼肌生长。来自动物研究的证据表明,依赖于微生物群代谢的唾液酸化HMO会增加成骨细胞驱动的骨形成,并且该过程是由 Th2 极化免疫反应介导的,即增加大肠中的嗜酸性粒细胞募集和嗜酸细胞趋化因子浓度。
中低收入国家儿科队列研究一致的证据表明,炎症介质也与IGF-1呈负相关。
注:前面讲过,营养良好和营养不良的儿童之间存在激素差异,尤其是与生长[生长激素 (GH) 和胰岛素样生长因子 1 (IGF-1)] 和食欲调节(瘦素和生长素释放肽)相关的激素差异。
包括 sCD14、补体蛋白 2、巨噬细胞炎症蛋白 1B 和 LBP 在内的炎症介质与SAM入院后康复儿童的体重和/或 MUAC 增加呈负相关。
▸ 炎症介质对生长的直接影响
无菌小鼠持续过度表达促炎细胞因子 IL-6 和循环 IGF-1 减少,生长速度较慢,并且比非无菌同窝小鼠小 30-50%,这种表型可以通过给予 IL-6 来部分挽救。
研究发现,IL-1β 和TNFα 与 IL-6 一起下调人肝细胞中生长激素受体 (GHR) 的表达、通过细胞因子信号传导抑制因子 3 (SOCS3) 产生的 GH 信号传导以及 IGF-1 的产生体外细胞系和小鼠肝脏体内细胞系。
▸ 微生物群:或将使炎症驱动的生长缺陷正常化
在一项以豆类为基础的治疗性营养的临床试验中,已经探索了将微生物群作为使炎症驱动的生长缺陷正常化的一种手段的潜力,该营养旨在增强营养不良的孟加拉国儿童肠道微生物组的多样性和成熟度。
与之前的观察结果一致,30 名 SAM 儿童在基线时可以通过血浆蛋白质组与 21 名健康儿童区分开来,该血浆蛋白质组与较低的骨化和成骨细胞分化以及较高的急性期炎症反应有关,包括 C 反应蛋白 (CRP)、IL- 6、促炎核因子 kappa B (NF-κB) 信号通路中的中间蛋白。干预后,尽管证据表明总体肠道病原体携带或绝对粪便微生物群多样性存在差异,但 WHZ 和微生物群成熟度有所增加;这些变化与血浆蛋白质组向健康生长和减少炎症特征的转变有关,表明肠道微生物组针对性的干预措施可以减少营养不良相关的炎症。
菌群失调引起肠道和全身炎症的能力也可能取决于抗体介导的肠道微生物组成的控制。肠道中的分泌性免疫球蛋白,特别是免疫球蛋白 A (IgA),选择性地结合微生物组成分,从而调节微生物组组成。
扩展阅读:
▸ 发育不良:IgA靶向的细菌比例更高
研究发现,与来自马达加斯加和中非共和国的非发育迟缓对照儿童相比,发育不良儿童的粪便中 IgA 所靶向的细菌比例更高。除了 IgA 靶向肠道微生物群的数量差异外,IgA 还靶向健康儿童与 SAM 儿童不同的肠道微生物子集。其中 IgA 倾向于靶向SAM 儿童中的肠杆菌科细菌,同时针对健康儿童中更广泛的共生生物。
从患有 SAM 的儿童身上提取的IgA +微生物群在移植到小鼠体内时会诱发类似 EED 的病理学和全身炎症,这种效应依赖于营养不良的饮食。
在另一个模型中,给小鼠喂食低蛋白、低脂肪饮食,并进行或不进行细菌灌胃来模拟 EED,这些小鼠的 IgA 对乳杆菌属的靶向作用受损。尽管空肠中乳酸杆菌的相对丰度、粪便 IgA 总量以及 IgA 目标细菌总数的百分比与营养良好的对照组相似。
这些差异是由于乳杆菌碳水化合物代谢对饮食变化的适应,而不是 IgA 丰度或亲合力的差异。总的来说,这些观察结果强调了肠道屏障处免疫-微生物群相互作用的可塑性,有证据表明,微生物群和组织驻留免疫细胞的适应可能会损害 EED 中微生物及其抗原的免疫介导遏制,从而导致生长缓慢。
▸ 营养不良儿童的口服疫苗反应受损并反映营养不良中存在的一些免疫缺陷
小鼠模型为营养不良时微生物组失调如何损害口服疫苗的免疫原性提供了一些线索。然而,这些范式需要在人类队列研究中进一步探索。
在针对产肠毒素大肠杆菌(ETEC)进行初免加强口服疫苗接种后,由于饮食缺乏和大肠杆菌粘附定植而诱导出现 EED 样表型的小鼠,其小肠中的疫苗特异性 CD4 + T 细胞较低,且疫苗水平较低-相对于饲喂营养充足饮食的小鼠和饲喂营养不足或充足饮食的未定植小鼠的特异性 IgA。这些差异取决于微生物群,因为 ETEC 定植小鼠的小肠疫苗特异性 T 细胞数量在广谱抗生素治疗 3 周后恢复正常。
EED 表型中疫苗反应受损是由于微生物群依赖性 RORγT + FOXP3 +Treg 的扩张,这些细胞能够抑制小肠中的疫苗反应;小肠中疫苗特异性 CD4 + T 细胞增殖和 IgA 丰度得到恢复,并且在有条件地消耗 Tregs 后体重增加百分比增加。
总的来说,这些研究为微生物群靶向疗法如何恢复营养不良儿童受损的免疫表型(包括受损的疫苗反应)提供了概念证明,但也强调了固有的免疫和微生物异质性,在设计转化研究和人群时应考虑到这一点。
许多研究开始探索食物或食物成分对整个童年时期肠道微生物组的影响。
纳入的试验采用了涉及天然食品的干预措施;微量营养素补充或强化;食品成分,例如牛乳脂肪球膜(MFGM);以及特殊配方食品,例如早期限量配方食品(ELF)、即用治疗食品、即用补充食品(RUSF)和脂类营养补充剂(LNS)。
母乳
纯母乳喂养的婴儿往往含有较高比例的双歧杆菌和乳酸菌属。与配方奶喂养的婴儿相比,他们的肠道微生物组往往含有更高丰度的潜在致病菌,例如变形菌门成员。
双歧杆菌属丰度更高对婴儿健康有益,而肠球菌属的比例较高与不良的健康结果相关。
从瓶子中挤出的母乳,与潜在病原体的富集和双歧杆菌的消耗相关。
▸ 母乳是一种复杂的基质,有助于双歧杆菌定植
母乳含有许多成分,包括乳糖、400 多种不同的脂肪酸、蛋白质(乳清)、核苷酸、维生素、矿物质、乳脂肪球 (MFG) 、HMO等。
HMO 可以与牛奶中的其他化合物(例如糖复合物)结合,形成母乳聚糖 (HMG),其完整地到达婴儿结肠并驱动细菌定植,特别是双歧杆菌的定植。
HMG 逃脱肠道消化并转运到结肠,进入那里常驻双歧杆菌的发酵循环,使这些物种能够增殖并在 HMO 的双歧杆菌效应的过程中占据主导地位。特别是,婴儿双歧杆菌(ATCC 15697) 、短双歧杆菌、长双歧杆菌和双歧双歧杆菌(PRL2010) 在婴儿期占主导地位,是更健康肠道微生物组的标志。
▸ 母乳本身也含有细菌
在几组哺乳期妇女中,发现母乳样本最常见有葡萄球菌、链球菌和假单胞菌,其他分类单元因女性和环境而异;这些细菌可能有助于在婴儿肠道中播种。
配方奶
▸ 配方奶与对肠道微生物群的潜在负面影响有关
a ) pH 值的变化,导致大肠杆菌和沙门氏菌等细菌过度生长,从而破坏肠道完整性,可能是由于蛋白质类型和含量的差异
b ) 牛乳中缺乏母乳中存在的游离氨基酸和某些生物活性化合物。
食用牛奶配方奶粉的婴儿往往具有较高的肠道微生物多样性和丰富的厚壁菌门、梭状芽胞杆菌、肠球菌属、肠杆菌科和拟杆菌属和双歧杆菌属的丰度较低。
在配方奶喂养的婴儿中存在的双歧杆菌属中,有更多的青春双歧杆菌和假链状双歧杆菌,这两种细菌都与成人肠道微生物群有关。
▸ MFGM 对肠道菌群的影响:嗜血杆菌水平较低
MFGM (牛乳脂肪球膜)因其在婴儿肠道成熟、免疫以及大脑结构和功能中的潜在作用而受到关注。MFGM 源自乳腺上皮,包含 60% 蛋白质和 40% 脂质,使 MFG 稳定为乳液。为了复制母乳,婴儿配方奶粉中添加了牛 MFGM。
在 2 至 6 个月龄期间,MFGM 配方奶粉组的几种氨基酸及其分解产物的含量较低,乳酸和琥珀酸的含量也较低。12 个月时,MFGM 组的婴儿嗜血杆菌水平较低与接受标准配方奶粉的婴儿相比,该属含有多种病原体。
然而,与母乳喂养(非随机)参考组相比,MFGM 配方奶粉组的微生物群与标准配方奶粉组的微生物群更相似,因此,将 MFGM 和标准组的结果汇总进行分析,并与来自 MFGM 配方奶粉组的结果进行比较。
▸ ELF:改善健康的同时,尽量不破坏肠道菌群
母乳和婴儿配方奶粉中乳清蛋白和酪蛋白的含量各不相同。婴儿配方奶粉中牛奶的比例较高,较难消化。水解牛奶可以提高其消化率,水解牛奶用于早期限量配方食品(ELF),用于纯母乳喂养的新生儿作为干预措施,以增加肠内摄入量并避免并发症,例如胆红素血症或脱水。
与纯母乳喂养相比,ELF 不会导致α 多样性或群落结构出现显着差异,也不会导致乳杆菌丰度降低或更高丰度的梭状芽胞杆菌。这些发现表明,ELF 可能有助于改善体重大幅减轻的新生儿的健康,同时不会对肠道微生物群产生不利影响。
碳水化合物
碳水化合物包括简单的单糖和二糖以及复杂的寡糖和多糖,例如淀粉和纤维素。简单的糖在小肠 (SI) 中被消化和吸收,而复杂的或非血糖碳水化合物在到达结肠之前仍未被消化。
后者已被证明可以通过聚糖的降解来调节肠道微生物群,特别是以纤维和寡糖的形式。
关于单糖对肠道微生物群影响的研究有限,因为它们通常不会到达大肠;更常见的是针对人工甜味剂影响的研究或高糖、高脂肪的西方饮食的组合对肠道微生物群的影响。
注:单糖,如葡萄糖、半乳糖和果糖;二糖,例如乳糖、蔗糖、麦芽糖和海藻糖;和糖醇(多元醇)
▸ 果糖
一项小鼠研究中,果糖可以逃避肠道吸收并到达结肠,从而降低多形拟杆菌的丰度。
在一项针对 12-19 岁青少年的队列研究中,高果糖摄入量与真杆菌和链球菌含量降低有关,而这些细菌被认为有利于碳水化合物代谢。这些研究的结果提供了一些证据,证明在随机试验中检查单糖对人类肠道微生物组的影响是有益的,这些试验尚未在儿童中进行。
▸ 复杂碳水化合物
包括寡糖、多糖和膳食纤维,可以起到益生元的作用,被定义为“被宿主微生物选择性利用并赋予健康益处的底物”。这些分子不会被人类消化,而是被完整地运送到结肠,在那里微生物可能会代谢和发酵它们。
碳水化合物益生元包括HMO、低聚果糖、低聚半乳糖、甘露低聚糖、低聚木糖和膳食纤维,例如不溶性纤维,包括纤维素和半纤维素,例如β-葡聚糖(来自燕麦)。碳水化合物益生元还包括可溶性纤维,例如果胶和菊粉,两者都是微生物发酵罐的底物,包括长双歧杆菌亚种、婴儿杆菌、拟杆菌、拟杆菌、乳杆菌和普氏粪杆菌。
▸ 益生元通过直接机制发挥作用
简而言之,结构与宿主聚糖相似的碳水化合物分子可以直接阻断与宿主细胞的粘附;β-葡聚糖可以与吞噬细胞和自然杀伤细胞上的受体结合,引发中性粒细胞的吞噬作用;
菊粉型果聚糖可以通过 Toll 样受体、C 型凝集素受体和半乳糖凝集素作为肠道树突状细胞的受体,诱导抗炎细胞因子。
▸ 益生元可以间接地选择有益共生细菌的增殖
其代谢副产物可以直接影响肠道环境或宿主基因表达。例如,与潜在致病性大肠杆菌和梭菌相比,双歧杆菌属、拟杆菌和厚壁菌门中的物种将到达结肠的未消化碳水化合物发酵成微生物副产物,宿主或其他共生细菌可以将其用作底物。
▸ 麸皮添加:微生物群的变化因基线饮食差异而异
麸皮(小麦、燕麦和大米等谷物的外皮)是益生元可溶性纤维以及其他营养素(如植物化学物质、脂肪酸和酚类物质)的主要来源。
在一项试验中,生活在尼加拉瓜 ( n = 47) 和马里 ( n = 48)的 6 个月大婴儿每天补充米糠(每天 1-5 克),添加到断奶食品中,或者不进行干预 6 个月。
不同国家的基线肠道微生物群落结构(通过非度量多维尺度(NMDS)绘制的布雷-柯蒂斯差异来测量)存在差异,这种差异导致 8 个月和 12 个月龄时微生物对米糠补充剂的反应越来越明显;例如,马里样本在两个时间点的群落结构差异(NMDS 图上的分离)更为明显。对米糠摄入量敏感的属也因国家而异:在尼加拉瓜,8 个月和 12 个月龄时,双歧杆菌属、乳杆菌和韦荣球菌的相对丰度增加,而在马里乳杆菌在 8 个月和 12 个月大时,对米糠的反应丰度有所增加。
这些反应性类群被公认为碳水化合物消化者。这项研究在比较这些人群时的一个局限性是,整个马里队列都是纯母乳喂养和阴道分娩,而尼加拉瓜样本包括配方奶喂养和大多数剖腹产婴儿;这些基线饮食差异可能导致了微生物对米糠的不同反应。
引入补充食品,包括低聚糖的植物性食物来源,例如大豆和其他豆类、水果和蔬菜,帮助婴儿肠道微生物群多样化并增加其丰富度,使其达到类似成人的组成。
▸ 蜂蜜:双歧双歧杆菌有变化
蜂蜜是单糖(即葡萄糖、果糖、蔗糖和麦芽糖)以及益生元低聚果糖的来源。
在早产儿肠道微生物群研究中,埃及早产儿 ( n = 40) 连续 14 天食用添加到牛奶配方奶粉中的 5、10、15 或 0 克医用级三叶草蜂蜜。从定量实时聚合酶链反应 (qRT-PCR) 结果来看,双歧双歧杆菌似乎以剂量依赖性方式对蜂蜜做出反应,而乳酸杆菌种不会。10g 组的计数最高,5g、15g 和 0g 组变化不大;这可能与这些细菌的底物代谢差异有关。
一些局限性包括样本量小(每组仅 10 名婴儿)、通过 qRT-PCR 定量特定细菌(相对于整个细菌群落的下一代测序)、干预持续时间短以及研究结果的适用性(考虑到不推荐蜂蜜)对于 12 个月以下的儿童,因为担心它可能含有导致婴儿肉毒杆菌中毒的细菌。
然而,作为一项试点研究,这些发现为进一步研究蜂蜜和单糖对老年人群肠道微生物组的潜在影响提供了支持。除了豆类外,没有其他试验研究过碳水化合物在天然食品中的作用,包括天然存在的益生元,对足月婴儿或年龄较大的儿童或青少年人群的作用。
脂 肪
脂肪酸,包括单不饱和脂肪酸 (MUFA)、多不饱和脂肪酸 (PUFA)(例如亚麻酸 ω-3 和亚油酸 ω-6 脂肪酸)和饱和脂肪酸 (SFA),构成脂质分子的一部分,例如甘油三酯、磷脂、胆固醇和植物甾醇。
膳食脂肪在整个胃肠道中被分解。大多数甘油三酯的消化和吸收发生在小肠(特别是十二指肠)中,并且依赖于胰脂肪酶、肝脏中的胆汁盐和胆囊中的胆汁。
初级胆汁盐,包括胆酸盐和鹅脱氧胆酸盐,是由胆固醇合成的;共生微生物群从初级胆汁盐合成次级胆汁盐、脱氧胆酸盐和石胆酸盐,这些盐进一步被细菌用作底物或被肝细胞修饰。大约 7% 的游离脂肪酸完好无损地到达结肠,它们可能会影响体内的微生物群。食物通常含有短链、中链和长链脂肪酸的混合物。
脂肪酸影响肠道微生物群的机制仍然是一个活跃的研究领域,并且关于 SFA、MUFA 和 PUFA 对人类肠道微生物组的影响存在相互矛盾的证据。
▸ 促炎:饱和脂肪酸、ω-6 多不饱和脂肪酸; 抗炎:ω-6多不饱和脂肪酸、单不饱和脂肪酸
一些研究表明,SFAs 和 ω-6 PUFA 会促进炎症和氧化应激,而 ω-3 PUFA 和 MUFA 则具有积极作用,例如增加乳酸杆菌和双歧杆菌属。由于膳食脂肪的代谢需要氧气,因此脂肪不太可能成为厌氧肠道细菌的能量来源。然而,较高的脂肪摄入量可能会取代饮食中的膳食纤维和碳水化合物;因此,对肠道微生物群的影响可能是由于饮食替代或较低的碳水化合物底物可用性,而不是较高的脂肪摄入量。膳食脂肪可能对细胞膜有杀菌作用,导致细菌丰度降低。此外,膳食脂肪可以诱导细菌增加胆汁酸代谢,以应对增加的脂肪。
一项研究旨在分析鱼和红花油的混合物对接受小肠肠造口术的早产儿(n = 16)肠道微生物群的影响(即在腹壁上开一个开口,以便在出生后进行肠内喂养)因炎症性疾病而需要进行腹部手术,例如坏死性小肠结肠炎 (NEC),与标准护理相比这是早产儿的常见病症。
与标准营养疗法相比,干预措施持续 9 周,结果增加了微生物α 多样性,降低了潜在致病菌(肠杆菌科、梭状芽胞杆菌)的丰度,并丰富了碳水化合物代谢的预测基因功能。
总之,这些研究表明,ω-3 LCPUFA 干预可能会改善婴儿肠道微生物群多样性、组成和预测功能,特别是患 NEC 的早产儿,但母亲在怀孕期间摄入 LCPUFA 不会影响婴儿肠道微生物组。
蛋白质
膳食蛋白质由形成肽的氨基酸 (AA) 组成,肽是组织的基本组成部分。氨基酸对于骨骼肌功能、生长、健康、发育和生存至关重要,可以为宿主和肠道微生物群提供能量,而肠道微生物群可以改变宿主对氨基酸的生物利用度。
膳食蛋白质的消化从胃开始,蛋白酶将蛋白质切割成大肽。小肠中的肽酶分解这些肽,以便随后由肠上皮细胞和腔细菌进行转运和分解代谢。
增加蛋白质摄入量通常会导致结肠消化率降低和可发酵底物增加。细菌将游离氨基酸转化为多肽有助于肠道中氨基酸的代谢和生物利用度,而 L-谷氨酰胺等氨基酸的可用性可以调节必需和非必需氨基酸的小肠细菌代谢。
结肠细菌,特别是拟杆菌、梭状芽胞杆菌和大肠菌,将摄入的蛋白质和来自宿主酶、粘蛋白和脱落的肠细胞的内源蛋白质转化,产生副产物,例如较短的肽、AA、脂肪酸(例如 SCFA)和气体例如氨和硫化氢。
整个肠道的蛋白水解活性各不相同:例如,体外实验发现,与回肠微生物群相比,结肠微生物群可以更有效地降解结肠中的牛血清白蛋白,具体取决于 pH 水平、碳水化合物可用性和肠道模型保留时间。
▸ 较高的蛋白质摄入量:促进潜在致病菌
较高的蛋白质摄入量(例如西方饮食中的蛋白质)被认为会增加 pH 值,从而减少双歧杆菌等严格厌氧菌的生长。并促进蛋白质发酵,潜在致病性兼性厌氧细菌。
这些细菌,例如大肠杆菌和沙门氏菌,可以通过形成降解产物(例如三甲胺氧化物以及芳香族和支链氨基酸)来破坏肠道屏障和免疫系统;这些副产品与胰岛素抵抗和 2 型糖尿病有关。除了摄入水平之外,蛋白质来源、浓度和 AA 组成也会影响肠道微生物群的组成和功能。
▸ 蛋白质来源会导致微生物组成和功能的变化
由于植物细胞壁的原因,豆类等植物蛋白不能被宿主酶完全消化,导致它们作为微生物发酵的益生元运输到结肠。
难解析出植物蛋白来源中的蛋白质、纤维或其他化学物质的个体效应,但总的来说,这些蛋白质来源往往与细菌组成的有益变化有关,包括乳酸菌的生长和更大的微生物多样性。
进行了两项试验,利用 V4 区的 16S 测序来检查植物性蛋白质来源(包括豇豆、黄豌豆和普通豆)对肠道微生物群的影响。
一项试验比较了烤豇豆粉(25% 蛋白质,21% 纤维)、烤普通豆粉(25% 蛋白质,28% 纤维)和挤压煮熟的玉米大豆混合 (CSB) 面粉(13% 蛋白质,8% 纤维) ,6 个月大的儿童每天服用 6 个月,豇豆导致双歧杆菌属的比例更高。
与普通豆和 CSB 相比, 9 至 12 个月期间普雷沃氏菌丰度较低,6 至 9 个月期间埃希氏菌/志贺氏菌丰度较低;这是出乎意料的,因为与普通豆相比,豇豆的纤维含量较低。
另一项针对儿童(6-10 岁)的研究检查了四种不同剂量的补充微量营养素的豆类蛋白质(黄豌豆)(即 6、8、10 或 12 克),连续 1 个月每天食用两次,在厚壁菌门和拟杆菌门中发现了 9 个有区别的类群,其中许多与植物多糖发酵和 SCFA 生产有关——对应于肠道微生物组的变化。
三个类群(普雷沃菌属、颤旋菌属、普氏镰刀菌)与儿童线性生长的增加显着相关,并且所有类群的相对丰度发生变化,特别是在最低蛋白质剂量组(6 g)和最高蛋白质剂量组(12 g)。这些结果强调了豆类对肠道微生物群的潜在剂量反应效应,并确定了与功能结果(例如儿童线性生长)相关的分类群以进一步研究。
与植物蛋白相比,动物来源的蛋白质在近端肠道更容易消化,因此运输到结肠的蛋白质较少,导致结肠微生物群调节减少,并可能抑制病原体。
维生素A
维生素A是一类具有全反式视黄醇生物活性的类视黄醇化合物,包括视黄醛(视黄醛)、视黄酸、视黄酯(主要是棕榈酸视黄酯)和类胡萝卜素化合物,如β-胡萝卜素、α-胡萝卜素和β-胡萝卜素。
▸ 维生素 A 的功能
维生素 A 对于维持肠道屏障的完整性和受损粘膜上皮的再生至关重要,特别是肠上皮细胞的正常增殖和产生粘液的杯状细胞分化,这会影响肠道微生物群的定植和粘附。
膳食维生素 A 可以作为植物来源的维生素 A 原(类胡萝卜素)或动物来源的预制维生素 A(视黄酯)形式食用。
▸ 维生素 A在体内的加工
消化从咀嚼开始,包括通过胆汁盐和胰脂肪酶的胃作用,胆汁盐和胰脂肪酶在肠腔中从膳食脂质形成混合胶束以供吸收。虽然预先形成的维生素 A 来源更容易被宿主肠细胞吸收以运输至储存或循环,但维生素 A 原类胡萝卜素必须进一步加工才能转化为类视黄醇并被宿主使用。
▸ β-胡萝卜素的吸收
根据食物基质的不同,大约 5-50% 的 β-胡萝卜素被吸收。例如,膳食脂质的存在会增加小肠中类胡萝卜素的吸收;如果β-胡萝卜素被纤维吸附,它可以绕过上肠的吸收并被转运到结肠。结肠微生物群可以消化纤维,释放β-胡萝卜素供结肠细胞吸收。在结肠粘膜中发现了类胡萝卜素,主要是在升结肠中。
一项研究发现,大肠杆菌表达一种与 β-胡萝卜素单加氧酶 1 同源的耐盐酶,使大肠杆菌能够积累 β-胡萝卜素;然而,没有证据表明这种β-胡萝卜素被裂解形成视网膜以供进一步使用。
▸ 维生素A与普通拟杆菌:此消彼长
在一项针对小鼠的研究中,普通拟杆菌(Bacteroides vulgatus)先前被证明是一种生长歧视类群,随维生素 A 补充而丰度降低,并因维生素 A 缺乏而丰度增加,可能与胆汁酸代谢的改变有关。作者报告说,这些变化是由于普通双歧杆菌视黄醇流出系统的破坏以及随后对视黄醇和胆汁辅助敏感性的影响造成的。
▸ 肠道共生菌与视黄酸代谢
另一项针对小鼠的研究发现,粘膜树突状细胞 (DC) 对肠道共生婴儿双歧杆菌进行摄取,导致其从维生素 A 向视黄酸的转化增加,并且具有更高数量的具有耐受性的粘膜 DC,例如抑制 1 型 T 辅助细胞(Th1) 和 Th17 细胞。这种效果也随着宿主视黄酸状态的不同而变化。然而,还需要对人类进行进一步的研究,因为啮齿类动物的类胡萝卜素代谢效率比人类高得多,并且没有其他动物模型能够完全代表人类类胡萝卜素代谢。
最近的一项研究检查了补充维生素 A 对新生儿肠道微生物群的影响,结果发现对细菌组成(包括大双歧杆菌属)有积极的以及性别特异性的影响。
与安慰剂相比,入组时单剂量 50,000 国际单位剂量不会改变α-多样性,但在 6-15 周龄时对雄性产生双歧效应,但对雌性没有影响;作者推测,这可能有助于解释本研究中男性死亡率低于女性的原因。
维生素E
维生素 E 主要通过 α-生育酚活性发挥抗氧化剂的作用。
α-生育酚可来源于坚果、植物油、乳制品、奶酪和鸡蛋,也可以作为酯化 α-生育酚的补充剂形式食用。
作为自由基清除剂,α-生育酚可破坏细胞膜和血浆脂蛋白中的自由基链,以维持 LCPUFA 的完整性。维生素E与膳食脂质一起被吸收到肠道细胞中,融入乳糜微粒中,分泌到淋巴系统中,并转运到肝脏,然后被极低密度脂蛋白吸收并分泌到与α-生育酚转移蛋白结合的血液中; 然而,其吸收和贩运的许多细节基本上不为人所知。
经过额外的代谢步骤后,未结合的维生素 E 异构体通过粪便和尿液排出体外。维生素 E 与铁一起,与氧化电位降低有关;因此,维生素 E 被认为可以改善铁相关炎症的影响,改善肠道微生物群的结果。
一项针对美国缺铁 6 个月大婴儿的研究发现,每天两次服用 18 毫克维生素 E 和 15 毫克元素铁,持续 2 个月,并不会导致细菌多样性的变化,但确实会导致相对细菌多样性的变化出现差异。随着时间的推移,维生素 E 与铁的结合导致拟杆菌门(尤其是拟杆菌科)数量减少,而厚壁菌门(尤其是毛螺菌科)和罗氏菌属(Roseburia)数量增加。Roseburia产生丁酸盐,可以刺激结肠血流。
铁
铁是人体内最丰富的微量营养素,对于人体的氧运输、氧化还原反应、新陈代谢和电子传递链机制以及许多细菌的新陈代谢和毒力功能至关重要。
膳食血红素铁 (10%) 和非血红素铁 (90%) 的摄取和吸收存在不同的机制。牛肉是血红素铁的来源;美国的一项对测序研究使用牛肉作为干预措施。从 16S测序数据来看,以牛肉作为补充食品的群体中双歧杆菌属没有下降。与基线相比,4 周后细菌种类丰富度更高;4 个月后,放线菌和 XIVa 族梭菌(丁酸盐生产者)的丰度增加,并且与铁强化婴儿谷物相比,拟杆菌门较低。
差异可能是由于肉类中铁的生物利用度较高,以及未吸收的铁进入结肠,以及铁强化谷物类中存在植酸盐。
▸ 铁的生物利用度
铁的生物利用度随着植酸盐和多酚的存在而降低,而抗坏血酸(维生素 C)则提高铁的生物利用度。胃酸和蛋白水解可能会从食物基质中释放非血红素铁,需要更多的消化才能释放血红素和铁蛋白。一些细菌可以通过特殊机制获取食物中的铁源,例如解没食子链球菌或路邓葡萄球菌降解多酚单宁酸。
营养干预措施对肠道菌群影响的潜在机制
doi.org/10.1146/annurev-nutr-021020-025755
▸ 未吸收的铁被认为会刺激肠道中细菌病原体的生长和毒力
例如大肠杆菌,而宿主铁的状态会影响细菌免疫防御和宿主炎症反应,包括乳杆菌科和伯氏疏螺旋体在内的一些细菌不依赖铁生长,而是利用锰。
链球菌属可以使用铁或锰,具体取决于可用性。大肠杆菌使用 Feo 摄取系统来摄取二价铁,而三价铁在摄取之前首先被细胞外还原酶还原为二价铁,或者被摄取为柠檬酸铁或与细菌铁载体结合。
▸ 感染期间可用铁量的变化向毒力基因发送信号
低铁会导致铁载体抑制和毒素上调,而较高的铁可用性会诱导细菌粘附到肠上皮细胞,如肠沙门氏菌的情况鼠伤寒血清型。缺铁还会减少肠道细菌(包括Roseburia 、直肠真杆菌和梭状芽胞杆菌IV 族成员)等产生的短链脂肪酸。
在易缺铁的人群中,婴儿和幼儿最常需要口服铁剂治疗,例如补充剂,尽管他们的肠道微生物群仍在成熟。
▸ 铁干预措施对腹泻:负面影响
多项研究表明铁干预措施对腹泻等胃肠道症状有负面影响以及肠道微生物群的变化,例如较高的肠杆菌科和较低的乳杆菌科和双歧杆菌属。
▸ 铁补充剂,取决于基线铁或贫血状态
为了帮助抵消铁的这些影响,儿童随机试验检查了铁与维生素 E 等抗氧化剂结合使用的效果或冻干覆盆子作为抗氧化剂来源。例如,在加拿大一项研究中,与仅接受铁强化谷物的婴儿相比,接受含冻干覆盆子的电解铁强化米粉的婴儿在2 -4周后肠道微生物组的丰富度和多样性有所增加。
然而,接受冻干覆盆子的组活性氧并没有显着减少,与胃肠道中过量铁相关的炎症过程的引发剂;这可能是由于冻干覆盆子的消耗量很小,或者与新鲜覆盆子中的抗氧化剂含量相比可能较低,而新鲜覆盆子没有被任何群体食用。
在未来的研究中,考虑其他抗氧化剂来源(例如新鲜浆果或提取物)和不同剂量的这些抗氧化剂来源,以及对大量贫血婴儿的研究或铁充足,将有助于建立铁和抗氧化剂之间潜在的相互作用。
▸ 使用铁剂联合干预的随机试验
包括叶酸, 锌和多种微量营养素(MMN),无论是片剂的形式还是作为微量营养素粉(MNP)的一部分。铁的形式包括硫酸亚铁、富马酸亚铁、NaFeEDTA 和电解铁,它们可能对儿童肠道微生物群产生不同的影响;其他变量包括给药剂量、基线铁和贫血状况、抗氧化剂和其他微量营养素等辅助干预措施以及研究环境。
大多数检查 MNP 的研究都是在肯尼亚针对开始添加辅食的 6 个月大婴儿进行的;MNP 与玉米粥一起服用 3 至 4 个月。MNP 的微量营养素成分各不相同,但都含有维生素 A、叶酸和维生素 C,并且除了一种还含有 B 族维生素、维生素 D、铜、碘、硒和锌。
根据靶向 qRT-PCR 结果,MNP ( MixMe ) 加上 2.5 mg NaFeEDTA 4 个月,导致大肠杆菌/志贺氏菌丰度增加,以及肠杆菌科:双歧杆菌属比例增加。与单独使用相同MNP产生的丰度相比,10个月大时的比例增加。
在一项比较 MNP(Sprinkles)加 12.5 毫克富马酸亚铁与单独使用相同 MNP 的试验中,以及当含铁组组合并与仅使用 MNP 的组进行比较时,也观察到了类似的结果。
在另一项试验中,与单独使用相同的 MNP 相比,MNP 中的铁含量(2.5 mg NaFeEDTA 和 2.5 mg富马酸亚铁)对微生物组组成有显着影响,包括较低丰度的有益菌(如乳杆菌属和双歧杆菌属)以及较高比例的梭菌目,而拟杆菌门在各组之间保持相似。在一项辅助研究中,抗生素治疗并没有抵消铁的作用,铁仍然导致肠杆菌科细菌的增加。
最后,在另一项试验中,与单独的 MNP 相比,含铁的 MNP(12.5 毫克富马酸亚铁)在多样性或相对丰度方面没有组间差异。然而,接受含铁 MNP 的组梭状芽胞杆菌增加,双歧杆菌减少,而仅接受 MNP 的组大肠杆菌减少。
尽管 MNP 配方和 16S 测序区域存在差异,但这些研究一致发现铁会导致有益细菌减少和可能有害细菌增加,这为铁对肠道微生物组的影响提供了多种证据。需要进一步的研究来检查铁在其他环境中对肠道微生物组的影响。
▸ 铁强化和补充剂:对肠道菌群的影响
在科特迪瓦 6-14 岁儿童中(n = 60),铁强化饼干(20 毫克电解铁)不会导致微生物多样性发生变化,肠杆菌科细菌增加,乳杆菌属细菌减少,并且双歧杆菌属没有差异。6个月后这些发现与之前对婴儿进行的研究一致。
在南非进行的另一项针对 6-11 岁儿童的研究中,与安慰剂组(两组均服用维生素 C)相比,饮用含 50 毫克硫酸亚铁的饮料会导致组内相对含量存在差异;然而,尽管铁剂量较高,但没有发现组间差异。这些发现可能是由于肠道病原体负担和卫生设施的差异造成的,包括优质水和卫生设施、饮食质量和感染负担。
▸ 存在于全食物基质中的铁可能有利于铁的吸收
如LNS,不会产生与铁相关的负面影响,例如增加潜在致病菌、炎症和腹泻等胃肠道疾病症状。
LNS由植物油、花生、奶粉、糖、维生素和矿物质组成,食用量约为54g小袋,或在少量的情况下,食用量为20g(~6g脂肪),以帮助解决大量营养素和能量不足问题,并满足微量营养素需求。
已经进行了三项随机试验来检验直接给予婴儿 LNS 的影响或在怀孕期间给予母亲,然后给予婴儿。在同一队列的两项研究中,6 个月大的儿童接受基于牛奶蛋白的 LNS、基于大豆蛋白的 LNS、CSB 或 12 个月内不接受干预。通过 16S rRNA V4 区域测序评估肠道微生物群,双歧杆菌属的定植率或计数没有差异。与未接受营养补充剂的对照组相比,接受 LNS 和 CSB 补充剂的组中发现了金黄色葡萄球菌或其他肠道细菌。
在另一项试验中,将 SQ-LNS(20 克铁)给予孕妇(妊娠 <29 周),然后给予 6 至 18 个月大的婴儿;对照组包括给怀孕期间和哺乳期前 6 个月的母亲服用含有 20 毫克铁的 MMN,或者给怀孕期间的母亲服用标准护理铁和叶酸(含有 60 毫克铁)加上安慰剂哺乳期的前 6 个月。
12 个月时,与任一对照组相比,SQ-LNS 组的婴儿肠道微生物α 多样性和均匀度更高,而β 多样性没有差异或观察年龄微生物群 z 评分 (MAZ)。
然而,由于干预组之间干预的类型、数量、接受者和给药方案存在差异(只有 SQ-LNS 组中的婴儿接受直接补充),因此很难确定任何一种特定的营养素或干预类型可能会造成这些影响。总之,这些发现表明,怀孕和哺乳期间补充铁可能不会影响新生儿和婴儿的微生物组。
锌
微量矿物质锌在体内发挥催化、结构和调节作用,包括肠道健康和免疫健康,并已广泛用于治疗严重腹泻。
锌的吸收主要发生在人体的小肠中,受到食品中含锌物质是否存在以及食品加工方法的影响。例如,植物性锌来源(如种子、根和块茎)中的植酸盐会抑制锌的吸收,而铁等其他微量营养素会竞争性地抑制锌的吸收,而谷物的发酵可以提高锌的吸收。
此外,由于存在组氨酸等氨基酸增强锌的溶解度,动物源产品中的锌更容易被利用。过量的锌,包括未吸收的膳食锌和内源性锌,以受控机制通过粪便排出体外,以维持体内平衡。由于体内没有锌的储存,低锌饮食后可能会迅速出现锌缺乏症。
▸ 共生菌和病原菌在肠道中的定植和功能可能受到锌的调节
锌对于许多细菌(例如毒力因子)至关重要,并因其抗菌作用而用于动物生产。
在大肠杆菌中,锌受到严格调控,并在 300 多种蛋白质中发挥结构和催化作用,并且许多细菌拥有重金属外排系统或进行特定重金属质粒的基因转移。乳酸杆菌等细菌对膳食锌的抗性也不同。
关于锌和肠道微生物群的研究主要在动物模型中进行;这些研究的作者发现了细菌组成的差异,特别是乳杆菌属、梭菌属和肠杆菌科。
一项针对患有继发于肺炎的抗生素相关性腹泻的 2-36 个月大儿童的研究,检查了锌补充剂与益生菌的作用,为期 14 天,与单独益生菌相比,双歧杆菌属的计数没有显着差异。与基线相比,每个干预组中大肠杆菌减少。
另一项针对 6 个月大儿童食用铁和锌强化或仅铁强化谷物的研究发现,锌可以抵消铁强化对肠道微生物群的潜在不利影响。
上面的证据表明肠道微生物组在生命早期生长中的作用,为儿童营养不良的营养和药物治疗提供了新的目标。
目前预防发育迟缓和消瘦的营养策略并不能完全解决短期和长期生长缺陷或相关的临床结果。6-24 个月龄小剂量脂质营养补充剂可将发育迟缓发生率降低12%,将严重发育迟缓发生率降低 17%。
使用即用型治疗食品 (RUTF) 对 SAM 进行社区管理可显着改善营养恢复;然而,复杂的 SAM 后仍然存在高死亡率和长期生长缺陷。
总的来说,目前的治疗方法通过抗生素解决感染负担,并通过单糖、脂质和微量营养素恢复宿主营养;然而,这些治疗方法并不专门针对肠道微生物组,而肠道微生物组可能有助于改善生长。
事实上,目前对复杂 SAM 的建议(包括在所有情况下进行抗生素治疗)可能会损害肠道微生物组的恢复。而越来越多的试验报告了针对微生物群的干预措施对儿童营养不良的临床有益效果。
益生菌
少数益生菌试验报告了在营养不良负担较高的环境中益生菌对儿童生长的不同影响。对 795 名 SAM 儿童进行的一项大型随机临床试验发现,尽管观察到门诊死亡率有降低的趋势,但多物种益生菌和益生元联合治疗对营养恢复、死亡率或相关临床症状没有影响。较小规模的试验表明,其他益生菌种类对 SAM 和其他形式的营养不良具有潜在益处。
长双歧杆菌亚种由于婴儿益生菌与资源匮乏环境中的生长呈正相关,因此它具有作为促进生长的潜在益生菌的巨大潜力。在孟加拉国开展的一项 SAM 儿童试验,在临床稳定和急性期管理后,将 62 名参与者随机分为婴儿双歧杆菌益生菌(婴儿双歧杆菌 EVC001)、益生菌和纯化 HMO(乳-N-新四糖)或安慰剂,为期4周在医院。
在开始治疗 8 周后的研究终点,益生菌组的年龄别体重 Z 评分 (WAZ) 和 MUAC 显着更高。鼠李糖乳杆菌GG (LGG) 和动物双歧杆菌亚种组合的试验。SAM 治疗期间的乳酸菌和 LGG 也证明了感染发生率和门诊腹泻减少的证据。
由于患有复杂 SAM 的儿童的临床不稳定和高死亡率,特定益生菌用作 SAM 标准治疗的潜力将在很大程度上取决于成本、可持续性和安全性。
此外,需要合理选择益生菌,以确定那些能够适当定植于营养不良儿童受损肠道的益生菌,并针对可以改善生长恢复的特定途径。
来自动物研究的进一步数据可能有助于为未来合适益生菌的临床试验提供信息,例如针对内分泌生长途径的益生菌。
即食治疗性食品(RUTF)
针对肠道微生物群的改良营养疗法有潜力成为儿童营养不良的可持续且经济有效的疗法。SAM 的证据表明,RUTF 喂养后微生物组成熟度的恢复是短暂的,并且往往在治疗后 3-4 个月恢复到不成熟状态。
因此,针对 SAM 恢复中肠道微生物组和预防发育迟缓的改良补充食品可能有助于促进生长。
一项试点试验评估了在 SAM 治疗期间向 F75 和 F100 治疗奶中添加可微生物发酵的碳水化合物菊粉或豇豆粉,发现与对照组相比,对营养恢复没有改善作用;然而,补充营养可以防止住院治疗期间物种多样性的暂时丧失,这部分是由抗生素治疗引起的。
豇豆辅助喂养可以显着减少有发育迟缓风险的儿童的一些 LAZ 缺陷;然而,它仅引起肠道微生物组组成的适度变化,包括双歧杆菌增加和大肠杆菌/志贺氏菌减少,表明对生长的有益影响可能与肠道微生物组无关。
来自孟加拉国的一个队列的研究,与标准 RUTF 疗法相比,微生物群导向的补充食品 (MDCF) 对 MAM 恢复儿童生长的影响显着增强。通过合理设计由当地可用的、文化上可接受的食物组成的补充食品组合 (MDCF-2),该组合可促进人源化动物模型中早期生命肠道微生物组的成熟。
这些有希望的数据表明,与目前的疗法相比,针对微生物群的补充食品可以在更大程度上促进儿童营养不良后的生长恢复。从长远来看,这些小但显着更大的生长改善是否与持续的生长改善、认知益处或感染和慢性病风险的降低相对应,目前尚不清楚。
来自高收入环境的临床试验越来越多的证据支持针对微生物群的治疗在各种感染、胃肠道和代谢疾病中的功效。
由于世界上超过五分之一的儿童发育迟缓或消瘦,旨在进一步表征导致儿童营养不良的微生物介导的病理生理途径的研究对于为更好的治疗提供信息至关重要。
儿童营养不良涉及许多生理系统的紊乱,包括代谢、免疫和内分泌系统,其中许多系统与肠道微生物组密切相关,因此可能适合针对微生物组的干预措施。
未来潜在的微生物组靶向疗法将补充针对宿主营养需求和感染负担的现有疗法。此外,必须根据国家或地区的具体要求调整这些干预措施,以制定具有成本效益且本国或本地区上可接受的可持续干预措施。
Tips
在这篇文章中综合了营养干预试验的现有证据,这些试验测试了多种饮食干预措施对婴儿和儿童微生物组相关结果的影响,并讨论了来自实验室和动物研究的支持证据,以及来自人类研究的观察数据,旨在指导未来的研究并增强可解释性,为饮食相关政策提供信息。
可比性较差,因为纳入的研究在干预类型和持续时间上有所不同,是在有或没有既往疾病的不同儿科人群中进行的,并且是在可能影响基线微生物组成的各种环境中进行的。
虽然调查婴儿微生物群的研究发现,母亲在怀孕期间的饮食变化几乎没有影响儿童肠道微生物群。但是通过单独检查研究而不是包括整个全球背景,很难将研究偏差与真实的生物现象分开。可以使用 Qiita 等工具尝试进行此类分析,前提是研究数据与符合标准的样本元数据是公开的,以促进未来分析中的跨研究可比性。
在进行 16S rRNA 测序的 19 项研究中,只有两项对 16S V4 区域进行测序的试验可用于 Qiita 的进一步分析。作者将这两个试验人群的肠道微生物群与 2012 年具有里程碑意义的微生物组队列研究的亚组进行了比较。
在 2012 年的研究中发现,马拉维出生的婴儿和美国出生的婴儿之间存在显着的微生物分离,但在纳入最近的两项试验时,缺乏数据来深入研究营养干预措施的效果与2012年的研究对比。
尽管微生物组生物信息学取得了很大进展,并且研究的人群类型和健康状况的广度不断扩大,但在营养和肠道微生物组领域,特别是儿童,仍需要解决许多研究空白和问题。
为了解决基于发现的差距,未来的研究人员将需要:
a)识别饮食细分成分响应微生物群并确定它们是否影响宿主的生理结果;
b)与最适合现实世界应用的特定膳食成分相比,了解全食干预措施的作用;
c)提高复制性和再现性,例如在不同人群中使用相同的饮食干预措施,以及在同一人群中测试不同的饮食干预措施;
d)确定食品加工和准备的作用,了解熟食或生食如何影响肠道微生物群(烹饪的影响最近已被研究,但仍是一个研究不足的领域);
e)考虑到依从性的差异,设计和使用饮食干预措施,这需要大量的队列和长时间的随访;
f)将研究结果和序列数据整合到一个数据库中,用于对类似处理的序列进行汇总分析并了解全局现象,同时最大限度地减少研究偏差。
介入/治疗差距
未来的研究应解决以下五个介入和治疗差距。
首先,需要解决稳定性和可塑性问题。虽然短期饮食变化可以改变肠道微生物群,但长期饮食模式与更稳定的微生物群构象相关,并且很难改变。仍有待确定的是哪种饮食模式具有最大或最小的可塑性,以及这种可塑性是否也取决于基线微生物种群和过去的饮食模式。
第二个差距是干预研究中针对不同人群的营养素和食物研究不足。尽管本次综述确定了几项微量营养素粉 (MNP) 试验,而关于补充个别维生素、矿物质和天然食品的试验相对较少,但仍然需要在中国以及其他国家重复研究中对 MNP 进行调查。
第三,应进行纵向、长期的人体研究。需要对 2-18 岁婴儿、青春期、成年早期和晚年等人群进行长期喂养研究,以了解衰老微生物群的动态。
第四,解决精准营养健康问题。
第五,未来健康建议应考虑大局。建议食物和饮食(生活方式)改变需要全面的方法和来自营养师和营养科学家、心理学家、医生和生物统计学家的多方面团队的支持。
小编寄语
中国在医疗和队列研究方面的发展仍有待提升。正如首都医科大学附属北京天坛医院院长王拥军教授所指出的:“中国目前还缺乏具有全球影响力的标志性队列研究,尤其是能够改变临床指南的里程碑试验”。
举例来说,美国的弗明汉心脏研究和英国的UK Biobank人群队列都对临床研究产生了重大影响。弗明汉心脏研究自1948年开始,最初只有5200名参与者,但经过70年的发展,参与者数量增加到15000人,产生了3698篇文章。这项研究改变了几乎所有心血管疾病的临床危险因素的认知。
另外,英国的UK Biobank人群队列从2006年开始策划,至今已发表超过3000篇文章。该队列成为世界上其他国家难以逾越的临床队列研究之一。
因此,谷禾也愿意和期待与各大医疗机构合作构建大型研究队列,尤其是关于青少年儿童的。通过对这些队列进行全面多组学以及生活营养指标的调查分析,将为我国医疗研究带来新的机遇和突破,为改善人们的健康水平做出重要贡献。
主要参考文献
Jones HJ, Bourke CD, Swann JR, Robertson RC. Malnourished Microbes: Host-Microbiome Interactions in Child Undernutrition. Annu Rev Nutr. 2023 Aug 21;43:327-353.
Acosta A, De Burga R, Chavez C, Flores J, Olortegui M, et al. 2017. Relationship between growth and illness, enteropathogens and dietary intakes in the first 2 years of life: findings from the MAL-ED birth cohort study. BMJ Glob. Health 2(4):e000370
Alves da Silva AV, de Castro Oliveira SB, Di Rienzi SC, Brown-Steinke K, Dehan LM, et al. 2019. Murine methyl donor deficiency impairs early growth in association with dysmorphic small intestinal crypts and reduced gut microbial community diversity. Curr. Dev. Nutr. 3(1):nzy070
Mehta S, Huey SL, McDonald D, Knight R, Finkelstein JL. Nutritional Interventions and the Gut Microbiome in Children. Annu Rev Nutr. 2021 Oct 11;41:479-510.
Amadi B, Fagbemi AO, Kelly P, Mwiya M, Torrente F, et al. 2009. Reduced production of sulfated glycosaminoglycans occurs in Zambian children with kwashiorkor but not marasmus. Am. J. Clin. Nutr. 89(2):592–600
Amadi B, Zyambo K, Chandwe K, Besa E, Mulenga C, et al. 2021. Adaptation of the small intestine to microbial enteropathogens in Zambian children with stunting. Nat. Microbiol. 6(4):445–54
Ansaldo E, Farley TK, Belkaid Y. 2021. Control of immunity by the microbiota. Annu. Rev. Immunol. 39:449–79
Attia S, Versloot CJ, Voskuijl W, van Vliet SJ, Di Giovanni V, et al. 2016. Mortality in children with complicated severe acute malnutrition is related to intestinal and systemic inflammation: an observational cohort study. Am. J. Clin. Nutr. 104:1441–49
Barratt MJ, Nuzhat S, Ahsan K, Frese SA, Arzamasov AA, et al. 2022. Bifidobacterium infantis treatment promotes weight gain in Bangladeshi infants with severe acute malnutrition. Sci. Transl. Med. 14(640):eabk1107
Bartelt LA, Bolick DT, Mayneris-Perxachs J, Kolling GL, Medlock GL, et al. 2017. Cross-modulation of pathogen-specific pathways enhances malnutrition during enteric co-infection with Giardia lamblia and enteroaggregative Escherichia coli. PLOS Pathog. 13(7):e1006471
Bartz S, Mody A, Hornik C, Bain J, Muehlbauer M, et al. 2014. Severe acute malnutrition in childhood: hormonal and metabolic status at presentation, response to treatment, and predictors of mortality. J. Clin. Endocrinol. Metab. 99(6):2128–37
Bhattacharjee A, Burr AHP, Overacre-Delgoffe AE, Tometich JT, Yang D, et al. 2021. Environmental enteric dysfunction induces regulatory T cells that inhibit local CD4+ T cell responses and impair oral vaccine efficacy. Immunity 54(8):1745–57.e7
Black RE, Victora CG, Walker SP, Bhutta ZA, Christian P, et al. 2013. Maternal and child undernutrition and overweight in low-income and middle-income countries. Lancet 382(9890):427–51
Bourdon C, Lelijveld N, Thompson D, Dalvi PS, Gonzales GB, et al. 2019. Metabolomics in plasma of Malawian children 7 years after surviving severe acute malnutrition: “ChroSAM” a cohort study. EBioMedicine 45:464–72
Aakko J, Grzeskowiak L, Asukas T, Paivansade E, Lehto KM, et al. 2017. Lipid-based nutrient supplements do not affect gut Bifidobacterium microbiota in Malawian infants: a randomized trial. J. Pediatr. Gastroenterol. Nutr. 64:610–15
Aly H, Said RN, Wali IE, Elwakkad A, Soliman Y, et al. 2017. Medically graded honey supplementation formula to preterm infants as a prebiotic: a randomized controlled trial. J. Pediatr. Gastroenterol. Nutr. 64:966–70
Amarri S, Benatti F, Callegari ML, Shahkhalili Y, Chauffard F, et al. 2006. Changes of gut microbiota and immune markers during the complementary feeding period in healthy breast-fed infants. J. Pediatr. Gastroenterol. Nutr. 42:488–95
Andrews SC, Robinson AK, Rodriguez-Quinones F. 2003. Bacterial iron homeostasis. FEMS Microbiol. Rev. 27:215–37
Arimond M, Zeilani M, Jungjohann S, Brown KH, Ashorn P, et al. 2015. Considerations in developing lipid-based nutrient supplements for prevention of undernutrition: experience from the International Lipid-Based Nutrient Supplements (iLiNS) Project. Matern. Child Nutr. 11:31–61
Arrieta MC, Stiemsma LT, Amenyogbe N, Brown EM, Finlay B. 2014. The intestinal microbiome in early life: health and disease. Front. Immunol. 5:427
Black RE, Victora CG, Walker SP, Bhutta ZA, Christian P, de Onis M, Ezzati M, Grantham-McGregor S, Katz J, Martorell R, Uauy R; Maternal and Child Nutrition Study Group. Maternal and child undernutrition and overweight in low-income and middle-income countries. Lancet. 2013 Aug 3;382(9890):427-451.
谷禾健康
偏头痛
偏头痛是一种常见且使人衰弱的神经系统疾病,也是世界经济的重大负担。大约14%的成年人患有偏头痛。其特点是反复出现一侧或两侧严重头痛(抽痛),并伴有独特的相关症状,包括畏光、恐声、恶心、呕吐等。
偏头痛在儿童晚期/青春期早期发病,在 40 多岁的人群中发病率最高,此后发病率下降。在所有年龄段中,女性偏头痛的发病率始终高于男性。
潜在危险因素包括压力、饮食、急性药物过量、激素波动、睡眠、环境、天气等。
对偏头痛根本原因的研究已经跨越了几个世纪,涉及外周和中枢机制等,但其根本机制仍未完全了解。已经确定三叉神经系统的激活和敏化在偏头痛发作期间至关重要。
胃肠道系统和中枢神经系统之间存在双向关系。多项研究表明偏头痛与某些胃肠道疾病有关,例如幽门螺杆菌感染、肠易激综合征(IBS)、胃轻瘫、乳糜泻等。
越来越多的证据表明微生物介导的肠-脑串扰可能导致偏头痛的发病机制。在偏头痛患者中,肠道微生物群的组成发生了改变,包括肠道菌群多样性下降,产丁酸菌减少,梭状芽孢杆菌增加等。
偏头痛患者肠道和大脑之间的相互作用,可能受到多种因素的影响,如炎症介质(IL-1β、IL-6、IL-8 和 TNF-α)、肠道微生物群、肠道菌群代谢产物、血清素途径、谷氨酸途径、神经肽(包括 CGRP、P物质、PACAP、NPY)等。
本文主要介绍了偏头痛相关症状、发病人群、四个阶段,基于偏头痛的发病机制,阐述肠道微生物群如何通过各个途径参与偏头痛的病理生理学,并探讨了潜在的干预策略。

很多人在听到偏头痛这个词的时候,会想到严重的头痛,但头痛并不直接等于偏头痛,头痛只是偏头痛的一种症状。
偏头痛是一种常见的神经系统疾病,会引起多种症状,最明显的是头部一侧的搏动性头痛,伴随着头部不适感和其他一些症状。
偏头痛是原发性头痛,这意味着它不是由其他疾病引起的。偏头痛的发作通常会对患者的日常生活和工作造成较大的干扰,那么偏头痛发作时,具体会有什么表现?
偏头痛可能会有以下症状:
日常体力活动、运动,甚至咳嗽或打喷嚏都会加剧头痛。
偏头痛最常发生在早晨,尤其是刚醒来时。有些人会在可预测的时间出现偏头痛,例如月经前或一周紧张工作后的周末。许多人在偏头痛后感到疲惫或虚弱,但在两次发作之间通常没有症状。
偏头痛的频率可以是每年一次、每周一次、或介于两者之间的任意时间。
每月发生两到四次偏头痛是最常见的。
未经治疗的发作持续 4~72 小时。
大多数偏头痛持续约 4 小时,但严重的可能会持续 3 天以上。
偏头痛的两种主要类型是:
先兆偏头痛
以前称为经典偏头痛,包括视觉障碍和其他神经系统症状,这些症状在实际头痛前约10-60分钟出现,通常持续不超过一小时。个人可能会暂时失去部分或全部视力。这种先兆可能会在没有头痛的情况下出现,并且随时可能发作。
其他典型症状包括:
说话困难;身体一侧感觉异常、麻木或肌肉无力;手或脸有刺痛感,意识混乱。头痛之前可能会出现恶心、食欲不振以及对光、声音或噪音的敏感性增加。
无先兆偏头痛
或普通偏头痛是更常见的偏头痛形式。症状包括毫无征兆地出现头痛,通常在头部的一侧感觉到,并伴有恶心、意识模糊、视力模糊、情绪变化、疲劳以及对光、声音或噪音的敏感性增加。
其他类型包括:
经期偏头痛
这些通常发生在经期开始前 2 天,并持续到经期后 3 天。可能还会在每月其他时间出现其他类型的偏头痛,但月经前后的偏头痛通常没有先兆。
沉默偏头痛
会出现前兆症状,但没有头痛。事实上,前兆通常是这种类型偏头痛的主要警告信号。但可能还会出现恶心和其他偏头痛症状。它通常只持续约20-30分钟。
前庭偏头痛
有平衡问题、眩晕、恶心、呕吐,伴或不伴头痛。这种情况通常发生在有晕车病史的人身上。
腹部偏头痛
可能会导致胃痛、恶心和呕吐。它经常发生在儿童身上,随着时间的推移可能会变成典型的偏头痛。
偏瘫偏头痛
身体一侧出现短暂瘫痪 (偏瘫)或无力。可能还会感到麻木、头晕或视力变化。这些症状也可能是中风的征兆,因此请立即寻求医疗帮助。
眼部偏头痛
也称为眼部或视网膜偏头痛。它会导致一只眼睛短暂、部分或完全丧失视力,并伴有眼睛后面的钝痛,这种疼痛可能会扩散到头部的其他部位。请立即就医检查这些症状。
带脑干先兆的偏头痛
头痛之前可能会出现头晕、意识混乱或失去平衡。疼痛可能会影响头后部。这些症状通常突然出现,并可能伴有说话困难、耳鸣和呕吐。这种类型的偏头痛与激素变化密切相关,主要影响年轻的成年女性。请立即就医检查这些症状。
持续偏头痛
这种严重类型的偏头痛可持续超过 72 小时。疼痛和恶心非常严重需要去医院。有时,药物或停药可能会导致它们出现。
眼肌麻痹性偏头痛
这会导致眼睛周围疼痛,包括周围肌肉麻痹。这是医疗紧急情况,因为这些症状也可能是由眼睛后面的神经受压或动脉瘤引起的。其他症状包括眼睑下垂、复视或其他视力变化。
活动性偏头痛的高峰发病年龄为 40 岁左右,其中 35%左右的女性和15%左右的男性受到影响。
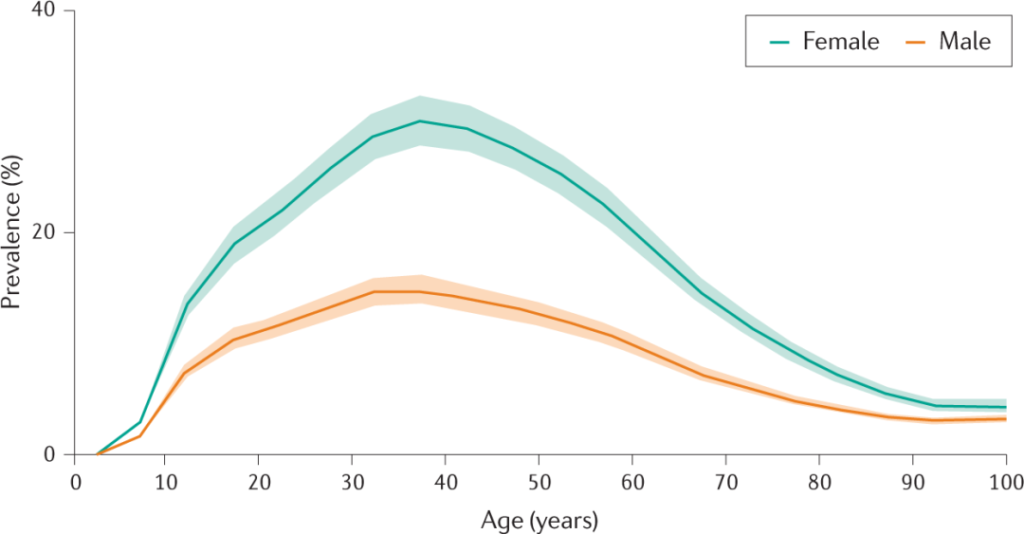
doi: 10.1038/s41572-021-00328-4.
一些常见的偏头痛诱因包括:
许多女性注意到她们在月经期间、怀孕期间或排卵期间会感到头痛。症状也可能与更年期、使用激素避孕或激素替代疗法有关。
当感到压力时,大脑会释放化学物质,这些化学物质会导致血管变化,从而可能导致偏头痛。
某些食物和饮料,例如陈年奶酪、酒精、硝酸盐(意大利辣香肠、热狗和午餐肉中的硝酸盐)、味精等食品添加剂,高盐和加工食物,可能对部分人造成影响。
摄入过多或未达到习惯的摄入量都会导致头痛。咖啡因本身可以治疗急性偏头痛。
风暴锋、气压变化、强风或海拔变化都可能引发偏头痛。
大声的噪音、明亮的灯光和强烈的气味都会引发偏头痛。
口服避孕药、血管扩张剂可以扩张血管,从而引发这些症状。
这包括体育锻炼和性生活等。
当睡眠过多或不足时,可能会感到头痛。
不良习惯包括不吃饭(或推迟进餐),吸烟,酗酒等,还有晕车也都可能引发偏头痛。
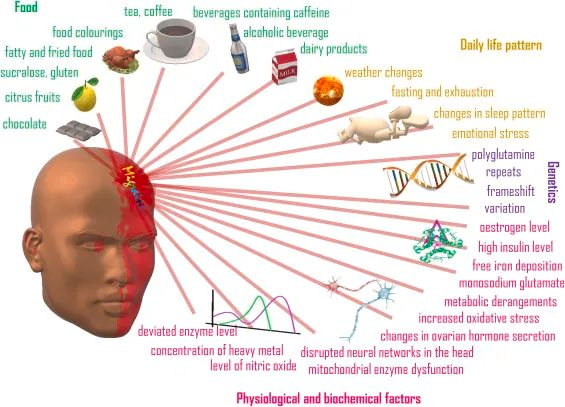
doi.org/10.1016/j.biopha.2021.111557
前驱症状阶段
有时称为头痛前阶段,此阶段的特点是在偏头痛出现前数小时或数天出现,特点是没有疼痛的症状。这些包括情绪波动、对食物的渴望、颈部僵硬、严重口渴、腹胀、便秘或腹泻、注意力不集中、排尿增多等。
先兆阶段
先兆是指偏头痛之前或期间发生的感觉障碍。这些障碍会影响一个人的视力、触觉或言语,但并不是每个偏头痛患者都会出现视觉异常期。例子包括:
视力模糊、看到黑点、波浪线、闪光或不存在的东西、渐渐扩大的盲点、手臂麻木、手臂和腿部有沉重感、口齿不清或语句混乱。
头痛阶段
这是通常出现疼痛的阶段,疼痛程度可能从轻微到无法忍受。
偏头痛通常以钝痛开始,然后发展为抽痛,有时候是钻孔感。也可能出现颈部疼痛、僵硬、鼻塞、恶心、呕吐、失眠等。
体力活动以及接触光、声音和气味可能会加剧疼痛。然而,有些人在发作偏头痛时并不会出现头痛。
恢复阶段
最后阶段是疼痛消退时。在此阶段,人们可能会感到疲惫、困惑或总体不适。
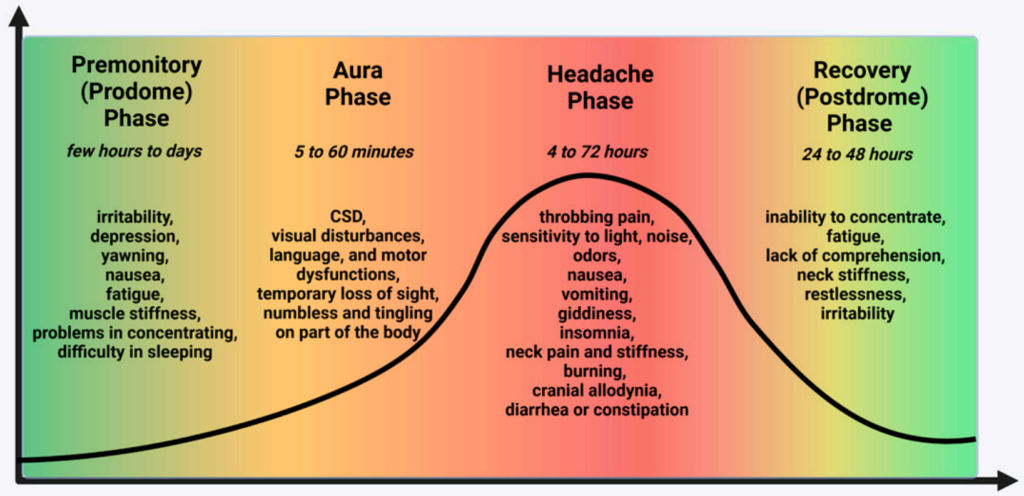
doi.org/10.3390/neurolint15030073
简单来说,在偏头痛发作之前几天,可能会感到疲劳,情绪变化,打哈欠,出现睡眠问题,恶心等情况,对光和声音敏感,这些预警信号与大脑中某个特殊的区域——下丘脑有关。下丘脑通常控制体内激素平衡,昼夜节律等,偏头痛发作之前下丘脑很活跃。
偏头痛还有常见的症状,视觉变化,刺痛感,言语困难等,这些感觉与细胞膜电位变化相关,导致脑活动和血流变化在大脑中扩散,电位变化快速在大脑表面传播,它传向哪里,哪里就出问题(*>﹏<*) …当它侵入视觉皮层,可能出现视觉盲点。
在头痛阶段,三叉神经起到关键作用,三叉神经会传递来自脸部皮肤,头皮,覆盖大脑皮层的血管和膜层的触觉,温度等,一旦被激活,三叉神经会传递痛觉信号,当偏头痛发作时,这个痛觉通路会变得敏感化,也就是说能触发痛觉的阈值下降了,那么平时不太会引起疼痛的也变得容易痛了,比如说,咳嗽,弯腰,一些强光,噪声等都会引起疼痛。
具体来说,关于偏头痛的发病机制,目前主要有以下几种理论。
I) 血管学说
该学说认为由血管舒缩功能障碍引起。基于先兆期间大脑血管收缩引起的三叉神经过度兴奋,随后产生炎症神经肽释放引起血管舒张,导致偏头痛。
II)神经学说 (皮层扩散性抑制)
该学说认为偏头痛是原发性神经功能紊乱疾病。其中通过皮层-三叉神经通路,大脑皮层的过度神经兴奋(异常的神经放电)会增加细胞外谷氨酸、钙离子、钠离子和钾离子的释放,从而引发去极化作用,造成皮质扩散性抑制(CSD)。
皮质扩散抑制是什么意思呢?
它其实是一种缓慢传播的大脑活动改变波,涉及神经、血管功能的巨大变化,皮质扩散抑制可能是偏头痛先兆的原因。这些慢电波可以激活负责感知大脑周围覆盖物(“脑膜”)疼痛的神经,并改变血管功能,这两者都可能导致偏头痛。
doi.org/10.3390/ijms221810134
III)三叉神经血管学说 (近年流传较广)
三叉神经感觉纤维的激活(传递疼痛信号),导致脑膜血管(硬脑膜)发生痛性神经源性炎症,此过程通过炎症神经肽(CGRP、SP、NK-A)的释放介导,这表明CGRP释放与神经源性硬脑膜血管舒张有关,这可能在偏头痛的发生中很重要。
注:关于CGRP在第四章节会详细介绍。
简单来说,激活三叉神经血管通路:
激活三叉神经元 → 释放P物质、CGRP等血管活性神经肽 → 血管扩张和促炎分子(组胺、缓激肽)的释放 → 神经源性炎症 → 激活脑膜痛觉受体
偏头痛中的 CGRP 和三叉血管系统
doi.org/10.3390/ijms22168929
三叉血管系统是一组感知面部和大脑覆盖层疼痛的神经细胞。三叉血管系统的反复激活会导致神经系统过敏和持续疼痛。
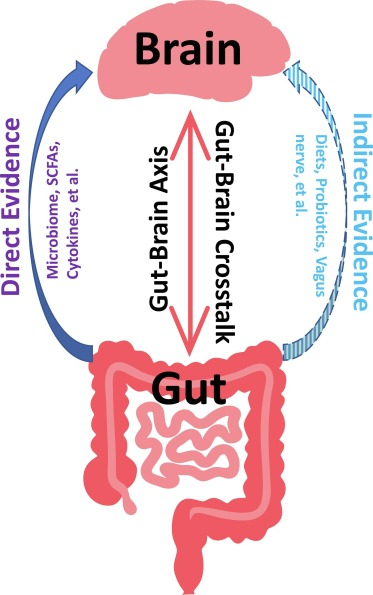
IV)肠脑轴(GBA)理论
肠-脑轴作为肠道功能和维护的协调系统,将大脑的情绪中心与肠外周机制连接起来,包括肠反射、肠道通透性、免疫反应和肠内分泌信号传导等。
肠道微生物群组成的改变可能会影响肠脑轴并引起炎症,从而可能导致偏头痛。
通过肠-脑轴影响偏头痛
doi.org/10.1111/ene.15934
众所周知,睡眠不足和压力是原发性头痛障碍的常见诱因,不良饮食会增加偏头痛的严重程度和频率。
a) 上述因素导致肠道微生物组多样性和组成的改变,导致肠道细菌产生的短链脂肪酸减少,LPS转移到系统循环中。
b) 此外,这些因子激活免疫细胞,产生的促炎细胞因子也进入系统循环。
c) 这反过来又促进了肠道微生态失调,增加了肠道上皮的通透性,并将分子转移到系统循环中。
肠道微生物组的功能障碍,会导致与头痛病理生理学有关的必需神经递质GABA和血清素的耗竭。这反过来又改变了迷走神经功能。
而系统性促炎细胞因子和LPS,改变了HPA轴的功能,并激活了孤束核,孤束核介导了大脑中的疼痛处理途径,包括前扣带、岛叶皮层、运动皮层和感觉皮层,导致疼痛感知的改变。
神经炎症刺激三叉神经纤维释放CGRP,并驱动皮层扩散性抑郁(CSD),改变兴奋性和抑制性传递,激活三叉神经-颈复合体,加剧头痛严重程度并介导头痛频率。
接下来,我们主要就以上肠脑轴理论展开讨论一下,这其中涉及到的肠道菌群及其代谢产物与偏头痛有什么样的关联。
偏头痛常伴随一些胃肠道症状,包括恶心、呕吐、腹泻、便秘和消化不良。一些研究表明,肠道微生物群失调,可能会下调免疫系统功能,改变宿主代谢,破坏肠-脑轴,导致代谢和神经疾病的发生。胃肠道中的炎症和神经免疫调节可能在偏头痛的发病机制中发挥重要作用。
偏头痛患者的肠道微生物群的物种多样性(α多样性)和代谢功能降低,产丁酸菌减少。
而梭状芽孢杆菌增加,如:
硝酸盐已被确定为一种普遍的偏头痛诱因。
与没有偏头痛的人相比,在偏头痛患者的口腔和粪便样本中观察到能够减少硝酸盐、亚硝酸盐和一氧化氮的细菌丰度更高,如嗜血杆菌属和Rothia属。
编辑
doi.org/10.3390/microorganisms11082083
特殊年龄段的偏头痛研究队列:
儿童和青少年
偏头痛在儿童和青少年中表现出多种形式,估计全世界儿童和青少年的总患病率为 10%。儿童双侧偏头痛更为常见,且持续时间较短。偏头痛儿童会出现多种胃肠道症状,包括腹痛、恶心、呕吐、腹泻、便秘。
在381名 7-18 岁儿童的队列中(40 名患有偏头痛,341 名没有偏头痛,平均年龄 11.5 岁),在偏头痛儿童和健康对照儿童有明显的菌群差异。
与健康对照相比,偏头痛儿童下列菌群升高:
老年患者

一项针对108位老年女性(54 名偏头痛患者、 54 名健康受试者)的宏基因组关联研究发现偏头痛患者的细菌特征如下:
厚壁菌门,尤其是梭菌属显著增加。
在健康对照中有更多有益菌,例如:
普氏粪杆菌、青春双歧杆菌、史密斯甲烷杆菌。
同时,该研究发现犬尿氨酸降解、谷氨酸降解和γ-氨基丁酸(GABA)合成途径较多,提示神经传递和代谢可能发生转变。
接下来我们看这些肠道菌群代谢产物会怎样参与到偏头痛的发病机制中。
谷氨酸和γ-氨基丁酸(GABA)等都参与疼痛感知。肠道中的这些神经递质参与了几种信号通路,这些信号通路除了调节疼痛外,还调节促炎细胞因子的释放。
★ 谷 氨 酸
谷氨酸作为一种兴奋性神经递质,通过不同的作用,包括皮质扩散抑制、中枢敏化和刺激三叉血管系统,在偏头痛病理生理学中发挥作用。
研究证实,各种细菌菌株,包括在环境中发现的或用于食品发酵的菌株,都能够产生谷氨酸。
偏头痛患者谷氨酸水平升高
由于谷氨酸可以沿着三叉神经血管通路对伤害性神经元产生刺激作用,因此它可能在偏头痛和偏头痛相关的中枢敏化的病理生理学中至关重要。这一理论得到了进一步的证明,偏头痛患者的血液谷氨酸水平在间歇期和发作期都有升高,在血浆和脑脊液中均升高。
有研究表明,血浆谷氨酸水平可能是慢性偏头痛和阵发性偏头痛的潜在指标。

此外,有证据表明谷氨酸在皮质扩散性抑制中起主要作用,皮质扩散性抑制被假设为偏头痛先兆的生理底物。基于这些,谷氨酸能神经传递可能是偏头痛和微生物组之间的联系。
扩展阅读:
★ 血 清 素
血清素存在于大脑、肠道和血液的组织中,其中肠道含有~95%的人体总血清素。血清素能神经元存在于中缝背核和整个疼痛通路中。
它在体内有很多作用,例如在神经细胞之间发送信号并帮助身体控制血管收缩的方式。它还在控制情绪、睡眠、饮食和消化方面发挥作用。
血清素从血小板释放到血浆中可能与偏头痛先兆期的病理生理学有关。偏头痛发作期间储存在血小板中的血清素被耗尽;血清素血浆水平降低,而相应代谢物羟基吲哚乙酸 (5-HIAA) 水平升高。
血清素既是血管扩张剂又是血管收缩剂,可作为伤害性疼痛的调节剂
偏头痛患者经常报告说,呕吐后头痛就会停止,呕吐会刺激肠道蠕动并提高血液血清素水平。而血清素的合成与肠道菌群有关,例如肠球菌、链球菌、大肠杆菌等。
血清素可能具有促伤害感受和抗伤害感受特性,具体取决于亚型
现在估计至少有七种不同的受体家族(5-HT1-7),其中许多具有亚型,偏头痛的发生涉及不止一种亚型。由于色氨酸是血清素的前体并且可以穿过血脑屏障,因此大脑中血清素的量取决于色氨酸的水平。
接下来我们看看关于色氨酸的代谢。
★ 色 氨 酸
色氨酸在人体内以三种主要途径代谢:血清素(5-HT),犬尿氨酸(l-kyn)和微生物群相关的吲哚途径。
一些报告表明,增加膳食色氨酸的摄入量可预防偏头痛的发生或减轻其胃肠道相关症状,如恶心、呕吐以及畏光。
色氨酸的代谢途径在五个肠道门中最有效:放线菌门、厚壁菌门、拟杆菌门、变形菌门、梭杆菌门。梭菌属、Burkholderia、链霉菌属、假单胞菌属、芽孢杆菌属5个属也具有较大的肠道内色氨酸代谢潜力。
色氨酸代谢的犬尿氨酸途径,可能对偏头痛具有治疗潜力
色氨酸代谢产物可能作用于谷氨酸能系统,该系统参与疼痛传递、中枢敏化和皮质扩散性抑制,谷氨酸能离子型和代谢型受体参与偏头痛的发病机制,KYNA(犬尿喹啉酸)是NMDA受体的竞争性拮抗剂,其抑制作用可防止谷氨酸诱导的兴奋性毒性,因此有理由推测色氨酸代谢的犬尿氨酸途径可能对偏头痛具有治疗潜力。
注:NMDA受体是离子型谷氨酸受体的一个亚型
犬尿氨酸途径是色氨酸转化的主要途径,因为它在正常情况下约占色氨酸代谢的95%,并且与神经系统疾病的行为和认知症状有关。
犬尿氨酸(l-kyn)途径(KP)将l-色氨酸转化为几种神经活性化合物。犬尿氨酸和喹啉酸的产生,耗尽了作为血清素前体的色氨酸和色胺的供应。

doi.org/10.3390/ijms221810134
犬尿氨酸衍生物具有有效的镇痛作用,其机制包括抑制CGRP。犬尿氨酸途径产物是芳烃受体(AhR)的重要配体,其激活与胃肠道炎症和偏头痛的发病机制有关。
AhR、TLR 和 MyD888 激活可能强调犬尿氨酸参与偏头痛和功能性胃肠道疾病。
扩展阅读:
★ 短 链 脂 肪 酸
短链脂肪酸 (SCFA) 是胃肠道细菌的代谢产物,对葡萄糖稳态、饱腹感、抗炎作用和大脑信号传导有许多局部和全身影响。
通过调节免疫细胞和细胞因子→影响神经炎症
如短链脂肪酸的施用可以减少硝酸甘油诱导引起的痛觉过敏,并导致肠道促炎细胞因子如 TNF-α 和 IL-1β 的释放减少。
丙酸可以保护血脑屏障免受氧化应激
一些菌群如:普通拟杆菌、B.uniformis、Alistipes putredinis、Prevotella copri、Roseburia inulinivorans、Veilonella、Akkermansia mucinophila等,具有很高的丙酸盐生产能力。
丁酸和丙酸等短链脂肪酸通过迷走神经,穿过血脑屏障,然后激活可能改变多巴胺能和血清素能信号传导的受体。
神经保护特性:如丁酸盐
丁酸盐影响肠嗜铬细胞释放血清素,前面我们已经了解到血清素在偏头痛发病中的重要性。
与产丁酸相关的菌群,例如:
快速和极端的饮食变化直接影响肠道微生物群,影响肠道微生物群的β多样性。在高脂肪饮食中添加益生元(可发酵纤维)可以恢复产丁酸菌和双歧杆菌水平,这也突出了饮食对肠道微生物群组成的关键影响。
丁酸盐刺激齿状回的细胞增殖和分化,并增强脑源性神经营养因子(BDNF)和胶质源性神经营养因子(GDNF)的表达。丁酸盐还通过抑制 TNF-α 的合成而在大脑中显示出抗炎作用,TNF-α 是由内毒素脂多糖 (LPS) 通过抑制NF-κB 诱导的。
下面我们来看看炎症因子在偏头痛发病中扮演怎样的角色。
炎症介质
在炎症性疾病和偏头痛中都观察到炎症免疫反应增强。促炎性免疫反应的主要触发因素是由于肠道通透性增加而导致脂多糖进入循环,那么,炎症反应可能出现在身体的各个部位,当三叉神经上伤害感受器的激活时,偏头痛就出现了。
研究表明偏头痛发作期间,下列炎症因子升高:
这些炎症因子是如何在偏头痛发病中发挥作用的呢?
IL-1β 是一种主要细胞因子,可驱动大脑和全身炎症,激活普遍存在的细胞表面受体 IL-1R1。
IL-1β/IL-1R1 轴激活一系列炎症分子,包括其他细胞因子和趋化因子。IL-1β 激活脑膜伤害感受器并使之敏感,是皮质扩散性抑制后三叉神经激活的关键介质。也就是说,IL-1β/IL-1R1 轴在外周TG和中枢神经系统的三叉血管通路中尤其发挥着至关重要的作用。
IL-1和IL-6 是由调节性B细胞响应微生物群的紊乱而释放的。
研究表明,肠道微生物群失调通过三叉神经伤害感受系统中的TNF-α水平上调,促进了类似偏头痛疼痛的持续性。
肠道菌群通过间接信号传导维持肠脑轴正常平衡的作用机制
doi: 10.1186/s10194-020-1078-9
IL-8的表达,涉及到神经肽,与P物质有关,P物质可以帮助调节免疫细胞及其产生的各种细胞因子。
接下来,我们来看偏头痛中重要的——神经肽。
★ CGRP(降钙素基因相关肽)
对于患有慢性偏头痛的患者,CGRP 水平在偏头痛发作期间持续升高,并且在两次发作之间继续升高。CGRP是我们反复提到的词,我们来看看它在偏头痛疾病中发挥什么样的作用。
CGRP,降钙素基因相关肽 ,一种由37个氨基酸组成的肽,可能通过胃肠道免疫细胞和肠道运动与肠道微生物有关。在偏头痛的情况下,它在三叉神经节、三叉神经尾核、杏仁核、丘脑和皮质中浓度很高。
CGRP有两种形式:
CGRP升高如何与偏头痛关联起来:
星形胶质细胞和神经元参与了CGRP合成释放过程的正反馈循环,并维持了增加的炎症和致敏状态。
CGRP 可以作为一种有价值的治疗标志物
目前,许多用于治疗和预防偏头痛药物的原理,就是针对这个CGRP或其受体的,抑制 CGRP 转录并减少其释放,从而缓解偏头痛。
★ P 物 质
P物质(substance P),是一种广泛分布于细神经纤维内的神经肽,主要作用是传递痛觉信息。
呕吐是最常见的胃肠道反应之一,受P物质的控制
在中枢神经系统中,延髓有面突区和孤束核的区域,这两个区域控制呕吐反射并含有高水平的P物质。P物质释放结合到NK1R上会触发呕吐反应。
P物质的一个功能是通过改变细胞信号通路作为神经递质和疼痛感知调节剂
有一个假说是P物质有助于突触后神经元对谷氨酸的敏感性,有助于将疼痛信号传递到大脑的体感区域。在许多其他中枢神经系统病理中通过神经源性炎症引起早期血脑屏障的破坏。
P物质的关键作用是双向调节免疫细胞及其产生的各种细胞因子
IL-1、IL-4和IFN-γ可以诱导巨噬细胞表达NK1R。诱导细胞因子释放会导致巨噬细胞和树突状细胞的招募,这有助于刺激IL-8的表达。P物质间接参与了免疫细胞的招募和迁移。P物质能刺激和诱导肥大细胞脱颗粒化。
★ PACAP
在与偏头痛病因机制相关的几个结构中发现了PACAP(垂体腺苷酸环化酶激活肽)的存在,包括硬脑膜、脑血管、三叉神经节、三叉神经原球和颈椎脊髓。
PACAP在神经调节、神经源性炎症和痛觉中起着重要作用。PACAP在感觉神经元炎症后上调。PACAP与CGRP在一些硬膜神经纤维中共同表达,也与疼痛的中枢敏化和情绪负荷有关。
PACAP对革兰氏阳性菌、革兰氏阴性菌和真菌具有抗菌活性,因此它可以直接影响膜的杀菌功能。有效的防御能力和较低的细菌耐药性使抗微生物神经肽成为一类有吸引力的新型抗生素。
★ NPY(神经肽Y)
NPY是去甲肾上腺素能系统功能的可能指标,通过脑循环调节影响脑血流量。值得一提的是,在偏头痛发作期检测到较高水平的NPY。
NPY已经在肠-脑轴的各个层面上被检测到。NPY通路也有助于改变胃肠道功能及其血流、免疫系统和炎症状态、疼痛、能量稳态、情绪、情绪以及行为和大脑认知功能等。
★ 胆囊收缩素 (CCK)
胆囊收缩素(CCK)由小肠粘膜内层(I 细胞)、哺乳动物大脑(例如皮质、丘脑、中脑边缘、导水管周围灰质和中脑)和脊髓的肠内分泌细胞合成。这种肽抑制胃排空和胃酸分泌,刺激胆囊收缩和胰腺分泌,并通过 CCK1 受体在大脑中激发饱腹感。
CCK在导水管周围灰质中产生,可能是偏头痛内源性疼痛信号系统及其水平升高的原因。CCK也存在于三叉神经节中,因此刺激三叉神经节会导致局部CCK增加。
CCK——肥胖和偏头痛之间的桥梁之一
肥胖患者偏头痛发作的频率和严重程度明显更高。偏头痛和肥胖之间联系的一种可能解释是,是高脂饮食引起的CCK分泌,因为十二指肠内游离脂肪酸会刺激CCK的分泌。
关于CCK可以详见我们之前肠道激素的文章:
当考虑到性激素时,我们知道偏头痛在女性中的发病率是男性的2-3倍,女性的发作时间更长、更严重,恢复时间也更长。
无先兆偏头痛的风险在月经前 2 天和月经期间最高,这也是生殖道微生物群多样性最低的时候。周期中期雌激素和孕酮水平高与无先兆偏头痛的风险较低以及生殖道内微生物群落的稳定性较高有关。
众所周知,雌激素会改变肠道内的紧密连接和粘蛋白保护,改变肠道通透性。
雌激素受体广泛表达于中枢神经系统,有证据表明雌激素调节痛觉传导,雌激素敲除模型在脊髓背角水平导致CGRP升高,从而改变了发起偏头痛攻击所需的阈值。临床上支持这一点的是黄体晚期偏头痛发作的可能性增加。虽然孕酮撤退似乎不会触发偏头痛发作,但它可能在疼痛敏感性和病程演化中起作用。
关于雌激素与肠道菌群详见我们之前的文章:
睾酮降低了对CSD的易感性,增加了血清素能调,并具有抗炎特性。较高水平的睾酮与肠道微生物群多样性增加有关,研究表明,患有偏头痛的男性存在雄激素缺乏和雌二醇水平增加。
因此,肠-脑轴可能介导性激素和头痛疾病之间的关系。
以上我们阐述了肠道菌群及其代谢产物等参与偏头痛发病机制,包括炎症介质、肠道微生物群、神经肽、血清素途径等。有证据表明偏头痛和胃肠道疾病之间存在共同的病理生理学,下面我们来了解一下它们之间的关联。
偏头痛和胃肠道合并症的病理生理学都很复杂,尚未完全阐明;然而,科学证据确实表明这些复杂疾病之间的病理生理学重叠。研究这种重叠有助于阐明常见的病理生理异常或生物学机制。
特别是,自主神经系统(ANS)被认为在偏头痛和胃肠道功能障碍之间的关联中起重要作用,因为它们的症状特征相似,包括恶心,呕吐,消化不良和胃轻瘫。
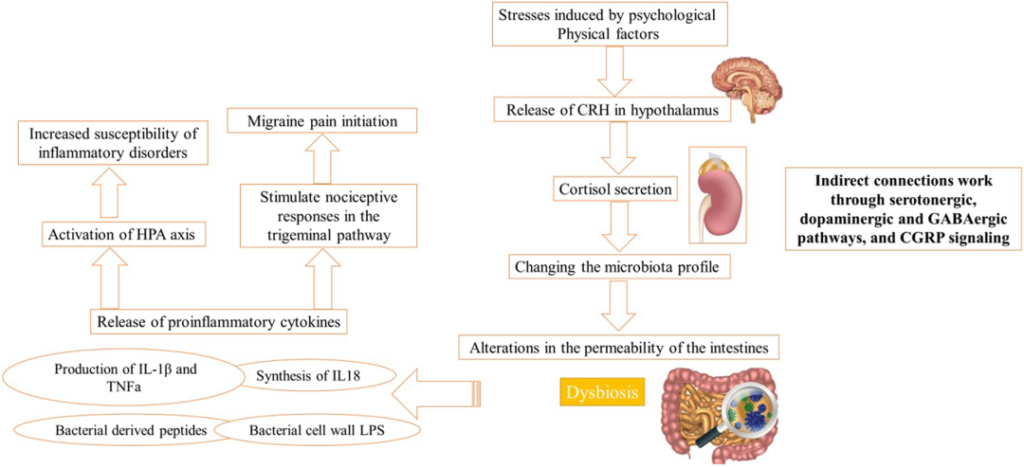
doi: 10.1111/head.14099
肠易激综合征(IBS)和炎症性肠病(IBD)的患者中,偏头痛的发生率增加。两者都是严重的肠道疾病,与肠道通透性增加和微生物引起的炎症有关。此外,中枢性、内脏性和热性皮肤过敏在IBS和偏头痛中很常见。患有长期和更频繁头痛的偏头痛患者更有可能被诊断为IBS。
偏头痛与IBS有一些共同的重要特征,这两种疾病都是慢性疼痛相关疾病,在女性中比男性更普遍,并且在纤维肌痛、慢性疲劳综合征、间质性膀胱炎、失眠、抑郁等方面与心理合并症有关。据估计,约60%的偏头痛患者患有异常性疼痛,除内脏超敏反应外,大多数IBS患者还报告异常性疼痛。
在IBS患者的粪便微生物群中评估出偏头痛的严重程度与肠道菌群失调之间存在强正相关。约一半没有先兆的年轻女性偏头痛患者患有肠道微生物群失调。
美国肠道计划队列研究发现,偏头痛与口腔微生物中具有还原硝酸盐、亚硝酸盐和一氧化氮功能活性的菌群水平呈正相关关系。
IBD是一种慢性复发-缓解炎症性疾病,由克罗恩病和溃疡性结肠炎组成。关于偏头痛和IBD之间可能关系的数据很少。
虽然机制不明确,IBD中存在的自身免疫性炎症反应、吸收不良、内皮功能障碍以及为该疾病开具的免疫抑制治疗可能参与了炎症性肠病和偏头痛之间的病理生理关联。
扩展阅读:
根据罗马IV标准,功能性消化不良分为餐后不适综合征(PDS)和上腹疼痛综合征(EPS)。
偏头痛是功能性消化不良和餐后症状患者的常见合并症。
扩展阅读:
基于人群的研究,个体主要是女性,最常见的症状(无论是持续性还是偶发性)是恶心和呕吐,但也可能包括腹痛、腹胀、体重减轻、餐后饱腹感和早饱感。
在患有特发性胃轻瘫和腹痛的个体中,腹痛严重的人比症状较轻的人更有可能患有重叠偏头痛。
在胃轻瘫中,观察到胃排空时间与偏头痛发作患者头痛、恶心和对光敏感的严重程度显著相关。多潘立酮是一种多巴胺受体拮抗剂,可用于治疗胃轻瘫,并已被证明在早期高剂量给药时可预防大多数偏头痛发作。另一种多巴胺受体拮抗剂甲氧氯普胺可用于治疗胃轻瘫和恶心,作为偏头痛的急性静脉注射治疗是有效的。
根据 5 项病例对照研究的荟萃分析结果,约 45% 的偏头痛患者患有幽门螺杆菌感染,而健康对照组的患病率估计约为 33% 。有证据表明根除幽门螺杆菌可能与缓解偏头痛症状有关。
幽门螺杆菌感染与持续的慢性炎症状态有关,这反过来可能导致炎症介质和血管活性化合物的产生增加。因此,偏头痛和幽门螺杆菌感染之间的关联机制可能包括诱导免疫、炎症和血管反应,以及随后免疫细胞、炎症和血管活性物质释放到胃粘膜中,最终可能导致大脑疼痛敏感结构的超敏反应。
扩展阅读:
正确认识幽门螺杆菌
乳糜泻具有多种神经系统表现,如癫痫、共济失调、小脑性共济失调、情绪障碍、脑炎、周围神经病变、神经肌肉疾病、痴呆、学习障碍、发育迟缓和偏头痛。
与没有这种疾病的人相比,被诊断患有乳糜泻(一种由谷蛋白肽引发的自身免疫性疾病)的人表现出更高的偏头痛发生率,据估计,大约 21-28% 的乳糜泻患者患有偏头痛。
相反,患有偏头痛的人乳糜泻的患病率更高。临床医生可能会考虑在存在此类改变的偏头痛受试者中寻找乳糜泻,特别是如果存在其他提示乳糜泻的症状。
偏头痛和乳糜泻之间的联系可归因于几种同时存在的机制,包括面筋引起的促炎细胞因子的激活、吸收不良导致的重要维生素和必需元素的缺乏、血管张力的紊乱、神经系统敏感性的增加、脑灌注不足、血管周围炎症等。
✔ 消除饮食
消除饮食需要先确定首先引发头痛的饮食成分,然后从常规饮食中排除这些成分。这是一种个人方法,个人可以识别引发或加剧头痛的成分。
如果某种食物在接触后 1 天内引起头痛,则可将其视为触发因素。大多数患者存在多种触发因素;因此,很难识别单一成分。况且有些食物含有不止一种成分,因此要完全识别出来并不简单。
✔ 综合饮食
富含ω-3和ω-6脂肪酸的低脂、高叶酸和生酮饮食对偏头痛患者有益。
改良的阿特金斯饮食提供神经保护,改善血清素能功能障碍,抑制神经炎症,改善线粒体功能。
生酮饮食会增加产生的酮体浓度,这对头痛患者有帮助。
低血糖饮食也能改善炎症状态。保持ω-6脂肪酸和ω-3摄入之间的微妙平衡可以减少炎症,维持血管张力,增强血小板功能。
偏头痛发作频率与坚持“健康”饮食模式(大量食用水果、蔬菜、鱼类、豆类、发酵食物等)成反比(P=0.04)。与坚持“西方”饮食方式(大量食用可乐、咸坚果、加工肉和快餐)成正比(P=0.02).
生姜、薄荷和辣椒都具有天然的止痛功效。生姜和薄荷有助于减少与偏头痛相关的恶心。
薰衣草可以减少血管炎症,通常是治疗焦虑、压力和压力引发的偏头痛有效的草药。
✔ 低钠饮食 / 高钠饮食
对脑脊液的分析显示,与对照组相比,偏头痛患者的钠含量较高,尤其是在头痛发作时。然而,低钠饮食的效果取决于许多因素,因此在考虑低钠饮食之前应详细评估其效果。
低钠饮食可以有效减少老年高血压患者头痛的发生。除了控制血压之外,低钠饮食还可以降低头痛的发生率。
相比之下,在没有高血压的低至正常体重指数的年轻女性人群中,高钠饮食有助于降低偏头痛发作的频率。
因此,低/高钠饮食应该根据患者群体进行调整。
低热量饮食 or 生酮饮食?
有研究认为,生酮饮食对偏头痛患者更有益,低热量饮食对偏头痛患者不利 (n = 108) 。在另一项研究中,生酮饮食显着改善了这些患者的头痛特征,并减少了发作频率和药物使用。停止生酮饮食后 2 个月观察到持续改善。
虽然看起来生酮饮食患者的头痛频率有所减少,但过渡期的头痛频率更严重。然而,经过3个月和6个月的随访后,低热量饮食组的头痛频率显著改善。
✔ 低血糖饮食(LGD)
通常从碳水化合物中获取总热量的 50-55% 是安全饮食。饮食转向低血糖指数碳水化合物已被证明可以增加短链脂肪酸水平。在某些情况下,LGD 是一种重要的替代方案,例如高脂血症、糖尿病、癫痫和体重管理。
罗马进行的一项队列研究中报告称,增加全麦面包(P = 0.04)和全麦面食(P = 0.004)的消费,以及减少白面包(P = .004)的消费,与偏头痛发作频率和每月使用药物救治的统计显著减少有关。
✔ 低脂饮食
一项研究调查了54名成年人减少脂肪饮食对偏头痛治疗的影响。患者被告知他们的脂肪消耗量将降至<20 g/天(12周)。发现头痛药物的发生率、严重程度和需求显著降低。
在一项为期 12 周的试验中,患有慢性偏头痛的成年人被随机分配接受高omega-3 / 低omega-6 饮食或低 omega-6 饮食。与采用低omega-6 饮食的偏头痛患者相比,采用高omega-3/低 omega-6 饮食的人的头痛改善程度更高。
可能与此相关:omega-6 和 omega-3 之间的平衡有助于炎症控制。omega-6 脂肪酸促进血管舒张。
谨慎选择下列食物
▸
味精在高浓度和溶解在液体中可能会引发偏头痛。并不是说引发每个患者的偏头痛发作,不能一概而论。
▸
咖啡因可能缓解偏头痛或者引发偏头痛。与阿司匹林和对乙酰氨基酚结合,咖啡因是一种高效的止痛药。咖啡因戒断会引发咖啡因使用者的偏头痛发作。需要注意自己的剂量。
咖啡因与偏头痛频率之间的联系没有定论。一些研究数据表明,不同的偏头痛和慢性日常头痛在咖啡因使用者中比不摄入这种物质的人更常见。也有研究认为偏头痛频率和咖啡因摄入之间没有关联。
▸
饮酒是偏头痛发作最常见的原因之一。酒精可以刺激三叉神经节中的脑膜伤害感受器,触发疼痛信号,然后在三叉神经脊核传递到丘脑核,最后传递到体感皮层。也可能涉及其他机制,例如血管舒张作用、脱水、毒性等。除了酒精,酒精饮料还含有某些化合物(酒精发酵的副产品),这些化合物都可能会引发偏头痛。
▸
许多研究提出了巧克力摄入与头痛之间的联系,但其确切的生理机制尚不清楚。可能是巧克力中的黄烷醇刺激内皮一氧化氮合酶(eNOS)活性,这可以通过增加一氧化氮(NO)的产生导致血管舒张。
也有研究认为巧克力含有许多维生素和矿物质(例如镁和核黄素),用于预防偏头痛。富含可可的饮食通过抑制CGRP的表达来预防三叉神经节神经元的炎症反应。
▸
酪胺(Tyramine),是一种衍生自酪氨酸的胺化合物,存在于各种食品中,包括陈奶酪、腌肉、熏鱼、啤酒、发酵食品和酵母提取物等。酪胺有可能通过促进去甲肾上腺素的释放并对α-肾上腺素受体产生激动作用而引发头痛。
▸
阿斯巴甜是一种人造甜味剂。几项研究表明,它会引起各种神经或行为症状;也会引起头痛,尤其是对于长期使用中等或高剂量(900–3000 mg/天)的人。
基于以上所述,识别和避免饮食中的偏头痛诱因至关重要,因为这有助于降低偏头痛的频率,让偏头痛患者能够控制让他们感到疲惫和无助的情况。
B族维生素
维生素B2对氧化代谢至关重要,可以降低偏头痛的风险。根据随机对照试验,服用维生素B2可以显著减少每月偏头痛天数1-3天。通过增加产短链脂肪酸菌丰度,维生素B2和其他B族维生素有助于对肠道微生物组产生正面影响。
扩展阅读:
维生素C
水溶性维生素C是最重要的非酶抗氧化剂之一,参与神经代谢。维生素C的膳食来源是水果和蔬菜。
维生素C可能调节偏头痛过程中的神经炎症和氧化应激活性的影响。
一项开放标签研究中,患者接受了含有120 mg粉红树皮提取物、60 mg维生素C和30 IU维生素E的胶囊(每粒胶囊)。在完成治疗期的患者中,得到了改善,包括头痛频率和头痛严重程度的降低。该研究人员还进行了一项开放标签研究,以检查维生素C(150 mg)和辐射松树皮提取物对偏头痛症状的影响。患者服用上述剂量的维生素C和辐射松树皮提取物3个月。治疗后,患者表现出显著改善:头痛频率和头痛严重程度减轻。
扩展阅读:
维生素D3
补充维生素D3会影响肠道微生物群的组成。为健康人补充8周维生素D3也显著减少了幽门螺杆菌的数量。几项研究报告称,血清维生素D水平可能与偏头痛/头痛风险增加有关。
偏头痛患者中这种维生素缺乏/不足的患病率可能更高。补充维生素D对偏头痛发作的强度和频率也有良好的影响。
镁
镁参与多种酶促反应,还维持细胞膜的平衡,影响其通透性并减少自发去极化的可能性。它影响外周和中枢神经系统的兴奋性和神经传导,因此在偏头痛病程中起着重要作用。
镁缺乏导致皮质扩散抑制或谷氨酸能神经传递异常是镁与偏头痛关系的一个可能机制。镁不足可能会影响 NMDA 受体阻断、钙通道、谷氨酸和 NO 活性,以及血清素受体的亲和力。
许多临床医生认为,以正确的剂量和形式补充镁可以成为预防偏头痛发作的治疗方法。补充镁也可以配合其他药物。
益生菌是偏头痛的另一种潜在疗法,它与饮食干预一样能够改变肠道微生物群。
在 NTG 诱导的偏头痛小鼠模型中,发现口服益生菌混合物显著抑制抗生素治疗引起的偏头痛样疼痛延长。
在一项随机双盲对照试验中观察到,与安慰剂对照相比,在 40 名发作性偏头痛患者和 39 名慢性偏头痛患者中,为期 8 周的益生菌试验显著降低了偏头痛的严重程度、频率和药物使用量。
其中含有14种益生菌菌株:
益生菌组偏头痛发作的平均频率显著降低(平均变化:-9.67 与 -0.22;p ≤ 0.001)。补充益生菌显著降低了严重程度(平均变化为-2.69;p≤0.001.),降低慢性偏头痛患者的发作持续时间(平均变化:-0.59;p≤0.034),减少每天服用药物数量(平均变化为-1.02;p<0.001)。
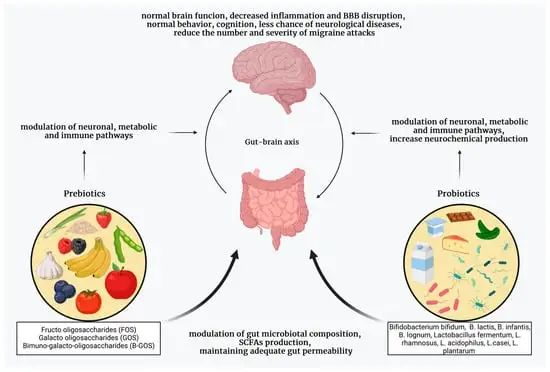
doi.org/10.3390/neurolint15030073
将芽孢杆菌、双歧杆菌、乳酸杆菌和链球菌菌株的混合物应用8-10周,可以降低发作性偏头痛患者的发作严重程度和频率,并降低慢性偏头痛患者的频率、严重程度、持续时间和每天服用的药物数量。
姜黄素
姜黄素是从姜黄根茎中提取的主要姜黄素,也是最著名的植物多酚之一。姜黄素具有许多有益的特性,如抗氧化、抗动脉粥样硬化、抗菌、免疫调节、抗衰等特性。
姜黄素可以显著抑制 IL-1β 和 TNF-α 表达、氧化应激和蛋白质积累。
对偏头痛治疗进行了一项研究,比较了单独使用舒米曲普坦(ST)和与姜黄素一起使用的效果,采用了硝酸甘油诱导的偏头痛大鼠模型。
姜黄素以下面两种形式静脉注射,因为姜黄素的肠道吸收较低:
a)酒精溶液(用生理盐水稀释)
b)脂质体的形式
当姜黄素以脂质体的形式进行注射时,其抗氧化作用更为显著。作者将所得结果归因于姜黄素能够清除羟基或过氧自由基、直接与过氧化物自由基相互作用以及抑制参与炎症性因子NF-κBs的活性。
偏头痛发病机制的一个考虑的机制涉及肿瘤坏死因子α(TNF-α)的参与,通过引发神经元超兴奋性、刺激伤害感受器和前列腺素的产生,从而引发神经炎症。
一项研究,旨在确定姜黄素和ω-3脂肪酸对TNF-α基因表达的协同作用。接受两种物质治疗的患者在血浆中显示出TNF-α mRNA水平的降低(反映了TNF-α表达的减少)。在只接受其中一种分析物的患者中,没有发现这种情况。
辅酶Q10
除了抗氧化特性外,辅酶Q10还表现出抗炎特性,参与嘧啶合成(作为辅因子),进而参与DNA复制和RNA修复过程。由于其潜在的积极作用,是许多神经系统疾病的膳食补充剂。
酶Q10被列为预防偏头痛最常用的治疗方法之一。给予偏头痛患者辅酶Q10会导致CGRP的降低。
儿童和青少年中研究了补充辅酶Q10与偏头痛发生之间的关系。患者每天服用100毫克辅酶Q10,为期4个月。结果显示,在主要结果方面,两组之间没有统计学上的显著差异。然而,与对照组相比,偏头痛患者的研究组头痛发作频率呈下降趋势。此外,在补充辅酶Q10的前四周,观察到发作性偏头痛患者头痛的严重程度降低。
在辅酶Q10的抗氧化特性中有以下方面,即超氧化物歧化酶活性的调节(导致细胞抗氧化防御的改善)、氧化应激OS的减少或增加谷胱甘肽还原形式(用作抗氧化剂)浓度的能力。上述机制可缓解偏头痛,降低偏头痛发作的频率,缩短偏头痛发作的持续时间。
银杏内酯B
银杏内酯B是从银杏叶中提取的一种草药成分。银杏叶提取物具有神经保护特性,对记忆有有益作用,也有抗氧化剂的某些特性。
一项为期六个月的开放标签多中心研究,证明了银杏内酯B对每月至少发作一次的偏头痛患者治疗先兆偏头痛的有效性。
槲皮素和银杏内酯B对减轻偏头痛症状有特殊作用。银杏叶提取物成分可降低氧化应激,抑制血小板活化因子,并影响谷氨酸能传递。
所有生物学机制都会增加神经保护作用,从而降低偏头痛的频率,减轻偏头痛,缓解先兆症状。
小白菊
小白菊(Tanacetum parthenium)属菊科植物,广泛分布于南美洲。其特征是具有抑制醛糖还原酶活性的高潜力,并显示出必要的抗氧化特性。
小白菊用于治疗多种疾病,不仅可以缓解偏头痛的症状,还可以缓解另一种来源的疼痛,如炎症、恶心和呕吐。
一项双盲、多中心、安慰剂对照研究,以确定小白菊稳定提取物(MIG-99)在降低偏头痛发作频率方面的有效性。最显著的效果记录为6.25mg剂量的MIG-99。三年后,同一作者发表了剂量为6.25 mg的MIG-99制剂的有效性和安全性结果。在服用该制剂的组中,偏头痛发作频率每月减少1.9次(安慰剂组每月减少1.3次)。
粪菌移植可以通过改变肠道菌群,帮助恢复肠道微生物平衡,使肠道微生物恢复更加有效和持久,理论上可减轻偏头痛发作和偏头痛严重程度,超过340项临床试验正在进行中。肠道菌群的改变可导致炎症介质和血清素途径的正常化,从而缓解偏头痛的频率和强度。
扩展阅读:
吴茱萸汤是一种临床用于治疗和预防偏头痛的配方,可anaerostipes和acidifaciens丰度,以恢复细菌的比例。由于5-HT合成与微生物群、功能和代谢紊乱相关,吴茱萸汤可以通过影响中枢和外周5-HT来缓解痛觉过敏。研究表明,在基因敲除小鼠和豚鼠中,5-HT1D受体具有抑制神经肽释放的作用,从而改变硬脑膜神经源性炎症反应。
良好的生活习惯
建立规律的睡眠时间。每天同一时间起床和上床睡觉,甚至周末也是如此。一天结束时放松一下。
减少吸烟。偏头痛患病率与每日吸烟的相关性为正相关(Spearman系数,rs=0.49)。
定期运动
身体活动期间,身体会释放某些化学物质来阻隔脑部疼痛信号。这些化学物质还有助于缓解焦虑和抑郁症,这两种状况都可能加剧偏头痛。
肥胖也会增加慢性头痛的风险。通过运动和饮食维持健康体重可能也有助于管理偏头痛。
值得尝试的有氧运动可能包括快走或慢跑、骑自行车、瑜伽、游泳等。
缓解压力
简化生活,明确管理时间,适当休息,可以选择接触大自然,做深呼吸(专注且缓慢),冥想,瑜伽等放松的方式,保持积极心态,享受乐趣,每天抽出至少 15 分钟做自己喜欢的事。
写偏头痛日记
记下偏头痛发作时周围的环境条件。写下感官刺激(明亮的灯光、响亮的音乐、奇怪的气味等)、压力的原因、饮食习惯和睡眠习惯。几次发作后,回顾一下日记,找出偏头痛发作前通常存在的常见情况。这些情况可能是“触发因素”,下次尽量避免。
当偏头痛发作时的缓解小方法:
关灯、静音
光线和声音会使偏头痛加剧,尽量在昏暗且安静的房间里放松,闭目休息,能睡就睡吧,让眼睛和大脑得到放松,帮助缓解头痛的不适感。
找一个安静的环境,避免嘈杂的声音,减轻对偏头痛的刺激。
如果不能马上找到这样的地方,可以考虑戴上太阳镜和耳塞。或者尝试舒缓的音乐。
试试温度疗法
热敷或冷敷头部或颈部。
按摩、放松
用双手的食指和中指,以小幅度打圈的方式轻轻按摩太阳穴、颈侧、颈后。
通过深呼吸放松身体和心理,减轻紧张和疼痛感。适量饮水,保持身体水分平衡,有助于缓解头痛。
偏头痛是由多种因素共同引起的,由遗传、内分泌、代谢和/或环境因素相互交织促成的。基于各种初始因素,广泛接受的观点是皮质扩散抑制假说和三叉神经血管假说。前者指出了大脑与神经炎症之间的相互关系,后者指出神经和血管是发生的关键因素。偏头痛复杂的机制和病理生理学仍在广泛研究中。
本文我们了解到,肠道微生物群通过参与肠-脑轴各个途径,肠道微生物群和大脑通过各种途径相互作用,包括免疫系统、色氨酸代谢、迷走神经和肠神经系统等,可能发挥着关键作用,或将作为偏头痛的有前途的生物标志物和治疗靶点。了解这种疾病的多系统联系,极大地扩展了对偏头痛机制的理解,并提供了更广泛的治疗蓝图。
偏头痛本身会产生一些诊断问题,这些问题可能会因合并症而加剧,包括功能性胃肠道疾病等。同时,复杂的疼痛通路,食物和药物代谢、免疫反应等造成的个体差异,会给在偏头痛的临床管理治疗过程中带来难度,目前药物并不能完全缓解症状或满足要求。
考虑以互补的方式将临床前和临床研究结合起来,同时包括科研人员、临床医生、健康管理以及其他相关机构的成员之间的相互交流、协作,在此过程中纳入肠道菌群健康检测,集结众多力量的合作,从预防偏头痛辅助判别其潜在风险,到偏头痛发作的疾病管理,再到预后减少发病次数等多个阶段,帮助降低偏头痛和偏头痛合并的各种胃肠道疾病的风险,改善偏头痛患者的生活质量,为他们带来更多希望。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Ferrari MD, Goadsby PJ, Burstein R, Kurth T, Ayata C, Charles A, Ashina M, van den Maagdenberg AMJM, Dodick DW. Migraine. Nat Rev Dis Primers. 2022 Jan 13;8(1):2.
Khan J, Asoom LIA, Sunni AA, Rafique N, Latif R, Saif SA, Almandil NB, Almohazey D, AbdulAzeez S, Borgio JF. Genetics, pathophysiology, diagnosis, treatment, management, and prevention of migraine. Biomed Pharmacother. 2021 Jul;139:111557.
Arzani M, Jahromi SR, Ghorbani Z, Vahabizad F, Martelletti P, Ghaemi A, Sacco S, Togha M; School of Advanced Studies of the European Headache Federation (EHF-SAS). Gut-brain Axis and migraine headache: a comprehensive review. J Headache Pain. 2020 Feb 13;21(1):15.
Aurora SK, Shrewsbury SB, Ray S, Hindiyeh N, Nguyen L. A link between gastrointestinal disorders and migraine: Insights into the gut-brain connection. Headache. 2021 Apr;61(4):576-589.
Zhou Y, Pang M, Ma Y, Lu L, Zhang J, Wang P, Li Q, Yang F. Cellular and Molecular Roles of Immune Cells in the Gut-Brain Axis in Migraine. Mol Neurobiol. 2023 Sep 11.
He Q, Wang W, Xiong Y, Tao C, Ma L, Ma J, You C; International Headache Genetics Consortium. A causal effects of gut microbiota in the development of migraine. J Headache Pain. 2023 Jul 17;24(1):90.
Kim JH, Lee Y, Kwon YS, Sohn JH. Clinical Implications of the Association between Respiratory and Gastrointestinal Disorders in Migraine and Non-Migraine Headache Patients. J Clin Med. 2023 May 12;12(10):3434.
Cámara-Lemarroy CR, Rodriguez-Gutierrez R, Monreal-Robles R, Marfil-Rivera A. Gastrointestinal disorders associated with migraine: A comprehensive review. World J Gastroenterol. 2016 Sep 28;22(36):8149-60.
Slavin M, Li HA, Frankenfeld C, Cheskin LJ. What is Needed for Evidence-Based Dietary Recommendations for Migraine: A Call to Action for Nutrition and Microbiome Research. Headache. 2019 Oct;59(9):1566-1581.
Park CG, Chu MK. Interictal plasma glutamate levels are elevated in individuals with episodic and chronic migraine. Sci Rep. 2022 Apr 28;12(1):6921.
Sgro M, Ray J, Foster E, Mychasiuk R. Making migraine easier to stomach: the role of the gut-brain-immune axis in headache disorders. Eur J Neurol. 2023 Jun 17.
Do TP, Hougaard A, Dussor G, Brennan KC, Amin FM. Migraine attacks are of peripheral origin: the debate goes on. J Headache Pain. 2023 Jan 10;24(1):3.
Pleș, H.; Florian, I.-A.; Timis, T.-L.; Covache-Busuioc, R.-A.; Glavan, L.-A.; Dumitrascu, D.-I.; Popa, A.A.; Bordeianu, A.; Ciurea, A.V. Migraine: Advances in the Pathogenesis and Treatment. Neurol. Int. 2023, 15, 1052-1105.
Kappéter, Á.; Sipos, D.; Varga, A.; Vigvári, S.; Halda-Kiss, B.; Péterfi, Z. Migraine as a Disease Associated with Dysbiosis and Possible Therapy with Fecal Microbiota Transplantation. Microorganisms 2023, 11, 2083.
Yamanaka, G.; Suzuki, S.; Morishita, N.; Takeshita, M.; Kanou, K.; Takamatsu, T.; Suzuki, S.; Morichi, S.; Watanabe, Y.; Ishida, Y.; et al. Role of Neuroinflammation and Blood-Brain Barrier Permutability on Migraine. Int. J. Mol. Sci. 2021, 22, 8929.
Martami F, Togha M, Seifishahpar M, Ghorbani Z, Ansari H, Karimi T, Jahromi SR. The effects of a multispecies probiotic supplement on inflammatory markers and episodic and chronic migraine characteristics: A randomized double-blind controlled trial. Cephalalgia. 2019 Jun;39(7):841-853.
Fila, M.; Chojnacki, J.; Pawlowska, E.; Szczepanska, J.; Chojnacki, C.; Blasiak, J. Kynurenine Pathway of Tryptophan Metabolism in Migraine and Functional Gastrointestinal Disorders. Int. J. Mol. Sci. 2021, 22, 10134.
Goschorska, M.; Gutowska, I.; Baranowska-Bosiacka, I.; Barczak, K.; Chlubek, D. The Use of Antioxidants in the Treatment of Migraine. Antioxidants 2020, 9, 116.
Spekker, E.; Nagy-Grócz, G. All Roads Lead to the Gut: The Importance of the Microbiota and Diet in Migraine. Neurol. Int. 2023, 15, 1174-1190

谷禾健康
不知道大家有没有这样的体验:紧张时会想上厕所,伤心时会食欲不振。任何情绪变化,好像都会反映在消化系统。
与此同时,你相不相信一个人的肠道微生物可以影响其认知、性格、气质、社交情况、甚至是责任心。
有大量证据表明神经系统与肠道微生物的组成和功能有关。目前,已经描述了各种肠-脑串扰途径,包括通过迷走神经途径的免疫、内分泌和神经回路。此外,中枢神经系统控制肠道菌群的失衡,构成双向通讯系统。
肠道菌群失衡,也许是导致精神问题的潜在原因。一些研究发现,肠道菌群改变(生态失调)与阿尔茨海默病、自闭症和帕金森病等神经精神疾病以及焦虑、抑郁和认知功能障碍等其他心理疾病有关。
肠道菌群可以分泌神经递质,例如乙酰胆碱、γ-氨基丁酸(GABA)和色氨酸;此外肠道中有数百万个神经元,可以通过神经递质向大脑发送信号。
肠脑轴功能障碍被认为是精神障碍的病理生理学;因此,恢复受干扰的微生物生态系统为管理或预防这些神经系统疾病提供了一种新颖且有前途的方法。
本文对人类肠道微生物群失调与几种精神和心理疾病之间联系进行了概述。此外,还展示了一些使用精神药物与调节肠道微生物相结合的方式以改善精神疾病或心理障碍的干预措施。肠道微生物群在未来可能成为缓解压力与治疗精神疾病的新工具。
人类肠道含有多样化的微生物群落,据估计,肠道中的微生物数量可以达到数万亿个。微生物群的密度在肠道不同部位也有所不同,结肠和直肠的微生物密度较高,而小肠的微生物密度较低。
肠道微生物由多种微生物类群组成,包括细菌、病毒、真菌、古细菌和原生动物,其中最主要的是细菌。
•古细菌
在健康的人类肠道中,古细菌的数量很少,其中史密斯产甲烷短杆菌(Methanobrevibactersmithii)是最常见的物种。
•真菌
肠道中最常检测到的真核微生物是真菌,例如念珠菌(Candida)和酵母菌(Saccharomyces)。这些真菌维持生态和免疫肠道微生物组的平衡。
•病毒
人体病毒组主要由噬菌体组成,它们在肠道中的作用是作为细菌组的调节剂。
•原生生物
一些原生动物,例如芽囊原虫属(Blastocystis),已在人类肠道微生物群中检测到,它们的存在通常与胃肠道疾病有关。
✦细菌是人类肠道中最常见的微生物
细菌是人体肠道中最常见的微生物,一般属于以下8个门:放线菌门 (Actinobacteria)、芽孢杆菌门 (Bacillota)(又名厚壁菌门)、拟杆菌门 (Bacteroidetes)、弯曲菌门 (Campylobacterota)、梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)、热脱硫杆菌门(Thermodesulfobacteriota)和疣微菌门(Verrucomicrobia)。
下图显示了健康人肠道微生物群中主要的门、科和属。
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
✦肠道不同部位的微生物群组成具有差异
肠道区室中的微生物有特定的空间分布。上消化道中最主要的是孪生球菌属(Gemella)、韦荣氏球菌属(Veillonella)、奈瑟菌属(Neisseria)、梭杆菌属(Fusobacterium)、链球菌属(Streptococcus)、普雷沃氏菌属(Prevotella)、假单胞菌属(Pseudomonas)和放线菌属(Actinomyces)。
而在下消化道中则有粪杆菌属(Faecalibacterium)、拟杆菌属(Bacteroides)和瘤胃球菌属(Ruminococcus)。
十二指肠
研究发现人类十二指肠粘膜富含芽孢杆菌(Bacillus)、Solibacillus、赖氨酸芽孢杆菌(Lysinibacillus)、微小杆菌属(Exiguobacterium)、海洋芽胞杆菌属(Oceanobacillus)和类芽孢杆菌(Paenibacillus)。
空肠
在空肠中,变形菌门和厚壁菌门是最常见的门,而埃希氏菌属、乳杆菌属和肠球菌属是空肠中最常见的属。
回肠
链球菌属(Streptococcus spp.)、大肠杆菌(Escherichia coli)和梭菌属(Clostridium spp.),是回肠中最常见的物种。
结肠
结肠是一个厌氧环境,以拟杆菌门、放线菌门和厚壁菌门以及毛螺菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)、普雷沃氏菌科(Prevotellaceae)、拟杆菌科(Bacteroidaceae)和理研菌科(Rikenellaceae)为主,以及已鉴定的主要细菌属乳杆菌属、双歧杆菌属和粪杆菌属。
研究了不同结肠区域的细菌属优势,他们发现乙状结肠中存在拟杆菌属、肠球菌属。近端结肠和远端结肠为粪杆菌和大肠杆菌。
阑尾中微生物多样性较高,以放线菌门、梭杆菌门、变形菌门、拟杆菌门和厚壁菌门为主;以及毛螺菌科、肠杆菌科、拟杆菌科、梭杆菌科和双歧杆菌科。
尽管人类肠道微生物群的组成因年龄、营养和抗生素使用等因素而在分类学和功能上存在差异,但人类肠道微生物群主要是由乳杆菌属、芽孢杆菌属、梭菌属、肠球菌属、瘤胃球菌属、粪杆菌属、罗氏菌属(Roseburia)、经黏液真杆菌属(Blautia)、Dorea属、拟杆菌属、普雷沃氏菌属、双歧杆菌属和埃希氏菌属。
✦肠道微生物对于消化非常重要
肠道微生物群为人类宿主提供了多种积极影响,包括免疫和代谢功能。肠道微生物是消化的关键调节者,通过营养物质的吸收以及多种代谢物的合成,包括脂质、氨基酸、维生素和短链脂肪酸。
✦肠道微生物有助于预防病原体感染
此外,肠道微生物群通过多种竞争过程在预防病原菌感染方面发挥着关键作用,并且还有助于维持肠上皮的完整性。
✦肠道微生物产生的化合物可作为信号分子
肠道微生物群从未消化的食物中产生多种分泌化合物。其中一些可以作为细菌间通讯的信号分子,影响细菌调节、稳态、生长、毒力和生物膜形成等。
色氨酸代谢物
细菌还可能分泌其他生物活性化合物,包括色氨酸分解代谢物、短链脂肪酸、多胺和组胺。色氨酸的代谢产物[5-羟色胺(血清素)、犬尿氨酸和吲哚]与生理和神经元活动有关。
吲哚
吲哚调节肠促胰岛素的分泌,调节肠道屏障通透性,并且可以作为微生物和宿主细胞之间细胞间通讯的信号分子。此外,吲哚及其衍生物被描述为神经炎症的抑制化合物。
短链脂肪酸
最重要的定量代谢物是由微生物降解不可消化的膳食纤维、蛋白质和糖蛋白产生的短链脂肪酸。如丁酸盐、乙酸盐和丙酸盐,可以作为信号分子,局部调节从十二指肠到结肠的肠道功能,并且通过肠内分泌细胞,它们还可以控制肝脏、肌肉和大脑的代谢,影响肠道功能及宿主能量稳态。
此外,短链脂肪酸通过诱导神经炎症反应呈现神经活性特性。短链脂肪酸是强大的表观遗传调节剂,控制DNA甲基化遗传物质的可及性并抑制组蛋白脱乙酰化。
该机制依赖于10-11易位 (TET) 蛋白,该蛋白催化胞嘧啶残基羟基化为5-羟甲基胞嘧啶,介导主动DNA去甲基化。确定丁酸盐诱导前额皮质中许多行为相关基因的变化,特别是影响涉及神经元兴奋或抑制的基因。几种兴奋性神经递质和神经元激活标记基因的减少,以及抑制性神经递质基因的增加表明丁酸盐促进抑制途径转录物的转录。
✦细菌代谢产物会影响神经发育
最近的研究表明,细菌代谢产物会影响神经发育。一些研究人员还报道了短链脂肪酸影响神经发生基因的表达。
使用无微生物的斑马鱼模型,观察到无微生物培养的胚胎中神经基因表达显著下降,并通过添加斑马鱼代谢物重新建立了该模型,识别出超过300个下调的基因。
基因分析表明,这些基因参与重要的神经发育途径,包括转录调控和Wnt信号传导。事实上,Wnt信号通路在发育和疾病中发挥着重要作用,可以推测其调控与多细胞真核生物的细菌定植共同进化。
下图展示了肠道微生物群合成的一些关键神经递质及其与心理和精神疾病的关联。这些神经活性化合物通过内在或外在传入神经通路将信息从肠腔传输到肠神经系统、肠神经胶质细胞和中枢神经系统。

Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
阿尔茨海默病(AD)是一种慢性神经退行性疾病,其中记忆和执行功能进行性丧失,与突触损伤和神经损失有关,主要发生在海马体和大脑皮层。
多项研究已明确β-淀粉样肽(Aβ)在阿尔茨海默病中的作用。最近的研究表明,细菌来源的淀粉样蛋白,例如curli、Csg A、tau、TasA、FapC和酚溶性调节蛋白,在Aβ寡聚体的聚集和促进错误折叠中发挥作用。
细菌淀粉样蛋白通过与Toll样受体2相互作用激活宿主免疫系统,诱导促炎介质刺激大脑中神经元淀粉样蛋白的产生。
•肠道微生物失调与阿尔兹海默病存在关联
其他证据表明肠道微生物群失调与阿尔茨海默病的早期阶段有关,导致细胞因子分泌增强、免疫衰老、神经炎症和氧化应激。
此外,肠道微生物失调会诱导脂多糖的分泌,从而破坏胃肠道通透性和血脑屏障,调节炎症途径,促进神经炎症和认知能力下降,并导致阿尔茨海默病中的神经元死亡。
在大鼠中,腹膜脂多糖给药导致炎症因子(例如IL-1、IL-6和TNF-α)水平升高,表明微生物组在阿尔茨海默病先天免疫反应的启动中发挥作用。
•阿尔兹海默病中短链脂肪酸水平降低
研究表明,阿尔茨海默病小鼠的微生物群组成和多样性受到干扰,短链脂肪酸水平降低,这预示着30多种代谢途径的改变,这可能与淀粉样蛋白沉积有关。
肠道菌群失调可能会增加氧化三甲胺(TMAO)浓度,这与不同的功能有关,例如β-淀粉样蛋白的形成、外周免疫反应的激活和氧化应激。此外,还与肠粘膜屏障功能障碍、血脑屏障通透性以及胆汁酸和胆固醇进入大脑的通道增加有关。
•阿尔茨海默病患者体内促炎菌群比例增加
研究发现阿尔茨海默病患者中大肠杆菌/志贺氏菌等促炎菌群的比例增加,而直肠真杆菌(eubacterium rectale)、霍氏大肠杆菌(E.hallii)、普拉梭菌(F. prausnitzii)和脆弱拟杆菌等产生丁酸的细菌则减少。
这些细菌与外周炎症状态有关,这是轻度认知障碍(MCI)和脑淀粉样变性患者的典型症状。
注:淀粉样脑血管病主要是由淀粉样物质在软脑膜以及大脑皮质小动脉中层沉积所导致的疾病,多见于80岁以上的老年人,可能会导致血管壁受损。
•阿尔茨海默病患者肠道微生物多样性较低
据报道阿尔茨海默病患者肠道菌群的微生物多样性较低,厚壁菌门和双歧杆菌种类减少。
此外,发现门水平上拟杆菌门细菌成员增加,放线菌门减少,以及科水平上瘤胃球菌科、肠球菌科和乳杆菌科增加,毛螺菌科、拟杆菌科和韦荣氏菌减少。
促炎细菌类群增加,同时产生丁酸盐的细菌减少,例如丁酸弧菌(B.proteoclasticus和B.Hungatei)、梭菌属、真杆菌属(E.Hallii、E.rectal和E.eligens)、普拉梭菌和罗斯拜瑞氏菌 (R.hominis)。
几种精神障碍疾病中的肠道菌群失调
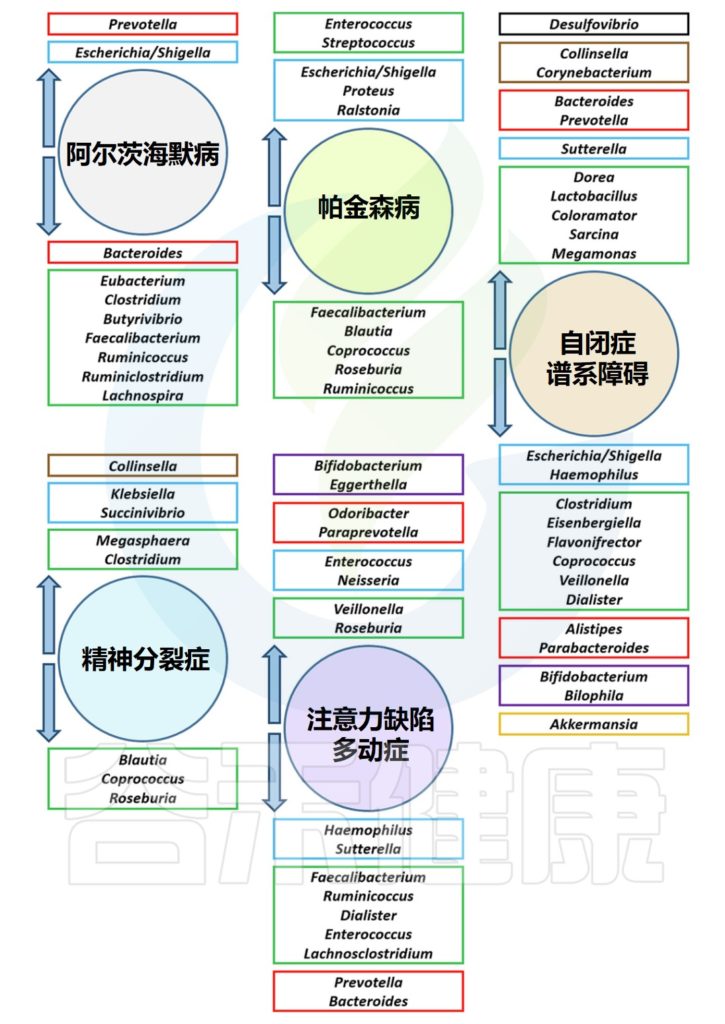
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
自闭症谱系障碍(ASD)是一种大脑发育障碍,其特征是刻板行为以及沟通和社交互动缺陷。
注:儿童自闭症是儿童精神类疾病当中最为严重的一种。
自闭症谱系障碍的确切病理学和病因很难确定,研究重点是调查遗传原因、免疫系统失调、环境毒物暴露以及肠道微生物群的改变。
•自闭症儿童的肠道微生物多样性较高
据报道自闭症儿童的肠道微生物多样性较高。自闭症谱系障碍样本中最常见的属如下:
拟杆菌属(Bacteroides),
脱硫弧菌属(Desulfovibrio),
柯林斯氏菌属(collinsella),
棒状杆菌属 (Corynebacterium),
乳杆菌属(Lactobacillus),
普雷沃氏菌属(Prevotella),
萨特氏菌属(Sutterella),
八叠球菌(Sarcina),
罗氏菌属(Roseburia),
粪杆菌属(Faecalibacterium),
巨单胞菌(Megamonas),
Caloramator,
Dorea;
此外以下属的存在减少:
双歧杆菌(Bifidobacterium) ↓↓↓
另枝菌属(Alistipes) ↓↓↓
嗜胆菌属(Bilophila) ↓↓↓
韦荣氏球菌属(Veillonella) ↓↓↓
阿克曼菌(Akkermansia) ↓↓↓
粪球菌属(Coprococcus) ↓↓↓
埃希氏杆菌属-志贺氏杆菌 ↓↓↓
梭菌属(Clostridium) ↓↓↓
艾森伯格氏菌(Eisenbergiella) ↓↓↓
嗜血杆菌属(Haemophilus)↓↓↓
Dialister ↓↓↓
Parabacteroides ↓↓↓
Flavonifractor ↓↓↓
这些发现强烈表明肠道微生物群失调与自闭症行为表现之间存在联系。
•有害菌会产生神经毒素影响自闭症
在自闭症行为表现患者中发现双歧杆菌丰度较低,而双歧杆菌是产生GABA神经递质的关键,双歧杆菌丰度过低会导致焦虑、认知缺陷和行为障碍。
产生神经毒素的艰难梭菌和溶组织梭菌的积累与自闭症谱系障碍症状相关。这些释放的有毒分子会影响血清素信号传导,可能导致自闭症谱系障碍行为模式,例如社交能力下降、对疼痛的反应减弱、语言异常以及自虐或重复行为。
受自闭症行为表现影响的个体表现出其他潜在有毒化合物水平的改变,例如抑制多巴胺-β-羟化酶的对甲酚和对甲酚硫酸盐。此外,在受自闭症谱系障碍影响的个体中检测到梭菌衍生的代谢物3-(3-羟基苯基)-3-羟基丙酸增加,这可能反映了儿茶酚胺代谢的改变。
•短链脂肪酸对自闭症的作用存在矛盾结果
短链脂肪酸在自闭症谱系障碍中的作用存在矛盾的结果。丙酸盐会诱导小胶质细胞激活、神经毒性细胞因子产生、基因表达改变、海马组织学异常和神经行为异常,例如重复动作和社交互动受损。
然而,丁酸盐对一种自闭症谱系障碍样小鼠模型的社交和重复行为具有有益影响。丁酸盐改善血脑屏障的不渗透性可能是丁酸盐可以恢复丙酸盐诱发的自闭症样疾病异常的另一种机制。
帕金森病(PD)是老年人中常见的一种痴呆症,其主要疾病症状包括神经炎症、中脑多巴胺能神经元丧失以及伴有非运动症状的异常运动。
•微生物失调引起的炎症可能导致帕金森病发展
一些研究人员认为,微生物群失调引起的炎症反应可能会导致帕金森病病理学的发展或恶化。这些反应可以促进脂多糖和α-突触核蛋白在肠道和大脑中的积累,并且由于促炎细菌活性导致氧化应激增加,从而促进α-突触核蛋白病理学通过迷走神经从头侧向尾侧区域扩散。
•帕金森病患者体内短链脂肪酸显著减少
另一方面,微生物短链脂肪酸可以防止肠粘膜通透性增加,从而减少细菌移位。帕金森病中短链脂肪酸显著减少。
短链脂肪酸在帕金森病病理学中的作用尚未完全阐明,报道短链脂肪酸的消耗导致肠神经系统中路易体的形成;相反,有研究表明短链脂肪酸能够降低血脑屏障的通透性。
注:路易体主要是以帕金森病为代表的脑门特征性标志物,患者常常会出现功能障碍。
考虑到短链脂肪酸缺乏与神经炎症和小胶质细胞激活以及便秘、肠漏和结肠炎症等胃肠道特征有关,这些研究结果支持了这样的假设:短链脂肪酸缺乏可能是帕金森病的病因。
•帕金森病患者有抗炎作用的菌群减少
帕金森病患者经常出现属于乳杆菌科、巴氏杆菌科和肠球菌科的某些细菌种类水平升高。
此外发现,帕金森病患者粪便和粘膜中产生抗炎丁酸的细菌水平显著降低(普雷沃氏菌、布氏菌、粪球菌属和罗氏菌属),以及粪杆菌属的水平显著降低。
此外,像罗尔斯通氏菌(Ralstonia)这样的促炎细菌在帕金森病患者的肠粘膜中更为丰富。
拓展
基于肠杆菌科细菌滴度与帕金森病症状严重程度之间的正相关性,这些作者认为肠道微生物群可能与帕金森病表型有关。
相关分析显示疾病严重程度和帕金森病持续时间与纤维素降解剂呈负相关,但与致病生物呈正相关,可能导致短链脂肪酸产生减少以及神经毒素和内毒素增加,可能与帕金森病病理学的发展有关。
此外,普雷沃菌科丰度的降低和乳杆菌科丰度的增加与胃饥饿素浓度的降低有关,胃饥饿素是一种与维持正常多巴胺功能有关的肠道激素,帕金森病患者的胃饥饿素分泌发生了改变。
精神分裂症是一种复杂的精神障碍,患者对现实的理解异常,经常出现焦虑和严重抑郁症状。
这种疾病的起源是有争议的,表明是遗传起源。然而,值得注意的是,通过表观遗传学机制,如神经传递基因甲基化、核苷酸修饰或非编码RNA的作用,一些环境因素可能在其易感性和疾病的发展中发挥作用。
•肠道菌群代谢物影响精神分裂症风险
短链脂肪酸、色氨酸分解代谢物和神经递质(GABA、谷氨酸)的差异被称为精神分裂症相关的肠脑模块。
微生物产生的多巴胺与精神分裂症有关,而与精神分裂症相关的胃肠道炎症增加强烈表明肠道微生物群可能在患精神分裂症或其表现的风险中发挥作用。
•精神分裂症患者肠道微生物群显著改变
研究表明抗生素治疗引起的肠道微生物群失调与精神分裂症的发病率之间存在直接关系。精神分裂症患者中巨球型菌属、琥珀酸弧菌属、梭菌属、柯林斯氏菌属、甲烷短杆菌属和克雷伯菌属的丰度显著增加,而与健康人相比,精神分裂症患者中经黏液真杆菌属、粪球菌属和罗氏菌属的滴度下降。
•抗精神病药物治疗后肠道微生物群发生改变
几项研究已经确定抗精神病药物治疗与肠道微生物群之间的联系。精神分裂症患者在接受抗精神病药物治疗后发现微生物群丰度发生了显著变化。
在其他研究中,接受抗精神病药物治疗的患者的厚壁菌门与拟杆菌门的比例逐渐增加,与体重指数的上升相关。此外,接受治疗的个体的肠道微生物群富含短链脂肪酸和血清素代谢的基因。
注意缺陷与多动障碍(ADHD)是一种神经发育障碍,其特征是高度多动冲动和注意力问题。尽管可能涉及环境和遗传因素,一些证据表明注意缺陷与多动障碍的发展或症状可能与饮食成分对肠道微生物组的调节有关。
•ADHD儿童体内有害菌丰度较高,有益菌较少
最近发现,食用加工饮食的注意缺陷与多动障碍儿童体内有害细菌(如肠杆菌、大肠杆菌和梭菌菌株)的丰度明显较高,而有益细菌(如双歧杆菌和瘤胃球菌菌株)的丰度明显较低。
食用加工食品的注意缺陷与多动障碍患者的肠道微生物群α多样性和短链脂肪酸水平显著低于对照组,研究人员认为不平衡的饮食会扰乱结肠微生物平衡,并可能成为多动症患病的潜在风险因素。
•患者肠道菌群失衡影响激素和神经递质水平
宿主-微生物组的相互作用对激素和神经递质水平产生影响,被认为与注意缺陷与多动障碍的病理生理学有关。肠道菌群失调加上持续接触微生物病原体引起的免疫功能障碍可能会导致受影响的多动症患者出现过度活跃的行为。
肠道菌群提供多巴胺和去甲肾上腺素的前体
注意缺陷与多动障碍与预测的多巴胺和去甲肾上腺素合成异常有关,其前体由肠道细菌(主要是双歧杆菌)提供。
压力被定义为由困难情况或环境压力源引起的非特定情绪或身体反应。这种反应与心理和生物因素有关,例如性激素、高情绪反应性、被动应对技巧、糖皮质激素抵抗以及中枢和外周免疫激活。
✦压力会影响肠道微生物组成与活动
不同类型的心理和社会压力源已被证明可以通过神经元、免疫细胞和结肠嗜铬细胞释放信号分子、激素或神经递质来调节肠道微生物群的组成和活动。
压力对肠道微生物群的影响可能直接通过宿主肠道微生物群信号传导介导,也可能间接通过肠道生态系统的变化介导,并涉及炎症反应、微生物栖息地的改变、肠道运动和粘蛋白分泌。
✦产生短链脂肪酸的细菌减少可能是导致焦虑的关键
暴露于压力会导致肠道微生物群组成的实质性变化,肠杆菌科细菌的增加,而乳杆菌属的细菌减少。拟杆菌属减少,梭菌属增加。以及大肠杆菌和假单胞菌属的增加。
某些微生物群可能参与应激性焦虑和一般性焦虑症,其特征是社交和职业功能下降。研究人员报道,在一般性焦虑症患者中,粪杆菌(Faecalibacterium)、直肠真杆菌(E.rectale)、毛螺菌属(Lachnospira)、丁酸球菌(Butyricicoccus)和萨特氏菌(Sutterella)较低。这些都是短链脂肪酸的重要生产者。
应激性焦虑是指在强烈的精神或躯体应激事件的刺激下,产生的过度焦虑、恐惧等情绪。患者可出现紧张、坐立不安、心慌、呼吸急促等症状,还可伴有睡眠障碍、食欲改变等表现。
大胆猜想
短链脂肪酸产生菌的减少是焦虑和抑郁单胺类假说的关键。
单胺假说——指科学家在抗抑郁药领域提出的假说,即抑郁患者神经突触间隙可有效利用的单胺类神经递质浓度明显下降,而升高突触间隙单胺递质浓度(主要是血清素)能发挥抗抑郁作用。
抑郁症是一种与压力相关的情绪障碍,涉及神经免疫-神经内分泌失调,与促炎细胞因子水平升高相关。
促炎细胞因子与高水平的皮质醇有关,通过抑制四氢生物蝶呤酶发挥重要作用,四氢生物蝶呤对于合成多巴胺、血清素和去甲肾上腺素至关重要。
多巴胺、血清素和去甲肾上腺素是人体内重要的神经递质,它们在神经系统中发挥着重要的作用。
✦肠道微生物的多样性与抑郁严重程度负相关
几项研究报告称,不同抑郁症患者的肠道微生物群组成差异较大,粪便微生物多样性的增加与抑郁症症状的严重程度呈负相关。
研究人员发现,Gelria、Turicibacter、Anaerofilum、Paraprevotella、Holdemania和Eggerthella属在抑郁症患者中普遍存在,而普雷沃氏菌(Prevotella)和戴阿利斯特杆菌(Dialiste)的存在减少。
抑郁症患者体内有益菌大量减少
后来的研究还发现,与对照组相比,抑郁症患者肠道微生物总体减少。肠道微生物群中的双歧杆菌和乳酸菌减少。Dorea、瘤胃球菌属和阿克曼氏菌属的显著减少,以及副拟杆菌属(Parabacteroides)、普雷沃氏菌属(Prevotella)和放线菌属(Actinobacteria)的增加与抑郁个体相关。
✦短链脂肪酸有助于释放神经递质和调节血脑屏障
几项研究表明,重度抑郁症患者的丁酸盐、乙酸盐和丙酸盐减少,表明短链脂肪酸可能通过直接刺激神经通路或通过神经内分泌和免疫激活的间接中枢效应改变行为。
短链脂肪酸也有助于结肠嗜铬细胞合成和释放外周神经递质(血清素和乙酰胆碱),并有助于交感神经元合成和释放去甲肾上腺素。
除了局部作用外,短链脂肪酸还可以直接作用于血脑屏障的中心受体。此外,体外研究表明,丙酸盐和丁酸盐,而不是乙酸盐,都可以调节血脑屏障的通透性,防止脂多糖引起的通透性增加。
强迫症是一种慢性且持久的疾病,会被迫出现侵入性、自我张力障碍的想法或冲动或重复行为。
尽管只有少数研究涉及肠道微生物群与强迫症的关系,但压力和抗生素治疗都会影响微生物群组成,已被认为是与强迫症症状同时发生的因素。
✦强迫症患者肠道微生物丰富度较低
据报道,患有强迫症的个体肠道微生物群的物种丰富度较低,产生丁酸盐的属(颤旋菌属、Odoribacter和Anaerostipes)的相对丰度较低。
最近还报道强迫症患者粪便样本显示文肯菌科(Rikenellaceae)(另枝菌属)丰度增加,而普雷沃氏菌和毛螺菌科(Lachnospiraceae)丰度降低。
几种心理障碍中的肠道菌群失调
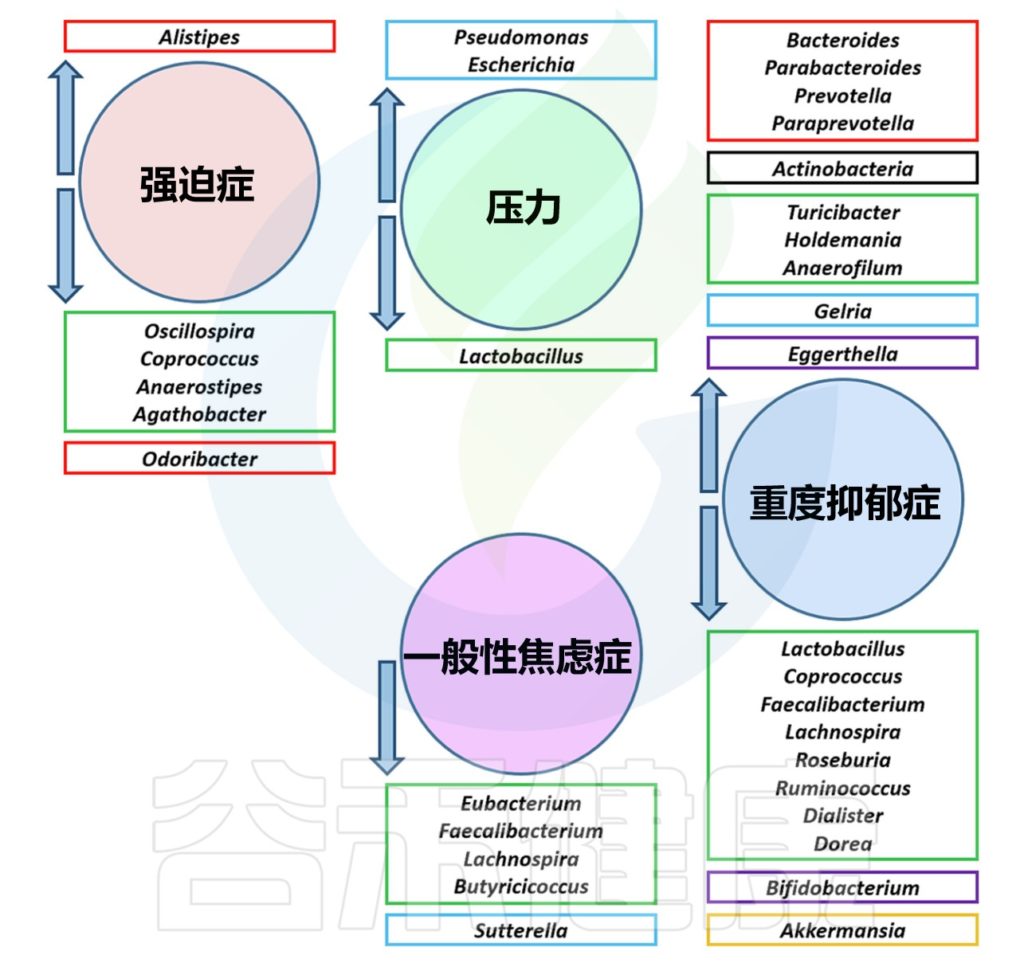
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
杏仁核在与压力相关的情绪、行为反应和情绪调节中发挥着关键作用,它显著受到肠道微生物群的影响。
杏仁核,又名杏仁体,呈杏仁状,是边缘系统的一部分。
√肠道微生物的变化可以调节认知功能
在动物模型中,有一些证据支持肠道微生物群组成的变化可以影响调节认知功能,尽管只有少数研究关注人类认知。
拟杆菌水平较高的人群拥有较好的认知表现
最近,根据粪杆菌(Faecalibacterium)、拟杆菌(Bacteroides)和瘤胃球菌科(Ruminococcaceae)的丰度建立了三组受试者,并得出结论,较好的认知表现与较高水平的拟杆菌相对应。
使用抗生素会影响认知功能,故不可滥用
用抗生素治疗剥夺或破坏肠道微生物群也会影响认知功能,包括语言学习能力以及工作和空间记忆。
√肠道微生物会影响一个人的气质和性格
由于人格特征和行为模式以及生理和心理健康结果之间存在很强的关联,一些研究已经证明肠道微生物群与气质和性格之间存在关联,这些特征甚至可以通过粪菌移植在受试者之间传播。
研究了肠道微生物的组成与儿童气质之间的关系,发现更大的暴躁/外向和恐惧与系统发育多样性呈正相关,包括戴阿利斯特杆菌属 (Dialister)、文肯菌科(Rikenellaceae)、瘤胃球菌科(Ruminococcaceae)和约氏副拟杆菌(Parabacteroides)的丰度变化。
产丁酸细菌更丰富的人可能有更高的责任心
发现高度神经质和低外向性与γ-变形菌纲丰度增加有关。低责任性与变形菌丰度增加和毛螺菌科丰度减少有关,而开放程度高的人与更大的系统发育多样性和丰富度相关。
另一方面,高度的责任心与产生丁酸的细菌滴度的增加有关,这些细菌主要属于毛螺菌科。
√多样化的肠道微生物有助于社交和好心情
最近有研究表明,特定细菌属的丰度与人格特征显著相关。对肠道微生物组多样性的分析表明,具有较高社交网络的个体呈现出多样化的肠道微生物组,而焦虑和压力与肠道微生物组的组成改变和多样性降低有关。
研究还发现某些细菌属,包括阿克曼氏菌、脱硫弧菌、乳球菌、颤螺菌和萨特氏菌可能与行为密切相关。
已经使用了几种方法来确定肠道微生物群对中枢神经系统功能的作用,包括抗生素治疗、无菌动物模型和粪菌移植。
此外,精神抗生素和益生元已被用作精神和心理疾病的辅助治疗。精神抗生素的类别可以定义为“一种活的有机体,通过与共生肠道细菌相互作用,为患有精神疾病的患者带来心理健康益处”。这些药物通过调节和改善肠道微生物群发挥作用。
为了让大家有更清晰的认识,谷禾在下表整理了使用益生菌或益生元治疗对心理或精神疾病的影响。





Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
•基因集富集分析展示下肠道菌群与精神疾病的关联
使用基因集富集分析 (GSEA) 能够检测肠道微生物群与精神疾病之间的以下显著关联:注意力缺陷与多动障碍常伴有脱硫弧菌和梭状芽孢杆菌富集;自闭症谱系障碍与拟杆菌属和脱硫弧菌有关;对于重度抑郁障碍,观察到脱硫弧菌、梭状芽孢杆菌目、钩端螺旋菌科和拟杆菌类的关联。
最近报道了普雷沃氏菌与自闭症谱系障碍以及放线菌属与精神分裂症之间的特定关联。还有一组研究人员提出了放线菌和假单胞菌与重度抑郁障碍之间的关系。
肠道微生物群和中枢神经系统通过两条途径进行交流:
(1)通过迷走神经途径的神经免疫和代谢回路;
(2)通过微生物群合成的代谢产物、肠道激素和内分泌肽。
先前的研究表明,肠道微生物群的失调是几种精神疾病的病理生理学。因此,恢复受干扰的微生物生态平衡可能为管理或预防神经系统疾病提供一种新的、有前景的方法。
另一方面,心理干预已证明在治疗功能性胃肠道疾病如肠易激综合征方面是有效的;然而还需要进一步的研究来确定心理干预对肠道微生物群变化的具体影响。
通过粪菌移植、健康的饮食和生活方式或使用心理生物药物等干预措施重建失调的肠道微生物群,可能在未来调节微生物群肠脑轴功能和促进心理精神健康方面具有重大潜力。
特别是,心理干预可能对某些神经系统疾病具有潜在的治疗作用。然而,这些干预措施的有效性并不相同,取决于给药方法、干预时间、使用的微生物菌株的数量和具体类型以及宿主的生理状况等因素。
在未来,单独或与抗精神病药物联合的个性化精神微生物干预可能成为临床患者的一种新的治疗策略。
主要参考文献
Borrego-Ruiz A, Borrego JJ. An updated overview on the relationship between human gut microbiome dysbiosis and psychiatric and psychological disorders. Prog Neuropsychopharmacol Biol Psychiatry. 2023 Sep 8:110861.
Abuaish S, Al-Otaibi NM, Abujamel TS, Alzahrani SA, Alotaibi SM, AlShawakir YA, Aabed K, El-Ansary A. Fecal Transplant and Bifidobacterium Treatments Modulate Gut Clostridium Bacteria and Rescue Social Impairment and Hippocampal BDNF Expression in a Rodent Model of Autism. Brain Sci. 2021 Aug 5;11(8):1038.
Bear T, Dalziel J, Coad J, Roy N, Butts C, Gopal P. The Microbiome-Gut-Brain Axis and Resilience to Developing Anxiety or Depression under Stress. Microorganisms. 2021 Mar 31;9(4):723.
Ansari F, Pourjafar H, Tabrizi A, Homayouni A. The Effects of Probiotics and Prebiotics on Mental Disorders: A Review on Depression, Anxiety, Alzheimer, and Autism Spectrum Disorders. Curr Pharm Biotechnol. 2020;21(7):555-565.
Bharwani A, Mian MF, Foster JA, Surette MG, Bienenstock J, Forsythe P. Structural & functional consequences of chronic psychosocial stress on the microbiome & host. Psychoneuroendocrinology. 2016 Jan;63:217-27.
Cerovic M, Forloni G, Balducci C. Neuroinflammation and the Gut Microbiota: Possible Alternative Therapeutic Targets to Counteract Alzheimer’s Disease? Front Aging Neurosci. 2019 Oct 18;11:284.
Cryan JF, O’Riordan KJ, Sandhu K, Peterson V, Dinan TG. The gut microbiome in neurological disorders. Lancet Neurol. 2020 Feb;19(2):179-194.