-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
粪菌移植(FMT)这几年很热,表面看,它的逻辑很直白:将健康人的肠道菌群移植到患病者体内,期望借此改善肠道微生态,帮助缓解疾病症状。但是,同样是 FMT,为什么有些人效果明显,甚至症状得到了长期缓解,而有些人却反应并没有达到预期?
其关键在于供体菌群能否在受体肠道定植并长期维持。
定植并不只是看移植后肠道菌群更像供体,而是看供体菌株是否能在受体体内站稳脚跟、稳定下来,并在长期的群落动态中维持。这个过程背后,涉及到很多因素——包括供体和受体肠道环境的相似度、供体菌群的多样性、移植方式等等。
目前,越来越多的研究开始聚焦于供体菌株的定植效率。换句话说,供体菌群是否真的能够在受体肠道环境中稳定生长,功能性地替代或补充原有群落。这是 FMT 成功的一个关键因素。
而定植的成败又受到多方面因素的共同影响,包括微生物物种之间的兼容性、菌株之间的互补性,以及肠道环境本身的特性。在不同的疾病状态下,影响定植效率的因素可能截然不同。
近期的两项大型随机对照试验(FOCUS Trial 和 Gut Bugs Trial)对这两种疾病背景下 FMT 的效果进行了深入分析,其研究结果发表在《Gut Microbes》期刊上。

研究表明,在溃疡性结肠炎的队列中,供体和受体菌群的相似性越高,定植效果越好;而在肥胖的队列中,更大的相似性反而可能降低定植效率,反而更互补的供体-受体匹配可能更有利。
本文我们将通过这两项试验的数据,探讨影响 FMT 定植效率的关键因素,并分析其如何在不同的疾病背景下产生不同的效果。随着对 FMT 机制的深入了解,未来我们也许能在个性化医疗的框架下,根据患者的疾病背景和微生物特点,更精确地选择供体和设计治疗方案,从而提高 FMT 的疗效。
许多FMT 研究会先用群落层面的指标(如 PCoA、α 多样性)说明受体菌群是否更像供体。但这类指标回答的仍是整体相似性问题。尤其在单供体 FMT 中,供体来源相对明确。
在多供体 FMT 设计的实际应用中,还有更棘手更具体的问题:
后面所有“哪些因素影响定植”的统计分析,都是围绕这个问题展开的。本章先把作者怎么定义与计算定植效率讲清楚。
多供体FMT第一道坎:究竟谁给了谁?
单供体 FMT 比较直观:受体出现一个新菌株,大概率来自那位供体。
但在溃疡性结肠炎(UC) 的 FOCUS 试验里,每次用的是 4–7 位供体混合。于是会出现两个麻烦:
所以作者先做了一个基础动作(逻辑很简单):
把受体治疗后样本里的菌株,拿去和每位供体的菌株做DNA 相似度比对,足够像就可以算供体匹配菌株(donor-matching strain)。
再统计一个受体样本里,能匹配上的供体菌株有多少——这就是后面要用到的定植相关指标的基础。
怎么“用菌株匹配”拼出每个受体的供体来源
这一步相当于在反向破案。
先定一条线——多像才算同一菌株
作者用 StrainPhlAn3 估计每个样本在每个物种里的“主导菌株”,再算菌株间 DNA 距离,并做了归一化(不同物种的菌株差异天生不一样,不能直接比)。
下图对比了两类距离:
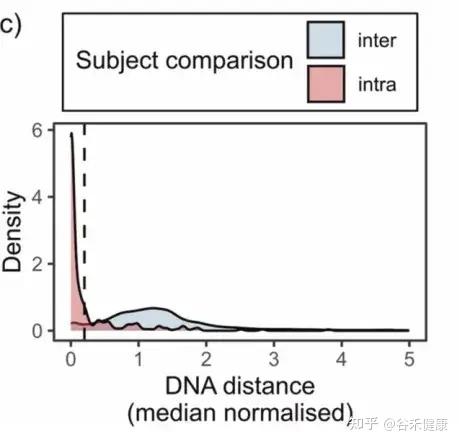
然后画了一条阈值线:0.2。
作者把距离 ≤0.2 当成是“同一菌株/高度匹配”的层级。
注:这条线很重要,因为后续所有“某受体匹配到某供体菌株”的判断,都建立在这个阈值上。
不同队列/测序条件下最优阈值不同,且优化阈值能显著提升配对预测的整体表现
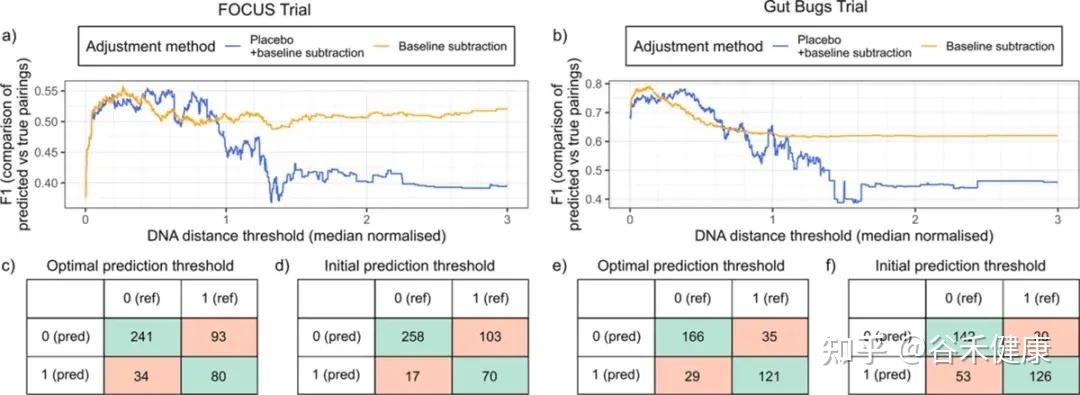
你可以把它理解成:作者先用数据告诉你,同一个人的前后样本(或者同来源)通常会落在怎样的距离范围,再在这个分布上划一个相对保守的界限,用它来决定是不是同一株。
安慰剂组里也会出现看似匹配的噪音,所以要剔除模糊供体菌株
你会注意到一个事实:安慰剂组里也可能出现一些供体匹配菌株 ——这显然不能被解释为真的做了 FMT。这类匹配可能来自背景噪音、算法阈值的误差、或某些菌株本来就在群体里很常见导致碰巧接近。

所以作者在 Figure 1b 做了关键一步:
把安慰剂组里出现的这些模糊供体菌株(ambiguous donor strains)当作噪音来源,从 FMT 组数据里移除,再重新画热图。这样就尽量避免把“背景共有菌株”误判成“FMT 导致的定植”。
这也是多供体、菌株匹配分析里比较严谨的一点:不是匹配上了就算,而是还要问一句,在没有 FMT 的情况下,这种匹配会不会也出现?
反推每个受体可能接到了哪些供体
剔噪后,下图统计每个受体匹配到的菌株分别来自哪些供体,用不同颜色表示不同供体贡献。
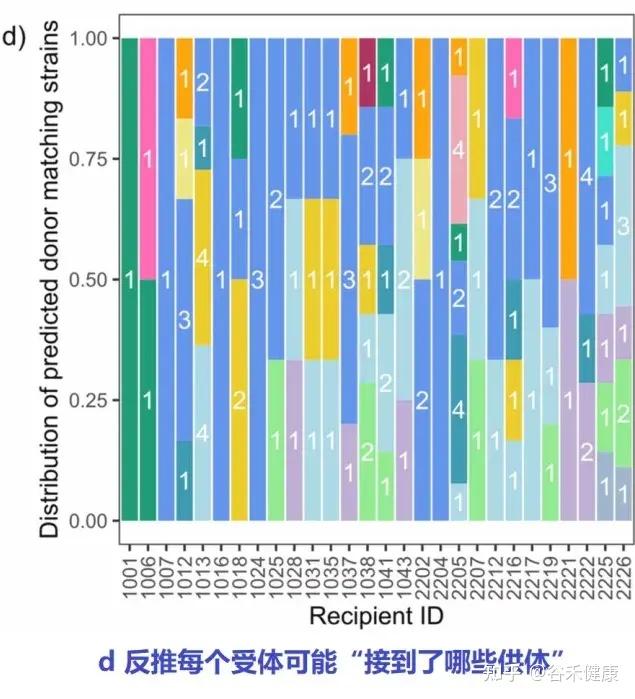
FOCUS 的 FMT 组里,28/32 名受体在 8 周能检测到“只在 FMT 组出现且基线不存在”的供体匹配菌株。
也就是说:大多数人确实能看到来自供体的新菌株信号。
在结果里把定植拆成了两类:新增与替换
同样叫“定植”,机制可能不同。
对每个发生定植的物种—菌株事件,看受体基线有没有这个物种:
注: 这两类在生态学上差别很大:
替换意味着同物种内的菌株竞争、基因型差异、以及原有菌株的生态位被重新占据;
新增更像是受体原来缺失的成员被补齐,或者说受体生态系统里存在可被填补的空位。
这一步很必要,因为它会影响你怎么理解后面供受体相似/不相似:
这也解释了为什么后面在不同疾病队列里,相似性指标的方向可能不一样。
那么,“定植效率”在本文里到底是什么
把“能住下来多少菌”变成一个数字。
当研究人员能数清,受体里到底出现了多少个“可追踪的供体匹配菌株事件”后,就能把它汇总成一个可建模的因变量:
供体的定植效率(engraftment efficiency)。
注:可以粗略地理解为供体带来的、能被追踪到的菌株,在受体体内“留下来”的程度。
后面所有模型(相关性、线性模型、线性混合模型)基本都是:用 定植效率 当结果,看看它和哪些因素有关。
到这里,作者先解决了“没配对表也能继续分析”的卡点。接下来进入论文真正想回答的核心:
哪些因素决定菌株能不能定植?
这种规律在不同疾病人群里是不是完全不同?
两个队列:UC vs 肥胖
作者选了两项双盲、随机、安慰剂对照的多供体 FMT 临床试验:
为什么要用两项试验来说?
这里研究人员认为,如果“哪些因素决定定植”是一条普遍规律,那么换一个疾病队列也应该差不多;如果规律会变,那说明定植机制是队列/疾病特异的。
FOCUS:强干预、长疗程、但测序相对浅
FOCUS试验对象:患有溃疡性结肠炎(UC)的成年人。
FOCUS(UC)试验采用多供体粪菌制备的灌肠剂及胶囊,给UC患者的治疗方案很猛:
采样与数据方面,作者为了让前后对比简单且可比,主要选了:
受体:基线 + 8 周(FMT 组与安慰剂组)
供体:个人供体样本 + 混合供体批次样本
对菌株来说,这是一个供体数量可变、竞争更复杂的输入环境。
Gut Bugs:供体数固定、胶囊给药、测序深
Gut Bugs Trial是另一种更标准化的多供体:
采样时间点:基线与6周(尽量对齐“即时干预后”)。
这些结构差异会怎么影响定植效率?
两项试验虽然都叫多供体,但 FOCUS 的结构更像供体数量可变的混合生态输入,Gut Bugs 更像供体数量固定的标准化输入。
在 FOCUS 里,受体面对的是 4–7 个供体生态位的竞争,而且批次大小(batch size,即每位受体的供体数量)在模型里被作者作为固定效应单独纳入(因为它会影响每个供体成分能否留下来)。
在 Gut Bugs 里,供体数恒定为 4,所以作者明确说明:不把 batch size 当作固定效应。
这会让后面的相关性(比如β多样性与定植效率的方向)更可能呈现队列差异。
再看分析结构:为什么FOCUS能盲法预测配对,而Gut Bugs更多是验证
Methods 里还特别强调了一个分析流程上的差异:
FOCUS 试验:作者在一开始不知道真实供体—受体配对的前提下,先用供体菌株匹配去反推每个受体可能用了哪些供体(盲分析)。之后才从原试验作者处拿到真实配对,用于验证与后续分析。
Gut Bugs 试验:真实配对关系在此前已发表,因此无法再做同样的盲法预测;它在该文章中的角色更像是验证集,验证这套菌株匹配框架在另一种疾病队列里是否还能工作、结论是否一致。
FOCUS更偏向从0推断供体贡献,Gut Bugs更偏在已知答案下验证规律是否可迁移。
FMT的定植不是供体越强越好,也不是受体越空越好,而是供体携带的菌株库、受体基线生态位,以及两者的匹配关系共同决定。
同样是健康供体,有的人就是更容易送进去
很多人会以为:多供体混在一起,最后效果应该差不多“平均掉”。但原文首先用数据把这个想法打破:供体之间的平均定植效率差异显著(p<0.001)。
更直观的是 FOCUS(UC)队列里两个常见供体的对比:
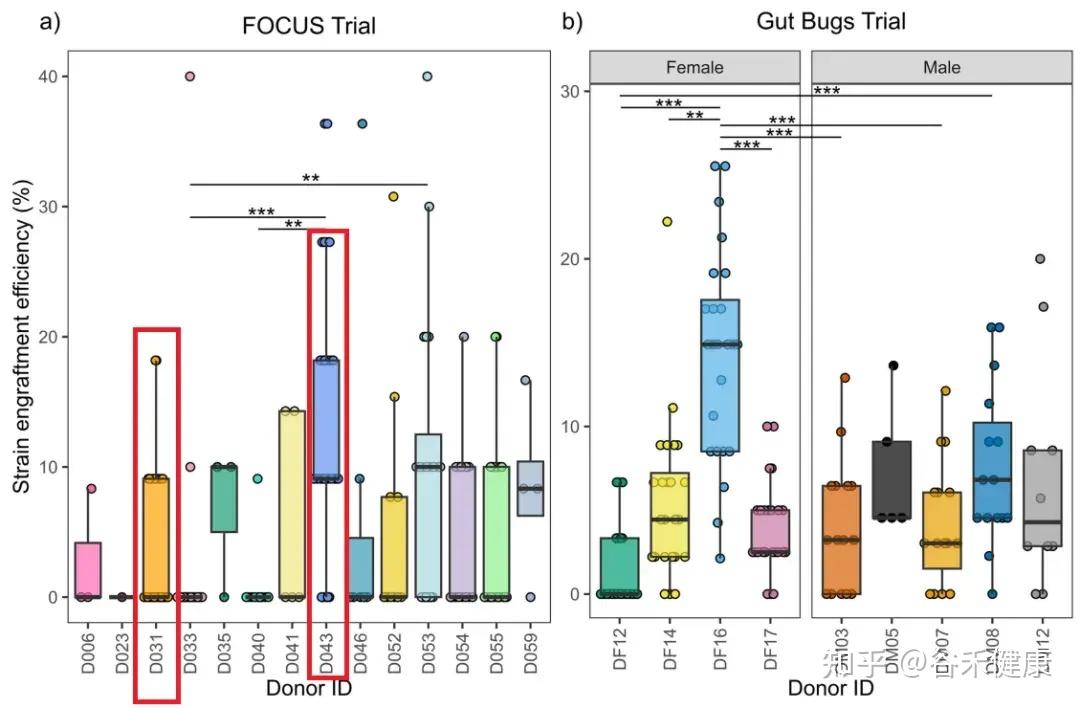
可以看到供体之间差异显著,比如说FOCUS里面:D043、D053 高,D033、D040 低;Gut Bugs里面:DF16 高、DF12 低。
而且这两位供体都被大量使用(分别对应 n=29、n=26 个受体)。这意味着:不是谁用得多谁就看起来强,而是供体本身确实存在可重复的可定植性差异 。
反转:用“匹配度”量化后,两队列规律不同
这个供体适不适合这个受体,它不靠主观印象,在这里研究人员用β 多样性把匹配变成可计算、可检验的量,并发现两队列的关键信号落在不同层面。
在 FOCUS(UC)队列中,供受体的功能谱越接近,供体菌株越容易留下来:
研究人员还进一步做了“按单个 COG 类别差异”去解释的线性模型,但没有找到某一个功能单独驱动的证据,因此提出更合理的解释:这更可能反映的是整体功能的互补性/匹配,而不是某一个功能类别单打独斗。
在 Gut Bugs(肥胖)队列中,功能 β 多样性并没有显著影响定植效率(下图显示相关性不显著)。也就是说,至少在这个队列与这套数据里,“功能越像越好”并不是主导信号。
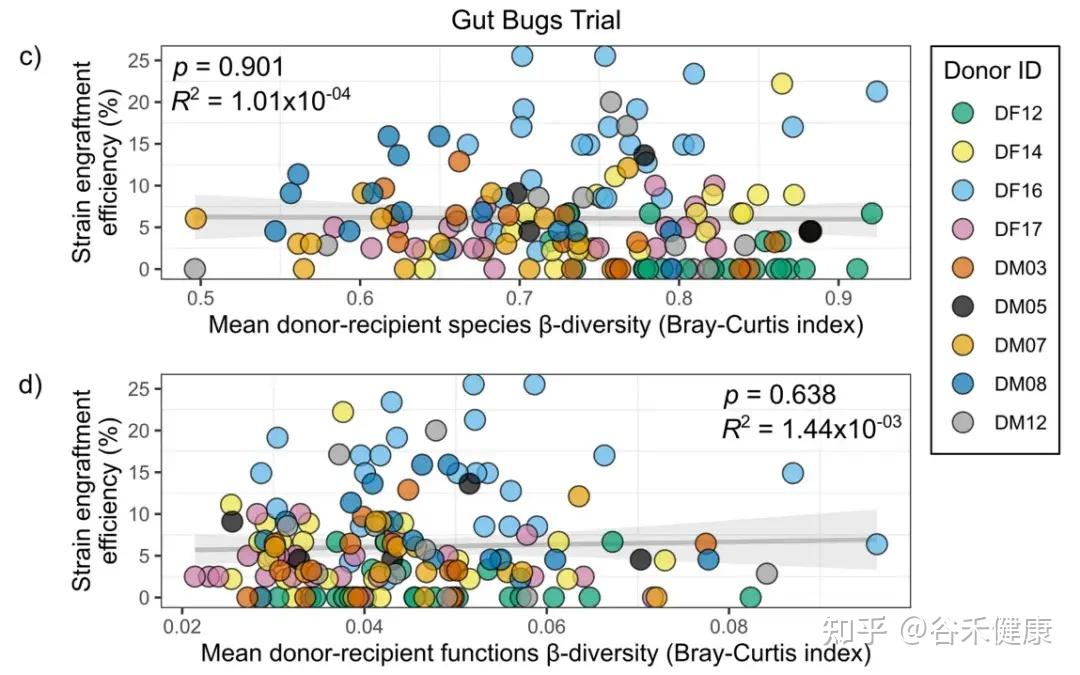
但 Gut Bugs 的匹配信号并不是不存在,而是体现在更接近缺口的指标上:
Jaccard更像在问:受体缺不缺这个物种席位。缺得越多,供体带来的成员越容易补进去。
简单来说,就是UC 队列更像功能上别差太远更容易留下(兼容性/匹配);肥胖队列更像物种上更不一样反而更容易留下(互补性/空位)。
这不是一句话能简化的供体筛选公式
到这里你已经知道为什么会被概括成相反规律:FOCUS(UC)更强调兼容性/匹配(尤其功能层面),Gut Bugs(肥胖)更像互补性/空位(物种有无层面的缺口)。
但这不等于能把它简化成一个选供体公式。下一章节的P/B模型会提示:供体强弱不仅是供体自身属性,还会受受体本身的影响(存在交互项)。换句话说,匹配本身就是关键变量。
原文还提到 D043 有一个很醒目的特征:
它是所有供体里面唯一的一个,平均 Prevotella/Bacteroides(P/B)比 > 1(也就是 Prevotella 更占优势)的供体,这个特征在一些研究里被联系到所谓“超级供体”现象。作者在这里比较谨慎:他们并不武断地说D043 就是超级供体,而是提醒你,它被用得多,也可能本身更容易定植。
α多样性不是越高越好,更像一个最低门槛
很多 FMT 文章都喜欢讲多样性,但这篇文章的结论更接近真实世界:多样性有用,但不是线性万能解释。
在 UC 的 FOCUS 队列里,作者观察到一个挺像门槛的现象:当供体 α 多样性(Shannon)比较低(大约 < 2.5)时,供体—受体配对更容易出现 0% 定植效率。
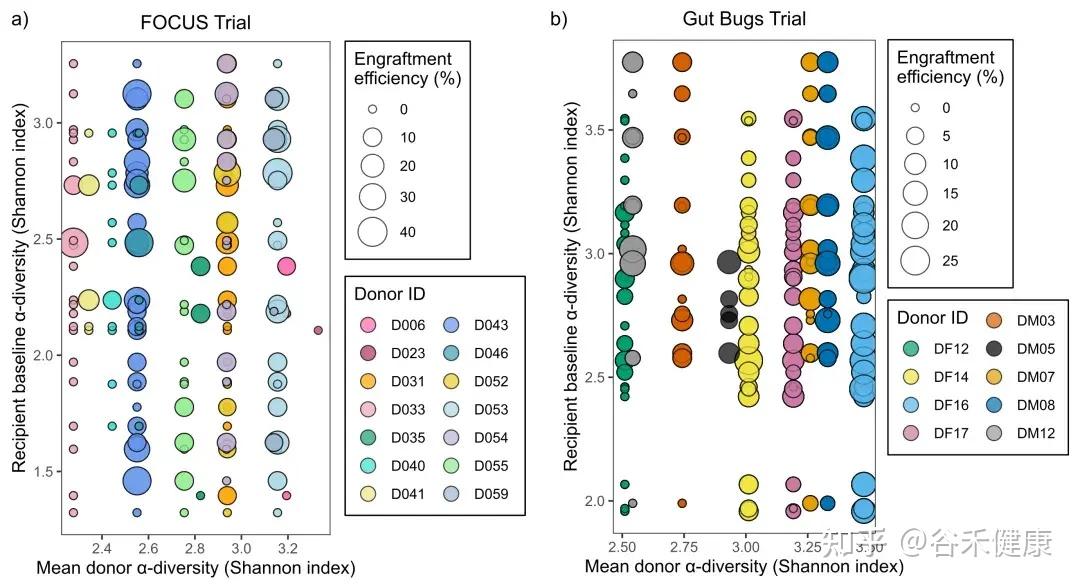
图中比例差异很明显:低于 2.5 时 86.5% 配对为 0%,高于 2.5 时下降到 44.9%.
也可以这样理解,供体群落太单薄,可输出的菌株本来就少,想在受体里留下来更难。
关键是:当供体多样性在常见范围内时,供体多样性与定植效率并没有稳定线性相关(FOCUS:p = 0.955;Gut Bugs 也未显著)。研究人员还强调,两项试验里都出现过“受体 α 多样性反而高于供体”的情况。于是,简单用“供体更丰富→就更能定植”来解释就站不住了。
P/B 比:一个很能用的群落标签(供体端与受体端)
作者用了一个相对好理解、也常用于描述群落结构的指标:Prevotella/Bacteroides 比例(P/B 比) 。有的人肠道菌群里 Prevotella 占优势,有的人 Bacteroides 占优势。
在两项试验的线性混合模型(Figure 6)里,P/B 比给出了比较稳定的信号:
供体 P/B 比越高,定植效率越高 FOCUS(b = 6.28, p = 0.023),Gut Bugs(b = 3.83, p = 0.036)。
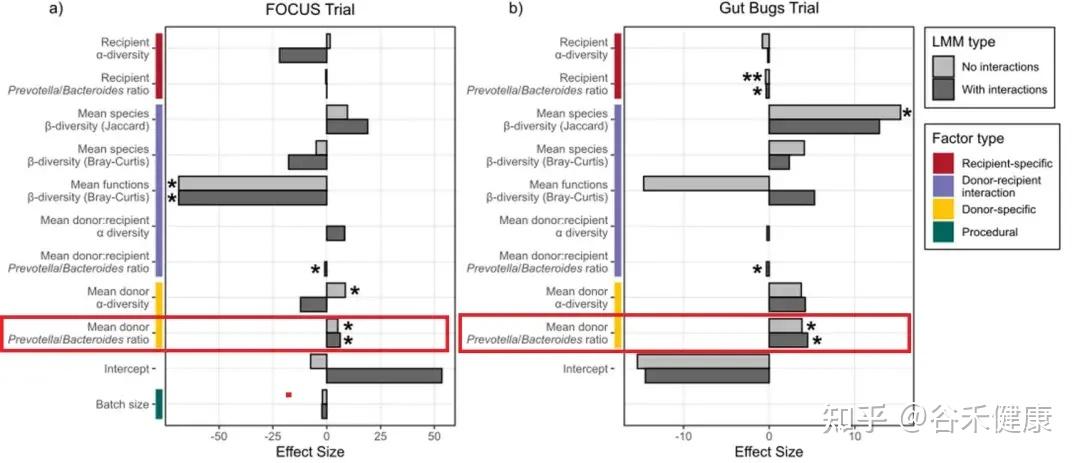
但 P/B 比并不是说,供体越偏 Prevotella 越好这么简单。
受体端与交互:同一供体,在不同受体身上不一定一样
模型同时显示:受体端的 P/B 比、以及供受体之间的组合关系,会显著改变这种供体优势的作用方式。
首先看 Gut Bugs(肥胖)队列:受体 P/B 比对定植效率是显著负向的(b = -0.424, p = 3.77×10^-3)。这意味着在这个队列里,受体本身越偏 Prevotella(P/B 越高),总体上越不利于供体菌株定植。可以理解为:当受体群落已经更偏向某一类“Prevotella 型结构”时,可被外来菌株占据的生态位更少(或同类竞争更强),因此总体定植更难发生。
再看 FOCUS(UC)队列:作者不仅看到供体 P/B 的正向主效应,还看到了一个显著的供体×受体 P/B 交互项(b = -0.899, p = 0.017)。
交互项为负的意思是:偏 Prevotella 的供体并非对所有受体都同样有效;当受体本身也偏Prevotella 时,供体的这种优势更可能被抵消,甚至变成同生态位的竞争。
可以这样理解:供体端的某些群落结构会加分,但受体端也会把关,而且不同疾病背景下,把关方式不一样。
总体思路:对的人 + 对的生态位规则
肠道菌群检测报告可以作为个性化 FMT 的入门级决策与随访工具:一方面用于治疗前分层与配对,另一方面用于治疗后量化是否定植、改了什么,并将结果回收为下一轮配对的证据。
该研究作者甚至强调应建立针对每种疾病的特异方法学,并提出 FMT 的真正潜力应以个体化医学实现:根据疾病/亚型,把受体与一个或多个最可能带来有益菌定植的供体进行配对。
这意味着:
同一份菌群报告,在不同疾病里“怎么解读、怎么用来配对”,规则不应相同。
个性化 FMT 的核心是两件事:
这里的落地流程(四步闭环):
筛受体 → 筛供体 → 做匹配 → 评估与复盘
治疗前——患者分层(用哪套匹配方案)
一份肠道菌群检测用于分病种策略选择,同时缩小供体候选池:
把菌群平衡指标作为受体“微生态脆弱程度”的一个粗筛维度,用于确定是否需要更强的干预(如多次给药、路线选择、随访更密集等),以及作为后续是否改善的评估指标之一。
把多样性作为“受体可被改造程度/生态位可用性”的基础变量。前面的研究也讨论到,跨疾病的 Meta分析中受体 α 多样性与定植常存在关系,但在不同队列呈现不同交互与权重,所以不能只用一个阈值做所有病种的决策,更合理的是在某病种人群里建立自己的判读边界。
哪些常见核心菌群、产丁酸相关菌、黏液层相关菌、有益菌等缺位,决定了后续更偏向新增还是替换。
简单来说,先别急着挑供体,用检测回答:这个受体的底盘是缺位型还是紊乱型,以及属于哪种疾病队列的生态规则。
供体筛选:从安全合格走向微生态特征可量化
传统供体筛选主要是安全(病原体/寄生虫等),而该研究认为,供体的物种组成、功能结构,以及与受体的互补/相似关系,会影响定植效率。
因此供体筛选至少要增加两层可量化标准:
基础质量指标:供体的 α 多样性、关键结构特征(例如 P/B 比在研究里被作为指标之一,也可以同时用其他的相关指标)。
报告列出多种有益菌(如 Lactobacillus、Bifidobacterium等)的丰度与检出情况,可作为供体是否具备可提供的功能模块的证据(例如 产丁酸相关菌群)。
有害菌总体是否过高、以及抗生素耐药风险评估等,可作为长期可用供体库管理的一部分。
供体稳定性:如果供体多次采样,观察其菌群波动(稳定供体更利于可复现)。
供体受体匹配:建立按疾病分轨的匹配规则
该研究给出的最重要启示,是同样的供受体差异度指标,在不同疾病队列里方向可能相反:
炎症性肠病类疾病(更强调功能兼容)
匹配优先级:供受体在功能维度不要差太远(避免来者水土不服),同时供体能补足受体缺失的关键菌群。
可以用谷禾检测报告里的菌群平衡、多样性等指标先做受体分层。炎症类可考虑供体中抗炎/屏障模块相关指标更好的(例如肠道屏障、LPS等指标),并避免在受体本已存在风险提示的方向上进一步加重。
屏障不足者在方案上更强调先稳环境再引入,并把屏障改善作为疗效评估的一部分,而不只追求菌的变化。
如果条件允许,可以用宏基因组做供受体功能匹配。
代谢类疾病(更强调生态位空缺)
匹配优先级:在安全与稳定的前提下,供体应能提供受体缺失的菌群模块;供受体在物种组成上适度拉开差异,可能更利于新菌株进入。
对多供体方案,可进一步用供体间互补减少内耗,避免多个供体在同一生态位高度重叠、彼此竞争导致有效输出下降。
匹配不是一个公式,而是一个分病种的规则库。
当疾病队列的生态位规则复杂、且个体差异大时,多供体更像提高覆盖率的工程策略;但最终仍需靠检测把贡献拆开、把有效组合沉淀下来。
治疗后评估——用同一套指标呈现是否定植
随访时不只看整体更像谁,还可以拓展一些:
这一步形成反馈:把这位患者用什么供体组合更容易定植沉淀为可复用规则,推动下一次配对更精确。
注:做前后评估要尽量保持同一检测平台与标准化流程。
这项研究真正的价值,不只是告诉我们某个供体更强,而是把FMT推进到更精细的层面: 从看群落像不像推进到追踪菌株能不能留下来,并提示不同疾病人群的肠道微生态规则不同。
当我们开始用整个肠道微生态的思路去理解FMT, 就不仅是找一个最强供体,未来更可行的路径是:分病种建立可验证的匹配策略,把治疗做成一套可测量、可比较、可迭代的闭环:治疗前的受体分层,治疗中的供受体匹配,治疗后的定植追踪与反馈,从而让 FMT 更接近可计算的精准干预。
主要参考文献
Behling, Anna H., et al. “Cohort-specific determinants of donor strain engraftment following multi-donor faecal microbiota transplantation in two randomised clinical trials.” Gut Microbes 17.1 (2025): 2597628.

谷禾健康
硒(Selenium)是一种人体必需的微量元素,参与多种生理过程,是多种活性酶和蛋白质的重要组成部分。它在抗氧化防御、免疫调节、甲状腺激素代谢、心血管保护以及神经系统功能甚至生殖能力维护中发挥着关键作用。
适量的硒对于维持人体健康至关重要,而其缺乏或过量都会对机体造成负面影响。硒缺乏被证实与多种疾病密切相关,如克山病、卡斯钦-贝克病、甲状腺功能障碍、免疫力下降和某些癌症。缺硒会削弱机体的抗氧化能力,导致活性氧的过量生成,从而引起细胞损伤与慢性炎症反应,最终增加多种代谢及心血管疾病的风险;而过量摄入则可能引起硒中毒。
近年来,越来越多的研究发现,硒与肠道微生物群之间存在密切的双向调节关系。约四分之一的肠道细菌含有编码硒蛋白的基因,如梭菌和肠杆菌。同时硒作为多种细菌酶的重要辅因子,影响其代谢功能;硒还对病原菌(如大肠杆菌)具有特定的抗菌活性,同时提高具有潜在保护作用的有益菌水平。
肠道菌群能够代谢多种无机和有机硒,过量细菌摄取硒可能导致宿主硒蛋白缺乏,部分细菌还会通过硒来改变致病性。并且硒与肠道微生物群的作用在炎症性肠病(IBD)、癌症、甲状腺功能障碍、糖尿病、心血管疾病和神经发生性疾病等疾病中存在重要影响。
在此背景下,科学合理的硒补充显得尤为重要。日常生活中,主要的硒来源包括富硒粮食、巴西坚果、海产品、动物内脏、蛋类及蘑菇等天然食物;此外,还可以通过富硒酵母、有机硒补充剂、硒强化食品等途径进行补充。然而,硒的安全剂量范围较窄,长期过量摄入可能导致中毒反应,因此补硒应遵循个体化、适量与安全的原则。
本文将系统探讨硒的生理功能、缺乏及过量危害、其与肠道微生物群的相互调节机制以及其与肠道菌群协作在疾病改善中的潜在作用,并总结安全有效的补硒策略,旨在为理解硒的健康作用机制及临床应用提供全面的参考。
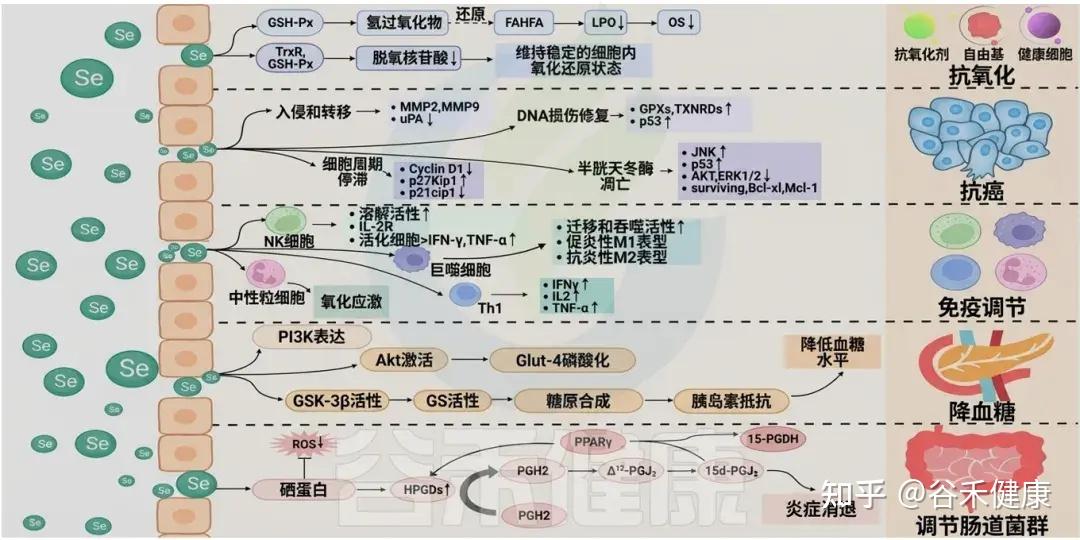
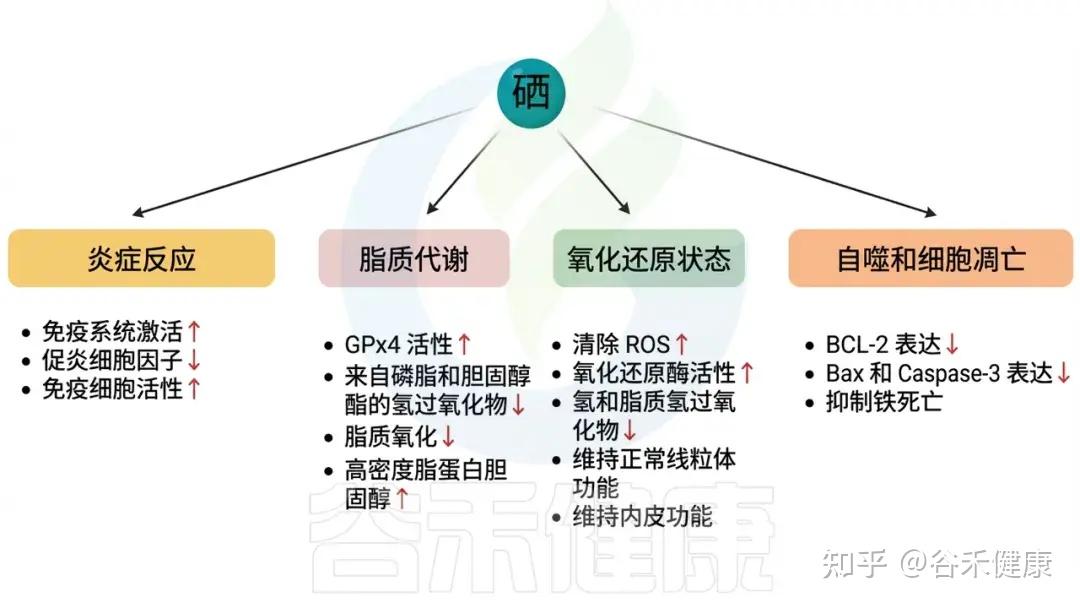
硒(Selenium)作为一种人体必需的微量元素,扮演着至关重要的角色,其生理作用涵盖多个方面。它不仅是多种生物活性酶和蛋白质的组成部分,如谷胱甘肽过氧化物酶和硫氧还蛋白,还在抗氧化、免疫防御、甲状腺功能调节、心血管保护以及糖代谢调节等方面发挥着重要作用。硒主要以体内的硒蛋白形式发挥其生物功能,以下是硒在人体内的主要生理功能:
硒及其作用机制的促进健康效应
1
抗氧化功能
证据较充分
研究表明,近一半的硒蛋白具有抗氧化功能,包括谷胱甘肽过氧化物酶(GPX)、硫氧还蛋白还原酶(TrxR)、碘甲状腺原氨酸脱碘酶 (DIOs)、硒蛋白P、硒蛋白M、硒蛋白H、硒蛋白O和硒蛋白V。
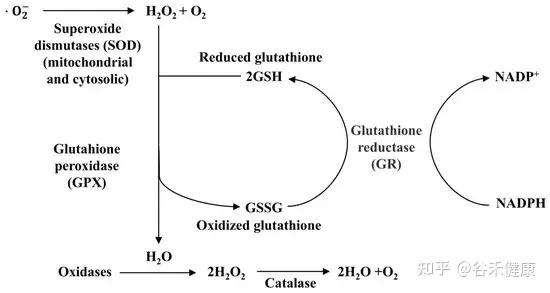
▸ 硒可将过氧化物转化为无毒性的氧化状态
硒通过直接、间接和联合作用三种机制发挥抗氧化作用。作为GPX的重要组成部分,硒通过催化谷胱甘肽(GSH)还原为氧化形态(GSSG),将有毒过氧化物转化为无毒的羟基化合物,从而将H2O2分解为H2O,保护细胞和组织免受过氧化物损伤。
硒蛋白还与细胞膜表面的肝素结合,有效抵抗过氧化物如过氧化亚硝酸盐。在间接作用中,硒蛋白促进其他抗氧化酶如GPX和TrxR的表达与活性,这对保护细胞(如线粒体、微粒体和溶酶体)尤为重要。
过氧化物酶在人体内过氧化氢去除中的作用
▸ 硒还与维生素E有协同作用
此外,硒与抗氧化剂维生素E具有协同作用。维生素E通过防止不饱和脂肪酸氧化成过氧化氢来发挥抗氧化作用,而外源性抗氧化剂则是抵御自由基损害的第二道防线。
近年来,研究人员通过体内富集和体外修饰获得了多种硒化合物,包括硒富集酵母、硒多糖、硒纳米颗粒和外源硒蛋白,这些化合物均显示出显著的抗氧化活性。
2
免疫调节功能
证据较充分
硒在淋巴结、肝脏和脾脏等富含免疫细胞的组织中极为丰富。研究表明,硒广泛存在于所有免疫细胞中,并在保护胸腺、维持淋巴细胞活性和促进抗体形成中发挥重要作用。硒同时参与先天免疫和适应性免疫,对多种免疫细胞具有调节作用。
▸ 硒可以影响免疫细胞的活性和分化
硒可以调控NK细胞、巨噬细胞、树突状细胞、粒细胞、肥大细胞和小胶质细胞的先天免疫活性。它还影响T细胞的增殖和分化,并通过调节Tfh细胞和5-脂氧化酶活性来影响B细胞的分化和存活能力。
硒在免疫系统中的作用
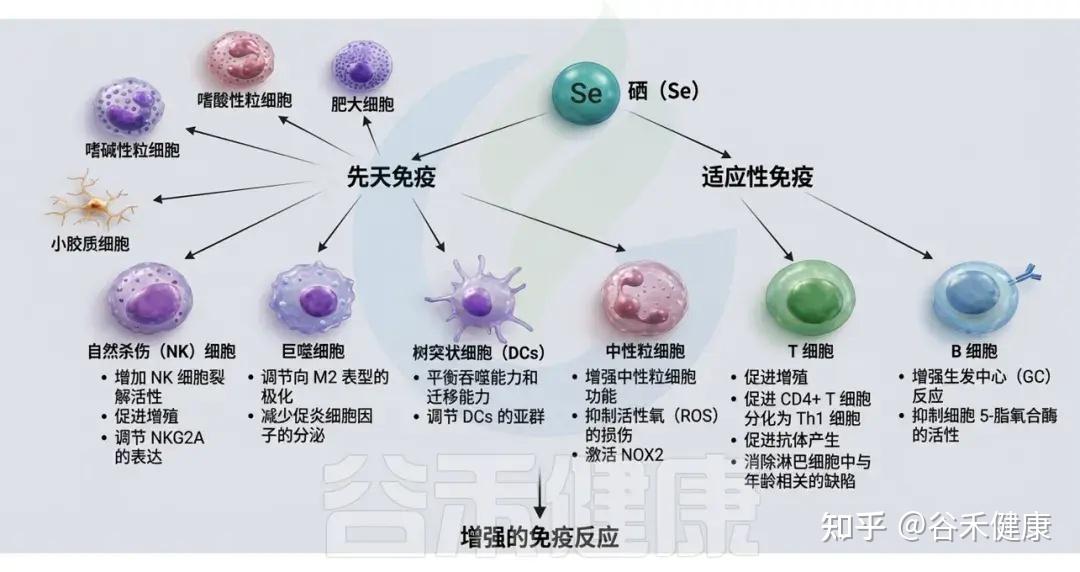
总之,硒缺乏会影响免疫系统的各个方面,而硒补充可以增强细胞免疫、体液免疫和非特异性免疫功能。这可能是通过提升含硒的GPX活性,减少免疫细胞中过氧化脂的积累,从而增强免疫细胞功能实现的。
3
甲状腺功能的维持
证据较充分
甲状腺是人体最大的内分泌腺,分泌甲状腺激素(TH),影响几乎所有细胞,调节生长、发育和新陈代谢。主要激素为三碘甲状腺原氨酸(T3)和甲状腺素(T4)。
▸ 硒调节甲状腺激素的平衡
硒能够帮助将甲状腺素T4转化为其更活跃的形式T3。硒还通过影响甲状腺去碘酶的活动,调节甲状腺激素的平衡,对代谢和生长具有重要意义。
4
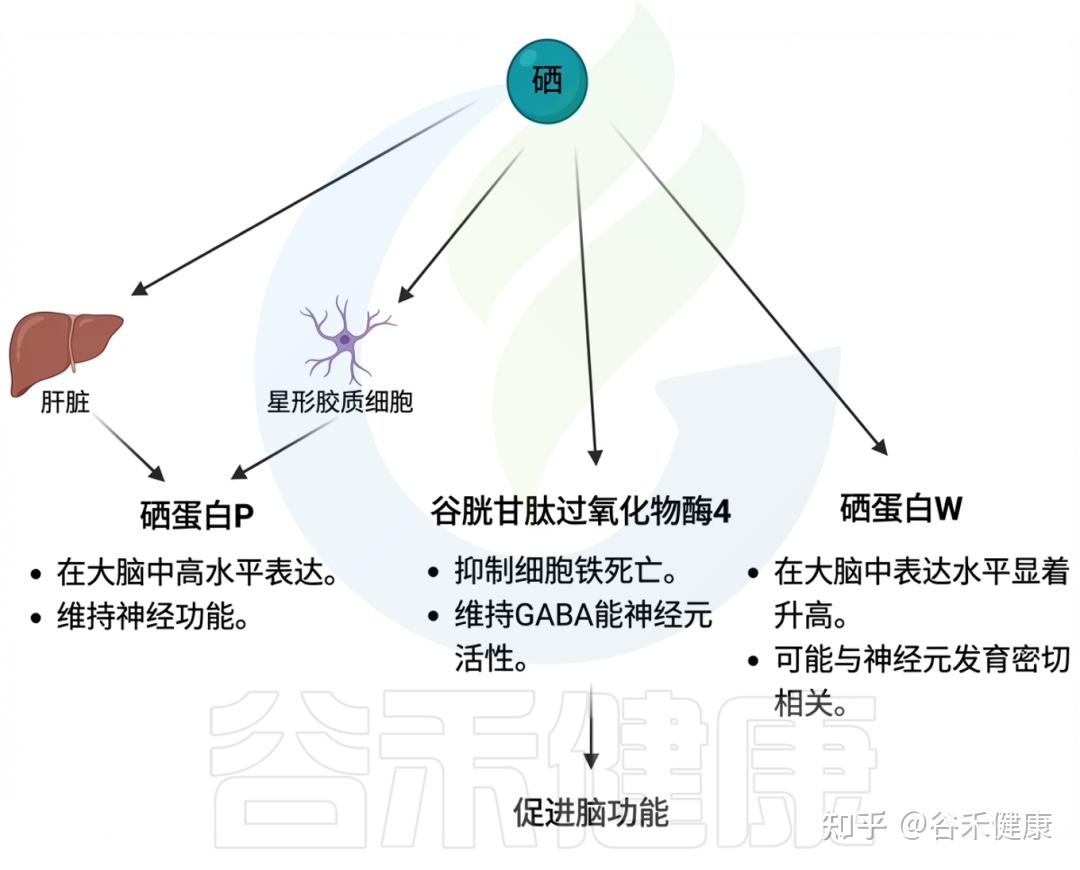
大脑、神经保护
证据一般
大脑的代谢高度依赖硒水平,人脑中的硒含量约为90–110 ng/mg湿重,低于肝脏。然而,在硒耗尽的情况下,大脑中的硒水平仍能保持。这表明硒对大脑功能的重要性。肝脏合成硒蛋白P、谷胱甘肽过氧化物酶4(GPX4)和血清蛋白W是大脑中表达最丰的三种蛋白,暗示它们在大脑功能中可能扮演关键角色。
▸ 硒水平影响阿尔兹海默病和帕金森病
硒缺乏可能导致神经系统和运动障碍。阿尔茨海默病(AD)患者的血浆硒水平和红细胞GPX活性显著降低。因此,外源性硒补充被发现能够减轻神经退行性疾病并逆转AD模型中的记忆缺陷。
帕金森病(PD)作为一种与运动控制失调相关的神经退行性疾病,也与硒水平有关,硒能减少大鼠PD模型中的运动缓动。此外,癫痫患者的血清硒水平通常低于健康人群。
硒对大脑功能的影响机制
5
糖代谢调节
证据较充分
研究表明,硒通过多种途径影响2型糖尿病(T2DM)。在一项为期7.7年的随机双盲对照试验中,每日口服200微克硒的人群其T2DM发病率高于安慰剂组。另一项剂量反应荟萃分析显示,硒暴露增加了T2DM风险,因其补充剂增加了肝脏中Sepp1的生成,而Sepp1是已知的胰岛素抵抗诱导因子。Sepp1可减少肝细胞中的胰岛素受体酪氨酸磷酸化,并降低肌细胞中的丝氨酸磷酸化,从而损害胰岛素信号传导和葡萄糖代谢。
▸ 硒水平过高和缺乏都会增加2型糖尿病风险
一项针对13460名个体的荟萃分析显示,血清硒含量低于97.5 μg/L和高于132.5 μg/L的人群中,2型糖尿病(T2DM)的患病率较高,且高硒水平个体的发病率上升更为明显。其他研究也表明,糖尿病患者的血浆硒浓度显著低于对照组。
硒对2型糖尿病的影响机制
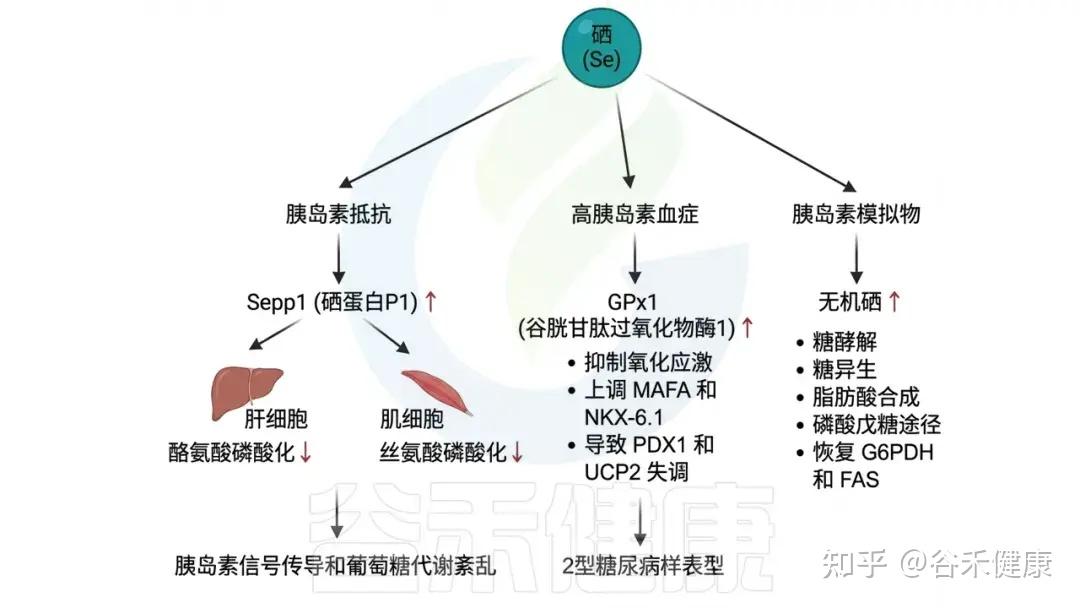
这些发现表明,T2DM与硒水平之间并不存在简单的线性关系,较高和较低的硒水平均是T2DM的潜在风险因素。适当的硒补充对于维持人类葡萄糖稳态至关重要。
研究发现,硒纳米颗粒通过降低血浆葡萄糖水平帮助预防高血糖,并提高糖尿病大鼠的血浆和胰腺胰岛素水平,修复受损的胰腺组织。此外,硒纳米颗粒还降低氧化应激,并增强过氧化物酶谷胱甘肽的活性。
6
抗癌作用
证据一般
多项研究表明,癌症发病率与硒缺乏密切相关。硒有助于预防肿瘤、抑制肿瘤生长、限制细胞分裂,并逆转恶性表型。
▸ 硒诱导癌细胞凋亡
硒的抗癌效果是多种机制共同作用的结果。有机硒化合物作为调控因子,可以影响致癌基因的表达,诱导癌细胞程序性死亡,并左右细胞的免疫功能。硒通过促进细胞凋亡发挥重要的抗癌作用。甲基硒酸(MSeA)能下调Bcl-xL和Mcl-1,增加半胱天冬酶介导的凋亡。
注:在LNCaP人类前列腺癌细胞中,硒诱导p53 Ser-15磷酸化并促使凋亡。MSeA还诱导DU145细胞浸润伴随Akt和ERK1/2磷酸化降低,与细胞G1停滞及p27kip1和p21cip1表达增高相关。硒诱导细胞生长停滞与细胞周期蛋白D1降低及JNK激活相关。
▸ 减少肿瘤细胞侵袭和转移、刺激DNA损伤修复
硒还通过抑制基质金属蛋白酶(MMP)-2、MMP-9和尿激酶型纤溶酶原激活剂(uPA)减少肿瘤细胞的侵袭与转移,进而发挥其抗癌效果。
刺激DNA损伤修复也是硒的重要抗癌机制。硒蛋白如谷胱甘肽过氧化物酶在抗氧化和维持细胞还原环境中发挥关键作用,能通过增强血清蛋白生成加速DNA修复。SeM通过抗氧化活性增强p53,保护细胞免受DNA损伤。
注:然而,研究发现硒补充并未预防基底细胞癌,反而增加了鳞状细胞癌和非黑色素瘤皮肤癌的发病率。
总之,硒作为抗癌剂在结肠癌、皮肤癌、乳腺癌、肝癌、肺癌和直肠癌中的效果已被广泛记录,显示出其巨大的临床潜力。
7
心血管保护
证据一般
各种心血管疾病的病理基础,如冠心病和高血压,都是动脉粥样硬化。
▸ 硒具有抗动脉粥样硬化的作用
流行病学研究和临床观察表明,硒具有抗动脉粥样硬化的作用,补充硒可以显著减少动脉粥样硬化的形成。含硒的抗氧化酶在心肌组织中发挥作用,帮助清除有害物质,从而保护心肌细胞膜和线粒体等细胞器的正常功能。
硒对心血管疾病的影响机制
此外,研究还显示饮食中的硒含量与高血压呈负相关。
8
重金属解毒
证据一般
研究表明,硒能影响抗氧化性和螯合作用,从而抑制重金属毒性,如汞、镉、砷、铬、铊、铅和银。
金属离子是多种蛋白质所必需的,参与电子转移、氧气运输、催化等生物过程。然而,体内重金属的积累会引发肝脏和肾脏毒性、神经毒性、生殖毒性和免疫毒性等多种不良反应,导致严重的健康问题。氧化应激是重金属的主要毒性机制。
例如研究发现,汞处理红细胞中的H2O2和超氧化物阴离子随剂量增加而增加,汞诱导的活性氧(ROS)可导致细胞坏死和凋亡。
▸ 硒能够减轻重金属的生物毒性
硒通过血清蛋白参与抗氧化防御,主要针对GPX和Trx系统这两大氧化防御体系。硒补充通过维持硒酶活性,减少重金属诱导的活性氧产生、蛋白质氧化和脂质过氧化,保护细胞免受免疫抑制、细胞毒性和内源性凋亡。
此外,硒还能直接与重金属特别是汞、镉和砷相互作用,这些重金属通常与含硫基团高度亲和,可能导致蛋白质结构变形。然而,硒对重金属的亲和力更高,能够封存金属离子,从而降低其生物利用性。
9
其他生物功能
▸ 硒会影响尤其是男性的生殖健康
此外,硒与生殖健康密切相关,尤其在男性中,影响睾丸组织、精子胚细胞数量、精子形成、精子形态和。严重的硒缺乏可能导致男性不育。
▸ 预防骨关节病变
硒补充还能预防骨髓病变并促进修复,对卡斯钦-贝克病和关节炎等疾病具有预防和治疗效果。
小结
因此,硒及其化合物能够作用于人体的多个器官和组织,促进和提升其功能,同时展现出广泛的生物活性。从细胞层面到系统层面,硒在维持健康和防治疾病中发挥着重要的作用,表明其潜在的应用价值和重要性。
人体中的硒含量
▸ 健康人体的硒浓度
一名健康成人体内平均含有约10-20毫克的硒,血液中的正常硒浓度为80–140 ng/mL。尽管这数量相对较小,但在生理功能中却发挥着不可或缺的作用。
血液中硒浓度与人体健康

▸ 硒的人体分布
硒广泛分布于各组织和体液中,但在不同器官中的含量差异显著:
•肝脏:作为硒的主要储存器官之一,肝脏含硒量高,负责重要的代谢和解毒功能。
•肾脏:肾脏同样富含硒,帮助调节体内矿物质平衡和排除代谢废物。
•甲状腺:甲状腺中的硒浓度较高,参与甲状腺激素的合成与代谢。
•肌肉和心脏:硒在肌肉组织(尤其是心肌)中也具有较高浓度,对心血管健康至关重要。
•生殖系统:在睾丸和卵巢等生殖器官中,硒的存在有助于支持生殖功能,促进精子的生成和激素的合成。
硒的吸收、代谢和分布
硒在人体具有重要的生理功能,但其缺乏与过量都会对健康产生显著的负面影响。以下是基于相关文献和我们已有的知识,详细总结硒缺乏和过量对人体健康的影响。
硒缺乏的危害
⑴克山病和卡斯钦-贝克病
凯山病是一种伴有肺水肿的青少年心肌病,主要由硒的缺乏和柯萨奇B病毒变异株引起。该病首次在中国东北黑龙江省克山县被发现,随着时间推移,这些症状在中国东北至西南地区普遍存在,该地区土壤缺乏硒。
凯山病可能引发癌症、高血压、中风,还可能导致湿疹、银屑病、关节炎和白内障。补充硒可以减轻这些症状。维生素E缺乏被认为与凯山病的发生有关,因此建议同时补充维生素E。
卡斯钦-贝克病也是由硒缺乏引起,主要影响5至15岁的儿童,特别是生活在硒水平较低的地区。该病为慢性骨软骨病,主要分布于中国东北及西南部。
硒和碘被视为该病的主要营养缺乏。此外,卡斯钦-贝克病的其他原因包括真菌产生的三聚霉菌(如Alternaria和Fusarium sp.)污染饮食中的大麦,以及饮用水中的富尔维酸。
注:针对儿童卡斯钦-贝克病,有多种硒补充剂可供选择,如硒酸钠、硒酸钠与维生素E、硒酸钠与维生素C、硒盐及硒富集酵母,与安慰剂/无治疗相比,这些补充剂在治疗中十分有效。
⑵免疫功能受损
硒缺乏会导致免疫系统的功能下降,增加感染的风险。研究表明,硒的补充能够改善HIV感染者的免疫应答,降低结核病的发病率。
⑶心血管疾病
硒的缺乏与心脏疾病的发展有一定关联。低硒水平可能导致细胞内氧化应激增加,从而促进动脉粥样硬化等心血管疾病。
⑷甲状腺功能障碍
硒在甲状腺激素的合成中发挥重要作用,缺乏硒可能导致甲状腺功能减退,影响代谢和生长。
⑸神经系统受损
缺乏硒可能对神经系统功能产生负面影响,增加神经退行性疾病的风险,如阿尔茨海默病等。
⑹糖代谢紊乱
硒缺乏与糖尿病的发生之间存在一定关系。这种关系主要是通过影响胰岛素的功能以及调节炎症反应来影响糖代谢过程。
⑺其他症状
硒缺乏还可能引起其他症状,包括:
•肌肉无力;
•碘缺乏加重;
•贫血;
•类风湿关节炎;
•生育能力下降;
•多种癌症,包括肺癌、前列腺癌、乳腺癌、食管癌和胃癌。
导致硒含量过低的原因
▸ 导致硒含量低的主要原因:
•饮食中硒含量不足;
•炎症性肠病(溃疡性结肠炎和克罗恩病);
•肠外营养,适用于通过静脉接受营养的病患者;
•肾脏疾病;
•阿尔茨海默病;
•格雷夫斯病(甲状腺功能亢进)或甲状腺功能减退(甲状腺功能减退);
•针对健康状况(如苯酮尿症,一种罕见的先天缺陷,会导致体内苯丙氨酸氨基酸堆积)的特殊饮食。
▸ 以下药物也可能降低硒水平:
•皮质类固醇,用于减轻炎症的药物。
•避孕药;
•氯氮平,一种用于治疗精神分裂症的抗精神病药物。
硒过量的危害
虽然硒缺乏会带来许多危害,适量摄入对健康有益,但过犹不及,硒过量也会产生一些不利影响。
⑴硒中毒
硒的过量摄入可能导致硒中毒,症状包括:
•恶心;
•呕吐;
•腹泻;
•胃痛;
•皮疹(皮炎);
•低血压;
•心跳加速
硒中毒还可能导致蒜味的口气、皮肤病、脱发、指甲脆弱等症状。严重时,可导致呼吸困难、心肌梗死和肾功能衰竭。
⑵代谢紊乱
过量的硒摄入可能干扰体内其他微量元素(如铅、镉和砷)的代谢,降低其排出,导致多种健康问题。
⑶糖尿病风险上升
糖尿病与硒之间的关系并非那么简单,研究发现T2DM与硒水平之间并不是简单的线性关系,较高和较低的硒水平均是T2DM的潜在风险因素。
⑷男性甲状腺激素(T3)水平下降
一项研究中,过量补充硒(每天300微克)使男性甲状腺激素(T3)降低。然而,更大规模的研究无法复制这些结果。
⑸血液脂肪水平增加
高血硒水平可能与总胆固醇、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、ApoB和A1(A-A1)升高相关。
⑹健康负担
大规模的随机对照试验表明,长期硒过量补充与死亡率相关,显示出U形关系,即过高或过低的硒水平均与死亡率增加相关。
小结
总之,硒在人体健康中扮演着双刃剑的角色。适量的硒摄入对免疫、心血管和甲状腺健康等多方面有积极作用,而不足或过量则可能导致严重的健康问题。
建议维持适宜的硒摄入水平,以促进身体健康并预防潜在的疾病风险。在某些环境(如土壤缺硒或污染)中,适当评估和监测硒的摄入是非常重要的。
▸ 自然界中硒主要分为元素硒、无机硒和有机硒
自然界中的硒主要存在三种形式(元素硒、无机硒和有机硒)。
元素硒对生物体来说难以吸收和利用。无机硒以硒化物(Se2+)、硒酸盐(Se4+或Se6+)的形式存在,具有较低的生物利用度。
生物体中的有机硒主要分为两类:一类是含硒氨基酸,如硒半胱氨酸(SeCys)和硒甲硫氨酸(SeMet);另一类是含硒蛋白,具有与代谢相关的生理活性。
▸ 硒的膳食来源
▸ 不同地区硒含量差异显著
人体中的硒主要来源于饮食,而食物中的硒则来自土壤。土壤中硒的存在和浓度主要取决于母质的成分。
土壤中硒的分布极不均匀,不同国家甚至同一国家不同地区内的土壤硒含量差异显著。根据世界卫生组织发布的数据,目前全球有40多个国家和地区,涉及5亿至10亿人口,处于不同硒缺乏状态。
全球及中国土壤中硒含量的分布图
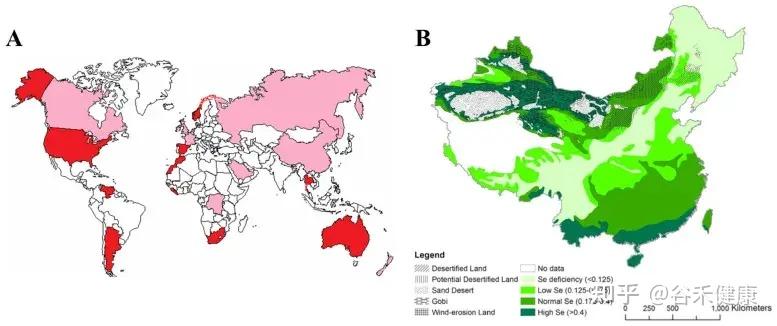
在世界地图上,红色表示硒充足,粉色表示硒缺乏,白色表示无硒含量数据;中国地图上,绿色越深表示硒越充足。
▸ 硒的浓度因食物而异
一般来说,硒的浓度因食物而异,动物性食品>蔬菜>谷物>水果。谷物是硒的主要来源,但其硒含量相对较低,范围在0.01至0.55微克/克之间。动物性食品中的硒含量介于0.08至0.7 微克/克之间,蔬菜和水果中低于0.1微克/克。
富含硒的食物及其成分比例
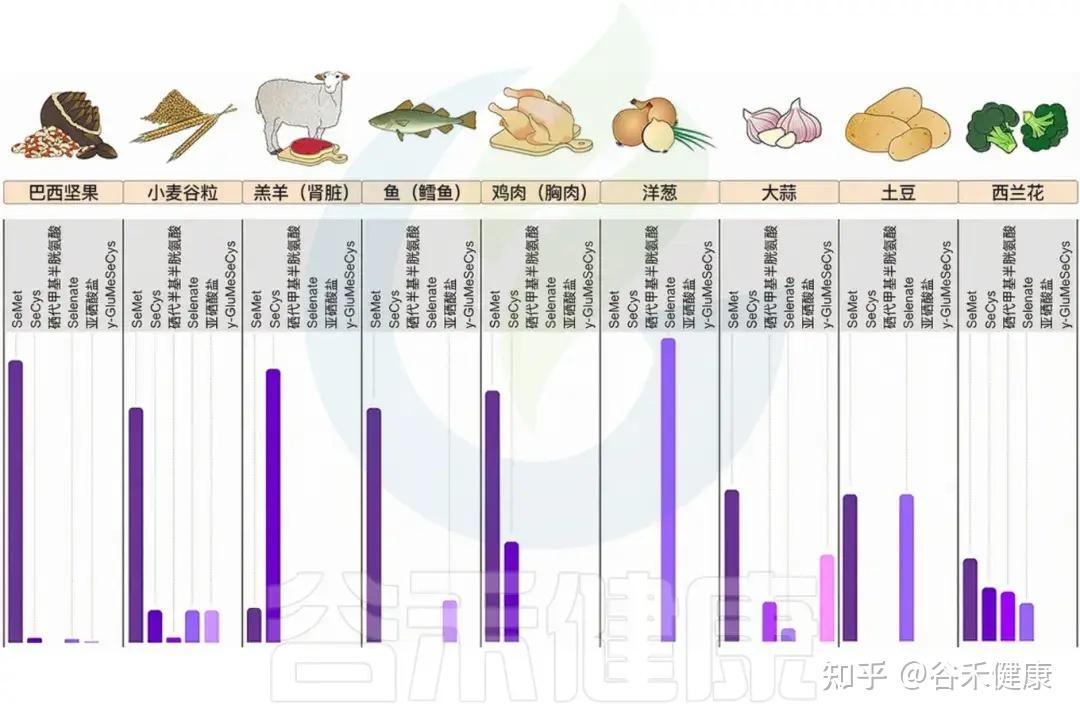
巴西坚果、小麦胚芽、燕麦等谷物、牛肉、鸡肉、贝类、鱼类、海鲜、牛奶和香菇和纽扣蘑菇是硒的优质来源。
巴西栗,又称巴西坚果,是硒含量最高的来源之一。一些草本植物如双黄耆和十字花科植物(西兰花)中也存在较高水平的硒。
▸ 不同形式的硒生物利用度不同
硒的生物利用度主要取决于其化学形式。一般来说,有机形式的硒吸收更快,硒氨基酸的生物利用度通常高于无机硒,常用于血清蛋白的生物合成。并且虽然植物中的硒浓度较低,但其比动物食品中的硒更具生物利用度。
硒半胱氨酸(Sec)是另一种主要来源于动物食品的有机硒化合物。无机硒主要通过硫同化途径在植物体内积累,但也存在于水中。人类摄入的硒酸和硒矿最终会转化为SeMet。
▸ 营养成分比例也会影响硒的生物利用度
此外,饮食中的蛋白质、脂肪和重金属含量也会影响硒的生物利用度。
▸ 不同人群的硒需求
适度摄入硒和均衡饮食对于维持健康至关重要。人体对硒的需求也因不同年龄阶段而异。婴幼儿、儿童、成人和老年人由于生理和代谢特性的不同,对硒的需求也各不相同。
▸ 中老年人和孕妇的硒需求量更高
例如,儿童和青少年在生长发育过程中需要增加硒的摄入,以支持快速的身体和大脑发育。成年人需要足够的硒来维持免疫功能和抗氧化防御,而老年人则因消化和吸收能力下降,可能需要调整硒的摄入。世界卫生组织建议成年人每天硒摄入量为55微克,耐受上限为400微克/天。
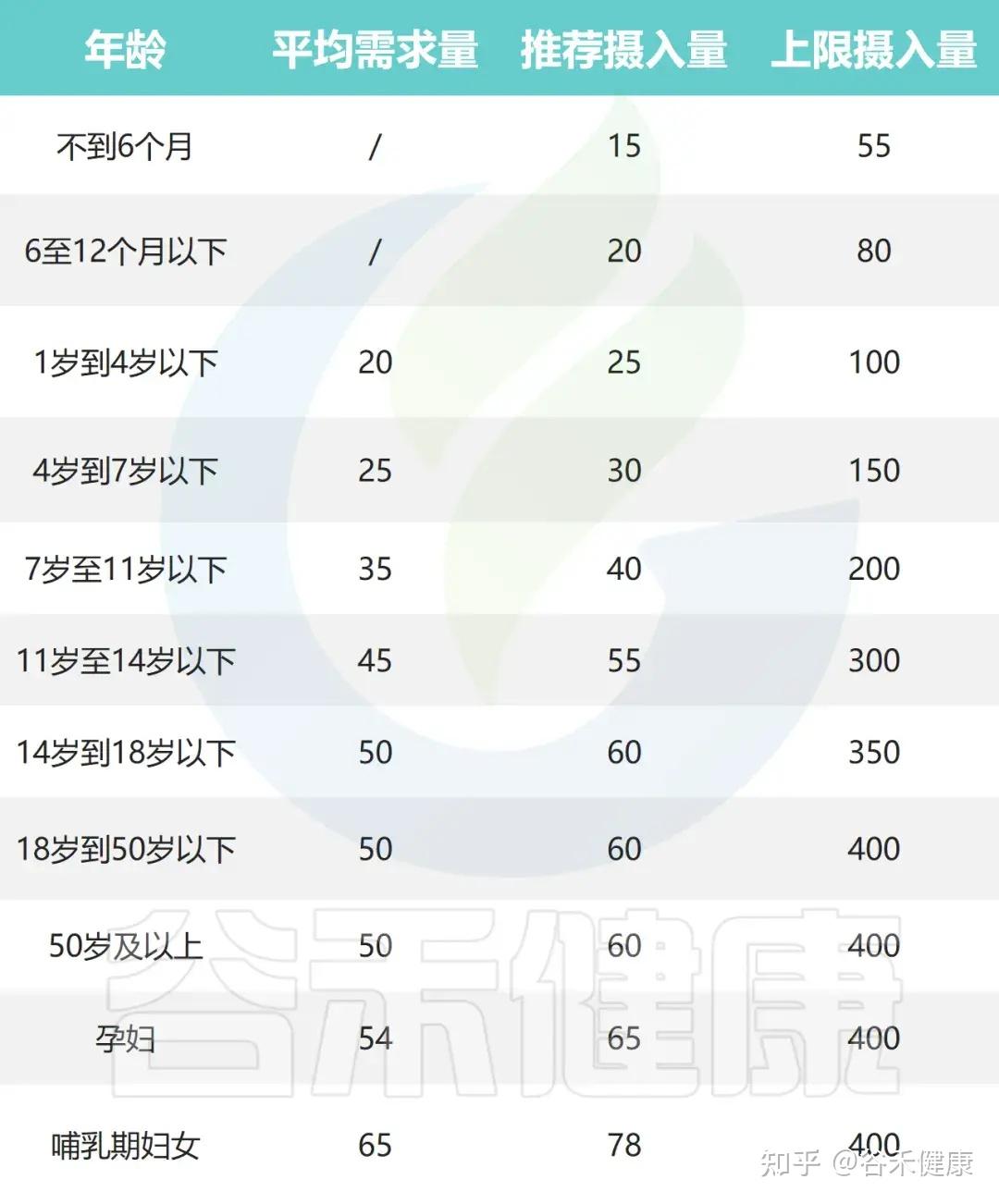
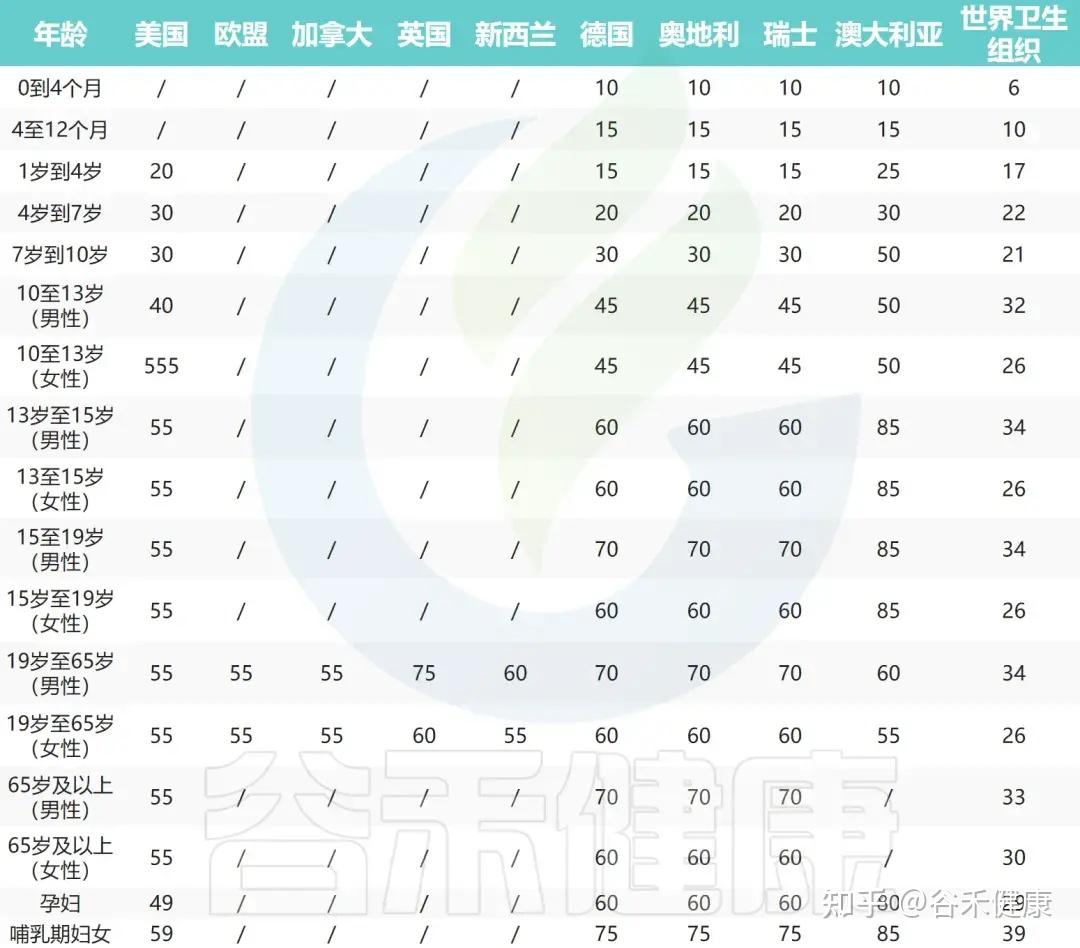
中国营养学会对不同人群推荐的硒的估计平均需求(EAR)、推荐营养摄入量(RNI)和最高耐受摄入量(UL)见下表;其他国家和世界卫生组织(WHO)推荐的每日硒摄入量也展示在下面第二个表中。
中国营养学会推荐的硒摄入量
其他国家和世卫组织推荐的每日硒摄入量
▸ 硒的吸收与代谢
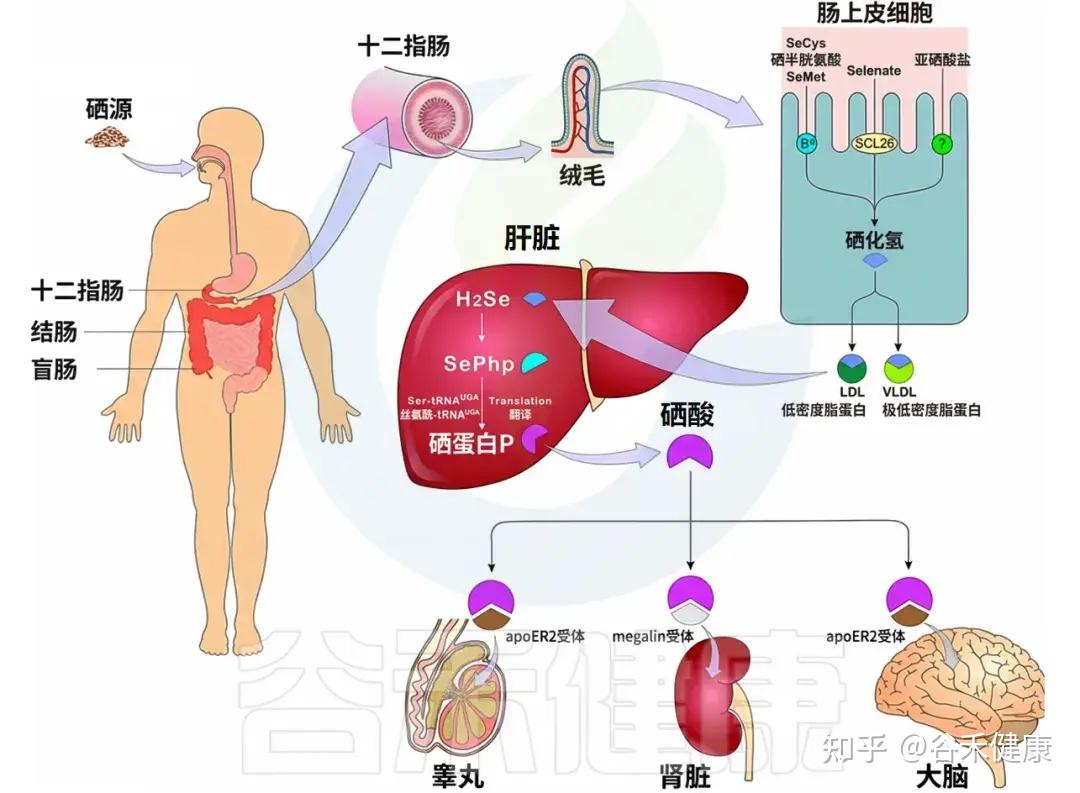
膳食硒包括无机硒(如硒酸盐和硒酸盐)和有机硒(如硒甲硫氨酸和硒半胱氨酸),不同形式的硒具有不同的吸收机制。无机硒:硒酸盐通过钠/硒酸盐共转运物质吸收,而硒石则通过简单扩散的方式吸收。有机硒:硒化合物及含硒氨基酸通过依赖钠的氨基酸转运机制被肠道吸收。总体而言,人体吸收有机硒的效率高于无机硒。
▸ 硒的吸收发生在十二指肠、盲肠和结肠
硒的吸收发生在十二指肠、盲肠和结肠。在肠细胞中,SeMet和SeCys通过主动运输被吸收,而硒酸则通过被动运输(SLC26基因家族的阴离子改变因子)吸收。吸收后,所有形式的硒通过肠道细胞内的反应转化为H2Se并通过血液结合的LDL(主要是VLDL)运输。
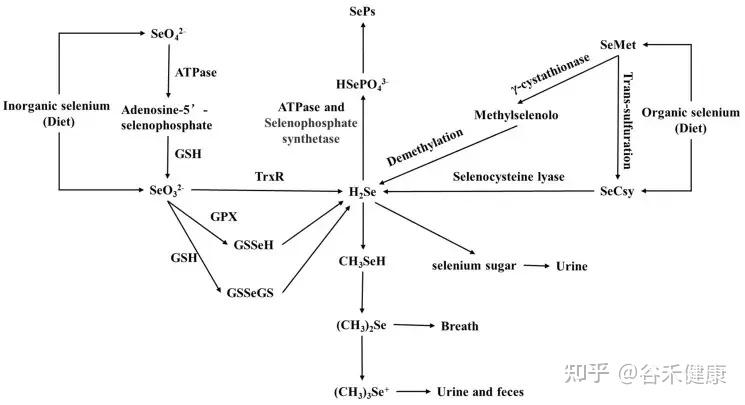
▸ 硒主要在肝脏中进行代谢,并运输到大脑、肾脏等器官
肝脏是硒代谢的关键器官,大多数含硒蛋白的合成都在这里进行。在肝脏中,H2Se被转化为SePhp,并以SeCys的形式掺入血清蛋白中。通过受体介导的胞吞作用——apoE2和巨型磷酸,主要通过SELENOP形式运输到睾丸、肾脏和大脑等其他组织。
硒的代谢途径
▸ 未被吸收的硒被掺入胆汁、肠道分泌物中
硒的主要排泄形式是通过尿液,但在过量摄入的情况下,也可能通过呼吸道排泄。当硒以三甲基硒(CH₃)₃Se的形式从尿液中排出时,肺部会以挥发性二甲基硒(CH₃)₂Se排出。在适度摄入的情况下,肾脏主要去除的单甲基化化合物是一种硒酸,即1β-甲基硒N-乙酰-D-半乳糖胺。未被吸收的硒还会掺入胆汁、胰腺和肠道分泌物中,最终通过粪便排出。
硒与肠道微生物群之间存在复杂的相互作用,这种关系在维持宿主健康方面发挥着重要作用。肠道微生物通过调节肠道细胞的成熟与增殖,促进食物消化,防止有害细菌,并调节免疫反应,从而对人体生理产生重要影响。膳食成分,尤其是微量元素,能够影响胃肠道内微生物的定植和结构。硒的含量会影响微生物群落的多样性,并对不同微生物群类别产生多种影响。硒在许多微生物群中具有独特的作用。
同时,微生物组编码超过数百万个基因,执行多种宿主无法实现的代谢功能,包括合成某些维生素和生物活性化合物、合成必需和非必需氨基酸、代谢不可消化的碳水化合物,以及通过肠脑轴传递神经、激素和免疫信号。此外,它还参与营养物质的吸收,并作为病原体的上皮屏障。
过去十年间,一些研究评估了硒在约600个细菌和古细菌基因组中的应用。富含硒蛋白的生物体主要是δ-变形菌(Deltaproteobacteria)和梭菌(Clostridia),尤其是Syntrophobacter fumarroxidans,其原核硒蛋白瘤数量最高。
让我们一起来深入了解硒与肠道微生物群之间的复杂相互作用。
▸ 硒作为肠道菌群调节剂
饮食中的硒会影响宿主的硒状态和硒蛋白的表达。同时,肠道微生物群能够利用摄入的硒来合成自身的硒蛋白。硒的摄入影响微生物群的组成和定殖,可能干扰微生物多样性并产生独特影响。
▸ 硒的摄入影响部分菌群合成硒蛋白
约四分之一的细菌具有编码硒蛋白的基因,其中包括大肠杆菌、梭菌和肠杆菌类,它们能够定殖于人类和动物的胃肠道。硒半胱氨酸合酶(SelA)是一种吡磷酸依赖酶(PLP),它催化细菌中由UGA解码的tRNASec(SelC)生成硒半胱氨酸-tRNA,该tRNASec由硒磷酸合成酶(SelD)生成。
除了SelB外,SelA、SelC和SelD作为特异性翻译因子,也是细菌Sec解码的组成部分,允许Sec纳入特定的UGA密码子,并插入Sec元素序列。
硒蛋白通过提高造血PGD2合酶(HPGDS)的表达,影响肠道微生物群,HPGDS催化免疫细胞(如巨噬细胞和T细胞)中PGD2的合成。PGD2经过自发脱水和异构化生成前列腺素J2(Δ13-PGJ2)和Δ12-PGJ2,其中Δ12-PGJ1可转化为15-脱氧-Δ12,14-前列腺素J2(15d-PGJ2),从而缓解炎症。作为转录因子过氧化物酶体增殖物激活受体γ(PPARγ)的配体,PGD2代谢物可结合HPGDS启动子中的PPAR反应元件,进而上调其表达,从而形成前馈回路。
▸ 细菌酶的关键辅因子,影响代谢功能
锰、锌、硒和铁是细菌酶的关键辅因子,负责DNA复制和转录、抗氧化作用以及细胞呼吸。铁和锌是几乎所有生物体在代谢和氧化还原过程中使用的金属。某些物种需要硒来维持正常代谢功能,例如大肠杆菌的结构中有三种血清蛋白。
▸ 提高具有潜在保护作用的有益菌水平
有研究比较了不同剂量的硒膳食补充剂(缺乏、充足和过量)对小鼠肠道微生物群的影响。与缺乏硒饮食相比,适量的硒补充显著减少了Dorea属的丰度。
注:Dorea属是肠道微生物群中常见的一种,能够产生氢气和二氧化碳,并在多发性硬化症、炎症性肠病患者,甚至结直肠癌、自闭症谱系障碍以及肥胖人群中高丰度富集。
同时,提高了对结肠炎和肠道屏障功能障碍具有潜在保护作用的微生物水平(如AKK菌和Turicibacter)。硒补充还显著增加了肠道微生物的多样性和丰富度,有益菌的相对丰度随之提升,特别是Lactobacillus、Ruminococcaceae和Christensenellaceae的丰度显著增加。
此外,硒的补充能够促进短链脂肪酸的生成,特别是丁酸和丙酸等关键脂肪酸的合成。这些短链脂肪酸在增强肠道的抗氧化能力、减少炎症反应以及改善肠道屏障功能方面发挥着重要作用。
▸ 硒能够特异性抵抗病原菌如大肠杆菌
硒在复杂的肠道菌群环境中对病原菌(如大肠杆菌)具有特定的抗菌活性,同时不影响其他微生物群落的丰度。
硒的施用部分恢复了肠道微生物群,并促进了暴露于甲基汞的大鼠的甲基汞分解和排泄。约五分之一的肠道微生物能够表达血清蛋白,而硒的可用性也影响其表达,血清蛋白对细菌和哺乳动物宿主的多种活性至关重要。膳食硒会影响肠道微生物群的组成和胃肠道定植,从而影响宿主的硒状态和血清蛋白表达。
▸ 对肠道微生物群的影响取决于硒摄入量
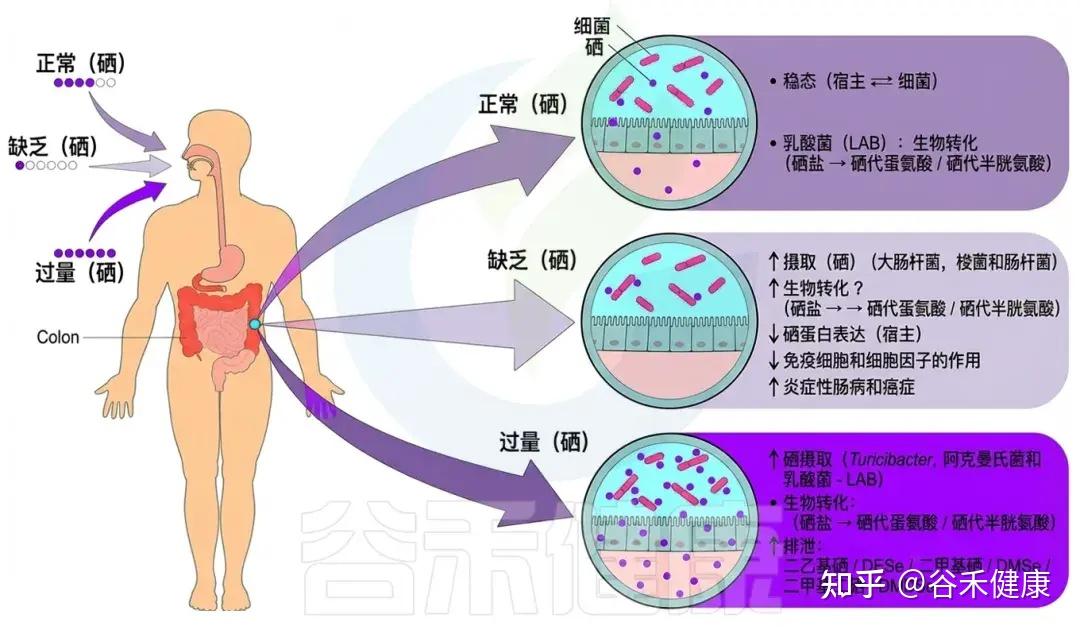
肠道微生物群的调节受硒状态和其衍生物的生物转化影响。在硒摄入充足的情况下,肠道与宿主细菌之间的有益关系促进了硒化合物(如硒盐转化为SeMet和SeCys)的生物转化,维持稳态。
硒缺乏会导致大肠杆菌、梭菌和肠杆菌等细菌对硒的摄取增加,促进硒化合物的转化,结果是宿主的血清蛋白表达减少、硒免疫细胞激活减少、促炎细胞因子增加,以及炎症性肠病和癌症风险上升。
另一方面,过量摄入硒会增加Turicibacter、Akk菌和乳酸菌的吸收,促使硒酸盐的生物转化,并增加挥发性Se化合物的排放。
肠道微生物群的调节取决于硒状态
▸ 微生物群作为影响硒状态的环境
研究表明,肠道微生物群能够调节宿主对硒的摄取和生物转化,同时也可能影响硒的生物利用度。
▸ 肠道菌群能够代谢多种无机和有机硒
一项研究发现,肠道微生物群能够代谢多种无机和有机硒化合物,并将其纳入细菌蛋白中。含有SeMet的蛋白质作为宿主动物的硒储存,累积在肠道微生物群中。
此外,主要的尿素代谢物SeSug1被转化为可供营养利用的硒化合物。最后,部分生物硒化合物如SeCN、MeSeCys和SeSug1在肠道微生物群中提高了生物利用度。
▸ 过量细菌摄取硒可能导致宿主硒蛋白缺乏
尽管宿主与肠道微生物群通过共生关系相互受益,但在微量营养素供应有限时,它们可能成为竞争对手。
同时,肠道微生物群偏向于硒化合物的生物转化,肠道细菌对硒的过量摄取会影响宿主的硒蛋白表达,导致在硒受限条件下硒蛋白水平降低两到三倍。目前,尚未确认这种效应对人类和动物的不利后果。鉴于益生菌的显著增殖,应研究这些生物体内的硒代谢,以评估是否需要推荐更高的硒摄入。
▸ 部分细菌会根据硒来影响致病性
一些细菌物种能够通过硒影响细菌致病机制。在这种细菌感染中,宿主的免疫反应、微生物病原体、微生物群和宿主的硒状态之间存在复杂的相互作用。具有硒依赖酶的细菌能够在哺乳动物肠道的厌氧条件下存活,利用宿主的硒来增强其毒力和致病性。
硒缺乏会降低个体的免疫功能,使不需要硒的细菌得以存活,进而引发感染和疾病。同时,宿主的微生物群也可能因硒的存在而有所不同,硒可以通过竞争或产生对致病细菌有害的代谢物来防止依赖硒的细菌感染。
★ 硒、微生物群与疾病间存在重要联系
硒蛋白和血清蛋白在某些疾病的发病机制中可能发挥重要作用,特别是在炎症性肠病(IBD)、癌症、甲状腺功能障碍和神经发生性疾病中。硒状态可能影响核因子κB(NF-κB)转录因子和过氧化物酶体增殖物激活受体(PPARs)的表达,这些因子参与免疫细胞激活,导致不同阶段的炎症。
▸ 硒、微生物群与炎症性肠病
炎症性肠病(IBD)包括克罗恩病和溃疡性结肠炎,其特征是肠道菌群失调,导致肠道活动和分泌发生变化、内脏过敏(痛觉过敏)以及肠脑通讯功能衰竭。约30.9%的肠炎患者存在硒缺乏,这表明硒在改善IBD中的重要性,主要归因于其在降低炎症反应中的作用。
▸ 缺少硒会加剧氧化应激
核因子红细胞2相关因子2(Nrf2)似乎也参与上皮细胞的氧化还原稳态。在IBD动物模型中,缺乏Nrf2会增加炎症性细胞因子(如TNFα和IL-6)和COX-2的表达。而在足够的硒浓度下,Nrf2可促进TXNRD和GPX的表达。此外,研究表明血浆硒浓度与Nrf2相关基因表达呈正相关。缺乏Nrf2还会增强NF-κB活性,从而加剧氧化应激。
在IBD患者中,具有促炎活性的细菌,如大肠杆菌和梭杆菌会增加,而具有抗炎活性的细菌如Faecalibacterium prausnitzii、Clostridide leptum、prausnitzii和双歧杆菌会减少。其它细菌门与IBD患者摄入硒有关。克罗恩病和溃疡性结肠炎患者的膳食硒分别与厚壁菌门的存在呈正相关,与疣状菌门呈负相关。
▸ 补充硒或与益生菌联合使用可以改善肠炎
研究了用硒纳米颗粒(ULP-SeNPs)对DSS诱导的小鼠急性结肠炎的保护作用,发现主要益处包括减少结肠CD68、调节IL-6和TNF-α、巨噬细胞失活,以及抑制NF-κB的核易位。
使用SeCys和硒半胱氨酸治疗的动物显示活性氧和腺二铝(MDA)浓度降低,肠道中SOD和GPX活性增加,表明其对肠道黏膜具有保护作用。此外,SeCys治疗组的IL-1、MCP、IL-6和TNF-α水平显著下降。
报告指出,与仅补充L.casei的动物相比,使用含硒纳米颗粒的Lactobacillus casei ATCC 393能更好地保护免受肠道屏障功能障碍和大肠杆菌(Escherichia coli)K88肠道毒素感染相关的氧化应激,表明L.casei 393-SeNPs在维持肠道上皮完整性方面的能力。
▸ 硒、微生物群与癌症
研究显示,饮食中的硒不仅影响肠道微生物群的组成,还影响其胃肠道的定植,从而影响宿主的硒状态和血清蛋白表达。肠道微生物群对硒蛋白及其他与氧化还原稳态相关的分子的影响,可能调控氧化应激、凋亡、炎症和免疫反应,从而直接影响癌症风险。
▸ 硒缺乏的状态下会导致炎症细胞因子水平升高
Dorea属的细菌是肠道微生物群中最常见的物种之一,在缺乏硒的情况下会增加,并与肠易激综合征、癌症、多发性硬化症和非酒精性肝病有关。硒缺乏和血清蛋白表达不足会通过较高水平的炎症性细胞因子,尤其是在结肠水平,损害先天和适应性免疫反应。
肠道微生物群对血清蛋白及其他与氧化还原稳态相关分子的影响,可能影响氧化应激、凋亡、炎症和免疫反应的调控,而这些反应似乎直接影响癌症风险和发展。
▸ 富含有机硒的益生菌能有效消除结肠癌中的致病菌
另一方面,富含有机硒的益生菌可能成为消除炎症性肠病和结肠癌中致病细菌的有效替代方案。研究显示,口服富含硒的酿酒酵母可减少小鼠小肠中嗜酸性粒细胞过氧化物酶活性、组织病理损伤和氧化应激。
因此,强烈建议开展涉及硒富集以及营养保健品中血清蛋白和硒代谢物生物功能及生物可及性/生物利用度/生物活性的临床研究,以验证前期研究结果。
▸ 硒、微生物群与甲状腺功能障碍
甲状腺是体内硒含量最高的组织之一,多种参与甲状腺代谢的蛋白质中含有硒,包括GPX(I型和II型)、DIOs和TXNRD。结肠常驻微生物能代谢硒,微生物通过调节碘的吸收、降解和肠肝循环影响甲状腺水平。此外,一些矿物质在宿主与微生物群的相互作用中,尤其是硒、铁和锌,发挥重要作用。
▸ 菌群稳态对甲状腺功能和甲状腺激素的平衡至关重要
除了促进免疫系统健康,健康的肠道微生物群还积极影响甲状腺功能。虽然自身免疫性甲状腺疾病(AITDs)中的菌群失调已被发现,但甲状腺癌患者中也存在致癌和炎症细菌株数量增加的现象。
此外,肠道微生物群的组成对甲状腺所需的微量营养素,如硒和锌的可用性有重大影响,这些矿物质是将甲状腺素(T4)转化为三碘甲状腺原氨酸(T3)的脱碘反应的辅因子。缺乏这些矿物质可能源于任何阶段的限制性或不均衡饮食,导致甲状腺激素产生减少。
▸微生物群对硒的摄取影响甲状腺素的可用性
微生物群影响硒的摄取,可能改变L-甲状腺素的可用性以及丙硫尿嘧啶(PTU)的毒性。在正常硒水平下,甲氧还蛋白还原酶系统和SH-Px能保护甲状腺细胞免受过氧化物活性影响,而硒缺乏时,H2O2的凋亡反应则会增强。例如,乳杆菌(Lactobacillus)水平的降低可能干扰碘甲状腺原氨酸脱碘酶 (DIOs)的形成,导致甲状腺功能障碍。
一些乳杆菌物种能够在细胞内保持硒酸钠,如SeCys和SeMet,从而提供更具生物利用度的硒形式,而无机形式的硒通常被人类细胞吸收较差。因此,甲状腺疾病患者中乳杆菌的减少可能降低硒的生物利用度,并降低其在激活甲状腺激素转化中的作用。此外,硒还能防止其他激素合成过程中的氧化损伤。
▸ 乳杆菌有助于提高硒在人体的浓度
一项队列研究证实了肠道微生物群、甲状腺癌与甲状腺结节之间的关系。研究中,甲状腺癌组和甲状腺结节组的丁酸单胞菌属(Butyricimonas)和乳杆菌相对丰度显著降低(p < 0.001)。作者指出,乳杆菌是肠道中重要的属,能够提高包括硒在内的多种金属在人体细胞中的浓度。
在人体和大鼠研究中,肠道微生物群的多样性和结构可能在调节药物控制的甲状腺代谢中发挥多重作用。尽管已有研究证实甲状腺疾病与肠道微生物的关系,其他研究表明小肠细菌过度生长可能损害甲状腺功能。然而,硒缺乏症、甲状腺与肠道微生物群的致病作用尚未彻底确立,因此强烈建议进行更多临床研究。
▸ 硒、微生物群与心血管疾病
肠道微生物群的代谢潜力被确认是心血管疾病发展的一个促成因素。肠道微生物群产生脂多糖(LPS)和肽聚糖等信号分子,通常通过模式识别受体(PRR)与宿主的黏膜表面细胞相互作用。
▸ 甘氨酸甜菜碱还原酶的活性依赖于硒
此外,它们还通过三甲胺(TMA)/三甲胺-N-氧化物(TMAO)和短链脂肪酸等途径与宿主相互作用。其中一些分子已被证实能与胃饥饿素、瘦素、胰高血糖素样肽1(GLP-1)和肽YY(PYY)相互作用,并刺激副交感神经系统,从而影响心血管疾病相关的代谢过程。
TMAO因其可能促进动脉粥样硬化、心血管代谢疾病、动脉高血压、缺血性中风、心房颤动、心力衰竭和急性心肌梗死而备受关注。肠道微生物群代谢磷脂酰胆碱和L-肉碱,产生三甲胺(TMA),随后由宿主肝酶进一步转化为TMAO。多种酶参与将膳食成分转化为TMA的过程。其中,甘氨酸甜菜碱还原酶(GrdH)是一种需要硒的酶,负责甘氨酸甜菜碱生成的TMA。
▸ 硒、微生物群与血糖失调
一项研究发现,喂养高脂饮食的小鼠血浆中脂多糖(LPS)浓度较高。脂多糖是革兰氏阴性细菌的易位标志物,与胰岛素抵抗、肥胖和糖尿病密切相关。在此背景下,双歧杆菌的存在与肠道中较低的LPS浓度相关,从而降低代谢疾病的发生率。此外,双歧杆菌还降低了2型糖尿病(DM2)患者的肠道通透性。
▸ 双歧杆菌与硒联合使用改善葡萄糖耐受性
双歧杆菌与硒联合使用时对糖尿病的作用更为显著。富含硒酸钠的双歧杆菌(B.longum DD98,Se-B)能改善糖尿病小鼠的口服葡萄糖耐受性,提高胰岛素敏感性并保护胰腺β细胞。
这些效应呈剂量依赖性,表明适当剂量对B.longum DD98和Se-B的疗效至关重要。还评估了在糖尿病C57BL/6小鼠中硒与微生物联合补充的效果,报告称使用富含硒的提取物可缓解因氧化应激引发的肝损伤。
▸ 硒有助于提高丁酸盐丰度来改善胰岛素抵抗
预防和治疗胰岛素抵抗的其他机制与短链脂肪酸(SCFAs)产生相关,特别是丁酸盐。在2型糖尿病鼠中增加丁酸盐浓度,辅以益生菌,可以降低糖化血红蛋白(HbA1c)水平,改善葡萄糖耐受性和胰岛素抵抗。
此外,施用硒纳米颗粒(0.9mg/kg)可增加丁酸盐及益生细菌如乳杆菌和粪杆菌的含量。口服B.longum DD98和Se-B后,在小鼠粪便中发现高浓度的丁酸、醋酸和异丁酸。
丁酸盐对于胰岛素的积极作用似乎与GLP-1水平升高有关,GLP-1进一步降低2型糖尿病患者的血糖。研究显示,益生菌VSL #3能预防和治疗小鼠的肥胖与糖尿病,机制涉及益生菌-肠道菌群-丁酸-GLP-1轴,促进代谢效率。因补充B.longum DD98和Se-B也促进GLP-1分泌并保护β细胞,因此有学者推测硒在该轴上可能作为调节糖尿病有害影响的因子。
▸ 硒、微生物群与神经系统疾病
随着研究发现某些肠道细菌能产生类激素和单胺类神经递质,微生物群-肠道-大脑轴的机制逐渐明晰。这种双向互动使大脑、胃肠功能与免疫反应之间可以相互影响。
▸ 硒具有一定的神经保护作用,配合益生菌使用效果更佳
神经退行性疾病的特征是活性氧(ROS)的产生增加,血脑屏障功能下降。由于硒的抗氧化特性,一些硒蛋白具有神经保护作用。例如,硫氧还蛋白还原酶(TXNRD)维持氧化还原平衡,保护多巴胺能细胞,这些细胞在帕金森病的病理生理中易受氧化应激影响。
有研究显示,与单独施用酿酒酵母(Saccharomyces cerevisiae)相比,补充富硒酵母(Selemax)可降低自身免疫性脑脊髓炎(EAE)发病率,增加CD103⁺树突状细胞数量,并减轻肠道炎症。
此外,富硒酵母通过促进中枢神经系统中tau蛋白表达发挥神经保护作用。Tau是维持神经元微管及MAPs(MAP1、MAP2)稳定性的关键蛋白。在阿尔茨海默病(AD)三重转基因小鼠模型中,连续3个月补充富硒酵母显著改善了空间学习、记忆和神经活动。
在一项人类研究中,含乳杆菌(Lactobacillus)、两歧双歧杆菌(Bifidobacterium bifidum)和长双歧杆菌(Bifidobacterium longum)(各2×109 UFC)及硒协同补充(200微克/天,硒酸钠)在阿尔茨海默病患者中改善了认知功能和代谢特征。
了解并判断自身硒含量是否处于健康范围,对于维持机体平衡与疾病预防非常重要。硒含量取决于摄入量、保留量和代谢情况。因此,硒含量可以通过摄入、保留/排泄和浓度等生物标志物以及功能性生物标志物在三个层面进行评估。
硒的生物标志物
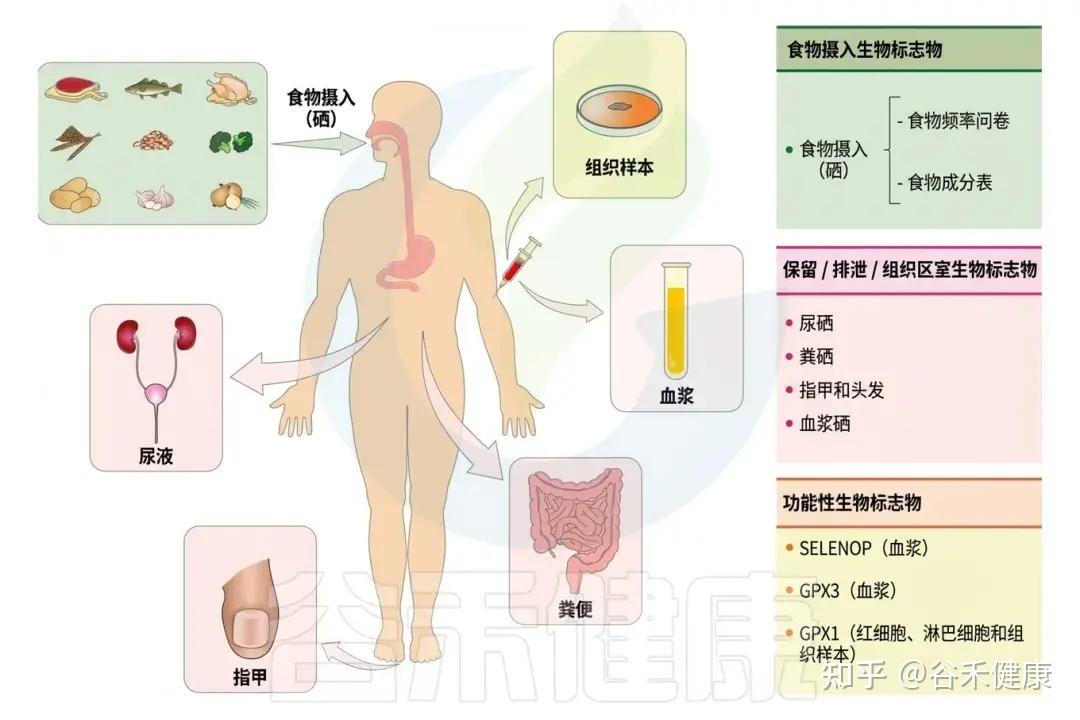
摄入评估
硒摄入量可通过食物摄入评估方法,如食物频率问卷进行估算,食物中的硒含量则依据食物成分表计算。
▸ 通过膳食摄入评估硒不够精确
由于食物成分表的精确度有限,加之土壤硒含量差异较大,评估饮食中硒的实际摄入仍具挑战。此外,饮食中的硒还会影响肠道微生物定植,从而调节宿主硒状态及硒蛋白的表达。
体内硒的评估
体内硒含量可通过摄入量与尿液、粪便中排泄量之差评估,这需连续数天收集排泄物。另一种方法是测定尿液中硒与肌酐浓度的比值,以减少排泄变异带来的误差。肾脏是吸收后硒的主要排出途径。遗传、环境、体型、年龄及性别等因素均会影响硒的保留与排泄。
▸ 尿液硒有助于成为评估职业暴露的敏感指标
尿液中硒浓度的测量被认为是群体研究中硒状态的潜在可行生物标志物,并且硒摄入增加会导致尿液中硒排泄迅速上升。因此,尿液硒可能是评估短期职业性硒暴露的敏感指标,但其特异性与代谢动力学仍有待深入研究。
此外,尿液中硒的浓度可用于识别硒状态的区域差异,可能反映土壤类型不同食物中硒含量的差异。
▸ 指甲和头发中的硒可反映长期水平
指甲中硒浓度被视为评估硒状态的高级生物标志物,可反映长达一年的长期暴露,而血液指标仅代表短期状态。趾甲因生长缓慢、采集方便、受外部污染影响小,被广泛用于大型流行病学研究。
为提高其实用性,样本采集、质量控制和分析方法的标准化至关重要。指甲中硒与血清蛋白P(SELENOP)及有机硒形式(尤其是SeCys)呈正相关,而与无机硒(如亚硒酸和硒酸)呈负相关,这可能与富含半胱氨酸的指甲蛋白易与硒结合有关。
头发硒常用于长期监测硒状态,具有成本低、样本易储存等优点。头发和指甲中的硒主要为排泄形式,更适用于饮食模式相对稳定的人群研究。
▸ 血浆硒是反映硒浓度较准确的标志物
由于硒在血浆中较为稳定,血浆硒浓度被认为是评估人体硒状态的理想生物标志物。一项系统综述建议在成人补充研究中采用该指标。血浆硒测定能有效反映高基线个体补充后摄入量的变化。此外,红细胞和全血硒浓度也被认为是反映长期硒状态的有用指标。
硒功能的生物标志物
硒功能的生物标志物包括血清蛋白P(SELENOP),其占血浆中硒的20–70%;谷胱甘肽过氧化物酶3(GPX3)占血浆中硒的10%至25%,以及谷胱甘肽过氧化物酶(GPX1),可在红细胞、淋巴细胞、口腔细胞和组织活检样本上检出。
▸ 血清蛋白P是评估低硒摄入人群的重要标志物
血清蛋白P(SELENOP)被认为是硒摄入量较低人群中硒状态的有用生物标志物,但在补充前已高硒水平的人群中不适用。SELENOP已被证明是可靠且敏感的硒状态生物标志物,能够提供剂量反应,用于估算达到血浆中硒水平所需的硒摄入量。
谷胱甘肽过氧化物酶(GPX)是细胞抗氧化防御系统中的关键硒蛋白。推荐的硒摄入量基于维持血浆GPX3最佳活性的血清蛋白层级结构计算,同时考虑达到生理正常硒水平所需的摄入量。
硒补充策略
硒的膳食来源我们前文中有讲过,为了更方便大家我们这里再作简单归纳:
⑴天然食物来源
植物性食品:
•巴西坚果:最丰富的天然来源;
•富硒蔬菜:大蒜、洋葱、蘑菇、西兰花等具有强硒富集能力;
•谷物作物:硒含量取决于种植土壤条件,一般范围0.1-1.0μg/g。
动物性食品:
•海产品:鱼类硒含量49-739μg/kg新鲜重量;
•内脏器官:肝、肾等可达1500μg/kg;
•奶制品和蛋类:硒水平受动物饲料影响显著。
⑵人工强化与补充策略
土壤施肥:
使用亚硒酸钠等硒肥,显著提高作物硒含量。
优点:成本低、覆盖广;
缺点:硒利用率受土壤pH、有机质等影响。
动物饲料添加:
直接添加亚硒酸钠或硒酸盐至饲料,通过富硒肥料→植物→动物的食物链传递。
食品加工强化:
开发硒强化食盐、调味品等日常食品;
通过富含硒的食品补充:如富硒的大米、富硒的鸡蛋、富硒的蘑菇、富硒的茶、富硒的麦芽等。
⑶膳食补充剂形式
无机硒补充剂:
•亚硒酸钠:常用补充形式,生物利用度较高;
•硒酸钠:吸收效率优于亚硒酸钠。
有机硒补充剂:
•富硒酵母:酿酒酵母在硒强化培养基中培养,硒主要以硒代蛋氨酸形式存在,硒含量可达3000μg/g,是当前最常用的补充形式。
•特定有机硒化合物:硒代蛋氨酸(SeMet)、甲基硒代半胱氨酸(SeMCys)、γ-谷氨酰-硒甲基硒代半胱氨酸。
新型补充剂:
•靶向性硒纳米制剂;
•缓释控释型硒补充剂;
•复合型抗氧化补充剂。
剂量与个性化补充
⑴推荐摄入量
最低需求:20μg/天(预防克山病);
推荐膳食供给量(RDA):50-60μg/天。
⑵安全阈值
上限摄入量:400μg/天(预防敏感个体风险);
可观察不良反应水平:850μg/天;
中毒剂量:≥1262μg/天出现临床硒中毒症状。
⑶个体化因素
基础硒状态:缺乏个体补充效果显著,充足个体可能无效甚至有害;
遗传因素:硒蛋白基因多态性影响硒需求;
健康状况:糖尿病、癌症等疾病状态改变硒代谢。
⑷特殊生理状态
孕期哺乳期:保证胎儿/婴儿硒需求,但不超过安全上限;
老年人:维持抗氧化功能,预防年龄相关疾病。
⑸疾病辅助治疗
癌症患者:200μg/天可能改善生活质量,但需注意皮肤癌风险;
HIV感染:补充改善免疫状态,减少机会性感染;
自身免疫性甲状腺炎:200μg/天硒代蛋氨酸改善抗体水平。
综观现有研究,硒不仅是维持生命活动的关键营养素,更是连接宿主代谢、免疫调控与肠道微生态的重要枢纽。它的作用早已超越传统意义上的抗氧化功能,而体现出复杂的系统性影响——既可通过硒蛋白调节炎症与代谢通路,又能借助肠道菌群实现间接的免疫与能量调控。硒与微生态的互作揭示了营养、代谢与疾病之间更为精细的耦合关系,也为理解“营养–肠道–健康”轴提供了新的生物学视角。
从应用层面看,硒可能成为调节肠道稳态与疾病防治的重要介质。合理利用不同形态的硒结合益生菌干预,有望在炎症性肠病、代谢疾病及神经退行性疾病等多领域实现营养精准化治疗。然而,硒的双刃性决定了补充策略必须建立在精准评估与个体差异分析的基础上,否则可能适得其反。
未来,应整合多组学技术和系统生物学方法,深入揭示硒在肠道生态网络中的动态平衡机制,明确宿主–微生物–营养三者间的信号通路。此外,将硒研究与临床实践相结合,探索其在疾病预防、药物增效及衰老干预中的潜在价值,也将成为实现“营养干预精准化”的关键方向。
硒不仅是维系健康的微量元素,更是揭示人体与微生态共生逻辑的重要线索。深入认识硒的多维作用,或将推动未来营养学、微生态医学与精准治疗的融合发展。
注:本账号发表的内容仅是用于信息的分享,在采取任何预防、治疗措施之前,请先咨询临床医生。
主要参考文献
Bai S, Zhang M, Tang S, Li M, Wu R, Wan S, Chen L, Wei X, Feng S. Effects and Impact of Selenium on Human Health, A Review. Molecules. 2024 Dec 26;30(1):50.
Ferreira RLU, Sena-Evangelista KCM, de Azevedo EP, Pinheiro FI, Cobucci RN, Pedrosa LFC. Selenium in Human Health and Gut Microflora: Bioavailability of Selenocompounds and Relationship With Diseases. Front Nutr. 2021 Jun 4;8:685317.
Sun Y, Wang Z, Gong P, Yao W, Ba Q, Wang H. Review on the health-promoting effect of adequate selenium status. Front Nutr. 2023 Mar 16;10:1136458.
Zhang F, Li X, Wei Y. Selenium and Selenoproteins in Health. Biomolecules. 2023 May 8;13(5):799.
Genchi G, Lauria G, Catalano A, Sinicropi MS, Carocci A. Biological Activity of Selenium and Its Impact on Human Health. Int J Mol Sci. 2023 Jan 30;24(3):2633.
Rayman MP. Selenium intake, status, and health: a complex relationship. Hormones (Athens). 2020 Mar;19(1):9-14.
Schomburg L. Selenium Deficiency Due to Diet, Pregnancy, Severe Illness, or COVID-19-A Preventable Trigger for Autoimmune Disease. Int J Mol Sci. 2021 Aug 8;22(16):8532.
Wrobel JK, Power R, Toborek M. Biological activity of selenium: Revisited. IUBMB Life. 2016 Feb;68(2):97-105.
Hadrup N, Ravn-Haren G. Absorption, distribution, metabolism and excretion (ADME) of oral selenium from organic and inorganic sources: A review. J Trace Elem Med Biol. 2021 Sep;67:126801.
Callejón-Leblic B, Selma-Royo M, Collado MC, Abril N, García-Barrera T. Impact of Antibiotic-Induced Depletion of Gut Microbiota and Selenium Supplementation on Plasma Selenoproteome and Metal Homeostasis in a Mice Model. J Agric Food Chem. 2021 Jul 14;69(27):7652-7662.
Callejón-Leblic B, Selma-Royo M, Collado MC, Gómez-Ariza JL, Abril N, García-Barrera T. Untargeted Gut Metabolomics to Delve the Interplay between Selenium Supplementation and Gut Microbiota. J Proteome Res. 2022 Mar 4;21(3):758-767.
谷禾健康
噬菌体(bacteriophages,phages)是专一感染细菌的病毒,它曾长期被视为抗生素时代之前的“旧疗法”,但在多重耐药(multidrug resistance, MDR)日益严峻和微生物组医学兴起的背景下,噬菌体疗法被重新定位为一种“可编程的微生物群编辑工具”。
噬菌体这一名称源于“吃细菌”之意。它广泛存在于一切有细菌的环境中,包括土壤、地壳深处、动植物体内以及海洋等,其中海洋是全球噬菌体最密集的天然库之一。
本文系统梳理噬菌体的生物学基础、肠道噬菌体组的生态学规律,以及噬菌体疗法在胃肠疾病与肝病中的证据链与关键瓶颈。
同时顺便讨论了噬菌体相较抗生素的优势:高度靶向特异性、可在靶点原位扩增、具备穿透和降解生物膜的潜力,以及与抗生素耐药机制的不交叉性;并分析其临床转化面临的核心挑战,如宿主谱狭窄、耐噬菌体进化、免疫反应与微生物组外溢效应、疗效评价体系与监管标准的不完善,以及高质量公共噬菌体库的匮乏。
更重要的是,肠道与肝病领域正在形成“从感染到菌群失衡相关疾病”的范式迁移:噬菌体不再仅是“杀菌药”,而是用于选择性削减致病共栖菌以恢复肠道稳态、影响免疫与代谢表型的精准干预手段。
噬菌体是一种感染细菌细胞并在其内部繁殖的病毒,它们形态和遗传物质类型多样。噬菌体由称为衣壳的蛋白质外壳包裹内部的DNA或RNA。噬菌体通常只识别特定细菌物种或菌株,在多种环境中对细菌种群的调控起着关键作用。
噬菌体疗法最大的优点之一是不会攻击其他细菌,只攻击特定类型或群体,我们的身体习惯了它们,因为我们被它们包围着。
噬菌体的发现历史
噬菌体实际上存在的时间比我们还长。
1915-1940年——发现与发展时期
1910年:噬菌体的发现;
1920年:噬菌体用于细菌感染治疗。
1940-2000年——停滞时期
抗生素的使用压制了西方国家的噬菌体疗法研究,但在苏联及其盟友中蓬勃发展,特别是在冷战期间。
1940年:难以重现,缺乏基本科学数据;
1970年:噬菌体与抗生素治疗比较。
2000年-至今——复兴时期
抗生素耐药性威胁加剧,结合现代生物技术和基因工程的进步,重新激发了对噬菌体疗法的兴趣。相关研究论文、临床试验及成功临床应用案例的数量均不断增加。
2005年:首次安全性测试;
2007年:人类微生物组计划;
2014年:CRISPR-Cas系统武装的噬菌体;
2019年:噬菌体可在肠道中特异性靶向细胞溶解性E.faecalis;
2020年:肠道微生物基因水平的原位调节;
2021年:口服噬菌体疗法BX002的I期药代动力学研究取得积极成果;
2023年:首个CRISPR噬菌体药物候选者进入临床试验。
2024年:小鼠肠道中细菌的原位靶向编辑。

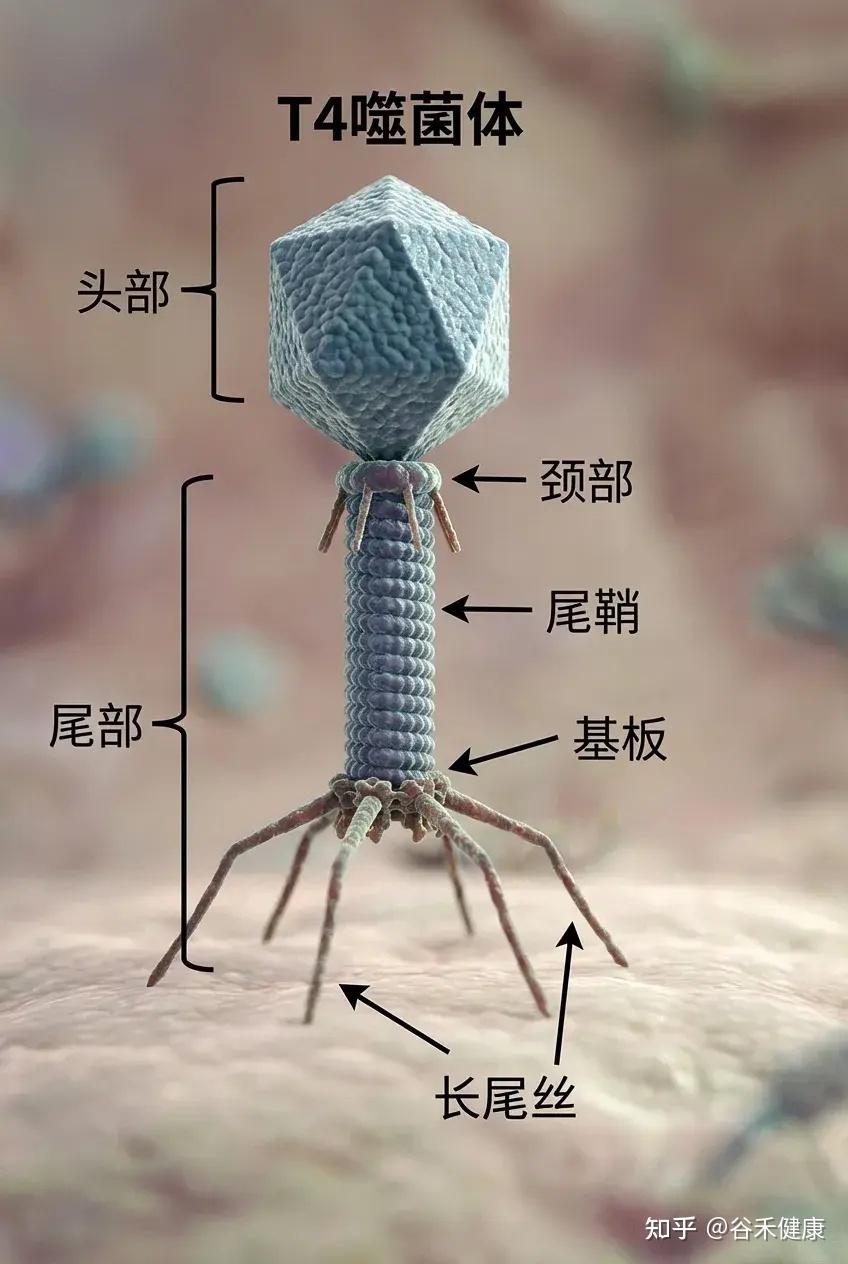
噬菌体结构
噬菌体由三部分构成:一个多面体的头部,一个短短的领口,以及一个螺旋形的尾部。
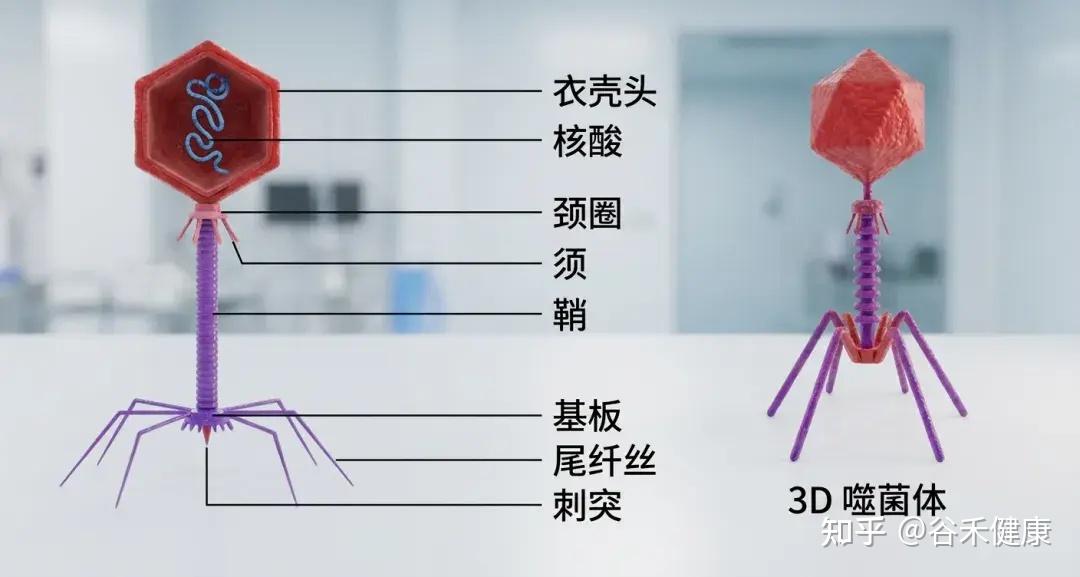
①头部
形状:多面体(就像一个有很多面的几何体)。
结构:由大约2000个囊聚体(capsomere)组成,囊聚体是构成头部外壳的基本单元。
内部:包含双链DNA,也就是噬菌体的遗传物质。
简单来说: 头部的作用就是保护噬菌体的DNA。
②项圈
位置位于头部和尾部之间,提供结构支撑,促进头部与尾部的连接。
③尾部
尾鞘:一种收缩结构,见于某些噬菌体(如T4噬菌体),有助于将遗传物质注入宿主体内。感染期间,鞘收缩并推动尾管穿过细菌细胞壁。
尾管:一种中空的管道,遗传物质通过它进入宿主细菌体内。
底板位于尾部末端,是连接细菌表面的关键。它通常包含受体结合蛋白、分解细菌细胞壁的酶以及其他有助于附着和穿透的特征。
尾纤维丝:长而灵活的延伸部分,使噬菌体能够识别并连接细菌细胞表面的特定受体。这些纤维非常特殊,决定噬菌体的宿主范围。
简单来说: 尾部的作用是像一根“注射器”,将噬菌体的DNA注入细菌体内。尾丝用来“抓住”细菌。
例如,T4噬菌体(如下图)是一种感染大肠杆菌的病毒,大肠杆菌是分子生物学领域研究最为深入的细菌类型之一。由于T4噬菌体感染大肠杆菌,科研人员得以结合对细菌的既有认知,借助T4噬菌体研究病毒在细胞内的感染与复制机制。
噬菌体的生命周期
噬菌体是感染细菌的病毒,它们有两种主要的生命周期:裂解循环和溶原循环。
•裂解循环或致病循环
裂解循环是指噬菌体感染细菌后,在细菌体内复制自身,最终导致细菌破裂(裂解)并释放出大量新的噬菌体,从而感染更多细菌。可以理解为“快速杀灭”的模式。这个过程包含以下几个步骤:
吸附 (Adsorption): 噬菌体利用其尾部的纤维,结合到细菌表面的特定受体上,就像钥匙插入锁一样。
穿透 (Penetration): 噬菌体的尾鞘收缩,并利用一种酶削弱细菌的细胞壁。然后,噬菌体将自身的DNA注入到细菌细胞内。
噬菌体组分的合成: 噬菌体的DNA进入细菌后,会“劫持”细菌的代谢系统,开始合成新的噬菌体所需的各种部件,例如头部、尾部以及各种蛋白质。这些蛋白质分为早期蛋白和晚期蛋白,早期蛋白负责复制DNA和合成其他蛋白质,晚期蛋白主要用于组装病毒颗粒。
成熟与组装: 噬菌体的头部、尾部等各个部件组装在一起,形成完整的病毒颗粒,称为病毒体。 噬菌体DNA会被装入头部中。
释放:最终,大量新形成的噬菌体会产生一些酶来破坏细菌的细胞壁,导致细菌裂解。 细菌破裂后,这些噬菌体就被释放出来,可以去感染其他细菌。
•溶原循环
噬菌体的生命周期要么是裂解性,要么是溶原性。
溶原循环是指噬菌体感染细菌后,并不立即导致细菌裂解,而是将自身的DNA整合到细菌的染色体中,成为前噬菌体。前噬菌体随着细菌的复制而复制,并传递给细菌的后代。可以理解为“潜伏”的模式。
当细菌分裂繁殖时,携带前噬菌体的细菌(称为溶原细菌)也随之分裂,将前噬菌体传递给所有后代。这样,噬菌体就可以在不杀死细菌的情况下进行繁殖。
但是,前噬菌体并非永久地潜伏在细菌体内。在某些条件下(例如紫外线照射),前噬菌体可能会从细菌的染色体上切除下来,并进入裂解循环,导致细菌裂解。
溶原细菌在繁殖过程中,也有可能因为切除作用而失去前噬菌体。
•裂解循环与溶原循环的区别
总而言之,裂解循环相当于“快攻”:迅速杀死宿主并大量产生子代,方式激进;溶原循环则类似“潜伏”:先藏入宿主基因组,随宿主繁殖扩增,在需要时再转入裂解。噬菌体选择哪种模式取决于细菌的生理状态和环境条件等多种因素。
噬菌体的类型
•按基因组分:
根据基因组,噬菌体可分为以下四种类型:
1.dsDNA 噬菌体(双链 DNA);
2.ssDNA 噬菌体(单链 DNA);
3.dsRNA 噬菌体(双链 RNA);
4.ssRNA 噬菌体(单链 RNA)。
噬菌体主要类群的示意图
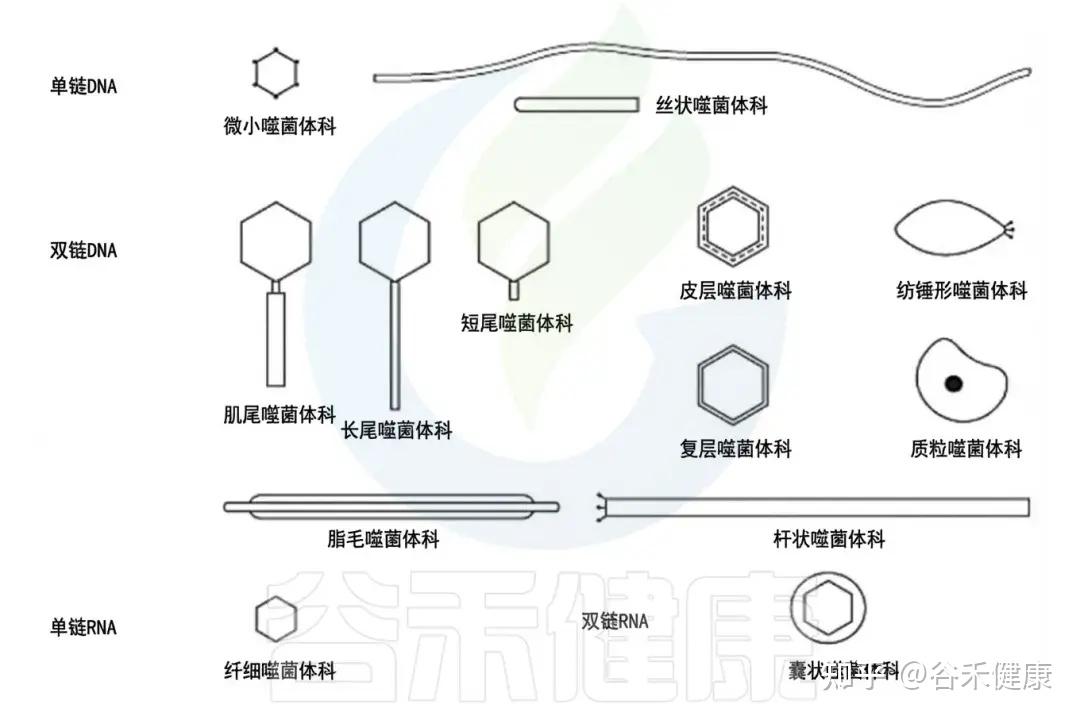
•按照生活史/复制策略分:
裂解性噬菌体: 这些噬菌体感染细菌细胞并在体内繁殖,最终使细胞裂解(破裂)并释放新形成的噬菌体。T4噬菌体是一种常见的裂解性噬菌体。
溶原噬菌体: 这些噬菌体将 DNA 整合进细菌染色体,并能长时间保持潜伏状态。在某些情况下,噬菌体 DNA 可以在复制过程中传递给子细胞,从而实现稳定感染。λ噬菌体是一种著名的溶原噬菌体。
•按形态结构分:
有尾噬菌体: 这些噬菌体具有独特的尾部结构,有助于附着在宿主细胞细菌表面 。偶T噬菌体(T2、T4、T6)是有尾噬菌体的例子。
丝状噬菌体: 这些噬菌体具有细长的丝状结构,有助于感染细菌细胞。它们通常感染革兰阴性菌,且没有尾巴。M13是一种著名的丝状噬菌体。
长尾噬菌体科(Siphoviridae):是国际病毒分类委员会确认的噬菌体主要科系,具有长而无收缩性的尾部结构,头部呈正多面体或扁形衣壳。其基因组为线型双链DNA,通过尾部吸附宿主细菌细胞壁实现感染,主要侵染大肠杆菌等革兰氏阴性菌。
该科成员以λ噬菌体和T5噬菌体为典型代表,能够在宿主基因组中整合并进行温和性复制。作为天然抗菌剂,其裂解酶特性被应用于绿脓杆菌感染治疗及工业发酵污染防控。
短尾噬菌体科(Podoviridae):这类噬菌体具有短尾、一般不可收缩;宿主范围因种而异,很多感染革兰氏阴性菌,代表如T7噬菌体。
噬菌体的分布
噬菌体无处不在;水、空气、土壤,几乎任何地方都能找到细菌。有人甚至认为,正因为噬菌体的存在和独特功能,我们的环境才没有被细菌完全占据。他们认为噬菌体是被允许控制自然界细菌水平的生物体。
噬菌体疗法已有近百年历史,但在抗生素广泛应用后迅速被边缘化。随着抗生素效果下降以及测序和微生物组研究的推进,噬菌体疗法重新受到关注,并被视为在缺乏有效手段时“恢复肠道微生物群”的潜在临床策略,其依据包括对靶菌的杀灭作用和免疫调节功能。
在胃肠—肝病领域,噬菌体疗法的应用已从霍乱、腹泻等感染扩展至多种与特定菌群相关的非传染性疾病,如克罗恩病中的黏附侵袭性大肠杆菌(AIEC)、溃疡性结肠炎中的艰难梭菌、结直肠癌相关的聚合梭杆菌、NAFLD 中的“产酒精”肺炎克雷伯菌以及酒精相关肝炎中的粪肠球菌等。
另一方面,从微生物组视角出发,噬菌体是人体最小且广泛存在的微生物之一,对细菌群体施加选择压力并塑造微生物组;噬菌体可与黏膜表面相互作用并跨越上皮层,同时还能调节免疫系统。这种“生态—免疫—代谢”的三重效应,使噬菌体疗法天然适配“精准编辑肠道菌群”的医学目标。
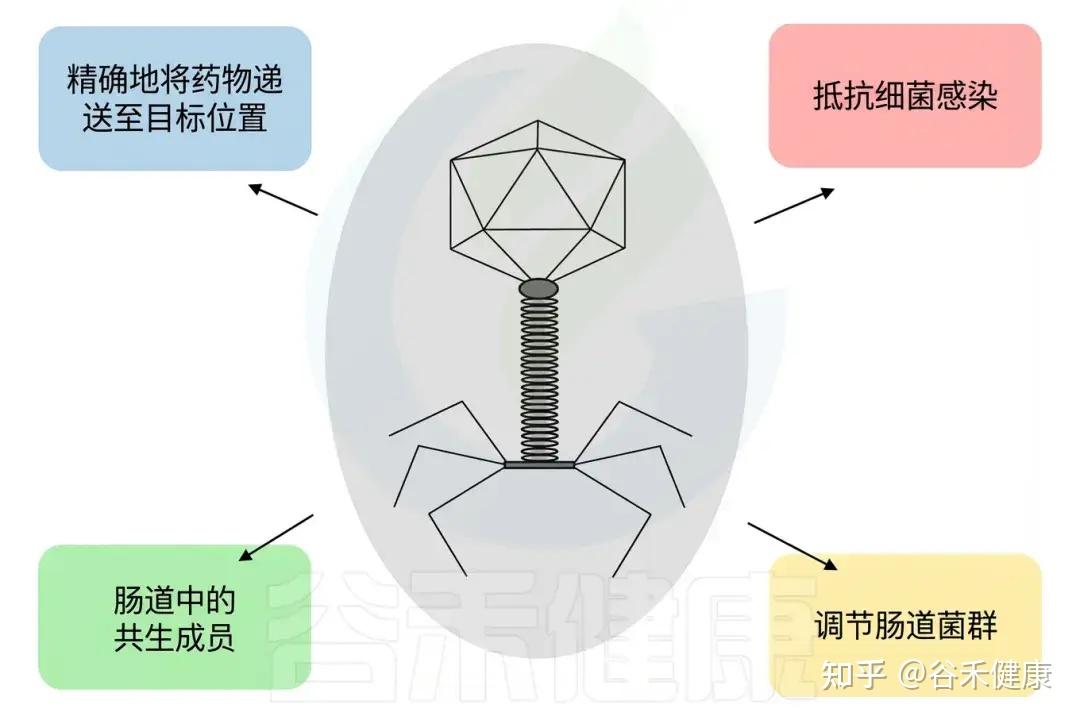
噬菌体的潜在应用
治疗为何偏好裂解噬菌体?
噬菌体的复制策略包括裂解型、温带型(溶原/可裂解)和慢性型。临床应用时,出于监管和安全性考虑,通常优先选择“严格裂解型噬菌体”。
温带噬菌体可整合为前噬菌体并介导基因转移,因而监管接受度较低;但在人类微生物群中却普遍存在,其受饮食、生活方式、化疗等因素诱导激活,可能导致群落扰动和菌群失调。
因此,“理解并可控诱导前噬菌体”正被视为新一代微生物群调控的重要方向。
机制性优势:为何噬菌体常被视为抗生素的互补/替代
•特异性靶向:噬菌体仅攻击被识别的细菌,避免广谱抗生素造成的微生物群破坏和继发感染风险;抗生素易诱发菌群失调,而噬菌体可选择性清除致病共栖菌。
•原位增殖与“自放大药代学”:在存在靶菌时,噬菌体可在局部扩增,呈现近似“单次击中”的动力学特征,其剂量—时间关系不同于需反复给药的抗生素。
•生物膜清除潜力:噬菌体及其脱聚合酶、裂解酶可穿透或降解生物膜胞外基质,提高对耐药生物膜相关感染的控制能力。
•耐药机制不交叉:细菌对抗生素和噬菌体的耐受机制不同,抗生素耐药菌仍可作为噬菌体靶标,反之亦然,因此噬菌体与抗生素的联合和协同应用成为可行策略。
•适应度权衡与表型重塑:噬菌体受体突变可在“噬菌体感染—细菌毒力—抗生素敏感性”之间形成适应度权衡。例如,当外排泵为噬菌体受体时,其突变虽可带来噬菌体耐受,却可能削弱外排泵功能,从而恢复对抗生素的敏感性。
★肠道噬菌体组是菌群稳态的重要调控层
肠道微生物组除细菌外还包括以噬菌体为主的病毒组(virome)。肠道病毒组中约90%为原核病毒、10%为真核病毒,其组成受饮食、生活方式和年龄等因素影响,呈现显著个体差异。
在生态学层面,噬菌体通过对细菌施加选择压力重塑菌群结构,可与黏膜表面互作并跨越上皮屏障,同时调节免疫系统。因此,噬菌体并非单纯的“外源抗菌剂”,而是长期参与“微生物—黏膜—免疫”互作的常驻调控因子。
在生命周期层面,噬菌体可表现为裂解、溶原(前噬菌体)或慢性感染。溶原噬菌体可整合入细菌染色体并在特定触发因素下被诱导进入裂解周期;伪溶原性则允许噬菌体DNA在不利环境中以外染色体形式“待机”,在条件适宜时再进入裂解或溶原通路。
这些机制表明:肠道噬菌体组对菌群稳态的作用既可能体现为“抑制性捕食”(裂解),也可能表现为“功能性重塑”(溶原带来的基因与适应度效应)。这为噬菌体疗法用于肠道疾病提供了理论基础:通过引入特定裂解噬菌体,对关键病原体或致病共栖菌施加定点压力,从而实现菌群结构与功能的可控回调。

噬菌体疗法的“靶向层级”
将噬菌体疗法用于“肠道菌群精准编辑”时,靶点的定义通常可分为三个层级:物种—菌株—功能表型。
•物种层级(species-level):对已知致病或与疾病密切相关的物种进行清除或抑制;
•菌株/群体层级(strain-/pathotype-level):针对同一物种内部与疾病相关的特定致病群体(例如具黏附侵袭表型的菌株群);
•功能表型层级(function-level):以“代谢/毒力功能”定义靶点(例如“产酒精”或“细胞溶解型”表型),强调并非该物种的所有成员均为治疗对象。
★噬菌体选择性靶向并清除特定菌株
通过选择性靶向并清除特定菌株来调节肠道菌群平衡的思路是一致的,也更有助于解释胃肠及肠—肝轴相关疾病机制。
噬菌体的核心优势在于高度特异性,但这也带来宿主谱受限的问题。其宿主范围受感染过程和受体识别等多重因素限制,在临床应用中,宿主谱过窄是公认的主要挑战之一。多数感染或菌群失衡涉及多菌株甚至多菌种,因此往往需要多噬菌体组合(鸡尾酒或联合)以扩大覆盖范围。在治疗设计上,可区分三类“覆盖策略”:
窄谱噬菌体(多为菌株水平):适用于“精准编辑”,最大限度减少对非靶向共栖菌的影响;
相对宽谱噬菌体(同种多株或同属多成员):可降低匹配难度,但并非“广谱抗生素式”全面覆盖;
噬菌体鸡尾酒/联盟(phage cocktails/consortia):通过组合实现更大覆盖并降低耐受风险,实践中常用于应对肠道靶菌的菌株多样性及耐噬菌体进化。
需强调的是,在“微生物群治疗”的语境下,真正意义上的“广谱杀菌”通常并非目标;更契合这一领域价值主张的,是“定点削减关键致病共栖菌、保留有益群落”,以减少菌群失调和继发问题的风险。
基于噬菌体的肠道微生物组生态与基因工程

从感染性腹泻到IBD与CRC相关菌
噬菌体疗法在胃肠领域的研究正由传统感染治疗拓展至与慢病相关的菌群失衡。早期研究主要针对霍乱等感染,而现阶段已开始在溃疡性结肠炎(UC)的艰难梭菌相关结肠炎,以及克罗恩病(CD)中黏附侵袭性大肠杆菌(AIEC)的清除方面开展探索。
•噬菌体定点清除靶菌而不破坏整体菌群
该方向的共同逻辑是:以裂解噬菌体定点清除加重炎症或与复发相关的关键靶菌,从而在不显著破坏整体菌群的前提下恢复微生态平衡。
此外,胃肠领域的综述也将噬菌体疗法延伸至肿瘤相关菌,如将结直肠癌(CRC)相关的具核梭杆菌(Fusobacterium nucleatum)视为潜在靶点。在“菌群—肿瘤微环境”框架下,噬菌体的特异性为“削减疾病相关菌而非整体抑菌”提供了方法学基础,但目前人体临床试验仍然有限。
炎症性肠病和肝病被视为“精准编辑”应用的代表性场景,在这些疾病中通过精确调控微生物或相关因子实现有针对性的干预尤为重要。
炎症性肠病(IBD)的治疗
原则:选择性抑制病原体/致病共栖菌,尽量保留有益菌群。
IBD(包括CD和UC)与菌群失调密切相关。当前调节菌群的手段主要是饮食干预和抗生素治疗,但多重耐药的上升削弱了抗生素的效果,并突显出对新策略的需求。
在此背景下,噬菌体疗法被视为可行替代方案:通过选择性靶向并清除致病细菌来重塑肠道菌群,从而影响炎症进程及临床结局。
(1)UC相关:艰难梭菌(Clostridioides difficile)
艰难梭菌过度生长常由抗生素诱发,可加重UC症状;裂解噬菌体治疗被认为可能帮助恢复微生物平衡。其临床意义在于:在“抗生素引发或加重菌群失调”的情境下,噬菌体的定点作用有潜力降低“治疗—再失衡”的循环风险。
(2)CD相关:黏附侵袭性大肠杆菌(AIEC)
AIEC在CD中被视为重要致病相关群体。综述明确指出,裂解噬菌体疗法正用于探索根除CD中的AIEC,并可能通过清除该致病群体减少炎症与复发。
这一靶点体现了“菌株/致病表型层级靶向”的典型特征:同为E.coli,但治疗目标锁定为与疾病表型相关的特定群体而非全部大肠杆菌。
肝病的治疗
肠道菌群改变与多种肝病密切相关,肠道病毒组的变化也被报道与疾病发生有关。在此背景下,噬菌体疗法的定位正由单纯“抗感染”转向“通过定点清除关键靶菌来编辑肠道菌群”,为肝病干预提供新的路径。
•靶向Enterococcus在治疗肝硬化中有效
近期一项RCT显示,靶向特定Enterococcus物种的噬菌体治疗在肝硬化患者中“非常有效”。研究指出,噬菌体可特异性靶向细胞溶解型(cytolytic)E.faecalis,从而实现对肠道微生物群的精确编辑。其重要意义在于:治疗靶点从“属/种”进一步下沉至“功能/毒力表型”(如细胞溶解型),与前文所述的“功能表型层级靶向”概念相契合。
在肠—肝轴相关肝病中,目前明确的代表性靶点包括:
酒精相关肝炎/肝硬化:肠球菌属(Enterococcus)及E.faecalis(尤其细胞溶解型);
非酒精性脂肪性肝病:Klebsiella pneumoniae(产酒精克雷伯氏菌),是以“功能表型”界定治疗对象的典型例子。
这些靶点共同体现了肝病领域噬菌体治疗的主线逻辑:并非追求“广谱清菌”,而是针对与病理表型高度相关、且具可解释机制链的关键菌群成员实施定点干预,并观察肠道生态与肝脏结局能否实现同步改善。
噬菌体疗法开发的核心在于确保所用噬菌体的安全性与有效性,当前研究主要依赖体内动物模型或合适的体外系统进行评估。同时,宿主谱狭窄与噬菌体耐受进化是公认难题,实践中往往需采用鸡尾酒策略以扩大覆盖并降低耐受风险。
因此,在炎症性肠病(IBD)情境下,研究重点不仅是“找到能裂解靶菌的噬菌体”,还包括:如何应对患者间菌株差异、如何设计组合以抑制耐受出现,以及如何量化其对整体菌群结构与功能的外溢影响。
转化层面上,由于人体试验数量有限,标准化方案和可比终点仍明显不足。尽管噬菌体在胃肠领域已展现出“较为理想的安全性特征”并进入临床评估,但用于胃肠疾病治疗的人体试验仍偏少。
因此,要在肠—肝轴方向开展“可发表、可转化”的研究,需要:
1.明确靶点定义(物种/菌株/功能表型)、患者分层及菌株匹配策略;
2.采用可比较的疗效终点(如靶菌负荷、菌群结构与功能指标、炎症与肝功能指标等);
3.系统评估耐噬菌体出现及菌群外溢效应风险,并据此论证鸡尾酒策略的必要性。
监管与安全性关注点
多个综述一致强调:西方主流监管机构尚未全面批准噬菌体用于常规人用治疗,主要担忧包括噬菌体耐药、对细菌基因组进化的影响、对人体微生物群的影响等;目前更多是在“同情用药”框架下开展个案或探索。
2019年人类微生物群焦点综述进一步把监管审批的科学问题具象化为三问:
•外源噬菌体治疗是否影响微生物群?
•是否影响非靶向共生菌?
•是否出现耐噬菌体突变体,其对微生物群平衡的影响是什么?
并指出现有文献稀缺且结论不一致。
•要注意肠道环境带来的“药物递送”问题
肠道环境的酸度与离子条件可显著影响噬菌体稳定性与滴度;例如空腹人胃pH中位数约1.7,而消化道部分区域pH可>6。因此口服噬菌体疗法常需抗酸策略(抗酸剂、包埋/包衣保护基质)。
这一点对“肠道微生物群编辑”的临床可重复性尤为关键:疗效的不确定性可能来自递送失败而非生物学无效。
主要争议与关键科学问题
需要从“仅仅证明治疗有效”进一步走向“疗效可预测、过程可监管”,实现从单点结果到全程可控的升级。
•宿主谱狭窄与鸡尾酒策略
噬菌体宿主谱狭窄既是优势也是临床障碍;多数感染或失衡为多菌种/多亚型并存,需多噬菌体组合扩大谱系。但鸡尾酒带来配方复杂性、生产一致性、批间稳定性与监管评估难度。
•耐噬菌体进化与共进化外溢
噬菌体—细菌呈捕食—猎物系统并持续共进化,细菌可快速产生耐受突变,噬菌体也可反适应。
鸡尾酒可通过叠加选择压力限制细菌对单一噬菌体的耐受进化。然而,在肠道这样高度异质且多物种互作的生态位中,耐受突变体与原菌株、其他共栖菌的竞争关系可能改变群落结构与功能,导致结果偏离体外培养预测。
•免疫反应与炎症风险
裂解噬菌体可能造成快速大量细菌裂解释放细胞壁成分与噬菌体蛋白,可能触发宿主免疫反应并诱导抗体,影响安全性与重复给药有效性。这也是需要系统研究“噬菌体—免疫”相互作用与合理剂量方案的原因。
•噬菌体选择标准不清与公共库缺乏
几篇权威研究一致指出:治疗性噬菌体选择不能只看宿主谱,还应考虑感染静止期细菌能力、酶活性、血清失活稳定性、突变率等指标;同时公共噬菌体库匮乏导致研发重复、共享不足、难以快速匹配患者菌株。这直接限制了“个体化噬菌体疗法”的规模化与规范化。
★ 什么是噬菌体?
噬菌体是一种感染细菌的病毒。
★ 噬菌体是如何工作的?
噬菌体附着在细菌细胞表面,并将其遗传物质注入细胞内。这些物质随后接管细胞,利用其资源制造更多病毒拷贝。
★ 噬菌体是如何感染细菌的?
噬菌体基因组接管宿主的代谢机制,利用它来生产新的噬菌体。最终,宿主细胞被裂解(破裂)以释放新的噬菌体,这些噬菌体随后可以感染其他细菌。
★ 噬菌体在生物学中有什么重要意义?
噬菌体在控制细菌数量方面发挥着关键作用,防止细菌过度繁殖并对其他生物造成危害。
★ 噬菌体在医学中是如何被利用的?
为抗生素耐药感染的替代治疗方法。它们可以外用或口服,在某些情况下已被证明能有效减少感染中的细菌数量。
将噬菌体送达胃肠道环境
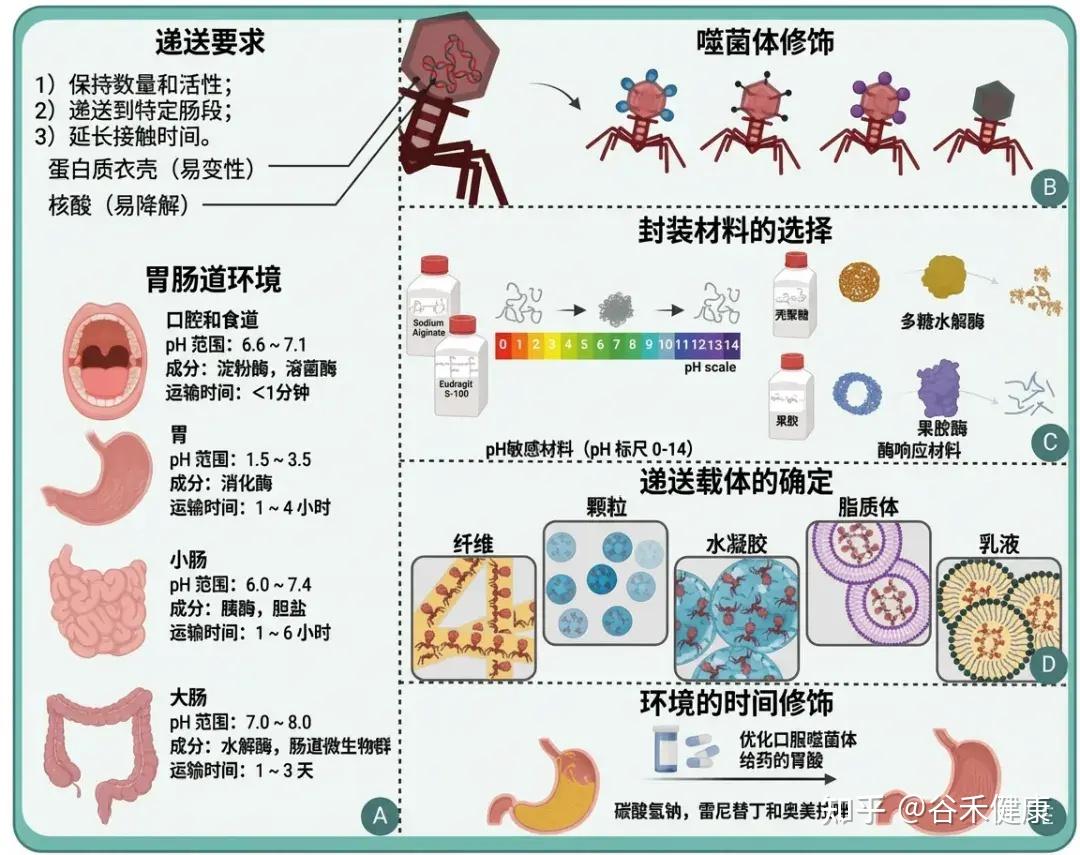
(A)噬菌体给药背景;(B)噬菌体的修饰;(C)封装材料的选择;(D)确定投递承运人;(E)环境的时间性变化。
★ 噬菌体是抗生素更好的替代品吗?
在某些情况下,噬菌体可能是抗生素的有用替代品,尤其是在导致感染的细菌具有抗生素耐药性时。
★ 使用噬菌体有哪些好处?
噬菌体可用于对抗细菌感染,因为它们具有高度特异性,能够针对特定类型的细菌。这常被用作抗生素的替代方案,因为它更具针对性,且对患者产生不良反应的可能性较低。
★ 使用噬菌体会有风险吗?
一个潜在风险是细菌耐药性的发展,因为病毒可能变异并对噬菌体产生抗药性。负责任地使用噬菌体并监测任何抗药性迹象非常重要。
主要参考文献:
Kuang X, Shen J, Zheng L, Duan Y, Ma Y, Leung EL, Dai L. Applications of bacteriophages in precision engineering of the human gut microbiome. Eng Microbiol. 2025 Jan 6;5(1):100189.
Sheraz, M., Shi, H. & Banerjee, S. Human Microbiome and Bacteriophages: Impacts on Health and Disease. Curr Clin Micro Rpt 12, 7 (2025). https://doi.org/10.1007/s40588-025-00243-2
Divya Ganeshan S, Hosseinidoust Z. Phage Therapy with a Focus on the Human Microbiota. Antibiotics (Basel). 2019 Aug 27;8(3):131.
De P, Bhat VG, Kamath V, Kolathur KK, Mazumder N. Insight into Bacteriophage Therapy for Bacterial Infections and Cancer. Mol Biotechnol. 2025 Jul 9.
Bozidis P, Markou E, Gouni A, Gartzonika K. Does Phage Therapy Need a Pan-Phage? Pathogens. 2024 Jun 20;13(6):522. doi: 10.3390/pathogens13060522.
Chen X, Mendes BG, Alves BS, Duan Y. Phage therapy in gut microbiome. Prog Mol Biol Transl Sci. 2023;201:93-118.doi: 10.1016/bs.pmbts.2023.04.005.

谷禾健康
夜幕落下,一场疲惫的战斗即将开始
翻来覆去,时间在无情地流逝
盯着天花板,期待天亮的时刻
却又害怕那一刻的真正到来
这意味着又一个疲惫的早晨
从整个歌单的催眠音乐到数了一万只羊
最终都只是让自己在煎熬中更加清醒

在快节奏的现代生活中,良好的睡眠已成为许多人难以实现的奢望。随着压力的增加,睡眠障碍,如失眠、睡眠呼吸暂停和不宁腿综合症等,成为越来越普遍问题。这些睡眠障碍不仅影响人的生活质量,还常伴随其他共病,如焦虑症、抑郁症、心血管疾病甚至癌症等。
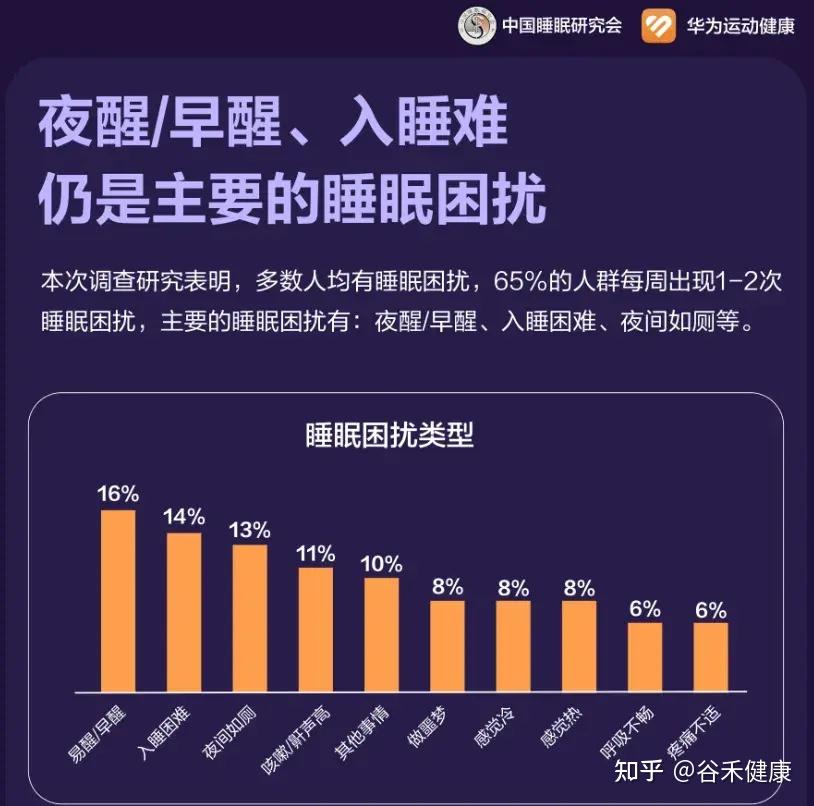
当前,失眠的治疗方法主要有药物治疗和心理疗法。例如,苯二氮䓬类药物虽然能快速缓解失眠症状,但常常伴随神经毒性、成瘾和耐受性等副作用。而认知行为疗法作为一种有效的心理治疗方式,依然缺乏熟练的治疗师,还有高昂的费用,令人望而却步。
当药物的副作用让人却步,心理疗法的门槛又难以触及,我们是否还有更安全、更普适的选择?
答案或许就藏在我们日常的饮食中。饮食不仅能通过营养成分直接作用于神经系统,还能通过调节肠道菌群这个第二大脑,间接影响我们的睡眠质量和昼夜节律。
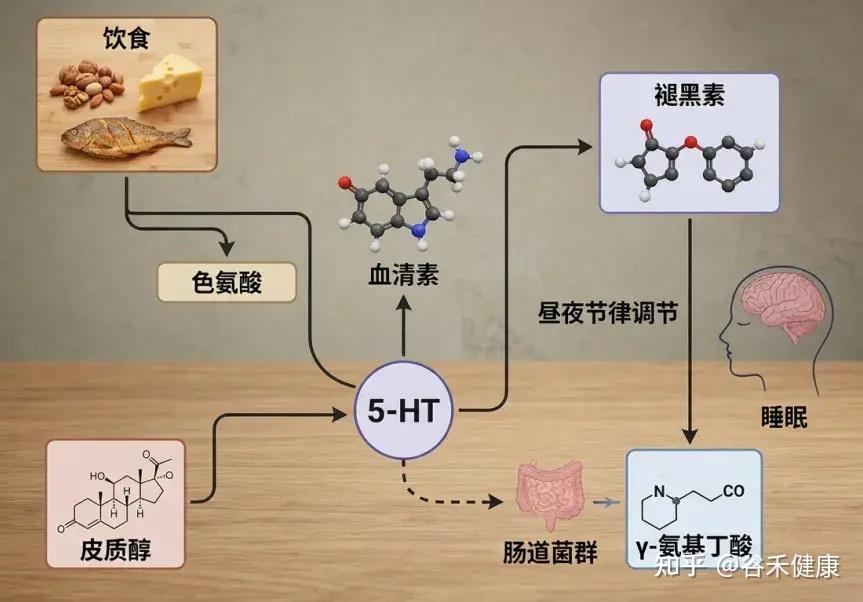
例如,富含色氨酸的食物(如坚果和牛奶)有助于促进血清素及褪黑素的合成,而神经递质和激素对调节睡眠周期至关重要。
健康的肠道菌群能够通过调节神经递质和激素,促进更好的睡眠。例如,乳杆菌和双歧杆菌,能够产生GABA等神经递质;进而帮助改善睡眠深度和质量。
然而,饮食与睡眠的关联并不是千篇一律的,因为我们每个人体内都有一套独特的生物钟。对于习惯早起的晨型人来说,他们的进食节奏通常与肠道菌群的活跃周期保持一致,而“夜猫子”们往往习惯晚睡晚起,甚至在深夜进食。
那么,晨型人与夜猫子不同的进食时间和作息习惯,会对肠道菌群的昼夜节律产生怎样的影响?
饮食作为连接两者的关键桥梁,怎样才能更好地帮助我们协调自身节律与肠道菌群的作息,从而改善睡眠呢?
本文我们将探讨饮食中关键的食物成分与睡眠之间的关系,分析饮食如何通过调节昼夜节律和肠道菌群来影响我们的睡眠状态,列举各类改善睡眠质量的营养干预措施,为大家提供切实可行的饮食建议,为您的轻松入睡增添更多选择。
本文目录
01 睡眠调节中的关键营养素及生物活性化合物
氨基酸:色氨酸、甘氨酸
微量元素:镁、锌、铁
维生素:维生素 D、B 族维生素
多酚:芹菜素、槲皮素、白藜芦醇等
02 饮食模式对睡眠质量的影响
地中海饮食、生酮饮食、植物性饮食
饮食时间
03 肠道菌群与睡眠的关系
肠道菌群如何影响睡眠
神经递质合成(GABA等)
昼夜节律与肠道菌群的双向关系
早鸟型or夜猫子型?不同睡眠类型的肠道菌群
饮食与微生物干预措施
04 增强睡眠的功能性食品
酸樱桃汁和褪黑素
猕猴桃和血清素
草本茶与镇静植物化合物
甘氨酸、L-茶氨酸和CBD
05 营养睡眠干预的实际应用与个性化营养方法
睡眠健康的一般饮食建议
场景化食谱与搭配建议
饮水与睡眠(补水节奏、起夜、微醺)
饮食与生活方式的协同作用(正念饮食、光照)
睡眠障碍:个性化营养方案

氨基酸:色氨酸、甘氨酸
✦ 色 氨 酸
色氨酸是一种必需氨基酸,意味着我们的身体无法自行合成它,而必须通过食物获得。色氨酸是合成血清素和褪黑素的重要前体,这两种神经递质对于调节我们的睡眠周期至关重要。特别是,褪黑素帮助信号传递,让我们的身体准备入睡。
无论是通过富含蛋白质的食物还是补充剂摄入色氨酸,都与缩短睡眠潜伏期和改善主观睡眠质量有关。
然而,色氨酸在经过血脑屏障进入大脑时,会与其他大型中性氨基酸(LNAAs)争夺运输通道。因此,膳食中碳水化合物与蛋白质的比例也会影响色氨酸在大脑中的可用性。如果你的饮食中碳水化合物的比例适当,就能更好地促进色氨酸的有效运输,有助于改善睡眠。
注:目前的共识倾向于高碳水、低蛋白的组合最有利于色氨酸进入大脑。研究显示,高升糖指数(高Gl)碳水化合物可能比低Gl碳水化合物更能显著提升Trp/LNAA比率。
来源
小贴士
早餐搭配全麦面包或燕麦粥食用富含色氨酸的食物(如鸡蛋、牛奶)。
下午茶喝一杯牛奶或吃一片全麦饼干,配合少量坚果。
睡前仪式一杯温牛奶,不仅含色氨酸,更重要的是其舒缓的温度也有助于褪黑素分泌。
在摄入色氨酸补充剂或富含色氨酸的食物时,避免吃入大量肉类或乳制品。
✦ 甘 氨 酸
甘氨酸是一种非必需氨基酸,通过在中枢神经系统中作为抑制性神经递质发挥促进睡眠的作用。
研究表明,口服甘氨酸补充剂可以改善主观睡眠质量并缩短入睡潜伏期。这种效果可能与甘氨酸降低核心体温有关,而降低体温是身体准备入睡的重要生理信号。
来源
小贴士
避免空腹大剂量:甘氨酸在高浓度下可能刺激胃黏膜,建议随餐或餐后服用。
搭配富含维C食物:维生素C能促进胶原蛋白合成,间接支持甘氨酸的代谢循环。
适量饮水:甘氨酸是水溶性的,充足的水分有助于维持体内代谢平衡。
在严重失眠时,甘氨酸(负责降温/放松)与褪黑素(负责启动睡眠)联合使用可能效果更佳。
微量元素:镁、锌、铁
✦ 镁
镁在睡眠调节中发挥着关键作用,它通过调节N-甲基-D-天冬氨酸(NMDA)受体和GABA系统的活性帮助我们入睡,这两个系统对催眠至关重要。
研究发现,镁缺乏与夜间觉醒次数增加和慢波睡眠减少相关,因此,确保摄入足够的镁对获得高质量的睡眠至关重要。
✦ 锌
锌是一种微量矿物质,具有抗氧化和神经调节特性,参与调节睡眠结构。
针对婴儿和学龄前儿童的研究表明,血清锌水平与睡眠时长之间存在正相关关系。这意味着锌的摄入可能与更长的睡眠时间有关。
锌可能通过影响突触可塑性和调节谷氨酸能神经递质来改善睡眠。
✦ 铁
铁是大脑健康的另一重要元素,尤其是在调节睡眠-清醒周期时起着关键作用。
铁缺乏与不宁腿综合症(RLS)有关,这是一种在休息时会感觉到不适并有强烈想抖腿的冲动的疾病。补充铁可以帮助缓解这些症状,同时改善睡眠质量。因此,获得足够的铁对维持良好的睡眠也是非常重要的。
来源

小贴士
吃富含铁/锌的植物食物(如菠菜、豆类)时,搭配富含维C的食物(如橙子、番茄),可显著提高吸收率。
避免过量咖啡/茶:咖啡因和鞣酸会抑制铁和锌的吸收,建议在餐后1小时再饮用。
动物性食物中的血红素铁(来自肉类)比植物性非血红素铁更容易被人体直接吸收。
维生素:维生素D、B族维生素
✦ 维生素D
维生素D在多种与睡眠调节相关的脑区中存在受体,包括下丘脑。
观察性研究发现,维生素D水平低与睡眠障碍的风险增加有关,特别是短睡时间和睡眠效率差。这可能与维生素D在调节炎症反应和促进褪黑素合成中的作用有关,褪黑素是调节睡眠的重要激素。
来源
维生素 D 是唯一一种人体可以通过皮肤在阳光下自行合成的脂溶性维生素。虽然食物是重要补充,比如蘑菇、香菇、三文鱼、燕麦奶、杏仁露等,但更重要的维生素 D 来源于晒太阳。
小贴士
晒背:每天中午前后(10:00-14:00)暴露手臂和腿部皮肤 15-30分钟,无需涂抹防晒霜。
注意吸收:维生素D是脂溶性的,建议随餐食用以提高吸收率。
避免过量:长期过量摄入可能中毒,每日上限通常为4000 lU。
✦ B族维生素
B族维生素,尤其是B6(吡哆醇)、B9(叶酸)和B12(钴胺素),在神经递质代谢中发挥着重要作用。维生素B6对于将色氨酸转化为血清素至关重要,而叶酸和维生素B12则参与支持褪黑素合成的甲基化过程。缺乏这些维生素可能导致睡眠问题,如失眠和睡眠片段化。
来源

小贴士
B12 是唯一一种几乎只存在于动物性食物中的 B 族维生素。素食者需通过强化食品或补充剂获取。
B族维生素属于水溶性,容易随尿液排出,因此需要每日通过饮食规律补充。
多酚:芹菜素、槲皮素、白藜芦醇…
多酚,尤其是存在于水果、蔬菜、茶和可可中的类黄酮,因其神经保护和促进睡眠的特性而备受关注。
类黄酮如芹菜素(在洋甘菊中发现)和槲皮素通过与GABA_A受体的相互作用,展现出抗焦虑和镇静效果。
其他多酚化合物,如白藜芦醇(存在于葡萄和浆果中)和表没食子酸没食子酸酯(EGCG)(来自绿茶),具有抗炎和抗氧化效果。
这些化合物可能通过降低全身性炎症和氧化应激间接促进睡眠。这些作用至关重要,因为慢性炎症和氧化应激的升高与失眠以及其他睡眠障碍密切相关。
来源
芹菜素:芹菜(尤其西芹含量极高)、洋葱、大蒜、欧芹、香菜、罗勒;苹果、梨、葡萄等。
槲皮素:苹果(果皮含量极高)、覆盆子、桑葚、樱桃、葡萄;洋葱、菠菜、羽衣甘蓝、番茄;小麦、大麦、燕麦等。
白藜芦醇:葡萄(果皮)、红酒(发酵过程产生)、桑葚、蓝莓;花生、核桃等。
小贴士
芹菜素和槲皮素属于脂溶性或半脂溶性物质,与橄榄油、坚果或牛油果同食可促进吸收。
槲皮素主要集中在苹果的果皮中,吃苹果记得连皮一起吃。
肠道菌群能将多酚转化为活性代谢物(如阿魏酸),因此富含膳食纤维的食物有助于提高利用率。
褪黑素和L-茶氨酸
褪黑素是主要由松果体分泌的内源性激素,是调节昼夜睡眠-清醒节律的关键因素。而外源性褪黑素(可以通过补充剂或一些食品如酸樱桃获取)越来越多地被用于改善睡眠,特别是对那些有昼夜节律障碍的人群。研究表明,褪黑素补充剂可以有效缩短入睡所需时间,增加总睡眠时间,并改善整体睡眠质量。
L-茶氨酸是一种主要存在于绿茶中的氨基酸,它展现出促进放松而不引起镇静的潜力。临床试验证实,L-茶氨酸补充可以改善睡眠质量,减少睡眠干扰,并通过调节大脑α波活动和GABA水平增强睡眠的恢复阶段。

地中海饮食
地中海饮食(MD) 特点
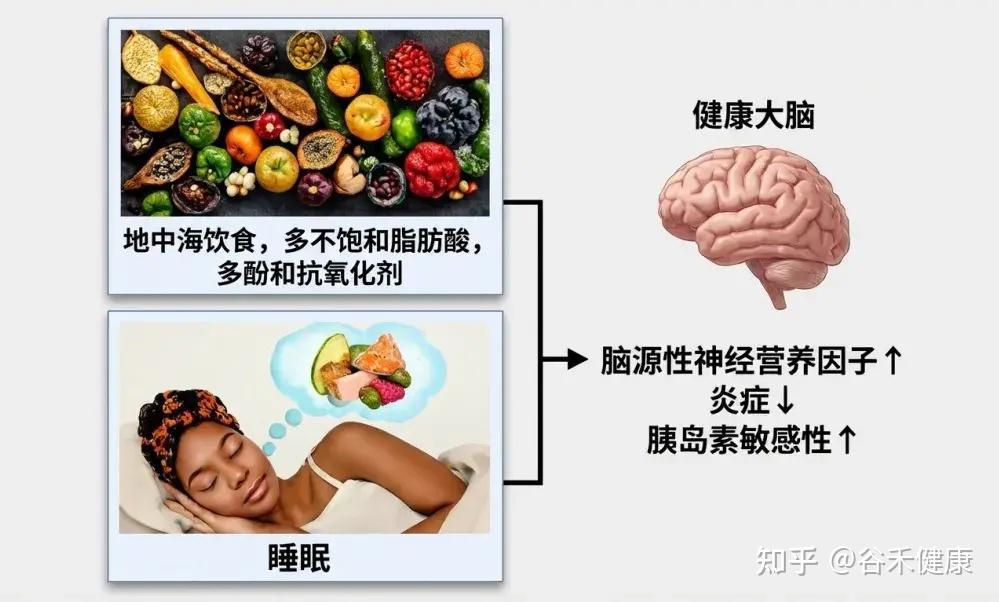
研究表明,遵循这种饮食模式与更好的睡眠效果密切相关。许多研究发现,地中海饮食能够提高睡眠持续时间、效率和主观睡眠质量,这可能与其抗炎和抗氧化特性有关。
关键营养成分
这种饮食富含多酚、ω-3脂肪酸和复杂碳水化合物,这些成分有助于合成褪黑素,减少氧化压力,并增强血清素的传递,这些都是调节睡眠所需的关键途径。此外,地中海饮食中的镁丰富食物,也可能通过调节NMDA和GABA受体来促进睡眠。
Li Rang等人的一项大型横断面研究报告称,对地中海饮食的更高依从性与老年人失眠症状风险的降低相关。地中海饮食中普遍存在的复合碳水化合物通过增加色氨酸在大脑中的可用性,可能有助于睡眠的开始和持续。
地中海饮食对睡眠的影响
生酮饮食
生酮饮食的特点
生酮饮食(KD)是一种高脂肪、极低碳水化合物的饮食模式,因其在治疗癫痫、肥胖和代谢疾病方面的疗效而受到关注。近期研究表明,生酮饮食可能还会影响睡眠结构。
对睡眠结构的影响
研究发现,处于生酮状态时,慢波睡眠(SWS)的比例增加,而快速眼动睡眠(REM)减少。这种变化可能与腺苷信号传导和能量代谢的改变有关。
一项关于癫痫儿童的临床试验显示,生酮饮食能改善睡眠质量,通过减少夜间觉醒和提高睡眠效率。同时,酮体本身可能具有神经保护和抗炎作用,有助于稳定与睡眠调节相关的神经网络。
复杂的影响
然而,生酮饮食对睡眠的影响并非一成不变。饮食的初期阶段常伴随生酮适应症状,这可能暂时干扰睡眠,因此饮食的坚持时间和个人的代谢反应是影响睡眠的重要因素。
植物性饮食
植物性饮食的特点
植物性饮食,强调以水果、蔬菜、豆类、全谷物、坚果和种子等植物来源的食物为主,同时尽量减少或不摄入动物产品。流行病学数据表明,植物性饮食者往往报告的睡眠质量优于杂食者。
对睡眠的积极影响
植物性饮食中的高纤维含量有助于改善肠道微生物组成,增强肠-脑轴信号,这可能有助于改善睡眠。此外,植物性饮食丰富的植物营养素和抗氧化剂形成的抗炎特性,可能有助于降低全身性炎症,而炎症与睡眠质量差有关。
营养素的关注
然而,植物性饮食需要仔细规划,以防止维生素B12、铁和ω-3脂肪酸等营养素的缺乏,这些营养素对良好的睡眠调节至关重要。有研究表明,这些微量营养素的低水平可能会影响睡眠质量。
饮食时间
新兴研究表明,在饮食中,不仅食物的选择很重要,饮食的时间也对睡眠健康有显著影响。不规律的就餐时间、夜间进食、跳过早餐与昼夜节律失调、入睡延迟和睡眠质量降低相关。
饮食时间对睡眠的影响
晚间食用高脂肪或高能量餐食可能会通过干扰昼夜节律激素的分泌(包括褪黑激素)来影响入睡和睡眠深度。相反,建议在睡前约4小时摄入高升糖指数的食物,这可能有助于减少入睡的延迟,表明餐食的合理时间安排能够改善睡眠。
限时饮食的益处
限时饮食(TRE)要求在一天中的特定时间窗口内进食。这种饮食方式已经显示出增强昼夜节律,从而提高睡眠效率和持续时间的潜力。

肠道菌群如何影响睡眠
新兴研究表明,肠道微生物群可以通过多种机制影响睡眠,包括调节免疫系统、调节代谢途径、产生神经递质以及与昼夜节律系统的相互作用。
神经递质合成
部分肠道细菌能够合成关键的神经递质,如GABA(γ-氨基丁酸)、血清素和多巴胺。人体约90%的血清素(睡眠激素褪黑素的前体)产生于肠道。这些神经递质的水平直接影响睡眠-觉醒周期的调节。
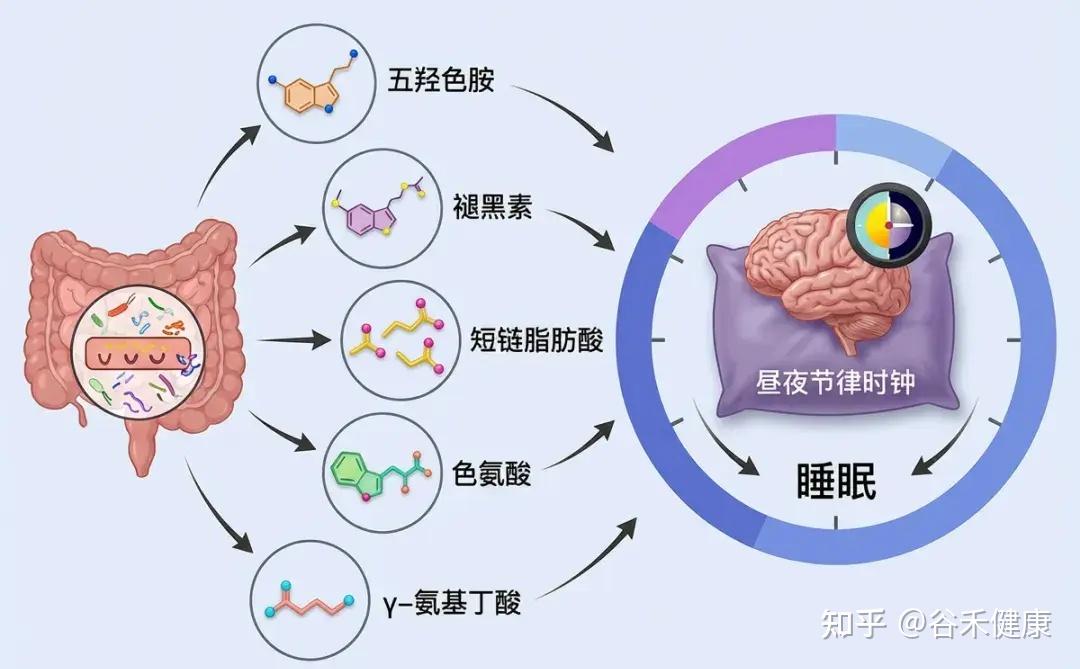
GABA
GABA(γ-氨基丁酸)是一种非蛋白质氨基酸,是大脑中主要的抑制性神经递质,主要负责抑制神经活动。它在缓解压力和调节睡眠方面起着重要作用。GABA通过引导突触后神经元的超极化过程,帮助产生抑制性的电信号。这导致细胞内负电荷增加,使神经细胞更难以被激活,从而减少神经冲动的产生。
一些研究表明GABA补充可能有助于睡眠质量。
一项研究显示,每天给失眠患者提供300毫克GABA,连续四周,与提高睡眠效率和降低睡眠潜伏期相关。
另一项研究,用含GABA和L-茶氨酸的混合物可减少睡眠潜伏期,并增加快速眼动和非快速眼动期。
GABA的饮食来源:
普通豆类和豌豆芽、大米、燕麦、小麦、菠菜、土豆以及许多蔬菜。
通过饮食摄入GABA有助于提高体内的水平,但食物中含量相对还是较少。研究表明,特定的肠道微生物能够有效地合成GABA,增加其生物利用度。
乳杆菌和双歧杆菌是GABA产生的关键成员
双歧杆菌在肠道粘液层定植:具有将谷氨酸、谷氨酰胺和琥珀酸转化为GABA的酶机制。
乳杆菌 :多个菌株都具备GABA合成能力
– Limosilactobacillus fermentum L18:
高效分泌GABA的专业户,通过增加连接蛋白的浓度和有益肠道细菌的丰度来增强肠道屏障。
– 鼠李糖乳杆菌GG:
除了保护肠道屏障外,还可以通过调节肠脑轴来提高海马和杏仁核中的脑源性神经营养因子(BDNF)和GABA受体水平。
– 短乳杆菌:
通过发酵产生高剂量GABA,可以提高肠道中有益细菌的相对丰度和SCFA的水平,进而可以上调GABA能和5-羟色胺能神经递质的mRNA和蛋白质表达水平。这将导致θ和δ波以及非快速眼动睡眠的显著增加。
免疫系统调节
肠道微生物通过调节炎症细胞因子(如IL-6和TNF-α)来影响睡眠结构。健康的肠道菌群能促进短链脂肪酸(SCFA)等抗炎代谢物的产生,从而改善睡眠连续性;反之,慢性低度炎症通常与肠道菌群失调有关,这也是导致失眠和睡眠碎片化的重要因素。
代谢途径与屏障功能
微生物发酵产生的短链脂肪酸(乙酸盐、丙酸盐、丁酸盐)已被证实能穿过血脑屏障,通过调节神经炎症和神经可塑性来优化睡眠调节。
注意:慢性或周期性纤维缺乏可能导致黏膜糖蛋白作为营养来源分泌,进而侵蚀结肠黏膜屏障。这反过来可能导致肠道屏障功能障碍,进而升级为致命的结肠炎。
研究表明,某些细菌菌株,包括Lachnospiraceae UCG004 ,Odoribacter,参与短链脂肪酸的产生,有助于延长睡眠时间。短链脂肪酸可能通过调节GABA和血清素的合成来影响睡眠。GABA是神经系统中的主要抑制性神经递质,通过抑制唤醒通路在促进睡眠中发挥重要作用。
昼夜节律与肠道菌群的双向关系
光是负责人类昼夜节律最佳功能和精准调节的主要因素,该时钟位于下丘脑的视交叉上核。然而,许多其他刺激和环境信号也可能显著影响昼夜节律,包括用餐时间、食物类型、运动、体温,甚至社交互动。
肠-脑轴是一个复杂的生物系统,促进大脑与肠道之间的双向通信。肠道微生物群在调节这种相互作用中发挥了关键作用,影响着多种信号通路。
微生物群的多样性和组成会发生变化,这些变化受到一天中的时间、所摄入食物的类型和禁食习惯等影响。因此,异常或单一的饮食习惯可能对生物钟的正常功能产生负面影响。此外,肠道微生物群与昼夜节律之间是一种双向关系,彼此的干扰和紊乱会相互影响。
一方面,宿主昼夜节律的紊乱(如轮班工作、时差或不规律饮食)会导致微生物生态失调,进而加剧睡眠问题。
昼夜节律紊乱对肠道菌群的具体表现:α‑多样性显著降低;有害菌如 Ruminococcus torques、Streptococcus、Alloprevotella增多,益生菌如 Lactobacillus johnsonii、Lactobacillus、Bifidobacterium减少。
菌群失调与睡眠障碍
肠道菌群失调与多种睡眠障碍的病理生理学密切相关,包括失眠、阻塞性睡眠呼吸暂停(OSA)和不宁腿综合征(RLS)。
例如,阻塞性睡眠呼吸暂停患者常表现出特征性的肠道菌群改变,具体为微生物多样性降低及促炎细菌丰度增加。这种失调引发的全身性炎症可能通过肠-脑轴反馈至中枢神经系统,进一步恶化睡眠病理。
另一方面,通过规律的作息维持同步的昼夜节律,可促进健康的微生物群,进而反哺睡眠质量。
固定进食窗口产生 “餐后高峰‑空腹低谷” 的碳源波动。
产短链脂肪酸的菌(如Faecalibacterium, Roseburia)在餐后 2‑4 h 达到丰度峰值;胆汁酸代谢菌(如Clostridium spp., Bacteroides)在胆汁分泌高峰时活跃。
规律作息降低全身 IL‑6、TNF‑α,使肠道屏障更完整(ZO‑1、occludin 表达↑),阻止致炎菌(如Enterobacteriaceae)越过黏膜进入血液。低炎症环境进一步促进产短链脂肪酸的菌代谢活性,形成正反馈。
规律作息通过同步中枢与外周时钟、固定进食窗口、调节激素与免疫状态,形成一个“时间‑营养‑免疫”三位一体的生态网络,从而塑造更为多样、功能更完整的肠道菌群。
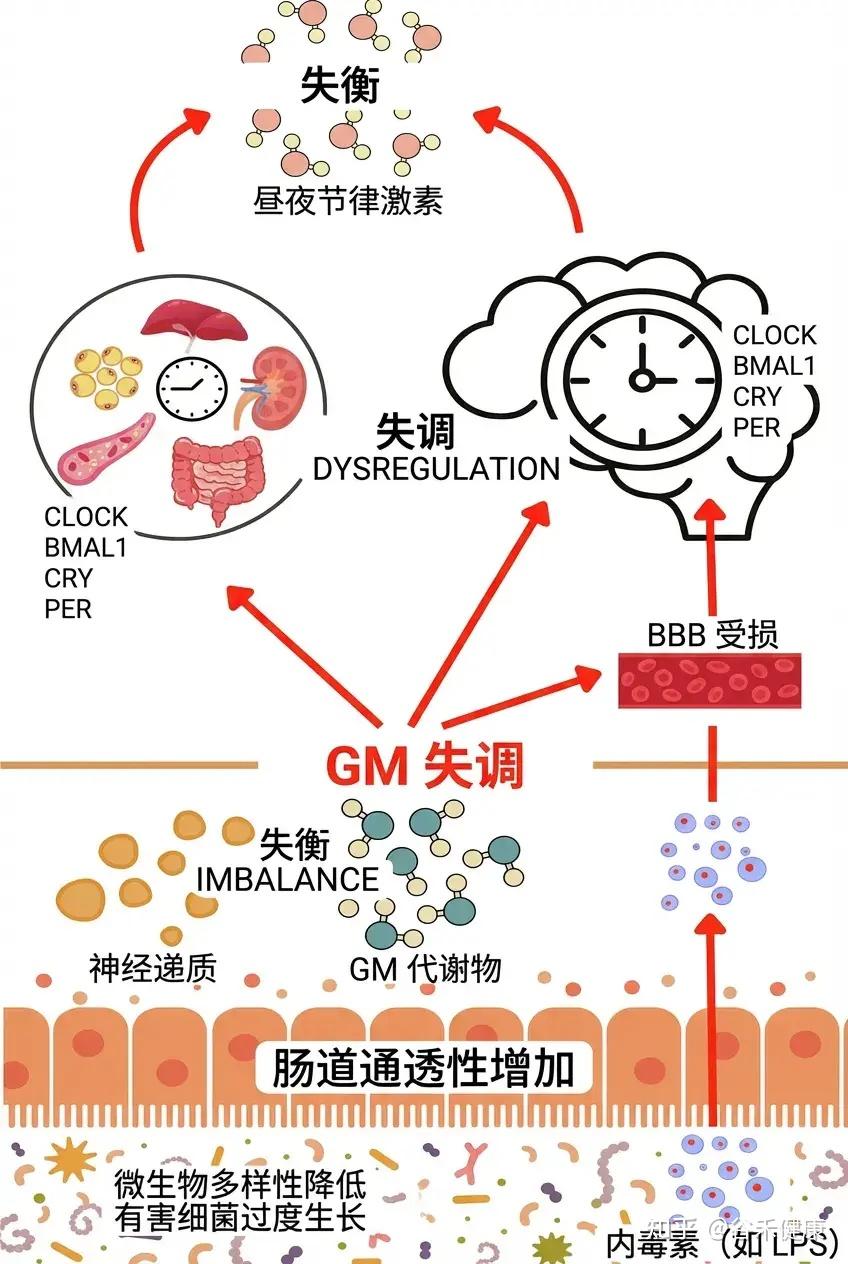
然而,这种双向调节在每个个体身上的表现并非千篇一律。要真正理解微生物组与生物钟的深层联系,我们不仅要看作息是否规律,还要看每个人独特的生物钟设定,你是早鸟型还是夜猫子型,本身就不一样。
早鸟型or夜猫子型?不同睡眠类型的肠道菌群
什么是睡眠类型,有哪几种常见的?
所谓睡眠类型,指的是一个人的昼夜节律表型,通俗来说,就是你在何时醒来、何时活跃以及何时入睡的天然偏好。
根据人体内部的昼夜节律,我们通常将人分为“晨型人”和“夜型人”(这两类又可细分为极端型和温和型)。此外,研究还确认了第三种类型:中间型(Neither-types)。
有趣的是,只有约40%的成年人属于典型的晨型或夜型,其余约60%都属于中间型。这类人群的作息往往更具弹性,能够根据具体情况或个人喜好灵活调整睡眠和活动时间。
早起鸟 和 夜猫子 在日常生活中有何不同?
这两类人的表现截然不同。晨型人倾向于早睡早起,他们的作息与日出日落的时间紧密同步,通常在一天中的早些时候达到身心状态的巅峰。
相反,夜型人倾向于晚睡晚起,他们的身心最佳状态通常出现在一天的后半段。然而,这也带来了一个问题:如果在不得不早起的情况下,他们更有可能面临精神不振的困难。
当夜型人被迫在他们生物钟认为的“深夜”(比如早上 7 点)进食早餐时,肠道代谢系统尚未完全苏醒(胰岛素敏感性低、消化酶分泌少)。
我们的肠道细菌与这种睡眠生物钟有关吗?
早起时的不适感可能不仅仅是大脑的问题,还可能与肠道有关。
研究发现,不同睡眠类型的人群拥有不同的肠道微生物群。例如,与晨型人相比,夜猫子人体内的 肠杆菌目(Enterobacteriales) 和 肠杆菌科(Enterobacteriaceae) 数量往往更高。
可能与延长睡眠时间相关的菌群包括:
微生物群-肠道-大脑轴如何影响昼夜节律
例如,硒单胞菌目(Selenomonadales)和Negativicutes 丰度较高的个体可能面临更高的失眠风险。相反,像Anaerofilum和肠杆菌目这样的细菌可以影响肠道上皮的时钟基因,从而增加成为夜猫子的概率,而夜猫子人与较高的体重相关。
给晨型人(早鸟型)的建议
利用早餐优势: 你的胰岛素敏感性在早晨极高。把一天中大部分的碳水化合物(全谷物、水果)放在早餐吃,不仅代谢快,还能为一整天提供能量。
警惕晚上能量透支: 晨型人容易在傍晚感到能量崩溃。
晚餐摄入适量的复合碳水化合物(如红薯、糙米),这有助于血清素的合成,不仅能维持情绪稳定,还能为入睡提供充足的褪黑素原料,防止“睡太早、半夜醒”的情况。
给夜型人(夜猫子)的策略
“时间限制进食法(TRE)”是关键:对夜型人来说,最危险的不是晚睡,而是晚吃。
在睡前 3-4小时 坚决停止进食。这给肠道留出了宝贵的清洗时间,防止细菌在不该繁殖的小肠内过度生长。
既然体内时钟慢,如果觉得需要,可以靠光来校准。早起第一件事接触阳光,这是告诉肠道菌群,新的一天开始了。
补给策略: 夜型人往往缺乏维生素D(晒太阳少)和B族维生素。结合肠道菌群检测相关的营养指标,如有缺乏则针对性补充这些营养素,有助于稳定生物钟基因的表达。
饮食与微生物干预策略
基于“饮食-微生物-睡眠”的调节路径,利用益生菌、益生元及膳食纤维进行干预,为管理睡眠障碍提供了有前景的新途径。
膳食纤维与益生元
膳食纤维(富含于水果、蔬菜、全谷物)作为微生物发酵的底物,能显著促进SCFA的产生。
对照喂养研究发现,较高的纤维摄入量与更长的慢波睡眠(深睡眠)时间相关,而高饱和脂肪摄入则导致睡眠质量下降。
益生元(如菊粉、FOS、GOS)被证明能增加非快速眼动睡眠(NREM),并提高机体对压力诱导的睡眠中断的抵抗力。
益生菌(精神益生菌)
益生菌在改善睡眠、缓解压力方面的潜力已在多项临床及临床前研究中得到证实。特定的益生菌菌株(有时被称为“精神益生菌”)通过调节神经递质途径和下丘脑-垂体-肾上腺(HPA)轴发挥作用。
临床证据
Nishida等人的随机对照试验表明,每日摄入
加氏乳杆菌CP2305 可显著提高轻度睡眠障碍成人的睡眠效率并缩短入睡潜伏期,这归因于其降低唾液皮质醇水平的能力。
机制研究
最近的研究进一步明确了特定菌株的神经化学机制。例如,鼠李糖乳杆菌GG被证明能增强海马和杏仁核中GABA受体的表达,通过迷走神经信号传导发挥抗焦虑和促睡眠作用。
代谢调节
长双歧杆菌1714和植物乳杆菌P8显示出降低皮质醇水平、改善主观睡眠质量的效果。这些菌株通过增加色氨酸的可用性并调节犬尿氨酸途径,增强中枢血清素的合成,从而巩固睡眠结构。
-只改睡眠时间而不管饮食,菌群会恢复吗?
部分恢复(尤其是夜间褪黑素对 Akkermansia 有正向作用),但若进食时间仍散乱,底物供给的节律仍缺失,恢复幅度有限。
-是否有推荐的作息模式?
目前证据最稳妥的模式是 “早起早睡 + 8‑10 h 进食窗口 + 早晨强光+ 低GI/高纤维饮食”,这套组合在多项研究中均能提升 α‑多样性、短链脂肪酸产生和睡眠质量。
注:作息干预的效果往往在 2‑4 周 开始出现可检测的菌群变化(α‑多样性、特定属丰度),完整的 功能恢复(SCFA 产量、炎症标记下降) 通常需要 8‑12 周 的持续坚持。
小 结
肠道微生物组通过产生神经活性代谢物(如短链脂肪酸、血清素前体)、调节炎症及与昼夜节律的交互,成为睡眠调节的关键一环。未来仍需更多临床试验来确立具体的因果关系及主要效果。
近年来,功能性食品和(提供基本营养以外的健康益处的食品)在睡眠健康方面的作用引起了人们的关注。几种富含生物活性化合物的天然产物已被证明可以通过多种生物机制调节睡眠质量、潜伏期和持续时间,包括抗氧化活性、抗炎作用和神经递质调节。
酸樱桃汁和褪黑素
酸樱桃(如蒙特莫伦西品种)是褪黑素的自然来源,这种荷尔蒙对调节我们的睡眠-觉醒周期至关重要。研究表明,喝酸樱桃汁可以改善睡眠的持续时间和质量,这主要得益于其中的褪黑素含量和抗氧化特性。
在一项随机、双盲、安慰剂对照的研究中,研究人员发现,患有慢性失眠的成年人每天喝两次酸樱桃汁后,睡眠持续性有所改善。这一结果表明,酸樱桃汁可能有助于提升睡眠的稳定性。
另一项研究发现,健康成年人饮用蒙特莫伦西酸樱桃浓缩汁后,平均睡眠时间增加了约34分钟,且睡眠效率也有所提高。这种改善可能与酸樱桃中增加的褪黑素有关。

猕猴桃和血清素
猕猴桃富含抗氧化剂、维生素(特别是维生素C和E)、叶酸以及血清素前体,这使其成为促进睡眠的理想食物。
临床研究显示,睡前1小时食用两个猕猴桃能够显著改善睡眠的开始时间、持续时间和效率,尤其对有睡眠问题的人群效果明显。
注:老年人缺乏直接的临床试验数据;基于生理差异,推测同样的摄入方案可能仍有助于改善睡眠(通过抗氧化、纤维促进肠道健康、提供血清素前体),但效果幅度可能低于年轻人。
这种积极的效果可能与猕猴桃中丰富的血清素含量有关,因为血清素能促进褪黑素的合成,从而调节睡眠周期。此外,猕猴桃的抗氧化特性可能有助于减少氧化应激,而氧化压力与睡眠障碍的发生有一定关系。
草本茶与镇静植物化合物
多种草本茶因其镇静和抗焦虑的效果而被传统使用,其中洋甘菊、缬草、薰衣草、百香果花是较常研究的几种。
洋甘菊茶富含一种叫芹菜素的类黄酮,它能与大脑中的苯二氮卓受体结合,有助于促进困倦感并减少夜间醒来的次数。
缬草根中含有缬草酸,这种成分可以调节GABA活性,从而产生镇静效果。
有系统评估的研究发现,缬草制剂与安慰剂相比显著改善了睡眠质量,尽管不同研究之间的结果存在一定的差异。
薰衣草和百香果花茶(西番莲茶)也具有抗焦虑特性,可能通过调节中枢神经系统中与压力和警觉性相关的通路来促进睡眠。
Omega-3脂肪酸与睡眠
Omega-3多不饱和脂肪酸,尤其是二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),因其抗炎和神经保护特性而受到关注。近期的研究表明,Omega-3的补充可能与改善睡眠模式有关。
在一项随机对照试验中,研究发现儿童体内DHA水平较高与睡眠干扰显著减少相关。此外,补充富含DHA的鱼油也显示出能延长睡眠时间,并减少夜间觉醒的次数。
注意:儿童研究中常使用的剂量(如 600mg DHA/天)在成人身上可能产生不同的代谢反应。此外,成人的睡眠问题往往由压力、焦虑或环境因素主导,单纯补充 DHA 的效果可能不如在发育期大脑中显著。
这些潜在机制包括调节褪黑素的分泌、减少促炎细胞因子的水平,以及稳定神经元膜,而这些都是维持健康睡眠结构所必需的因素。

EPA 和 DHA 在改善睡眠中的作用是否存在协同或拮抗效应?
多项研究同时使用 DHA 与 EPA(常以鱼油形式)进行干预,均报告了睡眠质量的改善。例如,针对 2 型糖尿病患者的 14 个月随机对照试验显示,鱼油(DHA + EPA)显著降低睡眠障碍风险、提升睡眠时长,并与血浆 DHA + EPA 水平呈正相关。
日本的研究把 DHA + EPA(约 860 mg/天)与单独 EPA(约 1260 mg/天)或单独 DHA(约 1170 mg/天)进行比较,结果显示,高剂量的 DHA + EPA 组合在提升睡眠效率和主观评价方面优于单一成分,提示两者可能产生加和或协同效应。
现有证据倾向于 EPA 与 DHA 共同补充对睡眠具有协同或至少加和的正向作用,而非拮抗。两者在调节褪黑素合成、炎症抑制以及生物钟分子(如 RORα、BMAL1)表达方面可能互补,从而共同改善睡眠质量。
甘氨酸、L-茶氨酸和CBD
新兴的营养药物作为改善睡眠的辅助疗法越来越受到重视:
甘氨酸是一种非必需氨基酸,研究表明,在睡前服用甘氨酸可以改善睡眠的主观质量并减少疲劳。甘氨酸可能通过降低体温和增强血管扩张来发挥作用,这些生理变化对于入睡至关重要。
L-茶氨酸是一种独特的氨基酸,存在于绿茶中,能够促进放松而不引起嗜睡,主要是通过增加GABA、多巴胺和血清素的水平。临床研究报告显示,L-茶氨酸补充能够提高有广泛性焦虑症的个体的睡眠质量。
CBD(大麻二酚)是一种来源于大麻植物的非精神活性成分,显示出通过抗焦虑和镇痛的作用改善睡眠的潜力。尽管初步证据支持CBD在减轻特别是与焦虑相关的失眠中的作用,但仍需进行更为严谨的长期临床试验来验证其效果。

将科学研究成果转化为可操作的饮食策略,对改善睡眠健康至关重要。随着关于特定营养素、饮食模式和生物活性化合物影响睡眠的证据日益增强,临床实践和个体健康管理中应用这些见解的机会也在增加。
睡眠健康的一般饮食建议
研究表明了一些可以推荐给大众的饮食策略,以促进更好的睡眠。
增加有助于睡眠的营养素摄入
通过均衡饮食确保摄入如镁、锌、Omega-3脂肪酸和色氨酸等关键营养素,有助于神经递质合成和昼夜节律调节。
采用抗炎饮食模式
强调地中海饮食或植物性饮食,这些饮食富含抗氧化剂、纤维和抗炎化合物,能通过减少系统性炎症和氧化应激来提高睡眠质量。
注意用餐时间
调整饮食模式与昼夜节律相吻合,例如在白天吃大餐,避免临睡前吃重餐,以优化入睡效率。
限制干扰睡眠的食物
减少晚间咖啡因、酒精和高升糖指数食物的摄入,有助于预防睡眠碎片化和干扰。
这些一般建议作为基础,但“放之四海而皆准”的方法可能无法满足个体在睡眠需求和饮食干预反应上的差异。
场景化食谱与搭配建议(仅供参考)


饮水与睡眠
在饮食干预中,液体摄入同样扮演着重要角色。水分的补给不仅影响身体的整体健康,也对睡眠质量有显著的影响。确保身体在白天的充分水分补给,对于身体性能和睡眠质量都至关重要。
补水节奏
白天补水:成年人通常需要每天摄入大约2-3升水(包括食物中的液体)。通过均匀分配全日饮水量,确保在工作和活动期间补充足够的水分。
睡前限制:在睡前2小时限制摄入液体,尤其是咖啡因和酒精饮料,以减少夜间起夜的可能性,从而保持更好的睡眠连续性。
平衡口渴与起夜的矛盾
饮水的时机和量的把控也很关键。为了平衡口渴与夜间起床的矛盾,可以采取以下策略:
-早上喝水
在一天开始时,补充70%甚至更多的日需水分,有助于唤醒身体,并提高白天的精神状态。
-定时小口喝水
可以考虑将白天的饮水分成多个小量,避免一次大量饮水。
-适当的液体选择
在喝水的同时,适当选择含电解质的液体(如椰子水、运动饮料)来补水,尤其是在炎热的天气或剧烈活动后,有助于更快速恢复水分和电解质平衡。
酒精的微醺更助眠?
很多人习惯,睡前喝上几杯更容易入眠。
这里要说明的是,虽然酒精确实能缩短入睡时间,但它可能会严重破坏快速眼动睡眠,也许并不是优质睡眠。
取而代之,睡前选择温和的茶类(如洋甘菊茶、洛神花茶、薄荷茶等无咖啡因饮品)将更有利于放松和准备入睡。
饮食与生活方式的协同作用
正念饮食
正念饮食是一种基于“正念”理念的饮食方式,强调在吃饭时保持全神贯注,关注食物的色香味,聆听身体的饥饿和饱腹信号。研究表明,进食时的情绪和心理状态不仅影响用餐体验,还会影响消化、吸收,最终影响睡眠质量。
饮食与情绪的关系
情绪状态不佳,比如焦虑、压力大或分心时,会导致以下影响:
建议
在用餐时,尽量保持放松的状态,可以采取以下措施促进正念饮食:
光照与饮食的配合
研究表明,光照与饮食的结合对维生素D的合成及身体生物钟的调节都有显著影响。
“早餐 + 晨光”的最佳组合
在早晨接触自然光可以帮助重置身体的昼夜节律,促进褪黑素和皮质醇的分泌,增强清醒状态,进而有助于晚上入睡的质量。

在早餐时,尽早接触自然光,可以进行以下实践:
睡眠障碍:个性化营养方案
个性化营养的概念是将饮食建议根据个体的生物学、遗传和生活方式因素进行调整,这为管理睡眠障碍提供了很大潜力。
遗传因素
参与昼夜节律调节(如CLOCK和PER3基因)、褪黑素生成(如MTNR1B基因)和营养代谢(如FADS1基因与Omega-3脂肪酸合成)等基因的多态性可能影响睡眠模式及对饮食干预的反应。营养基因检测可帮助识别适合特定营养素或时钟营养策略的个体。
代谢健康状况
肥胖、胰岛素抵抗和代谢综合症与睡眠呼吸暂停等睡眠障碍密切相关。针对减重和血糖控制的个性化干预可显著改善睡眠结果。
肠道菌群分析
越来越多的研究表明,肠道菌群的组成与睡眠质量之间存在显著关联。健康的肠道菌群不仅能促进消化,还通过调节神经递质的合成,影响情绪和睡眠模式。肠道菌群检测可以帮助识别个体特有的微生物特征,从而为优化干预方案提供依据。基于检测结果,个性化的益生菌或益生元治疗可以针对特定菌群进行设计,旨在改善整体睡眠质量与健康。因此,加强对肠道菌群的关注,可能是提升睡眠质量的重要策略。
生活方式和行为因素
睡眠习惯(如规律的作息、优化睡眠环境和减少临睡前的刺激性活动)、身体活动水平、压力管理和工作时间(如轮班工作)与饮食模式相互影响。个性化计划应整合这些行为因素以最大化效果。
生物钟类型(晨型人与夜猫子型)也会改变对用餐时间的代谢反应。个性化方法结合遗传、肠道菌群、代谢分析和生活方式因素,可以为特定睡眠障碍(如失眠、睡眠呼吸暂停和延迟睡眠相位综合征)提供精准的饮食推荐。
未来个性化工具:可穿戴设备和数字健康
技术进步使得可穿戴睡眠追踪器、数字饮食日志和基于机器学习的预测模型得以应用于高度个性化和动态的营养-睡眠程序。可穿戴设备能够实时监测睡眠指标,为饮食调整提供即时反馈。数字健康平台也可以整合遗传、代谢和生活方式数据,生成个性化、适应性的营养推荐。
在改善睡眠质量的过程中,饮食调整是一种有效的干预方式。同时,借助肠道菌群检测,可以更深入地了解自身状态,从而在营养干预上做出更加明智的决策。
将个性化营养与肠道菌群的研究相结合应用于睡眠医学,不仅有助于提高个体效果,也有助于通过尽早识别高风险人群并积极干预,为广泛人群制定有效策略。
本文内容主要集中在睡眠问题的营养干预措施,此外,还有中草药方面的介入措施,详细信息请参见我们之前撰写的文章。
主要参考文献
Abou-Khalil R. Nutritional Interventions for Enhancing Sleep Quality: The Role of Diet and Key Nutrients in Regulating Sleep Patterns and Disorders. Food Sci Nutr. 2025 Dec 4;13(12):e71309.
Sejbuk M, Siebieszuk A, Witkowska AM. The Role of Gut Microbiome in Sleep Quality and Health: Dietary Strategies for Microbiota Support. Nutrients. 2024 Jul 13;16(14):2259.
Bautista J, Hidalgo-Tinoco C, Di Capua Delgado M, Viteri-Recalde J, Guerra-Guerrero A, López-Cortés A. The gut-brain-circadian axis in anxiety and depression: a critical review. Front Psychiatry. 2025 Oct 30;16:1697200.
Minari TP, Pisani LP. Unraveling the connection between the Mediterranean diet and sleep health: from biological mechanisms to clinical implications. Sleep Breath. 2025 Nov 28;29(6):369.
Zhao D, Zou B, Do QL, Wu SK, Shen Y, Yang Y, Kang JX, Su KP, Wang B. Circadian rhythms and gut microbiota Dysbiosis: emerging gut-brain axis pathways in insomnia pathophysiology and Therapeutics. Brain Behav Immun. 2025 Nov 30;132:106203.
BaHammam AS, Pirzada A. Timing Matters: The Interplay between Early Mealtime, Circadian Rhythms, Gene Expression, Circadian Hormones, and Metabolism-A Narrative Review. Clocks Sleep. 2023 Sep 6;5(3):507-535.
Chaput JP, McHill AW, Cox RC, Broussard JL, Dutil C, da Costa BGG, Sampasa-Kanyinga H, Wright KP Jr. The role of insufficient sleep and circadian misalignment in obesity. Nat Rev Endocrinol. 2023 Feb;19(2):82-97.

谷禾健康
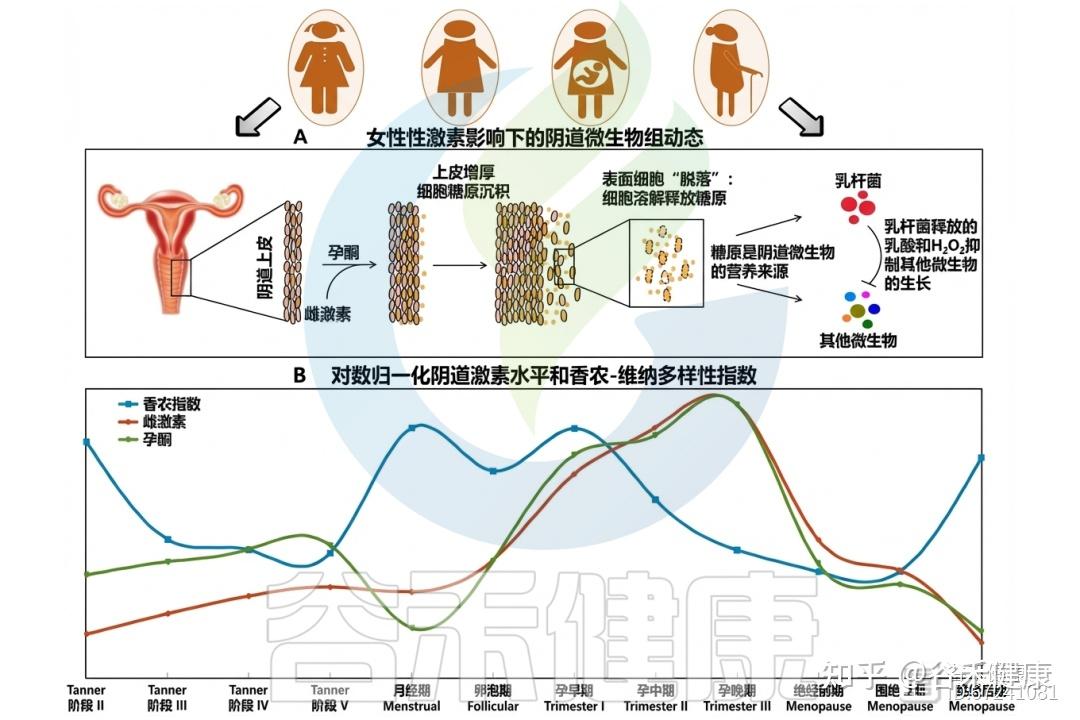
阴道是一个复杂的动态环境,会随着女性生命阶段的变化而不断调整,对于青春期、育龄期(包括未怀孕、产前和产后)及更年期的健康至关重要。
阴道微生态具有独特的特征,如糖原和黏蛋白含量高、pH值低、细胞免疫活跃,以及影响复杂微生物群的激素信号波动。例如,雌激素影响阴道上皮的屏障功能和糖原可用性,而糖原分解在塑造阴道微生物群中发挥关键作用。同时,激素调节粘液分泌,增强对病原体的抵抗力,而黏蛋白又为阴道微生物提供附着基质和营养来源。
尽管传统上认为阴道微生物群主要由乳杆菌主导的五种典型群落状态(CST I–V)构成,但新兴研究突出了微生物群的多样性,包括共生微生物和潜在致病微生物,同时揭示了阴道微生物群的时空动态。最近提出的27种宏基因组CST(mgCST)为潜在群落功能提供了关键线索,使研究重点从“有哪些微生物”转向“它们在做什么”。
本文采用生态系统视角,探讨阴道黏膜、微生物群、宿主及环境因素之间的多维关系。重点分析激素如何影响阴道微生物群及环境变化,强调月经周期中微生物群落的动态特征,以及阴道环境变化对定植抵抗力的影响。不同的阴道生态失调状态与乳杆菌丰度及微生物多样性变化密切相关。
此外,我们还将研究阴道中微生物与免疫细胞的相互作用,探讨免疫系统如何调节局部环境。通过宿主与驻留微生物之间的反馈循环,提升对阴道健康与疾病的理解。这些复杂相互作用的理解对于推动女性阴道健康至关重要。
众所周知,生殖激素信号传导可以驱动生理和环境变化,从而在塑造阴道微生物组方面发挥关键作用。
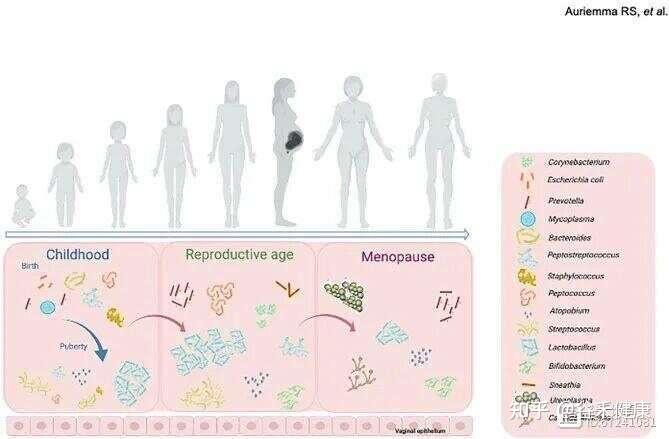
女性一生中阴道微生物群组成的变化
月经周期包括月经期、卵泡期(增殖期)、排卵期和黄体期,其特征是雌激素、孕激素、黄体生成素及促卵泡激素的波动,这些激素共同调控子宫内膜增厚及卵子释放。
阴道环境对月经周期及整个生殖生理过程中的荷尔蒙变化高度敏感,激素水平的波动会影响泌尿生殖系统对感染的抵抗力或易感性。宿主激素与微生物的相互作用构成了“微生物内分泌学”的研究基础,用以揭示激素对细菌生长与毒力的影响。本节将探讨激素分泌背景下阴道黏膜的变化,并分析其对营养供给、屏障功能及微生物群落结构的影响。
月经影响营养供应和阴道微生态稳定
月经期间,阴道微生物群发生显著变化,细菌多样性和丰富度增加。虽然这些变化源于月经期的生理波动,但个体差异明显。
据此,研究提出了四种阴道群落动力学(VCD),用于描述月经周期中微生物群的时间变化。VCD基于“稳定共生”与“持续失调”的特征,其中超过80%的日常样本分别由卷曲乳杆菌(Lactobacillus crispatus)、詹氏乳杆菌(Lactobacillus jensenii)、惰性乳杆菌(Lactobacillus iners)或高多样性群落占主导。低于80%生态阈值的个体则归为“不稳定”群落亚组。
另有约12%个体形成“月经相关失调”亚组,其益生性群落在增殖期、排卵期和黄体期占主导,而月经期间出现可检测的生态失调。
◮ 月经期乳杆菌减少,微生物稳定性较差
其他研究亦观察到月经期乳杆菌减少、菌群多样性上升。在一项为期16周、涉及32名育龄女性的纵向研究中,月经被认为与最低的微生物群稳定性相关,部分个体出现由卷曲乳杆菌主导向惰性乳杆菌或链球菌主导转变的现象。
这些变化可能源于糖原沉积减少及经血流入的影响。血液中的血红素铁可促进L.iners生长,从而取代L.crispatus优势;与此同时,碱性血液流入使阴道pH升至7.2–7.4,进一步改变微生物生态。这种环境转变促使金黄色葡萄球菌、链球菌等机会致病菌的短暂定植,以及细菌性阴道病(BV)相关菌如加德纳菌、普雷沃氏菌、Fannyhessea vaginae、Sneathia amnii、微小脲原体、Veillonella montpellierensis与消化链球菌等的增长。
目前尚无证据表明微生物多样性的变化仅由单一因素——如铁、糖原或pH变化——直接驱动。更可能的是,激素波动、营养变化及血流剪切力共同作用,塑造了月经期阴道微生态的动态特征。
注:血流剪切力是指血液流动时对血管内皮细胞产生的摩擦力,是影响血管功能和结构的重要机械力。
月经激素信号影响阴道微生态
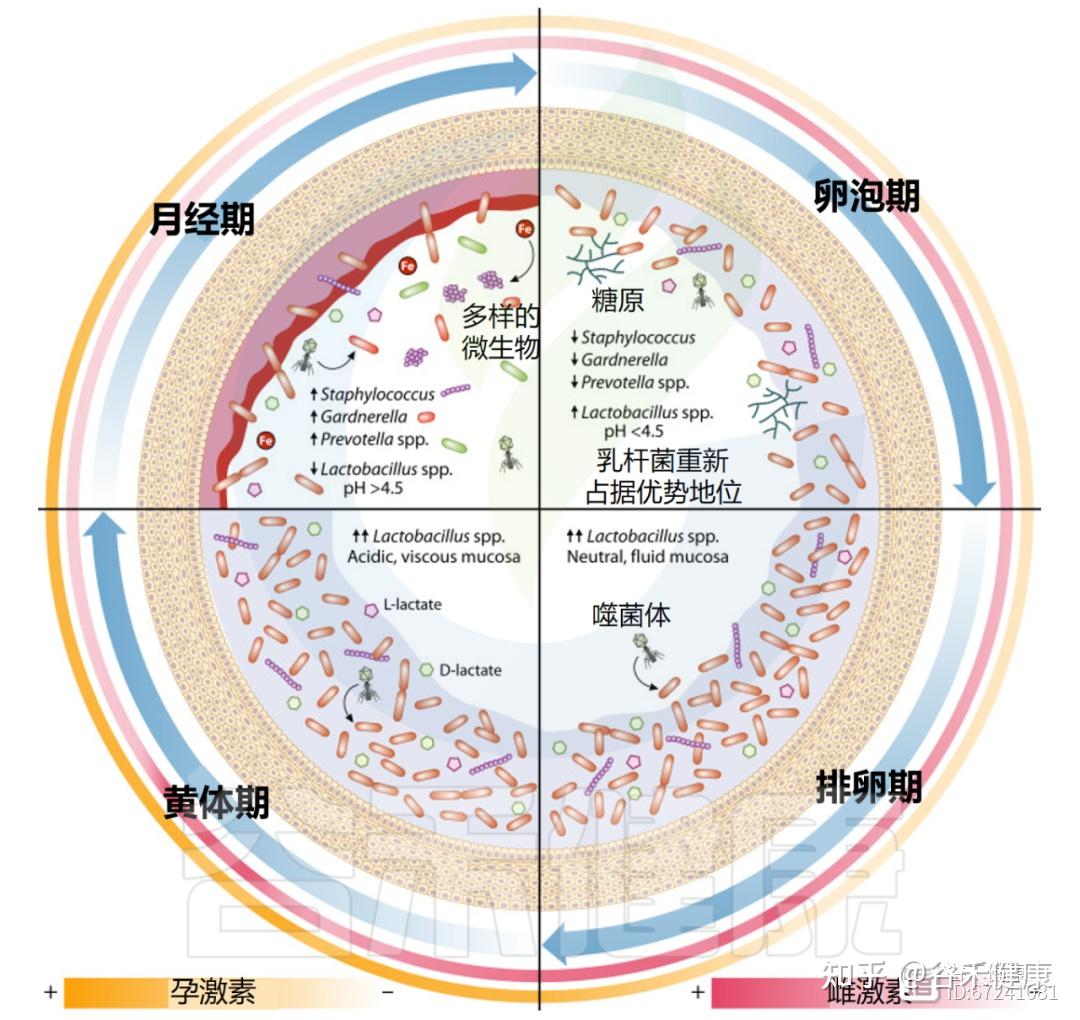
增殖期:影响上皮屏障与糖原可用性
月经期普雷沃氏菌和加德纳菌的增多可延续至增殖期初,此时雌激素水平仍较低;而在卵泡晚期至排卵前,雌激素达到峰值,与乳杆菌重新占优势相吻合。
◮ 雌激素影响阴道上皮屏障与糖原可用性
雌激素的作用超越月经周期,在青春期其分泌上升,促使阴道上皮成熟增厚,形成由富含糖原的多层细胞构成的屏障。顶层细胞周期性脱落,释放糖原至阴道腔内。卵泡晚期乳杆菌优势的恢复与糖原可用性增加密切相关,并在整个黄体期保持稳定。
雌激素和乳杆菌属
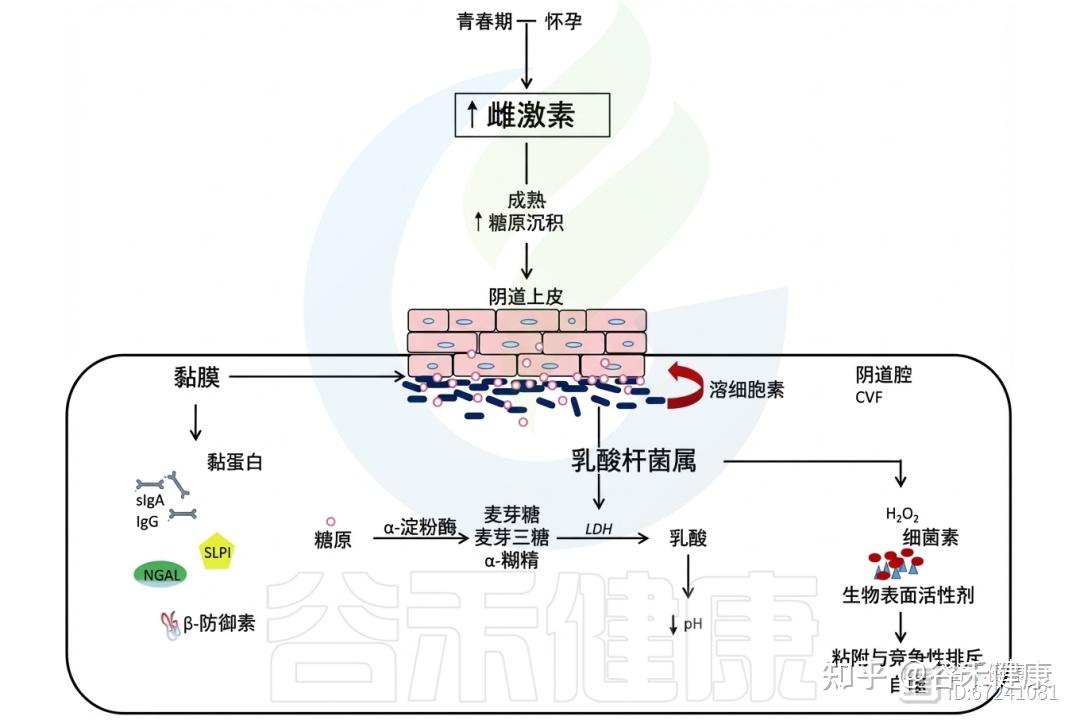
糖原是一种由α−1,4和α−1,6糖苷键组成的复杂分子,其在阴道中的浓度随月经周期波动且个体差异明显。有学者提出阴道乳杆菌可能将糖原作为碳源。然而,由于糖原结构复杂,微生物无法直接吸收,需经细胞外酶分解为糊精、麦芽糖、麦芽三糖等可利用的小分子糖,形成供微生物共享的“公共资源”。
阴道液中含有宿主和微生物来源的糖原水解酶,如α-淀粉酶和支链淀粉酶,分别裂解α−1,4和α−1,6糖苷键,其中宿主α-淀粉酶在阴道腔与宫颈内膜中含量丰富。
◮ α-淀粉酶有助于维持乳杆菌主导的环境
糖原的微生物利用最初被认为主要由保护性的乳杆菌完成,多项研究发现糖原水平、乳杆菌丰度及低阴道pH值之间存在正相关。但并非所有乳杆菌株都能利用糖原。
最新研究表明,各类阴道群落状态(CST)样本中均存在编码糖原降解酶的细菌基因,显示糖原可作为共生菌和病原菌在定植或感染期间的能量来源。研究发现,乳杆菌丰富的阴道样本中α-淀粉酶水平较高,而在乳杆菌减少或患有细菌性阴道病(BV)的个体中则显著降低,提示α-淀粉酶的产生有助于维持乳杆菌主导的环境。
相反,另一研究发现,当L.iners取代L.crispatus成为主要菌时,孕早期阴道分泌物中α-淀粉酶水平提高约5.4倍,可能反映宿主为恢复L. crispatus优势和稳定微生物群所作的代偿性反应。
◮ 糖原分解在塑造阴道微生物群中发挥关键作用
除乳杆菌外,阴道中的其他共生或致病微生物,如加德纳菌、无乳链球菌、白色念珠菌和阴道毛滴虫,也能表达糖原降解酶,这表明糖原分解对多种菌群的代谢至关重要。
值得注意的是,不同微生物的糖原酶在不同pH条件下活性最强:部分在低pH下最优,适应乳杆菌占优势的环境;而另一些则在pH 6–7的较中性环境中活跃。这意味着不同菌种可在月经周期或微生态失调等条件变化时,灵活利用糖原。
糖原降解酶的分泌还促进了“营养交叉喂养”,使无法直接分解糖原的菌种(如粪肠球菌)能利用分解产物生存。
尽管糖原可用性显然在塑造阴道微生物群结构与功能中发挥了关键作用,但其具体机制仍存在重要知识空白。进一步研究糖原供给与群落动态的因果关系,以及探明糖原是促进乳杆菌生长的驱动力,还是乳杆菌优势反过来维持糖原丰富的上皮屏障,将有助于全面理解糖原代谢对阴道健康的深远影响。
排卵期和黄体期:影响阴道粘膜屏障
排卵发生在增殖期雌激素激增之后,标志着黄体期的开始,其特点是黄体酮升高和雌激素的低次级峰值。
此阶段的激素变化显著影响阴道黏膜屏障的物理特性。该屏障由富含无机离子、防御素和免疫球蛋白的黏蛋白糖蛋白水凝胶组成,统称宫颈阴道黏液(CVM)。黏蛋白分为表面锚定型和分泌型,两者均高度O‑糖基化,形成带负电的大分子屏障。阴道及宫颈外上皮细胞主要表达MUC1和MUC16,而宫颈内皮与杯状细胞分泌MUC5B、MUC5AC及MUC6。
尽管MUC4在宫颈内高表达,近期蛋白质组学研究仅检测到MUC1和MUC16,未发现MUC4肽,其在CVM中的作用仍不明确。
阴道微生物组对女性性激素的反应
◮ 激素影响粘液的分泌量调节抵抗病原体能力
在排卵期,雌激素促使MUC5B分泌增加,使黏液稀薄、水样且pH更中性,有利于精子穿透。至黄体期,黄体酮上升使黏液减少,质地变黏稠、带负电,形成“黄体酮效应”,强化屏障功能,防御病原体入侵。CVM中含IgG,可抑制HIV‑1运动,其中以L.crispatus为主的群落较L. iners或失调型更具抗病毒力。
此外,噬菌体被发现可附着于黏膜表面,进一步阻止病原体定植。妊娠期,MUC5B与MUC5AC形成宫颈黏液栓,将富菌阴道环境与无菌子宫隔离,并富含抗菌肽(乳铁蛋白、溶菌酶、钙卫蛋白)、免疫球蛋白及具防御性的黏弹性结构。在小鼠模型中,缺失Muc5B会削弱屏障功能,增加感染与早产风险。
◮ 黏蛋白为阴道微生物提供附着基质和营养来源
黏液除了充当感染屏障外,还为阴道微生物提供附着基质和营养来源。无乳链球菌(S.agalactiae)和粪肠球菌(E.faecalis)通过表达可直接结合黏蛋白的菌毛结构,增强在阴道及肠道的定植能力。
同样,许多葡萄球菌和乳杆菌也能结合黏液,乳酸菌(LAB)中特有的黏蛋白结合结构域被认为参与黏液的附着或降解。感染后,黏蛋白及杯状细胞分泌通常上调,依赖NF‑κB信号通路,是维持黏膜屏障的先天免疫反应。
然而,部分微生物在长期适应过程中进化出可降解黏蛋白糖链、用于营养获取的糖苷酶。在阴道环境中,此类酶(如葡萄糖苷酶)的活性主要见于细菌性阴道病相关病原体,它们会破坏黏膜屏障,降低其黏度并增加感染风险。
◮ 细菌性阴道炎或菌群失调会影响酶活性
研究一致发现细菌性阴道炎女性中糖苷酶和唾液酸酶活性升高,而宏转录组分析显示CST IV群落患者的唾液酸酶表达最强。这种与细菌性阴道炎或菌群失调相关的酶活性增加,会导致N和O连接糖链耗竭,削弱黏膜屏障完整性并加剧炎症。
唾液酸酶主要由Gardnerella和Prevotella属产生,但近期研究发现其转录本在所有阴道CST类型中均较高,提示其作用可能超越病原入侵,参与群落代谢调控。支持这一观点的证据包括唾液酸酶促进微生物群共生与营养交互,如梭杆菌的唾液酸酶产物促进G. vaginalis生长与阴道定植。
类似的黏蛋白分解产物交叉喂养机制在肠道中更为常见,如Akkermansia muciniphila以黏液为主要营养源,分泌多种唾液酸酶和岩藻糖苷酶,助长与产丁酸梭菌的共生;双歧杆菌产生的唾液酸酶同样推动其与其他肠道双歧杆菌的共代谢。
阴道中,A.muciniphila与S.agalactiae的共栖可增强后者的持久性,代谢模型显示两者存在潜在的营养交换,但这种互作究竟源于免疫调节、物种交流或代谢互馈仍需进一步研究。
产后与绝经激素波动影响微生物群
◮ 产后和绝经后雌激素变化影响阴道微生物群结构
产后和绝经后阶段虽是关键的生理时期,却仍是生殖健康研究的薄弱环节。产后数天内雌激素水平急剧下降,常伴随出血、子宫收缩和疲劳等症状。更年期通常发生于45岁后,表现为雌激素分泌减少、月经不规律、阴道干燥及感染易感性增加。
这两个阶段雌激素下降均会削弱乳杆菌的优势。产后阴道微生物群常向多样化状态转变,L. iners、F. vaginae、G. vaginalis、Finegoldia magna和Prevotella spp. 等菌种显著富集,部分个体在分娩后一年的微生物组仍保持高多样性。同样,在绝经后,雌激素与黄体酮减少导致乳杆菌丰度下降,而无乳链球菌、表皮葡萄球菌及丙酮棒状杆菌等细菌性阴道病(BV)相关菌增多。
激素替代疗法是绝经后常用的治疗手段,可促使上皮成熟、提高碳水化合物供应以支持天然微生物群,并降低微生物多样性。然而,仍然需要更多研究扩大我们对这些人群阴道健康的理解。
阴道菌群CST分型最初源于对来自育龄女性进行16S rRNA测序的分析。结果确定了五种典型群落状态(CST I–V):CST I以L.crispatus为主,II、III和V分别以L. gasseri、L.iners和L.jensenii为主;CST IV则呈高度多样性,以Prevotella、Dialister、Fannyhessea、Gardnerella、Megasphaera、Peptoniphilus、Sneathia、Eggerthella、Aerococcus、Finegoldia和Mobiluncus等厌氧菌为特征。

乳杆菌优势群落通常具保护作用,惟CST III(以L.iners为主)被认为是一种过渡状态,反映阴道微生物群在健康、亚健康及细菌性阴道病(BV)状态间的动态变化。
阴道微生物群落在不断变化
随着新技术的应用与研究视角的拓展,CST分类体系不断完善。VALENCIA工具通过样本相似性对群落进行分层,将原有五类CST扩展为多级结构,提升分辨率,涵盖高、低丰度的特征物种及复杂混合群落的细节。
另一项研究采用混合成员主题模型分析群落结构,结合纵向变化探讨妊娠影响并识别亚群落。基于孕期与非孕期的大规模阴道拭子样本,共确定九种亚群落,其中四种以乳杆菌(L. crispatus、L. jensenii、L. iners、L. gasseri)为主,其余五种为非乳杆菌群落,富含链球菌、Prevotella、Gardnerella、Corynebacterium、Fannyhessea vaginae和Finegoldia等。
◮ 阴道菌群分型有助于动态平衡与功能多样性
宏基因组学和宏转录组学的进展促进了物种水平的功能解析,更深入揭示了阴道微生物群的时空动态。最新提出的27种宏基因组CST(mgCST)为潜在群落功能提供了关键线索,使研究焦点从“有哪些微生物”转向“它们在做什么”。
尽管CST方法在特定时点揭示了群落结构特征,但其静态视角限制了对动态变化和多样性的理解。为此,提出基于CST并结合纵向采样的VCD系统,以反映月经周期中细菌与噬菌体群落的协同变化。研究发现,“持续稳态”多与CST I和V(>80%检出率)相关,而“持续失调”则常见于CST III和IV。
阴道微生物组与健康及疾病状态关系
VCD分析进一步显示,不稳定或月经期失调状态下大肠杆菌丰度为稳态群落的两倍,且S. agalactiae、L. iners和U. parvum在这些状态中更为丰富。噬菌体鉴定显示,“稳态”个体的噬菌体丰度较其他类型高出约10倍,尽管群落多样性较低。这些研究为理解阴道微生态的动态平衡与功能多样性提供了新视角。
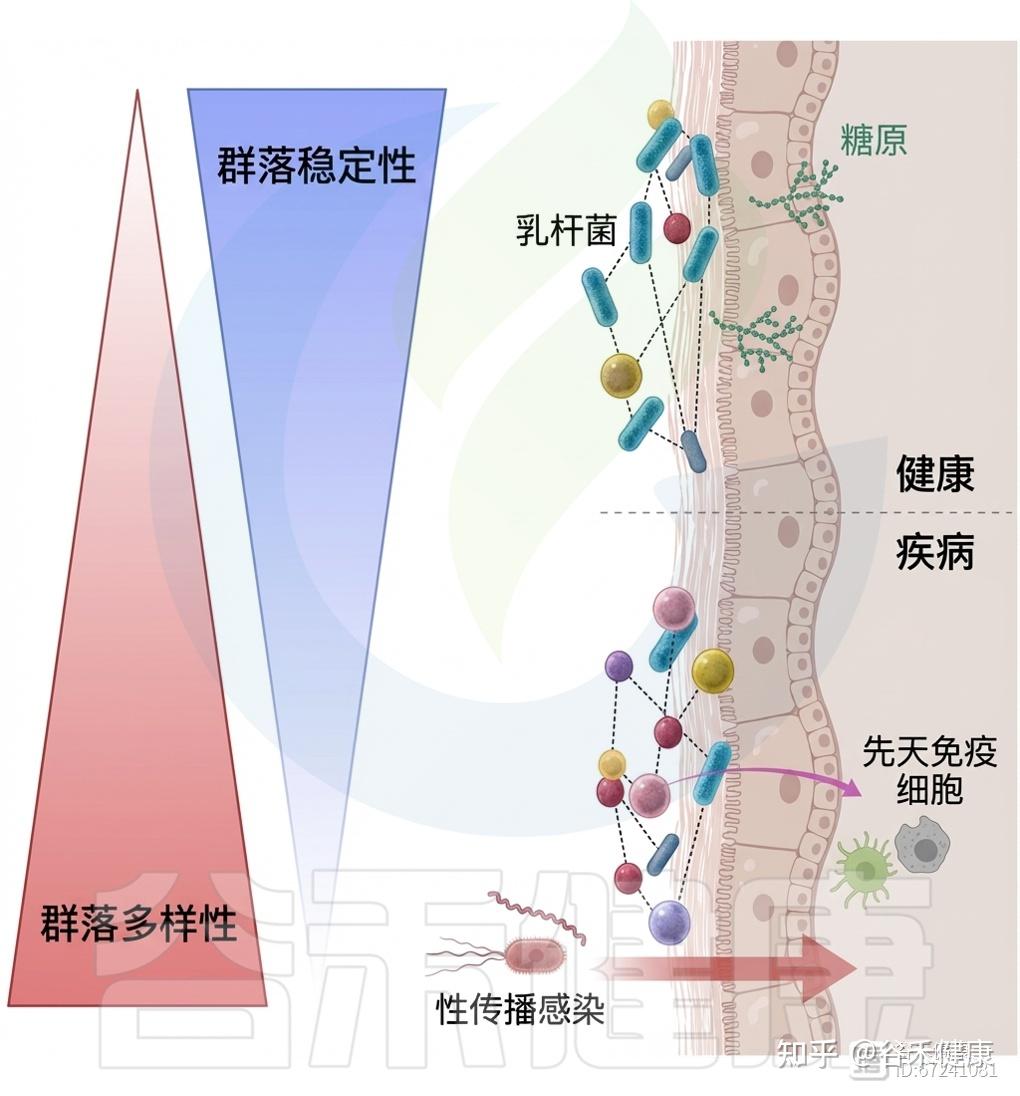
定植抗性:乳杆菌的保护作用
阴道低pH主要源于宿主与微生物共同将葡萄糖和糖原发酵为乳酸,从而使环境酸化。除上皮细胞产生的L-乳酸外,研究表明D-乳酸占阴道乳酸的大部分。
◮ 乳杆菌降低pH并增强黏膜屏障,形成保护环境
乳酸是乳酸菌(LAB)糖发酵的主要代谢产物,其中L. crispatus、L. gasseri和L. jensenii可产生高水平D-乳酸,而L. iners因缺乏D-乳酸脱氢酶而不具此能力。
微生物来源的乳酸通过降低pH并增强黏膜屏障,形成有利于乳杆菌定植、抑制其他细菌生长的保护性环境,是定殖抵抗的重要机制之一。然而,有研究发现,当pH升高时,乳酸对致病性厌氧菌不具显著抑制作用,提示乳酸产量与环境酸化对维持阴道定殖抵抗至关重要。
◮ 阴道pH变化可能是微生物群落失调的重要指标
阴道pH变化被视为细菌群落失调的重要指标之一,pH升高(>4.5)常与加德纳菌、普雷沃菌属和Sneathia等厌氧菌的增殖相关。能降解阴道带负电黏膜屏障的细菌可能削弱黏液层,从而导致pH升高。
此外,月经周期同样影响阴道pH,因糖原可用性、黏膜完整性及碱性经血的共同作用,短暂的pH升高可能促进潜在致病菌生长。通常,乳杆菌占优势时阴道pH < 4.5,但近期研究发现相当比例的乳杆菌型mgCST个体出现酸化减弱。
具体而言,L. crispatus的宏基因组亚型mgSs2与pH > 4.5相关,推测与第二种D-乳酸脱氢酶缺失有关。在包含1890个样本的研究中,16/27 mgCST以乳杆菌为主,但仅31%的样本pH < 4.5,69%的样本pH > 4.5,提示临床上存在不同程度的菌群失调。
部分乳杆菌可产生细菌素和过氧化氢,有助于定殖抵抗,但最新证据表明阴道中过氧化氢水平有限,其抗菌作用可能主要来自酸性环境或其他尚未明确的机制。
阴道生态系统在健康状态下维持着以乳杆菌为主的动态平衡,其低pH和代谢环境可有效抑制致病菌生长。然而,当这种平衡受到破坏时,便会出现不同类型的生态失调状态。常见的失调形式包括细菌性阴道炎(BV)、需氧性阴道炎(AV)、外阴阴道念珠菌症(VVC)、细胞溶解性阴道炎(CV)等。
这些状态常伴随乳杆菌减少、病原菌或真菌过度生长、阴道pH升高及黏膜防御功能减弱。阴道生态失调不仅影响局部微生物群结构和生理功能,还与性传播感染、高危妊娠及宫颈病变等一系列不良健康结局密切相关。因此,识别并理解不同类型的阴道生态失调及其微生态机制,对女性生殖健康的维护具有重要意义。
细菌性阴道炎(BV)
细菌性阴道炎(BV)是生育年龄女性中最常见的阴道炎类型,全球患病率为23%–29%。细菌性阴道炎与乳杆菌属数量偏低以及厌氧细菌过度繁殖有关,这些细菌来自阴道加德纳菌(Gardnerella)、普雷沃菌属(Prevotella)、Sneathia、动弯杆菌属(Mobiluncus)、Fannyhessea和Finegoldia等属。
携带细菌性阴道炎相关微生物的个体感染性传播感染(STI)和艾滋病病毒(HIV)、不良妊娠结局及宫颈发育不良的风险增加。虽然不建议孕期常规筛查细菌性阴道炎,但荟萃分析显示,阳性患者早产风险是正常孕妇的两倍,自然流产风险高出九倍。
◮ 短链脂肪酸在细菌性阴道炎中增加可能有害
细菌性阴道炎的特征是管腔内乳酸减少,短链脂肪酸(SCFAs)丰度增加,这些脂肪酸通常由微生物群中的厌氧成员通过发酵和氨基酸分解产生。肠道中的SCFAs已被证明具有抗炎作用;然而,近期研究表明,SCFA暴露(代表BV相关代谢产物)会诱导阴道上皮中促炎细胞因子的产生,并降低上皮屏障完整性。
研究还表明,肠道中的SCFA增加了罗伊氏乳杆菌(Lactobacillus reuteri)对原噬菌体元件的诱导。长链脂肪酸(LCFAs)在哺乳动物黏膜表面很常见,并已在从阴道腔采集的拭子样本中检测到。体外研究表明,LCFAs,特别是油酸,可以抑制L.iners及其他BV相关细菌的生长,并可能促进L.crispatus及其他有益乳杆菌的生长。
这些数据表明,长链脂肪酸和脂肪酸代谢可能作为阴道群落结构的潜在驱动因素发挥重要作用。
需氧性阴道炎(AV)
与细菌性阴道炎(BV)不同,阴道群落也可能被需氧性机会性病原体主导,这些病原体导致促炎标志物如白介素(IL)-6的增加,这种情况称为需氧性阴道炎(AV)。
◮ 大肠杆菌、无乳链球菌等可以成为需氧性阴道炎的病原体
需氧性阴道炎(AV)的患病率低于BV,仅占总人口的7%至12%。与Nugent评分用于BV诊断类似,AV诊断采用湿式相位对比显微镜评分系统。诊断标准依据乳杆菌的存在、炎症细胞的数量和上皮的形态。
AV最常见的病原体包括大肠杆菌(E.coli)、无乳链球菌(S.agalactiae)、粪肠球菌(E.faecalis)、肺炎克雷伯菌(Klebsiella pneumoniae)、凝血酶阴性葡萄球菌(如表皮葡萄球菌)和金黄色葡萄球菌。
外阴阴道念珠菌症(VVC)
念珠菌属,主要是白色念珠菌,是阴道微生物群中最常见的真菌之一,像许多细菌一样,可以作为共生菌在基础层面存活。念珠菌的过度生长可能引发外阴阴道念珠菌症(VVC),其症状包括阴道酸痛或不适、阴道瘙痒及异常分泌物。
◮ 阴道微生态失衡引起念珠菌过度生长
与阴道微生物群的其他成员一样,环境因素和群落动态会影响念珠菌的生长,其相互作用往往由乳杆菌及宿主因素驱动。例如,乳杆菌形成的生物膜有助于维持念珠菌的共生酵母状态,而非致病的菌丝形式。
尽管VVC及念珠菌对免疫系统的影响已有充分研究,但共生真菌在阴道微生物组中的具体作用仍需进一步探索。
细胞溶解性阴道炎(CV)
◮ 乳杆菌过度生长和乳酸水平过高也不健康
细胞溶解性阴道病(CV)是由乳杆菌过度生长和乳酸高于正常水平引起的,主要由卷曲乳杆菌(L.crispatus)引起。CV表现出类似的症状,经常被误诊为VVC,导致治疗不当,往往导致持续的症状。
细胞溶解性阴道病是一种有趣的病理学,表明群落平衡是生态平衡的一个更重要的因素,而不是纯粹的乳杆菌优势。
治疗阴道炎的方法
对有症状的细菌性阴道炎(BV)和好氧性阴道炎(AV)患者,推荐的治疗方法是使用处方抗生素。虽然抗生素通常是首选治疗,但滥用可能破坏阴道内细菌的自然平衡,影响致病菌和有益菌,增加对继发感染(如外阴阴道念珠菌症)的易感性。
◮ 通过微生物干预也有助于治疗阴道疾病
因此,已提出使用鼠李糖乳杆菌(Lactobacillus rhamnosus)或卷曲乳杆菌(L.crispatus)菌株的益生菌作为BV的替代治疗方案,以及选择性靶向BV相关微生物的重组噬菌体衍生内溶素。
对于细菌性阴道炎、好氧性阴道炎和细胞溶解性阴道炎是否应视为传染病,或其细菌群落状态是否是正常波动,仍存在不同意见。一些讨论建议对根据Amsel标准或Nugent评分被诊断为临床BV的患者,尤其是那些表现出可变或不一致症状的患者,进行更多关注,甚至对无症状但可检测到的细菌物种(如G. vaginalis)进行干预。
随着研究进展,应继续探讨这些问题,特别是在无症状个体的“生态失调或非最佳”微生物群落中引入抗生素时。
拓展:阴道环境中未充分研究的微生物
我们目前对阴道微生物群落的理解主要由优势物种定义。然而,在大型数据集中,稀有丰度物种的代表性通常较差,或被归为“其他”类别。关键物种生态的概念是阴道微生物组领域的一个新兴而未充分研究的方向,表明低丰度物种可能对微生物群落产生与其丰度不成比例的影响。
◮ 一些低丰度物种可能在阴道生态中起重要作用
近期的研究开始关注这些低丰度物种对阴道生态系统的重要性。例如,A. muciniphila促进无乳链球菌的定植并可能影响出生结果;奇异菌科(atopobiaceae)及Fannyhessea vaginalis在宫颈癌患者中常见,并与癌症免疫生物标志物增加相关;Sneathia与西班牙裔个体的宫颈癌和HPV发病率升高有关;Mobiluncus mulieris的细胞外囊泡刺激阴道和宫颈细胞中促炎细胞因子的产生;F.magna则被证明能激活中性粒细胞并触发中性粒细胞外陷阱(NET)释放等。
注:除了在性传播感染之外的阴道中发现的低丰度细菌种类外,栖息在这种环境中的病毒经常被忽视,尽管它们可能在阴道中发挥着重要作用。
◮ 噬菌体可能是阴道微生态的重要组成部分
研究评估阴道病毒组表明,只有4%-6%的总读数属于真核病毒,其余的94%-96%与噬菌体对齐。这些临床研究揭示了细菌与其在阴道中各自噬菌体之间的关联,表明噬菌体群落的组成是细菌性阴道炎(BV)的重要预测因子,并将特定噬菌体(如芽孢杆菌病毒Camphawk和Pony)与BV诊断联系起来。
噬菌体的分类与环境中宿主细菌的存在密切相关,已发现低噬菌体多样性与乳杆菌优势群落相关,而高噬菌体多样性则与非乳杆菌优势相关。
另一项研究指出,妊娠中期阴道中的噬菌体来自乳杆菌、链球菌、葡萄球菌和大肠杆菌,而非BV相关微生物,但特定噬菌体家族与CST之间并无联系。尽管噬菌体与阴道细菌群落之间存在某种关联,但尚不清楚噬菌体是否驱动了细菌群落的变化,或者特定噬菌体的存在是否仅是变化的伪影。
未来的研究,包括对阴道微生物组的纵向采样,将有助于阐明病毒与细菌群落之间的动态关系。
阴道具备一个强大的免疫细胞库,这些免疫细胞在维持阴道内环境的平衡和健康方面发挥着显著作用。这个多样化的细胞库不仅能够识别和应对潜在的威胁,还能够有效地影响炎症反应和免疫功能。
宿主免疫细胞与阴道炎症反应
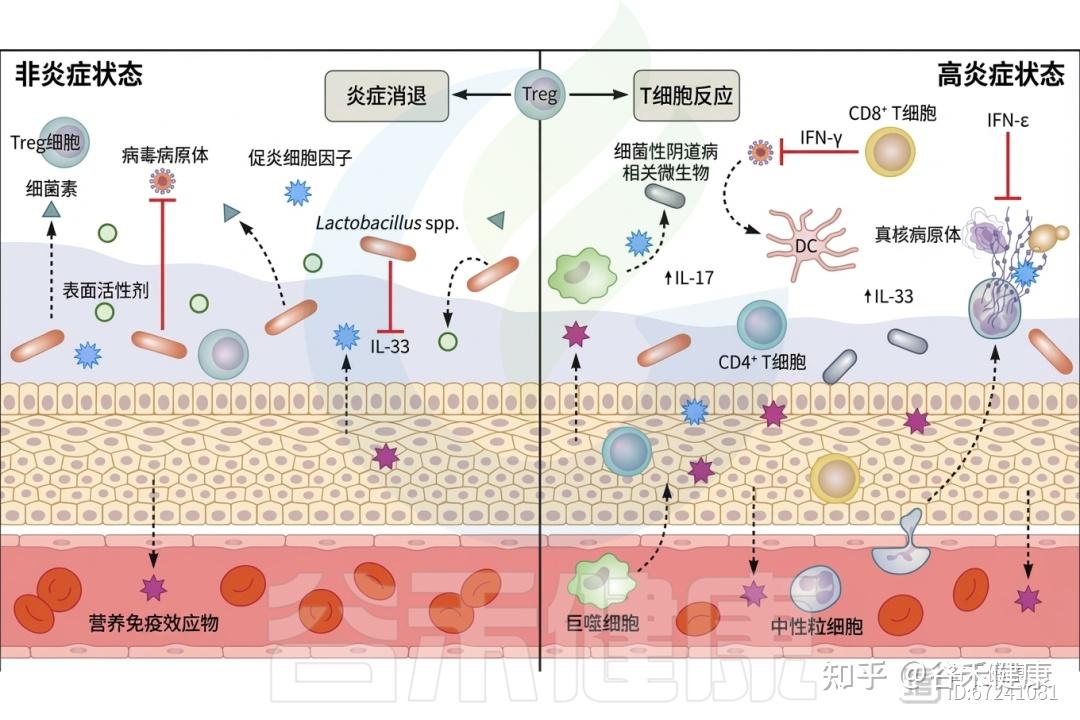
T细胞占比较高
其中CD8+ T细胞和CD4+ T细胞占阴道白细胞的50%。T细胞主要在性传播感染的研究中受到关注。CD8+组织驻留记忆淋巴细胞负责监测病原体入侵,并在识别后释放干扰素γ(IFN-γ),启动免疫细胞的招募。
◮ 调节性T细胞是阴道免疫稳态的关键参与者
调节性T细胞(Treg)是参与适当免疫反应启动的重要细胞,能够成功招募T细胞、自然杀伤细胞和树突状细胞(DC)。Treg在监测阴道炎症中发挥关键作用,激活后可抑制炎症细胞因子的产生、分泌抗炎性IL-10,并产生颗粒酶B,这是一种丝氨酸蛋白酶,有助于控制免疫相关的组织损伤和促进炎症消退。HIV阳性个体的Treg数量减少,伴随炎症粘膜(Tim)CD8+ T细胞的扩张,从而加剧阴道环境中的炎症。
此外,细菌性阴道炎(BV)阳性个体的Th17细胞中检测到了与BV阴性个体相比的T细胞功能变化和促炎标志物表达增加。这些慢性炎症状态会增加对性传播感染和BV等继发感染的易感性,以及感染HIV的风险。
其他免疫细胞
其他白细胞,如中性粒细胞、单核细胞、巨噬细胞和树突状细胞(DC),也在调节阴道免疫中发挥协同作用。
◮ 中性粒细胞具备多种杀菌机制
在阴道病原体入侵过程中,中性粒细胞通常是首批被招募的免疫细胞,具备多种杀菌机制,包括脱颗粒、吞噬作用和NETs的形成。NETs可以捕获病原体,其形成(NETosis)是针对病毒、真菌和寄生虫阴道感染的反应。
从非乳杆菌主导的阴道微生物群个体采集的宫颈阴道拭子和灌洗液中发现,促炎细胞因子和中性粒细胞相关标志物丰度增加,而闭留蛋白和去雾化素-1表达减少,反映出上皮屏障的完整性降低。
在直接实验中,感染BV相关微生物M.mulieris和G.vaginalis的小鼠中,观察到中性粒细胞招募和激活增加。
◮ 阴道微生物群影响抗原呈递细胞的活化
抗原呈递细胞(APC),如巨噬细胞、树突状细胞(DCs)和朗格汉斯细胞(LCs),在调控阴道免疫应对病原体方面发挥着重要作用。
阴道微生物群落影响巨噬细胞的极化, 厌氧消化链球菌(Peptostreptococcus anaerobius)促进抗炎的M2极化;而在孕小鼠中,白色念珠菌则驱动胎盘巨噬细胞的促炎M1极化,可能增加与念珠菌病相关的不良妊娠结局风险。
树突状细胞(DCs)的成熟是通过模式识别受体的信号激活而实现的,暴露于细菌性阴道病(BV)相关细菌或从BV患者采集的宫颈阴道灌洗后,DC的激活明显高于健康个体。然而,DC的活化并不针对所有阴道微生物,暴露于L.crispatus并未能诱导活化。
DC对病毒感染的反应同样重要;黏膜下DC负责向CD4+ T细胞呈递抗原并诱导IFN-γ产生,从而促使针对单纯疱疹病毒2型(HSV-2)的保护性Th1反应。尽管DC对HSV-2感染无直接反应,与细菌相关的Prevotella timonensis却使LCs更易摄取HIV-1病毒颗粒。
◮ 阴道乳杆菌丰度低且多样性高的个体,促炎细胞因子水平更高
乳杆菌丰度较低、微生物多样性较高的个体促炎细胞因子丰度增加。尽管高阴道多样性与乳杆菌主导微生物群体的DC、单核细胞和巨噬细胞丰度无显著差异,但这些抗原呈递细胞(APC)群体的转录组却存在显著差异。
该信号的潜在来源可能与细胞包膜相关,因为转录组分析中的目标基因与脂多糖刺激APC反应密切相关。然而,许多与高多样性相关的生物并不产生脂多糖,因此该领域需要进一步研究。
免疫分泌因子
除了细胞免疫反应,抗菌肽、趋化因子和细胞因子等分泌因子也有助于增强宿主防御。
◮ 白细胞介素-33生成受阴道菌群影响
一个重要的分泌因子是由阴道上皮产生的警报素IL-33,其生成通常受到阴道菌群的抑制。然而,在生态失调时,上皮细胞分泌IL-33作为危险信号,抑制干扰素γ的产生,从而影响宿主对HSV-2(单纯疱疹病毒)的易感性。
◮ 干扰素ε与黄体酮受体的表达相关
另一种在阴道中特殊表达且关键于防止病原体入侵的分泌因子是干扰素ε(IFN-ε)。IFN-ε在阴道和宫颈内皮细胞中以组成型方式表达,但在子宫内膜中受到激素调节,其表达与黄体酮受体的表达相关,卵泡期IFN-ε水平较低,而黄体期水平较高。IFN-ε已被证明对衣原体感染及HIV、寨卡病毒和HSV-2的病毒感染具有保护作用。
◮ 细菌性阴道炎个体IL-17及抗菌肽水平不同
此外,在活动性性传播感染个体的宫颈阴道灌洗中观察到IL-17水平增加,且这一现象与Th17细胞数量无关。需要注意的是,IL-17可以由多种细胞类型产生,包括中性粒细胞、粘膜相关不变T细胞(MAIT)和巨噬细胞等。
在乳杆菌占主导的微生物群体与BV相关微生物相比,阳离子抗菌肽(CAMP)也存在差异表达。最近的阴道宏转录组荟萃分析显示,与非BV微生物组样本相比,从BV相关微生物组样本中涉及CAMP耐药性的基因谱有所增加。
◮ 不同微生物产生的表面活性剂抑制病原菌定植
在阴道中,微生物和宿主细胞均能分泌调节环境的表面活性剂,这影响微生物定植和宿主对感染的反应。宿主表面活性剂通过与真菌细胞的碳水化合物部分相互作用,促进其吞噬。
近期研究发现,L.crispatus产生的细菌表面活性剂可以减少念珠菌对上皮细胞的粘附,并抑制宿主细胞的沙眼衣原体感染。同样,L.gasseri产生的表面活性剂也能阻止耐甲氧西林金黄色葡萄球菌的生物膜形成,表明表面活性剂在阴道微生物群落的建立与形成中可能发挥直接作用。
小结
阴道微生物群与免疫细胞之间的相互作用在维持阴道健康中发挥着重要作用。阴道内的免疫细胞库,特别是T细胞,能够有效识别和应对病原体,同时调节炎症反应。CD8+ T细胞监测病原体,并释放干扰素γ以招募其他免疫细胞。
其他免疫细胞,包括中性粒细胞和抗原呈递细胞(APC),共同参与阴道免疫的调节。研究表明,低丰度乳杆菌且高多样性的微生物群体与促炎细胞因子水平升高相关,提示其在炎症反应中可能发挥关键角色。
此外,分泌因子如IL-33和干扰素ε等对于防止病原体入侵及调节免疫反应也至关重要。不同微生物产生的表面活性剂可有效抑制病原菌的定植,彰显了微生物群在维持阴道微环境中的显著影响。
总的来看,阴道微生物群和免疫细胞的动态平衡对于宿主健康至关重要,但还需进一步研究以深入理解其机制与临床意义。
营养免疫是宿主的一种防御机制,主要涉及抗菌肽,这些肽通过封存可用的营养金属离子,旨在抑制入侵病原体的生长。
营养免疫效应分子对阴道健康的影响
◮ 钙卫蛋白有效捕捉锌、铁等重要金属离子
例如,效应蛋白如S100家族蛋白、脂素和乳铁蛋白能够螯合金属并在宿主的防御机制中发挥重要作用。具体而言,钙卫蛋白是一种由S100A8和S100A9四异二聚体构成的蛋白质,能够有效捕捉锌、锰和铁等金属离子。
另一个例子是S100A7,这种蛋白质表现出对锌的高亲和力;而S100A12,即钙颗粒素C,则表现出对锌和铜的双重亲和力。此外,脂质运载白蛋(lipocalin),亦称lipocalin-2或中性粒细胞相关明胶酶脂素,以及乳铁蛋白,分别是结合铁载体和铁离子的有效铁螯合分子。
◮ 健康阴道中钙卫蛋白丰富,有助于抵抗病原体
值得注意的是,许多营养免疫效应分子由宿主的角质细胞、上皮细胞和先天免疫细胞表达,尤其是中性粒细胞,在炎症期间这些效应分子会大量存在。
在以惰性乳杆菌(L. iners)为主的群落中,研究发现lipocalin-2和钙卫蛋白的浓度明显增加,这指向其在维持阴道健康中的潜在作用。相对而言,有研究表明,与细菌性阴道炎患者相比,健康对照人群中的阴道脂肪钙蛋白更为丰富,这可能与细菌性阴道炎相关微生物的免疫抑制潜力有直接关系。在观察到的动态变化中,阴道乳铁蛋白水平最初在月经后立即上升,并且与阴道微生物多样性的增加相关联。
然而,近来的证据表明,在某些个体中,月经期间及之后的时间窗口与微生物多样性的增加有本质的联系,这可能成为连接这两者的重要线索。这些分子共同作用,可以限制生物利用性的养分金属,同时帮助减少病原微生物的入侵或扩散,包括白色念珠菌、淋病奈瑟菌,以及机会性病原体无乳链球菌(S.agalactiae)等。
效应分子还能影响先天免疫
除了在营养免疫中的重要作用外,S100家族的蛋白质还可以作为警报蛋白或损伤相关分子模式,起到激活和增强先天免疫反应的作用。
◮ S100蛋白影响免疫及炎症反应
例如,钙卫蛋白已被证明能够通过抑制Toll样受体4的活性促进炎症的发生,多种S100家族蛋白结合该受体进行高级糖基化终产物,进而激活转录因子NF-кB。这些数据表明,S100蛋白不仅能够作为金属螯合剂,还可能在功能上促进炎症的发生。
需要指出的是,炎症在阴道环境中是一个研究较少的重要领域,对阴道健康有着显著影响,但这方面的知识仍然存在巨大的空白。因此,未来的研究需要着重深入探讨一些关键问题,例如理解饮食对金属供应的影响、金属摄入对于宿主易感性或感染韧性的作用、在塑造微生物群落形成中的重要性,以及探究在复杂微生物群落中如何使营养金属的获取受到宿主的主动抑制。
阴道微生态是一个动态且错综复杂的生态系统,由微生物群落与宿主之间的相互作用塑造,这些相互作用会随着激素信号传导、屏障完整性和营养可用性的变化而波动。
阴道微生物群的早期研究基于相关数据,但现在的研究已开始深入探索群落互动及其变化的后果。关键研究领域包括:
(1)群落变化的驱动因素:宿主是否通过调节营养选择微生物群落,或微生物代谢导致环境变化?
(2)明确“阴道健康”的定义:健康是以微生物为主还是个性化的标准?应评估临床症状而非仅用Amsel和Nugent评分;
(3)群落优势的概念:微生物优势定义为>50%或>30%?不同群落的保护等级是否不同?
(4)低丰度物种的贡献:阴道并非乳杆菌的单一构成;低丰度微生物在其中起什么作用?
(5)研究真核微生物、古菌和噬菌体的贡献,因为这些在阴道中仍被忽视。
在这些研究领域的基础上,我们还需进一步探讨微生物群落与宿主之间的相互关系及其如何受到环境因素的影响。例如,激素波动可能改变阴道内的pH值,从而影响微生物的组成,进而影响免疫反应。
此外,研究需要关注细菌与宿主免疫系统之间的相互作用。微生物不仅在维持阴道生态平衡中发挥作用,还通过其代谢产物调节宿主的免疫状态。我们必须深入理解这些微生物代谢产物如短链脂肪酸、共生抗菌肽等如何影响免疫反应的强度与方向。
对于不同个体,微生物群的组成及其功能可能有所不同,这也提示我们必须考虑遗传因素、生活习惯和饮食在阴道微生物组发展中的作用。这些差异可能会导致对相同微生物群体的不同免疫响应或营养利用,进而影响女性的健康状况。
最后,随着对阴道微生物群的了解不断深化,跨学科的合作将变得愈发重要。微生物学、免疫学和营养学等领域的相互结合,能够为我们提供更全面的视角,帮助我们理解更复杂的生物系统。这种综合的研究方法将有助于填补当前知识空白,并推动我们在改善女性生殖健康方面取得新的进展。
主要参考文献
Landolt EF, da Conceição Mendonça J, Behler AE, Lumsdaine SW, Jafar T, Burcham LR. Exploring the vaginal ecosystem: insights into host-microbe interactions and microbial community dynamics. Infect Immun. 2025 Sep 9;93(9):e0049924.
Greenbaum S, Greenbaum G, Moran-Gilad J, Weintraub AY. Ecological dynamics of the vaginal microbiome in relation to health and disease. Am J Obstet Gynecol. 2019 Apr;220(4):324-335.
Amabebe E, Anumba DOC. The Vaginal Microenvironment: The Physiologic Role of Lactobacilli. Front Med (Lausanne). 2018 Jun 13;5:181.
Shen L, Zhang W, Yuan Y, Zhu W, Shang A. Vaginal microecological characteristics of women in different physiological and pathological period. Front Cell Infect Microbiol. 2022 Jul 22;12:959793.
Holm JB, France MT, Gajer P, Ma B, Brotman RM, Shardell M, Forney L, Ravel J. Integrating compositional and functional content to describe vaginal microbiomes in health and disease. Microbiome. 2023 Nov 30;11(1):259. doi: 10.1186/s40168-023-01692-x. Erratum in: Microbiome. 2024 Feb 6;12(1):21.
Ma B, Forney LJ, Ravel J. Vaginal microbiome: rethinking health and disease. Annu Rev Microbiol. 2012;66:371-89.
Torcia MG. Interplay among Vaginal Microbiome, Immune Response and Sexually Transmitted Viral Infections. Int J Mol Sci. 2019 Jan 11;20(2):266.
Kaur H, Merchant M, Haque MM, Mande SS. Crosstalk Between Female Gonadal Hormones and Vaginal Microbiota Across Various Phases of Women’s Gynecological Lifecycle. Front Microbiol. 2020 Mar 31;11:551.

谷禾健康
肠道屏障是将宿主与外界隔离的主要防御,具有多项关键生理功能,包括营养消化、吸收以及防止潜在有害的膳食抗原和致病微生物的侵害。然而,饮食、药物、昼夜节律紊乱、年龄、肠道微生物群、微生物代谢物和遗传易感性等多种因素都可能破坏肠道屏障。这种破坏可能导致细菌易位,进而引发肠肝和全身性炎症。
目前,肠道屏障受损已被认为与多种疾病的发病机制有关,包括炎症性肠病(克罗恩病和溃疡性结肠炎)、肠易激综合征和结直肠癌等肠道疾病。此外,肝病(如代谢功能障碍相关脂肪性肝病、酒精性肝病和原发性硬化性胆管炎)和全身性代谢疾病(如糖尿病和肥胖)也与肠道屏障受损有关。
然而,目前大多数临床数据仅显示相关性,尚无法明确肠道屏障损伤是这些疾病的原因还是结果。目前,全世界药监督管理局尚未批准专门用于修复肠道屏障损伤的药物。现有疗法主要侧重于疾病的预防和管理,并严重依赖免疫抑制剂来控制炎症。
不幸的是,持续的屏障损伤和延迟愈合会降低这些治疗的疗效,并可能导致治疗耐受甚至复发。因此,开发直接靶向肠道上皮屏障的治疗策略至关重要。
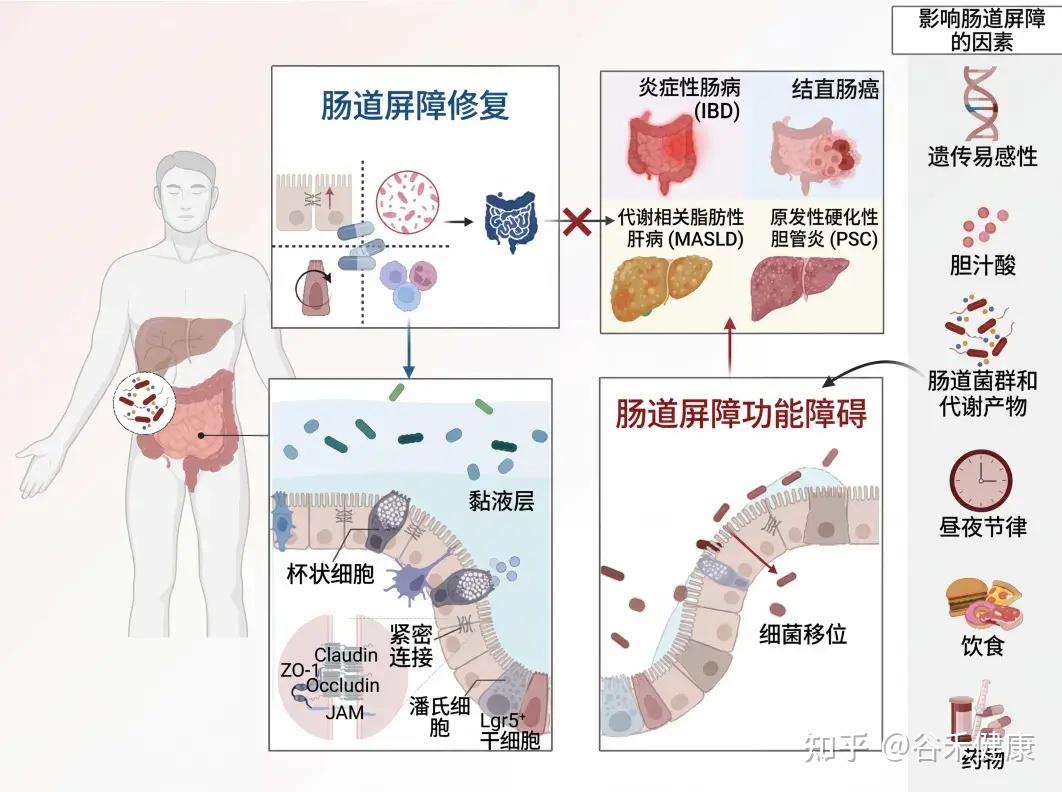
本文介绍肠道屏障的基本功能,生理结构和功能、影响其完整性的内外因素,重点介绍一些潜在的治疗策略,旨在恢复屏障完整性,改善和优化疾病管理。
肠道是一个独特的器官,在食物消化、营养吸收、动态的宿主与环境互动以及维持身体稳态方面发挥着关键作用。
为了保护宿主免受外部威胁,例如长期暴露于膳食抗原和病原微生物,肠道上皮细胞(IECs)形成了多种类型的屏障,包括机械屏障、富含共生微生物的粘液层,以及由免疫细胞及其活性物质组成的免疫屏障(下图)。

机械屏障:由紧密连接(TJs)形成的紧密排列的IECs层构成,确保肠道的结构完整性,调节肠道通透性,并控制水和大分子的运输。
粘液层:由杯状细胞分泌的粘蛋白组成,为共生细菌提供栖息地和营养。其独特的结构特征限制了病原体的渗透,进一步增强了TJs的物理隔离功能。
干细胞微环境:位于肠腺隐窝底部,由隐窝驻留肠道干细胞(ISCs)、间充质细胞、免疫细胞以及肠道分泌细胞(如杯状细胞和潘氏细胞)组成。这个微环境具有高度增殖性,因此负责组织更新和肠道屏障修复。它还介导抗原吞噬并释放抗菌肽(AMPs),通过清除潜在病原体来维持内部稳态。
这些元素共同构建了物理和生化屏障,保护宿主并调节内部和外部环境之间的交流。这种复杂的平衡对于胃肠系统的正常运作和维持身体整体平衡至关重要。
1
粘液层组成与免疫监测
粘液层的物理与生化屏障
粘液层是胃肠道的第一道防线,主要由90%-95%的水、1%-2%的脂质和1%-5%的粘蛋白组成。粘蛋白通过糖基转移酶高度糖基化,含有50%-80%的碳水化合物(w/w)。
粘蛋白聚糖多样而复杂的结构,为粘液相关细菌(如 R.torques、A.muciniphila、B.bifidum和R.gnavus)提供了理想的定植位点和营养来源。
动态防御:细菌即是住客,也是建筑师
MUC2是胃肠道中表达的主要粘蛋白。在细菌暴露后,杯状细胞通过meprin β介导的裂解机制分泌MUC2,形成保护性粘蛋白层。该结构允许共生微生物在外粘液层定植,并利用其多糖降解酶从粘蛋白O-聚糖中获取营养能量。这种宿主与微生物的相互作用,有助于调节近端结肠微生物群的结构和转录。
别让细菌吃肠壁:低纤维饮食的代价
研究表明,低纤维饮食会促进微生物群降解宿主粘蛋白,导致粘液层变薄,从而削弱屏障功能。Muc2缺陷小鼠表现出结肠组织学损伤增加、细菌易位至肝脏增多以及肠道紧密连接蛋白显著减少。此外,粘蛋白O-糖基化紊乱导致的粘液屏障完整性和功能受损与代谢疾病的发病机制有关。
粘液层的水龙头:谁在掌控肠道保护液的释放?
最近的研究发现,Gasdermin D (GSDMD) 是一种参与细胞凋亡的成孔效应蛋白,它通过scinderin介导的F-肌动蛋白解聚,促进钙依赖性胞吐作用,从而调节杯状细胞的粘蛋白分泌。GSDMD缺陷会破坏粘液屏障,使病原体粘附到上皮细胞,导致肠道疾病的发生。
严防细菌偷渡:一套保护肝脏的精密免疫系统
粘液层凭借其独特的粘弹性,能够有效滞留并扩散来自潘氏细胞和杯状细胞的抗菌物质及免疫细胞因子,形成化学屏障。
-抗菌肽 (AMPs) 与IgA的协同作用
潘氏细胞产生隐匿防御素、抗菌素和溶菌酶等AMPs。这些AMPs大量存在于肠道上皮表面,能够直接清除有害微生物。在新生非肥胖糖尿病小鼠模型中,生态失调导致的结肠AMPs缺乏会导致1型糖尿病中的胰腺自身免疫。
AMPs与微生物特异性免疫球蛋白IgA协调作用,在维持屏障稳定性和抑制炎症中发挥关键作用。
-IL-17和IL-22的调控
它们的调节受T辅助17(Th17)细胞和III型固有淋巴细胞(ILC3)产生的IL-17和IL-22的影响。
ILC3依赖于树突状细胞(DC)相关的Mincle信号通路,该通路与酪氨酸激酶偶联的C型凝集素受体有关。在Mincle缺失或酪氨酸激酶受损的情况下,肠道再生胰岛衍生III-γ(RegIIIγ)和IgA的合成会减少,从而导致肠道微生物群移位,进而引发肝脏炎症和脂质代谢失调。
这些发现表明粘液层完整性在维持肠肝稳态中的关键作用。
2
上皮连接:构筑肠壁防线的灰浆与砖块
微绒毛:不仅仅是吸收养分的地毯
功能:肠道上皮细胞顶端的微绒毛密集排列成刷状缘。它们既是营养吸收的高效界面(扩大表面积),又是阻止细菌附着的第一道物理防线。
脆弱性:在克罗恩病中,这些绒毛会变短、基因表达混乱。
破坏机制:就像拆除帐篷的支柱一样,肠出血性大肠杆菌的毒力因子通过CDK1-Formin信号轴,攻击支撑微绒毛的骨架蛋白(ACT-5),导致微绒毛坍塌消失,引发严重腹泻、出血性结肠炎等。
紧密连接(TJs):细胞间的拉链
在微绒毛下方,紧密连接(TJs)像拉链一样把相邻细胞的细胞膜紧紧锁死。
核心作用:这种吻合结构封堵了细胞间的空隙,相当于门控功能——只允许特定的物质通过,严防细菌和有害大分子渗透。
关键零件:谁在控制拉链的松紧?
病菌如何撬开防御?
紧密连接的稳定性高度依赖于细胞骨架的支撑,这成为了病原体的攻击目标:
3
动态防御机制:从干细胞再生到免疫感知
隐窝深处的生命源泉:肠道干细胞 (ISCs)
肠道屏障之所以能抵御消化道内持续的磨损与危害,归功于其惊人的自我更新能力。
核心机制: 位于肠道隐窝底部的肠道干细胞是这一过程的“总工程师”。它们通过持续增殖,不断分化补充受损的肠道上皮细胞(IECs),维持着组织的修复与动态平衡。
谁在调控修复?信号通路、压力与衰老
ISCs 的功能受到微环境信号的精密调控,同时也易受外部因素干扰:
-修复的加速器
当肠道受损时,IL-1R1 信号 和 Wnt 激动剂 RSPO3 会协同作用,强力促进 ISCs 的修复功能,加速伤口愈合。
-心理压力:让干细胞电量耗尽
心理压力不仅仅是情绪问题,它能产生实实在在的生理毒性。
心理压力会导致 ISCs 内部的 线粒体能量代谢 受损,进而干扰细胞分化。这种微观层面的能量危机削弱了宏观的肠道屏障,这科学地解释了为何精神疾病患者常伴有肠道问题。
-衰老的阻滞剂
随着年龄增长,ISCs 的数量和活性会下降,导致屏障完整性受损及菌群失衡。
关键原因:维持 ISCs 活性的关键信号——Wnt 信号通路随衰老而减弱,导致干细胞枯竭。
簇状细胞:不仅是免疫哨兵
簇状细胞是肠道屏障中一种重要的分泌型肠上皮细胞,与潘氏细胞和杯状细胞共同发挥作用。它们通过分泌IL-25来抵御病原体感染,激活2型免疫并清除病原体。簇状细胞还能感知病原体代谢物,并通过G蛋白偶联信号通路产生PGD2,从而刺激杯状细胞分泌粘液并促进自身增殖,进一步增强抗菌防御。此外,在肠道损伤时,簇状细胞可以充当储备肠道干细胞,协助屏障修复。
肠道屏障的健康受多种因素影响,包括遗传、饮食(如西式饮食)、药物(抗生素等)、疾病、生活习惯(昼夜节律)、心理状态(压力)和生理过程(衰老)。这些因素共同作用,可导致肠道微生物失衡,进而引发全身性代谢紊乱。这些代谢紊乱又会加剧炎症反应,进一步损害肠道屏障,形成一个恶性循环,持续破坏肠道健康。
下表总结了影响肠道和肝脏疾病的因素及机制与肠道屏障功能障碍相关的研究

1
遗传易感性
基因组关联研究(GWAS)的进展显著提升了疾病易感基因的识别和相关生物学通路的理解,这对临床转化具有重要价值。这些研究分析基因组中的遗传变异,以探索基因型和表型之间的关系。
免疫刹车失灵:IL-10 信号通路的遗传缺陷
尽管基因突变与肠道屏障功能障碍之间的直接联系有限,但GWAS已识别出许多与IBD(炎症性肠病)发展相关的基因座。例如,IL10基因突变是首批被发现能诱发IBD的突变之一。IL10基因敲除小鼠会自发发展结肠炎并增加肠道微生物易位。IL10受体(IL10R)的突变(由IL10RA和IL10RB基因编码的IL10R1和IL10R2蛋白组成)已与早发性小肠结肠炎相关联。这些突变损害了IL10诱导的信号传导,这可能增加TNF-α和其他促炎细胞因子的分泌,从而加剧炎症并削弱肠道耐受性。
离子转运障碍:SLC26A3 与物理屏障的松动
GWAS还显示SLC26A3基因(编码DRA蛋白,一种肠道氯离子转运蛋白)的显著下调。该基因在人类基因组中有害IBD变异中排名在前1%。SLC26A3表达的降低显著增加结肠旁细胞通透性,降低紧密连接(TJ)和黏附连接(AJ)蛋白的表达,从而增加对IBD的易感性。
黏液防线的溃败:ST6GALNAC1 与糖基化异常
糖蛋白组学分析揭示,先天性IBD(炎症性肠病)患者可能携带ST6GALNAC1(ST6)基因突变,该基因编码一种对维持黏液屏障稳态至关重要的唾液酸转移酶。该基因的突变会导致肠道黏膜层厚度减少,并破坏其保护功能。阐明这些调控机制对于理解先天性IBD的发病机制至关重要。此外,屏障功能还受到遗传易感性和环境因素相互作用的影响。DNA甲基转移酶编码基因DNMT3A的突变与IBD风险增加相关,已被证明能减少杯状细胞数量,缩短黏附连接(AJ)复合体,并增加肠道通透性。这些改变增加了对结肠炎的易感性,并阻碍了上皮再生和修复过程。
2
胆汁酸
胆汁酸(BAs)不仅是消化和脂质吸收的关键,还扮演着调节全身代谢和免疫的激素角色。它们通过激活FXR和TGR5等受体发挥作用。
修复的动力(次级胆汁酸)
最近研究发现,胆汁酸在维持肠道上皮屏障方面至关重要,能刺激Lgr5+肠道干细胞(ISCs)的自我更新,从而促进肠道修复。
修复的阻力(过量初级胆汁酸)
然而,过量的初级胆汁酸(如胆酸)会通过抑制脂肪酸氧化来减缓ISC的增殖,进而影响屏障修复。另一方面,TGR5在肠道代谢稳态中作用显著,其被次级胆汁酸(脱氧胆酸)激活后,会促进ISCs中YAP1和SRC等因子的转录,从而有效驱动肠道上皮的再生。
孕烷X受体 (PXR):抗炎与修复的化学感应器
孕烷X受体(PXR)是调节肠道上皮屏障稳态的关键核受体,它通过调控外源性物质代谢和先天免疫发挥作用。
溃疡性结肠炎患者中PXR及其靶基因的下调表明,PXR功能受损可能导致肠道损伤后屏障修复缺陷。PXR缺陷会加剧肠道上皮功能障碍,并增加对肠道损伤的易感性。
PXR的激活(例如通过石胆酸LCA)通过抑制NF-κB通路和炎症因子释放,以及维持紧密连接的完整性来发挥保护作用。
维生素 D 受体 (VDR):从抗菌防御到防癌屏障
胆汁酸也是维生素D受体(VDR)的内源性配体,对肠道稳态具有保护作用。VDR通过调节上皮分化和增强紧密连接表达来维护肠道屏障完整性,并支持潘氏细胞的抗菌功能。然而,在炎症性肠病(IBD)和结直肠癌(CRC)中,VDR的保护机制受损,其信号通路的失调与CRC的加速进展和不良预后密切相关。VDR激活不仅直接抑制肿瘤细胞增殖,还能通过增强黏膜屏障完整性来限制肿瘤进展,从而抑制CRC。
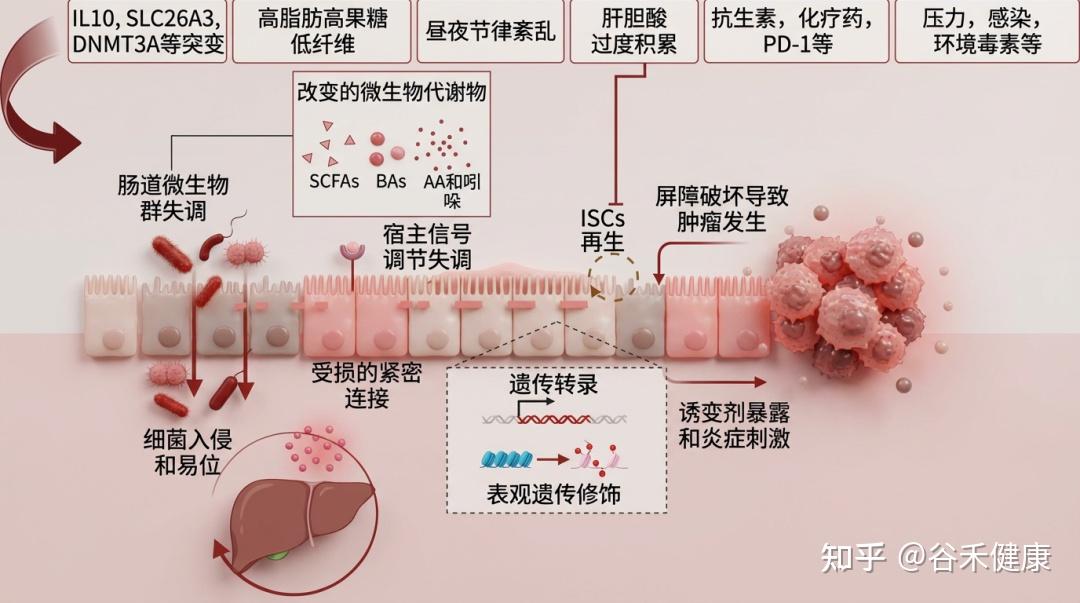
3
肠道微生物群及衍生代谢物
肠道微生物群通常与宿主共生,并被肠道上皮屏障限制在黏液层外。但有些微生物能突破屏障,损害胃肠道健康。抗生素虽看似能保护肠道,但实际上可能削弱屏障功能,增加新发炎症性肠病(IBD)的风险,这已在大量的研究中得到证实。与此相反,良好的肠道微生物结构对肠道屏障修复有积极作用。研究发现,肠道微生物群能通过激活巨噬细胞信号促进结肠上皮前体细胞生长,从而帮助修复受损的肠道上皮屏障。
色氨酸代谢物:PXR 与 AhR
肠道微生物群通过产生多种代谢物(如次级胆汁酸和色氨酸衍生物)来维护肠道屏障的完整性和整体健康。在IBD患者中,色氨酸水平显著降低,其代谢改变对疾病进程和预后有重要影响。
路径一:芳烃受体 (AhR) 的激活
色氨酸衍生物中的吲哚类物质是芳烃受体(AhR)的天然配体,AhR的激活能调节免疫细胞(如Tregs和Th17)及其细胞因子(特别是IL-22)的产生,从而促进肠道屏障的保护、修复和稳态。
路径二:孕烷 X 受体 (PXR) 的增强
除了AhR途径,这些代谢物还能通过孕烷X受体(PXR)增强屏障。例如,吲哚-3-丙酸(IPA)作为内源性PXR激动剂,通过TLR4信号通路减轻肠道通透性和炎症。PXR激活通过稳定紧密连接蛋白ZO-1、抑制MLCK表达和JNK1/2磷酸化来保护肠道屏障。
综上所述,色氨酸衍生的吲哚代谢物通过同时激活PXR和AhR信号通路,对肠道上皮发挥双重保护作用。
反面:犬尿氨酸 (Kyn) 途径
色氨酸代谢的犬尿氨酸(Kyn)途径与IBD进展密切相关,其限速酶IDO在炎症下促进Kyn途径,IDO的抑制或缺陷可减轻肠道炎症并增强屏障功能。
短链脂肪酸:能源与信号的结合
短链脂肪酸(SCFAs),包括丁酸、乙酸和丙酸,是肠道微生物分解膳食纤维等产生的关键代谢物,对肠道屏障功能至关重要。它们通过激活G蛋白偶联受体(如GPR43或FFAR2)来增强肠道屏障,并保护免疫细胞免受损伤,从而有助于预防结直肠癌(CRC)。
丁酸抑制组蛋白脱乙酰酶(HDACs)以调节基因转录,并通过调控紧密连接处的蛋白来促进屏障修复。GPCR信号和HDAC共同抑制维护上皮屏障完整性。此外,SCFAs还能刺激杯状细胞分泌黏蛋白,进而促进黏蛋白降解菌生长,通过消耗黏蛋白促进肠道干细胞分化,确保肠道上皮的再生能力。
4
昼夜节律
昼夜节律,常被称为生物钟,是代谢稳态的内部控制系统,旨在同步诸如光暗周期等周期性环境信号。该系统通过转录、转录后和翻译后修饰,在特定时间协调基因表达,以实现最佳代谢适应。
“什么时候吃”可能比“吃什么”更重要
多项研究表明,昼夜节律紊乱与代谢疾病之间存在密切关联。具体而言,不规律的进食时间会增加小肠暴露于膳食抗原和微生物刺激的风险,从而加重肠上皮细胞(IECs)主要组织相容性复合体II(MHC II)的负担。这种紊乱会削弱肠道微生态的调节功能,并减少IL-10的分泌。
神经免疫回路的失调:VIP 与 ILC3 的博弈
昼夜节律还会影响肠道中的神经免疫回路,这些回路受进食行为激活,并在饮食不规律时可能导致病理变化。食物摄入会触发肠道神经元分泌血管活性肠肽(VIP),该肽会上调与脂质吸收和转运相关的蛋白质。同时,VIP会降低IECs中的AMP水平,并减少ILC3产生的IL22。这种饮食节律的紊乱有助于病原体的肠道定植,尤其是在神经免疫回路的屏障功能受损时。
微生物振荡器:细菌也有生物钟
肠道微生物群自身也表现出丰度和功能的昼夜波动,被称为微生物振荡器,它们通过微生物代谢物或自身抗原影响宿主昼夜节律。肠道微生物群与宿主生物钟之间的这种相互作用显著影响屏障完整性和先天免疫反应。例如,短链脂肪酸通过抑制组蛋白脱乙酰酶(HDAC)活性,有助于调节小肠的昼夜节律相移。
肠道中的分节丝状细菌(SFB)驱动着与宿主节律同步的节律性ILC3回路振荡,从而通过时间依赖性地表达抗菌肽(AMPs)来介导感染抵抗力的昼夜变化。
5
饮食
高脂与快餐:胆汁酸的黑化与致癌风险
高脂肪和高糖、高加工饮食,与现代社会代谢疾病患病率的增加密切相关。饮食成分通过改变肠道微生物群以及主动参与宿主生理过程的次级代谢产物的产生,显著影响肠道微环境。
研究表明,现代快餐和西方饮食引起的肠道微生物群变化会提高脱氧胆酸(DCA)水平,这通过激活肠道FXR和I型干扰素(IFN)信号通路损害潘氏细胞。
动物研究进一步揭示,高脂肪饮食(HFD)在不同的结肠癌模型中,包括偶氮甲烷(AOM)-葡聚糖硫酸钠(DSS)诱导模型以及Apc突变诱导的自发模型,都会加剧肠道屏障损伤。HFD受损的肠道屏障允许更多病原体和衍生代谢物穿透上皮,从而加速结直肠癌(CRC)的发展。
糖衣炮弹:果糖与高血糖的双重打击
除了高脂肪摄入,过量的膳食果糖摄入也会损害上皮屏障。果糖水平升高会增加循环内毒素,从而激活巨噬细胞上的Toll样受体4(TLR4),引发全身性炎症反应。同时,葡萄糖代谢既对代谢综合征具有治疗潜力,也是肠道屏障功能的关键协调者。
在瘦素缺乏(ob/ob)和瘦素受体(LepR)缺乏(db/db)的2型糖尿病(T2DM)小鼠模型中,高血糖通过诱导肠上皮细胞(IECs)中葡萄糖转运蛋白2(GLUT2)依赖性转录重编程来破坏肠道屏障,这随后损害了紧密连接(TJ)和黏着连接(AJ)结构的完整性。
富含果糖的食物

6
药物
抗生素:精准打击与地毯式搜捕
抗菌素的使用对肠道微生物群落的丰度和结构有着深远的影响,进而影响肠道屏障的完整性。
例如,利福昔明-α (Rifaximin-α)常用来治疗小肠细菌过度生长:这种抗生素可以减少破坏粘膜的细菌,增加肠道内TNF-α和IL-17的水平,从而增强对病原体的抵抗力。它还能通过增加回肠中的乳杆菌水平来改善应激引起的肠道屏障功能障碍。
广谱抗生素会降低肠道微生物多样性,导致免疫失调,并增加感染的易感性。在健康成年小鼠中,广谱抗生素治疗会导致菌群失调,肠道上皮紧密连接(TJ)的完整性受损,表现为ZO-1表达减少和NLRP3炎症小体激活。
非抗生素药物:阿司匹林的隐形副作用
非抗生素药物也可能损害肠道屏障,例如阿司匹林,广泛用作消炎镇痛药,但会引起胃肠道损伤。
它会激活肠道FXR信号,并减少戈氏副拟杆菌(Parabacteroides goldsteinii)的数量。
戈氏副拟杆菌产生7-酮-LCA,这种物质能抑制肠道干细胞(ISC)的干性,从而减缓肠道屏障的修复。
化疗药物:再生能力的丧失
化疗药物:化疗是导致肠道屏障损伤的另一个主要原因。例如,5-氟尿嘧啶会加速黏膜细胞的死亡,而非再生。因此,超过40%的化疗患者会出现胃肠道损伤,表现为腹泻、便秘和消化不良等症状。
免疫检查点抑制剂:免疫激活的附带损伤
免疫检查点抑制剂(ICIs):靶向PD-1的ICIs彻底改变了抗肿瘤治疗。尽管这些抗体通过阻断PD-1通路来重建正常的免疫反应,但它们经常引起胃肠道毒性。
PD-1信号被发现对调节结肠淋巴组织诱导(LTi)细胞(ILC3的一个特定亚群,对维持免疫稳态至关重要)至关重要。
PD-1信号的缺失会导致LTi细胞中脂肪酸氧化过度激活,并反馈抑制LTi细胞的激活和IL-22的产生。这种失衡导致生态失调、肠道屏障损伤,并增加肠炎的易感性。
功能性测试:探针分子与 LMR 比值
乳果糖/甘露醇比值 (LMR) 是评估肠道通透性的重要生物标志物。
注:乳果糖(大分子)的尿液排泄量反映“肠漏”程度和上皮损伤。甘露醇(小分子)主要通过跨细胞途径吸收,代表非特异性上皮转运。
通过口服探针分子后检测尿液排泄来评估肠道通透性,这是最常用和直接的方法。
常用的探针分子包括不易代谢、吸收差的糖类(如甘露醇、鼠李糖、三氯蔗糖、乳果糖)或低分子量聚乙二醇(PEG)和乙二胺四乙酸(EDTA)。
为了避免饮食干扰,这些探针常使用同位素标记。
乳果糖-甘露醇测试 (LMT) 是临床广泛使用的评估方法。
在动物模型中,常用FITC标记的葡聚糖或铬-51标记的EDTA (51Cr-EDTA) 吸收到体循环的量来评估肠道屏障完整性。
其他方法:生物标志物的间接分析和多组学分析平台也是新兴的评估手段。
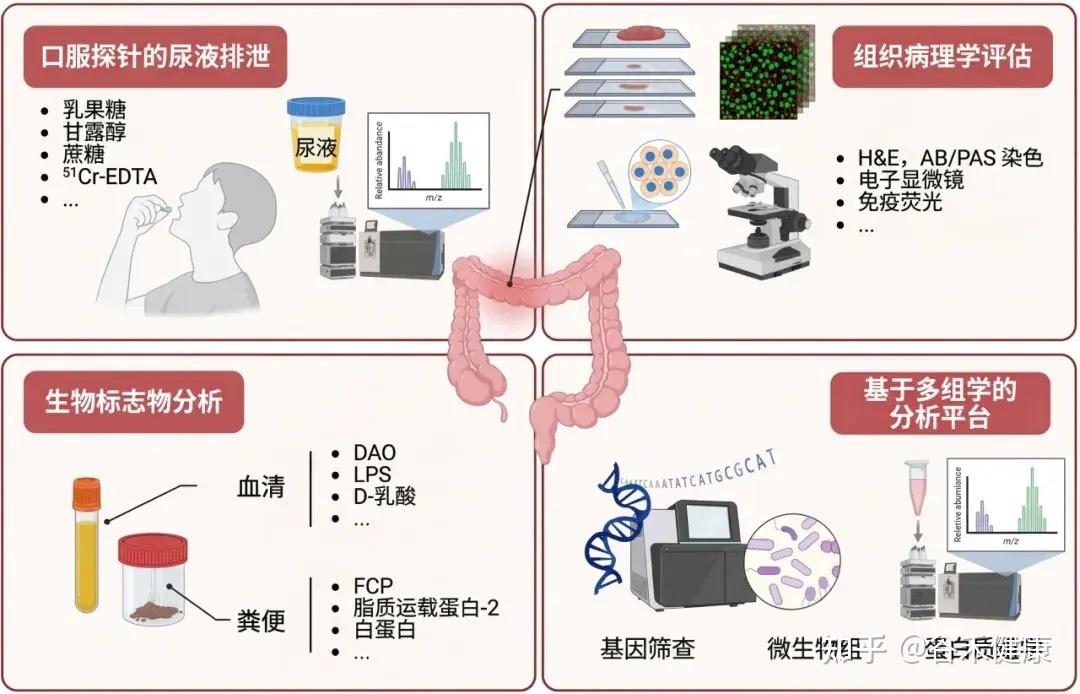
生物标志物:血液与粪便的线索
血清蛋白质组学和基因筛查技术:用于早期检测屏障功能障碍,并支持对其潜在原因的机制研究。
这些间接方法通过检测血液、粪便或分子水平上的特定物质,提供肠道屏障健康状况的重要信息。
组织病理学:屏障损伤的可视证据
内窥镜活检标本的组织病理学评估可以详细检查上皮绒毛形态和评估肠道屏障完整性。可以使用黏蛋白特异性阿尔辛蓝/过碘酸-希夫 (AB/PAS) 染色来评估黏液层,使用电子显微镜进行超微结构分析,以及使用免疫荧光技术精确定位和量化紧密连接 (TJ) 蛋白的表达,从而系统地分析黏膜成分的结构改变。
这些方法共同为评估肠道屏障完整性提供了全面的视角。
肠道上皮屏障的失调对多种肠道和肝脏疾病的发展和进展具有重要意义。肠道上皮的紧密连接功能障碍增加了通透性,促进细菌及其致病因子穿越屏障进入全身循环及其他组织。这种入侵会引发全身性炎症,破坏代谢稳态,而代谢稳态是肠道和肝脏疾病发生和进展的关键事件。虽然尚不确定肠道屏障的损伤是主要驱动因素还是偶然的病理特征,但越来越多的证据表明,肠道屏障的完整性在这些疾病的病因中起着关键作用。
1
炎症性肠病与结直肠癌
IBD 的病理核心:炎症因子的破坏机制
炎症性肠病 (IBD),包括克罗恩病 (CD) 和溃疡性结肠炎 (UC) 的特征是慢性胃肠道炎症。上皮屏障功能障碍是导致 IBD 发生和发展的关键因素。
临床研究表明,UC 和 CD 患者的肠道紧密连接 (TJ) 结构发生改变,导致肠道通透性增加。此外,黏膜免疫激活会引起TNF-α、IL-13、IL-17等细胞因子的产生。
屏障损伤是“因”而非“果”
进一步研究表明,由于 TJ 功能障碍和细胞骨架变化,细胞旁通透性增加可能在疾病发生前就已出现,例如 CD 患者亲属中早期肠屏障异常以及肠易激综合征 (IBS) 的较高患病率。同样,大规模队列研究已经发现 CD 诊断前三年内的屏障障碍标志物。这些发现支持屏障功能障碍是疾病进展的主要原因,而不是次要效应。
致癌风险:暴露于诱变环境
上皮屏障缺陷会使肠道内壁暴露于诱变化合物或长期炎症刺激,这可能通过氧化应激等机制启动并促进结直肠肿瘤的发生。在早期和晚期结直肠癌中,各种屏障相关蛋白的表达显著降低,这促进了微生物移位,引发炎症,并进一步加速肿瘤生长。然而,结直肠癌发生发展过程中上皮屏障成分异常表达的确切机制仍不清楚。
关键分子机制:GOLM1 与 NDRG2
事实上,实验模型表明,上皮屏障受损的小鼠更容易患结肠炎和炎症驱动的肿瘤。例如:
-GOLM1 缺失(细胞分化紊乱)
高尔基体膜蛋白 1 (GOLM1) 的缺失会过度激活 Notch 通路,从而破坏肠道稳态,改变肠上皮细胞 (IEC) 的分化和分泌细胞谱,并减少杯状细胞的数量,所有这些都会增加肠道通透性和促肿瘤炎症。机械屏障在预防结直肠癌发展中也至关重要。
-NDRG2(肿瘤抑制基因)
肿瘤抑制基因 N-myc 下游调节基因 2 (NDRG2) 已被证明可以增强 E3 连接酶 FBXO11 和 E-钙粘蛋白抑制剂 Snail 之间的相互作用,促进 Snail 泛素化。E-钙粘蛋白的这种稳定作用增强了黏附连接,从而限制了结肠炎相关肿瘤的发展。
2
慢性肝病
慢性肝病,包括 MASLD、ALD 和 PSC,常伴有肠道屏障受损和肠肝轴的失调。胃肠道物质,如营养素、分泌因子和微生物代谢物, 通过门静脉进入肝脏,并被代谢用于全身利用。这一过程使肝脏对病原体相关分子模式(PAMPs)极为敏感,成为肠道物质的主要靶点。
代谢功能障碍相关脂肪性肝病
代谢功能障碍相关脂肪性肝病 (MASLD, Metabolic dysfunction-associated steatotic liver disease):以前被称为NAFLD(非酒精性脂肪性肝病)。它是一种与代谢功能障碍相关的肝脏疾病,通常与肥胖、2型糖尿病、高血压和血脂异常有关。主要特征是肝脏中脂肪过度积聚,但与大量饮酒无关。
MASLD中,内毒素血症常见,提示肠屏障与肝炎症相关。DSS诱导小鼠肠屏障损伤加剧肝损伤。Il-10敲除鼠中,西方饮食+DSS处理降低BA水平,抑制肝脏FXR信号,加重MASLD。
肠道菌群失调是MASH早期驱动因素,宏基因组研究表明MASLD患者肝病发作前已存在肠道菌群失调。MASH患者粪外囊泡可能通过nmMLCK机制降低TJ表达,加剧肠屏障功能障碍。恢复肠屏障可逆转结肠炎引起的肝脂代谢失衡,特别是通过调节次级BA-TGR5/mTOR/氧化磷酸化通路。
酒精性肝病
酒精性肝病 (ALD, Alcoholic Liver Disease):是由于长期过度饮酒引起的肝脏损伤。 它可以表现为脂肪肝、酒精性肝炎和肝硬化等不同阶段。
酒精暴露破坏上皮连接,诱导肠屏障分解。ALDH2缺乏加剧酒精引起的肠道TJ/AJ蛋白降解,肠道ALDH2可能是酒精诱导的肠-肝轴损伤靶点。慢性酒精摄入减少肠道cDCs,导致AMP产量下降,保护性A. muciniphila丰度下降,AJs破坏,最终通过IL-12-IFNγ信号通路引起肝损伤。
原发性硬化性胆管炎 (PSC)
原发性硬化性胆管炎 (PSC, Primary Sclerosing Cholangitis):是一种慢性胆汁淤积性肝病,其特征是肝内外胆管的炎症和瘢痕形成。 最终可能导致胆管狭窄、肝硬化和肝功能衰竭。
PSC常与溃疡性结肠炎共病。PSC患者肠道微生物群与健康个体不同。门静脉中存在微生物提示肠屏障破坏,可能导致细菌易位。肺炎克雷伯菌等致病菌可通过接触依赖性细胞凋亡诱导上皮孔形成,加剧炎症和肝胆损伤。BDL诱导胆汁肝病小鼠模型中,肠道屏障破坏独立于菌群失调发生。敲除CHOP可缓解BDL小鼠肠屏障损伤、ISC干性丧失以及肝脏炎症和纤维化。
肠道屏障受损可刺激PSC中的保护性负反馈回路,LPS激活NF-κB通路抑制肝细胞BA代谢,减缓胆汁性肝病进展。抗生素或泛半胱天冬酶抑制剂能减弱菌群失调诱导的内毒素易位或NLRP3炎症小体激活,有望治疗PSC。
免疫靶向疗法,包括抗炎药、免疫抑制剂和生物制剂,已被证明在控制多种肠道疾病(如炎症性肠病)炎症方面有效。然而,这些治疗并不能直接解决肠道屏障的根本损伤。不幸的是,长期使用这些药物甚至可能增加感染、耐药性和疾病复发的风险,以及恶性肿瘤和死亡等严重不良反应。
确实,虽然减少炎症至关重要,但促进上皮屏障的愈合和恢复对于肠道疾病,尤其是炎症性肠病(IBD)的长期缓解至关重要。目前,没有临床批准的疗法专门针对肠道屏障的修复和维护。鉴于屏障功能障碍与肠道和肝脏疾病发病机制的密切联系,及时修复和恢复上皮屏障是一种有前景的治疗策略。与其仅关注症状管理,提升上皮愈合和健康完整性的治疗方法,可以减缓肠道和肝脏疾病的进展。
通过加强屏障,这类疗法还可能减少细菌易位、炎症以及肝损伤的加重。

1
紧密连接蛋白调节
靶向 MLCK:紧密连接稳态的核心调控
肠道屏障的维持在很大程度上依赖于多种 TJ 蛋白。肌球蛋白轻链激酶(MLCK)被视为开发炎症性肠病障碍疗法的有力候选目标,其在调节 TJs 及其分解中发挥核心作用,通过调节紧密连接(TJs)及其分解来保护屏障功能免受免疫诱导损伤。
对 MLCK 的缺失或抑制可以有效保护屏障功能免受免疫诱导损伤,但这些干预无法预防晚期结肠炎,后者涉及细胞凋亡和黏膜损伤,这些过程与 MLCK 介导的 TJ 分解无关。这些发现反映了 MLCK 抑制剂的治疗局限性。目前的 MLCK 抑制剂对上皮和平滑肌的催化域缺乏特异性,因此可能出现毒性副作用。
新机制发现:TCPTP 的双重保护
紧密连接 (TJ) 通过调节闭合蛋白 (occludin) 和封闭蛋白 (claudin) 来维持肠道完整性,而闭合蛋白和封闭蛋白是两种关键蛋白。
一项研究发现,上皮细胞中的蛋白酪氨酸磷酸酶 (TCPTP) 通过以下两种方式保护肠道屏障:
后者可以防止闭合蛋白 (occludin) 错位并降低上皮细胞的通透性。
目前尚无专门针对 TJ 蛋白的药物进入临床试验阶段,因此,需要在此领域进行深入研究和开发。
2
肠道微生物群的生态调控
益生菌疗法:从天然菌株到工程改造
益生菌已被发现通过多种机制调节屏障功能。例如,罗伊氏乳杆菌(Lactobacillus reuteri)激活Wnt/β-catenin信号通路,诱导Paneth细胞分化和AMP(抗菌肽)分泌,同时刺激Lgr5+肠道干细胞(ISCs)增殖以促进上皮修复。
此外,罗氏菌属(Roseburia)的鞭毛蛋白与Toll样受体5(TLR5)结合,可以上调occludin和MUC2,从而改善肠道屏障完整性,并增加IL-22和REG3γ水平,进一步调节肠道生态。
嗜黏蛋白阿克曼氏菌(AKK菌,Akkermansia muciniphila)也通过调节ISC程序来支持肠道上皮的修复、增殖、分化和稳定。因此,靶向肠道微生物失调成为恢复受损屏障功能的一种有前景的治疗策略。
最新的进展包括使用生物纳米材料包裹过表达人工酶的基因工程益生菌,这是一种用于黏膜修复和炎症治疗的新方法。长双歧杆菌(Bifidobacterium longum)经过修饰以表达过氧化氢酶和超氧化物歧化酶,表现出增强的肠道定植能力、强大的抗炎活性,促进肠道屏障重塑,并调节微生物平衡。这些进展有望减少传统抗炎药物的不良反应。
胆汁酸信号:FXR 激动剂的多重获益
胆汁酸在宿主与肠道菌群的交流以及肠道菌群的构成调节中起着关键作用。胆汁酸合成失调与多种疾病的发生密切相关。激活法尼酯X受体(FXR)能有效缓解胆汁酸过量带来的危害,它通过抑制胆固醇代谢、促进肝细胞将胆汁酸转运出去,从而减少胆汁淤积性肝损伤。
研究显示,FXR激动剂奥贝胆酸(OCA)能够:
此外,OCA治疗还能通过稳定内皮细胞内的β-连环蛋白来防止肠道血管屏障受损。
色氨酸代谢:AHR 通路与 IDO 的平衡
-AHR:屏障完整性的总开关
AHR(芳香烃受体)是一种色氨酸代谢物的受体,对维持肠道屏障的完整性至关重要。研究发现,Ahr−/−小鼠(即缺乏AHR的小鼠)的上皮屏障功能明显丧失,表现为肠道机械屏障受损以及细胞无法正常分化。缺乏AHR配体的小鼠也会出现类似的症状。
进一步研究表明,来自食物的AHR配体可以通过促进细胞内的锌离子(Zn2+)信号传导,从而提高紧密连接(TJ)蛋白的表达,有效预防损害肠道屏障功能的疾病。
-AHR 激动剂的治疗潜力:以尿石素 A 为例
其他AHR激动剂,例如微生物代谢产物尿石素A(UroA),也显示出保护肠道屏障功能的潜力。UroA具有抗炎作用,并且可以通过激活AhR–NrF2依赖性通路来上调TJ蛋白的表达,从而促进肠道屏障的修复。
这些研究表明,激活肠道AHR通路对于治疗酒精性肝病(ALD)具有重要意义,因为ALD与TJ屏障的丧失密切相关。因此,AHR可能成为修复肠道屏障的一个有价值的治疗靶点,尤其是在与肠道屏障功能障碍相关的慢性疾病中。
-IDO 抑制剂:代谢平衡与潜在毒性
正向:抑制 IDO -> 阻断色氨酸向犬尿氨酸转化 -> 迫使色氨酸转化为吲哚
抑制IDO(一种将色氨酸转化为犬尿氨酸的酶)可能有助于治疗肠道屏障功能障碍。IDO抑制剂通过促进色氨酸转化为吲哚,增加AHR配体的生成,从而改善肠道完整性。
虽然IDO抑制剂在癌症治疗中显示出潜力,但它们在治疗肠道屏障损伤方面的应用仍需更多研究。Indoximod是一种IDO抑制剂,已被证明能有效维持细胞间的紧密连接,并显著减轻DSS诱导的结肠损伤。
反向:过度抑制 IDO -> 减少犬尿酸生成 -> GPR35 失去激活 -> 削弱屏障保护
需要注意的是,IDO抑制也可能导致不良的肠道毒性反应。完全阻断犬尿氨酸通路可能会适得其反,损害上皮屏障的完整性。
研究表明,化疗药物引起的肠道损伤会激活色氨酸-犬尿氨酸-犬尿酸通路,增加肠道内犬尿酸的生成。犬尿酸随后激活GPR35,从而增强肠道完整性。这意味着,过度抑制犬尿氨酸通路可能会降低犬尿酸水平,削弱GPR35介导的保护作用,并可能延缓屏障修复。
综上所述,色氨酸代谢在肠道健康中扮演着复杂的角色。因此,在开发治疗肠道屏障功能障碍的新方法时,需要进行更深入的研究。
临床挑战:个体化差异
虽然大量研究表明直接调节肠道微生物群可以改善肠道屏障功能并缓解肠肝疾病,但基于微生物的疗法在临床应用上仍然受到限制。
肠道微生物群产生的有益代谢物,如吲哚-3-乳酸(ILA),其增强肠道屏障的特性取决于宿主特异性的微生物群调节。临床疗效主要取决于患者的初始肠道微生物群组成,这会影响微生物的定植情况。
此外,宿主的遗传变异也是治疗结果的关键因素。例如,携带CARD9风险基因的炎症性肠病(IBD)患者,其膳食色氨酸向芳香烃受体(AHR)激活代谢物的微生物转化能力受损。这些发现解释了微生物靶向疗法中个体差异显著的分子机制。
益生菌作为疾病状态下耗尽的共生微生物,需要稳定的宿主微环境才能定植和发挥作用。如果事先不恢复受损的肠道生态系统,微生物干预疗法往往无法建立持久的微生物平衡或实现有意义的临床结果。因此,未来的治疗策略应采用结合微生物调节和微环境恢复的双靶点方法。
3
肠道干细胞再生
Lgr5+ 肠道干细胞 (ISCs):修复的原动力
肠上皮细胞的更新、修复和再生在很大程度上依赖于位于隐窝底部的Lgr5+肠道干细胞(ISCs)。
Lgr5作为ISCs的特异性标记,编码一种受体,该受体能够响应Wnt等信号,从而触发ISCs重编程为上皮细胞谱系。ISC的活性受到细胞外信号和旁分泌信号的精密调控,以维持肠道稳态,并在损伤发生时启动适应性分化,从而保障肠道的基本生理功能。
调控胆汁酸水平,恢复干细胞活力
胆汁酸在介导肠肝轴通讯中扮演着关键角色,并整合了调控ISC功能的饮食和代谢信号。近期研究提示,通过减少病理条件下肠道内过量的胆汁酸累积,或可为治疗炎症性肠病(IBD)相关的肠道损伤提供新的干预策略。
例如,FXR激动剂治疗通过抑制肝脏中CYP8B1的表达,进而降低肠肝胆汁酸水平,从而减轻胆汁酸对Lgr5+ ISCs的相关毒性。上述发现提示,基于跨器官代谢调节靶向ISCs有望成为治疗IBD的新型目标。
4
免疫调节
传统抗炎疗法的局限性
传统的抗炎疗法,包括皮质类固醇、5-氨基水杨酸制剂以及新型TNF-α单克隆抗体,一直是炎症性肠病(IBD)和其他免疫介导疾病的标准治疗方法。
虽然这些疗法能有效减轻炎症并缓解症状,但它们在实现长期愈合方面往往力有不逮,尤其是在肠道屏障方面。许多患者随着时间推移出现疗效丧失和疾病复发。例如,尽管抗IL-6抗体疗法在临床试验中对中度至重度克罗恩病(CD)或溃疡性结肠炎(UC)有效,但在一些患者中仍持续发生脓肿和肠穿孔等严重不良反应。
这些疗法通常未能解决根本的上皮功能障碍问题,而这正是维持慢性肠道炎症的关键因素。
新兴策略:直接靶向屏障修复
为了解决这些局限性,人们对靶向更直接参与上皮屏障修复的免疫通路越来越感兴趣。IL-10是一种有效的抗炎和组织再生细胞因子,最近开发的IL-10制剂旨在通过靶向黏膜屏障来增强治疗效果。
另一个有前景的靶点是IL-22,其受体IL-22R在上皮细胞上表达,这使得IL-22和IL-22R成为旨在恢复上皮完整性和增强黏膜愈合疗法的潜在候选者。
IL-22通过刺激AMPs(抗菌肽)和粘蛋白的产生以及ISC(肠道干细胞)的再生,在维持肠道稳态中发挥关键作用。因此,IL-22被认为是屏障修复的潜在治疗方法。
IL-22 激动剂的临床与代谢获益
IL-22融合蛋白激动剂Efmarodocokin alfa (UTTR1147A) 目前正在研究中,用于活动性溃疡性结肠炎(UC)和克罗恩病(CD)的治疗(NCT02749630)。
临床试验表明,UTTR1147A在UC患者和健康个体中都能激活IL-22R信号通路,并改善UC相关的菌群失调。
此外,肠道中IL-22信号的特异性激活可以在代谢紊乱模型中以微生物依赖的方式增强肝脏和全身葡萄糖和脂质代谢稳态。此外,IL-22还对MASLD(代谢功能障碍相关脂肪性肝病)、ALD(酒精性肝病)和饮食诱导的肥胖表现出积极作用。
当外源性给药时,IL-22通过其在肠上皮细胞(IECs)而非肝细胞上的受体发挥治疗作用,然后激活STAT3并抑制WNT–β-catenin信号传导以减少吸收性肠上皮细胞的数量。
然而,IL-22在肠道屏障维持中的作用仍存在争议,人们担心可能产生致病性的免疫调节作用,例如在结肠组织中介导CXCR2+中性粒细胞的趋化作用,以及增加对IL-23单克隆抗体Ustekinumab的抵抗力。这些观察结果表明,IL-22靶向疗法可能并非总能达到预期的疗效,需要进一步研究以更好地了解IL-22激活的全部影响和潜在副作用。
5
肠道屏障功能增强相关的临床试验进展
前面介绍了目前针对肠道屏障完整性的多种创新疗法,包括药物、微生物疗法、吸附剂、饮食干预和工程益生菌,并同时也探讨了这些疗法在临床验证中的进展和未来面临的挑战。
其实核心要点如下:
创新疗法:多项创新疗法正在进行临床验证,以靶向肠道屏障完整性。
小分子创新 / 微生物疗法
ISM5411:一种新型肠道限制性选择性脯氨酰羟化酶结构域(PHD)抑制剂,通过AI平台开发,已完成I期临床试验。其在肠黏膜修复和免疫调节方面具有双重机制,在IBD模型中显示出显著疗效。
利福昔明-α (Rifaximin-α):通过上调粪便中的TNF-α和IL-17E来调节肠道微环境,增强抗菌防御,有效促进肠道屏屏障修复。
ZED1227:在乳糜泻中,作为转谷氨酰胺酶2抑制剂,显著改善十二指肠黏膜结构,减少上皮内淋巴细胞浸润,通过抑制免疫原性谷蛋白肽中谷氨酰胺残基的脱酰胺化来防止T细胞活化和黏膜损伤。
粪便菌群移植(FMT):健康供体FMT在恢复糖尿病远端对称性多发性神经病变(DSPN)患者肠道屏障功能和减轻全身炎症方面显示出治疗潜力。
工程益生菌:在恢复肠道屏障完整性和维持黏膜稳态方面具有显著治疗潜力,目前研究重点是结合其屏障增强和免疫调节作用,但仍在临床前阶段。
吸附剂:非吸收性、肠道限制性工程化碳珠吸附剂Yaq-001通过改善肠道屏障功能障碍和减少全身内毒素负荷,在肝硬化中显示出临床疗效。
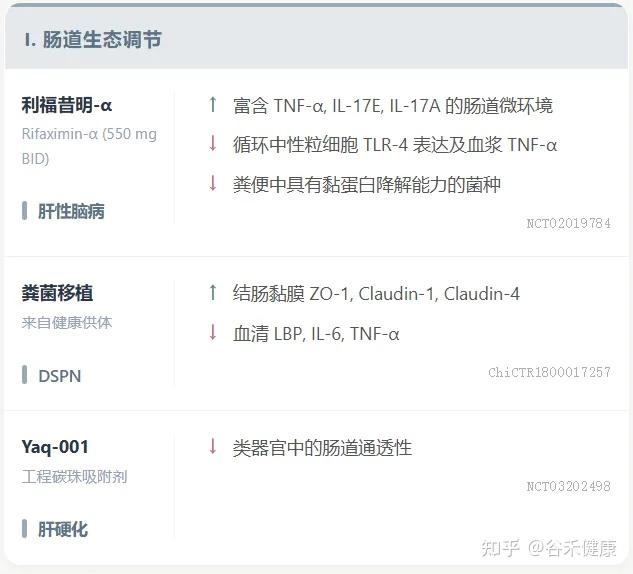

饮食干预
临床研究证实,膳食干预在多种胃肠道疾病中有效。
谷氨酰胺补充剂:显著恢复肠道通透性并缓解感染后肠易激综合征的腹泻 (NCT01414244)。
在肠易激综合征-腹泻、代谢紊乱和轻中度克罗恩病中均显示出益处。

未来挑战
尽管这些进展显示了靶向屏障修复策略的广阔前景,但仍需要在人体试验中全面评估长期安全性和有效性,以推进临床应用。
肠道屏障功能障碍是多种胃肠和肠外疾病(如IBD、MASLD)的关键因素。传统免疫抑制疗法虽能改善症状,但无法根治屏障问题,且副作用明显。新型疗法应结合屏障修复策略,如干细胞再生、微生物疗法、胆汁酸调节、TJ调节剂等。
肠道屏障功能障碍与疾病互为因果,受遗传、环境等因素影响。屏障破坏可引发炎症和多器官功能障碍,导致MASH、IBD、CRC等。同时,疾病微环境反过来又损害屏障,形成恶性循环。
免疫抑制疗法可能抑制黏膜愈合,加剧微生物失衡。需深入研究肠道细胞间通讯,以确定有效治疗靶点。
独立于免疫抑制的屏障防御和修复是治疗肝肠疾病的重要目标。个性化治疗策略可能更有效。增强肠道屏障完整性在MASLD预防和逆转中潜力巨大。未来人体研究至关重要。
恢复肠道屏障是治疗肝肠疾病的重要机遇。新生物技术、再生医学和微生物组研究有望重塑胃肠道治疗格局。
主要参考文献:
Zhang Y, Liu Y, Liang X, Wen Y, Zhao J, He Y, Xie Q, Xie C. Intestinal barrier in chronic gut and liver diseases: Pathogenesis and therapeutic targets. Acta Pharm Sin B. 2025 Nov;15(11):5515-5536.
Macura B, Kiecka A, Szczepanik M. Intestinal permeability disturbances: causes, diseases and therapy. Clin Exp Med. 2024 Sep 28;24(1):232.
Farré R, Vicario M. Abnormal Barrier Function in Gastrointestinal Disorders. Handb Exp Pharmacol. 2017;239:193-217.
Brandl C, Bucci L, Schett G, Zaiss MM. Crossing the barriers: Revisiting the gut feeling in rheumatoid arthritis. Eur J Immunol. 2021;51(4):798–810.
Ramakrishna BS. Role of the gut microbiota in human nutrition and metabolism. J Gastroenterol Hepatol. 2013;28(Suppl 4):9–17.
Bäumler AJ, Sperandio V. Interactions between the microbiota and pathogenic bacteria in the gut. Nature. 2016;535(7610):85–93
谷禾健康
在人类与微生物的共生世界中,新的发现正在不断刷新我们对健康与疾病的认知。肠道、呼吸道、生殖道——这些看似熟悉的环境中,栖息着数量庞大却性质各异的细菌,它们有的温和共生,有的在特定条件下摇身一变成为病原菌。
本次谷禾报告更新,新增了多种具有代表性的潜在致病菌和机会性感染菌——从龋齿放线菌到医院相关耐药菌,从新生儿高危感染的GBS到隐秘的粘质沙雷氏菌——这些微生物不仅展示了复杂的生态角色,也折射出人体微环境的脆弱平衡。
我们希望通过科学、系统的解读,帮助读者理解这些菌群在健康和疾病之中的真实意义:哪些只是短暂停留的“旁观者”,哪些则可能成为引发炎症、感染乃至系统性疾病的“潜在危险信号”。这既是一次对微生物多样性的探索,也是一场关于精准健康管理的知识升级。
龋齿放线菌(Actinomyces odontolyticus)是一种革兰氏阳性、厌氧、非产孢、非运动性杆菌,最早于1958年从口腔龋齿中分离。它通常作为口腔、上消化道和泌尿生殖道的正常菌群存在,但在特定条件下可成为机会致病菌,导致多种感染。
1
基本信息
•形态特征:革兰氏阳性,细长分枝杆菌样,呈丝状。
•需氧情况:严格或微需氧厌氧菌。
•人体分布:人类口腔、咽部、胃肠道和泌尿生殖道的常驻菌群之一。
•特点:与其他放线菌(如A. israelii)类似,可形成肉芽肿样、慢性脓肿,有“硫磺颗粒”。当黏膜屏障受损(如牙科操作、外伤、免疫抑制)时,易由定植转为致病。
2
可能导致的疾病
我们在下表中系统整理了由Actinomyces odontolyticus可能引起的各类疾病:

3
典型症状
•全身症状:患者可出现发热、乏力、体重减轻。局部出现慢性硬结,逐渐形成波动性脓肿,并可伴多发瘘管。脓液中常见黄白色“硫磺样颗粒”,实为菌落团。起病缓慢,虽少见明显全身中毒症状,但可长期低热、消耗,局部愈合不良。
•口腔/颈面部:牙痛、牙龈红肿、口腔脓肿、颈部肿胀。
•胸部/肺部:咳嗽、咳痰、呼吸困难、胸痛、胸腔积液。
•腹部/盆腔:腹痛、肝区压痛、腹部包块、女性可见盆腔炎症。
•中枢神经系统:头痛、意识障碍、神经功能缺损。
•皮肤/导管:脓性分泌物。
4
致病机理要点
•机会致病菌:Actinomyces odontolyticus通常在宿主免疫力下降或局部组织受损时,通过黏附并侵入受损的黏膜或牙龈组织,借此获得感染机会并逐步定植。
•在缺氧或厌氧条件下,该菌可迅速繁殖,形成致密的丝状菌丝团块。这些菌团被机体的肉芽组织所包绕,逐渐构成类似肉芽肿的慢性炎性病灶,使局部组织结构被破坏并持续扩展。
•随着感染进展,病原体可沿组织间隙缓慢向周围扩散,通过连续性扩展和瘘道形成进一步蔓延。由于这种蔓延方式不遵循正常的解剖间隙,病灶范围常远超出皮肤或黏膜表面肉眼可见的受累区域,导致诊断和治疗更加复杂。
5
在肠道里的意义
•这类放线菌本身就可以是口腔和消化道的共生菌之一,在粪便或肠道菌群中检出,并不罕见。多数情况下,仅仅检出不代表有病。
•还有部分研究显示,A.odontolyticus具备硝酸盐还原能力,可能影响口腔及肠道的亚硝酸盐水平,间接参与宿主的抗菌和血管舒张等生理过程 。
6
可能提示或潜在问题
•若在有腹腔感染、慢性脓肿、术后持续不愈的病例中,从腹腔脓液或病灶同时检出放线菌,才需要考虑:是否存在腹部放线菌病(如阑尾穿孔、肠穿孔后形成的慢性肉芽肿性炎症、瘘管等)。
•单纯在“肠道菌群报告”中出现,多半只是共生/或短暂存在,不必单独处理。
总结
A.odontolyticus虽为常见口腔定植菌,但在免疫低下或黏膜损伤时可引发多系统感染,临床表现多样,需高度警惕并结合多种检测手段早期诊断与干预。
摩氏摩根氏菌(Morganella morganii)是一种革兰氏阴性菌,兼性厌氧、杆状细菌,属于肠杆菌科,广泛存在于人类、哺乳动物、爬行动物肠道及环境中。
它通常作为肠道正常菌群存在,但在免疫力低下或特定条件下可成为机会致病菌,引发多种感染,且近年来耐药性和毒力增强,临床关注度显著提升。
1
基本信息
•分类:肠杆菌科,Morganella属,主要有M.morganii subsp. morganii和M.morganii subsp. sibonii 两个亚种。
•生物学特点:无芽孢、运动性强、杆状、兼性厌氧,具强尿素酶活性,能分解尿素。
•生态分布:广泛分布于水体、土壤、动物及人类肠道。
•重要性:常为医院获得性感染的机会致病菌。
2
可能导致的疾病
M. morganii作为机会致病菌,能引发多种感染,常见于以下疾病:
•尿路感染(UTI):常见于留置导尿、结构异常者或免疫低下、老年人、儿童中。
•伤口及软组织感染:包括手术后伤口感染、蜂窝织炎、坏死性筋膜炎等。
•败血症/菌血症:可导致高死亡率,尤其在老年及有基础疾病患者中。
•腹腔及肝胆系统感染:如腹膜炎、肝脓肿、胆道感染。
•其他:脑脓肿、心内膜炎、骨髓炎、关节炎、绒毛膜羊膜炎、食物中毒(组胺中毒)等。
3
典型症状
M. morganii感染的临床表现多样,取决于感染部位和宿主状况,常见症状包括:
•尿路感染:尿频、尿急、尿痛、血尿、发热。
•伤口/软组织感染:局部红肿、疼痛、化脓、坏死、发热,严重时可进展为坏死性筋膜炎。
•败血症:高热、寒战、低血压、意识障碍,严重时可致多器官功能衰竭。
•腹腔感染:腹痛、腹胀、发热、黄疸等。
•其他部位感染:如脑脓肿可表现为头痛、神经功能障碍,心内膜炎可有心脏杂音、心衰表现。
4
致病机理要点
•多重耐药性:M.morganii具备多种耐药基因(如 blaNDM-1、qnrD1、blaKPC-2),对多类抗生素(包括碳青霉烯类、氨基糖苷类等)表现耐药,治疗难度大。
•毒力因子:包括溶血素、尿素酶、IgA 蛋白酶、鞭毛、黏附素等,增强其致病性和组织侵袭能力。
•高危人群:老年人、免疫抑制者、慢性基础病患者、住院及手术后患者感染风险更高,且病死率较高
5
健康风险
•基因毒性与肿瘤风险:
M. morganii 可产生新型基因毒素“indolimines”,能直接损伤肠上皮细胞DNA,增加肠道通透性,并在动物模型中加重结肠肿瘤负担,提示其可能促进结直肠癌的发生与进展。
•炎症与免疫失调
该菌与炎症因子(如IL-6、IL-8、TNF-α)表达升高相关,且与短链脂肪酸水平降低有关,可能加剧肠道炎症和免疫功能障碍。在HIV感染者中,M.morganii丰度升高与抗逆转录病毒治疗后免疫重建不全密切相关。
•精神健康影响
研究发现M. morganii产生的特殊磷脂可激活免疫反应,诱导炎症,且其丰度与抑郁症发病风险增加有关。
6
在肠道里的意义
•属于肠杆菌科,本来就可以是肠道正常菌群的一部分。
•但它也是典型的机会致病菌+容易耐药的医院相关菌。
7
可能提示或潜在问题
•菌群失衡/抗生素压力下(特别是住院、用广谱抗生素的人):Morganella 可能扩增,成为潜在的感染源,例如尿路感染(尤其有导尿管者)、伤口感染、腹腔感染、菌血症、败血症(免疫抑制或重症患者)。
•从菌群学角度:此类条件致病菌大量增多,常提示肠道菌群多样性下降、共生菌被压制。
•什么时候要警惕:在ICU、肿瘤或老年患者中,若粪便或直肠拭子多次检出且丰度较高,并伴发热而无明确感染灶,应警惕其作为潜在的“肠源性血流或尿路感染”病原库,对经验性抗生素选择具有重要参考意义。
总结
M. morganii 虽为肠道常见菌,但其基因毒性、炎症促进、耐药性及与多种疾病的关联,使其成为值得高度警惕的潜在健康威胁。
无乳链球菌(Streptococcus agalactiae)(又称B群链球菌,GBS)是一种革兰氏阳性球菌,广泛存在于人类肠道和泌尿生殖道的正常菌群中,但在特定条件下可转变为重要的人类和动物病原体,导致多种严重感染。
1
基本信息
•革兰染色:革兰阳性球菌,成链状排列。
•溶血性:多为β溶血。
•分类:Lancefield B 群 → 常称“B 族链球菌(GBS)”目前已鉴定出10种血清型(Ia、Ib、II-IX),不同地区和宿主的流行型别有所差异。
•自然栖息地:成人肠道和女性阴道、下生殖道常见定植菌。
2
可能导致的疾病
•新生儿感染(核心重点):
-早发型:新生儿早期败血症、肺炎;
-晚发型:脑膜炎、败血症。
•妇产科感染:
产褥感染、绒毛膜羊膜炎、尿路感染。
•成人侵袭性感染:
皮肤软组织感染、尿路感染、菌血症、肺炎、骨髓炎等,尤其是糖尿病、老年或免疫低下者。
3
典型症状
•新生儿早发型:出生后数小时~数天内出现:呼吸急促、发绀、喂养困难、发热或体温不稳、嗜睡,可进展为呼吸窘迫、休克。
•新生儿脑膜炎:惊厥、反应差、长期可遗留神经系统后遗症。
•妇女:发热、下腹痛、恶露异常、尿频尿急尿痛等。
•成人/老年人:发热、意识障碍、关节炎、皮肤软组织感染、尿路感染、心内膜炎、脑膜炎等,重症可致死亡。
4
致病机理要点
GBS定植依赖多种黏附因子(如Fbs、Lmb、SfbA、HvgA等)和生物膜形成能力,这些机制增强其在肠道黏膜的持久性和侵袭性。
•荚膜多糖(CPS):抗吞噬作用,是主要毒力因子。
•表面蛋白(如C蛋白):有助黏附与免疫逃逸。
•妊娠晚期母体阴道/直肠定植 → 围产期经产道传播给新生儿。
•新生儿免疫系统未成熟,补体及吞噬功能不足,易进展为侵袭性败血症和脑膜炎。
5
在肠道里的意义
•GBS 本身就可定植在肠道和阴道,成人特别是健康人群中检出并不少见。
•对普通非孕成人,大多是良性定植。
6
可能提示或潜在问题
•孕妇:
肠道是阴道定植的“菌库”,肠道检出 GBS,说明机体有GBS 定植风险。
阴道/直肠 GBS 定植 → 分娩时可传给新生儿 → 新生儿早发型败血症/肺炎/脑膜炎。
实务上,真正决定产时预防用药的,还是孕晚期阴道+直肠拭子筛查结果,而不是单纯一份“肠道菌群报告”。
•老年/慢病/免疫抑制人群:
肠道是 GBS 侵袭性感染的潜在来源(菌血症、软组织感染),但总体风险仍属相对低,要结合临床症状。
总结
GBS作为肠道定植菌,既是正常微生态的一部分,也具有转化为致病菌的潜力。其在肠道的存在与新生儿、孕妇及免疫低下人群的感染密切相关。
粘质沙雷氏菌(Serratia marcescens)是一种广泛分布于环境中的革兰氏阴性杆菌,近年来作为机会致病菌在医院获得性感染中日益受到关注,尤其威胁免疫功能低下者和新生儿。
1
基本信息
•革兰染色:革兰阴性杆菌。
•特点:部分菌株产生红色色素,肉眼可见“红色菌落”但临床分离株中无色素菌株更为常见。
具备多种耐药机制,对多类抗生素(如青霉素、头孢菌素、四环素等)有固有或获得性耐药。
•自然栖息地:水、土壤、植物以及医院潮湿环境(洗手池、呼吸机管路等)。
•重要性:典型的医院获得性感染和器械相关感染病原菌。
2
可能导致的疾病
S. marcescens可引发多种感染,尤其在医院环境和免疫低下人群中高发:
•血流感染(菌血症):常见于中心静脉导管相关感染。
•肺炎:包括医院获得性肺炎和重症肺炎。
•尿路感染:尤其在留置导尿管患者中。
•脑膜炎:多见于新生儿或免疫低下者。
•伤口和手术部位感染。
•罕见病例:可见于皮肤软组织感染、心内膜炎、骨髓炎等、角膜炎、结膜炎。
3
典型症状
S.marcescens与其他革兰阴性杆菌感染类似:发热、局部红肿热痛、脓性分泌物,重症可出现败血症、脓毒性休克。具体取决于感染部位和宿主状况:

4
致病机理要点
•黏附与生物被膜形成:在导尿管、静脉导管、呼吸机管路表面形成生物膜,增加持久定植与耐药。
•产生多种水解酶和毒力因子:如蛋白酶、脂酶等,这些物质能够分解宿主组织成分,破坏细胞结构,削弱局部屏障功能,从而进一步导致组织损伤和感染扩散。
•常携带产β-内酰胺酶和多药外排泵:导致多重耐药 → 治疗困难。
•医院潮湿环境的储存与反复污染:是暴发院感的重要原因。
5
在肠道里的意义
•本身不是典型稳定的“常驻共生菌”,更常见为医院环境相关的机会致病菌。
•健康人群肠道中较少见,但在住院患者,尤其是ICU或长期使用抗生素者中检出率显著升高。
•新生儿与免疫低下:肠道定植可导致院内感染暴发,易扩散至血流、呼吸道等部位,致病率和死亡率高。
•抗生素耐药:具多重耐药性,易获得广谱抗生素耐药基因,增加治疗难度。
6
可能提示或潜在问题
•表明患者已被多重耐药医院菌群定植:肠道成为储存库,增加导尿管相关尿路感染、呼吸机相关肺炎及静脉导管相关菌血症的风险。
•肠道菌群失衡:定植后抑制益菌生长,降低菌群多样性,影响宿主免疫与发育。
•公共卫生与院感防控角度:若大量患者肠道定植 Serratia,病区院感暴发风险显著上升。并且可经医院环境、医护人员手部及医疗器械传播,且难以根除。
7
需要关注的人群
•ICU、血液肿瘤科、器官移植患者:如果粪便/直肠拭子筛查提示有 Serratia marcescens(尤其是已知多重耐药株):通常会在经验性抗生素选择、隔离防护上额外注意。
总结
Serratia marcescens是重要的机会致病菌,在肠道中不仅可引发局部和全身性感染,还会扰乱肠道微生态,促进耐药性传播,尤其对新生儿和免疫低下人群威胁极大。加强监测、感染控制和合理用药,是降低其危害的核心措施。
索氏志贺氏菌(Shigella sonnei),也叫宋内志贺菌,是全球重要的肠道致病菌,近年来在发达国家和部分发展中国家发病率持续上升,且耐药性问题日益突出。
1
基本信息
•革兰染色:革兰阴性短杆菌。
•生物学:不运动、不产H2S,极少发酵糖类。
•分类与流行病学:Shigella sonnei属于肠杆菌科、志贺菌属的四个主要种之一,在发达地区更常见(与 S. flexneri 相对),但随着全球卫生条件改善,其在中低收入国家的比例也在上升。
•传播途径:主要通过粪-口途径传播,包括被污染的水、食物、接触受污染物品等。人是其主要宿主,极低的感染剂量(1-100个细胞)即可引发疾病,极易造成暴发流行。
•耐药性:S.sonnei对多种抗生素(如氟喹诺酮、头孢菌素、阿奇霉素等)耐药性显著增强,已成为全球公共卫生关注的多重耐药菌株。
2
可能导致的疾病
•主要疾病:S.sonnei是细菌性痢疾(志贺菌病,shigellosis)的主要致病菌之一,尤其在发达国家占主导地位。
•特殊人群风险:儿童、免疫力低下者、男男性行为者(MSM)、流浪者等为高风险人群,部分病例可出现菌血症、重症结肠炎甚至败血症。
•暴发场景:可引起食源性、饮水型、性传播及机构内(如学校、收容所)暴发。
3
典型症状
•常见症状:水样腹泻、腹痛、发热、恶心、呕吐。部分病例可出现血便(即“痢疾”),严重者可有脱水、休克等并发症。
•潜伏期:通常为1-4天,部分个体可无症状但仍具传染性。
•重症:脱水、电解质紊乱、毒血症,少数可出现中毒性肠麻痹或中毒性脑病(儿童)。
•特殊表现:免疫力低下者、儿童及老年人更易发展为菌血症和全身感染。
4
致病机理要点
•极低的感染剂量(10~100个菌即可致病),因此高度传染性。
•S.sonnei通过多种毒力因子(如III型和VI型分泌系统、O抗原胶囊、群体感应信号4-HBA等)侵袭肠上皮细胞,破坏肠黏膜屏障,诱发炎症反应。
S.sonnei的毒力因子
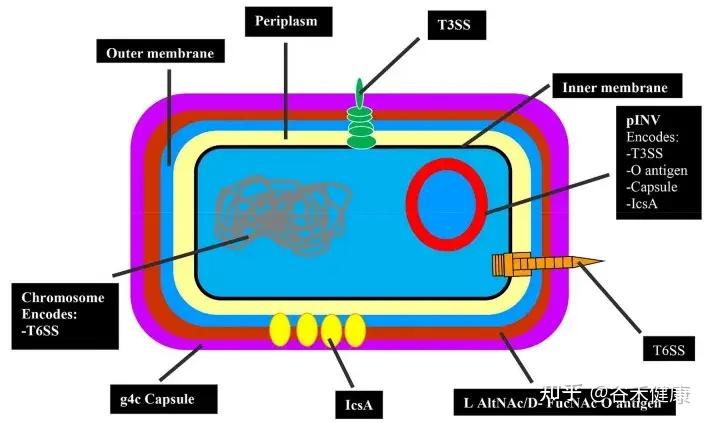
•其VI型分泌系统和细菌素(colicins)赋予其在肠道内与其他菌群竞争、占据生态位的能力,促进其流行。
•通过M细胞入侵肠上皮 → 细胞内增殖 → 从细胞侧面传播,造成上皮细胞坏死、溃疡。
•产生志贺毒素(Shiga toxin,一些菌株):抑制蛋白合成,导致黏膜细胞死亡,也可引起全身毒性反应
•粘膜受损导致渗出性炎症和溃疡 → 典型的黏液脓血便与里急后重。
•感染可显著扰乱肠道菌群多样性,部分患者即使临床恢复后,肠道微生态仍长期异常。
5
在肠道里的意义
•志贺菌是典型肠道致病菌,不是共生菌。
在粪便或肠道菌群中检出,尤其丰度不低时,通常意味着:
•正在感染期;
•或刚经历过感染,处于带菌/恢复期排菌状态。
6
可能提示或潜在问题
•急性期:细菌性痢疾 → 腹痛、里急后重、黏液脓血便、发热。
•恢复/带菌期:人本身症状可能已好转或无症状,但仍有:继续向他人传播的风险(粪–口),公共场所/托幼机构尤其要警惕。
•少数患者可发展为:
脱水、电解质紊乱;
中毒性肠炎/中毒性脑病(多见儿童);
感染后肠易激综合征等后遗症。
•耐药基因发展
S.sonnei对多种一线和二线抗生素(包括氟喹诺酮、头孢菌素、阿奇霉素等)耐药株迅速扩散,导致治疗选择受限。耐药基因可通过质粒在肠道内水平转移,增加耐药性在肠道微生物群中的传播风险。
7
检出后的处理思路
•若伴随腹泻、发热等症状 → 需要按细菌性痢疾评估和管理。
•即使暂时无症状,但粪便志贺菌阳性,尤其在托幼机构、食品从业人员等,应当从传染病防控角度处理。
总结
Shigella sonnei在肠道中不仅引发急性腹泻,还因其强竞争力、复杂致病机制和多重耐药性,带来持续的公共卫生威胁。加强监测、合理用药、疫苗研发及肠道微生态修复是未来防控的关键方向。
化脓性链球菌(Streptococcus pyogenes,简称GAS)是A群β溶血性链球菌。是全球重要的人体病原体,能引发从轻微到危及生命的多种疾病。
1
基本信息
•分类与特性:S. pyogenes 属于A群β溶血性链球菌,革兰阳性球菌,常呈链状排列。该菌能在富血培养基上生长并产生完全溶血。
•重要特点:多种毒力因子,可致急性感染及免疫后遗症。
GAS的毒力因子
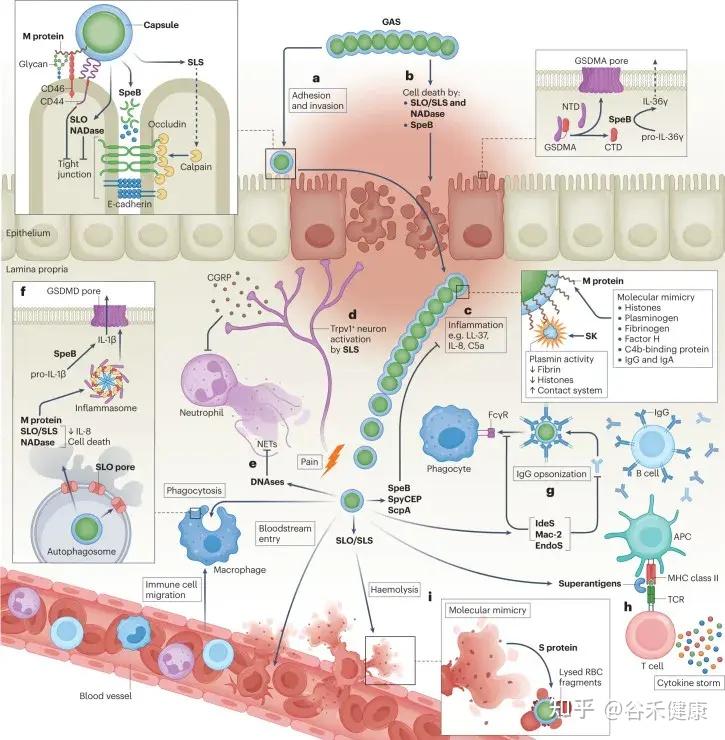
•传播途径:主要通过呼吸道飞沫、密切接触传播。上呼吸道和皮肤是主要的感染部位。
•流行病学:全球每年导致约50万例死亡,尤其在卫生条件较差地区危害更大。
2
可能导致的疾病
Streptococcus pyogenes感染后可能引发多种类型的疾病,如下:

3
典型症状
•咽炎/扁桃体炎:喉咙痛、发热、咽部充血、扁桃体肿大、化脓、软腭点状出血、颈部淋巴结肿大。
•猩红热:皮疹(常为沙粒状)、“草莓舌”、高热、咽痛、腺体肿大。
•皮肤感染:局部红肿、疼痛、脓疱、溃烂,严重时可发展为坏死性筋膜炎。
•侵袭性疾病:高热、休克、意识障碍、器官功能障碍(如肺炎、脑膜炎、败血症等)。
•免疫并发症:风湿热表现为关节炎、心脏炎、皮下结节等;急性肾小球肾炎表现为血尿、水肿、高血压,多在皮肤或咽部感染后1–3周出现。
4
致病机理要点
•M蛋白:抗吞噬、促进黏附,是关键毒力因子,也与风湿热的分子模拟相关。
•外毒素(SPE:streptococcal pyrogenic exotoxins):可作为超抗原 → 引起大量细胞因子释放 → 毒性休克、猩红热皮疹。
•溶血素(SLO、SLS):溶血、损伤组织。
•透明质酸荚膜:抗吞噬作用。
•免疫后遗症(风湿热、肾炎):多是免疫交叉反应与免疫复合物沉积所致,而非细菌直接侵袭。
5
在肠道里的意义
•主要定植于咽部和皮肤,并非典型肠道菌。
•在肠道菌群检测中检出,多见几种情况:
1.咽部分泌物被吞咽→通过粪便短暂排出;
2.可能存在上呼吸道感染;
3.极少数真正的肠道/腹腔感染(如坏死性小肠结肠炎等极罕见情形)。
6
可能提示或潜在问题
一般来说,单在菌群检测里偶然检出意义有限。真正需要警惕A组链球菌的,是:
•侵袭性疾病风险
GAS可通过肠道引发罕见但严重的腹膜炎,常被误诊为阑尾炎,延误治疗可能危及生命。女性、免疫抑制者及有水痘史者为高危人群,早期识别和抗生素治疗至关重要。
•免疫相关并发症
反复或持续感染可诱发免疫介导的疾病,如急性风湿热、风湿性心脏病和急性肾小球肾炎,尤其在发展中国家致死率高。
•功能性消化不良与肠道功能障碍
最新动物研究显示,GAS定植可通过皮肤-肠道轴影响胃肠动力,抑制RhoA/ROCK1信号通路,导致食欲下降、体重减轻和胃肠蠕动障碍,提示其可能加重功能性消化不良。
•抗生素耐药性与公共卫生挑战
GAS对青霉素的敏感性下降及大环内酯类耐药的增加,威胁一线治疗手段,需密切监测和合理用药。
总结
S.pyogenes是一种高度多样且致病力强的细菌,既可引发常见的咽炎、皮肤感染,也可导致危及生命的侵袭性疾病和免疫相关并发症。典型症状因疾病类型而异,需临床高度警惕并及时治疗。
解脲支原体(U.urealyticum,Uu),又称为溶脲脲原体。主要寄居于泌尿生殖道,在特定条件下可致病。
1
基本信息
•归类于支原体类,无细胞壁(对β-内酰胺类天然耐药)
•极小型(“类原核生物”),通过固着于黏膜表面生存。
•自然栖息地:男女泌尿生殖道黏膜正常菌群之一,常为性传播。
2
可能导致的疾病
•男性:非淋菌性尿道炎(NGU),精囊炎、附睾炎等。
•女性:宫颈炎、盆腔炎、输卵管炎、不孕风险增加。
•妊娠相关:绒毛膜羊膜炎、羊水感染、早产、胎膜早破。
•新生儿:肺炎、菌血症、脑膜炎,尤其极低出生体重儿。
•免疫低下者:机会性感染。
3
典型症状
•男性非淋菌性尿道炎:尿道刺痛、瘙痒、轻度分泌物,症状可较轻、反复发作。
•女性宫颈炎/盆腔炎:下腹痛、白带增多、性交痛、不规则出血。
•妊娠并发症:发热、下腹痛、胎动异常、早产征象。
•新生儿:呼吸窘迫、发热或体温不稳、反应差等。
4
致病机理要点
•黏附因子:附着于泌尿生殖道上皮细胞表面,干扰纤毛功能。
•尿素酶:分解尿素→生成氨和二氧化碳:
过量氨对上皮细胞有毒性作用,引发局部炎症;
改变局部pH,影响黏膜屏障。
•诱导宿主产生多种炎症因子(如IL-6、IL-8),使局部出现慢性炎症与微环境改变,影响孕囊稳定和胎膜完整性。
5
在肠道里的意义
•其典型定植部位主要位于泌尿生殖道黏膜,包括尿道、宫颈及阴道等区域,在这些部位最易形成稳定的定植状态并长期存在。
•在粪便或肠道菌群中也可检出该菌,但多数情况下为采样过程中会阴部污染所致,尤其在女性样本中这一情况更为常见。
6
可能提示或潜在问题
•对肠道本身的影响:目前尚缺乏充分而有力的科学证据,尚不能明确证明其在肠道内具有直接的致病作用,更多情况下可能仅为暂时定植或伴随现象。
•需要重点关注的情况是:如果在生殖道相关样本(如尿道拭子、宫颈分泌物)中检测到该菌丰度较高,同时伴随出现尿道炎、不孕或妊娠相关并发症等临床表现,此时检测结果才真正具有临床意义和诊断参考价值。
注:若仅在肠道菌群中偶然检出该菌,而未见相应的临床症状或体征,通常不建议仅依据此结果进行疾病诊断或启动抗菌治疗。
Mycoplasma pneumoniae(肺炎支原体)是一种无细胞壁、体积极小的专性寄生细菌,是全球社区获得性肺炎(CAP)尤其是儿童和青少年中最常见的病原体之一。其感染可导致多种呼吸道及肺外疾病,临床表现多样,部分病例可进展为重症甚至危及生命。
1
基本信息
•肺炎支原体为最小的自由生活原核生物之一,缺乏细胞壁,对β-内酰胺类抗生素天然耐药。
•主要通过飞沫传播,潜伏期为2-3周。
•该菌主要寄生于呼吸道上皮细胞,通过特殊的终末附着器实现黏附、侵袭和免疫逃逸。
•近年来,耐大环内酯类(如红霉素)菌株比例显著上升,尤其在中国和亚洲地区。
2
可能导致的疾病

3
典型症状
•呼吸道症状:持续性干咳(最常见,85-96%)、发热(86-96%)、咽痛、头痛、乏力、气促、胸痛、喘息等。
•肺外症状:皮疹、恶心/呕吐、关节痛、神经系统症状(如头痛、意识障碍)、心肌损伤、肝肾功能异常等,约1/4患者可见。
•儿童表现:咳嗽、哮喘样症状、低热,部分伴有皮肤表现(25%)、消化道症状(33%)。
•影像学:单侧或多叶浸润、实变、胸腔积液等,部分病例可见肺不张或大面积病变。
4
致病机理要点
•P1黏附蛋白:结合呼吸道上皮细胞表面的纤毛,牢固黏附 → 破坏纤毛运动,干扰黏液清除。
•产生CARDS toxin(Community-Acquired Respiratory Distress Syndrome toxin)等毒素,损伤上皮细胞,引发炎症。
•诱发宿主细胞免疫和体液免疫反应,其中部分交叉反应导致肺外免疫并发症(如溶血性贫血、皮疹、神经系统损害等)。
•由于细胞壁缺失,细菌形态柔软、易穿行于黏膜表面间隙,且对多种抗生素类别不敏感(需用大环内酯、四环素或氟喹诺酮类)。
5
在肠道里的意义
•是典型的呼吸道病原体(气道黏附),不属于肠道定植菌。
•在肠道菌群测序中检出,通常是吞咽气道分泌物中的菌体/DNA,短暂通过消化道。
6
可能提示或潜在问题
•一般不直接导致肠道疾病,更多表明可能存在呼吸道感染。但M. pneumoniae感染可显著改变肠道菌群结构,降低有益菌如乳酸杆菌和双歧杆菌的丰度。这种菌群失衡与炎症因子升高密切相关,尤其在伴喘息的患儿中更为明显。同时肠道菌群的变化会加剧免疫失调,促进炎症反应,增加哮喘等并发症风险。
•肺炎支原体真正的危害仍在:非典型肺炎、持续干咳、肺外免疫并发症(皮疹、溶血性贫血、中枢神经系统累及等)。
总结
M.pneumoniae不仅影响呼吸系统,还可通过肠道微生态紊乱和免疫调节,导致肠道损伤和多系统炎症反应。关注其肠道影响有助于早期识别非典型病例,并为综合治疗提供新思路。
Clostridium symbiosum(共生梭菌)是一种严格厌氧、具鞭毛、可运动、不产毒素的芽孢杆菌,属于厚壁菌门,在人体肠道中可作为正常菌群存在,但近年来被认为是新兴的致病菌,临床分离较为罕见。
1
基本信息
•形态与生理特征:C. symbiosum为芽孢形成、鞭毛运动、革兰氏阳性杆菌,但因其对氧的敏感性,常表现为革兰氏阴性染色。它不产毒素,能发酵多种糖类。
•生态分布:主要存在于人类肠道正常菌群中,也可在动物肠道及环境中发现。
•致病性:与其他梭菌如 C.perfringens、C.difficile 相比,其致病性报道较少。多在严重基础病或免疫抑制、肠道屏障破坏时成为机会致病菌。
2
可能导致的疾病
目前临床报道不多,可见于:
•腹腔内感染:如穿孔性腹膜炎、腹腔脓肿(与肠道穿孔/手术有关)。
•菌血症/败血症:多为重症患者、肿瘤患者、长期住院或使用广谱抗生素者。
•结直肠癌:C. symbiosum在结直肠癌患者肿瘤组织中显著富集,并与腺瘤复发风险增加相关。动物实验显示其可促进肠道干细胞增殖和癌变,机制涉及支链氨基酸代谢和胆固醇合成通路激活。
•可能参与某些肠道菌群失衡相关疾病(如代谢性疾病、肠炎)中的“共病菌”,但具体因果尚在研究中。
3
典型症状
•无特异性,通常与原发病及感染部位相关:
-腹痛、发热、白细胞升高、腹膜刺激征(腹腔感染);
–寒战、高热、低血压、脓毒性休克表现(菌血症)。
•其他:如合并腹腔脓肿、手术部位感染等,表现为局部红肿、疼痛、化脓等。
•多数为混合感染:与其他肠道厌氧和需氧菌同在,单独分离报道较少。
4
致病机理要点
•作为梭菌,可形成芽孢,在不利环境中长期存活;进入厌氧环境(如坏死组织、闭合脓腔)后即可迅速繁殖。
•当肠道屏障受损(如穿孔、手术、肿瘤浸润)时,可随肠内容物移位至无菌体腔或血流,引发机会性感染。
•可能分泌组织降解酶和毒力因子,但其毒力谱较艰难梭菌(C. difficile )等梭菌研究尚不充分。
5
在肠道里的意义
这是典型的肠道厌氧共生菌之一,在健康人粪便中检出是常见且正常的。
•能量代谢与交互喂养:C. symbiosum 能分解膳食抗氧化剂(如麦角硫因),产生可被其他菌(如 Bacteroides xylanisolvens)利用的电子受体,促进厌氧能量代谢和菌群协同生长。这种交互喂养机制有助于维持肠道微生态稳定,并可能影响个体疾病风险。
•短链脂肪酸(SCFA)合成:C. symbiosum 参与乙酸等 SCFA 的合成,SCFA 对维持肠道屏障、调节免疫和抑制肿瘤细胞增殖具有重要作用。
6
可能提示或潜在问题
•菌群失衡的“标志菌”之一(研究层面):
一些研究发现,在某些疾病(如结直肠癌、代谢性疾病、肠道炎症状态)中,某些梭菌(包括C.symbiosum在内)丰度升高或降低,可作为潜在“生物标志物”。但这些更多是统计学相关性,并不能简单说“检出/增多 = 一定有某种病”。
•机会致病菌:
当肠道屏障严重破坏(穿孔、手术、肿瘤浸润)或极度免疫抑制时,共生梭菌可随肠内容物进入腹腔或血流,引起腹腔感染或厌氧菌败血症。真正发生时,往往是与其他肠道菌“混合感染”,而不是它单独“作恶”。
•抗药性:
C. symbiosum中携带多种环境来源的抗生素抗性基因,提示其在抗药性传播中的重要角色。
总结
Clostridium symbiosum 在肠道生态、能量代谢、疾病发生及抗药性传播中扮演着双刃剑角色。其作为结直肠癌等疾病的潜在生物标志物和微生态调节靶点,具有重要研究和临床应用前景,但也需警惕其条件致病性和抗药性扩散风险。