-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
《血糖,微生物,胰岛素》
2型糖尿病(T2D)是一种全球性慢性代谢性疾病,目前已影响超过 4.6亿人,其社会经济负担巨大,迫切需要寻求有效的治疗方法。
根据中华医学会糖尿病学分会发布的《中国2型糖尿病防治指南》,我国2型糖尿病的管理路径清晰而规范:以生活方式干预为基石,以二甲双胍为一线首选,后续根据情况采取阶梯式的强化治疗。
然而,尽管指南明确,临床上仍然面临治疗反应个体差异大这一核心难题,这导致我国仍有近半数患者血糖控制不达标。为何同样的“金标准”方案,效果却天差地别?
多项研究发现,2型糖尿病的肠道菌群组成与健康人存在明显差异,菌群失衡可能通过影响短链脂肪酸合成、胆汁酸代谢及胰岛素敏感性等途径促进代谢紊乱。
甚至连二甲双胍这些药物的降糖效应,竟有相当一部分是依赖其对患者肠道微生物群的重塑和调节。
本文将介绍当前有关肠道微生物群调控葡萄糖稳态的潜在机制,并重点探讨近年来通过靶向肠道菌群改善糖代谢的研究进展。其中包括粪菌移植、益生元、益生菌、合生元与外源性代谢调节物质等多种策略在动物模型中的应用及其转化潜力。这些非侵入性干预手段有望为2型糖尿病带来新的、有效的治疗或至少是辅助选择。
要揭示肠道菌群与个体糖尿病的关系,需要谨慎和长期的队列研究
肠道菌群:一个多因素互动的复杂网络
然而,事情并非绝对“好细菌”与“坏细菌”的简单对抗。肠道菌群是一个复杂的生态系统,这个复杂的网络包括:
所有这些因素交织在一起,共同决定了我们的代谢健康状况。
因此,要真正揭示肠道菌群在糖代谢中的作用机制,就需要做到:
这类研究不仅能为糖尿病的早期预测和个体化干预提供坚实证据,也将为利用肠道菌群进行精准营养调控和代谢重塑奠定科学基础。
谷禾已经通过14,846例2型糖尿病患者(包括妊娠糖尿病)构建了早期糖尿病预测模型,但该模型仍面临若干挑战。
未来谷禾会继续推进研究结合代谢组,药理学等多组学数据,并通过多中心、纵向的设计来控制药物等潜在混杂因素,以实现更高精度、更具普适性的肠道菌群早期糖尿病预测模型。
通过深入探索这些微生物是通过哪些机制影响血糖平衡和代谢功能的,也许会为糖尿病治疗带来新的突破。
肠道屏障受损:免疫与糖代谢的微妙联系
肠道屏障是先天性免疫系统的重要组成部分,它的主要工作就是筑起一道坚固的墙,将肠道内的细菌、病原体及其代谢产物牢牢地限制在肠道内,防止进入血液循环。
▸当肠道屏障出现漏洞
然而,高脂饮食(HFD)会破坏肠道微生物群平调,诱发肠漏,这使得细菌内毒素,特别是革兰阴性菌产生的脂多糖(LPS),更容易进入血液循环,形成“代谢性内毒素血症”。
▸炎症的触发机制
—警报响起
泄漏到血液中的LPS会激活免疫细胞表面的Toll样受体4 (TLR4)。
—信号传导
TLR4被激活后,会启动一个信号级联反应,导致细胞核内的 NF-κB激活。NF-κB是调控炎症反应的总开关。
—促炎因子
被激活的NF-κB会命令细胞大量生产和释放促炎细胞因子,如肿瘤坏死因子-α (TNF-α)、白介素-6(IL-6)等。在全身造成低度慢性炎症。
值得注意的是,近期研究发现,不同菌种来源的LPS在影响葡萄糖代谢、炎症反应及肠屏障完整性方面存在差异,说明仅以LPS总量评价肠漏程度可能并不准确。
▸ 慢性炎症:导致胰岛素抵抗的元凶
这种炎症状态是导致代谢紊乱的关键因素之一,例如,TNF-α会直接干扰肌肉细胞对胰岛素的响应,阻碍血糖的正常利用,最终引发胰岛素抵抗、高血糖及高胰岛素血症。
▸免疫系统与菌群的双向互动
免疫系统和肠道菌群的关系并非单向的,而是一个复杂的双向互动。
关键免疫细胞:Th17细胞
这是一种特殊的T细胞,它在正常情况下分泌IL-17和IL-22等因子,对于维持肠道屏障的完整性和抵御病原体至关重要。可以看作是城墙的守护者。
➦ 菌群 → 免疫系统
证据1(生酮饮食):生酮饮食会减少肠道中Th17细胞的数量。但如果给无菌小鼠移植了采用生酮饮食的人的粪菌,小鼠的Th17细胞也会减少。而补充双歧杆菌则可以恢复Th17细胞的水平。
证据2(高糖高脂饮食):高糖高脂饮食会减少那些能够诱导Th17细胞发育的特定细菌。如果给高糖高脂饮食喂养的小鼠补充这些特定的细菌,它们的Th17细胞水平得以恢复,血糖也得到改善。
➦ 免疫系统 → 菌群
证据(过继转移):将Th17细胞直接移植到肥胖小鼠体内,这些小鼠的肠道菌群结构发生了有益的改变,葡萄糖耐量也得到了改善。
doi.org/10.1146/annurev-physiol-051524-094728
►▷
不良饮食 → 菌群失调 → 肠漏 → LPS进入血液 → 激活免疫系统(TLR4)→ 慢性炎症(TNF-α)→ 胰岛素抵抗。
菌群的改变会影响关键免疫细胞(如Th17)的数量,而免疫系统的状态反过来又能重塑肠道菌群的构成。
这种菌群与肠道免疫之间错综复杂的相互作用,是理解代谢性疾病病理生理的核心,也为未来的治疗提供了新的靶点。
短链脂肪酸:菌群送给你的控糖礼物
短链脂肪酸(SCFAs)包括丁酸、丙酸、乙酸,它们是由肠道细菌通过碳水化合物发酵产生。
它们不仅仅是代谢产物,更是重要的信号分子,是肠道菌群与我们身体对话的语言。
▸ 短链脂肪酸如何调控血糖?
▸ 动物研究,直接补充SCFA改善血糖
多项动物实验表明,外源性补充SCFAs可改善能量代谢与血糖稳态,表现为体重下降、葡萄糖耐受性提升及胰岛素抵抗减轻。
▸ 人体研究,效果不一致
例如,口服丁酸仅在健康受试者中改善血糖控制,而对代谢综合征患者无显著效应,提示代谢紊乱本身,可能就损害了人体对SCFA信号的响应能力。
▸ 口服补充为何会失效?
口服补充SCFA是不符合生理规律的。
在自然状态下,绝大多数SCFA是在远端肠道(结肠)中由细菌产生的。
口服的缺陷:口服的SCFAs在到达结肠之前,可能早已在胃或小肠中被吸收或代谢掉,无法到达它们应该发挥主要作用的地方。
有力的证据: 一项巧妙的研究解决了这个问题。科学家设计了一种“菊粉-丙酸酯”,这种特殊结构可以保护丙酸不被提前吸收,精准地将其运送到结肠释放。结果发现,这种精准投放的丙酸,确实能够有效改善超重和肥胖人群的能量代谢和胰岛素敏感性。
这说明,SCFA在哪里释放,比释放了多少,可能更为重要。
▸ 为何病人的粪便里SCFA反而更高?
库存 ≠ 产量
一些研究发现,代谢疾病患者粪便中的SCFA含量反而更高。这似乎与“SCFA是有益的”这一观点相矛盾?
合理解释:粪便中的SCFA含量,仅仅是未被肠道吸收和利用的“剩余物资”。
▸ 肠道菌群-短链脂肪酸-肠道激素轴
短链脂肪酸通过与肠内分泌细胞(EECs)上的受体结合,刺激激素的释放,比如说,GLP-1(胰高糖素样肽-1)、PYY(肽YY)、GIP(胃抑制肽)、CCK(胆囊收缩素)等。GLP-1与GIP为主要的“促胰素”,能够在摄食后迅速加强胰岛素分泌反应,是控制餐后血糖的关键。
doi.org/10.1146/annurev-physiol-051524-094728
近年来的新发现进一步揭示,微生物群可通过调控宿主营养感知机制影响肝脏糖异生,形成由GLP-1介导的“肠–脑–肝”信号轴。
►▷
由于肠道菌群与上皮层密切接触,它可能通过改变肠内分泌细胞的营养感知机制,并利用短链脂肪酸及其他微生物代谢物作为信号分子,调控肠激素分泌和葡萄糖平衡。这种微生物与宿主的相互作用网络为解析肠源信号调控代谢疾病提供了新的理论框架。
菌群把胆汁酸变成影响血糖的信号
肠道是一个高度复杂的生态系统,如同一个动态的生物反应器,在这个反应器里,无数的微生物与我们吃进去的食物、以及我们身体自己分泌的物质(如胆汁)发生反应,生成了大量独特的代谢产物。
关于肠源性代谢产物我们前面已经讨论过短链脂肪酸,现在焦点转向另一位主角:胆汁酸。
★ 胆 汁 酸
▸ 初级胆汁酸
出生地: 肝脏。 原料: 胆固醇。
初始形态:在肝脏合成后,它们会与牛磺酸(主要在小鼠中)或甘氨酸(主要在人类中)结合,形成结合型初级胆汁酸。
主要工作:进入肠道,帮助我们消化和吸收脂肪。
▸ 次级胆汁酸
一旦初级胆汁酸完成了消化任务并进入肠道后段,肠道菌群就接管了,对胆汁酸进行两步关键的改造:
这种从初级到次级的转变至关重要,因为不同形态的胆汁酸,会像不同的钥匙一样,激活不同的细胞受体“锁”,从而触发完全不同的生理效应。
doi.org/10.1146/annurev-physiol-051524-094728
▸ 两大关键受体:TGR5 与 FXR
次级胆汁酸主要通过激活两个著名的受体来发挥信号作用:
—— TGR5受体 (明确益处)
激活机制:菌群将初级胆汁酸(如鹅去氧胆酸)转化为次级胆汁酸(如石胆酸),后者是TGR5受体的强效激动剂。
明确的益处:激活肠道细胞上的TGR5受体,能够促进GLP-1的分泌,从而改善高脂饮食动物的血糖稳态。
—— FXR受体 (更具争议)
FXR受体则要复杂得多,它的作用似乎取决于它在哪个器官被激活。
在肝脏中(作用清晰):
激活肝脏的FXR受体,可以改善健康和糖尿病小鼠的胰岛素敏感性。
在肠道中(作用矛盾):
一些研究报告称,使用激动剂激活肠道FXR能改善胰岛素抵抗和葡萄糖耐量。
而另一些研究(包括我们之前讨论的产乳酸菌的研究)则发现,使用拮抗剂抑制肠道FXR,或者直接把肠道FXR基因敲除掉,反而能改善血糖稳态。
这说明,FXR在肠道中的作用远非简单的“开”或“关”,而是受到多种因素调控的复杂网络。
★ 其他代谢产物
这些肠源性代谢产物通过影响能量代谢、免疫反应以及宿主信号通路,构成肠道微生物–代谢–宿主疾病之间的重要生物学纽带。
既然我们已经明确,肠道菌群是糖尿病发生发展的关键一环,那么一个问题随之而来:我们目前广泛使用的那些经典降糖疗法,比如二甲双胍等,它们的疗效背后,是否也隐藏着菌群的秘密?下面我们就来看看,常见的治疗方式是如何通过影响肠道菌群来帮助我们控制血糖的。
二甲双胍
二甲双胍是最常见的降糖药之一。它降低血糖的传统机制是减少肝脏制造葡萄糖的能力。但近些年,人们发现——它在肠道里也发挥着巨大作用。
研究发现,口服二甲双胍比注射更能有效降糖,提示它在消化道内可能有额外的作用通路。科学家进一步发现,二甲双胍能改变肠道菌群结构:
更有趣的是,如果把“吃过二甲双胍的小鼠”的小肠菌群移植到其他糖尿病老鼠体内,这些受体小鼠体内的营养感知通路得以恢复,进而抑制了肝脏的葡萄糖生成——也就是说,药效可以通过菌群“传递”出来。
这说明,二甲双胍不仅是“肝药”,更是“肠药”。它同时通过肠道菌群、胆汁酸,以及“肠–脑–肝”信号网络,共同调控血糖代谢。
GLP-1受体激动剂
GLP-1受体激动剂(胰高糖素样肽-1受体激动剂,GLP-1RAs)是一类降糖药物,GLP-1受体激动剂通过多靶点机制发挥作用:
▸肠道菌群对GLP-1的双重影响
促进分泌:肠道菌群能够促进肠道内GLP-1激素的分泌,这是一种有益的代谢效应。
限制作用:分泌的GLP-1在体内极易被二肽基肽酶-IV(DPP-IV)快速降解,导致其对血糖和食欲的系统性调节作用受限,仅产生局部、短暂的代谢效应。
注:DPP-IV 是 Dipeptidyl Peptidase-IV 的缩写,中文名称为 二肽基肽酶-4。它是一种丝氨酸蛋白酶(serine protease),广泛存在于人体的多种组织中,包括肠道上皮、肝脏、肾脏、免疫细胞以及血浆中。
因此,肠道菌群在介导GLP-1药物系统性效应中的具体角色仍不明确。
▸动物与人体研究中的差异
关于GLP-1RAs对肠道菌群的影响,现有研究结果存在不一致。
动物研究:在高脂饮食或糖尿病动物模型中,GLP-1RAs治疗能够增加肠道菌群的多样性,并提升有益菌(如Akkermansia muciniphila、乳酸杆菌)的丰度。
🧍♀️人类研究:也有观察到双歧杆菌数量增加。但大多数人类临床研究报告称,在接受GLP-1RAs治疗后,患者的肠道菌群组成并无显著变化。
▸给药途径:可能是造成差异的关键因素之一
大部分GLP-1RAs均经皮下注射给药,因此菌群改变或许是药物通过影响肠道生理功能(如延缓胃排空、降低肠蠕动等)所致的间接效应,而非药物直接作用于菌群。
目前,虽然口服剂型司美格鲁肽已获批准,但其对肠道菌群的直接影响尚缺乏系统性评估。
▸新视角:来自肠道菌群的DPP-IV
近期的一项关键研究为理解这一复杂关系提供了重要的新视角:
部分肠道微生物自身能够产生并分泌DPP-IV酶。这种细菌源性的DPP-IV同样会降解宿主的GLP-1,从而削弱其生理活性。
临床关联: 研究发现,在对DPP-IV抑制剂药物西他列汀反应不佳的个体中,其肠道微生物的DPP-IV活性显著更高。
干预潜力: 基于此,研究人员已鉴定出一种能特异性抑制微生物DPP-IV的抑制剂,并在动物模型中证实其能改善葡萄糖耐受性,并降低粪便DPP-IV活性。
►▷
这一发现为2型糖尿病(T2D)的治疗开辟了新思路。未来可能开发出一种联合干预策略,即同时靶向宿主和菌群来源的DPP-IV。这种策略有望更有效地保护内源性GLP-1,从而实现更优的血糖控制效果。
减重手术
两种常见的减重手术——Roux-en-Y胃旁路术(RYGB)和 袖状胃切除术(VSG),在胃肠道生理结构上的改变机制不同,但它们在治疗肥胖和糖尿病方面的效果及益处相当。
起初,人们认为手术后的机械性限制,也就说胃容量变小减少食物摄入,是体重下降与代谢改善的主要原因。然而,后续研究发现,减重手术会引发一系列深远的胃肠道生理适应,包括肠道激素分泌、胆汁酸代谢及 肠道微生物群的显著变化,这些因素彼此关联,共同促进体重下降与血糖耐受性改善。
▸ 肠道菌群的核心作用与证据
——菌群持久且独立的变化
研究表明,减肥手术后,肠道菌群会发生显著且持久的变化(至少维持十年)。这种改变似乎是独立于体重减轻或热量限制本身。
证据:与仅节食减肥个体相比,RYGB手术患者的菌群多样性增加;并且,RYGB手术的肥胖大鼠菌群,与体重相当的假手术组大鼠(未真正手术但体重通过节食控制)的菌群显著不同。
——因果关系的探索 (动物、人类)
动物实验:将接受了RYGB手术小鼠的肠道菌群移植到无菌小鼠体内,能够复制体重下降的效果,这强烈暗示了由手术介导的菌群改变在驱动体重减轻中可能具有部分因果作用。
人类研究:然而,在人类研究中结果更为复杂。将术后一年且体重下降30%的供体的菌群移植给代谢综合征患者,并未能改善其葡萄糖稳态。但值得注意的是,这种移植确实阻止了受体胰岛素敏感性的进一步恶化(相比之下,接受其他代谢综合征患者菌群移植的对照组则出现了恶化)。
这说明,肠道微生物群在RYGB的代谢改善中虽起到一定作用,但更可能是与其他机制协同发挥效应,而非单一决定因素。
▸ 菌群发挥作用的关键途径
近期的证据揭示了菌群影响代谢的具体机制,主要涉及以下两个方面:
——胆汁酸信号通路
垂直袖状胃切除术的降糖效果依赖于肠道菌群,并且需要功能正常的FXR和TGR5受体(两者均为胆汁酸受体)。
手术后的菌群改变会增加肠道中胆汁酸转运体的表达,从而促进石胆酸 (lithocholic acid) 的吸收并将其运输至肝脏。
在肝脏,石胆酸被转化为CA7S,这种物质可以直接激活TGR5受体,从而增加GLP-1的分泌,最终改善血糖控制。
——短链脂肪酸信号通路
减肥手术后,肥胖个体循环系统中的丁酸和丙酸水平显著增加,而乙酸水平则降低。
这些短链脂肪酸的变化,同样被认为有助于改善体重和葡萄糖稳态。
减肥手术带来的全面健康益处(体重减轻和葡萄糖稳态改善)不能归因于任何单一机制。它很可能是多种因素,包括肠道菌群的深远影响、胆汁酸信号的改变和短链脂肪酸的产生等共同作用的结果。
总结来说,不同的减重手术(如胃旁路术和袖状胃切除术)虽然操作方式差别很大,但减重与控糖效果相近。关键并非只是吃得少、吸收少,而是对肠道—代谢轴的系统性重启。
肠道菌群、胆汁酸、激素信号和神经代谢网络共同协作,把机体从易胖、胰岛素抵抗的状态,切换回更健康、更稳定的能量代谢模式。
以上这些发现让我们意识到,我们可能一直在间接利用菌群的力量。这自然而然地将我们引向了糖尿病治疗的下一个前沿:与其依赖药物对菌群的附带效应,不如直接将肠道菌群作为干预的核心。接下来,我们将探索那些专门为此设计的创新途径。
FMT 是目前临床上应用最广泛且成功率最高的治疗方法之一,特别是在治疗艰难梭菌感染以及其他多种胃肠道疾病中表现突出。近年来,FMT 也被探索作为一种新型的神经系统、免疫系统及代谢性疾病(包括肥胖与2型糖尿病)替代疗法。
▸ 动物研究中,FMT显著成效
糖尿病小鼠实验:持续为糖尿病模型小鼠(db/db小鼠)移植健康人类的粪便菌群,能够改善它们的葡萄糖耐量和新陈代谢。
运动与饮食实验:从健康饮食并坚持运动的小鼠身上获取菌群,并将其移植给久坐不动的高脂饮食小鼠,可以改善后者的葡萄糖耐量并减少其脂肪堆积。
肠道内容物移植:将健康大鼠的小肠内容物移植到高脂饮食的大鼠体内,可以迅速改善其对葡萄糖的耐受能力,并减少葡萄糖的生成。
动物研究普遍表明,移植健康的肠道菌群能够有效改善代谢问题。
▸ 🧍♀️人体临床研究的:效果有限且短暂
关键研究案例: 在两项人类研究中,患有代谢综合征的男性受试者,接受了来自瘦型的健康捐赠者的FMT。
短期效果(6周后): 受试者的胰岛素介导的葡萄糖摄取能力得到改善,糖化血红蛋白(HbA1c)水平也下降了。这是一个积极的信号。
长期效果(18周后):然而,之前观察到的有益效果不再显著。
▸ 为什么在人类身上效果不佳?
▸ 未来的改进方向
为了让FMT成为治疗代谢疾病的可行方案,需要更精细化的策略:
优化方案:需要调整FMT的时间、重复和剂量。
联合疗法:将FMT与生活方式干预(如改变饮食、补充膳食纤维)相结合。
近期的两项临床试验证明,当FMT与饮食改变或膳食纤维补充相结合时,这种联合策略确实能改善肥胖或2型糖尿病患者的代谢结果。
个性化FMT:类似于个性化医疗,未来可能需要发展“个性化粪菌移植”。即根据每个患者的具体情况,精心挑选或设计最适合他们的菌群来进行移植。
谷禾也会根据肠道菌群检测报告为合作方提供相关指标,便于更好地筛选与匹配。
多项研究表明,在代谢性疾病(包括肥胖与2型糖尿病)的动物和人类模型中,补充益生菌可在急性及长期阶段均显著改善多项代谢指标。
在这里,介绍用产乳酸菌、产丁酸菌和特定物种Akkermansia muciniphila治疗2型糖尿病和其他代谢疾病状态的效果。
AKK菌|Akkermansia muciniphila
Akkermansia muciniphila(简称AKK菌)是一种革兰氏阴性菌,具有降解黏蛋白的能力,主要定植于肠道黏液层,并可在粪便样本中检测到。
肠道粘液层的主要成分是粘蛋白(Mucins),粘蛋白是一种富含糖基的结构蛋白,是肠道黏液层的重要组成部分,这也是Akk菌的“主食”。
AKK菌与健康的关系:绝大多数证据指向有益
大量研究发现,在啮齿动物与人类中,肥胖或2型糖尿病患者体内的Akk菌丰度都显著偏低;当其丰度减少时,常伴随炎症水平上升、肝脏脂肪变性以及胰岛素抗性增强。
有一项宏基因组学研究报告指出,AKK菌的增加与2型糖尿病相关,理由是它降解粘蛋白会破坏肠道粘液层的完整性。
更多的研究表明,AKK菌的丰度与更厚的粘液层和更低的肠道通透性(即更少的“肠漏”)正相关。它似乎能通过一种尚不完全明确的机制,刺激肠道中负责生产粘蛋白的杯状细胞数量增加,从而实现“越吃越有”的良性循环。
Akk菌如何发挥作用?
Akk菌的益处主要通过其菌体上的特定成分和它分泌的蛋白质来实现。
Akk菌外膜上的一种叫 Amuc_1100 的蛋白质。
作用过程: 这种蛋白质可以激活肠道细胞上的TLR2受体,进而调节一系列负责细胞连接的紧密连接蛋白(如Claudin 3,Occludin等)的表达。
最终效果: 这大大增强了肠道细胞间的连接,加固了肠道屏障。屏障加固后,肠道中的有害物质(如内毒素LPS)就难以泄漏到血液中,从而减轻了全身的低度炎症,最终改善胰岛素抵抗和血糖控制。
最近,科学家发现Akk菌还能分泌一种名为 P9 的新型蛋白质。
作用效果: 在小鼠实验中,P9被证实能够促进GLP-1(一种重要的降糖激素)的分泌,从而改善葡萄糖耐量。
研究发现,活的Akk菌和巴氏杀菌的Akk菌都有效,但高温彻底灭活(Heat-killed/Autoclaved)的Akk菌则无效。
原因在于:巴氏杀菌的温度(约70°C)足以杀死细菌,但不会破坏关键蛋白Amuc_1100的结构和活性。而更高的灭菌温度则会使其变性失效。这为开发安全的菌剂产品提供了重要依据。
🧍♀️人体临床证据
Akk菌的益处已经在人体上得到初步验证。
安全性:早期的临床研究证实,无论是活菌还是巴氏杀菌的Akk菌,对人体都是安全且耐受性良好的。
有效性: 在一项针对代谢综合征患者的研究中,与安慰剂组相比,服用巴氏杀菌Akk菌的患者出现了显著的积极变化:
►▷
综合来看,上述动物与早期临床研究一致显示:
AKK菌的干预可重建肠道屏障完整性、降低代谢炎症并改善血糖稳态,提示该菌株具有成为治疗肥胖与2型糖尿病的潜在候选益生菌的巨大应用前景。
产丁酸菌
产丁酸菌并非单一菌种,而是一个庞大的功能性菌群。产丁酸菌是一类能够在厌氧环境下、通过发酵多种底物产生丁酸的肠道共生菌群。
★ Faecalibacterium prausnitzii
F. prausnitzii 是一种严格厌氧、产丁酸的共生菌,在小鼠与人类结肠中含量丰富。
为什么它如此重要?(关联性证据)
研究发现,2型糖尿病患者体内 F. prausnitzii 的丰度显著降低,而在接受减重手术后,该菌丰度显著增加,且与炎症标志物水平呈显著负相关。
这一系列发现表明,F. prausnitzii 可能通过减少肠道炎症、增强肠屏障完整性、改善代谢性内毒症,从而发挥潜在益生作用。
它如何发挥作用?
在结肠炎小鼠模型中,给予 F. prausnitzii 或其上清液,可显著增加肠上皮紧密连接蛋白表达,并降低炎症性细胞因子水平。
一个关键的发现是:单独使用丁酸,其抗炎效果远不如用F. prausnitzii的培养上清液。这说明,F. prausnitzii的益处并不仅仅来自于丁酸,它还分泌其他抗炎的有益物质。
研究人员后来确实鉴定出了一种由F. prausnitzii产生的“微生物抗炎分子”(microbial anti-inflammatory molecule, MAM),这种分子能够修复糖尿病小鼠的肠道屏障功能,并上调紧密连接蛋白表达。
给予F.prausnitzii可以改善啮齿动物的葡萄糖稳态,并且对2型糖尿病患者进行GLP-1RA治疗可以增加粪便中F.prausnilzii的丰度,这与空腹血糖呈负相关。
虽然目前尚无直接临床试验验证F. prausnitzii 在血糖调节中的疗效,但近期一项研究已证实,其长期补充在人体中是安全且可耐受的,并已启动相关的临床试验以进一步评估其作为下一代益生菌的潜力。
★ Anaerobutyricum soehngenii
这个菌它最初是在一项粪菌移植临床试验中引起关注的。研究者观察到,Anaerobutyricum属增加与受试者胰岛素敏感性改善密切相关。
动物实验:给糖尿病小鼠补充 A. soehngenii 可显著提高粪便中丁酸及次级胆汁酸水平,增强胰岛素敏感性,提升能量消耗。
🧍♀️人体临床试验:两项针对代谢综合征人群的临床试验表明,A. soehngenii 的口服或十二指肠输注均安全且耐受良好;单次十二指肠灌注实验显著提升GLP-1水平,并改善胰岛素分泌与敏感性。
►▷
无论是F. prausnitzii还是A. soehngenii,它们的益处是多方面的,不仅仅是生产丁酸,还包括分泌其他抗炎分子和调节宿主激素(如GLP-1)。这些产丁酸菌的研究都凸显了它们作为治疗代谢疾病的新型疗法的巨大潜力。
产乳酸菌
产乳酸菌是一类耐酸的革兰氏阳性菌,通常不具运动性,主要通过发酵碳水化合物产生乳酸作为主要代谢产物。乳酸是厌氧呼吸中的重要代谢物,既是宿主能量代谢中关键的中间产物,也可作为底物被其他肠道菌群利用以产短链脂肪酸。
明星成员: 其中最著名、研究最广泛、应用最普遍的就是乳杆菌属和双歧杆菌属的成员。
动物研究,效果显著
在啮齿类动物模型中,补充多种乳酸生成菌可显著带来以下代谢益处:
在多项研究中,使用以下菌株治疗,显著改善小鼠的血糖控制:
乳杆菌属
双歧杆菌属
核心作用机制:巧妙抑制FXR信号,促进GLP-1分泌
产乳酸菌改善血糖的机制相当精妙,其中一个核心通路与胆汁酸受体FXR有关:
1
分泌“胆盐水解酶” (BSH)
许多乳杆菌能产生一种叫做“胆盐水解酶”的工具。
2
分解胆汁酸
胆盐水解酶这个工具可以将“结合型胆汁酸”分解为“游离型胆汁酸”。
3
抑制肠道FXR活性
“游离型胆汁酸”激活肠道FXR受体的能力较弱,因此,这一过程的最终结果是降低了肠道FXR信号的整体活性。
4
解放GLP-1
关键点来了,肠道中的FXR受体被激活时,会抑制GLP-1(一种重要的降糖激素)的分泌。因此,当产乳酸菌抑制了FXR后,就相当于解除了对GLP-1的束缚,从而促进了GLP-1的释放,改善了血糖控制。
双重协同作用:抑制FXR还能增强短链脂肪酸诱导GLP-1分泌的效果。同时,某些产乳酸菌自身也能促进丁酸等短链脂肪酸的产生。这种 抑制FXR + 增加短链脂肪酸的协同作用,可能共同放大了GLP-1的分泌。
🧍♀️ 人体临床研究,好坏参半
与动物实验的普遍成功形成鲜明对比,产乳酸菌在人体临床试验中的表现,结果好坏参半:
☺一项研究显示,包含多种产乳酸菌的复合益生菌产品,相比安慰剂,能够降低2型糖尿病患者的糖化血红蛋白(HbA1c)和空腹血糖。
☺另一项研究发现,单独使用植物乳杆菌也能降低餐后血糖和HbA1c。
☹ 然而,与安慰剂对照组相比,补充罗伊氏乳杆菌、嗜酸乳杆菌或乳双歧杆菌并没有显著改善健康或糖尿病患者的血糖控制或胰岛素敏感性。
☺一个值得注意的细节是,在一项研究中,乳双歧杆菌(B. lactis)虽然没有改善代谢综合征患者的指标,但成功维持了他们的胰岛素敏感性,阻止了其进一步恶化。
鉴于在糖尿病患者体内,许多产乳酸菌(尤其是双歧杆菌)的数量有所减少,那么通过“缺啥补啥”的思路来恢复它们的水平,理论上应是一种有前景的治疗方法。
然而,现有的人体临床证据有限,乳酸菌对改善代谢性疾病的作用不足,因为每个人的饮食、基线肠道菌群和疾病表现都千差万别(即高度异质性),想用标准化的益生菌对所有人都产生效果,是不容易的。因此,益生元等可以增加整体微生物群的多样性和丰富性,而不是单一细菌,这可能会为更广泛的人群提供更有效的治疗选择。
2型糖尿病的治疗策略
doi.org/10.1146/annurev-physiol-051524-094728
益生元被定义为:“能够被选择性发酵,并导致胃肠道微生物群组成和/或活性产生特定变化,从而对宿主健康带来益处的成分。”
简单来说,一种物质要被称为“益生元”,必须满足苛刻的条件:
基于这些标准,许多食物或成分都可以被归入益生元的范畴。在众多候选物质中,当前研究最为集中、并在糖尿病治疗中表现出潜在疗效的包括几类新型功能性益生元。
菊粉型果聚糖(ITFs)
菊粉型果聚糖(ITFs)——主要包括菊粉(inulin)、低聚果糖(OFS)和果寡糖(FOS),它们本质上是一类由果糖分子链组成的不可消化性碳水化合物。能够被肠道细菌发酵利用,从而促进宿主健康。
它们如何发挥作用?—— 多途径、多靶点的系统工程
核心作用:精准“施肥”,优化菌群
机制一:放大GLP-1信号,控制血糖
这是菊粉型果聚糖改善血糖的核心途径。
证据: 益生菌(特别是双歧杆菌)利用菊粉型果聚糖作为底物,发酵产生短链脂肪酸,如乙酸和丁酸。而短链脂肪酸是已知的肠道L细胞分泌GLP-1的强效刺激剂。
铁证: 在GLP-1受体被基因敲除的小鼠中,或者在使用了GLP-1受体拮抗剂的小鼠中,菊粉型果聚糖带来的所有降糖益处都完全消失了。这证明了GLP-1通路在其中的决定性作用。
菊粉型果聚糖也能显著提高人和动物的餐后GLP-1水平。
机制二:激活GLP-2信号,修复肠道屏障
GLP-2可以看作是GLP-1的兄弟,它主要负责维持和修复肠道屏障的完整性。
研究发现,补充菊粉型果聚糖能够增加内源性GLP-2的分泌。如果在小鼠中阻断GLP-2受体,那么菊粉型果聚糖带来的修复肠道屏障、抗炎等益处也大部分会消失。
机制三:调节内源性大麻素系统
这是一个更深层的机制。菊粉型果聚糖诱导的菌群变化(或AKK菌的增加)能够调节肠道的内源性大麻素信号系统(endocannabinoid),增加2-棕榈酰甘油(2-palmitoylglycerol)、2-油酰甘油(2-oleoylglycerol)和2-花生四烯酰甘油(2-arachidonoylglycerol);降低花生酰胺(anandamide)水平;进而增强肠道屏障功能,减少LPS泄漏。
🧍♀️ 人体临床证据
虽然不是所有研究都报告了积极结果,但大量的临床试验已经证实了菊粉型果聚糖在人体中的益处:
►▷
菊粉类果聚糖代表了一种非常有前景的、非侵入性的2型糖尿病治疗方案。它不像直接补充益生菌那样面临能否存活和定植的问题,而是通过为体内已有的有益菌(如Akk菌和双歧杆菌)提供精准的养料,激发一连串有益的生理反应——核心是驱动GLP-1和GLP-2的分泌,最终达到控制血糖和修复肠道屏障的双重目的。
其他膳食纤维
首先,一个基本共识是:增加膳食纤维的摄入量,能显著降低患上肥胖和2型糖尿病的风险。
膳食纤维主要分为两大类:
🧬 植物来源的主要可溶性纤维包括:
然而,研究发现,不同可溶性纤维的效果差异很大,这取决于纤维的用量、食物来源、补充方式(是直接吃食物还是吃提纯的纤维补充剂)等因素。
几种可溶性纤维的表现:
🧪 β-葡聚糖—— 全能选手
来源: 主要存在于燕麦和大麦中。
一项对比研究发现,在高脂饮食中添加富含β-葡聚糖的大麦粉,能增加肠道丁酸、改善血糖。但如果直接添加提纯的β-葡聚糖纤维,同样能改善代谢。这表明β-葡聚糖本身就是强效的功能成分。
⁎ 作用机制
无论是动物还是人体研究,都强有力地支持β-葡聚糖作为一种益生元,在改善血糖和治疗代谢疾病方面具有巨大潜力。
🌽 抗性淀粉—— 瞒过小肠的特工
抗性淀粉它本质上是淀粉,但由于其特殊的结构,能抵抗小肠的消化,完整地到达结肠,成为微生物的食物。
来源:冷却的米饭、土豆、未完全成熟的香蕉等。
⁎ 作用机制(与β-葡聚糖类似):
🧍♀️ 人体证据
在患有代谢综合征和2型糖尿病的人群中,补充抗性淀粉(特别是2型抗性淀粉,如高直链玉米淀粉)能够改善胰岛素敏感性并降低空腹血糖,同时也能观察到短链脂肪酸产量的增加。
一个有趣的发现:补充高直链玉米淀粉会特异性地增加双歧杆菌的丰度,而双歧杆菌正是一种擅长发酵抗性淀粉的细菌。
🍎 果胶 —— 机制独特
来源: 广泛存在于水果中,如苹果、柑橘等。
⁎ 作用机制(与其他不同):
►▷
简而言之,膳食纤维是“好菌的食物,也是代谢的调节器”:当你吃更多含纤维的天然食物(燕麦、豆类、全谷、蔬果),肠道菌群就会发酵产出丁酸等代谢产物,能修复肠道、提升GLP-1分泌、降低炎症、帮助降糖。β-葡聚糖与抗性淀粉尤其被视为下一代代谢健康促进纤维,未来可能成为糖尿病膳食疗法的核心成分。
合生元是一种同时包含益生菌和益生元的产品。
这个设计的初衷是,通过提供益生菌最喜欢吃的益生元,来帮助它在复杂的肠道环境中更好地存活、定植并发挥作用。
鉴于益生菌能产生短链脂肪酸,而益生元是产生短链脂肪酸的代谢前体物质(原料),那么将两者结合,应能够协同增加短链脂肪酸的产生,从而对代谢健康产生比单独使用任何一种都更强大的益处。
🧬 合生元的常见组合
双歧杆菌/乳杆菌 + 低聚糖/膳食纤维
这种组合的设计理念是:由益生元提供底物,使益生菌能够在肠道定植并活跃代谢,从而增强肠道生态修复与宿主代谢调节效应。
并未实现“1+1 > 2”的突破
动物与人体研究均表明,补充益生元或益生菌本身即可带来代谢性益处,合生元干预能够改善肠道菌群生态与增加粪便SCFA含量。然而,在大多数研究中,联合应用(合生元)并未显示出明显优于单独使用益生元或益生菌的效果。
为什么这个看似完美的策略效果不理想?
研究人员认为是由于缺乏精准匹配,也就是说大多数研究在设计合生元产品时,只是想当然地将一种常见的益生菌和一种常见的益生元组合在一起,但未能首先验证,这个益生菌是否真的喜欢吃、并且能高效利用配给它的那个益生元。
这并不意味着合生元的理念是错误的,而是说明我们的执行方式需要更加科学和严谨。
改进:在进行昂贵且复杂的人体临床试验之前,必须增加一个关键的验证步骤:
►▷
合生元的概念本身极具潜力,但需确保益生菌和益生元是真正的天作之合,这种“1+1>2”的协同效应才会在临床上有更好的效果。这要求我们对菌株和底物的特性有更深入的了解和更严格的前期验证。
外源化合物(Xenobiotics)被定义为:“在机体内非天然存在的外来化学物质。”这个范畴非常广泛,从化妆品、药物到膳食补充剂中的成分都可能属于外源物。
前文已提到二甲双胍(metformin)与GLP-1受体激动剂(GLP-1RA)的降糖作用同样被认为与肠道微生物介导机制相关,而这些药物本质上也属于外源化合物的范畴。
虽然很多外源物对健康有害,但我们这里聚焦的是那些有益的外源物,重点分析两种备受关注的有益外源物:多酚和小檗碱。
多 酚 类 化 合 物 (Polyphenols)
多酚是一大类存在于植物中的化合物,如白藜芦醇、类黄酮等。
多酚类化合物是植物来源的次级代谢物,主要包括:
这些分子既能调节肠道微生物群结构,也能改善2型糖尿病的多种代谢指标。
💊白藜芦醇(Resveratrol)
白藜芦醇是多酚中研究最为深入的代表性化合物之一。
来源: 葡萄皮、红酒、花生等。
它可显著改善胰岛素敏感性、葡萄糖稳态、血脂水平、高血压等。但它的生物利用度很低,口服后能进入血液循环的量很少,而且大部分还和蛋白质绑定,无法发挥活性。
那它是如何起作用的?
答案指向了肠道。
口服有效。 多项研究发现,口服白藜芦醇可以改善小鼠的血糖,但腹腔注射(绕过了肠道)则无效。这有力地证明了它的作用点在肠道内。
口服补充剂也有益地改变了啮齿动物的肠道微生物组,降低了厚壁菌门/拟杆菌的比例,增加了Akk菌、双歧杆菌和乳杆菌的丰度,这与改善葡萄糖稳态和炎症标志物有关。
最终证据——粪菌移植: 将服用过白藜芦醇的小鼠的粪菌移植给普通高脂饮食的小鼠,后者也出现了血糖改善的效果。
🧍♀️ 人体临床研究
尽管研究尚少,但已有临床试验发现,补充白藜芦醇可以增加代谢综合征男性体内的AKK菌,并轻微改善血糖。
💊 黄酮类化合物(Flavonoids)
除白藜芦醇外,黄酮类化合物也能增加肠道有益菌数量,并改善葡萄糖耐受性、抑制炎症反应、增强肠屏障功能。
来源: 广泛存在于各种水果、蔬菜、茶中。
动物实验研究
在高脂饮食诱导的肥胖或糖尿病小鼠模型中:
蔓越莓提取物可提高胰岛素敏感性、降低HOMA-IR与循环内毒素(LPS)水平;同时伴随AKK菌丰度显著上升与肠屏障完整性增强。
蓝莓原花青素含有丰富的花青素与原花青素,同样可改善葡萄糖耐受;增加AKK菌含量;并增厚胃肠道黏液层。
苹果原花青素处理高脂饮食小鼠时,也观察到一致的结果:肠道屏障功能及AKK菌丰度同步提升。
这些研究揭示不同植物来源的黄酮类多酚均通过促进有益菌的富集和黏液层重塑,实现改善肠屏障与系统代谢功能的作用。
🧍♀️ 人体及体外研究证据
尽管人群中关于单独考察黄酮类化合物作用的临床研究仍然有限,但已有体外模拟与部分干预研究提供了支持性证据:
红酒葡萄提取物或红茶多酚在人体肠道模拟模型中均能增加AKK菌的丰度。
可可黄烷醇则在健康人群中可显著增加双歧杆菌和乳杆菌的数量,表明其对肠道菌群结构也具有积极调节作用。
综上,黄酮类化合物以其独特的双重功能而受到关注:
这些作用共同促进了葡萄糖代谢与胰岛素敏感性的改善,为其作为代谢性疾病营养干预的潜在候选物提供了有力依据。
小 檗 碱
来源: 黄连、黄柏等中草药的主要活性成分。
小檗碱可以直接作用于肝细胞,激活AMPK(一个关键的能量代谢开关),从而改善血糖(增强胰岛素敏感性与葡萄糖稳态控制)。但它的口服生物利用度同样很低。
小檗碱是否进入循环系统,依赖肠道菌群
小檗碱只有在被肠道菌群代谢为更易吸收的衍生物后,其药效才能被充分发挥。
——肠道菌群:加工
肠道菌群能将小檗碱转化为更容易被人体吸收的形式,帮助它进入血液循环。
例如,某些肠道细菌可将小檗碱还原为二氢小檗碱,这种形式在肠上皮中的吸收效率更高,随后可重新氧化为小檗碱并在全身循环中发挥作用。
——肠道菌群:效应放大器
动物实验表明,口服(而非注射)小檗碱能增加肠道产丁酸菌的数量和丁酸产量,并改善空腹血糖。这说明小檗碱的另一部分功效是通过调节菌群-丁酸实现的。
临床研究与争议
动物研究:在动物模型中,小檗碱改善血糖的机制似乎与增加GLP-1/GLP-2、增加次级胆汁酸(DCA)从而激活TGR5受体、增加SCFA产量等有关。这是一个非常清晰、正面的通路。
人体研究的反转:迄今为止唯一一项相关的糖尿病人体研究却得出了矛盾的结果:小檗碱使血液中次级胆汁酸和有益的产短链脂肪酸菌的显著下降了,但同时它确实又显著降低了患者的糖化血红蛋白。
这凸显了小檗碱作用机制的复杂性。小檗碱确实是一种有效的降糖物质,但它究竟是如何通过菌群在人体内发挥作用的,远比我们想象的要复杂,目前仍是一个充满争议和未解之谜,其肠道依赖机制亟需更多临床研究验证来阐明。
►▷
小檗碱就像一个“需要肠道助手的药”:它自己难以被吸收,但一旦被肠道菌群“加工”成可利用的形式,便能帮助调节血糖、减少炎症、修复肠屏障。不过,因为每个人肠道菌群不同,它在不同人身上可能表现出截然不同的效果。
尽管大量动物研究已明确证实,肠道菌群在血糖稳态调控中扮演着核心角色,但将这些发现直接转化为对人类有效的通用疗法却挑战重重。其根本原因在于人类肠道菌群的复杂性与高度个体化。
这种个体差异正是许多干预措施(如益生元或益生菌)效果因人而异的关键。
益生元:当人们吃下富含β-葡聚糖的特制大麦面包后,只有一部分人的代谢状况得到了改善。科学家检查后发现,这些“有效者”在干预开始时,体内就存在着“无效者”所缺乏的特定肠道细菌。是这些细菌帮助他们更好地利用了膳食纤维。
益生菌:吃下益生菌,不代表它们就能在你的肠道里安家落户,一项研究发现,11种常见益生菌能否成功在肠道定植,取决于每个人已有的菌群构成。
既然每个人都是不同的,那么治疗方案也必须因人而异,兼顾菌群个体差异与动态变化。这个“个性化”会是什么样子呢?
比如,个性化饮食算法,这个算法不仅分析一个人吃了什么,更整合了这个人肠道菌群数据、血液指标等多种参数。这样不仅可以预测这个人吃下特定食物后的血糖反应,更能反过来为他量身定制一套可以最大程度平稳餐后血糖的个性化饮食方案。
在糖尿病前期人群中,通过整合基线菌群特征,机器学习模型,也能预测哪些患者能通过什么样的运动有效改善血糖,而哪些患者则收效甚微。
简而言之,要让基于微生物群的疗法真正在人体中奏效,我们需要摆脱“一刀切”的思路,而是把每个人的肠道菌群当作独特的生态系统。未来的糖尿病干预,可能需要“定制化的微生物处方”:先读取你的菌群模式,再精准投喂适合的菌与食物,让微生物群自己帮你稳糖、抗炎、调代谢。
深入理解并善用
每个人的独有菌群信息
将是我们开启
代谢疾病精准治疗
新时代大门的钥匙
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Weninger, Savanna N., Andrew Manley, and Frank A. Duca. “Managing Glucose Homeostasis Through the Gut Microbiome.” Annual Review of Physiology 88 (2025).
Howard, Elizabeth J., Tony KT Lam, and Frank A. Duca. “The gut microbiome: connecting diet, glucose homeostasis, and disease.” Annual review of medicine 73 (2022): 469-481.
Cho, Hyoung-Soo, et al. “Structure of gut microbial glycolipid modulates host inflammatory response.” Cell 188.19 (2025): 5295-5312.
Sun, Hanxiao, et al. “GLP‐1 receptor agonists alleviate colonic inflammation by modulating intestinal microbiota and the function of group 3 innate lymphoid cells.” Immunology 172.3 (2024): 451-468.
Su, Lili, et al. “Health improvements of type 2 diabetic patients through diet and diet plus fecal microbiota transplantation.” Scientific reports 12.1 (2022): 1152.
Anhê, Fernando F., et al. “Metabolic endotoxemia is dictated by the type of lipopolysaccharide.” Cell reports 36.11 (2021).
Baroni, Irene, et al. “Probiotics and synbiotics for glycemic control in diabetes: A systematic review and meta-analysis of randomized controlled trials.” Clinical Nutrition 43.4 (2024): 1041-1061.

谷禾健康
抑郁症,曾被简单地视为“情绪低落”或“脑化学失衡”的结果,如今已被重新定义为一种复杂的全身性疾病。它不仅涉及大脑神经递质的变化,更与遗传因素、免疫炎症反应、肠道微生物群失衡以及社会心理压力等多维机制密切相关。世界卫生组织数据显示,全球有超过3亿人正饱受抑郁症的困扰,其影响远超情绪波动,深入到个体的认知、睡眠、代谢乃至免疫系统之中。
传统的“脑化学缺陷”模型已无法全面解释抑郁症的发生与演变。越来越多的研究表明,抑郁症的病理图景更像是一场全身性“失调”,是神经、内分泌、免疫系统之间复杂交互失衡的结果。在此背景下,抗抑郁治疗的思路正从单一的药物干预转向综合与个体化路径——结合心理治疗、生活方式干预、脑科学技术与精准药物治疗,以期重塑大脑联结、调节生理系统、恢复心理韧性。
本文将带领读者走出“情绪低谷”的刻板印象,深入探讨抑郁症的多样成因与神经生物学基础,聚焦最新的治疗进展——从药物创新到脑刺激技术,从炎症调控到肠脑轴干预,阐明抑郁症治疗正迈入“精准与个体化”的新时代。
抑郁症(Depression)是全球最常见的精神心理疾病之一。世界卫生组织的最新估计显示,全球约有超过3亿人受到抑郁症困扰,在青年和中年人群中,它已成为导致工作能力受限、生活质量下降及自杀的主要健康负担之一。
▸ 抑郁症的基本特征与主要症状
抑郁症并不是单纯的“心情不好”,而是一种兼具情绪、认知、行为、生理变化的综合性障碍。其典型症状包括:
•情绪低落:持续的悲伤、空虚或易哭泣;
•兴趣或愉快感降低:对以往喜欢的活动失去兴趣;
•思维和注意力下降:难以集中注意、反应变慢;
•睡眠与食欲异常:早醒或嗜睡、暴饮或食欲不振;
•能量不足与自我评价低下:易疲劳、感到无助或内疚;
•严重时出现自伤或自杀意念。
抑郁症的持续时间通常超过两周,并明显影响学习、工作或社交功能。
▸ 不同人群的发病特征
•性别差异:
女性患病率约为男性的1.5–2倍,这与激素变化、社会角色压力等因素有关。
•年龄分布:
-首发高峰在20–40岁,年轻人群常受学习和职场压力影响;
-老年人则多因躯体疾病、社会孤立等因素诱发。
•特殊人群:
产后抑郁、更年期抑郁、青少年学生抑郁增势明显;长期慢性疾病患者(如糖尿病、肠易激综合征、肿瘤)中发病风险也显著较高。
▸ 目前临床上的诊断与分类方式
1.诊断体系
目前临床主要依据《国际疾病分类第十一版(ICD-11)》和《精神障碍诊断与统计手册第五版(DSM-5)》。诊断以症状学评估为核心:
–情绪低落、兴趣缺乏为主症;
–辅助症状(食欲、睡眠、能量、专注、罪疚、自杀意念等)达一定数量与持续时间;
–评估量表:汉密顿抑郁量表(HAMD)、PHQ-9抑郁症筛查量表、蒙哥马利抑郁量表(MADRS)等常用于量化病情。
2.传统分类方式
临床上目前仍以临床表现为分类依据,如:
–典型(忧郁)型抑郁症:显著情绪低落、早晨加重、体重下降;
–非典型抑郁症:情绪反应性较强、嗜睡嗜食、体重上升;
–焦虑型抑郁:伴强烈焦虑与躯体不适;
–季节性抑郁、产后抑郁、双相抑郁期等。
这些分型主要帮助医生选择抗抑郁药物、确定重症程度,但在病因或机制层面缺乏区分力,因此同样诊断的患者,疗效差异依然巨大。
▸ 常见治疗模式
当下临床治疗以“三大支柱”为核心:
联合方案:如药物+心理干预、药物+经颅磁刺激(rTMS),逐渐成为主流。
▸ 为什么需要“新的生物学分型思路”
尽管现有治疗能帮助多数患者缓解症状,但仍约有30–40%的患者对常规药物反应不佳,被称为“难治性抑郁症”。研究发现,不同患者的抑郁发作并非源自同一种脑化学异常,而是由多种体内机制失衡引起,包括:
•肠道菌群和代谢异常:如色氨酸-犬尿氨酸代谢、短链脂肪酸缺乏、嘌呤/肌苷(inosine)通路紊乱;
•神经可塑性与炎症机制:脑源性神经生长因子(BDNF)降低、谷氨酸过度释放、小胶质激活;
•应激-激素系统异常:HPA轴过度活跃导致皮质醇长期升高;
•表观遗传调控与早期创伤记忆的交互。
★ 精准分型诊疗模式
这些结果促使科研界提出一种新方向——基于分子通路与生物标志物的抑郁症多机制分类(biological subtyping of depression)。
通过整合肠道代谢组、血清分子、基因与影像数据,医生可以更精准地判断患者属于哪一类机制主导(如“炎症-代谢型”或“神经可塑性低型”),并选择最可能有效的治疗方式。这种新的“精准分型诊疗模式(Precision Psychiatry)”,正在逐渐改变过去“同病同治”的局限,为抑郁症的个体化治疗打开新的大门。
尽管“情绪低落”是抑郁症最显性的外在表现,但在生物层面,它更像是一个多层系统失衡后的临床终点。现代研究认为,抑郁症不再被视为单一的“神经递质不足”,而是一种由神经网络、代谢-免疫反应、心理应激和遗传易感共同驱动的复杂脑-身综合征。
▸ 抑郁症不再是“脑化学缺陷”的单维模型
早期(20世纪后半段)的研究认为,抑郁主要由5-羟色胺(5-HT)等单胺类递质不足引起。然而,长期临床观察发现,不同患者间药物反应高度差异,且一半以上患者伴随代谢、炎症或内分泌异常。这些发现提示:抑郁症的根源在于整个身-脑系统的稳态失衡。
▸ 三大生物心理根源模块
通过整合多组学(基因组、代谢组、神经影像组)与临床数据,研究者逐渐将抑郁的核心生理机制划分为三大根源性模块:
这些模块并非互相排斥,而是如同三条交织的支流,在不同个体中各自占主导比例。
同一患者可能同时存在“菌群失衡+应激高皮质醇”或“低可塑性+炎症反应”等复合机制。
▸ 从单一病因到多维机制的转变
临床诊断正逐步从单一症状学转向“整合机制-标志物分层诊断”,这不仅有助于提高治疗精准度,也为未来的抗抑郁药物研发提供了更清晰的靶点方向。
编辑
如果说抑郁症是一场脑与身体间沟通失序的“系统性危机”,那么肠道菌群与机体代谢的失衡,就是这场危机最重要的触发点之一。
研究表明,约有45%–55%的抑郁症患者存在明显的代谢与肠道生态异常,其中至少三分之一可被归入“肠-菌-脑代谢轴异常(Gut–Microbiota–Brain Axis Dysfunction)”范畴。
▸ 总体机制概览
人体肠道中含有超过10¹⁴个微生物,这些微生物通过代谢产物(如短链脂肪酸、嘌呤、色氨酸代谢物等)影响神经递质合成、免疫炎症信号及表观遗传调控。这些信号通过迷走神经-内分泌-免疫通道传递到脑内,调节情绪、认知与应激反应。
▸ 主要的五种代谢-菌群通路亚型
以下为五种主要的代谢-菌群通路亚型总结:
▸ 核心机制解析
•肠-脑化学沟通障碍
肠道产生超过90%的5-HT(血清素)。当炎症上调IDO1酶时,色氨酸被“改道”进入犬尿氨酸通路,减少5-HT合成,形成“情绪原料短缺”。
•代谢与炎症的双向循环
高脂饮食、肠屏障破坏等因素导致脂多糖(LPS)进入血液,激活全身炎症,炎症因子又可进入脑内,引发神经炎症。
•表观遗传重塑
研究发现,肌苷缺乏可激活脑内EZH2-H3K27me3甲基化通路,抑制神经可塑性基因表达,形成“情绪封闭状态”。
•能量与神经可塑性枢纽
短链脂肪酸(SCFA)缺乏时,神经可塑性相关基因表达下降,导致神经可塑性降低和精神疲乏。
▸ 针对各亚型的干预策略
临床意义:不同代谢-菌群亚型对治疗方式的响应差异,正推动“精准抑郁干预模型(Precision Depression Therapy)”的形成。
小结
情绪并不仅存在于脑中,也“滋养”于肠道与代谢之间。
从肌苷到丁酸盐,从犬尿氨酸到胆汁酸,每一种代谢产物都是情绪的化学语言。通过识别这些语言,我们或许能够真正理解“抑郁”的物质根源,并为不同患者提供机制匹配、靶向精准的治疗方案。
该类型约占全部抑郁症患者的25–30%,主要表现为情绪迟钝、思维缓慢、注意力不集中,其本质是脑网络的活跃度、灵活度与突触可塑性下降,使大脑进入一种“低功率运转模式”。
▸ 核心机制
主要涉及三条相互交织的通路:
1.突触可塑性与神经营养线路
突触可塑性与神经营养线路(BDNF–TrkB–CREB轴)核心是脑源性神经营养因子(BDNF)的减少,导致神经元突触重塑能力下降。多项研究发现抑郁症患者海马体积缩小,而运动和经颅磁刺激等治疗可提高BDNF水平。
2.谷氨酸和单胺类递质的信号传导系统
不仅是传统的单胺递质(5-HT, 去甲肾上腺素(NE)和多巴胺(DA))失衡,谷氨酸/NMDA受体信号过度活跃导致的神经毒性也至关重要。这解释了为何氯胺酮(NMDA受体拮抗剂)能产生快速抗抑郁效应。
3.神经炎症与胶质细胞调控通路
过度活化的胶质细胞(如小胶质细胞)会释放炎症因子,抑制突触形成,导致神经信号阻断。这一亚型常被误诊为“难治性抑郁”。
▸ 主要临床特征
临床暗示:当药物反应差而影像显示海马/前额叶功能减退时,应考虑“神经网络低激活型”抑郁。
▸ 针对性干预与前沿治疗方向
小结
情绪障碍的本质,不仅是“缺乏快乐”,而是“大脑网络失去灵动与连接”。
通过重启这些沉睡的回路——无论是利用经颅磁刺激、运动、氯胺酮或新型神经调控技术——我们正逐渐把抑郁症从“化学失衡”的旧定义,带回它真正的神经生物学本质。
该类型约占抑郁症患者的20–25%,多见于青年、女性及有童年创伤史者。其主要特征为症状受生活事件诱发,伴明显焦虑与失眠,并表现出应激轴长期高活化和神经内分泌失衡。
▸ 应激-抑郁的中枢核心:HPA轴失衡
人体的应激核心系统是下丘脑-垂体-肾上腺轴(HPA axis)。在易感个体中,持续应激会导致皮质醇长期分泌过量,使神经元处于“应激中毒”状态,引发海马萎缩、前额叶功能下降和杏仁核过度敏感。
▸ 心理应激的生物学痕迹:表观遗传改变
压力可通过多种表观遗传机制(如DNA甲基化、组蛋白修饰等)深刻影响基因的表达模式,在分子层面上改变神经系统的功能,从而在生物学上“刻录”下心理创伤的持久印记。这种变化不仅改变了个体对环境刺激的反应方式,也影响了长期的情绪调节能力。主要受影响的基因包括:
编辑
▸ 干预与恢复机制
此类型抑郁的治疗是“从心理到分子”的系统重建过程。
编辑
重点共识:社会支持也是一种分子疗法,社会连接能反向调节糖皮质激素受体敏感度与脑源性神经生长因子水平。
小结
“情绪受伤”具有生物学记忆。长期的压力与创伤不仅改变心理状态,也能在基因表达与脑结构层面留下可测量的痕迹。这意味着未来的抑郁防治,不只是药物与心理的对话,更是环境-基因-情绪三方共振的整合治疗。
抑郁并非单一疾病,而是一个由代谢、神经、应激等多机制交织形成的异质性综合征。约60–70%的抑郁症患者包含两种机制叠加表现,如“代谢-炎症+神经可塑性低下”或“应激-炎症+肠道菌群失衡”等复合型结构。
▸ 从“同病同治”到“精准分型”的过渡
精准精神医学(Precision Psychiatry)的兴起,正推动抑郁症诊疗模式的变革。最近,斯坦福大学医学院的一项研究利用脑成像和机器学习,将抑郁症分为了六种不同的生物亚型(biotypes),并为其中三种亚型确定了更有效的治疗方法,这为个体化治疗提供了强有力的证据。
1.机制导向诊断:通过检测生物标志物,为患者找到主导病理通路。
2.个体化治疗决策:根据分子和组学结果选择特定干预路径。
3.动态疗效监测:追踪生物标志物,实时调整治疗。
4.多组学整合平台:正在全球范围进入临床试点阶段。
▸ 三大模块与亚型的整合总表
▸ 未来临床蓝图
抑郁症的未来治疗将不再是“用一种药、治一堆人”,而是“为一个人,设计一整套生物-心理干预方案”。
•近期目标(1–3年):建立标准化生物标志物检测体系;多中心验证分型算法;AI临床辅助诊疗系统试点。
•中期目标(3–5年):实现全组学融合诊断;新型多靶点药物投入临床;分子亚型诊断纳入指南。
•长远目标(5年以后):建立“动态抑郁画像”,实现“在发病前预测,在情绪崩溃前防治”。
▸ 总结:走向整合生物-心理医学的新纪元
经过几十年的研究,人们认识到:
抑郁症不是一种单病,而是多种生物与心理机制的编织体。“精准分型”不只是科研语言,而正在逐步进入临床,为每位患者提供科学可测的机制依据、靶向有效的治疗方案和心理-社会-生物三维整合的康复路径。
这意味着,未来医生不再仅依据情绪描述开药,而是读懂“肠道、神经、基因”的语言,结合精神症状、躯体情况、影响因素、病程特定以及功能缺陷,用数据与机制多维度为患者重新点亮情绪的生理之光。
主要参考文献
Insel, T. & Cuthbert, B. (2015). Brain disorders? Precisely. Science, 348(6234), 499–500.
Drysdale, A. T. et al. (2017). Resting-state connectivity biomarkers define neurophysiological subtypes of depression. Nature Medicine, 23(1), 28–38.
Zheng P, Zeng B, Zhou C, et al., Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism. Mol Psychiatry. 2016 Jun;21(6):786-96.
Cryan, John F., and Timothy G. Dinan. “Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour.” Nature reviews neuroscience 13.10 (2012): 701-712.
Zhu S, Li X, Yu Y, Han X, Yang F, Lu M, Dai G, Guo L, Xu D. EZH2-mediated H3K27me3 links microbial inosine loss to depression: a gut-brain epigenetic switch. Theranostics. 2025 Sep 12;15(18):9969-9986.
Duman, R. S. & Aghajanian, G. K. (2012). Synaptic dysfunction in depression: potential therapeutic targets. Science, 338(6103), 68–72.
Suneson K, Lindahl J, Chamli Hårsmar S, Söderberg G, Lindqvist D. Inflammatory Depression-Mechanisms and Non-Pharmacological Interventions. Int J Mol Sci. 2021 Feb 6;22(4):1640.
Kas, M.J.H., Penninx, B.W.J.H., Knudsen, G.M. et al. Precision psychiatry roadmap: towards a biology-informed framework for mental disorders. Mol Psychiatry 30, 3846–3855 (2025).
Klengel, T. et al. (2013). Allele-specific FKBP5 DNA demethylation mediates gene-childhood trauma interactions. Nature Neuroscience, 16, 33–41.
Heim, C., & Binder, E. B. (2012). Current research trends in early life stress and depression: review of human studies on sensitive periods, gene-environment interactions, and epigenetics. Nature Reviews Neuroscience, 13, 798–810.

谷禾健康
真菌感染
真菌病原体正迅速崛起为全球公共卫生体系中最具挑战性的威胁之一,其引发的抗真菌耐药性问题日益严峻。每年,真菌感染影响数亿人,并导致约160万例死亡,其致病范围从浅表皮肤感染到危及生命的侵袭性疾病,尤以免疫功能低下患者为重。其中白色念珠菌(Candida albicans)、新型隐球菌(Cryptococcus neoformans)和烟曲霉(Aspergillus fumigatus)已被世界卫生组织列入重点优先监测病原体名单。
目前临床上可用的抗真菌药物主要局限于唑类、多烯类和棘白菌素类这三大类别,这一有限的药物谱系难以满足日益复杂的临床需求。并且耐药株的持续出现和积累,使传统药物的疗效显著下降,部分病例甚至对联合治疗方案也产生抵抗。
此外,真菌生物膜的形成进一步加剧了治疗难度。真菌生物膜是一种由真菌细胞附着在宿主组织或医疗器械表面形成的结构,外包裹复杂的细胞外基质(ECM),为真菌提供了物理与化学双重屏障。研究显示,生物膜中的真菌对抗真菌药物的耐受性可提高多达一千倍,导致感染顽固复发,并显著增加了住院时间和医疗成本。
面对这一挑战,科研界正积极探索创新治疗策略,包括靶向生物膜结构的药物、旧药新用及天然产物疗法。这些新兴方法展示出克服耐药性、破坏生物膜完整性与提升抗真菌疗效的潜力。深入理解真菌病原体的耐药机制,并结合多样化的干预手段,有望为未来开发更为高效、低毒的抗真菌疗法奠定基础,从而开辟对抗真菌生物膜相关感染的新局面。
真菌感染已成为全球重要的公共卫生问题,其中白色念珠菌(C.albicans)、新型隐球菌(C.neoformans)和烟曲霉(A.fumigatus)是最主要的病原体。
白色念珠菌普遍存在于人体黏膜,当宿主免疫功能下降时可引起侵袭性感染,其毒力源于形态转换和生物膜形成;新型隐球菌则以多药耐药性和持久生物膜为特征,已导致多起医院暴发;烟曲霉是免疫受损患者中侵袭性曲霉病的主要致病菌,能够形成致密菌丝生物膜并产生耐药突变。
生物与非生物上的真菌感染
Elgammal Y,et al.Crit Rev Microbiol.2025
生物膜可以在生物或非生物表面形成。生物感染发生在人体组织和器官上(例如脑,引起隐球菌性脑膜炎;口腔,引起口腔念珠菌病;肺部,引起肺曲霉菌病;皮肤,导致持续性皮肤感染;血液,引起侵袭性念珠菌病;非生物感染发生在植入式医疗器械(例如起搏器、导管等)上。 心脏装置)、假肢(例如人工关节或植入物)和气管插管。
白色念珠菌及治疗方法
白色念珠菌是一种常见于人体粘膜表面的真菌。但在免疫功能低下者中可过度生长并转变为致命的机会性病原体,导致侵袭性念珠菌病。
它是医院感染的主要原因,造成约15%的败血症病例和40%的血流感染。其毒力与酵母形态和菌丝形态之间的可逆转换密切相关,菌丝形式中更高含量的几丁质可提供额外的结构强度与环境保护。
• 生物膜促进真菌黏附并提高其抗性
生物膜的形成由细胞壁黏附素介导,使真菌黏附于宿主组织和医疗器械表面。发育成熟的生物膜以丝状菌为主,形成坚固的三维结构并大量产生胞外基质(ECM)。β‑1,3‑葡聚糖是其中的关键成分,可隔绝抗真菌药物并抑制中性粒细胞活化,从而增强真菌对先天免疫的抵抗力。随着生物膜相关感染和非白念珠菌种在医院中的增加,评估和改进现有治疗策略至关重要。尤其是耳念珠菌(C.auris),已成为全球多药耐药院内感染的重要来源。
真菌生物膜形成阶段
Elgammal Y,et al.Crit Rev Microbiol.2025
上图说明了三种医学上重要的真菌:白色念珠菌、新型隐球菌和烟曲霉的生物膜形成过程,经历了四个不同的阶段:
(1) 酵母/丝状细胞粘附到表面;
(2) 真菌细胞生长成薄层细胞并发育成微菌落,烟曲霉细胞发芽形成菌丝网络;
(3) 通过发育成熟具有细胞外基质的生物膜结构;
(4) 真菌细胞从生物膜中分散,促进其他位点的定植。
• 部分念珠菌已具有耐药性,急需开发新疗法
目前的主要抗真菌药物包括唑类、多烯类和棘白菌素类。
多烯类(如两性霉素B)通过与麦角甾醇结合并形成细胞膜孔道发挥广谱杀真菌作用,但在生物膜条件下效力显著下降,且其肾毒性限制了临床使用。
唑类药物以阻断麦角甾醇生物合成为作用机制,毒性较低,但白念珠菌近年来对其耐药性逐渐增强。
棘白菌素通过抑制细胞壁β‑葡聚糖合成,对生物膜更具靶向性,其良好的疗效和安全性使其成为念珠菌感染治疗的一线药物。然而,FKS基因突变已导致部分菌株对棘白菌素耐药。
部分临床分离的念珠菌已表现出泛耐药性,对目前三大类抗真菌药物均无效,并能形成持久的生物膜,进一步强化其耐药性。这凸显出研发新型抗真菌药物和改进现有疗法的迫切需求。
注:尽管移除受感染植入物仍是治疗生物膜感染的常用手段,但该方法风险高、成本大,进一步强调了开发更安全有效疗法以应对白色念珠菌生物膜感染的紧迫性。
生物膜相关真菌病原体的关键耐药机制
Elgammal Y,et al.Crit Rev Microbiol.2025
这些机制主要包括:
(1) 细胞外基质充当物理屏障,阻碍抗真菌药物渗透至生物膜内部;
(2) 外排泵转运蛋白在生物膜形成早期上调,主动排出药物,降低细胞内浓度并促进耐药性;
(3) 持久细胞处于代谢休眠状态,对药物高度耐受,使生物膜在治疗中存活并可在压力解除后再生;
(4) 其他机制如应激反应、细胞密度、化学环境和靶点蛋白过度表达等,也进一步增强了生物膜的耐药性。
新型隐球菌及治疗方法
新型隐球菌(C.neoformans)又名溶组织酵母菌,是土壤,鸽类,牛乳、水果等的腐生菌,也可侵犯人体。新型隐球菌是导致免疫功能低下个体脑膜脑炎的主要原因之一。
• 新型隐球菌可形成脑部生物膜样结构
其毒力主要源于由葡糖醛酸甘露聚糖(GXM)组成的多糖荚膜。GXM不仅调节宿主免疫反应,也是生物膜形成的关键成分,对生物膜结构的建立起重要作用。新型隐球菌可形成脑部生物膜样结构,使感染更具持续性和治疗难度。耐药机制的出现进一步削弱了现有疗法的效果,凸显出开发新型抗真菌策略以针对其生物膜的必要性。
• 当前治疗方法对生物膜感染效果有限
当前推荐的治疗方案为脂质体两性霉素B联合5-氟胞嘧啶诱导治疗,之后以氟康唑维持,用于肺隐球菌病及隐球菌性脑膜炎。该方案对浮游状态的新型隐球菌有效,但对生物膜内菌株疗效显著下降。
此外,氟康唑相关耐药病例中发现ERG11基因突变,该基因编码唑类药物靶标酶14α-脱甲基酶,导致药物敏感性降低。这些问题凸显了迫切需要新型疗法以有效靶向并控制新型隐球菌生物膜感染。
烟曲霉及治疗方法
烟曲霉是一种机会致病真菌,是侵袭性曲霉病的主要致病因子,尤其危害免疫功能低下者。其致病机制与形成致密交织的菌丝型生物膜能力密切相关,该生物膜经历多阶段发育过程。
烟曲霉广泛分布于环境中,因其强适应性、高效空气传播及能抵达远端气道而成为重要病原体。此外,它可形成由菌丝团构成的局部感染——曲霉瘤,进一步促进生物膜相关感染,可通过曲霉病患者的支气管肺泡灌洗液检测到。
• 目前主要以三唑类药物治疗,但也出现耐药性
目前,烟曲霉感染的主要治疗药物为三唑类(如伏立康唑、伊曲康唑、泊沙康唑和艾沙康唑)及两性霉素B。虽然这些药物对敏感菌株疗效良好,但多地已报告三唑类耐药菌株的出现,严重影响疗效并带来公共卫生风险。
耐药机制主要包括cyp51A基因突变(改变唑类靶点)及外排泵过度表达(降低药物浓度)。当出现唑类耐药时,两性霉素B常作为一线替代药物使用,其脂质体制剂因毒性较低正日益应用于临床。
针对耐药菌株的联合治疗显示出潜在疗效,例如棘白菌素与泊沙康唑或艾沙康唑联合使用可能产生协同作用,但相关临床证据仍有限。与唑类和多烯类不同,棘白菌素作用于真菌细胞壁,特异性高,且有助于减少交叉耐药性。然而,日益增加的耐药性与治疗选择受限依然是临床难题。应通过加强抗真菌药物管理、常规监测耐药性,并开发新型或改良制剂以提升治疗安全性和有效性。
新型抗真菌药物的研发对于应对系统性和生物膜相关真菌感染具有关键意义,因为现有治疗手段在面对耐药性和生物膜屏障时往往效果有限。通过开发能够有效穿透或破坏真菌生物膜的新型药物,可以显著增强抗真菌治疗的渗透性和杀菌效率,从而改善患者预后并降低感染复发风险。
这些新兴疗法的研究重点在于结合药理活性与生物膜干预机制,以突破传统药物难以到达感染核心区域的限制。在此背景下,我们系统评估这些潜在药物在临床重要真菌所致生物膜感染及系统性疾病治疗中的应用前景,深入探索其作用机制、疗效表现及潜在的临床转化价值,为未来抗真菌治疗策略的优化提供科学依据。
白色念珠菌的新型疗法
由于白色念珠菌在医院感染中的高发病率,针对其生物膜的抗真菌药物成为重点研究方向。
• Rezafungin(雷扎芬净)药效时间长
Rezafungin是FDA批准的第二代棘白菌素,具有改良的药代动力学特性。其半衰期高达130小时,可实现每周一次给药而非每日给药。Rezafungin能破坏白色念珠菌生物膜形成,降低成熟生物膜的代谢活性和厚度,并抑制菌丝生成,活性优于氟康唑。
• Ibrexafungerp药效更明显,且可减少耐药
Ibrexafungerp是一种源自恩夫曼芬的半合成三萜类药物,是首个具有高组织分布和优良口服生物利用度的葡聚糖合酶抑制剂。它对包括白色念珠菌在内的多种致病真菌具有广谱活性,已获FDA批准用于治疗外阴阴道念珠菌病。尽管其作用机制与棘白菌素相似,但因结合位点部分不同,可避免交叉耐药。体外研究表明,Ibrexafungerp在0.25 µg/mL即可使生物膜代谢活性降低50%,而氟康唑需超过256 µg/mL才能达到相同效果。
• Fosmanogepix削弱白色念珠菌的毒力因子
Fosmanogepix是一种由前体药物转化而来的新型抗真菌剂,经碱性磷酸酶激活为Manogepix。目前其治疗念珠菌血症和侵袭性念珠菌病的III期临床试验正在进行中。该药通过抑制肌醇乙酰转移酶Gwt1干扰真菌细胞壁合成,从而削弱白色念珠菌的黏附、菌丝化和生物膜形成等毒力因子。其>90%的口服生物利用度和广谱抗真菌活性显示出作为新型系统感染治疗药物的潜力。
• Turbinmicin降低生物膜代谢活性
从海鞘微生物组中发现的Turbinmicin能靶向Sec14蛋白,对白色念珠菌生物膜表现出优异活性。Sec14在生物膜基质的囊泡递送中起关键作用。Turbinmicin通过抑制囊泡输出破坏基质形成,并在极低浓度下显著降低生物膜代谢活性。
动物实验显示,其在2.5 µg/mL时即可减少生物膜衍生菌落约2 log₁₀,在10 µg/mL时可完全清除感染导管,展现出在医疗器械相关感染中的高应用潜力。
针对不同细胞途径的新型抗真菌药物的作用机制
Elgammal Y,et al.Crit Rev Microbiol.2025
• 四唑类新药有更高的选择性并降低对宿主毒性
此外,四唑类新药如VT‑1161(奥替瑟唑)和VT‑1598代表第四代唑类抗真菌药,具有对真菌CYP51酶更高的选择性(约2000倍)并显著降低宿主毒性。
VT‑1161已获FDA批准用于治疗复发性外阴阴道念珠菌病,VT‑1598则在白色念珠菌、耳念珠菌及隐球菌感染模型中均表现出良好疗效。
多重耐药白色念珠菌,尤其是形成生物膜的菌株,给临床治疗带来严峻挑战。新型抗真菌药物的出现为现有疗法提供了有效替代方案,不仅展现出更强的抗真菌活性,还能靶向生物膜特异性机制,克服传统治疗的局限。
未来需继续通过系统研究和临床试验验证其有效性与安全性,以期改善侵袭性念珠菌感染的治疗效果。
隐球菌的的新型疗法
虽然新型隐球菌整体耐药率较低,但近年对氟康唑的耐药性日益引起关注,约有10–30%的临床分离株表现出敏感性下降。同时,其对氟胞嘧啶的耐药性也不断增加,这正是临床常将其与两性霉素B联合使用的主要原因之一。
氟胞嘧啶耐药主要源于fcy1、fcy2和fur1基因突变,这些基因分别编码胞嘧啶脱氨酶、胞嘧啶通透酶和尿嘧啶磷酸核糖基转移酶。突变会阻碍药物的摄取与代谢,阻断5‑氟胞嘧啶向其活性形式5‑氟尿嘧啶的转化,从而削弱抗真菌效果。相比之下,对两性霉素B的耐药性较低。
值得注意的是,这些耐药性评估多基于浮游状态的菌体,未充分考虑隐球菌生物膜对药物的天然抗性。此外,真菌对唑类药物的固有耐药性进一步强调了开发新型靶向疗法的必要性,以减少对传统两性霉素B与氟胞嘧啶方案的依赖。
• Fosmanogepix也对新型隐球菌表现出显著抗菌作用
除对白色念珠菌的活性外,Fosmanogepix也通过抑制真菌细胞壁合成对隐球菌表现出显著抗真菌作用。其Gwt1抑制剂衍生物的MIC低至0.004 µg/mL。在隐球菌性脑膜炎小鼠模型中,Fosmanogepix显著降低了肺部和脑部真菌负荷,尤其在与氟康唑联合应用时效果更佳,显示出增强疗效和克服耐药的潜力。
新型隐球菌耐药性的上升表明开发新一代抗真菌药物迫在眉睫,尤其针对生物膜相关感染。隐球菌自身致密且富含多糖的基质,加之血脑屏障的限制,使脑部感染极难清除,需要长疗程治疗,而复发仍更为常见。Fosmanogepix等新兴疗法为此类顽固感染提供了新的希望。
未来,需通过系统的体内实验与严格的临床试验,全面评估并优化这些新型药物的疗效,以期为隐球菌性脑膜炎带来更有效的治疗方案。
烟曲霉的新型疗法
尽管抗真菌治疗取得显著进展,但烟曲霉仍是重要且难治的致病真菌,尤其危及免疫功能低下患者。其对现有抗真菌药物的耐药性及复杂的生物膜结构,凸显了对新型治疗手段的迫切需求。目前,多种新型抗曲霉药物正处于不同临床开发阶段,具有多样的作用机制和制剂形式,为临床治疗提供了新的可能。
• Olorofim抑制早期生物膜形成
Olorofim(F901318)是一种处于III期临床试验的抗真菌药,对包括烟曲霉在内的多种难治真菌感染有效。它抑制早期生物膜形成(4小时内减少约66.4%),虽对成熟生物膜作用有限,但强调了早期干预的重要性。
Olorofim通过抑制真菌二氢乳清酸脱氢酶(DHODH)阻断嘧啶合成,具有极低脱靶风险。其对唑类和两性霉素B耐药菌仍具活性,在大量临床分离株中未发现固有耐药。药物口服吸收良好,半衰期20–30小时,可穿越血脑屏障并分布于肺、肝、肾组织,每日一次服用耐受性佳,仅有轻度胃肠不适。
但需注意其与唑类药物可能存在拮抗作用。此外,对具有相似作用机制的农业杀真菌剂异氟醚喹的耐药性,可能促进其临床耐药风险。
• Opelconazole专门针对肺部烟曲霉感染
Opelconazole(PC945)是一种吸入型三唑类抗真菌药,专为肺部烟曲霉感染设计。其强亲脂性使药物可在肺内蓄积,即使停药后仍保持活性,表现出持久局部效应与低系统暴露。
该特性为高风险人群(如肺移植受者)提供了潜在的预防性治疗选择,但其对烟曲霉生物膜活性的研究仍不充分,尚需进一步验证。
• Ibrexafungerp对曲霉也有广谱抗性
Ibrexafungerp除对白色念珠菌有效外,对曲霉也具广谱活性。在侵袭性肺曲霉病实验模型中,与艾沙康唑联用表现出协同作用,提高生存率并降低肺组织损伤。在一项针对难治性或不耐受真菌感染(包括侵袭性肺曲霉病)的III期研究中,其成功率为46.2%,并涵盖生物膜相关病例,显示出临床应用潜力。
在这里总结了这些新兴药物的药代动力学、剂量与安全特征。
Elgammal Y,et al.Crit Rev Microbiol.2025
新型药物也存在一些限制
尽管这些化合物极大拓宽了抗真菌药物储备,但从实验室到临床的转化仍面临挑战。由于真菌与人体在主要代谢通路上的高度保守性,一些有效抑制真菌生长的药物也可能对宿主细胞产生毒性,加之药物相互作用风险,使得复杂用药患者群体(如免疫低下者)更易受不良反应影响。
此外,许多新药受限于药代动力学和药效学特征,如口服吸收差、组织渗透性不足或中枢神经系统分布有限,削弱了其在系统性或侵袭性真菌感染中的应用潜力。高昂的研发成本与严格的审批流程亦增加了临床转化难度,尤其对结构复杂的天然产物而言更为显著。因此,在药物开发早期整合药理学、临床与经济学考量,并采用创新研究设计,将是推动抗真菌新药成功转化的关键。
• 根据生物膜阶段选择合适的药物
为进一步理解这些药物对生物膜的作用机制,可根据其干预生物膜生命周期的阶段(如粘附、萌发或成熟)进行分类。
阻断早期粘附或代谢活动的药物可防止生物膜形成,如唑类和四唑类(氟康唑、奥替康唑、VT‑1598)通过抑制麦角固醇合成削弱膜功能、减少表面定植。
而针对已形成的生物膜,则需药物具备穿透或破坏胞外基质(ECM)的能力。两性霉素B与棘白菌素在此阶段仍具一定效力,但作用有限。新型葡聚糖合酶抑制剂及Turbinmicin等则能直接靶向基质运输与ECM结构,对成熟真菌生物膜展现出更强活性。
药物再利用,是指将原本用于治疗其他疾病、已获批准或正在研发的药物,重新用于治疗真菌感染的一种策略。它的核心理念是:“旧药新用”——基于已有的药物安全性、药代动力学以及临床数据,探索其潜在的抗真菌活性,从而发现新的治疗方案。
药物再利用为发现新的抗真菌疗法提供了有前景的途径,尤其针对由白色念珠菌、新型隐球菌和烟曲霉等引起的生物膜相关感染。该策略具有高性价比优势,且大多数已用于人体的药物其毒性特征明确,安全性可控。通过高通量筛选及现有药物协同效应的研究,科研人员能够加速抗真菌治疗的创新与开发。
再利用的药物治疗白色念珠菌
白色念珠菌的生物膜相关感染常与导管使用有关,对传统抗真菌治疗具有显著耐受性。药物再利用被视为克服这一挑战的有前景策略。
• 依布硒啉有效抑制白色念珠菌生物膜形成
依布硒啉(Ebselen)是一种合成有机硒化合物,原用于治疗听力损失、美尼尔病及SARS‑CoV‑2感染,具有显著的抗真菌潜力。其通过模拟谷胱甘肽过氧化物酶活性,保护细胞免受活性氧伤害,并以中和自由基发挥神经保护作用。在8.96 µg/mL浓度下,依布硒啉即可有效抑制白色念珠菌生物膜形成,对多重耐药的耳念珠菌亦有类似活性。
• 环孢菌素A、匹伐他汀等也表现出对念珠菌生物膜的抑制作用
环孢菌素A作为抑制IL‑2合成的免疫抑制剂,能恢复氟康唑的疗效并增强对白色念珠菌生物膜的抑制。降胆固醇药物匹伐他汀通过抑制HMG‑CoA还原酶,与氟康唑联合表现出明显的抗生物膜协同作用,提示其主要影响生物膜形成过程。
此外,5‑羟色胺再摄取抑制剂如舍曲林和氟西汀也表现出抗生物膜活性,无论单用或与氟康唑联用均能增强抗真菌效果。这些研究强调了药物再利用作为一种实用、经济的策略,可拓展对白色念珠菌及其生物膜相关感染的治疗手段。
• 动物研究已验证部分再利用药物的疗效
部分再利用药物已在动物模型中验证疗效。例如,用于治疗类风湿性关节炎的含金抗炎药金诺芬在小鼠导管感染模型中,于3 µg/mL和10 µg/mL时均显著减少白色念珠菌生物膜。与抗原生动物药喷他脒联合使用时,金诺芬对成熟生物膜表现出协同效应。
高通量筛选还发现多种具有抗生物膜活性的药物,包括阿维菌素、苯溴马隆、盐酸育亨宾、佐替平和双羟萘酸吡咯烷铵,均对白色念珠菌具有抑制作用。
此外,真菌线粒体复合物I组分NDU1被确定为新的抗真菌靶点。FDA批准的抗蠕虫药氯硝柳胺在2 µg/mL时即可抑制NDU1并破坏成熟生物膜。将其制成纳米颗粒后,在小鼠口咽和外阴阴道念珠菌感染模型中显著降低了舌部与阴道的真菌负荷。这类NDU1抑制剂突出显示了通过靶向线粒体功能和破坏生物膜保护性基质来突破真菌防御的潜力。
再利用的药物治疗新型隐球菌
新型隐球菌生物膜因对标准抗真菌治疗的高度耐药性,仍是治疗中的主要难题。药物再利用揭示了多种非抗真菌药物对其具有显著活性,为治疗提供了新的方向。
• 联合使用时可能具有更强的抗生物膜作用
其中,抗结核药物如异烟肼和乙硫异烟胺可使隐球菌生物膜代谢活性降低约50%。当二者与氟康唑或伊曲康唑联合使用时,产生明显协同效应,对成熟生物膜的作用优于单独使用唑类药物。
甲苯咪唑是一种抗寄生虫药,也表现出强效的抗隐球菌活性,在0.0156µM浓度下可显著减少隐球菌生物膜形成并根除成熟生物膜。此外,甲苯咪唑与阿替霉素B联合使用时,两种化合物在较低MIC下均表现出抗隐球菌活性。
• 精神药物氟哌啶醇也减少隐球菌生物膜形成
抗精神病药物对新型隐球菌具有抗真菌活性。特别是氟哌啶醇,主要用于治疗精神分裂症和图雷特综合征,具有抗真菌活性。特别是氟哌啶醇衍生物化合物B10在2µg/mL时可有效减少隐球菌生物膜形成≥80%,并与氟康唑协同作用,显著降低小鼠脑真菌负荷。
这些发现凸显了药物再利用作为对抗新型隐球菌生物膜的有效策略的潜力,为以更短的研发时间和更低的成本扩大现有抗真菌药物库提供了一条有前景的途径。
再利用的药物治疗烟曲霉
三唑类耐药烟曲霉株的流行率持续上升,尤其是能形成坚固生物膜的菌株,凸显出开发替代疗法的紧迫性。
• 新鱼腥草素钠可减少生物膜并使其变薄
源自鱼腥草素的新鱼腥草素钠(SNH)传统上因抗菌特性在亚洲广泛使用。SNH通过干扰烟曲霉类固醇合成途径,抑制麦角固醇生成。XTT还原实验显示,SNH在1×MIC时可使成熟生物膜减少约20%,在4×MIC时减少约80%。显微镜观察发现,其显著缩短菌丝并使生物膜变薄。此外,经SNH治疗的曲霉感染小鼠其真菌负荷、组织损伤及促炎因子水平均显著下降。
• 双胍类化合物等也能够抑制真菌增殖
双胍类化合物Alexidine dihydrochloride(AXD)对白色念珠菌、新型隐球菌及烟曲霉均具抗真菌活性。在1.5–6 μg/mL浓度范围内,AXD能通过抑制真菌的丝状化与增殖,完全破坏成熟烟曲霉生物膜。
同时,抗利什曼病药物米替福新(Miltefosine)也表现出抑菌作用,其通过干扰鞘脂生物合成并对唑类耐药株依然有效。转录组学结果表明,米替福新通过SmiA转录因子调控鞘脂途径相关基因,而鞘脂分析进一步证实处理突变株的鞘脂水平显著降低。
另有研究发现螺吖啶衍生物,原以抗利什曼病与抗肿瘤作用闻名,可作为几丁质酶抑制剂,显示其作为生物膜靶向抗真菌候选物的潜力。
小结
药物再利用为开发更高效、低毒且经济的抗生物膜策略提供了新思路。这些化合物与现有抗真菌药联合应用可能产生协同效应。对其抗真菌活性及联合疗法的持续研究,加之优化给药方式,有望改善生物膜相关感染的治疗并有效应对日益严峻的耐药挑战。
除了药物治疗外,天然产物在应对真菌生物膜方面同样扮演着重要角色。长期以来,天然产物一直是抗真菌药物发现的重要宝库,凭借其天然来源的丰富化学结构和独特活性,提供了与合成化合物截然不同的多样性和创新性。相比人工合成的药物,天然化合物往往具有更复杂的分子骨架和多重作用机制,这使其在破坏真菌生物膜结构、抑制其形成及干扰信号传导等方面展现出独特优势。
随着真菌对现有抗真菌药物耐药性的持续上升,传统治疗手段的有效性逐渐下降,促使科学界重新关注天然产物这一重要资源。近年来,来自植物、微生物乃至海洋生物等多种天然来源的化合物被系统研究,显示出显著的抗真菌和抗生物膜活性。一些研究揭示,这些天然化合物不仅能够影响真菌细胞壁组成和代谢通路,还可能作为潜在的药物先导物,为新型抗真菌治疗策略的开发提供了坚实基础。
具有抗真菌生物膜活性的天然产物
Elgammal Y,et al.Crit Rev Microbiol.2025
1
维生素可减少白色念珠菌生物膜
维生素已成为易于获取的抗生物膜剂。维生素D3在60微克/毫升的浓度下可将白色念珠菌生物膜的形成减少高达88%,其半抑制浓度(IC50)为7.5微克/毫升,通过干扰核糖体生物发生和代谢途径来发挥作用。
它不仅在0.4至0.8毫克/毫升的浓度下降低新型隐球菌生物膜的代谢活性,还能防止粘附,从而限制生物膜的形成。此外,维生素C或抗坏血酸也表现出抗生物膜作用,但其机制与维生素D不同。
2
精油具有抗真菌生物膜的作用
精油对白色念珠菌和新型隐球菌的生物膜具有显著的抗真菌作用。百里香和牛至油中的主要成分百里香酚与香芹酚可有效降低生物膜的粘附性与代谢活性。将精油与抗真菌药物联合使用能增强后者的疗效。
例如,桉树油成分桉树醇可与两性霉素B、制霉菌素及伊曲康唑产生协同作用,通过降低这些药物对白色念珠菌生物膜的MIC提升抗真菌效能。其他精油,如椰子油、茶树油和菜籽油,也表现出抑制白色念珠菌生物膜的潜力。
3
中草药活性成分同样具有抗真菌作用
中草药也被广泛应用于对白色念珠菌和新型隐球菌生物膜的治疗。其中,青蒿素作为FDA批准的抗疟药,可通过调控白色念珠菌生物膜相关基因,抑制菌丝形成。
丹皮酚源自牡丹根皮,具有抗炎及多靶点抗真菌活性。在4和8 mg/mL浓度下,丹皮酚能抑制白色念珠菌菌丝生长,破坏新型隐球菌成熟生物膜,并削弱其荚膜和黑色素的生成,显示出多重抗毒性机制。
此外,多种植物来源化合物如姜黄素、胡椒碱和生姜也表现出对白色念珠菌生物膜的抑制作用。然而,由于其药代动力学性质较差,体内血浆浓度低且半衰期短,难以达到有效水平。其他天然产物如大蒜、肉桂、石榴和蔓越莓提取物同样展现出一定的抗真菌活性,为开发新的抗生物膜策略提供了潜在方向。
4
抗真菌肽和靶向热休克蛋白抑制剂
抗真菌肽已成为治疗真菌感染(包括新型隐球菌)的有效药物。源自酿酒酵母的SP1抗真菌肽在16 µM浓度下可使新型隐球菌生物膜生物量减少86.4%,代谢活性降低96.9%,并在64 µM时使成熟生物膜代谢活性下降73.6%。同样,来源于家蝇的AMP-17肽在64 µg/mL下可分别降低生物膜生物量和代谢活性78%与86%。这些结果显示出新型抗隐球菌生物膜肽的巨大潜力。
根霉酚是一种从镰刀菌属(Fusarium)中提取的天然Hsp90抑制剂,对新型隐球菌的MIC为1–2 µg/mL。尽管单独使用时对生物膜活性有限,但与氟康唑或伊曲康唑联合后表现出协同作用,可显著抑制成熟生物膜的形成。这表明Hsp90抑制剂作为佐剂,具备增强现有抗隐球菌疗法效果的潜在价值。
注:靶向热休克蛋白(Hsp),尤其是Hsp90作为毒力因子,能增强新型隐球菌的抗药性与致病性,并参与多糖荚膜的分泌,对生物膜形成至关重要。
5
其他具有抑制烟曲霉能力的物质
Plakortide F酸(PFA)是一种来源于海洋的聚酮内过氧化物,可通过破坏细胞钙稳态诱导细胞死亡,对烟曲霉具有显著抑制作用。研究还发现,PFA能激活钙调神经磷酸酶依赖的反应元件,表明其干扰了酵母关键的钙信号传导通路。
顺式-9-十六烯醛是一种具备抗烟曲霉生物膜活性的植物来源化合物,在0.078 mg/mL时可抑制真菌生长,在0.156 mg/mL时表现出显著的抗生物膜效应。扫描电子显微镜观察显示,其可导致烟曲霉生物膜大面积破坏,表现为胞外基质缺失及菌丝受损,效果优于烟曲霉素B。细胞毒性实验表明,该化合物对白色肺上皮细胞(L‑132)毒性较低,安全性良好。
天然产物作为自然界中丰富且复杂的化学资源,依然是一片尚未被充分开发的潜力领域,在抗真菌感染的研究与治疗中展现出广阔前景。这些来源于植物、微生物或海洋生物的化合物往往具有多样的生物活性和独特的作用机制,能够干扰真菌的生长、粘附及生物膜形成。
通过与现有药物协同作用,提高药物的生物利用度或降低真菌的耐药性,从而显著增强整体治疗效果。同时,其免疫调节特性有助于激发或强化宿主自身的防御机制,为机体提供额外的保护屏障。正因如此,天然产物不仅为抗真菌研究提供了新的思路,也为防治真菌生物膜相关感染开辟了更具前景的治疗途径。
针对真菌生物膜的治疗手段并不仅仅局限于传统的抗真菌药物或天然产物,还探索了多种具有潜力的替代疗法。这些新兴策略旨在弥补现有治疗的局限性,为真菌生物膜相关感染提供更多元化和更有效的干预途径,从而拓展抗真菌治疗的整体思路与应用前景。
1
光动力疗法
光动力疗法使用一种光敏剂,其被特定波长的光激活,目的是产生活性氧(ROS),这导致微生物细胞损伤和死亡。(维生素B2)和金丝桃素,它们是在贯叶连翘中发现的蒽醌衍生物。核黄素和金丝桃素被蓝色和黄橙色光激活,并且已经证明了在降低真菌生物膜形成的活力方面的显著功效。然而,由于ROS具有潜在毒性,该技术仍需进一步研究与优化。
2
防止医疗器械表明真菌定植
改变医疗器械的表面是防止真菌定植的关键。例如,在不锈钢医疗器械上进行银亚胺处理可抑制白色念珠菌生物膜的定植约82%,无哺乳动物毒性。钛植入物上的石墨烯涂层也被证明可以显著减少真菌粘附。
其他防止医疗器械上真菌生物膜形成的涂层包括之前提到的聚氨酯静脉导管上的壳聚糖和咪唑鎓盐共轭聚(L-丙交酯)。
3
使用疫苗防止真菌感染
疫苗为防治真菌生物膜提供了一种替代策略,可靶向生物膜形成相关抗原或诱导针对真菌细胞壁的广泛免疫应答。新型疫苗NDV‑3A(处于Ⅱ期临床试验阶段)能够诱导产生抗rAls3p抗体,从而抑制白色念珠菌与内皮细胞的粘附和侵入,并在导管小鼠模型中有效防止中心静脉生物膜形成。
此外,真菌细胞壁碳水化合物也是极具潜力的免疫治疗靶点。糖缀合疫苗和针对β‑葡聚糖及甘露聚糖的单克隆抗体在临床前研究中均展现出保护效果,并筛选出多种有望开发的候选抗体。尽管目前尚无疫苗获批用于预防真菌感染或生物膜形成,但研究仍在积极推进中,目标是开发出能够有效防控真菌感染的新型疫苗。
4
结合疗法效果更好
真菌生物膜的预防可通过将抗真菌药物、新型小分子或肽与材料表面修饰相结合来实现。例如,与单独的钛相比,卡泊芬净涂层钛片可完全抑制真菌附着;β‑环糊精与咪康唑联合应用于医疗器械后,白色念珠菌生物膜减少约90%。
鉴于真菌对常规抗真菌剂的高耐药性,小分子和肽类物质被广泛用于防止生物膜形成。其中,白色念珠菌在生物活性玻璃(耳蜗植入体)、牙科树脂(义齿)和硅胶(导管)上的粘附分别减少99%、77%和60%。
真菌生物膜感染依然是临床医学中最复杂且最具挑战性的问题之一。现有抗真菌药物虽然仍是治疗的核心手段,但其疗效受到多重限制——包括毒性高、药物渗透性不足以及抗药性风险增加。尤其在生物膜相关感染中,由于细胞外基质的屏障作用与多重耐药机制的存在,传统药物的效果大幅削弱。这不仅凸显了研发新型抗真菌药物的迫切性,也强调了探索能够有效干预生物膜形成与维持机制的创新策略的重要意义。
近年来,新一代抗真菌药物的研发、旧药再利用及天然产物的研究展现出显著潜力。药物再利用提供了一种低成本、低风险且可直接进入临床应用的途径,而天然化合物作为药物或辅助剂,能在防止生物膜形成和抑制其生长方面发挥重要作用。这些新策略的出现,为应对真菌系统性感染与生物膜相关感染提供了新的可能性。
除传统药理学方法外,多种跨学科创新技术正加速推进抗真菌治疗的革新。例如,光动力疗法、表面功能化与抗黏附涂层、以及基于纳米技术的药物递送系统,为从病灶源头预防和根除真菌生物膜提供了全新思路。这些手段不仅能增强药物靶向性与局部浓度,同时降低宿主毒性。值得注意的是,这些新兴疗法在白色念珠菌、新型隐球菌及烟曲霉等医学关键病原体中均展现出广谱抗真菌活性。
未来,抗真菌领域正迎来转变。通过整合分子靶向药物、天然产物、智能材料与纳米技术,有望实现对真菌生物膜的精准破坏与再感染预防。同时,应以患者安全与疗效为核心导向,构建兼顾个体化与精准治疗的综合策略,以延缓甚至防止真菌耐药性的进一步扩散。随着多学科融合与临床应用的推进,这些新一代疗法有潜力显著改善抗真菌治疗的临床结局,并最终在保障患者安全的同时,重塑真菌感染防治的新格局。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Elgammal Y, Garcia Martinez RI, Requejo A, Martinez LR. Current and emerging therapies for fungal biofilms and systemic infections. Crit Rev Microbiol. 2025 Oct 10:1-20.
Agbadamashi DJ, Price CL. Novel Strategies for Preventing Fungal Infections-Outline. Pathogens. 2025 Feb 1;14(2):126.
Buil JB, Oliver JD, Law D, Baltussen T, Zoll J, Hokken MWJ, Tehupeiory-Kooreman M, Melchers WJG, Birch M, Verweij PE. Resistance profiling of Aspergillus fumigatus to olorofim indicates absence of intrinsic resistance and unveils the molecular mechanisms of acquired olorofim resistance. Emerg Microbes Infect. 2022 Dec;11(1):703-714.
Kirchhoff L, Dittmer S, Furnica DT, Buer J, Steinmann E, Rath PM, Steinmann J. Inhibition of azole-resistant Aspergillus fumigatus biofilm at various formation stages by antifungal drugs, including olorofim. J Antimicrob Chemother. 2022 May 29;77(6):1645-1654.
Sutar Y, Nabeela S, Singh S, Alqarihi A, Solis N, Ghebremariam T, Filler S, Ibrahim AS, Date A, Uppuluri P. Niclosamide-loaded nanoparticles disrupt Candida biofilms and protect mice from mucosal candidiasis. PLoS Biol. 2022 Aug 17;20(8):e3001762.
Vassiliou E, Awoleye O, Davis A, Mishra S. Anti-Inflammatory and Antimicrobial Properties of Thyme Oil and Its Main Constituents. Int J Mol Sci. 2023 Apr 8;24(8):6936.
Yang L, Tian Z, Zhou L, Zhu L, Sun C, Huang M, Peng J, Guo G. In vitro Antifungal Activity of a Novel Antimicrobial Peptide AMP-17 Against Planktonic Cells and Biofilms of Cryptococcus neoformans. Infect Drug Resist. 2022 Jan 25;15:233-248.
Liu Y, Zhang Y, Zhao X, Lu W, Zhong Y, Fu YV. Antifungal Peptide SP1 Damages Polysaccharide Capsule of Cryptococcus neoformans and Enhances Phagocytosis of Macrophages. Microbiol Spectr. 2023 Mar 14;11(2):e0456222.

谷禾健康
从吃什么到谁在消化
我们常常纠结于吃什么,食物的卡路里、蛋白质或脂肪含量,却可能忽略了一个关键问题:这些食物进入我们体内后,到底发生了什么?
我们吃下的每一口饭,其实都不是我们一个人在享用,在我们肠道里,还住着数万亿的成员——肠道菌群。我们吃进去的营养,需要先经过它们的“再加工”和“巧分配”,才能真正为我们所用。
我们很多人其实已经了解肠道菌群这个系统至关重要,但其内部精密的运作逻辑,对我们而言就像一个黑箱。
关于这些问题,我们用两篇研究来解析这一微观世界的运作机制。
发表在《The ISME Journal》的研究深入微观,揭示了菌群的“社会规则” 。肠道中大部分细菌都存在“氨基酸合成缺陷”,也就是说它们无法独立制造所有生存必需的氨基酸。这种缺陷却不一定是坏事,某种程度上反而驱动微生物群落多样性、稳定性,促成了它们之间广泛的“交叉喂养”(cross-feeding),形成了一个高度依赖、紧密协作的社会网络。
另一篇发表在《Cell》的研究,则是聚焦宏观,首次量化了菌群的“经济贡献” ,也就是说肠道微生物群每天向人体“输送”多少能量以及这一过程受饮食影响的规律。
通过构建一个精密的系统通量模型,该研究精确计算出,肠道微生物群的发酵产物(乙酸、丙酸、丁酸等)可为人体提供每日2%~10%的能量。这个比例受饮食结构(尤其是纤维摄入量)的显著影响,明确了微生物对宿主能量平衡的具体贡献值。
如果说前一篇回答了菌群之间如何协作,那么后一篇是让我们了解了菌群的协作对我们有什么用。这两篇一起能够让我们更系统、更完整地理解肠道菌群不仅是一个随机的微生物集合,而是一个遵循着内部协作规则、并能对外部宿主产生巨大影响的、有组织的生态系统。
本文将立足于这一整体视角,整合两大前沿发现,深入剖析菌群内部的互补协作逻辑与对宿主的代谢贡献,进而揭示“营养-微生物-宿主健康”核心轴线中的多层级调控规律。
氨基酸合成能力缺陷在肠道细菌中非常普遍
人类肠道内有些细菌,自己造不出某些生存必需的营养物质。比如氨基酸或维生素,它们必须依靠外部环境或其他细菌提供这些物质才能活下去,这种情况就叫“营养缺陷型”。这种“专性营养需求”会对单个细菌和整个菌群系统都产生很大影响。
发表在《The ISME Journal》这篇文章,通过对一个包含5414株肠道细菌的基因组目录进行分析后,选取了其中3687个高质量的基因组进行深入研究发现:
氨基酸合成能力缺陷在肠道细菌中非常普遍。例如,近64%的菌株缺乏合成色氨酸的能力。被“丢失”最多的氨基酸(如色氨酸、亮氨酸、异亮氨酸、缬氨酸等),恰好也是人类自身的必需氨基酸。
预测的氨基酸缺陷被分为人类必需和非必需氨基酸
doi.org/10.1038/s41396-023-01537-3
然而,这种看似的缺陷并非生存劣势,而是一种高效的进化策略与生态分工。
更有趣的是,研究还揭示了这种营养缺陷与特定发酵产物生成之间的深刻关联。例如:
这表明,当合成氨基酸的代谢路径被关闭时,其前体物质会被重新导向其他途径,生成对群落乃至宿主健康至关重要的发酵产物。
doi.org/10.1038/s41396-023-01537-3
总而言之,肠道菌群中的营养缺陷并非弱点,而是驱动群落形成社会性分工的关键。
有的细菌不会做饭,只能吃别人做的饭,但因为社区里有人乐意做、多余的饭还能分享,因此大家都能活得更好,整个微生物群落变得更有分工、更稳定。
通过这种交叉喂养,菌群不仅实现了整体的稳定与繁荣,更获得了强大的稳态韧性,使其在面对饮食波动或药物干扰等外界压力时,能更好地维持其核心功能,也增强了微生物与宿主之间的代谢联系。
“营养缺陷型”细菌越多,肠道菌群多样性越高
研究人员发现了一个有意思的现象:肠道菌群中“营养缺陷型”细菌的丰度,与菌群的多样性和长期稳定性呈显著正相关。也就是说,一个人肠道里营养缺陷型细菌越多,他的肠道菌群种类越丰富,也越稳定。
这其实验证了一个早期来自理论生态学的假说,即“代谢交叉喂养能创造新的生态位”。当细菌通过互相提供必需营养物来弥补彼此的合成缺陷时,它们便构筑了共存的基础,避免了直接的生存竞争。
为了验证该假说,研究团队分析了两个独立队列、跨度长达3~4年的纵向人体数据,结果高度一致:
这意味着,一个高度依赖内部“互助网络”的菌群,其整体结构更加稳固,对饮食波动、药物使用等外界干扰具有更强的抵抗力。
研究者引用的另一项关于B族维生素的研究也佐证了此观点:在小鼠模型中,即使科学家改变小鼠饮食中B族维生素的含量,小鼠肠道菌群的组成几乎没变化;B族维生素“缺乏型”的菌群比例也没明显改变。这说明这些菌并不是靠饮食提供的维生素生存,而是靠菌群内部那些“会合成维生素”的菌种提供营养。
因此,这又进一步印证了他们的观点:
肠道中的营养缺陷并非个体的弱点,反而是驱动群落走向更高层次合作与韧性的关键机制。营养缺陷型菌群的越多,越是促进了普遍的交叉喂养,由此形成的复杂互助网络,是维持整个生态系统平衡、健康和具备自我修复能力的核心。
超越肠道:菌群产物的全身性健康效应
研究人员发现肠道里“营养缺陷型”细菌,不仅仅影响菌群结构,也和宿主的代谢状态、体重以及血液代谢物水平之间存在联系。
研究团队注意到以前人们关注焦点是,“肠道菌群的代谢怎么影响人体健康”,但从来没有人专门去了解“这些营养缺陷型细菌的数量会不会和人体健康参数有关”。于是他们第一次统计分析了氨基酸营养缺陷型菌的比例与受试者健康指标的关系。
结果他们发现几个有意思的点:
①
营养缺陷型菌越多,BMI指数越低
他们发现某些氨基酸营养缺陷型菌的总数量跟人体的 BMI 呈负相关,也就是说,一个人的肠道里这些“营养依赖型”细菌比例越高,他的体重(或体脂)往往越低。
虽然不能说明因果,但这暗示了这些细菌群可能和更健康或更瘦的代谢状态有关。
同时,他们没发现这些细菌的丰度和血细胞计数(也就是血象指标)之间有明显关系,所以这种关联主要是代谢方面的,而不是炎症或免疫系统方面。
②
与血液中某些代谢物水平有关
色氨酸营养缺陷型细菌的比例跟血液中 3-吲哚乙酸(3-IAA)和 3-吲哚丙酸(3-IPA)含量呈正相关。
这两种物质都是由色氨酸经过微生物代谢产生的“吲哚类代谢物”,它们已知具有抗氧化、抗炎、神经保护作用,还能调节肠道屏障和免疫系统。
换句话说:这种缺色氨酸合成能力的细菌越多,人体血液里好的代谢产物越多。这说明这些缺陷菌可能刺激或依赖周围菌群代谢色氨酸,从而促进这些有益代谢物的产生。
不止色氨酸,其他几种氨基酸营养缺陷型(比如谷氨酸、天冬氨酸缺陷等)也和这些吲哚类代谢物呈现正相关。这种一致的趋势表明,肠道中代谢互助可能会提高吲哚相关代谢流通量。
③
与其他代谢物也存在相关性(尤其是胆汁酸和含氮代谢物)
他们发现特定氨基酸营养缺陷型细菌的总比例和对甲酚硫酸酯呈正相关。
这种物质是由肠道菌群将酪氨酸分解后经肝脏代谢转化的产物,通常被认为与肠道代谢活性有关。尽管高水平时可能与肾功能或炎症风险相关,但它也代表了一种活跃的芳香族氨基酸代谢通量。
这些胆汁酸变化说明,肠道代谢生态(由菌群活动决定)确实能影响宿主的脂肪吸收、胆盐循环与炎症信号。换句话说,这种“谁缺什么营养、谁提供什么”的群落特征不光影响菌和菌之间的平衡,也会通过代谢物反馈到宿主的肝脏和消化系统。
血清代谢物水平与肠道微生物组中营养缺陷型细菌频率之间的部分斯皮尔曼相关性
④
没有发现明显的氨基酸水平变化
意思是,虽然菌群结构(营养缺陷型比例)跟体重、代谢物水平有关系,但血液中的游离氨基酸浓度本身并没有明显改变。
这意味着这些影响不是因为“血液里多了或少了某种氨基酸”,而是因为菌群间代谢互动带来的代谢网络变化。
这为氨基酸交叉喂养提供了功能性证据:它不仅是“微生物之间共享营养”的现象,更是宿主健康稳态的化学纽带。
以上这些发现为“交叉喂养”提供了强有力的功能性证据。它不仅是微生物之间维持生存的生态策略,更是一条连接菌群内部互作与宿主全身健康稳态的关键化学纽带。
肠道菌群对宿主能量的直接贡献
肠道微生物群与人体的相互作用,主要通过一系列被称为发酵产物的小分子(以乙酸、丙酸和丁酸为主)来介导。
这些分子由大肠中厌氧微生物产生,这些微生物主要以植物性食物中的复合碳水化合物为食,如膳食纤维和抗性淀粉,以及通过小肠和粘蛋白的膳食蛋白质。
产生后,绝大部分发酵产物会被结肠上皮细胞吸收,并整合到宿主的代谢网络中,发挥多重生理效应:
► ▷
我们要讲的这篇发表在《Cell》的研究,其核心突破在于建立了一个“系统级通量模型”。
它是一个强大的计算框架,能够定量分析在真实生活状态下,人体肠道每天究竟产生了多少发酵产物,以及这些产物的代谢去向。
利用这个框架,研究者发现:
超过90%的可被微生物利用的碳水化合物最后会被转化为发酵产物,而这些发酵产物的大部分都被人体吸收。
这意味着发酵产物是肠道微生物与宿主之间最重要的代谢交换物质,对宿主的信号传导、行为和能量平衡都有显著影响。
微生物对能源供应的贡献
在缺氧的大肠中,微生物利用复合碳水化合物(膳食纤维、抗性淀粉)产生短链脂肪酸(乙酸、丙酸、丁酸)。
这些能量丰富的分子随即被结肠上皮细胞高效吸收,直接汇入人体的能量代谢系统。这一过程对宿主总能量的贡献不容小觑,其具体程度与饮食结构紧密相关:
换算成绝对通量,这意味着人体每天从肠道吸收的发酵产物总量约为 450–1500 mmol。这种“微生物供能”机制,因其难以直接测量,在传统营养学评估中常被忽视。而这项研究的定量模型则明确指出,它是一股对人体能量平衡有显著影响的“代谢暗流”。
DOI: 10.1016/j.cell.2025.07.005
饮食与菌群的明确分工:
饮食决定“量”,菌群决定“质”
研究的核心在于厘清了饮食与菌群在肠道发酵过程中的不同角色。结论非常明确:
饮食结构(尤其是微生物可利用碳水化合物 MACs 含量)是决定发酵产物通量的主因。
相比之下,菌群组成的变化对总产量的影响较小(约±10%),但它显著影响发酵产物的具体构成(如丁酸和乳酸的相对比例)。
研究团队首次利用宏基因组与通量模型估算了健康人肠道的发酵产能:
输入
每天约有 50–80克 的可发酵碳水化合物(MACs)进入结肠。
转化
微生物将其高效转化为 450–1500 mmol 的短链脂肪酸。
输出
这为宿主提供了 2%–10% 的总能量需求,具体比例因饮食模式而异。
这些SCFAs并非均质,而是有明确的组成和分工,其中:
这一发现可以用一句话概括:
“吃什么”(饮食)决定了发酵的总能量,而“谁在吃”(菌群)决定了这些能量以何种形式(哪种SCFA)被利用。
例如,高纤维饮食(>35 g/天)能显著增加短链脂肪酸总产量,促进产丁酸菌(如 Roseburia、Faecalibacterium)增殖,从而增强肠道的抗炎屏障。
相反,富集高蛋白与低碳水饮食则会使代谢转向蛋白质分解,增加氨和硫化氢等潜在有害物质的产生,使某些潜在致病菌(如 Bilophila wadsworthia)扩增。
营养-微生物共代谢模型:预测健康的新坐标
核心结论与研究启示
饮食作为核心驱动因素
研究最终明确指出,饮食是决定肠道发酵产物种类与总量的核心驱动力。它通过双重机制发挥作用:一方面,直接决定了可供发酵的底物(主要是MACs)的数量;另一方面,长期饮食模式会选择性地塑造菌群的结构。
研究者强调,理解宿主健康和微生物作用时,必须同时考虑饮食、微生物群组成与发酵产物之间的相互作用轴线。
对研究方法的反思与建议
该研究的一个重要启示是,粪便样本检测存在巨大局限性。由于高达95%的短链脂肪酸在结肠段即被宿主吸收,粪便中的残留量远不能反映肠道内真实的生产通量。因此,准确评估肠道发酵活动,必须超越简单的粪便分析,转而采用结合了饮食记录和微生物代谢通量计算的系统模型。
全球饮食模式与肠道生态的关联
将此模型应用于全球不同人群,研究揭示了饮食模式对肠道发酵功能的深刻影响。
数据显示,工业化国家(如美国的NHANES队列,平均产量286 mmol/天)的发酵产率显著低于仍保持传统高纤维饮食的人群(如哈扎狩猎采集者,产量最大可达~1000 mmol/天)。
发酵产物对宿主的能量贡献率也在 1.7% 至 12.1% 之间大幅波动。这些证据表明,现代饮食的精加工趋势可能正在系统性地削弱人类肠道微生物组的能量代谢功能。
对动物模型外推的审慎态度
研究还发现,实验常用的小鼠模型与人类在肠道发酵上存在显著的物种差异。按体重归一化后,小鼠的SCFA产率(~400 mmol/kg/天)远高于人类(~7 mmol/kg/天),其对微生物发酵的能量依赖也更高(小鼠>21% vs. 人类<12.1%)。
这一差异提醒科研人员,在涉及全身性代谢、能量平衡及行为的研究中,将小鼠数据直接外推至人类需格外谨慎。尽管如此,在局部肠道层面(比如每单位肠道表面积吸收的发酵产物量,人和鼠的数值相近),两者具有可比性,使小鼠在研究局部互作机制时仍具价值。
研究的宏观意义:迈向定量微生物生态学
总结来看,这项工作的核心贡献在于推动微生物组研究从定性的“存在性分析”迈向了定量的“通量分析”。它不再仅仅回答“微生物产生了什么分子”,而是通过整合代谢组学、宏基因组学和饮食数据,精确计算出宿主与微生物之间关键代谢物的交换速率与规模(即“通量”)。
这种对“剂量”的明确计算,为理解发酵产物如何具体影响宿主生理(即“剂量-效应关系”)提供了坚实的数据基础。
作者最后强调,这一强大的定量框架不仅适用于发酵产物,还具有广阔的应用前景,未来可扩展至氮循环、气体代谢、蛋白质降解等其他关键的宿主-微生物相互作用领域,从而开启一个系统化、定量化理解人体共生生态系统的新篇章。
精准氨基酸补充:基于菌群代谢特征
通过外源性氨基酸干预,可有选择地促进益生菌生长:
这种“氨基酸-选择性补养”策略可能成为未来益生营养的新方向。但其具体菌株配对及剂量效应仍需实验验证。
碳源结构优化:调控能量产物比例
通过调控可发酵碳水化合物的含量与结构,可以:
当菌群有充足、优质的碳源(可发酵碳水化合物)作为能量时,它们会优先利用这些碳源,从而减少对蛋白质的分解(即腐败发酵)。这会直接降低氨、硫化氢、部分吲哚和酚类等潜在有害物质的产生。
体化代谢预测:AI + 代谢组学融合
展望未来,我们可以通过整合微生物基因组尺度代谢模型、宿主代谢组学信息以及个体饮食数据,并利用机器学习算法进行深度分析,从而构建一个强大的综合预测模型。
该模型将能够精准评估个体的能量回收效率,预测其罹患肥胖、炎症性肠病(IBD)、2型糖尿病等代谢相关疾病的风险趋势,并模拟不同营养干预方案的个性化反应。这标志着我们正迈向一个能够为精准营养和预防医学提供坚实科学循证依据的新时代。
综合以上两篇《The ISME Journal》与《Cell》的标志性研究成果,一个突破性的生命科学框架逐渐清晰:肠道微生物群落本质上是一个分布式代谢系统 。其核心机制体现为“营养缺陷-代谢互补-发酵能量”的级联功能网络,三者通过动态互作构成人体代谢稳态的关键调控枢纽。
氨基酸营养缺陷型的普遍存在,说明肠道微生物早已从“个体独立的代谢单元”进化为“代谢互助的生态集合体”,代谢功能呈现出模块化和分工化趋势。
这令人联想到人类社会的分工协作:厨师专注烹饪、医生钻研医术、教师传道授业,正是通过放弃全能、追求专精,整个社会系统更能高效运转。菌群的营养缺陷何尝不是如此?
这种“丧失功能以换取依赖”的策略并非退化,而是一种进化经济学的最优解——正如团队成员通过各司其职提升整体效率,微生物通过外部化代谢与共生交换,降低了整个系统的能量成本。
群落层面的发酵产物研究进一步表明,这种微观的营养依赖会在更高层次上塑造整个碳流通量网络。
《Cell》的研究则将这一微观协作的宏观效应进行了精准量化,研究表明,正是通过交叉喂养(cross-feeding)等复杂的内部协作,菌群构建了一个强大的能量生态系统,最终能为宿主贡献每日高达2%-10%的能量。
这是从抽象概念到具体数值的飞跃,证明菌群这个微观社会,集体协作产生的巨大外部价值。这与人类社会的合作共赢理念不谋而合:供应链中上下游企业的互补、科研团队中不同领域专家的协作,都在印证同一个真理——真正的强大是群体互哺所带来的可量化的集体增益。
长期来看,这种“机制解析-模型构建-临床转化”的闭环路径,将重新定义健康管理的范式——从传统的宿主中心视角转向“菌群-宿主生态系统”的动态平衡监测。
未来,随着多组学检测成本的下降与算法迭代,这种“预测-干预-验证”的闭环管理模式有望成为常规临床实践的重要组成部分。结合AI驱动的多组学整合技术,我们有望实现从“疾病治疗”到“代谢稳态预测与维护”的跨越,为个性化营养干预与代谢疾病防治提供全新工具。
参考文献:
Starke S, Harris DMM, Zimmermann J, Schuchardt S, Oumari M, Frank D, Bang C, Rosenstiel P, Schreiber S, Frey N, Franke A, Aden K, Waschina S. Amino acid auxotrophies in human gut bacteria are linked to higher microbiome diversity and long-term stability. ISME J. 2023 Dec;17(12):2370-2380.
Arnoldini M, Sharma R, Moresi C, Chure G, Chabbey J, Slack E, Cremer J. Quantifying the varying harvest of fermentation products from the human gut microbiota. Cell. 2025 Sep 18;188(19):5332-5342.e16.

谷禾健康
白藜芦醇是一种来源于葡萄皮、蓝莓、花生、虎杖根等植物中的天然多酚化合物,被誉为“植物界的青春分子”。在过去二十年中,白藜芦醇成为科研界的明星物质,从抗氧化、抗炎、降脂,到抗衰老、心血管保护、神经保护、甚至代谢性疾病干预和抗癌,都有相关的研究支持。它的作用范围之广,让它一度被誉为“健康防护伞”。
正因如此,白藜芦醇逐渐从实验室走进大众视野,成为风靡全球的功能性补充成分。数据显示,2024年全球白藜芦醇市场规模达8.6亿美元,年增长率约为8.2%。在中国,含白藜芦醇的营养品、红酒饮品和护肤品等广泛应用于多个领域。从胶囊、片剂、饮品、粉剂到外用精华,白藜芦醇的产品层出不穷;它既是“抗氧化”营销的主角,也是“抗衰老配方”的常客。
然而,现实中的挑战在于——“吃进去”和“吸收到”并不是一回事。白藜芦醇的吸收率极低。口服后,它会在肠道与肝脏迅速被代谢,只留下极少量活性物质能够进入血液。并且不同产品的剂型、工艺和载体,也让有效吸收差异悬殊。换句话说,即使你喝下一整瓶红酒,身体中真正利用到的白藜芦醇也微乎其微。这一“高潜力、低利用”的特性,成为白藜芦醇临床转化的最大瓶颈。
近年来的研究揭示了一个新的突破口:肠道中的有益菌可以将白藜芦醇转化为更稳定、更容易吸收的代谢物,如二氢白藜芦醇;同时,白藜芦醇自身也能促进某些健康菌群(如Akkermansia muciniphila、Bifidobacterium)的生长,从而形成良性循环。这种“双向作用”不仅提高了其生物利用度,也放大了其抗炎、调节代谢及保护肠壁的健康效应。并且在临床治疗中也具有多种健康益处。包括降低炎症水平、缓解炎症性肠病、改善代谢功能障碍如肥胖、减轻糖尿病症状,改善生活质量等。
因此,现代的白藜芦醇补充理念,已经从单纯追求“吃多少”,转向“如何让它更被身体吸收、更懂身体需要”。正尝试通过多种创新方式让这类分子真正被身体“用得其所”:
如通过脂质体或纳米颗粒包裹可防止白藜芦醇在消化过程中被破坏;与特定益生菌、益生元结合可形成“菌群友好”配方,促进其在肠道转化为更高效的代谢产物。日常摄入富含膳食纤维和益生元的食物,如燕麦、洋葱、低聚果糖等,能为肠道“打好地基”,让白藜芦醇的代谢与吸收更流畅。
还有一些人群更进一步选择个性化补充方案——根据自身肠道菌群特征、饮食模式与代谢基因,定制出更高吸收率、更合适剂型的白藜芦醇产品。
除此之外,补充方式与时间也在影响吸收效果。研究发现,与含少量健康脂肪的食物同服,能显著提升白藜芦醇的溶解与穿透率;而分次小剂量摄入,则能在血液中维持更稳定的有效浓度。
通过本文,你将更加深入、系统地了解白藜芦醇,从它的来源与作用到它在身体中的多重益处。同时,我们还将一步步教你如何科学、有效地补充白藜芦醇,让它真正发挥应有的健康价值。
▸ 什么是白藜芦醇?
白藜芦醇(常写作 RSV)是一种天然多酚,属于“二苯乙烯”与“芪类化合物”。是植物在受伤、紫外线或病原侵袭时合成的自我保护性“植物抗毒素”。
白藜芦醇最初的来源是白藜芦(Veratrum grandiflorum)的根部,随后又在虎杖根和何首乌根中相继分离得到。
其主要有反式(trans)和顺式(cis)两种形态;反式更稳定,在食物与补充剂中最常见,也常被作为含量的标记形式。
白藜芦醇化学结构(顺式和反式)
doi: 10.3390/biomedicines6030091.
▸ 为何白藜芦醇近来受到广泛关注?
许多研究表明,白藜芦醇在抗氧化、抗炎、代谢调节方面展现出多重潜力,并对心血管系统与神经系统具有一定的保护作用;然而,口服进入机体后会迅速发生代谢或转化,导致体内可及的活性形式与暴露时间受限,其在人群中的真实有效性与剂量设定、给药制剂特性以及个体差异等因素密切相关。
部分观察到的生物效应还可能归因于其代谢产物(如二氢白藜芦醇等)在生理浓度下的作用,而并非完全来自母体分子本身的直接作用。
▸ 主要天然来源(食物与饮品)
白藜芦醇主要存在于植物中,但含量受品种、部位(尤其是果皮)、成熟度、气候/病虫压力、加工发酵和储存条件影响很大,范围变化可达数十倍。以下为常见来源(不同研究会有差异):
⑴葡萄及其酒类
红葡萄皮与红葡萄酒:大众最主要的膳食来源之一。红酒中一般为每毫升0.1–数微克,个别品种与特定发酵条件可更高;与果皮接触时间越长含量越高。
白葡萄酒:由于与果皮接触短,含量通常低于红酒。
鲜葡萄(尤其是皮):以微克/克量级存在,深色品
种通常更高。
⑵浆果类
蓝莓、越橘、蔓越莓、草莓等:多数在微克/克或更低水平。北方野生小浆果在某些季节或品种中含量可偏高。
白藜芦醇的膳食来源
Koushki M,et al.Food Sci Nutr.2018
⑶花生及其芽、花生皮
花生仁含量为微克/克级别;花生皮与花生芽通常更高一些。烘焙、储存方式会影响最终含量。
⑷其他植物来源(作为日常饮食的贡献较小)
蓼科植物如虎杖、何首乌等根茎中常含量较高,这些也是工业提取与标准化补充剂的主要原料。
桑科、松科及部分药食同源植物中也可检出,但平时摄入量有限。
白藜芦醇的植物来源
doi: 10.1002/jsfa.10152.
▸ 非天然来源
⑴生物技术生产
为克服天然来源含量低、波动大,已开发酵母/细菌发酵、植物细胞培养与酶法合成等途径,可规模化制备反式白藜芦醇及其结构类似物。
⑵富集或强化食品
市面上也有用提取物进行“功能强化”的饮品或食品,本质是外加标准化原料。
一句话小结
白藜芦醇是植物在遭受外界胁迫时为自我防御而合成的天然多酚化合物,人类的主要膳食来源包括葡萄,尤其是葡萄皮与由其酿制的红酒,以及多种浆果与花生等食物。
尽管这些来源广泛且日常可见,但天然食物中的绝对含量普遍不高,且因品种、产地与加工方式差异而波动明显,实际摄入常难以稳定达到预期水平,因而可能存在摄入不足的情况。
根据研究人员的实验(大部分为动物实验),白藜芦醇已展现出多重潜力:包括抗氧化、抗炎、抗癌、抗菌、心脏保护和神经保护等活性。
▸ 抗氧化
多项研究表明,白藜芦醇具有显著抗氧化活性,主要与其清除自由基(如超氧、羟基自由基、过氧化氢、一氧化氮、二氧化氮)、激活抗氧化酶及诱导其表达相关。
白藜芦醇的抗氧化能力甚至强于维C和维E
同一研究还显示,反式白藜芦醇的清除能力强于维生素E和维生素C,并可通过清除自由基与螯合铜离子减少脂质过氧化。
体外实验比较了反式白藜芦醇、紫檀芪和槲皮素在人人红细胞中的抗氧化效果。相较另外两者,白藜芦醇对AAPH诱导的溶血抑制更显著,并能防止AAPH处理下红细胞谷胱甘肽下降。
白藜芦醇抗氧化活性的机制
Radeva L,et al.Pharmaceutics.2025
以四丁基氢过氧化物诱导红细胞氧化应激时,白藜芦醇亦表现出保护作用,体现在提升细胞内膜相关的还原型谷胱甘肽与巯基水平。
▸ 抗炎
白藜芦醇的抗炎作用主要源于其对多条炎症信号通路的调控,如抑制花生四烯酸、NF-κB、MAPK 和 AP-1 等通路。
抑制NF-κB、MAPK等炎症通路,降低IL-8释放
在肺上皮细胞(A549)中,它可抑制 NF-κB、AP-1 与 cAMP 反应元件结合蛋白依赖性转录(甚至强于地塞米松),降低 IL-8 与粒细胞-巨噬细胞集落刺激因子释放,并抑制细胞因子刺激诱导的 iNOS 表达和亚硝酸盐生成。
此外,在经 PMA 与钙离子载体 A23187 处理的人肥大细胞系(HMC-1)中,白藜芦醇通过降低细胞内 Ca2+ 与 ERK1/2 水平,抑制 IL-6、IL-8、TNF-α 与 COX-2 的表达。
白藜芦醇下调的不同炎症细胞因子和信号通路
Prakash V,et al.Int J Mol Sci.2024
▸ 抗癌
白藜芦醇改变癌细胞代谢抑制其增殖
关于白藜芦醇的抗癌活性,普遍认为其多酚的促氧化效应及由此引发的凋亡是关键因素。其可能机制包括抑制I期代谢酶(CYPs),调控Nrf2及其靶基因表达,抑制肿瘤细胞生长,通过调节VEGF抑制血管生成与转移,并通过改变癌细胞代谢降低其增殖能力。
其官能团中,尤其是4′-羟基,被认为对遗传毒性活性(基因突变、染色体畸变、DNA损伤)至关重要。白藜芦醇的抗肿瘤作用已在体内外得到验证。在MCF-7、MDA-MB-231乳腺癌细胞系及EAC小鼠模型中,其与阿霉素联用表现出协同效应:通过抑制NF-κB、COX-2、LC3、Beclin-1和Nrf2增强阿霉素细胞毒性,并通过提高BAX/BCL-2比值促进凋亡。
白藜芦醇通过调节肿瘤进展的不同方面发挥抗癌作用
Prakash V,et al.Int J Mol Sci.2024
体内研究也证明白藜芦醇可抑制肿瘤增长
体内研究亦显示白藜芦醇可抑制肿瘤体积增长并延长生存期。其还能在体外增强吉西他滨对胰腺癌(PaCa)细胞的抗肿瘤活性,并在PaCa异种移植裸鼠中提高疗效:抑制增殖、增强凋亡,阻断NF-κB激活并下调BCL-2、BCL-xL、COX-2、Cyclin D1、MMP-9和VEGF的表达;同时降低增殖标志物Ki-67水平与微血管标志物CD31密度。
▸ 抗衰老
白藜芦醇还被认为具有抗衰老并延长寿命的潜力,其机制与抗氧化、减少白蛋白尿、炎症与细胞死亡、维持骨密度、提升主动脉弹性和运动协调等作用相关。
抑制衰老相关基因表达,减少认知衰退
此外,它可抑制衰老相关基因表达,调控 cAMP–PKA–AMPK 或 PI3K 级联反应,并激活去乙酰化酶家族成员,尤以 SIRT1 为代表。该家族(人类共7个成员)通过调节应激下的细胞代谢与多种底物,参与衰老相关病理过程。白藜芦醇还能降低认知与氧化损伤(如丙二醛水平)、减少大脑皮层脂褐素积累,促进端粒酶活性与 SIRT1 表达,并下调 p53。
白藜芦醇还可延缓卵巢衰老
研究亦显示,白藜芦醇可延缓卵巢衰老。长期给药可提高衰老小鼠卵泡与卵母细胞的数量与质量,增强端粒酶活性与 SIRT1 表达并抑制端粒缩短;在低浓度(0.1μM)下还能促进胚胎细胞增殖。因此,白藜芦醇被视为预防年龄相关疾病的有前景的抗衰老候选物。
▸ 抗菌
据报道,一些真菌对白藜芦醇敏感,特别是白色念珠菌、絮状表皮癣菌、扁桃体毛癣菌、北色毛孢菌等。作用机制包括通过抑制电子传递链和 F0F1-ATP 酶来减少细胞的能量产生,通过产生 DNA-白藜芦醇-Cu(II) 复合物来破坏 DNA,通过抑制 FtsZ 基因来抑制细胞分裂,抑制生物膜的形成,调节群体传感,降低运动和毒素的产生。
白藜芦醇可增强一些抗菌药物的疗效
例如,白藜芦醇可以增强氨基糖苷类药物对革兰氏阳性病原体(金黄色葡萄球菌、表皮葡萄球菌、屎肠球菌和粪肠球菌)的活性,并增强其对铜绿假单胞菌产生的生物膜的作用。研究观察到,4′OH基团与甲氧基基团的结合增强了抗菌活性。
多项研究证实,白藜芦醇能有效抑制细菌生物膜的形成,其主要机制之一是干扰细菌的运动能力。不仅如此,白藜芦醇还表现出强大的协同作用。临床研究发现,当白藜芦醇与抗生素“粘菌素”联合使用时,能够有效对抗那些已对粘菌素产生耐药性的铜绿假单胞菌(P.aeruginosa)菌株。在小鼠感染模型中,这种联合疗法成功清除了多重耐药菌。
进一步的机制研究表明,白藜芦醇之所以能产生如此显著的效果,是因为它能破坏细菌的细胞膜结构。这种破坏导致细胞膜通透性增加,最终引发细胞内容物泄漏和细胞裂解。这暗示白藜芦醇无论是单独使用还是与传统抗生素联用,都在应对日益严峻的细菌耐药性问题上展现出巨大的潜力。
▸ 血管松弛作用
白藜芦醇通过多种机制发挥血管舒张作用
白藜芦醇的血管舒张作用涉及多种机制:抑制TxA2合成、激活Ca2+依赖性K+通道、增强一氧化氮(NO)信号并抑制血管NADH/NADPH氧化酶活性,同时上调eNOS与iNOS表达。
在主动脉环模型中,存在内皮时以去氧肾上腺素预收缩,缺失内皮时以KCl预收缩。多种拮抗剂(如吲哚美辛、亚甲蓝、sGC抑制剂、L-NAME、TEA、4-AP、氯化钡、格列本脲及普萘洛尔)均在有内皮条件下显著减弱其舒张效应,尤以吲哚美辛最明显。进一步结果显示,白藜芦醇通过减少肌浆网Ca2+释放阻断钙通道,并影响K+通道、PGI2与NO/sGC/cGMP通路,以及G蛋白偶联的β肾上腺素能和毒蕈碱受体信号。
▸ 神经保护作用
白藜芦醇的另一项重要作用是神经保护。多酚对中风、痴呆、硬化症、阿尔茨海默病和帕金森病等多种神经系统疾病具有活性,其效应与抗氧化、血管舒张和抗炎作用相关。
白藜芦醇能抑制β-淀粉样蛋白聚集,防止神经元变性
白藜芦醇还能激活SIRT1与AMPK、抑制β-淀粉样蛋白聚集;通过增加阳性酪氨酸羟化酶细胞数,防止黑质多巴胺能神经元变性,并抑制α-突触核蛋白与GRP78聚集;同时保护Na+/K+ ATP酶泵、维持CYP2d22 mRNA表达,提升乙酰胆碱酯酶、ATP及囊泡单胺转运蛋白2的表达。
在体外,白藜芦醇可缓解SH-SY5Y细胞抗氧葡萄糖剥夺引起的线粒体功能障碍:降低caspase-3/9活性,通过增强AMPK/p-AMPK恢复细胞活力,并上调Bcl-2、CREB、PGC-1α与NRF-1。
减缓阿尔茨海默病的记忆衰退,延缓多发性硬化症发病
在阿尔茨海默病(APP/PS1)小鼠中,它减缓记忆衰退(伴随突触素增加)、降低Aβ斑块负荷,提升线粒体复合物IV蛋白和SIRT1/AMPK通路活性,并上调IL-1β与Tnf mRNA,有助于减少斑块。
多发性硬化模型中,纯白藜芦醇与增强吸收制剂SRT501在高剂量下均延缓发病与神经元丢失,改善视觉功能,但未降低脊髓与视神经炎症或改变表型。在脊髓损伤大鼠中,白藜芦醇通过降低TNF-α、IL-1β并提高IL-10改善运动与炎症;同时上调Beclin-1、LC3-II及p-AMPK,抑制p-mTOR,从而促进自噬、缓解炎症并促进功能恢复。
总体而言,白藜芦醇具有显著神经保护潜力,但其疗效受疾病类型与病理机制影响。
▸ 心脏保护作用
白藜芦醇的心脏保护效应被认为源于其抗增殖、抗氧化、抗炎(降低ROS与氧化LDL)、调控多条细胞信号通路、维持血管稳态、促进血管舒张、改善内皮功能及抑制血小板聚集的综合作用。
白藜芦醇抑制心肌肥大,减少间质纤维化
在小鼠异丙肾上腺素诱导的梗死后心衰模型中,白藜芦醇可抑制心肌肥大,降低血浆BNP,增强左室收缩功能,减少间质纤维化,改善应激与存活通路,并纠正氧化应激。
长期给药于自发性与恶性高血压大鼠可降压,抑制脂质过氧化,通过直接及酶促清除活性氧改善氧化状态,增强NO释放,上调SOD、过氧化氢酶与谷胱甘肽过氧化物酶,抑制髓过氧化物酶与TGF-β活性及细胞凋亡,并改善心肌形态学改变。
减轻化疗相关心脏毒性
白藜芦醇还能减轻化疗相关心脏毒性。在埃利希氏腹水癌小鼠中,与阿霉素(15 mg/kg)联用白藜芦醇(10 mg/kg)提高存活率与平均生存期;联合治疗的心肌组织未见阿霉素单用时的肌细胞溶解与碎裂,说明白藜芦醇既增强阿霉素对肿瘤的细胞毒性,又保护心肌。其减轻阿霉素心毒的主要途径包括降低氧化应激、凋亡、自噬与药物诱导纤维化。
注:阿霉素(Doxorubicin)是一种蒽环类抗生素类抗肿瘤药物,广泛用于治疗白血病、淋巴瘤、乳腺癌、肺癌等多种恶性肿瘤。
进一步研究表明,将白藜芦醇与阿霉素共同负载于复合纳米凝胶或聚合物胶束中可增强这一心脏保护效应。总体而言,白藜芦醇的心脏保护潜力显著,值得在治疗策略中进一步开发与应用。
尽管白藜芦醇以其抗氧化、抗炎与代谢调节等潜力备受关注,但作为一种植物激素,白藜芦醇水平因食物来源、季节和批次而异。某些食物天然富含白藜芦醇,如葡萄酒、莓果等;然而,膳食来源中的白藜芦醇含量仍处于较低的范围,并且以膳食补充时也存在一些限制。
▸白藜芦醇的吸收、代谢
在讨论补充白藜芦醇面临的限制前,我们先了解白藜芦醇在人体内的吸收与代谢过程。只有在充分掌握其进入机体后的吸收途径、转运方式以及代谢转化特征的基础上,才能更清晰地认识到这些限制因素。
▸ 营养素的溶解度影响白藜芦醇的吸收
摄入白藜芦醇或其前体后会通过胃肠道传播,在肠道中,白藜芦醇与多种营养物质结合,如蛋白质,这些营养素的溶解度会影响其的吸收或消除。
白芦藜醇的代谢过程
doi: 10.3945/an.117.016568.
白藜芦醇的吸收主要通过两种机制发生:其一为跨肠上皮细胞的被动扩散;其二为载体介导的转运,即与肠膜上的特定转运蛋白(如整合素)形成复合物而被主动摄入。
进入体循环后,游离形态的白藜芦醇会与血浆中的脂蛋白和白蛋白结合,从而被输送至全身组织。然而,白藜芦醇的生物利用度极低,其根本原因在于广泛的首过效应(first-pass effect):在吸收过程中及进入肝脏后,绝大部分游离白藜芦醇会迅速被肠道和肝脏中的II相代谢酶进行生物转化,主要发生葡萄糖醛酸化(glucuronidation)和硫酸化(sulfation)反应,形成无生物活性的代谢物,从而导致血液中具有生物活性的游离白藜芦醇浓度被显著降低。
▸ 主要以葡萄糖醛酸和硫酸盐形式运输至其他组织或器官
肠细胞,也称为吸收性上皮细胞,是白藜芦醇代谢的第一个位点,在被动扩散或载体介导的转运中内化后。一旦白藜芦醇被肠细胞吸收,就像其他异生素一样,它会经历药物代谢的 II 阶段,产生极性代谢物,更容易在体内排泄。
因此,白藜芦醇的主要循环形式是葡萄糖醛酸(反式白藜芦醇-3-葡萄糖苷酸、反式白藜芦醇-4′-葡萄糖醛酸)和硫酸盐(反式白藜芦醇-3-硫酸盐、反式白藜芦醇-3,4′-二硫酸盐、反式白藜芦醇-3,5-二硫酸盐)结合代谢物。
白藜芦醇在人体胃肠道中的代谢和转化
Springer M,et al.Nutrients.2019
当白藜芦醇及其代谢物进入血液后,可与脂蛋白、血红蛋白和白蛋白等结合并被运输,随后分布至肝脏、肾脏等外周组织。
▸ 影响白藜芦醇补充效果的因素
生物利用度低
白藜芦醇在体内活性降低的主要原因是生物利用度偏低,可能源于其广泛代谢。主要代谢途径包括肝肠道中的酚基硫酸化与葡萄糖醛酸化,以及可能由肠道菌群介导的脂肪族双键氢化。多数给药剂量以代谢物形式从尿中排出,广泛硫酸化被视为生物利用度低的关键原因。
在6名志愿者中分别以口服和静脉注射评估4种C-白藜芦醇的吸收与代谢:25 mg口服剂量的吸收率≥70%,半衰期9.2±0.6小时,但血浆中未转化白藜芦醇仅<5 ng/mL。
同样,有研究在体外(人肝微粒体、人肝细胞、大鼠肝细胞)与体内(大鼠/小鼠口服或腹腔给药)考察白藜芦醇的代谢途径。各样品均未见Ⅰ期代谢物,肝微粒体中亦未检出。大鼠尿液及人、鼠肝细胞中主要代谢物为反式白藜芦醇-3-O-葡萄糖醛酸与反式白藜芦醇-3-硫酸盐,并有少量顺式代谢物。与游离体相比,这些代谢物活性常降低或改变。
综上,白藜芦醇代谢物相较游离体在体外普遍显示活性减弱或改变;但体内受再生代谢、组织分布与酶环境影响,效应可能不同,仍需进一步研究。
低水溶性
另一个问题是其水溶性低。白藜芦醇在水中的溶解度为0.05 mg/mL,这被认为是其生物利用度低的原因之一。
相比之下,其在酒精(87.98 mg/mL)和PEG400(聚乙二醇400)中的溶解度更高。不同油中,椰子油的溶解度最高。采用羟丙基-β-环糊精(HP-β-CD)和甲基化β-环糊精(RM-β-CD)制备口服与静脉制剂可提高水中溶解度,但仍难以克服低生物利用度;仅RM-β-CD口服时可提升血浆峰值浓度。
稳定性低
白藜芦醇的另一个问题是它在不同条件下的稳定性较低。研究表明其在酸性条件(pH 2–7)更稳定,尤其在pH 5–6及中性环境下,>70%可稳定超过200天;而pH升至8–10时,约两个月仅剩2%,碱性水解被认为是主要降解机制。在pH 6.8的培养基中即开始降解,至pH 7.4、37 °C时24小时内降解更明显。降解程度与温度呈正相关:冷冻可抑制反应,37 °C降解加速。
pH 6.8–8范围内降解符合一级动力学,pH 9呈现一级与零级并存,pH 10则类似自催化过程,机制与结构中OH基团解离度相关。
光稳定性同样有限。紫外辐照后,在306 nm(反式)与287 nm(顺式)处出现峰,顺式保留时间更长。在254 nm与360 nm照射下观察到反式转顺式,并出现未知产物;在阳光下曝晒30分钟,顺式变化显著,且受日照强度影响。这些结果提示反式白藜芦醇的储存与运输较为困难。
上述这些存在的问题,都会在补充白藜芦醇时产生影响,进而削弱其实际效果与总体药理潜力。
口服后,白藜芦醇在上消化道(胃和小肠)中经历广泛而动态的代谢,从而转化为更易水溶的可吸收形式。然而研究发现,白藜芦醇及其代谢物可以通过肠道微生物群在结肠中进一步代谢。
▸ 肠道微生物代谢白藜芦醇
白藜芦醇及其代谢物可在结肠中被肠道微生物群进一步代谢:已生成的代谢物可被水解再生白藜芦醇,并发生额外的还原反应。
▸ 一些肠道细菌可将白藜芦醇前体代谢为白藜芦醇,提高其生物利用度
肠道细菌可将白藜芦醇前体代谢为白藜芦醇,提高其生物利用度。具体而言,它们水解植物糖苷(如前体piceid),释放其糖苷元。婴儿双歧杆菌(Bifidobacteria infantis)和嗜酸乳杆菌(Lactobacillus acidophilus)可由白藜芦醇苷生成白藜芦醇。
相反,白藜芦醇在肠道中也可再糖基化生成白藜芦醇苷。白藜芦醇苷(piceid)及其葡萄糖醛酸结合物既可游离态吸收,也可以结合态吸收。
▸ 肠道菌群代谢产生白藜芦醇衍生物
另一方面,肠道细菌可代谢白藜芦醇及其前体,生成多种衍生物。报道最充分的是二氢白藜芦醇,可由Slackia equolifaciens和Adlercreutzia equolifaciens产生;此外还可生成两种反式白藜芦醇代谢物:3,4′-二羟基反式二苯乙烯和3,4′-二羟基联苄(lunularin)。
肠道细菌还代谢花苜蓿产生二氢芼苜蓿和二氢白藜芦醇。作为白藜芦醇,肠道细菌来源的白藜芦醇衍生物也与其葡萄糖醛酸形式偶联。
肠道微生物群对白藜芦醇的代谢
Chaplin A,et al.Nutrients.2018
此外,摄入葡萄提取物或红酒后,人血浆与尿液中二氢白藜芦醇葡萄糖醛酸的水平高于白藜芦醇葡萄糖醛酸和其葡萄糖苷。在补充白藜芦醇的大鼠中,肝脏检测到二氢白藜芦醇葡萄糖醛酸,肝脏与脂肪组织检测到其硫酸酯;且肝脏中二氢白藜芦醇硫酸酯明显高于白藜芦醇硫酸酯。上述结果强调了肠道微生物群在白藜芦醇代谢中的关键作用,尤其在大量生成特定衍生物方面。
▸ 肠道菌群衍生的白藜芦醇代谢物活性更高
口服白藜芦醇后,本体在血液和组织中含量极低,但动物与人体研究却反复观察到其抗炎、抗癌等效应。研究发现,肠道细菌会将白藜芦醇转化成二氢白藜芦醇(DHR)和lunularin(LUN),且这两类代谢物(以及它们的葡萄糖醛酸化、硫酸化结合物)在组织、消化道和体液中的含量远高于白藜芦醇本身或其结合物,并且其活性更“给力”。
注:基于粪便16S rRNA测序,lunularin生产者与拟杆菌门、放线菌门、疣微菌门丰度更高、厚壁菌门更低相关。
抗癌相关作用:LUN在肾癌(786-O、A498)和结肠癌(HCT-116、HT-29)细胞中更强地抑制增殖与克隆形成;DHR单独作用中等,但与LUN合用常表现更强抑制,提示二者可能存在协同。
抗炎作用:在巨噬细胞与TLR4通路模型中,LUN对炎症介质(如NO、SEAP)的抑制呈剂量依赖,并且普遍强于同水平白藜芦醇;DHR单独抑制较弱,但与LUN联用可进一步增强抑制效果。
值得注意的是:若用相同“摩尔浓度”比较,白藜芦醇本体在体外也能很强,但这些高剂量在体内难以达到;相反,DHR和LUN在体内“确实达到的浓度”下就能表现出更贴近实际的生物效应。
▸ 白藜芦醇改善肠道屏障
大量证据表明,白藜芦醇及其代谢物有益于肠道健康。
▸ 上调紧密连接、改善黏膜屏障
在小鼠模型中,补充白藜芦醇可上调紧密连接与黏膜屏障相关分子(ZO-1、ZO-2、Occludin、JAM-A、MUC1/2、Claudins),从而强化屏障功能;并提高空肠/回肠绒毛高度,改善肠道形态(见仔猪与高脂饮食诱导的NAFLD模型),这对营养吸收具有重要意义。
▸ 减轻肠道菌群失衡引起的内皮损伤等
肠道菌群失衡与多种慢性病相关,相关研究迅速发展。在内皮功能障碍中,NO生物利用度下降、氧化应激增强、NLRP3炎性小体活化是特征。ADMA(NOS竞争性抑制剂)升高可通过改变肠菌组成并激活肠道与海马NLRP3,加重内皮损伤与认知障碍;此时拟杆菌类增加、Anaerotruncus减少,而白藜芦醇可部分纠正这些变化。
▸ 调整肠道微生物群组成
▸ 降低致炎菌丰度,增加产短链脂肪酸益生菌
在高脂饮食诱导的非酒精性脂肪性肝病(NAFLD)小鼠中,白藜芦醇通过重塑菌群、减轻体重、改善肠屏障,并缓解胰岛素抵抗、脂质沉积、氧化应激与炎症,从而改善病情。
具体表现为:降低产脂多糖并致炎的脱硫弧菌(Desulfovibrio)与与肥胖相关的Alistipes;提高产短链脂肪酸(SCFA)的Allobaculum与Blautia,升高异丁酸与丁酸水平;增加Roseburia(有助于抗病原与抗炎)与益生菌罗伊氏乳杆菌(可产生抗菌分子);并提高Tenericutes与放线菌门成员,分别参与顽固碳源降解与抗病毒。
▸ 白藜芦醇既能抗菌,又能调整菌群结构
研究表明,补充白藜芦醇通过两种主要方式影响微生物组:一是直接抗菌,二是调节肠道菌群结构。与对照组相比,白藜芦醇处理小鼠缺乏Parabacteroides jonsonii、Alistipes putredinis和Bacteroides vulgatus。在大鼠中,白藜芦醇提高双歧杆菌与乳酸杆菌水平,降低大肠杆菌和肠杆菌水平。其抗大肠杆菌作用与抑制FtsZ表达及Z环形成(细菌分裂关键步骤)有关,显示对革兰阳性与阴性菌均具广谱活性。
肥胖常伴厚壁菌门(Firmicutes)/拟杆菌门(Bacteroidetes)比值升高,而白藜芦醇在啮齿动物中降低了该比值。Firmicutes在肥胖人群更常见;Bacteroidetes与餐后脂肪氧化相关。在人群研究中,白藜芦醇联合表没食子儿茶素-3-没食子酸酯亦影响超重男性肠道Bacteroidetes含量。
白藜芦醇对肠道微生物群组成的影响
Chaplin A,et al.Nutrients.2018
▸ 优化菌群代谢物,减少氧化三甲胺等
白藜芦醇通过富集产丁酸盐菌(如Ruminococcaceae),增加乙酸、丁酸等SCFAs水平,改善能量代谢和免疫调节。
除短链脂肪酸外,菌群还生成多种小分子。膳食胆碱、左旋肉碱和卵磷脂在肠道转为三甲胺,肝脏进一步生成氧化三甲胺(TMAO),其水平与心血管病、2型糖尿病和肥胖相关。RSV通过增加肠道拟杆菌种群可降低TMAO生成。
白藜芦醇作为一种多酚类天然化合物,不仅具有抗氧化、抗炎和代谢调节等多重生物活性,还能与肠道微生物群形成协同作用,共同影响机体健康。
其在小肠中被部分吸收后,会在结肠中进一步受到菌群的代谢转化,产生如二氢白藜芦醇(DHR)等具有更高生物活性的代谢物。这种“白藜芦醇—肠道菌群”双向作用模式,不仅使其代谢产物具备持久的生理效应,还通过重塑菌群结构、改善肠屏障功能、调节炎症反应和优化能量代谢,在肥胖、糖尿病、炎症性肠病、非酒精性脂肪肝以及心血管疾病等多种代谢与慢性病中发挥保护作用。
肠道微生物组和白藜芦醇在疾病中的协同作用
Gostimirovic M,et al.Int J Mol Sci.2023
1
改善肥胖与代谢综合征
白藜芦醇与肠道微生物群协同作用改善肥胖与代谢综合征,其核心在于同时作用于菌群结构与宿主代谢通路,从而降低全身炎症、优化能量代谢并强化肠—代谢轴的健康状态。
该协同过程既包含对白藜芦醇本身的代谢与再活化,也包含其对关键菌群与代谢物谱的定向调控,最终体现在体重、脂肪分布与代谢炎症标志物的综合改善。
▸ 下调厚壁菌门/拟杆菌门比例,增加产丁酸菌
协同作用机制方面,首先体现在菌群重塑:白藜芦醇能够显著下调与肥胖相关的厚壁菌门/拟杆菌门(F/B)比例,推动菌群向更有利于代谢健康的构成转变。
同时,促进产短链脂肪酸(SCFAs)的有益菌增殖,如Roseburia与Allobaculum,从源头提高丁酸等代谢物的生成潜力;并且抑制促炎与产内毒素菌的丰度,从而降低肠源性炎症负担与内毒素应激。这种双向调节使菌群生态趋于稳态,强化肠屏障与系统代谢的互促效应。
▸ 提升脂肪酸氧化,改善葡萄糖稳态
白藜芦醇通过激活AMPK/SIRT1信号通路,提升脂肪酸氧化效率并抑制脂肪合成相关过程,减少脂质在肝脏与内脏脂肪中的堆积。
此外,由菌群产生的关键代谢产物(以丁酸为代表)可促进肠促胰素GLP-1的分泌,继而改善胰岛素敏感性与葡萄糖稳态,形成“菌群代谢物—肠激素—宿主代谢”的有益联动。上述通路既缓解胰岛素抵抗,也有助于降低慢性低度炎症水平。
综合来看,白藜芦醇通过“菌群重塑+代谢通路调控”的协同模式,推动肥胖与代谢综合征的多维度改善,并在动物实验中获得一致性支持。
2
改善肠道炎症
白藜芦醇对炎症性肠病的潜在机制已被综述,包括强化肠屏障、抑制病原易位、改善菌群失衡、抑制TLR2/4-MyD88促炎通路、提升抗炎因子与二十烷酸等。
▸ 白藜芦醇保护结肠黏膜、降低炎症因子
研究显示,连续25天给予低剂量白藜芦醇可保护结肠黏膜、降低炎症因子,并增加乳酸杆菌与双歧杆菌、减少大肠杆菌与肠杆菌。长期(200天、饮食中0.025%)喂养小鼠降低体重丢失、疾病活动指数和组织损伤,并显著抑制IL-2、IFN-γ、GM-CSF等;菌群层面恢复α/β多样性,增加双歧杆菌,减少Dorea、Sutterella、Bilophila。
▸ 提高AKK菌丰度,提高α多样性
白藜芦醇还能恢复Akkermansia muciniphila丰度;该菌在IBD模型中下降,而补充其本身对结肠炎具保护作用。另一研究观察到补充白藜芦醇后Epsilonbacteraeota、放线菌、双歧杆菌和Rikenellaceae_RC9_gut_group上升,拟杆菌下降。白藜芦醇相关的菌群改善伴随SCFAs增加,总体而言,白藜芦醇对化学诱导的IBD具有抗炎和菌群重塑效应。
除IBD外,白藜芦醇对其他肠道炎症亦有益。多项研究表明,白藜芦醇可缓解断奶相关的氧化应激与炎症并改善菌群:以300 mg/kg(体重%)喂养28天可降低TLR4、IL-1β、TNF-α,提升小肠免疫球蛋白分泌;口服白藜芦醇抑制致病梭菌与大肠杆菌,促进乳酸杆菌与双歧杆菌增殖并提高α多样性;与相近剂量姜黄素联用保护作用更强。
白藜芦醇通过强化屏障、抗炎信号调控与菌群重塑,在多种肠道炎症中展现出保护效应。
3
缓解2型糖尿病
▸ 肠道屏障保护和协同作用机制
白藜芦醇通过上调紧密连接蛋白(如ZO-1与occludin)的表达,增强上皮屏障稳定性,减少内毒素由肠腔进入循环的机会,从而降低内毒素血症所致的代谢压力。由此可减轻慢性低度炎症对胰岛素信号通路的干扰,缓解胰岛素抵抗,并有助于维持葡萄糖稳态与代谢灵敏度的提升。
▸ 临床关联:
在糖尿病人群中,补充白藜芦醇(500 mg/天)与空腹血糖下降及胰岛素抵抗指数改善相关,提示对胰岛素敏感性的积极影响。上述代谢获益与肠道菌群多样性的提升相伴出现,表明白藜芦醇的临床效果可能部分由菌群生态改善与炎症缓解共同介导,从而在代谢管理中发挥辅助作用。
4
改善非酒精性脂肪肝
▸ 研究数据
白藜芦醇(50 mg/kg/day)显著降低小鼠肝脏甘油三酯(TG)含量和谷丙转氨酶(ALT)水平,与菌群β多样性改善相关。
▸ 作用机制
•肠道-肝脏轴调控:白藜芦醇减少产LPS的Desulfovibrio,降低门静脉LPS水平,缓解肝脏炎症。
•增加Akkermansia muciniphila,改善肠黏膜屏障,减少肝脂肪沉积。
•代谢改善:通过调节FXR/TGR5胆汁酸受体,减少肝脏脂质合成。
白藜芦醇对不同疾病状况的影响
Prakash V,et al.Int J Mol Sci.2024
5
改善心血管疾病
白藜芦醇是一种酚类化合物,已证实具有降压作用。其降低收缩压的效应与基线BMI呈正相关,尤其在高剂量(≥300 mg/d)及糖尿病人群中更显著;后续研究亦证实其对收缩压与舒张压均有益。在大鼠模型中,肾动脉狭窄与RAS激活导致肾血管性高血压和心肥大;RSV单用即可降低收缩压与全心肥大,且作用独立于卡托普利。
▸ TMAO代谢抑制
白藜芦醇通过干预肠道菌群代谢通路,抑制其将胆碱转化为三甲胺氧化物(TMAO),这一代谢产物被认为是动脉粥样硬化的重要促进因子。
与此同时,白藜芦醇能够增强胆汁酸的生物合成与循环利用,该过程依赖于FXR信号通路的激活,从而促进胆固醇代谢与排泄,间接降低TMAO的生成与血浆水平,为心血管保护提供代谢层面的支持。
▸ 抗炎作用
白藜芦醇通过调节菌群结构减少促炎菌群(如Clostridium)的丰度,并促进短链脂肪酸(SCFAs)产生菌群的生长与活性,这些有益代谢产物可改善肠道环境、抑制炎症介质释放。
白藜芦醇还能通过降低内毒素水平与缓解氧化应激,减少血管内皮细胞的炎症反应,从而改善血管功能,减轻慢性炎症对心血管系统的不良影响。
6
白藜芦醇与生活质量
除了在患病人群中表现出一定的治疗和改善效果之外,白藜芦醇在正常健康个体中同样展现出积极的生理调节功能。它不仅能够维持机体内环境的平衡,还有助于支持代谢稳定与整体健康状态的巩固。
▸ 改善睡眠质量、对记忆具有一定保护作用
在健康人群的研究中,早期动物实验与临床结果存在差异,尤其在认知、情绪和睡眠方面改善不明显。然而,较新的临床研究显示,睡前单剂量14 mg 白藜芦醇可显著改善非快速眼动睡眠质量与休息感。
日本已有含白藜芦醇(RSV)的专利产品被用于改善睡眠。针对65–93岁久坐人群的研究发现,连续90天补充RSV(1000 mg/d)可提升精神运动速度,但对整体认知无显著影响。
其他研究在老年或绝经后女性中观察到执行功能和记忆域的改善,大多在连续补充两周后出现。在细胞水平上,这可能与RSV激活多种涉及细胞凋亡、存活、突触可塑性和去乙酰化酶(SIRT)等信号通路有关。同时,RSV可减少淀粉样前体蛋白积累,促进空间记忆与海马神经发生,从而被认为在阿尔茨海默病预防中具有潜在安全性与有效性。在绝经后女性中,含RSV的膳食补充剂能缓解情绪波动与认知减退。
▸ 缓解过敏性鼻炎,改善生活质量
持续14周补充(75 mg,每天两次)改善了围绝经期女性的植物神经症状(潮热、睡眠紊乱、出汗、情绪波动),提升了生活质量。
由于白藜芦醇对雌激素受体具有亲和力,研究者曾担心其对乳腺与子宫内膜的潜在风险。然而,临床结果表明RSV摄入与乳腺癌或子宫内膜增生无关。此外,连续治疗60天后可显著减少心绞痛发作并降低硝酸甘油使用需求;在鼻喷剂形式下,RSV与羧甲基-β-葡聚糖联合可缓解过敏性鼻炎及普通感冒症状,如鼻塞、流涕、咳嗽等。
总体而言,白藜芦醇通过与肠道微生态的动态互作,构建了以代谢、免疫与信号调控为核心的系统性健康调节机制,为多疾病干预提供了新的生物学基础。
▸ 当前补充白藜芦醇存在的不足
当前补充白藜芦醇虽然在多种代谢性、炎症性及神经退行性疾病中展现出潜在的治疗价值,但其临床应用仍受到多方面限制,主要不足可总结如下:
⑴口服生物利用度低
白藜芦醇在体内易被快速代谢为硫酸或葡萄糖醛酸结合物,导致血浆中游离形式浓度极低。其吸收虽迅速,但广泛的首过代谢和肠肝循环显著限制了系统暴露水平,使实际可利用量远不足以发挥预期的生理效应。
⑵体内稳定性差与易降解性
白藜芦醇对光、热及pH敏感,暴露于空气或消化液中易发生氧化、异构化与分解反应,导致有效成分在制剂及消化过程中显著损失,影响药效持久性与安全性。
⑶剂量依赖性明显,疗效不稳定
不同研究使用的剂量差异较大(从数十毫克至上千毫克/日),但个体吸收率和响应差异显著。即使在相似剂量下,个体间因代谢状态和基因差异而表现出高度变异,造成疗效可重复性不足。
⑷与肠道微生物群相互作用复杂性高
虽然白藜芦醇通过调节菌群改善宿主代谢和免疫功能,但个体间菌群差异显著,使其协同作用难以标准化。此外,抗菌特性在高剂量下可能造成菌群失衡,其最佳调节范围仍需进一步界定。
⑸代谢产物活性复杂
白藜芦醇在肠道被转化为多种代谢物(如二氢白藜芦醇和lunularin),其生物活性虽可能更强,但动力学特征不稳定、滞留时间有限,同时其贡献比例和作用机制尚未完全阐明,增加了临床验证的复杂性。
▸ 更好地补充白藜芦醇的方法
鉴于目前白藜芦醇在补充过程中仍存在生物利用度低、稳定性差及吸收不完全等方面的限制,我们在此对相关改进策略进行了系统梳理和总结。这些方法有助于优化其吸收和代谢效率,从而实现更合理、更有效的补充应用。
①给药补充策略的优化
利用纳米颗粒封装药物是提升溶解度、稳定性和生物利用度的有效手段。通过纳米颗粒、脂质体、固体分散体、环糊精包合物、微乳及自乳化系统等递送技术,可显著提高白藜芦醇的溶解性和血浆暴露水平,优化其药代动力学特性。
②注意补充白藜芦醇的衍生物或前体物质
白藜芦醇为疏水性分子,水溶性差,口服吸收率低。通过设计可溶性衍生物或亲水性前体(如磷酸酯、葡萄糖苷、硫酸盐或甲基化衍生物),可显著提升其在胃肠中的溶解度和吸收效率。
此外,白藜芦醇易被氧化、异构化并迅速代谢为结合物,活性维持时间短。化学修饰如甲基化(如紫檀芪)或氟代、羟基位点替换可减缓代谢速度,增强稳定性和细胞膜通透性。
③利用菌群代谢促进活性转化
通过调整膳食结构、增加膳食纤维摄入或联合益生元、益生菌的干预措施,可进一步促进肠道菌群功能活性,增强其对白藜芦醇的代谢转化效率,使其生成更多高活性代谢产物。这些代谢物不仅能提升白藜芦醇的抗炎和抗氧化能力,还能延长其作用时间,从而增强整体生物效益。
④个体化肠道微生物群检测与调控
通过粪便菌群测序等手段,了解个体肠道菌群的整体结构、优势菌群和多样性情况。这有助于判断个体在白藜芦醇吸收和代谢过程中的潜在差异,因为肠道菌群在白藜芦醇的化学转化中起到双向调控作用(既可能通过代谢生成更有活性的代谢物,也可能助推白藜芦醇的降解)。
针对不同个体肠道菌群组成存在的差异,可采用更具针对性的干预策略,实现白藜芦醇与菌群间的精确协同。通过分析和识别主导代谢菌群,优化其代谢途径、增强关键酶活性,可提高白藜芦醇转化率与利用率,减少个体间响应差异,从而实现更稳定、一致和持久的疗效。
⑤联合营养素补充
将白藜芦醇与一些营养成分联合使用可以提高药物的水溶性、稳定性和生物利用度。研究报告了白藜芦醇和大豆分离蛋白的络合,可提高多酚的溶解度及其抗氧化活性。
还制备了白藜芦醇和蛋白质之间的其他复合物,提高了药物的稳定性,特别是胶原蛋白,β-乳球蛋白提高了白藜芦醇的溶解度和光稳定性,以及酪蛋白酸盐或酪蛋白酸-葡聚糖,保护药物免于异构化。
▸ 注意:白藜芦醇与药物的互作
白藜芦醇具备多种生物活性,因而在体内可能与不同类型的药物发生相互作用,影响药物的代谢、吸收或疗效。
因此,在补充白藜芦醇时应保持谨慎,尤其是与处方药或长期服药者。为便于了解和避免潜在风险,我们将常见相互作用及注意事项总结如下表:
白藜芦醇,从葡萄酒中的天然多酚,到现代科学不断揭示的“青春因子”, 它展现出显著的健康益处,包括抗氧化、抗炎、降脂、心血管保护、神经保护以及延缓衰老等多重生物活性。通过提升身体内环境的平衡,白藜芦醇为我们的健康提供了强有力的支持。
但健康从来不是依靠某一种成分的“速成”,而是身体多个系统共同协作的结果。肠道微生物群在白藜芦醇的代谢中扮演着重要角色。这些微生物不仅能够将白藜芦醇转化为更易吸收的代谢物,还能使白藜芦醇代谢物活性更高。同时白藜芦醇能够促进有益菌群的生长,调整肠道微生物群的结构,形成互利共生的良性循环。进而帮助改善健康状况,包括减轻炎症、缓解代谢障碍以及促进肠道健康。
未来,个性化健康的重要性愈发突显。随着科学的发展,我们有望根据个人的肠道微生物组特征制定更为精准的营养补充方案。这样的个性化方法不仅能提升白藜芦醇及其他营养成分的吸收和效果,还能预测和预防与健康相关的风险。这种科学与智能的健康管理方式,将使每个人的身体需求都得到满足,实现真正意义上的“懂身体”。
因此,与其追求数量的“更多”,不如追求质量上的“更懂身体”。让饮食、微生物和科学在日常生活中相互交融,通过科学的补充方式,让白藜芦醇的能量在微小与持久之间,续写身体和谐健康篇章。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Radeva L, Yoncheva K. Resveratrol-A Promising Therapeutic Agent with Problematic Properties. Pharmaceutics. 2025 Jan 19;17(1):134.
Gostimirovic M, Rajkovic J, Bukarica A, Simanovic J, Gojkovic-Bukarica L. Resveratrol and Gut Microbiota Synergy: Preventive and Therapeutic Effects. Int J Mol Sci. 2023 Dec 17;24(24):17573.
Prakash V, Bose C, Sunilkumar D, Cherian RM, Thomas SS, Nair BG. Resveratrol as a Promising Nutraceutical: Implications in Gut Microbiota Modulation, Inflammatory Disorders, and Colorectal Cancer. Int J Mol Sci. 2024 Mar 16;25(6):3370.
Yao M, Fei Y, Zhang S, Qiu B, Zhu L, Li F, Berglund B, Xiao H, Li L. Gut Microbiota Composition in Relation to the Metabolism of Oral Administrated Resveratrol. Nutrients. 2022 Feb 28;14(5):1013.
Chen X, Zhang J, Yin N, Wele P, Li F, Dave S, Lin J, Xiao H, Wu X. Resveratrol in disease prevention and health promotion: A role of the gut microbiome. Crit Rev Food Sci Nutr. 2024;64(17):5878-5895.
Salehi B, Mishra AP, Nigam M, Sener B, Kilic M, Sharifi-Rad M, Fokou PVT, Martins N, Sharifi-Rad J. Resveratrol: A Double-Edged Sword in Health Benefits. Biomedicines. 2018 Sep 9;6(3):91.
Chaplin A, Carpéné C, Mercader J. Resveratrol, Metabolic Syndrome, and Gut Microbiota. Nutrients. 2018 Nov 3;10(11):1651.
Cai TT, Ye XL, Li RR, Chen H, Wang YY, Yong HJ, Pan ML, Lu W, Tang Y, Miao H, Snijders AM, Mao JH, Liu XY, Lu YB, Ding DF. Resveratrol Modulates the Gut Microbiota and Inflammation to Protect Against Diabetic Nephropathy in Mice. Front Pharmacol. 2020 Aug 19;11:1249.
Zhang B, Xu Y, Lv H, Pang W, Wang J, Ma H, Wang S. Intestinal pharmacokinetics of resveratrol and regulatory effects of resveratrol metabolites on gut barrier and gut microbiota. Food Chem. 2021 Sep 30;357:129532.
Koushki M, Amiri-Dashatan N, Ahmadi N, Abbaszadeh HA, Rezaei-Tavirani M. Resveratrol: A miraculous natural compound for diseases treatment. Food Sci Nutr. 2018 Oct 26;6(8):2473-2490.
Thapa SB, Pandey RP, Park YI, Kyung Sohng J. Biotechnological Advances in Resveratrol Production and its Chemical Diversity. Molecules. 2019 Jul 15;24(14):2571.
Wang P, Gao J, Ke W, Wang J, Li D, Liu R, Jia Y, Wang X, Chen X, Chen F, Hu X. Resveratrol reduces obesity in high-fat diet-fed mice via modulating the composition and metabolic function of the gut microbiota. Free Radic Biol Med. 2020 Aug 20;156:83-98.
Springer M, Moco S. Resveratrol and Its Human Metabolites-Effects on Metabolic Health and Obesity. Nutrients. 2019 Jan 11;11(1):143.
Farkhondeh T, Folgado SL, Pourbagher-Shahri AM, Ashrafizadeh M, Samarghandian S. The therapeutic effect of resveratrol: Focusing on the Nrf2 signaling pathway. Biomed Pharmacother. 2020 Jul;127:110234.
Li F, Han Y, Wu X, Cao X, Gao Z, Sun Y, Wang M, Xiao H. Gut Microbiota-Derived Resveratrol Metabolites, Dihydroresveratrol and Lunularin, Significantly Contribute to the Biological Activities of Resveratrol. Front Nutr. 2022 May 11;9:912591

谷禾健康
帕金森病(PD)是全球第二常见的神经退行性疾病,预计到2050年,全球患者可能达到约1200万。传统诊断依赖运动症状评估,往往在疾病晚期才发现,因此急需可用于早期识别的生物标志物。
近年来,研究发现PD患者常有肠道症状(如便秘、肠道炎症),这些症状可能早于运动问题出现,甚至与肠道微生物组变化相关。
既往研究中,关于PD肠道微生物组的研究和小规模整合分析虽提示产短链脂肪酸菌减少等共性,但研究间差异大、缺乏在跨队列层面验证可复现的“微生物特征”并评估其诊断价值,尤其尚未系统评估机器学习模型跨研究、跨人群的可迁移性与疾病特异性。
针对上述研究空白,近日,一个由德国欧洲分子生物学实验室(EMBL)等国际顶尖机构组成的研究团队,通过对帕金森病(PD)微生物组数据进行大规模跨队列分析,建立了一套旨在提高模型稳健性、泛化能力和可复现性的最佳实践框架。其相关研究的成果发表于《Nature Communications》上,为未来的相关研究提供了清晰的路线图。
原文研究通过大规模荟萃分析和机器学习评估,回答两类关键问题:
作者的研究思路可以归纳为两个部分:
这项覆盖11国4大洲22项病例对照研究,共计4489份样本,结合机器学习的荟萃分析,得到的主要结论是:
接下来,我们深入了解该研究的方法学细节和主要结论验证过程。详细解析该研究在数据准备、特征工程、模型训练和多维度评估等关键环节上采取的具体策略和宝贵经验。
下图展示了研究中使用的22项病例对照研究概述:
16S数据集:
宏基因组数据集(SMG):
每项病例对照研究都必须≥30个样本,且元数据足够。除此之外,还纳入了多发性硬化(MS)与阿尔茨海默病(AD)的16S数据用于交叉疾病验证。
初步研究,聚焦于β多样性和批次效应评估。基于Bray-Curtis距离的冗余分析(db-RDA)与PERMANOVA(置换多元方差分析),分别在16S与SMG上评估研究来源(Study)、疾病状态(Disease)因素解释的变异性。
分析结果显示,去除批次效应后,样本未根据疾病状态明显聚类,PD与对照组仅呈现弱分离(下图c,d,灰色是对照)。研究来源解释了较大方差(下图a,b,颜色区分不同研究,形状区分疾病状态,16S:R2= 19.9%;SMG: R2=7.7%;p-value<0.001),这表明批次效应是主要变异来源。
物种分类和功能注释
统计检验应用
机器学习应用
在R包SIAMCAT的帮助下,研究人员应用了线性模型(Ridge、LASSO、Elastic Net)和非线性模型(Random Forest)。
训练前对特征数据做标准化处理,log.std或clr,筛选出至少在5%样本中检出的特征,GBM和GMM不做过滤。
训练时的特征筛选主要使用嵌套监督式特征选择,基于 Wilcoxon–Mann–Whitney 检验识别差异特征,在训练集内选择效应量最大的特征数量(如 KO 层面 ,保留范围500–4000个特征,步长500,训练多个模型,选择中位数 AUC 最优的那个模型,最终保留2500个特征用来构建最终模型)。
统一以 AUC 评估,并在 CV、CSV、LOSO 三层验证策略中对比模型的准确率与泛化性能。
PD相关的微生物组组成变化
在初步研究中发现不同研究间群落构成差异显著,疾病状态仅解释≤1%的变异,标识批次效应影响大于疾病。继续分析菌群发现,与对照组相比:
PD组中显著减少的菌群有:
PD组中显著富集的菌群有:
虽然大部分菌群在合并所有研究数据的分析基础上有显著变化(上图a),但是仍有不少菌群仅在个别单项研究中呈显著变化(上图b)。
控制协变量进行分析,发现在PD组中可能受性别、年龄或用药混杂的分类群为少数(<23%),且具有显著差异的分类群总体不受这些协变量影响,单变量方向与Ridge模型系数方向总体一致(上图c)。
PD相关的微生物功能变化(基于SMG)
与对照组相比,重点在于以下四大类的变化:
碳水化合物与复杂多糖相关功能
氨基酸与神经递质相关通路
与宿主互作和致病相关功能
外源性物质代谢相关功能
外源性物质(Xenobiotics)代谢相关功能的多条通路在PD组中富集,例如:
机器学习疾病分类性能与泛化性
比较模型AUC指标发现,单个研究内验证(CV)模型准确性高,但模型泛化性能差,跨研究(CSV)验证,普遍AUC下降。LOSO相较CSV显著提升。
研究可能影响 LOSO AUC 的因素,发现LOSO AUC在不同测试集之间存在显著差异,测试集本身解释了相当比例的方差(ICC=0.19)。LOSO AUC与训练集样本数呈正相关(p<0.01,解释约15%方差)。
寻找帕金森的通用微生物特征:分类学特征优于功能特征
在特征探索方面,研究人员发现存在一个相对“通用而精简”的肠道微生物特征子集,模型的判别能力(PD vs CTR)近似使用全部特征进行训练的模型。
在SMG数据集中使用LOSO策略,遍历训练集,筛选出绝对效应量最高且FDR校正p值<0.05的20个特征,构建模型,结果如下图a,其总体平均LOSO AUC几乎与全特征模型一致,分别为72.3%和72.4%。图b热图中的白色方块表示相应模型中未包含的物种。
同时,在SMG数据集基础上,比较了基于分类学特征(taxonomic)和功能特征(KO、KEGG module、KEGG pathway、GMM、GBM)训练的机器学习模型性能。分析结果显示基于功能特征的模型总体上表现略逊于基于分类特征构建的模型。
跨疾病验证:LOSO模型显著降低对其他神经退行性疾病的误判率
最后,研究人员又进行了外部验证,检验这些模型在多大程度上会错误地将患有其他神经退行性疾病的患者预测为PD,以阿尔茨海默病(AD)和 多发性硬化症(MS)为例。
由于其他神经退行性疾病的SMG数据稀缺,仅使用16S数据进行此项验证。使用假阳性率(FPR)评估,将AD和MS样本的FPR与PD内部对照组的10% FPR进行比较。
分析结果显示单个PD研究构建的ML模型(Single-study models)在其他神经退行性疾病上的交叉预测率差异极大,FPR从0%到近100%不等,平均FPR为35.1%,远高于预期的10% FPR水平。
使用LOSO模型时,跨疾病预测表现显著改善,平均FPR从35.1%大幅降至18.7%,18.7%的FPR仅略高于PD内部对照组的预期10% FPR,表现出较好的疾病特异性。
小 结
事实上,PD疾病与肠道菌群的相关研究不少,对比同类研究,该篇研究的优势在于:
为什么初步研究得出结论“批次效应差异大于疾病状态”,但是“多研究合并训练 + LOSO”却能提升模型泛化性能与疾病特异性?
关键在于数据层面的差异分析与机器学习分类任务的本质区别,原文中批次/研究效应在“整体群落差异”(方差、β多样性)上确实大于疾病效应,但这不等于模型“无法分类”。
微生物组分类依赖的是特定分类群的丰度模式,而非整体群落结构的相似性。
没有完美的模型,只有相对完美
原文中,单研究训练的跨研究验证(CSV)平均 AUC 约 61%,合并训练的 LOSO 提升到约 68%,但仍低于研究内 AUC(约 72%)。这说明,合并训练确实提高了泛化,但并未消除强烈的研究/批次差异,只是更好的对冲了其负面影响。
在机器学习中,泛化能力与拟合精度之间存在固有张力。合并训练实际上是在研究内高精度(可能包含过拟合)与跨研究稳定性之间找到最优平衡点。这不是缺陷,而是在真实世界复杂性面前的理性选择。
虽然也可以通过其它策略来补足缺陷,例如集成学习策略(如漏斗型、投票型模型),但是这也有损失,就是会累加错误。但在临床转化上,这种相对完美是具有实际价值的,因为临床诊断工具必须适用于不同人群,所以模型泛化性能也就很重要。
基于原文经验,利用肠道微生物组数据训练疾病预测模型的技术路线
一、 数据准备与质量控制
模型训练通常要准备数据集,建立包含训练集、验证集和独立测试集的完整数据架构。对于小样本数据集,可采用交叉验证替代独立验证集,但必须保留独立测试集用于最终性能评估。
基于原文经验,先做一些统计检验,对一些影响因子评估效应,例如批次、年龄、性别、用药、地理位置等,这种系统性的统计检验与效应量评估为后续的特征筛选和模型训练奠定了坚实的数据质量基础,确保识别的疾病关联特征具有真实的生物学意义而非技术或混淆因子的产物。
数据标准化推荐使用log变换(log.std)或中心化对数比值变换(clr),这两种方法在原文验证中均表现良好。
二、 关键特征筛选
数据集确定好后,要开始特征筛选,通常都会先基于存在与否做初步筛选,原文中的经验是保留在至少5%样本中检出的分类群,优先选择在多个研究中表现一致的特征,这是实现良好泛化性能的关键。
特征维度方面,对于高维特征空间(如KOs),建议通过嵌套监督特征选择将特征数控制在2500个左右,这在原文中获得了最佳的中位AUC(75.3%)。
三、 算法选择与训练策略
特征筛选完成后,要开始选择算法和制定训练策略,基于原文大规模比较,SMG数据优选Ridge回归或LASSO,16S数据可选择Random Forest,但为保证可比性,建议统一使用Ridge回归。
训练策略推荐单研究内训练+多研究合并训练,前者适用于初步模型构建,可获得较高的内部准确性(平均AUC 71.9%),后者显著提升泛化能力(LOSO平均AUC 68%)。可能有同学会疑惑为什么会用回归模型,原文使用的是SIAMCAT包的LibLinear,这是一个专门用于大规模线性分类的库,Ridge和LASSO在其中是作为线性分类器实现的,不是传统的回归模型,它们通过线性决策边界进行二分类预测。
四、 多层次性能评估
最后是选择评估模型性能的方法和指标。原文采用多层次性能评估:
五、 研究规模适配策略
应根据研究的具体规模调整策略重点:
主要参考文献
Romano, S., Wirbel, J., Ansorge, R. et al. Machine learning-based meta-analysis reveals gut microbiome alterations associated with Parkinson’s disease. Nat Commun 16, 4227 (2025).

谷禾健康
您和身边人是否有过这样的经历:一场成功的手术结束后,身体的伤口在一天天愈合,但一些莫名的困扰却悄然而至。
明明伤口恢复得不错,
为什么总是感觉浑身乏力、精神萎靡?
为什么会食欲不振,
甚至出现腹胀、便秘等消化问题?
有时还会感觉思维变得迟钝
记忆力下降,像是隔了一层脑雾,
情绪也莫名地低落、烦躁…
大多数时候,我们习惯将这些问题归咎于手术创伤本身,认为是身体康复过程中的元气大伤。但如果这些症状持续存在,或许我们应当考虑围术期中另一个关键却常被忽视的因素——麻醉。
在现代医学中,麻醉是保障外科手术安全与舒适的核心环节。然而,临床实践中,麻醉医生常常面临诸多挑战:患者对麻醉药物的反应存在显著个体差异,术后认知功能障碍(POCD)或谵妄的发生率居高不下,尤其在老年人中,围手术期、感染、器官功能损伤等并发症的管理日益复杂。
近年来,随着多组学技术的飞速发展,我们了解了一个庞大而复杂的“器官”——肠道菌群。肠道菌群通过肠-脑轴、肠-肝轴等多维网络,深度参与宿主代谢、免疫与神经调节。这种动态平衡一旦打破,便可能触发从代谢综合征到神经退行性疾病的连锁反应。
麻醉在药效动力学和药代动力学方面可能受到肠道菌群的影响。
例如,菌群通过调控肝脏CYP3A4酶活性影响麻醉药物清除效率,菌群代谢产物短链脂肪酸可增强七氟烷的麻醉敏感性,而菌群失调则可能通过激活TLR4/NF-κB通路加剧术后神经炎症。
反过来,麻醉药物也会影响菌群稳态。丙泊酚(一种强效的静脉注射麻醉药)可短暂抑制乳杆菌增殖,七氟烷(现代常用的吸入性全身麻醉药)暴露甚至可能导致Akkermansia菌丰度下降,形成“菌群紊乱-炎症加重-药物代谢异常”的恶性循环。
本文基于最新的科学文献,探讨肠道菌群与麻醉药物之间千丝万缕的联系及相关信号机制,总结了当前研究进展,了解其如何通过“肠-脑轴”“肠-肝轴”这些复杂网络影响围手术期管理,展望基于菌群调控的精准麻醉新未来。
我们对麻醉的理解,是否还停留在“睡一觉,手术就做完了”的层面?本章节将带您深入了解现代麻醉学的复杂性与精妙之处。
麻醉是现代医学史上最伟大的进步之一,它通过可逆性地阻断神经信号,使患者在接受可能带来剧烈疼痛的治疗或手术时,免于痛苦和创伤,是外科手术得以实施的根本保障。
麻醉不仅仅是让患者进入睡眠状态,更是一门精密的医学科学。它包含了意识调控、疼痛管理、生命体征维持等多个维度。现代麻醉医师需要精确计算药物剂量,实时监测患者状态,并根据手术进程动态调整麻醉深度。
麻醉过程中,医师需要平衡多种看似矛盾的目标:既要确保患者完全感觉不到疼痛,又要避免麻醉药物对身体各系统产生过度抑制;既要维持适当的肌肉松弛度便于手术操作,又要保证基本的生理功能正常运转。
麻醉的分类:从局部到全身
根据作用范围和对意识的影响,麻醉主要可分为三大类,每种类型服务于不同的临床目的,选择哪种麻醉方式,需要综合考虑手术类型、患者身体状况、既往病史等多种因素。
◕ 全身麻醉(General Anesthesia)
这是一种诱导可逆性、覆盖全身的意识和感觉丧失的状态。它通常用于心脏直视手术、脑部手术等大型复杂手术,要求患者完全无意识。
全身麻醉通常联合使用多种药物,包括:
此外,常辅以芬太尼等镇痛药和琥珀胆碱等肌肉松弛剂,以达到理想的手术条件。
◑ 区域麻醉(Regional Anesthesia)
在保持患者清醒的同时,阻断身体特定大范围区域(如肢体、下腹部或盆腔)的感觉。这种方式创伤小于全麻,术后恢复更快。
最常见的两种形式是:
◔ 局部麻醉(Local Anesthesia)
作用范围最局限,仅麻醉身体一个微小、特定的区域,适用于各种小型手术和操作,如牙科治疗、痣切除或小型伤口缝合。
常用的局麻药有利多卡因、布比卡因等,通过皮下注射或局部涂抹乳膏给药。
麻醉药物如何发挥作用?
不同类型的麻醉药通过不同的药理机制来阻断神经信号:
全身麻醉药主要作用于中枢神经系统。它们通过增强大脑中主要的抑制性神经递质——γ-氨基丁酸(GABA)的信号通路,同时减弱兴奋性神经递质(如谷氨酸)的信号,最终导致意识的全面抑制和丧失。
局部和区域麻醉药的核心作用靶点是神经细胞膜上的电压门控钠离子通道(VGSCs)。这些药物能够可逆性地与通道结合,阻止钠离子在神经兴奋时大量内流,从而有效抑制了神经冲动的产生和传导。这样一来,来自手术区域的疼痛信号便无法上传至大脑,从而实现镇痛效果。
然而,值得注意的是,这些经典药理作用的最终效果,包括麻醉深度、持续时间以及个体敏感性,并非一成不变。新兴研究表明,宿主内在的因素,特别是肠道微生物群,正通过复杂的信号网络对这些中枢及外周的药物靶点产生着远距离的调控作用。 这种先前被忽视的联系,为理解麻醉药物的个体化差异提供了全新视角,其具体机制将在后续章节中深入探讨。
麻醉药物的代谢及安全性差异
临床上常用的局部麻醉药根据其化学结构可分为两大类,它们的代谢途径截然不同,这也与药物的安全性和过敏风险直接相关:
氨基酰胺类(Amino amides)
氨基酯类(Amino esters)
以上我们对麻醉的分类、机制、代谢等有了基本的了解。然而,一个核心问题依然存在:为何不同患者对相同麻醉方案的反应不一样?为何有些患者术后恢复良好,而另一些则饱受认知功能障碍的困扰?
除了年龄、性别、体重、肝肾功能、基础疾病等已知因素外,是否存在一个更深层次、更具可塑性的变量在其中扮演着关键角色?这一关键科学问题的答案,隐藏在“肠-脑轴”这一复杂而精密的信号网络之中。
接下来,我们将聚焦肠-脑轴,解析肠道菌群如何通过迷走神经、神经内分泌、免疫调节及代谢产物介导等多维途径,深度参与麻醉反应的调控机制。
肠-脑轴研究的核心,在于阐明肠道菌群与中枢神经系统之间的双向信息传递网络。这个复杂的系统主要包括四大核心通路:
这些通路共同构成了菌群影响麻醉效果和术后神经系统并发症的生理基础。
➤ 短链脂肪酸:麻醉敏感性的调节器
作为菌群发酵膳食纤维的主要产物,短链脂肪酸可通过迷走神经或血脑屏障进入中枢,影响麻醉药物的镇静深度与作用时长。
微生物的代谢产物是构成肠-脑轴功能的主要贡献者。其中,短链脂肪酸(SCFAs)是肠道细菌分解膳食纤维等碳水化合物后的主要产物,能够作为信号,直接作用于迷走神经的传入末梢。
– 短链脂肪酸如何“敲开”大脑之门?
短链脂肪酸并不需要自己“跑”到大脑,而是选择了一条更高效的通信线路——迷走神经,这是连接肠道和脑干的一条信息高速公路。
在小鼠研究模型中,短链脂肪酸通过两种主要方式激活迷走神经传入神经元:
一旦迷走神经被激活,这些信号沿迷走神经传递到大脑脑干中的一个关键“中继站”——孤束核(NTS),信号在这里被整合并进一步传递,进而调节自主神经反射和中枢神经系统活动。
这与麻醉有什么关系? 这一过程恰好能直接调节与麻醉密切相关的三大核心领域:镇静效果、疼痛感知、术后认知功能。
– 从动物到人的证据链
例如,研究发现由Roseburia intestinalis产生的丁酸,可以通过G蛋白偶联受体41(GPR41)激活迷走神经,来调控大脑中与疼痛相关的神经回路,从而在动物模型中起到了镇痛效果。
这不仅限于动物。一项包含31名参与者的人群研究甚至提示,女性和男性之间疼痛感的差异,可能部分由“肠道菌群-短链脂肪酸-皮质醇”轴的差异所介导。
注:目前关于短链脂肪酸调节麻醉机制的证据主要来自动物模型。
肠道菌群对麻醉下肠道-肝脏-大脑轴的调节机制
doi: 10.3389/fcimb.2025.1626585
破坏肠道屏障完整性可能促进 LPS 的易位并诱导微生物群失调。这会触发双重通路反应:
相反,微生物代谢物(如 SCFAs、IPA)在两个轴上均发挥保护作用。
➤ 色氨酸代谢物:从疼痛感知到术后情绪的平衡
肠道菌群参与色氨酸的分解代谢,生成5-羟色胺前体、犬尿氨酸等活性物质。这些代谢物不仅通过调节中枢神经递质影响麻醉后的疼痛阈值,还可能关联术后焦虑、谵妄等情绪障碍。
微生物来源的色氨酸代谢物(如吲哚-3-丙酸,IPA)能够调节5-羟色胺(5-HT)的合成,还能有效抑制大脑中的促炎细胞因子(如IL-6和IL-1β)的释放。
这种保护作用是有临床数据支持的。一项前瞻性观察队列研究发现,患者术前血浆中吲哚-3-丙酸(IPA)的基线水平与术后谵妄的发生呈显著负相关,也就是说,患者在手术前血液中的IPA水平越高,术后发生谵妄的风险就越低。这一关系在临床前小鼠模型中也得到了验证,IPA的这种保护作用,部分是IPA通过激活了海马体中的一种蛋白(PGC-1α)来实现的。
然而问题在于,麻醉和手术本身恰恰可能是这个保护通路的破坏者。
麻醉/手术可导致肠道菌群多样性下降,进而可能扰乱色氨酸代谢通路。已有研究表明,术后小鼠粪便中的色氨酸代谢物水平发生显著变化,包括5-HT前体和犬尿氨酸等关键代谢物的异常。也就是说这条“肠-脑”通讯线路因手术而陷入了紊乱。
当肠道屏障因麻醉或手术受损时,革兰氏阴性菌释放的LPS易位入血,触发全身炎症级联反应。LPS通过激活脑内TLR4-NF-κB通路,诱导IL-1β等炎症因子释放,直接损伤海马体神经元,成为术后认知功能障碍的潜在元凶。
脂多糖(LPS)是存在于大肠杆菌等细菌外膜的一种成分。它会损害肠道屏障,导致菌群失调,并让内毒素等有害物质进入血液。这个过程被称为肠漏,会触发全身性的炎症反应。随后,这种炎症信号会进一步削弱血脑屏障的保护功能,最终将炎症传递到中枢神经系统。
LPS进入大脑后,主要通过两种方式搞破坏:
直接点燃炎症风暴
在脑部的海马体区域,LPS会激活大脑里的一个炎症开关,也就是TLR4-NF-κB通路,这会进一步上调NLRP3炎症小体,导致IL-1β等多种炎症因子的释放。
研究人员认为,这正是很多人在麻醉手术后感觉脑子不清醒、认知能力下降的核心原因。不过,电针疗法正是通过抑制此通路来改善认知功能,并减少神经元损伤的。
削弱大脑的防御力
LPS诱导的神经炎症还与氧化应激失衡有关。大脑本身有一套抗氧化防御系统,由Nrf2蛋白负责,用来抵抗损伤。但研究发现,神经炎症会伴随着海马体中Nrf2表达的下降,从而加剧氧化损伤。
注:Nrf2是调节身体抗氧化能力的关键转录因子。
针对这一点,衣康酸可以重新启动这套防御系统,也就是可以通过恢复Nrf2的活性并抑制炎症,来缓解麻醉和手术后的认知障碍。
此外,肠道还有一个热线电话能直接打给大脑,那就是迷走神经。肠道的炎症信号可以通过这条神经专线,把坏消息直接传递给大脑,同样能引发大脑的炎症。研究发现,有一种药物(重组人脑钠肽)可以切断这条神经信号,从而保护大脑免受炎症和认知功能障碍的困扰。
肠道菌群与下丘脑-垂体-肾上腺(HPA)轴之间存在一个动态的相互作用网络,当这个网络失衡时,便构成了麻醉相关神经并发症的病理基础之一。
具体来说,由菌群产生的短链脂肪酸和色氨酸代谢物,能够直接调节HPA轴的活性,从而影响皮质酮或皮质醇等压力激素的分泌水平。
然而,麻醉和手术带来的巨大压力,常常会让这个HPA轴反应过度,进入一种红色警戒状态。这时候,一些特定的好细菌(如乳杆菌属)就能站出来安抚,可以抑制促肾上腺皮质激素释放激素(CRH)的产生,让它冷静下来,从而缓解这种过度反应。
短链脂肪酸还能够穿透血脑屏障,直接在大脑中发挥作用。它们通过抑制组蛋白脱乙酰酶(HDAC),降低HPA轴对压力的敏感性,进而改善麻醉后的神经炎症反应。也就是说进入大脑后,短链脂肪酸会帮助压力指挥中心进行降噪处理,让其对压力的敏感度降低。这样一来,手术后的脑部炎症反应就会减轻。
此外,另一种关键细菌 Akkermansia muciniphila 也被证实,能通过激活过氧化物酶体增殖物激活受体γ(PPAR-γ)通路来调节HPA轴的功能。
肠-肝轴是一个整合了胃肠道与肝脏之间解剖、代谢和免疫相互作用的双向交流系统。它通过胆汁酸的肠肝循环、微生物代谢物信号和肠道屏障完整性等机制,调控着营养物质处理、解毒和免疫稳态。对于麻醉学而言,这一轴线直接关系到麻醉药物的代谢和清除,是解释患者个体差异的关键。
肠-肝轴:肠道如何影响麻醉药的代谢
肝脏是分解麻醉药物的主要器官
像芬太尼、丙泊酚等常用麻醉药,都需要在肝脏中经过特定的酶(主要是细胞色素P450家族,如CYP3A4和CYP2B6)进行代谢分解。而肠道菌群,正是这个过程的一个重要的远程调控者。
肠道菌群主要通过以下几种方式影响肝脏的药物代谢:
有益代谢物的调控
健康菌群产生的短链脂肪酸可以进入肝脏,作为信号分子调节基因表达,从而增强某些关键药物代谢酶(如CYP3A4)的活性,帮助身体更有效地处理麻醉药。
有害物质的干扰
当肠道菌群失调时,肠漏风险增加,细菌的内毒素(LPS)等有害物质会进入肝脏。这会引发肝脏的炎症反应,并反过来抑制药物代谢酶的活性,导致麻醉药代谢变慢。
通过胆汁酸进行信号传导
肠道菌群能够修饰和改造胆汁酸。这些被改造后的胆汁酸,会作为信号分子,调节肝脏中与药物代谢相关的受体(如FXR和PXR)。这个过程能直接改变麻醉药在体内的代谢速率和清除效率。
这种相互作用是双向的。
因此,对于肝功能不佳的患者,麻醉药的选择和剂量需要格外谨慎。
个体差异:饮食塑造了不同肠道菌群
肠道菌群对麻醉药物代谢的影响存在巨大的个体差异,这很大程度上源于饮食习惯塑造了我们独特的肠道微生态。
综上所述,肠道微生态是影响麻醉药代动力学和术后结果的关键上游因素。为了完整地理解“菌群-麻醉”的关联,接下来章节我们来看反馈回路的另一端:麻醉药物和手术应激,将如何重塑肠道菌群的结构与功能。
麻醉药物对肠道菌群的塑造
麻醉药物不仅作用于中枢神经系统,还会直接或间接地影响肠道微生态。它们通过改变肠道内的酸碱度、氧气含量和粘液分泌等方式,可能导致菌群多样性下降、促炎细菌增殖和代谢紊乱。这些肠道内的变化,继而会通过免疫、神经及内分泌途径,反过来影响大脑的功能。
静脉麻醉药:以丙泊酚为例
动物实验表明,丙泊酚具有一定的抗菌效果,可能是通过破坏细菌的细胞膜来抑制其生长。
例如,在大鼠注射丙泊酚后,一些有益菌(如普雷沃菌和乳杆菌)的数量会在短时间内下降,但通常在大约两周后逐渐恢复。
吸入性麻醉药:影响更为显著
相比之下,吸入性麻醉药对肠道菌群的影响似乎更为突出。
➯ 七氟烷
研究发现,重复使用七氟烷麻醉,会显著降低肠道菌群的整体多样性。具体表现为,有益菌Akkermansia(Akk菌)数量减少,而一些潜在的致病菌(如链球菌)增多。这种菌群失衡在新生儿和老年人等脆弱群体中影响更大,与术后认知障碍和谵妄风险增加有关。
作用机制:
七氟烷主要通过两条途径制造麻烦:
➯ 异氟烷
另一种常用的吸入麻醉药异氟烷,同样会降低菌群多样性。它会导致肠道内不同菌门(如厚壁菌门增多、拟杆菌门减少)的比例失衡。这种变化与大脑内炎症因子(如IL-1β和IL-6)的积累密切相关,而这些炎症因子正是导致术后谵妄和认知障碍的关键驱动因素。
阿片类药物:对肠道菌群的快速冲击
阿片类药物(如吗啡、芬太尼)对肠道菌群的冲击是快速而剧烈的。
由于肠道本身就分布着大量阿片受体,这类药物可以直接作用于肠道,带来一系列负面影响:
这些因素共同作用,导致菌群多样性急剧下降,有益的产丁酸菌(如 Roseburia)减少,参与胆汁酸代谢的 Bilophila 也减少,而与炎症相关的细菌(如 拟杆菌属)可能占据主导。这种由药物引起的有害代谢物积累和神经炎症会形成一个难以打破的恶性循环,并且即便在停药后,菌群也往往难以完全恢复到初始状态。
麻醉药物对肠道菌群的影响
doi: 10.3389/fcimb.2025.1626585
长期麻醉暴露的潜在风险
在重症监护室(ICU)中,患者常常需要长时间使用镇静药物(如持续输注咪达唑仑)来维持治疗。然而,这种长期的麻醉暴露会带来一个潜在风险:肠道菌群失调,进而可能加剧肠道屏障的通透性(即肠漏)和全身性的炎症反应。
不同菌群特征与预后关联
一些临床研究为我们揭示了菌群与患者预后之间的密切联系:
一项针对61名ICU成年患者的前瞻性研究发现,最终存活下来的患者,其肠道中双歧杆菌属的丰度显著高于在住院期间不幸去世的患者。这暗示着,这种有益菌可能与更好的生存机会相关。
另一项规模更大的研究将目光投向了577名ICU中的早产儿。研究人员通过测序对他们的肠道菌群进行聚类分析,发现了不同菌群模式与婴儿健康状况的关联:
这些发现意味着,对微生物群落进行特定的聚类分析,未来可能成为一种评估患者状况的非侵入性生物标志物。
加剧菌群紊乱的ICU环境因素
ICU中的其他治疗因素也加剧了这一问题。长期镇静常导致胃肠动力减弱和肠内营养摄入不足,而营养不良本身就与高风险的菌群模式(如上述由葡萄球菌主导的聚类5)显著相关。同时,广谱抗生素的普遍使用和较长的治疗周期,也进一步加剧了菌群的紊乱。
肠道微生物群与术后疼痛
我们常以为疼痛源于受伤的部位,近年来,科学家发现,肠道菌群可能是术后疼痛管理中一个不容忽视的一环。
事实上,肠道菌群与疼痛之间的关系已成为生物医学领域的研究热点,其研究涵盖了内脏痛、神经痛、炎症性疼痛等多种疼痛类型,并涉及复杂的调控机制。
在术后疼痛方面,肠道菌群主要通过以下途径参与疼痛的发生与调节:
研究证据日益增多。例如,术前使用抗生素导致的菌群失调,会增加患者的内脏疼痛敏感性,而当菌群恢复平衡后,这种疼痛敏感性也随之逆转。
更有趣的是,一项研究揭示,术前的菌群特征甚至可以用来预测慢性术后疼痛的发生风险。该研究发现,在乳腺癌患者中,术前某些特定细菌丰度的减少,可能与她们痛觉敏感性的增加有关。
将“慢性术后疼痛患者的菌群”通过粪菌移植技术转移给无菌小鼠。结果发现:
这也就是说,不健康的菌群确实可以直接“传播”疼痛。
基于这些发现,一些潜在的干预方法正在被探索。例如,生长抑素这类药物,可能正是通过调节术后肠道菌群的构成(如减少肠杆菌科 Enterobacteriaceae的数量),来帮助降低胰腺瘘等并发症相关疼痛的风险。
总而言之,尽管菌群与术后疼痛的关联已基本明确,但其精确的因果机制以及如何据此制定个体化的干预方案,仍需在不同类型的手术和更广泛的患者人群中进行深入的探索和验证。
短链脂肪酸
短链脂肪酸在麻醉中有两大潜在应用:辅助麻醉和辅助术后恢复。
◖ 辅助麻醉
某些SCFAs或其代谢产物自身就具有类似麻醉的效果。
乙酸:能增强七氟烷的麻醉效果,从而可能降低其所需浓度。
异戊酸:在动物模型中被发现具有直接的麻醉活性。
丙酸和甲基丙二酸:虽然单独使用没有麻醉效果,但它们能显著增强异氟烷的效力,有潜力作为麻醉辅助剂。
β-羟基丁酸:这是一种酮体,结构与短链脂肪酸相似。它能通过增强GABA-A受体的功能来产生麻醉效果,这或许能解释为何在酮症状态下,人有时会出现意识抑制。
◗ 辅助术后恢复
研究表明,通过饮食或电针等方式调节肠道菌群,补充短链脂肪酸,有助于减少麻醉后的神经炎症和认知障碍,这一作用在老年或高风险患者中尤为重要。
胆汁酸
胆汁酸与麻醉的关联主要体现在三个方面:
首先,对于存在胆汁酸分泌障碍(如某些遗传性肝病)的患者,全身麻醉会加重其代谢负担,需要谨慎选择方案。
其次,胆酸及其衍生物被发现能增强利多卡因等药物的局部麻醉效果。
最后,在某些高风险患者无法耐受手术时,压电碎石术结合口服胆汁酸(如熊去氧胆酸)是一种安全且有效的选择。
研究表明,69%的单发结石患者在接受无麻醉的碎石治疗后能够实现胆囊完全清除。
色氨酸代谢物
这也是一个极具潜力的干预靶点。例如,研究发现电针能够通过增加肠道中一种产生吲哚丙酸(IPA)的细菌数量,来修复肠-脑轴功能,从而减轻术后认知障碍和神经炎症。
未来,直接补充IPA或抑制其代谢通路中的关键酶(如IDO1),可能成为预防和治疗术后谵妄的新策略。
抗生素:一把双刃剑
虽然围手术期使用抗生素是为了预防感染,但它们也可能增加风险。
因此,临床上需要仔细权衡患者的过敏史、手术类型和麻醉方案,来决定抗生素的使用。
益生菌:平衡菌群
在术前或术后使用益生菌,或许能通过调节肠道菌群来缓解麻醉和手术带来的炎症风暴。
一项荟萃分析研究分析了术后首次排气时间、首次排便时间、首次固体饮食天数、腹胀发生率和术后肠梗阻发生率,发现益生菌补充剂降低了腹胀发生率(RR,0.62)和术后肠梗阻(RR,0.47)。
在另一项针对 100 名慢传输便秘成年人的随机、双盲、安慰剂对照临床研究中,合生元补充剂增加了排便频率,改善了粪便性状,缩短了肠道传输时间,改善了肠道动力,并缓解了便秘。
乳杆菌GG 促进排气,并缓解了接受幽门保留胰十二指肠切除术患者的首次术后排便。
不过,目前益生菌在麻醉辅助治疗方面的人体研究结论尚不一致。不同的菌株、剂量和给药时机都会影响效果,有必要结合个性化策略来取得最佳效果。
靶向调节肠道菌群以实现精准麻醉:方法与未来策略
doi: 10.3389/fcimb.2025.1626585
粪菌移植(FMT)是一种将健康人粪便中的功能菌群移植到患者肠道内,以重建菌群平衡的治疗方法。它在治疗复发性艰难梭菌感染方面已取得巨大成功。
在麻醉领域的应用尚处于起步阶段,但已展现出巨大潜力。
改善认知
动物研究表明,对于因麻醉导致菌群失调和认知障碍的小鼠,通过FMT移植健康菌群后,其认知功能得到了缓解。这提示FMT或许能成为治疗麻醉相关神经毒性的一种新方法。
解决并发症
在ICU中,抗生素相关性腹泻是常见难题。一项临床试验证明,FMT能够通过恢复患者肠道菌群的多样性,有效加速腹泻的缓解。
安全性:
尽管前景看好,FMT在麻醉患者中的应用仍需高度关注安全性。首先,在镇静或麻醉状态下进行操作,需谨防误吸等风险。其次,对于免疫功能低下的ICU患者,FMT可能导致细菌易位或引发全身性炎症。因此,对供体粪便进行严格筛查和长期冷冻追溯至关重要。
总的来说,需要通过更多临床试验系统地评估 FMT在麻醉人群中的有效性和安全性,尤其是在预防和治疗多次麻醉后认知障碍方面的价值,同时,也需要优化供体选择、制备方法和给药时机等围手术期FMT的实施标准。
肠道菌群与麻醉相互作用的研究已取得显著进展,揭示了“肠-脑-肝轴”在调节麻醉效果和术后并发症中的巨大潜力,但从实验室的发现到真正的临床应用,仍有一段路要走。
当前的瓶颈与挑战
动物实验 ≠ 人体实验
那些在动物身上观察到的机制,在人体内是否以同样的方式运作、作用强度如何、靶点是否一致,这些关键问题仍需在临床人群中直接验证。
个体差异
每个人的年龄、遗传背景、饮食习惯、基础疾病和用药情况都不同,这些因素如何影响菌群与麻醉的相互作用,目前没有系统整合分析。
样本量不大
目前的临床研究普遍存在样本量小、观察期短的问题,且大多集中在特定人群(如ICU患者),且不同研究的结果难以比较。
突破口与未来方向
从基础到临床,验证核心代谢物
设计小规模的早期临床试验,直接评估某些关键微生物代谢物(如特定的短链脂肪酸SCFAs、吲哚丙酸IPA)作为麻醉辅助用药的安全性、药代动力学和初步效果,并验证它们是否能精准抵达目标组织并激活预期的信号通路。
构建精准预测模型
将常规化的围手术期肠道菌群检测纳入大规模、前瞻性的队列研究中。通过系统收集患者的多维度数据(包括术前菌群构成、血液代谢物、宿主基因等),并利用机器学习算法(如XGBoost和随机森林),从海量数据中挖掘出与麻醉敏感性及术后认知障碍高度相关的菌群特征谱,最终构建能够辅助临床决策的智能预测模型。
大规模临床试验证实干预效果
针对老年患者等高风险人群,开展多中心、大样本、安慰剂对照的随机临床试验(RCT)。在试验中,通过肠道菌群检测来动态监测干预前后的变化,从而明确益生菌等手段的最佳菌株组合、剂量、给药时机和疗程,并客观评估其真实效果。
开发智能靶向干预技术,实现精准调控
为了提高效率并减少副作用,需要开发更精准的干预工具。例如:
设计能够智能导航的纳米载体,将丁酸等有益物质的前体药物精准送达肠道。
利用CRISPR-Cas9技术改造噬菌体,如同生物导弹一般,精准剪断围手术期有害细菌的特定功能基因,从而减少毒性代谢产物的生成。
建立标准与指南,指导临床实践
系统性地建立微生物群-麻醉药物相互作用数据库。基于不断积累的证据,逐步制定关于围手术期肠道菌群检测以及后续益生菌、益生元或特定饮食干预的专家共识和临床指南,为临床实践提供标准化流程。
通过“肠-肝-脑轴”等多维互动机制,肠道菌群不仅参与麻醉药物的代谢调控,还通过其代谢产物直接影响中枢神经系统的功能状态,从而调节麻醉和术后恢复过程。同时,麻醉过程本身也对肠道菌群产生动态的重塑效应。这种双向互动关系提示我们,未来的麻醉管理可以将维持微生物稳态纳入考量。
随着微生物学与麻醉药理学的深度融合,我们可以看到其临床应用前景十分广阔。
术前:
通过肠道菌群检测了解患者术前肠道菌群特征谱,包括菌群多样性、核心菌属(如拟杆菌属、普雷沃氏菌属)及关键代谢产物(如短链脂肪酸SCFAs、胆汁酸)水平。可制定定制化干预方案包括饮食、补充剂等方式优化菌群结构,提高患者对麻醉药物的耐受性,降低术中药物不良反应风险。
术中:
可以利用噬菌体等精准技术,精确抑制特定有害菌的代谢通路,从而降低麻醉药物可能带来的肝毒性。
术后:
基于术后动态菌群监测,构建菌群生物标志物预测模型,通过机器学习算法筛选与谵妄、感染等并发症高度相关的菌群特征(如Akkermansia菌丰度降低、肠球菌属富集)及代谢物信号(如色氨酸代谢物IPA减少)。一旦监测到高风险信号,可启动一些干预措施如粪菌移植或补充特定代谢物,主动逆转菌群失衡,降低并发症发生率。
术后肠道功能的早期恢复不仅可以改善患者的临床效果和生活质量,特别是对于接受胃肠道手术的患者,还可以缩短住院时间,提高床位周转率,并节约医疗资源。
该领域的探索可能将围手术期医学带入菌群靶向治疗的新时代。
从实验室到临床的进展,仍需突破跨学科技术瓶颈:
随着肠道菌群检测技术的应用拓展,对微生物、宿主和药物三方交互的深入了解,可以推动“微生物检测辅助麻醉”模式的转化,最终提高手术安全性和患者的长期预后,为个体化麻醉管理和术后康复开辟创新的道路。
展望未来,这一领域的突破不仅依赖于持续的基础研究,更需要产学研的紧密协作,以加速科研成果向临床应用的转化。
在谷禾开放基金支持的研究方向中,也有关于“肠道菌群与老年患者骨科手术术后谵妄相关性及干预研究”等围手术期关键问题,旨在加速探索肠道菌群在围手术期神经认知功能障碍(如谵妄、POCD)中的作用机制及干预策略。
我们相信,随着研究的不断深入,一个全新的麻醉管理时代即将到来。欢迎有志于此的临床医生、科研人员及研究团队,与谷禾携手合作,共同探索肠道微生态在围手术期医学中的巨大潜力,推动菌群靶向干预策略的临床转化,最终为改善患者的术后康复与长期健康贡献力量。
主要参考文献
Zhang R, Li L, Yu G, Li Y, Wei K, Lin L, Ye Y. Interaction between gut microbiota and anesthesia: mechanism exploration and translation challenges focusing on the gut-brain-liver axis. Front Cell Infect Microbiol. 2025 Sep 8;15:1626585.
Garmon EH, Hendrix JM, Huecker MR. Topical, Local, and Regional Anesthesia and Anesthetics. [Updated 2025 Feb 21]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-.
Ma, T., Xue, X., Tian, H. et al. Effect of the gut microbiota and their metabolites on postoperative intestinal motility and its underlying mechanisms. J Transl Med 21, 349 (2023).
Majumdar JR, Forrester JW, Haviland KS, Massaro CD, Welch JC, Kelleher DC. PrEP-ared for Surgery? A Comprehensive Narrative Review of Perioperative Recommendations for Anesthesia Providers. AANA J. 2025 Oct 1;93(5):353-362.
Claesen J. L. A., Koomen E., Schene I. F., Jans J. J. M., Mast N., Pikuleva I. A., et al. (2020). Misdiagnosis of CTX due to propofol: The interference of total intravenous propofol anaesthesia with bile acid profiling. J. Inherited Metab. Dis. 43, 843–851
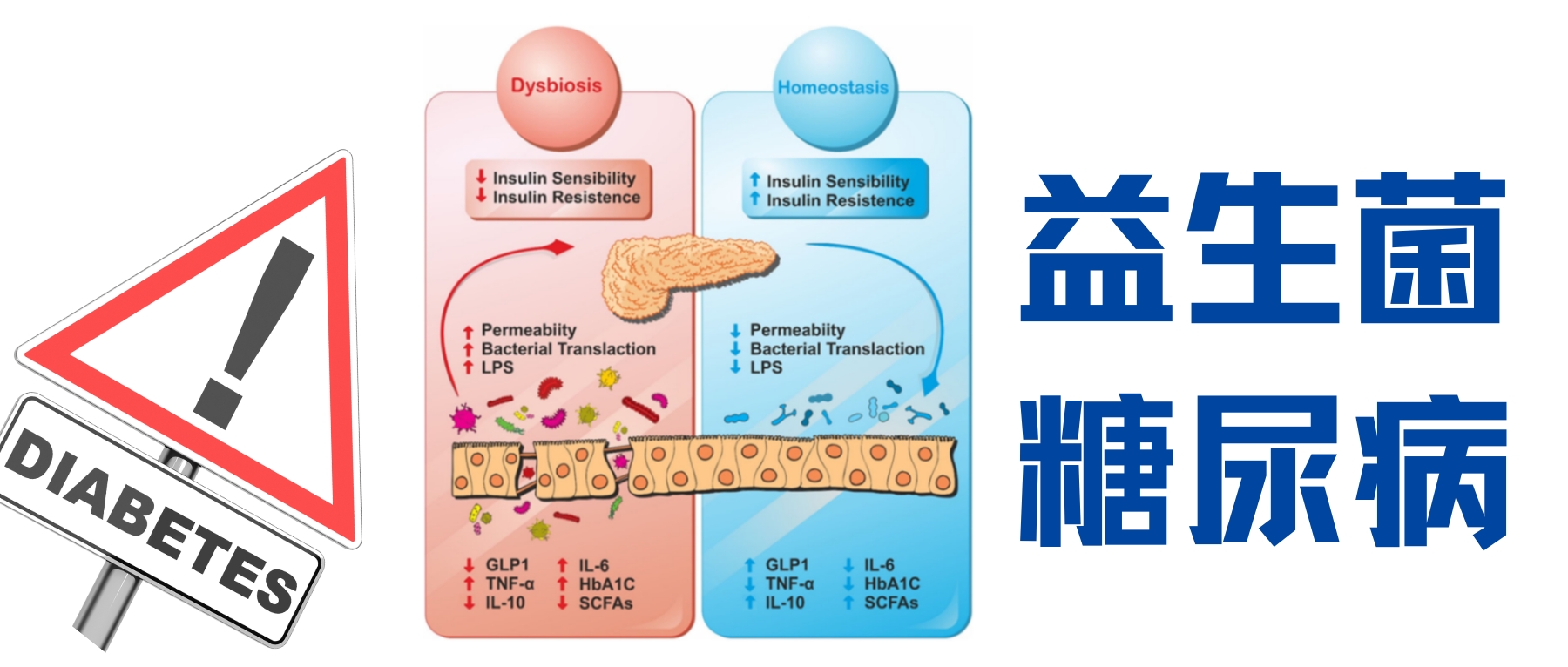
谷禾健康
糖尿病,一个日益严峻的全球健康挑战,其影响远不止血糖升高那么简单。在血糖波动的背后,看不见的慢性低度炎症,正悄然侵蚀着患者的健康,加速并发症的到来。
当我们谈论炎症时,脑海中浮现的可能是皮肤割伤后的红肿热痛,那是身体对损伤的快速、有益的防御反应,属于急性炎症;然而还有一种更隐蔽、更持久的炎症形式——慢性低度炎症,它没有明显症状,却像温水煮青蛙般长期损害我们的身体,被认为是心脏病、癌症以及糖尿病等诸多慢性疾病的共同根源。
这场炎症风暴的源头可能隐藏在我们体内最复杂的微生态系统——肠道菌群中。研究发现,糖尿病患者常存在菌群失衡:有益菌(如双歧杆菌、乳杆菌)减少,潜在致病菌增多,这些改变会导致肠道通透性增加(肠漏),使脂多糖(LPS)等微生物成分进入血液,通过 Toll 样受体激活引发全身性炎症。形成“菌群失调→肠漏→炎症→胰岛素抵抗”的恶性循环。
能否通过调节肠道菌群来阻断这一恶性循环?益生菌,作为定植于肠道的友好菌群,为我们提供了新的解题思路。在代谢性疾病中常见的益生菌属包括双歧杆菌属、乳杆菌属等通过发酵膳食纤维产生短链脂肪酸(SCFAs)——如丁酸(增强肠道屏障、直接抗炎)、丙酸(调节肝脏糖代谢)、乙酸(参与全身代谢),这些短链脂肪酸具有抗炎和改善胰岛素敏感性的作用。
但益生菌的抗炎效果是否真能得到科学验证?不同菌株、剂量的干预差异何在?这些问题亟待更权威的证据解答。
近日,一篇荟萃分析发表在《Frontiers in Cellular and Infection Microbiology》上,该研究系统整合了46项随机对照试验,覆盖3580名糖尿病患者,旨在揭示益生菌及其代谢产物对糖尿病患者体内炎症标志物的真实影响。
这项研究不仅回答了“益生菌是否有效”的简单疑问,更深入探究了“哪种方案更优”、“需要多长时间见效”以及“其作用机制是否与短链脂肪酸直接相关”等核心问题。为临床实践提供了可靠的循证医学指导,也为未来精准干预策略的制定奠定了坚实的科学基础。
在糖尿病患者体内,慢性炎症状态尤为普遍。它不仅是疾病的结果,更是推动疾病恶化的帮凶。
炎症因子,作为炎症反应中的信使分子,在其中扮演了关键角色,就像一支特殊的信号部队,负责传递指令,协调免疫系统的行动。炎症因子主要分为两大类:
促炎因子
点燃和助长炎症的分子,如肿瘤坏死因子-α (TNF-α)、白细胞介素-6 (IL-6) 和 白细胞介素-1β (IL-1β)。
在糖尿病中,这些因子水平的升高会干扰胰岛素信号传导,加剧胰岛素抵抗,损害血管内皮功能,为心血管并发症埋下祸根。
抗炎因子
它们是负责对抗炎症和修复的分子,其中最著名的是白细胞介素-10 (IL-10)。它能够抑制促炎因子的产生,帮助炎症反应消退,维持免疫系统的平衡。
还有一个重要的炎症标志物——C反应蛋白 (CRP)。它由肝脏在炎症刺激下产生,是临床上常用于衡量全身性炎症水平的指标之一。在糖尿病患者中,CRP水平的持续轻度升高,预示着心血管事件的风险增加。
研究表明,在明显的临床症状出现之前,这些炎症因子的水平可能已经悄然改变。而最早发出预警信号的,可能就是我们的肠道菌群。
健康的肠道菌群平衡(共生)对维持新陈代谢和免疫稳态至关重要。然而,在糖尿病患者中,这种平衡常常被打破,出现所谓的菌群失调——有益菌(如双歧杆菌、乳酸杆菌)减少,而一些潜在的致病菌增多。
菌群失调会导致肠道屏障功能受损,即肠漏。这使得细菌的某些成分(如脂多糖LPS)更容易进入血液,触发全身性的炎症反应。因此,通过调节肠道菌群来恢复平衡,成为控制糖尿病相关炎症的一个极具前景的策略。
益生菌,即“摄入足够数量时能对宿主健康产生有益作用的活的微生物”,正是实现这一目标的有力工具。常见的用于改善代谢疾病的益生菌属包括乳杆菌属、双歧杆菌属等。
益生菌发挥作用的一个关键机制,是通过发酵我们无法消化的膳食纤维(如菊粉、低聚果糖等益生元),产生一系列代谢产物如短链脂肪酸 (SCFAs) 。其中最重要的三种是:
这些短链脂肪酸不仅在肠道局部发挥作用,还能进入血液循环,对全身的免疫细胞和代谢器官产生深远影响,被认为是连接肠道菌群与宿主免疫的关键信使。
那么,补充益生菌是否真的能增加短链脂肪酸,是否能有效降低糖尿病患者的炎症水平呢?
为了解决更深入了解以上问题,近日一项大规模的系统回顾和荟萃分析,严格遵循PRISMA指南,从全球六大数据库中检索了从2000年1月至2024年3月的所有相关研究。
经过层层筛选,最终纳入了46项符合标准的随机对照试验,共涉及3580名1型或2型糖尿病患者。这些研究评估了口服益生菌或合生元(合生元是指益生菌+益生元)对炎症标志物(CRP, IL-6, TNF-α, IL-10)和短链脂肪酸水平的影响。
(对炎症标志物和菌群代谢物的影响)
经过对46项研究数据的严谨分析,研究者们得出了相关结果。以下我们将详细解读益生菌/合生元对各项关键指标的影响。
C-反应蛋白(CRP)——显著下降
在34项报告了CRP数据的研究中,合并分析结果显示,与安慰剂组相比,益生菌/合生元干预显著降低了CRP水平(SMD = –0.54;95% CI:–0.72 至–0.35;p < 0.0001),异质性为中度(I² = 64%),这是一个中等强度的、具有临床意义的改善。
更深入的亚组分析揭示了几个关键因素:
干预时长是关键
干预时间≥8周的研究显示出更强的CRP降低效果(SMD = –0.66),而短于8周的干预效果较弱(SMD = –0.31)。这表明,调节肠道菌群并影响全身免疫系统需要一定的时间。
“1+1 > 2”的合生元效应
使用合生元(益生菌+益生元如菊粉或低聚果糖)的干预比单独使用益生菌效果更优(SMD = –0.71 vs. –0.45)。这印证了益生元为益生菌提供食物,从而增强其功能和代谢产物生成的理论。
研究者发现,体内丁酸和丙酸水平的升高与CRP的下降显著相关。这首次在如此大规模的人群证据中,将益生菌的代谢产物(SCFAs)与全身炎症标志物的改善直接联系起来,揭示了其作用的可能机制。
白介素-6(IL-6):关键促炎因子下降
IL-6是驱动胰岛素抵抗和血管功能障碍的关键促炎因子。在29项报告了IL-6数据的研究中,益生菌/合生元干预同样显示出显著的降低效果(SMD = –0.41)。
亚组分析发现,干预时长≥12周时效果更为明显(SMD = –0.51),进一步证实了长期干预的必要性。
此外,分析还提示了菌株的特异性,含有干酪乳杆菌 (Lactobacillus casei) 和 短双歧杆菌(Bifidobacterium breve) 的制剂在降低IL-6方面表现尤为突出。
多变量荟萃回归模型再次证实,即使在校正了年龄和BMI等混杂因素后,丁酸和丙酸水平的升高仍然是IL-6降低的独立预测因素。这强有力地支持了肠道来源的短链脂肪酸通过抑制细胞因子来缓解糖尿病中代谢应激的假说。
益生菌来源的SCFAs降低IL-6的机制通路
doi.org/10.3389/fcimb.2025.1677671
TNF-α:胰岛素抵抗元凶之一被抑制
TNF-α在脂肪组织炎症和胰岛素抵抗中扮演着核心角色。26项RCTs的数据显示,益生菌干预显著降低了TNF-α水平(SMD = –0.48)。分析发现了一些有趣的差异:
对2型糖尿病更有效
在2型糖尿病患者中,TNF-α的降低效果(SMD = –0.52)比1型糖尿病患者(SMD = –0.36)更显著。这可能因为2型糖尿病通常与更严重的代谢综合征和胰岛素抵抗相关,为益生菌提供了更大的改善空间。
多菌株的协同作用
使用多菌株混合制剂的干预效果优于单菌株制剂(SMD = –0.50 vs. –0.28),这提示不同菌株之间可能存在功能互补和协同增效的作用。
相关性分析再次给出了强有力的证据:
在那些同时测量了丁酸水平的研究中,丁酸水平的变化与TNF-α的变化呈现出极强的负相关(r = –0.72)。这意味着丁酸水平越高,TNF-α的下降越明显。
益生菌衍生的丁酸盐在糖尿病中调节TNF-α和炎症信号通路
doi.org/10.3389/fcimb.2025.1677671
IL-10:抗炎主力军增强
与促炎因子下降相反,抗炎因子IL-10的水平在干预后出现了显著升高(SMD = +0.38),这表明免疫系统正向着一个更平衡、更具耐受性的状态转变。在18项研究中,这一发现在统计学上非常稳健。
合生元再次显示出其优越性,其提升IL-10的效果最为强劲(SMD = +0.49)。与IL-10升高最相关的菌株包括植物乳杆菌 (Lactobacillus plantarum) 和 长双歧杆菌 (Bifidobacterium longum)。
荟萃回归分析发现,丙酸浓度的升高是IL-10增加的强预测因子。这为SCFAs不仅能抑制促炎因子,还能增强抗炎因子提供了证据,共同促进了免疫稳态的恢复。
微生物代谢物变化
21项研究直接定量了SCFAs,为上述所有发现提供了直接的生化基础。合并分析显示,干预后:
这些代谢物的增加在使用合生元和多菌株配方的研究中最为明显,特别是那些包含长双歧杆菌 (B.longum)、鼠李糖乳杆菌 (L. rhamnosus) 和 植物乳杆菌 (L.plantarum) 的制剂。
这些发现无可辩驳地证明,益生菌/合生元干预确实能够改变肠道菌群的代谢功能,增加有益的短链脂肪酸产量。而这些短链脂肪酸,正是连接肠道与全身免疫系统,发挥抗炎作用的关键介质。
稳健性于偏倚性
为了确保结论的可靠性,研究者还进行了一系列严格的敏感性分析和发表偏倚评估。结果显示,即使剔除单个研究或质量较低的研究,总体结论依然不变,表明结果非常稳健。
虽然在CRP的分析中检测到轻微的发表偏倚(倾向于发表阳性结果的研究),但经过校正后,其显著的抗炎效果依然存在。这大大增强了本研究结论的可信度。
doi.org/10.3389/fcimb.2025.1677671
这项荟萃分析的意义不仅在于学术层面,更在于为临床实践和个人健康管理提供了清晰的指导。它系统地证明了益生菌和合生元作为辅助疗法,在管理与糖尿病相关的代谢性炎症方面的巨大潜力。
研究结果反复指向短链脂肪酸的核心作用。科学界目前认为,短链脂肪酸主要通过以下途径发挥抗炎作用:
这些机制共同解释了在这项荟萃分析中,短链脂肪酸水平的升高与炎症标志物的改善呈现出如此强烈的相关性。
实践建议:如何选择和使用益生菌?
基于这项研究的发现,我们可以总结出一些给糖尿病患者的实用建议,以最大化益生菌的抗炎效益:
优先选择合生元或多菌株产品
研究明确指出,含有益生元(如菊粉、低聚果糖)的合生元产品,以及包含多种菌株(特别是乳杆菌属和双歧杆菌属)的混合产品,效果优于单一菌株的益生菌。寻找包含如干酪乳杆菌、植物乳杆菌、短双歧杆菌、长双歧杆菌等经研究验证的菌株。
保证足够的使用剂量和时长
为了达到有效的抗炎效果,建议的剂量通常在每天 109~1010 CFU(菌落形成单位)。更重要的是,干预需要足够长的时间,至少应持续 8-12周,甚至更长,才能观察到显著的免疫调节效果。
关注饮食协同
益生菌的效果离不开“燃料”。在补充益生菌的同时,增加膳食纤维的摄入(如全谷物、豆类、蔬菜、水果),可以为益生菌提供充足的食物,促进短链脂肪酸的产生,达到事半功倍的效果。
对于那些已经存在明显代谢性炎症(如CRP/IL-6升高)、中心性肥胖或非酒精性脂肪肝(NAFLD)的糖尿病患者,益生菌干预可能带来更大的获益。
作为辅助而非替代疗法
益生菌是一种辅助管理策略,不能完全替代标准的降糖药物和生活方式管理,益生菌可以从源头改善,通过调节肠道微生态,靶向慢性炎症,缓解糖尿病,且减少并发症的风险。
益生菌与常规治疗相结合,共同控制疾病。益生菌创造的低炎症、更健康的肠道环境,可能有助于提高身体对降糖药物的反应,并优化健康饮食的营养吸收效果。这种协同作用,最终可能带来比单一策略好得多的整体管理效果。
肠道菌群与糖尿病炎症的深度关联,已从基础研究走向临床转化的关键节点。益生菌通过调节短链脂肪酸代谢实现抗炎降糖,但“菌株选择、剂量优化、疗效预测”等核心问题,始终依赖对个体菌群特征的精准洞察。
益生菌通过重塑肠道微生态、修复肠道屏障、抑制慢性炎症,为2型糖尿病的辅助管理开辟了充满希望的新途径。它从源头上干预了由菌群失调驱动的代谢紊乱,展现出巨大的应用潜力。
从盲目补充到精准调养
肠道菌群检测将成为个性化健康管理的起点。通过检测,你能清晰了解自身菌群结构(如双歧杆菌、乳杆菌等有益菌丰度)、短链脂肪酸代谢能力及炎症风险,从而告别试错式补充,精准匹配最适合的菌株与饮食方案(如搭配益生元增强效果),让益生菌的抗炎潜力得到最大释放。
从单一产品到生态协同
人群研究数据(如干预≥8周效果提升、合生元方案优于单一益生菌)揭示,肠道菌群调节需“检测-干预-跟踪”的闭环支持。
主要参考文献
Xie Y, Zheng Y, Jiang F, Cai X. Meta-analytical insight on probiotic metabolites and inflammatory markers in diabetes. Front Cell Infect Microbiol. 2025 Sep 22;15:1677671.