-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
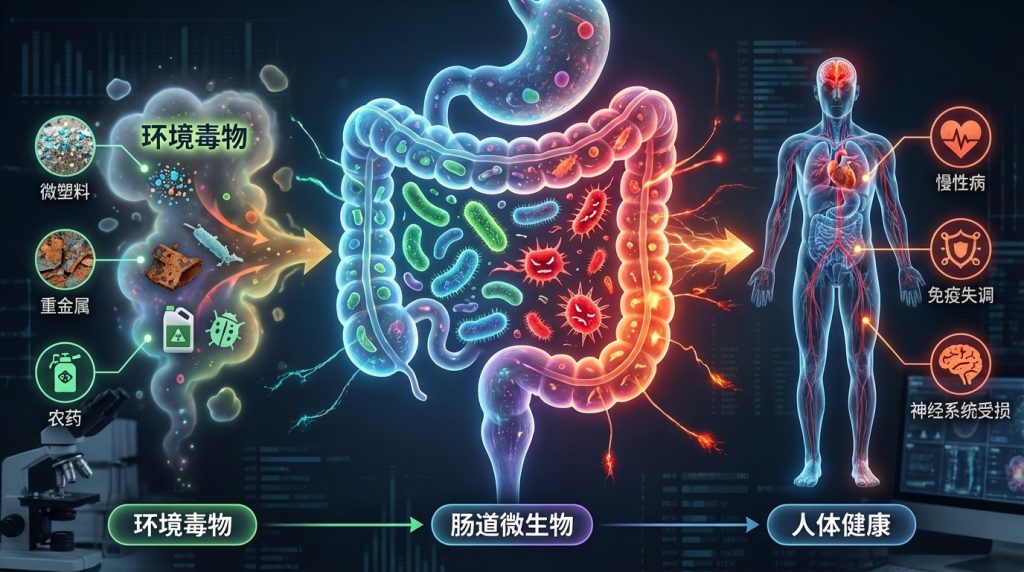
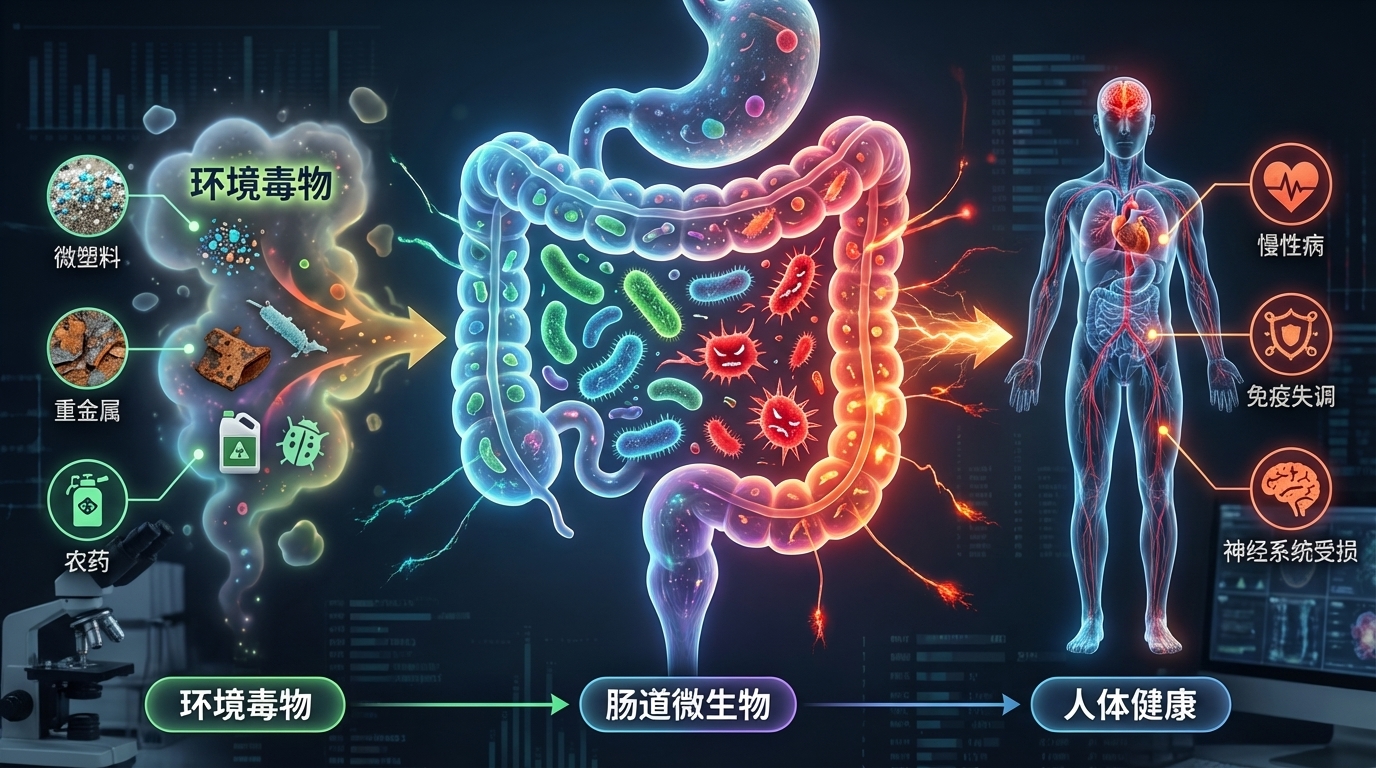
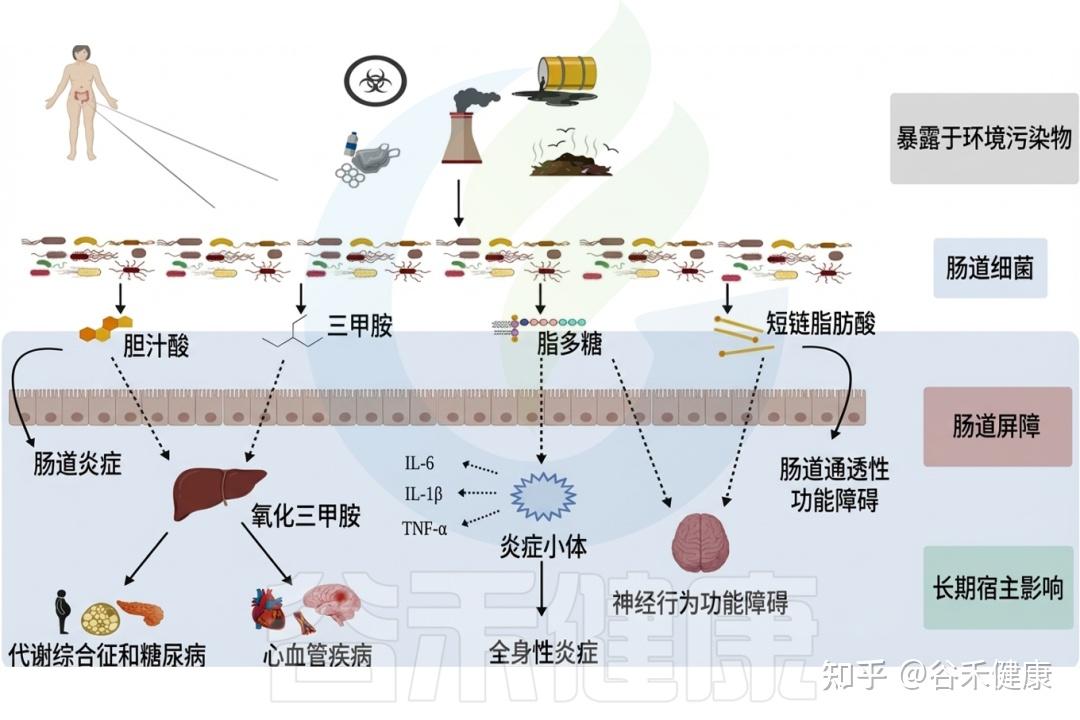
在现代社会,环境毒物已成为影响人类健康且尚未得到充分研究的风险因素。这些有害物质,从工业化学品和污染物到日常家居用品,均可能通过复杂的生物机制对健康产生深远影响。尤其令人关注的是,研究发现这些环境毒物不仅直接影响人体,还对肠道微生物群这个复杂的生态系统造成显著干扰。
肠道微生物群是我们消化道内的重要组成部分,对调节免疫系统、代谢功能和神经活动等方面起着关键作用。例如,肠道菌群能够通过产生短链脂肪酸(SCFAs)来调节免疫反应,增强肠道屏障的功能,从而降低慢性炎症的风险。然而,若这种微妙的平衡被扰动,将可能引发一系列健康问题,包括慢性炎症、肥胖、糖尿病、癌症和神经退行性疾病等。
研究表明,环境毒物的暴露(如铅、镉、农药和邻苯二甲酸盐等)会导致肠道微生物的组成和功能改变。例如,铅暴露与有益细菌数量的减少相关,导致乳球菌和阿克曼菌减少,而脱硫弧菌和大肠杆菌等机会性致病菌则显著增多。此外,还发现环境毒物影响下维生素和胆汁酸的浓度失衡,以及一氧化氮生成的增加也随之发生。这直接影响宿主的代谢和免疫功能。
相反,肠道微生物组也能影响环境毒物的毒性。例如,某些肠道细菌能够代谢并转化环境中的化学物质,从而减轻它们对宿主的损害。一项研究指出,某些益生菌如植物乳杆菌能够帮助降解体内的有机污染物,减少其生物积累和毒性。此外,肠道微生物能通过直接与环境毒物相互作用、影响其生物利用度,间接改变其对健康的影响。
本文通过综合各领域的研究成果,探讨环境毒物如何通过肠道微生物组影响人类健康,尽量基于研究结论去揭示环境毒物与肠道微生物组之间的复杂关系。本文还将探讨如何通过调整饮食与生活方式来调控肠道微生物反应,从而缓解环境毒物的潜在危害。
我们希望本文不仅能为学术界提供有价值的见解,还能激发公众对环境健康问题的关注,共同应对这一全球性挑战。
▸ 什么是环境毒物?
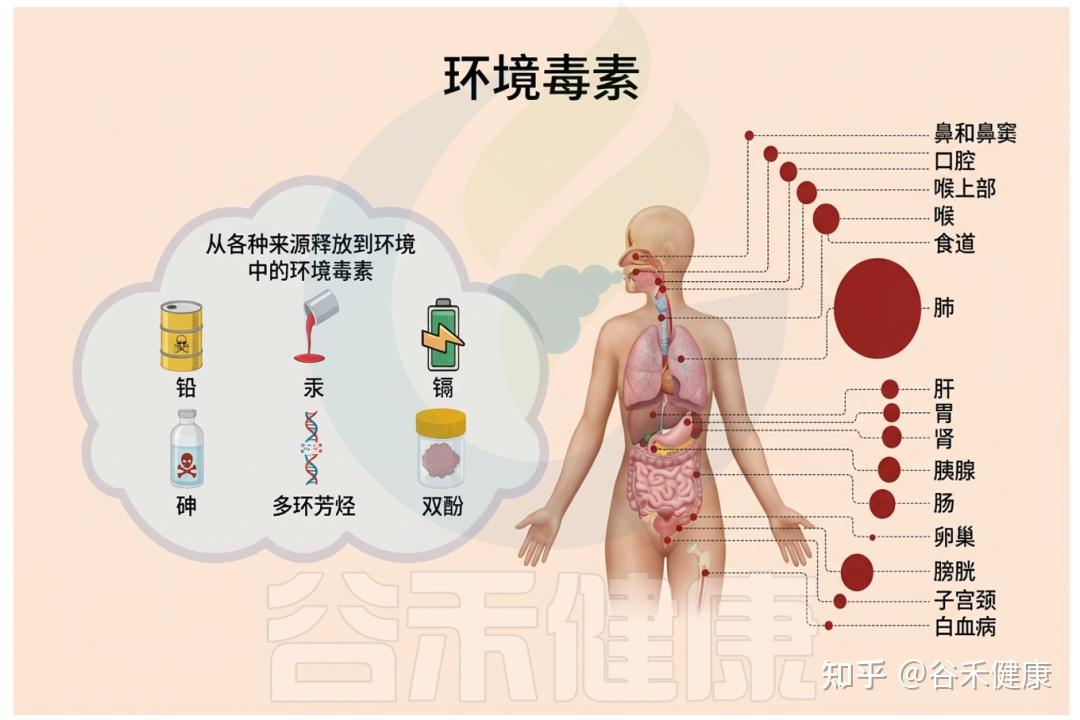
环境毒物是指广泛存在于空气、水、土壤、食品和日常用品中的有害化学或金属物质,如重金属(铅、汞、镉、砷)、农药、工业有机污染物、增塑剂(邻苯二甲酸盐)等。
它们可通过饮食、饮水、吸入或皮肤接触进入人体,扰乱机体免疫、代谢和神经等系统,进而增加多种慢性疾病甚至癌症的风险。
多种引起毒性的环境毒物
★ 剂量和胃肠道对物质毒性有重要影响
帕拉塞尔苏斯(Paracelsus,1493-1541)提出的名言“仅剂量决定某物不是毒药”奠定了当代毒理学的核心原则,强调评估物质毒性必须关注剂量。
他另一句“生命中最重要的事情发生在消化道的开始和结束之间”,突出了消化系统在毒理学中的重要性。由此引出对环境毒物与胃肠道微生物群相互作用的研究,强调剂量对毒性的关键影响,以及肠道内数万亿微生物对人类健康与疾病的重要作用。
▸ 胃肠道微生物与环境毒物
胃肠系统是人体微生物最密集的区域,细菌量从胃的101–103 CFU/mL到结肠的1011–1012 CFU/mL不等,已鉴定出数千种细菌,显示肠道微生物群高度复杂,以细菌为主,古细菌、真菌和原生动物为次要成分。
微生物群参与胃肠道的形成与稳态,并与免疫和神经系统协同,其与摄入外源性物质存在密切且重要的相互作用。
▸ 环境毒物扰动肠道微生物群
研究表明,环境毒物暴露会显著扰动肠道微生物群。如镉暴露与微生物多样性降低及特定菌群丰度变化相关;汞暴露同样可改变菌群构成,并可能促进其整体毒性作用。
由于肠道微生物群在营养代谢、免疫调节及抵御病原体方面发挥关键作用,这一脆弱生态系统的失衡将损害上述功能,从而危及宿主健康。
微生物组与环境毒物的相互作用
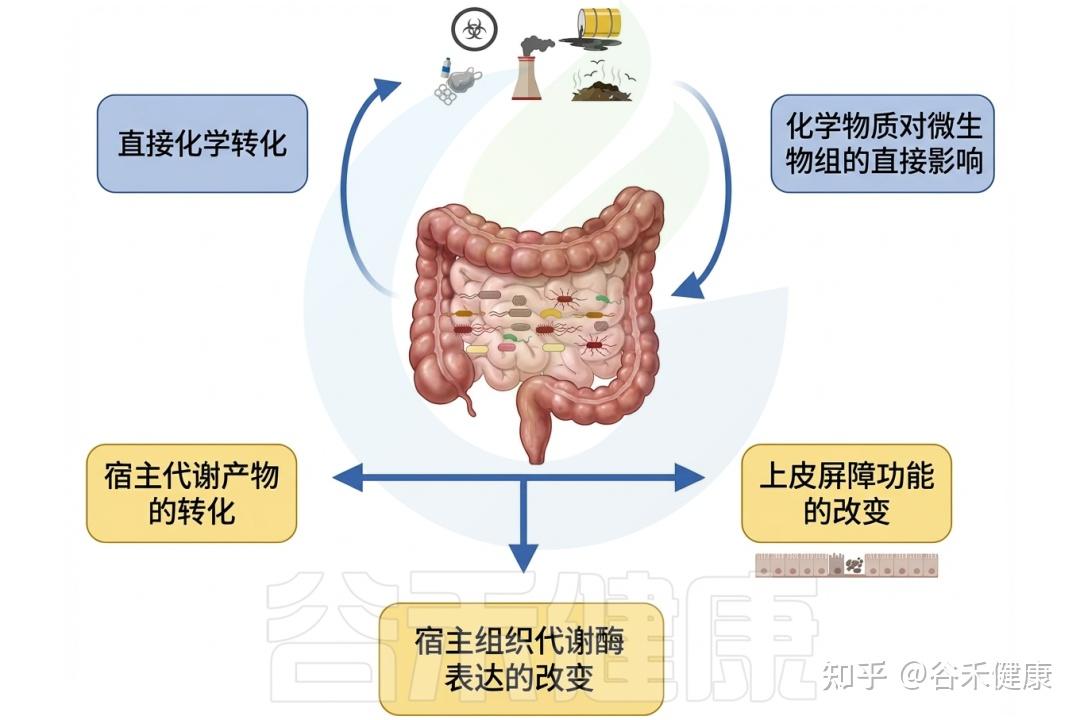
▸ 肠道微生物影响环境毒物毒性
相反,肠道微生物群可以通过各种机制影响环境毒物的毒性。微生物可以改变环境毒物的化学形态,影响其吸收和生物利用度。
此外,某些细菌具有解毒或隔离环境毒物的能力,可能减轻它们对宿主的有害影响。肠道微生物组参与调节炎症和免疫反应,使环境毒物与宿主毒性之间的关系进一步复杂化。
肠道微生物群影响环境毒物的生物利用度和毒性
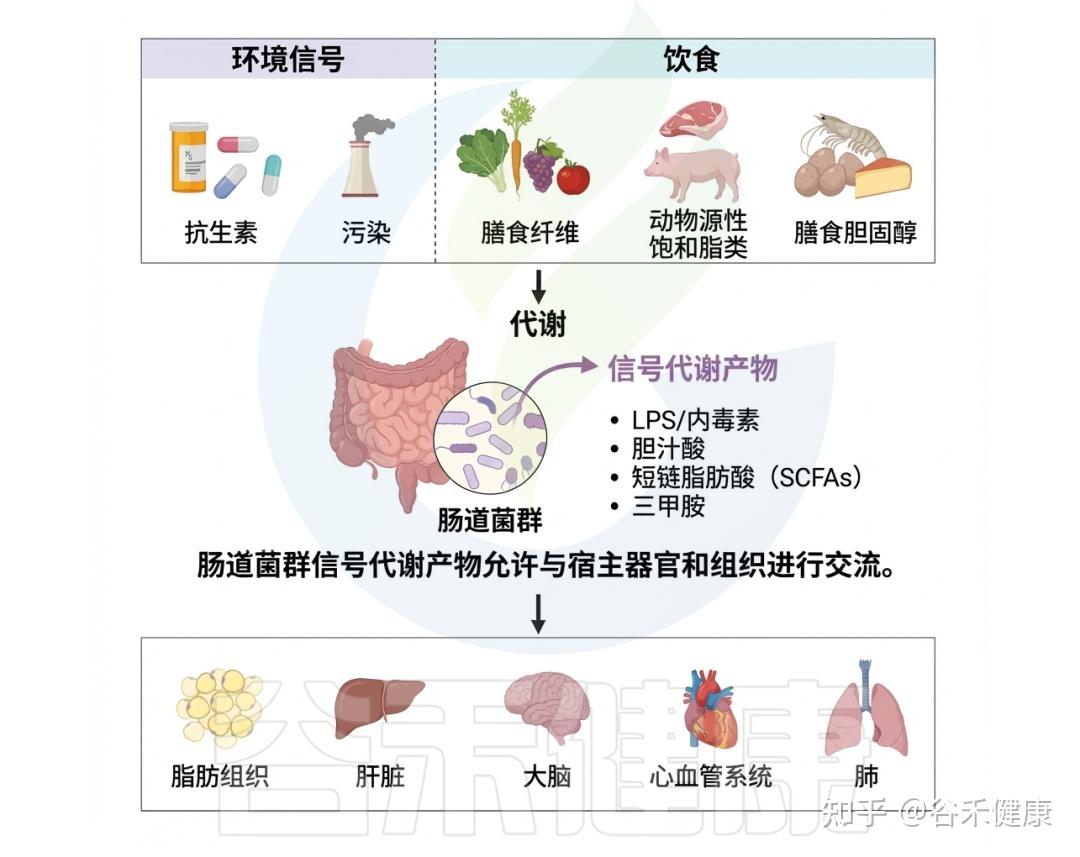
深入理解肠道微生物与环境毒物之间的复杂互作,是全面认识环境暴露相关健康结局的关键。环境毒物与肠道微生物组之间的精细关系突显了环境毒理学的多维性。随着对肠道微生物组认识的不断加深,其在调控环境毒物健康效应中的核心作用日益清晰。
环境毒物对肠道微生物群及人体的影响
环境毒物影响肠道微生物组,反过来微生物组也调节环境毒物毒性,这一双向作用已成为快速发展的研究热点,对人类健康和环境管理具有重要意义。只有全面阐明环境污染物与胃肠道微生物群的相互作用,才能制定有效策略减轻健康损害,维护个体与生态系统的整体福祉。下面我们将详细具体地阐述日常生活环境中常见有毒物质与肠道微生物群的相互作用及其对人体健康的影响。
▸ 邻苯二甲酸盐(PAE):来源、健康影响
▸ 什么邻苯二甲酸盐(PAE)?
直接说“邻苯二甲酸盐”(PAE),很多人可能并不了解;但如果说它是一种用来让塑料更柔软、有弹性、不易脆裂的添加剂,这样可能就容易理解多了。
▸ 食品、日用品、玩具、医疗用品中都有PAE
人类接触邻苯二甲酸盐(PAE)可分为直接和间接两类。直接接触指直接使用PAE或含PAE的产品;间接接触则是PAE通过浸出或渗透污染环境或其他产品。研究显示,截至2017年,全球PAE年产量已超过600万吨,其年消耗量持续增加,人群体液样本中PAE代谢物检出频率亦在升高。
食品是人类暴露PAE的重要来源之一,已在酒精饮料、食用油、乳制品、饮用水、肉类、家禽和蔬菜等中检测到。其脂溶性、低熔点、高沸点及易溶于乙醇等特性,促进其由接触材料迁移至食物并被摄入。
在儿童用品中,塑料玩具、牙胶和餐具因价廉耐用而被广泛使用,部分含有邻苯二甲酸酯(PAEs)的产品可能导致儿童通过手口接触和含吮行为摄入该类毒物。
在医疗领域,邻苯二甲酸二(2-乙基己基)酯(DEHP) 常作为医疗器械增塑剂,为留置类器械提供柔韧性。因其不与塑料形成化学键,使用中易析出并在体内累积。药物制剂中部分杂质来源于增塑剂的浸出或迁移。片剂和胶囊通常包裹聚合物包衣,以调控其在胃肠道内释放的时间和部位。
最常见的邻苯二甲酸盐
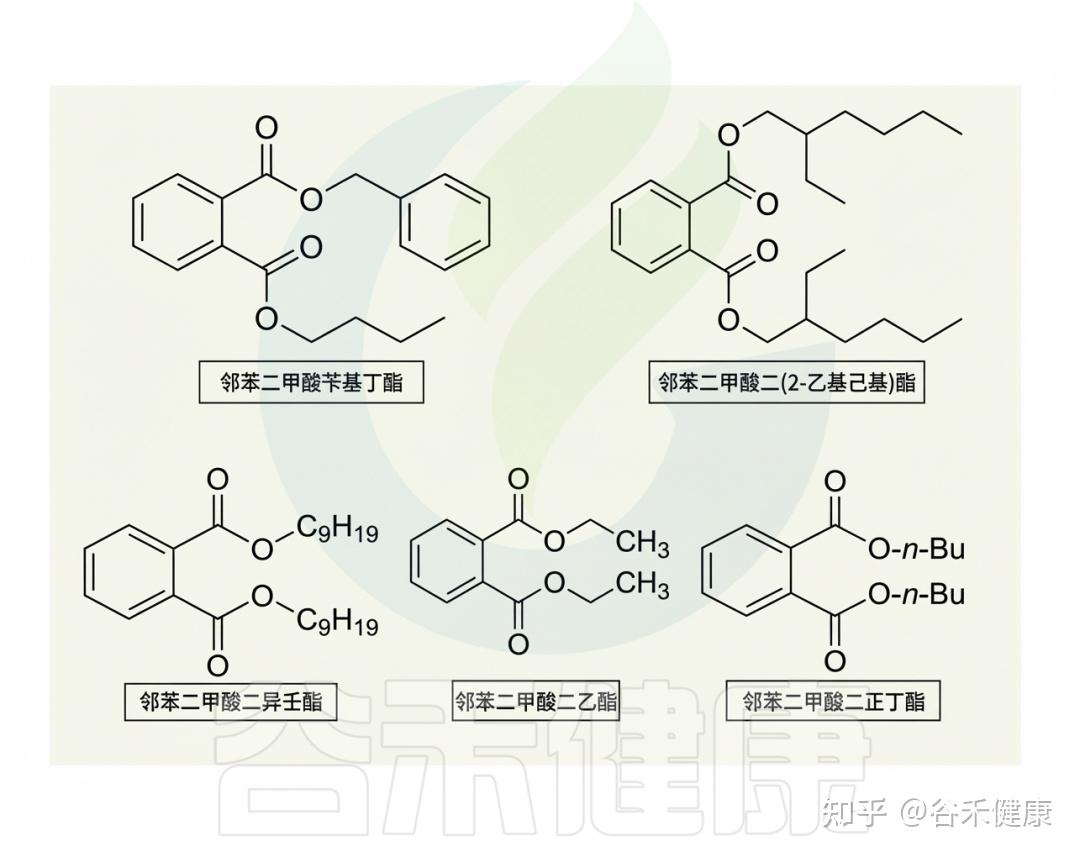
多种日常用品,如清洁剂、指甲油、香水和个人护理品中普遍含有PAE,邻苯二甲酸二乙酯(DEP)常作香精定香剂。研究表明,环境PAE可沉积于棉和聚酯纤维,且棉中浓度更高,这些纺织品主要经皮肤致暴露。
此外,PAE还可由家用产品、服装、建材和汽车部件等释放至空气,通过吸入进入人体。
▸ PAE暴露与多种健康问题有关
目前,PAE暴露已被关联于多种健康问题,包括内分泌与生殖功能紊乱、性早熟、子宫内膜异位症、性发育异常、不孕不育、胎儿发育异常、乳腺癌和皮肤癌、肥胖、2型糖尿病、注意力缺陷多动障碍、自闭症谱系障碍,以及心、肝、肾毒性、哮喘和过敏等。
邻苯二甲酸盐对人体健康造成的影响
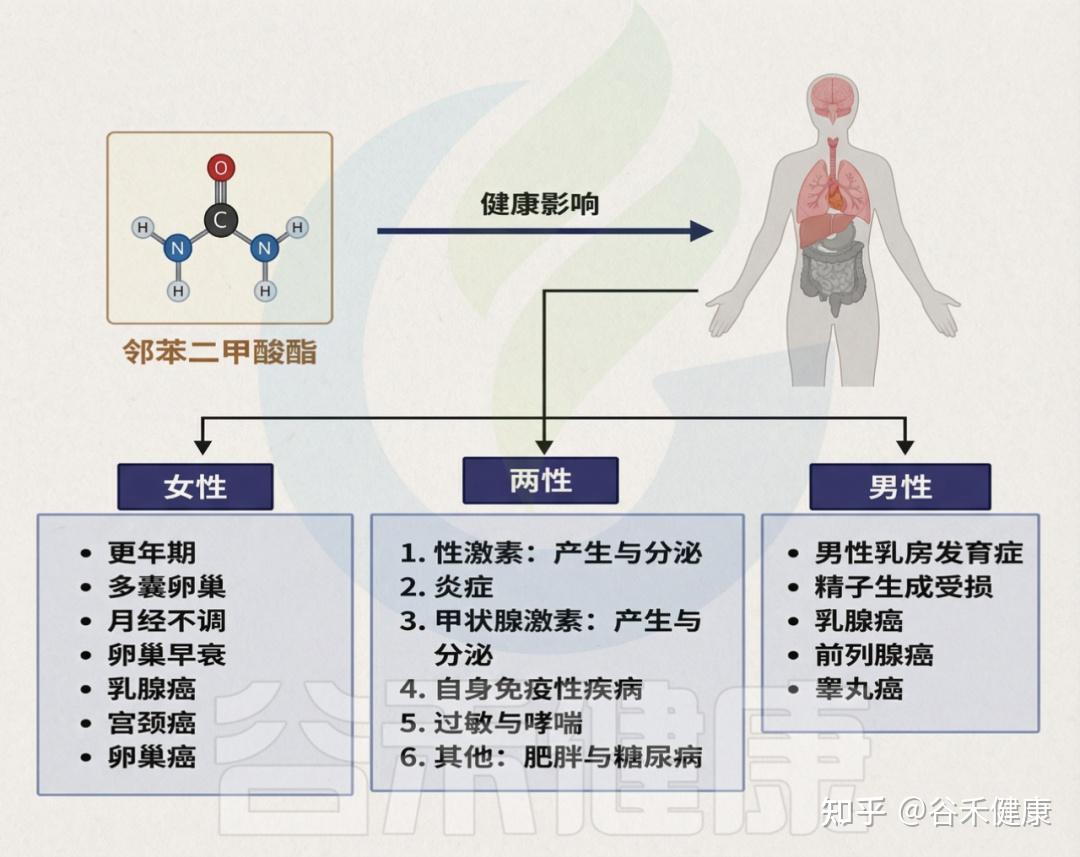
需强调的是,儿童与成人对PAE的反应可能不同,儿童因频繁手口行为而更易摄入,暴露风险更高。
▸ 邻苯二甲酸盐(PAE)与肠道微生物的互作
邻苯二甲酸盐(PAE)因广泛存在及其潜在健康危害而备受关注。近期研究逐步揭示PAE暴露与肠道菌群(GM)之间的复杂联系,表明其可影响微生物组成及宿主健康。
▸ 暴露于PAE后,乳杆菌和双歧杆菌减少
暴露于常见邻苯二甲酸盐(PAE)化合物邻苯二甲酸二(2-乙基己基)酯(DEHP) 后,多种关键菌种水平明显变化,其中乳杆菌和双歧杆菌等有益菌显著减少,导致整体菌群多样性和丰度发生重塑。
PAE经摄入或吸收后在体内代谢,产生可干扰微生物生长和代谢的活性产物;同时,PAE还可能损伤微生物细胞结构或关键代谢过程,打破菌群平衡。
▸ PAE可能营造导致菌群失衡的环境
新证据显示,PAE暴露可引发肠道炎症并削弱黏膜屏障,从而营造有利于菌群失衡的环境。人群流行病学研究亦支持这一关联:在成人队列中发现,尿中PAE代谢物水平与肠道微生物多样性及丰度变化之间存在显著相关。
这些结果突显PAE相关菌群生态失调在实际人群中的重要性,并提示其对公共卫生干预具有潜在影响。PAE导致的肠道微生物群改变不仅破坏肠道微生态,还影响宿主整体健康和疾病易感性。肠道微生物群在维持代谢稳态、调节免疫功能及保障肠屏障完整性等方面至关重要;因此,PAE 诱导的菌群失衡可能增加代谢综合征、胃肠道疾病、免疫失调及神经发育异常等多种健康风险。
▸ PAE还通过营养可用性和免疫影响肠道菌群
此外,PAE还可通过改变微生物生长与代谢所需营养和底物的可及性来影响肠道微生物群,干扰肠腔中膳食成分的吸收和利用,并通过调节肠上皮营养转运与代谢相关基因的表达,改变宿主—微生物相互作用。营养供给和宿主信号的变化共同塑造肠道微生物群的结构与功能。
PAE还可通过调节宿主免疫反应间接影响菌群。已有研究将PAE暴露与免疫失调联系起来,如炎症水平升高和免疫细胞功能异常,这会改变肠道微环境和菌群构成。肠道炎症有利于有害菌繁殖并抑制有益菌生长。PAE还与破坏肠上皮屏障完整性相关,导致通透性增加及微生物产物大量进入血液,即“肠漏”现象,从而诱发系统性免疫激活和炎症,进一步影响肠道微生物群的组成和功能。
▸ 肠道菌群调节PAE的代谢和生物效应
邻苯二甲酸盐(PAE)与肠道微生物群之间存在双向关系:PAE可改变肠道微生物群的组成和活性,而肠道微生物群又能调节PAE的代谢和生物效应。
研究发现,肠道细菌具有多种酶,可通过水解、还原和氧化等过程分解PAE。由于肠道微生物群的组成和代谢活性在个体间差异显著,PAE的代谢效率及对其不良作用的易感性亦随之不同。部分菌群可将 PAE 转化为毒性较低或更易排出的代谢物,有助于解毒并降低健康风险;而特定菌种则可能将PAE转化为更具毒性的代谢物,放大其对宿主的危害。
此外,肠道微生物群还能调节机体对 PAE 暴露的免疫和炎症反应,从而影响 PAE 相关疾病的发生风险。例如,肠道细菌可通过与宿主免疫系统互作,改变 PAE 诱导的炎症程度。研究表明,在炎症性肠病(IBD)等慢性炎症性疾病中,菌群失调引起的持续炎症,可进一步加剧 PAE 对肠道健康与功能的负面影响。
▸ 邻苯二甲酸盐(PAE)对肠道健康的影响
▸ 破坏肠道屏障功能
邻苯二甲酸盐(PAE)通过影响紧密连接蛋白破坏肠上皮完整性。PAE 可干扰这些蛋白的表达和组装,使紧密连接减弱、屏障通透性升高。多项研究发现,暴露于PAE会降低关键屏障蛋白水平,导致屏障功能下降。
此外,PAE 可在肠上皮诱导氧化应激(OS)和炎症,进一步削弱屏障功能。其通过提高活性氧(ROS)水平、抑制抗氧化酶活性,导致脂质、蛋白质和 DNA 氧化损伤,并破坏紧密连接结构。
PAE 还能诱导肠黏膜炎症,增加屏障负担,可激活巨噬细胞、树突状细胞等免疫细胞,促进 IL-6、TNF-α、IL-1β 等促炎因子及趋化因子释放,加重炎症并损伤屏障。
同时,PAE 可改变肠道微生物组组成与功能,诱发菌群失调,导致通透性升高和屏障障碍。其暴露会破坏菌群平衡,减少短链脂肪酸产生,部分菌还可将 PAE 代谢为有害或促炎产物,进一步加重屏障损伤。
▸ 邻苯二甲酸盐的促炎作用
PAE与肠道炎症密切相关,多项研究表明其长期暴露可促发并加重消化道炎症。PAE通过激活巨噬细胞、树突状细胞和淋巴细胞,诱导 IL-6、TNF-α、IL-1β、IL-8 等促炎因子和趋化因子产生,招募更多免疫细胞并加剧肠壁损伤和炎症,同时打破促炎与抗炎信号平衡,放大炎症反应。
PAE还能在肠黏膜诱导氧化应激,进一步推动炎症和组织损伤。其通过增加活性氧生成、抑制抗氧化酶活性,导致脂质、蛋白质和 DNA 氧化损伤,并激活炎症通路,放大肠道炎症级联反应。动物研究证实,PAE 暴露可显著引起肠道炎症。
▸ PAE可诱发炎症性肠病、肠易激综合征等疾病
PAE可通过破坏肠道屏障、诱导炎症和干扰肠道微生物群,整体损害肠道健康,并促进炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌(CRC)等疾病的发生与进展。
慢性肠炎是炎症性肠病(IBD)核心病理环节,并与结直肠癌风险升高相关。动物研究表明,PAE能导致结肠炎症和氧化应激,产生类似结肠炎的病理改变并增加CRC易感性,提示 PAE 相关炎症可能通过组织破坏、免疫失衡及形成促癌微环境,加速肠道疾病进程。
此外,PAE 对肠道微生物群的干扰也是影响肠道疾病的重要因素。菌群组成和多样性改变(菌群失调)与 IBD、IBS、CRC 等密切相关。PAE 暴露可打乱菌群平衡,减少有益菌、增加有害菌,改变宿主—微生物互作、免疫稳态和代谢途径,从而共同促进肠道相关疾病的发生与恶化。
小结
邻苯二甲酸盐(PAE)广泛存在于消费品中,经摄入或吸收后代谢为具生物活性的产物,可显著改变肠道菌群组成与功能,降低多样性并引发菌群失调。
PAE 对肠道的危害不仅包括破坏屏障和诱导炎症,还在炎症性肠病、肠易激综合征和结直肠癌等疾病的发生与进展中发挥重要作用。通过纵向和机制研究加深对邻苯二甲酸盐–肠道微生物群关系的理解,将为降低PAE暴露相关健康风险提供依据,亦是维护肠道健康和应对环境暴露的关键。
3
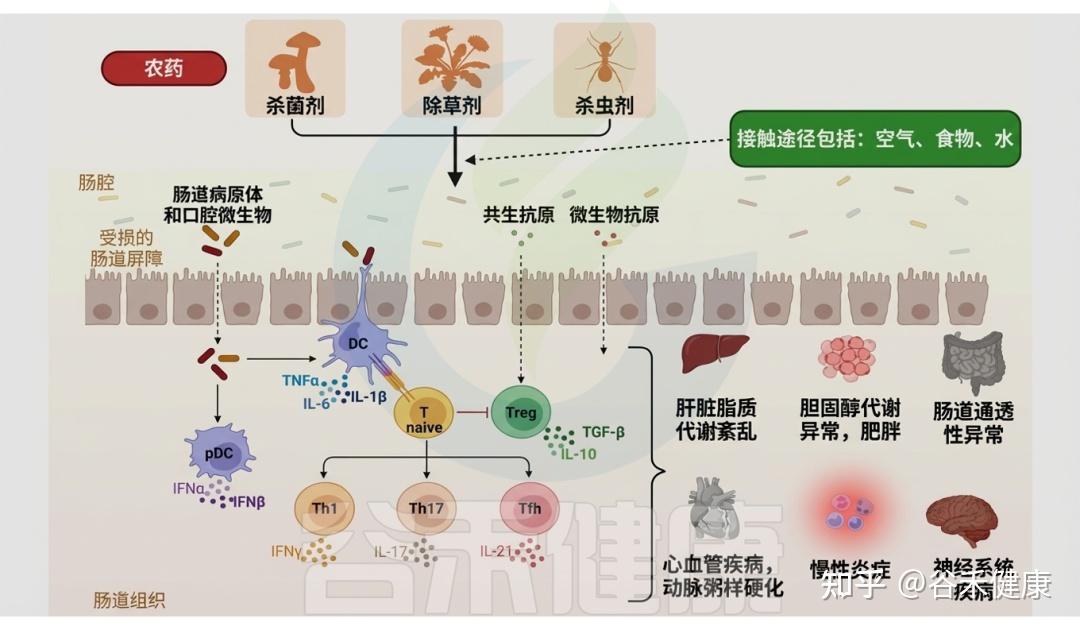
农药和肠道微生物群
伴随全球人口增长,对高产与优质农产品的需求推动农药使用急剧增加,以满足粮食供给并追求经济效益。然而,农药的不受控和不合理施用对农产品和整个生态系统构成潜在毒性威胁。由于农药在土壤中的高持久性及其在大气和水体中的残留,非靶标生物(尤其是动物和人类)通过摄入受污染的食物和水而面临更高的农药暴露风险。
大量研究表明,农药暴露与癌症、哮喘、激素紊乱和过敏等疾病相关;同时,多种农药的联合作用可诱发肠道菌群失调,改变微生物组成与功能以及宿主代谢表型。
▸ 肠道菌群失调可作为农药暴露的生物标志物
肠道微生物群的多样性对维持宿主正常生理功能至关重要。最新研究表明,农药暴露会显著影响肠道微生物群,菌群失调可作为评估农药毒性的潜在生物标志物。
▸ 农药导致肠道微生物代谢改变
精确评估特定农药引起的菌群失调及肠道毒性,有助于理解微生物群对污染物暴露的响应机制,并挖掘诊断相关疾病的生物标志物。例如,在二嗪农(一种广谱、高效的有机磷杀虫剂)暴露下,肠道微生物相关信号通路发生改变,导致代谢物谱重塑,并以性别依赖的方式触发神经毒性。这类由微生物产生的神经毒性代谢物可用作二嗪农相关肠道毒性的生物标志物。
各类农药对肠道微生物群的影响
DOI:10.1201/9781003489221-6
农药毒理学风险评估依赖明确且可靠的终点。需要筛选合适的生物标志物,限定其使用条件,界定诊断阈值和异常范围,建立作用机制,并明确其在何种场景下最具适用性。
注:欧洲食品安全局已指出,微生物多样性在环境污染物毒性和健康风险评估中具有重要意义,但仍需进一步界定方法学的局限性、研究空白、纳入/排除标准以及数据处理与解释的标准化要求。
▸ 农药相关毒性还受饮食、年龄、胃肠状况影响
肠道菌群对宿主健康的影响及其在农药相关毒性中的作用极为复杂,还受到饮食、年龄、遗传背景、胃肠动力、地理位置和抗生素使用等多重因素干扰。
要全面理解菌群毒性与宿主健康之间的关系,仍需大量系统研究。针对农药暴露对肠道菌群和宿主健康影响的文献中普遍存在方法学不足:多数研究缺乏体内、体外实验流程及分析手段的标准化与优化。标准化是确保实验可重复性和结果可比性的关键步骤;体外发现也应在体内模型中得到验证。
此外,农药毒理实验的设计必须能准确测定化学残留量及其生物学效应,从而构建可靠的剂量–反应关系,并最终界定慢性暴露水平及其健康风险。
小结
除已阐明的分子通路外,多种细胞过程也可能受到农药毒性的影响,肠道微生物组成与农药毒性之间的关联仍需在人群中深入验证。近期研究已提示子宫内农药污染及其跨代效应,多代暴露人群的肠道微生物组更易发生改变。在农业生态系统中,农民和一线工人因高水平残留及职业暴露而面临严重健康风险;同时,农药在食物链中的渗透污染也亟需持续监测。
因此,有必要系统评估农药污染引起的肠道菌群失调对公众健康的长期影响,并制定有效的干预与缓解策略。对新型和现用农药的风险评估应在透明、统一的框架下进行,系统研究其使用与对人群和环境影响之间的关系。同时,必须为相关实验所得数据的解读制定明确的标准和指南,以规范各类农药风险研究与监管实践。
4
有机污染物和肠道微生物群
近年来,石化、塑料、合成纤维、焦化、印染、印刷等行业的快速发展,导致环境中高浓度有机污染物(OPs)广泛存在。
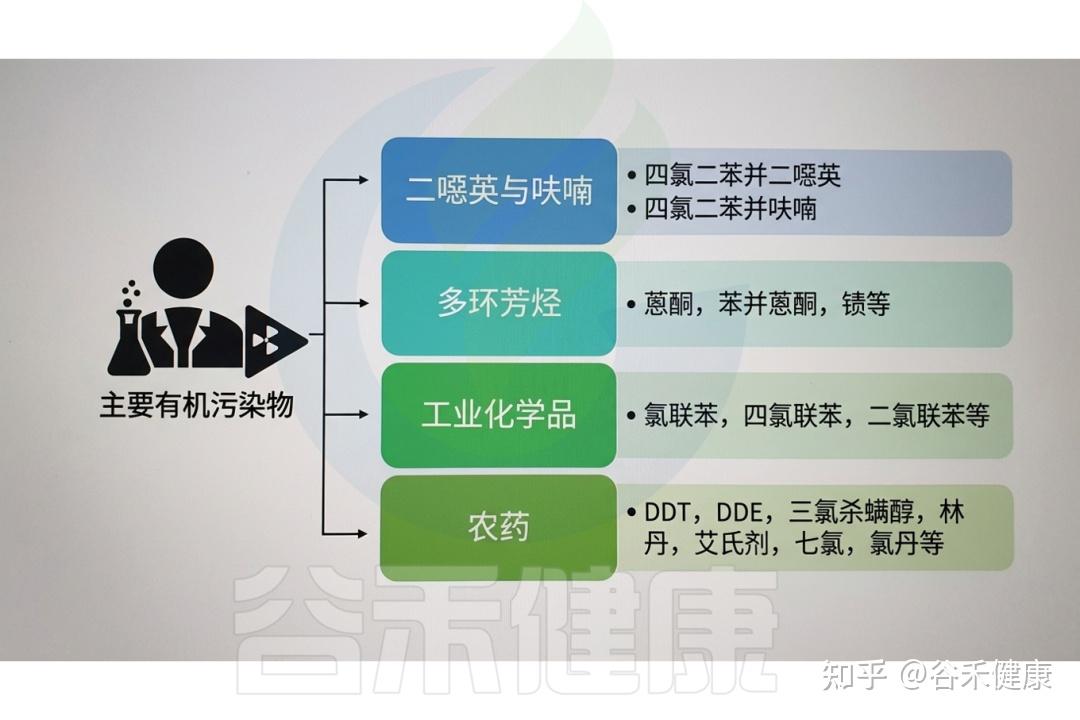
▸ 常见的有机污染物
有机污染物种类繁多,对环境和人类健康均构成潜在威胁。其来源广泛,包括农用化学品和药品、个人护理品、非法药物、工业污染物、阻燃剂、增塑剂、多环芳烃(PAHs)、卤代多环芳烃、二噁英及其他持久性有机污染物(POPs)残留等。它们通过多种人类活动进入环境,如污水处理厂排放、废弃物无序排放、前体物质降解、海滩塑料碎片累积、工业生产及热处理过程等。
常见的有机污染物类别及示例
DOI:10.1201/9781003489221-7
常见的有机污染物(OPs)包括以下物质:
农药:用于农业、家庭和公共卫生等场景的害虫防治,包括杀虫剂、除草剂、杀菌剂和杀鼠剂。
溶剂:广泛用于清洗、脱脂及化学反应的有机溶剂,如苯、甲苯、二甲苯及三氯乙烯(TCE)等氯代溶剂。
药物:经人畜排泄或不当处置进入环境的药物化合物,包括抗生素、激素、止痛药及其他处方药。
多氯联苯(PCB):一类曾广泛用于电气设备、液压油和工业过程的合成有机物,属于具有生物累积性的持久性有机污染物。
二噁英:在废物焚烧及含氯化学品生产等工业过程中产生的剧毒副产物,具有高度持久性和生物累积潜力。
▸ 有机污染物与肠道微生物群的互作
▸ 有机污染物引发菌群失调、炎症
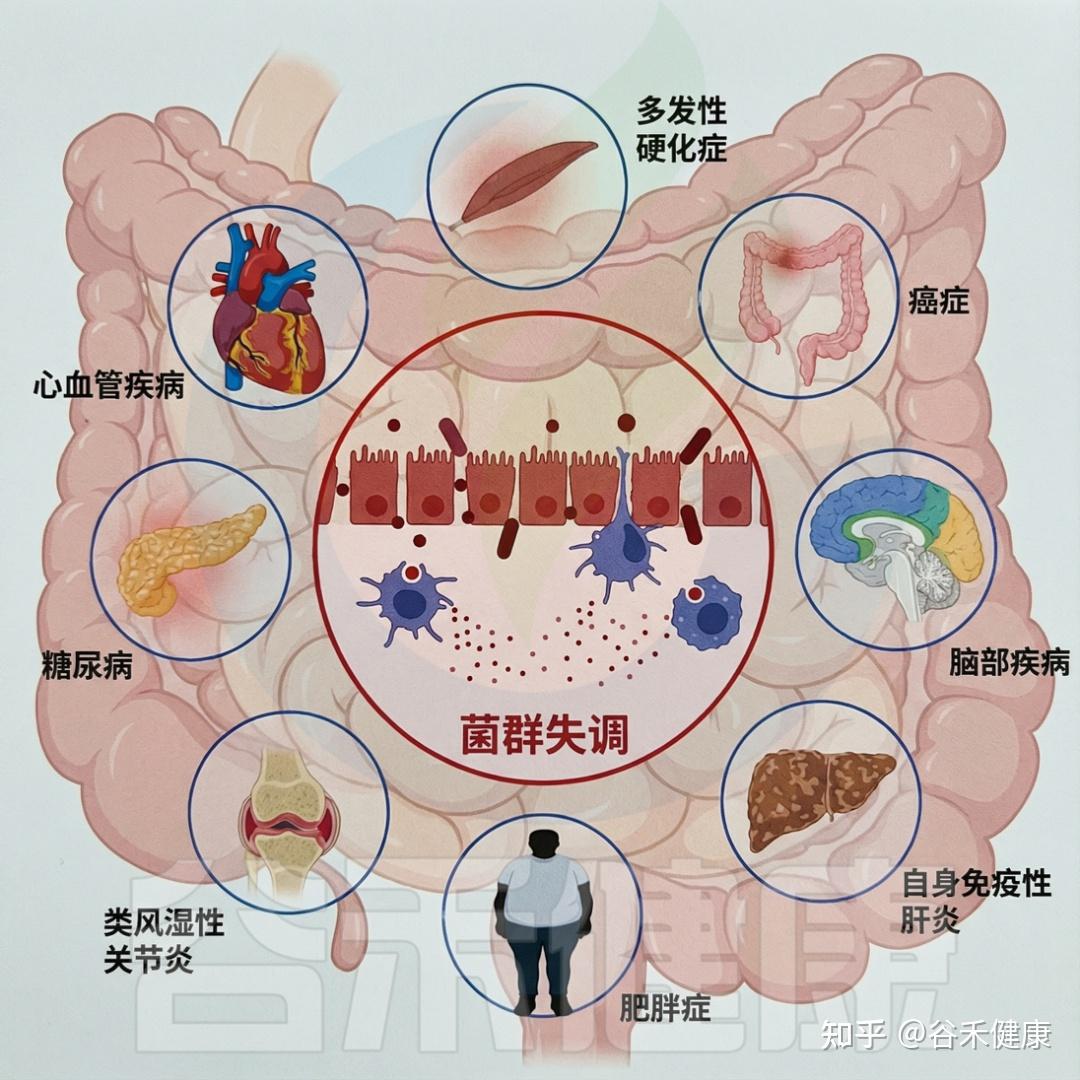
研究表明,有机污染物(OP)可扰乱肠道微生物群的平衡和功能,引发菌群失调、炎症,并增加多种疾病风险。
常用除草剂草甘膦(GLP)是其中一例,农产品中常可检出。GLP 暴露会降低动物和人群中的肠道微生物群多样性。研究发现,接触 GLP 会减少双歧杆菌、乳杆菌等有益菌,同时增加梭菌等潜在有害菌。
此外,多氯联苯(PCB)和多溴联苯醚(PBDE)等工业化学品也被证明与肠道微生物群变化相关,PBDE 暴露可导致变形菌增加、拟杆菌减少,引发菌群失调和炎症。
生态失调会导致各种不良的健康结果
DOI:10.1201/9781003489221-7
▸ 有机污染物损害肠屏障、诱发肠炎
有机污染物(OP)还可能损害肠屏障完整性,屏障受损后,微生物产物和毒素更易进入血液,引起炎症,并促进炎症性肠病(IBD)和代谢综合征(MS)等疾病的发生与进展。
同时,OP 还能干扰宿主–微生物互作,打破有益菌与致病菌平衡。空气污染及烧烤、熏制食品中的多环芳烃(PAH)可改变肠道菌群对胆汁酸的代谢,引发失调和炎症。
有机磷杀虫剂与短链脂肪酸(SCFA)异常相关,而 SCFA 对肠道和免疫功能至关重要。长期 OP 暴露可致轻度慢性肠炎,促炎因子和免疫活性升高,进一步加剧菌群失调。研究还发现,多氯二苯并二恶英(PCDD)、多氯二苯并呋喃(PCDF)等工业污染物同样可诱发肠炎并改变特定菌群数量。
▸ 肠道微生物群能改变有机污染物毒性
另一方面,肠道微生物群也可通过多种酶促途径调节有机污染物的毒性。肠道微生物能够将有机磷转化为性质不同的代谢物,其毒性可能升高或降低。
研究显示,肠菌产生的酶可将多环芳烃分解为毒性较低或更易清除的形式。例如,部分梭菌属菌株可将致癌多环芳烃苯并[a]芘(BaP)转化为危害较小的羟基化代谢物;肠道微生物群来源的细胞色素 P450 单加氧酶可氧化多环芳烃,生成具有不同生物效应的代谢物。
对于以高毒性和持久性著称的多氯联苯 (PCB),肠道微生物群能通过还原脱氯途径促进其代谢,即逐步去除分子上的氯原子。厌氧菌 Dehalococcoidesspp. 已被证实可催化 PCB 脱氯,将高度氯化同系物转化为毒性较低或近乎无毒的产物。类似的微生物过程会影响 PCB 在机体内的生物利用度和实际危害。
▸ 假单胞菌、芽孢杆菌等可减轻有机污染物毒性
肠道细菌还可通过水解与解毒过程分解有机污染物(OP)。假单胞菌(Pseudomonas)、芽孢杆菌(Bacillus)等可产生有机磷水解酶,切断 OP 分子中的磷酸酯键,促进其在胃肠道内的解毒和清除,从而减轻对宿主的毒性。
此外,三氯乙烯(TCE)、四氯乙烯(PCE)等常见于受污染地下水和土壤的氯代溶剂,也可被肠道微生物群通过还原脱氯及其他酶促反应代谢。Dehalococcoides spp. 含有还原性脱卤酶,可去除 TCE 和 PCE 中的氯原子,将其转化为毒性更低的乙烯和乙烷。此类微生物转化过程对环境中氯代溶剂的自然衰减至关重要。
▸ 有机污染物对肠道健康的影响
大量研究表明,不同有机污染物可干扰肠屏障,损害胃肠道健康。
▸ 削弱肠道屏障,上调炎症因子
双酚 A (BPA) 暴露可通过改变紧密连接蛋白的表达和分布削弱肠屏障,而紧密连接蛋白对维持上皮完整性至关重要。
多氯联苯 (PCB)暴露则可诱导氧化应激和肠壁炎症,破坏屏障功能。进一步证实,PCB 同系物混合暴露会提高小鼠肠通透性,并伴随上皮促炎细胞因子增加及 NF‑κB 通路激活。
多种广泛存在于工业和消费品中的化学物质也被证明会影响肠屏障功能。全氟辛烷磺酸(PFOS)暴露会提高小鼠肠通透性,并伴随紧密连接蛋白减少和炎症因子上调。邻苯二甲酸二(2‑乙基己基)酯(DEHP)暴露会增加大鼠肠通透性,与 occludin 和 ZO‑1 表达下降及肠黏膜活性氧升高相关。
▸ 有机污染物会诱发或加重胃肠道疾病
有机污染物(OP)可通过干扰多种胃肠生理过程诱发或加重胃肠道疾病,并参与炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌(CRC)的发生发展。
其主要机制包括影响肠道屏障、免疫调节及炎症。双酚A(BPA)暴露会破坏肠屏障并诱导肠黏膜炎症;动物实验表明,多氯联苯(PCB)可增加肠通透性和免疫细胞浸润,从而加剧肠炎并可能触发 IBD。OP 还可通过影响肠蠕动、内脏高敏和免疫反应与 IBS 相关:草甘膦 (GLP)暴露会扰乱肠道微生物群并在动物中诱导内脏高敏;全氟化合物(PFC)则与肠蠕动改变和内脏疼痛有关,提示其可能参与IBS发病。
▸ 调节肠道微生物以解毒有机污染物
肠道微生物群参与药物、环境污染物和膳食成分的代谢与清除,在解毒过程中至关重要。其与外源物之间的复杂相互作用依赖多种微生物酶和代谢途径,对维持宿主健康具有关键意义。
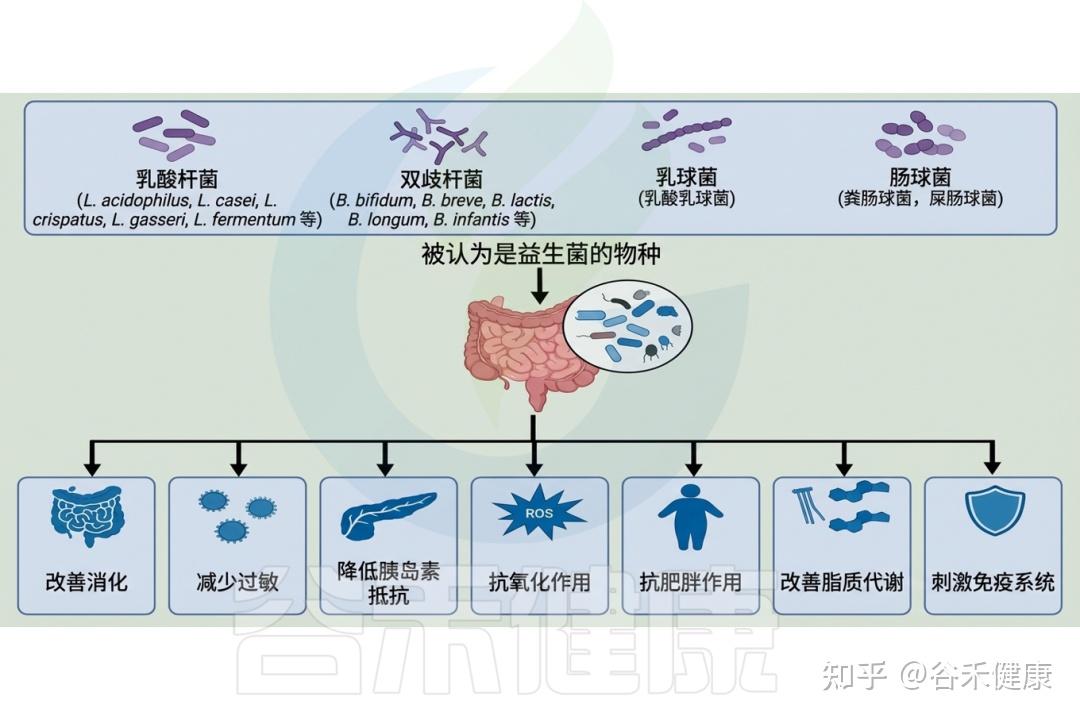
已经提出了几种方法来调整肠道微生物群以增强其解毒能力,包括饮食改变以及益生菌和益生元的使用。
▸ 纤维、多酚和发酵食品的摄入增强肠道菌群的解毒作用
一种策略是通过饮食干预促进有利于解毒的有益肠道菌群。研究表明,膳食纤维、多酚和发酵食品有助于维持肠道微生物群平衡并增强解毒功能。
高纤维、低脂、以植物性食物为主的饮食可促使肠道微生物群朝有利方向改变,如增加产丁酸菌、减少潜在有害菌,并与炎症标志物下降和代谢健康改善相关,从而可能提升机体排毒能力。
富含多酚的食物同样可以调节肠道微生物群并提高解毒潜力。研究发现,补充富含多酚的葡萄提取物可显著增加双歧杆菌和乳杆菌等有益菌,并改善代谢指标和氧化应激标志物,提示解毒能力增强。
▸ 补充益生菌和益生元改善代谢解毒能力
益生菌是活微生物,足量摄入可带来健康益处,而益生元是不可消化的膳食纤维,专门促进肠道有益细菌的生长。研究显示,益生菌补充剂对异生素代谢和解毒有积极影响。
研究发现,给大鼠补充益生菌植物乳杆菌可通过增加粪便排泄帮助去除镉和铅等重金属。另外,添加益生元也能改变肠道微生物组成并增强解毒能力。例如,菊粉作为益生元纤维的添加使益生菌增多,潜在有害菌减少,进而改善代谢指标和炎症标志物,解毒能力提升。
益生菌的干预显示出积极作用
DOI:10.1201/9781003489221-7
▸ 粪菌移植促进解毒和改善健康
此外,粪便微生物群移植(FMT)是一种新兴方法,用于调整肠道微生物组并提高解毒能力。FMT 通过将健康供体的粪便转移到受者体内来恢复健康的微生物组成。研究探索了 FMT 在促进解毒和改善健康方面的潜力。
FMT 也能改变肠道微生物组成,并缓解炎症性肠病(IBD)患者的症状,显示其在疾病状态下促进解毒的前景。
▸ 微生物衍生的酶和代谢物作为潜在治疗剂
微生物衍生的酶和代谢物作为潜在治疗剂也展现了改善解毒的潜力。微生物产生的酶,如葡萄糖醛酸酶和硫酸酯酶,对分解结合代谢物和帮助清除体内异生物质至关重要。
研究表明,添加微生物葡萄糖醛酸酶能促进癌症患者的新陈代谢并增强化疗效果。此外,短链脂肪酸及次级胆汁酸等微生物代谢物可影响宿主的代谢和免疫功能,从而影响解毒过程。例如,短链脂肪酸显著调控肝脏内药物代谢酶的表达与功能,有助于改善解毒和药物清除。
小结
有机污染物(OP)和肠道微生物群之间的复杂关系突显了环境毒理学和人类健康的重要性。该领域的研究揭示了 OP 破坏肠道微生物群和影响宿主生理机能的不同方式。这些机制包括微生物组成的变化、肠道屏障功能的紊乱、炎症反应的触发以及解毒过程的调整。 OP 会加重肠道炎症,破坏代谢平衡,并通过影响肠道微生物群在慢性疾病的发展中发挥作用。
研究有机污染物和肠道微生物群是一个结合了环境毒理学、微生物学和人类健康的动态领域。通过了解背后的机制及其对健康和环境可持续性的影响,研究人员可以帮助创建新方法来降低有机污染物风险并保障公众健康。这一领域的进一步探索对于解决有机污染物带来的复杂问题并加深我们对其对人类健康和环境影响的理解至关重要。
5
铅与肠道微生物群
重金属(HM)如汞、铅、镉在环境中广泛存在,并因其毒性而备受关注。铅(Pb)是一个非必需重金属,常见的环境污染物,对人类健康构成重大风险。
▸ 铅的存在情况及危害
研究表明,城市土壤中的铅浓度通常高于环境背景值,范围在100至1000毫克/千克。一项研究发现,经济地位较低和中等的国家儿童的平均血铅含量(0.84 µg/dl)更高,其中埃及为6 µg/dl、印度为5.46 µg/dl、中国为3.71 µg/dl。即使是极低水平(2 µg/dl)的铅暴露也对健康构成威胁,因此需进一步减少铅暴露。
▸ 铅会对神经、消化、免疫等产生危害
铅接触对社会影响深远,可能导致多种疾病,特别是对儿童的神经系统和认知发展造成严重危害。铅中毒可引发神经、血液、心脏、消化、免疫和肾脏等系统的问题。
学术研究表明,铅暴露显著提高死亡率。与其他重金属一样,铅的毒性与其对靶器官的影响密切相关。研究发现,铅可降低免疫反应、增加氧化应激和炎症,并导致金属稳态失调。此外,铅还可能干扰激素功能。尽管铅危害已知,但其中毒机制仍需进一步研究。
▸ 铅对肠道微生物群的改变
▸ 短期接触铅就会显著影响肠道菌群,代谢表达下降
短期接触铅可以直接影响肠道菌群。在一项初步研究中,口服铅两周的成年大鼠肠道微生物群中乳糖阴性大肠杆菌显著增加。
斑马鱼在暴露于30 µg/L铅7天后,其肠道微生物群发生显著变化,包括厚壁菌门和拟杆菌门显著增加,梭杆菌门和变形菌门减少,以及微生物丰度和种类的变化。
其他肝脏代谢组学研究发现与葡萄糖、脂质、氨基酸和核苷酸代谢相关的41种代谢物变化。通过饮水接触500 mg/kg铅14天后,糖酵解和脂质代谢相关基因(如Gk、Aco、Acc1、Fas、Apo和Dgat)的表达持续下降。
铅暴露对肠道微生物群的影响
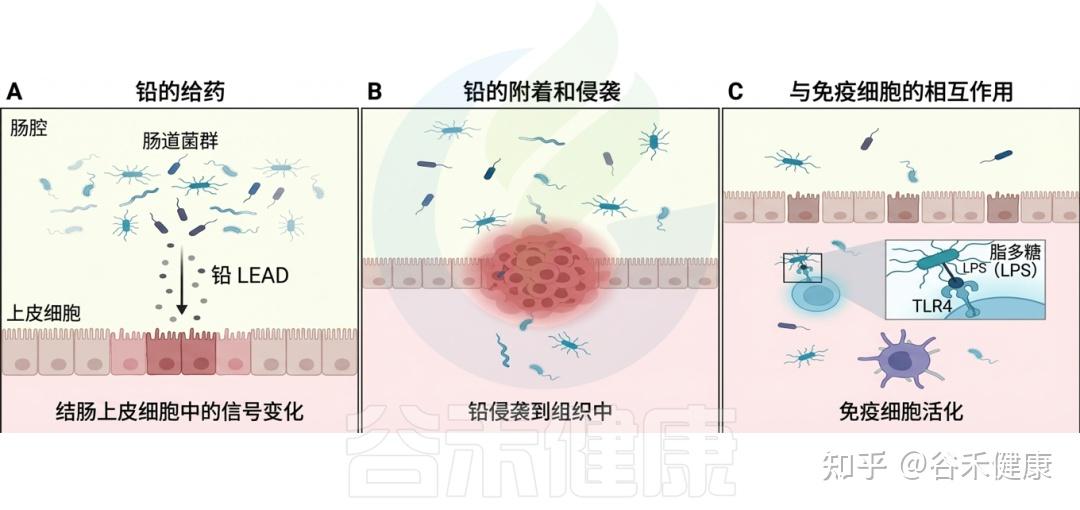
DOI:10.1201/9781003489221-9
▸ 厚壁菌与拟杆菌比例上升
相较于急性铅暴露,长期铅接触较为少见,但会改变细菌的丰富度和多样性,可能导致肠道微生物群失调。
接触铅可能导致厚壁菌门与拟杆菌门的相对比例(F/B比)上升,厚壁菌门的优势显著增加,而拟杆菌门则相对减少。研究表明,高F/B比与肥胖和脂质代谢疾病密切相关。
▸ 铅接触减少了乳球菌、肠杆菌、阿克曼菌等
早期接触铅影响了六个分类群:乳球菌属、肠杆菌属和柄杆菌目(Caulobacterales)减少,而脱硫弧菌科、Barnesiella和梭状芽胞杆菌XIVb增加。脱硫弧菌将胆碱转化为三甲胺(TMA),后者在肝脏氧化为TMA N-氧化物(TMAO),与结肠癌和心血管疾病相关。
同年发现,在同一浓度和时间下,小鼠出现肾脏和肝脏结构与功能的改变以及认知能力下降,Lachnospiraceae_NK4A136_group显著增加,螺杆菌种群减少。
铅暴露后,微生物组的变化在前四周更为明显,研究人员推测那时肠道菌群处于铅敏感阶段。铅接触显著减少多种微生物,同时长期铅接触加重胃痛,降低瘤胃球菌科的比例,可能加重胃肠不适,且阿克曼氏菌显著下调,已与结肠炎相关。这些变化与肠道炎症和其他胃肠疾病密切相关,例如某些颤杆菌属(Oscillibacter)的戊酸可能与胃肠问题负相关,而某些毛梭菌(Lachnoclostridium)则促进次级胆汁酸的产生。
健康微生物群与受铅暴露影响的患病微生物群
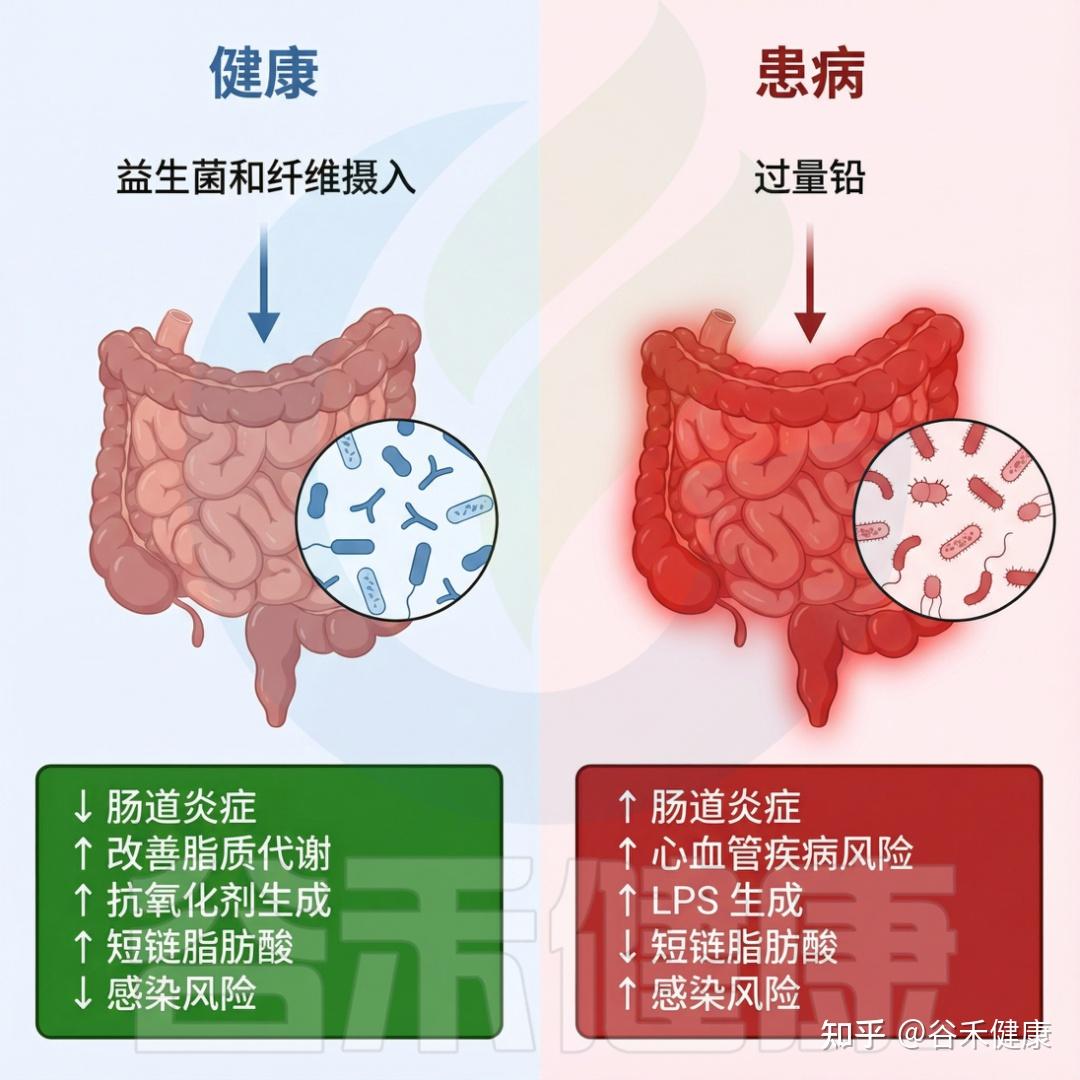
DOI:10.1201/9781003489221-9
▸ 铅对肠道微生物群相关代谢的改变
▸ 维生素E和胆汁酸浓度失衡
研究人员采用多组学技术分析了暴露于10 ppm铅4周和13周的C57 BL/6小鼠的微生物组和代谢特征,结果显示铅暴露显著改变了微生物的代谢过程,包括能量代谢、氧化应激、维生素E及胆汁酸的变化以及防御/解毒机制。
共鉴定出1314种显著变化的分子特征,其中维生素E和胆汁酸浓度失衡。暴露于铅的小鼠胆固醇及其相关物质显著减少。
▸ 增加一氧化氮生成
在正常与异常胃肠道功能中,一氧化氮(NO)起到关键作用。铅暴露还可能引起编码铜亚硝酸还原酶的基因过度表达,从而增加肠道菌群中一氧化氮(NO)的生成。
核磁共振 (1NMR) 研究显示,饮用水中添加0.1 mg/L铅15周后,小鼠盲肠中15种代谢物水平显著变化,如4-胍基丁酸、胆碱和谷氨酸等增加,而β-半乳糖、苯丙氨酸等则减少。这些变化可能影响三羧酸循环、氨基酸代谢和宿主的能量代谢。
▸ 脂质代谢紊乱
有趣的是,铅处理后的小鼠肝脏显示出脂质代谢基因的剂量依赖性上调,包括参与新脂肪酸合成和转运的基因。暴露于铅八周的小鼠粪便中短链脂肪酸如丙酸、丁酸和醋酸盐的浓度显著降低,这可能与脂质代谢紊乱相关。
这些发现与早期研究一致,表明铅接触可能导致肠道微生物群及其代谢产物发生失调,从而影响宿主的代谢过程。
▸ 铅对肠道屏障的影响
铅暴露显著影响了肠道的结构和屏障功能。扫描电子显微镜显示,小肠表面绒毛不均匀,并出现大片退行性病变,有时缺乏肠上皮细胞微绒毛。
▸ 肠道屏障和通透性显著受损
铅几乎完全保留了与肠道屏障功能相关的ZO-1、Foxp3和Foxo4基因,而与炎症相关的基因(如Il1b、Tnf和Ifng)及抗炎基因(如Tgfb和Il-10)的表达显著下降。
在人类细胞模型中,进一步研究显示跨上皮电阻降低。口服高剂量(1 g/L)铅八周后,小鼠的肠道屏障和通透性显著受损,紧密连接(TJ)相关mRNA(ZO-1、claudin-1和occludin)表达下调,瘤胃球菌增多,Turicibacter减少。
▸ 紧密连接受损,微绒毛收缩
研究还发现,铅暴露使小鼠结肠和小肠中ZO-1、ZO-2、claudin-1和occludin基因表达显著降低。在铅处理后,小鼠的紧密连接mRNA表达进一步下调,尽管其肠道菌群已受损。
此外,长期接触铅对日本鹌鹑盲肠的组织学产生重大影响,导致粘膜脱落、利伯库恩腺损伤和淋巴细胞扩张。透射电子显微镜分析显示超微结构缺陷,包括细胞核固缩、线粒体空泡化和微绒毛收缩。盲肠形状的改变与IFN-γ和IL-2表达水平降低,以及TNF-α、NF-κB和IL-6水平升高相关,并且与粪杆菌和双歧杆菌的减少,以及拟杆菌的增加有关。
▸ 益生菌作为铅对抗治疗策略
铅是重要的有毒金属污染物之一,因此关于使用益生菌作为治疗干预以减少铅中毒的研究不断增多。
▸ 屎肠球菌Pb12能够吸收铅,减少生物体内的积累
研究首先测试了两种屎肠球菌株(Enterococcus faecium)EF031和M74在去除水中铅的能力。据初步研究,粪肠球菌能够有效捕获铅。屎肠球菌 Pb12 的变种是去除环境中铅 (Pb) 的有效菌株。这些细菌能够从鱼类胃肠系统中吸收铅,从而减少组织和器官中铅的生物累积。
▸ 罗伊氏乳杆菌也具有铅去除能力
研究发现,罗伊氏乳杆菌(Lactobacillus reuteri)P16表现出强大的胆汁和酸抵抗力,以及>15%的铅去除率。喂食P16(108 CFU/g)六周,结果显示可改善生长性能,减少组织铅积累,减轻氧化应激等影响。
从发酵食品中分离出的耐铅菌株肠膜状明串珠菌(Leuconostoc mesenteroides)显著降低肝酶水平并恢复部分雄性生殖功能。给暴露于铅的小鼠喂食特定肠道微生物群,结果显示铅去除和紧密连接蛋白表达增加。
▸植物乳杆菌螯合铅并减少损伤
植物乳杆菌CCFM8661能螯合铅并保护小鼠免受氧化应激。该菌在后续研究中显著降低鱼类的血红细胞核异常,提高铅引起的免疫状态。
综上所述,益生菌可能预防铅中毒,并通过改变肠肝循环、增加胆汁流量及谷胱甘肽的产生,促进胆汁和粪便中铅的排泄。使用FXR激动剂时,这种效果显著减弱。膳食补充剂中的益生菌及其他成分也可能提高抗铅效果,并帮助恢复铅暴露小鼠的记忆和学习能力。
小结与未来展望
近期研究显示,胃肠道中的铅对肠道有直接或间接影响。铅中毒损害肠上皮、紧密连接、免疫功能并引发炎症,导致大分子渗透增加。此外,铅暴露可能导致肠道微生物群失调,破坏肠道屏障,影响微生物多样性和代谢物,导致内毒素血症。
一些研究显示益生菌可能有效解毒和治疗铅中毒,但大多数研究关注铅对微生物种群的整体影响,而非特定菌株。因此,需要更深入的宏基因组和代谢组研究,以了解重要细菌对肠道和其他器官的影响。铅对消化道和其他器官的毒性尚不明确,特别是其对脂多糖和其他微生物副产物的影响,还需探讨益生菌减少铅暴露的机制。
▸ 汞污染及其各种来源
汞是全球普遍存在的污染物,存在多种形式,包括元素汞(Hg)和无机汞(Hg+和Hg2+)。
▸ 食物中的汞污染
食品中的汞污染是一个严重问题,尤其是在工业活动造成环境污染的地区。许多人喜欢食用鱼,而鱼类可能通过生物累积过程储存汞。
此外,作为全球许多人主食的大米,可能是在汞污染的土壤中种植,从而导致汞在谷物中积累。
▸ 药物、环境中的汞污染
含汞药物也增加了汞暴露的风险,尽管低于食品中的汞。过去,牙科汞合金、抗菌霜及其他药物中均含有汞。尽管由于其毒性,药品中使用的汞量有所减少,但它在某些补充和替代医疗中仍然是重要的接触源。
此外,空气中汞沉积在土壤中,一些细菌将其转化为甲基汞,植物吸收后使汞进入食物链,这使得汞更容易从土壤迁移到植物,并最终传递到更高级别的动物中。
▸ 汞的毒性及危害
汞是已知的环境毒素之一,对人类健康产生复杂的负面影响,尤其是对肝脏、肾脏和中枢神经系统。它的毒性源于双重作用,表现为氧化应激增加和对特定器官系统的集中攻击。
汞对肠道屏障、微生物紊乱等的影响
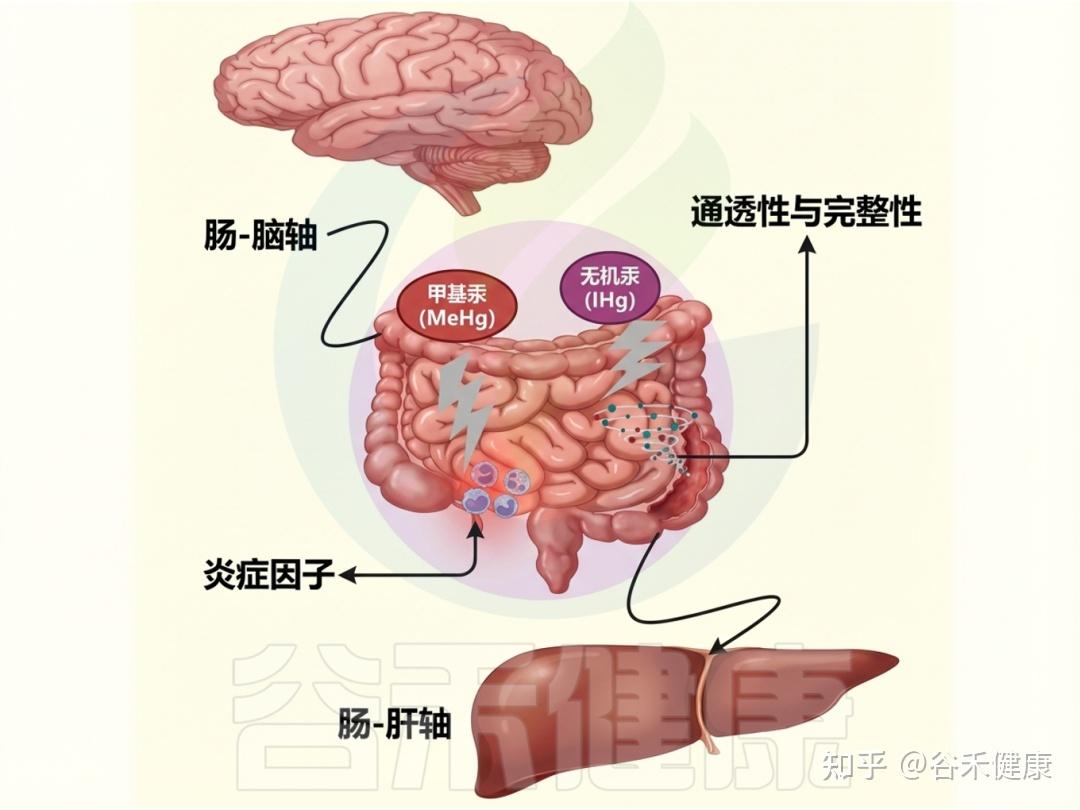
▸ 氧化损伤:汞损害身体的主要方式
汞对身体有害的主要方式之一是引起氧化应激。当元素汞和无机汞相互作用时,会产生活性氧(ROS),如超氧自由基和过氧化氢。当这些活性氧水平过高时,将压垮人体的抗氧化防御系统,导致脂质、蛋白质和DNA的氧化损伤。
汞造成的氧化损伤广泛影响细胞结构,导致膜不稳定和细胞功能障碍。蛋白质的氧化改变了多种生理过程,而氧化应激诱导的DNA损伤则可能引起突变。
▸ 器官特异性毒性:汞的不同目标
汞对某些器官也有独特的影响。汞中毒影响的主要器官是肝脏、肾脏和中枢神经系统。
肝脏作为解毒中心,汞在进入循环系统后通常积聚于此。肝脏尝试清除汞,导致氧化应激增加,长期接触可能损害肝功能并增加肝毒性风险。
肾脏在过滤血液中的汞时,可能会受到损害。无机汞在肾脏组织中的积累会导致肾毒性,干扰其过滤和重吸收功能,进而损害肾功能。
汞的神经毒性特别影响中枢神经系统,因其能穿过血脑屏障。甲基汞的神经毒性尤为明显,影响整体神经健康、运动能力和认知功能。与汞接触相关的神经系统症状部分源于神经递质途径的破坏及炎症激活。
▸ 肠道微生物群影响汞的作用
▸ 微生物基因簇影响汞转化
某些基因簇(如hgcAB和mer操纵子)决定了肠道微生物群在汞转化中的作用。hgcAB基因簇促进无机汞(IHg)转化为甲基汞(MeHg),而mer操纵子(包括merA和merB基因)则将MeHg去甲基化还原回IHg。
肠道中汞生物转化的复杂过程
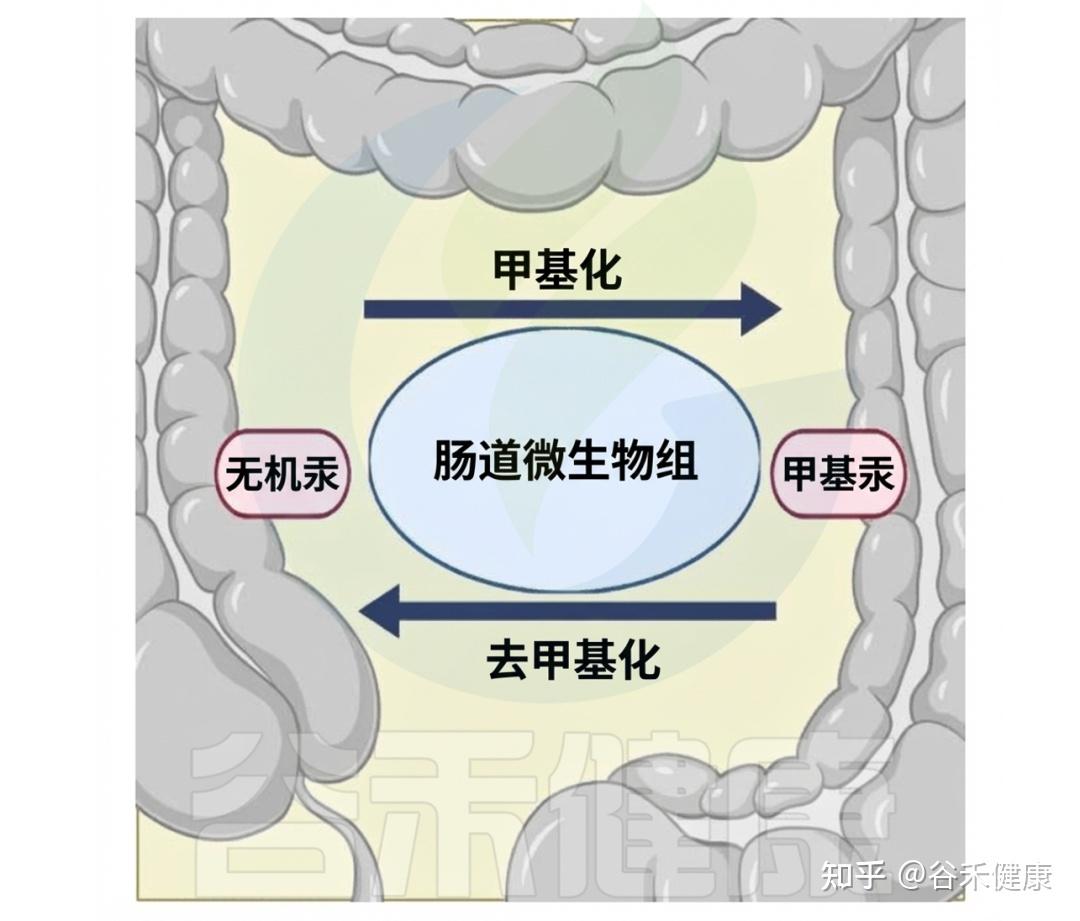
这些基因簇作为微生物工具,使肠道微生物能够参与汞的复杂变化,其丰度因接触汞而增加,显示出微生物群落的适应性和在肠道汞循环中的重要性。
▸ 影响汞的毒性和生物利用度
肠道微生物群在汞代谢中不仅限于甲基化和去甲基化,还积极改变汞的化学形态,影响生物体的命运。与汞暴露相关的毒理学后果受到微生物群调节汞形态能力的影响。同时,新的研究揭示了汞引起的肠道功能障碍与肠道菌群之间的复杂相互作用,为健康后果提供了新见解。
汞与肠道微生物群的最新研究
▸ 肠道菌群有助于减少汞的吸收和解毒
最新研究发现,肠道细菌在汞的解毒与生物转化中发挥关键作用,可能影响体内的汞形态和生物蓄积。有研究指出可利用人胃中的细菌减少对有害金属如汞的吸收,但两者之间的关系仍需进一步探讨。
益生菌可表达一种酶,将易吸收的汞形式转化为难以吸收的形式,为减少人类接触汞提供了可能的策略,尤其对于弱势群体。此外,研究中还显示,改变肠道微生物群(如通过抗生素或粪便微生物群移植)可以减轻汞暴露引起的肝脏损伤,并展示了汞暴露如何影响肠道微生物的多样性和构成,导致肝脏铁死亡(一种受控细胞死亡过程)。
▸ 汞的接触改变了肠道微生物群的组成
此外,汞暴露显著影响肠道菌群。一项研究显示,湿地植被的存在促进了汞的甲基化,而无植被沉积物中甲基汞的生成与微生物组变化有关。研究还表明,肠道微生物群的去甲基化能力可能受到汞暴露水平和来源的影响,且某些细菌如脱硫弧菌和产甲烷菌可能对肠道甲基汞去甲基化有所贡献。
重金属如汞的接触改变了肠道微生物群的组成,病原菌如气单胞菌(Aeromonas)数量显著增加。这表明健康、肠道微生物群以及重金属暴露之间可能存在密切联系。
坦桑尼亚的一项研究探讨了补充益生菌的酸奶是否能降低幼儿和孕妇的重金属,尤其是汞的含量,结果表明,益生菌酸奶能够防止汞含量上升,从而证明其减少重金属暴露负面影响的潜力。
这些发现强调了肠道微生物群与重金属(如汞)之间复杂而相互的关系,以及益生菌和其他疗法可能减轻重金属暴露负面后果的前景。
镉是一种有毒重金属,来源于自然和人为因素,其渗透到环境中对人类健康构成潜在威胁。
▸ 镉的来源和健康危害
作为一种广泛存在的环境污染物,这种重金属普遍存在于沉积物、溪流水和土壤中。中国同样面临镉暴露问题,在大米中检测到较高的镉含量。
▸ 镉会导致糖尿病、心血管疾病、慢性肾病等
镉与多种严重健康问题相关,包括癌症、糖尿病、心血管疾病、慢性肾病、骨质疏松、肝病和不良的神经发育结果。
研究估计,高浓度镉暴露可导致死亡率增加17%,突显了解决这一环境挑战的紧迫性。历史上,对镉影响健康的研究主要关注与接触相关的有害结果,包括金属动态失衡、氧化应激、炎症、内质网应激和基因组不稳定等问题。
镉毒性的影响
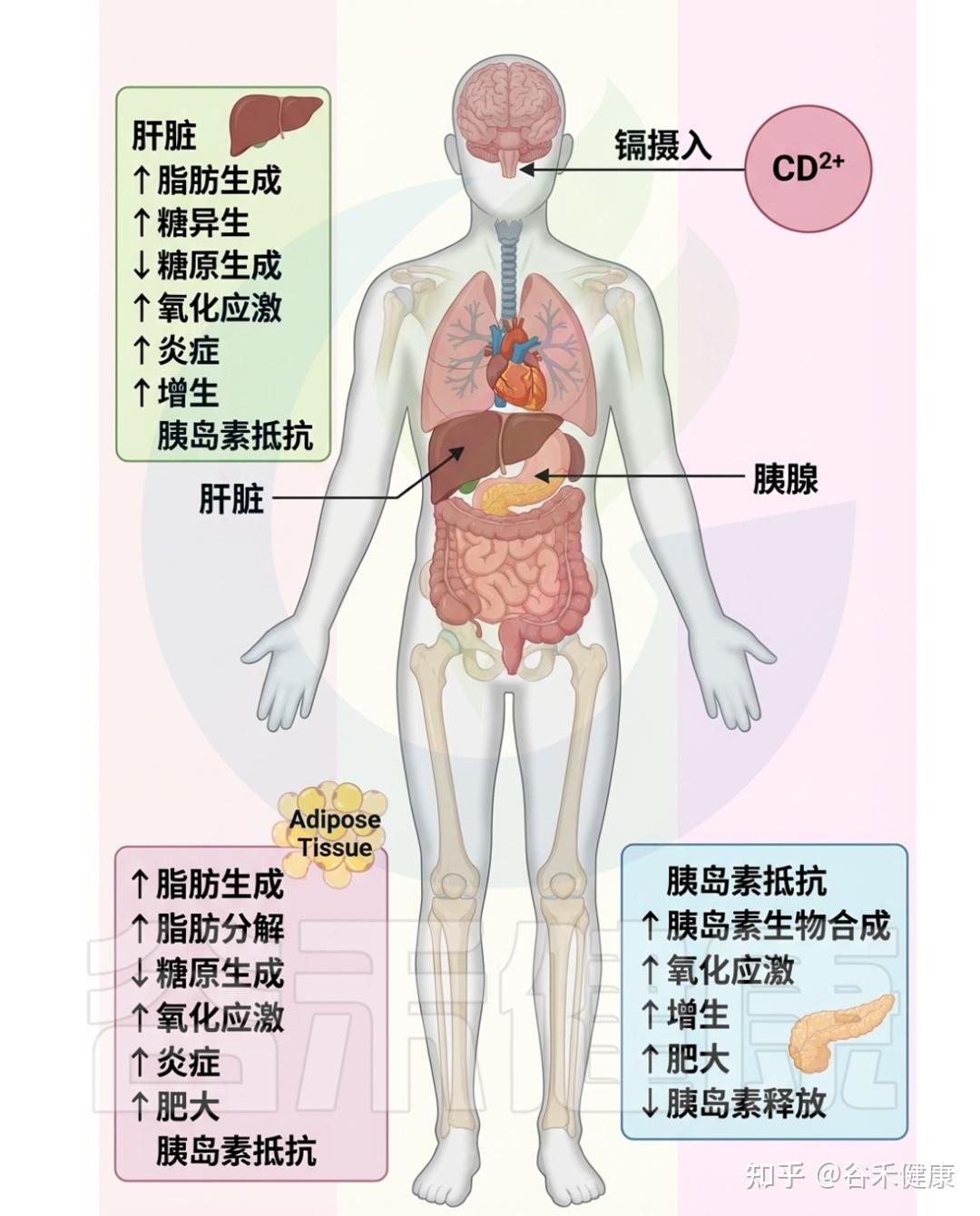
▸ 导致锌、铜等微量元素的失衡
在细胞水平上,镉破坏金属稳态,导致锌和铜等必需微量元素的失衡,主要通过与这些金属竞争结合运输蛋白而实现。这种不平衡损害细胞功能,并引发各种健康问题。
▸ 损害脂质、蛋白质和DNA等细胞成分
从分子层面来看,镉诱发氧化应激,表现为活性氧(ROS)产生与机体对其的清除能力之间的不平衡。镉刺激超氧自由基和过氧化氢等的生成,损害脂质、蛋白质和DNA等细胞成分,导致细胞功能障碍,并激活与炎症和细胞凋亡相关的信号通路。此外,镉还会引发内质网应激,破坏其蛋白质折叠能力。
▸ 增加遗传突变风险,干扰正常内分泌
镉还与基因组不稳定性相关,影响细胞遗传物质的完整性,增加DNA损伤和突变的风险,从而可能导致癌症的发生。此外,镉还充当内分泌干扰物,模仿激素作用并扰乱正常内分泌功能,尤其在生殖和发育过程中影响显著。
总的来说,镉毒性对细胞和分子的影响表现为金属稳态破坏、氧化应激、内质网应激、基因组不稳定性和内分泌干扰。这些复杂机制共同导致与镉暴露相关的各种不良健康结果,反映出其多方面的毒理学影响。
▸ 镉与肠道微生物群的互作
镉的毒性不仅源于直接的细胞相互作用,还涉及肠道微生物群的复杂生态系统。镉一旦摄入,便穿过胃肠道,首先与粘膜内层的多种微生物群接触,可能与产生粘蛋白的杯状细胞相互作用。这些相互作用可能损害肠道屏障的完整性,促进镉向肠道深层的转移。
▸ 镉会诱导氧化应激扰乱肠道微生物平衡
镉诱导的氧化应激能扰乱肠道微生物群的平衡,促进某些细菌生长并抑制其他细菌繁殖。它还倾向于与酶和关键蛋白质的巯基结合,这种结合影响微生物的结构与功能,从而可能中断重要的代谢途径和营养循环。
▸ 镉还会通过肠道微生物群影响免疫功能
镉的影响还延伸至肠道微生物组的免疫调节功能,微生物群与免疫系统的相互作用对维持对病原体的有效反应至关重要。镉引起的微生物组成变化可能触发免疫反应,导致炎症加剧肠道疾病。因此,深入理解镉与肠道微生物组成的复杂相互作用非常重要。
▸ 镉暴露导致乳杆菌、梭状芽胞杆菌等减少
对不同年龄实验动物的研究发现,短期和长期镉暴露都会显著影响肠道微生物组的生理。暴露于镉42天的成年大鼠消化道中的需氧和厌氧乳酸菌均显著减少。镉在属和科水平上引起了肠道微生物群的特殊变化,例如,在饮用水中接触镉45天的小鼠中,
蜡样芽孢杆菌、乳杆菌、梭状芽胞杆菌和大肠杆菌数量显著减少,并呈剂量依赖性。而八周镉暴露则以剂量依赖的方式增加小鼠盲肠中放线菌的相对丰度,但对拟杆菌门和厚壁菌门的影响未达到统计显著性。
在盲肠菌群的科水平上,Coriobacteriaceae和Lactobacillaceae的相对数量以剂量依赖性方式增加,而Lachnospiraceae的百分比下降。尽管在镉暴露的小鼠中,粪便微生物的变化不那么明显,但Odoribacter和Alistipes属的相对丰度显著增加。
注:镉引起的微生物群变化在初期四周更为明显。由于无菌动物不易表现出促炎反应,观察到的NF-kB激活和促炎细胞因子的产生至少部分依赖于镉诱导的肠道微生物群改变。
▸ 镉还影响短链脂肪酸和细菌蛋白的表达
从三周开始,增加剂量的镉显著减少了肠道细菌数量及厚壁菌门与拟杆菌门的比例。乳杆菌的显著降低仅在三周后出现,而双歧杆菌的数量在一周后便开始下降。同时,TNF-α合成增加,伴随与短链脂肪酸(SCFA)相关的基因变化。
研究还表明,镉暴露降低了粪便中的短链脂肪酸含量。除了影响肠道生物多样性,短期镉治疗也对肠道微生物组功能产生影响。研究显示,接触镉后15分钟内,细菌蛋白质组发生显著变化,表明对镉暴露的反应可能与肠道微生物群中蛋白质表达的独特变化有关。
早期体外研究也表明,镉影响整体基因表达,尤其是在能量代谢、转运、细胞周期和结合蛋白基因的表达上,镉暴露后0、5、15和25分钟,相关基因的表达均有所上升,可能涉及脂多糖的生产或运输。
长期低剂量镉(Cd)暴露的影响
这些发现说明,镉几乎立即影响肠道微生物群。婴儿期低剂量镉暴露也显著改变肠道微生物群的数量和种类。在八周龄接触镉的雄性小鼠中,拟杆菌数量显著增加,而厚壁菌相应减少,双歧杆菌和普雷沃菌的数量下降幅度最大。
此外,接触镉的动物体内的粘液鞘氨醇单胞菌(Sphingomonas)数量明显增加,并与较高的肥胖程度相关。另一项研究显示,暴露于镉的五周大雄性小鼠的盲肠厚壁菌门显著降低,而拟杆菌门和g-变形菌门未显著下降。这些变化可能与肝脏能量平衡基因的改变有关,进而影响脂肪酸的生产和运输。
总体上,由于拟杆菌门丰度的增加及厚壁菌门数量的减少,多项研究表明这二者的比率显著上升。有关镉暴露对特定细菌群体影响的不一致性可能与不同的暴露方案(剂量、持续时间、种类)有关。
▸ 镉与肠道通透性和炎症
▸ 镉破坏肠道屏障,提高肠道通透性
研究表明,镉暴露显著降低肠上皮细胞活力,并损害紧密连接,影响细胞旁通透性。后续研究发现,HT-29细胞单层中紧密连接蛋白分布不均,镉暴露小鼠的结肠和空肠中ZO-1、ZO-2、occludin和claudin-1的mRNA表达显著减少。这些变化与肠道通透性提高相关,导致血液中LPS水平升高。
在Caco-2细胞培养中,镉显著破坏紧密连接,造成细胞间连接损伤,并上调与氧化应激、热休克蛋白和胱天蛋白酶3相关的基因。这验证了Caco-2细胞旁通透性显著增加的研究,伴随HSP70水平升高和坏死病变的存在。此外,镉暴露还导致小鼠血清脂多糖结合蛋白水平升高,且呈剂量依赖性。
▸ 提高炎症细胞因子水平,促使肠道炎症
长期接触镉改变肠道组织学,显示绒毛增厚变短,且伴有融合和坏死区域。肠道乳酸菌数量减少,TNF-α、IFN-γ、IL-1β和IL-17水平升高,导致肠道形态改变。肠系膜淋巴结呈现镉诱导的变化,包括细胞增殖和结构变化。
Caco-2细胞模型表明,镉通过I-kBa降解诱导NF-kB激活,促使肠道炎症反应。镉和脂多糖的联合暴露显著增强了肝损伤,相较于单独暴露,氧化、亚硝化应激和炎症反应加剧。共同暴露也影响一氧化氮的生成,并且镉会替代必需金属(Cu、Zn)。
▸ 高镉暴露还会导致内毒素血症
值得注意的是,高镉暴露与代谢综合征的频率显著相关。研究表明,镉可阻碍细胞中的脂多糖信号传导,抑制巨噬细胞中NF-kB通路,降低对感染因子的抵抗力。
镉诱导的氧化应激可能导致小鼠巨噬细胞反应性失调。在患有结肠炎的小鼠中,镉的接触显示促炎细胞因子表达的剂量依赖性减少。迄今的研究表明,镉可能通过增加肠道通透性来诱发内毒素血症,并提高脂多糖水平。然而,脂多糖与镉之间的关系可能表现出拮抗和协同作用,具体取决于剂量和作用机制。
▸ 益生菌作为镉暴露的治疗策略
大量研究表明,益生菌在镉中毒中发挥显著保护作用,可以缓解肠道菌群失调。
▸ 植物乳杆菌和菊粉等有助于减轻镉引起的损伤
含有凝结芽孢杆菌、植物乳杆菌和菊粉的膳食已被证实能减轻镉引起的肝脏和肾脏损伤。具体而言,富含益生菌的饮食显著减少了镉在肝脏和肾脏中的积累,并降低了血液中ALT、AST、肌酐和尿素的水平。
此外,接受益生菌治疗的镉暴露大鼠中,乳酸菌丰度增加,与观察到的健康改善一致。在暴露于镉的HT-29结肠细胞中,植物乳杆菌显著减弱了镉诱导的炎症反应,减少了TNF-α、IL-1β、IL-6和IL-8的产生。
植物乳杆菌治疗还减少了镉暴露大鼠的内毒素血症、肠道通透性和紧密连接异常,并增强了肾脏和肝脏的抗氧化反应,降低了镉造成的损伤。这些结果促使研究人员认为,与抗氧化疗法相比,益生菌可能是治疗镉中毒的更有效方法。
▸ 益生菌降低了镉的毒性并恢复肠道微生态
值得注意的是,尽管腹腔注射植物乳杆菌对接触镉的动物未能减少器官中镉的积累,但却增强了抗氧化活性并保护组织。含有鼠李糖乳杆菌、嗜酸乳杆菌和长双歧杆菌的益生菌可有效逆转镉诱导的乳酸杆菌和双歧杆菌数量减少,从而显著降低镉的遗传毒性,并减少肝细胞DNA损伤。
此外,益生菌通过与结肠中的金属离子结合,降低其生物可及性,从而对汞暴露产生预防作用,研究发现血液金属浓度下降、粪便中镉水平和乳杆菌含量增加之间存在显著相关性。
在体外模型中,Cd(NO3)2与开菲尔乳杆菌的预孵育显著降低了其对HepG2细胞的毒性。研究表明,益生菌在预防镉中毒方面主要针对镉引起的紧密连接破坏和肠道炎症,此外,添加锌补充剂可能增强益生菌的保护作用。
砷是全球最危险的环境污染物之一,广泛存在于自然环境中,主要来源于地表侵蚀。它与食物、饮水以及空气中土壤和颗粒密切相关,人类活动(尤其是砷采矿和工业使用)进一步加剧了这种污染。
砷化合物对大多数生物构成威胁,长期接触低水平砷也与多种疾病相关。国际癌症研究机构(IARC)已将砷及其无机化合物列为一级致癌物,与皮肤癌、肺癌和膀胱癌密切相关,并且暴露于砷与代谢紊乱、皮肤损伤、糖尿病、心血管疾病等非癌性疾病也有关。
砷存在于多个化学形式中,分别具有不同的毒性和生物可及性,其中As(III)和As(V)是饮用水中最常见的二价和五价形式。
▸ 肠道微生物群对砷的作用
肠道微生物可代谢砷,从而改变其在宿主中的毒性。相反,如果砷导致特定微生物的死亡,则可能削弱它们的保护作用。细菌砷加工的研究主要集中于研究微生物对砷有害影响的“抵抗力”,例如其导致细胞死亡的能力。
▸ 部分肠道细菌具有抗性基因或能编码代谢砷的酶
Ars操纵子是抗性基因簇,最初在大肠杆菌和金黄色葡萄球菌的质粒中发现,后来在多种医学相关病原体中得到验证,如耶尔森氏菌、单核细胞增生李斯特菌和空肠弯曲菌。Ars操纵子还在人类肠道共生体中被鉴定,如枯草芽孢杆菌和普通拟杆菌。
细菌编码的酶能够通过氧化、还原、甲基化和去甲基化过程改变无机和有机砷,这些过程与特定底物相关联。细菌代谢物可能对胃肠道中砷化合物的转化有显著影响。
砷与肠道微生物群间的相互作用
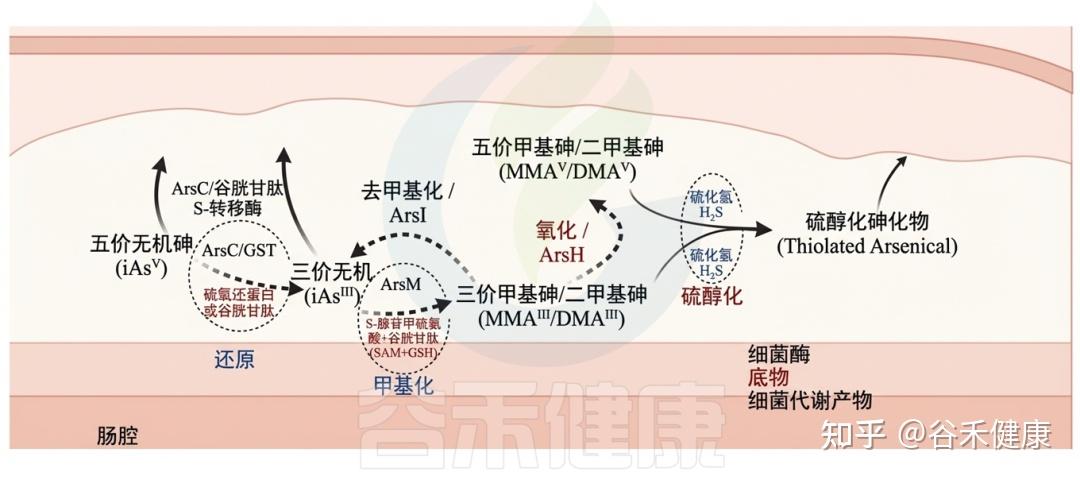
▸ 肠道微生物群能够改变砷暴露水平
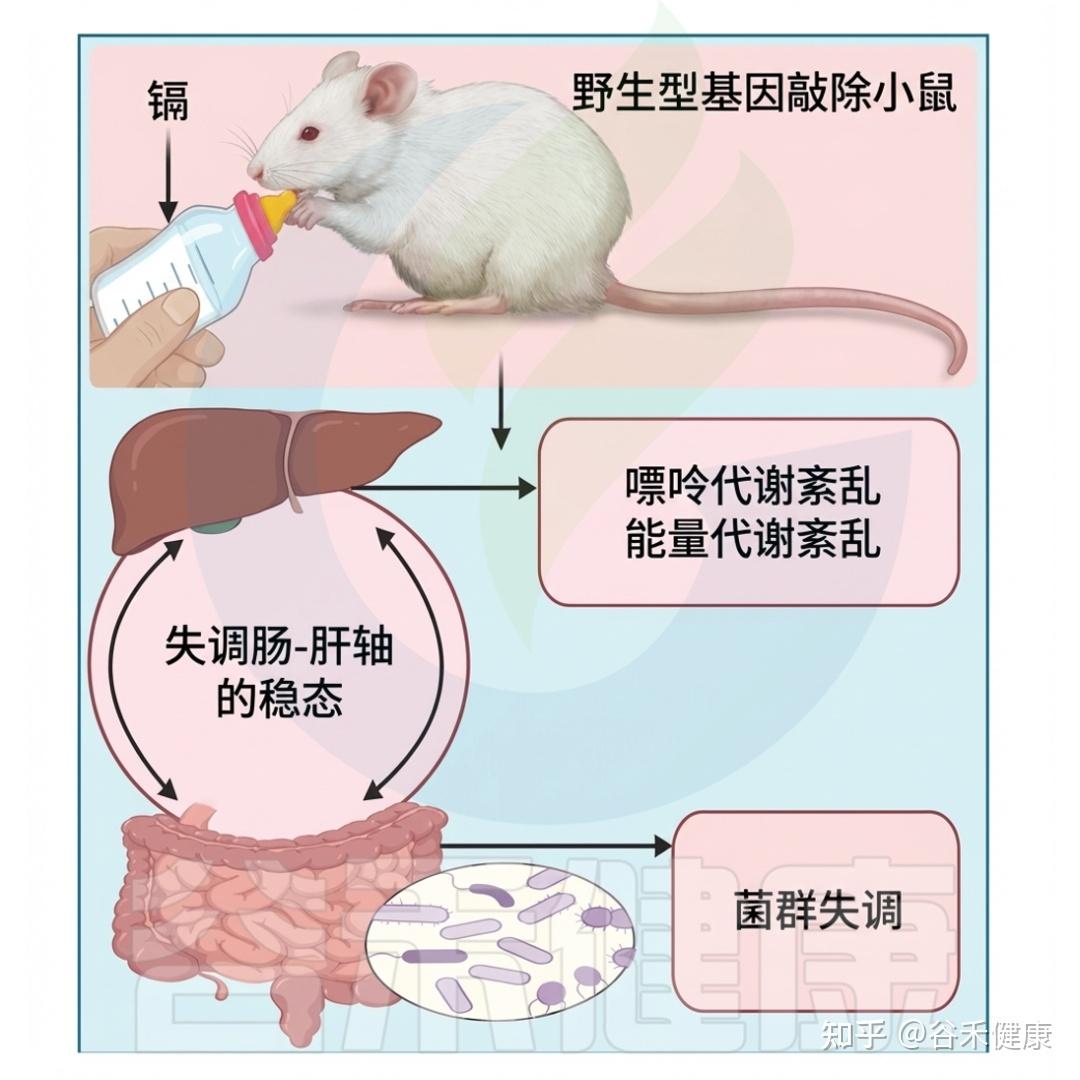
最近的研究表明,大鼠盲肠中的大肠杆菌能够代谢二甲基亚砷酸盐(DMAsV),生成三甲基亚砷酸盐(TMAVO)和一种未确定的砷化合物。研究者还考察了微生物组成员在实验室中的砷吸收。小鼠的微生物组在酶促还原和甲基化无机砷(iAs)的能力方面表现出强大效果。
两项独立研究显示,在模拟人类肠道环境中,微生物群可减少无机砷(iAsV)的浓度并进行甲基化,生成毒性较低的砷化合物。即便在高压灭菌实验对照中,iAsV也仍能转化为iAsIII,这表明非酶机制可能参与此转化。
研究发现,给小鼠服用抗生素会显著减少其粪便中砷的排泄,同时增加其肝脏和肺组织中的砷积累。研究人员推测,抗生素暴露降低了肠道微生物的生物量,从而影响了砷的排泄。其他实验表明,无机砷(iAs)会被吸附到革兰氏阳性细菌的胞外聚合物上,而革兰氏阴性细菌则不然,这可能说明微生物对砷的积累是通过该过程实现的。
▸ 肠道微生物群可降低砷毒性
微生物组的“表型”与宿主内甲基化砷与无机砷比例的变化相关。然而,鲜有研究明确证实微生物组的修饰、变化或缺失与宿主健康之间的直接联系。研究人员使用已人源化且无菌的AS3MT-KO小鼠进行实验,旨在评估微生物组的异质性如何影响疾病结果,特别是死亡率。
研究发现,只有少数细菌始终表现出积极作用(即延长存活时间),这些细菌为人类肠道中一些常见物种。例如,经黏液真杆菌属(Blautia)的两个成员,以及来自毛螺菌科、瘤胃球菌属和粪杆菌科的细菌,与不同供体的生存有强相关性。
▸ 宿主基因决定肠道微生物表型对砷代谢的影响
大量证据表明,个体对砷暴露引发疾病的易感性差异显著,这通常与体内对砷的处理方式不同有关。在此环境中,肠道微生物群对砷代谢及多脏器的全身反应起着直接作用,表明微生物群特征可能影响砷化合物的代谢范围。
然而,宿主遗传学与肠道微生物组如何结合影响砷的生物转化机制尚不明确。我们采用综合方法,将16S rRNA基因测序与HPLC-ICP-MS砷形态分析结合,发现IL-10基因的缺失会显著改变肠道微生物组的组成,从而对砷代谢产生重要影响。
然而,证据表明,保留微生物组的小鼠组比无菌或接受抗生素治疗的小鼠组在砷引起的死亡时间上显著延长。因此,微生物组具有保护宿主免受砷毒影响的潜力。这些发现可能为开发砷中毒的创新治疗和预防方法提供基础。
▸ 砷对肠道微生物群的影响
研究发现砷能够改变肠道微生物群的组成,但其对微生物组功能的影响,尤其是在环境相关剂量下,尚未充分评估。使用16S rRNA测序和宏基因组测序,检查了在100 ppb砷处理下小鼠肠道微生物组的组成和功能。
▸ 影响碳水化合物代谢和维生素合成
结果显示,砷暴露不仅改变了微生物群的组成特征,还导致了α和β多样性的变化。宏基因组分析表明,碳水化合物代谢相关基因的表达显著变化,特别是在丙酮酸发酵、脂肪酸合成和淀粉利用方面。
此外,砷暴露小鼠的肠道微生物群中,脂多糖合成和压力响应基因的表达显著增加,与维生素(如叶酸、维生素B12、B6和K2)合成相关的基因含量也更高。同时,砷治疗后,与药物耐药性和接合转座子蛋白相关的基因表达显著上升。
▸ 破坏胆汁酸的代谢平衡
让 C57BL/6 小鼠的饮用水中砷浓度达到百万分之一 (ppm),目的是检查砷暴露对胆汁酸平衡的影响。研究结果表明,砷暴露导致初级胆汁酸(特别是那些未结合的胆汁酸)发生明显变化,并持续降低血清和肝脏中的次级胆汁酸。
拟杆菌门与厚壁菌门的比例与血流中胆汁酸的浓度相关。目前的研究提供的证据表明,砷暴露引起的肠道微生物群失衡可能会导致受砷影响的胆汁酸调节的破坏。
最终结果显示,即使在适宜的环境砷水平下,仍会破坏肠道微生物组的整体结构并显著改变一些关键的细菌功能途径。接触100 ppb砷会扰乱小鼠肠道微生物组的典型组成和功能,这对环境具有重要意义。能量代谢基因的表达发生了变化,与脂多糖生成、氧化应激和DNA修复相关的基因广泛上调。
此外,砷暴露还导致与接合转座子蛋白、外排多药元件及维生素合成相关的基因表达增加。这些发现为理解砷对肠道微生物组影响提供了新的见解,尤其是在环境相关的剂量下。
环境毒物无处不在, 如果积累到上限,不仅直接挑战人体的解毒器官,更在悄无声息中重塑着我们体内的“隐形生态”——肠道菌群。科学研究已经证实,环境污染物与肠道微生物之间存在着复杂的双向互作:过量的毒物可以破坏菌群平衡,诱发代谢与免疫紊乱;而健康的肠道菌群和肠道屏障则是人体抵御外源毒素的第一道防线,甚至能协助降解部分有害物质。
面对这一挑战,我们既无需过度恐慌,也不能掉以轻心。未来的健康管理将不再局限于对疾病的被动治疗,而是转向对环境暴露风险的主动评估。
这需要我们在三个维度上通过跨学科的协同努力实现突破:
首先是强化内在防线,通过回归自然饮食,利用富含膳食纤维和植物化学物的全谷物、蔬果来“喂养”体内的有益菌等自然疗法,激发菌群自身的解毒潜能;其次是落实精准医疗,结合基因组与代谢组数据,为不同体质的人群定制个体化的健康管理方案;最后是筑牢社会屏障,推动更严格的环境卫生政策,重点保护儿童及弱势群体。
本文仅供科研交流。
主要参考文献
Fuloria, Neeraj Kumar, Shivkanya Fuloria, Mahendran Sekar, Kamal Narain, and Sokindra Kumar. 2025. “Introduction to Environmental Toxicants.” In Gut Microbiome and Environmental Toxicants. 1st ed. CRC Press.https://www.taylorfrancis.com/chapters/edit/10.1201/9781003489221-1.
Campana AM, Laue HE, Shen Y, Shrubsole MJ, Baccarelli AA. Assessing the role of the gut microbiome at the interface between environmental chemical exposures and human health: Current knowledge and challenges. Environ Pollut. 2022 Dec 15;315:120380.
R.M. Abdel-Megeed, Probiotics: a promising generation of heavy metal detoxification, Biological Trace Element Research, 199 (2021) 2406–2413.
K.S. Alharbi, W.H. Almalki, M. Albratty, A.M. Meraya, A. Najmi, G. Vyas, S.K. Singh, K. Dua, G. Gupta, The therapeutic role of nutraceuticals targeting the Nrf2/HO-1 signaling pathway in liver cancer, Journal of Food Biochemistry, 46 (2022) e14357.
A.Giuliani, M. Zuccarini, A. Cichelli, H. Khan, M. Reale, Critical review on the presence of phthalates in food and evidence of their biological impact, International Journal of Environmental Research and Public Health, 17 (2020) 5655.
Y.Wang, H. Qian, Phthalates and their impacts on human health, Healthcare, 9 (2021) 603.
C.Tropini, How the physical environment shapes the microbiota, mSystems, 6 (2021) e0067521.
G.McCallum, C.Tropini, The gut microbiota and its biogeography, Nat Rev Microbiol, 22 (2024) 105–118.
H.R. Safford, K. Shapiro, H.N. Bischel, Wastewater analysis can be a powerful public health tool—if it’s done sensibly, Proceedings of the National Academy of Sciences, 119 (2022) e2119600119.
B.D. Anderson, J.E. Bisanz, Challenges and opportunities of strain diversity in gut microbiome research, Frontiers in Microbiology, 14 (2023) 1117122.
D.O’Connor, D. Hou, J. Ye, Y. Zhang, Y.S. Ok, Y. Song, F. Coulon, T. Peng, L. Tian, Lead-based paint remains a major public health concern: a critical review of global production, trade, use, exposure, health risk, and implications, Environment International, 121 (2018) 85–101.
T.E. Adolph, L. Mayr, F. Grabherr, J. Schwärzler, H. Tilg, Pancreas-microbiota cross talk in health and disease, Annual Review of Nutrition, 39 (2019) 249–266.
Y. Pan, Y. Song, Broken thermometer in hand: mercury elevation caused by improper debridement, Clinical toxicology, 60 (2022) 654–656.
F.U. Haider, C. Liqun, J.A. Coulter, S.A. Cheema, J. Wu, R. Zhang, M. Wenjun, M. Farooq, Cadmium toxicity in plants: impacts and remediation strategies, Ecotoxicology and Environmental Safety, 211 (2021) 111887.
Q.Gu, C.Wang, Q.Xiao, Z.Chen, Y.Han, Melatonin confers plant cadmium tolerance: an update, International Journal of Molecular Sciences, 22 (2021) 11704.
B.Lv, H.L. Yang, Y.D. Peng, J. Wang, Z. Zeng, N. Li, Y.E. Tang, Z. Wang, Q.S. Song, Cadmium exposurealters expression of protective enzymes and protein processing genes in venom glands of the wolf spider Pardosa pseudoannulata, Environmental Pollution, 268 (2021) 115847.
Martinez-Guryn K, Leone V, Chang EB. Regional diversity of the gastrointestinal microbiome. Cell Host & Microbe. 2019 Sep 11;26(3):314–24.
Chi L, Xue J, Tu P, Lai Y, Ru H, Lu K. Gut microbiome disruption altered the biotransformation and liver toxicity of arsenic in mice. Archives of Toxicology. 2019 Jan 21;93:25–35.