-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
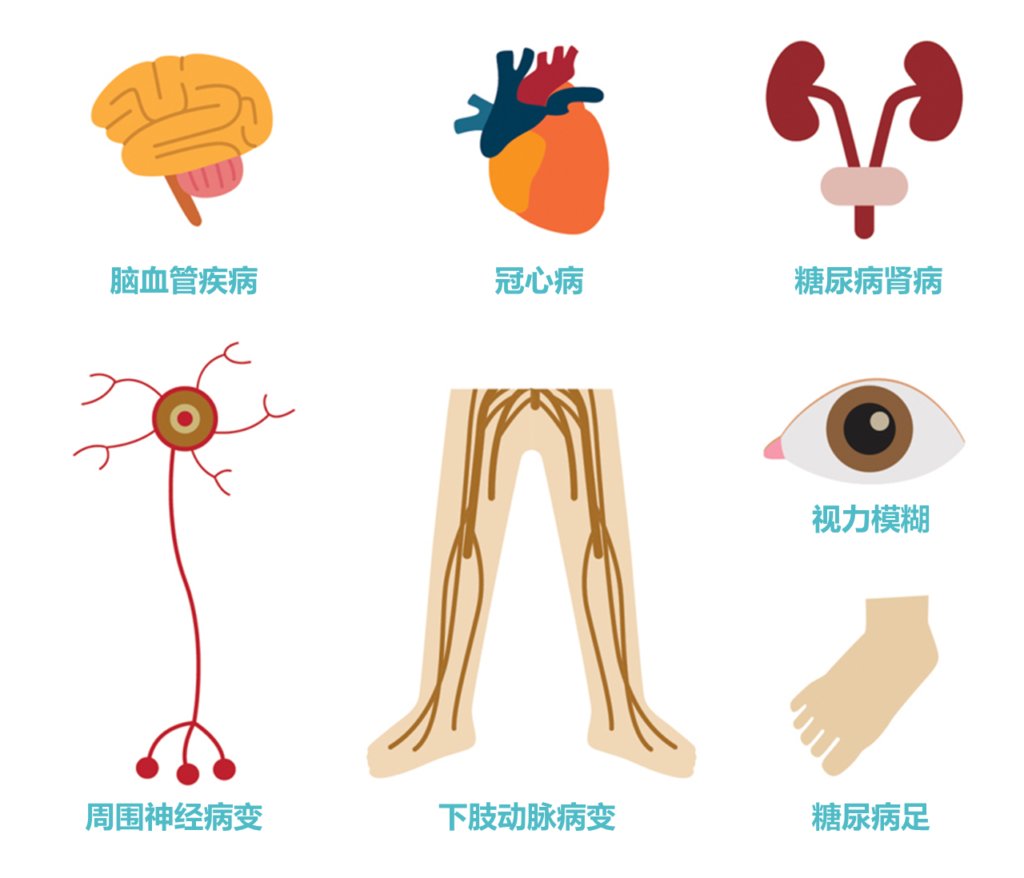
2型糖尿病是一种血糖水平升高(高血糖)的慢性代谢疾病,主要由胰岛素抵抗和胰岛素分泌不足引起。2型糖尿病全球患病率在不断上升。
截止到2020年,根据美国糖尿病学会评估标准,糖尿病患病率已达到12.8%。其实在我国成年人中,已经有将近一半的人存在血糖异常,未来极有可能发展为2型糖尿病。如果不加干预治疗,会引发许多不良后果。
很多研究表明,肠道菌群在宿主的代谢和疾病状态中起着重要的作用。特别是2型糖尿病,其病因复杂,包括肥胖、慢性低度炎症,受肠道微生物群和微生物代谢产物的调节。
本文将从肠道菌群的角度了解其与2型糖尿病的关系;肠道菌群及其代谢物对葡萄糖代谢、免疫系统的影响;
从影响肠道菌群变化的因素来了解各种干预措施,包括药物,饮食,益生菌/益生元,粪菌移植,间接性禁食等方式。
葡萄糖主要通过食用的食物和饮料进入人体。胰腺会产生一种叫做胰岛素的激素,以帮助血液中的葡萄糖进入肌肉、脂肪和肝脏,用作能量。
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像钥匙打开锁一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
刚开始的时候,胰腺会觉得自己使不上力,于是不甘心开始拼命工作,产生更多的胰岛素来克服这种抵抗。
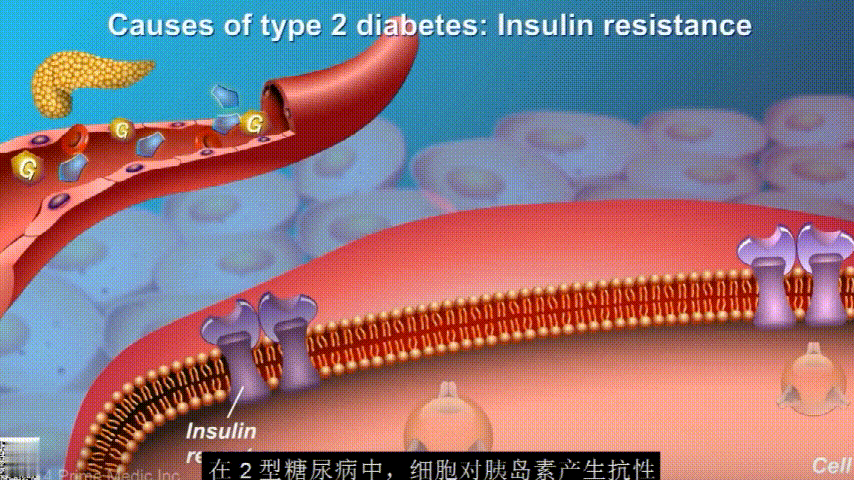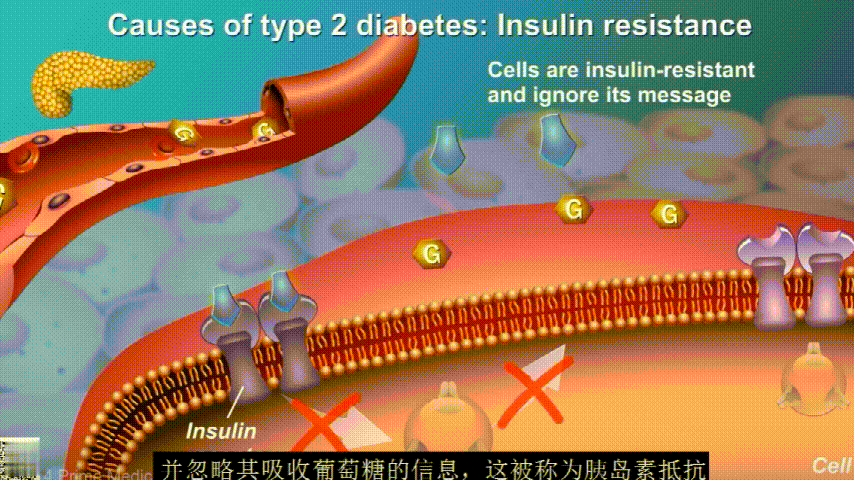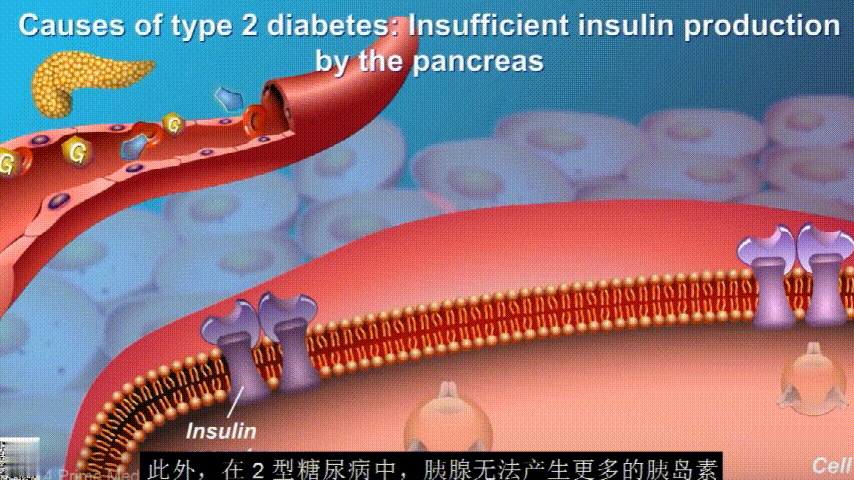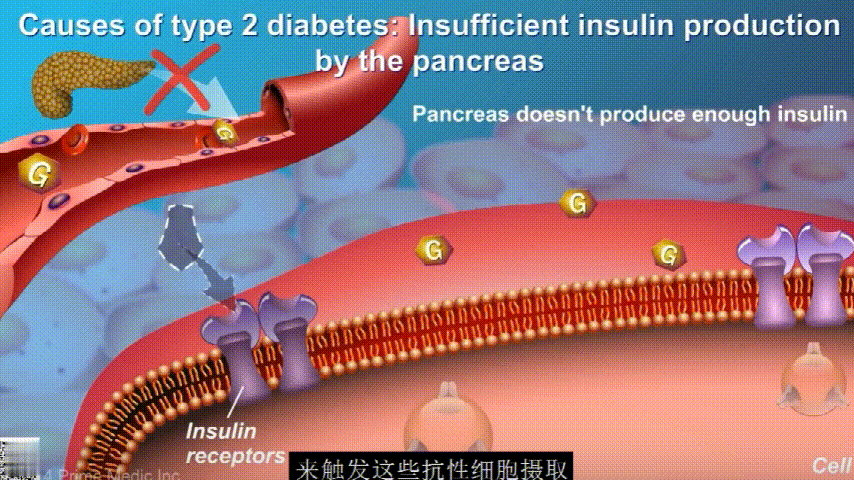
随着时间的推移,胰腺开始累了,力不从心,不能产生更多的胰岛素,这时候就是2型糖尿病开始了。
肠道微生物群可以直接或间接地影响人类健康,肠道微生物群失调可能会增加促炎疾病的患病率,如肥胖、炎症性肠病、2 型糖尿病、关节炎和癌症。
2型糖尿病人群中个体微生物群的差异
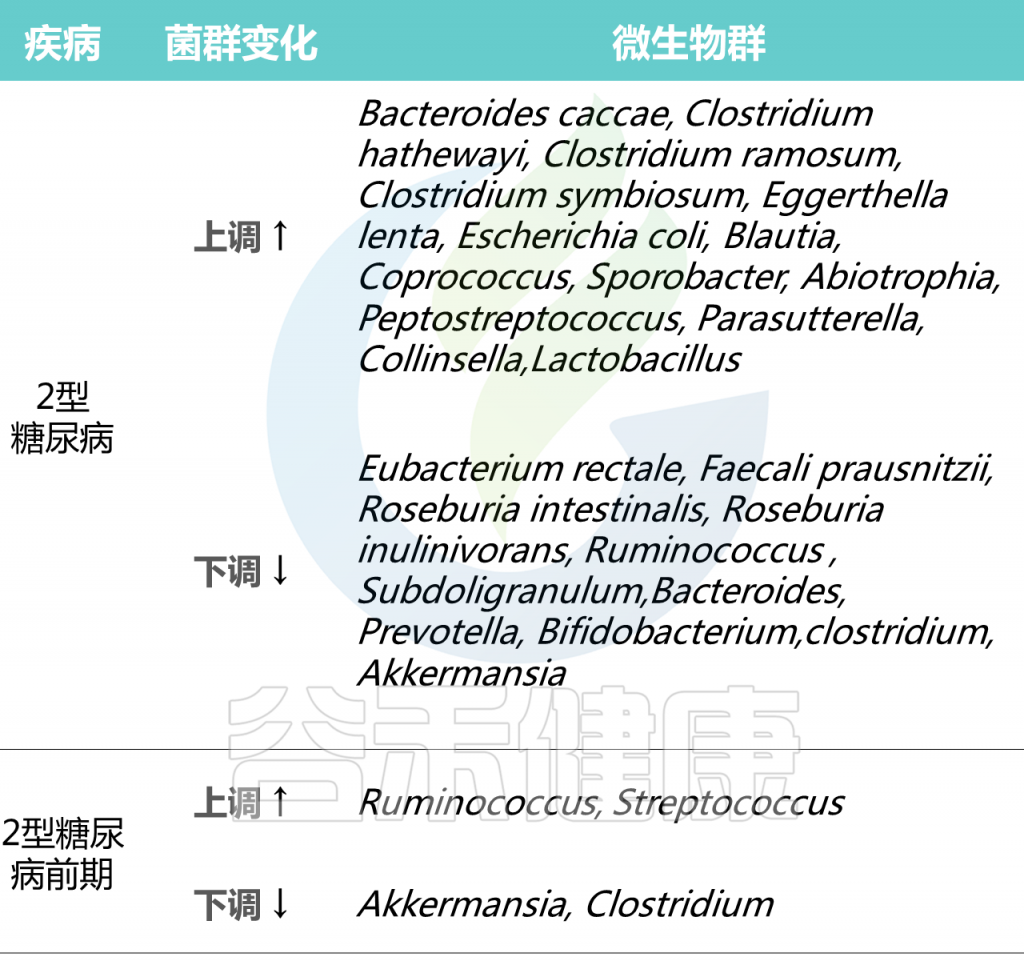

Cunningham A L et al., Gut Pathog, 2021
在2型糖尿病患者普遍具有相对高丰度的特定属:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
2型糖尿病患者中,产生丁酸菌特别缺乏,特别是梭菌目,包括:
Ruminococcus、Subdoligranulum,Eubacterium rectale、Faecali prausnitzii、Roseburia intestinalis 、
Roseburia inulinivorans
2型糖尿病患者中,其他明显较少的菌属有:
拟杆菌属、普雷沃氏菌属、双歧杆菌属
双歧杆菌属具有显著的健康益处,包括改善肠道通透性,从而降低内毒素的循环水平并减少全身炎症。这与改善宿主的糖耐量和葡萄糖诱导的胰岛素分泌,并减少炎症有关。
来自欧洲的女性2型糖尿病患者队列显示了乳酸杆菌Lactobacillus增加,五种梭菌的丰度下降。
在另外两项研究中也有类似的结论。乳杆菌属的增加与较低的空腹血糖水平和改善的糖化血红蛋白(HbA1c)水平正相关。这两种菌都与BMI指数没有关系。给糖尿病啮齿动物补充丁酸梭菌可以改善循环血糖水平,降低全身胰岛素抵抗和炎症,增加线粒体代谢,显著减少肠道破坏。
Akkermansia muciniphila和Faecali prausnitzii这两种菌为2型糖尿病的发展提供了保护。
Akkermansia菌在维持粘蛋白层的完整性和减少炎症方面起着关键作用。粘蛋白是大型、高度糖基化的蛋白质,参与GIT的腔内保护,导致细菌移位减少,并改善脂肪储存、脂肪组织代谢和葡萄糖稳态。给啮齿动物补充低聚果糖(使Akkermansia二次增加)或直接用Akkermansia治疗可以改善它们的整体代谢状态。
2型糖尿病的Faecali prausnitzii丰度降低,2型糖尿病的治疗似乎也直接导致了Faecali prausnitzii丰度的增加、全身炎症的二次减少和胰岛素抵抗的改善。
2型糖尿病前期菌群变化
2型糖尿病前期患者在其微生物群落中也有类似的发现,包括微生物多样性降低;Akkermansia菌和梭状芽孢杆菌属数量的减少;瘤胃球菌属和链球菌增多。
如果可以确定2型糖尿病的“共同”微生物群分布,就有可能在机器学习预测模型中利用微生物生物标志物和临床参数,以可靠的诊断准确性区分2型糖尿病风险患者。其次,如果该模型被证明是成功的,所选择的微生物生物标志物可以用于监测患者的血糖控制和新疗法的引入。
肠道微生物群具有通过多种机制改变宿主葡萄糖稳态的能力,包括:
2型糖尿病患者表现出糖的膜转运、支链氨基酸(BCAA)转运、甲烷代谢、异生素降解和代谢以及硫酸盐还原的富集。同一队列显示细菌趋化性、鞭毛装配、丁酸盐生物合成以及辅因子和维生素代谢水平降低。
微生物群对葡萄糖稳态的影响
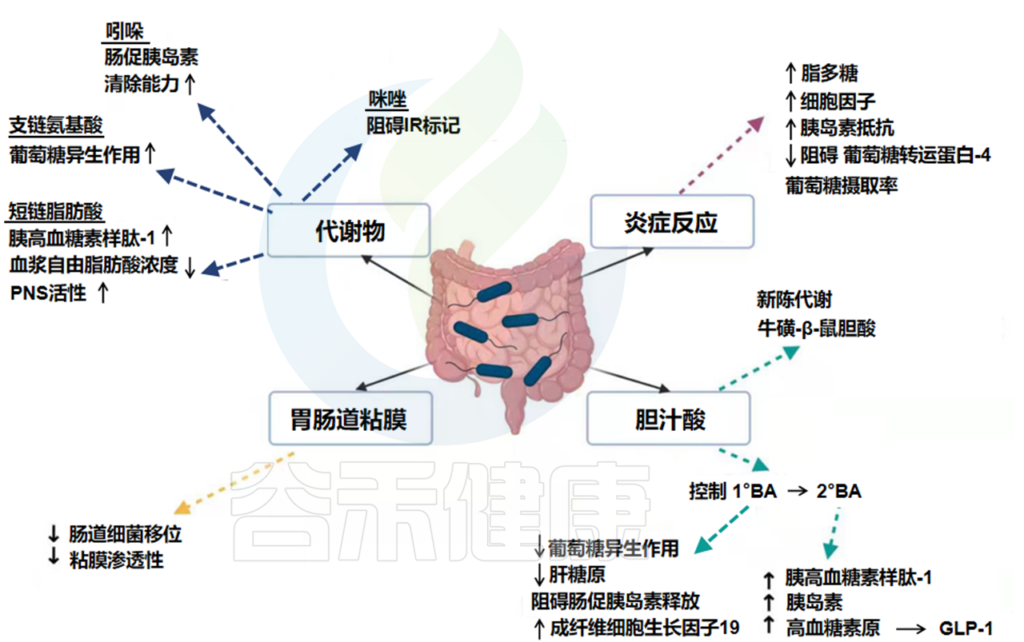
Cunningham A L et al., Gut Pathog, 2021
短链脂肪酸、BCAAs、琥珀酸盐、吲哚、咪唑都是肠道厌氧发酵过程中产生的微生物代谢产物,是微生物-宿主信号通路的核心成分。
这些代谢物主要由微生物群产生,如Akkermansia、普雷沃氏菌属Prevotella、瘤胃球菌属Ruminococus、粪杆菌属Faecalibacterium、真细菌属Eubacterium、Roseburia、梭菌属Clostridium、拟杆菌属、乳杆菌属、链球菌属、丙酸杆菌属Propionibacterium、梭杆菌属Fusobacterium。2型糖尿病病患者体内这些特殊微生物群的大部分已经耗尽。

Huda MN, et al., Front Endocrinol (Lausanne). 2021
丁酸盐、乙酸盐和丙酸盐是膳食纤维肠道发酵产生的最丰富的短链脂肪酸。乙酸盐和丙酸盐主要由拟杆菌门产生,而丁酸盐由厚壁菌门产生。短链脂肪酸被肠粘膜细胞直接用作能量来源,或转移到体循环中,为宿主产生重要的能量来源,并具有作为信号分子的能力。
短链脂肪酸如何影响葡萄糖代谢?
短链脂肪酸通过与选定的G蛋白偶联受体的偶联作用强烈影响葡萄糖代谢。这些主要在脂肪组织、肠道和免疫细胞中表达。GPR43和GPR119刺激促进肠内分泌L细胞分泌肠促胰岛素GLP-1。GLP-1增强葡萄糖诱导的β细胞胰岛素释放,抑制胰高血糖素分泌,保护β细胞免于凋亡,促进β细胞增殖并延长肠转运时间。
丁酸盐和丙酸盐对受体GPR41的刺激具有通过两种不同的作用机制诱导肠道糖异生的能力。
短链脂肪酸还可以直接影响肝脏葡萄糖代谢,减少糖酵解和糖异生,增加糖原合成,降低血浆脂肪酸浓度。干细胞因子具有激活副交感神经活性的能力,从而增加食欲并促进葡萄糖刺激的胰岛素分泌。
短链脂肪酸通过AMP激活蛋白激酶(AMPK)活性的作用,通过增加葡萄糖转运蛋白4型(GLUT4)的表达来增强外周葡萄糖摄取。其次,在骨骼肌中,短链脂肪酸具有减少糖酵解的能力,导致葡萄糖-6-磷酸的二次积累,从而导致更大的糖原合成。
▇ 乙酸盐
乙酸盐是最丰富的短链脂肪酸,被肠上皮吸收,通过门静脉输送到肝脏,并最终分布到外周组织,在那里被代谢。全身性乙酸盐具有穿过血脑屏障的能力,在那里它可以激活乙酰辅酶a羧化酶,导致神经肽表达增强,从而诱导下丘脑神经元激活并抑制食欲。
▇ 丁酸盐
丁酸盐是结肠细胞的主要底物和能量来源,提供结肠粘膜至少60-70%的能量需求,对其增殖和分化至关重要。丁酸盐在维持结肠上皮稳态中发挥重要作用,主要是利用其抗炎特性,从而防止氧化应激产生活性氧和氮。在口服葡萄糖耐量试验期间,大量产生丁酸盐的微生物群与改善的胰岛素反应有关(这表明β细胞功能改善)。
餐后血浆丁酸浓度升高与丁酸肠杆菌Intestinimonas butyriciproducens 、Akkermansia muciniphila的丰度增加有关。值得注意的是,通过口服葡萄糖胰岛素敏感性(OGIS)模型评估,丁酸盐浓度与餐后胰岛素敏感性直接相关。
▇ 丙酸盐
肠道产生的丙酸盐是已知的糖异生的首选前体,其中约50%以这种方式利用。丙酸盐进入三羧酸(TCA)循环,通过三个连续的反应转化为琥珀酰辅酶a,生成的琥珀酰辅酶a重新进入TCA循环,并转化为草酰乙酸,即糖异生前体。
肠道丙酸酯释放增加与β细胞功能增强和葡萄糖刺激的胰岛素分泌有关,与GLP-1水平的变化无关。丙酸盐还通过直接抑制炎性细胞因子诱导的细胞凋亡为人类胰岛提供保护。
最后,用肠道丙酸盐补充超重患者导致能量摄入减少和肥胖,并且肽YY (PYY)和GLP-1的血浆水平升高。
膳食纤维的细菌发酵产生大量琥珀酸,通过激活肠道糖异生来改善血糖控制,对于丁酸和丙酸也是如此。
▇ 必需氨基酸
据报道,包括碱性氨基酸和芳香族氨基酸在内的少量必需氨基酸的增加与未来发展2型糖尿病的风险增加五倍有关。血中碱性成纤维细胞生长因子水平升高也被证明是胰岛素抵抗的特征,与两种特定的细菌相关,即普雷沃氏菌和拟杆菌。
胰岛素抵抗患者表现出丰富的支链氨基酸生物合成,并被发现缺乏编码这些特定氨基酸的细菌内向转运蛋白的基因。在啮齿类动物中,普雷沃氏菌可诱导胰岛素抵抗,加剧葡萄糖耐受,并增加支链氨基酸水平。
▇ 吲哚丙酸
吲哚丙酸是细菌芳香族氨基酸分解代谢产生的代谢产物,与膳食纤维摄入高度相关,似乎可以降低患2型糖尿病的风险。它提供了有效的自由基清除活性,提示它可以保护胰腺β细胞免受与代谢和氧化应激相关的损伤。它还可能通过抑制电压门控钾通道,触发GLP-1分泌,参与调节肠内分泌L细胞的肠促胰岛素分泌。
由肠道微生物群降解组氨酸产生的咪唑丙酸盐,通过作为细胞内胰岛素受体信号级联的抑制剂,损害了细胞正确响应胰岛素的能力。
▇ 胆汁酸
胆汁酸是类固醇羧酸,主要通过限速酶7α‐羟化酶(CYP7A1)的作用从胆固醇衍生而来,然后在分泌到胆汁中之前与甘氨酸或牛磺酸结合。超过95%在末端回肠和结肠通过肠肝循环被重吸收。
胆汁酸的主要功能是小肠内脂类和脂溶性维生素的消化和吸收。
乳酸杆菌、双歧杆菌、肠杆菌、拟杆菌、梭菌是影响胆汁酸合成、修饰和信号传导的主要肠道微生物群。它们具有通过解偶联过程控制初级胆汁酸(胆酸和鹅去氧胆酸)转化为次级胆汁酸(脱氧胆酸和石胆酸)的能力,以及代谢天然存在的FXR拮抗剂牛磺β-胆酸的能力。反过来,胆汁酸由于其强大的抗微生物活性,通过抑制细菌在肠道中的定居和生长来促进肠道稳态。
除了在肠道消化和吸收中的作用外,胆汁酸还具有发挥激素作用的重要代谢作用的能力。
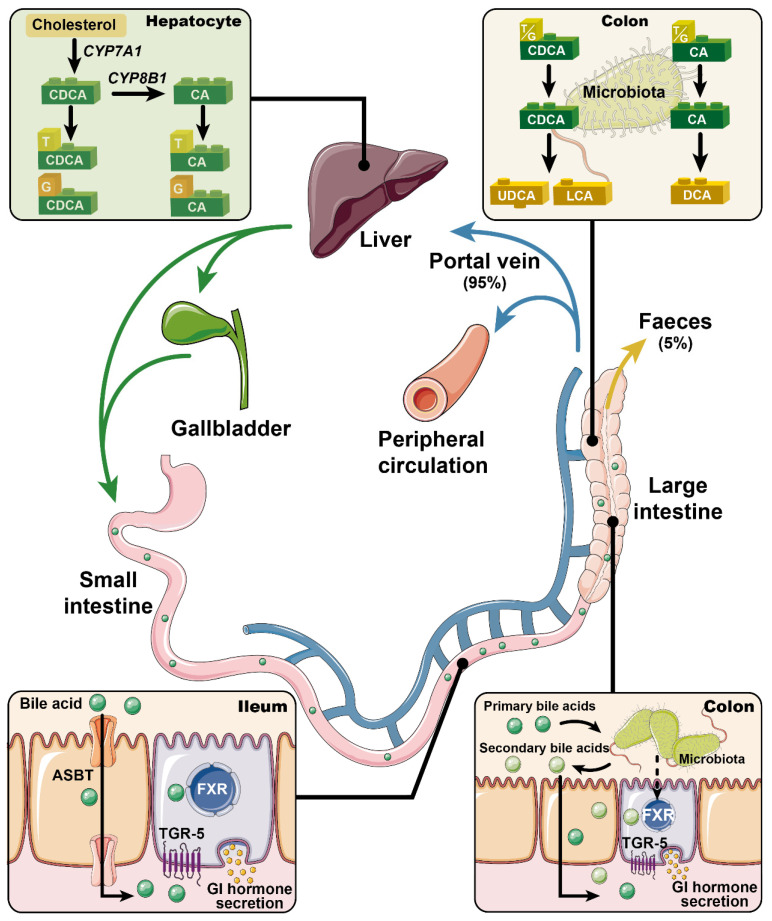
Xie C,et al., Nutrients. 2021
胆汁酸可以利用FXR和G蛋白受体5 (TGR-5)通过受体偶联信号调节葡萄糖代谢。FXR偶联只有通过原发性胆汁酸才有可能,并且具有减少糖异生、促进肝糖原产生、抑制GLP-1释放和刺激成纤维细胞生长因子(FGF-19)从回肠分泌的能力。
FXR信号抑制糖异生基因的表达,如那些编码磷酸烯醇丙酮酸羧激酶、果糖-1,6-双磷酸酶-1和葡萄糖-6-磷酸酶的基因。FGF-19通过降低CYP7A1的表达、抑制葡萄糖产生和诱导糖原合成来调节BA的合成。TGR-5(仅通过二级BAs结合)偶联导致肠L细胞分泌GLP-1,增加葡萄糖刺激的胰岛素释放,并促进前胰高血糖素转化为GLP-1。
在骨骼肌和棕色脂肪组织中,BATGR5信号通过刺激2型碘甲状腺原氨酸脱碘酶促进甲状腺素(T4)转化为具有生物活性的三碘甲状腺原氨酸(T3),导致更大的能量消耗。两种受体的偶联促进胰腺β细胞产生胰岛素。
研究表明,使用钡螯合剂操纵钡池可以改善2型糖尿病患者的血糖控制。钡螯合剂在肠内结合钡,形成不可吸收的复合物,导致肠肝循环中断。胆汁酸螯合剂降血糖作用的潜在机制知之甚少,但据信涉及胆汁酸库组成的破坏、增强肝脏葡萄糖代谢、增加肠促胰岛素激素的释放和诱导肠道微生物群组成的改变。
肠粘膜内层作为与潜在有害物质不良相互作用的预防性屏障,在免疫系统的调节中起着不可或缺的作用。
众所周知,2型糖尿病具有显著增强的肠道通透性,允许细菌穿过肠道上皮移位,导致引发低度炎症的宿主代谢性内毒素血症。由此产生的影响可以引发β细胞破坏和胰岛素抵抗。
如前所述,粪杆菌属Faecalibacterium、罗氏菌属Roseburia、双歧杆菌属都被认为具有防止细菌移位和降低肠道通透性的能力。众所周知,2型糖尿病患者体内这些特殊微生物群的丰度已经耗尽。
2型糖尿病的特征是慢性低度炎症状态,伴有大量炎症介质的异常表达和产生。患有2型糖尿病的个体产丁酸盐菌群数量减少,导致肠道轻度炎症。
肠道微生物通过脂多糖(LPS)的活性激活宿主炎症和胰岛素抵抗,脂多糖是革兰氏阴性菌细胞壁的重要组成部分。细菌片段和脂多糖被先天toll样受体(TLRs)识别,特别是TLR4,触发细胞内信号通路NF-κB的激活和促炎细胞因子的释放。LPS的释放还通过与在巨噬细胞和树突状细胞上表达的NLRP3炎症体和NOD样受体(NLRs)的高亲和力偶联来刺激局部免疫反应。炎性NF-κB级联中血清激酶(Jnk和IKK)的激活诱导胰岛素受体底物丝氨酸磷酸化,恶化胰岛素抵抗。
促炎细胞因子的释放会破坏葡萄糖代谢和胰岛素信号。2型糖尿病患者表现出肿瘤坏死因子-α水平升高,这与糖耐量改变、胰岛素抵抗增强和胰岛功能障碍密切相关。肿瘤坏死因子-α具有上调细胞因子信号转导抑制因子-3 (SOCS-3)转录的能力,该抑制因子与胰岛素受体的酪氨酸-960偶联,防止胰岛素受体结合。这导致IRS-1的降解和胰岛素信号通路的破坏。
白细胞介素-1 (IL-1)是白细胞介素家族的一种炎性细胞因子,具有降低IRS-1表达、抑制GLUT-4向质膜移位和减少胰岛素刺激的葡萄糖摄取的潜力。最近的研究表明,IL-1受体拮抗剂(IL-1RA)和IL-1β特异性抗体治疗改善了2型糖尿病患者的糖代谢和胰岛素分泌。
IL-6已被确定为2型糖尿病的独立预测因子。它对IRS-1、GLUT4和过氧化物酶体增殖物激活受体(PPARs)的基因转录产生长期抑制作用,并显著降低胰岛素刺激的酪氨酸磷酸化和胰岛素刺激的葡萄糖转运。
以上部分是微生物群的改变直接或间接影响2型糖尿病的发展,那么微生物群会受到哪些因素的影响呢?
影响肠道微生物群的因素
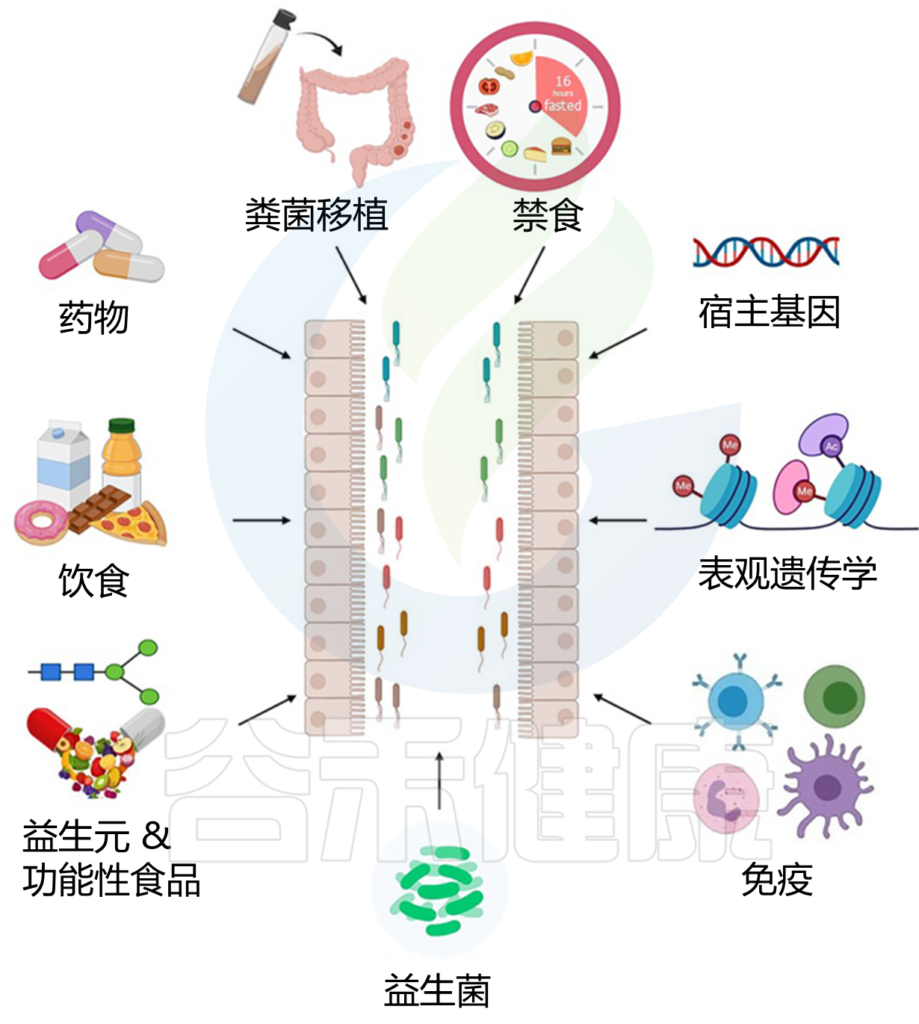
Huda MN, et al., Front Endocrinol (Lausanne). 2021
以上因素都会改变肠道微生物群,其中如益生元、益生菌、FMT和间歇性禁食,都被认为是2型糖尿病的潜在疗法。
一些2型糖尿病的药物改善循环血糖水平部分通过调节肠道微生物群,这进一步支持了肠道菌群作为2型糖尿病治疗的可能性。接下来我们看看它们如何调节肠道微生物群。
肠道微生物的组成在个体之间有很大的差异,并被内源性和外源性因素不断改变。地理和环境因素,如饮食、疾病、生活方式、卫生和药物都会导致变化。抗生素治疗能够在给药后几年内破坏肠道微生物群落。
在斯堪的纳维亚的2型糖尿病患者中发现的拟杆菌属、普雷沃氏菌属和双歧杆菌属的数量明显较少,这表明抗生素暴露与随后的2型糖尿病发展之间存在很强的相关性。2型糖尿病的诊断与抗生素处方数量之间的关系需要进一步建立因果关系。
抗生素可能使患者更容易发展为2型糖尿病,然而,在确诊前几年,有2型糖尿病风险的患者可能更容易患病。
下面,来看看抗生素治疗对肠道微生物群的影响,以及由此对肥胖和胰岛素抵抗患者代谢参数的影响。
万古霉素显著降低了微生物多样性,厚壁菌门丰度降低,变形菌数量增多,尤其是乳杆菌属,外周胰岛素敏感性下降。包括双胍类、α-葡萄糖苷酶抑制剂、肠促胰岛素类药物、胰高血糖素样肽1 (GLP-1)受体激动剂、二肽基肽酶-4抑制剂和噻唑烷二酮类在内的降糖药物都会影响肠道微生物群。
▇ 二甲双胍
二甲双胍是2型糖尿病患者最广泛使用的口服药物之一,不会有意改变肠道微生物群。
然而,越来越多的证据表明,微生物群可能会增强某些效应。二甲双胍增加了Akkermansia属、双歧杆菌属和乳杆菌属的相对丰度。其他丰富的关联包括拟杆菌属、丁酸球菌属、普雷沃菌属、巨球菌属和丁酸杆菌属。这些特殊的微生物群都具有产生短链脂肪酸的能力。
二甲双胍治疗可改善肠道微生物多样性,快速改变肠道菌群组成,通过增加短链脂肪酸的产生,促进内分泌细胞活性,调节胆红酸(BA)的周转,减少内毒素血症,改善肠道功能。
短期二甲双胍治疗与脆弱拟杆菌的丰度显著降低相关,导致肠道中BA糖链酸水平的二次增加。GUDCA抑制肠法呢样X受体(FXR)信号传导,从而改善葡萄糖耐量。重新引入脆弱拟杆菌逆转了使用二甲双胍后葡萄糖代谢的改善。
二甲双胍治疗下的微生物转移有助于改善血糖控制和不良反应
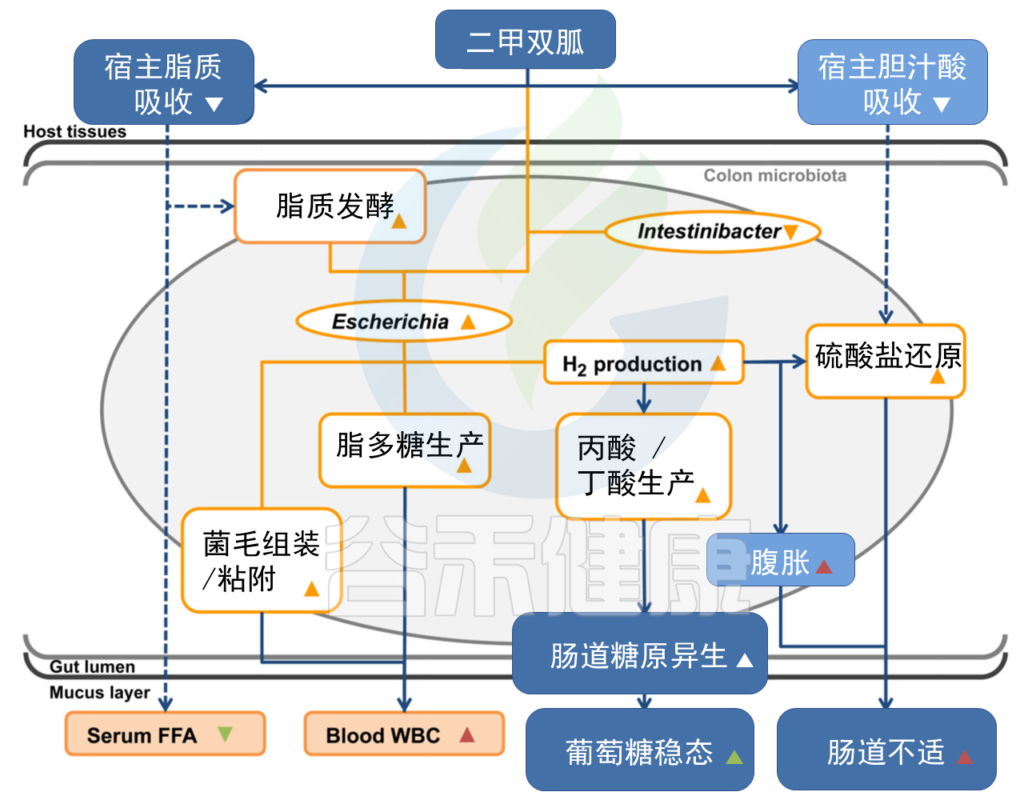
Forslund K, et al., Nature. 2015
▇ 格列本脲
其他糖尿病药物还没有像二甲双胍治疗那样被广泛研究。格列本脲对肠道微生物群α多样性的影响很小。它增加了Paraprevotellaceae 和普氏菌属 Prevotella 的相对丰度。当与二甲双胍联合使用时,达帕利沙星或格列齐特均未显示能显著改变2型糖尿病患者的肠道微生物群。
▇ 利拉鲁肽
在高脂饮食(HFD)中,利拉鲁肽降低了肠道微生物的多样性,降低了拟杆菌门、变形菌门和放线菌门的丰度。所有与肥胖相关的菌(Romboutsia,Ruminiclostridium,Erysipelotrichaceae)的相对丰度也有所下降,同时与瘦相关的菌Blautia和Coprococcus有所增加。
接受GLP-1激动剂联合二甲双胍治疗的患者,Akkermansia丰度高于接受单一利拉鲁肽治疗的患者。
间歇性禁食被定义为一种周期性的饮食限制,已被证明可以延长寿命,并降低罹患包括2型糖尿病在内的各种年龄相关疾病的风险。
动物研究表明,间歇性禁食可改善机体组成、糖脂代谢、减少炎症和自噬,肠道菌群可能在这一过程中发挥关键作用。虽然大多数人类间歇性禁食研究显示了一个有益的影响,结果还不完全确定。
最近一项使用糖尿病小鼠的研究报告称,28天间歇性禁食干预通过增加气球菌Aerococcus、棒状杆菌Corynebacterium、Odoribacter、乳酸杆菌的丰度,减少链球菌、Rummeliibacillus和Candidatusarthromitu的丰度,重组了肠道微生物群,从而降低了血糖和胰岛素水平,改善能量代谢。
间歇性禁食引起的细菌丰度变化与血浆次级胆汁酸浓度、绒毛长度增加、肠道渗漏减少、血浆LPS水平降低相关,提示轻度炎症改善。更重要的是,抗生素治疗抑制了间歇性禁食对2型糖尿病的影响,提示微生物群是间歇性禁食改善2型糖尿病的诱因。
间歇性禁食的另一种选择是禁食模拟饮食法,它含有非常低的热量和低蛋白质。禁食模拟饮食法通过增加 Parabacteroides和Blautia的数量,减少普雷沃氏菌科、Alistipes、Ruminococcaceae属的数量,重建肠道微生物群,使血糖水平正常化,改善血糖高db/db小鼠的胰岛素敏感性和β细胞功能。
该研究进一步强调了胰岛细胞和β细胞的缺失可以通过禁食模拟饮食法介导的改变肠道微生物群来预防,提示禁食模拟饮食法通过胰腺β细胞的功能来改善2型糖尿病。
综上,间歇性禁食可调节肠道菌群,改善2型糖尿病。然而,这些发现需要在人类队列中进行验证,使用纵向研究来确定间歇性禁食在影响2型糖尿病结果中的长期有效性。
益生元、益生菌和合生元能够调节肠道微生物群组成,目的是为改善葡萄糖代谢创造环境。越来越多的文献支持临床使用添加益生元、益生菌和合生元来改善2型糖尿病患者的血糖控制。
然而,由于研究方法(研究时间、补充量、患者人口特征)之间的异质性,阻碍了研究的比较,而且研究可用性差、单个研究的规模相对较小以及明显缺乏微生物群数据,数据仍然有限,这是具有挑战性的。
▇ 益生菌
益生菌是活的微生物,当以足够的量给药时,对个体的健康有益。
证据表明,益生菌能够改善肠道微生物群,从而实现更好的2型糖尿病控制,同时增强肠道完整性、降低循环LPS、降低内质网应激和改善外周胰岛素敏感性。
一项荟萃分析,重点是研究补充益生菌对2型糖尿病患者糖化血红蛋白水平、空腹血糖和胰岛素抵抗的影响。共纳入了15项随机对照试验,涉及902名患者。结果表明,益生菌可降低基线水平的糖化血红蛋白(p = 0.02)、FBG(p=0.003)和胰岛素抵抗(p < 0.00001)。
有限的研究评论了微生物群的变化。两项研究提到了添加益生菌后的微生物群分析,并报告了细菌组成的变化。嗜酸乳杆菌Lactobacillus acidophilus的丰度从干预前的接近不可检测的水平显著增加。双歧杆菌属(4.5倍)和乳杆菌属(两倍)数量的显著增加。
▇ 益生元
益生元是食物成分,如不易消化的多糖或纤维,通过选择性刺激一个或有限数量的肠道微生物群的生长和/或活性而有益地影响宿主。
补充益生元与改善血糖控制有关,然而,根据益生菌研究报告,方法学的异质性也很大,导致文献不确定。
迄今为止最全面的荟萃分析,包括33个随机对照试验,涉及1346名参与者,分布在健康、肥胖和2型糖尿病队列中。仅关注糖尿病前期和2型糖尿病队列,与对照组相比,补充后FBG、糖化血红蛋白水平、空腹胰岛素浓度和胰岛素敏感性的相对降低,分别为基线值的7.15、7.00、16.58和25.34%。建议每日补充剂量大于10 g,持续时间至少42天,以持续改善血糖指标。
目前尚不清楚观察到的影响是与肠道微生物群的改变有关,还是因为发酵底物的可用性更高。文献中一直缺乏微生物群分析,直接归因于葡萄糖水平的改善。
研究表明,补充益生元六周可产生显著的双歧杆菌效果,并提高粪便短链脂肪酸浓度,但未观察到对整体微生物多样性的影响。其次,补充益生元可以增加细菌多样性,如Shannon和inverse Simpson指数所评估的,并增加2型糖尿病患者的丰富度。然而,在饮食治疗12周后,没有观察到葡萄糖控制的统计学改善。
▇ 合生元
合生元:”包含活微生物和被宿主肠道微生物群选择性利用以赋予‘宿主健康益处’的底物的混合物”。
一种合生元给六十名高血压前期患者2型糖尿病(两种乳酸杆菌和双歧杆菌各一种,一种链球菌和酵母,以及300毫克低聚糖)。据报道,干预后乳酸杆菌属(32.6%)和双歧杆菌属(131.6%)均有所增加,肠道致病菌(44.6%)显著减少,空腹血糖(3.3%)和HbA1c水平(14%)也有所改善。
越来越多的证据表明,添加益生元、益生菌和合生元可以改善血糖控制。需要进行详细的工作来设计稳健的方法,以确定这些积极的变化是否直接归因于肠道微生物群的改变和所涉及的复杂代谢机制。一旦这种关系被更好地理解,在2型糖尿病的管理中利用这些饮食补充的潜力就可以充分发挥。
粪便微生物群移植(FMT)是将最低限度操作的预先筛选的供体粪便转移到已确定的“患病”患者的肠道中,目的是纠正异常生物状态,增加整体多样性并恢复微生物群的功能。
被诊断为代谢综合征的男性受体在接受异源菌群6周后,胰岛素敏感性提高,产丁酸盐菌群(Roseburia肠胃炎种)丰度增加。
其次,一项研究报告了代谢综合征患者,观察到异体粪菌移植后HbA1c水平显著降低,并与肠道微生物群组成的变化相关。异体粪菌移植之前参与者基线微生物组中基因丰富度的降低与临床结果的改善相关。
应该注意的是,这两项研究的临床益处随着时间的推移而恶化,并且存在相当大的个体差异。
因此,粪菌移植治疗虽有希望,但还需进一步研究,例如:
2型糖尿病是一种多因素疾病。这意味着不是仅仅停止吃糖或开始锻炼就可以来避免这种健康状况。
以下是一些可能影响患2型糖尿病风险的因素:
肥胖
肥胖或超重患2型糖尿病的风险很大
不良的饮食习惯
美国糖尿病协会(ADA)强调,吃太多不健康的食物会增加你患2型糖尿病的风险。研究表明,经常吃高热量、加工食品和饮料的饮食,而完整的、富含营养的食物却吃的少,这样的饮食习惯会显著增加患2型糖尿病的风险。
看电视时间过长
哈佛大学公共卫生学院指出,长时间看电视(和久坐)可能会增加肥胖、2型糖尿病和其他疾病的风险。
缺乏足够的锻炼
就像体脂与胰岛素和其他激素相互作用影响糖尿病的发展一样,肌肉也是如此。通过心血管运动和力量训练可以增加的肌肉量,在保护身体抵抗胰岛素抵抗和2型糖尿病方面发挥着作用。
睡眠习惯
美国国家睡眠基金会指出,睡眠障碍会增加对胰腺的需求,从而影响身体胰岛素和血糖的平衡。随着时间的推移,这会导致2型糖尿病。
多囊卵巢综合征(PCOS)
根据2017年8月发表在《临床内分泌与代谢杂志》上的一项研究,被诊断患有多囊卵巢综合征(一种激素失衡疾病)的女性比她的同龄人患2型糖尿病的风险更大。胰岛素抵抗和肥胖是这些疾病的共同特征。
45岁以上
根据ADA的说法,年龄越大,患2型糖尿病的可能性越大。但近年来,越来越多的儿童和青少年被诊断出患有前体糖尿病和2型糖尿病。
对于预防2型糖尿病,没有万无一失的方法,但是根据上述风险因素进行相应调整,保持健康的体重,遵循健康的饮食,定期锻炼,降低高胆固醇和高血压等可以帮助预防这种疾病。
▇ 饮食
因为某些食物,如碳水化合物,直接影响你的血糖,所以饮食是控制糖尿病最重要的因素之一。
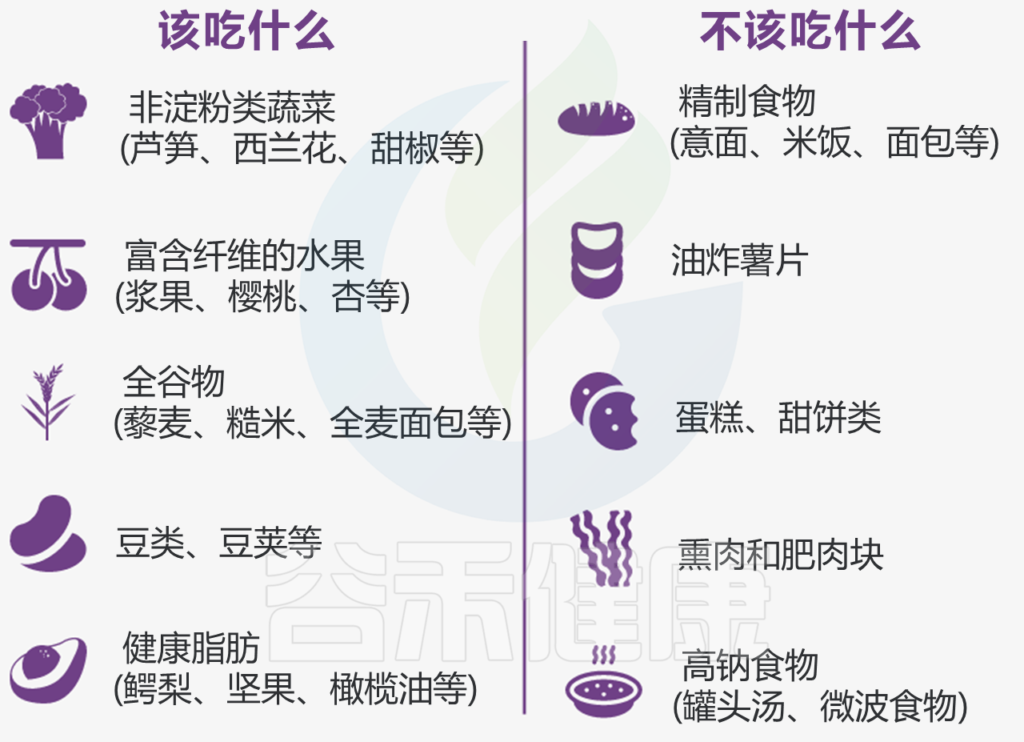
重要的并不是不吃,而是尽可能均衡饮食。
一种简单的标准餐盘法控制饮食:
盘子的一半:不含淀粉的蔬菜
盘子的四分之一:瘦肉蛋白
盘子的四分之一:谷物或淀粉类蔬菜
按照上述方式吃完饭,如果你还觉得饿,可以再吃一点不含淀粉的蔬菜。重要的是,一定要慢慢吃,享受食物。

餐盘法可以帮助你增加纤维摄入量。富含纤维的食物可以帮助减缓血糖上升的速度。让你有饱腹感,潜在地促进减肥和提高胰岛素敏感性。高纤维食物通常富含维生素和矿物质,也可以增加营养。
已有研究证明,鼓励患者摄入高纤维饮食可以提高产生短链脂肪酸的菌群数量,从而通过增加GLP-1的产量来降低糖化血红蛋白水平。接受高纤维饮食的患者HbA1c水平比对照组下降更大,更高比例的患者实现了充分的血糖控制(HbA1c < 7%)。
注:糖化血红蛋白(HbA1c)是红细胞中的血红蛋白与血清中的糖类(主要指葡萄糖)通过非酶反应相结合的产物。
进一步的临床研究,摄入地中海饮食(富含纤维),也报告了高心脏代谢风险个体的葡萄糖和胰岛素敏感性的改善。
因此,高纤维饮食用于控制2型糖尿病是可能的。
▇ 运动
运动对于利用胰岛素(帮助将糖分转移到细胞中)和降低血糖至关重要。通过运动,新陈代谢加快,身体就会逐渐熟练地燃烧卡路里。此外,锻炼有助于保持胆固醇含量,避免胆固醇过高和斑块的形成(这些斑块可能会阻碍血液顺利通过动脉)。
你可能会说工作生活很忙,找时间锻炼很困难,但不得不说,运动非常重要。试着让运动变得有趣,给自己足够的动力,或者把锻炼计划写在本上,比如说每周150分钟的运动量。
常见运动活动的生理成分
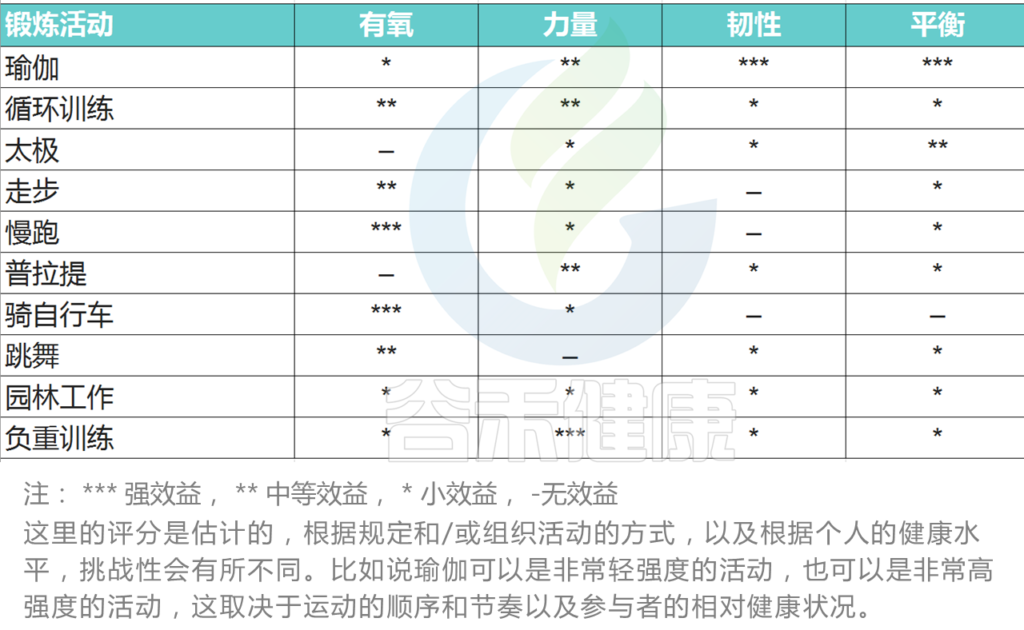
Andrew Williams et al., CLINICAL,2021
运动方式对2型糖尿病患者健康相关结果的影响
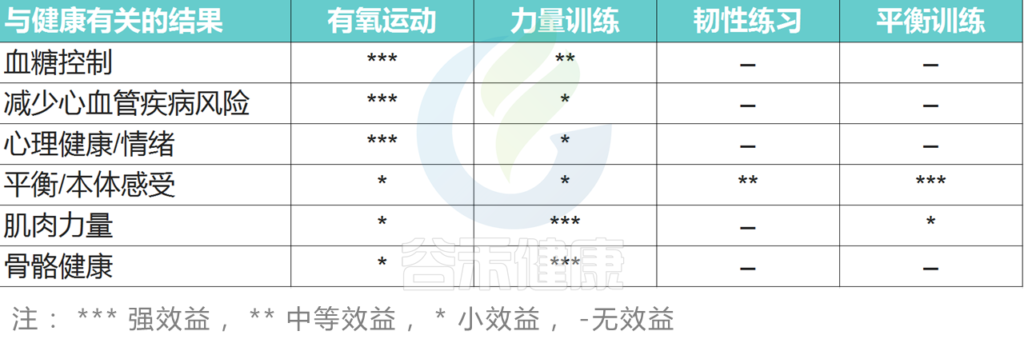
Andrew Williams et al., CLINICAL,2021
重要的是,要选择适合自己的运动方式,比如说肥胖的人可能会减少负重训练,从而减少与冲击相关的肌肉骨骼问题加重的风险。
有人认为,2型糖尿病患者在运动过程中发生不良事件的风险增加,但不良事件的发生率较低,定期运动的好处远远大于风险。
注:不稳定型心绞痛、不稳定呼吸系统疾病、未经治疗的心力衰竭或心肌病、严重主动脉狭窄和未控制的糖尿病患者,运动需要遵医嘱。
总之,运动计划必须是有目标的并且是自己感兴趣的,才能坚持下去。
▇ 肠道菌群健康检测
定期进行肠道菌群检测,了解2型糖尿病的患病风险,也是一种可行的预防措施。当发现风险较高就及时调整,不恐慌不焦虑,对自身健康状况了如指掌。
2型糖尿病是一种复杂的多系统疾病,如果不加以适当的识别和治疗,可能会出现并发症。特定的肠道微生物群可能通过葡萄糖代谢途径的改变来避免2型糖尿病的恶化。
随着对微生物群的了解逐渐深入,利用微生物群来识别“高危”人群以及通过微生物群靶向治疗成为可能。对于益生菌,益生元等治疗方案还需进一步研究,最终目标是在已确定的风险人群中简化早期干预,真正做到可防可控。
主要参考文献
Cunningham A L,Stephens J W,Harris D A,Gut microbiota influence in type 2 diabetes mellitus (T2DM).[J] .Gut Pathog, 2021, 13: 50.
Huda MN, Kim M, Bennett BJ. Modulating the Microbiota as a Therapeutic Intervention for Type 2 Diabetes. Front Endocrinol (Lausanne). 2021 Apr 7;12:632335. doi: 10.3389/fendo.2021.632335.
Al-Jameel SS. Association of diabetes and microbiota: An update. Saudi J Biol Sci. 2021;28(8):4446-4454. doi:10.1016/j.sjbs.2021.04.041
Muñoz-Garach A, Diaz-Perdigones C, Tinahones FJ. Gut microbiota and type 2 diabetes mellitus. Endocrinol Nutr. 2016 Dec;63(10):560-568.
Forslund K, Hildebrand F, Nielsen T, Falony G, et al. Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota. Nature. 2015 Dec 10;528(7581):262-266.
Vitale M, Giacco R, Laiola M, et al. Acute and chronic improvement in postprandial glucose metabolism by a diet resembling the traditional Mediterranean dietary pattern: can SCFAs play a role? Clin Nutr. 2021;40(2):428–37
Tao YW, Gu YL, Mao XQ, Zhang L, Pei YF . Effects of probiotics on type II diabetes mellitus: a meta-analysis. J Transl Med. 2020;18(1):30
Zhang F , Wang M, Yang J, et al. Response of gut microbiota in type 2 diabetes to hypoglycemic agents. Endocrine. 2019;66(3):485–93.
Gérard C, Vidal H. Impact of gut microbiota on host glycemic control. Front Endocrinol (Lausanne). 2019;10:29.
Xie C, Huang W, Young RL, Jones KL, Horowitz M, Rayner CK, Wu T. Role of Bile Acids in the Regulation of Food Intake, and Their Dysregulation in Metabolic Disease. Nutrients. 2021 Mar 28;13(4):1104.