-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
胃肠道是众多微生物的栖息地,这些微生物既相互关联又各具特点。部分微生物以自由漂浮的形式存在于管腔中,另一些则聚集和吸附在粘膜或组织表面形成生物膜这一结构。
胃肠道生物膜是基质封闭、高度异质性和空间组织化的多微生物群落,由微生物群体及其包被的细胞外聚合物和基质网组成,它们彼此黏附或者黏附到组织或器官的表面,可以覆盖胃肠道大面积区域。
胃肠道疾病的发生与致病性生物膜有关,例如炎症性肠病、肠易激综合征、消化性溃疡病、胃炎、胃酸缺乏和胃肠道癌症。形成与疾病相关生物膜的细菌菌株包括脆弱拟杆菌、艰难梭菌、致病性和肠粘附性大肠杆菌、活泼瘤胃球菌和幽门螺杆菌。除了引起胃肠道疾病外,致病性生物膜还可能导致肠道微生物群失调、粘液破坏和上皮细胞受损。
生物膜在溃疡性结肠炎和肠易激综合征患者中非常普遍,可以在肠镜检查期间观察到这种生物膜,但许多医师可能还没有意识到它们的生物学和临床重要性。胃肠道生物膜具有保护性的细胞外基质,这使得它们对抗生素耐药性增强,变得难以治疗。
但并非所有胃肠道生物膜都是致病性的,共生生物膜使宿主获取营养效率提高,有助于肠道吸收;能够利用体内老化细胞并产生能量;还能够通过物理结构、化学成分和特定代谢活动,作为对抗环境分子、免疫细胞、捕食性原生动物和其他病原微生物的保护屏障,来限制病原菌的定植和侵袭。这种保护机制有助于维持肠道微生物群落的稳定性和抵抗力。
生物膜有希望作为胃肠道疾病和内窥镜病理检测的新型生物标志物。因此,清楚地了解体内的生物膜,然后对致病性生物膜进行治疗或对共生生物膜进行保护和修复对人体肠道健康甚至全身健康都非常重要。
本文涵盖胃肠道生物膜的形成、外观和检测、生物膜的疾病和临床相关性以及目前的一些治疗方法。未来对生物膜性质、组成和临床相关性的研究将为肠道生理学提供新的认识,并为胃肠道疾病的治疗提供潜在的新选择。
1
什么是生物膜?
胃肠道微生物的生物膜是由微生物群体及其包被的细胞外聚合物和基质网组成,它们彼此黏附或者黏附到组织或器官的表面,以此在生长过程中适应生存环境,是一种特殊的细菌生存形式。
▸ 肠道粘膜表面三种细菌生活方式
生活在胃肠道表面的微生物可能会采取三种不同的生活方式之一。
生活方式1:它们可以组织成一个交流细胞网络,导致一种群落行为,称为生物膜表型。
生活方式2:它们可以从生物膜中分散,并向管腔或宿主迁移,称为生物膜分散。
生活方式3:或者他们可以作为自由生活、自由漂浮的浮游表型。
细菌生活方式及其与宿主的关系
doi: 10.1038/s41575-020-00397-y.
这些微生物群的生活方式与固有特性(运动,粘附性和代谢)可以影响宿主对它们的不同反应。
2
生物膜的构成
生物膜基质主要由水和生物聚合物组成,包括多糖、蛋白质、脂质和细胞外DNA,形成水凝胶状结构。
细菌细胞嵌入该基质中,共同形成生物膜。生物膜使用高效的细菌调节途径,如群体感应、严格反应和第二信使来调节生物膜的组织、结构和行为。
胃肠道生物膜外观和基质组成
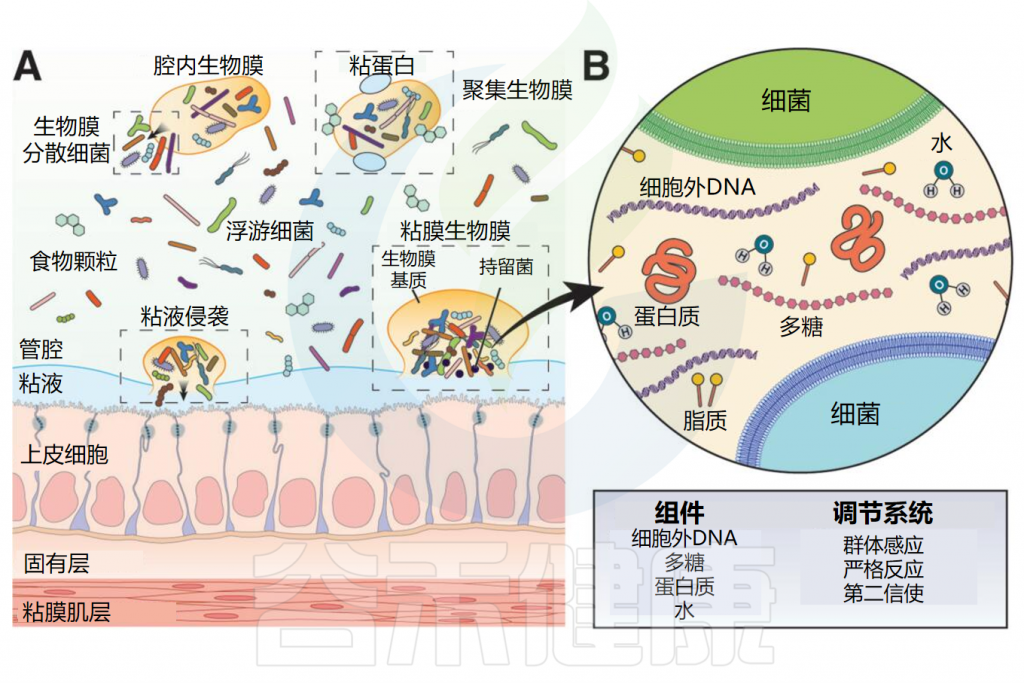
Jandl B,et al.Gastroenterology.2024
(A)肠道细菌和生物膜外观;(B)生物膜基质组成
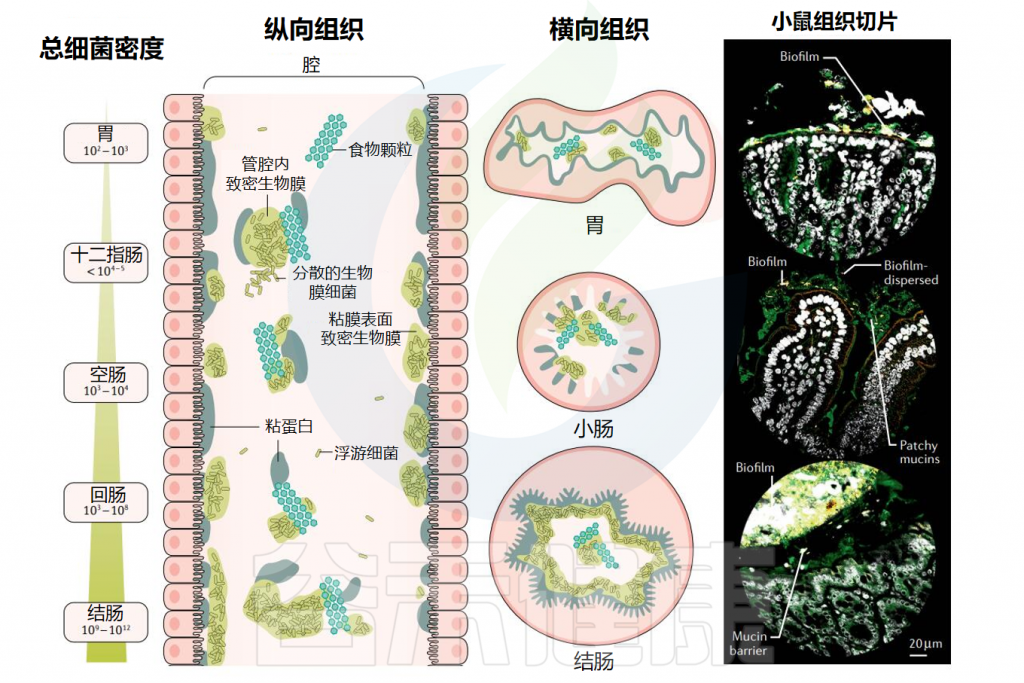
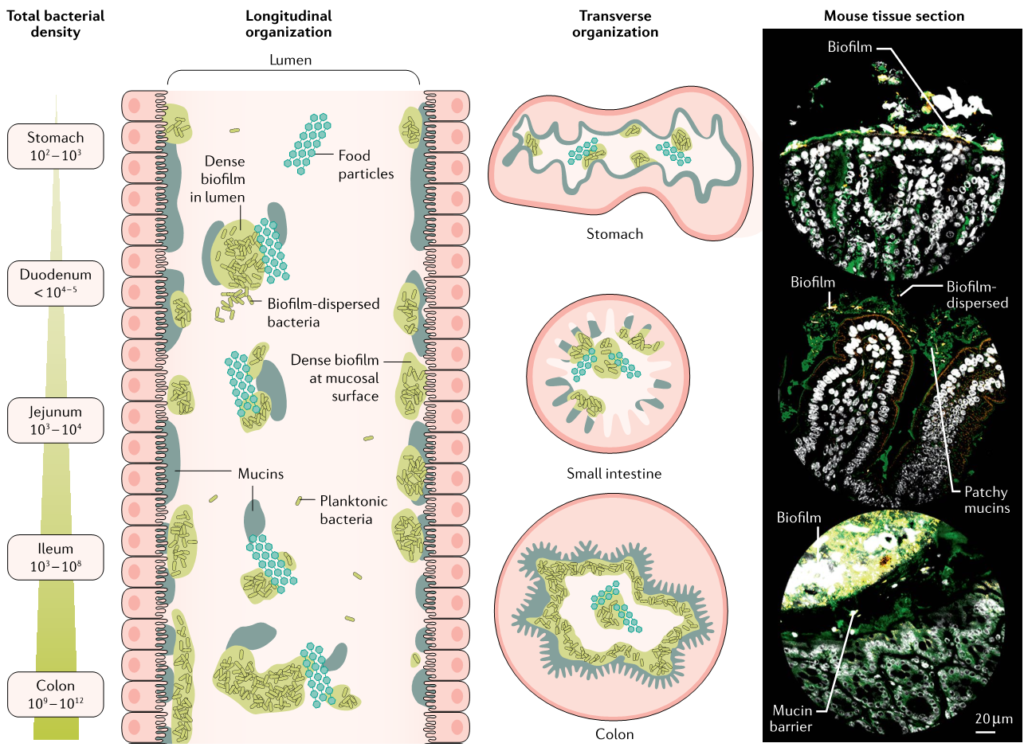
▸ 沿着胃肠道,生物膜的数量和厚度逐渐增加
在整个消化道中,生活在粘膜表面的共生微生物群由沿着纵向(中左)和横向(中右)轴的生物分层的群落组成。从胃到结肠,微生物密度和多样性增加。
粘膜微生物群在消化道形成大小不一的生物膜聚集体,在小肠中有更松散的粘附聚集体,在大肠起始处形成较为密集均匀的生物膜群落,在结肠中形成一个连续的凝胶形成层。在整个消化道中,微生物生物膜与粘蛋白聚集体和食物颗粒密切相关。
胃肠道生物膜表现为(1)具有富含粘蛋白基质的粘膜生物膜;(2)粘蛋白聚集体周围的生物膜簇;(3)粘附在食物颗粒上的生物膜;(4)这些形式的混合版本。
微生物群生物膜遍布胃肠道
doi: 10.1038/s41575-020-00397-y.
3
生物膜对宿主的影响
生物膜的一些特性
doi: 10.1038/nrmicro.2016.94.
① 细菌抗生素耐药性增强,消除病原菌更困难
与自由生活的细菌细胞相比,生物膜的一大特点是对抗生素和其他抗菌素的耐药性或耐受性增强。
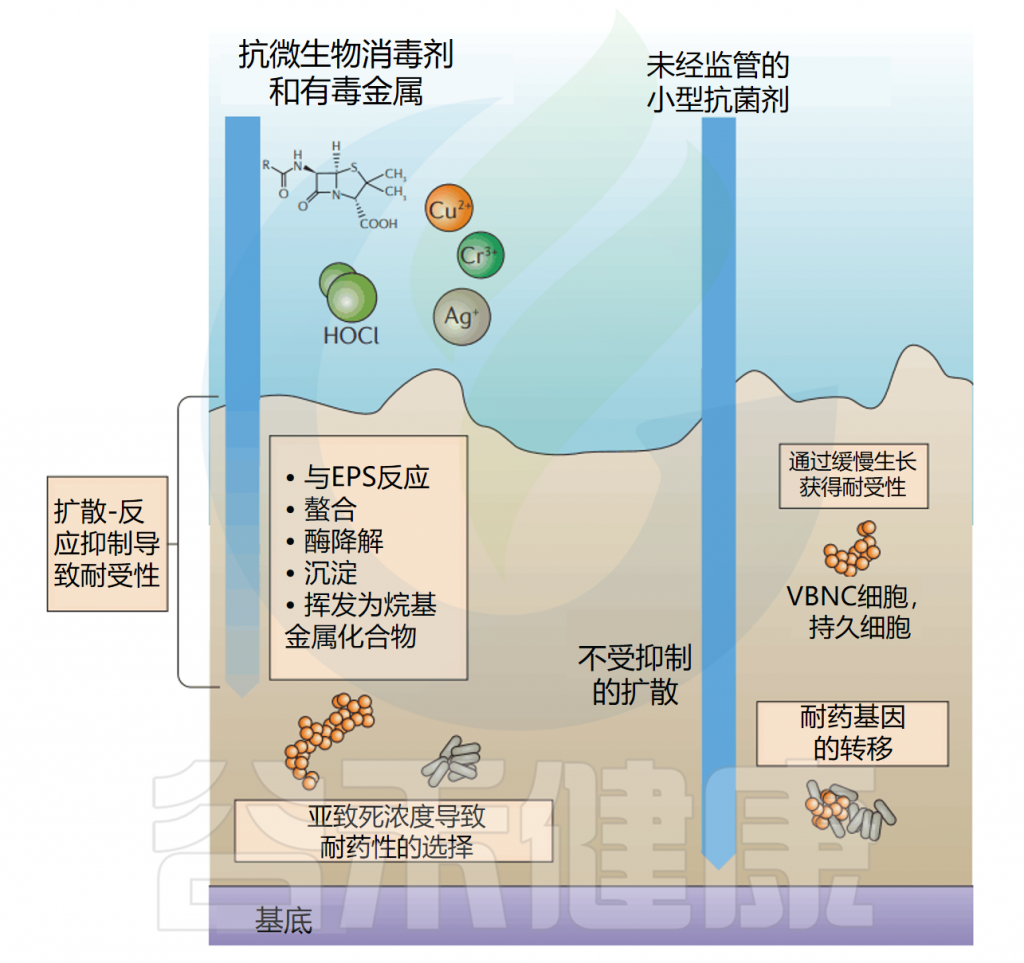
生物膜可以以一种称为扩散反应抑制的形式,淬灭通过生物膜扩散的抗菌物质的活性,这种抑制形式可能将抗微生物药物的有效浓度降低到不致死浓度。
受基质扩散反应抑制的抗菌剂包括有毒金属,如铜,其与Erwinia amylovora生物膜基质中的多糖络合以保护细菌免受铜胁迫。
生物膜包含大量处于”静止期”的细胞,这些细胞对许多依赖细菌细胞代谢来获得活性的抗微生物药物的敏感性降低。对于处于静止期的生物膜中的细菌,至少有1%对抗生素产生抗药性。随着时间的推移,生物膜中大量的细胞进入静止期。随着生物膜的老化,一些抗生素(万古霉素)的杀伤效率显著降低。
生物膜中细胞对抗菌剂的抗性增强另一种机制是通过水平基因转移抗性基因。例如,对几种抗生素具有抗性的基因质粒很容易转移到大肠杆菌(E.coli)和P.putida中。
doi: 10.1038/nrmicro.2016.94.
生物膜中的细菌对抗生素的耐药性增强,使得临床上治疗一些能够形成生物膜的致病菌感染更加困难。
② 获取营养效率提高,可能有助于肠道吸收
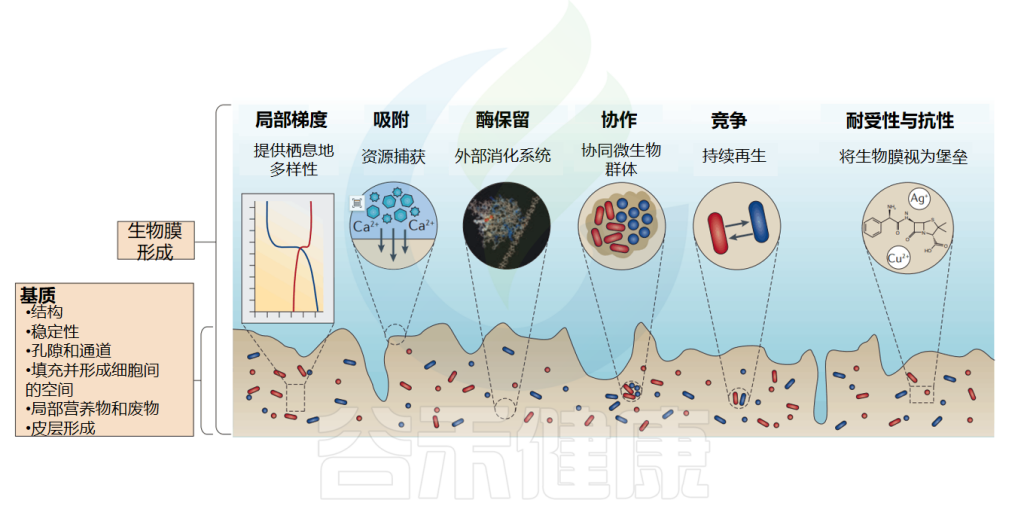
营养获取是所有生物的基本过程,生物膜具有一种非常有效的营养获取策略,超过了自由生活的细菌。
生物膜是复杂的吸附系统,在生物膜的细胞质、细胞壁和基质的胞外聚合物(EPS)中具有不同的吸附机制和结合位点,这意味着生物膜中的细胞可以捕获和积累非常广泛的营养物质,即使浓度很低。这种强大的获取能力使生物膜即使在高度缺营养的环境中也能生长。
doi: 10.1038/s41575-020-00397-y.
注意:强大的捕获能力使有毒物质也更易积累!
但生物膜的吸附不是化合物特异性的,这意味着不仅营养物质,而且有毒物质都可以在生物膜中积累,在胃肠道生物膜中发现了红霉素琥珀酸乙酯、乙酰氨基酚、酸性药物、甾体激素和4-壬基酚合物等化合物。
③ 回收裂解细胞并产生能量,有效利用体内老化细胞
当细胞腐烂和分解时,它们的碎片留在基质中,被存活的细胞作为营养物质“蚕食”。这一过程已经在枯草芽孢杆菌(B.subtilis)生物膜中进行了详细的研究。
结果表明,裂解细胞中的DNA是磷、碳和能量的来源。铜绿假单胞菌(Pseudomonas aeruginosa)已被证明能够在生物膜中特异性地产生细胞外DNA酶,利用裂解细胞中的DNA作为营养来源。生物膜可以被视为一个高效的细胞碎片回收利用场。
④ 作为一种保护屏障,有助于人体肠道健康
生物膜是一种具有化学成分和特定代谢的物理结构,起着保护屏障的作用,可以抵御环境分子、免疫细胞、捕食性原生生物和细菌。
无论是微生物、膳食分子、污染物还是外来生物,要么可以自由地扩散穿过生物膜并到达宿主上皮,要么被生物膜阻断,生物膜作为一个紧密的屏障。这些腔内化合物可以被生物膜过滤,生物膜只允许某些分子通过,从而起到选择性过滤器的作用。
生物膜中的细菌拥有许多竞争策略,例如快速生长以获得营养,直接攻击以将其他竞争物种排除在环境之外,从其他竞争物种中获益或剥削其他竞争物种。
这种生物膜诱导的对入侵者的保护作用可以通过肠道微生物群对肠道病原菌的定殖抗性来证明。这种抗性在小鼠体内通过直接机制(如细菌素的产生、短链脂肪酸的产生、胆汁酸的转化和VI型分泌系统的表达)和间接机制(宿主生理和免疫的调节)介导。
生物膜通过物理结构、化学成分和特定代谢活动,作为对抗环境分子、免疫细胞、捕食性原生动物和其他细菌的保护屏障。这种保护机制有助于维持肠道的稳定性和抵抗力。
⑤ 多微生物相互作用,维持生态平衡
胃肠道表面的微生物群包含古细菌、原核生物和真核生物和病毒。肠道生物膜内的微生物相互作用,并与人体细胞相互作用。这些跨“区域”的相互作用可能在维持消化系统健康方面起着重要作用,当这些体内平衡相互作用被破坏时,可能在疾病中起着重要作用(称为失调)。
越来越清楚的是,这些微生物群与宿主的相互作用高度依赖于细菌群落作为生物膜结构的性质和空间组织。
⑥ 影响药物的活性,可能导致失效或效率提高
治疗药物可改变动物模型和人类肠道微生物群的组成,但肠道微生物群本身也参与药物加工。这种代谢功能对药物的有效性和安全性有重要影响。
肠道微生物群确实可以直接代谢外源性物质(例如胺碘酮、他克莫司、地高辛等),从而改变其化学性质、稳定性、生物利用度和潜在的生物效应。
因此,由微生物群驱动的外源性物质加工可能会导致不必要的不良反应,导致分子失效,或相反地导致更具活性和效率的分子。这一观察结果对人类使用药物的建议和剂量提出了严重的问题,特别是考虑到其中一些药物由于毒性而必须仔细监测。
胃肠道内的不同环境导致不同的生物膜分类组成以及不同的代谢过程。这一观察结果增加了试图解决微生物群对外源或药物加工的影响的复杂性。
4
生物膜的生命周期
生物膜生命周期
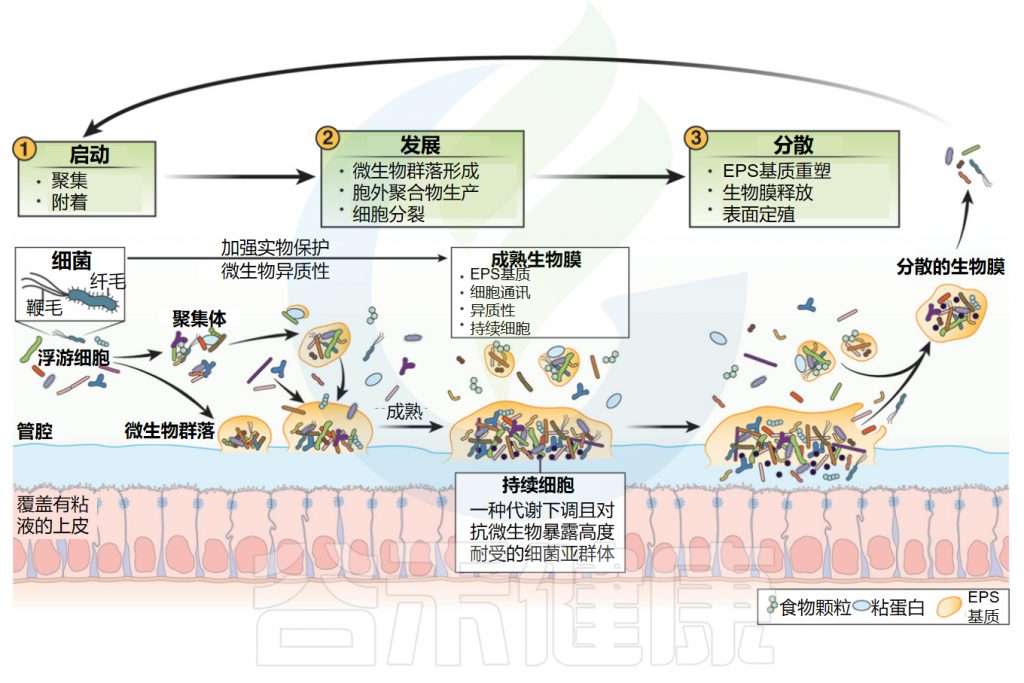
Jandl B,et al.Gastroenterology.2024
生物膜的形成、生长和增殖是生物膜生命周期的关键部分。生物膜生命周期的三个阶段包括以下内容。
(1)起始:细菌使用表面表达的粘附蛋白、鞭毛和菌毛附着在粘膜表面或聚集体(彼此或管腔内容物),如未消化的食物颗粒或宿主粘蛋白上,形成微菌落。
(2)发育:粘液附着的微菌落开始细胞分裂并建立由胞外聚合物(EPS)组成的EPS基质,该基质具有支持细菌共存和有效通讯的异质化学和物理微环境。
生物膜生长和发育是一个动态过程,其中管腔浮游细菌可以迁移到已建立的生物膜结构中,管腔细菌生物膜聚集体通过团聚膨胀,非表面附着的聚集体附着在粘膜生物膜上。持久性细胞形成于营养缺乏区域,通常位于成熟生物膜的核心,对环境压力和抗菌素暴露表现出高度耐受性。
(3)扩散:胞外聚合物(EPS)基质重塑有助于释放生物膜分散的聚集体,这些聚集体可以在未感染的粘液中定植。由于肠道蠕动,肠道中的扩散方向从近端区域到远端区域发生。分散的生物膜是一种独特的表型,有助于生物膜沿肠道扩展。
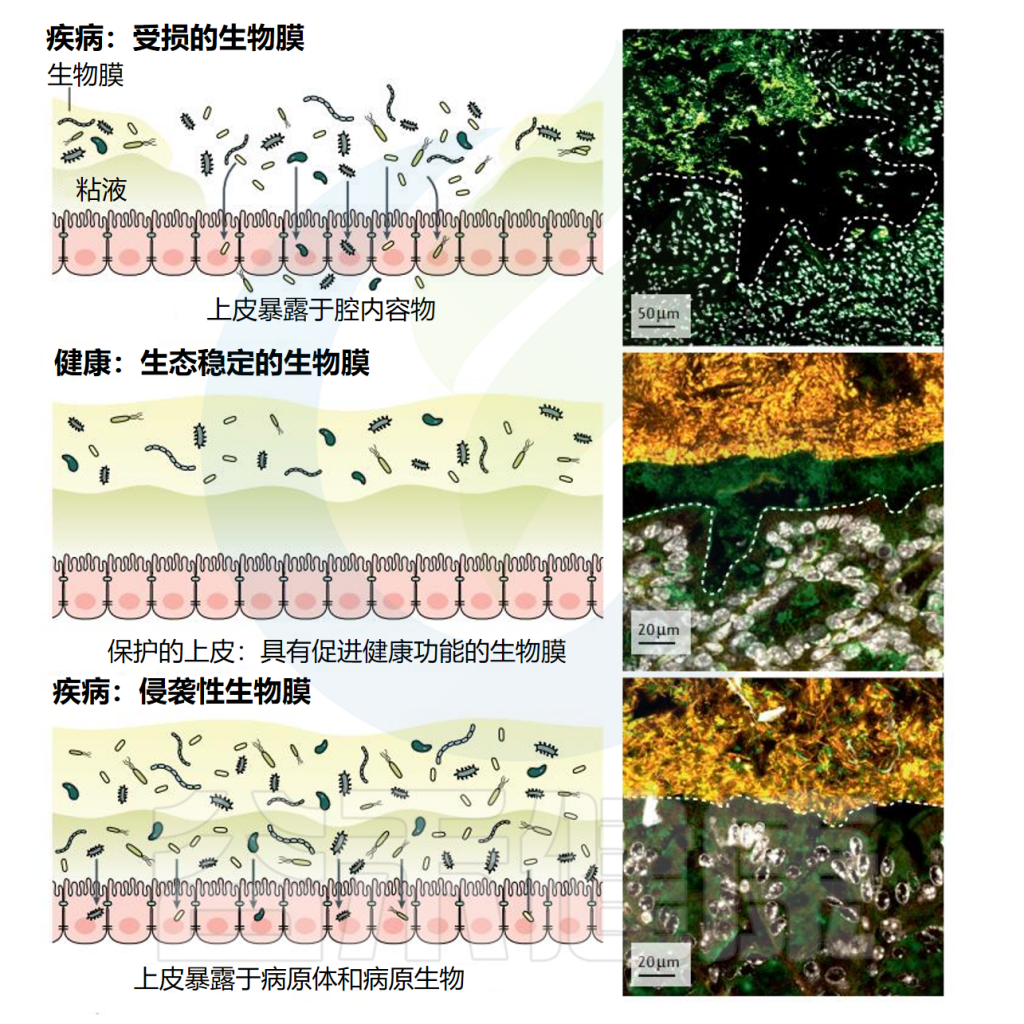
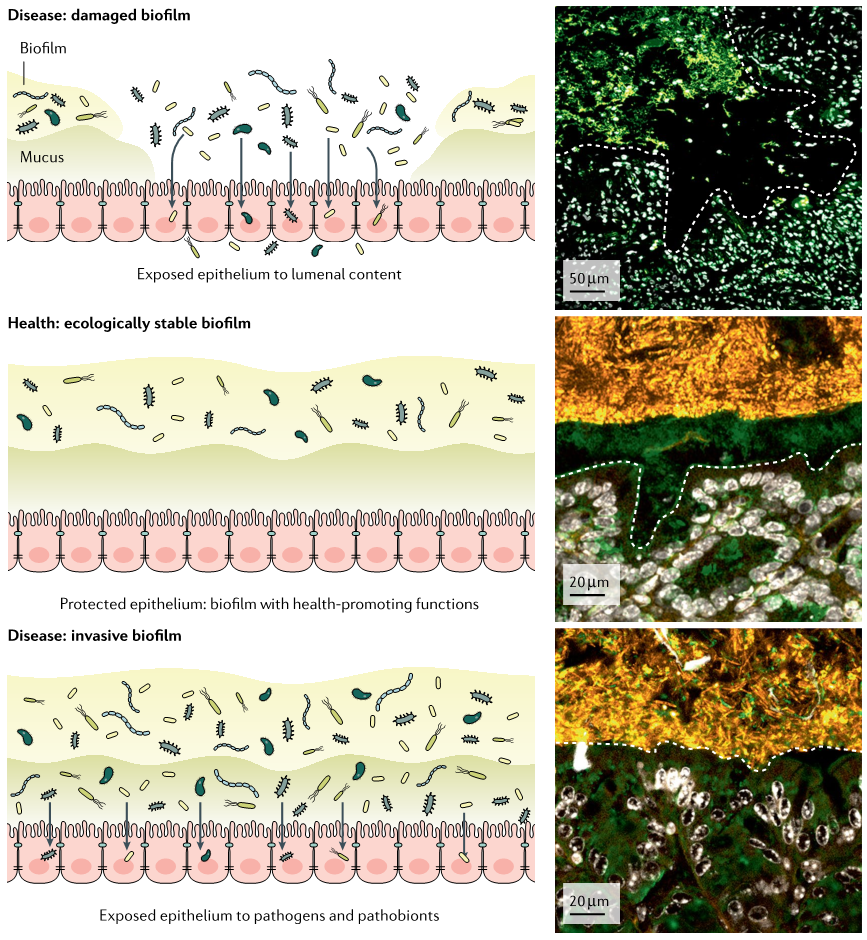
生物膜在肠道和整体健康中发挥重要作用,通过提供物理屏障、维持生态平衡、促进营养竞争和参与代谢过程等机制,有助于维持健康。
但生物膜相关感染在临床上具有重要意义,因为大多数持续性感染源于生物膜。研究发现生物膜与炎症性肠病(IBD)、癌症和胃肠道感染相关,并与分类学组成变化、抗生素耐药性提高以及病原体的生物膜分散有关。
编辑
doi: 10.1038/s41575-020-00397-y.
研究生物膜在疾病中的作用,可能会为胃肠病学带来重要的临床发现。
1
胃肠道感染
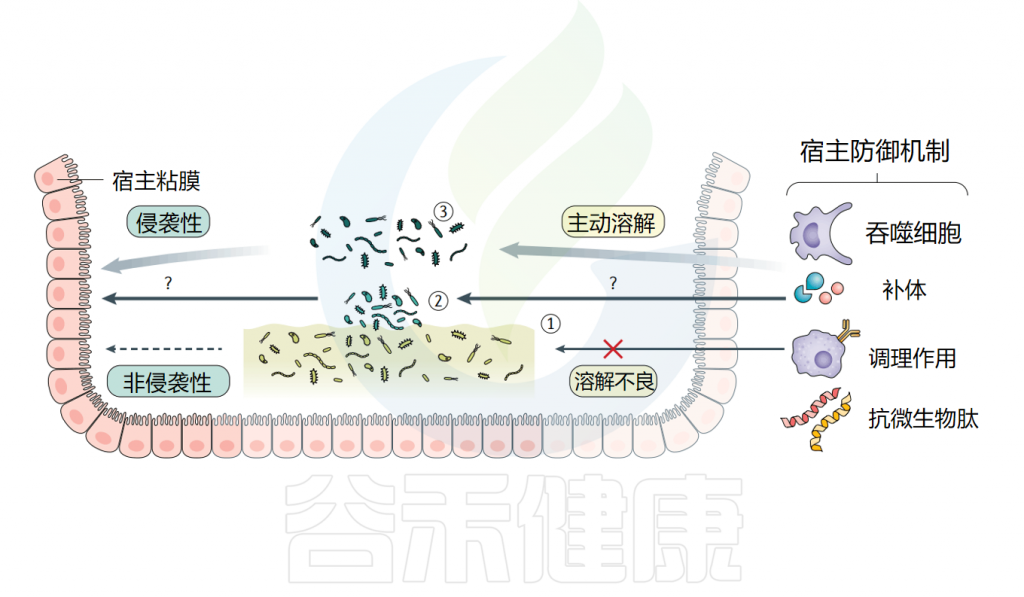
人类胃肠道可被各种肠道病原体定植,这些病原体可导致各种疾病,从无症状定植(如幽门螺杆菌)到轻度症状和自限性(如弯曲杆菌、螺旋体门和幽门螺杆菌),以及潜在的危及生命的慢性感染(如耐药肠球菌和艰难梭菌引起的相关感染)。
◮ 病原体可以形成有害生物膜并释放毒素
多项研究表明,这些肠道病原体(如幽门螺杆菌、肠球菌、艰难梭菌和艰难梭菌)在能够有效形成生物膜。胃肠道感染的动物模型显示出有害生物膜菌落的组织学特征,这些菌落密集堆积并粘附在上皮表面,例如胃中的幽门螺杆菌生物膜,以及大肠中的空肠弯曲菌和艰难梭菌生物膜。
这些病原体在生物膜中可能释放毒素,导致局部组织的炎症和损伤,进而引发发热、溃疡等并发症。
◮ 生物膜内的病原体耐药性更强,导致持续感染
生物膜内的细菌通常对抗生素具有更高的耐药性,治疗效果降低,增加了治疗的复杂性。并且生物膜中的病原体能够抵抗宿主免疫系统的攻击,使感染难以清除,导致慢性或反复感染。
在人类肠道活检样本中,微生物群的组织学和显微镜染色显示存在致密的粘膜相关生物膜覆盖组织(例如胃溃疡中的幽门螺杆菌生物膜和直肠中的螺旋体生物膜)。
虽然研究已经确立了形成生物膜的肠道病原体与感染之间的联系,但生物膜生活方式本身对感染的慢性和持续性尚未得到充分了解,对抗这种情况的生物膜特定战略仍有待充分评估。
2
炎症性肠病
越来越多的证据支持炎症性肠病(IBD)特异性粘膜生物膜通过多种途径在宿主组织中引发促炎反应。
◮ 炎症性肠病患者形成生物膜的能力更强
分类差异和粘膜相关微生物群的多样性降低与炎症性肠病相关,具体表现为克罗恩病中普拉梭菌丰度降低,而毒力大肠杆菌丰度增加;同时,溃疡性结肠炎和克罗恩病中肠毒性脆弱拟杆菌和铜绿假单胞菌的丰度也有所增加。
炎症性肠病患者的活检样本中,上皮粘附生物膜的患病率高于健康对照者。与健康组织的微生物群相比,IBD患者的粘膜微生物群在体外产生更大的生物膜。此外,肠球菌和从克罗恩病患者分离的粘附侵袭性大肠杆菌在肠上皮细胞系培养物上形成生物膜的能力更强。
◮ 炎症性肠病相关生物膜的细菌可以作为病原体
此外,来自炎症性肠病相关生物膜的生物膜分散细菌可以在体内和体外成为侵袭性病原体,这一现象可能在IBD的病理生理中起致病作用。
黏液共生微生物(如嗜黏蛋白阿克曼菌和瘤胃球菌科)的丰度改变和释放蛋白酶和糖苷酶的细菌(如卟啉单胞菌、粘附侵入性大肠杆菌和拟杆菌)的生物地理重新定位也可能促进邻近共生微生物进入肠上皮表面。
来自新发儿科克罗恩病患者多个胃肠道位置的样本显示细菌过度生长,包括肠杆菌科、巴氏杆菌科、韦荣氏菌科和梭杆菌科,以及丹毒菌门、拟杆菌门和梭状芽胞杆菌门的丰度降低,与疾病类型相关。
与健康对照相比,上皮粘附细菌越来越多地出现在IBD患者中,IBD患者微生物群产生的生物膜在大小和细胞数量上比健康受试者更突出。
◮ 可能成为炎症性肠病的生物标志物
一项对1426名溃疡性结肠炎(UC)和肠易激综合征(IBS)患者的研究发现,这些患者具有独特的生物膜特征,IBS患者的生物膜发生率为57%,UC患者的发生率为34%,而对照组仅为6%。
此外,生物膜检测呈阳性的患者钙卫蛋白水平较高,生物膜中胆汁酸积聚,这表明炎症和腹泻更严重。在显微镜下,IBD患者来自回肠、升结肠和乙状结肠的活检标本显示细菌浓度显著更高。
随着临床研究的深入,生物膜可能成为内窥镜检查和活检信号易感性及疾病严重程度更具代表性的标志物。
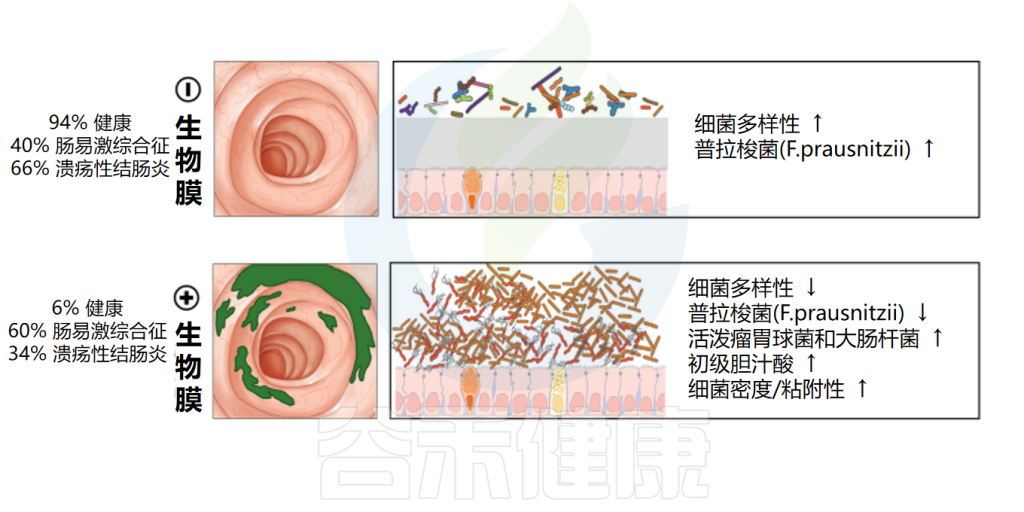
doi: 10.1053/j.gastro.2021.06.024.
◮ 产短链脂肪酸的益生菌抑制病原菌的生物膜
益生菌的突然下降,尤其是那些产生丁酸盐的益生菌,改变了细菌生长模式,从而促进了生物膜的产生。
体外实验表明,短链脂肪酸(SCFA)抑制生物膜的形成,包括大肠杆菌、鼠伤寒沙门氏菌、表皮葡萄球菌和戈登链球菌。并且,随着IBD的进展,SCFA的活跃生产者大大减少。因此,我们认为SCFA是生物膜形成的合理天然抑制剂,有助于解释抗生素治疗对IBD患者的双重影响。
◮ 生物膜的形成使病原菌持续存在,并加速黏膜损伤
在炎症性肠病(IBD)患者活检中经常发现的一种可能病原体是粘附侵袭性大肠杆菌(AIEC)。AIEC可以通过用蛋白酶促进粘蛋白降解来穿透粘液层。然后,它们中的很大一部分通过增加氧化代谢物的使用来竞争肠道中的共生体,这可能会引发慢性炎症和纤维化。一小部分已被证明侵入和复制人巨噬细胞和中性粒细胞,以侵入免疫反应或诱导自噬。
生物膜的形成能力可以将这些过程联系起来。首先,最近的研究显示AICE中的IV型分泌系统(T4SS)在克罗恩病中显著上调,这有助于在上皮细胞表面构建生物膜。
除了粘附和运动外,生物膜还可能与sfa/focDE和ibeA等毒力基因的表达有关。对克罗恩病相关菌株 AIEC LF82 的研究表明,巨噬细胞是生物膜样细菌群落的家园。因此,生物膜的形成使 AIEC 能够在炎症环境中持续存在,加速粘膜损伤,并产生免疫细胞相关的慢性感染库。
3
慢性胃炎
在大多数情况下,慢性胃炎是消化性溃疡和胃癌的主要原因。幽门螺杆菌与胃炎在胃恶性肿瘤的发展中存在密切联系。幽门螺杆菌感染是成人慢性胃炎发展的公认病因因素(在90%以上的病例中)。
◮ 生物膜使幽门螺杆菌能在恶劣环境下生存
最初于2006年在消化性溃疡和尿素酶阳性的个体中,在胃粘膜中拍摄了胃幽门螺杆菌生物膜,胃是生物膜生长的理想环境。生物膜中的幽门螺杆菌细胞在长时间的体外培养下经历形态变化,最终进入球状物状态(幽门螺杆菌的休眠状态),表明生物膜使幽门螺杆菌能在恶劣环境中耐受生存。
虽然在患者中发现的大多数幽门螺杆菌对治疗有反应,但一小部分细菌可能会抵抗它们的作用,导致感染继续。随着抗生素浓度的下降,幽门螺杆菌从球状恢复到螺旋状,重新填充生物膜或引起扩散。
◮生物膜使幽门螺杆菌耐药性增强,不利于彻底根除
在慢性胃炎中,幽门螺杆菌生物膜作为外部因素的物理屏障,它响应降钙素等药物改变其表面结构,从而提高环境适应能力,这可能部分解释了吞噬细胞无法根除在生物膜中发育的细菌的原因。
幽门螺杆菌在处于生物膜状态时对抗生素的耐药性增加,对克拉霉素、阿莫西林和甲硝唑表现出增强的耐药性。
此外,eDNA 可以促进微生物粘附和螯合阳离子以抑制抗生素扩散。除了上述机制外,幽门螺杆菌的表面内毒素和外膜结构可以在免疫系统的恒定压力下通过生物膜形成过程中的基因交换而改变,最终导致幽门螺杆菌疏水性降低,这进一步阻碍了生物膜的药物渗透。
临床信息进一步支持生物膜和疾病发展相关的观点。在幽门螺杆菌患者的治疗过程中,在常规治疗前用生物膜破坏剂N-乙酰半胱氨酸治疗幽门螺杆菌患者导致实验组根除幽门螺杆菌,而常规治疗组没有表现出相同的结果。
4
癌症
生物膜与胃、小肠和结肠的癌症发生和发展有关。
◮ 结直肠癌患者中的生物膜比健康人更普遍
在健康的人结肠组织中,通过显微镜可以看到附着在肠上皮上的生物膜。尽管如此,厚的微生物生物膜在结直肠癌患者中比健康人更普遍,在50%的结直肠癌(CRC)患者中观察到粘液侵袭性细菌生物膜,但仅在13%的健康个体中观察到。
有趣的是,在89%的右侧结直肠肿瘤中检测到生物膜,但仅在12%的左侧结直肠肿瘤中检测到生物膜。
结直肠癌患者的生物膜相关微生物群包含多种菌株,包括具核梭杆菌(Fusobacterium nucleatum)、产肠毒素脆弱拟杆菌、产生基因毒素的大肠杆菌和解没食子酸链球菌。
◮ 生物膜通过影响炎症环境或基因诱导致癌
关于生物膜对结直肠癌的临床贡献,使用小鼠模型和人类结肠组织的研究表明,生物膜可以直接致癌,但也可以在炎症环境和遗传易感宿主的背景下参与组织转化。
对无菌小鼠的研究表明,侵袭性生物膜通过改变宿主mRNA或microRNA而致癌,特定类群的贡献对致瘤复制至关重要。具核梭杆菌可以通过在遗传易感个体中募集肿瘤浸润免疫细胞直接促进结直肠癌的发生。
产肠毒素的脆弱拟杆菌可能促进结直肠癌的发生,部分原因是通过分泌金属蛋白酶毒素导致辅助T17(Th17)细胞依赖性反应的过度激活和基因毒性氧自由基的产生。生物膜诱导致癌的其他潜在机制包括多胺(精胺和亚精胺)宿主途径的代谢组学变化,以及对粘膜相关微生物组功能变化。有益的共生微生物被更适应肿瘤微环境的机会性病原体所淘汰。
◮ 其他癌症组织附近也有异常粘附的生物膜
家族性腺瘤息肉病患者在息肉附近也有异常粘附的细菌生物膜,这些生物膜主要由编码大肠杆菌素的大肠杆菌菌株和产肠毒素脆弱拟杆菌组成。有趣的是,在该研究中,这些遗传生物膜的分类组成似乎不同于在散发性结直肠癌或健康宿主中检测到的生物膜(与散发性结直肠癌相比,明显富含黏液侵入性变形杆菌和拟杆菌)。
微生物群诱发的癌症可能不是由单一微生物引起的,而是需要一个复杂的细菌群落聚集在生物膜环境中,其中有益的共生体被病原体(如前面讨论的那些)取代,这些病原体更适应肿瘤微环境,可以发挥关键病原体的致病作用。
!
Tips
并非所有肠道生物膜都是致病性的,共生生物膜有几个例子。共生生物膜可以通过竞争肠腔中的空间和营养物质以及释放抑制性代谢物(如乙酸盐或丁酸盐)来限制病原菌的定植和侵袭。
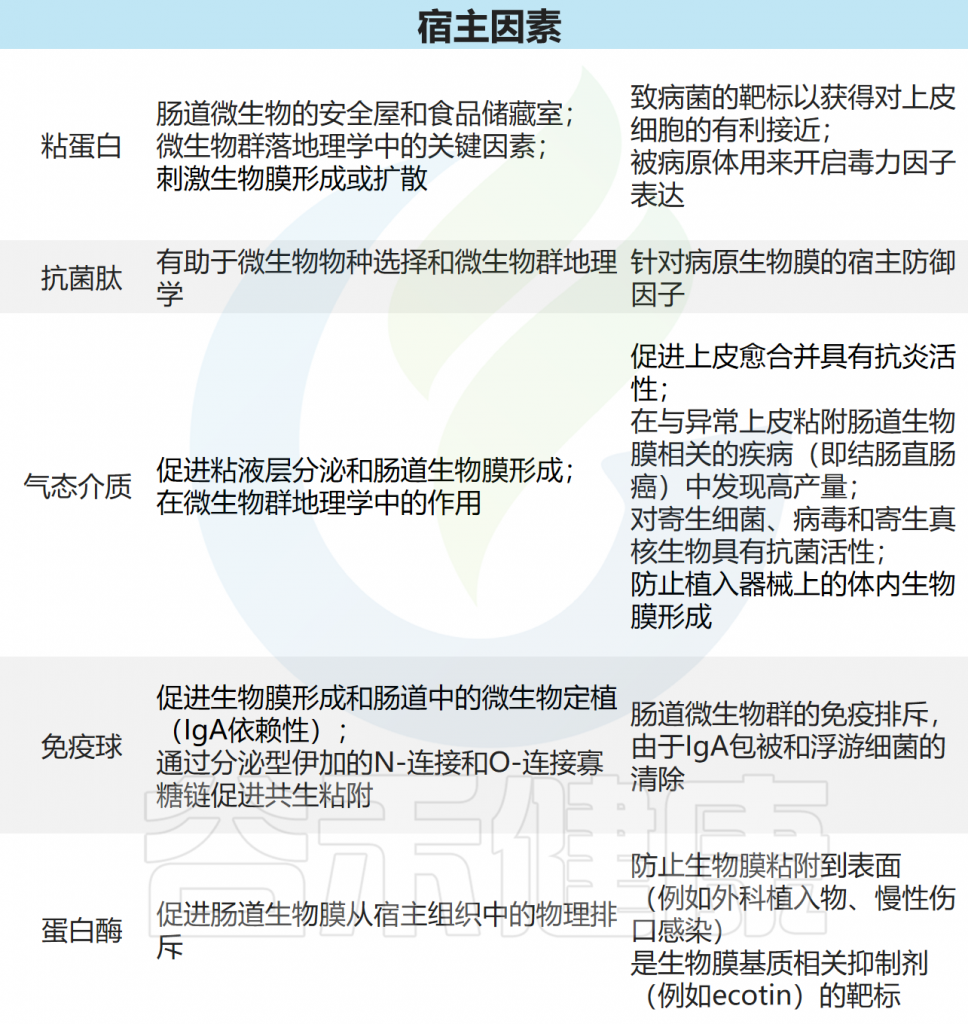
生物膜-宿主相互作用
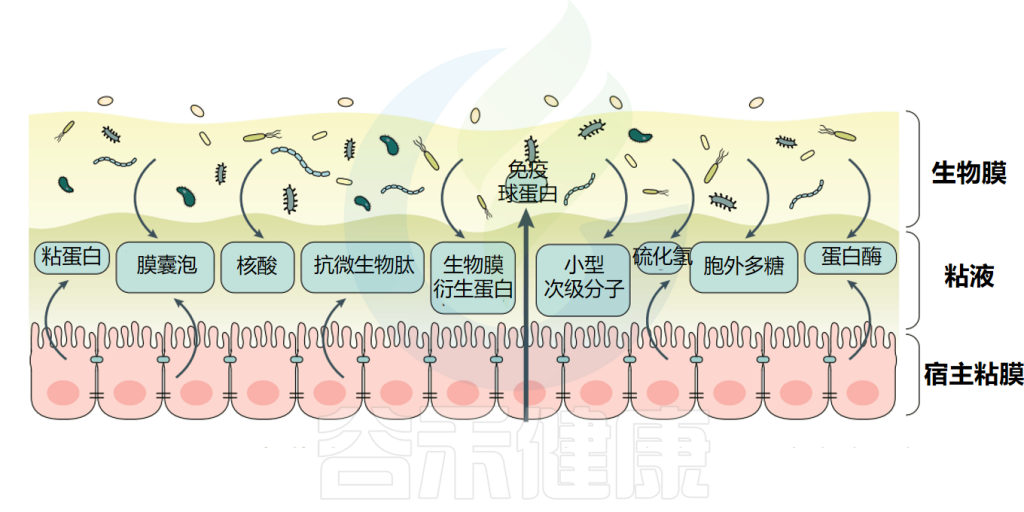
doi: 10.1038/s41575-020-00397-y.
生物膜的共生性或致病性有时取决于单个基因(例如,翻译促炎或致癌功能)、细菌菌株上具体的生物膜内源性因子或是宿主免疫反应。

doi: 10.1038/s41575-020-00397-y.
知道了生物膜在健康和疾病中的作用后,想必迫切地需要了解目前有哪些方法可检测和控制体内生物膜,并治疗致病性生物膜。那让我们接着往下看。
▸ 临床上用内窥镜可以看到生物膜,但不易分辨
目前临床上有经验的医师会在内窥镜检查期间看到生物膜。炎症性肠病(IBD)患者和肠易激综合征(IBS)患者在内窥镜检查下发现普遍存在生物膜。
肠道生物膜在医学界仍然是一个相当新颖的概念,生物膜经常被忽视或被认为是不完整的肠道准备。
区分生物膜和肠道残留物对于指导诊断和治疗至关重要,一般可以通过以下方式进行评估:
(1)如果可以用喷射清洗机轻松去除多余的层,则很可能是残留物;
(2)如果清洁程序很困难并且该层像膜一样粘在回肠壁上,则很可能是生物膜;
(3)由于重力,残留物通常与液体一起积聚在底部,而生物膜通常在整个肠壁周围形成360°附着层。
◮ 内窥镜会对肠道菌群平衡产生一定干扰
内窥镜等一些侵入性的方法,会对肠道菌群产生一定的干扰和影响。
谷禾通过真实案例检测并对比了做肠镜前后的肠道菌群变化:原本肠道内占极高比例的黄色拟杆菌属比例大幅压缩,罗氏菌属几乎消失不见。对应的普雷沃氏菌属以及埃希氏菌属(主要是大肠杆菌)比例快速增加,另外除了这些菌外还有大量的原占比很低的其他菌属出现。

而更大的变化出现在完成肠镜检查后,核心菌属变为埃希氏菌属、韦荣氏球菌属、梭杆菌属和瘤胃球菌属。原来的三大核心菌属占比被压缩到了5%左右。
与抗生素杀死菌群的情况类似,服用泻药将大量菌群排出同样也会导致菌群数量和丰度下降,和抗生素不同的是肠道不同部位的菌可能清除比例存在差异。肠道菌群平衡这项指标明显下降,菌群多样性也随之下降。有益菌减少,有害菌上升(虽然这可能只是暂时的)。
▸ 拓展:其他生物膜检测方法
此外还有一些方法被用于检测及了解生物膜。
聚合酶链反应(PCR):用于直接在临床样本中检测生物膜形成的病原体。通过扩增特定区域,提供高特异性和敏感性。
荧光原位杂交:结合短荧光标记的寡核苷酸,与目标微生物的特定核糖体RNA结合,通过显微镜分析样本。
宏基因组学:通过分析整个微生物群落的基因组,识别生物膜形成的病原体。宏基因组中有大量的基因信息,对于生物膜描述更准确。
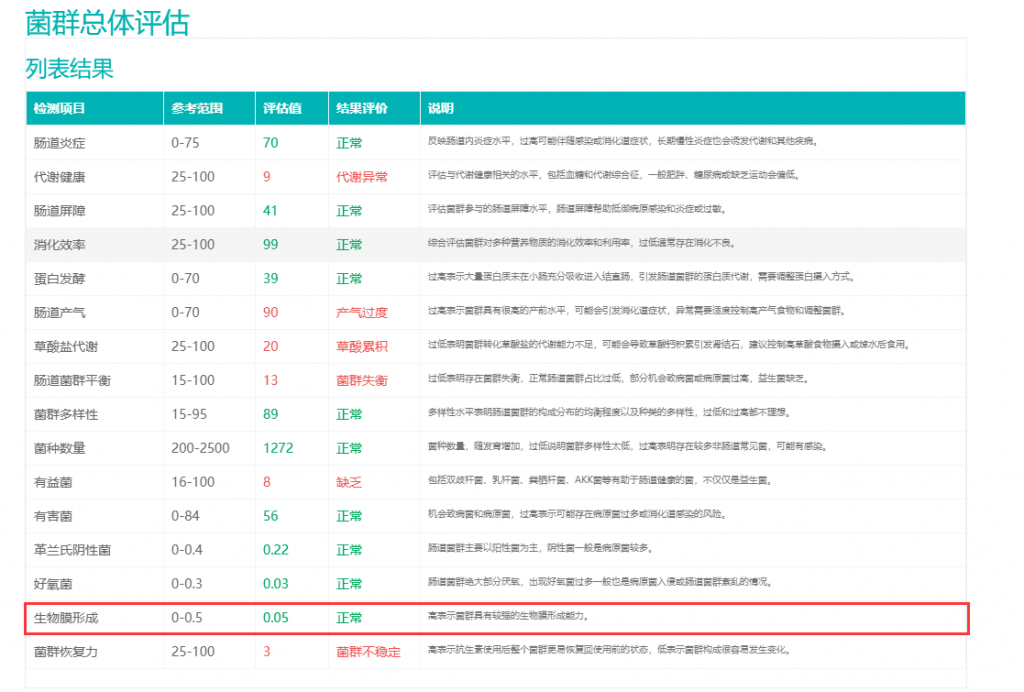
谷禾的宏基因组检测报告中,对生物膜的形成能力进行了分析评估。
刚果红琼脂试验:特别适用于检测金黄色葡萄球菌生物膜生产者。
微生物生物膜在胃肠道内稳态的多个方面发挥重要作用。然而,在某些临床情况下,当这些生物膜受到破坏时,需要对其进行保护或修复;或在其他情况下,对于某些附着于上皮的病原体生物膜,则可能需要将其彻底清除。
因此,在开发针对生物膜的治疗性控制策略时,目前的干预措施主要可分为以下几类:(1)抑制细菌粘附;(2)抑制生物膜的形成;(3)清除成熟生物膜。
针对胃肠道生物膜的治疗干预方法
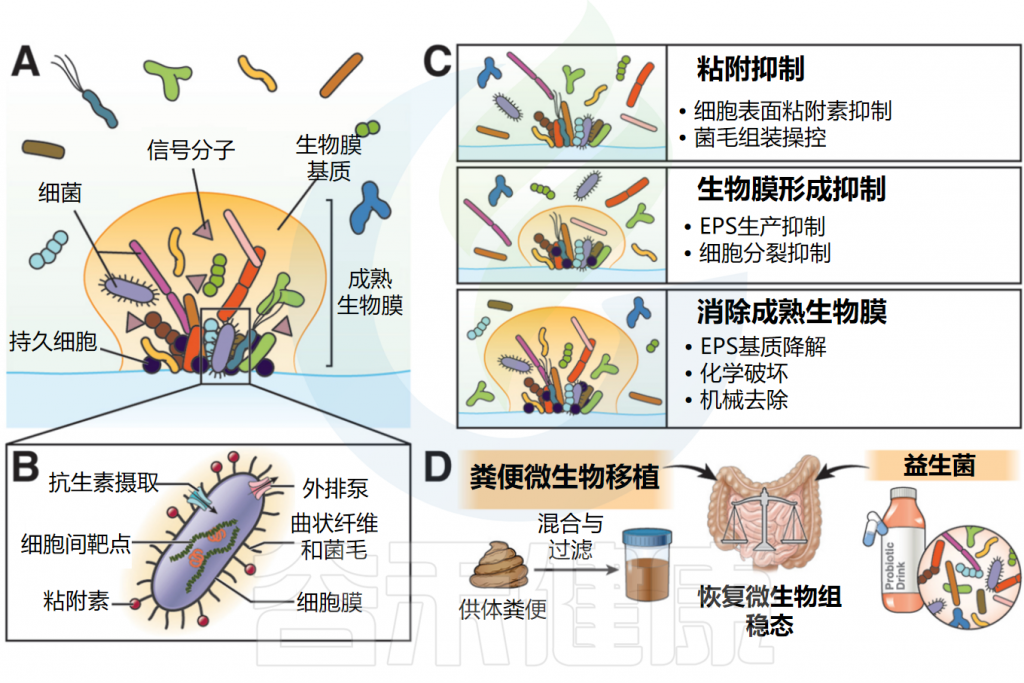
Jandl B,et al.Gastroenterology.2024
▸ 使用药物抑制细菌粘附素的表达
病原体生物膜预防策略主要侧重于抑制细菌粘附。方法包括通过引入细胞表面改变或抑制细菌粘附素表达(如curli或pili)来靶向细菌表面特性,调节生物合成,是抑制粘附的有前景靶点。
菌毛生物发生的小分子抑制剂成功地破坏了这一途径并干扰了细菌表面粘附。例如,黄烷醇杨梅素是一种具有代表性的化合物,可抑制生物膜形成。其他方法包括使用甘露糖苷等抗粘附剂来抑制粘附素的产生并减少胃肠道定植。
抗粘附素的一个关键优点是此类化合物不会影响细菌的活力,也不会根除共生细菌。然而,这种抗粘附策略的大多数体内数据是在肺部感染或伤口感染的动物模型中生成的, 其对肠道生物膜的有效性还有待研究。
▸ 使用抗生素杀死病原菌
也可以使用抗生素直接杀死病原菌,但这可能无法完全根除体内生物膜,并可能导致生物膜的持续存在和耐药性。在这种情况下,细菌虽能存活但不一定生长。
并且这可能为抗生素耐药性的产生提供条件,如通过诱变和自然选择形成的外排泵挤出抗菌剂。肠道作为复杂的多微生物环境,是遗传转移和可变亚群选择的理想场所。生物膜对抗生素治疗的持续耐受可能与慢性胃肠道感染密切相关。
▸ 使用天然化合物抑制生物膜形成
抑制胞外聚合物(EPS)基质的产生是另一种治疗策略。天然产物和小分子可以抑制基质的形成并减少细胞之间的细菌粘附和聚集。
例如,大蒜、肉桂、生姜、银杏、蔓越莓和柑橘类水果的各种提取物具有抗生物膜特性。天然衍生的生物表面活性剂也显示出抗生物膜特性。例如,鼠李糖脂包含一个与烷酸脂肪酸链相连的鼠李糖部分,可以抑制几种病原体的生物膜形成,包括变形链球菌(S.mutans)和血链球菌(Streptococcus sanguinis)。Zerumbone和α-humulene是其他天然产物,通过下调不同的外排泵相关基因和抑制生物膜形成。
氨基酸也显示出有趣的抗生物膜效应。例如,L-半胱氨酸、d-亮氨酸、d-蛋氨酸、d-色氨酸和d-酪氨酸可以单独减少生物膜生长并触发成熟生物膜的生物膜扩散。此外,当与环丙沙星共同给药时,天冬氨酸和d-谷氨酸可以抑制生物膜的形成并分散成熟的生物膜。
▸ 天然抗菌肽消除生物膜和感染
天然来源的抗菌肽(AMP)是另一类重要的抗生物膜药物,因为它们具有巨大的化学、结构和机制多样性,以消除生物膜和感染。
例如,Indolicidin是一种AMP,来源于牛中性粒细胞的细胞质颗粒,可渗透细胞壁而不破坏其完整性以抑制细菌DNA合成。
另一个例子是cathelicidin衍生的人类宿主防御肽LL-37,它可以防止细菌粘附并下调群体感应(QS)的基因。
总体而言,抗菌肽通过调节宿主免疫反应来有效地对抗生物膜。通过β-防御素1的防御素片段修饰进行优化,抗菌肽(AMP)Pam-3的开发,该肽能有效对抗胃肠道致病生物膜,而不会伤害共生菌。但抗菌肽(AMP)的一个缺点是由于酶的快速降解,其肠道稳定性较差。
▸ 使用益生菌形成“保护型”生物膜
另一种对抗胃肠道生物膜的治疗方法包括使用益生菌。
益生菌菌株的理想特性包括对肠道表面的良好粘附和在胃肠道中停留时间长,这是恢复健康的肠道微生物群和促进肠道稳态所必需的。益生菌在肠道粘膜表面形成无害的生物膜,从而可能防止病原菌的(再)定植、生物膜的形成和粘膜屏障的浸润。
例如,益生菌大肠杆菌 Nissle 1917 是治疗由肠致病性或肠毒素性大肠杆菌感染引起的胃肠道疾病的一种有前景的策略,其非致病性表现出优于病原菌株的生物膜形成能力。经过基因工程改造的大肠杆菌 Nissle 1917已被证明能够促进肠道屏障功能和上皮修复,从而增强肠道上皮完整性。
注:一些益生菌对胃肠道疾病显示出有益作用,例如感染性腹泻、抗生素相关性腹泻、肝性脑病、溃疡性结肠炎和肠易激综合征。
此外,某些具有益生菌特性的乳酸菌物种会分泌抗菌、抗粘附和抗生物膜分子,使它们能够对抗病原生物膜的定植。
▸ 使用噬菌体削弱生物膜
噬菌体是感染细菌并最终通过裂解杀死细菌的病毒。它们可以消除医疗设备上的生物膜,并且已经在各种体内感染模型中进行了研究(例如皮肤、肺和骨感染,以及败血症)。T7噬菌体通过基因工程促进糖苷酶的表达,比单独的非酶噬菌体更有效地根除大肠杆菌生物膜。
噬菌体似乎是对抗生物膜感染的有希望工具,但在应用这种工具对抗肠道中有害的生物膜之前,仍有许多问题需要解决。这些问题包括缩小噬菌体的宿主范围(如确定哪种噬菌体对特定菌株的作用更好),了解噬菌体耐药性的风险,确定宿主因子是否会使噬菌体特性失活,以及确定噬菌体制剂在人类中的长期安全性)。
▸ 纳米医学可能成为新型抗生物膜疗法
纳米医学的技术进步也可能有助于开发抗生物膜药物,因为它们解决了药物输送和疗效的挑战。纳米颗粒的大小通常在1-100nm 之间,有望用于治疗应用,尤其是肠道特异性作用。它们可以用作药物载体或直接发挥抗生物膜作用,例如基于银、铁、铜、锌、镁和稀土金属的金属基纳米颗粒。
胃肠道生物膜是一种特殊的细菌生存形式,它们彼此黏附或者黏附到组织或器官的表面,以此在生长过程中更适应生存环境。临床上通过内窥镜在回结肠区域下可见,并且在一些炎症性肠病、肠易激综合征以及胃癌和结直肠癌患者中更为常见。
但它不应该仅被视为一种病理性的慢性感染,而且还是微生物生活在粘膜表面的一种普通生活方式。微生物生物膜是许多肠道疾病病理生理的核心,但同时它们也是肠道稳态发展的关键贡献者。
需要充分表征体内肠道生物膜的组成和性质,以便更好地了解疾病相关生物膜与健康生物膜的不同结构和功能特征。这将有助于确定宿主采用何种方式以及如何应对这些生物膜。
这些微生物聚集体会不断相互作用,就像与宿主细胞相互作用一样。未来的研究必须更好地了解肠道生物膜中微生物的多样性和复杂性。通过对粪便微生物的测序可以从一定程度上反映肠道微生物群的表型以及与肠道粘膜组织的相互作用。这对于评估生物膜的病理生理作用至关重要,并可能有助于识别生物标志物以实现早期诊断和干预。这是开发更好的肠道疾病生物标志物和治疗方法的必要步骤。
主要参考文献
Jandl B, Dighe S, Baumgartner M, Makristathis A, Gasche C, Muttenthaler M. Gastrointestinal Biofilms: Endoscopic Detection, Disease Relevance, and Therapeutic Strategies. Gastroenterology. 2024 Nov;167(6):1098-1112.e5.
Wang Y, Xu S, He Q, Sun K, Wang X, Zhang X, Li Y, Zeng J. Crosstalk between microbial biofilms in the gastrointestinal tract and chronic mucosa diseases. Front Microbiol. 2023 Apr 13;14:1151552.
Baumgartner M, Lang M, Holley H, Crepaz D, Hausmann B, Pjevac P, Moser D, Haller F, Hof F, Beer A, Orgler E, Frick A, Khare V, Evstatiev R, Strohmaier S, Primas C, Dolak W, Köcher T, Klavins K, Rath T, Neurath MF, Berry D, Makristathis A, Muttenthaler M, Gasche C. Mucosal Biofilms Are an Endoscopic Feature of Irritable Bowel Syndrome and Ulcerative Colitis. Gastroenterology. 2021 Oct;161(4):1245-1256.e20.
de Vos WM. Microbial biofilms and the human intestinal microbiome. NPJ Biofilms Microbiomes. 2015 Mar 25;1:15005.
Srivastava A, Gupta J, Kumar S, Kumar A. Gut biofilm forming bacteria in inflammatory bowel disease. Microb Pathog. 2017 Nov;112:5-14.
Motta JP, Wallace JL, Buret AG, Deraison C, Vergnolle N. Gastrointestinal biofilms in health and disease. Nat Rev Gastroenterol Hepatol. 2021 May;18(5):314-334.
Flemming HC, Wingender J, Szewzyk U, Steinberg P, Rice SA, Kjelleberg S. Biofilms: an emergent form of bacterial life. Nat Rev Microbiol. 2016 Aug 11;14(9):563-75.
Sinha S, Aggarwal S, Singh DV. Efflux pumps: gatekeepers of antibiotic resistance in Staphylococcus aureus biofilms. Microb Cell. 2024 Nov 11;11:368-377.
Silva NBS, Marques LA, Röder DDB. Diagnosis of biofilm infections: current methods used, challenges and perspectives for the future. J Appl Microbiol. 2021 Nov;131(5):2148-2160.
谷禾健康
假单胞菌属(Pseudomonas)是最多样化和普遍存在的细菌属之一,其物种存在于沉积物、临床样本、植物(或植物根际)、患病动物、水、土壤、海洋、沙漠等,这反映在它们多变的代谢能力和广泛的适应环境的潜力上。
假单胞菌属是一类革兰氏阴性的好氧或微需氧的细菌,属于 Proteobacteria(变形菌门),代表种包括:
Pseudomonas aeruginosa(铜绿假单胞菌)
Pseudomonas putida (恶臭假单胞菌)
图源:CDC
假单胞菌属是机会性病原体,是全世界医院获得性感染的主要原因。它可以侵入多个器官系统,包括血液、肺、软组织(皮肤、肌肉和肌腱)、身体的其他部位。症状取决于感染部位。
与假单胞菌属感染相关包括免疫系统受损患者的感染和医疗器械相关感染等,如刚接受过手术的人和免疫功能低下的人,艾滋病或糖尿病患者。
假单胞菌属与人体健康相关,其中一些菌株可以引起感染和疾病,如铜绿假单胞菌(Pseudomonas aeruginosa),可以引起呼吸道、肠道、泌尿道和皮肤感染。
免疫抑制个体和住院患者的铜绿假单胞菌肠道携带率显着升高,因此感染和抗生素相关性腹泻的风险增加。
假单胞菌属与其他菌属如葡萄球菌、普雷沃氏菌属、不动杆菌属、芽孢杆菌属、肠杆菌属、肠球菌属等菌属有互作关系。
假单胞菌不被认为是肠道微生物组的典型成员,并且假单胞菌在肠道定植与发生肺部感染和死亡率的风险增加有关。
研究表明,假单胞菌与肠道屏障功能障碍和感染有关,可能导致败血症和多器官功能障碍综合征。此外,假单胞菌与炎症性肠病的发生也有关系,它在IBD患者的肠道中检测到丰度更高,而且它参与引起其他菌群的失衡会影响疾病的进展。
细菌有可能在人体内的不同部位之间转移,防止肠道定植或肠道到其它器官尤其肺部的传播,可能是预防重症患者假单胞菌感染的有效策略。
本文主要分享假单胞菌属(Pseudomonas)的生态,分类,致病因素以及与人体相关健康特性和可能的生活干预措施。
假单胞菌属(Pseudomonas),是革兰氏阴性、好氧菌属,于 1894 年被描述,是最多样化和普遍存在的细菌属之一。有些物种对人类、动物或植物具有致病性。
▼
假单胞菌属(Pseudomonas)属于假单胞菌科,包含200多个有效描述的物种。该属的成员表现出大量的代谢多样性,因此能够在广泛的生态位中定居。
它们易于体外培养,并且越来越多的假单胞菌菌株基因组序列可供使用,这使得该属成为科学研究的绝佳焦点。
Photograph by Kateryna Kon
研究最好的物种包括铜绿假单胞菌。直的或略微弯曲的棒状但非螺旋状,0.5–1.0 × 1.5–5.0 µm。由一根或数根极鞭毛运动;很少不动。在某些物种中,也可能形成短波长的侧鞭毛。有氧,具有严格的呼吸型代谢,以氧为末端电子受体;在某些情况下,硝酸盐可用作替代电子受体,从而允许厌氧生长。
大多数物种(不是全部)无法在酸性条件(pH 4.5 或更低)下生长。大多数物种不需要有机生长因子。氧化酶阳性或阴性。过氧化氢酶阳性。化学有机营养的。
▼
——分布广
假单胞菌属是变形菌门的一个庞大而多样的属。从北极苔原到热带雨林,从干旱的土壤到雨云,几乎在地球的每个角落都可以找到该属的成员。这种令人难以置信的环境适应性归功于假单胞菌非凡的新陈代谢多样性。
——野蛮生长
假单胞菌可以在 0 至 42 °C 的温度范围内生长,甚至可以在更极端的温度下存活。它们对营养的需求很少,可以利用多种碳源。尽管假单胞菌在有氧环境中生长最佳,但它们也可以利用氮进行厌氧呼吸。
它们可以作为自由生活的浮游细胞或作为生物膜群落的成员生活,并且具有将微生物信号和环境线索转化为特定生态位过程的非凡能力。
基因组分析表明,许多其他因素有助于假单胞菌属的多样性和适应性。除了赋予调节和代谢灵活性的常见基因的大量等位基因差异外,水平基因转移影响了致病性假单胞菌属的能力。
▼
第一个假单胞菌基因组测序于 2000 年,有 630 万个碱基对,是当时最大的细菌基因组测序。基因组包含大量参与分解代谢、运输、流出、运动和信号响应调节的基因。
事实上,铜绿假单胞菌基因组中超过 8% 的基因被认为参与了调控,这远远超过了在任何其他细菌基因组中观察到的百分比。很明显,假单胞菌成功的关键在于它可以表达其基因的可塑性,这是由多层监管复杂性提供的。

Sem Photograph by David M. Phillips
自 2000 年以来,已测序的 1000 多个假单胞菌基因组中的绝大多数都是铜绿假单胞菌的临床菌株。
总的来说,铜绿假单胞菌基因组的主要部分(约 4000 个基因)在所有菌株中都是保守的,代表了“核心基因组”。多达另外 20% 的基因驻留在共同代表“附属基因组”的基因组岛上。正是这个附属基因组赋予了铜绿假单胞菌的可塑性,并包含许多参与代谢、毒力和抗生素抗性的基因。
由于已在测序分离株的附属区域鉴定出大约 10 000 个独特基因,因此估计铜绿假单胞菌泛基因组可以接近甚至超过 100 000 个基因,这意味着假单胞菌这一物种的遗传库将远远超过人类。
该属的分类学多年来一直存在争议,因为许多最初包含在假单胞菌属中的细菌类群已被重新归类为其他属或来自不同类别的变形杆菌的物种。
可以根据16S rRNA、gyrB、rpoB和rpoD基因的序列分为三个谱系和13个群。
临床常见菌种主要包括:
• 铜绿假单胞菌(Pseudomonas aeruginosa)
• 斯氏假单胞菌(Pseudomonas stutzeri)
• 恶臭假单胞菌(Pseudomonas putida)
• 荧光假单胞菌(Pseudomonas fluorescens)
• 门多萨假单胞菌(Pseudomonas mendocina)
• 产碱假单胞菌(Pseudomonas alcaligenes)
• 假产碱假单胞菌(Pseudomonas pseudoalcaligenes)
其它菌种见附录一
致病性菌株见附录二
▼
详见附录三
此外,铁是细菌必需且稀缺的营养素,也是重要的信号因子。铜绿假单胞菌已经开发出多种铁吸收系统来隔离足够的铁以维持其生存,在毒力因子的释放和生物膜的形成中具有重要的调节作用。
▼
假单胞菌适应进化的特性对人类既有益又有害。
——有益
一方面,我们利用假单胞菌的力量进行生物修复和生物防治。例如,荧光假单胞菌和P. protegens已被证明在害虫控制和作物保护方面特别成功,它们被认为可以战胜和/或对抗植物病原体。
假单胞菌的分解代谢能力也被用于杀虫剂、重金属和碳氢化合物(例如石油泄漏)以及许多其他污染物的生物降解和/或解毒。
——有害
另一方面,某些种类的假单胞菌对植物和动物具有致病性,导致极难根除的感染。例如,铜绿假单胞菌是世界范围内医院获得性感染最常见的原因之一,并在使用消毒剂和抗生素后存活下来。
它可以在许多解剖部位引起感染,包括皮肤、大脑、眼睛、耳朵、泌尿道、肺部等。免疫抑制的个体,尤其是那些有过度烧伤、囊性纤维化或中性粒细胞减少症的个体,尤其处于危险之中。(这在后一章节会详细介绍)
▼
一般非特异性症状(许多疾病中常见的症状)包括:
假单胞菌感染的症状取决于它们发生在身体的哪个部位。
假单胞菌(Pseudomonas)可引起以下器官感染:
耳朵(外耳炎或游泳者的耳朵):
疼痛、水肿(肿胀)、压痛和分泌物
皮肤:
假单胞菌通过压疮、烧伤和手术伤口或从血流进入菌血症患者的皮肤,还可能引起毛囊炎等。
具体可表现为:脓肿(感染肿块)、皮疹、脓液、皮肤溃疡、坏死组织(皮肤变黑,表明组织正在死亡)。
骨骼或关节:
受影响区域行动不便、关节或背部疼痛、肿胀、疼痛或发热。
这些通常是由于静脉内 (IV) 药物使用或感染的手术伤口或受伤造成的伤口细菌传播到皮肤、骨骼和关节的结果。
伤口:
伤口有分泌物或结痂(通常是黄绿色),可能有甜味或难闻的气味。
消化道:
阑尾炎(由于治疗导致白细胞低的人发生肠道感染)腹痛、腹胀和腹泻的症状。
肺:
假单胞菌可能会导致严重的肺炎,通常发生在住院、已经生病和免疫功能低下的人身上。它可引起囊性纤维化患者的慢性肺部感染(遗传病),支气管扩张(气道永久性扩张),或慢性阻塞性肺病。
具体可表现为:呼吸急促、胸痛、咳痰(伴有白色、黄色或绿色粘液)和充血。
泌尿道:
排尿疼痛、尿液难闻或有甜味、尿急、尿液浑浊。
因此,假单胞菌感染的特征在于广泛的症状。
▼
紧急情况下:呼吸急促、心率加快、脉搏微弱、意识模糊、发烧、发抖或剧烈疼痛是败血性休克的症状,是对血流感染的全身反应。
在极少数情况下,心脏瓣膜可能会受到感染,尤其是在静脉注射药物的人群中。
脏东西的细菌可以进入血液,会传播到心脏并感染心脏瓣膜,这种情况称为心内膜炎。
使用静脉注射药物的人出现新的杂音(心音异常)可能会怀疑与假单胞菌相关的心内膜炎。
▼
未经治疗、治疗不足或复发的假单胞菌感染会导致更广泛的感染,例如败血症,这可能是致命的。
更可能出现严重并发症的高危人群包括:
值得注意的是,假单胞菌属内的抗生素耐药性正在增长。这些细菌正在寻找新的方法来避免死于以往最强大有效的抗生素。
假单胞菌属与人体健康相关,其中一些菌株可以引起感染和疾病,如Pseudomonas aeruginosa 绿脓杆菌,又称铜绿假单胞菌,可以引起呼吸道、泌尿道、皮肤感染。虽然不是正常口腔菌群的成员,但在口腔疾病和牙齿矫正治疗中可能会富集。
▼
假单胞菌属不被认为是肠道微生物群落的典型成员,肠道定植假单胞菌属与发展肺部感染和死亡风险增加有关。
假单胞菌属的过度生长可能会导致肠道炎症和系统性炎症反应。
假单胞菌属感染会引起机体的Th17细胞反应和系统性炎症反应,因此,干预Th17细胞免疫反应可能是缓解肺炎的有效方法。此外,假单胞菌属也可以通过产生GABA来影响蛋白质代谢和细胞稳态,从而影响宿主的摄食行为。
▼
假单胞菌属与其他菌属如大肠杆菌、沙门氏菌等有关,与肠道微生物群的平衡和健康密切相关。
假单胞菌属与其他菌属如葡萄球菌属和普雷沃氏菌属等,共同存在于囊性纤维化患者的肺部感染中。
假单胞菌属与其他菌属如不动杆菌属(Acinetobacter)等一起被发现在冷鲜乳中,产生脂肪酶和蛋白酶,参与乳制品和肉类的变质。
假单胞菌属与其他菌属如Bacillus、Enterobacter、Enterococcus等一起参与了肠-肺轴的微生物和免疫调节,影响呼吸道疾病的发生和发展。
▼
与假单胞菌属相关的疾病包括:免疫系统受损患者的感染和医疗器械相关感染等。免疫抑制个体和住院患者的铜绿假单胞菌肠道携带率显著升高,因此感染和抗生素相关性腹泻的风险增加。
研究表明,假单胞菌属与肠道屏障功能障碍和感染有关,可能导致败血症和多器官功能障碍综合征。假单胞菌属与肺部疾病也有关联,如支气管扩张症。
肺部疾病
研究发现,肺部假单胞菌属感染会影响肠道菌群,而通过调节肠道菌群可以影响肺部疾病的治疗效果。
肠道定植通常先于肺部感染,并且相同菌株经常在肠道和肺部中发现,表明肠道充当了假单胞菌属的储存库,可以传播到肺部和其他感染部位。
肠道微生物群的免疫调节对呼吸道疾病的发生有影响,肠道共生菌通过屏障效应提供菌群抵抗力,从而保护肠道生态环境不被改变。
以肺部假单胞菌、肠道拟杆菌和肠道酵母菌为特征的高肠-肺相互作用集群,与加重的恶化,整体支气管扩张严重相关。
炎症性肠病(IBD)
假单胞菌属与炎症性肠病的发生也有关系。
研究表明,IBD患者肠道中假单胞菌属的种类和数量与非IBD患者存在显著差异。
其中,克罗恩患者中假单胞菌属的检出率明显高于非IBD患者。此外,假单胞菌属的多样性在活动性IBD患者中也明显降低。这些结果表明假单胞菌属可能与IBD的发病机制有关。具体而言,假单胞菌属可能通过影响肠道菌群的平衡和多样性,导致肠道免疫系统的异常反应,从而引发IBD的发生。
因此,调节肠道菌群可能是预防和治疗肠道疾病的一种新策略。
▼
铜绿假单胞菌(Pseudomonas aeruginosa)是一种普遍存在的革兰氏阴性细菌,存在于许多不同的环境中,包括不同的生命来源,如动物和人类。
铜绿假单胞菌能够以最低的营养需求生存并耐受各种身体条件,这使得该生物体能够在社区和医院环境中持续存在。
图源:EYE OF SCIENCE / SCIENCE PHOTO LIBRARY
引发感染
铜绿假单胞菌是一种机会性病原体,这意味着它利用宿主防御系统中的一些漏洞来引发感染。
铜绿假单胞菌是世界范围内医院感染的罪魁祸首,其医学和兽医重要性日益增加,并且主要在免疫系统受损的患者中引起感染。
这种细菌几乎从不感染未受损的组织,但如果组织防御以某种方式受损,它就会发起攻击。
铜绿假单胞菌可能引起尿路感染、呼吸系统感染、皮炎、软组织感染、菌血症、骨和关节感染、胃肠道感染和各种全身感染,特别是在严重烧伤患者和免疫抑制的癌症和艾滋病患者中。
在免疫缺陷的人群中,如严重烧伤患者、人工呼吸机使用者和支气管扩张症患者。
在囊性纤维化患者中,铜绿假单胞菌是慢性肺部感染的主要来源,导致患者的发病率和死亡率增加。
铜绿假单胞菌感染会导致肺部炎症和肺损伤,引起细胞浸润和肺泡水肿。在肺移植患者中,铜绿假单胞菌的分离率更高,但与非囊性纤维化肺移植患者相比,死亡率没有增加。铜绿假单胞菌感染会导致肺血管通透性增加,从而引起肺水肿。
耐药性
铜绿假单胞菌显示出对抗生素的高内在耐药性,并具有获得新耐药机制的非凡能力。由于临床治疗选择有限,多重耐药 (MDR) 铜绿假单胞菌分离株的流行率不断上升是一个全球性健康问题。
对来自西班牙两个不同地区的儿童粪便样本中铜绿假单胞菌的发生率、抗菌素耐药性表型、毒力基因型和遗传谱系表征数据显示:从1,443 个粪便样本中,有72份分离分离出来铜绿假单胞菌,并检测到低水平的抗菌素耐药性:头孢他啶 (8%)、头孢吡肟 (7%)、氨曲南 (7%)、庆大霉素 (3%)、环丙沙星 (1%) 和亚胺培南 (1%);对美罗培南、阿米卡星、妥布霉素、左氧氟沙星和粘菌素敏感,此外还发现了四种多重耐药菌株。
定植
人类粪便样本中的定植率范围为 2.6% 至 24 %。关于铜绿假单胞菌分离株在健康人粪便中定殖的数据很少。
其他研究表明,肠易激综合征患者的小肠和粪便样本中铜绿假单胞菌的定植率很高。迄今为止,关于铜绿假单胞菌分离株在健康人粪便中的定植及其抗菌素耐药性和毒力特征的数据相对较少。
尽管肠道微生物群作为抵御肠道病原体的屏障,但铜绿假单胞菌通过产生一系列令人印象深刻的毒力因子,克服了肠道微生物群和先天免疫系统介导的定植抵抗。
铜绿假单胞菌凝集素 LecA 和 LecB 以及细胞外附属物,如鞭毛和菌毛,在细菌附着到宿主上起着重要作用,并与粘附有关。
此外,铜绿假单胞菌携带属于双伙伴分泌(TPS)家族(也称为Vb型分泌系统,T5bSS)的大型蛋白质系统,TPS系统主要由分泌的TpsA效应蛋白及其TpsB伙伴转运蛋白组成。TpsA1 (CdiA2, 573 kDa) 和 TpsA2 (CdiA1, 361 kDa) 通过接触依赖性生长抑制系统 (CDI) 以及粘附和生物膜形成促进细菌竞争。
因此 TPS 系统效应子被指定为对革兰氏菌有益的主要毒力决定因素阴性病原体。
▼
铜绿假单胞菌等的特殊能力引起如此多样化感染的假单胞菌属是因为它们能够产生名副其实的毒力因子库,包括毒素、生物膜、蛋白酶和溶血素。
考虑到铜绿假单胞菌的医学重要性,假单胞菌领域的大部分研究工作都致力于了解影响这些毒力因子释放的调节、生物合成和环境因素。
此外,它们还可以获得赋予进一步抗菌素耐药性的移动遗传元件;因此,可以鉴定出泛耐药菌株。
▼
假单胞菌感知和适应环境的能力导致了一系列活动,例如许多酶和其他生物分子的分泌。虽然这些毒素、降解酶和抗菌剂可以将假单胞菌的环境转变为理想的微生物生态位,但它们可能对植物和动物宿主造成严重后果。例如,绿脓素是一种蓝/绿色色素毒素,它赋予铜绿假单胞菌培养物特有的颜色,并作为一种抗菌剂可以杀死竞争性微生物。然而,它也会破坏真核细胞过程,这会对人类细胞产生不利影响。
▼
过去几年的工作提供的证据表明,群体感应是一种通用的调节机制,它允许细菌以种群密度依赖的方式发起统一、协调的反应,以完成即使不是不可能,也很难完成的任务。
群体感应系统广泛存在于假单胞菌中,人类机会性病原体铜绿假单胞菌,属于研究最广泛的细胞间通讯系统。在这种生物体中,群体感应非常复杂,由两个相互关联的 N-酰基高丝氨酸内酯 (AHL) 依赖性调节回路组成,这些调节回路由非 AHL 相关信号分子和许多调节剂进一步调制,这些调节剂在转录过程中起作用和转录后水平。这种遗传复杂性可能是导致铜绿假单胞菌具有巨大环境多样性的关键因素之一。
过去几年的工作表明,群体感应对于一系列毒力因子的表达以及铜绿假单胞菌中生物膜的形成至关重要,因此代表了设计用于治疗铜绿假单胞菌的新型药物的有吸引力的目标感染。
此外,细胞间通讯能力也在许多额外的假单胞菌中得到证实。铜绿假单胞菌,因此可以用于设计新型药物来治疗铜绿假单胞菌感染。
长时间住院、创伤ICU住院、消毒干预等与肠道假单胞菌过度生长有关,而TAP暴露与抗菌剂干预则与肠道假单胞菌过度生长有负相关。
注:TAP的暴露是指肠道上皮细胞上的TAP暴露在肠道腔中,从而使肠道内的微生物可以通过TAP进入肠道上皮细胞内部。一些研究表明,TAP的暴露与肠道微生物群失调和某些疾病(如炎症性肠病)有关。而抗菌剂干预可以抑制肠道内细菌的生长,从而减少TAP的暴露,因此与假单胞菌肠道过度生长有负相关。
对于免疫功能低下的患者,应特别注意水的纯度,有些水中可能含有假单胞菌等细菌。
研究发现用海洋益生元岩藻依聚糖补充饮食可以通过抑制分泌性毒力因子 (TpsA/CdiA) 与粘蛋白的相互作用并促进有益种群的生长,从而介导铜绿假单胞菌从肠道菌群失调和去定植中的早期恢复。
芪归饮是一种用于治疗铜绿假单胞菌感染的中药。在门和属水平上显著抑制脱铁杆菌和粘孢子菌的过度积累。鉴定了11种潜在的代谢产物,这些代谢产物在铜绿假单胞菌感染中异常表达,服用芪归饮显著逆转。
此外,部分研究表明以下物质也可以抑制肠道内的假单胞菌属。
假单胞菌属相比于其它细菌引起人们广泛的研究兴趣,该属不仅包括人类病原体铜绿假单胞菌,还包括一系列与植物致病性、生物修复和环境微生物学相关的其他重要物种。
假单胞菌被广泛用作模型原型细菌,用于研究宿主-病原体相互作用、细胞-细胞通讯系统、进化生物学、基因调控和代谢网络、分泌系统、抗生素(耐药性)、生物修复、生物膜、细菌基因组学以及与微生物学和分子生物学广泛相关的许多其他主题。
假单胞菌属因其复杂的信号和调节系统,特别是细胞密度依赖性群体感应而被广泛研究。未来只有了解复杂调节回路中涉及的机制,才能确定新型抗菌方法的可能目标。铜绿假单胞菌中的锌、铁稳态是替代抗菌策略的一个有希望的目标。
由于其复杂性和适应性,它存在于无数的环境和临床生态位中,以及它在不同层面(种内、种间和与其宿主)相互作用的能力,假单胞菌属很可能在未来许多年内吸引更多研究人员。我们期待未来有更好的解决假单胞菌属,尤其人类病原体铜绿假单胞菌的抗菌策略。
附录一:
其他菌种
附录二:
致病菌菌株
附录三:
可能参与的代谢
谷禾健康
阴道微生物组是一个复杂而动态的微生态系统,在女性月经周期和女性的一生中不断发生波动。
在过去几年中,对阴道微生物群关注随着测序技术的发展和应用逐渐广泛和突出,有关以往传统正常和异常阴道微生物组的知识也发生了变化。培养技术可能不再适用于确定正常或异常的阴道微生物群。以非培养为基础的分析生物技术揭示了一个动态且主要由乳酸杆菌主导的复杂动态系统。
该生态系统受基因、种族背景、发育以及环境和行为因素的影响。每个个体都有几种乳酸杆菌在健康的阴道中占主导地位。它们与抗菌物质、细胞因子、防御素和其他物质一起支持防御系统,以对抗菌群失调、感染和早产以及不孕不育等问题。
在这里,我们主要讨论和介绍女性生命周期不同阶段阴道区域微生物群落的变化,哪些因素会影响阴道菌群,及阴道菌群对性健康和病理状况的影响。
育龄女性产生约 1 至 4 mL 的阴道液,每 mL 含有 108至 109 个细菌细胞。阴道微生物从女性出生的最初几个小时开始就开始定居,并伴随她的一生一直存在到死亡。
这些细菌群落在个体之间和随着时间的推移可能会有产生差异。
• 阴道微生物群被定义为在阴道内定殖的共生和病原微生物群;
• 阴道微生物群从女性出生的最初几个小时开始就开始定居,伴宿女性一生;
• 随着年龄的变化,从青春期前的厌氧微生物过渡到生殖年龄时富含乳酸杆菌的阴道。
• 在大多数健康育龄妇女中,阴道微生物群以乳酸杆菌为主。
+
阴道菌群中 70%是乳杆菌
阴道拥有自己的原生微生物群落,这是抵御病原体的主要防线。
最主要的阴道种群是乳酸菌,占细菌群落的近 70%。这些包括下列菌群等:
此外,其他细菌种类如下列菌群等也存在于健康个体的阴道中:
研究人员通过16s技术等在研究中将阴道微生物群分为编号为 I-V 的进化枝。其中,Clades I、II、III、V以乳酸杆菌为主,Clade IV无优势群,是微生物的混合体。
注:CST I、II、III 和 V 以L. crispatus 、L. gasseri、L. iners、L. jensenii 为主,而 CST IV 是指以专性厌氧菌为特征的微生物群落的高度多样性。
每个女性体内的原生微生物群数量因种族、地理、生活方式、卫生和冲洗方法而异。
注:已经发现,在疾病进展期间,乳杆菌种群发生了从L. crispatus 到 L. iners 的转变。这种转变的原因尚不清楚。有人提出,与L. iners 产生的L-乳酸相比, L . crispatus 产生的d-乳酸可能提供更好的保护,防止病原体定植。
因此,许多其他细菌在健康的阴道菌群中的浓度较低,例如消化链球菌(Peptostreptococcus)、拟杆菌(Bacteroides)、棒状杆菌(Corynebacterium)、链球菌(Streptococcus)和消化球菌(Peptococcus)。
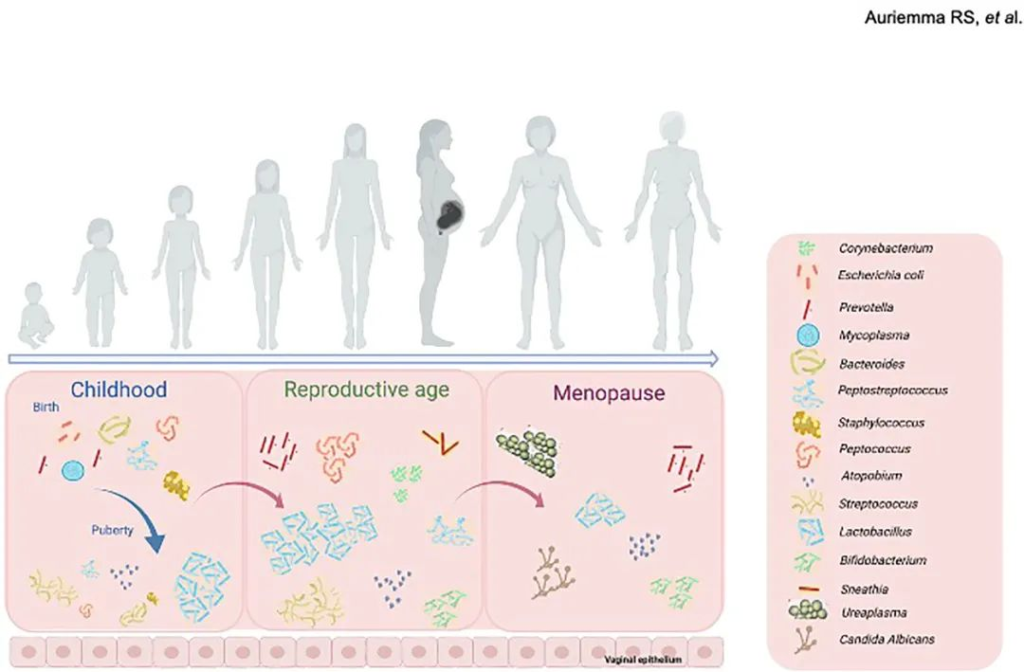
阴道微生物群的组成在女性的一生中不断演变。在女性生命的这些不同阶段,阴道菌群会发生各种生理和荷尔蒙变化(下图)。
健康的阴道微生物群通常由乳杆菌属控制,乳杆菌属对阴道失调或感染具有保护作用。尽管这种保护作用的确切机制尚不清楚,但新出现的研究表明,阴道菌群产生多种分子来维持阴道内稳态并防止感染。
例如,健康的阴道环境的特征是阴道乳杆菌产生乳酸,这在消除入侵病原体方面发挥着重要作用。此外,Lactobacilius还产生许多化合物,如细菌素和H2O2,以选择性地抑制入侵病原体并保持阴道内稳态。
阴道微生物失调的特点是乳酸杆菌属的丰度较低,而CST IV微生物群的水平较高,如厌氧链球菌、阴道加德纳菌、阴道阿托波菌、莫比伦氏菌属、斯内氏菌属(Sneathia)、普雷沃氏菌属、支原体,这会对阴道和生殖健康产生不利影响,并导致对各种阴道感染(如细菌性阴道病和念珠菌病)的易感性,甚至可能导致不良妊娠结局,如早产、先兆子痫、妊娠高血压等。
世界范围内进行的大量研究已确定乳酸杆菌是育龄健康女性阴道微生物群的主要成分。阴道微生物组因种族和地区而异。目前尚不清楚种族因素是否单独或结合行为和环境变量可以解释这些差异。
▸ 不同地区的阴道菌群存在差异:
来自不同国家的女性在其阴道微生物群中有一定程度的差异,不过差异不大。
在中国育龄健康女性的生殖微生物群落中以 L. gasseri, L. crispatus 和 L. iners为主要。
欧洲女性有一个独特的阴道微生物群,包括L. crispatus, L. jensenii, L. gasseri, L. iners.
而非洲研究表明,植物乳杆菌是阴道微生物群中的主要物种,其次是:
L. gasseri
Lactobacillus rhamnosus
L. crispatus
Lactobacillus plantarum
上述发现表明,来自世界各地的健康女性的阴道微生物组存在物种水平的差异。这些差异也可以用所研究社区内的种族差异来解释。
▸ 同一地区不同种族的阴道菌群存在差异:
育龄妇女的阴道细菌群落在不同地区的妇女之间可能存在差异,但在生活在同一地理区域的不同种族的妇女之间也可能存在差异。
2011 年的一项研究对无症状北美女性的阴道微生物群进行表征,表明亚裔和美国白人女性的阴道菌群以乳酸杆菌为主,这与西班牙裔和非裔美国女性不同,后者只有 60% 的阴道菌群以乳酸菌为主。
此外,与非洲女性相比,白种人和亚洲女性的L. crispatus含量较高,而 L. iners 含量较低。
在另一项使用 16S rRNA 基因测序的研究中,表明欧洲血统女性的阴道微生物群以乳酸杆菌为主,而非裔美国女性则相反,后者呈现出混合的阴道群落,其中包括人型支原体、气球菌、惰性乳杆菌和许多严格的厌氧菌,包括:革兰氏-阳性厌氧球菌、细菌性阴道炎相关细菌、Sneathia、Prevotella amnii、Megasphaera、Atopobium、Gardnerella vaginalis。
阴道 pH 值也因种族而异。非裔美国人和西班牙裔女性的阴道 pH 值(分别为 4.7 和 5.0)高于标准值(<4.5)。
阴道及其微生物群形成了一个生态系统,随着时间的推移,从婴儿期到儿童期再到青春期和成年期,影响这些变化的主要力量是雌激素水平的波动和性活动的出现,卫生实践和药物,包括口服避孕药和抗菌剂,也会影响阴道中存在的各种菌群之间的复杂相互作用。
下面我们来看每个时期阴道菌群的特点及相关影响因素:
出生后或出生后不久,婴儿的阴道微生物群从母亲身上吸收细菌时开始繁殖。
许多研究表明,怀孕期间的母体微生物组对妊娠结局和分娩方式(阴道或剖宫产)有很大影响,这会显著影响婴儿的微生物组。
出生后,微生物群需要数年的时间才能充分发展和多样化,这是一个动态过程,并受到多种外部因素的严重影响。例如,早期喂养方式或接触抗生素会影响婴儿的微生物群。
▸分娩方式不同影响菌群定植
在阴道分娩时,新生儿暴露于母亲的阴道和粪便微生物群,这些微生物群中含有大量乳酸杆菌、普雷沃氏菌、斯奈氏菌和双歧杆菌;
然而,剖腹产婴儿从母亲的皮肤或周围医院环境中接受了不同的微生物接种物,这些接种物通常主要由棒状杆菌、葡萄球菌和丙酸杆菌居住,有时还含有传染性微生物制剂,如梭状芽孢杆菌、肠球菌和克雷伯菌。
胎盘和羊水的微生物组在成功分娩和新生儿微生物组发育中起着重要作用。最初的胎粪显示胎盘和羊水中的细菌占优势。
▸阴道菌群与激素调节相关
在怀孕和产后阶段,身体经历了许多变化,通常由雌激素等各种激素调节。
阴道雌激素水平高,有助于维持较高水平的阴道糖原,乳酸杆菌通常将其用作维持阴道酸性环境的食物。
此外,新生儿还通过母乳接触母体雌激素,这有助于维持健康的新生儿菌群。相反,阴道雌激素水平随着年龄的增长而降低,这反过来导致阴道乳杆菌和中性阴道pH值的降低。
▸乳酸杆菌是大多数女孩的主要菌群
在完成如厕训练之前,婴儿和学步儿童通常会遇到革兰氏阴性肠道细菌和肠球菌,但之后会较少遇到。
在儿童中,乳酸杆菌在 2 岁以下的女孩中比在青春期前年龄较大的女孩中更常见,并且可能在限制其他菌群过度生长方面发挥保护作用。
在儿童早期,阴道的 pH 值是中性或微碱性。
几个内在和外在因素可以显著影响女性一生中的阴道微生物群。
青少年时期的厌氧菌流行率更高。从青春期开始,有氧定植随着年龄、性活动的开始和胎次而增加。
在月经初潮前,低雌激素水平通常与由需氧、厌氧和肠道微生物组成的多种阴道微生物群落有关,微生物多样性增加的梭杆菌属、普雷沃氏菌属和Ezakiella属(普雷沃氏菌为主);在生命的这一阶段,阴道pH值呈微碱性(pH 7.5–8)或中性(pH 7.0)(下图)。
给父母的重要提示:
青春期前的儿童可能会出现阴道感染,这通常是由于高香味的沐浴产品造成的。鼓励孩子在上厕所时从前到后擦拭,洗澡时不要使用香皂等产品洗,尤其是直接进入阴道区域。
青少年时期对年轻人来说是一个充满挑战的时期,他们的身体在进入青春期时会发生变化。此时阴道微生物组也发生了很大变化。
从青春期初期到生殖阶段,阴道微生物组成不断变化:
青春期早期通常由Finegoldia、Anaerococcus、Prevotella、Dialister、Peptoniphilus和乳杆菌属组成,而后期主要由乳杆菌属和较低丰度的Sneathia、Prevotela、嗜血杆菌属、Atopobium、Gardnerella组成。
不断增加的雌激素水平导致高水平的糖原存在于阴道内膜中。乳酸杆菌家族的细菌发酵糖原,从而产生乳酸。这有助于保护阴道。
在这个阶段,乳酸杆菌的丰度降低会导致阴道生物失调和细菌性阴道病。
在生殖阶段的初始阶段,一系列因素有助于阴道微生物组的动态。青春期初期女性性腺激素水平的增加导致阴道微生物多样性的增加,这是通过诱导阴道壁中糖原沉积的增加,较低的阴道性腺水平和激素刺激的糖原支持乳酸杆菌的生长。
月经期的阴道微生物组成似乎与青春期早期观察到的相似:两个属(消化链球菌Peptostreptococcus和链球菌属Streptococcus)通常占主导地位,而不是乳杆菌属,这可以通过测定期间阴道pH值的变化来解释。
新的研究表明,在月经期间,月经液与阴道壁的相互作用中和了酸性阴道微环境,导致pH值升高(7.2–7.4)。乳杆菌属的下降导致许多其他厌氧菌上升。
尽管在月经周期中阴道菌群发生这些实质性变化的确切原因尚不清楚,但过去的结果表明,这一阶段的一些生理事件可能会影响阴道微环境。
例如,黄体期(月经前)被认为以子宫壁增厚为特征,特别是子宫内膜和阴道上皮增厚,导致阴道区域糖原沉积增加,而缺乏受精导致性激素水平突然下降,以及子宫内膜衬里脱落和中性pH,为许多微生物的增殖创造了理想的栖息地。
在随后的卵泡期,月经流量的减少再次降低了阴道pH值,增强了糖原降解和乳酸生产(通过乳酸杆菌),从而抑制了其他厌氧微生物的生长。
月经与阴道微生物群落的动态变化有关。一些女性有强健的阴道微生物群落,在月经期间群落状态之间有简单和可预测的过渡,而其他女性在整个月经期间表现出相对稳定的微生物群落。
在生殖阶段,阴道微生物群落通常以脆乳杆菌为主,而在月经期间观察到阴道微生物群失衡,其特征是脆乳杆菌减少,混合厌氧菌增加,如Gardnerella、Atopobium、Prevotella、Megasphaera sp.、L.iners、链球菌等。因此,CST从CST I转移到CST III或CST IV,有时在整个月经周期中,社区保持稳定和相同。
新的研究表明,阴道微生物环境是由宿主因素(种族、遗传和免疫介质)和微生物生物学在整个生殖周期中的微妙相互作用维持的。虽然在月经期间已描述了改变的阴道细胞因子模式,但其与阴道微生物群和生殖健康的关系尚未完全确定。此外,女性阴道微生物群落的个体间差异也很高。
一旦我们度过了青春期,我们就达到了生育年龄。性活动可能会随之而来,并伴随着怀孕的机会。在怀孕期间,阴道菌群会发生变化,并且在乳酸杆菌中变得更加占优势。人们认为,由于荷尔蒙的变化,乳酸杆菌的这种增加的优势是为了防止感染,这种感染可能在这个脆弱的时期被触发。
怀孕的特点是各种生理变化,这些变化有助于胎儿适应母亲身体的微生物群,反之亦然。这种多样化的状态受到激素和生理变化的调节,这些变化导致免疫调节、行为、粘膜理化、代谢和生殖道变化,从而导致微生物组的结构和功能被调节,这与非怀孕女性的不同。
怀孕是一个“形成期”,由各种相互关联的生理和分子过程控制,以支持胎儿的生长和发育。
在怀孕过程中,身体经历了大量的激素、免疫和微生物变化,以促进母体内稳态并支持胎儿生长。阴道菌群在怀孕过程中也会发生实质性变化,并随着怀孕的进行而变得更加均匀。在妊娠早期,胎盘为支持胎儿而增加的雌激素和孕激素分泌。
实际上触发了总体微生物多样性的丰富;然而,怀孕期间持续升高的激素水平和阴道乳杆菌的拮抗反应导致稳定和健康的阴道菌群。另一方面,不断变化的阴道环境也会导致几种氨基酸(例如,苯丙氨酸、丝氨酸、天冬氨酸、异亮氨酸、色氨酸、苏氨酸、甘氨酸、谷氨酸、亮氨酸)和乳酸水平升高,同时耗尽有机酸(乙酸盐、丙酸盐)、葡萄糖和生物胺(腐胺、酪胺、甲胺)以支持胎儿。
与怀孕期间阴道微生物的变化类似,母体免疫反应也发生了从促炎反应到抗炎细胞因子的实质性变化,以接受胎儿同种异体移植,同时性腺激素水平升高。阴道免疫系统在稳定阴道微生物群和防止上行生殖道感染中起着至关重要的作用。
产后阶段的阴道菌群显著不同,其特征通常是乳酸杆菌的丰度较低,而其他菌群的丰度相对较高,如阴道加德纳菌、无乳链球菌和普雷沃氏菌,导致阴道微生物群落更加多样。
怀孕后雌激素(雌二醇和雌二醇)水平的降低是一个显著影响阴道微环境的因素,包括菌群,这对于非怀孕阶段、恢复自然生理状态和为连续怀孕准备阴道微环境非常重要。未能在1年内恢复自然生理和免疫阴道微环境或随后的妊娠可能会严重影响妊娠结局。
产后抗生素预防是决定产后阴道微生物组成的另一个重要因素。与未经治疗的女性相比,分娩时使用抗生素预防的女性。
与雌激素水平降低同时,与分娩和分娩相关的自然生理变化会刺激炎症反应,以促进子宫收缩、宫颈扩张和胎膜破裂,这可能会显著导致阴道微生物成分的变化。
除雌激素外,其他分泌化合物如透明质酸和Hsp70在重塑阴道微环境中发挥着重要作用,因为它们在分娩期间的水平调节子宫颈并为分娩做好准备,而分娩后它们有助于重塑子宫颈,包括阴道上皮衬里和阴道液体成分。
更年期是女性停止月经周期的时候。在这个阶段,卵巢停止释放雌激素和卵子,这导致生殖周期结束,性腺激素和阴道壁糖原水平降低。随后,雌激素水平的降低也导致阴道微环境的变化,包括乳酸杆菌和乳酸的丰度降低以及中性pH值,这促进了潜在致病微生物的定植,并增加了对泌尿生殖道感染的易感性。
绝经后妇女不仅阴道感染风险增加,而且还会出现其他血管舒缩症状,如潮热、失眠、抑郁等。这些症状是更年期雌激素缺乏的结果,对女性的健康和生活质量产生负面影响。
阴道微生物组极其重要,对绝经后妇女的整体生活质量有重大影响,包括性健康、阴道干燥和外阴阴道萎缩等。不幸的是,新出现的结果表明,大约25-50%的女性在绝经后阶段经历了外阴阴道萎缩,这包括外阴阴道症状,如疼痛的性活动、性交后出血、小便时灼热、疼痛、瘙痒和带有难闻气味的阴道分泌物。
尽管医生已经尝试了不同的治疗方法来改善妇女的绝经后生活,包括使用雌激素的激素替代疗法,这种疗法导致乳酸杆菌数量和糖原水平的增加,从而导致泌尿生殖道感染的减少。
然而,这种疗法未能在不同人群中显示出一致的效果,特别是在有肝病、冠心病、心脏病或乳腺癌病史的患者中。在这些患者中,治疗会导致严重的不良反应,如乳房疼痛或持续阴道出血。
用益生菌鼠李糖乳杆菌GR-1和罗伊氏乳杆菌RC-14 进行的另一种阴道治疗已经证明,这显示出对阴道菌群的有益影响,有助于避免绝经后女性的阴道感染。有限的科学证据和不适当的数据阻止了此类益生菌的使用。
阴道微生物群在保护阴道上皮免受病原微生物污染方面发挥着重要作用。这种保护机制基于三种机制:
1)天然微生物群与病原体的竞争
乳酸杆菌粘附到阴道上皮,通过竞争性占领过程形成抵抗病原微生物的保护层。
2)针对这些不良微生物的抗微生物物质的生产
生产三种不同类型的物质:乳酸、过氧化氢和细菌素。
乳酸:维持阴道的 pH 值在酸性,抑制病原微生物的生长。
过氧化氢:由于其氧化能力而具有抗菌作用。
细菌素:是蛋白质来源的毒素,具有抗菌功能,因此它们可以抑制其他可能致病的微生物的生长。它们的作用是通过在细菌的细胞质膜中产生孔来溶解或破坏细菌的细胞质膜。
3)病原物种的共聚集能力以提高抗微生物能力
病原微生物被来自天然阴道微生物群的细菌包围的机制。
这些形成阴道菌群的微生物与其他微生物群在共生或稳态的情况下生活在一起,也就是说,在阴道中存在的所有物种之间保持平衡。
然而,当由于某种原因阴道中乳酸杆菌的浓度降低时,我们就会进入一种生态失调的情况,其中体内平衡被破坏,因此对粘膜的保护作用降低。
导致乳酸菌减少的原因是多种多样的:
在这种低保护的情况下,病原体会引起感染,包括细菌性阴道病、念珠菌属阴道炎(念珠菌病)、滴虫病或尿路感染等,其他包括早产,不孕不育等也与阴道菌群变化相关,接下来章节我们来详细了解一下相关妇科疾病。
早产(PTL)是指怀孕37周之前的分娩,影响15-30%的妊娠,是导致产前死亡的主要原因。尽管早产的确切病因仍不明确,但胎膜早破、阴道上升感染、羊膜内感染、压力、宫颈功能不全和血管疾病是关键的促成因素;其中,某些细菌引起的宫内感染或上行尿路感染是不良妊娠结局或PTL的影响关键因素。
越来越多的证据表明阴道微生物组与自发性早产风险有关。
阴道微生物群在妊娠健康和结局中起着重要作用,阴道失调的增加(通常以CST IV菌群的丰度较高和乳酸杆菌的丰度较低为特征)导致妊娠并发症和早产风险增加。
足月分娩中,阴道菌群以厚壁菌为主
足月分娩妇女的阴道微生物群落通常是稳定的,在怀孕早期以乳杆菌为主;而经历早产的女性通常阴道菌群以厌氧菌为主。
在大多数足月分娩中,阴道微生物群的特点是厚壁菌门成员占优势,放线菌门、变形菌门、拟杆菌门和细杆菌门成员的丰度较低,而在早产的情况下,厚壁菌的数量减少。
饮食对阴道微生物群有重要影响
在怀孕期间,几种维生素和小分子是必不可少的,每一种都在不同的代谢和生理变化以及胎儿的整体发育中发挥作用。
据指出,女性的饮食中缺乏铁、钙、叶酸、核黄素、钾和维生素D,更容易早产。
维生素D在怀孕期间会对阴道微生物群产生影响,因为它可以加强、保护和维持阴道的上皮衬里;诱导抗微生物肽(LL-37)的表达、增加胰岛素合成;并且通过抑制糖原合成酶激酶最显著地模拟糖原合成。
低丰度的乳酸菌与早产风险最高相关
对至少三种不同CST中的阴道微生物组进行分类以评估早产风险的纵向研究。所有17项研究均在2014年至2021期间发表,包括38-539例妊娠和8-107例早产。与脆乳杆菌占优势的女性相比,具有“低乳杆菌”阴道微生物组的女性早产风险增加(OR 1.69,95%CI 1.15–2.49).
网络荟萃分析支持微生物组可以预测早产,其中低丰度的乳酸菌与最高的风险相关,而L. crispatus优势菌群的早产风险最低。
不孕症对社会、经济以及夫妻双方的心理健康都有严重的不良影响。全球育龄夫妇的患病率为 8–12%.导致不孕的因素复杂且范围广泛。
年龄是导致女性生育力下降的关键影响因素,其他例如卵巢早衰、多囊卵巢综合征和子宫内膜异位症都是公认的导致女性不孕的原因。
越来越多的证据表明,每个女性独有的阴道微生物群在决定生殖健康许多方面起着重要作用。
之前的研究还表明, L. iners 、L . crispatus、L. gasseri可以区分特发性不孕女性与健康女性或阴道病患者。
乳杆菌主导的阴道菌群通常被视为正常的标志。然而,许多研究表明,并非所有类型的乳酸菌都是有益菌,例如,L . crispatus似乎具有有益特性,而L. iners 则没有。
患有特发性不孕的女性似乎更容易出现阴道菌群失调。
研究人员将阴道微生物群分为两类:低乳酸杆菌阴道微生物群 (LL-VMB) 和高乳酸杆菌阴道微生物群 (HL-VMB)。研究人员开始评估女性不育与阴道微生物群之间的统计关联,结果如下:
高乳酸菌阴道微生物群与不孕症之间呈负相关
DOI: 10.1007/s00404-020-05675-3
数据显示,细菌性阴道炎与女性不孕症呈正相关,并且细菌性阴道炎阳性者的影响大于细菌性阴道炎中间值者。
女性不孕症可根据不同的标准分为不同的类型,其中与阴道微生物群的关联可能有所不同。从病因学的角度来看,输卵管性不孕症是与阴道微生物群相关的最常见疾病。
由细菌性阴道炎引起的慢性炎症反应也可能是输卵管粘连的原因,至少是部分原因。
低乳酸杆菌阴道微生物群 或 细菌性阴道病 如何对受精过程产生影响?
通过回顾文献,研究人员确定了三种可能的途径。
第一个:慢性炎症假说
已知一部分女性不孕症可归因于亚临床盆腔炎。此外,细菌性阴道病常伴有 pH 值升高、粘膜细胞损伤和局部炎症反应。虽然阴道炎症不会直接影响卵子,但微生物群仍有可能发挥作用。
最近的一项研究还表明,女性生殖道存在微生物群连续体,包括宫颈管、子宫、输卵管和腹膜液。由于一些盆腔炎是慢性的,没有临床症状,许多女性在诊断出不孕症后才意识到这些问题。
第二个:对性传播感染 (STI) 的易感性
最近的一项荟萃分析提供了高乳酸杆菌阴道微生物群对 HPV 和沙眼衣原体的保护作用的证据。 此外,许多研究表明,细菌性阴道病是感染 STI/HIV 的危险因素。
第三个:指非因果关联
多囊卵巢综合征是女性不孕症的一个非常常见的原因,代表了以高雄激素血症、少排卵/无排卵和卵巢囊肿为特征的内分泌疾病综合症。
已知雌激素或下丘脑-垂体-卵巢轴的变化与 多囊卵巢综合征和阴道微生物群相关,但所涉及的机制仍不清楚。有一些证据表明肠道微生物群与多囊卵巢综合征有关。
需要进一步的研究来系统地探索阴道微生物群、不孕症和其他混杂/中介因素之间的因果关系。
总的来说研究结果表明,健康的阴道微生物群与较低的不孕风险相关。
健康的阴道微生物组以产生各种抗菌化合物的乳杆菌为主。细菌性阴道病(BV)的特征是乳酸杆菌总数的减少或急剧下降,以及相应的厌氧微生物浓度显着增加。
细菌性阴道病是一种在全球育龄妇女中非常普遍的阴道微生物群疾病。全世界23%–29%的女性患有此病。细菌性阴道病已被证实与妇科和产科不良结局有关,例如性传播感染、盆腔炎和早产。
BV的特征是:
乳酸杆菌总数的减少或急剧下降,同时兼性或专性厌氧微生物的浓度相应增加100–1000倍,如Gardnerella、Prevotella、Atopobium、Mobiluncus、双歧杆菌、Sneahia、Leptotrichia,以及梭状芽胞杆菌目中的一些新细菌,称为BV相关细菌(BVAB)1–3.
加德纳菌是从患有 BV 的女性阴道样本中鉴定出的最常见的微生物。
健康或无症状的女性也可能携带G. vaginalis. 这表明阴道中存在G. vaginalis并不一定导致 BV。因此,正确理解G. vaginalis的作用非常重要。
G. vaginalis 含有多种与致病潜力相关的毒力因子,其中唾液酸酶和阴道溶血素是研究最广泛的因子。唾液酸酶A基因与BV和生物膜的存在有关。
G. vaginalis 利用唾液酸酶水解阴道内粘液唾液聚糖中的唾液酸残基,然后分解代谢游离碳水化合物,从而促进阴道粘液屏障的降解。
至于阴道溶解素,它是一种属于胆固醇依赖性溶细胞素家族的成孔毒性化合物,有助于靶细胞(如阴道上皮细胞)的裂解。
细菌性阴道病的发病机制和益生菌对抗BV的作用机制
doi: 10.3390/antibiotics10060719
生物膜是一个附着在非生物或生物表面的结构化微生物群落,镶嵌在其自身分泌的聚合物基质中,包括碳水化合物、蛋白质和核酸。生物膜的形成是一个复杂、动态和相互作用的过程,与活动的浮游微生物和微生物聚集体有关。
多种细菌和真菌微生物,如加德纳菌属和念珠菌属,可以形成生物膜。
阴道上皮上形成的多微生物生物膜在BV的发病机制中起着关键作用。G. vaginalis是主要的定植体,它可以为其他BV相关微生物的附着建立支架,从而能够开发多微生物生物膜。
Atopobium vaginae 是多微生物生物膜的第二个定殖者之一,是一种严格的厌氧微生物,对BV具有很大的预测性。
G. vaginalis 生物膜对两种常见的健康阴道分泌物(即乳酸和H2O2)的耐受性高于浮游细胞。这可以保护阴道毛滴虫和其他BV相关微生物免受不利环境的影响。
BV被认为是一种生物失调,通常表现出临床症状,可由大量具有促炎特征的微生物以及宿主免疫反应引起。
据报道,BV女性的阴道样本中含有高水平的免疫介质,如白介素(IL)-8、IL-6、IL-1α、IL-1β、IL-12p70和TNFα。
不同物种可能采用不同的免疫因子。例如,脆乳杆菌与γ诱导蛋白10(IP-10)的显著增加以及IL-12(p70)、IL-8、IL-1β和IL-1α的显著下降相关。
然而,根据阴道拭子的分析,G. vaginalis与IP-10的下降和IL-12(p70)、IL-8、IL-1β和IL-1α的增加相关。G. vaginalis也与相同因素的增加和减少有关。
在携带大量Prevotella spp.的女性中观察到了更高水平的IL-1β、IL-8和干扰素(IFN-γ)。
IL-36G对BV女性的关键作用得到了验证。因此,BV患者阴道样本中IL-36G水平升高。IL-36G可能在BV和其他疾病的免疫应答中发挥重要作用。
通过阴道菌群的检测,可以了解更多相关疾病风险。
谷禾阴道菌群检测数据库
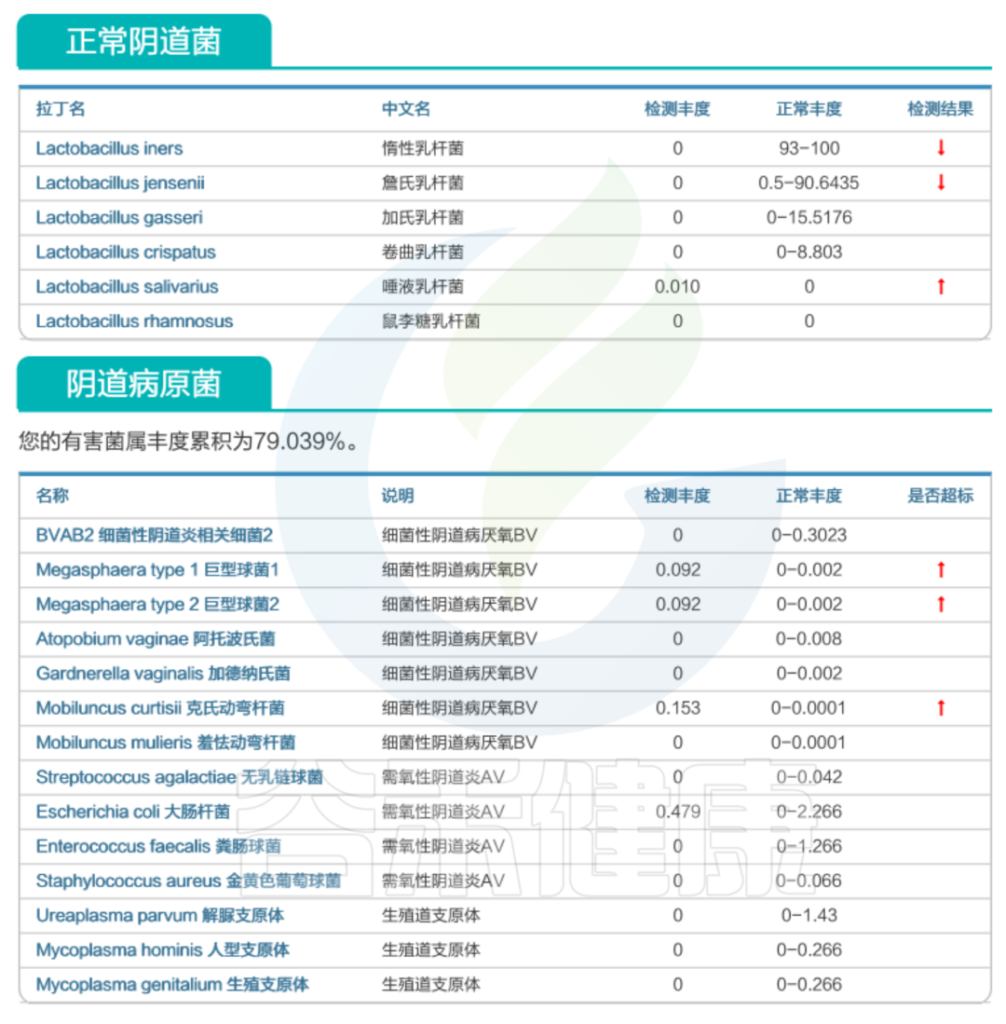
该案例选自谷禾阴道菌群检测数据库,相关菌群检测结果的异常对细菌性阴道病的风险具有提示作用。
盆腔炎是由上生殖道炎症引起的感染。细菌性阴道病被认为是盆腔炎的一个危险因素,可导致不良的生殖后遗症,如不孕、慢性骨盆疼痛和异位妊娠。
据报道,细菌性阴道病相关微生物与盆腔炎发病风险升高有关,而非细菌性阴道病相关微生物对盆腔炎发病风险没有影响。
急性子宫内膜炎患者更有可能细菌性阴道病,而携带乳酸杆菌的可能性较小。与阴道微生物群正常的女性相比,细菌性阴道病患者亚临床盆腔炎的检出率是正常女性的2.7倍。
A. vaginae, S. amnionii, BVAB1, S. sanguinegens的存在与盆腔炎及其后遗症相关,包括复发性盆腔炎和不孕。
在最近一项针对性传播感染高危女性的研究中,阴道中存在BV相关微生物,如A. vaginae, Megasphaera spp., Sneathia spp., Prevotella amnii, Eggerthella-like bacterium,可增加盆腔炎发生的可能性。
此外,BV相关微生物的更大细菌负荷预测了盆腔炎。盆腔炎中BV相关微生物的鉴定表明,生殖道上升的程度从低到高。
这一发现可能是由于BV相关微生物产生的酶。这些酶,如粘蛋白酶和唾液酸酶,可以降解粘蛋白屏障,促进上升感染,从而导致盆腔炎。
其他相关妇科疾病与阴道菌群详见:
阴道中有益和有害细菌之间的平衡非常脆弱,如果阴道 pH 值不够酸性,就会出现不平衡。阴道酸碱度应该在 3.8 到 4.5 之间,以保持健康的阴道酸度。
如果由于缺乏乳酸杆菌而导致阴道酸度不足,那么真菌和“坏”细菌的繁殖能力就会比平时更多。
可能增加阴道菌群失衡并因此感染的生理或外部风险因素包括:
帮助恢复阴道菌群平衡的措施:
益生菌是体内天然存在的细菌,通常被推荐用于治疗阴道菌群失衡。益生菌有助于恢复健康的乳酸杆菌水平。通过保持阴道菌群的健康平衡,身体对感染的防御能力得以恢复。
益生菌的开发和临床应用的最新进展为治疗开辟了新途径。极大地克服了因抗生素的适宜性、用量、给药方式等使用不当而导致病原体耐药性增强的现象。
有些益生菌例如鼠李糖乳杆菌、罗伊氏乳杆菌、植物乳杆菌、长双歧杆菌等,已被证明可以改善整体阴道健康。
每天口服一次或两次胶囊化鼠李糖乳杆菌GR-1和发酵乳杆菌RC-14菌株可将细菌性阴道病相关微生物群转化为以乳杆菌优势为标志的正常微生物群。
益生菌在外阴阴道念珠菌病(VVC)的阴道微生物组改变的治疗中也很有效。研究人员调查了7918名VVC孕妇阴道菌群的变化,发现外阴阴道念珠菌病阴道菌群可以在正常(以乳酸菌为主)和异常(乳酸菌减少)之间振荡。
临床试验表明,嗜酸乳杆菌、鼠李糖乳杆菌GR-1和发酵乳杆菌RC-14在恢复以乳酸杆菌为主的阴道菌群方面具有有效性。
它会对阴道健康产生负面影响。对于更容易受到阴道酵母菌感染的女性,建议采用均衡且高纤维的低糖饮食。摄入大量糖会促进肠道中致病性酵母菌的生长。如果这些在上厕所时进入阴道,可能会导致阴道酵母菌感染。
高热量和高脂肪消耗的女性患细菌性阴道病的风险增加。
一些研究已经确定微量营养素摄入不足,尤其是维生素 A、C、E 和 D 以及 β-胡萝卜素、叶酸、钙的不足,会增加细菌性阴道病的风险。
各种疾病所需的抗生素疗程会扰乱健康的阴道菌群。这使得病原体和酵母菌很容易传播。
有香味的卫生用品或其他物品,如用含有合成香料的洗衣粉洗涤的内衣,会破坏阴道微生物组。阴道有一种自然的气味。如果闻到比平时更刺鼻的气味,则可能表明阴道微生物组失衡。
冲洗会破坏阴道的天然微生物组,使其容易受到感染。肥皂和化学女性卫生用品会改变 pH 值的酸度,也可能杀死或去除有益细菌,还会引入新的细菌,从而降低抵御潜在感染的防御屏障。
有些女性认为所有的内衣都是一样的。但是紧贴生殖器区域皮肤穿的衣服会有所不同。“穿白色棉质内衣,不要染色”,研究人员表示,“而且阴道需要呼吸空间,所以不要穿紧身牛仔裤。”
膳食糖会滋养阴道中的酵母菌和其他有害细菌。“避免在饮食中加糖——不要吃小麦,不要吃甜食,”一些研究人员提倡“绿色”饮食,富含健康脂肪和低糖食物、富含微量营养素的植物性食物,如鳄梨、坚果、种子和十字花科蔬菜。
吸烟可以改变阴道内的雌激素和 pH 值;同时研究发现宫颈/阴道分泌物中含有微量尼古丁,可能会促进炎症。
如果低雌激素或阴道干燥影响阴道 pH 值,外用雌激素乳膏可能会有所帮助。 外用雌激素乳膏仅供处方使用,因此如果怀疑低雌激素(或雌激素波动不稳定)导致阴道生态系统失衡,请咨询医生。“如果女性处于围绝经期或绝经后,阴道雌激素治疗是降低阴道 pH 值的最有效方法。”
拥有健康的阴道菌群对孕妇尤为重要。怀孕对身体来说是一个非常特殊的条件。它还会改变荷尔蒙平衡。伴随的高水平雌激素也会影响阴道菌群。由于免疫系统更敏感,孕妇也更容易受到感染。
孕妇阴道菌群紊乱可能导致病原体传播。在细菌性阴道病的情况下,早产或流产的风险会增加。注意到阴道分泌物(外观和气味)发生变化的孕妇应咨询妇科医生。
阴道微生物组与人类宿主形成稳态和互惠关系,并在阴道健康和疾病中发挥重要作用。内部和/或外部因素的变化导致平衡的生态系统崩溃,这也称为生态失调。
乳酸杆菌似乎在维持健康的阴道微环境中起着核心作用。阴道菌群失调涉及微生物多样性或丰度的变化,特别是乳酸杆菌或某些厌氧细菌,这会导致炎症。这些相关微生物会影响免疫介质,而免疫介质可作为阴道环境中生态失调的预测性生物标志物。
基于调节阴道菌群平衡的研究,可用于了解阴道微生物组如何影响怀孕和分娩;同时可能成为细菌性阴道病、早产、不孕等疾病的新的靶点,深入了解相关作用机制,有助于更多改进的和准确的诊断和治疗策略的开发。

主要参考文献:
Gudnadottir U, Debelius JW, Du J, Hugerth LW, Danielsson H, Schuppe-Koistinen I, Fransson E, Brusselaers N. The vaginal microbiome and the risk of preterm birth: a systematic review and network meta-analysis. Sci Rep. 2022 May 13;12(1):7926. doi: 10.1038/s41598-022-12007-9. PMID: 35562576; PMCID: PMC9106729.
Hong X, Ma J, Yin J, Fang S, Geng J, Zhao H, Zhu M, Ye M, Zhu X, Xuan Y, Wang B. The association between vaginal microbiota and female infertility: a systematic review and meta-analysis. Arch Gynecol Obstet. 2020 Sep;302(3):569-578. doi: 10.1007/s00404-020-05675-3. Epub 2020 Jul 8. PMID: 32638096.
Joseph RJ, Ser HL, Kuai YH, Tan LT, Arasoo VJT, Letchumanan V, Wang L, Pusparajah P, Goh BH, Ab Mutalib NS, Chan KG, Lee LH. Finding a Balance in the Vaginal Microbiome: How Do We Treat and Prevent the Occurrence of Bacterial Vaginosis? Antibiotics (Basel). 2021 Jun 15;10(6):719. doi: 10.3390/antibiotics10060719. PMID: 34203908; PMCID: PMC8232816.
Chen X, Lu Y, Chen T, Li R. The Female Vaginal Microbiome in Health and Bacterial Vaginosis. Front Cell Infect Microbiol. 2021 Apr 7;11:631972. doi: 10.3389/fcimb.2021.631972. PMID: 33898328; PMCID: PMC8058480.
Zheng N, Guo R, Wang J, Zhou W, Ling Z. Contribution of Lactobacillus iners to Vaginal Health and Diseases: A Systematic Review. Front Cell Infect Microbiol. 2021 Nov 22;11:792787. doi: 10.3389/fcimb.2021.792787. PMID: 34881196; PMCID: PMC8645935.
Bastianelli C, Farris M, Bianchi P, Benagiano G. The effect of different contraceptive methods on the vaginal microbiome. Expert Rev Clin Pharmacol. 2021 Jul;14(7):821-836. doi: 10.1080/17512433.2021.1917373. Epub 2021 Apr 23. PMID: 33863265.
Saraf VS, Sheikh SA, Ahmad A, Gillevet PM, Bokhari H, Javed S. Vaginal microbiome: normalcy vs dysbiosis. Arch Microbiol. 2021 Sep;203(7):3793-3802. doi: 10.1007/s00203-021-02414-3. Epub 2021 Jun 13. PMID: 34120200.
Auriemma RS, Scairati R, Del Vecchio G, Liccardi A, Verde N, Pirchio R, Pivonello R, Ercolini D, Colao A. The Vaginal Microbiome: A Long Urogenital Colonization Throughout Woman Life. Front Cell Infect Microbiol. 2021 Jul 6;11:686167. doi: 10.3389/fcimb.2021.686167. PMID: 34295836; PMCID: PMC8290858.

谷禾健康

有人在的地方就有江湖,这也同样适用于细菌。
单个细菌的行动往往只是徒劳,然而当它们在一起的时候,集体行动的能力令人刮目相看。
细菌使用化学物质作为它们的“语言”,使用化学通讯来区分自己的物种和其他物种。
实际上它们看不到,并不知道彼此在那里,但它们可以测量化学物质的浓度。
当这些化学物质的水平达到临界水平时,会向细胞内部传递一个信号,该信号会提醒每个细菌细胞及其他在附近的细菌同胞,告诉它们已达到“法定人数”。

然后,整个细菌群作为一个大的、协调的群体,去执行单个细菌无法完成的任务。
以上就是所谓的“ 群体感应 ”。
微生物细胞群体密度的增加使微生物之间的细胞间通讯成为可能,从而产生群体感应信号。
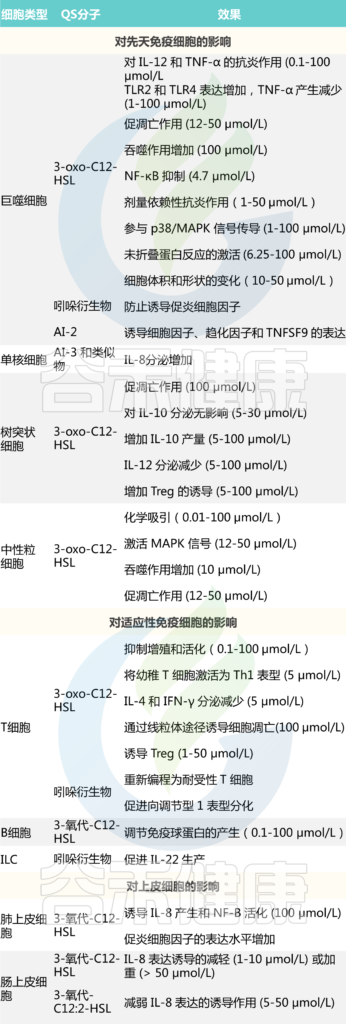
生物发光、毒性因子产生、次级代谢产物产生、DNA摄取能力、生物膜形成等,这些都离不开群体感应。
如果有一两个细菌进入我们体内,它们释放出一些有毒物质或毒素,对于我们几乎没啥影响。
但是如果它们“略施计谋”,等待并计算自己的数量,等到大量细菌一起分泌毒素,攻击人体,那么就可能会压倒人的免疫系统。
它们可以利用群体感应启动致病性。
干扰群体感应有可能阻止有害细菌的致病。当然,促进群体感应,特别是有益细菌,也可以使我们更健康,并可能产生有价值的药品和工业产品。
本文我们详细了解一下细菌世界里的各种故事,群体感应期间会发生什么,群体感应如何影响宿主,群体感应在生物膜的形成中发挥什么作用,与哪些疾病相关,该如何利用群体感应控制疾病从而利于人体健康。
群体感应(简称QS)是细菌细胞与细胞之间的交流过程,涉及到细胞外信号分子自诱导剂(AIs)的产生、检测和响应。AIs使细菌能够感知和响应时间和连续环境,并通过改变基因表达来协调菌落的行为。
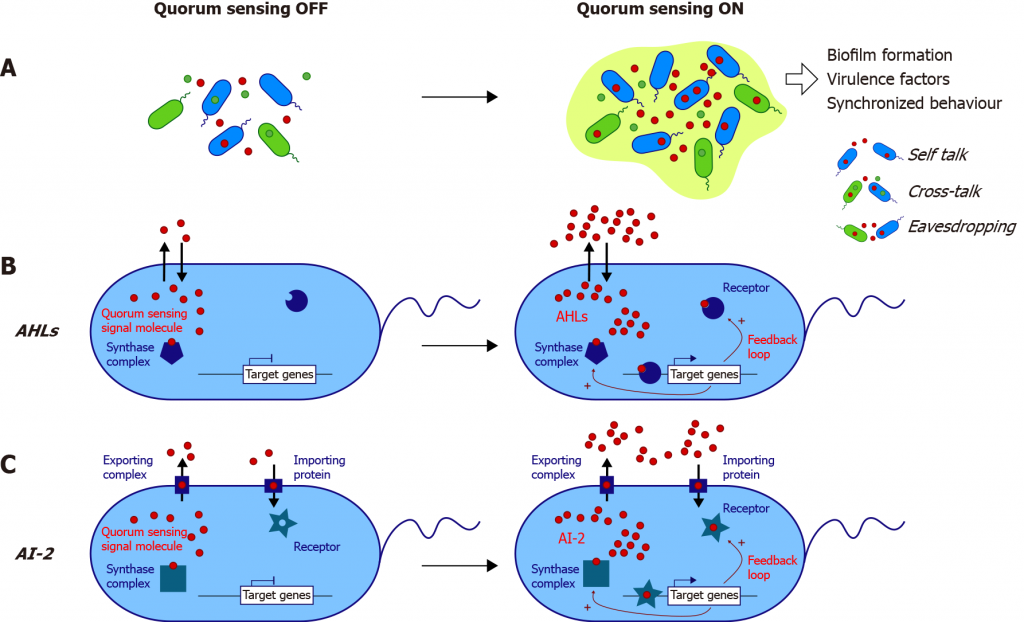

doi: 10.3748/wjg.v27.i42.7247
说起群体感应,就要了解以下三个主要的信号分子。
1. AHL(酰基高丝氨酸内酯Acyl-Homoserine Lactones)
在革兰阴性菌中由AHL介导
AHL是由合成酶复合物产生的,AHL可以通过膜自由扩散。AHL被其细胞内受体识别,复合物与靶基因调控元件结合。
许多革兰氏阴性细菌利用LuxI/LuxR型群体感应系统,产生一系列AHL信号,当与同源LuxR同源物结合时,这些信号可调节控制多种性状的基因的表达。LuxR同系物可与一系列AHL结合。
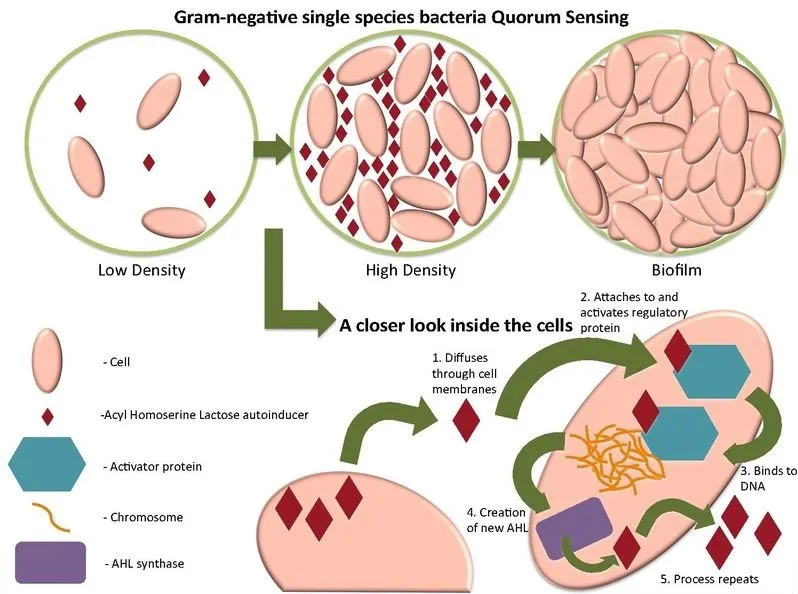
图片来源:Wikimedia Commons
2.自诱导肽 AIP(Autoinducing Peptides)
在革兰阳性菌中的由AIP介导
在革兰氏阳性细菌中,群体感应通常由称为自动诱导肽(AIPs)的小分泌肽控制。AIP由核糖体作为前体肽合成,然后加工并主动运出细菌细胞。
AIP传感涉及与细菌膜中的传感器激酶信号受体结合,然后使控制靶基因转录的细胞质反应调节器磷酸化。
AIP控制革兰氏阳性细菌的一系列细菌功能,包括枯草芽孢杆菌的产孢和能力,以及金黄色葡萄球菌的毒力。
3. AI-2(Autoinducer 2)
在革兰阴性菌和革兰阳性菌中均能由AI-2介导,细菌世界里的“通用语言”
Al-2存在于一些革兰氏阴性和革兰氏阳性细菌中。AI-2需要一种转运蛋白才能进出细胞。现在人们普遍认为,AI-2在革兰氏阳性和革兰氏阴性细菌中都是一个重要的信号,但其信号活性仅限于具有特定AI-2受体的细菌。
AI-2控制多种细菌功能,包括哈维氏弧菌的发光和许多细菌的生物膜形成。
除了以上三种之外,当然也有其他一些信号分子,例如:
研究人员从luxS/AI-2细菌性肠出血性大肠杆菌中纯化了一种假定的自诱导信号AI-3。进一步的研究证实,AI-3的合成独立于LuxS(AI-2合酶)。
AI-3是属于吡嗪酮家族的几种产物。苏氨酸脱氢酶(Tdh)介导的AI-3信号产生和氨基酰基tRNA合成酶相关的自发环化是两个基本反应。
不同细菌种类采用的主要群体感应系统


doi.org/10.3390/microbiolres12040068
肠道是一个特别动态的环境,许多观点表明群体感应是肠道生态系统中的一个新角色。
微生物群具有极其稳定的结构。肠道微生物群的稳定性取决于群体感应。
▸在正常生理条件下,群体感应可能有助于肠道细菌的空间分布
肠道细菌分布和群体感应信号
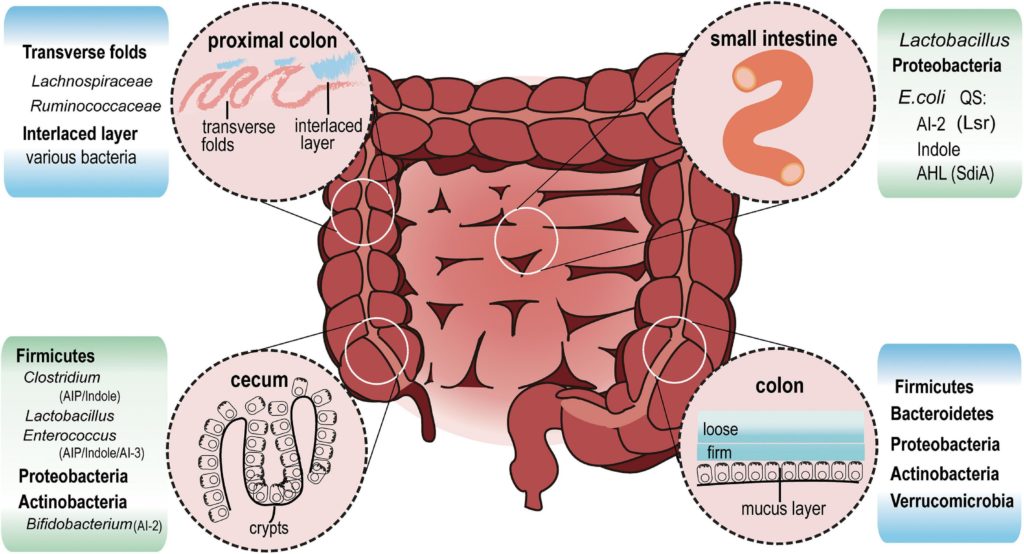
doi.org/10.3389/fmicb.2021.611413
在回肠(小肠)中,乳酸杆菌和变形杆菌是最丰富的细菌。大肠杆菌属于变形杆菌,通过AI-2、吲哚和AHL信号与其他细菌进行通信。
在盲肠隐窝中,可以发现厚壁菌,包括梭状芽孢杆菌、乳酸杆菌、肠球菌、变形杆菌和放线杆菌。该区域可能存在AIP、AHL、吲哚、AI-2和AI-3。
在近端结肠的远端,一条薄而致密的带(交错层)将细菌与上皮分离。近端结肠的交错层主要为毛螺菌科和瘤胃菌科。
从横结肠到直肠,粘液增加并分为两层。厚壁菌、拟杆菌、放线菌、变形菌和疣微菌门生活在松散的黏液层中。
▸肠道菌群如何利用群体感应来生存?
根据已发表的研究,可以推断,盲肠和近端结肠的隐窝和横向皱襞中的聚集物的大小大于肠腔中的聚集物,在肠腔中,粪便不断被肠道运动挤压。生活在这里的厚壁菌可能会产生足够的群体感应信号,通过AI-2影响自己的群落以及邻近物种。
厚壁菌
约83.33%的厚壁菌含有LuxS蛋白直系同源物,这是一种产生AI-2的必要合成酶,而拟杆菌中仅在16.83%发现。这种AI-2生产能力的显著差异可能加强厚壁菌的竞争优势,使其能够支配盲肠和近端结肠。
拟杆菌
在拟杆菌中,B. thetaiotaomicron从膳食中植物多糖或无多糖的黏液聚糖中获取碳源。它们有很高的代谢能力,在粘液和管腔中同样复制自己。然而,由于缺乏LuxS直系同源物(KEGG碱基),它们发现很难与其他物种竞争,如梭状芽孢杆菌和乳酸杆菌等,它们利用AI-2形成生物膜或自我生长。
▸同样是大肠杆菌,生活在粘液比管腔获取更多铁,这离不开群体感应AI-2
粘液驻留细菌和管腔共生细菌种类繁多,通常分布在不同的生态位中,营养素的利用方式不同。
同样是大肠杆菌,它在外粘液中能够快速复制;而在肠腔中,由于有限的糖苷水解酶,大肠杆菌保持在固定相。
粘液是分离细菌和肠上皮的物理保护屏障,并不断更新。内粘液层周转迅速,最终转化为松散的外粘液层。外层通过肠道运动与结肠内容物一起排出。下一轮的食物伴随着潜在的粘液,使细菌重新定居。
AI-2分子调节生物膜的形成,并允许一些细菌(如双歧杆菌和乳酸杆菌)粘附和富集。在粘液周转期间,生活在粘液中的大肠杆菌细胞选择性增殖,而不是从管腔内容物中重新定居。
此外,AI-2信号与细菌的铁代谢调节有关,包括放线杆菌、弧菌和双歧杆菌。
研究表明,相对管腔而言,定植于粘液中的大肠杆菌可以利用更多的铁,这可能是由于在粘液中暴露更多的AI-2信号所致。
群体感应信号可能有助于共栖肠道细菌相互协作,增强抵抗入侵者定殖的能力,并通过调节某些物种的相对丰度来保持动态平衡。当然这是一个需要进一步探索的研究领域。
在肠道这样一个网络化、复杂的生态系统中,宿主不断与数以万亿计菌群相互作用。 细菌的交流必须从一个大的角度来看待。群体感应如何影响宿主?
可以通过两种方式:直接或间接。
细菌和宿主之间通过群体感应分子的对话
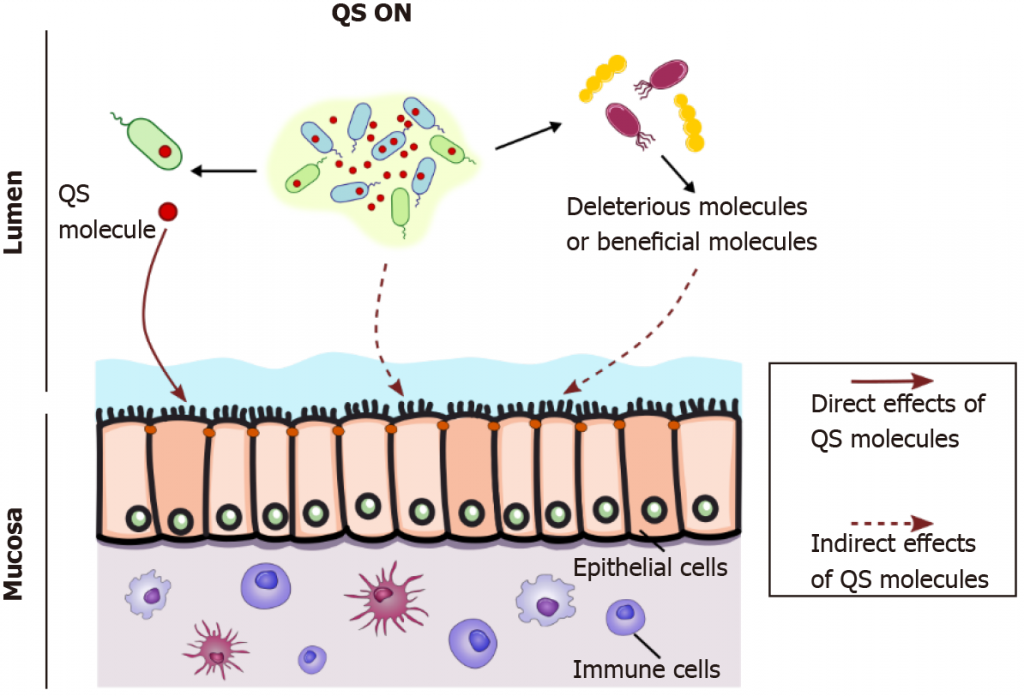

doi: 10.3748/wjg.v27.i42.7247
▸直接的方式:
群体感应分子可以通过与宿主细胞(如上皮细胞或免疫细胞)的直接接触(全箭头,左)影响宿主,如铜绿假单胞菌群体感应分子3-oxo-C12-HSL那样,它可以自由进入哺乳动物细胞。
▸间接的方式:
当达到细菌群落内的阈值浓度时,群体感应自动诱导剂会同步群体行为,如肠出血性大肠杆菌中的毒力和附着消除策略,从而间接影响宿主(上图虚线箭头,中间)。
此外,群体感应分子可以通过对具有不同代谢特性的其他细菌种群的影响,间接改变宿主(右虚线箭头)
细菌代谢改变有益的代谢产物,如短链脂肪酸和胆汁酸。通过调节肠道微生物群组成,群体感应可以通过促进有害或有益细菌间接影响肠道生理学。
例如,AI-2通过促进厚壁菌生长来调节失调菌群。体外和体内的一些研究描述了肠道病原体如何通过群体感应向共生体发出信号,并触发毒素、毒力因子和生物膜的表达。
此外,AI-3控制使肠出血性大肠杆菌通过附着和清除过程引起损伤的基因。
以上是群体感应影响宿主的途径。接下来我们来看,肠道细菌的群体感应给宿主带来的影响具体表现在哪些方面?
目前研究其对宿主的影响,主要包括屏障功能、炎症过程、致癌作用这三方面。
群体感应分子对肠上皮屏障功能不同参数的影响


doi: 10.3748/wjg.v27.i42.7247
铜绿假单胞菌群体感应分子3-oxo-C12-HSL诱导多种细胞类型的凋亡,包括上皮细胞,促进肠道屏障的破坏。此外,3-oxo-C12-HSL破坏紧密连接,从而导致细胞旁通透性增加,并影响粘蛋白的产生。而3-oxo-C12:2-HSL和色氨酸代谢物吲哚保护紧密连接。
与OCTN2结合的枯草芽孢杆菌CSF也通过激活HSP27信号来减少细胞死亡,从而促进肠道屏障的完整性。
群体感应分子对肠道屏障功能和免疫反应的影响
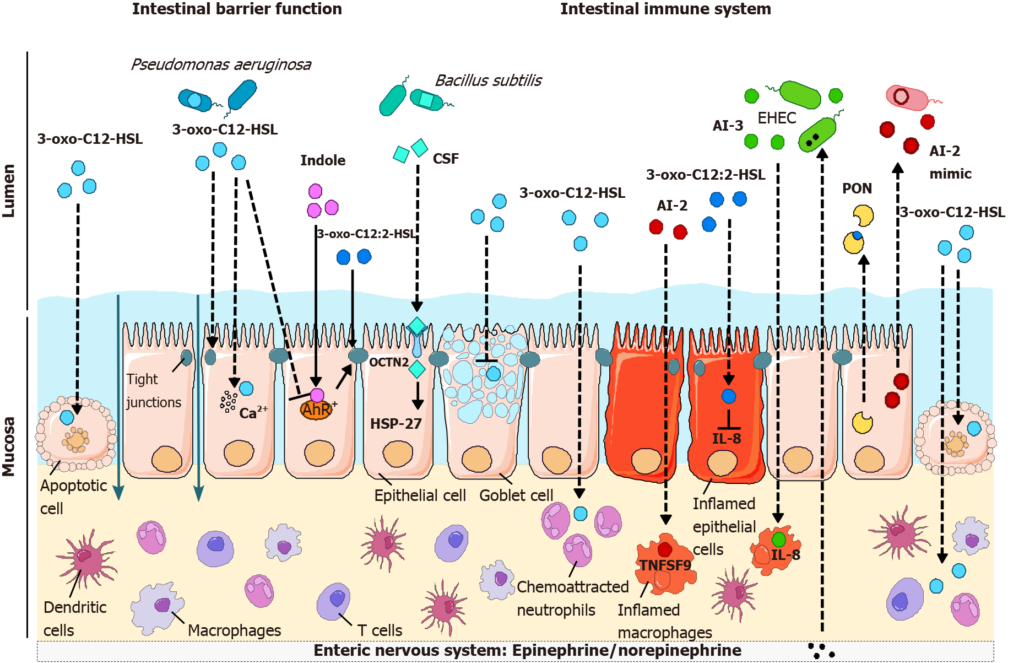
doi: 10.3748/wjg.v27.i42.7247
3-oxo-C12-HSL刺激中性粒细胞的化学吸引和吞噬并诱导细胞死亡,其对免疫细胞的促炎或抗炎作用更为复杂。
除了对肠道屏障的作用外,群体感应分子在肠道免疫室的不同因子也产生作用,该免疫室参与与上皮室的复杂串扰,以维持对肠腔内容物的适当免疫反应。
群体感应分子对不同细胞类型炎症的影响
doi: 10.3748/wjg.v27.i42.7247
自体诱导剂AI-2和AI-3通过分别诱导免疫介质TNSF9和白细胞介素(IL-8)的表达,对巨噬细胞产生促炎作用,而3-oxo-C12:2-HSL可减少上皮细胞产生IL-8。
所有这些群体感应分子如何在生理环境中穿过肠道屏障和/或到达体内免疫细胞仍有待澄清。
越来越多的证据表明,肠道微生物群失调在大肠癌的发展中起着重要作用。条件致病菌较多促进肠道炎症,这是大肠癌发病的驱动因素之一。
一些驱动病原体,如脆弱拟杆菌,可以促进强烈的Th17炎症反应。这种促炎微环境可能有利于条件致病菌(如梭杆菌属)的定植。因此,梭杆菌优势生物膜与人类结直肠癌相关。
总之,这些发现支持多微生物相互作用和细胞间通讯可能在大肠癌的发展中发挥重要作用。然而,在大肠癌期间,细菌如何与自身和宿主进行沟通仍不清楚。
最近的研究,为群体感应分子AI-2在大肠癌细胞间通讯中的作用提供了新的见解。
首先,与人类大肠癌周围正常组织相比,肿瘤中的AI-2浓度增加。根据CRC TNM(肿瘤结节和转移)评分,这些水平也与疾病的进展相关。
CD4-TnAi的表达与肿瘤细胞的免疫反应呈负相关。
在分子水平上,已证明AI-2通过TNFSF9信号通路诱导U987衍生巨噬细胞的体外M1极化。
这些发现表明,AI-2可能是与免疫肿瘤微环境相关的一个重要因素,并阐明了群体感应系统在大肠癌发展和进展中的作用。
有趣的是,哺乳动物上皮细胞能够产生模拟AI-2效应的AI-2类似分子,这说明了细菌-宿主串扰的复杂性。因此,更好地了解参与肿瘤发生的群体感应分子,可能是提高我们对大肠癌发生机制的认识的一个机会。
以上是群体感应对宿主的影响,那么对于群体感应的影响,宿主有没有什么回应?下面章节我们继续来看。
宿主细胞除了受到细菌群体感应分子的调控外,还通过反击对群体感应信号作出反应。
肠上皮细胞分泌模拟AI-2的信号类似物
当受细菌衍生的可溶性分子影响时,肠上皮细胞可以分泌模拟AI-2的信号类似物,从而影响肠道细菌。当缺乏AI-2信号产生的LuxS突变株与从结肠组织分离的上皮细胞共培养时,发现通常由AI-2诱导的lsr基因转录增加。这归因于肠上皮细胞生产的AI-2模拟物。
此外,这些信号与上皮紧密连接损伤有关。上述结果表明,宿主衍生的AI-2模拟物可能与肠道细菌粘附和上皮屏障破坏有关。
宿主分泌的分子可以被细菌利用,作为肠道微环境中的群体感应信号
儿茶酚胺等宿主激素可促进细菌生长。Epi/NE可由群体感应系统的QseC受体感知。最近的研究表明,其他肾上腺素能受体包括QseE和CpxA在内,它们与 QseC 在系统发育图谱上存在显着差异,它们也充当受体发挥作用。
1-辛酰基-rac-甘油(OCL),一种在哺乳动物胃肠道中含量丰富的单酰甘油,形成三酰甘油,并作为化学伴侣稳定大肠杆菌中的SdiA,使其具有基础活性。
脂肪酸抑制生物膜,影响群体感应
脂肪酸(FAs)广泛存在于各种生物体中,其化学结构与扩散信号因子(DSF)家族相似。一些革兰氏细菌将DSF用作生物膜形成和毒力的群体感应信号。FAs与DSFs相似,可抑制细菌生物膜或其他群体感应依赖性基因的表达,并影响AHL和AI-2信号转导。
常见的人体病原体,包括伯克霍尔德菌、铜绿假单胞菌、弧菌、幽门螺杆菌和沙门氏菌,都利用DSF。其中一些药物专门针对胃肠系统。在小肠缺乏物理屏障的情况下,化学屏障在分离小肠中的细菌和上皮细胞,从而保护宿主免受病原体感染方面起着关键作用。胆汁中的FAs还可以模拟群体感应信号来调节细菌生物膜的形成。
以上是细菌通过群体感应和宿主之间的互相交流,具体到疾病中,这些交流是怎么运作的?
铜绿假单胞菌是一种作用于人体组织的条件致病菌。它通过三个主要的群体感应系统起作用,包括两个AHL依赖的LuxI/LuxR型系统和一个假单胞菌喹诺酮类信号(PQS)系统。
铜绿假单胞菌利用AHL信号家族中的N-3-氧代-十二烷基-高丝氨酸内酯(3O-C12-HSL)和N-丁基-L-高丝氨酸内酯(C4-HSL)控制300多个基因,其中许多基因参与毒力调节。PQS系统与生物膜的形成有关。
当铜绿假单胞菌感染人体时,上述群体感应信号与人体细胞相互作用,导致包括中性粒细胞、巨噬细胞以及上皮细胞在内的免疫细胞发生生理和功能变化。
与缺乏AHL产生的突变铜绿假单胞菌菌株相比,含有3O-C12-HSL和C4-HSL的野生型菌株促进巨噬细胞吞噬。3O-C12-HSL导致细胞体积增加,这与水通道蛋白9(AQP9)的上调有关,AQP9是炎症性肠病(IBD)的一种慢性炎症标记物。
研究分析了健康受试者和出现炎症发作或病情缓解不足的IBD患者的粪便。使用液相色谱法和质谱法检测这些样品中的AHL。
在AHL中,3-oxo-C12:2在健康组中显著富集,与伴有FLARE的IBD患者相比,IBD缓解组中含量更高。与3-oxo-C12(3O-C12-HSL)不同,3-oxo-C12:2可以减少IL-1β刺激的肠上皮细胞中IL-8的分泌,但对上皮细胞旁通透性没有影响(图2)。
此外,3-oxo-C12:2水平与粪杆菌、类球梭状芽孢杆菌和细梭状芽孢杆菌的较高计数呈正相关。这些细菌种类很罕见,属于厚壁菌,尤其是普拉梭菌F.prausnitzii。事实上,一项早期研究报告称,口服活的 F.prausnitzii 或其上清液可降低2,4,6-三硝基苯磺酸(TNBS)结肠炎的严重程度。F.prausnitzii的抗炎作用部分是由于其分泌的代谢物阻止IL-8的产生。
与CDI阴性腹泻患者相比,艰难梭菌感染(CDI)患者的粪便中含有高水平的吲哚和艰难梭菌毒素诱导的群体感应信号肽。这表明艰难梭菌利用群体感应信号调节其在胃肠道的感染,并且该群体感应信号与吲哚的产生有关。
然而,艰难梭菌缺乏色氨酸酶基因,这有助于吲哚的生成。随后的研究结果表明,艰难梭菌可能利用毒素诱导的群体感应信号来调节吲哚产生菌的相对丰度,并为其生存创造有利的环境。
同时,共生肠道细菌的吲哚耐受性低于艰难梭菌,共生肠道细菌的恢复将受到抑制,从而为艰难梭菌的定植和扩张提供更有利的环境。
理论上,AHL仍然是使用群体感应中的天然分子调节微生物群组成和肠道炎症的良好候选方法。AHL信号可能涉及有助于控制肠道炎症的不同途径,例如抑制NF-κB、调节、抑制MAPK激活、增加调节性T细胞诱导、减少促炎细胞因子和调节上皮屏障中的连接复合物。
事实上,使用群体感应分子可以在代谢和炎症疾病中的肠道生态系统紊乱的两个组成部分(肠道微生物群和宿主反应)中发挥作用。基于AHL的群体感应已经作为治疗应用存在,用于动态控制革兰氏阴性菌群,尤其是在传染病中。其他群体感应分子可以扩展为潜在的临床治疗方法,用于治疗与肠道微生物群相关的疾病,尤其是涉及生物膜形成和抗生素耐药性相关。
当然以上只是从群体感应的角度来了解其与疾病之间的关联,我们知道,疾病的发生发展不止这些因素,还包括其他的,比如说致病菌生物膜的存在,会使某些致病菌难以清除,与疾病的发生有关。
为什么生物膜的存在会使某些致病菌难以清除?我们前面阐述的群体感应与生物膜是不是类似?它们之间又有什么样的联系?
下一章节我们继续了解。
在了解群体感应与生物膜的关联之前,我们先了解一下生物膜是什么?
生物膜是粘附在表面上的细胞外基质,由核酸、蛋白质、多糖和脂质的复合物组成。
约 80% 导致慢性感染的细菌都能产生生物膜,它是一种重要的毒力机制,可诱导对抗菌剂的耐药性和逃避宿主免疫系统。
许多细菌物种,包括病原菌都能产生生物膜,如金黄色葡萄球菌、铜绿假单胞菌等,它们通过产生生物膜,变得对细胞外应激条件更具抵抗力,更能生存下去,所以生物膜是微生物的一种有用的适应。
它们更好的生存能力对人类来说可不是好事,一般来说,生物膜内的微生物比以单细胞存在时更难根除。这主要是由于生物膜相关的细胞外网络、代谢休眠和其他潜在机制介导的耐受性。
参与生物膜形成的细菌种类及其生物效应的例子

doi: 10.15190/d.2019.13
形成生物膜的细菌嵌入在由细胞外聚合物(EPS)构成的自生黏液基质中。这种生长模式可以改变细菌的生物学和生理特性,如繁殖、生长、基因转录率和对抗生素的耐药性。
生物膜的形成需要五个成熟阶段:
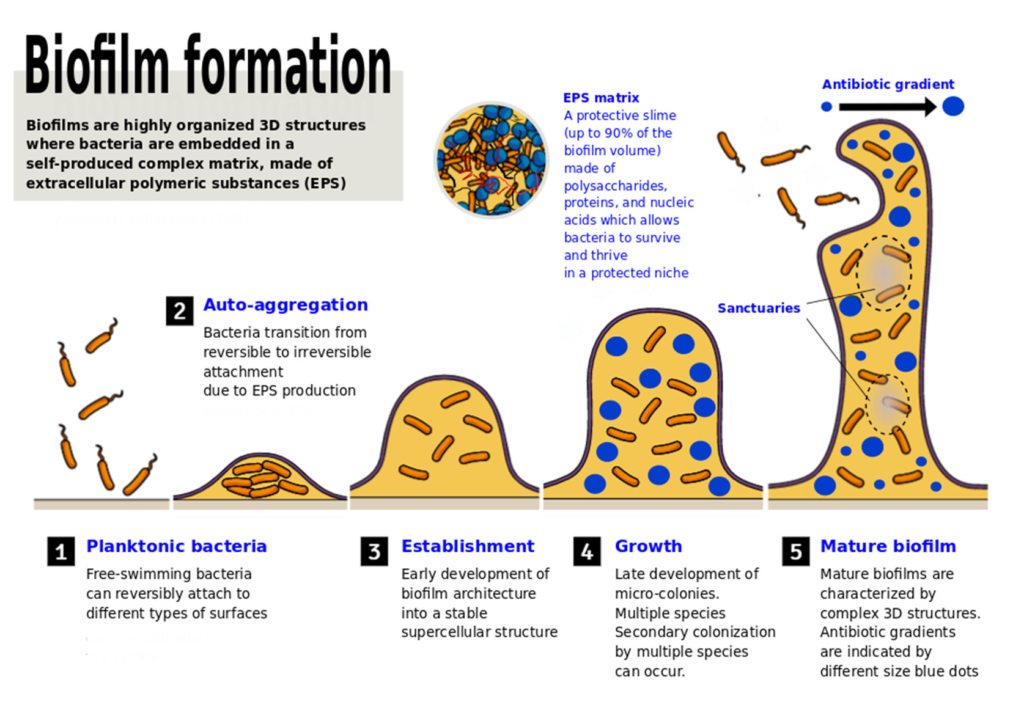
doi.org/10.3390/microbiolres12040068
小蓝点和大蓝点代表抗生素浓度不同的区域(表示存在梯度),灰色区域是细菌可以在低浓度抗生素下存活的“避难所”,有利于产生耐药性。
(i) 浮游细菌在表面的初始附着(可逆)
(ii)产生和分泌EPS和/或其他对接方式,以及驱动从可逆到不可逆的过渡附着的特定粘附素(例如,鞭毛、自转运蛋白、菌毛、卷曲纤维和F型结合菌毛)
(iii)作为超级细胞结构的生物膜结构的早熟
(iv)微菌落的晚熟和进化为成熟生物膜
(v) 细胞从生物膜上分离并分散到周围环境中
所有这些过程都受到不同细胞间信号分子的严格调控,这些信号分子负责种群密度依赖的基因表达,这些基因表达会深刻影响生物膜的形成过程。
生物膜的成熟与细胞外聚合物物质的积累并行。最后一步涉及到细菌菌株从微菌落分离,可能导致在不同位置形成一个新的生物膜菌落。
以上我们可以看到,群体感应和生物膜形成是细菌的两种群体行为。
由于生物膜聚集体中的细胞非常相似,并通过自生的细胞外基质相互连接,因此生物膜代表了与群体感应相关的生态环境。
一些研究表明,群体感应信号分子在革兰氏阳性和革兰氏阴性细菌的生物膜形成中起着重要作用。
S. oralis 34 产生的AI-2信号分子已被证明是口腔链球菌34 和Antinomyces naeslundiiT14V 形成生物膜所必需的。AI-2介导的群体感应也参与大肠杆菌生物膜的形成、运动基因的调节、鞭毛的合成和趋化性。
乳糖可诱导蜡样芽孢杆菌生物膜,观察到AI-2产生的乳糖以剂量依赖性方式增加。而其他研究表明,添加外源AI-2可以削弱金黄色葡萄球菌生物膜的形成。
低浓度的AI-2可以促进猪链球菌生物膜的形成,但高浓度的AI-2显示出抑制作用。
细菌生物膜的形成是一个动态的分层过程。粘附在宿主表面是细菌生物膜形成的第一个也是关键的阶段。细菌通常有两种粘附表面的方式:
(i)通过外膜粘附蛋白与宿主表面结合;
(ii)胞外多糖(EPS)对宿主表面的粘附,如多糖细胞间粘附(PIA)。
以目前研究较多的铜绿假单胞菌为例,我们具体来看群体感应对生物膜形成的影响。
铜绿假单胞菌的群体感应非常复杂,可以由转录调节器(MvaT和RsaL)、转录后调节器(RsmA)、σ因子因子(RpoN和RPO)甚至其他群体感应系统(PQS系统)进行调节。
在LasI/LasR-RhlI/RhlR系统调节的功能中,有几种与生物膜形成相关的毒力因子,如鼠李糖脂、凝集素和铁载体。鼠李糖脂被证明是维持生物膜聚集所必需的,它影响一种称为“聚集”的表面运动,这种运动与生物膜的形成有关。
LecA和LecB是两种依赖群体感应的碳水化合物结合凝集素,已被证明会影响生物膜的形成,突变菌株无法形成成熟的生物膜。
群体感应控制的铁载体,如吡啶,不能产生这种影响生物膜聚集体形成的铁螯合剂。
与野生型铜绿假单胞菌形成的生物膜聚集性大的特点不同,lasI突变株产生的生物膜结构均匀,结构平坦,多层细胞密集。
在生物膜形成过程中,PQS群体感应系统负责增加细胞外DNA(eDNA)的产生,eDNA可与基质中带正电的EPS相互作用,产生生物膜。在PQS缺陷突变体中,生物膜聚集体不能充分发育。
因此,铜绿假单胞菌的三个群体感应调节系统可以影响生物膜的形成,并具有一定的促进作用。
微生物感染与群体感应介导的生物膜密切相关,群体感应信号分子参与各种细菌生物膜的形成、成熟和功能调节。那么,治疗微生物生物膜相关的感染可以从群体感应入手,群体感应抑制可作为对抗生物膜感染的有效工具。
通常,群体感应可通过以下三种方式受到抑制:
(1) 延迟或阻断群体感应信号分子的产生(细菌利用QSI阻断AIs);
(2) 使用QSMs同系物阻断受体。例如,从革兰氏阴性菌Rheinhemiera aquimaris QSI02中获得的活性二酮哌嗪环(Trp-Ser),不仅可以降低由QS调节的紫罗兰素的生物合成能力(67%),还可以降低弹性蛋白酶活性、铜绿假单胞菌生物合成和PAO1的生物膜形成能力。可能是环(Trp-Ser)比通常的革兰氏阴性信号分子(AHLs)更容易与lasR受体结合;
(3) 在氧化压力下,群体感应信号分子的酶降解,例如通过酰化酶和乳糖酶降解类似于AHL的群体感应信号更有效。这些策略已被证明是降低细菌致病性和生物膜的有效方法,有可能提高细菌对抗生素和噬菌体等抗菌剂的敏感性。
群体感应抑制剂影响生物膜的形成

doi.org/10.1016/j.foodres.2020.109742
以上是群体感应通过影响生物膜生成来阻止细菌感染,其他只要能干扰群体感应的物质,也可以作为微生物感染的治疗方式。
通过靶向细菌群体感应系统,可以开发新的治疗策略。
与健康人相比,大肠腺瘤和结直肠癌(CRC)患者的结肠粘膜和粪便中观察到更高的AI-2水平。重要的是,发现AI-2浓度随着大肠癌的进展而增加,这表明其有可能成为大肠癌临床筛查的新标志物。
另一项关于烧伤部位感染的最新研究集中于铜绿假单胞菌群体感应系统。烧伤常伴有肠道菌群失调、肠道完整性受损、免疫失调和细菌肠外移位。铜绿假单胞菌是烧伤后感染的主要病原体。其毒性产物可延长肠道功能障碍,加重全身感染。
研究人员观察到,在使用MvfR拮抗剂抑制MvfR转录因子后(一种控制该菌株毒力的重要群体感应相关转录调节因子),肠道功能障碍得到改善,铜绿假单胞菌传播减少。
事实上,抗菌治疗策略已经开始从使用抗生素扩展到开发基于群体感应系统的抑制剂,如抗毒性或抗生物膜。这些抑制剂或类似物内源性存在于细菌或真核细胞中。
一个例子是鼠尾草酸,它是金黄色葡萄球菌群体感应系统的一种特殊抑制剂。它存在于迷迭香叶中,可以在低浓度下抑制Agr表达和金黄色葡萄球菌毒力。
综上,这些研究指出了难治的传染病药物开发的新潜力。下面列举一些小分子物质,通过干扰细菌群体感应系统,从而达到抑制致病菌的效果。
具有酚类结构的黄酮类化合物有槲皮素、山柰酚、黄芩素等。黄酮类单体对细菌群体感应和生物膜均显示出抑制活性。
研究表明,这是由于黄酮类骨架中存在的两个羟基基团,阻止LasR/RhlR受体与信号分子的结合,从而抑制群体感应系统。
▸槲皮素
槲皮素是一种天然存在的黄酮醇,普遍存在于蔬菜和水果中。64μg/mL槲皮素显著抑制铜绿假单胞菌生物膜的形成,并且当槲皮素的浓度为16μg/mL时与阿奇霉素浓度为32 μg/mL具有相同效应的生物被膜抑制作用。
PCR显示lasI、 lasR、rhlI 和 rhlR等群体感应相关基因与相关毒力因子基因的mRNA表达水平均显著降低。
利用计算机分子对接技术,观察到槲皮素与LasR受体蛋白通过竞争性结合方式与LasR受体蛋白进行结合,且槲皮素比信号化合物结合更为牢固。
▸山柰酚
研究显示,64 μg/mL山奈酚对生物膜形成的抑制率为 80%,粘附降低约75%,说明山柰酚可影响生物被膜形成的粘附阶段。
柚皮素、山柰酚和槲皮素均显著抑制信号分子诱导的生物发光,槲皮素和柚皮素对哈维氏弧菌生物膜的形成有抑制作用。
▸黄芩素
研究了40种中药及天然来源的黄酮化合物,对耐药鲍曼不动杆菌菌株的体外抑菌作用和生物膜形成能力的影响,结果显示黄芩素和汉黄芩苷具有良好的抑菌效果。
其最低抑菌浓度(MIC)分别为0.0625和0.125 mg/mL, 黄芩素对鲍曼不动杆菌生物膜的形成具有明显抑制作用。
32、64 μg/mL黄芩素下调群体感应系统调节因子agrA、RNAIII和sarA等基因的mRNA表达水平,明显抑制生物膜的形成。
有研究报道,一些苯甲酸衍生物如没食子酸、香草酸、肉桂酸等可通过群体感应系统调节细菌的致病性和毒力。
▸肉桂酸
亚MIC的肉桂酸(CA)显著影响细菌的群集运动和生物被膜完整性, 减少EPS的产生。CA对LasR和RhlR受体均有拮抗作用,从而影响细菌群体感应活性。
▸没食子酸
Luis等研究结果显示,4 μg/mL的没食子酸可使金黄色葡萄球菌菌株的生物膜形成减少约40%。Srivastava等研究结果表明,没食子酸、香草酸等 中药单体的合成衍生物可抑制群体感应系统和生物膜的形成。
萜类化合物是甲戊二羟酸衍生的一类化合物。从植物中提取的萜类化合物有香芹酚、丁香酚、芳樟醇,甘草次酸、熊果酸和白桦脂酸等。
▸香芹酚
百里香精油中含有较高的单萜类化合物香芹酚和麝香草酚,可抑制紫色杆菌的紫色菌素产生。亚MIC的香芹酚和麝香草酚可以显著减少紫色杆菌CV026中信号分子的产生。
L-香芹酮是一种单萜,是传统香料植物的主要成分。亚MIC的L-香芹酮可显著减少蜂房嗜血杆菌在聚丙烯和锌表面形成生物膜。
▸丁香酚
丁香酚可以显著降低紫色杆菌CV026中的紫色菌素生成;亚MIC的丁香酚可抑制铜绿假单胞菌弹性蛋白酶、绿脓菌素的产生和生物膜的形成。
将丁香酚转化为纳米乳状态后对群体感应的抑制显著增强,亚MIC的丁香酚纳米乳剂对紫色杆菌中的紫色菌素生成可抑制约50%。
Joshi等通过分子对接技术将丁香酚与高丝氨酸内酯合成酶(ExpR)和调节蛋白(ExpI)进行对接,观察到丁香酚与受体蛋白的对接效果优于呋喃酮C-30等已知的抑制剂,因此推断丁香酚的作用机制可能是通过与ExpI/ExpR蛋白的结合,抑制信号分子的产生。
▸芳樟醇
芳樟醇具有显著的抗菌活性,MIC值在2 μg/mL~8 μg/mL之间;亚MIC的芳樟醇对紫色杆菌的群体感应系统有抑制作用。此外,芳樟醇可以减少鲍曼不动杆菌生物膜的形成和降低其粘附性。
100 μg/mL香豆素及其衍生物能够显著抑制紫色杆菌CV026的紫色菌素产生和铜绿假单胞菌生物膜的形成;在7种香豆素衍生化合物中,含6,7二羟基和7-羟基的化合物对生物膜形成的抑制活性更强。
▸小檗碱
小檗碱亦称黄连素,是中药黄连抗菌作用的主要有效成分。1/2MIC和1/4MIC小檗碱显著下调大肠杆菌群体感应系统相关基因luxS、pfS、hflX、ftsQ和ftsE,对生物膜的形成表现出明显的抑制作用。扫描电镜结果显示,菌株经处理后,粘附性下降,菌体形态也发生改变。
▸苦参碱
苦参碱明显抑制大肠杆菌群体感应系统;2.56 mg/mL苦参碱能显著降低大肠杆菌的LuxS 、 sdiA等群体感应相关基因和生物被膜相关基因的mRNA表达水平;在对大肠杆菌外膜蛋白ompA基因和群体感应基因表达的双重抑制作用下,使细菌不易产生聚集和粘附。
除上述提及的中药单体外,硫类化合物、苯丙素类化合物和单宁类等中药单体均具有群体感应抑制作用。
作用于细菌群体感应系统的中药单体的抗细菌感染,与传 统的抗菌中药相比具有剂量明确、副作用少等特点。
但是,中药单体抗细菌感染的研究主要局限于体外实验,研究方式过于单一,具体作用机制的研究还不够深入,研究多集中在观察与验证上;但细菌感染机制是复杂的,中药单体的作用机制也是多样性的,因此需要更进一步研究。
此外,大部分中药单体通常在较高的浓度发挥抗菌或抗毒力作用,这也增加了产生毒性的风险并且在体内也难以达到有效的浓度,对其进行适当的结构修饰合成中药单体衍生物则表现出对群体感应活性抑制更高,同时降低了药物浓度,这为后续抗菌药物研发提供新的思路。
由于目前临床常规使用的抗菌药物不足以对抗耐药性细菌感染,因此抗菌药物与中药单体联合用药是提高耐药细菌感染疗效的新策略。
小檗碱与亚胺培南和美罗培南联用时89%表现为协同抗菌作用;黄芩苷联合替加环素则100%协同抗菌作。
姜黄素降低头孢他啶和环丙沙星的MIC;姜黄素和头孢他啶组合具有协同抗菌效应,姜黄素和环丙沙星组合具有相加效应。
头孢他啶单独和与姜黄素联合使用时,群体感应系统的lasR基因的mRNA表达水平显著降低。
文献报道,阿奇霉素具有群体感应拮抗活性,2 μg/mL阿奇霉素可能通过影响自身诱导分子的合成,抑制铜绿假单胞菌PAO1的群体感应并能减少毒力因子的产生。1/4和1/16MIC的阿奇霉素、庆大霉素和姜黄素单独和联合用药均可显著降低生物膜形成能力。
阿奇霉素单独和与姜黄素联合作用时,lasR基因的表达水平显著下降。阿奇霉素单独给药和与姜黄素联合给药使群体感应系统的rhlI基因的mRNA表达分别降低60%和67%.
头孢吡肟、头孢他啶和亚胺培南等抗菌药物具有群体感应抑制活性。
亚MIC的阿奇霉素、美罗培南、头孢吡肟和哌拉西林/他唑巴坦对群体感应依赖性毒力因子的影响,结果所有菌株的群体感应依赖性毒力因子(如生物被膜、绿脓
菌素、蛋白酶、溶血素和DNase生成)均明显降低。
亚MIC多西环素显著降低紫色杆菌的紫色菌素产量(70%),4 μg/mL多西环素显著抑制生物被膜的生成
(72.8%),并显著降低铜绿假单胞菌的弹性蛋白酶(67.2%)、绿脓菌素(69.1%)产量以及群集运动(74%) 。
亚MIC红霉素对紫色杆菌群体感应系统的抑制率为84%,红霉素抑制群体感应的机制可能是与AbaI自身诱导剂合成酶结合而阻止信号分子合成。
许多中药单体通过作用于细菌群体感应系统而发挥抗感染作用;当与抗菌药物联合应用于细菌感染,不仅可产生协同抗菌和协同抗群体感应作用,还能提高抗感染的疗效、降低单一药物的剂量、减少不良反应,逆转细菌的耐药性。
将群体感应抑制剂中药单体与抗菌药物联合应用,成为恢复抗菌药物对细菌敏感性的一种新策略。中药单体种类繁多,抗感染作用机制复杂多样,还需要对其更深入研究,为临床多重耐药菌引起的感染提供新的治疗药物。
除中药外,益生菌也能作为群体感应的干扰剂,通过群体感应来预防病原体定植和黏膜感染。
另一方面,对于益生菌,我们更多的是希望延长它们在肠道中的停留时间并最大限度地发挥益生菌的作用。
生物膜的形成依赖于粘附、自聚集和共聚集作为细菌的重要特征。益生菌最理想的特性是其良好的粘附性,可延长它们在肠道中的停留时间,从而有效增强屏障功能,维持肠上皮稳态,增加黏液分泌、改善肠蠕动来保护或治疗肠道疾病。
益生菌对肠道菌群和宿主生理具有恢复或保护作用,例如,在存在生态失调或微生物群受到干扰的情况下,缓解胃肠道症状。
IBD患者菌落生物膜的平均密度比健康人高100倍。核梭杆菌以侵袭性生物膜的形式引起肠道疾病。同时,在感染CRC和IBD的邻近健康组织中也出现了成熟的生物膜。
生物膜可能是肠道疾病的早期预警信号。在某种程度上,生物膜提供了一个保护性环境,促进宿主防御机制的逃避,并进一步加剧疾病。虽然抗生素可以去除大多数有害细菌的生物膜,但生物膜在慢性伤口愈合过程中可以快速再生,表明生物膜中存在持久性细胞。
厚的多微生物致病性粘膜生物膜的生长标志着健康微生物群和疾病微生物群之间的过渡。
大肠杆菌Nissle 1917具有良好的生物膜形成能力,其生物膜形成能力强于肠致病性大肠杆菌(EPEC)和肠毒性大肠杆菌(ETEC),并在生物膜形成过程中与这些菌株竞争。因此,大肠杆菌Nissle 1917可作为一种益生菌用于治疗各种肠道疾病。
双歧杆菌
双歧杆菌是人类健康中最重要的益生菌之一,具有LuxS/AI-2 群体感应系统,产生包括AI-2在内的群体感应信号分子,并促进生物膜的形成。
添加碳水化合物后,双歧杆菌中AI-2的生成量正增加至89.45%。对感染产志贺毒素大肠杆菌(STEC)O157:H7的小鼠施用短双歧杆菌,通过产生高浓度的乙酸(56 mM)抑制STEC的Stx毒素表达,显示出强大的抗感染活性。
乳酸杆菌
植物乳杆菌中也存在LuxS/AI-2 群体感应系统和细菌素的产生,植物乳杆菌是一种控制一些重要区域(如肠道和阴道)微生态平衡的益生菌,在保持食品质量方面也有实际应用。
一些病原体对植物乳杆菌群体淬灭系统敏感(例如,铜绿假单胞菌PAO1/ATCC 27853,耐甲氧西林金黄色葡萄球菌ATCC 43300),该系统对金黄色葡萄球菌的生物膜形成和铜绿假单胞菌的绿脓菌素生成表现出最大的活性。
用铜绿假单胞菌感染小鼠烧伤皮肤模型,并用植物乳杆菌上清液处理。结果显示,感染后5、10和15天,铜绿假单胞菌在皮肤、肝脏和脾脏中的定植受到抑制,这表明局部益生菌给药已经阻止了病原体的血液传播。
体内研究表明,不同益生菌(例如干酪乳杆菌酪蛋白亚种ATCC 393、乳乳杆菌罗伊氏亚种ATCC 23272、植物乳杆菌植物亚种ATCC 14917和唾液乳杆菌ATCC 11741)对口腔病原体变形链球菌具有抗链球菌活性。
研究人员开发了一种牛奶模型,以研究LAB的抗李斯特菌活性(抗单核细胞增生李斯特菌),使用具有AI-2分子的沙克乳杆菌Lactobacillussakei和植物乳杆菌。
群体感应系统可能在生物膜的组织、形成和成熟阶段发挥关键作用;因此,它可以被视为开发新型抗菌剂的一个有吸引力的目标。
乳酸菌菌株——QS拮抗剂

doi.org/10.3390/microorganisms10020350
细菌群体感应和生物膜领域的研究迅速扩大,群体感应在细菌行为中发挥着关键作用,通过细菌-宿主串扰影响感染状态和疾病发展。目前很多临床难以治疗的感染或疾病与细菌的群体感应和生物膜形成有关。大多数病原菌病理反应受群体感应系统的调控。生物膜细菌通过屏障作用、群体感应系统、抗免疫清除机制、特殊的生长特性及独特的微环境、生物膜耐药基因开启等机制形成耐药,造成临床耐药菌株增多,给临床治疗带来严重困难。
上述我们可以看到,利用各种群体感应抑制剂或干扰病原菌群体感应的药物进行治疗,是一种合理且有前景的策略。例如通过群体感应靶向剂调节细菌 群体感应信号传导是控制细菌毒力因子产生和生物膜形成的有效策略。这种新型的非抗生素疗法可以抑制致病基因的表达,预防感染,降低细菌细胞耐药性的风险,近年来得到了广泛的应用。
还可以考虑群体感应分子作为菌群失调相关慢性疾病(如IBD或CRC)的可靠生物标志物。已证明,肠道生态系统中某些AI-1 群体感应分子的存在与细菌群大小直接相关。AHL可以代表细菌水平群体的生物标记物,作为菌群失调的放大镜。
此外,在腺瘤向结肠直肠转移和大肠癌进展期间,AI-2浓度增加。这为使用群体感应系统作为慢性病预防和随访的生物标志物开辟了前景。
主要参考文献:
Coquant G, Aguanno D, Pham S, Grellier N, Thenet S, Carrière V, Grill JP, Seksik P. Gossip in the gut: Quorum sensing, a new player in the host-microbiota interactions. World J Gastroenterol. 2021 Nov 14;27(42):7247-7270. doi: 10.3748/wjg.v27.i42.7247. PMID: 34876787; PMCID: PMC8611211.
Deng Z, Luo XM, Liu J, Wang H. Quorum Sensing, Biofilm, and Intestinal Mucosal Barrier: Involvement the Role of Probiotic. Front Cell Infect Microbiol. 2020 Sep 25;10:538077. doi: 10.3389/fcimb.2020.538077. PMID: 33102249; PMCID: PMC7546212.
Meroni, G.; Panelli, S.; Zuccotti, G.; Bandi, C.; Drago, L.; Pistone, D. Probiotics as Therapeutic Tools against Pathogenic Biofilms: Have We Found the Perfect Weapon? Microbiol. Res. 2021, 12, 916-937. doi.org/10.3390/microbiolres12040068
Li J, Zhao X. Effects of quorum sensing on the biofilm formation and viable but non-culturable state. Food Res Int. 2020 Nov;137:109742. doi: 10.1016/j.foodres.2020.109742. Epub 2020 Sep 22. PMID: 33233307.
Prazdnova, E.V.; Gorovtsov, A.V.; Vasilchenko, N.G.; Kulikov, M.P.; Statsenko, V.N.; Bogdanova, A.A.; Refeld, A.G.; Brislavskiy, Y.A.; Chistyakov, V.A.; Chikindas, M.L. Quorum-Sensing Inhibition by Gram-Positive Bacteria. Microorganisms 2022, 10, 350. doi.org/10.3390/microorganisms10020350
Wu L, Luo Y. Bacterial Quorum-Sensing Systems and Their Role in Intestinal Bacteria-Host Crosstalk. Front Microbiol. 2021 Jan 28;12:611413. doi: 10.3389/fmicb.2021.611413. PMID: 33584614; PMCID: PMC7876071.
曾利,凌保东.作用于细菌群体感应系统的抗菌中药单体[J].中国药理学与毒理学杂志,2021,35(10):802-803
Preda VG, Săndulescu O. Communication is the key: biofilms, quorum sensing, formation and prevention. Discoveries (Craiova). 2019 Sep 30;7(3):e100. doi: 10.15190/d.2019.13. PMID: 32309618; PMCID: PMC7086079.
Jiang Q, Chen J, Yang C, Yin Y, Yao K. Quorum Sensing: A Prospective Therapeutic Target for Bacterial Diseases. Biomed Res Int. 2019 Apr 4;2019:2015978. doi: 10.1155/2019/2015978. PMID: 31080810; PMCID: PMC6475571.

谷禾健康
有证据表明,从地球生命的开始,细菌就能够形成固着群落。尽管如此,科斯特顿(Costerton)等人创造了“生物膜”这个术语(Bill Costerton教授是世界著名生物膜专家,他首先在世界上提出了生物膜概念及理论),作为描述表面上各种各样微生物聚集体的一个简单表达,至今还不到50年。此后,环境微生物学家报告了几乎所有自然和工业生态系统中都存在生物膜。
就像在自然界中一样,微生物在人类栖息地中可以定居各种生态位。 称为生物膜的多细胞群落的主要定居形式是在人类组织表面。胃肠道是大量微生物的家园,它们的生活方式相互交织,但并不完全相同。
定义
生物膜
微生物在生长过程中为适应生存环境而形成了生物膜。微生物生物膜是由微生物群体及其包被的细胞外多聚物和基质网组成,它们彼此黏附或者黏附到组织或物体的表面。微生物生物膜与微生物的耐药性形成,基因的转移以及疾病发生的持续性感染等都密切相关。
长期以来,与粘膜组织接触的异常有害生物膜与人类疾病有关,包括外科植入物感染、牙龈疾病、导管引起的尿路和肺部感染以及一些肠道疾病。
然而,生物膜表型也有助于肠道内稳态、组织定植抗性、群落稳定性和恢复力、宿主防御成熟、食物消化和化学药物修饰。生物膜的这些有益作用尚未完全纳入我们目前对肠道微生物群的认识。
近年来有几项研究已经在成分、遗传和行为方面明确区分了粪便和粘膜附着的微生物群落。因此,粘膜多微生物群落对于寻找新的疾病生物标志物(例如,结直肠癌CRC和炎症性肠病IBD)尤其重要。
从相关性到这些疾病的潜在病因,将需要对粘膜群落进行进一步的研究,重点放在宿主与其自然生物膜表型下的微生物群之间的相互作用。
分类
目前对粘膜和粪便微生物群在微生物结果表明粘膜和粪便微生物群在微生物组成是不同的。粘膜生物膜的需要从粘膜取样推断,而不是粪便样本。
不同生态位的菌群构成也不一样。
在人类结肠中,健康人的结肠活检样本被薄薄的生物膜所覆盖,这些生物膜主要由拟杆菌科、乳酸菌科和肠杆菌科组成,位于右升结肠,拟杆菌科和乳酸菌科位于左降结肠。
健康成人的口咽组织通常定植有厌氧共生菌属,如:
韦荣球菌属Veillonella, 普氏菌属Prevotella, Leptotrichia 和 梭菌属Fusobacterium 潜在致病菌如 链球菌Streptococcus, 嗜血杆菌Haemophilus 和 奈瑟氏菌属Neisseria。
而在在小鼠小肠中,多糖和氨基酸的代谢有利于兼性厌氧菌,如变形杆菌和乳酸杆菌。小鼠结肠主要是富含梭状芽胞杆菌簇XIVa成员的粘膜群落(如羊肠球菌科和瘤胃科的物种),以及在较小程度上富集于拟杆菌科、肠球菌科和乳酸杆菌科的粘膜群落。
稳定性和弹性
除了分类学方面的考虑,微生物群的稳定性和微生物群的恢复力也是至关重要的。
从生态学的角度来看,生物膜内的这种持久竞争导致了整个群落的稳定,部分原因是可用生态位的划分。在多物种生物膜环境中,细菌之间的相互作用对群落的最终结果功能起着关键作用,因为一些生物体依赖于其他生物体的代谢活性生长。
实际上,从人类粪便样本中回收的拟杆菌、梭状芽胞杆菌、梭杆菌、金黄色葡萄球菌、普雷沃氏菌和韦荣氏球菌属的厌氧菌分离物在体外不同地粘附并形成单种生物膜。有趣的是,这项利用肠道相关分类群的研究表明,不会单独形成生物膜的细菌物种可以从与其他形成生物膜的强物种共存的混合生物膜群落中获益。
在抗生素治疗、粪便微生物群移植和益生菌定植后,粘膜相关群落可能在促进微生物群复原力方面发挥关键作用。我们可以期待关于生物膜生活方式在与肠道内稳态相关的微生物群的稳定性和恢复力特性方面的重要发现。
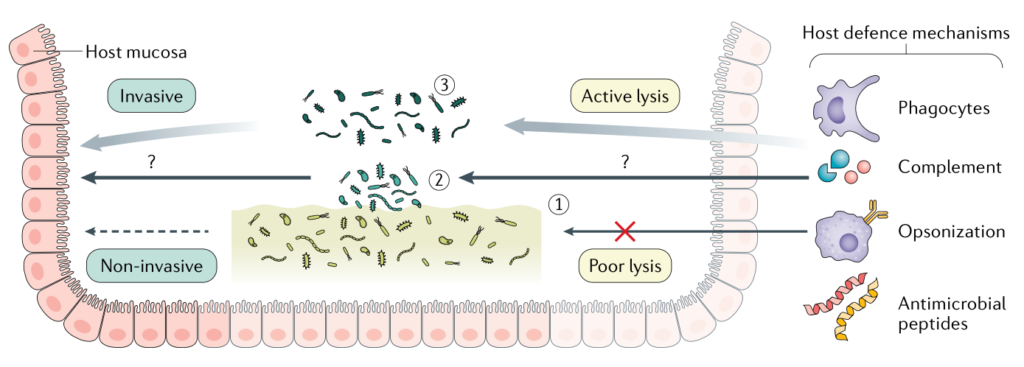
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
定植抗力
生物膜是一种具有化学成分和特定代谢的物理结构,起着保护屏障的作用,可以抵御环境分子、免疫细胞、捕食性原生生物和细菌。
共栖物种确实拥有许多竞争策略,例如快速生长以获得营养,直接攻击以将其他竞争物种排除在环境之外,从其他竞争物种中获益或剥削其他竞争物种。
这种生物膜诱导的对入侵者的保护作用可以通过肠道微生物群对肠道病原菌的定殖抗性来证明。这种抗性在小鼠体内通过直接机制(如细菌素的产生、短链脂肪酸(SCFA)的产生、胆汁酸的转化和VI型分泌系统的表达)和间接机制(宿主生理和免疫的调节)介导。
共生体也在体内与病原体竞争营养物质、获取金属和封存残余氧。最后,共生菌株(特别是大肠杆菌)的生物膜表型驱动了对占据类似生态位的相关分类群如:为肠聚集性大肠杆菌和肺炎克雷伯菌的定植抗性。
多微生物和跨生态位相互作用
与胃肠道表面相关的微生物群包含所有4个生命域(古细菌、原核生物和真核生物)和病毒。肠道生物膜内的细菌相互作用,并与人体细胞相互作用。这些跨“区域”的相互作用可能在维持消化系统健康方面起着重要作用,当这些体内平衡相互作用被破坏时,也可能在疾病中起着重要作用(称为失调)。
发生这种情况的机制在很大程度上虽然还不清楚,但是越来越清楚的是,这些微生物群与宿主的相互作用高度依赖于细菌群落作为生物膜结构的性质和空间组织。
随着测序技术的进步,微生物组成的变异在每个个体之间都可以观察到,在单个人体器官(如消化道)的景观中也可以观察到。利用显微镜和测序方法对小鼠和非人灵长类动物进行的研究表明,在不同的空间尺度和轴上,共生微生物群落确实在整个胃肠道的地理上是分层的。
最高的微生物密度通常出现在富含粘液的区域,靠近胃肠上皮和食物颗粒周围,在管腔中形成斑片状聚集体(下图)。因此,肠道生物膜利用形成凝胶的粘液层作为基质在活体中附着。
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
在微米尺度上,每个微生境都被混合类群的群落所占据,这些类群在物理上相互粘合。这个组织不太可能是随机的,尽管它的生物学重要性还不清楚。
总的来说,小鼠的生物地理学被认为受动态因素的控制,包括运动、粘液流量、胃肠道上皮细胞分泌、对宿主和食物颗粒的亲和力,以及微生物之间的生态相互作用。
粘膜相关微生物群的生物地理、组成和代谢活动也受到每日振荡的影响,这有助于使肠道生理在昼夜节律上同步。
现在,重要的工作仍然是精确描述整个胃肠道的微生物微生境,确定每个分类群在粘膜生物膜中的确切位置,以及更好地理解微生物生物地理学对肠道健康的生理贡献(下图)。
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
生物膜组分诱导宿主反应
肠道生物膜刺激独特的粘膜反应。宿主粘膜防御系统对肠道生物膜的每一个组成部分都有不同的识别和反应,即使这些分子可以隐藏在生物膜基质中。
在体内平衡的背景下,这些相互作用可能在培养宿主防御和塑造肠道生理学方面发挥重要作用。
多糖
生物膜基质可由参与多种结构和代谢功能的多糖家族组成。体外实验证明鼠伤寒生物膜以及其作为一个屏障,以防止非生产者的基质成分从进入已建立的生物膜。
植物乳杆菌Lactobacillus plantarum, ,伯克霍尔德菌Burkholderia cepacia和肠炎沙门氏菌亚种Salmonella enterica subsp分泌的多糖(也称为胞外多糖)。伤寒降低人和猪免疫细胞在体外的细胞因子产生并抑制趋化性和氧爆发反应和人类结肠组织外植体。 鉴定肠道生物膜在体内自然产生的多糖,并了解宿主对此类成分的反应,可能有助于开发新的疗法,以防止病原性生物膜在粘膜表面生长。
蛋白质
基质相关蛋白是体外生物膜基质的重要组成部分,其总生物量与多糖相当。它们具有结构功能,促进细菌扩散,保护宿主介质并参与细胞间的通讯。
作为生物膜生长的特定细菌的基质相关蛋白质组不同于同等浮游生物培养物的分泌体。例如,在生物膜中,毒力蛋白的表达上调,其表达谱在作为单一菌种生长的生物膜和带有白色念珠菌的多菌种生长的生物膜之间不同。
宿主对体内生物膜蛋白质组分的反应可分为先天性和适应性机制。天然反应和抗菌防御蛋白可通过激活甲酰肽受体介导,该受体可识别含有N-甲酰蛋氨酸衍生物的生物膜相关寡肽。
与同一病原体的浮游培养物相比,在生物膜的刺激下,对金黄色葡萄球菌的先天性和适应性免疫反应被证明是不同的,这在小鼠白细胞和兔子中得到了证实。这些研究表明,20种金黄色葡萄球菌生物膜特异性蛋白具有免疫原性,可引起特定的宿主反应。
有趣的是,一组微生物胞内蛋白(特别是核糖体蛋白、RNA聚合酶和精氨酸脱氨酶)包裹在体外生长的人肠道多微生物生物膜的生物膜基质中,也可以被肠上皮蛋白酶凝血酶切割。这一发现可能表明生物膜相关细菌利用宿主蛋白酶来切割包裹在生物膜基质中的微生物蛋白。
这种裂解的目的是激活还是降解微生物蛋白质还有待研究。然而,这一观察结果提供了一个潜在的基于蛋白质的生物膜——宿主信号传递的额外例子。
膜泡和疏水化合物
膜泡(也称为外膜泡)由细菌和古细菌释放,是其生物膜基质的重要组成部分。基质相关蛋白主要来源于膜囊泡,如铜绿假单胞菌生物膜。
膜泡的产生依赖于细菌的应激反应。膜泡在体内的假定生物学作用可能是保护分泌的细菌分子不被降解或充当抗菌剂的诱饵。与可溶性分子相比,铜绿假单胞菌膜泡在体外增强了人巨噬细胞的活化。
虽然在肠道生理学的背景下说明的不充分,但生物膜囊泡的研究有望增强我们对肠道生物膜成分对肠道内稳态的贡献的理解。生物膜基质中存在的其他疏水性化合物是糖脂和肽脂。
鼠李糖脂是一类糖脂表面活性剂(如粘蛋白和表面蛋白),存在于变形杆菌生物膜中。它们介导群菌(一种集体运动行为)并增加中的生物膜分散。葡萄球菌在体外产生的肽脂参与其生物膜表面的疏水性。这一过程有助于确定生物膜对环境分子的不可渗透性。
核酸
细胞外核酸在一些肠道相关菌属如大肠杆菌、柠檬酸杆菌、李斯特菌、肠球菌、链球菌、假单胞菌和奈瑟菌作为生物膜基质的结构支架发挥作用。它们促进水平基因转移,并有助于细菌粘附和聚集到表面。
铜绿假单胞菌生物膜基质细胞外DNA中的非甲基化胞嘧啶-磷酸鸟嘌呤(CpG)基序可触发人中性粒细胞TLR9的激活。体外实验证明,铜绿假单胞菌的胞外DNA与多糖结合形成阳离子受限的环境,以保护生物膜不被抗菌肽(AMPs)溶解。
致病性变形杆菌(P.aeruginosa和E.coli)分泌的RNA可通过膜泡到达宿主粘膜,抑制小鼠膀胱(尤其是尿路致病性E.coli)、人气道上皮细胞系和小鼠肺(尤其是P.aeruginosa)的免疫应答。
当一个细菌群落达到一个临界值时,细菌可以同步它们的新陈代谢,并参与类似群落的行为,形成生物膜。这种机制被称为群体感应。
群体感应由革兰氏阴性细菌中的两亲性小分子和革兰氏阳性细菌中的小肽介导。铜绿假单胞菌衍生的群体感应分子(例如,3-氧代-C12-HSL)可以改变免疫细胞和肺上皮及内皮细胞凋亡的体外细胞因子产生和趋化性。铜绿假单胞菌群体感应分子在肠道中的类似作用有待证实。相反,大肠杆菌通过群体感应途径识别肾上腺素和去甲肾上腺素等肠道激素。
阿片类物质(例如内啡肽和强啡肽)也能被小鼠体内的铜绿假单胞菌识别,并作为群体感应分子。有趣的是,去甲肾上腺素增强了短螺旋体粘附和附着于人类肠上皮细胞系的能力,这一特性可以解释人类体内肠螺旋体病期间结肠上皮上生物膜的形成。
其他几种肠道相关分类群,如:伤寒沙门菌Salmonella typhi,单核细胞增生李斯特菌Listeria monocytogenes,弗氏柠檬酸菌 Citrobacter freundii,阪崎肠杆菌Cronobacter sakazakii,粪肠球菌Enterococcus faecalis,幽门螺杆菌Helicobacter pylori,空肠弯曲杆菌Campylobacter jejuni,梭杆菌属Fusobacterium spp对人体肠道激素(如去甲肾上腺素)有反应,多巴胺和肾上腺素),直接影响动物模型的感染结果。
总之,宿主和肠道微生物生物膜之间通过群体感应途径存在着明显的跨生态位对话。未来对体内多微生物生物膜的研究将成为“微生物内分泌学”这一朝阳领域。
控制生物膜的宿主因素不仅取决于宿主的遗传和免疫状况,而且还取决于生物膜及其亚基因组的分类组成。宿主和/或微生物方面这种微妙平衡的改变可能是肠道疾病的主要驱动因素,并可能解释与许多肠道疾病相关的失调。
宿主-生物膜相互作用的相关因素:对肠道健康和疾病的贡献和意义

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
为了开发旨在恢复肠道内稳态的改良疗法,确定宿主组织控制粘膜表面肠道生物膜生长的因素和途径非常重要(下图)。

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
粘蛋白
粘蛋白是上皮杯状细胞分泌的一类高度糖基化的蛋白质。它们是覆盖在肠上皮上的粘液屏障的主要蛋白质成分。这种粘液层的组成和屏障特性在胃肠道的不同部分有所不同(图2)。
共生细菌和病原细菌已经进化出几种机制,使它们能够粘附在粘液上,并相互竞争,利用粘液作为有益的栖息地。空肠弯曲菌和霍乱弧菌等病原体利用粘蛋白作为信号,促进毒力因子的表达,并诱导形成生物膜。
在健康的远端结肠中,粘液层由内层组成,内层致密,无细菌,牢固地附着在上皮上。松散粘附的外层容纳了大多数细菌群落。粘液层可能更紧密地附着于生物膜群落而不是肠上皮本身。因此,体内肠道生物膜可定义为粘液包埋、粘液粘附的微生物聚集体。
胃肠道自然含有非溶粘液细菌的分类群。由于粘蛋白的消耗需要大量酶活性的组合,非溶粘液性肠道细菌将共同受益于多微生物生物膜生活方式的代谢特性。最后,人们普遍认为胃肠道中的粘蛋白层阻止病原体以及共生体到达和接触肠上皮细胞。
然而,粘液层的组成,厚度和粘弹性沿胃肠道变化很大。微生物聚集体和上皮之间的接触在上肠道和近端结肠中很常见。体外研究表明,胃源性粘蛋白通过诱导鞭毛运动引起铜绿假单胞菌生物膜的扩散。
下消化道粘蛋白(如MUC2)在肠道生物膜上的确切作用仍有待澄清。虽然粘蛋白在防止生物膜与粘膜表面接触方面的作用在结肠中已被明确确立,但这种粘蛋白也可能对生物膜内的细菌种类有特定(但尚未发现)的作用。
抗菌肽
AMPs是一类广泛分布于自然界的宿主防御肽。它们由真菌、昆虫、两栖动物、哺乳动物和原核生物产生。大多数AMP是阳离子的,这种性质有助于通过破坏膜、形成孔隙、渗透和抑制细菌细胞内分子和酶以及抑制细胞壁合成来杀死浮游细菌。
AMPs在体外对多种药耐药和临床分离的细菌群具有很强的抗生物膜活性。它们通过减少生物膜对表面的粘附力、杀死嵌入的细菌或直接干扰生物膜形成的代谢途径,在体外分散生物膜。
体内实验的研究表明,防御素(例如,人α-防御素6)可以形成称为“纳米网”的自聚合结构,然后可以捕获细菌并防止其与肠上皮细胞物理接触。
有趣的是,这种聚合可以通过不同于肠隐窝和绒毛顶部的氧化还原条件进行微调。总的来说,AMPs可以被认为是对抗有害生物膜的传统抗生素的良好替代品。
硫化氢
硫化氢(H2S)是胃肠道炎症、稳态和修复的介质。肠道共生菌群是H2S的主要来源,其中一些作为能量来源。
此外,一些报告表明,微生物产生的H2S(由硫酸盐还原细菌以及其他肠道菌株,如大肠杆菌、梭状芽孢杆菌和肠杆菌)具有遗传毒性,可能在大肠癌和溃疡性结肠炎的病理生理学中起作用。另外,H2S的局部作用也会对肠道组织产生一些有益的影响。例如,H2S抑制NF-κB的活化,具有抗氧化活性,并抑制caspase-3的裂解,从而限制凋亡。研究还表明,H2S可保护健康的远端结肠生物膜组织。
根据一项体外研究,表明大肠炎患者炎症发作中存在微生物群衍生的H2S 可能与结直肠癌的发生有关。结肠上皮本身也通过胱硫醚-β-合酶、胱硫醚-γ-裂解酶(CSE)和3-巯基丙酮酸硫转移酶产生H2S。
结肠内源性H2S生成已被证明有助于促进健康结肠微生物群生物膜的形成和粘液屏障功能。在结肠炎期间将释放H2S的化合物直接注入小鼠结肠可促进粘液的正常产生并恢复健康的微生物群生物膜。
有趣的是,大蒜中富含H2S的膳食化合物在体外对各种病原体(如伤寒杆菌、金黄色葡萄球菌、恶性疟原虫、布氏锥虫和白色念珠菌)具有抗菌、抗真菌和抗寄生虫的特性。
此外,一种释放H2S的抗炎药(Antibe therapeuticals)可降低IBD患者体内生物膜的毒性。然而,如果要在人类身上实现基于H2S的疗法的转化应用,还需要进一步研究H2S在生理肠道生物膜上的确切作用。
免疫球蛋白
肠腔分泌免疫球蛋白(特别是IgA)和微生物毒素并包裹细菌,防止其粘附在上皮细胞上。高亲和力IgA涂层表明炎症细菌的一个亚群,其侵入粘液层的能力增强,激活炎症小体途径,从而导致肠道疾病,如IBD。由于许多其他肠道相关细菌在其生物膜基质(例如,大肠杆菌和铜绿假单胞菌)中产生卷曲或卷曲样淀粉样蛋白,这种新的生物膜特异性免疫疗法有可能应用于多种致病性生物膜。
虽然细菌的生长通常受到IgA涂层的损害,但在体外,共生微生物可以被IgA涂层,而不会对其生长产生实质性的改变。事实上,IgA可以促进肠道内的微生物定植,因为肠道细菌(大肠杆菌和幽门螺杆菌)表达识别IgA糖蛋白基因的受体。IgA与这些表面受体的结合确实可以促进细菌与宿主表面的初始粘附,例如在牙菌斑生物膜中。
肠道上皮细胞表面的肠道生物膜形成(如人类细胞系单层所示)也通过向环境中添加分泌性IgA(但不是通过添加IgG)来帮助。相反,体外生物膜的形成是由IgA特异性蛋白酶阻止的。
因此,免疫球蛋白可以对肠道生物膜发挥免疫排斥和免疫包容功能。它们可以促进肠腔中的生物膜表型,同时防止浮游元素或最终生物膜分散元素侵入粘液层,接触并穿过上皮屏障。
蛋白酶体
存在于肠腔中的真核蛋白酶,例如从丝光绿蝇蛆中提取的糜蛋白酶,对细菌生物膜的形成具有负面影响。有趣的是,宿主胰蛋白酶样蛋白酶在小鼠泌尿道传播粪肠球菌生物膜的形成。
通过体内方法(小鼠模型)和体外人体肠道微生物群生物膜培养,上皮凝血酶被确定为结肠粘膜表面内稳态生物膜抑制的关键因子。以生物膜的基质相关蛋白骨架为靶点,例如通过蛋白酶引起的酶解,似乎是一种很有希望的方法来控制或根除医学和宿主表面的生物膜。
有趣的是,肠杆菌科如铜绿假单胞菌和大肠杆菌可以释放其生物膜基质中的蛋白酶抑制剂ecotin,以保护其免受中性粒细胞弹性蛋白酶的溶解。胃肠道含有多种来源的蛋白酶,其中许多蛋白酶的产生和活性在疾病条件下发生改变。
肠道生物膜有什么临床意义?
生物膜相关感染的临床相关性很重要,因为人体内绝大多数持续性感染源于生物膜。生物膜特征的改变与IBD、癌症和传染病有关,并与分类组成的改变、生物地理分布、抗生素耐受性或耐药性以及生物膜分散的病理生物出现有关。
生物膜是肠道微生物的一种自然生活方式,不一定是疾病的标志物,因此未来的治疗方向可能侧重于恢复宿主生物膜稳态,而不一定消除粘膜表面的生物膜。由于整个胃肠道的生物膜组织可能会有所不同,因此这些方法也需要区域特异性。
微生物生物膜群落有助于维持整个胃肠道内各个方面的稳态。然而,在某些临床情况下,这些生物膜需要保存或修复时破坏,而在其他上皮附着生物膜可能需要根除。因此,在尝试开发治疗性生物膜特异性控制策略方面花费了巨大的研究努力
胃肠道管腔化合物、生物膜和宿主之间的相互作用是复杂的,需要在健康和疾病方面加以考虑。
生物膜可以以多种不同的方式管理胃肠道管腔化合物。管腔化合物,无论是微生物、饮食分子、污染物还是外源性物质,都可以自由扩散穿过生物膜并到达宿主上皮细胞,或者被生物膜阻断,生物膜起着严密的屏障作用。这些管腔化合物也可以通过生物膜过滤,生物膜只允许某些分子通过,从而起到选择性过滤的作用。
消化过程中产生的一些饮食分子、外源物质或污染物也可以通过生物膜工厂进行化学转化(下图),然后产生新的化合物,释放到宿主细胞附近。这些转化生物膜的化合物对宿主是有益还是有害,当然取决于生物膜的组成及其代谢。
最后,宿主和生物膜可能相互竞争的管腔化合物。因为生物膜与管腔的内容物接触更紧密,它可能比宿主有优势。然而,在上消化道,上皮的某些区域似乎与管腔化合物密切接触。

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
综上所述,可以合理地认为,根据生物膜的组成,更重要的是根据生物膜的代谢,宿主识别的管腔化合物可能具有不同的性质和不同的浓度。当这些分子来源于健康的生态稳定的生物膜时,它们可能是有益的;当它们来源于不健康的不稳定的生物膜时,它们可能是有害的。因此,综合了解生物膜的组成、代谢活性及其空间分布具有重要意义。
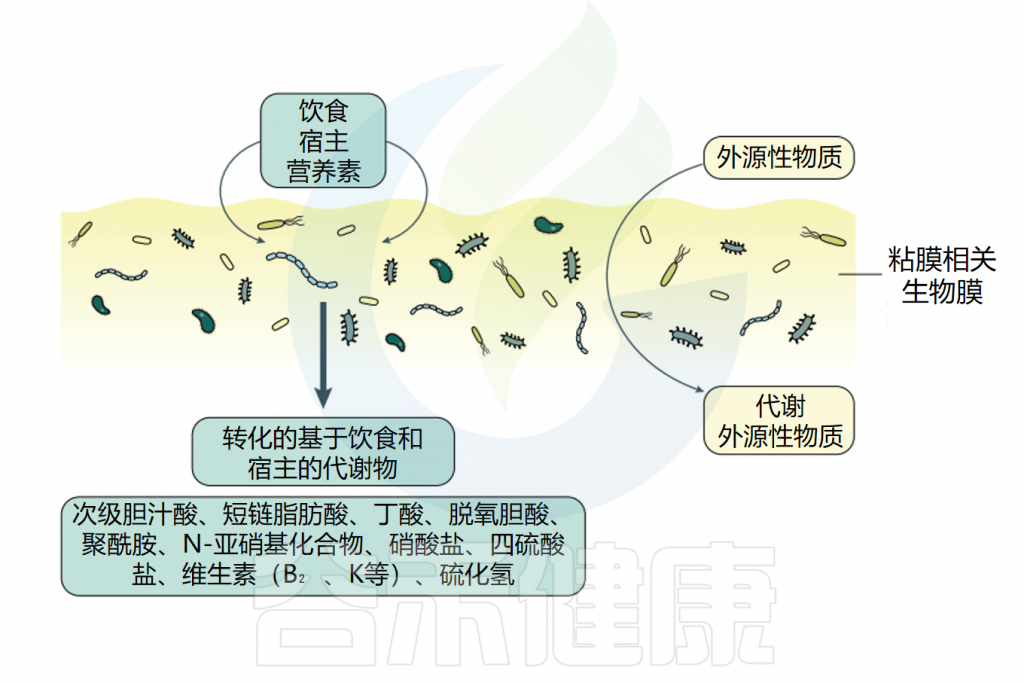
结肠可被视为一个中央发酵器官,参与消化残渣的发生和加工。肠道微生物群可以改变几乎所有种类的膳食化合物,包括复杂的多糖、脂类、蛋白质和植物化学物质(图5)。早期观察表明,在粪便中心、粘液-粪便界面和食物颗粒附着的微生物群落上,细菌的生长存在差异。这些研究为生物膜表型对微生物结肠发酵的贡献提供了有用的信息。
肠道生物膜对未消化碳水化合物复合物(如饮食中的碳水化合物复合物以及与粘蛋白相关的碳水化合物复合物)的代谢可导致SCFA的产生,主要是乙酸盐、丙酸盐和丁酸盐。SCFAs的其他来源是氨基酸,如缬氨酸、亮氨酸和异亮氨酸,它们是由蛋白质分解产生的。
SCFAs在肠道中的生物学作用是多方面的:它们可以作为肠上皮的能量来源,有助于降低肠腔pH值,直接抑制病原菌的生长,促进T调节细胞的分化,改善上皮紧密连接的完整性。有趣的是,在喂食不同纤维来源的模型猪的肠腔中,SCFA的浓度从结肠的近端到远端减少。这一观察结果有些令人惊讶,因为远端结肠的细菌密度高于近端结肠。
生物膜表型为细胞在其环境中代谢氨基酸提供了有利条件,这一特性已在工业生物技术过程中得到利用。蛋白质的微生物代谢可导致最终产物的形成,如多胺(来自精氨酸、赖氨酸、酪氨酸或组氨酸)、H2S(来自蛋氨酸和半胱氨酸)、酚类和吲哚类化合物(来自色氨酸),以及N-亚硝基化合物(亚硝胺和亚硝胺)的产生,它们是动物模型中肠道肿瘤的有效诱导物。
维生素B12(一种用于DNA合成、脂肪酸和氨基酸代谢的关键维生素)和维生素K(一种用于合成凝血级联蛋白酶的关键维生素)是由肠道微生物群落中一小部分分类群合成的。假单胞菌属合成维生素B12的所有维生素体(也称为钴胺素),包括氰钴胺、羟基钴胺素、腺苷钴胺素和甲基钴胺素。
假单胞菌还利用维生素B12在生物膜形成过程中通过氧依赖途径合成蛋氨酸和核糖核苷酸。因此,在人类IBD中观察到的维生素B12的可利用性降低可以部分解释为在炎症过程中蛋白细菌的粘膜丰度增加和氧张力的改变。
维生素K缺乏症在接受大剂量抗生素治疗的人中发生得很快,这种缺乏症与严重的胃肠道损伤(出血和溃疡)有关。枯草芽孢杆菌的生物膜表型有利于体外特定的发酵途径,显著提高维生素k的产量。尽管生物膜对止血和粘膜组织本身的生理学至关重要,但生物膜表型对维生素K产生的贡献仍有待阐明。
治疗药物可改变动物模型和人类肠道微生物群的组成,但肠道微生物群本身也参与药物加工。尽管宿主的新陈代谢通常会将外源物质从体内清除,但肠道微生物可以将这些化合物用作营养和能源。
肠道微生物群确实可以直接代谢外源性物质(例如,胺碘酮、他克莫司、地高辛等),从而改变其化学性质、稳定性、生物利用度和潜在的生物效应。因此,由微生物群驱动的外源性物质加工可能会导致不必要的不良反应,导致分子失效,或相反地导致更具活性和效率的分子。这一观察结果对人类使用药物的建议和剂量提出了严重的问题,特别是考虑到其中一些药物由于毒性而必须仔细监测。
越来越清楚的是,肠道微生物群的代谢谱比人类细胞的代谢谱要大。不幸的是,在绝大多数情况下,具体的微生物或微生物群落,以及介导这些反应的酶,都是未知的。此外,胃肠道内的不同生境可导致不同的分类组成以及不同的代谢过程。这一观察结果增加了试图解决微生物群对外源或药物加工的影响的复杂性。
生物膜生活方式在地球上的每一个自然栖息地中都占主导地位,包括胃肠道表面。然而,生物膜在医学上的概念只有50年的历史,不仅应被视为一种病理性慢性感染,而且应被视为一种生活在粘膜表面的微生物的普通生活方式。
微生物生物膜是许多肠道疾病病理生理学的核心,但它们也是肠道稳态发育的关键因素。肠道生物膜的调节可能是新疗法的关键。
我们需要将微生物生态学的重要概念转化为我们目前对肠道生理和宿主-微生物群相互作用的看法。这些概念包括微生物群稳定性、复原力和微生物生物地理学,并要求我们确定它们如何影响胃肠健康。有机会使用生物膜的代谢能力超过浮游生物培养中所描述的,以帮助代谢外来的优势。
未来的研究将有助于更好地了解肠道粘膜生境中多微生物的多样性和复杂性。这一认识构成了开发更好的肠道疾病生物标志物和治疗方法的必要步骤。
为了迎接这一挑战,我们将受益于跨学科的合作,不仅是微生物学家、生理学家和临床医生之间的合作,而且还将受益于与生物物理学家开发临床相关的生物膜模型,生物信息学家分析大数据集,以及微生物生态学家的理论框架来理解这样一个异常复杂的栖息地。
相关阅读:
参考文献:
Motta Jean-Paul,Wallace John L,Buret André G et al. Gastrointestinal biofilms in health and disease.[J] .Nat Rev Gastroenterol Hepatol, 2021
Tomkovich, S. et al. Human colon mucosal biofilms and murine host communicate via altered mRNA and microRNA expression during cancer. mSystems 5, e00451-19 (2020).
Raffatellu, M. Learning from bacterial competition in the host to develop antimicrobials. Nat. Med. 24, 1097–1103 (2018)
Zmora, N. et al. Personalized gut mucosal colonization resistance to empiric probiotics is associated with unique host and microbiome features. Cell 174, 1388–1405. (2018)
Rumbaugh, K. P. & Sauer, K. Biofilm dispersion. Nat. Rev. Microbiol. 10, 571–586 (2020)
Guilhen, C. et al. Colonization and immune modulation properties of Klebsiella pneumoniae biofilm-dispersed cells. NPJ Biofilms Microbiomes 5, 25 (2019).
Jalili-Firoozinezhad, S. et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nat. Biomed. Eng. 3, 520–531 (2019).

谷禾健康
S. pneumoniae (or pneumococcus,肺炎链球菌)是中耳炎、细菌性脑膜炎、败血症和社区获得性肺炎的主要病因。世卫组织将肺炎链球菌列为一种抗生素耐药的“优先病原体”。
肺炎链球菌是下呼吸道感染的主要原因之一,每年在全世界造成近100万儿童死亡。肺炎链球菌在人类宿主中占据不同的生态位,导致共生和致病性存在。侵袭性肺炎链球菌疾病是一个多步骤的过程。它是通过肺炎链球菌渗透进入富含糖的粘液层,然后粘附到人鼻咽的上皮细胞层而引发的。通常,微生物在鼻咽中定殖较长时间而不会引起疾病。
另外,由于未知的原因,它可以扩散到中耳,肺,大脑或血液中。直接从鼻咽或最经常通过肺部进入血液,可以进入中枢神经系统,心脏和脾脏。在所有这些组织中,肺炎链球菌都受到免疫系统和各种环境条件的攻击。

刚刚,来自美国宾夕法尼亚州匹兹堡卡内基梅隆大学生物科学系的一篇综合评论文章题为:“The pneumococcal social network” 综合阐述了人类致病菌肺炎链球菌分泌肽的机制和功能特点。讨论了三大类小肽的序列特征、转运机制和受体:双甘氨酸肽、Rap、RGG、NprR、PlcR和PRGX(RRNPP)结合肽,以及含羊毛硫氨酸的小肽。强调影响携带和致病的因素,特别是遗传多样性、微生物竞争、生物膜发育和环境适应。
注:羊毛硫氨酸是一类结构独特的肽类,因其序列中含有羊毛硫类非常规氨基酸而得名。
革兰氏阳性细菌使用一系列分泌肽来控制种群水平的行为,以响应环境提示。最近肺炎链球菌多肽研究的扩展揭示了一个相互作用的信号系统的复杂网络,其中多个多肽被整合到同一信号通路中,允许多个进入该通路的点,并向新的方向扩展信息内容。
此外,由于多肽存在于细胞外环境中,因此存在串扰、群体感应(QS)以及株内、株间和种间相互作用的机会。关于人群行为导致疾病的方式的知识为设计和开发抗感染策略提供了一条途径。
社会行为在生物体内广泛存在。蚁群的形成、蝗虫的协调运动和鱼类的浅水化都是复杂的社会行为例子。这些行为通过保护人们免受捕食、增加食物供应或比竞争对手具有战略优势而受益。细菌也不例外。
细菌执行群体感应(QS):细胞密度相关的信号传导,导致群体水平的反应。QS的早期证明是在海洋细菌fischeri弧菌中,高细胞密度诱导生物发光,这是细菌与鱿鱼共生关系的一部分。从那时起,细菌群的行为就被牵涉到细胞过程中,比如基因转移、运动、抗生素的产生和生物膜的形成。
细胞-细胞间的通讯是由供体细胞分泌到细胞外环境中的信号分子来协调的,并由产生细胞和邻近细胞感应到。感知导致基因表达的变化,最终触发同步的群体行为。这种细胞-细胞通讯的核心是通过自体诱导剂-2(AI-2)和肽发出信号。
肺炎链球菌细胞-细胞通信系统可根据肽序列、转运蛋白和受体分为3大类(图1)。这些是(1)双甘氨酸肽,(2)与QS蛋白RRNPP超家族相关的肽,(3)含羊毛硫氨酸肽。从它们的作用来看,肽介导的细胞-细胞通信系统至少履行了三个主要功能:确保遗传多样性、微生物竞争和环境适应。
图1 肺炎链球菌分泌肽的三大类示意图
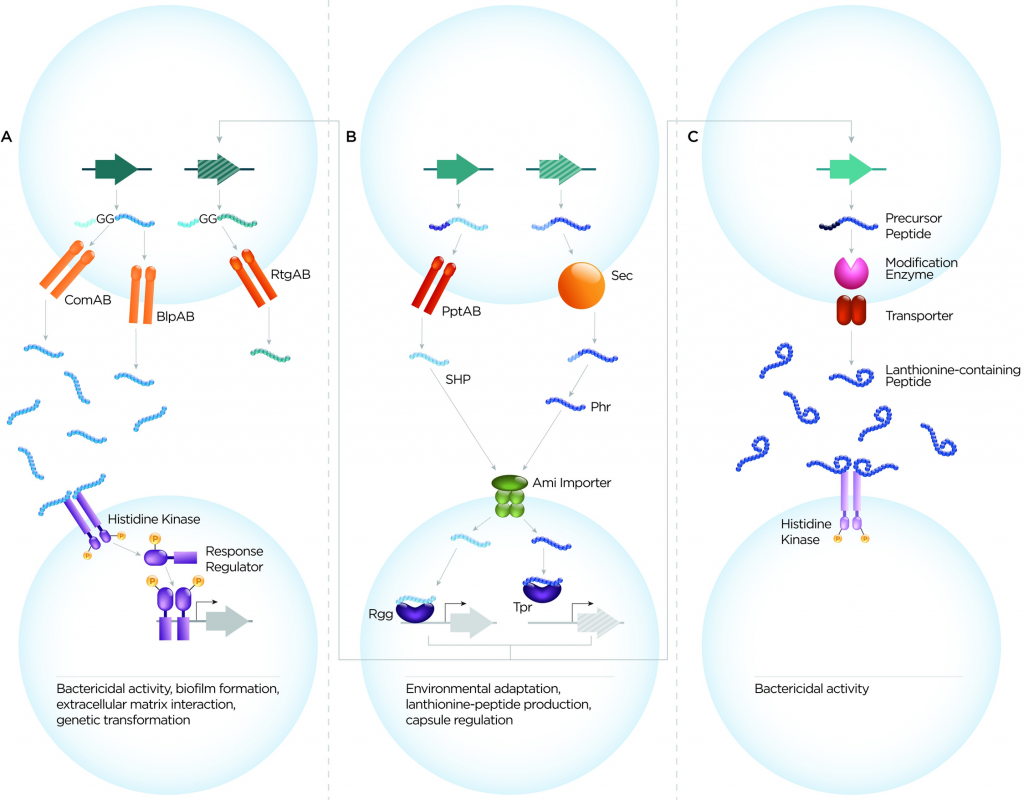

双甘氨酸肽
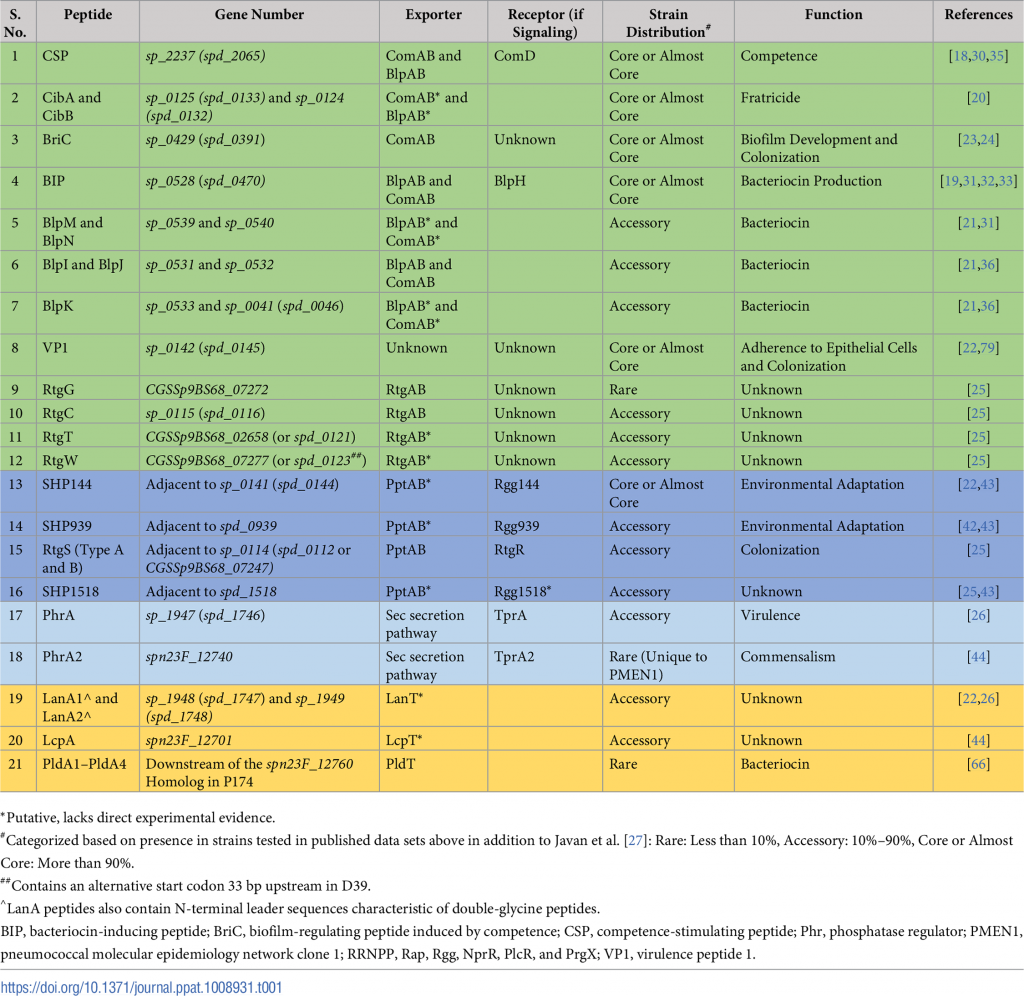
最具特征的肺炎链球菌双甘氨酸肽是能力刺激肽(CSP)。其他例子包括细菌素诱导肽(BIP)、感受态诱导细菌素(Ciba和CibB)、细菌素免疫区的肽(BIR)、毒力肽1(VP1)、感受态诱导的生物膜调节肽(BRIC)、RTG位点的肽和LANA(表1)。此外,比较基因组学方法已经揭示了额外的双甘氨酸肽,这些多肽还有待鉴定。
表1:核糖体合成肽在肺炎链球菌中的实验研究

双甘氨酸肽的特征是保守的N末端前导序列,该序列终止于Gly–Gly残基(或更常见于Gly–Ala或Gly–Ser)。前导将这些肽引导至含有肽酶的ATP结合盒(ABC)转运蛋白(具有C39肽酶结构域),其可切割前导序列并将肽输出到细胞外。 CSP和BIP的基因座分别编码同源的输出蛋白ComAB和BlpAB。移码突变使BlpAB在大约60%的菌株中失去功能。
QS蛋白的RRNPP超家族的肽
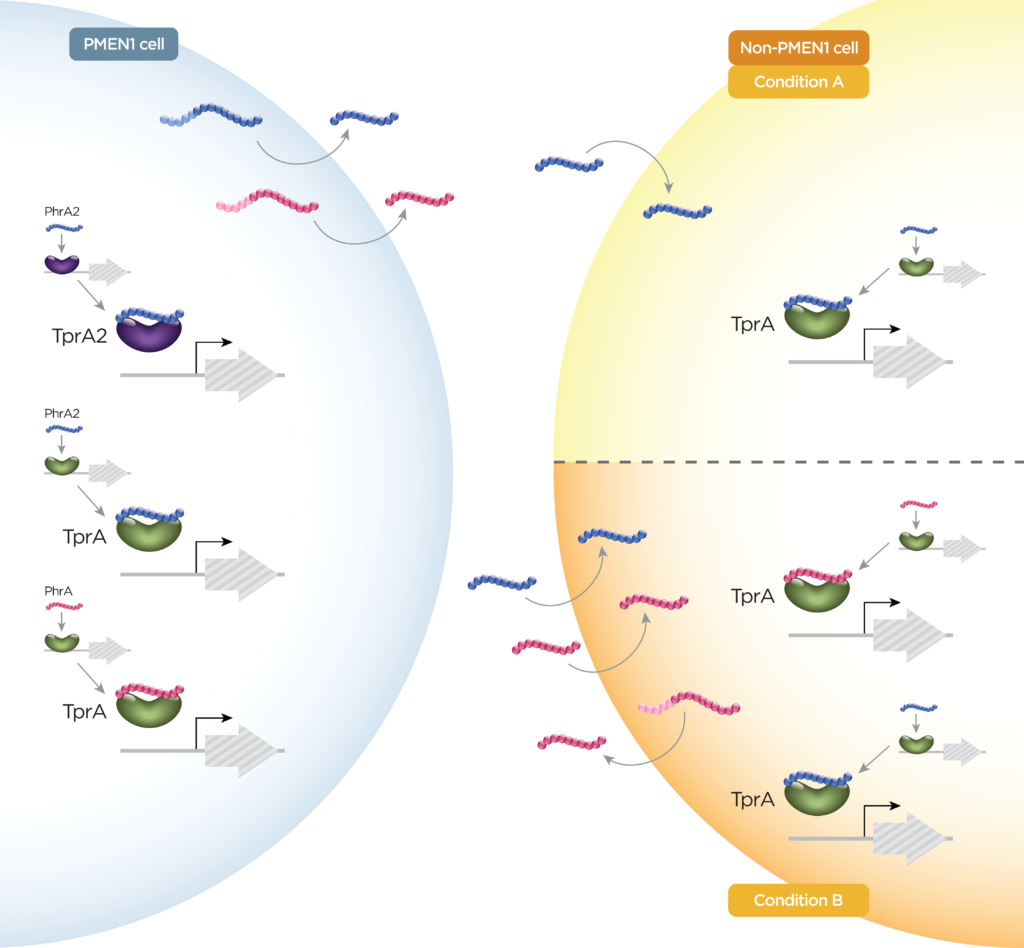
该组中的肽通过与它们的同源细胞质转录因子直接相互作用而发出信号,它们是RRNPP超家族的成员(图1B)。如前所述,这些肽可以基于多种序列特征进行分类。在肺炎链球菌中,已经鉴定了短疏水肽(SHP)SHP144,SHP939,SHP1518和RtgS,以及磷酸酶调节剂(Phr)肽PhrA和PhrA2。
在整个链球菌中,糖基转移酶(Rgg)蛋白质的调节基因与它们的同源SHP结合后被激活,后者通常在rgg基因附近编码。 SHP仅在出口后才有活性,这是由通常短于35个残基的前体多肽加工而成的。尚未在肺炎链球菌中研究加工蛋白酶,但在其他链球菌物种中,膜结合金属蛋白酶(Eep)有助于加工。
多种链球菌物种通过ABC转运蛋白PptAB出口SHP,其粪便肠球菌的同源物出口性信息素。在缺乏已知靶序列的情况下,将SHP引导至其转运蛋白的机制仍不清楚。成熟的肽通过寡肽渗透酶系统重新导入细胞,在那里它们与同源的Rgg调节剂相互作用,从而改变细胞的转录状态。
在肺炎链球菌中,RtgS是唯一显示其前体肽由PptAB出口并由Ami寡肽进口商AmiACDEF内化的SHP。鉴于PptAB在物种间的广泛功能,其他肺炎链球菌SHP可能利用相同的机制进行进出口。
含羊毛硫氨酸肽类
这是由革兰氏阳性细菌产生的一族小肽(19-38个氨基酸),具有各种结构和功能。这些是环状肽,其特征是翻译后修饰,导致硫醚氨基酸、羊毛硫氨酸和甲基羊毛硫氨酸的引入(图1C)。当前肽中的丝氨酸或苏氨酸残基脱水并与半胱氨酸硫醇连接时,它们的特征结构由LanM修饰酶形成。该肽通过专用的LanT转运蛋白输出。许多含羊毛硫氨酸的肽形成细菌素的两大类中的一种。
这些肽被称为羊毛硫氨酸抗生素或羊毛硫氨酸的抗生素。用于加工羊毛硫氨酸的肽,修饰酶,免疫蛋白和转运蛋白的基因通常以簇的形式组织。肺炎链球菌中有许多这样的簇。其中,已经研究了与Tpr / Phr和肺炎链球菌素簇相关的瘦肽。
肺炎链球菌肽介导的细胞-细胞通讯系统提供多种功能,而不是相互排斥。细胞-细胞通信系统可以被概念化为控制种群水平结构和行为的电路。
许多细胞-细胞通讯回路对不同的环境刺激作出反应,如菌群密度、营养状况、pH值、氧气供应和抗生素压力。来自细胞-细胞通讯系统的信号在群体水平的变化中表现为聚合。这些可能会影响生物膜的发育或与细胞表面成分的改变有关,如膜成分和胶囊表达。
细胞-细胞通讯系统的行为也可能伴随着DNA摄取、自残或杀菌能力的改变。这些生理变化可能改变细胞获得抗生素抗性基因的倾向,并影响疫苗逃逸株的出现。
此外,细胞间通讯系统还可以调节宿主基质的降解、生物膜的发育和营养吸收能力。因此,这些特性共同影响致病潜能、抗生素耐药性和对疫苗的反应。
调节群体反应的能力为肺炎链球菌细胞提供了相对于居住在鼻咽的其他微生物物种的竞争优势。细胞间的通讯系统使微生物能够改变其转录模式,以获得合适的表型,从而优化种群水平的适应性。它能在DNA水平和转录水平上引入多样性,从而能够长期维持鼻咽部的共生生活方式,在无症状时期,肺炎链球菌在高度可变的生物膜中被发现。
此外,一般来说,“转录适应”不仅有助于在动态的鼻咽中存活,而且在感染期间微生物从一个宿主生态位迁移到另一个宿主生态位时也能促进存活。
当检测到CSP,双甘氨酸肽家族的典型代表就会被激活。肺炎链球菌泛基因组拥有comC的6个不同等位基因,其中大多数菌株编码2个等位基因变体中的1个。在混合种群中,能力不仅在空间上局限于生物膜内的某个区域;信号可能局限于单个的信息类型(框1)。CSP是由高细胞密度、pH值增加、氧利用率和抗生素压力等因素引起的。
除了在环境中扩散外,CSP还通过其他机制(包括自分泌信号和细胞-细胞接触)向邻近细胞发出信号。激活会导致一个菌株的10%的基因发生转录变化。最典型的反应是激活转化机制,允许通过重组将外源DNA纳入,并且在这样做的过程中,通过等位基因的交换和基因拥有量的变化来促进遗传多样性的产生(图2)。
全基因组内遗传物质的交换测试了新颖的遗传组合,其中单个等位基因或基因片段已经克服了通过选择修剪的问题。
图2 多个双甘氨酸肽的分级活化
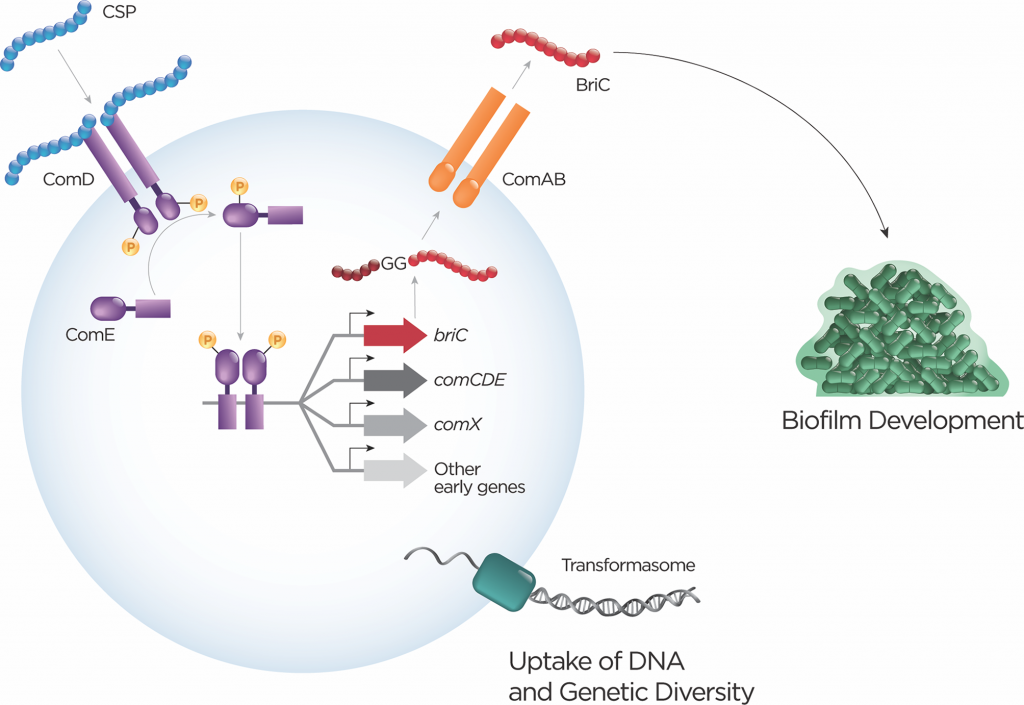

种内和种间竞争是呼吸道肺炎链球菌生活方式的一部分。杀菌活性通过双甘氨酸和羊毛硫氨酸的肽家族中的小分子产生。限制竞争者生长的能力对于细菌定殖很重要。此外,受害者可能成为DNA的来源,增加了进化的可能性。
能力激活导致许多这些效应分子的产生,包括CibAB和BIR基因座。双甘氨酸肽CibAB引发异源分解或反式裂解,并以细胞接触依赖性方式负责非功能细胞的裂解。与乳酸乳球菌IFPL105相似,据信这种杀微生物剂是通过将细菌素插入敏感细胞的膜中而导致其细胞能量消耗而产生的。
此后,细胞壁水解酶(包括自溶素LytA,溶菌酶LytC和莫林蛋白酶水解酶CbpD)的作用引起裂解。跨膜肽CibC保护细胞免受CibAB的同素分解作用。 CibAB从非感受态细胞释放的营养物质和DNA可能会使攻击细胞受益。在定殖的鼠模型中,CibAB诱导的同素分解作用使常驻菌株具有通过入侵菌株抵抗竞争和定殖的能力。
IR编码多种效应基因,赋予其抑菌作用或抑制作用的免疫力。 BIR基因座是同系的,但细菌素(假定的和特征的)和免疫蛋白在不同菌株之间差异很大。blpIJ,blpMN和blpK的产品已证实具有杀菌活性。这些是双甘氨酸肽,由BlpAB输出,并与同源免疫蛋白共转录。所有这些肽都显示出菌株间的活性,并且在体内,BlpMN和BlpIJ细菌素在定植过程中提供了比免疫缺陷型菌株更具竞争优势的菌株。
除肺炎链球菌外,细菌素基因座的表达还抑制了一些其他革兰氏阳性细菌,包括化脓性链球菌,链球菌性微生物,口腔链球菌和乳酸乳球菌,但不抑制其他细菌,例如变形链球菌,粪肠球菌或单核细胞增生李斯特菌。
BIR基因座的表达是由BIP诱导的,BIP由blpC和BIR的上游编码。与CSP相似,BIP结合膜结合的组氨酸激酶(B1pH),并且在肽及其受体之间具有特异性。这种特异性限制了竞争性表型之间的串扰。与能力途径的激活相似,BIP的表达是由抗生素诱导的,并且会增加pH值。而且,在能力和细菌素系统之间存在串扰,其中BIP的产生是在CSP刺激后诱导的。
另一类细菌素是羊毛硫氨酸的肽,其特征是肺炎链球菌素(pld)。pld基因座在肺炎链球菌分离株中很少见,其特征是有4个串联推定的短肽同源物(PldA1-PldA4)。这4种肽中的3种PldA1-3对细胞的杀菌活性是必需的,而第4种肽PldA4对于该表型是必不可少的。
除具有杀菌特性外,肺炎链球菌素(PldA1-3)还可作为自动诱导信号肽,通过位点(pldK)中编码的组氨酸激酶进行信号传导,从而激活pld位点。免疫是由邻近的ABC运输商PldFE授予的。这些肽的信号传导和杀菌作用是相互联系的:当Pld肽的信号传导低时,PldA2不会诱导细菌抑制作用。另外,肺炎链球菌素在小鼠定植过程中为肺炎链球菌菌株提供了竞争优势。
最后,全面的比较基因组筛选揭示了许多其他肽,它们在肺炎链球菌菌株之间分布不同(从稀有到核心),而且是肺炎链球菌特有的或在链球菌种之间共有。许多细胞与推定的转运蛋白,修饰蛋白或免疫蛋白一起组织成操纵子。肺炎链球菌菌株和相关物种内的多样性分布与种内和种间微生物竞争中的作用一致。
肺炎链球菌有一个细胞间通信系统网络,可调节其对宿主环境的适应性。肺炎链球菌只能使用糖来产生其代谢能。此外,糖被用于胶囊生产和信号传递。此外,通过磷酸转移酶系统(PTS)转运糖可以触发磷酸化依赖性信号通路。此外,宿主糖的降解不仅是营养的来源,而且还是宿主粘附,定植和致病性的主要因素。
几种细胞间通讯肽的表达对宿主碳水化合物的水平有反应:甘露糖和半乳糖诱导SHP144和SHP939,半乳糖诱导PhrA。另外,这些肽以及PhrA2和VP1在丰富的培养基中被阻遏。Rgg144 / SHP144系统是核心。当自诱导肽SHP144导入细胞并结合Rgg144时,它被激活。Rgg144受主要营养调节剂CodY和谷氨酰胺/谷氨酸代谢的负面控制。
SHP939是一种正向调节Rgg939的自诱导肽。该系统是辅助基因组的一部分。 Rgg939 / SHP939调控的基因多样性随环境条件的变化而变化,当在甘露糖上生长时具有广泛的调节子,而在半乳糖中则具有有限的调节子。
Rgg系统并非孤立运行,而是看起来形成了一个连接的网络。因此,为了最大程度地诱导SHP144和SHP939,需要存在非同源Rgg调节剂。此外,Rgg1518控制其邻近基因座(SPD_1513–1517),这些基因也受Rgg144和Rgg939调控。这种串扰可能会超出物种的范围。 SHP939的序列与化脓性链球菌中发现的SHP3的序列相同,无乳链球菌和米氏链球菌中的SHP序列相差1个残基。SHP序列的相似性可能使肺炎链球菌Rgg系统受到其他常驻细菌的影响。
类似于TprA / PhrA,PhrA2与TprA2相互作用,导致TprA2调节子的阻遏并诱导紧靠下游的羊毛硫氨酸肽(LcpA)的表达。有证据表明TprA2 / PhrA2与TprA / PhrA系统之间存在单向串扰(图3)。
图3 如PhrA和PhrA2所示的肽串扰示例
肺炎链球菌所编码肽的多样性凸显了群落水平表型在引入遗传多样性、微生物竞争和环境适应方面的重要性。一些研究证实了细胞间通讯在肺炎链球菌毒力中的作用。需要更多的研究来绘制这些系统在感染过程中的时空表达。
上呼吸道是许多细菌物种的常住栖息地。为了在宿主环境中立足,肺炎链球菌细胞必须在竞争中生存并抵抗住其他寄居物种的挑战。肺炎链球菌产生大量的肽,直接或间接地通过激活下游分子(例如,由CSP激活CibAB或CbpD)介导杀菌活性。虽然其中一些细菌素已被鉴定,但许多假定细菌素有待功能鉴定,尤其是在目标菌株/物种和刺激其合成的环境条件下。
多种肺炎链球菌肽与生物膜形成有关,包括CSP、BriC和VP1。生物膜在运输和疾病中起着关键作用。载体包括一种生物膜生长模式,它本身能够实现局部细胞-细胞通讯(通过肽和AI-2)和吸收生物膜基质中提供的DNA。
此外,生物膜为表型异质性提供了一个平台,这是一个未被充分研究的课题,可能有助于肺炎链球菌适应慢性感染和适应宿主生态位。生物膜促进发病。它们不仅是细菌传播的场所,而且从生物膜中传播的细菌比它们的生物膜或浮游生物具有更强的毒性。
综上所述,肺炎链球菌信号肽和生物膜紧密相连:生物膜中的局部环境可能促进细胞-细胞通讯的条件,而肽会影响生物膜的发育和向其他组织和新宿主的扩散。
肽对调控网络的控制使肺炎链球菌不仅在单个细胞水平上,而且在整个群体水平上对其环境作出快速反应。系统间的串扰和由多个肽对一条通路的调节使不同的信号得以整合,可能会增加反应的动态性和复杂性。研究表明,多链肺炎链球菌共定植是一种相对常见的现象,突出了跨菌株肽交换的重要性。PhrA2和PhrA存在串扰(图3)。
来自同一家族或不同家族的肽可以在同一途径中发出信号。例如,通过CSP的信号转导可诱导多个双甘氨酸蛋白,而SHP144诱导VP1(一种双甘氨酸肽)的水平。这种肽激活的层次结构描述了生物途径激活的多个入口点的存在。这表明这些途径的激活是严格控制的,代表了相关但不同的可能性。
一种可能性是,不同的信号组合允许诱导整个通路或通路的一部分,提供与反应相关的类型、幅度和代谢成本的粒度。或者,当遇到合适的条件时,细胞可以激活肽信号,为诱导下游通路做好准备。
抗生素耐药性是一个全球性的公共卫生问题,因此迫切需要开发有效的抗感染药物。非抗生素抗感染药物有望减少抗生素耐药性的出现。开发破坏细胞-细胞通讯的化合物的不同策略包括抑制信号产生、信号降解或阻断信号转导。在化脓链球菌和其他一些链球菌中,化合物的使用会破坏Rgg/SHP信号传导,从而破坏生物膜的形成。在肺炎链球菌中,使用竞争性类似物可以抑制能力发展和水平基因转移。此外,以可溶性LMIP形式靶向PhrA肽的抗感染药物可降低肺炎链球菌介导的小鼠发病率。不同的抗感染药物是如何影响细菌适应度和促进耐药性发展的,还有待检验。肺炎链球菌细胞间通讯系统的多样性为探索不同的可能性提供了许多机会。对肺炎链球菌群体水平表型的研究为开发新的抗感染靶向肽介导系统以及这些系统调控的途径提供了机会。
参考文献:
Aggarwal SD, Yesilkaya H, Dawid S, Hiller NL (2020) Thepneumococcal social network. PLoS Pathog 16(10): e1008931.
Bassler BL. Small talk: Cell-to-cell communication in bacteria.Cell. 2002;109:421–424. pmid:12086599
Slager J, Kjos M, Attaiech L, Veening JW. Antibiotic-inducedreplication stress triggers bacterial competence by increasing gene dosage nearthe origin. Cell. 2014;157:395–406. pmid:24725406
Miller EL, Evans BA, Cornejo OE, Roberts IS, Rozen DE. Pherotypepolymorphism in Streptococcus pneumoniae has no obvious effects on populationstructure and recombination. Genome Biol Evol. 2017;9:2546–2559. pmid:28992304
Junges R, Sturød K, Salvadori G, Åmdal HA, Chen T, Petersen FC.Characterization of a signaling system in Streptococcus mitis that mediatesinterspecies communication with Streptococcus pneumoniae. Appl EnvironMicrobiol Microbiol. 2019;85:e02297–e02218. pmid:30389765