-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
胃肠道是众多微生物的栖息地,这些微生物既相互关联又各具特点。部分微生物以自由漂浮的形式存在于管腔中,另一些则聚集和吸附在粘膜或组织表面形成生物膜这一结构。
胃肠道生物膜是基质封闭、高度异质性和空间组织化的多微生物群落,由微生物群体及其包被的细胞外聚合物和基质网组成,它们彼此黏附或者黏附到组织或器官的表面,可以覆盖胃肠道大面积区域。
胃肠道疾病的发生与致病性生物膜有关,例如炎症性肠病、肠易激综合征、消化性溃疡病、胃炎、胃酸缺乏和胃肠道癌症。形成与疾病相关生物膜的细菌菌株包括脆弱拟杆菌、艰难梭菌、致病性和肠粘附性大肠杆菌、活泼瘤胃球菌和幽门螺杆菌。除了引起胃肠道疾病外,致病性生物膜还可能导致肠道微生物群失调、粘液破坏和上皮细胞受损。
生物膜在溃疡性结肠炎和肠易激综合征患者中非常普遍,可以在肠镜检查期间观察到这种生物膜,但许多医师可能还没有意识到它们的生物学和临床重要性。胃肠道生物膜具有保护性的细胞外基质,这使得它们对抗生素耐药性增强,变得难以治疗。
但并非所有胃肠道生物膜都是致病性的,共生生物膜使宿主获取营养效率提高,有助于肠道吸收;能够利用体内老化细胞并产生能量;还能够通过物理结构、化学成分和特定代谢活动,作为对抗环境分子、免疫细胞、捕食性原生动物和其他病原微生物的保护屏障,来限制病原菌的定植和侵袭。这种保护机制有助于维持肠道微生物群落的稳定性和抵抗力。
生物膜有希望作为胃肠道疾病和内窥镜病理检测的新型生物标志物。因此,清楚地了解体内的生物膜,然后对致病性生物膜进行治疗或对共生生物膜进行保护和修复对人体肠道健康甚至全身健康都非常重要。
本文涵盖胃肠道生物膜的形成、外观和检测、生物膜的疾病和临床相关性以及目前的一些治疗方法。未来对生物膜性质、组成和临床相关性的研究将为肠道生理学提供新的认识,并为胃肠道疾病的治疗提供潜在的新选择。
1
什么是生物膜?
胃肠道微生物的生物膜是由微生物群体及其包被的细胞外聚合物和基质网组成,它们彼此黏附或者黏附到组织或器官的表面,以此在生长过程中适应生存环境,是一种特殊的细菌生存形式。
▸ 肠道粘膜表面三种细菌生活方式
生活在胃肠道表面的微生物可能会采取三种不同的生活方式之一。
生活方式1:它们可以组织成一个交流细胞网络,导致一种群落行为,称为生物膜表型。
生活方式2:它们可以从生物膜中分散,并向管腔或宿主迁移,称为生物膜分散。
生活方式3:或者他们可以作为自由生活、自由漂浮的浮游表型。
细菌生活方式及其与宿主的关系
doi: 10.1038/s41575-020-00397-y.
这些微生物群的生活方式与固有特性(运动,粘附性和代谢)可以影响宿主对它们的不同反应。
2
生物膜的构成
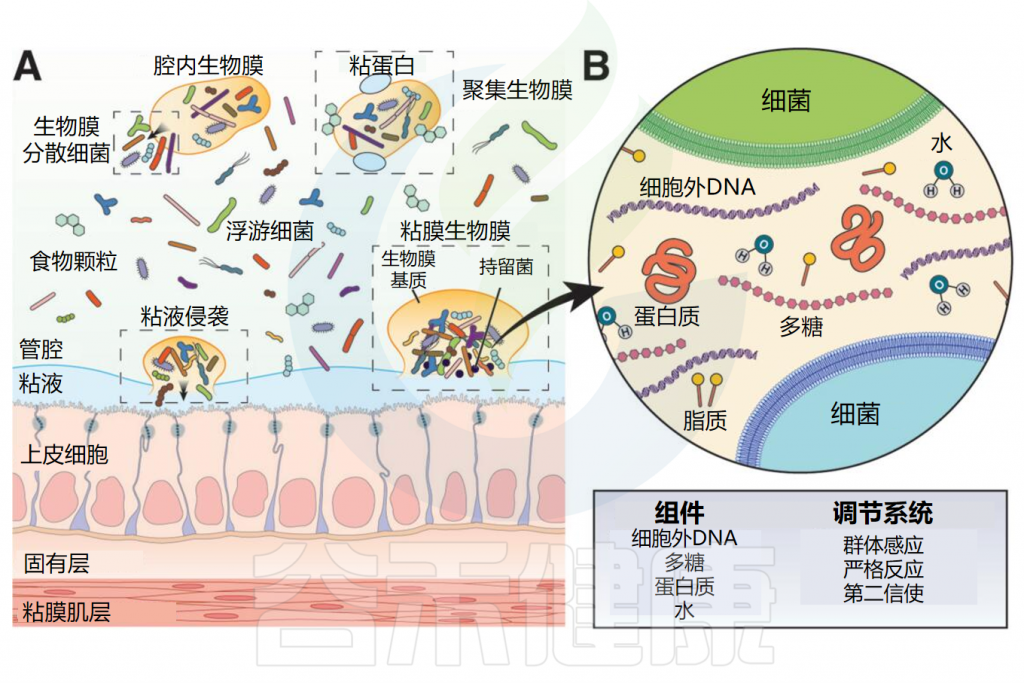
生物膜基质主要由水和生物聚合物组成,包括多糖、蛋白质、脂质和细胞外DNA,形成水凝胶状结构。
细菌细胞嵌入该基质中,共同形成生物膜。生物膜使用高效的细菌调节途径,如群体感应、严格反应和第二信使来调节生物膜的组织、结构和行为。
胃肠道生物膜外观和基质组成
Jandl B,et al.Gastroenterology.2024
(A)肠道细菌和生物膜外观;(B)生物膜基质组成
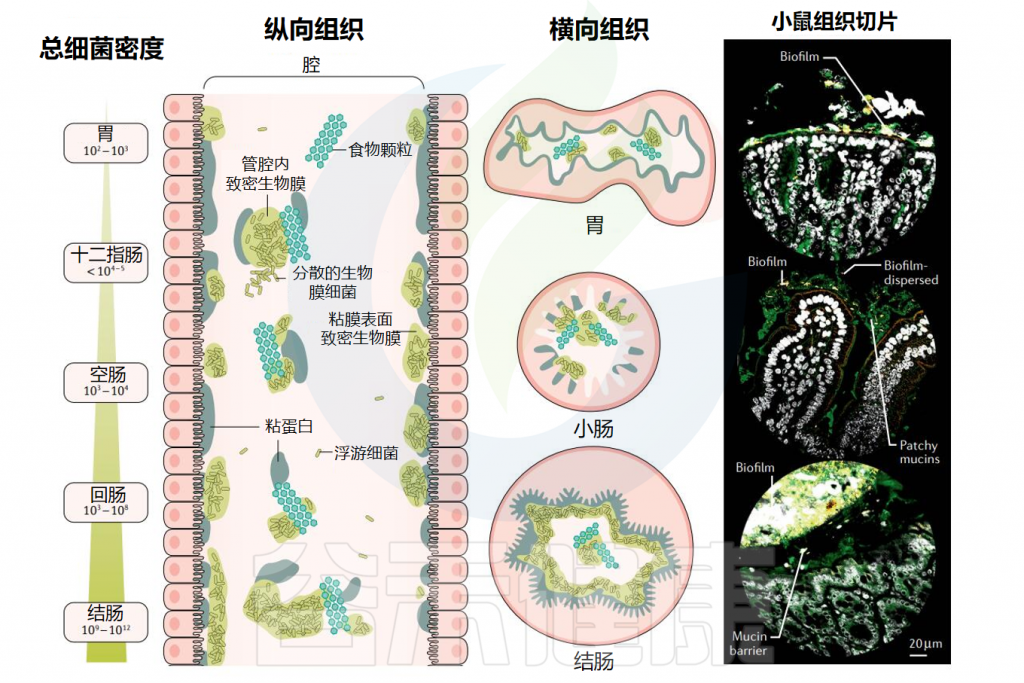
▸ 沿着胃肠道,生物膜的数量和厚度逐渐增加
在整个消化道中,生活在粘膜表面的共生微生物群由沿着纵向(中左)和横向(中右)轴的生物分层的群落组成。从胃到结肠,微生物密度和多样性增加。
粘膜微生物群在消化道形成大小不一的生物膜聚集体,在小肠中有更松散的粘附聚集体,在大肠起始处形成较为密集均匀的生物膜群落,在结肠中形成一个连续的凝胶形成层。在整个消化道中,微生物生物膜与粘蛋白聚集体和食物颗粒密切相关。
胃肠道生物膜表现为(1)具有富含粘蛋白基质的粘膜生物膜;(2)粘蛋白聚集体周围的生物膜簇;(3)粘附在食物颗粒上的生物膜;(4)这些形式的混合版本。
微生物群生物膜遍布胃肠道
doi: 10.1038/s41575-020-00397-y.
3
生物膜对宿主的影响
生物膜的一些特性
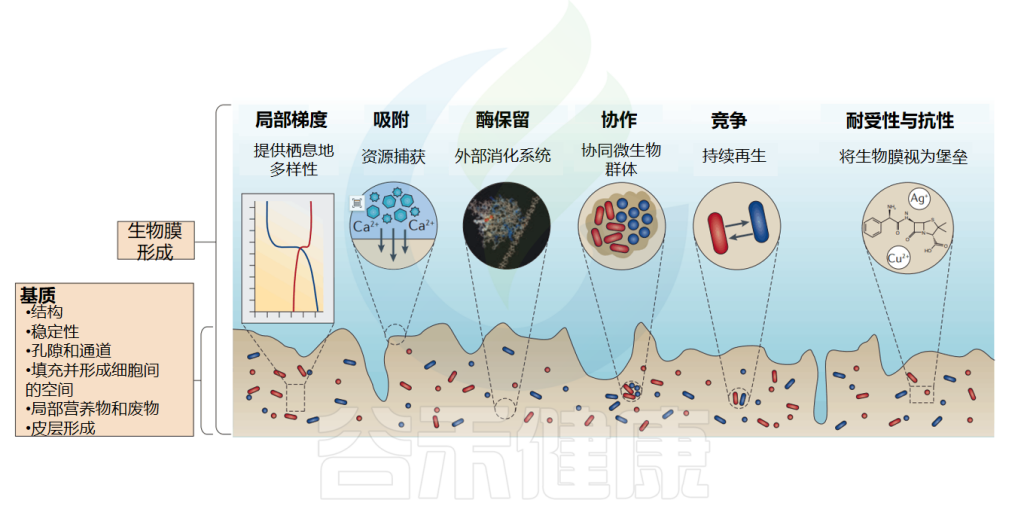
doi: 10.1038/nrmicro.2016.94.
① 细菌抗生素耐药性增强,消除病原菌更困难
与自由生活的细菌细胞相比,生物膜的一大特点是对抗生素和其他抗菌素的耐药性或耐受性增强。
生物膜可以以一种称为扩散反应抑制的形式,淬灭通过生物膜扩散的抗菌物质的活性,这种抑制形式可能将抗微生物药物的有效浓度降低到不致死浓度。
受基质扩散反应抑制的抗菌剂包括有毒金属,如铜,其与Erwinia amylovora生物膜基质中的多糖络合以保护细菌免受铜胁迫。
生物膜包含大量处于”静止期”的细胞,这些细胞对许多依赖细菌细胞代谢来获得活性的抗微生物药物的敏感性降低。对于处于静止期的生物膜中的细菌,至少有1%对抗生素产生抗药性。随着时间的推移,生物膜中大量的细胞进入静止期。随着生物膜的老化,一些抗生素(万古霉素)的杀伤效率显著降低。
生物膜中细胞对抗菌剂的抗性增强另一种机制是通过水平基因转移抗性基因。例如,对几种抗生素具有抗性的基因质粒很容易转移到大肠杆菌(E.coli)和P.putida中。
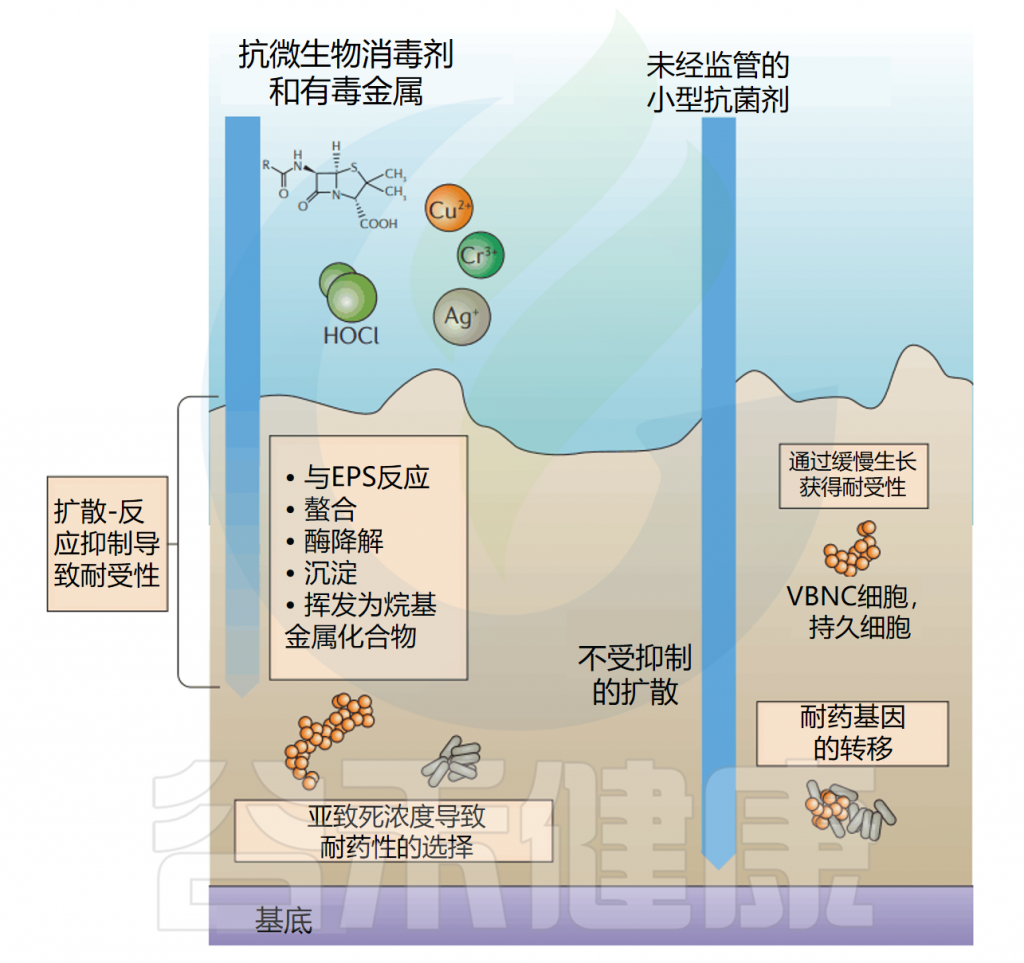
doi: 10.1038/nrmicro.2016.94.
生物膜中的细菌对抗生素的耐药性增强,使得临床上治疗一些能够形成生物膜的致病菌感染更加困难。
② 获取营养效率提高,可能有助于肠道吸收
营养获取是所有生物的基本过程,生物膜具有一种非常有效的营养获取策略,超过了自由生活的细菌。
生物膜是复杂的吸附系统,在生物膜的细胞质、细胞壁和基质的胞外聚合物(EPS)中具有不同的吸附机制和结合位点,这意味着生物膜中的细胞可以捕获和积累非常广泛的营养物质,即使浓度很低。这种强大的获取能力使生物膜即使在高度缺营养的环境中也能生长。
doi: 10.1038/s41575-020-00397-y.
注意:强大的捕获能力使有毒物质也更易积累!
但生物膜的吸附不是化合物特异性的,这意味着不仅营养物质,而且有毒物质都可以在生物膜中积累,在胃肠道生物膜中发现了红霉素琥珀酸乙酯、乙酰氨基酚、酸性药物、甾体激素和4-壬基酚合物等化合物。
③ 回收裂解细胞并产生能量,有效利用体内老化细胞
当细胞腐烂和分解时,它们的碎片留在基质中,被存活的细胞作为营养物质“蚕食”。这一过程已经在枯草芽孢杆菌(B.subtilis)生物膜中进行了详细的研究。
结果表明,裂解细胞中的DNA是磷、碳和能量的来源。铜绿假单胞菌(Pseudomonas aeruginosa)已被证明能够在生物膜中特异性地产生细胞外DNA酶,利用裂解细胞中的DNA作为营养来源。生物膜可以被视为一个高效的细胞碎片回收利用场。
④ 作为一种保护屏障,有助于人体肠道健康
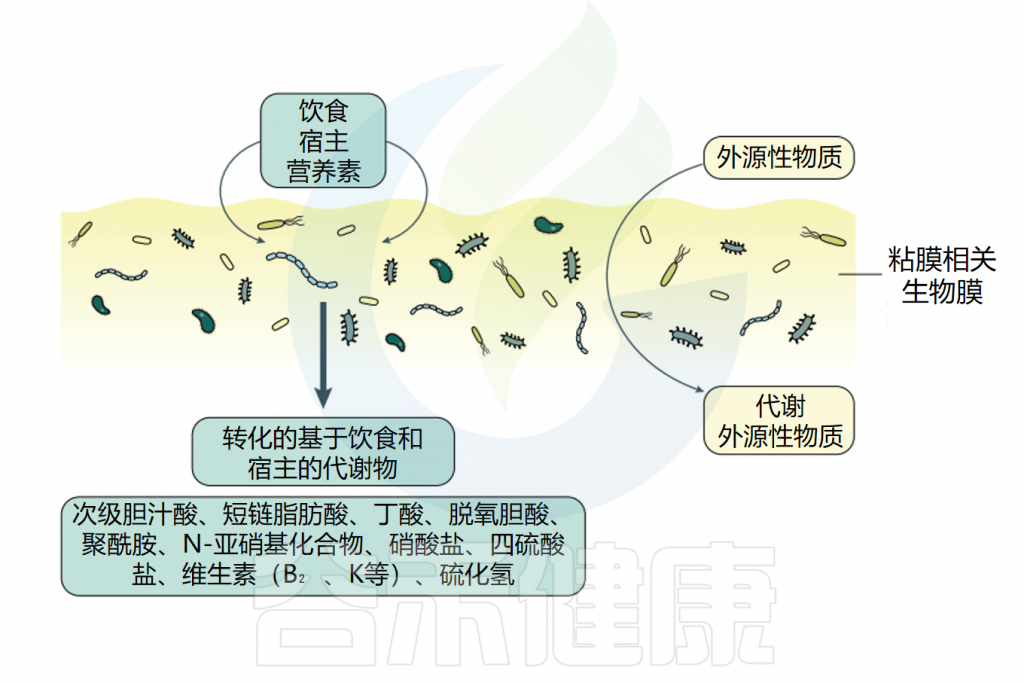
生物膜是一种具有化学成分和特定代谢的物理结构,起着保护屏障的作用,可以抵御环境分子、免疫细胞、捕食性原生生物和细菌。
无论是微生物、膳食分子、污染物还是外来生物,要么可以自由地扩散穿过生物膜并到达宿主上皮,要么被生物膜阻断,生物膜作为一个紧密的屏障。这些腔内化合物可以被生物膜过滤,生物膜只允许某些分子通过,从而起到选择性过滤器的作用。
生物膜中的细菌拥有许多竞争策略,例如快速生长以获得营养,直接攻击以将其他竞争物种排除在环境之外,从其他竞争物种中获益或剥削其他竞争物种。
这种生物膜诱导的对入侵者的保护作用可以通过肠道微生物群对肠道病原菌的定殖抗性来证明。这种抗性在小鼠体内通过直接机制(如细菌素的产生、短链脂肪酸的产生、胆汁酸的转化和VI型分泌系统的表达)和间接机制(宿主生理和免疫的调节)介导。
生物膜通过物理结构、化学成分和特定代谢活动,作为对抗环境分子、免疫细胞、捕食性原生动物和其他细菌的保护屏障。这种保护机制有助于维持肠道的稳定性和抵抗力。
⑤ 多微生物相互作用,维持生态平衡
胃肠道表面的微生物群包含古细菌、原核生物和真核生物和病毒。肠道生物膜内的微生物相互作用,并与人体细胞相互作用。这些跨“区域”的相互作用可能在维持消化系统健康方面起着重要作用,当这些体内平衡相互作用被破坏时,可能在疾病中起着重要作用(称为失调)。
越来越清楚的是,这些微生物群与宿主的相互作用高度依赖于细菌群落作为生物膜结构的性质和空间组织。
⑥ 影响药物的活性,可能导致失效或效率提高
治疗药物可改变动物模型和人类肠道微生物群的组成,但肠道微生物群本身也参与药物加工。这种代谢功能对药物的有效性和安全性有重要影响。
肠道微生物群确实可以直接代谢外源性物质(例如胺碘酮、他克莫司、地高辛等),从而改变其化学性质、稳定性、生物利用度和潜在的生物效应。
因此,由微生物群驱动的外源性物质加工可能会导致不必要的不良反应,导致分子失效,或相反地导致更具活性和效率的分子。这一观察结果对人类使用药物的建议和剂量提出了严重的问题,特别是考虑到其中一些药物由于毒性而必须仔细监测。
胃肠道内的不同环境导致不同的生物膜分类组成以及不同的代谢过程。这一观察结果增加了试图解决微生物群对外源或药物加工的影响的复杂性。
4
生物膜的生命周期
生物膜生命周期
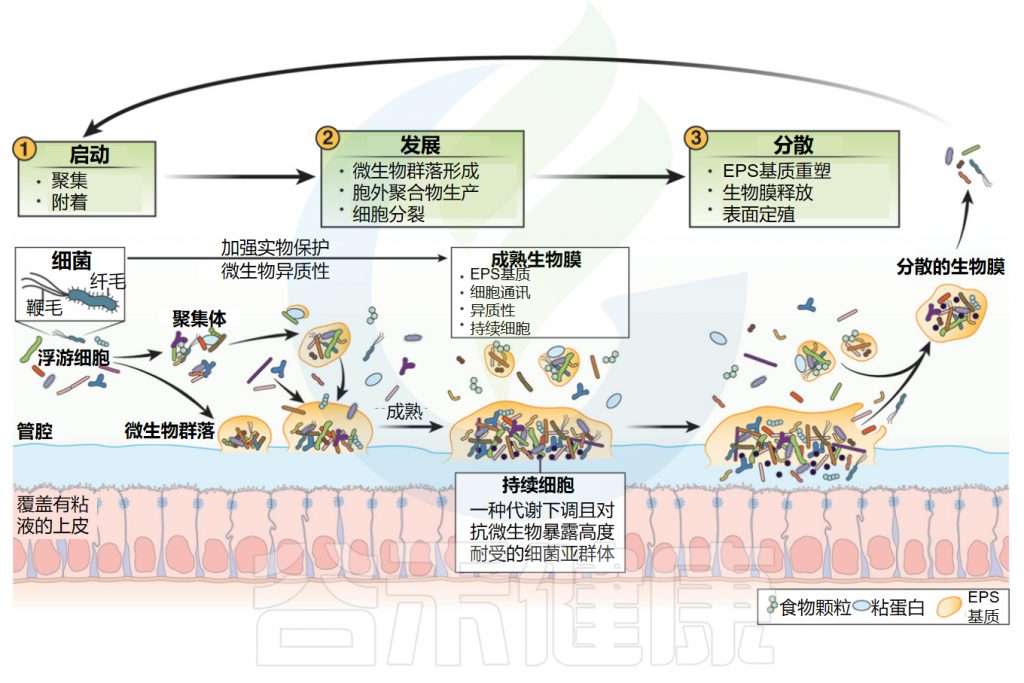
Jandl B,et al.Gastroenterology.2024
生物膜的形成、生长和增殖是生物膜生命周期的关键部分。生物膜生命周期的三个阶段包括以下内容。
(1)起始:细菌使用表面表达的粘附蛋白、鞭毛和菌毛附着在粘膜表面或聚集体(彼此或管腔内容物),如未消化的食物颗粒或宿主粘蛋白上,形成微菌落。
(2)发育:粘液附着的微菌落开始细胞分裂并建立由胞外聚合物(EPS)组成的EPS基质,该基质具有支持细菌共存和有效通讯的异质化学和物理微环境。
生物膜生长和发育是一个动态过程,其中管腔浮游细菌可以迁移到已建立的生物膜结构中,管腔细菌生物膜聚集体通过团聚膨胀,非表面附着的聚集体附着在粘膜生物膜上。持久性细胞形成于营养缺乏区域,通常位于成熟生物膜的核心,对环境压力和抗菌素暴露表现出高度耐受性。
(3)扩散:胞外聚合物(EPS)基质重塑有助于释放生物膜分散的聚集体,这些聚集体可以在未感染的粘液中定植。由于肠道蠕动,肠道中的扩散方向从近端区域到远端区域发生。分散的生物膜是一种独特的表型,有助于生物膜沿肠道扩展。
生物膜在肠道和整体健康中发挥重要作用,通过提供物理屏障、维持生态平衡、促进营养竞争和参与代谢过程等机制,有助于维持健康。
但生物膜相关感染在临床上具有重要意义,因为大多数持续性感染源于生物膜。研究发现生物膜与炎症性肠病(IBD)、癌症和胃肠道感染相关,并与分类学组成变化、抗生素耐药性提高以及病原体的生物膜分散有关。
编辑
doi: 10.1038/s41575-020-00397-y.
研究生物膜在疾病中的作用,可能会为胃肠病学带来重要的临床发现。
1
胃肠道感染
人类胃肠道可被各种肠道病原体定植,这些病原体可导致各种疾病,从无症状定植(如幽门螺杆菌)到轻度症状和自限性(如弯曲杆菌、螺旋体门和幽门螺杆菌),以及潜在的危及生命的慢性感染(如耐药肠球菌和艰难梭菌引起的相关感染)。
◮ 病原体可以形成有害生物膜并释放毒素
多项研究表明,这些肠道病原体(如幽门螺杆菌、肠球菌、艰难梭菌和艰难梭菌)在能够有效形成生物膜。胃肠道感染的动物模型显示出有害生物膜菌落的组织学特征,这些菌落密集堆积并粘附在上皮表面,例如胃中的幽门螺杆菌生物膜,以及大肠中的空肠弯曲菌和艰难梭菌生物膜。
这些病原体在生物膜中可能释放毒素,导致局部组织的炎症和损伤,进而引发发热、溃疡等并发症。
◮ 生物膜内的病原体耐药性更强,导致持续感染
生物膜内的细菌通常对抗生素具有更高的耐药性,治疗效果降低,增加了治疗的复杂性。并且生物膜中的病原体能够抵抗宿主免疫系统的攻击,使感染难以清除,导致慢性或反复感染。
在人类肠道活检样本中,微生物群的组织学和显微镜染色显示存在致密的粘膜相关生物膜覆盖组织(例如胃溃疡中的幽门螺杆菌生物膜和直肠中的螺旋体生物膜)。
虽然研究已经确立了形成生物膜的肠道病原体与感染之间的联系,但生物膜生活方式本身对感染的慢性和持续性尚未得到充分了解,对抗这种情况的生物膜特定战略仍有待充分评估。
2
炎症性肠病
越来越多的证据支持炎症性肠病(IBD)特异性粘膜生物膜通过多种途径在宿主组织中引发促炎反应。
◮ 炎症性肠病患者形成生物膜的能力更强
分类差异和粘膜相关微生物群的多样性降低与炎症性肠病相关,具体表现为克罗恩病中普拉梭菌丰度降低,而毒力大肠杆菌丰度增加;同时,溃疡性结肠炎和克罗恩病中肠毒性脆弱拟杆菌和铜绿假单胞菌的丰度也有所增加。
炎症性肠病患者的活检样本中,上皮粘附生物膜的患病率高于健康对照者。与健康组织的微生物群相比,IBD患者的粘膜微生物群在体外产生更大的生物膜。此外,肠球菌和从克罗恩病患者分离的粘附侵袭性大肠杆菌在肠上皮细胞系培养物上形成生物膜的能力更强。
◮ 炎症性肠病相关生物膜的细菌可以作为病原体
此外,来自炎症性肠病相关生物膜的生物膜分散细菌可以在体内和体外成为侵袭性病原体,这一现象可能在IBD的病理生理中起致病作用。
黏液共生微生物(如嗜黏蛋白阿克曼菌和瘤胃球菌科)的丰度改变和释放蛋白酶和糖苷酶的细菌(如卟啉单胞菌、粘附侵入性大肠杆菌和拟杆菌)的生物地理重新定位也可能促进邻近共生微生物进入肠上皮表面。
来自新发儿科克罗恩病患者多个胃肠道位置的样本显示细菌过度生长,包括肠杆菌科、巴氏杆菌科、韦荣氏菌科和梭杆菌科,以及丹毒菌门、拟杆菌门和梭状芽胞杆菌门的丰度降低,与疾病类型相关。
与健康对照相比,上皮粘附细菌越来越多地出现在IBD患者中,IBD患者微生物群产生的生物膜在大小和细胞数量上比健康受试者更突出。
◮ 可能成为炎症性肠病的生物标志物
一项对1426名溃疡性结肠炎(UC)和肠易激综合征(IBS)患者的研究发现,这些患者具有独特的生物膜特征,IBS患者的生物膜发生率为57%,UC患者的发生率为34%,而对照组仅为6%。
此外,生物膜检测呈阳性的患者钙卫蛋白水平较高,生物膜中胆汁酸积聚,这表明炎症和腹泻更严重。在显微镜下,IBD患者来自回肠、升结肠和乙状结肠的活检标本显示细菌浓度显著更高。
随着临床研究的深入,生物膜可能成为内窥镜检查和活检信号易感性及疾病严重程度更具代表性的标志物。
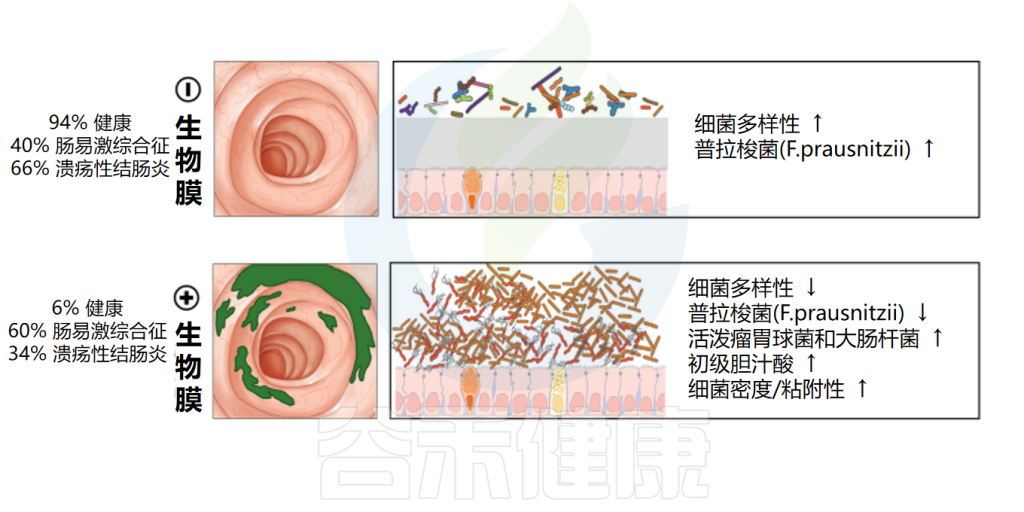
doi: 10.1053/j.gastro.2021.06.024.
◮ 产短链脂肪酸的益生菌抑制病原菌的生物膜
益生菌的突然下降,尤其是那些产生丁酸盐的益生菌,改变了细菌生长模式,从而促进了生物膜的产生。
体外实验表明,短链脂肪酸(SCFA)抑制生物膜的形成,包括大肠杆菌、鼠伤寒沙门氏菌、表皮葡萄球菌和戈登链球菌。并且,随着IBD的进展,SCFA的活跃生产者大大减少。因此,我们认为SCFA是生物膜形成的合理天然抑制剂,有助于解释抗生素治疗对IBD患者的双重影响。
◮ 生物膜的形成使病原菌持续存在,并加速黏膜损伤
在炎症性肠病(IBD)患者活检中经常发现的一种可能病原体是粘附侵袭性大肠杆菌(AIEC)。AIEC可以通过用蛋白酶促进粘蛋白降解来穿透粘液层。然后,它们中的很大一部分通过增加氧化代谢物的使用来竞争肠道中的共生体,这可能会引发慢性炎症和纤维化。一小部分已被证明侵入和复制人巨噬细胞和中性粒细胞,以侵入免疫反应或诱导自噬。
生物膜的形成能力可以将这些过程联系起来。首先,最近的研究显示AICE中的IV型分泌系统(T4SS)在克罗恩病中显著上调,这有助于在上皮细胞表面构建生物膜。
除了粘附和运动外,生物膜还可能与sfa/focDE和ibeA等毒力基因的表达有关。对克罗恩病相关菌株 AIEC LF82 的研究表明,巨噬细胞是生物膜样细菌群落的家园。因此,生物膜的形成使 AIEC 能够在炎症环境中持续存在,加速粘膜损伤,并产生免疫细胞相关的慢性感染库。
3
慢性胃炎
在大多数情况下,慢性胃炎是消化性溃疡和胃癌的主要原因。幽门螺杆菌与胃炎在胃恶性肿瘤的发展中存在密切联系。幽门螺杆菌感染是成人慢性胃炎发展的公认病因因素(在90%以上的病例中)。
◮ 生物膜使幽门螺杆菌能在恶劣环境下生存
最初于2006年在消化性溃疡和尿素酶阳性的个体中,在胃粘膜中拍摄了胃幽门螺杆菌生物膜,胃是生物膜生长的理想环境。生物膜中的幽门螺杆菌细胞在长时间的体外培养下经历形态变化,最终进入球状物状态(幽门螺杆菌的休眠状态),表明生物膜使幽门螺杆菌能在恶劣环境中耐受生存。
虽然在患者中发现的大多数幽门螺杆菌对治疗有反应,但一小部分细菌可能会抵抗它们的作用,导致感染继续。随着抗生素浓度的下降,幽门螺杆菌从球状恢复到螺旋状,重新填充生物膜或引起扩散。
◮生物膜使幽门螺杆菌耐药性增强,不利于彻底根除
在慢性胃炎中,幽门螺杆菌生物膜作为外部因素的物理屏障,它响应降钙素等药物改变其表面结构,从而提高环境适应能力,这可能部分解释了吞噬细胞无法根除在生物膜中发育的细菌的原因。
幽门螺杆菌在处于生物膜状态时对抗生素的耐药性增加,对克拉霉素、阿莫西林和甲硝唑表现出增强的耐药性。
此外,eDNA 可以促进微生物粘附和螯合阳离子以抑制抗生素扩散。除了上述机制外,幽门螺杆菌的表面内毒素和外膜结构可以在免疫系统的恒定压力下通过生物膜形成过程中的基因交换而改变,最终导致幽门螺杆菌疏水性降低,这进一步阻碍了生物膜的药物渗透。
临床信息进一步支持生物膜和疾病发展相关的观点。在幽门螺杆菌患者的治疗过程中,在常规治疗前用生物膜破坏剂N-乙酰半胱氨酸治疗幽门螺杆菌患者导致实验组根除幽门螺杆菌,而常规治疗组没有表现出相同的结果。
4
癌症
生物膜与胃、小肠和结肠的癌症发生和发展有关。
◮ 结直肠癌患者中的生物膜比健康人更普遍
在健康的人结肠组织中,通过显微镜可以看到附着在肠上皮上的生物膜。尽管如此,厚的微生物生物膜在结直肠癌患者中比健康人更普遍,在50%的结直肠癌(CRC)患者中观察到粘液侵袭性细菌生物膜,但仅在13%的健康个体中观察到。
有趣的是,在89%的右侧结直肠肿瘤中检测到生物膜,但仅在12%的左侧结直肠肿瘤中检测到生物膜。
结直肠癌患者的生物膜相关微生物群包含多种菌株,包括具核梭杆菌(Fusobacterium nucleatum)、产肠毒素脆弱拟杆菌、产生基因毒素的大肠杆菌和解没食子酸链球菌。
◮ 生物膜通过影响炎症环境或基因诱导致癌
关于生物膜对结直肠癌的临床贡献,使用小鼠模型和人类结肠组织的研究表明,生物膜可以直接致癌,但也可以在炎症环境和遗传易感宿主的背景下参与组织转化。
对无菌小鼠的研究表明,侵袭性生物膜通过改变宿主mRNA或microRNA而致癌,特定类群的贡献对致瘤复制至关重要。具核梭杆菌可以通过在遗传易感个体中募集肿瘤浸润免疫细胞直接促进结直肠癌的发生。
产肠毒素的脆弱拟杆菌可能促进结直肠癌的发生,部分原因是通过分泌金属蛋白酶毒素导致辅助T17(Th17)细胞依赖性反应的过度激活和基因毒性氧自由基的产生。生物膜诱导致癌的其他潜在机制包括多胺(精胺和亚精胺)宿主途径的代谢组学变化,以及对粘膜相关微生物组功能变化。有益的共生微生物被更适应肿瘤微环境的机会性病原体所淘汰。
◮ 其他癌症组织附近也有异常粘附的生物膜
家族性腺瘤息肉病患者在息肉附近也有异常粘附的细菌生物膜,这些生物膜主要由编码大肠杆菌素的大肠杆菌菌株和产肠毒素脆弱拟杆菌组成。有趣的是,在该研究中,这些遗传生物膜的分类组成似乎不同于在散发性结直肠癌或健康宿主中检测到的生物膜(与散发性结直肠癌相比,明显富含黏液侵入性变形杆菌和拟杆菌)。
微生物群诱发的癌症可能不是由单一微生物引起的,而是需要一个复杂的细菌群落聚集在生物膜环境中,其中有益的共生体被病原体(如前面讨论的那些)取代,这些病原体更适应肿瘤微环境,可以发挥关键病原体的致病作用。
!
Tips
并非所有肠道生物膜都是致病性的,共生生物膜有几个例子。共生生物膜可以通过竞争肠腔中的空间和营养物质以及释放抑制性代谢物(如乙酸盐或丁酸盐)来限制病原菌的定植和侵袭。
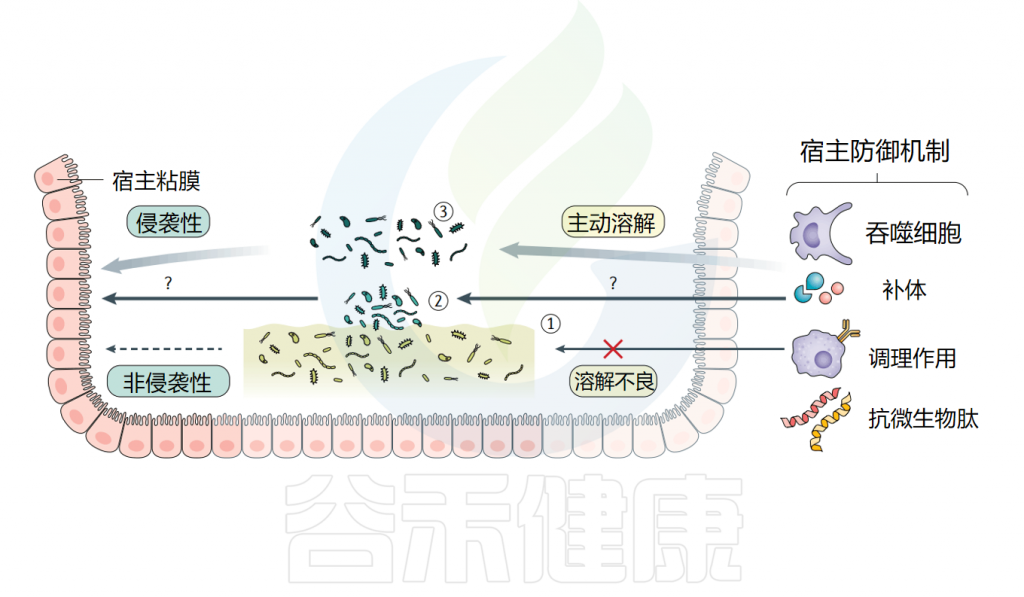
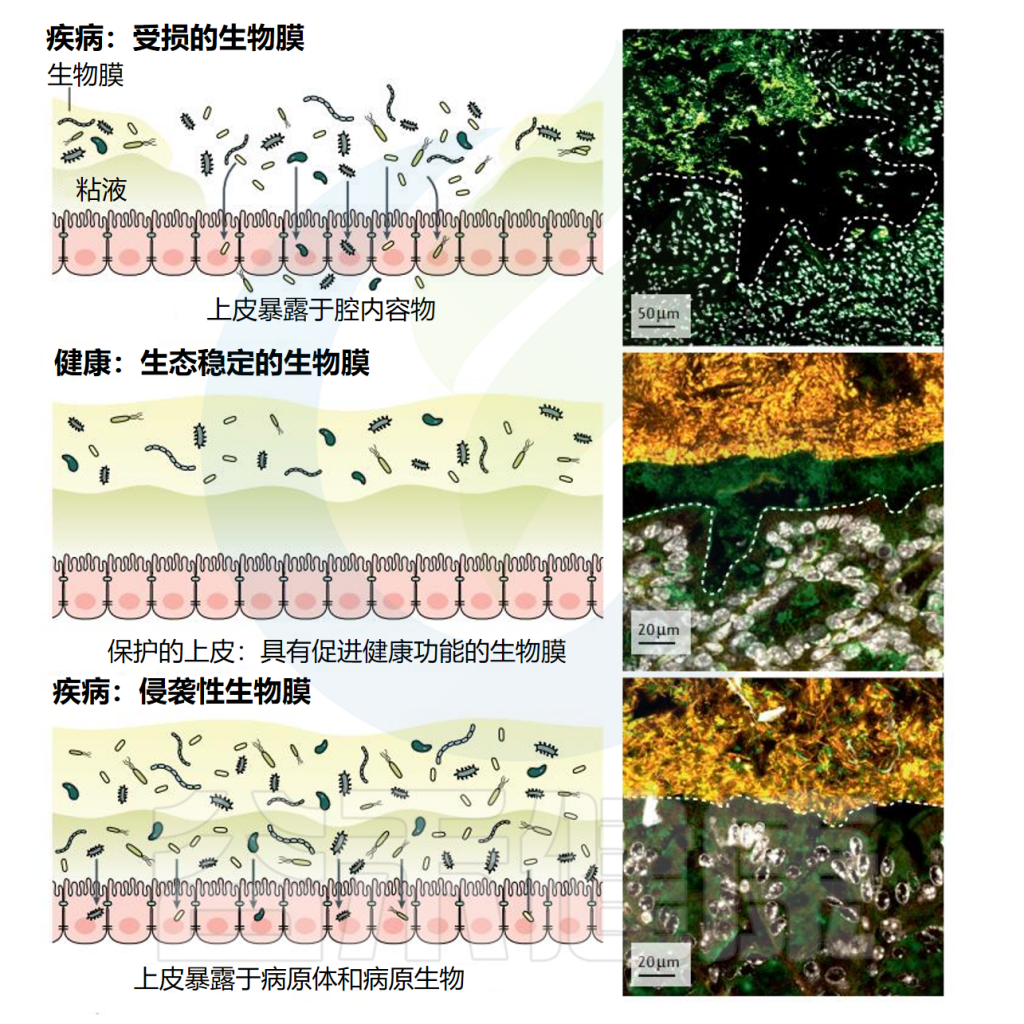
生物膜-宿主相互作用
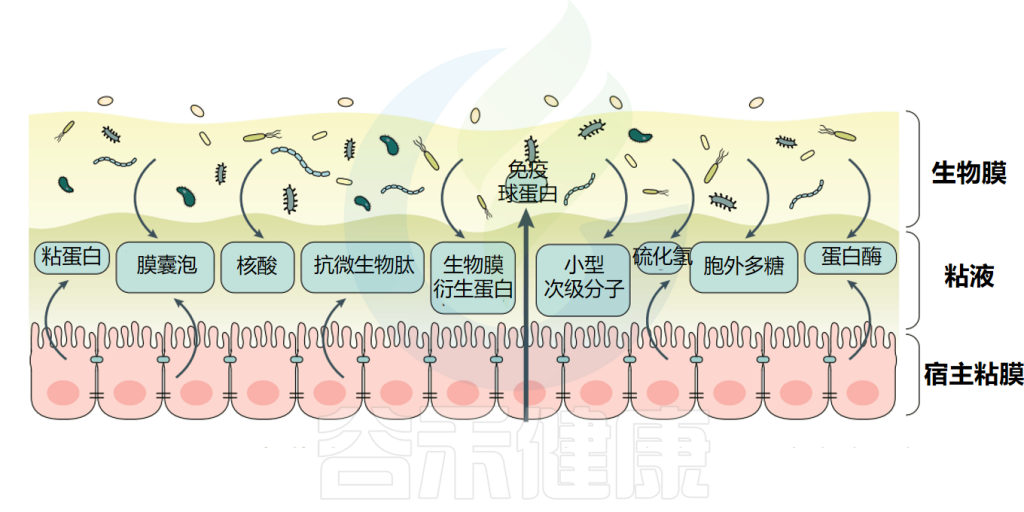
doi: 10.1038/s41575-020-00397-y.
生物膜的共生性或致病性有时取决于单个基因(例如,翻译促炎或致癌功能)、细菌菌株上具体的生物膜内源性因子或是宿主免疫反应。

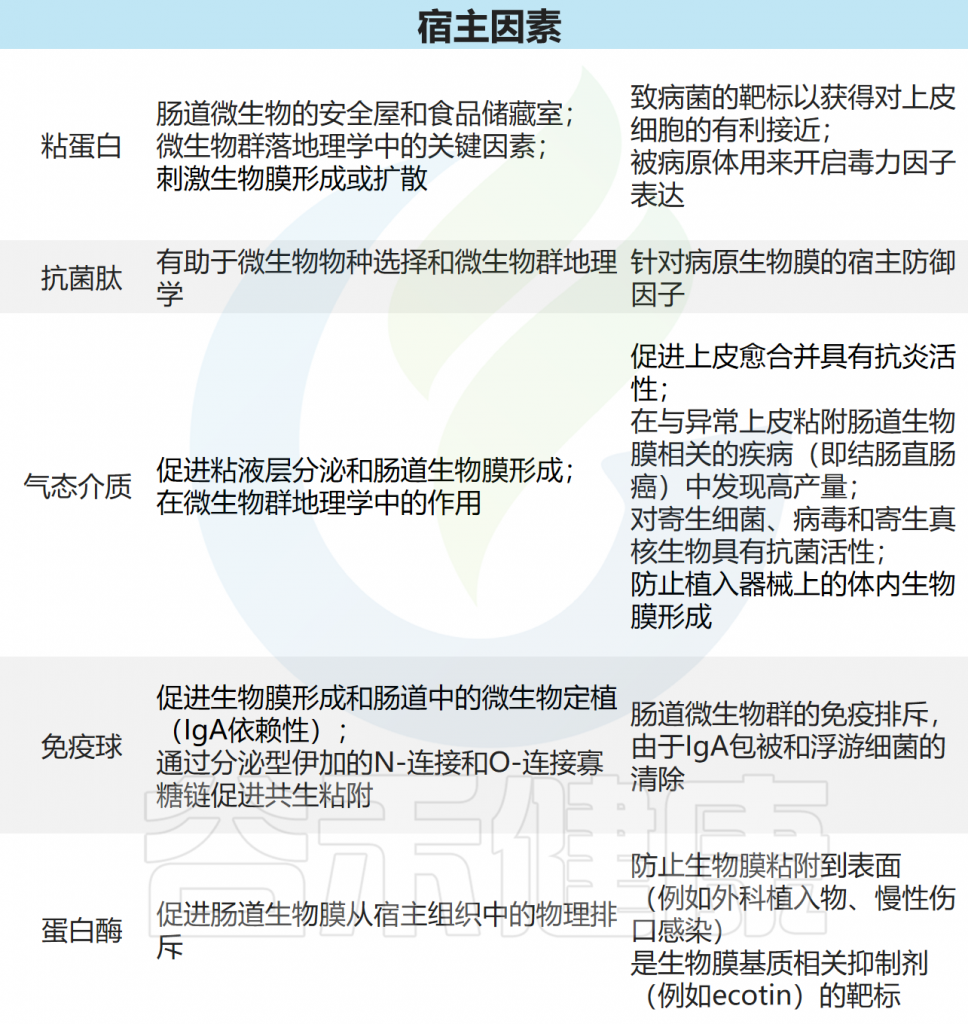
doi: 10.1038/s41575-020-00397-y.
知道了生物膜在健康和疾病中的作用后,想必迫切地需要了解目前有哪些方法可检测和控制体内生物膜,并治疗致病性生物膜。那让我们接着往下看。
▸ 临床上用内窥镜可以看到生物膜,但不易分辨
目前临床上有经验的医师会在内窥镜检查期间看到生物膜。炎症性肠病(IBD)患者和肠易激综合征(IBS)患者在内窥镜检查下发现普遍存在生物膜。
肠道生物膜在医学界仍然是一个相当新颖的概念,生物膜经常被忽视或被认为是不完整的肠道准备。
区分生物膜和肠道残留物对于指导诊断和治疗至关重要,一般可以通过以下方式进行评估:
(1)如果可以用喷射清洗机轻松去除多余的层,则很可能是残留物;
(2)如果清洁程序很困难并且该层像膜一样粘在回肠壁上,则很可能是生物膜;
(3)由于重力,残留物通常与液体一起积聚在底部,而生物膜通常在整个肠壁周围形成360°附着层。
◮ 内窥镜会对肠道菌群平衡产生一定干扰
内窥镜等一些侵入性的方法,会对肠道菌群产生一定的干扰和影响。
谷禾通过真实案例检测并对比了做肠镜前后的肠道菌群变化:原本肠道内占极高比例的黄色拟杆菌属比例大幅压缩,罗氏菌属几乎消失不见。对应的普雷沃氏菌属以及埃希氏菌属(主要是大肠杆菌)比例快速增加,另外除了这些菌外还有大量的原占比很低的其他菌属出现。

而更大的变化出现在完成肠镜检查后,核心菌属变为埃希氏菌属、韦荣氏球菌属、梭杆菌属和瘤胃球菌属。原来的三大核心菌属占比被压缩到了5%左右。
与抗生素杀死菌群的情况类似,服用泻药将大量菌群排出同样也会导致菌群数量和丰度下降,和抗生素不同的是肠道不同部位的菌可能清除比例存在差异。肠道菌群平衡这项指标明显下降,菌群多样性也随之下降。有益菌减少,有害菌上升(虽然这可能只是暂时的)。
▸ 拓展:其他生物膜检测方法
此外还有一些方法被用于检测及了解生物膜。
聚合酶链反应(PCR):用于直接在临床样本中检测生物膜形成的病原体。通过扩增特定区域,提供高特异性和敏感性。
荧光原位杂交:结合短荧光标记的寡核苷酸,与目标微生物的特定核糖体RNA结合,通过显微镜分析样本。
宏基因组学:通过分析整个微生物群落的基因组,识别生物膜形成的病原体。宏基因组中有大量的基因信息,对于生物膜描述更准确。
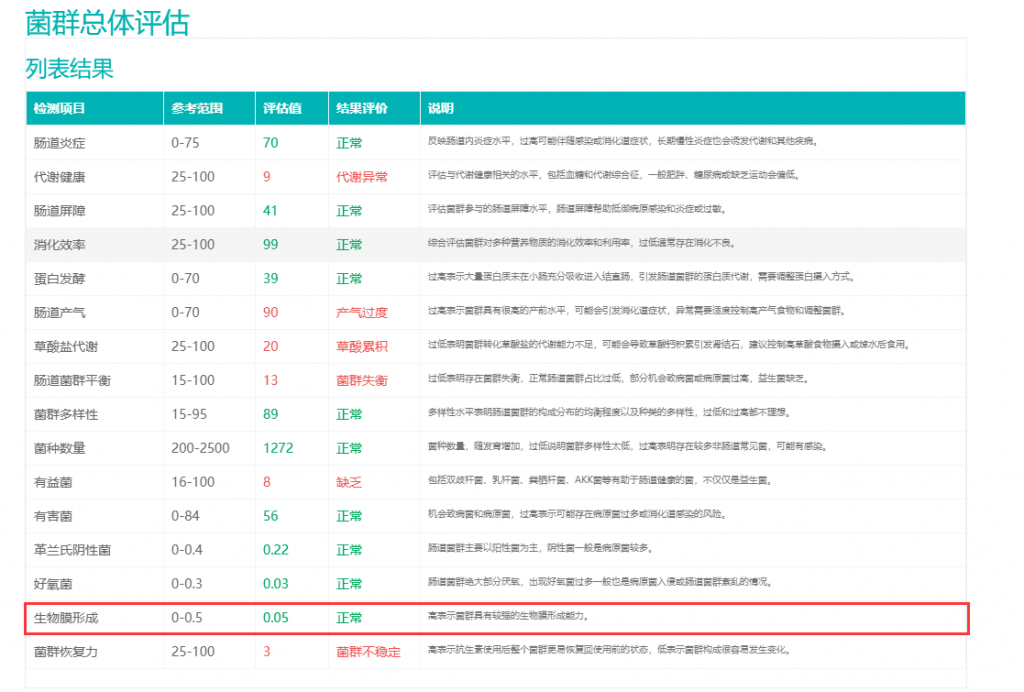
谷禾的宏基因组检测报告中,对生物膜的形成能力进行了分析评估。
刚果红琼脂试验:特别适用于检测金黄色葡萄球菌生物膜生产者。
微生物生物膜在胃肠道内稳态的多个方面发挥重要作用。然而,在某些临床情况下,当这些生物膜受到破坏时,需要对其进行保护或修复;或在其他情况下,对于某些附着于上皮的病原体生物膜,则可能需要将其彻底清除。
因此,在开发针对生物膜的治疗性控制策略时,目前的干预措施主要可分为以下几类:(1)抑制细菌粘附;(2)抑制生物膜的形成;(3)清除成熟生物膜。
针对胃肠道生物膜的治疗干预方法
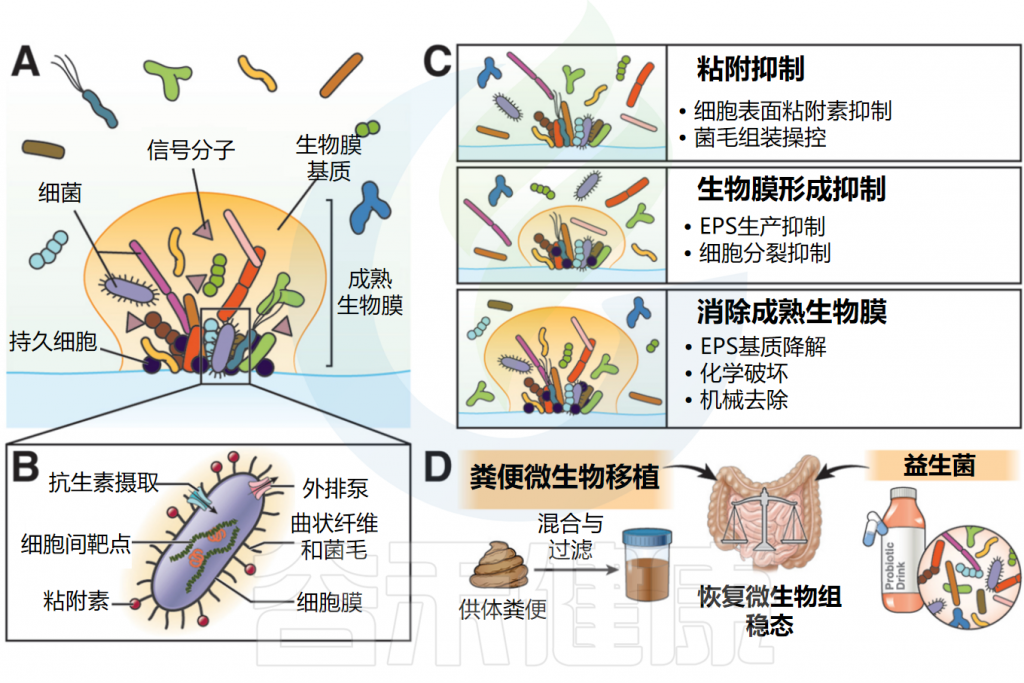
Jandl B,et al.Gastroenterology.2024
▸ 使用药物抑制细菌粘附素的表达
病原体生物膜预防策略主要侧重于抑制细菌粘附。方法包括通过引入细胞表面改变或抑制细菌粘附素表达(如curli或pili)来靶向细菌表面特性,调节生物合成,是抑制粘附的有前景靶点。
菌毛生物发生的小分子抑制剂成功地破坏了这一途径并干扰了细菌表面粘附。例如,黄烷醇杨梅素是一种具有代表性的化合物,可抑制生物膜形成。其他方法包括使用甘露糖苷等抗粘附剂来抑制粘附素的产生并减少胃肠道定植。
抗粘附素的一个关键优点是此类化合物不会影响细菌的活力,也不会根除共生细菌。然而,这种抗粘附策略的大多数体内数据是在肺部感染或伤口感染的动物模型中生成的, 其对肠道生物膜的有效性还有待研究。
▸ 使用抗生素杀死病原菌
也可以使用抗生素直接杀死病原菌,但这可能无法完全根除体内生物膜,并可能导致生物膜的持续存在和耐药性。在这种情况下,细菌虽能存活但不一定生长。
并且这可能为抗生素耐药性的产生提供条件,如通过诱变和自然选择形成的外排泵挤出抗菌剂。肠道作为复杂的多微生物环境,是遗传转移和可变亚群选择的理想场所。生物膜对抗生素治疗的持续耐受可能与慢性胃肠道感染密切相关。
▸ 使用天然化合物抑制生物膜形成
抑制胞外聚合物(EPS)基质的产生是另一种治疗策略。天然产物和小分子可以抑制基质的形成并减少细胞之间的细菌粘附和聚集。
例如,大蒜、肉桂、生姜、银杏、蔓越莓和柑橘类水果的各种提取物具有抗生物膜特性。天然衍生的生物表面活性剂也显示出抗生物膜特性。例如,鼠李糖脂包含一个与烷酸脂肪酸链相连的鼠李糖部分,可以抑制几种病原体的生物膜形成,包括变形链球菌(S.mutans)和血链球菌(Streptococcus sanguinis)。Zerumbone和α-humulene是其他天然产物,通过下调不同的外排泵相关基因和抑制生物膜形成。
氨基酸也显示出有趣的抗生物膜效应。例如,L-半胱氨酸、d-亮氨酸、d-蛋氨酸、d-色氨酸和d-酪氨酸可以单独减少生物膜生长并触发成熟生物膜的生物膜扩散。此外,当与环丙沙星共同给药时,天冬氨酸和d-谷氨酸可以抑制生物膜的形成并分散成熟的生物膜。
▸ 天然抗菌肽消除生物膜和感染
天然来源的抗菌肽(AMP)是另一类重要的抗生物膜药物,因为它们具有巨大的化学、结构和机制多样性,以消除生物膜和感染。
例如,Indolicidin是一种AMP,来源于牛中性粒细胞的细胞质颗粒,可渗透细胞壁而不破坏其完整性以抑制细菌DNA合成。
另一个例子是cathelicidin衍生的人类宿主防御肽LL-37,它可以防止细菌粘附并下调群体感应(QS)的基因。
总体而言,抗菌肽通过调节宿主免疫反应来有效地对抗生物膜。通过β-防御素1的防御素片段修饰进行优化,抗菌肽(AMP)Pam-3的开发,该肽能有效对抗胃肠道致病生物膜,而不会伤害共生菌。但抗菌肽(AMP)的一个缺点是由于酶的快速降解,其肠道稳定性较差。
▸ 使用益生菌形成“保护型”生物膜
另一种对抗胃肠道生物膜的治疗方法包括使用益生菌。
益生菌菌株的理想特性包括对肠道表面的良好粘附和在胃肠道中停留时间长,这是恢复健康的肠道微生物群和促进肠道稳态所必需的。益生菌在肠道粘膜表面形成无害的生物膜,从而可能防止病原菌的(再)定植、生物膜的形成和粘膜屏障的浸润。
例如,益生菌大肠杆菌 Nissle 1917 是治疗由肠致病性或肠毒素性大肠杆菌感染引起的胃肠道疾病的一种有前景的策略,其非致病性表现出优于病原菌株的生物膜形成能力。经过基因工程改造的大肠杆菌 Nissle 1917已被证明能够促进肠道屏障功能和上皮修复,从而增强肠道上皮完整性。
注:一些益生菌对胃肠道疾病显示出有益作用,例如感染性腹泻、抗生素相关性腹泻、肝性脑病、溃疡性结肠炎和肠易激综合征。
此外,某些具有益生菌特性的乳酸菌物种会分泌抗菌、抗粘附和抗生物膜分子,使它们能够对抗病原生物膜的定植。
▸ 使用噬菌体削弱生物膜
噬菌体是感染细菌并最终通过裂解杀死细菌的病毒。它们可以消除医疗设备上的生物膜,并且已经在各种体内感染模型中进行了研究(例如皮肤、肺和骨感染,以及败血症)。T7噬菌体通过基因工程促进糖苷酶的表达,比单独的非酶噬菌体更有效地根除大肠杆菌生物膜。
噬菌体似乎是对抗生物膜感染的有希望工具,但在应用这种工具对抗肠道中有害的生物膜之前,仍有许多问题需要解决。这些问题包括缩小噬菌体的宿主范围(如确定哪种噬菌体对特定菌株的作用更好),了解噬菌体耐药性的风险,确定宿主因子是否会使噬菌体特性失活,以及确定噬菌体制剂在人类中的长期安全性)。
▸ 纳米医学可能成为新型抗生物膜疗法
纳米医学的技术进步也可能有助于开发抗生物膜药物,因为它们解决了药物输送和疗效的挑战。纳米颗粒的大小通常在1-100nm 之间,有望用于治疗应用,尤其是肠道特异性作用。它们可以用作药物载体或直接发挥抗生物膜作用,例如基于银、铁、铜、锌、镁和稀土金属的金属基纳米颗粒。
胃肠道生物膜是一种特殊的细菌生存形式,它们彼此黏附或者黏附到组织或器官的表面,以此在生长过程中更适应生存环境。临床上通过内窥镜在回结肠区域下可见,并且在一些炎症性肠病、肠易激综合征以及胃癌和结直肠癌患者中更为常见。
但它不应该仅被视为一种病理性的慢性感染,而且还是微生物生活在粘膜表面的一种普通生活方式。微生物生物膜是许多肠道疾病病理生理的核心,但同时它们也是肠道稳态发展的关键贡献者。
需要充分表征体内肠道生物膜的组成和性质,以便更好地了解疾病相关生物膜与健康生物膜的不同结构和功能特征。这将有助于确定宿主采用何种方式以及如何应对这些生物膜。
这些微生物聚集体会不断相互作用,就像与宿主细胞相互作用一样。未来的研究必须更好地了解肠道生物膜中微生物的多样性和复杂性。通过对粪便微生物的测序可以从一定程度上反映肠道微生物群的表型以及与肠道粘膜组织的相互作用。这对于评估生物膜的病理生理作用至关重要,并可能有助于识别生物标志物以实现早期诊断和干预。这是开发更好的肠道疾病生物标志物和治疗方法的必要步骤。
主要参考文献
Jandl B, Dighe S, Baumgartner M, Makristathis A, Gasche C, Muttenthaler M. Gastrointestinal Biofilms: Endoscopic Detection, Disease Relevance, and Therapeutic Strategies. Gastroenterology. 2024 Nov;167(6):1098-1112.e5.
Wang Y, Xu S, He Q, Sun K, Wang X, Zhang X, Li Y, Zeng J. Crosstalk between microbial biofilms in the gastrointestinal tract and chronic mucosa diseases. Front Microbiol. 2023 Apr 13;14:1151552.
Baumgartner M, Lang M, Holley H, Crepaz D, Hausmann B, Pjevac P, Moser D, Haller F, Hof F, Beer A, Orgler E, Frick A, Khare V, Evstatiev R, Strohmaier S, Primas C, Dolak W, Köcher T, Klavins K, Rath T, Neurath MF, Berry D, Makristathis A, Muttenthaler M, Gasche C. Mucosal Biofilms Are an Endoscopic Feature of Irritable Bowel Syndrome and Ulcerative Colitis. Gastroenterology. 2021 Oct;161(4):1245-1256.e20.
de Vos WM. Microbial biofilms and the human intestinal microbiome. NPJ Biofilms Microbiomes. 2015 Mar 25;1:15005.
Srivastava A, Gupta J, Kumar S, Kumar A. Gut biofilm forming bacteria in inflammatory bowel disease. Microb Pathog. 2017 Nov;112:5-14.
Motta JP, Wallace JL, Buret AG, Deraison C, Vergnolle N. Gastrointestinal biofilms in health and disease. Nat Rev Gastroenterol Hepatol. 2021 May;18(5):314-334.
Flemming HC, Wingender J, Szewzyk U, Steinberg P, Rice SA, Kjelleberg S. Biofilms: an emergent form of bacterial life. Nat Rev Microbiol. 2016 Aug 11;14(9):563-75.
Sinha S, Aggarwal S, Singh DV. Efflux pumps: gatekeepers of antibiotic resistance in Staphylococcus aureus biofilms. Microb Cell. 2024 Nov 11;11:368-377.
Silva NBS, Marques LA, Röder DDB. Diagnosis of biofilm infections: current methods used, challenges and perspectives for the future. J Appl Microbiol. 2021 Nov;131(5):2148-2160.