-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
通常认为人类体内微生物群存在于与外部环境接触的体腔和器官中,例如胃肠道、皮肤、口腔、上呼吸道(尤其是鼻咽)和泌尿生殖道。然而在过去十年中,越来越多的研究确定了肿瘤内存在着低生物量而独特的微生物群落(瘤内微生物群)。
在肿瘤内,细菌、真菌、病毒和古菌等微生物形成了肿瘤微生物群,主要存在于肿瘤细胞、免疫细胞和细胞间基质中。这些微生物群落构成了肿瘤微环境(TME)的一部分,影响免疫调节、炎症和代谢控制等过程,这些过程与肿瘤的发生和进展密切相关。迄今为止报道的证据表明,肿瘤微生物组存在于33种主要癌症类型中。
大量证据表明,多达20%的癌症与微生物感染有着错综复杂的联系。最初在伯基特淋巴瘤中发现了EB 病毒(EBV)。从那时起,病毒感染就被认为是导致人类癌症的重要因素,包括确定人乳头瘤病毒(HPV)是导致宫颈癌的原因,乙型肝炎病毒(HBV)是导致肝癌的原因,以及人T细胞嗜淋巴细胞病毒是导致白血病和淋巴瘤的主要原因。
伯基特淋巴瘤(Burkitt淋巴瘤)是儿童恶性淋巴瘤中最常见的类型,起病急,进展快,侵袭强和恶性度高。1964年首先从非洲儿童Burkitt淋巴组织中分离出EB病毒。
1982年,就在胃中发现幽门螺杆菌(Helicobacter pylori)证实了其作为消化性溃疡和胃癌病原体的作用。2020年,对来自七种常见实体瘤(包括乳腺癌、肺癌、卵巢癌、胰腺癌、黑色素瘤、骨癌和脑肿瘤)的超过1526个样本进行了分析,发现大多数实体瘤含有细菌,其中许多是存活在癌细胞内的细胞内细菌。随后,在各种人类癌症标本中也发现了真菌,包括胰腺癌、肺腺癌和结直肠癌。
本文介绍了肿瘤微生物组的相关概念、来源和特征及检测方法。然后,我们描述了常见肿瘤中肿瘤微生物组的组成及其在塑造肿瘤微环境中的作用。肿瘤微生物组和免疫系统之间的相互作用可以调节宿主的抗肿瘤免疫,影响肿瘤治疗的疗效。理解肿瘤微生物组与肿瘤之间的相互关系,有助于为肿瘤的早期诊断和治疗带来新的突破。
▸ 肿瘤微生物的定义
“肿瘤微生物”,其定义为在肿瘤组织中发现的可影响癌症易感性和治疗反应的微生物。国际癌症登记协会(IARC)将11种微生物归类为人类致癌物。
其中包括7种病毒,即乙型肝炎病毒(HBV)、丙型肝炎病毒、人类嗜T细胞病毒、人乳头瘤病毒(HPV)、EB病毒、卡波西肉瘤相关疱疹病毒(KSHV)和默克尔细胞多瘤病毒(MCV);三种寄生虫,即华支睾吸虫、埃及血吸虫和Clonorchis mukusicus;和一种细菌,幽门螺杆菌(Helicobacter pylori)。
术语“瘤内微生物群 ”和 “瘤内微生物组 ”经常被人们混用。在本文中,我们将前者定义为肿瘤组织内所有微生物(包括细菌、病毒、真菌、原生动物和古细菌)的集合,而后者包括肿瘤组织内所有微生物的基因组和产物,包括所有分泌毒素(如来自脆弱拟杆菌和具核梭杆菌的毒素)、代谢物(如短链脂肪酸)和氧化还原活性小分子(活性氧、活性氮)。
并且在本文的术语中,“肿瘤”主要是指癌症(恶性肿瘤)。尽管良性肿瘤(如子宫肌瘤)也含有微生物群,但关于良性肿瘤的微生物群和微生物组的研究较少。此外,良性肿瘤不具有转移特性,限制了对微生物组在转移中作用的探索。
▸ 肿瘤微生物的来源
肿瘤微生物群的来源可分为两类。第一类是“常驻”生物,它们栖息在人类生态位中,在正常情况下通常不会引起疾病。然而,在微生物组的整体扰动导致生态失衡(生态失调)之后,共生微生物群的比例被破坏,导致共生微生物易位,从而诱导肿瘤形成。
第二类由“外来入侵者”组成,例如致癌微生物和其他病原微生物。入侵的肿瘤微生物群可以根据入侵途径进一步分为三种类型。
(一)微生物通过粘膜屏障侵入
微生物群落栖息在人体的各种粘膜表面,形成不同的微生物组生态位。在健康状态下,微生物群保持动态平衡,调节免疫系统以抵抗外部病原体的定植,并抑制内源性微生物的致病潜力。
然而,微生物组成的破坏或这些群落的位移会导致生态位间微生物串扰,从而可能影响癌症进展。在肿瘤发生过程中,粘膜屏障的损伤(无论是由细菌还是其他因素引起)可能使粘膜微生物有机会侵入肿瘤组织,从而导致结直肠癌、胰腺癌、肺癌和宫颈癌等癌症的发展。
(二)源自邻近健康组织的微生物
一些研究发现,肿瘤组织的微生物群组成与邻近正常组织的组成非常相似。胰腺癌患者肿瘤组织和十二指肠组织之间的细菌DNA谱相似性表明胰腺组织中的细菌可能起源于十二指肠。
起源于口腔的具核梭杆菌(Fusobacterium nucleatum)可进入肠道并在结直肠癌内增殖,从而在肿瘤微环境(TME)内诱导免疫细胞激活。小鼠模型显示,具核梭杆菌通过将其粘附素Fap2与结直肠癌细胞上表达的糖分子Gal-GalNAc结合来定植结直肠癌组织,而Fap2缺陷细菌在这些小鼠中的定植受损。
同样,发现口服荧光标记的粪肠球菌(Enterococcus faecalis)从肠道转移到肿瘤外围,改变了肿瘤微生物组的基因组特征并调节免疫功能。
此外,与正常组织相比,肿瘤微环境(TME)的特点是免疫抑制和缺氧,这些条件更有利于微生物定植,因此假设肿瘤微生物群可能起源于正常组织。
(三)微生物通过血液迁移到肿瘤
血液是肿瘤微生物组的另一个潜在来源。由于肿瘤组织的丰富血管化,它们为微生物的生存和传播提供了合适的环境。红细胞在细菌易位中起着至关重要的作用,有助于免疫逃避。使用 16S rDNA 定量聚合酶链反应测定和 MiSeq 测序(16S 靶向宏基因组测序)证实了健康人血液中存在细菌,并且在红细胞中检测到的细菌 DNA 浓度高于血浆。
活细菌,如肺炎链球菌和金黄色葡萄球菌,已被证明存在于红细胞中。
源自口腔、肠道、呼吸道和其他区域的微生物可以通过血流运输到肿瘤部位,通过受损的血管浸润肿瘤。坏死肿瘤细胞碎片的趋化梯度可能引导从身体不同部位进入血液的微生物迁移到肿瘤。
例如,金黄色葡萄球菌(Staphylococcus aureus) 的肺部感染已被证明会影响乳腺癌转移。结肠中的大肠杆菌(Escherichia coli)在结直肠癌期间破坏肠道血管屏障,进入血液,随后定植于肝脏,诱导转移前生态位的形成并促进肝转移。
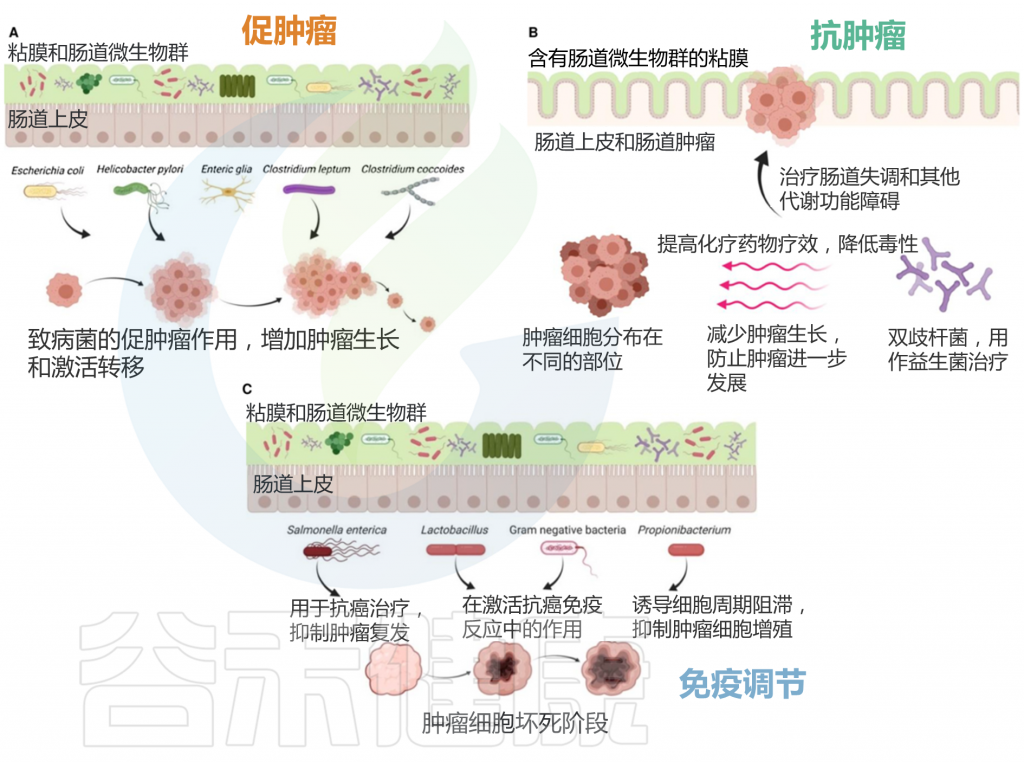
★ 不同类型的癌症微生物群组成不同
许多研究已经确定了肿瘤组织内微生物组的存在,并强调了癌症微生物群的异质性。癌症微生物群是多种多样的,癌症微生物群的组成在不同类型的癌症之间,甚至在同一癌症的不同病理亚型之间也不同。
例如厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是结直肠癌中最丰富的物种,而变形菌门(Proteobacteria)在胰腺癌的微生物群中占主导地位。肝细胞癌富含变形菌门、拟杆菌门和Patescibacteria。
不同的癌症类型承载着不同的微环境,具有不同的氧分压、血管生成能力和周围组织的微生物群,这会影响肿瘤微生物群的组成并产生肿瘤类型的异质性。
不同肿瘤类型中微生物群的组成



Ma Y,et al.Microb Pathog.2024
★ 癌症不同阶段的微生物群也存在变化
除了类型异质性外,癌症微生物群还表现出位点异质性和分期异质性。前者是指肿瘤组织和非肿瘤组织之间微生物群组成的差异,主要包括特定个体微生物的存在或生态失调。肿瘤组织中的微生物群多样性通常低于非肿瘤组织,这可能与肿瘤微环境中特定微生物的选择性扩增有关。
后者是指癌症发展不同阶段肿瘤微生物群的变化。在口腔鳞状细胞癌的进化过程中,癌前阶段(癌前病变)显示链球菌(Streptococcus)和罗氏菌(Rothia)的高富集。而在晚期癌症中,Capnocytophaga在肿瘤组织中富集。
★ 癌症微生物组与宿主之间存在双向作用
肿瘤微生物组和宿主之间的相互作用是双向的。
这种影响主要体现在两个方面:
首先,细胞内和细胞外肿瘤环境之间的生化和生物差异与细胞内和细胞外肿瘤微生物组之间的功能变化有关。例如,某些细菌可以在癌细胞侵袭过程中调节RhoA-GTP酶-Rock-肌动蛋白细胞骨架重塑途径,从而促进携带细菌的癌细胞远处转移——这是细胞内肿瘤微生物组特有的作用。
其次,肿瘤微环境对肿瘤微生物组产生选择性影响。不同微环境中血管生成、氧水平、微生物来源、内吞作用和胞饮作用活性的变化导致肿瘤内的微生物组成不同。
让我们一起来看下不同癌症中的肿瘤微生物组与宿主之间可能存在的相互作用。
结直肠癌(CRC)是全球最常见的肿瘤之一,也是与肿瘤微生物组密切相关的肿瘤之一。
菌群失调可能是结直肠癌的诱因之一
动态平衡的微生物群对人类健康有益,但菌群失调可能导致结直肠炎症、炎症性肠病,甚至结直肠癌。
一项对423名I-IV期结直肠癌患者的肿瘤组织和正常粘膜进行 16S rRNA 测序的研究发现,与正常肠粘膜相比,结直肠癌组织的α多样性降低,β多样性增加。
变形菌门、梭菌门、弯曲杆菌门在肿瘤组织中的含量增加,而拟杆菌门、厚壁菌门、疣微菌门、放线菌门和古细菌减少。
有益菌和有害菌在结直肠癌环境中的作用
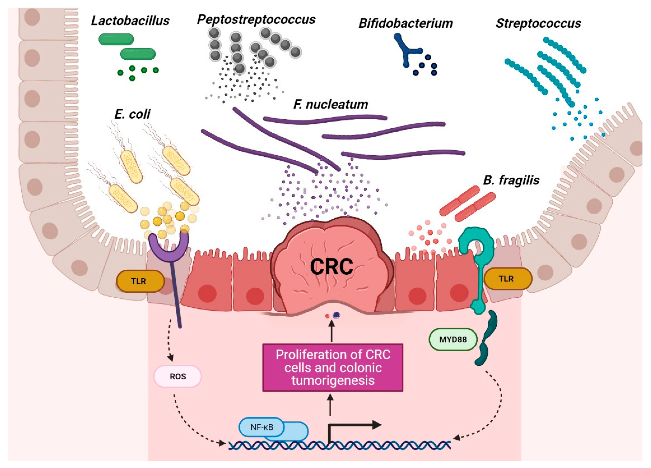
Torres-Maravilla,et al.Microorganisms.2021
产生毒素的特定细菌诱导肿瘤的进展
结直肠癌患者富含特定菌群,包括产生肠毒素的脆弱拟杆菌(B.fragilis)、肝螺杆菌(Helicobacter hepaticus)、败血梭菌(Clostridium septicum)、粪肠球菌(Enterococcus faecalis)、具核梭杆菌(F.nucleatum)、大肠杆菌、无乳链球菌和幽门螺杆菌。
这些细菌可通过释放破坏宿主细胞基因组的毒素,激活STAT3、NF-κB、Wnt和SREBP-2途径、诱导COX-2表达、与TRL2和TRL4相互作用、刺激促炎细胞因子(IL-1β、IL-6、IL-8、IL-17、TNF-α和IFN-γ)产生、调节NLRP3炎症体活性,通过氧化应激活性氧(ROS)和活性氮(RNS)DNA损伤来促进肿瘤中炎性微环境的形成并导致免疫逃逸来影响肿瘤的发展。
由于肿瘤粘膜微生态中的病原体网络与肿瘤突变和代谢特征相关,我们预计肿瘤微生物群组成的分析可以预测接受切除的结直肠癌患者的预后。
肺癌是常见的恶性肿瘤之一,肺癌的发生与下呼吸道以及口腔、鼻腔、胃肠道的微生物群密切相关。
肺癌患者中Gemmiger、Blautia等菌增加
普雷沃氏菌属(Prevotella)、链球菌属(Streptococcus)和韦荣氏球菌属(Veillonella)常见于口腔中,在肺癌中的含量增加。
并且与良性肺病患者相比,肺癌患者发现的菌群之间存在高度差异,Capnocytophaga、Sediminibacterium、吉米菌(Gemmiger)、Blautia和颤螺菌属(Oscillospira)这几个细菌相对丰富。
与肺癌可能相关的微生物
从全球角度来看,假单胞菌、链球菌、葡萄球菌、韦荣球菌属和莫拉克斯氏菌属经常被报道为与肺癌最相关的微生物群。

Liu NN,et al.NPJ Precis Oncol.2020
通过qPCR确定,二氧化碳嗜纤维菌(capnocytophaga)和韦荣氏球菌在肺癌患者的唾液样本中含量更高,而奈瑟菌属的丰度相对较低,它们有可能用作肺癌早期检测的生物标志物和微生物组治疗的靶标。
对30项相关研究的荟萃分析发现,肺部感染结核分枝杆菌、非结核分枝杆菌和其他病原体会增加患肺癌的风险。
胰腺癌是一种主要起源于胰腺导管上皮及腺泡细胞的恶性肿瘤,起病隐匿,早期诊断困难,进展迅速,生存时间短,是预后最差的恶性肿瘤之一,被称为“癌中之王”。
胰腺中存在细菌,胰腺癌患者细菌更多
胰腺以前被认为是一个完全无菌的器官。然而,在2017年,在人胰腺癌组织中发现了γ-变形杆菌。随后,其他研究通过 16S rRNA 测序、NGS 和免疫荧光鉴定了胰腺癌中的肠杆菌科、假单胞菌属和变形杆菌科等细菌。
用16S rRNA基因特异性PCR对胰腺囊肿标本进行分析,发现优势菌:氨基酸球菌属(Acidaminococcus),埃希氏菌属(Escherichia),拟杆菌属(Bacteroides),志贺氏菌(Shigella)。
最近,对胰腺癌样本进行的16S rRNA荧光探针和qPCR实验都证实,与正常人相比,胰腺癌患者中存在的细菌约为正常人的1000倍。
肿瘤微生物可引发炎症,促进胰腺癌变
此外,胰腺组织中的真菌组相比正常组织富集度增加了3000倍,主要成分为马拉色菌(Malassezia)。研究表明,马拉色菌属激活并结合甘露糖结合凝集素(MBL)蛋白,触发诱导胰腺癌的补体级联反应。
此外,肿瘤微生物组中的代谢物可以引发炎症和免疫抑制反应,并产生有利于肿瘤进展的免疫抑制微环境,促进胰腺癌变。
微生物组与胰腺癌发生的关系
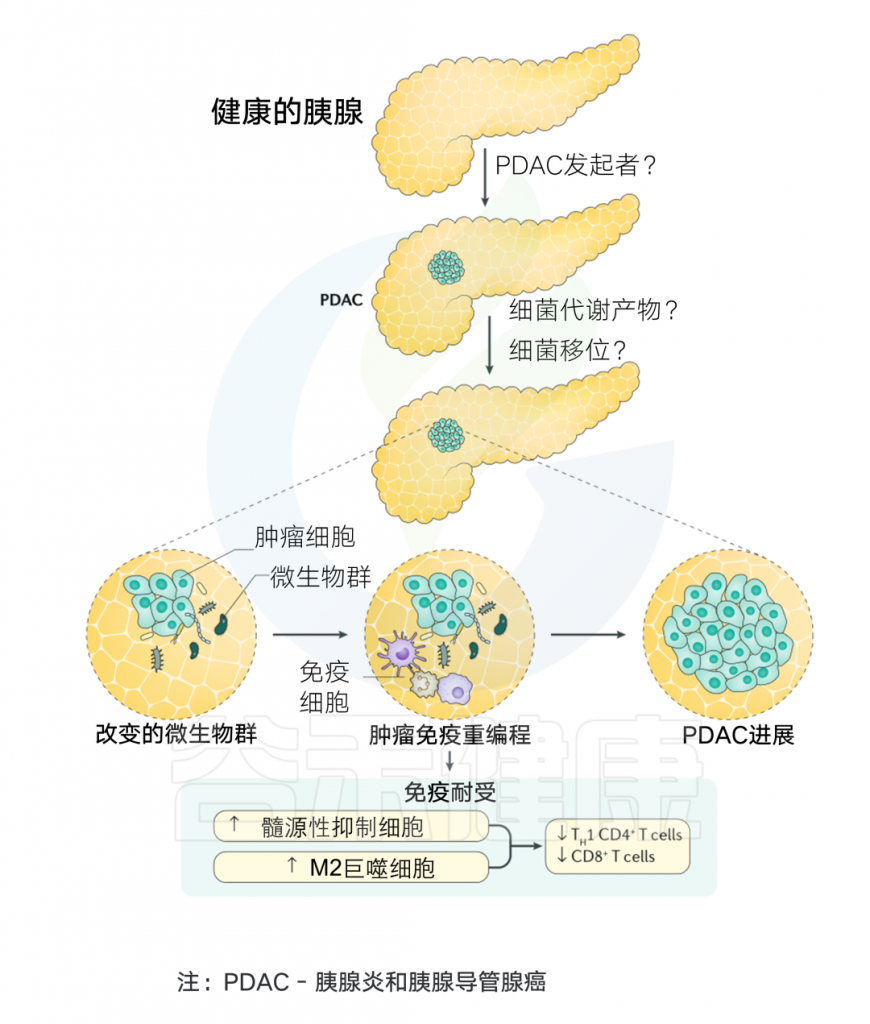
Thomas R M, et al.Nature Reviews Gastroenterology & Hepatology.2019
乳腺癌是常见的癌症之一,也是全球女性癌症相关死亡的主要原因。
乳腺癌组织中的微生物稳态受到破坏
与正常乳腺组织相比,乳腺癌组织中的细菌 DNA 总水平较低,并且这些水平随着癌症的进展而持续下降,这表明癌症可能会破坏微生物组稳态。此外,已经确定肠道微生物群中预先存在的干扰增加了乳腺癌细胞转移,但还需要更多的研究来确定这些发现在临床环境中的相关性。
进一步表征乳腺组织中的正常微生物群和乳腺癌组织中的群落结构变化,可能会确定乳腺癌预防和诊断的新靶点。
阴道微生物组影响卵巢癌、子宫内膜癌和宫颈癌的发生和进展。研究表明,阴道细菌多样性的增加和乳杆菌丰度的降低可能导致持续的HPV感染。
阴道微生物组与HPV感染、宫颈上皮内瘤变相关
评估了250名女性的阴道菌群,证明了阴道微生物组、HPV感染与宫颈上皮内瘤变之间存在联系。阴道微生物群以阴道加德纳菌为主,其次是 Lactobacillus iners、Lactobacillus crispatus、Lactobacillus taiwanensis。
与健康女性相比,子宫肌瘤(UF)患者的宫颈和阴道微生物群相互作用和相对微生物丰度发生了改变。Erysipelatoclostridium、Mucispirillum、Finegoldia相对丰富,而Finegoldia的丰度降低,这表明子宫肌瘤患者可能存在宫颈和阴道微生物群的生态失调。
促炎微生物群与前列腺癌有关
前列腺癌是男性人群中常见的癌症,前列腺癌和非前列腺癌患者的尿液测序显示,促炎微生物群与泌尿生殖系统感染和前列腺癌有关。
研究报告了前列腺癌中促炎拟杆菌和链球菌丰度的显著差异,叶酸和精氨酸途径显著改变。对前列腺肿瘤微环境的分析显示,与非肿瘤组织相比,肿瘤/肿瘤周围组织中的葡萄球菌(Staphylococcus)明显更多,而丙酸菌属(Propionibacterium)在所有测试的肿瘤/肿瘤周围和非肿瘤组织中最为丰富。
病例对照研究还发现,良性对照受试者和前列腺癌男性的肠道微生物组的组成有很大不同,这可能适应前列腺癌的发病机制和对其危险因素的进一步研究。特别是,与对照组相比,前列腺癌病例中Bacteroides massiliensis的相对丰度较高,而对照组中普氏栖粪杆菌(Faecalibacterium prausnitzii)和直肠真杆菌(Eubacterium rectalie)的相对丰度较高。
超过700种不同的微生物定植于人类口腔,健康人的口腔微生物群保持相对稳定。而口腔癌患者的口腔微生物群发生了变化。
口腔癌患者丰度和多样性比正常人群更高
对121例患者的分析显示,与健康个体相比,口腔癌患者的戴阿利斯特杆菌属(Dialister)含量显著增加,放线菌属、乳酸菌属和链球菌属丰度显著降低。牙龈卟啉单胞菌和核镰刀菌等主要牙周病原菌的慢性感染可增强IL-6-STAT3 轴信号传导并诱导口腔鳞状细胞癌。
使用16S rDNA测序来表征口腔鳞状细胞癌(OSCC)组织的微生物群,肿瘤部位细菌的丰度和多样性显著高于来自同一患者的正常组织样本。在OSCC样本中检测到梭杆菌属、卟啉单胞菌属、消化链球菌科、Flavobacteriaceae、Prevotellaceae和Campylobacteraceae,可能是诊断标志物和治疗靶点。
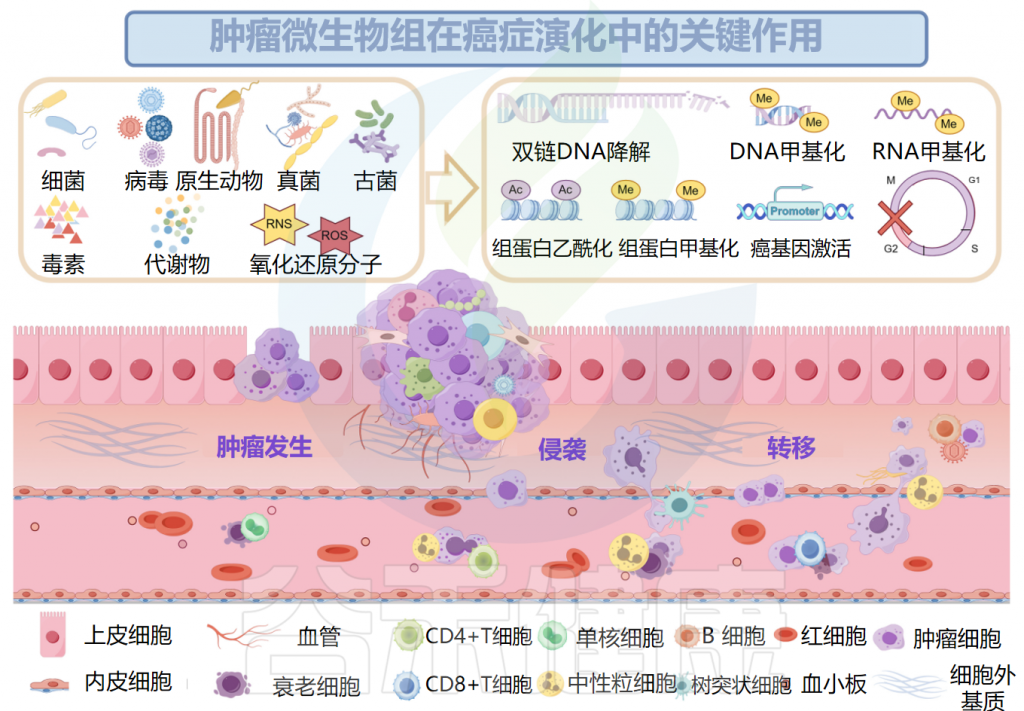
肿瘤微生物组与肿瘤发生、发展和转移密切相关,研究人员认为可以将多态性微生物组列为肿瘤的标志。接下来,我们将讲述肿瘤微生物组与肿瘤之间关系的代表性机制。
肿瘤微生物组与肿瘤密切相关
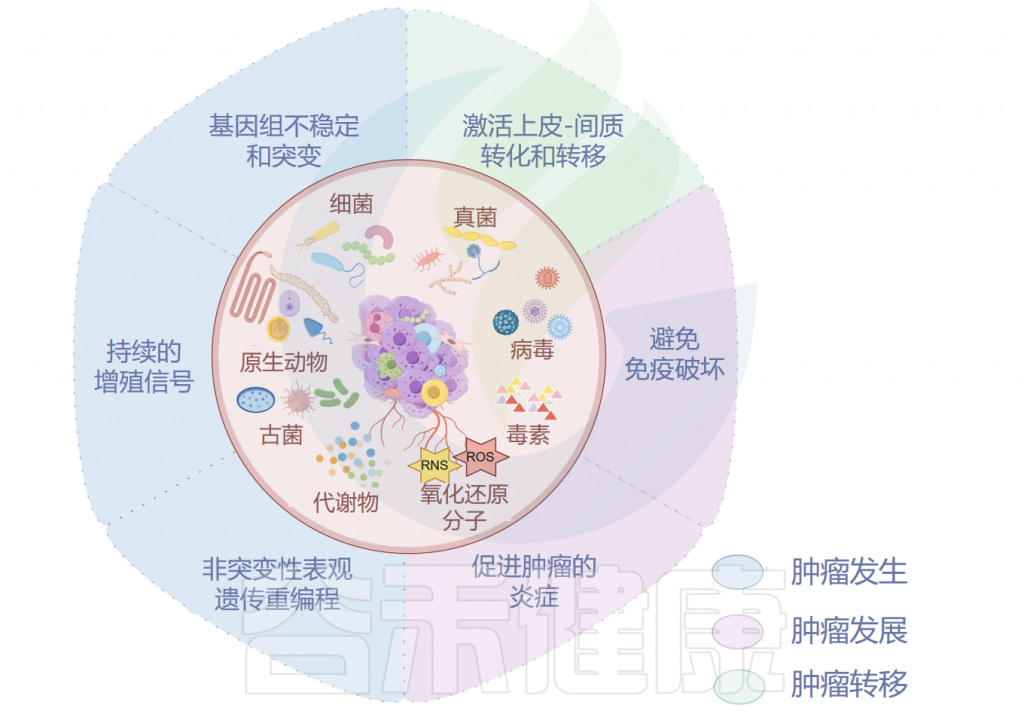
Ma Y,et al.Microb Pathog.2024
▸ 与肿瘤发生之间的关系
已被证明有助于肿瘤发生的肿瘤微生物组成分包括毒素、代谢物、酶和触发氧化应激的反应性小分子。这些物质可通过诱导基因组不稳定、表观遗传修饰和刺激宿主细胞的持续增殖而导致癌症。
细菌产生的毒素破坏基因稳定性并导致氧化应激
例如,由聚酮合酶阳性(pks+)大肠杆菌产生的大肠杆菌素和空肠弯曲菌分泌的细胞致死性膨胀毒素(Cdt)具有DNA酶活性,可以直接降解双链DNA,也可以导致DNA烷基化,从而在表观遗传水平上破坏基因组的稳定。
毒素介导的对DNA结构的间接损伤也可能是由反应性小分子的失衡引起的,例如脆弱拟杆菌毒素(BFT),它通过增加活性氧(ROS)的水平来诱导宿主细胞中的氧化应激。
此外,许多研究证实了肿瘤发生与癌微生物群产生的代谢物之间的联系。黄曲霉毒素B1(AFB1)是黄曲霉的代谢产物,可与DNA中的鸟嘌呤残基形成DNA加合物并诱导DNA损伤,最终致癌。在肝脏中,细胞色素P450酶参与AFB的代谢,它经历环氧化并转化为具有遗传毒性的8,9-环氧化物。8,9-环氧化物随后形成DNA加合物并促进突变,导致肝细胞癌的发展。
丁酸表达异常可能导致上皮细胞过度增殖
丁酸盐是一种短链脂肪酸,由结肠中的细菌发酵可溶性纤维衍生而来,是首选的宿主能量底物,可抑制结肠癌的发展。
丁酸抑制组蛋白脱乙酰酶(HDACs)和 DNA 修复蛋白的表达,在表观遗传水平上调节细胞增殖和凋亡,并减轻淋巴瘤。然而,在错配修复缺陷(dMMR)小鼠模型中,丁酸与结肠上皮细胞的过度增殖有关。
除了遗传起源外,表观遗传,包括由DNA甲基化、组蛋白甲基化和组蛋白乙酰化驱动的表观遗传,可以驱动宿主细胞恶性转化为癌细胞。
致癌微生物会驱动肿瘤的发生
EB病毒(EBV),也称为人类疱疹病毒4型(HHV-4),是一种致癌病毒,可诱导表观遗传变化以驱动肿瘤发生。溶原性EBV可诱导基因组不稳定并改变免疫逃逸,而潜伏的EBV有助于肿瘤细胞获得干性。
注:肿瘤干性被认为是肿瘤发展的关键组成部分
具核梭杆菌(F.nucleatum)通过钙黏附蛋白(E-cadherin)和粘附A蛋白(FadA)与癌细胞或免疫细胞结合,并激活β-catenin和Wnt信号通路以促进癌细胞增殖。
微生物组产生的炎症反应会增加对肿瘤的易感性
肿瘤微生物组产生炎症反应,以增加宿主对肿瘤的易感性。肿瘤微生物群的抗原表位被肿瘤微环境(TME)中的模式识别受体(如Toll样受体)识别,并导致活性氧、细胞因子和趋化因子等炎症介质的诱导,触发促进血管生成、癌细胞增殖以及肿瘤生长和进展的信号级联反应。
口腔牙龈卟啉单胞菌在癌症和胰腺导管腺癌中定植,促进CXCR2介导的中性粒细胞浸润,增强中性粒细胞弹性蛋白酶分泌,重塑肿瘤的炎症微环境,从而导致癌症进展。结直肠癌中,牙龈卟啉单胞菌激活造血NLRP3炎症小体,招募髓细胞,创造促炎微环境,与结直肠癌的发展和不良预后相关。
Ma Y,et al.Microb Pathog.2024
!
代谢物可能促癌也可能抑制癌症
重要的是要注意,代谢物的活性取决于肿瘤类型。色氨酸是变形杆菌和放线菌的能量来源,其代谢衍生物吲哚-3-醛激活肿瘤相关巨噬细胞中的芳烃受体(AHR),改变炎症基因的表达,随后可能诱发结直肠癌。
相反,在黑色素瘤中,罗伊氏乳杆菌代谢产生的吲哚-3-醛通过IFN-γ激活CD8+T 细胞中的AHR并增强免疫检查点抑制剂的疗效,从而促进肿瘤治疗。
▸ 与肿瘤发展之间的关系
肿瘤微生物群及其结构成分调节宿主代谢和免疫力,从而影响肿瘤的发展。
抑制自然杀伤细胞并促进肿瘤发展
除了激活长链非编码RNA ENO1-IT1的转录并影响组蛋白修饰外,具核梭杆菌(F.nucleatum)还调节结直肠癌细胞中的糖酵解途径,抑制自然杀伤细胞的活性并促进肿瘤发展。
肿瘤微生物的作用在不同肿瘤中可能有所不同,而不同生物体也可能在肿瘤中产生相同的生理效应。
例如,食管癌中的具核梭杆菌(F.nucleatum)以趋化因子(CCL20)依赖性方式促进Treg淋巴细胞浸润到肿瘤中,从而增强了肿瘤的侵袭性。在结直肠癌中,具核梭杆菌通过CCL20诱导巨噬细胞M2型极化参与肿瘤转移。
口腔鳞状细胞癌(OSCC)是一种起源于口腔粘膜复杂鳞状上皮的恶性肿瘤。具核梭杆菌激活自噬途径可促进体内癌细胞的迁移和侵袭。
同样,产气荚膜梭菌肠毒素诱导紧密连接蛋白Claudin 4(CLDN4)的核转位,增强OSCC细胞的增殖、迁移和侵袭,抑制YAP1磷酸化,促进YAP1表达以驱动肿瘤进展。
▸ 与肿瘤转移之间的关系
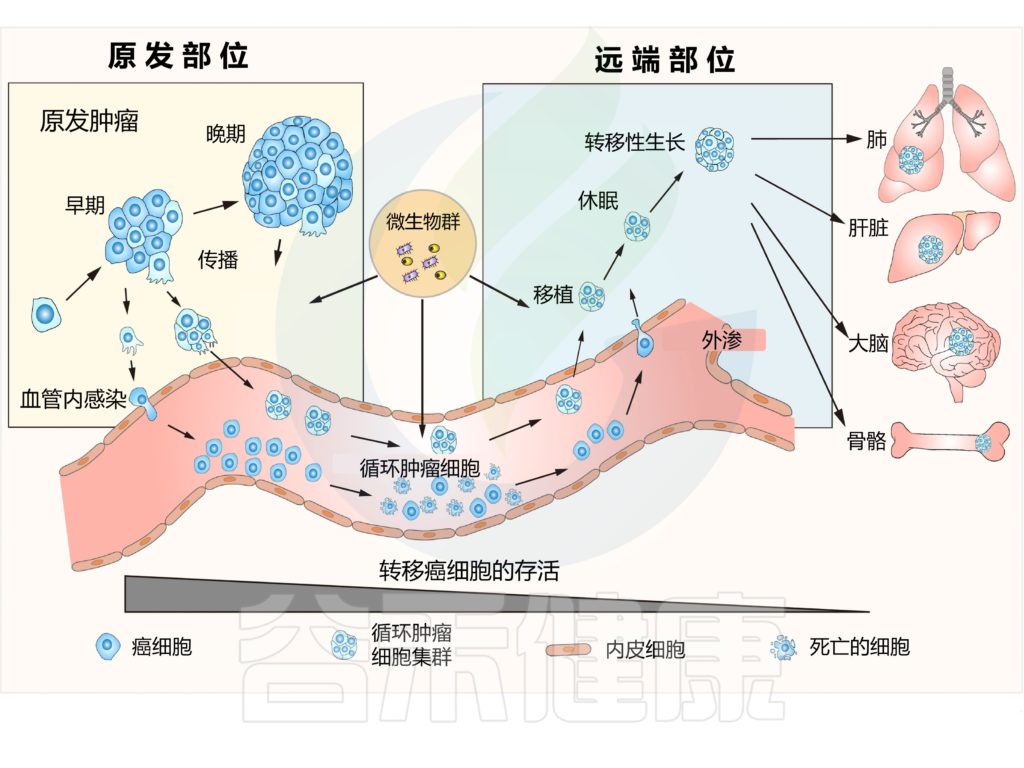
癌症转移是指肿瘤从原发部位迁移到远端器官的复杂过程,形成继发性肿瘤,是恶性肿瘤的一个重要标志。在发现癌微生物组作为肿瘤成分后,多项研究表征了癌微生物组在肿瘤转移中的作用。
调节上皮-间充质转化的激活
上皮-间充质转化(EMT)是将上皮细胞转化为间充质细胞的过程,其特征是细胞间极性和粘附丧失,运动和迁移增加。EMT的激活是肿瘤适应恶劣环境以促进侵袭和转移的关键策略,也可以由肿瘤微生物组调节。
在口腔癌小鼠模型中,具核梭杆菌(F.nucleatum)分泌的外膜囊泡调节EMT相关蛋白的表达,上调波形蛋白和神经钙网蛋白(N-cadherin)的表达,下调E-钙网蛋白(E-cadherin)的表达,从而促进口腔癌转移。
白色念珠菌是口腔癌菌群的主要组成部分,分泌蛋白酶诱导上皮细胞整合素的变化,增加E-钙粘蛋白表达,增强口腔癌的EMT表型,并促进侵袭和转移。
定植于乳腺导管腺癌的产肠毒素脆弱拟杆菌(ETBF)分泌的毒素可影响 Slug 和 Twist(EMT 标志物)的表达,并激活 β-catenin 和 Notch1 信号通路,促进肿瘤转移。
驱动细胞因子产生刺激癌细胞增殖和迁移
在胰腺癌中,具核梭杆菌(F.nucleatum)通过Fap-2依赖性途径靶向胰腺癌细胞紧密连接。这种相互作用驱动细胞因子的产生,这些细胞因子刺激癌细胞增殖并促进通过自分泌和旁分泌途径的迁移,最终驱动恶性肿瘤进展。
此外,紧密连接的破坏会激活YAP信号转导,从而抑制FOXD3的表达,从而降低m6A甲基转移酶甲基转移酶样3(METTL3)的表达。这随后降低了m6A甲基化,并促进了靶驱动蛋白家族成员26B的表达,从而驱动结直肠癌转移。
分泌细胞外囊泡,促进胰腺癌转移
最后,胰腺肿瘤微生物群可以分泌小的细胞外囊泡(sEVs),这些囊泡重塑细胞外基质,促进血管生成,并形成转移前生态位,促进胰腺癌转移。
与转移相关的肿瘤微生物群的研究

doi.org/10.1016/j.tcb.2022.11.007
对肿瘤微生物组及其异质性的研究发现了其在肿瘤诊断、预防和治疗方面的重要作用。
★ 有助于作为早期癌症的诊断标志物
迄今为止的研究表明,肿瘤微生物组可用作早期癌症诊断的标志物。幽门螺杆菌、梭杆菌、肠球菌属、沙门氏菌属、假单胞菌属和双歧杆菌属在特定的肿瘤部位富集,它们的检出可能用于诊断。
例如在原发性人类结肠癌和远处转移中检测到梭杆菌门(Fusobacteria),而使用甲硝唑抗生素治疗可以消除梭杆菌,并减缓肿瘤生长速度。
肝脏中Stenotrophomonas maltophilia丰度的增加诱导了肝星状细胞的细胞衰老相关的分泌表型(SASP),从而促进了肝癌发生。
微生物组对肿瘤细胞和免疫细胞的特异性机制
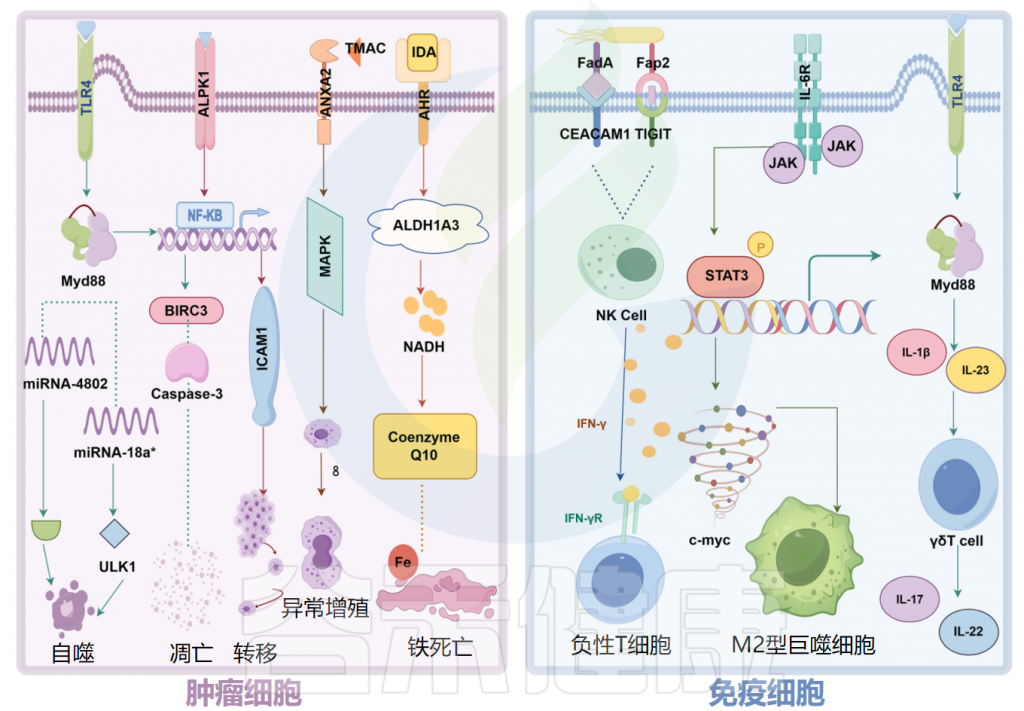
Ma Y,et al.Microb Pathog.2024
测序技术的广泛使用大大提高了我们研究肿瘤微生物组的能力。这些测序技术包括16S rRNA测序、DNA测序、下一代测序技术(NGS)、表观遗传学测序(例如染色质免疫沉淀测序和DNA/RNA甲基化测序)和三维(3D)基因组技术。
肿瘤内微生物的生物量相对较低,这导致了多路复用16S rRNA 测序方案的开发,以最大限度地减少污染并准确表征癌微生物组。
例如,利用qPCR和16S测序技术从肿瘤组织获取测序数据,并构建了一个表征肿瘤微生物组的数据库,实现了检测灵敏度103-104每克组织对应的细菌数。
宏基因组是一种针对样本中所有DNA的非靶向测序方法,包括微生物群落的全基因组序列,广泛应用于复杂微生物组的分析。宏基因组的分辨率更高,可以达到物种甚至菌株水平。此外,宏基因组学可以提供功能信息。最近的研究表明,宏基因组数据涵盖了更多类型的癌症,这可能促进肿瘤内微生物群领域的新进展。
代谢组学,特别是质谱法,可以检测和表征人类微生物群产生的小分子,并了解这些微生物代谢物的功能作用。这提高了我们研究肿瘤微生物群的能力,并可能开发出非侵入性的诊断性肿瘤生物标志物。
微生物产生的多种细胞毒性代谢物在肿瘤发生和发展中起着至关重要的作用。单一的实验技术可能不足以完全解释肿瘤和微生物之间的复杂相互作用,需要基因组学、转录组学、蛋白质组学和代谢组学的组合来了解各种代谢物在调节肿瘤发生和发展中的作用。
肿瘤微生物组检测技术

Ma Y,et al.Microb Pathog.2024
▸ 微生物组在癌症治疗中的作用
现有的癌症疗法很多,化疗、放疗等方式虽然有效,但副作用较多;免疫疗法有其局限性,有效率低且针对癌症类型有限。
靶向肿瘤微生物组的治疗方法可能通过增强宿主抗肿瘤免疫、诱导肿瘤细胞焦亡、促进CD8+ T 细胞活性以及避免干扰健康组织及其相关微生物群来改善肿瘤的治疗。
肿瘤微生物组在肿瘤治疗中的应用
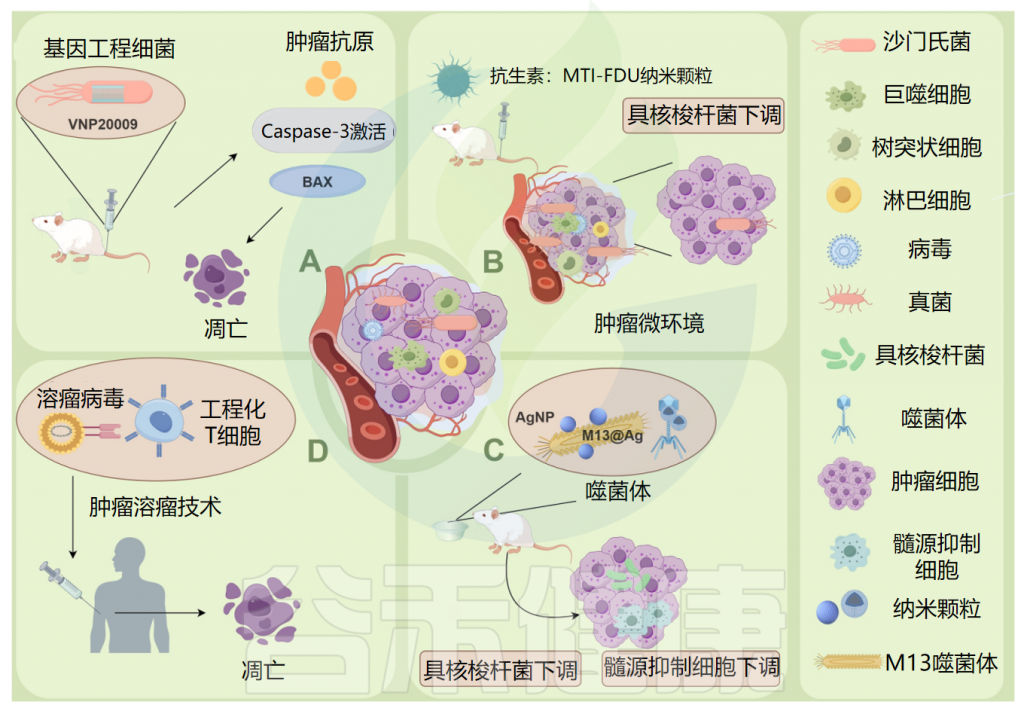
Ma Y,et al.Microb Pathog.2024
例如:(A)将基因工程减毒细菌菌株VNP20009直接递送到肿瘤发生部位,以及caspase-3凋亡酶活性的增加和促凋亡蛋白 Bax 的表达,显著诱导小鼠胰腺肿瘤细胞坏死,可作为杀死胰腺肿瘤的有效药物。
(B)甲硝唑-氟尿嘧啶利用增强的渗透性和保留作用,靶向肿瘤中的微生物群和肿瘤细胞,可以有效地从结直肠癌癌症组织中去除具核梭杆菌(F.nucleatum),具有低毒性和副作用。
(C)ONCOTECH(溶瘤病毒T细胞嵌合体)递送技术不仅增强了溶酶体病毒的靶向递送,而且改善了肿瘤微环境,能够在肿瘤中诱导长期免疫记忆。
(D)M13噬菌体特异性结合具核梭杆菌,在其表面外壳蛋白上静电组装银纳米粒子(AgNP)(M13@Ag),从肿瘤中去除具核梭杆菌,导致肿瘤部位髓系衍生抑制细胞(MDSC)减少。
除此之外,许多研究和谷禾的检测数据发现肠道微生物群可以调节癌症治疗,针对性地提高治疗效果并预防不良反应。
减轻化疗副作用,提高治疗效果
一些证据清楚地表明,调节肠道菌群可以减轻化疗药物的副作用,提高治疗效果。

减轻放疗毒性
在进行异基因造血干细胞移植预处理过程中,观察到患有白血病的患者的粪便样本中存在着毛螺菌科(Lachnospiraceae)和肠球菌科(Enterococcaceae)。这些患者在接受全身放疗治疗时出现的肠道毒性较轻。
几项研究表明,产生短链脂肪酸的益生菌,如乳酸杆菌和双歧杆菌,可以预防全身放疗治疗毒性。可能对癌症免疫和治疗毒性产生复杂影响,包括粘膜保护作用,部分由ANGPTL4、IL-18和IL-22的诱导介导,以及通过Treg细胞诱导和抑制树突状细胞功能介导的对立的免疫调节效应。
影响免疫疗法的效果
当前的癌症免疫疗法集中于利用特异性抗体来自我调节癌症免疫周期,这确保了应答的传播而没有生物中断。
微生态的改变会中断和削弱化学信号,导致致病状态,包括与炎症相关的疾病和癌症。
肠道微生物群对抗癌免疫反应的调节活性也与通过微生物群影响PD-L1和CTLA-4抑制剂的疗效有关。当与双歧杆菌的口服给药相结合时,PD-L1特异性抗体疗法的给药可以显著调节肿瘤的发展,在小鼠模型中肿瘤的生长几乎被消除。
我们预计肿瘤微生物组的研究将继续引起关注。然而,肿瘤微生物组在肿瘤预防和诊断中的应用,还存在着一些挑战。包括以下几点:
(一)人类微生物组在健康人群中的差异
同一个体在不同年龄的微生物组组成是可变的,更不用说不同个体中的微生物组成差异。部分原因是微生物组受饮食习惯、生活环境、药物暴露、生活方式和其他因素的影响。
因此,一个重大的挑战是根据微生物组的变化来确定个体的健康状况和癌症风险。未来,研究应探索肿瘤微生物组与环境、饮食和个人因素之间的相互作用。
(二)肿瘤微生物组的内容非常多样化
迄今为止已发表的大多数研究主要集中在细菌组上,而分析真菌组或病毒组的研究较少。此外,缺乏关于微生物组在非粘膜器官来源的肿瘤发展中的作用的数据。对肿瘤微生物组中微生物之间的关系也了解有限。例如,目前尚不清楚肿瘤微生物组中不同种类的细菌和真菌以及不同的病毒家族是相互独立的、协同的还是拮抗的。
(三)缺乏微生物代谢物等机制细节
尽管一些研究已经阐明了微生物改变肿瘤发生和发展的机制,但大多数仅具有相关性,缺乏与肿瘤发生因果关系的直接证据。特别是,其中许多研究无法确定微生物在肿瘤中定植的时间点。并且缺乏机制细节,主要集中在微生物种类的检测上,而忽略了分泌的毒素、代谢物和其他产物的功能。
未来的临床进展需要更精确地鉴定细菌分类单元对癌症早期诊断和治疗的因果关系,并了解其作用机制,因此需要进行更广泛的试验。改进的细菌可能作为抗癌药物,甚至可被改造成“微型机器人”用于药物传递。
总体而言,这一领域的发展为癌症患者提供了新的治疗选择和希望,但也需谨慎评估和监测以确保安全性和有效性。
微生物群在开发癌症诊断和抗癌策略中的重要性和潜力值得强调,将微生物调节疗法纳入癌症管理的整体方法很有必要。未来,我们有望实现更精准和个性化的菌群调节策略,为癌症治疗带来更大突破。
主要参考文献
Ma Y, Chen T, Sun T, Dilimulati D, Xiao Y. The oncomicrobiome: New insights into microorganisms in cancer. Microb Pathog. 2024 Oct 29;197:107091.
Azevedo MM, Pina-Vaz C, Baltazar F. Microbes and Cancer: Friends or Faux? Int J Mol Sci. 2020 Apr 28;21(9):3115.
Wong-Rolle A, Wei HK, Zhao C, Jin C. Unexpected guests in the tumor microenvironment: microbiome in cancer. Protein Cell. 2021 May;12(5):426-435.
Gagliani N, Hu B, Huber S, Elinav E, Flavell RA. The fire within: microbes inflame tumors. Cell. 2014 May 8;157(4):776-83.
Nejman D, Livyatan I, Fuks G, Gavert N, Zwang Y, Geller LT, Rotter-Maskowitz A, Weiser R, Mallel G, Gigi E, Meltser A, Douglas GM, Kamer I, Gopalakrishnan V, Dadosh T, Levin-Zaidman S, Avnet S, Atlan T, Cooper ZA, Arora R, Cogdill AP, Khan MAW, Ologun G, Bussi Y, Weinberger A, Lotan-Pompan M, Golani O, Perry G, Rokah M, Bahar-Shany K, Rozeman EA, Blank CU, Ronai A, Shaoul R, Amit A, Dorfman T, Kremer R, Cohen ZR, Harnof S, Siegal T, Yehuda-Shnaidman E, Gal-Yam EN, Shapira H, Baldini N, Langille MGI, Ben-Nun A, Kaufman B, Nissan A, Golan T, Dadiani M, Levanon K, Bar J, Yust-Katz S, Barshack I, Peeper DS, Raz DJ, Segal E, Wargo JA, Sandbank J, Shental N, Straussman R. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science. 2020 May 29;368(6494):973-980.
Poore GD, Kopylova E, Zhu Q, Carpenter C, Fraraccio S, Wandro S, Kosciolek T, Janssen S, Metcalf J, Song SJ, Kanbar J, Miller-Montgomery S, Heaton R, Mckay R, Patel SP, Swafford AD, Knight R. Microbiome analyses of blood and tissues suggest cancer diagnostic approach. Nature. 2020 Mar;579(7800):567-574.
Narunsky-Haziza L, Sepich-Poore GD, Livyatan I, Asraf O, Martino C, Nejman D, Gavert N, Stajich JE, Amit G, González A, Wandro S, Perry G, Ariel R, Meltser A, Shaffer JP, Zhu Q, Balint-Lahat N, Barshack I, Dadiani M, Gal-Yam EN, Patel SP, Bashan A, Swafford AD, Pilpel Y, Knight R, Straussman R. Pan-cancer analyses reveal cancer-type-specific fungal ecologies and bacteriome interactions. Cell. 2022 Sep 29;185(20):3789-3806.e17.
El Tekle G, Garrett WS. Bacteria in cancer initiation, promotion and progression. Nat Rev Cancer. 2023 Sep;23(9):600-618.

谷禾健康

植物多酚是一大类生物活性化合物,其特点是化学和结构特性不同、生物利用度低,并具有多种体外生物活性。在这些化合物中,木脂素因其类固醇类似物的化学结构而受到广泛研究,被认为是植物雌激素。
木脂素是一类与纤维相关的化合物,存在于许多植物家族和常见食物中,包括谷物、坚果、种子、蔬菜以及茶、咖啡或葡萄酒等饮品中。膳食木脂素浓度最高的食物是亚麻籽和芝麻,其中含有一种叫做松脂素二葡萄糖苷的化合物。其他膳食木脂素包括芝麻素、松脂醇、松脂素和落叶松脂素。
肠道细菌代谢能够将膳食木脂素转化为治疗相关的多酚(即肠木脂素),例如肠内酯和肠二醇。这些肠木脂素具有多种生物活性,包括组织特异性的雌激素受体激活、抗炎和促凋亡作用。因此,木脂素与肠道菌群的相互作用,不仅关系到个体对特定食物的响应,也关系到整体健康和疾病预防。
肠木脂素的生物利用度在个体间存在很大差异,受遗传、饮食和生活方式等因素影响。
流行病学研究发现木脂素可降低心血管疾病的风险,并具有针对各种肿瘤(如乳腺癌、结肠癌和前列腺癌)和/或心血管疾病的化学预防特性。
与其他多酚一样,木脂素在被全身吸收之前先被肠道细菌代谢。饮食等因素已被证明会影响微生物群的组成。植物性饮食者的微生物群在微生物多样性方面与非素食者存在很大差异,从而影响代谢物的产生和提取效率。
约 80% 的木脂素相关论文发表于 2000 年之后,其中约一半发表于 2010 年或之后;这清楚地表明在过去 20 年里人们对这一天然产物家族的兴趣显著增长。此外,亚麻、五味子、连翘的整体重要性在木脂素的文献分析中显而易见。许多论文不仅局限于植物生物学,还集中在药理学(约四分之一)和化学(约四分之一)上。
本文主要讲述了木脂素的多方面特性,包括其在自然界中的分布、如何通过肠道细菌的代谢转化,讨论了木脂素在降低某些疾病风险中的潜在作用,尤其是在乳腺癌、结直肠癌和前列腺癌的预防中。同时,也探讨了影响木脂素代谢的个体间差异因素,如性别、饮食习惯和生活方式等。了解这些可以为个性化的医学和营养方案提供更好的指导。
根据其来源,木脂素大致可分为:
植物木脂素主要在对位含有氧取代基,而哺乳动物木脂素则在间位具有羟基。这种细微的结构差异,决定了它们在生物体内的不同作用和代谢途径。
木脂素在结构上类似于木质素,木质素是三维聚合物,与纤维素、半纤维素和果胶交织在一起,形成植物细胞的坚固细胞壁。此外,木脂素和木质素都是通过相同的初始苯丙烷途径产生的,它们是由单木质素(来源于苯丙氨酸或酪氨酸)合成的,但最终进入不同的生化途径。实际上,尽管木质素在植物界无处不在,但并非所有植物都会产生木脂素。
已知来自食用植物的糠醛型木脂素,包括落叶松树脂醇、开环异落叶松树脂醇、马泰尔树脂醇和松脂醇,可被肠道微生物群转化为哺乳动物木脂素、肠二醇或肠内酯。与木质素前体相比,这些细菌副产物对人类健康更有益。
肠木脂素(哺乳动物木脂素)也是食物木脂素的代谢产物,是人类肠道细菌的产物。它们经常在人类血浆和尿液中被检测到。
作为食物成分,木脂素存在于大多数富含纤维的植物中:
常见食物中木脂素(以苷元形式)的每份和
100克(鲜重)总微克含量及其分布及其植物来源
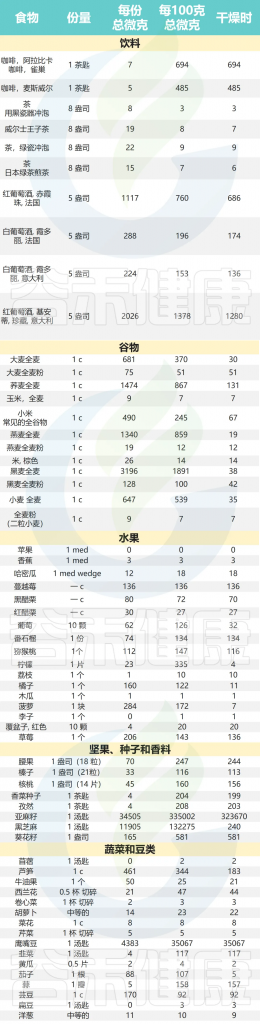
Peterson J, Nutr Rev. 2010 (10):571-603.
食物中的木脂素含量通常较低,一般不超过2毫克/100克。芝麻和亚麻籽是例外,它们的木脂素含量比其他食物来源高出几倍。
亚麻籽来源于亚麻科植物亚麻(Linum usitatissimum L.),其含有的生物活性成分可能对健康有益,例如 α-亚麻酸(占总脂肪酸组成的 50–55%)、膳食纤维(25–28%)和酚类化合物。
亚麻籽是已知最丰富的木脂素来源 [ 9–30 毫克/克(约 301 毫克/100 克)],木脂素产量是谷物、豆类、其他油籽、蔬菜和水果的 75–800 倍。亚麻籽中存在的主要膳食木脂素是开环异落叶松树脂酚(2,3-双(3-甲氧基-4-羟基苄基)丁烷-1,4-二醇),它以共轭 SDG 的形式储存,是植物中线性酯键复合物的组成部分。
芝麻(Sesamum indicum L.)是一种开花植物,属于胡麻科。芝麻籽中的木脂素浓度相对较高(接近29mg/100g,主要是松脂素和落叶松脂素)。芝麻素是一种呋喃型木脂素,是芝麻中的主要木脂素成分之一,在种子中的含量为 0.1–0.5%。
芝麻素还可以通过肠道微生物群转化为哺乳动物木脂素,这可能对乳腺癌等激素相关疾病具有保护作用。
木脂素的健康益处
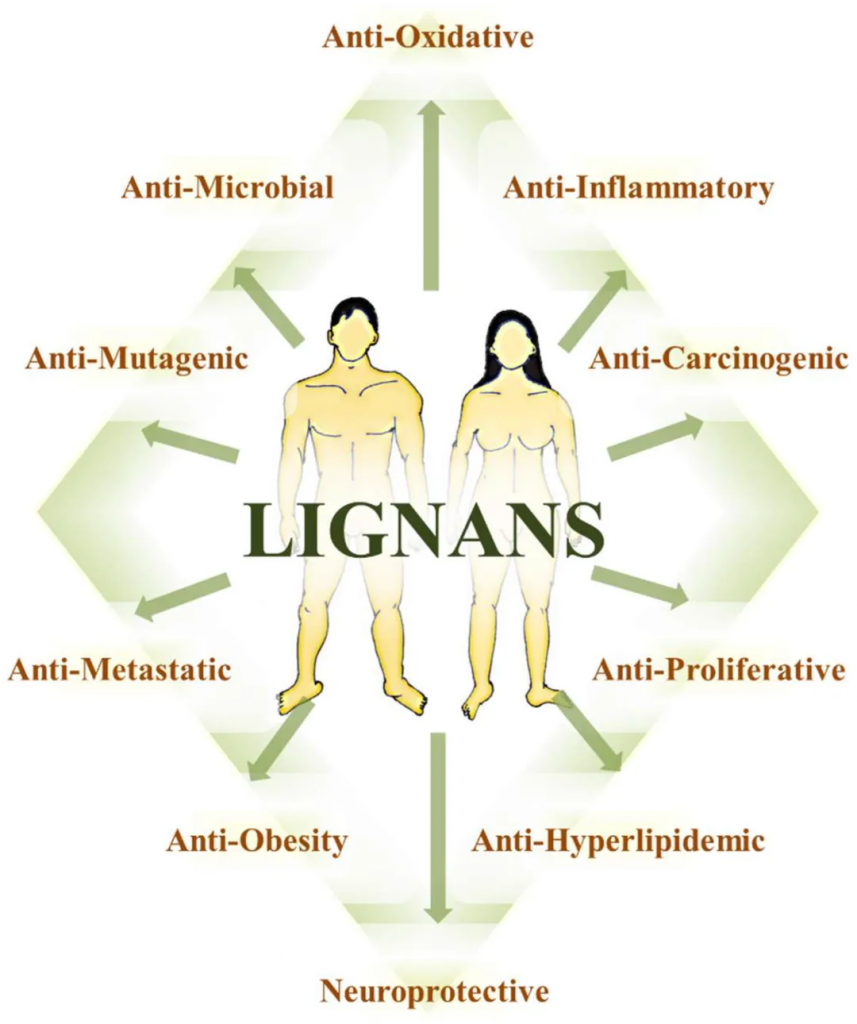
doi.org/10.3390/ph12020068
饮食中木脂素的消耗主要因地理位置而异,但饮食模式也受到文化和种族的影响。
传统的地中海饮食以植物为主,其特点是:
这种饮食的健康益处主要归因于纤维和生物活性化合物(包括抗氧化剂和功能性脂肪酸和脂质)摄入量的增加,以及饱和脂肪摄入量低。
木脂素来源
地中海人群饮食中的木脂素来源包括:
每种食物在总多酚摄入中所占的比例(11–70%)和亚型都不同。
事实上,许多典型的地中海饮食食品(例如谷物)都含有高浓度的木脂素和其他酚类化合物。
最近,人们开始评估全谷物摄入在预防慢性病方面的作用。许多研究表明,作为全谷物饮食的一部分,木脂素摄入与心血管疾病、癌症和糖尿病等慢性病发病率降低之间存在联系。
栗子、特级初榨橄榄油
地中海饮食的另一个组成部分——栗子,是钙、抗氧化剂和酚类化合物的极佳来源。
特级初榨橄榄油是地中海饮食的重要组成部分。事实上,经常食用特级初榨橄榄油与动脉粥样硬化、心血管疾病和某些类型癌症的发病率降低有关。这种效果可能归因于特级初榨橄榄油中含有高浓度的 (+)-1-乙酰氧基松脂醇和(+)-松脂醇。

这种饮食习惯常见于北欧和北欧地区,特点是:
大量食用海藻、贝类、多脂鱼(如鲭鱼、鲱鱼和鲑鱼)、瘦肉、菜籽油、豆类、坚果(如杏仁)、蔬菜、水果(如浆果)、全谷物(如燕麦)、低脂乳制品,并限制盐和糖的摄入量。
在北欧国家,植物木脂素的主要饮食来源是蔬菜、水果和全麦谷物。
在许多经常食用的富含木脂素的植物物种中,一些物种主要分布在北半球(例如菊科的蓟属植物)。这些植物的营养结构含有三萜、多乙炔、酚酸、黄酮类化合物和生物碱。欧洲蓟属植物的最新植物化学研究表明,其种子是新木脂素和木脂素的丰富来源。
印度餐桌上的木脂素宝库
各类食品构成了典型印度饮食的重要组成部分,其中包括鱼、葡萄、巧克力、油、咖啡、茶、饼干和面包。
巴戟天——传统医学中的木脂素宝库
巴戟天(印度桑树)的果实传统上被广泛用于治疗癌症、糖尿病、高血压、腹泻、头痛和炎症,这主要是由于其木脂素含量高。
芝麻:印度饮食中的木脂素明星
芝麻是印度饮食中的典型成分,芝麻和芝麻油都富含木脂素。芝麻油因其显著的抗氧化性和营养价值而闻名。
尽管木脂素仅占芝麻总质量的一小部分(0.5 %至 1.0%),但主要的芝麻木脂素——例如 (+)-芝麻素酚、(+)-芝麻林和 (+)-芝麻素葡萄糖苷——因其显著的健康促进特性而备受关注(已在体内和体外得到证实),包括抗炎、抗氧化和抗高血压活性。
疾病预防
有研究表明,长期摄入(+)-芝麻素酚可抑制阿尔茨海默病中观察到的致病性细胞外β-淀粉样蛋白聚集。同样,(+)-芝麻素具有预防前列腺癌和乳腺癌的作用,并且是肠二醇和肠内酯的前体(已证明具有抗癌、抗糖尿病和抗衰老作用。
亚洲饮食的特点是大量食用大米、面条、香料和蔬菜、芝麻和油。此外,人们也常食用海鲜、豆腐和其他大豆制品。
亚洲是木脂素的主要植物来源;这些植物通常被纳入饮食中,在中国也被用作药用植物。这类植物包括:
牛蒡
其果实提取物和种子是生物活性木脂素的丰富来源,包括牛蒡苷和牛蒡苷元。这两种木脂素具有抗炎活性,例如,抑制脂多糖诱导的一氧化氮生成和小鼠巨噬细胞中促炎细胞因子的释放。此外,牛蒡中的木脂素在抗癌方面也显示出了强大的潜力,能诱导癌细胞凋亡并抑制其增殖。
某些草药通常用作水浸剂。其中包括香茶菜属植物和雷公藤属植物。
香茶菜属
香茶菜属植物包括近 150 个种,分布于亚洲亚热带和热带地区,是极好的木脂素来源。一些种,如日本香茶菜,已被用于传统中药,治疗关节痛、胃痛、乳腺炎、胃炎和肝炎等。香茶菜还因其降血压、抗氧化、免疫、抗菌、抗肿瘤和抗炎特性而被用于传统医学。
雷公藤
一种传统药草,可以改善类风湿性关节炎和其他自身免疫性疾病的症状。多项植物化学研究已从该植物的根部分离出数百种生物活性化合物,包括木脂素。
五味子
长期以来,中药一直将五味子果实用作镇静和止咳补药,广泛分布于中国四川东南部和湖北西部地区。其他国家还使用这种水果来生产功能性食品、果酱和饮料。
从五味子中分离出的二苯并环辛二烯木脂素具有抗炎和抗氧化特性,并能改善认知功能(如记忆力)。此外,先前的研究报告称,五味子果实提取物(其中主要生物活性成分是木脂素)具有神经保护作用,并具有有助于预防阿尔茨海默病的生物活性。
五味子果实可能对肝脏、胃肠道、免疫、交感神经和中枢神经系统有积极作用。木脂素提取物已被证明能成功抑制肝细胞癌细胞增殖,并防止化学毒素引起的肝损伤。然而,整个五味子果实中只有 2% 由木脂素组成,而且大部分木脂素存在于种子中,而种子通常在制造水果衍生产品的过程中被去除。
这种藤本植物的茎被用作多种疾病的止痛药,包括关节炎、风湿病和挫伤。迄今为止,已从五味子中分离出 1 种倍半萜类化合物、25 种木脂素和 43 种三萜类化合物。此外,五味子浆果被认为对肾脏和肺部有益,例如可缓解哮喘症状。
山楂
已被用于功能性食品行业。一些研究报告称,它具有防止低密度脂蛋白 (LDL) 氧化、清除自由基和发挥抗炎作用的能力。山楂主要以新鲜水果、加工果汁或果酱的形式食用。果汁和果酱的制造会产生大量副产品,包括种子和叶子。
红花南洋参
根、茎、果实和叶均可入药,尤其是其果实,具有重要的药用和营养价值。其活性三萜类化合物和木脂素因其报道的生物活性而备受关注,包括抗炎和抗肿瘤作用 。
花椒
已被用于促进血液循环以及治疗各种疾病。由于其独特的味道和独特的香气(通常被描述为绿色、辛辣、花香和清新),花椒果实在许多传统的亚洲美食中被用作香料。先前的药理研究表明,这种植物的叶子和果实具有药用特性,包括抗肿瘤、抗炎和抗氧化活性,以及抑制血小板聚集和单胺氧化酶的产生。
拉丁美洲饮食的基础是玉米、土豆、花生和豆类。这种饮食中还包括亚麻籽。
亚麻籽是木脂素的最佳膳食来源之一,其木脂素含量高于豆类或谷物 。富含亚麻籽的饮食与降低各种疾病的风险有关,包括心血管疾病、骨质疏松症、糖尿病、前列腺癌和乳腺癌。可能的机制包括降低循环葡萄糖、LDL 和总胆固醇水平的能力。
亚麻籽具有重要的商业应用,例如在亚麻纤维制造中。就木脂素而言,亚麻籽主要含有secoisolariciresinol和 secoisolariciresinol二葡萄糖苷,但也含有少量的matairesinol 。事实上,亚麻籽总质量的 95% 以上是由开环异落叶松树脂醇二葡萄糖苷组成,其主要位于种子的纤维壳中,而不是其内部 。
亚洲饮食似乎最有利于木脂素的摄入,而且木脂素的生物利用度也更高。这主要是由于亚洲人食用大量蔬菜,以及传统医学中使用富含木脂素的植物浸剂。
在大多数人群中,木脂素摄入量通常不超过 1 mg/天。木脂素摄入量的估计值从约 150 μg/天(马泰瑞香酚和开环异落叶松树脂醇)到约 1600 μg/天(松脂醇、丁香树脂醇、开环异落叶松树脂醇、中树脂醇、马泰瑞香酚、落叶松树脂醇、肠内酯、肠二醇)不等。
木脂素的肠道代谢
几种摄入的植物木脂素在结肠细菌的作用下去糖基化并部分转化为哺乳动物木脂素肠内酯和肠二醇。肠二醇很容易氧化成肠内酯。然后,这些代谢物在结肠中被吸收。
注:含有酚羟基的木脂素是 II 期代谢反应的靶点,并与谷胱甘肽(GSH)、硫酸盐或葡萄糖醛酸结合,导致木脂素的药理活性降低。
尽管植物木脂素具有抗微生物特性,但它们可以被居住在肠道中的细菌代谢并转化为肠内木脂素(”entero-“来源于希腊语的”enteron”,意为“肠”)。肠内木脂素也被称为哺乳动物木脂素,是由两支研究团队几乎同时独立发现的。随后,在人体中证明了植物木脂素是肠内木脂素的膳食前体。
代谢物的吸收与排出
一些代谢物可能经历肠肝循环。木脂素以结合葡萄糖醛酸苷的形式随尿液和胆汁排出,以非结合形式随粪便排出。
亚麻籽木脂素增强、吸收和生物利用度
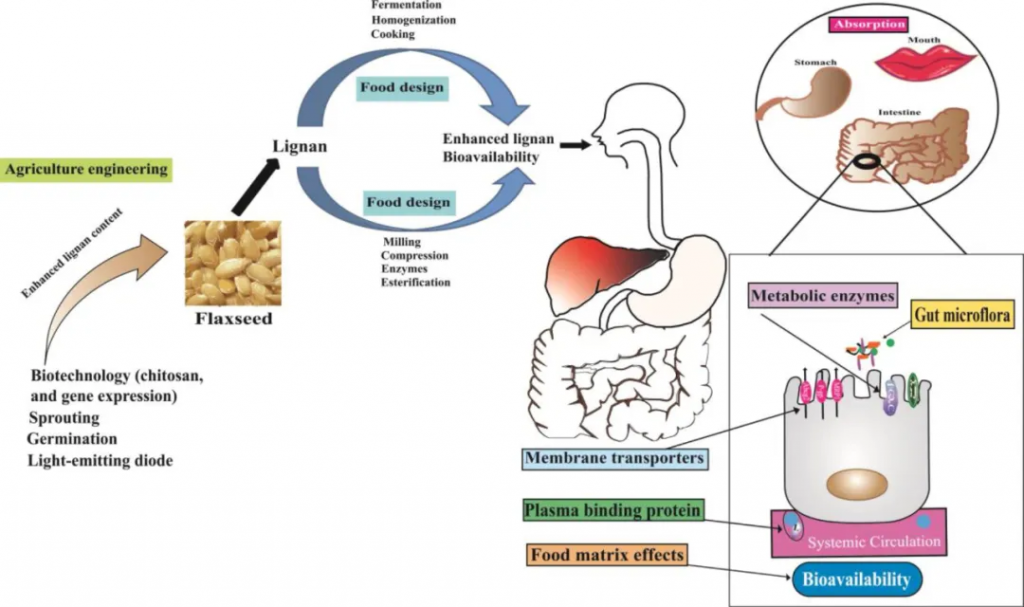
doi.org/10.1080/10408398.2022.2140643
在植物木脂素向哺乳动物木脂素的吸收和生物转化以及随后的吸收上,不同形态吸收不同,人与人之间存在显著差异(关于个体之间的差异在后面章节会详细阐述)。
木脂素的不同形态与吸收
木脂素在植物中既以糖苷形式存在(含糖),又以糖苷配基形式存在(不含糖)。不同形态的木脂素在肠道中的释放和吸收效率不同,进而影响其生物利用度。
目前,亚麻籽中仅发现开环异落叶松树脂醇作为木脂素低聚物。木脂素糖苷经肠道细菌代谢为肠木脂素(肠二醇和肠内酯)和木质素糖苷配基后,在胃肠道中被吸收。从亚麻中的糖和低聚物中释放木脂素的水解量以及肠木脂素的形成和其生物利用度因人而异。
亚麻籽木脂素结构变化导致生物利用度变化
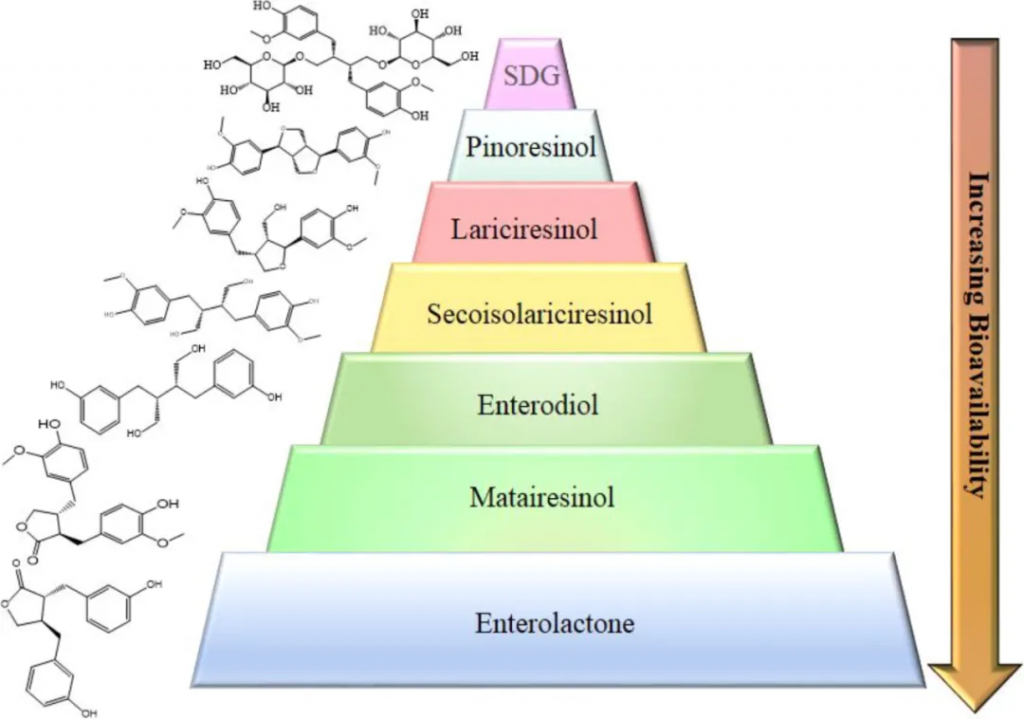
doi.org/10.1080/10408398.2022.2140643
不同吸收速度
肠木脂素肠内酯和肠二醇在结肠中被吸收,其中大部分与结肠组织中的葡萄糖醛酸结合。它们通常在饮食摄入后 8-10 小时出现在血液中。
另一项研究表明,一些植物木脂素(例如环松脂素、脱水开环异松脂素、7′-羟基松脂素、松脂素、松脂素、松脂素、落叶松脂素、开环异松脂素和芝麻素)在摄入芝麻籽一小时后被小肠迅速吸收并在体循环中检测到。
肠木脂素、开环异松脂素和芝麻木脂素的肠肝循环显著。肠内酯、肠二醇和开环异落叶松树脂醇的硫酸盐和葡萄糖醛酸苷可能只是通过胆汁、尿液排出,或进行肠肝循环。
常见植物食物木脂素转换为肠内木脂素
(肠内木脂素和肠内二醇)的转化途径
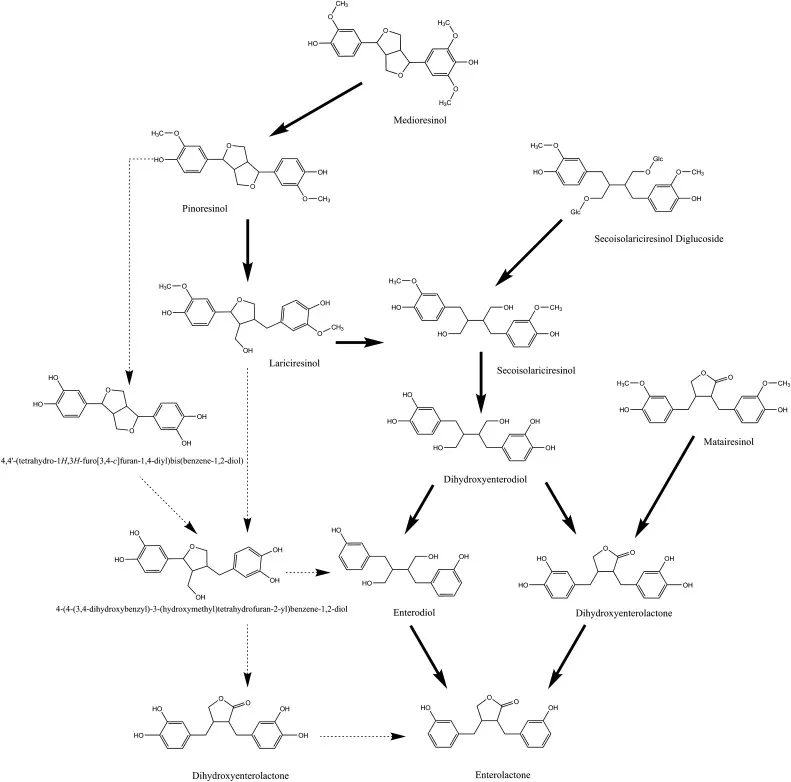
实箭头表示已知的途径。虚箭头表示理论路径。
木脂素糖苷,如芝麻芝麻林三葡萄糖苷和亚麻 SDG 酯基复合物,在肠道厌氧微生物的作用下水解为木脂素苷元。然后,游离木脂素在几种肠道细菌的代谢反应中转化为肠木脂素。转化效率取决于多种因素。
组织中的木脂素代谢受遗传因素影响,但这些因素目前尚不十分清楚。在体外粪便微生物群代谢系统中,落叶松树脂醇在 24 小时内完全转化为肠木脂素、肠二醇 (54%) 和肠内酯 (46%);而其他植物木脂素如松脂醇二葡萄糖苷(55%)、马泰尔木脂醇(62%)和 SDG(木酚素)(72%)转化不完全。
许多研究者评估了多种特定肠道细菌进行必要的反应以将糖苷化木脂素转化为肠内木脂素的能力。确定了脆弱的拟杆菌(Bacteroides fragilis)、卵拟杆菌(Bacteroides ovatus)、Clostridium cocleatum、丛形菌、噬糖梭菌(Clostridium saccharogumia)、多枝梭菌(Clostridium ramosum),吉氏拟杆菌(Bacteroides distasonis)其中前四个细菌在实验的20小时内可以完全去糖基化SDG。而且这些菌被证明可以降低李斯特菌相关的感染。
此外,有研究发现十种双歧杆菌菌株能够水解SDG。一旦去糖基化后,SECO 可以去甲基化生成中间产物DHEND。其中丁酸菌、Enterobacter Callander、 Clostridium limosum、Bacteroides Producta能够催化这一反应。
植物性食物或植物油主要以加工形式使用,如薯片、烘焙产品、焯水和煮熟的蔬菜。因此,在加工过程中考虑木脂素含量的变化非常重要。
烘焙、研磨、加热、干燥、煮沸和提取等加工技术可能会影响木脂素含量,因此可能会影响木脂素的生物利用度,因为在食用前会破坏天然食物基质或微观结构。
干燥和烹饪等其他加工过程对木脂素含量的影响各不相同,具体取决于木脂素的结构、木脂素概况、结合类型和食品基质的性质。
不同食物:大麦加工 vs 小麦加工
将大麦加工成膨胀大麦可以降低松脂醇、马泰瑞斯醇、开环异落叶松脂醇的含量,而提高落叶松脂醇的含量。
干燥精制小麦粉对木脂素的总浓度有总体积极影响,并提高了开环异落叶松树脂醇、松脂醇和落叶松树脂醇的浓度。虽然全粒燕麦对松脂醇水平有积极影响,但其开环异落叶松树脂醇、松脂醇和落叶松树脂醇的含量较低。
不同温度:蒸汽(100℃) vs 烘烤(250℃)
用蒸汽(或 100 摄氏度)处理谷物、黑麦粉和芝麻可以降解木脂素,而更高的烘烤温度(例如 250 摄氏度)会降解芝麻和黑麦中的糖苷和苷元。在亚麻籽中,松脂醇、落叶松脂醇、开环异落叶松脂醇和异落叶松脂醇主要以酯化化合物的形式存在,在 250 摄氏度下加热 3.5 分钟后,这些物质会保持稳定。
不同食物基质
在芝麻油中,加热条件几乎不影响芝麻素的含量,而芝麻酚的含量会增加,而芝麻林的含量会略有降低。此外,当油温保持在 200℃ 并持续 20 分钟时,芝麻素会降解。
报告称,煮沸十字花科蔬菜样品会降低木脂素含量,而胡萝卜的木脂素含量没有显著变化。研究表明,许多蔬菜(尤其是块茎类蔬菜)的木脂素含量在烹饪后会有所增加。
从芝麻饼中分离出的 STG 和芝麻中最丰富的木脂素糖苷与人体肠道细菌一起发酵时,与对照组相比,STG 样品中的系统发育群双歧杆菌、乳酸杆菌、肠球菌明显更多。
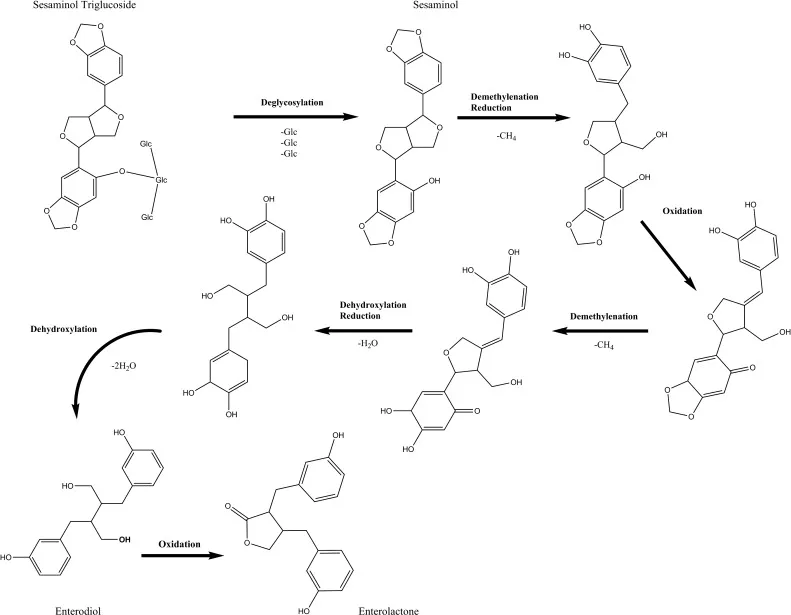
植物木脂素底物也会影响肠道微生物群体产生肠二醇(Enterodiol,简称,END)和肠内木脂素(Enterolactone,简称,ENL)的潜力。不同的植物来源木脂素向END和ENL的转化率各异,从异落基瑞醇没有转化,到LARI的100%转化。类似地,生成ENL的效率在牛蒡苷葡萄糖苷和MAT之间分别为5%到62%。这些结果进一步支持了植物木脂素与肠道微生物群体相互作用的重要性,这在决定肠内木脂素的暴露上起到了关键作用。
注:END和ENL这两种化合物是植物木脂素在肠道内经过微生物代谢生成的生物活性代谢产物。在肠道微生物群体中,植物木脂素底物的摄入会影响肠道微生物产生肠二苯乙烯二醇和肠内木脂素的能力。这些代谢产物可能对健康和疾病风险具有一定影响,因此对它们的生成过程和机制进行研究具有重要意义。
食物中的大多数植物木脂素通过大肠上部的肠道菌群转化为肠木脂素。
血浆肠内酯含量低可能会增加乳腺癌的风险,主要是雌激素阴性乳腺癌。有证据表明,纯木脂素、亚麻籽和 SDG 可抑制肿瘤形成并减少血管细胞进展,从而预防前列腺癌、结肠癌、卵巢癌和转移、心血管疾病、糖尿病、肥胖症、肾脏和骨骼疾病等多种疾病。
功能性食品或营养食品是除提供基本营养成分外,还声称具有预防疾病或促进健康特性的食品。许多功能性食品或营养食品都是用亚麻粉、全亚麻籽和磨碎的亚麻制成的。
此外,通过添加木脂素等成分、加工或包装,可以增加食品的价值。与主要原始来源相比,这些产品更受消费者的接受和青睐。增值产品的一些例子有挤压零食、酸奶、脱脂牛奶、冰淇淋、奶酪、早餐麦片等。
木脂素在商业上用于烘焙、乳制品、挤压、零食、发酵、传统(印度薄饼、哈克拉、蔬菜奇拉)产品等产品。例如,亚麻籽可以作为整粒、烘烤、磨碎、碾磨和油的形式加入到烘焙产品中。
此外,亚麻籽木脂素已被添加到各种乳制品中,包括牛奶、酸奶、奶酪、冰淇淋、黄油和乳清饮料。研究发现,添加到牛奶、酸奶和奶酪中的 SDG 具有良好的耐受发酵、高温巴氏杀菌和牛奶凝乳酶工艺。
天然抗氧化剂花青素、黄酮类胡萝卜素和多酚在预防和治疗多种疾病方面发挥着重要作用。尽管近年来有多项研究表明天然抗氧化剂主要在过渡金属离子(主要是 Cu 和 Fe)存在下才具有促氧化活性。酚类化合物在某些条件下(例如高酚浓度、高 pH 值和存在金属离子)可诱导促氧化活性并产生自由基,最终导致诱变和 DNA 损伤。
研究报道了芝麻木脂素芝麻酚的反常作用。在这项研究中,芝麻酚在人类结肠直肠癌 (HCT116) 细胞中表现出高浓度(0.5、1、2 和 5 mM) 的促氧化活性和低浓度 (<0.05 mM)的抗氧化活性。芝麻酚基于其促氧化作用,通过细胞内 O2−生成诱导 HCT116 细胞中的线粒体凋亡途径。
活性氧 (ROS) 是有氧代谢的必然结果。
内源或外源产生的 ROS 可能导致多种病理因素,如细胞变性和DNA损伤。如果阻止氧化损伤的细胞抗氧化能力不能中和 ROS 的产生,细胞就会表现出一种称为氧化应激的状态。
氧化应激直接或间接地导致多种疾病
ROS 在细胞器或细胞质中积累可以通过破坏核酸的结构和功能、激活凋亡途径、蛋白质氧化修饰、引起脂质过氧化、抑制抗氧化酶以及最终导致细胞功能障碍来破坏细胞的平衡。
木脂素的抗氧化活性可通过多种机制实现
包括减弱 ROS 生成和 MDA,以及通过增强 SOD、CAT、GSH-Px 和 GSH 活性来增加组织抗氧化酶能力。
它们还可以抑制脂质过氧化、蛋白质和 DNA氧化。抗氧化剂激活 JAK2/STAT3信号通路,通过P38MAPK磷酸化和Nrf2/ARE通路上调 PI3K/AKT 信号和 HO-1。
通过这些不同的机制,抗氧化剂可以通过下调I – κB激酶的活性和NF-κB的DNA结合活性,减少促炎细胞因子(IL-1β、IL-6、TNF-α)和介质(COX-2、iNOS、ROS)的产生,来调节参与氧化应激和炎症的关键分子。
大肠杆菌、克雷伯氏菌、肠杆菌、沙门氏菌和许多其他细菌是导致人类许多疾病的病原菌。
金黄色葡萄球菌可产生多种肠毒素,导致胃肠炎,而胃肠炎是大多数国家的主要食源性疾病。
一项研究表明,亚麻籽木脂素提取物在 MIC 值为 1.5 mg/ml 时,对金黄色葡萄球菌和弧菌等革兰氏阳性菌具有有效的抗菌活性。同样,由于含有多酚(包括木脂素),亚麻籽粗木脂素提取物和水解木脂素提取物对革兰氏阳性菌和革兰氏阴性病原体都表现出抗菌活性。
亚麻籽粉酚提取物可抑制单核细胞增生李斯特菌,其抑菌圈直径为 26 毫米,其次是鼠伤寒沙门氏菌、大肠杆菌和铜绿假单胞菌,其抑菌圈直径分别为 25 毫米、22 毫米和 10 毫米。
木脂素可以与 Ca+2和 Mg+2离子结合,降低外膜脂多糖的离子浓度,引发脂多糖释放,从而削弱膜,从而增加木脂素活性。
黄曲霉和黑曲霉这两种真菌都会产生黄曲霉毒素,这是一种强烈的肝毒素和致癌物。它们是各种主要粮食作物收获前的感染物。这些化学物质可导致农场动物死亡或生产力下降。2.5-3.0 mg/ml 的木脂素粗提取物对黄曲霉和黑曲霉均表现出相当强的抗真菌功效。
一项研究表明,亚麻籽成分具有显著的抗真菌作用,特别是对抗白色念珠菌的生长。此外,与常用的制霉菌素相比,富含木脂素的亚麻籽水提取物表现出明显更强的抗真菌活性。亚麻木脂素能刺激胃中益生菌的生长,还能帮助消除引起真菌感染的酵母菌和念珠菌。
以上是木脂素抗氧化,抗菌的一些特性,这些特性为木脂素在维护健康方面的潜在作用提供了科学依据。接下来我们来进一步了解木脂素与人类健康之间的密切关系。
植物木脂素,尤其是其代谢产物——肠内木脂素,显示出了多种生物活性。
由于END和ENL结构上与常见性激素17β-雌二醇相似,使得肠内木脂素能够结合到雌激素受体α(ERα)上,从而产生微弱的雌激素或抗雌激素效应,这也是它们最初被归类为“植物雌激素”的原因。
然而,无论是在体外还是体内的研究,都鉴定出肠内木脂素可能影响几种慢性疾病风险的多种其他机制。这些机制包括抗增殖、抗炎和促进细胞凋亡的效应。这里我们总结了木脂素及其对人类健康影响的现有证据。
在与木脂素暴露相关的研究中,探讨最深入的三类癌症是乳腺癌、结直肠癌和前列腺癌,这些癌症与木脂素的癌症预防作用有关。
注:关于其他类型癌症的研究较为稀少。人类关于子宫内膜癌和木脂素的少数几项研究倾向于无关联,另外在欧洲癌症与营养前瞻性研究(EPIC-Norfolk)中的一项嵌套病例对照研究显示木脂素与胃癌之间没有关联。
尽管胃癌和子宫内膜癌的研究结果不显著,但总体证据倾向于支持木脂素与几种常见癌症之间存在负相关关系。
木脂素与癌症风险的流行病学研究
在2005年,Webb和McCullough对已有的关于膳食木脂素暴露与癌症的文献进行了综述。他们得出结论,体外和动物研究支持富含木脂素的食物和提取的木脂素在调节结肠、乳腺和前列腺癌的癌变过程中的作用;然而少数可用的流行病学研究结果可能不一致。
结直肠癌是一种在结肠或直肠内发展的恶性肿瘤。它是一种常见的癌症,通常起因于结肠或直肠内的息肉转变成癌细胞。结直肠癌早期可能没有明显症状,但随着病情不断恶化,患者可能出现腹痛、腹泻、便秘、便血等症状。
木脂素摄入降低结直肠癌风险
一项在加拿大进行的病例对照研究考察了通过食物频率问卷(FFQ)测量的木脂素摄入量与结直肠癌风险之间的关系,包括1095个病例和1890个对照组。
研究人员发现,摄入高水平的木脂素与降低结直肠癌风险相关。具体来说,摄入最高水平的膳食木脂素(每天超过0.255毫克)的个体显示出显著降低的结直肠癌风险,其几率比为0.73(95% CI 0.56–0.94)。也就说摄入较高水平的人群其患结直肠癌的风险更低。
血浆中END含量与结直肠腺瘤风险
2006年的一项荷兰研究发现,血浆中END(肠内一种木脂素)的含量与显著降低的结直肠腺瘤风险相关。在这项研究中,对首次确诊的结直肠腺瘤患者进行了分析,结果显示END与降低的风险相关,其几率比为0.53(95% CI 0.32–0.88)。这意味着含有较高END水平的个体患结直肠腺瘤的风险更低。
ENL与结直肠腺瘤风险
另一种肠内木脂素ENL也与降低结直肠腺瘤风险相关,但其影响程度较弱。具体而言,ENL与降低的风险相关,其几率比为0.63(95% CI 0.38–1.06)。这表明相对于END,ENL对结直肠腺瘤风险的影响较轻。
总的来说,这些研究结果显示了木脂素在降低结直肠癌和结直肠腺瘤风险中的潜在作用,尤其是高水平的木脂素摄入与较低的患病风险相关。然而,需要更多研究来确认这些关联以及木脂素对人类健康的确切影响。
性别差异在木脂素影响中的表现
在丹麦进行的一项病例队列研究同样探讨了血浆ENL与结直肠癌之间的关系,发现女性中血浆ENL浓度每增加一倍,结肠癌的发病率比值显著降低(IRR 0.76;95% CI 0.60–0.96)。然而,有趣的是,在男性中,直肠癌的发病率与血浆ENL浓度每增加一倍相关,风险增加(IRR 1.74;95% CI 1.25–2.44)。
乳腺癌是一种影响女性乳腺组织的恶性肿瘤。基于人类流行病学研究的结论对于木脂素在绝经前和绝经后乳腺癌风险中的作用存在差异。在2005年的综述中,Webb和McCullough总结道,当时关于木脂素在癌症预防中的作用,最有支持力的是绝经前乳腺癌。
一项综合分析包括了21个研究,其中有11个前瞻性队列研究和10个病例对照研究,得出的结论是总体上植物木脂素摄入与乳腺癌风险无关。
绝经后的女性:木脂素摄入与降低乳腺癌风险显著相关
当研究根据绝经状态进行分析时,他们发现绝经后的女性中植物木脂素摄入与降低乳腺癌风险显著相关,合并风险比为0.85 (95%的置信区间是0.78-0.93,p<0.001),有显著性关联。而在绝经前女性中,植物木脂素摄入与乳腺癌风险之间则没有明显相关。
肠内木脂素与乳腺癌风险呈负相关
研究人员进一步检查了血液中肠内木脂素ENL的浓度,并尝试用体外发酵模型来估计肠内木脂素的暴露。他们发现,肠内木脂素暴露与乳腺癌风险之间存在着显著的负相关,合并风险比为0.73(95%的置信区间是0.57-0.92)。但是,当考虑血液ENL水平时,这种关联性就不再显著。
在四项研究中观察膳食中的肠内木脂素,也发现了类似的关联,即高摄入肠内木脂素与降低乳腺癌风险相关。
近期的研究继续支持着肠内木脂素对乳腺癌的保护作用的假说,但这种作用取决于绝经状态。
总的来说,这些研究表明绝经状态在木脂素与乳腺癌之间的关系中扮演着重要的角色,可能需要考虑不同的机制来理解这种复杂的关联。
另一研究表明,高木脂素摄入量的女性乳腺癌发生率降低40-50%,不受绝经状态影响。不过,在绝经前女性中,与PINO和LARI有较强关联,而绝经后女性与MAT有较强关联。
动物模型的研究显示,木脂素可以促进乳腺细胞的分化,延缓乳腺肿瘤的发生,并在妊娠和哺乳期对乳腺结构具有益处的变化。
实验证明,SES可以减少乳腺癌细胞的增殖,增加凋亡。在另一项研究中发现,肠内木脂素对抗癌效应产生影响。
综合这些研究结果,表明植物木脂素摄入可能对乳腺癌的风险有保护作用,尤其在特定类型的肿瘤和绝经后女性中表现更为显著。动物模型的研究也支持了木脂素在乳腺癌防治中的潜在作用。
前列腺癌是一种发生在前列腺组织中的恶性肿瘤。前列腺是男性生殖系统的一部分,位于膀胱下方,主要负责产生精液。前列腺癌通常会导致尿频、尿急、尿痛等症状,严重时可能会影响患者的性功能和生活质量。早期发现和治疗前列腺癌对于患者的康复非常重要。
木脂素在前列腺癌中作用的证据多样化
一方面,一些体外和动物研究,这些研究表明木脂素在前列腺细胞中具有化学预防作用。
最近的证据确认,即使在进食木脂素前体后体内可达到的浓度下,ENL(肠内植物雌激素)也能抑制早期前列腺癌细胞的增殖。
来自人类研究的数据却不一致
一些证据显示有益处,而一些研究则发现木脂素与前列腺癌之间没有关联。
有两项病例对照研究显示,较高的木脂素摄入与前列腺癌风险增加相关。
EPIC-Norfolk的一项嵌套病例对照研究考察了木脂素与前列腺癌的关系。
参与者完成了为期7天的饮食记录,用以估算每日木脂素摄入量。除了估算植物木脂素MAT和SECO的摄入量,研究人员还估算了来自乳制品和其他动物产品的预形成肠内木脂素的摄入量。
这是首次在木脂素暴露的总体估算中考虑动物来源的肠内木脂素。考虑到哺乳动物,尤其是反刍动物,能够在其瘤胃中生成大量肠内木脂素,因此一些动物产品,特别是乳制品,含有肠内木脂素。
该研究包括204例前列腺癌病例和812个对照组。估算的预形成肠内木脂素平均摄入量在前列腺癌病例中为20 μg/天(±9),在对照组中为18 μg/天(±9)。在年龄调整模型中,总木脂素摄入量与前列腺癌无关(OR 1.05; 95% CI 0.81–1.36; p=0.72)。然而,总肠内木脂素摄入量(包括非木脂素植物雌激素Equol)与前列腺癌呈正相关(OR 1.41; 95% CI 1.12–1.76; p=0.003),Equol(OR 1.43; 95% CI 1.14–1.80; p=0.002)和ENL(OR 1.39; 95%CI 1.12–1.71, p=0.003)单独考虑时也是如此。
然而,在进一步调整了年龄、身高、体重、身体活动、社会阶层、前列腺癌家族史和每日能量摄入等协变量后,这些关联性变得不显著,表明木脂素的对前列腺癌健康的影响可能取决于木脂素在肠内转化。
心血管疾病是指影响心脏和血管系统的疾病。包括高血压、冠心病、中风、心肌病等。心血管疾病是导致全球死亡的主要原因之一。
2010年发表的一篇关于木脂素和心血管疾病风险的综述总结了随机对照试验(RCTs)和观察性研究的发现。虽然一些RCTs未显示出任何效果,但许多研究显示对血压、C反应蛋白和血脂分布有有益效果。作者还讨论了研究木脂素摄入的观察性研究以及研究血清中ENL(肠内木脂素)的观察性研究。
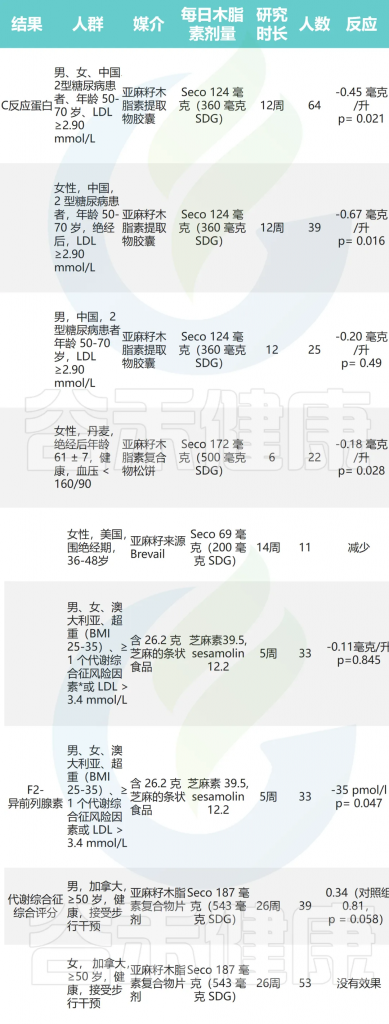
在11项观察性研究中,有5项显示随木脂素饮食摄入增加或血清ENL浓度增加,心血管风险降低;有5项被作者描述为具有边缘显著性,另有1项未发现任何关联。作者指出,由于研究间实验协议的差异,系统评估这些干预措施的能力受到限制。
2012年的一项横断面研究发现,尿液中的肠内木脂素与血清甘油三酯水平呈负相关,与高密度脂蛋白(“好”胆固醇)呈正相关。
以上是木脂素与各类疾病之间的关联,这些研究为我们提供了木脂素潜在的健康益处的宝贵信息。
然而,每个人对木脂素的代谢能力是不同的,这可能会影响其健康效果的个体体验。接下来,我们深入了解个体间木脂素代谢的差异。个体间的这些差异可能由遗传因素、肠道微生物组成、饮食习惯、生活方式等多种因素造成。
食物中木脂素的复杂摄入模式
研究人群中木脂素暴露与疾病风险之间的关系既具有挑战性又复杂。各种食物都是木脂素的来源,而且这些食物不会单独食用。传统上,饮食来源木脂素的菜肴也包含其他可能被视为健康或不那么健康的食物。要分辨一般高木脂素食物(通常也是高纤维食物)或特定木脂素的摄入量与疾病风险之间的关联是非常困难的。
高木脂素食物与疾病风险的关联难度
比如在乳腺癌研究中,作者描述了几种可能导致流行病学研究中获得结果模糊的因素。他们指出,几种因素在肠木脂素暴露中起作用,包括肠道微生物群的组成、含木脂素食物的饮食摄入、抗生素使用、吸烟状况、便秘等。作者还指出准确可靠地确定肠木脂素暴露的难度,以及基因因素在癌症发展和肠木脂素作用中的复杂角色。
即使在受控条件下,关于肠木脂素生产的个体差异也很大。
一项药代动力学研究中显示,固定剂量的 SDG 会产生多种血浆曲线,其中一些个体产生大量的 ENL 和 END,或者产生较高量的其中一种(例如,高ENL、低END,反之亦然),或者两者产生量都很低。
肠道菌群
这种变异大部分被认为是由于个体之间的肠道微生物群差异所致。不同的 END 和 ENL 血液循环出现模式及累积排泄值范围表明,肠道微生物在处理 SDG 代谢的不同步骤上的能力不同(有些不能有效地将 SDG 水解成 SECO,有些则无效将 END 转换为 ENL)。
木脂素转换细菌的系统发育树显示参与肠木脂素生成的生物分布于不同门类中
不同个体肠道菌群,在肠木脂素生成中的差异
有研究将新鲜粪便样本与630 μmol/L 的亚麻籽提取物孵育72小时,发现100个个体中END和ENL的生成量存在很大差异。63%的样本生成了不同量的END,而只有39%的样本生成了ENL。此外,END和ENL的生成量呈正相关,并且与较高的β-葡萄糖醛酸苷酶活性相关,这支持了在SDG转换过程中初始步骤的重要性。
个体在肠木脂素生物转化过程中的差异
另一个导致尿液或血液中ENL和END测量值变异的潜在来源,可能是个体在肠木脂素生物转化过程中的差异。尽管尚未进行遗传变异对木脂素可利用性影响的控制评估。
在人体内,植物木脂素及其代谢物有效地与葡萄糖醛酸或在较小程度上与硫酸结合。结合过程在肠道上皮和肝脏中由UDP-葡萄糖醛酸转移酶(UGT)和硫转移酶进行,结合体通过尿液和胆汁排出。那些重新经胆汁排出的进行肠肝循环。
在尿液中,ENL和END主要以单葡糖醛酸结合物形式排出(分别为95%和85%),小部分以单硫酸盐形式(2-10%)和自由苷元形式(0.3-1%)排出。
结肠细胞系已被证明能快速葡糖醛酸化肠木脂素,这表明大多数木脂素的结合可能在结肠中发生。此外,肝微粒体氧化比葡糖醛酸化慢得多,这表明END和ENL的氧化产物是肠木脂素的小代谢物。
饮 食
饮食在肠木脂素生成中起着重要作用,这不仅是由于食物中前体物质含量的差异,还因为食物基质和其他饮食因素对植物木脂素的可用性和转换为肠木脂素的影响。
水果、蔬菜和浆果已被证明能增加ENL的生成。黑麦作为一种富含植物木脂素的食物,在三项饮食干预研究中被证明能增加ENL的生成。
然而,一项涉及黑麦制品的类似干预研究显示,ENL生成没有增加。这种差异的原因尚不清楚,但研究作者指出,他们的参与者通常较年轻,可能比其他研究的参与者摄入更多的膳食纤维,这可能导致木脂素在肠道中的转运速度加快,从而导致不完全的植物木脂素生物转化。其他涉及富含木脂素的亚麻籽和芝麻的饮食试验显示显著的ENL生成。
食物基质和食物加工影响木脂素的生物利用度
在一项随机交叉研究中,12名参与者每天摄入全亚麻籽、压碎的亚麻籽和研磨的亚麻籽(0.3 g/kg体重)。结果表明,与研磨的亚麻籽相比,全亚麻籽的平均相对生物利用度为28%,压碎的亚麻籽为43%。
另一项饮食研究发现,烘焙对尿液或血浆中肠木脂素浓度没有影响,当参与者摄入混入苹果酱中的研磨亚麻籽或烘焙在面包和松饼中的研磨亚麻籽时,表明这些化合物是热稳定的。
不同类型膳食纤维,影响肠木脂素的生成
在体外实验中,通过不同提取方法得到的黑麦分馏产生了截然不同的结果。
总体来说,不同类型的膳食纤维可能会影响木脂素的生物利用度。含有不可提取分馏的悬液产生了显著更多的ENL。
性 别
关于木脂素代谢的性别差异的证据不一,但似乎女性比男性生成更多的肠木脂素。
几项研究饮食与肠木脂素生成关系的横断面研究显示没有性别差异。
女性的血浆ENL和END更早达到更高的浓度
然而,一项对2380名芬兰男女的横断面研究显示,女性血清ENL浓度高于男性。确实,当服用一次SDG剂量(1.31 μmol/kg体重)时,女性的血浆ENL和END不仅出现的更早,而且达到了更高的最大浓度。
女性的平均基线血清ENL浓度更高
一项全谷物饮食试验,发现女性的平均基线血清ENL浓度更高,尽管全谷物饮食后血清ENL的上升在男女之间是相似的。
亚麻籽,无性别差异;
蔬菜,男性排泄ENL比女性多
另一个随机交叉试验中,研究人员给男女吃亚麻籽并测量尿液中的木脂素排泄量,结果显示男女之间没有差异。其他涉及木脂素剂量的类似试验也未显示男女之间的肠木脂素生成差异。相反,在一项蔬菜摄入的控制饮食研究中,男性在实验饮食期间排泄的ENL比女性多。
女性:更多生成ENL和END的细菌
女性可能比男性生成更多肠木脂素的趋势,往往女性携带更多生成ENL和END的细菌。
此外,研究表明女性的胃肠道通过时间较男性更长;这种含纤维食物和植物木脂素在肠道中停留时间更长,可能进一步导致更多肠木脂素生成。
其他因素
抗微生物剂使用
由于肠道微生物群对肠木脂素生成的关键作用,口服抗微生物药物的使用与血清ENL浓度呈负相关。
在一项横断面研究中,在2753名芬兰男女样本中,使用抗微生物剂的参与者,ENL浓度明显降低,尽管在取样前的12-16个月内未接受治疗。而且抗微生物剂使用次数也与ENL浓度呈负相关。
肠道停留时间
肠道停留时间似乎是影响ENL生成的另一因素,尽管大多数研究依赖于非定量测量方式评估此因素。同一研究还发现,在女性中,血清ENL浓度与年龄和便秘呈正相关,而与吸烟呈负相关。
体重
此外,体重正常的女性ENL浓度明显高于体重不足或肥胖女性。其他欧洲研究支持Kilkkinen的发现,报告了BMI、吸烟和排便频率与血浆ENL浓度成反比。
生活方式
最近,一项研究考察了其他生活方式因素与尿液ENL水平之间的关系,该研究在一大样本20岁以上的美国男女中进行。
在2003-2006年国家健康与营养检查调查(NHANES)的一部分(n=3000)中,发现年龄、收入和体育活动与尿液ENL呈正相关。
此外,与欧洲研究相似,吸烟和BMI与尿液ENL呈负相关。尽管存在这些关联,选择的社会人口学和生活方式因素仅解释了总变异量的一小部分(R2≤4%),这表明,它们对肠木脂素水平的影响相对较小。
木脂素作为一类多酚,由植物木脂素和哺乳动物木脂素组成。本文探讨了什么是木脂素,哪些食物和饮食方式中木脂素的分布差异,同时概括总结了在体外、动物和人类三个层面上可能的对健康的影响。
木脂素的健康效益并非一成不变,比如芝麻酚在低浓度下显示抗氧化活性,在高浓度下呈促氧化活性,并在细胞中引发线粒体凋亡途径。在动物和体外模型中,木脂素的氧化应激研究主要涉及亚麻木酚素、芝麻素、厚朴酚、五味子,而只有少数临床试验评估了其作用。
根据现有研究,我们了解到这种暴露因多种环境和生理因素而异,包括植物木脂素类型、食物基质、其他可能影响肠道微生物活性的摄入物(如膳食纤维、抗微生物药物)、肠道微生物组成和活性,以及肠道停留时间及其他影响因素。
测量尿液或循环中的肠二苯乙烯二醇(END)和肠木质素(ENL)可能更好地表征这些生物活性化合物的内部暴露水平。这种方法也可作为饮食和健康生活方式的生物标志,甚至是肠道微生物活性的指标。
随着新技术的出现,能够有效快速地表征肠道微生物组,将其信息整合到统计模型中,未来将会有助于更好地理解微生物对木脂素与疾病风险关联的调节作用。
主要参考文献:
Seth C. Yoder, Samuel M. Lancaster, Meredith A.J. Hullar, Johanna W. Lampe, Chapter 7 – Gut Microbial Metabolism of Plant Lignans: Influence on Human Health, Editor(s): Kieran Tuohy, Daniele Del Rio, Diet-Microbe Interactions in the Gut, Academic Press, 2015,Pages 103-117
Senizza A, Rocchetti G, Mosele JI, Patrone V, Callegari ML, Morelli L, Lucini L. Lignans and Gut Microbiota: An Interplay Revealing Potential Health Implications. Molecules. 2020 Dec 3;25(23):5709.
D. Ayres, J. Loike, Lignans: Chemical, Biological and Clinical Properties, Cambridge University Press, Cambridge (1990)
Adlercreutz H. Lignans and human health. Crit Rev Clin Lab Sci. 2007;44(5-6):483-525.
T. Umezawa. Diversity in lignan biosynthesis
Phytochem Rev, 2 (2003), pp. 371-390
W.M. Hearon, W.S. MacGregor. The naturally occurring lignans. Chemical Rev, 55 (1955), pp. 957-1068
J.-Y. Pan, S.-L. Chen, M.H. Yang, J. Wu, J. Sinkkonen, K.
Zou. An update on lignans: natural products and synthesis.
Nat Prod Rep, 26 (2009), pp. 1251-1292
D.R. Gang, A.T. Dinkova-Kostova, L.B. Davin, N.G. Lewis. Phylogenetic links in plant defense systems: lignans, isoflavonoids, and their reductases.
P.A. Hedin, R.M. Hollingworth, E.P. Masler, J. Miyamoto (Eds.), Phytochemicals for Pest Control, American Chemical Society, Washington, DC (1997), pp. 59-89
P. Mäki-Arvela, B. Holmbom, T. Salmi, D.Y. Murzin
Recent progress in synthesis of fine and specialty chemicals from wood and other biomass by heterogeneous catalytic processes
Catal Rev, 49 (2007), pp. 197-340
B. Holmbom, C. Eckerman, P. Eklund, et al. Knots in trees – a new rich source of lignans. Phytochem Rev, 2 (2003), pp. 331-340
I. Cesarino, P. Araújo, A.P. Domingues Júnior, P. Mazzafera. An overview of lignin metabolism and its effect on biomass recalcitrance
Braz J Bot, 35 (2012), pp. 303-311
L.B. Davin, M. Jourdes, A.M. Patten, K.-W. Kim, D.G. Vassão, N.G. Lewis. Dissection of lignin macromolecular configuration and assembly: comparison to related biochemical processes in allyl/propenyl phenol and lignan biosynthesis
Nat Prod Rep, 25 (2008), pp. 1015-1090
W.R. Cunha, M. Luis, R.C. Sola, et al. Lignans: chemical and biological properties V. Rao (Ed.), Phytochemicals – A Global Perspective of Their Role in Nutrition and Health, InTech, Rijeka, Croatia (2012), pp. 213-234
J. Harmatha, L. Dinan. Biological activities of lignans and stilbenoids associated with plant–insect chemical interactions. Phytochem Rev, 2 (2003), pp. 321-330
N.G. Lewis, M.J. Kato, N. Lopes, L.B. Davin. Lignans: diversity, biosynthesis, and function. P.R. Seidl, O.R. Gottlieb, M.A.C. Kaplan (Eds.), Chemistry of the Amazon, American Chemical Society, Washington, DC (1995), pp. 135-167
I.E.J. Milder, I.C.W. Arts, B. Van de Putte, D.P. Venema, P.C.H. Hollman Lignan contents of Dutch plant foods: a database including lariciresinol, pinoresinol, secoisolariciresinol and matairesinol
A.I. Smeds, P.C. Eklund, S.M. Willför
Content, composition, and stereochemical characterisation of lignans in berries and seeds
Food Chem, 134 (2012), pp. 1991-1998
A.I. Smeds, P.C. Eklund, R.E. Sjöholm, et al.
Quantification of a broad spectrum of lignans in cereals, oilseeds, and nuts. J Agric Food Chem, 55 (2007), pp. 1337-1346

谷禾健康
衰老通常伴随着心血管、神经和免疫系统等一系列疾病的风险增加。
虽然在理解微生物组导致与衰老相关的个别疾病的细胞和分子机制方面取得了显著进展,我们在之前的文章也有这方面的阐述:
但微生物组对衰老过程的实际影响或操纵微生物组促进健康衰老的潜力仍不清楚。
这方面的研究因许多导致衰老和年龄相关表型的人口统计学因素而变得更加复杂。在世界各地几乎所有的人口中,女性的寿命都显著高于男性,世界卫生组织的大多数常见的与年龄相关的死亡原因都是性二型的,导致这些性二型表型的机制仍然知之甚少。
研究表明,人类微生物组在衰老个体中发生了改变,微生物组影响了模式生物的寿命。


本文重点介绍了最近在人类和模式生物中进行的研究,这些研究表明微生物组与多种年龄相关疾病有关,重点关注癌症、肥胖、2型糖尿病和帕金森氏病。同时解释了为什么性别是理解微生物组如何塑造衰老的关键差距。这些讨论共同强调了微生物组在整个生命周期中的广泛影响,以及在这一跨学科领域快速展开新发现的潜力。
通过微生物组预测年龄
人类微生物组与年龄之间的总体关联足够强,因此可以通过微生物组精确预测生物年龄。
在生命早期就证明了这一概念,在营养不良的情况下,在健康个体中建立的“微生物群成熟度指数”被推迟了。
最近,机器学习工具能够根据远端肠道宏基因组数据准确预测成年人的年龄,平均绝对误差为6至8岁。


其他部位菌群也与年龄相关
在其他身体部位发现的微生物群的组成也与年龄有关,包括皮肤和口腔在内。皮肤微生物群甚至在尸体解剖后被用于确定尸体的年龄,强调与人类微生物群的时间关系涵盖了整个生命周期以及生命周期结束后。
在法医学中有应用前景
这一领域的持续进展对法医学有着明确的影响,有助于采用新的方法来识别嫌疑人,甚至可能识别他们的年龄。微生物组特征也与老年人的生存有关,这进一步强调了了解微生物组如何在衰老中改变的重要性。
对百岁老人的研究促进健康衰老
对百岁老人(100岁以上的人)的研究为可能促进健康衰老的微生物组成分提供了有价值的见解。
健康的百岁老人和虚弱的老人
doi.org/10.1371/journal.pbio.3002087
百岁老人比年轻人表现出更高的细菌多样性,且Alistipes、Parabacteroides、Clostridium等丰度较高。
与这些分类变化一致的是,百岁老人体内也富含多种微生物代谢产物,包括肠道细菌产生的抗炎胆汁酸。
需要进行后续研究,测试特定细菌种类、基因和代谢产物在促进健康衰老中的因果作用;然而,这些数据清楚地表明,处于寿命极端的个体拥有独特的微生物类群和代谢最终产物。
虚弱老年人:肠道菌群多样性低,皮肤菌群中多种潜在的致病菌
虚弱也与人类肠道微生物组的个体间差异有关(图1)。经过年龄调整后,与不太虚弱的个体相比,虚弱的老年个体肠道细菌多样性降低。
对居住在社区和护理机构的老年人的纵向分析揭示了与虚弱相关的皮肤、口腔和肠道微生物群的差异。
在虚弱的老年人的皮肤上观察到多种潜在致病细菌,以及大量抗生素耐药性基因。与百岁老人一样,微生物群在导致虚弱中的因果作用仍有待确定,特别是考虑到许多可能解释人类微生物群中这些与虚弱相关的差异的混杂因素。
什么因素影响老年微生物组变化?
年龄与生活方式的多个方面和宿主生物学的变化有关,这些变化可以解释人类微生物群中观察到的许多或所有差异。
衰老伴随着宿主免疫受损,这可能导致以前被免疫系统控制的微生物的扩张,这可能解释了虚弱的老年人中潜在细菌病原体的富集。
饮食也是一个明显的混淆因素,因为疗养院居民更受限制的饮食可能是一些老年人肠道微生物群变化的关键驱动因素。
肠道运动通常也会随着年龄的增长而减慢,这可能会对肠道微生物群产生下游影响。
最后,老龄化健康的社会决定因素,如独居、住院护理的可能性增加、行动不便和人际关系的丧失,都可能影响微生物组。
考虑到可能起作用的众多因素,最近的一项研究采取了一种更为综合的方法,证明了肠道微生物组与整体生活史之间的联系,其中包括有关药物、体育活动、饮食和血液标志物的信息。因此,微生物组随年龄的变化似乎是由许多宿主和环境因素的净影响驱动的。
►▷
这些结果强调,人类微生物组是衰老过程中一个重要但研究不足的方面。鉴于这种微生物生态系统的复杂性,解开因果关系在人类中是难以解决的,这推动了我们在下一节中讨论的模式生物的新兴工作。
对无菌模式生物的研究,为微生物组在决定宿主寿命方面的因果作用提供了有力的支持,包括对蠕虫、苍蝇、鱼和小鼠的研究。
综合考虑,以下讨论的研究结果表明,人类微生物组在寿命中也起着因果作用;然而,将与衰老相关的人类微生物组的特定方面直接“反向翻译”为这些模式生物仍有待探索。
生命早期接触微生物组有利于延长寿命
跨多个模型系统的研究表明,在早期接触微生物组有利于延长寿命。这在斑马鱼中最为显著,由于表皮退化表型,可能是由于营养不足,斑马鱼在无菌条件下无法成熟。同样,胚胎发育过程中的细菌定植延长了黑腹果蝇的寿命。
然而,以上结果与来自无菌秀丽隐杆线虫、无菌小鼠和无菌大鼠的数据相冲突,这些动物的寿命都比传统饲养的对照动物更长。因此,微生物在生命早期定植的潜在好处可能会被生命后期的有害影响所抵消。
微生物组可能缩短老年动物的寿命
在秀丽隐杆线虫中,大肠杆菌的胃肠道积累会导致与年龄相关的死亡。将无菌条件下的无菌果蝇去除后,成年果蝇的寿命会缩短。
最近,人们用非洲绿松石溪鱼研究了微生物组对衰老动物的有害影响。使用抗生素治疗的中年鱼(9.5周龄)比未经治疗的鱼活得更长,这表明微生物群会损害老年鱼的寿命。
值得注意的是,6周大的溪鱼的胃肠道微生物群显著延长了中年溪鱼群体的寿命。
基于微生物组的干预措施延长寿命
这些发现也与哺乳动物有关。在2种早衰症小鼠模型中的研究,支持了基于微生物组的干预措施延长寿命的潜力。
早衰小鼠的肠道微生物群发生了改变,包括了LmnaG609G/G609G模型中的Akkermansia muciniphila的显著减少,该模型含有导致最常见的人类早衰综合征的核膜层粘连蛋白A/C点突变。
正如在鳉鱼中一样,野生型小鼠的粪便微生物群移植(FMT)显著增加了转基因过早衰老受体小鼠的寿命。
人类肠道微生物群的常见菌群疣微菌属(Verrucomicrobium) A.muciniphila足以延长小鼠的寿命。
这些结果为确定微生物群依赖性寿命变化的细胞和分子机制迈出了重要一步,也是将这些结果潜在地转化为人类的重要一步。
微生物增加膳食营养素的消化吸收
多种模式生物的研究结果支持的一种机制是,微生物组可能通过增加膳食营养素的可利用性来缩短寿命。因此,微生物组的差异可能会抵消甚至加剧热量限制的影响,从而延长多种物种的寿命。
简言之,微生物组对植物多糖的消化、脂质的吸收和氨基酸的吸收至关重要。关于肠道微生物组在营养中作用的我们也有多篇文章提及:
微生物定植激活多种被抑制途径,从而延长寿命
微生物定植还可以激活被热量限制抑制的多种途径(延长寿命),包括胰岛素样生长因子1和AMP活化蛋白激酶。值得注意的是,与传统饲养的对照动物小鼠相比,当热量受到限制时,无菌小鼠失去了寿命优势。
此外,最近对人类和小鼠模型的研究表明,热量限制会以促进减肥的方式扰乱人类肠道微生物组。大量数据也表明微生物组与营养不良有关。
►▷
需要做更多的工作来解开饮食和微生物组之间的这些复杂相互作用,以及它们对宿主健康和寿命的长期影响。
从前面了解的内容我们可以看到,微生物组可以通过影响疾病的风险和治疗来影响寿命。
最近的研究支持宿主年龄导致疾病相关微生物组和健康个体微生物组之间的差异。
鉴于涵盖多个疾病领域的大量文献,我们选择将以下部分重点放在3个年龄相关疾病领域:
这里讨论的研究强调了将机制和转化微生物组研究配对的潜力,以及这些方法对其他年龄相关疾病的可推广性。
研究人员认为,所有这些途径的净效应通过决定疾病的风险和治疗来决定寿命。
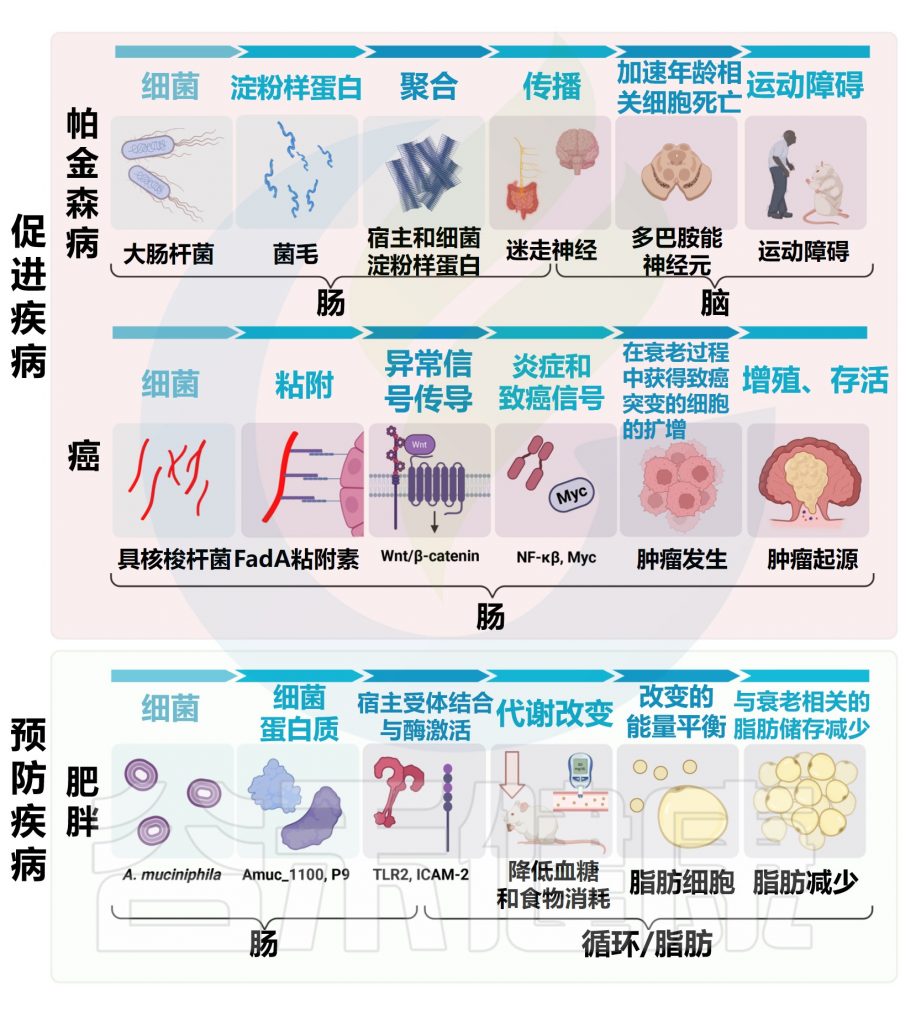
微生物组与3种不同的年龄相关疾病有关的一些机制

doi.org/10.1371/journal.pbio.3002087
癌症与年龄有关:
20岁以下:每10万人中有25例以下
45至49岁:每10万人为350例
60岁及以上:每10万人中有1000例以上
大多数癌症类型,包括乳腺癌、前列腺癌和结肠直肠癌,都遵循这一趋势。


单个物种的影响:具核梭杆菌
最近,将结直肠癌肿瘤与邻近的非恶性粘膜进行比较,发现具核梭杆菌(Fusobacterium nucleatum)显著富集。
具核梭杆菌在结肠癌中因果作用的证据来自小鼠,在小鼠中,这种细菌激活信号通路,促进髓样细胞浸润,并表达促炎和致癌基因。
整体微生物组:评估疾病状态
除了具核梭杆菌等单个物种外,整个微生物组都可以作为疾病状态的有价值的生物标志物。使用肠道微生物组数据作为筛查工具可将结直肠腺瘤预测成功率提高50倍以上。
肠道微生物组也与其他器官中发现的癌症有关,包括肝脏、前列腺和乳腺。
扩展阅读:
此外,全身发现的肿瘤通常含有可检测的微生物,包括细菌和真菌,这表明微生物组可能对肿瘤进展具有局部和全身影响。
改变免疫力
癌症化疗和免疫治疗工作强调了微生物组在塑造癌症治疗结果中的广泛作用。从对免疫疗法反应良好的黑色素瘤患者通过粪菌移植到其他患者之后,一部分受试者的肿瘤大小减小。这些研究强调了肠道微生物组的变化如何改变宿主免疫力,从而改变对免疫检查点阻断的反应性。
代谢抗癌药物
除了免疫相互作用外,微生物组还可以通过将抗癌药物代谢为下游代谢产物,使其活性增加或降低,从而直接影响抗癌药物。
选择性抑制重新激活抗癌药物伊立替康(β-葡萄糖醛酸酶)的细菌酶可以挽救胃肠道毒性,而细菌前TA操纵子的高水平表达会干扰卡培他滨(抗癌药物5-氟尿嘧啶的口服形式)的疗效。
►▷
在了解微生物组如何影响癌症风险、治疗和生存方面取得的持续进展,对解决这一影响全球人口老龄化的毁灭性疾病具有深远的意义。
代谢性疾病的常见医疗干预措施对肠道菌群有深远的影响
肥胖和2型糖尿病都与年龄有关,并且与微生物组有着广泛的联系。在人类中,由于糖尿病药物二甲双胍、胃旁路手术和减肥饮食的混杂影响,与这些疾病的一致微生物组相关性一直难以实现。
扩展阅读:
种族之间的差异也可能起到一定作用,例如,在美国的一个队列中,在东亚个体中没有检测到与肥胖相关的白人肠道微生物群差异。
总之,这些结果强调,旨在改善代谢性疾病的常见医疗干预措施对肠道微生物组有着深远的影响,而肠道微生物组也可能与衰老过程有关。此外,所涉及的特定微生物物种、基因和途径可能因个体和队列而异,这促使人们努力实现基于微生物组的精准营养和医学。
微生物组可以通过多种途径影响与肥胖和2型糖尿病相关的表型
如上所述,微生物组可以通过帮助消化饮食中其他无法获得的成分来促进热量摄入,这与最近在人类中的数据一致。该数据显示,抗生素万古霉素治疗后,饮食能量收获显著减少。
反过来,微生物组也会影响宿主的能量消耗,部分是通过改变宿主基因表达和酶活性。
最近,对A.muciniphila的研究已经鉴定出一种细菌蛋白,该蛋白足以改善小鼠的糖耐量并挽救代谢性疾病表型。
额外的研究已经确定了一种单独的粘蛋白原蛋白,该蛋白足以改善小鼠的糖耐量并挽救代谢性疾病表型。这些发现与来自人类的数据一致,这些数据支持灭菌的A. muciniphila的安全性和益处。
►▷
未来重要的是,要了解微生物组对衰老个体宿主能量学的影响是如何变化的,特别是考虑到饮食摄入和药物使用的伴随变化。
微生物组也可能在多种神经系统疾病的病因和治疗中发挥因果作用,这些疾病的风险和/或严重程度随着年龄的增长而增加,包括阿尔茨海默病、多发性硬化症和帕金森病。
扩展阅读:
在这里,我们重点关注帕金森病,因为最近在理解其与肠道微生物组的关系以及与衰老的明确联系方面取得了进展。
95%以上的帕金森病病例发生在50岁以上的人群中;然而,人口老龄化不足以解释帕金森病发病率的上升,这涉及到微生物组等因素。
胃肠道与帕金森症有关
便秘是一种早期症状;淀粉样蛋白α-突触核蛋白在到达中枢神经系统之前在迷走神经(连接大脑和肠道)中发现;迷走神经干切断术(切除胃食管交界处的迷走神经)可降低近50%的帕金森病风险。
然而,尽管胃肠道和帕金森氏症之间有许多联系,但微生物组的作用直到最近才成为焦点。
肠道菌群与大脑沟通影响帕金森病的发病机制
帕金森病小鼠模型中的微生物群发生了改变,其中α-突触核蛋白过表达(ASO模型)。与对照组相比,ASO-无菌小鼠以及帕金森病的替代小鼠模型与受影响小鼠或人类的肠道微生物群的定殖会加剧大脑病理和运动功能障碍。
细菌淀粉样蛋白也可能引发疾病,如大肠杆菌制造的细胞表面淀粉样curli蛋白。
最近研究表明,肠道细菌也会影响宿主淀粉样蛋白的产生,因为细菌硝酸盐的减少会刺激α-突触核蛋白的肠道聚集。
再加上来自帕金森病患者和健康个体的越来越多的宏基因组数据,表明多种不同的微生物组依赖性细胞和分子机制可能共同驱动帕金森病患者的疾病。
肠道菌群也可能导致帕金森病治疗结果的个体间差异
帕金森病的治疗通常从小分子药物左旋多巴(L-多巴)开始,左旋多巴在中枢神经系统中转化为多巴胺,从而缓解神经元多巴胺耗竭引起的帕金森病症状。
左旋多巴通常与卡比多巴(一种脱羟基酶抑制剂)配对使用,可降低药物的外周代谢。然而,卡比多巴不会抑制肠道细菌酶酪氨酸脱羧酶(TyrDC),该酶催化肠道细菌在胃肠道内将左旋多巴代谢为间酪胺的第一步。相反,化合物(S)-α-氟甲基酪氨酸可用于特异性抑制细菌TyrDC,导致小鼠血清L-多巴增加。
值得注意的是,帕金森病患者的TyrDC水平随着时间的推移而增加,并与多种帕金森病药物治疗的胃肠道不良反应有关。
TyrDC可能只是肠道细菌代谢的多种途径之一;产孢梭菌也可以使左旋多巴脱氨化。
►▷
需要更多研究来了解这些和其他途径在模型生物和帕金森病患者中的相对贡献,以及它们对药物疗效和不良反应的下游影响。
这一概念也可以更广泛地应用于其他用于治疗神经疾病的药物;例如,阿尔茨海默病药物加兰他敏和美金刚,在体外生长过程中被人体肠道细菌分离株耗尽。
扩展阅读:
衰老在男性和女性中有着根本的区别,在寿命、虚弱和与年龄相关的疾病方面有着广泛的差异。女性的虚弱贯穿一生,晚年达到残疾高峰。然而,在世界上几乎所有的人口中,女性的寿命都比男性长。即使根据社会经济地位、种族和教育程度进行调整,这些数据仍然有效。
多种分子机制导致衰老过程中的两性异形,包括内分泌和宿主遗传差异。例如,尽管存在相互矛盾的发现,报告存在更温和甚至相反的影响,但一些报告表明,在人类和小鼠中,卵巢切除术会降低健康寿命。
男性性腺和激素会对寿命产生负面影响
一些证据支持男性性腺和激素会对寿命产生负面影响,虽然也是一个争论的话题。例如,对太监的研究表明,阉割可以延长男性的寿命,对啮齿动物的研究表明某些外源性雄激素会缩短寿命。此外,在小鼠身上进行的性腺交换实验支持了卵巢(以及可能的激素)可以显著延长寿命的结论。
大多数与衰老相关的疾病也是性二型的,包括上面强调的3个疾病领域。
癌症:
女人和女孩的癌症发病率和生存率较高,许多非生产性癌症在发病率上具有强烈的性别偏见,尤其是内分泌癌(女性偏见)和卡波西肉瘤(男性偏见)。
代谢性疾病:
与男性相比,女性肥胖的风险增加,但患2型糖尿病的风险相当。
神经退行性疾病:
神经退行性疾病的严重程度和风险与性别有关:例如,男性患帕金森病的风险更高,但女性表现出更严重的疾病。
初步数据表明,性激素是这种关系的重要介质。在人类中,从青春期到更年期的平均年龄,性别与肠道微生物群的差异有关,这与性激素是差异的重要驱动因素的假设一致。反过来,微生物组也可能在控制性激素水平方面发挥重要作用。
相对于CONV-R动物,无菌小鼠的性激素水平发生了变化:无菌雄性的睾酮和β-雌二醇较低,而无菌雌性的孕酮和β-雄二醇较低。
肠道细菌β-葡糖苷酸酶可以重新激活雌激素葡糖苷酸,这与人类的数据一致,这些数据将抗生素与血清性激素浓度降低和性激素偶联物粪便排泄增加联系起来。此外,循环性激素水平与肠道微生物群的多样性和组成有关。
虽然关于性别、微生物组和衰老交叉的文献仍然很少,但一些初步观察结果突出了这一研究方向的价值。
对无菌小鼠的研究表明,雌性的长寿优势需要微生物群。
一项针对1型糖尿病非肥胖糖尿病模型的开创性研究表明,微生物组的性别差异会影响自身免疫性疾病。雄性CONV-R小鼠免受糖尿病的影响,但由于睾酮水平下降,无菌雄性小鼠的这种差异消失了。
值得注意的是,将雄性相关肠道微生物群移植到雌性受体中足以预防疾病。这些影响可能与睾酮有关:最近一项关于小鼠饮食诱导肥胖的研究表明,雌激素诱导的肠道微生物组差异可能会保护其免受代谢疾病的影响。
微生物组与衰老研究中生物性别的考虑


编辑
doi.org/10.1371/journal.pbio.3002087
►▷
今后,至关重要的是要确定性别改变微生物组的机制,以及年龄相关疾病和整体寿命的下游后果。在这样做的过程中,研究人员应该考虑重要因素,以了解生物性别如何影响微生物组对衰老表型的影响。
本文讨论了新出现的证据支持微生物组在衰老和年龄相关疾病中的作用。这些发现对生物医学和其他生物学领域具有广泛的意义。
从事微生物组的研究人员最好在研究中控制或考虑年龄、性别和其他人口统计变量。反过来,衰老和许多年龄相关疾病领域的研究人员应该考虑微生物组在研究中的潜在作用;例如,收集用于微生物组分析的探索性样本;控制与微生物组相关的变量,如饮食起居;或使用无菌模型。
通过合作,这一跨学科研究领域有望迅速发展,并可能解决长期存在的问题,即控制微生物群落结构和功能的因素,以及年龄相关疾病风险和治疗结果个体间差异的驱动因素。
当然,我们需要的并不是在微生物组和衰老领域大肆宣传,而是优先考虑旨在理解基本生物过程的严谨、机制性和实验可处理的工作,这一点至关重要。
虽然说长生不老这个目标可能还有很长的路要走,但也许这条结合微生物组的研究路线,可以帮助我们实现活得更长,生命质量更高。
主要参考文献:
Rock RR, Turnbaugh PJ. Forging the microbiome to help us live long and prosper. PLoS Biol. 2023 Apr 5;21(4):e3002087. doi: 10.1371/journal.pbio.3002087. Epub ahead of print. PMID: 37018375.
Kim M, Benayoun BA. The microbiome: an emerging key player in aging and longevity. Transl Med Aging. 2020;4:103-116. Epub 2020 Jul 21. PMID: 32832742; PMCID: PMC7437988.
Glowacki RWP, Engelhart MJ, Ahern PP. Controlled Complexity: Optimized Systems to Study the Role of the Gut Microbiome in Host Physiology. Front Microbiol. 2021 Sep 27;12:735562. doi: 10.3389/fmicb.2021.735562. PMID: 34646255; PMCID: PMC8503645.
Chen Y, Wang H, Lu W, Wu T, Yuan W, Zhu J, Lee YK, Zhao J, Zhang H, Chen W. Human gut microbiome aging clocks based on taxonomic and functional signatures through multi-view learning. Gut Microbes. 2022 Jan-Dec;14(1):2025016. doi: 10.1080/19490976.2021.2025016. PMID: 35040752; PMCID: PMC8773134.
Baruch EN, Youngster I, Ben-Betzalel G, Ortenberg R, Lahat A, Katz L, Adler K, Dick-Necula D, Raskin S, Bloch N, Rotin D, Anafi L, Avivi C, Melnichenko J, Steinberg-Silman Y, Mamtani R, Harati H, Asher N, Shapira-Frommer R, Brosh-Nissimov T, Eshet Y, Ben-Simon S, Ziv O, Khan MAW, Amit M, Ajami NJ, Barshack I, Schachter J, Wargo JA, Koren O, Markel G, Boursi B. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science. 2021 Feb 5;371(6529):602-609. doi: 10.1126/science.abb5920. Epub 2020 Dec 10. PMID: 33303685.
谷禾健康
癌症是一种复杂的疾病,归因于多因素变化,导致治疗策略困难。
90%的癌症患者死于复发或转移。癌症转移是恶性肿瘤进展的关键步骤,由癌细胞内在特性和外在环境因素决定。
一些微生物组通过诱导癌性上皮细胞和慢性炎症促进癌发生、癌症进展和调节癌症治疗。
关于微生物群在肿瘤发生和临床效率中的作用的大部分认知都与肠道微生物群有关。
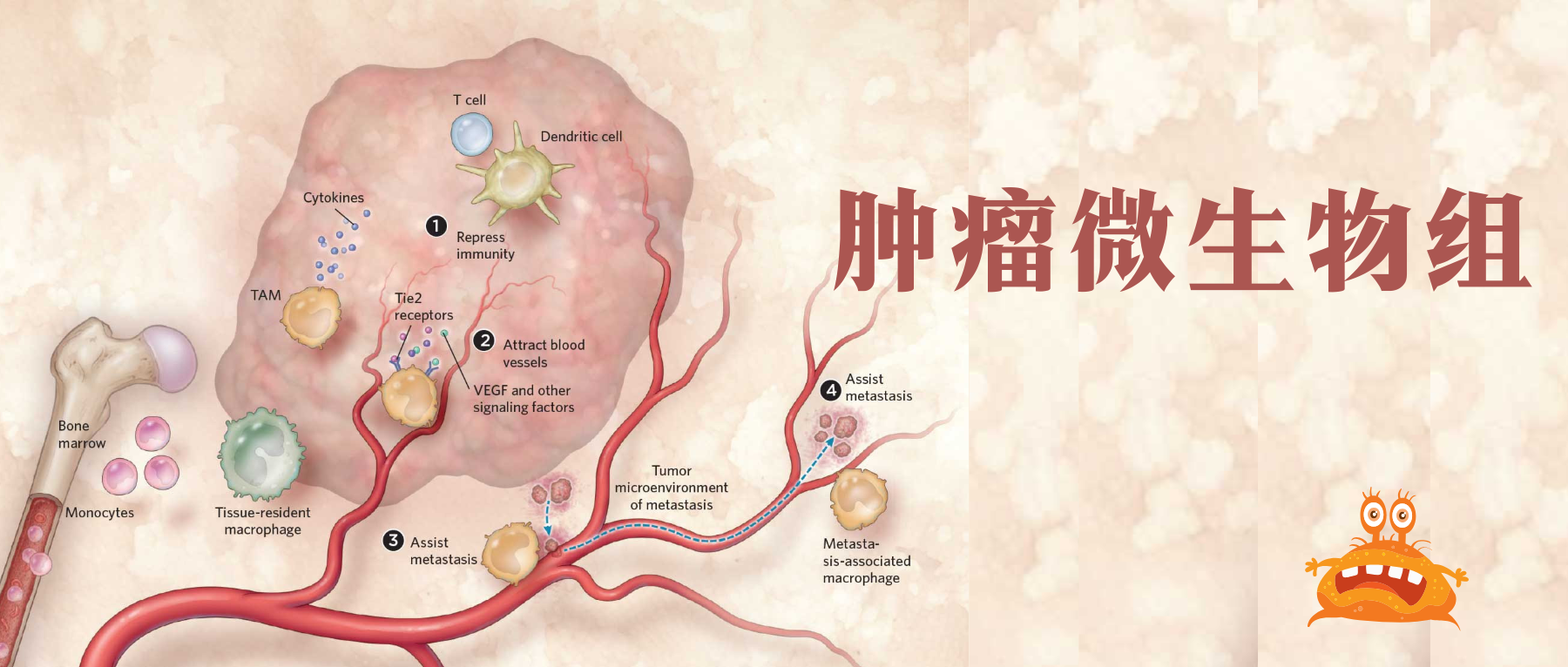
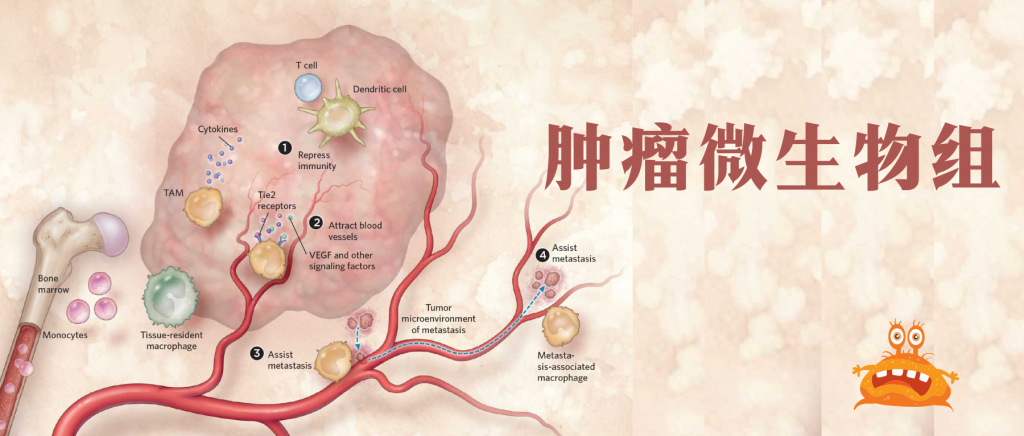
然而,研究也证实了肿瘤内微生物群在癌症中的作用。近年来,肿瘤内微生物群已被确定为肿瘤的一个组成部分,并可能在功能上调节转移的各个方面。
肿瘤内微生物群与区分正常组织与癌组织、药物反应者与无反应者癌症、良好与不良预后、转移性与非转移性癌症有关。
肿瘤内微生物群的调节可以减少癌症转移,阻止癌症进展,并重新编程免疫反应。
本文主要集中于肿瘤内微生物群的发现和表征及其在肿瘤转移过程中的独特功能,并讨论了癌症治疗的挑战和意义。
癌症转移通常被定义为:
肿瘤从原始肿瘤部位转移到远端器官的多步骤过程。
这一过程涉及几个步骤,包括入侵、传播、血管内、外渗、定植。
转移的一个关键特征是其极低效率,这是由于癌细胞在成功到达并定居目的地之前,需要应对许多物理、化学和生物挑战。
转移级联期间的应激源包括:
• 细胞外基质(ECM)僵硬
注:肿瘤细胞外基质的硬度约为周围正常组织的1.5倍
• 失巢凋亡
注:失巢凋亡是由于细胞与细胞外基质和其他细胞失去接触而诱导的一种特殊的程序化细胞死亡形式,在机体发育、组织自身平衡、疾病发生和肿瘤转移等方面起重要作用。
• 流体剪切应力
注:压缩、拉伸、剪切力导致的组织变形导致组织液在细胞周围运动。
• 化疗
注:使用化学治疗药物杀灭癌细胞达到治疗目的。
• 免疫监视
注:免疫系统具有识别、杀伤并及时清除体内突变细胞,防止肿瘤发生的功能,称为免疫监视。
确定转移效率的关键是:
了解早期转移细胞如何能够抵抗这些挑战并增强其对不同环境的适应性,以及每种类型的压力对最终转移效率的影响程度。
转移是一个低效的多步骤易位过程
doi.org/10.1016/j.tcb.2022.11.007
新的研究扩大了我们对转移的认知。例如,研究表明转移开始发生在肿瘤进展的非常早期。
集体侵入相邻组织
在这些转移细胞到达远端器官之前,癌细胞甚至可以通过分泌成分远程准备转移前生态位(PMN)。当转移细胞开始迁移时,它们通常会集体侵入相邻组织,并作为寡克隆细胞簇在血流中传播,以增强其定植新生态位的能力。
doi.org/10.1016/j.canlet.2021.09.009
改变代谢程序,逃避免疫监视
这些先驱转移起始细胞改变它们的代谢程序以增强它们的转移潜能,并且可以逃避免疫监视并长时间保持休眠状态,直到开始分裂。
转移能力高度依赖于癌细胞内部细胞特性
这些研究使我们对转移细胞生存策略的理解更进一步,并证实了癌细胞转移能力高度依赖于癌细胞内部细胞特性的观点,例如 EMT 状态、干细胞可塑性、遗传学、表观遗传学、染色体不稳定性和代谢适应,以及环境因素,如机械压力、免疫反应、ECM、PMN 和肠道微生物组。
那么,癌细胞获得这些转移性状的驱动力是什么?

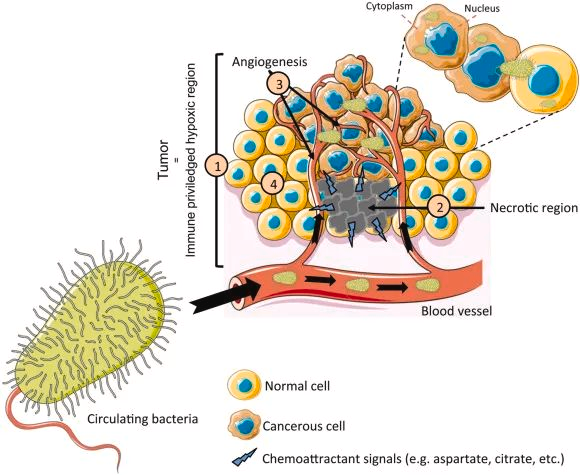
在实验上,肿瘤内微生物群已被确定为组织的一个组成部分。这些肿瘤内细菌是癌症进展不同阶段的新参与者,可以从外部相互作用和细胞内部影响癌细胞。
下面一个章节,我们来看肿瘤内微生物群是什么,有什么作用?
我们知道,已经有越来越多的文章阐述肠道微生物组在癌症进展中的作用,这方面我们的理解在迅速增长,然而我们对肿瘤内微生物群的理解仍处于初级阶段。
近期与转移相关的肿瘤内微生物群的研究

doi.org/10.1016/j.tcb.2022.11.007
人类组织,包括癌组织,通常被认为是无菌的,除了结肠、皮肤和口腔。
▸ 肿瘤内微生物群
癌症生物学的最新概念进展是,鉴定出癌症组织中存在微生物群。这些肿瘤组织驻留细菌被归类为“肿瘤内微生物群”。
我们知道,肠道微生物群可以通过代谢产物或通过与免疫细胞的相互作用,远距离影响肿瘤组织。
而肿瘤内微生物群与癌细胞密切接触,因此可能与肠道微生物群有不同的功能模式。
我们其他文章有对肠道微生物组在癌症诊断、预后和治疗反应中的作用进行详细介绍:
肠道微生物群与五种癌症的相互作用:致癌 -> 治疗 -> 预后
因此,本文主要集中于肿瘤内微生物群的发现和表征及其在肿瘤转移过程中的独特功能。
▸ 肿瘤内微生物群发现的证据:
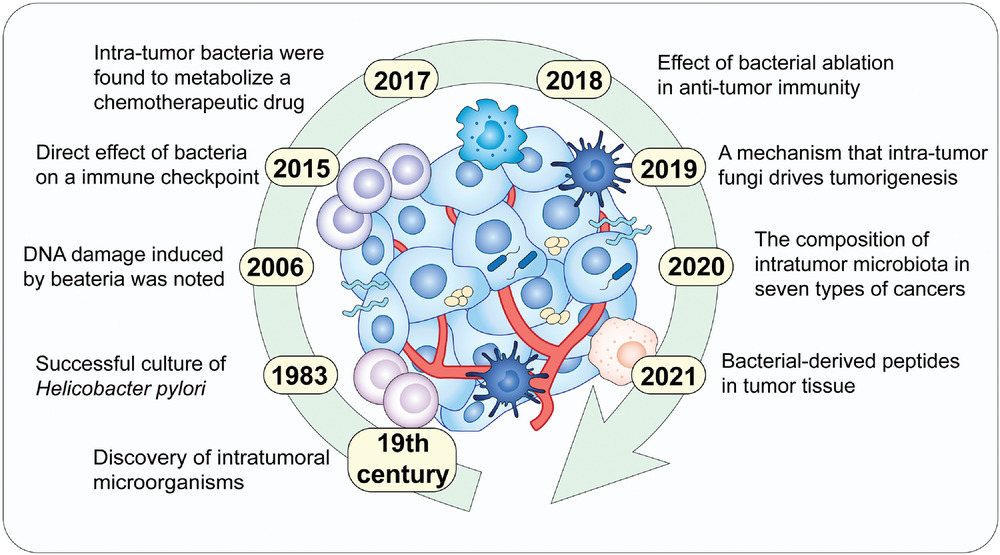
-早前提出假设
一百多年前,威廉·科利发明了科利毒素(化脓性链球菌和粘质沙雷菌的混合物)来治疗一位癌症患者,并观察到肿瘤消退。
他假设“每一种恶性肿瘤都可能有外源性或微生物来源”。然而,在这个假设之后的几十年里,没有直接证据表明肿瘤内细菌的存在。
瘤内微生物群研究的重大突破包括发现、机制等成果
doi.org/10.1002/advs.202200470
-攻克瘤内微生物的检测技术挑战
到现在,下一代测序技术 (NGS) 能够使用 16S rDNA 测序将细菌 DNA 与肿瘤组织区分开来,然而,由于瘤内细菌丰度低和宿主基因组污染严重,从组织处理或试剂中引入的环境噪声信号使数据收集变得复杂,因为它们会掩盖组织的真实微生物概况并削弱结论的稳健性。
这些技术挑战在过去几年已被攻克,多个研究小组报告了大量数据,进一步支持瘤内微生物群的存在。此外,生物信息学微生物特征能够区分健康个体和癌症患者。
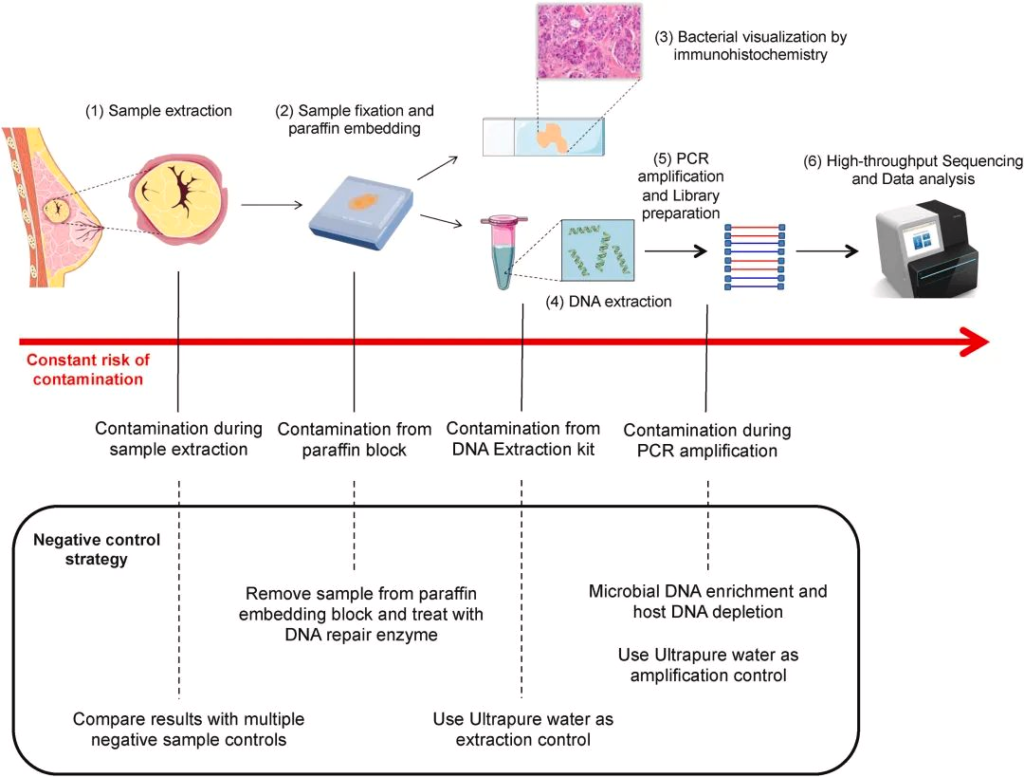
doi.org/10.1016/j.canlet.2021.09.009
识别肿瘤微生物组为癌症研究领域开辟了新的机遇。更好地表征肿瘤内微生物组可能会导致开发新的治疗方法,从而克服传统的癌症治疗方法。下一代测序方法,包括 16S 扩增子测序,可以在组织提取和石蜡固定后,将肿瘤内细菌精确地聚集在确定的细菌亚群中。
此外,宏基因组学对于肿瘤内微生物的鉴定也很重要。
宏基因组
宏基因组是一种针对样本中所有 DNA 的非靶向测序方法,包括微生物群落的全基因组序列,广泛应用于复杂微生物组的分析。宏基因组的分辨率更高,可以达到物种甚至菌株水平。此外,宏基因组学可以提供功能信息。
此外,宏基因组学可以与转录组分析结合使用,以消除死亡微生物和细胞外DNA造成的干扰。
最近的研究表明,最新的宏基因组数据涵盖了更多类型的癌症,这可能促进肿瘤内微生物群领域的新进展。
在瘤内微生物研究中,宿主DNA和环境微生物DNA的污染是最大的障碍。因此,需要开发从 TCGA 中丢弃不可信数据的方法。
在一项分析多种癌症的研究中,研究人员删除了总序列数据的 92.3%,以确保分析中数据的可靠性。2021 年,Dohlman 等人开发了一种去污染算法,可以去除 TCGA 数据中的污染。
随着这些方法的发展,宏基因组学可以为肿瘤内微生物群的研究提供更有力的支持。
▸ 细菌是各种癌症类型中肿瘤组织不可或缺的组成部分和活的居民
各种癌症类型有不同的微生物群。
肿瘤内微生物群的组成与许多类型的癌症有关。器官和组织包括食道、肺、乳腺、前列腺、膀胱、胃、肾、肝、胰腺等,以前被认为是无菌的。下一代测序显示这些器官含有低生物量微生物群。瘤内微生物组是肿瘤微环境的主要组成部分,影响肿瘤发生、疾病进展、耐药性和预后。
不同癌症类型的肿瘤内微生物群生态位
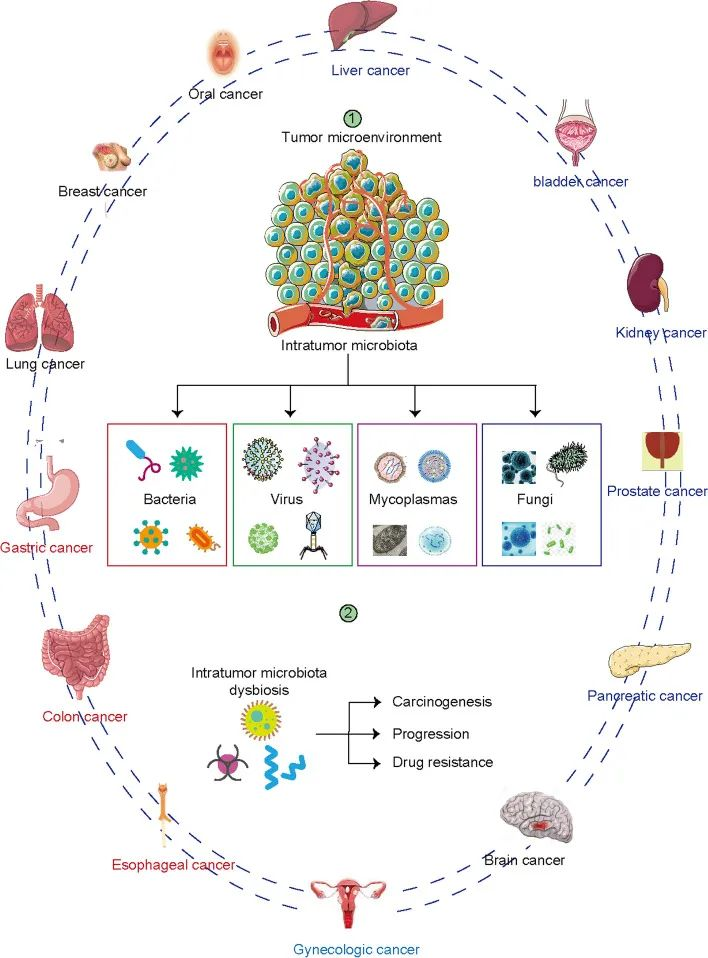
Liu J, et al., Biomark Res. 2022
在暴露于环境的组织(如肺癌和黑色素瘤)中并未发现微生物群丰度最高,而是在乳腺癌,骨癌,胰腺癌中。这表明肿瘤内微生物群的丰度是肿瘤特异性的。
作为癌症生态系统不可或缺的组成部分的肿瘤内微生物群
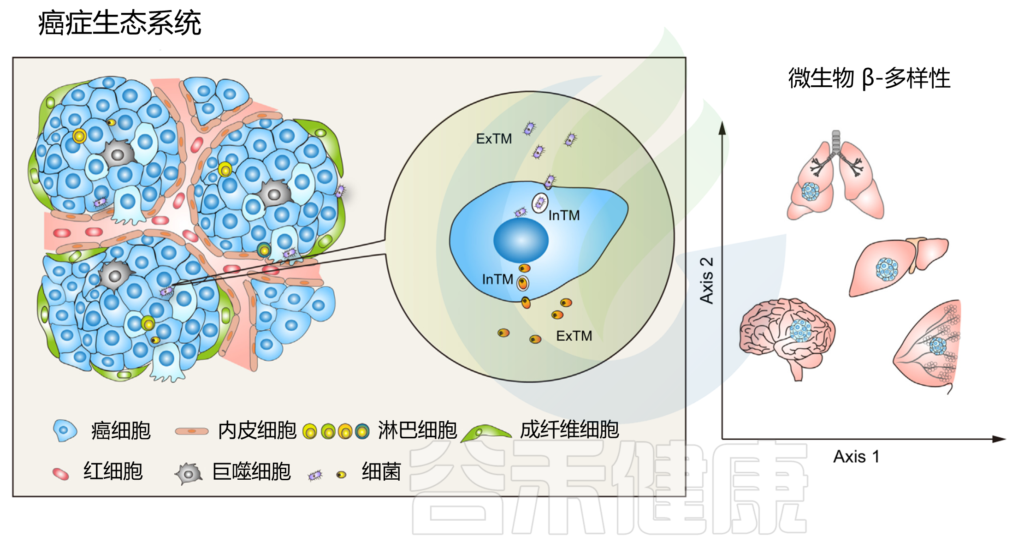
doi.org/10.1016/j.tcb.2022.11.007
如果肿瘤内微生物群存在于广泛的癌症类型中,那么它们来自哪里?
很少有研究专门去调查其原始来源。然而,对来自肿瘤组织的分离细菌菌株的分析提供了一些见解。
在小鼠乳腺肿瘤中,在正常组织对应物中检测到肿瘤内细菌菌株,这表明肿瘤组织从周围组织获得某些细菌。这些细菌菌株在体内的主要栖息地是多种多样的,有皮肤上的葡萄球菌、口腔中的链球菌和肠道中的肠球菌。
鉴于细菌具有在组织之间传播的能力,肿瘤内微生物群可能有多个起源。对鼻咽癌的分析表明,瘤内细菌主要来自鼻咽部,一小部分来自口腔和肠道。
* 也需要通过宏基因组比较和基因追踪分析来进一步加强。
肿瘤内微生物群的来源
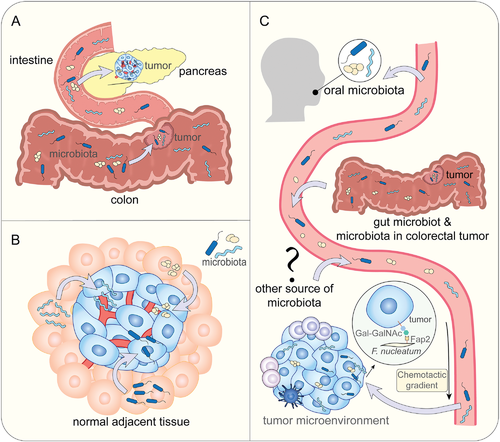
doi.org/10.1002/advs.202200470
A) 通过粘膜屏障从粘膜部位产生的肿瘤内微生物
B) 从正常邻近组织产生的肿瘤内微生物
C) 肿瘤内微生物是血行传播的结果
瘤内细菌的共同特征
1- 丰度低
它们在癌组织中的丰度远低于肠道中的丰度,根据 qPCR 定量和成像定量,0.1-10% 的癌细胞携带细菌,不同的量化方法和/或细菌 DNA 的提取效率引入了差异。
2- 多样性低
癌组织中微生物群落的多样性通常低于正常组织,这表明肿瘤可能形成一个独特的环境,选择性地扩展某些细菌种类。
3- 活的
这些细菌是活的。主要是主要存在于细胞内空间的共生生物。癌组织中不同的细菌栖息地可能与其在与癌细胞相互作用时的多效性作用模式有关。
细胞内外微生物群功能不一
鉴于细胞内和细胞外空间之间存在巨大的分子、生物化学和生物物理学差异,在肿瘤起始、肿瘤进展过程中,与细胞外肿瘤驻留微生物群 (ExTM) 相比,细胞内肿瘤驻留微生物群 (InTM) 可能具有完全不同的功能和免疫相互作用。
长期以来,细胞内细菌一直被研究为参与病原体-宿主相互作用的致病菌菌株。致病菌通过“触发”或“拉链”模式侵入宿主细胞,并能够迅速破开核内体膜进入细胞质。
肿瘤内共生细菌是遵循相同的原则还是使用不同的机制来侵入癌细胞?这方面仍知之甚少。在特定的癌症类型中,如乳腺癌,肿瘤内微生物群落主要以革兰氏阳性和兼性厌氧细菌为主,这表明肿瘤微环境具有选择效应。
不同的肿瘤类型具有不同的血管生成和氧水平、内吞作用和微胞作用以及周围组织中的微生物来源。这些因素共同决定肿瘤内微生物群的组成,并形成肿瘤类型特异性特征。
肠道菌群刺激特定代谢物的产生,调节免疫系统,并重建远端器官的微环境。相比之下,专门研究肿瘤内微生物群在癌症转移中的作用的研究有限。
这个领域的研究还比较浅,缺乏合适的实验工具来准确和特异性地调节肿瘤内的微生物群,同时又不扰乱身体其他部位的共生细菌。这个问题可以通过使用各种抗生素给药方案、使用无菌小鼠和原位细菌再给药来部分解决。
越来越多的证据证实,瘤内细菌可以调节癌细胞的内在特性及其外部环境,从而增强癌细胞的能力并为癌症转移铺平道路。
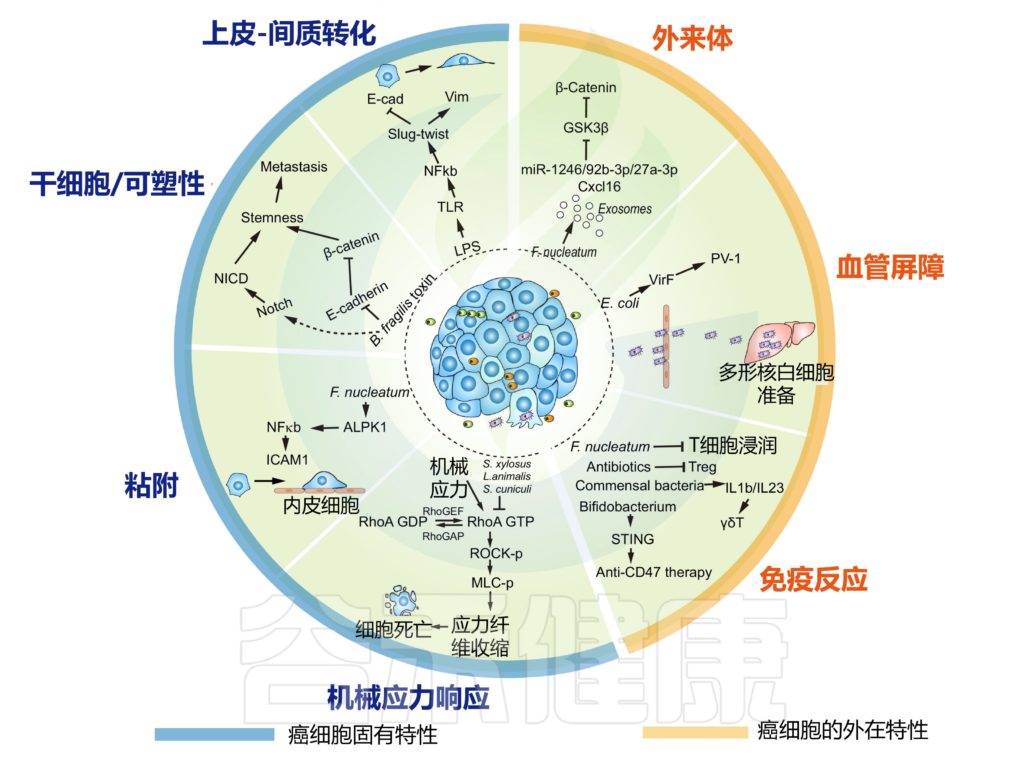
为了克服转移过程中的物理、化学和生物学挑战,癌细胞通常会改变其内在程序以应对不利的环境。这些包括干细胞程序/可塑性(用于新位点的肿瘤起始)、EMT 程序(用于癌症侵袭和传播)、粘附程序(防止失巢凋亡诱导的细胞死亡)和机械应激反应程序(抵抗机械力诱导的损伤) 。
研究表明,这些程序也可以通过肿瘤内微生物群进行调节。
肿瘤内微生物群改变癌细胞的内在特性并重塑转移中的肿瘤微环境
doi.org/10.1016/j.tcb.2022.11.007
我们先来看看,EMT程序是什么?
EMT程序赋予癌细胞迁移性间充质特征,具有松散的细胞间粘附特性,可动员癌细胞进行侵袭和扩散。这是由 TGFβ 信号通路的激活和与 Zeb、Twist 和 Snail 相关的协调转录程序驱动的。
微生物群和EMT程序之间有关联吗?
答案是肯定的。多项研究表明微生物群与 EMT 之间存在相关性。
在人类乳腺癌细胞系中,肿瘤驻留脆弱拟杆菌分泌的毒素诱导迁移和侵袭表型,EMT 相关的 Slug 和 Twist 的表达升高。在位于乳腺导管的肿瘤细胞中,脆弱拟杆菌的定植刺激了远端器官转移的增强。
这种功能调节是否仅限于细胞外肿瘤驻留微生物群,还是也适用于细胞内肿瘤驻留微生物群,以及不同的肿瘤驻留细菌对 EMT 的影响有多普遍,仍然是一个悬而未决的问题。
然而,有证据表明,脂多糖能够在依赖于 TLR-NFκB 通路的正常人肝内胆管上皮细胞中诱导 EMT.
在 EMT 驱动的小鼠结肠癌模型中,微生物群的存在对于肿瘤的发展至关重要。
这些研究支持组织驻留微生物群与 EMT 计划之间存在联系。
癌细胞的可塑性和干性是转移启动的另一个重要因素。
研究发现,脆弱拟杆菌毒素可以裂解 E-cadherin,触发下游 β-catenin 核定位,伴随 Notch 效应子 NICD 在乳腺癌中的核聚集。
在小鼠移植肿瘤模型中,Wnt 和 Notch 信号通路的后续激活,导致干性和肿瘤生长以及转移进展。
在自发性 MMTV-PyMT 乳腺肿瘤模型 [具有多瘤病毒中间 T 抗原 (PyMT) 的小鼠乳腺肿瘤模型在小鼠乳腺肿瘤病毒 (MMTV) 长末端重复序列下表达],各种肿瘤驻留细菌物种侵入 PyMT 癌症细胞触发了乳腺干细胞程序的富集。 由于与细菌侵入的癌细胞的体内分离相关的挑战,尚不清楚干细胞程序是否可以在生理细胞环境中被肿瘤内细菌激活。
癌细胞渗入血流引发细胞死亡程序
癌细胞渗入血流伴随着粘附丧失,这通常引发失巢凋亡,或其他形式的细胞凋亡的细胞死亡程序。癌细胞表面粘附分子的表达增强了它们的存活,并防止了转移失败。
在人类结直肠癌细胞系中,结直肠癌中常见的具核梭杆菌通过上调粘附分子 ICAM1 显着增强癌细胞对内皮细胞的粘附。这种增强的粘附力使癌细胞能够在尾静脉注射测定中外渗并引发新的转移灶。ICAM1 的上调部分是通过细菌依赖性激活 Alpk1-NFκB 通路实现的。
循环癌细胞受机械应力的影响导致细胞损伤
除了失巢凋亡依赖性细胞死亡外,循环癌细胞还会受到血液中各种机械应力的影响,从而导致细胞损伤,例如流体剪切应力,并在远端器官中,导致结构限制。
这些应激源部分被粘附分子(如整合素)感知,由 RhoGTPase 信号级联传递,并由 Yap/Taz 转录因子协调。
小鼠肿瘤模型的新发现表明,InTM 在侵入宿主癌细胞时会触发流体剪切应力反应,并且这种反应与细菌物种促进转移的能力相关。
被细菌侵入的癌细胞可以携带细菌,游走至远端器官,促进癌细胞的存活。这种表型是 InTM 特有的,因为通过调节 RhoAGTPase-Rock-actin 细胞骨架重组途径,癌细胞变得更能抵抗机械应力。引发这种反应的细菌机制仍不清楚。
然而,从肉毒梭状芽胞杆菌中分离出来并被多种细菌共享的 ADP-核糖基转移酶 C3 胞外酶是一个潜在的候选者,因为 C3 对细胞是不可渗透的,并且与膜穿透肽融合的 C3 经常被细胞生物学家用来解离肌动蛋白应力纤维并增强细胞扩散。
除了直接调节癌细胞外,瘤内细菌是重要的炎症介质,可以在癌细胞周围形成特定的微环境,从而间接促进癌症转移。
调节 PMN 的关键因素之一是细菌本身
结直肠癌研究表明,肿瘤驻留细菌能够通过毒力因子 VirF 调节肠道血管屏障。PV-1 表达升高的血管屏障受损,促进了细菌从原发性结直肠肿瘤传播到肝脏,并在癌细胞到达之前建立了 PMN.
注:PMN-迁移前生态位
患者体内较高的 PV-1 水平与较高的细菌负荷和较远的转移有关。这种依赖于细菌的 PMN 远程控制是一个新概念,可能对癌症以外的疾病有影响。
肿瘤外泌体可以调节 PMN 并决定转移器官的趋向性
肿瘤外泌体含有多种功能性脂类、蛋白质、RNA和DNA,释放到细胞外环境中调节靶细胞,重塑微环境。
源自具核梭杆菌侵入的人结直肠癌细胞,分离出含有 miR-1246/92b-3p/27a-3p 和 Cxcl16 的外泌体。这些外泌体在调节结直肠癌细胞迁移方面发挥作用,并通过靶向 GSK3β 激活 Wnt-β-catenin 信号通路显著增加肺转移。
这意味着邻近的癌细胞不一定需要被细菌侵入才能转移;相反,它们也可以通过旁分泌外泌体信号来动员以启动转移。
瘤内细菌最显着的特征之一是它们可以被免疫系统识别,从而触发特定的免疫反应
有许多关于肠道菌群失调与异常免疫反应之间关联的报道,但肿瘤内微生物群在调节免疫系统中的作用仍不清楚。
一方面,抗生素治疗和细菌再给药试验显示肿瘤内细菌抑制免疫反应的证据
在乳腺癌中,瘤内具核梭菌以免疫介导的方式加速肿瘤进展和肺转移,瘤内给药具核梭菌减少浸润的 CD4+ 和 CD8+ T 细胞。
在小鼠黑色素瘤癌症模型中,肺组织的抗生素治疗降低了细菌负荷,显示出调节性 T 细胞减少,T 细胞和自然杀伤 (NK) 细胞活化增强,同时肺转移显着减少。
在转基因小鼠肺癌模型中,肺部共生细菌激活了 γδT 细胞,这是一种 T 细胞亚群,通过刺激骨髓来源的 IL1β 和 IL23 并引发肿瘤炎症来促进淋巴和骨髓谱系的炎症反应。
另一方面,肿瘤内细菌可以触发抗肿瘤免疫。
例如,益生菌(鼠李糖乳杆菌)的施用强烈促进了针对小鼠黑色素瘤肺转移的肿瘤免疫。
此外,瘤内注射双歧杆菌可刺激 STING 通路,增加树突状细胞数量,并促进基于抗 Cd47 的免疫治疗。
因此,肿瘤内细菌的免疫调节作用是复杂的,并且依赖于环境,并且可能是细菌物种特异性的和/或受其细胞内/细胞外居住状态的高度影响。
传统癌症疗法的限制
迄今为止,主要的癌症疗法基于手术、放疗和化疗。尽管对大多数确定的肿瘤有效,但它们都有缺点,依赖于冗长、乏味的程序,非特异性地对抗肿瘤,通常无法区分恶性组织和健康组织。
由于缺乏对肿瘤样区域的特异性,某些癌细胞得以存活并定植在附近的组织中,从而导致潜在的癌症复发。靶向健康组织可能会产生意想不到的副作用,从而导致严重的致癌 DNA 损伤。
所有这些缺点,加上对治疗产生耐药性的持续风险,与癌症死亡率和发病率的增加有关。
90%的癌症患者死于复发或转移。
肿瘤内微生物群的作用可以通过具有肿瘤内微生物群信息的癌症患者的生存数据来评估。
在胰腺癌患者中,与短期幸存者相比,长期幸存者往往具有更高的微生物群落多样性。
此外,肿瘤内微生物群特征(假黄单胞菌Pseudoxanthomonas–链霉菌Streptomyces–糖多孢菌Saccharopolyspora –克劳氏芽孢杆菌Bacillus clausii)被确定与生存相关。
在其他癌症类型中,尽管样本量有限,但据报道特定的肿瘤内微生物组特征也与转移有关。
在对 800 多个患者样本进行分析的鼻咽癌临床研究中,肿瘤内细菌载量被确定为一种强有力的预后工具,可以区分恶性进展的风险。这些研究证实了肿瘤内微生物群的预后价值,并支持其在临床肿瘤进展中的作用。
然而,在临床上特异性调节肿瘤内微生物群具有挑战性。
有几项关于抗生素治疗和癌症风险、癌症反应和生存的回顾性研究,但它们很少专门设计用于剖析肿瘤内微生物群的消除和患者预后。
这些广泛的抗生素治疗数据分析报告了癌症发病率的增加和对免疫疗法的一般反应受损。鉴于已经确定肠道微生物组与免疫检查点抑制剂治疗密切相关,目前尚不清楚肠道肿瘤微生物组在调节癌症进展方面是否具有相似或不同的作用。
相比之下,一项胰腺腺瘤研究表明,抗生素治疗与晚期转移性胰腺导管腺癌的更好预后相关。
鉴于抗生素在效力、吸收效率、细胞渗透性以及给药途径和时间窗的可变性方面存在巨大差异,所有这些变量都可能导致肠道微生物组和细胞内/细胞外肿瘤微生物组概况的根本差异。因此,迫切需要精心定义的肿瘤内微生物群调节临床研究集。
肿瘤内微生物群数据在癌症筛查和治疗中的应用
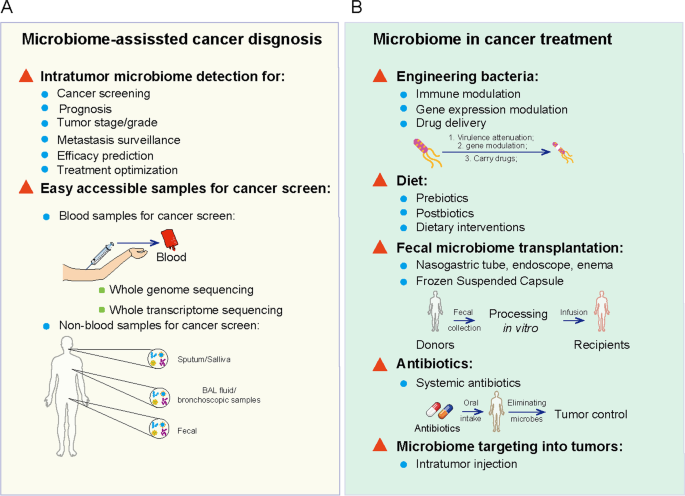
Liu J, et al., Biomark Res. 2022
A) 来自临床样本的数据可能有助于开发新的癌症筛查和预后,包括来自肿瘤部位和易于获取的样本的微生物群模式。
B) 肿瘤内微生物群可用于癌症治疗,包括工程菌、饮食调节、粪便微生物组移植、抗生素和肿瘤内微生物组注射等。
新兴研究揭示了肿瘤内微生物群在癌症转移的各个步骤中的生物学功能。这些肿瘤内微生物群不仅是肿瘤环境的传感器、肿瘤病理类型、药物反应和预后的指标,而且在功能上也参与肿瘤进展。
肠道细菌的宿主内进化会导致共生菌株变成致病。因此,需要进一步的研究来测试肿瘤内细菌促进癌症转移的能力是否源于细菌进化。这或许可以解释不同的细菌种群及其在正常组织和癌组织中的各种功能,以及为什么某些肿瘤类型比其他肿瘤发展得更快。
未来,肿瘤内微生物领域将受到更多关注,该领域有四个方面可能成为未来研究的重点:
肿瘤内微生物群可以作为癌症筛查的生物标志物。
包括肿瘤内微生物组衍生的个性化数据,这些数据可以将食管癌、胰腺癌、肺癌和口腔癌患者与健康人区分开来。分析肿瘤内微生物群特征,可能为患者的预后提供潜在的生物标志物。
此外,肿瘤内微生物群为癌症治疗带来新的机遇。
考虑到肿瘤内微生物群的异质性,个性化治疗策略因其高效和靶向作用而具有吸引力。
肿瘤内细菌的细胞外和细胞内定位使它们成为药物载体的完美候选者,可以在肿瘤细胞内外递送,以倒带细胞间和细胞内信号网络。
与其他抗肿瘤疗法一样,细菌疗法和抗生素也可以与其他疗法结合使用,例如免疫疗法和化学疗法。
使肿瘤内微生物群正常化和移植某些微生物也是提高抗肿瘤治疗效率的潜在策略。
癌症疗法正面临着巨大的转变:传统疗法正逐渐被更精确和复杂的疗法所取代。了解肿瘤内微生物群对癌症发生和发展的不同贡献,将有助于制定癌症预防和治疗策略。
主要参考文献:
Fu A, Yao B, Dong T, Cai S. Emerging roles of intratumor microbiota in cancer metastasis. Trends Cell Biol. 2022 Dec 13:S0962-8924(22)00258-6. doi: 10.1016/j.tcb.2022.11.007. Epub ahead of print. PMID: 36522234.
Liu J, Zhang Y. Intratumor microbiome in cancer progression: current developments, challenges and future trends. Biomark Res. 2022 May 31;10(1):37. doi: 10.1186/s40364-022-00381-5. PMID: 35642013; PMCID: PMC9153132.
An Y, Zhang W, Liu T, Wang B, Cao H. The intratumoural microbiota in cancer: new insights from inside. Biochim Biophys Acta Rev Cancer. 2021 Dec;1876(2):188626. doi: 10.1016/j.bbcan.2021.188626. Epub 2021 Sep 11. PMID: 34520804.
Heymann CJF, Bard JM, Heymann MF, Heymann D, Bobin-Dubigeon C. The intratumoral microbiome: Characterization methods and functional impact. Cancer Lett. 2021 Dec 1;522:63-79. doi: 10.1016/j.canlet.2021.09.009. Epub 2021 Sep 10. PMID: 34517085.
Wang Y, Guo H, Gao X, Wang J. The Intratumor Microbiota Signatures Associate With Subtype, Tumor Stage, and Survival Status of Esophageal Carcinoma. Front Oncol. 2021 Oct 27;11:754788. doi: 10.3389/fonc.2021.754788. PMID: 34778069; PMCID: PMC8578860.
Xie Y, Xie F, Zhou X, Zhang L, Yang B, Huang J, Wang F, Yan H, Zeng L, Zhang L, Zhou F. Microbiota in Tumors: From Understanding to Application. Adv Sci (Weinh). 2022 Jul;9(21):e2200470. doi: 10.1002/advs.202200470. Epub 2022 May 23. PMID: 35603968; PMCID: PMC9313476.
Huang Y, Zhu N, Zheng X, Liu Y, Lu H, Yin X, Hao H, Tan Y, Wang D, Hu H, Liang Y, Li X, Hu Z, Yin Y. Intratumor Microbiome Analysis Identifies Positive Association Between Megasphaera and Survival of Chinese Patients With Pancreatic Ductal Adenocarcinomas. Front Immunol. 2022 Jan 25;13:785422. doi: 10.3389/fimmu.2022.785422. PMID: 35145519; PMCID: PMC8821101.

谷禾健康

现代化疗,放射疗法在摧毁癌细胞的同时,对健康细胞也造成了伤害,引发相关毒性,反应例如便秘,腹泻,疲劳,恶心,呕吐等。
癌症患者的营养状况可能是癌症治疗相关毒性的核心决定因素,也是癌症症状的指标。
一些临床前研究和初步临床试验表明,饮食干预可能会减轻某些癌症治疗相关的症状和毒性。可能机制包括影响炎症、氧化应激、肌肉质量、心脏健康和调节肠道菌群。
本篇涵盖了三大块内容,包括:
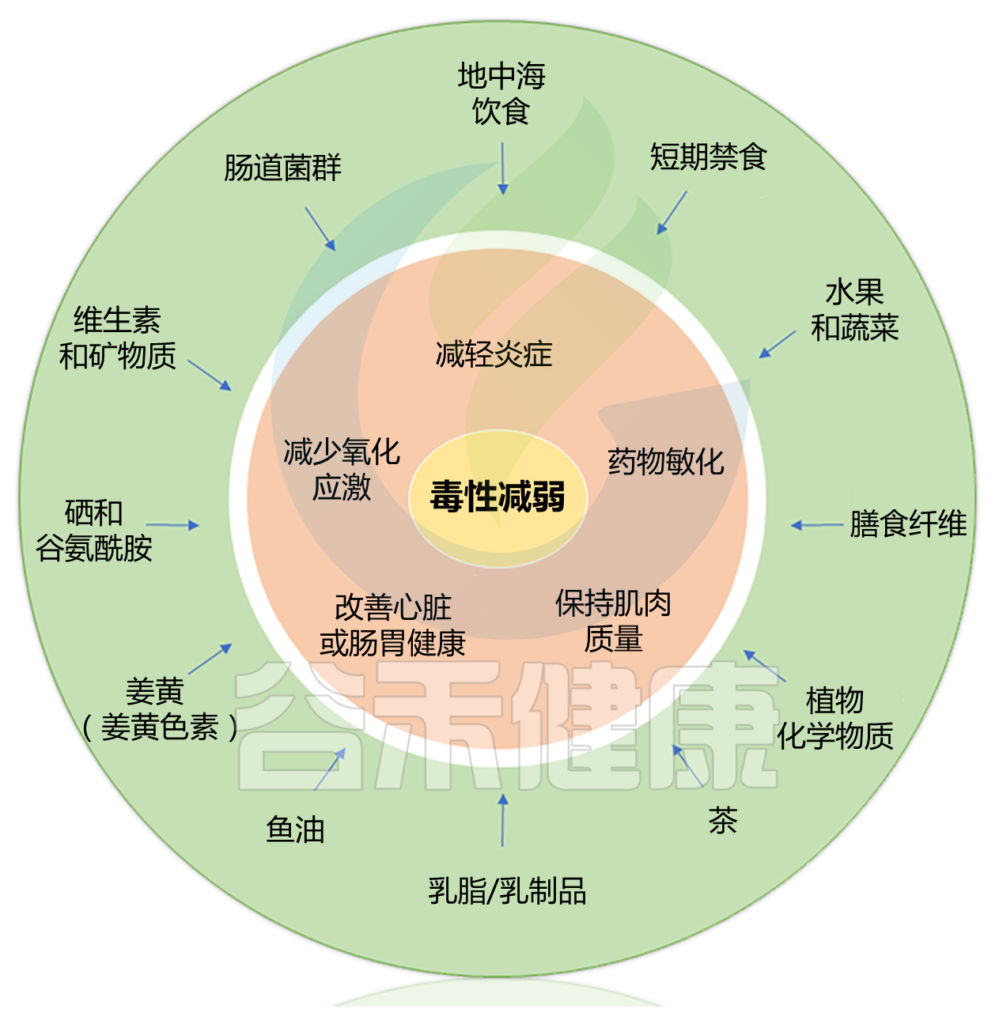
Alan J. Kim et al.,Cancer Treatment Reviews, 2022
地中海饮食模式,其特点是大量摄入水果、蔬菜、豆类、橄榄、全谷物、不饱和脂肪、坚果和鱼类;适度饮酒;减少红肉和加工肉类以及高脂肪乳制品的摄入,对减少炎症,改善心血管健康,抗肥胖,改善血脂以及对肠道菌群和免疫调节有积极作用。
↓↓ 降低心源性猝死
在一项大型前瞻性研究中,调查了激素替代疗法、钙和维生素D或饮食调整对健康绝经后妇女的影响,发现地中海饮食模式与降低心源性猝死的风险有关。
↓↓ 缓解癌症相关的疲劳
一项随机对照试验中,23名前列腺癌男性患者接受了至少3个月的雄激素剥夺治疗,被随机分成两组,一组接受12周常规治疗,另一组接受地中海饮食并同时接受六次个性化营养咨询,与常规治疗相比,坚持地中海饮食与缓解癌症相关的疲劳以及提高总体生活质量有关。
↓↓ 减轻妇科肿瘤患者症状
一项对22名接受铂类化疗的妇科肿瘤患者的观察研究表明,坚持地中海饮食的患者胃肠道毒性较小,恶心、胃痛、腹胀和干扰日常活动的频率和严重程度差异有统计学意义。
周期性禁食即在给定的时间内部分或完全不吃除水以外的食物和饮料。在动物模型和人类患者中,周期性禁食与降低癌症治疗中的毒性密切相关。
↓↓ 延缓肿瘤进展
例如,在一项临床前研究中证明,禁食条件增加了对化疗药物的敏感性,并延缓了肿瘤的进展。还有人发现,在荷尔蒙受体阳性乳腺癌的小鼠模型中,周期性禁食或类似禁食的饮食(FMD)可增强激素治疗的活性(如他莫昔芬和氟维司群),并通过降低循环中胰岛素、瘦素和IGF1的水平以及抑制AKT-mTOR信号传导来促进长期的肿瘤消退。
↓↓ 提升生活质量
在一项针对131名HER2阴性的II/III期乳腺癌患者的II期临床研究证实了4天FMD的潜在益处。在新辅助化疗前3天和新辅助化疗当天,接受了植物性、低氨基酸替代饮食(包括肉汤、汤、液体、维生素片和茶)的患者报告称,与对照组(常规饮食)相比,总体幸福感有所提高,情绪、身体、认知和社会功能都有所改善。
↓↓ 减少化疗相关毒性
在一项对照交叉初步研究中,调查了30名接受化疗的妇科癌症患者,结果表明,短期禁食的改良形式减少了化疗相关的毒性,包括口腔炎、头痛、虚弱和总体毒性。
据报道,FMD是安全可行的,可以减少脂肪量,降低循环中胰岛素生长因子1、胰岛素和瘦素的水平。禁食强烈影响新陈代谢和细胞途径,导致循环中类胰岛素一号生长因子(IGF-1)和葡萄糖水平下降。这些变化反过来影响几个癌基因,包括RAS和AKT信号通路,导致细胞生长和增殖的下调。
禁食和FMD(低卡路里、低蛋白质和低糖的饮食)可能与减少化疗副作用有关,即当营养素缺乏时,正常细胞,而不是肿瘤细胞,可以切换到抑制生长和增殖途径的保护模式,这一过程被称为差异应激抵抗。
↓↓ 增强免疫
此外,禁食和/或FMD已被证明可以增强免疫系统,减少炎症,减缓小鼠的骨密度损失,并减少HER2阴性的II期乳腺癌患者化疗引起的淋巴细胞DNA损伤。
生酮饮食的特点通常是碳水化合物消耗量低,占每日总热量摄入量的5%-10%,但其他产生能量的大量营养素,即脂肪和蛋白质的含量却不同。生酮比用来定义饮食的生酮能力,定义为脂肪克数与碳水化合物和蛋白质克数之和的比值。
在癌症中研究最多的生酮饮食包括经典生酮饮食(CKD),其特征是生酮比为4:1或3:1,每日87%-90%的热量来自脂肪)和中链甘油三酯生酮饮食[MCTKD,其中30%-60%的总热量来自中链脂肪酸,如己酸(C6)、辛酸(C8)、葵酸(C10)和月桂酸(C12)]。
↓↓ 血糖,体重更可控,生活质量高
在接受放化疗和辅助化疗的胶质母细胞瘤患者中,那些生酮饮食患者的血糖水平低于那些标准饮食的患者。有人研究发现,在接受放疗的非转移性乳腺癌患者中,以天然食物为基础的生酮饮食与未指定标准饮食相比,体重和脂肪减少得更多,生活质量水平更高。
↓↓ 降低癌症治疗相关毒性
生酮饮食降低癌症治疗相关毒性的机制可以用瓦氏效应(Warburg effect)来解释,在瓦氏效应中,癌细胞利用糖酵解而不是氧化磷酸化,能预防由活性氧引起的氧化损伤。
生酮饮食(通常是高脂肪低葡萄糖),可以利用这种代谢差异,要么让癌细胞挨饿,要么迫使它们转而利用氧化磷酸化。与正常细胞相比,癌细胞中氧化应激的增加可以使它们对化疗和放射更加敏感,从而减少治疗所需的剂量,降低与治疗相关的毒性。
↓↓ 注意高脂肪生酮饮食的副作用
有限的依据支持在临床实践中使用生酮饮食,而且,根据总含量和相对常量营养素组成,不同类型的生酮饮食可能对治疗相关的毒副作用产生不同的影响。例如,长期食用高脂肪生酮饮食可能会增加心血管或脑血管疾病的风险,特别是与特定的抗癌药物联合使用时。高脂生酮饮食还可能增加严重脂肪性肝炎的风险,促进肝纤维化的进展。此外,研究表明,高脂肪生酮饮食增加了酮体乙酰乙酯的循环水平,并促进了异种移植小鼠中表达BRAF-V600E致癌基因的人类黑色素瘤细胞的肿瘤生长潜力。
因此,根据目前对营养的理解,接受癌症治疗的患者的饮食应该包括所有的常量营养素,以降低营养不良的风险。
膳食纤维与多种肿瘤类型的胃肠道毒性和症状的预防有关。在一项随机对照试验中,在放疗期间服用高剂量膳食纤维(18克/天)的盆腔癌患者报告称辐射引起的胃肠道毒性发生率较低,证明了膳食纤维在预防放射治疗相关毒性方面存在潜在影响。
膳食纤维还可以促进健康的肠道菌群,从而降低毒性并增强治疗效果,例如纤维与促进免疫的普拉梭菌和短链脂肪酸丁酸盐的有关。有人发现在黑色素瘤患者中,膳食纤维会影响肠道菌群,并与免疫检查点阻断反应的增强有关。

Spencer CN, et al.,Science. 2021
tips
对于腹膜癌、肠癌进展或原发性胃肠癌的患者来说,可能需要低膳食纤维饮食,以降低肠梗阻的风险。
增加水果和蔬菜的摄入量与改善胃癌幸存者的身体和认知功能、减少疲劳和食欲不振有关。
水果和蔬菜含有过多的植物化学物质,并且已经检查了几种植物化学物质的影响,并在下表中进行了总结。

Alan J. Kim et al.,Cancer Treatment Reviews, 2022
例如,葡萄产品的抗氧化和抗炎作用归因于它们的植物化学物质,即芪类、花青素和原花青素,包括白藜芦醇。
其他几种水果,包括黑醋栗、李子、石榴和苹果,已经被证明具有抗癌和细胞毒性作用,这归因于植物化学物质,特别是多酚和黄酮类物质的抗氧化和抗炎作用。
tips
对于肠梗阻风险较高的患者,应避免过量摄入水果和蔬菜相关的膳食纤维。
据报道,在70多种植物中发现的一种植物化学物质白藜芦醇可以增加结直肠癌细胞系对化疗药物的敏感性,包括阿霉素、索拉非尼、5-氟尿嘧啶、依托泊苷、丝裂霉素、奥沙利铂和姜黄素。
关于白藜芦醇在该文有详细介绍:
注意:高剂量(每天>2.5克)会引起轻微的毒性(包括腹泻、胃肠道症状和前额头痛),即使在健康的人身上也是如此。
其他多酚也可能具有抗炎和抗氧化作用。
▸槲皮素是浆果中一种常见黄酮醇,它通过作用于炎症介质,包括白细胞介素6、白细胞介素8、干扰素γ、诱导型一氧化氮合酶、环氧合酶2和肿瘤坏死因子α来诱导抗炎作用,并在对促凋亡刺激敏感的癌细胞系中提供促凋亡作用。
▸非瑟素是一种存在于草莓、苹果和柿子中的类黄酮类化合物,在结构上与槲皮素相似,具有类似的抗炎和抗癌活性。
▸番茄红素是番茄和红色水果(包括木瓜和西瓜)中的一种植物化学物质,具有高抗氧化活性,并通过减少氧化应激以及染色体和膜的异常来减轻致癌损害。此外,番茄红素具有神经保护作用,并被认为可以通过减少氧化应激和神经炎症来预防神经毒性。
喝茶,尤其是绿茶,与抗癌作用、减轻药物引起的毒性以及对化疗药物的敏感性有关。
↓↓ 抑制继发性肿瘤
茶中存在的儿茶素在促进健康的作用中起着重要作用。表没食子儿茶素没食子酸酯在体外和体内乳腺癌模型中显示了抗氧化和抗炎活性(尤其是在他莫昔芬诱导的氧化应激情况下),能够抑制头颈部或盆腔癌症患者的放射性皮炎,并抑制继发性肿瘤的继发发展。
↓↓ 防止辐射带来的不良反应
据报道,表没食子儿茶素没食子酸酯还可用于预防暴露于γ辐射或以顺铂为基础的治疗后的唾液腺细胞功能障碍,防止辐射引起的不良血液学变化(如贫血、血小板减少),以及预防博莱霉素引起的肺纤维化。
↓↓ 减少药物引起的毒性
此外,表没食子儿茶素没食子酸酯可减少伊立替康治疗期间的胃肠紊乱、顺铂引起的肾毒性和耳毒性,以及阿霉素和柔红霉素治疗引起的心脏毒性。
在药物致敏方面,绿茶显示了许多与化疗的协同作用,其中一些包括与4-羟基他莫昔芬联合使用可以提高细胞毒性水平,通过降低大B细胞淋巴瘤(Bcl-xL)基因(编码抗凋亡蛋白)的表达使得MCF7细胞对5-氟尿嘧啶增敏,以及4只接种T1的Balb/c小鼠对紫杉醇的敏感性。这种致敏作用通过降低所需化学治疗药物的剂量有效地降低了药物引起的毒性的严重程度。
乳制品/奶制品与癌症治疗之间的关系一直存在争议。尽管据报道在Balb/c小鼠中,乳制品/乳脂可以增强紫杉醇治疗的有效性,并减少与该制剂相关的毒性,例如,器官损伤、腓肠肌丧失、附睾脂肪组织减少、红细胞和白细胞损失以及空肠形态、绒毛长度和肠 γ-谷氨酰转肽酶活性的破坏。
tips
有研究表明,在被诊断患有早期浸润性乳腺癌的女性中,高脂牛奶与乳腺癌、全因和非乳腺癌死亡率的增加有关,以及与绝经前妇女乳腺癌进展的风险增加有关。
鱼油富含omega-3脂肪酸,如二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),在减少癌症和癌症治疗相关症状和毒性方面的作用已被广泛研究。
↓↓ 减少化疗引起的毒性
一项随机临床试验表明,在宫颈癌患者(n=40)中,补充鱼油可以减少化疗引起的毒性,如厌食、恶心、口干和味觉障碍。一项对88例癌症患者补充精氨酸、谷氨酸和鱼油的研究表明,补充精氨酸、谷氨酸和鱼油可显著减少3-4级血液毒性,并提高两年总生存率。
↓↓ 增强抗肿瘤作用
一些体外和体内研究表明,与单纯化疗相比,化疗期间给予EPA和DHA可以增强抗肿瘤作用,减少化疗对正常组织的毒性,抑制全身炎症,改善癌症患者的营养状况。同样,在紫杉醇和顺铂/卡铂治疗期间,在等卡路里饮食中添加EPA与非小细胞肺癌患者的疲劳减轻、食欲改善和化疗引起的神经病变减少有关。
↓↓ omega-3脂肪酸减少化疗毒性
omega-3脂肪酸还可以减少癌症相关的恶病质,增加免疫调节作用,从而增强结直肠癌和食道癌患者的化疗与放疗,减少食道癌患者化疗引起的毒性(如口腔炎,3/4级腹泻,以及天冬氨酸转氨酶和丙氨酸转氨酶水平的升高)。
已经提出了多种机制来解释omega-3脂肪酸在降低癌症治疗相关毒性方面的作用。其中一种假设是细胞膜的组成,这表明不饱和脂肪酸掺入癌细胞膜中,导致细胞膜组成模式与正常细胞不同。考虑到细胞膜是细胞内信号传导和基因表达调控的中心,癌细胞和正常细胞之间细胞膜上脂肪酸分布的不同可能导致信号通路的不同激活(例如,PKC激活和NF-KB 通路)。
尽管omega-3脂肪酸在临床试验中显示出了益处,但在临床前模型中,omega-3脂肪酸十六碳-4,7,10,13-四烯酸已证明可以抑制铂化合物的肿瘤导向细胞毒性,这可能会对患者造成潜在的伤害。
因此,在建议临床食用鱼油之前,有必要进一步研究普通鱼油成分与纯化的EPA/DHA对特定化疗药物的细胞毒性的影响。
姜黄是一种开花植物,可从中提取姜黄素。它们与预防和治疗化疗和放疗相关的不良事件有关。姜黄/姜黄素对癌症的有益作用归因于它们的抗氧化和抗炎特性,以及它们在抑制细胞增殖和肿瘤干细胞发展方面的作用,以及它们对肠道菌群和免疫系统的积极作用。
↓↓ 姜黄油降低化疗4级毒性发生率
姜黄油具有保肝作用,并缓解刀豆蛋白A诱导的氧化应激和炎症,从而减少人类患者的多种症状和毒性。同样,与其他草本物质:发酵大豆提取物、绿茶提取物、樟芝菌丝体、螺旋藻和葡萄籽提取物相结合,可显著降低接受亚叶酸钙/5-氟尿嘧啶化疗患者的4级毒性发生率。
↓↓ 姜黄/姜黄素减轻粘膜炎严重程度
一项评估的结论是,局部应用姜黄和姜黄素可以控制接受化疗和/或放疗的癌症患者的口腔粘膜炎,而接受姜黄/姜黄素治疗的患者报告称疼痛较轻,红斑强度较低,溃疡区域较少。一项评估32名接受放射治疗的头颈部癌症患者的临床试验也得出结论,口服纳米胶束姜黄素显著减轻了放疗引起的粘膜炎的严重程度。
↓↓ 姜黄/姜黄素有助于控制癌症相关的疼痛
一项针对绝经后乳腺癌患者的多中心临床试验(n=45)显示,联合应用羟基酪醇(一种在橄榄油中发现的具有强大抗氧化作用的酚类植物化学物质)、omega-3脂肪酸和姜黄素可以减轻患者报告的疼痛,并降低炎症生物标志物的水平。
↓↓ 姜黄与常见化疗药物的协同 / 拮抗作用
姜黄素在I期临床试验中协同增强化疗药物FOLFOX(5-氟尿嘧啶、亚叶酸钙、奥沙利铂)和达沙替尼对经FOLFOX处理的HCT116和HT-29细胞有抗增殖作用。
尽管这些结果提示了有希望的进一步研究领域,但对人乳腺癌细胞株(即MCF-7、MDA-MB-231和BT-474)的体外实验表明,姜黄素与以伊立替康或环磷酰胺为基础的化疗之间存在拮抗作用,饮食补充姜黄素可能会抑制基于化疗的肿瘤消退。这些发现表明,需要更多的研究来确定乳腺癌患者是否应该在化疗期间避免补充姜黄素。
谷氨酰胺是巨噬细胞、淋巴细胞和肠细胞的主要燃料来源,具有多种有益作用,包括改善免疫系统、减少炎症和分解应激状态。
↓↓ 化疗配合谷氨酰胺补充,降低血液学毒性发生率
一项针对接受同步放化疗的癌症患者的随机研究表明,除了常规饮食外,还接受精氨酸、谷氨酰胺和鱼油营养补充剂的患者与未接受补充剂的患者相比,发生3级或4级血液学毒性的发生率较低。
↓↓ 补硒改善免疫系统
据报道,补硒在脂质过氧化方面具有抗氧化作用,刺激自然杀伤细胞的细胞毒活性,减少肿瘤内血管生成,并在体外改善免疫系统。硒与重金属的解毒作用有关。这些影响的产生可能是因为硒是硒蛋白和酶的重要组成部分,这些硒蛋白和酶有助于抗氧化防御、减少炎症、甲状腺激素产生、DNA合成。
一项对关于硒和放射治疗的文章进行了评估,得出的结论是,每天服用300-500微克的硒,持续10天到6个月,可以减少放疗的副作用,包括腹泻、唾液腺损伤和辐射伤口,不会产生不良影响。
tips
高剂量的硒(>400微克/天)会产生严重的副作用,像指甲变脆、脱发、胃肠功能障碍、皮疹、神经紊乱等。
维生素补充剂在减少癌症和癌症治疗相关症状和毒性方面的功效研究显示出相互矛盾的结果。
例如,尽管许多研究表明维生素C补充剂具有潜在的抗癌作用和降低毒性作用,但对接受化疗的癌症患者的维生素C进行的系统审查发现,没有明确的证据表明服用维生素C补充剂可以减少毒性或改善治疗的抗癌效果。
同样,尽管维生素D补充剂已被证明可以预防癌症治疗引起的骨质流失,并恢复许多早期乳腺癌患者经历的维生素D不足,但在各种研究中报告的维生素D的抗肿瘤效果仍然很差。
tips
由于维生素补充剂在癌症治疗期间的效果尚不清楚,强烈建议患者遵守饮食建议,通过水果和蔬菜等天然食物摄入维生素,而不是依赖膳食补充剂。
一个健康人体胃肠道中的各种复杂的微生物群已显示出显著的生理益处,如增强肠道功能和消化能力、抵御病原体和调节免疫力。
虽然“健康”肠道菌群的定义并不明确,但数据表明,具有高度功能冗余度的多样化和稳定的微生物群是健康状态的关键标志。
肠道菌群对癌症患者的治疗反应有显著影响。例如,白血病或淋巴瘤患者在造血干细胞移植后具有高水平的粘液真杆菌,其复发或肿瘤进展的可能性较低。
↓↓ 肠道菌群失调影响抗PD-L1治疗效果
人类、动物和体外研究表明,肠道菌群的免疫调节影响靶向免疫治疗的疗效,如细胞毒性T淋巴细胞相关4(CTLA-4)阻断和抗PD-L1治疗。与这些发现一致的是,一部分接受抗PD-L1治疗和广谱抗生素治疗的上皮性肿瘤患者经历了失败治疗,其原因可能是导致了微生物群的失调。
进一步支持这些发现的是,从应答者和无应答者患者向有免疫活性小鼠的粪便转移导致小鼠对抗PD-L1抗体产生了与相应粪便移植供体相同的反应,从而证明了肠道菌群对抗PD-L1治疗的效果。
↓↓ 肠道菌群调节化疗的疗效和毒性
化疗药物环磷酰胺和阿霉素能诱导革兰氏阳性菌(约氏乳杆菌、鼠乳杆菌和海氏肠球菌)转移到小鼠的次级淋巴器官中。一旦转移到淋巴器官,微生物就会刺激17型和1型T辅助细胞反应的积累,从而增强免疫反应。
临床前和临床证据都表明,抗生素会降低化疗的疗效。例如,长期使用抗生素已被证明会降低环磷酰胺治疗荷瘤小鼠P815肥大细胞瘤的疗效,支持了肠道细菌易位的重要性。
一项对C57BL/6(B6)和129SvEv(129)小鼠化疗所致周围神经病变的临床前研究表明,肠道细菌在确定紫杉醇诱导的疼痛敏感性中起主导作用;在对紫杉醇诱导的疼痛敏感和抵抗的小鼠之间,观察到肠道微生物群组成的显著差异。
↓↓ 肠道菌群与胃肠道不良反应的发生率有关
一项对接受放化疗的宫颈癌患者进行的临床研究(n=35)得出结论,肠道微生物多样性与胃肠道毒性的发生率呈负相关。
同样,一项针对儿童急性淋巴细胞性白血病患者(n=51)的临床研究确定,化疗期间肠道微生物群的变化与胃肠道不良反应的发生率有关,如全身炎症和肠道粘膜炎。Toll样受体(TLRs)和肠道微生物之间的免疫调节相互作用可能调节结肠的炎症和愈合,防止甲氨蝶呤化疗的毒性。
↓↓ 肠道菌群从根本上与粘膜炎的发病机制相关
粘膜炎是一种常见的胃肠道毒性,会导致腹泻、疼痛、体重减轻和剂量限制。例如,伊立替康是一种已知会引起严重腹泻的化疗剂。这种毒性的一种机制可能是某些细菌β-葡萄糖醛酸酶的作用,这些酶已被证明通过将伊立替康的活性代谢物SN-38释放到肠腔中来诱导腹泻。
与这一假设一致,通过喹诺酮类抗生素环丙沙星抑制此类酶可抑制伊立替康治疗小鼠的腹泻,从而证明肠道微生物群的调节可以降低伊立替康的毒性。
↓↓ 肠道菌群影响癌症治疗相关的心理神经症状
一项系统评价评估了肠道微生物群与化疗之间关系的研究,得出的结论是,肠道微生物群可能会影响癌症治疗相关的心理神经症状,例如疲劳、焦虑、抑郁和睡眠障碍。
因此,相对健康的肠道微生物群可以改善癌症患者的健康,通过增强治疗效果和减少免疫疗法和化学疗法的副作用以及通过免疫调节等方式。
饮食影响肠道微生物种类的组成和多样性。膳食纤维的高摄入量有利于膳食纤维消化细菌的增加。作用机制是消化膳食纤维的细菌产生丁酸等短链脂肪酸,滋养肠道上皮细胞,从而加强肠道黏膜屏障,增强黏膜和全身免疫。
↓↓ 食品补充剂调节微生物群驱动的化学治疗毒性
由于肠道屏障和微生物群稳态的潜在损害,化疗通常与肠道菌群的改变有关。因此,预防和治疗与化疗相关的肠道菌群改变可能有助于预防与化疗相关的胃肠道毒性。
▸从鱿鱼墨汁中提取的多糖在小鼠给药环磷酰胺后可富集双歧杆菌,并减少拟杆菌,从而改善肠道微生物群功能障碍。
▸人参化合物可以增强化疗药物5-氟尿嘧啶对结直肠癌细胞系的作用,特别是当这些化合物被肠道微生物群菌群代谢时。
▸鞣花酸,一种常见于草莓、葡萄和黑莓等蔬菜和水果中的多酚,被肠道菌群代谢释放尿石素,这对人类结肠癌具有抗增殖作用。
↓↓ 益生元和益生菌在癌症治疗中发挥作用
益生元(促进有益肠道微生物生长的难消化的食物成分,例如香蕉、芦笋和朝鲜蓟)和益生菌(引入体内以发挥有益作用的微生物,例如酸奶、克非尔、酸菜、豆豉,和泡菜)与肠道菌群的组成密切相关,这些物质在癌症治疗过程中的作用很关键。
许多动物和人类研究表明,益生元、益生菌在预防化疗期间的粘膜炎方面具有强大的作用。
对于接受同步放化疗的鼻咽癌患者,益生菌与放射治疗相结合,可以通过改变肠道菌群,显着增强宿主免疫力,缓解放化疗相关的口腔黏膜炎。
VSL #3(包括Streptococcus thermophiles, Bifidobacterium breve, B. longum, B. infantis, Lactobacillus paracasei, L. delbrueckii subsp. bulgaricus, L. acidophilus, L. plantarum),在伊立替康治疗期间,减少大鼠腹泻和体重减轻。
L. casei, L. rhamnosus, B. bifidum 通过抑制肿瘤坏死因子α、白细胞介素-1b和白细胞介素-6 mRNA的表达减少化疗诱导的小鼠腹泻。
鼠李糖乳杆菌GG补充可减少人类大肠癌患者在5-氟尿嘧啶化疗期间的严重腹泻和腹部不适。
在接受化疗的儿童中使用养乐多的短双歧杆菌菌株可预防发烧并减少静脉注射抗生素的频率。
膳食补充益生元低聚果糖和菊粉可放大药物对小鼠的作用(5-氟尿嘧啶、多柔比星、长春新碱、环磷酰胺、甲氨蝶呤、阿糖胞苷),从而证明了益生元与化疗之间的协同作用。
编辑
大量临床前数据以及有限的临床证据表明,饮食因素可能在预防和/或治疗癌症以及癌症治疗相关的症状和毒性方面发挥作用,寻求特定饮食干预措施的数据仍在不断涌现。
人们对肠道菌群的性质和对癌症治疗的影响也越来越感兴趣。期待更大样本量的随机对照试验,进一步研究饮食干预措施。
最好的饮食是患者愿意并且能够坚持的饮食,因此在将这些策略引入临床时可能需要一定程度的个性化。
如果能开发出,通过调节肠道菌群来改善治疗效果的药物,其潜力是巨大的。
主要参考文献
Spencer CN, McQuade JL, Gopalakrishnan V, McCulloch JA, Vetizou M, Cogdill AP, Khan MAW, Zhang X, White MG, et al. Dietary fiber and probiotics influence the gut microbiome and melanoma immunotherapy response. Science. 2021 Dec 24;374(6575):1632-1640. doi: 10.1126/science.aaz7015. Epub 2021 Dec 23. PMID: 34941392; PMCID: PMC8970537.
Yu ZK, Xie RL, You R, et al. The role of the bacterial microbiome in the treatment of cancer. BMC Cancer. 2021;21(1):934. Published 2021 Aug 19. doi:10.1186/s12885-021-08664-0
Kim AJ, Hong DS, George GC. Dietary influences on symptomatic and non-symptomatic toxicities during cancer treatment: A narrative review. Cancer Treat Rev. 2022 May 13;108:102408. doi: 10.1016/j.ctrv.2022.102408. Epub ahead of print. PMID: 35623220.
Barrea L, Caprio M, Tuccinardi D, Moriconi E, Di Renzo L, Muscogiuri G, Colao A, Savastano S; Obesity Programs of nutrition, Education, Research and Assessment (OPERA) group. Could ketogenic diet “starve” cancer? Emerging evidence. Crit Rev Food Sci Nutr. 2022;62(7):1800-1821. doi: 10.1080/10408398.2020.1847030. Epub 2020 Dec 4. PMID: 33274644.
Baguley BJ, Skinner TL, Jenkins DG, Wright ORL. Mediterranean-style dietary pattern improves cancer-related fatigue and quality of life in men with prostate cancer treated with androgen deprivation therapy: A pilot randomised control trial. Clin Nutr. 2021 Jan;40(1):245-254. doi: 10.1016/j.clnu.2020.05.016. Epub 2020 May 25. PMID: 32534948.

谷禾健康
肠道微生物群在癌症中发挥免疫调节和抗肿瘤作用,肠道微生物失调可诱导有毒代谢物的释放,并在宿主体内表现出促肿瘤作用。肠道微生物群也能调节标准化疗药物和天然抗癌药物的疗效。
本文列举5种常见的癌症(结直肠癌、肺癌、乳腺癌、前列腺癌、胃癌),以及肠道微生物群在癌症中的复杂作用。
肠道微生物群与癌症发病的关系概览
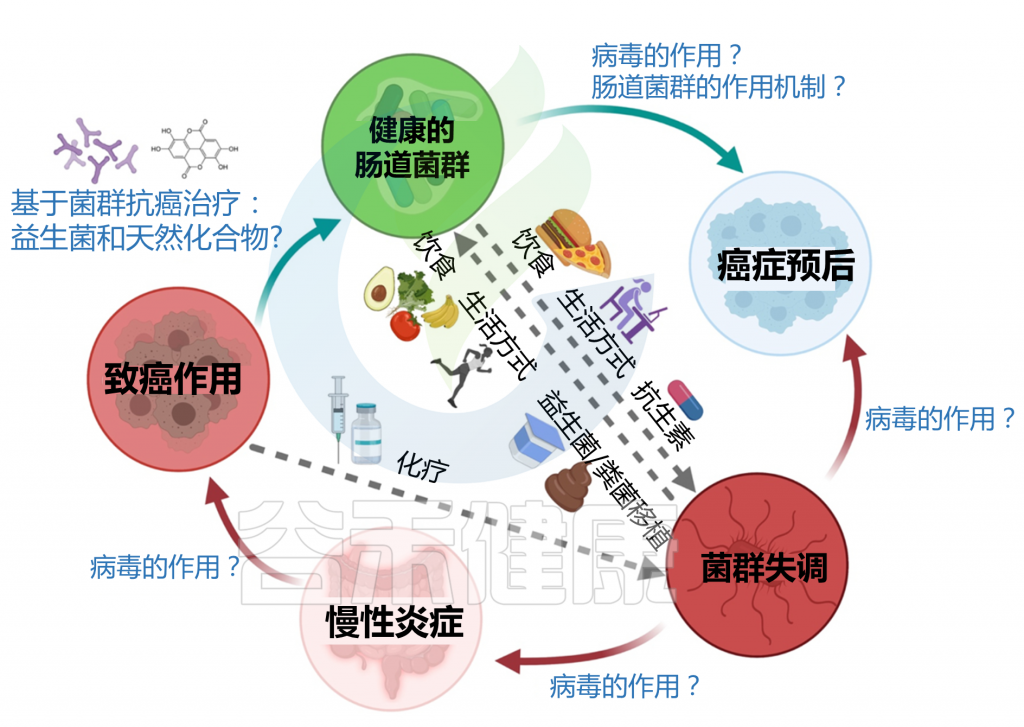

在进入具体的5种癌症章节之前,我们先来了解一下,微生物群与癌症的关系。有研究人员将微生物群和癌症之间的关系分为三个层次: 一级、二级和三级相互作用。
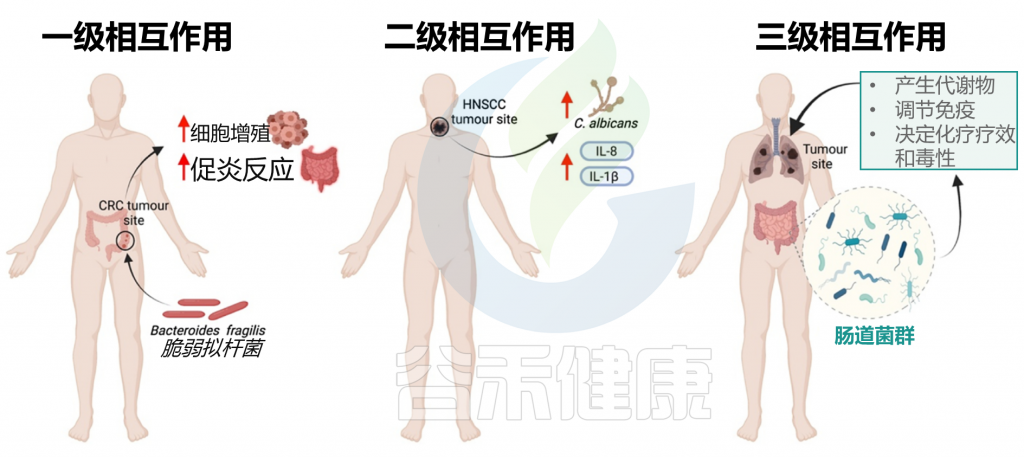

一级相互作用(主要)
主要的相互作用考虑了肿瘤微环境和微生物群之间的直接联系。几项体内和体外研究主要从两个方面支持了这种关系:
a) 肠道微生物群可通过生物失调导致致癌
b) 肠道微生物可通过调节肿瘤活性干扰化疗药物的疗效
二级相互作用(次要)
次要的相互作用考虑了组织或器官系统的微生物群和同一大体分区内的肿瘤之间的联系。这种相互作用水平有助于识别用于筛选不同癌症类型的潜在生物标志物。特别地,来自局部组织或器官环境的次级微生物群可包含来自肿瘤微环境和初级微生物群落的痕迹,其可用作癌症的生物标志物;但这些诊断过程往往很复杂。
三级相互作用
肠道微生物群和肿瘤之间的三级相互作用解释了位于体内不同部位的肿瘤上的微生物群的影响。对这种相互作用水平的研究对于确定生理上遥远的微生物种类和感兴趣的肿瘤之间的关系具有重要意义,这对于确定癌症患者中潜在治疗选择的功效也具有临床相关性。
这些三级相互作用可以通过以下方式影响癌症:
肠道微生物群可以通过启动代谢过程(包括水解和还原)来调节口服药物代谢,这直接影响药物毒性,并可以增强或抑制药物活性。微生物群与肿瘤之间的三级相互作用也可以帮助诊断不同类型的癌症。
肠道微生物群的促肿瘤、抗肿瘤和免疫调节作用