-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
前几日,南方医科大学深圳医院院长周宏伟教授团队在国际顶尖医学期刊《Nature Medicine》上发表了一项重要研究。首次揭示一种名为活泼瘤胃球菌(Ruminococcus gnavus)的细菌产生的物质——苯乙胺,在肝性脑病发生中的关键作用。

同时谷禾的人群检测数据及相关研究也发现,活泼瘤胃球菌(R.gnavus)广泛存在于人体中,超过90%的人可以检测到。并且在例如肥胖、抑郁症、炎症性肠病、2型糖尿病等疾病患者中丰度偏高。
想必很多人对这个名字比较陌生,可能只知道瘤胃球菌属。虽然其名为活泼瘤胃球菌,但关于其的具体归属还有争议(有一段时间它被归类为Blautia属,但最近又被重新归为Mediterraneibacter属)。
活泼瘤胃球菌(Ruminococcus gnavus)是一种革兰氏阳性、严格厌氧的细菌,属于毛螺菌科,普遍存在于人类和动物的肠道中,是婴儿肠道的早期定植者,并在成年后也持续存在,占健康个体肠道微生物群丰度的0.1%至2%。
拉丁语gnavus的意思是忙碌,R.gnavus具有积极的碳水化合物发酵能力,可以将复杂的淀粉降解成更简单的分子。在淀粉、麦芽糖和岩藻糖基化聚糖等食物消化中具有重要功能。并产生乙酸盐、丙酸盐、甲酸盐和乙醇,但不产生丁酸盐。
虽然R.gnavus能有效利用植物性食物中的糖,但肠道中的糖并非全来自食物,人体自身也会生成糖类,如构成肠道内壁的粘蛋白聚糖。一些菌株依赖这些糖,并进化出策略以持续获取,可能破坏肠道屏障。
活泼瘤胃球菌(R.gnavus)生活在我们的肠道内壁,因此可以很好地感知肠道环境的变化并将其与身体的其他部分进行沟通。这在我们的免疫系统中发挥作用,也会对体内其他器官的功能产生影响。
研究发现R.gnavus能够产生一种炎性多糖,该分子诱导树突状细胞产生炎性细胞因子,如TNFα(肿瘤坏死因子),可能导致人体的炎症反应。并且越来越多的证据表明,R.gnavus的过度生长可能与某些肠道疾病有关,包括炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌。
此外,研究还发现,患有影响身体其他部位的健康问题(包括感染、过敏、肥胖、代谢综合征、2型糖尿病、肝脏疾病和神经系统疾病)的人肠道中活泼瘤胃球菌(R.gnavus)的水平较高,说明R.gnavus与这些疾病之间存在相关性。
注:这种关联并不一定意味着R.gnavus是这些疾病的原因。相反,它可能只是表明这些疾病为R gnavus在肠道中的生长创造了有利条件。
活泼瘤胃球菌(Ruminococcus gnavus)到底是多种疾病的风险标志物还是正常的肠道共生菌?让我们来一探究竟。
活泼瘤胃球菌(Ruminococcus gnavus)是一种革兰氏阳性厌氧菌,属于厚壁菌门。R.gnavus于1974年首次从人类胃肠道的粪便和内容物中分离出来。当时它被描述为专性厌氧、非孢子形成、非运动或运动球菌,具有1-3个鞭毛,以链状或成对出现。
R.gnavus ATCC 35913 的扫描电子显微镜图像

拉丁语gnavus的意思是忙碌,指的是该物种的积极发酵能力。这种细菌具有特殊的酶,可以将复杂的淀粉降解成更简单的分子。在淀粉、麦芽糖和岩藻糖基化聚糖等食物消化中具有重要功能。可以产生乙酸盐和甲酸盐,但不产生丁酸盐。
R.gnavus的细胞壁由一种复杂的葡配甘露聚糖组成,它具有高度的免疫原性,可以在宿主中诱导特异性抗体。
R.gnavus的脂聚糖是一种附着在脂质上的聚糖,也是免疫原性的,可以调节宿主免疫系统。不同品系的R.gnavus具有不同的结构。
R.gnavus的基因组由一条约2.5Mb的圆形染色体和几个不同大小的质粒组成。它编码许多参与碳水化合物代谢的基因。其基因组DNA的G+C含量为43mol%。
虽然R.gnavus ATCC 29149无法在氧气存在下生长,但它确实表现出对大气氧气的一定耐受性,10%-15%的细胞在暴露于氧气1小时后仍保持活力,3小时后下降到0.05%-0.1%左右
该菌株对阿莫西林、替卡西林、头孢噻肟、亚胺培南、普那霉素、万古霉素、利奈唑胺、甲硝唑、利福平、甲氧苄啶/磺胺甲噁唑敏感,对林可霉素、红霉素、左氧氟沙星耐药。
▸ 在生命早期就定植于肠道
活泼瘤胃球菌(R.gnavus)是“正常”人类肠道微生物群的常见成员,多项证据表明其在生命早期就普遍存在。
生命第一年,分娩方式、饮食和遗传等因素都会影响微生物定植。一项针对25名1至24个月大婴儿样本的研究中,确定R.gnavus普遍存在;具体来说,在25个样本中的22个(88%)都检测到了活泼瘤胃球菌(R.gnavus)。
▸ 可能在婴儿消化与代谢中发挥作用
活泼瘤胃球菌(R.gnavus)可能是婴儿肠道的主要物种,其水平与双歧杆菌属相当。通过16S rRNA基因测序分析的研究强调了R.gnavus与母乳喂养或不同配方奶粉之间的饮食关联。
例如,在一项针对90名2个月大婴儿(每组30名)的比较研究中,与喂食牛奶的婴儿中更多样化的微生物特征相比,母乳或山羊奶喂养的婴儿中,毛螺菌科(Lachnospiraceae)的存在仅限于一种物种,即R.gnavus。
在另一项随机对照试验比较了喂食乳糖牛奶配方奶粉(CMF)与广泛水解蛋白配方奶粉(EHF,适用于牛奶蛋白不耐受婴儿)的婴儿粪便微生物群。结果显示,随着时间推移,EHF组中R.gnavus丰度增幅最大,成为区分不同食物喂养微生物组的显著特征。
这些数据表明,R.gnavus可能在肠道微生物群构建中发挥作用,并与婴儿正常体重增长和状态相关。
▸ 淀粉等固体食物会增加R.gnavus丰度
R.gnavus的相对丰度变化可能体现了婴幼儿微生物群的正常“成熟”。一些证据表明,R.gnavus在断奶后相对丰度增加,而其他物种,如双歧杆菌,已知相对丰度降低。
注:最近一项针对怀孕和分娩时婴儿肠道微生物群(脐带血)的研究显示,R.gnavus与产前血浆25-羟基维生素D(25[OH]D)呈正相关,但与脐带25[OH]D呈负相关。
一项研究调查了断奶对605名婴儿微生物群的影响,结果显示首次引入固体食物后,R.gnavus所属的比例显著增加。短链脂肪酸(SCFA)分析也反映了肠道微生物群的变化,数据显示断奶期间丁酸盐的产生发生变化。
对28名尼日利亚婴儿出生后第一年内粪便微生物群的分析显示,母乳喂养婴儿以R.gnavus、Collinsella和Sutterella为主。丁酸盐在断奶开始时(4-6个月大)首次检测到,引入固体食物后乙酸盐和乳酸仍然较高,12月龄时丁酸盐水平较低,与R.gnavus的已知发酵能力一致。
综上所述,这些研究支持R.gnavus在肠道早期定植中的作用。一些R.gnavus菌株能够代谢人乳低聚糖(HMO)和粘蛋白,其结构聚糖相似性进一步支持该物种在其他细菌定植过程中发挥重要作用的假设。
▸ R.gnavus在成年后也持续存在于肠道
R.gnavus在成年后也持续存在;根据对来自北美和欧洲的健康成年人的粪便样本的宏基因组测序,发现它是存在于≥90%的个体中的物种。
最近,在来自中国、埃塞俄比亚、西班牙、美国和瑞典的健康成年人的公开肠道微生物群宏基因组中发现了R.gnavus平均丰度为0.3%。
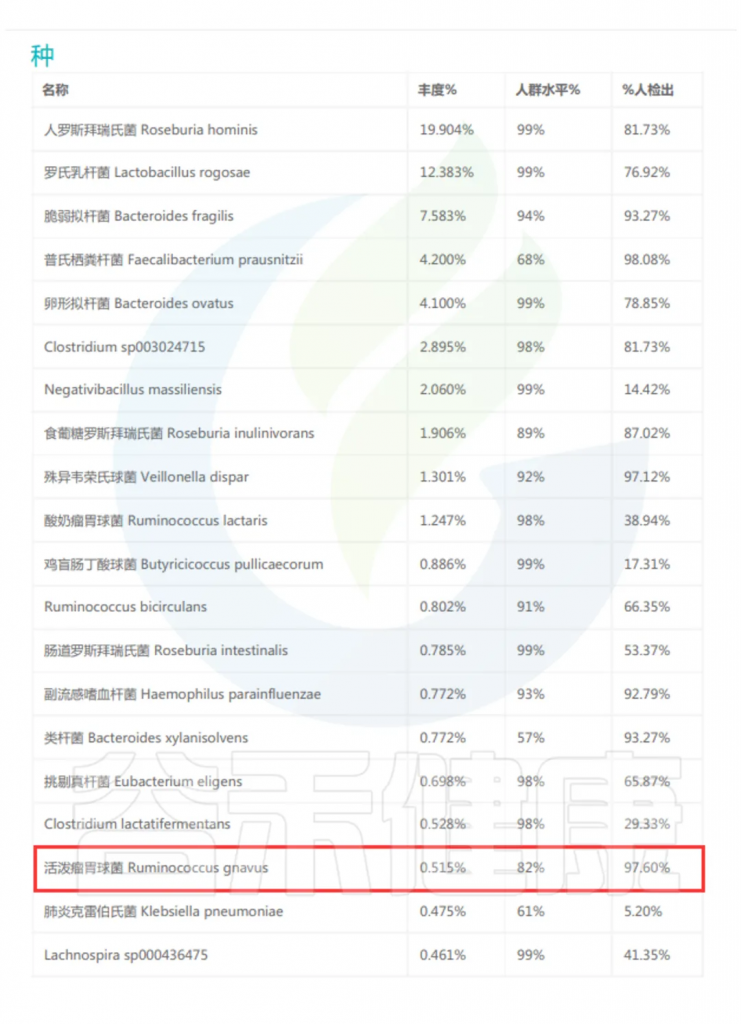
谷禾多年的检测数据显示,国人活泼瘤胃球菌(R.gnavus)检出率超过95%,表明其在人群中普遍存在,是肠道微生物群的基本组成部分。
▸ R.gnavus有助于消化复杂的碳水化合物
瘤胃球菌是分解碳水化合物最有效的细菌属之一。我们知道瘤胃球菌是“降解抗性淀粉的关键菌”。瘤胃球菌能有效地分解坚硬的植物物质,如细胞壁,这有助于人体消化水果蔬菜,不太可能引起胃痛。
注:抗性淀粉是在小扁豆、豆类和未加工的全谷物等高纤维食物中发现的复杂碳水化合物。
这种细菌具有特殊的酶,可以将这些复杂的淀粉降解成更简单的分子。这也与它利用一些母乳低聚糖和在粘蛋白聚糖表位上觅食的能力有关。值得注意的是,R.gnavus ATCC 29149具有一种独特的唾液酸代谢途径,专门用于2,7-脱水Neu5Ac。
R.gnavus碳水化合物的最终发酵产物包括乙酸盐、甲酸盐和乙醇,以及丙醇和丙酸盐,但不包括丁酸盐。
尽管活泼瘤胃球菌(R.gnavus)是人类肠道微生物群的组成部分,正常情况下在健康个体的肠道中普遍存在,但许多研究表明,当其丰度过高时,可能与多种疾病的发生发展存在密切关联。这些疾病不仅包括与肠道相关的疾病,如炎症性肠病(IBD)、肠易激综合征、结直肠癌,还涉及一些非肠道相关的疾病,如代谢性疾病和免疫系统紊乱等。
R.gnavus与疾病和潜在分子介质的关联
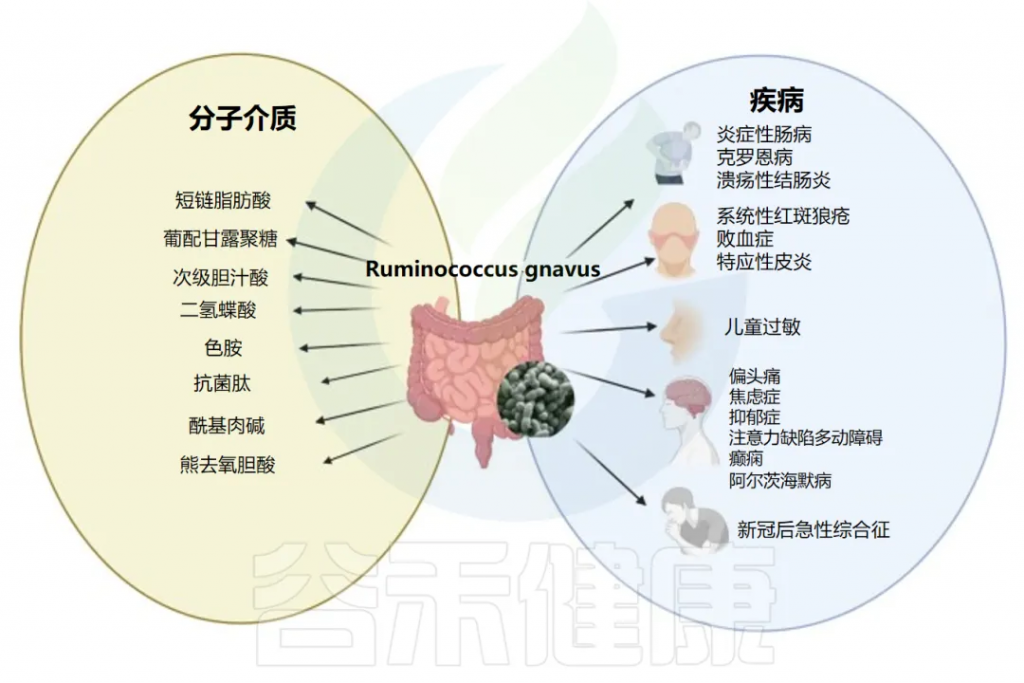
Crost EH,et al.FEMS Microbiol Rev.2023
1
炎症性肠病
克罗恩病(CD)和溃疡性结肠炎(UC)是多因素慢性炎症性肠病,一直与肠道微生物失调有关。越来越多的研究表明R.gnavus与炎症性肠病(IBD)之间存在正相关,尽管因果关系仍有待证明。
▸ R.gnavus在IBD患者中含量增加
分析了炎症性肠病(IBD)患者肠粘膜组织的早期研究表明,粘膜相关细菌的丰度增加。例如,与健康粘膜相比,R.gnavus和R.torques在CD和UC粘膜中含量更高,而主要的粘液降解细菌A.muciniphila在CD和UC粘膜中的含量明显较低。
在一项后续研究中,分析了68名CD患者、84名未受影响的亲属和55名匹配的对照者粪便样本,并使用实时PCR进行定量。结果显示,R.gnavus是五种与菌群失调相关的细菌中唯一在克罗恩病(CD)中丰度增加的物种。
通过内窥镜采集IBD患者粘膜表面样本(43名UC患者、26名CD患者和14名非IBD对照),利用16S rRNA 基因测序分析粘膜相关微生物群落。结果显示,与非IBD对照相比,CD患者变形菌门丰度显著增加,而厚壁菌门和拟杆菌门丰度显著降低。其中,埃希氏菌属、瘤胃球菌属(R.gnavus)、放线杆菌属和肠球菌属显著增加,而粪杆菌属、粪球菌属、普雷沃氏菌属和罗氏菌属显著减少。
▸ R.gnavus能够诱导产生炎性细胞因子

一项研究发现,肠道细菌R.gnavus产生了炎性多糖,其种群在克罗恩病患者的症状发作期间丰度增加。R.gnavus可以合成并分泌具有鼠李糖骨架和葡萄糖侧链的复杂多糖glucorhamnan,它有效诱导树突细胞分泌炎性细胞因子(TNFα),并可能导致R.gnavus与克罗恩病之间的关联。
另一项基于对40对双胞胎的肠道微生物群分析的研究显示,在回肠CD患者中,肠杆菌科和R.gnavus的丰度增加,而粪杆菌属(Faecalibacterium)和罗氏菌属(Roseburia)等核心细菌的消失。
▸ R.gnavus丰度与IBD疾病结果相关
R.gnavus是与克罗恩病相关的菌群,已被确定为导致克罗恩病症状的原因之一。在克罗恩病患者中活泼瘤胃球菌(R.gnavus)的相对丰度升高与症状严重相关。
通过Illumina MiSeq对IBD患者(70名UC,39名CD)及100名健康对照的粪便微生物群分析显示,它们在 IBD中表现出差异丰度。结合20名IBD患者和12名对照的宏基因组分析与R.gnavus分离株的全基因组测序,强调了R.gnavus菌株水平的重要性。
研究还揭示了IBD特异性、菌株特异性的基因,这些基因参与氧化应激反应、粘附、铁获取和粘蛋白利用,可能赋予R.gnavus在IBD患者肠道中的适应性优势。在小鼠模型中,提出了多种支持R.gnavus与 IBD关联的机制。
此外,分析了化疗后接受造血细胞移植和干细胞植入的癌症患者的>10000个纵向微生物群样本,发现R.gnavus的绝对丰度与淋巴细胞率负相关,与其生长速率正相关,表明R.gnavus可能驱动高中性粒细胞与淋巴细胞比率,这一特征与IBD不良预后密切相关。
注:R.gnavus的富集还与CD患者的心理评分呈正相关,与次级胆汁酸TDCA和TLCA呈负相关,进一步表明其与患者心理状态和疾病进展的关联。
综上所述,一些研究人员认为R.gnavus可以作为 炎症性肠病(IBD)的生物标志物,但因果关系仍有待证明。
2
肠易激综合征
肠易激综合征(IBS)是一种慢性异质性疾病,影响约6%的人口。IBS的病理生理学是多因素的,其中包括肠道微生物群的改变。
对IBS患者、健康个体粪便和结肠活检样本,以及小鼠模型样本的细菌测序分析表明,症状和炎症的严重程度可能与粘液相关细菌(如R.gnavus)的变化密切相关。
编辑
▸ 在腹泻型IBS患者中明显更丰富
对80名IBS患者(16-70岁)和65名无IBS对照的粪便进行鸟枪法和16S rRNA 测序显示,R.gnavus和毛螺菌科其他物种在 IBS 中显著更丰富,尤其在腹泻型IBS(IBS-D)患者中,与外周5-羟色胺(5-HT)水平和严重症状相关。
这一现象也在R.gnavus单定植小鼠中得到验证。代谢组学和宏基因组学研究表明,R.gnavus的富集与二氢蝶酸水平降低密切相关,二氢蝶酸是叶酸合成的重要中间体,其失调可能导致IBS病理变化。
此外,在新诊断的初治IBD或IBS患者(13UC、10CD和26IBS)与健康对照中,基于粪便和粘膜微生物群的16S rRNA 基因测序进一步证实了R.gnavus 作为区分疾病表型潜在生物标志物的作用。
3
结直肠癌
多项宏基因组学研究表明,结直肠癌(CRC)与肠粘膜相关微生物群的显著变化有关。
▸ 粘膜菌群失调与肿瘤形成存在关联
异常隐窝病灶(ACF)是CRC患者结肠中最早可识别的形态学病灶。对接受结肠镜筛查或监测个体的粘附细菌分析显示,与正常粘膜相比,ACF的细菌微生物组谱异质性显著更高;KRAS癌基因突变与R.gnavus呈正相关,提示特定结肠细菌与CRC相关突变之间可能存在联系。
这些结果表明,正常粘膜微生物群的扰动可能是早期肿瘤形成的危险因素,粘膜菌群失调可能影响ACF的组织微环境和行为,促进其向高级肿瘤发展。
此外,最近一项研究通过16S扩增子测序分析CRC患者治疗前后肠道微生物群,发现R.gnavus与脂肪细胞因子信号通路和过氧化物酶体通路相关。
4
过敏、免疫和炎症
▸ R.gnavus可能对特应性皮炎有一定保护作用
肠道微生物组失调与儿童过敏密切相关,R.gnavus 是儿童过敏的重要参与者。研究表明,患特应性皮炎(AD)的婴儿肠道微生物群与健康婴儿存在差异。通过对129名婴儿队列中随机选取的40名6个月大婴儿(20名对照组,20名AD患者)的肠道微生物组进行全宏基因组测序,发现与免疫发育相关的功能基因存在差异。AD组中A.muciniphila、R.gnavus和Lachnospiraceae bacterium 2_1_58FAA的定植减少,与免疫发育迟缓显著相关。临床前研究进一步支持了R.gnavus在特应性皮炎模型中的保护作用。
▸ 食物或呼吸道过敏儿童中R.gnavus升高
相比之下,在受食物或呼吸道过敏影响的儿童中观察到R.gnavus(和F.prausnitzii)的丰度更高。在一项前瞻性双胞胎队列的研究中,在过敏表现出现之前观察到粪便微生物群中R.gnavus的丰度增加,并且与呼吸道过敏或呼吸道过敏与特应性湿疹共存有关。
在小鼠模型中,添加R.gnavus ATCC 29149 导致气道高反应性和炎症(哮喘),表现为结肠和肺中辅助T细胞2的扩增,以及嗜酸性粒细胞和肥大细胞浸润结肠和肺实质。
▸ 一些炎症反应中R.gnavus增多
系统性红斑狼疮(SLE)患者中R.gnavus丰度显著增加,且与整体疾病活动呈正比,在狼疮性肾炎患者中尤为明显。狼疮性肾炎患者的粪便中sIgA包被的R.gnavus细菌更多,血清IgG水平升高,主要针对R.gnavus菌株特异性细胞壁脂聚糖抗原。
R.gnavus水平升高也与脊柱关节炎相关,这是一类炎症性风湿病,但其机制尚不明确。此外,COVID-19患者(未使用抗生素)及长期并发症患者的肠道微生物组中R.gnavus水平较高,可能与细菌的肠肺易位或免疫与炎症调节有关。
5
代谢综合征
▸ R.gnavus与体脂率、腰围、血清甘油三酯等指标相关
R.gnavus与代谢综合征的多个特征密切相关,包括体脂百分比增加。这一关联得到了以挪威20-94岁参与者为基础的大型发现队列(n=2875)及两个复制队列(n=999和n=1341)的分析支持。
编辑
在联合队列中,33.7%的参与者检测到R.gnavus,其存在与脂肪量、腰围、血清甘油三酯、C反应蛋白(CRP)、HbA1c增加及HDL降低相关。这些关联在调整混杂因素后依然显著,且在不同性别和年龄(以中位年龄 59.6 岁为界)分层分析中表现一致。
6
肥胖
▸ R.gnavus在肥胖者中更丰富
在一项横断面多种族肥胖表型研究(812 名男性,843名女性,60-77 岁)中,16S rRNA 基因测序显示 R.gnavus与能量调整饮食炎症指数(E-DII)和肥胖表型相关。
另一项研究发现,在41名BMI正常者中,R.gnavus 与内脏脂肪密切相关,并与代谢指标呈正相关。早期研究也表明,R.gnavus在肥胖者中明显更丰富,并在减重期间减少,且与高BMI呈正相关。此外,一项研究显示,R.gnavus在对减肥手术无反应的患者中更为丰富。
注:瘤胃球菌喜欢植物中的多糖。如果肠道中有过多的瘤胃球菌,可想而知细胞会吸收更多的糖,那就不可避免地导致体重增加。
▸ R.gnavus会影响脂质代谢及信号通路
最近的动物研究表明,R.gnavus影响宿主代谢物。在高脂肪饮食小鼠中,R.gnavus影响肝脏的信号通路和下游脂质代谢,特别是降低FGF21表达,增加肝脏甘油三酯水平、血清总胆固醇和低密度脂蛋白(LDL)水平,所有这些都会导致代谢紊乱。
7
冠状动脉和肝脏疾病
▸ 冠状动脉疾病晚期患者R.gnavus相对丰度增加
肠道微生物组的改变与心血管疾病相关。一项病例对照研究通过16S rRNA测序分析了53名晚期冠状动脉疾病(CAD)患者与53名年龄、性别、种族和BMI匹配的对照者的粪便微生物群,发现CAD患者的肠道微生物组丰富度和均匀度降低。R.gnavus是相对丰度增加超过数倍的五个分类群之一,并在调整糖尿病和血脂异常等风险因素后,与晚期CAD的存在显著相关。
▸ 在脂肪性肝病肝硬化中丰度显著增加
宏基因组测序显示,R.gnavus是脂肪性肝病(MASLD)肝硬化和脂肪性肝病-肝细胞癌(HCC)患者中最丰富的五种细菌之一,且在MASLD-HCC患者中丰度最高。
此外,R.gnavus与MASLD-HCC和MASLD肝硬化患者的细胞毒性CD8+ T细胞呈负相关,而在MASLD合并冠心病患者中,其丰度低于仅患冠心病的个体。然而,这些研究未包含MASLD对照组,限制了对MASLD肠道微生物组的理解。
已有研究表明,与健康对照和脂肪性肝病对照相比,脂肪性肝病肝硬化患者的R.gnavus丰度显著增加,暗示其可能与脂肪性肝病向肝硬化的进展有关。
▸ 驱动肝性脑病
高达50-70%的肝硬化患者会发展为肝性脑病(HE),这与肠道菌群失调密切相关,机制尚不清楚。通过构建肠脑模块评估宏基因组数据集中的细菌神经毒素,研究人员发现主要来自R.gnavus的苯丙氨酸脱羧酶(PDC)基因在肝硬化患者中增加了约10倍,在HE患者中更高。
用R.gnavus定植的肝硬化、不健康的小鼠表现出脑苯乙胺(PEA)积累,以及记忆障碍、对称性震颤和皮层特异性神经元丢失,通常见于肝性脑病患者。
8
2型糖尿病
▸ 2型糖尿病患者中R.gnavus较高,而抗炎细菌丰度较低
肠道菌群的变化和慢性低度炎症在2型糖尿病(T2D)发展中起关键作用。一项对T2D患者粪便样本的初步研究发现,R.gnavus、Lactobacillus ruminis、Bacteroides caccae、Butyricimonas 和 Collinsella aerofaciens丰度较高,而抗炎细菌F.prausnitzii和Butyrivibrio丰度较低。
在一项随访的人群队列研究中,R.gnavus被确定为与新发2型糖尿病(T2D)持续相关的四个物种之一。对134名糖尿病前期成年人的分析显示,梭菌目(Clostridiales)和阿克曼菌(A.muciniphila)丰度降低,而R.gnavus丰度增加。一项基于258名T2D患者的研究发现,富含R.gnavus的微生物簇与适中血糖、严重胰岛素抵抗、高胆固醇水平相关。
▸ 与妊娠晚期空腹血糖呈正相关
妊娠糖尿病(GDM)研究表明,R.gnavus与妊娠晚期空腹血糖呈正相关。此外,糖尿病周围神经病变(DPN)研究显示,甘氨酸熊去氧胆酸和牛磺熊去氧胆酸与R.gnavus和Phascolarctobacterium的丰度呈正相关。
9
感染与脓毒症
编辑
▸ R.gnavus可能导致外周感染及血液感染
R.gnavus感染病例包括血液恶性肿瘤和外周感染,如泌尿生殖系统感染。例如,一名患深部浸润性子宫内膜异位症和盆腔炎的女性在双侧输卵管卵巢脓肿中培养出R.gnavus。
R.gnavus血流感染还与憩室病、化脓性关节炎、胆囊穿孔、多发性骨髓瘤和乙状结肠癌化疗患者的肠穿孔以及小肠疝和穿孔引起的粪便腹膜炎相关。这些研究表明R.gnavus感染的致病性与胃肠道损伤密切相关。
10
神经系统疾病
新出现的证据表明,微生物失调可导致神经认知障碍的发生和发展,如精神分裂症、抑郁症、双相情感障碍、焦虑症和痴呆症。
有人认为,饮食、生活方式、遗传因素和外部压力源“合作”调节肠道微生物群组成,从而影响大脑的反应。越来越多的研究报告了患有神经系统疾病的患者R.gnavus水平的变化。
▸ 焦虑症、脑癫痫患者R.gnavus增加
尽管研究规模有限,但焦虑症患者的肠道微生物丰富度和多样性显著降低,同时R.gnavus丰度增加。一项为期8周的临床试验测试了益生菌对抑郁症的治疗效果,结果显示益生菌组和安慰剂组均有症状减轻,但肠道微生物群未发生显著变化。然而,重度抑郁患者的R.gnavus相对丰度显著增加,并与抑郁焦虑压力量表评分呈正相关。
另一项研究发现,R.gnavus与脑癫痫患者的癫痫发作显著正相关,这种神经系统疾病以癫痫发作易感性为特征,与健康对照组相比差异明显。
▸ 阿尔茨海默病和认知障碍患者中R.gnavus丰度增加
随着人口老龄化的加剧,微生物代谢物在神经退行性疾病如阿尔茨海默病(AD)和帕金森病(PD)进展中的作用受到越来越多关注。在AD患者中,主要特征是淀粉样蛋白β(Aβ)在记忆相关脑区的积累。一项基于AD小鼠模型的研究发现,Aβ蛋白的过表达显著影响肠道微生物群,其抗菌活性导致R.gnavus等物种的丰度变化。
另一项研究调查了PD患者的肠道微生物群,并根据疾病严重程度分组。结果显示,路易体痴呆患者中R.gnavus和粪杆菌的相对丰度更高。这与另一项研究的结果一致,该研究发现帕金森病(PD)患者肠道中R.gnavus的丰度显著高于健康对照组。
在易患神经认知障碍的老年人和患有心理症状的克罗恩病患者中观察到R.gnavus的富集。与健康对照相比,中风后认知障碍患者的R.gnavus丰度增加,且与认知测试结果呈负相关。对患偏头痛的老年妇女与健康对照(年龄和BMI匹配)的粪便样本进行宏基因组学分析显示,R.gnavus是偏头痛组中显著富集的物种之一。
综上所述,这些研究表明R.gnavus在神经系统疾病中的丰度增加,尽管因果关系尚未明确。文献倾向于将粘膜相关或粘液溶解细菌的存在与肠道屏障通透性增加或炎症相关联,导致细菌代谢物或分子泄漏,触发炎症并向大脑发出信号。例如R.gnavus ATCC 29149 能够将色氨酸脱羧形成色胺,提高了肠道和中枢神经系统互作的可能性。
然而,目前尚无证据表明R.gnavus能物理改变粘膜屏障。与多形拟杆菌(Bacteroides thetaiotaomicron)或A.muciniphila等物种因其广泛的粘蛋白-聚糖降解能力可分解完整的粘蛋白聚糖链不同,R.gnavus的粘蛋白聚糖降解能力具有菌株特异性,仅限于从上皮屏障外觅食聚糖表位。
R.gnavus与疾病关联的研究
编辑
Crost EH,et al.FEMS Microbiol Rev.2023
▸ 高糖高肉会增加R.gnavus
饮食是肠道微生物群的主要调节因素。在题为“满足欧洲老年人口健康老龄化特定需求的新饮食策略”(NU-AGE)的研究中,调查了饮食、肠道微生物群和认知之间的关联,结果表明R.gnavus和Collinsella spp.与富含动物产品的饮食有关,被称为“促炎物种”。
通过对多种族队列研究(5936名参与者)的粪便样本进行16S rRNA基因测序,确定了饮食质量与肠道微生物组的长期关联。结果显示,R.gnavus的存在与健康饮食指数呈负相关。
健康饮食指数(HEI)由13个组成部分组成,最高100分,包括9个充足性组成部分(总水果、全水果、总蔬菜、蔬菜和豆类、全谷物、乳制品、总蛋白质食品、海鲜和植物蛋白以及脂肪酸)以及四个适度成分(精制谷物、钠、添加糖和饱和脂肪)。大多数成分按每1000大卡摄入量的摄入量评分。2
以羊肉、猪肉等红肉为基础的饮食会增加活泼瘤胃球菌(Ruminococcus gnavus)的丰度。
此外,经常食用糖果、饮料、糕点等,也会导致Ruminococcus gnavus升高,并降低了肠道中某些有益菌。
▸ 富含多酚的食物有助于减少R.gnavus
针对R.gnavus的饮食干预研究较少。一项对23名健康个体的随机交叉试验发现,在高红肉饮食中添加高直链淀粉玉米可降低R.gnavus的比例;补充富含多酚的红树莓可减少糖尿病前期和胰岛素抵抗成人的R.gnavus。这表明针对活泼瘤胃球菌(R.gnavus)的饮食干预可作为促进健康的策略。
▸ 益生菌调节
唾液乳杆菌(Lactobacillus salivarius Ren)显著减少R.gnavus的数量。
Lactobacillus paracasei DG干预后,瘤胃球菌丰度下降55%(P = 0.016)
口服长双歧杆菌BB536 和鼠李糖乳杆菌HN001 1个月后,Ruminococcus gnavus丰度减少。
此外,我们推测多形拟杆菌(Bacteroides thetaiotaomicron)等能够降解碳水化合物的有益细菌可能会与R.gnavus竞争,从而抑制R.gnavus的丰度。
但在注射了乳杆菌的小鼠小肠微生物群中,瘤胃球菌过度生长。
以下的细菌也可能对R.gnavus具有抑制作用
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Bacteroidales
Bacteroides
Porphyromonadaceae
Odoribacter
Parabacteroides
Porphyromonas
Prevotella
Rikenellaceae
Alistipes
Turicibacter
Streptococcus
Clostridiales
Catabacteriaceae
Clostridium
Clostridiales incertae sedis
Peptoniphilus
Clostridiales Family XIII. Incertae Sedis
Lachnospiraceae
Blautia
Lachnospiraceae
Coprococcus
Dorea
Eubacterium
Lachnobacterium
Lachnospira
Roseburia
Lachnospiraceae
Peptococcaceae
Ruminococcaceae
Ruminiclostridium
Acetivibrio
Eubacterium
Faecalibacterium
Oscillospira
Ruminococcus
Acidaminococcus
Dialister
Phascolarctobacterium
Veillonella
Rubrivivax
Alcaligenaceae
Oxalobacter
Bilophila
Desulfovibrio
Campylobacteraceae
Enterobacteriaceae
Escherichia
Erysipelotrichaceae
Erysipelotrichaceae
Holdemania
Akkermansia
▸ 益生元调节
施用低聚半乳糖(GOS)后,R.gnavus丰度下降。
龙舌兰菊粉,3周,随机对照试验,交叉试验,R.gnavus减少。
玉米可溶性纤维21g/d, 3周,随机对照试验,交叉试验,R.gnavus减少。
尽管活泼瘤胃球菌(Ruminococcus gnavus)是人类肠道微生物群的重要组成部分,通常在健康个体的肠道中广泛存在,但研究表明,其丰度的异常升高可能与多种疾病的发生和发展密切相关。这些疾病不仅包括肠道相关疾病,如炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌,还涉及非肠道相关疾病,如神经发育障碍、神经系统疾病、代谢性疾病以及免疫系统紊乱等。
例如,除了最近《Nature Medicine》揭示活泼瘤胃球菌可通过苯丙氨酸脱羧酶及其代谢产物苯乙胺驱动肝性脑病,为肝性脑病提供了潜在诊疗靶点。 今年江南大学王鸿超团队基于机器学习识别关键菌群,发现肥胖个体中肠道共生菌活泼瘤胃球菌的丰度增加,且与临床指标显著相关,且通过调节胆汁酸代谢(如促进次级胆汁酸的生成)对宿主代谢产生不利影响,间接阻碍了体重的下降;并可能导致肝脏损伤。
因此,监测和预防活泼瘤胃球菌丰度的异常升高对于维持肠道菌群平衡和降低疾病风险具有重要意义。然而,要实现这一目标,需要建立可靠的健康人群和疾病人群的肠道微生物数据库,以明确健康状态下该菌的正常丰度范围及其在疾病状态下的异常变化边界。这些数据库应包括不同年龄、性别、生活方式和地理区域的健康人群数据,同时结合疾病人群的微生物组特征,明确活泼瘤胃球菌的丰度变化与疾病的关联模式。通过这些数据的积累和分析,不仅可以更准确地识别活泼瘤胃球菌的异常丰度阈值,还能为个性化的肠道健康管理和疾病预防策略提供科学支持。
主要参考文献
Crost EH, Coletto E, Bell A, Juge N. Ruminococcus gnavus: friend or foe for human health. FEMS Microbiol Rev. 2023 Mar 10;47(2):fuad014.
Juge N. Microbe Profile: Ruminococcus gnavus: the yin and yang of human gut symbionts. Microbiology (Reading). 2023 Aug;169(8):001383.
Grahnemo L, Nethander M, Coward E, Gabrielsen ME, Sree S, Billod JM, Engstrand L, Abrahamsson S, Langhammer A, Hveem K, Ohlsson C. Cross-sectional associations between the gut microbe Ruminococcus gnavus and features of the metabolic syndrome. Lancet Diabetes Endocrinol. 2022 Jul;10(7):481-483.
Henke MT, Kenny DJ, Cassilly CD, Vlamakis H, Xavier RJ, Clardy J. Ruminococcus gnavus, a member of the human gut microbiome associated with Crohn’s disease, produces an inflammatory polysaccharide. Proc Natl Acad Sci U S A. 2019 Jun 25;116(26):12672-12677.
Titécat M, Wallet F, Vieillard MH, Courcol RJ, Loïez C. Ruminococcus gnavus: an unusual pathogen in septic arthritis. Anaerobe. 2014 Dec;30:159-60.
de la Fuente-Nunez C, Meneguetti BT, Franco OLet al. Neuromicrobiology: how microbes influence the brain. ACS Chem Neurosci. 2018;9:141–50.
Fan X, Chen Y, Liu Yet al. First case of bloodstream infection caused by Ruminococcus gnavus in an 85 year old man in China. Lab Med. 2022;53:e36–9.
Hall AB, Yassour M, Sauk Jet al. A novel Ruminococcus gnavus clade enriched in inflammatory bowel disease patients. Genome Med. 2017;9:103.

谷禾健康

编辑
癌症一直是全球人类关注的重点,近年来癌症的发病率迅速增加,例如乳腺癌、前列腺癌和肺癌非常普遍。胃肠道癌在发病率和死亡率方面位居首位,并造成重大的社会经济负担。
胃肠道癌症包括胃癌、肝癌、食道癌、胰腺癌和结直肠癌等,占所有癌症的四分之一以上。
▷生活行为影响胃肠道癌症
目前的证据表明,社会经济发展导致生活方式的一些改变。如吸烟和饮酒是癌症最常见的风险因素,越来越多的共识也将饮食习惯列为胃肠道癌症的相关风险因素。这些行为与各种慢性非传染性疾病和胃肠道癌症的出现直接或间接相关。
▷肠道微生物影响胃肠道癌症
肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。大量研究证明肠道微生物群对胃肠道癌症(包括食管癌、胃癌、结直肠癌、肝癌和胰腺癌)具有一定的影响。
在本篇文章中,讲述了胃肠道癌症的一些基本特征,并探讨了在社会进步的背景下,不健康的行为、饮食,及其影响的肠道微生物群变化对胃肠道癌症的影响。希望在未来有助于胃肠道癌症的预防、诊断和治疗。
本文主要分三部分讲述
Part1:胃肠道癌症的一些基本特征
Part2:不良生活方式对胃肠道癌症的影响
Part3:肠道微生物与胃肠道癌症的关系
胃肠道 (GI) 癌症,包括胃癌、肝癌、食管癌、胰腺癌和结直肠癌,胃肠道癌症是全球最常见的癌症,也是导致死亡的主要原因之一,它们的患病率正在持续上升。
疫情前的数据统计,2018年,约有500万例新增胃肠道癌症病例,超过300万例相关死亡。
胃肠道癌症严重危害人们健康
从GLOBOCAN数据库获得的数据估计,2020年食管癌新发病例超过60万例,相关死亡超过50万例。
使用同一数据库,分析估计2020年全球有110万例胃癌新发病例和超过70万例相关死亡。
同样,结直肠癌的发病率一直在以惊人的速度上升,2020年全球估计有190万新病例和90万例相关死亡。
胃肠道癌症已经成为不容忽视的健康问题,下面先来了解一下这些癌症:
▼
食管癌是第四常见的胃肠道癌症。
鳞状细胞癌是食管癌最常见的组织学类型
食管癌有两种主要的组织学亚型:腺癌和鳞状细胞癌 (SCC)。鳞状细胞癌是世界范围内的主要亚型。
我国食管癌90%以上为鳞状细胞癌,少数为腺癌。大多数食管癌患者表现为疾病晚期;因此,平均5年内总生存率仅为18%。
注:腺癌在美国和北欧排名第一(约60%)。
✦食管癌的症状
早期无明显症状
食管癌在早期往往是无明显症状的,偶有表现为胸骨后隐痛不适。随着肿瘤增大,患者会出现进食时吞咽不适或异物感。常表现为进食速度减慢并常需汤水送饭。
病情加重导致肿瘤增大阻塞食管
数月后因肿瘤进一步增大并阻塞食管腔,患者只能进食流质,当肿瘤完全阻塞管腔时,病人表现为“滴水难通”。从症状出现至完全梗阻一般约一年时间。
因此,有可疑症状时应尽早到医院检查。
✦男性食管癌的发病率高于女性
食管癌的男女差异较大,男性患食管癌的比例明显高于女性。食管癌在男性患者中的发生率是女性患者的三倍。
鳞状细胞癌的主要危险因素是饮酒和吸烟,而腺癌的主要危险因素是胃食管反流(尤其是糜烂性食管炎和巴雷特食管)、吸烟和肥胖。
胃食管腔因过度接触(或暴露于)胃液而引起的临床胃食管反流症和食管黏膜损伤的疾病称为胃食管反流。
▼
胃癌是全球第五常见癌症,也是癌症相关死亡率的第三大原因。
✦胃癌的症状
根据癌组织浸润深度分为早期胃癌和进展期胃癌(中、晚期胃癌)。
胃癌早期较难诊断
胃癌及癌前病变的症状隐匿且无特异性,因此早期胃癌很难发现。事实上,中国只有5~10%的胃癌能被早期诊断。
如捉摸不定的上腹部不适、隐痛、泛酸、食欲减退、轻度贫血等部分类似胃十二指肠溃疡或慢性胃炎症状。
随着病情的进展,胃部症状渐转明显出现上腹部疼痛、食欲不振、消瘦、体重减轻和贫血等。后期常有癌肿转移、出现腹部肿块、左锁骨上淋巴结肿大、黑便、腹水及严重营养不良等。
✦胃癌在不同人群中差异很大
非贲门胃癌 (NCGC) 占胃癌病例的近75%。与其他胃肠道癌症类似,非贲门胃癌的流行病学在不同人群中差异很大。
非贲门胃癌在东亚的发病率(韩国每10万人中有34人;日本每10万人中有28人)明显高于欧洲或美国(每10万人中有6人)。
✦影响胃癌的风险因素
除了幽门螺杆菌感染外,胃癌的其他主要危险因素包括年龄增长、性别、种族、饮食摄入类型、社会经济地位、遗传和吸烟。
尽管在过去几十年美国胃癌的发病率有所下降,但50岁或以下人群的非贲门胃癌发病率却出现升高,并且经常出现诊断晚和预后不良的情况。
▼
结直肠癌是常见的消化道恶性肿瘤,也是导致癌症相关死亡的第二大原因,每年全世界约有180万新发病例。
发病多在40岁以后,好发部位为直肠及直肠与乙状结肠交界处,男女比约为2:1。
✦结直肠癌的症状
结直肠癌的临床表现随其病灶大小、所在部位及病理类型而有所不同。
早期症状:
腹部不适:可能表现为腹胀、腹部隐痛等不适症状,疼痛多出现在中下腹部,逐渐加重;
排便习惯的改变:可能出现便频、腹泻或便秘,腹泻和便秘可交替出现,还可能出现腹部隐痛、肛门坠胀感等。
中期症状:
腹部肿块:当肿瘤生长到一定大小后,可能在腹部触及肿块,初期可推动,待到侵袭周围组织后则不易推动;
恶心、呕吐:当肿瘤侵犯胃部时,患者可能出现恶心、呕吐等症状;
晚期症状:
肠梗阻:以左侧结肠多见,由肿瘤向肠壁四周侵袭浸润,导致肠腔狭窄引起肠梗阻,多为慢性不完全性肠梗阻。可先出现腹胀、腹痛、肠鸣音亢进、便秘、粪便变细等;
全身中毒症状:以右侧结肠多见,由于肿瘤消耗体内营养,并造成慢性长期出血,还可继发感染,因此可出现贫血、消瘦、发热、无力、水肿等全身中毒症状;
转移症状:结肠癌晚期时可出现多处转移,肝转移可造成肝大、黄疸、腹水;肺转移可出现咳嗽、气促、血痰或呼吸困难等症状;脑转移可出现偏瘫、昏迷;骨转移可出现骨痛、跛行等。发展到最后可出现恶病质表现,引起全身多器官功能衰竭。
✦影响结直肠癌的风险因素
超过90%的结直肠癌病例是偶发的,这突显了除了癌症相关基因之外,环境风险因素的重要性。例如不健康的饮食模式、超重、肥胖、2型糖尿病、久坐不动、吸烟和饮酒。
正如在其他胃肠道癌症流行病学研究中观察到的那样,不同国家和地理区域之间的结直肠癌发病率差异很大,澳大利亚和新西兰的发病率最高,中南亚的发病率最低。
工业化影响了结直肠癌的发病率
多项研究支持高人类发展指数与结直肠癌发病率和死亡率之间的关系;发达国家通常报告的发病率最高。尽管经济发展和随之而来的工业化有望改善医疗保健的可及性,但这极大地影响了生活方式和不健康习惯。
尽管如此,许多欠发达国家的发病率正在上升,加拿大和巴西等国家的结直肠癌发病率的巨大差异可能不仅与卫生政策有关,还与地区贫困有关。
扩展阅读:结直肠癌防治新策略——微生物群
▼
一般分为肝细胞癌和肝内胆管癌
原发性肝癌一般可分为肝细胞癌(HCC)和肝内胆管癌(ICC),这两种约占肝癌75-85%的病例。
预后不良是该疾病的标志;因此,肝癌的发病率和死亡率密切相关。肝癌在胃肠道癌症中的发病率与死亡率均排名第三。此外,肝癌是全球第六至第七常见的癌症,也是导致癌症相关死亡的第四大原因。
✦肝癌的症状
早期症状:肝癌从第一个癌细胞形成发展到有自觉症状,大约需要2年时间,在此期间,病人可无任何症状或体征,少数病人会出现食欲减退,上腹闷胀、乏力等,有些病人可能轻度肝肿大。
中、晚期症状:肝癌的典型症状和体征一般出现于中、晚期,主要有肝痛、乏力、消瘦、黄疸、腹水等。
转移症状:如果肝癌出现转移,可能出现相对应的症状。肺转移可能出现咳嗽、咳痰等症状,骨转移可能出现疼痛的症状。
✦肝癌的地区差异较大
肝癌的全球分布差异很大,近75%的病例发生在亚洲,其中中国占病例的50%以上,蒙古的发病率最高(93.7/100000)。
在过去的四十年里,一些国家,如美国、加拿大、新西兰和澳大利亚,出现了肝癌病例增加的趋势。
✦影响肝癌的风险因素
病毒性肝炎
乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)以及饮酒被认为是世界范围内肝细胞癌最重要的危险因素。
非酒精性脂肪肝
随着肥胖、糖尿病和相关代谢综合征的高度流行,非酒精性脂肪肝被认为是慢性肝病最常见的原因之一,也是肝细胞癌的相关原因。
工业化进程影响着社会经济环境,人们生活方式的改变,有利于高热量的西方化饮食,并增加了肥胖和糖尿病的发病率。
扩展阅读:
▼
胰腺癌是五种主要胃肠道癌症中最不常见的,累计5年生存率仅为5–15%。
胰腺癌的发病率近年来呈快速上升的趋势,死亡率排在首位,因此也被称为“癌中之王”。
✦胰腺癌的症状
胰腺癌是最致命的癌症之一,其特点是:难发现(发现多为晚期),病程短,发展恶化速度快,中位生存期为3-6个月,正所谓 “无声杀手”。
胰腺癌的早期临床表现往往是无特异性的,与许多其它常见疾病症状相似。中后期主要症状有:不明原因的厌食,消化不良及体重下降;腹部不适或疼痛;黄疸。
✦影响胰腺癌的风险因素
高人类发展指数国家胰腺癌的发病率和死亡率均高出3-4倍,其中北美、欧洲和澳大利亚/新西兰报告的发病率最高,男性患者的发病率略高于女性患者。
高体重指数(BMI)、2型糖尿病,以及酗酒和吸烟是胰腺癌的可变风险因素。关于胰腺癌的风险,发现吸烟者与非吸烟者的发病率比值约为1.74。大量饮酒似乎与胰腺癌有关,是胰腺炎的相关原因,胰腺炎也是胰腺癌的一个既定风险因素。
注:胰腺癌通常具有高度侵袭性,由于非特异性的临床表现而难以诊断。此外,同一国家的国家和地区的诊断准确性差异很大,主要与城市、大都市和高度发达的中心有关。
扩展阅读:“隐藏高手” 胰腺癌的新出路——微生物
中国是全球肝癌、食管癌、胃癌新发病例和死亡人数最多的国家,2020年新增确诊病例121万。中国结直肠癌发病率也在快速上升,占2020年全球发病率的40%以上。
中国胃肠道肿瘤负担沉重,发病率高于世界平均水平。
★ 胃肠道癌症与生活习惯有关
中国近几十年经历了饮食和营养、身体活动及吸烟等生活方式的快速变化。大量证据支持胃肠道癌症与饮食和其他生活行为风险因素有关。
统计与胃肠道癌症风险相关的饮食等生活因素的时间趋势,将有助于衡量由这些因素引起的胃肠道癌症发病的未来趋势,影响预防癌症的公共卫生政策,并优化健康促进的资源分配。
研究团队根据1991年至2011年中国健康与营养调查 (CHNS) 的数据描述和预测了中国饮食和生活方式因素以及相关胃肠道癌症负担的时间趋势。
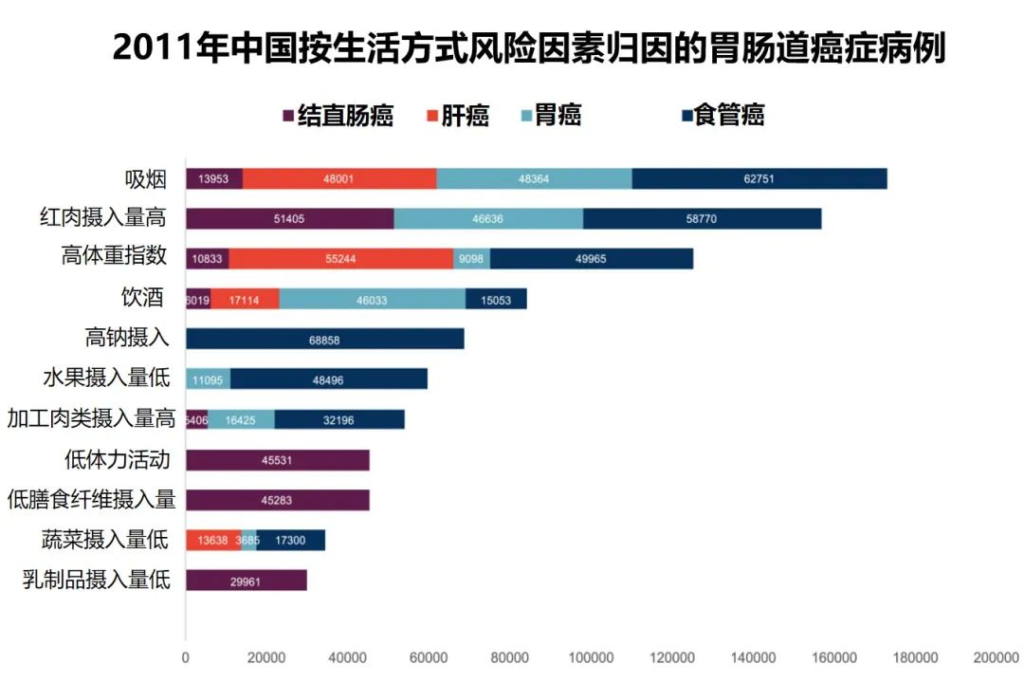
Wu Y,et al.Gastroenterology.2021
下面来讲述一下这些生活方式与胃肠道癌症之间的具体关系:
▼
饮酒是全球疾病负担的主要风险因素,饮酒会增加患癌症的风险。1990年至今,全球成人人均酒精消费量增加,当前饮酒率从45%增加到47%,终生戒酒率从46%减少到43%,预计到2030年这两种趋势将持续。
✦大量饮酒会增加癌症风险
酒精饮料导致近4%的癌症,而最高风险与大量饮酒有关。考虑到不同的饮酒模式,研究表明癌症风险与饮酒频率、每天通常饮酒的量和偶尔大量饮酒之间存在不同的关联,所有这些都与风险增加有关。
教育状况、饮食、吸烟、个人偏好以及地区和宗教习惯是与饮酒或戒酒模式相关的多种生活方式因素中的一部分,可能会混淆当前的研究结果。
几种胃肠道癌症与饮酒有关:
鳞状细胞食管癌与饮酒有关,但与食管腺癌无关。
研究显示关于结直肠癌和胰腺癌的不同结果;胰腺癌的风险似乎与大量饮酒有关,而 结直肠癌的风险与中度或大量饮酒有关。
关于胃癌,世界癌症研究基金会/美国癌症研究所2018年的报告观察到,酒精摄入量 >45 克/天的人群患胃癌风险增加。
肝细胞癌与饮酒直接相关;该关联主要由酒精相关性肝硬化、乙型或丙型肝炎病毒携带者饮酒以及可能大量饮酒驱动。
✦酒精致癌的一些途径
酒精可能通过多种途径促进致癌作用,包括:乙醇及其代谢物乙醛会影响DNA甲基化,导致致癌基因的表达;乙醛形成DNA加合物,损害DNA合成和修复并导致突变。
除此之外,炎症、氧化应激的诱导、叶酸吸收的破坏、免疫系统功能下降、微生物群失调、肝硬化和雌激素调节的变化也可能在癌症发展中发挥作用。
▼
吸烟是多种疾病的主要危险因素,包括胃肠道癌症。
★ 烟草的危害非常大
尽管近几十年来吸烟率有所下降,但与吸烟相关的疾病和死亡仍然是一个令人严重关切的问题,也是一个全球健康问题。
《2019年全球疾病、伤害和风险因素负担研究》确定,就残疾调整寿命而言,吸烟是87个风险因素中的主导因素。
烟草烟雾含有不同的化学制剂,包括活性氧(ROS)和活性氮(RNS)。氧化损伤导致遗传和表观遗传改变、基因失调、调节元件破坏和炎症反应途径激活,在恶性循环中导致活性氧的进一步生成,并可能最终演变为癌症的发生和发展。
✦吸烟者患胃肠道癌症风险更高
食管鳞状细胞癌风险增加
过去几十年的研究支持吸烟与胃肠道癌症之间的关系。吸烟也与食管鳞状细胞癌风险增加20-30%有关,重要的是,注意到烟酒联合使用的具有协同作用。
吸烟人群患胃癌风险较高
数据还表明,吸烟是贲门型和非贲门型胃癌的危险因素。对于其他胃肠道癌症,吸烟率较高的吸烟者患胃癌的风险更高。
荟萃分析还支持吸烟在结直肠癌发展中的作用。 吸烟是肝癌和胰腺癌的公认危险因素。2014年美国卫生部长的报告显示,目前吸烟者因吸烟而患肝癌的风险增加了70%,以前吸烟者增加了40%。
在那些每天吸烟量最大的人中,患胰腺癌的风险最高。荟萃分析研究发现,与不吸烟者相比,当前吸烟者的胰腺癌患者比值升高,但重度吸烟者的比值更高,随着戒烟后的年数成比例下降。
戒烟的好处已经得到了很好的证实。戒烟者的死亡和癌症风险降低。
戒烟和控制烟草消费需要战略规划。成功的戒烟尝试与社会经济地位、教育水平、获得原烟草广告、反烟草运动以及与其他吸烟者一起生活有关。
▼
高脂饮食可显著促进胃肠道肿瘤的发生和发展,主要涉及代谢重编程和多种致癌分子的改变。
高脂饮食与胃肠道癌症的关联
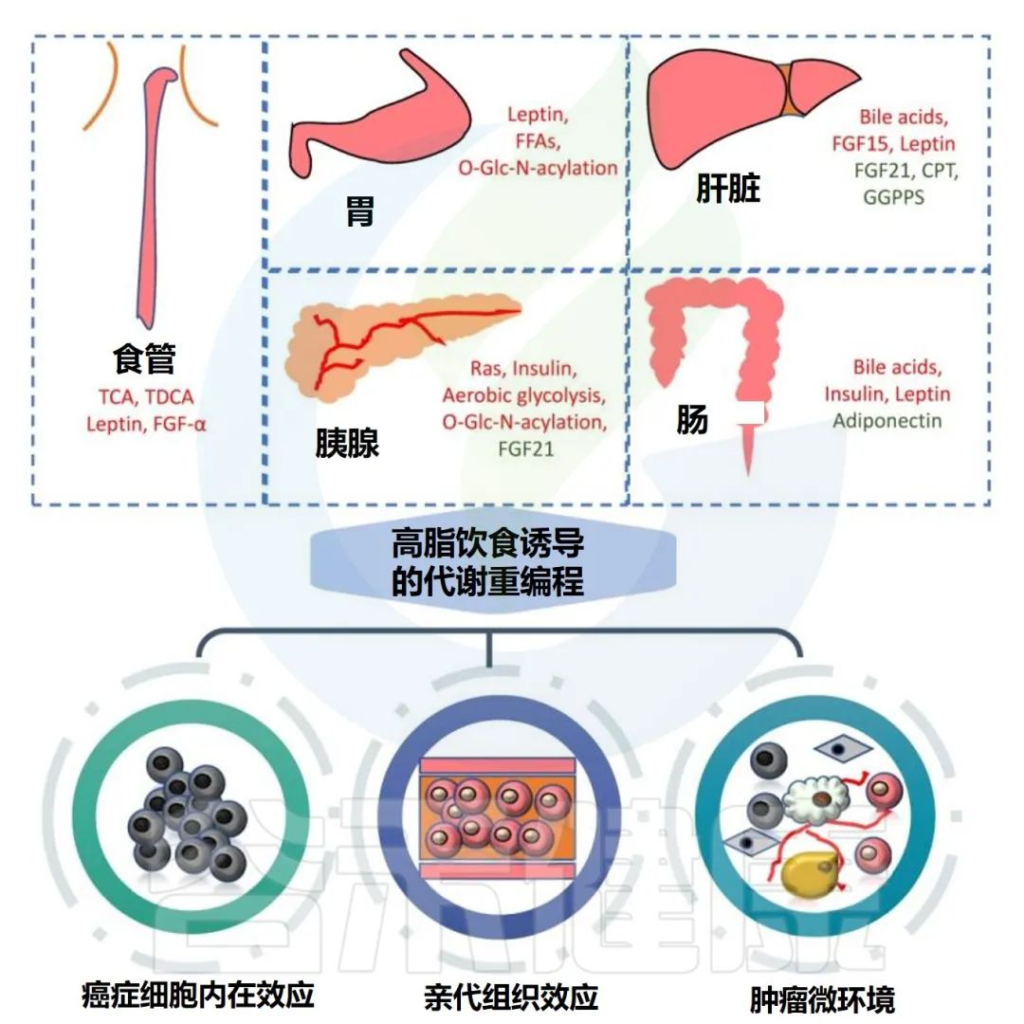
Tong Y,et al.Theranostics.2021
✦高脂饮食下食管癌发病率较高
早在1994年,就发现喂食高脂饮食的小鼠食管癌发病率较高,提示高脂饮食与食管癌之间存在关联。
胆汁酸组成发生变化
高脂饮食可导致小鼠胆汁酸组成发生变化,尤其是牛磺胆酸和牛磺熊去氧胆酸,导致小鼠巴雷特食管和食管癌的发病率增加。
巴雷特食管——食管下段的鳞状上皮被柱状上皮覆盖,可能与反流性食管炎相关,并有发生腺癌的可能。
促炎和致瘤因子增加
喂食高脂饮食的小鼠的食管腺癌具有更高的生长和代谢活性,脂肪组织中促炎和致瘤因子(如瘦素、IGFBP)的表达增加,而抗炎和生长抑制分子减少。
在临床流行病学研究中,发现“肉和脂肪”与食管腺癌和食管鳞状细胞癌密切相关。同时还发现,较高比例的脂肪会加剧食道癌和食道胃腺癌的发生,而碳水化合物会降低食道腺癌的发生。
✦过量膳食脂肪易导致胃癌
许多流行病学研究报告说,膳食脂肪可能是胃癌的危险因素。
瘦素在胃癌中发挥重要作用
瘦素被认为在肥胖相关的胃肠道恶性肿瘤中发挥重要作用,因为它在血管生成、细胞凋亡、细胞增殖和细胞迁移中发挥作用。
瘦素是一种由脂肪组织分泌的激素,它在血清中的含量与动物脂肪组织大小成正比。瘦素作用于位于中枢神经系统的受体,从而调控生物的行为以及新陈代谢。
它还显示通过调节mTOR、STAT3和ERK依赖性途径、PI3K依赖性途径和MAPK依赖性途径来促进粘蛋白产生和胃肠道肿瘤形成。
作用机制
过度的瘦素和瘦素信号激活通过抑制胃肠道上皮细胞中的细胞因子信号3的抑制剂以及增加与肠上皮相关的异位分子如肠粘蛋白2和潘氏细胞标志物PLA2的表达而导致胃肿瘤,以及转录因子SRY-box转录因子2和H+/K+ATP酶的表达降低。
由于瘦素受体(OBR)信号介导的胃上皮细胞器稳态、组织完整性和干性基因表达的破坏,与高脂饮食相关的脂肪毒性会诱发癌前病变。
简而言之,高脂饮食通过上皮细胞中PI3K-Akt通路的上调,促进β-连环蛋白并破坏细胞器稳态,并且可以上调癌症干细胞的特性。
一项研究发现,在高脂饮食喂养的8-20周内,胃壁细胞出现线粒体损伤,并伴有粘膜厚度增加。游离脂肪酸(FFAs)的添加可以复制这种表达并促进后生变化,表明游离脂肪酸的脂质毒性诱导壁细胞死亡和癌前病变的发生。
还有研究发现高脂饮食可以为转移提供足够的能量,并增加O-Glc-N-酰化水平,从而促进脂肪酸受体CD36的转录激活。CD36上调导致癌症细胞脂肪摄取增加,形成促进癌症转移的恶性循环。
✦高脂饮食促进了肝癌
研究证实,高脂饮食可导致疏水性胆汁酸的肝脏滞留显著增加,这与肠道微生物的变化显著相关。同时,肝内胆汁酸的合成和转运紊乱,导致多种炎性细胞因子释放和胆汁酸严重沉积,促进癌症的发生。
此外,调节新陈代谢的各种分子也发生了变化。例如,饮食诱导的肥胖小鼠肝脏中的FGF21和CPT2减少,而FGF15、IRE1α和瘦素上调,然后与其他病理变化联系起来,促进致癌作用。
FGF21减少与过度增殖、TGF-β和Smad信号以及肝脏中上皮-间质转化和Wnt信号通路/β-连环蛋白 信号的异常表达密切相关。
脂肪酸氧化酶CPT2在高脂喂养小鼠体内显著下调,导致酰基肉碱在肝细胞癌组织和血清中蓄积,协同抑制脂肪酸氧化和激活STAT3,共同促进肝癌发生。
高脂饮食产生的代谢变化导致肝脏炎症
长期高脂饮食可降低小鼠香叶基香叶基二磷酸合酶的表达。肝香叶基香叶基二磷酸合酶敲除增强肝激酶B1超法尼基化,通过调节AMPK 活性破坏线粒体功能并促进糖酵解。这些代谢变化导致肝脏炎症,巨噬细胞和促炎细胞因子浸润,进而促进肝脏病理进展。
IRE1α与癌症内质网应激有关,并驱动发病机制。一方面,IRE1α促进NFκB途径的肥胖相关抑制剂的激活,导致肝脏中产生典型的促炎细胞因子,如肿瘤坏死因子和白细胞介素6。
另一方面,它维持STAT3的激活,从而促进肝细胞增殖。瘦素信号通路可以通过下游PI3K/Akt信号激活mTOR,而mTOR间接激活真核起始因子4E,从而刺激编码增殖和抗凋亡因子的mRNA的翻译。
同时,高脂饮食可显著提高血清DPP4水平,促进DPP4/CL2/血管生成的级联反应和DPP4调节的巨噬细胞浸润介导的炎症反应,所有这些都在高脂饮食相关的肝细胞癌进展中起着关键作用。
✦高脂饮食对胰腺癌有影响
高脂饮食降低了上皮对癌症的防御
高脂饮食能促进细胞增殖,抑制异常细胞清除。西方饮食诱导小鼠胰腺上皮细胞过度增殖,并导致突变频率和可能性增加。高脂饮食喂养显著降低了RasV12转化细胞的清除能力,从而损害了上皮对癌症的防御。
高脂饮食可以产生炎症和免疫抑制性肿瘤微环境。发现喂食高脂饮食的小鼠的胰腺组织具有更高的KRAS活性、纤维化基质、更短的存活时间和更高程度的胰腺上皮内肿瘤和胰腺导管腺癌。
高脂饮食导致高胰岛素血症
高脂饮食还可以导致高胰岛素血症并加速胰腺上皮内肿瘤小鼠中的形成和进展。同时发现增加的内源性胰岛素会促进高脂饮食诱发的癌前病变和胰腺癌,这表明可能存在致癌机制。
胰腺导管腺癌发展的机制可能与DNA损伤有关。给 小鼠喂食高糖、高脂肪饮食,高糖处理的正常胰腺细胞系在体外表现出明显的DNA损伤和KRAS突变增加,他们还发现KRAS突变细胞在正常和高糖条件下均具有生长优势环境。
✦高脂饮食促进结直肠癌的发生和转移
对结直肠癌和高脂饮食的流行病学研究证实了它们之间的联系。
高脂饮食促进结直肠癌的发生和转移。伴随着APC基因的杂合丢失和ERK1/2、AKT和mTOR 信号通路的下调。
以下几种途径在高脂饮食促进结直肠癌中发挥关键作用:
JNK通路在肥胖和胰岛素抵抗中起着至关重要的作用并促进致癌转化和细胞增殖。
STRA6通路充当高脂饮食和结直肠癌之间的桥梁,维持结直肠癌干细胞。高脂饮食促进肿瘤组织中STRA6的增加,而STRA6激活转导JAK2-STAT3信号级联。
高脂饮食还可以激活MAPK、ERK和PI3K/Akt信号通路。在一项研究中,高脂饮食引起的肥胖可促进炎症相关结直肠癌的发生,这是由PI3K/Akt途径和肿瘤微环境中IL-12、MCP-1、IL-6和TNF-α的增加驱动的。
关于高脂饮食对细胞因子或肥胖因素的影响,也有许多研究。血清胰岛素、瘦素、TNF-α、IGF1水平升高,以及增殖细胞核抗原、COX-2、细胞周期蛋白 D1、β-连环蛋白和 NFκB 蛋白水平升高表明高脂饮食促进通过炎症和代谢异常形成结肠腺瘤,并影响细胞周期。
▼
慢性心理压力也被认为是包括癌症在内的多种疾病发展的危险因素。
慢性应激刺激下丘脑-垂体-肾上腺轴和交感神经系统,导致应激相关介质的合成和肾素-血管紧张素系统的激活 。
皮质类固醇和儿茶酚胺的过量产生会导致促炎细胞因子的产生和代谢变化,包括胰岛素抵抗的增加和脂肪分解释放游离脂肪酸。
✦慢性心理压力造成炎症环境
总而言之,这些改变似乎创造了一个炎症环境,加剧代谢综合征、糖尿病和胰岛素抵抗的发病机制以及其他非传染性慢性和免疫介导疾病的发展,所有这些都可能由慢性心理压力介导。
在癌症中,肾上腺素能受体在肿瘤细胞和肿瘤微环境中过度表达。肾上腺素能受体的下游激活反过来会抑制细胞凋亡和DNA修复,并具有增强细胞周期进程的原癌效应。
肾上腺素能受体的激活会诱导PI3K/AKT信号通路,从而刺激细胞增殖和血管生成。此外,应激介导的炎症反应和免疫功能改变可能会损害免疫监视机制,进一步促进癌变。
▼
恶性肿瘤的发展是一个多步骤的过程,病毒已被确定为肿瘤促进剂。肿瘤促进剂刺激信号通路和细胞增殖,最终导致癌症。
✦乙肝病毒、丙肝病毒感染易诱发肝癌
乙型肝炎病毒和丙型肝炎病毒感染是目前肝细胞癌最重要的全球危险因素,肝细胞癌是肝癌的主要组织学类型。
注:来自肝细胞癌高患病率地区的患者在诊断时往往比患病率地区的患者更年轻。
乙型肝炎病毒引起的慢性坏死性炎症性疾病会诱发肝细胞突变,估计发生肝细胞癌的风险为10-25%,并且取决于是否存在活动性乙型肝炎病毒感染或肝硬化。
丙型肝炎病毒是一种不整合到宿主基因组中的RNA病毒。丙型肝炎病毒引起的肿瘤发生可能是重复性损伤、再生和纤维化的结果,并且近90%的丙型肝炎病毒相关肝细胞癌之前有肝硬化。
扩展阅读:细菌,真菌,病毒——感染,免疫反应以及治疗用药差异
▼
研究团队应用比较风险评估方法估计归因于每个风险因素的胃肠道癌症的人群归因分数
2011年中国不同生活方式危险因素的胃肠癌归因分数
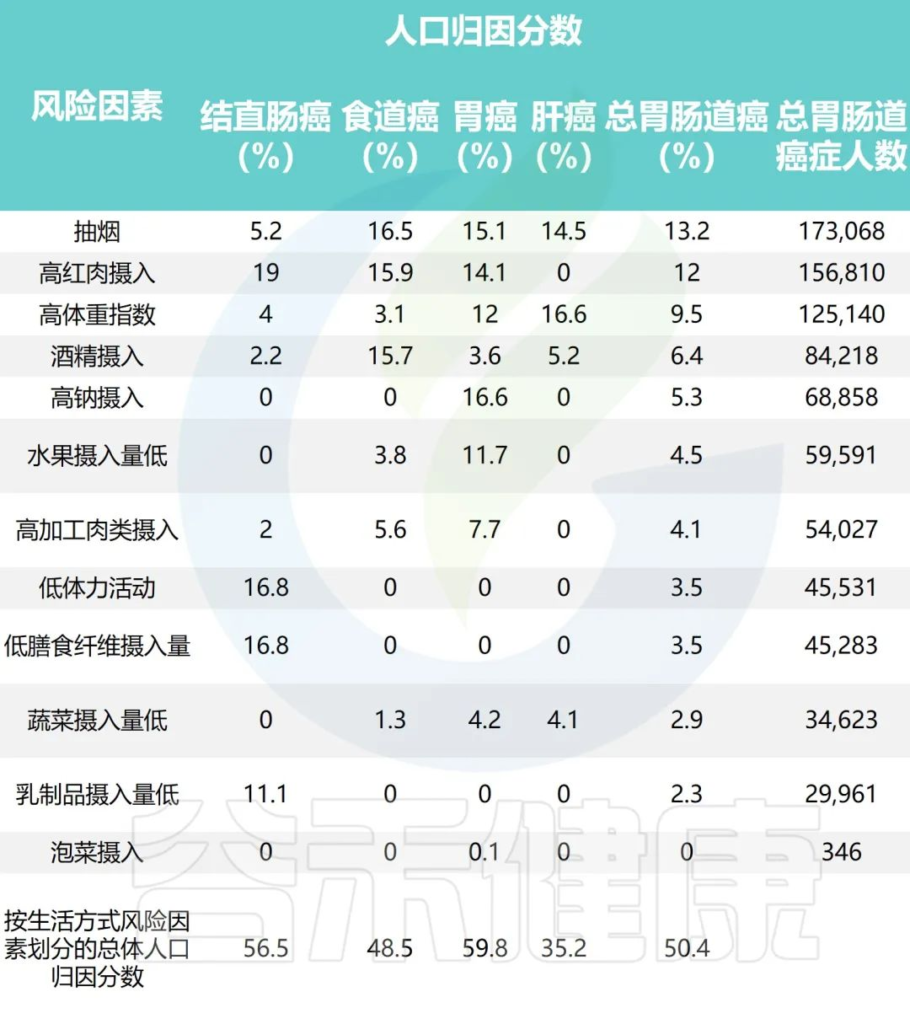
Wu Y,et al.Gastroenterology.2021
•高红肉摄入与51405例结直肠癌病例相关(PAF=19.0%)
•据估计,高身体质量指数(BMI)导致55244例新发肝癌病例 (PAF=16.6%)
•吸烟是食管癌的首要归因危险因素,占48364例病例 (PAF=16.5%)
•高钠摄入量与最多(68,858)例胃癌(PAF= 6.6%) 相关。
研究团队还根据1991年至2011年中国健康与营养调查估计了生活方式因素的时间趋势,同时预测了2011年至2031年生活方式因素的流行程度和胃肠道癌症的相关负担。
1991年至2031年按生活方式风险因素划分的胃肠癌病例的历史和预测趋势
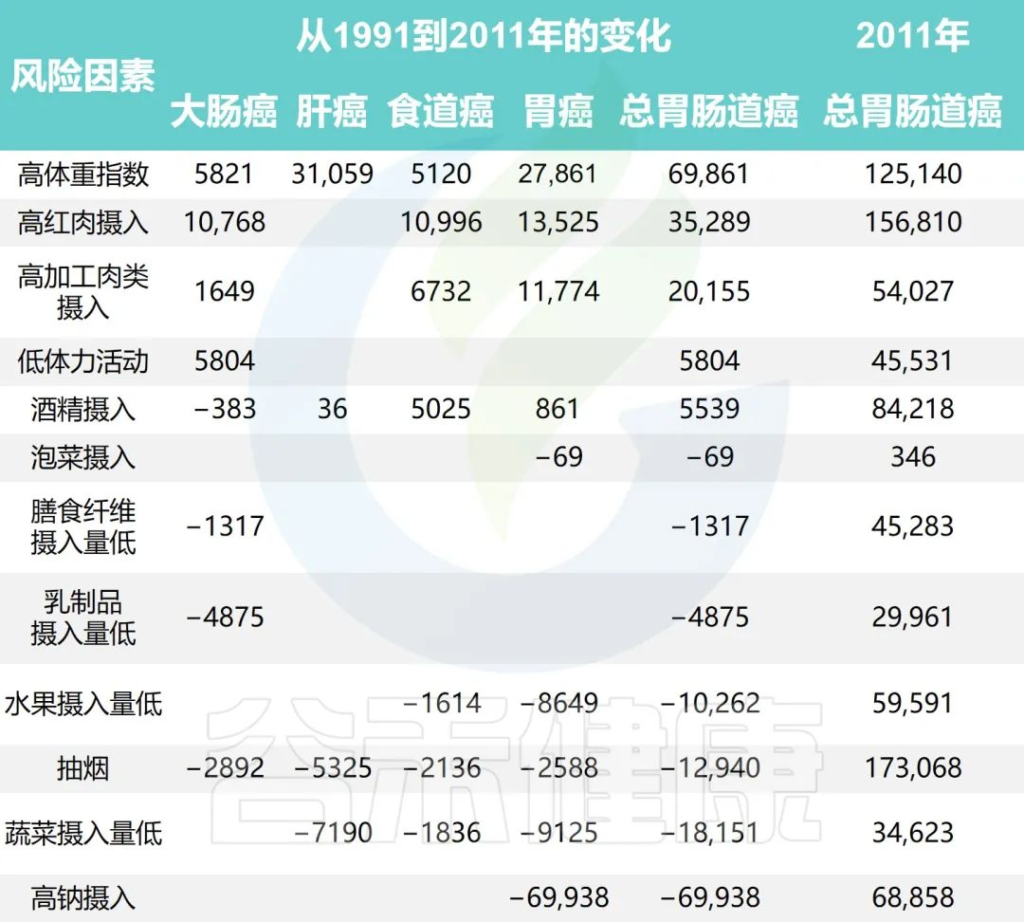
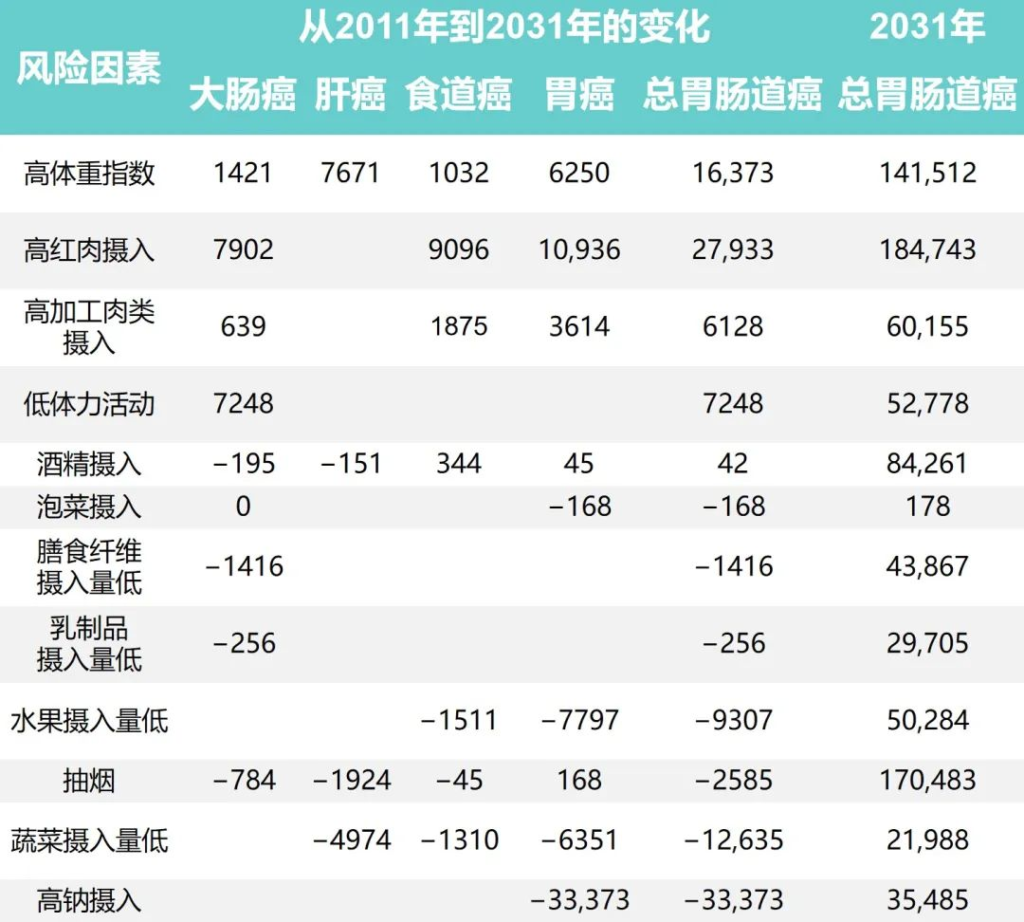
Wu Y,et al.Gastroenterology.2021
•钠摄入量降低减少了胃癌
随着时间的推移,钠摄入量、低蔬菜摄入量、低水果摄入量和吸烟情况有所改善。人口的平均钠摄入量已从1997年的7.5 克/天减少到2011年的5.6克/天,预计到2031年将进一步减少到3.3克/天。
相应的归因胃癌病例估计为138796、68858和 35484,每20年下降约50%。
•蔬菜、水果的摄入增加有助于减少胃肠道癌症
随着平均蔬菜摄入量从252.6克/天上升到323.8克/天,肝癌、食管癌和胃癌的相关数量从1997年的 52774例减少到2011年的34623例。
水果摄入量表现出类似的趋势,1997年总体水果摄入量为18.2克/天,2011年中国人水果消费量为69.6克/天,与1997年相比新增病例减少10262例;到 2031 年,由于水果摄入量增加,预计年发病率将再次下降。
扩展阅读:常见水果对肠道菌群、肠道蠕动和便秘的影响
•吸烟减少胃肠道癌症的发病率也减少
同时,与2011年和1991年相比,吸烟减少与胃肠道癌症事件减少12940例相关,预计2011年至2031年期间将进一步减少。
•饮酒使得胃肠道癌症病例增加
从1997年到2011年,与饮酒相关的胃肠道癌症病例增加了5539例,之后的预测趋势也稳定在每年约84000例。
•锻炼、乳制品和膳食纤维摄入影响结直肠癌
体力活动、乳制品和膳食纤维摄入量仅与结直肠癌有关。据估计,2011年身体锻炼不足与45531例结直肠癌病例相关,预计到2031年还会有7248例病例发生。
1997年、2011年和2031年的预计平均膳食摄入量乳制品分别为5.8克、12.4克和17.6克,膳食纤维分别为10.5克、10.8克和11.1克。2011年,摄入不足分别导致了29961起和45283例结直肠癌病例。
扩展阅读:
人类肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。在过去的十年中,微生物与肿瘤之间的相互作用引起了人们的广泛关注,人们努力了解复杂微生物群落的各种特征,以及微生物群参与癌症预防、致癌和抗癌的可能机制。
大量研究表明,微生物失调通过多种途径促进癌症易感性。肠道微生物主要通过其细菌或分泌的代谢物成分导致消化道肿瘤的发生。
微生物群及其相关代谢产物不仅通过诱导炎症和免疫失调与致癌作用密切相关,还会干扰抗癌药物的药效学。
肠道微生物组与胃肠道癌症的关联
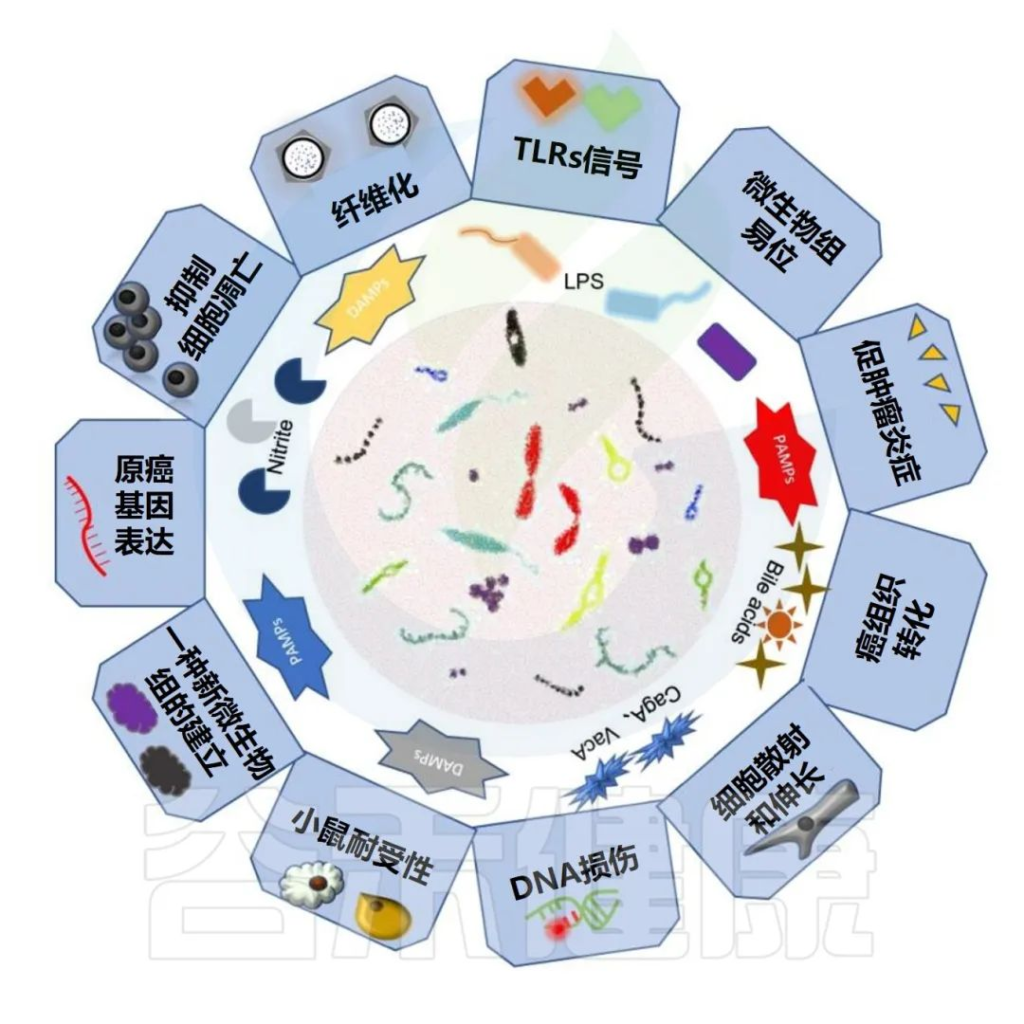
Tong Y,et al.Theranostics.2021
▼
√幽门螺杆菌影响胃癌患病率
胃癌被认为是一种与炎症相关的癌症。幽门螺杆菌(H.Pyloni)感染被称为I类危险因素,可以刺激免疫反应和炎症,调节许多信号通路,并诱发胃酸缺乏、上皮萎缩和发育异常。因此,有效根除幽门螺杆菌可预防胃癌。
癌蛋白细胞毒素相关基因A(CagA)和空泡毒素A(VacA) 是幽门螺杆菌的关键毒力因子。幽门螺旋杆菌感染会显著增加患胃癌的风险。
空泡毒素A可通过直接作用于线粒体 ,导致细胞空泡形成,并在人源性胃上皮细胞内诱导自噬 , 上调 MAP激酶和ERK1/2表达, 激活血管内皮生长因子, 上调细胞生长和分化所必需的 Wnt/β-catenin 信号通路, 抑制GSK3通过PI3K/Akt信号通路。
幽门螺杆菌感染个体中炎症细胞因子增加
在幽门螺杆菌感染个体的胃中发现炎症细胞因子的积累增加,包括干扰素-γ、肿瘤坏死因子、IL-1、IL1β、IL-6、IL-7、IL-8、IL-10和IL-18。
因此,多种类型的免疫细胞受到刺激,包括淋巴细胞、外周单核细胞、嗜酸性粒细胞、巨噬细胞、嗜中性粒细胞、肥大细胞和树突细胞。
包含ERK/MAPK、PI3K/Akt、NF-κB、Wnt/β-catenin以及STAT3的致癌通路的活性随着幽门螺杆菌的感染而上调。相反,肿瘤抑制通路因诱导的P53突变而失活。
此外,幽门螺杆菌感染可导致E-钙粘蛋白和抑癌基因的CpG 岛甲基化,包括编码三叶因子2(TFF2)和叉头盒转录调节因子(FOXD3)的基因,导致显著增加胃癌的风险。
扩展阅读: 正确认识幽门螺杆菌
√其他微生物群
目前的测序技术使研究人员能够深入研究肠道微生物群的复杂性。
幽门螺杆菌阳性个体的微生物群落特征是以下细菌的数量增加:
变形杆菌(Proteobacteria) ↑↑↑
螺旋体(Spirochaetes) ↑↑↑
酸杆菌门(Acidobacteria) ↑↑↑
而以下菌群的数量减少:
放线菌门(Actinobacteria) ↓↓↓
拟杆菌门(Bacteroidetes) ↓↓↓
厚壁菌门(Firmicutes) ↓↓↓
相反,幽门螺杆菌阴性个体携带更丰富的厚壁菌、拟杆菌和放线菌。
√肠道微生物失调增加胃癌发生率
微生物失调也与胃癌发生有关。使用定量PCR,已经表明胃癌患者的微生物群组成非常多样化。
例如卟啉菌属(porphyromonas)、奈瑟菌属(Neisseria)、苍白普氏菌(prevotella pallens)、Streptococcus sinensis的减少,以及大肠杆菌、 肺炎克雷伯菌(Klebsiella pneumoniae)、鲍氏不动杆菌(Acinetobacter baumannii)和毛螺菌科(Lachnospiraceae)的富集。
扩展阅读:
全面认识——肺炎克雷伯菌 (Klebsiella pneumoniae)
来源于幽门螺杆菌的致病成分,如外膜蛋白磷脂酶C-γ2、BAK蛋白和镍结合蛋白,帮助微生物在胃粘膜层定植,然后加剧胃炎的进程,最终增加胃中肿瘤发生的可能性。
肠道微生物与食管癌
据报道,食管癌与常见的潜在危险因素密切相关,如人类乳头状瘤病毒和EB病毒的感染,尽管致病机制仍有争议。除了病毒,细菌感染也会导致食管恶性肿瘤的形成。
√感染幽门螺杆菌的人群食管癌呈下降趋势
在最近20多年来,在感染幽门螺杆菌的普通人群中,食管腺癌的发病率呈下降趋势,尤其是在东部人群中。与此同时,食管鳞状细胞癌的发病率也有所下降。
胃食管反流病是巴雷特食管的主要原因,巴雷特食管是食管腺癌的一种癌前病变。通过抑制壁细胞功能或诱导萎缩性胃炎的发展,慢性幽门螺杆菌感染可以抑制壁细胞分泌盐酸,从而增加胃肠道的pH值,最终导致食管腺癌降低。
√食管炎患者体内肠杆菌丰度较高
与正常人群相比,食管炎和巴雷特食管患者胃中肠杆菌科的相对丰度更高。
有人认为,抗生素可能会改变胃食管反流病患者食道中的微生物组。定植在食管和胃中的肠道微生物群通过质子泵抑制剂(PPIs)的治疗而显著改变。然而,质子泵抑制剂引起的变化是否有益还没有定论。
最新的系统综述和荟萃分析表明,质子泵抑制剂不会减少发育不良和巴雷特食管相关食管腺癌的发展。
√食管中的微生物参与致癌过程
食道传统上被认为是无微生物的部位,只有有限的微生物来自吞咽和胃食管反流。通过应用16S rRNA 测序技术,发现一些特定的微生物栖息在食管粘膜中,包括厚壁菌门、拟杆菌门、变形菌门、放线菌门和梭杆菌门。
此外,与正常食管相比,食管鳞状细胞癌(I-II 期)和食管鳞状异型增生 (ESD) 患者的食管中发现了不同的微生物群落。
与正常胃粘膜微生物群一致,早期食管鳞状细胞癌和食管鳞状异型增生样本中最常见的门是变形菌门、厚壁菌门和拟杆菌门。当食管微生物群失调时,它们参与食管的致瘤过程。
已经发现人类远端食管具有其自身特征性的微生物群。包括厚壁菌门和链球菌在内的革兰氏阳性细菌在正常食管中占主导地位,而革兰氏阴性厌氧菌/微需氧菌,如拟杆菌、变形菌、梭杆菌和螺旋体,主要与食管炎和巴雷特食管有关。
注:脂多糖是革兰氏阴性菌细胞壁的重要组成部分,通过多种机制参与肿瘤发生过程。这些包括激活导致NF-κB激活的先天免疫反应, 促进包括IL1β、IL6、IL8和TNFα在内的炎症相关介质的释放和延迟胃排空。
▼
结直肠中的肠道微生物组是人体中最复杂的群落。细菌种群主要包括厚壁菌门和拟杆菌门和变形杆菌门。
√饮食、微生物代谢物影响结直肠癌
各种因素都会导致结直肠癌,而饮食是与结直肠癌相关的重要环境因素。许多不同的肠道微生物群代谢物具有致瘤或抗肿瘤特性。
在结肠细胞上表达的脂多糖受体抑制细胞死亡,通过Toll样受体2激活细胞免疫反应,然后刺激下游促炎细胞因子信号传导,导致肿瘤发生。
脂磷壁酸是一种来自革兰氏阳性菌细胞壁的元素,被认为是脂多糖的对应物。高脂肪饮食会增加硫酸盐还原菌的相对丰度,例如普通脱硫弧菌,它将初级胆汁酸转化为次级胆汁酸,如石胆酸和脱氧胆酸,具有潜在的致瘤性。
丁酸盐具有抗肿瘤作用
相反,丁酸是一种重要的短链脂肪酸 ,由结肠细菌从饮食中的可发酵纤维中产生,已被证明具有抗肿瘤作用。
参与发酵过程最重要的丁酸盐产生微生物群是普拉梭菌(Faecalibacterium prausnitzii)和直肠真杆菌(Eubacterium rectale)。
丁酸被结肠细胞中的线粒体利用,这有助于维持健康的能量平衡并有益于结肠上皮细胞增殖。GPR109a是一种在免疫细胞上表达的短链脂肪酸受体,主要激活丁酸的配体,然后抑制炎症细胞因子,从而抑制炎症过程。宿主免疫反应通过干扰素γ对抗DNA甲基化介导的GPR109a沉默,从而相应地促进抗癌作用。
丁酸通过诱导P21基因表达、抑制激活蛋白-1(AP-1)信号通路以及增加c-Fos和ERK1/2的磷酸化来发挥各种化学预防作用。此外,尿石蛋白如尿石蛋白A是水果和坚果的肠道微生物群代谢产物,含有大量鞣花酸。据报道,它们可以抑制Wnt信号传导,并显示出对癌症的益处。
扩展阅读:如何通过喂养菌群产生丁酸调节人体健康
√长期炎症容易导致结直肠癌
肠道微生物群引起的通路
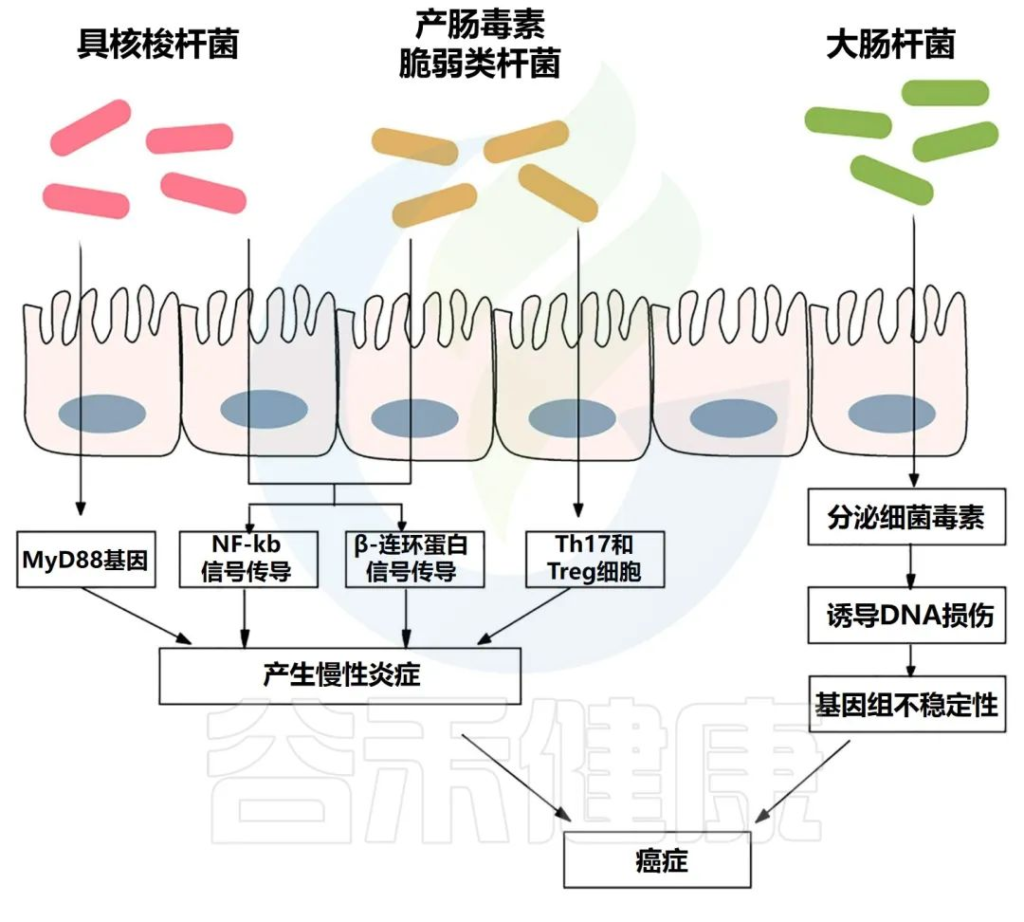
Si H,et al.Semin Cancer Biol.2021
慢性炎症会产生大量炎症介质,如肿瘤坏死因子、白细胞介素6、白细胞介素1b和其他细胞因子,它们会激活NF-κB,从而导致结肠癌发生。
炎症性肠病与更高的结直肠癌风险相关。例如,与局限性结肠炎患者相比,全结肠炎患者患癌症的风险更高。
与健康受试者相比,炎症性肠病患者的肠道微生物群具有较低的多样性和生态失调,其特征是厚壁菌门和拟杆菌门的丰度较低。
产肠毒素脆弱拟杆菌与炎症性肠病的存在显著相关。炎症性肠病和结直肠癌都有一个共同的过程,即转化生长因子-β (TGF-β)、TNFα、NF-κB、ROS 和其他信号分子水平升高,导致肠道微生物失调。
已经证明伴有炎症性肠病的结直肠癌患者比没有炎症性肠病的患者预后更差。
扩展阅读:肠道菌群失调与炎症性肠病的关联
√肠道菌群失调导致结直肠癌风险增加
如果肠道微生物群保持在失调状态,有益共生体的多样性和丰度可以最小化。一旦受干扰的微生物过度生长,它们就会产生积累的外毒素和内毒素。
如大肠杆菌的细胞致死性膨胀毒素和大肠杆菌素,痢疾志贺菌的细胞致命性膨胀毒素,脆弱芽孢杆菌的脆弱芽孢杆菌毒素,粪肠球菌的细胞外超氧化物和过氧化氢等。
这些细菌毒素能够直接或间接诱导DNA损伤、基因组不稳定、肿瘤发生和腺癌的侵袭。
此外,微生态失调导致结肠上皮细胞暴露于致癌物质的增加。未修复的DNA和碱基切除修复(BER)中间体的积累导致基因组不稳定,并最终致癌。
注意:微生物生态失调会使免疫反应失调并增加炎症,导致PIK3CA基因突变,这可能会加速结直肠癌的发生或生长。
//梭杆菌粘附素A可作为生物标志物
梭杆菌粘附素A(FadA)是一种由梭杆菌表达的细胞表面毒力因子,经常在腺瘤性息肉或结直肠癌患者中检测到。
FadA与内皮上的E-钙粘蛋白相互作用,并调节E-钙粘素/β-连环蛋白通路,导致转录因子、癌基因和炎症基因的表达增加。
它还促进梭杆菌粘附并入侵表达E-钙粘蛋白的细胞,从而直接影响上皮细胞的增殖和生长。最近的一份报告表明,结直肠癌组织中梭杆菌的总体丰度是邻近正常组织的400多倍。因此,FadA可能是结直肠癌诊断和治疗的潜在生物标志物。
▼
虽然肝脏通常被认为是无菌的,但肝脏环境受到胃肠道微生物群通过肝门静脉系统产生的病原体或代谢物的极大影响。
肝细胞癌和胆管癌是最常见的肝癌组织学类型。酒精性肝病、非酒精性脂肪肝以及食源性污染物黄曲霉毒素B1、乙型或丙型肝炎病毒感染被认为是肝细胞癌的主要危险因素。
值得注意的是,肠道菌群失调是非酒精性脂肪性肝病的主要诱因之一。
√肠道微生物失调会导致肝癌发生
肝脏通过过滤血流以及代谢和中和肠道微生物产生的毒素对宿主微生物群落产生重要影响。肠道微生物失调会导致肝癌发生,因为微生物群和微生物代谢物可被肝脏常驻免疫细胞检测到,并能够改变肝脏代谢。
肝细胞癌患者粪便中大肠杆菌的丰度远高于健康对照者粪便中的大肠杆菌,而迪茨氏菌科(Dietziaceae),假单胞菌属(Pseudomonas)和草酸杆菌科(Oxalobacteraceae)在胆管癌患者的胆管样本中比非胆管癌个体的样本更丰富。
据推测,肠道微生物的过度生长可能会促进肝癌的发展,这需要进一步探索。
√幽门螺杆菌促进肝癌的生长和迁移
幽门螺杆菌通常栖息在人的胃中。然而,来自肠道的幽门螺杆菌可以通过门静脉的血流到达肝组织,在吞噬消除后幸存下来,或者通过十二指肠反向迁移。
已在肝细胞癌患者的肝组织中发现幽门螺杆菌产生的代谢物 。已经表明,来自幽门螺杆菌的脂多糖通过增加白细胞介素8和转化生长因子β1的水平直接促进肝癌的生长和迁移。
作为螺杆菌科的一员,幽门螺杆菌通过激活NF-κB 和Wnt信号通路、肝细胞更新和氧化应激导致肝细胞癌的发展。
此外,一些螺杆菌属物种,如胆螺杆菌(H.bilis)、H.ganmani和H.hepaticus,与胆管癌特异性相关,但与胆管中的非肿瘤疾病无关。
√肠道微生物代谢物影响肝癌
微生物代谢物会扰乱肝脏中的代谢途径和免疫反应。
Toll样受体4(TLR4)识别来自细菌的脂多糖(LPS),并通过脂多糖诱导的TNF-β和IL-6激活库普弗细胞。它还可以通过上皮调节蛋白等生长因子刺激星状细胞,并启动各种炎症和致癌途径。LPS-TLR4通路可促进肝细胞癌,而去除脂多糖或Toll样受体4 基因失活可降低肝细胞癌的发展。
库普弗细胞——是位于肝脏中的特殊巨噬细胞,是单核吞噬细胞系统的一部分。
胆酸和鹅脱氧胆酸是肝脏产生的主要初级胆汁酸。它们通过增加活性氧的产生而导致DNA损伤,从而诱发肝癌的发展。
此外,胆汁酸也被证实可以调节肠道微生物群。胆汁酸数量减少会导致肠道菌群过度生长并加速炎症。梭菌产生的脱氧胆酸的肠肝循环会导致DNA损伤并在肝星状细胞中引发衰老相关分泌表型。
这个过程涉及许多炎症细胞因子和生长因子,从而导致炎症和肥胖相关的肝细胞癌转变。脱氧胆酸和石胆酸被证明可通过DNA损伤直接促进癌症。
▼
胰腺是胃外消化器官。胰腺导管腺癌(PDAC)是全球最致命的癌症之一,是最常见的胰腺癌类型。越来越多的研究表明,肠道微生物群可能通过促进炎症、激活免疫反应和使癌症相关炎症持续存在来影响胰腺癌发生。
√幽门螺杆菌感染是胰腺导管癌的风险因素
对数百项胰腺癌荟萃分析的回顾表明,幽门螺杆菌感染是胰腺导管腺癌的一个重要危险因素。除胰腺导管腺癌外,幽门螺杆菌还参与急性和慢性胰腺炎以及自身免疫性胰腺炎。
许多源自幽门螺杆菌的致病成分,包括氨和脂多糖,以及由此产生的大量炎性细胞因子,都会损害胰腺。
幽门螺杆菌感染激活NF-κB和AP-1,导致细胞过程失调。白细胞介素8水平升高会加速炎症反应,最终导致胰腺癌发生。
此外,幽门螺杆菌感染持续激活STAT3可通过上调抗凋亡和促增殖蛋白(包括Bcl-xL蛋白、MCL-1、生存素、c-myc和细胞周期蛋白D1)的表达来促进胰腺癌进展。
√炎症及免疫反应与胰腺癌
微生物引起轻微和持续的免疫反应和炎症反应,会导致胰腺癌的形成。
已经进行了许多研究来探索可能的机制。在各种免疫细胞上表达的toll样受体使免疫细胞能够识别多种微生物相关分子模式 (MAMP) 和非感染性炎症损伤相关分子模式 (DAMP),然后激活NF-κB和MAPK信号通路。这些过程引发并延续胰腺炎,最终促进胰腺癌的进展。
NLRs是细胞质模式识别受体(PRRs),参与NF-κB的激活和炎症小体的形成。P38丝裂原活化蛋白激酶(P38 MAPKs)对细胞因子有反应,参与细胞分化、凋亡和自噬,从而加速胰腺导管腺癌的过程。因此,P38抑制剂可能是治疗癌症的药物。
味觉受体2型成员38(TAS2R38)是一种苦味受体。有趣的是,T2R38不仅在口腔细胞中表达,也在胰腺癌细胞中表达。铜绿假单胞菌(Pseudomonas aeruginosa)是T2R38的独特配体,据称可激活 T2R38,诱导多药耐药相关蛋白1(ABCB1),并参与癌症侵袭和转移。
此外,梭杆菌属存在于8.8%的胰腺癌组织中。值得注意的是,梭杆菌属的状态是胰腺癌的一个独立的阴性预后生物标志物。
扩展阅读:梭杆菌属Fusobacterium——共生菌、机会致病菌、致癌菌
√其他肠道微生物对癌症的作用




Tong Y,et al.Theranostics.2021
研究显示生活方式对胃肠道癌症风险的影响越来越大。吸烟、饮酒、饮食构成、肥胖等都是影响胃肠道癌症的重要因素。
肠道微生物群与人类密切相关,在人类健康和疾病中也发挥着重要而独特的作用。肠道微生物群还能够与化学治疗剂和免疫治疗剂发挥协同作用。
基于对肠道微生物群的研究,人们也在探索新的治疗靶点,以及使用人类肠道微生物群的诊断、预测和预后癌症生物标志物。加速肠道微生物组研究在精准医学中的转化。
生活行为及肠道微生物群与胃肠道癌症之间的准确关系需要进一步探索,将对我们的日常生活和临床治疗将产生重大影响。
主要参考文献:
Jardim SR, de Souza LMP, de Souza HSP. The Rise of Gastrointestinal Cancers as a Global Phenomenon: Unhealthy Behavior or Progress? Int J Environ Res Public Health. 2023 Feb 18;20(4):3640. doi: 10.3390/ijerph20043640
谷禾健康
Eubacterium 通常翻译为真杆菌属或优杆菌属
Eubacterium,革兰氏阳性细菌,属于真杆菌科,厚壁菌门。
Eubacterium 是在健康人结肠中发现的一种重要的肠道细菌,它是人类肠道微生物群的核心菌属之一,并显示出在大部分人群肠道,口腔等部位的广泛定植,对机体有营养代谢和维持肠道平衡有重要的作用。但是少数菌种可与其它兼性厌氧菌造成混合感染,引起人心内膜炎,盆腔炎等疾病。
这个家族的成员很重要,因为许多菌种产生短链脂肪酸,尤其丁酸。短链脂肪酸普遍被认为对维持人体健康具有多种重要作用,例如充当肠道上皮特殊营养和能量组分、保护肠道黏膜屏障、降低人体炎症水平和增强胃肠道运动机能等等。
F.prausnitzii、Eubacterium rectale、Eubacterium hallii、Roseburia gutis和Ruminococcus bromii是人类肠道中产生丁酸的主要物种。真杆菌属的几个成员均产生丁酸盐,丁酸盐在能量稳态、结肠运动、免疫调节和肠道炎症抑制中起着关键作用。
同时真杆菌属成员还被证明在以下过程中发挥关键作用:
胆汁酸和胆固醇转化
参与草酸盐分解代谢
促进抗炎分子的产生
预防气道过敏性炎症
降低胰岛素分泌并增加“健康”脂肪的水平
与下腹部脂肪之间的关联
…
在越来越多的肠道菌群研究中发现,Eubacterium的减少或缺乏与很多疾病相关,比如抑郁和/或疲劳、肥胖、IBD、II型糖尿病、心脑血管、结直肠癌、自闭症、老年肌少症、肠道健康以及肿瘤预后良好和肠道稳态状态等。
该属的多个物种目前被认为是微生物治疗的有希望的目标。事实上,基于谷禾长期的菌群检测实践与肠道微生物科学研究等达成的“共识”表明,肠道真杆菌属(Eubacterium)、罗氏菌属(Roseburia)和粪杆菌属, (Faecalibacterium, 也称为普拉梭菌)等的特定产丁酸盐微生物菌株属于对人类健康有益的菌属,其作用方式与乳杆菌属和双歧杆菌属菌株可能相同。
但是,需要注意的是,Eubacterium属正如下面进一步讨论的一样,很难定义,因为最初分配给该属的几个物种随后被重新分配给现有的或新的属。即使是现在,该属在系统发育上仍然是多样化的,成员可以被分配到几个谱系。认识到这种分类学的变化,我们将包括一些最近重新分配给其他属的前真杆菌属物种。此外,本文也将在很大程度上讨论对真杆菌属的与肠道以及健康相关的信息。
真/优杆菌属(Eubacterium)是人类胃肠道含量较为丰富的菌属,是人和动物口腔与肠道正常菌群的成员。
该属由系统发生学上和表型上不同的物种组成,使真杆菌属成为分类学上独特且具有挑战性的属。该属的特征是包含多种表型多样化的物种,革兰氏阳性,杆状生物属,非孢子形成,这些细菌的特点是坚硬的细胞壁。它们可以是能动的或不能动的。如果能动,它们就有鞭毛。通常单独出现,成对出现,或短链。偶尔与腹部、骨盆或泌尿生殖道的混合感染有关。
该物种是厌氧的,这使得真杆菌属的表型鉴定非常耗时,这可能一定程度抑制了对从粪便中分离的属成员的详细研究。
真杆菌属
Eubacterium
化能有机营养,发酵代谢,有些种利用碳水化合物。发酵葡萄糖或蛋白胨的主要产物通常包括大量的丁酸、乙酸或甲酸并有可测得的H2的混合酸。接触酶阴性,通常吲哚阴性。可能还原硝酸盐,可能液化明胶。
1938年首次提出,常在哺乳动物的口腔和肠道中发现,包括在反刍动物的瘤胃以及在环境中。
该属构成人类肠道微生物群的核心属之一,并显示出在全世界人类肠道的广泛定植,包括亚洲、非洲、澳大利亚、欧洲、南美洲、北美洲等不同人群中,表明该菌属具有高度的特异性和适应性。真杆菌属DNA(G + C)含量约为30~57mol%,代表菌种为黏液真杆菌。
多数物种要求特殊的厌氧培养技术和营养丰富的培养基,菌落通常低凸或平坦。这个属里的有些种在自然界中可被糖乳酸化或可运动。
本属细菌从碳水化合物或蛋白胨中产生有机酸混合物,其可能包括大量的丁酸、乙酸和甲酸。
根据Bergey的《细菌和古菌系统学手册》以及NCBI分类学的最新版本,真细菌属属于厚壁菌门、梭状芽胞杆菌目和真细菌科。
由于该属的定义相当宽松,目前该属中的许多物种不属于严格意义上的属,很可能会及时移至新的或现有的属中。
2020年爱尔兰Cotter 团队提供了该树的更新,以显示该属某些成员与其他密切相关物种之间的系统发育关系(下图)。
真杆菌属的系统发育关系
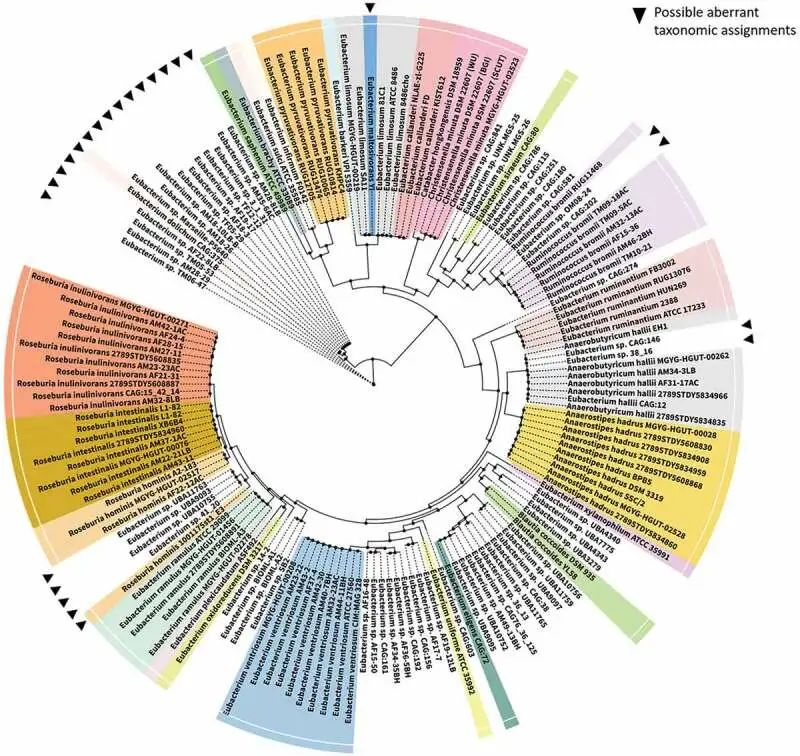
doi: 10.1080/19490976.2020.1802866
▸ 真杆菌属的重新分类
经过重新分类的真杆菌属的大多数成员被归入厚壁菌门,并广泛分布于其中。例如,E. formicgenerans和E. timidum,它们分别被重新分配到Dorea属和Mogibacterium属。
然而,其他几个成员已被重新分配到其他门;实例包括将真杆菌物种重新分配给Slackia 、Cryptobacterium和Eggerthela等属,所有这些属都属于放线菌门。
值得注意的是,某些E. cylindroides等真杆菌属物种可能同时表现出革兰氏阳性和革兰氏阴性特征,从而在分类学分配中经常实施的基本表型特征中产生歧义;这进一步导致了真杆菌属物种分类的相当大的混乱。
▸ 狭义的真杆菌属
有人提出,狭义真杆菌属的核心基因型仅限于该属的模式种Eubacterium limnosum,以及Eubacterium callanderi 、Eubacterium barkeri和Eubacterium aggregans,当有足够的基因组和系统发育证据支持时,其余物种可能被同化为/重新分类为现有或新属。
为实用起见,迄今为止,成员已根据系统发育特征分为子类别。提议的松散系统发育子类别之一包含E. rectale、E. oxidoreducens、E. ramulus、Roseburia cecicola和R. intestinalis,其中除E. oxidoreducens之外的所有物种都产生丁酸盐并且是糖分解的。
▸ 进一步分类的必要性
后来又有科学家提出了对其中一些物种进行重新分类的有力案例。E. eligens是一种重要的肠道真杆菌,已被发现与Lachnospira pectinoschiza具有相当大的系统发育和表型相似性,并且随着进一步证据的可用性而值得重新分类。
鉴于它们不同的表型和系统发育特征,某些对肠道健康很重要的真杆菌属物种已经或计划进行重新分类。例如,建议将E. hallii重新分类为Anaerobutyricum hallii Comb。
2020年11月,报道了一种类似的新型产丁酸盐和丙酸盐的物种Anaerobutyricum soehngenii。事实上,E. hallii与E. indolis、E. cellulosolvens、E. plexicaudatum、E. ruminantium、E. saburreum、E. xylanophilum、E. uniforme 和 E. ventriosum 一起构成了真杆菌属中有趣的种。
值得注意的是,这一群体的成员在系统发育上或表型上与该属中的其他物种没有亲缘关系,并表现出独特的特征,从而为每个物种创建一个新的属。
▸分类对人类微生物群研究影响大,重新分类需谨慎
此外,最近有人提议将最重要的肠道微生物之一直肠肠杆菌重新归类为直肠Agathobacter。然而,这种重新分类受到其他科学家等人的质疑。认为没有理由重新分类并指出其分类学或系统发育隶属关系的任何变化都将对人类微生物群研究产生重大影响。
可以理解的是,提出的分类学重新分配尚未被普遍接受,事实上,如前所述,在考虑真杆菌属任何成员的分类学分类和报告时必须小心。与属的分类有关的进一步努力应该主要关注基因型,并强调基因组特征。
真杆菌属目前的模式菌种为黏液真杆菌(Eubacterium limosum)。研究较多的是:
饮食是决定肠道菌群组成和多样性的最重要因素之一。就真杆菌属而言,它们在肠道中的存在在很大程度上与膳食纤维摄入量的增加有关,多项研究证真杆菌属对消化抗性复合碳水化合物的利用,并且已被证明随着饮食中蛋白质/脂肪百分比的增加而减少。
E. hallii和E. rectale被证明能够利用证明能够利用补充有抗性碳水化合物的培养基,即长链的果聚糖,如低聚果糖、高性能菊粉。
▸ 地中海饮食增加真杆菌属的数量
多项研究报告称,西方饮食中动物蛋白和脂肪的比例增加且纤维含量低,导致肠道细菌丰度显着下降,包括双歧杆菌和真杆菌属等理想的菌群。涉及地中海饮食的研究也表明,地中海饮食可以增加肠道中真杆菌属(Eubacterium)的数量。
研究显示45岁男性食用富含多不饱和 omega-3 脂肪酸的饮食时,肠道微生物群的变化,包括真杆菌在内的几种丁酸盐菌的丰度急剧增加,表明多不饱和脂肪酸对真杆菌的正向调节。
在衰老过程中,胃肠道会发生变化,包括粘膜屏障和肠神经系统的退化以及肠道运动的改变和胃肠道病变的增加。
▸老年菌群多样性↓,短链脂肪酸生成↓,肠道炎症↑
总的趋势是,老年人的微生物群多样性随着丁酸盐生产者的减少和潜在病原体数量的增加而减少。肠道中短链脂肪酸生成的减少可导致肠上皮细胞粘蛋白分泌受损,从而增加病原体进入肠粘膜的机会, 潜在的肠道炎症。
在老年人中,肠道相关淋巴组织 (GALT) 受损会加剧肠道炎症,导致无法有效控制常驻微生物群并导致肠细胞释放促炎细胞因子和趋化因子;后者驱动效应 TH1、TH2 和 TH17 细胞的分化。
与上面观察结果一致的是,在百岁老人中,在百岁老人中发现了E. hallii、E. rectale 和 E.ventriosum相对比例降低,而来自变形杆菌门的潜在致病细菌增加。
▸ 真杆菌:老年肠道微生物生态系统中的关键物种
后续的研究进行的一项广泛研究强调了真杆菌属的有益作用,其中调查了一大群老年人(n=612),以评估地中海饮食对其肠道微生物群的调节作用。作者报告称,真杆菌(Eubacterium)物种,如直肠真杆菌(E.rectale)和 E.eligens与一些较低虚弱、认知能力提高以及短/支链脂肪酸产量增加的标志物呈正相关。
真杆菌与炎症标志物如IL-2和C反应蛋白呈负相关。此外,网络分析显示,真杆菌属是老年肠道微生物生态系统中的关键物种。然而,与这些一般观察结果相反,其他研究推断出真杆菌属与年龄之间存在正相关。
短链脂肪酸有益于人类健康,它们由不同的结肠微生物群产生,包括来自真杆菌属的几种物种(上图)。
▸ E. rectale 是研究最广泛的真杆菌种之一
它首先从健康的日本-夏威夷男性的粪便中分离出来,被确定为主要的丁酸盐生产者,能够利用复杂的碳水化合物(如纤维二糖和淀粉)进行生长和增殖。
▸ 产丁酸的途径,与真杆菌相关
E. hallii也是人体肠道中的丁酸盐生产者。在肠道中,丁酸可以通过糖酵解从碳水化合物中产生,其中两分子乙酰辅酶A结合形成乙酰乙酰辅酶A,然后逐步还原生成丁酰辅酶 A。
目前已知丁酸CoA最终转化为丁酸的两种不同途径;这通过丁酸CoA:乙酸CoA转移酶途径或磷酸转丁酸酶和丁酸激酶途径进行。丁酰辅酶 A 转移酶途径与丁酸合成基因与直肠真杆菌和Roseburia等物种密切相关。
其他真杆菌种也采用相同的途径,例如E. hallii和E. biforme(现在重新归类为Holdemanella biformis)用于生产丁酸盐。
▸ 丁酸高产的真杆菌属——E. rectale 和 E. hallii
E. rectale和E. hallii随后被确定为肠道中的高产丁酸盐生产者。它们被发现是人类粪便微生物群中最丰富的 10 个成员之一,贡献了从 10 名健康志愿者的粪便样本中检索到的超过 44% 的丁酰辅酶 A:乙酸 CoA 转移酶序列。
瑞士最近的一项队列研究也表明,E. hallii 是婴儿肠道中丁酸的首批生产者之一。
▸ 转化为丙酸的1,2-丙二醇可被E. hallii 代谢
肠道微生物通过糖发酵的两种途径形成丙酸。虽然琥珀酸途径处理大多数戊糖和己糖产生丙酸,但丙二醇途径代谢脱氧糖如岩藻糖和鼠李糖。后者作为膳食(例如人乳低聚糖)或宿主衍生(粘蛋白)聚糖在肠道环境中很容易获得,并且在被各种肠道微生物利用后可以产生 1,2-丙二醇作为最终产物。虽然不能降解脱氧糖,但 1,2-丙二醇可被E. hallii代谢,已证明携带甘油/二醇脱水酶PduCDE,这是1,2-丙二醇转化为丙酸和丙醇并生成一个ATP的关键酶。
1,2-丙二醇转化为丙酸取决于维生素B12的有效性,并发生在称为多面体的小隔间内,以隔离有毒中间体丙醛。
虽然真杆菌属(Eubacterium)可以降解复合碳水化合物,但某些真杆菌属菌株可能缺乏降解特定复合碳水化合物的能力,并依赖于其他肠道微生物产生的代谢产物;然后,这些其他肠道微生物产生的发酵产物可以被真杆菌利用。
▸ 交叉喂养机制在真杆菌属生产短链脂肪酸中的重要性
已在多个实例中得到证明。在这些研究中,真杆菌与双歧杆菌在复合碳水化合物存在下共培养。这些双歧杆菌菌株能够降解阿拉伯木聚糖低聚糖和岩藻糖基乳糖等复合碳水化合物,可产生乙酸盐、乳酸和 1,2-丙二醇,所有这些物质又被真杆菌属吸收和利用,生成丁酸和丙酸。真杆菌属这种交叉喂养的证据。
这不仅强调了肠道微生物与抗性碳水化合物的产丁酸作用之间的协同相互作用,而且强调了肠道微生态整齐的生态互作,不是关注一个菌而是整体的菌群健康状况。同时也突出了真杆菌属在维持肠道健康中的生态作用。
研究已经证实丁酸盐构成了结肠细胞的主要能量来源,促进了它们的增殖、成熟,发育成健康的结肠。事实上,据报道,E. rectale (直肠真杆菌)优先定殖粘液层,从而增加丁酸盐对上皮结肠细胞的生物利用度。
▸ 短链脂肪酸促进肠道完整性
此外,短链脂肪酸已被证明在通过促进肠道完整性和调节免疫反应来调节肠道炎症方面发挥重要作用。短链脂肪酸可以通过上调紧密连接蛋白(例如 claudin-1 和 occludin)以及肠粘蛋白、粘蛋白 2 来改善肠上皮抵抗力。
▸ 短链脂肪酸激活GPCR,抑制HDAC
短链脂肪酸对免疫反应的调节,包括G 蛋白偶联受体 (GPCR) 的激活和组蛋白脱乙酰酶 (HDAC) 的抑制。 短链脂肪酸可以结合至少四种离散的 GPCR——FFAR2(游离脂肪酸受体)、FFAR3、GPR109a 和 Olfr78 作为配体,尽管具有不同的特异性。
▸ 短链脂肪酸抑制促炎细胞因子,上调抗炎细胞因子
一些研究表明,短链脂肪酸可以通过抑制促炎细胞因子(如 IFN-γ、IL-1β、IL-6、IL-8 和 TNF-α)发挥抗炎作用,同时上调抗炎细胞因子例如 FFAR2/FFAR3 依赖性方式的 IL-10 和 TGF-β。
GPR109a 激活结肠巨噬细胞和树突状细胞中的炎性体通路,从而诱导调节性 T 细胞和产生抗炎性 IL-10 的 T 细胞的分化。
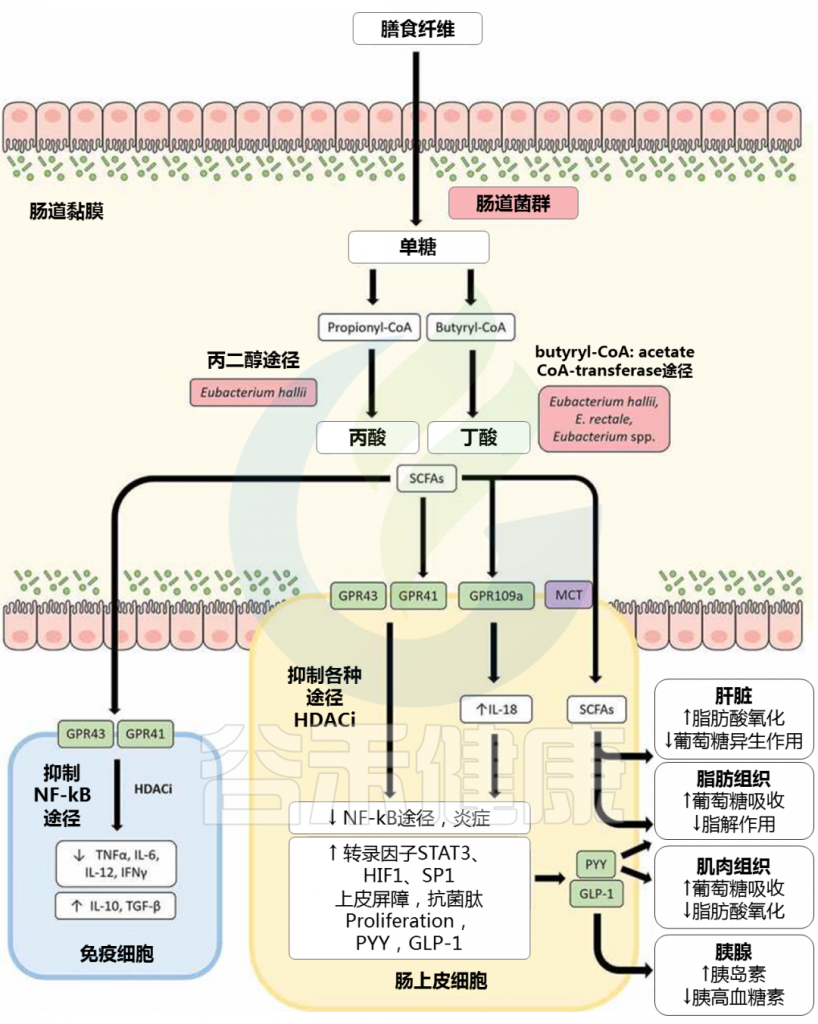

doi: 10.1080/19490976.2020.1802866
▸ 短链脂肪酸增加IL-18 的产生
短链脂肪酸在肠上皮细胞 (IECs) 中激活 GPR109a 也可以增加 IL-18 的产生,IL-18 是修复和维持肠上皮完整性的关键细胞因子。丙酸盐和丁酸盐对 HDAC 活性的抑制与 IEC 中促炎细胞因子和趋化因子(如 CXCL8 和 CCL20)的表达下调有关。
短链脂肪酸对 HDAC 的抑制也与 β-防御素和导管素(如 LL-37)的表达增加有关。鉴于如上所述,短链脂肪酸广泛参与调节肠道健康,尤其是丁酸盐,由于肠道中短链脂肪酸分布的改变,涉及短链脂肪酸生产者的肠道微生物群失调具有重大影响。
注:组蛋白去乙酰化酶(histone deacetylase,HDAC)是一类蛋白酶,对染色体的结构修饰和基因表达调控发挥着重要的作用。
炎症性肠病 (IBD) 是胃肠道的严重和慢性炎症,其特征在于两种主要的临床表型:克罗恩病 (CD) 和溃疡性结肠炎 (UC)。克罗恩病涉及上皮壁所有层的透壁炎症,而溃疡性结肠炎仅影响浅表粘膜层。
▸ IBD患者真杆菌属持续减少
一般来说,IBD 反复表现出肠道微生物群失调,其特征是微生物群的多样性和时间稳定性下降。虽然微生物干扰在 IBD 的发病机制或病因中的确切作用仍在阐明,但包括真杆菌属(Eubacterium)在内的丁酸盐生产者的比例在 IBD 受试者中肠道中的持续减少。
▸ IBD患者丁酸水平降低
事实上,与非 IBD、健康个体相比,IBD 患者中梭菌簇 IV 和 XIVa 的丰度减少以及伴随的致病变形杆菌增加构成了 IBD 微生物失调的特征,可以被视为生物标志物。因此,在患有 IBD 的患者中通常会观察到肠道丁酸水平降低,从而导致宿主免疫系统调节不当。IBD 和实验性结肠炎患者肠道中短链脂肪酸水平降低也与调节性 T 细胞功能降低和炎症增加相关。
▸ 真杆菌在IBD中提供了丁酸盐介导的保护作用
用溃疡性结肠炎和克罗恩病患者粪便微生物群的体外研究表明,丁酸盐产生者较少,定植能力和丁酸盐产生能力降低;用已知的丁酸盐产生菌(包括真细菌属)补充IBD微生物群可恢复丁酸盐的产生,并改善上皮屏障完整性和定植能力。
真杆菌的作用在接受抗 TNF-α 治疗的患有 IBD 的儿童中,进一步证明了肠道健康中的丁酸盐-抗炎轴;E. rectale基线丰度较高的患者对治疗更敏感,E. rectale(直肠真杆菌)的存在预示着炎症的成功减轻。
在体外和小鼠模型中已经证明了E. limosum(粘液真杆菌)及其产生的短链脂肪酸对肠道炎症的保护作用。当TNF-α处理刺激时,由E.limsum产生的短链脂肪酸诱导T84结肠细胞生长,并降低结肠细胞IL-6和TLR4的表达,其中丁酸盐是最显著的效应物。此外,与对照组相比,当提供5%的E. limosum时,小鼠在结肠炎诱导时显示出体重和结肠长度的显著保留。这些观察表明,真杆菌属对肠道健康具有丁酸盐介导的抗炎作用,并将其作为炎症性肠道疾病的一种有吸引力的生物治疗药物。
到目前为止,真杆菌属与肥胖的关系仍存在争议,有几份报告表明真杆菌属和肥胖呈正相关。BMI通常被认为是用来衡量肥胖的参数;一些基于BMI的研究也报告了肥胖受试者体内真杆菌的丰度更高。
▸ 为什么肥胖人群真杆菌的丰度更高?
有趣的是,据报道,在接受治疗的肥胖受试者中,粪便短链脂肪酸减少的肥胖个体中总丁酸水平较高,这表明碳水化合物和脂质的同化增强,这可能导致肥胖表型。这一观察结果可以解释肥胖个体中丁酸盐产生菌(包括真杆菌属)的丰度较高。
仔细观察饮食干预研究表明,肥胖受试者中真杆菌属和其他丁酸盐产生者的比例可能主要受饮食影响。在几项研究中,肥胖个体肠道微生物对复合碳水化合物的利用受到限制,一直有报道称真杆菌属的显著减少。
对印度肥胖和非肥胖儿童进行的一项研究没有发现各组间直肠大肠杆菌(Eubacterium rectale) 丰度的差异。
综合来看,目前的证据表明,当通过合理数量的复合碳水化合物的持续供应在肠道时,真杆菌属和其他丁酸盐产生菌在肥胖个体中的比例增加,从而促进肠道中的能量提取。肥胖个体的饮食而非改变的代谢参数也可能驱动丁酸盐产生菌(包括真杆菌属)的生长和增殖。
▸ 肠道微生物群调节肥胖的确切机制仍在阐明中
丁酸盐已被证明可以缓解饮食诱导的肥胖和改善葡萄糖稳态,这使得很难得出线性结论。在推断肠道菌群和肥胖之间的直接关联时必须谨慎,因为对于具有多因素影响的代谢综合征,任何的相关性结论可能会过于简单。我们在检测实践中也发现,菌群可能只能解释60%左右的肥胖,肥胖是一种多因素代谢综合征,还与菌群外的其他很多因素相关。
在几项研究中,真杆菌属和丁酸盐产生菌与胰岛素敏感性呈正相关。最近的独立研究比较了健康和2型糖尿病个体的宏基因组,明确表明肠道微生物群与2型糖尿病病理生理学之间的潜在相关性。
▸ 2型糖尿病患者真杆菌显著减少
一项在中国和欧洲人群中进行的研究均报告了2型糖尿病受试者中丁酸盐产生菌(包括真杆菌属)的显著减少。其他研究表明,在人和小鼠胰岛素抵抗模型中,丁酸盐生产商(包括从瘦个体移植的真杆菌属)具有恢复作用。
▸ 粪菌移植后真杆菌的增加,代谢改善
事实上,粪菌移植后真杆菌的增加与胰岛素抵抗个体的代谢改善相关。当向肥胖和胰岛素抵抗的db/db小鼠口服给药时,已表明E.hallii显著改善胰岛素敏感性和能量代谢。
▸ 2型糖尿病的代谢调节,与菌群代谢产物短链脂肪酸相关
短链脂肪酸对肠道激素的刺激和对食物摄入的抑制,是2型糖尿病个体肠道微生物群调节宿主代谢的可能机制。这种提出的机制与观察结果一致,即与FFAR2受体结合的丁酸盐和丙酸盐可以调节饱腹激素,例如生长素释放肽(促食欲肽)、胰高血糖素样肽-1(GLP-1)和PYY(促食欲肽) 。
短链脂肪酸对生长素释放肽和 GLP-1/PYY 的相反调节,其中 GLP_1/PYY 上调,生长素释放肽下调,确保减少食物摄入、饱腹感和减少肥胖。 Ghrelin,也与产生丁酸盐的E. rectale呈负相关。
注:Ghrelin,也被称为“饥饿激素”,刺激食欲,在饭前分泌,而 GLP-1 和 PYY 由肠内分泌 L 细胞合成和释放,刺激胰腺 β 细胞分泌胰岛素,减少食物摄入,使能量正常化摄入量和体重减轻。
▸ 直肠真杆菌高丰度与较低的餐后血糖反应呈正相关
一个大型队列(n=800)进行了一项基于机器学习的研究,以便使用从饮食习惯、肠道微生物群、人体测量、身体活动和血液参数中得出的综合特征数据集来预测个体的个性化餐后血糖反应,也支持真杆菌属在胰岛素敏感性中的肯定作用。在他们的研究中,肠道微生物组的72个特征被推断为具有预测性,其中直肠大肠杆菌(Eubacterium rectale)是最强大的特征之一,肠道中较高的细菌丰度与较低的餐后血糖反应呈正相关(n = 430)。
▸ 真杆菌产生的丁酸盐改善胰岛素敏感性和饱腹感
真杆菌产生的丁酸盐也可以通过HDAC(组蛋白去乙酰化酶)抑制介导的胰腺β细胞重编程来改善胰岛素敏感性和饱腹感,从而为2型糖尿病患者提供额外的益处。
▸ 真杆菌产生的短链脂肪酸有助于恢复炎症
据报道,2型糖尿病中存在低度炎症,其中炎症分子在胰岛素靶组织中上调,并导致胰岛素抵抗。例如,TLR4依赖性通过激活胰岛中的巨噬细胞和β细胞产生促炎细胞因子,导致β细胞的调节失调、功能受损和生存能力下降。由真杆菌产生的短链脂肪酸可通过上述机制有助于恢复生理炎症环境。2型糖尿病中其他肠道丁酸盐产生者的持续减少也加强了这种联系。因此,目前的观察结果一致表明,真杆菌属是缓解2型糖尿病的积极贡献者,应被视为一种潜在的治疗方法。
20世纪30年代首次报道了肠道细菌将胆固醇转化为粪甾醇(coprostanol),此后进行了几项研究,以确定能够将胆固醇转化成粪甾醇的细菌。许多已鉴定的微生物最终被归入真细菌属。
▸ 可降解胆固醇的真杆菌:
——Eubacterium coprostanoligenes HL
Eubacterium coprostanoligenes HL (ATCC 51222) 代表了一种这样的细菌,该菌是从生猪污水泻湖中分离出来的,并且由于其降低胆固醇的特性而受到相当大的关注。
尽管随后有报道称多氏拟杆菌 (Bacteroides dorei)、乳杆菌(Lactobacillus sp)和双歧杆菌(Bifidobacterium sp)具有胆固醇利用特性,但这些特性似乎是暂时性的,可能会丢失,从而使Eubacterium coprostanoligenes HL成为唯一可降解胆固醇的可培养肠道分离物。
▸ 肠道微生物群中E. coprostanoligenes 的存在与粪便粪甾醇密切相关
最近,在肠道宏基因组中发现了E. coprostanoligenes 的3β-羟基类固醇脱氢酶同系物,可将胆固醇转化为粪甾醇。
有趣的是,这些肠道甾醇代谢A基因(ismA)被归因于尚未培养的肠道微生物,它们与生命树中的真杆菌物种形成了一个连贯的分支,并可能代表了参与肠道胆固醇降低的新真细菌物种。
▸ Eubacterium coprostanoligenes的胆固醇代谢
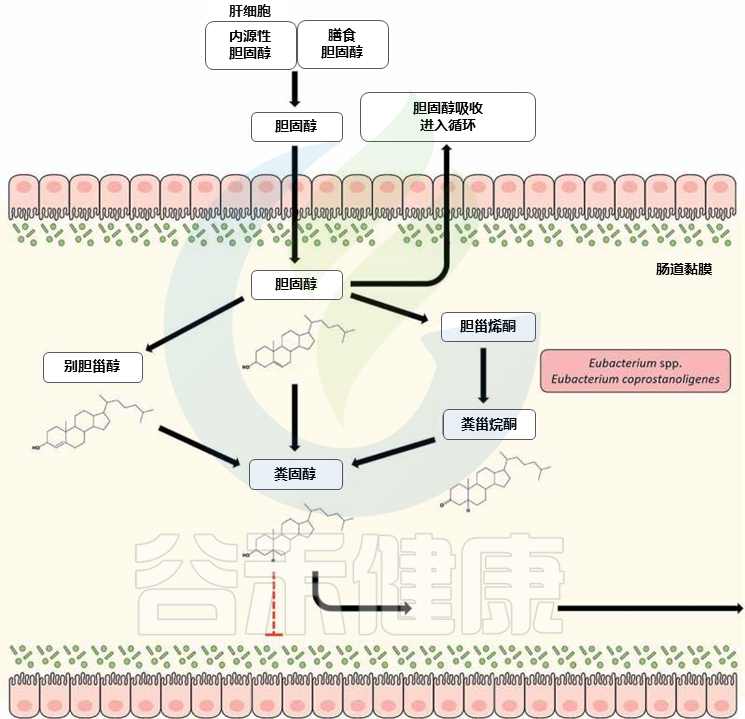
doi: 10.1080/19490976.2020.1802866
来自膳食和额外膳食来源的近1克胆固醇每天到达人体结肠,在那里由共生肠道细菌代谢为粪甾醇。与胆固醇不同,粪甾醇在肠道中吸收不良,并被认为对胆固醇代谢和血清胆固醇水平的调节有影响。
发现血浆胆固醇水平与粪便中胆固醇与粪甾醇的比例之间存在反比关系,这一观点得到了证实。因此,胆固醇向共甾醇的转化被认为是人类胆固醇稳态管理的新策略。作为一种延伸,研究了肠道内高度参与粪甾醇代谢的真杆菌属(Eubacterium spp)的降胆固醇作用。
▸ 动物实验发现E. coprostanoligenes降低胆固醇
据报道,喂食E. coprostanoligenes的高胆固醇血症兔子的血浆胆固醇水平降低,消化液中的粪甾醇/胆固醇比值增加。在这些兔子中观察到的效果进一步归因于E. coprostanoligenes降胆固醇,因为E. coprostanoligenes优先在空肠和回肠中定殖,这两个地方都是胆固醇吸收的场所。在无菌小鼠中也发现了类似的观察结果。
代谢组学和宏基因组学联合研究的其他结果已经确定了多种细菌门型,包括 Eubacterium eligens ATCC 27750 发光真杆菌ATCC 27750(p=1.477e-02)与高粪便粪便甾烷醇显着相关。
▸ 肠道菌群的变化与胆固醇转化速率直接相关,从而影响心血管疾病风险
动脉粥样硬化性心血管疾病 (CVD) 发展过程中的关键风险因素包括血液胆固醇水平失衡和血清低密度脂蛋白胆固醇浓度高。事实上,CVD 患者的肠道胆固醇吸收更高。值得注意的是,肠道微生物群的变化与胆固醇转化为粪前列醇的速率直接相关,而胆固醇转化为粪前列醇的效率高与 CVD 风险降低有关。
由于它们的降胆固醇作用,真杆菌属和其他降低胆固醇的微生物可以预防心血管疾病。
事实上,肠道真杆菌属在动脉粥样硬化受试者中,与已动脉粥样硬化标志物(如低密度脂蛋白、胆固醇和白细胞)呈显着负相关。当给小鼠喂食甲硫氨酸-胆碱饮食以诱发非酒精性脂肪性肝炎时,小鼠肠道中的Eubacterium coprostanoligenes 也减少了,其中对肝脏的损害会抑制内源性胆固醇的产生。
胆汁酸 (BA) 是宿主产生的代谢物,来源于肝脏周围肝细胞中的胆固醇。
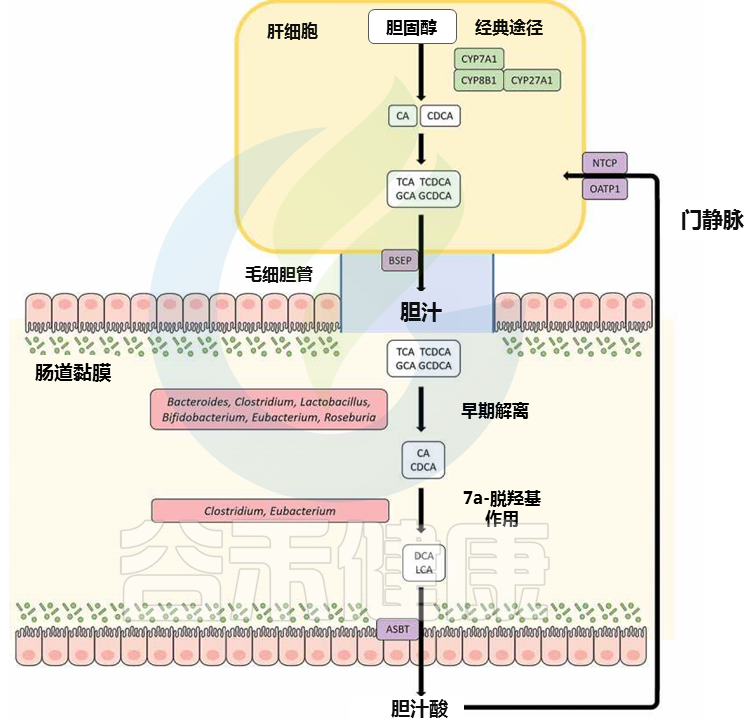
我们来了解一下肝肠循环。
胆酸 (CA) 和鹅去氧胆酸 (CDCA) 是肝脏中产生的主要 BA,然后与牛磺酸或甘氨酸结合,然后暂时储存在胆囊中;这些胆汁酸随后经过餐后分泌到达肠道。肠道中 95% 的总胆汁酸池被有效吸收并通过门静脉循环回肝脏,这个循环过程被称为肠肝循环。其余的作为肠道细菌代谢的底物,构成胆固醇从体内排泄的关键途径。
胆汁酸可以以多种形式出现,包括初级胆汁酸、次级胆汁酸、共轭或非共轭。肠道微生物群的各种成员都能够转化胆汁酸,从而影响局部胆汁酸库的组成以及宿主生理学的其他各个方面。
有胆汁盐水解酶(BSH)酶的肠道微生物(包括真杆菌属)能够水解共轭胆汁酸中的C-24 N-酰基酰胺键,以释放甘氨酸/牛磺酸部分。
真杆菌对胆汁酸的修饰与肠肝循环
doi: 10.1080/19490976.2020.1802866
▸ 真杆菌参与人体代谢,通过影响胆汁酸的溶解率,影响胆固醇水平
事实上,真杆菌属与其他属(如Roseburia和Clostridium)一起构成了肠道中胆汁盐水解酶的主要储存库。解偶联使BAs的pKa增加到约5,从而使其不易溶解,这反过来导致胆固醇从头合成所损失的胆汁酸的吸收和补充效率低下。
▸ 调节胆汁盐水解酶活性来调节宿主的体重增加和胆固醇水平
胆汁盐水解酶活性广泛分布于肠道微生物群中,因此可以通过调节胆汁盐水解酶活性来调节宿主的体重增加和胆固醇水平。解偶联还通过产生的游离胆汁酸重新捕获和输出共转运的质子,从而帮助胆汁解毒,从而抵消 pH 值。
▸ 肠道细菌转化胆汁酸的方式:生成异胆汁盐
肠道细菌转化胆汁酸的另一种方式是通过C3、C7和C12位羟基的氧化和差向异构化,从而生成异胆汁盐(β-羟基)。
聚合涉及从α构型到β构型的可逆立体化学变化,反之亦然,生成稳定的氧代胆汁酸中间体。这一过程由α-和β-羟基类固醇脱氢酶(HSDHs)催化,可以由含有两种酶的单个细菌物种进行,也可以通过两种物种之间的原合作进行,每个物种贡献一种酶。据报道,包括真杆菌在内的几个物种具有HSDH活性。
▸ 肠道中胆汁酸的细菌转化,真杆菌能够进行
肠道中的细菌 7α-脱羟基酶将初级胆汁酸、CA 和 CDCA 分别转化为脱氧胆酸 (DCA) 和石胆酸 。尽管从数量上讲,7α-羟基化代表了肠道中胆汁酸最重要的细菌转化,但据报道只有少数肠道微生物群的不同成员,如真杆菌和梭菌XIVa 簇能够进行这种反应。
▸ 真杆菌:催化初级胆汁酸7α-脱氢化,对肠道健康有重要影响
对真杆菌菌株 VPI 12708 的研究已经鉴定出由胆汁酸诱导型 ( bai ) 操纵子编码的酶,该操纵子催化初级胆汁酸7α-脱氢化的多步途径。
脱氧胆酸DCA 和 石胆酸LCA 通过真细菌对初级胆汁酸的 7α-脱氢化作用产生属 可对主要通过胆汁酸信号受体表现出来的肠道健康和体内平衡产生重大影响。DCA 和 LCA 都是核激素受体法尼醇 X 受体 (FXR) 的高亲和力配体;DCA 或 LCA 激活肠道 FXR 会上调成纤维细胞生长因子 19 (FGF19) 的表达,后者又与肝成纤维细胞生长因子受体 4 (FGFR4) 结合,随后下调肝细胞中胆汁酸的合成。
胆汁酸诱导的信号通路影响胆汁酸稳态和炎症
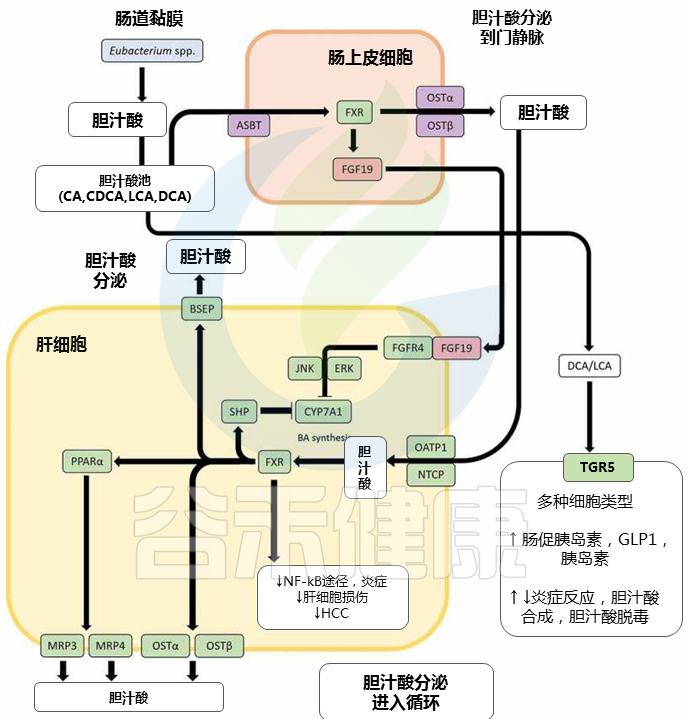
doi: 10.1080/19490976.2020.1802866
▸ FXR促进抗炎特性,有助于控制病原体
主要是通过抑制 NF-κB 通路和胆汁酸解毒,通过调节增殖物激活受体 α (PPARα)。据报道,FXR 激活可诱导抗菌肽的表达,从而有助于控制病原体。
▸ TGR5刺激GLP-1和胰岛素分泌,调节炎症反应
TGR5是一种在与胆汁酸相互作用后激活各种细胞内通路的 GPCR,它也以胆汁酸池中最高的亲和力结合 LCA 和 DCA。一旦被激活,TGR5 会刺激肠促胰岛素激素 GLP-1 和胰岛素的分泌,从而促进能量消耗。
此外,TGR5 可以调节炎症反应,这在本质上可以是促炎或抗炎的;BA-TGR5 信号在肠道促炎细胞因子和抗炎细胞因子的复杂平衡中起着关键作用。
LCA 和 DCA 还与孕烷 X 受体 (PXR)、维生素 D 3受体 (VDR) 和组成型雄激素受体 (CAR) 结合,以不同方式影响胆汁酸稳态和胆汁酸解毒。
生产LCA和DCA的真杆菌属是TGR5的高亲和力配体。
胆汁酸信号受体对微生物群诱导的次生胆汁酸的强亲和力,突出了包括真菌属在内的肠道菌群如何通过胆汁酸信号调节胆汁酸稳态、胆汁酸解毒、控制和维持肠道细菌生长、炎症和血糖反应。
▸ 高脂饮食过度刺激->次级胆汁酸的产生↑->促炎
受饮食和其他因素调节的肠道微生物群可导致特定的胆汁酸分布,进而产生重要后果。高脂肪饮食(HFD)(如西方饮食)过度刺激胆汁酸向肠道的排放,导致肠道微生物群失调,并增加次级胆汁酸的产生,特别是LCA和DCA。
DCA和LCA是胆汁酸池中最疏水的,升高的水平可能具有细胞毒性;DCA和LCA产生的有害影响可通过对DNA的氧化损伤、引发促炎反应和增加细胞增殖来破坏结肠上皮的结构和功能。
▸ LCA/DCA的增加间接与真杆菌相关
在喂食高脂肪饮食的小鼠中,LCA/DCA的增加与梭状芽孢杆菌(一种来自XI梭状芽胞杆菌簇的细菌)丰度的增加相关。令人惊讶的是,据报道,真杆菌属的梭状芽孢杆菌簇XIVa是次要的贡献者,尽管它们表现出7-α羟基化性质。
如上所述,这种观察结果与真细菌属一致,真细菌属受到高脂肪饮食(HFDs)的负调节。
高脂饮食引起的肠内继发胆汁酸的重吸收增加,随后转运至肝脏,导致肝脏炎症。由于炎症增加导致FXR信号减少,导致肝胆汁酸转运蛋白功能降低,这会导致持续的肝脏炎症,最终导致肝细胞癌。
肝脏疾病(如肝细胞癌、脂肪酸肝病(FLD)、纤维化和肝硬化)中的生物失调还表现为需氧、促炎、富含BSH的细菌(如肠杆菌和肠球菌)的增加,这也导致继发胆汁酸的产生增加。
▸ 肝病患者粪便真杆菌比例较低
事实上,在非酒精性脂肪肝(NAFLD)患者中,粪便中的初级和次级胆汁酸之间的比率以及血清中结合和非结合胆汁酸的水平更高,而真细菌在肝脏疾病中的比例始终较低。与健康个体相比,患有纤维化和肝硬化的受试者的肠道微生物组真细菌种类(如E. rectale, E. hallii 和 E. eligens )显著减少。
肠道微生物群产生的二级胆汁酸也可能在结直肠癌(CRC)的发展和建立中发挥关键作用。
▸ 结直肠癌患者中真杆菌属显著减少
如上所述,丁酸盐抑制结直肠癌的发生,并且在结直肠癌患者中通常观察到包括真杆菌在内的肠道中产丁酸盐菌的显著减少。几种丁酸盐生产者,包括属于梭状芽胞杆菌簇 XIVa 的真杆菌属,可以通过初级胆汁酸(BA) 的 7-α 羟基化额外产生次级 BA。
据报道,在患有肠道慢性炎症的 IBD 受试者中,二级 BA 水平显着降低,同时粪便结合 BA 增加,梭菌簇 XIVa 显着减少。
次级 BA 水平的降低导致次级 BA 对肠上皮细胞的抗炎作用丧失,从而加剧慢性炎症。尽管 IBD 中丁酸盐生产者和二级 BA 生产者的损失是分开进行的,但这两个群体有很大的重叠,并且都在肠道慢性炎症中被耗尽。
▸ 炎症性肠病患者中真杆菌属显著减少
事实上,最近对肠道宏基因组的生物信息学分析显示,IBD患者中丁酸盐产生者F.prausnitzii和E.rectale的数量显著减少。可以理解的是,这组丁酸和次级胆汁酸产生细菌(包括真杆菌属)的缺失促进了IBD的发展,并可能最终发展为结直肠癌,因为在那里观察到类似的肠道微生物群。
实际上,胆汁酸分布和/或肠道微生物群的调节正被作为肝癌和结直肠癌的新治疗方法。
▸真杆菌改善自闭症儿童症状和肠道问题
我国陆军军医大学的专家,去年在《Frontiers in Cellular and Infection Microbiology》上发表了研究报告,指出真杆菌是通过肠道菌群调整,改善自闭症患儿症状,及肠道问题的重要关键菌群。而且该研究验证了特定细菌,即真杆菌特别是其中的产粪甾醇真杆菌(Eubacterium coprostanoligenes)丰度变化,可以改善患自闭症患儿症状和多种肠道问题,也让调整肠道菌群成为治疗自闭症的新手段。
▸真杆菌可能避免患上痴呆症
来自日本东京工业大学的 Takuji Yamada 团队通过粪便 16S rRNA 基因测序比较了健康、轻度认知功能障碍(Mild cognitive impairment,MCI)和阿尔茨海默病组的肠道微生物组成,发现肠道关键菌株——普拉梭菌 Faecalibacterium prausnitzii(F. prausnitzii)具有保护人避免患上痴呆症的作用,此外,真杆菌属在两组之间也是存在显著差异,普拉梭菌和真杆菌都是产丁酸重要的肠道核心菌,可以推断真杆菌属可能也具有保护人避免患上痴呆症的作用。
▸重度抑郁症的真杆菌水平较低
来自中国和美国三个不同机构的的一组研究人员,最近在《Science Advances》上发表了一项研究,指出了人类肠道微生物组紊乱与重度抑郁症(MDD)之间的联系。研究人员从156名重度抑郁症患者和155名没有重度抑郁症的人中,收集了311份粪便样本进行基因分析,发现重度抑郁症患者的粪便样本中,出现了高水平的拟杆菌属 和较低水平的真杆菌和布氏杆菌(Blautia)。这意味着,重度抑郁症患者可能具有独特的肠道微生物特征,其中真杆菌是重要的菌群特征菌。
常驻微生物群对肠道中特定化合物的代谢转化对人类健康至关重要。人体无法解毒或分解的物质可能会进入肠道,从而导致毒性作用。
真杆菌属已被证明能够在肠道中进行重要的代谢转化,对人类健康产生积极影响,包括将有毒化合物解毒为更良性的形式。
▸E.hallii 将致癌物转化为不可用形式
最近报道了E.hallii的多种有益转化。E.hallii非常擅长将高度丰富的食物衍生杂环芳香胺致癌物2-氨基-1-甲基-6-苯基咪唑并(4,5-b)吡啶(PhIP)转化为生物学上不可用的形式7-羟基-5-甲基-3-苯基-6,7,8,9-四氢吡啶并[3′,2′:4,5]咪唑并[1,2-α]嘧啶-5-鎓氯化物(PhIP-M1)。
▸E.hallii 转化后的显示其作为保护剂的潜力
此外,在模拟的近端和远端结肠菌群存在的情况下,E.hallii的PhIP转化导致其丰度分别增加300倍和120倍,表明其作为保护剂的巨大潜力。
在同一项研究中,还观察到E.hallii能够将甘油代谢为3-羟基丙醛(3-HPA),其在水溶液中以罗伊氏菌素(Reuterin)的形式存在。有趣的是,罗伊氏菌素已被证明对革兰氏阳性和革兰氏阴性细菌、真菌和酵母具有抑制作用,可能通过调节细胞内谷胱甘肽增加氧化应激,从而使其成为治疗的一个有吸引力的靶点。
注:Reuterin是罗伊氏乳杆菌代谢甘油产生的一种特有广谱抗菌物质,它是一种复杂混合物,主成分为3-羟基丙醛,对多种病原微生物均有较强的抑制作用,在生物防腐方面极具潜力
除了生产短链脂肪酸,需要进一步的研究来真正开发真细菌属所能提供的所有潜在益处。
老年肌少症(Sarcopenia)是以肌肉量减少、肌力下降和肌肉功能减退为特征的增龄性疾病。研究表明肠道微生物可以通过参与宿主体内的多条代谢通路来影响宿主肌肉量与肌肉功能。
北京协和医院共招募87名受试者,包括11名肌少症患者、16名可能肌少症(Possible Sarcopenia)患者和60名健康对照受试者发现毛螺菌属(Lachnospira)、真杆菌属和瘤胃球菌属(Ruminococcus)与握力具有显著正相关性(P < 0.05),罗氏菌属(Roseburia)、真杆菌属(Eubacterium)和蓝绿藻菌属(Lachnoclostridium)与五次起坐时间具有显著负相关性(P< 0.01),结果提示这些菌属的降低与肌肉量的减少和功能的降低存在相关性。
Eubacterium
真杆菌属(Eubacterium)是一组系统发育多样的微生物,这一事实使得相关的分类学分配具有挑战性。
但是,该属的许多现任和前任成员都表现出与肠道健康密切相关,并且作为主要的丁酸盐生产者和核心肠道微生物群组成部分,非常重要。
真杆菌在调节炎症、调节免疫反应、维持肠道屏障完整性、调节血糖反应和胆固醇稳态等方面发挥重要作用。在几种临床条件下与有益效果的强相关性促使人们对该属产生了进一步的兴趣,多个物种被考虑作为下一代益生菌/生物治疗剂进行商业尝试。
最值得注意的是,目前国际上已正在创建含有E. hallii菌株的口服制剂作为生物治疗药物,以降低患有代谢综合征的个体的胰岛素抵抗并预防2型糖尿病的发展。
但是,应该警惕的是,我们对所有相关物种的肠道微生物群在多大程度上影响临床状况以及反之亦然的理解仍然有限。可能需要对严格控制的饮食方案进行纵向研究,在长时间内评估肠道微生物群和相关健康参数,谷禾也在积极推进这样的研究合作,以阐明此类因果关系。
关于真杆菌属的体外和体内表征,需要在基因组、代谢组以及最终在生态水平上进行研究。这将使我们能够更好地了解相对未被充分研究的真杆菌属与肠道微生物组的其他成员相互作用(这也是我们非常看重的),比如它们与其他潜在的下一代健康促进微生物(如Akkermansia muciniphila和F. prausnitzii)分离和组合,以确保其在循证肠道治疗中的有效实践(这也是我们非常看重的)。
主要参考文献
Mukherjee A, Lordan C, Ross RP, Cotter PD. Gut microbes from the phylogenetically diverse genus Eubacterium and their various contributions to gut health. Gut Microbes. 2020 Nov 9;12(1):1802866. doi: 10.1080/19490976.2020.1802866. PMID: 32835590; PMCID: PMC7524325.
Gomes AC, Hoffmann C, Mota JF. The human gut microbiota: Metabolism and perspective in obesity. Gut Microbes. 2018 Jul 4;9(4):308-325. doi: 10.1080/19490976.2018.1465157. Epub 2018 May 24. PMID: 29667480; PMCID: PMC6219651.
akansson A, Molin G. Gut microbiota and inflammation. Nutrients. 2011 Jun;3(6):637-82. doi: 10.3390/nu3060637. Epub 2011 Jun 3. PMID: 22254115; PMCID: PMC3257638.
Wing Sun Faith Chung, Marjolein Meijerink, Birgitte Zeuner, Jesper Holck, Petra Louis, Anne S. Meyer, Jerry M. Wells, Harry J. Flint, Sylvia H. Duncan, Prebiotic potential of pectin and pectic oligosaccharides to promote anti-inflammatory commensal bacteria in the human colon, FEMS Microbiology Ecology, Volume 93, Issue 11, November 2017, fix127,
Mukherjee A, Lordan C, Ross P & Paul D. Cotter. Gut microbes from the phylogenetically diverse genus Eubacterium and their various contributions to gut health, Gut Microbes, 12:1.
Chung W S F, Meijerink M, Zeuner B, Holck J, Louis P, Meyer A S, Wells J M, Flint H J, Duncan S H. Prebiotic potential of pectin and pectic oligosaccharides to promote anti-inflammatory commensal bacteria in the human colon, FEMS Microbiology Ecology, Volume 93, Issue 11, November 2017, fix127,
Chung WSF, Meijerink M, Zeuner B, Holck J, Louis P, Meyer AS, Wells JM, Flint HJ, Duncan SH. Prebiotic potential of pectin and pectic oligosaccharides to promote anti-inflammatory commensal bacteria in the human colon. FEMS Microbiol Ecol. 2017 Nov 1;93(11).
Peñaloza HF, Noguera LP, Riedel CA and Bueno SM. Expanding the Current Knowledge About the Role of Interleukin-10 to Major Concerning Bacteria. Front. Microbiol. 9:2047.
Iyer SS, Cheng G. Role of interleukin 10 transcriptional regulation in inflammation and autoimmune disease. Crit Rev Immunol. 2012;32(1):23-63.
Nauli A M and Matin S. Why Do Men Accumulate Abdominal Visceral Fat? Front. Physiol. 10:1486. December 2021.
Nie X, Chen J, Ma X, Ni Y, Shen Y, Yu H, Panagiotou G, Bao Y. A metagenome-wide association study of gut microbiome and visceral fat accumulation. Comput Struct Biotechnol J. 2020 Sep 20;18:2596-2609.

谷禾健康

巨单胞菌属(Megamonas)
巨单胞菌属(Megamonas),厚壁菌门,梭状芽孢杆菌目的革兰氏阴性菌,发酵各种碳水化合物,终产物是乙酸、丙酸和乳酸。分离于人、动物和家禽的肠道。
巨单胞菌作为肠道核心种,可能是亚洲人种的特征。与炎症性肠病、结直肠癌、强制性脊柱炎(AS)、自闭症谱系障碍(ASD)、肥胖等疾病密切相关。
巨单胞菌属(Megamonas)革兰氏阴性,专性厌氧,嗜中温,亲糖,不产芽孢,杆状,不产芽孢,不运动。分离于人、动物和家禽的肠道。

doi.org/10.1099/ijs.0.65456-0
基于比较16S rRNA基因测序的系统发育分析表明,该菌种与“氨基酸球菌科(Acidaminococcaceae)” 的菌种聚为一类,故有研究者认为巨单胞菌属应归入厚壁菌门( Firmicutes )、巨单胞菌属的谱系中。
化能有机营养,发酵各种碳水化合物,终产物是乙酸、丙酸和乳酸。
属内成员有三个种:
Megamonas hypermegas(趋巨巨单胞菌)
Megamonas funiformis(单形巨单胞菌)
Megamonas rupellensis
此属的模式种为趋巨巨单胞菌 ( Megamonas hypermegale )。
目前该类型菌株M. funiformis JCM 14723、M. funiformis菌株1CBH44的完整基因组已被报道,从健康日本男性的人类粪便中分离出来。
Megamonas rupellensis sp. nov,一种从鸭子的盲肠中分离出来的厌氧菌。
结直肠癌
宏基因组和代谢组学揭示早期结直肠癌患者的肠道微生物群特征,对616名参与者进行了粪便宏基因组和代谢组学研究。在代谢组学研究中,他们发现:
在19.2%的患者(616名中的118名)中,巨单胞菌属(Megamonas)数量非常丰富。但在以往欧美受试者的肠道微生物群研究中,巨单胞菌没有被报道为优势属,只在中国个体的研究中发现,这表明该属可能是亚洲人群的特征;但在另外一篇研究中表明,炎症性肠病患者巨单胞菌属度显著降低。
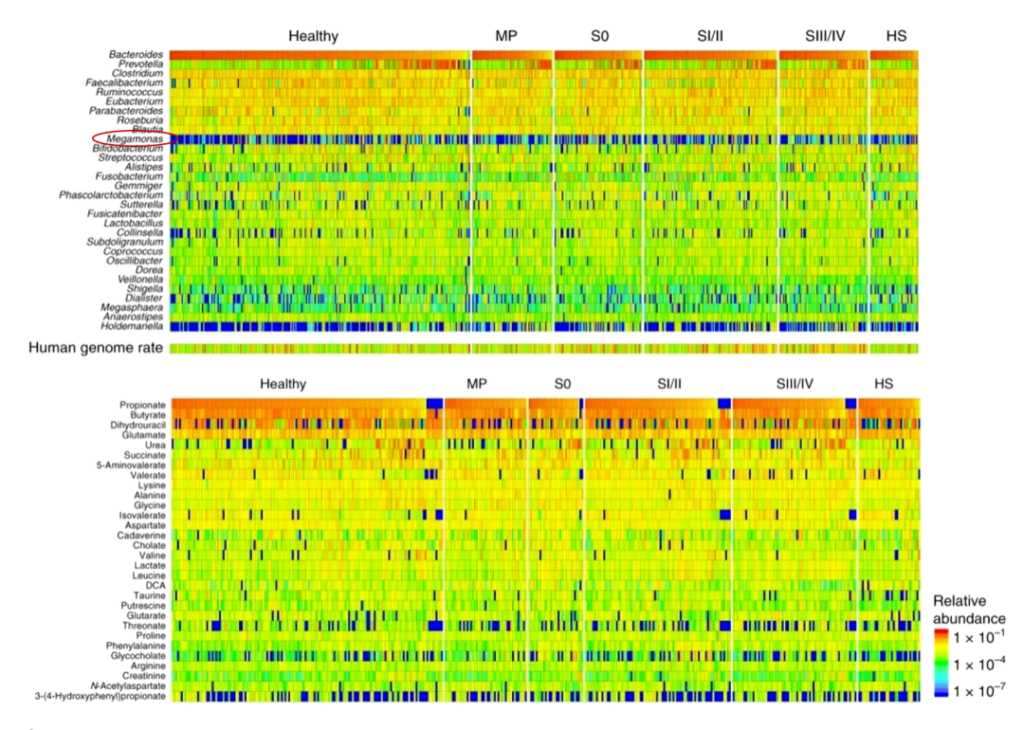
Yachida S, et al., Nat Med. 2019
Megamonas funiformis 可以作为区分胆囊切除术后病人与普通人的生物指标。其丰度与胆囊切除术后结直肠癌的发展有关。
没有癌前期病变或结直肠癌的胆囊切除术后病人比起有癌前期病变或结直肠癌的胆囊切除术后病人其Megamonas. funiformis丰度更高。
此外,研究发现巨单胞菌属(Megamonas)相对丰度与结直肠息肉发病风险增大呈负相关。
Ren, X et al., Frontiers in oncology. 2020
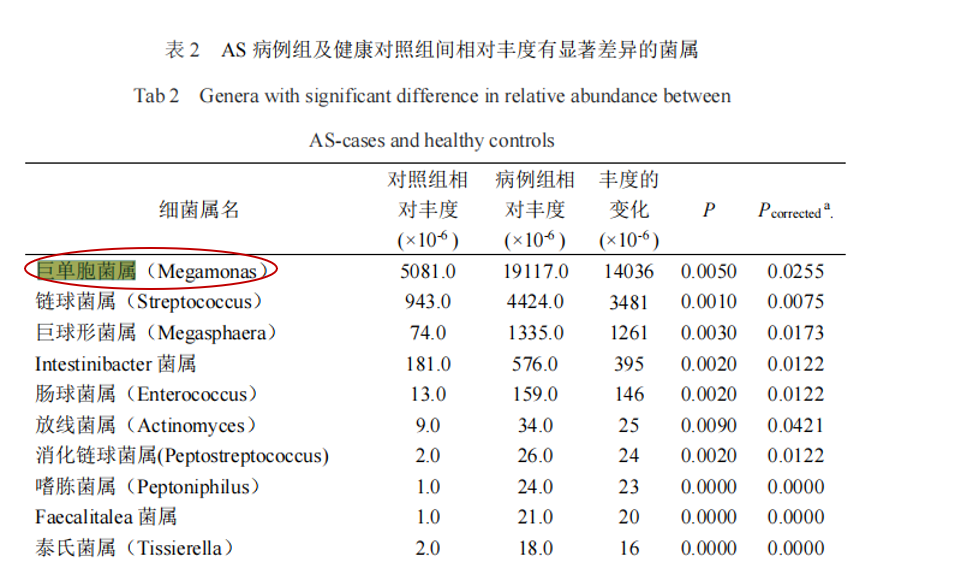
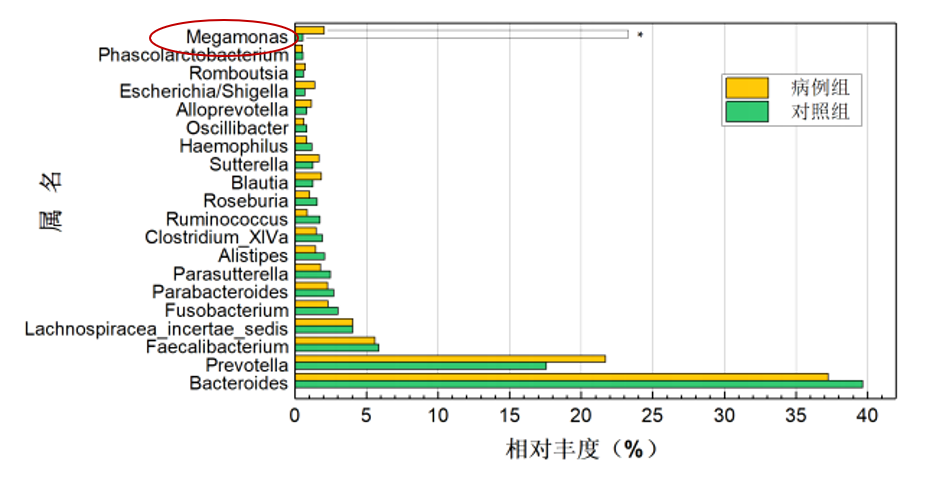
强制性脊柱炎(AS)
研究共纳入207名研究对象(包括103名AS患者和104名健康对照),结果显示巨单胞菌属(Megamonas)和链球菌属(Streptococcus)是强直性脊柱炎组中相对丰度增幅最大的2个属,通过聚类分析发现,巨单胞菌属的相对丰度在 AS、溃疡性结肠炎(ulcerative colitis,UC)、RA 及银屑病等病种组间的欧氏距离较近,而与Ⅱ型糖尿病及腺瘤较远。
蒋光明,安徽医科大学,2021
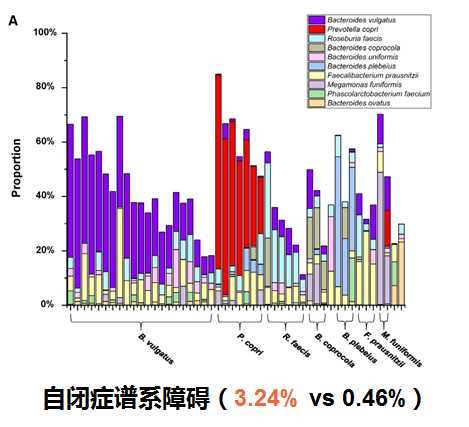
自闭症谱系障碍(ASD)
肠道微生物群的改变可能会影响自闭症谱系障碍(ASD),患者中可能出现胃肠道(GI)生态失调。研究发现在自闭症儿童粪便中Megamonas丰度显著高于健康儿童。同时在矮身材儿童组的Megamonas丰度显著高于健康组,表明维持一定丰度在巨单胞菌属在儿童神经和体格生长发育方面的重要作用。

Zou R, et al., Autism Res. 2020
注意缺陷/多动障碍 (ADHD)
注意缺陷/多动障碍(ADHD)是一种神经发育障碍,其特征在于持续存在注意力不集中、多动和冲动的症状,导致个体生活两个或更多区域的功能(ADHD)组在属水平上显示出较高水平的Dialister和Megamonas以及较低的Anaerotaenia 和 Gracilibacter 丰度。
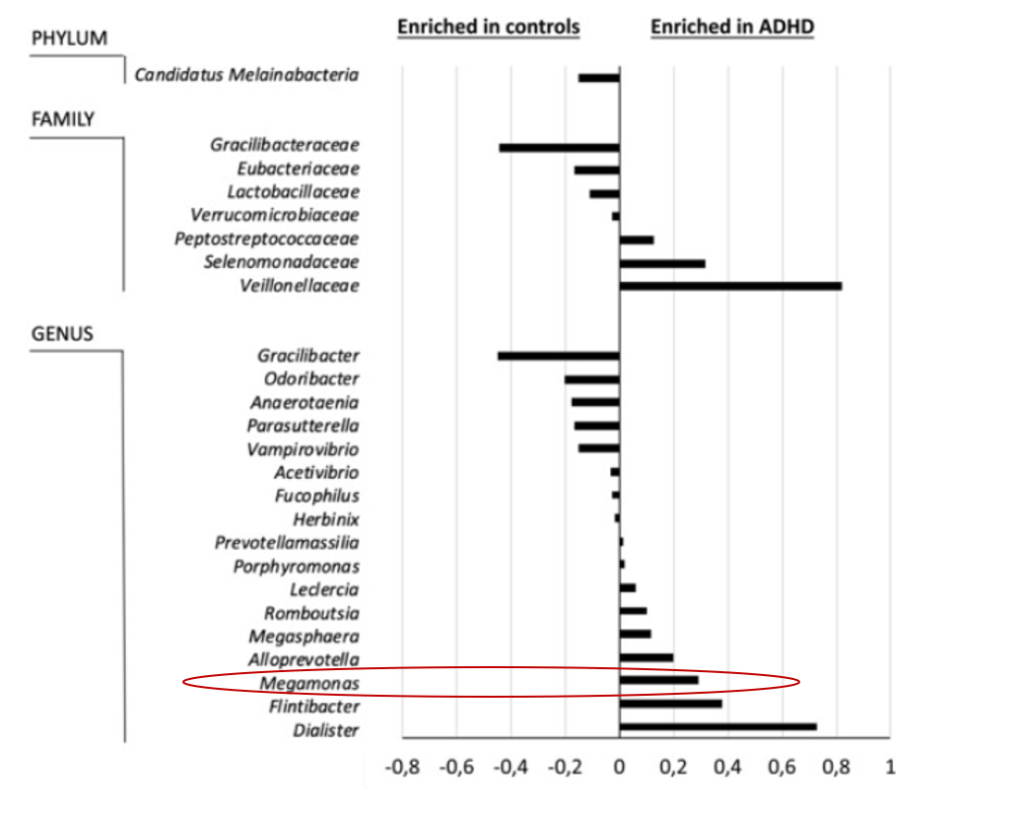
Richarte V, et al., Transl Psychiatry. 2021
注意缺陷多动障碍患者巨单胞菌丰度提高。同时作者还指出巨单胞菌可作为区分多动症患者与正常人的指标之一。
肥胖
研究发现在肥胖和对照受试者之间微生物群的显着差异。肥胖组的Prevotella、巨型单胞菌(Megamonas)、梭杆菌属和Blautia显著增加。
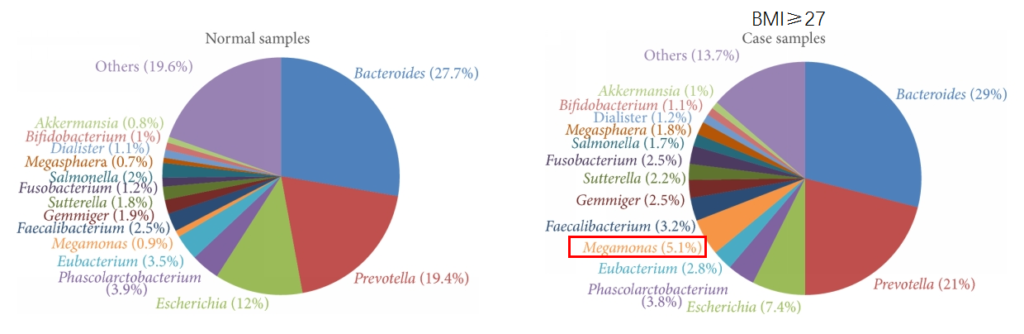
Chiu, C.M., et al., BioMed research international, 2014
另外一项研究表明体重降低或营养不良与巨单胞菌丰度减少有关联。巨单胞菌的丰度与体重减轻率呈负相关,Megamonas的丰度与肥胖犬减重的速度呈负相关。
急性缺血性脑卒中(AIS)
急性脑卒中(AIS)是一类脑部血液供应障碍引起局部组织缺血缺氧性坏死、相应神经功能出现缺损的不可逆性损害的临床综合征。同健康组比较,AIS组患者肠道中巨单胞菌属相对丰度上调,大肠杆菌属相对丰度下调。
通过将健康组和AIS患者肠道中巨单胞菌属和大肠杆菌属相对丰度进行分析,发现二者相对丰度及比值对潜在AIS具有一定诊断效能,可作为潜在的AIS诊断指标。
抑郁
部分研究报道巨单胞菌属的丰度在抑郁症患者中增加。脑卒中后抑郁患者巨单胞菌属水平上均显著高于对照组。巨单胞菌属与精神分裂症阳性和阴性症状量表(PANSS)总分呈正相关。
但也有个别文献检测到其丰度在抑郁症患者中下降。实际变化需要进一步研究。
其他
在最近的一项研究中,根据16S rRNA测序结果,发现Megamonas、放线杆菌属、Dorea和Ruminococcus与男性血清睾酮浓度呈正相关。
在另一项关于肠道微生物群性别差异的研究中,发现Megamonas、Prevotella、梭杆菌属和Megasphaera在男性中比在女性中更丰富。前列腺特异性抗原(PSA)水平高(G3)组的Megamonas丰度低于中等PSA水平(G2)组;此外,观察到PSA水平与先前报道的其他属之间没有关联。暗示Megamonas在雄激素代谢中具有潜在积极作用。
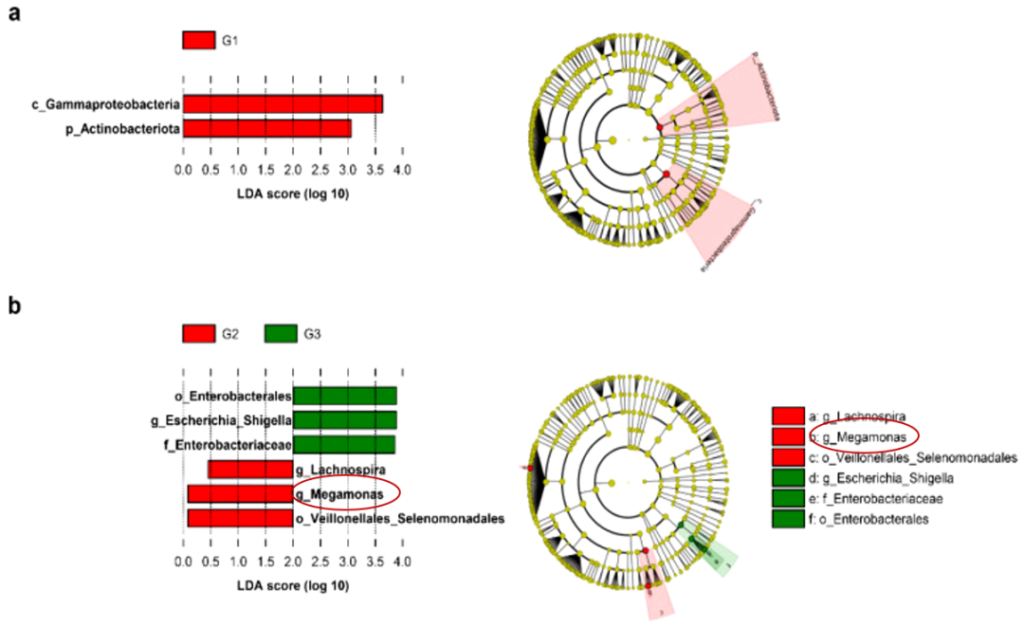
Kim HN, et al., J Pers Med. 2021
虚弱
虚弱是一种常见的老年综合征,主要根据症状进行诊断和分期。以确定这种综合征的微生物生物标志物收集了94名社区居住的老年人的血清和粪便样本,采用16SrRNA扩增子测序法测定粪便微生物群的粪便组成。
与对照组相比,来自虚弱组的粪便样本下列菌群具有较高的水平:
Akkermansia, Parabacteroides, Klebsiella
而共生属较低水平菌群如下:
Megamonas, Faecalibacterium, Prevotella, Roseburia, Blautia
推测其中Megamonas减少与老年人虚弱症状有关。
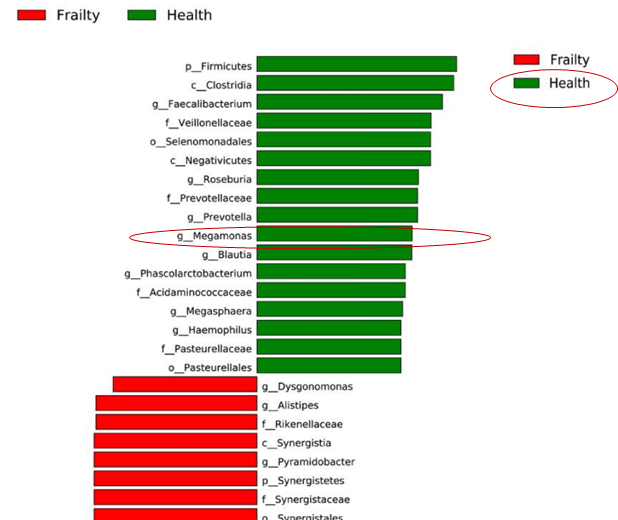
Xu Y, et al., Front Cell Infect Microbiol. 2021
炎症性肠病,白塞病,肝病等
IBD患者肠道中巨单胞菌属相对丰度显著降低。
与 正常个体相比,白塞病患者肠道中巨单胞菌物种的相对丰度显着降低。这可能与白塞病患者代谢物改变导致的 T 细胞畸变有关。
代偿期肝硬化患者巨单胞菌丰度下降。
老年血液透析(HD)患者巨单胞菌属减少。
血肌酐升高和血液透析可能影响肠道菌群的生存环境心力衰竭组与对照组相比,巨单胞菌属丰度降低。
▾ 该菌丰度较少相关:
动物脂肪摄入过多,肠道中产生短链脂肪酸(SCFAs) 的细菌(如Blautia、Megamonas)的丰度显着降低。
一项针对3500名加拿大儿童进行了从出生前直至青春期的持续追踪,其主要目标是为了发现过敏、哮喘、肥胖症及其它慢性疾病的根本原因。他们发现无论婴儿采用何种喂养方式(母乳喂养或配方奶喂养),直接补充维生素D滴剂的婴儿体内巨单胞菌属丰度都较低。
▴ 该菌丰度增加相关:
在体外发酵条件下,含牛肉蛋白和鸡肉蛋白组巨单胞菌属(Megamonas) 相对丰度显著增加,有益菌相对丰度增加。
饮食中豆类消费的高频率与Megamonas属呈正相关,但是目前该证据样本量太小,还需要进一步研究。
抗性淀粉(RS)在小肠中不能被酶解,大部分在结肠被肠道微生物发酵。研究显示玉米,马铃薯可以增加巨单胞菌属丰度。
岩藻糖基硫酸软骨素(fCS)是从海参中提取的一种独特的天然硫酸软骨素类似物,fCS-Sc显著增加了Megamonas(1.26倍)。
燕麦阿拉伯木聚糖 (AX) 刺激了鸭肠巨单胞菌和双歧杆菌的生长物种,其中巨单胞菌表现出最大的刺激。
在日粮中添加桑叶粉后,鸡肠道中的拟杆菌属、普氏菌和巨单胞菌属的相对丰度增加。
作为亚洲人肠道重要的菌属——巨单胞菌属,关于其与疾病的研究还处于开始阶段。部分数据能说明其与炎症性肠病、结直肠癌、强制性脊柱炎(AS)、肥胖、神经系统的相关性。但具体的因果关系与分子机制仍待研究,可能的研究方向有巨单胞菌的代谢产物短链脂肪酸在机体中的作用以及其与免疫反应互作反应。p.s. 本文感谢提供部分资料的各位同学。
主要参考文献:
Richarte V, Sánchez-Mora C, Corrales M, Fadeuilhe C, Vilar-Ribó L, Arribas L, Garcia E, Rosales-Ortiz SK, Arias-Vasquez A, Soler-Artigas M, Ribasés M, Ramos-Quiroga JA. Gut microbiota signature in treatment-naïve attention-deficit/hyperactivity disorder. Transl Psychiatry. 2021 Jul 8;11(1):382. doi: 10.1038/s41398-021-01504-6. PMID: 34238926; PMCID: PMC8266901.
Yachida S, Mizutani S, Shiroma H, Shiba S, Nakajima T, Sakamoto T, Watanabe H, Masuda K, Nishimoto Y, Kubo M, Hosoda F, Rokutan H, Matsumoto M, Takamaru H, Yamada M, Matsuda T, Iwasaki M, Yamaji T, Yachida T, Soga T, Kurokawa K, Toyoda A, Ogura Y, Hayashi T, Hatakeyama M, Nakagama H, Saito Y, Fukuda S, Shibata T, Yamada T. Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer. Nat Med. 2019 Jun;25(6):968-976. doi: 10.1038/s41591-019-0458-7. Epub 2019 Jun 6. PMID: 31171880.
Ren, X., Xu, J., Zhang, Y., Chen, G., Zhang, Y., Huang, Q., & Liu, Y. (2020). Bacterial Alterations in Post-Cholecystectomy Patients Are Associated With Colorectal Cancer. Frontiers in oncology, 10, 1418. https://doi.org/10.3389/fonc.2020.01418
Duan, M., Wang, Y., Zhang, Q., Zou, R., Guo, M., & Zheng, H. (2021). Characteristics of gut microbiota in people with obesity. PloS one, 16(8), e0255446.
Chiu, C. M., Huang, W. C., Weng, S. L., Tseng, H. C., Liang, C., Wang, W. C., Yang, T., Yang, T. L., Weng, C. T., Chang, T. H., & Huang, H. D. (2014). Systematic analysis of the association between gut flora and obesity through high-throughput sequencing and bioinformatics approaches. BioMed research international, 2014, 906168. https://doi.org/10.1155/2014/906168
Elizabeth P. Cato, Ella M. Barnes. Designation of the Neotype Strain of Bacteroides hypermegas Harrison and Hansen. https://doi.org/10.1099/00207713-26-4-494
Zou R, Xu F, Wang Y, Duan M, Guo M, Zhang Q, Zhao H, Zheng H. Changes in the Gut Microbiota of Children with Autism Spectrum Disorder. Autism Res. 2020 Sep;13(9):1614-1625. doi: 10.1002/aur.2358. Epub 2020 Aug 24. PMID: 32830918.
Morotomi M, Nagai F, Sakon H. Genus Megamonas should be placed in the lineage of Firmicutes; Clostridia; Clostridiales; ‘Acidaminococcaceae’; Megamonas. Int J Syst Evol Microbiol. 2007 Jul;57(Pt 7):1673-1674. doi: 10.1099/ijs.0.65150-0. PMID: 17625216.
Shimizu, J., Kubota, T., Takada, E., Takai, K., Fujiwara, N., Arimitsu, N., Ueda, Y., Wakisaka, S., Suzuki, T., & Suzuki, N. (2019). Relative abundance of Megamonas hypermegale and Butyrivibrio species decreased in the intestine and its possible association with the T cell aberration by metabolite alteration in patients with Behcet’s disease (210 characters). Clinical rheumatology, 38(5), 1437–1445. https://doi.org/10.1007/s10067-018-04419-8
Romain Chevrot, Arnaud Carlotti, Valérie Sopena, Pierre Marchand, Eric Rosenfeld. Megamonas rupellensis sp. nov., an anaerobe isolated from the caecum of a duck. https://doi.org/10.1099/ijs.0.2008/001297-0
Cheung, S. G., Goldenthal, A. R., Uhlemann, A. C., Mann, J. J., Miller, J. M., & Sublette, M. E. (2019). Systematic Review of Gut Microbiota and Major Depression. Frontiers in psychiatry, 10, 34. https://doi.org/10.3389/fpsyt.2019.00034
Kelly, J. R., Minuto, C., Cryan, J. F., Clarke, G., & Dinan, T. G. (2017). Cross Talk: The Microbiota and Neurodevelopmental Disorders. Frontiers in neuroscience, 11, 490.
Kim HN, Kim JH, Chang Y, Yang D, Kim HL, Ryu S. Gut Microbiota Composition across Normal Range Prostate-Specific Antigen Levels. J Pers Med. 2021 Dec 17;11(12):1381. doi: 10.3390/jpm11121381. PMID: 34945854; PMCID: PMC8703440.

谷禾健康
微生物群代表宿主肠道中存在的整个微生物群。肠道内细菌界的“贫富差距”非常大,和人类社会创造的大部分的财富都流向少部分人口的现实类似,只有少数几十种的细菌分布在近乎90%的人群中。换句话说,大部分细菌都只能在特定的环境中生存,只有少数细菌适应能力超强,这可能也是我们需要重点关注的对象。
如果把不同细菌品种看作互相竞争的国家,那么细菌界的“超级大国”就属拟杆菌门和厚壁菌门了。当然它们都不是单独某一种细菌,而是一大类细菌的统称。
然而近年来随着患有肠内外疾病的人群越来庞大,变形菌门也逐渐被关注和研究,变形菌门是含有最丰富细菌的门,麾下包括多种“著名的”病原菌,如大肠杆菌、幽门螺杆菌、克雷伯氏菌、沙门氏菌、志贺氏菌、绿脓杆菌、霍乱弧菌、空肠弯曲菌、鼠疫杆菌、脑膜炎双球菌、淋球菌等,让其备受关注。
事实上,越来越多的数据将变形菌确定为疾病的可能微生物特征。目前主要证据涉及代谢紊乱和炎症甚至癌症。然而,最近的研究表明,在哮喘和慢性阻塞性肺病等肺部疾病中也有作用,有些疾病中变形菌不受控制扩张导致疾病易感和发生。
变形菌(proteobacteria)是细菌中最大、种类最多的一个门,它们在系统发育、生态和致病方面具有广泛的重要性。所有变形菌都是革兰氏阴性菌,外膜主要由脂多糖组成。
图源:esacademic
变形菌门主要是由核糖体RNA序列定义的,名称取自希腊神话中能够变形的神普罗透斯(这同时也是变形菌门中变形杆菌属的名字),因为该门细菌具有极为多样的形状,代谢特征等。
△ 形状:杆状和球菌、弯曲的、螺旋状的、环状的、丝状的和带鞘的细菌都有。
△ 新陈代谢:新陈代谢类型也多种多样,一系列代谢特征包括化学自养(从无机化合物的氧化中获取能量)、化学有机营养(从有机化合物的氧化中获取能量)和光养(从光中获取能量)。
△ 氧气利用:从严格厌氧菌和严格需氧菌到兼性厌氧菌和微需氧菌株的都有,但是大多数变形菌门的成员是兼性厌氧菌。
△ 运动:许多使用鞭毛移动,但有些不能移动或依赖细菌滑动,而一些细菌是不运动的。
△ 生态分布:变形菌门的成员具有极大的可变形态和多才多艺的生理学,这使它们在各种生态位中生存具有竞争优势。已观察到变形菌在不同生境中无处不在。
Shin NR, et al., Trends Biotechnol. 2015
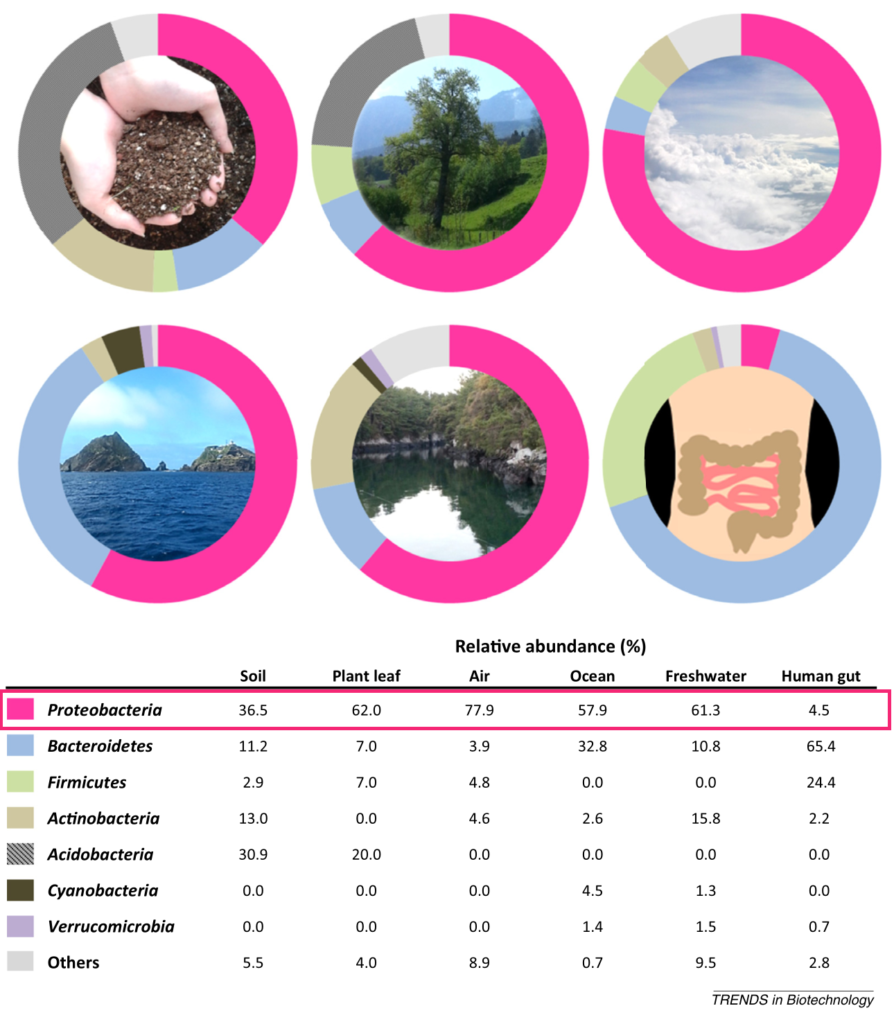
植物 、海水、淡水 ,空气,以及人和动物的身体部位,包括肠道、口腔、皮肤、阴道。尽管存在研究间差异,但健康人口腔微生物群的变形菌相对丰度最高(17.2-36.8%),其次是皮肤(6.8-30.0%)、胃肠道(2.5-4.6%)和阴道(2.3%)。
在系统发育学上,变形菌是根据小核糖体亚单位RNA基因(16S rRNA)的测序定义的。这是一个巨大的革兰氏阴性原核生物门,原线粒体起源于此。
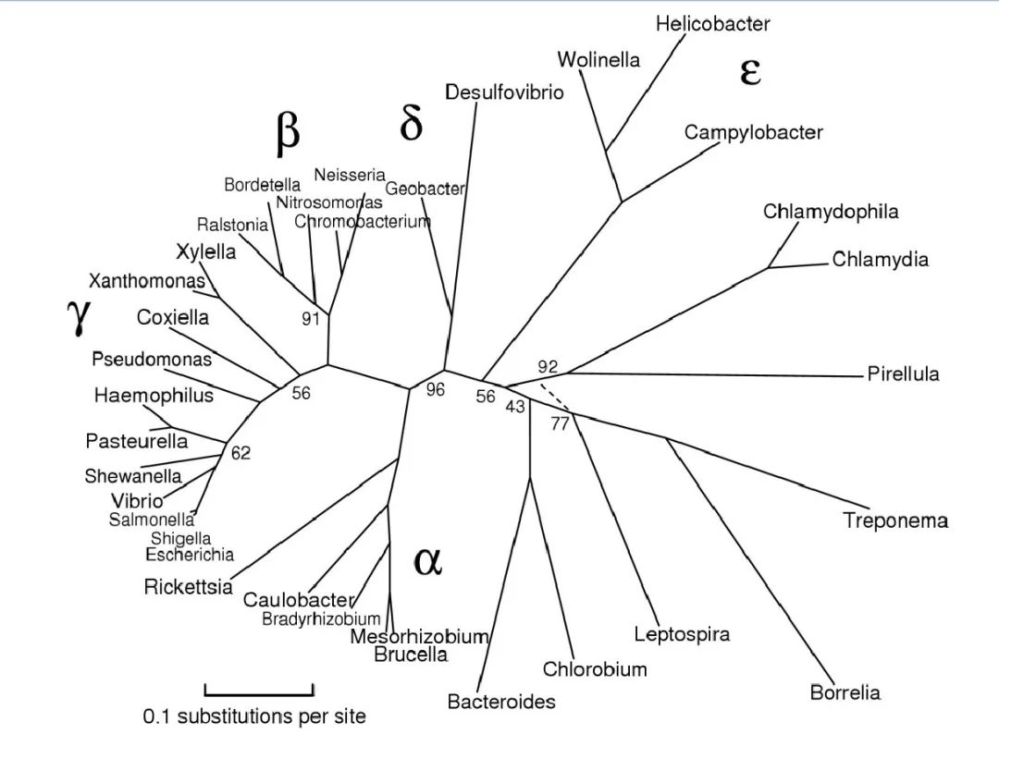
图片来源:Maria Lane,eportfolio
该门主要分为以下几大类:
最初,变形菌包括 α、β、γ 和 δ 四个亚类。ε变形菌 和 δ变形菌 通常被认为是最古老的变形菌群,因为它们包括利用硫化合物进行能量代谢的专性厌氧菌。
α变形菌(Alpha-proteobacteria)
第一类变形菌是α-变形菌。这一类的统一特征是它们是寡营养生物,能够生活在低营养环境中,如深海沉积物、冰川或深层地下土壤。同时α-变形菌是多样化的细菌分支之一,在生活方式、地理分布和基因组大小方面表现出极大的差异。
在 α-变形菌 中有两个重要分类群,衣原体和立克次体,它们是专性细胞内病原体,这意味着它们的部分生命周期必须发生宿主细胞内。由于它们无法合成自己的三磷酸腺苷 (ATP),因此,量需求依赖宿主于细胞。
立克次体属是人类很多严重疾病的病原体。例如,布鲁氏菌属、埃立克体属和立克次氏体。立克次氏杆菌会导致落基山斑疹热,这是一种威胁生命的脑膜炎(包裹大脑的膜发炎)。R. rickettsii 感染蜱,并可以通过被感染的蜱叮咬传播给人类。此外,布鲁氏菌科(Brucellaceae)和巴尔通氏菌科(Bartonellaceae)的细菌是人类病原体。
α-变形菌 还包括固氮细菌,例如固氮螺菌属和根瘤菌属。这两种细菌都使用一种称为固氮酶途径的复杂酶途径将大气中的氮 (N2) 转化为氨 (NH3)。此外,α变形菌还包括硝化细菌。这种类型的细菌将氨和铵 (NH4+) 还原为硝酸盐 (NO3–)。乙酸杆菌属和葡糖杆菌属的变形菌可用于生产乙酸。
β变形菌(Beta-proteobacteria)
与依靠最少量营养物质生存的 Alpha-proteobacteria 不同,Beta-proteobacteria 类是富营养生物,这意味着它们需要大量的有机营养物质。
Beta-proteobacteria 通常在需氧和厌氧区域之间生长(例如,在哺乳动物的肠道中)。一些属包括作为人类病原体的物种,能够引起严重的,甚至可能危及生命的疾病。例如,奈瑟球菌属包括淋病奈瑟菌( STI淋病的病原体)和脑膜炎奈瑟菌(细菌性脑膜炎的病原体)
β变形菌中的亚硝化单胞菌可以将亚硝酸盐还原为亚硝酸盐 (NO2–)。同时,硫杆菌属物种是将硫化氢 (H2S) 和元素硫氧化成硫酸盐 (SO42-) 的细菌,以及用于污水处理的菌胶团(Zoogloea)和Sphaerotilis 。
γ变形菌(Gamma-proteobacteria)
最多样化的革兰氏阴性细菌是γ-变形菌,它包括许多人类病原体。包括几个医学和科学上重要的细菌群,例如肠杆菌科、弧菌科和假单胞菌科。
此外,许多重要的病原体属于这一类,例如:
Richard B. Frankel
△ 铜绿假单胞菌
一个庞大而多样的科,假单胞菌科,包括假单胞菌属。铜绿假单胞菌在该属内,它是一种病原体,可以造成身体不同部位的各种感染。铜绿假单胞菌是一种严格需氧、不发酵、高度运动的细菌。
它通常可能造成伤口和烧伤感染,也可能是慢性尿路感染的原因,并且可能是囊性纤维化患者或机械呼吸机患者呼吸道感染的重要原因。
铜绿假单胞菌感染通常难以治疗,因为该细菌对许多抗生素具有抗性,并且具有形成生物膜的非凡能力。
△ 肠杆菌科
肠杆菌科是属于γ-变形菌 的一大类肠道细菌。它们是兼性厌氧菌,能够发酵碳水化合物。在这个家族中,微生物学家认识到两个不同的类别。
第一类,大肠杆菌,以其原型细菌种类大肠杆菌命名。大肠菌能够完全发酵乳糖(即产生酸和气体)。
第二类,非大肠杆菌,要么不能发酵乳糖,要么不能完全发酵(产生酸或气体,但两者不能同时产生)。
非大肠杆菌包括一些值得注意的人类病原体,例如沙门氏菌属,志贺氏菌,鼠疫耶尔森氏菌。
δ 变形菌(Delta-proteobacteria)
δ-变形菌(Delta-proteobacteria )包括基本好氧的形成子实体的粘细菌和严格厌氧的一些种类,如脱硫球菌属(Desulfococcus)、脱硫线菌属(Desulfonema)、硫酸盐还原菌(脱硫弧菌属(Desulfovibrio)、脱硫菌属(Desulfobacter)、和硫还原菌(如除硫单胞菌属Desulfuromonas),以及具有其它生理特征的厌氧细菌,如还原三价铁的Geobacter和互营菌属(Syntrophus)。
△ 蛭弧菌属:
δ-变形菌还包括蛭弧菌属,Bdellovibrio侵入宿主细菌的细胞,将自身定位在周质中,即质膜和细胞壁之间的空间,以宿主的蛋白质和多糖为食。这种感染对宿主细胞是致命的。
△粘细菌:
粘细菌(“粘液细菌”)是一组主要生活在土壤中并以不溶性有机物质为食的细菌。与其他细菌相比,粘细菌具有非常大的基因组,例如 9-1000 万个核苷酸。
Sorangium cellulosum 拥有最大的已知(截至 2008 年)细菌基因组,有 1300 万个核苷酸。
粘细菌产生许多在生物医学和工业上有用的化学品,例如抗生素。他们将这些化学物质输出到细胞外。
ε变形菌(Epsilon-proteobacteria )
ε-变形菌(Epsilon-proteobacteria) 是革兰氏阴性微需氧细菌(意味着它们在其环境中只需要少量氧气)。多数是弯曲或螺旋形的细菌,如沃林氏菌属(Wolinella)、螺杆菌属(Helicobacter)和弯曲菌属(Campylobacter)。它们都生活在动物或人的消化道中,为共生菌(沃林氏菌在牛中)或致病菌(螺杆菌在胃中或弯曲菌在十二指肠中)。
△ 弯曲杆菌:
变形菌门Epsilon-proteobacteria 中的两个临床相关属是弯曲杆菌属和螺杆菌属,它们都包括人类病原体。
弯曲杆菌可引起食物中毒,表现为严重的肠炎(小肠发炎)。这种由空肠弯曲杆菌引起的疾病在发达国家相当普遍,通常是因为食用了受污染的家禽产品。鸡通常携带空肠弯曲杆菌在胃肠道和粪便中,它们的肉在加工过程中可能会受到污染。
△螺杆菌:
螺杆菌是ε-变形菌的一个属,具有特征性的螺旋形状。它们最初被认为是弯曲杆菌属的成员,但自 1989 年以来,它们独立为自己的属。
螺杆菌属属于ε-变形菌,弯曲杆菌目,螺杆菌科,已经有超过 35 种。已经发现一些菌生活在上胃肠道的内壁,以及哺乳动物和一些鸟类的肝脏中。
该属中最广为人知的物种是幽门螺杆菌,它感染多达 50% 的人口。这种细菌的某些菌株对人类具有致病性,因为它与消化性溃疡、慢性胃炎、十二指肠炎和胃癌密切相关。它也作为该属的模式种。
幽门螺杆菌在胃的高酸性环境中存活的能力有些不同寻常。它产生脲酶和其他酶来改变其环境以降低其酸性。
幽门螺杆菌也有它存在的意义,可能抑制引起结核的细菌(结核分枝杆菌),预防哮喘,克罗恩病,食管反流,腹泻病以及食道癌。
❥ 识别微生物编码的基因,与特征相关联
栖息在哺乳动物肠道中的微生物编码了大量的蛋白质,这些蛋白质有助于广泛的生物功能,从调节免疫系统到参与新陈代谢。
我们从这些微生物中识别蛋白质编码基因并将基因水平与疾病、药物功效或副作用以及其他宿主特征相关联。
例如,与传统的高纤维农业饮食相关的人类肠道微生物群编码了参与纤维素和木聚糖水解的基因家族,而这些基因家族在吃典型西方饮食的人群(年龄匹配)中不存在。
一般编码适应肠道环境所必需的功能的微生物有很强的选择性,在不同宿主中具有大量冗余的基因库。然而,目前的研究和临床很容易忽略健康人类微生物组之间基因丰度的生理意义差异。
❥ 较少丰度的变形菌门,才是是跨宿主丰度变异性最大的基因的主要来源
人体肠道通常由拟杆菌门和厚壁菌门主宰,这些门内的进化枝(尤其是拟杆菌属、普氏菌属和瘤胃球菌科)是最常用于将个体聚集成“肠型”,因为它们解释了最多的分类变异。Bacteroidetes 与 Firmicutes 的比率也被推定为疾病或健康的潜在生物标志物。
有人提出,人类肠道微生物组中可能存在少量“肠型”,每一种都具有不同的分类组成。因此,虽然拟杆菌门和厚壁菌门可能对宿主之间的分类变异贡献最大,但变形菌门的丰度可能会捕获更多的功能变异。
与先前确定的肠型标记分类群相比,变形菌门的水平和可能的 Euryarchaeota 更好地解释了肠道微生物基因功能的人与人之间的差异。
在肠型研究中遗漏了这些不太丰富的门,可能是因为肠型是通过倾向于对高丰度分类群进行更多加权的方法鉴定的,并且肠型是从分类学而非功能数据中鉴定的。这对解释人类肠道微生物群的分类数据具有重要意义。
例如,变形菌门的过度生长与代谢综合征和炎症性肠病有关。通过 TLR5 敲除小鼠测试的肠道炎症关联到变形菌门(超过拟杆菌门和厚壁菌门),并且一些变形杆菌可以在这种背景下诱发结肠炎,可能导致反馈循环。因此,可变基因家族对解释人类肠道微生物群的分类数据具有重要意义。
备注:肠道受体蛋白TLR5参与积极地塑造新生小鼠肠道微生物群落的长期组成,敲除的Toll样受体(TLR5),是免疫系统识别鞭毛细菌(比如变形菌和梭状芽孢杆菌)的关键受体,缺乏它则机体可能不会在感知到细菌鞭毛时对细菌产生免疫应答。
肠道相关微生物群落组成的变化与许多人类疾病有关,但驱动这种不平衡(生态失调)的机制尚不完全清楚。
在肠道菌群失调期间观察到的最一致和最强大的生态模式是属于变形菌门的兼性厌氧细菌的扩张。
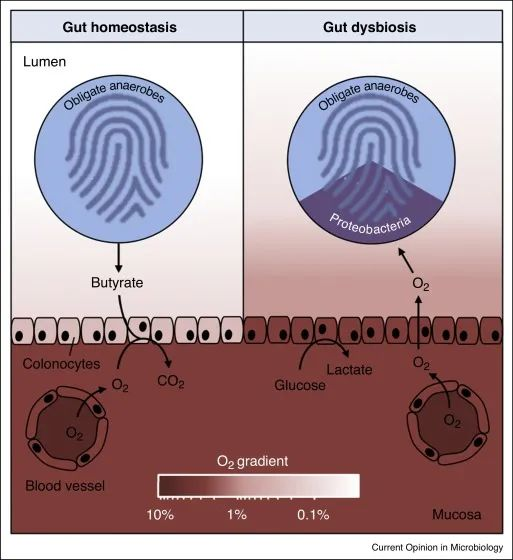
变形菌的菌群失调是上皮功能障碍的微生物特征
在肠道稳态期间(左),微生物群衍生的丁酸盐的 β 氧化导致上皮缺氧,从而维持大肠腔内的厌氧状态。反过来,腔内厌氧症导致肠道微生物群内专性厌氧菌占主导地位。
备注:丁酸(Butyrate acid,BA),俗称酪酸,是构成脂肪的一种脂肪酸,含有4个碳原子又称短链脂肪酸。人体的丁酸部分来自于食物中丁酸的吸收,主要的来自结肠厌氧菌的发酵产生。人体结肠产生的短链脂肪酸丁酸占比大部分)。
在肠道菌群失调期间(右),表面结肠细胞通过无氧糖酵解获得能量,从而导致上皮氧合增加,这种上皮功能障碍破坏了管腔中的厌氧菌,从而通过有氧呼吸推动兼性厌氧变形菌的扩张。
健康结肠的厌氧菌导致肠道微生物群的组成以专性厌氧菌为主,而菌群失调通常与兼性厌氧变形菌的丰度持续增加有关,这表明厌氧菌的破坏。
结肠上皮是缺氧的,但肠道炎症或抗生素治疗会增加结肠中的上皮氧合,从而破坏厌氧作用,通过有氧呼吸驱动兼性厌氧变形菌的菌群失调。
肠沙门氏菌(S. enterica)是一种食源性病原体,属于肠杆菌科,变形菌门,可引起小鼠结肠炎。在肠道沙门菌S. enterica诱导的结肠炎期间,肠腔内的氧气可用性增加,这表明结肠中病原体的氧气呼吸依赖性大量繁殖以及随之而来的专性厌氧梭状芽胞杆菌的丰度下降。
同样,结肠隐窝增生由鼠肠道病原体柠檬酸杆菌(肠杆菌科,变形菌门)引发,可提高肠腔内的氧气利用率,从而通过有氧呼吸推动变形菌病原体扩张。
这些观察结果表明,变形菌的菌群失调是上皮功能障碍的潜在诊断微生物特征,建议将变形菌负荷作为生态失调和疾病的潜在诊断标准,所以在谷禾即将更新的肠道菌群检测报告中,我们会加入变形菌门丰度和参考范围这一指标。
大肠中专性厌氧菌的优势可能是宿主环境的氧气限制严重的结果,这反过来又对用于营养物质的分解代谢途径产生重要影响。
避免被上消化道中的宿主酶降解的复合碳水化合物,可以被大肠中的专性厌氧细菌水解并发酵成更小的化合物。专性厌氧菌最终将许多发酵产物转化为短链脂肪酸,其中乙酸盐、丙酸盐和丁酸盐是最丰富的产物。宿主吸收了大约 95-99% 的微生物产生的短链脂肪酸,它到达血流以影响免疫发育。因此,大肠中专性厌氧菌的优势确保了维持肠道稳态的代谢物的产生。
变形菌是平衡的肠道相关微生物群落中的一个次要成分。然而,由遗传易感性、化学物质或肠道病原体感染引起的肠道炎症会导致小鼠模型中变形杆菌的管腔扩张不受控制。
同样,在患有严重肠道炎症的人类中,包括炎症性肠病、结直肠癌或坏死性小肠结肠炎的患者中观察到变形杆菌的丰度增加。此外,在包括肠易激综合征和代谢综合征在内的低水平肠道炎症条件下观察到大量变形菌。
肠道炎症增加了替代电子受体的可用性,这些电子受体通过厌氧呼吸支持兼性厌氧细菌的生长。肠道炎症过程中产生的活性氧可以将内源性硫化合物氧化为连四硫酸盐,这是一种电子受体,通过连四硫酸盐呼吸作用在鼠结肠中驱动类似肠沙门氏菌和Yersinia enterocolitica(一种属于肠杆菌科,变形菌门的病原体)的管腔扩张 。
一氧化氮由宿主酶产生化学诱导的结肠炎或由遗传易感性引发的结肠炎期间的诱导型一氧化氮合酶(iNOS) 。一氧化氮在肠腔内分解成硝酸盐,从而通过硝酸盐呼吸支持生长,从而增加小鼠结肠中共生大肠杆菌的丰度。类似,宿主衍生的硝酸盐的呼吸有助于在 S. enterica 诱导的小鼠结肠炎期间腔内病原体扩张。
有趣的是,即使在没有明显肠道炎症的情况下,例如在抗生素治疗期间,呼吸电子受体也有助于细菌群落从专性厌氧菌转变为兼性厌氧菌。为了支持这一观点,用链霉素治疗小鼠可将盲肠中的氧化还原电位提高到接近需氧培养液的水平。链霉素治疗通过硝酸盐呼吸和氧气呼吸的结合增加结肠中共生大肠杆菌或致病性肠杆菌的生长。
其他类似研究的结论也表明,氧气,单独或与其他呼吸电子受体结合,是广泛的胃肠道失衡中肠道菌群失调的常见驱动因素。因此,为了开发新的预防或治疗策略,必须了解在肠道菌群失调期间呼吸电子受体的可用性如何升高。
基于这些观察,有人提出变形菌的扩增是肠道菌群失调的微生物特征,而氧气、用药,遗传易感,肠炎驱动了变形菌的扩张,反过来加剧疾病的进展。
宿主遗传因素和外在环境因素,如饮食和生活环境,不断影响肠道微生物群的分类和功能组成。鉴于具有高度稳定性的平衡肠道微生物群与宿主的免疫系统具有共生相互作用,能够抑制变形杆菌失控的扩张,肠道中变形杆菌的大量繁殖可以反映肠道微生物群落结构的不稳定;这种不稳定的结构可以在非疾病状态下观察到(例如,新生儿期 和胃绕道手术后和疾病状态例如,代谢紊乱和肠道炎症)。
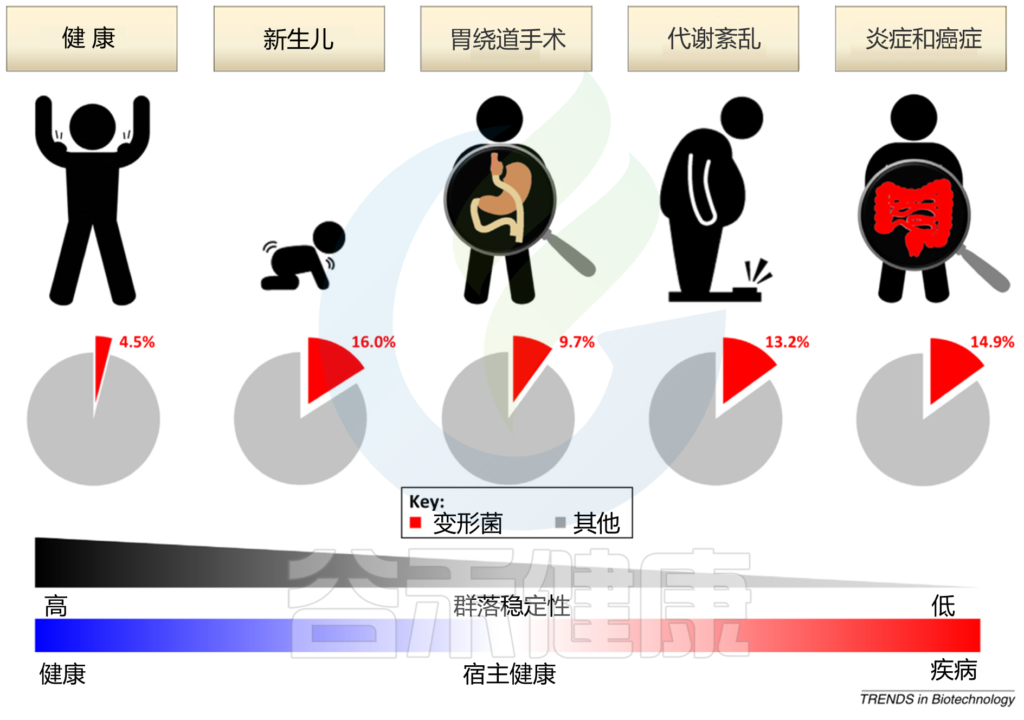
Shin NR, et al., Trends Biotechnol. 2015
在新生儿胃肠道的初始定植期间,兼性厌氧变形菌使肠道生态位有利于专性厌氧菌的定植;后者很快被专性厌氧的厚壁菌门和拟杆菌门所取代,它们在健康成年人的肠道微生物群中占主导地位。胃绕道手术导致的胃肠道重排可以改变 pH、胆汁流量和肠道激素,所有这些因素都会影响变形杆菌的丰度。
新生儿肠道中的变形菌
新生儿肠道中的微生物群备受关注,因为它不仅反映了细菌群落的脆弱结构,而且反映了哺乳动物肠道微生物群的真正起源。新生儿肠道中的细菌群落由于其快速的时间变化而不稳定。然而,这种脆弱性与更重要的肠道菌群定植有关,例如严格的厌氧菌。
具体来说,由于新生儿肠道中的氧气丰富,生命第一周的微生物群经常以兼性厌氧菌为主,主要是变形菌属(例如,埃希氏菌属、克雷伯氏菌属和肠杆菌属)。这些兼性厌氧菌通过消耗氧气、改变 pH 值、降低氧化还原电位并产生二氧化碳和营养物质,使栖息地适合严格的厌氧菌定殖。
因此,可以推测变形杆菌在为新生儿肠道准备好接受严格厌氧菌的连续定植方面发挥了作用,这些厌氧菌在健康成人的肠道中含量丰富。
最近对母体胎盘微生物组的一项研究描述了共生细菌群落的存在,其中大肠杆菌的丰度最高。尽管关于胎盘微生物群的活力和起源存在争议,但在母体胎盘中发现的这些有趣的细菌群落与来自母体羊水和新生儿胎粪的细菌群落重叠。
因此,新生儿肠道中的变形菌可能通过胎儿在子宫内吞咽羊水从母体胎盘传播。有趣的是,妊娠后期孕妇肠道中变形菌的比例增加。这意味着母亲微生物群中的这种特定细菌群转移到了新生儿身上。
在新生儿肠胃道中观察到的变形杆菌定植生长的持续时间很可能在母体控制之下。事实上,新生儿微生物群会受到各种母体因素的影响,例如分娩方式、饮食和怀孕期间接触抗生素。
最重要的是,新生儿肠道中变形菌的丰度受喂养类型的影响,这些细菌在配方奶喂养的婴儿中的频率更高,但在母乳喂养的婴儿中很少见。
人乳寡糖 和分泌型 IgA 的产生参与在最初的肠道定植过程中选择性抑制变形菌。因此,越来越多的人认为,及时减少变形菌的丰度是初始微生物定植的正常部分,而这种定植模式的紊乱与新生儿疾病的风险增加有关。
肠道中微生物群和宿主细胞之间的相互作用对于免疫系统的形成和调节至关重要,由于肠腔内有大量外源性抗原,免疫系统必须严格调节其反应以维持与共生菌的共生关系。共生体传递一种信号,诱导宿主免疫的耐受性反应。因此,宿主可以区分有益的本土微生物和有害病原体,并建立健康的微生物群。
变形杆菌的主要分类及其与IBD的关系

Mukhopadhya I, et al., Nat Rev Gastroenterol Hepatol. 2012
为了防止对共生细菌的炎症反应,肠道内的免疫细胞,如单核吞噬细胞(巨噬细胞和树突状细胞)和 CD4 + T 细胞,对微生物刺激反应迟钝或表现出共生反应。
同时,黏膜免疫系统负责清除病原体,这一过程需要积极的促炎信号级联反应。因此,不适当的免疫反应会破坏肠道稳态,引发生态失调,并导致局部和全身炎症和代谢功能障碍。
这种慢性进行性肠道炎症的状态在临床上被诊断为炎症性肠病 (IBD),其中包括溃疡性结肠炎 (UC) 和克罗恩病 (CD)。IBD 的确切病因仍然无法获得,但新出现的证据表明,肠道微生物群成为了这种疾病的主要嫌疑。
许多研究报告了动物和人类各种炎症持续条件下微生物群组成的改变。在这种情况下,通常发现变形菌在疾病中增加,变形菌在肠道炎症中的作用已在各种结肠炎小鼠模型中得到解决,与疾病呈正相关。
例如,使用易发炎症的小鼠模型,即鞭毛蛋白受体 TLR5 缺陷小鼠 (T5KO),发现,进展为结肠炎的小鼠表现出明确的微生物群特征,其特征是变形菌的水平增加,尤其是大肠杆菌属。并且一些作者已将其确定为微生物群不稳定性的潜在标志物,因此易诱发疾病发作。
与变形杆菌属大量繁殖的同时,结肠炎Tlr5-/- 小鼠表现出杂乱无章的结肠粘液层,与非结肠炎Tlr5-/- 同胞相比,感染性病原体的清除延迟。
这些结果表明,短暂不稳定的肠道微生物群,尤其是以变形菌为主的群落,会使遗传易感的小鼠易患慢性结肠炎。
先天免疫反应失调推动变形杆菌生长的假设这反过来又会促进肠道炎症,这一点得到了其他小鼠模型研究的支持,这些小鼠模型具有影响适应性免疫的突变,白细胞介素 (IL)-10 是对本地微生物群产生免疫耐受所需的主要免疫调节细胞因子。
IL-10 缺陷小鼠由于对肠道菌群不耐受而表现出自发性结肠炎。随着结肠炎症的发生和发展,在定植常规微生物群或缺乏特定病原体的微生物群的 IL-10-/- 小鼠中,变形杆菌和大肠杆菌比野生型小鼠多。
在另一项对 IL-10 缺陷小鼠的研究中,富含饱和乳脂的饮食扰乱了肠道微生物群,导致亚硫酸盐还原Delta-proteobacteriumBilophila wadsworthia 大量繁殖。这种病原菌在 IL-10 -/-小鼠中诱导促炎性黏膜免疫反应并促进自发性结肠炎的发生率和严重程度;它还在喂食高乳脂饮食的野生型小鼠中促进葡聚糖硫酸钠 (DSS) 诱导的结肠炎。
除了对结肠炎的易感性与肠道变形菌的相对丰度之间存在正相关性之外,对先天性和适应性免疫系统均缺陷的小鼠的研究提供了支持变形菌在肠道炎症中的致病作用的证据。
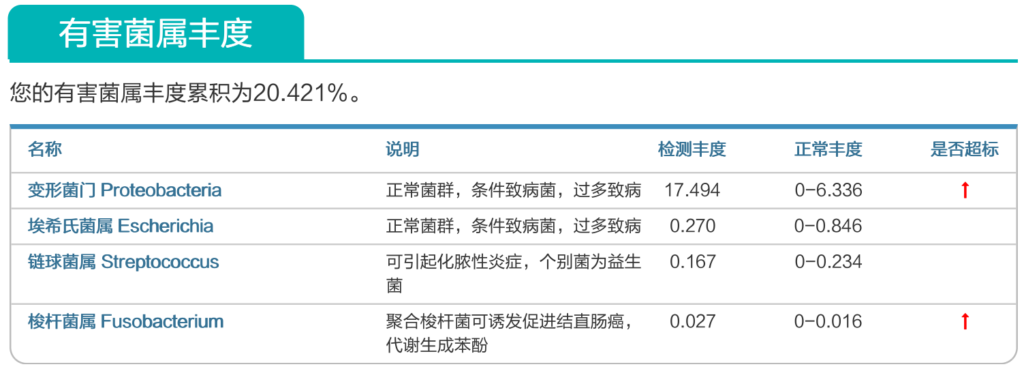
来源:谷禾健康肠道菌群数据库
谷禾健康肠道菌群检测大数据也显示,在炎症性肠病,结直肠癌等患者的肠道菌群检测报告中,85%以上的患者显示变形菌门超标或多项变形菌门病原菌超标或占比丰度偏高。
在最近的一项研究中重现了,结肠炎中变形杆菌的显着扩增,该研究比较了患有活动性结肠炎的 TRUC 小鼠的肠道微生物组与因庆大霉素、甲硝唑或抗肿瘤坏死因子 (TNF)-α 治疗而缓解的小鼠的肠道微生物组。
值得注意的是,从 TRUC 小鼠的粪便中分离出的两种肠杆菌科细菌(肺炎克雷伯菌和奇异变形杆菌)即使在没有任何遗传免疫缺陷的受体小鼠中也足以引发结肠炎。
然而,这两种微生物的致结肠潜力并未在无菌 TRUC 小鼠中复制,这表明结肠炎的发病机制需要其他共生成员。口服伤寒杆菌,另一种富含 TRUC 小鼠的变形菌,也会在非结肠炎 TRUC 小鼠中引发结肠炎,这些小鼠具有大量的促炎细胞因子(例如,TNF-α)。
遗传易患结肠炎的小鼠的生态失调与人类 IBD 特别相关,因为与 IBD 相关的风险等位基因或多态性与先天性和适应性免疫成分有关。与小鼠研究相似,两项人类研究表明,与健康受试者相比,IBD 患者肠道微生物群落的特点是微生物多样性低、变形菌门(尤其是肠杆菌科)的产物以及厚壁菌门的减少。
一项人类队列研究发现,核苷酸结合寡聚化结构域 (NOD)-2 风险等位基因剂量与 IBD 患者肠道标本中肠杆菌科的相对丰度呈正相关。
在 UC 患者中,与炎症的中度和轻度阶段相比,在严重阶段观察到的变形杆菌水平显着升高。
在新发 CD 的初治儿科患者和非 IBD 对照受试者之间,回肠和直肠活检(但不在粪便样本中)的粘膜相关微生物组存在明显差异。变形菌的相对丰度增加,包括肠杆菌科、巴氏杆菌科和奈瑟菌科,将 CD 相关细菌群落与健康对照组区分开来。与慢性炎症一致,伴随变形杆菌属优势的肠道微生物群落改变不仅见于传染性病原菌或原生动物寄生虫引起的急性炎症,而且见于实验性和人类结肠炎相关的结肠直肠癌。
最有趣的生物体,通过一个孤立的病例报告与 IBD 有关,该病例报告一名感染这种细菌的小男孩在放射成像上出现回肠增厚,这是克罗恩病的典型表现。
血清学研究表明,与健康对照相比,克罗恩病患者的大肠杆菌抗体数量增加。具体地说,已发现37-55 % 的克罗恩病患者、2-11% 的溃疡性结肠炎患者和 <5% 对照组患者的百分比。
此外,克罗恩病患者中这些抗体的存在与更严重的表型相关,其特征是小肠受累、疾病进展频繁、病程更长和对手术的需求更大,这表明它们可以用作克罗恩病的预后标志物。
饮食被认为是塑造肠道微生物结构的最关键的环境因素之一。
△ 肥胖:丰富的变形菌为特征
累积证据表明,人类和啮齿动物的健康和肥胖个体的肠道微生物群的分类和功能组成存在差异。
此外,肥胖表型通过粪便移植的传播能力表明肠道微生物群落的改变,作为主要触发因素,是因果关系而不是结果。
肠道微生物群的分类组成失衡,称为生态失调,在代谢紊乱中得到充分证明,并被视为厚壁菌门相对于拟杆菌门的相对丰度增加(F:B 比率)。尽管一致的研究结果普遍支持这一概念,但代谢紊乱期间的生态失调通常包括变形菌的患病率增加。
例如,一项对儿童肠道微生物群的研究发现,与低脂肪、高纤维饮食儿童相比,食用高热量、高脂肪、低纤维饮食的欧洲儿童中的变形杆菌数量更多。
这种差异揭示了肠道微生物群落对非洲儿童饮食的适应性,这可以提高他们从难消化的多糖中获取能量的能力。此外,一些导致有害代谢影响的因素,例如食用无热量的人造甜味剂和乳化剂(通常用作加工食品中的添加剂),也会损害血糖控制并诱发变形杆菌繁殖。
特别是,人造甜味剂介导的肠杆菌科和Delta-proteobacteria类相对丰度的升高与 2 型糖尿病 (T2DM) 患者的结果一致,表明葡萄糖稳态和肠道变形菌之间存在联系。相比之下,证明变形菌的丰度与糖尿病表型呈负相关,挑战代谢疾病患者中高丰度变形菌的概念。
为支持代谢紊乱与变形菌属的扩张之间的关系,变形杆菌属的致肥胖潜力已在无菌小鼠的单关联研究中被确定。
在对一名病态肥胖志愿者进行的减肥试验中,肠杆菌科的相对丰度逐渐减少,假设肠杆菌在代谢恶化中具有致病作用。用从肥胖的人类肠道中分离出来的阴沟肠杆菌B29对无菌小鼠进行单菌定植足以诱导肥胖和胰岛素抵抗。
这一发现支持了这样一个假设,即以丰富的变形菌为特征的不稳定的肠道微生物群落可能代表代谢紊乱的主动特征,而不是被动后果。
△ 营养不良儿童:变形菌成为优势菌
营养不良会导致其他健康问题,例如消瘦和夸希奥科病。在发展中国家,营养不良是威胁 5 岁以下儿童生命的疾病。
营养不良的主要病因是在孕期或产后头 3 年由于大量营养素缺乏和微量营养素缺乏导致的慢性能量负平衡。
然而,最近的研究表明,孟加拉国和马拉维营养不良儿童的肠道微生物群落结构和基因含量与营养良好的儿童不同。在这些研究中,在营养不良的儿童中普遍观察到变形菌的优势和肠道微生物群的低多样性,并被认为是肠道微生物群成熟的障碍。
此外,最近的一项研究揭示了肠杆菌科细菌与营养不良下的肠道黏膜免疫球蛋白 A (IgA) 反应之间存在机制上的相互关系,这会引发肠病并中断黏膜免疫的发展和健康微生物群的组装。
鉴于生态失调驱动的选择压力似乎干扰了微生物群的稳定性,变形菌随后借此机会增加了它们的适应性。微生物群落在异常代谢条件下的不稳定性已被解释为对定植的抵抗力受损。
当接种来自肥胖人类供体的培养细菌(“肥胖受体小鼠”)的无菌小鼠与携带来自瘦肉供体的细菌物种(低脂肪、高纤维饮食)的小鼠共同饲养时,它们被瘦肉有效定殖供体来源的细菌菌株及其肥胖表型得到改善。相比之下,瘦小鼠没有被来自肥胖小鼠的外源或外源细菌菌株定殖。
这一发现表明,生态失调的特点是传播能力减弱和对定植的抵抗力。鉴于 kwashiorkor 儿童的肠道微生物不成熟且富含肠道病原体营养不良被认为与对殖民化的抵抗力有缺陷有关。
总的来说,这一间接证据导致了这样一种观点,即肠道变形菌的扩张反映了宿主的能量不平衡和不稳定的微生物群。有趣的是,在非疾病状态下,如新生儿期和胃绕道手术后也观察到肠道微生物群落的不稳定结构和高丰度的变形菌。
与大多数细菌一样,在细胞外环境中对变形菌的初步识别是通过病原体识别受体 (PRRs) 发生的,PRRs 识别微生物相关分子模式 (MAMPs)——一个包括病原体相关分子模式 (PAMPs) 和危险相关分子模式的统称分子模式(DAMP)。
这些信号受体可分为三个家族:
尽管至关重要的是,只有 TLR 家族参与识别肠细胞表面的细菌配体。
存在于变形菌细胞表面的主要 MAMP 是脂多糖 (LPS) 和鞭毛蛋白,它们分别被 TLR4 和 TLR5 识别。其他参与细菌识别的TLR包括检测细菌脂蛋白的TLR2和检测未甲基化 CpG DNA 的细胞内受体 TLR9。
LPS 的产生和鞭毛组装是在原核生物中观察到的两个最动态的过程,这些结构组成的巨大差异反映在不同变形菌家族成员中观察到的先天免疫反应的强度和方向上。例如,弯曲杆菌和螺杆菌属LPS 与大肠杆菌LPS 的不同之处在于具有更长的酰基链和增加的链连接和脂质 A 磷酸基团的修饰。
在许多病原生物体(例如百日咳杆菌和幽门螺杆菌)中观察到脂质 A 锚中的一个或两个磷酸基团丢失,并且已被证明可提供对抗菌肽的抗性。
参与细菌识别的 TLR 的遗传变异与 IBD 相关。2010 年发表的一项荟萃分析表明,TLR4 Asp299Gly 和 Thr399Ile 变体都赋予白人患克罗恩病和溃疡性结肠炎的统计学显着风险。有趣的是,这两种变体都位于 LPS 结合域内 TLR4 的胞外域,并且被认为会影响蛋白质的二级结构。
这些功能变体的存在已被证明会影响 LPS 反应性,并使个体更容易受到革兰氏阴性菌的感染。证据还表明,这些遗传变异的存在可能会影响基础免疫状态。
因此,有理由推测,在 TLR4 基因变异的携带者中,在营养不良事件之前或期间发生的免疫反应改变,可能足以驱动 IBD 发生不可挽回的免疫反应改变。TLR9 中的遗传变异也与 IBD 易感性增加有关。证据不如TLR4那样令人信服,尽管这一警告可能反映了 TLR9 处理来自所有细菌的配体而 TLR4 反映革兰氏阴性菌易感性的事实。
变形菌门是肠道菌群中四个主要门(厚壁菌门、拟杆菌门、变形菌门和放线菌门)中最不稳定变化最快的门。变形菌门作为一线反应者,对环境因素(如饮食)反应敏感。
总的来说,迄今为止的许多研究都支持这样一个概念,即肠道中大量变形菌反映了生态失调或不稳定的肠道微生物群落结构。除了外源性肠致病性变形杆菌外,健康的哺乳动物肠道还含有数种属于该门的共生细菌,作为其天然肠道菌群。
这些细菌在比例较小时似乎是良性的,而在某些肠道环境下,它们会变成可引发炎症反应甚至代谢障碍。
然而,肠道中变形菌的长期富集可能代表不平衡的不稳定微生物群落结构或宿主的疾病状态。因此,时间顺序监测,而不是横断面研究,可能是根据肠道中变形菌的比例确定疾病风险的更好方法。
在健康肠道中,免疫系统严格调节其反应以维持与共生菌的共生关系。这种可能性表明存在正反馈循环。环境或宿主因素(例如低纤维饮食和急性或慢性炎症)破坏体内平衡,具有选择性并导致肠道内大量变形菌的生态失调。由于宿主无法保持共生的变形菌而导致变形菌的不受控制的扩张,在一小部分和微生物群落对定植的抵抗力降低的情况下,可以进一步促进炎症或外源性病原体的入侵。
因此,切断反馈回路的策略可能包括优化肠道微生物群和宿主之间的伙伴关系。鉴于大多数研究已经在与宿主生理学相关的背景下描述了微生物群落状态,因此对于未来的炎症和代谢干预治疗,首先需要判别变形菌的丰度以及是其是否不受控制扩张,另外需要确定变形杆菌大量繁殖的原因以开发有效的治疗方法。
主要参考文献:
Rizzatti G, Lopetuso LR, Gibiino G, Binda C, Gasbarrini A. Proteobacteria: A Common Factor in Human Diseases. Biomed Res Int. 2017;2017:9351507. doi: 10.1155/2017/9351507. Epub 2017 Nov 2. PMID: 29230419; PMCID: PMC5688358.
Mukhopadhya I, Hansen R, El-Omar EM, Hold GL. IBD-what role do Proteobacteria play? Nat Rev Gastroenterol Hepatol. 2012 Feb 21;9(4):219-30. doi: 10.1038/nrgastro.2012.14. PMID: 22349170.
Litvak Y, Byndloss MX, Tsolis RM, Bäumler AJ. Dysbiotic Proteobacteria expansion: a microbial signature of epithelial dysfunction. Curr Opin Microbiol. 2017 Oct;39:1-6. doi: 10.1016/j.mib.2017.07.003. Epub 2017 Aug 4. PMID: 28783509.
Shin NR, Whon TW, Bae JW. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol. 2015 Sep;33(9):496-503. doi: 10.1016/j.tibtech.2015.06.011. Epub 2015 Jul 22. PMID: 26210164.
Shin NR, Whon TW, Bae JW. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends Biotechnol. 2015 Sep;33(9):496-503. doi: 10.1016/j.tibtech.2015.06.011. Epub 2015 Jul 22. PMID: 26210164.
Rigottier-Gois L. Dysbiosis in inflammatory bowel diseases: the oxygen hypothesis. ISME J. 2013 Jul;7(7):1256-61. doi: 10.1038/ismej.2013.80. Epub 2013 May 16. PMID: 23677008; PMCID: PMC3695303.

谷禾健康
梭杆菌属(Fusobacterium),是梭菌门最主要的菌属,厌氧革兰氏阴性细菌,与拟杆菌属、普氏菌属、卟啉单胞菌属一样都是医学上重要的厌氧革兰氏阴性杆菌。
梭杆菌属是人类和动物的身体共生菌之一,主要定植在人类和动物的粘膜中,两个最主要的聚集地是口腔和结肠,某些类型物种属于机会性病原体,会引起菌血症和各种快速进展的感染。这些微生物比大多数正常的厌氧菌群更具毒性,产生重要的 脂多糖(LPS),内毒素和溶血素等,这可能是毒力的原因。
其中具核梭杆菌(Fusobacterium nucleatum, 简F. nucleatum)和坏死梭杆菌(Fusobacterium necrophorum,简F. necrophorum) 是可怕的厌氧病原体之一,最常存在于口腔、牙菌斑中,与牙周病、急性坏死性牙龈炎、口腔癌、溃疡性结肠炎、克罗恩病和结直肠癌有关。
此外,梭杆菌与大约一半的头颈部厌氧菌感染有关,包括牙龈和牙齿感染、慢性扁桃体炎、慢性鼻窦炎、中耳炎、咽旁感染以及口腔感染。它们不仅在这些组织中繁盛,而且很容易扩散,有时会引起肿瘤、息肉、囊肿和其他无害组织块的破坏。即使是局部炎症环境的变化也可能导致无功能组织过度生长,因此也称为“癌杆菌”。
梭杆菌属对粘菌素和卡那霉素敏感,这将它们与拟杆菌属和卟啉单胞菌区分开来。一些菌株产生β-内酰胺酶并对青霉素耐药。
梭杆菌
梭杆菌是一种独特的细菌门,是以前研究不足的分类群中的一个主要例子。该门下研究广泛的主要是梭杆菌属。
梭杆菌属细菌是革兰氏阴性、不形成孢子的厌氧菌,球状、多形性小球(坏死梭杆菌)到杆状的一系列细胞形态。当杆状时,梭杆菌细胞具有平行的壁,具有圆形或锥形末端,可分为运动和不运动。
梭杆菌属DNA(G + C)含量约为26~34mol%,正常存在于人或动物的口腔、消化道和土壤中,已知对人和动物致病的有十几种以上,其中主要代表为具核梭杆菌(F. nucleatum)和坏死梭杆菌(F. necrophorum).
在健康人的粪便中,发现以下数量的梭杆菌:
幼儿: 108-109 CFU/g
成人: 107-1010 CFU/g
老年人:108-109 CFU/g
通常,在成人的口腔中,含有 102 -104 CFU/g 的梭杆菌。
在血琼脂上,梭杆菌会形成圆形或不规则的针状菌落,一些物种,如具核梭杆菌,在孵化 3 至 5 天后会形成伞形“煎蛋”菌落。根据菌株的不同,它们可以是溶血的,并且一些菌株具有血凝作用。
临床感染中最常见的梭杆菌属有:
具核梭杆菌、坏死梭杆菌。
它们几乎存在于儿童的所有类型的感染中,包括菌血症,与耳科疾病相关的脑膜炎 ,内脏破裂后的腹膜炎,以及口腔或肛门口附近的皮下脓肿等。
致病梭杆菌在生物膜(特别是软组织)中粘附革兰氏阴性和革兰氏阳性菌斑微生物的卓越能力使其成为一种高度侵入性的病原体。
最常存在于口腔、牙菌斑中,与牙周病、急性坏死性牙龈炎、溃疡性结肠炎和克罗恩病有关。在免疫缺陷中,可引起继发性坏疽和化脓性坏疽过程。对于扁桃体炎,疱疹性口炎,儿童营养不良,免疫缺陷病,可能会发生梭菌病,扁桃体,口腔粘膜的坏死性炎症过程。
梭杆菌具有独特的代谢能力, 梭杆菌细胞通过发酵碳水化合物和蛋白获得能量。这种发酵产生丁酸盐,在某些情况下产生乙酸作为主要的代谢副产物。这是梭杆菌属物种与其他革兰氏阴性、非孢子杆状细菌的区别。
致病性
在革兰氏阴性厌氧菌中,梭杆菌作为主要病原体侵入人类宿主的能力很强。已经描述了许多毒力决定因素,包括白细胞毒素、蛋白水解酶、脂多糖(LPS)和血凝素的表达。
虽然是人体组织正常菌群的一部分,但梭杆菌可以在手术或意外创伤、水肿、缺氧和/或组织破坏后侵入组织。
★ 坏死梭杆菌 (F. necrophorum)
坏死梭杆菌在其细胞壁中含有特别强大的内毒素脂多糖,并产生一种促进凝块形成的凝固酶。此外,它还产生多种外毒素,包括杀白细胞素、溶血素、脂肪酶和细胞质毒素,所有这些都可能导致其致病。
坏死梭杆菌的粘附素和菌毛在宿主细胞附着中起关键作用。
白细胞毒素是已知的坏死梭菌的毒力因子,可能促进脓肿形成。内毒素和溶血素似乎也是脓肿形成和局部感染组织坏死增加的重要毒力因子。血凝素和尚未确定的导致血小板聚集的因素与Lemierre 综合征中发现的血栓形成后果相关性很大。
★ 具核梭杆菌 (F. nucleatum)
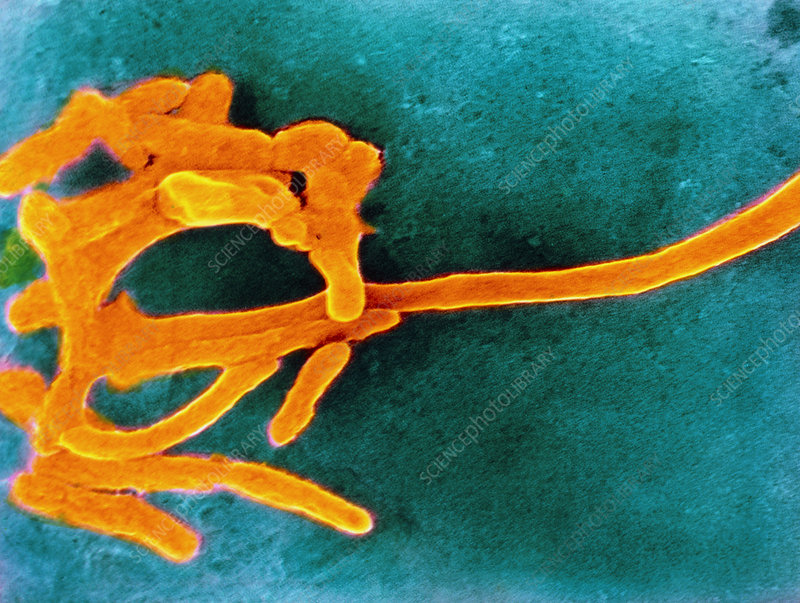
具核梭杆菌是少数利用氨基酸分解代谢来提供能量的非产孢厌氧物种之一,能使用谷氨酸、组氨酸和天冬氨酸。梭杆菌代谢通过消耗氨基酸和释放氨自然增加其局部环境的 pH 值,从而使酸敏感细菌(如牙龈卟啉单胞菌)生长。
但是,具核梭杆菌不使用葡萄糖作为其主要能源。现有数据表明,葡萄糖用于细胞内分子的生物合成,而不是能量代谢。具核梭杆菌也可以在低至 5 的 pH 值下存活。
——粘附各种细菌和细胞
具核梭杆菌是革兰氏阳性和革兰氏阴性物种之间物理相互作用的中心物种,可能对生物膜的形成很重要。
F. nucleatum具有外膜,于其细胞外表面上有大量蛋白质,可以发现细菌与宿主细胞表面上的各种互补结构具有特定的相互作用。这种粘附是由粘附素介导的。这种依从性对于易感宿主中感染的定植和建立非常重要。
它是附着在牙齿和上皮表面的共生体与真正的病原体。F. nucleatum有两种物质:菌毛和非菌毛粘附素,用于附着在其他细菌和细胞上。这些物质有助于定植以及细菌发病机制和感染。
——梭杆菌粘附 A (FadA)
梭杆菌粘附A (FadA) 是一种菌毛粘附蛋白,最近被证明是细菌附着和侵入牙龈上皮和内皮细胞所必需的。它在栖息于口腔黏膜的梭杆菌属中是保守的,并且对细胞结合很重要。
FadA 是一种含有 129 个氨基酸的蛋白质,具有 18 个氨基酸的信号肽。它具有一种分泌形式,可导致 β-连环蛋白途径和 Wnt 基因表达上调,这两种重要的发育途径在失调时都是致癌的主要原因。
FadA 的晶体结构揭示了一种独特的“亮氨酸链”结构,该结构在发生突变时会破坏宿主细胞的结合。尽管他们没有确定 FadA 的受体结合位点,但他们认为 FadA 作为细丝发挥作用,该区域的治疗靶点可能适用于未来的临床治疗。
梭杆菌多样性和生态位
从 1880 年代和 1890 年代开始,科学家们在各种人畜共患病和人类样本中发现了梭形杆状物,包括健康和患病的口腔。
以前梭杆菌属区分开来的特征主要是代谢与发酵和分泌的有机酸谱、吲哚和硫化氢的产生以及胆汁敏感性有关。尽管这些指标在区分梭杆菌中无法真正有效,从基因组上层面区分和鉴定梭杆菌属是在测序时代,而且还提高了对梭杆菌内部差异的理解。
目前梭杆菌属鉴定的有30 多个物种,包括:
通过对 16s rRNA 序列的系统发育分组分析,发现F. nucleatum与拟杆菌属和黄杆菌属密切相关。
比较基因组学研究表明,梭杆菌物种之间主要可以分为三个谱系。在这个模型中,F. nucleatum 进化为与牙周梭杆菌的谱系,这些物种不仅共享一个生态位,而且还具有与宿主细胞入侵相关的相似功能。
F. nucleatum本身可进一步划分为四个亚种:nucleatum、animalis、vincentii、polymorphum
虽然有人认为这些亚种在 DNA 水平上有足够的差异,可以被认为是独立的物种。
梭杆菌栖息在人类和动物的粘膜中,是两者的病原体。由于其致病性和寄生性,梭杆菌不会直接影响环境,但它可能会通过对受感染宿主动物菌群的影响来改变生态系统。
常见感染
一些梭杆菌菌株会导致多种人类疾病,包括牙周病、Lemierre 综合征和局部感染或溃疡。
较早的研究表明梭杆菌在人类口咽部很常见,但目前的共识是梭杆菌应始终被视为病原体。与拟杆菌属相比,梭杆菌属具有强效的脂多糖。
在与牙周病统计学相关的所有牙周菌群中,具核梭杆菌是在其他身体部位发现的临床感染中最常见的。
“具核梭杆菌心包炎”——一名疑似感染分枝杆菌的 49 岁男子胸部发现具核梭杆菌心包炎。被认为分枝杆菌是原因,因此对他使用了抗结核药物。然而,这是F. nucleatum导致的。这一发现使人们认识到,具核梭杆菌通过口咽入口进入是导致此类疾病的原因。这是较早的发现之一,即具核梭杆菌也可能影响除口腔以外的其他体腔。
一些身体感染包括:皮肤溃疡、扁桃体周围脓肿、脓肌炎和化脓性关节炎、菌血症、肝脓肿、宫内感染、细菌性阴道病、尿路感染、心包炎和心内膜炎、肺和胸膜肺感染。巧合的是,它更常见于儿童体内。
F. necrophorum 在某些类型的感染中可能具有很强的毒性。在心绞痛后脓毒症(Lemierre 综合征)中,感染始于膜感染,如扁桃体炎,然后发展为伴有转移性感染的败血症,包括肺脓肿、脓胸、肝脓肿、骨髓炎和化脓性关节炎。
梭杆菌属以多种方式与其他细菌相互作用。相对于人类口腔和胃肠道中同时存在的微生物,梭杆菌属可以是互惠者、促进者、拮抗者和/或协同者。
梭杆菌代谢的副产物可以促进其他细菌种类的生长。上面提到的梭杆菌粘附素库就允许与许多不同的菌属共聚集,甚至可以促进其他非侵入性细菌物种的入侵。
担当调解者——连接主要定植菌和厌氧菌——有益牙周健康
F. nucleatum在有助于牙周健康和疾病的生物膜中发挥不可或缺的有益作用。在牙菌斑生物膜中,具核梭菌作为桥梁生物在结构上起到支持作用,将主要定植菌(如链球菌属)与主要厌氧的次级定植菌(牙龈卟啉单胞菌和Aggregatibacter actinomycetemcomitans )连接起来。
许多口腔微生物,包括梭杆菌属是专性厌氧的,并且作为生物膜的一部分存在于口腔的富氧环境中。然而,溶解在唾液中的氧气可能会通过牙龈下生物膜中的通道深入渗透到牙龈下生物膜中。尽管在单一培养中,对氧气极为敏感的口腔菌斑衍生微生物(如牙龈卟啉单胞菌)无法在这种微通气条件下存活,但与更耐氧的具核梭菌共培养可以促进专性厌氧菌的生长,这可能是由于梭杆菌对局部还原条件的贡献。
能在酸性条件存活,增加pH值,促进其他菌生长
除了在低氧水平下生长的能力,F. nucleatum也可以在低至 5 的 pH 值下存活。梭杆菌代谢通过消耗氨基酸和释放氨自然增加其局部环境的 pH 值,从而使酸敏感细菌(如牙龈卟啉单胞菌)生长。除了促进其他细菌的生长,梭杆菌细胞可以将它们的 “同居者” 固定在适当的位置。
梭杆菌属,特别是具核梭杆菌,已显示与所有测试的口腔细菌属可以发生共聚集。然而,这种聚合并不是无差别的。在每个属中,梭杆菌分离物优先与特定的某些菌株而非其他菌株共聚集。由于这种相互作用,具核梭菌是口腔生物膜发育的重要贡献者,是早期和晚期定植者之间的桥梁。
接下来,我们了解一下,F. nucleatum可能与之共聚的细菌。
与肠源性细菌共聚集——协同作用
梭杆菌细菌素可以通过去除特定的口腔和/或肠道微生物来促进其他微生物的生长,从而促进互惠相互作用的选择性。
通过与具核梭菌的侵入性菌株共聚集,一种具有粘附和侵入哺乳动物细胞能力的梭杆菌分离物——非侵入性细菌“乘客”可以穿梭到哺乳动物细胞中。
例如,具核梭菌的侵入性菌株,促进一些源自口腔的非侵入性细菌能够侵入人类口腔细胞。有趣的是,尽管F. nucleatum原产于人类口腔已证明菌株但是能够与人类胃肠道结直肠区域的原生细菌共聚集。
细菌共聚集可能对人类健康产生的影响
这种共聚集能力可能通过协同相互作用在结直肠癌(CRC)的病因中发挥作用。
尽管大量研究调查了结肠微生物群与结直肠癌进展之间的联系,结直肠癌病例相关的细菌包括F. nucleatum、产肠毒素脆弱拟杆菌(ETBF)、致肠致病大肠杆菌(EPEC)、侵入性大肠杆菌(AIEC)、粪肠球菌、弯曲杆菌属和Leptotrichia spp 等。
已发现具核梭杆菌和以上菌可能协同加速结直肠癌进展和/或转移。
早在 1936 年,科学家就将梭杆菌感染与颈静脉血栓性静脉炎联系起来。
最近,梭杆菌感染的发病率有所增加。虽然这种增加的原因尚不清楚,但抗生素使用减少和检测技术改进有关的理论可能解释了这种变化。
临床医生能够发现梭杆菌属感染的早期迹象至关重要,这种感染会迅速出现一系列并发症,如 Lemierre 综合征(心绞痛后脓毒症)、菌血症、骨髓炎和感染性休克。
儿童发病 ↓↓↓
儿科人群中的梭杆菌感染主要影响头部和颈部区域,因为细菌主要存在于口腔内。急性中耳炎是最常见的感染部位,尤其是在 2 岁及以下的儿童中。
一项研究了 27 名中位年龄为 3.5 岁的儿童的梭杆菌感染的神经系统表现,发现其中 5 人出现意识水平下降,7 人在开始治疗前癫痫发作。
厌氧菌引起的中耳感染不到 1%;但是,如果不及时治疗,可能会出现严重的并发症,例如骨膜下和硬膜外脓肿。
菌血症是一种严重的并发症,常见于高达 77% 的儿童梭杆菌病例,可能是由于颅内窦靠近乳突骨所致。在 40% 的患者中也观察到骨髓炎,并且通常是多灶性的,需要长期静脉内抗生素治疗。
成年发病
在免疫功能正常的患者中,男性和女性的发病率相等。最初的症状包括发烧(38°C ~ 39°C)并伴有急性中耳炎,通常进展为乳突炎。实验室评估显示炎症标志物升高:C 反应蛋白水平、白细胞计数和中性粒细胞绝对计数。
梭杆菌引起的脑膜炎罕见且被描述少于 20 次;然而,人们经常注意到它会导致严重的发病率和死亡率。
Lemierre 综合征
有人提出,Lemierre 或 Lemierre 样综合征的发展通常发生在梭杆菌感染中耳之后。这是由于中耳感染延伸到静脉窦血栓形成。
Lemierre 综合征是梭杆菌感染的严重并发症。
在一项对 12 名感染患者的研究中,58% 的患者发展为 Lemierre 或 Lemierre 样综合征。该综合征以颈内静脉脓毒性血栓性静脉炎或血栓形成为特征,可在肺部或其他无菌部位引起脓毒性栓塞性病变。
坏死梭杆菌(F. necrophorum)是导致 Lemierre 综合征的梭杆菌属物种,是造成 10% 的急性咽喉痛和 21% 的复发性咽喉痛的原因,其余由引起由A 组链球菌或病毒引起。
F. necrophorum的其他并发症包括脑膜炎,并发脑静脉血栓形成, 以及泌尿生殖道和胃肠道感染。
菌血症
具核梭杆菌引起的菌血症不常见,但死亡率高
一些危险因素包括恶性肿瘤、年龄较大、酗酒、免疫抑制和透析;通常是通过医院感染。然而,F. nucleatum菌血症的死亡率可达 10%,并且与基础疾病的严重程度相关。
有一项研究调查了有梭杆菌属感染事件病例。研究期间的菌血症(每年 0.55 例/100,000 人),具核梭杆菌是最常见的物种(61%),其次是坏死梭杆菌(25%)。
许多具核梭杆菌菌血症发生在不同的疾病患者(糖尿病、肠道、肺部、肝脏或妇科疾病),其中口咽部、胃肠道、泌尿生殖道和呼吸道,通常是F. nucleatum定植,可能成为感染源。
在强化化疗后患有恶性肿瘤(白血病和淋巴瘤)的血液病患者中,发生了具核梭杆菌菌血症。在大多数情况下,发生在口腔粘膜炎患者中。值得注意的是,F. nucleatum菌血症的病程似乎比由F. necrophorum等梭杆菌属引起的其他菌血症更有利,后者通常会导致 Lemierre 综合征。
F. nucleatum 感染与新冠感染有关
比利时研究团队报告了2020 年 3 月和 2020 年 4 月,比利时布鲁塞尔的 2 家主要医院观察到 4例 具核梭菌感染病例,均与冠状病毒病(COVID-19)患者的严重急性呼吸综合征冠状病毒 2(SARS-CoV-2)感染有关。
在口腔中,细菌、真菌、病毒和古细菌在不同的栖息地自然定殖,包括牙齿、牙龈沟、舌头、脸颊、软硬腭和扁桃体。口腔微生物群是指这些生物的高度多样化和复杂的生态系统。超过 700 种细菌是口腔特有的,而本土口腔菌群则可以防止外来细菌的定居。
口腔菌群的两面性
口腔中的一些细菌是有害的,会导致严重的疾病,而同时也有许多口腔细菌上对预防疾病是有益的。
现在已经确定,许多慢性炎症状况是由宿主-微生物群相互作用之间的不平衡引起的。口腔共生菌在口腔疾病的发展中起着至关重要的作用,包括牙周病和牙齿脱落,以及维持正常的口腔生理环境。此外,已知口腔共生菌参与了肺炎、心血管疾病、糖尿病、痴呆等系统性疾病的发病和发展。
梭杆菌在口腔疾病中的作用
梭杆菌是口腔中常见的专性厌氧革兰氏阴性菌,可充当牙菌斑中早期和晚期定植细菌之间的桥梁,并在口腔和口腔外感染中发挥作用。
具核梭杆菌是一种常见于人类牙菌斑中的细菌。这种细菌已被证明在牙菌斑形成和牙龈炎等其他疾病中起着核心作用。
这是因为它能够粘附广泛的革兰氏阳性和革兰氏阴性菌斑微生物,例如牙龈卟啉单胞菌。与牙周炎以及头部和颈部、胸部、肺部、肝脏和腹部的侵入性人类感染密切相关。由于其粘附能力,它可以与病毒相关联,病毒粘附在宿主组织细胞上作为入侵并调节宿主的免疫反应。
口腔鳞状细胞癌中的梭杆菌
最近已经表明,在口腔鳞状细胞癌(OSCC)组织中检测到梭杆菌一种口腔共生细菌。OSCC 组织表面生物膜内需氧菌和厌氧菌的比例约为 1:2,而健康对照组为 2:1,表明 OSCC 表面为厌氧菌提供了重要的储存库。梭杆菌在 OSCC 组织中的分布可能与健康口腔粘膜组织中的分布不同。
具核梭杆菌侵入上皮细胞
与P. gingivalis相比,F. nucleatum 显着粘附并侵入人牙龈上皮细胞 (HGEC) 。具核梭菌的自发突变体无法侵入HGEC ,这表明它们的侵入需要细菌成分。
此外,葡萄糖抑制试验表明,凝集素样相互作用参与了具核梭菌与 OSCC 细胞的附着。
具核梭杆菌在上皮细胞促进细胞迁移
具核梭杆菌的感染在人类上皮细胞中促进细胞迁移,可能通过刺激 Etk/BMX、S6 激酶 p70 和 RhoA 激酶,并通过激活丝裂原活化蛋白激酶 p38 增加 MMP-13(胶原酶 3)的产生 。
然而,梭杆菌在 OSCC 细胞中的粘附以及具核梭杆菌介导的OSCC细胞侵袭的详细机制仍不清楚。但是,普遍共识认为在OSCC 患者的口腔中富含具核梭杆菌这一事实似乎在口腔癌的肿瘤发生和/或进展中很重要。
具核梭杆菌通过产生有毒代谢物成为牙周病原体
这些有毒成分具有杀死或阻止附近牙周正常细胞(成纤维细胞)增殖的能力。
F. nucleatum形成的硫化物可能为细菌提供了一种避开宿主免疫系统的方法。丁酸(以组织刺激性丁酸的形式)、丙酸和铵离子,由具核梭菌产生,抑制人牙龈成纤维细胞的增殖。
具核梭杆菌有穿透牙龈上皮的能力
且在与牙周炎相关的斑块中,以高水平存在。
因此,它们可能对产生牙龈炎等口腔疾病具有非常重要的作用。
毒素的作用对细胞来说不是致命的,但成纤维细胞增殖的抑制很严重,因为伤口快速愈合的潜力受到了损害。
通过对龈下菌斑样本进行聚类分析,发现牙菌斑中的细菌之间存在特定关联。如下图,如金字塔所示,存在各种细菌。具核梭杆菌在金字塔的中间。
梭杆菌属参与口腔癌发生和癌症进展的示意图
编辑
Fujiwara, Natsumi et al, INT J MOL SCI, 2020
在金字塔中部的物种中,具核梭菌在牙菌斑形成后期的牙齿生物膜中占优势。
如上所述,梭杆菌感染通过各种反应影响 OSCC 的肿瘤发生和发展。然而,梭杆菌的靶分子仍然未知。需要进一步的研究来阐明梭杆菌参与 OSCC 肿瘤发生和发展的证据。
梭杆菌属物种可能与炎症性肠病 (IBD) 有关,包括溃疡性结肠炎和克罗恩病。IBD 是一个已知的危险因素,它是结直肠癌的三个最高风险因素之一。
已报道了几种梭杆菌菌株与 IBD 相关。然而,大多数 (69%) 与F. nucleatum相关。
F. nucleatum和其他梭杆菌属物种可以引发宿主促炎反应,并具有促进它们与宿主上皮细胞粘附的毒力特征以及它们侵入上皮细胞的能力细胞。
因此,与正常邻近组织和健康对照中的水平相比,结直肠癌中的具核梭杆菌富集,这些微生物可能导致肿瘤发生的可能性,可能在有限的患者亚群中,最可能是通过炎症介导的机制。
具核梭杆菌在结直肠癌患者中丰度及作用
最近的一项荟萃分析表明,与邻近的健康组织和对照组的健康组织相比,结直肠肿瘤组织中检测到具核梭杆菌DNA 的几率更高。与对照组的健康组织相比,结直肠息肉组织中的具核梭杆菌DNA 也较高。
结直肠癌患者粪便样本中,具核梭杆菌高
研究表明,结直肠癌患者的粪便样本中F. nucleatum 含量丰富。Meta 分析发现,与健康对照组相比,结直肠癌患者粪便样本中具核梭菌阳性的综合几率更高;与结直肠息肉患者相比,结直肠癌患者更高;但与健康对照相比,结肠直肠息肉患者的情况并非如此。
F. nucleatum已从消化道其他部位的癌症中分离出来,即胰腺 、食道和胃。
肿瘤内具核梭杆菌可能起源于口腔
有趣的是,已经表明结直肠癌中的具核梭杆菌菌株与从口腔中分离的该物种的菌株相同,这表明肿瘤内具核梭杆菌可能起源于口腔。如果来自口腔的具核梭菌在口腔外部位的癌症发展中起作用,那么假设这种细菌可能导致口腔本身的致癌作用是合理的。
具核梭菌感染诱导特定的肿瘤分子事件
F. nucleatum曾经被认为是胃肠道中的被动细菌。然而,现在人们认识到,具核梭菌感染可以在结直肠癌中诱导一系列特定的肿瘤分子事件,包括 CpG 岛甲基化表型、微卫星不稳定性以及BRAF和TP53的基因突变。
肿瘤内有具核梭杆菌的存在,与较差生存率相关
此外,许多这些研究已经确定,肿瘤内有具核梭杆菌的存在与较差的生存率有关 。还观察到,具核梭杆菌感染与更差的临床病理学特征相关,例如更大的肿瘤、更差的分化、淋巴结和远处转移、晚期肿瘤分期和更深的肿瘤侵袭。
总之,结直肠癌微生物组的基因组分析揭示了这些癌症中梭杆菌属的显着富集,尤其是与具核梭杆菌、死亡梭菌和坏死梭杆菌具有最大相似性的种系型。这种富集通过肿瘤组织的组织学分析以及结肠肿瘤转移中梭杆菌DNA 的鉴定得到证实。
梭杆菌介导结直肠癌发生,随着肿瘤转移进肝脏
2017年发表在《Science》肠道细菌Fusobacterium介导结肠癌的发生及伴随肿瘤的转移。作者进行以下操作:
结果发现,10个患者里面,只有2个患者的原位病灶和肝转移病灶中Fusobacterium含量不一样,其他8个病人是高度吻合的(Fuso-qPCR)。
由以上结果我们可以得知:Fusobacterium阳性的患者中,原发灶和肝转移灶中的细菌谱是高度相似的。Fusobacterium很有可能能够随着结肠癌一起进入肝脏。
接下来,作者从病人体内分离出Fusobacterium,通过给小鼠口服Fusobacterium,发现可以诱导结肠癌的产生。同时再次分离小鼠结肠癌中的细菌,通过测序发现,小鼠结肠癌中的细菌谱跟之前病人结肠癌中的细菌谱也是高度一致的。
是否可通过抗生素消灭具核梭杆菌及其他细菌,能否抑制结肠癌的生长?
作者先使用了没有Fusobacterium的细胞系HT-29,通过皮下成瘤,发现甲硝唑并不能够抑制肿瘤的生长。然后使用了从结肠癌患者的肿瘤组织中分离出Fusobacterium,诱导产生结肠癌。发现甲硝唑能够显著抑制肿瘤的生长。
具核梭杆菌高与复发相关
此外,上海交通大学仁济医院房静远教授团队在《Cell》上发表了相关论文,发现在肿瘤复发患者中肠菌具核梭杆菌含量明显升高,并明确了该菌诱导癌细胞自噬而导致化疗耐药与肿瘤的术后复发机制,从而引起大肠癌患者五年生存率降低。
另外,2017年发表在《Gastroenterology》上复旦大学肿瘤研究所领衔完成和《Oncotarget》(由西南医科大学领衔完成)杂志上的两篇也从另外的角度阐述了具核梭杆菌促进肿瘤发生发展的分子机制。
总结一下梭杆菌与结肠癌的进展:
1)研究发现Fusobacterium在结肠癌组织中大量富集;
2)研究发现Fusobacterium能够抑制免疫,减少T细胞的在肿瘤组织中的浸润;
3)研究发现Fusobacterium能够促进结肠癌的发生和发展,通过给小鼠口服Fusobacterium可以诱导结肠癌的产生;
4)研究发现Fusobacterium在结肠癌原位和肝转移灶都能检测到,意味着Fusobacterium可能能够跟随肿瘤细胞一起转移到肝;
5)研究发现使用抗生素消灭Fusobacterium后可以抑制结肠癌细胞的生长(这里使用甲硝唑做实验并不代表今后治疗中可以直接使用,毕竟这是个广谱抗生素)。
那这些研究对我们临床有什么启示呢?
近些年来的很多研究都表明,Fusobacterium与结直肠癌的发生有很大的关联性。我们知道肿瘤防治重点在于防而不在于治。关于肿瘤跟细菌的相关研究,大家最熟悉的是幽门螺杆菌和胃癌的研究。
2017年8月《Nature》首度报道了幽门螺杆菌导致胃癌发生的机制。通过对幽门杆菌的清除可以将胃癌的患病风险降低65%,那么通过以后监测Fusobacterium以及清除Fusobacterium可能为以后结肠癌的预后提供新的思路。同时,为什么Fusobacterium能够介导结肠癌的发生也同样值得研究。
越来越多的证据表明,微生物会影响癌症治疗的效果。具核梭杆菌在具有不同微卫星不稳定性 (MSI) 状态的结直肠癌中,诱导不同的免疫反应。
增强PD-L1阻断剂疗效
高F. nucleatum水平与结直肠癌患者对 PD-1 阻断的治疗反应改善相关。此外,F. nucleatum增强了 PD-L1 阻断剂对小鼠结直肠癌的抗肿瘤作用并延长了生存期。结合F. nucleatum补充免疫疗法,挽救了 PD-L1 阻断的治疗效果。
激活信号,诱导 PD-L1 表达
此外,具核梭杆菌通过激活 STING 信号传导诱导 PD-L1 表达,并在 PD-L1 阻断治疗期间增加干扰素-γ (IFN-γ) + CD8 +肿瘤浸润淋巴细胞 (TIL) 的积累,从而增强肿瘤对PD-L1 阻断。
最后,源自患者的类器官模型表明,增加的具核梭菌水平与改善对 PD-L1 阻断的治疗反应相关。这些发现表明,F. nucleatum可能会调节结直肠癌的免疫检查点治疗。
1
与其他微生物共聚集
F. nucleatum是早期和晚期定植者之间的关键“桥梁”生物,其外膜粘附素 Fap2 部分负责促进多物种生物膜的形成 。当口腔生物膜中报告牙龈卟啉单胞菌(P. gingivalis)时,始终存在F. nucleatum,这表明它先于该物种,并且是其殖民化所必需的。
P. gingivalis是一种酸敏感细菌,但F. nucleatum可以通过发酵谷氨酸和天冬氨酸产生氨,从而为P. gingivalis定殖提供更中性的环境。
F. nucleatum和P. gingivalis可能协同工作,通过引发慢性炎症来促进肿瘤变化,刺激了人 OSCC 细胞的体外增殖 。
白色念珠菌是一种机会性致病酵母,常见于胃肠道和口腔。最近的真菌生物组研究表明,OSCC 中包括白色念珠菌在内的几种真菌种类的丰度增加 。众所周知,口腔中的念珠菌属具有乙醇脱氢酶,负责催化酒精产生乙醛,乙醛是一种有效的致癌物质 。已经表明,具核梭菌与念珠菌共聚集,这可以促进定殖。念珠菌口腔白斑的定植与F. nucleatum水平升高有关。F. nucleatum可能通过增加口腔黏膜与念珠菌产生的乙醛的接触而间接增加口腔癌的风险。
2
激活细胞增殖
最简单的癌症是不受控制的细胞生长,而有核梭菌已被证明通过与内皮钙粘蛋白(E-钙粘蛋白)相互作用来影响癌细胞的增殖。梭杆菌 FadA 与在宿主细胞膜表面表达的 E-钙粘蛋白结合。E-cadherin 是一种通过 β-catenin 发挥作用的肿瘤抑制因子。梭杆菌 FadA 与 E-cadherin 的相互作用激活 WNT/β-catenin 信号传导,导致细胞增殖并增加致癌和炎症基因的表达。
类似地,已显示F. nucleatum通过激活 Toll 样受体 4 (TLR4) 向 MYD88 发出信号来增加小鼠异种移植物中的 CRC 增殖,从而导致核因子 NFκB 的激活和 miR21 的表达增加;这种 miRNA 降低了负责控制细胞增殖和分化的 RAS GTPase RASA1 的水平 。
由细胞周期蛋白激活的细胞周期蛋白依赖性激酶促进细胞周期进程。F. nucleatum感染与细胞周期蛋白 D1 的激活有关,这促进了肠道肿瘤的发生 。在 OSCC 中,F. nucleatum和P. gingivalis均被证明能够通过上调 cyclin D1 和 c-Myc显着刺激 OSCC 细胞增殖。
TLR4 的细菌激活导致白细胞介素 6 (IL-6) 的表达增加,白细胞介素 6 (IL-6) 反过来又激活了 STAT3,这是一种负责调节细胞周期蛋白 D1 和 c-Myc 的关键信号分子 。而且,F. nucleatum通过降低 p27(一种细胞周期蛋白依赖性激酶抑制剂)的表达和加速细胞周期来引起 DNA 损伤并促进口腔癌细胞的细胞增殖 。此外,具核梭菌下调 DNA 修复蛋白 Ku70 和 p53,从而削弱细胞修复能力。
最近的一项研究发现,HNSCC 中具核梭菌的富集与宿主基因启动子甲基化有关,包括肿瘤抑制基因LXN和SMARCA2的高甲基化。SMARCA2是一种参与与 DNA 修复和复制相关的 ATP 依赖性染色质重塑的基因。这表明F. nucleatum感染可能通过表观遗传沉默导致细胞增殖。
3
炎症的诱导
F. nucleatum的促炎潜力已得到充分证明,因为它可以促进活性氧 (ROS) 的产生和细胞因子的产生 。慢性炎症在致癌过程中起着关键作用,并且可以解释牙周炎与 OSCC 高风险之间的密切关联。已发现具核梭菌与 CRC 和 OSCC 中的高细胞因子水平相关,从而产生支持肿瘤进展的炎症微环境 。LPS,存在于细胞外膜中F. nucleatum激活 TLR4 介导的 NF-κB 信号通路以产生促炎细胞因子,如 IL-6、IL-8 和肿瘤坏死因子 α 。
4
抗肿瘤免疫反应
F. nucleatum在 ApcMin/+ 小鼠模型中已显示将骨髓来源的抑制细胞募集到肿瘤微环境中。髓源性抑制细胞可抑制 T 细胞增殖并诱导 T 细胞凋亡 。
这与最近发现的F. nucleatum的数量与结肠直肠癌和乳腺癌组织中 CD3 和 CD4 T 细胞的密度之间的负相关的发现一致。
还观察到 OSCC 中具核梭菌负荷与 B 淋巴细胞、CD4 T 辅助淋巴细胞、M2 巨噬细胞和成纤维细胞的标志物之间存在显着负相关。
F. nucleatum抑制蛋白还可以通过将细胞阻滞在细胞周期的 G1 期来抑制人类 T 细胞活化 。梭杆菌 Fap2 粘附素结合并激活具有 Ig 和 ITIM 结构域 (TIGIT) 的 T 细胞免疫受体,TIGIT 是 T 细胞和自然杀伤 (NK) 细胞中的一种免疫调节信号受体。这种 Fap2-TIGIT 相互作用可保护具核梭菌和附近的肿瘤细胞免于被免疫细胞杀死。局部免疫抑制也可能发生,因为有核梭菌的Fap2和 RadD 外膜蛋白会诱导淋巴细胞中的细胞死亡。
F. nucleatum还通过促进有核梭菌相关 CRC中巨噬细胞的 M2 极化发挥免疫抑制作用,可能通过 TLR4/IL-6/p-STAT3/c-MYC 信号通路。
5
细胞迁移和侵袭
基质金属蛋白酶 (MMP) 是一个锌依赖性内肽酶家族,它们共同能够降解细胞外基质 (ECM) 的所有成分。MMP 在 ECM 过度降解的病理状况中发挥作用,包括肿瘤侵袭和转移。P. gingivalis和F. nucleatum都可以通过不同的机制产生 MMP,从而促进癌细胞的侵袭和转移。
在 OSCC 中,已观察到暴露于牙龈卟啉单胞菌和具核梭菌导致 MMP-1 和 MMP-9 的诱导。同样,与F. nucleatum一起孵育的 AT3 小鼠乳腺癌细胞也表现出 MMP-9 的过表达。
上皮-间质转化 (EMT) 定义为上皮细胞采用间充质表型的过程,是在癌症发展和进展中观察到的现象。
一般来说,进入 EMT 的细胞表现出上皮标志物(如 E-钙粘蛋白)的下调和间充质标志物的上调,包括神经钙粘蛋白(N-钙粘蛋白)和波形蛋白 。这种细胞分化行为的转变是由一组转录因子控制的,包括锌指 E-box 结合同源框 1 和 2 蛋白 (ZEB1/2)、SNAIL 和 TWIST。
CRC 中高水平的具核梭杆菌与 E-cadherin 表达呈负相关,但与 N-cadherin 表达呈正相关。同样,OSCC 细胞系暴露于F. nucleatum与 E-cadherin 转录的显着降低以及 N-cadherin、vimentin 和 Snail 的上调有关。
F. nucleatum可以上调ZEB1 在口腔癌细胞中诱导这种间充质状态,一种先前已在H. pylori感染的胃上皮细胞中发现的机制。
痛风
痛风患者中普氏杆菌(Prevotella)、梭杆菌(Fusobacterium)和拟杆菌(Bacteroides)的相对丰度增加,而肠杆菌科(Enterobacteriaceae)和产丁酸盐菌的相对丰度减少。
胃肠道肿瘤
梭杆菌属(Fusobacterium)在胃肠道肿瘤的发生和发展中起重要作用。与正常组织样本,尤其是正常血源性样本相比,原发肿瘤中梭杆菌较多。泛癌分析还显示,在原发肿瘤组织和邻近正常组织样本中,将所有胃肠道癌(n = 8)与非胃肠道癌(n = 24)进行比较时,梭杆菌丰富度都是较高的。
胰腺导管腺癌
与其他肿瘤相比,胰腺导管腺癌中的肿瘤相关细菌 Gammaproteobacteria较多,尤其是肠杆菌Enterobacterales,与胃癌和结肠癌不同的是,它们的梭杆菌fusobacteria 较少。
口腔和唾液微生物群组成的改变与PDAC(胰腺癌主要是指胰腺导管腺癌,简称PDAC)的风险相关。最近的研究表明,口腔中参与PDAC肿瘤发生的主要致病菌有:
在健康对照组和胰头癌患者中分别观察到嗜血杆菌、卟啉单胞菌、纤毛杆菌、梭杆菌的丰度有显著差异。
PDAC肿瘤内梭杆菌的定殖与PDAC患者的预后更差相关。这项研究的结果表明,梭杆菌属可以作为PDAC的预后生物标志物。
梭杆菌的严重程度和传播范围,决定了所需治疗程度
一般所有梭杆菌感染都必须用抗生素治疗,并且通常对 β-内酰胺类药物敏感,例如青霉素或头孢菌素或其衍生物。
一些梭杆菌菌株被发现含有 β-内酰胺酶,因此建议使用特定的厌氧抗生素,例如甲硝唑或克林霉素。
适当的抗生素治疗与手术清创相结合可预防并发症
抗生素治疗通常通过肠胃外给药 1 至 2 周,然后进行大约 10 天的口服治疗。有些孩子需要切除坏死组织或手术引流。
在一项对 7 名小于 2.2 岁的梭杆菌感染患者的监测研究中,除了乳突切除术外,所有患者都需要一根通气管。
在以色列对 22 名感染梭杆菌的儿童进行的一项为期 14 年的研究中,5 名出现 Lemierre 综合征的患者中有 3 名接受了低分子量肝素治疗以缓解脑窦静脉血栓形成的症状,但是该治疗仍存在争议。
一项 40 年文献回顾确定了, 12 例 2 岁以下儿童的梭杆菌感染病例;所有儿童都出现了乳突炎,并接受了乳突切除术和抗生素治疗,无论严重程度如何,都取得了成功。
早期发现和适当治疗,可以有效阻止和逆转感染的进展
梭杆菌感染在 2 岁及以下的儿童中,临床表现为急性中耳炎,但如果不及时治疗,则会发展为乳突炎和更严重的菌血症、骨髓炎症状,并可能出现 Lemierre 综合征和感染性休克。
使用适当的抗菌检测技术以及适当的成像程序应允许及时使用抗生素和手术参与,以防止感染的进一步传播。
虽然对梭杆菌感染的研究和分析有限,但对感染症状和严重程度的重要认识可以帮助临床医生发现感染的早期发作并将患者引导至适当的专科医生处。
口腔牙周病感染中,高达 90% 的菌群由专性厌氧菌组成,钙化合物已被证明是牙科中有价值的材料。钙与酯的配方在牙齿结构的愈合过程中表现出显着的特性。根据国外“Calcium Therapy Institute”研究所的介绍,他们长达16 年的时间里,发现使用钙化合物来开发治疗牙髓和牙周(牙龈和骨)感染的牙周治疗钙法 (CMPT)具有重要意义。
口腔厌氧菌分散的一个原因是梭杆菌在上颌骨中获得了稳定的立足点,以增殖并将其大量的毒素释放到多孔的上颌骨、上颚和下牙列中。这个过程与人体正常的进食、呼吸、说话和吸吮机制相联系,是梭杆菌对人体细胞异常失衡的完美寄生关系。
北美该研究人员最近报告了的一项突破,发现厌氧细菌被局部刺激或炎症所吸引,会开启“饥饿触发”信号,向侵袭性细菌发出信号,释放一种酶以减少抗生素的影响。
这种自我饥饿细菌的“饥饿信号”会产生一种冬眠状态,或者说是防御状态,直到不再使用抗菌药物。他们进入休眠状态,只是为了在更有利的条件下重新发动进攻。
该研究所实验人员发现舌下颌下腺唾液肽的生物学特性,以及用于根管和牙周治疗的钙材料有助于深入了解答案。
它们是具有解热、抗炎、定时释放特性的非类固醇。几项临床研究表明,长期摄入唾液腺分泌物和对组织有益的钙材料具有积极的全身作用。
——降低有害菌的复制率
在 1980 年代中期,一些的血清研究表明,某些钙质材料不会杀死细菌,而是“降低”它们的复制率,而流行的抗菌剂在几毫秒内杀死一切,包括健康的细胞和细菌。在那项研究中,根据对口腔组织钙治疗的多年临床观察,消除细菌需要十个小时。关键因素是时间。
鉴于饥饿细菌的发现,钙材料会发出警报,但不会造成伤害。
——饿死那些“自我饥饿的细菌”
几十年来,钙疗法已被证明对口腔或皮肤的任何正常健康细胞无害,同时它们还能维持环境“围攻”。不是直接杀死它们,而是逐渐将饥饿细菌饿死。
然后,由于几乎没有复制能力,它们开始消亡,而健康细胞迅速蓬勃发展并主导该领域,尤其是在定时释放钙离子的情况下。
如果厌氧梭杆菌最常存在于口腔、牙菌斑中,并且与牙周病和炎症性牙龈炎有关,那么梭杆菌的下一个最有利的栖息地是结肠,可以刺激溃疡性结肠炎、癌症和克罗恩病。
口腔和结肠这两个区域很容易受到异常水平的梭杆菌的影响,这会长时间造成炎症环境并增强细胞的扩散或分布,甚至会扩散到以厌氧微生物而臭名昭著的身体远处器官。众所周知,生物膜菌落容易引起囊性和脓肿感染。
梭杆菌的管理,中和它们的毒素仍然在控制厌氧微生物环境的范围内。同样,健康的一个主要考虑因素是限制侵入性病原体的局部和全身传播。
从用钙材料管理口腔环境可以明显看出,下颌前切牙上的斑块沉积快速愈合和减少。对口腔黏膜和牙周组织进行长期钙治疗的患者会显著减少牙菌斑和牙石。
考虑到梭杆菌的两个最主要的聚集地,口腔和结肠,那么未来继续研究钙材料应该是价值的。这种病原体比预期的更容易控制,至少在口腔和下消化道的炎症和感染的早期阶段是如此。
声明:关于药物、诊断和治疗方法的部分中提供的信息仅供医疗专业人员交流使用,并非使用说明。
主要参考文献:
Brennan CA, Garrett WS. Fusobacterium nucleatum – symbiont, opportunist and oncobacterium. Nat Rev Microbiol. 2019 Mar;17(3):156-166. doi: 10.1038/s41579-018-0129-6. PMID: 30546113; PMCID: PMC6589823.
Susan Bullman et al. Analysis ofFusobacteriumpersistence and antibiotic response in colorectal cancer, Science (2017). DOI: 10.1126/science.aal5240
Castellarin M, Warren RL, Freeman JD, Dreolini L, Krzywinski M, Strauss J, Barnes R, Watson P, Allen-Vercoe E, Moore RA, Holt RA. Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma. Genome Res. 2012 Feb;22(2):299-306. doi: 10.1101/gr.126516.111. Epub 2011 Oct 18. PMID: 22009989; PMCID: PMC3266037.
Kostic AD, Gevers D, Pedamallu CS, Michaud M, Duke F, Earl AM, Ojesina AI, Jung J, Bass AJ, Tabernero J, Baselga J, Liu C, Shivdasani RA, Ogino S, Birren BW, Huttenhower C, Garrett WS, Meyerson M. Genomic analysis identifies association of Fusobacterium with colorectal carcinoma. Genome Res. 2012 Feb;22(2):292-8. doi: 10.1101/gr.126573.111. Epub 2011 Oct 18. PMID: 22009990; PMCID: PMC3266036.
Vidaurrazaga MM, McKinley GF, Camins BC. Postpartum Fusobacterium gonidiaformans bacteremia. Anaerobe. 2020 Apr;62:102168. doi: 10.1016/j.anaerobe.2020.102168. Epub 2020 Jan 28. PMID: 32045837.
Centor RM, Huddle TS. Should the risk of Fusobacterium necrophorum pharyngotonsillitis influence prescribing empiric antibiotics for sore throats in adolescents and young adults? Anaerobe. 2021 Oct;71:102388. doi: 10.1016/j.anaerobe.2021.102388. Epub 2021 Jun 2. PMID: 34089856.
Duncan SH, Hold GL, Harmsen HJM, Stewart CS, Flint HJ. Growth requirements and fermentation products of Fusobacterium prausnitzii, and a proposal to reclassify it as Faecalibacterium prausnitzii gen. nov., comb. nov. Int J Syst Evol Microbiol. 2002 Nov;52(Pt 6):2141-2146. doi: 10.1099/00207713-52-6-2141. PMID: 12508881.
Arane K, Goldman RD. Fusobacterium infections in children. Can Fam Physician. 2016 Oct;62(10):813-814. PMID: 27737977; PMCID: PMC5063768.
Peluso EA, Scheible M, Ton-That H, Wu C. Genetic Manipulation and Virulence Assessment of Fusobacterium nucleatum. Curr Protoc Microbiol. 2020 Jun;57(1):e104. doi: 10.1002/cpmc.104. PMID: 32539234; PMCID: PMC7398570.
Broadley M, Schweon SJ. Get the facts about Fusobacterium. Nursing. 2017 May;47(5):64-65. doi: 10.1097/01.NURSE.0000515524.23032.d5. PMID: 28445341.
Tadepalli S, Narayanan SK, Stewart GC, Chengappa MM, Nagaraja TG. Fusobacterium necrophorum: a ruminal bacterium that invades liver to cause abscesses in cattle. Anaerobe. 2009 Feb-Apr;15(1-2):36-43. doi: 10.1016/j.anaerobe.2008.05.005. Epub 2008 May 24. PMID: 18595747.
Mark J. Manhart DDS, Thomas B. Steg DDS,2011, Calcium Method of Fusobacteria Management. Alciumtherapy.com

谷禾健康

Alistipes是拟杆菌门的一种革兰氏阴性细菌,也是相对新的细菌属,主要从医学临床样本中分离出来。该菌的生态失调,可能是有益的也可能是有害的。
Alistipes可能对某些疾病有保护作用,包括肝纤维化、癌症免疫治疗和心血管疾病。相比之下,其他研究表明Alistipes在结直肠癌中具有致病性,并且与抑郁症有关。
该菌避开富含植物性食物的饮食,可以在高脂肪饮食中茁壮成长,并且在肥胖患者的肠道微生物群中生长得特别好,表明与肥胖相关。
Alistipes 是拟杆菌门中的一个属,革兰氏阴性,专性厌氧,是肠道共生的细菌,G+C 含量为55–58%,直径为 0.2–0.9 µm,长度为 0.5–4 µm 的直或略微弯曲的棒状,末端为圆形。不会形成孢子。细胞通常单独或成对出现,偶尔以较长的细丝出现。
不运动,可产生吲哚。不能还原硝酸盐,不水解精氨酸和尿素,葡萄糖代谢终产物是琥珀酸和少量的乙酸,丙酸。
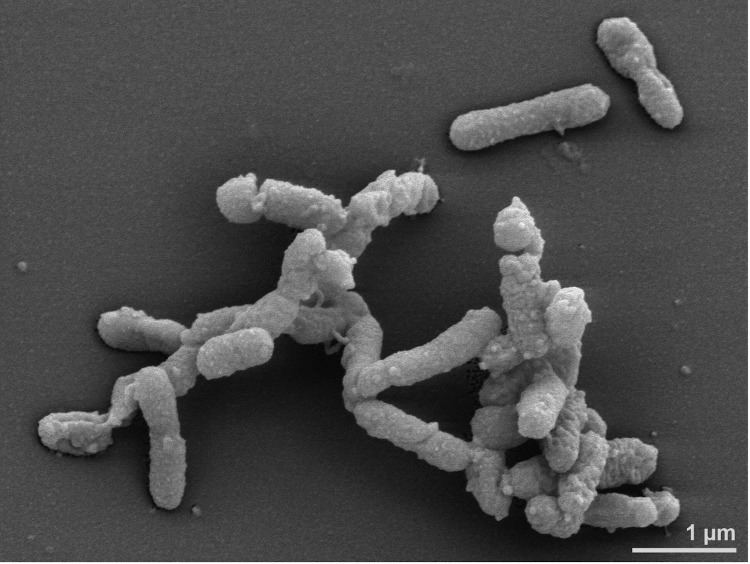
microbiomology
在分类学上,Alistipes 是在 2003 年在患有阑尾炎的儿童的组织样本中发现后描述的一个属。第一个被发现的Alistipes物种是Alistipes Finegoldii,它是以美国厌氧细菌学和传染病临床研究学家Sydney M. Finegold 的名字命名,极大地促进了我们对厌氧菌的理解。
根据NCBI分类数据库,目前Alistipes由13个物种组成:
2017 年从肠易激综合征患者的结肠中分离出来一种名为Tidjanibacter massiliensis Marseille-P3084 的新物种,与A. putredinis具有 92.1% 的序列同源性,不过该菌株尚未被官方认可或存放在公共菌株生物储存库中。
此外,三个较新的亚种:
从生态学角度来看,Alistipes主要存在于健康人的肠道中。然而,Alistipes也从其他液体中分离出来、如尿液、阑尾、腹部、直肠周围和脑脓肿中分离出来,突出了它们在人类疾病中潜在的机会致病作用。
A. putredinis(ATCC 29800 T型菌株)已从各种标本中分离出来,例如粪便、急性阑尾炎患者的阑尾组织、腹部和直肠脓肿、甚至农场土壤。该菌株对克林霉素、头孢西丁、氯霉素、红霉素和甲硝唑敏感,对四环素和强力霉素有中度耐药。
Alistipes finegoldii 已被认为是肉鸡的生长促进剂,并且已观察到在人类中,A. putredinis随着十字花科蔬菜摄入量的增加而增加,因此可以合理假设不同的Alistipes物种在营养和健康方面可能具有不同的作用。
A. onderdonkii和 A. shahii 分别从腹部脓肿和阑尾组织以及尿液中分离出来。它们具有圆形菌落。这两个种都对 20% 的胆汁具有抗性,并将色氨酸水解为吲哚。它们是过氧化氢酶、氮还原酶和脲酶阴性。琥珀酸是主要的代谢终产物,少量产生乙酸和丙酸。
其他两个种,A. senegalensis 和 A. timonensis 最初是从健康患者的粪便菌群中分离出来的。它们有圆形菌落并产生色素,可以将色氨酸水解为吲哚。A. senegalensis会发酵甘露糖,而A. timonensis 不会。这些细菌菌株对青霉素、阿莫西林加克拉维酸、亚胺培南和克林霉素敏感。此外,A. senegalensis菌株对甲硝唑耐药,A. timonensis 菌株对甲硝唑敏感。
Alistipes inops从人类粪便中分离出物种。它对吲哚产生呈阳性,对过氧化氢酶、硝酸还原酶和脲酶呈阴性。这种细菌是非发酵的,主要代谢终产物是琥珀酸和乙酸。
A. megaguti (Marseille-P5997 T型菌株)是从一名年轻健康女性的新鲜粪便样本中分离出来的。
A. megaguti是过氧化氢酶、脲酶和氧化酶阴性。
A. provencensis (Marseille-P2431 T型菌株) 分离自一名患有高血压和糖尿病的男性患者。该种属氧化酶和脲酶阴性,而过氧化氢酶阳性。
A.ihumii 已从患有神经性厌食症的患者的粪便中分离出来,而A.obesi则从患有病态肥胖症的患者中分离出来。
该菌属大部分耐胆汁,因此,有必要确定对胆汁酸的抗性是否确实决定了Alistipes胃肠道内的区域性富集,或临床上以胆汁改变为特征的疾病,其与Alistipes菌的关系。
肝病和短链脂肪酸中的 Alistipes
肝细胞癌 (HCC) 是全球第二大致命癌症。HCC 通常是由肝硬化、非酒精性脂肪肝病 (NAFLD) 或非酒精性脂肪性肝炎 (NASH) 引起的晚期肝纤维化发展而来的。这些肝脏疾病与“微生物-肝轴”有关,表明生态失调是潜在原因之一。
肝纤维化中Alistipes减少
在对微生物群组成和肝纤维化进行的研究中可以看出,在纤维化的整个进展过程中,Alistipes减少。
例如,在代偿性和失代偿性肝硬化 (LC) 患者中,来自健康志愿者和各种类型 LC 患者的新鲜粪便宏基因组序列表明,与健康对照组相比,A. shahii和A. putredinis菌减少。
针对 LC 患者粪便和活检的研究中,与 LC 患者相比,健康对照患者的Alistipes丰度增加。
代偿发展到失代偿,Alistipes减少
随着疾病从代偿发展到失代偿,观察到Alistipes indistinctus 的减少。一旦个体出现失代偿性肝硬化,患者就会开始产生多种严重并发症,例如肝性脑病。
另一项研究表明,在比较失代偿性肝硬化和急性肝性脑病患者的粪便微生物群时,Alistipes具有保护作用,其丰度的降低与肝性脑病复发的增加相关。因此,Alistipes的减少与肝硬化进展为失代偿状态有关。
NASH 和 NAFLD中 Alistipes 降低
在NASH 和 NAFLD 等其他纤维化疾病中可以看到肝纤维化患者的Alistipes丰度降低。有实质性纤维化的 NAFLD 患者粪便中乙酸盐和丙酸盐浓度降低,丁酸盐浓度无显着差异。当将健康对照与 NASH 患者进行比较时,A. finegoldii 显着减少,标准化计数平均值从 542 减少到 19。在具有显着纤维化的 NAFLD 患者中,观察到 A. onderdonkii 的显着减少从 285 到 31。
Alistipes生产短链脂肪酸
值得注意的是,这些晚期纤维化患者的粪便乙酸盐和丙酸盐水平降低。
Alistipes是一种丙酸生产者,表达甲基丙二酰辅酶A差向异构酶,其中该酶的基因位于具有乙酰辅酶A羧化酶基因的操纵子上。
此外,Alistipes是乙酸盐生产者,由于先前的研究表明短链脂肪酸具有抗炎机制,因此可以表明Alistipes 减少促使短链脂肪酸减少,可能加剧这些 NAFLD 患者中的晚期纤维化。
心血管疾病、高血压和上皮中的 Alistipes
心血管疾病 (CVD) 是发展中国家和发达国家死亡和发病的主要原因。随着全球人口老龄化,预计心血管疾病在未来会上升,因此对与肠道微生物群关系的评估进行了更广泛的研究。
Alistipes与高血压等心血管疾病风险因素以及心房颤动 (AF)、充血性心力衰竭 (CHF) 和动脉粥样硬化性心血管疾病 (ACVD) 等多种心血管疾病相关。
各种研究表明,Alistipes在心血管疾病中起保护作用。
心房颤动患者Alistipes减少
Alistipes与心房颤动 (AF) 等心血管疾病直接相关。心房颤动是最常见的心律失常,在高血压、心力衰竭和肥胖患者中普遍存在。
为了量化肠道微生物组和心房颤动之间的关系,对来自中国参与者的 100 个粪便样本全基因组鸟枪序列进行分析,显示在心房颤动患者肠道中Alistipes急剧减少。
Alistipes和链球菌的拮抗作用
然而,研究中提出在心房颤动期间急剧增加的细菌,如链球菌,可能是导致Alistipes下降的原因,这表明Alistipes和链球菌之间存在潜在的拮抗作用。这种趋势在其他心脏病中很常见,例如 ACVD和 CHF。
但是Alistipes在心血管疾病中证据是矛盾的,尚不清楚关联是保护性的、有益的还是致病的。因为大多数心血管疾病具有共同的病理生理特征,例如内皮功能障碍 ,Alistipes的作用可能取决于多个心血管疾病共享的疾病机制。因此,更多关于肠心轴的研究可能会导致未来对微生物组相关疾病和潜在疗法的理解。
高血压中Alistipes有助于炎症和上皮细胞的改变
宏基因组分析研究了 22 名高血压患者和 18 名对照患者的粪便样本。数据显示A. finegoldii和A. indistinctus的增加与收缩压呈正相关,表明该物种是高血压患者肠道屏障功能障碍和炎症的潜在驱动因素,但是该研究样本量较少,证据力度不大。
肠道炎症和结直肠癌中不一样的 Alistipes
由于胃肠道中微生物群的多样性,菌群失调与炎症性肠病(IBD)之间存在很强的相关性。
人群中最常见的炎症性肠病是克罗恩病 (CD) 和溃疡性结肠炎 (UC)。溃疡性结肠炎是一种主要针对结肠的慢性炎症性疾病。有人提出A. Finegoldii是一种针对结肠炎的保护性物种,因为A. Finegoldii在患有结肠炎的小鼠中减少。
基于这个事实,进行了一项研究,其中微生物群耗竭的小鼠用口服 DSS 治疗以诱发结肠炎。当用 A. finegoldii 灌胃时,结肠炎的严重程度与野生小鼠相似。当给患上结肠炎小鼠添加了A. finegoldii和 Bacteroides Eggerthii (一种结肠炎诱导细菌)时,与单独添加B. Eggerthii 或添加其他细菌(如Parabacteroides distasonis或Prevotella falsenii)的小鼠相比,结肠炎的严重程度显着降低,这进一步表明A. Finegoldii是一种减轻结肠炎的细菌。
具有对比临床意义的是,已从严重克罗恩病的肠壁海绵状瘘管 (CavFT) 微病变中分离出与其他拟杆菌有关的 A. finegoldii. 对自发性克罗恩病回肠炎小鼠模型粪便样本的宏基因组研究显示,与亲代 AKR/J 小鼠群体相比,Alistipes 富集。
8 周龄 NOD2 敲除小鼠富含Alistipes、抗炎细胞因子(TGF-β 和 IL-10)和 CD4 + LAP + FoxP3 –调节性 T 细胞。这些观察结果的一个可能联系来自对姜黄素的研究,姜黄素是一种已被证明可通过 IL-10增加 CD4 + LAP + FoxP3 -细胞来调节肠道炎症的香料。
有趣的是,有炎症的患者服用益生菌后,Alistipes增加了。迄今为止,尚不清楚该属与肠道中的其他微生物(包括食物和益生菌菌株)之间存在哪些相互作用机制。
诱发结直肠癌
已发现Alistipes作为潜在的病原体可能会诱发结直肠癌。A. Finegoldii 通过 IL-6/STAT 3 途径促进右侧结直肠癌。报告指出Alistipes能产生磺脂,已知磺脂类药物可作为血管性血友病因子受体的拮抗剂并抑制肿瘤坏死因子-α (TNF-a),这些物质与微炎症和血管内皮功能障碍有关。
Lipocalin 2 (LCN 2) 是一种与铁载体结合的抗微生物蛋白,最终会降低铁的利用率。
在 IBD 患者中,LCN 2 在黏膜和粪便样本中的浓度很高。从本质上讲,这可以减少Alistipes的繁殖,因为铁是A. finegoldii 生长的调节因子。
小鼠研究表明A. finegoldii在 WT、LCN 2 KO 和 IL-10 KO C57BL/6J 小鼠中口服给药 1 周后引起肠道炎症。因此,该论文得出结论,Alistipes在缺乏 LCN 2 并促进炎症和肿瘤形成的发炎环境中茁壮成长。此外,他们发现在盲肠中发现Alistipes finegoldii的丰度高于大肠内的其他位置。
癌症免疫疗法中的Alistipes
该属已被证明可以通过调节肿瘤微环境在癌症免疫治疗中发挥有益作用。癌症的主要标志之一是逃避免疫系统。因此,一种形式的抗癌治疗是操纵肿瘤微环境。
免疫疗法的一个例子是通过诱导肿瘤相关骨髓细胞产生肿瘤坏死因子 (TNF) 来操纵微环境,最终导致肿瘤根除。
一种方法是使用肿瘤内 CpG-寡脱氧核苷酸 (ODN) 的组合来激活 TLR9 和抑制性 IL-10R 抗体。这种免疫疗法通常会阻止肿瘤生长并通过肿瘤相关的骨髓细胞诱导肿瘤坏死因子依赖性出血性坏死,从而导致肿瘤抑制。
免疫疗法效果依赖微生物群的存在
由于 TNF 产生减少,抗生素导致肿瘤根除效率降低。然后,研究人员怀疑这是否取决于肠道中的细菌负荷。因此,具有 MC38 肿瘤的无菌 (GF) 小鼠接受了抗 IL-10R/CpG-ODN 治疗。与无特定病原体 (SPF) 小鼠相比,经处理的 GF 小鼠产生的 TNF 量显着降低。
这表明肿瘤相关的先天性骨髓细胞由微生物群引发,以响应抗 IL-10R/CpG-ODN 产生炎性细胞因子,并且抗生素治疗或无菌状态导致的细菌负荷减少会降低这种反应,并且TNF依赖的早期肿瘤坏死。
为了更好地了解抗生素的作用和肠道微生物群的作用,用 LPS 灌胃 MC38 荷瘤小鼠并重建 TNF 表达。Alistipes属和 TLR4 引发/TNF 产生的作用,两者之间存在正相关。
TNF 恢复是由于促炎性革兰氏阴性菌A. shahii与 TLR4 结合,启动 TNF 产生表达的作用。
为了进一步证明他们的假设,作者随后显示了抗生素治疗后A. shahii恢复的延迟,这也与抗生素给药后约 4 周的 TNF 恢复阶段平行。
此外,他们表明,当用抗生素预处理并用A. shahii灌胃的小鼠时,与肿瘤相关的骨髓细胞产生 TNF 的功能得到恢复。临床相关,该研究表明,当Alistipes减少,对癌症免疫疗法的最佳反应平行减少 。陆续其他人也确定了Alistipes在癌症免疫治疗中的作用。
精神健康中的 Alistipes
虽然Alistipes常见于肠道,但它已被证明对定位于肠道外的疾病有显着影响,例如抑郁症、焦虑症、慢性疲劳综合征、自闭症、肝硬化和衰老。肠道内的生态失调会影响肠脑轴,并用于解释肠道微生物群、抑郁症和其他情绪障碍(如焦虑)之间的关系。
抑郁患者中Alistipes增加
与健康对照组相比,重度抑郁症患者的粪便中肠杆菌科和Alistipes水平升高,粪杆菌水平降低。Alistipes属吲哚阳性,影响血清素前体色氨酸,而Faecalibacterium具有抗炎特性。
在一项对 BALB/c 小鼠进行的研究中,该小鼠置于压力环境中,Alistipes丰度显着增加。此外,还发现挪威患有慢性疲劳综合症的患者的Alistipes浓度增加了近 4 倍。这些发现与抑郁症患者Alistipes增加的证据相关,因为抑郁症患者通常与疲劳和压力作斗争 。
Aistipes丰度的增加可能与GABA增加有关
研究指出,Alistipes的增加扰乱了肠-脑轴,因为Alistipes是一种吲哚阳性生物体,因此会降低血清素的可用性。色氨酸是血清素的前体,血清素的减少与抑郁症有关。此外,Alistipes已被证明可表达谷氨酸脱羧酶,这是一种在鸡体内将谷氨酸代谢为 γ-氨基丁酸 (GABA) 的酶。因此Alistipes丰度的增加也可能与 GABA 的增加有关。然而,应该进行研究以证明 GABA 是否被分泌到肠腔中。
自闭症患者中Alistipes研究不一致
此外,自闭症谱系障碍患者的大脑和肠道之间存在关联。研究发现自闭症谱系障碍患者的Alistipes减少。然而,另一项针对不同形式的自闭症 PDD-NOS 的研究表明,儿童中存在大量Alistipes。据推测,这可能来自丙酸的产生,丙酸已被证明对大鼠具有神经生物学作用。需要对Alistipes进行更多研究及其对肠脑轴的影响,因为关于其在两个系统中的保护/致病作用存在矛盾的证据。
磺胺类和生化标志物
Alistipes是一种细菌,具有许多与上述疾病相关的免疫和生化途径。一个重要的意义是Alistipes通过 IL-6/STAT 3 途径促进结直肠癌。
因此,未来的研究可以考虑使用Alistipes物种作为结直肠癌的潜在生物标志物,利用我们基于微生物组 DNA 数据的理解以及对疾病发病机制的生化概念的整合。
实现这一目标的一种潜在方法是寻找磺基脂,这是一类独特的鞘脂,在鞘氨醇碱基中具有磺酸基团。
Alistipes产生磺基脂
研究表明,当 C57BL/6N 小鼠喂食含有红花油或猪油脂肪的高脂肪饮食 3 周时,与喂食正常食物的小鼠相比,磺胺脂以及体重都会增加。进行了宏基因组分析并筛选了这些小鼠盲肠中参与磺胺脂生物合成的细菌基因。发现除A. inops外的所有Alistipes物种都产生磺基脂(关于最新物种 A. megaguti、A.provencensis和磺基脂生产的信息仍然未知)。
为了进一步证明磺基脂是细菌的产物和Alistipes的标志物,科学家们对带有Alistipes的无菌 (GF) 小鼠进行了单定殖研究并检测到单定殖小鼠盲肠中明显出现了以前在无菌小鼠中不存在的磺基脂。
因此,由于结直肠癌的常见风险因素是高脂肪饮食、肥胖和年龄,除了这些结肠疾病中Alistipes的丰度增加外,还有一个有趣的提议是使用磺基脂类作为结直肠癌患者风险的标志物。此外,应进行研究以验证Alistipes丰度是否在息肉中增加,癌前与癌性,息肉是结直肠癌的另一个危险因素。
有害代谢产物与结直肠癌相关
此外,Alistipes在共生细菌中具有最多的腐败途径。腐败是肠道微生物群在胃肠道中发酵未消化的蛋白质,通常会导致细菌产生有害代谢物。据报道,这些产物有害并与结直肠癌相关。此类产品包括氨、H2S、甲酚、吲哚和苯酚。
在一项旨在确定肠道细菌使用的主要腐败途径的研究中,发现Alistipes有助于组氨酸降解/四氢呋喃产生、吲哚产生和苯酚产生。已发现组氨酸降解/THF 产生会释放过量的氨,当吸收时会损害结肠细胞。还发现氨会增加肠细胞增殖并有助于结直肠癌中癌细胞的生长。当患者有结直肠癌风险时,发现过量氨和其他Alistipes产生的腐败产物可能对临床医生有用。
Alistipes是一种从临床样本中分离出来的相对较新的细菌属,尽管与拟杆菌门中的其他细菌相比,其分离率较低。全基因组蛋白质系统发育分析表明,与拟杆菌门中的其他成员相比,该属可能具有独特的功能特性。
一般,超过一定量的Alistipes在临床和临床前研究中已被认为是导致疾病的原因。有趣的是,其他研究表明它们的存在与促进健康表型相关,例如Alistipes在结肠炎、自闭症谱系障碍以及各种肝脏和心血管纤维化疾病等疾病中的保护作用。
尽管Alistipes在健康表型中发挥作用,但与之形成鲜明对比的是,Alistipes在焦虑、肌痛性脑脊髓炎/慢性疲劳综合征、抑郁症、PDD-NOS 和 CRC 等疾病中具有致病作用。
根据相关研究的结论,该属可能在疾病的调节中起主导作用,或者可能只是具有辅助作用或共同诱导作用。将进一步需要动物研究来破译其复杂多模式疾病机制,以及亚型表型的有针对性研究。
使用无菌动物和模型将有助于了解该属在疾病和健康中的作用以及与宿主免疫防御耐受性的相互作用,例如应该有研究调查Alistipes及其生产的 SCFAs 的作用对各种肝病的影响和Alistipes对T细胞分化的直接作用。
主要参考文献
Parker BJ, Wearsch PA, Veloo ACM, Rodriguez-Palacios A. The Genus Alistipes: Gut Bacteria With Emerging Implications to Inflammation, Cancer, and Mental Health. Front Immunol. 2020 Jun 9;11:906. doi: 10.3389/fimmu.2020.00906. PMID: 32582143; PMCID: PMC7296073.
Sakamoto M, Ikeyama N, Ogata Y, Suda W, Iino T, Hattori M, et al. . Alistipes communis sp. nov., Alistipes dispar sp. nov. and Alistipes onderdonkii subsp. vulgaris subsp. nov., isolated from human faeces, and creation of Alistipes onderdonkii subsp. onderdonkii subsp. nov. Int J Syst Evol Microbiol. (2020) 70:473–80.
Rau M, Rehman A, Dittrich M, Groen AK, Hermanns HM, Seyfried F, et al. . Fecal SCFAs and SCFA-producing bacteria in gut microbiome of human NAFLD as a putative link to systemic T-cell activation and advanced disease. United Euro. Gastroenterol J. (2018) 6:1496–1507. 10.1177/2050640618804444
Song Y, Könönen E, Rautio M, Liu C, Bryk A, Eerola E, et al. . Alistipes onderdonkii sp. nov. and Alistipes shahii sp. nov., of human origin. Int J Syst Evol Microbiol. (2006) 56:1985–90. 10.1099/ijs.0.64318-0
Kim S, Goel R, Kumar A, Qi Y, Lobaton G, Hosaka K, et al. . Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure. Clin Sci. (2018) 132:701–18. 10.1042/CS20180087
Shen L, Liu L, Ji HF. Regulative effects of curcumin spice administration on gut microbiota and its pharmacological implications. Food Nutr Res. (2017) 61:1361780. 10.1080/16546628.2017.1361780
Merrill AH. Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics. Chem Rev. (2011) 111:6387–422. 10.1021/cr2002917
Parker BJ, Wearsch PA, Veloo ACM, Rodriguez-Palacios A. The Genus Alistipes: Gut Bacteria With Emerging Implications to Inflammation, Cancer, and Mental Health. Front Immunol. 2020 Jun 9;11:906. doi: 10.3389/fimmu.2020.00906. PMID: 32582143; PMCID: PMC7296073.
Sakamoto M, Ikeyama N, Ogata Y, Suda W, Iino T, Hattori M, et al. . Alistipes communis sp. nov., Alistipes dispar sp. nov. and Alistipes onderdonkii subsp. vulgaris subsp. nov., isolated from human faeces, and creation of Alistipes onderdonkii subsp. onderdonkii subsp. nov. Int J Syst Evol Microbiol. (2020) 70:473–80.
Rau M, Rehman A, Dittrich M, Groen AK, Hermanns HM, Seyfried F, et al. . Fecal SCFAs and SCFA-producing bacteria in gut microbiome of human NAFLD as a putative link to systemic T-cell activation and advanced disease. United Euro. Gastroenterol J. (2018) 6:1496–1507. 10.1177/2050640618804444
Song Y, Könönen E, Rautio M, Liu C, Bryk A, Eerola E, et al. . Alistipes onderdonkii sp. nov. and Alistipes shahii sp. nov., of human origin. Int J Syst Evol Microbiol. (2006) 56:1985–90. 10.1099/ijs.0.64318-0
Kim S, Goel R, Kumar A, Qi Y, Lobaton G, Hosaka K, et al. . Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure. Clin Sci. (2018) 132:701–18. 10.1042/CS20180087
Shen L, Liu L, Ji HF. Regulative effects of curcumin spice administration on gut microbiota and its pharmacological implications. Food Nutr Res. (2017) 61:1361780. 10.1080/16546628.2017.1361780
Merrill AH. Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics. Chem Rev. (2011) 111:6387–422. 10.1021/cr2002917

谷禾健康
肠道微生物群在癌症中发挥免疫调节和抗肿瘤作用,肠道微生物失调可诱导有毒代谢物的释放,并在宿主体内表现出促肿瘤作用。肠道微生物群也能调节标准化疗药物和天然抗癌药物的疗效。
本文列举5种常见的癌症(结直肠癌、肺癌、乳腺癌、前列腺癌、胃癌),以及肠道微生物群在癌症中的复杂作用。
肠道微生物群与癌症发病的关系概览
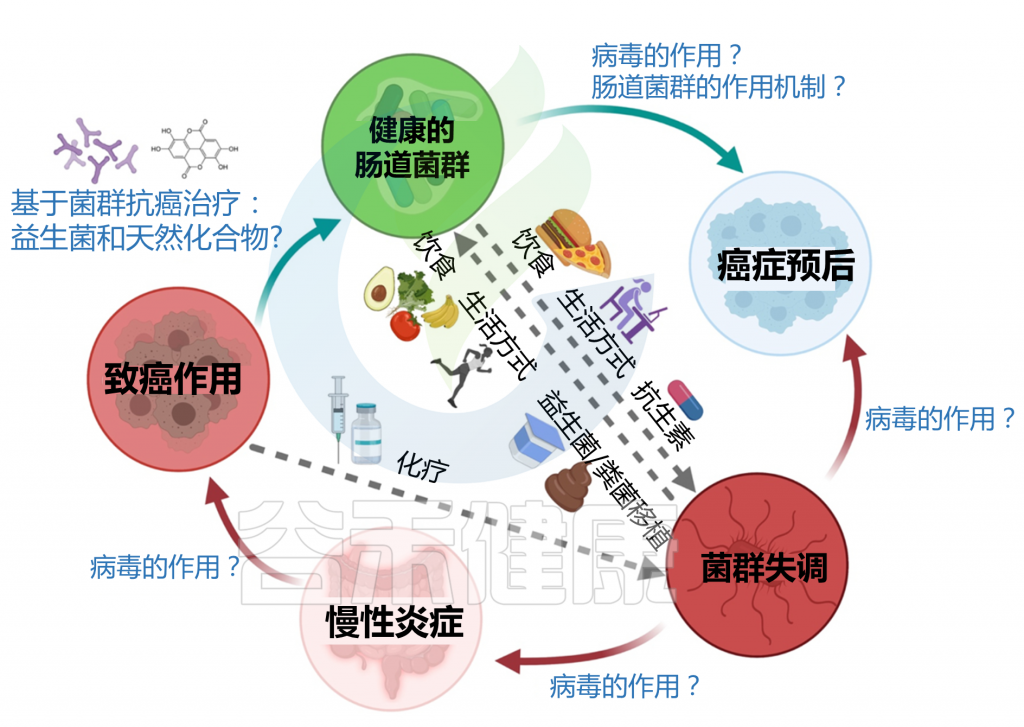

在进入具体的5种癌症章节之前,我们先来了解一下,微生物群与癌症的关系。有研究人员将微生物群和癌症之间的关系分为三个层次: 一级、二级和三级相互作用。
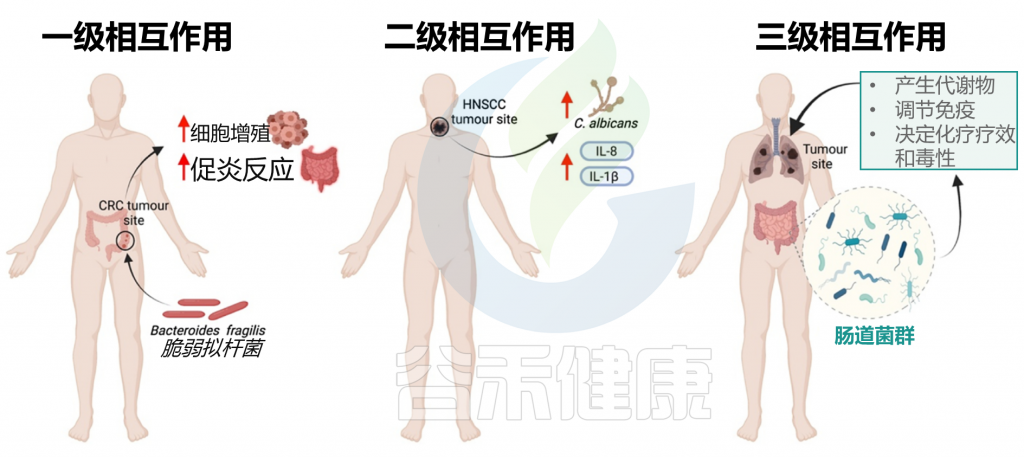

一级相互作用(主要)
主要的相互作用考虑了肿瘤微环境和微生物群之间的直接联系。几项体内和体外研究主要从两个方面支持了这种关系:
a) 肠道微生物群可通过生物失调导致致癌
b) 肠道微生物可通过调节肿瘤活性干扰化疗药物的疗效
二级相互作用(次要)
次要的相互作用考虑了组织或器官系统的微生物群和同一大体分区内的肿瘤之间的联系。这种相互作用水平有助于识别用于筛选不同癌症类型的潜在生物标志物。特别地,来自局部组织或器官环境的次级微生物群可包含来自肿瘤微环境和初级微生物群落的痕迹,其可用作癌症的生物标志物;但这些诊断过程往往很复杂。
三级相互作用
肠道微生物群和肿瘤之间的三级相互作用解释了位于体内不同部位的肿瘤上的微生物群的影响。对这种相互作用水平的研究对于确定生理上遥远的微生物种类和感兴趣的肿瘤之间的关系具有重要意义,这对于确定癌症患者中潜在治疗选择的功效也具有临床相关性。
这些三级相互作用可以通过以下方式影响癌症:
肠道微生物群可以通过启动代谢过程(包括水解和还原)来调节口服药物代谢,这直接影响药物毒性,并可以增强或抑制药物活性。微生物群与肿瘤之间的三级相互作用也可以帮助诊断不同类型的癌症。
肠道微生物群的促肿瘤、抗肿瘤和免疫调节作用
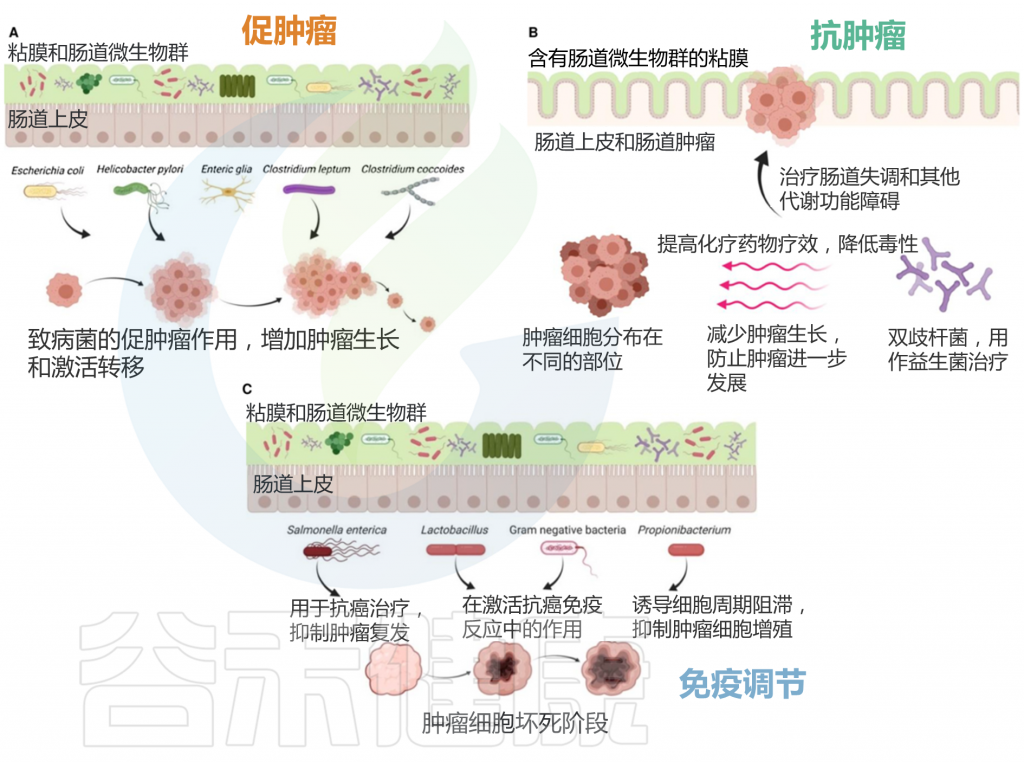

谷禾健康
2020年8月的一则消息让人深感痛惜,漫威系列电影《美国队长3》中饰演黑豹的演员查德维克·博斯曼因患结肠癌去世,享年43岁。

结直肠癌 (CRC) 是全球第三大常见癌症,每年有超过 100 万新病例和 600,000 例死亡。更糟糕的是,该病有越来越年轻化的趋势,有报告称,与1950 年出生的人相比,1990 年之后出生的人患结肠癌的可能性是其两倍,患直肠癌的可能性是其四倍。
科学家正在研究其原因,遗传因素在癌症发展中的作用相对较小(<10% 至 30%);而某些环境因素,例如食用大量加工食品、高脂饮食、纤维摄入不足、压力、炎症,甚至在儿童时期过度使用抗生素,这些可能是导致年轻一代结直肠癌风险显著增加的潜在原因。
以上所有因素都会改变肠道微生物群并诱导肠道微生态失调,从而导致宿主免疫系统低下进而发展为各种疾病。
肠道生态失调可分为三种类型:
有益菌的丧失
病原体或潜在有害物种的扩张
整体微生物多样性的丧失
在结直肠癌患者中这三种类型的失调都存在。
本文主要围绕肠道微生物群的改变与结直肠癌的关系展开讨论,也包含益生菌、益生元、合生元、后生元在结直肠癌中发挥的重要作用,以及结直肠癌的预防措施。
结直肠癌早期可能不容易被发现,很多情况直到晚期才引起症状。最常见的症状包括:
排便习惯的改变,例如腹泻、便秘或大便变窄,持续数天以上;
腹泻与便秘交替;
一种需要排便的感觉,但排便后也依然不能缓解这种感觉;
直肠出血,伴有鲜红色血液;
大便中带血,使粪便看起来发黑;
痉挛或腹痛;
虚弱或疲劳;
不明原因的体重减轻
结直肠癌患者具有独特的粘膜相关微生物群。例如,结直肠癌对微生物群的影响通常以微生物多样性的增加为特征,这似乎随着癌症的发展而进展——晚期结直肠癌样本(III 期和 IV 期)通常比早期结直肠癌样本(I 期)表现出更高的丰度。
黏 膜 菌 群
结直肠癌患者中,黏膜菌群变化如下:
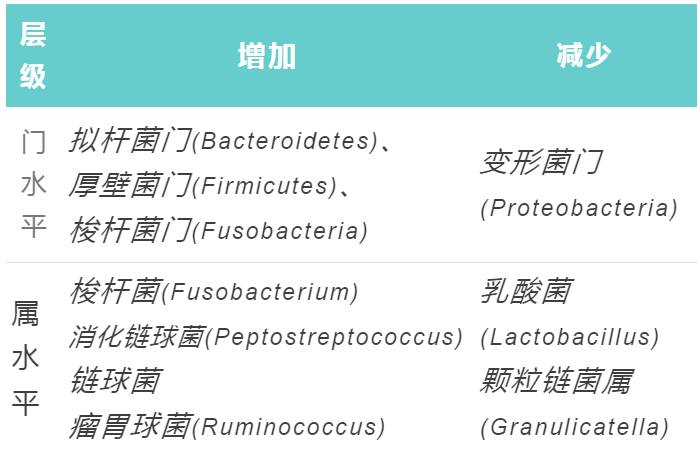

在癌变状态出现之前,也可以观察到黏膜相关微生物群的差异。来自息肉受试者和健康对照组的粘膜相关微生物群之间存在显着差异,这表明肠道微生物群从很早的阶段就参与了癌症的发展。
* 关于息肉和腺瘤:细胞的分化速度超过正常速度就会形成息肉,广义上来说,腺瘤就是息肉的恶变。
腺瘤组织的特征是变形杆菌和梭杆菌的丰度增加。
另一个大型队列多组学数据集表明,微生物组和代谢组的变化发生在结直肠癌发展的早期阶段,这可能具有病因学和诊断重要性。在成年早期至中期长期(≥2 个月)接触抗生素与60 岁时患结直肠腺瘤的风险增加有关。在结直肠癌患者中观察到的微生物群改变不仅限于肿瘤部位;也可以在周围的健康组织中看到。
正常和腺瘤患者体内微生物群主要细菌科的分布

Aprile, F. et al., Cancers,2021
谷禾健康
微生物群失调与人体中的多种疾病有关。在个体中,每个微生物栖息地都表现出不同的微生物种群模式。迄今为止,关于微生物组相关疾病的研究集中在器官特异性微生物组上。然而,器官间微生物网络正在成为生理功能和病理过程中的重要调节剂。
口-肠
口腔和肠道是两个最大的微生物栖息地,在微生物组相关疾病中起主要作用。即使口腔和肠道是通过胃肠道相连的连续区域,由于口腔-肠屏障的原因,口腔和肠道的微生物群分布很好的分离。
然而,在口腔-肠道屏障功能障碍的情况下,口腔微生物群可以转移到肠粘膜。相反,肠道至口腔的微生物传播也以人际和社区传播发生。
最近,有报道说口腔和肠道微生物组相互依赖地调节生理功能和病理过程。口腔到肠道和肠道到口腔的微生物传播可以塑造和/或重塑两个生境中的微生物生态系统,最终调节疾病的发病机理。
在这里,我们将讨论总结口腔-肠道微生物组轴在胃肠道疾病和癌症中的作用, 更好地了解肠道-肠道微生物组轴在发病机理中的作用将有利于精确的诊断/预后和有效的治疗。

人体消化系统由胃肠道和包括肝和胰腺在内的辅助消化器官组成。 胃肠道的粘膜排列整齐,从口腔开始,直到肠道(更准确地说是肛门)结束。 因此,口腔和肠道是通过胃肠道连接的解剖学连续区域。
此外,由于唾液和消化后的食物都通过胃肠道,因此这两个位置也是化学相连的。
通常,由于中空的运河结构,胃肠道被认为在人体外部。 口腔是消化道的通道,直接暴露于外部环境,例如微生物,营养物和其他外源性物质。 在这方面,口腔和肠道都为不同的微生物繁衍提供了适当的环境。
HMP(第一阶段人类微生物组计划)揭示了人体中一半以上的细菌位于胃肠道(29%)和口腔(26%)中。 除了这些丰富的生物外,口腔和肠道微生物群也高度多样化,并同时显示出与每个生境区分开的独特特征。
根据人类口腔微生物组数据库(HOMD),口腔中大约有700种微生物。口腔中的共生菌包括厚壁菌门、变形杆菌门、拟杆菌门、放线杆菌门、梭杆菌门、奈瑟菌门和TM7。口腔有几种不同的微生物环境,包括:颊粘膜、龈下菌斑、龈上菌斑、角化牙龈、硬腭、唾液、扁桃体、舌头和喉咙。口腔和腭粘膜的多样性低于其他口腔栖息地。

无论小生境的位置如何,健康受试者的所有口腔部位在属水平上的菌如下:
双歧杆菌 Gemella链球菌 Streptococcus
韦荣氏菌 Veillonella嗜血杆菌 Haemophilus
奈瑟菌 Neisseria卟啉单胞菌 Porphyromonas
放线菌 Actinomyces梭菌 Fusobacterium
普雷沃氏菌 Prevotella
除了这些常见的细菌进化枝外,每个小生境还具有分化良好的细菌组成。
根据微生物群落结构,口腔生态位可分为三组:
第一组:颊粘膜、角化牙龈和硬腭
第二组:唾液、舌头、扁桃体和喉咙
第三组:龈下和龈上菌斑
生态位对口腔微生物组的隔离可能归因于多种因素,例如pH,盐度,氧化还原电位,氧气和营养。 此外,牙齿卫生是影响口腔微生物组的另一个重要因素,因为口腔是直接向外界开放的。
肠道是人体内最大、最具特征的微生物生态系统,在50多个不同的门中有大约500到1000个物种。
由五个主要的拟杆菌门、厚壁菌门、放线菌门、变形菌门和疣状菌门组成,但以两个拟杆菌和厚壁菌门为主,占90%以上。
在属的水平上,拟杆菌是最丰富的。已知人类肠道微生物群在生命早期就已建立,然后可以随着年龄和环境(如饮食和营养)而改变,类似于人类口腔微生物群。因此,口腔和肠道微生物组直接反映了宿主的健康状况。
尽管肠道与口腔相连,但肠道微生物群的组成可与口腔微生物群的组成区分开来。在门的水平上,口腔主要由厚壁菌门控制,而粪便微生物群主要富含拟杆菌。这种分离可归因于胃中的胃酸和十二指肠中的胆汁酸。
据报道,长期使用质子泵抑制剂(PPI)会增加肠道感染的风险。值得注意的是,PPIs降低胃酸可以减少肠道微生物生态系统的多样性,改变肠道微生物组的组成。
此外,胆汁酸可引起肠细菌膜和/或DNA完整性的破坏,在口腔和肠道之间起有效的抗菌屏障作用。 因此,胃酸度和胆汁酸池负责肠道和口腔微生物组的独特模式。
人类肠道微生物组的概况可以根据健康状况,环境因素,遗传学甚至生活方式而改变。
宏基因组学分析表明,人类肠道菌群调节代谢途径,例如碳代谢和氨基酸合成。微生物显示出保守的分子基序,称为微生物相关的分子模式和病原体相关的分子模式(PAMP),宿主可通过模式识别受体(PRRs)识别这些基序,如toll样受体。
这种微生物与宿主的相互作用可以刺激人体的免疫系统和炎症反应。 这意味着肠道菌群可以调节人体的主要生物学功能,新陈代谢和免疫力,因此肠道菌群失调与多种人类疾病有关,从传染病到阿尔茨海默氏病。然而,要证明肠道微生物群是人类健康状况的原因还是后果是一个挑战。
另外,无菌(GF)动物为肠道微生物组的生理功能提供了深刻的线索。与无特定病原体(SPF)的小鼠相比,GF小鼠的肠重量减少,绒毛更短,小肠的总表面积减少,表明胃肠道发育存在缺陷。
与此相一致,GF小鼠显示出代谢异常,例如胆固醇代谢改变和肠道内短链脂肪酸的减少,短链脂肪酸是重要的能量来源之一。
因此,与SPF小鼠相比,GF小鼠显示出较低的体内脂肪含量和对高脂饮食诱导的体重增加的抵抗力。 但是,通过应用SPF小鼠的盲肠含量,通过GF小鼠的常规化可以恢复体内脂肪含量。
在免疫方面,GF小鼠在Peyer斑块和肠系膜淋巴结发育方面存在缺陷,CD4,CD8和Foxp3 T细胞数量减少,B细胞分泌的免疫球蛋白A产生减少。
通过与SPF小鼠共栖或口服SPF小鼠粪便中的成分,可以通过微生物群重建来恢复这些疾病。 两者合计,很明显,肠道菌群在维持生理稳态方面起着至关重要的作用,主要是代谢和免疫。
尽管口腔是人体第二大的微生物栖息地,但是累积的知识不足以完全了解口腔微生物组对人类健康的影响。 毫无疑问,口腔微生物组与牙齿健康直接相关。
口腔疾病中有许多已被确认的关键病原体,如龋齿的变形链球菌(Streptococcus mutans )和牙周炎的牙龈卟啉单胞菌(Porphyromonas gingivalis)。此外,与健康受试者相比,口腔鳞状细胞癌患者的口腔微生物组发生了改变。根据口腔微生物群分析,口腔鳞状细胞癌(OSCC)患者中的梭杆菌属(Fusobacterium)水平较高。
口腔微生物组会影响全身健康状况,而不仅限于牙齿健康(下图)。
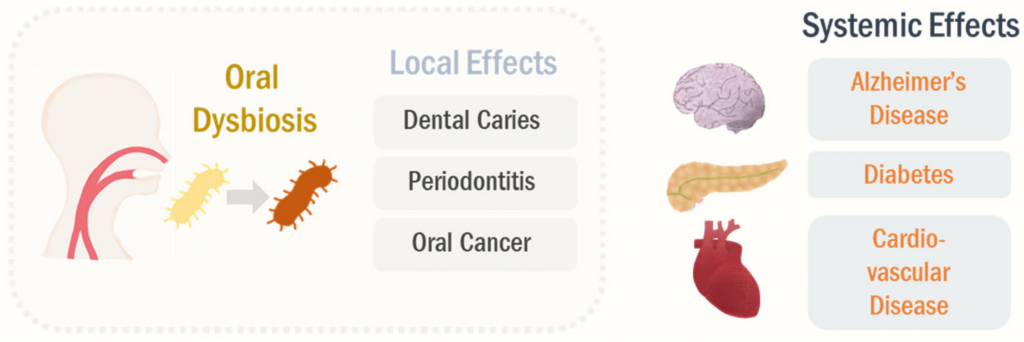

Park Se-Young, et al., Cancers (Basel),2021
流行病学和实验证据支持口腔菌群失调与全身性疾病密切相关,包括阿尔茨海默氏病,糖尿病和心血管疾病。 与此相符,阿尔茨海默氏病的口腔微生物群特征发生了显着变化,例如莫拉氏菌属(Moraxella),纤毛菌属(Leptotrichia)和鳞球菌属(Sphaerochaeta)的患病率。口腔不良反应的改变与阿尔茨海默氏病的进展有关。
I型糖尿病患者的放线菌门和厚壁菌门的丰度更高。此外,据报道,在有症状的动脉粥样硬化患者的口腔微生态环境中,厌氧菌属的富集已被报道。
在牙周炎(一种口腔失调疾病)的情况下,其标志性病原体牙龈卟啉单胞菌(P. gingivalis)感染可引起局部以及全身慢性炎症。
此外,口腔异位症可以诱导PAMP信号的产生,例如脂多糖(LPS),导致系统性刺激先天免疫应答和炎症转录因子,包括核因子κB。 这些全身性炎症和免疫反应被认为是主要机制之一,强调口腔微生物组调节远端器官的发病机理。
值得注意的是,口腔微生物群可以转移到其他器官,这被认为是口腔生物失调引起的全身性疾病的另一种机制。
在短期死后阿尔茨海默氏病患者的脑组织中已检测到口腔致病菌牙龈卟啉单胞菌(P. gingivalis)。 口腔病原体直接转移到大脑可以通过诱导神经炎症和神经变性而加剧阿尔茨海默氏病。
此外,在冠心病患者的动脉粥样硬化斑块中检测到许多口腔共生细菌,这进一步表明口腔细菌可能转移到远端器官。 由于物理和化学联系,口腔微生物向胃肠道系统的迁移可能更频繁。
在某些致病条件下,一些口腔细菌类群定居并富含胰腺和肠道,表明口腔和肠道菌群之间存在直接的串扰。
由于存在肠-肠屏障,物理距离以及化学障碍(例如胃酸和胆汁),因此口腔和肠道微生物组被很好地隔离了。 然而,口腔-肠道屏障的损伤会导致器官间的易位和交流。
一般来说,新生儿和老年人体内存在不成熟或功能性障碍较少。双歧杆菌是新生儿肠道中最丰富的细菌属。有趣的是,在新生儿的口液中发现了肠道内的双歧杆菌。
同样,与健康成年人相比,老年人肠道内口腔细菌的检出率也较高,如:
卟啉单胞菌(Porphyromonas)、梭杆菌(Fusobacterium) 和假分枝杆菌 (Pseudoramibacter)。
此外,低胃酸使肠道微生物群的组成向口腔微生物群转移。已在体外证明,通过分别引入人类粪便和唾液微生物群的GF小鼠组,口腔微生物群可以侵入肠道并重塑肠道微生物群。
综上所述,这些数据表明口腔微生物可以在某些情况下克服口腔与肠道之间的物理和/或化学障碍,并有可能转移到肠道中。
值得注意的是,在胃肠道的病理条件下已检测到典型的口腔驻留物种。 例如,炎症性肠病(IBD)患者的肠道粘膜中有大量嗜血杆菌和Veillonella富集,已知它们是口腔共生微生物。
在结肠癌患者中,他们的肠道微生物群包含几种口腔类群,包括梭菌。这意味着正常的人口腔微生物群可以在肠粘膜稳态中破坏并在肠道粘膜中定植,并成为条件致病菌。
而且,这种经口-粪便传播也可以在生理条件下发生,而不仅仅是在病理或屏障破坏的情况下。HMP联盟的数据被划分为每个身体部位的群落类型时,口腔和肠道微生物群类型显示出强烈的关联,尽管它们在分类上不同。
在唾液细菌中,普雷沃氏菌(Prevotella)大量存在于粪便样本中。与此相一致,从同一健康受试者的口腔和粪便样本中同时检测到几个属。通过分析470名个体口腔和粪便微生物群中的310种,唾液和粪便样本中普遍存在125种,包括链球菌(Streptococcus)、韦荣氏球菌属(Veillonella)、放线菌(Actinomyces)和嗜血杆菌(Haemophilus)菌株。
综上所述,很明显口腔微生物群可以比预期更广泛地进入肠道,即使在健康状态下,而不仅仅是在病理情况下。
肠道微生物可通过粪-口途径通过直接接触或通过受污染的液体和食物间接接触传播。人的手部微生物群与口腔和肠道微生物群模式高度重叠,表明人的手是粪便到口腔微生物传播的载体。因此,在发展中国家,由于卫生状况不佳,如缺乏清洁供水和公共卫生系统,微生物的粪-口途径经常被报道。
此外,免疫功能低下的个体也容易通过粪-口传播。在头颈部癌症患者中,放射治疗与革兰氏阴性杆菌的口腔定植高度相关,不良的口腔卫生状况会进一步加剧这种情况。因此,不良的卫生和/或免疫损害条件可能会促进同一个体的粪-口途径。
除了体内传播外,粪-口途径也被认为是病原体在人与人之间传播的重要机制。众所周知,甲型肝炎病毒(HAV)和戊型肝炎病毒(HEV)等肠道病毒通过粪-口途径传播,因此很容易通过人与人之间的接触传播,特别是在不卫生的条件下。
肠道病毒可以直接和间接地与肠道微生物群相互作用,对肠道微生物生态系统造成破坏性影响。据报道,戊型肝炎病毒感染会增加急性肝衰竭患者粪便样本中乳酸杆菌科(Lactobacillaceae)和伽马蛋白杆菌( Gammaproteobacteria)的丰度。
添加益生菌粪肠球菌NCIMB 10415(Enterococcus faecium NCIMB 10415) 可有效促进感染猪的HEV清除。
除了肠道病毒外,幽门螺杆菌(Helicobacter pylori)是严重胃十二指肠疾病的主要致病菌,也可以通过粪-口途径传播,显示出与甲型肝炎感染的相关性。
虽然需要进一步的研究来了解粪-口传播在口腔和肠道微生物群中的作用,但令人信服的是,口腔和肠道微生物群通过口-肠和粪-口途径紧密相连(下图)。
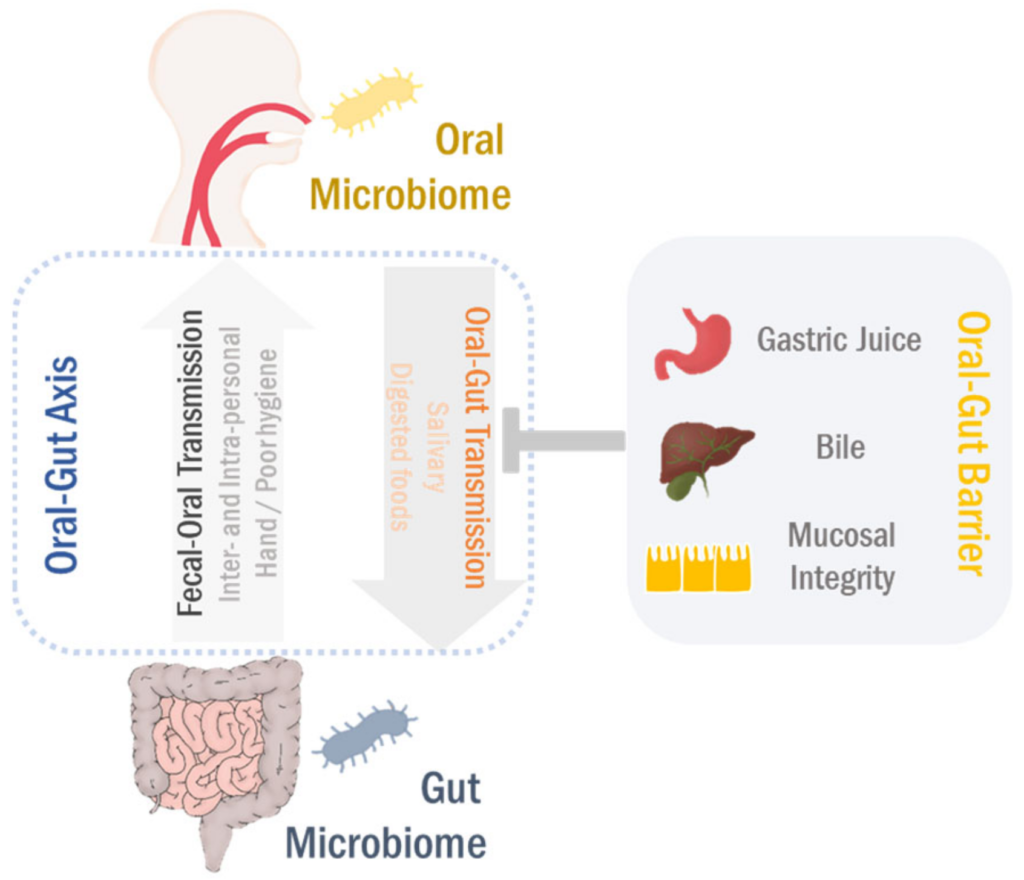
Park Se-Young, et al., Cancers (Basel),2021
这种双向相互作用可以相互塑造和/或重塑两个栖息地的微生物生态系统,最终调节胃肠系统的生理和病理过程。因此,口腔-肠道和粪便-口腔方向在以下中统称为“口腔-肠道微生物群轴”。

IBD代表结肠和小肠的慢性炎症性疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC)。因此,IBD与肠道微生物群失调密切相关。IBD患者的肠道微生物组显示出细菌组成的多样性降低和变化,包括厚壁菌门的丧失和变形菌门和拟杆菌门的丰度增加。在肠道粘膜组织活检中而不是在粪便中更深刻地观察到了这些不良生物事件。与健康受试者相比,在肠黏膜表面,IBD患者经常检测到细菌入侵和生物膜形成,表明肠屏障功能障碍与IBD发病有关。
在健康状态下,由于完整的粘膜屏障,肠道微生物群很少受到来自其他栖息地的微生物的入侵和定植。然而,IBD患者由于粘膜屏障受损而表现出肠上皮通透性增加。
值得注意的是,口腔内细菌菌株是从IBD患者的肠道微生物组中分离出来的,这可能是由于肠道渗漏造成的。具核梭杆菌( Fusobacterium nucleatum )通常存在于口腔中,但很少存在于健康人的肠道中。
有趣的是,IBD患者在肠道中出现了F. nucleatum,比其他F. nucleatum菌株更具侵袭性,表明IBD患者存在肠道-肠道微生物组轴。这一点已在体外通过将口腔微生物群移植到动物模型中得到证实。
在大鼠中,F.nucleatum的侵袭导致肠道微生物组发生转移并加重内脏超敏性。 此外,CD患者的唾液微生物群成功地定居在GF小鼠的肠道中。
克雷伯菌(Klebsiell)是最流行的定植菌,可促进肠道Th1细胞的诱导和炎症,这是IBD发病机理中的关键事件。 这些结果进一步支持了口腔微生物群,无论是共生的还是病原菌,都可以传播到肠道,通过肠道失调促进IBD的发病。
因此,口腔失调可以通过募集口腔-肠轴来直接调节IBD的发病机制。牙周炎是一种慢性炎性口腔疾病,与口腔微生物群的改变密切相关,特别是与其关键性病原体牙龈卟啉单胞菌的过度生长有关。
在C56BL/6小鼠中,口服牙龈卟啉单胞菌通过下调紧密连接蛋白来减弱肠道屏障功能,从而导致肠道微生物组发生重大变化,包括梭菌科的丰富。
此外,接种牙龈卟啉单胞菌的小鼠表现出肠道以及全身性炎症,这可以由牙龈卟啉单胞菌衍生的内毒素例如LPS介导。 与动物实验一致,荟萃分析表明牙周炎分别与IBD,CD和UC的两种主要形式密切相关。
两者合计,口腔病原体可以干扰肠屏障功能并侵入肠粘膜,从而引起肠道失调和慢性炎症,从而导致IBD发病。 值得注意的是,IBD患者以及结肠炎引起的小鼠唾液微生物群组成发生变化,这与炎症反应有关,表明口腔-肠道微生物相互作用可能是双向的。
大肠癌(CRC)是世界上最常见的癌症类型之一,也是导致癌症死亡的第二大原因。IBD是CRC发生和发展的最公认的危险因素。因此,IBD和CRC在发病机理中共享病因,包括肠道微生物组的明显变化。 与IBD相似,CRC与肠道失调密切相关。与健康个体相比,CRC患者在粪便和肠粘膜样品中均显示出不同的微生物组成模式。
一直以来,在结肠炎相关和化学诱导的大肠癌小鼠模型中都发现了肠道微生物群的深刻变化,支持肠道失调和大肠癌之间的关系。使用GF小鼠的研究进一步证明,肠道微生物群的改变可以直接促进炎症相关的结直肠癌的发展。
有趣的是,在大肠癌患者的肠道中发现了几种口腔分类群,包括细小单胞菌(Parvimonas)、消化链球菌(Peptostreptococcus)和梭形杆菌(Fusobacterium),表明大肠癌中存在口腔-肠道微生物群轴。
在这些口腔常驻细菌中,具核梭杆菌 (F.nucleatum)与健康人相比,结直肠癌患者的肿瘤组织和粪便中普遍存在细胞核,这与IBD一致。
在小鼠结肠炎模型中,口服具核梭杆菌(F.nucleatum) 细胞核引起的炎症以及小肠和大肠的肿瘤发生。具核梭杆菌 (F.nucleatum)细胞核似乎很容易附着在表达内皮钙粘蛋白的宿主CRC细胞上,然后刺激促炎症反应和细胞增殖。与IBD相似,结直肠肿瘤显示肠道屏障功能受损,这可能解释了口腔微生物群的肠道定植。
此外,据报道,具核梭杆菌 (F.nucleatum) 与口腔病原体牙龈卟啉单胞菌共聚并共感染。尽管体外方法存在局限性,但牙龈卟啉单胞菌仍侵袭CRC细胞并促进癌细胞增殖,这表明牙周病原体参与了结直肠肿瘤的发生。 与此相一致,牙龈卟啉单胞菌血清抗体水平与CRC患者的死亡率呈正相关。
此外,一项荟萃分析表明,牙周炎与CRC风险增加有关。 综上所述,这些研究可以证明口腔失调,口腔-肠道微生物组轴与CRC发病机理之间存在关联。
肝硬化是由慢性肝脏疾病引起的晚期肝病,例如非酒精性脂肪肝疾病(NAFLD)和非酒精性脂肪性肝炎(NASH)。 健康对照组相比,NAFLD、NASH或肝硬化患者粪便样本中的变形杆菌门显著增加,表明肠道微生物组与肝脏发病机制相关。在这方面,与SPF小鼠相比,GF小鼠免受高脂饮食诱导的脂质在肝脏中的蓄积。此外,定居于NAFLD易感肠道微生物的GF小鼠发生了严重的肝脂肪变性,进一步支持了肠道失调可能是慢性肝病的直接病因。
由于肠道和肝脏通过胆道和门静脉进行物理连接,如果粘膜屏障受损,肠道微生物可以转移到肝脏。胆汁酸具有抗菌活性,在肠道和肝脏之间循环循环,具有屏障和桥梁的双重功能。
慢性肝病通常与胆汁酸形成和/或分泌不良有关,会增加肠道通透性。 因此,胆道梗阻促进了细菌从肠道到肝脏的移位。 在胆结石患者中,与正常对照组(例如富集变形杆菌)相比,胆道和肠道中的微生物组成均发生了变化,这支持了慢性肝病中肠道-肝脏微生物组轴的存在。
通过与肠-肝微生物串扰的融合,口腔-肠道微生物组轴正在成为慢性肝病的重要调节剂。
值得注意的是,宏基因组学分析已证明肝硬化患者肠道内的口腔粘膜有侵袭和定植。另一项研究还显示,酒精依赖型肝硬化患者的肠道中口腔微生物的富集。 这些数据支持口腔微生物的肠道迁移与肝硬化有关。 但是,其潜在机制尚不清楚。如前所述,由于胃酸度低,PPI促进了从口腔到肠道的微生物转化。 同样,PPI治疗改变了肝硬化患者的肠道菌群组成,特别是肠道内口腔细菌的过度生长。 相同的研究小组已经证明了肝硬化患者唾液和粪便微生物组的伴随变化,进一步表明口腔-肠道微生物组轴调控肝脏的发病机制。
因此,口腔失调可能会通过改变肠道微生物组而加重慢性肝病。 确实,牙周炎与NASH,NAFLD和肝硬化显着相关。 在来自NAFLD和与病毒感染相关的肝硬化患者的口腔样本中已经检测到牙龈卟啉单胞菌,一种牙周基石病原体。
在高脂饮食喂养的小鼠中,牙龈卟啉单胞菌的牙源性感染通过脂质积累,纤维化和肝脏炎症促进了NAFLD和NASH的进展。 总体而言,口腔失调可能会通过调节肠道生态系统而加剧慢性肝病。 同时,口腔失调可能反映了由肝病驱动的肠道失调生态系统。
肝细胞癌(HCC)的发展经历了一个逐步的过程,从NAFLD/NASH到肝硬化,最后发展为HCC。在小鼠肝癌发生模型中,SPF小鼠比GF小鼠更易发生肝癌,类似于慢性肝病。
在生态型小鼠模型中,某些类型的肠道细菌,如大肠杆菌和粪链球菌,可显著增加肝肿瘤的发生,表明肠道微生物群直接参与了肝癌的发病机制。与这一观点一致,与健康对照组相比,HCC患者的丁酸产生菌属减少,如反刍球菌(Ruminococcus)、大肠杆菌(Oscillibacter)、粪杆菌(Faecalibacterium)、梭状芽孢杆菌IV(Clostridium IV)和粪球菌(Coprococcus),而LPS产生菌属增加,包括粪便样本中的克雷伯菌(Klebsiella)和嗜血杆菌(Haemophilus )。
此外,随着HCC的发展,肠道失调的水平趋于增加。 在患有肝硬化的HCC患者中,粪便微生物群的成分与没有HCC的肝硬化患者的粪便微生物群成分有所不同,例如大肠杆菌和Fusobacteriia的大量富集。 在化学诱导的HCC小鼠模型中,已在肿瘤内发现了一种肠道细菌肝幽门螺杆菌(Helicobacter hepaticus),它直接引起HCC的发展和进程,进一步支持肠道失调可以诱导HCC的发病机理。 然而,在人类HCC样品中未检测到肝炎性肝炎,而确诊存在其他幽门螺杆菌,例如幽门螺杆菌。因此,肝癌的发展与肠道失调密切相关。
有趣的是,据报道,与健康受试者相比,肝癌患者的口腔微生物群发生了变化。肝癌患者唾液微生物群中嗜血杆菌属、卟啉单胞菌属和Filifactor的丰度较高。在肝硬化的HCC患者中,根据舌苔的微生物组学特征,颤杆菌克属(Oribacterium)和梭形杆菌属(Fusobacterium)普遍存在。
此外,慢性牙周炎与晚期HCC相关,提示口腔失调与HCC相关。值得注意的是,肝硬化HCC患者的口腔和肠道微生物群中都富含梭杆菌,这表明口腔微生物可能通过口腔-肠道微生物群轴调节HCC发病机制,但需要进一步研究。
胰腺是消化系统的一部分,分泌分解脂类、蛋白质和碳水化合物的酶。主胰管与胆总管相结合,两者都与十二指肠相连。在正常健康条件下,胰腺被认为是一个无菌器官。
然而,胰腺导管腺癌(PDAC)患者的细菌数量增加,如肿瘤内的γ-变形菌纲(Gammaproteobacteria)和胰液和胰腺组织中的粪肠球菌(Enterococcus faecalis)。
此外,肿瘤内微生物组多样性与PDAC的预后相关。从更全面的角度来看,PDAC患者在胰腺组织、肿瘤以及粪便样本中表现出不同的微生物群模式,表明肠-胰腺微生物串扰参与了PDAC发病机制。特别是,PDAC患者的肠道和胰腺中同时富集了变形菌(Proteobacteria)。
在实验小鼠中,肠道通透性增加与肠道到胰腺的微生物易位有关,这可能加速PDAC的进展。在肠道菌群清除的小鼠中,用PDAC荷瘤小鼠的粪便菌群重新填充可显著促进胰腺肿瘤的发生,表明肠道菌群对PDAC进展的直接贡献。因此,肠道微生物组似乎与胰腺微生物生态系统密切相关,而胰腺生态系统在PDAC发病机理中起着至关重要的作用。
惊讶的是,口腔微生物组也与PDAC的发病机理有关。 根据元流行病学研究,牙周炎是一种主要的口腔菌群失调疾病,可以显着增加PDAC的风险和死亡率。
携带其关键病原体牙龈卟啉单胞菌与PDAC患者的较高风险和死亡率正相关。 在小鼠PDAC模型中,口服牙龈卟啉单胞菌可加速细胞增殖和上皮-间质转化,最终促进PDAC进程。
有趣的是,细胞内牙龈卟啉单胞菌直接促进人胰腺癌细胞系中肿瘤细胞的生长。 这些表明口腔菌群失调可能是直接的病因,也是诊断和预后PDAC发病机理的有用标志。
与健康受试者相比,PDAC患者的口腔微生物组有明显变化。 值得注意的是,尽管在人类PDAC组织中已发现了一种广为人知的口腔细菌群Fusobacterium,但其与PDAC预后的关系仍存在争议。
此外,PDAC患者的胰腺微生物组与肠道微生物组高度重叠。胰腺和肠道菌群均表现出口腔类群富集细菌和卟啉单胞菌的相对丰度。因此,某些类型的口腔微生物可能迁移到肠道,甚至进一步迁移到胰腺,这可能通过肠道和胰腺微生物群的协调调节促进PDAC的发病。
为了支持这一观点,在PDAC患者的口腔,肠道和胰腺微生物群之间发现了相关性,尤其是口腔起源的F. nucleatum subsp. vincentii亚种的丰度。
这些数据表明,口腔-肠道微生物组轴可以调节PDAC的发病机制,甚至进一步创造口腔-肠道-胰腺的微生物途径。

口腔和肠道是人体内最大的两个微生物栖息地。累积证据表明,口腔微生物群可以通过口腔细菌分泌体的直接易位和/或间接地改变整个肠道微生物生态系统。
肠道到口腔的微生物传播也可能发生,特别是在某些情况下,如卫生条件差和免疫功能低下。总之,口腔和肠道微生物群之间的双向串扰可以形成口腔-肠道微生物群轴,它在调节各种人类疾病的发病机制中起着关键作用,主要是在胃肠道系统(见下表)。
结肠疾病中的口腔-肠道微生物群轴

Park Se-Young, et al., Cancers (Basel),2021
肝脏疾病中的口腔-肠道微生物轴

Park Se-Young, et al., Cancers (Basel),2021
胰腺疾病的口腔-肠道微生物组轴
Park Se-Young, et al., Cancers (Basel),2021
值得注意的是,口腔-肠道微生物组轴改善了胃肠道系统的发病机理和预后的预测。荟萃分析表明,口腔微生物组的变化与胃肠道癌的风险有关,包括CRC,PDAC和HCC,这可能是早期发现的潜在指标。已经验证了PDAC特定的口腔微生物模式作为PDAC生物标志物。两种口腔细菌物种长奈瑟菌Neisseria elongata 和 轻型链球菌Streptococcus mitis
同时富集可以将PDAC患者与健康受试者区分开来。
口腔微生物分析的情况下,所述样品可从棉拭取,唾液和口腔冲洗获得。与肠道菌群的采样方法相比,无论健康状况如何,口腔菌群的收集实际上更为方便和可用,没有任何侵袭或卫生问题。因此,结合肠道微生物组,口腔微生物组还提供了作为诊断/预后工具以及治疗靶标的可行优点。
未来我们谷禾也将考虑口腔和肠道微生物组的相结合,结合口腔和肠道微生物组数据可以显着提高预测和检测息肉和/或肿瘤的敏感性。尽管揭示微生物组与疾病之间的因果关系具有挑战性。
参考文献:
Zhang, Z.; Yang, J.; Feng, Q.; Chen, B.; Li, M.; Liang, C.; Li, M.; Li, Z.; Xu, Q.; Zhang, L.; et al. Compositional and Functional Analysis of the Microbiome in Tissue and Saliva of Oral Squamous Cell Carcinoma. Front. Microbiol. 2019, 10, 1439
Wypych, T.P.; Wickramasinghe, L.C.; Marsland, B.J. The influence of the microbiome on respiratory health. Nat. Immunol. 2019, 20, 1279–1290
Park Se-Young,Hwang Byeong-Oh,Lim Mihwa et al. Oral-Gut Microbiome Axis in Gastrointestinal Disease and Cancer.[J] .Cancers (Basel), 2021, 13
Bathini, P.; Foucras, S.; Dupanloup, I.; Imeri, H.; Perna, A.; Berruex, J.L.; Doucey, M.A.; Annoni, J.M.; Auber Alberi, L. Classifying dementia progression using microbial profiling of saliva. Alzheimers Dement. 2020, 12, e12000.
Seedorf, H.; Griffin, N.W.; Ridaura, V.K.; Reyes, A.; Cheng, J.; Rey, F.E.; Smith, M.I.; Simon, G.M.; Scheffrahn, R.H.; Woebken, D.; et al. Bacteria from diverse habitats colonize and compete in the mouse gut. Cell 2014, 159, 253–266.