-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

胃肠道除了在食物消化和吸收中发挥作用外,还是一个主要的内分泌器官,产生多种生物活性肽和胺类物质,作为肠道激素。
大多数肠道激素来源于肠内分泌细胞,但来源于其他肠上皮细胞类型的生物活性肽也与代谢调节有关。
为什么说肠道激素重要呢?我们在日常生活中胃口好不好都可能与它相关,它能影响食欲和食物摄入,通过影响大脑中的食欲中枢,减轻食欲或刺激饱腹感。
其实,肠道激素在多种器官的多种代谢活跃组织中协调关键的生理过程,包括胰腺、肝脏、脂肪组织、肠道和中枢神经系统等。从局部控制营养吸收和调节肠道生长、肠道运动和液体分泌,到远距离调节胰岛素释放、脂肪细胞功能。
近日,来自英国剑桥大学威康Trust-MRC代谢科学研究实验室团队发表了一篇文章在《Nature Reviews Gastroenterology & Hepatology》期刊,主要讲述了参与代谢调节的肠道激素,讨论了它们在胃肠系统内外的作用。

肠道激素由多种肠内分泌细胞和非肠内分泌细胞产生,它们对不同刺激的反应不同,并分泌特定的激素组合。
肠内分泌细胞通过一系列感觉转运蛋白、离子通道和受体感知各种营养和非营养刺激,使其成为营养吸收和肠道激素反应之间的有效联系。
这些肠道激素信号传导过程可以作为治疗靶点;例如,GLP2受体激动剂用于治疗短肠综合征,并且GLP1受体激动器用于治疗2型糖尿病和肥胖。此外,激素类药物的组合可用于最大限度地提高疗效,同时最大限度地减少不良反应。
因此,深入了解肠道内分泌系统介导的复杂器官间串扰,有助于设计基于或靶向肠道激素及其受体的更有效药物,并将其治疗潜力扩展到肥胖和糖尿病之外的疾病。
肠内分泌细胞沿着胃肠上皮的长度广泛分布。肠道内的一些细胞会分泌一些激素来应对不同的刺激。
■ 肠内分泌细胞可分为两大类:
以前我们认为这些肠内分泌细胞只会分泌单一类型的激素,但现在我们知道,实际上它们通常会同时分泌多种不同的激素,所以它们之间的分泌有一些重叠的部分。
■ 肠道中不同部位的激素表达也会有所不同,如:
肠道特定区域的激素产生与激素的功能作用及其反应的感觉输入有关。
决定肠道不同区域肠内分泌细胞激素特征的因素在很大程度上仍然未知。来自不同肠段的肠道类器官似乎保留了与起源相关的激素特征,这表明肠道干细胞的效力有限。
■ 肠道细胞功能受限的机制与激素分泌的发育演化
然而,随着细胞的发育成熟,肠内分泌细胞的激素特征会发生变化,并沿着隐窝-绒毛轴分化。
举个例子,回肠L细胞在肠隐窝中共表达GLP1和肽YY(PYY),但当这些细胞到达绒毛时,前胰高血糖素转录下调,分泌素转录上调。一旦这些激素分泌出来,它们有两条路:
■ 激素在肠道中的分泌调节及其影响
肠道激素控制多种代谢活性组织的广泛生理过程,包括胰腺、肝脏、脂肪组织、肠道和中枢神经系统。这些激素大多具有不止一种生理作用,许多生理作用由不止一种激素发挥。如下表:
调节新陈代谢的主要肠道激素的特征

Bany Bakar R, et al., Nat Rev Gastroenterol Hepatol. 2023
■ 肠内分泌细胞如何与营养物质密切接触
这就需要我们先来了解一下,肠内分泌细胞的结构特点,大多数肠内分泌细胞是开放型细胞,也就是说它们有一个顶端表面,带有向肠腔延伸的微绒毛,以及一个基底外侧表面,负责在刺激时通过胞吐释放分泌颗粒。
因此,这些细胞与消化和吸收的营养物质直接接触,把它们推向产生肠道激素反应的理想位置,将营养吸收的变化传达给身体其他部位。
它怎么传达呢?
肠内分泌细胞的化学感受能力归因于它们表达一系列感觉转运蛋白、离子通道和受体,这些受体解释了它们对各种营养刺激的反应能力,包括葡萄糖、消化脂质、碳水化合物和蛋白质,以及非营养刺激,如胆汁酸、肠道激素、肠道神经递质,微生物产物和炎性胞质分裂。
■ GPCR——肠内分泌细胞通过其检测营养物质吸收
G蛋白偶联受体(GPCR)检测到广泛的营养和非营养刺激,肠内分泌细胞差异表达一系列GPCR,这些GPCR主要位于其基底外侧表面,能够检测出胆汁酸、游离脂肪酸(FFAs)和氨基酸在上皮层内的消化和吸收过程中的变化。
与肠道激素释放密切相关的GPCR包括:
各种脂质感应受体,包括:
相反,葡萄糖在通过顶端膜上的钠偶联葡萄糖转运蛋白SGLT1吸收时激活肠内分泌细胞。SGLT1对钠离子与葡萄糖的共转运直接触发质膜去极化,进而激活电压门控钙通道。由此产生的钙流入进一步使肠内分泌细胞质膜去极化,并启动分泌颗粒的释放(下图)。
调节肠内分泌细胞活性的营养诱导机制
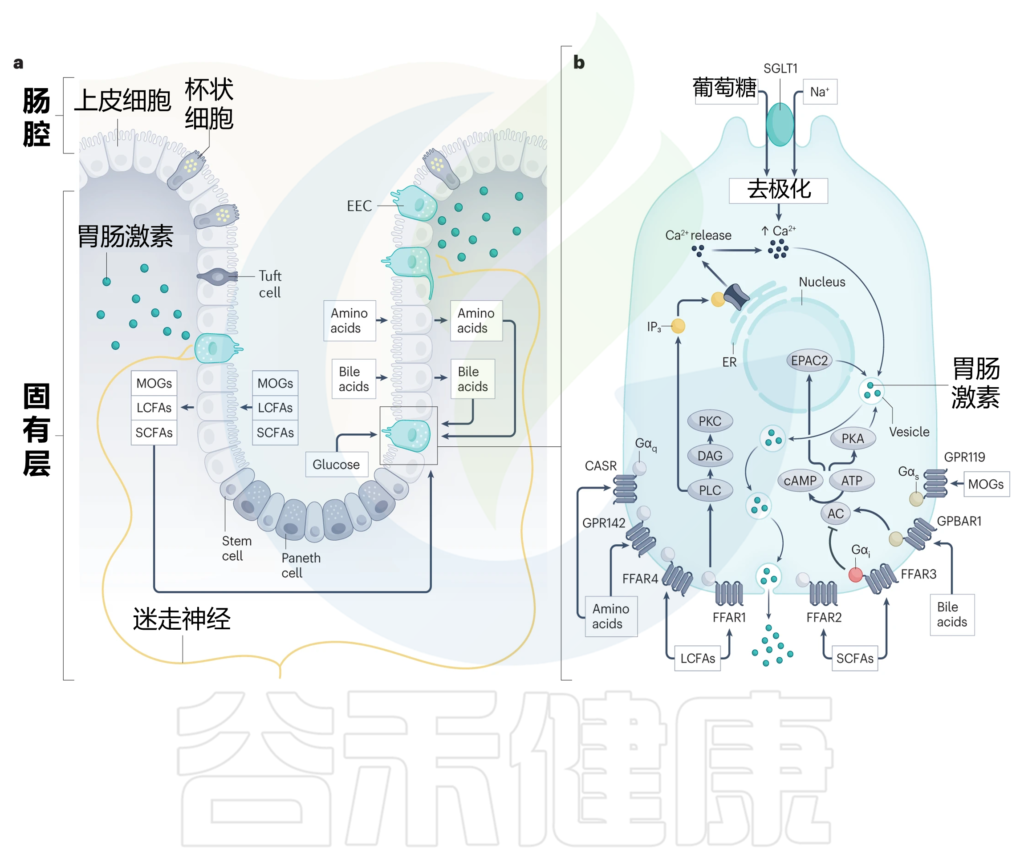
Bany Bakar R, et al., Nat Rev Gastroenterol Hepatol. 2023
肠道激素GDF15、FGF19(小鼠中的FGF15)、鸟苷素和尿鸟苷素不是由肠内分泌细胞产生的,而是由肠细胞和其他上皮谱系产生的。对这些激素生物合成和释放的途径了解相对较少。
肠内分泌细胞衍生的肽激素是由激素原转化酶的活性产生的,这些酶共同储存在囊泡中,囊泡与细胞膜融合以响应分泌刺激;而其他细胞类型中激素的产生则不同,它们并不经过传统的囊泡激素原转化酶和调节的囊泡分泌机制。
■ 肠道激素与二甲双胍疗效的关联
这些激素的生物合成与它们的mRNA水平有关,mRNA对特定刺激有反应。举例来说,FGF19(小鼠中的FGF15)的表达仅限于回肠末端,并通过核法尼糖样受体FXR被胆汁酸上调。在人体中,饭后胆汁释放后90-120分钟内FGF19的循环水平上升。在小鼠中,GDF15在多个器官中表达,但其在肠道中的表达受到细胞应激途径的增加的影响,就像在二甲双胍治疗过程中观察到的那样。实际上,治疗2型糖尿病患者的二甲双胍可能导致循环GDF15水平升高,从而产生该药物减肥效果。
■ Proguanylin:胃切除后水平升高?
Proguanylin在成熟肠细胞、一些杯状细胞和Paneth细胞中表达,在接受胃切除术或肠移植的患者中检测到的循环水平高于健康人。
Proguanylin释放到肠腔中,在那里被切割形成成熟的生物活性鸟苷肽。鸟苷由两个分子内二硫键稳定,这两个键对消化酶提供了一些保护,并从顶端方向靶向上皮膜鸟苷环化酶受体。Proguanylin和 prouroguanylin 也进入血液,但这些形式是如何分泌和激活的尚不清楚。
肠道激素控制许多胃肠道功能,这些功能涉及协调对食物摄入的反应,并确保摄入的食物被有效消化和吸收。
肠内分泌细胞检测管腔内容物的化学成分和局部营养吸收率,以及它们释放的激素控制过程,如胃酸分泌的调节、胃排空、胆囊收缩、胰腺酶和电解质的分泌、肠道运动和上皮屏障功能。
▸ 胃酸分泌
胃中特殊的壁细胞分泌酸有助于食物的消化和矿物质的吸收,并降低胃肠道感染的风险。胃酸的产生受到严格调节,以确保有效的食物消化,而不会损害胃和十二指肠粘膜。
胃窦G细胞分泌的胃泌素作用于肠嗜铬细胞上的胃泌素受体(称为CCKB或CCK2受体),刺激组胺的释放,组胺是一种强效的盐酸促分泌剂。胃窦和胃底D细胞的生长抑素对该系统进行微调,除了直接抑制壁细胞的酸释放外,生长抑素还能抑制胃泌素和组胺的释放。
其他几种肠道激素,包括胆囊收缩素(CCK)、氧调素、PYY和分泌素,通过不完全表征的机制抑制胃酸分泌,并募集涉及生长抑素的旁分泌回路。
▸ 胃排空
胃排空的速度决定了胃内容物输送到十二指肠的速率,并受到各种因素的调节,包括食物特性、肠道神经信号、肠道激素和血糖水平。胃排空率与食物消化率和营养吸收率密切相关,并受到调节,使得胃排空率仅反映小肠消化和吸收所接收营养的能力。
如果胃排空速率超过十二指肠吸收能力,营养物质会进入小肠并触发回肠制动,从而导致胃排空的反馈抑制,从而恢复平衡。主要位于回肠和结肠的肠道激素GLP1和PYY在回肠制动中起主要作用。回肠制动导致食物滞留在胃中,导致胃胀,从而激活发出饱腹信号的机械敏感迷走神经传入神经元。
▸ 胰腺和胆囊功能
一旦胃内容物进入小肠,其他激素就会被吸收以促进消化。由十二指肠 I 细胞产生的CCK刺激胰腺酶分泌,并通过刺激胆囊神经节中传出迷走神经神经递质的释放来促进胆囊排空。
分泌素在各种成熟的肠内分泌细胞中产生,刺激胰腺碱性电解质分泌,也与餐后热遗传学有关。鸟苷激活肠细胞中的鸟苷酸环化酶-cGMP信号,从而触发上皮氯化物和液体分泌。
这种途径被热稳定肠毒素劫持,是它们引发分泌性腹泻的能力的基础。鸟苷素-cGMP信号通路也与结直肠癌的抑制有关。
▸ 肠道运动
幽门以外胃肠道的运动由协调纵向蠕动波的肠神经系统和几种肠道激素之间的相互作用调节。
其中一种激素是胃动素,它存在于人类十二指肠中(尽管啮齿类动物不存在),并在胃中启动迁移运动复合体,特别是在餐间状态。胃动素受体激动剂,如低剂量红霉素,对胃轻瘫有治疗作用,一项研究表明,胃动素接收器的功能缺失变体在胃轻瘫患者中富集。
与调节小肠和大肠运动有关的其他激素包括:
粘膜血清素对肠道运动和液体分泌的重要性受到质疑,因为缺乏产生粘膜血清素所需的色氨酸羟化酶1的小鼠没有强烈的表型。然而,在一个模型中,产生血清素的肠嗜铬细胞被有条件地切除,这一发现强调了这些细胞确实在肠道转运控制中发挥作用。
▸ 肠道功能
除了控制肠道通道外,肠道激素还调节其他重要的肠道过程。例如:
GLP2刺激上皮生长,从而增加给定肠段的吸收能力。这种作用可能有助于GLP2治疗短肠综合征的疗效,
GLP1–GLP2双激动剂更有效。与血清素和神经降压素等其他肠道激素一样,GLP1和GLP2也会影响屏障功能并调节免疫系统。分泌血清素的肠嗜铬细胞与内脏疼痛有关,对肠道炎症、肝脏病理生理学和焦虑具有重要意义。
内 分 泌 胰 腺
我们知道饭后一段时间,人体内胰岛素的分泌量会增加,这其实也跟肠道激素有关。GLP1和GIP是两种主要的肠促胰岛素,占餐后胰岛素分泌的70%。
肠促胰岛素对葡萄糖刺激的胰岛素释放的影响可以通过以下事实来证明:口服葡萄糖比静脉注射葡萄糖(不刺激肠促胰岛素释放)能引起更大的胰岛素分泌——这种效应被称为肠促胰岛素效应。从生理上讲,肠促胰岛素调节对碳水化合物摄入的反应,并确保餐后健康的葡萄糖耐受性,无论摄入的葡萄糖负荷如何。
GLP1和GIP如何增加胰岛素分泌?
GLP1和GIP分别通过直接作用于GLP1受体和GIP受体来增加胰岛素分泌,这两种受体在胰腺β细胞中高度表达。
在β细胞中,GLP1和GIP受体主要募集Gαs并触发cAMP的升高。cAMP影响通过激活蛋白激酶A(PKA)和由cAMP-2激活的交换蛋白(EPAC2)调节胰岛素释放的几种下游途径。这两种效应物都调节离子通道活性以及参与葡萄糖依赖性胰岛素分泌的囊泡运输和融合。
GLP1和GIP具有额外的促胰岛素作用,但两者对肠促胰岛素作用的贡献有争议
GLP1和GIP对β细胞的作用不仅限于调控胰岛素分泌,还包括上调PDX1,促进胰岛素基因转录,增加β细胞质量并通过细胞周期和MAPK的激活促进新生。
基于这些作用,GLP1受体激动剂的长期治疗被认为是2型糖尿病的一种疾病改良治疗方法,可以通过增加或保留功能性β细胞质量来减轻β细胞功能障碍的进展。
注:迄今为止还没有证据表明GLP1受体促动剂调节人类的β细胞质量。
虽然说GLP1和GIP都刺激胰岛素分泌,但它们对胰腺α细胞分泌胰高血糖素的作用相反。
GIP刺激胰高血糖素分泌,而GLP1抑制分泌。
有证据表明,GLP1对胰岛素和胰高血糖素分泌的相反作用都有助于降低血浆葡萄糖。
GLP1通过激活GLP1受体介导的内在(非旁分泌)途径抑制α细胞,从而减少了胰高血糖素的分泌。
然而,其他研究结果表明,GLP1通过涉及胰岛内生长抑素的旁分泌机制间接抑制胰高血糖素的释放,并且GLP1和GIP的不同作用可以通过GIP对α细胞具有强大的直接刺激作用来解释,该作用掩盖了局部生长抑素的抑制作用。
肠促胰岛素的作用通常在2型糖尿病中受损,这种作用是糖尿病的后果而非原因。
在这种情况下,即使GIP的水平是超生理的,其作用也会减弱或缺失,而GLP1的促胰岛素作用相对保留。然而,GIP在2型糖尿病中保留刺激胰高血糖素分泌的能力,这会导致餐后高血糖。在各种研究中,GIP对胰腺β细胞的作用减弱归因于GIP受体表达减少、GIP受体下调或细胞内信号机制的受体后缺陷。
值得注意的是,2型糖尿病患者的血糖正常化提高了对GIP和GLP1的敏感性,这也许解释了为什么在双激动剂药物中在GL1中添加GIP对胰岛素分泌有额外的有益作用。
2型糖尿病是否与GLP1或GIP分泌缺陷有关尚不清楚。对2型糖尿病患者循环GIP水平的研究产生了矛盾的结果——高、低和不变的水平都有报道。相比之下,几项研究表明,2型糖尿病患者在混合餐后GLP1的分泌减少。
总的来说,2型糖尿病对肠道激素分泌的影响显然相对较小,这可能反映了这样一个事实,即:
肠内分泌细胞从隐窝干细胞中不断更新,在不利的代谢条件下,细胞损伤几乎没有时间积累。
然而,2型糖尿病对肠道运动和营养吸收的影响可能通过改变营养和胆汁酸刺激的局部递送而间接影响肠内分泌细胞的释放。
GLP1对胰岛素释放的影响比GIP大,GLP1已被开发为2型糖尿病的主要治疗靶点,并改变了2型糖尿病和肥胖患者血糖控制和体重减轻的临床治疗。
肝 脏
来自动物研究和临床试验的数据强调了GLP1和GLP1受体激动剂对肝脏代谢的多种有益作用。
GLP1受体是否在肝脏中表达有争议:
因此,在将GLP1对肝脏病理和功能的任何观察到的影响归因于肽对肝脏本身的直接影响之前,必须谨慎。
GLP1和GLP1受体激动剂对肝功能的间接作用
GLP1和GLP1受体激动剂对肝功能的间接作用是预期的,因为它们能够刺激胰岛素释放、降低胰高血糖素水平、改善葡萄糖稳态、减少胃肠道中乳糜微粒的产生以及减少热量摄入和体重。GLP1对肝脏影响的复杂性体现在它可以抑制肝脏葡萄糖产生并刺激肝脏葡萄糖摄取的发现上。20世纪90年代发表的研究将这些观察结果归因于胰岛素水平改变的间接影响,但后来的研究表明,胰岛素不是关键因素。
GLP1对肝脏脂质代谢有几种有益作用:
肝脏脂质代谢的这些改善可能至少部分归因于食物摄入的减少和随之而来的体重减轻。然而,一些研究结果表明,GLP1在调节肝脏脂质代谢方面具有额外的直接作用。
GLP1是否具有与体重减轻、胰岛素和胰高血糖素相关的肝脏作用之外的肝脏作用是一个有趣的问题。一项研究令人惊讶地表明,GLP19-36是GLP1的主要循环代谢产物,它独立于胰岛素的变化而抑制肝葡萄糖的产生,当GLP1受体被阻断时,这种作用仍然存在。这种作用的机制尚不清楚。一些证据表明,它涉及一种未鉴定的膜受体的激活,而其他研究结果表明,GLP19–36的降解产物(GLP128–36和GLP132–36)靶向PKA–β-连环蛋白–Wnt信号通路;这些降解产物可以在不涉及特定受体的情况下穿透质膜。需要进一步调查,以澄清和验证所涉及的机制。
无论GLP1对肝脏的有益作用是直接的还是间接的,GLP1受体激动剂正在被研究用于治疗非酒精性脂肪肝(NAFLD),这是肝脂代谢紊乱的最常见的慢性肝病之一。
GLP1受体激动剂:治疗非酒精性脂肪肝的希望
GLP1受体激动剂可以通过多种途径的组合来改善与非酒精性脂肪肝的发作和进展相关的基本代谢变化。
对非酒精性脂肪肝和非酒精性脂肪性肝炎(NASH)小鼠模型的研究表明,GLP1受体激动剂可降低肝脏脂肪含量,逆转脂肪变性,发挥抗炎作用,并改善纤维化的组织学严重程度。
此外,GLP1受体激动剂治疗非酒精性脂肪肝的临床试验(主要包括T2DM患者)产生了有希望的结果。几项研究表明,用GLP1受体激动剂治疗可降低肝脏脂肪含量,导致非酒精性脂肪性肝炎的组织学消退,并减缓纤维化的进展。然而,在这些临床研究中观察到体重和血红蛋白A1c水平显著降低,因此GLP1受体激动剂的作用是否独立于体重减轻和血糖控制的改善仍不清楚。
双激动剂疗法:研究非酒精性脂肪肝的新选择
双激动剂疗法,其中GLP1受体激动剂与直接抑制脂肪酸合成或靶向纤维化的第二分子结合,正在作为非酒精性脂肪肝的治疗选择进行研究;一个例子是GLP1–胰高血糖素组合肽。
其他肠内分泌激素(包括胃饥饿素和胃肠肽)对肝脏的影响尚不清楚。几项研究表明,GIP调节肝脏脂质含量,并可能参与非酒精性脂肪肝的发病机制。然而,GIP是否独立于其对胰岛素和脂肪组织的影响而直接影响肝脏中的脂质积聚(见“脂肪组织”)仍存在争议,因为GIP受体在肝脏中的表达仍未得到证实。几项动物研究表明,GIP信号传导的遗传或药理学破坏可以减少肝脏脂质积聚,但这些干预措施也可以防止饮食诱导的体重增加,因此研究结果不能证明GIP对肝脏有直接作用。
FGF19的多重代谢作用
与肠内分泌细胞衍生的肽不同,FGF19(小鼠中的FGF15)在回肠末端上皮中对胆汁酸吸收产生反应,是调节肝胆汁酸生物合成的重要抑制性反馈回路的基础。它还通过激活肝糖原合成和抑制糖异生等途径具有更广泛的代谢作用。
在不同器官中由肠道激素调节的过程
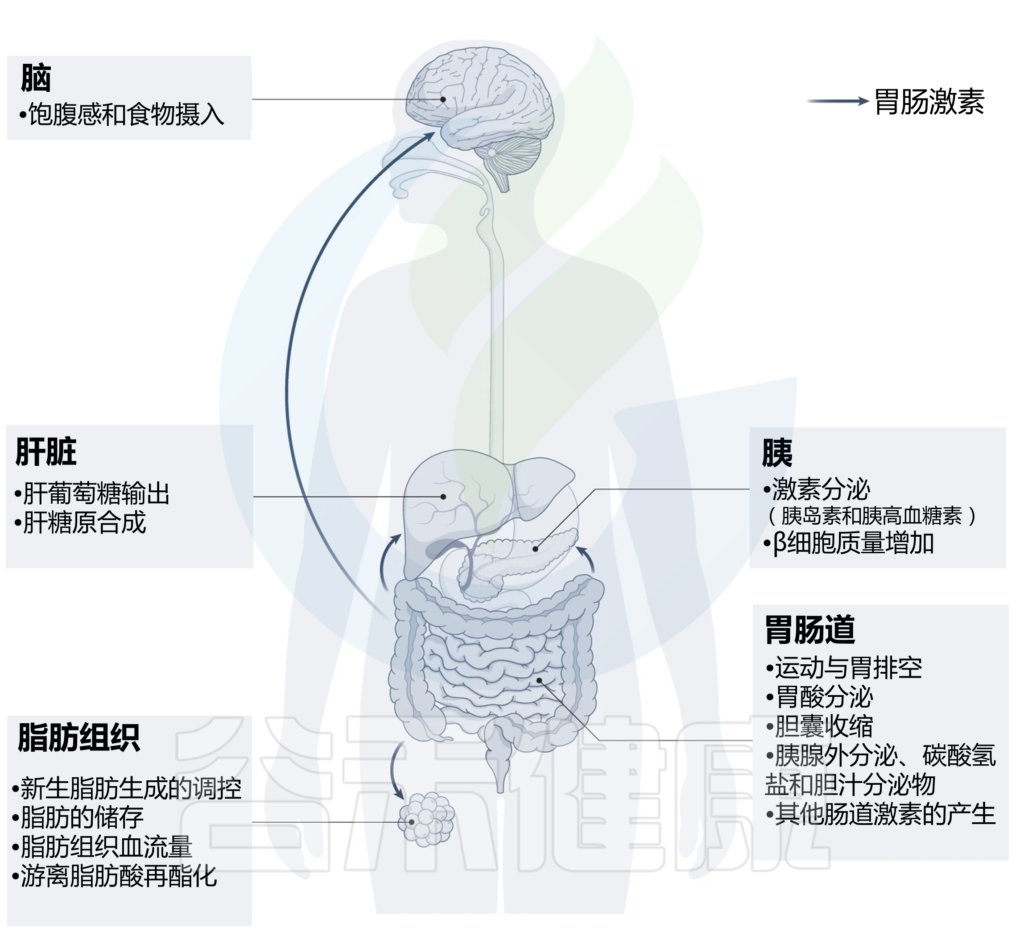
Bany Bakar R, et al., Nat Rev Gastroenterol Hepatol. 2023
脂 肪 组 织
脂肪细胞是哺乳动物的主要燃料储存室,它们的调节可以产生重要的代谢后果。在肠内分泌激素中,GIP与脂肪细胞功能的关系最为密切。
GIP与脂肪细胞功能:代谢调节的关键
几项研究表明,GIP促进白色脂肪组织(WAT)中的脂质储存,包括在大鼠中观察到,GIP通过增加脂肪组织葡萄糖摄取、从葡萄糖重新生成脂肪和将FFAs重新酯化为甘油三酯来支持脂肪组织中的脂质存储,以及在小鼠中敲除GIP受体可以预防饮食诱导的肥胖。
几项研究表明,脂肪组织中的GIP受体激活与胰岛素协同作用,增加脂质积累、葡萄糖摄取、新生脂肪生成和FFA再酯化。
脂肪细胞中的GIP受体类型:研究争议与需解决的问题
然而,这些发现需要在脂肪组织中哪些细胞类型表达GIP受体的争议中进行解释。单核转录组学表明,GIP受体不在成熟脂肪细胞中表达,而是在周细胞和间充质细胞中表达。考虑到许多脂肪细胞模型是由可以表达GIP受体的未成熟细胞在体外产生的,这些模型中的GIP受体表达是否能概括天然成熟脂肪细胞中的表达值得怀疑。
另一个必须考虑的因素是,GIP受体与Gαs偶联,Gαs下游cAMP水平升高通常与脂解而非脂肪生成有关,例如β3-肾上腺素能受体激活的脂解作用。
GIP的脂肪生成作用有益,改善脂质储存,减少异位脂肪积聚
有趣的是,GIP受体在小鼠和人类脂肪组织周细胞中表达的发现与GIP在体内显著增加脂肪组织血流量的证据一致,这一过程可以间接促进胰岛素依赖性作用,比如:清除甘油三酯、摄取葡萄糖。
无论潜在机制如何,GIP的脂肪生成作用都是有益的,因为它改善了白色脂肪组织中健康的长期脂质储存,减少了肝脏、心脏和胰腺等外周组织中的脂质溢出和异位脂肪积聚。
在2型糖尿病和肥胖的GLP1受体激动剂上添加GIP受体激动剂的代谢益处
早期的研究表明,GIP纯粹是致肥胖的,因此有利于GIP拮抗作用的翻译策略来实现减肥,而自从2018年以来发表的研究表明双重GIP受体-GLP1受体激动剂,替西帕肽在2型糖尿病患者中实现血糖控制和减轻体重方面比单独使用任一受体的激动剂更有效,该治疗改善了白色脂肪组织健康。替西帕肽治疗显著降低了肝脏脂肪含量以及内脏和皮下脂肪组织的体积,因此可能成为非酒精性脂肪肝或非酒精性脂肪性肝炎的重要治疗选择,尤其是在同时患有2型糖尿病或肥胖的患者中。
然而,对于是激动还是拮抗GIP受体,仍存在不清晰性;强有力的证据表明,任何一种方式都可以减轻肥胖和体重。
注:已经提出了几个假设来调和这些自相矛盾的观察结果,但还需要更多的研究来澄清这一领域。
尽管GIP在肠道白色脂肪组织轴中的确切作用机制仍有争议,但GIP在脂肪组织中的生理作用是明确的。在啮齿类动物中,棕色脂肪细胞组织(BAT)中GIP受体的表达已得到充分证实,给予GIP或替西帕肽可促进产热;替西帕肽也与支链氨基酸分解代谢增加有关。
然而,小鼠棕色脂肪细胞组织中GIP受体的条件性敲除并不能像全局敲除GIP受体那样防止饮食诱导的肥胖,这表明GIP对棕色脂肪细胞组织的影响在生理上并不是主要的。那主要的会是什么呢?
其他激素在肠道棕色脂肪细胞组织轴中发挥重要作用
例如,血清素抑制棕色脂肪细胞组织活性,而缺乏血清素产生所需的色氨酸羟化酶1的小鼠可以免受饮食诱导的肥胖。然而,鉴于血浆5-羟色胺是由血栓细胞缓冲的,肠道来源的5-羟色胺的内分泌作用值得怀疑,而且关于血浆5-羟色胺水平相对于用餐时间的日变化的报道一直不一致。相反,分泌素激活棕色脂肪细胞组织,这种激活与食欲的改变有关。
脑
肠-脑轴是胃肠道和大脑之间传递信息的渠道,包括神经、激素和营养信号;下丘脑核团和后脑是检测和整合这些外周信号的主要中心。肠-脑轴的紊乱已在多种疾病中被发现,包括炎症和功能性胃肠道疾病以及饮食障碍。
肠道激素在大脑的作用可以解释一些饮食失调和进食障碍的发生?
肠道向大脑发送关于饮食营养摄入状态的实时信号,肠道激素是肠道和大脑之间复杂相互作用的主要介质,这些相互作用是饱腹感(两餐之间不饿的感觉)和饱足感(一餐结束时吃得足够的感觉)的基础。许多肠道肽及其受体也在中枢神经系统中表达,并调节中枢回路,包括与食欲有关的回路。这种在中枢神经系统中的表达可能会使涉及肠道激素受体的药理学或全局遗传操作的研究的解释复杂化,因为其结果可能归因于对中枢神经系统回路的影响,而与肠道分泌的激素无关。
传入迷走神经神经元的细胞体位于结节神经节,并投射到孤束核(NTS),是介导肠道激素对食物摄入影响的主要途径。肠内分泌细胞通过局部升高的肠道激素水平以及可能的突触连接与传入迷走神经和内脏神经末梢进行交流。到达心室周围器官(例如,脊后和正中隆起区)和邻近细胞核(分别为下丘脑的NTS和弓状核)的循环肠道激素与这些信号汇合,以调节进食行为。几种肠道激素对大脑有着重要而独特的影响,下文将对此进行讨论。
CCK是在食欲调节中发挥作用的肠道激素。餐后释放CCK通过与CCK1受体结合激活传入迷走神经,向大脑提供反馈信号,从而减少进食。然而,根据小鼠研究,反馈信号的性质仍不清楚,因为动物可能因各种原因停止进食。在人类中,输注生理浓度的CCK可以抑制能量摄入并增加幽门收缩,而不会引起恶心;食物摄入减少被认为是幽门收缩的结果。在小鼠中,CCK通过传入迷走神经发出信号,激活中枢奖赏通路,并增加脂肪和糖的消耗。
CCK似乎会触发相对短暂的饱腹信号,PYY与餐后食物摄入的长期抑制有关。已知PYY的两种不同形式:PYY1-36和PYY3-36。PYY1–36通过二肽基肽酶IV转化为PYY3–36。两种形式的PYY都参与调节食物摄入,但它们表现出不同的特性和受体偏好。
GLP1和GLP1受体激动剂可以抑制食欲
GLP1受体激动剂主要通过作用于中枢神经系统内的GLP1受体来抑制食物摄入,但肠道来源的GLP1在大脑中是否达到足够高的水平以在生理条件下激活GLP1受体仍不清楚。
几项研究表明,迷走神经传入神经元的末端暴露于胃肠道中高水平的局部生物活性GLP1,介导内源性肠道衍生的GLP1的饱腹作用。
肠道来源GLP1控制食物摄入——不是主要的
在小鼠中,迷走神经神经元表达GLP1受体,而且响应机械刺激,外源性GLP1也可以增强由胃和肠道拉伸引起的饱腹感。然而,敲除肠道来源的GLP1不会影响小鼠的食物摄入或体重,这表明肠道来源的GLP1对控制食物摄入并不重要。
脑源性GLP1控制食物摄入——明显作用
虽然去除后脑GLP1表达也不会影响自由进食行为,但当化学遗传学激活时,它确实削弱了表达GLP1的神经元减少进食的能力,证明了脑源性GLP1在控制食物摄入方面的明显作用。
GLP1受体与氧调素的互动:探索胰岛素类似物的潜力
GLP1受体也被氧调素激活,氧调素是一种由肠道L细胞分泌的37个氨基酸的略微延伸的胰高血糖素类似物,在胰岛素受体处也具有活性。氧调节蛋白在体重管理和葡萄糖稳态方面具有有益作用,这一作用正开始通过使用GLP1受体和胰岛素受体双激动剂而得到利用;鉴于目前还没有发现特异性的尿囊素受体,这些作用被认为是由其对这两种受体的双重作用介导的。
减肥手术后,餐后GLP1、氧调节蛋白和PYY水平显著升高;循环水平足以对食物摄入和葡萄糖耐受性产生有益影响。然而,在小鼠中,Roux-en-Y胃旁路术的减肥作用在缺乏神经肽Y受体2型和GLP1受体的动物中仍然存在,这表明这些激素作用之外的机制也有助于减肥手术的益处。
神经降压素也与减肥手术的效果有关
神经降压素(Neurotensin)是一种13个氨基酸的肽,主要存在于大脑和胃肠道中。在啮齿类动物中,神经降压素直接进入大脑时会减少食物摄入,这种作用主要由NTSR1(神经降压素受体1)介导。
在一些研究中,Ntsr1敲除小鼠食欲增加,体重增加,对神经降压素的食欲抑制作用没有反应。
然而,在其他研究中,Ntsr1敲除降低了进食量并增加了活性,但对体重或组成没有影响。
脑源性神经降压素抑制食欲,外周的神经降压素对代谢的影响尚不清楚
一些研究表明,神经降压素的外周给药会导致啮齿动物的食物摄入量暂时减少。一些证据表明,这种影响可能归因于肠道中脂肪吸收的减少,但减少进食的确切机制尚不清楚。
另一种与减肥手术结果有关的激素是分泌素,因为它在手术后的餐后水平也会升高,尽管它在这些患者中的生理重要性尚不清楚。
来自非肠道内分泌细胞的肠道激素(GDF15、FGF19、uroguanylin)似乎也通过中枢途径调节食欲的作用。
最有力的证据是GDF15,它靶向后脑中有限的神经元群体,并导致由一系列毒性刺激(如化疗剂)诱导的恶心,这种恶心发生在癌症恶病质和妊娠剧吐中。
GDF15反应神经元表达GDF15受体,即GFRAL,并与脑干GLP1受体和CCK回路密切相关。有趣的是,GIP可以通过表达GIP受体的海马后区GABA能神经元抑制GDF15(和其他肠道激素,包括GLP1和PYY)引起的恶心。
Ghrelin:非凡食欲刺激者
胃饥饿素(Ghrelin)是唯一被广泛接受的刺激食物摄入的肠道激素。根据这种生物活性,血液中胃饥饿素的水平在用餐前升高,在进食后下降。
其生物学效应是通过生长激素促分泌受体(GHSR)介导的,GHSR存在于全身,包括胰腺、迷走神经传入神经元和大脑。几项研究表明,Ghrelin通过在下丘脑弓状核的中央和迷走神经传入神经的外周发挥其食欲产生活性。
然而,后一种机制是有争议的,一些研究表明,胃饥饿素的食欲产生作用不需要迷走神经传入信号。一些研究表明,胃动素也能促进食物摄入,但胃动素的生理学特征很差,因为它不存在于啮齿类动物中。
注:胃动素是一种与胃饥饿素有关的肽,由十二指肠中重叠的肠内分泌细胞群体产生。
INSL5:微弱但可能的食欲促进者
INSL5由远端结肠和直肠L细胞的一个子集分泌,对小鼠的研究表明它它具有食欲促进作用。它通过RXFP4(松弛素-胰岛素样家族肽受体4)发挥作用,该受体在大脑的关键进食中心表达。
INSL5的增食欲作用远低于胃饥饿素,这在一些研究中没有观察到,并且可能在体内被PYY所淹没,PYY是从相同的肠内分泌细胞平行分泌的。这些观察结果让人怀疑外周释放的INSL5是否在控制食物摄入方面具有重要的生理作用。然而,一项研究已经确定了腹内侧下丘脑中表达RXFP4的神经元在调节食物摄入和偏好方面的潜在作用。
胃肠道和身体其他活跃的组织之间有着双向的信息传递,而这个信息传递的改变与多种代谢性疾病有关。目前对于胃肠激素如何与这个复杂的调节网络相互作用的理解正在逐渐加深,但仍需要进一步的研究来完全揭开这个谜团。
肠道菌群的异常变化可能影响肠道激素的正常分泌,从而导致代谢相关疾病发生。因此,肠道菌群的稳定和平衡对于保持肠道激素的正常分泌和代谢健康非常重要。这些发现为我们深入了解肠道菌群和肠道激素的相互作用、开发相关治疗方法提供了新的方向。通过调节肠道菌群的结构和功能,我们可能能够干预肠道激素的分泌,从而实现对代谢相关疾病的治疗和预防。
通过开发创新、微创且耐受性良好的治疗方法,我们可以利用胃肠激素受体的转化潜能。GLP-1双重和三重激动剂疗法的临床试验已经证明了这种方法的价值。这个领域研究进展迅速,很可能会进一步细化现有的认识,解决关键的机制问题。期待揭示出胃肠激素控制的多个信号通路,可以成功地用于治疗2型糖尿病和肥胖,并且将这些基于胃肠激素的药物在其他代谢性疾病中推广应用。
主要参考文献:
Bany Bakar R, Reimann F, Gribble FM. The intestine as an endocrine organ and the role of gut hormones in metabolic regulation. Nat Rev Gastroenterol Hepatol. 2023 Aug 25.


小编最近仔细阅读了一本书,书名是《战斗细胞:人体免疫系统奇妙之旅》(海南出版社2022年10月出版的),该书是德国科学家菲利普·德特玛(Philipp Dettmer)撰写的一本书,作者是一名信息设计师。在32岁被确诊癌症并接受了一系列手术和化疗后,他逐渐痴迷于研究免疫学,目前已成为一名科学传播者和免疫研究爱好者。
译者李超群,英国利兹大学应用翻译专业硕士,译有《饮食的迷思》《显微镜下的室友》等。
在书中,作者以亲切易懂的语言、切入场景确切的比喻,生活化的语言描绘出免疫细胞世界的模样、运行的方式、如何使我们生病或保护健康,帮助读者轻松理解复杂的免疫相关知识。
免疫系统本来是对普通人比较陌生的领域,专业名词也多,但是作者通过生动的比喻帮我们克服了概念上的障碍,例如,他将普通体细胞比作“平民”,免疫细胞则是“各种专门士兵”——肠道有益菌是可爱小兔子、抗体是小龙虾等。看书的过程就好像在看影视剧一样。就算你从未接触过医学知识,也丝毫不影响阅读和理解。
回顾我们以往的科普文章,虽然前期选定主题,查阅大量研究文献和资料,再整理撰写花费时间很多,但是没有将科普文章写得如《战斗细胞》一书一样让不同知识面的客户都可以轻而易举读懂和受益。
在此有机会阅读此书并分享书中部分关于免疫系统和肠道黏膜和肠道菌群的内容,帮助读者增进对人体免疫系统的了解,从而更好地守护自身健康。
前序:在我们生活的环境中有着不计其数的病原体,不仅有病毒,还有细菌、寄生虫等等。人类几乎每时每刻都在和环境中的危险因素接触、斗争,只不过,我们常常感知不到这个“斗争”的过程。
免疫系统的构成:一支精密完备的“老牌”军队
用作者的话说,要回答什么是人类的免疫系统,还真有点不容易,但既然叫做“系统”,也就表明它不是一个单独的东西,而是一整套完整的体系。
作者把人类免疫系统比作是“一套军队系统”,说它“是由成百上千的营地和征兵处组成的遍布全身的复杂网络”,这说的就是免疫网络,是免疫系统的“基础设施”。
而所谓的“营地”,其实就是指免疫系统中专门的免疫器官,比如骨髓、胸腺、盲肠、扁桃体等等,这些免疫器官有些也是免疫细胞的诞生地;此外还有淋巴结。另外,免疫细胞内部还会释放出各种免疫活性物质,或者称为“细胞因子”,例如常见的有抗体、补体、免疫球蛋白等等,它们也是整个免疫系统重要的组成部分。
按照不同的免疫功能,免疫系统由两大王国组成,即先天性免疫(或说非特异性免疫),以及后天的适应性免疫(或说特异性免疫)。从名称就可以看出,两者的区别在于,先天性免疫是我们一出生就具有的,或者说不是针对特定的、单一的病原体的。
➤ 初代生命的进化与互相攻击:35亿年前,泥坑中的奇迹诞生
要是你因为每天早起上学,工作,路上堵车就觉得生活不顺,那原始的单细胞生命可以给你好好上一课。
35亿年前,地球还是一片蛮荒之地,在某个神奇的泥坑里,生命诞生了,而免疫系统要也随之出现了。我们不知道这些初代生命做过什么,又怎么活下来,但知道它们很快就开始了互相攻击。
➤ 生命的合作进化:从单细胞到多细胞
它们必须想办法把周围的化学物质转化为能为己用的东西,同时获取生成必需的能量,而其中几种细胞就盯上了“捷径”。
能偷别人干的,干嘛要自己干呢?
有几种办法实现了这一目标,比如:
可以整个同事其他细胞,或是在别的细胞上打洞并从其内部吸食营养……不过这样做颇有风险,成功了能饱餐一顿,失败了则会惨遭反噬,特别是在对手更大,更强的情况下。
风险更小的办法是潜入对手细胞内部并在此安家:分享宿主的粮食,享受它的呵护。这个办法相当成功,当然对宿主来说就很可怕了。
既然擅长“吸血”成了有效的生存技能,那么保护自己不被“吸”就成了演化上的必需。接下来的29亿年里,微生物凭借相似的招数,互相竞争厮杀。
假如有个时光机,能回到过去的微观世界一睹此类战争的宏大场面,你多半会失望,除了潮湿的石头上有一些纤薄的细胞膜之外,什么都没有。
在最初的几十亿年里,地球是个相当乏味的地方,直到生命形式的出现和飞越。
我们现在并不特别清楚,到底是什么让单打独斗的细胞开始向着密切合作并有专门分工的庞大细胞群发展的。
➤ 多细胞生物的兴起与免疫系统的重要性
大约在5亿4100万年前,多细胞动物出现了爆发性增长,体型变得肉眼可见,多样性也以极快的速度大大增加。
这当然就给刚演化出来的古代微生物们提出了一个问题:几十亿年来,生活在微型世界中的它们,无论进入任何生态系统,都要为其中的空间和资源争斗,而对这些细菌及其他微小生物来说,还有比多细胞动物更好的生态系统吗?这个系统里,从头到脚都是免费的营养!所以从一开始,多细胞生命就面临着细胞入侵者和机体寄生者的威胁。
只有能应付这种威胁的多细胞生物才能存活下来并有机会演化得越来越复杂。可惜,经过数亿年的时间,细胞和组织都没有得到好好的保存,我们看不到免疫系统的化石遗迹。但通过科技的魔法,我们可以看到生命树的各个分叉,并观察现存动物,研究它们的免疫系统。如果有些免疫特征,为生命树上差距越大的物种共同拥有,那么一般而言,这些特征也就越久远。
那么重要的问题就变成了:
➤ 免疫系统会在哪里产生区别,不同动物的免疫系统有哪些共性?
几乎所有当今的生物都有某种形式的内部防御机制,而生物越复杂,免疫系统也越复杂。选取相差悬殊的动物,比较它们的防御机制,我们就可以了解很多免疫系统的历史。
从最微小的层面来说,细菌也有抵御病毒的方法,它们不可能乖乖就范。而在动物世界中,海绵这种已经存在了5亿多年的最古老、最简单的动物,就拥有可能是最原始的动物免疫反应:“体液免疫”(“体液/humor”一词来自古希腊语,这里可不是“幽默”)。
体液免疫主要通过游离在细胞外体液中的微小蛋白来实现功能,杀伤、歼灭不该出现的外来微生物。这类防御非常有用,也非常成功,几乎所有现存的动物,包括我们人类,都有体液免疫。它没有被演化淘汰,而是变得举足轻重。原则上说,体液免疫在5亿年里都没怎么变。
但体液免疫只是个开端。多细胞动物的优势之一是就发展出了专业的防御细胞,相应的免疫就叫“细胞[介导]免疫”。
这种新型的免疫一开始就大获成功。连在蠕虫和昆虫的小小身体里,我们都发现了专门的免疫细胞卫士,它们能在小虫体内自由巡行,与入侵者正面交锋。
沿着演化之树,越是向枝头探寻,免疫系统就变得越是精妙。而在最早的脊椎动物身上,我们就已经看到了重大的创新:出现了专门的免疫器官暨细胞的“训练场”,以及最为强大的免疫原理之一——能够识别特定的敌人,并快速制造大量的针对性武器实现精准打击,还要牢牢记住它们!
即使是最原始的脊椎动物,比如样子诡异的无颌鱼,体内也有同样的免疫机制。

图源:dashangu
在数亿年的岁月里,这些防御机制变得越发复杂和精密。不过,简而言之,上面都是基本的免疫原理,它们有着出色的防御效果,所以或许在5亿年前的某些生物体内就已经存在了。因此,虽然你我的免疫系统很复杂、很强大,但其底层机制在动物界却很普遍,它擅长调动多种多样的特化细胞。
因此,从演化上来看,动物很可能没用多久其起源可以追溯回几亿年前。演化之手无须一次次地重新发明免疫系统——它发现了一套了不起的系统,并将其不断完善。
好,话题终于要回到人类,回到你我身上了。我们都在享受着数亿年来免疫系统不断演进的丰硕果实。不过,免疫系统并不只是存在于你的体内,它就是你本身。“免疫”只是对守护自身并维系生命的所有生物机制的一种表达方式。所以讨论免疫系统就是在讨论人本身。
免疫系统也不是一个单独的东西。它像一套军队系统,是由成百上千的营地和征兵处组成的遍布全身的复杂网络。它们和心血管系统一样,分布广泛,无处不在,由像高速路网一样的管道网连接起来。另外,人体还有专门的免疫器官,位于胸腔内,大小和鸡翅差不多,会随着人的衰老而逐渐退化。
基于免疫器官和免疫“基础设施”,有几百亿免疫细胞在免疫路网和血流中巡逻,可以随时应召和敌人作战。此外,人体外部组织表面也有几十上百亿的免疫细胞形成的屏障,准备抵挡入侵。

这还只是积极防御,还有1018数量级的蛋白质武器组成的防御系统,它们就像能自动组装、四处散布的地雷。免疫系统中还有专门的“大学”,供细胞学习如何识别敌人及怎样作战。这所大学有着世界上最大的生物学图书馆,可以教你识别一生中可能碰到的所有敌人并记住它们。
在最核心的意义上,免疫系统就是区分自身和异物的工具
无论对方是否恶意,并不重要,只要不是被授予自由通行证的贵宾,免疫系统都会发动攻击与歼灭,因为这些被视为潜在的威胁。对免疫系统来说,为任何“他者”冒险都不值得。没有它们的此种忠诚,我们可能活不了几天。可惜,免疫系统如果忠诚不足或忠诚过头,也会造成困扰甚至引发严重后果致人死亡,后面我们会谈到这些情况。
免疫系统的首要目标——维持稳态
虽然说区分自身和异物是免疫功能的核心,但并不是它的目标。免疫系统的首要目标是维持“稳态”,即维持体内全部细胞及物质的平衡。免疫系统真是投入了最大的努力保持平衡,也在尽心安抚自己免于反应过激,这一点我们怎么强调也不为过。
你也可以理解成,它在追求和平,追求让生存变得愉悦和轻松的稳定秩序,也就是我们所说的“健康”。健康是轻松自由地生活的基础,拥有健康,我们才能从心所欲,不受病痛的阻挡。
只有当我们失去健康时,才会真正意识到它的宝贵。健康其实是一个抽象的概念,因为它描述的并不是一种实质的存在,而是没有病痛、不受限制的状态,不是“有”而是“无”。拥有健康的时候,你觉得一切正常,感觉良好。而一旦健康离你而去,哪怕只有几天,都很难忽视人的脆弱和生命的稍纵即逝。疾病是生命中不可避免的事情。对于美好生活而言,没有什么比健康的身体更重要。
对免疫系统来说,健康就是稳态
尽管这场守护健康的战争终会不可避免地输掉,变成徒劳,但我们仍在努力夺取多一些时间,哪怕只是几个小时。总体而言,生而为人是幸福的,我们都希望自己可以活得久一点。
但维持健康殊非易事,因为我们每天都会遇到上亿的细菌和病毒,它们巴不得占领你的身体,就像几十亿年前那些单细胞生物之间发生的战争那样。
对微生物来说,你就是一套有待征服的生态系统。这片广袤无垠的土地资源丰富,适合繁殖,充满了机遇,是理想的栖居之地。当然,等我们最终离开这个世界时,它们还是会胜利的;没有了免疫系统的保护,大量疯狂的微生物组成的军团会大大加速尸体的分解过程。
预防癌症是免疫系统的头等大事之一
要担心的还不止这一大堆想要入侵的微生物,还包括可能误入歧途的身体本身,就是癌症。事实上,在你读这几页书的时候,身体里可能就有早期癌细胞正在被免疫系统悄无声息地清除掉。
免疫系统也可能出错——自身免疫性疾病、过敏
旨在保护你的免疫系统也可能出错,可能堕落。免疫系统一旦受了蒙骗,可能就会助长疾病的蔓延,或是保护癌细胞不被发现。免疫系统也可能失衡或受损,从而糊涂地攻击自身。它会把“我”误判为“他”,实实在在地攻击起它本该保护的那些身体细胞,导致一系列自身免疫性疾病,而病人不得不长期服用可能伴有严重副作用的免疫抑制药物。
过敏反应是指免疫系统对无害的物质产生了过激反应。“过敏性休克”就是一种严重的过敏反应,它凸显了免疫系统有多强大,一旦出错又多么可怕:疾病未必会马上置人于死地,而免疫系统带来的过敏性休克却能在几分钟内夺人性命。

免疫系统在帮助你的同时也会带给你痛苦
生病时的很多糟糕症状都是被激活的免疫系统引发的后果——对某些疾病来说,最严重的损伤甚至死亡都是免疫系统对入侵事件的失控反应造成的。比如,COVID-19导致的许多死亡病例都是免疫过激的结果。
伤害的累积是严重疾病的基础
免疫系统发挥防御功能的同时造成的损害会不断累积,于是今天有人认为,免疫系统的正常运转正是一些致命疾病的发展基础。因此,尽管拥有能对外界威胁做出快速有力反应的免疫系统对健康很是关键。
但同时保证它不会失控和搞破坏也很重要。就和人类社会一样,如果你的身体不得不打仗,那它至少想要快速地结束战争,赢得干净利落,而不想经历长期的被占领或冲突,那只会耗尽资源,毁坏基础设施。
人不管怎样生存和行动,都离不开世界本身及世上的一切。温馨私密的城堡,偏僻的森林木屋,遥远的社交距离,都无法让你免于和世界打交道,哪怕你是最叛逆的网瘾少年-最起码你需要稳定的食物来源,因此总要和外界有最基本的互动。

人体面临着同样的问题,因为细胞需要氧气和营养来维持生存和运转,并排出代谢产生的有害废物。就是说,资源要从外面进来,废物要从里面出去。因此,人体不可能是封闭的系统,内部总要有和外界直接接触的地方。
绝大部分病原体入侵都发生在这些内外交界之处
而这样的地方也就是人体的薄弱环节,从这里,不速之客能偷偷入侵血肉大陆。事实上,绝大部分的病原体入侵都发生在这些内外交界之处,包括从口腔一直到肛门的消化道,还有通向和外界进行交换的“洞穴系统”的多分支管道。
开头我们就说过,人体的肺和呼吸道、口腔和肠道,以及生殖道,其实是身体的外部,只是被卷到了里面。按理说,这些“管道”里铺的东西应该叫“内皮”,可惜,正确的名字是黏膜。为了听起来更酷一些,我们就叫它“沼泽之国”。
沼泽之国要解决的一大难题,方便营养进来、废物出去,同时又要让病原体难以逾越
这意味着,沼泽之国的免疫系统要和身体其他地方的不一样。肠道黏膜人体大部分都是无菌的,没有微生物,没有异物,而沼泽之国却在持续接触着各种“异物”:有待吸收的食物碎块,由此通过的可消化物质,可以自由进入并在肠道安居的有益菌,还有从空气中吸入的各种颗粒物,如污染物、灰尘等等。
这样一来,当然会有数不清的不速之客想要偷偷潜入,越过防线。其中一些是不小心闯入的无辜过客,另一些则是专门攻击人体的危险病原体。

这使得这些部位的免疫系统有着格外艰巨的职责,要维持平衡更是难上加难——因为沼泽之国的免疫系统要有一定的宽容度。
与此相反,身体多数部位的免疫系统对异物是毫不留情的。划伤之后,细菌侵入软组织,免疫系统就会发动猛烈的还击。皮下或者肌肉组织是容不得细菌的,会不惜一切代价把它们消灭掉。而这在黏膜附近就不可能了。

黏膜处的免疫系统小心处事
黏膜处的免疫系统不能像其他部位一样有攻击性,否则这些负责气体和营养交换的部位会遭到严重破坏,从而影响正常生活甚至造成死亡(许多患有自身免疫性疾病或过敏的人,就会遇到这种情况,不过我们后面再详细讲)。黏膜的免疫系统必须小心行事,被激活后要尽量把免疫反应限制在最必要的范围内。但同时,黏膜又是身体最薄弱的地方,免疫系统必须要能发挥保护作用,不能太过散漫,非常棘手。
针对入侵的第一项反制措施,就是把黏膜变成不适合危险微生物生存的死亡之地。为此,黏膜动用了一系列不同的防御系统。
如果说皮肤像广袤的荒漠,又像一道无法逾越的边境长城,黏膜就像一大片沼泽地,遍布着陷阱和巡逻的卫兵队伍。黏膜比皮肤容易入侵,但这也并不轻松。那么黏膜究竟是什么,又是怎样保护你的呢?
沼泽之国动用的第一道防线就是它本身的黏液层。黏液是细胞分泌的黏滑的物质,有点像水凝胶。你可能知道鼻涕,鼻子里面黏糊糊的东西,感冒时会流很多,看起来有点恶心。实际上黏液遍布身体里的各个地方:口腔、肠道、呼吸系统(包括肺部)、眼睑内侧等等。
与外界进行物质交换的通道表面上都有黏液。持续生产黏液的是杯状细胞,它们的样子很好玩,但我们主要讲免疫系统,就不过多介绍它们了。你可以把它们想象成被踩扁的怪虫子,不停地吐出黏液,形成了黏液层。
湿滑的黏液发挥着几方面的作用
它是一道阻止外敌入侵的物理屏障
假设你在满是污泥的泳池里游泳,还要潜到池底,而污泥有近百米深。黏液不仅是一层黏糊糊的屏障,还和皮肤荒漠一样充满了陷阱:有盐,有可以溶解微生物外部结构的酶,还有一些特殊的物质能耗尽细菌赖以为生的关键营养,从而饿死细菌。
大多数部位的黏液富含杀伤力强大的IgA抗体
所以黏液层本身就不是宜居之地。而且,黏液层不仅能为你抵御外敌,还能让你免受自身的伤害。你是否想过,胃里有那么多胃酸,你为什么没事?因为胃黏膜就是一层屏障,能保护胃壁细胞,令其不与胃酸接触。
黏液可以移动
黏膜表面是一层名为“上皮细胞”的特殊细胞,你可以把它们看成“内皮的皮肤细胞”。它的细胞膜上覆盖着形如发丝的纤毛,这种微小的细胞器聚在一起,连成大片的网。上皮细胞位于黏膜的最外层,就像“身体里的皮肤”,表面只有一层黏液。
有些地方黏液和身体内部之间只隔着薄薄的一层,一个上皮细胞的厚度。上皮可没有皮肤那么奢侈,能让好几百个细胞一层层摞在一起。也正因为这样,上皮细胞可不好对付。它们尽管不是真正的免疫细胞,但也发挥着重要的防御作用:它们特别擅长激活免疫系统,以及释放特殊的细胞因子以请求支援。它们就像民兵组织,虽不能与敌军旗鼓相当,但在身体遭遇入侵时,是非常有用的补充性防御力量。
上皮细胞的任务之一,就是借助细胞膜上的纤毛让黏液流动
有些微生物会借助纤毛移动,而上皮细胞则是摆动纤毛让表面的黏液一起有节律地流动。摆动的方向取决于上皮细胞的位置。呼吸道、鼻腔、肺里的黏液,要么从口鼻排出体外,要么绕个弯被吞进胃里。
我们在一生中会吞下相当多的黏液,虽然听起来可能有点恶心,但这种机制很是有用。毕竟,胃里充满了强酸性的胃液,绝大部分病原体都无法幸存。而肠道上皮细胞纤毛运动的方向也很清楚:从胃向肛门——吃进来的东西都从这里要排出去。
沼泽之国——合作联盟
不过黏膜形成的沼泽之国不是单一国家,而更像彼此迥然不同的多个国家,为了共同目标而结成的合作联盟。
比如在荒漠之国皮肤的情况中,脚底和腰部的皮肤厚度就有很大差异。相应的,肺部黏膜和肠道黏膜有着完全不同的功能,而女性生殖道黏膜的功能又大不一样。根据不同部位黏膜特化情况的不同,相应的免疫系统也各有特点。
在讲病毒之前,我们先看看肠道这个神奇的国度,看看它是怎么和足足几十万亿细对免疫系统来说,肠道是个非常特别的地方,因为在这里,免疫系统要应对许多复杂的挑战,才能保持身体健康和正常运转。
我们还是来把肠道想象成贯穿人体的长管道,它把一点“体外”裹进了“体内”。在这些“外”表面,即肠道黏膜上,生活着1000多种细菌,数量多达三四十万亿,还有几千种病毒,它们共同组成了“肠道微生物群”(绝大多数肠道病毒攻击的是肠道细菌而非人体)。
关于免疫系统和肠道微生物组各自的功能及其相互作用,我们还很缺乏了解。许多疾病和失调都跟两者间的失衡有关,不过要完全理解两者间的各种关系,还需要大量的研究。未来几年,我们很可能会有重大突破。
在本章中,我们会探讨免疫系统是怎样和如此众多的微生物和平共存的。
首先,肠道免疫系统是一个半封闭系统,它会试图和身体其他部位免疫系统保持一定的界线。
肠道黏膜遇到的最大挑战,就是它的防线一直在被攻破。对肠道来说,外界的侵扰永不停歇,肠道免疫系统要持续响应,分辨敌友,这和身体其他任何地方都不一样。肠道是个繁忙的地方,除了生活着组成肠道微生物组的几十万亿有机体之外,还有吃进来的所有东西。
食物消化
食物的旅程始于口腔。食物要被消化吸收,变成身体和细胞养分,第一步就是被牙齿磨碎,并被唾液浸润、炮制。唾液中含有一些可以分解食物的化学物质,从你吃第一口开始,整个消化过程就拉开了序幕。
从进食到把废物排出体外,吸收营养的时间是有限的,所以越早开始越好。嚼碎的食物接着会被吞下去,在胃酸之海里停留片刻。胃酸不仅可以帮助消化,分解结实的肉类和植物纤维,它还能淹没并杀死大量微生物,从而大大减轻免疫系统的负担。
经过胃部后,食物就到了肠道。肠道长约3—7米,是最长的一段消化道。90%以上人体所需的营养都是在肠道吸收的。这里生活着大量人体必需的细菌伙伴,它们进一步分解食物,便于身体吸收营养。但这些可不是随便什么细菌。
几百万年以前,人类祖先和某些微生物群做了个小约定:
肠道细菌——租客;生成的营养物质——租金
人允许它们住在温暖的肠道里,并提供源源不断的食物;作为交换,这些微生物负责分解人类自己无法分解的碳水化合物,并生成人体自身不能合成的维生素。
肠道细菌:亦友亦敌
这些细菌就叫“[偏利]共生细菌”,“共生”(commensal)一词来自拉丁文,意为“同在一张桌前”。就和生活在皮肤表面的那些细菌“部落”一样,肠道的共生细菌也是我们的朋友。这些细菌只要不危害人体健康,免疫系统就不会攻击它们,这就是双方守约定的最理想情况。
为了维持秩序与和平,肠道细菌也像皮肤表面的细菌那样,生活在肠道黏膜的表面之上。只要肠道细菌不越线,不侵入上皮层,双方就相安无事。当然,事情不会这么简单。
细菌可不是人类真正的朋友,它们不知道什么约定,也不会去遵守任何东西。而肠道面积辽阔,细菌多得惊人,时刻都有一些共生细菌侵入肠道内壁。这就不太妙了。要是这些细菌进入血流,即进入真正的“体内”,会带来可怕的后果,甚至危及生命。而黏膜的一大目标就是防止这种情况。
肠道黏膜有三层
1
先是黏液层,内含大量抗体、防御素(前面讲皮肤时提过,它们就像微型针头,能杀死微生物)和其他一些能杀伤或杀灭细菌的蛋白质。肠道的黏液层很薄,且要有一定的通透性,好让食物中的营养物质通过,要是第一层保护太厚,你可能就要饿死了。
2
黏液层之下是肠道上皮细胞,它们是人体内外之间的真正屏障。和肺部相似,肠道的上皮层也只有一个细胞那么厚。为了更好地起保护人体内部的作用,肠道上皮细胞彼此连接得非常紧密,被特殊的蛋白紧紧粘在一起,就像真正的墙一样牢固。免疫系统严密监控着这里的情况,对于一切企图黏附到上皮细胞上的微生物,它都会毫不客气。
3
共生细菌突破防护墙的情况每时每刻都在发生,所以上皮细胞下面还有第三层,“固有层”,这里是肠道免疫系统的大本营。

在紧贴着黏膜表面的固有层之内,有特殊的巨噬细胞、B细胞和树突状细胞随时待命,等着收拾那些不速之客。
免疫系统会极力避免引发炎症
因为炎症会让肠道产生大量多余的液体,造成腹泻。腹泻不仅会使大便呈水样,还会损伤负责从食物中吸收营养的、敏感纤薄的上皮层,并迅速导致重度脱水。
很多人不知道,腹泻现在仍是重要的死因,每年约有50万儿童因此死去。所以,从几百万年前,人类这一物种登上演化的舞台开始,人体和人体免疫系统就明白要谨慎对待肠道炎症。
守卫肠道的巨噬细胞有两个特点:
一、很擅长吞噬细菌;
二、不会释放召集中性粒细胞进而引发炎症的细胞因子。
这里的巨噬细胞更像是无声的杀手,不慌不忙地吃掉越界的细菌,不会大呼小叫。

编辑
肠道的树突状细胞也很特别
大量树突状细胞直接待在上皮细胞下面,将长触手从上皮细胞之间挤过去,直接伸入肠道黏液。这样,它们就能对不安分的调皮鬼,即想侵入体内的细菌,不断进行采样。
这里就埋藏着免疫学中的一大未解之谜,将来解开谜题的人定能获得诺贝尔奖:
树突状细胞怎么知道它采样的细菌是危险的病原体,还是无害的共生细菌?
目前我们还不知道答案;我们知道的是,采样是共生细菌时,树突状细胞会让肠道免疫系统保持冷静,不要为这些细菌携带的抗原而烦恼。
肠道还有特殊的B细胞,只生成大量的IgA
这些抗体特别适合在黏液中工作,简直就是为肠道的环境而设的:
这两点对肠道来说都很重要。
IgA还有别的长处:
它们有四只钳子,伸向两个相反的方向,这让它很擅长抓住两种不同的细菌,并把它们粘在一起。于是,大量IgA可以把无法反抗的细菌黏成大团,这些菌团会成为粪便的一部分,被排出体外。毕竟,粪便有三成多都是细菌,其中相当多的细菌是被IgA粘在一起的(让人担心的是,其中约一半的细菌在被排出时仍然是活菌)。
探索肠道免疫系统的守护之路
肠道免疫系统默默地守护着你,确保内部和外界的细菌不会作乱。有了这些机制和特殊细胞,免疫系统就保证了肠道黏液不会被野心太大的共生细菌所侵扰,同时自己也不会因过激而损伤身体,如此看来,肠道免疫系统可真是一支维和部队。
但要是有真正的敌人入侵,比如有致病菌经受住了胃酸的洗礼,存活到了肠道,这些机制就成了可怕的漏洞。此时,为了尽快捕获敌人,肠道有一种名为“派尔集合淋巴结”的特殊淋巴结,它们直接长在肠道上。

会有“微皱褶细胞”直接伸入肠壁,对免疫系统可能感兴趣的对象进行采样,某种意义上它们有点像电梯,装上乘客后会直接把它们送进派尔集合淋巴结,让适应性免疫细胞能检查肠道的各种情况。这样一来,肠道就相当于拥有了超快速的免疫筛查,可以持续地密切监测肠道的细菌组成。
本文选取了《战斗细胞:人体免疫系统奇妙之旅》该书中,与肠道免疫相关的几个章节作为分享,希望大家能更轻松地了解关于肠道免疫相关的知识,进一步引发对肠道免疫的思考和探索。让我们共同努力,推动肠道免疫健康知识的普及与实践,走向更健康美好的生活。
本文用于分享和交流,部分图片如有侵权请联系我们删除。

谷禾健康

我们知道,人体的皮肤、口腔、肺部、肠道、阴道等都是微生物的栖息地,每个部位都有独特的微生物群组成。微生物群受到基因、饮食、环境和生活方式等多种因素的影响。
当然,人体微生物群的组成也会随着年龄的增长而发生变化。从婴儿期到老年阶段,微生物群的种类和数量都会发生变化,这些微生物与人体形成了错综复杂的共生关系,这对我们的健康和免疫系统功能产生重要影响。
人体微生物群与发育、免疫、营养、神经、代谢稳态等方面有密切关联。反过来,宿主也会提供营养并促进健康和有弹性的微生物群的发展。
了解以上这些可以帮助我们更好地理解微生物与人类的共生关系,拓展对微生物多样性和生态系统的认知,为预防和治疗相关疾病提供新的思路。
本文讲述了不同年龄和不同部位的人体微生物群、影响微生物组成的各种因素、微生物与宿主的相互作用(包括对生理、疾病的影响及相关治疗中的作用)、及其对于健康管理和疾病治疗的价值。
目录
•人体不同部位的微生物群
•不同年龄下的微生物群
•影响微生物组成的因素
•微生物群对宿主生理的作用
•微生物群与疾病的关联
•微生物群与医学治疗
•结语
不同环境提供了不同的营养资源、温度、湿度、pH值等生态因素,这些因素会影响各种微生物的生存和繁殖。
多样化的全球微生物数据集
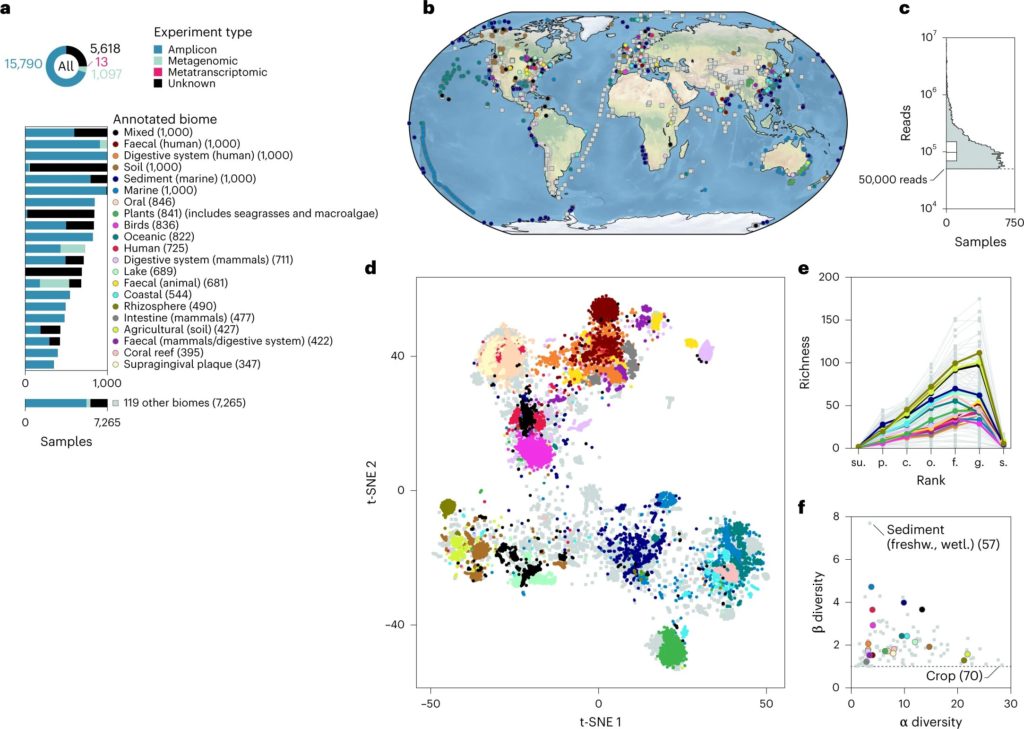
Hogeweg P,et al.Nat Ecol Evol.2023
a:样本来自截然不同的带注释的生物群落和研究设计;
b:样本的地理分布;
c:每个样本的分类注释读数总数(n = 22,518 个样本);
d:来自相似注释生物群落的样本根据 t-SNE 可视化中的分类概况(困惑度 = 500)聚集在一起;
e:类群丰富度因注释的生物群落和分类等级而异
人体微生物群是指在人体内外生活的微生物群落,包括细菌、真菌、病毒等。这些微生物群落分布在人体的不同部位,如口腔、皮肤、肠道、生殖道、大脑等。人体的不同部位提供了不同的环境条件,适合不同类型的微生物生长和繁殖。
每个部位的微生物群落都有其独特的组成和功能,它们与人体之间存在着相互作用和影响。
注:肠道微生物是人体内最丰富、最多样化、功能最大的微生物群落
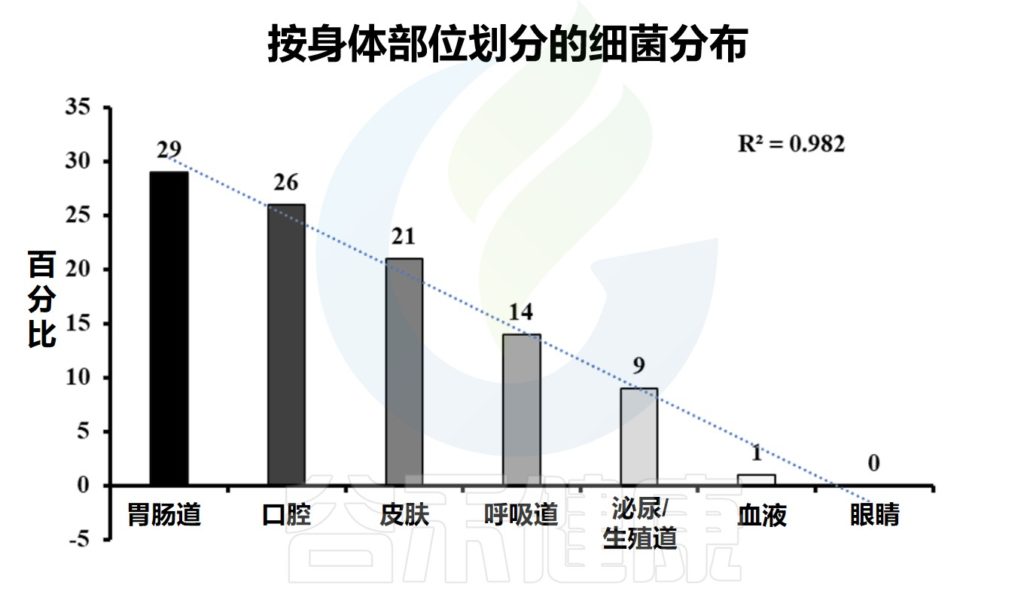
Ayariga JA,et al.Arch Microbiol.2022
Zaidi S,et al.Arch Microbiol.2023
在人体内,微生物群主要包括以下几个方面:
▼
肠道提供了温暖、潮湿、酸性和富含营养物质的环境,适合多种菌群的繁殖。此外,肠道还有大量的食物残渣和纤维素,为益生菌提供了生长的基质。
肠道中居住着高度多样化的微生物群落,其肠道内容物密度达到10^12个微生物/毫升,包含超过1000万个基因。
一般来说,肠道首先由兼性厌氧菌如肠球菌(Enterococci)和肠杆菌(Enterobacteria)定植,然后由专性厌氧菌定植。
肠道微生物群所拥有的基因编码了数千种微生物酶和代谢物。它们在消化、降解、消除有毒化合物、将难消化的复合糖聚合物转化为短链脂肪酸和维生素等多种功能中发挥着关键作用。
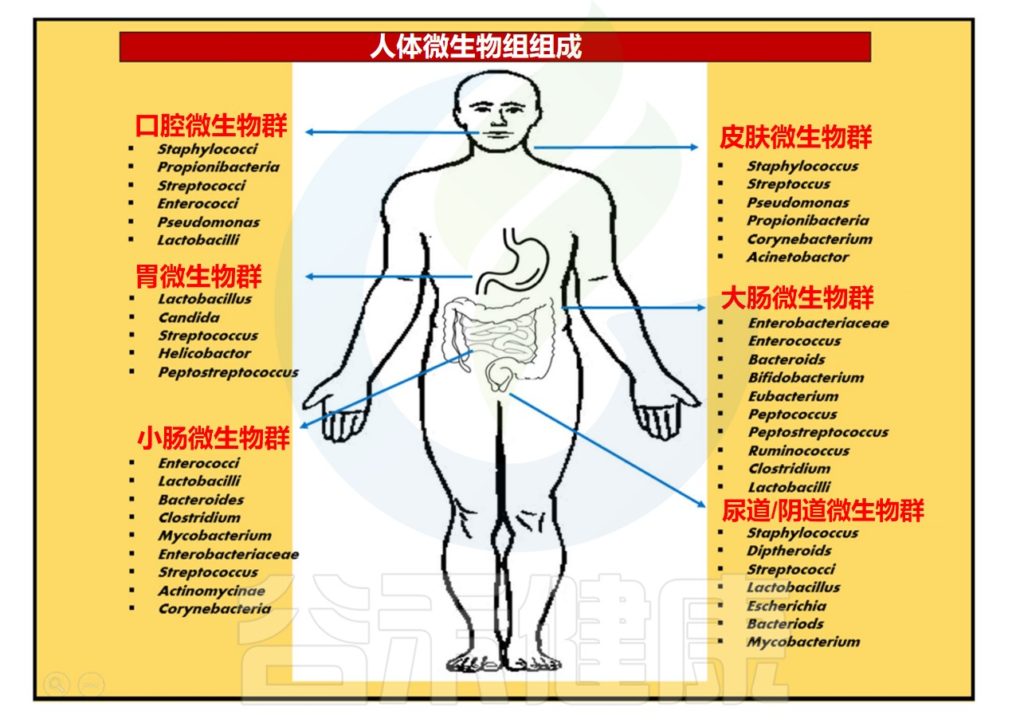
肠道菌群的分布
Ayariga JA,et al.Arch Microbiol.2022
▸ 空肠和回肠中主要的微生物群
通过分析空肠和回肠内容物,发现最丰富的群落是链球菌(Streptococci)、乳杆菌(Lactobacilli)、γ-变形杆菌、肠球菌(Enterococcus)和拟杆菌(Bacteroides)。
随着小肠远端向回肠推进,微生物群落变得更加复杂。回肠末端以梭菌科、毛螺菌科、消化链球菌科、瘤胃球菌科、肠杆菌科和拟杆菌科较丰富。
此外,十二指肠还含有与胃相似的菌属,包括肠杆菌科、链球菌科、韦荣氏球菌科和假单胞菌科。
▸ 结肠中主要的微生物群
结肠中栖息的微生物群丰富多样,主要包括放线菌门、拟杆菌门、厚壁菌门、变形菌门和疣微菌门。
与小肠相比,结肠黏液有更明确的层状组成。结肠黏液层具有物理清除细菌的内黏液层,并含有针对微生物群的免疫效应细胞。外层是松散的,为许多微生物提供了一个定植点。
嗜黏蛋白阿克曼菌(Akkermansia)、瘤胃球菌(Ruminococcus)和一些拟杆菌属是肠道黏液外层的居民。
★ 肠道核心微生物群
此外,从肠腔到粘膜存在氧梯度,并通过结肠向下移动,对结肠微生物组成产生影响。大部分细菌种类总是存在并形成稳定的核心微生物群。
这些核心微生物包括另枝菌属(Alistipes)、拟杆菌(Bacteroides)、经黏液真杆菌属(Blautia)、粪杆菌(Faecalibacterium)、瘤胃球菌属(Ruminococcus)、罗氏菌属(Roseburia) 、 普拉梭菌(Faecalibacterium prausnitzii)和颤螺菌属 (Oscillospira)。
▼
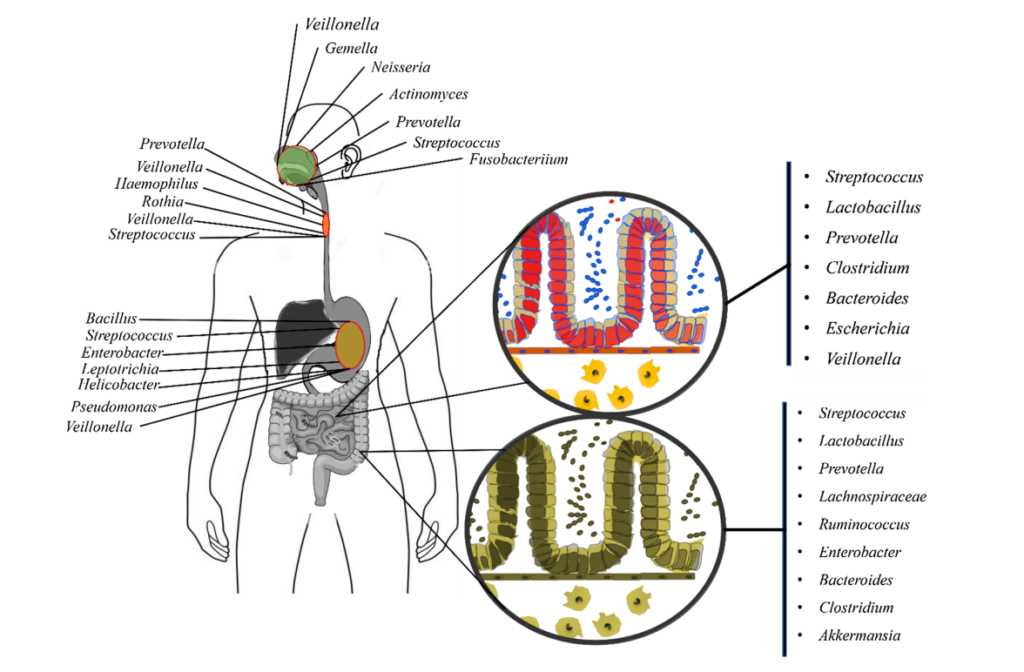
口腔是微生物群落多样性排名第二的地方,大约有700种不同亚群的细菌。
人体口腔包含牙龈、面颊、扁桃体、舌头、牙齿、软硬腭等多种微生物环境。口腔提供了温暖、潮湿和富含碳水化合物的环境,适合细菌的繁殖。此外,口腔还含有唾液,其中的酶可以帮助控制微生物的生长。
由于口腔内含有众多菌群,因此有自己的数据库——人类口腔微生物组数据库。健康人的唾液中含有Gemella、韦荣氏球菌属(Veillonella)、奈瑟菌属(Neisseria)、梭杆菌属(Fusobacterium)、链球菌属(Streptococcus)、普氏菌属(Prevotella)、Pseudomonas、放线菌属(Actinomyces) 等多个属,占总分类群的96%。
▼
早期的理论认为胃是一个无菌器官,不适合细菌生存,然而胃腔内幽门螺杆菌的发现打破了这一观点。
采用16S rRNA测序技术的研究进一步表明,胃内存在着链球菌(Streptococcus)、假单胞菌(Pseudomonas)、肠球菌、葡萄球菌(Staphylococcus)、以及变形菌门、放线菌门、厚壁菌门、拟杆菌门和梭杆菌门。
▼
呼吸道包括鼻腔、咽喉和肺部等部位。这些部位通常比较干燥,但仍然存在微生物的定居。
▸ 鼻腔中的微生物群
鼻腔是人体呼吸道的入口,也是微生物的第一个定居地。鼻腔内存在多种细菌,如葡萄球菌、链球菌等。这些细菌可以与宿主共生,帮助抵御潜在的病原体侵袭。
鼻腔内还有纤毛和黏液,可以帮助清除微生物
▸ 咽喉处的微生物群
咽喉是连接鼻腔和气管的部位,也是呼吸道的一部分。咽喉内存在多种细菌,包括厌氧菌和革兰氏阴性菌等。这些细菌参与了呼吸道的免疫调节和防御功能。
▸ 肺部的微生物群
正常情况下,肺部是相对无菌的环境。然而,在某些情况下,如免疫系统受损或存在呼吸道感染时,肺部可能会受到微生物的感染。常见的肺部微生物包括肺炎链球菌、流感病毒等。
▼
皮肤被认为是人体最大的器官。皮肤是一个动态的、复杂的生态系统,其中含有许多共生细菌。皮肤是人体最外层的保护屏障,同时也是微生物的栖息地。皮肤表面有油脂和汗液分泌物,提供了微生物生长所需的水分和营养物质。
注:研究表明,皮肤的生理特征,如温度、湿度、pH值、皮脂含量等,会影响和塑造微生物群。皮肤微生物群落的变异性和多样性还受到人口统计学、遗传学、区域环境波动等因素的影响,从而导致微生物群落结构的改变。因此,皮肤微生物群应该是独一无二的,因此可以作为“微生物指纹”。
最近的研究,在毛囊深处发现了大量细菌。棒状杆菌(Corynebacterium)和葡萄球菌(Staphylococcus)在特定的身体部位如脚底和腘窝繁殖良好。
✦湿润和干燥皮肤下的微生物群不同
大多数不同种类,以及不同相对丰度的厚壁菌门、变形菌门、拟杆菌门和放线菌门都被发现存在于干燥的皮肤中。
注:变形杆菌定植于深层的皮肤区域,可能参与控制宿主和环境之间的皮肤稳态。
棒状杆菌(Corynebacterium)是一种普遍存在于湿润和干燥皮肤的菌属,在表皮区比真皮区数量更丰富。
此外,Pelomonas spp是皮肤群落的核心共生生物之一。对金黄色葡萄球菌、表皮葡萄球菌、痤疮丙酸杆菌、马拉色菌等皮肤相关微生物进行分析,有助于阐明其复杂的分子机制及与皮肤的关联。
注:后三种被发现在湿润的皮肤占主导地位。
▼
阴道酸性较高,含有乳酸菌等益生菌。阴道微生物群被认为是预防许多泌尿生殖系统疾病的关键,可以防止病原体在阴道内定植。如艾滋病毒、细菌性阴道病和酵母菌感染。
然而,与月经周期相关的激素变化可以显著改变微生物群的组成,并在阴道微生物群的动态中发挥主导作用。
✦女性生殖道微生物群
测序表明,主要的乳杆菌属,如卷曲乳杆菌(L.crispatus)和惰性乳酸杆菌(L.iners)构成了一个“健康”的阴道微生物群。
这些物种产生乳酸、抑菌和杀菌分子,创造一个低pH的生态位,并通过竞争排斥提供保护。阴道微生物群的一部分在分娩时传递给婴儿,这反过来又推动了新生儿消化道中微生物群的初始定植。
✦男性生殖道微生物群
与女性生殖道和其他身体部位相比,男性生殖道微生物群的鉴定和研究一直较少。
男性下生殖道(即尿道和冠状沟)的微生物群主要由放线菌门、梭菌门、厚壁菌门、拟杆菌门和变形菌门组成,尽管受试者之间存在很大的差异。
注:与未行包皮环切术的个体相比,人工干预包皮环切术导致革兰氏阴性菌和厌氧菌的丰度减少。
▼
一系列突破性研究表明神经和神经胶质细胞内存在微生物。然而,生活在大脑中的共生细菌比肠道中的要少的多。
大脑常驻微生物的RNA测序显示,这些微生物属于肠道中常见的门,即厚壁菌门、变形菌门和拟杆菌门,它们可能影响情绪、行为或使个体易患神经系统疾病。
注:先前的研究表明,弓形虫可以侵入大脑,但不会引起明显的疾病。
大脑微生物群主要在黑质、海马体和前额叶皮层的星形胶质细胞内,这些发现有助于未来研究与神经精神疾病的关联。
▼
人类的血液通常被认为是无菌的,然而最近的研究表明,健康的人有一个血液微生物群。
✦血液中的微生物主要是其他部位转移而来
来自不同队列的测序数据描述了9770名健康人血液中的微生物。过滤污染物后,血液中有117种微生物,它们主要是来自胃(n=40)、口腔(n=32)和泌尿生殖系统(n=18)的共生菌,而不是医院血液培养中发现的病原体。
这些发现不支持人类血液固有稳定核心微生物群的观点。相反,它支持共生微生物从其他身体部位暂时和偶尔转移到循环中。
越来越多的证据表明,年龄与人类微生物群之间的关联很大,随着年龄的增长,人体内的微生物群落会发生变化。
人类相关微生物群从出生到死亡的变化
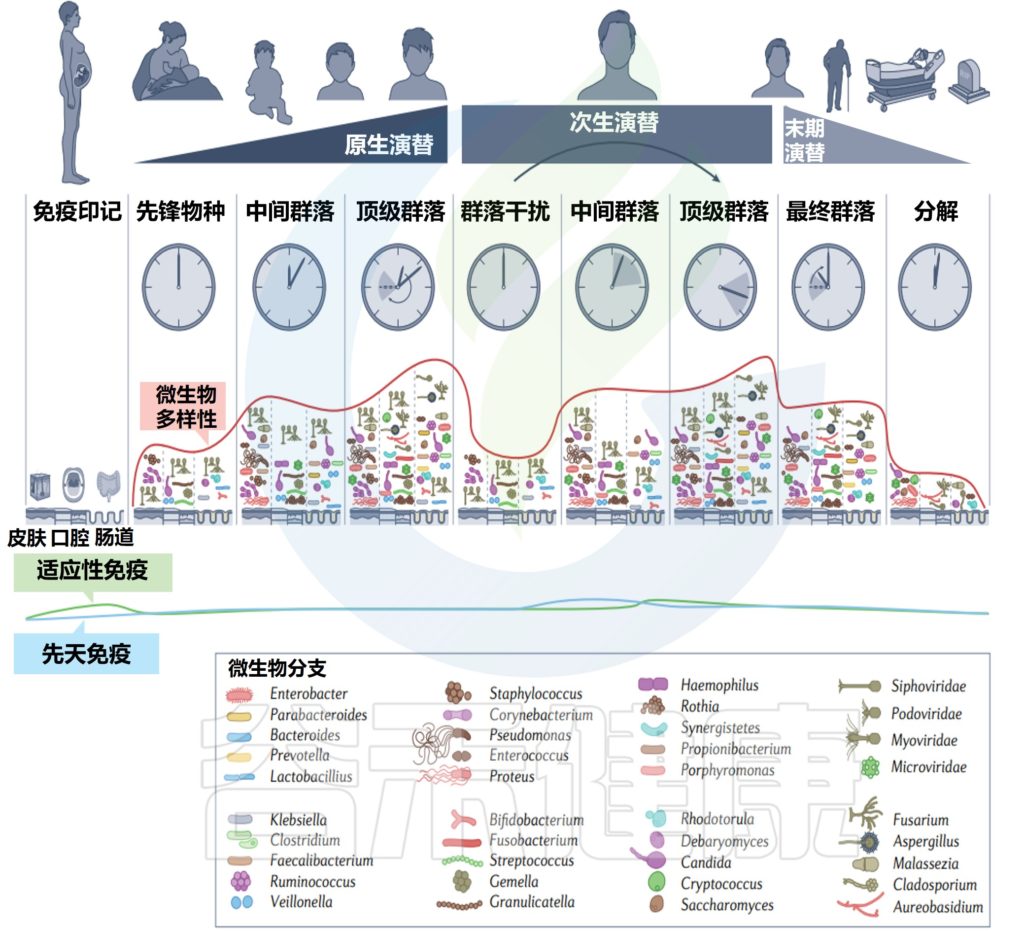
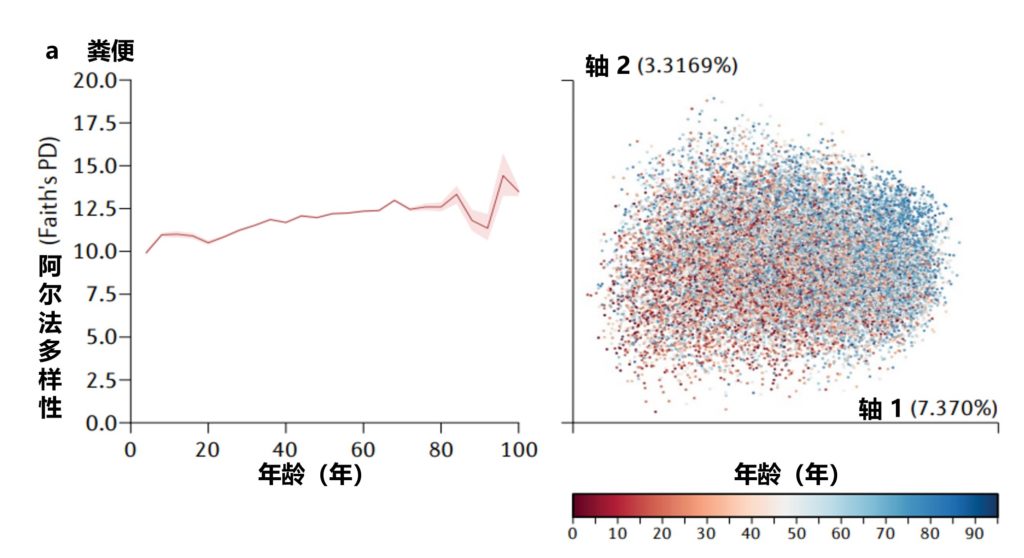
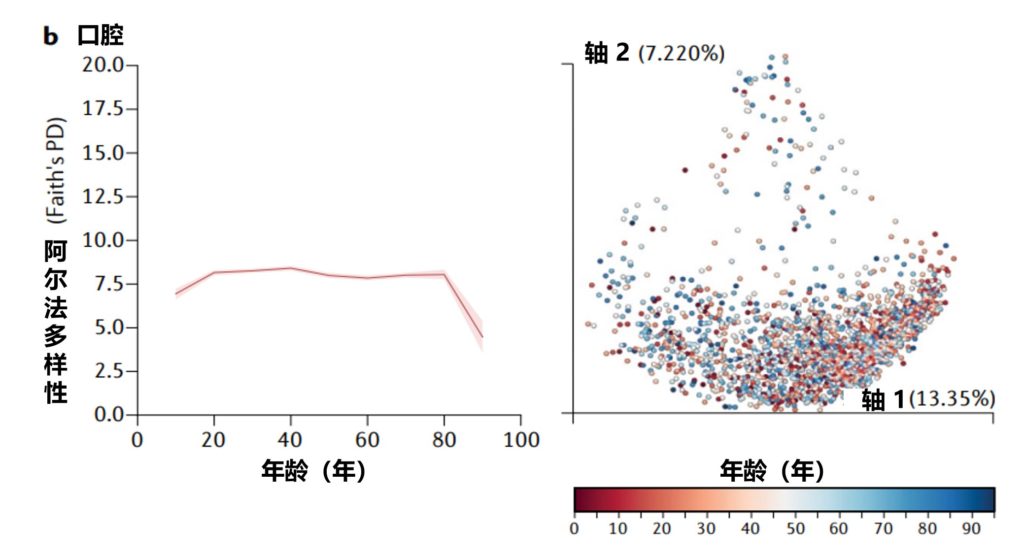
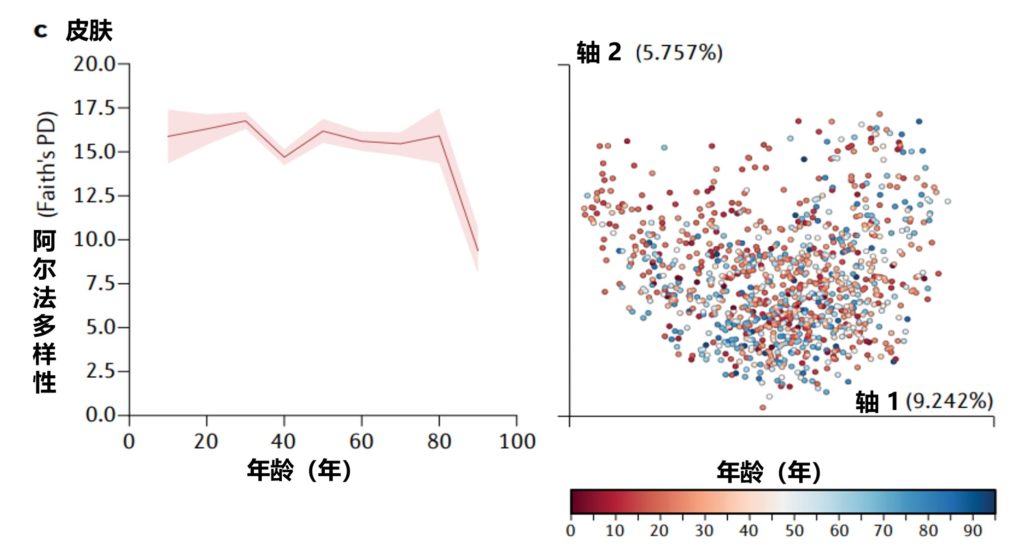
Martino C,et al.Nat Rev Microbiol.2022
美国一项研究集中测量了从儿童到老年人的粪便(a部分)、口腔(b部分)和皮肤(c部分)微生物群的细菌多样性,该项目包含21919个粪便、1920个口腔和998个皮肤微生物群样本。
α多样性,一种对样本中不同类型微生物数量的定量测量,通过Faith的系统发育多样性(PD)α多样性度量跨年龄测量。
UniFrac β多样性主坐标分析,一种用于比较微生物群落相似性的方法,其中空间上接近的点表示相似的样本,空间上远离的点表示不同的样本,按年龄着色。
Martino C,et al.Nat Rev Microbiol.2022
▼
关于出生时获得的微生物群是否通过混合来源于阴道和粪便,或者阴道微生物群本身在出生时是否具有多能性,是否是微生物先驱的主要来源,存在一些争议。
无论确切的母体来源如何,这一阶段的特征是先锋细菌种类。包括下列菌群:
•Lactobacillus
•Enterobacter
•Escherichia
•Bacteroides
•Parabacteroides
•Prevotella
这些细菌定居在常规身体部位:肠道、口腔和皮肤。
许多先锋细菌是兼性厌氧菌,它们会消耗氧气,从而使专性厌氧菌能够在以后的环境中定居。先锋细菌进驻后,生命早期的微生物群逐渐开始形成。
双歧杆菌属(Bifidobacterium)在婴儿刚出生时占主导地位,直到在生命的第一年结束时,它们被双歧杆菌、梭状芽孢杆菌和拟杆菌的组合所取代。拟杆菌属的丰度增加,而双歧杆菌属等物种的丰度相对减少。
▼
健康成年人中的微生物群也会随着时间的推移而进化,不过功能和组成的进化以较稳定状态发生。饮食或是疾病会在一定时间内改变成年人的微生物群构成。
•不同季节饮食对微生物的影响
一个经过充分研究发生在几周到几年范围内变化的例子是饮食驱动的肠道微生物群的改变。
例如,坦桑尼亚哈扎部落在旱季食用富含肉类和块茎的饮食,但在雨季食用富含蜂蜜和浆果的饮食,拟杆菌等属中表现出较大的季节波动。
饮食对微生物群的影响也可能在人类健康中发挥作用,许多工作致力于了解特定的饮食成分和总体饮食模式如何影响微生物群及其对健康的影响。
•疾病在短期内改变微生物群
肠道中的许多疾病,如炎症性肠病,破坏了微生物群落,但没有达到新的稳定群落组成,而是在没有干预的情况下继续长期不稳定。
在皮肤上,特应性皮炎的特征是免疫介导的炎症引起的金黄色葡萄球菌大量繁殖和细菌多样性减少。在金黄色葡萄球菌大量繁殖期间观察到马拉色菌属的数量减少,反之亦然,真菌数量增加导致金黄色葡萄菌数量减少。
除了饮食和疾病,还有许多其他因素会在一定时间内影响成年人的微生物群,包括地理因素、压力、代谢情况等。
注:谷禾将在下一章节中具体讲述影响人体微生物群的因素
▼
衰老会影响细胞功能的各个方面,微生物群也不例外。随着年龄的增长,微生物群α多样性减少,β多样性增加。
•肠道
一般而言,老年人肠道中观察到的微生物群变化是年轻成年人中占优势和普遍的细菌属丰度减少,如双歧杆菌(Bifidobacteria), 拟杆菌(Bacteroides),乳杆菌(Lactobacillus), 抵御机会细菌爆发的能力降低。
•皮肤
在65岁及以上的人群中,genera Cutibacterium和Staphylococcus的皮肤细菌数量减少,同时观察到更多的Corynebacterium。
•口腔
在口腔部位,Rothia和Streptococcus spp.是核心口腔细菌群落,Porphyromonas,Treponema和Faecalibacterium spp.的数量持续减少。
由于微生物组的动态特性,它在空间和时间上会不断变化,还与个体的健康状况有关。
这些变化的程度和后果取决于性质、持续时间、扰动强度和微生物群的结构和稳定性。
已经发现许多因素影响微生物群的组成,如分娩方式,年龄、性别、地理位置、饮食、怀孕、昼夜节律、宿主遗传和社会经济地位,药物以及其他一些因素(益生元和益生菌补充剂,手术和非手术治疗)。
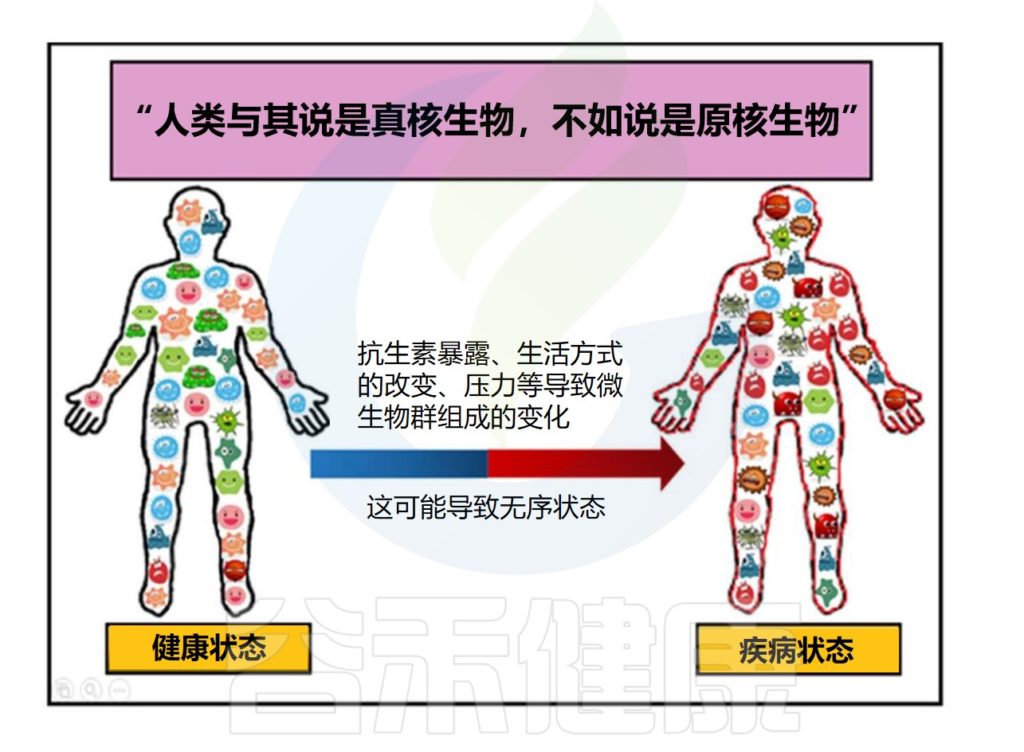
Zaidi S,et al.Arch Microbiol.2023
下面谷禾列举了其中一些对微生物群组成有重要影响的因素。
1
上一章节讲述了微生物群会随着年龄而变化。微生物群经历了一系列的发育阶段,它们的复杂性和丰富性提高,从新生儿期到断奶后的明显稳定。
这样的初级共生群落不断进化,变得更加多样化和稳定。一旦儿童达到3岁,其微生物群变得与成人的微生物群相似。
2
出生方式会决定了最初的微生物。在剖腹产和顺产婴儿之间有惊人的微生物差异。
√阴道分娩的婴儿微生物群和母亲更相似
在阴道分娩时,孩子接触到女性产道的微生物,导致母亲和孩子的微生物组成相似。这些婴儿的肠道中含有大量的乳杆菌(Lactobacillus)和普雷沃氏菌(Prevotella)。
√剖腹产分娩的婴儿微生物群主要来自母亲皮肤
相反,在剖腹产分娩的母亲和婴儿之间没有观察到大量微生物群重叠。通过剖腹产出生的新生儿从母亲的皮肤中获得细菌群,从而导致链球菌(Streptococcus)、棒状杆菌(Corynebacterium)和丙酸杆菌(Propionibacterium)较多。
剖腹产出生的婴儿在头六个月中乳杆菌的丰度较低,不像顺产的婴儿,在前六个月的时间里乳杆菌的百分比都在增加。
不过一旦儿童满3岁,乳杆菌检出率的这种差异就会消失。产后,尤其是拟杆菌和双歧杆菌在剖腹产出生的婴儿肠道内的定植也较晚,相反,他们的艰难梭菌水平增加。
注:剖腹产似乎是婴儿早期微生物群落破坏的原因之一。这种在剖腹产时定植的躁动扰乱了微生物与宿主的相互作用,这可能进一步表现为代谢紊乱的形式。在剖腹产分娩后的最初两年里,婴儿患特应性疾病的比例更高。
3
一旦婴儿出生,影响微生物群组成的最重要因素是婴儿饮食,要么是配方奶,要么是母乳。
√母乳喂养有助于诱导肠道微生物群成熟
饮食塑造了早期的微生物群,尤其是肠道中的微生物群。母乳中含有低聚糖,容易被乳酸菌和双歧杆菌(普遍存在于母乳喂养的婴儿肠道中)代谢,从而导致短链脂肪酸浓度上升。
这些短链脂肪酸进一步控制免疫系统过度表达免疫球蛋白G,并诱导新生儿肠道微生物群的成熟。
而在用配方奶粉喂养的婴儿中,常见的种类是肠球菌、肠杆菌、拟杆菌、梭菌和链球菌。
√母乳喂养下得婴儿免疫系统更完善
婴儿时期的微生物群定植似乎在整个儿童生长阶段的早期免疫发展中起着关键作用。因此,初始微生物群的组成是重要的,因为它可以防御可能由于免疫力低下而引起的多种疾病。
许多研究比较了母乳喂养和配方奶喂养的新生儿的肠道微生物群和粘膜免疫反应。观察到母乳喂养导致更稳定和更好的粘膜免疫反应。
相反,依赖配方奶粉的婴儿在以后的生活中发现免疫系统发育受损以及代谢不正常。在哺乳期间,影响母乳成分的生理和激素波动也可能影响微生物群的组成。
4
抗生素会扰乱微生物群结构。它们不仅对消化道上下段微生物的系统发育组成有不同的影响,而且对去除抗生素后微生物群落的恢复也有不同的影响。
√抗生素会减少微生物多样性
抗生素的使用导致肠道微生物多样性的减少,耐药物种的增加,宿主的应激反应和噬菌体基因的表达。
使用抗生素是一把双刃剑:它消除了病理微生物和有用微生物,最终导致生态失调。研究表明,一些抗生素如克林霉素、克拉霉素、甲硝唑和环丙沙星对微生物群结构的影响是长期的。
下面列举了使用一些抗生素后的微生物变化:
克林霉素可以持续2年而不恢复拟杆菌的多样性;同样,使用克拉霉素对抗幽门螺杆菌导致放线菌数量减少,然而环丙沙星已被提出导致鲁米诺球菌数量减少。
万古霉素是治疗艰难梭菌感染的最佳药物,但它也会引起肠道微生物群的改变,导致艰难梭菌感染的复发性感染,并诱导致病性大肠杆菌菌株的生长。
此外,万古霉素还会导致拟杆菌(Bacteroidetes)、Fuminococcus、普拉梭菌(Faecalibacterium)等肠道微生物群的减少,以及变形菌门(Proteobacteria)种类的增加。
特定抗生素对肠道菌群的影响和恢复时间取决于个体的生理状况。此外,围产期给孕妇服用抗生素也会影响新生儿的微生物群,因为其中一些抗生素可以穿过胎盘。
√抗生素的作用取决于身体部位
此外,抗生素的作用取决于身体部位。例如,与肠道相比,在抗生素治疗后,喉咙和唾液在更短的时间内恢复了最初的共生多样性。
抗生素还会干扰微生物组和免疫系统的相互作用,导致免疫紊乱,并增强宿主对病原体的易感性。抗生素的广泛使用推动了病原微生物耐药性的进化,导致耐药基因的流行增加。
5
膳食成分除了影响微生物组的功能外,还能调节其组成。
√不同饮食成分下的微生物群组成不同
饮食对于确定微生物群的形态、结构和多样性至关重要。素食饮食与健康、多样的微生物群有关,其特征是能够代谢不溶性碳水化合物的物种占优势,即瘤胃球菌(Ruminococcus)、罗氏菌属(Roseburia)和真杆菌(Eubacterium)。
而非素食饮食与厚壁菌门比例下降和拟杆菌门比例增加有关。随着肉类的摄入,微生物群代谢氨基酸,以短链脂肪酸的形式产生能量源,但也会形成产生不利影响的化合物。
在一项研究中,测定了150名健康的杂食性、素食性和纯素食性志愿者粪便中存在的微生物群的组成结构以及代谢组。研究表明,富含蔬菜的食物增加了纤维降解细菌的丰度,并导致粪便短链脂肪酸的产生。
对地中海饮食依从性降低的志愿者拥有较高百分比的有害微生物代谢产物,如酚类和吲哚衍生物,以及三甲胺N-氧化物。
这些例子表明,饮食调节微生物群的组成和功能,从而影响个体的代谢状态。
6
不同身体部位的微生物组成是不同的,那么当微生物群的位置从身体的一个部位交换到另一个部位时,优势微生物物种的生态或流行如何受到影响,这是一个有趣的研究。可见,器官相关微生物群既具有动态性,又具有可塑性。
器官特异性微生物群可以跨界到与身体其他部位相关的其他生态位,在此过程中,微生物承受与身体各器官相关的pH、温度、毒素、免疫细胞等变化。
然而,在给定的生态位上,微生物群的结构组成基本上没有受到干扰。
微生物群在不同器官内混合的机制在很大程度上是未知的。
√器官间的微生物联系可能有利于宿主平衡
从空间和生长的角度来看,跨生态位的微生物对特定器官的优势微生物群体构成了挑战,但不同微生物物种之间的竞争是有利于宿主的微妙平衡。宿主细胞的器官特异性微环境有利于与该器官相关的微生物群的优势种群,并防止微生物群生态中的无意干扰。
宿主和微生物群之间存在着复杂的相互作用。宿主提供了微生物群生存和繁殖的环境,而微生物群则对宿主的生理状态和代谢产生着重要的影响。
由于微生物群与其宿主之间存在高水平的串扰,因此对微生物与宿主之间相互作用的研究仍然具有挑战性,尽管如此,以代谢物为中心的研究已经认识到对宿主健康重要的各种微生物靶点。
▼
微生物群对人体食欲的影响是非常复杂的,因为不同类型的微生物群会产生不同的代谢产物,一些研究表明,肠道微生物群可以通过产生短链脂肪酸等代谢产物来影响人体的食欲和能量代谢。
短链脂肪酸是肠道微生物群代谢产物的一种,主要包括丙酸、丁酸和乙酸等。
▷短链脂肪酸影响神经系统进而影响食欲
关于短链脂肪酸在调节能量摄入和食欲中的作用已经有了详细的研究。研究表明,这些化合物也可以影响外周和中枢神经系统的活动。
不过目前尚不清楚是单一的短链脂肪酸驱动,还是这些化合物的组合被利用。
目前关于可发酵纤维在食欲调节中的作用的研究有限,但增加每日纤维摄入量在16-35克/天范围内可以帮助改善这种调节。
虽然短链脂肪酸在食欲调节中的确切作用机制尚不清楚,但已有研究表明,人类体内短链脂肪酸的存在可以触发短期食欲调节。
例如,人类结肠丙酸盐通过PYY和GLP-1介导的机制诱导短期食欲调节。
▼
短链脂肪酸对脂肪代谢的影响也是显著的。
▷调控脂质积累和瘦素分泌
研究表明丙酸盐可以防止脂肪和胆固醇生成,它可以通过抑制FARE 2信号的活性来阻止脂肪细胞中的脂质积累。
还有研究表明,乙酸盐可以刺激脂肪细胞中瘦素激素的分泌。这一关键信号调节食欲和能量平衡。其他研究表明,抑制脂肪分解可以减少游离脂肪酸从脂肪细胞向肝脏的转运。
在脂肪肝疾病中,已知来自脂肪细胞的脂肪积累贡献了肝脏中总脂肪酸的60%。直肠输注丙酸和乙酸显示血清脂肪酸水平降低40%。
因此,重要的是保持丙酸与乙酸的比例,以确保结肠乙酸对脂质储存的最佳贡献。
▼
几项临床研究指出,肠道中细菌过度增殖与骨矿物质密度(BMD)降低之间存在关联。小肠细菌过度生长综合征患者的骨矿物质密度值低,骨软化,其中一些患者具有高水平的促炎细胞因子TNF-α和IL-1,以及破骨细胞活化增加。
肠道微生物组和骨骼之间的联系
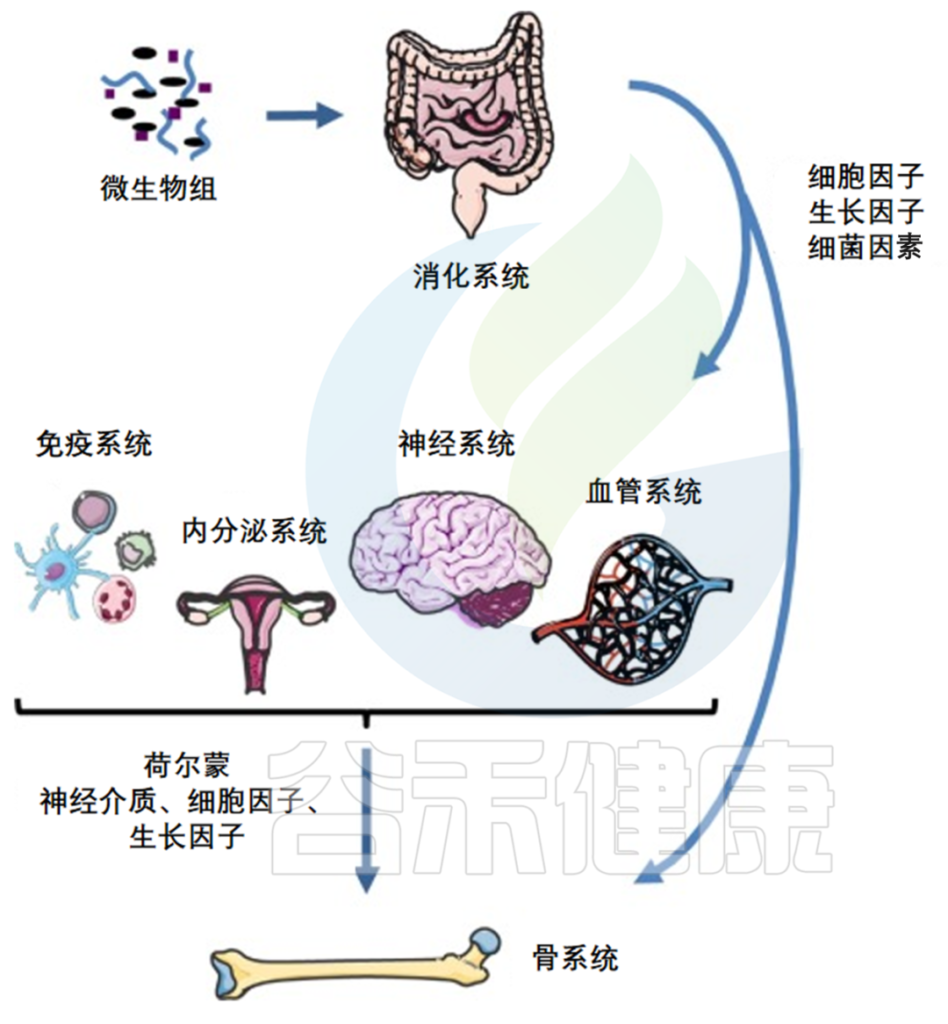
doi.org/10.1016/j.jbspin.2018.02.008
近年来,一些横断面的临床研究以及系统评价和荟萃分析均发现肠道菌群改变与调节骨量、骨髓生成,骨骼发育、骨代谢、骨质疏松、骨骼炎症、骨折风险以及骨癌有关。
▼
微生物群对宿主免疫系统的影响非常重要,可以通过多种机制来影响宿主的免疫系统。
▷直接影响免疫细胞功能
微生物群中的某些成分可以直接影响宿主免疫细胞的功能,如调节巨噬细胞和树突状细胞的活性,从而影响宿主的免疫反应。
▷调节免疫细胞分化和增殖
微生物群中的一些成分可以影响免疫细胞的分化和增殖,如调节T细胞的分化和功能,从而影响宿主的免疫反应。
▷影响肠道黏膜屏障
微生物群可以通过影响肠道黏膜屏障的完整性和功能来影响免疫系统。肠道黏膜屏障是宿主体内与外部环境之间的主要屏障,它可以防止有害物质和微生物进入宿主体内。微生物群通过增强肠道黏膜屏障的功能来促进免疫系统的正常功能。
总之,微生物群对宿主免疫系统的影响是非常重要的,它们可以影响宿主的免疫反应、调节免疫细胞的分化和增殖、以及影响肠道黏膜屏障的完整性和功能。
肠道菌群及其代谢产物对人体还有其他影响,谷禾罗列在下表中:


Ayariga JA,et al.Arch Microbiol.2022
微生物群不仅影响宿主的生理功能,研究发现病理状况也与微生物群的组成、功能和生长动态密切相关。
如肥胖、高血压、2型糖尿病、非酒精性脂肪肝以及胃肠道疾病、过敏、自闭症、神经退行性疾病甚至癌症等都被发现与微生物群生态失调相关。
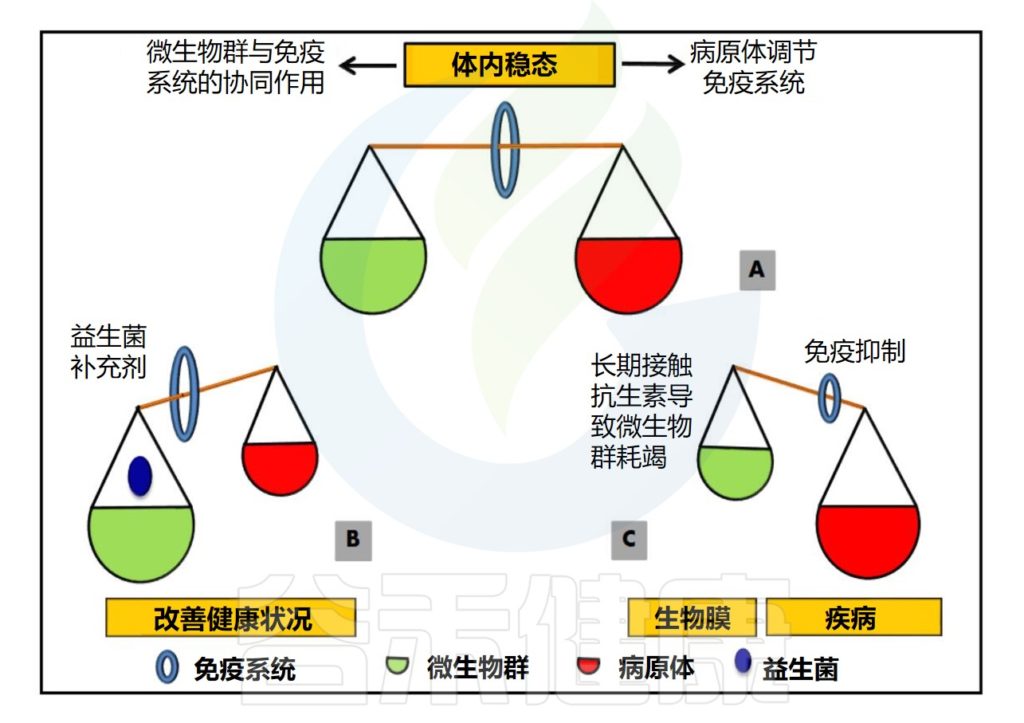
Zaidi S,et al.Arch Microbiol.2023
▼
研究表明肠道微生物群的存在可以影响血压调节。
在高血压大鼠中,观察到肠道中的微生物多样性和丰富度显著下降。这种情况已知是由血管收缩和血管阻力引起的。
在无菌小鼠中观察到血管紧张素II对血压的影响,表明肠道微生物群在调节血压方面发挥作用。尽管肠道微生物群调节血压的机制尚不完全清楚,但人们认为这种情况可能是导致高血压发展的一个因素。
动物中的特定肠道微生物代谢物,如短链脂肪酸,可能是导致高血压的一个因素。
来自HELIUS队列研究表明,克雷伯氏菌属和链球菌属与血压呈正相关。已显示,Lactobacillus coryniformis可以改善血管功能和胰岛素敏感性。
注:乳杆菌(Lactobacillus)治疗不仅可以改善心血管疾病,还可以改善实验性自身免疫性疾病。
▼
一些研究表明,微生物群的失调可能与某些癌症的发生有关。
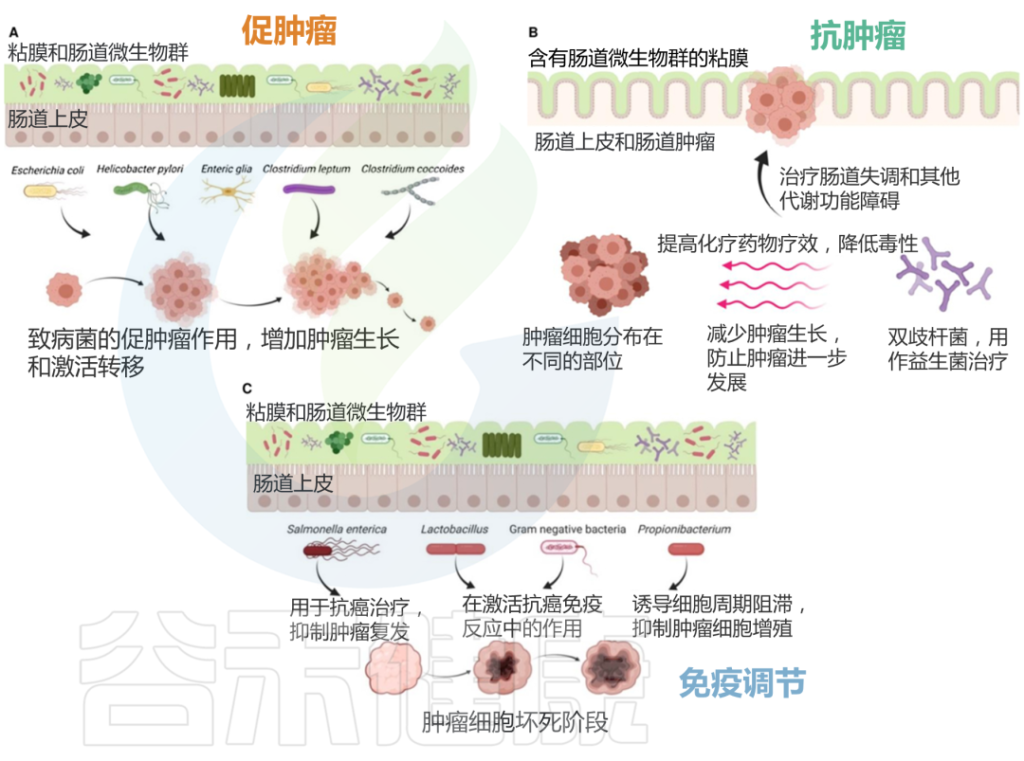
•结直肠癌
在与肠道微生物群相关的各种癌症中,对结直肠癌的研究最为广泛。
已经确定了肠道微生物群中的几种菌,这些细菌除了它们的致病性之外,还被假设对结肠直肠癌具有致癌作用,包括幽门螺杆菌、肝螺杆菌(Helicobacter hepaticus)、牛链球菌(Streptococcus bovis)、大肠杆菌、脆弱拟杆菌、败血梭菌(Clostridium septicum)、粪肠球菌、具核梭杆菌、厌氧消化球菌(Peptostreptococcus anaerobius)和牙龈卟啉单胞菌(Porphyromonas gingivalis),所有这些细菌都显示出潜在的致癌作用。
•肺癌
肺癌是常见的恶性肿瘤之一,迫切需要制定有效的肺癌治疗策略。研究表明,肠道和肺部微生物群之间通过淋巴和血液循环系统在双向轴上存在复杂的联系。
Martins D,et al.Pathobiology.2020
•乳腺癌
一项关于绝经后妇女的研究调查了乳腺癌与肠道代谢组学改变的相互关系。发现健康对照受试者和绝经后乳腺癌患者的肠道微生物组的组成和生物活性存在差异,其中绝经后乳腺癌患者的肠道宏基因组具有编码β-氧化、铁复合物转运系统和脂多糖生物合成的基因。
体外研究提供了支持肠道微生物群与乳腺癌转移进展之间联系的功能证据,其中微生物代谢物可以通过血液传播,影响乳腺癌细胞和免疫细胞的功能。
除此之外,分析唾液微生物组组成的变化有助于早期发现胰腺癌。另一种被称为产肠毒素脆弱拟杆菌的菌株与肠上皮细胞的致癌性有关。
▼
肠道微生物群的扰动可能导致炎症性肠病。同样,厚壁菌门相关细菌的不足和某些变形菌门数量的升高,可能导致粘膜免疫功能受损,这是引发慢性肠道炎症的主要原因,从而导致炎症性肠病的发生。
•肠易激综合征
肠易激综合征中厚壁菌门(Ruminococcus和Clostridium)数量增加,普拉梭菌和双歧杆菌种类数量减少。
•克罗恩病
此外,与克罗恩病患者或健康患者相比,回肠克罗恩病患者的普拉梭菌(Faecalibacterium Prausnitzii)数量明显减少,而大肠杆菌(Escherichia coli)数量过多。
▼
已经证明某些微生物可以通过感染特定的组织而引起疾病。
•细菌性相关组织感染
最早被人们了解的传染病是那些由制造毒素的细菌引起的传染病。白喉、肉毒杆菌和破伤风毒素分别与白喉棒状杆菌(Corynebacterium diphtheria)、肉毒梭菌(Clostridium botulinum)和破伤风梭菌(Clostridium tetani)引起的局部感染相关。
•细菌性腹泻和败血症
大肠杆菌、沙门氏菌、志贺氏菌、葡萄球菌和霍乱弧菌产生的肠毒素可导致由这些微生物引起的腹泻病。
革兰氏阴性菌脂多糖的脂质A部分具有强大的生物活性,可引起革兰氏阴性细菌性败血症的许多临床表现,包括发热、肌肉蛋白水解、血管内凝血失控和休克。
大多数致病的病原体都经过类似的途径,如呼吸道、胃肠道和生殖器官,这些途径被认为是通过与身体直接接触传播的;然而,其中一些微生物也可以通过与环境的间接接触获得,例如通过血液或水。
注:外科手术中的一些植入物也有可能引发细菌感染。
外科植入物引起的相关细菌感染
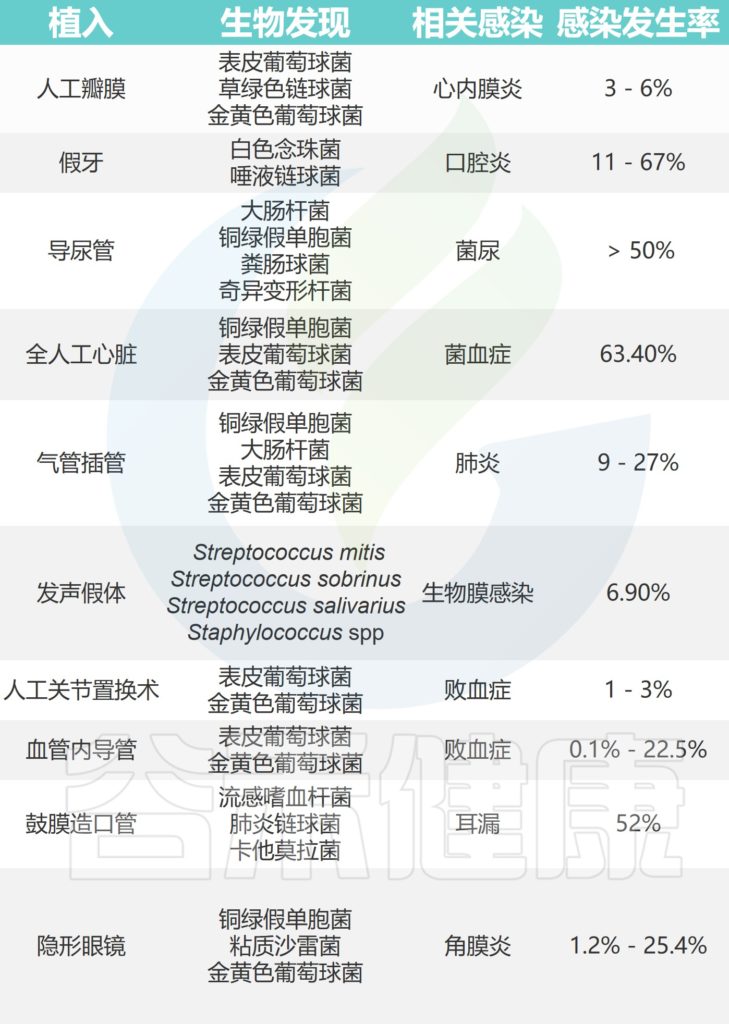
Zaidi S,et al.Arch Microbiol.2023
微生物群与其他一些疾病:
过敏
最近的研究表明Faecalibacterium、Bifidobacterium或Akkermansia的减少,加上Rhodotorula或念珠菌数量的增加,可能通过影响T细胞分化而使新生儿易过敏。
哮喘
同样,已发现罗氏菌属(Rothia)、毛螺菌属(Lachnospira)、韦荣氏球菌属(Veillonella)或普拉梭菌(Faecalibacterium )数量的减少会增加患哮喘的风险。
帕金森病
帕金森病最一致的发现是阿克曼菌(Akkermansia)的丰度增加。
其他组成特征包括双歧杆菌(Bifidobacterium)和乳杆菌(Lactobacillus)的丰度增加,丁酸生产菌(Roseburia)、(Faecalibacterium)和(Blautia)的丰度减少。
注意
微生物群评估有望在早期发现不同的疾病,如癌症、神经退行性疾病、代谢性疾病和自身免疫性疾病等。它采用非侵入性采样技术,同时降低了分析成本,从而使诊断过程变得可行。
对人类生理学、基因组学更好理解使我们的重点转向了针对患者的个性化/精准诊断和治疗。
个性化医疗的标志之一是对易感亚人群的特定疾病风险进行评估,从而可以对人群进行分层,提供更准确和更具成本效益的治疗。
微生物群在人类疾病和健康中的作用致使新的生物疗法发展,可以解决特定的疾病机制。微生物和免疫系统之间的相互作用是复杂的,它们的治疗可以提高患者的生活质量。
▼
每个人对医疗药物的反应也有很大的差异,可能与体内微生物群不同有关。不同微生物组在药物吸收、代谢、功效和毒性方面起着关键作用,并具有重大的健康影响。
地高辛
例如,地高辛是一种心脏糖苷类药物,专门用于治疗充血性心力衰竭。在微生物组研究进展之前,人们注意到一些患者能够化学还原地高辛,从而导致其失活,抗生素的使用导致血浆地高辛浓度增加两倍。
研究人员推断肠道细菌能够调节地高辛的代谢。最近的报告表明地高辛可被Eggerthella lenta灭活,而抗生素的摄入可使这种作用最小化,从而导致其在血浆中的浓度大幅增加。
对乙酰氨基酚
同样,对乙酰氨基酚,一种存在于许多镇痛药物中的化合物,在个体的临床作用中表现出明显的差异。这种个性化的反应最近被解释为与微生物组功能的差异有关。
他汀类药物
另一个微生物组驱动的个体化药物案例是他汀类药物和化疗药物,它们也被发现由于共生菌的作用而受到显著影响。
另一方面,药物可以通过微生物群转化为衍生物,这些衍生物可能具有非靶标效应。用于生产这些营养物质的底物的变化会影响肠道的代谢组学特征。这可能会对宿主产生不同的影响。
▼
根据上述数据,针对患者量身定制的微生物组操作似乎是多因素疾病更精确的微生物组特异性治疗的最佳替代方案。
如饮食干预、抗生素的应用、益生菌和益生元的使用以及粪便微生物群移植可用于调节微生物群以获得有利的反应。
微生物疗法的原理是通过调节宿主的微生物群,来促进身体健康和预防疾病。它可以包括多种形式,例如口服益生菌、粪菌移植、皮肤微生物移植等。
★ 肠道微生物群检测
要对人体的微生物群进行干预,首先要做的就是对体内的微生物群进行检测。肠道微生物群检测是一种通过分析肠道微生物群的组成和数量来评估患者的健康状况的方法。这种方法已经被证明对诊断肠道炎症、炎症性肠病等多项疾病有效。
口服益生菌改善健康
口服益生菌可以帮助恢复肠道菌群的平衡,从而改善肠道健康和免疫系统功能。
口服补充乳杆菌,可以提高耐受性,减轻儿童对牛奶的过敏,并通过过敏患者粪便中产生丁酸盐的细菌的活性恢复丁酸盐的最佳水平。
此外,酵母菌和乳酸菌可以将抗生素相关疾病的风险降低50%。益生菌持续治疗多种胃肠道和肠外疾病,如阴道感染、肠易激综合征、炎症性肠病和免疫增强。
食用合生元改善健康
此外,合生元是微生物群靶向治疗的另一种有效方法。包括在原始微生物群中引入新的微生物,补充足够的底物以促进新的所需微生物的生长。
例如,植物乳杆菌(益生菌)与低聚果糖(益生元)一起生长被发现可以减轻新生儿因败血症而死亡的数量。
麦角硫因是一种在蘑菇、豆类和谷物等食物中发现的著名抗氧化剂。研究证明麦角硫因被幽门螺杆菌利用来保护它免受宿主胃组织的侵害。
麦角硫因对人体有抗炎作用。更重要的是,麦角硫因的减少与心血管疾病、自身免疫性疾病和神经系统疾病的风险增加有关,这意味着肠道中的细菌会影响人类健康。
微生物移植改善健康
粪菌移植疗法的工作原理是通过引入健康的微生物群来替代患者肠道中的有害菌群,从而恢复肠道菌群的平衡。
这可以改善肠道健康和免疫系统功能,从而减少肠道炎症和其他与肠道微生物群失调相关的疾病的发生。
除了治疗肠道疾病外,粪菌移植疗法还可以用于治疗其他疾病,例如自身免疫性疾病、代谢性疾病和神经系统疾病等。皮肤微生物移植可以用于治疗某些皮肤疾病,例如顽固性湿疹和痤疮。
微生物群在我们身体的许多部位中存在着,如肠道、皮肤、口腔和生殖道等。这些微生物群与我们的身体密切相连,对我们的健康和疾病起着重要作用。
了解人体微生物群的组成、功能和影响因素,对于我们更好地了解自身健康以及疾病的预防和治疗具有重要意义。
主要参考文献
Zaidi S, Ali K, Khan AU. It’s all relative: analyzing microbiome compositions, its significance, pathogenesis and microbiota derived biofilms: Challenges and opportunities for disease intervention. Arch Microbiol. 2023 Jun 6;205(7):257.
Ayariga JA, Ibrahim I, Gildea L, Abugri J, Villafane R. Microbiota in a long survival discourse with the human host. Arch Microbiol. 2022 Nov 28;205(1):5.
Abenavoli L, Scarpellini E, Colica C, Boccuto L, Salehi B, SharifiRad J, Aiello V, Romano B, De Lorenzo A, Izzo AA, Capasso R (2019) Gut microbiota and obesity: a role for probiotics. Nutrients 11(11):2690.
Apparao Y, Phan CW, Kuppusamy UR, Sabaratnam V (2022) Ergothioneine and its prospects as an anti-ageing compound. Exp Gerontol 170:111982.
Aarnoutse R, Ziemons J, Penders J, Rensen SS, de Vos-Geelen J, Smidt ML (2019) The clinical link between human intestinal microbiota and systemic cancer therapy. Int J Mol Sci 20:4145.
Aggarwal N, Kitano S, Puah GR, Kittelmann S, Hwang IY, Chang MW (2022) Microbiome and human health: Current understanding, engineering, and enabling technologies. Chem Rev 123:31.
De Angelis M et al (2020) Diet influences the functions of the human intestinal microbiome. Sci Rep 10:1–15.

谷禾健康

人类微生物组有多种来源(比如通过母亲向婴儿的垂直传播,通过饮食等)。环境暴露允许人类与整个微生物生态系统相互作用,并且有新证据表明,生态系统中微生物的多样性可能影响人类微生物群的组成,从而对免疫功能和健康结果产生影响。
人类在富含微生物的环境中进化,病原体和共生菌共同调节着肠道微生物群和免疫系统。然而,城市化、土地利用变化、相关的生物多样性损失,以及室内时间的增加,都使我们减少了对更具多样性的环境微生物群的接触。
“卫生假说”的一个扩展假设是,如果减少与更多样的环境微生物群接触,可能导致人类微生物群的不利变化,从而导致各种疾病,比如自身免疫性疾病、过敏和哮喘。
近期的动物和人类研究,证明了环境微生物群暴露对宿主微生物组的影响;从而提供了环境微生物群对人体肠道微生物群和免疫功能的潜在调节作用的证据。
本文主要介绍研究人员提出的,环境微生物群暴露可能会改变人体肠道微生物群和免疫功能,且基于该理论的微生物群针对性改善措施。
目前有几项人类干预研究发现,与自然环境的相互作用(如接触土壤、植物物质)会影响皮肤、口腔、鼻腔和肠道微生物群,这里重点关注肠道微生物群,包括儿童和成人人群。4项研究总结如下:

doi.org/10.1016/j.mucimm.2023.03.001
通过这些研究,我们可以看到对影响肠道微生物组和/或免疫功能的干预措施研究包括:
直接接触堆肥和土壤混合物,在微生物富集的沙坑中玩耍(包括植物物质和商业园艺土壤);接触室外绿地和绿墙等。
沙坑
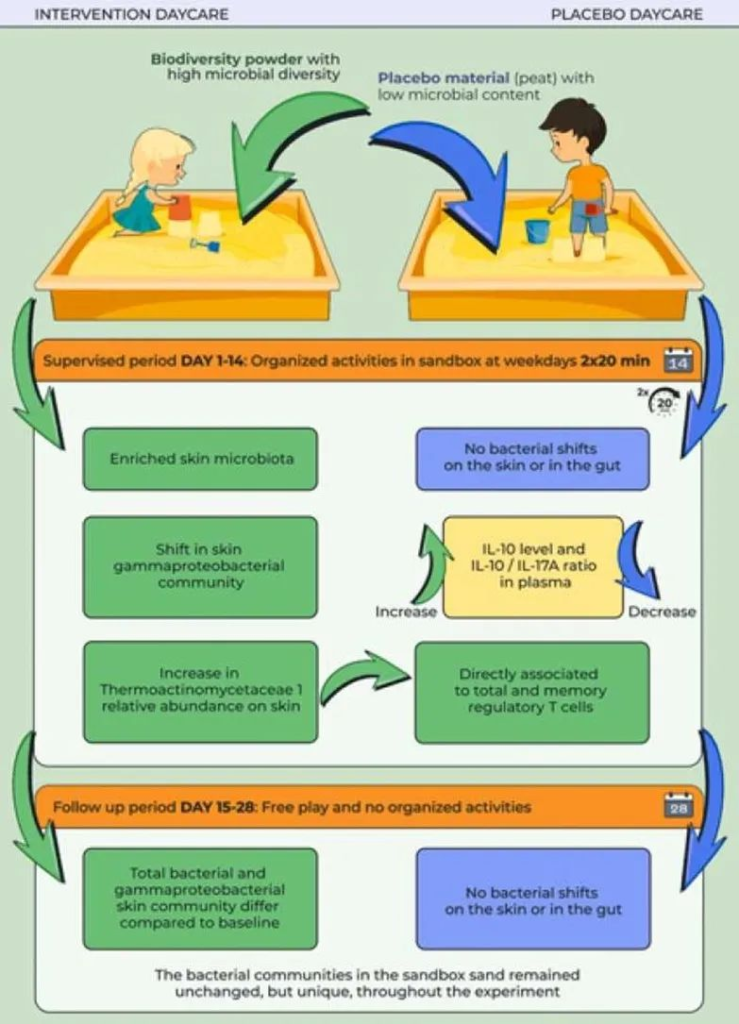
添加富含微生物的土壤粉末可使沙子微生物群多样化,影响儿童微生物群
一项双盲安慰剂对照研究,在干预组中,3-5岁的儿童暴露于富含微生物多样化土壤的操场沙子中,或者在安慰剂组中,视觉相似但微生物贫乏的泥炭沙子(n=13)。孩子们每天在沙盒中玩两次,每次20分钟,持续14天。
肠道变形杆菌多样性仅在干预组0至14天之间下降(线性混合效应模型简称LMM:P = 0.02, Q = 0.03),而安慰剂组则保持在基线水平(LMM:P > 0.6)。
在第14天,与安慰剂组相比,干预中的肠道变形杆菌辛普森多样性较低(t检验P<0.016,Q = 0.06),但在第28天不再降低(t检验P = 0.23)。
肠道菌群潜在变化与免疫标志物之间的关联
进一步探讨了肠道菌群测量值是否与线性混合效应模型的免疫参数相关。
——干预组中血浆中IL-17A的水平降低
干预组的肠道变形细菌多样性(辛普森和香农)降低,这种减少与血浆IL-17A水平降低有关。
注:IL-17是一种促炎细胞因子,与几种免疫介导的疾病有关,包括炎症性肠病,类风湿性关节炎和多发性硬化症。
——干预组中血浆中IL-10的水平增加
其他几种已知健康结果的肠道菌群与血浆IL-10水平相关。其中,厚壁菌门与拟杆菌门的比值(肥胖相关)与IL-10呈负相关,拟杆菌属的相对丰度与血浆中IL-10水平呈正相关。
注:IL-10是一种抗炎细胞因子,可通过限制促炎细胞因子的分泌以及调节巨噬细胞,T细胞和B细胞来预防自身免疫性疾病。
扩展阅读:肠道细菌四大“门派”——拟杆菌门,厚壁菌门,变形菌门,放线菌门
Faecalibacterium和Roseburia相对丰度的变化直接相关,而Romboutsia相对丰度的变化与IL-10水平的变化呈负相关。
扩展阅读:肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
编辑
doi.org/10.1016/j.ecoenv.2022.113900
总的来说,该研究支持免疫介导疾病的生物多样性假说,干预组儿童的免疫应答与安慰剂组儿童的免疫应答不同。环境微生物群可能有助于儿童健康。
绿地
邻近自然绿地对儿童特异性过敏具有保护作用
来自加拿大健康婴儿纵向队列研究的数据(699名婴儿)表明,婴儿早期生活在邻近自然绿地,在3岁时对多种吸入性特应性过敏的发展具有保护作用(优势比 = 0.28[95%CI 0.09,0.90])。4 个月大时肠道微生物群的放线菌门多样性介导了这种关系。
自然植被与更大的物种丰富度相关,但降低了小婴儿肠道中放线菌门的辛普森多样性。
这听起来有点矛盾。
我们知道,双歧杆菌作为益生菌可以预防特应性疾病,双歧杆菌属于放线菌门,为什么减少放线菌多样性值,反而可能降低过敏风险有利健康?
实际上,放线菌多样性辛普森测量值较低,表明物种分布不均匀,且少数优势双歧杆菌富集。
越来越多的证据表明,当大量的成人双歧杆菌相关物种,如B. catenulatum和青春双歧杆菌(B. adolescentis)在幼年时主导肠道菌群时,特异反应的风险更大。
也就是说,本来放线菌的辛普森多样性与吸入物致敏状态之间的正相关,但这种相关性因接近自然绿地而降低,据推测,这是婴儿主要双歧杆菌物种(如婴儿双歧杆菌)富集的结果。
鉴于早期双歧杆菌定植和低多样性的肠道微生物组的重要性,自然植被通过婴儿特异性双歧杆菌富集对吸入物致敏的保护作用值得进一步研究。
总之,该研究强调了促进自然城市绿地保护的重要性,通过降低特应性疾病的易感性来改善儿童健康。
扩展阅读:肠道核心菌属——双歧杆菌,你最好拥有它
绿墙
办公场所空气流通的绿墙会改变微生物组并调节上班族的免疫系统
最近的一项研究发现,暴露在办公场所的绿墙(带有植物)14天后,可能增加皮肤微生物组的多样性,绿墙研究中观察到的变化与对人类健康有益的变形杆菌和乳酸杆菌有关。
这种变化与血液样本中细胞因子转化生长因子βmRNA的表达有关,表明环境微生物群在免疫功能中的潜在作用。
由于没有直接接触绿墙,这些发现表明,皮肤微生物组和免疫功能可能与接触三种治疗的空气生物群落有关;然而该研究并未对空气微生物组进行评估。
空气微生物组的研究
不过呢,这一想法得到了一项小鼠研究的支持,在这项研究中,小鼠暴露于无土壤、低多样性土壤和高多样性土壤的空气微生物群中,在暴露7周后,各组之间的粪便和盲肠微生物群的群落组成存在显著差异。
关于空气微生物组对肠道微生物组和免疫功能的潜在影响的证据尚处于起步阶段,由于目前对低生物量样本的微生物组研究的局限性,在人类中建立这种关系将具有挑战性。
方法偏差
迄今为止,包含比较组的人类研究相对较少,也存在一系列潜在的方法偏差。例如,两项研究中的分配偏差,没有将微生物群暴露与干预措施的其他因素(如自然因素)隔离,干预措施的相对短期性质以及干预措施停止后的随访期。需要更多研究。
样本量
所有研究中的样本量相对较小。
精细化程度
目前微生物组分析侧重于相对较高的分类群,在DNA提取和测序技术以及生物信息学方面,通常缺乏明确性和精细度。还需要对免疫功能进行更全面的评估。
普遍性
在确定这些发现如何适用于所调查的场景之外时,还必须考虑这些发现的普遍性。
由于暴露环境组成的潜在差异以及暴露人群的行为差异(如室内时间、饮食、体力活动),此类干预措施调节肠道微生物群的普遍性尚不清楚。
对于健康状况较差的人,目前还没有关于环境微生物群如何影响其肠道生态和免疫功能的数据。关于暴露于环境微生物群作为调节肠道微生物群的工具的一个潜在问题是安全性。虽然我们总是与环境微生物群接触,但在建议改变这种接触时,我们必须注意潜在的感染风险增加(例如环境中的病原体),特别是对于免疫系统受损的人群。
虽然以上不足可能会影响我们对环境微生物群暴露如何影响肠道微生物群的理解,但研究提供了初步证据,表明这些暴露可能会改变人体肠道微生物群和免疫功能。
关于剂量、治疗持续时间和干预停止后变化的持续性,仍有许多问题,但随着这一领域研究的增长,预计将有更多明确的研究证据提供。
研究人员认为,可以采取几种方法来改善对更多样环境微生物群的暴露。具体如以下几个方向:
行为改变:
土壤摩擦、园艺、更多时间在绿地中户外活动;
优化人们常接触空间中的环境微生物群:
在室外环境中,更大的植被多样性与更多样的土壤微生物多样性和更多样的空气生物群落相关联;
而在室内环境中,环境微生物群可以通过建筑设计特征来改变,包括允许阳光和通风的窗户、控制湿度和温度以及减少室内污染物。
均质化、富含微生物的土壤可用于重建城市游乐场。
微生物接种的油漆和瓷砖:
这可能正在成为一种新的策略,作为一种更具针对性的方法,可以在不太可能有绿地的环境中,调节环境微生物群,从而调节人类微生物群。(例如边界生物安全、潜艇或太空旅行)
与其他基于微生物群干预措施并用:
环境微生物组暴露干预措施可与其他基于微生物组的干预措施一起使用,以实现协同增效,从而增强和/或延长任何益处。例如,如果暴露于更多样的环境微生物群延长其效力,粪菌移植给药的频率可能会降低。
暴露于环境微生物群可能会改变人体肠道微生物群和免疫功能,这一领域的研究尚处于起步阶段,需要进行更多的研究,以更好地了解暴露的类型和剂量、不同人群发现的普遍性,并确保此类干预措施的安全性。
这些研究为我们拓宽视野,应对城市居民免疫介导疾病的高发病率,新的可持续的基于自然的预防性干预措施正在涌现,增加户外活动与自然重新建立联系,生物多样性粉末用来制造沙子,重建城市栖息地,或者绿墙的建筑改造也可以成为新的选择。
主要参考文献:
Buchholz V, Bridgman SL, Nielsen CC, Gascon M, Tun HM, Simons E, Turvey SE, Subbarao P, Takaro TK, Brook JR, Scott JA, Mandhane PJ, Kozyrskyj AL. Natural Green Spaces, Sensitization to Allergens, and the Role of Gut Microbiota during Infancy. mSystems. 2023 Feb 15:e0119022. doi: 10.1128/msystems.01190-22. Epub ahead of print. PMID: 36790181.
Soininen L, Roslund MI, Nurminen N, Puhakka R, Laitinen OH, Hyöty H, Sinkkonen A; ADELE research group. Indoor green wall affects health-associated commensal skin microbiota and enhances immune regulation: a randomized trial among urban office workers. Sci Rep. 2022 Apr 20;12(1):6518. doi: 10.1038/s41598-022-10432-4. PMID: 35444249; PMCID: PMC9021224.
Stanhope J, Weinstein P. Exposure to environmental microbiota may modulate gut microbial ecology and the immune system. Mucosal Immunol. 2023 Mar 9:S1933-0219(23)00015-6. doi: 10.1016/j.mucimm.2023.03.001. Epub ahead of print. PMID: 36906178.
Roslund MI, Puhakka R, Grönroos M, Nurminen N, Oikarinen S, Gazali AM, Cinek O, Kramná L, Siter N, Vari HK, Soininen L, Parajuli A, Rajaniemi J, Kinnunen T, Laitinen OH, Hyöty H, Sinkkonen A; ADELE research group. Biodiversity intervention enhances immune regulation and health-associated commensal microbiota among daycare children. Sci Adv. 2020 Oct 14;6(42):eaba2578. doi: 10.1126/sciadv.aba2578. PMID: 33055153; PMCID: PMC7556828.
Sacks D, Baxter B, Campbell BCV, Carpenter JS, Cognard C, Dippel D, Eesa M, Fischer U, Hausegger K, Hirsch JA, Shazam Hussain M, Jansen O, Jayaraman MV, Khalessi AA, Kluck BW, Lavine S, Meyers PM, Ramee S, Rüfenacht DA, Schirmer CM, Vorwerk D. Multisociety Consensus Quality Improvement Revised Consensus Statement for Endovascular Therapy of Acute Ischemic Stroke. Int J Stroke. 2018 Aug;13(6):612-632. doi: 10.1177/1747493018778713. Epub 2018 May 22. PMID: 29786478.
谷禾健康
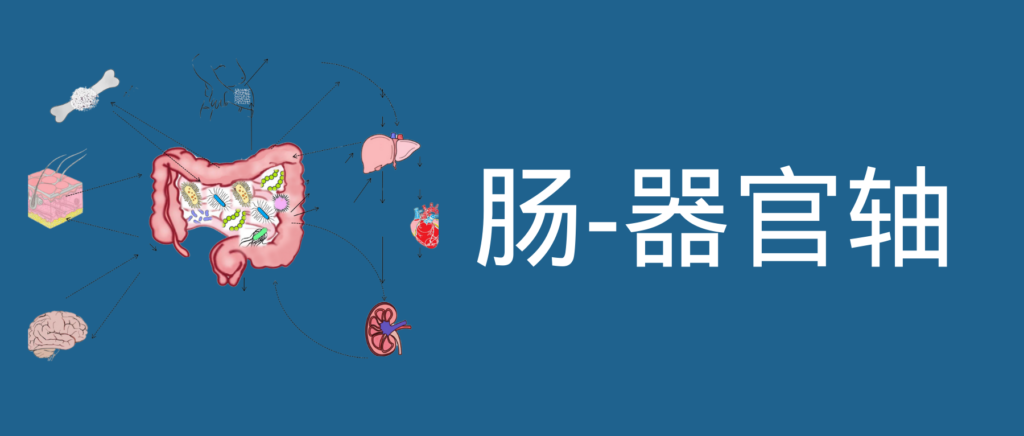
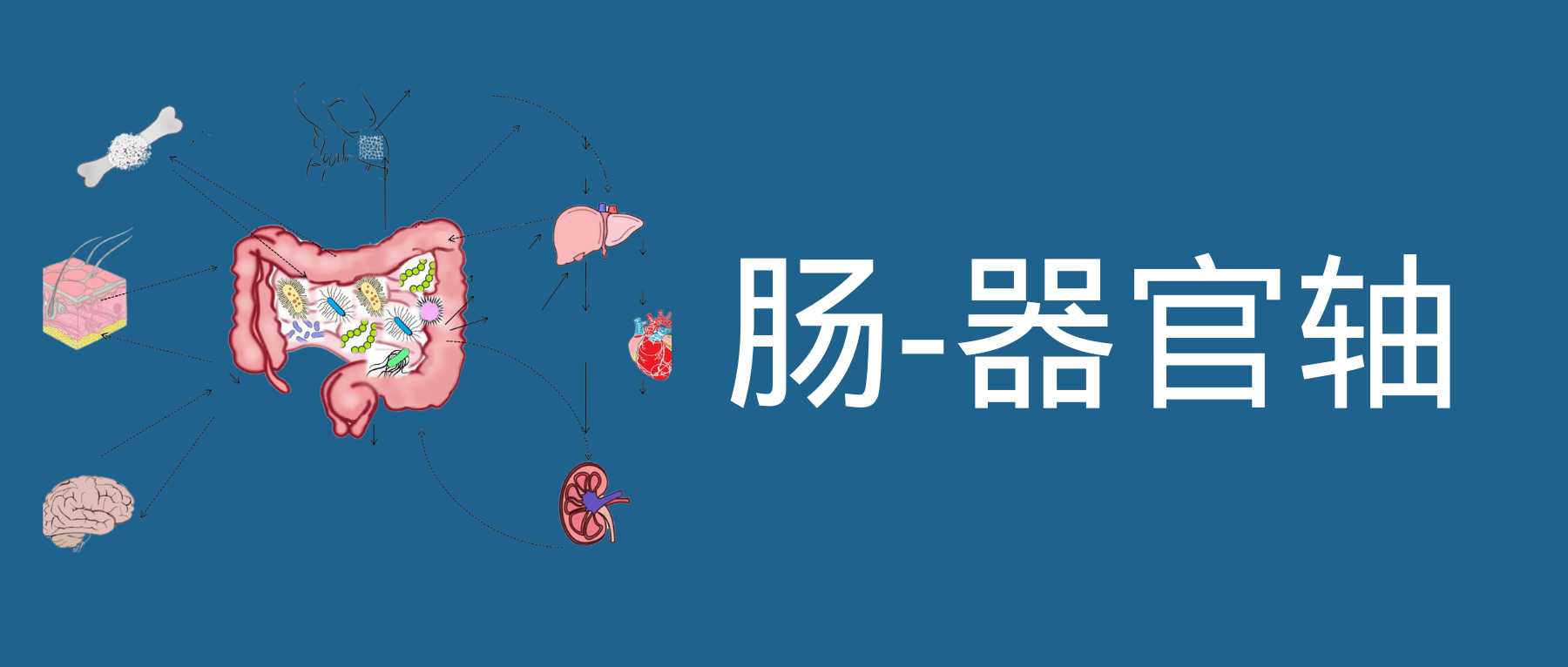
肠道菌群和宿主免疫代谢系统之间的复杂相互作用会影响与其他器官相关的身体功能,它们之间形成“轴”。
这种串扰通过宿主和微生物及其代谢物之间的直接或间接相互作用发生。宿主-微生物免疫代谢轴是宿主细胞途径和各种微生物群之间的多向通信系统。在这个轴内,不同的微生物通过产生胆汁酸、胆碱、短链脂肪酸、神经递质、小分子、有毒物,炎症因子等来调节生理代谢过程,从而对健康和疾病发生产生重要的影响。
图1 在肠道、相关微生物群和各种器官之间的双向或多向通信连接(轴)
Ahlawat S,et al.,Lett Appl Microbiol. 2021
肠道菌群在个体之间或在同一个人的一生中是不同的,并且受到各种因素的影响,包括饮食、年龄、生活方式、药物、疾病状态等。受这些因素影响的动态的肠道菌群成分可能会通过改变多样性或组成来影响健康或疾病风险。
因此,胃肠道和相关微生物群的一个复杂综合的对话机制在越来越多的研究中被证实,肠道以及肠道菌群与各个器官的对话交流机制,即“肠道-器官轴”,在维持各个器官的健康方面变得越来越重要。
本文主要讨论了肠道和人体重要器官之间的双向关系,以及在各类疾病中肠道菌群发挥的作用。
本文主要介绍的各类肠轴如下:
01 肠-大脑轴
02 肠-肾脏轴
03 肠-肝脏轴
04 肠-骨骼轴
05 肠-皮肤轴
06 肠-脂肪轴
07 肠-心脏轴
“肠道作为“第二大脑”影响情绪和行为
大脑和肠道的双向沟通,构成了“肠-脑轴”的基础。肠-脑轴相互作用的证据来自各种研究,涉及无菌动物模型、抗生素、益生菌、中枢神经系统疾病和功能性胃肠道疾病的生态失调。
通过建立肠-脑轴,肠道菌群可以影响大脑,如行为、食欲调节、肠道糖异生和5-羟色胺代谢。
肠道菌群的改变与焦虑、多发性硬化、自闭症谱系障碍、帕金森病等多种神经系统疾病有关。
在了解肠道菌群是如何影响肠脑轴之前,我们先了解一下肠-脑轴是怎么回事。
肠道-大脑轴将大脑的认知和情感中心与外周肠道功能(即免疫激活、肠道反射、肠道通透性和肠道内分泌信号)联系起来。
肠-脑轴涉及:
中枢神经系统(CNS),包括大脑和脊髓;
自主神经系统(ANS)及其交感和副交感肢体;
肠神经系统(ENS);
下丘脑-垂体-肾上腺轴(HPA)
自主神经系统驱动从管腔到中枢神经系统的传入信号,通过脊髓、肠道和迷走神经通路传输,以及从中枢神经系统到肠壁的传出信号。
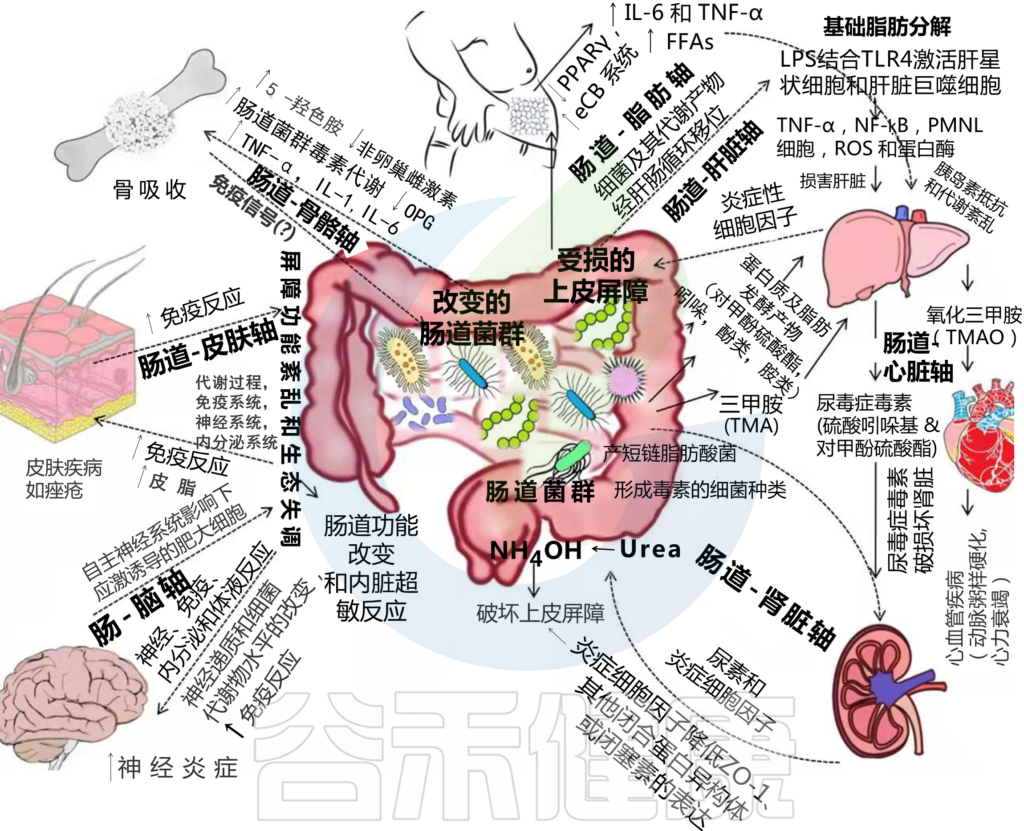
HPA轴涉及记忆和情绪反应,协调生物体对压力源的适应性反应。促炎细胞因子增加的环境应激通过下丘脑分泌促肾上腺皮质激素释放因子(CRF)触发该系统。CRF刺激垂体分泌促肾上腺皮质激素(ACTH),进而导致肾上腺分泌皮质醇,影响包括大脑在内的各种器官(下图)。
图2 “肠-脑轴”(GBA)结构示意图
Ahlawat S,et al.,Lett Appl Microbiol. 2021
因此,不同的通讯线路一起允许大脑控制肠道效应细胞的活动,这些细胞也受肠道菌群的影响。
关于肠脑轴,在我们之前的文章中也有详细介绍:深度解读 | 肠道菌群和中枢神经系统的关系
肠道菌群通过代谢和神经内分泌途径与肠道细胞和肠神经系统以及中枢神经系统进行沟通。
肠-脑轴的破坏控制着肠道功能的变化,如分泌和运动,导致内脏过敏,从而导致肠内分泌和免疫系统的细胞变化。
如果没有微生物定植会发生什么?
改变神经递质的表达(包括5-羟色胺、褪黑素、乙酰胆碱、GABA和组胺)和肠道感觉运动功能,如减少肠道运输、迁移性运动复合体循环复发、远端繁殖、延迟胃排空、扩大盲肠大小…
可能还有各种想象不到的后果,总之,肠道菌群在调节肠道和大脑功能方面起着至关重要的作用。
以细菌物种特异性的方式对动物进行定植可以恢复所有这些异常。
微生物群通过在肠腔中产生局部神经递质和儿茶酚胺的生物活性形式来影响肠神经系统活性。短链脂肪酸等细菌代谢物通过刺激交感神经系统、粘膜5-羟色胺释放、记忆和学习过程影响肠神经系统。
肠神经系统是什么?
肠神经系统主要由肠胶质细胞(EGCs)组成,类似于中枢神经系统中的星形胶质细胞。肠上皮细胞分布于肠壁,包括粘膜固有层。
肠神经系统有什么功能?
——肠神经系统自主调节胃肠道的生理和功能
肠神经系统可以自主调节胃肠道的生理和功能,并通过迷走神经通路与中枢神经系统进行双向沟通,从而形成“肠-脑轴”。
随着肠神经胶质网络的发展,肠道菌群在肠神经系统的调节中起着关键作用。肠神经胶质网络通过钙依赖性信号传导在调节胃肠功能方面发挥作用(如血流、肠道运动、免疫炎症反应和外分泌/内分泌)。
所以说,如果肠神经胶质细胞出了问题,就会导致胃肠道疾病,如炎症性肠病、运动障碍、PD等神经退行性疾病和感染引起的肠道炎症。
通过Toll样受体(TLR)发出的LPS信号在肠道菌群和肠神经系统发育之间起着中介作用。
——肠神经系统是肠内神经肽合成的关键来源
通过信号传递到远端器官,如大脑,产生肠外作用,而远端器官有迷走神经上的神经肽受体。
这些神经肽可以通过影响肠道菌群成分来调节肠道内稳态。它们水平的改变导致各种肠道失调和肠道炎症相关的神经精神障碍。例如,自闭症和重度抑郁症分别与降钙素基因相关肽(CGRP)、神经肽Y(NPY)和P物质(SP)(即神经传递介质)的循环水平改变有关。
微生物群调节血清素能系统,因为在无菌动物的边缘系统中发现血清素和相关代谢物水平的改变。
此外,肠道菌群具有多种氧化还原酶,可以调节神经递质的水平。例如,漆酶(一种多铜氧化酶或MCO)调节肠道中合成的血清素的数量,参与其代谢,在肠-脑轴中起重要作用。漆酶可将儿茶酚胺氧化为活性氧(ROS)和多巴胺奎宁(DAQ)。
研究发现,发现生成的 ROS 受损细胞和 DAQ, 与 帕金森患者的线粒体功能障碍和痴呆有关。微生物群通过迷走神经与大脑沟通,迷走神经将信息从管腔传输到中枢神经系统(图2)。
肠道细菌具有神经递质的表面受体,使肠道和中枢神经系统之间的联系更加有效。
例如,Pseudomonas fluorescence 具有GABA受体,而肾上腺素和去甲肾上腺素受体存在于大肠杆菌O157:H7上(图2)
肠道菌群调节肠道屏障和传入感觉神经,增强其兴奋性,从而调节肠道运动和疼痛感知。
肠道菌群通过激素调节饱腹感
肠道菌群也可能通过从肠内分泌细胞释放各种生物活性肽与肠-脑轴相互作用。例如,甘丙肽触发HPA轴的活动;因此,释放CRF和ACTH可增强肾上腺皮质的糖皮质激素释放,或直接刺激肾上腺髓质的去甲肾上腺素和肾上腺皮质细胞的皮质醇分泌。
几种外围使食欲减退的激素,如肽YY(PYY)、胰高血糖素样肽-1(GLP-1)、胰岛素、瘦素和阿片黑皮素原,以及含有可卡因和安非他明调节转录物的神经元,可诱导饱足感。然而,含有NPY和刺鼠相关肽(AGRP)的神经元的ghrelin(胃饥饿素)会增加饥饿感。
肠道菌群影响粘膜免疫激活
这可能部分由蛋白酶介导。蛋白酶是粘膜和肠神经损伤的终末期效应物,在几种肠道免疫介导的疾病中上调。
大脑调节来自免疫细胞、神经元和胃肠道嗜铬细胞的信号分子的分泌,这可能会影响微生物群的组成。
肠-脑轴的任何失调都会通过扰乱正常粘膜栖息地,影响肠道菌群。胃肠道转运的变化对营养物质输送到肠道微生物群有着深远的影响。
由于自主神经系统影响下应激诱导的肥大细胞导致肠道通透性增强,因此微生物群组成有所不同。这导致类胰蛋白酶和组胺失衡。微生物群的改变也是由于胃肠道Paneth细胞释放抗微生物肽,如α-防御素。
总之,肠道菌群对中枢神经系统的发育和功能有重大影响。同样,中枢神经系统调节胃肠道的生理,最终调节肠道环境。

Ahlawat S,et al.,Lett Appl Microbiol. 2021
许多神经系统疾病包括多发性硬化、帕金森病、阿尔茨海默病、癫痫症、中风与脑损伤等在这两篇文章中有详细介绍:
肠道微生物组在人类神经系统疾病中的作用
最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用
“调节体内废物的水平
肠道和肾脏也具有双向协同关系。
在一个方向上,尿毒症毒素如三甲胺-N-氧化物(TMAO)、对甲酚硫酸盐和吲哚硫酸盐从微生物代谢中产生;
而在另一个方向上,尿毒症会破坏肠道菌群组成和代谢。
这种双向交流之间的任何干扰都会导致各种严重并发症,如慢性肾病(CKD)、终末期肾病(ESRD)和脓毒性急性肾损伤(AKI)。
膳食纤维:通过菌群发酵成短链脂肪酸,修复肾上皮细胞
膳食纤维是菌群的碳水化合物来源。结肠微生物群的组成受到饮食及其在小肠中的同化作用的显著影响。膳食纤维逃避小肠的消化过程,成为结肠菌群碳水化合物的主要来源。
膳食纤维被结肠微生物群发酵成短链脂肪酸。短链脂肪酸在保持肠道上皮完整性和能量稳态方面发挥着重要作用。它们通过改善线粒体生物发生来修复肾上皮细胞的缺氧损伤。
膳食蛋白质:通过菌群发酵,形成尿毒症毒素,加剧肾病
抵抗上消化道消化的膳食蛋白质是结肠微生物群的氮源。这些蛋白质在结肠中的命运主要取决于结肠菌群生长和发育所需能量的可用性,而结肠菌群主要来自碳水化合物发酵。
如果碳水化合物的利用率较高,蛋白质及其中间产物要么被同化为细菌生物量,要么在碳水化合物缺乏的情况下被梭菌和拟杆菌发酵为对甲酚、吲哚、酚和胺。
蛋白质发酵产物经过进一步加工,形成尿毒症毒素,如对甲酚硫酸盐和硫酸吲哚酚。
——尿毒症毒素如何导致肾病发展?
这些毒素由于与白蛋白有较高的亲和力(非共价相互作用)而在血液中循环,并由肾小管分泌物释放出来。如果尿毒症滞留溶质在体内积聚,则会增加肾小球硬化的发生率和肾脏疾病的进展。因此,它们在血液中的浓度可以用来衡量肾脏的功能效率。
硫酸吲哚酚和对甲酚硫酸盐的其他毒性作用包括炎症反应增加、内皮功能障碍、血管钙化、氧化应激增强、红细胞生成减少、细胞衰老增加、血栓形成、动脉粥样硬化形成,左心室肥厚、胰岛素抵抗、肾小管-间质纤维化和肾素-血管紧张素-醛固酮系统激活。
膳食脂肪:高脂饮食导致TMAO升高,与慢性肾病进展直接相关
胆碱、肉碱和卵磷脂是膳食脂肪的主要成分。哺乳动物缺乏打破这些脂肪成分的氰化物键所需的酶。
然而,结肠微生物群有TMA裂解酶,可以破坏氰化物键。胆汁中的TMA裂解酶和肝酶(即含黄素的单加氧酶)的联合作用导致肉碱和胆碱形成TMAO。
2021年发表在Science期刊上的一篇文章指出,高脂饮食会损害结肠上皮细胞线粒体的功能,使肠道氧气和硝酸盐的浓度增加,促进大肠杆菌的生长以及对胆碱的分解,导致TMA水平增加,最终导致循环中有害代谢物TMAO水平的升高。
——TMAO的升高会发生什么?
TMAO与其他尿毒症毒素一样,进入身体循环,并由肾脏释放。TMAO增加与慢性肾病进展直接相关。与健康对照组相比,终末期肾病患者体内的TMAO浓度可高出20倍。
TMAO高导致有害后果,如血小板活性增加、血栓形成潜能、肾小管间质纤维化和动脉粥样硬化的发展。
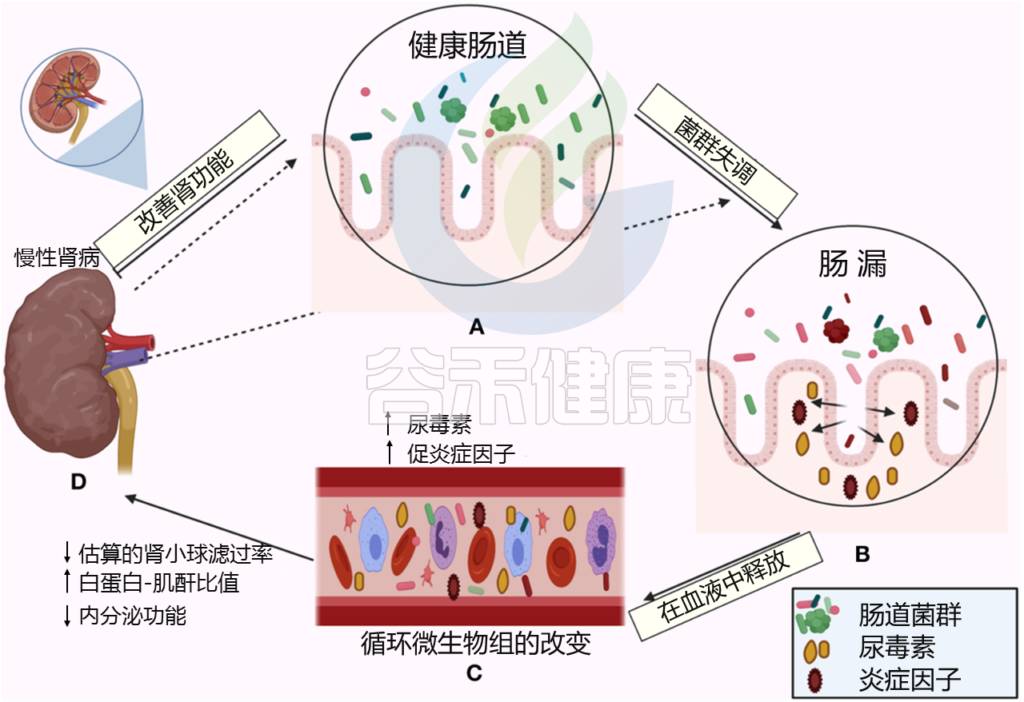
Al Khodor D, et al., Frontiers in Medicine,2022
← 在一个方向上,肠道菌群影响肾脏:
(A)健康的肠道
(B)肠道微生物失调和破坏粘膜层
(C)释放血液中炎性因子和炎症级联的开始,尿毒症毒素积累
(D)估计的肾小球滤过率下降(eGFR),白蛋白肌酐比值(ACR)升高,肾脏内分泌功能丧失
→ 在另一个方向,慢性肾病驱动肠道内的生态失调(虚线箭头所示),并引发炎症级联
尿毒症患者的微生物群组成与健康人不同。据观察,在接受血液透析的尿毒症患者中,需氧菌如肠杆菌和肠球菌增加很多倍,而厌氧菌如双歧杆菌则减少。
5期慢性肾病患者体内含有短链脂肪酸形成酶的细菌较少;然而,其中含有更多的脲酶、尿酸酶、吲哚和对甲酚产生菌。
另一项研究发现,在区分慢性肾病患者和健康对照组方面表现最好的两种菌:
Lachnospira 和 Ruminocococus gnavus
慢性肾病进展和血液透析和Holdemanella、巨单胞菌、普雷沃氏菌属Prevotella和Scardovia有关。
关于慢性肾病的进一步报告表明,慢性肾病是一种蛋白质发酵增加的状态,与肾功能恶化有关。发现这些细菌蛋白发酵产生的代谢物(对甲酚硫酸盐、吲哚硫酸盐和苯乙酰谷氨酰胺)与肾功能呈负相关。
结肠微生物群通过其代谢产生尿毒症毒素,其失衡可能导致上皮屏障损伤。尿毒症毒素的增加会降低紧密连接蛋白的表达,如紧密连接蛋白(ZO-1)、闭合蛋白、claudin-1。
急性肾损伤也有各种原因引起的,有感染性的,败血症性的,脓毒性的等。
感染性急性肾损伤:
肾功能受损->肠道通透性增高->全身炎症->肾功能进一步损伤
患者的炎性细胞因子增加,肾功能受损,导致肠道损伤。细胞因子水平的增强作用于胃肠道壁的连接复合体;因此,通过改变紧密连接蛋白的表达,导致其通透性增高。此外,增加的肠道通透性会以正反馈方式放大全身炎症反应。增强的全身炎症进一步促进肾功能障碍。
败血症性急性肾损伤:
水分潴留->肠壁水肿->尿素代谢->破坏屏障->细菌移位->炎症->衰竭
该类患者中,钠、尿素、尿毒症溶质和水的潴留是由于其肾功能障碍引起的。过多的水分滞留导致肠壁水肿显著增加。来自体循环的尿素扩散到胃肠道腔,肠道细菌脲酶在那里代谢尿素。
尿素转化为氨[CO(NH2)2+H2O→ CO2+2NH3]
进一步代谢为氢氧化铵(NH3+H2O→ NH4OH)
此后,肠道菌群产生的氢氧化铵(NH4OH)作用于连接蛋白,破坏上皮屏障(图1)。
受损的上皮屏障导致肠腔毒素流入,同时细菌从肠腔转移到肠系膜淋巴系统和体循环。这会促进局部和全身炎症,从而导致多器官衰竭和死亡。
脓毒性急性肾损伤:
外部+内部因素->菌群变化
患者的微生物组成发生改变,这可能是由于炎性细胞因子或上皮屏障受损。肠道菌群及其代谢产物能够改变胃肠道细菌细胞受体的表达,从而改变微生物组成。
肠道微生物组成也受到脓毒症患者肠道生理学各种变化的影响,这些变化可能是由于肠外营养和抗生素等外部因素,也可能是肠道渗漏和全身炎症等内部因素。
当使用微生物源性短链脂肪酸治疗时,败血症性AKI患者的肾功能得到改善。这种改善与低水平的细胞浸润/激活、炎症、氧化性细胞应激和凋亡有关。
一项确定蛋白质发酵代谢物对肠道微生物特征的作用的研究显示,梭菌有56个成员,在早期肾脏疾病中,以Christensenellae、Ruminococaceae和Lachnospiraceae为代表。
对终末期肾病患者的类似研究表明,从普雷沃氏菌向拟杆菌转变,产丁酸菌包括 Roseburia、粪球菌、梭菌、粪杆菌、普雷沃氏菌减少。
此外,他们还增加了来自下列菌的OTU:Brachybacterium, Catenibacterium,
Enterobacteriaceae, Moraxellaceae,
Nesterenkonia, Halomonadaceae,
Pseudomonadaceae, Polyangiaceae, Thiothrix
据报道,钙肾结石患者粪便微生物多样性降低,粪便杆菌、大肠杆菌和肠杆菌的代表性显著降低。
此外,在泌尿系结石病中,抗生素引起的泌尿道微生物群的长期变化从乳杆菌(健康保护)转变为肠杆菌科(促结石)。

Ahlawat S,et al.,Lett Appl Microbiol. 2021
扩展阅读:慢性肾脏病中的人类微生物组:一把双刃剑
“酒精不一定是导致肝脏退化的罪魁祸首
肠道和肝脏之间的双向通讯网络涉及这些器官之间的相互关系,肝脏在这些器官中产生有益物质并被肠道吸收。
肠道菌群变化使肠道通透性增加,内毒素移位,肝毒素进入肝脏。
“肠道-肝脏轴”对于理解各种肝脏疾病的病理生理学至关重要。
肠道菌群如何与肝脏产生联系?
肝脏通过门静脉从肠道的静脉流出接收近70%的血液供应,因此,它持续暴露在肠道菌群及其代谢产物。
在健康个体中,进入肝脏的微生物代谢产物,如氨、乙醛和乙醇,由肝脏巨噬细胞(库普弗细胞)代谢。因此,肠道菌群对肝脏生理有很大影响。
肠道菌群变化如何导致肝脏受损?
炎症和门脉高压或肠道微生物组成变化导致的肠道上皮改变增加了肠道通透性。肠道通透性增加导致内毒素移位,导致肝脏中各种促炎基因和细胞因子的转录激活。由于肠道屏障受损,大量细菌及其代谢物如脂多糖(LPS)通过肝肠循环进入肝脏。
在激活LPS时,发生了一系列级联事件,通过NF-kβ介导的机制产生促炎症细胞因子,如TNF-α,这些细胞因子与肝损伤有关(图1)。
LPS是一种肝毒素;因此,暴露于肝脏会导致形态和功能改变。诱导的变化导致急性炎症反应和多形核细胞的积聚,通过从颗粒中释放蛋白酶、活性氧代谢物和其他酶,进一步加剧肝脏损伤。
肝硬化合并门脉高压导致肠道运动受损,促炎细胞因子释放增加,上皮通透性增加,从而影响肝脏。
对于理解各种肝脏疾病的病理生理学至关重要,如非酒精性脂肪肝(NAFLD)、脂肪性肝炎(NASH)、酒精性肝病(ALD)、肝癌发生和肝性脑病(HE)、急性或慢性肝衰竭、肝硬化的进展和并发症。
非酒精性脂肪肝是代谢综合征的一种肝脏表现,其原因是肥胖的普遍存在。
原发性脂肪性肝炎与肥胖、高脂血症和2型糖尿病(T2D)等代谢表现相关。而继发性脂肪性肝炎则是由于空肠回肠旁路手术、全肠外营养、快速减肥、脂肪营养不良或威尔逊氏病以及药物摄入所致。
肠道菌群在能量摄取中的作用
有趣的是,瘦肉型和肥胖型个体的肠道菌群成分不同,肥胖型个体具有的厚壁菌、普雷沃菌、卟啉单胞菌和更少的拟杆菌,这表明肠道菌群在肠道内容物的能量摄取中的作用。
此外,肠道菌群对能量收集和脂肪储存途径有影响,表明它们在胰岛素抵抗和相关代谢疾病的发展中起直接作用。在肥胖个体中,双歧杆菌与血清丙氨酸转氨酶水平呈负相关,丙氨酸转氨酶可作为非酒精性脂肪肝的标志物。
肠道通透性增加、小肠细菌过度生长
肠细胞释放乳糜微粒是脂肪代谢(代谢性内毒素血症)的结果,支持含LPS细菌的生长和移位。它会导致肠道失调和促炎细胞因子的释放(即由于LPS、乙醇和内毒素等细菌产物与TLR之间的相互作用),以应对肥胖。因此,非酒精性脂肪肝的发展主要取决于TLR-4或TLR-9和TNF-α受体的流行。
然而,非酒精性脂肪肝导致脂肪性肝炎的发生过程尚不清楚,但研究表明,产乙醇的肠道菌群的改变导致脂肪性肝炎的发生。肥胖患者的肠道菌群改变可诱导瘦素产生,通过STAT3信号上调CD14。这会导致对低剂量LPS的更高反应性,导致脂肪性肝炎中的肝脏炎症和纤维化。
非酒精性脂肪肝中的肠道菌群变化
在一项对86名经活检证实的非酒精性脂肪肝患者(72名患者患有轻度/中度非酒精性脂肪肝,14名患者患有晚期纤维化)的研究中,在轻度/中度非酒精性脂肪肝患者中,厚壁菌、Eubacterium rectale、普通拟杆菌Bacteroides vulgatus 数量丰富,而变形菌门,晚期(3-4期)纤维化患者中大肠杆菌和普通拟杆菌的比例过高。与轻度/中度非酒精性脂肪肝相比,晚期纤维化患者下列菌群显著减少:
Eu. rectale, Ruminococcus obeum , R. obeum
另一项针对非酒精性脂肪肝患者的研究显示,Alistipes和Prevotella的丰度较低。厌氧菌属、大肠杆菌属、链球菌属和乳酸杆菌属在这些患者中更为丰富。
紧密连接变宽,微绒毛排列异常,T淋巴细胞减少,TNF-α、IFN-γ和IL-6升高,揭示了肠道菌群介导的炎症在非酒精性脂肪肝发病机制中的重要性。
其他各类非酒精性脂肪肝中肠道菌群变化
一项针对100名患有2型糖尿病的非酒精性脂肪肝患者的研究中,50名糖代谢正常的非酒精性脂肪肝患者和60名对照组报告,患有2型糖尿病的非酒精性脂肪肝患者的双歧杆菌显著减少。然而,这两组患者的多形拟杆菌丰度均较低,而Eu. rectale ,Lactobacillus 较高。
在一项研究中,使用定量实时PCR进行肠道菌群肠道菌群结构分析,涉及11名单纯性脂肪变性(SS)患者、22名非酒精性脂肪性肝炎(NASH)患者和17名健康对照者(HC)。与单纯性脂肪变性患者和HC患者相比,脂肪性肝炎患者中的拟杆菌显著减少,而与SS患者相比,脂肪性肝炎患者中的Clostridium coccoides 更丰富。
另一项针对22名脂肪性肝炎患者、25名肥胖者和16名对照者的研究显示,肥胖和脂肪性肝炎患者的拟杆菌数量增加,厚壁菌数量减少。与对照组相比,脂肪性肝炎患者的放线菌丰度较低;然而,肥胖组和脂肪性肝炎组之间的变形菌存在显著差异(表1)。
肠道通透性增加、内毒素进入肝脏、促炎
酒精性肝病(ALD)是一系列肝脏疾病,包括脂肪肝、脂肪变性、急性酒精性脂肪性肝炎,酒精性肝纤维化和肝硬化是由成瘾性饮酒引起的,酒精及其代谢物(如乙醛)通过产生ROS导致肝损伤。
它们能够破坏上皮细胞紧密连接,从而导致肠道通透性增加。这会导致细菌易位,增加内毒素、LPS、细菌DNA和其他代谢物通过门静脉进入肝脏。库普弗细胞激活在ALD的发病机制中起着核心作用,LPS通过TLR-4或TLR-9激活库普弗细胞,导致促炎细胞因子的释放。
LPS、TLR-4和炎症细胞因子通过生长因子-β信号激活星状细胞,导致纤维化,这是一个的渐进过程。
酗酒者:
人类酗酒者的肠道菌群与健康对照组不同,前者的拟杆菌科减少,而后者的拟杆菌科增加。
酒精依赖综合征和酒精性肝硬化:
一项关于酒精依赖综合征(ADS)和酒精性肝硬化(ALC)的研究报告,肠杆菌科、拟杆菌、普氏杆菌、粪杆菌、克雷伯菌、乳球菌增加。然而,通过对肠道群落结构的比较,可以确定这两个群体之间差异丰富的分类群。尤其是,ADS患者的阿克曼病、粪球菌、未分类梭状芽胞杆菌显著减少。然而,ALC表现为拟杆菌、Blautia、双歧杆菌、链球菌、乳酸杆菌增加,普雷沃氏菌属、Paraprevotella、Alistipes 减少(表1)。
肝硬化:
肝硬化患者低水平的胆汁酸分泌和门脉高压会影响肠道菌群的组成和生长。肝硬化患者肠道内的病原体(链球菌科和肠杆菌科)增加,有益细菌(双歧杆菌和乳酸菌科)减少,从而导致生态失调。进一步的报道表明,拟杆菌门、变形菌门和毛螺菌科的比例降低;然而,肝硬化患者中梭杆菌类、肠杆菌科、韦荣球菌科和链球菌科的比例增加。
在另一项研究中,在肝硬化患者中观察到厚壁菌门比例降低,链球菌和韦荣球菌数量增加。在这些患者中,生物失调导致其他严重并发症,如菌血症、HE伴SIBO和肠道通透性增加。他极大地影响着生活质量;由于器官损伤和微生物产生的有毒物质(主要是氨,其他还有酚类、硫醇、苯二氮卓、短链和中链脂肪酸等)的综合作用,以认知功能受损为特征。
TH17与肠道菌群相互作用
肠道菌群在肝癌发生中的作用也很明显,研究表明,肠道菌群可以减少无菌小鼠的肝癌发生,丙酸盐可以抑制肝癌细胞的增殖。产生肿瘤内IL-17的T辅助细胞(Th17)通过与肠道菌群相互作用在肠道中生成。发现它们与肝细胞癌患者的不良预后相关,可能是由于血管生成和肠道菌群肿瘤生长的进展。
因此,从上述讨论中可以看出,不是单个微生物而是微生物失调会导致几种肝脏相关疾病。因此,可以得出结论,肠道菌群在通过“肠道-肝脏轴”维持个体健康方面起着关键作用。

Ahlawat S,et al.,Lett Appl Microbiol. 2021
扩展阅读:深度解析 | 肠道菌群与慢性肝病,肝癌
“微生物代谢产物和骨骼健康
肠道菌群及其衍生分子对骨骼健康有影响。
肠道菌群对骨密度、骨强度、养分吸收产生影响。
饮食影响肠道菌群,从而影响骨骼健康。
骨骼:身体的支撑框架,细胞因子的仓库
人体骨骼对身体的整体功能起着至关重要的作用。除了作为身体的特殊支撑框架,骨骼还保护重要器官,充当钙稳态的矿物质储库,为骨髓(脂肪储存和血液形成)提供环境,并且是细胞因子和生长因子的仓库。
有趣的是,肠道菌群及其衍生分子对骨骼健康有影响。
最近的报告揭示了肠道和骨骼健康之间通过“肠道-骨骼轴”的复杂关联。在宫内和产后早期,暴露或限制环境因素可调节生长迟缓、骨矿化以及身体和肠道微生物组成。
肠道菌群对骨密度和骨强度的影响
各种临床前试验显示,乳酸杆菌是主要影响因素。骨丢失和肠道细菌过度生长验证了肠道、其微生物群和骨骼健康之间的沟通。肠道菌群通过各种潜在机制调节骨骼生长,如营养吸收、免疫系统成熟、释放各种代谢产物、改变胃肠道通透性、肠源性血清素和LPS诱导的全身炎症。
肠道菌群对养分吸收有重大影响
例如,胃肠道中长双歧杆菌和罗伊氏乳杆菌水平的增加通过钙、磷和镁等矿物质吸收水平的提高导致骨密度增加。肠道菌群在维生素B和K的合成中起着重要作用,维生素B和K对骨骼健康调节和胆汁酸代谢至关重要。
胆汁酸调节钙的吸收过程,就像脱氧胆酸抑制钙的吸收一样;然而,熊去氧胆酸会提高钙吸收过程。
饮食->肠道菌群->营养吸收->进一步影响骨骼
饮食对肠道菌群(碳水化合物作为主要能源)的组成有很大影响;因此,对营养吸收过程的影响进一步影响骨骼健康。有效的蛋白质含量对骨骼生长至关重要,而高蛋白饮食会导致胃肠道中甲烷和硫化氢等毒素的产生增加。
因此,饮食中适当的碳水化合物与蛋白质比例至关重要,任何偏差都会导致肠道菌群成分的破坏,从而可能导致骨代谢过程的故障。骨干细胞分化依赖于细胞因子等全身因素;此外,微生物群组成破坏导致的免疫改变会影响骨骼。
多种免疫因子参与骨代谢的调节
核因子-κB受体激活剂(RANK)、RANK配体(RANKL)和骨保护素(OPG)等多种免疫因子参与骨代谢的调节。
有两种类型的细胞,间充质干细胞来源的成骨细胞和单核细胞系来源的破骨细胞。单核细胞系细胞通过RANKL途径分化为巨噬细胞/树突状细胞或破骨细胞,具体取决于细胞周围的微环境。巨噬细胞集落刺激因子(M-CSF)的存在导致RANK表达增加,导致RANKL信号的刺激,最终通过形成破骨细胞导致骨吸收。
TNF-α、IL-6和IL-1等细胞因子也通过RANKL途径直接或间接放大骨吸收,因为细胞因子增加髓系细胞上RANK受体的表达。然而,OPG(RANKL的天然受体)阻止它与RANK结合,从而减少破骨细胞的生成过程。OPG的主要来源是B细胞,炎症状态下B细胞的失调导致B细胞RANKL表达升高,OPG表达降低,从而导致更高水平的骨吸收和破骨细胞过度生成。
血清素水平的增加与骨量的减少有关
据报道,肠道菌群通过维持代谢激素5-羟色胺或5-羟色胺(5-HT)的水平来影响骨代谢,5-羟色胺是由肠道嗜铬细胞在色氨酸羟化酶-1(Tph1)酶的帮助下合成的。由于这两种细胞类型,即骨细胞和成骨细胞都有5-HT受体,它通过5-HT信号转导途径在骨发育和维持的调节中起主要作用。
短链脂肪酸等微生物产物在骨密度调节中发挥作用
短链脂肪酸通过OPG和Runx信号通路参与骨矿化和骨形成;然而,丁酸通过抑制RANKL信号通路减少破骨细胞的生成过程。研究表明,短链脂肪酸通过潜在影响宿主内分泌因子(如胰高血糖素样肽1(GLP-1)和肽YY(PYY))的功能,在维持骨密度方面发挥间接作用,这些内分泌因子与骨代谢有关。
PYY和GLP-1均由胃肠道内分泌L细胞分泌,其中GLP-1通过破坏成骨细胞和脂肪细胞之间的平衡,从骨髓间充质干细胞分化为骨代谢调节器。然而,在绝经前妇女中,PYY与全身和髋部骨密度之间存在矛盾的联系。
肠道菌群改变激素水平影响骨骼健康
肠道菌群还通过改变肠道来源的非卵巢雌激素(如己烯雌酚和类黄酮)水平影响骨骼健康。雌激素水平低是绝经后骨质疏松风险的主要因素。
其他疾病中,肠道菌群和骨骼健康的联系
克罗恩病(CD)和肥胖会增加骨折风险,因此,将骨密度和肠道菌群联系起来。
早些时候,一项用于测定类风湿性关节炎(一种关节慢性炎症性疾病)中肠道菌群改变的研究显示乳酸杆菌显著增加。
另一份报告显示拟杆菌、普雷沃菌,Porphyromonas的数量较低。然而,最近的一项研究表明,以下菌群比例过高:Porphyromonadaceae, Carnobacterium, Parabacteroides, Phascolarctobacterium, Bacteroides, Paraprevotella. 此外,据报道,产生丁酸盐的粪杆菌、Roseburia、Subdoligranulum、瘤胃球菌、Pseudobutyrivibrio 数量减少。
类似地,强直性脊柱炎(关节炎的一种形式)患者在回肠末端有离散的微生物特征,属于毛螺菌科、卟啉单胞菌科、瘤胃球菌科、拟杆菌科、Rikenellaceae的细菌数量增加。Prevotellaceae和Veillonellaceae科细菌的丰度降低(表1)。

Ahlawat S,et al.,Lett Appl Microbiol. 2021
扩展阅读:肠道微生物组:肌肉骨骼研究的新领域
“肠道健康对容光焕发的皮肤的重要性
皮肤内稳态和外稳态与胃肠道有关,皮肤和肠道之间存在双向沟通。
胃肠道疾病和饮食都会影响皮肤的病理生理学。
肠道菌群通过产生短链脂肪酸、免疫系统修饰等影响皮肤健康。
各类皮肤病中肠道菌群的作用。
皮肤和肠道对维持生理内环境平衡至关重要。它们具有多种共同特征,如大量微生物群的定植、高度神经支配、大量血管化,并提供与外部环境的接口。皮肤再生过程对于维持其内环境稳定状态非常重要,这是通过持续更新和有效的表皮更新来实现的。
处于稳态的皮肤可以执行各种基本功能,如温度调节、保护和保水。皮肤内稳态和外稳态与胃肠道有关;因此,考虑到皮肤和肠道之间的双向沟通。尽管肠道和皮肤关系的完整机制尚不清楚;然而,研究表明,它涉及代谢系统、免疫系统、神经系统和内分泌系统之间的复杂通信网络。
胃肠道疾病和饮食都会影响皮肤的病理生理学,皮肤表现与某些胃肠道疾病有关。
皮肤通常由四个细菌门控制,包括拟杆菌门、变形菌门、放线菌门和厚壁菌门。
肠道菌群通过产生短链脂肪酸影响皮肤微生物群
短链脂肪酸在决定皮肤微生物群物种的流行程度方面具有重要作用,从而影响皮肤免疫反应机制。通过抑制炎症细胞的粘附、迁移、增殖和细胞因子的产生,短链脂肪酸(尤其是丁酸)减缓了免疫反应。短链脂肪酸还通过组蛋白去乙酰化酶(HDAC)抑制和NF-kB信号通路失活在调节免疫细胞凋亡和激活中发挥作用。
许多皮肤生理功能,如伤口愈合和毛囊干细胞分化的调节,都受皮肤调节细胞的控制,其增殖受到HDAC抑制的刺激。
重要的皮肤菌——表皮葡萄球菌和痤疮丙酸杆菌
有趣的是,据报道,两种最显著的皮肤共生菌,即表皮葡萄球菌和痤疮丙酸杆菌能够耐受短链脂肪酸的显著变化。丙酸杆菌本身产生类似丙酸和乙酸盐的短链脂肪酸。丙酸对条件致病菌耐甲氧西林金黄色葡萄球菌具有抗菌作用。
补充副干酪乳杆菌NCC2461降低皮肤敏感性
在皮肤的功能中,屏障功能可以防止病原体入侵以及皮肤水分、电解质和蛋白质的流失。经表皮失水(TEWL)是一种测量稳态水蒸气穿过皮肤进入环境的通量,已被用作皮肤屏障功能的标志。人类临床研究表明,服用短乳杆菌SBC8803口服补充剂12周后,角膜水合作用显著增加,TEWL降低。同样,补充副干酪乳杆菌NCC2461 2个月的个体TEWL和皮肤敏感性降低。
肠道微生物组主要通过免疫系统修饰影响皮肤健康
它通过影响T细胞对各种免疫刺激的反应,从而增强皮肤的异质性。Th-17细胞数量异常或更高,以及促炎细胞因子与白塞病(BD)等多种炎症表现有关。这验证了肠道菌群在通过免疫系统修饰维持皮肤健康方面的关键作用。
免疫改变、皮肤屏障功能障碍
特应性皮炎(AD)是一种皮肤炎症性疾病,其发病机制主要由免疫反应改变和皮肤屏障功能障碍控制。由于Th1/Th2比率中断,以细胞因子产生增加(IL-4、IL-5和IL-13)为标志的免疫改变导致IgE水平升高,并增加金黄色葡萄球菌与特应性皮炎患者皮肤的结合。这种免疫失衡是由于存在特定类型的微生物群时,炎症微环境导致肠道菌群及其代谢物发生改变的结果。
特应性皮炎患者肠道菌群增加了金黄色葡萄球菌、大肠杆菌、艰难梭菌的数量,其中拟杆菌和双歧杆菌减少。
另一项针对特应性皮炎患者的研究显示,Faecalibacterium prausnitzii在亚种水平上存在失调,丙酸盐和丁酸盐的产生量较低,包括与菌株A2-165相关的产生量。它导致皮肤对过敏原产生异常的Th2型免疫反应(表1)。此外,还发现大肠杆菌和梭菌通过嗜酸性炎症与特应性皮炎相关。
然而,屏障功能障碍的主要遗传原因是丝聚蛋白(filaggrin)基因突变导致的功能丧失,这对维持表皮内环境稳定至关重要,因为丝聚蛋白基因有助于屏障功能和保水。因此,对环境抗原的易感性增加和TEWL增加可能是该特定基因突变的结果。
逐渐地,已确定的肠道菌群失调以及免疫系统失衡持续到成年,从而导致疾病的自然病程。肠道菌群破坏降低了其调节宿主免疫系统的能力。这会导致局部和系统性炎症,如牛皮癣(银屑病)。
扩展阅读:微生物群对三大过敏性疾病发展的影响
生命早期微生物接触和过敏风险:如何预防
菌群变化、肠道炎症
据报道,牛皮癣患者的肠道菌群多样性较低,粪球菌数量减少。
此外,一项针对15名银屑病患者、16名银屑病关节炎(PsA)患者和17名对照受试者的研究显示,银屑病和PsA患者中的粪球菌数量均减少。同时,PsA患者的Akkermansia、瘤胃球菌和假丁酸菌数量减少(表1)。
银屑病可导致身体其他器官发炎。据报道,7–11%的炎症性肠病患者患有银屑病,银屑病进一步将皮肤与胃肠道连接起来。
发现银屑病患者的血浆中含有肠道细菌的DNA。其他皮肤表现如酒渣鼻与幽门螺杆菌感染有关。这些患者的SIBO发病率更高,通过产生有毒代谢物导致肠道通透性、肠细胞损伤和全身炎症。
扩展阅读:牛皮癣看似皮肤病,实则关系到肠道
阻塞、炎症、痤疮杆菌介导、mTOR途径
痤疮,一种较常见的皮肤异常,是由于皮脂分泌过多、导管阻塞和炎症引起的,由痤疮杆菌介导。对寻常痤疮患者粪便的高通量测序显示,变形菌数量增加,放线菌、双歧杆菌、丁酸杆菌、共细菌、乳酸杆菌和异杆菌的数量减少(表1)。
据报道,痤疮的病理生理学受到mTOR途径和肠道菌群之间双向通讯的影响。
在一个方向上,肠道代谢物对mTOR途径介导的代谢过程具有调节作用,如脂质代谢和细胞增殖。或者,mTOR途径通过调节肠道屏障的完整性来影响肠道菌群成分。
扩展阅读:痘痘?粉刺?皮肤问题很可能是肠道问题
这7种类型的食物可能引起 “痘痘”
菌群变化
湿疹的标志是双歧杆菌、巨球菌、嗜血杆菌、脆弱拟杆菌和唾液链球菌的丰度降低。此外,这些患者以下菌群数量增加:
Escherichia/Shigella, Veillonella, Clostridium XlVa,
Lachnospiraceae incertae sedis, F. prausnitzii,
Ruminococcus gnavus, A. muciniphila
免疫功能障碍、菌群变化
研究表明,肠道菌群的改变与白塞病患者的免疫功能障碍有关。这些患者双歧杆菌和埃格特菌的数量增加,而巨单胞菌和普氏杆菌的数量减少(表1)。
总之,这些发现为皮肤和肠道之间的功能互动机制提供了强有力的支持性证据。

Ahlawat S,et al.,Lett Appl Microbiol. 2021
“肠道菌群和能量平衡
脂肪介导的小肠效应可能有助于理解脂肪介导的代谢紊乱的病因。
肠道脂肪吸收可以根据饮食中的脂肪含量进行调整。
肠道菌群通过与脂肪组织的通讯轴影响代谢
膳食脂肪的消化吸收过程
在我们的饮食中,甘油三酯(TAG)几乎占膳食脂质的95%。在吸收之前,它在胃中被酸性稳定的胃脂肪酶部分水解成二酰甘油(DAG)和游离脂肪酸(FFA)。
它在小肠中继续消化,在小肠中,依赖于脂肪酶的胰脂肪酶释放2-单酰甘油(MAG)和长链脂肪酸(LCFA)。长链脂肪酸具有可能对细胞完整性有害的清洁剂特性。因此,它们分散在肠腔中的胶束中,与肠吸收细胞中的脂质结合蛋白结合,并作为富含甘油三酯的脂蛋白(乳糜微粒)分泌到淋巴中,这些脂蛋白被内皮脂蛋白脂肪酶进一步水解,为外周组织提供长链脂肪酸。
小脂蛋白中剩余的甘油三酯和残余物被肝脏脂肪酶进一步水解,并被肝脏从血液中清除。因此,膳食脂肪的高效消化和吸收确保了长链脂肪酸正确供应到发挥各种基本细胞功能的身体。
脂肪吸收可以根据饮食中的脂肪含量进行调整
小肠是一种选择性屏障,可有效吸收膳食脂肪并负责其处置。新出现的数据表明,肠道的甘油三酯的高生物利用度是后天获得的特性。
这表明肠道脂肪吸收可以根据饮食中的脂肪含量进行调整。有趣的是,这些脂质介导的肠道适应防止了高脂肪饮食期间粪便中脂质的过度清除。
因此,在食物匮乏的环境中提供生存优势。相反,在食物充足的时期,它们会增加肥胖和相关疾病的患病率。
总之,这些数据强调,脂肪对小肠的影响可能是促成脂肪介导的代谢紊乱的病因。
过度摄入脂肪的肥胖,引起系列代谢紊乱
过度摄入脂肪会增加肥胖的风险,肥胖涉及一系列代谢改变,如葡萄糖稳态紊乱(胰岛素抵抗和2型糖尿病或T2D)、心血管疾病(CVD)或风险因素(如高血压)和非酒精性脂肪肝。它涉及器官间(肠-脂肪组织和肠-大脑)通讯网络的严重紊乱,这有助于能量消耗、脂肪组织发育和胰岛素抵抗的改变。然而,并非所有肥胖者都有胰岛素抵抗和糖尿病。
它与两个主要细菌分类的相对丰度的改变有关,即拟杆菌减少,厚壁菌增加。因此,微生物组从饮食中提取能量的能力更高。
肠道菌群不仅是代谢紊乱的结果,也可能是原因
有几项研究将肠道双歧杆菌数量的减少与肥胖和/或糖尿病的发病联系起来。然而,现有证据表明,肠道菌群成分的改变不仅仅是结果,还可能导致肥胖。
高脂饮食改变菌群引发炎症反应,导致代谢综合征
高脂饮食也与肠内拟杆菌相对丰度降低、含LPS细菌丰度增加以及血浆LPS水平升高(称为代谢性内毒素血症)有关,通过增加LPS-TLR4结合增强局部炎症反应。
其次是脂肪/肠系膜脂肪组织积聚和胰岛素抵抗。胰岛素敏感性受绕过LPS诱导的CD95介导的髓样细胞炎症的影响。然而,在生理学上,局部肠道炎症是一种调节肠道屏障功能和促进乳糜微粒转运的适应,以在脂质摄入增加的情况下存活。但长期高脂肪摄入和肠道菌群改变会在肠道引发持续/慢性低度局部炎症反应,进而导致代谢综合征(图1)。
代谢异常也受脂肪分布的影响。中枢性肥胖的个体,脂肪主要集中在上胸廓和腹腔内沉积,更容易发生这种异常。
肠道菌群通过与脂肪组织的通讯轴影响代谢
由生物活性脂质组成的内源性大麻素(eCB)系统可以调节肠道和脂肪组织之间的联系。它通过与大麻素受体结合而引发细胞信号。此外,它的严格调控依赖于特定酶的合成和降解之间的平衡。它在控制能量平衡的组织中表达,因此,其失调会导致各种代谢状况,包括肥胖和2型糖尿病。
免疫反应诱导胰岛素抵抗,维持平衡,但长时间会引起代谢异常
免疫细胞尤其是巨噬细胞(具有LPS受体)对代谢内毒素血症的反应,增加白色脂肪组织浸润,产生炎症免疫反应,增强IL-6和TNF-α,从而诱导胰岛素抵抗,以维持饥饿和感染条件下的体内平衡。
然而,在肥胖患者中观察到的,如果它持续很长时间,就会产生有害影响,并导致代谢异常。
类似地,肠屏障功能受损和肠系膜脂肪大量积聚的克罗恩病患者中,细菌向肠系膜脂肪的移位增加。
脂肪细胞肥大->游离脂肪酸升高->代谢紊乱
LPS可以降低前脂肪细胞中过氧化物酶体增殖物激活受体γ(PPARγ)的表达,即脂肪生成(脂肪细胞分化和脂肪生成)的关键调节因子,并激活eCB的产生。这会对前脂肪细胞分化产生不利影响,并导致脂肪细胞肥大。
肥大脂肪细胞沉积游离脂肪酸的能力受损,从而导致循环游离脂肪酸水平升高,从而导致基础脂肪分解(图1)。
相反,它们会释放更多的游离脂肪酸和炎性细胞因子,包括脂肪因子,也就是不好的代谢特征。
总之,肝脏代谢受内脏脂肪和肠道分泌特征的影响。在肥胖个体中,内脏脂肪沉积物中的FFA和促炎细胞因子以及肠道进入门静脉循环的内毒素(LPS)的释放增加对肝脏胰岛素敏感性产生负面影响,这可能导致代谢综合征的发生。这证实了“肠道脂肪组织”和肝脏之间存在一个网络。
扩展阅读:体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
“双向通信网络
大多数心血管疾病风险因素,都会导致与肠道炎症和肠道屏障完整性降低相关的生态失调。
肠道和心脏之间双向沟通,“肠道-心脏轴”
肠道菌群参与各类心血管疾病的进展。
心血管疾病由多种风险因素引起,分为可改变的(饮食和生活方式)和不可改变的(年龄和遗传学)。
几项研究表明,肠道菌群与宿主生理过程保持着复杂的关系,因此表明它是心血管疾病风险的基因外因素。
大多数心血管疾病风险因素都会导致与肠道炎症和肠道屏障完整性降低相关的生态失调,提高肠道细菌结构成分和循环中微生物代谢产物的水平,从而加快了心血管疾病的发展。
一些影响心脏的疾病,如代谢综合征或肥胖症,与出生后微生物组的获取受到干扰或不足有关,或与儿童时期肠道微生物组中存在特定细菌或细菌家族的环境微生物的早期接触有关。
此外,患有肠易激综合征等肠道疾病的患者患冠心病的风险增加。这表明肠道和心脏之间存在额外的连接。
以上证据共同表明,肠道和心脏之间存在双向通信网络,即“肠道-心脏轴”。
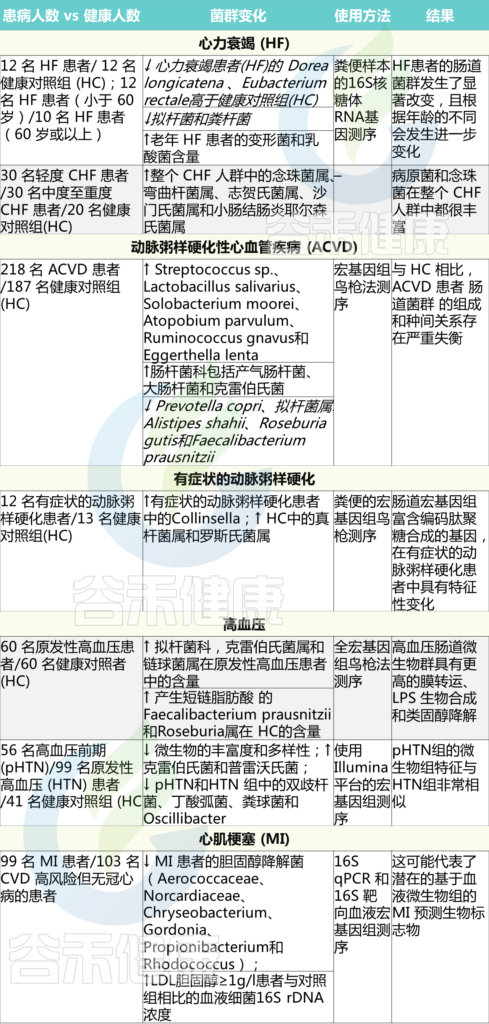
越来越多的数据表明,肠道在心力衰竭(HF)的病理生理学中起着至关重要的作用。
心力衰竭患者损害肠道,导致疾病发展
心力衰竭患者会出现外周血管收缩、心输出量减少和组织充血等障碍,这些障碍会在结构和功能上损害肠道,导致肠道血流量减少、肠壁增厚(结肠和回肠末端),增加(小肠中)胶原蛋白的积累和血流动力学改变。由于缺氧诱导的肠缺血,这些微循环障碍在功能上损害了肠上皮细胞,从而损害营养吸收,导致疾病发展和营养不良。
肠道细菌及其产物转移到循环中,诱发炎症反应
屏障功能障碍导致肠道细菌及其产物转移到循环中。当进入循环系统时,肠道细菌源性内毒素(如LPS)结合其受体,即心肌细胞上的Toll样受体4(TLR-4)。这种结合与循环细胞因子(TNF-α)增加、结构组织损伤、收缩力下降和心功能受损等炎症反应的诱导有关。LPS还会触发吞噬细胞和粒细胞释放儿茶酚胺,从而对肠道灌注产生额外的不利影响。
心力衰竭与菌群失调有关
最近,心衰患者的肠道菌群分析表明,肠道菌群发生了显著改变, 以下菌群较少:
Dorea longicatena 、 Eu. rectale
菌群随着年龄的不同而进一步变化,因此老年心力衰竭患者(60岁或以上)的拟杆菌和粪杆菌数量较少,变形菌和乳酸杆菌比例较大。
另一项针对慢性心力衰竭(CHF)患者的研究显示,患者的肠壁厚度增加,三氯蔗糖和乳果糖/甘露醇的通透性增加,D-木糖吸收减少,同时乙状结肠粘膜生物膜中的粘附细菌水平升高。这些变化共同导致肠道缺血、慢性炎症和营养不良。
此外,与健康对照组相比,CHF患者肠道内念珠菌和沙门氏菌、弯曲菌、志贺氏菌和小肠结肠炎耶尔森氏菌等病原菌过度生长(表1)。
心力衰竭和代谢产物的异常产生有关
肠道菌群衍生的代谢物也会促进疾病进程。尿毒症毒素,如TMAO、对甲酚硫酸盐和吲哚氧基硫酸盐,是从饮食摄入的微生物发酵中产生的。硫酸吲哚氧基对心脏有促肥大和促纤维化作用,而TMAO是预测心血管疾病风险的一个有前途的生物标志物。
一项大型队列研究表明,在接受选择性冠状动脉造影的患者中,血浆TMAO水平升高与心肌梗死、中风和死亡风险增加有关。此外,心力衰竭患者的TMAO血浆水平也明显高于健康对照组。
动脉粥样硬化涉及代谢和炎症成分,受肠道菌群变化的影响
新出现的报告提出了一种新的途径,将膳食脂质摄入、肠道菌群和动脉粥样硬化联系起来。从膳食磷脂酰胆碱(卵磷脂)中产生甜菜碱、胆碱和TMAO代谢物取决于肠道菌群的代谢,TMAO与心血管疾病风险呈最强正相关。
根据一项研究,TMAO可减少胆汁酸的合成,并抑制胆固醇的逆向转运,而胆固醇的逆向转运与动脉粥样硬化的增加有关。然而,确切的机制仍然难以捉摸。
此外,人们认为慢性肺炎衣原体和幽门螺杆菌感染以及随后的免疫反应对动脉粥样硬化的发展至关重要。
LPS升高与动脉粥样硬化有什么样的关联?
各种研究支持血清LPS(内毒素)水平升高与动脉粥样硬化之间的关联。IBD或肝硬化患者的肠道屏障功能受损,导致血清LPS水平升高,动脉粥样硬化发生率增加。
LPS通过与低密度脂蛋白(LDL)相互作用影响脂蛋白代谢,诱导内皮细胞损伤,刺激超氧阴离子释放和低密度脂蛋白氧化。氧化低密度脂蛋白有利于巨噬细胞释放细胞因子(IL-1和TNF-α),刺激巨噬细胞转化为泡沫细胞。这些特征共同促进动脉粥样硬化的发展和进展。
肠道菌群参与动脉粥样硬化性心血管疾病的发展
动脉粥样硬化斑块和同一个体的肠道中存在不同种类的细菌DNA,表明肠道菌群是动脉粥样硬化细菌的潜在来源。因此,肠道菌群可能参与冠心病的发病和进展。
在早期的研究中,动脉粥样硬化性心血管疾病患者中链球菌属和肠杆菌科的比例高于健康对照组。另一项针对症状性动脉粥样硬化患者的研究显示,与健康对照组相比,症状性动脉粥样硬化组的Collinsella数量增加,Eubacterium ,Roseburia比例降低(表1)。
此外,肠道菌群是多种疾病的风险因素,如代谢综合征、肥胖、糖尿病和动脉粥样硬化,这些疾病与高血压有关。
高血压的发病机制是复杂的、多因素的。由细菌诱导的膳食纤维厌氧发酵在肠道产生的短链脂肪酸在调节血压(BP)方面具有生理功能。短链脂肪酸的高血压和降压作用分别通过与受体Olfr78和GPR41结合来介导(图3)。
图3 “肠道-心脏”轴
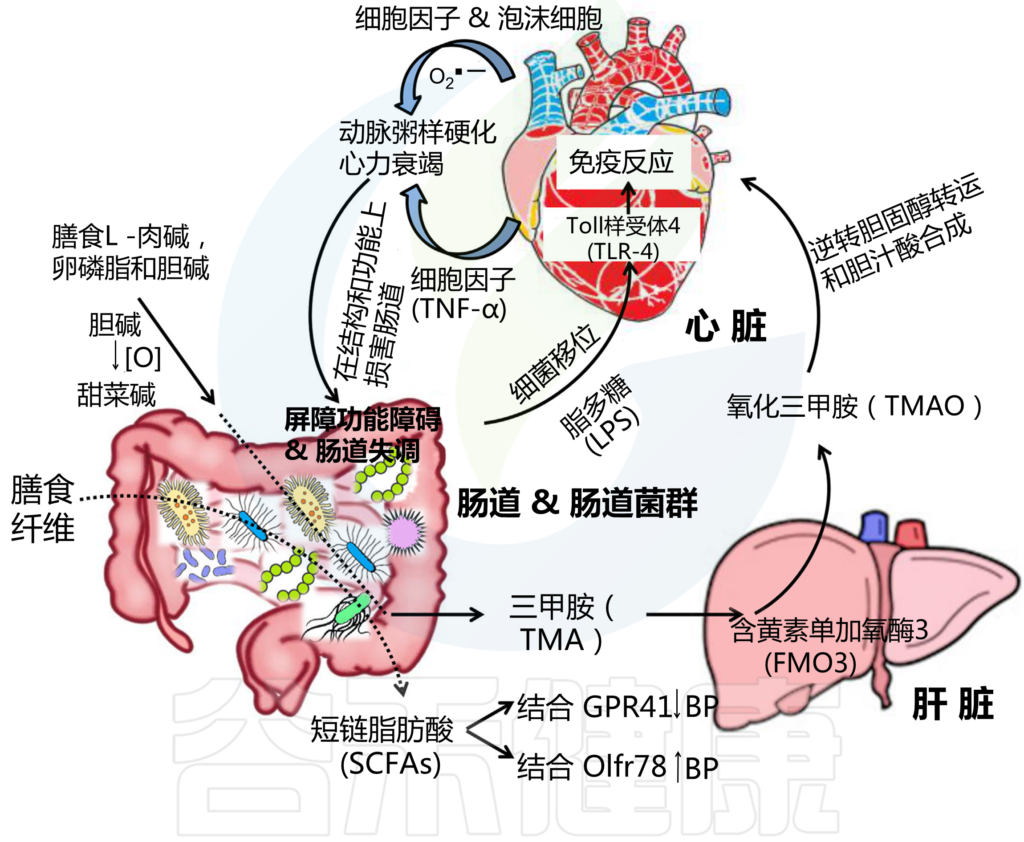
Ahlawat S,et al.,Lett Appl Microbiol. 2021
最近一项针对56名高血压前期(pHTN)、99名原发性高血压(HTN)患者和41名健康对照(HC)的研究表明,在pHTN和HTN两组中,产生短链脂肪酸的F. prausnitzii 和 Roseburia 均减少。
另一份报告提出了条件致病菌(Parabacteroides merdae, Klebsiella, Streptococcus)在高血压发病机制中的作用(表1)。
扩展阅读:认识肠道微生物及其与高血压的关系
总之,血压与肠道菌群的多样性、丰富度和均匀度密切相关,并受厚壁菌/拟杆菌比率的影响。
Ahlawat S,et al.,Lett Appl Microbiol. 2021
扩展阅读:与心血管疾病相关的肠道菌群代谢产物或毒素
最新 | 肠道微生物群与心血管疾病:机遇与挑战
微生物群与宿主之间的相互作用对维持内稳态很重要,但这种相互作用一旦受到干扰,就会成为许多慢性疾病的核心驱动因素。
目前随着对肠道菌群的了解逐步深入,我们开始了解它们的信号以及与人类健康和相关疾病的相关性。当然还有更多需要探索的问题,肠道菌群的改变是导致疾病的原因还是仅仅反映疾病状态,应该如何针对菌群作出精准干预等。
当我们真正开始理解微生物彼此之间的关系,及其与宿主之间复杂多变的进化和生态关系时,对疾病的机制理解就会越来越清晰,从而在菌群的基础上进行有效的干预措施。
主要参考文献:
Ahlawat S, Asha, Sharma KK. Gut-organ axis: a microbial outreach and networking. Lett Appl Microbiol. 2021 Jun;72(6):636-668. doi: 10.1111/lam.13333. Epub 2020 Jul 16. PMID: 32472555.
Yoo W, Zieba JK, Foegeding NJ, Torres TP, Shelton CD, Shealy NG, Byndloss AJ, Cevallos SA, Gertz E, Tiffany CR, Thomas JD, Litvak Y, Nguyen H, Olsan EE, Bennett BJ, Rathmell JC, Major AS, Bäumler AJ, Byndloss MX. High-fat diet-induced colonocyte dysfunction escalates microbiota-derived trimethylamine N-oxide. Science. 2021 Aug 13;373(6556):813-818. doi: 10.1126/science.aba3683. PMID: 34385401; PMCID: PMC8506909.
Rinninella E, Raoul P, Cintoni M, Franceschi F, Miggiano GAD, Gasbarrini A, Mele MC. What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases. Microorganisms. 2019 Jan 10;7(1):14. doi: 10.3390/microorganisms7010014. PMID: 30634578; PMCID: PMC6351938.
Parikh K, Antanaviciute A, Fawkner-Corbett D, Jagielowicz M, Aulicino A, Lagerholm C, Davis S, Kinchen J, Chen HH, Alham NK, Ashley N, Johnson E, Hublitz P, Bao L, Lukomska J, Andev RS, Björklund E, Kessler BM, Fischer R, Goldin R, Koohy H, Simmons A. Colonic epithelial cell diversity in health and inflammatory bowel disease. Nature. 2019 Mar;567(7746):49-55. doi: 10.1038/s41586-019-0992-y. Epub 2019 Feb 27. PMID: 30814735.
Lun H, Yang W, Zhao S, Jiang M, Xu M, Liu F, Wang Y. Altered gut microbiota and microbial biomarkers associated with chronic kidney disease. Microbiologyopen. 2019 Apr;8(4):e00678. doi: 10.1002/mbo3.678. Epub 2018 Aug 7. PMID: 30088332; PMCID: PMC6460263.
谷禾健康

现在经济飞速发展,随着生活条件改善,人们的寿命开始变长,对健康长寿的研究也逐渐开始增多。
然而寿命变长却不一定健康,越来越多人开始患上各种慢性疾病。
慢性疾病怎么来的?
首先从炎症开始。炎症其实是身体在与自身有害的物质(例如感染,毒素)作斗争来自愈的过程。当细胞要被破坏时,身体就会释放化学物质,从而触发免疫系统的反应。
当这种反应持续存在时,就会发生慢性炎症,身体处于持续的警觉状态。随着时间的流逝,慢性炎症可能会对组织和器官造成负面影响。于是各种疾病就开始了。
那慢性疾病为什么与肠道健康有关呢?
看过我们文章的朋友,大概已经开始有了这样的概念:许多疾病始于肠道。
因为免疫系统有很大一部分在肠道,具体来讲,这要涉及到肠道通透性的问题。
来自麻省总医院儿童医院腹腔研究和治疗中心主任Fasano博士和他的团队发现了zonulin蛋白(连蛋白),这为研究肠道通透性功能的新方法打开了大门,不仅因为它影响肠道,而且还影响了整个过程中炎症和自身免疫的作用。
除了基因组成和暴露于环境诱因外,还有三个引起慢性炎症性疾病的额外因素:
肠道通透性的不适当增加(可能受肠道菌群组成的影响);
负责耐受性免疫应答平衡的“超好战”免疫系统;
肠道菌群的组成及其对免疫系统的表观遗传影响宿主基因组的表达。
近十年来,人们开始越来越多关注到人类遗传学、肠道微生物组学和蛋白质组学,表明粘膜屏障功能的丧失,特别是胃肠道粘膜屏障功能的丧失,可能会严重影响抗原的运输,最终影响肠道微生物组和免疫系统之间密切的双向相互作用。
这种相互作用对宿主肠道免疫系统功能的形成有很大影响,并最终将遗传易感性转化为临床结果。这一观察导致了对慢性炎症性疾病流行的可能原因的重新审视,表明肠道通透性的关键致病作用。
临床前和临床研究表明,连蛋白家族是调节肠通透性的一组蛋白质,与多种慢性炎症性疾病有关,包括自身免疫性,感染性,代谢性和肿瘤性疾病。这些数据为多种慢性炎症性疾病提供了新的治疗靶点,其中连蛋白途径与它们的发病机理有关。
Fasano指出,根本没有足够的基因来解释众多慢性疾病,基因也不能解释疾病发作的时间。他说,要解决这些谜团,我们必须关注微生物组,因为“决定个人临床命运的是个体之间的相互作用和我们所生活的环境。”
除了微生物本身,肠粘膜的状况也起着重要作用。Fasano解释说:“尽管这种巨大的粘膜界面(200 m2)看不见,但它通过与周围环境中各种因素的动态相互作用而起着关键作用,这些因素包括微生物,营养素,污染物和其他物质。”
虽然过去人们认为细胞内紧密连接是静态且不可渗透的,但我们现在知道并非如此。正如Fasano所解释的,连蛋白是肠道渗透性的强大调节剂。然而,尽管连蛋白是肠道通透性的生物标志物,并在许多慢性炎性疾病中起着致病作用,但并非所有慢性炎症性疾病都是由肠道渗漏引起的。
在他的综述中,一篇题为“Zonulin,一种上皮和内皮屏障功能的调节因子,及其在慢性炎症疾病中的作用”的文章,详细描述了“导致慢性炎症疾病的连锁反应”。
在正常情况下,你的肠道会保持健康的内稳态,当遇到抗原时,不会发生过度的免疫反应。在图中第2点,肠道菌群失调(即肠道菌群的数量和多样性不平衡)正在形成,导致连蛋白的过量生产,从而使肠道内壁更容易渗透。
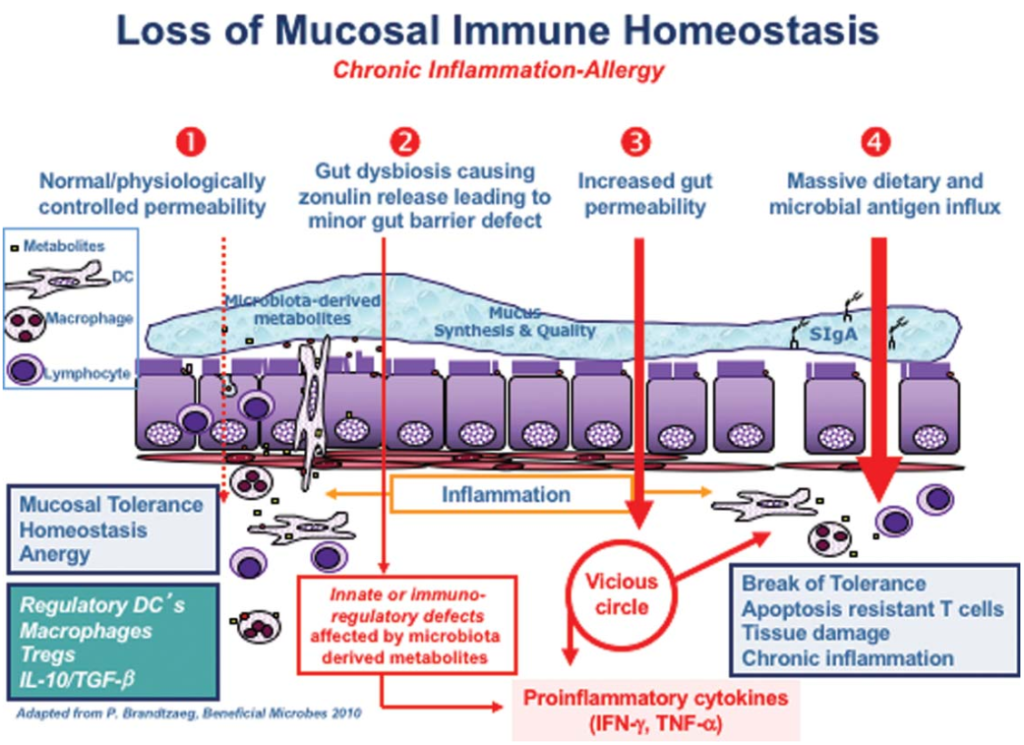
Sturgeon C et al., Tissue Barriers, 2016
两个最强大的触发连蛋白释放是细菌过度生长和谷蛋白。连蛋白是对坏细菌的反应产生的——它通过打开紧密连接帮助细菌排出体外,所以细菌过度生长是有意义的。但是为什么它对谷蛋白有反应呢?
有趣的是,连蛋白途径将谷蛋白误解为微生物的潜在有害成分。这就是为什么谷蛋白会触发连蛋白的释放。虽然Fasano没有提到,除草剂草甘膦也触发连蛋白,而且是谷蛋白10倍的效力!
随后的通透性允许微生物群衍生的抗原和内毒素从管腔迁移到固有层(肠粘膜的结缔组织),从而引发炎症。
随着过程的继续恶化(上图中第3阶段),适应性免疫反应开始,触发促炎性细胞因子的产生,包括干扰素γ(IFN-γ)和肿瘤坏死因子α(TNF-α)。这些细胞因子使通透性进一步恶化,从而形成恶性循环。
最终(第4阶段),粘膜耐受性被完全破坏,导致慢性炎症性疾病的发作。
最终出现的特定的慢性炎症性疾病,部分取决于你的基因组成,部分取决于你所接触的类型以及部分取决于肠道菌群组成。
除了遗传易感性和环境触发因素外,各种慢性炎症性疾病的发病机理还涉及到相互影响的肠道通透性/ Ag转运,免疫激活以及肠道菌群的组成/功能的变化。
连蛋白是上皮和内皮屏障功能的调节剂,肠营养不良可能导致连蛋白的释放,从而导致腔内物质穿过上皮屏障的释放,导致促炎性细胞因子的释放,而促炎性细胞因子本身会导致通透性增加,形成恶性循环,从而导致大量的饮食和微生物Ag大量涌入,触发了T细胞的活化。
根据宿主的遗传组成,活化的T细胞可能保留在胃肠道内,导致肠道慢性炎症性疾病或迁移到几个不同的器官以引起全身性慢性炎症性疾病。”
与zonulin通路失调相关的慢性炎症疾病包括:
自身免疫性疾病如腹腔疾病、1型糖尿病、炎症性肠病、多发性硬化症和强直性脊柱炎
代谢紊乱如肥胖、胰岛素抵抗、非酒精性脂肪肝、妊娠期糖尿病、高脂血症和2型糖尿病
肠道疾病如肠易激综合征、非腹腔麸质敏感性和环境肠道功能障碍
神经炎症性疾病如自闭症谱系障碍、精神分裂症、重度抑郁症和慢性疲劳/肌痛性脑脊髓炎
癌症脑癌和肝癌
2018年,发现的肠道菌群实际控制肝脏中的抗肿瘤免疫应答,并且抗生素可以改变免疫细胞的组成在肝脏中触发肿瘤生长。
哈佛医学院的研究人员已经确定了肠道微生物的特定种群,可以调节局部和系统的免疫反应来抵御病毒入侵。
某些肠道细菌也会促进炎症,炎症是几乎所有癌症的潜在因素,而其他细菌则会抑制炎症。某些肠道细菌的存在甚至可以增强患者对抗癌药物的反应。
肠道菌群提高癌症治疗效果的一种方法:
激活你的免疫系统,让它更有效地发挥作用。
研究人员发现,当这些特定的微生物缺失时,某些抗癌药物可能根本不起作用。
最近的研究表明,肠道细菌也参与了抗病毒防御。
哈佛医学院的研究人员第一次确定了特定的肠道微生物群,这些菌群调节局部和全身免疫反应,抵御病毒侵略者。这项工作确定了一组肠道微生物,以及其中的一个特定物种,它能使免疫细胞释放出抗病毒化学物质——1型干扰素。
研究人员进一步确定了许多肠道细菌共有的确切分子,它开启了免疫保护级联反应。研究人员指出,这种分子并不难分离,可能成为增强人类抗病毒免疫的药物的基础。”
虽然这些发现还需要重复和证实,但它们指出了一种可能性:你也许可以通过在肠道中重新播种脆弱拟杆菌和拟杆菌科的其他细菌,来增强你的抗病毒免疫。
这些细菌启动一个信号级联,诱导干扰素的释放,通过刺激免疫细胞攻击病毒,并导致病毒感染的细胞自我毁灭来保护免受病毒入侵。
具体来说,驻留在细菌表面的一个分子通过激活所谓的TLR4-TRIF信号通路触发干扰素的释放,这种细菌分子刺激免疫信号通路,该通路由9种toll样受体(TLR)之一启动,TLR是先天免疫系统的一部分。
最近的研究还强调了维生素D在肠道健康和全身自身免疫中的作用。一篇综述文章发表于《免疫学前沿》中:
自身免疫性疾病往往会导致维生素D缺乏症,这会改变微生物组和肠道上皮屏障的完整性。
这篇综述总结了肠道细菌对免疫系统的影响,探讨了自身免疫疾病研究中出现的微生物模式,并讨论了维生素D缺乏症如何通过其对肠道屏障功能,菌群组成的影响而有助于自身免疫,和/或对免疫反应的直接影响。
维生素D对免疫系统具有多种直接和间接的调节作用,包括促进调节性T细胞(Tregs),抑制Th1和Th17细胞的分化,损害B细胞的发育和功能,减少单核细胞的活化和刺激来自免疫细胞的抗菌肽。
也就是说,维生素D与自身免疫之间的关系很复杂。除了免疫抑制,维生素D还通过影响菌群组成和肠道屏障的方式改善自身免疫性疾病。
该文章引用了一些研究,这些研究表明维生素D会改变肠道微生物组的组成。一般而言,维生素D缺乏倾向于增加拟杆菌和变形杆菌,而更高的维生素D摄入量则倾向于增加普氏杆菌并减少某些类型的变形杆菌和厚壁菌。
虽然关于维生素D对肠道细菌的影响的研究仍很薄弱,尤其是在患有自身免疫性疾病的患者中,但已知维生素D缺乏症和自身免疫性疾病是合并症,通常建议这些患者补充维生素D。
众所周知,维生素D支持肠道和免疫细胞的防御。维生素D是维持紧密连接所需的关键成分之一。
肠上皮与外部环境不断相互作用。上皮表面适当的屏障完整性和抗菌功能对于维持内稳态和防止特定微生物物种的入侵或过度定殖至关重要。
健康的肠上皮和完整的粘液层对于防止病原性生物入侵至关重要,而维生素D有助于维持这种屏障功能。多项研究发现,维生素D3 / VDR信号调节紧密连接蛋白的数量和分布。
作为一种可使离子进入肠腔的“泄漏”蛋白,在功能性维生素D缺乏症的情况下,claudin-2表达可能会导致结肠炎。
维生素D上调抗菌肽的mRNA和蛋白质表达,包括抗菌肽,防御素和溶菌酶。
抗菌肽主要由肠道Paneth细胞分泌,是微生物组组成的重要介质。
防御素由上皮细胞,Paneth细胞和免疫细胞分泌,并且是肠道固有免疫反应的重要组成部分。
维生素D缺乏症可能通过以下方式影响微生物组和免疫系统,从而导致自身免疫疾病:
1 维生素D缺乏或补充会改变微生物组,细菌丰度或组成的操纵会影响疾病的表现。
2 由于饮食不足而缺乏维生素D信号传导会损害肠道的物理和功能屏障完整性,从而使细菌之间的相互作用刺激或抑制免疫反应。
3 如果缺乏维生素D,先天免疫防御能力可能会受到损害。
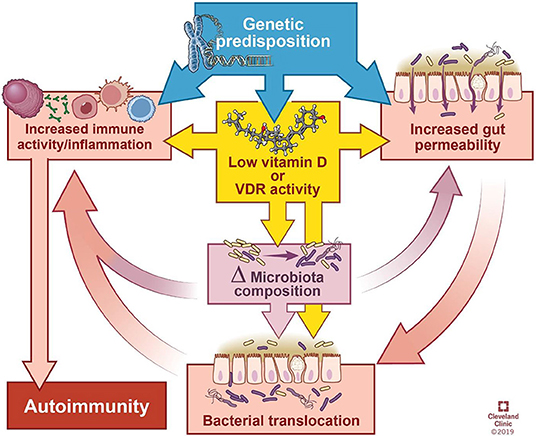
Yamamoto Erin A et al.,Front Immunol, 2019
以上所有,我们可以看到,优化肠道菌群和维生素D水平对于保持健康至关重要。通过肠道菌群检测,查看自己的肠道菌群的构成,适当补充益生菌,维生素D将有助于避免肠道泄漏。
对肠道微生物组产生重大影响的最简单,最有效和最便宜的方法:定期食用发酵食品。
健康的选择包括酸奶,纳豆和各种发酵蔬菜。
避免破坏或杀死微生物组,其中包括:
如果可以的话,尽量避免抗生素。抗生素杀菌一视同仁,不管好坏。
尽量少吃常规饲养的肉类和其他动物产品,因为这些可能会被喂食低剂量的抗生素。
尽量避免经基因工程处理和/或草甘膦处理的谷物。
少吃加工食品(由于过量的糖会滋生病原菌)
相关阅读:
参考文献:
Krautkramer KA, Kreznar JH, Romano KA, Vivas EI, Barrett-Wilt GA, Rabaglia ME, Keller MP, Attie AD, Rey FE, Denu JM. Diet-Microbiota Interactions Mediate Global Epigenetic Programming in Multiple Host Tissues. Mol Cell. 2016 Dec 1;64(5):982-992. doi: 10.1016/j.molcel.2016.10.025. Epub 2016 Nov 23. PMID: 27889451; PMCID: PMC5227652.
Guglielmi Giorgia,How gut microbes are joining the fight against cancer.[J] .Nature, 2018, 557: 482-484.
Larsen Nadja,Vogensen Finn K,van den Berg Frans W J et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults.[J] .PLoS One, 2010, 5: e9085.
Sturgeon Craig,Fasano Alessio,Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases.[J] .Tissue Barriers, 2016, 4: e1251384.
Yamamoto Erin A,Jørgensen Trine N,Relationships Between Vitamin D, Gut Microbiome, and Systemic Autoimmunity.[J] .Front Immunol, 2019, 10: 3141.