-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

癌症——这个困扰人类几个世纪的疾病,至今仍是全球死亡率最高的疾病之一。
国际癌症研究机构调查显示,2022年,全球有超过 1900 万新诊断的癌症病例和近1000 万癌症死亡病例,无数家庭因此经历痛苦。
癌症是一种复杂的多步骤慢性疾病,由活跃分裂细胞在 DNA 复制过程中获得的自发突变积累而成,环境也对癌症风险产生了相当大的影响。
传统的癌症治疗方法——手术切除、放射治疗和化学疗法,虽然在过去几十年中挽救了无数患者的生命,但它们的局限性也日益明显:手术无法完全清除微小转移灶;放疗和化疗的副作用严重,往往让患者雪上加霜;而且,即便是相同类型、相同分期的癌症患者,对同一治疗方案的反应也可能截然不同。
传统的癌症生物学理论难以完全解释这些差异。
这些问题引发了研究人员的深思:也许我们需要超越单纯关注癌细胞本身,将目光投向更广阔的“宿主环境”——患者的整体生理状态、免疫系统功能,以及体内的微生态系统。
从结直肠癌到肝癌,从乳腺癌到胰腺癌,微生物的”指纹”无处不在,它们通过复杂的代谢网络和免疫调节机制,参与肿瘤的发生、发展、转移和治疗反应全过程。
例如,肠道微生物群与宿主黏膜表面之间存在相互作用,后者在肿瘤发生中起着主要作用。微生物可能通过在胃黏膜中诱导氧化应激来损伤 DNA,增强上皮炎症并破坏黏膜屏障,从而增加肿瘤发生风险。
本文我们主要来了解微生物与癌症之间错综复杂的关系,探讨微生物如何成为癌症研究的新焦点,以及这一领域如何有可能彻底改变我们对癌症的认知和治疗方法。
随着年龄增长,我们的身体就像一台逐渐磨损的精密机器,各个部件的功能开始下滑。这种时间依赖性的细胞和生理功能退化过程,被称为”衰老“,它是多种重大疾病的主要风险因素之一,也包括癌症。
衰老的基本特征
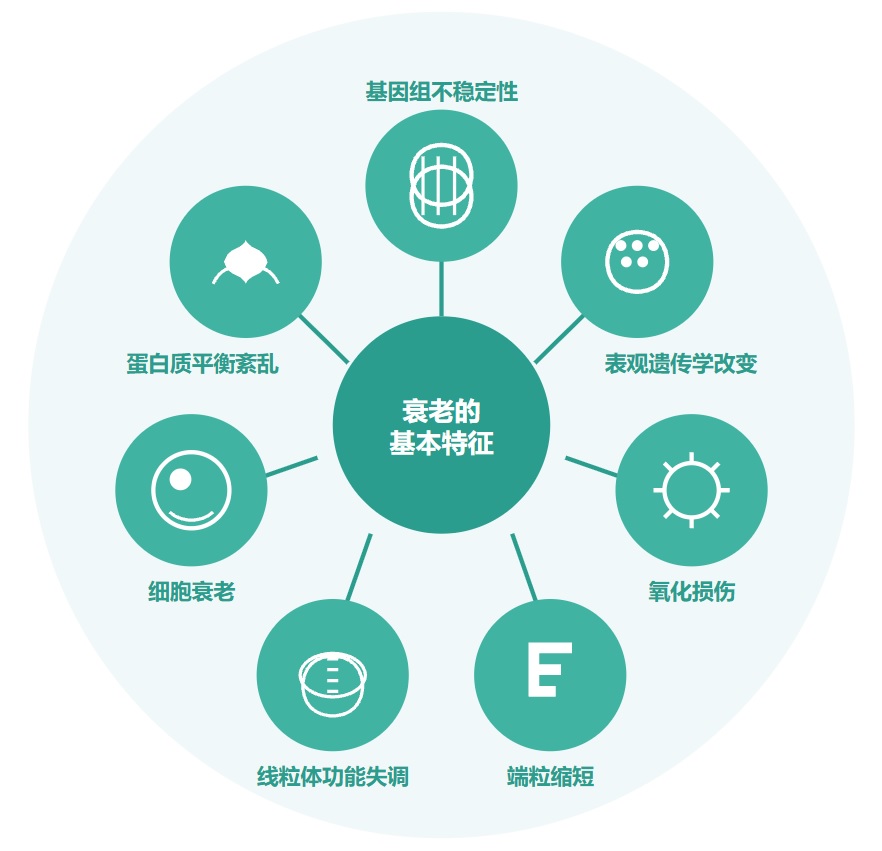
有人提出,尽管存在显著的个体间异质性和生活方式、饮食和治疗等外部因素的影响,但人类的肠道微生物组成在衰老过程中会逐渐变化。
多项报告表明,与有益菌相比,微生态失调在衰老过程中会增加,并导致促炎共生菌的大量存在,这些菌的富集,可以滋养生理性炎症。
对人类老龄化队列的研究表明,包括 Akkermansia、Anaerotruncus、Eggerthella、Bilophila 在内的一组属的丰度随着年龄的增长而显著增加,而 Faecalibacterium、Prevotella、Bacteroides 的丰度在老年人中相对较低。
衰老可能导致癌症,癌症治疗可能导致过早衰老

doi.org/10.1186/s12935-025-03787-x
微生物代谢物如何影响细胞衰老和健康?
短链脂肪酸,包括丁酸,可以帮助减缓细胞衰老。它们通过抑制组蛋白脱乙酰化酶来实现这一点,这调节代谢过程,增加胰岛素分泌,并调节免疫反应。
相比之下,致病菌的代谢产物,如脂多糖(LPS),通过加速炎症和增加氧化应激来增强细胞衰老,这是衰老的一个标志。
此外,铜绿假单胞菌和幽门螺杆菌产生的毒素会导致宿主 DNA 损伤并增加氧化应激。
因此,这加剧了 DNA 损伤反应、基因组不稳定性和细胞衰老。
菌群失调和细菌毒素促进衰老人群中衰老细胞的积累、DNA 损伤和促炎微环境的形成。这导致代谢紊乱,并创造一个促进肿瘤细胞生存和增殖的 肿瘤微环境,最终导致癌症。
癌症如何开始?
癌症起源于普通细胞中的遗传变化。当细胞DNA受到致癌物损伤时,会触发一系列变化。这些变化可能不会立即表现出来,但会逐渐积累。关键的基因突变会赋予细胞生长优势和抵抗死亡的能力,导致异常增殖,最终形成肿瘤。

癌细胞有什么特别之处?
癌细胞最显著的特征之一是它们的代谢方式发生了改变,也就是“代谢重编程”。正常细胞和癌细胞使用能量的方式完全不同。癌细胞即使在氧气充足的环境中也会进行糖酵解,这种现象称为”有氧糖酵解“。
此外,它们还进行大分子合成、维持氧化还原平衡,谷氨酰胺分解代谢,所有这些都有助于细胞快速增殖和生长。所有这些都有助于癌细胞快速分裂、扩散并侵入身体不同部位。
一个具体例子是D-2-羟基戊二酸的累积,这个代谢物抑制细胞分化,加速癌症发展。这是由于异柠檬酸脱氢酶-1/2 的连续突变。这表明通过抑制分化直接促进癌症的发生和进一步发展。
一个肿瘤内部并非完全一致,不同区域的细胞可能有不同的代谢特性,这种现象称为肿瘤异质性,这使得癌症治疗更加复杂。

肿瘤微环境:癌症的”生态系统”
肿瘤微环境(TME)是另一个在癌症发生和进展中发挥关键作用的组成部分。
肿瘤微环境是围绕癌细胞形成的高度组织化区域,就像一个小型社会,其中癌细胞只是众居民之一。其他成员如下图:

这个微环境如何影响癌症发展?
癌细胞能够改造邻居,使整个环境有利于肿瘤生长。
比如,癌细胞怎样获得养分和氧气?它们促使血管内皮细胞形成新血管。肿瘤相关巨噬细胞(TAMs)被招募后,会分泌生长因子和细胞因子,刺激血管生成和肿瘤侵袭。
癌细胞甚至能重新编程癌细胞相关成纤维细胞(CAFs),使它们分泌ECM蛋白和血管生成因子(如VEGF-A)。ECM则作为信号分子的储存库,增强细胞间通讯、粘附和迁移。
因此,TME 的不同组成部分通过影响各种细胞过程,有助于癌症的发生、进展和迁移。更深入地了解调节癌症进展和可塑性的分子机制,有助于开发精确和针对性的癌症治疗疗法,并预防复发。
微生物如何影响癌症发展?
最直接的联系是某些微生物直接致癌的能力:
动物研究显示,微生物可促进多种癌症的发展,包括:

doi.org/10.1186/s12935-025-03787-x
微生物群如何变化?
高通量DNA测序揭示了癌症相关的微生物群落变化:
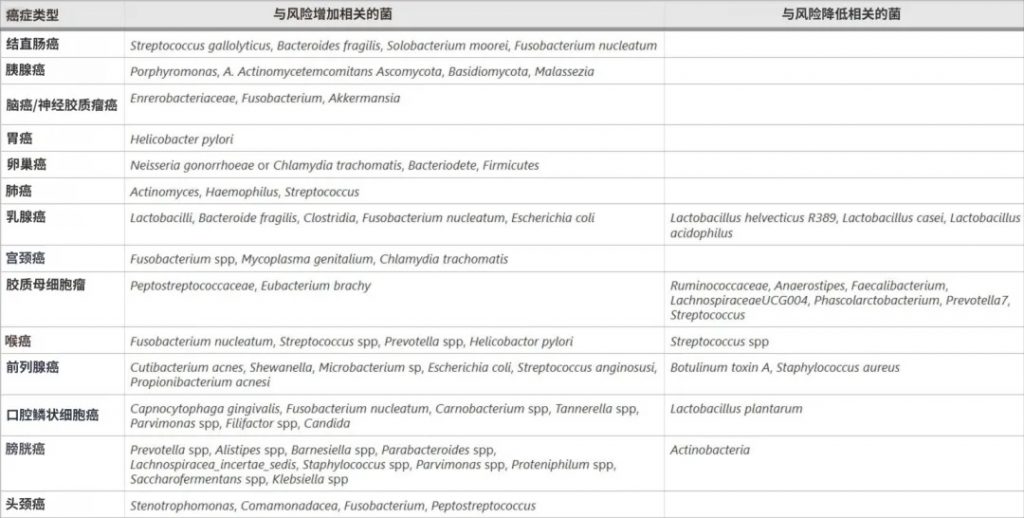
doi.org/10.1186/s12935-025-03787-x
微生物如何促进癌症?
微生物可能通过多种机制促进肿瘤发生:
了解微生物与癌症的关系,可能帮助我们开发新的癌症预防策略、提高治疗效果,甚至预测哪些患者可能对特定治疗产生耐药性。
实际上,微生物群可以同时扮演促进肿瘤发展和抑制肿瘤生长的双重角色,这取决于肿瘤进展的阶段以及微生物群的功能和分布位置,那么,哪些微生物会致癌?又是如何作用的?
微生物的促癌作用
结直肠癌
脆弱拟杆菌、大肠杆菌、Streptococcus gallolyticus、Enterococcus faecalis、Fusobacterium nucleatum、Parvimonas micra等在结直肠癌患者肠道中大量存在,通过分泌短链脂肪酸等代谢物、DNA甲基化、组蛋白修饰等表观遗传机制影响肿瘤形成。
胰腺癌
牙龈卟啉单胞菌、奈瑟菌、放线菌、链球菌、双歧杆菌、拟杆菌、梭杆菌等与胰腺癌的发生有关,它们通过引起炎症和免疫抑制影响肿瘤生长。
口腔微生物群和幽门螺杆菌通过诱导炎症而成为胰腺癌症的危险因素。
乳腺癌
对人类乳腺癌症组织16S rRNA基因序列的分析显示,与早期乳腺肿瘤相比,晚期乳腺肿瘤中卟啉单胞菌、Lacibacter、Ezakiella、Fusobacterium的丰度更高。
具核梭杆菌(Fusobacterium nucleanum)和脆弱拟杆菌通过定植于乳腺肿瘤和促进癌症细胞的自我更新来加重乳腺癌症的生长和转移。
脑癌
Enterobacteriaceae、Fusobacterium、 Akkermansia是脑癌患者肠道中的主要菌群,它们可能通过免疫抑制、激活炎症、限制细胞死亡以及促进血管生成和侵袭性来影响胶质瘤。
微生物虽然不能穿过血脑屏障,但能释放具有穿透能力的细胞外囊泡,这些囊泡有能力穿过屏障进入大脑。
其他
其他癌症相关的微生物还包括:
这些菌在相应的癌症中大量存在,并通过改变代谢和免疫反应、增强炎症和毒性以及改变信号通路来提高肿瘤易感性。
微生物的抗癌作用
一些微生物如乳杆菌、双歧杆菌、Faecalibaculum rodentium、Streptococcus thermophiles等具有抗肿瘤特性,它们主要通过以下机制抑制肿瘤生长:
调节免疫系统
一组共生肠道细菌,如Paraprevotella xylaniphila、Bacteroides dorei、 Parabacteroides distasonis,可以诱导 CD8 T 细胞产生 IFNγ,抵抗单核细胞增生李斯特菌感染,并增强免疫检查点抑制剂在小鼠体内的疗效。
产生抑制性毒素
其他细菌,如铜绿假单胞菌、鼠伤寒沙门氏菌、艰难梭菌,分别在黑色素瘤、胰腺癌和乳腺癌癌症中表现出抗肿瘤特性。它们通过产生抑制增殖、使细胞停滞在G1-S期并诱导细胞凋亡的毒素来实现这一点,从而促进抗癌活性。
嗜热链球菌还抑制细胞增殖,引发细胞周期阻滞,增强体外结直肠细胞的凋亡,并减少结直肠癌异种移植物的生长。此外,肠道微生物群通过抑制结肠lncRNA Snhg9和上调p53表达来限制小鼠结直肠癌癌症的进展。
产生有益代谢物
– 微生物本身及其毒素能抗癌
科利毒素:赋予宿主抗肿瘤免疫力。
产气荚膜梭菌毒素(CPE)能识别乳腺癌、前列腺癌等细胞表面高表达的claudin-3/4蛋白,与这些蛋白结合后直接引发癌细胞死亡。
Akkermansia muciniphila在肝癌小鼠模型中减少免疫抑制细胞(单核MDSC、M2巨噬细胞),同时增强PD-1免疫治疗的疗效。
– 微生物代谢产物:短链脂肪酸抗癌
丁酸钠,在非小细胞肺癌中消除肿瘤细胞生长,诱导细胞周期阻滞,促进细胞凋亡,并改变免疫反应。
异丁酸,通过减少肿瘤体积来提高癌症结肠癌小鼠模型中抗PD-1免疫疗法的效率。
色氨酸,是人体必需氨基酸,其代谢途径包括:
拟杆菌、Clostridium sporogenes、 Eubacterium、Ruminococcus gnavus等菌群通过吲哚途径产生吲哚-3-乳酸、吲哚-3-丙酸、吲哚-3-乙酸等代谢物,这些物质既能抑制肿瘤免疫逃逸,也可能促进癌细胞生长,具体作用取决于代谢物种类和浓度。
吲哚代谢物可改善化疗和免疫治疗效果,但菌群失衡可能导致色氨酸代谢紊乱,反而加速癌症进展。
微生物与肿瘤微环境的相互作用
具核梭杆菌的Fap2蛋白可与抑制性受体TIGIT结合,抑制NK细胞和T细胞清除肿瘤的能力。
幽门螺杆菌与微环境中的巨噬细胞互动,诱导其极化为M2样巨噬细胞,促进胃癌进展。
肿瘤内微生物也参与肿瘤生成和进展,例如:
也有报道称,一些瘤内微生物可以增强抗肿瘤免疫反应,从而抑制肿瘤进展。
了解微生物在癌症中的双重作用,可能为开发新型抗癌疗法提供思路,包括调节微生物群落和利用微生物产物来增强现有治疗方法的效果。
转移是癌症细胞的一个关键标志,大多数癌症类型的晚期通常以转移开始为特征。
转移,是指癌症细胞通过血液循环从原发肿瘤转移到其他器官的继发部位。它涉及上皮间质转化(EMT)、迁移、侵袭、外渗和继发部位的定植。
转移过程包括哪些步骤,癌细胞面临哪些挑战?
这个过程对癌细胞来说充满了物理和化学挑战,包括需要穿越坚硬的细胞外基质、承受液体剪切应力、逃避免疫监视,并最终在可能与原发部位环境截然不同的部位建立殖民地。
微生物如何协助癌细胞转移?
– 乳腺癌:细菌随转移扩散
– 具核梭杆菌的多重促转移机制
有核梭杆菌可诱导乳腺癌、结直肠癌、喉癌的转移。它是口腔中常见的革兰氏阴性菌,通常与牙周病、口臭有关。
结直肠癌

doi.org/10.1186/s12935-025-03787-x
喉癌
– 抗生素治疗的启示
当然,微生物并不总是促进转移,已知许多微生物群也能抑制转移,从而为防止癌症进展提供了一种自然的方法。
微生物如何阻止转移?
– 抑制转移的菌群代谢物
– 调节肿瘤微环境
膀胱癌中的菌群关联:
– 抗癌微生物的鉴定
前列腺癌数据分析:
肿瘤内微生物种类在转移中的重要性在其他癌症中也得到了证实(下表)。

doi.org/10.1186/s12935-025-03787-x
这些研究表明,癌症中微生物的特异性靶向可以抑制肿瘤的转移,从而成为抗癌联合治疗的重要组成部分。未来需揭示菌群与宿主互作的具体机制,探索“以菌治癌”的精准策略,为癌症治疗提供新突破口。
微生物不仅参与癌症的发生和发展,还可能影响癌症治疗的效果。为什么有些患者对治疗产生耐药性?微生物可能是其中一个关键因素。
微生物如何影响抗癌疗效?
微生物群主要通过两种方式来影响抗癌疗效:
这样一来,药物的疗效和对癌细胞的毒性都会发生变化。
以环磷酰胺(CTX)为例,它是一种常用的抗癌药,用于治疗各种血液系统恶性肿瘤和实体瘤。
环磷酰胺不仅能杀伤癌细胞,还能调节肠道微生物的组成。它会促使一些特定的革兰氏阳性细菌从肠道转移到次级淋巴器官,而这些细菌到达那里后,会激活致病性 T 辅助细胞,从而增强环磷酰胺的抗癌活性。
但如果通过某种方式消除肠道微生物,比如用无菌小鼠或给小鼠喂食抗生素,特别是针对Barnesiella intestinihominis、Enterococcus hirae等特定菌群时,就会发现一个很棘手的问题:环磷酰胺的抗癌效果会变差,耐药性出现了。这说明肠道微生物群在化疗耐药性中扮演着重要的角色。
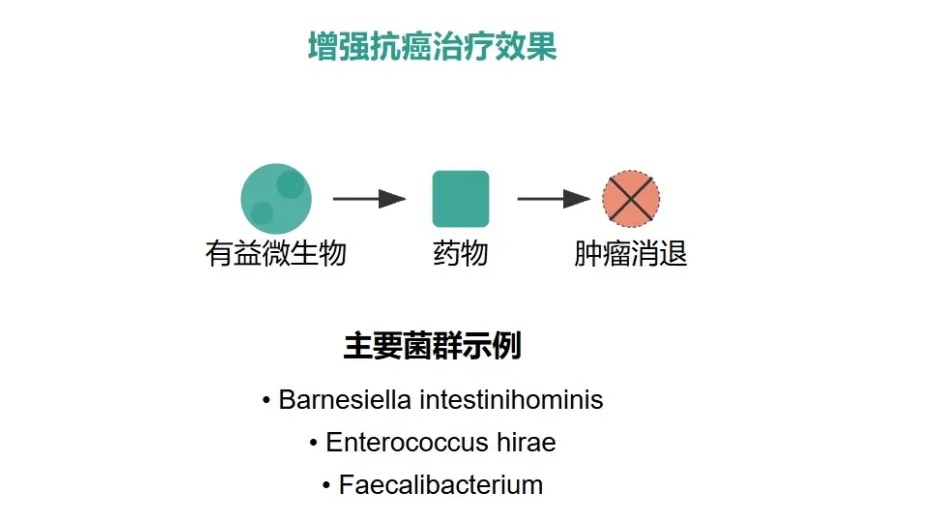
不过,这里又出现了一个违反我们直觉的情况。抗生素虽然可以杀菌,但用多了反而会导致细菌耐药性增加。
研究还在不断深入,科学家们发现:
微生物群调节有助于提高癌症治疗的效率,并通过改变代谢和免疫反应促进更好的预后。
比如,García-González 等人做了一项很有意思的研究,大肠杆菌可改变线虫体内代谢通路,增强5-氟尿嘧啶(FUDR)的疗效。
同样,在黑色素瘤患者的治疗中,研究发现粪杆菌Faecalibacterium能帮助增加免疫细胞和抗原呈递,从而让细胞毒性 CD8 + T 细胞在肿瘤床的浸润程度更高,引发大规模的免疫反应,这对抗 PD-1治疗很有帮助。
基于这些发现,有人提出一个大胆的想法:
肠道微生物群也可以用作生物标志物,来预测患者化疗和免疫治疗的治疗反应和疗效。
肝癌患者的肠道菌群失衡指数(Ddys) 反映了HCC患者粪便样本中的微生物干扰,可用于预测治疗效果。
失衡指数是根据HCC患者粪便样本中有益菌与有害菌的相对丰度计算的。
工程菌成为抗癌新武器
直接杀伤癌细胞:
靶向递送药物:
激活免疫:
现有研究揭示了微生物群在癌症治疗中的多重价值:增强药效、预测疗效、直接作为治疗载体。需深入解析不同癌症特异的菌群特征,明确特定菌种的作用机制,同时解决工程菌的生物安全性问题。
化疗不仅直接作用于肿瘤,同时也会对人体内的微生物群落产生显著影响。肠道微生物在应对化疗时,会通过代谢和免疫调节来影响化疗的疗效和毒性。
化疗如何破坏肠道菌群平衡?
化疗不仅攻击癌细胞,还会显著扰乱肠道微生物的组成。例如,在肠道中,化疗可能会破坏黏液层,使部分肠道微生物能够穿透黏膜层,引发免疫反应。
在结直肠癌患者中,化疗会降低肠道菌群的多样性,这种变化可能反向影响治疗效果——菌群结构越失衡,化疗耐药风险可能越高。
菌群网络的重构:竞争还是合作?
梭杆菌、拟杆菌、粪杆菌分别与肿瘤标志物CEA、CA724、CA242相关,但它们的丰度不受不同化疗阶段的影响。这提示特定菌群可能成为化疗反应的独立预测指标。
注:CEA是一种糖蛋白,最初在胚胎组织和结肠癌组织中发现。作为最早被应用于临床的肿瘤标志物之一,CEA主要用于消化系统肿瘤的辅助诊断和监测。
CA724是一种高分子量糖蛋白,是胃癌较为特异的肿瘤标志物。
CA242是一种新型的消化系统肿瘤标志物,主要用于胰腺癌和胆道系统肿瘤的辅助诊断。
菌群如何“对抗”化疗药物?
某些细菌通过代谢转化直接削弱药物活性:
菌群失衡是否会加剧化疗副作用?
5-氟尿嘧啶(5-FU)为例
5-氟尿嘧啶用于治疗乳腺癌、结直肠癌、胃癌、胰腺癌、胃癌等。其作用方式涉及DNA损伤,导致细胞凋亡或RNA合成抑制。
菌群也能增强化疗效果吗?
奥沙利铂和丁酸盐为例
奥沙利铂是晚期结直肠癌患者的一线化疗药物。
研究表明,肠道微生物产生的代谢物丁酸盐能增强奥沙利铂的抗癌效果。
丁酸盐通过依赖ID2的方式激活CD8 + T细胞。在结直肠癌患者中,对奥沙利铂有反应的患者血清丁酸盐水平高于无反应患者。这表明,肠道微生物产生的丁酸盐可能是决定患者对奥沙利铂反应的关键因素。
临床转化方向
预测性生物标志物
精准调控策略
化疗与肠道菌群存在双向影响:药物破坏菌群平衡,菌群则通过代谢和免疫调控反作用于药物疗效。未来研究需结合菌群检测,在分子机制与临床干预之间架起桥梁,最终实现精准治疗策略。
多项研究表明,放射治疗和微生物群之间存在相互交织的关系。虽然放射治疗可以杀死有益的微生物群,但某些微生物群也可以通过影响患者的免疫系统来提高放射治疗的敏感性。
例如,口腔中的具核梭杆菌会被转移到结直肠肿瘤部位,从而降低放疗的治疗效果。
而甲硝唑是一种针对具核梭杆菌的抗生素,研究发现,在结直肠癌小鼠模型中,甲硝唑可以作为一种放疗增敏剂,提高放疗的效果。
微生物群导致放疗抵抗
丁酸盐在肠道健康中通常被认为有益,为何在放疗中反而有害?
由Lachnospiraceae合成的丁酸盐与放疗抵抗有关
细菌和真菌对放疗的影响相反
小鼠模型(黑色素瘤、乳腺癌)研究发现:
关键分子:免疫受体Dectin-1(感知真菌感染)高表达的乳腺癌患者生存率较差。抑制Dectin-1可提升放疗疗效。
临床转化方向
精准菌群干预:
免疫微环境重塑:
传统癌症治疗方法存在很多局限性,例如对正常细胞的附带损伤、产生治疗耐药性的可能性以及无法完全穿透肿瘤等。因此,迫切需要开发新的、更好的癌症治疗方法。有文献表明,对癌症患者的肠道微生物群进行干预可以增强当前抗癌药物的疗效,如化疗和免疫疗法。
微生物群提高各种肿瘤免疫疗法的效率
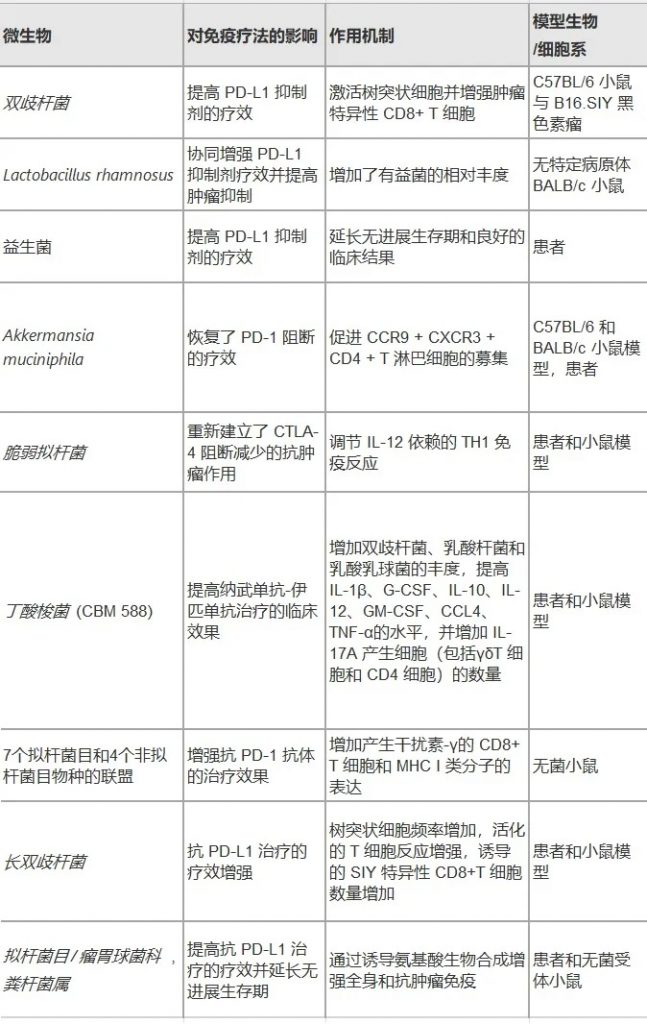
doi.org/10.1186/s12935-025-03787-x
细菌疗法
早在1868年,William Coley发现细菌感染可导致肿瘤消退,开创了细菌疗法的先河。现代研究揭示了细菌靶向肿瘤的独特机制:
研究人员改造了专性厌氧鼠伤寒沙门氏菌菌株YB1,并通过在神经母细胞瘤小鼠模型的肿瘤核心注射这种修饰的细菌观察到对肿瘤生长的抑制。
重组减毒沙门氏菌菌株SL7207被用作在黑色素瘤小鼠模型中递送工程肿瘤疫苗的载体。活细菌也可以与纳米粒子结合,形成有效的药物递送系统。
挑战:
细菌介导的抗癌疗法带来了一些挑战,包括半衰期短、DNA不稳定性和微生物的内在致病潜力。
基因工程有助于删除致病菌株的一些毒力基因,从而可以控制其抗肿瘤活性、特异性和定植。
目前,一些临床试验正在确定功能化鼠伤寒沙门氏菌菌株的效果。这些菌株要么通过各种遗传技术进行工程改造,要么通过纳米粒子或其他试剂进行表面修饰,以显示出所需的肿瘤靶向和定植。
粪菌移植 (FMT)
最近的研究表明,使用FMT重塑微生物群失调可以潜在地抑制癌症进展,特别是结直肠癌。
结直肠癌(CRC)
移植健康小鼠粪便至CRC模型,逆转菌群失衡,增加CD8+ T细胞浸润,减少促炎因子(IL-6、IL-17),抗炎细胞因子IL-10增加,抑制肿瘤进展。
临床试验进展

注:部分试验中FMT导致腹泻等副作用,提示需优化供体筛选。
宏基因组分析显示,在反应者中,FMT后Prevotella copri、Ruminoccocaceae、Eubacterium丰富。此外,与非反应者相比,反应者在FMT后一个月的粪便样本在小鼠模型中抑制肿瘤生长的能力更强。
涉及粪便微生物移植的临床试验

doi.org/10.1186/s12935-025-03787-x
关于 FMT的研究我们之前也写过,详见:
益生菌
益生菌如何帮助对抗癌症?
最近的一项队列研究中,发现益生菌的低等和中等摄入量与癌症死亡率的降低显著相关。
益生菌通过以下机制发挥作用:
鼠李糖乳杆菌(LGG)通过释放脂磷壁酸(LTA)激活TLR2信号,保护肠道干细胞免受放疗损伤。
另一种益生菌Prohep由鼠李糖乳杆菌GG(LGG)、具有活性的大肠杆菌Nissle 1917(EcN)和热灭活VSL3组成,用于在HCC小鼠模型中通过减少Th17细胞和IL-17细胞因子来减少肿瘤生长。
工程化益生菌有何突破?
益生菌要适量
益处:适量补充益生菌可降低癌症死亡率。
风险:过量可能干扰免疫治疗,如黑色素瘤模型中PD-1抑制剂疗效下降。
益生元
益生元——激活菌群抗癌潜能的“燃料”
益生元选择性地促进有益菌(如产丁酸菌)增殖,协同抗癌治疗。
益生元如何优化药物递送?
临床启示与风险管控
个体化菌群干预:
动态监测必要性:
风险提示:
免疫缺陷患者慎用活菌制剂,优先选择灭活益生菌或纯化代谢产物。
总的来说,益生菌双刃剑效应显著,需严格把控种类和剂量;而益生元通过调节菌群代谢,相对安全增强化疗/免疫疗效。
益生菌+益生元+传统疗法可能成为癌症治疗新方向,但需更多临床验证。
抗癌药物
为什么同种药物在不同患者中效果差异显著?
肠道微生物群还参与抗癌药物的生物转化和代谢,导致这些药物的差异吸收和生物利用度。在药物的生物转化过程中,微生物群采用各种机制,如脱氨基、水解、去甲基化、葡萄糖醛酸化和其他反应。
伊立替康(CPT11):
5-氟尿嘧啶(5-FU):
如何减轻菌群介导的副作用或耐药?
抑制特定酶活性:
调控菌群组成:
壳寡糖通过降低肠球菌、大肠杆菌-志贺氏菌、Turicibacter的密度以及促进丁酸产生菌的生长,对结直肠癌具有保护潜力。

临床潜在方向
未来,建立“菌群-药物代谢”数据库,结合人工智能预测个体化用药方案。例如,对高β-葡萄糖醛酸酶活性的患者,优先选择不受该酶影响的化疗药物(如奥沙利铂)。
关于常用药物和肠道菌群之间复杂的双向相互作用,我们之前的文章也写过,详见:
为什么药物对人效果不一?探索药物-微生物群相互作用对效果的影响
全球癌症治愈率依然不高,肠道微生物群在癌症发生、发展、转移和药物反应中的关键作用正逐渐成为研究热点,为精准抗癌策略提供了全新思路。
菌群在癌症治疗中的关键作用
微生物通过多种机制影响癌症治疗效果:
doi.org/10.1186/s12935-025-03787-x
当前挑战:从实验室到临床的鸿沟
– 研究方法的“碎片化”
样本收集(粪便 vs 肿瘤组织)、测序技术(16S rRNA vs 宏基因组)的差异导致结果难以比较;
解决方案:建立全球统一的微生物组分析标准。
– 个体化差异
年龄、饮食、地理因素使菌群组成差异巨大——同一疗法在不同人群中的响应率波动;
突破口:开发基于AI的个体化菌群图谱,预测治疗敏感性与毒性风险。
– 治疗复杂性的叠加
在现有化疗/免疫治疗基础上引入菌群调控,可能引发不可预见的药物-微生物相互作用;
未来方向:迈向精准菌群医学
– 精准菌群分层
通过多组学技术(宏基因组+代谢组)构建个体化菌群图谱,识别“促癌菌”与“抑癌菌”。
针对不同化疗方案调整菌群结构,丁酸水平低者优先使用奥沙利铂联合益生元。
– 联合干预策略
饮食-菌群协同:高纤维饮食联合特定益生元(如菊粉),可使MEK抑制剂疗效提升。
个性化膳食(如高纤维饮食)联合益生菌,改善肠道健康并增强治疗响应。
结合基因、饮食等多维度数据定制治疗方案。
工程菌开发:设计靶向降解耐药相关酶(如β-葡萄糖醛酸酶)的工程菌。
– 临床转化路径
推动大规模临床试验,验证菌群移植(FMT)、益生元/菌在特定癌种中的疗效。
探索菌群标志物(如丁酸盐水平)作为治疗响应预测指标。
开发微生物群-人工智能联合预测模型,优化治疗决策。
将菌群检测纳入癌症辅助诊疗,实现早筛与疗效监控。
总的来说,微生物组研究不仅扩展了我们对癌症发生发展的认知,更为癌症治疗提供了新的可能性。通过系统化的菌群检测与精准干预,跨学科协作与技术创新,未来有望实现真正的个体化治疗方案,提高抗癌疗效并改善患者生活质量。这一领域的进步,代表着癌症治疗从单一靶向向生态系统整体调控的深刻范式转变。
主要参考文献
Adlakha YK, Chhabra R. The human microbiome: redefining cancer pathogenesis and therapy. Cancer Cell Int. 2025 Apr 28;25(1):165.
Shi Z, Li Z, Zhang M. Emerging roles of intratumor microbiota in cancer: tumorigenesis and management strategies. J Transl Med. 2024 Sep 11;22(1):837.
Murayama M, Hosonuma M, Kuramasu A,et al., Isobutyric acid enhances the anti-tumour effect of anti-PD-1 antibody. Sci Rep. 2024 May 17;14(1):11325.
Jia D, Kuang Z, Wang L. The role of microbial indole metabolites in tumor. Gut Microbes. 2024 Jan-Dec;16(1):2409209.
Sun X, Shan X, Zhu B, Cai Y, et al., 5-Fluorouracil Loaded Prebiotic-Probiotic Liposomes Modulating Gut Microbiota for Improving Colorectal Cancer Chemotherapy. Adv Healthc Mater. 2025 Feb;14(4):e2403587.
Zhang H, Xu Z. Gut-lung axis: role of the gut microbiota in non-small cell lung cancer immunotherapy. Front Oncol. 2023 Nov 22;13:1257515.
Wang S, Yin F, Guo Z, Li R, Sun W, Wang Y, Geng Y, Sun C, Sun D. Association between gut microbiota and glioblastoma: a Mendelian randomization study. Front Genet. 2024 Jan 4;14:1308263.
谷禾健康
近年来,免疫治疗在癌症治疗领域展现出了巨大的潜力,特别是针对PD1/PDL1通路的免疫检查点抑制剂(ICIs)已在多种实体瘤患者中取得显著疗效。然而,治疗反应的异质性和耐药性的出现依然是当前面临的主要挑战之一。越来越多的研究表明,肠道菌群作为人体内一个庞大的微生态系统,不仅参与机体代谢和免疫调控,而且在调节肿瘤免疫反应方面发挥着关键作用。
让我们快速了解一下肠道菌群如何通过细胞水平、分子信号通路和代谢产物来影响PD1/PDL1肿瘤免疫疗法的疗效。
1 核心菌群与免疫调控机制
多项临床与实验室研究均显示,特定菌群对PD1/PDL1免疫检查点抑制剂治疗具有显著的正向作用。
例如,Bifidobacterium属菌群被发现能显著促进抗PDL1疗法的抗肿瘤作用;而Akkermansia muciniphila在PD1抑制治疗中也表现出与治疗反应正相关的趋势。此外,研究还发现,黑色素瘤患者中较高的微生物多样性和特定菌群如Ruminococcaceae和Faecalibacterium的丰富度均与更长的无进展生存期相关。
肠道菌群对免疫调控的机制主要表现在以下几个方面:
促进树突状细胞成熟:某些菌群(如Bifidobacterium)可通过激活树突状细胞,从而增强抗原呈递能力,提高CD8+ T细胞的活性。
调节T细胞免疫状态:特定菌群通过影响细胞因子分泌和T细胞亚群分布,调节包括CD8+效应T细胞和调节性T细胞(Treg)在内的免疫平衡,从而实现抗肿瘤效应。
通过代谢产物发挥作用:菌群代谢产物,如短链脂肪酸(SCFAs)和次级胆汁酸,对免疫细胞储存、功能激活具有直接调控作用。
这些作用机制不仅在单一免疫治疗模式中发挥效应,同时也对联合治疗(例如PD1/PDL1抑制剂与CTLA-4抑制剂联合使用)产生协同增效作用。
2 关键代谢物及其信号调控路径
肠道菌群通过发酵膳食纤维等底物,产生大量的短链脂肪酸(SCFAs),如丁酸盐和丙酸盐,这些代谢物在调节宿主免疫功能中起到关键作用。研究发现,短链脂肪酸不仅参与维持肠道上皮屏障的稳定,还能调节T细胞分化和促炎/抗炎反应的平衡。此外,菌群代谢的次级胆汁酸也被证明在免疫抑制和调控细胞因子水平中起到重要作用。
值得注意的是,不同菌群通过生成不同的代谢产物,对免疫系统的影响可能存在正负两方面的效应。例如,有研究显示高浓度的丁酸盐和丙酸盐可能会在某些条件下限制CTLA-4抑制剂的疗效,从而提示适度平衡菌群代谢产物对于免疫治疗的成功至关重要。同时,某些菌群如Prevotellaceae和Rikenellaceae则可能通过降低丁酸盐水平来促进促炎性巨噬细胞M1型的极化,从而间接影响免疫治疗的疗效。
3 不同肿瘤类型中的菌群特征与免疫应答
肠道菌群对免疫治疗的影响在不同肿瘤类型中可能存在显著差异。下面介绍一下在黑色素瘤、非小细胞肺癌(NSCLC)、肝细胞癌(HCC)以及结直肠癌(CRC)中的相关发现。
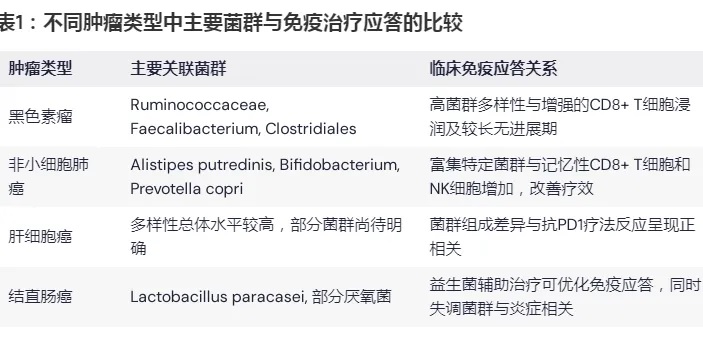
表1说明:各肿瘤类型中显示出菌群多样性和特定菌群丰度与PD1/PDL1免疫治疗效果之间存在明显相关性,该表对比了不同肿瘤中的主要菌群与免疫应答情况。
4 肠道菌群调控机制的分子与细胞通路
肠道菌群通过多条分子信号通路及细胞间相互作用调控宿主的免疫反应,进而影响PD1/PDL1免疫治疗的疗效。
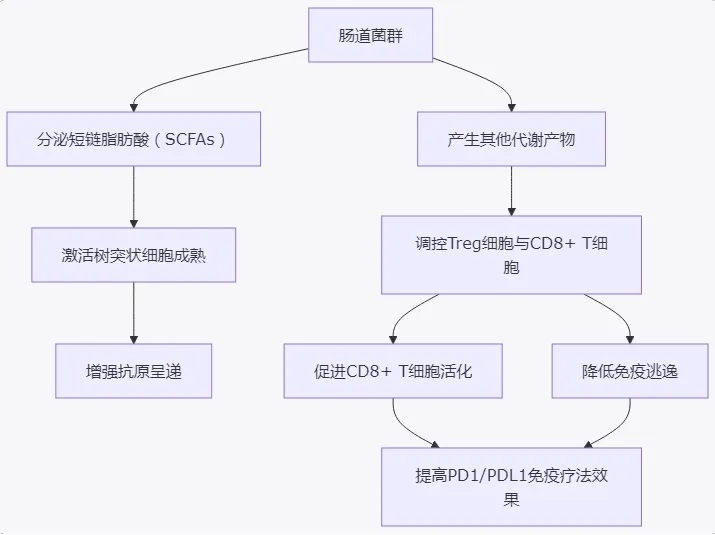
图1:肠道菌群通过分泌代谢产物调控树突状细胞成熟、T细胞活性与调节性T细胞平衡,从而增强PD1/PDL1免疫治疗效果。
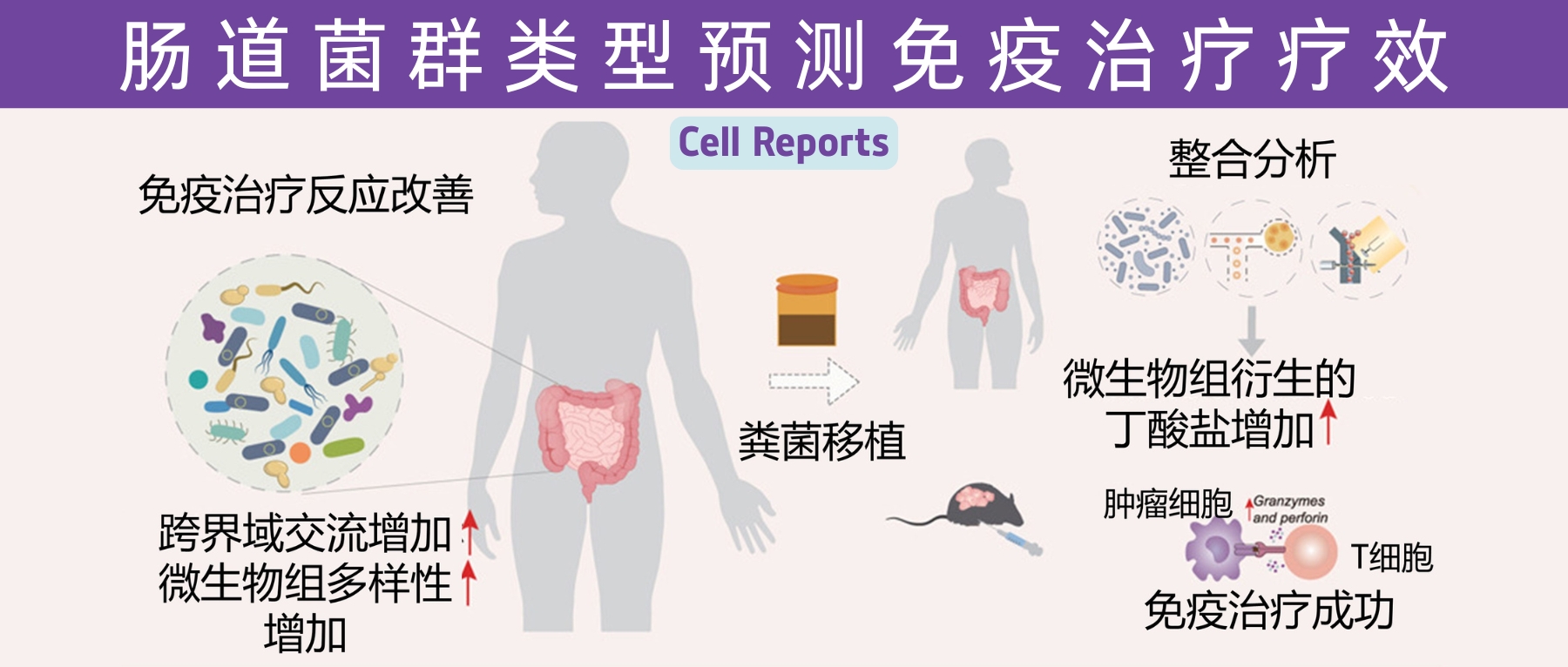
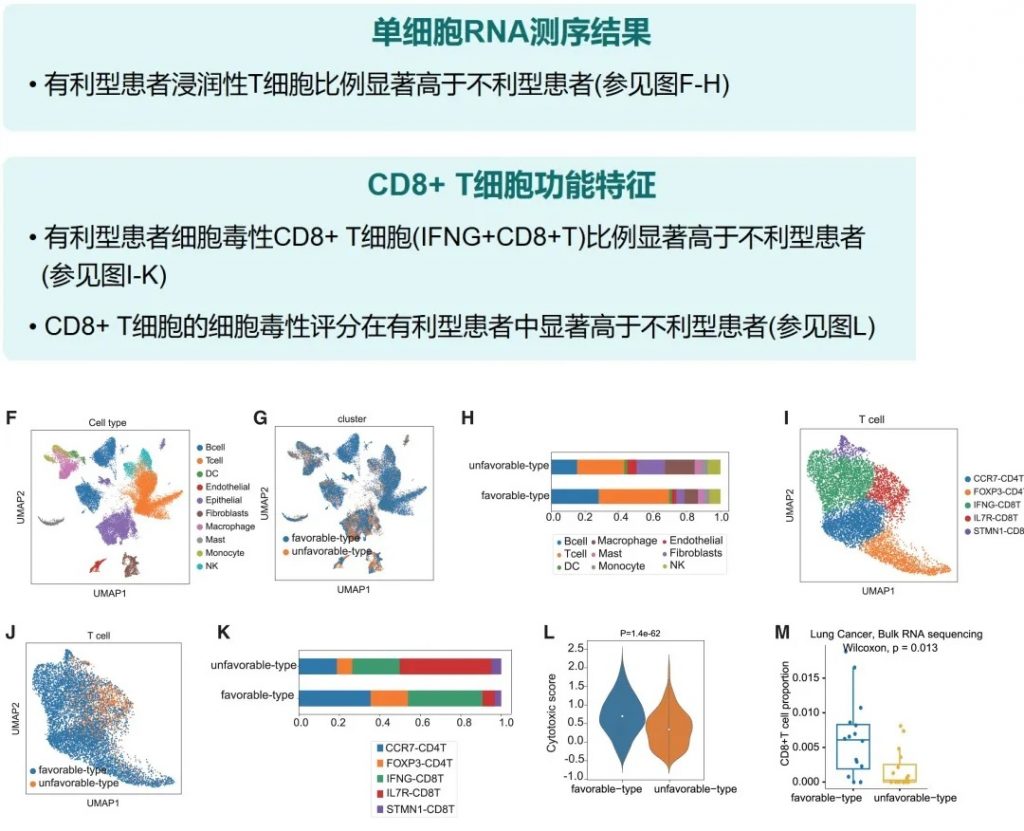
近日,一项来自上海交通大学医学院研究团队的成果发表在《Cell Reports》,通过整合多组学数据与临床队列,揭示了基于肠道菌群分类(有利型与不利型)与抗PD-1/PD-L1免疫治疗疗效的显著关联。

其中,有利型患者表现出更高的真菌与细菌多样性、富集丁酸代谢通路及促免疫菌群(如Faecalibacterium prausnitzii),以及肿瘤微环境中细胞毒性CD8+ T细胞浸润增强的特征,且在多癌种队列中显著关联于抗PD-1/PD-L1治疗的临床缓解与生存获益。
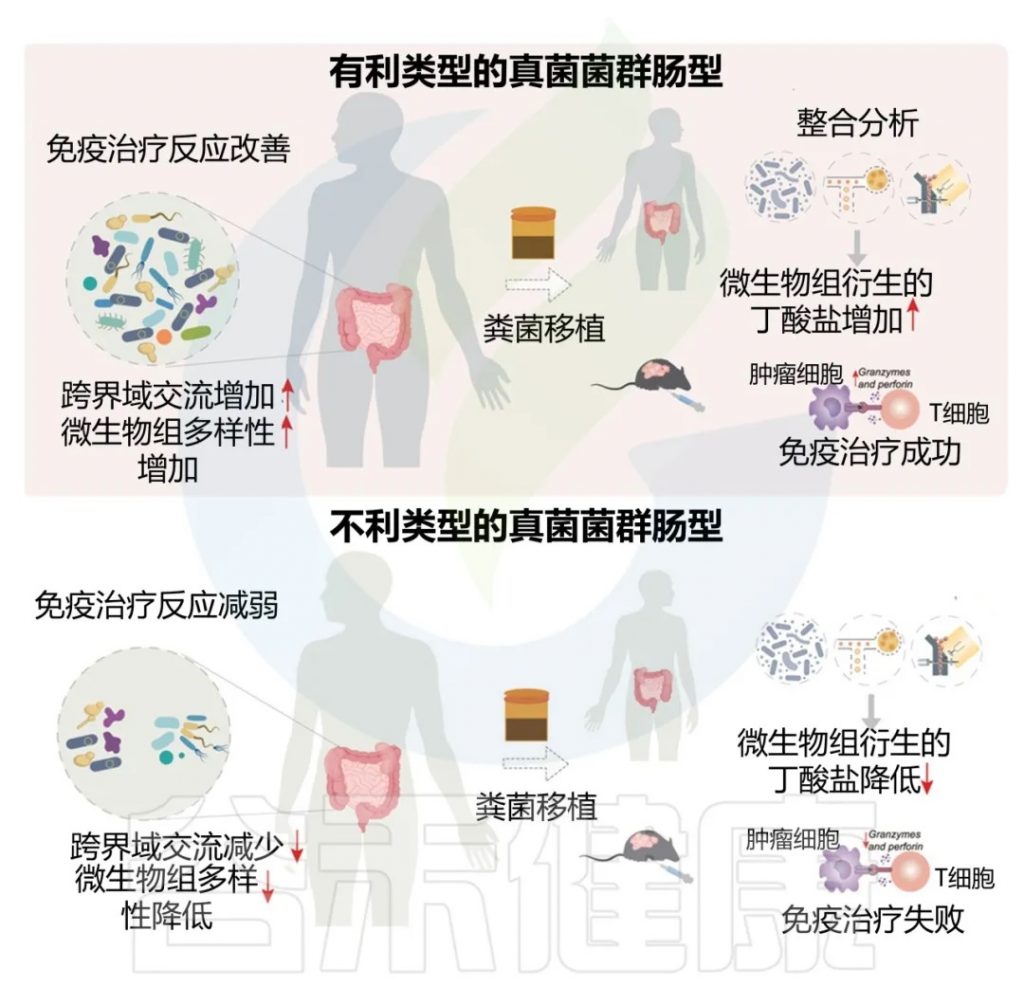
进一步通过FMT实验证实,移植来自有利型供体的粪便可显著提升受体对免疫治疗的敏感性,并重塑肠道菌群代谢功能。
这些发现不仅深化了对肠道真菌组-细菌互作网络的理解,为优化个体化免疫治疗提供了新型生物标志物,更为优化免疫治疗分层策略及FMT供体筛选提供了科学依据,具有重要的临床转化潜力。

多组学关联分析与肠道菌群类型特征
详细对比了两种肠道菌群类型的微生物群落特征差异,包括多样性、产丁酸菌含量、代谢通路等,并展示了它们与临床疗效的关联。
粪便微生物移植实验验证
呈现了临床FMT研究和动物模型验证结果,证明来自有利型供体的FMT可显著提升受体对免疫治疗的敏感性。
总结了研究的创新点及其在预测分层和干预优化方面的临床应用价值。
肠道菌群类型:免疫治疗疗效的新生物标志物
免疫检查点抑制剂(如抗PD-1/PD-L1)显著改变了癌症治疗格局,但患者反应差异大。
该研究团队采用无监督聚类方法分析肠道菌群组成,在多个独立队列中成功识别并验证了两种截然不同的类型——“有利型”与“不利型”,这一发现揭示了肠道菌群对免疫治疗应答的预测价值。

肠道菌群的类型不仅与临床反应相关,还与患者总生存期密切相关,为个体化治疗策略提供了新思路。
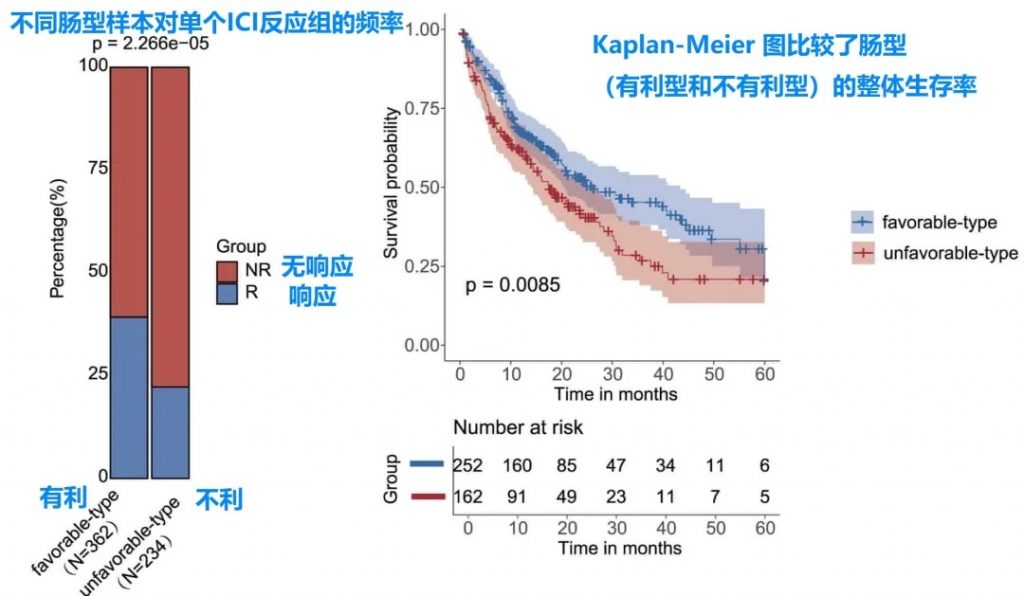
有利型患者对抗PD-1/PD-L1免疫治疗的响应率显著高于不利型 (p=2.266e−5),总生存期也更长 (p=0.0085)。
“有利型”和“不利型”肠道菌群差异 细菌、真菌
细菌 多样性
——α多样性差异
有利型患者表现出显著更高的细菌α多样性指数(Shannon、Chao1、Simpson),这与既往研究发现的免疫治疗响应者多样性更高的结论一致。
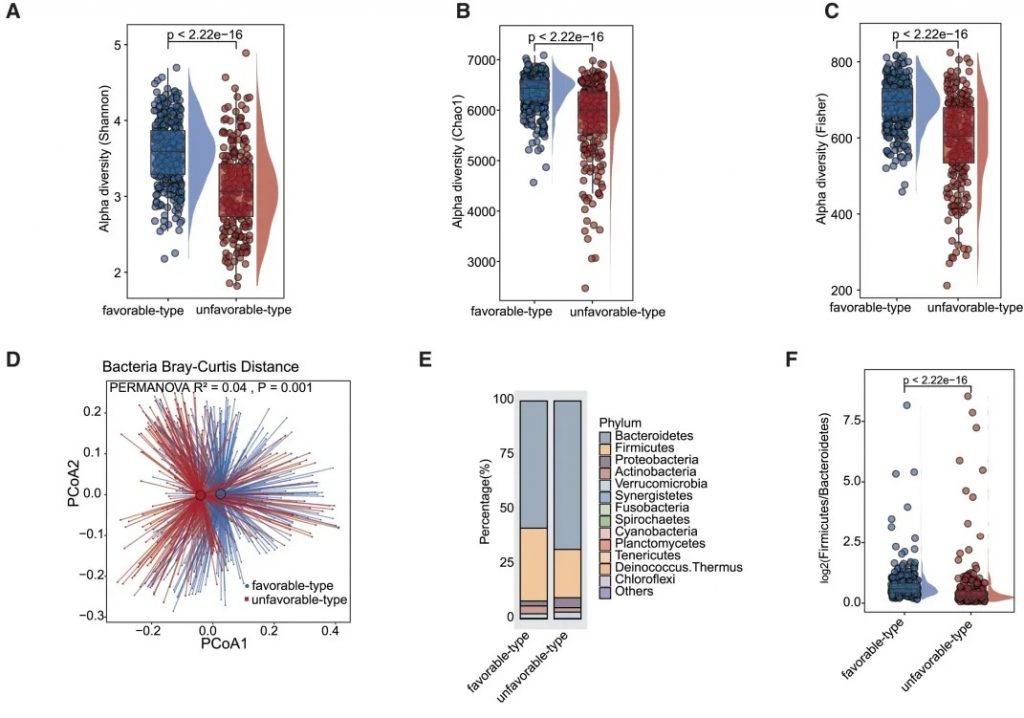
——β多样性差异
细菌 主要构成
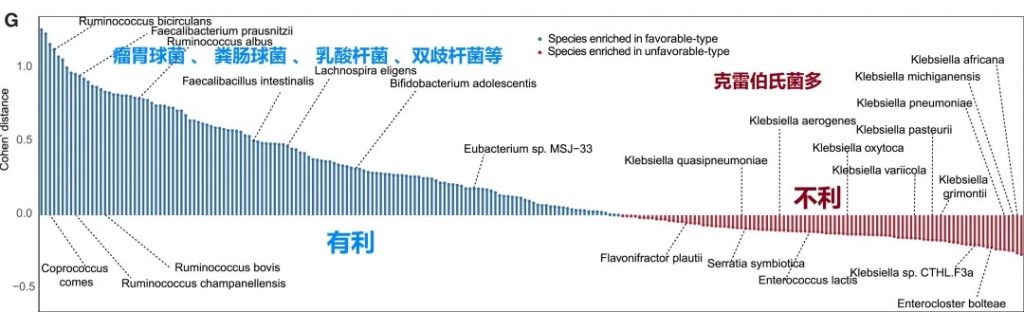
有利型患者表现出更高的Firmicutes/Bacteroides比值,这被认为是肠道菌群平衡的重要指标,与免疫治疗的良好反应相关。
有利型的患者肠道中富含产丁酸盐的细菌,特别是Faecalibacterium prausnitzii、Lachnospira eligens,这些细菌通过产生丁酸盐调节肠道微环境,增强抗肿瘤免疫反应。
真菌 多样性
有利型表现出更高的Shannon指数和OTU丰富度,真菌物种多样性更丰富,这与对免疫治疗的更好反应相关联。
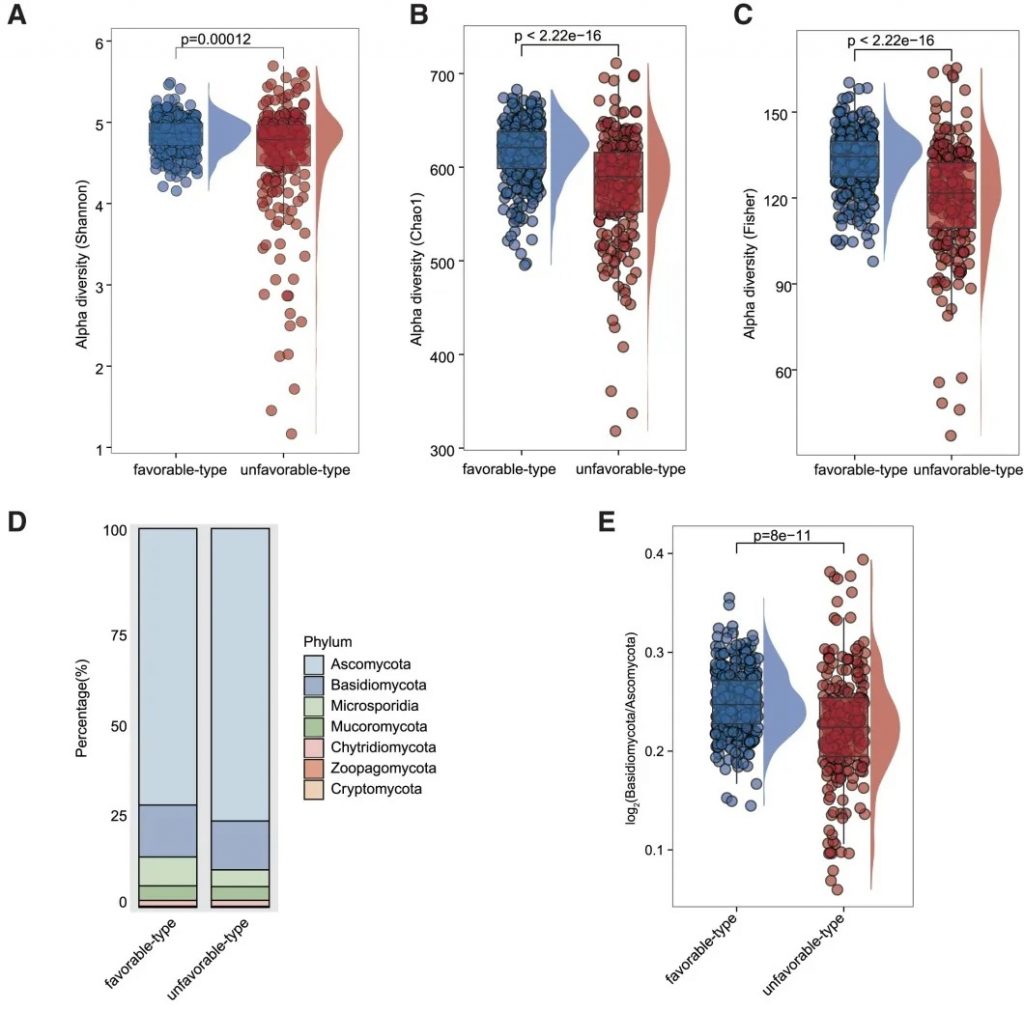
真菌 主要构成
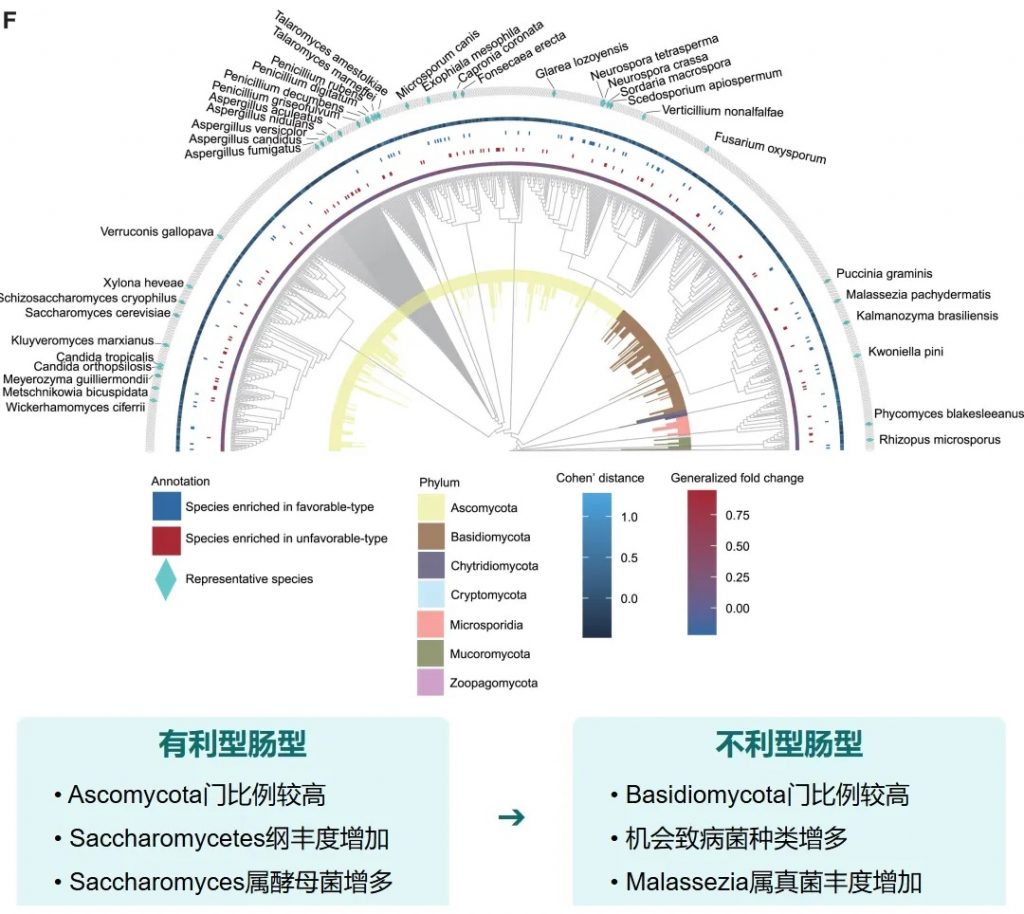
关键真菌与细菌的共现分析
有利型样本在真菌-细菌界中表现出增加的正相互作用,而不利型样本在菌-细菌界表现出更多的负相互作用。
关键真菌-细菌互作对有利型中的关键互作真菌-产丁酸盐细菌正向互作:
有利型的真菌群落结构似乎与某些细菌表现出更积极的共生关系。真菌-细菌间相互作用可能在抗PD-1/PD-L1 ICI的反应中发挥关键作用。
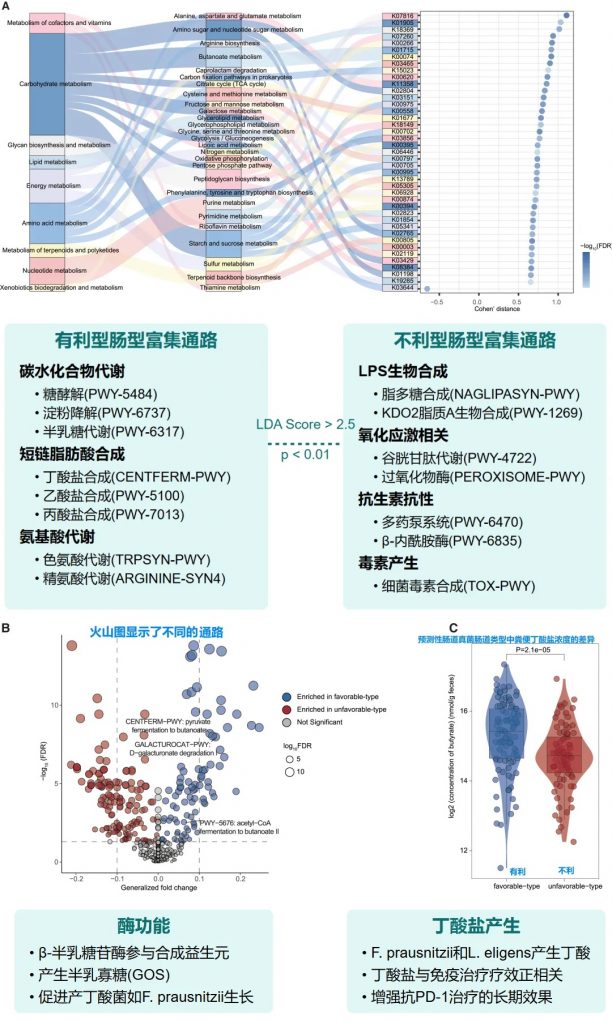
基于特定菌群类型的微生物功能分析
肠道菌群类型的外部验证与多组学分析
验证队列特征
• 125名接受PD-1抗体治疗的泛癌症患者
• 基于随机森林分类器(RandomForestClassifier)进行肠道菌群类型的预测
• 预测结果: 83名有利型患者,42名不利型患者
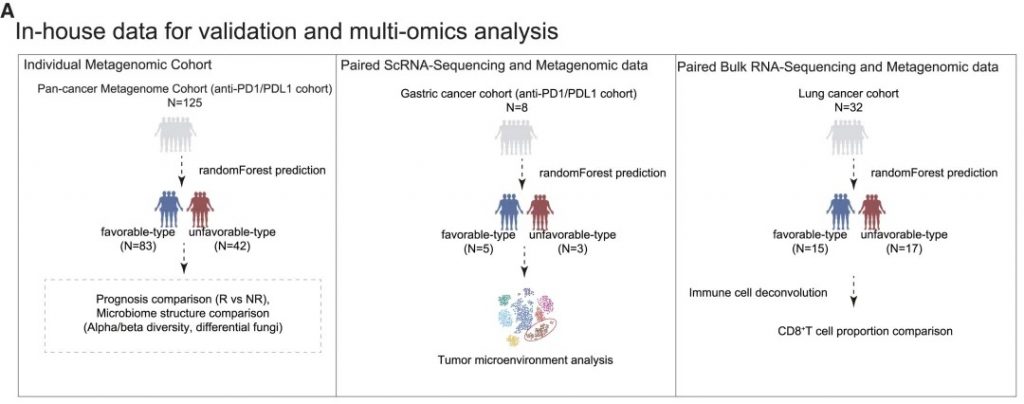
验证分析方法
• 基于机器学习的肠道菌群类型预测模型
• 随访评估对免疫治疗的临床反应
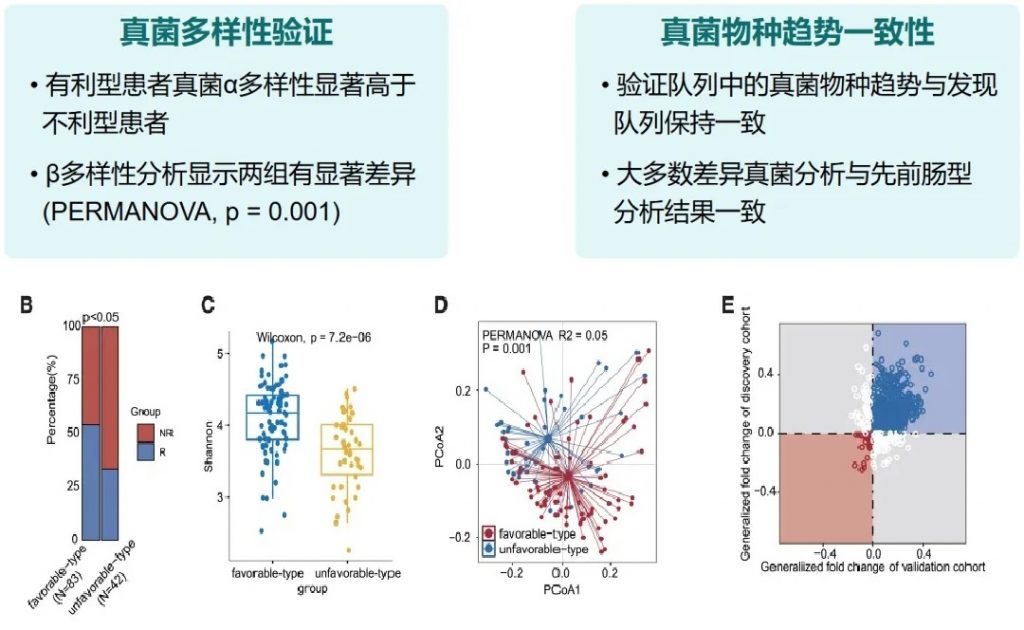
丁酸可促进CD8+ T细胞浸润肿瘤微环境,直接增强抗肿瘤免疫。
FMT供体选择:优化免疫治疗疗效
整合数据构成
• 3个近期发表的临床试验数据
• 12名FMT供体 (5名有利型, 7名不利型)
• 43名黑色素瘤患者接受者
• 包含宏基因组数据和临床结果
FMT临床疗效分析
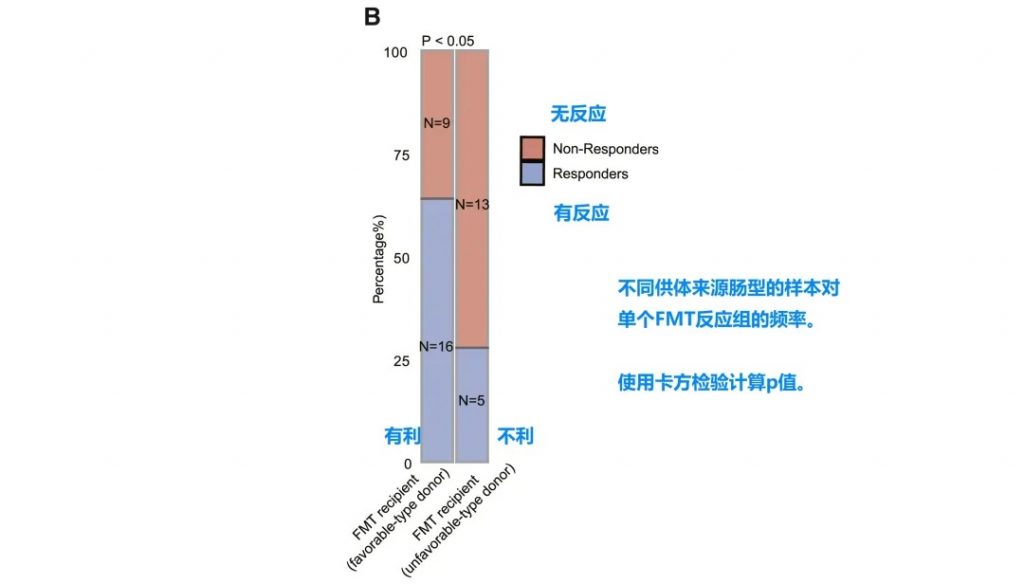
• 接受有利型供体FMT的患者对抗PD-1/PD-L1抗体免疫治疗的反应明显改善
• 卡方检验证实统计学显著差异 (p < 0.05)
接受“有利型”供体FMT的患者显示出对抗PD-1/PD-L1抗体免疫治疗的显著改善反应(p < 0.05)。这一发现具有临床指导意义,为FMT供体筛选提供了新的标准。
FMT前后微生物多样性变化
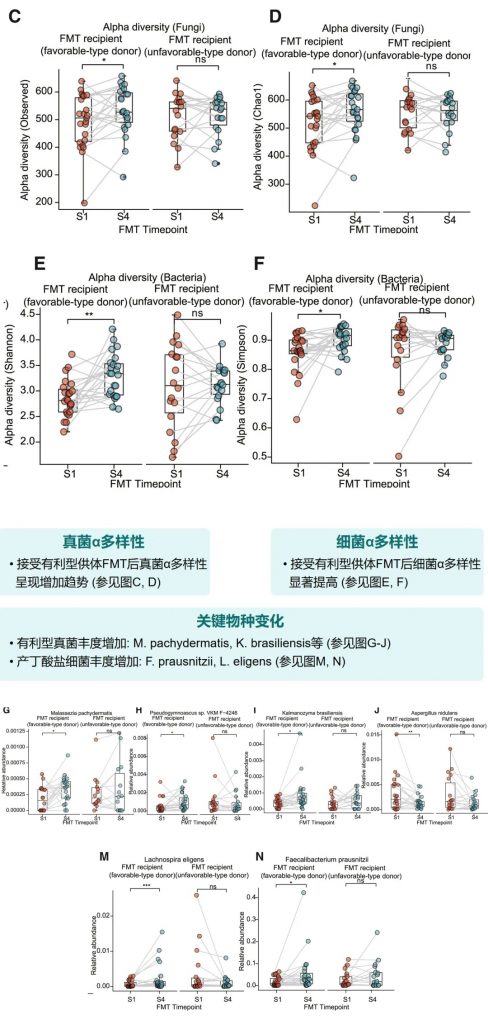
接受有利型供体FMT后,受者的真菌和细菌α多样性均有明显提高。特别是,有利型特征真菌和产丁酸菌的丰度显著增加,这与增强的免疫治疗效果相关。
体内验证实验结果
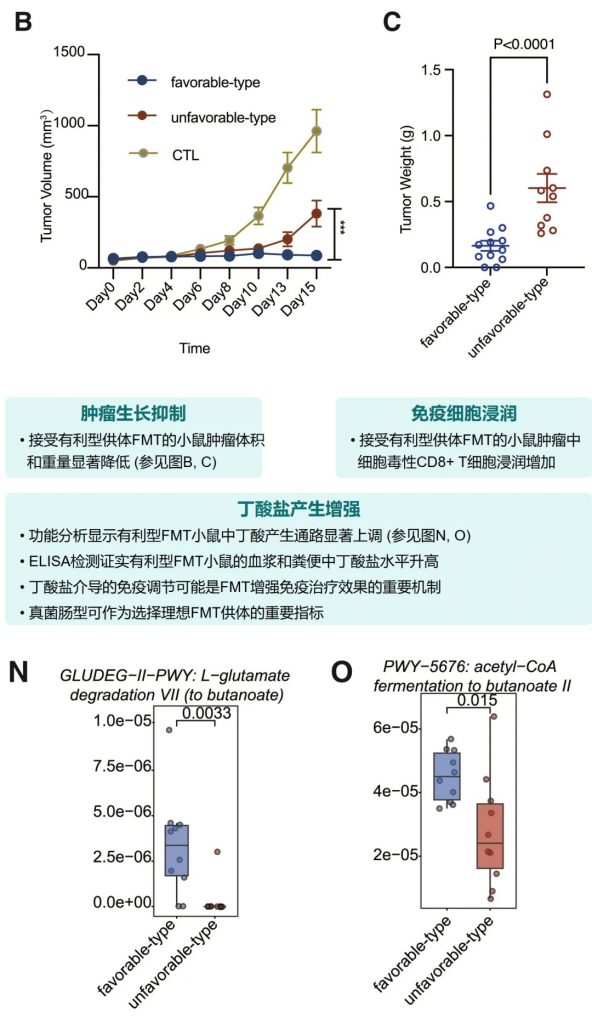
小鼠实验进一步确认了有利型供体FMT可以增强抗PD-1治疗效果,表现为肿瘤生长抑制、CD8+ T细胞浸润增加,以及丁酸盐产生增强。这为FMT增强免疫治疗提供了机制解释。
该研究揭示了肠道微生物群类型与免疫检查点抑制剂(ICI)疗效之间的密切关系,为优化癌症免疫治疗策略提供了新的视角。
肠道菌群与免疫治疗响应之间存在显著关联,且这种关联可通过粪菌移植等干预手段加以调控,为克服免疫治疗耐药提供新策略。
以下是几个具有前景的研究和临床应用方向:
辅助诊断的开发与实施
随着肠道菌群类型与免疫治疗疗效之间关联的确立,开发肠道微生物群分析作为免疫治疗的伴随诊断工具已成为一个明确的临床需求。
粪菌移植(FMT)作为辅助治疗手段
对于被确定为不利型的患者,粪菌移植提供了一种有前景的干预手段,可能显著提高免疫治疗的响应率。
更大规模的临床验证研究
为了将这些发现转化为临床实践,需要进行更大规模的验证研究:
未来,肠道微生物群检测有望成为免疫治疗患者的常规伴随诊断工具,帮助临床医生识别潜在的治疗无应答人群。
也就是说做免疫治疗的人群可以做肠道菌群评估作为辅助诊断,如果免疫治疗没有效果的病人,考虑通过FMT调整菌群后,提高治疗效果。来自有利型供体的粪菌移植可能成为提高治疗效果的有效辅助手段。
这一整合策略不仅能够优化现有免疫治疗的应用,也为开发新型微生物组靶向干预手段提供了方向,最终实现免疫治疗疗效的最大化和个体化。
在癌症精准医疗的框架下,肠道微生物组评估和干预将与基因组学、免疫学等多组学手段一起,共同构成未来肿瘤免疫治疗的个体化决策基础,为患者带来更好的临床获益。
主要参考文献
Hu M, Zhu X, Huang X, Hua L, Lin X, Zhang H, Hu Y, Tong T, Li L, Xuan B, Zhao Y, Zhou Y, Ding J, Ma Y, Jiang Y, Ning L, Zhang Y, Wang Z, Fang JY, Zhang Y, Xiao X, Hong J, Chen H, Li J, Chen H. Optimizing anti-PD-1/PD-L1 therapy efficacy and fecal microbiota transplantation donor selection through gut mycobiome-based enterotype. Cell Rep. 2025 Apr 20;44(5):115589.
谷禾健康
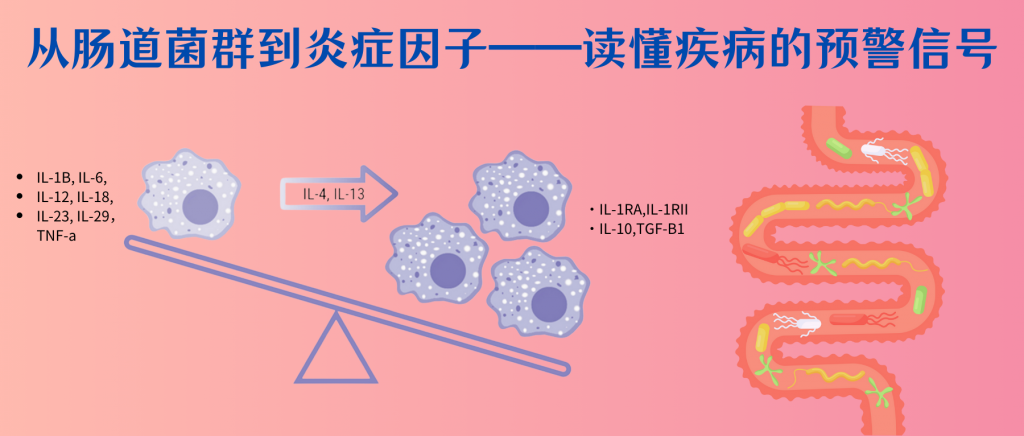
当我们的皮肤被轻微割伤或烧伤时,伤口周围区域可能会变得红肿、发热,甚至伴有疼痛;感冒时,喉咙痛、肿胀;不小心扭伤后,可能会肿胀、疼痛和僵硬…这些都与炎症相关。
炎症,作为身体对损伤或感染的自然防御机制,是一种复杂的生物学过程,涉及到免疫细胞和多种分子介质的相互作用。它可以帮助身体对抗病原体、清除死亡细胞和促进组织修复。然而,当炎症反应过度或持续时间过长时,它也可能成为许多疾病的驱动因素,包括心脏病、糖尿病、某些类型的癌症,自身免疫疾病等。因此,了解炎症及其相关症状对于早期识别和治疗炎症相关疾病至关重要。
你是否想过,在身体出现炎症之前,其实已经有一些潜在的信号出现?炎症这个过程看似简单,但背后却涉及复杂的免疫系统调控,以及多种炎症因子的参与。值得注意的是,在这些可见的炎症症状出现之前,我们体内的炎症因子可能已经悄然发生了改变。
研究表明,肠道菌群的失调往往是最早的预警信号之一。当肠道微生物群的平衡被打破时,会引发一系列连锁反应:有益菌群(如双歧杆菌、乳酸杆菌)数量减少,条件致病菌和致病菌的比例升高。这种失衡会导致肠道屏障功能受损,使得细菌产物(如脂多糖LPS)更容易进入血液循环。
早期的肠道菌群改变会引起炎症因子水平的显著变化。比如说:血清中促炎因子如TNF-α、IL-1β和IL-6的水平开始升高,而抗炎因子如IL-10的水平则呈现下降趋势。同时,由于有益菌群减少,短链脂肪酸等具有抗炎作用的代谢产物的产生也会减少。这些变化都可能发生在明显的炎症症状出现之前。
这种早期的炎症因子改变往往具有预警作用。例如,在动脉粥样硬化的发展过程中,即使尚未出现明显的斑块形成,血液中的炎症因子水平就已经开始发生变化。
本文将带大家了解炎症因子,具体怎么看,它的高低代表着什么,发挥什么作用,探讨炎症因子作为早期诊断生物标志物的价值,以及肠道菌群与炎症因子之间的复杂联系。通过监测肠道菌群的变化和炎症因子水平的波动,我们可以更早地发现潜在的健康问题,为疾病的预防和早期干预提供重要的时间窗口。

◑ 炎症
炎症是身体对外界损伤、感染或内部损伤的一种自然防御反应,旨在清除有害刺激因子、清除死亡细胞和组织碎片,并启动修复过程。它是免疫系统的一部分,涉及多种细胞类型和分子介质,包括白细胞、血管系统、补体系统和各种炎症因子。
日常可见的炎症反应可分为两类:
不健康的生活方式,如吸烟、不良饮食、过量饮酒、久坐不动、压力、体重增加等,都可能导致慢性炎症。
慢性低度炎症——疾病之源
慢性低度炎症是在没有明显感染的情况下,体内炎症介质水平持续升高。这种炎症状态往往不会引起明显的临床症状,但会长期影响人体健康。
慢性炎症可以攻击全身,并在此过程中增加特定区域某些类型疾病和紊乱的风险,如心脏、大脑、关节、胃肠道等。
炎症是如何被触发的?
炎症的触发是一个复杂的过程,感染、损伤、应激、自身免疫反应、坏死细胞、代谢紊乱…这些都可能是炎症触发的途径。
随着损伤信号的识别,免疫细胞如巨噬细胞和树突状细胞迅速响应,受体的激活促使免疫细胞分泌炎症因子,这些炎症因子是炎症反应中的关键分子。
炎症因子的释放不仅放大了炎症信号,还促进了血管的扩张和通透性增加,使得免疫细胞和分子能够更有效地到达受损部位。这些炎症因子的相互作用和级联反应构成了炎症反应的基础,它们共同协调了机体对损伤和感染的防御机制。
接下来我们来深入认识炎症过程中的核心”信使”——炎症因子。
◑ 炎症因子
炎症因子在疾病发展过程中扮演着关键角色,其水平变化不仅反映了疾病的发展态势,更为疾病的早期诊断和预后评估提供了重要依据。研究表明,炎症因子的变化往往早于临床症状的出现,这种特性使其成为疾病发展的重要生物标志物。
我们先看一下,炎症因子是什么?
炎症因子是一类由免疫细胞和其他细胞产生的特殊蛋白质分子,它们在体内发挥着”信使“的作用。也就是说,炎症因子就像是我们身体内的一支特殊”信号部队“,它们负责在炎症发生时传递各种指令,协调免疫系统的行动。
无论是急性炎症还是慢性炎症,炎症因子都扮演着不可或缺的角色,它们决定着炎症反应的强度、持续时间和最终结果。
炎症因子与细胞因子有什么区别?
炎症因子主要是指那些能够引起或加剧炎症反应的分子,而细胞因子则是一类更广泛的信号分子,包括炎症因子在内的多种类型,比如生长因子、趋化因子等,它们参与调节免疫细胞的功能和相互作用。
炎症因子可以被视为细胞因子的一个子集,也就是那些具有促进炎症反应功能的细胞因子。
在疾病发展的早期阶段,即使尚未出现明显的临床表现,体内的炎症因子已经开始发生显著变化。
例如,促炎因子TNF-α和IL-6的水平会逐渐升高,而抗炎因子IL-10的水平则呈现下降趋势。这种变化具有明显的时序性和渐进性特征,为疾病的早期预警提供了可能。同时,C反应蛋白(CRP)等急性期蛋白的轻微升高,也常常预示着潜在的健康问题。
主要的促炎因子和抗炎因子有哪些?
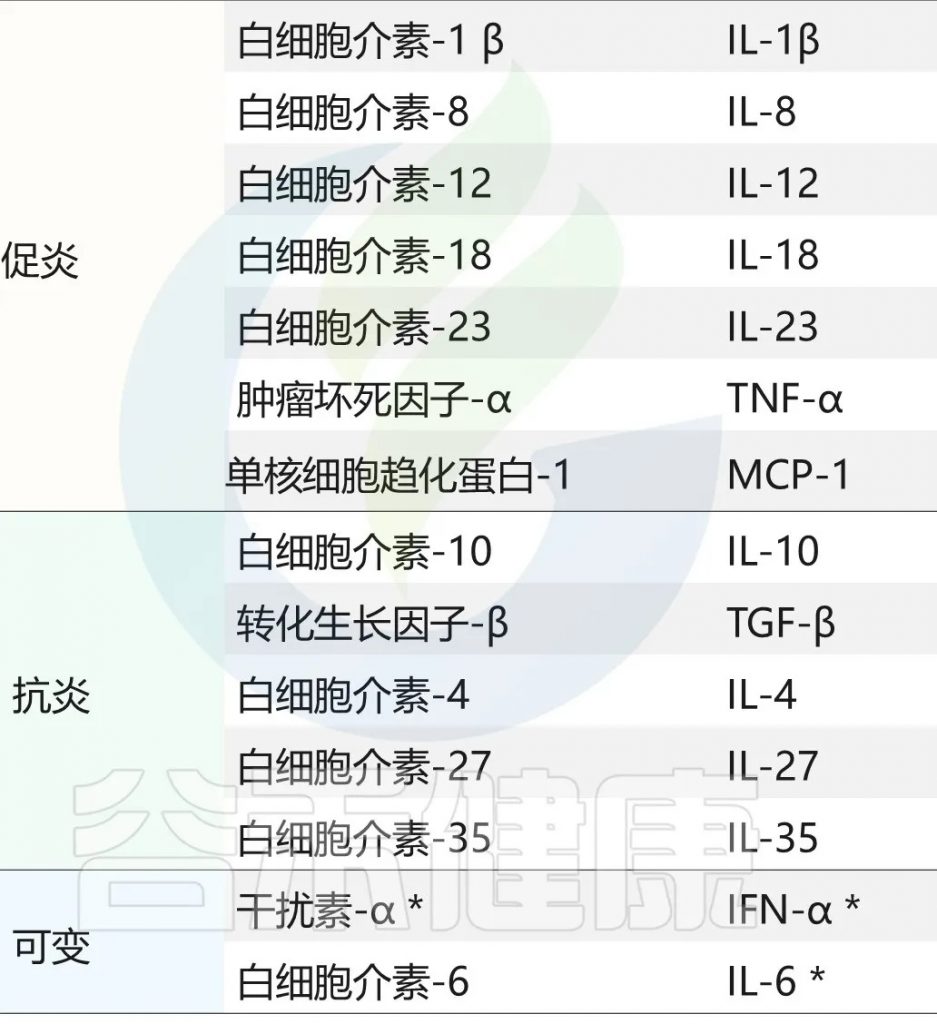
doi:10.3390/ijeph17207618
随着疾病的进展,炎症因子会呈现出不同的变化模式。在急性疾病中,IL-1β和TNF-α等促炎因子会快速升高,同时伴随着中性粒细胞趋化因子的显著增加。而在慢性疾病中,则常常表现为持续的低度炎症状态,多种炎症因子维持在较高水平,形成促炎和抗炎因子的失衡状态。
不同类型的疾病中,炎症因子往往表现出特征性的变化。以心血管疾病为例,患者体内的CRP和IL-6水平通常持续升高,同时伴有粘附分子表达的增加。在自身免疫性疾病中,TNF-α和IL-17的显著升高,以及特异性自身抗体的出现,往往是重要的诊断依据。而在代谢性疾病中,脂联素水平的改变和瘦素抵抗的出现,则与胰岛素抵抗密切相关。
炎症因子作为生物标志物在临床实践中有多重价值
在诊断方面,它可以用于疾病的早期筛查、鉴别诊断和病情评估;
在预后评估方面,能够预测疾病的进展趋势,评估并发症风险,并监测治疗效果;
在治疗指导方面,帮助医生选择合适的治疗方案,调整用药剂量,评价治疗效果。
了解炎症因子的作用机制不仅有助于我们更好地理解炎症过程,也为开发新的治疗策略提供了靶点,通过调节炎症因子的活性来治疗炎症性疾病,那么,如何有效地调节这些炎症因子的活性呢?近年来,越来越多的研究开始关注肠道菌群在调节炎症因子和免疫反应中的作用。
在疾病发展的早期阶段,即使在临床症状尚未显现时,身体内部可能已经发生了微妙的改变。肠道菌群作为人体最大的微生态系统,常常能够最早感知这些变化,并通过多种途径向身体发出预警信号。
我们以前的文章也有很多提及,肠道菌群不仅能影响局部的免疫反应,还能通过多种机制影响全身性的炎症状态,比如说:
代谢产物:
肠道菌群通过发酵膳食纤维产生短链脂肪酸(SCFAs),如乙酸、丙酸和丁酸,这些代谢产物能够调节免疫细胞的功能,特别是对调节性T细胞(Treg)的分化和功能具有重要作用,进而影响炎症因子的产生。
免疫细胞调节:
肠道菌群能够影响树突状细胞(DCs)和巨噬细胞的成熟和功能,这些免疫细胞在调节炎症因子的表达和释放中起着关键作用。
肠道屏障功能:
维持健康的肠道菌群有助于维持肠道屏障的完整性,防止病原体和有害物质的入侵,从而减少炎症因子的激活。
抗炎和促炎平衡:
某些肠道菌群成员能够促进抗炎细胞因子如IL-10的产生,而抑制促炎细胞因子如TNF-α和IFNγ的表达。
肠道菌群发出的预警信号,主要通过代谢产物、免疫细胞调节、肠道屏障功能维持以及抗炎促炎平衡等途径实现,而炎症因子则是传递这些预警信号的关键分子。
通过监测这些早期的分子标志物,我们可以在疾病发展的早期阶段进行干预,从而更有效地预防和控制炎症反应的发生发展。
接下来,我们将深入探讨常见的炎症因子(炎症标志物),包括C反应蛋白、粪便钙卫蛋白、TNF-α、IL-1、IL-6、IL-10、IL-17、IL-22等,这些炎症因子的具体功能,肠道菌群与这些炎症因子的关联等。
C反应蛋白(CRP)是一种重要的由肝脏产生的急性期反应蛋白,是临床上最常用的炎症标志物之一。比如,广泛使用于IBD筛查和评估疾病活动性、临床复发和治疗反应。
什么时候需要做CRP测试?
——急性
CRP水平在体内发生炎症或组织损伤时会急剧上升。比如说,感冒时身体的免疫系统会被激活,C反应蛋白的产生显著增加,反映了身体正在经历一种急性炎症反应,通常伴随着其他症状,如发热、 寒战、喉咙痛、全身乏力、呼吸急促、恶心呕吐等。一般出现这种情况的时候医生会要求抽血,看看CRP指标。
——慢性
除了感染性疾病的早期诊断外,CRP水平的升高还可用于判断疾病的严重程度和监测治疗效果。例如,在风湿性关节炎、狼疮、炎症性肠病、血管炎、哮喘等慢性疾病中,CRP常常作为一种重要的生物标志物,帮助医生评估病情进展及治疗反应。也可用于术后并发症监测。
例如,血液中高水平的hs-CRP与心脏病发作的风险增加有关。如果hs-CRP水平较高,心脏病发作的人更有可能再次心脏病发作。
CRP水平的高低意味着什么?
一般来说,健康人的血液中CRP含量很低。

CRP与肠道菌群有什么关联?
一项研究中,在CRP血浆水平升高的肥胖小鼠中,Akkermansia muciniphila的比例下降。
Phascolarctobacterium属成员的丰度与较低水平的CRP有关。这种关系可能会解释为什么该菌属比例的下降与结肠炎症有关:Phascolarctobacterium是丙酸的生产者,丙酸是一种短链脂肪酸,通过抑制促炎调节因子NFκB的活性来抑制促炎级联反应。同样,粪杆菌的丰度与CRP水平呈负相关。
因此,CRP是一种下游炎症标志物,可以通过特定肠道微生物的抗炎代谢产物的作用下调。
对BMI超过25的健康受试者的基线血清和微生物群数据的评估表明,CRP水平较高的受试者乳杆菌属和双歧杆菌属的细菌丰度明显较低,但大肠杆菌属和拟杆菌属的丰度较高。
钙卫蛋白是一种胞浆蛋白复合物,在中性粒细胞中组成性表达,并在肠道炎症期间迁移至肠粘膜时释放。
在健康状况下,钙卫蛋白具有免疫调节功能,对免疫防御至关重要;在慢性炎症性疾病中,钙卫蛋白可通过细胞因子受体结合和活性氧的产生来促进疾病进程。
钙卫蛋白——非侵入性生物标志物
自20世纪80年代钙卫蛋白的鉴定和表征以来,粪便钙卫蛋白成为一种经过显著验证的非侵入性生物标志物,可用于评估肠道炎症,是短期复发和IBD炎症活动的可靠预测指标。
举个例子:一个人去医院看病,主诉反复腹泻、腹痛、体重下降,有慢性腹泻的病史,过去几个月中症状有所加重,医生考虑他可能与肠道疾病相关,为了确诊,医生可能会开具粪便钙卫蛋白检测进行辅助诊断,帮助区分炎症性肠病和肠易激综合征。
钙卫蛋白水平高低意味着什么?
粪便钙卫蛋白与肠道菌群有什么关联?

一项来自TREND队列的大样本老年人研究发现,在高钙卫蛋白组与低钙卫蛋白组中,几种促炎肠道微生物属显著增加,而产短链脂肪酸菌减少。
在粪便钙卫蛋白升高的组中,几种产短链脂肪酸菌属(如梭菌属、Blautia、Turicibacter)的丰度降低与IBD、帕金森和心血管疾病中的许多发现一致。这些产生SCFA菌减少可能是几种疾病机制的关键,因为SCFA可以防止病原体,调节代谢,内分泌和免疫功能,并影响药物代谢和吸收。
发炎的肠道中较高水平的氧气可以允许肠杆菌科的有氧呼吸,同时抑制专性厌氧菌、拟杆菌和产生SCFA的梭菌的生长。此外,通过与富含脂肪的西方饮食的相互作用,含有促炎脂多糖作为膜成分的革兰氏阴性菌可能会引发炎症和粪便钙卫蛋白水平升高。
血清中,高粪便钙卫蛋白组IL-17 C、CCL 19和毒性代谢产物硫酸吲哚酚升高。这些变化部分由肠道微生物群介导。此外,高粪便钙卫蛋白组显示BMI增加,心脏病发作和肥胖的患病率较高。
在免疫疗法治疗肝细胞癌患者期间,粪便钙卫蛋白显示出与阿克曼氏菌与肠杆菌科比例和肠道微生物群α多样性相反的时间演变,但与zonulin-1和LBP相似。
肿瘤坏死因子-α(TNF-α)是驱动炎症的关键细胞因子。TNF-α在炎症级联反应的上游启动阶段,是Th1信号通路关键的细胞因子,在人体免疫系统中扮演着“紧急呼叫器”的角色。
该分子水平升高与胰岛素抵抗和葡萄糖耐受不良相关,因为TNF-α能够激活各种信号传导途径,包括mTOR途径,使其成为代谢疾病发展中的关键分子。
TNF的“好”
TNF诱导睡眠,并增加非快速眼动睡眠。因此,当我们晚上想入睡时,它提高一些是很好的。TNF在健康人中在夜间自然升高。
TNF是一种直接的脂肪克星,它导致脂肪细胞中的胰岛素抵抗,但也导致肌肉细胞中的胰岛素抵抗。这意味着葡萄糖不能进入这些细胞。
TNF通过抑制食欲素来抑制食欲。因此,高水平的TNF会使你吃得更少,并抑制葡萄糖进入脂肪细胞,从而使你变瘦。如果你减少TNF,会变得更饿,储存更多的脂肪。因此,抗TNF治疗导致体重增加并不奇怪。
TNF的“坏”
TNF通过抑制食欲素让人感到疲劳,降低情绪并降低认知和身体表现。
注:食欲素是一种非常重要的神经递质,对许多身体功能。食欲素在记忆获得和巩固以及长期记忆强化中起着许多关键作用。因此,如果你有炎症升高,它会损害你的认知能力。
TNF可以通过破坏线粒体造成持久的伤害。
TNF还可以降低甲状腺激素,导致“低T3综合征”。它也可以降低睾酮(趋势,但不显著)。
TNF会减缓伤口愈合,这意味着需要更多的时间从运动/受伤中恢复。
TNF可诱导“肠漏”。
长期升高的TNF-α也会扰乱昼夜节律并导致白天疲劳。
与TNF-α相关的疾病:炎症性肠病(IBD)、类风湿性关节炎(RA)、2型糖尿病、肥胖、系统性红斑狼疮、神经退行性疾病、精神分裂症等。
哪些肠道菌群与TNF-α呈负相关?
哪些肠道菌群与TNF-α呈正相关?
TNF-α在不同类型的感染中表现出不同的作用,例如在真菌感染中,TNF-α通过调节Th17/Th2和中性粒细胞/嗜酸性粒细胞的平衡来影响炎症反应。而在克罗恩病患者中,TNF-α的诱导活性与某些革兰阴性菌有关。
肠道菌群通过其代谢产物,如短链脂肪酸,可以影响TNF-α的水平。短链脂肪酸能激活AMPK,减少FIAF(诱导型脂肪因子)的产生,从而抑制脂多糖的活性,进而影响TNF-α的产生。
★ 如何减少TNF-α?
生活方式:运动(骑车)、瑜伽、太极拳、睡眠不足后的小睡、谈恋爱等。
饮食:沙丁鱼、蘑菇、大蒜、蜂蜜、大豆、苦瓜、十字花科蔬菜(西兰花、花菜)、水果(红树莓、蓝莓、黑醋栗果、李子、桃、荔枝、巴西莓)等。
其他补充剂:姜黄素、鱼油、肉桂、精氨酸、甘氨酸、组氨酸、铬、植物淄醇、黄芪、青蒿素、柠檬苷、辅酶Q10、紫锥菊、葡萄糖胺、小檗碱、黄芩、银杏、南非醉茄、槲皮素等。
IL-1是一种重要的促炎细胞因子。促进炎症细胞的招募和活化,增加血管通透性,吸引免疫细胞到达炎症部位。参与调节T细胞和B细胞的活化、增殖和分化,促进发热反应、疼痛、肿胀。同时也可以诱导某些细胞类型的凋亡,参与组织修复和再生。
与IL-1相关的疾病:自身免疫性疾病、感染性疾病、心血管疾病、代谢性疾病、神经退行性疾病等。
哪些肠道菌群与IL-1呈负相关?
哪些肠道菌群与IL-1呈正相关?
肠道菌群代谢产物,短链脂肪酸,通过激活AMPK和抑制PGC-1α,进而影响IL-1的产生。
◆ IL-1β
IL-1β是IL-1家族的重要成员之一,同属于促炎性细胞因子,IL-1β常作为特异性炎症标志物。
IL-1β的“好”
IL-1β是诱导睡眠机制的一部分,并增加非快速眼动睡眠,IL-1β具有昼夜节律,在睡觉前升高,但如果你是夜班工人,它会转移到白天。
IL-1在记忆功能中发挥作用,所以人需要一定水平的IL-1,但要“尽可能低”。
在啮齿动物中,IL-1β增加了催产素和加压素的释放。
IL-1β增加NGF。
NGF和NT-3在刺激神经突起生长方面有些独特,这是NGF、BDNF或NT-4无法单独完成的。IL-1β还会增加GDNF,这再次刺激神经突起的生长。
此外,它可以通过增加bFGF来增加多巴胺促进神经元。
IL-1β的“坏”
如果你的IL-1水平升高,那么这将影响你的情绪、认知功能、清醒程度和动力,需要关注降低慢性炎症。
IL-1与抑郁症有关,可能通过减少雌激素合成、增加黄体酮分解影响情绪,同时降低雄性激素水平。压力可通过IL-1b介导的途径导致抑郁,同时损害认知能力,影响学习和记忆,这可能与脑源性神经营养因子(BDNF)的减少有关。
IL-1通过抑制食欲素引起疲劳,并与焦虑、HPA轴激活、IBS、认知缺陷和多种慢性疾病相关。
IL-1β与低睾酮水平相关,可能通过影响甲状腺激素和皮质醇水平降低性能。它还抑制胰岛素释放,影响血糖水平,降低乙酰胆碱水平,并在肠道中抑制胃酸,可能导致幽门螺杆菌感染失控。
IL-1β与肠道菌群的关联
★ 如何减少IL-1β?
饮食:蔬菜和水果(花青素)、芹菜、生姜、十字花科蔬菜(西兰花、花菜)、燕麦鱼(虾青素)等。
益生菌:植物乳杆菌等
其他补充剂:维生素A、VB2、穿心莲、β-葡聚糖、葡萄籽提取物、水飞蓟素、红景天、黄连素、小檗碱、葡萄籽提取物、鱼油、茶多酚、蜂蜜、黄芩苷、迷迭香酸、丹参、锌(如果缺乏)、苜蓿、白术、紫苏等。
IL-6是与系统性炎症相关的炎症因子,调节免疫反应,参与激活和分化T细胞,促进B细胞分化和抗体产生,促进急性期蛋白的合成,促进中性粒细胞的募集,参与炎症性疾病的发生发展。
IL-6在中枢神经系统中也发挥作用,参与调节神经炎症和情绪反应。
IL-6可以通过两种方式激活细胞:
IL-6在你生病和运动后升高,特别是有氧运动。如果运动增加炎症标志物,那么怎么理解运动是健康的?
当你运动时,肌肉会释放IL-6,这是抗炎的。然而,当免疫细胞(巨噬细胞)释放它时,它是促炎性的。
IL-6还抑制Th1细胞,同时诱导Th2细胞,因此对Th2占主导地位的人来说情况更糟。它还增加了B细胞,这是产生抗体并导致过敏和自身免疫的原因。
不易患自身免疫性疾病的人也可能患有IL-6升高。这是与现代文明病有关的细胞因子。最常见的原因可能是肥胖。
IL-6升高的其他常见原因可能是慢性压力、睡眠太少、吃得太多(特别是吃太多糖或精制食品)、吸烟、过量酒精、运动过多。
IL-6的“坏”
IL-6水平在几乎所有疾病状态中都升高。
它减少了Treg细胞,这反过来又阻碍了我们对摄入的蛋白质产生耐受性的能力-引起过敏。它还增加了中性粒细胞的产生,这是炎症。
IL-6是中年后期认知能力下降的一个很好的预测因子。
IL-6可能会导致情绪恶化,绝望的感觉。IL-6还与暴力自杀、冲动和避免单调乏味相关。
IL-6导致血糖水平升高,增强了应激激素(CRH)对肠道粘膜的影响,导致IBS。IL-6可导致肠漏。
IL-6通过抑制(或超甲基化)对GABA正常工作重要的基因(GAD 67)而导致精神分裂症。
IL-6是CRP最有效的诱导剂,CRP就是我们前面讲的炎症标志物。
它可以通过增加IgG和IgM抗体产生和恶化食物敏感性和自身免疫问题。
IL-6也会导致皮肤问题。IL-6在患有皮肤真菌变色菌的人中升高。IL-6还增加了Th 22细胞,这破坏了皮肤微生物平衡。
IL-6的“好”
IL-6如果升高大多是不好的,但短暂的峰值可能是有益的。
TNF和IL-1β增加IL-6,但IL-6反过来抑制这两种细胞因子,其比IL-6本身更有害。在这种方式下,它是一种抗炎。抑制TNF,分解脂肪细胞并降低胰岛素抵抗。
IL-6在一些细菌、病毒和真菌感染中起保护作用。
IL-6的正常水平是什么?
在健康受试者中,IL-6血液水平几乎检测不到,范围在2-6 pg/ml之间。另一项研究提到,健康人的平均水平为0.5 pg/ml 。
抑郁症患者的IL-6水平比健康人高约1.78 pg/ml。
在患有风湿性关节炎的人中,水平可以增加到1000倍(不常见)。在败血症中,这是非常危险的,它可以增加到一百万倍。
IL-6与肠道菌群有什么关联?
高脂饮食会削弱粘液层的完整性,增加血液中LPS的水平,通过TLR-4传递,导致血液中TNF-α、IL-1、IL-6和PAI-1(纤溶酶原激活抑制剂-1)的水平升高,引起系统性炎症。
坏死的肠道粘膜细胞会刺激巨噬细胞产生IL-6。
★ 如何减少IL-6?
生活方式:情绪积极、睡眠不足后的小睡、听音乐等。
饮食:地中海饮食、燕麦、多酚、坚果(腰果)、豆类、橄榄油、蔬菜、蓝莓、红树莓、蜂蜜等。
其他补充剂:鱼油、植物甾醇、螺旋藻、维生素B2、VB12、VE、镁、铬、锌、精氨酸、组氨酸、甘氨酸、银杏、维生素E、黄芩苷、乳铁蛋白、葡萄籽提取物、黄芪、丹参、紫锥菊、迷迭香酸、牛至、鼠尾草等。
IL-10是一种重要的抗炎因子。
它能抑制促炎细胞因子的产生(如TNF-α、IL-1β、IL-6),降低抗原呈递细胞的活性,减少炎症细胞的募集,有助于炎症反应的消退。抑制Th1细胞的活化,从而调节Th1/Th2平衡。
IL-10的“好”
在自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮等)和移植免疫中,IL-10有助于防止自身反应性T细胞的活化,减少对移植器官的排斥反应。
IL-10抑制COX-2,这是参与偏头痛,疼痛和炎症。COX-2通常被非甾体抗炎药如阿司匹林和布洛芬阻断。
通过抑制肥大细胞,它抵消了这些细胞在过敏反应部位的炎症作用。
IL-10通过减少暴饮暴食并降低下丘脑(控制食欲的腺体)中的胰岛素和瘦素抵抗(通过抑制细胞因子、Nf-kB和ER应激)来减少肥胖。
IL-10的“坏”
IL-10可以阻断对病毒感染的反应,甚至直接增加病毒蛋白的产生,比如说,在慢性疲劳综合征中,IL-10增加;慢性感染的丙型肝炎患者在遗传上倾向于高IL-10产生,对治疗的积极反应较低。
平衡 IL-10 的“好”与“坏”
Th 1免疫系统,特别是CD 8 + T细胞和IFN γ,是人体对抗癌症的机制的一部分。阻断IL-10显示出作为癌症治疗的前景。然而,IL-10在某些情况下也通过促进细胞毒性T细胞活性和IFN-γ产生而发挥保护性抗癌作用。
重要的是认识到全身和癌组织中的IL-10水平之间存在差异。如果IL-10在正常组织中处于健康水平,在癌组织中处于低水平,那么这是比较理想健康的。
血液中IL-10的水平并不一定代表肠道或其他组织中的水平,但通常存在相关性。
在现代环境中,高IL-10水平可能比低IL-10水平更好,因为可以对抗细菌感染。
IL-10与肠道菌群有什么关联?
乳杆菌、双歧杆菌、普氏粪杆菌、某些产丁酸菌:能促进IL-10的产生,从而改善肠道炎症。
益生菌通过促进调节性T细胞(Treg)的分化来增加IL-10的产生。
★ 如何增加IL-10?
生活方式:运动、晒太阳、冥想等。
饮食:芝麻油、肉桂、大蒜、辣椒素、甘草、芥末等。
益生菌:植物乳杆菌、布拉氏酵母菌、干酪乳杆菌、枯草芽孢杆菌等。
益生元:阿拉伯半乳聚糖
其他补充剂:姜黄素、表儿茶素EGCG、Boswellia、橄榄苦苷、褪黑素、白藜芦醇、维生素D3、辅酶Q10、植物甾醇等。
IL-17(白细胞介素-17)是一种重要的促炎细胞因子,在自身免疫和炎症反应中发挥关键作用。IL-17能够促进多种细胞产生炎症因子,如IL-1β、TNF-α和IL-6,促进中性粒细胞募集,加剧炎症反应。
在肿瘤微环境中具有双重作用,既可以促进抗肿瘤免疫反应,也可能促进肿瘤的侵袭和转移。
与自身免疫性疾病、肿瘤、感染性疾病等相关。
IL-17水平的变化可以作为某些疾病预后的生物标志物。
IL-17 C属于IL-17细胞因子家族,由上皮细胞而不是免疫细胞产生。它作为对上皮损伤的快速局部自分泌反应,促进抗微生物保护反应和肠屏障维持。
分节丝状菌(SFB):通过其鞭毛蛋白促进其产生。
青春双歧杆菌(Bifidobacterium adolescentis):能够诱导肠道Th17细胞积累,从而促进IL-17的产生。
IL-22(白细胞介素-22)是IL-10家族的重要成员,主要参与组织修复和黏膜免疫。
具体来说,IL-22在组织损伤后的修复和再生过程中起着重要作用,特别是在肝脏和肠道等上皮组织中。
它是一种促炎细胞因子,但它也能发挥抗炎作用,特别是在抑制过度的炎症反应和促进组织稳态方面。
IL-22能够增强上皮细胞的抗菌肽表达,从而增强机体对细菌和病毒感染的防御能力。
在急性结肠炎中具有保护作用,但在慢性结肠炎中,IL-22与IL-17A协同介导致病性。
分节丝状菌(SFB):通过鞭毛蛋白参与调节其产生,诱导SAA产生来促进IL-22的分泌,刺激树突状细胞促进IL-22的产生。
IFNγ(干扰素-γ)是一种重要的细胞因子,它在免疫反应、抗感染、抗肿瘤和调节免疫应答中扮演着重要角色。
IFNγ是Th1细胞介导免疫反应的关键因子,它能够促进Th1细胞的分化,并抑制Th2细胞的分化,从而调节Th1/Th2平衡。
在某些自身免疫性疾病中,如多发性硬化症和类风湿性关节炎,IFNγ的过度产生与疾病的发生和发展有关。
肿瘤:IFNγ在肿瘤免疫监视中起关键作用,但其在肿瘤微环境中的作用可能更为复杂,包括促进肿瘤免疫逃逸。
TGF-β(转化生长因子-β)是一种多功能细胞因子,在调节免疫反应和促进Tregs细胞的增殖中起作用。
肠道菌群的变化可以影响TGF-β的产生,进而影响Tregs和Th17细胞的平衡。
丁酸梭菌,诱导树突状细胞中TGF-β信号传导,进而诱导调节性T细胞(Treg)的产生。
以上我们了解一些常见的炎症因子的功能,与肠道菌群的关联,基于这一认识,我们将进一步探讨这种异常变化如何表征不同疾病的风险,以及如何通过早期干预来预防和治疗相关疾病。
在探讨肠道菌群与炎症因子异常之间的关系时,我们不得不关注它们在多种慢性疾病中的作用,尤其是那些与炎症密切相关的疾病。
这里我们通过举例分析几种典型疾病(抑郁症、心血管疾病、炎症性皮肤病)中肠道菌群与炎症因子的动态变化特征,更深入地理解肠道菌群如何作为炎症反应的早期指标,为疾病的早期预防和个体化治疗提供科学依据。
抑郁症是一种常见的精神障碍,其特征为情绪低落、食欲不振和高自杀率。研究表明,炎症反应在抑郁症的发病中起着关键作用,炎症水平的紊乱可增加抑郁症的发病率。
调节炎症水平可能是肠道菌群影响宿主健康的途径之一。通过调节特异性肠道菌群和炎症反应,可以实现抑郁症的早期预测、预防和个性化治疗。
➤ 抑郁症
一项研究通过孟德尔随机化分析方法确定了15个与抑郁症相关的肠道菌群分类群和4种细胞因子,并证实了某些细胞因子在肠道菌群对抑郁症影响中的介导作用。
研究发现,Romboutsia、Intestinimonas、瘤胃球菌UCG 011等对抑郁症具有保护作用。
Romboutsia,Ruminococcaceae UCG 011,Intestinimonas都是产丁酸菌,临床研究发现,Romboutsia的丰度与帕金森病患者的抑郁状态呈负相关。同样,应激耐受性较差的小鼠含有较少的Romboutsia,导致对抑郁症的易感性更高。
Intestinimonas与IL-10水平呈正相关,与能够修复肠道损伤的促炎细胞因子DAO、D-LA呈负相关。
瘤胃球菌科UCG 011能够影响促炎细胞Th17的分化,减少促炎细胞因子IL-17的分泌,改善慢性炎症,缓解疼痛和焦虑抑郁症状。
毛螺菌FCS 020、链球菌、Marvinbryantia等被确定为抑郁症的危险因素。
毛螺菌科FCS 020能够诱导炎症反应,与血清脂多糖和细胞因子产生正相关,并且在自闭症儿童中丰度增加。
链球菌是一种与LPS密切相关的促炎性肠道菌群。
Marvinbryantia在慢性轻度应激大鼠中数量增加。
ADA 和 IL-18 R1是抗抑郁的保护性细胞因子。
VEGF_A和TNFSF 14是促进抑郁的危险因子。
抑郁症的严重程度与VEGF_A呈正相关。这可能与VEGF介导的血脑屏障功能障碍有关。许多抗抑郁药物通过调节VEGF_A发挥抗抑郁作用,因此VEGF_A对抑郁症的治疗效果具有预测作用。
TNFSF 14是TNF受体超家族的成员,其通过激活NF-κB信号通路促进促炎细胞因子的产生。TNF损害神经递质的合成并降低5-羟色胺的可用性,导致神经毒性代谢物的积累,这反过来会导致神经系统损伤并导致抑郁症。
循环细胞因子介导的肠道菌群对抑郁症的影响
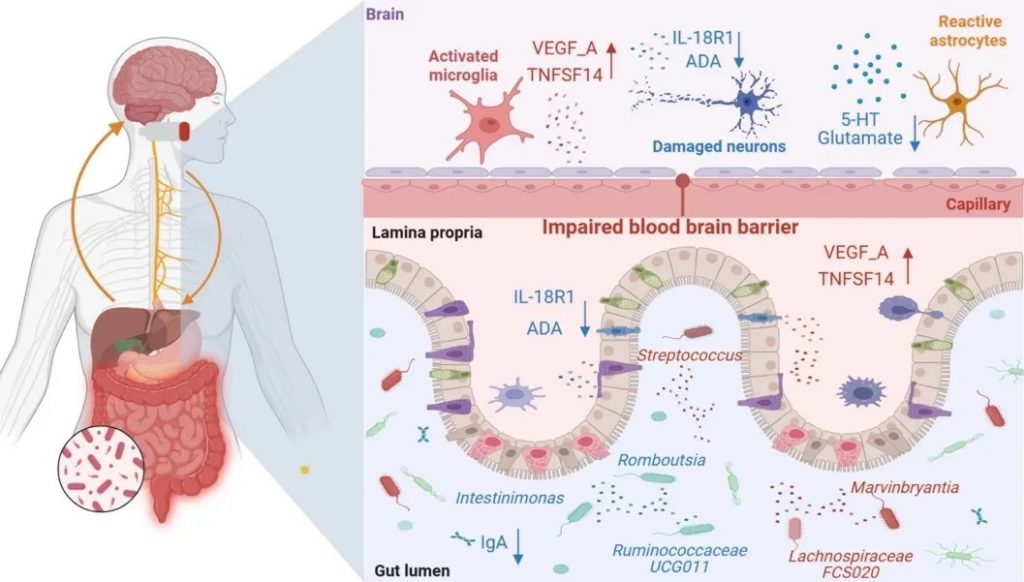
doi.org/10.1007/s13167-024-00379-z
➤ 重度抑郁症(MDD)
一项研究探讨了首发未经治疗的重度抑郁症(MDD)患者的肠道菌群组成与炎症因子和认知功能之间的关系。
研究发现MDD患者的肠道菌群多样性显著降低,某些菌群如拟杆菌属、Alistipes增加;一些菌群如梭菌科、Turicibacter减少。这些肠道菌群的改变与炎症因子(如IL-6、CRP)水平升高以及认知功能障碍(如执行功能、记忆力下降)显著相关。
在MDD患者中,拟杆菌科和拟杆菌属均与hsCRP、CCT1、CCT2呈正相关。
拟杆菌属是嗜酸性和革兰氏阴性的,是存在于人类胃肠道系统中非常丰富的细菌。拟杆菌属的某些菌株由于其许多能力对人类健康有利。然而,当人们经历压力,如休克,虐待,失去家庭成员等。拟杆菌属物种的某些菌株如脆弱拟杆菌可分泌脂多糖(LPS)、细菌淀粉样蛋白、内毒素(如脆弱溶素)和外毒素。这些神经毒素刺激各种细胞类型中TNF-α、IL-1β、IL-8、IFN-γ、CXCL 8和其他炎性细胞因子和趋化因子的释放,导致对这些细菌分子病原体的炎症反应。
活化的炎症反应可以破坏肠粘膜屏障以及血脑屏障,并且进一步地,它们可以活化CNS的小胶质细胞。发现活化的小胶质细胞参与促炎细胞因子的分泌,包括IL-1β、IL-6、TNF-α和TGF-β,从而有助于患有神经障碍的个体中认知障碍的发展。
Alistipes与IL-6呈正相关,与延迟记忆、总分和标准化评分呈负相关。
Alistipes也是促炎细菌,有研究表明,Alistipes属以IL-6依赖性方式参与促进炎症和肿瘤发生。本研究中Alistipes与IL-1、IL-6无显著相关性,与TNF-α呈负相关。因此,Alistipes可以通过炎症反应以外的其他方式加重认知障碍。
扩展阅读:
肠道重要菌属——另枝菌属(Alistipes),调节炎症情绪等的潜力菌
Clostridiaceae、Turicibacterae、Turicibacter与IL-1β和IL-6均呈负相关。
➤ 伴有厌食症的重度抑郁症
与健康个体相比,患有厌食症重度抑郁症患者具有不同的肠道微生物群,具有更高的CRP水平。伴厌食症的抑郁症患者中Blautia含量更丰富,并与CRP、HAMD评分和厌食症呈正相关。肠道菌群可能通过炎症因子CRP影响MDD和厌食症。
粪杆菌、拟杆菌、Roseburia和副拟杆菌与厌食、HAMD评分和CRP水平呈负相关。
短链脂肪酸通过干扰NF-κB通路发挥抗炎作用,补充短链脂肪酸可以减少炎症并缓解抑郁症状。
因此,MDD患者中产短链脂肪酸菌的减少可能会通过炎症反应引起抑郁症。这些炎症分子干扰食欲并促进厌食。下丘脑的炎症通过上调5-羟色胺的可用性,并刺激其在下丘脑中的信号传导途径而引起厌食症。
总的来说,由于肠道生态失调引起的免疫失衡是抑郁症发病的早期风险指标。这为利用无创肠道菌群检测对抑郁症进行早期筛查、及时预防和个性化治疗提供了依据。通过将非侵入性肠道菌群检测与现有方法(如心理问卷)相结合,可以共同预测和评估患抑郁症的风险。
心血管疾病(CVD)对人类健康构成了巨大的威胁。炎症是心血管疾病病理过程的普遍原因,包括免疫细胞的激活、积聚和炎症因子的释放。
➤ 动脉粥样硬化(AS)
动脉粥样硬化是CVD的病因之一。脂质沉积和持续性血管炎症被认为是动脉粥样硬化斑块进展的两个核心因素。
一项基于粪便宏基因组学、临床测量和流行病学的研究表明,日常饮食通过影响肠道微生物群促进动脉粥样硬化的形成,而抗炎反应功能障碍可能是核心过程。
脆弱拟杆菌的增加减少了乳酸杆菌的丰度,增加了脱硫弧菌科的丰度,导致葡萄糖或脂质代谢功能障碍,加重炎症反应。
循环中低密度脂蛋白含量显著增加,斑块中CD 36、F4/80增加,促进主动脉斑块的形成和动脉粥样硬化的进展。
衰老是动脉粥样硬化发展的另一个关键危险因素。
在炎症反应加重的衰老个体中,参与花生四烯酸(AA)代谢途径的组分(如20-HETE、PGF 2 α、花生四烯酸和LTB 4)显著增加。因此,建议肠道微生物群与动脉粥样硬化可能通过“肠道微生物群-代谢物-局部炎症-动脉粥样硬化”轴联系起来。
花生皮提取物(PSE)可降低动脉粥样硬化小鼠的血清TC和LDL-C含量,增加HDL-C含量,从而减缓动脉粥样硬化斑块的形成。
天麻素可以调节肠道微生物种类和丰度,降低促炎细胞因子TNF-α和IL-6的水平,增加抗炎因子IL-10的水平。
通心络干预是一种传统中药,通过增加肠道中益生菌的水平来改变斑块稳定性,从而增加有益代谢产物的含量,如反式阿魏酸,这可以抑制斑块中NLRP 3相关的炎症通路并稳定斑块。
乳酸杆菌的管理减少了来自受干扰的肠道微生物群的毒素,并增加了SCFA的水平,抑制了动脉粥样硬化的进展。
黄酮类化合物通过抑制TMA裂解酶而具有治疗冠心病的作用。
燕麦纤维可以防止动脉粥样硬化的恶化,阻断了TLR 4信号通路,降低了NF-κB p65的表达,并通过影响肠道微生物源性异丁酰-L-肉碱、戊酰肉碱、1-甲基鸟苷和2-甲基鸟苷来维持肠粘膜屏障的完整性。
鱼油衍生的长链单不饱和脂肪酸(LCMUFA),通过降低厚壁菌门和拟杆菌门的比例,增加肠道中阿克曼氏菌的丰度,上调SCFA以及SCFA诱导的一些胰高血糖素样物质来维持肠道微环境的平衡,降低了血清中炎性细胞因子的水平,抑制了动脉粥样硬化病变的进展。
支链氨基酸(BCAA)补充剂可以通过调节炎症来减轻动脉粥样硬化,包括减少巨噬细胞浸润、降低炎症因子的血清水平和抑制炎症相关信号通路。
➤ 慢性心力衰竭(CHF)
对53名慢性心力衰竭患者和41名对照成员的粪便宏基因组分析显示,慢性心力衰竭患者的肠道微生物群组成和代谢特征与对照组有显著差异,提示肠道微生物群功能障碍与慢性心力衰竭密切相关。
当肠道微生物群被破坏时分泌的LPS,以TLR4依赖性方式减少ZO-1紧密连接(TJ),并诱导肠上皮TJ的明显变形,导致肠屏障完整性的破坏。
心力衰竭患者会发生慢性全身炎症反应,血浆中几种促炎细胞因子的水平与疾病的严重程度和预后相关。肠道微生物群破坏和细菌产物(如LPS)易位到血液中是炎症过度状态的主要因素。
LPS是最强的促炎介质之一,可诱导心力衰竭患者血清中TNF-α、IL-1和IL 6的释放。另一方面,LPS通过TLR 4直接诱导心肌细胞损伤。
研究表明,晚期心力衰竭患者心脏中TLR 4的表达增加,与心脏炎性损伤高度相关,而抑制TLR 4可缓解心力衰竭的进展。
然而,一些研究表明,通过适当调节肠道微生物群,从而减轻或逆转心室重塑,可以减轻炎症。
目前有报道称,一些中药,如芪荔强心(QL),可稳定心力衰竭后的肠道菌群,通过减少炎症因子(如NLRP 3、IL-1β和TNF-α)的产生来抑制心肌纤维化和心脏重塑。
严重的心力衰竭总是伴随着肠道功能障碍。因此,重视肠功能的维持,可能会改善心力衰竭患者的预后。
肠道微生物群失衡会加重心血管疾病
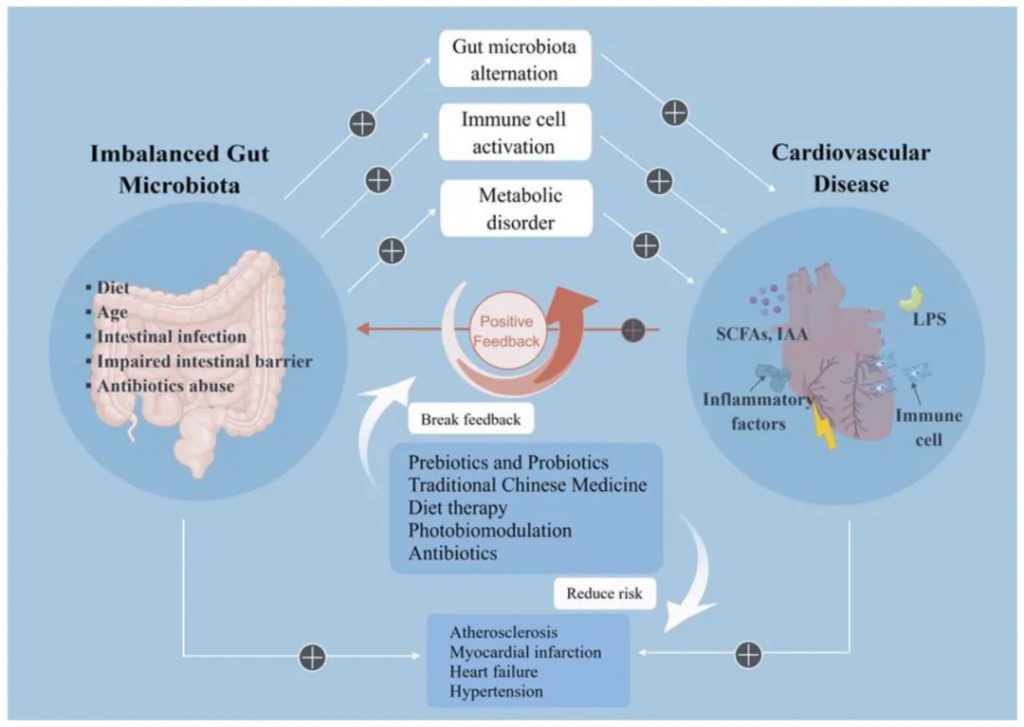
doi.org/10.3390/nu15030607
➤ 高血压
• 高盐饮食与肠道菌群失衡:
高盐饮食导致乳杆菌属减少,这些菌株能够产生肠道吲哚-3-乳酸,进而影响Th17细胞的活化。
• Th17细胞与炎症因子IL-17A:
Th17细胞的活化与IL-17A的产生增加有关,IL-17A通过上调肾脏中的钠转运蛋白(如钠氢交换蛋白3和氯化钠共转运蛋白)促进肾钠再吸收,这可能导致盐敏感性高血压。
• 益生菌治疗与血压调节:
用鼠乳杆菌(Lactobacillus murinus)进行的益生菌治疗可以预防小鼠的盐敏感性高血压,这表明通过调节肠道菌群可以影响血压。
• 高盐饮食与肠道菌群代谢物:
高盐饮食降低了肠道中脆弱拟杆菌和花生四烯酸的水平,这可能增加肠源性皮质酮的产生,进而提高血清和肠道中的皮质酮水平,促进血压升高。
• 饮食中钠的减少与SCFA:
减少饮食中的钠可以增加循环中的短链脂肪酸(SCFA),降低血压,这表明菌群代谢物SCFA可能在血压调节中发挥作用。
• 神经炎症与高血压:
肠道微生物群的紊乱及其代谢产物失调,会刺激巨噬细胞释放过量的炎症因子,加剧高血压的进展。
• 交感神经系统的激活与肠道菌群:
交感神经系统的激活增加了肠粘膜的渗透性,破坏了肠道微生物群的平衡,导致炎症细胞的动员和分化,这些炎性细胞返回大脑后加重神经炎症。
双歧杆菌能够增加eNOS的活性,降低血清过氧化氢酶的活性,这可能有助于维持血管的舒张和降低血压。
高纤维饮食增加了共生细菌的丰度,抑制了机会致病菌的繁殖,例如,产乙酸菌比例的增加有效降低了血压,减轻了心脏肥大和纤维化。
总的来说,维持肠道微生物群的稳定性对CVD的进展具有抑制作用。合适的饮食疗法,如益生菌和益生元补充剂,可以维持肠道微生物群的平衡,这已被证明可以有效降低血液中炎症因子的水平,改善心血管疾病的预后。
炎症性皮肤病代表了一组具有多种病因的疾病,包括遗传因素、感染和免疫失调,涉及先天性和适应性免疫系统中各种免疫细胞和炎症介质的激活。
一项研究首次使用双样本MR分析评估肠道微生物群与炎症性皮肤病之间的双向因果关系。
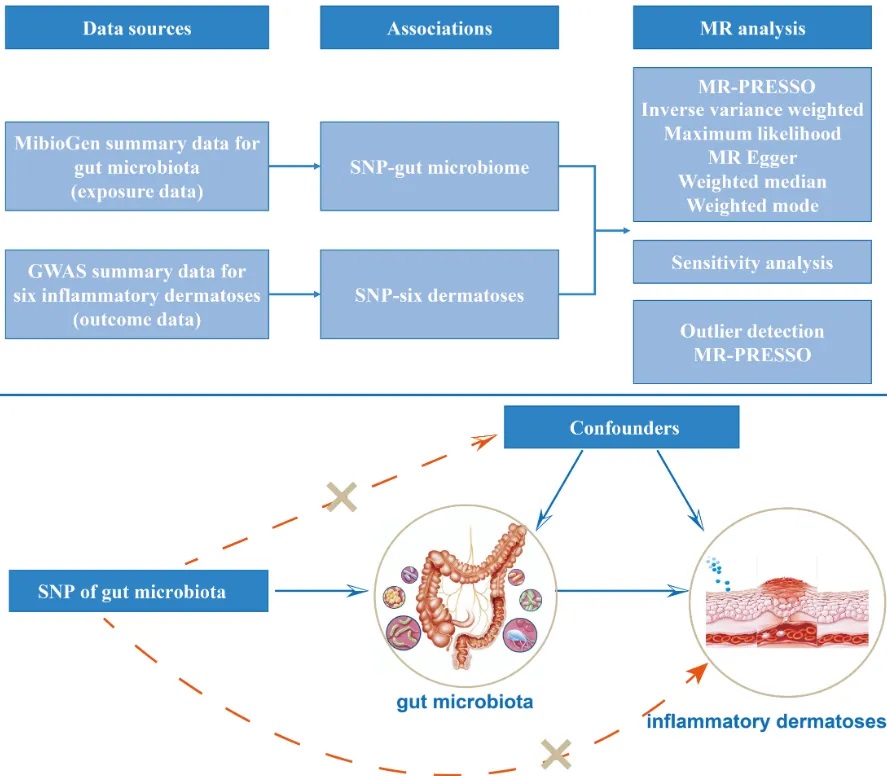
doi.org/10.3389/fimmu.2023.1231848
▸阿克曼氏菌属、瘤胃球菌属、双歧杆菌属、真杆菌属、粪球菌属等:
产生乙酸盐、丙酸盐和丁酸盐,通过GPCR和PPARγ受体调节免疫细胞,减少炎症因子释放,抑制组蛋白脱乙酰酶(HDAC),促进线粒体脂肪酸β-氧化。
▸乳酸杆菌和双歧杆菌:
增加色氨酸(Trp)和Trp代谢物,维持肠道屏障功能,减少痤疮炎症。
▸长双歧杆菌特殊作用:
将Trp代谢为吲哚-3-甲醛(I3C),通过AHR途径抑制Th2细胞,缓解特应性皮炎(AD)。
▸双歧杆菌、乳杆菌、Roseburia:
将多不饱和脂肪酸代谢为共轭亚油酸(CLA),抑制COX-2/5-LOX途径,抑制TLR4/NF-κB信号通路,减轻特应性皮炎皮肤病变。
▸硫酸盐还原菌(SRB):
如Desulfovibrionaceae,产生硫化氢(H2S),干扰丁酸盐氧化,损害肠道屏障,增加炎症因子释放。
以银屑病(牛皮癣)为例
银屑病是一种慢性复发性炎症性皮肤病,其特征是促炎细胞因子的释放增加。
Th-1、Th-17、Th-22细胞的扩增和活化, 一旦活化,这些细胞促进大量促炎介质的产生,包括但不限于来自角质形成细胞、淋巴细胞和其它免疫细胞的TNF-α、IL-6、IL-1、IL-17、IL-22、IL-23、VEGF、IFN-γ。此外,这些细胞促进皮肤病变的免疫发病机制,并在银屑病过程中驱动全身参与。
通过健康的饮食和运动获得的体重减轻能够改善银屑病的临床病程和治疗反应,甚至防止其发生,这种平衡的一个关键因素是肠道微生物群。(这在我们之前的文章中也详细阐述过)
肠道菌群在代谢综合征和银屑病中的多效性作用
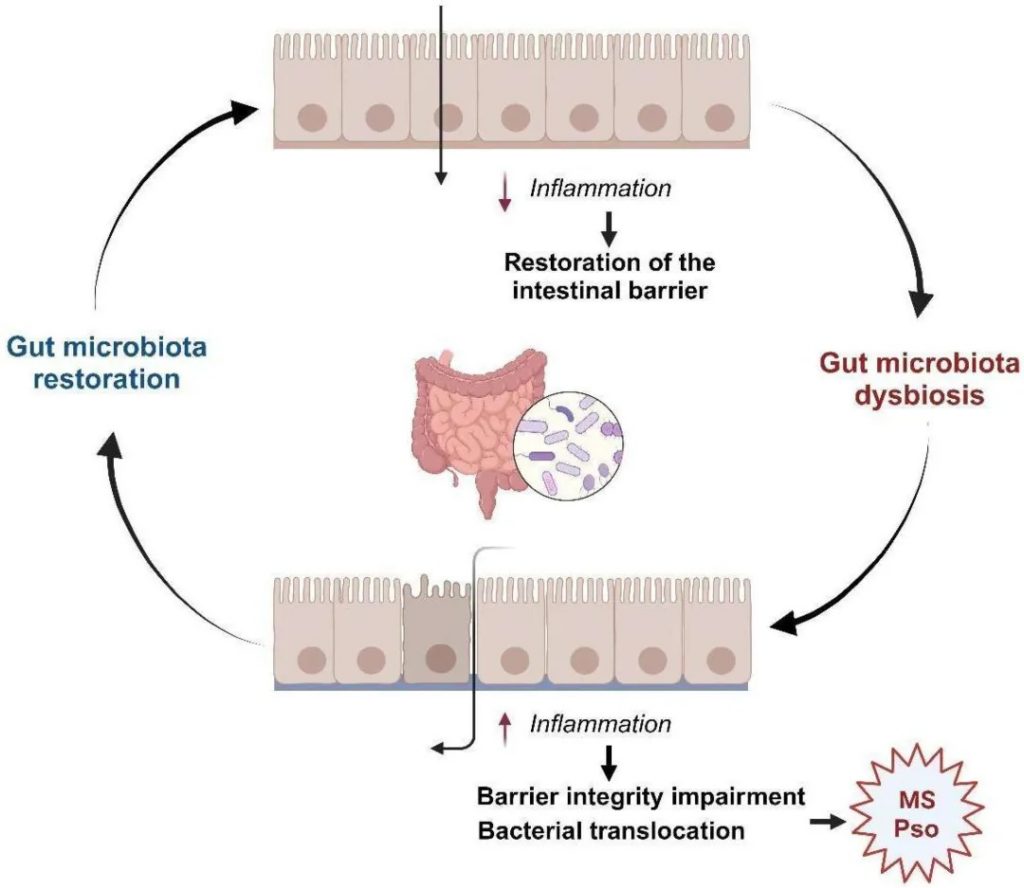
doi.org/10.3390/ijms25158098
哪些菌群产生炎症因子,影响银屑病发生发展?
厚壁菌门中,金黄色葡萄球菌(Staphylococcus aureus)产生超抗原如TSST-1,其刺激角质形成细胞和DC分别产生促炎细胞因子和IL-23。这导致Th17细胞活化和IL-17产生,促进银屑病特征。
放线菌门中,纹状体棒状杆菌(Corynebacterium striatum)直接刺激角质形成细胞和DC产生IL-1β、IL-6和IL-23,增强Th17细胞分化。
在变形菌门中,大肠杆菌和粘膜奈瑟氏菌(Neisseria mucosa)通过LPS激活巨噬细胞和DC,触发IL-23、IL-6和IL-1β的产生,从而稳定Th17细胞并促进IL-17的产生。
孢子形成细菌如梭菌和脆弱拟杆菌通过诱导结肠T淋巴细胞和平衡Th1/Th2/Th17细胞来调节免疫应答.
分节丝状细菌(SFB)诱导Th17细胞分化。
在标准治疗的协同作用下,可以建议采用适当的饮食或其他干预措施来调节肠道菌群,从而改善银屑病的临床表现,并降低合并症的发生率。
婴儿双歧杆菌35624和1:1:1的益生菌混合物(即长双歧杆菌CECT 7347、乳双歧杆菌CECT8145、鼠李糖乳杆菌CECT 8361)在8至12周的治疗过程后,要么降低促炎TNF-α和血浆C-反应蛋白,要么降低患者的银屑病面积和严重程度指数。
在用咪喹莫特治疗的BALB/c小鼠中,戊糖乳杆菌GMNL-77显著降低了红斑鳞屑病变和促炎细胞因子如IL-23和IL-27的mRNA水平。
有趣的是,补充短双歧杆菌CCFM683有效地下调了角蛋白16/17、IL-17和TNF-α的表达,通过调节FXR/NF-κB通路和角质形成细胞增殖来改善银屑病。
以上我们了解了炎症因子在多种疾病中的作用机制,以及肠道菌群如何通过影响这些因子的水平和功能来调节炎症反应。炎症因子不仅反映了炎症的状态,还可以作为疾病进展和治疗效果的生物标志物。
为了有效地评估炎症因子的变化,临床上采用了多种检测方法。这些方法能够提供准确的炎症因子水平信息,辅助医生做出及时的诊断和治疗决策。接下来,我们将详细介绍几种常用的检测技术。
检测体内炎症通常需要特定的血液检查,以测量指示炎症反应的各种标志物。
◉ ELISA(酶联免疫吸附测定)
原理:抗原-抗体特异性结合,通过酶标记检测
优点:
灵敏度高、特异性强、可批量检测
缺点:
检测时间较长、操作步骤多、成本较高
适用:
IL-1β、IL-6、TNF-α等细胞因子的定量检测
◉ 化学发光免疫分析
原理:利用化学发光物质标记抗体或抗原
优点:
检测速度快、灵敏度高、自动化程度高
缺点:
仪器要求高、试剂成本高
适用:CRP、PCT等急性期蛋白的快速检测
◉ 免疫比浊法
原理:
抗原抗体形成免疫复合物产生浊度
优点:
操作简单、成本低、检测快速
缺点:
灵敏度较低、易受干扰
适用:CRP、血清淀粉样蛋白等的常规检测
◉ 流式细胞术
原理:通过荧光标记检测细胞因子
优点:
可同时检测多个指标、特异性强、定量准确
缺点:
设备昂贵、要求技术人员专业水平高
适用:细胞内细胞因子和膜表面标志物检测
◉ PCR技术
原理:检测炎症因子的基因表达水平
优点:
灵敏度极高、特异性强、可检测微量样本
缺点:
操作复杂、成本高、易污染
适用:炎症因子基因表达研究
◉ 蛋白质芯片
原理:多种抗原抗体反应的微阵列分析
优点:
可同时检测多个指标、样本用量少、高通量
缺点:
成本高、技术要求高、标准化难度大
适用:多种炎症因子的同时检测
◉ 肠道菌群健康检测
原理:通过分析肠道菌群及其代谢产物的变化情况,间接反映人体的炎症状态
优点:
非侵入性、可重复采样、早期预警、利于干预、反映整体状态、长期监测
缺点:
成本高、技术要求高、数据分析复杂
适用:多种炎症因子的同时检测
通过肠道菌群监测炎症因子的方法虽然存在一些局限性,但其独特的预警价值和非侵入性特点使其成为传统炎症监测方法的重要补充。
随着技术的进步和研究的深入,这种检测方法的局限性正通过多种创新手段得到克服:
这些技术创新显著提升了肠道菌群检测在临床应用中的价值,特别是在精准医疗和预防医学领域,使其成为疾病预警和健康管理的重要工具。
饮食方式
地中海饮食(MD)包括水果、蔬菜、全谷物、橄榄油、红酒等,可能对IBD有益。有证据表明,地中海饮食后可降低IBD和炎症的发生率。地中海饮食有助于抗炎菌群的存活,并防止肠道微生物群的失调发展。
通过调节肠道微生物群,改变肠道微生物组成,增加SCFA水平,降低尿TMAO水平,地中海饮食可以成为阿尔茨海默的潜在治疗干预措施。此外,更严格地遵守地中海饮食会延缓阿尔茨海默的进展,并提供1.5-3.5年的阿尔茨海默防护。
更多抗炎饮食,详见我们之前的文章:
益生菌
益生菌引入人体后,不仅会产生抗炎代谢产物,下调IL-6、IL-12、TNF-α等炎症因子和NF-κB通路等相关信号通路,还有助于抑制病原体的生长,修复肠道屏障,调节初始淋巴细胞的分化和增殖。
在BALB/c小鼠中,引入干酪乳杆菌可以预防肠道和关节炎症,不仅在膝盖,还在肠系膜和腘淋巴结中下调IL-1β、IL-6、IL-17、IL-23、TNF-α。
在一项涉及18名活动性强直性脊柱炎患者的试点研究中,补充嗜酸乳杆菌和唾液酸乳杆菌4周后,巴斯强直性脊柱炎疾病活动指数和视觉模拟量表有所改善。
此外,干酪乳杆菌、嗜酸乳杆菌、罗伊氏乳杆菌、双歧杆菌和嗜热链球菌的组合成功降低了用光受体间类维生素A结合蛋白免疫的C57BL/6小鼠的视网膜组织学评分,这是一种自身免疫性葡萄膜炎的动物模型。
在牙周炎的背景下,引入乳双歧杆菌HN019或罗伊氏乳杆菌显著改善了牙周炎的临床指标,包括减少探诊深度、减少探诊出血和降低手术风险。上述临床试验或动物实验中没有报告严重不良事件。
下一代益生菌,如F.prausnitzii、A.muciniphila,它们对IBD的治疗效果已经得到证实。这些益生菌可以减少浸润的巨噬细胞,抑制NF-κB信号通路,减少IL-8的产生,最终降低结肠炎的严重程度。
考虑到IBD和常见肠易激综合征之间肠道生态失调的相似模式,下一代益生菌在肠易激综合症管理中的应用也可能很有前景。
益生元
益生元是指微生物选择性利用以带来健康益处的底物。菊粉和低聚果糖等益生元的微生物发酵会产生代谢物(如SCFA),进一步调节肠道微生态系统和免疫反应。
在SpA的背景下,据报道,口服长链菊粉和低聚果糖可显著降低HLA-B27转基因大鼠结肠炎和关节炎的发病率。
对于牙周炎的动物模型,口服甘露寡糖成功地防止了牙槽骨丢失,降低了IL-10和IFN-γ的表达,下调了TNF-α和IL-1β的水平,并显著恢复了肠绒毛和隐窝深度。
值得注意的是,益生元具有广泛可接受的安全性,报告的严重不良事件很少。
后生元
在国际益生菌和益生元科学协会的指导下,益生元是指死亡的微生物或其对宿主有益的成分,包括SCFA、SBA等。
在SpA的背景下,直接外源性补充短链脂肪酸可以减轻各种动物模型中的关节炎严重程度。此外,口服短链脂肪酸还可以防止效应T细胞的激活和免疫细胞向脾脏和颈部淋巴结的运输,最终降低C57BL/6J和Kaede转基因小鼠模型中葡萄膜炎的严重程度。
该领域对原发性硬化性胆管炎的研究相对丰富。已经启动了几项为期12-24周的II期临床试验,报告称,无论是去甲熊去氧胆酸(SBA的衍生物)、奥贝胆酸(FXR配体)还是西洛菲索(FXR激动剂),都能显著降低原发性硬化性胆管炎患者(有或没有IBD)血清中的碱性磷酸酶。
此外,在患有IBD相关肝损伤的C57BL/6J小鼠中,添加乳脂球膜(Milk Fat Globule Membrane)与促炎细胞因子减少、Faccalibacumum和Roseburia恢复、结肠炎和肝损伤减轻以及谷胱甘肽转移酶途径的重新激活有关。
对于牙周炎患者,口服热灭活植物乳杆菌L-137有效地减少了同时接受支持性牙周治疗且基线深度不小于4mm的患者的探诊深度。
此外,小檗碱促进丁酸盐的产生,改善肠道屏障,降低循环LPS和促炎细胞因子水平,下调牙槽骨中的促炎细胞,最终改善牙周炎动物模型中的牙槽骨损失。同样,在后生元中也没有报告严重的不良事件。
抗生素
临床上,抗生素用于杀死致病菌或抑制其增殖。
在SpA的背景下,口服美罗培南和万古霉素有效地抑制了BALB/c和SKG小鼠脾脏中Th1和Th17细胞减少的外周附着点炎的发展。
对于葡萄膜炎,甲硝唑或万古霉素已被证明可以缓解葡萄膜炎,并增加用光受体间维甲酸结合蛋白预处理的B10.RII小鼠肠外淋巴组织中Tregs的丰度。
对于原发性硬化性胆管炎患者,应用万古霉素、甲硝唑和米诺环素可改善肝酶和梅奥风险评分。
此外,阿莫西林联合甲硝唑、单独甲硝唑和阿奇霉素可有效改善牙周炎患者的临床结果,其中阿莫西林联合甲硝唑在减少探诊袋深度、探诊出血和提高临床附着水平方面表现最佳。
粪菌移植 (FMT)
FMT是指将健康人类粪便中的微生物群移植到患者消化道中,使肠道微生态系统快速恢复的疗法。FMT的效果受到各种因素的干扰,包括供体的粪便质量、粪便的制备程序、给药方法和频率、FMT前的个体化肠道微生物组成(包括细菌、真菌和病毒)以及操作员技术。
一项试点随机对照研究表明,FMT组的内镜严重程度指数降低,C反应蛋白水平降低,这证明了FMT在维持克罗恩病缓解方面的疗效。
FMT还可以通过改善肠道微生物群的失调来减少肝脏脂肪积聚,从而减少NAFLD。
对FMT在阿尔茨海默病治疗中的作用的系统综述表明,FMT可以恢复SCFA和健康的微生物组,从而破坏阿尔茨海默患者的Aβ寡聚体,从而减少阿尔茨海默的发病机制。进一步机制研究表明,FMT降低了结肠、血清和SN中的LPS水平,抑制了TLR4/MyD88/NF-κB信号通路,使肠道微生物群和SCFA正常化,增加了突触素I的表达,并改善了阿尔茨海默模型小鼠的认知缺陷和Aβ沉积。
在许多慢性疾病中,例如肥胖症、动脉粥样硬化、2型糖尿病、炎性肠病、多发性硬化、类风湿性关节炎等,炎症是主要原因。肠道菌群的结构成分可能引发炎症,这可能引发一系列涉及白细胞介素和其他细胞因子的炎症反应。同样,某些短链脂肪酸和细菌代谢的其他代谢副产物可能有助于抑制炎症反应。因此,肠道菌群改变往往可能是炎症的预警信号,更早于临床症状的出现,其在疾病防治中的价值正逐渐被认识和挖掘。
特别是在当今精准医疗时代,结合人工智能深度学习算法、多组学整合分析等创新技术,肠道菌群检测的准确性和临床应用价值将得到进一步提升。随着检测技术的不断优化、数据分析方法的持续改进,以及临床验证研究的深入开展,肠道菌群检测将在疾病预警、健康管理、个体化治疗,响应监测以及预后评估中发挥越来越重要的作用。
未来,深入了解肠道微生物诱导的炎症因子的信号机制,有助于为肠道微生物诱导的炎症性疾病开发更精确、更有效的治疗方案。
本文内容仅供学习和交流目的,不构成任何形式的医疗建议。
主要参考文献
Chaudhary S, Kaur P, Singh TA, Bano KS, Vyas A, Mishra AK, Singh P, Mehdi MM. The dynamic crosslinking between gut microbiota and inflammation during aging: reviewing the nutritional and hormetic approaches against dysbiosis and inflammaging. Biogerontology. 2024 Oct 23;26(1):1.
Bai S, Bai H, Li D, Zhong Q, Xie J, Chen JJ. Gut Microbiota-Related Inflammation Factors as a Potential Biomarker for Diagnosing Major Depressive Disorder. Front Cell Infect Microbiol. 2022 Mar 15;12:831186.
Wu, J., Ou, G., Wang, S. et al. The predictive, preventive, and personalized medicine of depression: gut microbiota and inflammation. EPMA Journal (2024).
Liu P, Gao M, Liu Z, Zhang Y, Tu H, Lei L, Wu P, Zhang A, Yang C, Li G, Sun N, Zhang K. Gut Microbiome Composition Linked to Inflammatory Factors and Cognitive Functions in First-Episode, Drug-Naive Major Depressive Disorder Patients. Front Neurosci. 2022 Jan 28;15:800764.
Secchiero, P.; Rimondi, E.; Marcuzzi, A.; Longo, G.; Papi, C.; Manfredini, M.; Fields, M.; Caruso, L.; Di Caprio, R.; Balato, A. Metabolic Syndrome and Psoriasis: Pivotal Roles of Chronic Inflammation and Gut Microbiota. Int. J. Mol. Sci. 2024, 25, 8098.
Wang, W.; Zhu, L.-J.; Leng, Y.-Q.; Wang, Y.-W.; Shi, T.; Wang, W.-Z.; Sun, J.-C. Inflammatory Response: A Crucial Way for Gut Microbes to Regulate Cardiovascular Diseases. Nutrients 2023, 15, 607.
Mao R, Yu Q, Li J. The causal relationship between gut microbiota and inflammatory dermatoses: a Mendelian randomization study. Front Immunol. 2023 Sep 27;14:1231848.
Heinzel, S., Jureczek, J., Kainulainen, V. et al. Elevated fecal calprotectin is associated with gut microbial dysbiosis, altered serum markers and clinical outcomes in older individuals. Sci Rep 14, 13513 (2024)
Saedi, S., Derakhshan, S., Hasani, A. et al. Recent Advances in Gut Microbiome Modulation: Effect of Probiotics, Prebiotics, Synbiotics, and Postbiotics in Inflammatory Bowel Disease Prevention and Treatment. Curr Microbiol 82, 12 (2025).
Jukic A, Bakiri L, Wagner EF, Tilg H, Adolph TE. Calprotectin: from biomarker to biological function. Gut. 2021 Oct;70(10):1978-1988.
Zhao M, Chu J, Feng S, Guo C, Xue B, He K, Li L. Immunological mechanisms of inflammatory diseases caused by gut microbiota dysbiosis: A review. Biomed Pharmacother. 2023 Aug;164:114985.
Tie Y, Huang Y, Chen R, Li L, Chen M, Zhang S. Current insights on the roles of gut microbiota in inflammatory bowel disease-associated extra-intestinal manifestations: pathophysiology and therapeutic targets. Gut Microbes. 2023 Dec;15(2):2265028.
Nigam M, Devi K, Coutinho HDM, Mishra AP. Exploration of gut microbiome and inflammation: A review on key signalling pathways. Cell Signal. 2024 Jun;118:111140.
Soares CLR, Wilairatana P, Silva LR, Moreira PS, Vilar Barbosa NMM, da Silva PR, Coutinho HDM, de Menezes IRA, Felipe CFB. Biochemical aspects of the inflammatory process: A narrative review. Biomed Pharmacother. 2023 Dec;168:115764.
谷禾健康
桥本甲状腺炎(HT)是一种慢性自身免疫性甲状腺炎。其发病率因地区和人群而异,30~50岁人群发病率高,女性比男性患病率高很多。
近几十年来,HT发病率逐步升高,已成为全球公共卫生问题。此外,在碘充足地区,HT是成人甲状腺功能减退症最常见的原因。一项关于中国碘摄入量低、充足和过量地区人群甲状腺疾病发病率的研究显示,HT的累计发病率分别为0.2%、1%和1.3%。
桥本甲状腺炎的病理学特点为淋巴浆细胞浸润、组织纤维化、淋巴滤泡形成、实质萎缩、滤泡细胞嗜酸性改变。
最常见的临床表现是甲状腺肿大,可伴有或不伴有甲状腺功能减退症。肿大的甲状腺压迫颈部,可导致发音困难、呼吸困难和吞咽困难。由于甲状腺功能丧失和原发性甲状腺功能减退症,HT患者常有累及全身多个系统的其他症状,尤其是疲劳和便秘。
在患桥本甲状腺炎的早期,许多人经历了消化不适症状,其中大部分最初并没有将其与甲状腺功能减退或自身免疫性疾病联系起来。直到现在包括有的医生也不明白肠道健康与甲状腺和免疫系统健康有多么密切的关系!
甲状腺疾病或甲状腺功能障碍,例如桥本甲状腺炎(HT)和格雷夫斯病(GD)或甲状腺功能减退症,通常的认知是与不孕、荷尔蒙失调、体重增加、疲劳或焦虑等症状有关。
然而,鲜为人知的是,甲状腺功能障碍的胃肠道症状有很多,包括吞咽困难、胃灼热、消化不良、胃酸分泌减少、恶心或呕吐、胆囊不适、腹部不适、腹胀、腹泻、便秘以及包括肠易激综合征(IBS)在内的一般消化系统不适。胃肠道症状常由血清甲状腺激素改变引起,其中便秘是最常见的临床症状。HT患者常因甲状腺激素降低,肠道蠕动明显减弱,严重者可出现假性肠梗阻或肠梗阻。这是因为甲状腺激素如甲状腺素(T4)和三碘甲状腺原氨酸(T3)决定了整个身体,特别是肠道和内脏器官的基础代谢(完成生物任务/功能所消耗的能量)。
三碘甲状腺原氨酸(T3)还被认为是肠粘膜上皮细胞发育和分化的最重要调节剂之一 。临床上,甲状腺激素血液浓度的变化是胃肠道症状的原因,证据是腺体功能低下和亢进时经常出现的胃肠道紊乱。这种影响可能是由于胃肠道神经运动功能的改变,表现为肠道肌肉收缩传播速度的不同以及由于局部糖胺聚糖浸润导致的肌肉层水肿。
反过来,肠道屏障的破坏以及肠道菌群的失调对桥本甲状腺等自身免疫性疾病的影响非常重要。研究人员已将肠道通透性与每一种自身免疫性疾病联系起来,包括桥本甲状腺炎。
肠道菌群失调一方面导致肠道屏障受损,细菌易位,通过分子模拟、旁观者激活、表位扩散等一系列机制破坏甲状腺自身免疫中的免疫耐受性。
另一方面,它可以通过自身的脱碘酶活性和 促甲状腺激素(TSH)抑制直接影响甲状腺激素水平。肠道微生物群还影响对甲状腺很重要的矿物质的吸收,包括碘、硒、锌和铁。所有这些都是甲状腺功能所必需的,甲状腺功能障碍与这些矿物质水平的改变之间存在明显的联系。例如,碘缺乏可能导致甲状腺肿,可能是甲状腺结节,甚至滤泡性甲状腺癌。高碘摄入量可诱发易感患者的甲状腺功能减退或甲状腺功能亢进。铁是细菌生长所必需的,铁的利用率会影响微生物群的组成,同时,微生物群也会影响铁的利用率。铁对于有效利用碘和甲状腺激素合成至关重要,碘可能导致甲状腺疾病,包括甲状腺激素合成、储存和分泌受损。
目前传统医学对桥本氏病(自身免疫性甲状腺炎)的检查不够及时和全面。导致许多患者在未经充分评估的情况下就开始服用甲状腺药物(一线药物为左旋甲状腺素钠)。但是自身免疫性甲状腺炎患者常对常规药物治疗反应不佳。在精准医学时代,对不同细菌菌株所具有的酶活性的了解越来越多。研究证实肠道菌群组成会影响口服左旋甲状腺素的疗效,即通过改变肠道吸收表面或直接与细菌结合,如大肠杆菌所证明的那样。与肠道菌群正常的小鼠相比,无菌小鼠的促甲状腺激素增加了25%。此外,肠道菌群还在甲状腺激素的肠肝循环和代谢中发挥作用 :事实上,在小鼠和人类粪便内容物中都检测到了β-葡萄糖醛酸酶和硫酸酯酶活性 ,可能导致小肠水平上甲状腺激素的肠道解离和重吸收,可防止甲状腺素随粪便流失,从而使激素在肠肝内循环。
由于HT通常伴随患者终身,且难以康复,往往会严重影响患者的正常工作和生活质量。目前,HT尚缺乏有效的治疗方法,亟待寻找一种有效的,适应个体的干预手段来治愈疾病。
本文将就上述机制进行讨论,在本文中,您将了解有关桥本甲状腺炎和肠道的许多事实。您还将了解:
•桥本氏病的常见症状
•甲状腺和自身免疫与菌群失调和肠漏症的关系
•肠道细菌失衡的常见原因
•桥本应该接受实验室检查
•为什么许多人患甲状腺疾病的根本原因都是相同的
•为什么桥本氏病常常被误诊
•桥本甲状腺炎是可以逆转的
•饮食可以改变桥本甲状腺炎的病情
•桥本氏病患者可能缺乏的常见营养素
如果你服用 Synthroid/左旋甲状腺素或患有甲状腺功能减退症、甲状腺水平低或甲状腺功能低下,则很可能患有桥本甲状腺炎。
★ 注意:桥本甲状腺炎和甲状腺功能减退症不同
桥本甲状腺炎和甲状腺功能减退症并不总是一回事。虽然桥本甲状腺炎是甲状腺功能减退症的主要原因,但桥本甲状腺炎和甲状腺功能减退症之间还是有区别的。一个人可能患有其中一种,而不患有另一种。
大多数单纯性甲状腺功能减退症可通过服用甲状腺激素来治愈。然而,约95%的甲状腺功能减退症病例是由晚期桥本甲状腺炎(自身免疫性甲状腺炎)引起的,即使通过药物恢复了适当的甲状腺激素水平,桥本甲状腺炎和自身免疫攻击仍会持续存在(除非找到并治疗根本原因)。
✦ 甲状腺功能减退症
甲状腺功能减退症的定义是甲状腺无法为身体产生足够的甲状腺激素,通常表现为促甲状腺激素(TSH)水平高或游离T4和游离T3水平低。一些医生将其称为“甲状腺功能低下”。
甲状腺功能减退症是一种临床状态,可能由于多种因素而发生,例如碘缺乏、甲状腺手术切除、放射性碘治疗、甲状腺激素摄入不足、服用甲状腺抑制药物,或者由于感染、事故或桥本甲状腺炎等疾病导致甲状腺受损。
✦ 桥本甲状腺炎
但是,桥本甲状腺炎是一种渐进性自身免疫性疾病,会导致身体攻击自己的甲状腺,最终导致甲状腺功能减退。
桥本甲状腺炎早期患者可能还没有甲状腺功能减退,只是攻击了甲状腺。这种对甲状腺的自身免疫攻击会引起症状,由各种因素引发,并对生活方式的改变作出反应。将在下文进一步讨论这一点。
甲状腺的自身免疫攻击在一个人患上甲状腺功能减退症之前几年就已经出现了,因此及早发现这种疾病可以防止其发展。一个人可能在最终被诊断出患有甲状腺功能减退症并接受甲状腺药物治疗之前,已经患有桥本甲状腺炎多年。
▸ 桥本甲状腺炎的症状
常见症状包括:焦虑、抑郁、健忘、体重增加、情绪波动、疲劳、脑雾、皮肤干燥、便秘、肌肉痉挛、心跳缓慢、指甲易碎、关节炎、手脚冰冷和胃肠道问题。
此外一些症状包括:对多种食物敏感,尤其是对麸质、乳制品和大豆敏感,这可能不会在标准血液测试中显示出来,但可能会在食用这些食物后表现为延迟症状。
另一方面,当我们的身体处于甲状腺功能亢进状态时,症状包括:体重减轻、心悸、焦虑、眼睛凸出、易怒、月经不调、疲劳、不耐热、食欲增加、脱发、甲状腺肿大、易出汗、排便频繁、不孕不育、软指甲、手指震颤、失眠、肌肉无力。
正如您在下图中看到的,人们可能会同时出现甲状腺功能减退和甲状腺功能亢进的症状。
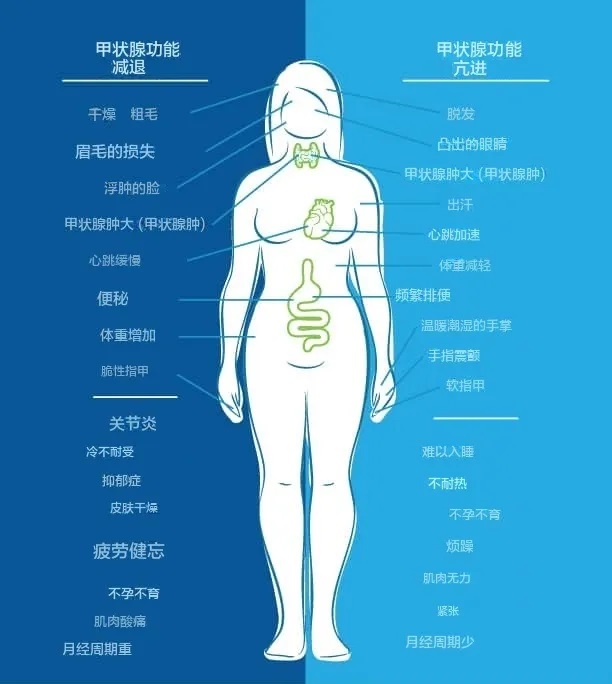
图片来源:thyroidpharmacist
以上种种证明,桥本甲状腺炎症状可能会影响一个人,即使他表面看起来很好!
桥本甲状腺炎是一种自身免疫性疾病,但研究表明多种因素可能共同作用导致该病的发生。以下是一些可能的诱因和关键触发因素:
1
毒素
已发现多种环境毒素可引发桥本氏病和甲状腺抗体。减少接触这些毒素保护肝脏将是减少抗体的关键。需要注意的毒素包括:
·碘过量
·铜中毒
·汞,如牙科填充物(汞合金)中常见的汞
·砷
·氟化物
·其他重金属
·药物,包括锂、避孕药、PPI、干扰素、异维甲酸
·个人护理产品和家用清洁剂中发现内分泌干扰物
·辐射
·镍毒性
·乳房植入物
·网片植入手术
2
感染
感染是桥本甲状腺炎的常见诱因,如果饮食干预不能让你感觉好转,感染往往就是问题所在。这些是口腔和肠道感染,以及多种细菌和病毒感染,在桥本甲状腺炎中很常见。
可能引发桥本甲状腺炎的感染包括:
·口腔感染,如牙脓肿、根管感染和牙周炎
·念珠菌感染
·幽门螺杆菌感染
·细菌感染
·EB病毒
·丙型肝炎
·巨细胞病毒 (CMV)
·莱姆病
·链球菌感染
3
情绪和身体压力
各种压力源都可能引发自身免疫问题。情绪和身体压力源可能包括:
·生活事件(离婚、创伤)
·身体虐待、情感虐待
·社会排斥
·血糖异常
·过度运动
·睡眠呼吸暂停
·外科手术
·睡眠不足
4
营养缺乏
低热量饮食和西式饮食会导致营养缺乏,各种消化酶缺乏也会导致营养缺乏。一些常见的可能引发桥本甲状腺炎的营养素缺乏包括:
·硒
·维生素D
·B族维生素
·铁/铁蛋白
·碘
·锌
5
食物敏感
食物敏感可能是桥本甲状腺炎和自身免疫性疾病的主要诱因。
桥本甲状腺炎最常见的敏感食物有:
·麸质
·奶制品
·大豆
·谷物
·鸡蛋
·坚果
·种子
·茄科植物
6
激素变化
雌激素占主导地位、催乳素升高和孕酮缺乏都可能导致或加剧自身免疫性甲状腺问题。女性生活中最大的激素变化是:
·青春期
·怀孕
·围绝经期
这是女性被诊断患有桥本甲状腺炎的最常见时间。
研究人员过去认为怀孕是诱因,因为胎儿细胞会进入母体的甲状腺;然而,进一步的研究表明,母亲甲状腺内的婴儿细胞实际上可能具有保护作用。
7
输血
我们知道,当一个人接受输血时,他们会接触到捐献者血液中的抗原。输血被发现会增加自身免疫性疾病的发病率,包括桥本氏病。
8
菌群失调为桥本氏病埋下隐患
肠道菌群失调是肠道通透性的潜在原因,我们知道肠道通透性是桥本氏病发展的三个必要因素之一。
厚壁菌门/拟杆菌门比例更高
2017年的一项研究发现,与健康对照组相比,桥本氏病患者的细菌组成(多样性和丰度)存在显著差异。其中一个例子就是厚壁菌门/拟杆菌门的比例,桥本氏病患者和肠易激综合征等其他疾病患者的厚壁菌门/拟杆菌门比例明显更高。比例较高通常是健康状况不佳的征兆,与微生物失衡有关。
注:厚壁菌门与拟杆菌门比例较高也与肥胖有关。减肥后,这一比例会有所改善。
抗炎细菌的水平较低
桥本氏病患者的肠道菌群中,对肠道屏障完整性和调节炎症至关重要的细菌水平较低。例如,拟杆菌属会产生短链脂肪酸 (SCFA),粪杆菌属会产生丁酸并具有抗炎作用,而普氏菌属会产生抗炎代谢物。
最有趣的发现是,某些细菌含量较高与甲状腺抗体存在之间存在相关性。这些细菌包括Blautia、Roseburia、Ruminococcus twists、Romboutsia、Dorea、Fusicatenibacter和Eubacterium hallii。
另外的研究采用16S rRNA基因测序对桥本甲状腺炎(HT)患者肠道菌群进行分析,结果显示在门控水平上,变形菌门和蓝藻门的丰度较高,放线菌门水平提高,而厚壁菌门和拟杆菌门的丰度降低;在科和属水平上,肠杆菌科、产碱菌科和Parasutterella属增加,而普雷沃氏菌科、瘤胃球菌科、韦荣氏球菌科和小杆菌科减少。
同时,实时PCR数据显示,双歧杆菌和乳酸杆菌在桥本甲状腺炎(HT)患者中显著减少。有趣的是,在另一项研究中,发现HT患者肠道中双歧杆菌的丰度随着病情的发展而增加。此外,有研究结果显示, HT患者的物种丰富度指数Chao1显著升高,这可能表明肠道细菌过度生长。虽然高微生物多样性通常与更好的健康结果相关,但也可能带来破坏性的影响,如蛋白质分解增加,多酚转化、黏液分泌和上皮周转减少。
因此,虽然HT患者肠道菌群发生了变化,但还需要更大的样本人群库来确定桥本甲状腺炎的菌群特征。
检测甲状腺激素水平是诊断甲状腺疾病和确定适当治疗方案的第一步。然而,实践中也许医生并不检测桥本甲状腺炎,尽管病人出现了甲状腺疾病的症状。
根据传统指南,大多数初级保健医生仅通过检测患者的TSH(促甲状腺激素)和T4水平(血液中循环的T4甲状腺激素量)来筛查甲状腺功能减退症。然而,这些测试并不总区分自身免疫性甲状腺问题和桥本甲状腺炎,并且经常会忽略桥本甲状腺炎和甲状腺功能减退症早期阶段出现的甲状腺激素细微波动和甲状腺抗体升高。这些阶段通常有症状,可能持续十年,之后TSH或T4水平才会被标记为异常。
经常看到患有桥本甲状腺炎早期阶段的人被告知是“甲状腺测试正常,没有问题”,即使表现出明显甲状腺功能障碍的症状,而这些症状可以通过其他测试明确证实。
因此,进行全面的甲状腺检查非常重要,不仅包括TSH和T4,还应包括T3,以及两种最常见的桥本抗体、TPO和TG抗体(当它们升高时,表明甲状腺内存在自身免疫过程,其水平可以指示对甲状腺的自身免疫攻击的强度,并有助于预测甲状腺完全破坏的时间表)。
此外,超声波检查可以帮助诊断桥本甲状腺炎,并揭示甲状腺的情况并查看是否存在结节。
1
甲状腺筛查测试
促甲状腺激素(TSH)测试用于筛查甲状腺疾病,以及监测个人所需正确药物剂量的测试。该测试很重要,如果可以建议每次检查甲状腺功能时都进行这项测试。
注:TSH是一种脑垂体激素,对循环中甲状腺激素的低/高水平有反应。TSH升高意味着体内没有足够的甲状腺激素,并且可能患有甲状腺功能减退症。这是因为TSH激素可以感知甲状腺水平低下,并在缺乏甲状腺激素时释放,以向身体发出信号以产生更多的甲状腺激素。
在患有晚期桥本甲状腺炎和原发性甲状腺功能减退症的患者中,该测试结果会升高。在患有格雷夫斯病和甲状腺功能亢进症的患者中,TSH 水平会降低。患有桥本甲状腺炎和轻度或中枢性甲状腺功能减退症的患者在该测试中的读数可能为“正常”。
测试前注意事项:建议在清晨测试TSH,并将甲状腺激素测试推迟到测试后,以确保结果准确,特别是如果正在服用含T3的药物。测试前服用药物会抑制TSH,这会是医生判别用药过量,但实际上并非如此。此外,常用于治疗脱发的补充剂生物素也会抑制TSH水平,也会使看起来用药过量或甲状腺机能亢进。
2
甲状腺激素水平测试
已确定有四种主要的甲状腺激素:T1、T2、T3 和 T4。
T4(甲状腺素)和T3(三碘甲状腺原氨酸)是两种主要的甲状腺激素。T4被称为激素原,其生物活性比T3低 300%。T3是主要的生物活性甲状腺激素,它能让我们有美丽的头发、补充能量并促进新陈代谢。
大多数常用的甲状腺药物(如左甲状腺素钠)仅含有T4,因此它们需要在体内转化为活性T3形式。
从理论上讲,T4到T3的转换很顺利,但在现实世界中,在真实的人体中,T4转换为T3会受到很多因素的影响,如下图所示。
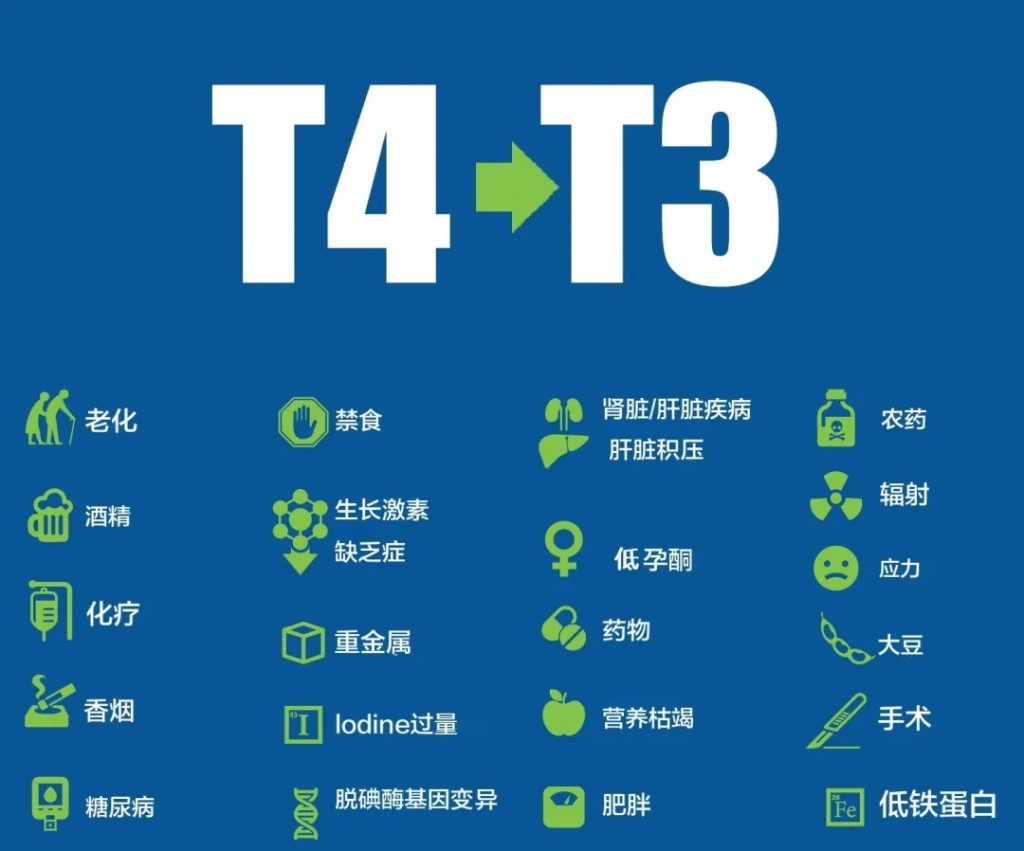
图片来源:thyroidpharmacist
通过测试游离T4和游离T3水平,我们可以了解T4与T3的比例,并测量体内可发挥作用的激素。
游离T3和游离T4测试可测量体内循环的活性甲状腺激素水平。当这些水平较低,但同时 TSH 处于正常范围内时,这可能会导致医生怀疑你患有一种罕见的甲状腺功能减退症,即中枢性甲状腺功能减退症。
有些临床医生可能只检测T4,但检测T3也很重要,因为有些人可能无法顺利将T4转化为活性T3。因此,有些人的T4水平可能正常,但T3水平较低。
3
甲状腺抗体
甲状腺疾病患者体内可检测到多种类型的抗甲状腺抗体。甲状腺抗体的存在表明甲状腺已被免疫系统识别为外来入侵者,甲状腺正在遭受攻击。
甲状腺抗体是甲状腺问题的第一个迹象
在桥本甲状腺炎中,触发因素会导致身体出现所谓的“缺乏自我耐受性”。这时身体不再能够将自己的组织识别为自身的一部分,而是开始将其组织视为外来入侵者。它不再“容忍”自己,这会导致自身免疫疾病。当身体开始破坏其免疫耐受性时,我们最初会看到甲状腺抗体升高。
桥本甲状腺炎患者中约有80%至95%有甲状腺抗体。 在许多情况下,甲状腺抗体是甲状腺问题的第一个迹象。在检测到TSH变化之前,它们可能会升高5年、10年,有时甚至15年。即使 TSH 水平“正常”,甲状腺抗体升高也意味着甲状腺被破坏到无法再产生足够激素的程度只是时间问题。
有些临床医生会说,一旦你有甲状腺抗体,你就会一直有甲状腺抗体,所以实际数字并不重要,因为抗体会随机波动。小编相信抗体会因触发因素(如压力等常见因素)而波动,而且它们可以成为追踪疾病进展的极其有用的标记。
桥本氏病中最常见的抗体是甲状腺过氧化物酶抗体(TPO抗体)和甲状腺球蛋白抗体(TG抗体)。大多数桥本氏病患者会出现其中一种或两种抗体升高的情况,而TPO抗体是最常见的。
甲状腺抗体表明甲状腺正在受到主动破坏,因此可用于诊断目的,并可进行监测以追踪缓解情况。
4
甲状腺超声检查
有些人可能患有甲状腺疾病,但血液检查结果可能没有发现任何变化。事实上,研究表明,10%至50%的桥本甲状腺炎患者可能没有抗体检测阳性。 在这些情况下,患者可能患有一种侵袭性较小的桥本甲状腺炎,称为抗体阴性或血清阴性桥本甲状腺炎。
在这种情况下,可以使用甲状腺超声检查来发现指向桥本甲状腺炎的甲状腺物理变化。甲状腺超声检查将帮助医生确定你是否患有与桥本甲状腺炎一致的变化(例如甲状腺弹性变大、甲状腺萎缩、甲状腺肿大或甲状腺异常生长)。
一些生长可能表明存在自身免疫过程或存在良性结节,而其他生长可能表明存在癌性结节。
注:我们了解到,大约10%的桥本甲状腺炎患者是通过超声波诊断出来的,建议每个桥本甲状腺炎或甲状腺疾病患者,尤其是育龄妇女,一生中至少做一次超声波检查。如果发现甲状腺结节,建议每年做一次超声波检查。
5
你的症状
俗话说,自己身体是疾病最好的显示器。我们经常忙于日常生活工作,忽视身体发出的微小信号。对于桥本甲状腺炎来说,你的症状应该作为重要的甲状腺测试。因为有些微妙的信息可能只有你知道。
身体症状为我们体内发生的状况提供了重要线索,并且这些症状会随着甲状腺激素水平的变化而变化。
您是否有甲状腺功能减退或甲状腺激素缺乏的症状。前文我们给出了桥本对应的症状。
!
其他注意事项
这里还是要分享下有些重要因素,它们可能会影响甲状腺测试结果和激素水平。
可能干扰甲状腺检查结果的补充剂和药物
药物相互作用是指甲状腺激素与各种药物、补充剂和食物之间的相互作用,它会导致甲状腺激素水平发生实际变化,一旦停止使用相互作用的药物,这种变化是可逆的。
一些例子包括:钙补充剂、咖啡和非处方 PPI,如奥美拉唑。如果您在服用甲状腺药片后几小时内服用这些药物,这些往往是最相关的。
影响甲状腺功能的物质
虽然有些补充剂会导致甲状腺水平测试误差,但补充剂补充后的测试水平会反映甲状腺水平的真实变化——这种变化可以用于监测实际改善或恶化,这个和任何一项测试一样。
导致甲状腺功能长期改善的物质:例如芦荟、冬虫夏草、维生素A、肌醇在某些情况下可以降低/使 TSH 正常化,这意味着你只需要更少的药物。
导致甲状腺功能长期恶化的物质:锂、胺碘酮和高剂量碘等药物会导致甲状腺损伤,从而需要更多的甲状腺激素。
甲状腺药物需要以适当的剂量使用
用药过量的症状包括但不限于:心跳加快或不规律、紧张、易怒或情绪波动、肌肉无力或震颤、腹泻、月经不调、脱发、体重减轻、失眠、胸痛和过度出汗。
未经咨询医生,请勿擅自开始、更改、增加、减少或停止用药。
总而言之,有些药物会干扰甲状腺检查结果,因为它们实际上会干扰甲状腺激素的功能——这意味着它们会导致甲状腺激素水平发生真正的变化。其中一些变化具有临床意义,当同时服用这两种药物时,可能需要调整甲状腺药物的剂量。
▸ 桥本甲状腺炎与消化道功能的关系
小学生物课上就讲过,消化从口腔开始,口腔会产生富含酶的唾液,从而分解食物,特别是淀粉。因此,分泌足够的唾液对正确启动消化过程非常重要。
✦ 桥本甲状腺炎唾液分泌减少
然而,研究表明,相当一部分患有自身免疫性甲状腺疾病(如桥本甲状腺炎)的人缺乏足够的唾液,并出现“口干”的症状。这在一定程度上是由于促炎细胞因子的过量产生阻碍了唾液的正常产生。
✦ 桥本甲状腺炎胃食管运动能力降低
研究还表明,甲状腺功能减退会显著降低胃食管运动能力,从而导致胃肠功能障碍,因此建议消化不良患者检查甲状腺功能。
既往研究也已证实了甲状腺功能在胃肠道系统中的作用。严重的甲状腺功能减退症可导致食管蠕动。当近端受累时黏液水肿引起吞咽困难,远端可出现食管炎、食管裂孔疝等。
✦ 甲状腺功能减退与消化不良呈正相关
胃肌电研究显示,消化不良与甲状腺功能减退评分呈正相关。甲状腺功能减退症患者由于肌肉水肿、肌电节律减退,常出现胃动力障碍,导致胃排空延迟、胃酸缺乏。
另一方面,甲状腺功能也会影响肠道菌群,研究表明,甲状腺功能明显减退的患者更容易出现肠道细菌过度生长。
▸ 桥本甲状腺炎与消化系统疾病
早在20世纪50年代,胃肠道与甲状腺的关系就被提出,并被称为“甲状腺胃综合征”。这种一致性可以通过共同的胚层起源和微生物群的特定组成来解释。近年来,桥本甲状腺炎与消化道疾病之间的共同机制引起了人们的关注。
✦ 桥本甲状腺炎和乳糜泻(CD)
乳糜泻是一种具有自身免疫特征的小肠炎症性疾病,由摄入小麦、大麦和黑麦中的储存蛋白(麸质)引发和维持。由于麦谷蛋白的分子结构与甲状腺组织相似,可导致多种自身免疫性甲状腺疾病。
一项单中心回顾性病例对照研究表明,桥本是乳糜泻患者中最常见的自身免疫性疾病。加之它们的症状常有重叠,因此我们有理由相信它们可能通过肠-甲状腺轴相互联系。
非乳糜泻小麦敏感性(NCWS)是一种非过敏性、非自身免疫性疾病,它还可以通过Toll样受体(如TLR2和TLR4)增加 TNF-α 的表达和活化。
✦ 桥本甲状腺炎和幽门螺杆菌感染性胃炎
近年来,大量研究已证明幽门螺杆菌(Hp)感染与消化性溃疡、胃癌的发病密切相关。在过去的20年中,Hp与其他非胃肠道疾病的相关性被揭示。甲状腺自身免疫与Hp的关系可以用分子模拟来解释。
首先,CD4+T细胞识别与甲状腺上H/K/ATPase结构相似的Hp表位,激活Th1诱导细胞凋亡。
其次,树突状细胞将Hp表位呈递给幼稚T细胞,由于缺乏外周免疫耐受,Th1会被激活。
最后,INF-γ可以刺激甲状腺滤泡细胞中MHCII的表达。
此外,Hp能产生细胞毒素相关基因A(CagA),研究发现,cag-A阳性的Hp菌株显示与甲状腺过氧化物酶(TPO)序列相似的核苷酸序列,说明血清CagA阳性增加了患自身免疫性甲状腺疾病的风险。
✦ 桥本甲状腺炎和自身免疫性萎缩性胃炎
桥本甲状腺炎(HT)见于近40%的自身免疫性萎缩性胃炎(AAG)患者,其血清中存在大量抗壁细胞抗体。由于AAG时胃酸分泌大大减少,铁吸收不良,无法促进T3和T4的合成。
此外,研究发现,血清胃泌素、嗜铬粒蛋白A水平及肠嗜铬样细胞(ECL)增殖与自身免疫性疾病的共存有显著相关性。
上述研究结果从多个角度提供了理论支持,通过探讨HT与其他胃肠道疾病的关系,可以进一步理解肠-甲状腺的作用和机制,进而拓宽HT及其并发症的临床治疗思路,开发新的治疗方法和药物,进一步提高HT的诊治水平。
▸ 甲状腺对其他消化器官的影响
其他器官在宏量营养素和微量营养素的分解和吸收中发挥着至关重要的作用,而甲状腺健康会影响这些器官。
✦ 肝脏受甲状腺功能影响巨大
肝脏会产生消化和吸收蛋白质、糖和脂肪所必需的酶和胆汁。肝脏还会努力代谢毒素(如杀虫剂或重金属)、酒精,并控制释放到血液中的葡萄糖量。换句话说:如果你的肝脏功能不正常,你的消化功能就会受到影响。
然而,如果没有健康的甲状腺,您的肝脏就无法发挥最佳功能,研究表明,肝脏是受甲状腺功能亢进和减退影响最大的器官。
因此,不健康的甲状腺会导致不健康的肝脏,从而影响胆囊并妨碍最佳消化、营养吸收和 T4/T3 转换。
✦ 胰腺与甲状腺功能也有联系
此外,胰腺和甲状腺之间存在联系,甲状腺对胰腺酶的产生和整体功能完整性有影响。
最后,甲状腺与肠道功能有许多联系,例如运动能力改变是便秘的诱因,关于甲状腺和肠道菌群的下面内容我们详细讲…..
▸ 肠道微生物群失调和桥本氏病
健康的肠道微生物群会影响免疫系统,也对甲状腺功能有重要影响,特别是对桥本甲状腺炎和格雷夫斯病等自身免疫性甲状腺疾病。
研究表明,肠道菌群的变化(包括菌群失调)会影响您的整体甲状腺健康,甚至导致和加剧包括桥本甲状腺炎在内的自身免疫性甲状腺疾病。
✦ 甲状腺功能减退的患者存在小肠细菌过度生长
2007年的一项研究发现,在有自身免疫性甲状腺功能减退症病史的人群中,54%的人小肠细菌过度生长(SIBO)呼气测试呈阳性,而对照组中这一比例为 5%。
✦ 肠道菌群会影响T4向T3的转化
虽然还未完全了解,但肠道微生物群也会影响T4向T3的转化——T3是甲状腺激素的活性形式。碘甲状腺原氨酸脱碘酶在T4向其活性形式T3的转化中起着核心作用。据推测,肠道和肠道微生物群会影响这些酶的活性。
这至少在一定程度上归因于肠道微生物群对将T4转化为T3所需的微量营养素(如硒和锌)的可用性的影响。
但事实可能远不止于此,因为人们在肠壁中发现了脱碘酶活性,而且至少有一项动物研究表明肠道细菌具有结合甲状腺激素的能力。
有趣的是:这个过程的成功在很大程度上取决于胆囊中初级胆汁酸的产生。这些初级胆汁酸在消耗脂肪后从胆囊分泌到小肠中,肠道细菌将它们代谢成所谓的“次级胆汁酸”,从而增加脱碘酶的活性。
而且,这些胆汁酸依赖于矿物质硒,而肠道和甲状腺健康问题患者通常会缺乏硒。而且,甲状腺功能减退症还会阻碍胆汁从胆囊中流出,从而进一步影响 T4/T3 的转换。这种胆汁也具有天然的抗菌作用,这可能进一步解释甲状腺疾病与特定细菌性肠道感染(如小肠细菌过度生长)之间的联系。
建议
如果你患有桥本氏病等自身免疫性甲状腺疾病,情况也是如此。可能认为自己的肠道健康很好。但是,鉴于肠道和甲状腺问题同时普遍存在,最好检查一下你的肠道健康。
▸ 甲状腺和菌群失调和肠漏症的联系
当谈到菌群失调、肠漏、甲状腺功能障碍和自身免疫之间的联系时,需要牢记以下关键点:
所有自身免疫性疾病(包括桥本氏病)都会出现肠道通透性一定程度的增加(导致肠漏)。
✦ 桥本甲状腺炎(HT)的肠道屏障通透性增加
正常情况下,肠黏膜屏障能有效阻止病原体进入循环系统。然而,当肠屏障完整性受损时,黏膜下免疫细胞暴露于细菌、饮食抗原和自身抗原,可导致不良免疫激活或耐受反应失败,从而导致自身免疫性疾病。如今,越来越多的证据表明肠道菌群在维持肠屏障完整性方面起着至关重要的作用。
在极端情况下,无菌动物研究证实,肠道菌群缺乏会导致肠黏膜屏障功能退化,具体表现为肠道整体表面积减少、肠绒毛变短、肠隐窝减少、肠道通透性增加、黏膜层变薄及不稳定。
大量研究表明,肠道菌群失调、细菌过度生长和肠道通透性增加(肠漏)会导致桥本甲状腺炎的发生。与IBD(炎症性肠病)患者的改变类似,桥本甲状腺炎患者也有肠道屏障通透性异常。因此,炎症存在时肠道屏障功能受损,肠道通透性增高导致无法穿过肠道屏障的抗原进入体循环激活免疫系统,产生的抗体攻击甲状腺组织是桥本甲状腺炎发生的重要原因之一。
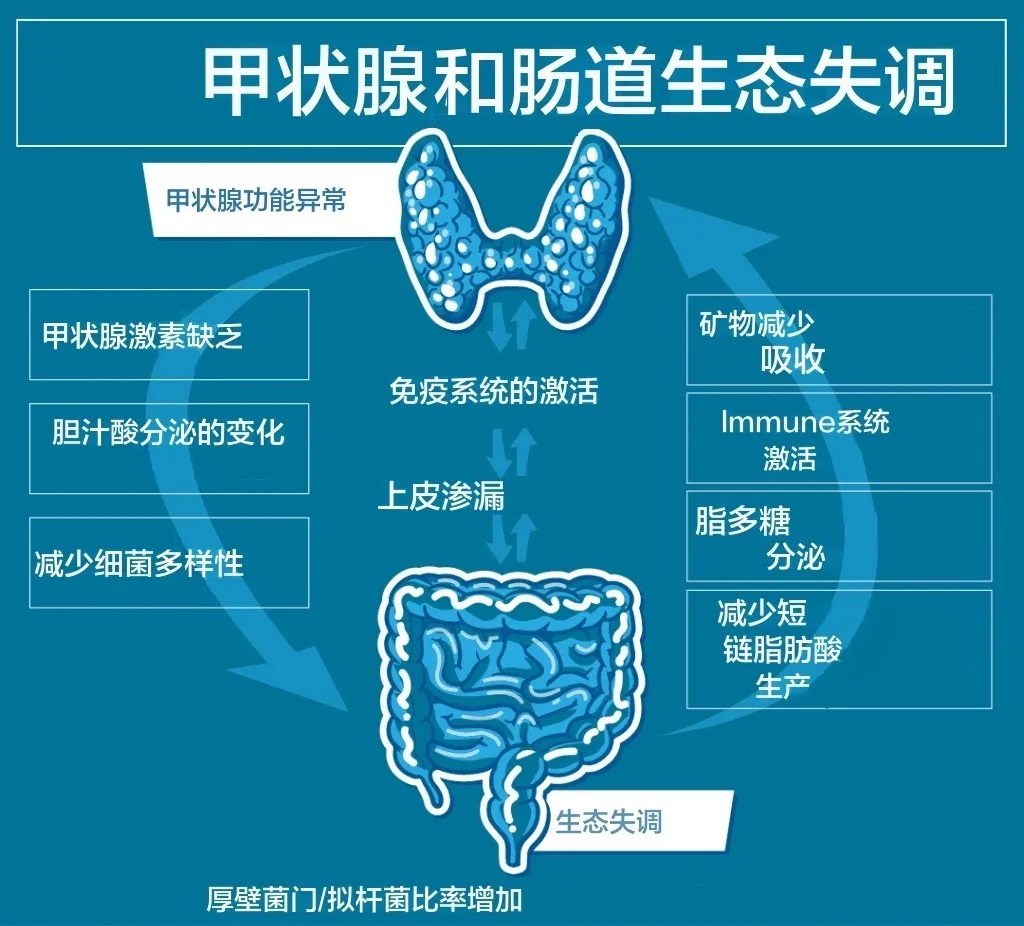
✦ 肠道菌群自噬与甲状腺
肠道菌群与自噬也存在相互作用,与甲状腺自身免疫性疾病的发病机制密切相关。自噬是一个高度保守的生理过程,细胞内的成分经过溶酶体介导的自我消化和循环,受损或老化的生物大分子和细胞器被从细胞质中清除。
一方面,肠道菌群及其代谢产物可以通过mTOR通路调控自噬。同时,自噬缺陷会改变肠黏膜中紧密连接蛋白claudin-2的表达水平。与大多数紧密连接(如occludin、claudin-1、ZO-1)的功能不同,claudin-2蛋白的表达增加了细胞旁路通透性,导致肠上皮屏障破坏,细菌易位和传输增加,进而导致肠道菌群失调。
自噬除了介导炎症反应和免疫外,也是清除过量活性氧(ROS)、防止细胞损伤和死亡的重要机制。自噬缺陷导致去极化的线粒体和蛋白质积聚,并诱导炎症小体激活物(ROS或线粒体DNA)的释放。作为重要的发病机制,炎症因子和ROS也参与了桥本甲状腺炎(HT)的炎症过程。正常情况下,ROS对甲状腺激素的合成至关重要,但过量的氧化应激可诱导甲状腺滤泡细胞(TFC)损伤,引起甲状腺炎症,促进HT的发生。
HT患者血清中可检测到IL-23浓度升高,这是因为IL-23通过促进Th17细胞分化和IL-17的分泌来促进HT的发展。近期有证据揭示了一种新的机制,即 IL-23 作为 AKT/mTOR 信号通路的强诱导剂,能够抑制 TFCs 的自噬活性,导致 ROS 过度积累 。此外,还发现Caveolin-1缺陷可抑制TFCs的自噬活性,诱导AKT/mTOR活化,这可能参与桥本甲状腺炎(HT)的发病过程。而过量的ROS又促进炎症反应和促炎细胞因子及IL-23的产生,形成正反馈循环,加重病情的严重程度。
✦ 菌群失调和甲状腺功能减退症
研究表明,甲状腺功能减退症患者的肠道细菌组成发生改变,产生有益短链脂肪酸(SCFA)的细菌数量减少,而产生炎症驱动脂多糖 (LPS) 的细菌数量增加。
2020年的一项研究涉及52名甲状腺功能减退症患者和40名健康对照者。他们用较新的16SrRNA测序技术分析了他们的肠道菌群,发现两组之间的肠道细菌存在显著差异。研究人员发现,四种特定细菌(Veillonella, Neisseria, Paraprevotella和Rheinheimera)的水平可以初步识别受试者是患有甲状腺功能减退症还是来自健康对照组。此外,甲状腺功能减退症患者的SCFA产生能力显著下降,LPS水平升高。
在物种水平上,荟萃分析最重要的结果是脆弱拟杆菌(Bacteroides fragilis)的相对丰度增加,这种细菌能够激活NLR 家族含吡啶结构域 3(NLRP3)的表达,NLRP3 是炎症小体成分,在 HT 患者的甲状腺组织中过表达。经Spearman相关性分析,一些门、科和属,如拟杆菌、瘤胃球菌科、肠杆菌科、韦荣球菌、链球菌和乳酸杆菌,与抗甲状腺过氧化物酶抗体(TPO)呈正相关,与 TSH 水平呈负相关;此外,链球菌属与抗甲状腺球蛋白抗体水平呈正相关。
谷禾健康经过多年检测实践和与临床的合作,已经积累了超过2000例的甲状腺患者肠道菌群样本,我们还与保定市第一中心医院席永昌医生合作开展“131-碘治疗对甲状腺疾病患者肠道菌群影响的分析的临床研究”,从初步的研究结果看,甲状腺功能减退症和甲状腺癌患者有明显的肠道菌群特征。
研究人员还进行了粪便微生物群移植(FMT),从两组人类身上提取菌群,并将其移植到小鼠体内。结果非常有趣,因为接受甲状腺功能减退组细菌移植的小鼠在移植后显示出总甲状腺激素水平下降。
有研究还证明脂多糖激活 TLR4 可在 NOD H2h4 小鼠中引发甲状腺炎。在对患有此病的甲状腺功能正常的患者进行形态学和功能研究时,检测到了肠道屏障的渗漏,这为肠道微生物群在桥本甲状腺炎 (HT) 发病机制中发挥作用提供了其他线索。
✦ 甲状腺激素药物的吸收和微生物群
研究发现,当发生细菌过度生长时,会导致微生物组成和药物吸收发生变化,并且可能需要更高剂量的甲状腺药物。
对于常见的引发甲状腺疾病的幽门螺杆菌(H. pylori)也发现了同样的结果。
有趣的是,一项较新的研究表明,有益细菌也会影响甲状腺激素的剂量。一项研究发现,与未使用益生菌的对照组相比,使用几种益生菌(三种双歧杆菌属、四种乳酸杆菌属和嗜热链球菌)可减少左旋甲状腺素剂量调整量。 另一项研究表明,罗伊氏乳杆菌可增加甲状腺激素。
▸ 肠道细菌失衡和肠漏的常见原因
许多因素会影响微生物群的组成和肠道通透性的水平,其中一些因素也是桥本甲状腺炎的常见诱因,这并非巧合。
•遗传易感性——某些基因变异会影响人体对细菌的识别和反应,并导致微生物群的变化。
•分娩过程中母体微生物群的定植——当婴儿通过阴道时,他们会接种来自母亲阴道微生物群的细菌(剖腹产出生的婴儿细菌多样性较低)。
•饮食——我们所吃的食物会影响我们微生物群的组成和肠道的通透性水平。例如,某些食品添加剂会改变肠道中的细菌。研究表明,麸质尤其会导致敏感人群的肠道通透性增加。
•食物敏感——食用我们敏感的食物会导致肠道发炎,从而导致肠道通透性改变。这会影响微生物群中的细菌。
•毒素——多种毒素会影响肠道通透性和肠道内各种细菌的水平。这包括环境毒素(如污染)以及内源性毒素(如脂多糖)。毒素超载导致肝功能障碍也是桥本氏病的常见诱因。
•压力——研究发现,社会压力会降低具有抗炎活性的微生物水平,并导致更高程度的炎症。慢性压力也会导致肠道通透性增加。
•肠道感染和寄生虫——幽门螺杆菌、小肠细菌过度生长、人芽囊原虫、贾第鞭毛虫和念珠菌等感染可导致肠道细菌失衡。例如,幽门螺杆菌感染(以及用于治疗幽门螺杆菌的抗生素)可导致细菌多样性降低。
•减肥手术——最近的研究发现,减肥手术对肠道细菌有很大影响(尽管可能通常是有益的)。
•抗生素——广谱抗生素如阿莫西林、四环素和氟喹诺酮类药物是严重的罪魁祸首,它们会降低厚壁菌门和拟杆菌门的多样性和丰富度。
•药物——质子泵抑制剂和避孕药(也有甲状腺毒性) 等常见药物会影响微生物群的组成。
•营养缺乏——现代农业实践(通常导致土壤和食物中的营养成分减少)是造成营养缺乏的部分原因,但消化酶含量低和胃酸含量低也可能是因素。 例如,谷氨酰胺和锌(重建肠道内壁所需的两种物质)含量低会导致肠道通透性增加。
•激素——性激素对微生物群组成和丰度有显著影响。雌性和雄性实际上具有不同的微生物特征。雌性激素占主导地位可能是桥本氏病的诱因。
•其他疾病状态——其他疾病状态,尤其是肥胖等代谢/能量相关疾病,可能是造成微生物组失衡的因素。研究表明,肥胖会增加产生内毒素脂多糖 (LPS) 的细菌数量,并减少抑制 LPS 的细菌数量。肥胖也可能损害肠道屏障的完整性。
★ 甲状腺→肠道菌群→营养素吸收
碘、硒、铁和锌是重要的甲状腺支持营养素,肠道细菌的组成会影响这些营养素的吸收方式。甲状腺功能障碍本身可以改变肠道微生物群的组成,并影响这些矿物质的吸收。
碘和铁对甲状腺激素合成至关重要,而硒和锌对T4到T3的转化和免疫健康很重要。 肠道屏障是一种半透性壁,允许从肠道吸收营养物质,其中一些营养物质对甲状腺的正常功能也至关重要。
碘
碘是甲状腺激素结构的必需成分,人体内的大部分碘都储存在甲状腺中。甲状腺对碘的吸收是一个主动过程,是甲状腺激素合成的限制步骤之一。NIS 是一种广泛弥散的碘转运蛋白,它利用细胞内H+与细胞外Na+交换获得的通量,逆电化学梯度共同转运碘。
此外,碘的肠道吸收是由位于上皮胃肠道质膜顶端的NIS介导的。负责肠道碘吸收的其他转运蛋白包括 Na+/多种维生素转运蛋白和囊性纤维化转运蛋白,但作用程度较小。
✦ 肠道菌群会影响碘的吸收
1972年,一篇论文展示了肠道菌群在调节大鼠碘吸收中的作用:与传统饲养的大鼠相比,用卡那霉素(一种可降低大鼠体内细菌总数的抗生素)治疗的动物在治疗 3 小时以及治疗 42 和 72 天后放射性碘吸收量降低。
然而,在人体研究中,结果更加矛盾。事实上,在短肠综合征和肠外营养患者中,尽管两组之间的微生物组成不同,但碘排泄量与健康对照组并没有显著差异。在减肥后患者的尿碘排泄量中也观察到了类似的结果。然而,在患有炎症性肠病(通常伴有菌群失调)的人中,观察到碘吸收不良的情况。此外,研究还发现,产生丁酸的肠道微生物群的减少与碘吸收减少有关,这一证据与高危甲状腺结节的发病机制有关。
事实上,短链脂肪酸,尤其是丁酸,通过抑制组蛋白去乙酰化酶,可能激活甲状腺癌细胞中NIS的重新表达。
✦ 碘会改变肠道菌群的组成
另一方面,由于碘具有内在的抗菌活性,它可能会改变肠道菌群的组成,影响常驻菌和致病菌。事实上,已经清楚地证明碘可能通过抑制需氧菌的ATP产生来干扰电子链传递;碘破坏微生物细胞壁结构的能力也已被描述。
一些动物模型分析了碘补充的影响,表明碘对微生物群调节的总体影响取决于宿主微生物组成的个体状况。
硒
甲状腺中的硒浓度高于任何其他器官。它是硒蛋白的重要组成部分,硒蛋白参与多种过程,其中最重要的是抗氧化和抗炎作用以及甲状腺激素的代谢活性。
自然界中的硒以无机形式存在,即硒酸盐和亚硒酸盐,以及有机形式,即含硫氨基酸类似物、硒代蛋氨酸和硒代半胱氨酸。这些化合物的吸收发生在十二指肠、盲肠和结肠中,有机形式的吸收比无机形式的吸收更快。
✦ 肠道菌群将硒转化为有机形式更利于吸收
硒和肠道菌群组成相互作用。事实上,大约25%的细菌拥有编码硒蛋白的基因:例如,大肠杆菌的结构中就含有三种硒蛋白。一些乳酸杆菌属能够将细胞内的亚硒酸盐转化为有机形式,促进人体对硒的吸收。
一项针对无菌小鼠和正常饲养小鼠的研究表明,肠道菌群对硒有部分封存作用。这种与宿主对硒吸收的竞争在硒供应有限的情况下最为明显。
✦ 硒摄入量能够调整肠道微生物组成
此外,不同的硒摄入量能够调节肠道微生物环境的组成:与饲喂缺硒饮食的小鼠相比,补充硒的动物的多雷亚菌相对丰度较低,而Turicibacter(在肠道中发挥抗炎活性)和阿克曼氏菌(以保护肠道屏障完整性而闻名)的丰度较高。
事实上,硒对免疫系统调节具有有益作用,还能促进Tregs细胞因子的分泌。桥本甲状腺炎患者经常出现硒缺乏的情况,而补充硒似乎能够降低甲状腺自身抗体水平。
铁
铁在甲状腺功能中起着关键作用,因为TPO酶的活性中心含有铁,并且参与甲状腺激素的储存和分泌。缺铁对甲状腺代谢有很大影响,因为当发生贫血时,它可能会降低氧气运输,诱发类似于甲状腺缺氧障碍的状况。
特别是,缺铁的动物表现出甲状腺功能障碍。所有形式的铁(无机铁、血红素和铁蛋白)的吸收主要发生在十二指肠和空肠上部。铁以还原形式的Fe(II)被吸收,与十二指肠相比,结肠铁的吸收效率仅为15%左右。
✦ 菌群能够调节铁的生物利用度
然而,该百分比可能会受到结肠pH值变化的调节,而结肠pH值变化可能是由 SCFAs 的产生引起的 。此外,已证明发酵乳杆菌具有铁还原活性,可将 Fe(III) 还原为 Fe(II),从而促进铁的吸收。
事实上,细菌能够调节铁的生物利用度,这要归功于几种促进铁吸收的高亲和力蛋白质。因此,与硒的观察结果一样,肠道菌群和宿主竞争铁的吸收。
✦ 缺铁或过量铁都会影响细菌的正常组成
动物研究发现,缺铁饮食会干扰细菌的生长,而高铁饮食会降低肠道菌群的生物多样性。在人类中,补铁会增加肠杆菌科和拟杆菌,同时减少乳杆菌科和双歧杆菌。
值得注意的是,后者不需要铁来生长。对未吸收铁的竞争也会调节菌群组成,对共生菌产生不利影响。富含血红素的肠道环境为能够代谢这种化合物的细菌种类的增殖提供了营养。过量摄入铁会增加致病性肠道细菌(沙门氏菌、志贺氏菌_、致病性大肠杆菌)的数量,这些细菌需要铁来定植和发挥毒性。同样,在摄入过量铁饮食的人类中,可以观察到 SCFA 生成的变化。
锌
锌在甲状腺病理生理中的作用是由于它参与脱碘酶和超氧化物歧化酶的活性。此外,它还是甲状腺激素结合转录因子的组成部分。事实上,锌参与了整个甲状腺机制主要成分的合成 [促甲状腺激素释放激素 (TRH)、TSH 和甲状腺激素]。除此之外,它还可能影响三碘甲状腺原氨酸与其核受体的结合。
✦ 补充锌可以抑制一些病原体的生长
在人类中,已经观察到甲状腺疾病和锌代谢之间的相互关系,因为甲状腺功能减退症患者通常表现为锌水平降低,而锌缺乏与游离甲状腺激素水平低有关。
一些研究表明,肠道微生物组成与锌之间存在相关性。人类证据支持补锌可抑制病原体(即腹泻致病性大肠杆菌相关)的生长,促进乳酸杆菌等有益细菌的生长。此外,在患有甲状腺自身免疫性疾病的人群中,乳酸杆菌和双歧杆菌的相对丰度与锌水平呈正相关。
贫血,桥本,营养素
许多人认为缺铁是贫血的原因。但根据多年查阅文献和检测经验,实际上有三种营养素缺乏会导致贫血,并且常见于桥本氏病患者:铁、维生素B12和叶酸。
铁蛋白
铁蛋白是人体铁储备蛋白的名称。女性的“正常”铁蛋白水平在12至150ng/mL之间。然而,观察到甲状腺功能的最佳铁蛋白水平在90至110ng/mL之间。
铁蛋白是在桥本甲状腺炎患者中发现的最常见的缺乏症之一,除了疲劳之外,铁蛋白缺乏还会导致呼吸短促、不安腿综合症、脱发、失眠、奇怪的食物渴望、反向T3水平升高和情绪波动。
但除非您经检测缺乏铁蛋白,否则不建议补充。因为铁/铁蛋白过多也会有问题。
维生素B12
B12是蛋白质合成、细胞繁殖和正常生长所必需的必需维生素。它还有助于褪黑激素和血清素的产生,从而促进安稳的睡眠和积极的情绪。
一项关于甲状腺功能障碍患者中维生素B12缺乏症患病率的研究发现,自身免疫性甲状腺疾病也与自身免疫性疾病恶性贫血有关,这可能导致维生素B12吸收不良。
由于某些人患有恶性贫血、小肠细菌过度生长或幽门螺杆菌感染等疾病,口服维生素B12可能难以吸收,因此医生可能会选择口服大剂量维生素B12或注射维生素B12以确保适当吸收。
叶酸
维生素B9是一种必需的营养素,又称为叶酸,在 DNA 的形成和细胞生长中起着至关重要的作用。在某些情况下,您的叶酸测试结果可能正常或偏高,但您仍然可能缺乏适合您身体的叶酸。
一些患有桥本氏病的人,有MTHFR基因变异,使他们无法正确处理可能存在于补充剂和加工食品中的叶酸。一些专业人士声称,这种类型的叶酸甚至可能导致体内积聚,从而导致毒性。
那些可能患有肾上腺疲劳、经常感到压力的人以及具有MTHFR基因变异和高同型半胱氨酸水平的人,可能会从活性或甲基化叶酸中受益,主要是因为单靠食物无法提供足够的叶酸。
降低甲状腺抗体的机制主要有以下几种:
•减少触发
•减少氧化应激
•免疫调节
•免疫抑制
•目标移除
1
去除麸质
2001年,意大利的一项多中心前瞻性研究结论强调了无麸质饮食对患有乳糜泻和桥本氏病的人的益处。这项研究中的受试者在开始无麸质饮食之前患有亚临床甲状腺功能减退症,甲状腺抗体升高。
研究显示,71%的受试者恢复了正常的甲状腺功能;19% 的受试者能够在一年内将甲状腺抗体恢复正常。

编辑
无麸质饮食也帮助了大多数患有桥本氏病的患者,尽管他们中的大多数人并没有乳糜泻。
关于麸质的另一个需要注意的是,它通常是导致肠道通透性的原因。(您具备患上桥本氏病的三个必要条件中的两个:遗传易感性、肠道通透性和诱因。)
2
去除乳制品
戒掉乳制品可能不再有肠易激综合征、腹胀、反流等。在该甲状腺资深专家的调查中,79%的桥本氏病患者在停止食用乳制品后感觉好多了,而且抗体减少了20%。
但是查阅文献发现关于乳制品和桥本氏病的研究有限,后续值得在本地人群中开展相关研究。
3
解决幽门螺杆菌感染
多种细菌感染都与引发自身免疫性甲状腺炎有关,包括幽门螺杆菌(一种导致胃炎胃癌的细菌)、伯氏疏螺旋体(与莱姆病有关)和小肠结肠炎耶尔森氏菌。
根据桥本研究专家 IZABELLA WENTZ博士的分享,在其饮食中去除麸质和乳制品时,大部分症状也消失了。但检测甲状腺抗体检测结果仍然呈阳性,所以WENTZ博士不得不深入研究其他根本原因。最终发现是肠道感染。
她还给其80%咨询客户中的人营养干预达到瓶颈的时候推荐了肠道检测,结果检测出至少一种肠道感染。
4
解决小肠细菌过度生长 (SIBO)
小肠细菌过度生长是指小肠内细菌过度生长。虽然从技术上讲这不是一种感染,但小肠细菌过度生长确实有细菌成分,可能是桥本氏病的诱因、后果或加剧因素。
编辑
根据2014年发表的一项研究,多达54%的甲状腺功能减退症患者会出现小肠细菌过度生长(SIBO)。
桥本氏病患者通过治疗小肠细菌过度生长缓解了肠易激综合征、不安腿综合症、低铁蛋白和低维生素 B12 等症状;在某些情况下,甲状腺抗体通过小肠细菌过度生长治疗而降低,甚至消失。
5
肠道治疗方法
肠道在桥本甲状腺炎中起着重要作用——事实上,肠漏是自身免疫性疾病发展的三个必需因素之一(另外两个是遗传因素和诱因)。
虽然并非所有患有桥本氏病或肠漏症的人都会出现腹胀、胃痛、肠易激综合征和胃酸反流等症状,但大多数桥本氏病患者确实存在一定程度的肠道通透性。对于任何患有自身免疫性疾病的人来说,治愈肠道可以大大减轻症状,甚至可能缓解病情。
通过查阅文献了解到2018年意大利的一项研究,该研究特别关注了芦荟对桥本甲状腺炎的益处。有趣的是,发起这项研究的一位研究人员发现,在她开始每天喝芦荟以促进消化并用作治疗便秘的泻药后,她自己的桥本甲状腺炎标志物得到了改善。
编辑
通过优化肠道健康并恢复肠道微生物平衡,可以从内部开始治愈。为此,可以去除反应性食物,补充酶,平衡肠道菌群,滋养肠道。感兴趣可以关注谷禾以往的专题文章。
6
广谱抗菌
肠道感染,往往是自身免疫性疾病发展的诱因。其他感染,如Epstein-Barr virus(EB病毒)和莱姆病,也可能引发体内的自身免疫反应。
EB 病毒会在体内产生潜伏感染,潜伏到合适的时间才会被重新激活并苏醒。重新激活的病毒有可能诱导甲状腺抗体的产生,并可能导致许多使人衰弱的自身免疫症状。
2015 年波兰的一项研究发现,80%的桥本甲状腺炎患者和62.5%的格雷夫斯甲状腺炎患者的甲状腺细胞中存在EB病毒,而对照组的甲状腺细胞中没有 EBV。
一些研究发现黑种草籽油(Black seed oil)是抗感染草药之一,因为它具有广泛证实的抗菌特性,对桥本甲状腺炎患者来说是一种有用的药物。它之所以特别受人关注,是因为最近的研究表明它也能降低甲状腺抗体。
7
血糖平衡
当血糖水平不断波动时,身体会将这些变化视为慢性压力。当肾上腺(负责释放压力激素的腺体)受到压力时,它们会释放过量的皮质醇激素,这也会导致与免疫反应增强相关的炎症蛋白的产生增加。这种模式最终会导致皮质醇释放改变,从而导致多种症状,包括慢性疲劳、情绪波动和甲状腺抗体增加。
建议从食物开始——在用餐时优先考虑蛋白质和健康脂肪,并尽量减少碳水化合物的摄入,尤其是加工食品。锻炼和充足的睡眠也有助于维持健康的血糖水平。
二甲双胍也有助于降低甲状腺抗体
二甲双胍是一种支持血糖代谢和胰岛素敏感性的药物,通常用于治疗糖尿病患者,最近在桥本氏病患者中进行了研究,结果显示它具有降低甲状腺抗体的能力。
小檗碱是一种植物碱,已被证明对血糖有类似的有益作用。研究表明,每天服用一克小檗碱可使糖尿病患者的空腹血糖降低 20%,这与二甲双胍相当。如果您难以平衡血糖,除了改变生活方式外,小檗碱也是一种不错的选择。
8
减肥
近年来,自身免疫性疾病和肥胖症的发病率显著上升,许多研究都探讨了两者之间的关联。一种可能的机制是,由于肥胖症中的脂肪组织发挥着类似内分泌器官的功能,它会释放细胞因子,通过激活辅助T细胞和抑制调节T细胞来引起促炎作用。这可能导致自身免疫反应,尤其是在有遗传倾向的人身上。
2021年的一项研究调查了减肥是否会影响桥本氏病肥胖患者的甲状腺抗体水平。这项研究包括 BMI 超过 30 且 TPO 抗体水平超过 5.6 IU/mL 的个体。在六个月的研究结束时,研究人员发现减肥的人的 TPO 抗体水平也降低了。减掉多余的体重可能对桥本氏病患者有益。
9
减少氧化应激
谷禾以前专门写过氧化应激对健康的威胁的文章(点击查看 大脑退行疾病的两个重要诱因:氧化应激和肠道失衡)。下面将介绍几种减少氧化应激的方法。桥本甲状腺炎患者的氧化应激增加,因此这可能是一种减少甲状腺抗体和感觉较好的有益策略。
✦ 限制碘以减少氧化应激
限制碘摄入已被证明可以减少氧化应激,根据多项研究,有些人通过限制碘摄入量可以降低甲状腺抗体。但请注意,其他人报告说,增加碘摄入量会降低抗体。这恰恰强调了为什么寻找根本原因是因人而异的。
在一项调查中,有356人尝试了高剂量碘,其中 25% 的人表示服用后感觉好些,28% 的人表示服用后感觉更糟。46%的人表示没有发现任何变化,但这并不意味着他们的甲状腺抗体没有受到某种影响。
另一方面,碘限制使31.7%的人感觉好些,7% 的人感觉更糟。
碘是一个非常有争议的话题,但我还是把它放在这里,希望它能帮到你。话虽如此,在考虑改变碘摄入量之前,我会先消除常见的诱因。你也可以采取其他措施来减少氧化应激,效果会更好,比如服用硒。
✦ 硒作为抗氧化剂制造商
桥本甲状腺炎患者常见营养缺乏,通常是由于肠道通透性问题造成的。
桥本氏病中一种特别缺乏的营养物质是硒。硒是一种微量矿物质,参与制造谷胱甘肽过氧化物酶等抗氧化剂。谷胱甘肽过氧化物酶有助于清除受氧化损伤影响的细胞。
临床试验发现,每天200微克的剂量可以降低甲状腺抗体。在一些研究中,硒在六个月内显著降低了抗体。
在一项的调查中,服用硒补充剂的人中有 63% 感觉更好。34%的人感觉没有变化,而3.5%的人感觉更糟。
✦ 肌醇可减轻氧化应激(以及焦虑)
研究表明,焦虑、抑郁和总体感觉“不适”是甲状腺受到自身免疫攻击的早期迹象,并且可能与甲状腺抗体有关,即使 TSH 数值仍然正常。
据报道,甲状腺抗体阳性人群中最常见的焦虑症类型是强迫症 (OCD)。强迫症在A型人格中更为常见,所以强迫症倾向肯定会随着甲状腺抗体的上升而爆发,然后随着抗体的下降而减轻。
研究发现,肌醇有助于治疗多囊卵巢综合征 (PCOS)、强迫症和焦虑症。另外,肌醇被发现可以降低TPO抗体、降低TSH,还能平衡血糖。
在一项将肌醇和硒结合起来治疗桥本甲状腺炎患者的研究中,研究人员发现,这种组合可以降低 TSH、TPO 和 TG 抗体,并改善甲状腺激素水平和个人幸福感。
10
减少甲状腺抗体的免疫调节策略
✦ 系统酶
系统性酶作为天然免疫调节剂,帮助我们的免疫系统保持平衡。
欧洲对系统性酶进行了大量研究。在那里,酶是治疗关节炎和炎症(如桥本氏病)的一种流行止痛药替代品。
系统性酶可以分解自身免疫疾病中形成的循环免疫复合物,从而减少针对食物和甲状腺的抗体。它们还可以通过减少炎症来帮助组织修复。
✦ 阿纳他滨
阿那他滨是一种合成物质,由茄科植物(奇怪的是包括烟草)中发现的一种天然生物碱制成。早在 2012-2014 年,由于临床试验结果良好,它就作为桥本氏病的补充剂上市销售。它有助于减少炎症和抗体,同时寻找免疫系统失衡的根本原因。
一项针对患有桥本甲状腺炎且甲状腺功能正常的患者的研究结果显示,使用阿那他滨后,甲状腺球蛋白抗体显著降低。
✦ 维生素 D – 轻松增强免疫力
如果每天在户外的时间不多,那么可能面临维生素 D 缺乏的风险。维生素 D 缺乏(由于缺乏阳光照射、使用防晒霜或饮食不良等因素)与免疫功能不正常有关。
维生素 D 缺乏症在桥本甲状腺炎患者中也更为常见。一项研究中,桥本甲状腺炎患者中,68% 的人报告自己也患有维生素 D 缺乏症,这种缺乏症与抗甲状腺抗体的存在有关。
另一项研究发现,92% 的桥本甲状腺炎患者缺乏维生素 D,而 2013 年的一项研究发现,维生素 D 水平低与甲状腺抗体较高和疾病预后较差有关。
最近一项研究表明,补充维生素D可以降低自身免疫性甲状腺疾病患者的甲状腺过氧化物酶抗体水平。
✦ 羟氯喹 – 用于治疗多种自身免疫性疾病
羟氯喹(Plaquenil)是一种最初用于预防或治疗疟疾的药物。然而,在第二次世界大战期间,人们发现这种药物对治疗狼疮、类风湿性关节炎和其他自身免疫性疾病的症状也有效。
甲状腺功能障碍和抗体常与系统性红斑狼疮 (SLE) 和类风湿性关节炎 (RA) 有关。
羟氯喹可减少淋巴细胞、自身抗体的产生、免疫介质、细胞因子和 NK 细胞活性;并抑制向 B 细胞、树突状细胞和单核细胞呈递的抗原。
一项研究表明,使用羟氯喹治疗可显著降低甲状腺抗体的 DNA 水解活性。甲状腺功能减退症患者的 DNA 水解 IgG 抗体水平较高。使用羟氯喹可减少这些抗体,并改善甲状腺激素的产生并提高甲状腺的功能活动。羟氯喹还改善了患者的临床状况。
注意,这种药物确实有很多潜在副作用,包括:心律不齐、精神/情绪变化(焦虑、抑郁、幻觉)、呼吸短促、视力模糊、手臂/腿部/背部疼痛、疲劳和胸部不适。
11
靶向去除是降低甲状腺抗体的策略
✦ 甲状腺切除术
通过手术切除甲状腺可以消除甲状腺抗体,因为没有任何东西可以攻击。但是,切除甲状腺并不能消除自身免疫性疾病。无数人因为甲状腺疾病而切除甲状腺(最常见的是格雷夫斯病、结节和甲状腺癌,但偶尔也有桥本甲状腺炎)。在某些情况下,同时患有桥本甲状腺炎和甲状腺癌的患者可能希望采用这种方法。
一般不建议桥本甲状腺炎患者手术切除。有上述很多其他方法可以改善,防止自身免疫的进展。
✦ 新兴解决方案
干细胞最近已成为自身免疫性疾病患者的潜在治疗选择。在干细胞治疗中,患者将接受可修复受损器官的细胞输注。在桥本甲状腺炎病例中,有人报告称甲状腺抗体减少,甲状腺组织再生。请注意,使用捐赠者的干细胞实际上可能会增加自身免疫性疾病的风险,而据报道,使用自己的干细胞有助于治疗自身免疫性疾病。
Tips 降低抗体需要多长时间?
✦
大多数人在开始干预后一个月内就会开始看到抗体减少的趋势,也可能需要三个月到九个月甚至更长时间才能看到全部效果。
对于患有乳糜泻和麸质过敏症的患者,抗体水平的变化似乎与肠道愈合一致。对于患有幽门螺杆菌(H. pylori)的患者,在根除幽门螺杆菌后,肠道内壁可能需要数月才能愈合。
建议在实施干预措施时每 1-3 个月进行一次测试。这可以了解抗体的趋势,并清楚改变正在产生效果。
桥本氏病和其他自身免疫性疾病是由三种因素引起的。遗传易感性就是其中之一。
另外也存在两个因素,即,肠道通透性和自身免疫触发因素,幸运的是,人们可以通过生活方式干预来解决和改善这些问题。
桥本氏病和其他自身免疫性疾病的共同点是,触发因素会导致身体产生一种称为“缺乏自我耐受”的状态。这时身体不再能够将自己的组织识别为自身的一部分,而是开始将其组织视为外来入侵者。它不再对自己“宽容”,这就是导致自身免疫性疾病的原因。这是怎么发生的?
可以说是一个误认的情况。
一些微生物触发因素或感染产生的细菌细胞确实会触发人体免疫系统攻击入侵细胞。但由于所谓的分子模拟,人体可能会瞄准与这些入侵者相似的其他细胞。这可能导致免疫系统攻击自己的身体。
触发因素包括食物敏感、营养素缺乏、毒素暴露、慢性感染、压力反应不佳以及许多其他因素。一些触发因素实际上也会导致肠道通透性(肠漏)问题,例如麸质敏感。
因此,大多数甲状腺疾病都是由于免疫系统失衡而攻击甲状腺造成的。即使通过手术切除甲状腺或用放射性碘治疗,在大多数情况下,自身免疫问题仍然存在。许多人会切除甲状腺,并可能会患上新的自身免疫性疾病,如狼疮、类风湿性关节炎等。好像免疫系统只是找到了不同的目标。
在大多数桥本甲状腺炎病例中,这种自我耐受能力的缺乏在甲状腺功能受到影响之前就开始出现(通常甚至在症状出现之前)。当身体的免疫耐受能力开始崩溃时,就像文中详细提到的首先会看到甲状腺抗体升高。
在桥本氏病中,抗体针对甲状腺球蛋白(80%)和甲状腺过氧化物酶 (TPO) (95% 的人)。因此有很多方法可以检测甲状腺抗体,一旦发现有抗体,就可以采取纠正措施:
•减少触发
•减少氧化应激
•免疫调节
•免疫抑制
•目标移除
从而防止甲状腺疾病出现或发展。
与此同时,很多抗体的半衰期比检察官,可在免疫细胞中停留约两到三个月。它们需要以抗原的形式不断“提醒”,以便继续产生。因此如果去除抗原,抗体也会消失。大部分抗体完全忘记抗原并消失所需的时间是九到十二个月。意味通过降低或靶向去除抗体,是可以扭转桥本甲状腺炎的。
为了让抗体忘记甲状腺,需要做到以下几点:
而甲状腺会因两个原因停止表达TPO:
在自身免疫性疾病的情况下,传统和替代医学从业者可能会专注于重新平衡免疫系统(即传统医学中使用的类固醇和免疫调节药物,或者替代医学中使用的草药、补充剂或针灸)。
虽然这种方法可能有助于在短期内驯服免疫系统或克服自身免疫爆发,但它通常是一种临时解决方案,如果不解决导致免疫系统失衡的根本问题,一旦停止使用药物、针灸、草药和补充剂,免疫系统可能会再次失衡。因此,我们可以说免疫调节只能治疗症状,而不是根本原因。
由于我们无法改变基因,我们解决桥本甲状腺炎根本原因的方法有三方面:
小编寄语
希望今天这些分享能对桥本患者有所帮助!面对桥本甲状腺炎,保持积极的心态和健康的生活方式是非常重要的。记住,你并不孤单,很多人都和你一样,正在经历相同的挑战。
治愈是一个循序渐进的过程,定期就医进行必要的检查,遵医嘱定时服药,合理饮食,适当锻炼,坚持健康的生活方式,关注肠道健康,恢复肠道微生物群平衡,都有助于改善病情。希望大家都能在这个过程中找到适合自己的方法,收获健康与快乐。
免责声明:本文所含信息仅供参考,不应视为医疗建议。如有任何健康问题,以及在进行任何医疗或生活方式改变之前,请咨询您的医生。
主要参考文献
Lzabella Wentz, PharmD, 2018.Thyroid Antibodies Part 1: An Early Warning for Thyroid Disease. Thyroidpharmacist.
Lzabella Wentz, PharmD, 2024.Thyroid Antibodies Part 2: Mechanisms to Reduce Thyroid Antibodies. Thyroidpharmacist.
Hutfless S, Matos P, Talor MV, Caturegli P, Rose NR. Significance of prediagnostic thyroid antibodies in women with autoimmune thyroid disease. J Clin Endocrinol Metab. 2011;96(9):E1466-E1471.
Müssig K, Künle A, Säuberlich AL, et al. Thyroid peroxidase antibody positivity is associated with symptomatic distress in patients with Hashimoto’s thyroiditis. Brain Behav Immun. 2012;26(4):559-563.
Bucci I, Giuliani C, Di Dalmazi G, Formoso G, Napolitano G. Thyroid Autoimmunity in Female Infertility and Assisted Reproductive Technology Outcome. Front Endocrinol (Lausanne). 2022;13:768363.
Geracioti TD Jr, Kling MA, Post RM, Gold PW. Antithyroid antibody-linked symptoms in borderline personality disorder. Endocrine. 2003;21(2):153-158.
Wang N, Sun Y, Yang H, et al. Hashimoto’s Thyroiditis Induces Hippocampus-Dependent Cognitive Alterations by Impairing Astrocytes in Euthyroid Mice. Thyroid. 2021;31(3):482-493.
Geracioti TD Jr, Kling MA, Post RM, Gold PW. Antithyroid antibody-linked symptoms in borderline personality disorder. Endocrine. 2003;21(2):153-158.
Wang N, Sun Y, Yang H, et al. Hashimoto’s Thyroiditis Induces Hippocampus-Dependent Cognitive Alterations by Impairing Astrocytes in Euthyroid Mice. Thyroid. 2021;31(3):482-493.
Mazaheri T, Sharifi F, Kamali K. Insulin resistance in hypothyroid patients under Levothyroxine therapy: a comparison between those with and without thyroid autoimmunity. J Diabetes Metab Disord. 2014;13(1):103. Published 2014 Oct 30.
Brent GA. Environmental exposures and autoimmune thyroid disease. Thyroid. 2010;20(7):755-761. doi:10.1089/thy.2010.1636
Edwards C. Surgical mesh implants may cause autoimmune disorders. Medical Device Network. August 1, 2018. Accessed June 28, 2023.
Fadaee N, Huynh D, Khanmohammed Z, Mazer L, Capati I, Towfigh S. Patients with systemic reaction to their hernia mesh: An introduction to mesh implant illness. Frontiers. January 30, 2023.
Tomer Y, Davies TF. Infection, thyroid disease, and autoimmunity. Endocr Rev. 1993;14(1):107-120.
Mizokami T, Wu Li A, El-Kaissi S, Wall JR. Stress and thyroid autoimmunity. Thyroid. 2004;14(12):1047-1055.
Hu S, Rayman MP. Multiple Nutritional Factors and the Risk of Hashimoto’s Thyroiditis. Thyroid. 2017;27(5):597-610.
Coucke F. Food intolerance in patients with manifest autoimmunity. Observational study. Autoimmun Rev. 2018;17(11):1078-1080.
Rogers MA, Levine DA, Blumberg N, Fisher GG, Kabeto M, Langa KM. Antigenic challenge in the etiology of autoimmune disease in women. J Autoimmun. 2012;38(2-3):J97-J102.
Desai MK, Brinton RD. Autoimmune Disease in Women: Endocrine Transition and Risk Across the Lifespan. Front Endocrinol (Lausanne). 2019;10:265. Published 2019 Apr 29.
Sategna-Guidetti C, Volta U, Ciacci C, et al. Prevalence of thyroid disorders in untreated adult celiac disease patients and effect of gluten withdrawal: an Italian multicenter study. Am J Gastroenterol.
Hollon J, Puppa EL, Greenwald B, Goldberg E, Guerrerio A, Fasano A. Effect of gliadin on permeability of intestinal biopsy explants from celiac disease patients and patients with non-celiac gluten sensitivity. Nutrients. 2015;7(3):1565-1576. Published 2015 Feb 27.
Bell DS, Ovalle F. Use of soy protein supplement and resultant need for increased dose of levothyroxine. Endocr Pract. 2001;7(3):193-4.
Fruzza AG, Demeterco-Berggren C, Jones KL. Unawareness of the effects of soy intake on the management of congenital hypothyroidism. Pediatrics. 2012;130(3):e699-702.
Eschler DC, Hasham A, Tomer Y. Cutting edge: the etiology of autoimmune thyroid diseases. Clin Rev Allergy Immunol. 2011;41(2):190-197.
Aghili R, Jafarzadeh F, Bhorbani R, Khamseh ME, Salami MA, Malek M. The association of Helicobacter pylori infection with Hashimoto’s thyroiditis. Acta Med Iran. 2013;51(5):293-296.
Yason JA, Liang YR, Png CW, Zhang Y, Tan KSW. Interactions between a pathogenic Blastocystis subtype and gut microbiota: in vitro and in vivo studies. Microbiome. 2019;7(1):30. Published 2019 Mar 11.
Lepczyńska M, Białkowska J, Dzika E, Piskorz-Ogórek K, Korycińska J. Blastocystis: how do specific diets and human gut microbiota affect its development and pathogenicity?. Eur J Clin Microbiol Infect Dis. 2017;36(9):1531-1540.
Diagnosis | Blastocystis Research Foundation. Blastocystis Research Foundation. http://www.bhomcenter.org/info/diagnosis.htm.
Rajič B, Arapović J, Raguž K, Bošković M, Babić SM, Maslać S. Eradication of Blastocystis hominis prevents the development of symptomatic Hashimoto’s thyroiditis: a case report. J Infect Dev Ctries. 2015;9(7):788-791. Published 2015 Jul 30.
Patil AD. Link between hypothyroidism and small intestinal bacterial overgrowth. Indian J Endocrinol Metab. 2014;18(3):307-309.
Shenkman L, Bottone EJ. Antibodies to Yersinia enterocoliticain Thyroid Disease. Ann Intern Med. 1976;85:735–739.
Chatzipanagiotou S et al. Prevalence of Yersinia plasmid-encoded outer protein (Yop) class-specific antibodies in patients with Hashimoto’s thyroiditis. Clinical Microbiology and Infection. 2001;7(3):138–143.
Pamphlett R, Doble PA, Bishop DP. Mercury in the human thyroid gland: Potential implications for thyroid cancer, autoimmune thyroiditis, and hypothyroidism. PLoS One. 2021;16(2):e0246748. Published 2021 Feb 9.
Sterzl, Ivan I. Removal of dental amalgam decreases anti-TPO and anti-Tg autoantibodies in patients with autoimmune thyroiditis. Neuro-endocrinology letters. 27(25):0172-780X.

谷禾健康

这篇文章总结了关于肠道微生物群(GM)在糖尿病中的作用的研究现状与结论,内容来自《Diabetes》、《Diabetes Care》和《Diabetologia》最近举办的一次国际专家论坛,该论坛在2023年的欧洲糖尿病研究协会年会上举行。论坛参与者包括在肠道微生物组和代谢领域的领军研究人员,其中既有临床医生,也有基础科学家。
讨论主要分为四个主题:流行病学、生理学和病理生理学、技术和方法以及临床应用。他们得出的结论如下:
肠道微生物群参与2型糖尿病的病理生理过程。微生物产生的代谢物与疾病有正面和负面的关联,而且最近通过人类的孟德尔随机化研究,发现了肠道微生物功能(如丁酸盐生产基因)与葡萄糖代谢之间的机制联系。
肠道微生物群的高度个体化特性是研究的一大障碍。需要大型队列和深度测序的方法来稳健地评估关联性和因果关系。
由于单次采样对于捕捉糖尿病个体内肠道微生物群的动态变化有些困难,建议未来需要要对个体多次重复测量的研究,就是要增加纵向队列的研究。
未来还需要大量研究来确定这些不断扩展的知识如何应用于糖尿病的诊断和治疗。新技术和改进的计算工具将对实现这一目标很重要。
研究小组承认,对肠道菌群在代谢疾病中的作用的理解存在许多差距,这并非糖尿病领域所独有,而是反映了更广泛的需求。开展更多控制良好的前瞻性和回顾性人体研究,并在机制上跟进模型系统研究,改进计算工具,将有利用将目前的微生物组数据应用于未来糖尿病的诊疗。
Perspectives
1)
肠道菌群与糖尿病之间的流行病学关联
肠道微生物群是人体最大且最复杂的微生物群落,它连接着我们的外部和内部环境。对肥胖症和心血管代谢疾病(包括2型糖尿病)中肠道微生物群进行流行病学研究的动机源于啮齿动物研究,这些研究证明了肠道微生物群、脂肪性和葡萄糖耐受性之间的联系。
在人类研究中,流行病学研究观察到肥胖症患者的微生物多样性降低,但通过对小型队列进行16S rRNA基因测序或全基因组宏基因组学分析的荟萃分析,并未发现普遍适用的与肥胖相关的肠道微生物特征(换句话说,微生物与疾病的研究需要大队列和大数据库)。
然而,一项对以色列和美国34057名个体进行深度测序全基因组宏基因组学的大规模肠道微生物研究显示,肠道微生物与表型之间存在一致的关联,并且基于微生物组数据训练的机器学习模型对体重指数(BMI)和糖化血红蛋白(HbA1c)的预测准确性可以在不同队列间复制。
通过对训练队列进行子采样,发现随着队列规模的增加,预测准确性也随之提高,约7500-10000个体的样本量可以获得可重复的结果(目前谷禾糖尿病模型使用了9989个样本队列)。这一发现强调了在人类肠道微生物横断面研究中使用大型队列(包含数百名个体)和深度测序组学的必要性,以充分代表人群中的个体异质性以及地区和人口统计学变异。
Byndloss M, et al.Diabetes Care.2024
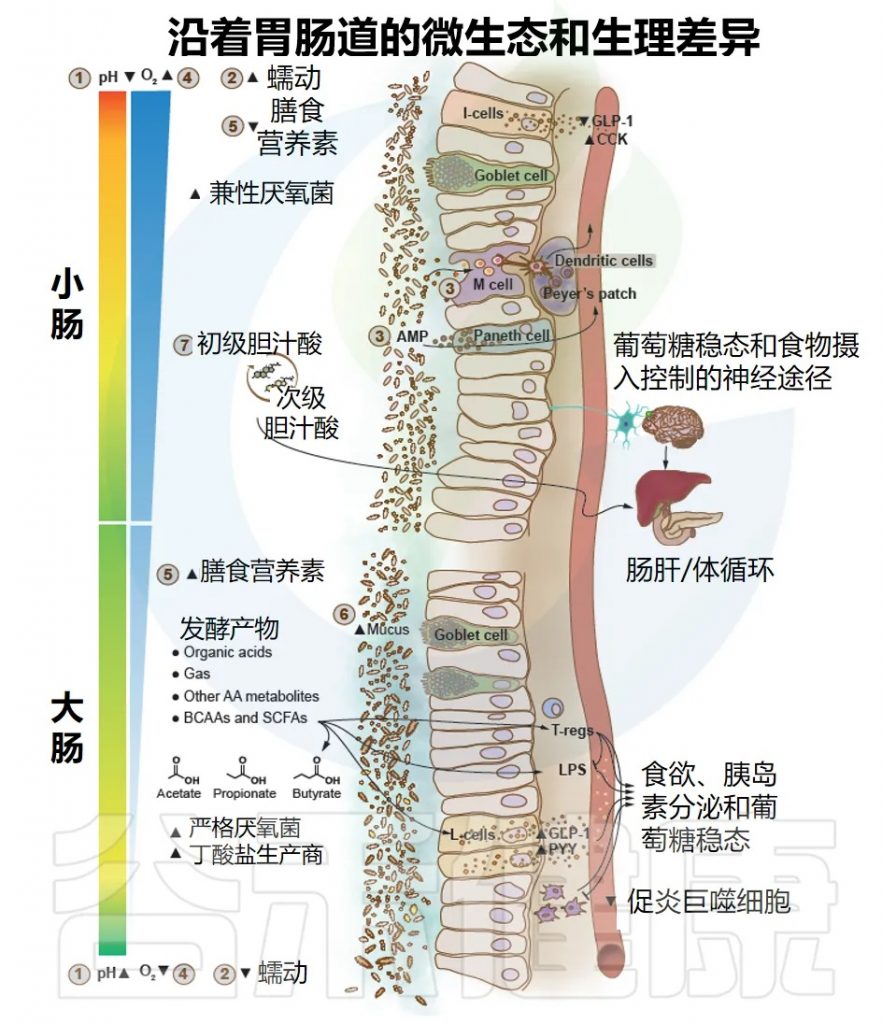
胃肠道(GI)沿线的微生态和生理差异反映了各种环境因素的变化,这些变化依赖于物理、营养和生物学的宿主因素。这些因素导致肠道不同区域的细菌及其生理功能的适应和差异,通过可能影响葡萄糖代谢和糖尿病风险的多向交互产生效果。
以下是影响不同区域微生物数量和组成的主要因素:
pH值:从胃(pH1.0–4.4)到小肠(pH 5.5–7.0),然后更为渐进地到达结肠,在那里由于复杂碳水化合物(纤维)的微生物发酵,pH值可能再次下降(pH5.5)。在粪便中pH值再次升高(可达pH7.8)。
肠道蠕动:在小肠中,肠道通过时间较短,肠蠕动更为强烈,而在大肠中则不然。
肠道上皮细胞:小肠的泛素细胞分泌抗菌肽(AMPs),充当天生防御屏障以减少细菌定植;而M细胞从肠腔中捕获细菌。
氧气浓度:从小肠到大肠,氧气水平逐渐降低。
膳食营养:主要在小肠中由宿主酶消化和快速吸收蛋白质、脂肪和简单碳水化合物,因此限制了细菌对这些营养物质的获取;而部分未消化的膳食残留(例如复杂碳水化合物和部分水解的蛋白质/氨基酸)则积聚在大肠,为细菌提供营养。
宿主糖基:它是由杯状细胞产生的粘液层的一部分,在大肠中远比小肠厚,也是肠道细菌的营养来源,支持其生长。
胆汁酸:分泌至小肠,抑制和有利于某些参与其代谢和再循环的特定细菌的生长。
以上所有生物和非生物因素影响生态条件,使得细菌群体可以在向肠道最远端部分移动时更加密集(从十二指肠的每克102–104个细菌到回肠的107–109个,以及结肠的1011–1012个),并导致细菌组成的差异,其中兼性厌氧菌优先在小肠定殖,而严格厌氧菌在大肠内的微生物中占主导地位,包括丁酸盐生产者。
因此,为了在种族/民族、生活方式和其他人口特征差异之外识别疾病特异性的微生物特征,重要的是在大型人群中进行研究,并将来自不同研究的健康个体/对照参与者作为参考;这些方法已被证明可以提高疾病预测准确性。
2)
肠道微生物代谢与葡萄糖稳态的关联
多项观察性研究报告了肠道微生物群与2型糖尿病之间的关联。在全球流行病学研究中发现,2型糖尿病和糖耐量受损/空腹血糖异常患者的肠道微生物组成发生了一致的改变,这些改变在代谢综合征中也存在,主要特征是微生物多样性降低和产生短链脂肪酸(SCFA)丁酸盐的细菌丰度减少。一些研究还观察到机会性病原体的增加。
最近,粘液降解菌Ruminococcus gnavus被确定为代谢综合征多个特征的预测因子,包括低度炎症、腰围增大、血清甘油三酯升高、糖化血红蛋白升高和高密度脂蛋白胆固醇降低。然而,正如对不同疾病(包括胃肠道和代谢性疾病)肠道菌群改变的荟萃分析所指出的,这些特征中的几个并非疾病特异性,可能代表了一般的肠道菌群的失调。
与葡萄糖代谢和2型糖尿病相关的肠道微生物代谢物和信号分子,肠道微生物群的结构蛋白和分泌蛋白参与调节免疫反应和炎症,正如F. prausnitzii(普拉梭菌)分泌的蛋白质(微生物抗炎分子[MAM]),它能够抑制核因子-κB(NF-κB)通路。另一个例子是A. muciniphila(AKK菌)的外膜蛋白Amuc_1100,它能改善肠道屏障并降低炎症。
①短链脂肪酸
肠道菌群生成短链脂肪酸(SCFAs),SCFAs调节几个过程,包括肠道蠕动和pH值、肠道屏障免疫反应以及通过影响糖异生、胰岛素敏感性和胰岛素分泌的途径来调节系统代谢。
此外,SCFAs调节免疫细胞功能,增强肠道屏障,并刺激肠神经的信号传导。其中丁酸盐还为结肠细胞提供主要能量,并通过激活过氧化物酶体增殖物激活受体γ(PPARγ)增加结肠细胞的β-氧化(β-ox)。
然而,人类研究显示,2型糖尿病患者粪便或血液中不同SCFAs的水平存在广泛变异,这可能是由于方法学局限性造成的。支持SCFAs在调节葡萄糖代谢中作用的最强有力证据来自动物研究和最近一项使用孟德尔随机化统计方法的人类研究(参见下文)。
②胆汁酸
胆汁酸是两性分子,可介导膳食脂肪和脂溶性维生素的吸收。这些分子也被认为是调节脂质、葡萄糖和能量代谢的主要参与者。因此,在2型糖尿病和其他肥胖相关疾病中发现了胆汁酸池的改变,并被认为可能是2型糖尿病病理生理学的潜在贡献因素。
12α-羟基化胆汁酸水平的增加和6α-羟基化胆汁酸水平的降低与胰岛素抵抗有关,并在2型糖尿病患者中出现。胃旁路手术后观察到6α-羟基化胆汁酸水平增加,可预测2型糖尿病的缓解。
干预研究也调查了胆汁酸在人类代谢中的潜在重要性。在减肥手术后,系统性胆汁酸水平升高以及肠道信号激发GLP-1释放的现象得到了验证,尤其是餐后增加被认为特别重要。
然而,在一些进行过胆囊切除术的个体中发现胆汁酸反应过度,并与GLP-1和胰岛素反应的进一步增强相关联。在2型糖尿病患者中,已证明二甲双胍通过减少脆弱拟杆菌的丰度来改善葡萄糖代谢,这与肠道中甘牛胆酸水平的增加和法尼醇X受体(FXR)的抑制有关。
然而,对肠道微生物群与胆汁酸之间直接相互作用及其与2型糖尿病及相关疾病的发展和治疗的关联的理解仍然有限,还需要更多的人体研究来探索。
③色氨酸代谢物
肠道菌群色氨酸代谢物,如吲哚丙酸(IPA)和吲哚丙烯酸(IA),通过孕烷X受体(PXR)改善肠道屏障,并通过肠道免疫细胞上的芳香烃受体(AHR)进行信号传导,增加白介素-22(IL-22)的产生,从而调节免疫和代谢反应。
④其他代谢物
在血液中,IPA和IA还提供抗氧化和抗炎功能。研究还表明,3-吲哚丙酸(色氨酸的代谢产物)的循环水平升高与胰岛素分泌和敏感性改善以及2型糖尿病风险降低相关。
咪唑丙酸和支链氨基酸(BCAAs)通过激活雷帕霉素复合体1(mTORC1)的机制型靶标来损害胰岛素信号传导。
肠道菌群还产生乙醇,与脂肪肝病和胰岛素抵抗有关。
肠道微生物群产生的氨基酸代谢物也与2型糖尿病相关(前两个图)。研究表明,3-吲哚丙酸(色氨酸的代谢产物)的循环水平升高与胰岛素分泌和敏感性改善以及2型糖尿病风险降低相关。
此外,在存在胰岛素抵抗和2型糖尿病的个体中,血浆组氨酸代谢的细菌产物——咪唑丙酸水平增加。来自肠道菌群对芳香氨基酸代谢的这些代谢物和其他一些代谢物也与欧洲和美国独立队列中的心血管事件风险和死亡率有关。
肠道菌群还产生乙醇,与脂肪肝病和胰岛素抵抗有关。
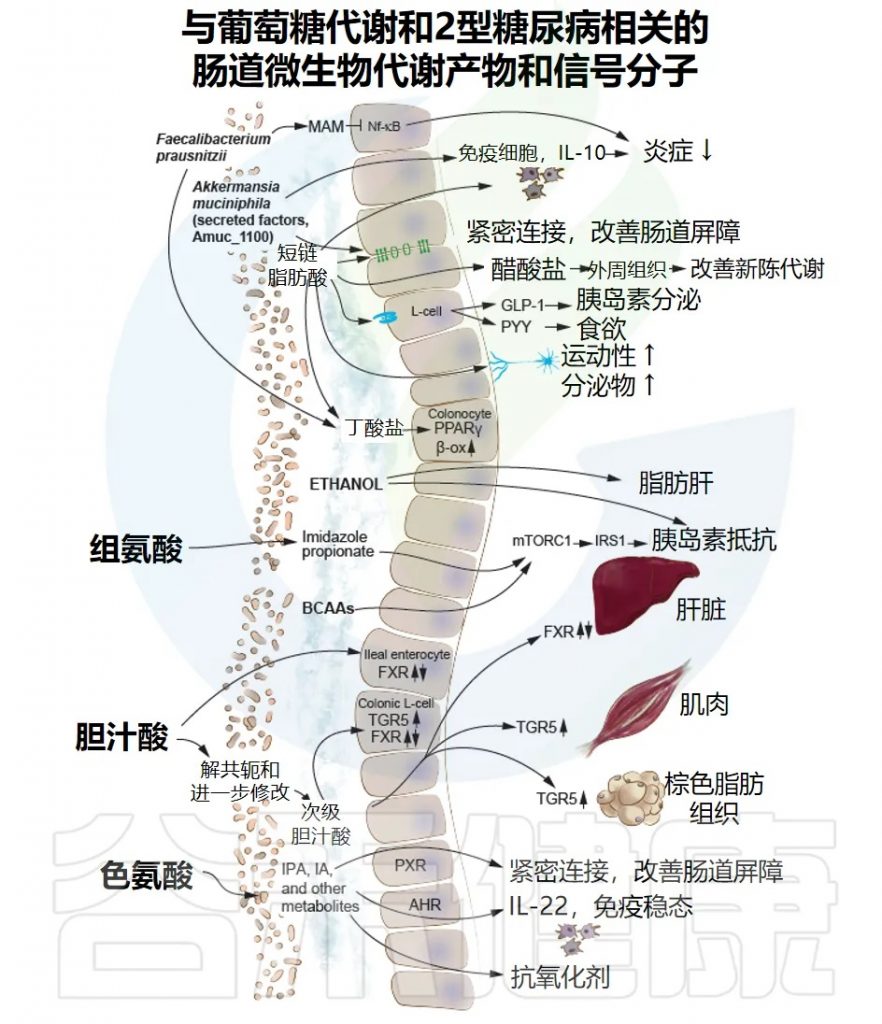
Byndloss M, et al.Diabetes Care.2024
3)
肠道菌群或其代谢产物和降糖药物治疗的关系
支持肠道微生物群在2型糖尿病中作用的证据已通过观察性和干预性研究得到加强。这些研究表明,二甲双胍使用者的肠道菌群中多种细菌物种的相对丰度发生了变化。
二甲双胍使用者肠道菌群发生显著变化
在多个涉及接受二甲双胍治疗个体的队列研究中,发现大肠杆菌(Escherichia coli)的相对丰度升高,而Intestinibacter bartlettii的丰度降低。
此外,最近一项大规模宏基因组研究发现,接受二甲双胍治疗的个体中Escherichia marmotae增加,而Romboutsia timonensis减少。
随机试验和对未使用药物的个体的研究为这些肠道菌群差异在2型糖尿病中的因果效应提供了支持。这些研究表明,肠道菌群组成的变化转化为丙酸盐和丁酸盐产生的增加以及胆汁酸池的调节,这可能介导了二甲双胍降血糖效应的一部分。
然而,肠道菌群也可能是约30%服用二甲双胍的个体经历短暂或持续肠道不适的原因(例如,通过一些大肠杆菌属种增加气体产生)。
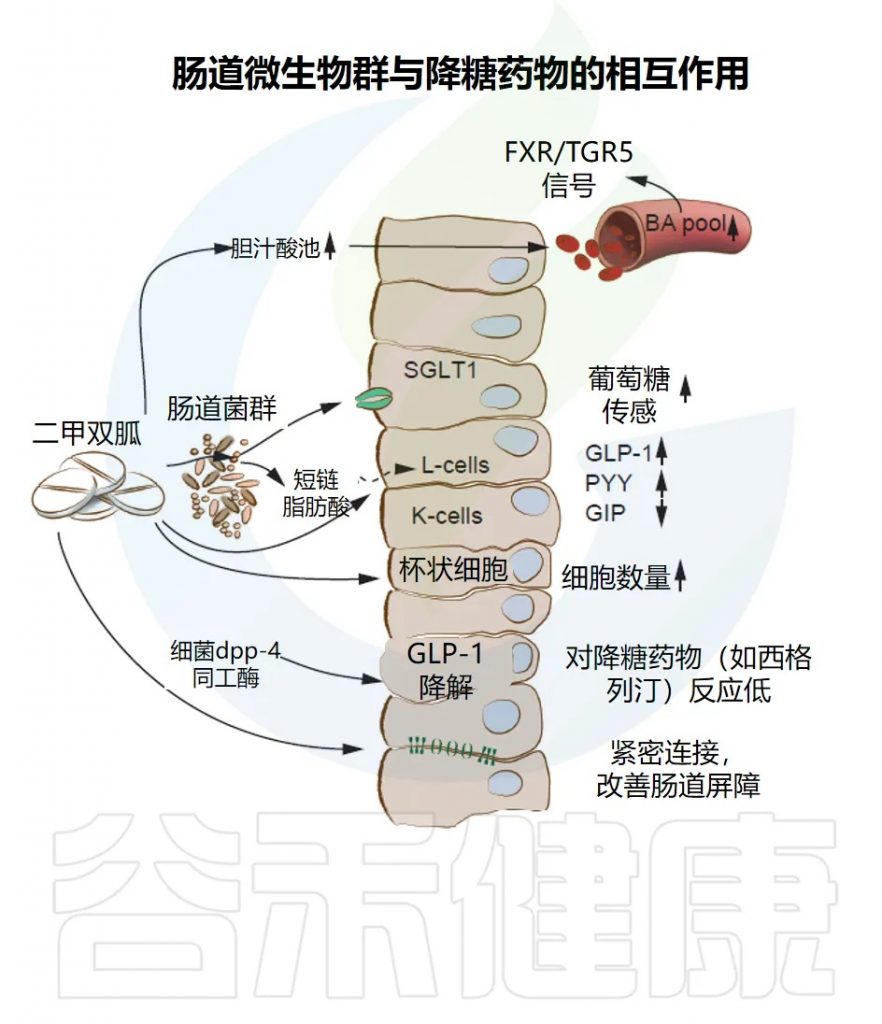
Byndloss M, et al.Diabetes Care.2024
肠道微生物代谢物参与二甲双胍的作用机制
肠道微生物代谢物参与二甲双胍的作用机制,包括通过胆汁酸受体FXR和TGR5进行胆汁酸信号传导,以及生产短链脂肪酸,这些都调节了内分泌细胞(K细胞和L细胞)中胰高血糖素样肽-1(GLP-1)、胃抑制多肽(GIP)和肽YY(PYY)等促胰岛素分泌激素的释放。
其他与二甲双胍作用相关的肠道菌群依赖机制包括通过钠-葡萄糖共转运蛋白1(SGLT1)改善葡萄糖感知和提高肠道屏障功能(例如,恢复紧密连接和增加产粘蛋白的杯状细胞)。
然而,肠道菌群通过表达二肽基肽酶-4(DPP-4)同工酶,可能降低GLP-1活性并影响降糖药物的疗效。
其他降糖药物与肠道微生物群的关联
关于其他口服降糖药物,研究表明二肽基肽酶4(DPP-4)抑制剂和α-葡萄糖苷酶抑制剂对肠道微生物群和微生物代谢物有影响,但钠-葡萄糖共转运蛋白2(SGLT2)抑制剂、噻唑烷二酮类和胰高血糖素样肽1(GLP-1)受体激动剂的影响较不明确。
迄今为止,大多数涉及SGLT2抑制剂的研究都是在小鼠模型中进行的,少数现有的人体研究结果存在矛盾,无法清楚地区分SGLT2抑制剂的效果与之前或同时使用二甲双胍治疗或同期生活方式改变的影响。
GLP-1受体激动剂可能通过激活上皮内淋巴细胞GLP-1受体产生抗炎作用,进而可能有助于调节肠道微生物群。尽管需要更多研究,但现有证据表明肠道菌群可能介导一些降糖治疗的益处,某些益生菌或益生元可能通过影响肠道微生物或其功能进一步改善这些药物的降糖效果。
需要进一步的干预和转化研究来确定药物诱导的肠道菌群变化是否在介导健康效应中起因果作用,并揭示潜在机制。
重要的是,肠道菌群还可能影响降糖药物的效果,例如通过表达人类DPP-4的同源物,这可能降低GLP-1的活性并影响葡萄糖代谢(下图)。由于细菌DPP-4同源物似乎对一些靶向人类DPP-4的药物具有耐药性,因此可能需要抑制细菌同工酶来改善当前药物的代谢反应。
4)
孟德尔随机化在阐明因果关系中的作用
肠道微生物群能够通过多种方式影响和与宿主健康互动,因果关系的方向通常是双向的甚至是多向的。肠道微生物群特征在不同层次(如群落、物种、途径、基因和代谢物)能影响宿主表型(例如改变肥胖的风险),同时,表型的发展(如肥胖)又可以反过来改变肠道微生物群。
孟德尔随机化(MR)是一种统计方法,利用与暴露相关的人类遗传变异体来区分疾病结果的因果效应、混杂、反向因果关系或其他因素导致的关联。为了应用MR研究肠道微生物与2型糖尿病的联系,所研究的肠道微生物特征需要受到一个或多个强烈的人类遗传变异体的影响,以便在工具变量分析中用作工具。
尽管已经有若干全基因组关联研究针对不同的肠道菌群特征(如肠道细菌分类群的相对丰度和人类粪便微生物代谢物)进行,但研究其在2型糖尿病中的因果作用的大型MR研究仍然有限,且尚未在重复研究中得到证实。
部分鉴定出与粪便短链脂肪酸(SCFA)水平相关的人类遗传变异体,并报告了肠道菌群丁酸盐生成潜力(即负责肠道丁酸盐生成的基因)与口服葡萄糖耐量测试中胰岛素反应改善之间的潜在因果联系。这些作者还发现异常的粪便丙酸水平与2型糖尿病风险增加之间存在因果关系。
另一项MR研究报告称,2型糖尿病和肾脏疾病提高了血浆中肠道菌群依赖的代谢物三甲胺氧化物(TMAO)的水平,并提出此前观察到的较高TMAO水平与心血管疾病风险升高的证据可能是由于混杂或反向因果关系,而非因果效应。
另一项近期研究则表明某些细菌属与2型糖尿病之间可能存在因果联系。考虑到MR(如多效性和与弱工具变量相关的问题)及肠道菌群研究(如方法学差异、个体间异质性和个体内可变性)的局限性,需要进行大型高质量研究,以评估使用MR的宿主遗传变异体模拟特定肠道菌群特征(无论是特定细菌物种、属还是代谢产物)的能力,以理解与2型糖尿病发病机制的因果关系。
Relationship
▸ 膳食纤维摄入量较少可能导致2型糖尿病
膳食纤维摄入量减少与2型糖尿病风险增加有关;因此,新的糖尿病管理饮食建议鼓励多食用加工程度低的植物性食物,如全谷物、蔬菜、全水果、豆类、坚果和种子。
饮食是肠道生态系统的驱动因素,微生物可及碳水化合物促进菌群多样性和短链脂肪酸生成,从而减少炎症并支持肠道屏障的维持。
就肠道菌群和葡萄糖代谢而言,增加纤维摄入量与不同菌种水平的增加有关,例如Prevotella copri(现已更名为Segatella copri)。研究还表明,纤维对 HbA 1c的有益作用可能是由特定的基线肠道菌群组成和纤维促进的短链脂肪酸产生菌的多样性介导的。
▸ 肠道微生物的特定成分会影响其宿主反应
然而,即使在控制良好的饮食干预中也会观察到不同的影响,而且鉴于肠道菌群的个体间差异很大,对肠道菌群的饮食反应是高度个性化的。
精准营养或“个性化”营养是一个不断发展的领域,它基于识别可用于设计饮食干预措施的个体特定反应预测特征。利用关于肠道菌群成分的个人数据以及血液生物标志物和饮食习惯等其他信息,机器学习方法已被用于预测标准化膳食后的血糖反应,其准确度高于其他预测方法。
这些研究表明,肠道微生物的特定成分会影响其宿主的特定反应(即在不同细菌存在的情况下,对饮食的反应不同)。因此,肠道菌群至少在一定程度上决定了人类代谢的异质性。肠道菌群可改变且代谢活性高,为更精确的生活方式干预和新疗法提供了可能性。
知识差距、挑战和机遇
目前已有数个大型的高质量参考基因组目录 ,它们为人类研究中肠道微生物的分类和功能表征提供了极大的便利。然而,这些数据库并非没有局限性。
对于流行病学分析而言,肠道菌群数据充满了挑战,包括个体间和个体内巨大的变异性、高维性(即观察到的肠道菌群特征的数量可能大于样本和受试者的数量)和稀疏性(即肠道菌群特征,如物种,仅在部分样本中检测到)。
在种群水平上,肠道菌群由数千个相互作用的物种组成,每个物种在不同宿主之间以及在同一宿主内随时间推移都具有遗传多样性;然而,常见的分析往往忽略了这种非独立性、微生物之间复杂的加性与相互作用效应,以及肠道菌群的可修改性和波动性。然而,最近的一些分析表明,不同细菌物种的个体内变异和对宿主生理的适应模式不同。
其他挑战与肠道微生物群可能影响和响应的大量表型和环境因素有关。大规模群体研究的重要性在人体遗传学中已被无可置疑地证明;大多数多基因性状已知受许多具有小效应的遗传变异影响,但这些变异可以汇总成具有临床重要性的强大多基因风险评分。
类似地,大规模宏基因组研究结果表明,单一的细菌物种可能与人类表型存在低效应大小的关联,或以低丰度存在。因此,需要大样本量以获得足够的统计能力和涵盖个体间变异性,以获得可复制的结果和高预测准确性。
为了更好地理解肠道菌群变异和动态对2型糖尿病的长期影响,前瞻性研究至关重要。在目前发表的少数前瞻性研究中,肠道菌群特征与中国地区多样人群中发生的2型糖尿病事件和西班牙一项临床试验的子集相关,这些研究均使用16S rRNA基因测序。
在一个拥有18年随访的大规模芬兰基于人群的队列研究中,肠道菌群特征也与2型糖尿病有关,使用的是浅层宏基因组测序。然而,在这些研究中,发生病例的数量有限,分析的分辨率也有限。
例如,Faecalibacterium prausnitzii是下一代益生菌最有希望的候选者之一,但也有其他有希望的候选者,如Akkermansia muciniphila和P. copri。关于F. prausnitzii,已在人体肠道中发现了几种潜在亚种,它们具有利用复杂多糖的不同功能潜力 。
与此观察一致,大型宏基因组学研究也发现了几种F. prausnitzii 亚种,但仅其中一部分亚种与 BMI 呈负相关。就P. copri 而言,已发现其与宿主代谢表型(如内脏脂肪和葡萄糖反应)呈正相关和负相关。
这些不一致的发现可以部分地用种内和种间多样性来解释。例如,这些差异可能将同一物种内的菌株定义为共生菌或致病菌,如脆弱拟杆菌和艰难梭菌的情况,这取决于该菌株是否编码毒力因子。
Perspectives
在进化过程中,哺乳动物必须适应充满微生物、病毒和真菌的世界。在无菌的宫内环境中,哺乳动物在出生期间和出生后立即暴露于潜在的有害微生物中。进化创造了实质性的屏障,包括胃肠道运输过程、免疫球蛋白A (IgA) 、粘液、上皮层、内皮屏障、淋巴结和肝脏,所有这些屏障阻止微生物易位进入体内,但为微生物生态系统创造了最佳储存库。上消化道中的微生物数量较少。同时,大肠内微生物密度和丰富度较高,从小肠到大肠,pH值和有氧/厌氧条件发生生理变化,大肠内为厌氧条件。
1)
微生物的基本功能
肠道微生物除了对哺乳动物造成潜在的有害威胁外,还为哺乳动物提供必需功能,包括训练免疫系统、保护其免受病原体的侵害(即抗定植)、代谢功能、营养物质供应(如维生素)、肠道蠕动和外来生物的解毒。
同时,微生物和宿主在小肠中竞争营养物质,微生物产生的常量营养素副产物被提供给宿主。
营养物质(即纤维)和哺乳动物代谢物(如葡萄糖醛酸苷、粘液多糖和胆汁酸)通过微生物代谢进行发酵或转化。微生物代谢以及微生物细胞的死亡和周转形成了外周血中微生物代谢物池,其中约30%的外周血代谢物与肠道菌群及其代谢物有关。
这些微生物代谢物被G蛋白偶联受体(GPCR) 或芳烃受体(AHR)等受体识别,或被哺乳动物酶(如 TMAO)进一步加工,通过表观遗传修饰调节哺乳动物基因表达,对代谢健康产生影响。
2)
不可消化纤维及其代谢物的作用
不可消化的碳水化合物是大肠中特定细菌的能量来源,这些细菌含有宿主所缺乏的酶,这些酶可以代谢这些纤维并促进SCFA的产生。大量研究表明,外源性短链脂肪酸(尤其是丙酸和丁酸)对糖尿病样表型的啮齿动物模型有益。然而,1型和2型糖尿病临床试验的证据尚不明确。
在结肠中,短链脂肪酸(SCFA)通过与GPCR和游离脂肪酸受体2和3结合激活肠内分泌细胞(EEC),诱导肠道肽(主要是GLP-1和肽YY)的释放。为了支持这一发现,啮齿动物和人类补充益生元可以改善葡萄糖耐量和胰岛素抵抗,并且与肠道肽水平升高有关 。
在一项研究中,高纤维饮食改善了2型糖尿病患者的葡萄糖耐量,这种效果与粪便丁酸水平和循环GLP-1水平升高有关。GLP-1通过增加胰岛素分泌、促进胰岛素敏感性和减少肝葡萄糖生成来调节葡萄糖稳态。
此外,短链脂肪酸(SCFA)对于维持整体肠道健康和肠道屏障至关重要,因为丁酸是结肠细胞的主要燃料来源。相反,丁酸减少会促使结肠细胞进行无氧糖酵解,从而增加上皮氧合,破坏结肠的厌氧环境。
3)
肠道菌群在肠道屏障功能中的作用
肠道微生物在肠道屏障功能中起着至关重要的作用。肠道屏障受损会导致肠漏,从而引发低度全身性炎症,这是肥胖和糖尿病的特征。尽管这些机制主要在实验模型中进行研究,但导致全身性炎症的一个潜在机制是来自革兰氏阴性细菌细胞包膜的脂多糖(LPS)内毒素增加,也称为代谢性内毒血症。
肠道菌群失调会导致促炎反应,影响葡萄糖稳态
脂多糖(LPS)可以作用于全身特定的病原体相关分子模式 (PAMP) — Toll 样受体 4 (TLR4) — 从而引发促炎免疫反应,从而对葡萄糖稳态产生负面影响。一系列研究表明A. muciniphila通过作用于 TLR4 和肠道屏障,在介导肠道微生物改变对全身炎症的一些影响方面发挥潜在作用;
然而,关于其在代谢疾病中介导葡萄糖代谢作用的证据较少 。然而,还需要更多的研究来确定TLR4以外的 PAMPs 对代谢物的感知是否与调节宿主-微生物串扰和人类肠道屏障完整性有关。
与此同时,在肥胖个体的肠道中观察到促炎性巨噬细胞的积聚、CD8αβ T 细胞浸润和 IgA+ 免疫细胞减少 ,导致胰岛素抵抗。肠道菌群调节策略可以减轻高热量饮食对肠道免疫的不利影响。例如,减少促炎性巨噬细胞的比例并增加 3 型先天淋巴细胞和调节性 T 细胞与改善葡萄糖代谢有关。
尽管如此,了解驱动肠道微生物与免疫相互作用的精确分子机制及其在人类中的应用也需要未来进行广泛的研究。
Progress
在微生物组领域,将现象学与实际生物学区分开来需要工具和方法来识别机制,以解析微生物组是否是代谢疾病的驱动因素或提供治疗机会。在这里,我们讨论了推动该领域发展的最有希望的技术发展。
模型系统
在比较研究肠道微生物与代谢疾病之间关系的模型系统时,必须同时考虑传统模型(例如无菌和无菌小鼠)和新兴技术(例如器官芯片和非鼠类GF模型,如斑马鱼和猪)。
无菌模型有利于研究肠道菌群与特定疾病的关联
无菌动物已被广泛用于研究人类肠道微生物在肥胖和糖尿病中的作用。这些动物出生时没有任何微生物群,可以在没有微生物组的情况下对干预措施进行研究。因此,我们可以深入了解微生物组是否对给定的生物过程必不可少。
通过将整个肠道菌群(通过供体粪便)或特定的分离菌株定植到无菌小鼠体内,建立无菌疾病模型。研究表明,将肥胖和2型糖尿病患者粪便中的微生物接种到无菌动物体内后,无菌动物成功复制了疾病表型,这为肠道菌群与代谢疾病的关联提供了证据。
此外,从患有病态肥胖和糖尿病的人的肠道中分离出一种过度生长的产生内毒素的细菌阴沟肠杆菌B29,它在无菌 C57BL/6J 小鼠中诱发了肥胖、脂肪肝和胰岛素抵抗,而这些小鼠对高脂饮食引起的代谢缺陷具有抵抗力。敲除B29菌株中产生内毒素的基因或C57BL /6J小鼠中的Tlr4基因可预防代谢缺陷,强调了特定肠道细菌和宿主反应在代谢疾病的发生和发展中的因果关系。
然而,某些关于肠道微生物小鼠的概念一直流传,而这些概念只是研究一种基因型的结果。例如,GF C57BL/6J 小鼠对饮食诱导的肥胖具有抗性,而 GF Swiss Webster 小鼠则不能;因此,由于大多数 GF 小鼠研究都使用 C57BL/6J 小鼠,因此 GF 小鼠通常必须比传统小鼠吃得更多才能维持体重,这已成为事实。这些模型对高脂饮食的不同反应凸显了遗传背景在研究结果中的重要性。
其他GF模型(如猪和斑马鱼)的存在补充了 GF 小鼠的使用。在开发与人类微生物群相关的无菌模型时,GF 猪和仔猪比小鼠能提供更多与人类相关的见解,尽管饲养它们所需的空间对于许多机构而言过于宽裕,或限制了研究只能使用少数动物。另一方面,无菌斑马鱼已被证明可用于研究肠道微生物和不同宿主细胞发育阶段 。
鱼体的透明度、在不同细菌存在下荧光标记和成像不同细胞类型的能力,以及饲养和繁殖斑马鱼的便利性,都有利于研究特定问题。这些模型不能完全复制人类生理学,但它们允许在严格控制的条件下进行纵向和侵入性采样,这在探究机制问题时非常重要。
器官芯片利于研究人体组织内的相互作用
器官芯片(如肠道芯片)提供了更多与人类相关的系统,因为它们可以直接从人体组织或血液来源的诱导性多能干细胞中获得,这些干细胞保留了宿主的遗传特征,因此,它们使我们可以在受控环境中研究复杂的人体组织和细胞相互作用。
最近的研究已经证明了在半厌氧环境中将微生物群接种到肠道芯片中的能力,目前许多研究小组正在测试在这些芯片上接种日益复杂的群落的效率。虽然肠道芯片模型缺少一些关键的细胞类型,如免疫细胞,但重大进展包括能够连接不同的器官芯片,如肠道芯片和神经元芯片,以模拟肠脑相互作用。利用器官芯片研究微生物组的创造性方法将继续涌现,并可能填补重要的空白,补充动物模型。
了解细菌基因和功能
对细菌全基因组进行测序和组装的能力是一种非常强大的方法,可用于识别菌株的谱系和相关性,以及识别可能与人类健康或疾病相关的特定细菌表型所涉及的假定途径。如果我们思考已从基因改造小鼠研究中阐明的人类疾病机制,就不难想象在细菌中进行同样研究可以获得的大量信息。敲除和操纵细菌基因的能力并不是什么新鲜事。
近80年的细菌遗传学研究已经阐明了病原体如何在肠道上皮中定植并分泌毒素从而导致霍乱等疾病,它们如何相互共享信息以适应不同的环境,以及营养选择如何驱动它们在宿主中的组成。大肠杆菌可以被认为是 C57BL/6 小鼠的细菌版本;其基因定义明确且易于改造,而且它已经成为在特定环境下测试改造效果的主力。然而,共生肠道细菌的多样性远不止大肠杆菌;因此,研究人员正在积极寻求对肠道j基因的更深入了解,例如使用拟杆菌和梭菌作为代表性生物 ,因为大量人类和小鼠研究已经证明了这些生物在健康和疾病中的重要作用。
人工智能等先进计算工具通过预测蛋白质的三维结构,为细菌基因组中未注释部分提供了新的见解,AlphaFold2 等技术极大地推进了这一任务。通过分析这些结构,研究人员可以根据它们的形状和结合位点推断出可能的功能。这些潜在作用可以通过生化和微生物学研究中的实验验证来证实。这些知识,特别是关于蛋白质如何影响代谢途径的知识,对于将微生物活动与糖尿病等健康状况联系起来至关重要,有助于深入了解疾病机制和潜在的治疗靶点。
无参考数据分析
目前,微生物组测序分析中依赖数据库的方法最关键的问题是它们在检测新型或研究不足的微生物方面存在局限性。当使用基于已充分表征的细菌的参考基因组的数据库分析微生物群落样本时,不匹配的序列会被忽略或错误分类。
这一过程导致对微生物生态系统的看法出现偏差,可能会遗漏在健康和疾病(包括糖尿病)中发挥重要作用的关键成分。因此,推进微生物组研究需要开发和使用能够发现和表征这些代表性不足的微生物实体的方法。
从宏基因组测序数据中从头组装基因组是微生物组研究中一种强大的方法,该方法涉及直接从测序读取构建基因组,而不依赖于参考数据库。
该方法使用先进的计算算法将样本中的 DNA 片段拼凑在一起,从而可以识别来自各种生物体的遗传物质,包括那些以前未测序或编目的生物体。通过组装这些基因组,研究人员可以发现新物种并揭示新的基因功能,从而大大扩展我们对微生物多样性及其在包括人体在内的各种环境中的潜在作用的理解。
对于16S测序来说,由于其经济和丰富的样本积累,对于构建疾病的大数据库来说存在很大的优势,虽然16S分辨率没有宏基因组高,但是通过方法和技术的弥补,可以大大提供16S的预测精准度。
例如谷禾健康结合宏基因组数据和已有的菌群构成数据,通过算法可以大大提高扩增子数据的物种分辨率。此外病毒、真菌、寄生虫和部分16S难区分的病原菌目前通过增加靶向引物进行tNGS的方式来实现,大大拓展了二代测序微生物多样性检测领域的涵盖范围。
这种方法在揭示微生物生命的全部范围方面特别有用,包括可能在健康和疾病中发挥关键作用的物种或基因。
了解小肠微生物群
小肠是营养吸收、肠肝循环和承受肠道激素刺激的主要部位;因此,深入了解人体这一部位的微生物功能至关重要。然而,我们对人类微生物组的大部分了解都基于粪便样本和结肠微生物群,因为即使使用现代内窥镜检查方法,获取小肠微生物群也很困难。
最近的进展使用了创新方法,例如可摄入的胶囊,它可以对整个胃肠道中的肠道物质进行取样。由于每个胶囊都由肠道中不同的 pH 值触发,因此这种方法可以提供肠道群落的微生物图谱。这些工具正在进一步完善和商业开发,以用于诊断和研究。但需要注意的是,样本采集到胶囊内后,微生物有可能继续生长,因此不能准确地代表原生微生物群落。
此外,这些胶囊和其他胶囊都是为空腹状态下的取样而开发的,因此对餐后反应的研究仍然有限,尽管这些反应对于全面了解微生物对葡萄糖代谢调节的贡献可能很重要。解决这些问题对于确保使用此类设备进行微生物组研究的可靠性和准确性至关重要。
同工酶和小分子筛选
微生物组研究中,同工酶和小分子筛选对于识别可以作为治疗目标的特定细菌产物至关重要。微生物同工酶是具有不同分子结构但催化与宿主酶相同反应的酶。筛选这些产物可以揭示微生物代谢的变化,这些变化可能会影响健康并可能干扰药物治疗,例如细菌 DPP-4 同工酶的情况。
小分子筛选专注于识别微生物产生的生物活性化合物 。这些化合物可对宿主的病理生理学产生显著影响。通过识别特定的同工酶和小分子,研究人员可以针对它们进行降解或增强,从而为糖尿病等疾病提供潜在的治疗策略。
Treatment
如上所述,目前尚未发现针对1型或2型糖尿病的诊断性和广义的粪便微生物群分类学特征。因此,未来的研究应转向在大规模前瞻性人群中进行菌种和菌株水平的研究,并在可能的情况下,重点研究胃肠道肠道微生物的功能分析,特别关注稳定同位素前体,以研究不同胃肠道区域重要微生物代谢物的生成和底物通量。
1
高纤维饮食和基于短链脂肪酸的治疗
关于基于肠道菌群的糖尿病疗法,高纤维饮食已被证明可有效控制1型和2型糖尿病患者的血糖水平并降低胰岛素抵抗。尽管膳食纤维通过肠道菌群直接起作用的方式仍有待证实,但这些试验强调了将肠道菌群调节策略纳入糖尿病干预试验的潜在重要性,特别是对于生产有益代谢物(如 SCFA)而言。
但是,如上所述,口服短链脂肪酸(丁酸盐)补充剂的干预试验并未显示在1型或2型糖尿病患者的血糖控制或其他糖尿病调节标志物上 ,可能是因为给药部位与内源性产生不同。对于其他短链脂肪酸,包括丙酸盐和乙酸盐,数据太少,无法得出关于对代谢调节的可能影响的任何结论。
2
传统益生菌和新一代益生菌
用于糖尿病的益生菌疗法可分为传统益生菌,特别是乳酸杆菌和双歧杆菌菌株,它们历来被用于发酵食品或补充剂中以促进健康,以及下一代益生菌,它们是最近被鉴定为人类肠道菌群成员的新菌种菌株。这些菌株与健康有关,但在疾病环境中存在会减少。
传统益生菌
关于传统益生菌,一项关于益生菌(双歧杆菌、乳酸杆菌和唾液链球菌菌株)的开放标签试验发现,益生菌对1型糖尿病患者的兄弟姐妹的1型糖尿病易感性和进展有益。
针对新发1型糖尿病的前瞻性随机对照试验 (RCT) 正在进行中(NCT03961854、NCT03961347、NCT04769037 和 NCT05767450),一项规模较小的试验显示,其对长期 1 型糖尿病仅有中等效果。
在2型糖尿病中,最近的一项荟萃分析描述了这些益生菌菌株在代谢控制和降低胰岛素抵抗方面具有一定功效。
新一代益生菌
关于下一代益生菌,在人体中产生的数据较少。例如,尽管特定菌株(例如Akkermansia)与健康的代谢表型相关,但使用A. muciniphila的 RCT 干预并未发现强烈的代谢影响。
这一发现可能是由于这些测试菌株与代谢综合征缺乏因果关系、通过胃后活力降低、剂量不足或引入人体肠道时缺乏定值。
由于小肠对1型和2型糖尿病的病理生理学都很重要,因此需要进一步分析1型和2型糖尿病患者的小肠微生物群,并研究确定的下一代益生菌菌株组合作为糖尿病的可能干预措施。然而,这种努力应该考虑细菌菌株的植入条件、对其他细菌成员的生态或功能依赖性、以及功能上的潜在冗余。
3
供体粪菌移植
在完成针对特定菌株组合的研究之前,供体粪菌移植(FMT)可能有助于了解调节肠道菌群的效果以及这种调节对糖尿病病理生理和潜在可逆性的影响。
最近发表了一项研究,探新鲜粪菌移植在维持残余β细胞功能和抑制新发1型糖尿病患者自身免疫方面的功效。其他针对 2 型糖尿病和胰岛素抵抗的研究显示,FMT 对胰岛素抵抗和非酒精性脂肪肝疾病有适度影响 ,而一项研究表明对这些参数没有影响。
此外,微囊供体 FMT 和纤维补充的联合干预显示出对葡萄糖代谢有益的影响,这表明干预设计不仅需要合成菌株联合体,还需要饮食支持(例如纤维来滋养菌株)。最后,评估生活方式干预后自体 FMT 是否有助于防止体重反弹的研究发现,饮食引起的低丰度细菌变化可能是维持减肥效果的原因,这可以指导更精准的干预措施,减少伦理负担,降低传播疾病的风险。
总体而言,与针对性菌株或代谢物的干预措施相比,供体 FMT 是一种更为分散的方法。此外,现有数据集中的粪便物质给药方式(胶囊与新鲜 FMT)、肠道 pH 值(例如由于抗酸药)和结肠转运时间存在差异,并且施用的粪便微生物群的数量似乎也会影响供体细菌菌株的植入。
关于糖尿病和基于肠道菌群的疗法的试验结果,使用随时间动态测量葡萄糖代谢(例如混合餐测试或连续血糖监测)可以更好地了解在 FMT 和施用确定的菌株组合期间肠道微生物、饮食和葡萄糖稳态之间的相互作用。
对小肠微生物组的研究仍不足,但对肠道微生物的新认识越来越多地将其与人类糖尿病联系起来。对人类 FMT 的干预研究已经能够从因果关系中分离出关联,并且确实显示出一些临床益处,虽然平均而言相对较小的治疗效果和伦理问题阻碍了这种治疗方法在糖尿病临床护理中的广泛实际应用。
因此,还需要在多民族队列中对肠道菌群和糖尿病之间的前瞻性关联进行更多研究。与此同时,还应探索合成的肠道菌群衍生的细菌菌株或群落和工程系统在糖尿病中靶向肠道输送已识别代谢物的治疗潜力。
Perspectives
在过去二十年中,肠道微生物的改变与糖尿病患者的异常葡萄糖代谢和脂肪变性有关。流行病学研究中的较大样本量现已开始显示肠道菌群与肥胖或2型糖尿病相关的人类代谢特征之间的相关性的大小和可能的一致性;然而,对于1型糖尿病,情况就不那么明朗了。
未来的研究应更严格地考虑糖尿病药物与种族和饮食摄入之间的相互作用。此外,近年来,人们对肠道菌群的功能有了更多的了解,而不仅仅是其成分,这些信息与之前关于特定代谢物(包括短链脂肪酸、支链氨基酸和胆汁酸)与肥胖和糖尿病之间联系的报告非常吻合。
关于肠道菌群成分,只有少数研究探讨了噬菌体和真菌的作用以及这些菌落与细菌菌株在糖尿病中的相互作用。显然,未来的研究还需要关注小肠微生物群的功能,以及开发足够的生物信息学流程和正确组装基因组。
我们还必须考虑到,迄今为止的大多数数据都是在小鼠研究中产生的,由于小鼠和人类在饮食、遗传和寿命方面存在巨大差异,其与人类糖尿病的相关性需要进一步证实。尽管如此,在人类糖尿病环境中对单一菌株和粪菌移植的人体干预研究表明,存在一系列临床代谢效应(与药物更一致的效果相比),但没有严重的副作用。
总之,经过近二十年的研究,我们仍然必须期待未来的努力,以阐明肠道微生物研究对人类糖尿病的临床诊断和治疗适用性。
主要参考文献
Caesar R. Pharmacologic and Nonpharmacologic Therapies for the Gut Microbiota in Type 2 Diabetes. Can J Diabetes. 2019 Apr;43(3):224-231.
Ridaura VK, Faith JJ, Rey FE et al (2013) Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science 341:1241214.
Sze MA, Schloss PD (2016) Looking for a signal in the noise: revisiting obesity and the microbiome. mBio 7:e01018-16.
Duvallet C, Gibbons SM, Gurry T, Irizarry RA, Alm EJ (2017) Meta-analysis of gut microbiome studies identifies disease-specific and shared responses. Nat Commun 8:1784.
Pasolli E, Truong DT, Malik F, Waldron L, Segata N (2016) Machine learning meta-analysis of large metagenomic datasets: tools and biological insights. PLoS Comput Biol 12:e1004977.
Rothschild D, Leviatan S, Hanemann A, Cohen Y, Weissbrod O (2022) An atlas of robust microbiome associations with phenotypic traits based on large-scale cohorts from two continents. PLoS One 17:e0265756.
谷禾健康
让食物成为你的药物,让药物成为你的食物
随着现代生活节奏的加快,疲劳、压力、不均衡的饮食,都在悄悄侵蚀着我们的健康。多糖,这些来自植物、真菌乃至海洋生物的天然赠礼,正以其独特的方式,为我们提供了一种全新的健康支持。
多糖由单糖通过糖苷键结合而成的高分子碳水化合物。研究表明,多糖具有多种生物活性,包括调节免疫功能、降低血脂和血糖、抗癌、抗病毒、抗肥胖、抗精神病、抗氧化、抗炎、抗凝血、止吐、抗辐射等作用。因此,多糖已成为最重要的天然成分之一,并引起了世界上越来越多研究者的关注。
虽然部分多糖如淀粉可以在人体胃和小肠中被消化吸收,但仍有许多特殊结构的多糖不能在这两个部位分解。对于那些不能被宿主消化的多糖,它们可以进入结肠,而结肠是大多数肠道菌群居住的地方。在结肠中,多糖可以与肠道菌群相互作用,从而发挥营养或药理作用。
多糖与肠道菌群之间相互作用可以影响健康,同时也通过肠道菌群的代谢作用,转化为有益的代谢产物,如短链脂肪酸,这些产物对维持肠道屏障的完整性、调节免疫反应发挥着至关重要的作用,甚至扩展到了全身的健康状况,可以影响我们的精力水平、情绪状态,对疾病的抵抗力等方方面面。
本文将深入探讨多糖,了解其在人体内的消化过程、与肠道菌群的相互作用,以及它们如何通过调节肠道菌群代谢物影响健康,如短链脂肪酸、三甲胺、色氨酸,还讨论了多糖在疾病预防和治疗中的应用,包括它们在改善代谢性疾病、炎症性肠病、缓解疲劳、改善肿瘤,神经系统疾病等方面的潜在效果。这为靶向肠道菌群开发新型的营养补充剂和药物提供了新的思路。

本文目录
01 多糖
02 多糖调节肠道菌群的组成
为什么多糖可以调节肠道菌群的组成?
多糖促进或抑制肠道微生物群
多糖分子量、糖苷键影响其细菌调节活性
03 肠道微生物将多糖代谢为短链脂肪酸
短链脂肪酸的生物学效应
人体内的多糖代谢
多糖补充与短链脂肪酸的生成
04 多糖调节其他肠道微菌群代谢物
三甲胺和氧化三甲胺(TMAO)
色氨酸及其代谢产物
胆汁酸、脂多糖、胃肠道气体
05 多糖调节肠道菌群修复肠道屏障
06 多糖通过肠道菌群改善疾病
2型糖尿病、非酒精性脂肪肝、肥胖、高血脂症
炎症性肠病、其他肠胃疾病、肿瘤
疲劳、神经系统疾病(认知障碍、抑郁等)
07 部分多糖营养与菌群调节
路易波士茶多糖、地黄多糖、五指毛桃根多糖
大蒜多糖、槐耳多糖、黄芩多糖、枸杞多糖
岩藻多糖、桑叶多糖、沙棘多糖、蘑菇多糖
08 结语
糖,这个小小的分子,是能量的源泉,是细胞的加油站。除了我们熟知的葡萄糖以外,还有一种叫做多糖,由许多糖分子手拉手组成,从植物的根茎到海洋生物的细胞壁,它们以复杂多样的形态存在。
根据糖单元的数量,碳水化合物可分为几类:
多糖是由多个单糖分子通过糖苷键连接而成的聚合物,属于高分子碳水化合物。它们广泛存在于自然界中,包括植物、真菌和海藻等生物体内。根据其来源和结构特性,多糖具有多种生物活性,如免疫调节、抗氧化、抗肿瘤等。
多糖是由10个以上相同或不同的单糖通过α或β糖苷键连接而成的大分子化合物,分子量从几万到数百万。
多糖的空间构象非常复杂,具有一级、二级、三级和四级结构。研究表明,多糖的活性与其结构密切相关。此外,通过分子修饰,如乙酰化、硫酸化、羧甲基化、硒化、磷酸化和磺化等可显著提高多糖的生物活性。
根据来源和结构的不同,多糖可以分为天然多糖和合成多糖,其中天然多糖又可根据其在自然界中的分布分为植物多糖、动物多糖、微生物多糖等。
例如,透明质酸和硫酸软骨素属于动物多糖,而纤维素、淀粉和糖原是常见的植物多糖。
淀粉
由大量葡萄糖分子通过α-1,4-糖苷键和α-1,6-糖苷键连接而成,形成直链淀粉和支链淀粉两种结构。广泛存在于谷物(如大米、小麦、玉米)、薯类(如土豆、红薯)等食物中。在人体消化过程中,被淀粉酶逐步分解为葡萄糖,为身体提供能量。
纤维素
由葡萄糖分子通过β-1,4-糖苷键连接而成,形成长而直的链状结构。是植物细胞壁的主要成分,在蔬菜(如芹菜、菠菜)、水果(如苹果)中含量丰富。由于人体缺乏分解β-1,4-糖苷键的酶,纤维素难以被人体消化吸收,但对促进肠道蠕动、预防便秘等具有重要作用。
果胶
是一种复杂的多糖,由半乳糖醛酸等组成。常见于水果(如柑橘、苹果)中。在食品工业中,常用于制作果酱、果冻等,增加其黏稠度和稳定性。
尽管功能性糖因其在健康和疾病预防中的潜在作用而受到越来越多的关注,但它们的天然可用性相对较小。这意味着,为了充分利用这些有益的分子,需要采用特定的提取方法来增加它们的可获得性,多糖提取常用的方法有热水提取、酸提取、碱提取和酶水解等。
近年来,一些新的方法,如超声波提取、微波提取、超滤、高压电场法、超临界流体萃取、亚临界水萃取等也用于多糖的提取。这些方法不仅能够提高多糖的提取率,还能够在一定程度上保护多糖的结构完整性,从而保留其生物活性。
通常,人体分泌的消化酶只能分解几种多糖,而纤维等许多多糖不能被吸收和直接使用。因此,多糖可以通过小肠进入结肠,这是大多数肠道细菌居住的地方,然后与肠道微生物群相互作用。
细菌在肠道中通过发酵降解多糖
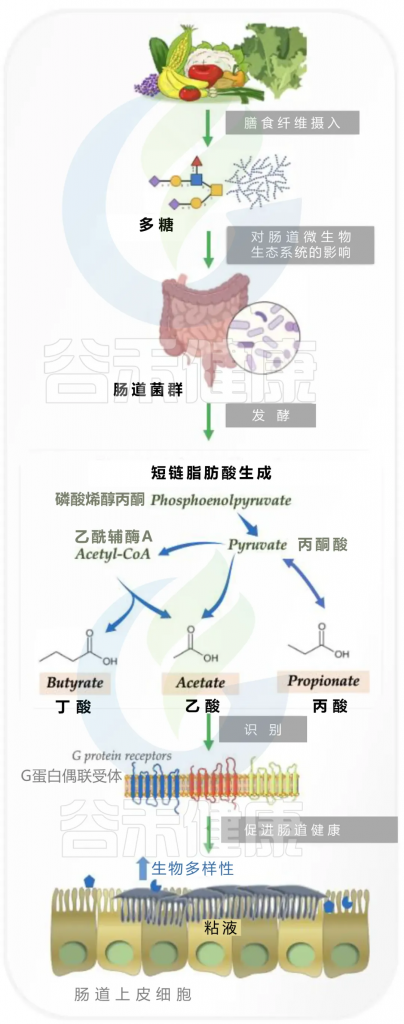
doi.org/10.3390/nu14194116
多糖转化为短链脂肪酸
首先与多糖能够发酵生成酸性的短链脂肪酸密切相关。未电离的短链脂肪酸能够穿过细菌细胞膜,对肠道细菌产生一系列影响,例如改变DNA合成和氨基酸摄取。
短链脂肪酸对肠道细菌的影响
例如,短链脂肪酸能够通过调节侵袭基因的表达,抑制沙门氏菌(一种常见的食源性病原体)的生长。因此,短链脂肪酸的增加可以改变肠道菌群的功能,进而影响其组成。
肠道pH值的变化
短链脂肪酸的增加还会导致肠道pH值下降,影响细菌的适应能力。每种细菌都有其适宜的pH范围,不同细菌在特定pH条件下的适应能力各异。
多糖的降解产物作为能量来源
多糖对肠道菌群组成的调节作用还与其降解产物有关。一些肠道细菌能够利用多糖的降解产物作为碳源和能量来源,而另一些细菌则不能。
综上所述,多糖通过影响肠道菌群的代谢功能,直接调节了肠道菌群的组成。这些发现为我们理解多糖如何通过肠道菌群影响宿主健康提供了新的视角。
多糖的益生元效应
具有选择性刺激有益微生物生长能力的多糖被称为益生元,例如果聚糖,它能丰富乳酸菌和/或双歧杆菌。这些有益细菌的减少与糖耐量受损密切相关。一些多糖能够丰富这些细菌,因此可以用来改善糖尿病表型。
多糖抑制病原菌
病原菌在胃肠道中的定植和增加会导致一系列疾病,而抑制它们可以控制疾病的严重程度。例如,致病性 Sutterella、Desulfovibrionaceae、Streptococcaceae 、Clostridium 的比例较高与肥胖发展呈正相关。
多糖的双向调节作用
疾病的发生是一个复杂的过程,涉及不同的微生物,包括有害细菌和有益细菌。例如:
多糖能够对肠道微生物发挥双向调节作用,即促进有益细菌的同时抑制有害细菌。
例如,口服灰树花多糖(GFHP)对非酒精性脂肪肝病的积极作用与调节肠道菌群有关。
在分子量方面,不同分子量的魔芋葡聚糖(KGM)对2型糖尿病(T2DM)大鼠的降血糖作用研究表明,中等分子量的KGM显著增加了Muribaculaceae,减少了Romboutsia和Klebsiella,但高分子量和低分子量的KGM对这些细菌的影响不显著。
灵芝的低分子量多糖(<10 kDa)具有更好的发酵和更高的产气能力,刺激肠道细菌快速生长。另一方面,高分子量多糖(>100 kDa)更难被肠道细菌发酵,并且在肠道中的停留时间更长,导致对肠道微生物群的影响更长。
高分子量的黄芪多糖具有一定的生物活性,但其相对分子量较大,溶解性差,生物利用度低,限制了其功效的发挥。低分子量的黄芪多糖具有较好的水溶性,能够在更大程度上刺激巨噬细胞摄取中性红、NK细胞增殖,发挥免疫活性。
多糖由各种通过糖苷键连接的单糖组成,糖苷键的类型和位置导致肠道微生物群的选择性发酵存在差异。
多糖的单糖组成越复杂,调节细菌的活性越强
一项关于龙眼多糖和燕麦多糖的研究表明,龙眼多糖能显著促进干酪乳杆菌、嗜酸乳杆菌、植物乳杆菌、粪肠球菌的增殖,但燕麦多糖的作用并不明显。原因是龙眼多糖由葡萄糖、甘露糖和阿拉伯糖组成,而燕麦多糖的单糖主要是葡萄糖。
短链脂肪酸(SCFA)是一组含有少于六个碳的脂肪酸,包括甲酸盐、乙酸盐、丙酸盐、丁酸盐、戊酸盐。
乙酸盐、丙酸盐和丁酸盐是肠道中的主要SCFA,约占所有SCFA的95%,三者的比例约为3:1:1。
作为肠道微生物群和宿主的重要能量来源,短链脂肪酸通过不同的作用模式在健康和疾病中发挥着重要作用。
作用机制
与GPRs的相互作用
抗炎作用
免疫调节
HDAC抑制作用
丁酸盐的作用
与疾病的关系
多糖对SCFA的调节及其对靶标的影响
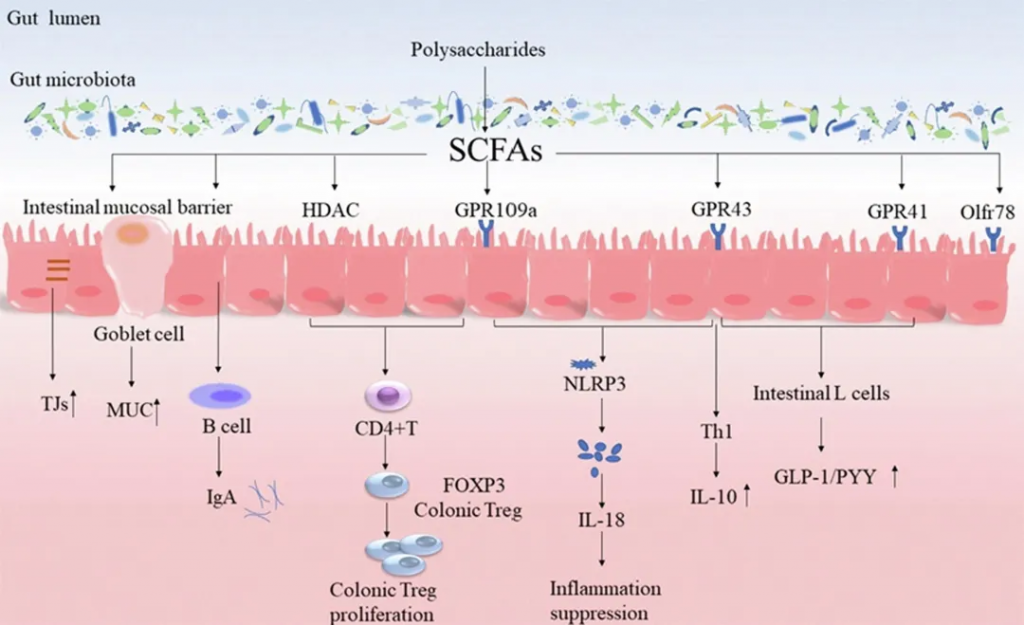
doi.org/10.1016/j.foodres.2022.111653
人体内消化酶的局限
在人体消化系统中,我们自身分泌的消化酶往往难以分解复杂的多糖。这些多糖分子,因其结构复杂,通常在我们体内无法被有效代谢。
肠道菌群的代谢作用
我们的肠道菌群拥有破解这些复杂多糖的秘密武器——一系列的酶,统称为碳水化合物酶(CAZymes)。这些酶能够分解多糖,将其转化为对人体健康有益的短链脂肪酸。
碳水化合物酶的种类
肠道菌群中的“专家”与“通才”
在肠道菌群中,拟杆菌门和厚壁菌门是编码CAZymes的两大主力。
多糖的初步降解
在属的水平上,多糖最初可以由某些微生物降解,例如双歧杆菌属、真杆菌属、梭菌属、罗氏菌属(Roseburia spp.)。
SCFAs的生成途径
尽管人体自身无法分解复杂的多糖,但我们的肠道菌群却具备了这一能力,它们通过一系列特殊的酶,将多糖转化为对人体健康有益的短链脂肪酸。
多糖对SCFAs生成的促进作用
饮食补充多糖可以为产生SCFAs的细菌提供有利的生长环境,从而促进SCFAs的生成。例如,沙棘多糖(CCPP)通过调节肠道菌群和SCFAs,能够缓解2型糖尿病。
沙棘多糖调节肠道菌群和SCFAs,缓解2型糖尿病
枸杞多糖调节肠道菌群,提高SCFAs
多糖结构对短链脂肪酸生成的影响
不同的多糖因其分子结构的不同,对SCFAs的调节作用也不尽相同。
多糖的疗效与SCFAs的非直接关联
尽管大多数多糖可以被代谢成SCFAs,但它们的疗效并不一定与SCFAs直接相关。
多糖通过调节肠道菌群和促进SCFAs的产生,对健康具有多方面的益处。然而,多糖的结构与它们对SCFAs生成的调节作用之间的关系仍需进一步研究。此外,多糖的疗效可能不仅限于SCFAs的产生,还可能涉及肠道菌群产生的其他分子。
在肠道微生物群的作用下,脂质和蛋白质等饮食成分可以代谢为一系列代谢产物,如三甲胺-N-氧化物(TMAO)、色氨酸、脂多糖(LPS)等。此外,肠道微生物群还可以与宿主合成和释放的化合物相互作用。例如,肠道微生物群可以将初级胆汁酸(BA)转化为次级胆汁酸。由于肠道微生物群的组成与肠道微生物群代谢物的产生直接相关,因此可以推断,除了SCFAs,多糖还可以调节其他肠道微生物群代谢产物,如BA。
三甲胺和TMAO的代谢过程
在肠道中,饮食中的四胺类物质如胆碱、L-肉碱和卵磷脂(来自红肉、鸡蛋、鱼、海鲜)首先被微生物胆碱三甲胺裂解酶分解成三甲胺(TMA)。随后,TMA被吸收进入门脉循环,并运输到肝脏,在黄素单加氧酶1和黄素单加氧酶3的作用下转化为三甲胺-N-氧化物(TMAO)。
TMAO的潜在危害
值得注意的是,TMAO是一种潜在的有害代谢产物。多项研究指出,TMAO水平的增加与多种疾病的发生和发展呈正相关。例如,TMAO可以直接增强血小板的反应性,促进血栓形成,并通过激活核因子κB(NF-κB)和NLRP3炎症体影响血管炎症。
多糖对TMA和TMAO代谢的影响
最近的研究表明,TMA和TMAO在理解多糖的作用机制中扮演重要角色。例如:
不同多糖对肠道菌群的调节作用
不同的多糖可以通过调节相同的肠道细菌来降低TMA和TMAO的代谢,例如变形菌门。研究表明,变形菌门负责TMA的转化,增加变形菌门可能导致TMA增加。然而,也有研究表明TMAO与变形菌门呈负相关,这表明多糖调节变形菌门与TMA产生的效应之间的关系需要进一步研究。
多糖通过调节肠道菌群,影响TMA和TMAO的代谢,从而可能对人体健康产生积极影响。然而,多糖与TMAO之间的关系复杂,需要更多的研究来阐明这些相互作用的确切机制。
色氨酸代谢的重要性
色氨酸(Trp)是人体必需的氨基酸。它的代谢可以分为内源性代谢和细菌性代谢。内源性代谢主要通过犬尿氨酸途径(KP)和5-羟色氨酸途径进行,前者产生犬尿氨酸(KYN)、犬尿酸(KA)、烟酸、黄嘌呤酸等,后者转化为5-羟色氨酸(5-HT)和褪黑素。
色氨酸代谢物的生理功能
增强免疫:色氨酸可加强免疫力,减少炎症。
神经保护:KA作为谷氨酸受体拮抗剂,具有神经保护和抗惊厥作用,还能调节能量代谢。
情绪调节:5-HT作为神经递质,可调节情绪、肠道通透性和肠道蠕动。
肠道菌群在色氨酸代谢中的作用
肠道细菌代谢色氨酸产生吲哚及其衍生物,如吲哚丙酸、吲哚乙酸等,这些物质可以缓解炎症,促进肠道上皮屏障功能。肠道菌群的色氨酸代谢异常与肠易激综合症、代谢综合症和结肠癌等疾病有关。例如,结肠癌患者常伴有色氨酸水平下降和KP代谢物水平升高。
多糖影响肠道微生物色氨酸代谢,从而改善疾病
吲哚是硫酸吲哚酚的前体,是一种蛋白结合尿毒症毒素,是心血管疾病的危险因素。对于患有终末期肾病心血管疾病的患者,吲哚水平升高,患者粪便中产吲哚细菌丰富。
总的来说,多糖可以通过调节肠道菌群来改变色氨酸代谢,最常见的是增加乳杆菌和阿克曼菌,从而缓解疾病。
胆汁酸的生物合成与功能
胆汁酸(BAs)是一类由肝脏产生的特殊类固醇分子,经过肠道菌群转化。肝脏中存在两种BA生物合成途径:
CA和CDCA是体内的主要胆汁酸。经过肠道菌群的改造,CA转化为脱氧胆酸(DCA),CDCA转化为鹅去氧胆酸(LCA)。
胆汁酸受体及其作用
胆汁酸受体包括细胞表面受体和细胞内受体。细胞表面受体包括TGR5,细胞内受体包括法尼酰X受体FXR、孕烷X受体、维生素D3受体(VDR)和组成型雄烷受体。胆汁酸通过激活相应的受体调节脂质、葡萄糖和能量代谢。例如,TGR5和VDR的激活导致GLP-1和FGF19分泌,GLP-1可以改善胰岛素敏感性,FGF19可以通过抑制脂肪生成减少肝脏脂肪变性。
多糖对胆汁酸代谢的调节作用
近年来的研究表明,多糖可以通过恢复胆汁酸的代谢来缓解疾病。
多糖对胆汁酸代谢影响的总结
多糖通过调节肠道菌群的组成,特别是Bacteroides、Lactobacillus、Clostridium、Ruminococcus、Bifidobacteria,影响胆汁酸的代谢。
某些多糖如岩藻聚糖和灰树花多糖减少了Clostridium的水平,这与文献报道的促进胆汁酸转化的作用似乎矛盾,需要进一步研究确认这些肠道细菌与多糖之间的关系。
脂多糖的危害
脂多糖(LPS)是由革兰氏阴性细菌(如大肠杆菌)产生的内毒素。持续暴露于LPS或LPS异常增加,可通过减少肠道上皮细胞活性、降低肠道细胞增殖、抑制肠道细胞迁移和诱导肠道细胞凋亡等方式,导致肠道损伤。
LPS的转移还能损伤肠道,并可能通过与多种受体的相互作用,如LPS结合蛋白、簇分化14、髓样分化2和Toll样受体4,引发糖尿病、非酒精性脂肪肝病、肥胖、动脉粥样硬化等一系列疾病。
多糖对LPS产生菌的抑制作用
许多多糖能够抑制产生LPS的细菌。例如,在链脲佐素(STZ)诱导的糖尿病肾病模型中:
多糖调节肠道菌群的矛盾效应
尽管多糖可以通过调节肠道细菌来抑制LPS,但对特定细菌的调节作用可能存在矛盾。例如,作为LPS产生菌的拟杆菌门,在多糖处理后的水平变化并不一致。有研究表明,黄精多糖和蝉花多糖增加了拟杆菌门的水平,而竹荪多糖却降低了它。这些研究表明,多糖对肠道菌群的调节效应有时可能相互矛盾,需要进一步研究以确认结果。
胃肠道气体的生成
胃肠道内通过细菌发酵食物,会产生一系列气体,包括氢气(H2)、甲烷(CH4)、二氧化碳(CO2)、硫化氢(H2S)和一氧化氮(NO)。这些气体在胃肠道中发挥着调节作用,例如影响结肠蠕动、神经通讯、血管功能和免疫反应等。
气体产生的部位和作用
CO2 主要在胃中产生,而其他气体如 H2、CH4、CO2 和 H2S 主要在小肠和结肠中产生。
这些气体对人体健康至关重要,它们可以调节肠道功能,影响营养物质的吸收和疾病的发生。
多糖对气体产生的调节
尽管多糖对 H2、CH4 和 CO2 的产生有明显影响,但关于多糖结构与气体产生之间具体关系的研究会相对较少。需要更多的研究来明确这些关系,以及多糖如何通过影响肠道菌群来调节气体的产生。
肠道菌群是一个复杂的微生物群落,具有显著的组成和功能多样性。不同的微生物可以介导相同或不同的代谢物的产生,相同的微生物也有助于不同代谢物的生产。
例如,持续的研究表明:
拟杆菌门(特别是Bacteroides thetaiotaomicron、Bacteroides fragilis)、厚壁菌门(如Clostridiaceae、Erysipelotrichia)、以及变形菌门可以促进TMA的产生。
放线菌门(如Bifidobacteria)、厚壁菌门(如Lactobacillus、Clostridium、Peptostreptococcus)、拟杆菌门(如Bacteroides)可以促进色氨酸(Trp)的转化。
双歧杆菌、乳酸菌、梭菌、Peptostreptococcus、拟杆菌也有助于次级胆汁酸(BAs)的产生。
因此,就像肠道菌群组成的调节一样,多糖对特定肠道菌群代谢物功能的调节作用不是孤立的。
肠道是我们抵御外界有害物质和病原体侵袭的第一道防线。它由多个层次的子屏障构成:
生物屏障:由肠道细菌和病毒组成;
化学屏障:包含免疫球蛋白A(IgA)、抗菌肽(AMPs)和粘液(MUC);
物理屏障:由肠道上皮细胞构成;
免疫屏障:含有T细胞、B细胞、巨噬细胞和树突细胞等免疫细胞。
这些子屏障协同工作,限制病原体与肠道的接触,维持肠道稳定。肠道屏障的损伤与多种疾病正相关,包括肠易激综合症(IBS)、代谢综合征、过敏、肝脏炎症等。
肠道菌群及其代谢物可以直接或间接影响肠道屏障:
越来越多的证据表明,多糖通过调节肠道菌群对肠道屏障有益。正常的肠道菌群组成可以通过竞争性排除,通过消耗营养源和占据附着位点,作为抵御外界病原体的屏障。
多糖→ 调节肠道菌群→ 修复肠道屏障
肠道菌群可以刺激宿主产生抗菌化合物,如IgA和AMPs,这些是化学屏障的关键组成部分。
例如,菊粉型果聚糖可以促进乳杆菌的丰度和IgA的分泌。在DSS诱导的溃疡性结肠炎小鼠模型中,金银花多糖通过增加双歧杆菌和乳杆菌,增加了分泌型IgA含量,从而调节肠道屏障。
在DSS诱导的结肠炎小鼠中,海蜇皮多糖增加Akkermansia,Akkermansia muciniphila作为粘液的降解者,可以增强肠道屏障的完整性,减少炎症。同时海蜇皮多糖增加结肠中TJs和MUC2的表达,保护了肠道屏障。
多糖→ 短链脂肪酸→ 修复肠道屏障
短链脂肪酸和胆汁酸等肠道菌群代谢物在调节肠道屏障功能中也扮演重要角色。
多糖→ 色氨酸和胆汁酸代谢→ 修复肠道屏障
这些研究表明,多糖可以通过调节肠道菌群及其代谢物,维护肠道屏障的完整性。
代谢性疾病包括一组因碳水化合物、脂质和蛋白质代谢错误而导致的疾病。2 型糖尿病 (T2DM)、非酒精性脂肪性肝病 (NAFLD) 和肥胖是常见的代谢性疾病。
生活方式干预、全身药物治疗和外科手术等多种方法被用于预防和治疗代谢性疾病。尽管代谢性疾病的药物治疗取得了最新进展,但潜在的不良反应仍然是关键挑战。
使用天然物质的药物治疗被认为是改善代谢疾病的一种有前途且可行的方法。
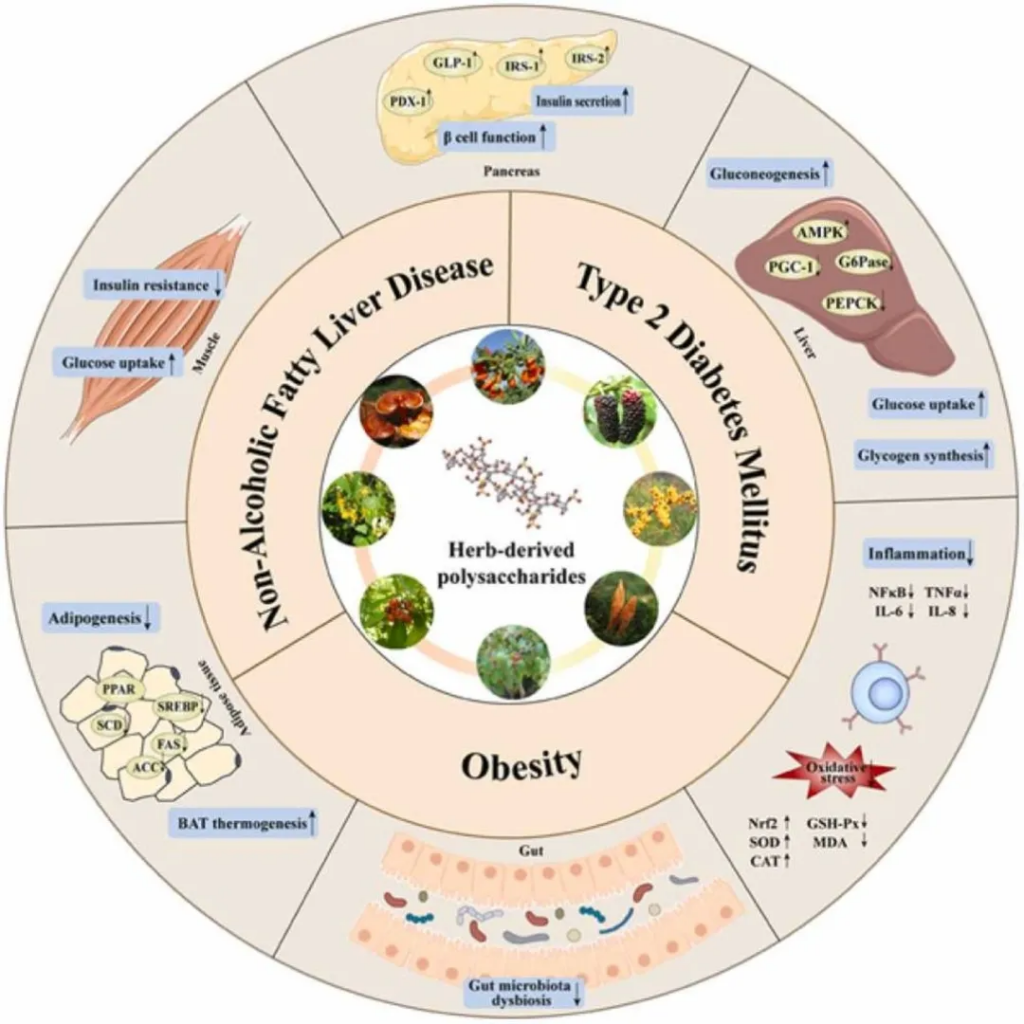
doi.org/10.1016/j.biopha.2023.114538
多糖通过多种机制在治疗2型糖尿病方面表现出良好的效果,比如:
肠道菌群在代谢紊乱,特别是 2 型糖尿病的发展中起着重要作用。
◤车前子多糖 对 STZ 诱导的 2 型糖尿病大鼠有抗糖尿病作用,这可能与其调节肠道菌群和增加短链脂肪酸水平有关。车前子多糖可显著增加糖尿病大鼠粪便中Bacteroides vulgatus、发酵乳杆菌、Prevotella loescheii、Bacteroides vulgates等结肠细菌的多样性和丰度,以及短链脂肪酸的浓度。
◤桑果多糖 可以丰富糖尿病小鼠的功能菌并调节微生物多样性。具体而言,该多糖显著富集了一些有益细菌(拟杆菌目、乳杆菌属、Allobaculum、拟杆菌属、阿克曼菌属),同时减少了一些致病菌(葡萄球菌、棒状杆菌属、Jeotgalicoccus、Aerococcus、Enterococcus、Facklamia)。
◤罗布麻叶的两种富含多糖的提取物改善了糖尿病小鼠的肠道微生物群失调,包括增加了Odoribacter、Anaeroplasma、Parasutterella、Muribaculum的丰度,并降低了肠球菌属、克雷伯菌属、Aerococcus的丰度。这可能有助于它们的抗糖尿病作用。
◤菊粉补充增加了双歧杆菌的丰度并增强了肠道屏障的完整性,这与2型糖尿病呈负相关。
◤青钱柳叶中分离的多糖通过增加 SCFAs 含量和有益的肠道细菌瘤胃球菌科来减轻 HFD/STZ 诱导的 2 型糖尿病大鼠的糖尿病症状。
◤苦瓜中的天然多糖通过增加 SCFAs 含量和Prevotella loescheii、Lactococcus laudensis 的丰度来改善 HFD/STZ 诱导的 2 型糖尿病大鼠的高血糖、高脂血症、高胰岛素血症。
◤天然南瓜多糖通过增加阿克曼氏菌和减少丹毒丝菌科(Erysipelotrichaceae)来显示出对 HFD/STZ 诱导的 2 型糖尿病的降血糖作用。此外,南瓜多糖还能增加 2 型糖尿病模型中肠道短链脂肪酸的产生。
◤灵芝多糖(GLP)通过恢复HFD/STZ诱导的肠道微生物群失调,特别是通过增加Blautia、拟杆菌、Dehalobacterium、Parabacteroides,以及减少有害的肠道细菌Aerococcus、Corynebacterium、Ruminococcus、Proteus,显示出抗糖尿病作用。
◤薏苡仁多糖通过降低厚壁菌门/拟杆菌门的比例和增加SCFAs的含量,在HFD/STZ诱导的T2DM小鼠模型中表现出降血糖活性。
◤葡甘聚糖作为铁皮石斛、芦荟和魔芋的天然多糖,通过增加厚壁菌门的丰度和减少拟杆菌门、变形杆菌的丰度,改善HFD/STZ喂养大鼠的T2DM代谢紊乱。
多糖对改善NAFLD具有有益作用,比如:
多糖可以改善肠道菌群失调并保护非酒精性脂肪性肝动物的肠道屏障完整性
◤枸杞多糖结合有氧运动通过改善肠道菌群失调改善 NAFLD,包括调节肠道菌群的丰度和多样性,增加微生物代谢产物 SCFA 的水平,减少变形菌和厚壁菌门/拟杆菌门的比例。厚壁菌门和拟杆菌门是参与宿主代谢和脂肪积累的关键细菌。
◤麦冬多糖可以通过调节肠-肝轴显著保护 NAFLD。具体来说,这种多糖显著降低了一些有害细菌的相对丰度,包括乳球菌、肠杆菌、Turicibacter、Clostridium- sensu-stricto -1、Tyzzerella、Oscillibacter,并增加一些有益菌的相对丰度,如Alistipes、Ruminiclostridium、Rikenella。这种多糖还显著增加了两种产SCFAs菌( Butyricimonas、Roseburia )的丰度以及乙酸和戊酸的水平,从而改善了炎症反应和肝脏脂质代谢。
◤灰树花杂多糖可通过调节肠道菌群来改善高脂饮食诱导的NAFLD,包括显著增加Allobaculum、拟杆菌属和双歧杆菌属丰度,减少Acetatifactor、Alistipes、Flavonifractor、Paraprevotella、Oscillibacter的丰度。
◤黄芪多糖可减轻HFD喂养小鼠的NAFLD,丰富了脱硫弧菌属,尤其是作为SCFAs、乙酸的产生者的Desulfovibrio vulgaris,减轻肝脂肪变性。
◤诺尼果多糖来源于辣木,通过促进短链脂肪酸的产生缓解HFD喂养小鼠的NAFLD,并通过改善肠道微生物群的多样性和组成逆转HFD诱导的肠道微生态失调。
◤核桃青皮多糖通过提高肠微生物群(包括普氏菌科、Allobaculum)的SCFAs含量和丰度,预防HFD喂养大鼠的肥胖和NAFLD。
◤从贻贝中提取的贻贝多糖,α-D-葡聚糖(MPA)可保护HFD喂养的大鼠的NAFLD,补充MPA可逆转HFD抑制的微生物微生态失调和SCFAs。
◤海带可溶性多糖通过降低厚壁菌门/拟杆菌门的比例,促进Verrucomirobia和丙酸盐产生菌拟杆菌和阿克曼菌,减轻高脂饮食喂养小鼠的NAFLD。
多糖通过多种机制表现出良好的抗肥胖作用,作用机制如:
◤枸杞多糖补充剂可降低厚壁菌门与拟杆菌门的比例,增加产短链脂肪酸菌,如Lacticigenium、Butyricicoccus、Lachnospiraceae_NK4A136_group数量,从而改善肥胖小鼠的肠道菌群失调。
◤桑叶多糖治疗可调节肥胖小鼠肠道菌群的组成和功能,这与增加Allobaculum、Parabacteroides、Porphyromonadaceae、Butyricimonas、Ruminococcus 的水平有关。
◤黄精多糖调节HFD喂养的肥胖大鼠的肠道微生物群结构,包括降低梭菌、肠球菌、Coprobacillus、乳球菌、Sutterella的相对丰度。
◤沙蒿多糖给药8周显著上调了屏障完整性的结肠基因,并通过增加有益细菌(双歧杆菌和Olsenella)和抑制有害细菌(Mucispirillum和幽门螺杆菌)改善了肥胖小鼠的肠道微生物微生态失调。同时,它显著富集了与促进SCFAs产生相关的碳水化合物代谢,同时显著抑制了与肥胖和肠道微生态失调相关的氨基酸代谢。
◤从海带中提取的天然多糖可通过使肠道菌群正常化来缓解小鼠HFD引起的肥胖,特别是通过增加拟杆菌目和Rikenellaceae的丰度。
◤从杏鲍菇中分离出的蘑菇多糖通过增加产生 SCFA 的肠道细菌Anaerostipes和Clostridium 的数量,在高脂饮食喂养的小鼠中表现出抗肥胖作用。
◤茶树菇多糖对HFD诱导的小鼠脂肪堆积和减肥的影响,发现脱硫弧菌减少,副拟杆菌增加,从而显著降低肥胖相关的TNF-α 和 IL-6 的水平。
◤从苦瓜中获得的多糖通过增加有益细菌(如放线菌、Coprococcus、乳酸杆菌)和减少有害细菌(变形菌和幽门螺杆菌)来改善HFD诱导的小鼠肥胖。
◤日本刺参的硫酸多糖通过富集益生菌Akkermansia、减少携带内毒素的变形杆菌和提高SCFAs含量来预防HFD诱导的小鼠肥胖。
◤ 破壁灵芝孢子多糖能逆转 HFD 喂养小鼠中许多细菌的相对丰度,特别是一些潜在的益生菌,包括Allobaculum、双歧杆菌,这与抗肥胖呈正相关。双歧杆菌、乳杆菌和阿克曼菌可促进SCFAs的产生,并抑制梭菌科、脱硫弧菌和肠球菌的丰度,这将有助于减少体重和脂质积累。
总的来说,多糖可通过作用于多个环节、调控多个疾病相关靶点来改善这三种代谢性疾病。
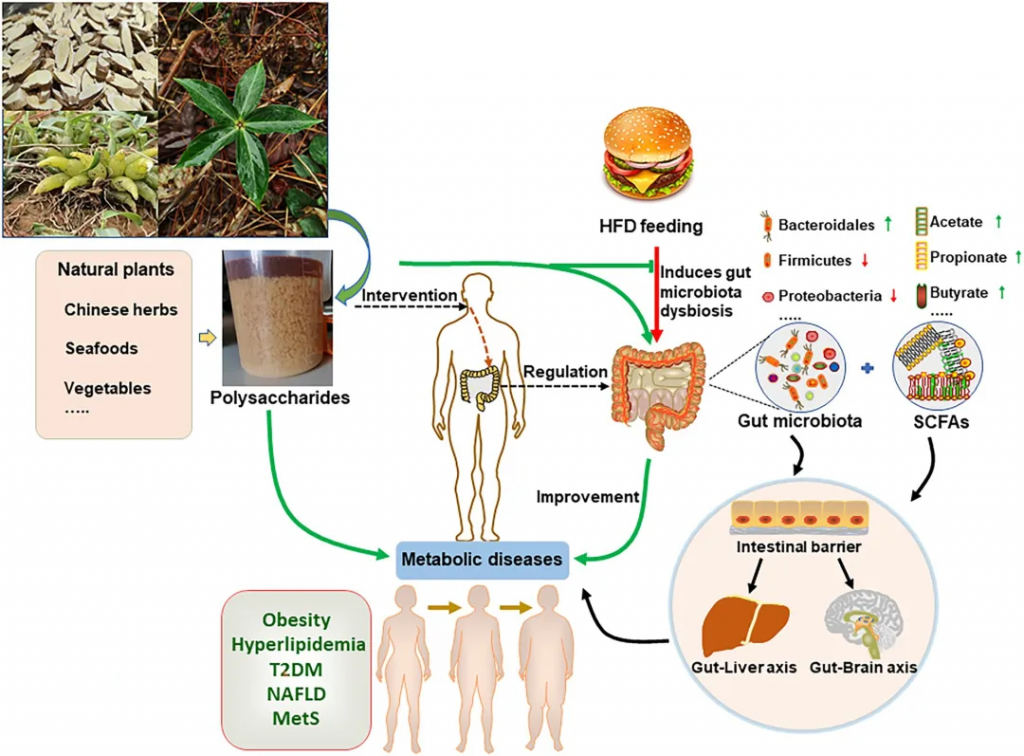
doi.org/10.3389/fmicb.2022.859206
高脂血症是指脂质代谢紊乱,其特征是甘油三酯 (TG)、总胆固醇 (TC) 和低密度脂蛋白浓度升高,同时高密度脂蛋白水平降低。
◤果胶多糖(高支链 RG-I,531.5 kDa)显著改善了 HFD 引起的脂质代谢异常,TG、TC、LDL-C 和游离脂肪酸水平降低。它还通过增加Roseburia、Clostridium等产生 SCFA 的细菌的数量来恢复肠道菌群失衡。
◤裙带菜多糖 ( Undaria pinnatifida )修复了高脂饮食引起的肠道微生物群改变,特别是Prevotellaceae_UCG-001,发现这与脂质代谢紊乱有关。
◤鲍鱼性腺多糖显著增加了丁酸水平,丁酸是一种重要的短链脂肪酸,它通过GPR依赖性途径抑制脂质相关基因的表达。
◤龙须菜多糖调节拟杆菌、瘤胃球菌_1和乳酸杆菌的相对丰度来增强胆固醇向BAs的转化。在遗传水平上,有人认为BA代谢的调节主要涉及CYP39A1和CYP7B1。
炎症性肠病 (IBD) 包括溃疡性结肠炎 (UC) 和克罗恩病 (CD),其特点是胃肠道持续炎症。IBD 的症状包括腹泻、腹胀、腹痛、便血、体重减轻和不适。
◤银耳多糖(TPs)通过多途径调节肠道菌群及其代谢物,改善了DSS诱导的溃疡性结肠炎。TPs可以增加Lactobacillus的丰度,从而改善色氨酸的分解代谢。这导致黄嘌呤酸、KA和吲哚衍生物(如5-羟吲哚、5-羟吲哚-3-乙酸、5-羟吲哚乙酰酸)的增加。
TPs还可以增加Romboutsia的水平,促进DCA的产生。因此,TPs可以通过影响色氨酸代谢和胆汁酸代谢来保护小鼠免受结肠炎的侵害。
◤金针菇多糖已被证明可以通过控制结肠微生物失调、增加短链脂肪酸和抑制 TLR4-NF-κB 信号通路来缓解结肠炎。能促进益生菌的生长,抑制致病菌的生长,恢复肠道稳态,缓解IBD症状。
◤竹荪多糖由59.84%的葡萄糖、23.55%的甘露糖和12.95%的半乳糖组成,已被证明可以通过增加粘蛋白和紧密连接蛋白的表达,抑制有害细菌(如γ-变形菌、变形菌、拟杆菌科、拟杆菌科和肠杆菌科)并增强有益细菌(如嗜酸乳杆菌)来改善肠道菌群组成和肠道屏障功能。
◤坛紫菜多糖通过上调紧密连接蛋白,增加粘液层及其分泌,调节肠道微生物群落,富集有益细菌,如拟杆菌、Muribaculum和乳酸杆菌,从而减轻DSS诱导的结肠损伤,从而改善结肠粘膜屏障的完整性。
◤白术多糖可以缓解在DSS诱导的溃疡性结肠炎小鼠模型炎症。白术多糖可以增加Butybacterium、Lactobacillus,同时减少Actinomyces、Akkermansia、Faecalibaculum、Verrucomicrobia、Bifidobacterium等。
肠道菌群的变化逆转了DSS引起的短链脂肪酸的减少以及色氨酸和色氨酸相关代谢物5-羟基-N-甲酰基犬尿氨酸和吲哚-3-乙酸的减少。白术多糖还剂量依赖性地逆转了LCA、DCA、缬氨酸、亮氨酸等的异常变化。
天然植物多糖治疗IBD的机制
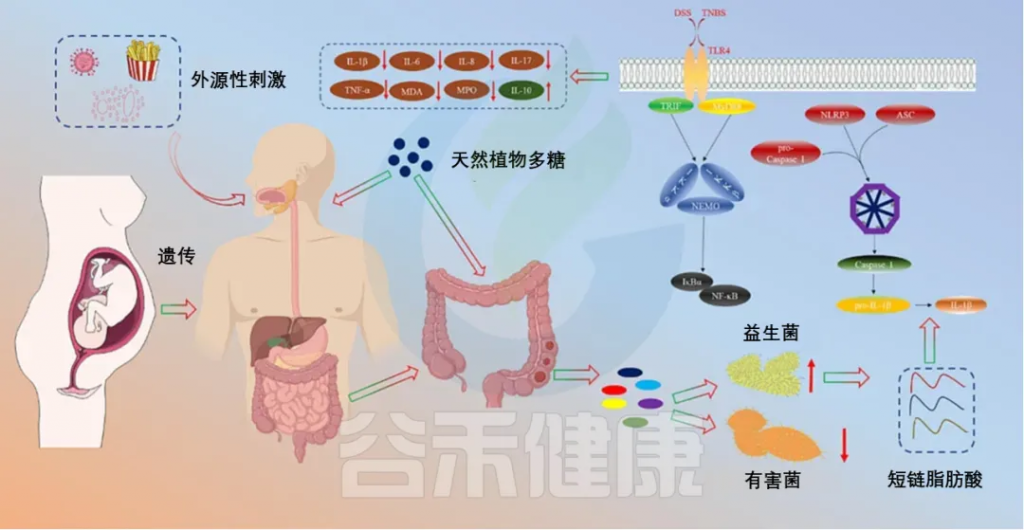
doi.org/10.1016/j.ijbiomac.2023.126799
◤甘草多糖GPS上调乳杆菌科、S24–7、Turicibacteraceae、Verrucomicrobiaceae和双歧杆菌科的丰度,下调脱硫弧菌科、瘤胃球菌科、毛螺菌科、肠杆菌科、丹毒丝菌科的丰度。GPS能促进乳杆菌、拟杆菌和产SCFAs菌的生长繁殖,起到减轻炎症、升高IL-10水平、抑制TLR4活化、降低血浆LPS水平的作用,从而保护肠道免受LPS诱导的炎症。
◤何首乌多糖(TSG)的给药显著增加了厚壁菌门和拟杆菌门的相对丰度,同时也降低了幽门螺杆菌和拟杆菌门的属水平,改善了肠道菌群,起到治疗IBD的作用。

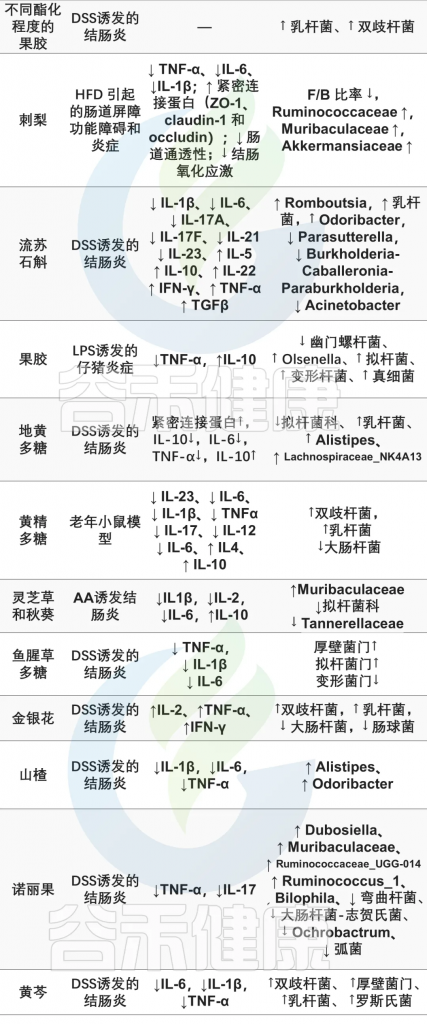
doi.org/10.3390/nu15153321
◤乳果糖通过重塑肠道菌群组成和代谢物,改善了由洛哌丁胺引起的便秘小鼠模型中的肠道水和盐代谢。具体来说,乳果糖上调了Bacteroides的丰度,并显著降低了厚壁菌门和Verrucomicrobia的水平。
此外,乳果糖减少了胆汁酸(包括CA、DCA等)、粪便中高浓度的吲哚(高浓度吲哚对细胞有毒)并增加了丙酸。
◤西洋参多糖(WQP) 可增强大鼠肠道结构的恢复,降低炎性细胞因子水平,改善短链脂肪酸 (SCFA) 水平,促进肠道菌群和肠黏膜屏障的恢复,并减轻盐酸林可霉素引起的腹泻和菌群失调等抗生素相关副作用。
◤葛根多糖( PPL )可缓解抗生素相关性腹泻引起的结肠病理改变和肠道菌群失调。
◤紫菜中提取的多糖(Nemacystus decipiens)能显著缓解小鼠抗生素相关性腹泻(AAD)的症状,并且显著增加了 Muribaculum、Lactobacillus 和 Bifidobacterium 的丰度,降低Enterobacter 、Clostridioides 的丰度。
◤茯苓多糖(PCP)通过恢复7种肠道菌菌缓解了抗生素相关性腹泻小鼠的症状,包括:Parabacteroides distasonis、Akkermansia muciniphila、Clostridium saccharolyticum、Ruminococcus gnavus、Lactobacillus salivarius、Salmonella enterica、Mucispirillum schaedleri.
适当调节免疫反应可以降低炎症反应引起的病原体入侵的风险。
结直肠癌
◤灵芝多糖在缓解结直肠癌症状方面比瓜尔胶更有效,因为它们能增加Akkermansia、结肠长度,并下调直肠癌相关基因。灵芝多糖通过动态调节肠道菌群和宿主免疫反应,已证明具有预防和治疗癌症的功能。
灵芝多糖通过调节乳酸杆菌、双歧杆菌等有益菌的相对丰度,诱导SCFAs的产生,改善肠道屏障损伤,抑制TLR4/MyD88/NF-κB信号通路,从而降低结肠炎和致癌风险。
◤绞股蓝与灵芝多糖联合使用显著提高了SCFAs产生菌的丰度,提高了丁酸和异丁酸水平,抑制了硫酸盐还原菌的丰度。
乳腺癌
◤来自灵芝破壁孢子(分子量为 3659 Da)的多糖可作为乳腺癌治疗的天然佐剂,增加细胞毒性 T 细胞和辅助性 T 细胞的数量。
灵芝孢子提取物(ESG)重塑了4T1荷瘤小鼠的肠道菌群:厚壁菌门和变形菌门的相对丰度增加,放线菌、拟杆菌门和蓝藻的相对丰度降低。
◤灵芝多糖联合紫杉醇对4T1乳腺荷瘤小鼠有抗肿瘤作用。联合治疗能显著富集拟杆菌、瘤胃球菌等5个菌属,降低脱硫弧菌和Odoribacter的丰度,平衡肠道菌群,抑制肿瘤代谢。
疲劳是一种普遍的不适感,表现为极度疲倦和力竭,通常在生理、病理或心理失衡时出现。体力劳动、心理压力、高原缺氧和长期疾病都可能引发疲劳。疲劳不仅影响日常生活,还可能导致内分泌、免疫、代谢等系统功能受损,甚至与癌症、糖尿病等严重疾病相关。此外,疲劳还与焦虑、抑郁和神经系统疾病有关。
近年来,天然多糖因其在缓解运动性疲劳中的潜在效果和较少的副作用而受到关注。研究表明,肌肉功能与肠道菌群的多样性和组成密切相关,而天然多糖如决明子、灵芝、枸杞和冬虫夏草等可通过不同机制发挥抗疲劳作用。
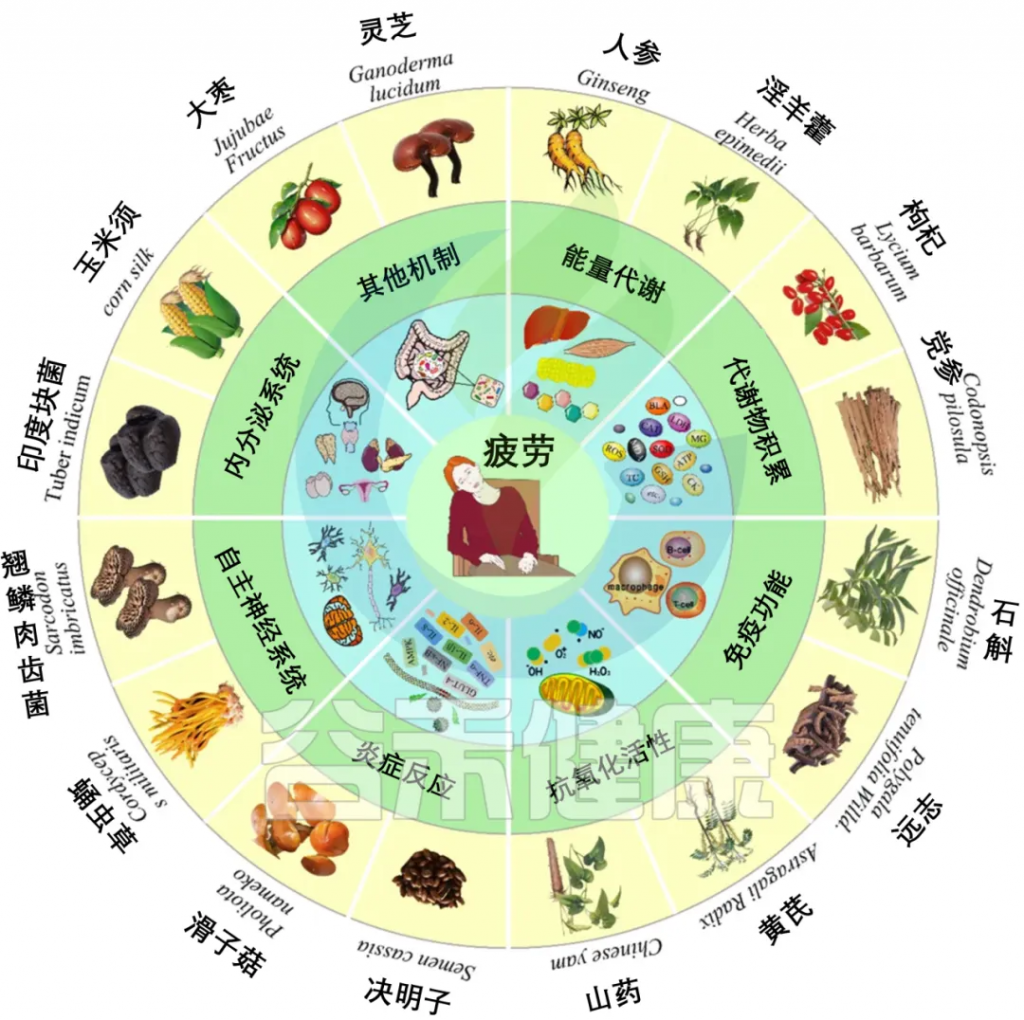
doi.org/10.3390/foods12163083
多糖抗疲劳机制如下:
抗疲劳多糖干预后肠道菌群的变化
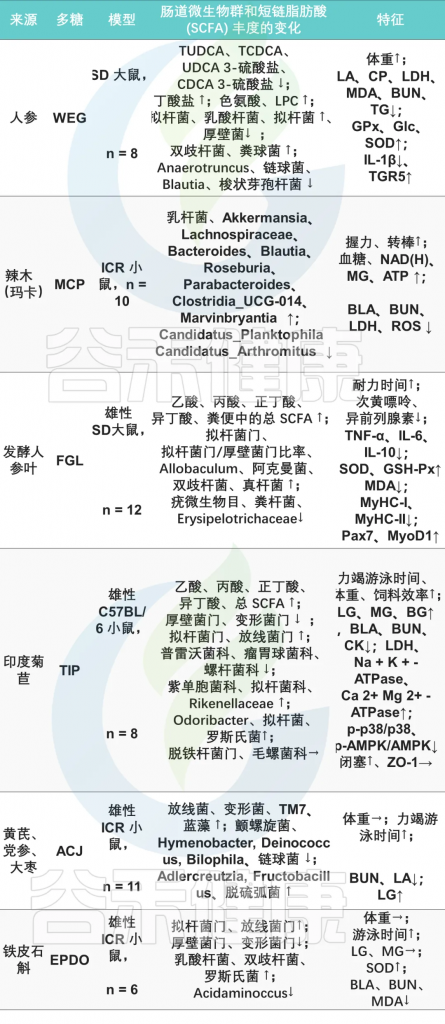
doi.org/10.3390/foods12163083
肠道-肌肉轴是肌肉与消化道之间的双向沟通,微生物可以通过微生物-肠道-肌肉轴作用于全身的肌肉。肠道微生物在膳食多糖的作用下,产生一些代谢产物(短链脂肪酸等),有些代谢产物会直接穿过肠道上皮细胞,通过血液循环直接或间接作用于肌肉组织和细胞,引起细胞发生生理生化反应,对疲劳产生一定的影响。
补充膳食多糖通过作用于肠道菌群及其代谢产物,间接激活AMPK/PGC-1α、PI3K/AKT、NF-κB、Nrf2/Keap1信号通路,调节能量代谢,降低炎症水平,增强线粒体功能和抗氧化能力,进一步维持肌肉质量和功能,从而缓解疲劳。
扩展阅读:
◤银杏叶中的一种水溶性多糖(GPS)可减轻压力引起的抑郁症并逆转肠道菌群失调。GPS 治疗可以缓解压力引起的血清素阳性和多巴胺阳性细胞密度降低。GPS 逆转了与抑郁相关的肠道菌群失调,并增加了乳杆菌的丰度,而乳杆菌已被证明是缓解抑郁的途径。
◤从秋葵中提取的多糖,发现它对抑郁小鼠的肠道菌群有明显的恢复作用,表现为厚壁菌门比例上调,拟杆菌门和放线菌门相对比例下调。这种调节有助于强化肠黏膜屏障,维持肠道免疫系统正常功能,减少肠道炎症反应,对抗抑郁有效,抑郁症小鼠的抑郁症状有所改善。用秋葵多糖治疗的小鼠体内的SCFAs显著增加,而SCFAs作为重要的通讯介质,对抗抑郁障碍有积极的影响。
◤接受金针菇多糖 (FVP)治疗的小鼠的肠道微生物组成发生显著改变,放线菌、丹毒菌和拟杆菌的丰度增加,梭菌的丰度降低,并且接受FVP治疗的小鼠的学习和记忆能力得到改善。
◤肉苁蓉多糖可以通过恢复小鼠模型中D-半乳糖诱导的衰老引起的肠道菌群稳态来抑制氧化应激和外周炎症,从而改善小鼠的认知功能。
◤从黄芪中提取的一种多糖已被证明可以通过改变糖尿病小鼠的肠道菌群来改善认知障碍。
扩展阅读:
以下是关于一些多糖的详细介绍,包括其功效,与肠道菌群的关联等,更深入地了解多糖在人体中的重要作用。
路易波士茶是什么?
路易波士茶(Rooibos)又名Aspalathus linearis,中文也有译作“路易博士茶”,取自原产于南非的一种豆科植物的茎叶。虽然带有一个茶字,但路易波士茶并不是传统意义上的茶叶。
路易波士茶因不含咖啡因、单宁含量低而受到南非人的喜爱,并在全球范围内进行商业化种植和销售。2014年,中国卫生和计划生育委员会批准路易波士茶作为新的食品原料,丰富了中国的食品和药物资源。
路易波士茶具有良好的抗氧化、抗过敏、解痉和降血糖作用。也可以预防心血管疾病、神经退行性疾病、各种癌症、骨质疏松症等。
路易波士茶多糖
一项研究从路易波士茶中分离得到均一酸性多糖(ALPs) ,水溶性多糖ALP由β-糖苷键连接,含有吡喃糖环,主要由岩藻糖、鼠李糖、阿拉伯糖和半乳糖组成。
结合RT-PCR结果推测,ALP可能通过降低Cyp2e1和Keap1的mRNA表达,增加Nrf2和HO-1的mRNA表达,激活Cyp2e1/Keap1-Nrf2-HO-1信号通路,调控下游抗氧化酶活性和炎症因子表达,减轻氧化应激损伤和炎症反应造成的损伤,从而改善急性酒精性肝损伤。
路易波士茶多糖对肠道菌群的影响
多样性
急性酒精性肝病模型对照组(MC)的物种多样性和丰富度显著降低(p≤0.05)。高剂量和低剂量ALP处理组的物种多样性和丰富度有所增加,其中高剂量组的增加更为显著。
干预后改善的菌群
ALP 干预后疣微菌丰度显著升高(p≤0.01),而脱硫杆菌丰度及F / B值均降低,但差异不显著。
肠道菌群中乳酸杆菌科的丰度与肝脏 AST 和 ALT 水平呈负相关。小鼠ALP干预后,乳酸杆菌科的丰度显著增加(p ≤ 0.05),而Rikenellaceae的丰度显著降低(p ≤ 0.05)。
ALP 显著改善了小鼠急性酒精性肝损伤中Alloprevotella和Alistipes丰度显著降低的情况( p ≤ 0.05)。
“肠-肝轴”途径
对属级别排名前20位的菌种进行了 Spearman 相关性分析。
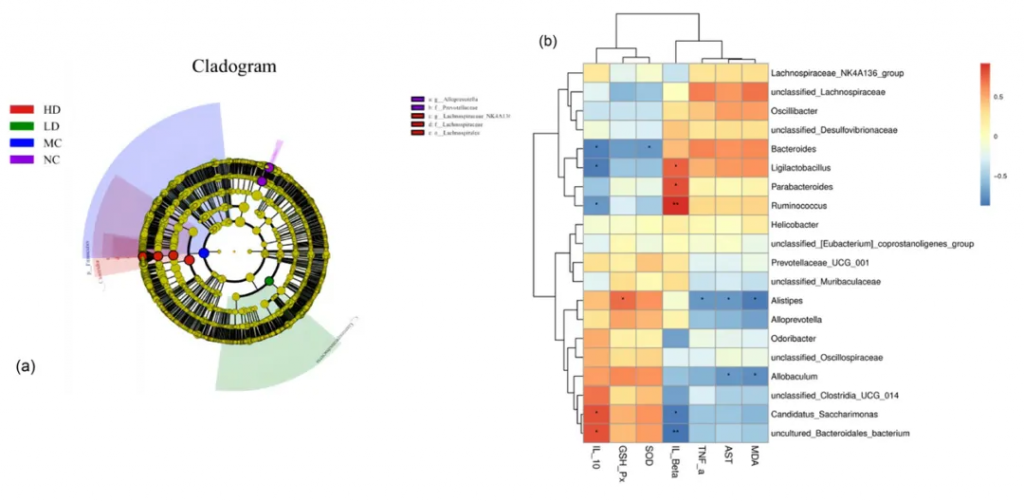
推测ALP可能通过“肠-肝轴”通路促进肠道菌群与抗氧化酶及炎症因子相互作用,从而减轻酒精性肝损伤,而上述菌群与酒精损伤标志物、抗氧化酶及炎症因子的表达均密切相关。
酒精及其代谢产物会影响肠道菌群的平衡和组成,导致肠道功能受损。这反过来又会影响肝脏健康,而肝脏健康与肠道菌群稳态密切相关。肠道和肝脏之间的相互作用被称为“肠-肝轴”通路。
地黄是玄参科地黄属植物,在我国拥有久远的药用历史,作为滋阴补肾的传统中药,也被《神农本草经》列为上品。
多糖是地黄中的主要活性成分之一。地黄多糖具有免疫调节、抗肿瘤、抗氧化、抗衰老等多种生物活性。
迄今为止,从地黄中分离纯化了20多种多糖,主要由阿拉伯糖、鼠李糖、半乳糖、葡萄糖、甘露糖、木糖、岩藻糖和半乳糖酸组成。
地黄多糖能增加DSS诱发小鼠的体质量指数和结肠长度、降低DAI评分,改善组织病理学损伤。同时,地黄多糖能阻断NF-κB信号通路,降低细胞内促炎因子表达,减轻炎症,增加紧密连接蛋白表达,维持肠道上皮屏障。
地黄多糖可能在肠道微生物作用下发酵转化为SCFAs,增加肠道中乙酸、丙酸和丁酸的含量,起到缓解IBD的作用。
拟杆菌属、乳酸杆菌属、Alistipes是导致DSS结肠炎组肠道微生物组失衡的关键细菌类型,而补充地黄多糖可以逆转这种有害变化。
五指毛桃,又叫粗叶榕(Ficus hirta Vahl),常被用作滋补品的草药成分,以其丰富的多糖含量和生物活性而闻名。
一项研究发现,FHVP-3 对肠道微生物群产生影响:
下列菌群富集:
FHVP-3 抑制了下列机会性致病菌属的丰度:
作为可发酵底物,FHVP-3 还增加了短链脂肪酸的浓度,包括乙酸盐、丙酸盐和丁酸盐。FHVP-3 对脂多糖 (LPS) 诱导的 RAW 264.7 巨噬细胞表现出显着的抗氧化活性和显着的抗炎作用。
doi.org/10.1021/acsfoodscitech.3c00626
大蒜多糖 (GP) 占大蒜干重的 75% 以上。它们的特征是具有 2,1- β – d -Fruf 主链和 2,6- β – d -Fruf 分支的果聚糖。
研究表明,大蒜多糖在调节肠道微生物群方面发挥着作用,但它们是否具有维持肠道健康的全面功能并可作为有效的益生元仍不清楚。
为了探索这一点,通过管饲法给昆明小鼠施用不同剂量的大蒜多糖(1.25-5.0g/kg 体重)和菊粉(作为阳性对照),并评估它们对肠道上皮、化学和生物屏障的影响。还使用洛哌丁胺建立了便秘模型,以研究大蒜多糖对缓解便秘的潜在影响。
施用大蒜多糖显著上调昆明小鼠小肠组织中紧密连接蛋白和粘蛋白的表达。大蒜多糖提高了盲肠丁酸含量,降低了脱硫杆菌的丰度,并降低了厚壁菌门与拟杆菌门的比例(F/B)。大蒜多糖还促进了 Bacteroides acidifaciens、Clostridium saccharogumia的生长。
Tax4Fun 功能预测表明,大蒜多糖具有预防人类疾病的潜力,可降低胰岛素抵抗、传染病和耐药性的风险。
大蒜多糖还通过增强小肠转运、软化粪便稠度、加速排便和促进兴奋性神经递质的释放,在缓解洛哌丁胺引起的便秘症状方面表现出有益作用。
多年来,槐耳 (Trametes robiniophila Murr) 一直被用于药物治疗。槐耳含有多种成分,包括多糖、蛋白质、酮和生物碱,其中蛋白聚糖和多糖是主要的生物活性成分。
槐耳提取物具有免疫调节活性,并可通过激活自噬、抑制铁死亡、抑制内质网应激等过程对细胞发挥保护作用。研究表明,槐耳水提取物可通过抑制NLRP3炎症囊泡活化,减轻肠道屏障损伤和炎症反应,并抑制DSS和氧化偶氮甲烷 (AOM) 联合诱导的结肠肿瘤形成。
可缓解 DSS 引起的肠道菌群紊乱
一项小鼠研究显示,槐耳多糖干预显著逆转了 DSS 引起的Muribaculaceae_unclassified、Anaerotruncus、Ruminococcaceae_unclassified丰度的下降以及Escherichia-Shigella丰度的增加( p < 0.05)。
其中,Muribaculaceae_unclassified是健康人中发现的肠道微生物,参与丁酸代谢和色氨酸代谢,可产生对人体有益的短链脂肪酸。
相关性分析,Muribaculaceae_unclassified与结肠长度、SOD 和 T-AOC 呈正相关,而与 DAI 评分以及炎症和氧化指标呈负相关。
Anaerotruncus与结肠长度、SOD 和 T-AOC 呈正相关,但与炎症标志物 LPS、MDA 和 MPO 呈负相关。
黄芩的根通常用作药物,用于清热利湿、泻火解毒。多糖是黄芩的最重要成分之一。
一种来自黄芩的多糖通过抑制 NF-κB 信号传导和NLRP3 炎症小体活化来改善溃疡性结肠炎。在多糖的分离和纯化过程中,研究人员还获得了另一种名为 SP2-1 的均质多糖。SP2-1由甘露糖、核糖、鼠李糖、葡萄糖醛酸、葡萄糖、木糖、阿拉伯糖和岩藻糖组成。
研究人员发现其对肠道菌群紊乱、肠道屏障改善以及短链脂肪酸产生影响。
在UC患者中,SP2-1显著抑制了促炎性细胞因子IL-6,IL-1β和TNF-α。
溃疡性结肠炎患者的屏障完整性被破坏,TJ 蛋白的表达发生改变,SP2-1增加小鼠TJ蛋白的表达,修复肠道屏障。
SP2-1对肠道菌群的影响
SP2-1组的粪便微生物群多样性明显高于DSS组。
临床上,溃疡性结肠炎患者的双歧杆菌和乳酸杆菌的丰度降低。与模型组相比,SP2-1 组的双歧杆菌、乳酸杆菌和Roseburia的水平提高。
而拟杆菌和葡萄球菌的种群受到抑制。肠道菌群中存在过量的拟杆菌和葡萄球菌对肠道免疫系统有害。
Roseburia 通过调节调节性 T 细胞的发育和分化、增加抗炎细胞因子的分泌和抑制促炎细胞因子的产生来缓解UC。
枸杞多糖(简称LBPs)是从枸杞中提取的一类多糖物质。枸杞是一种多年生灌木,属于茄科,枸杞多糖因其多样的药理活性和生理功能而受到越来越多的关注。
枸杞多糖 (LBPs)作为最重要的生物活性分子,可通过肠道微生物参与有益作用,包括调节代谢、降血糖、神经保护、抗衰老、保护各种器官免受氧化应激相关疾病的侵害。
枸杞多糖对肠道菌群的影响
癌症
一般来说,抗癌化疗药物除了会诱导癌细胞凋亡外,还会对肠道菌群产生不利影响,主要表现在肠绒毛缩短,乳酸杆菌和肠球菌丰度下降,节段丝状菌丰度增加。而枸杞多糖治疗可通过增加有益菌相对丰度来改善肠道环境和免疫功能,逆转环磷酰胺引起的有害菌(瘤胃拟杆菌科、Longibraceae、脱硫弧菌和厌氧拟杆菌科)相对丰度的增加。
还发现毛螺菌科、瘤胃菌科、脱铁菌科、脱硫弧菌科、Aneoplasmataceae与细胞因子IL-2、IL-6、IL-1β、TNF-α、IFN呈负相关。因此,主要肠道菌群的相对丰度可能与免疫调节有关。
厚壁菌门与拟杆菌门(F/B)比例的变化与许多疾病状态有关,它被视为菌群失调的重要指标,有助于了解肝脏和代谢疾病的发展。枸杞多糖可降低高脂饮食大鼠的 F/B 比,表明补充枸杞多糖有助于调节肠道菌群失调。
doi.org/10.1080/10408398.2022.2128037
神经系统
枸杞多糖可通过调节肠道菌群-肠-脑轴的神经免疫通路,对中枢神经系统产生多方面的保护作用。枸杞多糖可改善菌群失调、肠道屏障受损等问题,并通过抑制细胞凋亡、促进自噬等机制发挥神经保护效应。
肝脏
枸杞多糖能够影响NAFLD患者的肠道菌群组成、肠道屏障及肝脏炎症。
代谢(肥胖、糖尿病)
肥胖个体的研究中,肠道内F/B比例较高,因此推测肠道内F/B比例与肥胖呈显著正相关。
后续研究发现,LBPs可通过调节肠道菌群组成和短链脂肪酸生成来改善肥胖。
枸杞多糖可作为2型糖尿病的潜在辅助药物。
LBPs能调节肠道菌群,激活大鼠肠黏膜TLR2+上皮细胞γδT细胞,增强肠道屏障功能,改善糖尿病。此外,LBPs能明显降低血浆中促炎性细胞因子IL-1β、IL-6、IL-17A和TNF-α,而抗炎性细胞因子IL-10水平在糖尿病大鼠中有所升高。
哮喘
枸杞多糖还可以通过直接或间接地改变肠道菌群,参与炎症介质的调控,从而改善肺功能和过敏性哮喘症状。
肠道菌群测序分析显示,LBPs能够促进哮喘小鼠肠道中乳酸杆菌和双歧杆菌增加,并降低厚壁菌门和放线菌水平,通过肠道介导缓解哮喘。
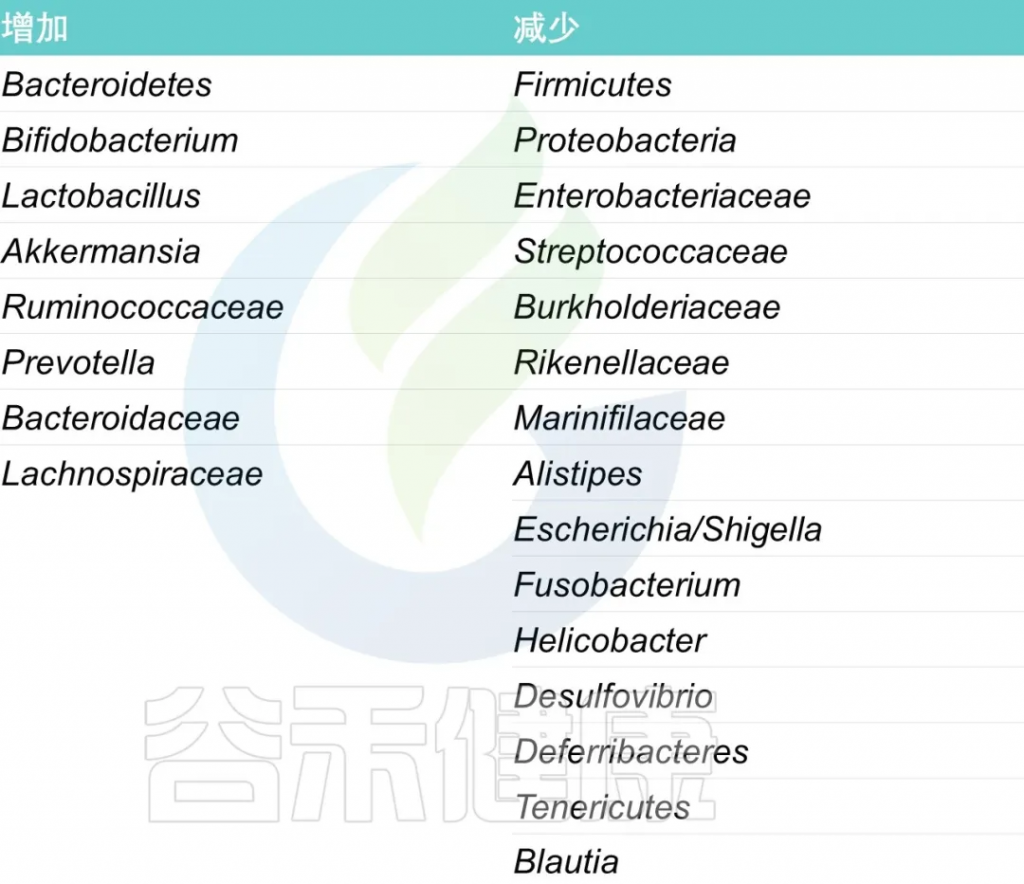
岩藻糖(Fucose),参与构成肠上皮细胞(IEC)顶端表达的聚糖,并介导肠道中的许多生物过程,尤其是宿主-微生物相互作用。
释放的岩藻糖可被微生物用作膳食聚糖、能量来源或合成结构蛋白。肠道中岩藻糖的变化影响微生物群的定植。
岩藻多糖
岩藻多糖是一种含有岩藻糖和硫酸基团的多糖,可改善糖尿病肾病。
一项小鼠研究发现,岩藻多糖可显著改善肾小球滤过率高滤过和肾纤维化,其机制与短链脂肪酸产生菌富集、增加盲肠内乙酸浓度、提高肾脏ATP水平以及改善线粒体功能障碍有关。此外,岩藻多糖还可通过抑制MAPKs通路来改善肾脏炎症和纤维化。总之,岩藻多糖可通过改善线粒体氧化应激和抑制MAPKs通路,靶向肠道菌群-线粒体轴,改善早期糖尿病肾病。
桑叶的药用功能最早在2000多年前的汉代被发现,并记载于《神农本草经》。明代李时珍在《本草纲目》中对桑叶的药用功效有更详细的描述,包括活血化瘀、祛风、清热解毒等功能。桑叶已被列入国家卫生健康委员会公布的食药同源资源名单。
桑叶多糖(Mulberry Leaves Polysaccharides,MLPs)是从桑树(Morus alba L.)叶片中提取的一种植物多糖。它们是桑叶中主要的活性成分之一,由多种单糖组成,主要包括木糖、阿拉伯糖、果糖、半乳糖、葡萄糖、甘露糖等。
桑叶多糖对人体的影响
桑叶多糖具有多种生物学活性,包括降低血糖、抗氧化、免疫调节、抗肿瘤、抗菌、抗凝和调节肠道菌群等。这些活性使得MLPs在医药和食品领域具有广泛的应用前景。并且安全、有效、低毒、副作用小。
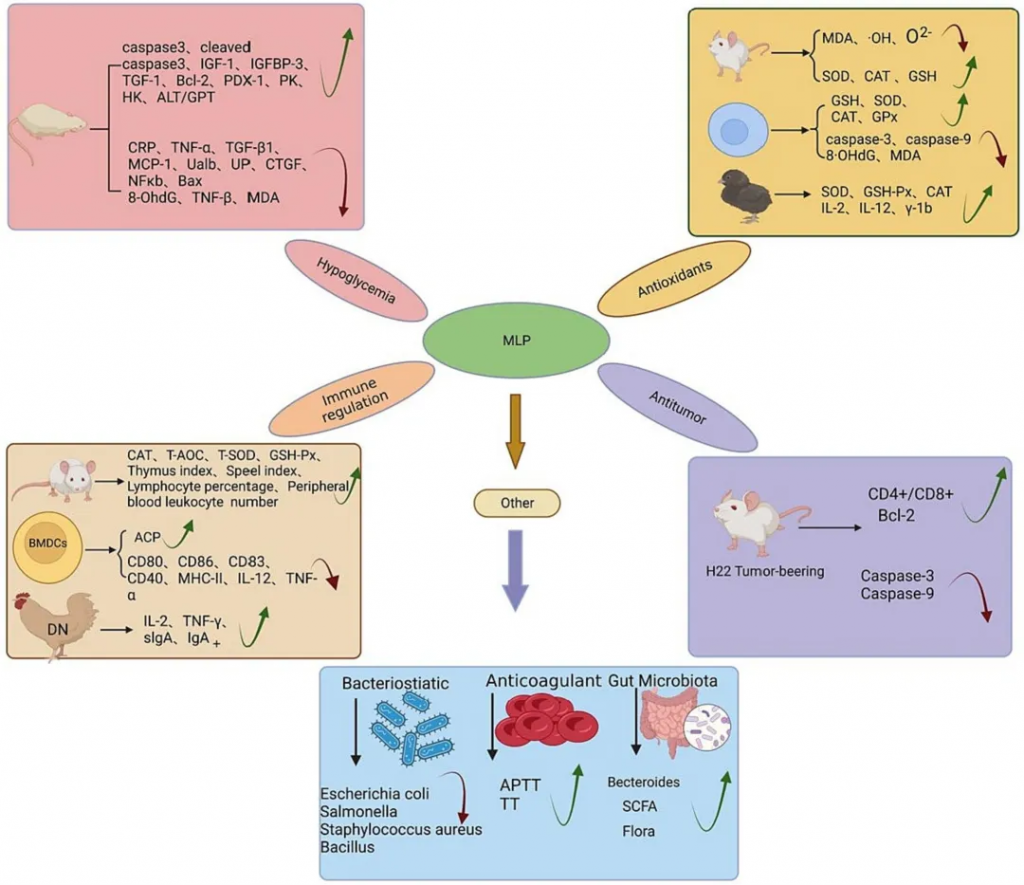
doi.org/10.1016/j.ijbiomac.2023.128669
桑叶多糖对肠道菌群的影响
桑叶多糖通过调节肠道菌群的平衡,进而对人体的健康产生积极的影响。以下是桑叶多糖影响的肠道菌群及其变化情况:

桑叶多糖能够调节短链脂肪酸和肠道菌群的相对丰度,降低真细菌与过敏性细菌的比例,从而改善肠道屏障功能。
沙棘果实在藏族食品和药物中已有数千年的传统。沙棘多糖 (SP) 是沙棘果实中的主要功能成分之一。
对高脂饮食诱导的肥胖小鼠:沙棘多糖治疗提高了 p-AMPKα 和 PPARα 蛋白的表达,刺激了小鼠肝脏中 ACC1 的磷酸化,并抑制了 FAS、PPARγ 和 CD36 的蛋白表达。
沙棘多糖上调Muribaculaceae_unclassified、双歧杆菌、Rikenellaceae_RC9_gut_group、Alistipes、Bacteroides的比例,并下调Lactobacillus、 Firmicutes_unclassified 、Dubosiella Bilophila、 Streptococcus 的比例,重组了HFD诱导的肥胖小鼠的肠道微生物群。
此外,粪便中的微生物代谢物短链脂肪酸 (SCFAs) 的产生也有所增加。此外,相关性分析结果表明沙棘多糖的肥胖改善作用与粪便中的SCFAs水平高度相关。因此,沙棘多糖对肝脏脂质代谢的调节可能是由于肠道微生物群的变化和SCFAs产生量的增加。这些结果表明,沙棘多糖可以通过调节肠-肝轴发挥改善肥胖的潜在营养保健作用。
蘑菇多糖是一类存在于蘑菇中的生物活性多糖,它们包括但不限于几丁质、甘露聚糖、半乳糖聚糖、木聚糖、葡聚糖、云芝多糖、灵芝多糖、半纤维素。这些多糖在蘑菇细胞壁中含量丰富,赋予蘑菇独特的结构和生物活性。
蘑菇多糖的功效
蘑菇多糖对人体具有多种潜在的健康益处。它们可以增强免疫系统、具有抗肿瘤活性、调节肠道菌群、抗氧化、抗糖尿病、抗衰老作用。
蘑菇多糖对肠道菌群的影响
促进益生菌生长
蘑菇多糖通过选择性地促进益生菌的生长,增强肠道健康。例如,灵芝和茯苓中的多糖被发现可以增加有益细菌的数量,这些细菌可以对抗肥胖、产生短链脂肪酸和乳酸。香菇中的多糖也显示出对嗜酸乳杆菌(Lactobacillus acidophilus)有促进作用。
抑制病原菌
蘑菇多糖能够通过增强肠道屏障功能和促进益生菌的生长来间接抑制病原菌。双孢蘑菇中的多糖已被证明可以限制大肠杆菌的生长。
增强肠道屏障功能
蘑菇多糖通过增强肠道上皮细胞的功能,提高肠道屏障的完整性,减少有害物质的渗透。云芝(Trametes versicolor)中的多糖肽PSK和PSP能够调节肠道菌群,增加有益菌双歧杆菌和乳杆菌的数量,同时减少有害菌如梭状芽孢杆菌和金黄色葡萄球菌。在降低腹泻、艰难梭菌感染、炎症性肠病等方面发挥作用。
调节免疫反应
蘑菇多糖通过激活肠道相关淋巴组织,增强机体的免疫反应。灵芝多糖能刺激和增加免疫细胞如自然杀伤细胞、T淋巴细胞和巨噬细胞的数量。
产生短链脂肪酸
蘑菇多糖在肠道发酵过程中产生短链脂肪酸,这些物质对维持肠道健康和调节宿主代谢具有重要作用。蚝菇(Pleurotus ostreatus)中的β-葡聚糖衍生物能够诱导前列腺癌细胞的凋亡,并且显示出免疫调节、巨噬细胞激活、抗肿瘤和免疫刺激活性。

多糖的多样性和复杂性使其在人体内的作用千变万化,它们能够通过与肠道菌群的互动,从调节免疫功能到改善代谢性疾病等。
然而,利用天然多糖通过肠道菌群治疗疾病仍存在一些限制和挑战。对肠道菌群和多糖之间相互作用的全面了解需要进一步研究,由于大多数研究都是在动物身上进行的,因此开展研究多糖-微生物组-疾病相互作用的临床试验并实现临床转化至关重要。
幸运的是,随着生命科学领域新兴技术的发展,我们有了更多的工具来揭示这些复杂问题。高通量测序技术、多组学技术、人工智能和大数据分析的交叉融合,为研究多糖和肠道菌群的相互作用提供了强大的技术支持,推动了这一领域的快速发展。
此外,多糖与肠道菌群之间的相互作用不仅揭示了多糖的生物活性,也突显了肠道菌群对健康的重要贡献。多糖与肠道菌群的相互作用为我们提供了一个全新的视角,了解个体的肠道菌群组成,不仅有助于我们理解自身的健康状况,更为个性化的营养和健康管理提供了科学依据。肠道菌群检测可以揭示个体对多糖等营养成分的响应差异,从而为制定个性化的饮食和治疗计划提供指导。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Xue H, Mei CF, Wang FY, Tang XD. Relationship among Chinese herb polysaccharide (CHP), gut microbiota, and chronic diarrhea and impact of CHP on chronic diarrhea. Food Sci Nutr. 2023 Aug 6;11(10):5837-5855.
Xu X, Wang L, Zhang K, Zhang Y, Fan G. Managing metabolic diseases: The roles and therapeutic prospects of herb-derived polysaccharides. Biomed Pharmacother. 2023 May;161:114538
Zhang D, Liu J, Cheng H, Wang H, Tan Y, Feng W, Peng C. Interactions between polysaccharides and gut microbiota: A metabolomic and microbial review. Food Res Int. 2022 Oct;160:111653.
Chen R, Zhou X, Deng Q, Yang M, Li S, Zhang Q, Sun Y, Chen H. Extraction, structural characterization and biological activities of polysaccharides from mulberry leaves: A review. Int J Biol Macromol. 2024 Feb;257(Pt 2):128669.
Lan Y, Sun Q, Ma Z, Peng J, Zhang M, Wang C, Zhang X, Yan X, Chang L, Hou X, Qiao R, Mulati A, Zhou Y, Zhang Q, Liu Z, Liu X. Seabuckthorn polysaccharide ameliorates high-fat diet-induced obesity by gut microbiota-SCFAs-liver axis. Food Funct. 2022 Mar 7;13(5):2925-2937.
Feng Y, Song Y, Zhou J, Duan Y, Kong T, Ma H, Zhang H. Recent progress of Lycium barbarum polysaccharides on intestinal microbiota, microbial metabolites and health: a review. Crit Rev Food Sci Nutr. 2024;64(10):2917-2940.
Cui L, Guan X, Ding W, Luo Y, Wang W, Bu W, Song J, Tan X, Sun E, Ning Q, Liu G, Jia X, Feng L. Scutellaria baicalensis Georgi polysaccharide ameliorates DSS-induced ulcerative colitis by improving intestinal barrier function and modulating gut microbiota. Int J Biol Macromol. 2021 Jan 1;166:1035-1045.
Tang YF, Xie WY, Wu HY, Guo HX, Wei FH, Ren WZ, Gao W, Yuan B. Huaier Polysaccharide Alleviates Dextran Sulphate Sodium Salt-Induced Colitis by Inhibiting Inflammation and Oxidative Stress, Maintaining the Intestinal Barrier, and Modulating Gut Microbiota. Nutrients. 2024 Apr 30;16(9):1368.
Zhao Q, Jiang Y, Zhao Q, Patrick Manzi H, Su L, Liu D, Huang X, Long D, Tang Z, Zhang Y. The benefits of edible mushroom polysaccharides for health and their influence on gut microbiota: a review. Front Nutr. 2023 Jul 6;10:1213010.
Álvarez-Mercado AI, Plaza-Diaz J. Dietary Polysaccharides as Modulators of the Gut Microbiota Ecosystem: An Update on Their Impact on Health. Nutrients. 2022 Oct 3;14(19):4116.
Tang M, Cheng L, Liu Y, Wu Z, Zhang X, Luo S. Plant Polysaccharides Modulate Immune Function via the Gut Microbiome and May Have Potential in COVID-19 Therapy. Molecules. 2022 Apr 26;27(9):2773.
Sun CY, Zheng ZL, Chen CW, Lu BW, Liu D. Targeting Gut Microbiota With Natural Polysaccharides: Effective Interventions Against High-Fat Diet-Induced Metabolic Diseases. Front Microbiol. 2022 Mar 15;13:859206.
Gan L, Wang J, Guo Y. Polysaccharides influence human health via microbiota-dependent and -independent pathways. Front Nutr. 2022 Nov 9;9:1030063.
Chen J, Gao Y, Zhang Y, Wang M. Research progress in the treatment of inflammatory bowel disease with natural polysaccharides and related structure-activity relationships. Food Funct. 2024 Jun 4;15(11):5680-5702.
Chen P , Hei M , Kong L , Liu Y , Yang Y , Mu H , Zhang X , Zhao S , Duan J . One water-soluble polysaccharide from Ginkgo biloba leaves with antidepressant activities via modulation of the gut microbiome. Food Funct. 2019 Dec 11;10(12):8161-8171.
Wang, A.; Liu, Y.; Zeng, S.; Liu, Y.; Li, W.; Wu, D.; Wu, X.; Zou, L.; Chen, H. Dietary Plant Polysaccharides for Cancer Prevention: Role of Immune Cells and Gut Microbiota, Challenges and Perspectives. Nutrients 2023, 15, 3019.
Zhou, Y.; Chu, Z.; Luo, Y.; Yang, F.; Cao, F.; Luo, F.; Lin, Q. Dietary Polysaccharides Exert Anti-Fatigue Functions via the Gut-Muscle Axis: Advances and Prospectives. Foods 2023, 12, 3083
Shen, Y.; Song, M.; Wu, S.; Zhao, H.; Zhang, Y. Plant-Based Dietary Fibers and Polysaccharides as Modulators of Gut Microbiota in Intestinal and Lung Inflammation: Current State and Challenges. Nutrients 2023, 15, 3321
Lv H, Jia H, Cai W, Cao R, Xue C, Dong N. Rehmannia glutinosa polysaccharides attenuates colitis via reshaping gut microbiota and short-chain fatty acid production. J Sci Food Agric. 2023 Jun;103(8):3926-3938.


病原微生物和/或有害微生物成功入侵、繁殖并定居于宿主的体内或体内,从而导致健康障碍,称为感染。简单地说,它可以定义为由微生物引起的疾病。感染也被称为传染病或传染病或传染性疾病。
感染每年导致 1300多万 人死亡;2019 年死亡人数为 1370万人(新英格兰医学,2022年统计)。在这 1370 万人死亡中,有 770 万人与细菌感染有关。由于抗菌素耐药性的迅速出现和蔓延,与传染病相关的病例严重程度和死亡率也在增加。
感染和疾病是两个经常互换使用的术语,但它们的含义截然不同。了解两者之间的区别对于有效预防、诊断和治疗至关重要。
感染是指有害微生物(如细菌、病毒或真菌)侵入人体。这些病原体可以通过各种途径进入人体,如呼吸系统、消化系统或皮肤等。感染可以是局部的,也可以是全身性的,程度可轻可重。
疾病是指由于感染或其他原因而出现的症状或异常的表现。感染是原因,而疾病是结果。简而言之,感染是体内存在病原体,而疾病是感染导致的症状的表现。感染可能只是局部的轻微症状,而疾病则是影响身体正常功能的更严重的情况。在某些情况下,如果免疫系统无法控制微生物的传播,感染可能会发展成疾病。
在诊断时,区分感染和疾病非常重要。一个人可能感染了病原微生物,但没有表现出任何疾病症状。另一方面,一个人可能患病但没有活动性感染。在这种情况下,疾病可能是由感染以外的因素引起的,例如遗传易感性或环境诱因。
虽然预防策略主要侧重于避免感染,但防止感染发展为疾病也同样重要。及早发现和适当治疗感染有助于防止发展为严重疾病。比如,长期的呼吸道或肠道感染被认为是相关肿瘤发生的高风险因素之一。
因此,早期识别感染、诊断、治疗和预防是控制感染和疾病的重要组成部分。感染可以用抗生素或抗病毒药物等药物治疗,而疾病可能需要更专业的治疗方案。准确诊断潜在病因对于有效治疗至关重要。
疾病的定义,原因,诊断
// 定义
疾病是一种以身体或精神功能异常为特征的医疗状况。它通常由感染或受伤等外部因素引起,但也可能是由内部失衡或遗传倾向造成的。疾病的严重程度各不相同,会影响身体的不同器官或系统。
// 原因
疾病有多种原因,包括:
// 症状
疾病可表现出各种症状,包括疼痛、疲劳、发烧和身体功能异常,以及癌症。疾病的症状会因具体情况而有很大差异。
常见症状包括发烧、疲劳、疼痛、炎症和身体功能变化。某些疾病还可能导致与受影响器官或系统相关的特定症状,例如呼吸系统疾病的咳嗽或胃肠道疾病的消化问题。
疾病的形成方式多种多样。有些疾病,例如由遗传性疾病引起的疾病,是天生的。其他疾病可能是通过接触有害物质或环境因素而获得的。感染也会导致疾病的发展。当病原体侵入人体并造成伤害时,免疫反应可能会引发炎症、组织损伤和其他导致疾病的变化。
// 诊断和预防
诊断疾病通常需要结合病史、体格检查、实验室检查和影像学检查等。
预防疾病对于保持整体健康至关重要。这可以通过各种方式实现,例如保持良好卫生习惯、接种疫苗、保持健康的生活方式以及避免危险因素。早期发现和治疗感染也有助于防止其发展成更严重的疾病。
疾病的治疗包括药物治疗、手术治疗、其他疗法或这些方法的组合。
总之,疾病涉及身体或精神的异常功能,可能由感染、受伤、遗传因素或失衡引起。识别症状、诊断和了解疾病的原因对于有效预防和治疗疾病至关重要。
感染的定义,原因,诊断
// 原因
感染是一个术语,用于描述有害微生物在体内的入侵和繁殖。这些微生物被称为病原体,包括细菌、病毒、真菌和寄生虫。当这些病原体进入人体时,它们会引起感染。
感染的原因多种多样,包括细菌、病毒、真菌和寄生虫。这些微生物可以通过各种途径进入人体,例如吸入、摄入或通过皮肤破损。
// 症状
虽然感染的严重程度各不相同,但它们通常具有共同的症状。这些症状包括发烧、疲劳、咳嗽、打喷嚏、喉咙痛和炎症。在某些情况下,感染还可能导致更具体的症状,具体取决于所涉及的病原体类型。
感染可能是局部的,即传染源仅感染特定的器官或组织,或者可能是全身性的,即传染源通过血液或淋巴到达身体的不同部位,从而感染不同的器官和组织。
感染可能不会导致疾病等特定症状,因为大多数感染往往是亚临床的。相反,其他感染可能导致严重的症状和并发症。
虽然有些感染可能不被宿主的免疫系统察觉并自行消退,但其他感染可能会引起症状并发展为疾病。
// 预防与治疗
预防是控制感染的一个重要方面。这可以通过保持良好的卫生习惯来实现,例如经常洗手和避免与受感染者密切接触。疫苗接种也可以通过提供针对特定病原体的免疫力来帮助预防某些感染。
预防在降低感染和疾病风险方面发挥着重要作用。保持良好的卫生习惯、接种疫苗和避免与受感染者接触等措施有助于防止感染传播。此外,保持健康的生活方式和增强免疫系统可以降低感染发展为疾病的可能性。
一旦感染,治疗可能涉及使用抗生素、抗病毒药物、抗真菌药物或抗寄生虫药物,具体取决于引起感染的具体微生物。在某些情况下,支持性护理(如休息、补液和缓解症状的药物)可能足以恢复。
// 原因与传播
感染的原因可能因所涉及的微生物类型而异。例如,细菌可通过直接接触受污染的表面、咳嗽或打喷嚏时产生的飞沫,或通过食用受污染的食物或水引起感染。另一方面,病毒通常通过呼吸道飞沫、与受感染者的直接接触或通过受污染的表面传播。
总之,了解感染的原因和传播方式对于预防、诊断和治疗感染至关重要。通过保持良好的卫生习惯、采取适当的预防措施并及时就医,个人可以降低感染风险并最大程度地减少相关疾病的影响。
感染的诊断是基于通过不同的诊断过程对传染源的识别。
某些感染可能会表现出可用于症状诊断的症状,但通常需要进一步确认。感染直接取决于传染源以及宿主对该传染源的免疫反应。
现在我们认为手术是理所当然的,但不久前,即使是最小的手术,如果感染进入体内,也可能是致命的。消毒为我们提供了一种预防手术感染和确保手术安全的方法。
消毒法是使用化学物质(称为防腐剂)来消灭引起感染的细菌的方法。它是由英国外科医生约瑟夫·李斯特发明的。
约瑟夫·李斯特找到了一种预防手术期间和手术后伤口感染的方法。他是第一个将细菌理论的科学应用于外科手术的人。李斯特消毒系统是现代感染控制的基础。
感染和疾病的区别在于症状的严重程度以及对个人整体健康的影响。
感染的定义是细菌、病毒和真菌等微生物在体内的入侵和生长。
感染可能由多种因素引起,包括接触病原体、卫生条件差、免疫系统受损以及食物或水受污染。感染的症状因感染类型和部位而异,但通常包括发烧、疼痛、炎症和疲劳。
疾病是指影响身体或精神功能的特定状况。
疾病可能是由感染引起的,但也可能是由其他因素引起的,例如遗传异常、环境毒素、生活方式选择或自身免疫反应。疾病的症状范围从轻微到严重,并且可能持续很短时间或变成慢性病。
感染的诊断通常涉及检测体液或组织样本以确定病原体的存在。另一方面,疾病的诊断通常需要结合病史、体格检查、实验室检查和影像学检查。
在治疗方面,感染通常使用抗生素、抗病毒药物或抗真菌药物治疗。治疗的目的是消除入侵的微生物并缓解症状。另一方面,疾病可能需要更全面的方法,包括药物治疗、手术、改变生活方式和支持疗法。
大致的区别总结如下:

总之,虽然感染和疾病相关,但它们的定义、原因、症状和治疗方法不同。了解两者的区别可以帮助医护人员和个人采取适当的措施来预防和控制疾病。
感染常见类型
细菌感染是由有害细菌进入人体引起的。它们会影响身体的不同部位,例如呼吸系统、泌尿道或皮肤。常见症状包括发烧、疼痛、肿胀和发红。细菌感染通常用抗生素治疗。
病毒感染是由病毒引起的。它们可导致各种疾病,例如普通感冒、流感或 COVID-19。症状从轻微到严重不等,可能包括发烧、咳嗽、喉咙痛和疲劳。病毒感染通常会自行痊愈,但有些可能需要抗病毒药物。
真菌感染是由真菌引起的,例如酵母菌或霉菌。它们会影响皮肤、指甲或内脏器官。常见的真菌感染包括足癣、酵母菌感染和癣。症状可能包括瘙痒、发红和不适。真菌感染的治疗方法包括抗真菌药物和外用药膏。
寄生虫感染是由寄生在人体内或体表的寄生虫引起的。寄生虫感染的例子包括疟疾、虱子感染和贾第虫病。症状可能因寄生虫类型而异,但可能包括发烧、瘙痒、腹泻和疼痛。寄生虫感染的治疗可能涉及抗寄生虫药物。
性传播感染是通过性接触传播的感染。常见的性传播感染包括衣原体感染、淋病和疱疹。症状范围从轻微到严重,可能包括生殖器分泌物、疼痛和溃疡。性传播感染通常通过检测诊断,可以用抗生素或抗病毒药物治疗。
通过了解不同类型的感染、其症状、原因和治疗方法,个人可以采取预防措施来降低感染风险并在需要时寻求适当的医疗护理。
说到疾病和健康,有各种各样的疾病会影响人体。以下是一些常见的疾病类型:
– 传染性疾病
传染病是由细菌、病毒、真菌和寄生虫等微生物引起的。它们可以通过各种方式在人与人之间传播,包括直接接触、呼吸道飞沫和受污染的食物或水。传染病的例子包括普通感冒、流感、肺结核和艾滋病毒/艾滋病。症状和治疗方法因具体感染而异。
– 慢性疾病
慢性病是一种长期疾病,通常会随着时间的推移而发展,并且没有已知的治疗方法。这些疾病通常有多种原因,并可能受到遗传、生活方式选择和环境因素的影响。慢性病的例子包括心脏病、糖尿病、癌症和慢性阻塞性肺病 (COPD)。治疗通常侧重于控制症状和预防并发症。
其他常见疾病类型
– 自身免疫性疾病
当免疫系统错误地攻击健康细胞和组织时,就会发生此类疾病,从而导致炎症和组织损伤。例如类风湿性关节炎、狼疮和多发性硬化症。
– 心血管疾病
影响心脏和血管。包括冠状动脉疾病、心力衰竭和中风等。
– 呼吸系统疾病
这些疾病会影响肺部和呼吸。一些常见的呼吸系统疾病包括哮喘、慢性支气管炎和肺炎。
– 精神健康障碍
这些障碍会影响一个人的情绪、心理和社会健康。例如抑郁症、焦虑症和精神分裂症。
– 遗传性疾病
这些疾病是由遗传异常基因或突变引起的。这些疾病包括囊性纤维化、镰状细胞病和亨廷顿氏病等。
这些疾病的诊断、治疗和预防策略因具体情况而异。
预防感染
预防是感染和疾病管理的一个重要方面。虽然治疗和诊断很重要,但采取措施预防感染可以大大降低疾病的发病率。
预防感染的一个关键因素是了解病因和传播方式。感染可通过与感染者直接接触、受污染的表面或空气中的颗粒传播。通过了解传播途径,个人可以采取必要的预防措施,将感染风险降至最低。
定期洗手是预防感染最有效的措施之一。用肥皂和水洗手至少 20 秒或使用含酒精的洗手液有助于消除有害微生物。
此外,例如咳嗽或打喷嚏时捂住口鼻,有助于防止呼吸道感染的传播。
接种疫苗是预防感染的另一个重要方面。疫苗刺激免疫系统产生对抗特定病原体的抗体,从而提供免疫力。通过接种疫苗,个人可以保护自己并为社区免疫做出贡献,从而降低传染病的总体流行率。
教育和意识在预防感染方面也发挥着重要作用。了解常见感染的体征和症状可以及早发现并及时治疗,防止进一步的并发症。此外,提倡卫生习惯并提供有关适当预防措施的教育可以使个人能够做出明智的决定并保护自己和他人。
总之,预防是对抗感染和疾病的关键。通过采取积极措施,例如保持良好的卫生习惯、接种疫苗和提高认识,个人可以大大降低感染风险,并为整个社区的健康做出贡献。
预防疾病
预防在减轻疾病负担方面起着至关重要的作用。了解各种感染和疾病的原因、症状和诊断有助于制定有效的预防策略。
预防疾病不仅仅是避免感染。它涉及采取健康的生活方式并做出明智的选择以降低患病风险。这包括保持均衡饮食,定期进行体育锻炼,避免吸烟和过量饮酒等行为,这些行为会增加患某些疾病的风险。
定期筛查和检查对于疾病的早期发现和治疗也很重要。通过早期发现疾病,医护人员可以及时治疗,改善治疗效果并减轻疾病的总体负担。
感染和疾病预防还涉及教育公众预防的重要性,并提供必要的资源和服务。
总之,预防在减少疾病的发生和影响方面起着至关重要的作用。通过了解感染和疾病的原因、症状和诊断,实施预防措施并促进健康行为。
感染治疗
在治疗感染时,了解这些疾病的病因、预防和诊断非常重要。
治疗感染的关键因素之一是防止其传播。
感染的诊断对于有效治疗至关重要。医生可以使用多种方法,包括体检、实验室检查和成像技术来确定感染的原因并确定最合适的治疗方案。
感染的治疗方法取决于感染的类型和严重程度。细菌感染通常用抗生素治疗,而病毒感染则使用抗病毒药物。真菌感染使用抗真菌药物,寄生虫感染则使用抗寄生虫药物。
症状管理
除了针对感染的根本原因外,症状管理也是治疗的一个重要方面。这可能涉及使用非处方药来缓解疼痛、发烧和充血等症状。
治疗持续时间
感染的治疗时间各不相同。有些感染可能需要短期用药,而有些感染可能需要更长时间的治疗。即使症状有所改善,也必须完成处方药物的全部疗程,以确保感染完全根除。
总之,感染的治疗涉及多方面的方法,包括解决根本原因、症状管理和防止感染扩散。通过了解感染的原因、预防和诊断,医疗保健专业人员可以为患者提供最有效的治疗。
疾病治疗
疾病的治疗取决于具体症状和致病因素。
在感染病例中,治疗通常侧重于消除引起感染的生物体。这可能涉及使用抗生素、抗病毒药物或抗真菌药物,具体取决于感染的具体类型。在某些情况下,可以预防性地使用抗病毒或抗真菌药物,以防止感染传播给他人。
另一方面,疾病的治疗不仅仅是治疗感染本身。当疾病被诊断出来后,治疗的目的是缓解症状、控制并发症,并改善整体健康和福祉。
疾病的治疗可能涉及药物治疗、生活方式改变和支持疗法的结合。对于糖尿病或高血压等慢性疾病,主要重点通常是通过药物治疗和生活方式改变(包括定期锻炼和健康饮食)来控制病情。
在某些情况下,可能需要手术干预来治疗疾病。这可能涉及切除受感染或患病的组织、修复受损器官,或在受伤或退化的情况下恢复功能。
预防也是疾病治疗的一个重要方面。通过解决风险因素并实施预防措施,例如接种疫苗、定期健康检查和改变生活方式,可以减少疾病的发生和严重程度。
诊断在确定疾病的最适当治疗方法方面起着至关重要的作用。准确及时的诊断使医疗保健提供者能够根据每位患者的个人需求量身定制治疗计划。
总之,治疗疾病需要综合考虑具体症状、潜在病因和个体因素。通过了解感染和疾病之间的区别,医护人员可以就治疗方案做出明智的决定,并改善患者的治疗效果。
▼
与心血管系统相关的感染,包括血液,即心脏、血管和血液的感染,也称为血流感染或血液循环系统感染。与心血管系统相关的一些常见感染包括:

▼
消化系统是参与食物消化的身体系统。它包括胃肠道 (GI 道) 和相关消化器官。胃肠道两端开放,是外来、可能受污染的物质(包括食物和饮料)的停靠点。这使得消化系统极易受到感染。
幽门螺杆菌感染
消化系统感染包括胃肠道任何部位(从口腔到肛门)和任何消化器官(如肝脏、胰腺和胆囊)的感染。消化系统感染主要包括细菌、病毒、原生动物和寄生虫,真菌病原体感染较少。


▼
呼吸道感染 (RTI) 是指呼吸系统任何器官的感染。它是人类最常见的感染类型。根据感染呼吸道的部位,RTI 可分为上呼吸道感染 (URTI)(即鼻、鼻窦、咽和喉感染)和下呼吸道感染 (LRTI)(即气管、支气管、细支气管和肺感染)。

▼
神经系统感染是指大脑、脊髓和/或人体神经的任何形式的感染。此类神经系统感染可能危及生命。它们是由不同的微生物引起的,主要是病毒和细菌。
▼
泌尿系统包括尿道、膀胱、输尿管和肾脏。这些器官中的任何一个感染都称为尿路感染 (UTI)。UTI 主要由细菌引起,但也有真菌和病毒感染的报道,但这种情况很少见。由于女性尿道较短,因此女性比男性更容易患上 UTI。

▼
生殖系统包括所有参与生殖过程的器官。它在人类中与泌尿系统非常接近。许多引起尿路感染的微生物是造成生殖系统感染的原因。生殖系统感染分为三种类型:

▼
淋巴系统是淋巴管、淋巴结和淋巴器官的网络,淋巴液在其中流动。它是免疫系统的一部分,也是循环系统的一部分。淋巴感染并不常见,但有报道称存在多种细菌和寄生虫感染。

▼
外皮系统包括身体的所有外部覆盖物。它包括皮肤、头发和指甲。外皮系统是我们身体的第一层防御。它是数百万微生物作为正常菌群的家园。病原体在侵入身体之前首先与外皮接触。

▼
肌肉系统包括我们身体的所有肌肉。肌肉感染通常是血源性或传染性传播,但通常很严重,需要立即治疗。

骨骼:
▼
内分泌系统由内分泌腺组成,内分泌腺感染主要是通过血源性播散感染或进行性全身感染而引起。
在当今世界,传染病始终是一个威胁,了解感染的各个阶段对于有效诊断和治疗至关重要。从感染到康复的过程可以粗分为四个不同的阶段,每个阶段都有各自的症状和结果。
了解感染的四个阶段对于确定适当的行动方案至关重要,从预防和早期发现到治疗和康复。识别前驱期及其独特症状有助于早期干预,降低传播率并预防并发症。下面详细了解一下每个时期不同的特征及相关干预。
▼
潜伏期
感染的第一阶段称为潜伏期,在此期间,患者接触到病原体,但可能不会出现任何症状。潜伏期的长短取决于具体感染源,可能为几小时至数周不等。
最初接触病原体的方式多种多样,例如接触受污染的表面、空气中的颗粒物,或直接接触受感染者。在此期间,患者可能并未意识到自己已经接触到病原体。
潜伏期内可能出现前驱期
此阶段的特点是出现轻微症状,这些症状通常不具特异性,容易被忽视或归因于其他因素。前驱期的症状可能包括疲劳、头痛、轻微发烧和全身不适。
值得注意的是,并非所有感染都会经历前驱期。有些感染可能直接从潜伏期进入急性期,这取决于具体病原体和个人的免疫反应。
▼
潜伏期过后,感染进入第二阶段,即入侵和复制。在此阶段,病毒或细菌已成功侵入宿主体内,并开始快速繁殖。这导致体内病原体的浓度较高,从而导致症状的出现。
前驱期是侵袭和复制阶段的一部分,其特点是出现初始症状。这些症状可能是一般性的和非特异性的,例如疲劳、发烧、头痛和肌肉疼痛。前驱期是感染正在发展的警告信号,可让免疫系统为即将到来的战斗做好准备。
随着感染的进展,它会进入急性期,症状会变得更加严重,并且针对特定病原体。人体的免疫系统在各种防御机制的帮助下,试图对抗入侵的病原体。然而,在这个阶段,战斗仍在继续,结果尚不确定。
在慢性期,一些感染可以在体内持续很长一段时间。此阶段的特点是症状较轻,甚至完全没有症状。然而,病原体继续复制并慢慢损害身体组织。如果不及时治疗,慢性感染会导致长期并发症和后遗症。
在某些情况下,随着人体免疫系统成功消灭病原体,感染会自然消退。这会导致康复,症状逐渐消退,患者恢复正常健康状态。然而,在其他情况下,可能会出现并发症,如继发感染或器官损伤,这会延长康复过程,并可能需要额外的医疗干预。
值得注意的是,感染过程的各个阶段可能因具体病原体、个人免疫反应和医疗条件而异。
▼
经过潜伏期和症状出现后,感染者进入前驱期,预示着疾病急性期的开始。
在前驱期,症状逐渐恶化,变得更加明显。感染者可能会出现疲劳、不适和发烧等一般症状,以及特定感染特有的特定症状。
此阶段至关重要,因为它通常表明免疫系统正在积极对抗感染。然而,需要注意的是,并非所有感染都有明确的前驱期。有些人可能会直接从潜伏期进入急性期,而不会出现任何前驱症状。
可能出现并发症
如果不及时治疗或免疫系统无法有效控制感染,前驱期可能会导致进一步的并发症。这些并发症的严重程度可能因感染类型和个人的整体健康状况而异。
前驱期可能出现的一些并发症包括继发感染、器官损伤或感染扩散至身体其他部位。这些并发症会延长病程,增加重症甚至死亡的风险。
前驱期的恢复
对于大多数感染来说,前驱期标志着急性期的开始,在此期间症状达到顶峰。急性期过后,身体逐渐恢复并进入缓解期,症状开始消退,患者开始感觉好些。
从前驱期和随后的急性期恢复可能需要一些时间,因此遵循处方治疗并根据需要休息很重要。在某些情况下,即使感染痊愈后,也可能出现复发或出现长期后遗症,如慢性疲劳或器官损伤。
总体而言,了解前驱期的进展和症状对于有效管理和治疗感染至关重要。认识到这一阶段的开始可以帮助个人寻求适当的医疗护理并采取措施预防进一步的并发症。
▼
潜伏期结束后,感染者进入感染的急性期。在这个阶段,症状会完全显现,感染也会达到高峰。
前驱期是急性期的初始阶段,其特点是出现发烧、疲劳、头痛和肌肉疼痛等症状。在此阶段,感染者还可能感到全身不适。
严重感染的急性期通常持续数天至数周。此阶段的严重程度和持续时间可能因具体病原体和个人的免疫反应而异。
并发症和后遗症
在某些情况下,感染的急性期会导致并发症。这些并发症可能是由于病原体对身体的直接影响或身体对感染的免疫反应而引起的。常见的并发症包括肺炎、器官衰竭和继发感染。
一旦成功控制了急性期,感染者就会进入恢复期。在此阶段,身体会逐渐消除感染,症状开始改善。根据感染的严重程度,恢复可能需要几天到几周的时间。
在某些情况下,感染可能会发展为慢性阶段。当身体无法完全消除病原体时,就会发生这种情况,并且感染会持续很长时间。慢性感染可能导致长期健康问题,可能需要持续治疗。
值得注意的是,并非所有感染都会经历所有阶段,并且进展和症状可能因具体病原体和个体因素而异。
常见症状
在感染的这个阶段,可能会出现常见症状,这些症状可能因具体病原体和个人的免疫反应而异。值得注意的是,并不是所有人都会出现相同的症状,有些人的表现可能比其他人更严重。
在急性期,患者可能会出现发烧、疲劳、身体疼痛和头痛等症状。这些症状通常表明身体对感染产生了免疫反应,可能会持续数天。
急性期过后,患者可能会进入慢性感染期。在此阶段,症状可能会持续很长时间,有时持续数月甚至数年。常见的慢性症状包括持续疲劳、关节疼痛、肌肉无力和认知困难。
有些感染还可能产生后遗症,即感染导致的长期后果或并发症。这些后遗症的严重程度可轻可重,可能影响身体的各个器官或系统。后遗症的例子包括器官损伤、神经系统疾病和免疫功能受损。
复发是另一种可能的结果,尤其是某些病原体引起的感染。经过一段时间的明显缓解后,症状可能会再次出现,表明感染复发。这可能是由于各种因素造成的,例如病原体根除不彻底或休眠感染重新激活。
▼
在感染的呼吸道症状阶段,病毒已到达呼吸系统并开始影响肺部和呼吸道。此阶段通常是在前驱期结束后,发烧和疲劳等一般症状开始消退。
呼吸道症状的严重程度因个人和引起感染的特定病毒而异。常见症状包括咳嗽、呼吸急促、胸痛或不适以及喘息。这些症状通常表明呼吸系统发炎和充血。
在某些情况下,呼吸道症状可能导致肺炎、支气管炎或呼吸衰竭等并发症。这些并发症可能需要额外的医疗干预,并可能延长整体康复过程。如果呼吸道症状恶化或没有随着时间的推移而改善,请务必就医。
一旦呼吸道症状开始改善,患者即被认为处于康复阶段。在此阶段,身体继续抵抗感染,免疫系统努力清除呼吸系统中的病毒。康复阶段的持续时间可能因个人和感染严重程度而异。
在极少数情况下,有些人可能会出现与呼吸道症状相关的后遗症或长期影响。这些可能包括慢性肺损伤、肺功能下降或感染痊愈后仍持续存在的呼吸道疾病。同样,有些人可能会出现呼吸道症状复发,即症状在改善一段时间后再次出现。
为了帮助康复和预防并发症,休息、保持水分充足并遵照处方治疗或药物非常重要。健康的生活方式(包括均衡饮食和定期锻炼)也可以支持免疫系统并促进整体呼吸系统健康。
▼
在感染的第七阶段,即胃肠道阶段,患者可能会出现一系列与消化系统相关的症状。这些症状的严重程度和持续时间可能有所不同,
可能包括:
这些胃肠道症状可能是感染扩散至肠道或人体对感染的免疫反应所致。在某些情况下,这些症状可能会随着时间和休息而自行缓解。但是,可能会出现脱水等并发症,需要医疗干预。
对于处于此阶段的人来说,控制症状并在必要时寻求适当的医疗护理非常重要。根据症状的严重程度,医疗保健专业人员可能会建议休息、补充水分和改变饮食。在某些情况下,可能会开药来缓解症状或治疗并发症。
还要注意的是,虽然有些人可能在此阶段后症状完全消失,但其他人可能会继续经历其他阶段,例如复发或出现后遗症。
▼
神经系统症状可发生在感染的急性期,也可发生在恢复期、复发期和并发症期。这些症状可能是病毒直接入侵的结果,也可能是病毒对神经系统的继发影响。
在感染的急性期,部分患者可能会出现头痛、头晕和精神错乱等神经症状。这些症状通常较轻且短暂,可在数天或数周内缓解。
但在某些情况下,神经系统症状可能会在恢复阶段持续存在。这些症状可能包括持续性头痛、注意力不集中和记忆力问题。
在复发阶段,神经系统症状可能会再次出现或恶化。这可能是病毒重新激活或对神经系统造成进一步损害的结果。
此阶段还可能出现并发症,导致更严重的神经系统症状。这些并发症可能包括脑炎、脑膜炎和中风。
经过适当的医疗护理和治疗,大多数人可以从这些神经症状中恢复过来。然而,有些人可能会出现长期的神经后遗症,如认知障碍或运动功能障碍。
值得注意的是,感染潜伏期也可能出现神经症状。这是接触病毒和出现症状之间的阶段。此阶段的神经症状很少见,但可能包括嗅觉或味觉丧失。
在慢性感染病例中,神经系统症状可能会持续很长一段时间。这些症状可能是间歇性的,严重程度也各不相同。
如果您在感染的任何阶段出现任何神经系统症状,请务必重视。
▼
在感染的急性期,个人通常会出现皮肤症状。皮肤症状是指影响皮肤的任何症状。这些症状的范围从轻微到严重,并可能以各种方式表现出来,具体取决于感染的类型。
在潜伏期,个人可能不会出现任何皮肤症状。然而,随着感染进展到慢性阶段,皮肤症状可能开始出现。这些症状可能包括皮疹、水泡、病变或皮肤变色。这些症状的严重程度因人而异,有些人只会出现轻微症状,而另一些人可能会出现影响日常活动的严重症状。
在某些情况下,皮肤症状可能导致并发症。当感染扩散到身体其他部位或免疫系统对感染反应强烈时,就会出现并发症。这些并发症可能导致更严重的皮肤症状,甚至可能导致其他健康问题。
感染急性期过后,患者可能会出现感染的后遗症或长期影响。这些后遗症可能包括持续的皮肤症状,如疤痕或色素沉着变化。这些长期影响因人而异,取决于感染的严重程度和个人的免疫反应等因素。
在某些情况下,即使感染痊愈,患者也可能会出现皮肤症状复发。如果感染未从体内完全清除,或者免疫系统受损,则可能会出现这种情况。如果患者出现皮肤症状复发,请务必就医,因为这可能表明感染复发或其他潜在健康问题。
总之,皮肤症状可发生在感染的各个阶段,从急性期到慢性期,甚至感染消退后。这些症状可从轻微到严重,并可能对皮肤产生长期影响。个人必须注意这些症状,并在必要时寻求医疗帮助,以确保正确的诊断和治疗。
▼
血液学症状通常出现在感染的恢复期。此阶段发生在急性期之后,急性期的特点是出现症状并出现并发症。
在此阶段,人体的血液系统开始稳定并恢复正常。前驱症状(即感染前出现的一般症状)开始消退。人体开始产生更多的白细胞,负责抵抗感染。
在某些情况下,血液学症状可能会复发。如果感染在急性期没有完全解决,就会出现这种情况。复发可能是由于病毒重新激活或出现新的细菌菌株引起的。
常见的血液学症状:
潜伏期(即从接触感染到症状首次出现之间的时间)也会出现血液学症状。然而,此阶段的症状通常较轻微,可能不明显。
如果血液学症状在恢复期持续存在或恶化,则可能表明出现并发症或发展为慢性感染。在这种情况下,可能需要额外的医疗干预。
在感染的不同阶段密切监测血液学症状对于确保正确的诊断和治疗非常重要。可以定期进行血液检查以跟踪血液系统的变化并指导治疗计划。
▼
在感染的肌肉骨骼症状阶段,患者可能会出现肌肉、关节和骨骼的急性疼痛、僵硬和肿胀。这些症状通常发生在前驱期之后,可能是身体对感染的免疫反应的结果。
肌肉骨骼症状的强度和持续时间会有所不同,具体取决于个人和引起感染的具体病原体。有些人可能只会感到轻微不适,而另一些人则可能会感到剧烈疼痛和活动受限。
在某些情况下,肌肉骨骼症状可能是感染的后遗症,这意味着即使感染已经消退,这些症状仍会持续存在。这在某些病毒感染中更为常见,例如寨卡病毒或基孔肯雅病毒。
注:寨卡病毒属黄病毒科,黄病毒属,单股正链RNA病毒,直径20nm,是一种通过蚊虫进行传播的虫媒病毒,宿主不明确,主要在野生灵长类动物和栖息在树上的蚊子。
基孔肯雅病是由伊蚊传染的一种急性传染病,其临床症状为突然发烧、头疼、呕吐、关节痛及腰下部疼痛等,而最有效的应对途径是采取预防措施,减少蚊虫的滋生。
肌肉骨骼症状的恢复通常包括休息、疼痛管理和物理治疗,以改善力量和活动能力。如果症状严重或持续,可能需要更密集的治疗。
值得注意的是,肌肉骨骼症状也可能是感染的并发症,可能需要额外的医疗干预。并发症可能包括关节炎症、骨骼或软骨损伤或周围组织感染。
在极少数情况下,患者在经过一段时间的缓解或恢复后可能会出现肌肉骨骼症状复发。这可能是由于引起最初感染的病毒或细菌重新激活,或被同一病原体再次感染。
总体而言,感染过程中的肌肉骨骼症状会极大地影响个人的生活质量。如果您出现任何这些症状,建议处理以便获得准确的诊断和适当的治疗。
▼
泌尿生殖系统症状可作为某些传染病发展的一部分出现。这些症状可能表明感染已到达泌尿生殖道,包括生殖系统和泌尿系统的器官。并非所有感染都会发展到这个阶段,并且出现泌尿生殖系统症状并不总是表明感染严重或晚期。
泌尿生殖道阶段通常发生在感染的初期阶段之后,例如急性期和前驱期。在此阶段,病毒或细菌可能已经通过血液或其他身体系统到达泌尿生殖道。
出现泌尿生殖系统症状的患者可能会注意到泌尿系统的变化,例如排尿频率或尿急增加、排尿疼痛、尿液浑浊或带血,或难以完全排空膀胱。影响生殖系统的感染也会导致阴道分泌物、异常出血、盆腔疼痛或男性睾丸疼痛等症状。
在某些情况下,泌尿生殖系统症状可能伴有并发症。这些并发症可能包括肾脏感染、尿路感染、盆腔炎或性传播感染。如果出现这些症状或怀疑有感染,请务必就医。
泌尿生殖系统阶段的持续时间可能因具体感染和个人因素而异。在某些情况下,症状可能会通过适当的休息、补水和对症治疗自行缓解。但是,如果感染未得到适当治疗或存在潜在健康问题,感染可能会发展为慢性阶段或导致复发。
值得注意的是,某些感染会对泌尿生殖系统产生长期影响或后遗症。这些后遗症可能包括不孕症、慢性疼痛、疤痕或其他可能需要持续医疗管理的并发症。
常见的泌尿生殖系统症状:
▼
在感染过程中,个人可能会经历多个阶段。这些阶段包括潜伏期、复发、并发症、缓解,甚至慢性和急性后遗症。然而,一个经常被忽视的阶段是心理症状阶段。
心理症状可发生在感染的任何阶段,程度从轻微到严重不等。这些症状通常表现为情绪、行为和认知的变化。常见的心理症状包括焦虑、抑郁、易怒、困惑和注意力难以集中。
心理症状的存在会对个人的整体幸福感和生活质量产生重大影响。这些症状会影响一个人进行日常活动、维持人际关系甚至工作或上学的能力。为了提供适当的支持和治疗,识别和解决这些症状非常重要。
病原微生物检测在感染管理中的重要性不容忽视。通过病原微生物检测可以有效地控制和预防医院内感染,并加速患者的恢复过程。
随着分子生物学技术的发展,现代医学微生物学检验技术已经取得了显著进步,正在成为指导临床感染辅助诊断和治疗的重要依据。
多种检测手段应用于病原体检测,例如:
在感染的临床管理中,除了传统的病原体检测方法外,肠道菌群检测也是一个重要的发展方向。肠道菌群有助于消化、吸收营养物质,同时还调节人体免疫系统的功能,对人体健康起着至关重要的作用,肠道菌群失衡与多种疾病的发生发展密切相关。
肠道菌群与宿主之间的相互作用对维持内稳态很重要,但这种相互作用一旦受到干扰,就会成为许多慢性疾病的核心驱动因素。
在肠道、相关微生物群和各种器官之间的双向或多向通信连接(轴)
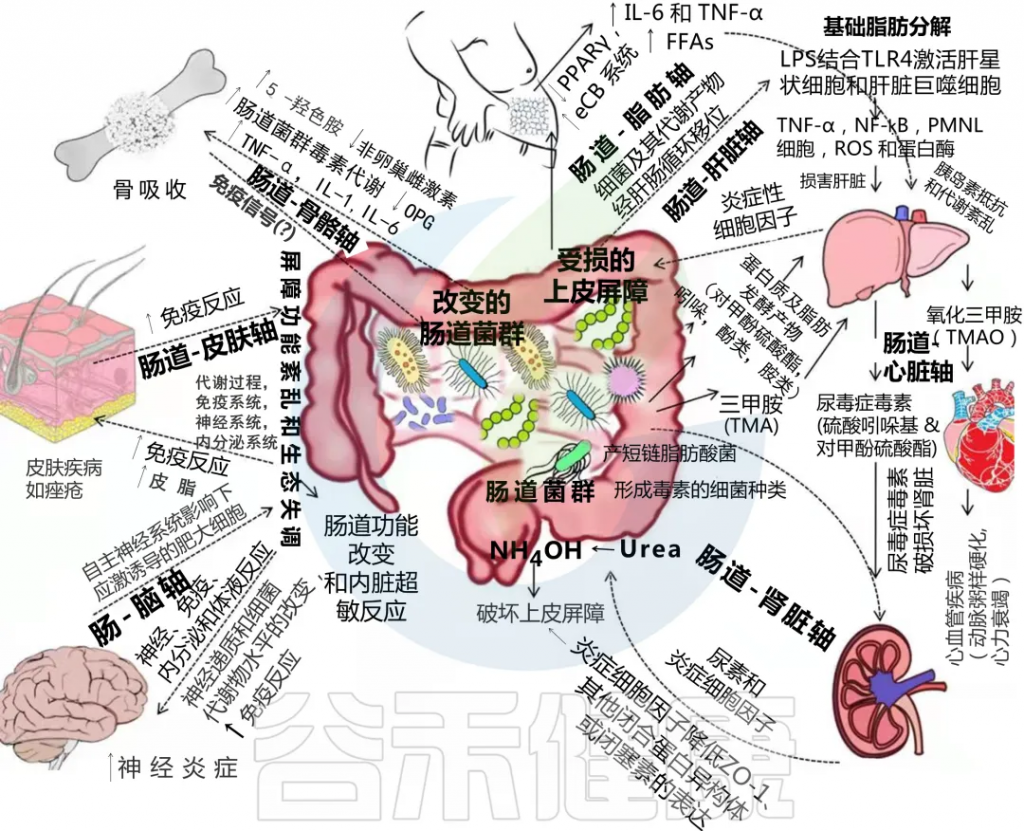
Ahlawat S,et al.,Lett Appl Microbiol. 2021
关于这方面可详见我们之前的文章:
肠道菌群报告中会有致病菌超标等明确指示,此外我们还可以判断整个肠道微生态的健康状况。肠道微生物群的失调可能导致肠道易感性增加,使得易感性疾病如艰难梭菌感染更容易发生。
通过分析肠道微生物组的变化,可以帮助我们更好地理解感染过程,评估治疗效果,并为个性化干预提供依据。
感染,作为全球健康的主要威胁,其影响甚至超过个体的病痛,它触及社会的每一个层面。本文在了解各种感染阶段、症状的同时,也强调了病原体检测在感染管理中的重要性,病原体相关检测手段让我们能够及时识别感染类型,评估其严重程度,并预测可能的并发症。
面对不断演变的病原体和日益严峻的抗生素耐药性问题,我们在推动科研创新的同时,也需提高公众对感染性疾病的认识,强化预防措施,如感染源的识别、个人卫生习惯等,对于控制感染的传播同样至关重要。
在治疗方面,针对病原体的特异性治疗是帮助患者恢复健康的关键。这需要医疗相关专业人员根据相关诊断结果,选择最合适的治疗方案,包括抗生素、抗病毒、抗真菌等。同时,症状管理和支持性护理也是治疗过程中不可或缺的组成部分。
随着科技的进步和医疗知识的积累,整合病原体相关检测,加强跨学科的研究,以及普及健康教育,有望不断提升治疗效果,为患者带来更好的康复和生存机会。
免责声明:本文仅供参考,不构成医疗建议。请务必咨询医疗保健专业人员,以正确诊断和治疗任何感染。
主要参考文献:
Murray, P. R., Rosenthal, K. S., & Pfaller, M. A. (2013). Medical microbiology. Philadelphia: Elsevier/Saunders
Parija S.C. (2012). Textbook of Microbiology & Immunology.(2 ed.). India: Elsevier India.
Sastry A.S. & Bhat S.K. (2016). Essentials of Medical Microbiology. New Delhi : Jaypee Brothers Medical Publishers.
Joseph Lister’s antisepsis system,2018,Science Museum
sciencedirect.com/topics/immunology-and-microbiology/germ-theory-of-disease
biologydictionary.net/germ-theory/
infectioncycle.com/articles/infection-stages-understanding-the-progression-of-infectious-diseases-and-their-impact-on-health
germ theory,Adam Augustyn,2024, 5
National Research Council (US) Committee to Update Science, Medicine, and Animals. Science, Medicine, and Animals. Washington (DC): National Academies Press (US); 2004.
Murray, P.R., Rosenthal, K.S., & Pfaller, M.A. (2015). Medical microbiology (8th ed.). Elsevier.
Fauci, A.S., Braunwald, E., Kasper, D. L., Hauser, S. L., Longo, D. L., & Jameson, J. L. (Eds.). (2008). Harrison’s principles of internal medicine (17th ed.). McGraw-Hill Medical
Mandell, G. L., Bennett, J. E., & Dolin, R. (2010). Mandell, Douglas, and Bennett’s principles and practice of infectious diseases (7th ed.). Churchill Livingstone.
Brook, I. (2013). Microbiology and management of respiratory tract infections. CRC Press.
Control of Communicable Diseases Manual by David Heymann.
G. Authia, S. Fablina, 2022. Global and regional sepsis and infectious syndrome mortality in 2019: a systematic analysis. Published by Elsevier Ltd. Published:March, 2022
Loretta J. Bubenik (2005). Infections of the Skeletal System. , 35(5), 0–1109. doi:10.1016/j.cvsm.2005.05.001
Morrison WB, Kransdorf MJ. Infection. 2021 Apr 13. In: Hodler J, Kubik-Huch RA, von Schulthess GK, editors. Musculoskeletal Diseases 2021-2024: Diagnostic Imaging [Internet]. Cham (CH): Springer; 2021.
Megran DW. Enterococcal endocarditis. Clin Infect Dis. 1992 Jul;15(1):63-71. doi: 10.1093/clinids/15.1.63. PMID: 1617074.
Roberts RB, Krieger AG, Schiller NL, Gross KC. Viridans streptococcal endocarditis: the role of various species, including pyridoxal-dependent streptococci. Rev Infect Dis. 1979 Nov-Dec;1(6):955-66. doi: 10.1093/clinids/1.6.955. PMID: 551516.
Infective endocarditis: A contemporary update. Ronak Rajani, John L Klein. Clinical Medicine Jan 2020, 20 (1) 31-35; DOI: 10.7861/clinmed.cme.20.1.1
Lamas, C. C., & Eykyn, S. J. (2003). Blood culture negative endocarditis: Analysis of 63 cases presenting over 25 years. Heart, 89(3), 258-262.
Smith DA, Nehring SM. Bacteremia. [Updated 2022 Jul 31]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan-.
Britannica, The Editors of Encyclopaedia. “septicemia”. Encyclopedia Britannica, 23 Jun. 2022
Martinez RM, Wolk DM. Bloodstream Infections. Microbiol Spectr. 2016 Aug;4(4).
Akhondi H, Simonsen KA. Bacterial Diarrhea. 2022 Aug 8. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 31869107.
Bacterial gastroenteritis: Causes, treatment, and prevention (medicalnewstoday.com)
Typhoid (who.int)
Imam Z, Simons-Linares CR, Chahal P. Infectious causes of acute pancreatitis: A systematic review. Pancreatology. 2020 Oct;20(7):1312-1322.

谷禾健康

自闭症谱系障碍 (ASD) 是一组神经发育疾病,其特征是社交互动和沟通的质量障碍、兴趣受限以及重复和刻板行为。
环境因素在自闭症中发挥重要作用,多项研究以及谷禾队列研究文章表明肠道微生物对于自闭症的发生和发展以及存在明显的菌群和代谢物的生物标志物。
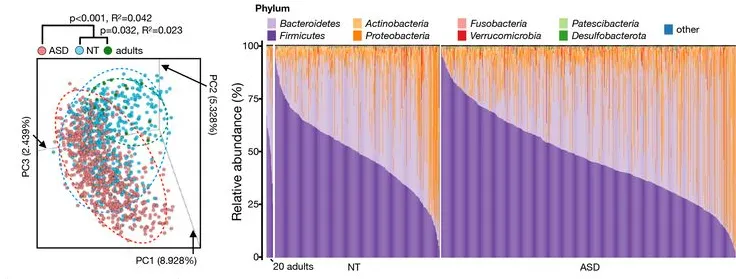
doi: 10.1136/gutjnl-2021-325115.
尽管环境因素在自闭症中发挥重要作用,但几乎没有确凿的证据将饮食与疾病的发生和进展联系起来。然而,最近关于饮食如何塑造肠道-大脑轴的研究可能会为环境对疾病机制的影响提供新的见解,并提出至少通过饮食改善某些自闭症谱系障碍症状的可能性。
此外,在谷禾检测实践过程中,也发现部分自闭症儿童的消化功能,以及饮食营养存在问题,主要集中表现为挑食,消化不良等。
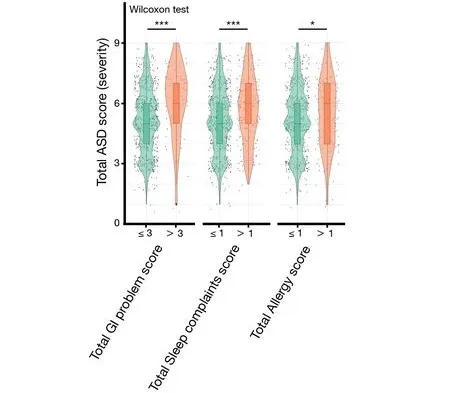
doi: 10.1136/gutjnl-2021-325115.
本文参考以往相关研究性文章,详细讨论饮食和肠道微生物群-肠-脑轴如何影响自闭症,主要概述肠道微生物群对分子代谢(各类氨基酸、γ-氨基丁酸、不饱和脂肪酸、短链脂肪酸、胆固醇、丁酸盐、乙酸盐、N-乙酰天冬氨酸、多酚等)和与自闭症发病和进展相关的酶(二糖酶、己糖转运蛋白和单羧酸转运蛋白等)。还回顾了饮食模式、益生菌和肠道微生物群在大脑发育中的作用及与自闭症的关联,这些都为自闭症的干预策略提供了重要的理论支持。
自闭症谱系障碍 (ASD) 是一组神经发育疾病,一般在 3 岁之前发病,其特征是社交互动和沟通的质量障碍、兴趣受限以及重复和刻板行为。
直到几十年前,自闭症谱系障碍还被认为相当罕见,但自 20 世纪 80 年代以来,全世界自闭症谱系障碍快速增加,这给自闭症谱系障碍患者的家庭和整个社会带来了重大的后果。
目前在临床上自闭症谱系障碍的诊断仍然是根据行为来定义的,通过详细的发展史、父母对孩子日常行为的描述以及对孩子的社交互动方式以及沟通和智力功能的直接评估。
一个重要问题让人对自闭症表型发病机制的理解变得更加复杂,简而言之,自闭症谱系障碍的发病和表现远非同质:
此外,除了核心症状之外,这些儿童通常还表现出一系列其他相关特征,例如:
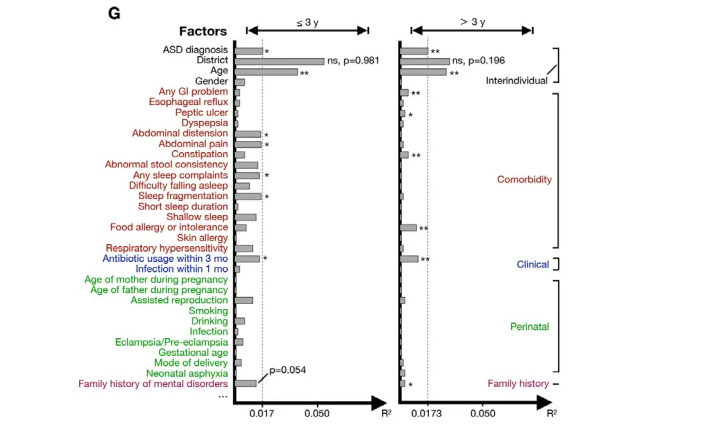
doi: 10.1136/gutjnl-2021-325115.
饮 食
人体必需氨基酸必须由食物供给,喂养可能代表环境因素和神经生物学因素之间的桥梁,因此可能在导致疾病表型的途径中发挥作用。从临床经验和文献中都知道,自闭症儿童往往与喂养和饮食态度有特殊的关系。
部分自闭症儿童可能有进食困难及胃肠道症状,对食物的味道和颜色非常挑剔。因此,自闭症儿童必需氨基酸 (赖氨酸、色氨酸、苯丙氨酸、组氨酸) 减少,可能部分是由于食物摄入不足或饮食习惯不良所致。
非常有限的饮食可能会使任何儿童面临营养缺乏和发育不良的风险,包括大脑发育。
遗 传
强有力的证据支持遗传因素对自闭症和相关疾病的疾病风险有影响。
然而,与自闭症风险有关的许多不同基因编码参与各种生理过程的各种不同蛋白质,包括大脑发育和功能、神经递质受体或转运蛋白、细胞粘附/屏障功能蛋白、免疫相关蛋白、参与胆固醇代谢或运输的蛋白质,以及影响线粒体功能的蛋白质。
近期,发表在《Cell》的一项研究对一个出生队列进行了 20多年的跟踪,详细的早期纵向问卷记录了感染和抗生素事件、压力、产前因素、家族史等饮食,在随访的 16,440 名瑞典儿童中,1,197 名患上神经发育障碍。下面一些有关自闭症风险的研究数据出自该文章:
家族病史
环 境
并非所有携带这些特定突变的个体都会患自闭症谱系障碍。最近的一项同卵双胞胎研究强调,环境因素可能解释了他们患自闭症谱系障碍相对风险的 55%,环境因素为自闭症谱系障碍型症状的出现提供了选择性压力,这些症状从各种不同的症状中出现。各种易诱发的遗传异常,结合起来会引起明显的疾病。
重大生活事件
化学物质暴露
早期感染和抗生素
儿童早期(出生至 5 岁)感染与自闭症风险增加显著相关,最显著的是第一年内中耳炎和反复湿疹。
微生物组
胃肠道症状长期以来表明,肠道和大脑之间存在着紧密联系,即”肠-脑轴”。
——胃肠道问题
在未来患有神经发育障碍的儿童中,早期胃肠道问题明显,情绪问题程度较轻。
——肠道菌群
肠道细菌可能在自闭症病理生理学中发挥一定作用。事实上,各种研究表明肠道微生物群在自闭症中发生了改变, 尽管文献中对于参与其中可能发挥作用的细菌几乎没有达成一致。
肠道细菌及其代谢产物不仅影响肠道功能和饱腹感,还可能与情绪、认知、行为、抑郁以及大脑发育等方面有关。
饮食在塑造哺乳动物代谢通量(包括神经化学物质的通量)以及塑造肠道微生物群及其活动方面具有重要作用。
例如,纤维和益生元尤其支持有益的糖分解肠道微生物群,其特征是双歧杆菌和乳酸菌的相对丰度增加以及短链脂肪酸 (SCFA) 的产生。来自水果、谷物和蔬菜等全植物食品的多酚也会影响肠道微生物群组成、免疫功能,充当抗氧化剂,防止大脑炎症并改善血脑屏障 (BBB) 功能。
Kieran M. Tuohy, et al.,Diet and the Gut Microbiota,2015,225-245
接下来我们着重就微生物组这方面,详细探讨肠道微生物群如何在自闭症的发展中起作用,以及相关的最新研究进展。
肠-脑轴作为外部环境与人类大脑之间的沟通通路,在体内有重要的“内部”通道——人类肠道微生物群。许多营养物质和摄入的化学物质必须经过这些通道,转化为生物可利用和活跃的中间产物,然后通过肝门静脉被吸收并在全身分布。
许多对大脑重要的化学物质也由肠道微生物群在肠道中产生,包括色氨酸、多巴胺、血清素、GABA、β-羟基丁酸、胆碱、牛磺酸、乙酸盐、琥珀酸、乳酸、乙酰辅酶A、肌酐、甜菜碱、谷氨酸、谷氨酰胺、对甲酚、反式吲哚丙烯酸甘氨、脂肪酸和马尿酸。
一些其他化学物质可能由细菌(例如在消化和发酵过程中)调节,或者是细菌成分,如革兰氏阴性细菌细胞壁的组成部分脂多糖(LPS),它可剂量依赖性地减少人类肠道细胞对血清素的吸收,并在外周和大脑引发炎症,影响大脑功能。
神经递质:GABA、血清素
最近有研究表明,神经递质GABA在自闭症谱系障碍神经元发育中可能起作用,尤其是考虑到它在婴儿期从神经递质兴奋剂到抑制剂的转变。
另一种神经递质,血清素(5-羟色胺,5-HT),也被怀疑在自闭症中起作用。自闭症患者的血液中,血清素和 GABA 水平均发生了变化。有趣的是,这两种神经递质都是由氨基酸代谢产生的,分别是色氨酸和谷氨酸。
肠道代谢物是否直接影响大脑的神经发育?
取决于它们是否能够穿过血脑屏障(BBB)。
比如说,肠道细菌可以产生GABA,这个 GABA 可能会影响到肠道神经系统的工作,或者改变血液中 GABA 的含量。但是,在正常健康的情况下,肠道产生的 GABA 是不能直接穿过”血脑屏障”进入大脑的。
反之,乙酸盐作为肠道微生物群发酵碳水化合物的主要终产物和哺乳动物细胞胆固醇生物合成的底物,可以迅速通过血脑屏障。
然而,血脑屏障可能会因氧化或炎症压力等原因受到损伤,与胃肠道屏障类似出现“漏”,允许不需要的化学物质进入大脑。在自闭症患者中血脑屏障受到损伤。
为什么说肠道菌群可用于区分自闭症与非自闭症?
研究表明,肠道微生物群在影响自闭症谱系障碍(ASD)代谢产物谱和生理参数的过程中起着重要作用。
首先,自闭症患者的肠道微生物群与健康对照组或非自闭症的兄弟姐妹有显著差异,显示出异常的肠道微生物组成和活动是自闭症的一个特征。
研究报告显示,自闭症群体与非自闭症对照组之间在拟杆菌门、厚壁菌门、变形菌门和放线菌门的组成上存在差异。
前面提到的发表在《Cell》大队列的自闭症儿童研究,在 11.9 ± 2.9 个月时采集了 1,748 名婴儿的粪便样本,将所有可用的对照与未来的神经发育障碍进行比较,然后匹配风险因素和微生物组多样性混杂因素。
doi.org/10.1016/j.cell.2024.02.035
在未来的神经发育障碍中,下列菌群丰度较高:
在我们的GUT队列里,也发现自闭症儿童这个菌的Veillonella显著富集。
doi: 10.1136/gutjnl-2021-325115.
注:Veillonella是一种革兰氏阴性的厌氧球菌,正常情况下通常存在于人体口腔和胃肠道中。该菌以其乳酸发酵能力而闻名,能代谢乳酸产生丙酸、CO2和H2。
下列菌群始终较少富集:
这些菌属具有抗炎、维护肠道屏障、产生短链脂肪酸等有益作用,其减少可能导致肠道功能紊乱和免疫失调。
Akkermansia muciniphila在后来被诊断患有自闭症或自闭症-多动症合并的婴儿中不存在,并且与儿童早期的胃肠道和情绪症状呈负相关。
Akkermansia muciniphila促进粘蛋白并产生叶酸,丙酸和乙酸;以增强肠细胞单层完整性和强化受损的肠道屏障而闻名;并具有免疫调节特性。
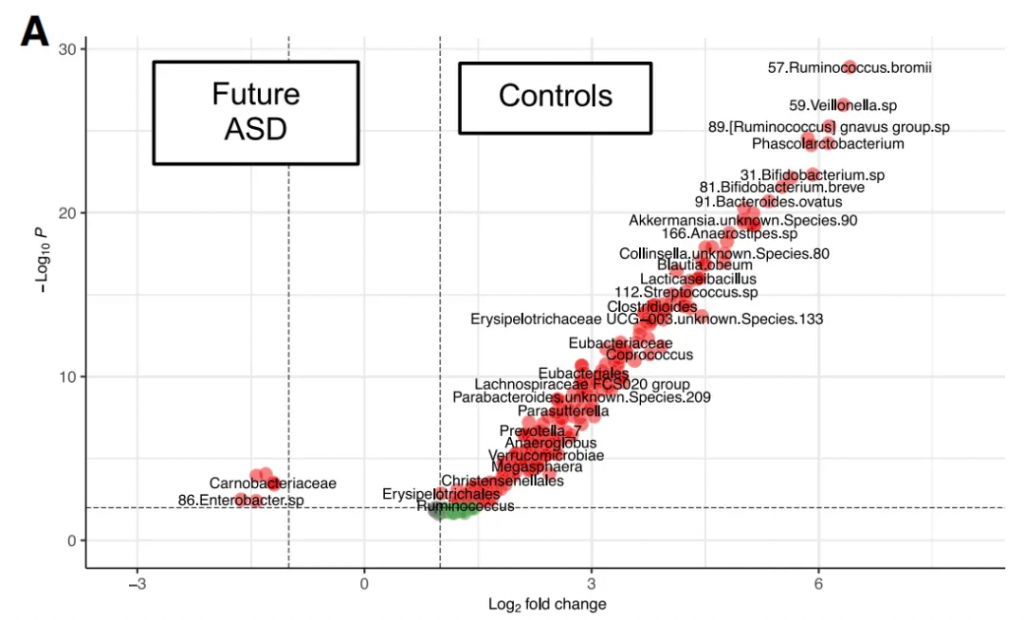
doi.org/10.1016/j.cell.2024.02.035
特定菌群:
与对照组(21.7%)相比,两种Klebsiella michiganensis菌株(HCXXMCOL0180 和 HCXXMCOL0513)在自闭症儿童中更普遍(43.6%),携带这两种菌株的婴儿日后患自闭症的风险更高。
携带这两种菌株的对照组婴儿抗生素使用频率更高(27.1%),提示抗生素暴露可能促进了这些菌株的定植。
性别和诊断年龄影响:
菌群自闭症男童的肠道菌群组成可能因诊断年龄不同而异,如晚期诊断与Akkermansia muciniphila丰度增加相关,而这种模式在女童中并不明显,女童中一些Bacteroides菌株丰度升高。
而早期诊断男童,Enterobacteriaceae科一些菌属如Enterobacter、 Klebsiella丰度升高。
这提示自闭症的肠道菌群变化可能具有性别特异性,且随年龄和病程进展而动态变化。
代谢物异常与菌群相关:
粪便代谢组学分析显示,自闭症儿童的某些代谢物如酪氨酸、色氨酸(儿茶酚胺、血清素前体)、精氨酸、赖氨酸等氨基酸,亚油酸等脂肪酸以及维生素B6等水平异常。
注:关于氨基酸,脂肪酸等详细介绍与自闭症的关联详见后面章节。
精氨酸水平与Roseburia、Coprococcus、Akkermansia丰度呈正相关,提示菌群失调可能影响宿主氨基酸代谢。
色氨酸代谢产物:吲哚-3-乙酸盐(AhR激动剂)在自闭症组中升高,且与Ruminococcaceae和Lachnospiraceae科菌属丰度正相关。
其他的一些与自闭症相关菌群的研究结果:
多样性降低
一些菌群减少,包括:
一些菌群增多,包括:
下列菌群可作为3-6岁有胃肠道症状儿童自闭症的可靠生物标志物:
菌群代谢产物LPS→慢性炎症→血脑屏障损伤
研究表明,细菌脂多糖(LPS)会引发慢性低度系统性炎症或“代谢性内毒素血症”,在动物模型中,这被证明会损害包括血脑屏障(BBB)在内的屏障功能。实际上,出生期暴露于LPS引发的系统性炎症的小鼠表现出永久性的血脑屏障损伤和渗透性增加,且在青少年和成年期表现出行为改变。对自闭症患者而言,血脑屏障功能的永久性损害将只会加剧肠道微生物及异常代谢产物输出所带来的病理后果。
母亲妊娠期:LPS诱导的系统性炎症如何影响孩子神经发育,增加自闭症风险?
妊娠期由LPS诱导的系统性炎症可以改变后代的神经发育和脑功能。自闭症中的这种先天性或细胞介导的炎症反应,可能会因获得性免疫系统中明显的自身免疫成分而加剧。由系统性炎症或母体自身免疫疾病触发的自身抗体在妊娠期间产生,现在被怀疑在胎儿异常神经发育和受损的血脑屏障发展中起作用,并影响婴儿期的大脑功能,包括增加自闭症的风险。
肠道菌群失调诱导产生自身抗体,影响神经系统发育
在自闭症患者中,对叶酸、血清素和GABA受体的自身抗体水平,以及一些重要的免疫相关酶如转谷氨酰胺酶2的抗体水平也有所升高。尽管自身抗体生成的分子触发机制尚不完全了解,但有一个可能性是,对关键代谢物如神经递质受体的自身抗体可能是在血液中异常代谢物浓度、早期生活中的不当免疫教育或由肠道细菌模拟引导下由免疫系统产生的。
这样的“代谢组-炎症组”调控网络也在其他自身免疫性疾病中出现,包括1型糖尿病和炎症性肠病(IBD),并且似乎与肠道微生物群密切相关。
氨基酸代谢在神经传递相关代谢物的生物合成中扮演着重要角色,长期以来被怀疑在自闭症谱系障碍中发挥作用。
血液分析氨基酸变化
Glu:Gln比率升高
有许多研究报告称,自闭症患者的血液中谷氨酸与谷氨酰胺(Glu:Gln)的比率升高。
将谷氨酸转化为谷氨酰胺是大脑中处理氨废物的主要方式,这对于避免氨中毒和在突触中谷氨酸的过度积累以减少兴奋性毒性非常关键。因此,血液中Glu:Gln比率的升高可能表明自闭症患者大脑中的氨解毒和谷氨酸循环发自闭症生了变化,这会影响行为。
注:低纤维高蛋白饮食可能会使这种氨中毒恶化,因为这样的饮食会导致肠道中的蛋白水解微生物群发酵氨基酸,从而增加系统性氨贡献。饮食中氨基酸的微生物分解会影响哺乳动物体内氨基酸的可用性和循环,也可能产生生物活性化合物,如短链脂肪酸、支链脂肪酸和生物胺。
蛋氨酸
一项包括87项研究的自闭症氧化应激生物标志物的汇总荟萃分析发现,参与甲基化循环和硫酸盐转移途径的几种代谢物异常。
蛋氨酸在硫酸盐转移途径中利用半胱氨酸合成,该途径连接蛋氨酸和谷胱甘肽的生物合成,蛋氨酸显著降低(p < 0.001),异常甲基化会增加自闭症谱系症状的风险 。
瓜氨酸
有研究发现,自闭症儿童的瓜氨酸水平与刻板行为(ADOS-2 上的 RRB 评分)之间存在正相关,且具有统计学意义。瓜氨酸和氨的累积暴露是经典瓜氨酸血症(精氨琥珀酸合成酶缺乏症)患者认知功能较差的最可靠标志。
尿液代谢物分析氨基酸变化
色氨酸
色氨酸因与自闭症症状相关而闻名,它是血清素 (5-HT) 的前体,血清素是一种抑制性单胺类神经递质,一些研究报告色氨酸水平升高,而另一些研究报告色氨酸水平降低 。
关于色氨酸,详见我们之前的文章:
苏氨酸
有研究发现,自闭症组男孩的苏氨酸含量明显高于对照组男孩。5 岁以下自闭症儿童的尿液苏氨酸含量高于 5 岁以上儿童。苏氨酸属于天冬氨酸家族,是一种蛋白质氨基酸,其分解产生乙酰胆碱酯酶 A 和甘氨酸,促进各种生理过程和整体身体稳态 ,它也可以通过影响色氨酸进入大脑,间接影响5-羟色胺的合成。
脯氨酸
有研究发现,5 岁以下自闭症儿童的脯氨酸含量明显低于 5 岁以上儿童。
与 22q11.2 染色体缺失的 CMPT158 基因型相关的脯氨酸水平异常升高,会影响自闭症谱系症状的严重程度,尤其是影响面部情绪识别、行为和认知。
β-丙氨酸
β-丙氨酸,在肉类中常见的氨基酸,会抑制肠道细胞(如Caco-2细胞)对GABA的吸收。β-丙氨酸也可以在肠道内由白色念珠菌产生的丙酸和氨反应形成,尽管这些化合物也由肠道内的许多其他微生物产生。
HPHPA
有研究报告了一种稀有代谢物3-(3-羟基苯基)-3-羟基丙酸(HPHPA)的出现。HPHPA是梭菌属细菌特有的代谢产物,会耗尽大脑中的儿茶酚胺,导致自闭症症状。
HPHPA在患有艰难梭菌感染的个体中也有发现,并且在急性精神病发作的精神分裂症患者中甚至达到非常高的水平。
以上这些研究是基于血浆、尿液氨基酸变化,血液和尿液中的氨基酸(AA)水平受许多因素影响,包括从食物中吸收的氨基酸、氨基酸和蛋白质的降解、宿主蛋白质的分泌和在粪便中的排泄。这些氨基酸相对比例的改变也可能对它们参与的代谢途径的产物产生连锁反应,包括不同神经递质的生产或相对比例。
肠道菌群代谢分析氨基酸变化
大多数氨基酸来自饮食或由体内合成,但肠道微生物群也会影响饮食氨基酸的回收以及氨基酸的生产或分解。
目前,我们对参与氨基酸生物利用度和肠道微生物群体生物转化的微生物种类或代谢过程知之甚少,对于其对神经功能的可能影响了解更少,也不清楚不同食物和食物成分如何相互作用以调节肠道微生物群对氨基酸的摄取或代谢。
有早期体外研究显示,人类肠道微生物群对氨基酸的发酵受到低pH值和可发酵纤维/碳水化合物(抗性淀粉)存在的抑制。然而,目前不知道这种过程在体内如何转化,或在自闭症等疾病状态或抗生素治疗下如何变化。
谷禾肠道菌群健康检测数据库中有这样的案例,一起来看一下:
一名5岁自闭症男孩,检测结果,自闭症为中等风险,符合实际情况。
<来源:谷禾健康肠道菌群检测数据库>
这是谷禾利用几十万例的临床和人群样本数据(其中4895例自闭症患者),结合机器学习方法,使用肠道菌群数据进行疾病状态和风险的预测,并给出了的风险值。
<来源:谷禾健康肠道菌群检测数据库>
从该患者肠道菌群检测报告可以看到,蛋白质,脂肪水平都相对偏低。
<来源:谷禾健康肠道菌群检测数据库>
我们再来看肠道菌群检测报告中的氨基酸水平,部分氨基酸严重缺乏,例如组氨酸;
其他氨基酸如酪氨酸、谷氨酸、甘氨酸、亮氨酸、赖氨酸、蛋氨酸也都相对偏低。
酪氨酸是一种与认知功能相关的儿茶酚胺前体。
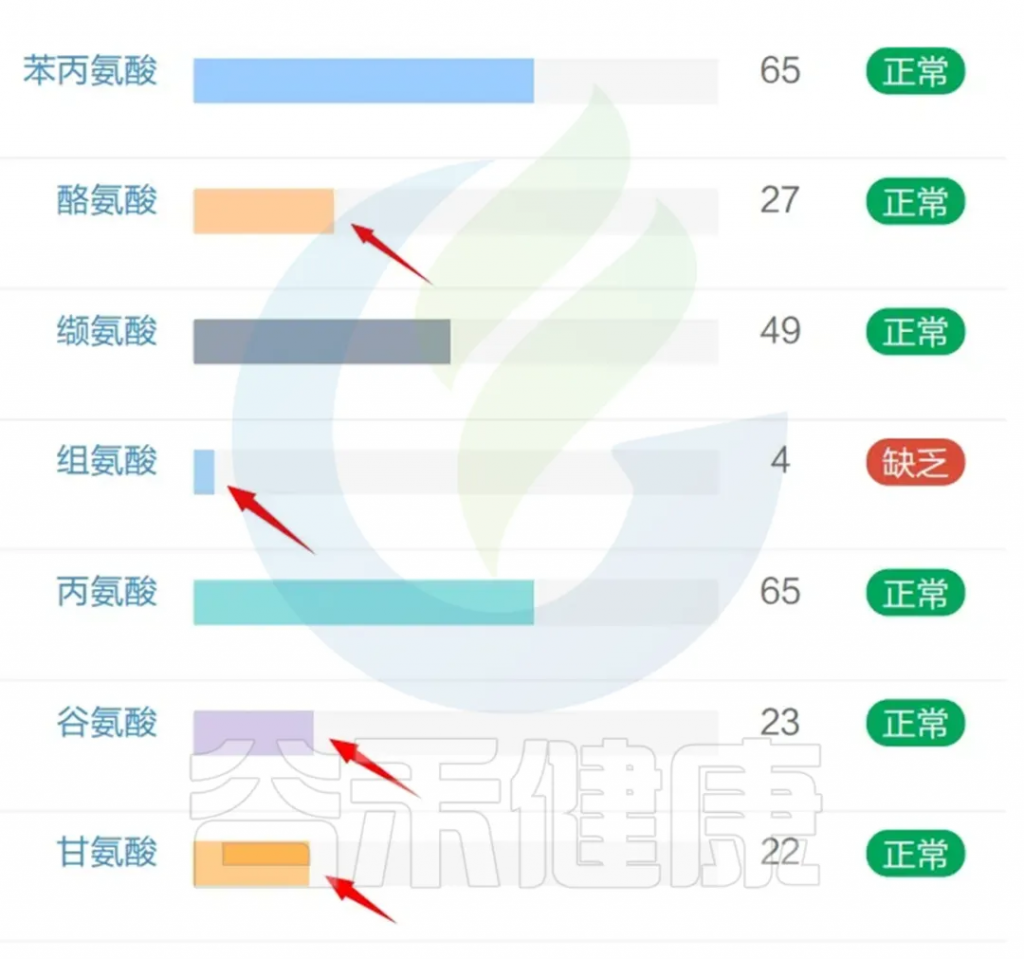
<来源:谷禾健康肠道菌群检测数据库>
组氨酸通过清除氧自由基发挥抗氧化作用,从而参与缓解氧化应激。组氨酸是肌肽的前体,肌肽是一种含有 β 丙氨酸和组氨酸的二肽,在人脑中起到缓冲剂和抗氧化剂的作用。肌肽可以调节与智力障碍相关的各种生物途径。
组氨酸是组胺的前体,而组胺是一种重要的神经递质和神经调节因子。关于组胺,详见之前的文章:
有小鼠研究显示,组氨酸缺乏的小鼠表现出一些类似自闭症的行为,如社交互动减少、刻板重复行为增多等。其他也有多项研究表明,组氨酸血症与自闭症和语言发育迟缓之间存在关联。
谷氨酸,可以调节记忆和学习等认知功能,而这些功能在自闭症患者中通常会受损,关于谷氨酸,详见谷禾之前的文章:
甘氨酸是一种具有抗炎、细胞保护和免疫调节特性的抑制性神经递质,甘氨酸以多种方式与线粒体代谢相关。
其他,赖氨酸,蛋氨酸,亮氨酸都属于人体必须氨基酸,是人体不能自行合成或以适合人体需要的速率合成的氨基酸,必须通过食物摄入来获取。
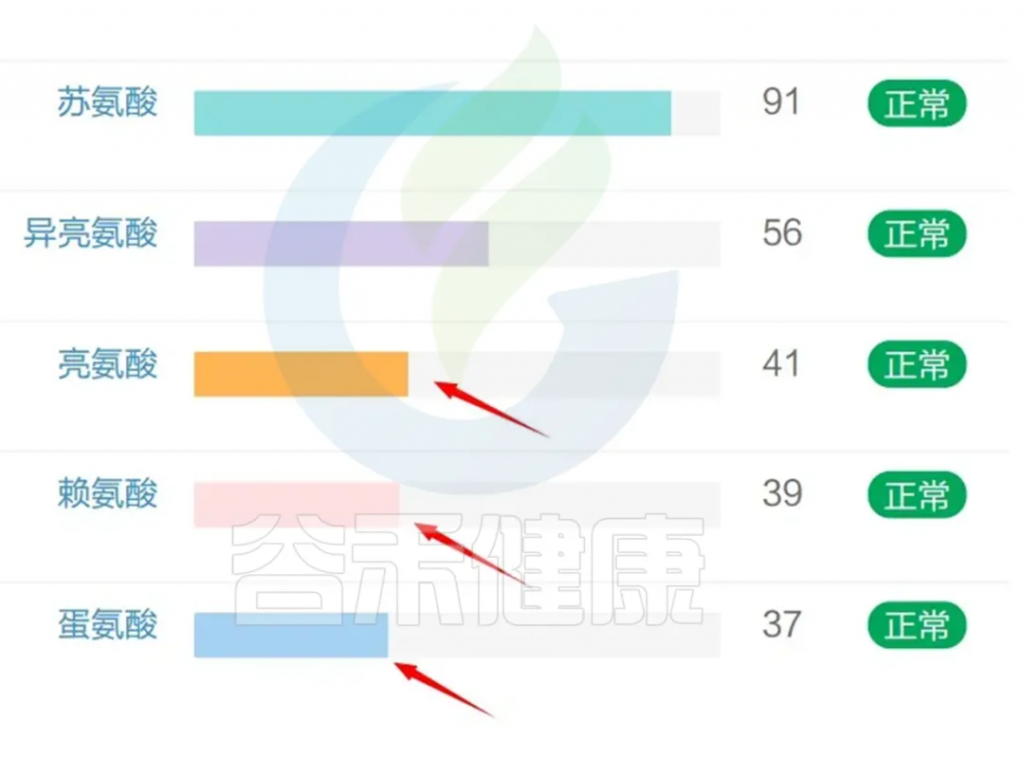
<来源:谷禾健康肠道菌群检测数据库>
亮氨酸,属于支链氨基酸,支链氨基酸生物合成与自闭症症状、甲基化潜力和细胞内 GSH 比率相关。支链氨基酸具有多种生理作用,包括调节葡萄糖和脂肪酸代谢以及调节重要的分子途径和促进蛋白质合成,它们通过琥珀酰辅酶 A 进入 CAC 与线粒体功能相连。大多数自闭症患者都会有线粒体功能障碍。
赖氨酸,是一种生酮氨基酸,通过合成谷氨酸作为其分解的副产物,参与肠道菌群-肠-脑轴。
经过几个月的干预,再次检测肠道菌群,该患者的自闭症风险有所下降,症状也有相应好转。

<来源:谷禾健康肠道菌群检测数据库>
未来患有自闭症的新生儿中关键脂质减少,如亚油酸、α-亚麻酸、胆汁酸、甘油三酯。
这些必需脂肪酸、它们的衍生物、相对比例和个体分子种类在许多哺乳动物的生理过程中起关键作用,包括磷脂生成、膜流动性和大脑发育。
亚油酸和α-亚麻酸
亚油酸和α-亚麻酸是哺乳动物不能自行合成的必需脂肪酸(EFA),必须通过饮食摄取。
注:亚油酸: LA,C18:2n-6,n-6脂肪酸的前体
α-亚麻酸: ALA,C18:3n-3,n-3脂肪酸的前体
它们对大脑具有抗炎作用,并调节自噬、神经传递和神经发生。它们通过抑制神经递质(例如GABA)的释放来调节内源性大麻素系统,从而影响突触功能和可塑性。
ARA、DHA、EPA
与其他身体组织相比,大脑中亚油酸和α-亚麻酸的浓度较低,而其衍生物,特别是ARA(花生四烯酸)和DHA(即二十二碳六烯酸)的浓度较高。
在妊娠晚期,胎儿大脑快速积累多不饱和脂肪酸,特别是DHA。
亚油酸和α-亚麻酸的衍生物可以进一步被宿主磷脂酶修饰,转化为主要来自ARA的二十碳烷类,如前列腺素、白三烯和血栓素。这些二十碳烷是促炎分子,作为局部激素来激活免疫细胞、启动血小板聚集和引发分娩。
相反,DHA和EPA可以进一步转化为抗炎的消退素(resolvins)和保护素(protectins)。
胆汁酸
关于胆汁酸,UDCA,熊去氧胆酸,一种天然存在的次级胆汁酸,在代谢性疾病、自身免疫性疾病、慢性炎症性疾病和神经病理学等疾病中显示出治疗前景。研究发现,UDCA在未来自闭症患者中较低。
ARA加DHA改善自闭症
一项双盲、安慰剂对照随机试验发现膳食补充ARA加DHA(ARA占优势)显著改善了自闭症患者(n=13)在异常行为检查表-社区量表测量的社交退缩和社交回应量表测量的沟通情况。虽然样本量较小,但这个研究证明了通过饮食调节大脑脂肪酸谱可能带来的好处,这种脂肪酸调节在动物研究中也可以通过益生菌达到。
n-3和n-6脂肪酸
一些小规模的n-3和n-6脂肪酸的膳食干预研究显示,自闭症患者的症状有所缓解,虽然并非所有研究都显示有改善。
自闭症患者可能与母乳喂养较少有关
自闭症和精神分裂症患者较少接受母乳喂养,而健康对照组则较多,这表明富含ARA、EPA和DHA的人类母乳对婴儿大脑发育的最佳饮食份额的重要性。相反,早期断奶与自闭症风险增加相关。这些观察结果不仅强调了早期产后饮食对大脑发育和自闭症风险的重要性,还暗示了肠脑轴和肠道微生物群在这一发育过程中的可能早期作用。
补充益生菌,改变脂肪酸
一些肠道微生物,最著名的是某些乳酸菌属和双歧杆菌属的菌种,具备进行脂肪酸生物氢化所需的酶,从而增加脂肪酸的不饱和度。
研究表明,饮食补充α-亚麻酸(ALA)会改变小鼠肝脏、脂肪组织和大脑中的脂肪酸谱,并且在联合补充α-亚麻酸与益生菌Bifidobacterium breve NCIMB 702258时,脂肪酸谱会进一步改变。
注:B. breve NCIMB 702258是高效生产共轭亚油酸(CLA)的菌。
相比于对照组喂养或单独补充α-亚麻酸的情况,食用n-3脂肪酸加益生菌的动物其大脑中的DHA水平升高,而ARA水平下降。
同一组作者随后表明,单独使用B. breve NCIMB 702258菌株,相比于另一种共轭亚油酸(CLA)产生的B. breve菌株和对照组,小鼠的大脑中DHA和ARA的水平也有所上升,证实了益生菌调节大脑脂肪酸谱的能力,并显示这种活动具有明显的菌株特异性。
LA和ALA不够,其他饱和脂肪酸来凑
尽管亚油酸(LA)和α-亚麻酸(ALA)是磷脂形成所必需的必需脂肪酸,但当饮食中这些脂肪酸含量偏低时,其他脂肪如饱和脂肪酸有时可作为替代品,从而对最终磷脂的结构和可能的功能产生影响。
磷脂代谢异常、脂肪酸缺乏或血脂异常已牵涉到多种神经和大脑发育或退行性疾病,包括精神分裂症、注意力缺陷多动障碍(ADHD)、抑郁症、广泛性发育障碍、发育性协调障碍、癫痫、双相情感障碍、阿尔茨海默病、帕金森病、尼曼-皮克病、亨廷顿舞蹈病、中风。
胆固醇代谢和磷脂代谢异常在自闭症中起作用
自闭症患者血液中磷脂酶A2水平较高,细胞膜中的ARA和DHA水平较低,并且可能具有更高的n-6脂肪酸与n-3脂肪酸的比例。
与健康对照组相比,自闭症儿童(n=16)的红细胞脂质谱被修改,表现为较低的胆固醇水平和细胞膜中单唾液四己糖神经节苷脂(GM1)的比例较高。研究人员认为这可能反映了更普遍的胆固醇合成缺陷,在大脑中,结合GM1表达的变化,可能会促成自闭症的病理生理机制。
BDNF对突触传递和神经元胆固醇合成的影响
自闭症与BDNF和益生菌的关联
然而,并非所有益生菌研究都显示BDNF与实验动物观察到的脑功能改善有关。
益生菌、益生元与改善脑功能
然而,需要在人类受试者和相关实验模型中进行基础研究,以验证这些假设的有效性并在机制上将肠道细菌与这些病情联系起来。
大脑占人体质量约2%,但却占胆固醇约20%。血脑屏障(BBB)对脂蛋白是不可通透的,这意味着大脑所需的胆固醇是内源性形成的。
其中星形胶质细胞和神经元分别是胆固醇的净生产者和使用者,体现了胆固醇生物合成机制的独特分区化。
神经元——胆固醇的使用者
神经元需要大量的胆固醇来维持其广泛的膜表面积并提供突触前囊泡的形成。它们还有稍微不同的酶途径,将鲨烯转化为胆固醇。出生后的胆固醇主要由星形胶质细胞提供,并优先来源于乙酸盐。
注:鲨烯(C30H50)是一种多不饱和烃类,也称为角鲨烯或三十碳六烯。 它是一种在人体胆固醇合成等代谢过程中产生的萜类化合物。鲨烯在自然界中广泛存在,尤其是在鲨鱼肝油中含量较高,同时也是橄榄油、米糠油等少数几种植物油中的成分。具有良好的生物活性,在食品、化妆品、保健品等领域广泛应用。
星形胶质细胞——胆固醇的净生产者
星形胶质细胞是包裹神经细胞的细胞,负责供应细胞外钾、谷氨酸、能量和抗氧化剂,并调节大脑中的活性依赖性血流,并可能影响突触活动。
星形胶质细胞在大脑胆固醇运输中的关键作用
ApoE缺乏的啮齿动物模型,表现出各种行为和神经系统症状,并在感觉系统中也有缺陷,这些缺陷与随年龄增长而丧失的突触和树突,突触膜胆固醇分布的改变有关。
CYP46,在维持大脑胆固醇稳态中的作用
短链脂肪酸——乙酸,对神经发育的作用
出生后乙酸在神经发育中重要,母乳喂养乙酸多
AceCS1的表达及其功能
乙酸是胆固醇的组成成分
乙酸的代谢去向
乙酸作为特殊代谢产物的重要性
NAA——乙酸的主要来源之一
N-乙酰天冬氨酸(NAA)在大脑中的作用
自闭症儿童大脑中NAA浓度降低
短链脂肪酸——丙酸,对大脑的负面影响
饮食如何影响大脑中短链脂肪酸的可用性?
自闭症中二糖酶和己糖转运蛋白减少
研究发现,在自闭症儿童中,二糖酶和己糖转运蛋白的表达显著减少,这些变化与肠道微生物群组成的变化相关。这些变化与厚壁菌门相对丰度较高,拟杆菌门较少,以及β-变形菌门升高有关。
注:至少是三种常见肠道二糖酶之一:蔗糖酶-异麦芽糖酶(SI)、麦芽糖酶-异麦芽糖酶(MGAM)、乳糖酶(LCT)
己糖转运蛋白:SGLT1、GLUT2
肠道二糖酶和糖转运蛋白的表达受到多种因素的调控,包括饮食、肠道微生物以及肠神经系统等。
丁酸:结肠健康的关键能量源与吸收机制
考虑到丁酸是结肠细胞的首选能量来源、黏膜更新和分化的介质,以及其生产率在早期肠道微生物群继发发育过程中发生变化,丁酸在肠黏膜成熟中的作用可能非常重要。
丁酸吸收机制:MCT1负责运输,GPR109A助攻
在了解了丁酸在肠黏膜中的重要性及其吸收机制之后,我们再探讨不同饮食和环境因素对MCT1表达的影响及其对丁酸和其他短链脂肪酸吸收的调节作用。
饮食影响短链脂肪酸(丁酸)吸收的机制
高纤维饮食和益生元→MCT1表达和短链脂肪酸吸收↑
高脂肪饮食→抑制短链脂肪酸在结肠中的吸收
肠道炎症和氧化应激→MCT1表达↓→丁酸吸收↓
以上我们知道,MCT1表达异常会影响丁酸吸收,不仅如此,MCT1表达异常还可能与肥胖相关的神经系统疾病有关。
在饮食诱导和遗传性肥胖动物中,MCT1-4 表达都增加,特别是在神经元和神经元胞体中,说明这种变化可能不全是饮食因素,也可能是由于肥胖引起的激素变化间接导致的。
前面我们知道,MCT与短链脂肪酸转运相关,那么MCT表达异常,短链脂肪酸也异常,可能会影响大脑的能量代谢,如果这些变化发生在生命早期,可能会影响神经系统的发育过程,并与个体成年后的肥胖易感性相关。
注:从母乳到固体食物的饮食结构转换可能会影响生理发育、代谢途径和营养转运蛋白(如MCT)的表达,从而对大脑功能产生重要影响。
谷禾发表在 GUT上的队列也表明,随着断奶或引入辅食,自闭症儿童的肠道菌群发育轨迹逐渐偏离健康儿童。如下:
doi: 10.1136/gutjnl-2021-325115.
不良饮食,尤其是在断奶后采用现代西式饮食,实际上可能通过将营养素转运蛋白关闭,重定向营养流向,从而下调了必需营养素(如氨基酸、脂肪和SCFA)的肠道流动。
对比现代西式饮食和古老传统的饮食,有助于重新定义营养不良的范式。营养不良不再仅限于某些必需营养素的缺乏,还包括营养过剩和异常的营养素比例和结构。

在人类“超级有机体”中,这种改变的营养环境的代谢后果,最明显地体现在肠道微生物群与宿主能量代谢和大脑功能的相互作用中。
生命早期:母乳喂养
前面我们了解到,早期断奶与自闭症风险增加相关。很多自闭症患者较少接受母乳喂养,这表明母乳中含有ARA、EPA和DHA,是婴儿大脑发育的最佳饮食。
随着年龄增长:其他饮食
多酚及其代谢物
现有的研究确认了流行病学数据,表明多酚及其代谢物可能有助于促进大脑健康。提出的作用机制包括抗氧化活动、改善血管功能和脑部血流、直接增强神经元信号传递、缓冲钙离子、增强神经保护性应激蛋白和减少应激信号。
线粒体功能障碍在自闭症谱系障碍、神经退行性疾病和一般脑老化的发病机制中得到了关注。线粒体常被认为是氧化应激的启动者和目标,植物多酚代谢物可能具有保护作用。
体外研究在生理相关剂量下测试了选定多酚代谢物对高级糖化终产物形成的抑制能力以及对人类神经元细胞中轻度氧化应激的对抗能力。例如:
药用植物的多酚提取物
少数研究探讨了来自药用植物的多酚提取物对自闭症动物模型的影响,发现:
注:尚需确定这些高剂量植物提取物的抗氧化活性仅与减轻丙戊酸引起的氧化损伤相关,还是在氧化损伤可能只是一个影响因素的神经病理情况下更具广泛相关性。
——黄酮类化合物
肠道菌群对黄酮类化合物的吸收转化
估计有95%的膳食植物多酚在上肠道内无法消化和吸收,并最终到达结肠中的肠道微生物群。一些黄酮类糖苷进入结肠,被肠道菌群分解为更简单的代谢物,比如:
黄酮类化合物对肠道菌群的调节
膳食类黄酮调节肠道菌群改善自闭症
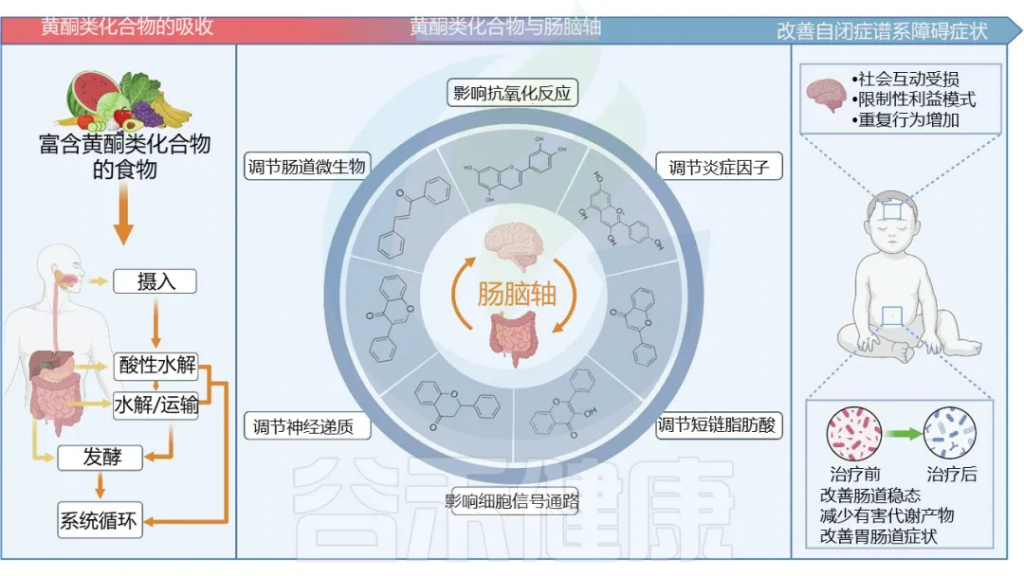
doi.org/10.1016/j.foodres.2024.114404
黄酮类化合物抗自闭症作用的实验研究


doi.org/10.1016/j.foodres.2024.114404
肥胖和不良饮食与抑郁症和自闭症谱系障碍发病率增加有关。同样,母亲的不良饮食(特别是高脂肪饮食),健康状况(特别是肥胖/代谢综合症),会影响胎儿和新生儿的大脑发育过程,从而增加焦虑、抑郁、注意力缺陷多动障碍(ADHD)和自闭症等神经系统疾病的风险。
神经内分泌系统,特别是下丘脑-垂体-肾上腺(HPA)轴,代表了肠道环境和中枢神经系统(CNS)之间的主要通信通道。
在动物模型中,使用各种益生菌微生物干预,既包括乳酸杆菌也包括双歧杆菌,已显示能够减轻标准动物应激挑战下的类似焦虑行为。
婴儿双歧杆菌
L. helveticus R0052 和 B. longum R0175
L. rhamnosus JB-1
脆弱拟杆菌NCTC 9343
注:脆弱拟杆菌是一个比较复杂的菌种,里面既有潜在的益生菌株,也有致病的病原菌株,具体可以查看我们以前文章:
益生元
最近的研究表明,饮食中补充益生元发酵纤维,可以选择性地刺激对人体有益的肠道细菌,如双歧杆菌,从而对大脑产生重要变化。
实验动物在摄入果寡糖(FOS)或半乳寡糖(GOS)后,海马中的BDNF和N-甲基-d-天冬氨酸受体(NMDARs)亚基NR1的表达增加,并且GOS似乎通过诱导肠道激素PYY来介导这一过程。FOS和GOS都能够上调肠道微生物群中短链脂肪酸的产生,特别是乙酸和丁酸,同时增加肠道双歧杆菌的相对丰度。
L-肌肽
胆固醇或DHA
从模拟人类婴儿营养的猪仔研究中,发现婴儿配方奶粉中的胆固醇补充会改变大脑中的氨基酸谱,降低谷氨酸、丝氨酸、谷氨酰胺、苏氨酸、β-丙氨酸、丙氨酸、蛋氨酸、异亮氨酸、亮氨酸和γ-氨基丁酸的浓度,同时增加甘氨酸和赖氨酸的浓度。
二十二碳六烯酸(DHA)也有类似的效果,但会降低牛磺酸水平,对异亮氨酸和赖氨酸没有影响。胆固醇或DHA膳食补充剂也会影响猪仔肝脏、肌肉和血浆中的氨基酸水平。DHA还会减少肌肉和大脑中的肌肽和氨的含量。
这些观察结果确实对食物选择或家庭饮食对营养可用性和代谢的影响有重要启示,进而影响早期儿童的大脑发育和功能,当然还需在人类队列中进一步研究其潜在机制。
药物
对自闭症儿童每周使用万古霉素治疗,可显著改善神经行为和胃肠道症状。
粪菌移植
一项开放标签研究对18名自闭症儿童进行了粪菌移植(每日口服8周),结果表明移植后其胃肠道症状和自闭症核心症状评分均有所改善。
移植后8周,受试者的肠道菌群多样性增加,厚壁菌门丰度下降,拟杆菌门和变形菌门丰度上升。
随访2年后,受试者的部分症状改善仍然维持。这提示通过重建肠道菌群可能成为干预自闭症的新策略。
关于粪菌移植,仍需更多深入研究。
自闭症谱系障碍 (ASD) 是一组神经发育疾病,一般在 3 岁之前发病,目前的发病率在全世界逐渐升高,与多种因素有关,其中饮食会影响和塑造肠道微生物群,孕期和幼儿期似乎是一个关键时期,尤其从哺乳/配方奶→断奶→成人“家庭”饮食的过渡过程中饮食和环境暴露影响较大。
人类微生物组对宿主代谢过程和膳食化合物加工的核心贡献,许多营养物质和摄入的化学物质必须经过肠道及肠道微生物,转化为生物可利用和活跃的中间产物,然后通过肝门静脉被吸收并在全身分布。
研究表明,大部分自闭症患者的肠道菌群异常,这可能与饮食习惯、抗生素使用等因素有关。同时,自闭症患者某些氨基酸水平也存在异常。
饮食作为塑造肠道微生物群的重要因素,可能在自闭症的发病中扮演重要角色。优化孕期和幼儿期的饮食结构,如母乳喂养、合理添加辅食、避免过多加工食品和添加剂等,有助于维持肠道菌群平衡,从而有助于大脑健康。
针对自闭症患者的饮食干预,如补充益生元、益生菌,调整膳食纤维和蛋白质比例等,可能对改善部分症状有一定帮助。但由于自闭症的高度异质性,饮食干预的效果可能因人而异,还需要更多的结合个体化健康信息及相应症状进行个性化指导和干预。
此外,幼儿早期尤其6-12个月能够更早判别出自闭症风险,对于神经发育的改善和行为的扭转非常重要,希望临床上与相关机构能够合作共同推进自闭症的研究和个性化干预。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Lou M, Cao A, Jin C, Mi K, Xiong X, Zeng Z, Pan X, Qie J, Qiu S, Niu Y, Liang H, Liu Y, Chen L, Liu Z, Zhao Q, Qiu X, Jin Y, Sheng X, Hu Z, Jin G, Liu J, Liu X, Wang Y. Deviated and early unsustainable stunted development of gut microbiota in children with autism spectrum disorder. Gut. 2022 Aug;71(8):1588-1599.
Ahrens A P, Hyötyläinen T, Petrone J R, et al. Infant microbes and metabolites point to childhood neurodevelopmental disorders[J]. Cell, 2024, 187(8): 1853-1873. e15.
Chen, WX., Chen, YR., Peng, MZ. et al. Plasma Amino Acid Profile in Children with Autism Spectrum Disorder in Southern China: Analysis of 110 Cases. J Autism Dev Disord 54, 1567–1581 (2024).
Chang, X., Zhang, Y., Chen, X. et al. Gut microbiome and serum amino acid metabolome alterations in autism spectrum disorder. Sci Rep 14, 4037 (2024).
Kieran M. Tuohy, Paola Venuti, Simone Cuva, et al, Chapter 15 – Diet and the Gut Microbiota – How the Gut: Brain Axis Impacts on Autism, 2015, Pages 225-245, American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders (4th ed.), American Psychiatric Association, Washington DC (1994)
Anastasescu, C.M.; Gheorman, V.; Popescu, F.; Stoicănescu, E.-C.; Gheorman, V.; Riza, A.-L.; Badea, O.; Streață, I.; Militaru, F.; Udriștoiu, I. Serum Amino Acid Profiling in Children with Autistic Spectrum Disorder: Insights from a Single-Center Study in Southern Romania. Healthcare 2023, 11, 2487
V. Hughes. Epidemiology: complex, disorder, Nature, 491 (2012), pp. S2-S3
S. Baron-Cohen, F.J. Scott, C. Allison, et al., Prevalence of autism-spectrum conditions: UK school-based population study. Br J Psychiatry, 194 (2009), pp. 500-509
T.S. Brugha, S. McManus, J. Bankart, et al., Epidemiology of autism spectrum disorders in adults in the community in England Arch Gen Psychiatry, 68 (2011), pp. 459-466
B.S. Abrahams, D.H. Geschwind., Advances in autism genetics: On the threshold of a new neurobiology, Nat Rev Genet, 9 (2008), pp. 341-355
Brister, D.; Rose, S.; Delhey, L.; Tippett, M.; **, Y.; Gu, H.; Frye, R.E. Metabolomic Signatures of Autism Spectrum Disorder. J. Pers. Med. 2022, 12, 1727.
S. Ozonoff, B.J. Williams, R. Landa, Parental report of the early development of children with regressive autism: The delays-plus-regression phenotype, Autism, 9 (2005), pp. 461-486
S. Ozonoff, G.S. Young, M.B. Steinfeld, et al., How early do parent concerns predict later autism diagnosis?
J Dev Behav Pediatr, 30 (2009), pp. 367-375
G. Esposito, P. Venuti, Symmetry in infancy: Analysis of motor development in autism spectrum., disorders, Symmetry, 1 (2009), pp. 215-225
Zhao Y, Wang Y, Meng F, Chen X, Chang T, Huang H, He F, Zheng Y. Altered Gut Microbiota as Potential Biomarkers for Autism Spectrum Disorder in Early Childhood. Neuroscience. 2023 Jul 15;523:118-131.
G. Esposito, P. Venuti, F. Apicella, F. Muratori, Analysis of unsupported gait in toddlers with autism, Brain and Development, 33 (2011), pp. 367-373
F. Happé, A. Ronald, R. Plomin, Time to give up on a single explanation for autism, Nat Neurosci, 9 (2006), pp. 1218-1220
T. Charman, C.R.G. Jones, A. Pickles, E. Simonoff, G. Baird, F. Happé, Defining the cognitive phenotype of autism, Brain Res, 1380 (2011), pp. 10-21
P. Krakowiak, C.K. Walker, A.A. Bremer, et al.,Maternal metabolic conditions and risk for autism and other neurodevelopmental disorders,Pediatrics, 129 (2012), pp. e1121-e1128
J.A. Hollway, M.G. Aman Pharmacological treatment of sleep disturbance in developmental disabilities: a review of the literature,Res Dev Disabil, 32 (2011), pp. 939-962
Shen L, Liu X, Zhang H, Lin J, Feng C, Iqbal J. Biomarkers in autism spectrum disorders: Current progress. Clin Chim Acta. 2020 Mar;502:41-54.
C.A. Molloy, P. Manning-Courtney,Prevalence of chronic gastrointestinal symptoms in children with autism and autistic spectrum disorders, Autism, 7 (2003), pp. 165-171
D.V. Keen , Childhood autism, feeding problems and failure to thrive in early infancy: Seven case studies, Eur Child Adolesc Psychiatr, 17 (2008), pp. 209-216
L.G. Bandini, S.E. Anderson, C. Curtin, et al., Food selectivity in children with autism spectrum disorders and typically developing children, J Pediatr, 157 (2010), pp. 259-264
S.A. Cermak, C. Curtin, L.G. Bandini, Food selectivity and sensory sensitivity in children with autism spectrum disorders, J Am Diet Assoc, 110 (2010), pp. 238-246
Y. Martins, R.L. Young, D.C. Robson, Feeding and eating behaviors in children with autism and typically developing children, J Autism Dev Disord, 38 (2008), pp. 1878-1887, View at publisher
E. Cornish, A balanced approach towards healthy eating in autism, J Hum Nutr Diet, 11 (1998), pp. 501-509
P. Whiteley, J. Rodgers, D. Savery, P. Shattock, A gluten-free diet as an intervention for autism and associated spectrum disorders: Preliminary findings, Autism, 3 (1999), pp. 45-65
K. Fitzgerald, M. Hyman, K. Swift, Autism spectrum disorders, Glob Adv Health Med, 1 (2012), pp. 62-74
E. Courchesne, K. Campbell, S. Solso, Brain growth across the life span in autism: age-specific changes in anatomical pathology, Brain Res, 1380 (2011), pp. 138-145
M. Rutter, Aetiology of autism: findings and questions, J Intell Disabil Res, 49 (2005), pp. 231-238, View at publisher
J.J. Michaelson, Y. Shi, M. Gujral, et al.
Whole-genome sequencing in autism identifies hot spots for de novo germline mutation, Cell, 151 (2012), pp. 1431-1442
B.N. Vardarajan, A. Eran, J.Y. Jung, L.M. Kunkel, D.P. Wall, Haplotype structure enables prioritization of common markers and candidate genes in autism spectrum disorder
Transl Psychiatry, 3 (2013), p. e262
Yu X, Qian-Qian L, Cong Y, Xiao-Bing Z, Hong-Zhu D. Reduction of essential amino acid levels and sex-specific alterations in serum amino acid concentration profiles in children with autism spectrum disorder. Psychiatry Res. 2021 Mar;297:113675.
J. Veenstra-Vanderweele, R.D. Blakely
Networking in autism: Leveraging genetic, biomarker and model system findings in the search for new treatments, Neuropsychopharmacol, 37 (2012), pp. 196-212
K.T.E. Kleijer, M.J. Schmeisser, D.D. Krueger, et al. Neurobiology of autism gene products: towards pathogenesis and drug targets, Psychopharmacology (Berl), 231 (6) (2014), pp. 1037-1062
Li H, Dang Y, Yan Y. Serum interleukin-17 A and homocysteine levels in children with autism. BMC Neurosci. 2024 Mar 12;25(1):17.

谷禾健康

编辑在老龄化过程中,生理功能逐渐衰退,伴随着多种疾病的发生,对老年人的身心健康构成重大威胁。
衰老是一个渐进、持续的过程,受到多种因素的影响,包括遗传、饮食、运动、生活方式等生理因素,也有社会、文化等复杂因素的交互影响,目前,越来越多的证据支持肠道菌群在衰老过程中的作用。
自然或“健康”的衰老,伴随着普雷沃菌属、粪杆菌属和双歧杆菌属以及直肠真杆菌属等减少,被其他共生微生物群所取代,如Butyricimonas、Akkermansia、Odoribacter等,尤其Akk菌与百岁老人的健康有关。而不健康衰老,则意味着致病菌或条件致病菌增多,包括肠杆菌科、放线菌属等。
肠道菌群与衰老相关的变化与认知能力下降、肌肉质量下降、骨质减少、皮肤稳态、血管老化、免疫衰老、代谢改变、肺和肝功能下降等密切相关。这些身体机能的衰退往往伴随着心理健康的变化,尤其是晚年抑郁症的发病率增高,约4%的老年人被诊断患有晚年抑郁症。
与成年人抑郁症相比,晚年抑郁症更多表现为生理症状突出,认知功能损害更严重,晚年抑郁症可能是老年痴呆的先兆。
经常看我们文章的朋友都知道,肠-脑轴与神经精神疾病的发病机制密切相关。这一双向调节轴通过神经免疫、神经内分泌等通路,以及肠道屏障、微生物代谢物和血脑屏障等,影响大脑功能,当然也包括认知水平。
近期几项研究(包括纵向跨诊断研究,横截面研究等)表明,肠道菌群可以预测未来的认知能力下降和抑郁症状,未来认知功能下降与较低的Intestinibacter相对丰度、较低的谷氨酸降解以及较高的组胺合成水平相关。关于谷氨酸和组胺可以详见我们之前的文章:
晚年抑郁症中总游离脂肪酸部分介导了Akkermansia与认知功能之间的关系,IL-6、IFNγ、疣微菌门和Akkermansia水平与抑郁严重程度相关。
本文我们通过这几项研究,来更深入具体地了解肠道菌群对老年人认知能力下降和抑郁症状的当前和未来影响,同时也包括其他老年神经系统疾病相关合并症,营养不良住院老年人的肠道菌群紊乱和临床结果,以及针对衰老的相关干预措施的介绍。希望为大家提供更多关于肠道菌群在老年健康领域重要作用的见解。
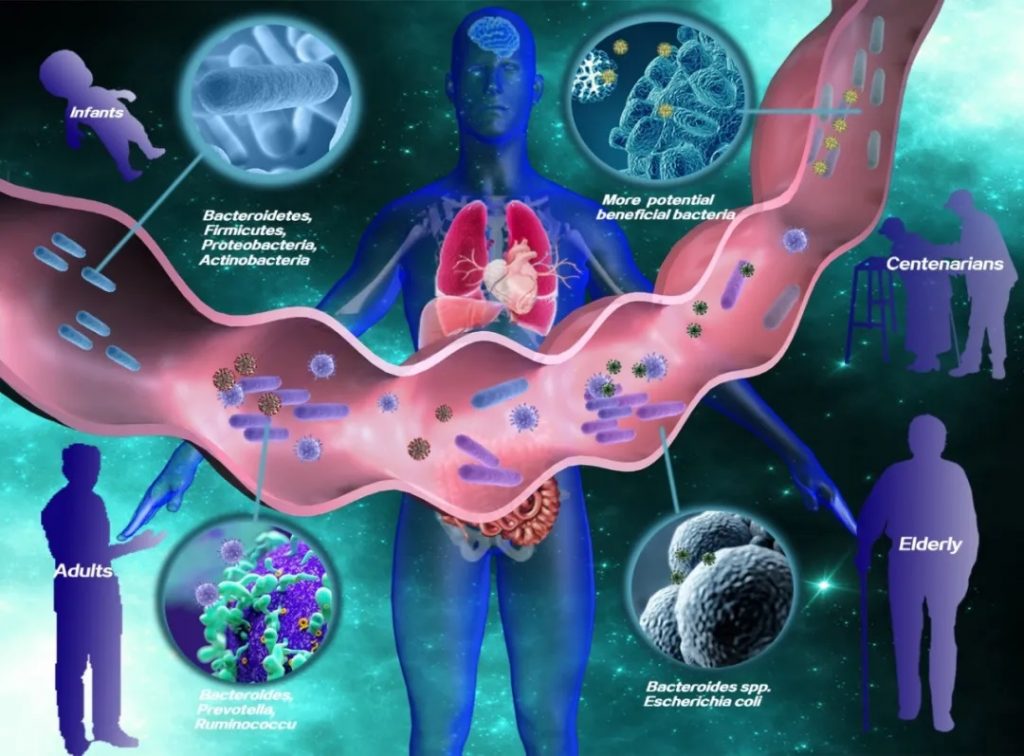
doi.org/10.14336/AD.2024.0331
在人类的整个生命周期中,肠道微生物群的变化和转变伴随着衰老过程。
婴儿从出生起就接触各种环境微生物,导致肠道微生物群逐渐丰富和多样性增加。
新生儿肠道最初定植主要涉及兼性厌氧微生物,如肠杆菌科和链球菌,其次是专性厌氧微生物,如双歧杆菌、梭菌和拟杆菌。
Prausnitfaecali和喜爱粘蛋白的Akkermansia muciniphila等细菌在婴儿早期要么不存在,要么以非常低的水平存在,并在 1-2 岁左右增加到成人水平。
共生且稳定的肠道微生物群通常在9至36个月大的婴儿中形成,常见的分类群包括拟杆菌门、厚壁菌门和放线菌门。
3-5岁儿童的肠道菌群组成逐渐向成人趋同。一旦建立,肠道微生物群的组成在整个成年期保持相对稳定。
成年人的肠道菌群包括拟杆菌型、普雷沃氏菌型等几种常见肠型。个体间差异与饮食、生活方式、运动频率、种族、文化习惯等许多因素相关。
在中老年人中,肠道微生物群多样性下降。某些核心肠道微生物类群在老年人中也会发生变化。例如,拟杆菌属和大肠埃希氏菌的比例较高。
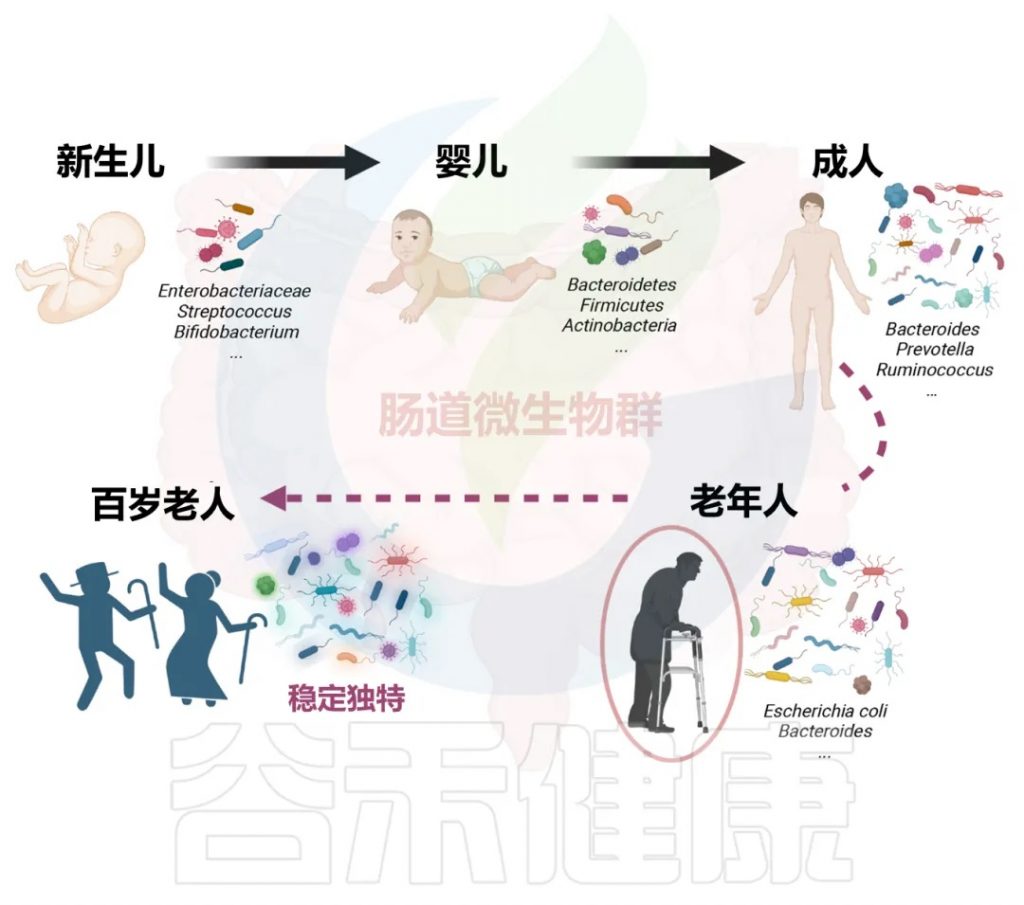
DOI: 10.14336/AD.2024.0331
自然或“健康”的衰老会导致肠道微生物组组成的特定变化,例如某些共生菌属的丧失,包括普雷沃菌属、粪杆菌属和双歧杆菌属以及直肠真杆菌属。在老年阶段,这些菌群被其他共生微生物所取代,如丁酸杆菌属(Butyricimonas)、Akkermansia、Odoribacter等。
特别是Akkermansia muciniphila,已知其有助于肠道中的粘蛋白降解。研究人员推测,AKK菌的水平可以指示健康状况,其相对丰度增加(高于健康老化时的水平)与百岁老人的极佳健康状况相关,而相对丰度降低则与肠道粘液层变薄和酰基甘油减少有关。
注:酰基甘油是一种调节肠道通透性和减少肠道炎症的内源性大麻素。
长寿人群的肠道菌群特征
研究发现,与100岁以下人群相比,百岁老人体内有益细菌(如拟杆菌属、Desulfovibrio suis、Pameliagodonibacterium pamelaeae、瘤胃球菌科、乳杆菌、Akkermansia、 甲烷短杆菌属)含量更高,而Faecalibacterium 、普雷沃特菌属、克雷伯氏菌属、链球菌属、肠杆菌属、肠球菌属含量较低。
百岁老人肠道菌群多样性有所增加。百岁老人肠道微生物群中有益细菌占主导地位,可能有助于抵消与年龄相关的健康问题和衰老。
长寿人群的肠道菌群功能分析
2019年,一项对百岁老人肠道微生物功能的分析显示,中枢代谢能力增强,特别是在产生短链脂肪酸的糖酵解和发酵途径中。此外,百岁老人还表现出更高水平的磷脂酰肌醇信号系统、鞘脂生物合成和不同水平的n-聚糖生物合成。
2020年,一项对肠道微生物组的功能研究揭示,随着年龄的增长,与异养降解代谢相关的途径增加,与碳水化合物代谢相关的通路减少。
2021年进行的一项研究,包括吲哚和苯乙酰谷氨酰胺在内的七种微生物代谢产物与百岁老人肠道微生物群的不同组成之间存在显著关联。这两种代谢产物先前被证明可以延长小鼠的寿命,在百岁老人的血液中发现了高水平的代谢产物。
总之,肠道微生物群不仅是衰老的标志,而且在维持人类健康和寿命方面发挥着至关重要的作用。
肠道微生物群与年龄相关的变化不仅影响肠道健康,而且还延伸到其他生理系统。
炎症衰老
早在20世纪60年代的研究就表明老年人的免疫功能有所下降,这一过程现在被称为免疫衰老,与免疫系统功能下降有关,从而导致促炎细胞因子的积累。
老年人群中炎症状态的增加现在通常被称为“炎症衰老”。促炎症状态使患者面临多种疾病的更高风险,例如自身免疫性疾病、心血管疾病、感染。
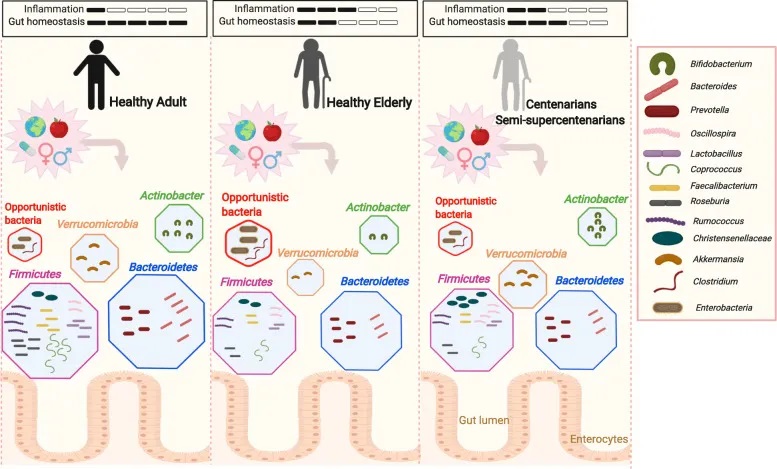
doi: 10.1186/s12979-020-00213-w
在胃肠道内,维持功能性上皮和粘液屏障对于预防感染和疾病至关重要。肠道通透性增加可导致微生物易位至宿主循环中,加剧促炎状态。
科学家还发现了几种在“不健康”衰老过程中会增加的致病生物或条件致病微生物,这一过程的特点是身体和精神迅速衰退,并与疾病进展和身体虚弱有关。其中一些病原体包括埃格特菌属(Eggerthella)、放线菌属、肠杆菌科,它们的存在和数量可以帮助预测寿命和疾病结果。
老龄化人群:微生物组本身的变化导致促炎状态
在无菌小鼠模型中进行的实验表明,老龄化人群中微生物组本身的变化导致了促炎状态,无菌小鼠的寿命比传统小鼠要长得多。此外,与灌胃其他年轻小鼠微生物组的小鼠相比,灌胃老年小鼠微生物组的年轻无菌小鼠表现出更大的肠道通透性和循环肿瘤坏死因子。
与各种器官和疾病相关的年龄相关肠道菌群
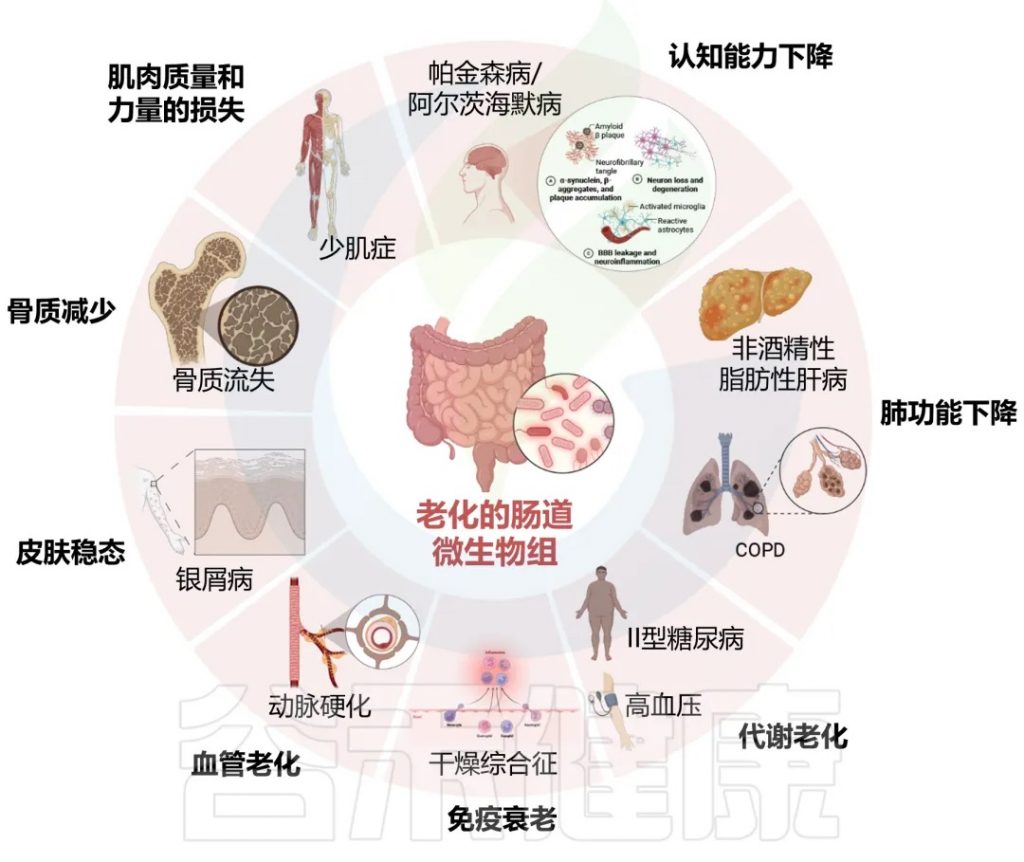
DOI: 10.14336/AD.2024.0331
肠道微生物群与年龄相关的变化与认知能力下降、肌肉质量和能力下降、骨质减少、皮肤稳态、血管老化、免疫衰老、代谢改变、肺和肝功能下降密切相关。
表1 不健康衰老过程中的肠道微生物组
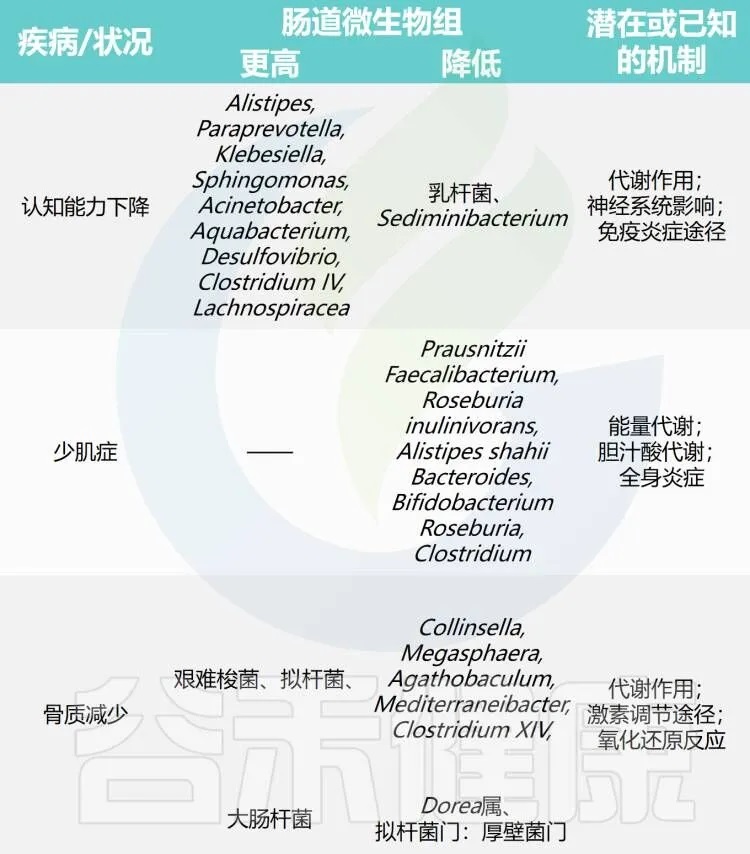

doi.org/10.14336/AD.2024.0331
一个越来越受关注的领域是通过可能影响认知功能的微生物群-肠-脑轴。神经精神疾病的病因复杂,肠道菌群和炎症可能是神经系统疾病发病机制的关键因素。接下来我们通过几项近期的研究队列,来了解老年人的肠道菌群与神经系统疾病关联。
随着全球人口预期寿命的增加,晚年抑郁症的患病率显著上升,约4%的老年人被诊断患有晚年抑郁症。晚年抑郁症更多表现为明显的躯体症状,而情感症状不突出,认知功能障碍也更严重。
有认知障碍的老年人抑郁会增加痴呆的进展。微生物群与当前的情绪和认知有关,近日,几项关于肠道菌群与老年抑郁、认知能力下降关联的研究发表,这些有助于我们更好地理解和应对老年抑郁和认知能力下降,一起来看一下:
literature 1
肠道菌群对老年人认知能力下降和抑郁症状的当前和未来影响

从268名有不同认知和抑郁症状的参与者中收集临床评估和粪便样本。
70名参与者接受了为期2年的随访。
肠道菌群多样性↑ 认知↓ 抑郁严重程度↑
更大的微生物群落多样性,表明群落中物种的数量更高,分布更均匀,与样本中当前认知功能更差以及未服用抗抑郁药的参与者抑郁严重程度更高有关。
认知功能差与双歧杆菌的相对丰度较低有关。
GABA↓ 抑郁症严重程度↑
在功能水平上,GABA 降解程度越高,基线抑郁症严重程度越高。
GABA 是一种主要的抑制性神经递质,抑郁症患者表现出较高的GABA降解和较低的 GABA 生物合成,GABA功能的减少在认知功能中起着至关重要的作用,影响抑郁和衰老过程中出现的症状,微生物衍生的GABA会影响全身的GABA 水平,并与行为和功能连接的变化相关。
未来认知能力下降 与下列因素有关:
未来抑郁症状的增加 与下列因素有关:
doi: 10.1038/s41380-024-02551-3
这是第一项纵向跨诊断研究,它代表着在精神病学、衰老和微生物组的交叉点上迈出了重要的一步。
微生物组可以预测未来的认知能力下降和抑郁症状,有可能为识别可能经历认知能力或情绪下降的人提供生物标志物。
literature 2
晚年抑郁中,总游离脂肪酸与肠道菌群组成和认知功能相关性的的中介分析
近日,来自浙江省人民医院精神病科康复医学中心廖峥娈团队的相关研究成果发表在《Lipids in Health and Disease》期刊上。这也是谷禾健康开放基金合作项目,一起来看一下。

晚年抑郁症是指60岁以上老年人出现的抑郁障碍,包括老年首发抑郁和老年复发的抑郁。该研究纳入来自老年抑郁认知结果队列研究的29名晚年抑郁症患者。
Spearman相关分析显示,Akkermansia丰度、总游离脂肪酸和MoCA评分之间存在显著相关性(P<0.05)。多元回归分析表明Akkermansia和总游离脂肪酸能显著预测MoCA评分(P<0.05)。
肠道微生物群、认知评估和脂质代谢指标之间的相关性
doi: 10.1186/s12944-024-02056-6.
调解分析显示,晚年抑郁症患者中Akkermansia相对丰度降低与认知功能下降的关系,部分由总游离脂肪酸介导(Bootstrap 95%CI: 0.023-0.557),占相对效应的43.0%。
肠道微生物群、脂质代谢产物和认知功能评分之间的相关性
doi: 10.1186/s12944-024-02056-6.
这些发现表明,晚年抑郁症中认知功能与Akkermansia及总游离脂肪酸存在显著关系。总游离脂肪酸部分介导了Akkermansia与认知功能之间的关系。
晚年抑郁症患者的认知功能与总游离脂肪酸呈负相关,尤其是视觉空间/执行功能。
游离脂肪酸作为非酯化脂肪酸,是甘油三酯分解的产物,具有脂毒性,可通过被动转运或蛋白介导的内吞作用进入大脑,从而影响血管内皮功能。它们被认为可预示II型糖尿病(T2DM)患者阿尔茨海默的发生。有研究报告,在II型糖尿病合并轻度认知障碍的患者中,游离脂肪酸与注意力和执行功能呈负相关。另有研究发现,健康人群中游离脂肪酸水平升高与认知功能下降相关。这些发现揭示了游离脂肪酸对晚年抑郁症患者认知功能的影响。
总游离脂肪酸在阿克曼症和认知功能之间关系中作用的中介模型
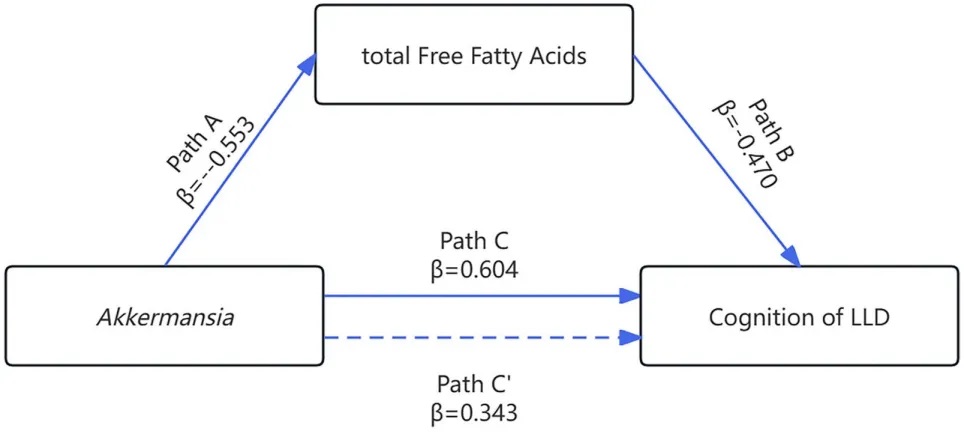
这是首次评估晚年抑郁症患者中认知功能、肠道菌群和脂质代谢关系的研究。这些结果有助于理解肠道微生物-宿主脂质代谢轴在晚年抑郁症认知功能中的作用。
literature 3
晚年抑郁症患者肠道微生物群失调和信息功能障碍的横断面观察分析
这项研究也是来自浙江省人民医院精神病科康复医学中心廖峥娈团队的,其相关研究成果已于近日发表在《Neuropsychiatric Disease and Treatment》期刊上。
这也是谷禾健康开放基金合作项目,该研究分析了晚年抑郁患者的肠道菌群特征和血清炎症细胞因子,探讨这两个因素在晚年抑郁潜在生物标志物中的联合作用。一起来看一下。

收集29名晚年抑郁患者和33名性别年龄匹配的健康对照(HC)的粪便样本和外周血,检测肠道菌群和12种炎症因子。
晚年抑郁症患者存在系统性炎症细胞因子水平升高和肠道菌群失调。
晚年抑郁症和健康对照的LEfSe分析
doi: 10.2147/NDT.S449224.
值得注意的是,IL-6、IFNγ、疣微菌门和Akkermansia水平与抑郁严重程度相关。
IL-6是神经元和胶质细胞表达的一种促炎症细胞因子,对免疫和急性期反应至关重要。有研究人员提出,高IL-6水平可促进5-羟色胺降解和减少5-羟色胺产生,从而损害神经可塑性,导致海马和前额叶萎缩等脑结构异常,这些异常已被证实与晚年抑郁症及其引起的认知障碍相关。与该研究一致。
IFNγ是一种参与中枢神经系统炎症的促炎因子,并激活大脑中的小胶质细胞以诱导促炎反应。研究表明,IFNγ激活的小胶质细胞改变了海马神经原生态位,抑制神经干细胞和祖细胞的增殖,并促进未成熟神经元的凋亡,从而导致小鼠的抑郁症状和认知障碍。该研究在临床上证实了这一观点,并证明IFNγ水平与晚年抑郁严重程度有关。简而言之,这项研究表明,晚年抑郁是一种促炎和抗炎细胞因子共存的炎症状态,IL-6和IFNγ与疾病严重程度有关。
既往研究发现,焦虑和抑郁患者中疣微菌门丰度降低,而Akkermansia丰度增加可降低焦虑,增强老年小鼠的认知功能。这与研究结果一致。回归分析显示,Akkermansia丰度是预测晚年抑郁概率的一个风险因素。但Akkermansia丰度与炎症因子水平无相关性,提示Akkermansia可能不通过炎症通路参与晚年抑郁的发病机制。
有趣的是,有研究发现,Akkermansia的外膜蛋白Amuc_1100可直接与TLR2结合,促进5-HT合成率限速酶Tph1的表达,并降低肠上皮细胞中5-HT转运体的表达,从而增加5-HT的生物合成和胞外可用性,这提示Akkermansia可能通过直接调节肠屏障的神经递质释放来影响晚年抑郁。
肠道菌群改变、临床变量和炎症因子之间的关联(Spearman相关分析)
doi: 10.2147/NDT.S449224.
研究确定了IL-6、Akkermansia和Sutterella为晚年抑郁症的预测因子,它们的组合在区分晚年抑郁症患者和健康对照方面的曲线下面积为0.962。
通过回归分析,Sutterella可作为预测晚年抑郁的指标。Sutterella是一种重要的肠道共生菌。既往研究发现,Sutterella丰度在重度抑郁和广泛性焦虑障碍患者中显著增加。许多研究也发现Sutterella与肥胖以及体重和脂肪增加呈正相关。
肥胖和抑郁之间存在双向关系,研究表明,促使垂体肾上腺皮质轴(HPA轴)过度激活、导致皮质醇失调可能是两者的共同机制。因此推测Sutterella可能通过影响HPA轴,从而影响皮质醇的释放,进而触发晚年抑郁的发生。
利用差异丰度属作为晚年抑郁症诊断因子的灵敏度和特异性的ROC曲线分析
doi: 10.2147/NDT.S449224.
这是一项横断面观察研究。该研究提供了晚年抑郁中肠道菌群和系统性炎症变化的证据。重要的是,将肠道菌群和炎症标志物结合使用,可以增强其作为晚年抑郁症潜在生物标志物的预测能力。这些发现有助于阐明肠道菌群和系统性炎症在晚年抑郁发展中的作用,并为临床实践中晚年抑郁的生物标志物提供新思路。
其他合并症相关的研究:
轻度认知障碍(MCI)在老年人中高度普遍,影响了大约10%的70-74岁老人和25%的80-84岁老人。此外,轻度认知障碍患者更有可能进展为痴呆。迄今为止,药物治疗只能减缓轻度认知障碍的进展,但不能逆转它。
注:轻度认知障碍、阿尔茨海默虽然都涉及认知功能下降,但严重程度有所不同,轻度认知障碍是认知功能较正常人有轻微下降,但日常生活功能基本正常。阿尔茨海默是认知功能严重下降,严重影响日常生活。
虽然对微生物群改变是否会影响认知功能仍有分歧,但正在进行的长期项目,如MOTION(衰老肠道的微生物群及其对人类肠道健康和认知的影响),研究健康老龄化的认知和微生物群变化,为解释清楚这些相互作用提供了希望。
表2 选择随机对照试验和观察性研究(2019-2023)
评估老年人认知功能和肠道微生物组

DOI: 10.1007/s11894-024-00932-w
痴呆症:促炎菌增多
2019 年的一项鸟枪法宏基因组序列研究将 57 名患有痴呆症(包括阿尔茨海默病)的疗养院居民与 51 名未患有阿尔茨海默或其他形式痴呆症的老年人进行了比较,结果发现痴呆症患者体内的促炎性肠道细菌水平较高。
阿尔茨海默:产丁酸菌减少,α 多样性降低
作者还注意到,与没有痴呆症的受试者和患有阿尔茨海默病以外的其他痴呆症的受试者相比,阿尔茨海默组中丁酸合成细菌的种类(例如丁酸弧菌属Butyrivibrio和真细菌属Eubacteria)有所减少。
随后的系统回顾和荟萃分析同样发现,与健康对照者相比,阿尔茨海默患者肠道微生物组的 α 多样性有所降低,但轻度认知障碍 (MCI) 患者与健康对照者之间的差异并未降低。
阿尔茨海默病、轻度认知障碍和健康样本之间微生物组组成的差异(即β多样性)并没有一致改变。研究与痴呆症相关的肠道微生物组的一个挑战是缺乏明确、客观和非侵入性的测试来最终确定诊断和疾病阶段,从而使研究结果的解释进一步复杂化。虽然超出了肠道微生物组的范围,但阿尔茨海默病脑组织的尸检研究已经确定了大脑内存在微生物,这表明存在与神经退行性疾病相关的大脑微生物组。
促炎Collinsella菌和APOE风险的强相关性
一项大型全基因组关联研究确定了几个与载脂蛋白E ε4 (APOE ε4) 基因高风险等位基因相关的微生物组属,载脂蛋白E ε4 是阿尔茨海默的一个公认的危险因素。这项研究的一些最重要的发现包括促炎Collinsella菌和 APOE 风险等位基因之间的强相关性,以及提出对Eubacterium fissicatena的保护作用。
帕金森病 (PD) 是另一种神经系统疾病,在老年人中更为常见,人们越来越关注肠道微生物组作为其生物标志物或治疗方法。
帕金森:产丁酸菌如Roseburia、粪杆菌减少
2020 年对来自日本、美国、芬兰、俄罗斯和德国的 16S 测序数据进行荟萃分析发现,帕金森病患者的Roseburia和粪杆菌相对减少,这两者都是丁酸盐的重要生产者。
帕金森:普雷沃氏菌里的致病菌种增加
2022 年对 490 名帕金森病和 234 名健康对照者进行的鸟枪法测序研究证实了这些发现,并确定了帕金森病患者中发生改变的其他几个属,例如普雷沃氏菌里的致病菌种增加。
帕金森:阿克曼氏菌属增加
有趣的是,多项研究指出,帕金森病患者中阿克曼氏菌属(AKK菌)的数量有所增加,考虑到阿克曼氏菌通常与健康衰老相关,并且在超级百岁老人中尤其丰富,这一点令人惊讶。一些科学家推测阿克曼氏菌是健康衰老的重要组成部分,但数量的增加使患者面临神经认知疾病的风险。
进一步假设,阿克曼氏菌丰度的变化可能继发于便秘的发生,便秘是帕金森病的常见胃肠道并发症,并且在多项其他研究中与阿克曼氏菌增加独立相关。由于帕金森病和阿克曼氏菌之间的联系是一个不一致的发现,因此需要进一步的研究来确定该属在帕金森病和更广泛的衰老中的确切作用。
在过度表达 α-突触核蛋白聚集体(PD 患者大脑中常见的现象)的帕金森病小鼠模型中,与移植有健康供体微生物群的小鼠相比,移植有 6 名人类帕金森病患者肠道微生物组的小鼠的身体运动障碍和便秘有所增加。
粪菌移植改善帕金森病患者便秘和神经系统症状
基于帕金森病微生物群改变的这些早期发现,一项随机对照试验发现,健康捐赠者的粪便以冻干药丸形式每周两次服用,持续 12 周,可以改善便秘和肠道蠕动,并暂时提高轻度至中度帕金森病患者的客观运动技能。虽然仍需要大量的转化和临床数据开发,但这些初步发现表明肠道微生物组调节可能改善帕金森病的胃肠道和/或神经系统症状,并提供对疾病病理生理学的更深入了解的希望。
需要更多协助完成日常活动(ADL)的老年人,可能会从社区生活过渡到长期护理机构。这种迁移会由于环境、饮食和医疗因素的推测变化而导致微生物群的变化。
在一般成年人群研究中,家庭表面的微生物与肠道微生物群组成相关,这在过渡到长期护理环境时需要考虑。此外,老龄化和接触医疗机构(如长期护理机构)都与艰难梭菌感染(CDI)的风险增加有关,CDI是医疗相关性炎性腹泻的主要原因。
无论年龄如何,都有强有力的证据表明,特定的饮食可以引起微生物组的独特改变以及相应的血清和粪便代谢物的变化。
相对而言,高纤维受试者微生物组恢复能力最好
一项严格对照的研究跟踪了 30 名受试者,他们被随机分为纯素食(高纤维)、杂食(中纤维)和配方饮食(无纤维)。 6 天后,受试者接受口服抗生素和聚乙二醇的组合进行“肠道净化”。
研究人员发现,与其他群体相比,纯素食受试者的微生物组在“净化”后恢复得更快,在更短的时间内恢复了更大的多样性。另一方面,坚持配方饮食的受试者的恢复期最长。
不同生活方式下,微生物多样性的差异
在一项横断面研究中,将以前未接触过的亚诺马米美洲印第安人的肠道微生物组与居住在美国和和半跨文化人群的个体微生物组进行了比较,与美国人相比,亚诺马米人的肠道微生物群多样性明显更高,而半跨文化人群的多样性水平居中。然而,值得注意的是,不仅仅是饮食,其他社会和医学因素,也可能导致多样性增加。
从社区生活转向长期护理机构,饮食变化如何影响肠道菌群及功能?
微生物组中与年龄相关的变化的一个组成部分似乎与饮食和进食明确相关,特别是因为老年人在获取营养食物方面,出现牙列不良或咀嚼困难、食欲下降以及缺乏社会支持的风险增加。
例如,会导致微生物组改变的最显著的饮食变化之一,是从独立的社区生活转向长期护理机构内的辅助生活。
这种转变通常会导致从高纤维、低脂肪饮食向低纤维、高脂肪饮食的转变,与社区居民相比,长期护理居民的微生物组多样性较低。值得注意的是,这些长期护理居民和社区居民之间的差异与长期护理所花费的时间相关。
在消化过程中,纤维被代谢为短链脂肪酸,它可以作为保护性微生物群的能量来源,协助抗炎反应并维持肠道屏障完整性,从而为胃肠道带来许多好处。因此,转移到长期护理机构时因饮食改变而导致的短链脂肪酸缺乏,可能会间接导致肠道功能障碍。
营养不良住院老年人的肠道菌群紊乱和临床结果
营养不良是住院患者尤其是老年人中最普遍和最具威胁性的综合征之一。营养不良表现为身体成分改变和生物功能减弱,导致体力下降和恢复速度减慢。此外,它降低了对医疗干预的耐受和反应能力,使受影响的人容易出现并发症和预后较差。
一项研究对来自入院时和住院 72 小时评估的前瞻性队列中的 108 名急性重症老年患者进行了二次纵向分析。收集了临床、人口统计、营养和 16S rRNA 基因测序肠道微生物群数据。

严重营养不良患者α多样性较差
与住院期间营养良好的患者相比,营养不良患者 (51%) 的微生物群组成不同 (ANOSIM R = 0.079,P = 0.003)。
严重营养不良患者在入院时(Shannon P = 0.012,Simpson P = 0.018)和随访时(Shannon P = 0.023,Chao1 P = 0.008)表现出较差的α多样性。
营养不良与特定菌群的关联
Lachnospiraceae NK4A136组、Subdolilegum和普拉梭菌的差异丰度显着降低,与营养不良呈负相关,而棒状杆菌(Corynebacterium)、Ruminococcaceae Incertae Sedis和Fusobacter的差异丰度显着升高,与营养不良呈正相关。
棒状杆菌(Corynebacterium)、Ruminococcaceae Incertae Sedis及其总体组成是住院期间营养不良患者重症监护的重要预测因子。
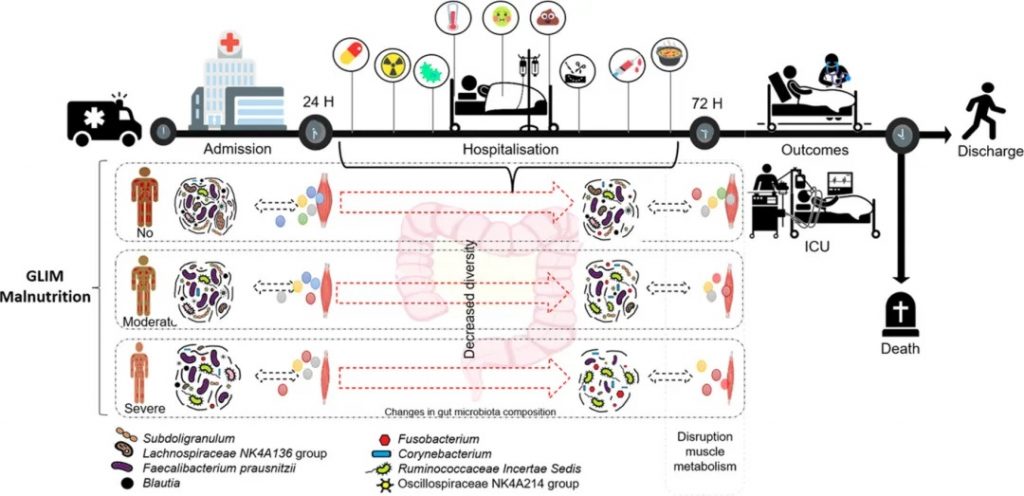
doi.org/10.1016/j.nut.2024.112369
总的来说,营养不良的老年急症患者肠道菌群组成不同,多样性较差,潜在有益菌丰度较低,住院期间机会致病菌增多。 “营养不良的肠道微生物群”可能能够预测不良的医院结果。为与疾病相关的营养不良进行更大规模的临床研究和临床前机制探索开辟了新的视角。
★ 地中海饮食
除了特定的补充剂外,某些饮食也与肠道健康有关。地中海饮食由植物性食品、全谷物和健康脂肪组成,已被证明可以预防所有年龄段的心血管疾病,这种饮食的影响可能是由肠道微生物组介导的。
一项研究发现,坚持地中海饮食至少一年,肠道内的普氏杆菌、人型杆菌、直肠杆菌、埃里根杆菌、嗜木杆菌、多形杆菌、普氏杆菌、哈德鲁斯杆菌相对增加。此外,坚持饮食还与认知功能的改善相关,以及高敏 C 反应蛋白 (hsCRP) 和IL-17水平等全身炎症标志物的降低。
饮食习惯(尤其是地中海饮食)与肠道菌群和衰老病理生理学方面的联系机制
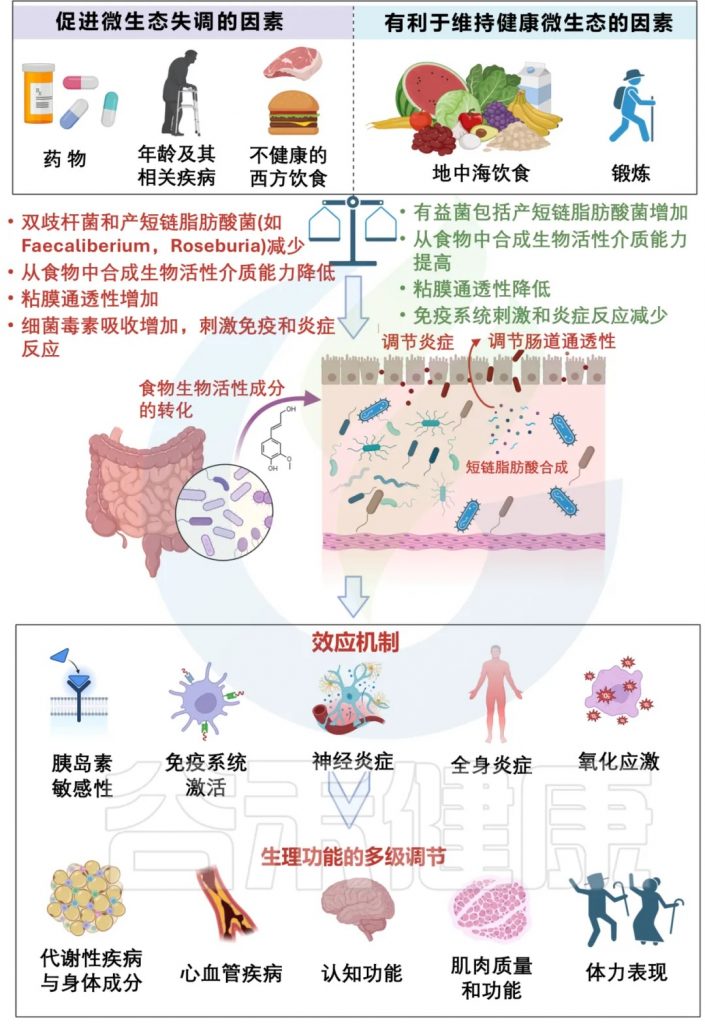
doi.org/10.1007/s40520-024-02707-9
如何理解肠道微生物群介导的地中海饮食抗衰老作用?
短链脂肪酸的微生物合成
患有虚弱、肌少症、认知能力下降的老年人肠道微生物组的一个关键特征,是产短链脂肪酸的菌减少,包括普拉梭菌、罗氏菌属、丁酸弧菌属(Butyrivibrio)、琥珀酸弧菌属(Succinivibrio)等。而身体健康的百岁老人粪便中短链脂肪酸水平通常高于 60-70 岁的受试者。
地中海饮食刺激短链脂肪酸合成细菌生长和提高短链脂肪酸的能力很重要,然而,肠道细菌有效释放短链脂肪酸的功能能力不仅取决于饮食中的纤维含量,还取决于细菌之间复杂的交叉喂养相互作用以及细菌与宿主之间的相互作用,例如,只有在肠道环境中存在大量双歧杆菌的情况下,普拉梭菌才能产生足够的丁酸。
注:丁酸可以促进肠道粘膜完整性;调节炎症反应;改善胰岛素抵抗,并具有整体促合成代谢功能。
降低肠粘膜通透性
衰老,即使具有健康的活动模式,也与肠通透性增加相关,血清生物标志物连蛋白水平升高就证明了这一点。荟萃分析表明,虚弱者的血清连蛋白水平平均高于健康老年受试者,反映出肠粘膜屏障功能的逐渐丧失。这种情况与健康或患有慢性阻塞性肺病和痴呆等慢性疾病的老年受试者的骨骼肌力量丧失、肌少症等有关。
肠粘膜通透性增加与细菌毒素(包括脂多糖LPS)增加有关,这些化合物激活先天免疫反应和适应性免疫的抗原刺激,最终导致典型的衰老和虚弱的持续性亚临床炎症,也就是炎症衰老。 LPS 毒素增加在与年龄相关的认知衰退和阿尔茨海默病的病理生理学中起着关键作用,并且被认为是肠-脑轴失调的主要原因之一。
在患有慢性疾病的成年受试者和老年人中,较高的地中海饮食依从性与胃肠粘膜通透性生物标志物和循环 LPS 水平呈负相关。
食品生物活性物质的生物转化
地中海饮食中通常建议大量摄入水果和蔬菜、全麦谷物、坚果、豆类和特级初榨橄榄油,这其中含有丰富的多酚或酚类化合物,膳食多酚和肠道微生物组之间的相互作用能够产生多种具有抗衰老作用的生物活性代谢物,特别是在骨骼肌和中枢神经系统水平上。
尿石素 A、异尿石素 A 和尿石素 B 是肠道微生物在摄入鞣花酸和鞣花单宁(核桃、石榴和草莓中常见的多酚)后释放的代谢物。
尿石素 A 的潜在抗衰老作用包括:改善肌肉力量和运动耐力、调节神经炎症和细胞凋亡并改善认知、促进胰岛素敏感性、调节脂质代谢和炎症反应。
地中海饮食与尿液中尿石素排泄的平均增加有关,即使分析没有考虑代谢型。同样,在两个不同的随机对照试验中,尿石素的尿液排泄与内脏脂肪减少和磁共振测量的海马占用评分显着相关,这些随机对照试验测试了长期地中海饮食干预的效果。
除鞣花单宁外,肠道微生物群衍生的多酚亚类代谢型鲜为人知。在饮食中摄入黄烷酮(一种特别以柑橘为代表的多酚亚类)后,已确定了橙皮苷的高排泄者和低排泄者。橙皮苷具有抗氧化、抗炎和促合成代谢作用,促进肌肉蛋白合成并减少阿尔茨海默病动物模型中的淀粉样蛋白沉积和神经炎症。
在一项测试地中海饮食对2型糖尿病受试者的影响的干预研究中,12周后检测到橙皮苷和其他黄烷酮衍生物的血浆水平增加,炎症生物标志物显著减少。
同样,雌马酚是大豆异黄酮大豆苷元肠道生物转化后释放的生物活性化合物,但它仅由一部分具有特定微生物特征的群体产生。雌马酚在体外表现出针对痴呆症发作的神经保护作用,但在体内,只有在存在雌马酚产生微生物组代谢型的情况下,它才与更好的认知表现相关。
多酚对衰老过程中肠道菌群的影响

doi.org/10.3390/nu16071066
扩展阅读:
★ 高脂肪和高钠的西方饮食
小鼠研究还表明,高脂肪和高钠的西方饮食会导致肠道微生物组的“预测年龄”增加,该模型基于对雄性 C57BL/6 J 小鼠进行贝叶斯模型训练,这些小鼠的微生物组从第 9 周起就已被表征到生命第 112 周。一旦小鼠恢复标准饮食,这些微生物组紊乱就会逆转。因此,鉴于老年人易受认知能力下降和不健康衰老的影响,评估老年人肠道微生物群和临床结果的干预性饮食研究很有意思。
★ 模拟禁食饮食
模拟禁食饮食(FMD)是一种日益流行的热量限制模式。研究人员发现模拟禁食饮食显著延长了过早衰老小鼠的寿命。在自然衰老的小鼠中,模拟禁食饮食改善了认知和肠道健康。
在肠道中,模拟禁食饮食循环增强了肠道屏障功能,减少了衰老标志物,并维持了固有层粘膜中 幼稚T细胞的记忆平衡。模拟禁食饮食重塑了肠道细菌组成,显著增加了约氏乳杆菌Lactobacillus johnsonii的丰度。模拟禁食饮食作为一种抗衰老干预手段,具有进一步研究的价值。
粪便菌群移植(FMT)是一种越来越多地被纳入复发性艰难梭菌治疗的疗法,并且还针对炎症性肠病和抗生素后菌群失调进行了研究。这使得研究人员猜测是否可以将来自年轻健康捐赠者的微生物组移植到老年人体内,以逆转不健康衰老的一些影响。
粪菌移植用于延缓衰老和改善认知功能
一项研究证明,“老年”微生物组从老年小鼠转移到年轻小鼠会导致多种与年龄相关的表型,包括晚期中枢神经系统恶化和视力缺陷。重要的是,在一组相关实验中,用年轻小鼠的粪便进行微生物组移植后,老年小鼠的年龄相关变化得到改善。这项工作提供了强有力的临床前证据,表明年轻和老年小鼠之间的微生物组特征不仅不同,而且这些微生物组的相关生理效应是可转移的。其他研究人员也重复了这些和类似的发现,证明将老年小鼠的微生物组转移给年轻小鼠可能会导致认知缺陷。
粪菌移植在早衰症模型研究中的应用
早衰症是一种特别独特的疾病,可以用来研究微生物组和衰老,因为受影响的个体携带编码层粘连蛋白 A 的基因突变,从而导致快速衰老。尽管出生时外观正常,受影响的个体通常会在青少年或成年早期出现致命的疾病并发症,主要是心血管疾病。
菌群移植延长小鼠寿命并逆转肠粘膜变薄
早衰症小鼠模型研究表明,在早衰小鼠模型中发现肠道微生物群中变形菌和Cyanobacteria丰度增加,疣微菌丰度减少。某些人类百岁老人富含的细菌菌株,例如Akkermansia muciniphila,可以通过移植来延长小鼠寿命并逆转肠粘膜变薄。
接受长寿菌群小鼠α多样性↑ 产短链脂肪酸菌↑
与普通老年组的小鼠相比,接受长寿个体肠道微生物群的小鼠表现出更长的小肠绒毛、更低的脂褐质和β-半乳糖苷酶(衰老标志)的积累;更高的α多样性,乳酸杆菌、双歧杆菌和产短链脂肪酸菌丰度更高。
恢复外周免疫,改善记忆、学习和行为缺陷
通过粪菌移植,老年小鼠部分恢复了外周免疫(尤其是肠系膜淋巴结免疫细胞)并改善了海马小胶质细胞的缺陷。小鼠海马代谢组(包括维生素 A、GABA、Neu5Gc、精氨酸和相关途径)和谷氨酰胺合成酶表达发生有益变化,从而改善与年龄相关的记忆、学习和行为缺陷。
尽管这些发现仍处于临床前阶段,但它们为使用年轻捐赠者的 FMT 或其治疗成分来逆转不健康衰老的某些方面带来了希望。
扩展阅读:
随着年龄的增长,老年人的饮食习惯通常会发生变化,这会导致微生物组的变化。与衰老相关的饮食变化中研究最多的一项是纤维摄入量的减少。然而,补充纤维的临床试验在微生物群组成和炎症状态的变化方面产生了相互矛盾的结果,一些研究人员假设饮食干预和补充剂的功效可能取决于宿主的初始微生物组特征。
阿拉伯木聚糖
在一项对 21 名 60 岁以上健康志愿者进行的双盲交叉试验中,他们补充了麦麸衍生的阿拉伯木聚糖,结果发现,所产生的微生物组组成因受试者最初的普雷沃氏菌丰度而异。尽管有限,但这些研究结果表明,需要采取个体化的方法来操纵微生物组,并且需要检测患者的初始微生物组,以调整实现预期结果所需的干预措施。
益生菌干预措施已在老年人中进行了专门研究。可惜,与一般人群的研究类似,临床可操作数据的生成因研究产品和结果的巨大异质性以及大量动力不足的研究而受到抑制。虽然尚未发现单一或组合的益生菌能够明确改善或逆转衰老迹象,但越来越多的研究正在评估特定的微生物菌株及其对客观生理效应的影响。
罗伊氏乳杆菌ATCC PTA 6475
在一项双盲、安慰剂对照研究中,骨矿物质密度较低的老年女性补充罗伊氏乳杆菌ATCC PTA 6475 可改善胫骨总体积 BMD (vBMD)。
干酪乳杆菌
在衰老加速SAMP8小鼠模型中,益生菌干酪乳杆菌代田株(Lactobacillus casei Shirota)的给药可减少与年龄相关的肌肉退化和线粒体功能障碍。
研究发现补充干酪乳杆菌 LC122或长双歧杆菌 BL986可改善小鼠外周组织氧化应激和炎症反应,增加海马神经变性和神经营养因子表达,并增强学习和记忆能力。
乳杆菌和双歧杆菌等细菌以光保护方式与真皮成纤维细胞结合,表现出抗衰老特性。
在人类中,一些小型但双盲随机对照试验已经确定了特定的益生菌改善老年人的认知功能,尤其是包括双歧杆菌和乳杆菌在内的益生菌。因此,随着对微生物组操纵和客观健康措施之间更加严格理解的发展,益生菌疗法可能需要定制微生物混合物,以针对个性化护理方法中的特定缺陷或状况。
扩展阅读:
多项研究报告了实施锻炼计划后肠道微生物组发生了变化,早期结果表明老年人群中也是如此。
2020 年的一项研究利用美国肠道项目的粪便样本,其中还包括患者报告的体重指数和运动习惯信息。该研究包括 1,589 名具有健康 BMI(18.5 ≤ BMI ≤ 25)的成年人(年龄 18-60 岁)和 897 名老年患者(年龄 > 60)的样本,他们根据 BMI 进一步分层为正常体重(n = 462),超重(BMI > 25,n = 413)和体重不足(BMI < 18.5,n = 22),并按运动频率分层。
研究人员发现,随着老年患者运动频率的增加,基于特定分类群和常见途径的相对丰度,老年患者的微生物组越来越接近健康BMI成年人的微生物组。例如,与不运动的老年人相比,运动的老年人中放线菌的相对丰度有所增加,并接近健康体重指数成年人的水平。此外,运动的老年患者的Cyanobacteria相对丰度有所下降,再次接近健康体重指数成人的水平。然而值得注意的是,Cyanobacteria产生的毒素如 β-N-甲基氨基-l-丙氨酸 (BMAA) 与阿尔茨海默病和渐冻症等神经退行性疾病有关。
一项小型研究中,招募了 15 名久坐的老年患者(50-75岁),参加一项为期 24 周、每周三次的心血管和阻力运动计划,干预前后收集粪便样本进行16S测序。研究人员观察到,经过 24 周的锻炼计划后,双歧杆菌的相对丰度有所增加,丁酸盐水平也有所增加。考虑到双歧杆菌在极端衰老和改善认知功能中的作用,这些研究结果表明,与运动相关的健康益处也可能是通过肠道微生物组介导的。
虽然有这些结果,但运动时的微生物组变化也存在显著的个体差异。此外,当前的许多研究没有对照组、缺乏严谨性和/或样本量较小。未来的研究需要确定运动与健康的衰老微生物群之间是否确实存在关系,以及可以影响肠道微生物群的体育活动类型。
扩展阅读:
一项研究观察艾灸“足三里”对亚急性衰老模型大鼠氧化应激和肠道菌群的影响,足三里组艾灸双侧“足三里”,每日 1 次,每次每穴 3 壮,连续 28天。
与模型组比较,足三里组大鼠Chao1、Shannon指数升高(P<0.01,P<0.05)。经艾灸干预后大鼠肠道菌群多样性改善。
与模型组比较,足三里组厚壁菌门、密螺旋体属_2相对丰度降低 (P<0.01),拟杆菌门、乳杆菌属、普雷沃氏菌科UCG-003相对丰度及B/F值升高 (P<0.05,P<0.01)。
注:
与模型组比较,足三里组大鼠血清SOD(血清超氧化物歧化酶)含量增加(P<0.01),MDA(丙二醛)含量减少(P<0.01)。
艾灸“足三里”可有效改善衰老大鼠氧化应激水平,调节肠道菌群结构,维持肠道菌群微生态平衡,从而起到延缓衰老的作用。
肠道菌群在预测及辅助治疗的应用
肠道微生物组可预测晚年的认知功能和抑郁症状;肠道微生物群和炎症标志物的组合,可能成为老年抑郁症的潜在生物标志物,具有更强的预测力。这些发现为老年认知下降和抑郁症的诊断和治疗提供了新的策略方向。
总游离脂肪酸在Akkermansia和认知功能之间的重要中介作用,为肠道微生物-脂质代谢轴在晚年抑郁症认知功能中的作用提供了新的视角。
营养不良的老年人肠道菌群可能能够预测不良的临床结果,肠道微生物群及其与宿主的相互作用,可能成为辅助个性化治疗/预防干预的新兴目标,有助于优化传统疗法的疗效。
基于肠道菌群的干预
益生菌、粪菌移植等方法,可能通过调节肠道菌群,改善免疫功能,为衰老提供新的解决方案。
地中海饮食中的多酚因其抗炎、抗氧化和免疫调节作用,与肠道微生物群的复杂互作也日益受到重视,多酚化合物可能是抵御这些与年龄相关表观遗传变化的关键。未来有望通过多酚化合物调节肠道菌群,利用生物活性化合物的功能属性,巧妙地调节和重新调整与衰老相关的过程。
随着对肠道菌群的研究不断深入,这些都可能成为未来抗衰老领域的突破口。
主要参考文献
Kolobaric A, Andreescu C, Jašarević E, Hong CH, Roh HW, Cheong JY, Kim YK, Shin TS, Kang CS, Kwon CO, Yoon SY, Hong SW, Aizenstein HJ, Karim HT, Son SJ. Gut microbiome predicts cognitive function and depressive symptoms in late life. Mol Psychiatry. 2024 Apr 25.
Chen Y, Li J, Le D, Zhang Y, Liao Z. A mediation analysis of the role of total free fatty acids on pertinence of gut microbiota composition and cognitive function in late life depression. Lipids Health Dis. 2024 Feb 29;23(1):64.
Chen Y, Le D, Xu J, Jin P, Zhang Y, Liao Z. Gut Microbiota Dysbiosis and Inflammation Dysfunction in Late-Life Depression: An Observational Cross-Sectional Analysis. Neuropsychiatr Dis Treat. 2024 Feb 27;20:399-414.
Chen LA, Boyle K. The Role of the Gut Microbiome in Health and Disease in the Elderly. Curr Gastroenterol Rep. 2024 Apr 20.
Muñoz-Fernandez SS, Garcez FB, Alencar JCG, Bastos AA, Morley JE, Cederholm T, Aprahamian I, de Souza HP, Avelino-Silva TJ, Bindels LB, Ribeiro SML. Gut microbiota disturbances in hospitalized older adults with malnutrition and clinical outcomes. Nutrition. 2024 Jun;122:112369.
Wu YL, Xu J, Rong XY, Wang F, Wang HJ, Zhao C. Gut microbiota alterations and health status in aging adults: From correlation to causation. Aging Med (Milton). 2021 Jun 24;4(3):206-213.
Pereira, Q.C.; Fortunato, I.M.; Oliveira, F.d.S.; Alvarez, M.C.; Santos, T.W.d.; Ribeiro, M.L. Polyphenolic Compounds: Orchestrating Intestinal Microbiota Harmony during Aging. Nutrients 2024, 16, 1066.
Wang XM, Fan L, Meng CC, Wang YJ, Deng LE, Yuan Z, Zhang JP, Li YY, Lv SC. Gut microbiota influence frailty syndrome in older adults: mechanisms and therapeutic strategies. Biogerontology. 2024 Feb;25(1):107-129.
Wang Q, Xu J, Luo M, Jiang Y, Gu Y, Wang Q, He J, Sun Y, Lin Y, Feng L, Chen S, Hou T. Fasting mimicking diet extends lifespan and improves intestinal and cognitive health. Food Funct. 2024 Apr 22;15(8):4503-4514.
Wang Y, Qu Z, Chu J, Hun S. Aging Gut Microbiome in Healthy and Unhealthy Aging. Aging Dis. 2024 Apr 9.
谷禾健康
大脑健康,其实是我们每个人日常生活质量的关键所在。从决策到记忆,从情绪管理到社交互动,大脑在我们生活中扮演着不可或缺的角色。
近年来,科学研究逐渐揭示大脑健康、神经发生与神经营养素以及肠道菌群之间存在着密切的联系。
研究人员逐渐认识到,大脑在一生中不断通过形成新的神经连接来进行自我重组。大脑中新神经元的诞生被称为神经发生。现在科学认为,大脑在一生中不断自我重组并创造新的脑细胞。
神经生长因子 (NGF) 是一组称为神经营养因子的类蛋白质小分子之一,负责神经发生或新神经元的发育以及成熟神经元的健康和维持。
根据动物研究结果,研究人员认为神经生长因子可能促进神经元和轴突的生长、维持和存活。它还被认为有助于修复髓鞘,髓鞘是轴突周围的绝缘涂层。
动物实验发现,随着大脑中神经生长因子产生的减少,动物形成新连接以及保留和访问记忆的能力就会受到损害。神经生长因子可能会挽救退化的神经并帮助恢复其功能,但缺乏人体数据。
神经营养素有的像是ω-3脂肪酸这样分子,给大脑细胞补充能量,让其更加强健;有的则像是维生素E和C这样的抗氧化剂,为大脑提供了一层无形的护盾,对抗那些想要损害大脑的自由基;还有的,比如B族维生素,它们确保大脑的能量供应,让我们的思维更加敏捷。
肠道菌群是肠道中的居民,它们与大脑通过“肠-脑轴”的紧密相连。肠道菌群可以通过多种机制影响大脑功能,包括通过调节免疫系统、产生神经递质以及影响神经发生。不健康的肠道菌群组成可能会导致炎症的增加,从而影响大脑健康,增加患有情绪障碍和神经退行性疾病的风险。“肠-脑轴”让我们的大脑和肠道可以互相传递信息,这导致吃进肚子里的食物,能影响我们的情绪和思维。
科学家们通过不断的研究,揭示了这些微生物如何帮助我们的大脑保持年轻和活力。例如,补充ω-3脂肪酸可以改善记忆力,抗氧化剂的摄入与减缓认知衰退有关。
本文我们来了解一下神经发生、神经营养素、神经营养因子及其与肠道菌群的关联等,通过了解这些关键的生物学概念及其相互作用,可以采取措施维持肠道微生物群的平衡,可以为大脑提供必要的支持,提高认知能力,有效减缓认知衰退,从而保持其长期的活力和健康。

神经发生,或称神经元发生,是指在成年大脑中新的神经元(神经细胞)的形成过程。
成年大脑定型了吗?
长期以来,科学家们曾认为成年人的大脑不再能够产生新的神经元,也就是说大脑的结构和功能一旦在儿童时期和青少年时期形成之后便定型,不会有太大的变化。
然而,近年来的研究发现,成年大脑确实能够通过神经发生产生新的神经元,尤其是在海马区和嗅球区等特定区域。这一发现不仅挑战了以往的认知,也为理解大脑的可塑性、学习记忆机制以及大脑疾病的治疗提供了新的视角。

神经发生对大脑健康的影响和意义是多方面的
首先,它是大脑适应环境变化、学习新知识和技能的基础。新的神经元能够形成新的神经网络,增强大脑的处理能力和记忆存储能力。例如,在学习和记忆过程中,海马区的神经发生是非常重要的。
其次,神经发生对情绪调节和应对压力也有重要作用。研究表明,抑郁症和焦虑症患者的海马区神经发生水平较低,而适当的运动和抗抑郁治疗可以促进神经发生,改善情绪。
然而神经发生并非在所有情况下都是有益的
在某些脑部疾病,如癫痫,过度的神经发生可能导致异常的神经网络形成,引发病症的加剧。因此,如何在促进神经发生的同时,维持神经网络的稳定性和功能性,是当前研究的一个重要课题。
生活方式对神经发生也有显著影响
研究发现,规律的身体锻炼、充足的睡眠、健康的饮食习惯、积极的社交活动、一些草药和补充剂例如褪黑激素、尿苷等都能够促进成年大脑的神经发生。相反,长期的压力、抑郁、睡眠不足以及不健康的生活方式则可能抑制神经发生。
总之,神经发生是大脑适应环境变化、学习和记忆、以及情绪调节的一个重要机制。了解和促进神经发生的过程,不仅对于提高个体的认知功能和情绪健康有重要意义,也为治疗各种神经系统疾病提供了新的策略和方法。随着科学研究的深入,相信在未来,通过调控神经发生,人类将能更好地维护大脑健康,提高生活质量。
大脑可以看做是一座正在建设中的超级城市,而神经营养素就是那些建设这座城市所需的原材料和工人。这些营养素通过一系列精妙的机制,共同打造出一个健康、功能强大的大脑。
那这些机制是如何运作的呢?
“大脑城市”的基础工程:细胞外基质分子及受体
首先,有些像是建筑工地上的脚手架和信号旗,细胞外基质(ECM)分子及其受体(比如层粘连蛋白和纤连蛋白)为神经元提供结构支持和方向指示。它们确保神经元能够正确生长和相互连接,就像确保城市中的道路和桥梁精准对接一样。
“大脑成长”的营养奶粉:关键营养素
假如说这座城市还是个婴儿城市,那它在成长的早期阶段需要大量的“营养奶粉”,这里指的是蛋白质、能量、长链多不饱和脂肪酸、维生素和矿物质。这些营养素保证了城市(也就是我们的大脑)的健康发育,为神经细胞的生长、分化提供能量和原料。
而微量元素,比如铁、锌和碘,就像是城市中的微型工程队,它们在大脑发育中扮演着至关重要的角色。铁负责运输“氧气”,锌则负责“通信系统”的建设,保证城市运转顺畅。
“大脑城市”规划师与交通系统:神经营养因子与神经活动的调节
还有前面说到神经营养因子,如NGF和BDNF,它们就像是城市规划师和建筑师,指导神经元如何成长和相互连接,确保大脑城市的设计既清晰又实用。
神经活动的调节作用就像城市中的交通系统,根据需要调整道路和信号灯,以保证信息流动的顺畅和效率,从而促进大脑的可塑性和学习能力。
脂质在这个比喻中,可以看作是提供能量和材料的重要来源,帮助城市中的建筑物更加坚固,同时保证城市的能源供应。
生命早期的营养对这座城市的未来有着长远的影响。正确的营养摄入不仅能促进城市的健康成长,还能避免未来出现结构和功能的问题,确保城市居民(即我们的神经细胞)能够快乐、健康地生活。
这些神经营养素和它们的作用机制共同努力确保了我们的大脑能够健康成长,展现出最佳的功能。
试想一下,你的大脑始终处于工作的状态——调整呼吸和心跳、接收和处理信息、产生思想和调控运动等,即使你在睡觉时,它依然在24小时全天候工作。这就意味着你的大脑需要持续稳定的燃料供应,而这种“燃料”正是来源于你每天所吃的食物。
相比于其他身体部位,大脑消耗大量的能量。虽然人的大脑仅仅占人体重量的2%,但它所消耗的能量可占总能量的20-25%。因此,从食物到大脑神经元的能量转移所涉及的机制可能是调控脑功能的基础,能量代谢紊乱可直接影响大脑功能。
过去人们对食物的认知,还停留在为人体提供能量和提供构造身体的原料。现在越来越多的证据表明,某些营养素的摄入不足或过量都可直接影响神经健康,从而影响大脑的结构和功能,并最终影响认知和情绪。
如果把大脑想象成一个超级复杂的宇宙,神经营养素则是其中的超级英雄,守护着我们的认知功能——记忆、学习能力,乃至抵御神经退行性疾病的侵袭。但这并不简单,因为这些超级英雄的力量来源,也就是我们的饮食模式和营养素摄入量是可变的,有时候也可能成为我们的隐形敌人。
首先,看下反面角色。
高脂肪和高糖的饮食模式,就像是给大脑施加了一个沉重的负担,特别是在海马体这个与学习和记忆密切相关的区域,它们会导致突触功能障碍和神经可塑性的减退。
但也有积极的力量。膳食脂质,比如磷脂和鞘脂,是认知功能的守护者,通过影响我们肠道的微生物组成,它们以一种隐秘的方式保护着我们的认知健康。
优质脂肪
起初,大家认为脂肪对心血管系统功能有影响;但最近的研究显示,有益的膳食脂肪更对大脑有直接的作用,包括:
抗氧化维生素如β-胡萝卜素、α-生育酚以及叶酸,可以抵御认知功能的衰退。
植物营养素
类胡萝卜素是食物中的色素,让水果和蔬菜呈现色彩,如黄色、红色和橙色等。
植物营养素家族中一些较有影响力的成员,叶黄素和玉米黄质,相比有益大脑的功效,它们支持眼睛健康的效果更熟为人知。这些营养素与正常健康的认知功能有关。
大脑也需要其它营养素。它们是帮助保护大脑免受氧化压力损伤的抗氧化成分,可以尝试以下食物:
胡萝卜、南瓜、菠菜、红薯、红甜椒、番茄、羽衣甘藍等。
而当谈论营养状况对认知能力的影响时,B族维生素、维生素D、E和omega-3脂肪酸的摄入量成了关键角色。它们是大脑宇宙中的正能量,但过量摄入又可能适得其反,成为负面力量,引发高血压和血糖控制不佳等问题。
图源:askthescientists
Omega-3脂肪酸在促进大脑发育和维持大脑正常功能方面起着重要作用,其中DHA还是神经细胞膜的重要成分。人体无法自行合成Omega-3脂肪酸,因此这属于人体必需脂肪酸,这意味着这些重要脂肪酸的唯一来源是我们所摄入的食物。
Omega-3脂肪酸的主要来源是多脂鱼类,包括:
三文鱼、沙丁鱼、鲱鱼等。其中主要以DHA和 EPA的形式存在。
研究表明,多摄入DHA和EPA对认知功能具有保护作用;还可帮助改善患有轻度认知障碍人群的认知功能。
胆碱
胆碱在人体中具有多种重要功能。胆碱可与磷脂结合成磷脂酰胆碱,是大脑和神经元细胞膜的重要组成成分。同时,它也是神经递质——乙酰胆碱的前体分子,对神经信息传递起着重要作用,可控制人的运动、记忆和情绪等。
胆碱的缺乏还与某些肝脏疾病和神经系统疾病的发生有关。
可以选择一些食物如:
叶酸和维生素B12
叶酸(维生素B9)和维生素B12对于生命早期的神经发育至关重要,孕期如果缺乏这两种营养素,可能会导致胎儿神经管发育畸形。
血液中同型半胱氨酸水平过高可增加认知功能减退和患痴呆症的风险,而叶酸和维生素B12可降低血液中同型半胱氨酸的水平,从而降低认知功能减退和患痴呆症的风险。
缺乏叶酸可导致神经和认知问题
临床试验结果显示叶酸补充剂本身或与其它维生素(B6和B12)结合一起服用,可在衰老过程中有效维持健全的认知功能。
可以选择以下这些食物:

维生素C和维生素E
维生素C和维生素E 作为抗氧化营养素,可保护神经免受氧化损伤。此外,大脑神经元中需要保持一定水平的维生素C才能维持大脑的正常功能。因此,食用富含维生素C的食物可以帮助延缓因年龄增长而导致的认知功能退化。
一些维生素C含量较高的食物
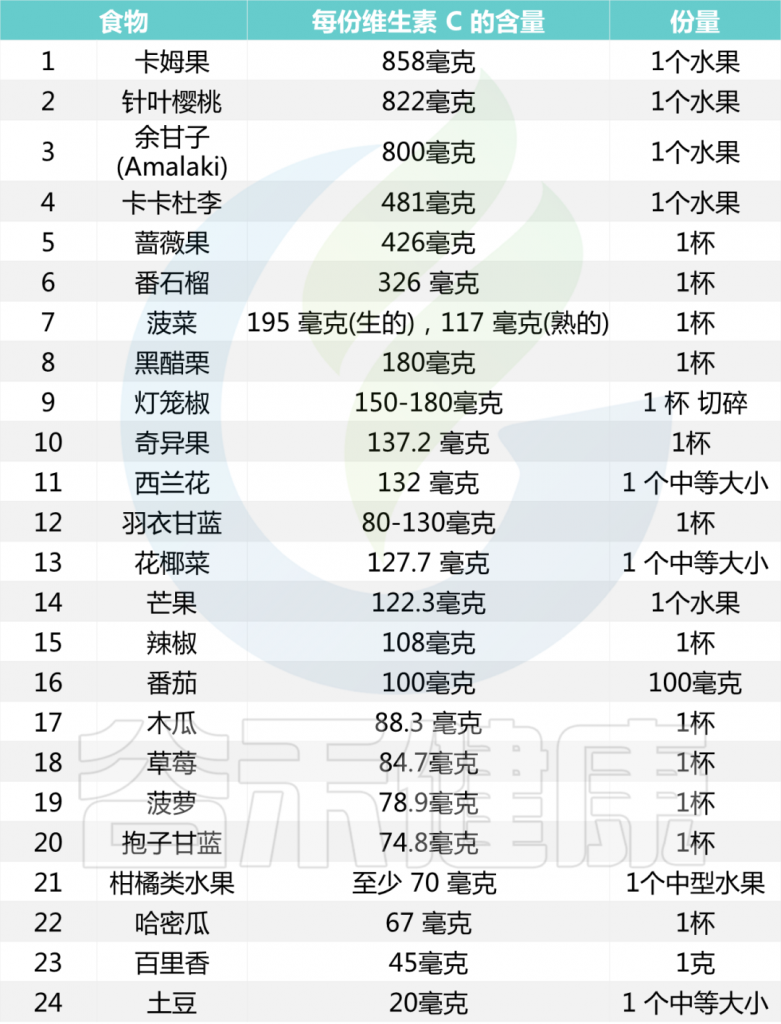
注:单位“杯”是一个常见的非正式计量单位,美规和英规略有区别,大约是237毫升-250毫升左右,涉及到果蔬的份量时,一杯通常是指将果蔬切碎后填满一杯容器的量。
维生素D
维生素D可影响神经元的生长、发育和存活的过程。研究表明,在老年人群体当中,体内维生素D水平低下,可能增加认知功能退化和患老年痴呆症的风险。
维生素D3是我们身体需要的维生素D形式。调节大脑中的钙水平,帮助保护脑细胞免受有害的氧化作用,并支持海马体(大脑记忆中心)的健康。
大多数研究发现,纯素食者的血液中维生素D3含量较低,并且在冬季,素食者更有可能出现维生素D3不足。
类黄酮
类黄酮可以提高血管功能,从而影响神经细胞间的物质传递和信息交流,进而影响神经健康和大脑功能。食用富含类黄酮的食物或饮料可以帮助提高人体健康水平,以及帮助提高患有轻度认知障碍老年人的认知功能。
类黄酮的抗氧化作用已在实验中获得证实,但这些植物化合物(如可可、银杏、葡萄籽提取物)在人体内具有更多的综合作用,目前仍在持续进行研究中。
一些类黄酮在保持健康的大脑功能方面表现出不错的结果。
槲皮素是一种类黄酮,是银杏萃取物中的主要成分,它已在一些研究中被证明能维持记忆力和学习能力。
类黄酮来自多种色彩丰富的植物食物。可以尝试以下这些食物:
钙和镁
大脑能如此天衣无缝地运作依靠的是神经元之间相互连结和交流的能力。钙和镁这两种矿物质对维持通讯顺畅进行发挥重要的作用。
钙质有助于维持神经细胞正常发挥功能,并有助于控制神经递质的流量。镁对脉冲传输发挥作用。它还透过催化B族维生素转化为活性形式,而帮助大脑释放B族维生素的所有益处。
富含钙质的食物如:
富含镁的食物如:
其它有益大脑的营养素
以下简要列举一些经研究对大脑健康有益的其它营养素:
α-硫辛酸
已获证实可维持记忆力和认知功能。它能够使其他抗氧化剂恢复到活性状态。富含的食物如:内脏(肾、心、肝)、土豆、菠菜、西兰花等。
咖啡因
不仅能帮助提神,摄入咖啡因还与大脑处理信息的能力之间存在联系有关。但注意适量,过多的咖啡因会让人过度兴奋或焦虑,一个健康的成年人每天的摄入量不应超过三到四百毫克。
锌
存在于大脑前部的一种必需矿物质。其运作机制仍需更多研究才能确定,但缺乏锌却与很多神经系统问题有关。当人的锌水平低时,可能会出现焦虑,抑郁,失眠和情绪失调等状况。
研究发现抑郁症和精神病患者的锌含量低。在患有帕金森氏病,阿尔茨海默氏病,唐氏综合症和多动症的患者中也发现了锌缺乏。
补锌有助于改善抑郁症状,是 “自然的抗抑郁药”。锌的饮食来源多种多样,尤其是在红肉,家禽和鱼类中。
姜黄素
一种强力抗氧化成分,可保护大脑免受脂质过氧化反应和一氧化氮类的影响。
新鲜姜黄可以适量切片或切碎后加入沙拉、汤或炒菜中。临床试验都表明姜黄素补充剂是安全且耐受性良好的。
几种胃肠激素或胜肽
如瘦素、饥饿肽、胰高血糖素样肽-1(GLP1)和胰岛素等, 可支持健康的情绪反应和认知过程。
不要忘了炎症——认知功能的隐形敌人,通过抗炎和促炎作用影响着大脑。而姜黄素、白藜芦醇、蓝莓多酚和多不饱和脂肪酸等超级食材,以及生活方式的选择,如热量限制和体育锻炼,都是强大的盟友,帮助保持认知功能。
地中海饮食、营养支持和热量控制饮食抵御了认知能力下降和神经退行性疾病的威胁。
如前所述大脑是一座忙碌的都市,神经营养素则是其中维持秩序的超级英雄,特别是在情绪调节这个复杂的领域。情绪调节就像城市交通系统,涉及多个区域,对我们的心理健康和行为至关重要。接下来我们再来探索一下大脑城市。
神经递质:大脑交通的信号灯
首先,神经递质犹如信号灯,这就像是在城市交通中错误地发出信号就会导致了交通堵塞甚至是严重的交通后果。所以神经递质和抑郁的严重程度之间的关系,就像是使用了不良情绪调节策略的结果。
前额皮质:情绪调节的指挥中心
然后,来到前额皮质区域,这个区域就像是大脑都市的交通指挥中心,它不仅参与情绪调节,还和身体的内分泌和免疫系统功能相关。这意味着,改善情绪调节就像是优化了城市交通,对整个都市的健康都有益处。
饮食与遗传:大脑都市的燃料与基础设施
我们的饮食,就像是为大脑都市提供燃料。特定的营养素能够影响神经元功能和突触可塑性,进而影响情绪。这就像是选择了高质量的燃料,让整个城市运转得更加顺畅。
遗传因素在情绪调节中也扮演了角色,就像是大脑都市中的基础建设。特定的遗传变异,比如血清素转运蛋白的变异,会影响情绪特征和神经系统,这就像是决定了城市交通系统的设计和效率。
神经影像学:交通管理
神经影像学研究揭示了参与情绪调节的特定大脑区域,就像是确定了城市中的关键交通节点。而实时功能磁共振成像神经反馈的研究,能够实时调节这些交通节点的流量,对精神障碍的治疗具有潜在的益处。
压力和性别:突发事件和不同司机
压力和性别在情绪调节中的作用,就像是突发事件和不同司机的驾驶习惯对城市交通的影响。急性压力可能会损害我们分散情绪刺激的能力,而性别差异则决定了我们减少负面情绪的能力。
总之,神经营养素通过对大脑功能和突触可塑性的影响,扮演着情绪调节中的超级英雄。无论是遗传因素还是饮食,都在这个复杂的城市交通系统中发挥着重要作用。而神经影像学的发现和实时神经反馈技术的进步,就像是为这座都市提供了新的管理工具。最后,不容忽视的是压力和性别差异,它们就像是影响交通流量的突发事件和不同司机的习惯。
在这个快节奏的世界里,大脑像是永不休息的工作狂,不断地处理信息、接收信息、做决策、回忆过去和规划未来。但是,就算是高效的机器,大脑也需要适当的燃料和维护来保持其最佳性能,特别是那些对脑健康至关重要的维生素B。
最新的研究发现让我们对维生素B和其他神经营养素在保持我们的思维敏捷和记忆力方面的作用有了更深的认识。比如说,一项研究发现,老年人补充omega-3脂肪酸可以让认知功能保持在较好的状态,甚至减缓认知衰退的脚步。另一项研究则揭示了维生素E补充剂与降低某些类型认知障碍风险的联系。
那么,具体来说,哪些人群最适合通过补充B族维生素来提升脑健康呢?
总的来说,补充维生素B似乎对记忆力有一定的益处,目前的证据还不足以推荐其用于改善认知功能、执行功能和注意力,或者用于稳定或减缓阿尔茨海默病患者的认知、功能、行为和整体变化的下降。还需要更多精心设计的、大样本量的随机对照试验来明确维生素B补充剂在这些亚组中的预防效果和最佳剂量。
接下来再聊聊那些让我们的大脑保持活力和健康的小帮手——神经营养因子。
神经营养因子:大脑城市的维护英雄
如果我们的大脑是一座充满活力的城市,那么神经营养因子就是那些维护城市基础设施、确保一切运转顺畅的英雄。
它们是一类特殊的蛋白质,对我们的神经系统来说,就像是超级食物一样,负责支持神经细胞的生存,促进受损神经细胞的修复,还有调节细胞之间的通信。简而言之,没有它们,我们的大脑就不能正常工作。
神经营养因子包括神经生长因子(NGF)和脑源性神经营养因子(BDNF)。
促进生长与修复
这些超级英雄通过与神经细胞表面的特定受体结合,激活一系列信号传导途径,从而促进神经细胞的生长、分化,增强我们大脑的可塑性和修复能力。
影响学习与记忆
神经营养因子在保护神经细胞、促进受损神经组织的修复,以及提高我们的学习和记忆能力方面发挥着显著作用。比如,BDNF的水平,就和我们的学习能力及记忆形成紧密相关。这也像是大脑的健身教练,帮助思维保持敏捷,记忆力强大。
与神经退行性和精神疾病相关
神经营养因子还参与了与神经退行性和精神疾病相关的病理生理学过程。它们的水平改变与阿尔茨海默病、亨廷顿舞蹈病、抑郁症和药物滥用等疾病有关。这些都表明,神经营养因子的平衡对我们的神经健康至关重要。
生活方式
运动
运动无疑是提高 BDNF 水平的最佳方法之一。
这些影响尚未在人类中进行研究。
睡觉
与睡眠健康的对照组相比,失眠患者的 BDNF 水平较低。根据一些未经证实的理论,压力是否会导致精神障碍取决于睡眠是否得到维持或受到干扰。在大鼠中,长期睡眠不足导致IL-1b和TNF增加,BDNF 减少。
在抗抑郁治疗中,BDNF 升高可能是抗抑郁药物是否有效的预测指标,尽管这一指标并不完全可靠。BDNF 实际上并不与抑郁症的减少同时发生,因此,人们认为大部分预测效果可能基于睡眠。这意味着 BDNF 可能是人们睡眠质量的一个标志,需要大规模研究来证实这一理论。
减轻压力
慢性或急性应激和皮质醇会降低大鼠海马和前额皮质中的 BDNF。
急性应激更显著降低 BDNF。
承受很大压力的人表现出较少的 BDNF。
晒太阳
对荷兰 2,851 人的分析发现,血液中的 BDNF 在春季和夏季增加,在秋季和冬季减少。BDNF 水平与一个人暴露在阳光下的小时数相关。
然而,维生素 D 补充剂可能无效。
人体试验中补充维生素D不会增加 BDNF。
绝经后女性补充维生素 D 实际上会降低 BDNF。
认知刺激
动物高度刺激的早期社会环境会增加 BDNF。
在小鼠中,探索行为的水平会诱发 BDNF,而在人类中,这相当于精神和身体刺激或新奇感。
当学习事物或挑战大脑时,大脑会增加 BDNF,因为它在学习和记忆中发挥着重要作用。
间歇性禁食
在小鼠中,隔日禁食(禁食日单餐摄入约 600 卡路里热量)可使 BDNF 的产生增加 50% 至 400%,具体取决于大脑区域。禁食对人类 BDNF 的影响还需进一步研究。
保持昼夜节律
一些科学家推测,昼夜节律失调与 BDNF 水平低有关。例如,昼夜节律失调的脑外伤患者的 BDNF 产生量也较低。
饮食/食物
科学家正在研究以下饮食因素是否会增加或降低 BDNF 水平:
西方饮食
所谓的“标准西方饮食”(“SAD”)——即高糖和饱和脂肪的饮食,可能会减少 BDNF 的产生。
鱼油 / DHA
抗性淀粉,例如抗性淀粉– 转化为丁酸盐,导致 BDNF 增加。
其他
下列物质均显着增加雌性大鼠额叶皮质中的 BDNF :
然而,没有临床证据支持上面列出的增加 BDNF 的方法。上述因素涉及动物和细胞研究,应进一步研究。
激素/神经递质
科学家发现动物体内以下激素与 BDNF 水平之间存在联系:
缺乏人类数据。
没有研究表明增加这些激素会增加人类的 BDNF。
在没有看医生的情况下不要服用任何激素。在没有医疗监督的情况下服用激素可能非常危险。
补充剂
膳食补充剂尚未获得批准用于医疗用途。补充剂通常缺乏扎实的临床研究。
一些研究表明,这些补充剂可能有助于增加 BDNF 并支持心理健康:
药物
尚未批准任何药物用于提高 BDNF 水平;以下研究是调查性的,不够有力,不足以被视为足够的使用证据。它仅供参考。
一些非法药物也会增加 BDNF,但会以整体有害的方式影响大脑并造成严重伤害。
其中许多药物可能劫持大脑的奖励系统,导致成瘾。它们的使用还可能导致危及生命的情况,应不惜一切代价避免使用。
注意:未经医生建议不要随意服用任何药物。
胃肠道(GI)对于营养物质的吸收,粘膜和全身免疫反应的诱导以及健康的肠道微生物群的维持是必不可少的。
你会发现肠道不只是消化的细胞,还有大量的神经元和免疫细胞,以及海量的肠道菌群。
想象一下,我们的肠道里住着数万亿的微生物,它们不仅帮助我们消化食物,还能影响我们的心情和大脑功能。
经研究发现,神经发育的主要过程与母体和新生儿肠道微生物的变化一致。
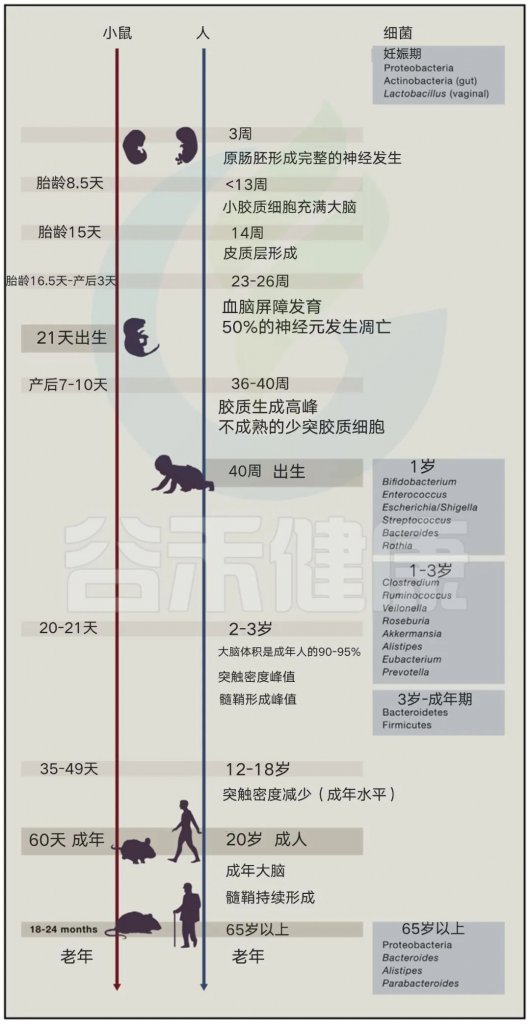
Sharon et al. Cell, 2016
微生物群对大脑结构的影响
关于微生物群在人类大脑结构发育中的作用的研究仍然很少。
在成年人中,聚类分析确定了与不同白质和灰质特征相关的不同微生物群组成,包括右海马、左伏隔核、右枕前沟和小脑的区域体积差异。微生物群中的α多样性也与肥胖成人的下丘脑、尾状核和海马的微观结构有关,而特定的放线菌门的相对丰度与下丘脑、丘脑和杏仁核的微观结构变量相关。
在儿童中,只有一项研究检测了大脑结构和肠道微生物群,报告了1岁时α多样性与2岁时左中央前回、左杏仁核和右角回体积之间的正相关。同样的研究还报告了基于微生物群聚类分析的特定区域脑容量差异。
微生物群对早产儿大脑发育的潜在影响
在新生儿重症监护病房早产儿粪便微生物群移植研究中采用了一种更具实验性的方法。与高生长菌群的受试者相比,在NICU中生长不良的婴儿微生物群定植的无菌小鼠在神经元分化、少突胶质细胞发育和大脑皮层髓鞘形成的标记方面表现出大脑发育延迟的迹象。来自低生长婴儿的微生物群也影响各种神经传递途径,增加神经炎症,同时降低生长激素的循环水平。
微生物群与大脑功能、神经发育的关联
去年两项研究都发表在儿童大脑功能或活动的微生物调节上。
相关动物研究
一项研究很好地拟合了动物早期应激模型中的观察结果。在母性分离后,一种已知会扰乱微生物群的早期应激啮齿动物模型,大鼠幼犬表现出条件性恐惧反应的加速成熟。在压力期间的益生菌补充足以逆转对这两种行为的影响前额叶皮层的激活。
在压力环境之外,在各种动物模型中,微生物调节大脑功能或活动的证据基础越来越强。例如,对无菌动物杏仁核的转录组分析揭示了差异基因表达、外显子使用和RNA编辑。
最近的一项关于在缺乏微生物群的小鼠中消除恐惧的研究发现,内侧前额叶皮层的基因表达、神经元活动和树突棘重塑发生了显著变化。此外,有许多关于通过操纵微生物群而改变各种神经递质系统的报告,特别是关于5-羟色胺和BDNF(脑源性神经营养因子)。这项工作与脑形态学的研究一起,强调了微生物群对大脑发育和健康的深远影响。
肠脑轴
我们的肠道和大脑之间有着一条看不见的纽带,这就是所谓的肠脑轴。这条线不仅仅是关于我们吃了什么,更是关于我们的情绪、认知能力乃至大脑的整体健康。
肠-脑轴综合示意图
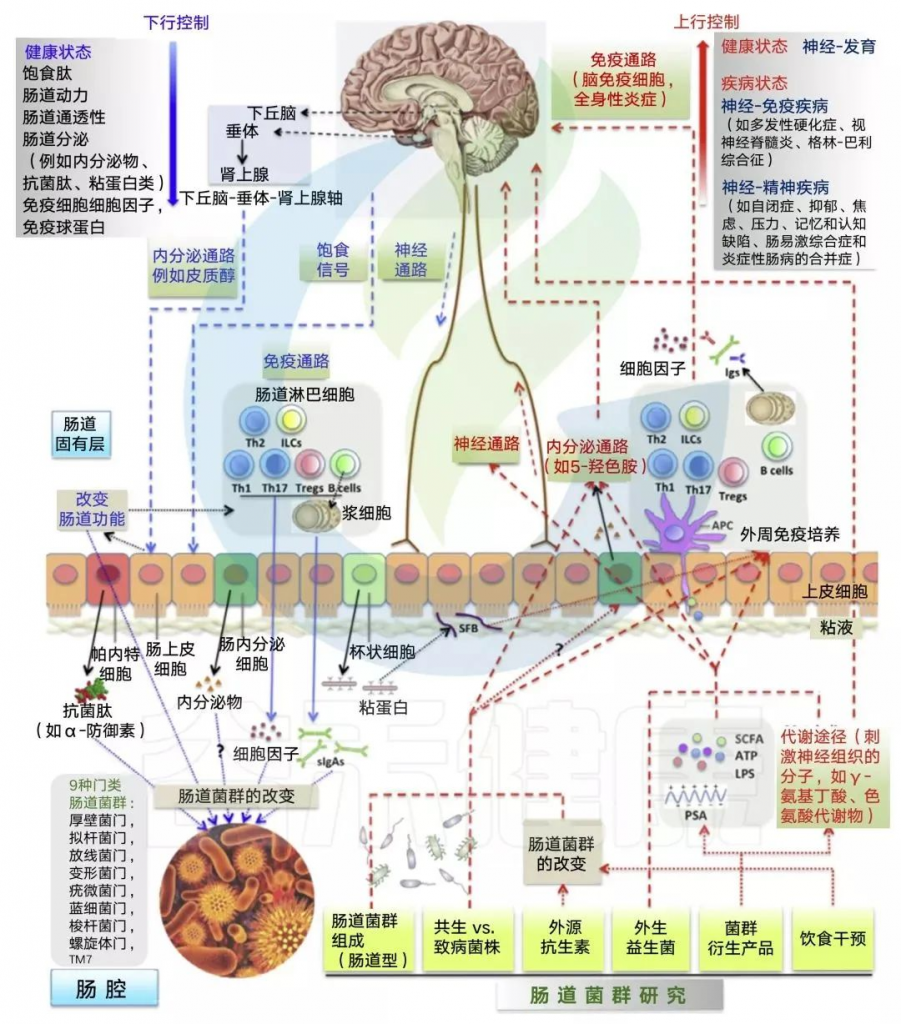
Wang and Kasper. Brain, behavior, and immunity, 2014
目前,微生物-肠道-脑轴内存在许多已知的通信途径,包括迷走神经、HPA轴、脊髓、免疫系统和代谢产物的外周传输等。这些已在其他地方详细阐述。在这里就提供一个简短的和简单的概述,其中一些路径与一个具体的发展重点(见下图)。
肠-脑轴参与婴儿早期神经发育与感受
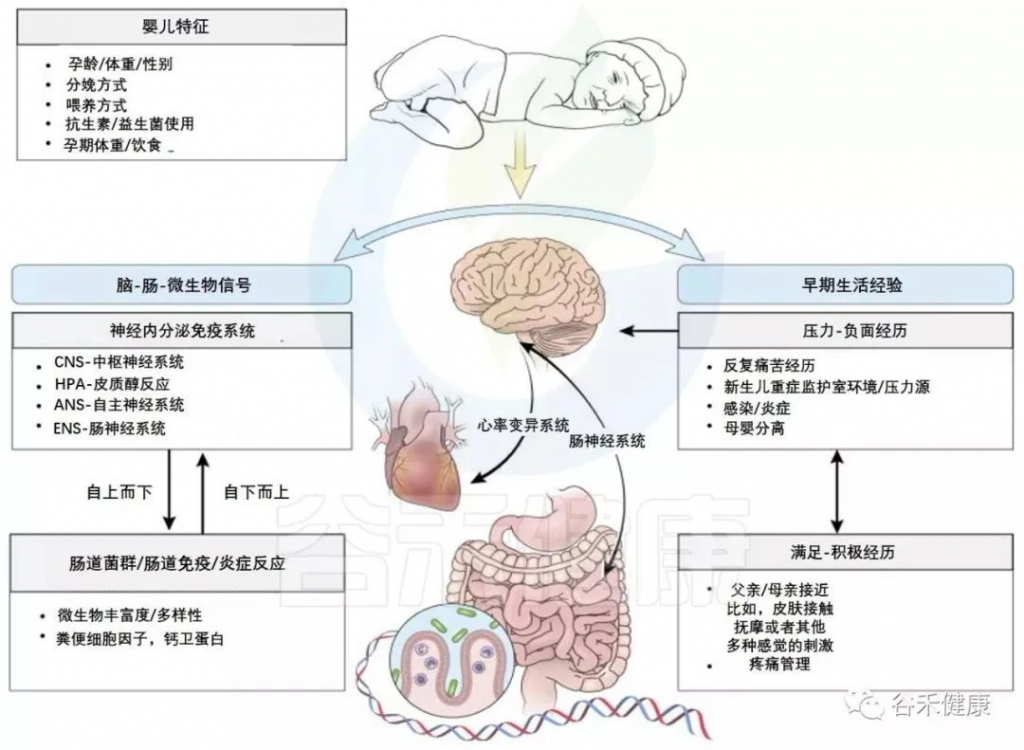
Cong et al., Advances in neonatal care: official journal of the National Association of Neonatal Nurses, 2015
此外,肠道菌群可以影响神经传递的产生和释放,比如血清素和多巴胺以及GABA,此外还有激素,谷氨酸,小分子肽等,这些都是影响我们情绪和认知的关键物质。
其次,通过调节免疫系统的反应,肠道菌群还能影响大脑中的炎症反应,这对于预防神经退行性疾病非常重要。
肠道菌群的代谢产物,比如短链脂肪酸,对大脑健康至关重要,它们不仅能为大脑提供能量,还能调节血脑屏障的完整性和功能。
由肠道微生物及其产物直接或间接驱动的基本发育过程
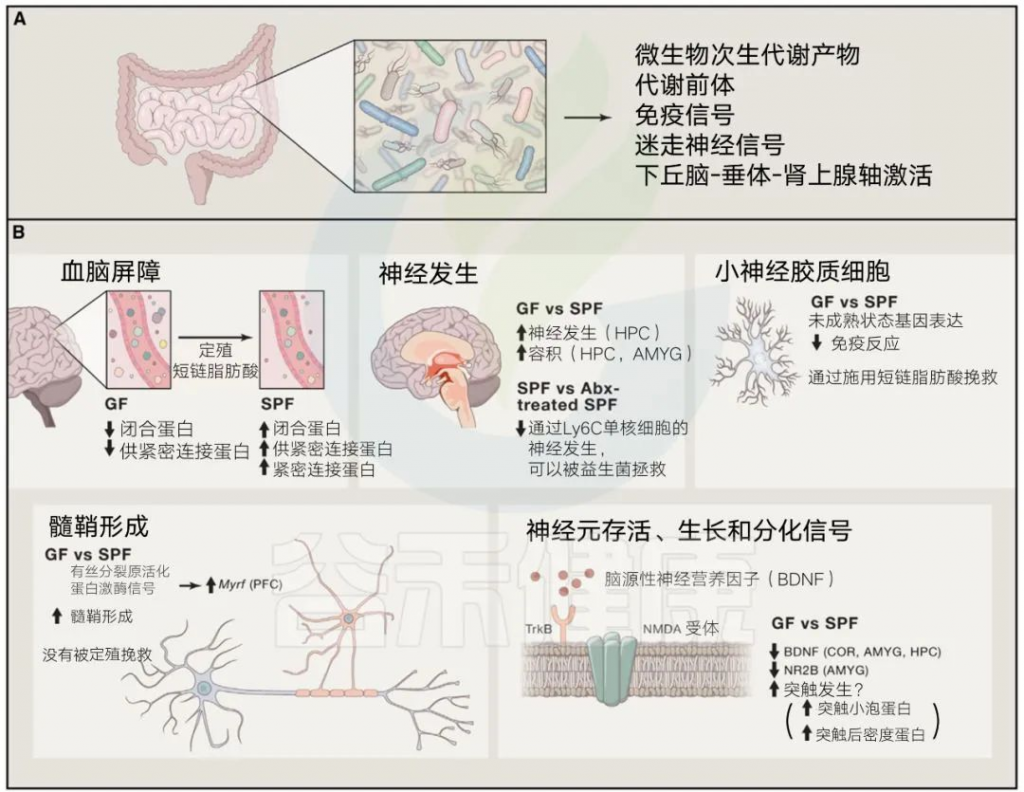
编辑
Sharon et al. Cell, 2016
深入一点来说,肠道微生物群通过涉及芳香氨基酸和色氨酸代谢的途径,影响诸如血清素、多巴胺和脑源性神经营养因子(BDNF)等神经递质水平。这就是为什么肠道菌群的失衡可能会导致神经递质途径紊乱,进而影响我们的大脑健康。
而且,特定的微生物酶能够直接产生神经递质,这说明了微生物群如何直接影响我们的生理和行为。肠道微生物群还能调节神经肽和神经递质受体的表达,影响体重调节和瘦素敏感性。
通过抗生素、益生菌或是粪菌移植等方式改变肠道微生物群组成,都会影响神经递质的调节,与一系列神经精神和神经系统疾病有关。
深入挖掘机制:微生物对神经发育的影响途径
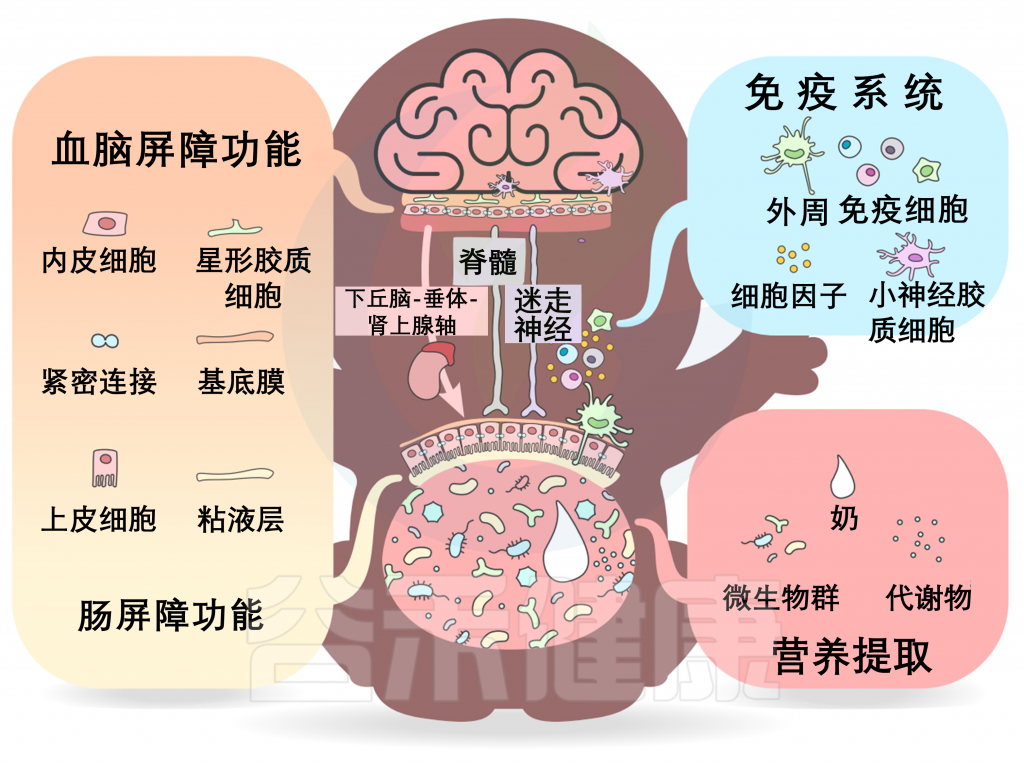
微生物群-内脏-大脑轴由多个通道组成,允许微生物群和大脑之间双向交流。在发育过程中,一些关键的通路包括营养提取、免疫信号和屏障功能,以及沿脊髓、迷走神经和下丘脑-垂体-肾上腺轴(HPA轴)的神经和激素信号。
之前的文章有详细介绍微生物群与大脑之间的通讯途径。
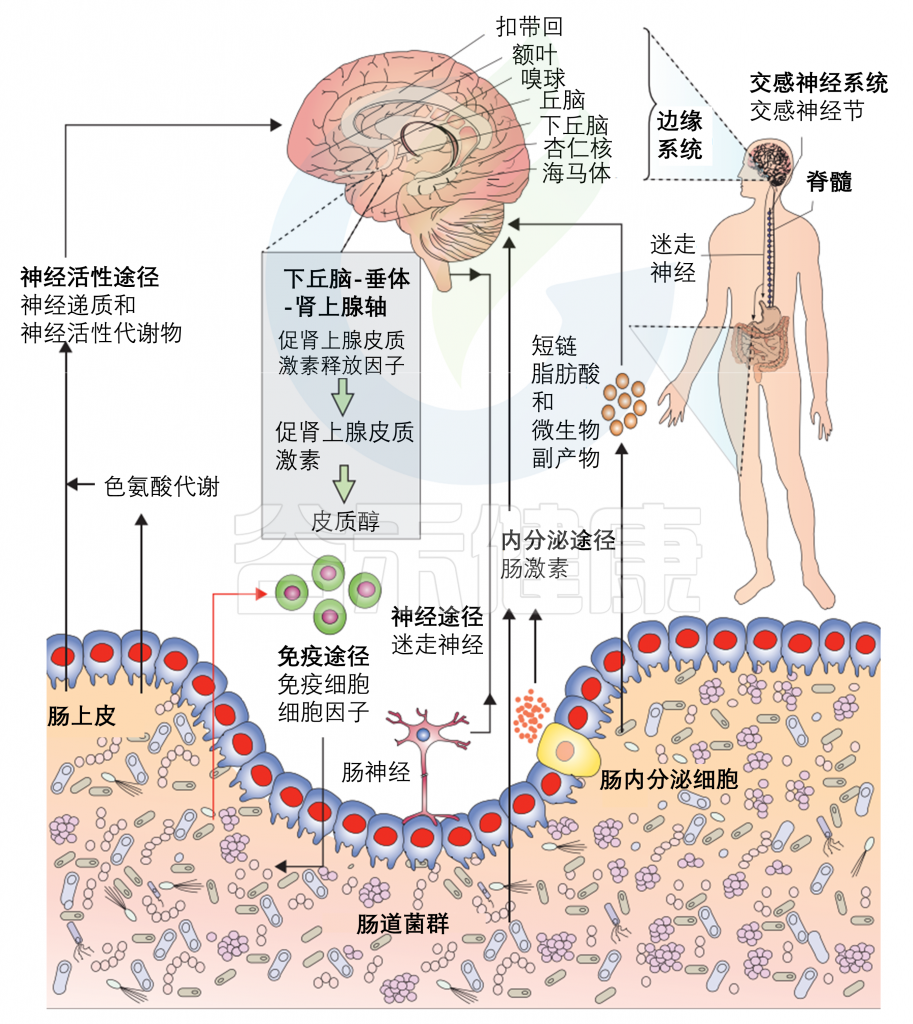
Cryan JF, et al., Lancet Neurol. 2020
多种直接(如迷走神经)和间接(如短链脂肪酸、细胞因子和关键的膳食氨基酸,如色氨酸、酪氨酸和组氨酸)途径,通过肠道微生物群可以调节肠-脑轴。
扩展阅读:
代谢和养分利用率
也许解释微生物群对神经发育的调节作用的最简洁的假设是,微生物群是生长中的大脑必需营养和能量的关键来源。微生物群将原本不易消化的食物成分,转化为具有营养或生物价值的产物,营养本身是一种公认的认知结果调节器。
母乳喂养是一种影响微生物群成熟的饮食因素,长期以来一直被认为可以改善认知结果,尽管最近的数据表明,这种影响是由诸如母亲智力或教育水平等混杂变量造成的。
另一方面,特定营养素缺乏和总体饮食质量低都与认知发展的长期负面影响有关,并且对易受伤害人群的营养干预可以改善儿童期的认知结果。有人认为,这些影响需要从发展中的微生物群的角度来考虑。
为了支持这一论点,最近对荷兰小学生进行的一项队列研究发现,学龄前饮食与代谢表型之间关系的强度取决于微生物群的组成。
儿童营养不良延缓了微生物的成熟,从营养不良的儿童身上移植到啮齿动物或猪身上的粪便菌群表明,这种改变的菌群在与营养不良相关的发育迟缓和代谢问题中起着因果作用。在这两种动物模型中,通过补充唾液酸化的母乳低聚糖来解决这些微生物依赖性问题。这些化合物通常存在于母乳中,作为微生物群的益生元,在营养不良儿童的母亲母乳中含量较低。
最近的另一项“微生物导向补充食品”试验发现,与传统食品治疗相比,在动物模型和营养不良儿童中都有很好的效果。
营养物的可利用性、微生物群和代谢发展之间似乎存在着重要的相互作用,通过喂养微生物群,微生物群可以喂养发育中的身体和大脑。
屏障功能
在微生物群和大脑之间,有两大屏障:胃肠道屏障和血脑屏障(BBB)。
这些屏障的通透性与微生物来源的代谢产物和神经递质在微生物-肠-脑轴之间的传递特别相关;渗透性越强,传递的信号就越多。
这两个障碍有惊人的相似之处:
饮食或益生菌干预有希望恢复?
饮食干预在减少压力或其他微生物群对整个生命周期学习和记忆结果的影响方面显示出了希望。
在成年啮齿动物中,益生菌补充被用于逆转压力、感染或抗生素治疗后的空间记忆缺陷,甚至在空间记忆、物体识别记忆和长期恐惧记忆方面为健康动物提供益处。
在青春期,饮食中添加ω-3多不饱和脂肪酸和维生素A可恢复慢性社会不稳定应激后盲肠微生物群的组成和新的物体识别障碍。
在发育早期,特定的益生菌菌株(鼠李糖乳杆菌和瑞士乳杆菌)拯救了暴露于早年母体分离应激的幼鼠条件恐惧行为的预期发育模式。压力大的婴儿表现出更持久的恐惧记忆,在恐惧消失后更容易复发,但这两种行为异常都可以通过益生菌治疗逆转。
饮食-微生物群相互作用在阿尔茨海默改善中的作用
鉴于阿尔茨海默患者与健康受试者之间微生物群差异的新数据,研究人员已经开始探索通过调节微生物群来改善阿尔茨海默。
我们知道肠道微生物群可以通过多种方法进行调控,包括使用益生菌、益生元、合生元和抗生素或改变饮食,但饮食是肠道微生物群的最重要调节方式。
以不饱和脂肪、水果和蔬菜以及全谷类为重点的饮食调节可以给阿尔茨海默相关的认知健康带来好处。例如,地中海饮食通过增加血浆类胡萝卜素和降低C-反应蛋白水平,与阿尔茨海默关键区域的脑萎缩减少相关,表明对阿尔茨海默病理学有积极影响。
此外,炎症也是阿尔茨海默的主要症状。食用富含二十二碳六烯酸(一种n-3多不饱和脂肪酸)的鱼制品与降低阿尔茨海默风险有关。富含维生素D3的鱼和富含维生素D的奶制品促进神经生长因子蛋白的分泌,这种蛋白可以防止大脑炎症和衰老。
由于地中海饮食对阿尔茨海默的这些改善作用,一项人体试验研究了MD-DASH饮食干预对神经退行性延迟(MIND)的影响,该饮食是地中海饮食与DASH饮食(阻止高血压的饮食方法)的结合,富含水果,蔬菜,全谷类,低脂乳制品和瘦肉蛋白,实验表明MIND饮食比单独使用地中海饮食或DASH更为有效。
除了某些饮食生活方式外,个别食物还可以带来抗阿尔茨海默病理学的益处。例如,在小鼠模型中:
几项研究探讨了直接针对阿尔茨海默肠道细菌的补充剂的使用:
益生菌和益生元的组合合生元也显示出对阿尔茨海默的益处。
综上所述,目前有关饮食和补充剂影响肠道微生物群和改善阿尔茨海默是有希望的,但更多的研究是也非常需要。
我们的肠道和大脑里都住着一些非常勤劳的免疫细胞。它们调节着炎症反应和免疫稳态。这种调节过程对于防止炎症相关疾病至关重要。
想象我们的肠道是一个繁忙的社交场所,各种微生物在这里聚会,它们通过免疫系统的路径与大脑沟通,影响着精神和神经发育。而饮食、压力和我们早期的生活经历则是这场社交活动的调味料,影响着微生物群的组成和它们的交流方式。
肠道微生物群和肠道屏障的微小变化,都能引起中枢神经系统内免疫调节的变化。这就像是在说,改变我们的饮食习惯有可能对治疗多发性硬化症等疾病有潜在的帮助。
而益生菌、益生元和健康饮食不仅能让我们的肠道微生物开心,还能通过一系列免疫、神经和代谢途径,帮助调节大脑的发育和行为。这就像是给大脑发送了一份特别的营养餐。
肠道微生物群的影响力非常强大,它们通过神经递质、神经肽、激素和细胞因子,成为大脑、肠道、免疫系统和自己之间沟通的信使。
肠-脑轴甚至能通过内分泌信号和免疫系统的激活,改变大脑的功能,有时候还会导致精神疾病。而迷走神经在这个双向通讯过程中,就像是一个忙碌的信息传递员。
有趣的是,微生物群还能通过抑制免疫系统和诱导炎症来影响脑肿瘤的发展和治疗结果。这让我们意识到,微生物群在精准肿瘤学中的作用可能远比我们想象的要大。
肠-脑轴内的相互作用,包括自主神经和中枢神经系统、应激系统和肠道免疫反应,都与炎症性肠病的发病机制有关。而大脑-肠道-微生物组通讯的干扰,可能会导致肠易激综合征、肥胖以及各种精神和神经系统疾病。
总之,肠-脑轴通过免疫系统调节大脑功能,免疫细胞、微生物代谢物和各种信号分子在肠道微生物群和大脑之间建立了一个复杂的通讯网络。饮食、压力和早期生活事件是塑造这种相互作用的关键因素,对于治疗精神、神经发育和神经退行性疾病,以及炎症和压力相关疾病的干预具有潜在的影响。
长双歧杆菌,能够通过阻止肠道菌群失调、降低内毒素水平和调节大脑炎症途径来保护我们的认知功能。简而言之,长双歧杆菌是我们大脑的守护神。
但是,就像任何城市一样,总有一些不那么受欢迎的居民。研究发现,Megamonas、Serratia、Leptotrichia和梭菌科的增加与阿尔茨海默病的早期阶段有关。同时,一些好家伙,比如CF231、Victivallis和肠球菌的数量减少,这也不是个好消息。
阿尔茨海默病患者的肠道小城市里,双歧杆菌、鞘氨醇单胞菌、乳酸菌和Blautia的数量丰富,但鞘氨醇单胞菌的增多似乎与认知功能的下降有关。同时,恶臭杆菌、厌氧杆菌的减少也值得我们关注。
认知障碍的情况下,放线菌和变形菌的丰度较高,而拟杆菌门和厚壁菌门的比例较低。这意味着,肠道小城市的居民组成与我们的认知健康紧密相关。
轻度认知障碍似乎与瘤胃球菌属、丁酸单胞菌属和草酸杆菌属的减少有关,而黄硝杆菌属的增加可能预示着问题。
主观认知能力下降的个体显示出抗炎的粪杆菌属显着减少,这提示我们,肠道中的抗炎英雄可能在保护我们的大脑健康方面发挥着关键作用。
科学研究已经锁定了一些特定的细菌属,它们似乎与重度抑郁症(MDD)有着密切联系。
研究人员发现,Gelria、Turicibacter、Anaerofilum、Paraprevotella、Holdemania、Eggerthella属在抑郁症患者中普遍存在,而普雷沃氏菌(Prevotella)和戴阿利斯特杆菌(Dialister)的存在减少。
抑郁症患者体内有益菌大量减少
后来的研究还发现,与对照组相比,抑郁症患者肠道微生物总体减少。肠道微生物群中的双歧杆菌和乳酸菌减少。
Dorea、瘤胃球菌属和阿克曼氏菌属的显著减少,副拟杆菌属(Parabacteroides)、普雷沃氏菌属和放线菌属(Actinobacteria)的增加与抑郁个体相关。
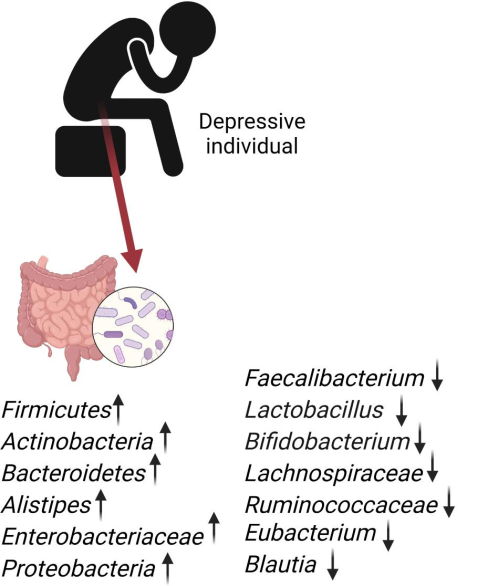
Basiji K, et al., Metab Brain Dis. 2023
通过饮食调整,增加那些能让有益菌群欣欣向荣的食物,比如高纤维的蔬菜和水果,以及富含益生菌的酸奶和其他发酵食品。同时,减少抗生素的使用和压力水平,也能帮助我们维持肠道菌群的平衡。
我们不仅能够保持消化系统的健康,还能通过肠脑轴的联系,促进大脑健康,提升生活质量。
首先,有一些细菌属如拟杆菌属和双歧杆菌属,它们就像是小小的神经发育助推器,特别是在认知和语言发育方面。这些微生物帮助大脑发育,让你变得更聪明。
Turicibacter和Parabacteroides在那些精细运动技能不太灵光的小朋友的肠道中更常见。相反,双歧杆菌和乳酸杆菌则在那些精细运动技能较好的孩子们中占据主导地位。就仿佛这些微生物在背后默默地支持着孩子们的每一个小动作。
Gordonibacter pamelae和Blautia wexlerae似乎与更高的认知功能有关,而瘤胃球菌则在认知得分较低的儿童中更常见。这就像是肠道中的智力竞赛,不同的细菌支持着大脑的不同功能。
毛螺菌科的出现与最佳的头围生长有关,而头围生长是神经发育的一个重要标志。
总的来说,特定的肠道细菌,如拟杆菌属、双歧杆菌属、乳杆菌属等,对早期神经发育有着不可忽视的影响。它们与认知和运动技能的发展,以及大脑的整体生长密切相关。这些发现让我们意识到,婴儿期肠道微生物组的组成可能对我们的神经和心理健康产生长期影响。
本文主要简述了大脑发育(神经发育),强调了神经营养素以及脑源性神经营养因子(BDNF)对神经发育以及功能和修复等的重要性。这些神经营养素或神经营养因子需要我们日常膳食足量足质的补充或摄入。此外,这些营养素吸收,转化以及代谢等都离不开肠道及其微生物群,而且肠道微生物还会通过其他多种途径影响大脑的发育,认知以及衰老和疾病发生。
如果将大脑和肠道都看着是两座超级大城市,那么神经营养素或因子和肠道菌群就是其中的参与者、建造者、使用者和维修者。例如优质的膳食脂质,比如磷脂和鞘脂,是认知功能的守护者,而双歧杆菌尤其长双歧杆菌就是肠道的领路者和超级英雄。
作为人体两大超级系统(大脑-肠道),它们之间的交流和互动密不可分,保持着信息和资源的畅通。我们在日常生活中的饮食习惯和生活方式不仅影响着肠道微生物的构成和功能,也直接关系到大脑的健康和发育。要想让这两座超级大城市运转良好,需要关注神经营养素的摄入和肠道菌群的平衡,尽可能让身体和大脑保持最佳状态。
主要参考文献
Borrego-Ruiz A, Borrego JJ. An updated overview on the relationship between human gut microbiome dysbiosis and psychiatric and psychological disorders. Prog Neuropsychopharmacol Biol Psychiatry. 2023 Sep 8:110861.
Cryan JF, O’Riordan KJ, Sandhu K, Peterson V, Dinan TG. The gut microbiome in neurological disorders. Lancet Neurol. 2020 Feb;19(2):179-194.
Bear T, Dalziel J, Coad J, Roy N, Butts C, Gopal P. The Microbiome-Gut-Brain Axis and Resilience to Developing Anxiety or Depression under Stress. Microorganisms. 2021 Mar 31;9(4):723.
Bryan B. Yoo et al. (2018) The Enteric Network: Interactions between the Immune and Nervous Systems of the Gut. Immunity. 46(6): 910–926.
Shivani Ghaisas et al. (2016) Gut microbiome in health and disease: linking the microbiome-gut-brain axis and environmental factors in the pathogenesis of systemic and neurodegenerative diseases. Pharmacol Ther. 158: 52–62.
Cerovic M, Forloni G, Balducci C. Neuroinflammation and the Gut Microbiota: Possible Alternative Therapeutic Targets to Counteract Alzheimer’s Disease? Front Aging Neurosci. 2019 Oct 18;11:284.
Cryan JF, O’Riordan KJ, Sandhu K, Peterson V, Dinan TG. The gut microbiome in neurological disorders. Lancet Neurol. 2020 Feb;19(2):179-194.