-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
便秘的全球患病率为14%。慢性便秘会影响生活质量。健康人相比,便秘还会导致粪便重量降低,且与结直肠癌风险增加相关。
饮食调整是治疗便秘的主要方法之一。世界胃肠病学协会建议通过饮食建议或补充来增加纤维摄入量。在英国,健康专家指南建议食用水果,包括富含山梨醇的水果,例如杏子、桃子和李子,以及相应的果汁。然而,关于水果对肠道运动和便秘的作用机制的证据有限。
本文旨在探讨水果和水果制品对肠道微生物群、肠道运动和便秘的作用机制和有效性。
关于水果中的成分,离不开以下几大成分。
▌ 膳食纤维
水果是膳食纤维的极好来源。
纤维是什么?
纤维是指三个或三个以上单体单元的聚合物碳水化合物加上木质素在小肠中不被消化或吸收的总和。纤维不是一个分子,而是一系列在溶解度、粘度和发酵性方面不同的分子。
纤维会增加粪便体积和生物量
不可发酵纤维完好无损地到达下消化道,而粘性纤维具有较高的水结合能力,因此,这两种纤维都能有效地增加粪便体积。
粪便体积的增加进一步导致管腔扩张并触发蠕动。可发酵纤维增加肠道微生物群的丰度,从而增加粪便生物量,并增加短链脂肪酸的产生。
纤维使粪便变软
这导致结肠渗透负荷增加,从而增加粪便的含水量,从而导致粪便变软。研究发现,各种高纤维食物可以缩短整个肠道的转运时间。
▌ 山梨糖醇
山梨醇是一种在植物中发现的糖醇。山梨醇在小肠内不被消化或吸收,并且能够在其分子中保持水分,从而导致肠腔中水分的增加,从而软化粪便,从而缓解排便。
在一项随机对照试验(RCT)中,与安慰剂相比,每天40克山梨醇持续6天会导致粪便水和粪便重量显著增加。此外,未被吸收的山梨醇到达结肠,在结肠中被肠道微生物群发酵,增加短链脂肪酸的产生,并可能改变微生物群。
虽然这一假设尚未在人类身上得到验证,但与低聚果糖和对照组相比,大鼠体内的山梨醇增加了粪便、结肠和盲肠乳酸杆菌AD102和粪便罗氏乳酸杆菌,并且结肠和盲肠样本中的丁酸含量高于对照组。
▌ (多)酚类
多酚是植物性食品和饮料中的一大类化合物,包括水果、蔬菜、谷物、茶、咖啡和葡萄酒。它们的结构由一个或多个与芳香烃基团结合的羟基组成。
只有一小部分低分子量(聚)酚在小肠中被吸收,而那些高分子量的酚到达结肠时不受影响,在结肠中它们可被肠道微生物群发酵,从而将较大的(聚)酚分解成较小的可吸收分子,可能对多种健康有益。
此外,现有证据表明,(多)酚有可能通过增加有益细菌(如双歧杆菌和乳酸杆菌)来积极改变肠道微生物群,或者通过抑制潜在致病菌的生长。虽然有人假设,由于其抗炎能力(多聚)酚类可能有助于治疗炎症性肠病或肠易激综合征,但目前没有足够的数据显示其对便秘的直接影响。
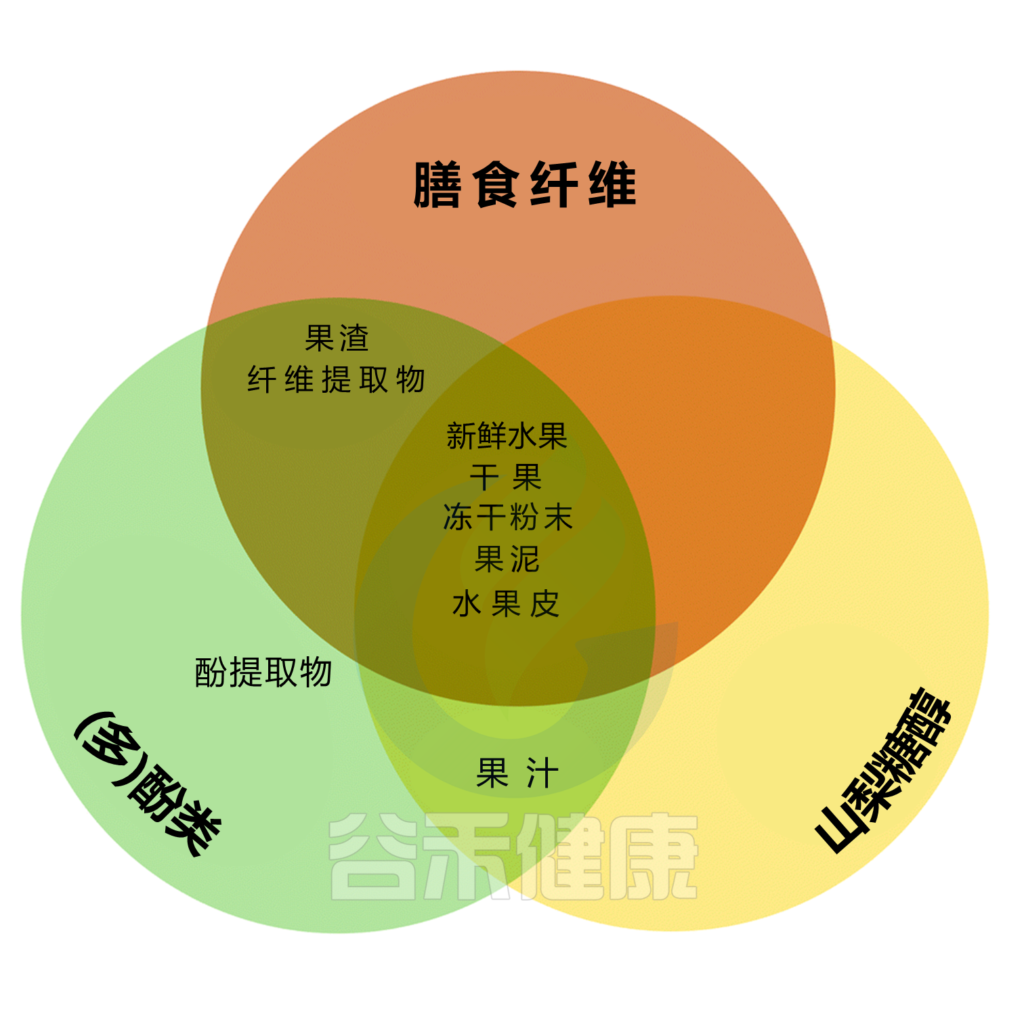
纤维、山梨醇和(多)酚是介导水果对肠道微生物群、肠道运动和肠道功能影响的主要成分,因此可能影响便秘。
不同的水果含有不同数量的纤维、山梨醇和(多)酚类物质,而水果的加工过程可能对这些物质产生重大影响。例如,新鲜或干果、果肉或全果冰沙(用新鲜、纯水果制成的饮料)可能含有大量的纤维、山梨醇和(多)酚,而浓缩果汁或浓缩果汁可能含有山梨醇和(多)酚,但纤维很少。
谷禾健康
生物累积(Bioaccumulation)是什么?
分解这个术语“生物累积”时,你会得到什么?accumulation ‘’积累’ 这个词意味着某种东西的积累,而前缀 bio- 意味着生命。把它放在一起,就是生物体内积累一些东西来定义生物累积。
那么生物物累积用于指生物体内化学物质的积累。这些物质没办法被代谢 ,便累积于生物体内,经由食物链中各阶层消费者的食性关系而累积,越高级消费者的体内其累积浓度越高的现象。
生物累积是如何发生的?
一种方法是让一定数量的化学物质进入生物体的速度快于生物体分解和使用它的速度。这意味着进入的比排出的多,导致化学物质在生物体内积累。
另一种主要方式是化学物质进入生物体,而生物体无法以某种方式将其分解或排泄。于是化学物质会继续积累,直到最终对生物体变得致命。
所有生物体面临的问题都是吸收和消除之间动态平衡的结果。生物蓄积发生的程度决定了所表现出的毒性作用。在某些情况下,保护机制免受沉积在特殊部位的某些不良物质的影响,以防止它们参与代谢反应。
本文的生物累积描述是用于评估药物及其有害代谢物的在肠道细菌内的积累。
治疗药物会对肠道微生物群产生强烈影响,反之亦然。潜在的药物-细菌相互作用可以通过生物转化降低微生物适应性或改变药物可用性。后者可以对药物活性和功效产生正面或负面影响。尽管洛伐他汀( lovastatin )和柳氮磺吡啶(sulfasalazine)等药物会被肠道细菌化学转化为活性形式,但细菌代谢可以使地高辛(digoxin)等药物失活,或者像伊立替康(irinotecan)一样引起毒性作用。为了进一步增加易感药物的多样性,最近报道,肠道细菌对一百多个分子进行了化学修饰。然而,这些相互作用的机制观点主要限于药物生物转化。
洛伐他汀(Lovastatin)
洛伐他汀(Lovastatin)可使胆固醇的合成减少,也使低密度脂蛋白受体合成增加,主要作用部位在肝脏,结果使血胆固醇和低密度脂蛋白胆固醇水平降低,由此对动脉粥样硬化和冠心病的防治产生作用(来源:百度百科)。
柳氮磺吡啶(sulfasalazine)
柳氮磺吡啶(sulfasalazine)磺胺类抗菌药。属口服不易吸收的磺胺药,吸收部分在肠微生物作用下分解成5-氨基水杨酸和磺胺吡啶。5-氨基水杨酸与肠壁结缔组织络合后较长时间停留在肠壁组织中起到抗菌消炎和免疫抑制作用,如减少大肠埃希菌和梭状芽孢杆菌,同时抑制前列腺素的合成以及其他炎症介质白三烯的合成(来源:百度百科)。
地高辛( digoxin)
地高辛是中效强心苷类药物,为白色结晶或结晶性粉末;无臭;味苦。在治疗时,对心脏的作用表现为正性肌力作用, 减慢心率,抑制心脏传导。适用于低输出量型充血性心力衰竭、心房颤动、心房扑动、阵发性室上性心动过速。
肠道中的细菌可以调节治疗药物的可用性和功效。然而,药物与细菌之间相互作用潜在机制是微生物对药物的化学转化或生物转化。
德国海德堡和英国剑桥科学家团队刚刚发在《Nature》上,成功研究了 25 种代表性肠道细菌菌株对 15 种结构不同的药物的消耗。揭示了 70 种细菌和药物相互作用,其中 29 种以前没有报道过。超过一半的新相互作用可归因于生物积累。
肠道细菌的这种生物累积可能是改变药物可用性和细菌代谢的常见机制,该机制会对个体微生物群组成、药代动力学、副作用和药物反应产生影响。
为了更详细调查药物与细菌之间相互作用的系统图谱,科学家使用两种分析方法核磁共振(NMR)光谱和液相色谱-质谱联用(LC-MS)系统地分析了 15 种人类靶向药物和 25 种人类肠道细菌(长双歧杆菌、大肠杆菌和均匀拟杆菌的其他亚种或同种菌株之间的相互作用)。选择细菌种类以涵盖代表健康微生物群的广泛系统发育和代谢多样性。在药物方面,选择了 12 种口服小分子药物(分子量小于 500 Da),这些药物可以基于超高效液相色谱结合紫外检测(UPLC-UV)进行定量,以跨越不同的化学,适应症区域和副作用概况。
细菌-药物相互作用网络。左网络:肠道细菌对药物的生物转化或生物累积。右网络:至少在两个独立筛选中检测到的药物对肠道细菌生长的影响(Student’s t检验,α = 0.05)。文中未提及的细菌全名如下:脆弱拟杆菌、普通拟杆菌、动物双歧杆菌亚种。乳杆菌BI-07, Coprococcus come ,梭菌,梭菌,副干酪乳杆菌, Ruminococcus gnavus。

谷禾健康


现如今,甲状腺疾病的发病率逐年递增,而女性更是甲状腺疾病的重灾区,据统计,每八名女性中就有一人患有甲状腺疾病。而甲状腺问题和肠道问题往往是齐头并进的。
本文我们将探讨肠道与甲状腺联系背后的科学事实,并提供有用的干预措施,助你走上改善肠道和甲状腺健康的道路。
甲状腺是位于颈部底部的一个小而重要的内分泌腺。
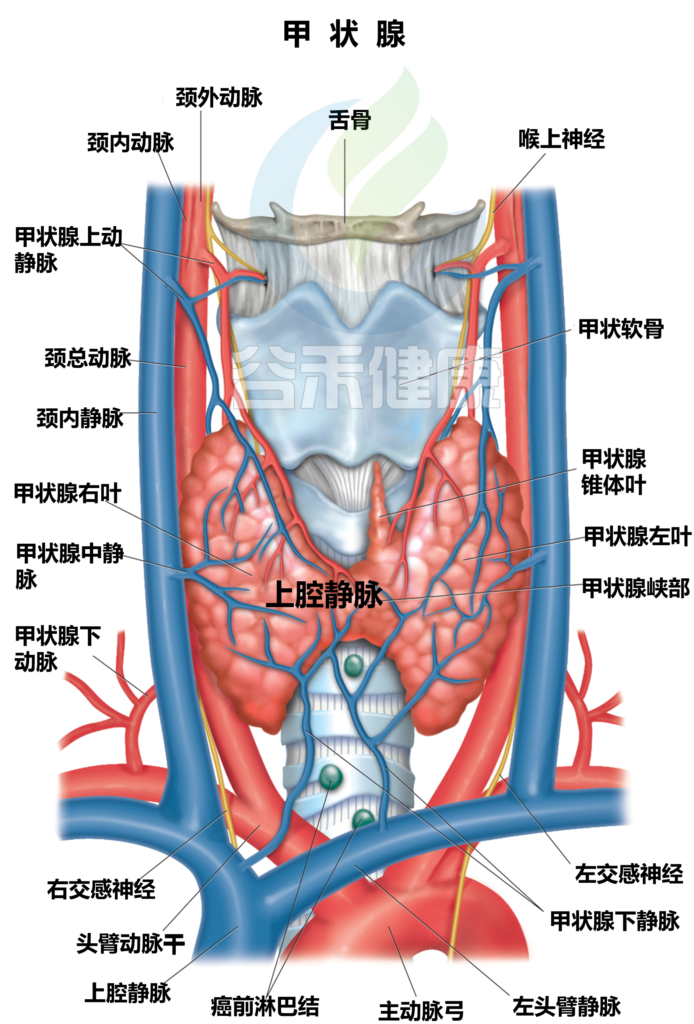
甲状腺如何参与调节新陈代谢?
甲状腺的工作是确保体内的细胞正常工作,通过激素来发送信息到每一个细胞。它生产两种重要的激素,分别是T4和T3(具体意思见本节末“名词小讲堂”),激素的工作是指导体内的细胞工作,何时该消耗氧气养分,从而维持体内新陈代谢的过程。
人体内的每个细胞都有这些激素的受体,甲状腺的作用包括:
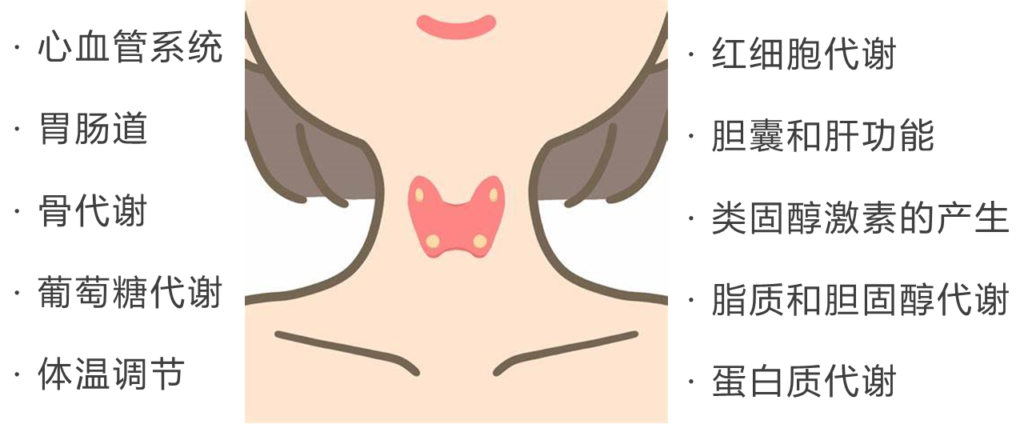
同时呢,甲状腺也是受约束的,它何时发送信息是被脑部的垂体监控着的,垂体会感受血液中的激素含量高低,以促甲状腺激素(TSH)的形式发出指示。可以看到,这是一个精密运作的系统。
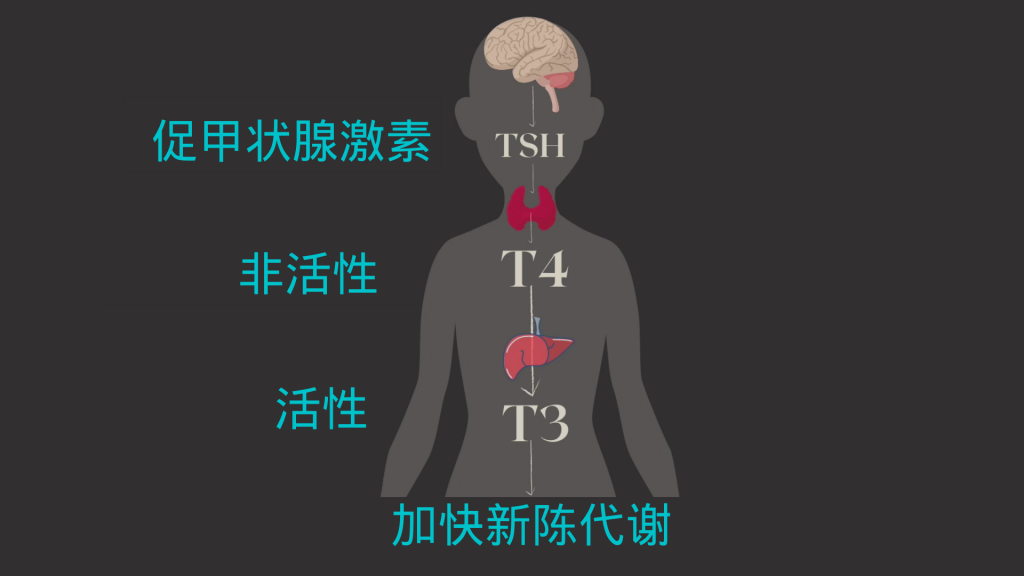

然而,甲状腺激素的产生、转化和摄取过程非常复杂,如果任何一步出错,就会出现甲状腺功异常的症状。
▲甲状腺过度活跃——甲亢
甲状腺过度活跃,发出太多激素时,就会出现甲亢,新陈代谢就会加快,表现为心率过快,持续饥饿,体重下降,出汗,焦虑,难以入睡。
▲甲状腺活动不足——甲状腺功能减退症
甲状腺活动不足时,就会出现甲状腺功能减退症,也就是甲状腺发出激素太少,没有足够的量去唤醒体内细胞,新陈代谢减慢,表现为体重增长,怕冷,关节肿大,感觉忧郁。
名词小讲堂:
促甲状腺激素释放激素 (TRH):这种激素在下丘脑中产生,它向垂体发出信号以产生多少促甲状腺激素 (TSH)。
促甲状腺激素(TSH):由垂体产生,TSH 刺激甲状腺产生甲状腺激素 T4 和 T3。TSH 水平升高可能表明甲状腺功能低下。需要注意的是,并非所有甲状腺功能减退症患者都符合这种模式。如果甲状腺激素水平低,TSH 水平低也可能表明存在问题。
甲状腺素 (T4) 和三碘甲状腺原氨酸 (T3):统称为“甲状腺激素”,T4 和 T3 由甲状腺产生。T4 是甲状腺激素的非活性形式,必须先转化为 T3,然后身体才能使用它。
总 T4 和 T3:它们与蛋白质载体结合,可以在血液中循环
游离 T4 和 T3:它们与载体分离,可以与细胞受体结合并发挥其功能 。
甲状腺结合球蛋白 (TBG): TBG 是与 T4 和 T3 结合并通过血液运输这些激素的蛋白质载体。过多的 TBG 会导致游离 T4 和 T3 水平降低。
甲状腺抗体:在自身免疫的情况下,这些抗体会攻击并损害甲状腺。我查看甲状腺过氧化物酶 (TPO) 抗体 (Ab)和甲状腺球蛋白 (Tg) Ab。这些抗体可以在临床甲状腺功能减退症发生前数年出现,因此及早发现它们尤为重要。
目前研究表明,良好的甲状腺健康始于肠道。随着我们对肠道微生物群的了解不断加深,可以看到研究表明,生活在人体内的微生物群在甲状腺功能减退症和自身免疫性甲状腺疾病中发挥着重要作用。
甲状腺疾病,例如桥本甲状腺炎或甲状腺功能减退症,通常与不孕症、荷尔蒙失衡、体重增加、疲劳或焦虑等症状有关。

谷禾健康
油炸是一种流行的烹饪方法,它使食物在质地和香味上更有吸引力,从而改善食物口感。


油炸食品通常被认为不健康的,因为油炸可能会增加食物的能量密度,从而增加能量摄入,并通过氧化和氢化过程使油变质,导致不饱和脂肪酸如亚油酸和亚麻酸的损失,但反式脂肪酸、油脂降解和晚期糖基化终产物的增加。
在流行病学研究中,油炸食品的高摄入量与多种不良健康后果有关(包括2型糖尿病),虽然结果并不完全一致。
可能原因:
油的类型
据报道,在主要使用橄榄油制备油炸食品的人群中,油炸食品和2型糖尿病风险之间没有关联,橄榄油比其他普通油(如玉米油)更抗氧化。
食物成分 、条件
被油炸食物的不同成分和油炸条件(温度、持续时间)也可能引发不同的结果。
混杂因素
各种混杂因素(如体重增加、高血压和高脂血症)增加了不一致观察结果的复杂性,这些因素与食用油炸食品和2型糖尿病风险相关。
综上,油炸食品和2型糖尿病之间的不良关联背后的潜在机制在很大程度上仍然未知。很多途径包括体重增加、炎症和脂质代谢等都有可能参与其中。
近年来,越来越多的数据表明,肠道微生物群可能在饮食因素(包括油炸食品)与宿主健康联系中发挥着关键作用。
对人类和动物模型的研究表明,油炸食品的摄入量或油炸和热加工的副产品与肠道微生物群的多样性和丰富性有关。然而,评估油炸食品对糖代谢影响的随机临床试验仍然缺乏。
近日,《糖尿病护理》杂志上,一项随机对照喂养试验旨在测试油炸肉类摄入对葡萄糖稳态的影响。
研究人员将117名年龄在18-35岁的青少年超重(BMI > 24 kg/m2)的成年人随机分为两组,分别提供等热量膳食和一致的食物,交替健康饮食指数(AHEI)评分>85。干预组是油炸,对照组是煮,蒸,或用调味汁拌。
葡萄糖代谢指数变化:
在两组的干预过程中,包括胰岛素生成指数(IGI)、肌肉胰岛素抵抗指数(MIRI)和胰岛素水平在内的几项葡萄糖代谢指数均有所改善,同时能量摄入也有所减少。
与对照组相比,油炸食品组的4周干预在IGI、MIRI和胰岛素曲线下面积(AUC)方面的改善较少,并且在HbA1c、C肽和葡萄糖的曲线下面积没有差异。作者得出结论,油炸肉的摄入损害了葡萄糖稳态。
肠内毒素和炎症标志物变化:
次要结果中,油炸肉干预组显示肠内毒素和全身炎症生物标志物减少较少,调节饱腹感和糖摄入的肝因子FGF21增加较少。
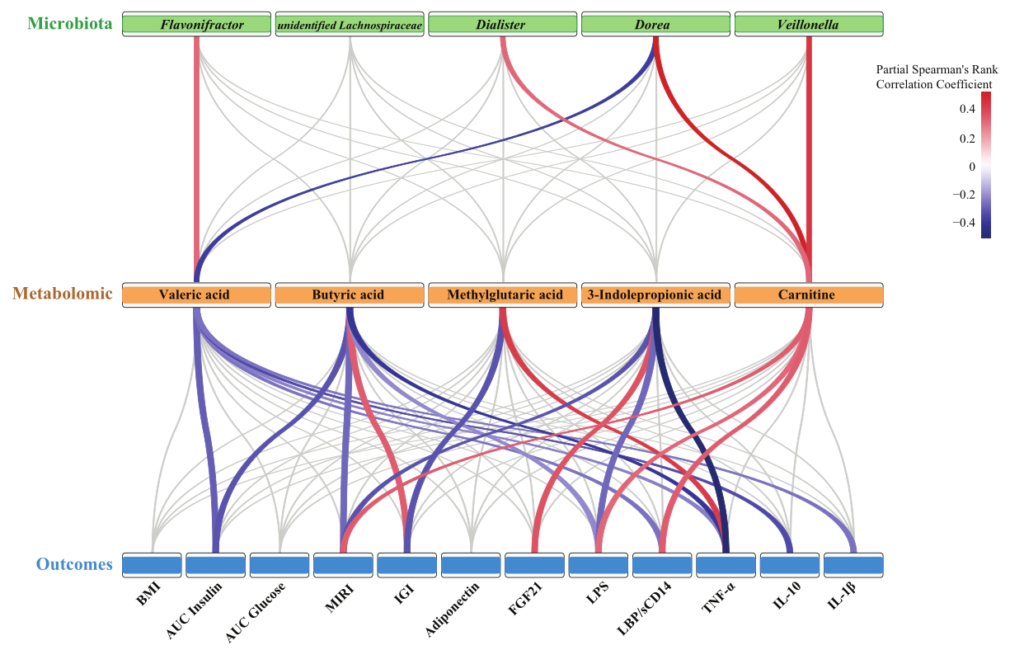
肠道微生物群变化:
发现油炸肉组的肠道微生物群丰富度低于对照组;总体微生物结构和组成以及微生物组预测的与葡萄糖稳态相关的途径在这两组之间也是不同的。
油炸组降低了Lachnospiraceae和Flavonifractor的丰度。

谷禾健康
人一生中平均有三分之一的时间在睡觉。睡眠对于我们是必不可少的存在,它能够促进我们的幸福感。

然而目前,睡眠障碍已经成为了一种流行病。尤其是在新冠肺炎流行之后,进一步加剧了睡眠问题。
随着睡眠障碍的患病率越来越高,人们开始深入研究——是什么因素决定了睡眠的质量?
众所周知,各种环境因素和其他因素(如心理压力和饮食)的共同作用会影响睡眠质量和睡眠持续时间(下图)。
图1 各种因素的相互作用影响睡眠质量和持续时间
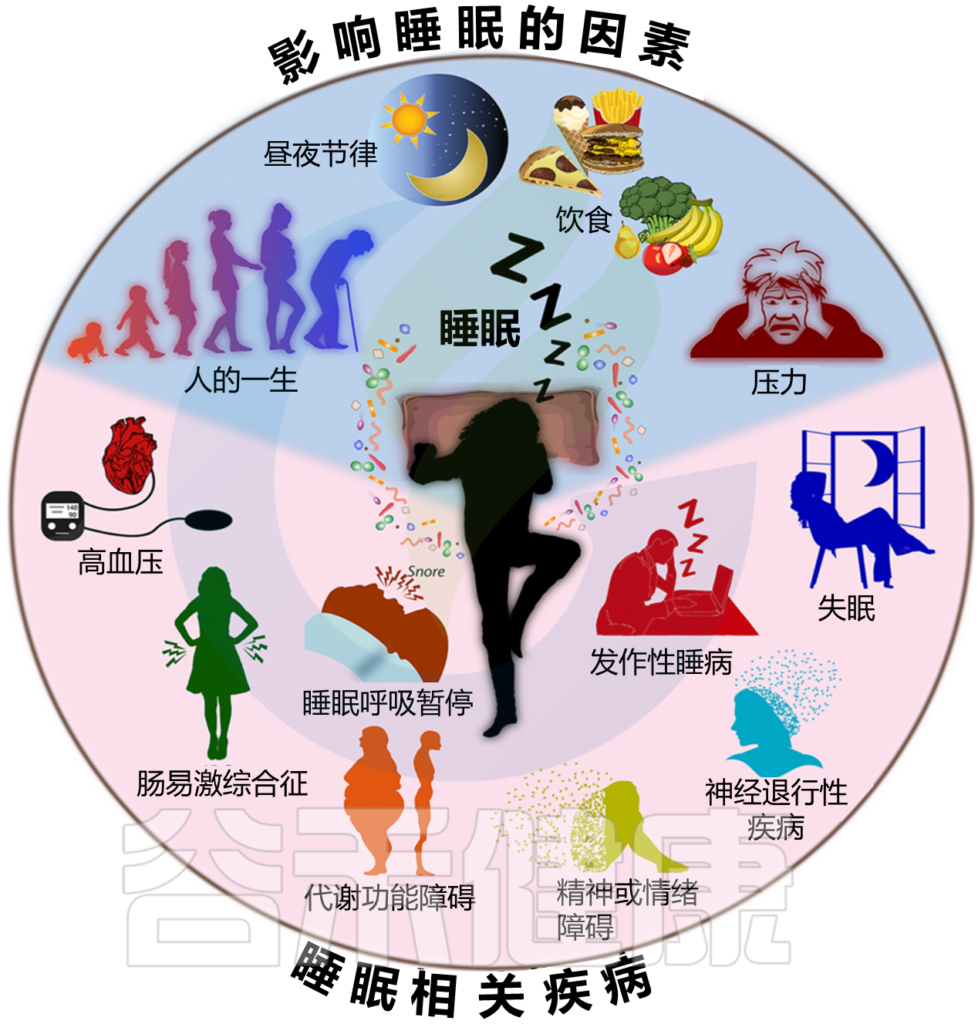
Sen P, et al.,Trends Mol Med. 2021
各种因素对睡眠质量和持续时间的相互作用影响。已知各种不同的因素会影响睡眠。其中包括饮食、压力、昼夜节律调整以及整个生命周期的各个阶段(上图,蓝色背景)。最近的研究表明,这些因素与肠道微生物群相互作用,影响睡眠。
反过来,睡眠质量和持续时间也影响各种因素。睡眠质量差或睡眠不足可导致免疫、代谢功能障碍、血压升高,并可发展为肠易激综合征、各种神经退行性疾病和精神障碍、睡眠呼吸暂停和发作性睡病(下窗格,粉红色背景)。睡眠不足可能通过影响肠道菌群组成而导致这些疾病的发展。
本文从微生物群的角度探讨各种因素如何与肠道微生物群相互作用影响睡眠。包括睡眠与微生物群具有相互作用的可能机制。
此外,还提出了常见的伴随睡眠障碍的疾病以及针对各种睡眠障碍时微生物群对肠道和大脑进行调节改变的现有证据。
睡眠质量与肠道菌群组成之间存在双向关系。使用抗生素干扰肠道微生物群会导致更大的非快速眼动(NREM)睡眠碎片化,从而降低睡眠质量,睡眠中断也会导致肠道微生物群组成的变化。不过,关于睡眠障碍和微生物组成之间关系的结果缺乏一致性。
此外,大多数睡眠研究只关注单一时间点的肠道微生物群。由于肠道菌群每天动态变化,睡眠和肠道菌群之间的关系可能在一天的不同时间有所不同。
尽管如此,越来越多的研究表明,微生物-肠道-大脑轴与睡眠生理和行为有关。
表1 探索肠道微生物如何影响睡眠的各种研究

Sen P, et al.,Trends Mol Med. 2021
睡眠和微生物群组成:交流机制
肠道微生物群通过微生物群-肠道-大脑轴与大脑沟通的各种可能机制。
图2 影响睡眠的微生物群-肠道-大脑轴交流模式

谷禾健康
2型糖尿病是一种血糖水平升高(高血糖)的慢性代谢疾病,主要由胰岛素抵抗和胰岛素分泌不足引起。2型糖尿病全球患病率在不断上升。
截止到2020年,根据美国糖尿病学会评估标准,糖尿病患病率已达到12.8%。其实在我国成年人中,已经有将近一半的人存在血糖异常,未来极有可能发展为2型糖尿病。如果不加干预治疗,会引发许多不良后果。
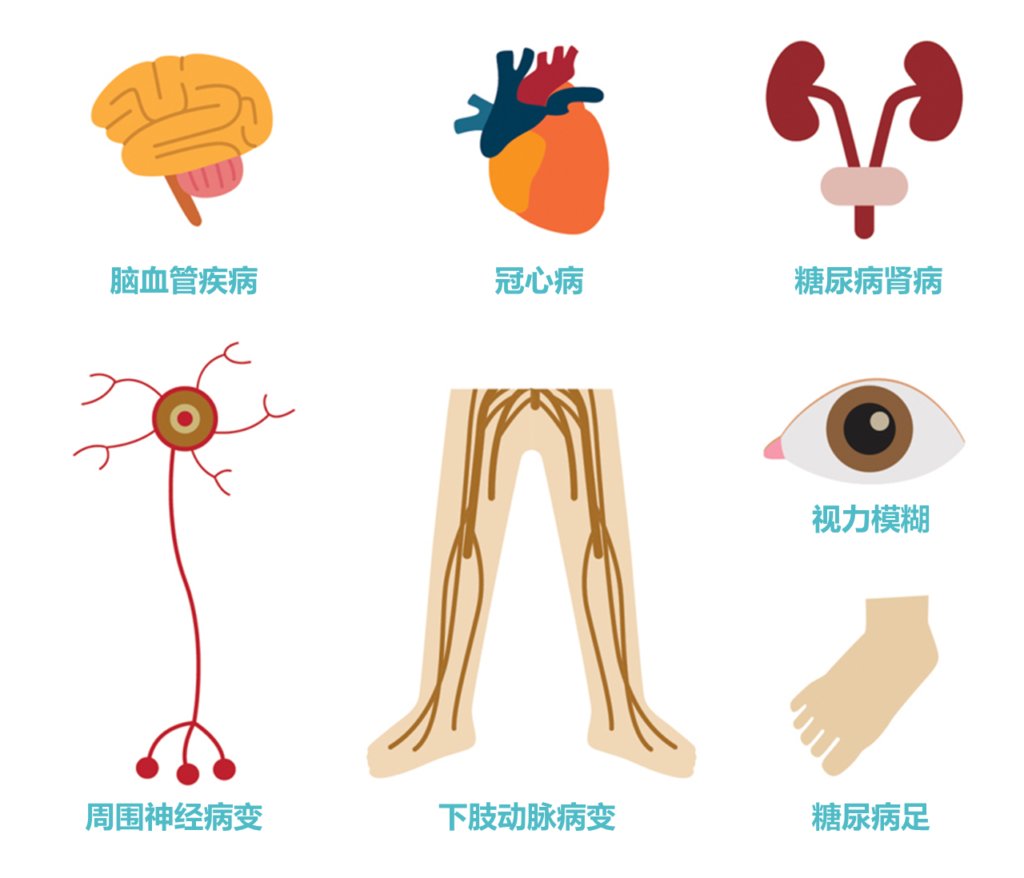
很多研究表明,肠道菌群在宿主的代谢和疾病状态中起着重要的作用。特别是2型糖尿病,其病因复杂,包括肥胖、慢性低度炎症,受肠道微生物群和微生物代谢产物的调节。
本文将从肠道菌群的角度了解其与2型糖尿病的关系;肠道菌群及其代谢物对葡萄糖代谢、免疫系统的影响;
从影响肠道菌群变化的因素来了解各种干预措施,包括药物,饮食,益生菌/益生元,粪菌移植,间接性禁食等方式。
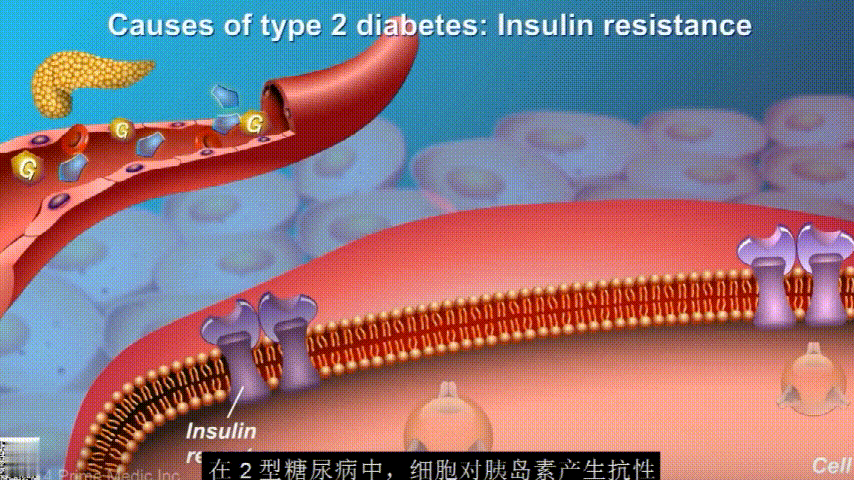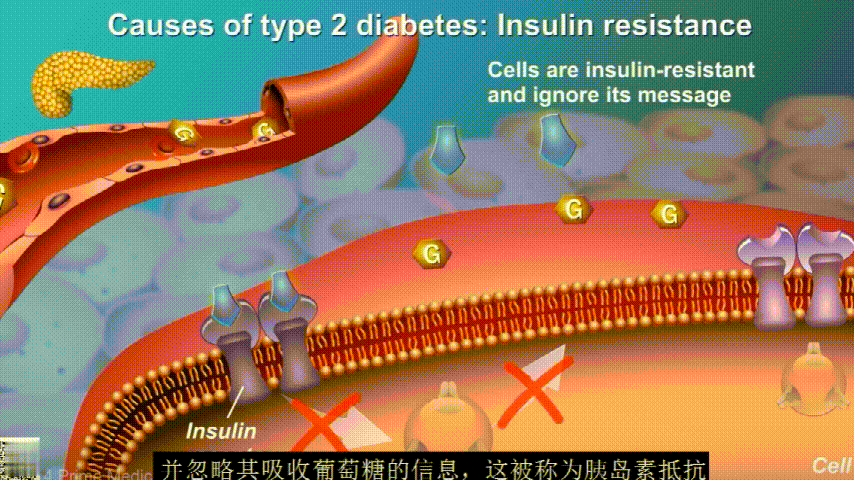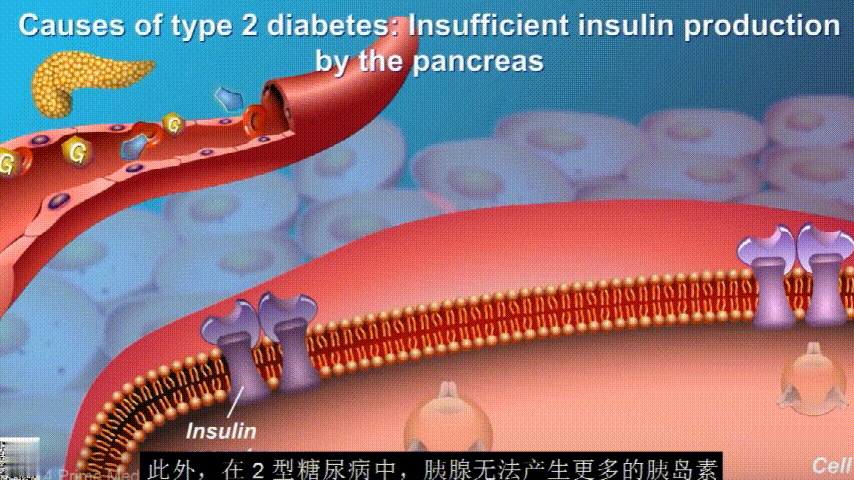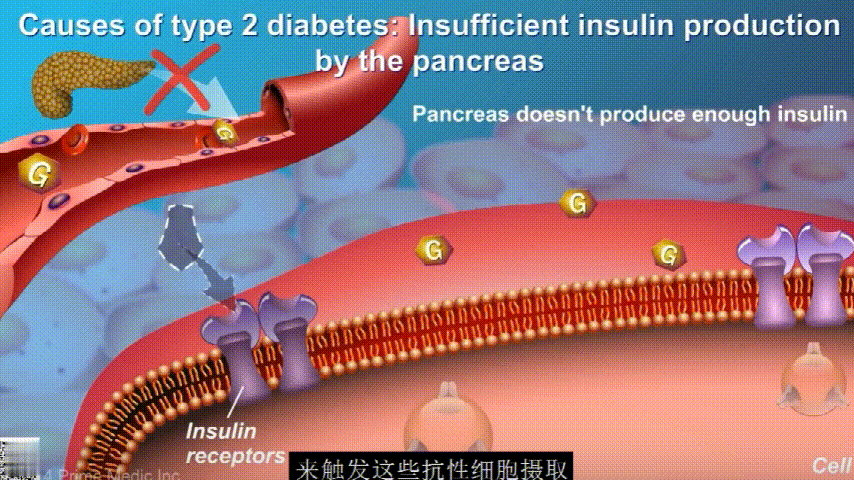
葡萄糖主要通过食用的食物和饮料进入人体。胰腺会产生一种叫做胰岛素的激素,以帮助血液中的葡萄糖进入肌肉、脂肪和肝脏,用作能量。
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像钥匙打开锁一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
刚开始的时候,胰腺会觉得自己使不上力,于是不甘心开始拼命工作,产生更多的胰岛素来克服这种抵抗。
随着时间的推移,胰腺开始累了,力不从心,不能产生更多的胰岛素,这时候就是2型糖尿病开始了。
肠道微生物群可以直接或间接地影响人类健康,肠道微生物群失调可能会增加促炎疾病的患病率,如肥胖、炎症性肠病、2 型糖尿病、关节炎和癌症。
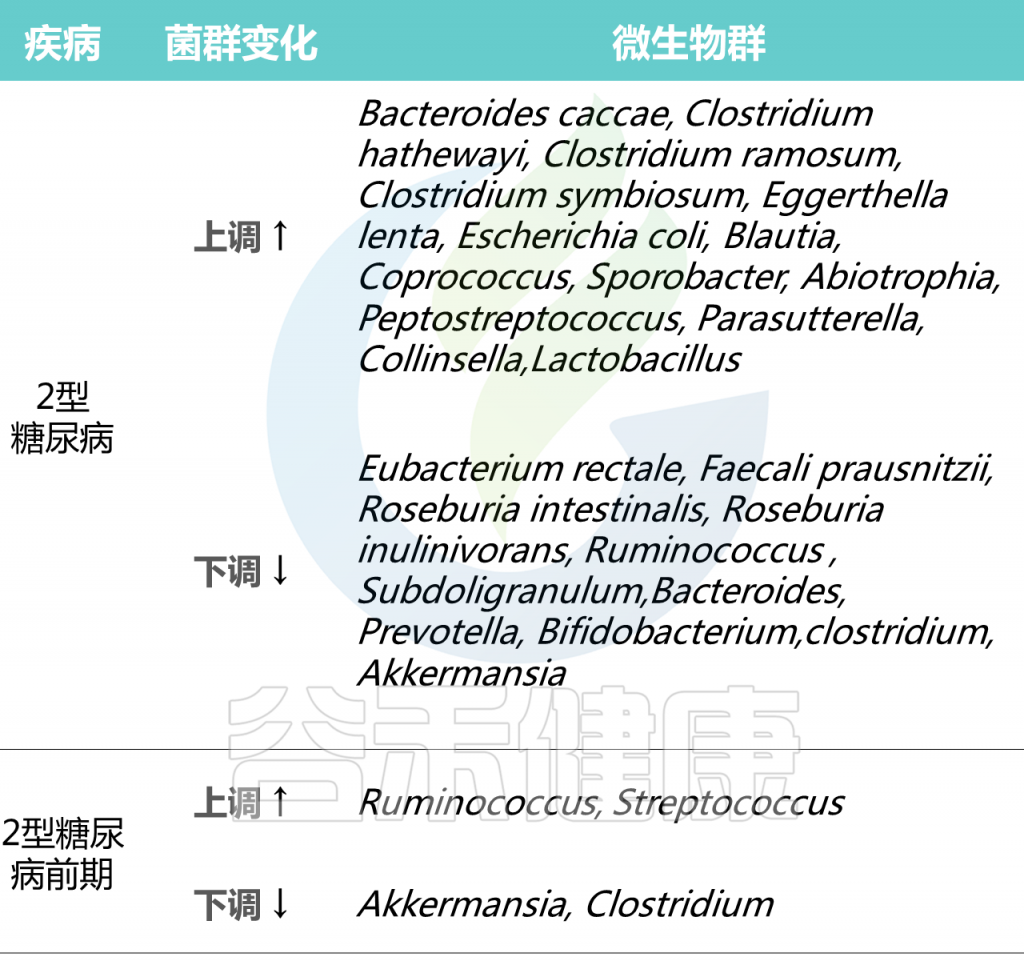
2型糖尿病人群中个体微生物群的差异

Cunningham A L et al., Gut Pathog, 2021
在2型糖尿病患者普遍具有相对高丰度的特定属:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
2型糖尿病患者中,产生丁酸菌特别缺乏,特别是梭菌目,包括:
Ruminococcus、Subdoligranulum,Eubacterium rectale、Faecali prausnitzii、Roseburia intestinalis 、
Roseburia inulinivorans
2型糖尿病患者中,其他明显较少的菌属有:
拟杆菌属、普雷沃氏菌属、双歧杆菌属

谷禾健康
围产期营养是健康生长和长期发育轨迹的早期决定因素。关键发育时期的营养不良可以显著、持续地改变许多身体系统的发育过程,包括神经系统。
营养不良 是指热量、大量营养素或微量营养素的缺乏、过量或差异比例的改变。
研究表明,肠道微生物组可以调节饮食对宿主生理的影响,且调节神经系统的发育和功能。
本文围绕营养不良、肠道微生物群和神经发育三者之间的关系,讨论了围产期营养不良改变孩子大脑发育的证据,并研究了母体和新生儿微生物群作为一个潜在的促成因素,介导营养不良和大脑发育之间的关系。
常量营养素
生命早期蛋白摄入:与运动,智商,抑郁等都有关
营养不良的幼儿在社会行为上有缺陷。尤其是出生后早期蛋白质摄入与早产儿的运动和认知评分以及总脑容量呈正相关,与髓鞘形成相关缺陷、脑萎缩和心室扩张、皮质树突发育不良以及枕大池扩大和室周白质异常呈负相关。
出生后第一年低蛋白摄入的青少年表现出认知功能下降,包括儿童时期的智商和注意力下降,青春期抑郁症状增加。
生命早期脂肪摄入:影响大脑发育,甚至持续到成年
其他常量营养素也同样至关重要:在早产儿中,出生后早期脂肪摄入与更大的小脑、基底神经节、丘脑和全脑有关,此外还有内囊、辐射状晕、丘脑放射、后纵束和皮质脊髓束的分数各向异性增加。重要的是,大脑发育与后来的精神运动功能有关。
一些神经缺陷可能会持续到成年:在荷兰饥荒出生队列的118名成员中,暴露于产前营养不良与成年后期脑白质灌注减少,男性扣带皮层血流量减少,与男性衰老相关的大脑特征相关。
来自巴巴多斯的成年人在出生后第一年受到蛋白质限制,有持续的注意力缺陷,执行功能下降,包括认知灵活性、工作记忆和视觉空间整合。
微量营养素
出生后早期缺乏微量营养素,如维生素B12、叶酸和维生素K,也与脑萎缩和胼胝体变薄、精神疾病和颅内出血风险增加有关。
营养过剩
母亲营养过剩(怀孕前和/或怀孕期间的高BMI)与婴儿在认知和语言发展领域得分下降、视觉运动技能受损、社交和学习能力下降(尤其是男孩)、胎儿丘脑和皮质连接性改变有关。
实际上,营养需求以及这些需求得不到满足的后果可能比以前的模型所显示的更加复杂和相互依存,可能构成一个连续体,而不是营养不足和营养过剩的二元对立现象。
为了进一步了解营养不良作为一个连续体,研究产前营养不良的特定亚型破坏大脑和行为发育的基本机制至关重要。
肠道微生物群是饮食对宿主生理影响的关键决定因素,具有调节大脑发育和行为的能力。
饮食和营养的变化,改变了肠道微生物群的结构和功能,尤其是在发育的关键时期。
营养不良——α多样性下降:
孟加拉国2岁以下儿童出生后严重急性营养不良与微生物α多样性(物种丰富度和均匀度)下降相关,表明菌群不成熟的情况即使在饮食干预后也持续存在。在一个类似的队列中,α多样性降低的原因是发育迟缓和非发育迟缓儿童之间噬菌体(细菌病毒)的差异。
营养不良不同亚型,α多样性下降程度不同:
在塞内加尔和尼日尔的幼儿中,出生后营养不良亚型之间的微生物多样性差异显著:
不同亚型之间的菌群构成差异:
出生后严重急性营养不良儿童体内的微生物群减少,代谢和营养吸收相关的功能途径减少,毒力相关基因增加。还显示肠道氧化还原电位增加,这可能是微生物群落组成改变的功能结果。
营养不良——α多样性升高:

谷禾健康
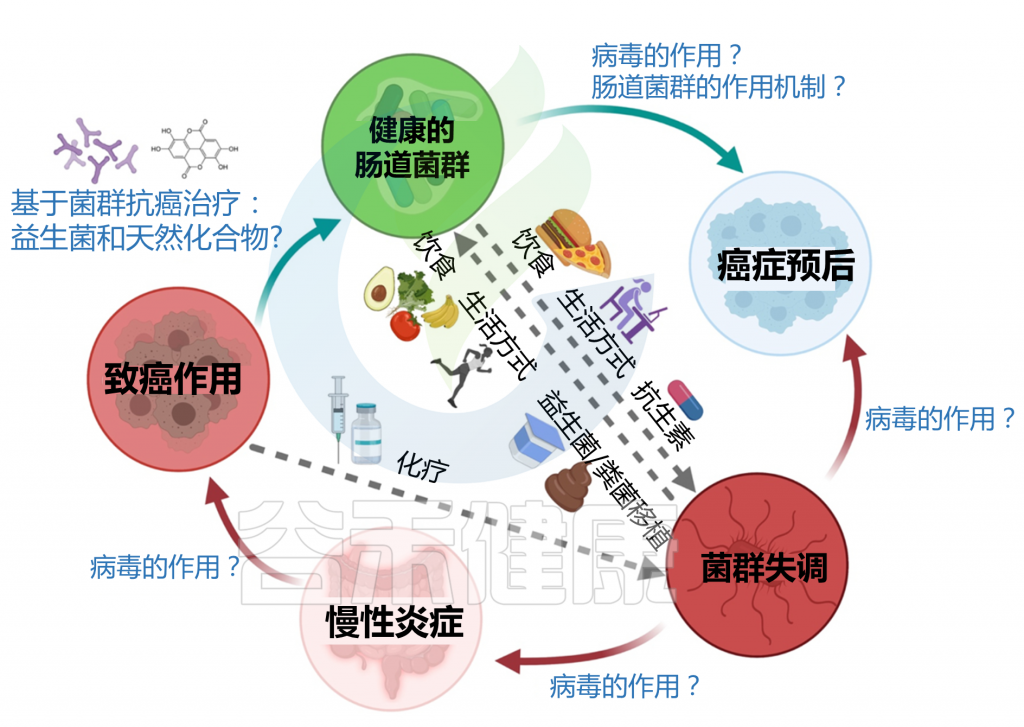
肠道微生物群在癌症中发挥免疫调节和抗肿瘤作用,肠道微生物失调可诱导有毒代谢物的释放,并在宿主体内表现出促肿瘤作用。肠道微生物群也能调节标准化疗药物和天然抗癌药物的疗效。
本文列举5种常见的癌症(结直肠癌、肺癌、乳腺癌、前列腺癌、胃癌),以及肠道微生物群在癌症中的复杂作用。
肠道微生物群与癌症发病的关系概览

在进入具体的5种癌症章节之前,我们先来了解一下,微生物群与癌症的关系。有研究人员将微生物群和癌症之间的关系分为三个层次: 一级、二级和三级相互作用。
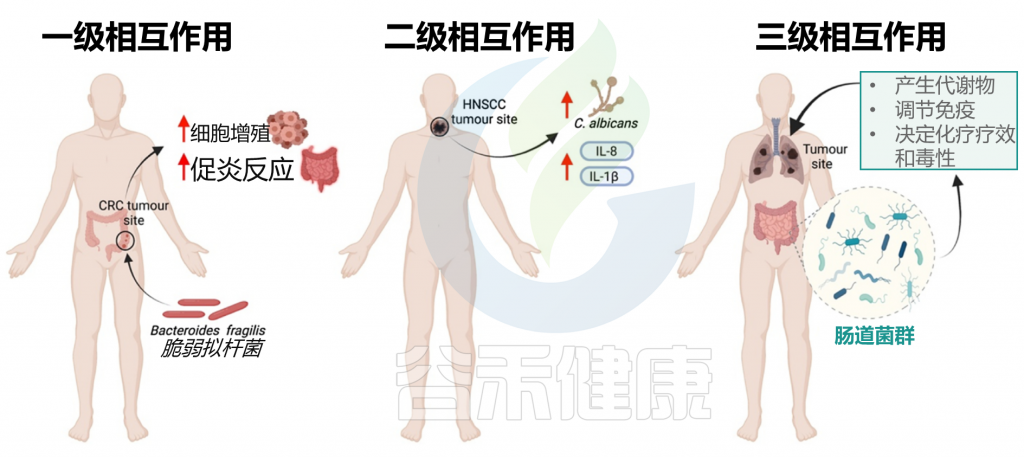

一级相互作用(主要)
主要的相互作用考虑了肿瘤微环境和微生物群之间的直接联系。几项体内和体外研究主要从两个方面支持了这种关系:
a) 肠道微生物群可通过生物失调导致致癌
b) 肠道微生物可通过调节肿瘤活性干扰化疗药物的疗效
二级相互作用(次要)
次要的相互作用考虑了组织或器官系统的微生物群和同一大体分区内的肿瘤之间的联系。这种相互作用水平有助于识别用于筛选不同癌症类型的潜在生物标志物。特别地,来自局部组织或器官环境的次级微生物群可包含来自肿瘤微环境和初级微生物群落的痕迹,其可用作癌症的生物标志物;但这些诊断过程往往很复杂。
三级相互作用
肠道微生物群和肿瘤之间的三级相互作用解释了位于体内不同部位的肿瘤上的微生物群的影响。对这种相互作用水平的研究对于确定生理上遥远的微生物种类和感兴趣的肿瘤之间的关系具有重要意义,这对于确定癌症患者中潜在治疗选择的功效也具有临床相关性。
这些三级相互作用可以通过以下方式影响癌症:
肠道微生物群可以通过启动代谢过程(包括水解和还原)来调节口服药物代谢,这直接影响药物毒性,并可以增强或抑制药物活性。微生物群与肿瘤之间的三级相互作用也可以帮助诊断不同类型的癌症。
肠道微生物群的促肿瘤、抗肿瘤和免疫调节作用
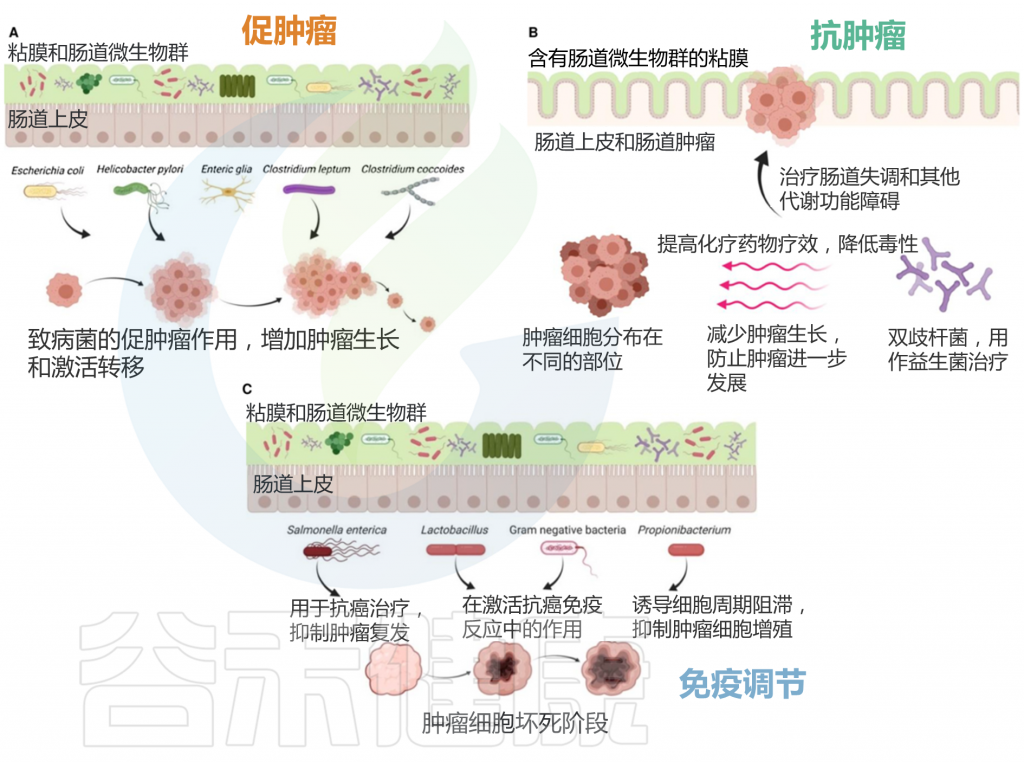


谷禾健康
一般在肠道菌群健康检测报告中,会有主要菌属构成比例,类似下图:
图源:谷禾肠道菌群健康检测报告我们可以看到图中列举了拟杆菌门,厚壁菌门…等。很多小伙伴拿到报告之后,对于这些细菌门表示困惑。
这些细菌门都代表了什么意思?
某个细菌门比例高了会怎么样?
某个细菌门比例高,是好是坏?
是不是与某些疾病相关?
…….
实际上,这几大类门的丰度和构成比例变化与人类健康和疾病发生息息相关。
两个主要门类,拟杆菌门和厚壁菌门,构成人类肠道细菌的大部分。七岁以后,拟杆菌和厚壁菌之间的比例相对稳定,而它们比例紊乱可能会导致肥胖和糖尿病等代谢综合征。
本文,我们就给大家详细介绍一下这其中最常见的几大细菌门:
拟杆菌门、厚壁菌门、变形菌门、放线菌门。
为什么选这四大细菌门?
依据自然属性分类,人类肠道菌群已经鉴定出细菌的几十个门,包括:拟杆菌门、厚壁菌门、变形菌门、放线菌门、疣微球菌门、梭杆菌门、蓝藻菌门、螺旋体门等。 但是其中98%的肠道菌可以归属为前四类,拟杆菌门、厚壁菌门、变形菌门和放线菌门,大多数人这4个门的菌占据肠道细菌数量的99%。 了解这四大细菌门,可以说你对大部分人体内肠道菌群的有了一定的了解。
▲ 拟杆菌 :革兰氏阴性菌
不形成孢子 厌氧菌 杆菌 ▲
它们具有外膜、肽聚糖层和细胞质膜。它们无氧呼吸的主要副产物是乙酸、异戊酸和琥珀酸。
包括碳水化合物的发酵、含氮物质的利用以及胆汁酸和其他类固醇的生物转化。大多数肠道细菌是糖酵解的,这意味着它们通过碳水化合物分子的水解获得碳和能量。
据估计,只有约 2% 的单糖通过上消化道到达结肠。因此,单糖可能不是拟杆菌的主要能量来源。然而,来自植物纤维的多糖,如纤维素、木聚糖、阿拉伯半乳聚糖和果胶,以及植物淀粉,如直链淀粉和支链淀粉,在结肠中更为普遍。
多糖还被证明可以诱导来自拟杆菌的多种葡糖苷酶活性,包括负责海带多糖降解的 β-1,3-葡糖苷酶活性以及多种 α、β-1,4 和 α、β–1,6 木糖苷酶和葡糖苷酶活性。大部分拟杆菌成员蛋白质组包括水解这些多糖的蛋白质。
表现出相当大的营养灵活性和对宿主和肠道环境施加的压力做出反应的能力。很难说肠道拟杆菌是否对宿主产生负面或正面影响。拟杆菌能够通过预防可能定植和感染肠道的潜在病原体感染来使宿主受益。由但是,在短链脂肪酸存在下,弱酸性 pH 值会抑制生长。诸如脆弱拟杆菌之类的致病物种已经开发出逃避宿主免疫系统的策略。
作为多糖降解联盟的成员,它们有助于从膳食纤维和淀粉中释放能量,它们很可能是丙酸盐的主要来源;然而,它们也参与了蛋白质分解过程中有毒产物的释放,这个群体的成员有一些可能有助于抑制炎症的活动,但他们也有可能促进炎症,有些是已知的机会性病原体。

谷禾健康

便秘是世界范围内高度流行的功能性胃肠道疾病,患病率为 2-20%.
根据罗马 IV 标准,慢性便秘的典型症状是排便困难、不频繁或不完全排便。便秘的症状总是连续不断、反复出现,严重影响患者的身心健康和生活质量。


慢性便秘与多种因素有关,如肠道神经细胞的变化、菌群改变、肌病、神经递质和生态失调。此外,部分原因是其久坐的生活方式,情绪、饮食方式和液体摄入偏少,用药物(例如磷酸盐结合剂)和多种合并症(例如糖尿病,甲状腺疾病等),
而长期便秘会使人心情烦躁、容貌衰老,还可能造成肛肠疾患、胃肠道功能紊乱、心血管疾病和性生活障碍等,同时还会增加溃疡性结肠炎、患结肠癌等疾病的患病率。
最近的流行病学研究表明,便秘与许多不良临床结局相关,例如结直肠癌、肝性脑病、乳腺疾病、阿尔茨海默病、终末期肾脏疾病(ESRD),心血管(CV)疾病和死亡率等。
便秘严重影响生活质量,耗费大量金钱与医疗资源,但目前临床治疗效果却不尽如人意,往往停药便复发,因此寻找新的治疗方法或改进现有的治疗方法,可改善患者生活质量与减少社会医疗负担。
临床上认为一周小于3次的排便就叫便秘,尽管很多患者想力求每天一次才舒适。此外,判别便秘的其他特征和症状还包括:
