-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

春节假期期间,亲朋好友欢聚一堂,美食佳肴各种狂炫,然而当传统节日遭遇现代饮食文化,频繁的高脂高蛋白摄入、不规律的进食节奏,正不断冲击着肠道屏障的免疫调控网络,部分人群可能正被食物过敏困扰。
食物过敏(FA)是一个当今面临公共卫生问题。一个人可以在任何时候对任何食物过敏,但有引起过敏反应最普遍的食物包括:牛奶、鸡蛋、花生、坚果、大豆、小麦、鱼类和贝类。这些过敏反应范围从肿胀和荨麻疹到危及生命的过敏性休克。
更不乐观的是,食物过敏在当今全球工业化社会中的流行率呈现显著代际增长(一代比一代增强)。与此同时食物过敏率的上升与很多疾病的增加相呼应,包括肥胖、糖尿病、哮喘、自闭症和炎症性肠病(以及其他疾病)。我们如何解释这种代际变化?
食物过敏是过敏性疾病的一部分,被称为I型超敏反应,是由食物蛋白(抗原)通过肥大细胞和/或嗜碱性细胞表面上的免疫球蛋白同种型E(IgE)交联引起的,这与由食物成分引起的食物敏感性不同(例如,乳糖不耐症)。
与此同时,我们的肠道相关淋巴组织(GALT)每天都面临着相当大的挑战。它遇到的抗原估计来自1014微生物和每年超过约30公斤的食物蛋白质。这要求它必须将这些无害的抗原与潜在的病原体区分开来,并能同时引起适当的宿主免疫应答。
目前越来越明确的是,与先天免疫细胞和常驻微生物群密切相互作用的功能性上皮屏障对于建立和食物过敏以及口服耐受性至关重要。而口服耐受性的形成取决于年龄、遗传学、粘膜屏障状态、抗原的物理性质、暴露剂量和频率以及肠道微生物群。
是什么驱动了对食物抗原的过敏反应,近年来有关微生物群在调节抗原摄取和抗原呈递中的作用开始被解开。在4至6个月大的婴儿中早期引入致敏性食物已被证明有希望降低部分但并非所有儿童的IgE-食物过敏(IgE-FA)发病率。
IgE-FA尚无明确的治愈方法,金标准治疗是在发生过敏反应时避免使用对症治疗。幸运的是,疾病修饰疗法,包括免疫疗法,生物制剂等有希望。
本文汇总和依托这些文献结果,讨论了IgE-食物过敏在其自然史的背景下,发展的风险因素,免疫生物学,诊断和治疗,包括新兴疗法。同时,我们也将探讨肠道微生物群在食物过敏中的作用,以及如何通过调节肠道微生物群来预防和管理食物过敏。
食物过敏是一种由免疫球蛋白E(简称IgE)引起的过敏反应。这种病近几十年来越来越常见,可能会威胁生命。特别是对于那些难以完全避开的食物(比如牛奶或鸡蛋)过敏的人来说,生活质量会受到很大影响。
对牛奶、鸡蛋、小麦和大豆的过敏,随着年龄增长可能会慢慢好转。
对花生、坚果和海鲜的过敏,通常会伴随终身。
食物过敏常常和其他过敏性疾病一起出现,比如:
虽然理论上任何食物蛋白质都可能引起过敏,但最常见的是:
小麦过敏和乳糜泻是两种不同的病:
小麦过敏是对小麦蛋白的过敏反应;
但在乳糜泻中,部分水解的麦醇溶蛋白被小肠粘膜中的组织转氨酶脱酰胺。这种特异性和有序的脱酰胺作用增强了小肠固有层中CD4+T细胞对麦胶蛋白的识别,导致免疫应答。细胞因子的后续释放导致肠粘膜的组织学变化。
◆ 过敏疾病是如何发展的?
医生们发现,很多孩子的过敏疾病会按照一定规律逐步发展,这个过程被称为“过敏进行曲”。大约有30-50%的过敏儿童会经历这个过程。不过每个孩子的发展过程可能不太一样。
◆ 过敏疾病通常会按这个顺序出现:
湿疹(特应性皮炎):通常在出生后6个月内最先出现
食物过敏:在1岁前就可能出现
过敏性鼻炎和哮喘:在有湿疹的孩子中,差不多三分之二会在3岁前出现这些症状。
特别提醒:如果湿疹控制得不好,更容易得其他过敏病。
◆ 为什么会得食物过敏?
食物过敏的形成和很多因素有关:
个人因素:
严重的早期湿疹
父母有过敏病史
环境因素:
接触过敏物的时间
肠道中的菌群平衡情况
环境因素如何影响过敏?
新出现的数据表明,在免疫系统发育过程中暴露于非微生物环境因素,包括空气过敏原、清洁剂、污染物和微塑料,可能会导致屏障功能障碍。霉菌、蟑螂和尘螨等空气过敏原含有促进上皮蛋白分解的蛋白酶,导致上皮渗透性增加,例如,清洁剂破坏角质层内的紧密连接和脂质依赖性相互作用,从而增加细胞旁渗透性。
◆ 食物过敏的风险因素:
对过敏原蛋白的反应会受到多种因素的影响,包括:
个人的敏感程度:有些人对过敏原特别敏感,而有些人反应较轻。
过敏原的特性:不同食物中的过敏原性质不同,反应也会有所差异。
食物加工方式:加工过程可能会改变过敏原的性质,比如加热可能降低或增强过敏性。
有的加工对某些过敏原有帮助,比如鸡蛋中的卵清蛋白和卵粘蛋白在加热后过敏原性下降。
但对某些过敏原(如花生蛋白)可能起反作用,加热会使其形成更稳定的抗性结构,增加过敏原性。
◆ 胃肠道屏障与过敏风险
婴幼儿风险更高: 由于他们的胃肠道屏障和免疫系统尚未成熟,食物过敏更容易发生。
胃酸不足: 服用抗酸剂可能降低胃酸浓度,使更多未被分解的蛋白质进入肠道,增加过敏风险。
肠道通透性增加: 肠道屏障功能受损可能导致更多过敏原进入免疫系统,增加致敏和过敏反应的可能性。
食物成分的相互作用:食物中的其他成分可能会影响过敏原的作用。
◆ 过敏反应的严重程度
敏感人群的过敏反应可能从轻微到严重不等,严重时甚至可能危及生命(如过敏性休克)。因此,避免接触过敏原是目前最有效的预防方法。
◆ 为什么食物过敏难以治疗?
目前还没有针对食物过敏的有效治疗方法,因为科学家对引发过敏的分子机制还没有完全弄清楚。因此,过敏患者最好的办法就是避免食用含有过敏原的食物。但问题是,只有在明确知道食物中含有过敏原时,才能做到有效避免。
◆ 食品标签的重要性
食品标签是帮助消费者了解食物中是否含有过敏原的重要手段。然而,确保全球食品标签的准确性并不容易,主要有以下几个挑战:
◆ 哪些食物最容易引发问题?
牛奶是最常见的未标注过敏原,其次是小麦和大豆。这些食物经常出现在食品召回事件中,很大程度因为它们被意外添加或未正确标注。
对于过敏患者来说,了解食品标签和避免过敏原是保护自己的关键。但由于标签错误、交叉污染等问题,完全避免过敏原仍然具有挑战性。
食物过敏原主要是一类特殊的蛋白质(糖蛋白),它们通常能溶于水,而且比较”顽固”-不容易被热、酸和消化酶破坏。
不过,不同的过敏原特性会有很大差异。有的需要糖分子的修饰才能发挥作用,有的则不需要。
过敏原的结构特点:
大小不一:从小分子到大分子都有。
结构多样:有的是单个分子,有的会几个分子组合在一起。
稳定性强:通常含有特殊的化学键(二硫键),使它们不容易被破坏。
结合能力:能与金属、脂肪等物质结合,这种结合会让过敏原更稳定。
不同食物的过敏原如果结构相似,可能会导致交叉过敏。
常见的交叉过敏组合:
过敏原的识别位点(表位):
直线型表位:像一串珠子一样排列的氨基酸片段
立体型表位:蛋白质折叠形成的特殊立体结构
一般认为直线型表位更重要,因为它们更稳定,不容易被破坏。
但在某些情况下,立体型表位也能在食物中保持稳定,发挥作用。
了解这些特性有助于预测哪些食物可能会引起交叉过敏;改进食物加工方法,降低过敏风险;开发更好的过敏预防和治疗方案。
致敏是指免疫系统首次接触到某种过敏原后,开始产生针对它的特异性抗体(IgE),但此时不会引发过敏症状。
致敏的主要途径:
小麦过敏是一种IgE介导的I型过敏反应,部分人群对小麦中的某些蛋白质成分较为敏感,即使在护肤品中接触也可能出现过敏症状。
如果你已知对小麦过敏,或者属于敏感肌肤,建议谨慎使用含有水解小麦蛋白的护肤品。
花生过敏者可能因皮肤接触花生而致敏,尤其是皮肤屏障受损的人。
胃肠道致敏(1类食物过敏): 最常见的方式,食物过敏原通过消化道进入身体,导致过敏反应,尤其常见于婴幼儿,因为他们的肠道屏障和免疫系统尚未完全发育。常见过敏原包括牛奶、鸡蛋和豆类。
吸入性致敏(2类食物过敏): 通过呼吸道接触到空气中的过敏原(如花粉、动物毛发等),随后对相关食物产生过敏。
皮肤接触致敏: 通过皮肤接触到过敏原而致敏。例如:
蜱叮咬致敏: 蜱叮咬可能导致对红肉的过敏反应,这是一种特殊的皮内致敏途径。
子宫内暴露: 胎儿可能通过胎盘接触到母体食物中的过敏原(如牛奶、鸡蛋和花生),但目前没有确凿证据表明母亲的饮食会直接影响婴儿的食物过敏风险。
B细胞的双重角色 | 引起过敏/预防过敏
什么是B细胞?
B细胞是我们身体里的一种免疫细胞,它最重要的工作就是产生抗体(免疫球蛋白)。在食物过敏中,B细胞主要产生一种叫IgE的抗体。
食物过敏发生的过程:
第一步: 识别“入侵者”
B细胞会产生IgE抗体,这些IgE能够识别食物中的特定蛋白质(过敏原)。
第二步: 设置“警报器”
IgE会附着在特殊的免疫细胞(肥大细胞和嗜碱性粒细胞)表面,这些细胞就像身体的“警报器”。
第三步: 过敏反应的触发
当吃到过敏食物时,IgE认出并抓住过敏原
“警报器”被触发,免疫细胞释放出化学物质,这些化学物质引起过敏症状(如皮疹、呼吸困难等)。
关于IgE的特点:
IgE在所有抗体中数量最少,但它在过敏反应中起着关键作用。
B细胞的变化过程:
B细胞可以通过特殊方式转变,开始产生IgE,这个转变需要其他免疫细胞(T细胞)的帮助,还需要特定的信号分子(IL-4和IL-13)的参与。
对花生过敏的研究发现,科学家从花生过敏患者的血液中找到了产生IgE的B细胞。这些B细胞寿命较短。
不同过敏患者的IgE抗体可能会以相似的方式识别花生中的过敏原,这些发现帮助我们更好地理解食物过敏的发生机制,为开发新的治疗方法提供线索,从而可能帮助预防或减轻过敏反应。
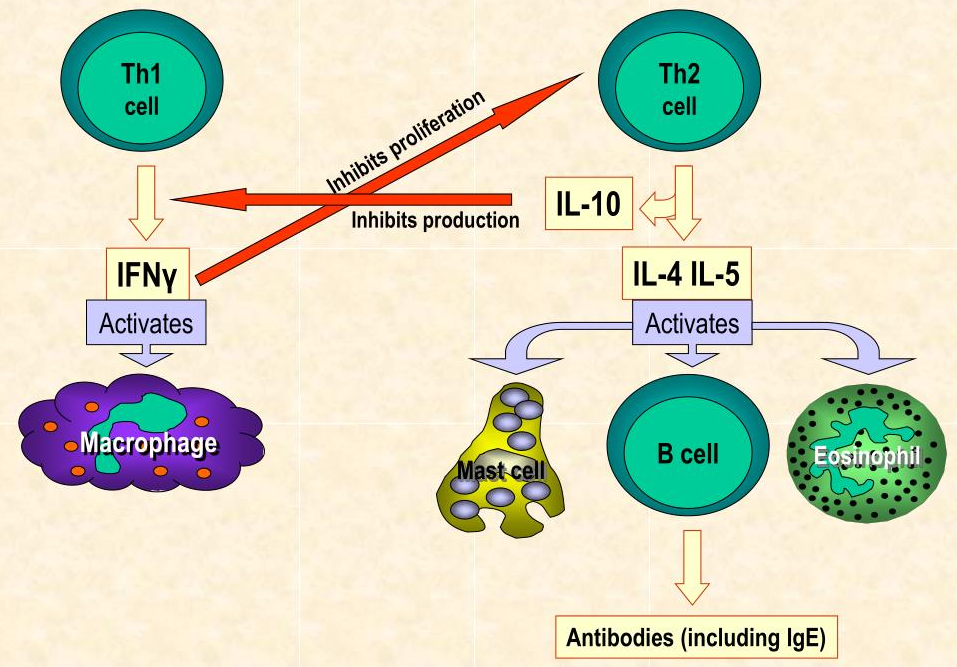
图 控制对过敏原反应的免疫过程
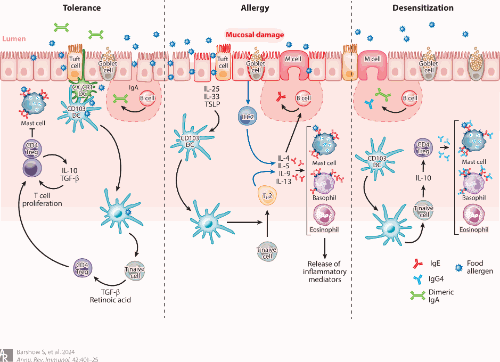
(左)耐受性:耐受性是一种主动免疫过程,在此过程中暴露于过敏原不会引发过敏性炎症。耐受性可涉及特异性抗原呈递细胞、TcB的诱导和活化以及B细胞同种型转换为伊加。
(中)过敏症:在过敏症中,上皮细胞功能障碍使抗原进入并触发alarmins IL-25、IL-33和TSLP的释放。幼稚T细胞分化成TH2细胞,其分泌促炎性TH2细胞因子IL-4、IL-5、IL-9和IL-13,其导致B细胞同种型类别转换为IgE。IgE通过高亲和力IgE受体(FcεR1)与肥大细胞和嗜碱性粒细胞结合,导致急性过敏性炎症。
(右)脱敏:过敏原免疫疗法的脱敏与IL-10的Treg产生相关。B细胞类别从IgE转变为IgG 4和伊加产生。IgG 4和伊加可通过分别与IgE竞争变应原结合位点和直接结合食物变应原而充当阻断抗体来抑制TH2适应性免疫应答。缩略语:DC,树突状细胞;TH2,2型辅助性T细胞; Treg,调节性T细胞; TSLP,胸腺基质淋巴细胞生成素。
不是所有抗体都会引起过敏;B细胞除了能产生引起过敏的IgE抗体,还能产生其他种类的保护性抗体,这些保护性抗体可以帮助预防食物过敏。
保护性抗体是如何工作的?
科学家通过小鼠实验发现粘膜中的IgA抗体能阻止过敏原被肠道吸收。
IgG抗体有两种保护作用:
直接捕获并中和过敏原;
通过FcγRIIb受体的作用抑制过敏反应。
此外,治疗食物过敏的新发现在口服免疫治疗(OIT)中观察到,保护性抗体IgG4会明显增加,IgG4与致敏抗体IgE的比值升高。这些变化与患者对食物的耐受性直接相关。
调节性B细胞的重要性
研究发现牛奶过敏患者与健康人对比,过敏患者的调节性B细胞明显减少,这些细胞产生的IL-10也较少。
IL-10的重要作用可以减少致敏抗体IgE的产生,促进保护性抗体IgG4的产生。
B细胞的信使功能:
B细胞也可通过IgE促进的抗原呈递作用作为T细胞的抗原呈递细胞(APC),其中IgE-过敏原复合物被低亲和力IgE受体CD 23(FcεRII)内化,后者在B细胞上表达。
值得注意的是,最近的一项研究表明,B细胞上CD 23的表面密度通过IgE促进的抗原呈递决定了过敏原特异性T细胞的活性,并与总血清IgE水平呈正相关。抗CD 23单克隆抗体鲁昔单抗通过靶向CD 23-IgE相互作用抑制IgE合成。
B细胞治疗方面潜力:
预防方面:
T细胞在食物过敏中的角色
1. TH2细胞:过敏反应的”指挥官”
研究发现,TH2细胞是引发食物过敏的核心细胞,它通过三种方式发挥作用:
2. 治疗的新发现
口服免疫治疗(OIT)的研究显示:能够抑制TH2细胞的活动,减少过敏相关物质的产生,帮助建立对食物的耐受性。
3. 新发现的重要T细胞类型
最新研究发现Tfh13细胞在食物过敏中的重要作用,动物实验证明,这种细胞对产生高效过敏抗体必不可少,能直接影响过敏反应的强度。
注:Tfh13(滤泡辅助性T细胞13)是一种特殊的免疫细胞亚型,属于CD4+ T细胞家族。它在免疫反应中起着重要作用,尤其是在过敏反应和IgE抗体的产生过程中。
此外,还有TH2A细胞,这是一种特殊的记忆性T细胞,该细胞只在过敏人群中发现,其表面有特定标记物(CD161、CRTH2、CD49d)。发现该细胞不仅与食物过敏有关,还与其他过敏病相关,例如,湿疹、过敏性鼻炎、哮喘和食管炎。
4. T细胞的共同识别标记
研究人员通过CD154标记发现:花生过敏患者的T细胞有特殊特征,17%的特定序列在不同花生过敏患者中相同。这说明花生过敏可能有共同的免疫机制。
5. 调节性T细胞(Treg):过敏的“刹车系统”
Treg细胞是免疫系统的调节者,有两种来源:
动物实验显示,牛奶过敏小鼠经过治疗后:Treg细胞数量增加,产生更多保护性物质(IL-10和TGF-β)。
人类研究发现,鸡蛋过敏儿童成功治疗后:特定类型Treg细胞增加。与此同时,花生过敏治疗后:Treg相关基因活性增加。
T细胞在诊断和治疗方面应用潜力:
肥大细胞:驻扎在“人体边防”的过敏触发器
主要在身体的”边界”位置:皮肤、呼吸道、消化道。
研究发现:对胃肠道过敏患儿的活检发现,他们的胃部和结肠中,肥大细胞数量比健康孩子多(通过CD117和类胰蛋白酶标记检测)。
临床观察:在食物过敏患者的肠道检查中发现,过敏相关物质明显增加:
特定条件下可能缓解过敏
小鼠实验发现,肥大细胞表面有个“刹车开关”(FcγRIIb),能接收IgG抗体的“停战指令”,抑制过敏反应,这可能是未来治疗的关键靶点。
嗜碱性粒细胞:血液中的哨兵
基本特征:在血液中数量很少(仅占白细胞的0.5-1%),但在过敏反应中作用重要。
临床应用:可以通过流式细胞术(BAT)检测,使用CD63和CD203c作为标记,帮助诊断食物过敏,监测治疗效果。
治疗相关发现:口服免疫治疗(OIT)研究显示,成功治疗后:
小鼠实验发现:在 IgE-FA 的小鼠模型中,嗜碱性粒细胞耗竭减轻了腹泻的发生率,临床过敏反应减弱。同一项研究表明,嗜碱性粒细胞来源的 IL-4 对于肥大细胞募集和/或增殖至关重要。
临床意义:可以通过检测这两种细胞,判断过敏严重程度,评估治疗效果。
治疗方向:可以破坏 IgE-FA 中肥大细胞和嗜碱性粒细胞反应性的新型干预措施,可能代表未来研究的有吸引力的治疗靶点。
抗原呈递细胞(APCs):免疫系统的“情报分析员”
主要包括三类细胞:
抗原呈递细胞是如何工作的?
➤ 发现并捕获食物过敏原 → 分解成小片段(肽段) → 用MHC II分子“举牌”展示
➤ 指挥CD4+ T细胞分化成不同细胞(TH1/TH2/Treg等)
不同派系的树突状细胞:过敏派 vs 和平派
◈ 过敏派(CD209+树突状细胞)
锁定目标:锁定致敏蛋白,如花生、坚果等。
煽风点火:释放信号诱导T细胞变身TH2(分泌IL-4/IL-5/IL-13)
研究证据:
◈ 和平派(CD103+树突状细胞)
维稳专家:在小鼠肠道训练T细胞成为Foxp3+ Treg(分泌IL-10),有助于预防过敏。
制衡机制:表达诱导性T细胞共刺激配体(ICOS-L),促进“调解员细胞”生成。
树突状细胞功能的其他重要考虑因素包括共刺激分子如 CD80 和 CD86 等表达,它们是 CD28 的天然配体;这些分子与 T 细胞表达的 CD28 的相互作用受损可能导致激活减少或缺失,并最终导致 T 细胞无反应。
花生口服免疫治疗降低了APC上CD86的表达,尽管这些变化可能是暂时的。
诊断方面:通过分析树突状细胞的亚型特征和活化状态,可评估个体过敏风险等级,并预测潜在的过敏反应发生概率。
治疗突破:为过敏治疗开辟了新路径。
1)精准调控不同功能亚型DC的比例平衡;
2)靶向干预DC表面关键分子(如共刺激分子)的表达;
3)特异性增强具有免疫调节功能的DC活性。
总之,免疫系统的多个部分协同作用。
正常耐受状态是B细胞生产保护性抗体(IgA),调节性T细胞(Treg)担任”指挥”角色,共同抑制过度反应,防止肥大细胞引发过敏症状。
过敏状态TH2细胞过度活跃,产生大量致敏物质,指导B细胞产生过敏抗体(IgE)。多种免疫细胞被激活,包括肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞等。受损的肠道细胞会释放:IL-25、IL-33、TSLP,这些物质进一步加重过敏反应。
成功的脱敏治疗会带来以下变化:
T细胞方面,抑制致敏T细胞(TH2)、增加调节性T细胞;
B细胞方面,增加保护性抗体(IgA和IgG4)、减少致敏抗体(IgE)。
来自人类和动物研究的越来越多的证据支持肠道微生态失调在食物过敏发展中的关键作用。
基于16S rRNA测序的研究发现,与没有食物过敏的儿童相比,患有食物过敏的儿童具有独特的肠道微生物组结构。
表. 在有和没有FA的小儿患者之间主要的肠道微生物组差异(基于16S-rRNA测序的研究)
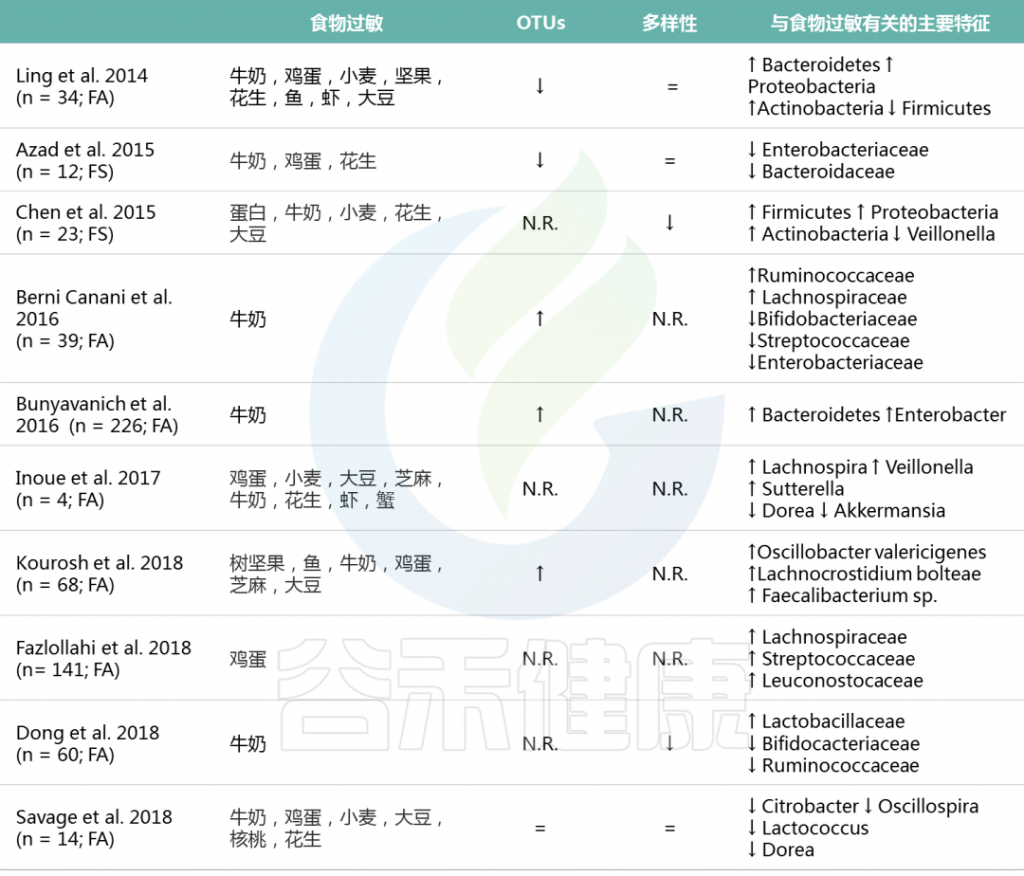
M.D.Costanzo et al, Int.J.Mol.Sci. 2020
FA:食物过敏; FS: 食物过敏; OTUs:操作分类单元; N.R.: 未报道过的; ↑ : 增加;↓: 减少; =: 不变.
表1中所有研究均调查了IgE介导的食物过敏。有趣的是,关于46例受非IgE介导的牛乳过敏(CMA)影响的患者的数据显示,与健康对照组相比,失调的菌群中拟杆菌Bacteroides (Bac 12) 和Alistipes丰富,IgE介导的CMA儿童的特征重叠,是从健康到IgE介导的CMA患者的拟杆菌逐渐增加。
在同一项研究中,患有非IgE介导的CMA的儿童的粪便中丁酸浓度明显低于健康人。
菌群失调先于食物过敏发作
来自人体研究的可用数据表明,菌群失调先于食物过敏发作。
Azad 等人研究发现,在婴儿早期肠道微生物组含量较低的情况下,肠杆菌科(Enterobacteriaceae) / 拟杆菌科(Bacteroidaceae)的比率增加和Ruminococcaceae的丰度较低与随后的食物敏感性相关,这表明早期肠道菌群失调对食物过敏的后续发展有促进作用。
此外,人类研究的可用数据表明,生命早期,尤其是生命的头6个月,微生物组构成与食物过敏的发展更为相关;
在出生后的前 6 个月内,在食物过敏儿童的肠道菌群中占比过高的菌如下:
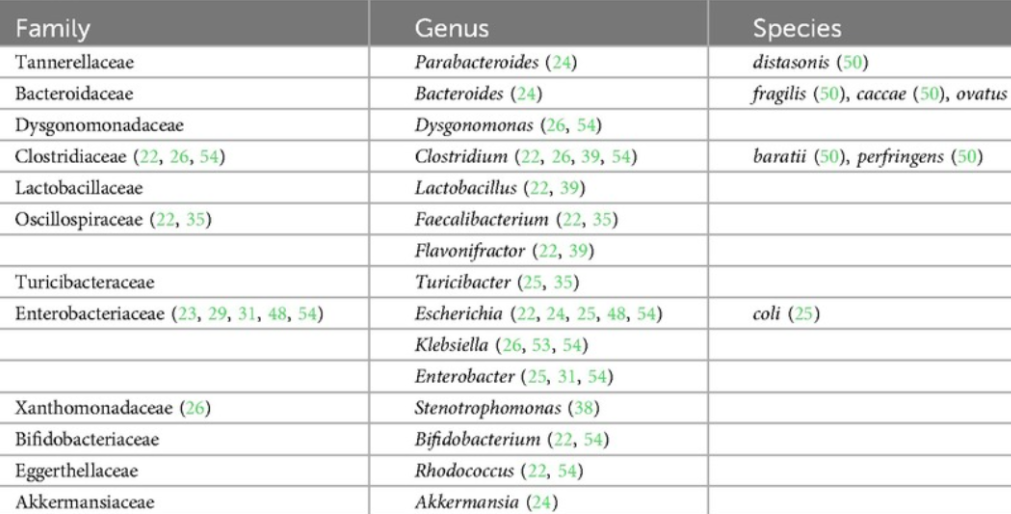
doi.org/10.3389/falgy.2024.1438252
在出生后的前 6 个月内,在食物过敏儿童的肠道菌群中缺乏的菌如下:
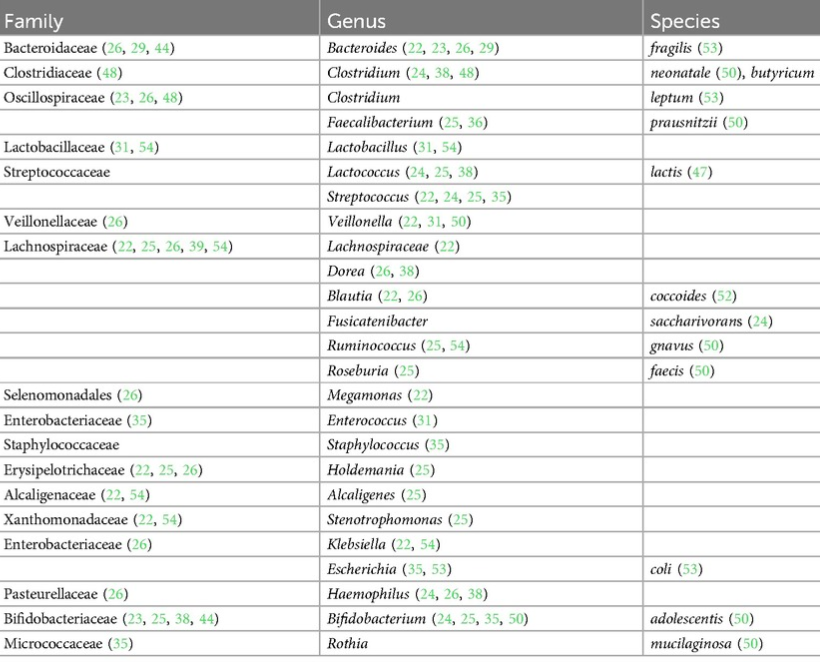
doi.org/10.3389/falgy.2024.1438252
▲ 有害菌增加:
肠杆菌等有害菌释放脂多糖(LPS)等毒素:
▼ 有益菌减少:
双歧杆菌、乳杆菌等能分解食物纤维,产生短链脂肪酸(如丁酸),这类物质:
调节免疫耐受
肠道菌群通过调节Tregs细胞的分化和功能,增强对食物抗原的耐受性。例如,梭菌和双歧杆菌能够通过其代谢产物(如SCFAs)和信号分子(如IL-10、TGF-β)促进Tregs的分化和增殖,从而抑制过敏反应。
肠道菌群还通过调节树突状细胞(DCs)的功能,影响免疫反应。例如,健康的肠道菌群能够使DCs产生TGF-β和视黄酸(RA),从而诱导Tregs的分化。
共生菌介导免疫耐受
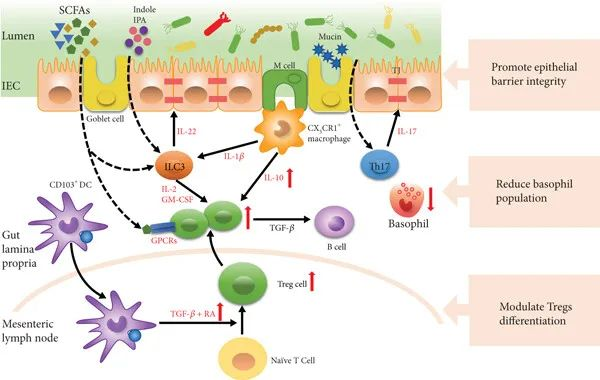
doi.org/10.1155/2023/9575410
增强肠道屏障功能
肠道菌群通过产生短链脂肪酸(如丁酸)和色氨酸代谢产物(如吲哚)来增强肠道上皮屏障的完整性。这些代谢产物能够促进黏液分泌和紧密连接蛋白的表达,从而防止食物抗原进入血液循环,减少过敏反应的发生。
例如,丁酸能够通过诱导IL-22的产生,增强肠道上皮细胞的屏障功能,减少过敏原的渗透。
调节过敏效应细胞
肠道菌群能够调节过敏效应细胞(如嗜碱性粒细胞)的数量和功能。例如,抗生素处理或无菌小鼠的嗜碱性粒细胞数量增加,而补充益生菌可以减少这些过敏效应细胞的数量,从而减轻过敏症状。
关于肠道菌群的干预措施,我们将在06章节详细阐述。
IgE-食物过敏的诊断依赖于临床病史和过敏试验的结合,如食物特异性IgE的存在。诊断指南和标准临床实践在国际上各不相同。这些差异主要是由于多种方法可用于评估IgE-FA;这些方法在灵敏度、特异性、成本、时间和可及性方面各不相同。准确的诊断对于防止不必要的食物避免和提供及时和适当的治疗建议至关重要。
金标准
双盲安慰剂对照食物激发试验(DBPCFC)是最可靠的确诊方法。由于12.9%的试验可能出现安慰剂反应,其准确性优于非盲法试验。
确定IgE对给定食物致敏的两种主要方法是:
体内皮肤点刺试验(SPT)
操作:将微量食物(新鲜的或更常见的作为提取物)刺入皮肤表层
判读标准:15-20分钟后,检查皮肤刺痛部位,若出现比阴性对照大3mm以上的红肿包块(因肥大细胞释放组胺所致)即为阳性。
编辑
血清特异性IgE(sIgE)
sIgE测定定量外周血中存在的过敏原特异性IgE的量。
传统标准:≥0.35 kU/L为阳性
新型检测:临界值可低至0.1 kU/L
注意:两项检测结果必须谨慎解释,均需结合症状分析,因可能出现”致敏但无过敏反应”的假阳性。
检测结果优化策略:
使用较大的SPT包块直径或较高的sIgE临界值可增加临床反应性的可能性,但这是以牺牲敏感性为代价的。
组合检测优势:
对1247例食物激发试验数据分析显示:
SPT+sIgE联合检测或sIgE/总IgE比值(sIgEr)
的阳性预测值显著优于单项检测。
应用价值:在临床试验等场景中可替代部分激发试验,但仍需更多验证。
现存挑战:许多具有临床相关IgE-FA的患者的SPT和/或sIgE值可能低于已发表的临界值,强调需要更稳健的诊断方法来取代口服食物激发试验。
食物过敏检测升级版:成分检测与表位检测有什么用?
除了常规的皮肤点刺、抽血验IgE,医生手里还有两把更精细的“放大镜”——成分检测和表位检测。它们能帮你区分“假警报”和“真危险”,甚至预测过敏反应有多严重。
成分检测:锁定过敏食物里的“关键蛋白质”
原理:
食物过敏其实是对其中某些蛋白质过敏。比如花生含有Ara h1、Ara h2等多种蛋白质,成分检测(CRD)可以单独测出你对哪一种蛋白质过敏。
实际用途:
区分“花粉过敏连带反应”和“真过敏”。
比如有人吃花生过敏,但检测发现只对Ara h8蛋白敏感,这通常是因为它和桦树花粉蛋白相似,属于“交叉反应”(可能症状轻微,比如口腔发痒)。
但如果对Ara h1/2/3敏感,则是真正的花生过敏,严重时可能引发全身反应。
预判过敏风险高低
研究证实:对花生中的Ara h2蛋白过敏的人,严重过敏风险更高;而另一种Ara h6蛋白(与Ara h2结构相似)阳性,也可能指向真实过敏。

表位检测: 看清IgE攻击的“精确靶点”
原理:如果把过敏蛋白比作一根长绳,表位就是绳子上被IgE抗体“咬住”的具体位置(分线性和构象两种结构)。表位检测能识别这些关键攻击点,帮助判断过敏是否会长期存在或容易引发严重反应。
在花生过敏的儿童和成人中,针对花生过敏的BBEA表位检测法(检测Ara h2蛋白的两个线性表位):灵敏度92%,特异性94%,准确度碾压常规检测:比皮肤点刺、普通IgE检测更准。
另一个相关的体液测试是 过敏原特异性IgG4
IgG4抗体通过充当阻断抗体而在IgE-FA中具有保护作用。一项研究发现,花生致敏但临床耐受或花生过敏并接受OIT治疗的儿童的血浆能够抑制花生诱导的肥大细胞活化。重要的是,当血浆中的IgG4耗尽时,肥大细胞的活化不能完全恢复。
但是目前需要进一步的研究来更全面地了解IgG4单独或与其他生物标志物结合在食物过敏诊断和/或预后中的作用。
编辑
诊断方法仍然主要限于研究环境,包括嗜碱性粒细胞活化试验(BAT)和肥大细胞活化试验(MAT)。
BAT与MAT的优劣对比:
BAT和MAT都是基于体外流式细胞术的实验室检测,用于测量过敏原刺激后活化标志物的表达。
BAT检测(嗜碱性粒细胞活化试验)
需要采集新鲜血液立即检测。
BAT在诊断IgE-食物过敏时的特异性高于SPT和sIgE水平,在花生过敏中的特异性为98%,灵敏度为75%。
但存在15%人群天生对检测无反应。
MAT检测(肥大细胞活化试验)
可用冷冻血清来激活培养的原代人血源性肥大细胞。
在花生过敏诊断中比BAT更准确。
重复检测结果高度一致(组内相关性:MAT 0.96 VS BAT0.43)。
新的诊断方法包括:
评估食物过敏原特异性B和T细胞
外周血中的过敏原特异性B和T细胞由于其稀缺性而历来难以分离。由于技术的进步,这些罕见的细胞现在可以通过几种方法来识别。
关于T细胞,这些方法包括:
a)用所选抗原或肽体外刺激PBMC,然后通过表达特异性活化标志物经由流式细胞术鉴定活化的T细胞;
b)用重组肽-MHC(pMHC)复合物离体染色T细胞。pMHC四聚体或多聚体技术也可用于鉴定变应原特异性B细胞。
多组学研究
包括基因组学、表观基因组学、转录组学、蛋白质组学、代谢组学、微生物组学和免疫组学在内的组学科学有望成为研究过敏性疾病(包括IgE-FA)的高通量方法。需要多组学方法来全面识别生物标志物,如基因,蛋白质和/或代谢产物,可以提高IgE-食物过敏诊断和预后的准确性。
此外,非常需要鉴定可预测IgE-食物过敏反应严重程度的生物标志物。特别令人感兴趣的是血小板活化因子乙酰水解酶(PAF-AH)。之前的研究已经证实,PAF-AH可以通过灭活PAF来预防过敏级联反应的进展。
肠道菌群检测
通过高通量测序技术获得菌群组成和功能数据,结合机器学习模型(如随机森林、神经网络)识别过敏相关特征。肠道菌群检测报告菌群失衡程度、关键菌群丰度及代谢物水平,提示过敏风险。
干预后复查菌群,观察过敏症状是否缓解,验证菌群与过敏的因果关系。
该方法是非侵入性的,且可以早期预警,因为很多时候菌群失衡可能早于过敏症状出现。通过个性化干预,指导益生菌、膳食调整等精准治疗。
肠道菌群检测可作为食物过敏的辅助诊断工具,为个性化治疗提供依据。可以结合临床传统方法(如食物激发试验)综合判断,通过连续检测评估过敏风险和干预效果,整合IgE检测、皮肤点刺试验和菌群数据,提高准确性。
1. 当前的食物过敏治疗方式
目前,食物过敏没有治愈方法,治疗的核心是避免接触过敏原。如果意外接触导致过敏反应,通常使用肾上腺素和抗组胺药进行处理。
由于食物过敏带来的严重健康和经济负担,科学界投入了大量资源研究新的治疗方法。
2. 预防的转变:从回避到早期接触
过去建议高过敏风险的婴儿(如父母有过敏史)避免接触过敏性食物,比如花生。
但后来研究发现,在婴儿早期引入过敏性食物(如花生)反而可以降低过敏风险。这项发现改变了过敏预防的建议,也激发了对免疫疗法的研究热情。
3. 免疫疗法的探索
免疫疗法的目标是通过逐步改变免疫系统的反应,让身体对过敏原“习惯”并耐受。方法包括:
其中,口服免疫疗法(OIT)效果最好,但也存在风险。比如,患者可能会出现轻微不适(如口痒、肚子痛),甚至更严重的过敏反应(如全身性过敏或嗜酸性食管炎)。
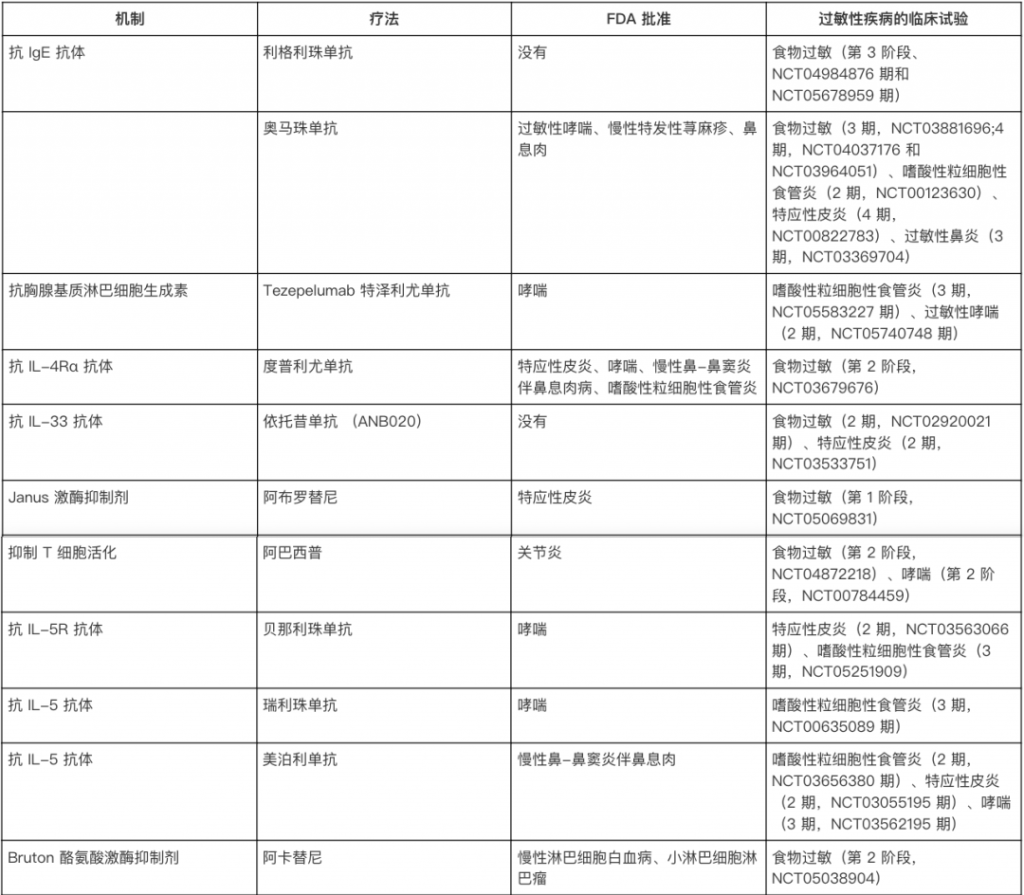
doi.org/10.1146/annurev-immunol-090122-043501
4. 辅助治疗:提高疗效,减少副作用
为了让免疫疗法更安全有效,科学家正在研究辅助治疗:
此外,新的治疗IgE-FA包括疫苗、纳米颗粒、Janus激酶(JAK)和布鲁顿的酪氨酸激酶抑制剂。
5. 基于微生物群的干预
研究发现,肠道中的某些细菌和它们的代谢产物(如丁酸盐)可以调节免疫系统,帮助身体更好地耐受过敏原。下列措施可以在调节肠道菌群的基础上干预食物过敏。
饮 食
增加膳食纤维
高纤维饮食(如全谷物、蔬菜、水果)可促进双歧杆菌、乳酸菌等有益菌增殖,增加短链脂肪酸的生成,抑制促过敏的Th2免疫反应。
举例:
菊粉(如洋葱、大蒜):增加双歧杆菌。
果胶(如苹果、柑橘):改变厚壁菌门与拟杆菌门的比例,增加血清和粪便中SCFA的含量,并通过损害树突状细胞功能来预防炎症的发展。
高纤维摄入通过重塑肠道微生物群和增加SCFA水平,特别是乙酸盐和丁酸盐水平,保护小鼠免受花生过敏。此外,这种保护作用取决于SCFA的受体GPR43和GRP109A,因为缺乏其中一种的小鼠表现出更严重的食物过敏。
减少高脂高蛋白饮食
过多动物蛋白和脂肪可能促进拟杆菌属等菌群占优,增加炎症风险,间接诱发过敏。建议适量摄入,平衡植物蛋白(如豆类)。
高脂饮食诱导的肠道菌群变化也被证实可以诱导食物过敏。
一项研究显示,高脂饮食通过增加Ruminococcaceae(梭菌目)、Desulfovibrionaceae(δ-变形菌纲)和Rikenellaceae(拟杆菌纲)的相对丰度,同时减少Muribaculaceae和Prevotellaceae的丰度来诱导食物过敏。
增加优质脂肪
ω-3脂肪酸,ω-3主要来自海洋来源(如鱼油、藻类)和某些植物(如亚麻籽):通过抑制树突状细胞(DCs)的激活、抑制CD4 T细胞的增殖和活化、减少促炎因子、降低IgE水平以及抑制肥大细胞脱颗粒,从而减轻食物过敏。
增加膳食多酚
多酚是次生植物代谢产物,富含水果、蔬菜、谷物、咖啡和茶。非结合多酚通过肠道菌群调节、紧密连接蛋白表达和 β-防御素分泌来缓解食物过敏。
可可多酚:
研究表明,富含可可多酚的饮食可以减少厚壁菌门和变形菌门,增加Tenericutes和蓝藻门(Cyanobacteria),从而抑制特定抗体和肠道IgA的合成,有助于减少过敏反应。
矢车菊素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside):
通过增加有益菌(如乳酸杆菌和Odoribacter)和减少有害菌(如幽门螺杆菌和Turicibacter)来上调紧密连接蛋白的表达,促进分泌型IgA和β-防御素的分泌,并平衡Th1/Th2水平,有助于增强肠道屏障功能,减少过敏原的渗透,从而减轻食物过敏症状。
槲皮素(Quercetin):
槲皮素具有抗氧化、抗炎和抗癌活性。它可以通过与卵清蛋白(OVA)结合,减少OVA的致敏性,并降低特异性免疫球蛋白水平,从而减轻过敏反应。
咖啡酸和表儿茶素没食子酸酯(Epigallocatechin-3-gallate, EGCG):
与乳清蛋白结合后,可以减轻乳清蛋白引起的口服致敏反应,降低小鼠血清中特异性抗体和mMCP-1水平,并减少体外CD4 T细胞的增殖,有助于减少乳清蛋白引起的过敏反应。
益生菌
双歧杆菌(Bifidobacterium)
乳杆菌(Lactobacillus)
丁酸梭菌(Clostridium butyricum)
混合益生菌
注意:
益生元
通过特定益生元干预食物过敏的机制主要是调节肠道菌群,促进短链脂肪酸生成,抑制过敏相关炎症反应。以下为具体益生元及研究证据:
临床试验显示,补充该组合可显著降低高风险婴儿食物过敏发生率,可能与促进双歧杆菌生长有关。
2’-岩藻糖基乳糖(2’-FL)和乳糖-N-新四糖(LNnT):添加到配方奶粉中可缓解牛奶蛋白过敏(CMA),降低IgE水平和炎症因子(如IL-4、IL-6)。
乳-N-岩藻五糖III(LNFP III):摄入量高的婴儿CMA风险更低。
动物实验表明,母体补充可诱导免疫耐受,降低后代小麦过敏风险。
多不饱和脂肪酸(PUFA)等可能减少儿童食物致敏风险。
合生元
合生元是一种包含活菌(益生菌)和宿主微生物选择性利用的底物(益生元)的混合物,能够为宿主带来健康益处。
在一项多中心随机对照试验(RCT)中,研究了含有短双歧杆菌M-16V和低聚果糖(scGOS/lcFOS)的氨基酸配方(AAF-S)对IgE介导的牛奶过敏(CMA)婴儿的安全性。
结果显示,与普通氨基酸配方(AAF)相比,AAF-S在控制过敏症状和促进正常生长方面同样有效,但在减少感染、用药次数和住院率方面效果更好。具体数据如下:AAF-S组婴儿的感染发生率显著降低、使用的药物更少、住院率显著降低(8.8% vs. 20.2%,p = 0.036)。
粪便微生物组分析显示,AAF-S组婴儿的双歧杆菌丰度显著增加,而Eubacterium rectale和C. coccoides的丰度显著降低。
代谢产物变化:AAF-S组婴儿的粪便中乙酸和L-乳酸水平显著升高,粪便pH值显著降低。
粪菌移植
最近,一项小鼠模型研究表明,FMT抑制了特应性皮炎小鼠中OVA诱导的过敏反应。
除了恢复肠道微生物群外,FMT还降低了IgE水平;受监管的Tregs;肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞减少;提高了SCFA的含量;恢复Th1/Th2平衡。
与其他方法相比,FMT是一种相对简单的治疗策略,可以改变人体肠道微生物群;然而,迄今为止,这项研究还不够充分,需要开展大量工作来提高我们对用FMT治疗食物过敏的理解。
中草药
中药因其低成本、高安全性以及高生物活性,近年来在食物过敏治疗中受到越来越多的关注。虽然传统中医中没有“食物过敏”的具体术语,但一些中药方剂在现代研究中显示出对食物过敏的潜在治疗效果。
食物过敏草药配方-2(FAHF-2):
来源:FAHF-2是从传统的“乌梅丸”(Wu Mei Wan)中开发而来的。
临床研究:在一项多中心、双盲、随机、二期临床试验中,68名12-45岁的食物过敏患者每天三次服用FAHF-2或安慰剂,持续六个月。结果显示,FAHF-2安全且耐受性良好。
免疫调节作用:FAHF-2能够显著抑制外周血单个核细胞(PBMCs)产生的IL-5,并增加IL-10和调节性T细胞(Tregs)的生成,显示出良好的免疫调节效果。
改进形式:由于FAHF-2的剂量较大,研究者开发了两种改进形式:丁醇纯化的FAHF-2(BF2)和乙酸乙酯及丁醇纯化的FAHF-2(EBF2)。在花生过敏的小鼠模型中,EBF2显示出很强的抑制IgE产生的能力,被认为是对花生过敏最有潜力的治疗药物。
尽管中药在治疗过敏性疾病中被广泛应用,但关于食物过敏的临床研究样本量小,且研究受限,需要进一步验证中药在食物过敏治疗中的效果。
从概念上讲,人类食物供应中的任何蛋白质都可能是潜在的过敏原,因此建立“无过敏原食品”体系不现实。由于不同个体的免疫系统对相同的过敏原可能会有不同的反应,因此很难对食物过敏做出普遍适用的定义。
现有诊断工具(如特异性IgE检测)可靠性有限,过敏原结构、加工方式及食物基质相互作用均影响致敏性。
引起个体过敏反应所需的最小量(阈值)也取决于个体的敏感性。大多数过敏性食物的阈值尚未确定,导致警示标签(如“可能含”)难以精准保护敏感人群。 需开发特异性强、灵敏度高的检测方法,并基于主要过敏食物(如牛奶)建立分级阈值标准——从鉴定关键过敏原及其表位入手,明确检测目标。
肠道菌群可能通过调节免疫耐受影响过敏风险。未来可探索菌群检测(如特定菌群丰度与过敏表型关联)作为辅助诊断工具,或通过益生菌等多种干预手段重塑菌群平衡,降低致敏性。
协同策略:
整合免疫学、微生物组学与食品加工技术,推动从“一刀切”警示转向动态风险评估,实现过敏防控的精准化与人性化。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Iweala OI, Nagler CR. The Microbiome and Food Allergy. Annu Rev Immunol. 2019 Apr 26;37:377-403.
Januszkiewicz, Emilia, et al. “The importance of the gut microbiome in the development of allergic diseases.” Alergologia Polska-Polish Journal of Allergology 10.3 (2023): 202-209.
Venter, Carina. “Immunonutrition: Diet diversity, gut microbiome and prevention of allergic diseases.” Allergy, Asthma & Immunology Research 15.5 (2023): 545.
Jiachen Liang, Baodong Zheng, Yi Zhang, Hongliang Zeng, Food allergy and gut microbiota, Trends in Food Science & Technology, Volume 140, 2023, 104141, ISSN 0924-2244
Farnetano M, Carucci L, Coppola S, Oglio F, Masino A, Cozzolino M, Nocerino R, Berni Canani R. Gut microbiome features in pediatric food allergy: a scoping review. Front Allergy. 2024 Sep 25;5:1438252.
谷禾健康
前几日,南方医科大学深圳医院院长周宏伟教授团队在国际顶尖医学期刊《Nature Medicine》上发表了一项重要研究。首次揭示一种名为活泼瘤胃球菌(Ruminococcus gnavus)的细菌产生的物质——苯乙胺,在肝性脑病发生中的关键作用。

同时谷禾的人群检测数据及相关研究也发现,活泼瘤胃球菌(R.gnavus)广泛存在于人体中,超过90%的人可以检测到。并且在例如肥胖、抑郁症、炎症性肠病、2型糖尿病等疾病患者中丰度偏高。
想必很多人对这个名字比较陌生,可能只知道瘤胃球菌属。虽然其名为活泼瘤胃球菌,但关于其的具体归属还有争议(有一段时间它被归类为Blautia属,但最近又被重新归为Mediterraneibacter属)。
活泼瘤胃球菌(Ruminococcus gnavus)是一种革兰氏阳性、严格厌氧的细菌,属于毛螺菌科,普遍存在于人类和动物的肠道中,是婴儿肠道的早期定植者,并在成年后也持续存在,占健康个体肠道微生物群丰度的0.1%至2%。
拉丁语gnavus的意思是忙碌,R.gnavus具有积极的碳水化合物发酵能力,可以将复杂的淀粉降解成更简单的分子。在淀粉、麦芽糖和岩藻糖基化聚糖等食物消化中具有重要功能。并产生乙酸盐、丙酸盐、甲酸盐和乙醇,但不产生丁酸盐。
虽然R.gnavus能有效利用植物性食物中的糖,但肠道中的糖并非全来自食物,人体自身也会生成糖类,如构成肠道内壁的粘蛋白聚糖。一些菌株依赖这些糖,并进化出策略以持续获取,可能破坏肠道屏障。
活泼瘤胃球菌(R.gnavus)生活在我们的肠道内壁,因此可以很好地感知肠道环境的变化并将其与身体的其他部分进行沟通。这在我们的免疫系统中发挥作用,也会对体内其他器官的功能产生影响。
研究发现R.gnavus能够产生一种炎性多糖,该分子诱导树突状细胞产生炎性细胞因子,如TNFα(肿瘤坏死因子),可能导致人体的炎症反应。并且越来越多的证据表明,R.gnavus的过度生长可能与某些肠道疾病有关,包括炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌。
此外,研究还发现,患有影响身体其他部位的健康问题(包括感染、过敏、肥胖、代谢综合征、2型糖尿病、肝脏疾病和神经系统疾病)的人肠道中活泼瘤胃球菌(R.gnavus)的水平较高,说明R.gnavus与这些疾病之间存在相关性。
注:这种关联并不一定意味着R.gnavus是这些疾病的原因。相反,它可能只是表明这些疾病为R gnavus在肠道中的生长创造了有利条件。
活泼瘤胃球菌(Ruminococcus gnavus)到底是多种疾病的风险标志物还是正常的肠道共生菌?让我们来一探究竟。
活泼瘤胃球菌(Ruminococcus gnavus)是一种革兰氏阳性厌氧菌,属于厚壁菌门。R.gnavus于1974年首次从人类胃肠道的粪便和内容物中分离出来。当时它被描述为专性厌氧、非孢子形成、非运动或运动球菌,具有1-3个鞭毛,以链状或成对出现。
R.gnavus ATCC 35913 的扫描电子显微镜图像

拉丁语gnavus的意思是忙碌,指的是该物种的积极发酵能力。这种细菌具有特殊的酶,可以将复杂的淀粉降解成更简单的分子。在淀粉、麦芽糖和岩藻糖基化聚糖等食物消化中具有重要功能。可以产生乙酸盐和甲酸盐,但不产生丁酸盐。
R.gnavus的细胞壁由一种复杂的葡配甘露聚糖组成,它具有高度的免疫原性,可以在宿主中诱导特异性抗体。
R.gnavus的脂聚糖是一种附着在脂质上的聚糖,也是免疫原性的,可以调节宿主免疫系统。不同品系的R.gnavus具有不同的结构。
R.gnavus的基因组由一条约2.5Mb的圆形染色体和几个不同大小的质粒组成。它编码许多参与碳水化合物代谢的基因。其基因组DNA的G+C含量为43mol%。
虽然R.gnavus ATCC 29149无法在氧气存在下生长,但它确实表现出对大气氧气的一定耐受性,10%-15%的细胞在暴露于氧气1小时后仍保持活力,3小时后下降到0.05%-0.1%左右
该菌株对阿莫西林、替卡西林、头孢噻肟、亚胺培南、普那霉素、万古霉素、利奈唑胺、甲硝唑、利福平、甲氧苄啶/磺胺甲噁唑敏感,对林可霉素、红霉素、左氧氟沙星耐药。
▸ 在生命早期就定植于肠道
活泼瘤胃球菌(R.gnavus)是“正常”人类肠道微生物群的常见成员,多项证据表明其在生命早期就普遍存在。
生命第一年,分娩方式、饮食和遗传等因素都会影响微生物定植。一项针对25名1至24个月大婴儿样本的研究中,确定R.gnavus普遍存在;具体来说,在25个样本中的22个(88%)都检测到了活泼瘤胃球菌(R.gnavus)。
▸ 可能在婴儿消化与代谢中发挥作用
活泼瘤胃球菌(R.gnavus)可能是婴儿肠道的主要物种,其水平与双歧杆菌属相当。通过16S rRNA基因测序分析的研究强调了R.gnavus与母乳喂养或不同配方奶粉之间的饮食关联。
例如,在一项针对90名2个月大婴儿(每组30名)的比较研究中,与喂食牛奶的婴儿中更多样化的微生物特征相比,母乳或山羊奶喂养的婴儿中,毛螺菌科(Lachnospiraceae)的存在仅限于一种物种,即R.gnavus。
在另一项随机对照试验比较了喂食乳糖牛奶配方奶粉(CMF)与广泛水解蛋白配方奶粉(EHF,适用于牛奶蛋白不耐受婴儿)的婴儿粪便微生物群。结果显示,随着时间推移,EHF组中R.gnavus丰度增幅最大,成为区分不同食物喂养微生物组的显著特征。
这些数据表明,R.gnavus可能在肠道微生物群构建中发挥作用,并与婴儿正常体重增长和状态相关。
▸ 淀粉等固体食物会增加R.gnavus丰度
R.gnavus的相对丰度变化可能体现了婴幼儿微生物群的正常“成熟”。一些证据表明,R.gnavus在断奶后相对丰度增加,而其他物种,如双歧杆菌,已知相对丰度降低。
注:最近一项针对怀孕和分娩时婴儿肠道微生物群(脐带血)的研究显示,R.gnavus与产前血浆25-羟基维生素D(25[OH]D)呈正相关,但与脐带25[OH]D呈负相关。
一项研究调查了断奶对605名婴儿微生物群的影响,结果显示首次引入固体食物后,R.gnavus所属的比例显著增加。短链脂肪酸(SCFA)分析也反映了肠道微生物群的变化,数据显示断奶期间丁酸盐的产生发生变化。
对28名尼日利亚婴儿出生后第一年内粪便微生物群的分析显示,母乳喂养婴儿以R.gnavus、Collinsella和Sutterella为主。丁酸盐在断奶开始时(4-6个月大)首次检测到,引入固体食物后乙酸盐和乳酸仍然较高,12月龄时丁酸盐水平较低,与R.gnavus的已知发酵能力一致。
综上所述,这些研究支持R.gnavus在肠道早期定植中的作用。一些R.gnavus菌株能够代谢人乳低聚糖(HMO)和粘蛋白,其结构聚糖相似性进一步支持该物种在其他细菌定植过程中发挥重要作用的假设。
▸ R.gnavus在成年后也持续存在于肠道
R.gnavus在成年后也持续存在;根据对来自北美和欧洲的健康成年人的粪便样本的宏基因组测序,发现它是存在于≥90%的个体中的物种。
最近,在来自中国、埃塞俄比亚、西班牙、美国和瑞典的健康成年人的公开肠道微生物群宏基因组中发现了R.gnavus平均丰度为0.3%。
谷禾多年的检测数据显示,国人活泼瘤胃球菌(R.gnavus)检出率超过95%,表明其在人群中普遍存在,是肠道微生物群的基本组成部分。
▸ R.gnavus有助于消化复杂的碳水化合物
瘤胃球菌是分解碳水化合物最有效的细菌属之一。我们知道瘤胃球菌是“降解抗性淀粉的关键菌”。瘤胃球菌能有效地分解坚硬的植物物质,如细胞壁,这有助于人体消化水果蔬菜,不太可能引起胃痛。
注:抗性淀粉是在小扁豆、豆类和未加工的全谷物等高纤维食物中发现的复杂碳水化合物。
这种细菌具有特殊的酶,可以将这些复杂的淀粉降解成更简单的分子。这也与它利用一些母乳低聚糖和在粘蛋白聚糖表位上觅食的能力有关。值得注意的是,R.gnavus ATCC 29149具有一种独特的唾液酸代谢途径,专门用于2,7-脱水Neu5Ac。
R.gnavus碳水化合物的最终发酵产物包括乙酸盐、甲酸盐和乙醇,以及丙醇和丙酸盐,但不包括丁酸盐。
尽管活泼瘤胃球菌(R.gnavus)是人类肠道微生物群的组成部分,正常情况下在健康个体的肠道中普遍存在,但许多研究表明,当其丰度过高时,可能与多种疾病的发生发展存在密切关联。这些疾病不仅包括与肠道相关的疾病,如炎症性肠病(IBD)、肠易激综合征、结直肠癌,还涉及一些非肠道相关的疾病,如代谢性疾病和免疫系统紊乱等。
R.gnavus与疾病和潜在分子介质的关联
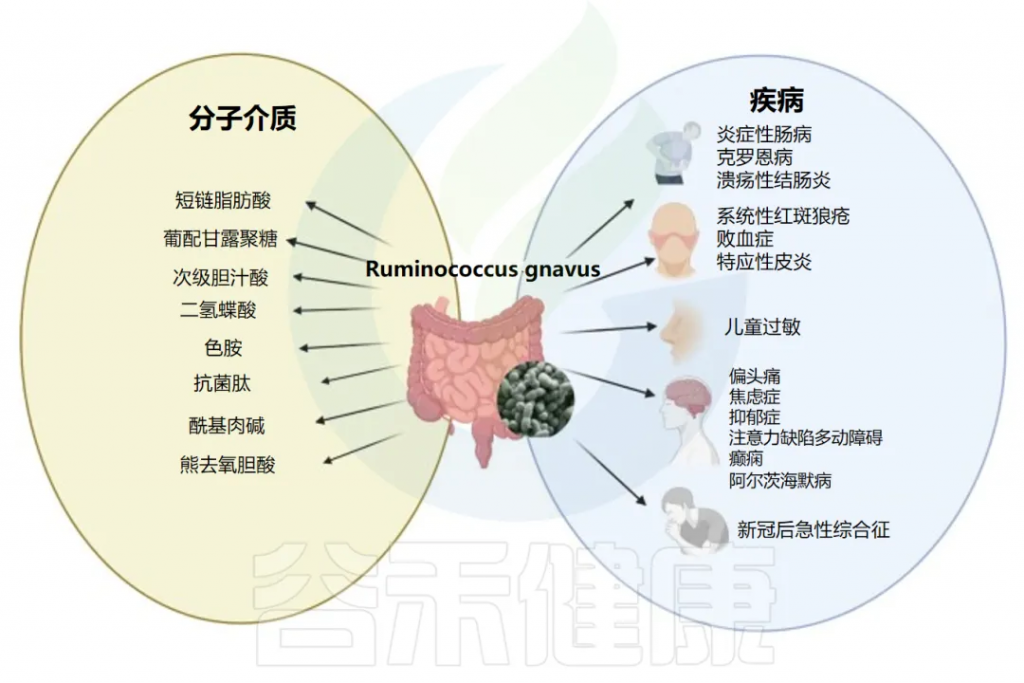
Crost EH,et al.FEMS Microbiol Rev.2023
1
炎症性肠病
克罗恩病(CD)和溃疡性结肠炎(UC)是多因素慢性炎症性肠病,一直与肠道微生物失调有关。越来越多的研究表明R.gnavus与炎症性肠病(IBD)之间存在正相关,尽管因果关系仍有待证明。
▸ R.gnavus在IBD患者中含量增加
分析了炎症性肠病(IBD)患者肠粘膜组织的早期研究表明,粘膜相关细菌的丰度增加。例如,与健康粘膜相比,R.gnavus和R.torques在CD和UC粘膜中含量更高,而主要的粘液降解细菌A.muciniphila在CD和UC粘膜中的含量明显较低。
在一项后续研究中,分析了68名CD患者、84名未受影响的亲属和55名匹配的对照者粪便样本,并使用实时PCR进行定量。结果显示,R.gnavus是五种与菌群失调相关的细菌中唯一在克罗恩病(CD)中丰度增加的物种。
通过内窥镜采集IBD患者粘膜表面样本(43名UC患者、26名CD患者和14名非IBD对照),利用16S rRNA 基因测序分析粘膜相关微生物群落。结果显示,与非IBD对照相比,CD患者变形菌门丰度显著增加,而厚壁菌门和拟杆菌门丰度显著降低。其中,埃希氏菌属、瘤胃球菌属(R.gnavus)、放线杆菌属和肠球菌属显著增加,而粪杆菌属、粪球菌属、普雷沃氏菌属和罗氏菌属显著减少。
▸ R.gnavus能够诱导产生炎性细胞因子

一项研究发现,肠道细菌R.gnavus产生了炎性多糖,其种群在克罗恩病患者的症状发作期间丰度增加。R.gnavus可以合成并分泌具有鼠李糖骨架和葡萄糖侧链的复杂多糖glucorhamnan,它有效诱导树突细胞分泌炎性细胞因子(TNFα),并可能导致R.gnavus与克罗恩病之间的关联。
另一项基于对40对双胞胎的肠道微生物群分析的研究显示,在回肠CD患者中,肠杆菌科和R.gnavus的丰度增加,而粪杆菌属(Faecalibacterium)和罗氏菌属(Roseburia)等核心细菌的消失。
▸ R.gnavus丰度与IBD疾病结果相关
R.gnavus是与克罗恩病相关的菌群,已被确定为导致克罗恩病症状的原因之一。在克罗恩病患者中活泼瘤胃球菌(R.gnavus)的相对丰度升高与症状严重相关。
通过Illumina MiSeq对IBD患者(70名UC,39名CD)及100名健康对照的粪便微生物群分析显示,它们在 IBD中表现出差异丰度。结合20名IBD患者和12名对照的宏基因组分析与R.gnavus分离株的全基因组测序,强调了R.gnavus菌株水平的重要性。
研究还揭示了IBD特异性、菌株特异性的基因,这些基因参与氧化应激反应、粘附、铁获取和粘蛋白利用,可能赋予R.gnavus在IBD患者肠道中的适应性优势。在小鼠模型中,提出了多种支持R.gnavus与 IBD关联的机制。
此外,分析了化疗后接受造血细胞移植和干细胞植入的癌症患者的>10000个纵向微生物群样本,发现R.gnavus的绝对丰度与淋巴细胞率负相关,与其生长速率正相关,表明R.gnavus可能驱动高中性粒细胞与淋巴细胞比率,这一特征与IBD不良预后密切相关。
注:R.gnavus的富集还与CD患者的心理评分呈正相关,与次级胆汁酸TDCA和TLCA呈负相关,进一步表明其与患者心理状态和疾病进展的关联。
综上所述,一些研究人员认为R.gnavus可以作为 炎症性肠病(IBD)的生物标志物,但因果关系仍有待证明。
2
肠易激综合征
肠易激综合征(IBS)是一种慢性异质性疾病,影响约6%的人口。IBS的病理生理学是多因素的,其中包括肠道微生物群的改变。
对IBS患者、健康个体粪便和结肠活检样本,以及小鼠模型样本的细菌测序分析表明,症状和炎症的严重程度可能与粘液相关细菌(如R.gnavus)的变化密切相关。
编辑
▸ 在腹泻型IBS患者中明显更丰富
对80名IBS患者(16-70岁)和65名无IBS对照的粪便进行鸟枪法和16S rRNA 测序显示,R.gnavus和毛螺菌科其他物种在 IBS 中显著更丰富,尤其在腹泻型IBS(IBS-D)患者中,与外周5-羟色胺(5-HT)水平和严重症状相关。
这一现象也在R.gnavus单定植小鼠中得到验证。代谢组学和宏基因组学研究表明,R.gnavus的富集与二氢蝶酸水平降低密切相关,二氢蝶酸是叶酸合成的重要中间体,其失调可能导致IBS病理变化。
此外,在新诊断的初治IBD或IBS患者(13UC、10CD和26IBS)与健康对照中,基于粪便和粘膜微生物群的16S rRNA 基因测序进一步证实了R.gnavus 作为区分疾病表型潜在生物标志物的作用。
3
结直肠癌
多项宏基因组学研究表明,结直肠癌(CRC)与肠粘膜相关微生物群的显著变化有关。
▸ 粘膜菌群失调与肿瘤形成存在关联
异常隐窝病灶(ACF)是CRC患者结肠中最早可识别的形态学病灶。对接受结肠镜筛查或监测个体的粘附细菌分析显示,与正常粘膜相比,ACF的细菌微生物组谱异质性显著更高;KRAS癌基因突变与R.gnavus呈正相关,提示特定结肠细菌与CRC相关突变之间可能存在联系。
这些结果表明,正常粘膜微生物群的扰动可能是早期肿瘤形成的危险因素,粘膜菌群失调可能影响ACF的组织微环境和行为,促进其向高级肿瘤发展。
此外,最近一项研究通过16S扩增子测序分析CRC患者治疗前后肠道微生物群,发现R.gnavus与脂肪细胞因子信号通路和过氧化物酶体通路相关。
4
过敏、免疫和炎症
▸ R.gnavus可能对特应性皮炎有一定保护作用
肠道微生物组失调与儿童过敏密切相关,R.gnavus 是儿童过敏的重要参与者。研究表明,患特应性皮炎(AD)的婴儿肠道微生物群与健康婴儿存在差异。通过对129名婴儿队列中随机选取的40名6个月大婴儿(20名对照组,20名AD患者)的肠道微生物组进行全宏基因组测序,发现与免疫发育相关的功能基因存在差异。AD组中A.muciniphila、R.gnavus和Lachnospiraceae bacterium 2_1_58FAA的定植减少,与免疫发育迟缓显著相关。临床前研究进一步支持了R.gnavus在特应性皮炎模型中的保护作用。
▸ 食物或呼吸道过敏儿童中R.gnavus升高
相比之下,在受食物或呼吸道过敏影响的儿童中观察到R.gnavus(和F.prausnitzii)的丰度更高。在一项前瞻性双胞胎队列的研究中,在过敏表现出现之前观察到粪便微生物群中R.gnavus的丰度增加,并且与呼吸道过敏或呼吸道过敏与特应性湿疹共存有关。
在小鼠模型中,添加R.gnavus ATCC 29149 导致气道高反应性和炎症(哮喘),表现为结肠和肺中辅助T细胞2的扩增,以及嗜酸性粒细胞和肥大细胞浸润结肠和肺实质。
▸ 一些炎症反应中R.gnavus增多
系统性红斑狼疮(SLE)患者中R.gnavus丰度显著增加,且与整体疾病活动呈正比,在狼疮性肾炎患者中尤为明显。狼疮性肾炎患者的粪便中sIgA包被的R.gnavus细菌更多,血清IgG水平升高,主要针对R.gnavus菌株特异性细胞壁脂聚糖抗原。
R.gnavus水平升高也与脊柱关节炎相关,这是一类炎症性风湿病,但其机制尚不明确。此外,COVID-19患者(未使用抗生素)及长期并发症患者的肠道微生物组中R.gnavus水平较高,可能与细菌的肠肺易位或免疫与炎症调节有关。
5
代谢综合征
▸ R.gnavus与体脂率、腰围、血清甘油三酯等指标相关
R.gnavus与代谢综合征的多个特征密切相关,包括体脂百分比增加。这一关联得到了以挪威20-94岁参与者为基础的大型发现队列(n=2875)及两个复制队列(n=999和n=1341)的分析支持。
编辑
在联合队列中,33.7%的参与者检测到R.gnavus,其存在与脂肪量、腰围、血清甘油三酯、C反应蛋白(CRP)、HbA1c增加及HDL降低相关。这些关联在调整混杂因素后依然显著,且在不同性别和年龄(以中位年龄 59.6 岁为界)分层分析中表现一致。
6
肥胖
▸ R.gnavus在肥胖者中更丰富
在一项横断面多种族肥胖表型研究(812 名男性,843名女性,60-77 岁)中,16S rRNA 基因测序显示 R.gnavus与能量调整饮食炎症指数(E-DII)和肥胖表型相关。
另一项研究发现,在41名BMI正常者中,R.gnavus 与内脏脂肪密切相关,并与代谢指标呈正相关。早期研究也表明,R.gnavus在肥胖者中明显更丰富,并在减重期间减少,且与高BMI呈正相关。此外,一项研究显示,R.gnavus在对减肥手术无反应的患者中更为丰富。
注:瘤胃球菌喜欢植物中的多糖。如果肠道中有过多的瘤胃球菌,可想而知细胞会吸收更多的糖,那就不可避免地导致体重增加。
▸ R.gnavus会影响脂质代谢及信号通路
最近的动物研究表明,R.gnavus影响宿主代谢物。在高脂肪饮食小鼠中,R.gnavus影响肝脏的信号通路和下游脂质代谢,特别是降低FGF21表达,增加肝脏甘油三酯水平、血清总胆固醇和低密度脂蛋白(LDL)水平,所有这些都会导致代谢紊乱。
7
冠状动脉和肝脏疾病
▸ 冠状动脉疾病晚期患者R.gnavus相对丰度增加
肠道微生物组的改变与心血管疾病相关。一项病例对照研究通过16S rRNA测序分析了53名晚期冠状动脉疾病(CAD)患者与53名年龄、性别、种族和BMI匹配的对照者的粪便微生物群,发现CAD患者的肠道微生物组丰富度和均匀度降低。R.gnavus是相对丰度增加超过数倍的五个分类群之一,并在调整糖尿病和血脂异常等风险因素后,与晚期CAD的存在显著相关。
▸ 在脂肪性肝病肝硬化中丰度显著增加
宏基因组测序显示,R.gnavus是脂肪性肝病(MASLD)肝硬化和脂肪性肝病-肝细胞癌(HCC)患者中最丰富的五种细菌之一,且在MASLD-HCC患者中丰度最高。
此外,R.gnavus与MASLD-HCC和MASLD肝硬化患者的细胞毒性CD8+ T细胞呈负相关,而在MASLD合并冠心病患者中,其丰度低于仅患冠心病的个体。然而,这些研究未包含MASLD对照组,限制了对MASLD肠道微生物组的理解。
已有研究表明,与健康对照和脂肪性肝病对照相比,脂肪性肝病肝硬化患者的R.gnavus丰度显著增加,暗示其可能与脂肪性肝病向肝硬化的进展有关。
▸ 驱动肝性脑病
高达50-70%的肝硬化患者会发展为肝性脑病(HE),这与肠道菌群失调密切相关,机制尚不清楚。通过构建肠脑模块评估宏基因组数据集中的细菌神经毒素,研究人员发现主要来自R.gnavus的苯丙氨酸脱羧酶(PDC)基因在肝硬化患者中增加了约10倍,在HE患者中更高。
用R.gnavus定植的肝硬化、不健康的小鼠表现出脑苯乙胺(PEA)积累,以及记忆障碍、对称性震颤和皮层特异性神经元丢失,通常见于肝性脑病患者。
8
2型糖尿病
▸ 2型糖尿病患者中R.gnavus较高,而抗炎细菌丰度较低
肠道菌群的变化和慢性低度炎症在2型糖尿病(T2D)发展中起关键作用。一项对T2D患者粪便样本的初步研究发现,R.gnavus、Lactobacillus ruminis、Bacteroides caccae、Butyricimonas 和 Collinsella aerofaciens丰度较高,而抗炎细菌F.prausnitzii和Butyrivibrio丰度较低。
在一项随访的人群队列研究中,R.gnavus被确定为与新发2型糖尿病(T2D)持续相关的四个物种之一。对134名糖尿病前期成年人的分析显示,梭菌目(Clostridiales)和阿克曼菌(A.muciniphila)丰度降低,而R.gnavus丰度增加。一项基于258名T2D患者的研究发现,富含R.gnavus的微生物簇与适中血糖、严重胰岛素抵抗、高胆固醇水平相关。
▸ 与妊娠晚期空腹血糖呈正相关
妊娠糖尿病(GDM)研究表明,R.gnavus与妊娠晚期空腹血糖呈正相关。此外,糖尿病周围神经病变(DPN)研究显示,甘氨酸熊去氧胆酸和牛磺熊去氧胆酸与R.gnavus和Phascolarctobacterium的丰度呈正相关。
9
感染与脓毒症
编辑
▸ R.gnavus可能导致外周感染及血液感染
R.gnavus感染病例包括血液恶性肿瘤和外周感染,如泌尿生殖系统感染。例如,一名患深部浸润性子宫内膜异位症和盆腔炎的女性在双侧输卵管卵巢脓肿中培养出R.gnavus。
R.gnavus血流感染还与憩室病、化脓性关节炎、胆囊穿孔、多发性骨髓瘤和乙状结肠癌化疗患者的肠穿孔以及小肠疝和穿孔引起的粪便腹膜炎相关。这些研究表明R.gnavus感染的致病性与胃肠道损伤密切相关。
10
神经系统疾病
新出现的证据表明,微生物失调可导致神经认知障碍的发生和发展,如精神分裂症、抑郁症、双相情感障碍、焦虑症和痴呆症。
有人认为,饮食、生活方式、遗传因素和外部压力源“合作”调节肠道微生物群组成,从而影响大脑的反应。越来越多的研究报告了患有神经系统疾病的患者R.gnavus水平的变化。
▸ 焦虑症、脑癫痫患者R.gnavus增加
尽管研究规模有限,但焦虑症患者的肠道微生物丰富度和多样性显著降低,同时R.gnavus丰度增加。一项为期8周的临床试验测试了益生菌对抑郁症的治疗效果,结果显示益生菌组和安慰剂组均有症状减轻,但肠道微生物群未发生显著变化。然而,重度抑郁患者的R.gnavus相对丰度显著增加,并与抑郁焦虑压力量表评分呈正相关。
另一项研究发现,R.gnavus与脑癫痫患者的癫痫发作显著正相关,这种神经系统疾病以癫痫发作易感性为特征,与健康对照组相比差异明显。
▸ 阿尔茨海默病和认知障碍患者中R.gnavus丰度增加
随着人口老龄化的加剧,微生物代谢物在神经退行性疾病如阿尔茨海默病(AD)和帕金森病(PD)进展中的作用受到越来越多关注。在AD患者中,主要特征是淀粉样蛋白β(Aβ)在记忆相关脑区的积累。一项基于AD小鼠模型的研究发现,Aβ蛋白的过表达显著影响肠道微生物群,其抗菌活性导致R.gnavus等物种的丰度变化。
另一项研究调查了PD患者的肠道微生物群,并根据疾病严重程度分组。结果显示,路易体痴呆患者中R.gnavus和粪杆菌的相对丰度更高。这与另一项研究的结果一致,该研究发现帕金森病(PD)患者肠道中R.gnavus的丰度显著高于健康对照组。
在易患神经认知障碍的老年人和患有心理症状的克罗恩病患者中观察到R.gnavus的富集。与健康对照相比,中风后认知障碍患者的R.gnavus丰度增加,且与认知测试结果呈负相关。对患偏头痛的老年妇女与健康对照(年龄和BMI匹配)的粪便样本进行宏基因组学分析显示,R.gnavus是偏头痛组中显著富集的物种之一。
综上所述,这些研究表明R.gnavus在神经系统疾病中的丰度增加,尽管因果关系尚未明确。文献倾向于将粘膜相关或粘液溶解细菌的存在与肠道屏障通透性增加或炎症相关联,导致细菌代谢物或分子泄漏,触发炎症并向大脑发出信号。例如R.gnavus ATCC 29149 能够将色氨酸脱羧形成色胺,提高了肠道和中枢神经系统互作的可能性。
然而,目前尚无证据表明R.gnavus能物理改变粘膜屏障。与多形拟杆菌(Bacteroides thetaiotaomicron)或A.muciniphila等物种因其广泛的粘蛋白-聚糖降解能力可分解完整的粘蛋白聚糖链不同,R.gnavus的粘蛋白聚糖降解能力具有菌株特异性,仅限于从上皮屏障外觅食聚糖表位。
R.gnavus与疾病关联的研究
编辑
Crost EH,et al.FEMS Microbiol Rev.2023
▸ 高糖高肉会增加R.gnavus
饮食是肠道微生物群的主要调节因素。在题为“满足欧洲老年人口健康老龄化特定需求的新饮食策略”(NU-AGE)的研究中,调查了饮食、肠道微生物群和认知之间的关联,结果表明R.gnavus和Collinsella spp.与富含动物产品的饮食有关,被称为“促炎物种”。
通过对多种族队列研究(5936名参与者)的粪便样本进行16S rRNA基因测序,确定了饮食质量与肠道微生物组的长期关联。结果显示,R.gnavus的存在与健康饮食指数呈负相关。
健康饮食指数(HEI)由13个组成部分组成,最高100分,包括9个充足性组成部分(总水果、全水果、总蔬菜、蔬菜和豆类、全谷物、乳制品、总蛋白质食品、海鲜和植物蛋白以及脂肪酸)以及四个适度成分(精制谷物、钠、添加糖和饱和脂肪)。大多数成分按每1000大卡摄入量的摄入量评分。2
以羊肉、猪肉等红肉为基础的饮食会增加活泼瘤胃球菌(Ruminococcus gnavus)的丰度。
此外,经常食用糖果、饮料、糕点等,也会导致Ruminococcus gnavus升高,并降低了肠道中某些有益菌。
▸ 富含多酚的食物有助于减少R.gnavus
针对R.gnavus的饮食干预研究较少。一项对23名健康个体的随机交叉试验发现,在高红肉饮食中添加高直链淀粉玉米可降低R.gnavus的比例;补充富含多酚的红树莓可减少糖尿病前期和胰岛素抵抗成人的R.gnavus。这表明针对活泼瘤胃球菌(R.gnavus)的饮食干预可作为促进健康的策略。
▸ 益生菌调节
唾液乳杆菌(Lactobacillus salivarius Ren)显著减少R.gnavus的数量。
Lactobacillus paracasei DG干预后,瘤胃球菌丰度下降55%(P = 0.016)
口服长双歧杆菌BB536 和鼠李糖乳杆菌HN001 1个月后,Ruminococcus gnavus丰度减少。
此外,我们推测多形拟杆菌(Bacteroides thetaiotaomicron)等能够降解碳水化合物的有益细菌可能会与R.gnavus竞争,从而抑制R.gnavus的丰度。
但在注射了乳杆菌的小鼠小肠微生物群中,瘤胃球菌过度生长。
以下的细菌也可能对R.gnavus具有抑制作用
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Bacteroidales
Bacteroides
Porphyromonadaceae
Odoribacter
Parabacteroides
Porphyromonas
Prevotella
Rikenellaceae
Alistipes
Turicibacter
Streptococcus
Clostridiales
Catabacteriaceae
Clostridium
Clostridiales incertae sedis
Peptoniphilus
Clostridiales Family XIII. Incertae Sedis
Lachnospiraceae
Blautia
Lachnospiraceae
Coprococcus
Dorea
Eubacterium
Lachnobacterium
Lachnospira
Roseburia
Lachnospiraceae
Peptococcaceae
Ruminococcaceae
Ruminiclostridium
Acetivibrio
Eubacterium
Faecalibacterium
Oscillospira
Ruminococcus
Acidaminococcus
Dialister
Phascolarctobacterium
Veillonella
Rubrivivax
Alcaligenaceae
Oxalobacter
Bilophila
Desulfovibrio
Campylobacteraceae
Enterobacteriaceae
Escherichia
Erysipelotrichaceae
Erysipelotrichaceae
Holdemania
Akkermansia
▸ 益生元调节
施用低聚半乳糖(GOS)后,R.gnavus丰度下降。
龙舌兰菊粉,3周,随机对照试验,交叉试验,R.gnavus减少。
玉米可溶性纤维21g/d, 3周,随机对照试验,交叉试验,R.gnavus减少。
尽管活泼瘤胃球菌(Ruminococcus gnavus)是人类肠道微生物群的重要组成部分,通常在健康个体的肠道中广泛存在,但研究表明,其丰度的异常升高可能与多种疾病的发生和发展密切相关。这些疾病不仅包括肠道相关疾病,如炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌,还涉及非肠道相关疾病,如神经发育障碍、神经系统疾病、代谢性疾病以及免疫系统紊乱等。
例如,除了最近《Nature Medicine》揭示活泼瘤胃球菌可通过苯丙氨酸脱羧酶及其代谢产物苯乙胺驱动肝性脑病,为肝性脑病提供了潜在诊疗靶点。 今年江南大学王鸿超团队基于机器学习识别关键菌群,发现肥胖个体中肠道共生菌活泼瘤胃球菌的丰度增加,且与临床指标显著相关,且通过调节胆汁酸代谢(如促进次级胆汁酸的生成)对宿主代谢产生不利影响,间接阻碍了体重的下降;并可能导致肝脏损伤。
因此,监测和预防活泼瘤胃球菌丰度的异常升高对于维持肠道菌群平衡和降低疾病风险具有重要意义。然而,要实现这一目标,需要建立可靠的健康人群和疾病人群的肠道微生物数据库,以明确健康状态下该菌的正常丰度范围及其在疾病状态下的异常变化边界。这些数据库应包括不同年龄、性别、生活方式和地理区域的健康人群数据,同时结合疾病人群的微生物组特征,明确活泼瘤胃球菌的丰度变化与疾病的关联模式。通过这些数据的积累和分析,不仅可以更准确地识别活泼瘤胃球菌的异常丰度阈值,还能为个性化的肠道健康管理和疾病预防策略提供科学支持。
主要参考文献
Crost EH, Coletto E, Bell A, Juge N. Ruminococcus gnavus: friend or foe for human health. FEMS Microbiol Rev. 2023 Mar 10;47(2):fuad014.
Juge N. Microbe Profile: Ruminococcus gnavus: the yin and yang of human gut symbionts. Microbiology (Reading). 2023 Aug;169(8):001383.
Grahnemo L, Nethander M, Coward E, Gabrielsen ME, Sree S, Billod JM, Engstrand L, Abrahamsson S, Langhammer A, Hveem K, Ohlsson C. Cross-sectional associations between the gut microbe Ruminococcus gnavus and features of the metabolic syndrome. Lancet Diabetes Endocrinol. 2022 Jul;10(7):481-483.
Henke MT, Kenny DJ, Cassilly CD, Vlamakis H, Xavier RJ, Clardy J. Ruminococcus gnavus, a member of the human gut microbiome associated with Crohn’s disease, produces an inflammatory polysaccharide. Proc Natl Acad Sci U S A. 2019 Jun 25;116(26):12672-12677.
Titécat M, Wallet F, Vieillard MH, Courcol RJ, Loïez C. Ruminococcus gnavus: an unusual pathogen in septic arthritis. Anaerobe. 2014 Dec;30:159-60.
de la Fuente-Nunez C, Meneguetti BT, Franco OLet al. Neuromicrobiology: how microbes influence the brain. ACS Chem Neurosci. 2018;9:141–50.
Fan X, Chen Y, Liu Yet al. First case of bloodstream infection caused by Ruminococcus gnavus in an 85 year old man in China. Lab Med. 2022;53:e36–9.
Hall AB, Yassour M, Sauk Jet al. A novel Ruminococcus gnavus clade enriched in inflammatory bowel disease patients. Genome Med. 2017;9:103.

谷禾健康

食物让我们填饱肚子,补充养分,且感受到快乐与满足,然而,对有些人来说,部分食物却成为了难以预料的健康障碍。
“当时坐在一家优雅的西餐厅,四周萦绕着新鲜烘焙面包的诱人香气,我感受到一场味蕾的盛宴”,刚毕业的小楠回忆着,“然而,就在我大口享受那细腻丝滑的奶油酱和意面时,肠胃却在暗暗策划一场叛变”… “随之而来的腹胀、腹痛,彻底破坏了圣诞节的氛围”…
小楠也是“食物不耐受”的群体之一。“当时出去吃饭常有状况发生,但并不知道是和食物不耐受有关,还是一起吃饭的同学提醒了我”。
对于食物不耐受的人来说,由于其症状形式多样,较迟缓发烧,且不那么严重,许多人甚至根本没有意识到自己患有食物不耐受。有时候,人会感到疲倦,但并没有把疲倦,或情绪低落,或头痛这些与食物不耐受关联起来。
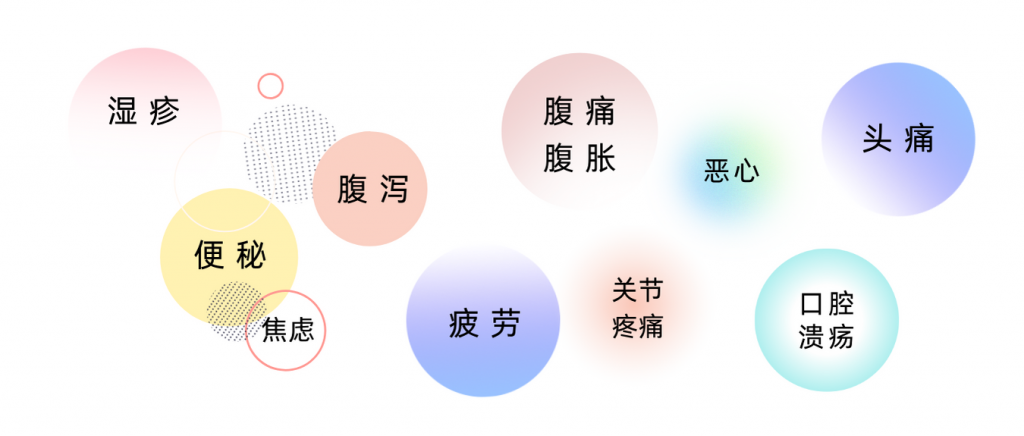
以上一系列症状都有可能与食物不耐受相关。其实,像小楠这样食物不耐受的人其实比较常见,据估计,全世界约有 20% 的人有食物不耐受。
很多人小时候并没有食物不耐受,等成年后的某一天突然发现出现食物不耐受,这说明遗传因素并不一定主导,有其他潜在的因素在起作用。环境因素、生活方式和饮食习惯的改变等都可能会导致食物不耐受的出现。
以下是一些常见的原因:酶缺乏(乳糖不耐受中的乳糖酶缺乏),化学物质敏感(如咖啡因、防腐剂、色素、味精等),药物反应,消化系统疾病,饮食习惯(高FODMAP食物),遗传,心理(压力和焦虑)等。
食物不耐受和食物过敏又不一样,食物过敏涉及免疫系统,如IgE介导的反应,这可能会迅速导致严重甚至危及生命的反应。而食物不耐受主要涉及消化系统。
食物不耐受可能在进食后30分钟左右开始,但也可能要在一两天后才发生。症状的延迟发作特点意味着食物不耐受的诊断可能更为复杂。症状包括腹泻、腹胀、胃痛、疲劳、头痛等,可能与消化系统的功能紊乱有关,而肠道菌群在这里扮演了重要的角色。
比如部分健康人群的肠道微生物组蛋白水解能力较低,可能与喝牛奶后肠道不适相关。有研究发现,在乳糖不耐受患者中,乳制品摄入量与胃肠道不适之间的关联部分是由双歧杆菌丰度介导的。
此外,由于感染,炎症等因素带来的肠道菌群失调,有害菌过度增长,产生毒素和其他代谢产物,损害肠道细胞,肠道功能紊乱,肠道屏障破坏增加肠道通透性,可能导致食物成分不能在正确的位置也不能恰当处理,从而发生食物不耐受。
虽然说食物不耐受很常见,但诊断起来却很困难,通常需要时间、耐心和仔细观察,也需要专业人士帮助识别触发食物或成分。症状及其严重程度取决于所吃食物的类型和数量。
许多食物都有可能触发一系列症状,比如牛奶、小麦、贝类、坚果、西红柿、花生、鱼、茄子等,但有时候我们并不知道是哪种食物,又是如何引发这些症状,因此常常踩雷而不自知。
当有一天食物成了罪魁祸首时,会面临一系列挑战,比如缺乏基础知识,对其诊断的延迟、不适当,而不正确的饮食管理更会放大该问题的影响,甚至带来营养缺乏,这对同时患有其他疾病的人群更是雪上加霜,这种情况下,了解食物不耐受就非常重要。
本文我们就来了解一下常见的食物不耐受的关键证据和科学理解,食物如何诱发其反应的机制及相关诊断,食物不耐受与肠道微生物群之间的复杂关系,这有助于我们更好地理解食物不耐受与身体症状的关联,从而采取措施来减轻其带来的不适。
“食物不耐受”(Food Intolerance)并不是一个最近出现的词,事实上,这个概念最早可以追溯到20世纪初。食物不耐受是指人体在消化某些食物时出现困难,这通常是由于缺乏特定的消化酶或者对食物中的某些成分有不良反应,但并不涉及免疫系统的反应。
在20世纪,随着医学和营养科学的发展,人们逐渐开始了解到并非所有的消化不良都是由传统意义上的疾病引起的,而有可能是由于身体对某些食物成分的不耐受。例如,乳糖不耐受是一种大家都知道的食物不耐受,它是由于身体内乳糖酶的缺乏或不足导致的,使消化乳糖变得困难。
在过去的二十年中,食物不良反应的病例显着增加,人们对食物不耐受的认识也不断深化,相关的研究不断增多。现如今,食物不耐受已经成为营养学和临床医学中的一个重要话题。
一般来说,食物不耐受的临床表现涉及多个器官或系统,常见症状包括:
但还有许多其他可能的症状,包括:
症状可能持续几个小时或几天。
不是。食物不耐受常常与食物过敏混淆。它们之间的区别在于其免疫基础。
食物不耐受主要是由于人体消化系统的问题导致对某些食物产生反应,但不涉及免疫系统。可由任何(非蛋白质)食物成分引起,比食物过敏更为常见。症状通常与食用量成正比,每次摄入都会有类似症状。有些人对乳糖不耐受,乳糖酶水平可能降低或缺乏。
而食物过敏涉及到免疫系统,对过敏食物的反应不仅与摄入量有关,即使很少量也可能引起严重反应。食物过敏的影响可能更严重,甚至可能涉及生命安全。
食物过敏的特征是摄入特定食物后,IgE介导的针对食物蛋白的抗体被激活。例如,对花生过敏的人可能会产生影响组织中肥大细胞和血液中嗜碱性粒细胞的反应。乳糜泻是一种 T 细胞介导的免疫反应,无 IgE 介导的反应。T 细胞免疫反应与更延迟的反应相关,这意味着症状在摄入后数小时或数天内出现,而不是在食用后立即出现。
总的来说,食物不耐受主要由消化问题引起,食物过敏则是由免疫系统的异常反应引起,两者机理上有区别。

有可能的。
虽然食物不耐受和食物过敏是由不同机制引起的,但一个人可能同时经历这两种情况。食物不耐受可能会加剧食物过敏的症状,反之亦然。此外,食物不耐受可能会导致肠道刺激和炎症,这可能会影响肠道菌群的平衡,进而影响免疫系统的反应。
据估计,食物不耐受影响多达 20% 的人口,但鉴于临床表现和非免疫机制差异很大,对诊断和管理的完全理解很复杂。
一项在瑞士儿童医院以及 4 家儿科私人诊所进行的横断面研究。共纳入2036名54个月至46岁(平均年龄:1.18岁)的儿童和青少年(7%为男性,4%为女性),其中316名(16%)参与者报告因不耐受而避免食物。乳糖不耐症是最常见的一种。在所有病例中,有55%没有进行任何医学检查来证实这种不耐受。251名(12%)参与者表示,出于假定的健康原因避免耐受的食物。
食物不耐受是由于身体无法消化某种食物或食物中的成分而引起的。
最常见的食物不耐受是乳糖不耐受。
当然,其他任何食物都可能与食物不耐受相关,例如:
◗ 麸质(小麦、黑麦和大麦)——存在于面包和面食等食物中
◗ 组胺——存在于葡萄酒和奶酪等食物和饮料中
◗ 咖啡因——存在于咖啡、茶和一些碳酸饮料中
◗ 亚硫酸盐——存在于苹果酒、啤酒和葡萄酒中
◗ 水杨酸盐——存在于一些水果、蔬菜、香草和香料中
◗ 谷氨酸钠 (MSG) – 存在于成熟的水果、腌肉和咸味食品中
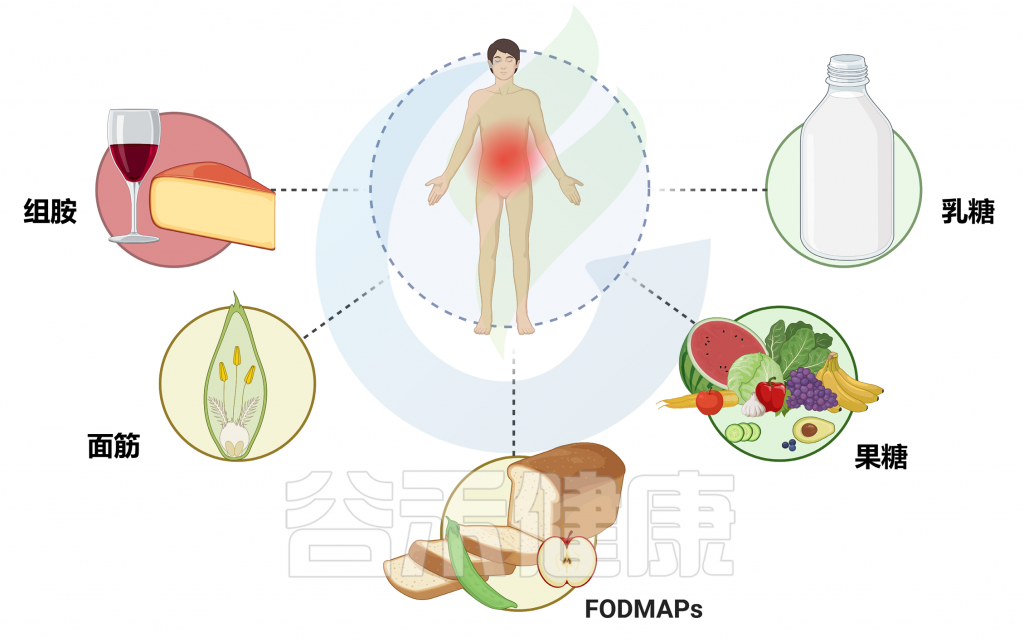
doi.org/10.3390/nu15234969
遗传、消化系统疾病(IBS、IBD等)、消化酶缺乏、对食品添加剂的敏感性、肠道菌群失调、药物食物相互作用、食物中的自然毒素、压力和情绪等因素都可能与食物不耐受有关。具体原因取决于食物不耐受的类型。
接下来我们逐一了解常见的食物不耐受、原因、诊断、治疗/改善措施等。
小时候,大家喝牛奶基本没啥问题,但现在越来越多人开始出现乳糖不耐受。
这其中有些人是随着年龄的增长慢慢地出现乳糖不耐受,也有人是生病或者服用一些药物之后突然开始了乳糖不耐受…
●
当未消化的乳糖通过肠道而不被吸收时,就会发生乳糖吸收不良。管腔中未消化的乳糖会受到细菌发酵,增加渗透压,导致摄入乳糖后出现不耐受症状。当乳糖吸收不良伴有上述症状时,通常称为乳糖不耐受。
简单来说:
乳糖不能直接在肠道中吸收,而是必须被乳糖酶分解成两种较小的糖成分。
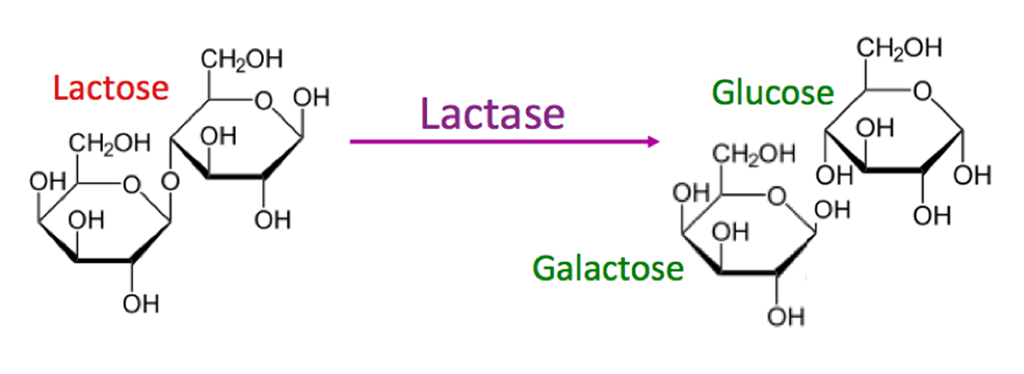
图源:evo-ed
乳糖酶缺乏可能导致乳糖不耐受。
主要原因有四个:
原发性乳糖酶缺乏或乳糖酶不持续
乳糖酶活性随着个体年龄的增长而逐渐下降。这种衰退从婴儿期开始,症状通常出现在青春期或成年早期。
乳糖酶持久性是由 2 号染色体上的显性基因突变引起的。乳糖酶不持久不是疾病而是遗传表型。
大约 70%–100% 的亚洲成年人口是乳糖酶非持久性 (LNP)基因型。
继发性乳糖酶缺乏症
继发性乳糖酶缺乏症是由肠上皮损伤引起的,可能发生在多种情况下,如胃肠炎、化疗、抗生素使用、乳糜泻、炎症性肠病、艾滋病、营养不良或吸收表面减少的情况,如短肠综合症。
乳糖酶活性的降低是暂时的、可逆的,一旦潜在的肠道损伤得到治疗或解决,乳糖酶活性的降低通常会得到改善。
先天性乳糖酶缺乏症
先天性乳糖酶缺乏症是一种极其罕见的儿科疾病,会导致婴儿出现严重症状和发育不良。这种情况源于常染色体隐性遗传模式,导致出生时乳糖酶活性降低或缺失。
发育性乳糖酶缺乏
在妊娠28-37周之间出生的早产儿中观察到发育性乳糖酶缺乏症。在这些情况下,婴儿的肠道发育不全导致无法分解乳糖。然而,随着年龄的增长,随着肠道的成熟和喂养,特别是母乳喂养,这种情况通常会改善。
乳糖吸收不良,无论是由于原发性还是继发性乳糖酶缺乏,都会导致未消化的乳糖与肠道微生物群相互作用。
乳糖的细菌发酵会产生短链脂肪酸(乙酸盐、丙酸盐和丁酸盐)和气体(氢气、二氧化碳,有时还有甲烷)。当乳糖的量超过结肠微生物群的发酵能力,或者短链脂肪酸的负荷超过结肠的吸收能力时,就会发生腹泻。水的渗透滞留进一步增加了结肠中的渗透负荷,从而放大了效果。
个体可能患有乳糖酶缺乏症但没有症状。
在出现临床表现的情况下,症状包括腹胀、腹痛、胀气、腹泻,有时还包括恶心。
症状的严重程度可能有所不同,大多数人可以耐受相对少量的乳糖而不会感到不适。
一些方法可以检查一个人是否有乳糖不耐症,如基因检测、酶活性测试、呼气测试等。在这些检测中,小肠活检测量乳糖酶的活性是最精确的方法,但是需要通过内窥镜检查直接从小肠壁取样,这种侵入性的方法通常不作为首选诊断手段。
乳糖呼气测试是一个更简单、不伤身体的方法,用来看一个人消化乳糖的能力,以及是否因为吃了乳糖而有不适的症状。
但是,这些测试有一个问题:有的人虽然测试显示他们有乳糖不耐症,但是他们吃乳糖后并没有不舒服,所以测试结果并不能完全确定不舒服是不是因为乳糖不耐症造成的。
为了解决这个问题,有些时候在做呼气测试的时候会用一些标准化的问卷,或者用盲测(测试者不知道他们吃的是不是含乳糖的东西)。盲测特别有用,因为很多时候人们自己说的乳糖不耐症的症状和客观结果之间的相关性较低,特别是在有肠易激综合征(IBS)的人群中。
总的来说,乳糖不耐症的诊断可以通过准确的病史和临床评估,并在避免含乳糖的食物 5-7 天后通过症状消退来确诊。
可以和其他食物一起吃
如果乳糖与其他营养素一起食用,耐受阈值就会升高。
因此,一种解决方案可能是将乳糖与其他食物一起食用,以减缓胃排空和小肠运输,从而使乳糖有更多时间分解和吸收,从而减少出现症状的可能性。
陈年奶酪也是比较好的选择
与新鲜奶酪不同,陈年奶酪几乎不含或不含乳糖。事实上,在成熟过程中,细菌消耗了所有存在的乳糖。
常见奶酪类乳制品的乳糖含量
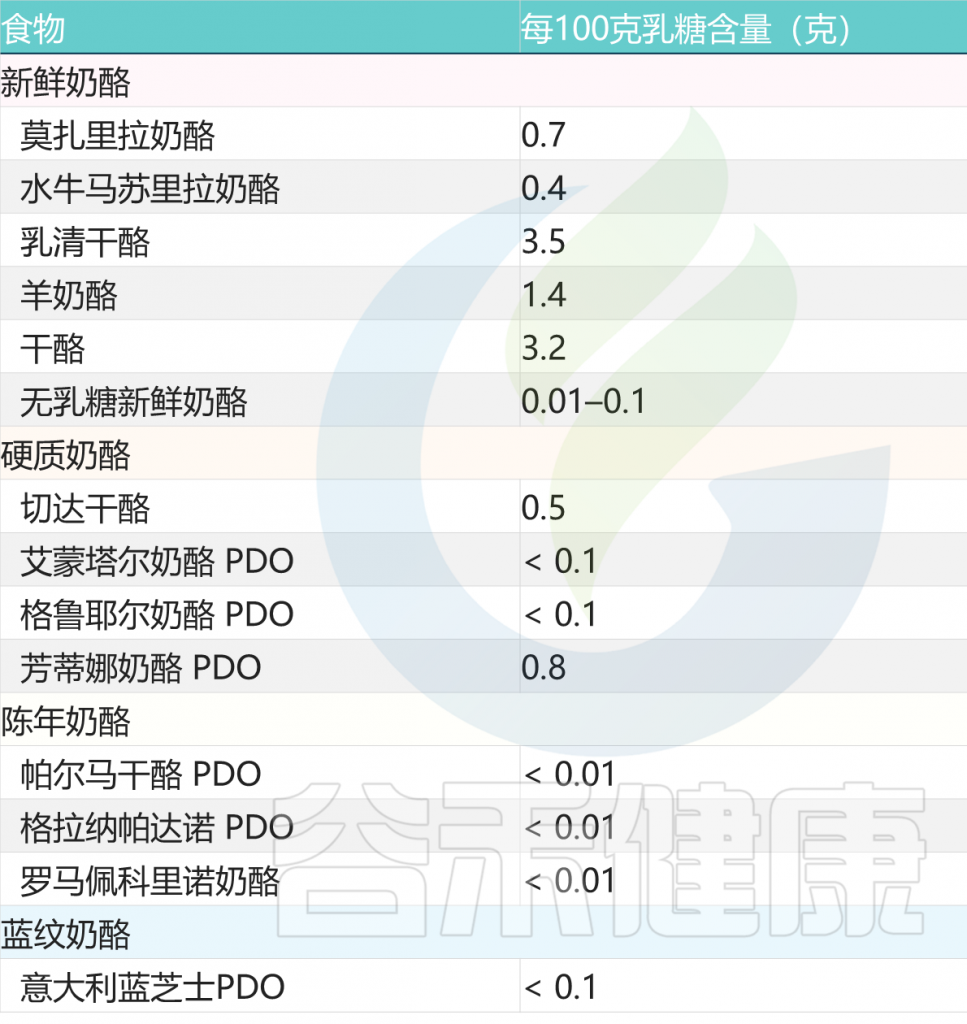
doi: 10.1186/s12967-020-02429-2
无乳糖食品
为了确保乳制品中所含物质的摄入不会因乳糖而引起腹部不适,现在有一些无乳糖食品。从营养的角度来看,它们与经典乳制品相当,不同之处在于它们不含乳糖。不含乳糖、添加乳糖酶的乳制品通常被认为是安全的。
技术的不断进步正在不断提高无乳糖乳制品的营养价值、功能、感官吸引力和质量。这些发展旨在为乳糖不耐症患者提供更多样、更可口的选择,同时确保最佳营养摄入和整体健康。
也可以喝牛奶,但一开始量不建议太多
对于乳糖不耐受患者,如今不再建议避免食用所有乳制品,因为大多数乳糖不耐受患者可以耐受每单剂量最多 5 克乳糖,大约相当于 100 毫升牛奶,并且可能比严格的无乳糖饮食有好处。
常见牛奶类乳制品的乳糖含量
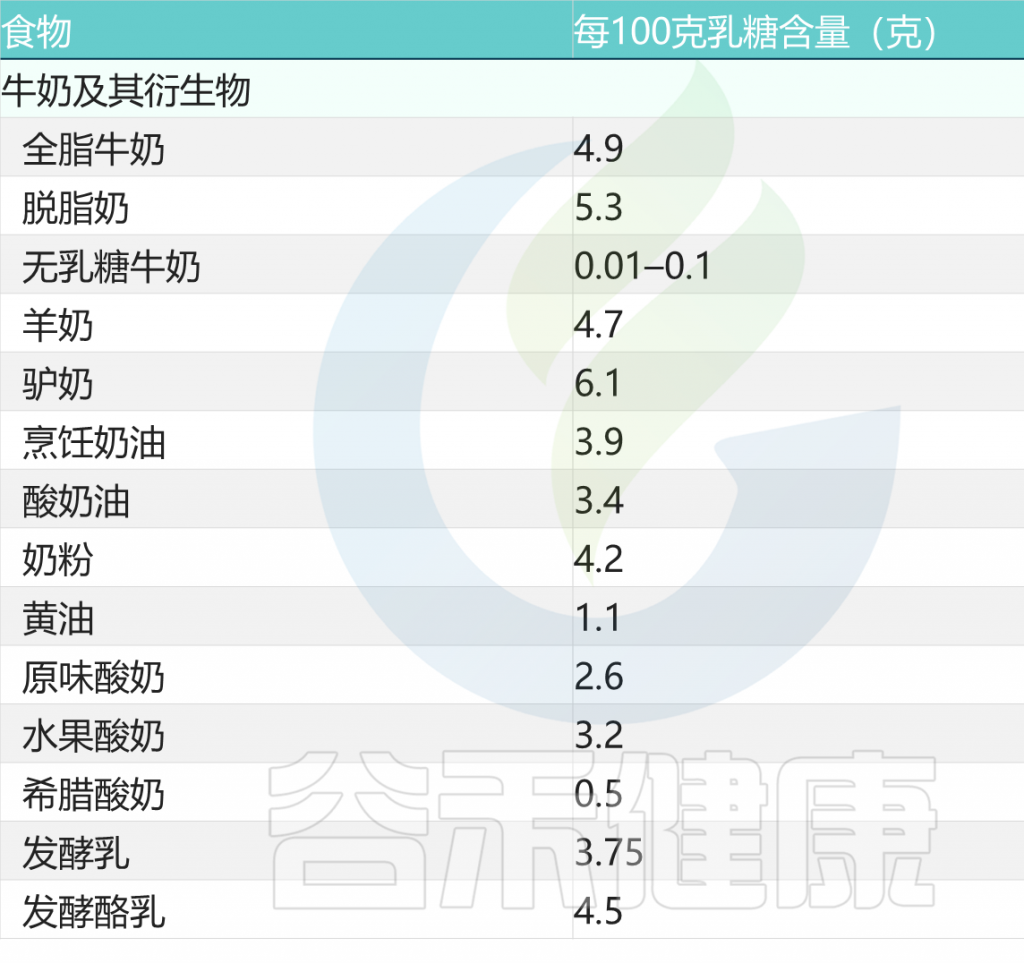
doi: 10.1186/s12967-020-02429-2
摄入乳糖后出现症状的可能性受到多种因素的影响。
外在因素包括:
内在因素包括:
我们详细看一下,肠道微生物组成这个内在因素发挥的作用。
有研究发现,与非乳糖不耐受个体相比,在乳糖不耐受个体中双歧杆菌丰度增加( P Wilcox =4.56×10 -9 ),并且与乳糖不耐受组的乳制品摄入量呈正相关 (R=0.22,p =0.05)。乳糖不耐受组和非乳糖不耐受组之间的乳制品摄入量没有显著差异。在乳糖不耐受个体中,双歧杆菌丰度与总肠道不适评分之间呈正相关(R=0.33,p=0.003)。
在六种特定的肠道疾病中,双歧杆菌丰度与腹痛、不适和腹胀呈正相关,但与任何其他疾病无关。研究人员发现乳制品摄入量与胃肠道不适之间的关联部分是由双歧杆菌丰度介导的(Prop介导=43%,p=0.054)
乳糖不耐症个体的双歧杆菌丰度和肠道不适
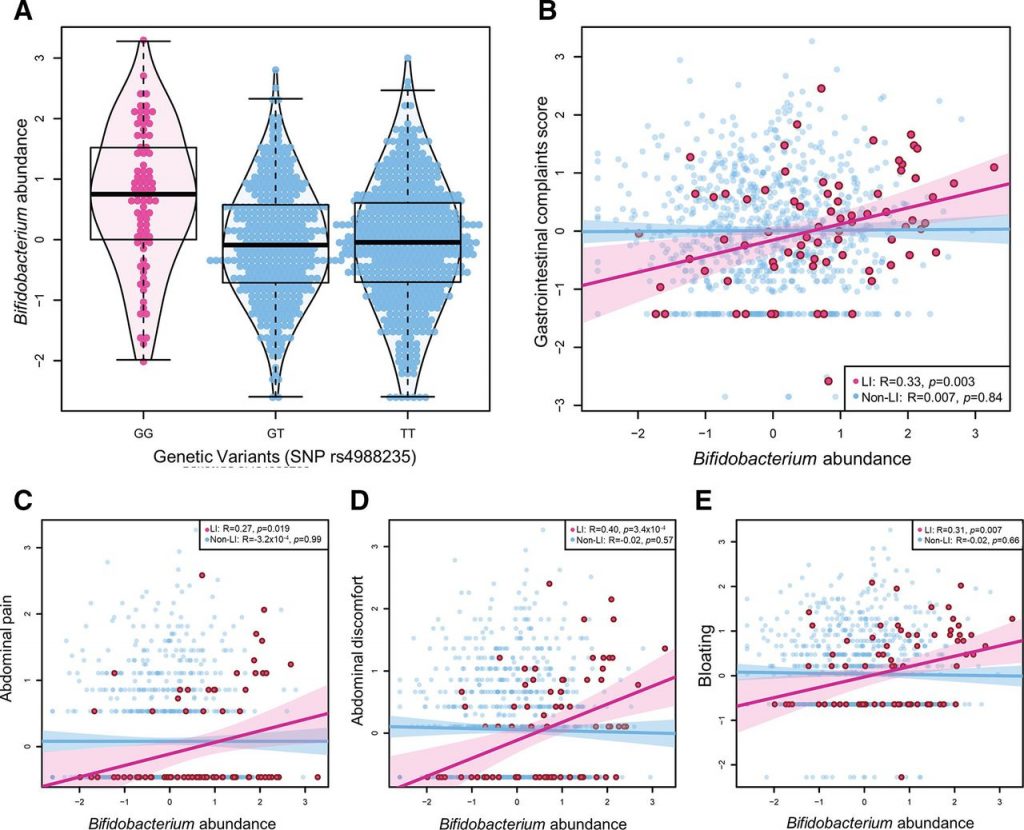
doi.org/10.1136/gutjnl-2020-323911
A)与 SNP rs4988235 的乳糖耐受基因型(G/T 和 T/T)相比,乳糖不耐受基因型(纯合 G/G)个体的双歧杆菌丰度更高。
B) 在乳糖不耐受个体中,双歧杆菌丰度与胃肠道症状总评分显著相关 (p=0.003)。
更具体地说,双歧杆菌丰度与 (C) 腹痛、(D) 胃肠道不适和 (E) 腹胀呈正相关。
分析牛奶摄入量、双歧杆菌丰度和肠道不适之间的直接和间接关系
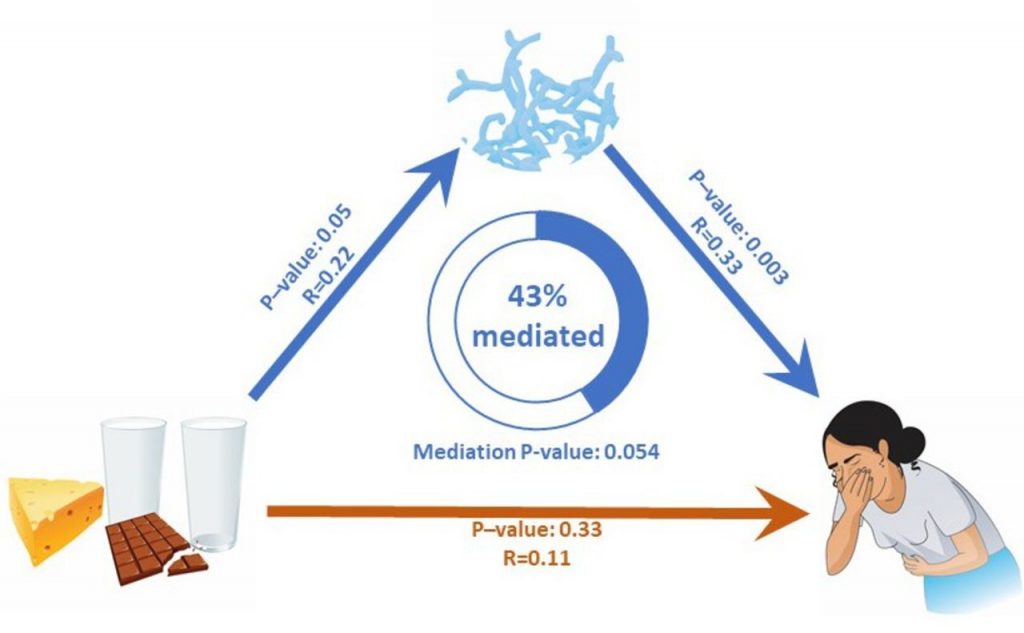
doi.org/10.1136/gutjnl-2020-323911
具有统计学意义的关联用蓝色箭头显示。
红色箭头表示不显著的相关性。
乳糖不耐受个体中与乳制品消费相关的肠道不适很大程度上是由双歧杆菌丰度介导的。
该研究结果证明,乳糖不耐受患者所经历的特定肠道症状可能是肠道中双歧杆菌丰度的结果,而不是乳糖摄入的直接影响。这项工作支持了初步报告,乳糖发酵细菌的代谢产物可能与乳糖不耐受症状的发生有关。
许多健康人尽管没有乳糖不耐症,但患有与牛奶相关的胃肠道不适;造成这种情况的机制尚不清楚,这可能与他们体内牛奶蛋白消化相关的生理反应有关。这种差异可能源于他们肠道微生物组的特定构成,这反过来又受到他们的饮食习惯影响。我们来看一项研究 ↓↓
该研究旨在探讨19名耐乳糖健康非习惯性牛奶消费者[NHMCs]在食用牛奶后报告胃肠不适的牛奶蛋白消化和相关生理反应(主要结果)、肠道微生物组和肠道通透性,并与20名没有胃肠不适的习惯性牛奶消费者[HMCs]进行比较。
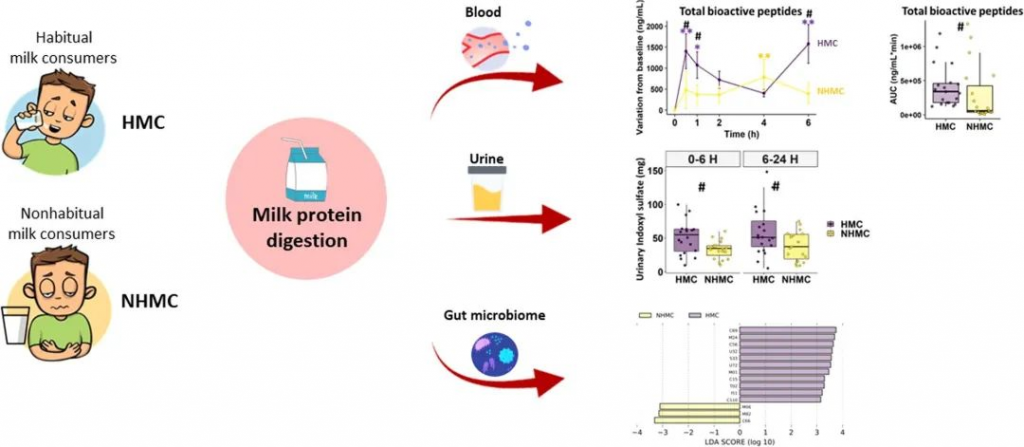
doi.org/10.1016/j.foodres.2023.112953
结果表明,与习惯性牛奶消费者相比,非习惯性牛奶消费者中的牛奶消耗量以及胃肠不适导致循环BAP缓慢而较低的增加,胃饥饿素(ghrelin)、胰岛素和内源性大麻素的反应较低,葡萄糖反应和血清DPPIV活性较高。
两组的肠道通透性相似,而习惯饮食(非习惯性牛奶消费者中乳制品含量较低,膳食纤维与蛋白质比例较高)可能形成了肠道微生物组;非习惯性牛奶消费者表现出双歧杆菌丰度较低、普氏菌丰度较高和蛋白酶编码基因丰度较低等特点,这可能会降低蛋白质消化,如硫酸吲哚的尿排泄量较低所示。
总之,研究结果表明,由于肠道微生物组较低的蛋白水解能力,牛奶蛋白质的消化效率较低,这可能解释健康人食用牛奶后的胃肠不适。
在精准医疗和个性化营养时代,该研究的结果有利于个性化饮食疗法。也就是是,患有牛奶相关胃肠道不适的健康人可能会受益于基于蛋白水解酶的疗法或针对微生物组的临时干预。此外,在个性化饮食方法中,牛奶相关的胃肠道不适可以通过食用含有预消化牛奶蛋白的牛奶食品来管理。食用在肠道中发挥蛋白水解活性的益生菌可能会进一步减轻敏感个体的胃肠道疾病和焦虑。
以前可能会建议乳糖不耐受患者尽量避免乳制品。但实际上,牛奶和乳制品是钙、磷、胆碱、核黄素、维生素 B12 和维生素 A 的主要来源,排除所有乳制品有可能会导致微量营养素缺乏。
从饮食中完全消除乳制品相关的主要风险是缺钙和损害骨骼健康。
* 膳食钙的最佳来源包括牛奶、奶酪、乳制品,西兰花、羽衣甘蓝、羽衣甘蓝、萝卜叶菜等。
大多数分析研究得出的结论是,乳制品是适当骨骼状态所需营养的极好来源,且在不食用乳制品的情况下达到建议的钙摄入量是具有挑战性的。
然而,对于乳糖不耐受的个体来说,摄入乳制品可能导致消化不适和其他相关症状。这就引出了一个重要的问题:如何在不引发消化不适的情况下为这些个体提供必要的营养素?
还是可以从肠道菌群的角度去考虑,因为肠道菌群的稳态,可能会帮助本来乳糖不耐受的人群慢慢适应乳糖。
我们来看最新的一项研究,该研究展示了乳糖酶非持久性基因型(LNP)个体每天补充乳糖前后肠道微生物群和乳糖不耐受症状的变化。
该研究前后为期 12 周,纳入了 25 名携带 LNP 基因型的亚洲裔健康成年人。参与者逐渐增加乳糖剂量,从每天两次 3 克到 6 克到 12 克,连续 4 周每天提供 6 克、12 克或 24 克的剂量。参与者在 12 周干预前后提交了重复的粪便样本,并接受了 25 克乳糖挑战氢呼吸测试 (HBT)。记录乳糖挑战期间的每日胃肠道症状和总症状评分(TSS)。
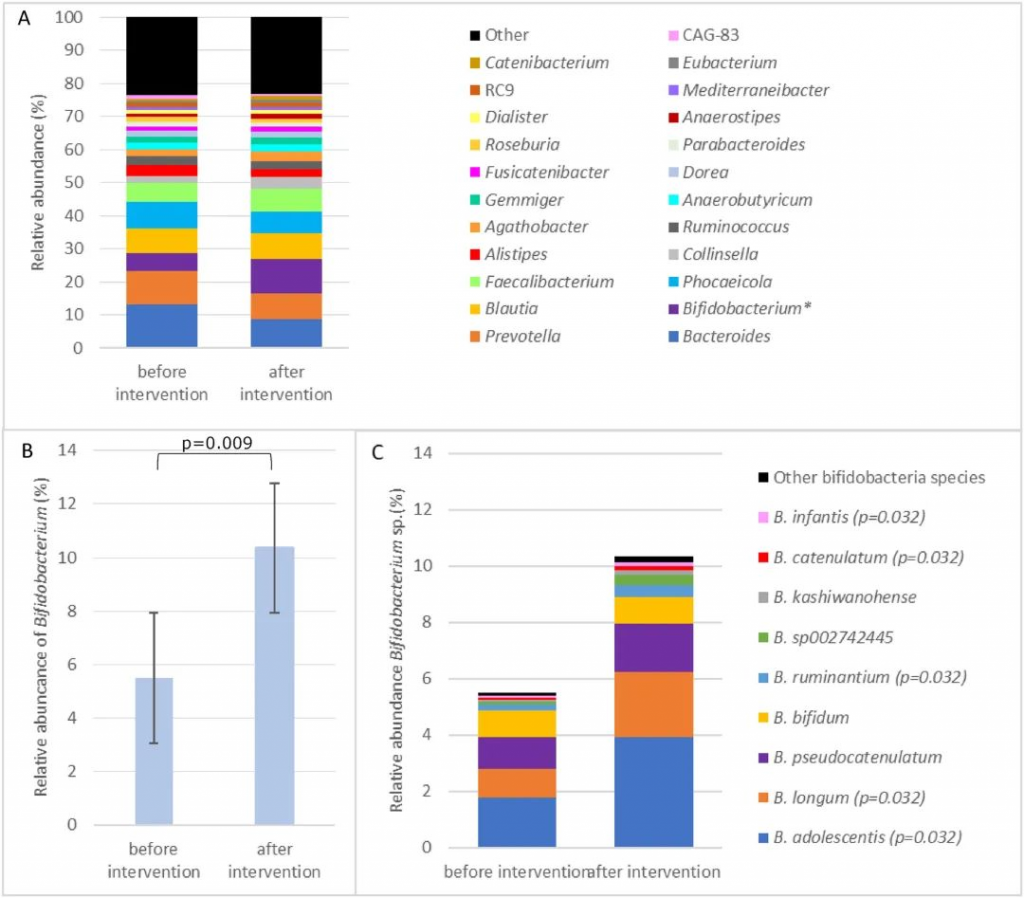
结果发现,干预后双歧杆菌相对丰度从 5.5% ± 7.6% 显著增加至 10.4% ± 9.6% (P =0.009),粪便 β-半乳糖苷酶活性增加2倍(570±269U/g;P <0.001),与基线 (272 ± 158 U/g) 相比。
双歧杆菌的β-半乳糖苷酶活性使这些个体能够更有效地消化乳糖。
双歧杆菌通过双歧分流发酵糖,比通过糖酵解发酵产生更多的 ATP,从而产生竞争优势。乳酸和乙酸盐是双歧杆菌乳糖发酵的主要代谢产物,不会产生氢气、二氧化碳或甲烷等气体。
乳酸和乙酸盐是肠道中其他细菌的底物,如产丁酸的Anaerostipes。Anaerostipes的相对丰度也因乳糖干预而增加。
双歧杆菌和Anaerostipes之间的交叉喂养可能发挥作用。这种交叉喂养产生的丁酸盐是肠细胞的重要能量来源,在改善肠道屏障功能方面发挥作用,并发挥抗炎活性。
乳糖干预前后优势属和双歧杆菌属的平均相对丰度
doi.org/10.1016/j.ajcnut.2023.12.016
与基线 HBT (57 ± 38 ppm·min) 相比,第二次 HBT (38 ± 35 ppm·min) 期间观察到呼出氢气减少 1.5 倍(曲线下增量面积;P = 0.01)。这也证实了双歧杆菌发酵不产生氢气,双歧杆菌多了,氢气就少了。
TSS 无显著下降(干预前为 10.6 ± 8.3,干预后为 8.1 ± 7.2;P =0.09)。
12 周乳糖干预前后的乳糖氢气呼气测试
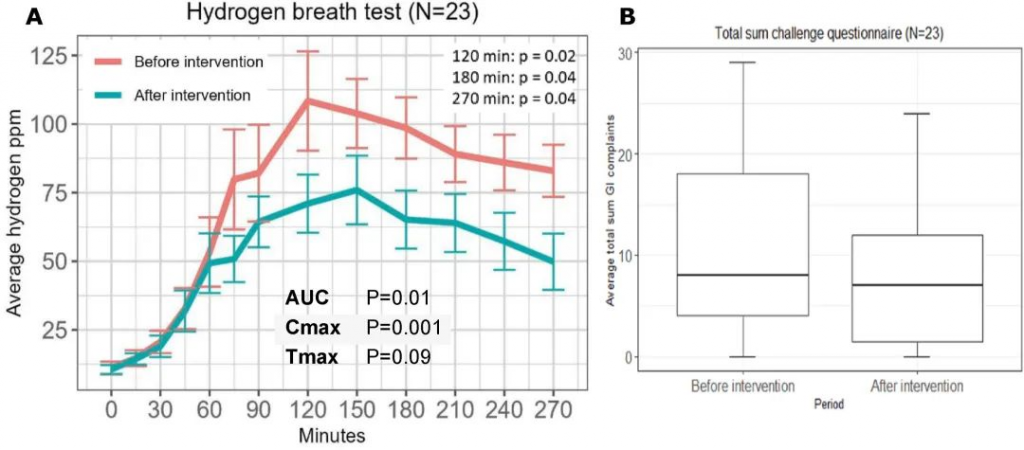
doi.org/10.1016/j.ajcnut.2023.12.016
每日摄入乳糖的耐受性良好,在干预期间报告有轻微甚至没有胃肠道不适。
双歧杆菌水平的增加表明肠道微生物群在重复消耗增量剂量的乳糖后发生了适应,第二次 25 g 乳糖 HBT 期间呼出的氢气浓度降低证明了肠道菌群的耐受性良好。双歧杆菌代谢乳糖而不产生气体,从而可能减少具有 LNP 基因型的个体肠道内气体的形成。
一些古代游牧民族可能就是通过这种肠道微生物组的改变适应了乳制品饮食,他们没有乳糖酶持续活性的遗传证据。
这表明,即使在遗传上缺乏分解乳糖的能力,人们也可能通过其他生物学机制,比如肠道菌群的改变来适应乳制品。
这种增加的乳糖耐受性可能消除了完全从饮食中去除乳制品的必要性。
上述研究我们了解到,既然肠道菌群的调整可以帮助逐渐适应乳糖,那么这可能会为乳糖不耐受者提供新的策略,通过益生菌、益生元等方式可以调节肠道菌群。
益生菌
益生菌经常被添加到乳制品中,既作为发酵剂又作为食品添加剂。例如乳杆菌、长双歧杆菌或动物双歧杆菌,它们在肠道中产生乳糖酶。
2022 年发表的文献包括使用益生菌双歧杆菌900791、罗伊氏乳杆菌DSM 17938和嗜酸乳杆菌DDS-1 的三项研究,共 117 名受试者。结果显示,只有罗伊氏乳杆菌DSM 17938 表现出症状显著改善和呼出氢气减少,而嗜酸乳杆菌DDS-1 表现出乳糖不耐受症状显著改善。
最近的一项荟萃分析包括 12 项研究,总样本量为 263 名患者,结果发现服用益生菌可以缓解乳糖不耐受症状。
摄入乳酸菌可以缓解乳糖不耐受的症状,但这些细菌可能不会在结肠中持久存在。一个新策略是“喂养”乳酸菌,益生元人类无法消化,但乳酸菌可以吃。在初步的临床试验中,使用这种“益生元”的受试者报告说乳糖耐受性有所改善,并且他们的肠道微生物组也相应发生了变化。
益生元
最近的一项系统回顾包括两项研究,其中在总共 462 名受试者中研究了短链低聚半乳糖 GOS (RP-G28) 的功效。作者发现,GOS (RP-G28) 在治疗阶段以及停止后 30 天内显示出乳糖不耐受症状的改善。
一项针对 377 名乳糖不耐受患者的随机安慰剂对照研究报告称,定期摄入短链 GOS (RP-G28) 发现,与安慰剂相比,总体评估结果显著改善,并且五种双歧杆菌分类群显著增加。
以上是研究中发现的部分有效果的益生菌和益生元,但对于每一位乳糖不耐受个体是否有效,效果是否持久,还需要结合肠道菌群检测报告辅助评估。比如某患者的有益菌并不是显著缺乏,但是其肠道菌群中某些条件致病菌超标,可能会加重乳糖不耐受的症状,这就需要医生或专业人士综合评估给出个性化干预建议。
此外,了解停止补充后某些症状恶化可能与哪些菌群及其相关代谢有关,也能帮助医生和患者更有针对性地进行干预,以达到更好的健康效果。
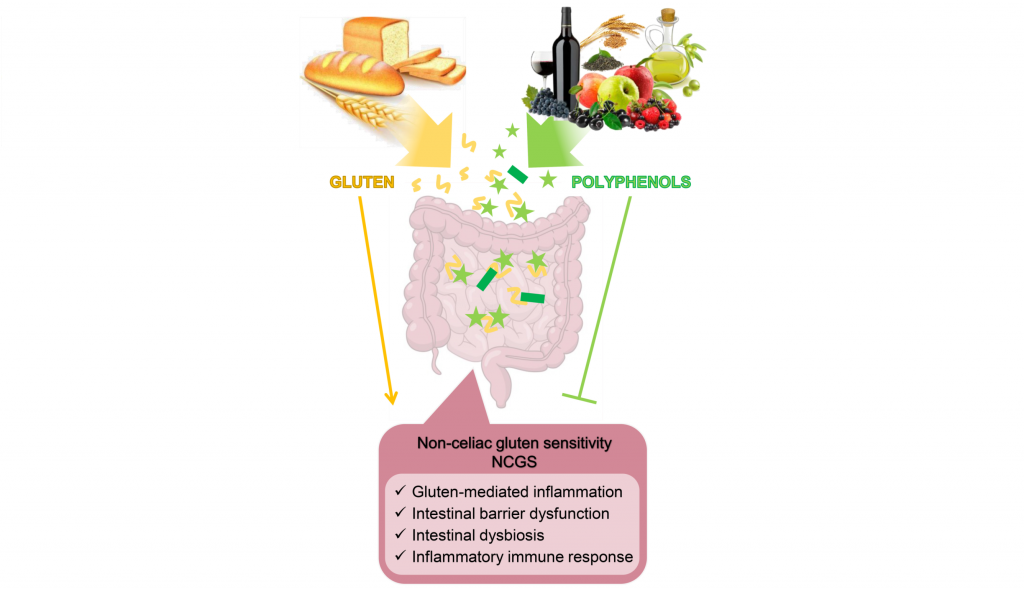
一类特定的食物不耐受与麸质摄入有关。
乳糜泻和小麦过敏是众所周知的病理状况,会引发独特的免疫反应。乳糜泻涉及主要针对胃肠道的自身抗体的产生,而小麦过敏会引发 IgE 介导的反应,过敏可能会导致瘙痒、呕吐或呼吸急促。
然而,有一部分人在食用麸质后会出现肠道和肠外症状,但没有表现出乳糜泻特异性抗体或过敏生物标志物。这些人被归类为患有非乳糜泻麸质敏感性 (NCGS),与乳糜泻不同,麸质敏感性不会损害小肠,麸质不耐受症状也往往比乳糜泻症状出现得更快,一般在食用麸质后几分钟到几小时内就出现了。
这种病症首次在 20 世纪 80 年代被描述,当时一名 43 岁的患者出现腹泻,但缺乏乳糜泻的生物标志物。该患者在采用无麸质饮食(GFD)后表现出显著改善。
典型的肠道症状包括:
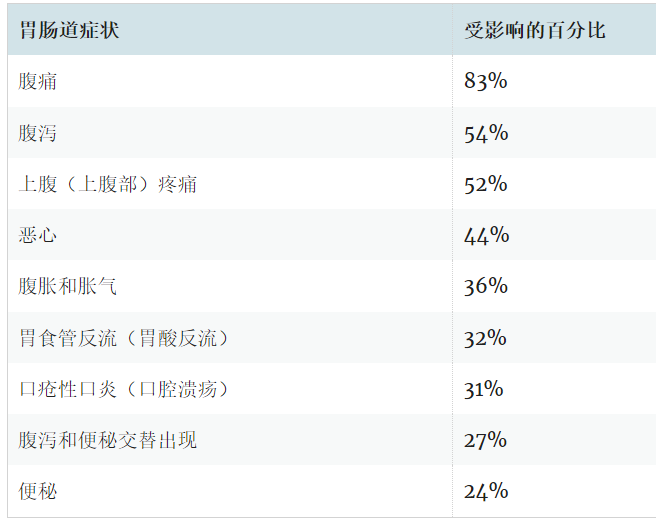
肠外表现可能包括:
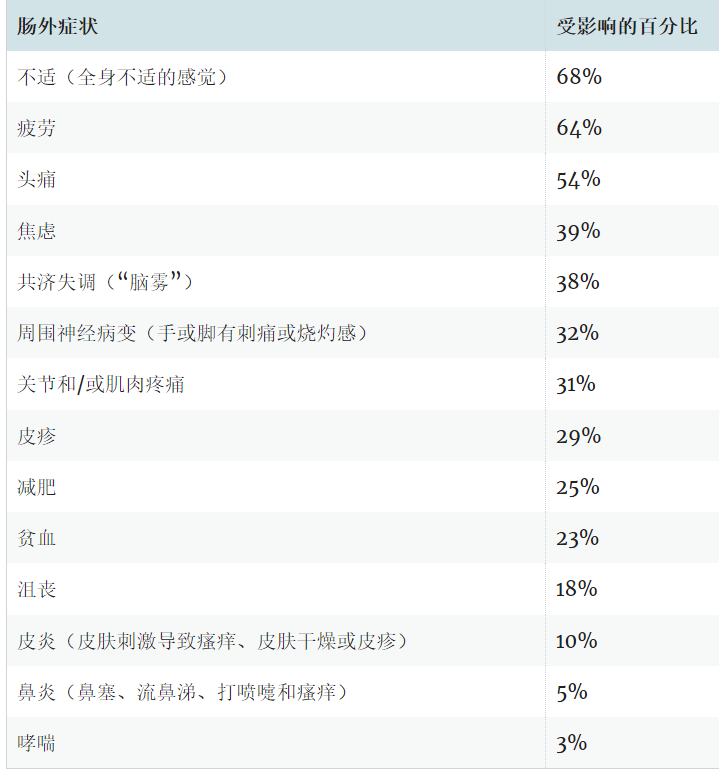
症状通常在摄入麸质后数小时至数天内出现,并在从饮食中去除麸质后消失。
通常,许多非乳糜泻麸质敏感性患者有乳糜泻或食物过敏家族史,并且还与桥本甲状腺炎和糖尿病等其他自身免疫性疾病相关。
麸质不耐受和乳糜泻虽然都是与麸质有关,都会引起胃肠道症状,如胃痛、腹胀、恶心和腹泻,但具有不同的生理机制和临床表现。

哪些食物中含有麸质?
小麦、大麦和黑麦都是含麸质的谷物。麸质也会出现在许多加工食品中,尤其是那些以这些谷物为基础或含有这些谷物成分的食品,例如:
小麦中的其他成分也可能引发不耐受
无麸质饮食在大多数情况下可以有效减轻症状,但一些 NCGS 患者尽管在诊断后多年遵循严格的无麸质饮食,但仍然报告症状。这表明除麸质外,小麦的其他成分可能是造成这些 NCGS 患者症状的原因。
小麦含有多种蛋白质,根据其功能可分为结构蛋白、功能蛋白或储存蛋白。其中,80%是储存蛋白,包括麦醇溶蛋白和麦谷蛋白,它们有助于麸质的形成。
注:这是一种蛋白质网络,赋予面包和硬质小麦面团独特的粘弹性。
这些储存蛋白富含脯氨酸,这使得它们能够抵抗肠道蛋白水解酶。高脯氨酸含量会导致免疫原性肽的产生,从而引发炎症和氧化应激反应。
麸质作为不耐受罪魁祸首的确切作用尚不完全清楚。小麦含有 2-4% 的淀粉酶胰蛋白酶抑制剂 (ATI),这也会加剧肠道免疫反应并增加炎症。
注:ATI是植物来源的蛋白质,可以使小麦具有抗虫性(能够抵抗黄粉虫和臭虫的损害)。
小麦中还包含一些果聚糖,这些也会在小肠中缓慢吸收,并被肠道细菌快速发酵,导致气体产生和腹胀。一项双盲交叉挑战,以检查麸质和果聚糖对自我报告的NCGS患者的影响。结果显示,在这一组中,似乎是果聚糖而不是麸质引发了更显著的胃肠道症状。
麸质不耐受其实比乳糜泻更常见。任何人都可能患有麸质不耐受,但在 30 岁- 40 岁之间人群发病率较高,在女性中更为常见。
也有研究认为,在儿童中,男性 NCGS 的患病率高于女性。
由于缺乏对该疾病及其致病原因的了解,因此没有可以诊断NCGS的实验室测试或影像学研究。诊断主要基于测试和排除所有其他可能的原因。
乳糜泻:通过可检测乳糜泻自身抗体的血液检查和小肠活检以检查绒毛萎缩来诊断。
小麦过敏:通过过敏血液测试、皮肤点刺测试或斑贴测试来诊断。
可能会进行其他测试以排除其他可疑原因。
如果排除乳糜泻和小麦过敏,可能会建议吃无麸质饮食六周,然后重新摄入麸质一周。一些人认为,饮食能使症状改善30%,重新引入麸质能使症状增加30%,即可诊断为非乳糜泻麸质敏感性。
IBS和NCGS的症状相似可能导致错误的诊断和无效的治疗。一例临床病例描述一名 49 岁女性,曾被诊断患有 IBS。患者主诉腹痛、便秘、胃酸反流和头痛。
考虑并最终排除以下情况:自身免疫性疾病、甲状腺激素水平异常、幽门螺杆菌感染。在不适当的治疗过程中,患者出现了类似系统性红斑狼疮的症状。此外,患者在服用皮质类固醇后表现出一些改善,这也很难做出正确的诊断。最终,经过多年的不当治疗,才发现是NCGS。
当然一些研究表明 NCGS 可能是发生 IBS 的主要触发因素。事实上,由于NCGS 和类似 IBS的症状往往重叠,因此诊断过程特别具有挑战性。
IBS 和 NCGS 之间的重叠
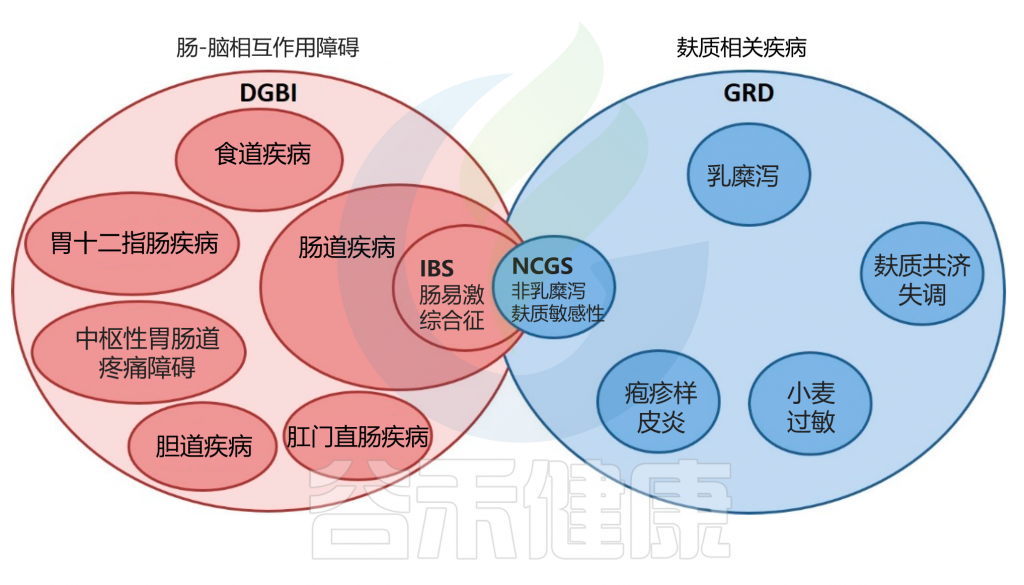
doi.org/10.3390/nu12123735
通常需要通过详细的病史收集、排除其他医学原因、饮食日记记录以及可能的饮食干预来辅助诊断。同时,也可以结合肠道菌群健康检测辅助判别,如果检测到肠道中某些细菌的增多,这些菌参与的代谢途径可能与小麦或麸质摄入有关,这可能支持NCGS的诊断。如果在饮食中去除小麦或麸质后肠道菌群发生了积极的变化,并且症状得到缓解,这也有助于NCGS诊断。
在进行诊断时,需要综合考虑多种因素,肠道菌群检测的结果与临床症状、病史、其他实验室测试和可能的饮食干预结果一起考虑,可以更加全面地加以评估。
NCGS 的病理生理学涉及免疫激活、通透性改变、神经免疫相互作用和遗传因素。麸质和微生物群可以增加上皮通透性,有利于不同抗原进入粘膜并随后激活免疫系统。神经免疫激活和分泌运动功能障碍可能影响大脑活动。
非乳糜泻麸质敏感性病理生理学中涉及的潜在机制
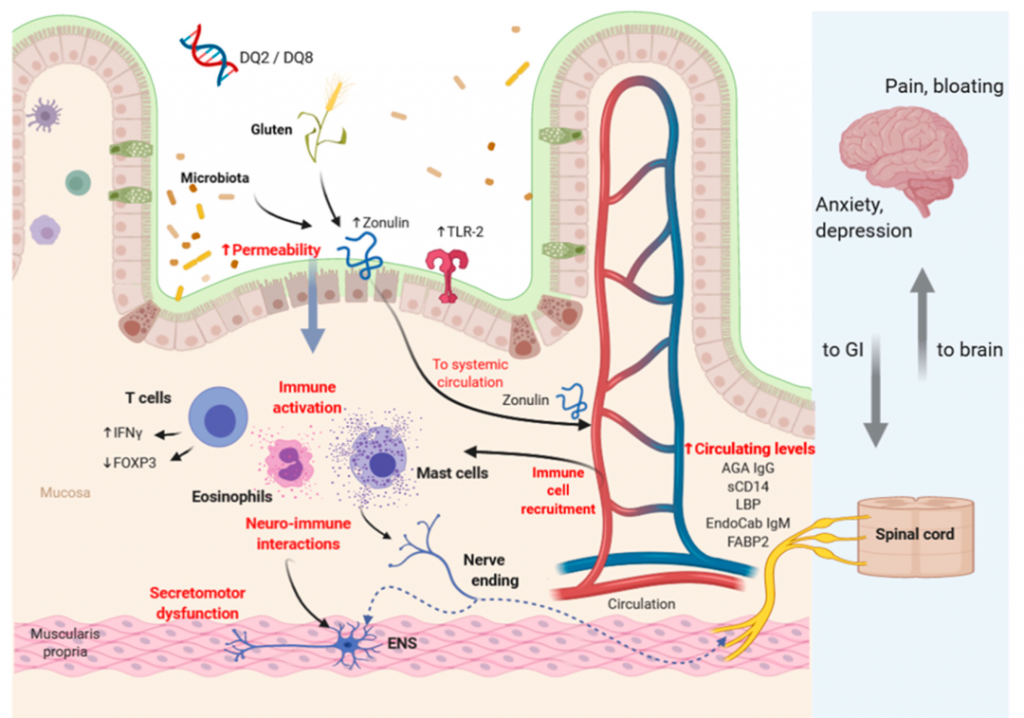
doi.org/10.3390/nu12123735
从组织学角度来看,与健康个体相比没有太多差异,因为正常的绒毛结构维持在十二指肠水平。上皮内淋巴细胞(IEL≤25/100肠细胞)的截止值用于定义正常十二指肠组织学,对应于Marsh 0。然而,归类为非乳糜泻麸质敏感患者显示十二指肠上皮内淋巴细胞计数增加(>25/100肠细胞),对应于Marsh I 病变。
绒毛上皮中 IEL 的不规则分布和簇状分布作为支持 NCGS 诊断的组织学发现,但需要更大规模的研究来证实。
最近一项多中心研究发现,即使在绒毛结构的Marsh 0期,非乳糜泻麸质敏感患者十二指肠粘膜也表现出与肠腔抗原反应一致的独特变化。非乳糜泻麸质敏感患者固有层水平存在嗜酸性粒细胞,这表明这种情况可能更接近于食物过敏。
Zonulin是一种在调节肠屏障通透性方面发挥作用的蛋白质。有人认为,在HLA-DQ2/8阳性个体中,非乳糜泻麸质敏感患者中zonulin增加,而在采用无麸质饮食后降低,因此可以用于与腹泻型肠易激综合征(IBS-D)进行鉴别诊断。
肠道微生物群与麸质相关疾病之间的关系很复杂。人类肠道中存在大量能够水解麸质蛋白和肽的细菌。
NCGS 患者表现出有益菌种(双歧杆菌)的减少和促炎细菌(肠杆菌科和大肠杆菌)的增加。
上皮水平上的 Toll 样受体 (TLR 2-4) 会因病原微生物而被激活。肠道微生物群的参与,非乳糜泻麸质敏感性患者中致病性拟杆菌门增加,腐生菌(厚壁菌门)减少。这种失调可能会导致患者出现腹胀,这可能是由于发酵增加所致。
在分子水平上,观察到Claudin-4的增加,这是负责细胞旁通透性的紧密连接的组成部分。因此,对非乳糜泻麸质敏感性提出了“漏肠”假设,表明肠屏障受损。这可以导致食物成分(如麸质)和其他外来物质更容易穿越肠道壁,这可能触发免疫反应和炎症,增加对麸质的敏感性。
★ 无麸质饮食
大多数麸质不耐受患者通过遵循无麸质饮食可以缓解症状。
无麸质饮食中可以吃的谷物有:
藜麦、糙米、野米、高粱、木薯、小米、燕麦等
麸质存在于无数食品、饮料和其他产品中,仔细阅读食品和饮料标签,了解哪些食物、饮料和成分含有麸质。
低麸质饮食通过调节肠道菌群改善不耐受
一项研究比较了60名丹麦成年人,他们分别接受了8周的低麸质饮食和8周的高麸质饮食。低麸质饮食改变了粪便微生物组,降低了双歧杆菌、Dorea、Blautia、Lachnospiraceae的相对丰度,以及两种产丁酸的细菌Anerostipes hadrus和Eubacterium hallii。然而,低麸质饮食也增加了梭状芽孢杆菌目和毛螺菌科一个未分类物种的相对丰度,这两个类群产丁酸。
总能量、纤维和FODMAP的摄入量在两种不同的饮食条件下没有变化。低麸质饮食减少了餐后的呼吸氢,减轻了自我报告的腹胀。它还显著增加了饱腹激素PYY的产生,并导致体重减轻。低麸质饮食可以降低血清IL-1β,这是参与炎症反应的分子。
需要更多的研究来了解不同的无麸质饮食如何影响粪便微生物组和免疫系统。
其他饮食方式也包括:
★ 低ATI饮食
我们前面讲到,小麦中的除了麸质之外的其他成分也可能引发消化道症状,其中也会ATI 可能会促进 NCGS 中出现的肠道炎症症状,这与乳糜泻不同。
应避免的 ATI 含量高的食物包括黑麦、大麦、小麦(以及所有小麦产品变体)以及含麸质的食物。
★ 益生菌
益生菌可能减轻麸质敏感个体的影响。在细胞培养和动物研究中,已发现某些长双歧杆菌(NCC2705 和 CECT 7347)、动物双歧杆菌(乳酸亚种)和鼠李糖乳杆菌 (GG) 菌株可减弱醇溶蛋白对肠粘膜的破坏作用。
在一项针对新诊断克罗恩病儿童的随机安慰剂对照试验中,长双歧杆菌 CECT 7347 补充剂三个月可改善生长参数,降低潜在促炎菌属脆弱拟杆菌的丰度,并减少粪便分泌 IgA,表明肠道免疫系统不再处于“高度警戒”状态。
另一项针对无麸质饮食的克罗恩病患儿的研究发现,补充短双歧杆菌(BR03 和 B632)三个月可显著降低循环 TNFα,这是全身炎症的标志物。停止补充益生菌三个月后,TNFα水平再次升高。
总的来说,补充益生菌在减轻麸质造成的损害和改善麸质敏感个体的整体健康方面潜力很大。
不过,在补充益生菌之前,最好进行肠道菌群健康检测,因为益生菌的效果因人而异,可能受到个体肠道菌群的影响。假如某位麸质不耐受患者本身长双歧杆菌较多,补充长双歧杆菌不一定有用,那么可能需要结合该患者的总体肠道菌群检测报告来看,哪些菌群不平衡,过多或多少带来怎样的健康风险,对麸质不耐受可能产生什么样的影响,综合评估是否需要补充以及什么方案更适合总体健康。
★ 益生元
多酚是我们饮食中常见的植物化学生物活性成分。多项研究表明,多酚可以通过与蛋白质等其他大分子相互作用来发挥促进健康的特性,优先与富含脯氨酸的蛋白质结合,例如麸质蛋白。
doi.org/10.3390/nu14132679
多酚通过改善肠道菌群缓解 NCGS 症状
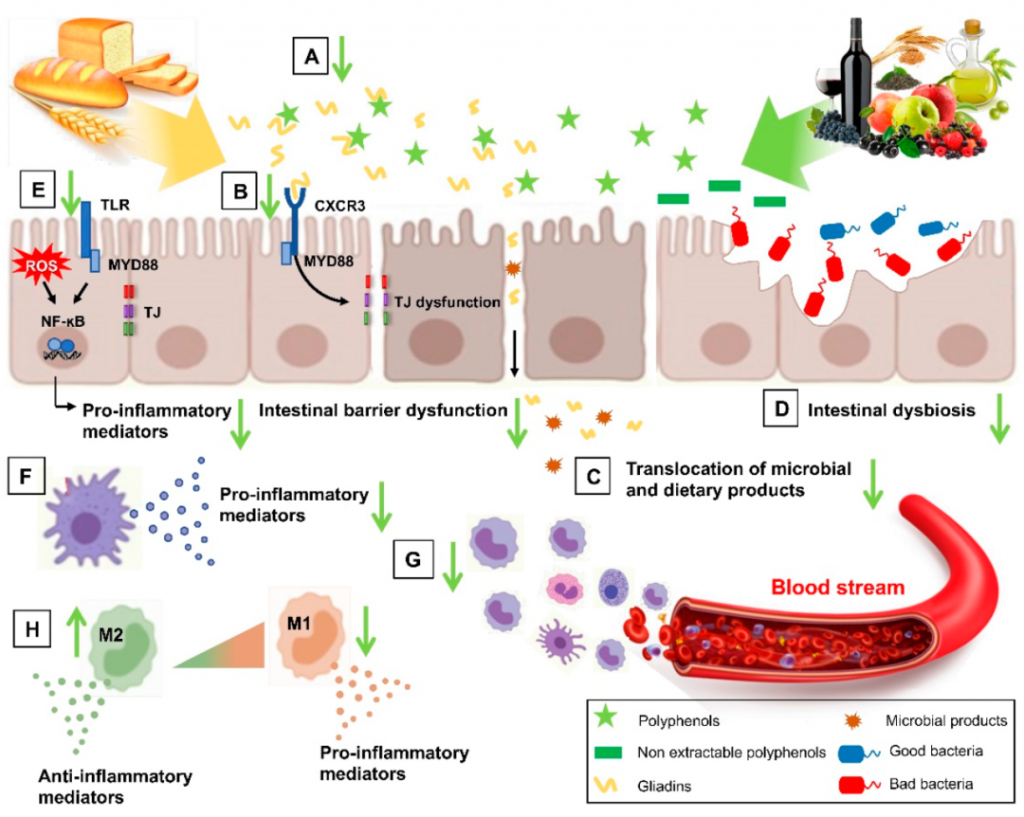
作为益生元底物,多酚刺激有益细菌种类的生长和活性,例如Akkermansia muciniphila、多形拟杆菌(Bacteroides thetaiotaomicron)、Faecalibacter prausnitzii 、双歧杆菌、乳杆菌,促进微生态转变,发挥其抗炎、抗氧化、免疫和屏障完整性保护作用,从而在肠道和全身水平上抑制麸质的毒性作用。
NCGS 中多酚及其代谢物的潜在目标
doi.org/10.3390/nu14132679
多酚可以结合并隔离麸质,降低麸质的生物利用度(A);它们可以抑制麦醇溶蛋白肽和 CXCR3 受体之间的相互作用,恢复改变的肠道通透性(B),然后减少微生物和膳食产品的易位(C);它们还可以改善肠道菌群失调,肠道屏障功能障碍(D)。多酚可以削弱肠道水平的氧化应激和炎症诱导途径 (E),并抑制压倒性的炎症免疫反应(F),减少固有层 (G) 中骨髓细胞的募集,并增加 M2 极化抗炎巨噬细胞 (H)。
富含多酚的食物包括:
橄榄油、红葡萄/葡萄酒、水果(浆果类如蓝莓、草莓、黑莓和覆盆子等)、蔬菜(如洋葱、茄子、菠菜等)、谷物(豆类如黑豆和红豆等)、坚果(如核桃、杏仁)、可可、咖啡、茶等。
现在“无麸质饮食”的概念越来越流行,无麸质饮食可以说是欧美健康饮食界近几年的流行饮食方式,甚至很多健康人包括各类博主也开始遵循无麸质饮食,然而这也可能会伴随一些健康风险。
与遵循常规饮食的受试者相比,无麸质饮食与常量营养素(例如饱和脂肪和糖)的消耗增加以及微量营养素(例如铁、叶酸和锌)的摄入量较低有关。
也有研究表明,健康成人持续无麸质饮食后,双歧杆菌、乳酸杆菌和长双歧杆菌减少,而肠杆菌科和大肠杆菌增加。
无麸质饮食饮食明显影响多种菌群的丰度,特别是那些专门参与碳水化合物和淀粉代谢的物种,如韦荣氏球菌科。
无麸质饮食也可能会导致下列风险增高:
无麸质饮食人群最好定期进行检查下列指标:
因此,对于健康人来说,在决定是否采用无麸质饮食之前,应该充分了解其可能的健康风险,每个人应该根据自身身体状况和需求来决定。
FODMAP 是短链碳水化合物,包括乳糖、超过葡萄糖的果糖、糖醇(山梨醇和甘露醇)、果聚糖和 GOS(水苏糖和棉子糖),天然存在于水果、蔬菜、谷物、乳制品等大量食品和甜味剂中。
这组碳水化合物已被确定为触发功能性胃肠道症状患者的症状,如肠易激综合征(IBS)。
高FODMAP食品是指含有超过 4 克乳糖、超过 0.3 克甘露醇、山梨醇、低聚半乳糖或果聚糖的食品。因此,可以通过考虑食物的 FODMAP 含量来对食物进行分类。
敏感个体食用高FODMAP饮食与腹痛、腹胀、肠胃胀气和肠道习惯改变等低胃肠道症状相关。
在IBS患者队列中,使用低FODMAP饮食对症状的改善已被证明在50-80%之间变化。该范围可能受到几个因素的影响,包括研究设计、患者选择和习惯饮食中的FODMAP摄入量。
FODMAPs难以被肠道细菌吸收和发酵。
因此,摄入大量FODMAPs会导致大量短链脂肪酸(SCFAs)和大量气体(包括二氧化碳、氢气和甲烷)的过度产生,这些物质会导致肠腔膨胀和肠腔内水潴留。
在内脏超敏反应患者中,增加内腔水分输送和气体的联合作用导致膨胀,导致疼痛和不适。
关于内脏超敏详见我们之间的文章:
腹胀、腹痛、肠胃不明原因疼痛?–可能是内脏高敏感,详细了解内脏高敏的原因后果
最近,还提出了其他作用机制,如由于低FODMAP饮食后尿组胺和促炎细胞因子的显著减少,高FODMAP食物的免疫激活潜力。
然而,需要进一步的数据来证实这些发现,并确认它们对症状反应的影响。
那些对特定高FODMAP食物反应明显的人,可能需要减少这些食物的摄入。
其他人群还包括:
肠易激综合征(IBS)患者
IBS是一种常见的消化系统疾病,其症状包括腹痛、腹胀、腹泻和便秘。低FODMAP饮食已被证明可以有效减轻这些症状。
小肠细菌过度生长(SIBO)患者
SIBO是一种病状,其中小肠中的细菌数量异常增多,可能导致类似IBS的症状。限制FODMAPs可以帮助减少细菌的食物来源,从而减轻症状。
功能性腹胀患者
这是一种以腹部不适和腹胀为主要症状的状况,而低FODMAP饮食可以帮助减少腹胀和其他相关症状。
炎症性肠病患者
如克罗恩病和溃疡性结肠炎,虽然低FODMAP饮食并非治疗这些疾病的主要方法,但它有时可以帮助控制某些症状,尤其是在病情活动期间。
其他消化不良的人
有些人可能没有特定诊断,但发现减少高FODMAP食物的摄入能够减轻他们的消化不良。
IBS 是一种功能性胃肠道疾病,影响全世界多达 20% 的人。胃肠道症状受到不同因素的影响,例如心理社会领域、生理功能及其相互作用(肠-脑轴)。IBS的特点是内脏运动和敏感性异常,以及免疫功能和微生物群组成异常;因此,它与各种胃肠道症状和生活质量受损有关。罗马 IV 诊断标准允许根据症状将 IBS 患者分为三类:伴有腹泻的 IBS(IBS-D)、伴有便秘的 IBS(IBS-C)和具有混合排便习惯的 IBS(IBS-M)。
IBS的发病机制仍不完全清楚,但不同的研究表明饮食在症状管理中发挥着重要作用。最有证据支持的饮食是低 FODMAP 饮食 (LFD),它对 IBS 治疗有效。
七项研究证实了低 FODMAP 饮食的积极作用,表明低 FODMAP 饮食后 IBS 严重程度评分系统(IBS-SSS)显著下降。同样,与遵循标准饮食的患者相比,生活质量有所改善。
最后,与 IBS-C 患者相比,低 FODMAP 饮食在 IBS-D 和 IBS-M 患者中的疗效似乎更高。
低FODMAP饮食在世界范围内广泛研究,并显示出良好的疗效证据,得到荟萃分析的支持,并已纳入临床指南。
低FODMAP饮食减少碳水化合物亚类的摄入,包括:
针对低 FODMAP 饮食的特点,可以采用“自上而下”的方法,分为限制、重新引入和个性化长期维护三个步骤。
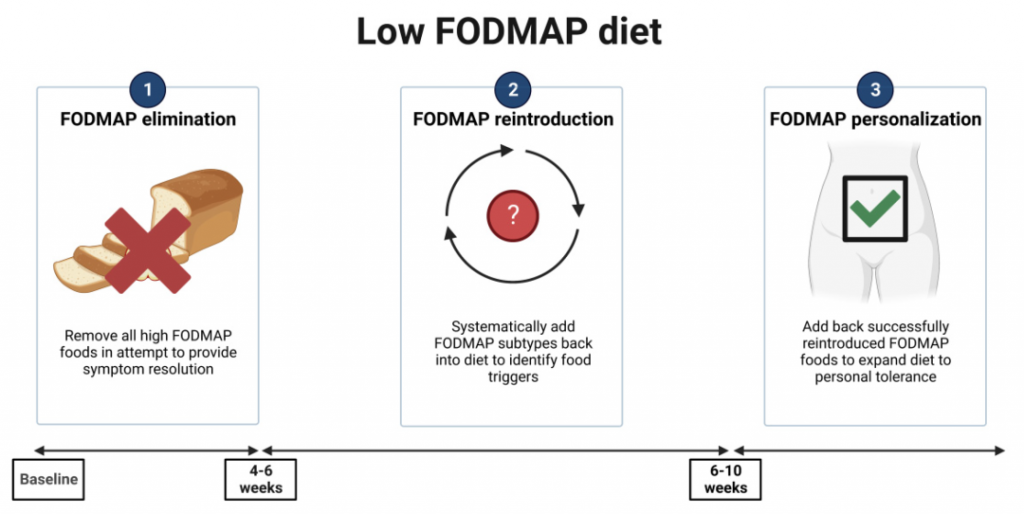
第一阶段要求从饮食中排除所有高 FODMAP 食物,通常持续 4-6 周。这是最关键的阶段,重要的是向患者解释 FODMAP 在胃肠道症状发生中的作用。
第二阶段的目的是重新引入 FODMAP 并评估每位患者的耐受性,调整饮食以进行长期维持。在此阶段,评估饮食依从性和临床反应也很重要;个性化重新引入食物,考虑每种食物 3 天,可以识别患者症状的特定触发因素。
第三阶段涉及制定长期饮食,根据患者的 FODMAP 耐受性进行定制。关键是要制定灵活的饮食结构,以保持多样化和营养充足,并控制肠易激综合征症状。
低 FODMAP 饮食并不是所有受胃肠道紊乱影响的患者的灵丹妙药。
营养缺乏风险
主要原因是缺乏适当的饮食咨询和自我限制饮食。关于膳食摄入量的研究并不一致。由于碳水化合物摄入量的减少,纤维缺乏症是最常见的;此外,当过量摄入乳制品时,钙摄入量也会降低。
考虑到维生素的消耗,维生素缺乏的风险与严格减少饮食中的蔬菜和水果有关。排除几种蔬菜可能会导致天然抗氧化剂的减少,例如类黄酮、类胡萝卜素和维生素C,酚酸和花青素等。
不过总的来说,缺乏有关低 FODMAP 饮食长期影响的数据,但如果患者在饮食过程中得到专业人员的适当监测,营养缺乏的风险非常低。
便秘风险
低 FODMAP 饮食的另一个潜在限制是纤维消耗量低,这可能会加重便秘,尤其是 IBS-C 患者。
适当的营养随访和知识科普可以改善饮食管理和纤维摄入量。
饮食失调风险
低 FODMAP 饮食第一步中施加的限制可能会对患者的情绪状态产生负面影响。有研究表明,低 FODMAP 饮食后的 IBS 患者与食物相关的生活质量较低。
此外,低 FODMAP 饮食对IBS症状恶化的焦虑以及随之而来的饮食限制似乎与饮食失调的发生相关。特别是,回避性限制性食物摄入障碍和神经性厌食症是与低 FODMAP 饮食相关的最常见的饮食失调。
微生物群变化的风险
高 FODMAP 食物通常是益生元的良好来源,尤其是那些含有低聚果糖、低聚半乳糖和纤维的食物,因此减少摄入量可能会改变微生物群结构。这会减少短链脂肪酸的产生及其对结肠细胞的重要保护和营养活性。
短期研究表明,低 FODMAP 饮食可能会导致总体细菌丰度、双歧杆菌和普拉梭菌减少。普拉梭菌的减少可能对肠粘膜屏障的完整性有害。
总之,这不是一种“简单”的饮食,当患者在没有任何专业建议的情况下遵循该饮食时,问题就会增加。同时,有必要在这一新领域进一步研究,以确定哪些患者可以从低FODMAP饮食中受益,并改善管理。
果糖不耐受分为遗传性果糖不耐受和非遗传性果糖不耐受。
遗传性果糖不耐受 (HFI) 是一种罕见的常染色体隐性遗传疾病,无法正常代谢果糖,导致各种代谢紊乱和临床症状。
这是由位于染色体 9q22.3 上的醛缩酶 B 酶突变引起,摄入果糖后可导致明显的胃肠道症状,并可能导致长期器官损伤,特别是肾和肝脏损伤。
临床特征
当患有这种疾病的个体直接或通过蔗糖或山梨醇间接接触膳食果糖时,遗传性果糖不耐受症状就会出现。
果糖不耐受的人在食用高果糖食物或饮料后经常会出现胃肠道症状,如腹痛、腹胀、腹泻和恶心。这些症状可以是轻微到严重的不适,并且可以显着影响个人的生活质量。
症状及其严重程度取决于果糖剂量、患者年龄、伴随疾病和醛缩酶 B 的残留酶活性,并且是非特异性的,因此很难仅根据症状来怀疑遗传性果糖不耐受。常见的临床表现是恶心、呕吐、腹部不适和生长受限/生长迟缓。
治疗
遗传性果糖不耐受的管理包括严格避免含有果糖、蔗糖和山梨醇的食物。通过正确的诊断和坚持果糖限制饮食,果糖不耐受的个体可以有效地控制他们的病情并改善他们的整体健康。
遵循严格的不含有果糖、蔗糖和山梨糖醇的饮食,并补充葡萄糖和玉米淀粉等碳水化合物,可以使症状迅速逆转。患者应避免使用含有蔗糖的药物和疫苗,例如两种口服轮状病毒活疫苗 Rotarix ® 和 RotaTeq ®。鉴于减少水果和蔬菜摄入量是饮食要求,建议每天补充“无糖”多种维生素,以防止微量营养素缺乏,特别是水溶性维生素缺乏。
非遗传性果糖不耐受是怎么回事?
相对于管腔果糖的量而言,肠上皮细胞摄取果糖不足。
小肠中果糖的吸收能力远低于葡萄糖的吸收能力;葡萄糖以剂量依赖性方式刺激果糖吸收,当果糖含量多于葡萄糖时,就会发生吸收不良。然后,未吸收的果糖进入结肠,并以与 LNP 患者的乳糖相同的方式发酵。
如何诊断?
果糖吸收不良 (FM) 的诊断通常需要结合病史评估、症状评估和特定测试。多年来,一直使用特定的氢气呼气测试来评估果糖吸收不良。关于氢气和甲烷呼气试验的适应症、性能和临床影响的欧洲指南建议,成人诊断果糖吸收不良和不耐受时的果糖剂量应为 20-25 克。
关于“胃肠道疾病中 H2 呼吸测试的方法和适应症”的罗马共识会议和 ESPGHAN 关于呼气测试使用的文件均表示,在临床实践中不建议进行果糖呼气测试。
鉴于这种诊断的不确定性,可能会建议消除饮食,即在特定时期内从饮食中去除高果糖食物。如果症状在此期间有所改善,然后在重新摄入含果糖食物时又出现,则可能表明果糖吸收不良。
如何改善?
由于果糖是一种 FODMAP,因此通常建议采用低 FODMAP 饮食来代替低果糖饮食,特别是对于怀疑患有伴随功能障碍的患者。先前的调查表明,诊断为 IBS 或 FGID 的个体中,很大一部分(35%~73%)表现出与果糖吸收不良一致的特征。
木糖异构酶已被提议作为果糖不耐受的潜在治疗方法,因为它能够将果糖转化为葡萄糖。一项双盲、安慰剂对照研究表明,口服木糖异构酶与摄入果糖后呼吸氢显著减少有关,并且恶心和腹痛显著改善。目前,经验疗法包括采取限制饮食和评估症状。
蔗糖由一种葡萄糖和一种果糖分子组成。这两个分子之间的结合被膜结合酶蔗糖酶-异麦芽糖酶破坏。先天性蔗糖酶-异麦芽糖酶缺乏症(CSID)是一种罕见的常染色体隐性遗传疾病,染色体 3q25-26 上的蔗糖酶-异麦芽糖酶基因发生突变。
获得性形式的蔗糖酶-异麦芽糖酶缺乏症可能继发于与肠绒毛萎缩相关的其他慢性胃肠道疾病,例如肠道感染、乳糜泻、克罗恩病和影响小肠的其他肠病。
功能性蔗糖酶-异麦芽糖基因变异似乎在具有提示 IBS 症状的患者中更为常见。然而,如上所述,最近的指南不建议对这些患者进行碳水化合物测试。
使用来自酿酒酵母产生的酶糖化酶来水解蔗糖,作为这种不耐受的可能治疗方法。因为一项古老的双盲研究显示,与安慰剂相比,这种酶与食物一起服用可以显著预防在含蔗糖饮食中的患者的不耐受症状。
组胺一般在哪些食物中出现?
发酵食品、酒精、贝类、熏肉、豆类、巧克力、某些水果和蔬菜等。
doi.org/10.3390/nu13051638
组胺不耐受是如何发生的?
由于二胺氧化酶(DAO)活性低,肠道中组胺降解途径受损或减慢,导致组胺在血浆中积聚并出现不良反应,特别是在高饮食摄入的情况下。然而,这种因果关系尚未得到证实。
组胺不耐受有哪些表现?
由于组胺受体普遍分布在身体的不同器官和组织中,组胺不耐受的临床表现包括多种非特异性胃肠道和肠外症状。
这种多形性的表现导致难以就组胺不耐受的诊断标准达成共识。
组胺不耐受的发病率
缺乏可靠的诊断系统对目前报告的组胺不耐受发生率产生了影响,估计约占人口的 1-3%。随着更多关于组胺不耐受的知识和诊断工具的出现,这种情况可能会增加。
肠道微生物会影响组胺不耐受的发生
肠道微生物群也会影响组胺不耐受的发生。最近的研究表明,组胺不耐受可能是由肠道微生物群的改变引起的。肠道中大量的组胺分泌细菌可能会导致组胺不耐受。健康人体内双歧杆菌的数量较多。而在血清二胺氧化酶活性降低的人群中观察到变形菌属数量较多。
在组胺不耐受人群中观察到肠道菌群失调,与健康个体相比,与肠道健康相关的普氏菌科(Prevotellaceae)、瘤胃球菌(Ruminococcus)、粪杆菌(Faecalibacterium)和普拉梭菌(Faecablibacterium prausnitzii)的比例明显较低。组胺不耐受人群还具有显著更高丰度的组胺分泌细菌,包括葡萄球菌属和变形杆菌属、属于肠杆菌科的几个未识别属,以及产气荚膜梭菌和粪肠球菌。
组胺不耐受的治疗建议
组胺不耐受疗法的基础是基于低组胺含量食物的消除饮食。一般来说,公认的饮食指南尚未制定;但是,建议避免食用富含组胺的食物如奶酪、油性鱼类和贝类,以及生发酵肉制品、腌菜、发酵豆制品、葡萄酒和啤酒、鸡蛋、巧克力和蘑菇。
此外,应避免食用会刺激内源性组胺释放的蔬菜和水果(如菠菜、西红柿、柑橘类水果、草莓、茄子、鳄梨、木瓜、香蕉、猕猴桃、菠萝和李子)。
关于组胺不耐受,详见之前的文章:
茄属植物是属于茄科的一组蔬菜。超过 3,000 种植物属于这一类。常见的品种有茄子、西红柿、土豆、青椒等。有些人对茄属蔬菜不耐受。
那些对茄属植物敏感或过敏的人可尝试一些替代品。其中包括:
亚硫酸盐
白葡萄酒和干果中含有大量的亚硫酸盐等,亚硫酸盐也会添加到其他食品中,增强脆度或防止霉菌生长,而 FDA 禁止亚硫酸盐作为新鲜水果和蔬菜的喷雾防腐剂。
摄入后,不良反应最常见于易感人群,例如哮喘患者。所提出的机制包括吸入摄入的亚硫酸盐产生的二氧化硫、亚硫酸盐氧化酶缺乏以及 IgE 介导的反应。
此外,有人提出可能涉及副交感神经系统,亚硫酸氧化酶不足会导致亚硫酸盐积累,引起胆碱能介导的支气管收缩。
谷氨酸钠
另一种被认为是不良非免疫反应罪魁祸首的食品添加剂是谷氨酸钠 (MSG-E621),它通常作为咸味增强剂添加。然而,富含天然结合或游离形式谷氨酸的食物以与味精相同的方式代谢,并且没有证明它会引起与添加味精的食物相同的症状。
食物不耐受的存在会影响患者的心理健康。与对照组相比,食物不耐受患者的焦虑、抑郁和躯体症状更常见。
一些关注心理社会相关性的研究表明,食物不耐受与年龄较小、女性、高等教育和肠易激综合症之间可能存在关联。
此外,研究表明,食物不耐受也可能与IBS中的食物厌恶重叠,并且这可能在食物不耐受中也很重要。事实上,如果摄入某种特定食物同时伴随着心理障碍,那么胃肠道症状就会在摄入某种食物后出现,并且可以习得对该食物的厌恶。
针对 IBS 人群的研究表明需要更好的沟通,积极的医患关系可以改善症状管理。因此,可以假设这对于食物不耐受的患者来说会是成功的。
此外,与胃肠道症状相关的食物不耐受的存在也可能成为饮食失调患者拒绝食物的理由。考虑到饮食失调患者中膳食相关症状的发生率很高,临床医生调查饮食行为障碍的存在至关重要。
饮食日记可以帮助你了解自己的饮食习惯和模式,帮助你识别对某些食物或成分的反应。

每天列出你吃的食物和出现的症状。一旦你确定了一种似乎会引发你症状的食物,就几个星期不吃它,看看会发生什么。过了几个星期后重新再吃它。如果症状随着它的减去而消失,但随着重新开始吃又复发,这样你就逐渐找到罪魁祸首。

编辑
每餐后填写相关栏目。列出症状时,按1-10 的等级对其严重程度进行评分。“其他因素”列用于记录压力或情绪不安等因素。
在每周结束时,寻找任何可能的模式或潜在的食物触发因素。一旦确定了可能存在问题的食物,请遵循消除饮食至少两周,有些认为4-8周,具体取决于严重程度。
每次最好只排除一种食物,以免其他因素干扰。
关于写饮食日记的小技巧:
饮食日记是一场马拉松,所以要对自己宽容一点,一开始不必面面俱到把所有的都记下来,那样只会变成日常生活的负担,轻松一点有利于坚持。
如果要记录的话,尽量在吃完几个小时内就写,不要拖太久,不然等过两天回忆再写会很麻烦。可以随身带个小本子或者记在手机等电子设备中。
如果在外面吃饭来不及记录,可以迅速把吃的东西拍个照,回去再写。
注:这里列的饮食日记的样式仅供参考,也可以用自己习惯的样式来进行。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Tuck CJ, Biesiekierski JR, Schmid-Grendelmeier P, Pohl D. Food Intolerances. Nutrients. 2019 Jul 22;11(7):1684.
Facioni MS, Raspini B, Pivari F, Dogliotti E, Cena H. Nutritional management of lactose intolerance: the importance of diet and food labelling. J Transl Med. 2020 Jun 26;18(1):260.
JanssenDuijghuijsen L, Looijesteijn E, van den Belt M, Gerhard B, Ziegler M, Ariens R, Tjoelker R, Geurts J. Changes in gut microbiota and lactose intolerance symptoms before and after daily lactose supplementation in individuals with the lactase nonpersistent genotype. Am J Clin Nutr. 2023 Dec 28:S0002-9165(23)66349-X.
Brandao Gois MF, Sinha T, Spreckels JE, Vich Vila A, Bolte LA, Weersma RK, Wijmenga C, Fu J, Zhernakova A, Kurilshikov A. Role of the gut microbiome in mediating lactose intolerance symptoms. Gut. 2022 Jan;71(1):215-217.
Tagliamonte S, Barone Lumaga R, De Filippis F, Valentino V, Ferracane R, Guerville M, Gandolfi I, Barbara G, Ercolini D, Vitaglione P. Milk protein digestion and the gut microbiome influence gastrointestinal discomfort after cow milk consumption in healthy subjects. Food Res Int. 2023 Aug;170:112953.
Sánchez-Pérez S, Comas-Basté O, Duelo A, Veciana-Nogués MT, Berlanga M, Latorre-Moratalla ML, Vidal-Carou MC. Intestinal Dysbiosis in Patients with Histamine Intolerance. Nutrients. 2022 Apr 23;14(9):1774.
Gargano D, Appanna R, Santonicola A, De Bartolomeis F, Stellato C, Cianferoni A, Casolaro V, Iovino P. Food Allergy and Intolerance: A Narrative Review on Nutritional Concerns. Nutrients. 2021 May 13;13(5):1638.
Hon E, Gupta SK. Gastrointestinal Food Allergies and Intolerances. Gastroenterol Clin North Am. 2021 Mar;50(1):41-57.
Légeret C, Lohmann C, Furlano RI, Köhler H. Food intolerances in children and adolescents in Switzerland. Eur J Pediatr. 2023 Feb;182(2):867-875.
Onyimba F, Crowe SE, Johnson S, Leung J. Food Allergies and Intolerances: A Clinical Approach to the Diagnosis and Management of Adverse Reactions to Food. Clin Gastroenterol Hepatol. 2021 Nov;19(11):2230-2240.e1.
Caio G, Lungaro L, Segata N, Guarino M, Zoli G, Volta U, De Giorgio R. Effect of Gluten-Free Diet on Gut Microbiota Composition in Patients with Celiac Disease and Non-Celiac Gluten/Wheat Sensitivity. Nutrients. 2020 Jun 19;12(6):1832.
Bascuñán KA, Araya M, Roncoroni L, Doneda L, Elli L. Dietary Gluten as a Conditioning Factor of the Gut Microbiota in Celiac Disease. Adv Nutr. 2020 Jan 1;11(1):160-174.
Calabriso N, Scoditti E, Massaro M, Maffia M, Chieppa M, Laddomada B, Carluccio MA. Non-Celiac Gluten Sensitivity and Protective Role of Dietary Polyphenols. Nutrients. 2022 Jun 28;14(13):2679.
Alkalay MJ. Nutrition in Patients with Lactose Malabsorption, Celiac Disease, and Related Disorders. Nutrients. 2021 Dec 21;14(1):2.
Leis R, de Castro MJ, de Lamas C, Picáns R, Couce ML. Effects of Prebiotic and Probiotic Supplementation on Lactase Deficiency and Lactose Intolerance: A Systematic Review of Controlled Trials. Nutrients. 2020 May 20;12(5):1487.
Roszkowska, A.; Pawlicka, M.; Mroczek, A.; Bałabuszek, K.; Nieradko-Iwanicka, B. Non-Celiac Gluten Sensitivity: A Review. Medicina 2019, 55, 222
Cenni S, Sesenna V, Boiardi G, Casertano M, Russo G, Reginelli A, Esposito S, Strisciuglio C. The Role of Gluten in Gastrointestinal Disorders: A Review. Nutrients. 2023 Mar 27;15(7):1615.
Losurdo G, Principi M, Iannone A, Amoruso A, Ierardi E, Di Leo A, Barone M. Extra-intestinal manifestations of non-celiac gluten sensitivity: An expanding paradigm. World J Gastroenterol. 2018 Apr 14;24(14):1521-1530.
Barbaro, M.R.; Cremon, C.; Wrona, D.; Fuschi, D.; Marasco, G.; Stanghellini, V.; Barbara, G. Non-Celiac Gluten Sensitivity in the Context of Functional Gastrointestinal Disorders. Nutrients 2020, 12, 3735.
Tagliamonte S, Barone Lumaga R, De Filippis F, Valentino V, Ferracane R, Guerville M, Gandolfi I, Barbara G, Ercolini D, Vitaglione P. Milk protein digestion and the gut microbiome influence gastrointestinal discomfort after cow milk consumption in healthy subjects. Food Res Int. 2023 Aug;170:112953.
Bellini M, Tonarelli S, Nagy AG, Pancetti A, Costa F, Ricchiuti A, de Bortoli N, Mosca M, Marchi S, Rossi A. Low FODMAP Diet: Evidence, Doubts, and Hopes. Nutrients. 2020 Jan 4;12(1):148.
Hrubisko, M.; Danis, R.; Huorka, M.; Wawruch, M. Histamine Intolerance—The More We Know the Less We Know. A Review. Nutrients 2021, 13, 2228.
Cotton, C.; Raju, S.A.; Ahmed, H.; Webster, G.; Hallam, R.; Croall, I.; Coleman, S.; Trott, N.; Rej, A.; Shiha, M.G.; et al. Does a Gluten-Free Diet Improve Quality of Life and Sleep in Patients with Non-Coeliac Gluten/Wheat Sensitivity? Nutrients 2023, 15, 3461.


大多数外行人没有听到过一个词——过敏级联反应,要深度了解过敏,非常有必要知道和了解过敏级联反应,在了解这个概念之前,我们先了解回顾下免疫系统的工作原理。
免疫系统是非常具体和目标导向的。虽然你可能对多种物质过敏,但过敏反应是针对特定过敏原的。例如,你可能对花生过敏,但一般对海鲜不过敏。
然而有时,两种或多种外来物质可能对于免疫系统而言,在性质上看起来相似,这可能会使免疫系统误认为另一种并对两者都产生反应。

例如,本来你是对桃树花粉过敏,但你的免疫系统也可能会对苹果或其他水果产生反应,免疫系统会误认为它们是桃树花粉。好比一个多层次的瀑布,水从一个壁到另一个壁越来越强。
这些交叉反应的发生是由于多种植物产生的类似过敏原。不幸的是,这会导致细胞和化学相互作用的有害序列,有时针对无害的物质。最终结果是由“过敏级联”产生的一系列明确的体征和症状。
身体的免疫系统旨在不断寻找入侵者。它能区分“我”和“非我”(它保护我们免受外来物质的侵害)。
来看看这个复杂的过程:
有些人接触到花粉过敏。一旦花粉进入体内,就会被免疫系统的侦察兵[称为抗原呈递细胞(APC)]吞噬。这些 APC 将花粉切成小碎片,然后与细胞中的特殊蛋白质结合,称为人类白细胞抗原 (HLA)。
HLA 的功能就像一个指南,帮助身体区分“自我”和“非我”。当与 HLA 结合时,这些碎片对于过敏级联反应中的关键参与者淋巴细胞变得可见,淋巴细胞将它们识别为外来物。这种花粉片段-HLA 组合暴露在 APC 的表面,这些特化的白细胞完全可见。
基本概念:免疫反应重要细胞类型和信使蛋白
术语白细胞源自希腊语单词“leukos”,意思是白色,“cytes”意思是细胞。白细胞对免疫系统至关重要,包括:单核细胞、巨噬细胞、中性粒细胞和淋巴细胞。
淋巴细胞是白细胞,在免疫和过敏中都起着关键作用。它们分为两种类型:T淋巴细胞和B淋巴细胞。每种类型负责免疫系统的特定分支。
T 淋巴细胞的职责是准备好直接转变为攻击外来物质的行动(细胞介导的免疫)。一些 T 淋巴细胞是“杀伤”(细胞毒性或杀伤性 T 细胞)专家。
而另一些则有助于免疫反应,被称为“辅助”细胞(TH 细胞)。根据它们释放的蛋白质,TH 细胞进一步分为 TH1(抗感染)和 TH2(过敏促进剂)。

T 淋巴细胞的伙伴是 B 淋巴细胞。B 淋巴细胞是微小的抗体工厂,当受到 TH 细胞的刺激时,它们会产生抗体以帮助破坏外来物质。
嗜碱性粒细胞和嗜酸性粒细胞是其他在过敏反应中起重要作用的白细胞。
T 细胞通常会在过敏条件下调用这些细胞。患有哮喘和其他过敏性疾病的人的血液嗜酸性粒细胞水平通常会升高。
细胞因子是一组多样化的蛋白质,由淋巴细胞和巨噬细胞在损伤或激活(例如过敏原)时释放。它们充当“加强”或“降低”免疫反应的化学信号。
淋巴细胞 — T & B
淋巴细胞 — T & B:淋巴细胞是白细胞家族的一部分,由 T 和 B 两种类型组成。每个 T 淋巴细胞或 T 细胞就像一个受过专门训练的侦探。T 细胞检查 APC 暴露的证据。
当特定 T 细胞与 APC 上的、花粉片段接触并将其识别为外来物时,就会触发“辅助”细胞(实际上是 TH2 细胞)的特化 T 细胞大军,从而释放刺激 B 淋巴细胞的化学物质(细胞因子)。
B 淋巴细胞产生与过敏原(如花粉片段)结合的 IgE 抗体。一旦 IgE 产生,它就会特异性识别花粉,并在未来暴露时识别它。
已发现促进过敏的 TH2 细胞和抗感染的 TH1 细胞之间的平衡是我们免疫系统的关键组成部分。过敏反应涉及大量 TH2 细胞,而感染会产生大量 TH1 细胞,然后释放出有助于消灭微生物的化学物质。
近几十年来,过敏和哮喘发病率一直在上升。一种“卫生假说”的理论解释了这种增加是由于现代人相对无菌的环境(可能是由于抗生素和疫苗接种)导致的人类免疫系统“装备不足”的结果。
这个概念意味着暴露于足够微生物的个体的免疫系统在受到刺激时会产生 TH1 细胞。但是,如果一个人的免疫系统因接触微生物而没有得到充分刺激以产生 TH1 细胞,它反而会倾向于产生过敏反应的系统并产生 TH2 细胞,结果就是过敏反应的倾向。
虽然这看起来很复杂,但了解不同的淋巴细胞反应对于治疗过敏很重要。理想情况下,我们希望用 TH1 淋巴细胞而不是 TH2 淋巴细胞对花粉作出反应,后者会促进过敏反应并大量产生 IgE。过敏者会召唤大量 TH2 细胞来响应过敏原,而非过敏者则不会。
最后,发生过敏性疾病的倾向(例如,对过敏原产生强烈的TH2反应)被认为部分遗传自父母。出生时,抗感染的 TH1 细胞和促进过敏的 TH2 细胞之间似乎存在平衡。
目前的看法是,当孩子暴露于环境中的某些物质时,过敏会在出生后发展。免疫系统受到这些暴露的刺激,因此倾向于产生促进过敏的 TH2 细胞。他们特别倾向于在继承父母遗传倾向的个体中促进过敏。
肥大细胞和嗜碱性粒细胞
如果你患有任何形式的肥大细胞增多症,重要的是要了解过敏级联反应链中每个环节的工作原理,以及肥大细胞以外的那些细胞与过敏反应以及每一步在身体中的发生。
肥大细胞和嗜碱性粒细胞是过敏级联反应中的下一个关键参与者。它们是具有潜在爆炸行为的“挥发性电池”。肥大细胞存在于组织中,而嗜碱性粒细胞存在于血液中。这些细胞中的每一个都有超过 100,000 个 IgE 受体位点,可以使 IgE 结合在这些细胞表面。
IgE 与这些细胞的结合就像炸弹上的保险丝。细胞现在用 IgE 致敏或引发。当这个过敏或致敏的个体再次接触花粉时,IgE 已准备好与这种花粉结合。当这种情况发生时,肥大细胞和嗜碱性粒细胞被激活并释放出许多化学物质,最终产生我们可以看到和感觉到的过敏反应。
这些化学物质在体内释放的任何地方都会显示过敏症状。以花粉为例,当鼻中的肥大细胞因接触花粉而被激活时,释放出的化学物质可能会导致打喷嚏、鼻塞和流鼻涕——这是花粉热的典型症状。一旦致敏,肥大细胞和嗜碱性粒细胞可以在数月甚至数年内保持准备好用 IgE 点燃。
化学介质
每个肥大细胞和嗜碱性粒细胞可能含有 1000 多个小包(颗粒)。这些颗粒中的每一个都含有 30 多种过敏化学物质,称为化学介质。许多这些化学介质已经准备好并在颗粒发生过敏反应时从颗粒中释放出来。这些化学介质中最重要的是组胺。一旦释放到组织或血流中,组胺就会附着在大多数细胞表面存在的组胺受体(H1 受体)上。
这种附着会对血管、粘液腺和支气管产生某些影响。这些影响会导致典型的过敏症状,例如鼻子、喉咙和上颚肿胀、打喷嚏和瘙痒。
一些化学介质直到肥大细胞或嗜碱性粒细胞活化 5 到 30 分钟后才会形成。其中最突出的是白三烯。白三烯 D4 的效力是组胺的 10 倍。其作用与组胺相似,但白三烯D4还会吸引其他细胞到该区域,从而加重炎症。
白三烯最初于 1938 年被发现,被称为“过敏反应的慢反应物质(SRS-A)”。四十年后,瑞典的 Samuelsen 发现它们在过敏性炎症中起着重要作用。
最近,发现一种白三烯调节剂的新药物家族有助于治疗哮喘。例如孟鲁司特( Singulair ) 和扎鲁司特( Accolate )。
在肥大细胞刺激后形成的另一组引起炎症的化学介质是前列腺素。特别是前列腺素 D2,是过敏性哮喘患者肺气道(支气管)炎症的一个重要因素。
回到过敏级联的概念,当医生使用这个术语时,他们指的是对过敏原的渐进致敏和反应。
有3个阶段:
致敏或诱导——早期阶段——后期
在这三个阶段中,每个阶段都有不同的身体细胞和激素或化学物质在起作用。例如,如上所述,最初 IgE 会引发过敏反应。后来,嗜酸性粒细胞发挥更大的作用。在这些阶段,化学介质也会与这些免疫系统细胞相互作用。
★ 致敏
我们每天都会接触到环境中的数百种物质。但是对于某些人来说,第一次接触其中的一些东西,例如花粉,会导致免疫系统反应过度并从此对这种物质变得“敏感”。
当这种情况发生时,免疫细胞之间会发生级联反应,例如:
T 辅助细胞因子刺激B细胞
B 细胞变成浆细胞,开始制造 IgE 抗体
IgE 抗体与肥大细胞结合
在大多数情况下,这一切都在悄无声息地发生。
这意味着虽然过敏过程已在体内触发,但你第一次可能不会有任何明显的症状。可能有些人仅与过敏原接触一次就发生完全致敏;但某些人,可能需要接触几次才能完全致敏。
★ 早期阶段
一旦完全敏感,到再次接触该过敏原时,身体就会知道这是一种(假定的)威胁,并准备好应对它。
从本质上讲,免疫系统的反应方式与它对抗引起感染的细菌和病毒等细菌的方式类似。
想想那些在致敏阶段形成的 IgE 抗体和肥大细胞的组合,就像士兵一样。它们会释放调解器,在全身上下移动并击退入侵者(如花粉)。最常见的介质之一是组胺。
早期阶段反应可以在暴露后几分钟内开始于变应原,然后可以持续3-4小时。
★ 后期
在花粉引起强烈过敏和哮喘发作后,症状在几个小时后开始消退。但随后又变得更糟了。级联的后期阶段是发生这种情况的原因。
晚期阶段的免疫系统反应与早期阶段同时开始。然而,它引起的变化实际上并不会立即引起症状。在这个阶段,早期动员的“士兵”招募帮手。
炎症细胞包括:
嗜酸性粒细胞、中性粒细胞、嗜碱性粒细胞、单核细胞、淋巴细胞
这些细胞导致气道进一步和持续的炎症。因此,该阶段的症状会在接触过敏原 4 小时后开始出现,然后会持续 6-12 小时。
总结下过敏级联过程:
1. 首次接触过敏原
2. 抗原呈递细胞向 T 细胞提供过敏原
3. T 细胞激活 B 细胞
4. B 细胞释放“Y”形 IgE 过敏原抗体(IgE – 免疫球蛋白 E)
5. IgE 抗体附着于肥大细胞和嗜碱性粒细胞表面的 FC 受体,等待下一次接触
6. 第二次接触过敏原(有时几年后)
7. 过敏原附着在从肥大细胞 / 嗜碱性粒细胞表面伸出的 IgE
8. 免疫反应细胞脱颗粒,释放介质或化学物质
9. 介质/化学品引起全身效应,例如血管舒张、粘液分泌、神经刺激和平滑肌收缩
10. 全身效应导致个体化过敏反应(从鼻子痒、哮喘、湿疹到过敏反应)
虽然一些过敏反应是轻微的,可能仅限于身体的某些部位,但有些过敏反应是严重的,会影响整个身体的健康。
// 黑眼圈
黑眼圈除了是熬夜,另外一个可能是过敏的一个迹象。当你总是揉眼睛发痒时,可能是过敏。服用抗组胺药可以缓解眼睛发痒、流泪、打喷嚏和流鼻涕等症状。

// 堵塞
感冒或流感,鼻塞应该在一两周内消失。如果充血一直持续下去,则更可能归咎于过敏。在过敏反应期间,鼻腔内壁会膨胀并产生额外的粘液,感到鼻窦压力和头痛。鼻用类固醇用于减少由过敏引起的鼻腔粘膜炎症。用药请咨询过敏症专科医生。
// 喘息
喘息通常与哮喘有关,但也可能与季节性过敏或严重的过敏反应有关。当你必须通过狭窄的气道呼吸时,就会发出口哨声。在严重的情况下,可能需要紧急护理。
图源:medicinenet
// 呕吐腹泻
进食某种食物后造成呕吐,腹泻及腹痛等不良反应。轻度食物过敏会慢慢好转,严重的食物过敏能引起喉咙水肿而造成窒息。食物过敏最常涉及的是消化系统,症状呈非特异,容易漏诊。
// 发痒
不停瘙痒或变成皮疹,则可能患有湿疹。这种皮肤反应在过敏人群中很常见。触发因素包括肥皂或洗涤剂、织物柔软剂中的化学物质、宠物皮屑和粗糙的织物。可以使用抗组胺药、保湿剂和氢化可的松乳膏治疗。
// 荨麻疹
伤口苍白、发痒、发红,可持续数小时到数天不等。它们是对食物、药物或昆虫叮咬等事物的过敏反应。抗组胺药通常可以立即缓解,也可能需要类固醇。最好的防御是找到过敏源避免触发。
// 失眠
皮肤和眼睛发痒、头痛不舒服、鼻窦疼痛和其他过敏症状会让人难以入睡。咳嗽或喘息也可能导致难以入睡。
希望每个人都远离过敏。请注意,本文信息仅供学习参考交流,不参与提供医疗建议。
谷禾健康

现如今,有过敏症状的宝宝越来越多,如何防治孩子过敏成了颇受关注的公共健康问题之一。
过敏的原因除了遗传因素外,还与宝宝肠道菌群失调,自身的免疫系统发育不成熟,环境因素等息息相关。
本文列举的最新研究进展,从过敏早期识别干预,耐药基因,食物过敏及其因果关联等方面,展示了微生物群如何在其中发挥作用,为儿童过敏的防治提供新思路。
新生儿的第一次大便可能揭示发生过敏的风险
微生物群的成熟与免疫系统的发育同时发生,两者都与一系列疾病有关,包括过敏、花粉热、哮喘和湿疹。
发表在Cell Reports Medicine 通过分析 100 名新生儿的粪便,研究人员发现婴儿第一次粪便的成分可以决定儿童在以后的生活中是否有可能患上过敏症和其他疾病。研究小组发现,缺乏特定分子与一年后过敏的风险增加有关。这些化学物质的减少与在微生物群成熟中起关键作用的细菌的变化有关。
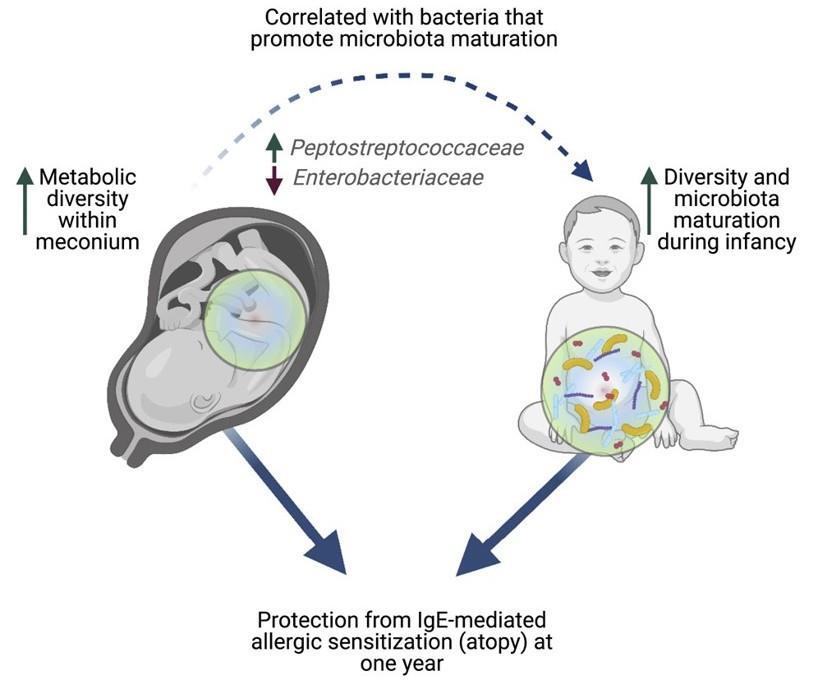
Petersen Cet al., Cell Rep Med. 2021
新生儿的第一次粪便,称为胎粪。胎粪是一种粘稠的深绿色物质,在怀孕 16 周左右开始在胎儿肠道中形成,含有羊水、皮肤细胞以及婴儿摄入的其他物质和分子。
胎粪也是出生后在肠道中定殖的第一批微生物的最初“食物来源”。胎粪就像一个时间胶囊,揭示了婴儿在出生前接触过的东西。
过 敏
为了评估胎粪成分是否会影响以后发生过敏的风险,研究人员研究了新生儿第一次粪便中存在的代谢物。然后,当孩子们满一岁时,该团队进行了一项皮肤测试,以测量免疫系统的反应性。
分析表明,婴儿胎粪中不同类型的分子越少,孩子在出生后第一年内发生过敏的风险就越高。
一些代谢途径,包括那些涉及氨基酸代谢的途径,在后来出现过敏性疾病的婴儿的胎粪中最少。
与没有发生过敏反应的新生儿相比,在一岁时发生过敏反应的新生儿在出生时的胎粪代谢多样性降低。
早 期 干 预
接下来,研究人员分析了胎粪成分是否会影响肠道微生物群的成熟。胎粪“代谢组”较少的婴儿的细菌丰度平较水平低,如肠杆菌科,这在微生物群的成熟中起着关键作用。
最后,研究人员将有关胎粪和微生物群组成的信息与新生儿及其母亲的临床数据相结合,以准确预测婴儿是否会在 1 岁时出现过敏反应。
这项工作表明,健康的免疫系统和微生物群的发展实际上可能在孩子出生之前就开始了——这表明婴儿在子宫内接触的微小分子对未来的健康起着至关重要的作用。
研究人员说,调节子宫内关键代谢物的早期干预措施有助于促进微生物群和免疫系统的健康发育,从而预防过敏性疾病的症状。
这些发现可能有助于识别有患过敏症或哮喘风险的婴儿,并制定有助于预防这些疾病的早期干预措施。
参考文献:
Petersen C, Dai DLY, Boutin RCT, Sbihi H, Sears MR, Moraes TJ, Becker AB, Azad MB, Mandhane PJ, Subbarao P, Turvey SE, Finlay BB. A rich meconium metabolome in human infants is associated with early-life gut microbiota composition and reduced allergic sensitization. Cell Rep Med. 2021 Apr 29;2(5):100260.
婴儿的肠道微生物群包含数百个抗生素抗性基因
人类肠道微生物群已成为细菌的储存库,这些细菌含有帮助它们抵抗抗生素的基因。
发表在Cell Host & Microbe的一项研究通过分析丹麦 650 多名一岁儿童的粪便样本,发现婴儿的肠道细菌有数百个抗生素抗性基因。