-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

食物让我们填饱肚子,补充养分,且感受到快乐与满足,然而,对有些人来说,部分食物却成为了难以预料的健康障碍。
“当时坐在一家优雅的西餐厅,四周萦绕着新鲜烘焙面包的诱人香气,我感受到一场味蕾的盛宴”,刚毕业的小楠回忆着,“然而,就在我大口享受那细腻丝滑的奶油酱和意面时,肠胃却在暗暗策划一场叛变”… “随之而来的腹胀、腹痛,彻底破坏了圣诞节的氛围”…
小楠也是“食物不耐受”的群体之一。“当时出去吃饭常有状况发生,但并不知道是和食物不耐受有关,还是一起吃饭的同学提醒了我”。
对于食物不耐受的人来说,由于其症状形式多样,较迟缓发烧,且不那么严重,许多人甚至根本没有意识到自己患有食物不耐受。有时候,人会感到疲倦,但并没有把疲倦,或情绪低落,或头痛这些与食物不耐受关联起来。
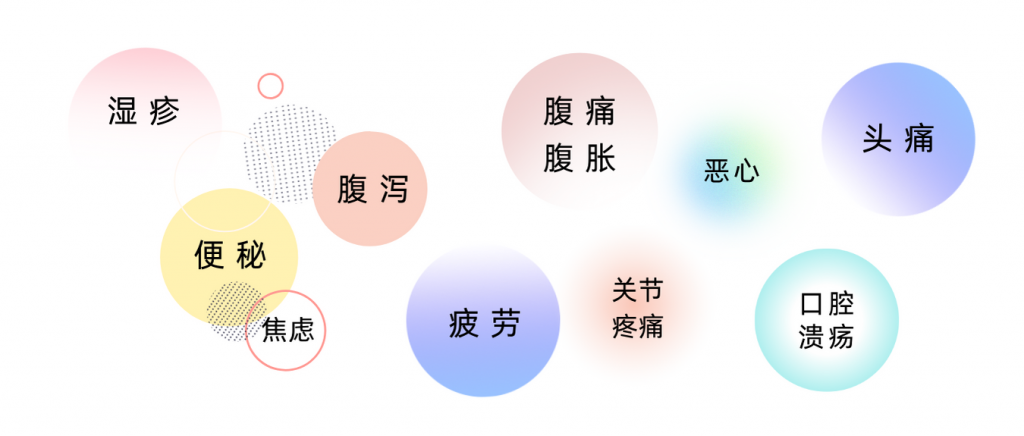
以上一系列症状都有可能与食物不耐受相关。其实,像小楠这样食物不耐受的人其实比较常见,据估计,全世界约有 20% 的人有食物不耐受。
很多人小时候并没有食物不耐受,等成年后的某一天突然发现出现食物不耐受,这说明遗传因素并不一定主导,有其他潜在的因素在起作用。环境因素、生活方式和饮食习惯的改变等都可能会导致食物不耐受的出现。
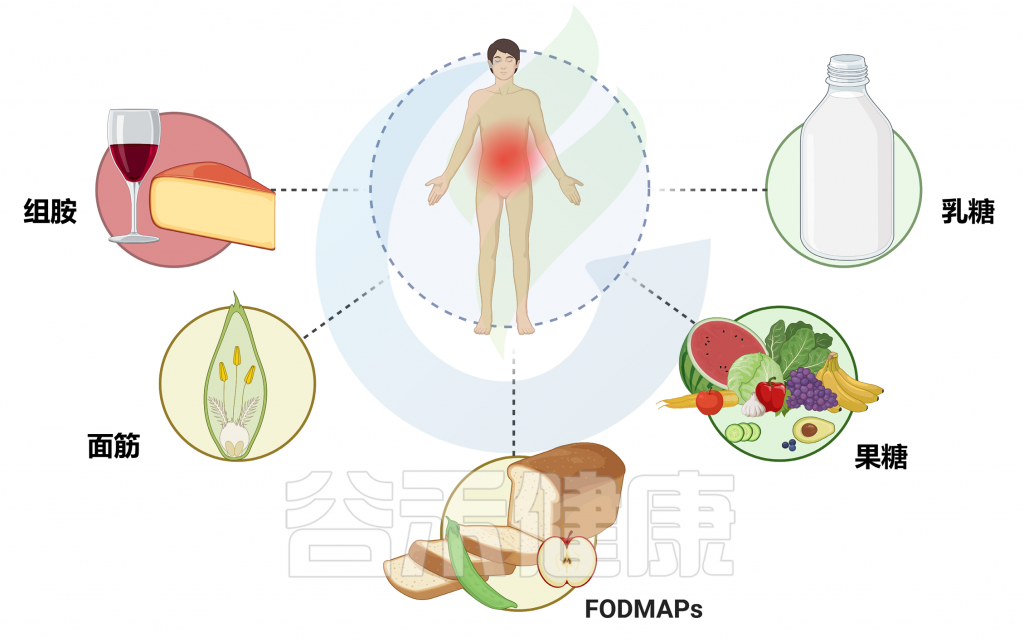
以下是一些常见的原因:酶缺乏(乳糖不耐受中的乳糖酶缺乏),化学物质敏感(如咖啡因、防腐剂、色素、味精等),药物反应,消化系统疾病,饮食习惯(高FODMAP食物),遗传,心理(压力和焦虑)等。
食物不耐受和食物过敏又不一样,食物过敏涉及免疫系统,如IgE介导的反应,这可能会迅速导致严重甚至危及生命的反应。而食物不耐受主要涉及消化系统。
食物不耐受可能在进食后30分钟左右开始,但也可能要在一两天后才发生。症状的延迟发作特点意味着食物不耐受的诊断可能更为复杂。症状包括腹泻、腹胀、胃痛、疲劳、头痛等,可能与消化系统的功能紊乱有关,而肠道菌群在这里扮演了重要的角色。
比如部分健康人群的肠道微生物组蛋白水解能力较低,可能与喝牛奶后肠道不适相关。有研究发现,在乳糖不耐受患者中,乳制品摄入量与胃肠道不适之间的关联部分是由双歧杆菌丰度介导的。
此外,由于感染,炎症等因素带来的肠道菌群失调,有害菌过度增长,产生毒素和其他代谢产物,损害肠道细胞,肠道功能紊乱,肠道屏障破坏增加肠道通透性,可能导致食物成分不能在正确的位置也不能恰当处理,从而发生食物不耐受。
虽然说食物不耐受很常见,但诊断起来却很困难,通常需要时间、耐心和仔细观察,也需要专业人士帮助识别触发食物或成分。症状及其严重程度取决于所吃食物的类型和数量。
许多食物都有可能触发一系列症状,比如牛奶、小麦、贝类、坚果、西红柿、花生、鱼、茄子等,但有时候我们并不知道是哪种食物,又是如何引发这些症状,因此常常踩雷而不自知。
当有一天食物成了罪魁祸首时,会面临一系列挑战,比如缺乏基础知识,对其诊断的延迟、不适当,而不正确的饮食管理更会放大该问题的影响,甚至带来营养缺乏,这对同时患有其他疾病的人群更是雪上加霜,这种情况下,了解食物不耐受就非常重要。
本文我们就来了解一下常见的食物不耐受的关键证据和科学理解,食物如何诱发其反应的机制及相关诊断,食物不耐受与肠道微生物群之间的复杂关系,这有助于我们更好地理解食物不耐受与身体症状的关联,从而采取措施来减轻其带来的不适。
“食物不耐受”(Food Intolerance)并不是一个最近出现的词,事实上,这个概念最早可以追溯到20世纪初。食物不耐受是指人体在消化某些食物时出现困难,这通常是由于缺乏特定的消化酶或者对食物中的某些成分有不良反应,但并不涉及免疫系统的反应。
在20世纪,随着医学和营养科学的发展,人们逐渐开始了解到并非所有的消化不良都是由传统意义上的疾病引起的,而有可能是由于身体对某些食物成分的不耐受。例如,乳糖不耐受是一种大家都知道的食物不耐受,它是由于身体内乳糖酶的缺乏或不足导致的,使消化乳糖变得困难。
在过去的二十年中,食物不良反应的病例显着增加,人们对食物不耐受的认识也不断深化,相关的研究不断增多。现如今,食物不耐受已经成为营养学和临床医学中的一个重要话题。
一般来说,食物不耐受的临床表现涉及多个器官或系统,常见症状包括:
但还有许多其他可能的症状,包括:
症状可能持续几个小时或几天。
不是。食物不耐受常常与食物过敏混淆。它们之间的区别在于其免疫基础。
食物不耐受主要是由于人体消化系统的问题导致对某些食物产生反应,但不涉及免疫系统。可由任何(非蛋白质)食物成分引起,比食物过敏更为常见。症状通常与食用量成正比,每次摄入都会有类似症状。有些人对乳糖不耐受,乳糖酶水平可能降低或缺乏。
而食物过敏涉及到免疫系统,对过敏食物的反应不仅与摄入量有关,即使很少量也可能引起严重反应。食物过敏的影响可能更严重,甚至可能涉及生命安全。
食物过敏的特征是摄入特定食物后,IgE介导的针对食物蛋白的抗体被激活。例如,对花生过敏的人可能会产生影响组织中肥大细胞和血液中嗜碱性粒细胞的反应。乳糜泻是一种 T 细胞介导的免疫反应,无 IgE 介导的反应。T 细胞免疫反应与更延迟的反应相关,这意味着症状在摄入后数小时或数天内出现,而不是在食用后立即出现。
总的来说,食物不耐受主要由消化问题引起,食物过敏则是由免疫系统的异常反应引起,两者机理上有区别。

有可能的。
虽然食物不耐受和食物过敏是由不同机制引起的,但一个人可能同时经历这两种情况。食物不耐受可能会加剧食物过敏的症状,反之亦然。此外,食物不耐受可能会导致肠道刺激和炎症,这可能会影响肠道菌群的平衡,进而影响免疫系统的反应。
据估计,食物不耐受影响多达 20% 的人口,但鉴于临床表现和非免疫机制差异很大,对诊断和管理的完全理解很复杂。
一项在瑞士儿童医院以及 4 家儿科私人诊所进行的横断面研究。共纳入2036名54个月至46岁(平均年龄:1.18岁)的儿童和青少年(7%为男性,4%为女性),其中316名(16%)参与者报告因不耐受而避免食物。乳糖不耐症是最常见的一种。在所有病例中,有55%没有进行任何医学检查来证实这种不耐受。251名(12%)参与者表示,出于假定的健康原因避免耐受的食物。
食物不耐受是由于身体无法消化某种食物或食物中的成分而引起的。
最常见的食物不耐受是乳糖不耐受。
当然,其他任何食物都可能与食物不耐受相关,例如:
◗ 麸质(小麦、黑麦和大麦)——存在于面包和面食等食物中
◗ 组胺——存在于葡萄酒和奶酪等食物和饮料中
◗ 咖啡因——存在于咖啡、茶和一些碳酸饮料中
◗ 亚硫酸盐——存在于苹果酒、啤酒和葡萄酒中
◗ 水杨酸盐——存在于一些水果、蔬菜、香草和香料中
◗ 谷氨酸钠 (MSG) – 存在于成熟的水果、腌肉和咸味食品中
doi.org/10.3390/nu15234969
遗传、消化系统疾病(IBS、IBD等)、消化酶缺乏、对食品添加剂的敏感性、肠道菌群失调、药物食物相互作用、食物中的自然毒素、压力和情绪等因素都可能与食物不耐受有关。具体原因取决于食物不耐受的类型。
接下来我们逐一了解常见的食物不耐受、原因、诊断、治疗/改善措施等。
小时候,大家喝牛奶基本没啥问题,但现在越来越多人开始出现乳糖不耐受。
这其中有些人是随着年龄的增长慢慢地出现乳糖不耐受,也有人是生病或者服用一些药物之后突然开始了乳糖不耐受…
●
当未消化的乳糖通过肠道而不被吸收时,就会发生乳糖吸收不良。管腔中未消化的乳糖会受到细菌发酵,增加渗透压,导致摄入乳糖后出现不耐受症状。当乳糖吸收不良伴有上述症状时,通常称为乳糖不耐受。
简单来说:
乳糖不能直接在肠道中吸收,而是必须被乳糖酶分解成两种较小的糖成分。
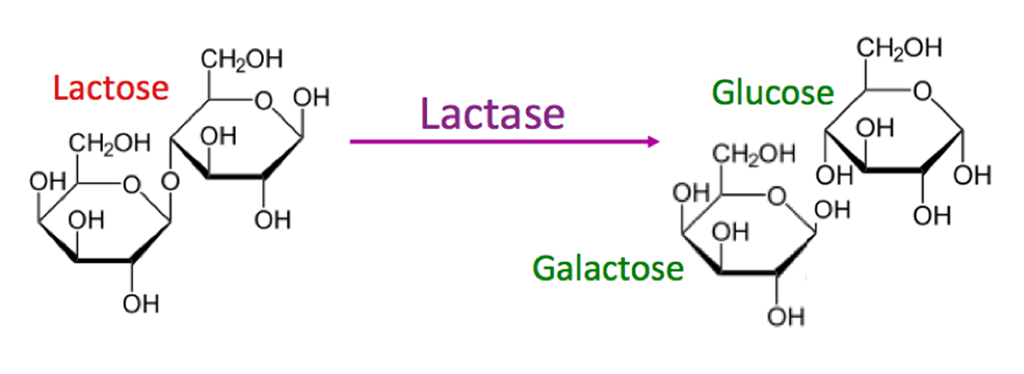
图源:evo-ed
乳糖酶缺乏可能导致乳糖不耐受。
主要原因有四个:
原发性乳糖酶缺乏或乳糖酶不持续
乳糖酶活性随着个体年龄的增长而逐渐下降。这种衰退从婴儿期开始,症状通常出现在青春期或成年早期。
乳糖酶持久性是由 2 号染色体上的显性基因突变引起的。乳糖酶不持久不是疾病而是遗传表型。
大约 70%–100% 的亚洲成年人口是乳糖酶非持久性 (LNP)基因型。
继发性乳糖酶缺乏症
继发性乳糖酶缺乏症是由肠上皮损伤引起的,可能发生在多种情况下,如胃肠炎、化疗、抗生素使用、乳糜泻、炎症性肠病、艾滋病、营养不良或吸收表面减少的情况,如短肠综合症。
乳糖酶活性的降低是暂时的、可逆的,一旦潜在的肠道损伤得到治疗或解决,乳糖酶活性的降低通常会得到改善。
先天性乳糖酶缺乏症
先天性乳糖酶缺乏症是一种极其罕见的儿科疾病,会导致婴儿出现严重症状和发育不良。这种情况源于常染色体隐性遗传模式,导致出生时乳糖酶活性降低或缺失。
发育性乳糖酶缺乏
在妊娠28-37周之间出生的早产儿中观察到发育性乳糖酶缺乏症。在这些情况下,婴儿的肠道发育不全导致无法分解乳糖。然而,随着年龄的增长,随着肠道的成熟和喂养,特别是母乳喂养,这种情况通常会改善。
乳糖吸收不良,无论是由于原发性还是继发性乳糖酶缺乏,都会导致未消化的乳糖与肠道微生物群相互作用。
乳糖的细菌发酵会产生短链脂肪酸(乙酸盐、丙酸盐和丁酸盐)和气体(氢气、二氧化碳,有时还有甲烷)。当乳糖的量超过结肠微生物群的发酵能力,或者短链脂肪酸的负荷超过结肠的吸收能力时,就会发生腹泻。水的渗透滞留进一步增加了结肠中的渗透负荷,从而放大了效果。
个体可能患有乳糖酶缺乏症但没有症状。
在出现临床表现的情况下,症状包括腹胀、腹痛、胀气、腹泻,有时还包括恶心。
症状的严重程度可能有所不同,大多数人可以耐受相对少量的乳糖而不会感到不适。
一些方法可以检查一个人是否有乳糖不耐症,如基因检测、酶活性测试、呼气测试等。在这些检测中,小肠活检测量乳糖酶的活性是最精确的方法,但是需要通过内窥镜检查直接从小肠壁取样,这种侵入性的方法通常不作为首选诊断手段。
乳糖呼气测试是一个更简单、不伤身体的方法,用来看一个人消化乳糖的能力,以及是否因为吃了乳糖而有不适的症状。
但是,这些测试有一个问题:有的人虽然测试显示他们有乳糖不耐症,但是他们吃乳糖后并没有不舒服,所以测试结果并不能完全确定不舒服是不是因为乳糖不耐症造成的。
为了解决这个问题,有些时候在做呼气测试的时候会用一些标准化的问卷,或者用盲测(测试者不知道他们吃的是不是含乳糖的东西)。盲测特别有用,因为很多时候人们自己说的乳糖不耐症的症状和客观结果之间的相关性较低,特别是在有肠易激综合征(IBS)的人群中。
总的来说,乳糖不耐症的诊断可以通过准确的病史和临床评估,并在避免含乳糖的食物 5-7 天后通过症状消退来确诊。
可以和其他食物一起吃
如果乳糖与其他营养素一起食用,耐受阈值就会升高。
因此,一种解决方案可能是将乳糖与其他食物一起食用,以减缓胃排空和小肠运输,从而使乳糖有更多时间分解和吸收,从而减少出现症状的可能性。
陈年奶酪也是比较好的选择
与新鲜奶酪不同,陈年奶酪几乎不含或不含乳糖。事实上,在成熟过程中,细菌消耗了所有存在的乳糖。
常见奶酪类乳制品的乳糖含量
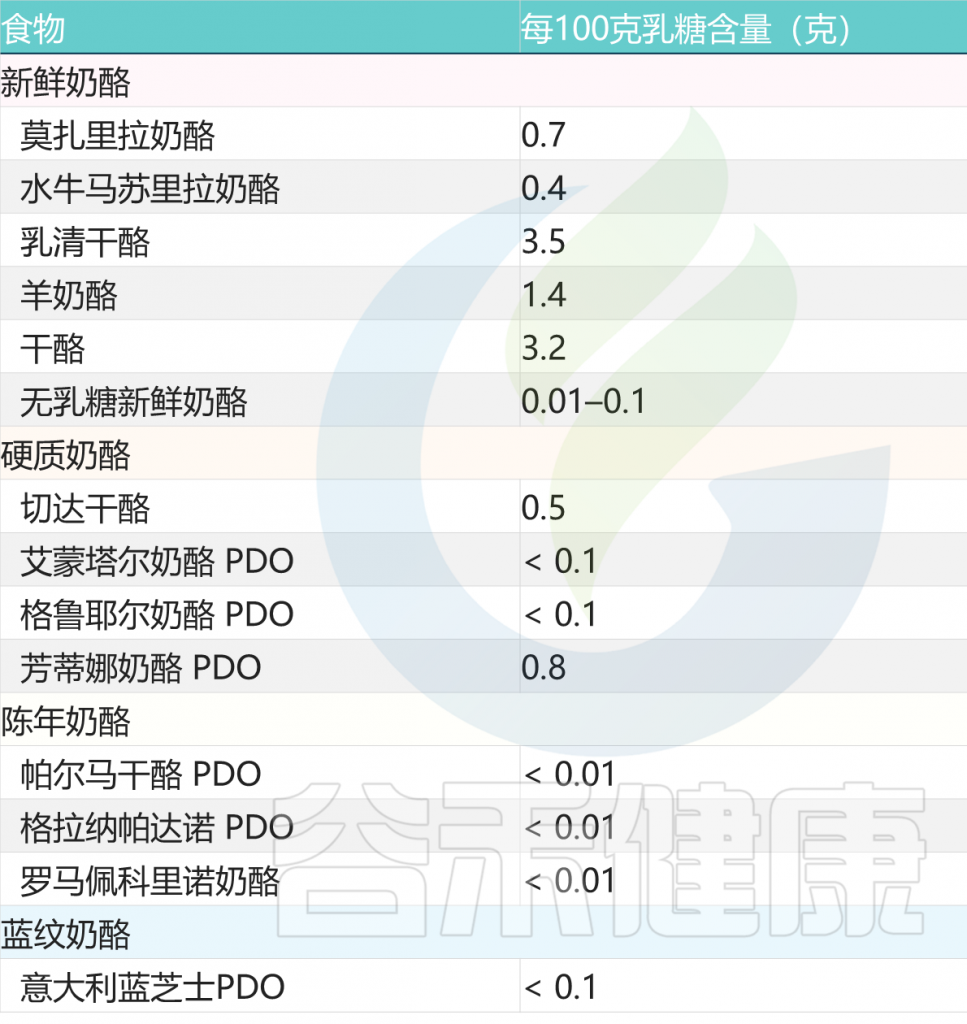
doi: 10.1186/s12967-020-02429-2
无乳糖食品
为了确保乳制品中所含物质的摄入不会因乳糖而引起腹部不适,现在有一些无乳糖食品。从营养的角度来看,它们与经典乳制品相当,不同之处在于它们不含乳糖。不含乳糖、添加乳糖酶的乳制品通常被认为是安全的。
技术的不断进步正在不断提高无乳糖乳制品的营养价值、功能、感官吸引力和质量。这些发展旨在为乳糖不耐症患者提供更多样、更可口的选择,同时确保最佳营养摄入和整体健康。
也可以喝牛奶,但一开始量不建议太多
对于乳糖不耐受患者,如今不再建议避免食用所有乳制品,因为大多数乳糖不耐受患者可以耐受每单剂量最多 5 克乳糖,大约相当于 100 毫升牛奶,并且可能比严格的无乳糖饮食有好处。
常见牛奶类乳制品的乳糖含量
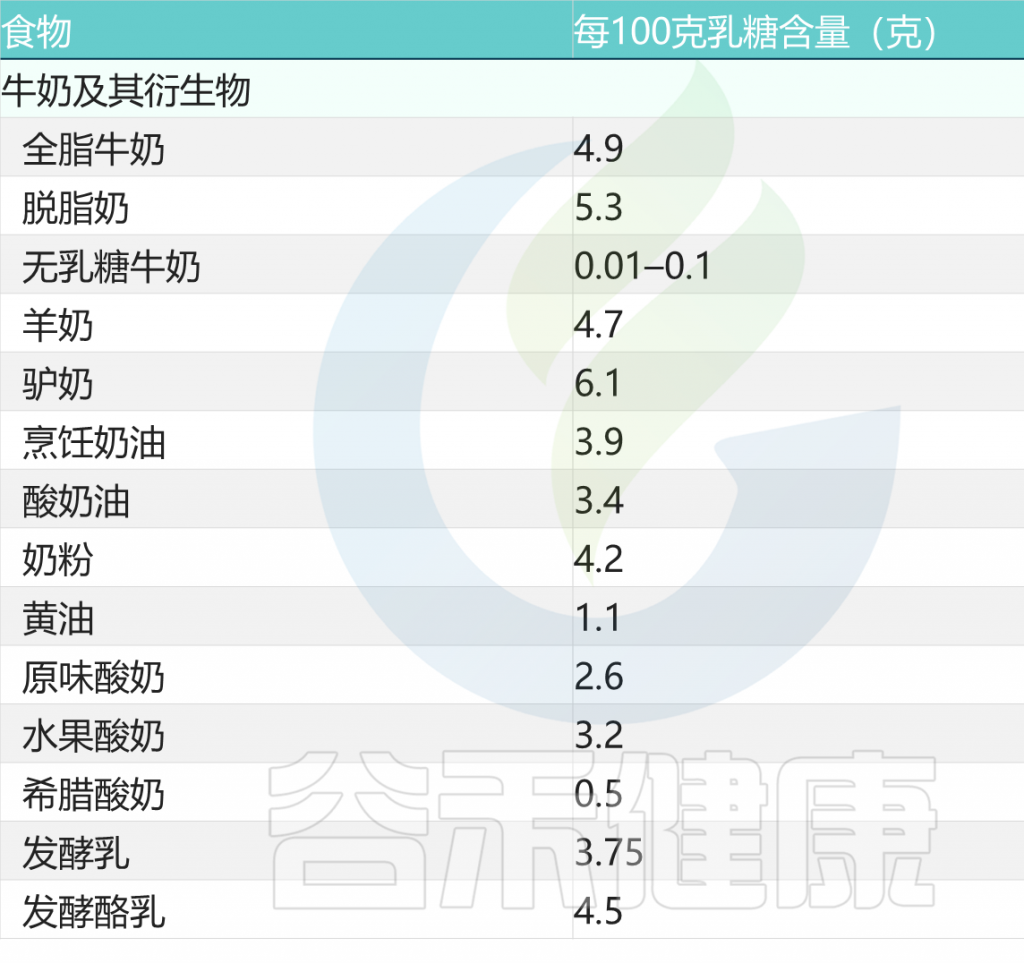
doi: 10.1186/s12967-020-02429-2
摄入乳糖后出现症状的可能性受到多种因素的影响。
外在因素包括:
内在因素包括:
我们详细看一下,肠道微生物组成这个内在因素发挥的作用。
有研究发现,与非乳糖不耐受个体相比,在乳糖不耐受个体中双歧杆菌丰度增加( P Wilcox =4.56×10 -9 ),并且与乳糖不耐受组的乳制品摄入量呈正相关 (R=0.22,p =0.05)。乳糖不耐受组和非乳糖不耐受组之间的乳制品摄入量没有显著差异。在乳糖不耐受个体中,双歧杆菌丰度与总肠道不适评分之间呈正相关(R=0.33,p=0.003)。
在六种特定的肠道疾病中,双歧杆菌丰度与腹痛、不适和腹胀呈正相关,但与任何其他疾病无关。研究人员发现乳制品摄入量与胃肠道不适之间的关联部分是由双歧杆菌丰度介导的(Prop介导=43%,p=0.054)
乳糖不耐症个体的双歧杆菌丰度和肠道不适
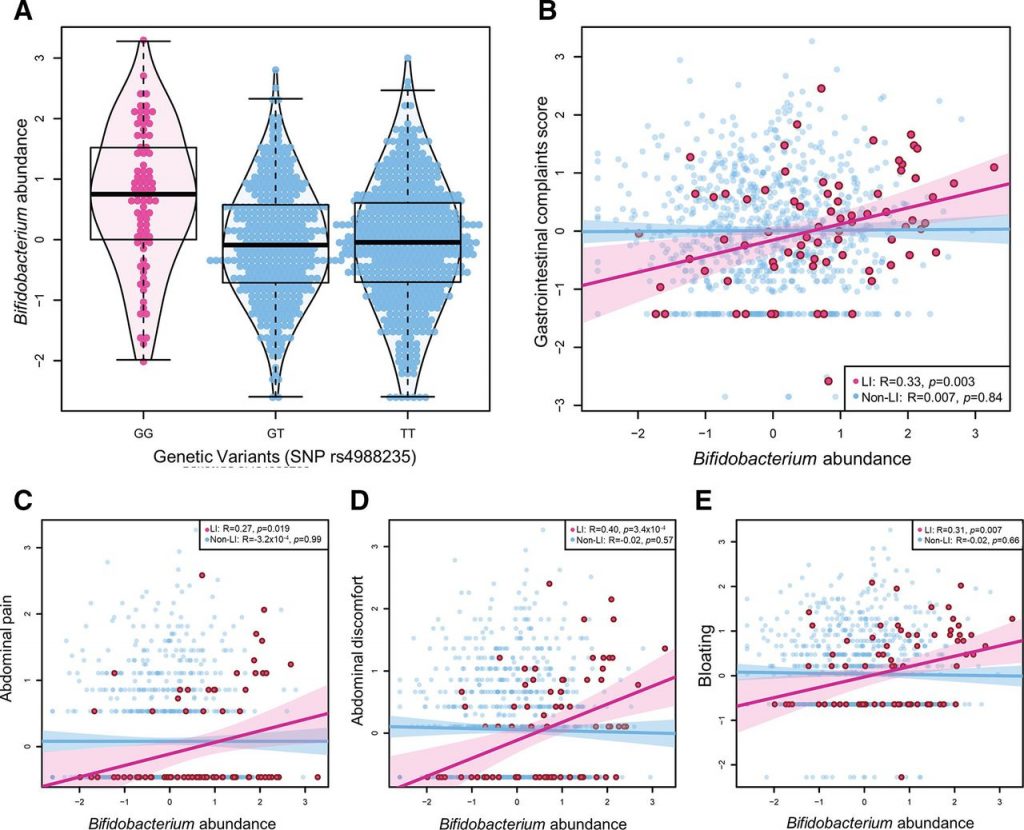
doi.org/10.1136/gutjnl-2020-323911
A)与 SNP rs4988235 的乳糖耐受基因型(G/T 和 T/T)相比,乳糖不耐受基因型(纯合 G/G)个体的双歧杆菌丰度更高。
B) 在乳糖不耐受个体中,双歧杆菌丰度与胃肠道症状总评分显著相关 (p=0.003)。
更具体地说,双歧杆菌丰度与 (C) 腹痛、(D) 胃肠道不适和 (E) 腹胀呈正相关。
分析牛奶摄入量、双歧杆菌丰度和肠道不适之间的直接和间接关系
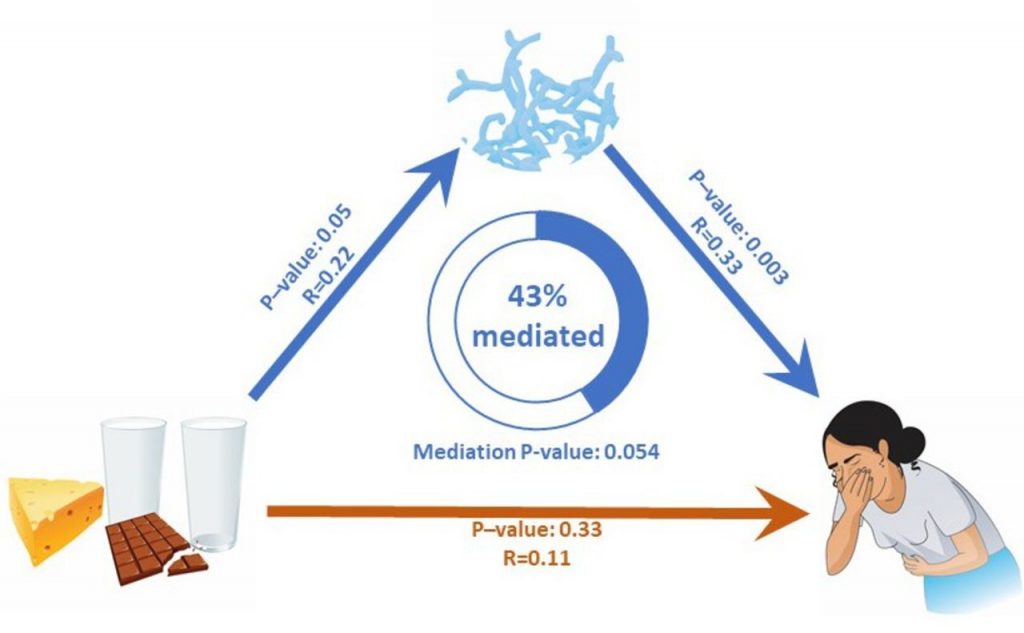
doi.org/10.1136/gutjnl-2020-323911
具有统计学意义的关联用蓝色箭头显示。
红色箭头表示不显著的相关性。
乳糖不耐受个体中与乳制品消费相关的肠道不适很大程度上是由双歧杆菌丰度介导的。
该研究结果证明,乳糖不耐受患者所经历的特定肠道症状可能是肠道中双歧杆菌丰度的结果,而不是乳糖摄入的直接影响。这项工作支持了初步报告,乳糖发酵细菌的代谢产物可能与乳糖不耐受症状的发生有关。
许多健康人尽管没有乳糖不耐症,但患有与牛奶相关的胃肠道不适;造成这种情况的机制尚不清楚,这可能与他们体内牛奶蛋白消化相关的生理反应有关。这种差异可能源于他们肠道微生物组的特定构成,这反过来又受到他们的饮食习惯影响。我们来看一项研究 ↓↓
该研究旨在探讨19名耐乳糖健康非习惯性牛奶消费者[NHMCs]在食用牛奶后报告胃肠不适的牛奶蛋白消化和相关生理反应(主要结果)、肠道微生物组和肠道通透性,并与20名没有胃肠不适的习惯性牛奶消费者[HMCs]进行比较。
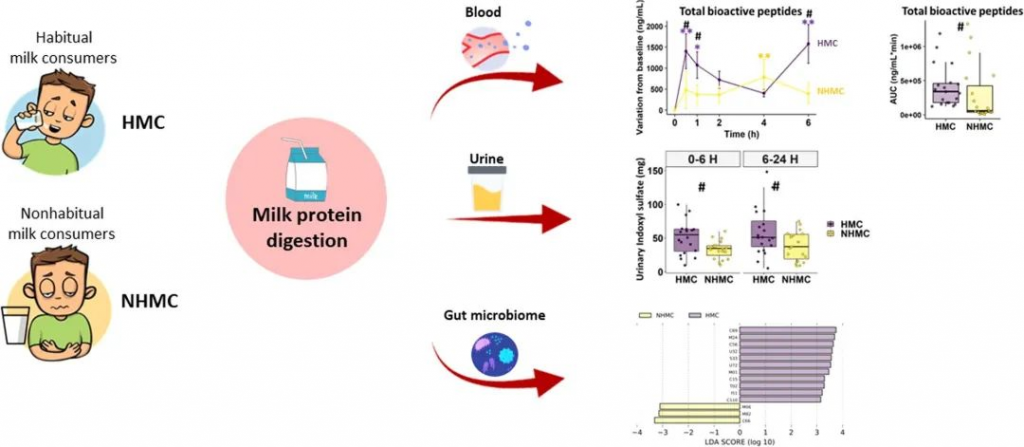
doi.org/10.1016/j.foodres.2023.112953
结果表明,与习惯性牛奶消费者相比,非习惯性牛奶消费者中的牛奶消耗量以及胃肠不适导致循环BAP缓慢而较低的增加,胃饥饿素(ghrelin)、胰岛素和内源性大麻素的反应较低,葡萄糖反应和血清DPPIV活性较高。
两组的肠道通透性相似,而习惯饮食(非习惯性牛奶消费者中乳制品含量较低,膳食纤维与蛋白质比例较高)可能形成了肠道微生物组;非习惯性牛奶消费者表现出双歧杆菌丰度较低、普氏菌丰度较高和蛋白酶编码基因丰度较低等特点,这可能会降低蛋白质消化,如硫酸吲哚的尿排泄量较低所示。
总之,研究结果表明,由于肠道微生物组较低的蛋白水解能力,牛奶蛋白质的消化效率较低,这可能解释健康人食用牛奶后的胃肠不适。
在精准医疗和个性化营养时代,该研究的结果有利于个性化饮食疗法。也就是是,患有牛奶相关胃肠道不适的健康人可能会受益于基于蛋白水解酶的疗法或针对微生物组的临时干预。此外,在个性化饮食方法中,牛奶相关的胃肠道不适可以通过食用含有预消化牛奶蛋白的牛奶食品来管理。食用在肠道中发挥蛋白水解活性的益生菌可能会进一步减轻敏感个体的胃肠道疾病和焦虑。
以前可能会建议乳糖不耐受患者尽量避免乳制品。但实际上,牛奶和乳制品是钙、磷、胆碱、核黄素、维生素 B12 和维生素 A 的主要来源,排除所有乳制品有可能会导致微量营养素缺乏。
从饮食中完全消除乳制品相关的主要风险是缺钙和损害骨骼健康。
* 膳食钙的最佳来源包括牛奶、奶酪、乳制品,西兰花、羽衣甘蓝、羽衣甘蓝、萝卜叶菜等。
大多数分析研究得出的结论是,乳制品是适当骨骼状态所需营养的极好来源,且在不食用乳制品的情况下达到建议的钙摄入量是具有挑战性的。
然而,对于乳糖不耐受的个体来说,摄入乳制品可能导致消化不适和其他相关症状。这就引出了一个重要的问题:如何在不引发消化不适的情况下为这些个体提供必要的营养素?
还是可以从肠道菌群的角度去考虑,因为肠道菌群的稳态,可能会帮助本来乳糖不耐受的人群慢慢适应乳糖。
我们来看最新的一项研究,该研究展示了乳糖酶非持久性基因型(LNP)个体每天补充乳糖前后肠道微生物群和乳糖不耐受症状的变化。
该研究前后为期 12 周,纳入了 25 名携带 LNP 基因型的亚洲裔健康成年人。参与者逐渐增加乳糖剂量,从每天两次 3 克到 6 克到 12 克,连续 4 周每天提供 6 克、12 克或 24 克的剂量。参与者在 12 周干预前后提交了重复的粪便样本,并接受了 25 克乳糖挑战氢呼吸测试 (HBT)。记录乳糖挑战期间的每日胃肠道症状和总症状评分(TSS)。
结果发现,干预后双歧杆菌相对丰度从 5.5% ± 7.6% 显著增加至 10.4% ± 9.6% (P =0.009),粪便 β-半乳糖苷酶活性增加2倍(570±269U/g;P <0.001),与基线 (272 ± 158 U/g) 相比。
双歧杆菌的β-半乳糖苷酶活性使这些个体能够更有效地消化乳糖。
双歧杆菌通过双歧分流发酵糖,比通过糖酵解发酵产生更多的 ATP,从而产生竞争优势。乳酸和乙酸盐是双歧杆菌乳糖发酵的主要代谢产物,不会产生氢气、二氧化碳或甲烷等气体。
乳酸和乙酸盐是肠道中其他细菌的底物,如产丁酸的Anaerostipes。Anaerostipes的相对丰度也因乳糖干预而增加。
双歧杆菌和Anaerostipes之间的交叉喂养可能发挥作用。这种交叉喂养产生的丁酸盐是肠细胞的重要能量来源,在改善肠道屏障功能方面发挥作用,并发挥抗炎活性。
乳糖干预前后优势属和双歧杆菌属的平均相对丰度
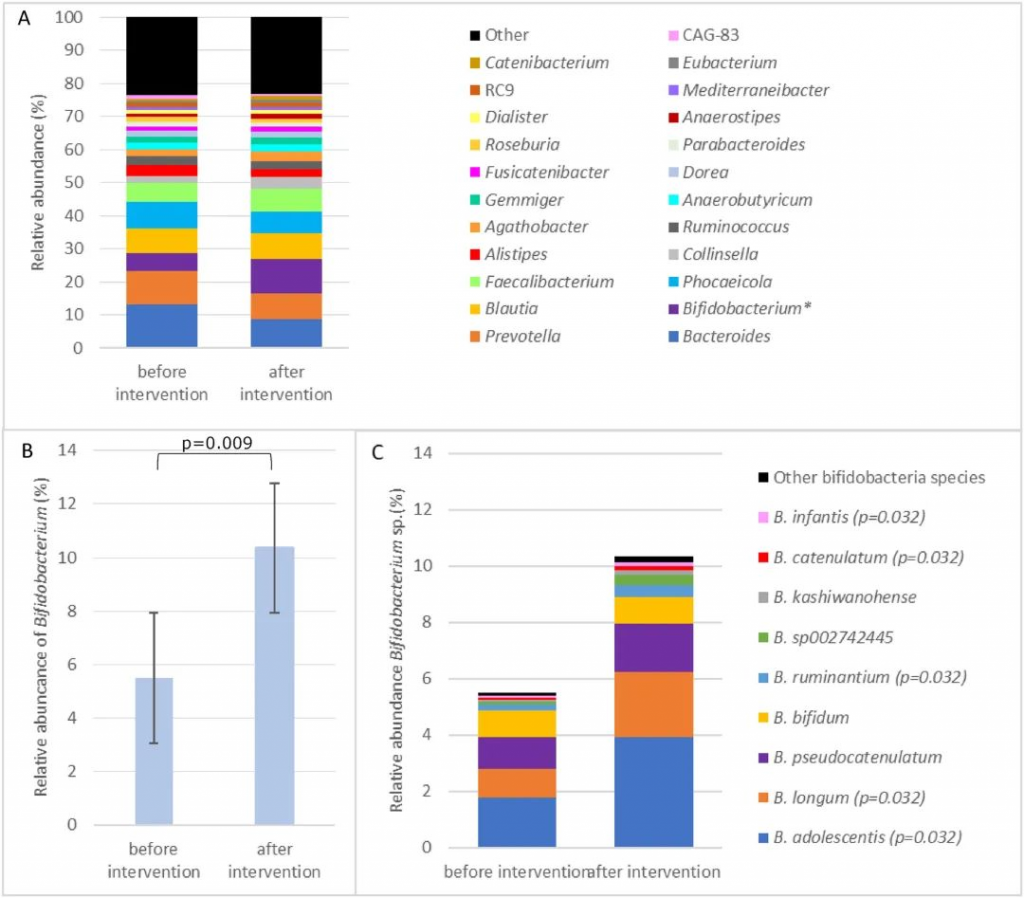
doi.org/10.1016/j.ajcnut.2023.12.016
与基线 HBT (57 ± 38 ppm·min) 相比,第二次 HBT (38 ± 35 ppm·min) 期间观察到呼出氢气减少 1.5 倍(曲线下增量面积;P = 0.01)。这也证实了双歧杆菌发酵不产生氢气,双歧杆菌多了,氢气就少了。
TSS 无显著下降(干预前为 10.6 ± 8.3,干预后为 8.1 ± 7.2;P =0.09)。
12 周乳糖干预前后的乳糖氢气呼气测试
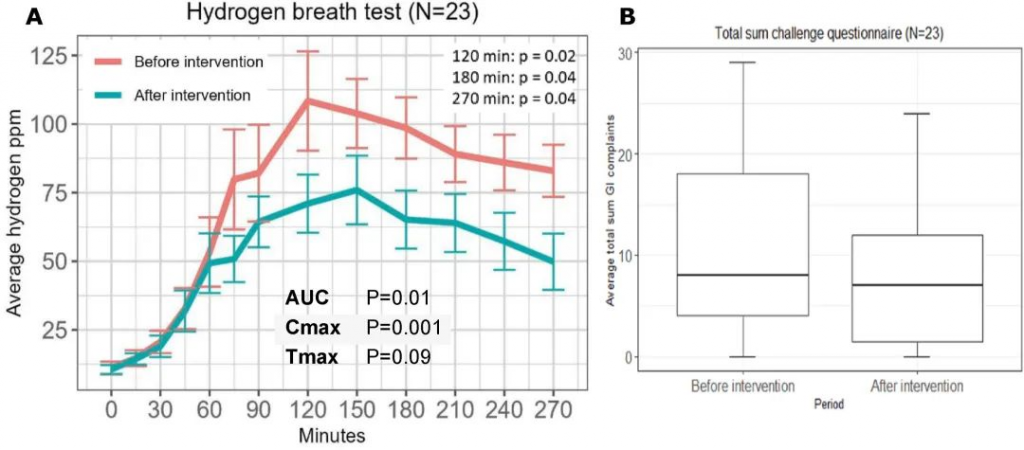
doi.org/10.1016/j.ajcnut.2023.12.016
每日摄入乳糖的耐受性良好,在干预期间报告有轻微甚至没有胃肠道不适。
双歧杆菌水平的增加表明肠道微生物群在重复消耗增量剂量的乳糖后发生了适应,第二次 25 g 乳糖 HBT 期间呼出的氢气浓度降低证明了肠道菌群的耐受性良好。双歧杆菌代谢乳糖而不产生气体,从而可能减少具有 LNP 基因型的个体肠道内气体的形成。
一些古代游牧民族可能就是通过这种肠道微生物组的改变适应了乳制品饮食,他们没有乳糖酶持续活性的遗传证据。
这表明,即使在遗传上缺乏分解乳糖的能力,人们也可能通过其他生物学机制,比如肠道菌群的改变来适应乳制品。
这种增加的乳糖耐受性可能消除了完全从饮食中去除乳制品的必要性。
上述研究我们了解到,既然肠道菌群的调整可以帮助逐渐适应乳糖,那么这可能会为乳糖不耐受者提供新的策略,通过益生菌、益生元等方式可以调节肠道菌群。
益生菌
益生菌经常被添加到乳制品中,既作为发酵剂又作为食品添加剂。例如乳杆菌、长双歧杆菌或动物双歧杆菌,它们在肠道中产生乳糖酶。
2022 年发表的文献包括使用益生菌双歧杆菌900791、罗伊氏乳杆菌DSM 17938和嗜酸乳杆菌DDS-1 的三项研究,共 117 名受试者。结果显示,只有罗伊氏乳杆菌DSM 17938 表现出症状显著改善和呼出氢气减少,而嗜酸乳杆菌DDS-1 表现出乳糖不耐受症状显著改善。
最近的一项荟萃分析包括 12 项研究,总样本量为 263 名患者,结果发现服用益生菌可以缓解乳糖不耐受症状。
摄入乳酸菌可以缓解乳糖不耐受的症状,但这些细菌可能不会在结肠中持久存在。一个新策略是“喂养”乳酸菌,益生元人类无法消化,但乳酸菌可以吃。在初步的临床试验中,使用这种“益生元”的受试者报告说乳糖耐受性有所改善,并且他们的肠道微生物组也相应发生了变化。
益生元
最近的一项系统回顾包括两项研究,其中在总共 462 名受试者中研究了短链低聚半乳糖 GOS (RP-G28) 的功效。作者发现,GOS (RP-G28) 在治疗阶段以及停止后 30 天内显示出乳糖不耐受症状的改善。
一项针对 377 名乳糖不耐受患者的随机安慰剂对照研究报告称,定期摄入短链 GOS (RP-G28) 发现,与安慰剂相比,总体评估结果显著改善,并且五种双歧杆菌分类群显著增加。
以上是研究中发现的部分有效果的益生菌和益生元,但对于每一位乳糖不耐受个体是否有效,效果是否持久,还需要结合肠道菌群检测报告辅助评估。比如某患者的有益菌并不是显著缺乏,但是其肠道菌群中某些条件致病菌超标,可能会加重乳糖不耐受的症状,这就需要医生或专业人士综合评估给出个性化干预建议。
此外,了解停止补充后某些症状恶化可能与哪些菌群及其相关代谢有关,也能帮助医生和患者更有针对性地进行干预,以达到更好的健康效果。
一类特定的食物不耐受与麸质摄入有关。
乳糜泻和小麦过敏是众所周知的病理状况,会引发独特的免疫反应。乳糜泻涉及主要针对胃肠道的自身抗体的产生,而小麦过敏会引发 IgE 介导的反应,过敏可能会导致瘙痒、呕吐或呼吸急促。
然而,有一部分人在食用麸质后会出现肠道和肠外症状,但没有表现出乳糜泻特异性抗体或过敏生物标志物。这些人被归类为患有非乳糜泻麸质敏感性 (NCGS),与乳糜泻不同,麸质敏感性不会损害小肠,麸质不耐受症状也往往比乳糜泻症状出现得更快,一般在食用麸质后几分钟到几小时内就出现了。
这种病症首次在 20 世纪 80 年代被描述,当时一名 43 岁的患者出现腹泻,但缺乏乳糜泻的生物标志物。该患者在采用无麸质饮食(GFD)后表现出显著改善。
典型的肠道症状包括:
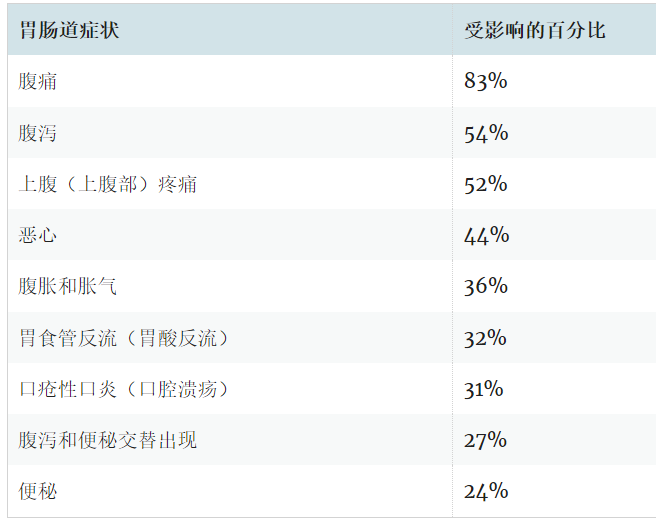
肠外表现可能包括:
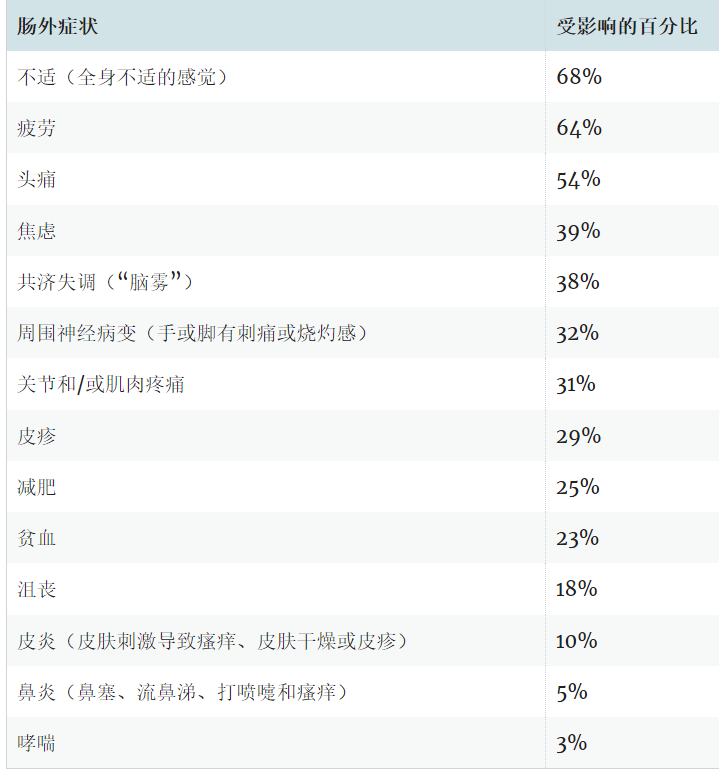
症状通常在摄入麸质后数小时至数天内出现,并在从饮食中去除麸质后消失。
通常,许多非乳糜泻麸质敏感性患者有乳糜泻或食物过敏家族史,并且还与桥本甲状腺炎和糖尿病等其他自身免疫性疾病相关。
麸质不耐受和乳糜泻虽然都是与麸质有关,都会引起胃肠道症状,如胃痛、腹胀、恶心和腹泻,但具有不同的生理机制和临床表现。

哪些食物中含有麸质?
小麦、大麦和黑麦都是含麸质的谷物。麸质也会出现在许多加工食品中,尤其是那些以这些谷物为基础或含有这些谷物成分的食品,例如:
小麦中的其他成分也可能引发不耐受
无麸质饮食在大多数情况下可以有效减轻症状,但一些 NCGS 患者尽管在诊断后多年遵循严格的无麸质饮食,但仍然报告症状。这表明除麸质外,小麦的其他成分可能是造成这些 NCGS 患者症状的原因。
小麦含有多种蛋白质,根据其功能可分为结构蛋白、功能蛋白或储存蛋白。其中,80%是储存蛋白,包括麦醇溶蛋白和麦谷蛋白,它们有助于麸质的形成。
注:这是一种蛋白质网络,赋予面包和硬质小麦面团独特的粘弹性。
这些储存蛋白富含脯氨酸,这使得它们能够抵抗肠道蛋白水解酶。高脯氨酸含量会导致免疫原性肽的产生,从而引发炎症和氧化应激反应。
麸质作为不耐受罪魁祸首的确切作用尚不完全清楚。小麦含有 2-4% 的淀粉酶胰蛋白酶抑制剂 (ATI),这也会加剧肠道免疫反应并增加炎症。
注:ATI是植物来源的蛋白质,可以使小麦具有抗虫性(能够抵抗黄粉虫和臭虫的损害)。
小麦中还包含一些果聚糖,这些也会在小肠中缓慢吸收,并被肠道细菌快速发酵,导致气体产生和腹胀。一项双盲交叉挑战,以检查麸质和果聚糖对自我报告的NCGS患者的影响。结果显示,在这一组中,似乎是果聚糖而不是麸质引发了更显著的胃肠道症状。
麸质不耐受其实比乳糜泻更常见。任何人都可能患有麸质不耐受,但在 30 岁- 40 岁之间人群发病率较高,在女性中更为常见。
也有研究认为,在儿童中,男性 NCGS 的患病率高于女性。
由于缺乏对该疾病及其致病原因的了解,因此没有可以诊断NCGS的实验室测试或影像学研究。诊断主要基于测试和排除所有其他可能的原因。
乳糜泻:通过可检测乳糜泻自身抗体的血液检查和小肠活检以检查绒毛萎缩来诊断。
小麦过敏:通过过敏血液测试、皮肤点刺测试或斑贴测试来诊断。
可能会进行其他测试以排除其他可疑原因。
如果排除乳糜泻和小麦过敏,可能会建议吃无麸质饮食六周,然后重新摄入麸质一周。一些人认为,饮食能使症状改善30%,重新引入麸质能使症状增加30%,即可诊断为非乳糜泻麸质敏感性。
IBS和NCGS的症状相似可能导致错误的诊断和无效的治疗。一例临床病例描述一名 49 岁女性,曾被诊断患有 IBS。患者主诉腹痛、便秘、胃酸反流和头痛。
考虑并最终排除以下情况:自身免疫性疾病、甲状腺激素水平异常、幽门螺杆菌感染。在不适当的治疗过程中,患者出现了类似系统性红斑狼疮的症状。此外,患者在服用皮质类固醇后表现出一些改善,这也很难做出正确的诊断。最终,经过多年的不当治疗,才发现是NCGS。
当然一些研究表明 NCGS 可能是发生 IBS 的主要触发因素。事实上,由于NCGS 和类似 IBS的症状往往重叠,因此诊断过程特别具有挑战性。
IBS 和 NCGS 之间的重叠
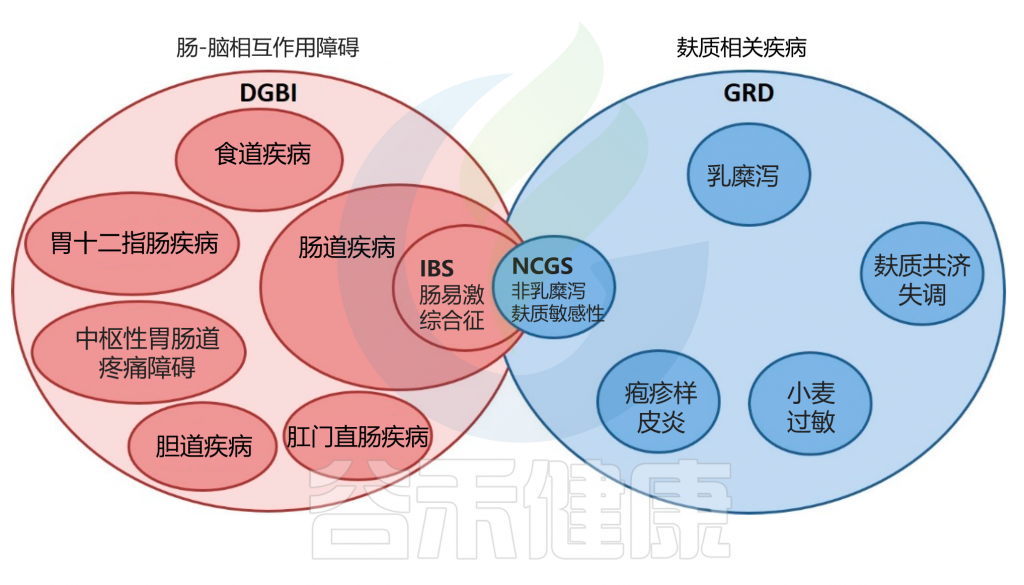
doi.org/10.3390/nu12123735
通常需要通过详细的病史收集、排除其他医学原因、饮食日记记录以及可能的饮食干预来辅助诊断。同时,也可以结合肠道菌群健康检测辅助判别,如果检测到肠道中某些细菌的增多,这些菌参与的代谢途径可能与小麦或麸质摄入有关,这可能支持NCGS的诊断。如果在饮食中去除小麦或麸质后肠道菌群发生了积极的变化,并且症状得到缓解,这也有助于NCGS诊断。
在进行诊断时,需要综合考虑多种因素,肠道菌群检测的结果与临床症状、病史、其他实验室测试和可能的饮食干预结果一起考虑,可以更加全面地加以评估。
NCGS 的病理生理学涉及免疫激活、通透性改变、神经免疫相互作用和遗传因素。麸质和微生物群可以增加上皮通透性,有利于不同抗原进入粘膜并随后激活免疫系统。神经免疫激活和分泌运动功能障碍可能影响大脑活动。
非乳糜泻麸质敏感性病理生理学中涉及的潜在机制
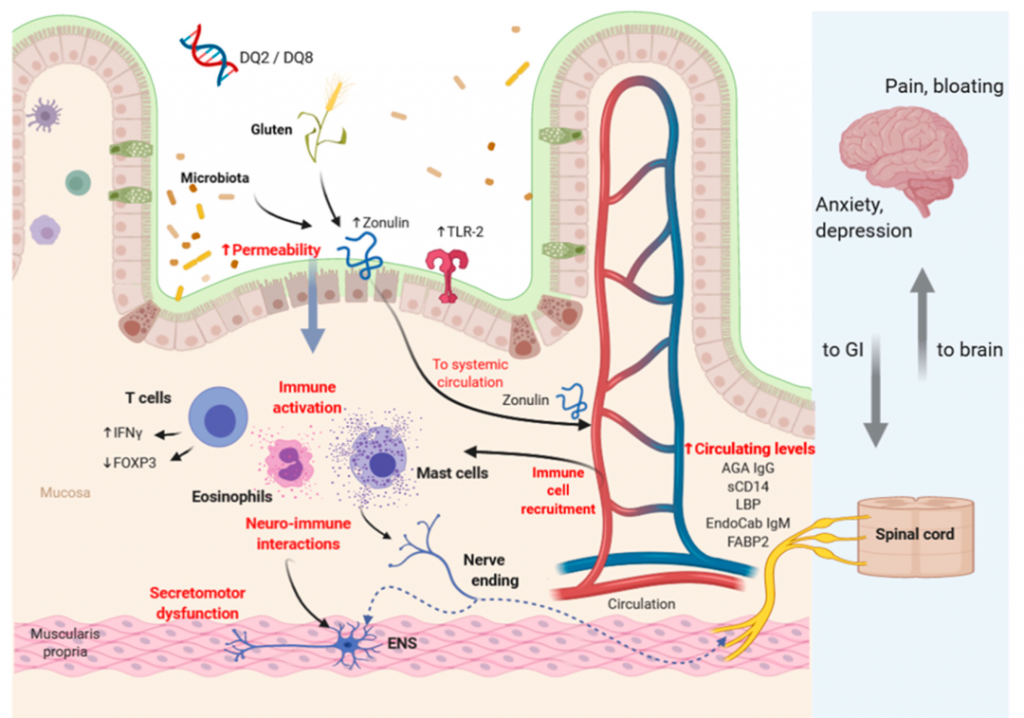
doi.org/10.3390/nu12123735
从组织学角度来看,与健康个体相比没有太多差异,因为正常的绒毛结构维持在十二指肠水平。上皮内淋巴细胞(IEL≤25/100肠细胞)的截止值用于定义正常十二指肠组织学,对应于Marsh 0。然而,归类为非乳糜泻麸质敏感患者显示十二指肠上皮内淋巴细胞计数增加(>25/100肠细胞),对应于Marsh I 病变。
绒毛上皮中 IEL 的不规则分布和簇状分布作为支持 NCGS 诊断的组织学发现,但需要更大规模的研究来证实。
最近一项多中心研究发现,即使在绒毛结构的Marsh 0期,非乳糜泻麸质敏感患者十二指肠粘膜也表现出与肠腔抗原反应一致的独特变化。非乳糜泻麸质敏感患者固有层水平存在嗜酸性粒细胞,这表明这种情况可能更接近于食物过敏。
Zonulin是一种在调节肠屏障通透性方面发挥作用的蛋白质。有人认为,在HLA-DQ2/8阳性个体中,非乳糜泻麸质敏感患者中zonulin增加,而在采用无麸质饮食后降低,因此可以用于与腹泻型肠易激综合征(IBS-D)进行鉴别诊断。
肠道微生物群与麸质相关疾病之间的关系很复杂。人类肠道中存在大量能够水解麸质蛋白和肽的细菌。
NCGS 患者表现出有益菌种(双歧杆菌)的减少和促炎细菌(肠杆菌科和大肠杆菌)的增加。
上皮水平上的 Toll 样受体 (TLR 2-4) 会因病原微生物而被激活。肠道微生物群的参与,非乳糜泻麸质敏感性患者中致病性拟杆菌门增加,腐生菌(厚壁菌门)减少。这种失调可能会导致患者出现腹胀,这可能是由于发酵增加所致。
在分子水平上,观察到Claudin-4的增加,这是负责细胞旁通透性的紧密连接的组成部分。因此,对非乳糜泻麸质敏感性提出了“漏肠”假设,表明肠屏障受损。这可以导致食物成分(如麸质)和其他外来物质更容易穿越肠道壁,这可能触发免疫反应和炎症,增加对麸质的敏感性。
★ 无麸质饮食
大多数麸质不耐受患者通过遵循无麸质饮食可以缓解症状。
无麸质饮食中可以吃的谷物有:
藜麦、糙米、野米、高粱、木薯、小米、燕麦等
麸质存在于无数食品、饮料和其他产品中,仔细阅读食品和饮料标签,了解哪些食物、饮料和成分含有麸质。
低麸质饮食通过调节肠道菌群改善不耐受
一项研究比较了60名丹麦成年人,他们分别接受了8周的低麸质饮食和8周的高麸质饮食。低麸质饮食改变了粪便微生物组,降低了双歧杆菌、Dorea、Blautia、Lachnospiraceae的相对丰度,以及两种产丁酸的细菌Anerostipes hadrus和Eubacterium hallii。然而,低麸质饮食也增加了梭状芽孢杆菌目和毛螺菌科一个未分类物种的相对丰度,这两个类群产丁酸。
总能量、纤维和FODMAP的摄入量在两种不同的饮食条件下没有变化。低麸质饮食减少了餐后的呼吸氢,减轻了自我报告的腹胀。它还显著增加了饱腹激素PYY的产生,并导致体重减轻。低麸质饮食可以降低血清IL-1β,这是参与炎症反应的分子。
需要更多的研究来了解不同的无麸质饮食如何影响粪便微生物组和免疫系统。
其他饮食方式也包括:
★ 低ATI饮食
我们前面讲到,小麦中的除了麸质之外的其他成分也可能引发消化道症状,其中也会ATI 可能会促进 NCGS 中出现的肠道炎症症状,这与乳糜泻不同。
应避免的 ATI 含量高的食物包括黑麦、大麦、小麦(以及所有小麦产品变体)以及含麸质的食物。
★ 益生菌
益生菌可能减轻麸质敏感个体的影响。在细胞培养和动物研究中,已发现某些长双歧杆菌(NCC2705 和 CECT 7347)、动物双歧杆菌(乳酸亚种)和鼠李糖乳杆菌 (GG) 菌株可减弱醇溶蛋白对肠粘膜的破坏作用。
在一项针对新诊断克罗恩病儿童的随机安慰剂对照试验中,长双歧杆菌 CECT 7347 补充剂三个月可改善生长参数,降低潜在促炎菌属脆弱拟杆菌的丰度,并减少粪便分泌 IgA,表明肠道免疫系统不再处于“高度警戒”状态。
另一项针对无麸质饮食的克罗恩病患儿的研究发现,补充短双歧杆菌(BR03 和 B632)三个月可显著降低循环 TNFα,这是全身炎症的标志物。停止补充益生菌三个月后,TNFα水平再次升高。
总的来说,补充益生菌在减轻麸质造成的损害和改善麸质敏感个体的整体健康方面潜力很大。
不过,在补充益生菌之前,最好进行肠道菌群健康检测,因为益生菌的效果因人而异,可能受到个体肠道菌群的影响。假如某位麸质不耐受患者本身长双歧杆菌较多,补充长双歧杆菌不一定有用,那么可能需要结合该患者的总体肠道菌群检测报告来看,哪些菌群不平衡,过多或多少带来怎样的健康风险,对麸质不耐受可能产生什么样的影响,综合评估是否需要补充以及什么方案更适合总体健康。
★ 益生元
多酚是我们饮食中常见的植物化学生物活性成分。多项研究表明,多酚可以通过与蛋白质等其他大分子相互作用来发挥促进健康的特性,优先与富含脯氨酸的蛋白质结合,例如麸质蛋白。
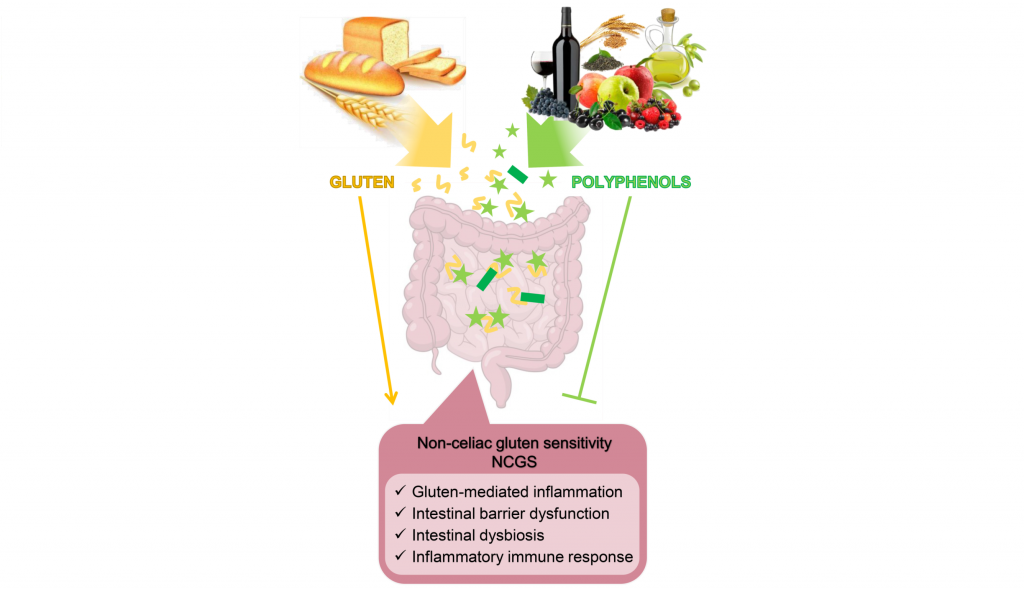
doi.org/10.3390/nu14132679
多酚通过改善肠道菌群缓解 NCGS 症状
作为益生元底物,多酚刺激有益细菌种类的生长和活性,例如Akkermansia muciniphila、多形拟杆菌(Bacteroides thetaiotaomicron)、Faecalibacter prausnitzii 、双歧杆菌、乳杆菌,促进微生态转变,发挥其抗炎、抗氧化、免疫和屏障完整性保护作用,从而在肠道和全身水平上抑制麸质的毒性作用。
NCGS 中多酚及其代谢物的潜在目标
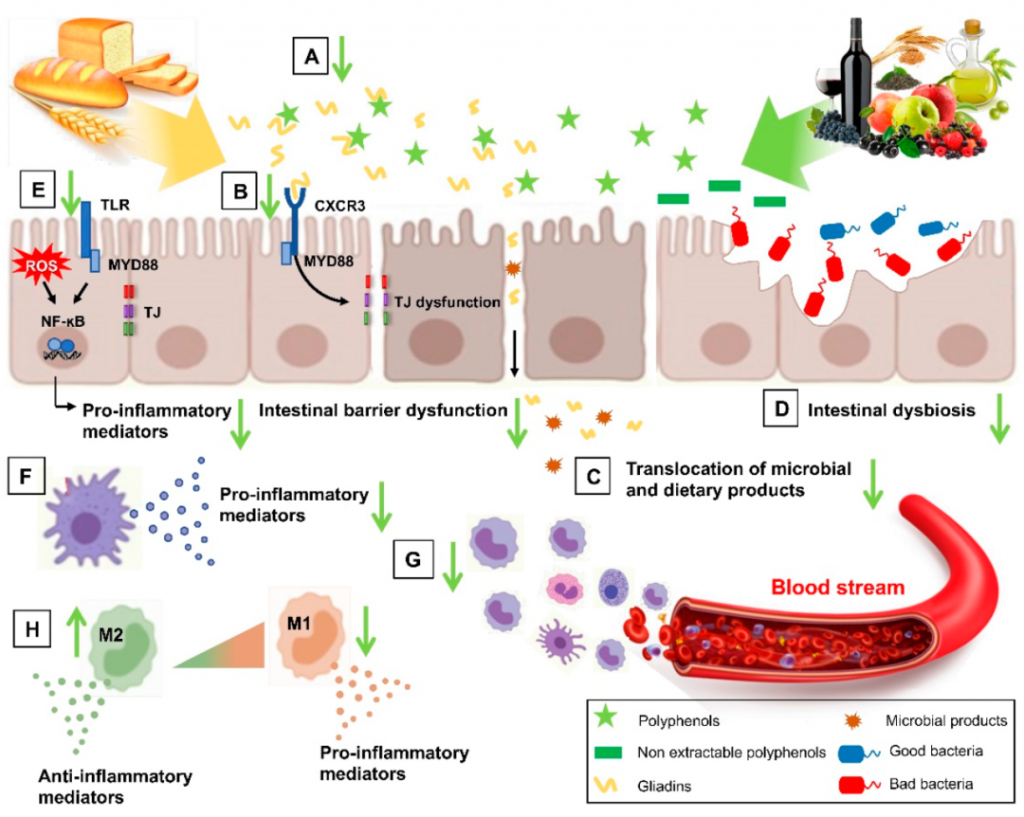
doi.org/10.3390/nu14132679
多酚可以结合并隔离麸质,降低麸质的生物利用度(A);它们可以抑制麦醇溶蛋白肽和 CXCR3 受体之间的相互作用,恢复改变的肠道通透性(B),然后减少微生物和膳食产品的易位(C);它们还可以改善肠道菌群失调,肠道屏障功能障碍(D)。多酚可以削弱肠道水平的氧化应激和炎症诱导途径 (E),并抑制压倒性的炎症免疫反应(F),减少固有层 (G) 中骨髓细胞的募集,并增加 M2 极化抗炎巨噬细胞 (H)。
富含多酚的食物包括:
橄榄油、红葡萄/葡萄酒、水果(浆果类如蓝莓、草莓、黑莓和覆盆子等)、蔬菜(如洋葱、茄子、菠菜等)、谷物(豆类如黑豆和红豆等)、坚果(如核桃、杏仁)、可可、咖啡、茶等。
现在“无麸质饮食”的概念越来越流行,无麸质饮食可以说是欧美健康饮食界近几年的流行饮食方式,甚至很多健康人包括各类博主也开始遵循无麸质饮食,然而这也可能会伴随一些健康风险。
与遵循常规饮食的受试者相比,无麸质饮食与常量营养素(例如饱和脂肪和糖)的消耗增加以及微量营养素(例如铁、叶酸和锌)的摄入量较低有关。
也有研究表明,健康成人持续无麸质饮食后,双歧杆菌、乳酸杆菌和长双歧杆菌减少,而肠杆菌科和大肠杆菌增加。
无麸质饮食饮食明显影响多种菌群的丰度,特别是那些专门参与碳水化合物和淀粉代谢的物种,如韦荣氏球菌科。
无麸质饮食也可能会导致下列风险增高:
无麸质饮食人群最好定期进行检查下列指标:
因此,对于健康人来说,在决定是否采用无麸质饮食之前,应该充分了解其可能的健康风险,每个人应该根据自身身体状况和需求来决定。
FODMAP 是短链碳水化合物,包括乳糖、超过葡萄糖的果糖、糖醇(山梨醇和甘露醇)、果聚糖和 GOS(水苏糖和棉子糖),天然存在于水果、蔬菜、谷物、乳制品等大量食品和甜味剂中。
这组碳水化合物已被确定为触发功能性胃肠道症状患者的症状,如肠易激综合征(IBS)。
高FODMAP食品是指含有超过 4 克乳糖、超过 0.3 克甘露醇、山梨醇、低聚半乳糖或果聚糖的食品。因此,可以通过考虑食物的 FODMAP 含量来对食物进行分类。
敏感个体食用高FODMAP饮食与腹痛、腹胀、肠胃胀气和肠道习惯改变等低胃肠道症状相关。
在IBS患者队列中,使用低FODMAP饮食对症状的改善已被证明在50-80%之间变化。该范围可能受到几个因素的影响,包括研究设计、患者选择和习惯饮食中的FODMAP摄入量。
FODMAPs难以被肠道细菌吸收和发酵。
因此,摄入大量FODMAPs会导致大量短链脂肪酸(SCFAs)和大量气体(包括二氧化碳、氢气和甲烷)的过度产生,这些物质会导致肠腔膨胀和肠腔内水潴留。
在内脏超敏反应患者中,增加内腔水分输送和气体的联合作用导致膨胀,导致疼痛和不适。
关于内脏超敏详见我们之间的文章:
腹胀、腹痛、肠胃不明原因疼痛?–可能是内脏高敏感,详细了解内脏高敏的原因后果
最近,还提出了其他作用机制,如由于低FODMAP饮食后尿组胺和促炎细胞因子的显著减少,高FODMAP食物的免疫激活潜力。
然而,需要进一步的数据来证实这些发现,并确认它们对症状反应的影响。
那些对特定高FODMAP食物反应明显的人,可能需要减少这些食物的摄入。
其他人群还包括:
肠易激综合征(IBS)患者
IBS是一种常见的消化系统疾病,其症状包括腹痛、腹胀、腹泻和便秘。低FODMAP饮食已被证明可以有效减轻这些症状。
小肠细菌过度生长(SIBO)患者
SIBO是一种病状,其中小肠中的细菌数量异常增多,可能导致类似IBS的症状。限制FODMAPs可以帮助减少细菌的食物来源,从而减轻症状。
功能性腹胀患者
这是一种以腹部不适和腹胀为主要症状的状况,而低FODMAP饮食可以帮助减少腹胀和其他相关症状。
炎症性肠病患者
如克罗恩病和溃疡性结肠炎,虽然低FODMAP饮食并非治疗这些疾病的主要方法,但它有时可以帮助控制某些症状,尤其是在病情活动期间。
其他消化不良的人
有些人可能没有特定诊断,但发现减少高FODMAP食物的摄入能够减轻他们的消化不良。
IBS 是一种功能性胃肠道疾病,影响全世界多达 20% 的人。胃肠道症状受到不同因素的影响,例如心理社会领域、生理功能及其相互作用(肠-脑轴)。IBS的特点是内脏运动和敏感性异常,以及免疫功能和微生物群组成异常;因此,它与各种胃肠道症状和生活质量受损有关。罗马 IV 诊断标准允许根据症状将 IBS 患者分为三类:伴有腹泻的 IBS(IBS-D)、伴有便秘的 IBS(IBS-C)和具有混合排便习惯的 IBS(IBS-M)。
IBS的发病机制仍不完全清楚,但不同的研究表明饮食在症状管理中发挥着重要作用。最有证据支持的饮食是低 FODMAP 饮食 (LFD),它对 IBS 治疗有效。
七项研究证实了低 FODMAP 饮食的积极作用,表明低 FODMAP 饮食后 IBS 严重程度评分系统(IBS-SSS)显著下降。同样,与遵循标准饮食的患者相比,生活质量有所改善。
最后,与 IBS-C 患者相比,低 FODMAP 饮食在 IBS-D 和 IBS-M 患者中的疗效似乎更高。
低FODMAP饮食在世界范围内广泛研究,并显示出良好的疗效证据,得到荟萃分析的支持,并已纳入临床指南。
低FODMAP饮食减少碳水化合物亚类的摄入,包括:
针对低 FODMAP 饮食的特点,可以采用“自上而下”的方法,分为限制、重新引入和个性化长期维护三个步骤。
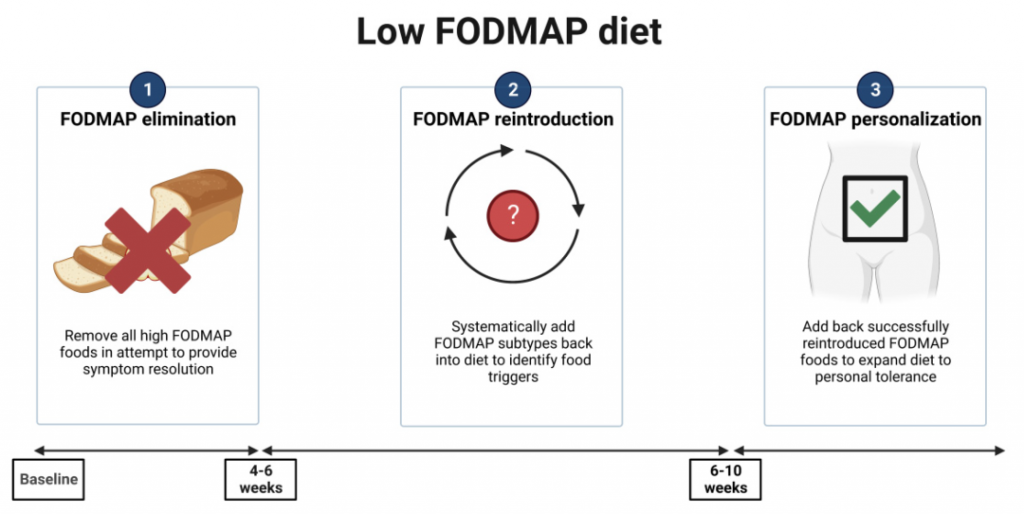
第一阶段要求从饮食中排除所有高 FODMAP 食物,通常持续 4-6 周。这是最关键的阶段,重要的是向患者解释 FODMAP 在胃肠道症状发生中的作用。
第二阶段的目的是重新引入 FODMAP 并评估每位患者的耐受性,调整饮食以进行长期维持。在此阶段,评估饮食依从性和临床反应也很重要;个性化重新引入食物,考虑每种食物 3 天,可以识别患者症状的特定触发因素。
第三阶段涉及制定长期饮食,根据患者的 FODMAP 耐受性进行定制。关键是要制定灵活的饮食结构,以保持多样化和营养充足,并控制肠易激综合征症状。
低 FODMAP 饮食并不是所有受胃肠道紊乱影响的患者的灵丹妙药。
营养缺乏风险
主要原因是缺乏适当的饮食咨询和自我限制饮食。关于膳食摄入量的研究并不一致。由于碳水化合物摄入量的减少,纤维缺乏症是最常见的;此外,当过量摄入乳制品时,钙摄入量也会降低。
考虑到维生素的消耗,维生素缺乏的风险与严格减少饮食中的蔬菜和水果有关。排除几种蔬菜可能会导致天然抗氧化剂的减少,例如类黄酮、类胡萝卜素和维生素C,酚酸和花青素等。
不过总的来说,缺乏有关低 FODMAP 饮食长期影响的数据,但如果患者在饮食过程中得到专业人员的适当监测,营养缺乏的风险非常低。
便秘风险
低 FODMAP 饮食的另一个潜在限制是纤维消耗量低,这可能会加重便秘,尤其是 IBS-C 患者。
适当的营养随访和知识科普可以改善饮食管理和纤维摄入量。
饮食失调风险
低 FODMAP 饮食第一步中施加的限制可能会对患者的情绪状态产生负面影响。有研究表明,低 FODMAP 饮食后的 IBS 患者与食物相关的生活质量较低。
此外,低 FODMAP 饮食对IBS症状恶化的焦虑以及随之而来的饮食限制似乎与饮食失调的发生相关。特别是,回避性限制性食物摄入障碍和神经性厌食症是与低 FODMAP 饮食相关的最常见的饮食失调。
微生物群变化的风险
高 FODMAP 食物通常是益生元的良好来源,尤其是那些含有低聚果糖、低聚半乳糖和纤维的食物,因此减少摄入量可能会改变微生物群结构。这会减少短链脂肪酸的产生及其对结肠细胞的重要保护和营养活性。
短期研究表明,低 FODMAP 饮食可能会导致总体细菌丰度、双歧杆菌和普拉梭菌减少。普拉梭菌的减少可能对肠粘膜屏障的完整性有害。
总之,这不是一种“简单”的饮食,当患者在没有任何专业建议的情况下遵循该饮食时,问题就会增加。同时,有必要在这一新领域进一步研究,以确定哪些患者可以从低FODMAP饮食中受益,并改善管理。
果糖不耐受分为遗传性果糖不耐受和非遗传性果糖不耐受。
遗传性果糖不耐受 (HFI) 是一种罕见的常染色体隐性遗传疾病,无法正常代谢果糖,导致各种代谢紊乱和临床症状。
这是由位于染色体 9q22.3 上的醛缩酶 B 酶突变引起,摄入果糖后可导致明显的胃肠道症状,并可能导致长期器官损伤,特别是肾和肝脏损伤。
临床特征
当患有这种疾病的个体直接或通过蔗糖或山梨醇间接接触膳食果糖时,遗传性果糖不耐受症状就会出现。
果糖不耐受的人在食用高果糖食物或饮料后经常会出现胃肠道症状,如腹痛、腹胀、腹泻和恶心。这些症状可以是轻微到严重的不适,并且可以显着影响个人的生活质量。
症状及其严重程度取决于果糖剂量、患者年龄、伴随疾病和醛缩酶 B 的残留酶活性,并且是非特异性的,因此很难仅根据症状来怀疑遗传性果糖不耐受。常见的临床表现是恶心、呕吐、腹部不适和生长受限/生长迟缓。
治疗
遗传性果糖不耐受的管理包括严格避免含有果糖、蔗糖和山梨醇的食物。通过正确的诊断和坚持果糖限制饮食,果糖不耐受的个体可以有效地控制他们的病情并改善他们的整体健康。
遵循严格的不含有果糖、蔗糖和山梨糖醇的饮食,并补充葡萄糖和玉米淀粉等碳水化合物,可以使症状迅速逆转。患者应避免使用含有蔗糖的药物和疫苗,例如两种口服轮状病毒活疫苗 Rotarix ® 和 RotaTeq ®。鉴于减少水果和蔬菜摄入量是饮食要求,建议每天补充“无糖”多种维生素,以防止微量营养素缺乏,特别是水溶性维生素缺乏。
非遗传性果糖不耐受是怎么回事?
相对于管腔果糖的量而言,肠上皮细胞摄取果糖不足。
小肠中果糖的吸收能力远低于葡萄糖的吸收能力;葡萄糖以剂量依赖性方式刺激果糖吸收,当果糖含量多于葡萄糖时,就会发生吸收不良。然后,未吸收的果糖进入结肠,并以与 LNP 患者的乳糖相同的方式发酵。
如何诊断?
果糖吸收不良 (FM) 的诊断通常需要结合病史评估、症状评估和特定测试。多年来,一直使用特定的氢气呼气测试来评估果糖吸收不良。关于氢气和甲烷呼气试验的适应症、性能和临床影响的欧洲指南建议,成人诊断果糖吸收不良和不耐受时的果糖剂量应为 20-25 克。
关于“胃肠道疾病中 H2 呼吸测试的方法和适应症”的罗马共识会议和 ESPGHAN 关于呼气测试使用的文件均表示,在临床实践中不建议进行果糖呼气测试。
鉴于这种诊断的不确定性,可能会建议消除饮食,即在特定时期内从饮食中去除高果糖食物。如果症状在此期间有所改善,然后在重新摄入含果糖食物时又出现,则可能表明果糖吸收不良。
如何改善?
由于果糖是一种 FODMAP,因此通常建议采用低 FODMAP 饮食来代替低果糖饮食,特别是对于怀疑患有伴随功能障碍的患者。先前的调查表明,诊断为 IBS 或 FGID 的个体中,很大一部分(35%~73%)表现出与果糖吸收不良一致的特征。
木糖异构酶已被提议作为果糖不耐受的潜在治疗方法,因为它能够将果糖转化为葡萄糖。一项双盲、安慰剂对照研究表明,口服木糖异构酶与摄入果糖后呼吸氢显著减少有关,并且恶心和腹痛显著改善。目前,经验疗法包括采取限制饮食和评估症状。
蔗糖由一种葡萄糖和一种果糖分子组成。这两个分子之间的结合被膜结合酶蔗糖酶-异麦芽糖酶破坏。先天性蔗糖酶-异麦芽糖酶缺乏症(CSID)是一种罕见的常染色体隐性遗传疾病,染色体 3q25-26 上的蔗糖酶-异麦芽糖酶基因发生突变。
获得性形式的蔗糖酶-异麦芽糖酶缺乏症可能继发于与肠绒毛萎缩相关的其他慢性胃肠道疾病,例如肠道感染、乳糜泻、克罗恩病和影响小肠的其他肠病。
功能性蔗糖酶-异麦芽糖基因变异似乎在具有提示 IBS 症状的患者中更为常见。然而,如上所述,最近的指南不建议对这些患者进行碳水化合物测试。
使用来自酿酒酵母产生的酶糖化酶来水解蔗糖,作为这种不耐受的可能治疗方法。因为一项古老的双盲研究显示,与安慰剂相比,这种酶与食物一起服用可以显著预防在含蔗糖饮食中的患者的不耐受症状。
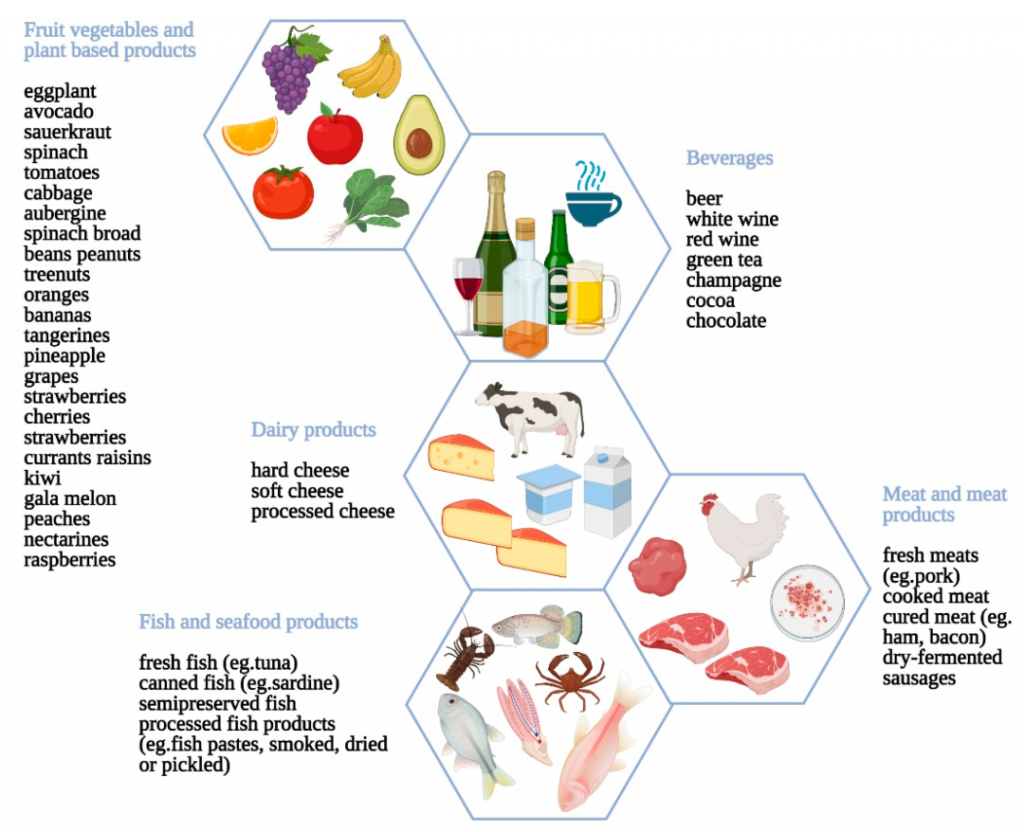
组胺一般在哪些食物中出现?
发酵食品、酒精、贝类、熏肉、豆类、巧克力、某些水果和蔬菜等。
doi.org/10.3390/nu13051638
组胺不耐受是如何发生的?
由于二胺氧化酶(DAO)活性低,肠道中组胺降解途径受损或减慢,导致组胺在血浆中积聚并出现不良反应,特别是在高饮食摄入的情况下。然而,这种因果关系尚未得到证实。
组胺不耐受有哪些表现?
由于组胺受体普遍分布在身体的不同器官和组织中,组胺不耐受的临床表现包括多种非特异性胃肠道和肠外症状。
这种多形性的表现导致难以就组胺不耐受的诊断标准达成共识。
组胺不耐受的发病率
缺乏可靠的诊断系统对目前报告的组胺不耐受发生率产生了影响,估计约占人口的 1-3%。随着更多关于组胺不耐受的知识和诊断工具的出现,这种情况可能会增加。
肠道微生物会影响组胺不耐受的发生
肠道微生物群也会影响组胺不耐受的发生。最近的研究表明,组胺不耐受可能是由肠道微生物群的改变引起的。肠道中大量的组胺分泌细菌可能会导致组胺不耐受。健康人体内双歧杆菌的数量较多。而在血清二胺氧化酶活性降低的人群中观察到变形菌属数量较多。
在组胺不耐受人群中观察到肠道菌群失调,与健康个体相比,与肠道健康相关的普氏菌科(Prevotellaceae)、瘤胃球菌(Ruminococcus)、粪杆菌(Faecalibacterium)和普拉梭菌(Faecablibacterium prausnitzii)的比例明显较低。组胺不耐受人群还具有显著更高丰度的组胺分泌细菌,包括葡萄球菌属和变形杆菌属、属于肠杆菌科的几个未识别属,以及产气荚膜梭菌和粪肠球菌。
组胺不耐受的治疗建议
组胺不耐受疗法的基础是基于低组胺含量食物的消除饮食。一般来说,公认的饮食指南尚未制定;但是,建议避免食用富含组胺的食物如奶酪、油性鱼类和贝类,以及生发酵肉制品、腌菜、发酵豆制品、葡萄酒和啤酒、鸡蛋、巧克力和蘑菇。
此外,应避免食用会刺激内源性组胺释放的蔬菜和水果(如菠菜、西红柿、柑橘类水果、草莓、茄子、鳄梨、木瓜、香蕉、猕猴桃、菠萝和李子)。
关于组胺不耐受,详见之前的文章:
茄属植物是属于茄科的一组蔬菜。超过 3,000 种植物属于这一类。常见的品种有茄子、西红柿、土豆、青椒等。有些人对茄属蔬菜不耐受。
那些对茄属植物敏感或过敏的人可尝试一些替代品。其中包括:
亚硫酸盐
白葡萄酒和干果中含有大量的亚硫酸盐等,亚硫酸盐也会添加到其他食品中,增强脆度或防止霉菌生长,而 FDA 禁止亚硫酸盐作为新鲜水果和蔬菜的喷雾防腐剂。
摄入后,不良反应最常见于易感人群,例如哮喘患者。所提出的机制包括吸入摄入的亚硫酸盐产生的二氧化硫、亚硫酸盐氧化酶缺乏以及 IgE 介导的反应。
此外,有人提出可能涉及副交感神经系统,亚硫酸氧化酶不足会导致亚硫酸盐积累,引起胆碱能介导的支气管收缩。
谷氨酸钠
另一种被认为是不良非免疫反应罪魁祸首的食品添加剂是谷氨酸钠 (MSG-E621),它通常作为咸味增强剂添加。然而,富含天然结合或游离形式谷氨酸的食物以与味精相同的方式代谢,并且没有证明它会引起与添加味精的食物相同的症状。
食物不耐受的存在会影响患者的心理健康。与对照组相比,食物不耐受患者的焦虑、抑郁和躯体症状更常见。
一些关注心理社会相关性的研究表明,食物不耐受与年龄较小、女性、高等教育和肠易激综合症之间可能存在关联。
此外,研究表明,食物不耐受也可能与IBS中的食物厌恶重叠,并且这可能在食物不耐受中也很重要。事实上,如果摄入某种特定食物同时伴随着心理障碍,那么胃肠道症状就会在摄入某种食物后出现,并且可以习得对该食物的厌恶。
针对 IBS 人群的研究表明需要更好的沟通,积极的医患关系可以改善症状管理。因此,可以假设这对于食物不耐受的患者来说会是成功的。
此外,与胃肠道症状相关的食物不耐受的存在也可能成为饮食失调患者拒绝食物的理由。考虑到饮食失调患者中膳食相关症状的发生率很高,临床医生调查饮食行为障碍的存在至关重要。
饮食日记可以帮助你了解自己的饮食习惯和模式,帮助你识别对某些食物或成分的反应。

每天列出你吃的食物和出现的症状。一旦你确定了一种似乎会引发你症状的食物,就几个星期不吃它,看看会发生什么。过了几个星期后重新再吃它。如果症状随着它的减去而消失,但随着重新开始吃又复发,这样你就逐渐找到罪魁祸首。

编辑
每餐后填写相关栏目。列出症状时,按1-10 的等级对其严重程度进行评分。“其他因素”列用于记录压力或情绪不安等因素。
在每周结束时,寻找任何可能的模式或潜在的食物触发因素。一旦确定了可能存在问题的食物,请遵循消除饮食至少两周,有些认为4-8周,具体取决于严重程度。
每次最好只排除一种食物,以免其他因素干扰。
关于写饮食日记的小技巧:
饮食日记是一场马拉松,所以要对自己宽容一点,一开始不必面面俱到把所有的都记下来,那样只会变成日常生活的负担,轻松一点有利于坚持。
如果要记录的话,尽量在吃完几个小时内就写,不要拖太久,不然等过两天回忆再写会很麻烦。可以随身带个小本子或者记在手机等电子设备中。
如果在外面吃饭来不及记录,可以迅速把吃的东西拍个照,回去再写。
注:这里列的饮食日记的样式仅供参考,也可以用自己习惯的样式来进行。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Tuck CJ, Biesiekierski JR, Schmid-Grendelmeier P, Pohl D. Food Intolerances. Nutrients. 2019 Jul 22;11(7):1684.
Facioni MS, Raspini B, Pivari F, Dogliotti E, Cena H. Nutritional management of lactose intolerance: the importance of diet and food labelling. J Transl Med. 2020 Jun 26;18(1):260.
JanssenDuijghuijsen L, Looijesteijn E, van den Belt M, Gerhard B, Ziegler M, Ariens R, Tjoelker R, Geurts J. Changes in gut microbiota and lactose intolerance symptoms before and after daily lactose supplementation in individuals with the lactase nonpersistent genotype. Am J Clin Nutr. 2023 Dec 28:S0002-9165(23)66349-X.
Brandao Gois MF, Sinha T, Spreckels JE, Vich Vila A, Bolte LA, Weersma RK, Wijmenga C, Fu J, Zhernakova A, Kurilshikov A. Role of the gut microbiome in mediating lactose intolerance symptoms. Gut. 2022 Jan;71(1):215-217.
Tagliamonte S, Barone Lumaga R, De Filippis F, Valentino V, Ferracane R, Guerville M, Gandolfi I, Barbara G, Ercolini D, Vitaglione P. Milk protein digestion and the gut microbiome influence gastrointestinal discomfort after cow milk consumption in healthy subjects. Food Res Int. 2023 Aug;170:112953.
Sánchez-Pérez S, Comas-Basté O, Duelo A, Veciana-Nogués MT, Berlanga M, Latorre-Moratalla ML, Vidal-Carou MC. Intestinal Dysbiosis in Patients with Histamine Intolerance. Nutrients. 2022 Apr 23;14(9):1774.
Gargano D, Appanna R, Santonicola A, De Bartolomeis F, Stellato C, Cianferoni A, Casolaro V, Iovino P. Food Allergy and Intolerance: A Narrative Review on Nutritional Concerns. Nutrients. 2021 May 13;13(5):1638.
Hon E, Gupta SK. Gastrointestinal Food Allergies and Intolerances. Gastroenterol Clin North Am. 2021 Mar;50(1):41-57.
Légeret C, Lohmann C, Furlano RI, Köhler H. Food intolerances in children and adolescents in Switzerland. Eur J Pediatr. 2023 Feb;182(2):867-875.
Onyimba F, Crowe SE, Johnson S, Leung J. Food Allergies and Intolerances: A Clinical Approach to the Diagnosis and Management of Adverse Reactions to Food. Clin Gastroenterol Hepatol. 2021 Nov;19(11):2230-2240.e1.
Caio G, Lungaro L, Segata N, Guarino M, Zoli G, Volta U, De Giorgio R. Effect of Gluten-Free Diet on Gut Microbiota Composition in Patients with Celiac Disease and Non-Celiac Gluten/Wheat Sensitivity. Nutrients. 2020 Jun 19;12(6):1832.
Bascuñán KA, Araya M, Roncoroni L, Doneda L, Elli L. Dietary Gluten as a Conditioning Factor of the Gut Microbiota in Celiac Disease. Adv Nutr. 2020 Jan 1;11(1):160-174.
Calabriso N, Scoditti E, Massaro M, Maffia M, Chieppa M, Laddomada B, Carluccio MA. Non-Celiac Gluten Sensitivity and Protective Role of Dietary Polyphenols. Nutrients. 2022 Jun 28;14(13):2679.
Alkalay MJ. Nutrition in Patients with Lactose Malabsorption, Celiac Disease, and Related Disorders. Nutrients. 2021 Dec 21;14(1):2.
Leis R, de Castro MJ, de Lamas C, Picáns R, Couce ML. Effects of Prebiotic and Probiotic Supplementation on Lactase Deficiency and Lactose Intolerance: A Systematic Review of Controlled Trials. Nutrients. 2020 May 20;12(5):1487.
Roszkowska, A.; Pawlicka, M.; Mroczek, A.; Bałabuszek, K.; Nieradko-Iwanicka, B. Non-Celiac Gluten Sensitivity: A Review. Medicina 2019, 55, 222
Cenni S, Sesenna V, Boiardi G, Casertano M, Russo G, Reginelli A, Esposito S, Strisciuglio C. The Role of Gluten in Gastrointestinal Disorders: A Review. Nutrients. 2023 Mar 27;15(7):1615.
Losurdo G, Principi M, Iannone A, Amoruso A, Ierardi E, Di Leo A, Barone M. Extra-intestinal manifestations of non-celiac gluten sensitivity: An expanding paradigm. World J Gastroenterol. 2018 Apr 14;24(14):1521-1530.
Barbaro, M.R.; Cremon, C.; Wrona, D.; Fuschi, D.; Marasco, G.; Stanghellini, V.; Barbara, G. Non-Celiac Gluten Sensitivity in the Context of Functional Gastrointestinal Disorders. Nutrients 2020, 12, 3735.
Tagliamonte S, Barone Lumaga R, De Filippis F, Valentino V, Ferracane R, Guerville M, Gandolfi I, Barbara G, Ercolini D, Vitaglione P. Milk protein digestion and the gut microbiome influence gastrointestinal discomfort after cow milk consumption in healthy subjects. Food Res Int. 2023 Aug;170:112953.
Bellini M, Tonarelli S, Nagy AG, Pancetti A, Costa F, Ricchiuti A, de Bortoli N, Mosca M, Marchi S, Rossi A. Low FODMAP Diet: Evidence, Doubts, and Hopes. Nutrients. 2020 Jan 4;12(1):148.
Hrubisko, M.; Danis, R.; Huorka, M.; Wawruch, M. Histamine Intolerance—The More We Know the Less We Know. A Review. Nutrients 2021, 13, 2228.
Cotton, C.; Raju, S.A.; Ahmed, H.; Webster, G.; Hallam, R.; Croall, I.; Coleman, S.; Trott, N.; Rej, A.; Shiha, M.G.; et al. Does a Gluten-Free Diet Improve Quality of Life and Sleep in Patients with Non-Coeliac Gluten/Wheat Sensitivity? Nutrients 2023, 15, 3461.