-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
由于生活方式改变,不健康饮食引起的糖尿病、肥胖、高血压和心血管疾病等慢性疾病已成为全球公共卫生危机,带来沉重医疗负担并造成现代社会生产力损失。在中国,慢性病患病率持续上升,成年人超重和肥胖率超过50%且无减缓趋势。高血压、糖尿病、慢性阻塞性肺病和癌症患病率也在增加,慢性病死亡占总死亡人数的88.5%(中国居民营养和慢性病状况报告,2020)。
慢性代谢性炎症和相关疾病
Yu S,et al.Pharmacol Ther.2025
慢性代谢炎症是肥胖、糖尿病和心血管疾病等代谢紊乱的共同发病机制,通常与肠道稳态改变相关。其病理过程包括肠道微生物失调、内毒素受体激活、代谢重编程、线粒体功能障碍等。最新研究揭示了一种涉及多个成分和靶标时序性相互作用的新机制。
而健康的饮食有助于降低患慢性病的风险,减缓疾病进展并预防心血管事件。抗炎饮食是健康饮食的主要类型之一,与降低代谢疾病(如心血管疾病和糖尿病)的风险密切相关。地中海饮食作为一种健康饮食模式,以其显著的抗炎特性而闻名。与此同时,还存在着其他一些同样具有健康促进作用的饮食模式,这些不同的健康饮食方式各自具有其特定的营养优势和健康效益。
茶作为中国广泛普及的饮料,已有数千年历史。明代李时珍《本草纲目》记载茶具有祛火、解毒、促进消化的作用,表明其可能具有抗炎相关的肠道调节功能。茶叶含有茶多酚、茶色素、茶多糖等生物活性物质,表现出包括抗氧化、抗炎、抗肿瘤和抗菌特性在内的广泛生物活性。
从体外研究到人群研究的一系列证据表明:表没食子儿茶素没食子酸酯(EGCG)被认为是发挥抗氧化和抗炎作用的最重要成分之一,它在绿茶中最为丰富。在乌龙茶和红茶中,一部分儿茶素在加工过程中通过内源性多酚氧化酶转化为茶黄素和茶红素。而后发酵黑茶特点是茶多糖和茶褐素富集,简单儿茶素减少。这些活性化合物与特定靶标相互作用并表现出独特的剂量-效应关系,产生多种效果。
随着高通量测序和生物信息学技术进步,肠道菌群对人类健康的重要性日益显现。大量研究表明,喝茶可通过调节肠道稳态增强葡萄糖和脂质代谢,肠道微生物群改善有助于预防肥胖、非酒精性脂肪肝、高血糖、高脂血症等代谢紊乱。此外,茶与炎症标志物改善之间已建立联系。
喝茶对代谢的积极影响可能归因于其减少慢性代谢炎症和调节肠道稳态的能力。研究表明,喝茶与肠道微生物群丰度相关,厚壁菌门/拟杆菌门比例发生变化,乳杆菌、双歧杆菌和嗜粘蛋白阿克曼菌丰度显著增加。而Turicibacter或Rombustsia等有害菌则减少。
茶对肠道稳态的直接影响主要针对脂多糖相关途径,包括减少肠道脂多糖合成、抑制其易位以及阻止与TLR4受体结合,从而阻断下游炎症途径。TLR4/MyD88/NF-κB p65通路对抗炎反应至关重要。茶的抗氧化特性通过清除自由基、抑制NLRP3炎性小体和调节Nrf2/ARE活性,增强线粒体功能并减轻相关炎症。茶还通过促进短链脂肪酸合成、激活肠道芳烃受体和法尼醇X受体以及改善肠炎等机制保护肠道屏障。
本文主要探讨了茶、肠道稳态和代谢健康关系,特别关注慢性代谢炎症,炎症指标改善和肠道菌群调节,并研究了这些影响的潜在机制和生物学基础。通过研究茶叶改善慢性代谢炎症的机制,关注其与食物或药物的相互作用,探索安全有效的用量,并调查个体差异对茶干预效果的影响。喝茶最终可能成为调节肠道稳态、抗慢性代谢炎症和促进代谢健康的一种便民通用疗法。
免疫反应与代谢调节是高度相关的,相互依存以维持机体稳态。这种平衡一旦被破坏,就可能导致肥胖、2型糖尿病和心血管疾病等代谢紊乱。
代谢疾病患者体内促炎细胞因子升高
炎症是机体对病原体入侵或细胞损伤等内源性刺激的保护性反应。代谢疾病患者体内促炎细胞因子水平升高,表明炎症过程是代谢疾病发展的重要生物标志物。这些疾病的共同特征是代谢紊乱以及游离脂肪酸和内毒素等代谢物的积累,这些代谢物可激活巨噬细胞并引发炎症反应。
脂肪摄入过多也会导致促炎细胞因子升高
脂肪组织在代谢炎症中发挥关键作用。过量卡路里摄入导致脂肪细胞增大并分泌TNF-α、IL-6和MCP-1等促炎因子,吸引免疫细胞聚集并维持持续的低水平炎症。
肝脏、肌肉等其他器官也参与代谢炎症过程。在非酒精性脂肪肝病中,肝脏脂肪积累引起局部和全身炎症反应;在动脉粥样硬化中,血管壁脂质沉积触发局部炎症,促进斑块形成和发展。
代谢炎症是一种慢性持续状态
急性炎症是机体对损伤或感染的正常生理反应,表现为红肿疼痛,而炎症因子的持续存在和组织损伤则导致慢性炎症。代谢性炎症特指发生在脂肪等代谢组织中的炎症,常由肠道微生物失衡引发,通常呈慢性状态。
已经提出了一个概念,将这种类型的炎症定义为代谢炎症(metaflammation)。Metaflammation的特征是慢性、低度全身炎症,与传统的急性和短暂炎症反应相反。这种情况不仅限于单个代谢组织;相反,它涉及全身的多个代谢器官,并与各种代谢紊乱有关。
茶具有抗炎作用
慢性代谢性炎症的管理需要药物干预和生活方式改善相结合。二甲双胍和噻唑烷二酮类药物已证实能提高胰岛素敏感性并降低炎症水平。健康的生活方式选择同样有助于减轻炎症反应。
膳食炎症指数通过定量建模评估饮食对C反应蛋白、白细胞介素和肿瘤坏死因子等炎症生物标志物的影响。
茶被发现具有抗炎作用,其主要成分槲皮素、花青素和表儿茶素均具有抗炎特性。抗氧化活性是茶发挥药理作用的关键。研究发现,膳食抗氧化质量评分和综合膳食抗氧化指数与IL-1β、TNF-α等炎症因子水平呈显著负相关,提示食物抗氧化活性与抗炎生物途径间存在相互作用。
因此,慢性代谢性炎症的治疗策略应超越单一疾病管理,重点关注整体抗炎和代谢健康的改善。
肠道稳态依赖于肠道微生物群、肠上皮和宿主免疫系统之间的复杂相互作用,其失衡与疾病发生密切相关。(图2)
◮ 肠道微生物失调和慢性炎症会相互加剧
不均衡饮食或抗生素滥用可破坏肠道微生物群,导致脂多糖等病原体相关分子模式释放。这些分子激活宿主免疫细胞受体,引发炎症并启动可能导致慢性炎症的级联反应。炎症过程损害肠道屏障完整性,增加其通透性,促进细菌和代谢物进入血液循环。这种易位进一步刺激免疫系统,使炎症反应持续存在。同时,炎症微环境抑制有益菌生长,促进有害菌增殖,加剧生态失调并维持慢性炎症。
肠道屏障的损伤促进慢性代谢炎症
Yu S,et al.Pharmacol Ther.2025
代谢性疾病,如2型糖尿病、肥胖和脂肪肝,通常与肠道菌群失调一起出现。肠道炎症环境促使有害细菌和代谢物从受损屏障释放入循环系统,引发慢性全身炎症并推动疾病进展。炎症性肠病作为免疫介导的肠道炎症,其患病率与代谢综合征同步增加,可能具有共同的环境致病因素。两者的潜在致病机制均涉及肠道微生物群改变和宿主对细菌衍生代谢物的异常处理。
而膳食纤维、类黄酮等饮食成分有助于维持肠道稳态并改善代谢健康。其作用机制包括:调节肠道菌群以减少内毒素产生;调控巨噬细胞等免疫细胞以控制炎症;增强紧密连接蛋白以保护屏障功能,防止内毒素转移;确保适当的营养利用和能量平衡。
▸ 肠道屏障对肠道稳态的影响
肠道屏障是由紧密连接蛋白连接的肠上皮细胞构成的机械屏障,结合粘液、胃酸、胆汁等化学屏障,肠道淋巴组织中免疫细胞形成的免疫屏障,以及肠道微生物群提供的生物屏障,共同构成维持肠道内稳态的复杂防御系统。
在病理状态下,肠道稳态被破坏,肠道屏障受损,促使脂多糖等细菌内毒素转移入血。异常的屏障功能还会促进有害细菌增殖,干扰肠道相关免疫细胞的稳态和正常功能,引发慢性代谢炎症。
◮ 肠道屏障受损会导致肠道稳态被破坏
在肠炎的情况下,肠道稳态被破坏,并激活全身和肝脏炎症,促进肝纤维化。紧密连接蛋白在粘膜愈合中发挥关键作用,其异常表达是炎症性肠病(IBD)发病进展的重要因素。
短链脂肪酸(SCFA)对肠上皮细胞的生长和修复至关重要。SCFA可结合并抑制组蛋白脱乙酰酶,抑制促炎基因表达,并通过促进调节性T细胞分化和增殖来增强其免疫抑制功能。研究还发现,SCFA能抑制脂多糖诱导的NF-κB信号通路,减少IL-1β、IL-6和NO等炎症介质产生,并抑制诱导型一氧化氮合酶(iNOS)活性。
◮ 色氨酸代谢产生的吲哚丙酸增强上皮屏障
NF-κB和缺氧诱导因子1-α(HIF-1α)作为脂多糖或活性氧下游的核受体,与炎症密切相关。G蛋白偶联受体、法尼醇X受体(FXR)、芳香烃受体(AhR)和过氧化物酶体增殖物激活受体(PPAR)通过抑制NF-κB通路或促进抗炎因子表达来保护肠道屏障。
AhR可被多环芳烃和色氨酸代谢物激活,对免疫细胞正常功能至关重要。它通过支持调节性T细胞生长和产生抗炎白细胞介素-22来减少炎症,并通过加强紧密连接屏障维护上皮细胞健康。肠道色氨酸代谢产生的吲哚丙酸通过AhR或孕烷X受体激活免疫系统,可减少肠道炎症,增强上皮屏障,抑制脂质积累并缓解非酒精性脂肪肝症状。体循环中吲哚丙酸水平可能还有助于预测非酒精性脂肪性肝病(NAFLD)、2型糖尿病(T2DM)和心血管疾病(CVD)风险。
▸ 脂多糖促炎途径对肠道稳态的影响
◮ 肠道屏障受损时脂多糖会诱导全身炎症反应
内毒素是革兰氏阴性菌细胞壁的主要成分,由脂多糖(LPS)构成。高糖高脂饮食会增加肠道革兰氏阴性细菌比例并促进LPS产生,LPS可通过受损的肠道屏障易位进入循环,转运至脂肪和神经系统等组织,诱导全身炎症反应。
LPS信号传导与神经退行性、代谢性和心血管等慢性炎症性疾病的病理生理学密切相关。LPS依次转移至CD14分子和TLR4-跨膜蛋白2复合物,随后募集MyD88和白细胞介素-1受体相关激酶,最终激活NF-κB或MAPK通路。LPS信号通路激活诱导COX-2、TNF-α、IL-1β、IL-6、iNOS等炎症基因表达。注:MAPK通路与NF-κB通路相互作用协同调节这些炎症基因的表达。
脂多糖与TLR4受体结合激活炎性小体
Yu S,et al.Pharmacol Ther.2025
◮ 肠道感染时巨噬细胞也会破坏肠道屏障
经典理论认为肠道巨噬细胞不表达LPS辅助受体CD14或免疫球蛋白受体(CD89、CD16、32、64)。但在肠道感染等病理状态下,血液单核细胞被募集至肠道,LPS通过TLR4受体依赖性或非依赖性途径诱导肠道通透性增加,导致巨噬细胞代谢重编程为炎症表型,进一步破坏肠道屏障并引发外周炎症。
▸ 线粒体功能异常与肠道稳态
线粒体作为细胞能量发生器,通过氧化磷酸化产生ATP。线粒体受损时ATP产生受影响,破坏细胞内能量代谢并引发炎症反应。
当细胞氧化应激或平衡中断时,异常线粒体通透性发生变化,导致功能障碍和线粒体损伤相关分子模式的释放。炎症通过两种途径触发:mtDNA激活的cGAS-STING信号传导,或mtDNA和ROS诱导的炎性小体信号传导。当mtDNA因氧化应激受损时,可逃避自噬并导致强烈炎症反应。
◮ 线粒体功能异常会导致肠道炎症和屏障受损
线粒体在维持肠道稳态中起关键作用,其功能异常会引发炎症甚至肿瘤。IBD患者线粒体表现出电子传递链复合物活性降低、线粒体ROS和mtDNA积累。这些异常与肠道炎症和屏障功能障碍相关,导致上皮屏障完整性丧失并促进细菌入侵。肠道屏障受损时,LPS转移影响肠道外围和周围组织的线粒体,这可能是导致炎症和疾病的重要机制。
肠道糖酵解细菌通过厌氧呼吸代谢碳水化合物,产生琥珀酸等副产品。人体肠道中,拟杆菌属、副拟杆菌属、韦荣氏球菌属、普雷沃氏菌属、双歧杆菌属、乳酸杆菌属和脱硫杆菌属是主要产琥珀酸盐的菌属,而瘤胃球菌属、梭状芽胞杆菌属和考拉杆菌属(Phascolarctobacterium)是主要利用琥珀酸盐的菌属。
注:琥珀酸盐在三羧酸循环中充当代谢中间体,连接线粒体电子传递链。过量琥珀酸盐触发HIF-1α/IL-1β炎症途径激活,将免疫细胞能量代谢与炎症变化联系起来。脂多糖显著提高三羧酸循环中琥珀酸水平,可能增强巨噬细胞对琥珀酸的摄取。相反,降低琥珀酸水平或琥珀酸脱氢酶活性会抑制HIF-1α募集,阻断IL-1β表达并减少活性氧产生。
线粒体释放与损伤相关的分子模式
Yu S,et al.Pharmacol Ther.2025
琥珀酸盐相关炎症反应存在于胃肠道和其他身体组织中。炎症性肠病(IBD)患者血液和肠道组织中检测到琥珀酸水平升高和琥珀酸受体的存在。
近年来,越来越多的研究证据发现了茶对肠道稳态和代谢健康的积极影响。茶饮与肠道微生物群之间的关系被认为在改善糖尿病、血脂异常、肥胖和心血管疾病等方面起着至关重要的作用。
适当喝茶有助于减轻2型糖尿病、肥胖
下表中总结了目前关于茶的人群和临床研究。四项元分析、两项队列研究和横断面研究均表明,饮茶与降低2型糖尿病(T2DM)风险相关,建议摄入量为每日1-4杯。
五项荟萃分析显示,饮茶与空腹血糖、糖化血红蛋白、胰岛素抵抗指数和胰岛素水平的改善相关。三项随机对照试验和荟萃分析表明,茶对T2DM患者血脂控制的影响主要体现在甘油三酯、HDL-C、TG和血清脂质载蛋白浓度的改善。两项随机对照试验和荟萃分析显示,饮茶与体重、腰围、BMI和体脂的显著降低相关。一项荟萃分析表明,饮用绿茶显著降低循环C反应蛋白水平。
五项荟萃分析和一项系统评价证实了茶和茶提取物的调脂作用,汇总结果显示总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)显著改善,说明茶作为肥胖干预和预防措施是可行的。
茶的减肥效果在较高剂量下更明显,如每日3-4杯绿茶、5000mg/天乌龙茶、1000mg/天普洱茶等。长期饮用效果更佳,如绿茶超过两个月、乌龙茶超过六周、普洱茶超过三个月。
还有四项剂量反应分析和荟萃分析及一项队列研究表明,饮茶与降低冠心病和中风等心血管疾病风险相关。
茶对人代谢健康影响的研究
Yu S,et al.Pharmacol Ther.2025
茶调节肠道微生物群并维持肠道稳态
九项随机对照试验证明茶具有调节肠道微生物群、减轻肥胖或高脂饮食引起的肠道微生态障碍的能力。这主要通过增加肠道微生物群丰度和改变菌群群落结构实现,如F/B比值变化,乳酸菌、双歧杆菌和嗜粘蛋白阿克曼菌(A.muciniphila)等有益菌属显著增加。
茶的健康促进作用源于其与肠道微生物群的相互作用,后者在维持肠道稳态中起关键作用。现有人群研究既检查了急性炎症的传统方面,也涉及慢性炎症相关内容。茶对增强慢性代谢性疾病肠道稳态的影响可能在慢性代谢炎症治疗中发挥重要作用。
在肥胖和非酒精性脂肪性肝病等代谢性疾病中,肠道微生物群的组成和功能发生改变。病原菌增加导致肠道屏障受损,随后通过肠道代谢轴引发炎症。此外,肠道微生物产生的特定代谢物与宿主酶相互作用,调节代谢器官或组织中的炎症和基因表达。
▸ 茶通过调节肠道菌群改善代谢和炎症
研究证据表明,不同的茶表现出与保护肠道屏障相关的抗炎作用。喝茶有助于改善肠炎对肠道上皮屏障的损害,在非炎症情况下保护上皮屏障,并可能影响AhR、FXR和PPAR等核受体相关通路。
◮ 喝茶增加了AKK菌等有益菌并展现抗炎作用
绿茶和乌龙茶已被证明对改善肠炎有积极作用。在绿茶粪便移植结肠炎小鼠中,嗜粘蛋白阿克曼菌或乳球菌等有益菌增加,Turicibacter或Rombustsia等有害菌减少。
结肠炎小鼠实验显示,绿茶和黑茶增加嗜粘蛋白阿克曼菌、乳杆菌和双歧杆菌比例,减少拟杆菌属。此外,紧密连接蛋白水平显著增加,增强肠道屏障并改善炎症。陈年乌龙茶通过调节氧化应激和炎症因子,上调肠道紧密连接蛋白表达(Occludin、Claudin-1、ZO-1和Mucin 2)来改善溃疡性结肠炎。它通过刺激与氨基酸、脂肪酸和胆汁酸代谢物相关的代谢途径发挥抗炎作用。
此外,Sutterella、Clostridium、Mucispirillum、Oscillospira和Ruminococcus已被确定为影响炎症发展和缓解的关键细菌。铁观音茶已被发现通过减少促炎细胞因子(如白细胞介素-4、干扰素-γ、白细胞介素-17 和转化生长因子)同时增加抗炎细胞因子 IL-10 对炎症产生积极影响。铁观音还抑制大肠埃氏菌属-志贺氏菌属(Escherichia-Shigella)等有害细菌,并增加Lachnospiraceae_NK4A136_group等有益细菌的存在,这有助于缓解结肠炎。
◮ 茶促进短链脂肪酸的产生并降低脂多糖
喝茶可以纠正肥胖或癌症等各种慢性疾病中出现的肠道微生物失调。它还影响参与代谢过程的细菌生长,例如影响脂多糖的水平或调节炎症因子的产生。
黄叶绿茶干预高脂饮食小鼠粪便菌群移植实验导致 unclassified_Muribaculaceae的增加和Colidextribacter的减少,以及抗肥胖作用。绿茶、乌龙茶和红茶中的儿茶素均显著改善高脂饮食小鼠的肥胖、减轻低度炎症并预防肝脂肪变性,同时上调 mRNA 和 PPARα 蛋白表达。肠道菌群的变化还包括降低F/B比值和变形菌门丰度。此外,代谢物的调节包括促进短链脂肪酸的产生和降低血液中高水平的脂多糖。
◮ 茶中的儿茶素成分能减轻炎症并改善代谢
使用宏基因组学对粪便样本的分析表明,所有三种类型的儿茶素都通过影响其结构、组成和蛋白质功能对微生物群产生相似的影响。
具体来说,表没食子儿茶素没食子酸酯(EGCG)增加了乳酸菌等有益肠道细菌的存在,同时降低了肠球菌和肠杆菌科的水平。黑茶(后发酵茶)包括普洱茶、福茶、六宝茶、青砖茶和康砖茶,含茶多糖(TPS)和茶褐素(TB)水平较高,儿茶素含量较低。黑茶提取物通过增加嗜粘蛋白阿克曼菌、普雷沃氏菌、拟杆菌属和拟普雷沃菌属等有益菌,改善肠道环境,降低糖尿病和肥胖风险。
青砖茶有效干预高脂饮食诱导的NAFLD,提高乳酸菌属、Alloprevotella和Ruminalococcaceae水平,降低分枝杆菌属(Mycobacterium)水平,平衡初级胆汁酸与次级胆汁酸比例,改善脂质代谢并减少炎症。
福茶中的茶多酚和茶褐素(TB)通过靶向AhR途径相关肠道菌群(如乳酸菌)缓解溃疡性结肠炎(UC),促进色氨酸向I3A的微生物转化激活AhR。福茶多糖缓解UC机制相似。TB激活肠道FXR抑制小肠胆盐水解酶活性,该酶会将初级胆汁酸转化为脱氧胆酸和石胆酸等炎性次级胆汁酸。而TB减少次级胆汁酸产生,促进糖脱氧胆酸等抗炎胆汁酸生成,调节肠道屏障功能,防止有害物质进入肠壁并降低全身炎症风险。
▸ 茶的肠道代谢物及其抗炎特性
由于茶已显示出不同程度的抗炎作用,其代谢物也可能表现出抗炎生理活性,因此茶叶微生物代谢物研究具有重要意义。
◮ 茶代谢产生的酚酸和儿茶素等物质具有抗炎活性
茶黄素在肠道中的主要代谢产物是酚酸,通过微生物酶作用产生没食子酸等代谢物,没食子酸在体外和体内均具有抗炎活性。儿茶素化合物属于黄烷-3-醇基,大多数可到达结肠被肠道菌群代谢,经历环裂解、还原、脱羧、β氧化和二羟基化反应。羟基苯基-γ-戊内酯(DHPV)可进一步转化为更小的酚酸,在IEC-6细胞模型中抑制脂多糖诱导的IκBα磷酸化和降解,显示抗炎潜力。
注:茶黄素是茶叶中重要的活性成分,主要存在于发酵茶(如红茶)中,由儿茶素氧化聚合形成。
4-羟基苯乙酸是小鼠粪便和血浆中最丰富的茶多酚代谢物。表儿茶素和主要结肠酚酸可防止高葡萄糖和脂多糖诱导的近端肾小管细胞炎症,表儿茶素和2,3-二羟基苯甲酸抑制促炎细胞因子(TNF-α、IL-6和MCP-1)升高。口服或腹膜内给予表没食子儿茶素没食子酸酯(EGCG)形成的半胱氨酰代谢物在LPS刺激的RAW264.7细胞中将异常花生四烯酸和NO恢复至正常水平,表现出抗炎活性。
茶及其成分的抗炎特性及影响的肠道菌群
Yu S,et al.Pharmacol Ther.2025
◮ 茶中的咖啡因、茶碱等生物碱也具有抗炎作用
茶中主要生物碱咖啡因、可可碱和茶碱具有抗炎作用。咖啡因通过控制NF-κB激活和MAPK磷酸化减少RAW264.7细胞炎症反应。茶碱将抗炎细胞因子IL-10自发产生提高2.8倍,抑制人肺上皮细胞中NF-κB活化和IL-6产生。可可碱抑制IL-1β诱导的软骨细胞NF-κB活性,改善ROS、COX-2和iNOS表达,抑制TNF-α和MCP-1产生。
茶多糖(TPS)具有复杂化学结构,对胃和小肠消化具有抵抗力,但可被大肠肠道菌群利用。虽然TPS代谢物研究有限,但已证明可调节肠道微生物群组成和丰度,增加短链脂肪酸产生,增强免疫反应,维持肠道功能。不同人群肠道环境和体内平衡差异导致茶叶成分代谢能力不同,可能影响抗炎能力。
下表概述了茶可以减轻炎症的几种方式。在目前的研究中,重点是探索黑茶、绿茶和乌龙茶等各种茶的抗炎特性。
茶可改善肠道稳态和慢性代谢炎症
Yu S,et al.Pharmacol Ther.2025
▸ 抑制脂多糖炎症通路
茶饮通过多组分多靶点方式抑制肠道脂多糖(LPS)通路,调节肠道微生物群,抑制LPS与TLR4受体结合或阻断LPS激活的下游炎症途径。主要功能成分包括茶多酚、茶黄素(TF)、茶褐素(TB)、咖啡因和茶氨酸。
◮ 茶抑制脂多糖下游通路,降低炎症水平
福茶、绿茶和乌龙茶通过调节肠道菌群、抑制脂多糖合成,改善小鼠血脂异常、肝脂肪变性和炎症反应,缓解高脂肪饮食和酒精诱导的肝损伤。绿茶提取物降低肝脏TLR4表达预防酒精相关肝炎,TLR4被确定为潜在核心靶点。
慢性炎症损害PI3K/AKT胰岛素信号通路,引起胰岛素抵抗。福茶干预8周有效控制高脂肪饮食引起的体重增加、葡萄糖代谢问题和器官脂肪堆积,减少氧化应激。免疫组织化学分析显示,下调NF-κB表达,抑制肝脏TNF-α、IL-1β和IL-6表达,使肝组织中IκB-α、JNK、AKT和PI3K水平正常化。
绿茶和红茶对结肠炎小鼠研究中,抑制脂多糖下游TLR4/MyD88/NF-κB信号通路,降低血清IL-1β、IL-6和TNF-α水平,增强抗炎因子IL-10表达。10mg/kg成熟普洱茶(相当于人体7g/60kg/天)产生优异结果,可作为结肠炎辅助治疗。富硒乌龙茶抑制NF-κB通路和MAPK促炎通路中p38、ERK和JNK磷酸化。
◮ 靶向抑制TLR4通路,降低TNF-α、IL-6等炎症因子
药理学分析确定TLR4为表儿茶素、咖啡因、EGCG等茶活性成分作用的中心靶标。EGCG通过抑制TLR4/MyD88/NF-κB炎症通路提高艰难梭菌感染小鼠存活率,与低剂量组相比,高剂量组在肠道和血清水平上的抗炎作用更为明显。
在肝损伤小鼠中,发现EGCG抑制 TLR4/MyD88/NF-κB 通路的激活。它还降低了TNF-α、IL-6和IL-1β等炎症标志物的水平,同时促进肝脏代谢组等变化。这导致结肠中的炎症以及全身和肝脏炎症显著减少。
茶黄素(TF)、茶褐素(TB)和茶氨酸(TA)主要通过阻断下游信号传导抑制脂多糖通路。TF和茶黄素-3,3′-没食子酸酯(TFDG)抑制NF-κB,下调COX-2、TNF-α、iNOS、ICAM-1、NO等促炎介质表达。TB通过抑制NF-κB和MAPK通路减轻肝损伤和炎症。
生普洱茶在调节血糖、减少炎症方面更有效,成熟普洱茶在抑制脂肪分解相关基因和调节肠道菌群方面更佳。乌龙茶茶氨酸通过抑制MEK-ERK磷酸化减少炎症。
◮ 茶多糖被肠道微生物利用促进短链脂肪酸产生并抑制脂多糖易位
茶多糖(TPS)主要作为肠道微生物的一种营养物质,在调节肠道微生态方面发挥重要作用。它们通过改变肠道细菌的组成和丰度来促进产生短链脂肪酸的细菌的生长。这种改变增强了SCFA的产生并降低了炎症因子的水平,而SCFA可以进一步减少脂多糖(LPS)的产生。TPS通过促进SCFA的肠道合成和激活保护肠道屏障的信号通路来抑制LPS易位。
然而,TPS与脂蛋白合成途径减弱间存在U形定量关系,约7克/天剂量显著抑制LPS相关通路,高剂量TPS则增强毒素-蛋白质途径,降低对肝脏脂肪堆积的保护作用。在RAW264.7巨噬细胞中,高剂量TPS显著增加IL-1β等炎症因子表达。由于TPS增加肠道双歧杆菌增殖并可能促进琥珀酸盐合成,过量摄入TPS可能导致琥珀酸盐水平升高,触发琥珀酸盐介导的炎症途径。
▸ 增强肠道和代谢部位的线粒体功能
最近的研究还表明,茶提取物或某些成分有可能改善细胞和动物模型中与炎症相关的线粒体功能障碍。这可以通过调节能量代谢和减少氧化应激来增强线粒体功能,最终导致炎症反应的减少。
◮ 茶多酚减少氧化应激和炎症状况
非酒精性脂肪性肝病(NAFLD)发展中,活性氧过多引起的氧化应激起催化作用,改善氧化应激和平衡氧化还原水平是治疗策略。绿茶含EGCG,通过减少氧化应激及相关代谢问题、炎症、纤维化和肿瘤形成预防和减缓NAFLD发展。与茶多糖和茶褐素相比,茶多酚对活性氧抑制作用更强,通过阻断Cytc/Cleaved-caspase-3信号通路显示最强抗凋亡作用和线粒体保护功能。
NLRP3炎症小体异常激活与多种炎症状况相关。表没食子儿茶素没食子酸酯(EGCG)通过阻止肺部NLRP3炎性小体激活防止急性胰腺炎肺损伤,消除线粒体活性氧及其氧化产物。茶黄素抑制NLRP3炎性小体组装和焦亡,通过改善线粒体功能和减少线粒体活性氧产生实现。口服茶黄素有效减少尿酸钠晶体诱导的小鼠腹膜炎,提高脓毒症小鼠存活率,显著减少IL-1β等炎性细胞因子。
◮ 增加线粒体解偶联蛋白1表达,降低炎症因子
茶色素和茶多糖通过影响肠道-线粒体通路促进脂肪褐变和产热。富含茶黄素、茶褐素、茶红霉素的红茶提取物促进棕色脂肪组织产热和白色脂肪组织褐变,增加线粒体解偶联蛋白1(UCP1)表达,防止体重增加,改善脂肪分布和葡萄糖代谢。
茶多糖显示抗肥胖作用,与肠道微生物丰度变化相关,通过增加产热基因表达引起脂肪褐变和产热活性。TF-2抑制COX-2基因表达,降低TNF-α、iNOS、ICAM-1和NF-κB水平,在炎症模型中显示抗炎作用。
虽然研究表明茶与线粒体在抗炎方面存在潜在联系,但需要更多研究了解具体分子机制和信号通路,特别是免疫细胞中脂多糖相关途径与线粒体能量代谢途径的相互作用。
小编的话
茶多糖(TPS)、多酚、茶氨酸(TA)、茶褐素(TB)、茶黄素(TF)及表没食子儿茶素没食子酸酯(EGCG)这些成分通过改善肠道屏障、抑制脂多糖易位发挥关键作用,增强抗炎效果,表现为短链脂肪酸和紧密连接蛋白含量增加。
茶成分除抑制NF-κB或MAPK等经典促炎途径外,还改善线粒体功能,抑制过度氧化,正向调节AhR和FXR核受体,产生协同抗炎作用。茶成分还调节肠道菌群,促进嗜粘蛋白阿克曼菌、Alloprevotella、Alistipes、双歧杆菌和毛螺菌科增殖,抑制拟杆菌门、变形菌门和Allobaculum,降低F/B比。
本文探讨了茶对慢性代谢炎症和肠道稳态的调节作用。研究表明,慢性代谢炎症已成为糖尿病、肥胖、心血管疾病等代谢性疾病的共同发病机制,而肠道稳态失衡是其重要诱因。茶作为一种传统饮品,通过其丰富的生物活性成分,包括茶多酚、茶黄素、茶褐素、茶多糖等,能够有效调节肠道微生物群组成,改善肠道屏障功能,抑制脂多糖介导的炎症通路,从而发挥抗慢性代谢炎症的作用。
研究证据显示,喝茶能够显著增加有益菌群如乳酸菌、双歧杆菌和嗜粘蛋白阿克曼菌的丰度,减少有害菌群,优化厚壁菌门/拟杆菌门比例,促进短链脂肪酸产生,增强肠道屏障完整性。这些变化直接转化为代谢健康的改善,包括血糖控制、脂质代谢优化、体重管理和炎症标志物的降低。
未来健康管理将越来越重视肠道微生物群的核心地位。肠道微生物群不仅是消化系统的重要组成部分,更是连接饮食、代谢、免疫和神经系统的关键枢纽。随着高通量测序技术和生物信息学的快速发展,我们对肠道微生物群功能的理解将更加深入,这将为精准健康干预提供科学基础。
肠道微生物群在未来健康改善中将发挥以下重要作用:
个性化营养指导:基于个体肠道菌群特征制定个性化饮食方案。
疾病预防:通过调节菌群组成预防代谢性疾病的发生。
治疗辅助:作为传统治疗方法的重要补充手段。
而茶作为一种安全、便捷且具有悠久历史的天然产品,在未来肠道微生物群调节方面具有巨大潜力:不同类型的茶(绿茶、红茶、乌龙茶、黑茶)具有不同的功能成分组合,未来可根据个体肠道菌群特征和健康状况,精准选择最适合的茶类和用量。将茶饮与益生菌、膳食纤维等其他肠道调节手段结合,构建多元化的肠道健康管理方案。
主要参考文献
Yu S, Zhu X, Zhao X, Li Y, Niu X, Chen Y, Ying J. Improvement of chronic metabolic inflammation and regulation of gut homeostasis: Tea as a potential therapy. Pharmacol Ther. 2025 May;269:108828.
Agirman G, Yu KB, Hsiao EY. Signaling inflammation across the gut-brain axis. Science. 2021 Nov 26;374(6571):1087-1092.
Al Bander Z, Nitert MD, Mousa A, Naderpoor N. The Gut Microbiota and Inflammation: An Overview. Int J Environ Res Public Health. 2020 Oct 19;17(20):7618.
Asbaghi O, Fouladvand F, Ashtary-Larky D, Bagheri R, Choghakhori R, Wong A, Baker JS, Abbasnezhad A. Effects of green tea supplementation on serum concentrations of adiponectin in patients with type 2 diabetes mellitus: a systematic review and meta-analysis. Arch Physiol Biochem. 2023 Apr;129(2):536-543.
Asbaghi O, Fouladvand F, Gonzalez MJ, Aghamohammadi V, Choghakhori R, Abbasnezhad A. The effect of green tea on C-reactive protein and biomarkers of oxidative stress in patients with type 2 diabetes mellitus: A systematic review and meta-analysis. Complement Ther Med. 2019 Oct;46:210-216.
Blander JM, Longman RS, Iliev ID, Sonnenberg GF, Artis D. Regulation of inflammation by microbiota interactions with the host. Nat Immunol. 2017 Jul 19;18(8):851-860.
Cao SY, Zhao CN, Gan RY, Xu XY, Wei XL, Corke H, Atanasov AG, Li HB. Effects and Mechanisms of Tea and Its Bioactive Compounds for the Prevention and Treatment of Cardiovascular Diseases: An Updated Review. Antioxidants (Basel). 2019 Jun 6;8(6):166.
Chen SY, Li YP, You YP, Zhang HR, Shi ZJ, Liang QQ, Yuan T, Xu R, Xu LH, Zha QB, Ou-Yang DY, He XH. Theaflavin mitigates acute gouty peritonitis and septic organ injury in mice by suppressing NLRP3 inflammasome assembly. Acta Pharmacol Sin. 2023 Oct;44(10):2019-2036.
谷禾健康
慢性肾病(CKD)在全球具有高发病率,并且发病率还在不断上升。CKD进展的机制之一涉及肾脏与肠道之间紊乱的器官间关系,被称为肾-肠轴。
在慢性肾病(CKD)中,两种病理性肠道状况——尿毒症性菌群失调(肠道微生物组成紊乱)和肠道通透性增加——促进了CKD的进展。
菌群失调与肠道源性尿毒症毒素产生增加、肠道渗漏和慢性系统性炎症相关,导致尿毒症恶化,进而加重肠道状况。这种恶性循环应该成为CKD治疗策略的目标。
对尿毒症性菌群失调的调节,包括益生元、益生菌和合生元,一直是典型的治疗方法,尽管关于其有效性的临床证据不足。一些非抗生素药物对人类肠道细菌有影响,这被认为在其肾功能临床疗效中发挥作用。
营养疗法,包括低蛋白饮食、膳食纤维、地中海饮食和全谷物,对肠道微生物群组成产生积极影响,并已与CKD风险降低相关联。
目前正在探索使用后生元、微生物组测序技术和粪菌移植等新策略来治疗或改善慢性肾病。
近年来,肾脏和肠道之间的器官间关系引起了关注。这种关系,被称为肾-肠轴,涉及肠道激素如生长激素释放肽和肠促胰岛素对肾脏的作用,以及尿毒症毒素吸收对肾功能的影响。
研究表明,在慢性肾脏疾病(CKD)中,某些肠道基因的表达和肠道微生物组成会发生改变。在终末期肾脏疾病患者中也观察到了类似的肠道微生物群落变化。
我们在之前的文章中也讲过:
肾-肠轴代表了一种以肾脏为中心的新型器官间关系,并且越来越被认为是CKD的潜在治疗靶点。
肾肠轴
Wakino S,et al.Nutrients.2025
✔ 肾功能下降时肠道微生物产生的毒素在体内积累
随着肾功能下降,由肠道细菌产生的尿毒症毒素在体内积累。已确定的毒素包括:
-对甲酚硫酸酯(pCS)
-吲哚硫酸酯(IS)
-三甲胺-N-氧化物(TMAO)
-二甲基甘氨酸
-戊二酸
这些毒素都与心血管事件有关。其中,吲哚硫酸酯(IS)和对甲酚硫酸酯(pCS)已知会增加心血管组织中的氧化应激,导致组织损伤。
这些毒素被认为源于肠道,是由于肾衰竭相关的肠道微生物群落改变所致。此外,研究表明肾衰竭时肠道通透性增加,这一过程由紧密连接蛋白如claudin、occludin和zonula occludens-1(ZO-1)调控。在慢性肾病中,这些维持上皮完整性的紧密连接蛋白表达下调。
肠道衍生的尿毒症毒素
Wakino S,et al.Nutrients.2025
✔ 肾衰竭患者存在肠道菌群失调和肠漏
在慢性肾衰竭大鼠模型中,观察到肠道内拟杆菌属增加,同时吲哚(肾毒素IS的前体)产生增加。相反,乳酸杆菌属丰度下降,导致toll样受体表达减少,继而紧密连接蛋白水平下降。紧密连接蛋白减少导致肠道通透性增加,促进吲哚的系统性吸收,吲哚随后在肝脏中转化为吲哚硫酸酯(IS)并促进系统性炎症。
IS水平升高与细胞因子产生增加相关,特别是白细胞介素-6(IL-6),这与CKD中心血管并发症风险增加相关。因此,肠道的两个关键病理变化——尿毒症菌群失调和肠道通透性增加(肠漏)——可能导致肾衰竭中的心血管事件。
肾功能衰竭中肠道环境的变化
Wakino S,et al.Nutrients.2025
菌群失调存在几种潜在机制:
其中一种是进行性肾功能衰竭中血液尿素或尿酸浓度升高。肠道细菌通过肠道分泌物接触尿素,导致尿素通过细菌尿素酶转化为氨。这种高浓度的尿素导致含有尿素酶的细菌家族过度生长。与健康对照组相比,终末期肾病(ESRD)患者体内产生尿酸酶和吲哚及对甲酚形成酶的细菌家族数量增加。
<来自:谷禾肠道菌群健康检测数据库>
关于对甲酚,我们在之前的文章中也写过:对甲酚——自闭症辅助诊断和干预的关键指标
同样,慢性肾病中尿酸分泌增加也导致产生尿酸酶的细菌种类增加。然而,在人类中,有时无法将尿毒症的影响与个体间差异、合并症以及饮食和药物干预的影响区分开来。
研究型试验使用实验性慢性肾病大鼠模型,显示5/6肾切除导致细菌组成丰度与对照动物相比有显著差异。这些实验证据支持菌群失调是慢性肾病的一种影响的结论。
✔ 菌群代谢物短链脂肪酸对肾脏有保护作用
肠道菌群还通过产生如短链脂肪酸(SCFAs)等代谢物对肾脏损伤起保护作用。急性肾损伤动物模型研究显示,SCFA给药可减轻肾脏损伤。SCFAs有助于维持肠屏障,促进调节性T细胞(Tregs)分化和增殖,这些细胞抑制炎症并调节肠道免疫。SCFAs还增强胰高血糖素样肽-1(GLP-1)分泌,这种肠源性激素调节葡萄糖和脂质代谢并具有抗炎作用。
在慢性肾病中,由于富含钾食物的饮食限制以及与产毒素微生物群的竞争,产生SCFA的肠道细菌数量减少,加剧疾病进展。研究显示,除产生尿毒症毒素的细菌增加外,产生SCFA的物种如乳酸杆菌、普雷沃菌和双歧杆菌数量减少。
这些变化归因于多种因素:包括尿毒症毒素积累、代谢性酸中毒、口服铁制剂和螯合剂对肠道功能的影响、缺血引起的肠道功能障碍,以及纤维摄入不足和便秘导致的肠道通过时间延长。
最近小鼠慢性肾病模型研究确定了新途径:普拉梭菌(Faecalibacterium prausnitzii)可能有助于肾功能恢复。这种效果与丁酸盐介导的G蛋白偶联受体43(GPR-43)在肾脏中的信号激活相关,突显了慢性肾病管理的潜在治疗途径。
目前有哪些通过针对肾-肠轴相互作用机制来改善慢性肾病的治疗干预策略和方法,以及这些策略在临床实践中的应用现状如何?
1
益生菌、益生元、合生元
✔ 通过调节肠道菌群有助于降低肾脏毒素
肾脏-肠道轴治疗慢性肾病主要通过改善菌群失调和减少尿毒症毒素发挥作用。益生元、益生菌和合生元虽能降低血液中吲哚硫酸盐和对-甲酚硫酸盐等毒素,但缺乏改善肾功能和生存率的证据。
近期研究显示,乳酸菌和双歧杆菌对慢性肾病G3期患者的干预改善了铁代谢、炎症和脂质代谢,但未显著影响肾小球滤过率(eGFR)。对血液透析糖尿病患者使用益生菌改善了葡萄糖稳态和营养状态,但同样未能改善肾功能。
注:肾小球滤过率(eGFR)是评估肾功能的核心指标,反映肾脏每分钟过滤血液的能力,用于早期发现肾功能损伤和监测慢性肾病进展。
补充产生短链脂肪酸的微生物和调节肾脏菌群可能有助于减缓慢性肾病进展,但目前证据显示益生菌虽能降低尿毒症毒素,却不改善肾功能。2022年意大利一项研究发现,在低蛋白饮食基础上添加益生菌12周可减少尿毒症毒素和药物剂量,但尿蛋白或eGFR无显著改善,仅情感功能有所提升。
SYNERGY II研究中,合生元补充12个月改变了肠道菌群,与肾小球滤过率(eGFR)下降相关,但两组在心血管功能、毒素水平、血压等方面无显著差异。
✔ 调整肠道菌群可降低炎症标志物,配合饮食干预效果更佳
近期荟萃分析显示益生元、益生菌或合生元在慢性肾病管理中的证据支持有限。一项涵盖16项随机对照试验的分析显示,这些干预对慢性肾病患者血清尿素和尿毒素几乎无影响。虽然合生元增加了双歧杆菌丰度,但临床意义不明确。另一项透析患者分析显示益生菌补充可降低炎症标志物并提高高密度脂蛋白水平。
尽管结果矛盾,生物制剂治疗仍有前景。研究局限包括试验时间短、样本量小、菌株差异大等导致结果不一致。改进建议包括延长试验时间、基于科学证据选择菌株。
需要认识到肾-肠轴只是慢性肾病病理的一部分,尿毒症毒素积累还受肾脏排泄减少等因素影响,慢性肾病进展涉及多种病理机制。单纯调节微生物群效果可能有限,需结合全面营养治疗来改善菌群失调。
2
非抗生素药物的影响
多种药物具有益生元效果,包括许多非抗菌药物都能改变肠道菌群。
SGLT-2抑制剂,中文名为钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂,可以抑制肾脏对葡萄糖的重吸收,使过量的葡萄糖从尿液中排出,降低血糖。
✔ 卡格列净提升乳杆菌水平并减少尿毒症毒素
SGLT-2抑制剂是降血糖药物,通过抑制肾脏糖重吸收增加尿糖排泄。卡格列净对SGLT-2选择性较低,也轻微抑制小肠的SGLT-1。研究发现,在肾切除大鼠中,卡格列净使结肠腔葡萄糖浓度增加,提高了乳酸杆菌水平,增强肠紧密连接蛋白表达,改善了菌群失调和肠漏。
卡格列净主要用于治疗2型糖尿病,可与二甲双胍、二甲双胍/磺酰脲类药联合使用。
此外,卡格列净降低了血液中尿毒症毒素水平,显著减轻了心肌纤维化和血管壁增厚,抑制了相关标志物表达。
✔ 药物会引起肠道菌群变化并影响肠道环境
被称为”肾脏吸尘器”的克里美净AST-120在肾功能衰竭大鼠中显示出改善作用。肾功能不全组拟杆菌增加、乳酸杆菌减少,AST-120治疗后乳酸杆菌增加。同时,治疗后紧密连接蛋白表达和杯状细胞比例得到改善。这表明AST-120通过减少吲哚水平或改变黏蛋白层来改善肠道环境,从而降低血液中吲哚硫酸盐和炎症因子。
研究表明SGLT-2抑制剂和AST-120的部分益处可能通过调节肠道微生物群实现。广泛的药物都能影响肠道菌群,包括针对慢性肾病的药物以及抗糖尿病药二甲双胍、非甾体抗炎药、抗精神病药、质子泵抑制剂、泻药和他汀类药物。这些药物引起的微生物群变化不一定有害,某些情况下反而增强药物疗效。
药物-微生物组-宿主相互作用的研究刚刚兴起,未来可能优化药物治疗并帮助开发新药。
1
低蛋白饮食
膳食成分影响肠道微生物群,蛋白质限制饮食的效果已得到研究。多项研究显示,有益的短链脂肪酸产生菌如乳杆菌科、拟杆菌科和链球菌属数量增加,同时埃格特氏菌(Bacteroides eggerthii)和Roseburia faecis减少,可能降低尿毒素水平。
✔ 蛋白质限制饮食搭配益生元降低尿毒素
由于蛋白质限制饮食对微生物群有积极影响,研究者尝试与肠道菌群干预联合应用。意大利研究给予3-4期慢性肾病患者0.6g/kg标准体重/天蛋白质限制饮食及每日19g菊粉,持续6个月后生活质量评分显示日常功能和整体健康认知改善。
另一项意大利研究也显示代谢作用和功能状态改善,但对肾功能无影响。还有研究显示,蛋白质限制至0.8g/kg体重/天同时补充13.5g β-葡聚糖,虽然肾功能无显著差异,但血液尿毒素有所下降。
✔ 能量摄入足够情况下,低蛋白饮食负面影响较小
关于低蛋白饮食目前有一些担忧,即低蛋白饮食会加剧慢性肾病(CKD)患者的营养不良或蛋白质-能量-消耗状况。不过临床研究已否定这一假设。无论是否补充酮类似物,甚至在老年人群中,低蛋白饮食通过改善代谢性酸中毒或胰岛素抵抗,保护CKD患者免受肌肉退化。
在摄入足够能量的情况下实行膳食蛋白质限制,充足的能量不会导致氨基酸通过酮生成和糖生成途径被降解用于能量生,并维持肌肉蛋白质。因此,对于没有营养状况不良的慢性肾病个体,应优先考虑蛋白质限制,并将其作为个性化营养干预的一部分。一旦引入,应定期监测其营养状况和能量摄入(注意要考虑患者的代谢状况)。
虽然目前对肾功能的影响令人信服,但不能忽视对某些虚弱慢性肾病个体的潜在负面影响。然而,蛋白质限制饮食值得在临床实践中应用。在这种情况下,蛋白质限制饮食最好与协同生物干预结合,以期获得代谢和功能效果。
2
高纤维饮食
膳食纤维被联合国粮农组织/世界卫生组织定义为存在于谷物、种子、蔬菜和水果中的不可消化碳水化合物。欧洲食品安全局将其定义为具有健康益处的不可消化、不可吸收碳水化合物聚合物和木质素。膳食纤维被分为以下四类:
(i)非淀粉多糖
(ii)不可消化多糖
(iii)不可消化淀粉
(iv)木质素
下表中总结了各组的特性:
Wakino S,et al.Nutrients.2025
✔ 膳食纤维可促进肠道细胞蠕动
膳食纤维对整体健康有益,其中一个关键优势是在肠道蠕动中的作用。黏性纤维遇水后形成凝胶,软化粪便并刺激肠道细胞促进蠕动。
✔ 膳食纤维产生短链脂肪酸并具有抗炎作用
更重要的是,纤维为糖分解菌提供能量,这些菌发酵糖类并产生短链脂肪酸(SCFAs)。糖分解菌被认为有益,因其产生的SCFAs为肠道细胞提供能量,增强肠道屏障功能,支持免疫反应,并具有全身抗炎作用。
肠道细菌分为糖分解菌(代谢碳水化合物)和蛋白分解菌(代谢蛋白质和氨基酸)。
此外,糖分解菌抑制蛋白分解菌生长,后者产生腐败性代谢物如吲哚硫酸盐、对甲酚和TMAO。这些代谢物促进炎症并在慢性肾病患者体内积累。抑制蛋白分解菌增殖是膳食纤维的主要益处。
膳食纤维的抗炎特性已通过流行病学研究证实。NHANES III研究显示,每增加10克膳食纤维摄入量,健康个体C反应蛋白水平降低11%,CKD患者则降低38%。健康个体推荐每日纤维摄入量为20-35克,但目前人群摄入量仍不足。
✔ 膳食纤维摄入与慢性肾病发病率成反比
研究表明膳食纤维摄入与慢性肾病发病率呈反比。队列研究发现高纤维摄入者CKD发病率比低摄入者低40-50%,荟萃分析显示素食饮食与更低白蛋白尿和更高肾小球滤过率相关。益生元如菊粉、抗性淀粉等可增加有益菌群,改善肾功能并减少并发症。膳食纤维还可降低血清肌酐和尿毒症毒素水平,但其减缓CKD进展的作用尚需更多研究证实。
肾衰竭饮食中,为限制钾摄入常减少水果蔬菜消费,导致纤维摄入不足。然而,研究发现血清钾与饮食钾摄入关系不强,且摄入更多蔬果的透析患者死亡率更低。因此,对纤维、蔬菜和水果摄入的限制可能弊大于利。
✔ 补充抗性淀粉有助于减少尿毒症毒素及改善肾功能
在膳食纤维中,抗性淀粉(RS)已引起关注。RS是一类在小肠内抵抗消化并到达结肠发酵的淀粉,分为五个亚型(RS1-RS5),如下表所示。
抗性淀粉的分类
Wakino S,et al.Nutrients.2025
实验性慢性肾病模型证明,抗性淀粉(RS)促进双歧杆菌和乳酸菌生长,增强短链脂肪酸产生,并减少肠道尿毒症毒素生成。CKD患者临床研究中,RS补充改变了血液透析患者肠道微生物组成,但未降低系统性尿毒症毒素浓度。
人类研究调查了CKD患者抗性淀粉补充情况,部分研究报告透析患者生化指标改善。荟萃分析显示,抗性淀粉补充可减少尿毒症毒素水平并改善肾功能,但不能减轻CKD患者炎症。
尽管膳食纤维摄入有益,但可能存在缺点,包括氨基酸、维生素B12、铁和锌缺乏。此外,不健康素食饮食通常含有高度加工食品、防腐剂和添加剂,可能对CKD患者有害。因此,专门饮食干预应在营养师指导下个性化定制。
3
全谷物饮食
全谷物富含膳食纤维、植物化学物质、矿物质、抗氧化剂、维生素等有益营养素。高摄入全谷物可降低2型糖尿病、冠心病和癌症风险。与精制谷物相比,全谷物对肠道微生物组成产生积极影响,并发挥抗炎和抗氧化作用,有助于预防各种疾病。
✔ 较低的全谷物摄入与慢性肾病风险增加相关
人群研究表明,相对于精制谷物,较高全谷物摄入与CKD患者心血管疾病、肾衰竭和死亡风险降低相关。值得注意的是,CKD患者易便秘,部分因肠道微生物失调所致,而富含纤维的全谷物可缓解这一问题。
大型队列研究报告了便秘与慢性肾病(CKD)患病率和进展的关联。全谷物有可能预防或减缓CKD进展。
大米是主食,特别在亚洲,也是全球消费最多的谷物之一。在生产过程中,粗米经脱壳得到糙米,再经碾磨去除米糠生产白米。糙米是富含生物活性化合物的全谷物,如类黄酮、酚类、维生素、植物固醇和油脂,这些化合物主要集中在糙米糠层。考虑到全谷物对CKD的有利影响以及糙米的抗炎和抗氧化特性,预期其消费将减轻CKD进展。
4
地中海饮食和其他健康饮食模式
地中海饮食富含蔬菜、水果、鱼类、橄榄油等不饱和脂肪酸,具有多种健康益处。相比之下,西式饮食含红肉、加工食品和精制谷物,富含糖、盐和饱和脂肪。
✔ 地中海饮食有助于改善肾功能
研究显示两种饮食对肠道微生物组成影响不同。地中海饮食促进糖分解细菌增殖,西式饮食有利于蛋白分解细菌生长。观察性研究表明地中海饮食可能通过调节肾-肠轴缓解慢性肾病尿毒症状况。
临床证据有限,但近期研究显示地中海饮食使肥胖和糖尿病患者肾功能下降减缓,减少尿蛋白排泄。另一项研究证明地中海适当平衡饮食有助于维持CKD患者肾功能。
✔ 以植物为主的饮食可能更适合肾病患者
除地中海饮食外,PLADO饮食(植物为主的低蛋白饮食)也被认为适合慢性肾病(CKD)患者,特点是蛋白质摄入0.6-0.8克/公斤/天,至少50%来自植物,避免超加工食品,保持适当能量摄入及低钠摄入。弹性素食饮食也以植物为基础,但可含少量动物制品。虽无相关随机对照试验,但这些植物性饮食增加纤维摄入,改善了肠道微生物群。
关于植物性饮食的担忧包括高钾血症和蛋白质消耗风险,但实际上植物食品中的钾与碱化效应相关,纤维减少便秘,碳水化合物促进钾进入细胞,降低高钾风险。观察性研究表明植物性饮食可减缓CKD进展,用豆类替代红肉与终末期肾病风险降低相关。
尽管通过生物制剂、膳食纤维和全谷物对肾-肠轴的干预效果有限,但饮食模式改变,如转变为限制蛋白质饮食或地中海饮食,对肾功能有效。这种有利效果源于其对预防CKD发生和进展的多方面优势。
地中海饮食含有充足膳食纤维、全谷物,并促进产生短链脂肪酸的糖分解细菌生长。当这种饮食模式持续应用时,其效果可持续。因此,在临床实践中,转变或坚持健康饮食可成为慢性肾病患者的合理治疗策略。
后生元制剂是由灭活微生物及其发酵产物组成的新兴干预措施。2019年,国际益生菌和益生元科学协会将后生元定义为”能够为宿主带来健康益处的非活性微生物或其组分的制剂”。
✔ 微生物靶向治疗减轻炎症和氧化应激
临床前研究已评估了超声处理的副干酪乳杆菌(Lactobacillus paracasei)在高脂饮食诱导的肾损伤以及GABA盐、乳-GABA盐和后生物-GABA盐在急性肾损伤中的作用。虽然这种策略在CKD和透析领域的临床应用仍处于临床前阶段,但一项单中心非随机试点研究显示,20名维持性透析患者接受短链脂肪酸丙酸钠给药后,促炎症参数和氧化应激减少,胰岛素抵抗和铁代谢改善。
✔ 评估微生物组对精准和个性化治疗至关重要
肠道微生物靶向治疗的效果取决于饮食、生活方式、年龄和药物使用的个体差异。为解决这些局限性,微生物组测序技术对实现更精确和个性化干预至关重要。一项使用16S rRNA测序的研究比较了健康对照组与慢性肾病、膜性肾病、IgA肾病、微小变化病和缺血性肾损伤患者,发现肠道微生物组失调与慢性肾病亚型间有强烈相关性。评估每个患者的微生物组对选择和监测针对CKD管理的饮食和生物策略至关重要。
粪便微生物移植(FMT)通过将健康供体的肠道微生物转移到患者体内来恢复微生物平衡。研究发现,FMT减少了IgA肾病小鼠模型中的蛋白尿并改善肾功能。随机对照试验评估胶囊化粪便微生物效果显示,FMT组CKD进展率低于安慰剂组,且FMT组的血清肌酐和尿素氮水平维持稳定。
虽然FMT对CKD或透析患者的临床应用仍处于临床前阶段,但已有一项单中心、双盲、随机、安慰剂对照试验报道。2-4期CKD患者随机接受FMT或安慰剂胶囊治疗6个月后,FMT组患者疾病进展较少。
如前所述,这些治疗策略仍处于早期阶段,尚未形成临床使用的产品或方案。其可行性或适应临床实践的能力有待进一步研究。
我们了解了肾-肠轴、治疗策略及其在慢性肾病(CKD)中的临床意义。关键发现是乳酸杆菌在肾衰竭时水平下降,破坏肠屏障,增加尿毒症毒素前体(如吲哚)侵入,这些毒素导致肾损伤、心血管疾病和全身炎症。
多种药物会影响肠道微生物组成和尿毒症毒素水平。SGLT-2抑制剂卡格列净调节肠道微生物,减少尿毒症毒素;AST-120改善肠道菌群失调,促进乳酸杆菌恢复,降低循环毒素水平,可能保护肾功能。
肾-肠轴背景下的饮食治疗对CKD管理至关重要。虽然食物是基本营养来源,但CKD中排泄和代谢障碍可将某些饮食成分转变为有害物质。营养治疗必须考虑CKD中的肠功能障碍,因为肾衰竭改变肠道微生物、吸收和蠕动。这种变化应纳入饮食治疗考量,表明肾衰竭营养治疗已进入新阶段。
慢性肾病(CKD)临床实践中应考虑肾-肠轴紊乱。通过单一治疗方案(包括生物制剂治疗、蛋白质限制饮食、膳食纤维和全谷物)部分纠正肾-肠轴紊乱,虽可能对患者生活质量有积极影响,但不足以阻止CKD进展。
转向健康整体饮食模式——采用以植物为基础的饮食(如地中海饮食),整合多种针对肾-肠轴的治疗策略,是CKD治疗的合理措施。未来研究还应集中于开发更有效的益生菌、益生元和微生物代谢调节药物,不仅针对CKD,也适用于其他系统性疾病。
主要参考文献
Wakino, Shu, Kazuhiro Hasegawa, Masanori Tamaki, Masanori Minato, and Taizo Inagaki. 2025. “Kidney-Gut Axis in Chronic Kidney Disease: Therapeutic Perspectives from Microbiota Modulation and Nutrition” Nutrients 17, no. 12: 1961.
Yoshifuji, A.; Wakino, S.; Irie, J.; Tajima, T.; Hasegawa, K.; Kanda, T.; Tokuyama, H.; Hayashi, K.; Itoh, H. Gut Lactobacillus protects against the progression of renal damage by modulating the gut environment in rats. Nephrol. Dial. Transplant. 2016, 31, 401–412.
Wong, J.; Piceno, Y.M.; DeSantis, T.Z.; Pahl, M.; Andersen, G.L.; Vaziri, N.D. Expansion of urease- and uricase-containing, indole- and p-cresol-forming and contraction of short-chain fatty acid-producing intestinal microbiota in ESRD. Am. J. Nephrol. 2014, 39, 230–237.
Vaziri, N.D.; Wong, J.; Pahl, M.; Piceno, Y.M.; Yuan, J.; DeSantis, T.Z.; Ni, Z.; Nguyen, T.H.; Andersen, G.L. Chronic kidney disease alters intestinal microbial flora. Kidney Int. 2013, 83, 308–315.
Koh, A.; De Vadder, F.; Kovatcheva-Datchary, P.; Bäckhed, F. From dietary fiber to host physiology: Short-chain fatty acids as key bacterial metabolites. Cell 2016, 165, 1332–1345.
Furusawa, Y.; Obata, Y.; Fukuda, S.; Endo, T.A.; Nakato, G.; Takahashi, D.; Nakanishi, Y.; Uetake, C.; Kato, K.; Kato, T.; et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature 2013, 504, 446–450.
Kasubuchi, M.; Hasegawa, S.; Hiramatsu, T.; Ichimura, A.; Kimura, I. Dietary gut microbial metabolites, short-chain fatty acids, and host metabolic regulation. Nutrients 2015, 7, 2839–2849.
Andrade-Oliveira, V.; Amano, M.T.; Correa-Costa, M.; Castoldi, A.; Felizardo, R.J.; de Almeida, D.C.; Bassi, E.J.; Moraes-Vieira, P.M.; Hiyane, M.I.; Rodas, A.C.; et al. Gut bacteria products prevent AKI induced by ischemia-reperfusion. J. Am. Soc. Nephrol. 2015, 26, 1877–1888.
Chung, S.; Barnes, J.L.; Astroth, K.S. Gastrointestinal microbiota in patients with chronic kidney disease: A systematic review. Adv. Nutr. 2019, 10, 888–901.
Li, H.B.; Xu, M.L.; Xu, X.D.; Tang, Y.Y.; Jiang, H.L.; Li, L.; Xia, W.J.; Cui, N.; Bai, J.; Dai, Z.M.; et al. Faecalibacterium prausnitzii Attenuates CKD via Butyrate-Renal GPR43 Axis. Circ. Res. 2022, 131, e120–e134.
Schepers, E.; Glorieux, G.; Vanholder, R. The gut: The forgotten organ in uremia? Blood Purif. 2010, 29, 130–136.
Simeoni, M.; Citraro, M.L.; Cerantonio, A.; Deodato, F.; Provenzano, M.; Cianfrone, P.; Capria, M.; Corrado, S.; Libri, E.; Comi, A.; et al. An open-label, randomized, placebo-controlled study on the effectiveness of a novel probiotics administration protocol (ProbiotiCKD) in patients with mild renal insufficiency (stage 3a of CKD). Eur. J. Nutr. 2019, 58, 2145–2156.

谷禾健康
全球过敏性疾病和多重共病负担日益加重,迫使我们需要创新策略以增强免疫健康。过敏性疾病和多重疾病常常共存,降低各年龄段人群的生活质量。尽管它们表面上不同,但过敏和心血管疾病、肥胖症及神经退行性疾病等慢性疾病经常共享潜在的免疫和微生物紊乱。这些包括炎症性老化、免疫衰老和肠道菌群失调,即微生物多样性减少和微生物代谢改变。
随着饮食和肠道健康被确立为免疫功能的关键调节因素,突出了肠道-免疫-代谢轴在疾病发病机制和管理中的关键作用,它们为干预提供了新的靶点。
通过组分分辨诊断、肠道微生物检测、嗜碱性粒细胞活化试验和表观遗传生物标志物等诊断技术的进步,个体化营养成为可能,可以针对不同的过敏表型和多重共病特征进行精准的饮食干预,将为可持续的疾病预防和提升多样人群免疫力带来了巨大前景。
科技进步,深度测序数据以及人工智能驱动的饮食评估、可穿戴设备和移动应用程序,又进一步革新了个性化饮食管理,实现了实时、精准的营养监测和干预。
一个功能良好的免疫系统是生存的关键。它必须准确识别自身与非自身成分,并区分有害病原体和无害的膳食抗原等外来物质。这种精确识别能力对预防自身免疫疾病和过敏等不当免疫反应至关重要。
先天性免疫和适应性免疫:同一枚硬币的两面
免疫系统通过两种主要机制运作:先天性免疫提供即时但非特异性的防御,适应性免疫则提供高度针对性但需要时间发展的反应。
尽管传统上被视为独立分支,现在认识到这两个系统深度互联,通过众多共享组件实现协调的免疫活动。
先天免疫和适应性免疫之间的主要区别
Andreou E,et al.Nutrients.2025
▸ 先天免疫
先天免疫是机体第一道防线,能快速响应病原体而无需事先致敏。它具有非抗原特异性且缺乏免疫记忆的特点,每次接触均以相同方式响应。该防御系统依赖多重保护机制:
物理和化学屏障(皮肤、黏膜、胃酸、抗菌肽);细胞成分(中性粒细胞、单核细胞、巨噬细胞、树突状细胞和NK细胞);可溶性因子(补体蛋白、细胞因子、急性期蛋白)。
虽然先天免疫响应迅速且覆盖面广,但其非特异性可能造成组织损伤。然而,其在物种间的进化保守性表明了它在宿主生存中的关键作用。
▸ 适应性免疫
相比之下,适应性免疫以抗原特异性和免疫记忆为特征。它由抗原呈递细胞(APCs)—尤其是树突状细胞和巨噬细胞启动,这些细胞处理并向淋巴细胞呈递源自病原体的抗原。
适应性免疫由两个主要组成部分构成:B淋巴细胞产生抗原特异性抗体介导体液免疫,T淋巴细胞协调细胞免疫。
在T细胞中,CD4+辅助T细胞通过细胞因子信号协调免疫反应,CD8+细胞毒性T细胞直接清除受感染或异常细胞。初次接触后形成的记忆B和T细胞在循环中持续存在,使机体在再次遇到相同抗原时产生更快速、更强烈的反应。
尽管适应性免疫强大而精确,但需要严格调控以防止自身免疫或慢性炎症等病理后果。
尽管先天免疫和适应性免疫有着不同的功能角色,但它们是高度整合的。树突状细胞是关键连接点,作为抗原呈递细胞,基于先天免疫环境信号启动T细胞反应。自然杀伤T(NKT)细胞兼具NK细胞和T细胞特征,通过产生调节性细胞因子在两个系统间发挥桥梁作用。
传统上与先天免疫相关的补体系统,也通过促进抗原呈递和B细胞激活来增强适应性反应。这些要素共同体现了先天免疫与适应性免疫间的动态交互和协调,这对维持免疫平衡和宿主防御至关重要。
过敏症:免疫系统的平衡之战
在近几十年来,全球过敏性疾病的发病率急剧上升,构成了日益严峻的公共卫生挑战。目前约有10亿人受到过敏症的困扰,预测表明这一数字可能在未来30-40年内上升至40亿。
过敏是由对特定抗原(过敏原)的免疫反应引发的超敏反应。常见过敏原包括花粉、尘螨、动物皮屑和某些食物。
注:世界卫生组织(WHO)认可多种过敏性疾病。这些包括哮喘、鼻炎、结膜炎、过敏性休克、特应性湿疹、荨麻疹和血管性水肿,以及对食物、药物和昆虫叮咬的超敏反应。值得注意的是,肠道微生物群已被确认为影响过敏性疾病发展的关键因素,尽管具体机制仍在研究中。
免疫系统在区分有害和无害物质方面发挥关键作用。然而,在过敏性疾病中,这种平衡被打破,导致对通常无害的环境抗原(过敏原)产生过度免疫反应。
过敏的定义已从历史上的”身体对外来物质反应能力的改变”演变为更精确的概念——一种由对通常良性抗原的不适当免疫反应所特征的疾病。
▸ 过敏反应的基本机制
过敏性疾病的核心是涉及先天和适应性免疫的免疫失调。过敏反应主要由过度的Th2免疫反应驱动,特征为过量产生IgE抗体。当再次接触过敏原时,过敏原特异性IgE抗体结合并激活肥大细胞,触发组胺、白三烯和细胞因子等炎症介质的释放。这些介质产生典型过敏症状,包括打喷嚏、瘙痒、气道收缩和炎症,严重程度从轻微不适到哮喘恶化或致命的过敏性休克。
正常情况下,调节性T细胞(Tregs)维持免疫耐受并防止不必要的免疫激活。然而,过敏性疾病患者的Treg功能常受损,抗炎细胞因子如IL-10和TGF-β的产生减少。这种调节障碍使Th2驱动的反应占主导地位,加剧过敏性炎症。
而肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞等关键免疫效应细胞的持续激活及其释放的炎症介质维持并强化过敏性病理学。
过敏反应中的关键免疫学参与者
Andreou E,et al.Nutrients.2025
▸ 什么是多重共病?
随着全球过敏性疾病的增加,多重共病——定义为两种或多种慢性疾病的共存——已成为一个主要的公共卫生问题,特别是在老龄化人群中。多种慢性疾病的存在使临床管理变得复杂,并大大提高了残疾、住院和死亡的风险。
多重共病通常始于获得单一慢性疾病,随着时间的推移,可能会出现其他疾病。许多慢性疾病,包括肥胖、2型糖尿病、心血管疾病(CVD)、自身免疫疾病和神经退行性疾病,都有一个共同点:慢性低度炎症。这种持续的炎症状态通常由免疫失调、肠道微生物群的改变和代谢失衡驱动,突显了免疫健康与多重共病之间的紧密联系。
慢性炎症可能驱动多重共病
某些多病共存被视为独特的临床实体,如代谢综合征(MS)。当中心性肥胖伴随至少两个额外因素时可诊断MS:甘油三酯升高、HDL胆固醇降低、血压升高或空腹血糖升高。该综合征与心血管疾病密切相关,两者均通过氧化应激和慢性低度炎症(炎症老化)机制显著促进生物学老化。
▸ 较高的炎症标志物与多病共存相关
慢性炎症作为老化标志之一,与多病共存密切相关。多种慢性疾病患者常出现炎症标志物升高,如IL-6、TNF-α和CRP。较高的炎症标志物水平与残疾、住院和死亡风险增加相关。因此,炎症生物标志物已成为临床试验中老化生物标志物组的重要组成部分。
最近一项研究显示,多病共存百分位较高的个体中IL-6和TNF-α水平显著升高,尤其在女性和70岁以上成年人中。值得注意的是,抗炎细胞因子IL-10与多病共存无相关性,表明促炎途径而非代偿性抗炎反应主要驱动多病共存状态。
▸ 某些特异性蛋白可作为慢性疾病风险标志物
近期的研究进展扩大了对多重疾病的理解,超越了传统炎症标志物。一项涉及超过53000名成人的大规模蛋白质组学分析识别出972种在多种慢性疾病中共同存在的蛋白质和345种疾病特异性蛋白质。研究强调了炎症在多重疾病中的核心作用,并确定NFKB1、JUN和RELA等转录因子为上游调节因子。
此外,GDF15、PLAUR、WFDC2和AREG等蛋白质与多种慢性疾病风险相关,凸显其作为多重疾病进展生物标志物的潜力。这些发现强调了开发针对慢性疾病集群潜在炎症和分子机制靶向干预措施的必要性。
多重疾病并非单一疾病的简单累积,而是涉及共享生物学和免疫学途径的复杂相互作用。炎症性衰老概念提供了理解慢性低度炎症如何加速疾病进展、导致功能下降和寿命缩短的有价值框架。
如美国中年研究(MIDUS)和InCHIANTI等研究表明,循环中IL-6和CRP水平随着慢性疾病数量的增加而成比例上升,且基线IL-6水平较高的个体在一段时间内疾病累积轨迹更为陡峭。
多病共存和免疫老化:慢性循环
虽然炎症衰老被广泛认为是衰老标志和多重疾病驱动因素,但新兴研究强调免疫衰老不仅涉及细胞因子调节紊乱,而是代表多维度衰退,特征为几个相互关联的过程:
▸ 免疫衰老——免疫监视功能丧失
衰老伴随衰老免疫细胞积累,特别是CD8+T细胞和记忆T细胞。这些细胞增殖能力降低,并分泌衰老相关分泌表型(SASP)的促炎介质。细胞积累不仅加剧全身性炎症,还破坏组织修复,削弱耐受机制,增加自身免疫疾病易感性。
▸ 神经免疫交互和认知衰退
神经免疫互动对衰老相关疾病至关重要。活化的小胶质细胞和升高的炎症因子(如IL-1β和IL-6)损害突触可塑性,导致认知障碍及阿尔茨海默病、抑郁症等疾病。这些神经系统疾病常与心脏代谢疾病同时出现,凸显其在老年人群中的互联病理发生。
▸ 代谢性炎症和线粒体功能障碍
代谢性炎症——由代谢超负荷和过度营养引发的慢性低度炎症反应——根本不同于经典炎症。代谢应激导致线粒体功能障碍,增加活性氧产生和线粒体DNA释放,激活NLRP3等炎症体。此过程显著促进代谢综合征和胰岛素抵抗,是多重疾病的关键组成部分。
▸ 表观遗传学衰老和生物钟
通过DNA甲基化钟(如Horvath钟)测量的生物学衰老与多重疾病风险的相关性比单纯年龄更密切。在慢性炎症、生活方式因素和微生物群落变化条件下,表观遗传漂变加速,形成连接免疫衰老与代谢、心血管疾病的机械性桥梁。
人们逐渐意识到共生微生物在黏膜表面免疫调节中的不可或缺作用,影响免疫系统发育和稳态。它们在塑造各器官免疫反应、调节2型免疫、调控嗜碱性粒细胞造血及维护上皮屏障完整性方面发挥重要作用。
▸ 肠道微生物群对免疫及相关疾病有重要影响
肠道微生物群产生的细菌代谢物对免疫成熟和功能有显著影响。短链脂肪酸(SCFAs),如丁酸盐和丙酸盐,发挥免疫调节作用,特别是通过调控FOXP3+调节性T细胞(Tregs),对维持免疫耐受性和防止炎症损伤至关重要。因此,黏膜免疫细胞与定居微生物群间的有效交流对维持平衡免疫反应、优化保护而不引发过度炎症至关重要。
微生物失调越来越多地与免疫介导的疾病,包括过敏性疾病相关。改变的微生物组成可诱导免疫调节紊乱,增加炎症和超敏反应的易感性。
微生物组也影响认知功能,凸显其系统性影响超出了胃肠道免疫。微生物组促进免疫耐受或引发炎症的双重能力说明了其在维持免疫平衡和疾病发病机制中的复杂参与。
▸ 肠道微生物群与免疫系统的动态平衡
肠道微生物群与宿主的先天性和适应性免疫系统之间的动态相互作用对肠道稳态和预防炎症至关重要。肠道微生物群通过代谢膳食蛋白质和碳水化合物,合成必需维生素,以及产生介导肠上皮细胞与免疫细胞对话的生物活性化合物,积极参与免疫反应。饮食、抗生素、环境暴露和生活方式等外部因素显著影响微生物组成,凸显其适应性。
肠上皮屏障是肠道防御系统的组成部分,由粘液层、分泌型IgA和抗菌肽加强,作为选择性过滤器将微生物与宿主免疫细胞分离。肠道微生物群与粘膜免疫之间的调节失衡可破坏这一屏障,导致肠道通透性增加(”肠漏”),伴随病原性革兰氏阴性菌增加的微生物失调,代谢紊乱,以及感染和慢性炎症性疾病的易感性增加。
过敏与肠道健康:微生物组-免疫系统的连接
过敏性疾病,包括呼吸道、皮肤和食物过敏,通常涉及优势Th2免疫反应。这种反应触发IL-4、IL-5和IL-13的产生,促进IgE类转换、嗜酸性粒细胞炎症和肥大细胞激活,这是过敏反应的特征。此外,T细胞亚群如Th9细胞通过分泌IL-9和IL-10加剧过敏性炎症。
▸ 微生物组是免疫功能的中央调节器
微生物组可作为免疫功能的中央调节器,对免疫发育、抗原耐受和炎症调节至关重要。气道微生物组直接调节哮喘等疾病的局部炎症反应,而肠道微生物群产生影响过敏性疾病易感性的系统性效应。饮食和环境变化导致的肠道菌群失调显著影响微生物组成和代谢活动,影响全身免疫反应。
肠道微生物群在生命各阶段的免疫系统发育和成熟中起重要作用。肠道微生物多样性在婴儿期相对较低,通过童年和成年期因各种饮食、环境和免疫因素而增加。
▸ 微生物代谢产物影响免疫耐受和炎症程度
在微生物代谢产物中,短链脂肪酸、胆汁酸结合物和色氨酸代谢物对调节过敏反应特别重要。短链脂肪酸(如丁酸盐和丙酸盐)对调节免疫稳态至关重要,影响结肠FOXP3+调节性T细胞活性,维持免疫耐受和减轻过度炎症。
肠道微生物与过敏性炎症间的联系涉及可发酵膳食纤维在影响微生物代谢中的作用。高纤维饮食改变肠道和肺部微生物组成,特别是厚壁菌门/拟杆菌门比例。肠道微生物对膳食纤维的发酵增强短链脂肪酸产生,具有免疫调节作用。高纤维饮食小鼠显示循环中SCFAs水平升高,受过敏性气道炎症保护,而低纤维饮食小鼠SCFAs水平降低,疾病易感性增加。丙酸通过GPR41在调节免疫反应和过敏疾病进展中发挥关键作用。
▸ 肠道微生物影响过敏风险
肠道微生物在调节过敏风险中的复杂作用得到了众多流行病学和机制研究的支持。出生队列研究进一步揭示,双歧杆菌和乳酸菌的减少与特应性皮炎风险相关,而丁酸产生细菌的减少与哮喘发展相关,以及艰难梭菌的早期定植与过敏性敏感增加有关。
宿主-微生物群落交流主要通过模式识别受体(如Toll样受体)进行。TLR4激活支持树突状细胞成熟和调节性T细胞发育,该通路破坏会加剧过敏性炎症。共生菌通过产生短链脂肪酸、脆弱拟杆菌多糖A及梭状芽胞杆菌簇诱导的上皮源性TGF-β促进Treg分化。
除诱导Treg外,微生物信号还影响Th1/Th2平衡。特定微生物可增强Th1和Th17反应,抵消Th2优势。分节丝状菌促进Th17分化,双歧杆菌通过树突状细胞促进Th1极化。幽门螺杆菌早期定植与哮喘风险呈负相关,可能通过诱导Treg和免疫耐受实现。
▸ 有益菌有助于减少特异性敏感
肠道微生物群有助于维护上皮屏障完整性。阿克曼氏菌等共生菌增强粘蛋白生成和紧密连接装配,丁酸盐通过调节紧密连接蛋白支持屏障功能。相反,肠道通透性增加(食物过敏个体的特征)与菌群失调和SCFA水平降低相关。
《妊娠期益生菌研究》调查了母亲从妊娠早期到哺乳期补充鼠李糖乳杆菌HN001是否能减少婴儿一岁时的湿疹和特应性敏感。研究发现益生菌补充与湿疹发病率显著降低相关,支持早期微生物干预在过敏预防中的作用。
此外,母亲健康益处包括降低妊娠期糖尿病、细菌性阴道炎和分娩前B组链球菌阴道定植率,以及减少产后抑郁和焦虑。特定细菌菌株诱导Foxp3+ T调节细胞在保护小鼠免受过敏性炎症方面起关键作用。
研究表明,长双歧杆菌AH1206显著增加婴儿、成年和无菌小鼠体内Foxp3+ T调节细胞数量,同时改变派氏斑基因表达,减少抗原呈递、TLR信号传导和细胞因子产生,并增强视黄酸代谢。该菌株对气道炎症提供保护,在口服过敏模型中阻断IgE诱导,而短双歧杆菌AH1205效果有限,仅在婴儿小鼠中诱导调节性T细胞。
▸ 微生物有望成为过敏预防和治疗的新靶点
唾液乳杆菌AH102对T调节细胞数量或过敏反应无影响。研究表明特定益生菌可能通过调节免疫反应缓解呼吸道和食物过敏。益生元如半乳寡糖和果寡糖减少高风险婴儿的过敏结果,人乳寡糖促进有益细菌生长。
随机双盲研究表明,短双歧杆菌M-16V与短链半乳寡糖和长链果寡糖的合生元成功补偿剖腹产婴儿双歧杆菌定植延迟。该干预使婴儿从生命早期就拥有显著较高比例的双歧杆菌,同时降低肠杆菌科水平,促进肠道环境酸化(乙酸盐产生增加)。这些变化模拟阴道分娩婴儿通常观察到的微生物群落组成,突显合生元在支持早期肠道健康方面的潜力。事后分析表明合生元组湿疹和特应性皮炎发生率较低,尽管需进一步研究确立直接临床益处。
未来以微生物组为靶点的干预为过敏预防和治疗提供有前景的策略,包括补充益生菌和益生元恢复微生物平衡,调整饮食增加纤维摄入和多酚消费,以及探索粪菌移植和新一代后生元等基于微生物组的治疗。
免疫功能不仅由遗传倾向决定,还受饮食模式和肠道微生物群的动态影响。肠道-免疫-代谢轴越来越被认为是健康的关键调节因素,营养素和微生物代谢物可作为强大的免疫调节剂。
接下来谷禾小编将深入探讨可以通过饮食干预来优化的特定营养素、饮食策略和代谢途径,以增强免疫功能并促进长期健康。
营养、肠道微生物群和免疫系统之间的相互作用
Andreou E,et al.Nutrients.2025
营养、肠道菌群和免疫系统之间的动态相互作用——统称为“韧性三元组”——及其在调节过敏和多种共病中的作用。
饮食输入塑造肠道微生物组,而肠道微生物组则产生短链脂肪酸(SCFAs)等代谢产物,这些代谢产物调节免疫功能。这一相互连接系统的中断可能导致免疫失调,从而促进慢性炎症状况和过敏性疾病的发生。
管理过敏和多重疾病的营养与肠道健康小窍门
饮食成分在塑造免疫反应中扮演关键角色,免疫系统与营养和代谢密切相关。影响免疫系统的主要饮食成分总结在下表中。
Andreou E,et al.Nutrients.2025
▸ 营养物质可调节细胞因子或充当辅助因子
营养物质作为免疫细胞的构建基块,调节细胞因子产生,并通过直接代谢信号或与肠道微生物相互作用调节炎症通路。营养状态、微生物组成和免疫功能间的复杂相互作用被称为肠道-免疫-代谢轴,突显饮食如何增强对病原体的免疫抵抗力,或促进低度慢性炎症和免疫失调。
营养物质(包括宏量和微量营养素)通过调节能量可用性、细胞代谢和炎症反应影响免疫活动。必需微量营养素如维生素A、C、D、E、B6、B12和叶酸,以及锌、硒、铁、镁和铜等重要矿物质,在支持免疫防御和信号传导的关键酶促反应中充当辅助因子。
▸ 抗炎饮食与微生物代谢物有助于增强免疫能力
此外,来自饮食的微生物代谢产物(包括短链脂肪酸、多酚和胆汁酸)作为重要免疫调节剂,影响T细胞分化、细胞因子分泌和肠道屏障完整性。
饮食对免疫功能的影响显著,有证据将抗炎饮食模式与增强免疫能力和降低慢性疾病风险联系起来。相反,富含加工食品、精制糖和不健康脂肪的饮食与代谢功能障碍和系统性炎症相关。新兴证据还支持间歇性禁食和热量限制能进一步促进免疫系统更新和代谢灵活性,潜在减轻与年龄相关的免疫功能下降。
虽然避免过敏原接触是主要策略,但类固醇、抗组胺药等药物治疗方法常被使用缓解症状。然而,以饮食和微生物组为中心的策略正成为过敏管理和免疫调节中有前景的辅助方法。
通过营养丰富的饮食优化免疫功能
营养对调节免疫反应至关重要,确保免疫细胞获得充分营养以有效应对病原体并调节炎症。
▸ 营养素影响快速免疫防御和防止过度慢性炎症
多种微量营养素、矿物质、维生素和特定宏量营养素(包括特定氨基酸、胆固醇和脂肪酸)在调节免疫活动中起关键作用。这些营养素对启动快速免疫防御和防止过度慢性炎症(可导致免疫功能紊乱)至关重要。
锌(存在于牡蛎、南瓜籽和豆类中)对胸腺素产生至关重要,这对T细胞成熟关键。
硒(丰富存在于巴西坚果和海鲜中)增强中性粒细胞和NK细胞活动,有助于身体抗氧化防御。
维生素D(普遍存在于脂肪鱼和强化食品中)在调节先天性和适应性免疫反应中发挥关键作用,对控制炎症和调节整体免疫功能至关重要。
饮食摄入不足或营养吸收不良可能显著损害免疫系统功能,增加感染和慢性炎症性疾病的易感性。
▸ 肠道微生物与多样化营养共同促进免疫系统
免疫系统的发育和功能也受细菌刺激影响,肠道微生物组在免疫成熟中发挥不可或缺的作用。保持富含必需营养素的饮食对支持免疫系统至关重要。
食用多样化饮食,富含色彩鲜艳的水果和蔬菜,提供重要抗氧化剂如维生素C和β-胡萝卜素,保护免疫细胞免受氧化应激。十字花科蔬菜(如西兰花、羽衣甘蓝和卷心菜)富含萝卜硫素,该化合物通过Nrf2信号通路激活抗氧化途径。柑橘类水果、浆果和甜椒以高维生素C含量著称,增强中性粒细胞功能并加强上皮屏障完整性。
维生素对免疫功能的作用
维生素对免疫系统的发育、功能和平衡至关重要,每种维生素在增强免疫反应中都发挥特定作用。下表总结了参与免疫功能的主要维生素、具体作用以及需求和来源信息。
关键维生素的免疫功能、推荐摄入量和食物来源
Andreou E,et al.Nutrients.2025
▸ 维生素之间协同优化免疫功能
维生素间的相互作用和协同效应在优化免疫功能方面起关键作用,因为许多微量营养素并非孤立发挥作用,而是共同支持免疫反应的各个方面。
例如,维生素C和E展现经典协同关系——维生素C有助于再生氧化的维生素E,使其继续作为强效脂溶性抗氧化剂发挥作用。这种协作增强了身体中和氧化自由基的能力,保护免疫细胞免受氧化应激影响,而氧化应激在感染和炎症反应期间尤为突出。
除此之外,其他维生素也以重要方式相互支持。维生素D增强钙吸收,间接支持免疫相关信号通路。叶酸和维生素B12共同参与甲基化反应和核酸合成,这对快速分裂免疫细胞的复制和修复都必不可少。此外,锌和硒与抗氧化维生素的相互作用支持缓解氧化应激和炎症的酶系统,进一步增强免疫功能。
通过营养丰富饮食实现全系列维生素的均衡摄入,比高剂量补充单一维生素更有效,后者可能导致营养失衡或毒性。
地中海饮食对过敏是否具有保护作用?
地中海饮食(MD)是一种受环地中海盆地某些国家传统饮食模式启发的饮食模型。尽管存在差异,地中海饮食模式具有几个共同特点。
其特点是大量使用橄榄油,高摄入水果、蔬菜、全谷物、豆类、坚果和种子。还包括适量食用鱼类和贝类、白肉、鸡蛋和发酵乳制品(如奶酪和酸奶),而红肉、加工肉类和高糖食品摄入很少。此外,地中海饮食模式传统上鼓励在餐食期间定期但适量饮用葡萄酒,特别是红酒。
▸ 地中海饮食可能有助于减轻儿童过敏风险
一些研究强调了地中海饮食在降低过敏性疾病风险方面的潜力,尽管不同人群和研究设计中的发现仍不一致。
一项系统综述评估了地中海饮食成分对食物过敏的影响,发现孕期和哺乳期母亲坚持地中海饮食与婴儿食物过敏风险降低相关。然而,当饮食干预仅在孕期引入或仅限于婴儿早期几个月时,保护作用不太明显。这些发现表明,早期接触地中海饮食中的生物活性化合物,特别是通过母亲营养,可能有助于塑造免疫耐受性并减少过敏性致敏。
保护作用的主要贡献者包括多酚、omega-3脂肪酸、纤维和维生素,它们有助于调节炎症通路、肠道微生物组成和免疫系统功能。
另一项系统综述分析了儿童过敏风险数据,发现虽然坚持地中海饮食与哮喘发病率降低相关,但对过敏性鼻炎、湿疹和特应性疾病的影响结论不太明确。同样,在儿科人群中进行的研究将更高的地中海饮食依从性与哮喘发病率降低联系起来,但发现过敏性致敏没有显著减少。
地中海饮食成分及其免疫益处
Andreou E,et al.Nutrients.2025
▸ 可能的保护机制
抗炎特性:地中海饮食富含抗炎化合物,包括多酚、黄酮类和ω-3脂肪酸,有助于调节免疫反应并抑制慢性炎症。由于过敏性疾病的特点是Th2驱动的免疫激活和炎症过度,地中海饮食调节细胞因子产生和抑制氧化应激的能力可能有助于减轻过敏症状。
肠道菌群调节:平衡的肠道菌群对免疫稳态和过敏耐受至关重要。地中海饮食富含纤维、发酵食品和植物性益生元,促进肠道微生物多样性和短链脂肪酸产生。这些微生物代谢产物增强调节性T细胞活性,减少肠道通透性,并减轻全身炎症,从而降低过敏易感性。
抗氧化防御对抗过敏反应:许多地中海饮食成分(包括水果、蔬菜、橄榄油和坚果)富含抗氧化剂,如维生素C和E、类胡萝卜素和多酚。这些化合物有助于保护免疫细胞免受氧化应激损伤,这是过敏性炎症和气道高反应性的关键因素。通过中和活性氧,这些抗氧化剂可能减少肥大细胞脱颗粒和组胺释放,从而减轻过敏反应的严重程度。
多不饱和脂肪酸和免疫调节:地中海饮食富含来自鱼类、橄榄油和坚果的长链ω-3脂肪酸(EPA和DHA),这些脂肪酸具有免疫调节作用。多不饱和脂肪酸影响二十碳烯酸合成,导致产生有助于平衡Th1/Th2免疫反应的抗炎介质。多项研究表明,更高的ω-3摄入量与较低的哮喘患病率和改善的肺功能相关,支持地中海饮食可能对呼吸道过敏特别有益的假设。
孕期营养和早期免疫调节:母体饮食对胎儿免疫系统发育起关键作用。研究表明,孕期坚持地中海饮食可能降低后代过敏性致敏风险,可能通过表观遗传修饰、改变肠道菌群传递和早期接触免疫调节营养素实现。
多重疾病,即个体同时患有两种或多种慢性疾病,是重大的公共卫生挑战,尤其在老龄人口中。吸烟、长时间久坐和肥胖等关键生活方式因素已被确定为发展多重疾病的重要风险因素。
在这些因素中,饮食模式作为多重疾病风险的关键决定因素尤为突出,有证据表明营养干预可能在疾病预防和管理中发挥关键作用。
▸ 免疫失调与多重疾病之间存在联系
多重疾病与免疫失调之间的复杂联系通过几个关键机制介导,慢性炎症既是各种疾病过程的结果,也是其驱动因素。免疫失调通常表现为持续的低度炎症,导致广泛的组织损伤,并促进多种慢性疾病同时发展。
这种动态受老龄化的显著影响,老龄化与免疫衰老相关——免疫系统逐渐减弱,降低疫苗效力并提高感染易感性。同时老龄化过程也可能由于免疫调节减弱和耐受机制损害而增加自身免疫风险。这种免疫老化过程可能加速年龄相关疾病进展,从而加剧多重疾病与免疫功能障碍之间的联系。
免疫失调的主要驱动因素是细胞因子的异常产生,促炎症信号对多个器官系统产生不利影响。这种细胞因子平衡的破坏与一系列疾病有关,包括心血管疾病、糖尿病和神经退行性疾病。此外,肠道微生物群在整体免疫功能中发挥关键作用,菌群失调显著促进免疫功能障碍。当这种微生物失衡与肠道通透性增加(也称为”肠漏”)结合时,细菌成分可进入血流,触发全身性炎症并促进慢性疾病发生。
代谢失调是另一个影响免疫功能的关键因素。在肥胖和糖尿病等条件下,代谢活跃组织(如脂肪组织)释放炎症介质,加剧全身性免疫失调。此外,氧化应激(以过度产生活性氧物质为特征)导致细胞和组织损伤,进一步助长免疫失调。这种氧化负担是多重疾病进展的重要贡献者,突显了营养在调节炎症和减轻整体疾病负担中的关键作用。
饮食对多重疾病的影响
多项研究已经探讨了饮食对多重疾病(同时患有多种慢性疾病)的影响。以下是这些研究的主要发现:
▸ 英国女性队列研究
跟踪了25389名35-69岁女性,中位随访期为22年:
-发现每日能量和蛋白质摄入量增加分别使多重疾病风险增加8%和12%。
-维生素C和铁的摄入量增加略微降低风险,铁对60岁以下女性具有特别的保护作用。
-维生素B12和维生素D摄入量与风险增加的关联在敏感性分析中失去统计学意义。
-强调了营养摄入对多重疾病风险的复杂性和个体化影响。
▸ 中国纵向研究
调查了1020名中国参与者在五年内的多重疾病进展:
-多重疾病患病率从14%上升到34%。
-水果、蔬菜和非大米小麦的谷物产品摄入量增加与多重疾病进展的更健康轨迹相关。
-这些食物提供更多的膳食纤维、铁、镁和磷,与改善健康结果相关。
▸ 荷兰Lifelines队列横断面研究
分析了129369名荷兰成年人,确定了四种饮食模式:
-肉类、酒精和土豆
-零食
-面包和甜食
-蔬菜、鱼和水果
发现更多遵循肉类、酒精和土豆模式以及零食模式与多重疾病患病率增加相关,尤其是在男性中。
面包和甜食模式以及蔬菜、鱼和水果模式具有保护作用,但后者在调整体重指数(BMI)后减弱。
▸ 英国生物银行前瞻性队列研究
分析了348290名参与者,中位随访期为8年:
确定了三种饮食模式:西方式、白肉式和谨慎式
-西方式饮食模式增加多重疾病风险。
-中度遵循白肉式饮食和高度遵循谨慎式饮食与风险降低相关。
-经常食用加工肉类和家禽与更高的多重疾病风险相关,而增加鱼类、水果和谷物的摄入则显示保护作用。
不同营养素与多重慢病
值得注意的是,营养不良既可能是多种慢性病的驱动因素,也可能是其结果。
▸ 营养不良会加剧全身炎症嗯好免疫紊乱
营养缺乏——通常源于加工食品和营养贫乏的食物——直接参与了多种慢性疾病的发展,包括缺血性心脏病、脑血管疾病、各种癌症、糖尿病和阿尔茨海默病。以加工食品为主的饮食不仅增加全身炎症水平,还会通过必需微量营养素(如铁、维生素B12、叶酸和钙)的缺乏,加剧免疫调节紊乱。
多种慢性病患者常常营养状况不佳。这通常由慢性疾病负担、食欲减退、药物副作用和胃肠功能障碍等因素造成。这些因素形成恶性循环:慢性疾病损害营养吸收和利用,从而进一步削弱免疫功能和整体健康状况。
▸ 不同营养素调节免疫老化和多种慢性病
越来越多的证据强调营养在调节免疫老化和多种慢性病的分子机制中起关键作用。除了提供必需的维生素和矿物质外,营养素还影响细胞过程,如线粒体效率、氧化应激平衡和表观遗传调节。例如:
镁、B族维生素和辅酶Q10改善线粒体功能并减少活性氧,从而减轻与老化相关的炎症。
叶酸、维生素B12、胆碱和膳食多酚作为表观遗传调节因子影响DNA甲基化,可能减缓生物学老化。
抗炎营养素——如omega-3脂肪酸、白藜芦醇、姜黄素和来自膳食纤维的短链脂肪酸——可抑制炎症小体激活和细胞因子过度产生,从而促进免疫耐受和代谢平衡。
微量营养素如锌、硒、维生素D和维生素C对维持T细胞功能、免疫监视和预防慢性炎症至关重要。
衰老、肥胖和多重疾病:精准营养的作用
如前所述,多重疾病代表着重大的公共卫生挑战,影响高达95%的65岁及以上人群。
老龄化被广泛认为是主要风险因素,近期研究表明,它反映了生理储备和功能的逐渐下降,通常伴随着慢性低度炎症、激素调节失衡以及对慢性疾病的脆弱性增加。然而,仅靠老龄化并不能完全解释该病症的复杂病因。
此外,肥胖已成为多重疾病的主要促成因素。为应对这一公共健康挑战,国家卫健委联合多部门出台了《健康中国行动——控制肥胖行动方案》,提出了”三减三健”的核心理念,即减盐、减油、减糖,健康口腔、健康体重、健康骨骼。该政策鼓励公众养成健康饮食习惯,增加日常身体活动,同时加强肥胖防治的科普宣传工作。
各地方政府也积极响应,在学校推广”每天一小时体育活动”,在社区建设健身设施,在医疗机构开设减重门诊。企业界也参与其中,食品企业被鼓励开发低糖、低脂、低盐产品,餐饮业推出健康菜单。
▸ 综合防控策略与个性化营养干预
应对与肥胖相关的多重疾病需要综合策略,包括生活方式改变、有针对性的营养、早期检测和公共卫生倡议。
专注于减轻体重和代谢健康的饮食干预——特别是那些强调水果、蔬菜、全谷物和瘦肉蛋白的干预——可以减少炎症并抵消肥胖相关的代谢紊乱。
具有抗炎特性的营养素,如omega-3脂肪酸、纤维和抗氧化剂,也有助于调节免疫反应并减轻慢性炎症。
当与体育活动和戒烟相结合时,这些策略可以增强整体健康并降低多重疾病的风险。促进健康饮食和积极生活方式的公共卫生宣传活动进一步支持预防和长期行为改变。这些措施总体上不仅有助于管理现有疾病,还有助于预防新疾病,最终帮助打破多重疾病的循环并改善公共卫生结果。
随着全球多重疾病的增加,传统的饮食建议常常无法满足同时管理多种慢性疾病的个体的复杂需求。个性化营养在精准医学原则的指导下,提供了更有效的替代方案。通过整合个体特定因素——如遗传和表观遗传谱、微生物组组成和生活方式特征——个性化营养能够开发针对每个人独特健康背景的定制饮食策略。新兴证据支持这些个性化饮食干预在降低多重疾病风险和负担以及改善相关健康结果方面的潜力。
在多重疾病(多病共存)的情况下实施个性化营养需要超越一般膳食指导的范畴,它要求整合多种个体特定变量,以解决多种慢性疾病共存所带来的独特挑战。准确的营养评估是有效膳食管理的基础,尤其在个性化医疗框架内。
▸ 人工智能、肠道菌群等有助于改善营养评估
近期技术进步——包括人工智能、肠道微生物组以及代谢组学、可穿戴传感器——正在改变营养评估,提供前所未有的精确度、易用性和实时功能。这些创新促进了量身定制的饮食干预,解决传统方法的局限性并推动个性化健康策略。
传统的饮食评估方法,如饮食回忆、食物日记和频率问卷,在准确性、回忆偏差、参与者负担和可扩展性方面存在固有的局限性。
人工智能和机器学习通过提高数据收集准确性、简化分析和实现个性化反馈来解决这些局限性。人工智能驱动的饮食评估工具利用自动图像识别、综合食物数据库和高精度估算营养成分的算法。
如今,消费者利用应用程序购买检测盒,尤其粪便采样盒来掌握自己的健康情况。这些工具克服了医疗保健院内就医检查的障碍,直接向个体提供实时数据,而个体则利用这些信息来制定从健身计划到饮食策略的各种方案。
无论是个性化健康还是精准营养,这都是一种革命性的健康方式,并且已在消化系统领域得到了很好的应用。
目前市场上很多补充剂研发或配方设计师也在考虑结合营养和菌群检测来挖掘消费者数据,了解不同个体的肠道健康需求,并定制个性化解决方案来满足这些需求。好消息是,这些解决方案通常简单、经济实惠,而且相对无害。
虽然我们今天看到的“精准化”是营养行业的一个阶段性转变,但长期以来,消费者一直在他们的补充剂方案中应用各种个性化元素。未来谷禾包括精准的检测让猜测变少了,有科学依据的选择变多了。
▸ 推动个性化营养的三项关键技术
“如果没有数据,这一切都不可能实现”,谷禾健康创始人一直持续强调,数据科学和人工智能的应用对个性化营养干预补充体验至关重要。
事实上,谷禾负责人认为,至少有三项关键技术的融合将在理论和实践上推动个性化营养的发展,无论是现在还是可预见的未来。
首先是深度测量技术,它能让我们以较低的成本对血液或粪便等样本进行成千上万次的测量。
接下来,综合多维度的数据特征,包括年龄、地区、人种、饮食习惯、食物成分分析、健康状况等,结合计算机呈现个体独特的个性化特征,帮助配方设计师模拟干预组合的预期效益。
第三种是我们都耳熟能详的大型语言模型,比如ChatGPT和Deepseek。
关键在于将这三种技术与可信赖的信息源结合起来,以确保反馈信息的准确性,并为这些技术提供个人的测量数据,从而实现深度个性化。我们以前从未有过这样的东西,它带来了真正大规模知识的民主化,彻底改变了我们的生活。
肠道菌群检测逐步解开代谢之谜
我们对新陈代谢和肠道微生物之间联系的理解几乎每天都在增长,许多研究人员相信,了解代谢紊乱的答案可能会在我们的肠道微生物组中找到。
我们从谷禾用户那里得到了很多关于代谢变化的反馈。一些用户抱怨说,以前他们无法减掉多余的体重。尽管尝试了几乎所有的节食方法,他们最终还是屈服于对食物的渴望,或者只是在体重管理之旅上停滞不前。在获得个性化推荐后,以下是他们现在的反馈:
“我的体重稳定了,消化能力也改善了。”
“在我上次测试和改变食物之后,我的体重又开始下降。”
“我感觉好多了。体重又掉下来了。我的过敏症消失了。”
对于我们的许多用户来说,改用适合他们的饮食习惯已经为他们快速启动新陈代谢、恢复健康体重以及让体重维持之旅重回正轨带来了改变。
随着谷禾的数据推荐引擎处理的信息越来越多,将会变得越来越智能,从而可以根据您身体当前发送的信号更精确地制定理想的营养计划。建议最终根据您的生物需求精确个性化,并解决您所经历的症状或问题的根本原因。
未来谷禾会继续不断探索某些食物、补充剂和生物素如何在此过程中发挥关键作用。
肠道菌群检测机构
当用户选择肠道菌群检测机构时,有几个关键标准需要考虑
数据和数据库支持:一个优秀的肠道菌群检测机构应该有充足的样本数据和相关的研究数据库。这些数据可以包括来自不同人群、不同地区和不同健康状况的样本,以确保检测结果的准确性和可靠性。此外,一个强大的数据库可以提供参考范围和比较数据,帮助解读和分析检测结果。
AI团队的应用:人工智能在肠道菌群分析中发挥着重要作用。一个不错的机构应该拥有专业的AI团队,能够应用最新的机器学习和数据挖掘技术,帮助解读复杂的肠道菌群数据。AI可以帮助发现潜在的菌群模式、预测风险因素,并提供个性化的建议和干预措施。
与疾病队列的合作:与疾病队列的合作可以为机构提供更全面的数据和验证机会。通过与疾病队列合作,机构可以建立与疾病发展和治疗效果相关的数据库,从而提高检测结果的应用性和准确性。这种合作还可以帮助机构与临床实践和科学研究保持紧密联系,不断改进和优化检测方法。
科学公正和专业能力:优质机构应该遵循科学研究的原则和道德准则。他们的研究结果应该经过严格的验证和复现,确保其可靠性和可信度。此外,机构的团队成员应该具备相关的背景和经验,包括微生物学、生物信息学、统计学等领域的专业知识。他们应该能够提供专业的解读和建议,帮助个体理解检测结果并采取适当的措施。
综上所述,选择一个认为不错的肠道菌群检测机构需要综合考虑数据和数据库支持、AI团队的应用、与疾病队列的合作以及科学公正和专业能力等方面。这些条件能够确保机构能够提供准确、可靠的肠道菌群检测服务,并为个体的健康管理和疾病预防提供有价值的信息和建议。
主要参考文献
Andreou E, Papaneophytou C. Boosting Immunity Through Nutrition and Gut Health: A Narrative Review on Managing Allergies and Multimorbidity. Nutrients. 2025 May 15;17(10):1685.
Childs, C.E.; Calder, P.C.; Miles, E.A. Diet and immune function. Nutrients 2019, 11, 1933.
Shin, Y.H.; Hwang, J.; Kwon, R.; Lee, S.W.; Kim, M.S.; Shin, J.I.; Yon, D.K. Global, regional, and national burden of allergic disorders and their risk factors in 204 countries and territories, from 1990 to 2019: A systematic analysis for the Global Burden of Disease Study 2019. Allergy 2023, 78, 2232–2254.
Han, P.; Gu, J.Q.; Li, L.S.; Wang, X.Y.; Wang, H.T.; Wang, Y.; Chang, C.; Sun, J.L. The association between intestinal bacteria and allergic diseases-cause or consequence? Front. Cell Infect. Microbiol. 2021, 11, 650893.
Lewis, E.D.; Wu, D.; Meydani, S.N. Age-associated alterations in immune function and inflammation. Prog. Neuropsychopharmacol. Biol. Psychiatry 2022, 118, 110576.
Yu, X.; Pu, H.; Voss, M. Overview of anti-inflammatory diets and their promising effects on non-communicable diseases. Br. J. Nutr. 2024, 132, 898–918.
Chi, H.; Pepper, M.; Thomas, P.G. Principles and therapeutic applications of adaptive immunity. Cell 2024, 187, 2052–2078.

谷禾健康
在追求健康与长寿的道路上,NAD+(烟酰胺腺嘌呤二核苷酸)近年来成为了科学研究和健康领域的热门话题。补充NAD⁺延缓衰老——仿佛补充了NAD+,就健康100岁更进一步。
烟酰胺腺嘌呤二核苷酸(NAD+),中文简称是氧化性辅酶Ⅰ,是人体内最重要且有趣的分子之一。它参与500多种酶促反应,并在几乎所有主要生物过程中发挥关键调节作用。
NAD+在我们体内的能量代谢、信号传递、DNA修复、免疫调节等多个重要生理过程中发挥着关键作用。除此之外,它还在胰岛素敏感性的提高、肌肉体能的提升、血流状态的促进、神经功能的调节及持肠道稳态等方面可能有益处。但最重要的是,它会影响细胞凋亡及人体衰老。
科学研究证实,一种名为「Sirtuins」的蛋白家族,或许能让人体寿命延长。Sirtuins的主要功能是去乙酰化蛋白质,这是一种重要的蛋白质修饰过程。通过去乙酰化,Sirtuins可以维持蛋白质的功能和稳定性,在细胞抗逆性、能量代谢、细胞凋亡和衰老过程中具有重要作用。而NAD+是Sirtuins发挥作用的唯一底物——就像只有特定形状的钥匙能打开保险箱,人体内没有任何其他物质可以替代NAD+激活 Sirtuins。NAD+水平降低与几种衰老相关疾病有关。
因此,越来越多的人开始选择通过摄入NAD+的前体物质,如酰胺单核苷酸(NMN)、烟酰胺核苷(NR)等,希望借此来补充体内的NAD+水平,以实现延缓衰老、提升健康的目标。然而,你有没有想过:你吃进去的NMN,真的被身体用上了吗?
就在前不久,权威期刊《Science Advances》发布了一项颠覆性研究:哈佛医学院团队发现,口服NMN和NR并不能直接转化为NAD⁺,它们必须经过肠道菌群的“加工”,先转化为烟酸类代谢物,再通过肠肝循环,最终在肝脏中生成NAD⁺。
因此,我们需要重新审视NAD+补充剂,如何确保补充效果,不再单纯关注前体物质的含量,而是采用综合方法,同时搭配科学的生活方式和精准的营养平衡,实现真正有效的健康老龄化。本文将带你详细认识烟酰胺腺嘌呤二核苷酸(NAD+)是什么、对身体的多重影响,以及究竟该如何正确地补充NAD+以延缓衰老并改善健康。
NAD+(Nicotinamide adenine dinucleotide)中文全称“烟酰胺腺嘌呤二核苷酸”,简称辅酶I。
烟酰胺腺嘌呤二核苷酸(NAD+)是体内最关键的分子之一,它是500多种酶促反应所必需的,并且在几乎所有主要生物过程的调节中起着关键作用。例如在糖酵解、糖异生、三羧酸循环及呼吸链中发挥着不可替代的作用。
▸ NAD+的历史
NAD于1906年首次被描述为增强酒精发酵的细胞成分。然后,在1936年,证明了氧化还原反应需要 NAD。并巩固了命名法:“NAD”是指与电荷无关的化学主链,“NAD+”和“NADH”分别是指氧化和还原形式。
1963 年,发现NAD+是聚ADP-核糖添加到蛋白质上的共底物,这一突破揭示了 PARP(多聚 ADP-核糖聚合酶)家族的功能。PARP涉及DNA修复和基因表达等多种细胞过程。
1990年,酵母研究发现 sirtuins 可延长寿命。SIR2 基因的上调能延长酵母的复制寿命,减少DNA损伤。Sir2 能调控基因沉默,随着细胞老化重新定位,防止 DNA 损伤积累。后来证实 Sir2 具有 NAD 依赖性的组蛋白去乙酰酶活性,哺乳动物的 sirtuins(SIRT1-7)也在衰老、长寿和应激反应中发挥重要作用。
注:Sirtuins被称为“长寿蛋白”,Sirtuins可以维持蛋白质的功能和稳定性,并参与多种细胞过程,如DNA修复、基因沉默、细胞周期调控和代谢调节等。
1999年发现哺乳动物 sirtuins 代谢 NAD+,并有研究证实,NAD+是Sirtuins发挥功能的唯一底物。2013年哈佛医学院大卫·辛克莱尔团队揭示了NAD+ 与衰老之间存在密切关联。
▸ NAD+的生理功能
NAD+(烟酰胺腺嘌呤二核苷酸)是细胞代谢的核心分子,具备以下主要功能:
NAD+的生理功能
Rajman L,et al.Cell Metab.2018
①能量代谢中的核心因子
NAD⁺在细胞能量生成中至关重要。它是细胞内最基本的氢受体与供体之一,在糖酵解、三羧酸循环和脂肪酸氧化等代谢通路中担任电子载体,催化底物的氧化还原反应,将能量储存在ATP分子中。
调节NAD+/NADH比率,这对维持线粒体功能和能量代谢至关重要。
②信号分子功能
NAD⁺不仅是代谢底物,更是许多关键酶类的必需共底物,主导细胞重要信号和修复通路:
去乙酰化酶(Sirtuins, SIRTs):NAD⁺依赖性去乙酰化酶,调控基因表达、代谢、细胞生长和寿命,参与衰老及抗逆境反应。
聚ADP核糖聚合酶(PARPs):NAD⁺为PARPs介导的DNA修复提供必需底物,维护基因组稳定。PARPs过度激活会消耗NAD⁺,诱发细胞凋亡。
CD38/CD157与钙信号:调节胞内钙信号,影响免疫细胞功能、代谢和衰老。
③细胞功能调节
NAD⁺具有广泛的细胞调节能力,包括:
-酶调节
-基因表达控制
-DNA修复
-细胞周期调节
-钙信号传导
-表观遗传重塑
NAD+代谢控制着广泛的生物过程
Navarro MN, et al.Br J Pharmacol.2022
④免疫系统调节
NAD⁺还能够调节免疫细胞功能
-控制T细胞存活、激活和分化
-调节巨噬细胞激活状态
-影响炎症反应的强度和持续时间
-参与免疫细胞的代谢重编程
具体机制
-通过ART2和P2X7受体调节T细胞凋亡
-通过SIRT1调节Treg/Th17平衡
-调节炎症因子产生(如TNF-α、IL-1β)
-影响免疫细胞的钙离子动员
⑤抗炎和抗衰老
NAD⁺通过调控PARPs、sirtuins和CD38等影响炎症因子的产生,对慢性炎症及炎症性衰老具有调节作用。
抗炎作用
-抑制NF-κB信号通路
-调节炎症小体组装
-减少促炎细胞因子分泌
抗衰老功能
-维持线粒体功能
-促进DNA修复
-调节细胞衰老过程
-对抗氧化应激
⑥影响细胞凋亡及人体衰老
NAD⁺作为DNA修复反应(如单链断裂修复和碱基切除修复)的必需辅因子,保障基因组稳定;NAD⁺枯竭则易导致基因损伤积累、细胞衰老乃至不同类型的细胞死亡(包括凋亡和坏死)。
并且随着年龄增长,NAD⁺水平普遍下降,被认为是组织功能衰退、代谢紊乱和多种年龄相关慢病(阿尔茨海默病、帕金森病、糖尿病、心血管病)发生的重要基础。
补充NAD+前体如NR和NMN可显著延缓衰老相关病理,改善线粒体功能、胰岛素敏感性和神经保护。并通过提升ATP生成、减少炎症及促进肌纤维类型转变来逆转与年龄相关的肌肉损害。
⑦调节代谢稳态和疾病防治
糖脂代谢:NAD⁺维持肝脏、脂肪组织和胰岛功能,对糖尿病和脂肪肝等代谢病防治至关重要。
心脑血管保护:NAD⁺通过抗炎、抗纤维化和抗氧化,减少内皮功能障碍、降低动脉僵硬度、保护心脏免受缺血性损伤。
Kane AE,et al.Circ Res.2018
神经保护:保护神经元免受退行性变化、改善认知功能、减轻神经退行性疾病症状、保护视网膜功能。
肿瘤治疗:NAD⁺代谢重编程调控癌细胞增殖和凋亡,是肿瘤治疗的重要潜在靶点。降低肿瘤组织的NAD+水平可削弱其DNA修复能力,提高对化疗药物的敏感性,目前已有多种PARP1和NAMPT抑制剂用于此目的并在临床测试。另一方面,提升NAD⁺水平可增强线粒体功能、下调糖酵解和抑制肿瘤生长。
⑧维护肠道稳态
NAD+代谢,特别是sirtuins和PARP-1等NAD+依赖性酶,以及与NAD+合成相关的酶如NAMPT,在维持肠道稳态、调控炎症反应和肠道上皮修复中发挥关键作用。
补充NAD+前体或激活sirtuins可改善肠道屏障功能,减轻结肠炎和相关炎症,但NAD+代谢的失衡,如NAMPT过度激活,也可能推动肠道炎症和肿瘤发生。因此,精准调控NAD+通路有望成为IBD及相关疾病的潜在治疗策略。
▸ 缺乏NAD的危害
NAD具有多种重要生理功能,那么其含量过低是否会有什么影响呢?糙皮病由缺乏烟酸导致NAD+和NADP+水平降低所致,表现为皮炎、腹泻和痴呆。近年来的研究还表明,低NAD+水平不仅与代谢和神经退行性疾病相关,还与啮齿动物和人类的衰老密切相关。
NAD⁺过低可能导致以下危害:
①加速衰老与寿命缩短
NAD⁺水平与生理健康、组织再生、干细胞功能密切相关。其稳步下降是衰老及相关功能障碍、寿命缩短的一个主因。
动物实验及部分临床证据显示,提升NAD⁺水平有望逆转部分衰老表型、延缓功能衰退。
②导致能量与代谢障碍
NAD⁺作为能量代谢(氧化磷酸化和糖酵解)核心辅因子,缺乏会导致ATP生成受损、细胞生长活性下降。坏死与细胞凋亡易发,组织损伤修复能力减弱。这可能是影响衰老的重要因素之一。
③基因组稳定性与DNA修复障碍
NAD⁺是PARP依赖性DNA修复所需底物,含量降低会削弱DNA修复能力,增加基因突变、癌变风险。
某些神经退行性疾病、衰老相关病变、肿瘤发生与此机制密切相关。
④炎症反应与免疫失调
NAD⁺不足可导致SIRT家族(NAD⁺依赖去乙酰酶)活性下降,削弱炎症抑制、细胞自噬、抗氧化等调控能力,促进慢性低度炎症和免疫失衡。
⑤肠道及其他器官功能障碍
NAD⁺对肠道上皮和干细胞修复、免疫屏障维持至关重要,缺乏时屏障功能显著下降,易导致肠道炎症(如IBD)、癌症风险上升。
NAD⁺缺乏影响神经元代谢和生存,促进神经退行性变化,如阿尔茨海默病、帕金森病和脑缺血等病理过程。
其他器官如肝脏、肾脏、心脏等NAD⁺相关信号异常,也会带来代谢紊乱、器官衰竭等问题。
NAD⁺含量降低,既是衰老及多种慢性疾病的重要机制,也是细胞功能紊乱、机体易感多种病理状态的根本驱动力。其危害涵盖能量代谢、基因组稳定、免疫炎症、神经健康及器官功能等多个层面。
▸ NAD⁺含量降低的原因
①衰老相关下降
随着年龄增长,所有物种(从酵母到人类)的NAD⁺水平都会自然稳步下降。原因包括:
-NAD⁺生物合成酶(如NAMPT、QPRT)的表达下调,NAD⁺新生途径能力减弱。
-消耗NAD⁺的酶如PARP-1、CD38等的活性升高,尤其是在DNA损伤积累和慢性炎症环境下。
②环境与代谢应激
-长期热量摄入过多、缺乏运动、代谢紊乱(如糖尿病、脂肪肝)等均可抑制NAD⁺合成或加速其分解。
-毒素、病原体、自由基等导致DNA损伤,促使PARP类酶大量消耗NAD⁺于DNA修复过程中。
–线粒体功能与能量代谢紊乱,导致NAD⁺循环效率下降,并诱发假缺氧状态;
–慢性炎症、免疫激活等病理状态也促进NAD⁺持续消耗。
③疾病和遗传因素
一些遗传代谢缺陷(如烟酸缺乏导致糙皮病)或酶功能异常影响NAD⁺合成/再生。
慢性免疫激活和自身免疫性疾病中,相关信号分子的上调可增加NAD⁺消耗。
随着人们对健康与长寿的关注不断提升,NAD+(烟酰胺腺嘌呤二核苷酸)逐渐成为科学研究和健康领域中的焦点,越来越多的研究人员和健康专家开始关注其在维持生命活力和促进健康方面的重要作用。
因此,深入了解NAD+的合成与代谢过程,对于我们科学把握其补充方式、提升健康水平以及实现延缓衰老的目标都极为重要。
▸ NAD+的合成
NAD+在哺乳动物中以四种主要方式合成:1.从头合成途径、2.挽救途径、3.烟酰胺核糖(NR)激酶途径和4.Preiss-Handler 途径。
▸ 从头合成途径
NAD+的从头合成以色氨酸为起点,主要在肝脏进行,过程受多种酶调控。喹啉酸磷酸核糖转移酶和吲哚胺2,3-双加氧酶或色氨酸2,3-双加氧酶催化关键反应。
吲哚胺 2,3-双加氧酶可被促炎介质(如干扰素、肿瘤坏死因子和脂多糖)激活,而色氨酸 2,3-双加氧酶可被压力荷尔蒙诱导,包括皮质醇、雌激素和催乳素。喹啉酸磷酸核糖转移酶催化喹啉酸从色氨酸转化为烟酸单核苷酸,随后转化为NAD+。
▸ 挽救途径
大多数组织通过挽救途径利用烟酰胺(NAM)合成NAD+。NAM 首先在关键限速酶烟酰胺磷酸核糖转移酶(NAMPT)的催化下转化为烟酰胺单核苷酸(NMN),然后NMN通过烟酰胺单核苷酸腺苷酸转移酶(NMNAT)转化为NAD+。
NAMPT存在于细胞内和细胞外亚型中,分别称为 iNAMPT和eNAMPT 。NMNAT有三种亚型:NMNAT1位于细胞核中,NMNAT2 位于高尔基体和神经元轴突中,NMNAT3位于线粒体中。
▸ 烟酰胺核糖(NR)途径
NAD+也可以通过烟酰胺核糖(NR)激酶途径从NR产生,以NMN为中间体。在细胞中,NR也可以通过嘌呤核苷磷酸化酶转化为烟酰胺,然后可以通过挽救途径转化为NAD+。
▸ Preiss-Handler途径
此外,烟酸(NA)(也称维生素B3)可通过Preiss-Handler途径生成NAD+,其中烟酸单核苷酸是关键中间体。相比之下,合成等量NAD+所需的色氨酸远多于NA,说明色氨酸合成NAD+效率较低。
▸ NAD+的代谢
▸ NAD+代谢可生成Ca2+动员信号分子
NAD+是多种代谢途径和细胞过程的关键代谢物和辅酶。CD38和CD157(BST1)是裂解NAD+生成NAM和腺苷二磷酸糖(ADPR)的糖水解酶,CD38还能将环状ADPR(cADPR)水解成ADPR。此外,这两种酶也作为ADP-核糖基环化酶,催化NAD+水解生成NAM和cADPR,而cADPR是许多细胞中活跃的Ca2+动员信号分子。
两种反应都会产生NAM,NAM可通过补救途径快速再生为NAD+。CD38广泛表达,CD157则主要分布于淋巴组织和肠道。这些酶与能量代谢、细胞粘附和免疫反应密切相关,并与帕金森病、卵巢癌和白血病等疾病有关。
▸ CD38是哺乳动物中NAD+的主要消耗酶
研究显示,缺乏CD38或用CD38抑制剂芹菜素处理的小鼠体内NAD+水平提高约50%,而衰老过程中多种组织的CD38蛋白水平升高,NAD+则下降。
32月龄野生型小鼠的NAD+仅为年轻小鼠的一半,而CD38敲除小鼠能维持NAD+水平,并抵抗高脂饮食引发的肝脂肪变性和葡萄糖耐受不良。相反,CD38过表达小鼠NAD+水平降低,线粒体功能受损,耗氧量下降,乳酸产生增加。
三大类NAD+消耗酶
doi: 10.1038/s41580-020-00313-x.
▸ NAD+在糖酵解和线粒体中发挥重要作用
在糖酵解中,NAD+被利用生成NADH,后者通过苹果酸/天冬氨酸和甘油醛3-磷酸穿梭转移到线粒体。线粒体内,苹果酸/天冬氨酸穿梭带来的NADH在电子传递链复合物I被氧化,甘油醛3-磷酸穿梭产生的FADH2则在复合物II被氧化。
线粒体中的NAD+被SIRT3-SIRT5消耗生成NAM。目前尚不明确NAM能否转化为NMN或在线粒体内再生为NAD+,或其他前体是否可跨膜促进NAD+合成。核内NAD+池可能通过核孔与胞质池平衡。
NAD+的生物合成及代谢
doi: 10.1038/s41580-020-00313-x.
a.烟酰胺腺嘌呤二核苷酸(NAD+)生物合成途径;b.不同亚细胞区室中的NAD+代谢。
▸ NAD+减少与神经元损伤相关
SARM1是一种新发现的NAD+切割酶,主要存在于神经元等细胞,是首个依赖TIR结构域活性的NAD+消耗酶。TIR结构域此前仅被认为是蛋白互作结构域,如今被证实具有酶活性。神经元损伤时,SARM1通过TIR结构域将胞质NAD+分解为ADPR、cADPR和NAM,启动细胞破坏,耗尽NAD+并引发轴突变性。
过表达NAMPT或NMNAT、补充NR可阻断这一过程。敲除SARM1能挽救NMNAT2缺陷小鼠的神经元异常和胚胎致死,说明SARM1在胚胎发育期也消耗NAD+。因此,SARM1是治疗急性神经损伤及神经退行性疾病的潜在靶点。
▸ 生活中常用的NAD+补充剂
NAD+水平会随着年龄的增长而逐步降低,或者在代谢失调和某些疾病的影响下出现明显下降。NAD+作为细胞内重要的辅酶,其含量减少会影响多项生理功能,甚至加速衰老进程。
这时就需要通过外部干预手段进行补充,当前,最常用和有效的方法是直接补充NAD+的前体物质。
▸ 常见NAD⁺前体有:
•烟酰胺单核苷酸(NMN):作为NAD⁺的直接前体,服用后可迅速在组织中提升NAD⁺水平(多项动物和人体初步实验得到支持)。
烟酰胺核糖(NR):作为新兴的NAD⁺前体,其生物利用度高,能显著提升多种组织中的NAD⁺浓度。
烟酸(NA):可通过饮食或口服补剂补充,也参与NAD⁺的合成,适合因烟酸缺乏导致的NAD⁺不足。
烟酰胺(NAM):是烟酸的酰胺化合物,通过补充可有效提高NAD⁺水平。
口服NAD+前体提高NAD+水平
Niño-Narvión J,et al.Nutrients.2023
然而,补充NAD+前体虽然是一种常见且有效的提升NAD+水平的方法,但在实际应用过程中依然面临许多问题。例如,不同的给药方式会对前体的吸收效率产生显著影响。此外,消化系统的状态以及肠道微生物群的组成,也会影响这些前体在体内的转运与利用。
因此,在考虑NAD+补充时,需要同时关注服用方法和个体肠道环境的差异。关于这些因素具体如何影响NAD+前体的吸收和代谢,我们将在下一章中进行更为详细的阐述与讨论。
人们通常通过口服给药补充NAD+前体,上文已经提到,烟酰胺单核苷酸(NMN)和烟酰胺核糖(NR)是最常用的补充剂。但需要注意的是,口服后,只有少量NMN和NR能直接被小肠吸收!
▸ 补充NAD+前体后的吸收过程
为了揭示口服NMN和NR的代谢途径,研究人员在单次口服NMN和NR后进行了时间过程NAD代谢组分析。
▸ 一部分NMN和NR可被小肠吸收,但数量有限
NMN管饲法在15分钟时显著增加小肠中的NMN水平。此外,口服NR灌胃NMN的升高远低于口服 NMN 的NMN增加(约 25 倍)。这些结果表明,在口服过程中,一定量的NMN被小肠直接吸收。此外,与 NR 给药相比,NMN 给药对 NR 水平的增加略有延迟。
口服灌胃NMN后小肠NR水平升高表明NMN迅速去磷酸化成为NR。还测量了脱酰胺的NAD代谢组,包括烟酸腺嘌呤二核苷酸(NAAD)和NAMN。我们发现 NAAD 和 NAMN 在较小的时间点 (180和360分钟)显著增加。小肠中的NAD水平分别在施用NMN和NR后15至30分钟达到峰值。这些结果表明,小肠中NAD的合成主要来自通过补救途径直接吸收的NMN和NR。
▸ 口服NMN和NR无法直接提升骨骼肌NAD水平
口服NAD前体经肝脏后分布到外周器官,其中骨骼肌是重要靶点,但其NAD合成主要依赖挽救途径。研究发现,NR和NMN给药后骨骼肌NAD提升有限,远低于肝脏,且大部分口服NR和NMN在到达肝脏前已转化为NAM和NA。
进一步的代谢组分析显示,NR和NMN给药后骨骼肌中NAD水平仅小幅上升,前体NMN和NR在60分钟内恢复基线,而NAM及相关脱酰胺代谢物则缓慢积累。骨骼肌中脱酰胺前体(如NAAD、NAMN和NA)水平较低,表明并非主要NAD来源。
(A)用 NMN 和 NR 管饲的小鼠肌肉 NAD+ 代谢组的时间过程分析;(B)口服 [m + 6] NR 后 3 小时的小鼠肌肉 NAD+ 代谢组;(C) 口服 [m + 8] NMN 后 3 小时小鼠的肌肉 NAD+ 代谢组。
▸ 肠道微生物群参与NAD+的合成代谢
补充NAD+前体物质时,这些物质首先需要经过肠道,而肠道中分布着种类繁多、数量庞大的微生物群。当烟酰胺单核苷酸(NMN)和烟酰胺核糖(NR)等NAD+前体进入体内,经过肠道时,必然会与这些丰富的微生物群发生接触与相互作用。在这一过程中,肠道微生物对NMN和NR等前体的吸收、分解及转化产生潜在影响。
▸ 肠道微生物群能积极转化和利用NAD+前体
大量研究表明,肠道微生物群不仅仅是被动的环境成分,而是在NAD+(烟酰胺腺嘌呤二核苷酸)的合成及代谢过程中发挥着积极的调控作用。正因为如此,对于NAD+前体物质的补充效果及其生物利用率,肠道微生物群的作用不可忽视。
注:微生物与哺乳动物在NAD+代谢上存在显著差异。例如,流感嗜血杆菌缺乏新生途径基因,而Cytophaga hutchinsonii则具备由色氨酸驱动的从头合成基因;部分真菌如光滑念珠菌也可能缺乏该途径。大肠杆菌和酿酒酵母则含有烟酰胺酶,可将NAM转化为NA参与Preiss-Handler途径。同时,一些细菌还能通过L-天冬氨酸合成NAD+。
肠道微生物群拥有独特的NAD代谢途径,有助于提升宿主补充NAD前体后的代谢能力。与肝脏不同,肠道菌群通过NaMNAT和NADS等关键酶,利用特定从头合成途径将NAD前体转化为NAD。梭杆菌属、厚壁菌门和变形杆菌均可通过此途径合成NAD,其中部分厚壁菌门还具备替代合成路径,能将喹啉酸转化为NaMN,并进一步生成NAD。
哺乳动物细胞和肠道微生物中的NAD+代谢途径
doi: 10.1016/j.aninu.2022.06.009.
此外,微生物对NAM、NA和NR等NAD前体的利用在NAD合成中也十分重要。只有放线菌门、厚壁菌门和变形杆菌能摄取NAM和NA,而NR的利用则限于厚壁菌门和变形菌门。
▸ 肠道微生物群合成了肝脏的大部分NAD+
研究表明,肠道微生物群广泛参与宿主NAD+代谢。大多数细菌具有将NAM转化为NA的NAM脱酰胺酶,而哺乳动物并无同源酶。肠道菌群将NAM转化为NA,对于口服NAD+前体转化为NAD+至关重要。
例如大肠杆菌和酿酒酵母中存在同源烟酰胺酶。烟酰胺脱酰胺酶(PncA)能将NAM转化为NA,从而激活Preiss-Handler通路。不同微生物和真核生物的NAM再生途径存在差异。
肠道微生物群利用PncA合成的NAD脱酰胺代谢物为肝脏NAD供应提供了主要来源。研究发现,肠道菌群与宿主的NA合成途径可以绕过肠道挽救途径,显示宿主与肠道菌群在NAD前体共享中的双向互动。
NAD的代谢及与肠道菌群和宿主的相互作用
Lu X,et al.iScience. 2024
肠道微生物还能提升宿主对NAMPT抑制剂的抵抗力,脱酰胺NAD前体可逆转NAMPT抑制导致的NAD和能量下降,突出Preiss-Handler途径在肝脏NAD合成中的重要性。此外,大肠杆菌中pncA基因的过表达会影响肝脏NAD代谢,优化后在哺乳动物体内表达可使NAD水平显著提升,甚至比正常饮食高约5倍。而常用的NAD前体NR和NMN由于肝细胞吸收有限,仅能使肝脏NAD水平增加1.5到2倍。
▸肠道菌群紊乱或多样性降低时,补充NAD前体效果有限
肠道菌群紊乱或多样性降低时,单独通过NR补充并不能显著提升肝脏NAD水平,这反映了肠道菌群在NR吸收和肝脏NAD提升中的重要作用。尤其是高烟酰胺脱酰胺酶(PncA)基因表达的肠道菌群能显著增加肝脏NAD水平。
▸ 连接NAD+和肠道微生物群的机制
• 代谢相互依赖
肠道微生物群通过利用宿主来源的烟酰胺合成NAD+,在这个过程中还会生成烟酸,烟酸随后又被宿主吸收并用于自身NAD+的生物合成。这样一来,宿主提供烟酰胺,微生物将其代谢为NAD+和烟酸,烟酸又返回到宿主体内被再次利用,形成了一个在宿主和微生物之间循环的NAD+前体交换系统。
这种循环不仅促进了双方的代谢活动,还体现了宿主与微生物之间密切的共生关系,是NAD+前体在二者间持续流动与利用的重要机制。
• 微生物酶
细菌酶如烟酰胺酶(PncA)能够将烟酰胺转化为烟酸,这一过程在微生物中起着关键作用。通过这一转化,微生物为宿主提供了烟酸,使宿主能够通过另一种替代的NAD+合成途径来补充NAD+。这种微生物介导的烟酰胺向烟酸的变化,为宿主拓宽了NAD+的代谢来源,还对宿主整体的代谢健康产生影响。
• 肠道微生物群的代谢物是NAD+的调节因子
研究发现,肠道微生物产生的二氢蝶酸、苯丙酮酸、吲哚-3-丙酸、苯乳酸、全反式维甲酸,以及多种脱氧、甲基和环核苷酸,是调节NAD+代谢的重要因子。进一步分析发现,共生埃希菌属、拟杆菌属、双歧杆菌属和乳酸杆菌属与NAD+产生等抗衰老代谢物相关。
• 微生物直接分泌
某些肠道细菌在宿主NAD+代谢中发挥着重要作用。例如,青春双歧杆菌能够产生代谢产物烟酸,这种烟酸在进入宿主机体后有助于恢复和提升肌肉中的NAD+水平。此外,还有一种名为ASTB Qing110的肠道细菌,可以直接分泌NAD+这一关键分子,为宿主补充NAD+。
NAD+与肠道菌群之间存在着密切的双向作用关系。一方面,肠道微生物群可以通过多种机制调节体内NAD+的生物利用度,对NAD+的代谢和供应起着调控作用。当肠道微生物群的结构或功能发生变化时,这种变化会进一步影响NAD+的生成与利用,可能导致体内NAD+的合成和使用减少,进而影响机体的代谢平衡。
另一方面,NAD+本身的含量和状态同样会反馈性地影响肠道微生物群的多样性和组成,甚至对整个肠道的健康状况产生一定的作用。这种相互影响表明,维持NAD+和肠道菌群之间的平衡对于机体健康和肠道环境的稳定具有重要意义。
NAD+主要通过以下方式影响肠道微生物:
▸ NAD+影响肠道微生物的代谢活动
▸ NAD+影响微生物的能量生成
NAD+作为微生物代谢所必需的酶辅因子、底物或氧化还原因子,可以直接影响肠道微生物的代谢,是微生物能量代谢的重要组成部分。NAD+作为如磷酸甘油醛脱氢酶、丙酮酸脱氢酶、3-羟酰基辅酶A脱氢酶、苹果酸脱氢酶、α-酮戊二酸脱氢酶和乳酸脱氢酶等能量代谢关键酶的辅因子,是细胞ATP产生的重要保障,因此提高NAD+有助于增强微生物能量生成。
▸ 影响长双歧杆菌等肠道微生物的繁殖
此外,以NAD+为底物的酶分子对于微生物的生存和繁殖至关重要。一些细菌具有NAD+依赖性DNA连接酶,它们在 DNA 复制、修复和重组中起关键作用。
在肠道中,长双歧杆菌和嗜酸乳杆菌可以通过使用 SIRT2(一种NAD+依赖性酶)催化蛋白质/组蛋白脱乙酰化,从而响应氧化应激。据报道,SIRT2 是酵母寿命的关键组成部分。此外,酿酒酵母中的多个硫胺素基因通过NAD+依赖性组蛋白脱乙酰酶Hst1和SIRT2受细胞内NAD+浓度的调节。
▸ NAD+影响肠道微生物群的组成
在高脂饮食诱导的大鼠中补充烟酰胺核糖(NAD前体)不仅改善了多项结果,还重塑了盲肠和结肠的微生物群结构。NR处理组在第4、8和12周均表现出α多样性提升,并通过促进丹毒菌科和瘤胃球菌科的持续增殖调节粪便菌群,同时Prevotellaceae在下消化道中的相对丰度也显著上升。
此外,NAD依赖性组蛋白脱乙酰酶SIRT1是调控肠道微生物群、上皮生物学和炎症的核心酶。肠道特异性SIRT1缺失小鼠表现出潘氏细胞和杯状细胞数量增加,并伴有肠道菌群重塑,这可能是NAD与肠道微生物群关联的关键环节。
▸ NAD+影响对病原菌的抵抗力
此外,提升NAD+水平可通过调节宿主免疫和代谢间接影响肠道菌群。
NAD+可以激活 SIRT1,SIRT1 介导对结核分枝杆菌感染的抵抗力。研究表明CD38缺陷小鼠更容易受到细菌感染。此外,补充NAM(NAD+的前体),已被证明可以增加宿主对金黄色葡萄球菌的抵抗,从而限制金黄色葡萄球菌的感染。因此,推测增强NAD+可以防止病原菌在肠道中的定植。
▸ 抑制有害菌增长
β-NAD是结肠的重要抑制性神经递质,能调节结肠运动,对肠道微生物发酵具有关键作用。此外,NAD+通过影响宿主胆汁酸的合成间接调节肠道微生物群。内质网合成胆固醇需NADH和NADPH作为电子供体,肝脏将胆固醇转化为胆汁酸,有助于脂肪和脂溶性营养素的吸收和代谢。
此外,分泌到肠道中的胆汁酸在破坏细菌细胞膜时也可以具有抗菌作用,从而抑制病原菌的增殖。相反,胆汁流动受阻会导致有害细菌在肠道中增殖。
▸ NAD+缺陷状态下的肠道炎症和菌群失调
NAD+缺乏状态可能导致包括肠道炎症和胃肠道功能受损(即IBD)的体征,并且出现有益共生菌与机会性病原体之间的不平衡。
▸ NAD缺乏对肠道屏障和炎症的影响
损害肠道屏障功能
NAD+在维持肠上皮细胞(IEC)能量代谢和屏障完整性中至关重要。NAD+缺乏导致上皮能量供应不足,使肠上皮通透性增加,易造成细菌和毒素穿透肠壁,引发局部和系统性炎症。
促发和加重肠道炎症
NAD+水平低下时,促炎信号(如NF-κB、IL-6、TNF-α等)激活,抗炎反应受阻,促使炎症细胞大量浸润肠道组织,加剧肠黏膜损伤和慢性炎症(如炎症性肠病)。
影响SIRT1等NAD+依赖酶活性
NAD+是SIRT1等一系列去乙酰化酶和PARP等修复酶的必需因子。NAD+缺乏导致这些关键酶活力下降,进一步削弱DNA修复、抗氧化和抗炎机制,使肠道对损伤和感染的易感性升高。
NAD+对宿主及肠道菌群的调节作用
doi: 10.1016/j.aninu.2022.06.009.
▸ NAD缺乏与肠道菌群失调
微生物群多样性下降
NAD+水平降低时,肠道内群落多样性和益生菌丰度减少,病原菌和条件致病菌增多。例如,乳酸杆菌等有益菌减少,肠杆菌科等致病菌升高,加剧肠道稳态失衡。
代谢产物的变化
肠道短链脂肪酸(SCFAs)、多酚代谢等微生物代谢产物减少,次级胆汁酸、氨等增加,削弱肠道抗炎能力,促进炎症环境。
加剧菌群紊乱-炎症正反馈
NAD+缺乏促进炎症,炎症又会进一步恶化菌群结构(如促进益生菌流失、促炎菌扩增),形成炎症-菌群失调的恶性循环,加重疾病进展。
▸ 实验与临床证据
动物实验
文献总结多项小鼠和大鼠模型的实验证据——饮食缺乏NAD+前体组出现更明显的肠道炎症、肠屏障破坏及致病菌增殖,补充NAD+前体可逆转上述现象。
人群研究
临床观察发现,炎症性肠病、慢性结肠炎等患者NAD+水平通常较低,且菌群多样性、功能均受损。
▸ 通过补充NAD+改善肠道健康
NAD+缺乏可能由营养不足、代谢异常、年龄相关疾病和免疫调节失衡引起,并与包括肠道在内的多系统不良结局有关。补充NAD+前体可提升组织NAD+水平,改善其缺乏引发的病理生理问题。
▸ 补充NAD+有助于缓解肠道炎症
鉴于NAD+增加方法在不同系统中具有良好的免疫调节和抗炎特性,通过增加NAD+前体的摄入量来提高NAD+的可用性可以被视为对抗肠道疾病的治疗策略。大多数研究表明,增加NAD+的疗法对肠道炎症有有益影响。
补充NAD+前体可直接或间接抑制肠道炎症的发展。其直接作用包括利用NA激活GPR109a或通过SIRT1抑制NFκB,均已被验证。同时,部分NAD+前体还能通过调节肠道菌群,间接发挥抗炎保护作用。
摄入的NAD+前体被细菌利用以合成NAD+,这是许多菌种(尤其是厚壁菌门和放线菌门)生长和代谢的关键。此外,NAD+前体可调节肠道菌群,影响次级胆汁酸和短链脂肪酸(SCFA)的合成,对宿主健康有积极作用。因此,提升NAD+水平有助于促进有益菌生长,并通过多种机制抵抗有害菌。
小结
不同NAD+前体可调节肠道生理并具有治疗肠道炎症的潜力。NAD+能够通过多种机制改善肠道炎症,增加NAD+成为潜在的治疗策略。数据显示,NAD+前体有助于通过调节肠道菌群部分恢复肠道功能。肠道菌群可将宿主的NAM转化为NA以合成NAD+,口服NR和NMN同样可经菌群转化为NA支持NAD+生成。然而,不同NAD+提升方法在各种免疫和代谢状态下的效果仍需进一步研究。
NAD+在能量代谢、细胞和免疫功能、抗炎抗衰老以及心血管和神经健康等方面都具有重要作用。但其水平会随着年龄的增长而逐渐下降,范围从10%到 65%,具体取决于不同的器官;或者在代谢失调和某些疾病的影响下出现明显下降。
因此,通过合理的方法使NAD+水平保持合理的范围,或是在其浓度过低时有效补充至关重要。上文中我们讲到NAD前体是最常用和有效补充NAD+的方法。除此之外,还有许多其他的方法,让我们一起来了解下。
▸ 调节NAD+生物合成
提升NAD+水平的另一途径是直接激活NAD+生物合成酶,尤其是调控从头合成和补救途径限速步骤的酶。
▸ 增强NAMPT和NMNATs活性促进NAD+合成
NAMPT激活剂和NMNATs被认为可有效促进NAD+的合成。神经保护剂P7C3能增强NAMPT活性并提高NAD+水平,显示出对衰老和神经退行性疾病的治疗潜力。
小分子SBI-797812被提出为高效的NAMPT激活剂,能提升体外和细胞中的NAD+水平,虽然在体内对肝脏的提升效果有限,仍具药理学发展前景。
此外,TES-991和TES-102524通过抑制ACMSD促进NAD+从头合成和SIRT1活性,从而提升肝脏、肾脏和大脑的线粒体功能。还有报道显示,绿茶成分EGCG可分别显著激活NMNAT2和NMNAT3,但相关数据尚需进一步验证。
▸ 调节NAD+/NADH平衡
除了调节NAD+含量外,还可通过外源性醌如β-lapachone调节NAD+/NADH平衡。作为NQO1的共底物,β-lapachone促进NADH转化为NAD+,有助于改善衰老小鼠的线粒体功能及运动、认知能力。注:然而,因NQO1在多种实体瘤中过度表达,β-lapachone可能引发氧化应激失衡,用药需谨慎。
▸ 抑制NAD+消耗
提升NAD+水平还可通过抑制其降解途径,如PARP或NADases(糖水解酶)。
▸ 槲皮素和芹菜素等类黄酮物质可抑制NAD降解
哺乳动物的主要NADase——CD38,可被低微摩尔浓度的类黄酮(如芹菜素、木犀草素、槲皮素等)抑制,这些分子在体内同样靶向CD38。芹菜素可提高多组织NAD+水平,降低蛋白质乙酰化,改善肥胖小鼠的葡萄糖和脂质稳态,作用机制可能与上调SIRT1、SIRT3有关。木犀草胺则有助于防止NAD+丢失,保护缺血后心脏功能。
SARM1是另一种NADase,参与神经损伤后NAD+的快速分解。XAV939是推定的SARM1抑制剂,同时也抑制PARP5a和PARP5b,不仅药代动力学良好,已进入神经疾病和轴突损伤的临床开发阶段。其在体内具体作用靶点仍待进一步明确。
总体而言,越来越多的证据表明,靶向相关的 NAD+消耗酶(如PARP)具有作为NAD+增强靶点的巨大潜力,以延长人类健康寿命。
除了补充NAD+前体;调节NAD+生物合成,以及抑制NAD+降解,NAD+水平可以通过生活方式和营养方法进行调节。
补充NAD+水平及其生理效应
Rajman L,et al.Cell Metab.2018
▸ 饮食会影响NAD+水平
均衡摄入宏量和微量营养素是健康的基础。热量限制(CR)被认为是有效、并有证据支持的延寿方式,在多种生物中,减少25-60%热量摄入可显著延长寿命。
▸ 热量限制有助于提高NAD+水平
热量限制与NAD+水平有何关系?研究发现,热量限制(CR)通过激活NAMPT,增强NAD+挽救途径,提高NAD+、降低NADH水平,从而激活sirtuins。NADH是Sir2等NAD+消耗酶的抑制剂,因此提升NAD+/NADH比值,尤其是降低NADH,对于提升NAD+水平至关重要。
▸ 饮食的时间种类也会影响NAD+的生物利用度
NAD+/sirtuin通路受饮食习惯等营养因素影响。我们在什么时间、吃什么食物和吃多少通过改变线粒体中的电子传递来影响细胞内的NAD+生物利用度。
高脂肪/高糖饮食会导致能量过剩,降低NAD+/NADH比率及NAD+水平,并因AMP/ATP比率下降、血糖和胰岛素升高,增加ROS生成和餐后氧化应激。高脂肪饮食和肥胖都会导致组织NAD+水平下降,肥胖人群的sirtuin和NAMPT表达降低,PARP活性上升;减重后这些指标均有所改善。而补充带有NAD+前体的物质可激活sirtuin和氧化代谢,改善高脂饮食诱导的肥胖和代谢紊乱。
烟酸等存在于多种动植物中,NMN和NR也见于黄瓜、卷心菜、生牛肉等。西兰花(每0.25克含1.88-100毫克NMN)、鳄梨和番茄(每100克含0.26-1.60毫克),生牛肉和虾、乳制品中NMN含量则较低。
▸ 运动有助于提高NAD+水平
运动如何影响NAD+水平?
▸ 运动可以促进NAD+挽救途径
研究发现有氧运动训练或任何类型的运动/体育活动都会增加NAD+的量,因为运动通过诱导骨骼肌中NAMPT的表达,促进NAD+挽救途径,从而提升NAD+水平,逆转NAD+随年龄下降的趋势。这一过程主要通过AMPK通路实现,有氧与阻力训练均能增加年轻人和老年人的NAMPT水平。在老年大鼠中,运动还提高了NAD+和SIRT1活性,加速L-色氨酸从头合成NAD+。
▸ 运动提高NAD+可利用水平
NAD+在细胞能量产生、线粒体生物发生和氧化还原反应中至关重要。运动增强ATP消耗,提高NAD+/NADH比值,激活去乙酰化酶、PARP和CD38等NAD+消耗酶,从而带来多方面健康益处。
高强度体育活动会增加对NADH的需求,促进NAD+再生,进一步提升NAD+/NADH比值。运动过程中能量需求增加激活AMPK,调节NAD+生物利用度。运动和热量限制均通过AMPK诱导NAMPT表达,提高sirtuins和PARP可利用的NAD+水平。
▸ 睡眠影响NAD+水平
睡眠障碍会增加肥胖、抑郁、糖尿病和多种代谢疾病的风险,这些病症与较高的死亡率和发病率密切相关。相反,规律的睡眠和清醒模式有助于健康和长寿。
▸ NAD+水平与昼夜节律之间存在双向作用
NAD+水平和sirtuin活性参与调节健康的睡眠和昼夜节律,且NAD+本身也受昼夜节律控制并参与其调节。NAD+水平呈24小时节律波动,受进食和睡眠时间影响。昼夜节律由下丘脑视交叉上核的生物钟协调,通过CLOCK和BMAL1激活因子及CRY与PER抑制因子的负反馈调节。CLOCK:BMAL1异二聚体调节NAMPT的昼夜表达,NAMPT影响NAD+合成,其活性受光照限制、黑暗增强。
注:CLOCK是一种组蛋白乙酰转移酶,其活性被NAD+依赖的去乙酰酶SIRT1拮抗。
随着年龄增长,NAMPT活性下降,NAD+利用度减少,导致昼夜节律变差。昼夜节律紊乱常见于多种疾病如心血管疾病、糖尿病、癌症及加速衰老。维持昼夜节律的正常同步有助于改善健康。
!
NAD+是否存在不利影响?
关于补充NAD+的效果与安全性,现有研究揭示了其复杂甚至矛盾的一面。
首先,补充NAD+前体对运动表现的影响因年龄而异,它虽能改善老年人的身体机能,却可能损害年轻个体的运动能力。同时,过量补充存在风险,不仅可能导致不良反应,高剂量的烟酰胺(NAM)和烟酰胺核苷(NR)还分别与肝毒性及代谢功能障碍有关。
此外,NAD+在疾病中的角色也具有两面性。在癌症中,它既能在早期发挥保护作用,也可能在后期助长肿瘤的生长和耐药性。同样,在败血症和某些炎症性疾病中,NAD+的作用也随疾病阶段而变,甚至可能加剧炎症反应。
综上所述,盲目补充NAD+并非总是有益,其应用需更加谨慎和精准。
NAD+作为细胞内重要的辅酶分子,在延缓衰老、人体的能量代谢、DNA修复等生理过程中发挥着至关重要的作用。但随着年龄增长,NAD+水平的下降被认为是衰老和多种慢性疾病发生的重要因素,这促使人们寻求通过补充NMN、NR等前体物质来提升NAD+水平。
但最近权威研究表明,口服的NMN和NR大部分不能直接转化为NAD+,而是需要经过肠道菌群的”预处理”,转化为烟酸类代谢物,再通过肠肝循环最终在肝脏中合成NAD+。这一发现颠覆了传统认知,表明肠道微生物群是影响NAD+补充效果的关键因素。
肠道微生物群与NAD+的相互作用表现在多个方面:肠道微生物拥有独特的NAD代谢途径,能够通过烟酰胺脱酰胺酶将NAM转化为NA,为宿主提供NAD+合成的原料;同时,肠道菌群的多样性和健康状况直接影响NAD+前体的转化效率。当肠道菌群紊乱或多样性降低时,单纯补充NAD+前体的效果将大大降低。
未来通过肠道微生物群有助于更好地补充NAD+,一个健康的肠道菌群,是确保补充效果的基石。这要求我们转变策略,不再单纯关注前体物质的含量,而是采用综合方法:将NAD+补充与肠道菌群维护相结合,同时搭配科学的生活方式和精准的营养补充,实现真正有效的健康老龄化。
主要参考文献
Yaku K, Palikhe S, Iqbal T, Hayat F, Watanabe Y, Fujisaka S, Izumi H, Yoshida T, Karim M, Uchida H, Nawaz A, Tobe K, Mori H, Migaud ME, Nakagawa T. Nicotinamide riboside and nicotinamide mononucleotide facilitate NAD+ synthesis via enterohepatic circulation. Sci Adv. 2025 Mar 21;11(12):eadr1538.
Rajman L, Chwalek K, Sinclair DA. Therapeutic Potential of NAD-Boosting Molecules: The In Vivo Evidence. Cell Metab. 2018 Mar 6;27(3):529-547.
Ren Z, Xu Y, Li T, Sun W, Tang Z, Wang Y, Zhou K, Li J, Ding Q, Liang K, Wu L, Yin Y, Sun Z. NAD+ and its possible role in gut microbiota: Insights on the mechanisms by which gut microbes influence host metabolism. Anim Nutr. 2022 Jun 22;10:360-371.
Lu X, Yang R, Chen Y, Chen D. NAD metabolic therapy in metabolic dysfunction-associated steatotic liver disease: Possible roles of gut microbiota. iScience. 2024 Feb 9;27(3):109174.
Covarrubias AJ, Perrone R, Grozio A, Verdin E. NAD+ metabolism and its roles in cellular processes during ageing. Nat Rev Mol Cell Biol. 2021 Feb;22(2):119-141.
Poljsak B, Kovač V, Milisav I. Healthy Lifestyle Recommendations: Do the Beneficial Effects Originate from NAD+ Amount at the Cellular Level? Oxid Med Cell Longev. 2020 Dec 12;2020:8819627.
Kane AE, Sinclair DA. Sirtuins and NAD+ in the Development and Treatment of Metabolic and Cardiovascular Diseases. Circ Res. 2018 Sep 14;123(7):868-885.
Bhasin S, Seals D, Migaud M, Musi N, Baur JA. Nicotinamide Adenine Dinucleotide in Aging Biology: Potential Applications and Many Unknowns. Endocr Rev. 2023 Nov 9;44(6):1047-1073.
Niño-Narvión J, Rojo-López MI, Martinez-Santos P, Rossell J, Ruiz-Alcaraz AJ, Alonso N, Ramos-Molina B, Mauricio D, Julve J. NAD+ Precursors and Intestinal Inflammation: Therapeutic Insights Involving Gut Microbiota. Nutrients. 2023 Jun 30;15(13):2992.
Navarro MN, Gómez de Las Heras MM, Mittelbrunn M. Nicotinamide adenine dinucleotide metabolism in the immune response, autoimmunity and inflammageing. Br J Pharmacol. 2022 May;179(9):1839-1856.
Devereaux J, Robinson AM, Stavely R, Davidson M, Dargahi N, Ephraim R, Kiatos D, Apostolopoulos V, Nurgali K. Alterations in tryptophan metabolism and de novo NAD+ biosynthesis within the microbiota-gut-brain axis in chronic intestinal inflammation. Front Med (Lausanne). 2024 Jul 2;11:1379335.
Chu X, Hou Y, Meng Q, Croteau DL, Wei Y, De S, Becker KG, Bohr VA. Nicotinamide adenine dinucleotide supplementation drives gut microbiota variation in Alzheimer’s mouse model. Front Aging Neurosci. 2022 Sep 15;14:993615.
Braidy N, Liu Y. NAD+ therapy in age-related degenerative disorders: A benefit/risk analysis. Exp Gerontol. 2020 Apr;132:110831.

谷禾健康
凌晨两点外卖订单又刷新了记录
刚下单的芝士炸鸡、烤串、肥宅快乐水…
这些号称“当代青年续命神器”的食物
在不知不觉中消耗着我们的情绪健康
越来越多人有这样的感觉
“吃饱” ≠ “快乐”
超加工食品,就是那些经过复杂工业加工的食物,主要由食物和添加剂制成的配方,几乎不含完整的天然食物,比如方便面、薯片、汉堡、冷冻披萨、各种包装零食等,与较差的身心健康结果相关。
一份涵盖15,262人的国际ALIMENTAL研究刚报道了一篇文章,发现女性/年轻人食用超加工食品后抑郁风险更高。
本文我们为大家介绍一下这项涉及15,262名参与者的大规模国际ALIMENTAL研究的核心发现,系统阐述了不同饮食模式与重度抑郁症风险之间的量化关联,了解不同饮食习惯可能会如何影响他们的抑郁症风险。基于研究结果,本文还提供了具有循证医学依据的饮食调整策略,为通过营养干预预防和辅助治疗抑郁症提供了科学指导。
研究采用横断面设计,通过在线问卷收集数据,使用主成分分析识别饮食模式,并通过多变量分析评估其与抑郁症的关联。
ALIMENTAL研究是一项模断面在线国际调查,在2021年11月~2023年6月期间进行。
研究获得了法国、德国和加拿大伦理委员会的批准,通过社交媒体、心理健康协会和医疗机构招募参与者。
为了确保研究结果的可靠性,研究团队设置了严格的筛选标准,这样做的目的是避免这些因素对结果造成干扰,确保观察到的关联确实来自饮食本身。
采用 Benjamini-Hochberg 法校正多重检验,以优势比(OR)和 95% 置信区间(CI)评估膳食模式与抑郁的关联强度。
然后用统计学方法,比如运用主成分分析(PCA)提取 13 种膳食模式,把复杂的饮食数据简化成几种主流的饮食模式,再分析这些模式跟抑郁症的关系。
主成分分析简单说,就是把一大堆食物信息压缩成几个关键的饮食模式因子,他们最终识别出了13个因子。
其中最引人注目的两个是:
其他的因子还包括了:
每个因子代表一类具有相似营养特征或加工程度的食物组合。这些因子就像是给我们的饮食习惯贴标签,方便后续分析。
1. 超加工食品增加抑郁风险,性别差异显著
核心发现:女性和年轻人最脆弱。
换句话说就是:
这个发现并不孤立,实际上是证实了之前科学界在2021年和2022年,研究人员发表的两项荟萃分析:
说完坏消息,再来说说好消息。
2.健康饮食可降低抑郁风险(仅女性有效)
健康饮食包括水果、坚果(杏仁或榛子)、绿色蔬菜(如四季豆、西兰花、芦笋)、橄榄油、菜籽油或大豆油、绿叶沙拉或苦苣、茶饮、全麦面包等。
3. 其他重要发现
除了超加工饮食和健康饮食之外,其他的饮食也值得关注,比如吃罐头食品、喝含糖饮料,似乎和女性抑郁症风险增加有关。
关于膳食补充剂和女性抑郁风险增加有关,这可能是因为,吃这些补充剂的人本身就可能已经有抑郁倾向,或者存在其他健康问题,所以才去补充。
不能排除这些食物的摄入与其他食物的排除呈负相关,这也可能有助于解释观察到的关联。
吃高血糖指数食物、乳制品等,反而和抑郁风险降低有关,这可能是因为这些食物提供了一些必要的营养素,比如说在营养不良或能量不足群体中(如老年/慢性病患者),高GI食物提供快速能量,短期改善情绪低落。
也可能是因为存在人与人之间本身存在代谢差异,某些体质对糖代谢更适应,这要根据个人肠道菌群结构来看,肠道菌群检测报告中也有相关指标,可以看出个体对于碳水、糖类的代谢能力。
混杂因素影响
该研究还发现,某些混杂因素在某些群体中与抑郁症风险降低相关,如更高的成就、营养知识、有在家居住的伴侣、在家居住的儿童;
而另一些混杂因素则与抑郁症风险增加相关,如当前每日吸烟、肥胖、失业、肤色等。
科学家们提出了几种可能的解释:
◆ 女性的身体构造不同
女性和男性的激素水平、新陈代谢方式都不一样,女性的激素水平在月经周期、怀孕、更年期等不同生理阶段会发生显著变化。超加工食品通常高糖、高盐、高脂肪,可能干扰女性体内激素的正常平衡。
比如说,雌激素会放大乳化剂对肠道紧密连接蛋白ZO-1表达的抑制作用,增加肠道通透性,肠漏则进一步影响免疫系统功能,体内炎症因子水平上升更明显。
女性的身体脂肪分布与男性不同,通常更容易在腹部、臀部和大腿堆积脂肪。超加工食品的高热量和高脂肪含量,会加剧这种脂肪堆积,这可能与心血管疾病、糖尿病等慢性疾病相关。
◆ 男女吃的不一样
男性和女性可能偏爱不同类型的垃圾食品,吃的量也不同。比如女性可能更爱吃甜食和零食,男性可能更偏爱油炸或肉类食品。这些”口味偏好”的差异,可能导致对心理健康的影响也不同。
女性可能更容易受到情绪的影响,而出现情绪性进食行为。超加工食品往往具有浓郁的口感和香气,能够快速满足情绪上的需求,但长期来看,这种饮食习惯会导致营养不均衡和体重增加。
比如说,膳食乳化剂可能对肠-脑轴产生影响,并通过微生物群依赖机制诱导暴露者的心理/行为障碍。
乳化剂中羧甲基纤维素和聚山梨酯80过量食用会导致微生态失调,粘液降解细菌过度生长,以及IL-10或Toll样受体5进一步缺乏。
乳化剂可能还会增加肠上皮屏障中病原微生物的易位,引起肠道炎症。
乳化剂和相关微生物代谢对大脑的影响
Tan H,Nie S.FEMS Microbiol Rev.2021
比如说一些冰淇淋、奶昔、预包装蛋糕里面都含有乳化剂,而女生相对更爱吃这类超加工食品,因此可能带来更高的抑郁症风险。
可以详见谷禾之前写过的文章:
抑郁症与肠道微生物群有何关联
抑郁、焦虑、压力的肠道故事——精神健康的改善新途径
食品添加剂:健康还是危险?——从肠道微生物角度分析
◆ 对健康信息的处理方式不同
** 需要坦诚地说,这项研究的参与者中女性比男性多很多。这在抑郁症研究中很常见,可能是因为:女性本来就更关注健康话题,而且研究主要通过医疗机构和社交媒体传播,这些地方本身可能女性用户更多。不过研究者认为,这种”男女比例不均”不太可能影响他们观察到的性别差异。
◆ 各年龄段的吃法本来就不一样
想想看,爷爷奶奶那一代和现在的年轻人,饮食习惯都不一样。最近的科学调查发现了一个很有意思的现象:
越年轻、住在大城市、单身或离异的人,
越爱吃超加工食品。
这背后有很现实的原因:年轻人可能工作忙、不会或不愿意做饭,单身的人懒得准备精致丰盛的食物,大城市生活节奏快、外卖方便——这些都让方便面、冷冻食品、各种包装零食成了救命稻草。
◆ “从小就被喂坏了”
现在的年轻人可以说是垃圾食品的原住民——从幼儿园开始就接触各种包装饮料、膨化食品、快餐。这种从小培养的饮食习惯,可能让年轻男性比老年男性更容易受到超加工食品的情绪攻击。
就像抽烟一样,越早开始接触,成瘾性和伤害性往往越大。
这里有个更可怕的发现:超加工食品不只是让人心情不好,它还会引发一连串的健康问题——糖尿病、高血压、心脏病、肥胖等等。而这些慢性病本身就容易让人患抑郁症,形成一个”恶性循环“。
吃垃圾食品→身体发炎、代谢乱套→得慢病→心情更差→可能更依赖安慰性食物→恶性循环
具体来说:
◆ 影响菌群
高糖、高脂、防腐剂、缺乏纤维等超加工食品,不利于有益菌的生长,人工添加剂改变肠道环境的酸碱度,当坏细菌占上风时,它们会产生有毒物质(如脂多糖),破坏肠道屏障,让本来不该进入血液的东西跑进去,触发炎症反应。
抑郁症个体与健康对照组相比,微生物群变化如下:
Basiji K, et al., Metab Brain Dis. 2023
◆ 肠-脑轴
迷走神经直接连接肠道和大脑;肠道菌群能产生血清素、多巴胺等代谢产物(我们90%的血清素其实是在肠道产生的)。
血清素,参与调节情绪、食欲、睡眠和其他身体功能,比如说:
这些代谢产物通过血液循环或直接通过迷走神经传递到大脑,影响我们的情绪和行为。肠道炎症也会激活大脑中的炎症反应。
微生物群-肠-脑异常导致抑郁症
DOI: 10.1007/978-981-19-7376-5_10
◆ 其他微生物代谢产物
超加工食品通过双重途径加剧抑郁症风险:
◆ 炎症反应
超加工食品会让身体产生慢性炎症,当大脑接收到来自肠道的炎症信号时,负责情绪调节的区域(如海马体、杏仁核)开始罢工,压力激素皮质醇飙升,可能带来焦虑、抑郁、注意力不集中等情况。
抑郁症患者的炎症标志物包括:血清 IL-6、IL-1β、C反应蛋白升高。
◆ 代谢紊乱
超加工食品中的高糖、高脂肪成分会导致血糖快速上升后迅速下降,这种波动会引起情绪的起伏。长期食用会干扰胰岛素敏感性,导致能量代谢紊乱,使人容易感到疲劳、注意力不集中。
◆ 心血管负担
超加工食品中的反式脂肪酸和高钠含量会增加心血管疾病风险,血管健康受损时,大脑供血也会受到影响,可能导致认知功能下降。
◆ 恶性循环启动
心情不好的人往往会更渴望高糖、高脂的”安慰性食物”(这是大脑的本能反应),更没有动力去准备健康食物,从而选择一些方便快捷的垃圾食品。
这种本能的自我安慰机制却可能成为抑郁发展的催化剂——当不健康的饮食选择形成恶性循环时,科学干预的价值就凸显出来。
这正是研究食物与抑郁关系的关键意义:揭示这些现象背后的生理机制,才能为精准的健康干预指明方向。
健康的饮食习惯会帮助摄入许多营养成分,可以减轻炎症。其中,蓝莓,姜黄素等存在的植物化学物质(例如多酚)具有很强的抗炎特性,可能有助于治疗多种精神疾病。
益生菌,单独乳酸菌或与双歧杆菌联合使用——可能会改善抑郁和焦虑。
益生元,每天 5 克的低聚半乳糖和 1 克或以下的二十碳五烯酸可以有效缓解抑郁症状。
Omega-3脂肪酸、多不饱和脂肪酸在鲑鱼等海洋食品中含量很高,具有抗炎特性,可以改善并延缓细胞因子诱发的抑郁症的发作。
维生素,例如抗坏血酸(维生素C)和α-生育酚(维生素E)具有直接清除自由基的特性。
营养素(例如硒,锌和半胱氨酸)是抗氧化剂系统(例如谷胱甘肽过氧化物酶和超氧化物歧化酶)的辅助因子。初步证据表明,补充抗氧化剂如n-乙酰半胱氨酸可以改善抑郁症状。
当心理健康成为
全社会关注的焦点时
答案或许就藏在
我们每一餐的选择里
主要参考文献:
Achour, Y.; Lucas, G.; Iceta, S.; Boucekine, M.; Rahmati, M.; Berk, M.; Akbaraly, T.; Aouizerate, B.; Capuron, L.; Marx, W.; et al. Dietary Patterns and Major Depression: Results from 15,262 Participants (International ALIMENTAL Study). Nutrients 2025, 17, 1583.

谷禾健康
肠道微生物群是居住在人类胃肠道中的复杂生态系统,由数万亿微生物(包括细菌、病毒、真菌和其他微生物)组成。通过代谢活动和与宿主相互作用,肠道微生物群在影响正常生理过程、代谢稳态和疾病易感性方面发挥重要作用,并影响健康的各个方面。
研究表明,肠道菌群失调或改变可通过影响葡萄糖代谢、胰岛素敏感性和炎症来促进2型糖尿病发展。此外,肠道菌群通过葡萄糖耐量受损和胰岛素抵抗增加等机制与2型糖尿病、肥胖、代谢综合征等疾病发作相关。
2型糖尿病患者通常表现出产丁酸盐的有益细菌(如罗氏菌属和普拉梭菌)减少,而有害细菌(如埃希菌属和扭链瘤胃球菌属)增加。
而平衡的肠道微生物群与葡萄糖代谢和胰岛素敏感性改善相关,有可能降低糖尿病相关并发症风险。最近的荟萃分析表明,微生物群衍生的干预措施可显著改善血清空腹胰岛素和糖化血红蛋白水平,这两者都是2型糖尿病患者疾病进展的关键标志物。调节肠道微生物群的策略包括使用益生菌、益生元和合生元。益生菌是摄入后对健康有益的活微生物,益生元是刺激有益肠道细菌生长的不可消化化合物,合生元是益生菌和益生元的组合,协同作用以增强肠道健康。
尽管关于益生菌在2型糖尿病中作用的研究正在迅速扩大,强调它们对血糖控制和代谢参数的积极影响,然而益生元作为细菌营养基质的重要作用经常被忽视。不同类型的益生元可直接影响血糖水平,并通过支持有益细菌生长间接影响糖尿病。菊粉、低聚果糖、低聚半乳糖、抗性淀粉、果胶低聚糖、多酚、β-葡聚糖和铁皮石斛等益生元已被证明可改善肠道微生物组成并支持2型糖尿病患者血糖控制。
本文将详细描述不同的益生元、它们建议的每日剂量、含有它们的食物、它们对2型糖尿病的直接影响,以及由此产生的肠道微生物群的变化。益生元还通过不同机制改善血糖指数,包括对短链脂肪酸的影响、抗炎作用、肠促胰岛素分泌优化、血脂水平改善和抗氧化特性。深入地了解如何利用益生元以及个性化饮食干预有望作为优化糖尿病管理和改善整体健康的治疗策略。
2型糖尿病(T2DM)是一种由胰岛素抵抗或分泌不足等导致血糖水平升高的慢性代谢性疾病,典型症状被称为”三多一少”:即多饮、多尿、多食和体重减轻。
2型糖尿病已成为21世纪最严重的全球性健康危机之一。据国际糖尿病联盟数据,全球糖尿病患者从2000年的1.51亿激增至2021年的5.37亿,预计2045年将达7.83亿,其中90-95%为2型糖尿病。并且在全球20-79岁成年患者中,中国占1.41亿人,超过总数的四分之一。
2型糖尿病的危害
这一”现代流行病”不仅以惊人的速度蔓延,更以其广泛而深远的健康危害威胁着人类生存质量:它是导致失明、肾衰竭、糖尿病截肢的主要原因,还会使心血管疾病风险增加2-4倍,每年夺走超过400万人的生命。
2型糖尿病的危害包括以下几方面:
▸ 急性并发症
①糖尿病酮症酸中毒 (DKA)
发生率:2型糖尿病患者中约5-25%;
病理机制:胰岛素严重不足,脂肪分解增加,酮体生成过多;
临床表现:恶心、呕吐、腹痛、意识障碍;
死亡率:未治疗情况下可达5-10%。
②高血糖高渗状态 (HHS)
血糖通常>33.3 mmol/L,血浆渗透压>320 mOsm/kg;
脱水严重,可达体重的20-25%;
死亡率:10-50%。
③严重低血糖
血糖<2.8 mmol/L且伴有症状;
可导致认知功能损害、昏迷、死亡;
老年患者风险更高。
▸ 慢性微血管并发症
①糖尿病肾病
病理改变:肾小球基底膜增厚、系膜扩张、结节性硬化;
分子机制:高血糖激活蛋白激酶C,促进细胞外基质合成;
糖基化终末产物 (AGEs) 激活炎症反应;
肾素-血管紧张素系统激活;
患病率:30-40%的糖尿病患者发生肾病,是导致终末期肾病的主要原因。
②糖尿病视网膜病变
病理机制:视网膜毛细血管基底膜增厚;
周细胞丢失,血管通透性增加;
视网膜缺血,血管内皮生长因子 (VEGF) 释放;
新生血管形成,纤维增殖;
患病率:病程20年后约60%患者发生;
致盲率:糖尿病是工作年龄人群致盲的主要原因。
③糖尿病神经病变
远端对称性多发神经病变:
病理:轴突变性、脱髓鞘、神经纤维丢失;
症状:疼痛、麻木、感觉异常;
患病率:50-90%。
自主神经病变:
心血管自主神经病变:心率变异性降低,体位性低血压;
胃肠道自主神经病变:胃轻瘫,腹泻或便秘;
泌尿生殖系统病变:膀胱功能障碍,勃起功能障碍。
▸ 慢性大血管并发症
①冠心病
发病机制:动脉粥样硬化加速形成;
内皮功能障碍,一氧化氮生成减少;
血小板聚集性增加,凝血功能异常;
炎症反应激活,C反应蛋白升高;
发病风险:比非糖尿病患者高2-4倍;
预后:糖尿病患者心肌梗死后死亡率更高。
②脑血管病
缺血性脑卒中风险:增加2-3倍;
病理机制:大动脉粥样硬化、小血管病变、心源性栓塞;
认知障碍:血管性痴呆风险显著增加。
③外周动脉疾病
下肢动脉疾病:患病率15-20%。
糖尿病足:
发病机制:神经病变+血管病变+感染;
溃疡年发生率:2-10%;
截肢率:比非糖尿病患者高10-20倍。
▸ 代谢和内分泌影响
①脂代谢紊乱
糖尿病性血脂异常:甘油三酯升高(>1.7 mmol/L);
高密度脂蛋白胆固醇降低(<1.0 mmol/L男性,<1.3 mmol/L女性);
小而密的低密度脂蛋白增加。
非酒精性脂肪肝:患病率60-70%。
②电解质和酸碱平衡紊乱
高钾血症:肾功能不全时常见;
低钠血症:高血糖导致的稀释性低钠;
代谢性酸中毒:晚期肾病或酮症时。
▸ 免疫功能损害
①感染易感性增加
机制:中性粒细胞趋化性和吞噬功能下降;
细胞免疫功能减退;
组织愈合能力降低。
常见感染:
泌尿系统感染
皮肤软组织感染
肺部感染
真菌感染(如念珠菌病)
②疫苗应答减弱
流感疫苗、肺炎疫苗效果降低;
需要加强免疫策略。
▸ 心理和认知影响
①认知功能损害
2型糖尿病引起的脑血管病变、慢性炎症、胰岛素信号异常、高血糖毒性可能损害认知功能;
表现:执行功能、记忆力、注意力下降;
痴呆风险:增加1.5-2倍。
②心理健康问题
抑郁症:患病率25-30%,是一般人群的2倍;
焦虑障碍:患病率15-20%;
糖尿病痛苦:疾病管理负担导致的心理压力。
2型糖尿病是如何形成的?
葡萄糖通过食物和饮料进入人体,此时胰腺会分泌胰岛素激素帮助血液中的葡萄糖进入肌肉、脂肪和肝脏以提供能量。
▸ 胰岛素有助于控制正常血糖水平
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像“钥匙打开锁”一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
初期,胰腺会代偿性地分泌更多胰岛素来克服胰岛素抵抗。随着时间推移,胰腺功能逐渐衰竭,无法产生足够的胰岛素,2型糖尿病由此发生。
▸ 胰岛素抵抗的发生机制
细胞水平机制
胰岛素受体缺陷:受体数量减少或亲和力下降;
胰岛素受体底物-1 (IRS-1) 功能障碍:磷酸化异常,信号传导受阻;
PI3K-Akt通路受损:葡萄糖转运蛋白4 (GLUT4) 转位障碍;
线粒体功能异常:氧化磷酸化效率降低,ATP生成受限。
分子机制
蛋白激酶C (PKC) 激活:由二酰甘油 (DAG) 激活,抑制胰岛素信号;
c-Jun氨基末端激酶 (JNK) 激活:促进IRS-1丝氨酸磷酸化;
核因子κB (NF-κB) 激活:促进炎症因子释放;
过氧化物酶体增殖物激活受体γ (PPARγ) 功能减退。
▸ β细胞功能衰竭
早期阶段
β细胞代偿性增生:胰岛β细胞质量增加20-50%;
胰岛素分泌相位改变:第一相分泌减少,第二相延迟;
淀粉样蛋白沉积:胰岛淀粉样多肽 (IAPP) 在胰岛内沉积。
进展阶段
β细胞凋亡:氧化应激、内质网应激诱导细胞死亡;
β细胞去分化:失去成熟β细胞特征,分泌功能丧失;
胰岛纤维化:细胞外基质沉积,胰岛结构破坏。
▸ 遗传易感性
主要易感基因
TCF7L2:最强的2型糖尿病易感基因,影响胰岛素分泌;
PPARG:调节脂肪细胞分化和胰岛素敏感性;
KCNJ11和ABCC8:编码胰岛β细胞ATP敏感性钾通道;
IGF2BP2、CDKN2A/B、CDKAL1:影响β细胞功能。
遗传风险
一级亲属患病风险增加2-6倍;
同卵双胞胎一致性达90%;
不同种族遗传易感性存在差异。
▸ 环境和生活方式等因素
肥胖会增加患2型糖尿病的风险
内脏脂肪堆积:释放游离脂肪酸,诱发胰岛素抵抗;
脂肪因子异常:脂联素减少,瘦素抵抗,抵抗素增加;
慢性低度炎症:TNF-α、IL-6等促炎因子升高;
异位脂质沉积:肝脏、肌肉、胰腺脂肪浸润。
其他环境因素
久坐行为:肌肉胰岛素敏感性下降;
睡眠障碍:皮质醇分泌异常,葡萄糖稳态破坏;
慢性应激:下丘脑-垂体-肾上腺轴激活;
肠道菌群失调:短链脂肪酸减少,肠道屏障功能受损。(肠道菌群与2型糖尿病的关系将在后续章节详细描述,通过益生元和改善肠道微生物群可能成为治疗2型糖尿病的一种新方法)
研究表明,肠道菌群失调可通过影响葡萄糖代谢、胰岛素敏感性和炎症反应促进2型糖尿病(T2DM)的发生发展。
此外,肠道菌群还通过葡萄糖耐量受损和胰岛素抵抗等机制与肥胖、代谢综合征和2型糖尿病相关。最新荟萃分析显示,微生物群干预可显著改善空腹胰岛素和糖化血红蛋白水平,这两项均为2型糖尿病进展的关键指标。
2型糖尿病患者的肠道微生物群组成显示出明显的改变,提供了微生物分类群和相关代谢物之间的重要相关性,这些代谢物要么增加了对2型糖尿病发展的敏感性,要么防止了2型糖尿病的发展。
1
产丁酸盐细菌减少
具体而言,2型糖尿病(T2DM)患者表现出有益的产丁酸盐细菌减少,微生物多样性降低,包括普拉梭菌(Faecalibacterium prausnitzii)、罗氏菌属(Roseburia)和直肠真杆菌(Eubacterium rectale)。
丁酸盐是一种短链脂肪酸(SCFA),在调节食欲、体重和胰岛素抵抗方面起着关键作用。此外,在糖尿病患者中,另一种丁酸盐生产梭菌的减少已有记录。
• 与葡萄糖代谢相关的青春双歧杆菌等有益菌群减少
此外,2型糖尿病患者中另一种有益细菌Anaerostipes hadrus含量降低,这种减少与葡萄糖代谢受损和胰岛素抵抗增加有关。研究还显示,直肠真杆菌水平下降与加重胰岛素抵抗的菌群失调有关。
瘤胃球菌(Ruminococcus bromii)对葡萄糖代谢至关重要,但在糖尿病患者(尤其是慢性胰腺炎患者)中含量较低。2型糖尿病患者的青春双歧杆菌(Bifidobacterium adolescentis)和克里斯滕斯菌科(Christensenellaceae)水平均降低,后者与糖化血红蛋白水平呈负相关。糖尿病前期个体的梭菌显著减少,其降低与血糖水平、胰岛素抵抗和炎症反应改善相关。
2
对血糖有积极影响的菌群减少
放线菌门中的双歧杆菌与较低的2型糖尿病风险相关,厌氧菌门对空腹血糖有积极影响。其他研究表明,2型糖尿病患者的肠道拟杆菌(Bacteroides intestinalis)、拟杆菌(Bacteroides)和普通拟杆菌(Bacteroides vulgatus)水平降低。
早期研究显示,2型糖尿病患者的梭状芽胞杆菌和厚壁菌门水平显著下降,新诊断患者中球囊梭菌(Clostridium coccoides)和柔嫩梭菌属(Clostridium leptum)水平尤其降低。
青春双歧杆菌(Bifidobacterium adolescentis)和Bifidobacterium angulatum有助于改善血糖控制,Oscillospiraceae水平升高与胰岛素抵抗改善相关。巨单胞菌高水平与正常葡萄糖耐量相关。
• 双歧杆菌减少
双歧杆菌属具有显著的健康益处,包括改善肠道通透性,从而降低内毒素的循环水平并减少全身炎症。这与改善宿主的糖耐量和葡萄糖诱导的胰岛素分泌,并减少炎症有关。
• Akkermansia菌减少
Akkermansia muciniphila和Faecali prausnitzii这两种菌为2型糖尿病的发展提供了保护。
Akkermansia菌在维持粘蛋白层完整性和减少炎症方面发挥关键作用。粘蛋白作为高度糖基化的大分子蛋白质参与胃肠道保护,减少细菌移位,改善脂肪储存、脂肪组织代谢和葡萄糖稳态。
• Faecali prausnitzii 减少
2型糖尿病的Faecali prausnitzii丰度降低,而糖尿病治疗可导致了Faecali prausnitzii丰度的增加、全身炎症的二次减少和胰岛素抵抗的改善。
3
与糖尿病风险增加相关的有害菌丰度升高
临床前和临床试验的系统评价显示,双歧杆菌、拟杆菌、粪杆菌、阿克曼氏菌和罗氏菌属与2型糖尿病发展呈负相关,有助于改善代谢和肠道健康。相反,瘤胃球菌属、梭杆菌属和经黏液真杆菌属(Blautia)与糖尿病风险增加相关。
• 扭链瘤胃球菌与胰岛素抵抗和高血糖相关
并且2型糖尿病患者中潜在有害细菌显著增加,例如埃希氏菌和普雷沃氏菌。还观察到糖尿病患者变形菌门的显著增加。在T2DM 患者中经常观察到更高水平的 Collinsella,尤其是 Collinsella aerofaciens。此外,扭链瘤胃球菌(Ruminococcus torques)与胰岛素抵抗和高血糖有关,在减重手术和糖尿病缓解后水平下降。
2型糖尿病患者中高丰度的特定菌属还包括:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
4
平衡的肠道菌群对改善2型糖尿病有益
• 双歧杆菌可能有助于改善2型糖尿病
多种双歧杆菌,包括青春双歧杆菌、两歧双歧杆菌、假链双歧杆菌、长双歧杆菌和齿双歧杆菌,与2型糖尿病呈负相关,尤其是在接受二甲双胍治疗的患者中。
产丁酸细菌如柔嫩梭菌属(Clostridium leptum)与糖化血红蛋白和空腹血糖呈负相关。2型糖尿病患者厚壁菌门水平普遍升高,但在糖尿病模型中与空腹血糖呈负相关。
• 阴沟肠杆菌与葡萄糖耐量受损相关
在2型糖尿病中观察到Desulfovibrio和Odoribacter水平升高。肥胖和糖尿病患者丹毒丝菌科(Erysipelotrichaceae)丰度较高,阴沟肠杆菌与葡萄糖耐量受损相关。
同时糖尿病患者免疫功能受损增加肺炎克雷伯菌感染风险。代谢综合征患者Odoribacter水平升高,产气荚膜梭菌可致糖尿病患者肝脓肿,体现其机会致病特性。
• 平衡的肠道菌群益于葡萄糖代谢和降低并发症
另一方面,平衡的肠道微生物群(共生状态)与2型糖尿病患者葡萄糖代谢改善和胰岛素敏感性增加相关。此外,共生状态有助于预防与2型糖尿病(T2DM)相关的并发症,因为健康的肠道微生物群可以降低糖尿病并发症的风险,如视网膜病变、肾病和其他相关疾病。
益生元选择性地刺激有益细菌的生长,增强微生物多样性。它们不会促进有害细菌,但可以影响某些细菌种类的生长,有时可能与在糖尿病等疾病中观察到的微生物变化重叠。
如上所述,某些细菌类型在糖尿病患者中可能更丰富。而服用益生元为2型糖尿病提供了双重好处,促进共生,同时改善血糖指数。
要被归类为益生元,食品成分必须满足特定标准:它必须抵抗胃酸,避免被消化酶水解,并能被胃肠道菌群发酵代谢,并增加促进健康的肠道细菌的丰度。
益生元本质上是不可消化的食物基质,绕过人体消化,最终到达肠道,为肠道微生物群提供能量来源。这种关系是共生的,因为益生元促进有益肠道微生物群的生长,如乳酸杆菌、阿克曼菌、双歧杆菌、粪杆菌和罗氏菌属,这有助于缓解与2型糖尿病相关的代谢过程。
碳水化合物被认为是最有效的益生元,可按分子大小或聚合程度分类。不可消化碳水化合物、特定蛋白质肽段及某些脂质也被确定为潜在益生元成分。菊粉、低聚果糖、低聚半乳糖、抗性淀粉、果胶低聚糖、β-葡聚糖、多酚和石斛属等益生元已被证实可通过优化肠道微生物组成对2型糖尿病患者血糖控制产生治疗作用。下面将讲述这些益生元的功能特性及其对肠道微生物组成和血糖指数的影响。
1
菊粉
菊粉是一种水溶性储存多糖,存在于36000多种植物中,属于果聚糖类不可消化碳水化合物。作为分类益生元,菊粉天然存在于多种食物中,建议每日摄入量为2-12克。
建议每天摄入菊粉量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
菊粉表现出显著的益生元特性,长链菊粉型果聚糖对发酵活性和细菌群落组成的影响更强。菊粉的药理特性使其成为各种食品类别的多功能成分。它作为一种低热量甜味剂和不易消化的纤维,有助于提高食品的粘度、形成凝胶并改善食品的感官特性。菊粉能开发出具有理想质地和感官品质的低脂肉类和家禽产品,其脂肪替代和质地改性特性适用于各种食品。
注:菊粉广泛用于肉制品、乳制品、酱汁和糖果的脂肪替代品,还作为食品添加剂应用于面包、烘焙产品、乳制品、糖果和婴儿食品中,在食品工业中发挥重要作用。
• 菊粉对治疗2型糖尿病具有益处
多项研究表明菊粉对2型糖尿病的潜在益处。一项涉及49名BMI为25-35 kg/m²的2型糖尿病女性研究显示,每日服用10g菊粉2个月可降低空腹血糖和糖化血红蛋白水平,同时增加总抗氧化能力。
另一项52名2型糖尿病女性患者研究表明,补充10g富含低聚果糖的菊粉8周同样可降低空腹血糖和糖化血红蛋白水平。
• 菊粉改善了糖尿病患者的胰岛素敏感性
双盲交叉研究发现,糖尿病前期患者每日服用30g菊粉2周可改善胰岛素敏感性。每日补充15g菊粉6个月可降低糖尿病前期患者空腹胰岛素水平并改善胰岛素抵抗。
然而,一项随机双盲试验报告每日摄入10g菊粉12周对2型糖尿病患者胆固醇、血糖或糖化血红蛋白无显著影响。尽管如此,大量证据支持菊粉作为2型糖尿病治疗选择的潜力。
• 菊粉增加抗炎细菌丰度,改善厚壁菌门/拟杆菌门比率
关于肠道微生物群影响,糖尿病前期患者每日服用15g菊粉6个月可增加放线菌、双歧杆菌、乳酸菌等相对丰度,同时降低另枝菌属(Alistipes)丰度。
健康成人每日服用5-7.5g龙舌兰菊粉21天后,放线菌门和双歧杆菌丰度增加,脱硫弧菌丰度降低。双歧杆菌作用与较高粪便短链脂肪酸浓度相关,可能对2型糖尿病产生有益影响。
小鼠模型显示菊粉补充剂通过调节肠道神经胶质细胞产生显著抗炎作用,改善厚壁菌门/拟杆菌门比率。丁酸盐水平升高可抑制NF-κB通路,降低促炎因子表达。人体研究证实菊粉的抗炎益处,60例糖尿病患者补充菊粉后TLR4、NF-κB和IL-1表达降低。
• 菊粉可改善胰岛素抵抗
菊粉还被证明可以改善胰岛素抵抗的标志物,包括特定基因和胰岛素受体底物的表达。在一项针对67例2型糖尿病患者的纵向研究中,每日补充10g菊粉2个月可降低INS基因甲基化。有趣的是,据报道,胰岛细胞的胰岛素启动子中含有 INS 基因甲基化,这进一步揭示了菊粉干预人类后表观遗传修饰的作用。
此外,在小鼠模型中,菊苣菊粉补充8周后,IRS-1和MAPK信号通路受到影响。该研究表明,IRS活性上调并抑制丝裂原活化蛋白激酶(MAPK)通路,该通路对T2DM发病机制和糖尿病肾病等并发症有重大影响。
最后,在一项针对60名2型糖尿病患者的研究中,补充菊粉与丁酸盐联合使用,改善了血糖标志物、血脂谱和GLP-1分泌。
总体而言,有大量证据支持菊粉在改善血糖指数、减轻2型糖尿病发病机制相关分子过程和增强肠道微生物组成方面具有作用。
2
抗性淀粉
抗性淀粉在碳水化合物中具有独特特性,能抵抗小肠内源性淀粉酶消化,到达大肠作为肠道细菌营养。这一特性使抗性淀粉被归类为膳食纤维,具有多种潜在健康益处。抗性淀粉分为五种类型,天然存在于全谷物、豆类、煮熟冷却的马铃薯、大米和未成熟香蕉等食物中。
抗性淀粉包括物理难接近淀粉(RS1)、酶抗性淀粉(RS2)、逆降解淀粉(RS3)和化学改性淀粉(RS4),对人体葡萄糖反应影响不同。
抗性淀粉可通过发酵、挤压和化学处理等加工技术生产和改性,增强其结构、发酵特性和抗消化性。建议每日摄入量为10-15克。由于热量低,抗性淀粉适合添加到纤维和膨化谷物、零食、意大利面和烘焙食品中,不会显著增加卡路里。此外,它还能改善食品质地、稠度和稳定性。
建议每天摄入抗性淀粉量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 补充抗性淀粉有助于血糖水平下降
2023年荟萃分析显示,2型糖尿病或糖尿病前期患者补充1型和2型抗性淀粉后餐后血糖降低,RS2的餐后胰岛素反应减少。另一荟萃分析发现,健康个体和糖尿病患者补充抗性淀粉后空腹胰岛素、HOMA-B、糖化血红蛋白降低,HOMA-S增加,糖尿病患者空腹血糖水平下降。
2020年的荟萃分析也表明,补充抗性淀粉可降低空腹血糖,摄入量超过28g/d或干预超过8周时改善更显著。
• 抗性淀粉具有抗炎抗氧化特性从而改善血糖
抗性淀粉改善血糖控制的机制涉及其抗氧化和抗炎特性。一项meta分析纳入了16项试验和706例2型糖尿病患者,结果显示,总抗氧化能力增加,炎症标志物(如CRP、IL-6和TNF浓度)降低。
这些发现一致强调了抗性淀粉在控制T2DM患者血糖水平和减少炎症方面的好处。除了这些荟萃分析外,个别临床试验还提供了强有力的证据,支持将抗性淀粉纳入2型糖尿病患者的饮食中,从而更详细地了解与食用相关的代谢改善。
例如,在60例T2DM女性患者中,补充10g/天的RS2持续8周,导致HgbA1c降低,甘油三酯降低,促炎性TNF-α减少,同时血清HDL水平升高。在另一项针对T2DM患者的研究中,补充RS2显示出对餐后GLP-1的有益影响,从而改善餐后胰岛素反应。
• 抗性淀粉饮食增加了罗氏菌属、阿克曼菌等
关于肠道菌群影响,富含抗性淀粉的饮食增加厚壁菌门与拟杆菌门比例,胰岛素敏感性低的个体中普拉梭菌、普雷沃氏菌科、瘤胃球菌、直肠真杆菌、罗氏菌属和嗜粘蛋白阿克曼菌增加。
不同类型抗性淀粉会引起不同反应:RS4可能促进拟杆菌门,RS2有利于厚壁菌门。研究显示,食用含RS4饼干的参与者放线菌门和拟杆菌门增加,厚壁菌门减少;食用含RS2饼干的个体瘤胃球菌和直肠真杆菌增加。但两种类型的抗性淀粉都与梭菌状芽胞杆菌比例的增加有关。
3
低聚果糖
低聚果糖(FOS)广泛用于生产功能性和低热量食品,作为甜味剂和生物防腐剂,以益生元作用著称。建议每日摄入量为12.5-20g,天然存在于洋葱、菊苣、大蒜、香蕉和朝鲜蓟等植物中。
建议每天摄入低聚果糖量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 补充低聚果糖增加了双歧杆菌丰度,但会因年龄而异
与其他益生元结合使用时,低聚果糖显示出更好的代谢控制。与多酚类配对时,联合益生元效应可改善胰腺β细胞功能,降低肝脏胰岛素抵抗和低密度脂蛋白胆固醇水平,肠道菌群也发生显著变化,双歧杆菌属增加4倍,真杆菌属增加2倍。
2022年荟萃分析显示,低聚果糖给药后双歧杆菌浓度增加(每日7.5-15g,持续4周以上),乳杆菌属或肠杆菌科无显著变化。低聚果糖对肠道菌群的影响因年龄而异,成人和老年人Odoribacter显著减少,所有年龄组嗜胆菌属和毛螺菌属减少,年轻人和成人颤螺菌属(Oscillospira)减少。
• 低聚果糖对GLP-1分泌的影响还未确定
分子水平上,低聚果糖在小鼠模型中对肠促胰岛素激素(如GLP-1)分泌有积极影响。在2型糖尿病模型中,低聚果糖减轻肠道L细胞凋亡,增强GLP-1分泌。含低聚果糖饼干可在体外增加GLP-1浓度并降低血糖。
然而,人类急性摄入低聚果糖未产生类似结果,肠道激素水平或饱腹感无显著变化。富含低聚果糖的糖浆也不会显著改变餐后生长素释放肽或GLP-1水平。
4
低聚半乳糖
低聚半乳糖是天然功能性低聚糖,也是牛奶中的关键活性成分和广泛使用的益生元。它存在于α-低聚半乳糖和β-低聚半乳糖两种亚型,通过特定半乳糖键区分。
低聚半乳糖因双重功能在食品生产中受到关注:既能改善加工食品的感官品质(如味道、质地和稳定性),又能通过选择性刺激双歧杆菌和乳酸杆菌生长促进肠道健康。建议每日摄入量为2-20克。
建议每天摄入低聚半乳糖量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 低聚半乳糖可能影响空腹胰岛素和血糖水平
关于低聚半乳糖对空腹胰岛素和血糖水平的影响,研究结果不一致,类似于低聚果糖。一项超重个体研究显示,每日补充5.5g低聚半乳糖84天后空腹胰岛素显著降低,同时总胆固醇、甘油三酯和炎症标志物(如CRP)也降低。
相反,另一项针对2型糖尿病患者的相同剂量和持续时间研究未观察到空腹血糖、糖化血红蛋白或空腹胰岛素水平的显著变化。荷兰一项针对超重或肥胖个体每日摄入15g低聚半乳糖84天的研究也未报告空腹血糖、胰岛素、肠道激素或炎症标志物的显著变化。
• 补充低聚半乳糖后双歧杆菌等有益菌丰度增加
虽然空腹胰岛素和血糖结果不一致,但低聚半乳糖对肠道微生物群的影响显示出更一致的结果。小鼠研究表明补充低聚半乳糖后双歧杆菌水平增加。人类研究同样显示低聚半乳糖增加双歧杆菌科,12周研究发现粪便双歧杆菌增加5倍。最近一项涉及53名糖尿病前期个体的研究显示,补充低聚半乳糖和短双歧杆菌12周后,糖化血红蛋白和空腹血糖显著降低。
除了增加双歧杆菌外,低聚半乳糖补充剂还与肠道微生物组成的其他有益变化有关。例如,在一项针对溃疡性结肠炎患者的研究中,每天服用2.8g低聚半乳糖,双歧杆菌属和克里斯滕森氏菌的丰度增加。还报道了几种有益细菌种类的增加,包括长双歧杆菌、青春双歧杆菌、乳酸菌科和瘤胃球菌属,以及补充低聚半乳糖后梭状芽胞杆菌、丹毒丝菌科、Odoribacteraceae和颤螺菌科(Oscillospiraceae)的减少。
总体而言,虽然低聚半乳糖在改善2型糖尿病血糖指数方面的功效仍无定论,但其对肠道微生物群的积极影响已得到充分证明。数据表明,与益生菌或其他有益剂结合使用时,低聚半乳糖可能增强疗效,尽管单独补充可能不会显著改变血糖结果。
5
果胶低聚糖
果胶是高等植物细胞壁中的必需多糖,对维持植物组织刚性和结构至关重要。水果和蔬菜中果胶含量为0.1%-2.5%,建议每日摄入30克可减少餐后血糖反应、维持正常胆固醇水平和增加饱腹感,从而减少热量摄入。
注:果胶含量因来源而异:橄榄渣34.4%,柑橘废料30%,洋葱皮27-34%,苹果浆20.9%,甜菜浆16.2%。果胶也是果胶低聚糖(POS)的来源,建议每日摄入10-20克,提供益生元益处并支持肠道健康。
• 果胶通过提高胰岛素敏感性等机制抗糖尿病
多项研究证实果胶的抗糖尿病特性。红辣椒果实提取的果胶可显著提高胰岛素敏感性并降低血糖水平。在含106g碳水化合物的膳食中添加16g瓜尔豆和10g果胶可显著降低胰岛素依赖型和非胰岛素依赖型糖尿病患者的餐后血糖和胰岛素水平。
健康成年人在含碳水化合物膳食中摄入10g果胶也可降低餐后血糖。一项涉及43名2型糖尿病志愿者的研究显示,补充果胶后空腹血糖和糖化血红蛋白水平显著降低,HOMA-IR指数降低表明胰岛素抵抗改善。
果胶还可以在胃肠道形成凝胶,减缓胃排空并减少葡萄糖吸收,调节血糖水平并增加饱腹感;对脂质代谢有积极影响,降低胆固醇水平;具有抗炎作用,可能通过减少炎症标志物改善整体代谢健康。
• 果胶促进有益菌生长并产生短链脂肪酸
果胶调节肠道菌群的能力是另一个关键因素,因为它促进有益细菌的生长,从而改善代谢健康和胰岛素敏感性。果胶经过缓慢发酵,并通过产生短链脂肪酸(SCFA)表现出益生元作用。
果胶低聚糖(POS)已显示出促进双歧杆菌的潜力,并提供各种健康益处,包括抗肥胖、抗癌和抗氧化特性。POS代表了一类新的益生元,它通过肠道微生物群的发酵产生SCFA。一项研究表明,甜菜中的POS具有最高的双歧杆菌生成促进作用和最高的SCFA浓度,而柑橘皮中的 POS 增加了乳酸菌种群。
2型糖尿病中响应益生元的肠道微生物组成变化
Iatcu OC,et al.Nutrients.2024
6
多酚类
酚类化合物是源自植物的具有生物活性的次生代谢产物,在蔬菜、水果、全谷物和其他植物来源中含量丰富。这些化合物因其抗炎、抗氧化和代谢调节特性而受到关注。每日定期摄入约1-2克多酚与预防慢性疾病相关,每日摄入超过650毫克可显著降低死亡风险。
• 酚类化合物具有控制糖尿病的潜力
膳食酚类化合物(如类黄酮、香豆素、醌、二苯乙烯和姜黄素类化合物)控制糖尿病的潜力受到关注。酚类已被证明能增强胰岛素分泌,调节血糖水平,并可能通过影响复杂分子过程帮助预防糖尿病相关并发症。
杨梅提取物通过增强肝细胞葡萄糖摄取和提高谷胱甘肽水平显示降糖活性。苹果多酚可刺激葡萄糖吸收,改善线粒体功能,减少氧化应激。牛至、黑莓提取物、白桑葚和发芽藜麦酸奶也显示出降血糖、抗氧化和抗炎作用。
• 2型糖尿病患者服用多酚后餐后血糖降低
临床试验进一步证实多酚的抗糖尿病潜力。一项涉及25名糖尿病风险男性的研究发现,早餐时食用250毫升芙蓉提取物可降低血糖、胰岛素、甘油三酯和C反应蛋白。
2型糖尿病患者每日两次补充160毫克纯化花青素24周后,低密度脂蛋白胆固醇、甘油三酯、空腹血糖和胰岛素抵抗降低,高密度脂蛋白胆固醇和抗氧化能力增加。对口服降糖药无反应的2型糖尿病患者每8小时补充350毫克越橘提取物2个月后,空腹血糖、餐后血糖和糖化血红蛋白显著降低,对肝肾功能无不良影响。
• 多酚可增加乳酸杆菌和双歧杆菌
生物活性酚类化合物,包括类黄酮和非类黄酮,在胃和小肠中部分吸收,其余部分到达大肠。在那里,它们要么被肠道微生物群利用以发挥益生元作用,要么转化为活性代谢物。大约90-95%的食用酚不会立即被吸收,而是到达大肠,在那里它们对人类健康起着保护作用。
各种研究表明,多酚可增加有益肠道细菌(如乳酸杆菌和双歧杆菌)的丰度,同时调节其他微生物群,包括拟杆菌、梭状芽胞杆菌和普拉梭菌。肠道微生物群的这些变化可能有助于酚类化合物的抗糖尿病、抗氧化和抗炎作用,进一步支持它们在代谢健康中的作用。
7
β-葡聚糖
β-葡聚糖是主要存在于燕麦和大麦中的可溶性膳食纤维,因其在糖尿病控制方面的健康益处而受到认可。这些化合物天然存在于植物细胞壁、谷物种子以及某些真菌、酵母、藻类和细菌中,高度集中在燕麦和大麦胚乳细胞壁中,占其含量的75%,在麸皮中占10.4%。
注:燕麦和大麦在谷物中β-葡聚糖浓度最高,燕麦每100克干重含3-8克(溶解度82%),大麦含2-20克(溶解度65%)。
• β-葡聚糖改善血糖控制,增加胰岛素敏感性
研究表明,β-葡聚糖可显著改善血糖控制,增加胰岛素敏感性,降低胆固醇水平。其主要作用机制是增加肠道粘度,减慢碳水化合物吸收,调节餐后血糖水平,防止血糖急剧飙升。
β-葡聚糖能在低浓度(1%)下形成高粘度溶液,在各种pH值下都具有稳定性,优于其他可溶性纤维。每日摄入约3克β-葡聚糖可显著改善2型糖尿病患者血糖控制,降低胰岛素抵抗,并与较低的糖化血红蛋白水平相关。
除改善血糖控制外,β-葡聚糖还对脂质代谢产生积极影响,有助于降低糖尿病患者心血管风险。它们通过与胆汁酸结合、促进胆汁排泄和减少肠道胆固醇吸收来降低总胆固醇和低密度脂蛋白胆固醇水平。这种降脂作用与其增加肠道粘度的能力相关,结合葡萄糖、胆汁酸和胆固醇,增强粪便排泄。β-葡聚糖通过肠道菌群发酵刺激短链脂肪酸产生,调节GLP-1和PYY等激素,增加胰岛素分泌并增强饱腹感。
• β-葡聚糖可增加肠道中阿克曼菌等产丁酸菌
β-葡聚糖发酵促进肠道菌群健康变化。糖尿病动物模型研究显示,酵母β-葡聚糖和面包酵母β-葡聚糖给药后阿克曼氏菌增加。燕麦β-葡聚糖增加梭菌和丁酸球菌,减少拟杆菌属、乳酸菌属、颤螺菌属和瘤胃球菌属。肥胖动物研究报道,大麦β-葡聚糖给药后双歧杆菌、拟杆菌属、乳酸菌属和Atopobium增加。
谷物β-葡聚糖对调节肠道微生物群的影响已得到广泛研究。有代谢综合征风险的患者食用富含β-葡聚糖的大麦粉面包后,双歧杆菌属和阿克曼菌属数量增加。动物研究表明,低分子量β-葡聚糖增加双歧杆菌和拟杆菌数量,促进短链脂肪酸(特别是乙酸盐和丁酸盐)产生。食用全麦大麦意大利面后,人罗氏菌属和瘤胃球菌属增加,梭菌门和厚壁菌门减少。
8
铁皮石斛
近年来,石斛属因其显著的益生元特性而受到关注,特别是在2型糖尿病动物模型中。它具有减少慢性炎症、防止胰腺β细胞功能障碍、刺激GLP-1分泌以及通过增强微生物多样性上调短链脂肪酸浓度等显著益处。这些作用改善多种代谢参数,包括葡萄糖耐量、胰岛素抵抗和血脂水平。
• 上调短链脂肪酸产生并改善胰岛素分泌
在糖尿病前期小鼠模型中,铁皮石斛通过调节炎症、修复胰岛损伤、增加肠促胰岛素释放和改善胰岛素分泌发挥作用,特别是通过减少脂多糖介导的TLR4激活。
补充铁皮石斛增加了Roseburia、Alloprevotella、拟杆菌、双歧杆菌和乳酸杆菌的相对丰度,同时上调短链脂肪酸产生和肠道GPR43表达。另一项研究发现类似的抗炎作用,铁皮石斛通过增加Allobaculum、双歧杆菌和乳酸杆菌丰度来增强代谢参数,通过下调LPS/TLR-4通路减少炎症,并加强肠道屏障。
• 铁皮石斛调节信号通路促进血糖控制
铁皮石斛多糖通过减少肝脏糖异生酶和调节AMP-PKA和Akt等信号通路促进血糖控制。在评估2型糖尿病小鼠模型脂质代谢的研究中,石斛补充剂通过激活PPAR信号通路改善肝功能,导致血脂水平降低和胰岛素敏感性提高。类似研究报道,石斛治疗4周后PPARγ激活导致炎症减轻。
尽管尚未在2型糖尿病患者中进行随机临床试验,但动物模型的有希望证据表明,石斛属的益生元作用可能需要进一步研究作为血糖控制的辅助治疗。
益生元和肠道菌群可以通过多种机制改善血糖参数,包括将食品发酵成生物活性短链脂肪酸 (SCFA)、减少炎症、增加降血糖激素水平、增强脂质代谢和提高抗氧化酶活性。
这些分子因素和途径的相互作用有助于2型糖尿病患者通过食用益生元改善健康状况。这些机制将在以下小节中具体讲述。
益生元对2型糖尿病患者血糖指数的影响
Iatcu OC,et al.Nutrients.2024
1
通过产生短链脂肪酸改善血糖指数
益生元主要由可溶性纤维组成,由肠道微生物群通过一系列反应发酵,产生短链脂肪酸(SCFA),即乙酸盐、丙酸盐和丁酸盐。
• 短链脂肪酸增强葡萄糖摄取,提高胰岛素敏感性
短链脂肪酸(特别是丁酸盐)作为结肠细胞关键能量来源,具有多种益处。研究表明,定期摄入纤维与人类短链脂肪酸浓度增加约4倍相关。各种益生元在微生物群组成和短链脂肪酸产生方面表现出相似反应。短链脂肪酸通过激活G蛋白偶联受体(GPR41/GPR43)和启动细胞能量稳态信号通路增强外周组织葡萄糖摄取,对提高胰岛素敏感性至关重要。
例如,小鼠模型中益生元纤维缺乏与GPR41和GPR43信号传导减少相关,导致心脏代谢健康状况下降。益生元补充剂通过增加产生短链脂肪酸的肠道微生物群,增强肝脏AMP活化蛋白激酶信号传导,从而降低胰岛素抵抗。AMPK激活通过促进葡萄糖和脂肪酸氧化、增强摄取、抑制脂肪合成和减少糖异生等能量消耗过程来提高胰岛素敏感性。丙酸盐通过GPR43/AMPK通路抑制肝脏糖异生,GPR43激活导致肝细胞钙依赖性AMPK激活,减少糖异生。
• 增加短链脂肪酸产生菌丰度并释放肠促胰素
此外,益生元通过增加短链脂肪酸产生和促进产生短链脂肪酸的细菌来增强抗炎作用、抗氧化特性、脂质代谢和肠促胰岛素激素释放。膳食纤维摄入通过增加短链脂肪酸产生改善2型糖尿病相关的各种参数,包括炎症、血脂水平和早期饱腹感。
2
抗炎作用改善血糖控制
2型糖尿病的特征是低度炎症,由脂肪组织释放促炎细胞因子、巨噬细胞浸润和有害肠道微生物及其代谢物驱动。这种炎症在临床上通常与C反应蛋白水平升高相关。
益生元干预措施的荟萃分析表明,2型糖尿病患者使用益生元后C反应蛋白水平显著降低,循环肿瘤坏死因子-α减少,抗氧化酶活性改善。另一项纳入27项研究的荟萃分析显示,抗性淀粉、抗性糊精和低聚果糖等益生元具有显著的降糖和抗炎益处。其中19项研究报告血糖指标改善,包括糖化血红蛋白、HOMA-IR评分和血糖,许多研究还显示抗炎作用增强。
• 益生元与肠道菌群通过抗炎作用改善2型糖尿病
脂多糖是革兰氏阴性菌外膜组成部分,通过与Toll样受体4结合,触发全身性促炎细胞因子释放,起到有效的炎症刺激作用。这些细胞因子(特别在脂肪组织和肝脏中)通过干扰胰岛素信号通路导致胰岛素抵抗。
白细胞介素-6和肿瘤坏死因子-α等细胞因子激活磷酸化胰岛素受体底物1的激酶,损害胰岛素信号传导。白细胞介素-6诱导细胞因子信号传导抑制因子3表达,降解胰岛素受体底物1,进一步恶化胰岛素抵抗。此外,白细胞介素激活核因子κβ,刺激细胞因子释放并产生反馈回路,加剧血糖失调。
肠道菌群和益生元通过发挥抗炎作用抵消这些炎症过程。多糖补充已被证明可减少2型糖尿病中脂多糖泄漏和代谢炎症。从机制上讲,益生元上调紧密连接蛋白,改善肠道屏障完整性,减轻脂多糖和核因子κβ介导的炎症损伤和氧化应激。
同时,有益的产生短链脂肪酸的双歧杆菌和乳酸杆菌种群增加两倍,有害的幽门螺杆菌种类受到抑制。研究表明,在脂多糖刺激的炎症细胞中进行短链脂肪酸治疗可降低血糖正常和控制不佳的2型糖尿病个体的肿瘤坏死因子-α和干扰素-γ。
注:异麦芽糖糊精是另一种潜在益生元,可抑制肿瘤坏死因子-α和白细胞介素-6,通过抑制脂肪组织中巨噬细胞浸润和恢复胰岛素受体底物1表达来调节免疫反应。它还提高拟杆菌-普雷沃氏菌浓度,改善微生物多样性,提高胰岛素敏感性。
总体而言,炎症是导致血糖控制不佳的重要因素,益生元和肠道菌群在减轻与2型糖尿病发作相关的炎症信号通路方面起着至关重要的作用。
3
影响激素水平从而调节血糖
肠促胰岛素激素(如胰高血糖素样肽1和胃抑制多肽)是众所周知的餐后胰岛素分泌增强剂,是目前流行的改善代谢健康的药物。
益生元摄入可通过改变肠道菌群组成及其代谢物自然刺激胰高血糖素样肽1、肽YY和胃抑制多肽的释放。例如,服用益生元2周与标准化膳食后血浆胰高血糖素样肽1和肽YY浓度升高及餐后血糖水平降低显著相关。
• 胰高血糖素样肽1和肽YY分泌增加
通过益生元增强胰高血糖素样肽1释放可部分归因于短链脂肪酸浓度增加。短链脂肪酸与分泌胰高血糖素样肽1的L细胞上的GPR41和GPR43受体结合,通过Gq信号传导促进胞质钙释放,刺激胰高血糖素样肽1分泌。低聚果糖和菊粉等益生元通过上调GPR43受体表达和增加结肠中分泌胰高血糖素样肽1的L细胞数量来促进这些作用。
例如康普茶作为富含多酚和益生元的茶,通过增加产生短链脂肪酸的细菌(如丁酸球菌、乳酸菌和毛螺菌科)水平来促进胰高血糖素样肽1和肽YY释放,对胰岛β细胞功能显示出有益作用。干预4周后,还观察到血糖控制的其他标志物改善,包括脂多糖水平降低、肠道屏障完整性改善,以及有害细菌属(如脱硫弧菌、大肠杆菌和志贺氏菌)减少。
总体而言,有强有力的证据支持益生元介导的肠促胰岛素激素释放增加,有助于改善血糖控制。
4
改善血脂水平进而增强血糖控制
益生元补充剂的另一个重要结果是改善血脂水平,从而直接或间接增强血糖控制。与其他有益机制类似,益生元通过促进产生短链脂肪酸的有益肠道微生物群生长来实现更好的脂质调节。
• 抑制肝脏胆固醇合成、减少异位脂肪沉积
丙酸盐通过下调参与胆固醇产生的关键酶(如乙酰辅酶A羧化酶和脂肪酸合酶)来抑制肝脏胆固醇合成,减少甘油三酯形成,降低极低密度脂蛋白分泌。
丁酸盐促进脂肪酸氧化,减少肝脏、肌肉和脂肪组织中的脂质积累。血糖控制改善主要由于异位脂肪沉积减少,因为无法抑制脂肪分解是导致2型糖尿病患者胰岛素抵抗的重要因素。
这些代谢益处通常同时发生,补充β-葡聚糖的益生元已被证明可减少胰岛素抵抗(AMPK信号传导)和脂肪酸储存(过氧化物酶体增殖物激活受体γ)的标志物。临床上,研究表明抵抗性糊精补充剂8周导致空腹血糖、糖化血红蛋白和低密度脂蛋白胆固醇水平降低,同时高密度脂蛋白浓度增加。
因此,益生元在控制脂质参数中的作用至关重要,因为脂质代谢与2型糖尿病的发生和发展有着密切关系。
5
益生元、抗氧化剂和血糖指数
氧化应激部分由有害微生物物种过度生长驱动,通过破坏胰岛素信号通路和促进胰腺β细胞功能障碍,在2型糖尿病发病机制和进展中起重要作用。
活性氧介导的通路触发胰岛细胞凋亡信号,导致细胞损伤和功能能力下降。在氧化应激状态下,胰岛素受体底物1磷酸化进一步损害胰岛素敏感性。
此外,促氧化剂损害内皮细胞,减少一氧化氮产生,而一氧化氮通过血管舒张作用将葡萄糖输送到细胞中是必不可少的。埃希菌属、梭状芽胞杆菌属和肠球菌属等细菌属,以及变形菌门和厚壁菌门与拟杆菌门比例增加,与2型糖尿病患者氧化应激增加相关。
• 减轻氧化应激、保护胰腺β细胞并改善葡萄糖稳态
益生元(特别是多酚)通过增加具有固有抗氧化能力的有益细菌相对丰度来减轻氧化应激,这些有益细菌可有效清除活性氧。多酚被肠道微生物群代谢产生酚酸,这是一种有效的抗氧化剂,已知可增强胰岛素信号传导、保护胰腺β细胞并改善葡萄糖稳态。
从机制上讲,酚酸通过下调NADPH氧化酶和上调核因子红细胞2相关因子2,后者是抗氧化酶的有效刺激剂。该研究还表明下游胰岛素信号传导增强,显著增加Akt磷酸化,表明胰岛素敏感性提高。
例如姜黄素是一种多酚,通过上调谷胱甘肽过氧化物酶和超氧化物歧化酶等抗氧化酶来促进胰岛细胞存活和功能,同时减少细胞凋亡。多酚已被证明可降低2型糖尿病患者脂质过氧化,通过降低低密度脂蛋白和增加高密度脂蛋白水平来优化血脂谱。这些改善与抗氧化防御机制增加相关,包括总谷胱甘肽水平升高,有助于防止糖尿病并发症进展。
因此,益生元的抗氧化特性在控制2型糖尿病氧化应激和控制血糖指数方面起着关键的治疗作用。
基于肠道微生物群的精准营养干预正成为功能食品和营养保健品行业的重要发展方向。随着个性化医疗的兴起,针对不同肠道菌群特征和代谢表型的定制化益生元产品将具有巨大的市场潜力。
肠道微生物群失调是2型糖尿病发生发展的重要机制,患者普遍存在产丁酸盐有益细菌(如双歧杆菌、罗氏菌属、普拉梭菌)减少,而有害细菌增加的现象。
研究表明,益生元在肠道菌群在2型糖尿病管理中的重要作用,本文深入分析菊粉、抗性淀粉、低聚果糖、低聚半乳糖、果胶低聚糖、多酚、β-葡聚糖和铁皮石斛等八种主要益生元,揭示了它们通过多重机制改善2型糖尿病的分子基础:促进短链脂肪酸产生、发挥抗炎作用、优化肠促胰岛素激素分泌、改善血脂代谢以及增强抗氧化特性。这些机制协同作用,显著改善血糖控制、胰岛素敏感性和代谢健康状况。
未来,应关注益生元与现有药物的协同作用,发展“药物+营养”的综合治疗模式。根据个体肠道微生物群特征和代谢特征定制益生元干预措施是一种策略。同时,这种“检测-分析-干预-监测”的精准营养循环,不仅能够实现血糖控制的显著改善,更能从根本上修复代谢紊乱的生物学基础。有望实现更好的血糖控制和整体健康改善。
主要参考文献
Iatcu OC, Hamamah S, Covasa M. Harnessing Prebiotics to Improve Type 2 Diabetes Outcomes. Nutrients. 2024 Oct 11;16(20):3447.
Zhou M., Zhao J. A Review on the Health Effects of Pesticides Based on Host Gut Microbiome and Metabolomics. Front. Mol. Biosci. 2021;8:632955.
Keivanlou M.H., Amini-Salehi E., Sattari N., Hashemi M., Saberian P., Prabhu S.V., Javid M., Mirdamadi A., Heidarzad F., Bakhshi A., et al. Gut microbiota interventions in type 2 diabetes mellitus: An umbrella review of glycemic indices. Diabetes Metab. Syndr. 2024;18:103110.
Quigley E.M.M. Prebiotics and Probiotics in Digestive Health. Clin. Gastroenterol. Hepatol. 2019;17:333–344.
Hamamah S., Iatcu O.C., Covasa M. Nutrition at the Intersection between Gut Microbiota Eubiosis and Effective Management of Type 2 Diabetes. Nutrients. 2024;16:269.
Megur A., Daliri E.B., Baltriukiene D., Burokas A. Prebiotics as a Tool for the Prevention and Treatment of Obesity and Diabetes: Classification and Ability to Modulate the Gut Microbiota. Int. J. Mol. Sci. 2022;23:6097.
Wu J., Yang K., Fan H., Wei M., Xiong Q. Targeting the gut microbiota and its metabolites for type 2 diabetes mellitus. Front. Endocrinol. 2023;14:1114424.
Gargari B.P., Dehghan P., Aliasgharzadeh A., Jafar-Abadi M.A. Effects of high performance inulin supplementation on glycemic control and antioxidant status in women with type 2 diabetes. Diabetes Metab. J. 2013;37:140–148.
谷禾健康
铁是地球上几乎所有生命形式包括人体与微生物不可或缺的微量元素。它不仅支撑着人类的呼吸、免疫和能量代谢,更是肠道微生物争夺的“战略资源”。铁稳态的破坏与肠道菌群失调和多种疾病的发展密切相关。
然而科学家发现,铁在人体与微生物之间也是一把双刃剑:它既能维持生命,也可能通过氧化应激引发DNA损伤和疾病。过量的铁主要通过芬顿反应产生有害的氧化应激,导致DNA、蛋白质和脂质等大分子损伤。因此,人体细胞和微生物系统的铁水平受到复杂机制的严格管控,以维持体内平衡。铁失调可以作为多种人类疾病的原因和结果。更微妙的是,人体与肠道微生物之间围绕铁的“争夺战”,直接决定了我们的健康与疾病状态。
肠道菌群是铁稳态和宿主健康的关键参与者,肠道中未吸收的膳食铁会影响肠道微生物群的组成。铁稳态的破坏可以引发肠道微生态的失调,从而影响宿主的的生理和免疫系统。
近年来,《自然·微生物学》等顶级期刊的研究揭示,铁的动态平衡不仅影响贫血或感染,还与炎症性肠病、癌症等慢性病密切相关。肠道微生物群的组成和功能,甚至药物疗效,都可能被铁的波动彻底改变。本文将从铁的核心作用出发,解析宿主、微生物与铁之间的复杂博弈,并探讨如何通过精准调控铁代谢实现个性化健康管理。
1. 铁的生理功能
铁是血红蛋白和肌红蛋白的核心成分,负责氧气的运输与储存;它也是细胞色素和铁硫簇蛋白的辅因子,参与能量代谢(ATP生成)和DNA合成。人体每天需要约20-25毫克铁,但仅1-2毫克通过肠道吸收,其余来自红细胞回收。
膳食铁分为两类:血红素铁和非血红素铁。
一般来说,血红素铁的生物利用度高于非血红素铁。这是因为,非血红素铁与各种饮食成分复合摄入,抑制其在十二指肠的吸收。虽然铁的还原亚铁形式(Fe2+)是可溶性的能被人类吸收和利用,但亚铁在生理pH值和有氧条件下被氧化为不溶性的三价铁形式(Fe3+)。因此,最常见改善机制是降低环境pH值为酸性条件或通过微生物代谢产物,来改善非血红素铁的溶解度和生物利用率。
2. 铁的毒性风险
游离铁通过芬顿反应(Fenton Reaction)产生活性氧(ROS),攻击脂质、蛋白质和DNA。有研究表明,活性氧水平升高可导致衰老加速,呼吸道和心血管疾病、IBD和癌症的风险增加。总之,这一临床证据突出了维持铁稳态对整体健康的关键作用。
注:芬顿反应是一种基于亚铁离子(Fe²⁺)催化过氧化氢(H₂O₂)产生羟基自由基(•OH)的高级氧化过程,具有极强的氧化能力,广泛应用于环境治理、有机污染物降解等领域。
3. 铁的调控系统
为了维持铁稳态,人体进化出严密的铁调控系统:
图1人类的铁调节
doi.org/10.1038/s41564-025-02001-y
1.宿主的防御策略:营养免疫(Nutritional Immunity)
在急性感染期间,病原体急需铁在宿主内增殖。因此,严格的监管机制,以限制铁的可用性有助于防止感染性疾病的发展。这种宿主防御策略通过调节铁转运蛋白和铁螯合蛋白来执行,被称为“营养免疫”。
案例:
脂质运载蛋白-2能捕获大肠杆菌的肠菌素(Enterobactin),但沙门氏菌通过分泌“隐形铁载体”沙门菌素(Salmochelin)逃逸这一机制,凸显了攻防的进化博弈。
2. 微生物的反击策略
为了克服宿主组织内严重的铁缺乏,病原体已经演化出了各种铁获取机制。最突出的策略就是分泌小的铁螯合分子(铁载体):
图2 细菌在肠道中获取铁的策略
doi.org/10.1038/s41564-025-02001-y
1. 微生物代谢物如何影响铁吸收
肠道微生物通过分泌一系列酶和代谢副产物,这些酶和代谢副产物可以提高或限制膳食铁的利用率,从而影响铁的吸收。
临床意义:高纤维饮食通过增加SCFA改善缺铁性贫血,而长期使用质子泵抑制剂(PPI)因抑制胃酸,可能加剧铁缺乏和肠道菌群失调。
图3 微生物衍生代谢物调节宿主铁吸收
doi.org/10.1038/s41564-025-02001-y
2. 微生物群落结构的铁依赖性
虽然缺铁和铁过量都有风险的记录,但重度缺铁会不可逆地降低微生物的多样性和丰富度,削减宿主健康所需的代谢物(如短链脂肪酸SCFA)。
典型表现为:产SCFA菌(厚壁菌门、罗氏菌属/直肠真杆菌)比例下降;SCFA合成相关基因表达受抑,由于SCFA具备抗炎特性,菌群代谢衰减可能放大缺铁引发的炎症。
图4 铁失调和微生物群失调相关的人类疾病
doi.org/10.1038/s41564-025-02001-y
最新的研究表明,膳食铁是微生物群构成的关键变量,铁-宿主-微生物群的交互作用可显著影响炎症性肠病(IBD)及癌症的病程发展。
1. 炎症性肠病(IBD)
铁代谢失调与感染IBD之间复杂的关联性:
2. 癌症
研究表明,过量摄入红肉中的血红素铁,会损害肠道黏液保护屏障。更关键的是,它会促进一种能分解肠道黏液的细菌——艾克曼菌(Akkermansia) 的生长,从而刺激肠道上皮细胞过度增殖,为癌变埋下隐患。
除了感染和免疫,失衡的铁代谢(尤其是红肉中过量的血红素铁)也是结直肠癌的重要推手。它破坏肠道屏障、喂养有害菌、并直接“喂养”癌细胞。癌细胞还会“劫持”铁调节系统囤积铁,而限制铁供应或调控铁代谢,可能成为抗癌新思路。
长期食用红肉和高脂肪饮食,还与两种有害细菌的滋生密切相关:产肠毒素脆弱拟杆菌(Bacteroides fragilis)和具有基因毒性的特定大肠杆菌(E. coli)。这两种细菌分别产生脆弱拟杆菌毒素(BFT)和大肠杆菌素(colibactin),这些毒素已被证实与结肠癌的发生有直接关联。
不过,有趣的是,高浓度的铁环境本身又会抑制大肠杆菌素(colibactin)的产生。这提示我们,饮食中的铁、肠道致病菌(pathobionts)与结直肠癌发病率之间的具体联系非常复杂,仍需更多研究来阐明。
癌细胞是“铁瘾患者”与铁调控的“劫持者”
癌细胞疯狂生长,对铁元素的需求量巨大。与正常的结肠上皮细胞相比,结直肠癌细胞装备了高效的“铁输入系统”:它们会过量表达铁输入蛋白DMT1(二价金属离子转运蛋白1),导致肿瘤内部铁大量积聚,加速肿瘤生长。
同时,癌细胞还非常“狡猾”。它们会在局部分泌一种名为铁调素(hepcidin)的激素。铁调素的作用是抑制铁输出蛋白膜铁转运蛋白(Ferroportin, Fpn)的功能。这样一来,癌细胞就能成功地将铁囤积在自己内部,进一步促进其生长。实验证据支持这一点:缺乏铁调素能降低肿瘤负担,因为肿瘤细胞内的铁水平下降,进而抑制了其赖以生存的线粒体呼吸作用和合成DNA所需的核苷酸生物合成。
肿瘤微环境中的铁:巨噬细胞角色与治疗潜力
除了癌细胞自身,肿瘤微环境中的其他细胞,特别是肿瘤相关巨噬细胞(TAMs),在调控铁分布和影响癌症进程中可能扮演关键角色。例如,一项转录组研究发现,膜铁转运蛋白(Fpn)的表达水平不仅是肝癌中特定巨噬细胞亚群的标志,还是一个不良预后的指标。
更令人鼓舞的是,另一项研究发现,共生益生菌
植物乳植杆菌(Lactiplantibacillus plantarum)能够促进肿瘤内巨噬细胞表达铁螯合蛋白脂质运载蛋白-2(lipocalin-2),从而增强抗肿瘤免疫力。
这些发现都指向一个极具前景的研究方向:限制肿瘤对铁的获取,或调控铁在肿瘤微环境中的分布,可能具有显著的抗癌治疗潜力。当然,这需要未来更多的研究来深入探索和验证。
3. 感染性疾病
宿主、肠道微生物与铁元素之间复杂的相互作用,给制定人群层面的膳食铁摄入标准和口服铁剂补充方案带来了巨大挑战。早期研究曾指出补铁可能导致菌群失调并增加疾病风险,但后续针对不同地区人群的试验却发现:肠道微生物的初始构成决定了补铁是否引发菌群失调。
饮食结构和微生物组的个体差异,是当前微生物疗法效果不稳定的关键原因。这种差异性要求我们采取个性化医疗策略——根据患者具体情况搭配营养干预和微生物疗法。
过去30年,癌症治疗已实现从“无差别放化疗”到“靶向基因突变”的精准医疗跨越。同样,如果我们能锁定调控铁代谢的核心通路、以及影响铁稳态的特定微生物(如导致感染、炎症性肠病和癌症的菌株),便有望开发出新一代精准疗法。
1. 个性化补铁策略
2. 饮食与药物的协同管理
3. 未来方向:微生物组精准编辑
通过基因工程改造益生菌,使其分泌铁载体拮抗剂或免疫调节分子,或开发“铁载体-药物偶联物”,靶向递送抗生素至病原体。若鉴定出有益菌(如罗伊氏乳杆菌),可开发对应益生菌疗法;对有害菌则可用噬菌体或抑制剂精准清除。
微生物的“双面剑”特性
尽管传统研究聚焦病原体,但共生微生物的作用也同样引发关注。多形拟杆菌、阿克曼菌等“益生菌”在特定环境下可能会助推感染和癌症风险。关键在于解析环境因素(如铁浓度、菌群互作)如何影响微生物行为。
未来研究需突破两大方向:
① 揭示健康/疾病状态下,共生菌、条件致病菌与病原体的互动机制;
② 追踪铁元素如何通过改变微生物代谢通路影响宿主健康。
铁的平衡艺术——迈向精准健康时代
铁不仅是生命的基石,更是宿主与微生物、健康与疾病的交汇点。
微生物组在补铁过程中的“保护 vs 致病”双重角色,解释了为何相同的疗法对不同患者效果迥异。
随着微生物组学、代谢组学和基因编辑技术的进步,我们有望像定制癌症治疗方案一样,为每个人设计铁代谢的个性化蓝图。从饮食调整到微生物干预,科学的铁管理将成为预防和治疗慢性病的核心策略之一。
主要参考文献:
Choi, G., Bessman, N.J. Iron at the crossroads of host–microbiome interactions in health and disease. Nat Microbiol 10, 1282–1293 (2025).

谷禾健康
失眠是一种常见的睡眠障碍,近 40%的成年人表现出失眠症状,10.8%的成年人患有慢性失眠症。
失眠主要表现为睡眠质量差、入睡困难、睡眠时间不足等,并与认知能力下降、焦虑、慢性疲劳、注意力不集中和记忆力减退等身心后果相关。睡眠不足也会增加慢病风险(如心血管疾病、糖尿病和肥胖),形成恶性循环,进一步威胁患者的整体健康状况。
目前的失眠疗法主要包括药物治疗和心理治疗。然而,像苯二氮䓬类药物有不良影响,如过度的神经毒性、成瘾性和耐受性。心理疗法,如认知行为疗法,已显示出长期的有效性。然而,由于缺乏训练有素的理疗师和高昂的成本,其可用性有限。
近年来,随着微生物群-肠-脑轴理论的深入发展,研究人员发现了肠道微生物不仅参与消化代谢过程,还能通过多种途径影响脑功能和行为,为失眠的发病机制研究提供了全新的视角。
在这一背景下,中草药及其活性成分作为独特的益生元,展现出巨大的治疗潜力。它们不仅为肠道菌群的活动提供能量,还通过调节肠道菌群改善肠道微环境,从而影响身体的多种生理功能,特别是睡眠调节功能。例如:
本文阐述了肠道菌群如何通过肠道-脑轴的复杂通信网络调节睡眠质量,也介绍了利用中药及其活性成分调节肠道微生物群来改善睡眠质量的潜力,同时探讨了基于肠道菌群的其他针对失眠的干预措施,为失眠治疗开辟了一条融合传统智慧与现代科学的创新路径。
失眠意味着晚上难以入睡、难以保持睡眠,或两者都有,它是最常见的睡眠障碍之一。
仅数天的失眠发作称为短期(急性)失眠。当持续存在睡眠问题时,通常会被诊断为长期(慢性)失眠。
注:慢性失眠有许多不同的定义。一个普遍接受的定义是:每周超过3晚,持续至少3个月,或持续一个月或更长时间的失眠。
急性和慢性失眠都非常普遍。大约每3个成年人中有1个有可能出现失眠症状。
症 状
失眠症状可能包括:
哪些人群更容易失眠?
几乎每个人偶尔都会有失眠的夜晚。但下列人群更可能出现失眠的情况:
月经周期和更年期期间激素变化可能起作用。更年期时,夜间盗汗和潮热常常会扰乱睡眠。失眠在怀孕期间也很常见。
由于睡眠模式和健康状况的变化,随着年龄的增长,更有可能患有失眠。
可能是什么原因?
慢性失眠通常是由压力、生活事件或破坏睡眠的习惯引起的。慢性失眠的常见原因包括:
对工作、学校、健康、金钱或家庭的担忧会使思绪在夜间保持活跃,难以入睡。压力性生活事件,如亲人的去世或疾病、离婚或失业或搬家,也可能导致失眠。
身体的“内部时钟”,即昼夜节律,指导着诸如睡眠-觉醒周期、新陈代谢和体温等。破坏这些节律可能导致失眠。比如跨越多个时区的旅行导致的时差反应、上晚班或早班、频繁轮班或三班倒等都可能引发失眠。
包括每天上床睡觉和起床的时间不同、午睡、睡前过于活跃以及睡眠区域不舒服。
其他不良的睡眠习惯包括在床上工作、吃饭或看电视。在睡前使用电脑或智能手机、玩电子游戏或看电视可能会破坏睡眠周期。
睡前吃点清淡的小零食是可以的。但如果吃太多,可能会在躺下时感到不舒服。很多人还会出现胃灼热的情况。这是指胃酸反流到从口腔到胃的食物管道中。胃灼热可能会让人无法入睡。
焦虑症,如创伤后应激障碍,可能会扰乱你的睡眠。过早醒来可能是抑郁的迹象。失眠常常与其他心理健康问题同时发生。
许多处方药会影响睡眠,例如某些抗抑郁药和用于治疗哮喘或高血压的药物。许多非处方药,如一些止痛药、过敏和感冒药以及减肥产品,含有咖啡因和其他兴奋剂,这些物质会干扰睡眠。
与失眠相关的状况包括慢性疼痛、癌症、糖尿病、心脏病、哮喘、胃食管反流病(GERD)、甲状腺功能亢进、帕金森病和阿尔茨海默病。
睡眠呼吸暂停症会导致在夜间有时停止呼吸,从而扰乱睡眠。不安腿综合征会在你试图入睡时引起强烈的、不适的移动双腿的欲望,这可能无法入睡难以再次入睡。
咖啡、茶、可乐和其他含有咖啡因的饮料让人兴奋。在下午或晚上饮用会难以入睡。烟草产品中的尼古丁是另一种会破坏睡眠的兴奋剂。酒精可能会让你入睡,但它会阻止更深睡眠阶段,在半夜醒来。
肠道菌群可以通过肠-脑轴直接或间接地参与调节大脑的睡眠功能。肠道菌群的失调,通过减少肠道屏障完整性和短链脂肪酸含量以及增加触发炎症反应的炎症介质等机制,影响宿主的睡眠行为。详见下一章节。
失眠会影响肠道菌群的丰富度和多样性
与正常组相比,睡眠缺乏小鼠的Akkermansia muciniphila、拟杆菌和粪杆菌(Faecalibacterium)丰度显著降低,气单胞菌(Aeromonas)丰度显著增加。
临床研究中的失眠或其他睡眠障碍菌群特征
与对照组相比,失眠患者的Collinsella、Adlercreutzia、Clostridiales、Pediococcus、Erysipeltrichaceae、拟杆菌属、葡萄球菌属、Carnobacterium、Odoribacter、假单胞菌属、长双歧杆菌属、Phascolarctobacterium的丰度存在显著差异。
同样,阻塞性睡眠呼吸暂停患者在下列菌群丰度存在显著差异:乳杆菌属、瘤胃球菌科、 变形杆菌科、梭菌科(Clostridiaceae)、 颤螺菌科(Oscillospiraceae)、 克雷伯氏菌(Klebsiella)、脱硫弧菌科(Desulfovibrionaceae)、脆弱拟杆菌(Bacteroides fragilis)、普拉梭菌(Faecalibacterium prausnitzii)。
无论是与炎症相关的菌株的改变,如变形杆菌科、梭菌科、Oscillospiraceae、克雷伯氏菌,还是与肠道屏障完整性相关的菌株,如脱硫弧菌科、脆弱拟杆菌、F. prausnitzii,这些变化都与睡眠质量相关的参数显著相关。
失眠不仅会降低肠道的抗氧化能力、抗炎细胞因子水平、粘蛋白2(MUC2)和紧密连接蛋白表达,还会增加促炎细胞因子的水平,导致肠道黏膜损伤和屏障通透性增加。
实验证据:睡眠剥夺通过肠道菌群影响大脑功能
当睡眠剥夺动物的肠道微生物群移植到正常小鼠体内时,供体动物的肠道菌群发生了变化,导致脂多糖(LPS)和气单胞菌水平升高,丁酸盐和Lachnospiraceae_NK4A136水平降低,海马小胶质细胞活化和神经元死亡增加。
然而,用植物乳杆菌124或A.muciniphila预处理可以恢复被破坏的肠道微生物群,减少肠道中的氧化应激、炎症和屏障损伤,增加乙酸和丁酸水平,并防止LPS刺激的小胶质细胞-神经元共培养中的突触损失。
因此,肠道微生物群的破坏通过降低肠道屏障完整性和短链脂肪酸含量,增加引发炎症反应的炎症介质等机制,影响宿主的睡眠行为。
下面章节我们就来详细看一下肠道菌群参与失眠症调节的相关机制。
下丘脑-垂体-肾上腺轴
失眠激活并导致HPA轴功能障碍。微生物可能通过神经信号传导、短链脂肪酸、表观遗传学、肠道屏障完整性或血脑屏障(BBB)通透性影响HPA轴活性。因此,失眠引起的肠道微生物群失调可能与HPA轴的激活有关。
HPA轴的破坏与致病菌(包括肠杆菌科、链球菌科、韦荣球菌科)的增加和有益细菌(包括双歧杆菌和毛螺菌科)的减少有关。
某些特定的肠道微生物群可以抑制HPA轴的激活,并介导相关的脑功能。大肠杆菌(Escherichia coli)和粪肠球菌(Enterococcus faecalis)可以降低小鼠血清中的皮质醇水平,从而缓解压力和抑郁焦虑行为。
分析表明,粪便中的羟甲睾酮(Oxymesterone)可以介导皮质醇对副拟杆菌属(Parabacteroides)的负面影响,而3-(2,4-环戊二烯-1-基)-5α-雄甾烷-17β-醇可以介导皮质类固醇对气球菌(Aerococcus)的负面影响;洛伐他汀酸(Mevinolinic acid)还可以介导气球菌对皮质醇的负面影响。这表明肠道微生物群和HPA轴之间的信号传导是双向的。
doi: 10.3389/fphar.2025.1572007
微生物内分泌产物和代谢物
★ 褪 黑 素
什么是褪黑素?
褪黑素(Melatonin,MT)又称为”暗激素”,因为它主要在黑暗环境中分泌,是我们身体内重要的睡眠调节激素。夜幕降临,褪黑素水平开始上升,告诉我们的身体该睡觉了;当太阳升起时,它的分泌减少,帮助我们保持清醒。可以说,褪黑素就像是身体内部的生物钟管家,维持着我们正常的睡眠-觉醒周期。
色氨酸的”三岔路口”
要理解肠道微生物与褪黑素的关系,我们首先需要了解一个关键的氨基酸——色氨酸(Trp)。色氨酸是合成褪黑素的重要原料,但在正常情况下,人体内仅有不到5%的色氨酸用于合成血清素(5-HT)和褪黑素,而高达95%都通过肝脏中的犬尿氨酸(Kyn)途径进行代谢。
这就像是一个”三岔路口”:
压力→肠道菌群失调→褪黑素下降
长期压力会破坏肠道菌群平衡,导致失调,失调的微生物刺激犬尿氨酸通路过度活跃,本应用于合成褪黑素的色氨酸被大量转移到犬尿氨酸途径,最终导致循环中的褪黑素水平下降,影响睡眠质量。
有益菌的助眠作用
令人惊喜的是,肠道中的某些微生物也能够主动促进其合成。研究发现,罗伊氏乳杆菌和大肠杆菌这两种微生物激活TLR2/4/MyD88/NF-κB信号通路,促进关键酶AANAT(芳烷基胺N-乙酰基转移酶)的表达,推动褪黑素的合成。
微生物代谢产物的协同效应
除了直接合成,肠道微生物的代谢产物——短链脂肪酸(SCFA)也发挥着重要作用:
外源性褪黑素补充
不仅能直接改善睡眠,还能帮助生物钟恢复正常运转,改善肠道菌群的组成和功能,增加短链脂肪酸水平,改善肠脑交流,优化肠道与大脑之间的信息传递。
研究表明,褪黑素补充能够通过多个途径改善睡眠剥夺引起的认知障碍:
最后,这些在肠道中产生的褪黑素分子会通过血液循环系统到大脑,与大脑中的MT1或MT2受体结合,最终调节我们的睡眠行为。这就形成了一个完整的”肠道-血液-大脑“调节环路。
★ γ- 氨 基 丁 酸
什么是GABA?为什么它能帮助睡眠?
γ-氨基丁酸(GABA)是一种众所周知的促进睡眠的氨基酸,是一种天然的抑制性神经递质。当我们感到焦虑、紧张或难以入睡时,GABA帮助我们的神经系统冷静下来,促进放松和睡眠。
简单来说,GABA的作用就像给过度活跃的神经系统踩了一脚”刹车“,让我们从兴奋状态转向平静状态,为优质睡眠创造条件。
肠道:GABA的”第二生产基地”
许多人以为GABA只能在大脑中产生,但实际上,我们的肠道也是一个重要的GABA生产基地。在肠黏膜中,存在着一系列特殊的细胞——肠神经内分泌细胞(如STC-1和STC-2),它们就像是内置的”GABA工厂“,它们可以表达GABAA受体及其受体亚型(α1、α3、α5、β1、β3、δ)的mRNA。
除了胃肠神经内分泌细胞合成、储存和分泌GABA的能力外,肠道微生物群的某些成员也可以产生GABA。
乳酸菌和双歧杆菌是GABA产生的关键成员
– Limosilactobacillus fermentum L18:
高效分泌GABA的专业户,通过增加连接蛋白的浓度和有益肠道细菌的丰度来增强肠道屏障
– 鼠李糖乳杆菌GG:
除了保护肠道屏障外,还可以通过调节肠脑轴来提高海马和杏仁核中的脑源性神经营养因子(BDNF)和GABA受体水平。
– 短乳杆菌:
通过发酵产生高剂量GABA,可以提高肠道中有益细菌的相对丰度和SCFA的水平,进而可以上调GABA能和5-羟色胺能神经递质的mRNA和蛋白质表达水平。这将导致θ和δ波以及非快速眼动(NREM)睡眠的显著增加。
GABA如何在肠道中发挥多重功效?
– 维护肠道屏障:构建健康防线
刺激Ca²⁺信号传导;增加MUC2释放,强化肠道黏膜屏障;促进肠道干细胞增殖,维持肠道健康。
– 调节肠脑轴:远程遥控大脑
增加海马和杏仁核中的BDNF水平,促进神经元健康;上调大脑中GABA受体水平,增强镇静效果;拟杆菌丰度与GABA受体蛋白表达呈正相关。
GABA很难穿过血脑屏障直接作用于中枢神经系统,那么肠道产生的GABA是如何影响大脑和睡眠的呢?
肠神经系统:另辟蹊径的”高速公路”
有研究人员认为,肠道内分泌细胞中存在大量GABA受体,通过肠神经系统这个”第二大脑”发挥作用,不需要直接穿过血脑屏障,而是通过肠-脑轴的复杂网络影响大脑功能。
★ 血 清 素
什么是血清素?
血清素(5-羟色胺,5-HT),有时候被称为”快乐激素”,因为它不仅能让我们感到愉悦和放松,还是调节睡眠-觉醒周期的重要神经递质。当血清素水平充足时,我们更容易感到心情平静、思维清晰,也更容易获得优质的睡眠。
作为肠脑轴中的关键神经递质,血清素(5-HT,血清素)是肠道微生物群和大脑之间进行交流的重要介质,将肠道的信息准确传递给大脑,告诉大脑什么时候工作,什么时候该休息了。
肠道:血清素的主要生产基地
体内约95%的血清素来源于肠道,而大脑反而只是小作坊。
一般生产路径:
非经典调控途径:
肠道菌群如何助力血清素的生产?
肠道菌群代谢产生短链脂肪酸,短链脂肪酸通过调节血清素转运体(SERT);调节5-HT受体的敏感性;抑制色氨酸转化为犬尿氨酸,确保更多原料用于血清素合成来促进合成。
肠道菌群多样性影响血清素
肠道微生物群的多样性会影响5-HT水平,进而影响人体的睡眠模式。补充色氨酸和血清素已被证明可以改善肠道微生物群的多样性,增加肠道中短链脂肪酸的量,提高血清素的血液水平,所有这些都可以改善老年人和新生儿的睡眠质量。
血清素代谢失衡与睡眠障碍的病理关联
在用抗生素耗尽微生物群后,5-HT的表达水平降低,导致REM睡眠的发作频率增加,NREM和REM睡眠之间的频繁转换,最终对睡眠产生负面影响。
如何通过调节血清素改善睡眠?
例如,灵芝可以调节肠道微生物群和5-羟色胺相关途径,增加5-羟色胺和GABA的血清水平,同时降低HPA轴激素水平,有效缓解焦虑小鼠的失眠行为。显然,微生物群可以通过影响肠道中5-羟色胺的合成和释放来调节大脑中的睡眠行为。
影响睡眠的微生物群-肠道-大脑轴交流模式
Sen P, et al.,Trends Mol Med. 2021
★ 短 链 脂 肪 酸
短链脂肪酸(SCFA)是肠道细菌通过发酵我们吃下去的膳食纤维产生的主要代谢产物,被认为是神经调节物质,对肠道微生物群控制睡眠至关重要。通过免疫、神经、内分泌途径,微生物群与大脑睡眠过程形成密切联系;“肠-脑轴”是两者之间的纽带,SCFA起着信使的作用。
失眠会减少产短链脂肪酸的菌的数量
产短链脂肪的菌如粪杆菌(Faecalibacterium)、Roseburia、Ruminococacaceae,这反过来又降低了肠道中SCFA的数量,而SCFA的缺乏又会进一步影响睡眠质量,形成一个难以打破的恶性循环。
肠道短链脂肪酸水平升高可提高睡眠质量
相关研究表明,短链脂肪酸水平的升高可以通过穿越血脑屏障和调节大脑中血清素和多巴胺(DA)的产生来影响大脑发育。
短链脂肪酸不仅能直达大脑,在肠道局部也发挥着重要的睡眠调节作用。
增强睡眠相关物质:
调节压力系统:
调节免疫功能
SCFA调节HPA轴:缓解压力促进睡眠
通过显著增加SCFA含量,可以带来一系列积极变化:
短双歧杆菌207-1可以通过显著增加SCFA和GABA水平,整体抑制HPA轴相关激素来改善睡眠质量。
不同SCFA的作用
乙酸盐、丁酸盐、戊酸盐与HPA轴相关激素水平呈负相关;丙酸盐显示出相反的模式。
因此,微生物群产生的SCFA可以通过改善肠道屏障和肠道免疫环境来影响神经系统。它们通过增加肠道中SCFA的多样性和水平、刺激睡眠相关细胞因子的分泌和抑制炎症反应等机制,改善失眠。
★ 多 巴 胺
多巴胺(DA)被称为大脑中的”奖励分子”和”动力激素”,但在睡眠调节中,它是”人间清醒”。作为一种促进警觉性的强效神经递质,多巴胺对于控制我们的睡眠-觉醒周期至关重要。
当多巴胺水平充足时,我们会感到精神饱满、注意力集中、反应敏捷;而当多巴胺不足时,我们可能会感到昏昏欲睡、缺乏动力、思维迟钝。
多巴胺:肠道保护功能
多巴胺在肠道中并不仅仅是一个”过客”,它还承担着重要的肠道保护功能:
通过D5受体的作用:
通过D2受体的作用:
肠道菌群失调:多巴胺代谢的破坏者
肠道菌群可以影响多巴胺的水平,相关研究表明,肠道菌群失调导致多巴胺代谢紊乱(以高香草酸减少为特征),从而影响大脑的清醒和认知功能。
注:高香草酸是多巴胺代谢的重要产物,它的减少就像是”多巴胺工厂”生产效率下降的信号。
补充益生菌可以有效逆转这些紊乱
补充益生菌已被证明可以恢复Blautia、Dialister、F.prausnitzii、Ruminococcus、拟杆菌属,这些菌群与高香草酸水平呈显著正相关。这意味着它们能够有效修复多巴胺代谢通路,恢复正常的觉醒调节功能。
两种特别的”多巴胺生产专家”
粪肠球菌(Enterococcus faecalis)和屎肠球菌(Enterococcus faecium) 具有酪氨酸羟化酶和多巴脱羧酶活性,使其能够将酪氨酸转化为L-dopa(多巴胺的前体)。进一步的研究表明,粪肠球菌和屎肠球菌的移植增加了PGF小鼠肠道内多巴/多巴胺的合成,促进了多巴/多巴胺从肠道进入血液,从而提高了大脑中的多巴胺水平。
这表明,调节肠道微生物群中苯丙氨酸酪氨酸多巴多巴胺的生物合成途径可能会改善脑功能。
短链脂肪酸的协同作用
研究表明,肠道微生物群代谢产生的短链脂肪酸可以直接穿透血脑屏障,控制5-羟色胺和多巴胺的合成,进而影响大脑发育。因此,肠道细菌可以通过多种途径调节大脑的多巴胺能系统,从而影响大脑的唤醒能力和功能。
微生物群-迷走神经通路
迷走神经就像是连接肠道和大脑之间的一条专线电话,肠壁中富含迷走神经纤维,这些神经纤维就像是密布在肠道中的信号接收器,能够从肠道接收各种信号并将其精确地传递到大脑。可以说,迷走神经是肠道微生物群影响大脑功能、调节睡眠的重要通路之一。
肠道微生物如何启动迷走神经?
通过这条”迷走神经专线”,肠道细菌能够:
粪菌移植和罗伊氏乳杆菌
粪菌移植可以触发肠道的迷走神经系统,从而导致脑干和海马体的5-HT和DA神经传递途径的长期改变。
通过迷走神经依赖机制,罗伊氏乳杆菌还可以改变催产素和多巴胺能信号在腹侧被盖区(VTA)的传递方式。值得注意的是,海马体和VTA中的多巴胺能回路在维持睡眠-觉醒相关行为方面都起着至关重要的作用。
证据:迷走神经切断实验
为了证实迷走神经参与肠道和大脑之间的信息传递,研究人员进行了一个实验:膈下迷走神经切断术。就像是切断电话线,看看肠道和大脑之间的通讯是否会中断。
治疗效果消失:
注:选择性5-HT再摄取抑制剂是一类通过抑制突触前膜5-HT再摄取、增强突触间隙5-HT浓度的抗抑郁药物。
信号传递的机制
当肠道内的5-HT与迷走神经纤维上密集分布的5-HT受体结合时,迷走神经被激活。然后,神经元通过特定的投射对5-HT信号做出反应并进行分类,然后将其传递到大脑。
迷走神经刺激:治疗睡眠障碍的新策略
研究表明,迷走神经刺激可通过降低外周血和海马中IL-1β和IL-6的水平,以及防止星形胶质细胞和小胶质细胞激活,从而改善由睡眠剥夺引起的抑郁样行为。
微生物-免疫炎症通路
免疫炎症通路就像是身体内部的警报系统,当有危险信号出现时,它会迅速启动防御机制。在肠道微生物调节睡眠的过程中,它也扮演着至关重要的角色。这套系统运行正常时,我们能享受优质睡眠;而当系统失调时,就可能出现失眠、睡眠质量下降等问题。
微生物通过免疫炎症途径与大脑的睡眠调节功能建立复杂的相互作用。简单来说,肠道微生物可以通过调节免疫系统的炎症反应,间接影响大脑的睡眠中枢,就像是通过免疫语言与大脑进行对话。
睡眠剥夺:引发免疫炎症风暴的导火索
睡眠剥夺破坏肠道屏障和血脑屏障通透性,增加NLRP3水平,并激活肠道中的TLR4/NF-κB信号通路,导致炎症信号传递到大脑,从而加剧大脑中的神经炎症和小胶质细胞激活。
恢复被破坏的肠道微生物群可以缓解肠道氧化应激、炎症反应和屏障损伤,从而改善睡眠质量。
肠道微生物代谢物:TMAO的双面性
某些肠道微生物可以通过其代谢产物介导宿主的炎症反应来调节大脑的睡眠功能。例如,三甲胺N-氧化物(TMAO)是肠道微生物群的代谢产物,可以通过调节膜联蛋白A1信号传导来增强血脑屏障的完整性,保护大脑免受炎症损伤,还可以通过NF-κB信号通路促进NLRP3激活来影响睡眠。
特定菌群与炎症因子
睡眠剥夺会引发肠道微生物群失调,导致炎症因子如IL-1β、IL-6、TNF-α的表达失衡。
相关分析表明,IL-1β和TNF-α与肠道中的Ruminococcus_1和Ruminococcoccus e_UCG-005呈正相关。
– NLRP3炎症体:睡眠调节的关键开关
NLRP3是参与IL-1β调控睡眠的关键介质之一。NLRP3的组装可以激活caspase-1,激活的caspase-1随后将pro-IL-1β切割成成熟的IL-1β,然后调节中枢神经系统对生理睡眠的控制。
TNF-α和IL-1β受体通过配体激活介导NF-κB转录,触发参与睡眠调节和影响睡眠的炎症相关分子的转录。
这个指挥系统一旦启动,就会产生级联放大效应,小小的炎症信号最终可能对睡眠产生显著影响。
尽管睡眠剥夺对血脑屏障的影响在某种程度上是可逆的,但修复过程并不简单,即使在恢复正常睡眠模式后,恢复正常的血脑屏障功能仍然是一个漫长的过程。
这些发现为失眠的免疫治疗提供了新的思路,通过调节肠道微生物群来优化免疫炎症反应,进而改善睡眠质量。
源自中草药的药用食品及其生物活性化合物是独特的“益生元”,具有以下优点:副作用小、安全性高、提高患者依从性、适合长期食用。这些特性突显了这些草药在营养和治疗应用中的双重价值。此外,它们具有调节肠道微生物群稳定性的潜力,为通过调节肠道微生物组预防和治疗失眠提供了新的视角。
酸 枣 仁
酸枣仁(Ziziphi spinosae semen,SZR)是指鼠李科植物枣属种类中,中国枣(Ziziphus jujuba Mill. var. spinosa (Bunge) Hu ex H. F. Chou)的干燥成熟种子。
酸枣仁以其酸甜口味和中性特性为特征,靶向肝、胆囊、心经。它以“滋阴养心、补血养肝、安神安神”的功效而闻名,对治疗虚证和慢性失眠特别有效。正是因为其卓越的安神助眠功效,酸枣仁被誉为”东方睡眠果实“,在临床上广泛用于治疗失眠。
注:从历史角度看,酸枣仁在中医中一直受到高度重视,无论是作为单一草药还是复方制剂,都展现出了令人瞩目的疗效。
酸枣仁的”睡眠密码”:三大活性成分
皂苷、黄酮、生物碱是酸枣仁镇静和催眠作用的主要活性成分。先前的研究表明,酸枣仁可以调节氨基酸代谢、神经递质释放、炎症因子平衡和HPA轴稳态等生理过程,从而调节神经活动,实现神经系统的平衡,改善睡眠。
最近的研究表明,酸枣仁可以恢复失眠引起的肠道菌群失衡,增加大鼠体内有益菌的相对丰度,如乳杆菌、双歧杆菌、乳球菌、真杆菌,同时减少普雷沃氏菌的相对丰度。
菌群代谢产物——短链脂肪酸(SCFA)
梭菌和乳杆菌丰度的增加导致其代谢产物丁酸盐含量的增加,这进一步影响了体内的氨基酸代谢途径,从而显著恢复了患有睡眠-觉醒节律紊乱的小鼠的睡眠-觉醒节奏。
SCFA可以间接调节肠道和大脑中的5-HT水平。
研究表明,通过酸枣仁的微生物代谢增加的SCFA,可以调节结肠中TLR4/NF-κB/NLRP3相关信号通路中代表性因子的表达,从而调节微生物群-肠-脑轴,改善小鼠的失眠和抑郁行为。
注: TLR4:控制肠道免疫系统的”警报器”;NF-κB:调节炎症反应的”总开关”;NLRP3:影响炎症体的活化程度。
酸枣仁调节肠道菌群,而不是直接作用于大脑
显然,酸枣仁可以通过微生物群神经通路和微生物群免疫通路调节微生物群肠脑轴,从而实现对生物体睡眠行为的控制。这可能解释了酸枣仁的活性成分不能穿过血脑屏障,但仍然能改善睡眠质量。
卷 丹 百 合
在中医传统中,百合类植物一直被认为具有”润肺止咳、清心安神“的功效,而现代科学研究正在揭示其改善睡眠的深层机制。
卷丹百合(LB)可以通过降低血清中HPA轴激素的水平、增加5-HT和MT的水平、降低下丘脑中去甲肾上腺素(NE)的水平以及上调GABAA受体和5-HT1A受体的表达,来改善大鼠的下丘脑病理并缓解失眠行为。
肠道菌群调节:失眠改善的核心机制
卷丹百合调节肠道菌群的方式可能直接关系到它缓解失眠的效果。除了逆转失眠对肠道微生物群的多样性、丰度和粪便代谢表型的不利影响外,卷丹百合还控制花生四烯酸和色氨酸的代谢,从而降低与心理健康问题相关的化学物质犬尿氨酸的表达水平。
卷丹百合显著调节肠道内乳杆菌、埃希氏菌、Porphyromonadaceae的相对丰度,并积极调节下丘脑中的5-羟基-L-色氨酸,后者参与5-HT的代谢。通过卷丹百合干预,最重要和最基本的途径被认为是5-羟色胺能系统和花生四烯酸代谢途径。
复方协同:卷丹百合与地黄汤的联合
卷丹百合和地黄汤(LBRD)可以通过纠正肠道微生物群失调和避免肠道屏障受损或血脑屏障泄漏引起的炎症,来减轻与抑郁行为相关的神经元损伤。根据粪便微生物群移植和肠道微生物群组成研究,通过肠道-脑轴,乳杆菌、双歧杆菌、乳球菌(Lactococcus)被证明是地黄汤抗抑郁作用的重要因素。
灵 芝
灵芝的镇静作用与肠道菌群密切相关
当灵芝与罗伊氏乳杆菌发酵时,它可以增加血清中5-HT和GABA的水平,降低HPA轴激素的水平,有效缓解焦虑小鼠的失眠症状。
灵芝的乙醇提取物也对微生物组的结构产生了显著影响。
下丘脑的5-HT浓度与双歧杆菌和动物双歧杆菌呈正相关,这不仅提高了那里的5-HT水平,还增加了包括Tph2、Iptr3、Gng13在内的重要转录因子的产生。在用抗生素耗尽肠道微生物群后,灵芝乙醇提取物的促进睡眠作用以及与睡眠行为相关的粪便代谢物的变化完全消失。这表明肠道微生物群在灵芝的促睡眠作用中起着不可或缺的作用。
多糖成分的免疫调节与神经保护作用
来自灵芝的多糖已被证明可以提高小鼠大脑中的GABA和5-HT水平,并通过延长NREMS期间的δ波来提高其睡眠质量。
此外,灵芝多糖及其水解产物,即灵芝肽,通过各种途径表现出免疫调节活性。具体而言,灵芝多糖不仅降低了肠道中的F/B比值,而且显著上调了回肠中NF-κBp65、IL-2、IL-4的表达水平;它们还显著增强BDNF的表达,抑制促炎细胞因子的表达,并抑制小胶质细胞和星形胶质细胞的激活,从而发挥抗抑郁作用。
灵芝肽参与关键途径,如叶酸循环、脂肪酸的生物合成和代谢以及cAMP代谢。灵芝多糖在调节肠道微生物群稳态和提供神经保护方面具有巨大潜力。
茯 苓
茯苓(P.cocos)自古以来就被誉为”四时神药”,茯苓性平味甘,具有健脾利湿、宁心安神的功效,是古代人治疗失眠的首选核心药物之一,
传统核心药物的现代机制:多糖和三萜
茯苓含有多糖和三萜类化合物,是其镇静和诱导宁静的主要活性成分。研究表明,茯苓中的酸性多糖可以通过干预肠道微生物群和调节相关途径发挥镇静作用。
这些多糖不仅增加了肠道微生物群的丰度,如厚壁菌门、杆菌门、乳杆菌门、Fusicatenibacter、Prevotellaceae_UCG-001;它们还上调下丘脑中关键神经递质5-HT、DA、NE、GABA的水平,增加神经元细胞的数量,同时降低炎症因子的表达水平。
此外,来自茯苓的水提取物和水溶性多糖可以通过改善肠道微生物群失衡、缓解代谢紊乱、调节肠道神经肽和神经递质水平以及抑制TNF-α/NF-κB信号通路来有效预防焦虑的发作。
增加短链脂肪酸、促进色氨酸代谢
茯苓多糖可以通过增加肠道中的短链脂肪酸水平和促进色氨酸代谢来增强肠道屏障。它们不仅通过增加吲哚乳酸盐和吲哚-3-醛的水平来促进色氨酸代谢;还通过增加肠道中短链脂肪酸的水平、调节IL-2、IL-4、IL-6、IL-10、TGF-β、IFN-γ等关键免疫因子的表达,激活Wnt/β-Catenin信号通路来维持肠道屏障的完整性和功能。
色氨酸和短链脂肪酸的水平以及肠道屏障的健康稳态与肠道微生物群密切相关,对改善睡眠质量有重大影响。
人 参
人参被誉为”百草之王”,是中药中最珍贵的滋补品之一。作为五加科植物,人参含有丰富的活性成分,具有补元气、复脉固脱、补脾益肺、生津养血、安神益智等功效。现代研究发现,人参不仅能直接作用于大脑,还能通过调节肠道微生物群来改善睡眠质量。
多重活性成分的协同作用:跨越血脑屏障
人参中发现的肽、多糖、皂苷具有穿过血脑屏障并调节神经内分泌平衡和大脑代谢环境的能力。人参多糖通过增强肠道吸收和影响肠道微生物代谢来增强人参皂苷Rb1和微生物代谢产物的暴露。Rb1通过调节瑞士乳杆菌丰度和GABAA受体表达发挥神经保护作用。
人参皂苷Rg1(Rg1)对神经系统具有潜在的健康促进作用。Rg1可以改善吗啡诱导的肠道微生物群失调(特别是拟杆菌),抑制肠道微生物群衍生的色氨酸代谢,调节异常升高的血清素、5-羟色胺受体1B和5-羟色胺受体2A水平,使其回归正常范围。
人参皂苷的多途径神经保护机制
人参皂苷Rg可能影响肠道微生物群,并通过多种不同途径提供神经保护。
Rg1可以通过调节5-HT神经递质系统、阻止肠道微生物群产生的色氨酸代谢和改善肠道微生物群失调(特别是拟杆菌)来防止小鼠产生吗啡依赖。
Rg5不仅可以纠正不平衡的肠道微生物群,恢复肠道屏障的功能,还可以通过控制脂肪和葡萄糖的代谢,提高GABA/Glu比值,上调GABAA、GABAB和5-HT受体1A的表达,改变时钟相关蛋白质的节律特征,改善睡眠质量,进而影响GABA和5-HT神经递质系统。
复方协同与代谢循环优化
人参和酸枣仁的联合使用,可以改善肠道微生物群的结构,促进Glu/GBA-Gln代谢循环的正常运作,增加海马中GABA的合成和释放,从而显著改善失眠大鼠的睡眠状态。这表明人参可以通过多种途径干预肠道微生物群并调节大脑睡眠功能。
doi: 10.3389/fphar.2025.1572007
天 麻
天麻(G.Blume)是兰科植物天麻的干燥块茎,素有”定风草”之称,是著名的息风止痉、平抑肝阳的中药材。
天麻素的多重神经保护机制:从炎症调控到信号通路调节
从天麻中提取和分离天麻素(GAS)已被证明对中枢神经系统疾病有显著影响,包括但不限于失眠、焦虑、抑郁、认知障碍、缺血性中风。
天麻素通过控制IL-6、IL-1β等炎性因子的表达、B细胞淋巴瘤-2(Bcl-2)蛋白的活性以及p-ERK与ERK的比值,不仅改善了失眠小鼠的睡眠质量,而且通过调节TLR4/NF-κB和Wnt/β-catenin信号通路,改善了快速眼动睡眠剥夺引起的睡眠障碍。因此,天麻素在提高睡眠质量方面具有很大的潜力。
肠道微生物群调节
已经进行的研究表明,天麻素可以通过调节微生物群-肠-脑轴来抑制神经元凋亡,从而改善阿尔茨海默病小鼠的认知障碍和神经变性。
在抑郁的小鼠中,天麻的水提取物可以通过促进潜在有益菌(Alloprevotella、双歧杆菌、Defluviitaleaceae UCG-011、Akkermansia、Parabifidobacter)和粪便SCFA水平的增加和平衡,使结肠中5-羟吲哚乙酸与5-HT的比例正常化,并降低犬尿氨酸与色氨酸的比例来重塑肠道微生物组结构。抗生素混合物的给药部分消除了天麻素对阿尔茨海默小鼠的神经保护作用。
天麻及其活性成分对大脑功能的影响是显而易见的,因为它们部分针对微生物群-肠道-大脑轴。然而,支持天麻素可以通过这种微生物群-肠-脑轴调节大脑睡眠功能这一观点的确凿实验证据仍有待观察。需进一步研究来确定天麻素通过改变肠道微生物群来改善睡眠质量的确切过程,以便更谨慎地开发和使用天麻。
蒙 古 黄 芪
蒙古黄芪是豆科植物蒙古黄芪的干燥根,被誉为”补气圣药”,在中医药学中具有重要地位。黄芪性温味甘,具有补气固表、托毒排脓、利水消肿的功效,是临床上最常用的补气药之一。
现代研究发现,蒙古黄芪富含黄酮类化合物、多糖、皂苷,通过控制肠道微生物群的组成、代谢和活性,有助于保持肠道微环境的稳定。
黄芪多糖的免疫调节机制:特异性菌群调控的双向作用
研究发现,不同浓度的黄芪多糖(APS)对睡眠剥夺小鼠的脾脏和身体损伤具有缓解和保护作用。
进一步的研究表明,黄芪多糖可以通过调节与炎症和免疫反应、短链脂肪酸合成和TLR4/NF-κB通路有关的某些微生物来改善免疫功能障碍。
例如,黄芪多糖可以改善免疫功能低下的小鼠和大鼠的免疫功能,这是由于减少了Pseudoflavonifractor、Oscillibacter、Tyzzerealla、Paraprevotella、Lachnoclostridium的丰度,并增加了乳杆菌、双歧杆菌、Roseburia、脱硫原体、Paracoccus、副拟杆菌、Clostridium XIVb、Butyricicoccus的丰度。
然而,在肠道微生物群减少的免疫功能低下小鼠中,黄芪多糖并没有改善免疫功能。
肠脑轴的积极调控:从代谢产物到神经递质的全面优化
为了积极控制肠-脑轴,黄芪多糖不仅增加了肠道中乳杆菌和芽孢杆菌的相对丰度,还增加了粪便中短链脂肪酸和GABA的含量,提高了虾的免疫力。
此外,黄芪多糖可以显著减轻与年龄相关的肠道屏障破坏、胃肠酸碱平衡丧失、肠道长度缩短、肠道干细胞过度增殖以及衰老后的睡眠障碍。
因此,肠道微生物群不仅积极帮助身体吸收黄芪多糖,而且通过提高肠道SCFA水平来改善免疫功能障碍,并通过促进神经递质的释放来积极调节肠道脑轴。
龙 眼
龙眼肉,又称桂圆肉,自古以来就被誉为”智慧果”。在中医理论中,龙眼肉性温味甘,具有补益心脾、养血安神的功效,《神农本草经》将其列为上品药材。龙眼肉是中国传统医学中常用的治疗失眠的草药之一,但关于其改善睡眠质量的潜力的药理活性研究很少。
龙眼含有GABA,可以用作天然膳食补充剂。龙眼中富含多种氨基酸,如GABA和Glu,并且随着果实年龄的增长,其浓度也会增加。成熟后在冷藏温度下储存可以增加水果中的GABA含量。
此外,通过增加胃中Lactobacilli、Pediococci、 Bifidobacteria的数量,肠道微生物群对龙眼多糖的代谢可以提高琥珀酸和SCFA(乙酸、丙酸和丁酸)的水平,增强肠道免疫力。
无论是作为富含GABA的膳食补充剂还是通过调节肠道内的微生物代谢产物,龙眼肉都有可能通过影响肠道中GABA、MT、5-HT等睡眠相关神经递质的合成和释放来调节肠道微生物群-肠脑轴。这可以直接或间接地调节身体的睡眠-觉醒周期,从而发挥强大的睡眠促进作用。
其他中草药及其成分
中医药宝库中蕴藏着众多具有安神功效的珍贵药材,这些草药在千百年的临床实践中积累了丰富的应用经验。
除了前述的经典药材外,栀子、三七、莲子等传统药材同样具有改善睡眠的潜力,但它们通过肠道微生物群调节睡眠机制的研究相对较少。这里讨论了其他一些草药及其活性成分如何影响肠道菌群,从而提高睡眠质量的能力。
栀子、三七
研究表明,栀子可以通过调节肠道微生物群和降低TNF-α和IL-7β水平来改善睡眠质量和缓解焦虑症状。
由肠道微生物群代谢的三七总皂苷转化为人参皂苷Rg,其保护海马神经元并调节大脑中的神经递质水平,从而改善失眠、抑郁和认知障碍。
莲子、荷叶
莲子和荷叶都可以通过调节肠道微生物群的丰度和结构来调节GABA能系统,从而促进睡眠。然而,它们调节肠道微生物群的方式存在显著差异。具体而言:
枣、谷芽
枣具有改善睡眠质量和通过调节GABA能系统提供神经保护的潜力。具体而言,它可以上调Lachnoclosdium、Marvinbryantia的丰度,同时下调Alistipes、Akkermansia的丰度。
谷芽[Setaria italica(L.)Beauv]可能会增加肠道中普雷沃氏菌、乳酸菌、Ruminococcus的丰度,从而通过调节神经递质和炎症因子水平来提高SCFA水平并改善睡眠质量。
山茶、枸杞
山茶[(L.)Kuntze]可能通过改善肠道微生物群来影响神经内分泌途径和免疫系统,从而调节睡眠-觉醒周期。
枸杞可能通过改善肠道屏障和抑制TLR4信号通路来保护神经系统。
交泰丸
由黄连根茎和肉桂皮组成的交泰丸可以改善睡眠,并减轻慢性睡眠剥夺引起的炎症和胰岛素抵抗。组学结果表明,交泰丸治疗显著增加了小鼠中毛螺菌科、拟杆菌属、AKK菌属的相对丰度。
黄连温胆汤对失眠的机制可能与它抑制 5-羟色胺含量的降低和γ-氨基丁酸水平的升高有关。同样,研究发现甘麦大枣汤可以增加 NE 和 5-羟色胺的含量,改善睡眠,在一定程度上缓解抑郁,柴胡加龙骨牡蛎汤主要通过调节下丘脑-垂体-肾上腺轴(ACTH、CORT等)和脑单胺神经递质(NE、DA、5-羟色胺等)的水平来治疗失眠。
草药及其活性成分在改变肠道微生物群和提高睡眠质量方面的巨大潜力已经得到证实,尽管这一研究领域仍处于早期阶段。更多的研究不仅可以为治疗失眠提供坚实的支持,还可以通过阐明这些草药与微生物群-肠道-大脑轴相互作用的机制来调节与睡眠相关的大脑功能,从而帮助我们更明智地开发和使用这些草药。
针 灸
针灸治疗注重根据辨证选择穴位,基于辨证的针灸疗法可以取得良好效果并改善胃肠功能,针灸结合腹部环形按摩可以改善下丘脑和海马旁回的功能,从而达到改善失眠症状的效果。
此外,研究发现针灸可以抑制 HPA 轴的活性,从而改善失眠症状。
有研究在微生物-肠-脑轴理论指导下总结了针灸的原则:
可以直观地发现,这些针灸穴位与微生物-肠-脑轴的解剖部位有许多重叠。从健脾和胃治疗失眠的角度来看,主要穴位有中脘、关元、天枢、气海等。
这些针灸疗法可以通过调节神经递质和某些激素的分泌,以及下调 HPA 轴来抑制交感神经并改善内分泌,从而改善失眠症状,这些症状是微生物-肠-脑轴相同调节机制的一部分。
doi: 10.12998/wjcc.v12.i18.3314
饮 食 调 整
不良饮食模式的负面影响
长期高糖摄入会刺激免疫系统,诱发过度炎症反应,导致睡眠片段化。
肥胖人群中Faecalibacterium丰度显著下降,这在慢性失眠患者中同样存在。
健康饮食模式的积极作用
富含植物性食物、抗氧化剂和不饱和脂肪酸;促进产丁酸菌丰度增加,显著改变肠道微生物代谢活性,与更好的睡眠质量和更长的睡眠时间相关。
适用人群:肥胖青少年、结合增加体力活动
增加肠道中乳杆菌的丰度,乳杆菌以其促进睡眠的有益作用而闻名。
其他,如习惯性饮茶,可能通过肠道菌群-胆汁酸轴减轻慢性失眠引起的肠道菌群失衡和胆汁酸代谢紊乱。
益 生 菌
接受发酵益生菌 Lactobacillus brevis DL1-11 牛奶的小鼠表现出更短的睡眠潜伏期和更长的睡眠时间。因为 DL1-11 可以产生大量的 GABA,GABA 可以促进放松并增强睡眠。
Lactobacillus fermentum PS150TM通过增加下丘脑腺苷 A1 受体的表达,有效地促进了正常小鼠的睡眠,并缓解了咖啡因诱导失眠小鼠的失眠症状。PS150TM 能够恢复因首夜效应导致睡眠障碍的小鼠的非快速眼动睡眠,这可能是由于其重塑肠道菌群组成的能力,改变血清素能通路,减少慢性轻度压力大鼠的抑郁和焦虑。
Bifidobacterium breve CCFM1025 通过抑制 HPA 轴活性,改善了睡眠并缓解了压力水平。
Bifidobacterium adolescentis SBT2786 可以通过增加快速眼动睡眠时间来延长总睡眠时间,白天疲劳减少。
Lactobacillus plantarum PS128 显著增强了深度睡眠,并减少了疲劳和抑郁症状。
Lactobacillus gasseri CP2305 也已可以改善肠道微生物群组成,并降低唾液皮质醇浓度,从而减轻压力并增强睡眠 。
Lactobacillus casei Shirota 牛奶通过延长睡眠时间和减少觉醒时的嗜睡感,帮助面临考试压力的个体 。
Lactococcus lactis subsp. cremoris YRC3780 也显示出改善睡眠和缓解压力的潜力,这一点由日本进行的一项双盲、安慰剂对照的临床试验所证实,接受 YRC3780 干预的参与者主观睡眠质量和心理健康均有显著改善。
doi: 10.3390/ijms252313208
益 生 元
益生元饮食(由半乳寡糖、聚葡萄糖、乳铁蛋白和乳清蛋白浓缩牛奶脂肪球膜蛋白-10 组成)通过在正常情况下增强非快速眼动睡眠,并在压力情况下延长快速眼动睡眠,对小鼠的睡眠模式产生了积极影响。
接受益生元饮食(由半乳寡糖和聚葡萄糖组成)的大鼠在睡眠紊乱情况下表现出更长的非快速眼动睡眠和快速眼动睡眠。菌群分析发现,在益生组中,Parabacteroides distasonis 的相对丰度增加,这与促进睡眠和恢复昼夜节律有关。
在一项人体研究中,45 名参与者被随机分为三组,分别接受低聚果糖(FOS)、低聚半乳糖(GOS)或安慰剂。结果表明,低聚半乳糖组的参与者睡眠质量得到改善,唾液皮质醇觉醒反应显著降低。这种皮质醇的减少与肠道菌群中 Bifidobacteria 的相对丰度增加有关,这些菌具有代谢低聚半乳糖的能力,并对心理健康有积极作用。
抗性淀粉是另一种已被证明能通过减少炎症和 HPA 轴活性来改善 2 型糖尿病患者睡眠质量的益生元。
一项随机、双盲、安慰剂对照的研究也报道了益生元酵母甘露聚糖的改善睡眠效果。酵母甘露聚糖组的非快速眼动睡眠第 3 阶段睡眠时间和总睡眠时间均显著长于安慰剂组。
粪菌移植 (FMT)
目前,越来越多的研究将粪菌移植作为精神健康疾病的一种潜在治疗方法,因为肠道微生物群可以通过微生物群-大脑轴影响中枢神经系统。
临床研究表明,洗涤微生物群移植增加了有益细菌(如 Bifidobacterium、Ruminococcus gnavus 、Prevotella 7、Faecalibacterium)的相对丰度,并减少了有害细菌(如 Escherichia-Shigella 、 Streptococcus)的相对丰度,显著改善了患有各种潜在疾病的患者睡眠障碍。睡眠质量得到改善的患者在抑郁程度和 IBS 症状严重程度上也表现出更大的减少。
另一项开放标签的观察性研究发现,在患有胃肠道疾病且出现睡眠障碍的患者中,结果相似,作者认为整体改善归因于FMT治疗后菌群多样性的增加。
一项真实世界研究发现,粪菌移植显著改善了失眠患者的睡眠质量,缩短了睡眠潜伏期,并提高了睡眠效率。通过比较肠道菌群组成,研究人员发现,粪菌移植显著增加了产短链脂肪酸菌的相对丰度,包括 Lactobacillus、Bifidobacterium 、 Turicibacter。
注:所有这些研究都将失眠视为与其他疾病相关的共病,这表明睡眠的改善也可能归因于疾病症状的缓解,粪菌移植对睡眠障碍的有效性需要进一步研究。
随着现代医学对肠-脑轴研究的深入,传统中医药”治未病“的理念与现代微生态学理论完美融合,为失眠治疗开辟了全新视角。
未来研究应重点关注个体化精准治疗策略的制定。肠道菌群检测技术的应用将为临床实践提供重要指导,通过分析患者特异性的菌群结构,识别关键的失调菌群如拟杆菌、双歧杆菌、乳杆菌等,可为选择最适宜的中药配方提供科学依据。
同时,肠道菌群代谢产物如短链脂肪酸、GABA、血清素等关键代谢产物水平,这些在谷禾肠道菌群检测报告中也都有相应指标,结合肠道菌群检测报告有助于辅助评估治疗效果并优化用药方案。
<来源:谷禾肠道菌群检测数据库>
在中医药现代化进程中,应深入挖掘经典方剂如甘麦大枣汤、安神定志丸等复方的菌群调节机制,探索经典方剂与菌群协同效应的内在规律。同时,结合中医体质辨识与肠道菌群分型,建立”体质-菌群-证候“三位一体的诊疗模式。
通过构建中药-菌群相互作用数据库,为临床医师提供相对精准的用药指导,最终实现传统中医智慧与现代精准医学的深度融合,为失眠患者带来更加安全、有效的个性化治疗方案。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Wu C, Dou J, Song X, Yang F, Liu X, Song W, Zhang X. Gut microbiota: a new target for the prevention and treatment of insomnia using Chinese herbal medicines and their active components. Front Pharmacol. 2025 May 6;16:1572007.
Li C, Chen S, Wang Y, Su Q. Microbiome-Based Therapeutics for Insomnia. Int J Mol Sci. 2024 Dec 9;25(23):13208.
Ito H, Tomura Y, Kitagawa Y, Nakashima T, Kobanawa S, Uki K, Oshida J, Kodama T, Fukui S, Kobayashi D. Effects of probiotics on sleep parameters: A systematic review and meta-analysis. Clin Nutr ESPEN. 2024 Oct;63:623-630.
Patterson E, Tan HTT, Groeger D, Andrews M, Buckley M, Murphy EF, Groeger JA. Bifidobacterium longum 1714 improves sleep quality and aspects of well-being in healthy adults: a randomized, double-blind, placebo-controlled clinical trial. Sci Rep. 2024 Feb 14;14(1):3725.
Liwinski T, Lang UE, Brühl AB, Schneider E. Exploring the Therapeutic Potential of Gamma-Aminobutyric Acid in Stress and Depressive Disorders through the Gut-Brain Axis. Biomedicines. 2023 Nov 24;11(12):3128.
Li L, Wu L, Jiang T, Liang T, Yang L, Li Y, Gao H, Zhang J, Xie X, Wu Q. Lactiplantibacillus plantarum 124 Modulates Sleep Deprivation-Associated Markers of Intestinal Barrier Dysfunction in Mice in Conjunction with the Regulation of Gut Microbiota. Nutrients. 2023 Sep 15;15(18):4002.
Pan LM, Hong ZB, Guan RQ. Research progress on insomnia treated by traditional Chinese medicine and acupuncture based on microbial-gut-brain axis theory. World J Clin Cases. 2024 Jun 26;12(18):3314-3320.

谷禾健康

当前微生物组研究面临的主要挑战包括数据的成分特性、高维度、分类单元间的系统发育关系以及潜在的多种效应模式——即少数几个具有中等强度效应的微生物和大量具有微弱累积效应的微生物可能共同影响宿主健康。
为了应对这些挑战,近日,来自美国大通福克斯肿瘤中心和肯尼索州立大学等研究人员提出了一个新型模型——贝叶斯成分广义线性混合模型(Bayesian Compositional Generalized Linear Mixed Model, BCGLMM),其研究结果发表在《BMC Bioinformatics》上。
BCGLMM旨在提高利用微生物组数据进行疾病预测的准确性和解释性,它采用对数转换和对回归系数施加软性零和约束来处理成分数据;利用结合系统发育信息的结构化正则马蹄形先验来识别具有中等效应的关键分类单元;并通过引入基于样本间微生物组相似性的随机效应项来捕捉众多微小分类单元的累积影响。
模型在模拟数据和真实数据(炎症性肠病)的测试结果表明,BCGLMM在预测性能和识别相关微生物特征方面均优于现有的一些方法,证明了其在微生物组相关疾病预测领域的有效性和潜力。
BCGLMM模型构建在广义线性混合模型(GLMM)的框架之上,专门针对微生物组数据的特性进行了调整。
数据预处理
1. 对OTU计数使用中心对数比(CLR)变换,回归系数施加软性零和约束。
2. 通过16S rRNA基因序列构建系统发育树,计算Bray-Curtis距离矩阵。
BCGLMM模型结构
BCGLMM模型主要由三个关键部分组成:
将线性预测器的输出通过sigmoid函数转为概率pi,然后根据预设的阈值转为二分类输出(如患病/健康)。
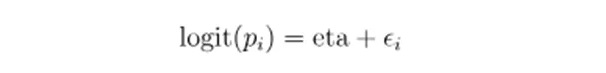
线性预测器(eta):
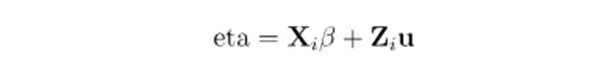
编辑
固定效应部分
随机效应部分
固定效应(如显著分类群)可能无法完全解释疾病风险,而大量微弱效应的分类群可能通过生态网络的整体扰动共同影响结果。随机效应用于建模这些样本层面的变异。两者结合后,模型既能抓住主要驱动因素,又能解释微生物生态系统的整体影响(如原文中IBD预测性能提升)。
后验分布输出
使用 R 包 brms(后端调用 rstan),通过 Hamiltonian Monte Carlo(HMC) 及其自适应变体 No-U-Turn Sampler (NUTS) 实现后验分布采样。
1
模拟数据测试模型
固定样本数量为400,分类单元数目分别选择100、300、500。
组合不同样本数量、中等效应数量和小效应数量,分别生成连续和二元数据,共得到了27种场景,每个场景下,测试三种模型,分别为:
下表是研究人员提供的当中等效应数量为6时,每个模型在不同数据集和小效应比例下的性能评估结果:
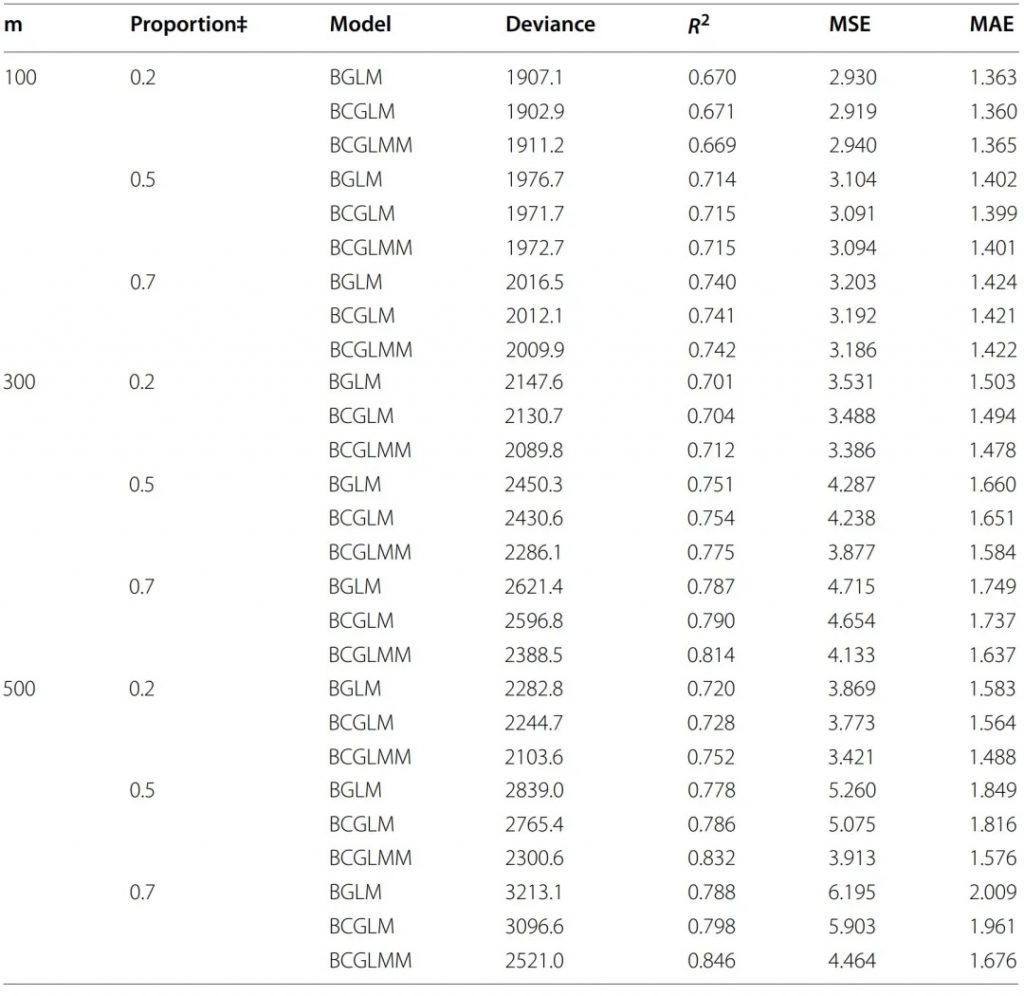
表1
结果显示,大部分场景下,模型性能从优到劣排序为:BCGLMM > BCGLM > BGLM
BCGLMM显示为R2最高、MSE和MAE最低。
这些都说明BCGLMM中的随机效应能够捕获所有标记的综合小效应。
另外,研究人员给出的相同场景下的二分类结果,显示BCGLMM准确性更好(更高的AUC值),如下表:
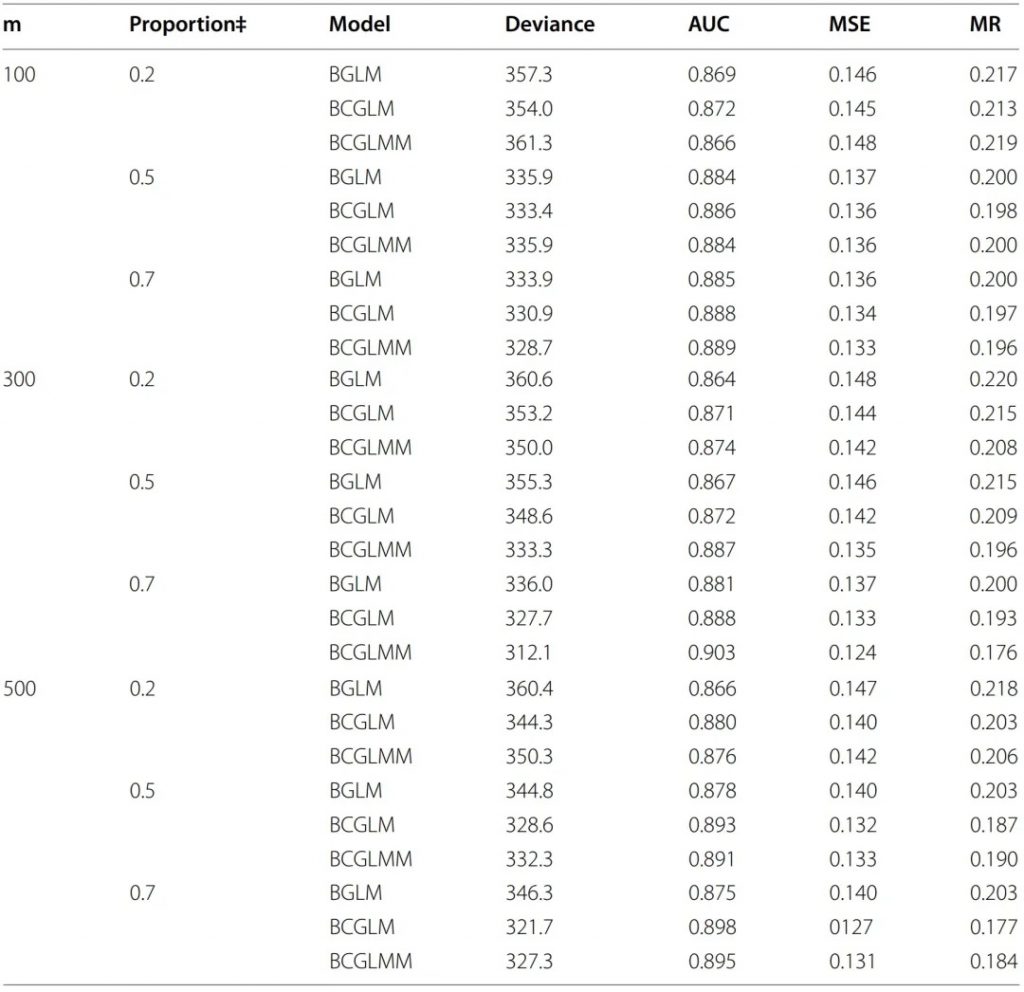
表2
对于其它中等效应数量的组合场景,结果如下图:
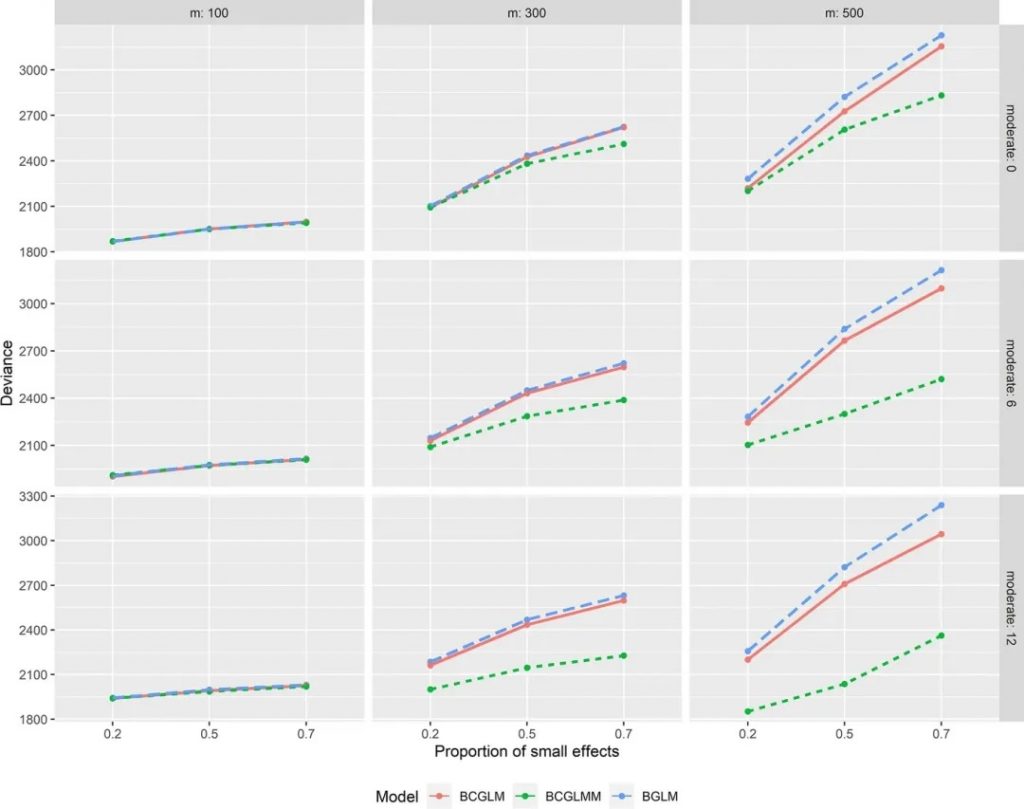
图1
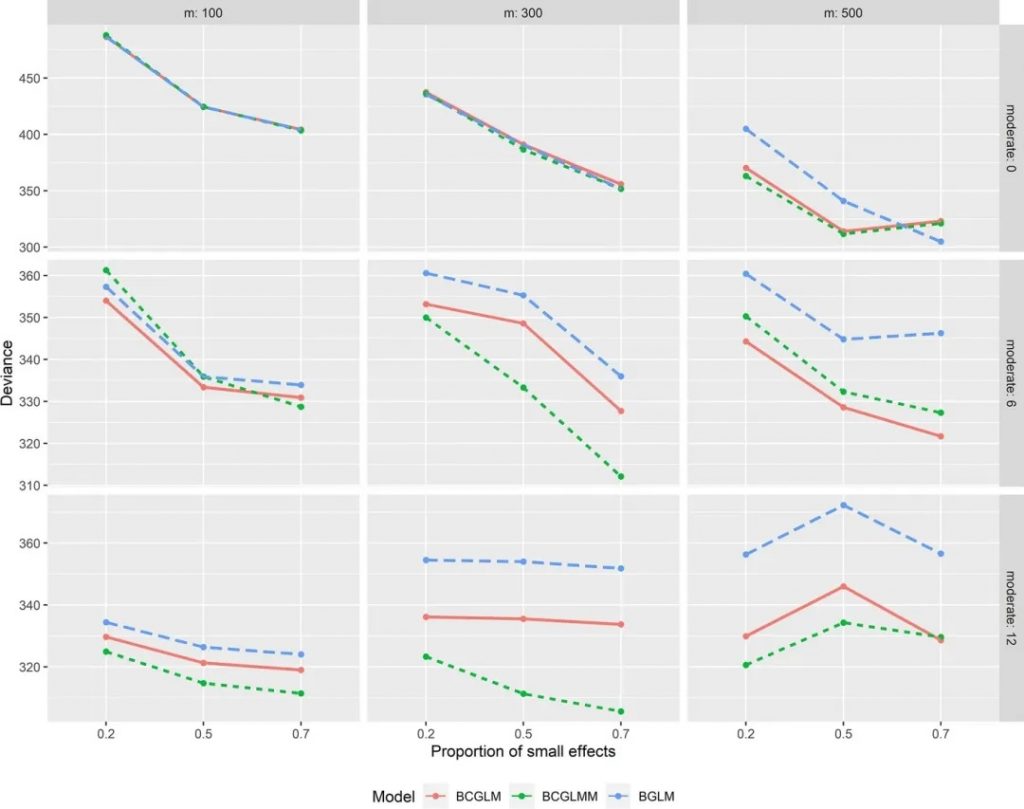
图2
图一对应表一(基于连续性结果的模型性能评估)
图二对应表二(基于二元结果的模型性能评估)
结果显示,在m介于300~500时,对比中等效应数量6,中等效应数量12场景下的BCGLMM模型性能更优。
2
真实数据测试模型
数据来自美国肠道项目(American Gut Project,AGP)的公开数据,旨在区分IBD患者和健康对照。含4684 个粪便样本和 1002 个物种数据。
基于“方法”对数据进行预处理后,分别应用BCGLMM(考虑了样本相关的随机效应和预测变量相关性)、BCGLM(仅关注预测变量相关性)、BGLM(不考虑随机效应和预测变量相关性)模型,比较三种模型的准确性。
根据AUC值判断,BCGLMM 、 BCGLM 和 BGLM 的交叉验证 AUC 值分别为 0.702 、 0.687 和 0.672,可以认为BCGLMM在真实数据集上的表现最优(AUC=0.702)。
基于模拟数据和真实数据的测试结果,可以得出结论,同时考虑样本相关的随机效应和预测变量相关性的BCGLMM模型能够识别出与疾病相关的潜在微生物特征,二分类任务下,提升疾病预测的准确性。
BCGLMM模型的局限性在于计算成本较高,在大规模研究中可能面临内存和CPU时间挑战。综合看,推荐使用场景为:高维微生物组数据(特征数≥300),预期存在大量小效应的疾病预测任务,需要考虑系统发育关系的研究,对预测精度要求较高且能承受计算成本的项目。
该研究中的BCGLMM模型,突破传统稀疏模型的限制,首次系统性地解决了微生物组数据分析中的核心挑战,通过混合模型框架,能够识别中等效应并累积大量小效应,显著提升了疾病预测的准确性。
BCGLMM模型具有很大的转化潜力。
总体而言,BCGLMM为微生物组驱动的精准医学提供了方法论基础,其兼顾统计学严谨性与生物学机制的框架有望成为探索微生物生态与疾病关联的核心技术之一。
主要参考文献
Zhang, L., Zhang, X., Leach, J.M. et al. Bayesian compositional generalized linear mixed models for disease prediction using microbiome data. BMC Bioinformatics 26, 98 (2025).

谷禾健康

在自然界中,一些引人注目的共生现象出现在能够改变宿主行为的微生物与其宿主之间。
这些病原体的“精神控制”能力激发了许多末日小说作品,如HBO剧集《最后生还者》中令人毛骨悚然的真菌感染场景。
延展小知识
关于细菌沃尔巴克氏体、狂犬病毒、偏侧蛇虫草菌
Wolbachia pipientis 操控昆虫生殖及神经
Wolbachia pipientis 被喻为生物基因“木马”,可以操控昆虫生殖。常见于节肢动物门和部分线虫体内,影响所寄生动物的生殖和发育。除了影响生殖外,当它们转移到一个新的物种时,会使新寄主产生各种严重的神经系统并发症。2009年开始,科学家发现Wolbachia pipientis阻止登革热病毒在蚊子体内复制增殖,从而阻隔登革热的传播。
2019年,中山大学的研究人员利用利用Wolbachia pipientis感染的雄蚊使得雌蚊无法繁殖下一代几乎消灭了世界上最具侵入性的蚊子种类 – 亚洲虎蚊(白纹伊蚊,本地俗称花脚蚊)。
狂犬病病毒 (Rabies virus)
狂犬病病毒(Rabies virus,RABV) 感染宿主中枢神经系统的重要人兽共患病,一旦发病死亡率接近100%,每年造成全球几万人死亡。
Ophiocordyceps unilateralis,僵尸蚂蚁
Ophiocordyceps unilateralis ,也被称为偏侧蛇虫草菌,是一种拟寄真菌,偏侧蛇虫草菌在感染蚂蚁后,能够通过释放化学物质改变和控制蚂蚁的行为,让变成蚂蚁自己的傀儡,直到最终死亡。HBO新剧《最后生还者》(The Last of Us)第一季让大家领教了真菌的厉害。剧中的这种致命真菌就是偏侧蛇虫草(Ophiocordyceps unilateralis),它能够入侵昆虫的大脑,使其成为僵尸。
然而,改变行为的微生物并不仅限于这些极端的寄生生物。在自然界中,已有关于共栖和互利微生物驱动宿主行为操控的描述。这个观点在发现胃肠道内的细菌可以调节宿主中枢神经系统后,得到了广泛关注和逐步证实。
肠道微生物群——这一动态且多样化的微生物群落,被认为是肠-脑相互作用的关键调节器。与自然界中那些极端的”精神控制”案例不同,人体肠道微生物群以更加微妙和复杂的方式影响着我们的情绪、认知和行为。
各种证据表明,肠道细菌发出的信号可以循环到大脑,或影响肠-脑轴免疫和内分泌细胞的功能。一个庞大的神经网络——外周神经系统,不断且迅速地在肠道和大脑这两个远距离器官之间传递信息,使大脑能够协调胃肠功能,而肠道也能够影响情绪、认知和行为。
临床意义:当微生物失衡遇上疾病
肠道微生物结构的改变与这些生物系统的变化相关,并对人类代谢、神经精神和肠道健康产生重要影响。焦虑、抑郁、自闭症谱系障碍(ASD)和帕金森病等多种神经疾病都具有明确的胃肠疾病合并症。诸如肠易激综合征(IBS)和炎症性肠病等胃肠疾病常常表现为心理症状。关键是,这些临床相关性与失衡的微生物群和紊乱的肠—脑信号密切相关。
四条通路:微生物与大脑的对话方式
目前已经比较清晰的知道,连接肠道微生物群和大脑的四种主要通信方式。
肠道微生物群-脑轴
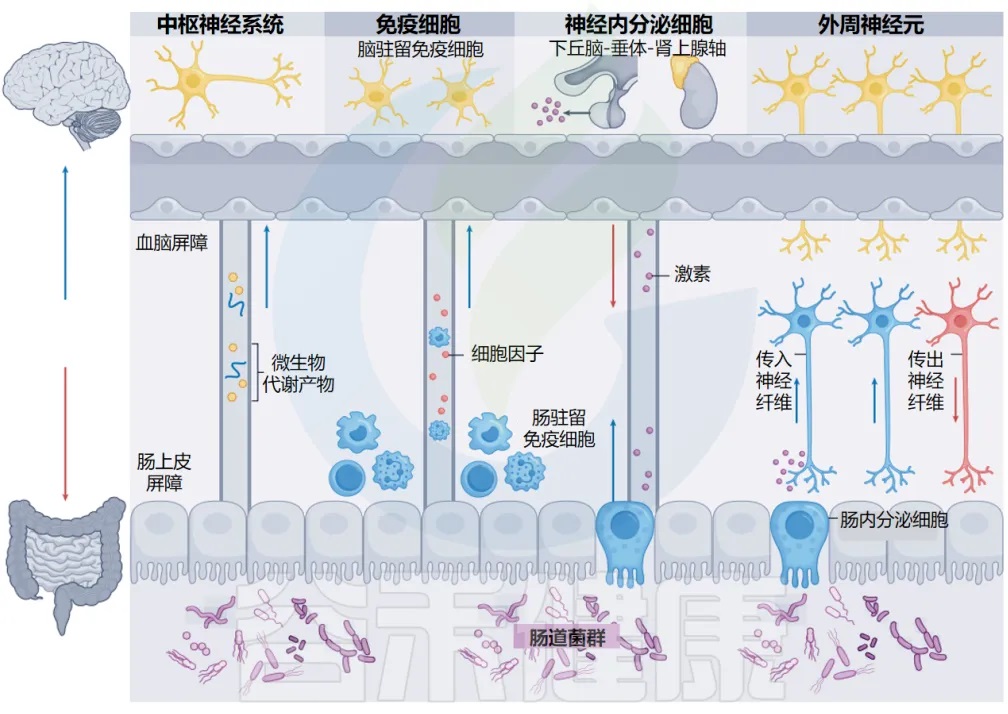
doi.org/10.1038/s41579-024-01136-9
聚焦核心:肠道神经上皮回路的精密机制
这些途径以多种方式相互交叉和影响。免疫细胞和周围神经元之间(神经-免疫轴)、神经内分泌细胞和免疫细胞之间(神经内分泌-免疫轴)、以及肠上皮细胞和周围神经元之间的双向串扰(肠神经上皮轴),为肠道和大脑之间的通信增加了额外的复杂性。
其中,肠上皮的化学感应细胞与支配肠道并延伸到中枢神经系统的周围神经元之间的关系尤为关键。这些肠道神经上皮回路代表了微生物-宿主相互作用的最前沿和最精密的机制。
本文我们将深入了解这些肠道神经上皮回路的分子机制、细胞间相互作用,以及它们如何导致疾病状态,揭示肠道微生物群如何通过这一精密的神经网络实现对宿主行为的影响。理解这些途径有助于促进基于微生物组的胃肠道和神经系统疾病新疗法的开发。
胃肠道免疫系统和神经系统
在哺乳动物中,胃肠道包含最大的免疫系统、微生物群生态系统和内源性神经系统,它们之间复杂的相互作用有助于维持正常的胃肠道生理功能。
特别是胃肠道的固有神经系统,即肠神经系统,调节着重要的胃肠道功能。肠神经系统回路的破坏会导致全身性的胃肠道症状,如腹泻、便秘、内脏疼痛等,这些症状影响着世界上高达40%的人口。
注:肠神经系统,enteric nervous system,简称 ENS,被誉为”第二大脑”。
神经免疫微环境的动态感知机制
胃肠道免疫系统和神经系统都进化出了感知和快速响应动态肠道环境的机制,能够实时监测并快速响应肠腔内的营养、微生物及病理性刺激信号。
许多神经将胃肠道粘膜中的局部免疫细胞连接起来,形成神经元免疫细胞单位,这些细胞单位可以通过肠道管腔营养来源和微生物来源的线索重塑。这些单元不仅能够独立启动局部免疫应答,还通过细胞间通讯网络进行信息整合,最终形成由肠道微生物群精密调控的”肠道神经-免疫轴”。这些协调一致的信号轴调节胃肠道屏障功能、免疫力和宿主保护。
病原感染中的神经免疫协同防御
肠道神经和免疫相互作用在感染期间尤为重要。感染应激可激活特定的胃肠道功能,可以通过腹泻反应快速清除病原体,腹泻反应可以通过增加局部水分泌到管腔中并促进推进性收缩模式来清除病原体,这两种反应都需要肠神经系统(ENS)的输入。
此外,感染或炎症引起的肠神经系统结构和/或活动紊乱可以促进或减少炎症,产生胃肠道症状,并限制组织病理学。
肠神经系统也可以再生,从而在损伤后恢复胃肠道功能。然而,在许多情况下,完全恢复往往受到限制,并且肠神经系统的损害可能产生长期后果,例如感染后胃肠道疾病。
肠道神经和免疫的相互作用的证据
尽管免疫系统与神经系统过去被分开单独研究,但现在越来越清楚,这两个复杂系统在功能上密切相关。这两个系统相互交流并不是一个新概念。两千年前,罗马医生Aulus Cornelius Celsus将炎症的四个主要症状归纳为:
疼痛、发红、肿胀、发热
其中疼痛由感觉神经系统引起,后三者则与血管和免疫功能相关。
神经对于宿主抵御病原体的调控也是进化上保守的特性,这一点从简单的多细胞动物(如线虫)到脊椎动物(如鱼和哺乳动物)的研究中都有明确证据。
过去几十年,科学家们发现神经—免疫交流在生理、抗感染、防御、修复和疾病中的多种作用。
肠道神经解剖——层层保护系统
肠道的神经解剖结构由居于器官内外的感觉神经元和自主神经元共同组成(感觉神经元负责感知信息,自主神经元负责自动控制),胃肠道在解剖学上由肠系膜、浆膜、肌肉、粘膜下层、固有层和上皮组成,由多个周围神经元群支配,这些神经元群与局部免疫细胞配合和协调反应。
肠系膜:是连接肠道与腹壁的重要结构,其主要功能是支撑、固定和保护肠道,同时为肠道提供血液供应和淋巴引流。
浆膜:保护器官,减少摩擦,参与免疫反应、维持器官位置。
肌肉:负责肠道蠕动的动力系统,推动食物通过消化道、进行机械性消化以及促进营养物质的吸收。
粘膜下层:提供营养和支持,还通过其神经和血管网络调节消化和分泌活动。
固有层:为上皮细胞提供结构支持,是免疫细胞聚集的防御前线,参与免疫防御、营养吸收和消化过程。
上皮:保护、分泌、吸收、免疫防御。
肠道支配神经元的命名法基于细胞体是位于胃肠道外部还是内部。肠道相关神经元通常归类为属于内源性肠道神经系统(ENS)。
相比之下,肠道外源性神经元包括体感神经元和自主神经神经元,其细胞体位于外周感觉或自主神经节、脊髓或脑干中。
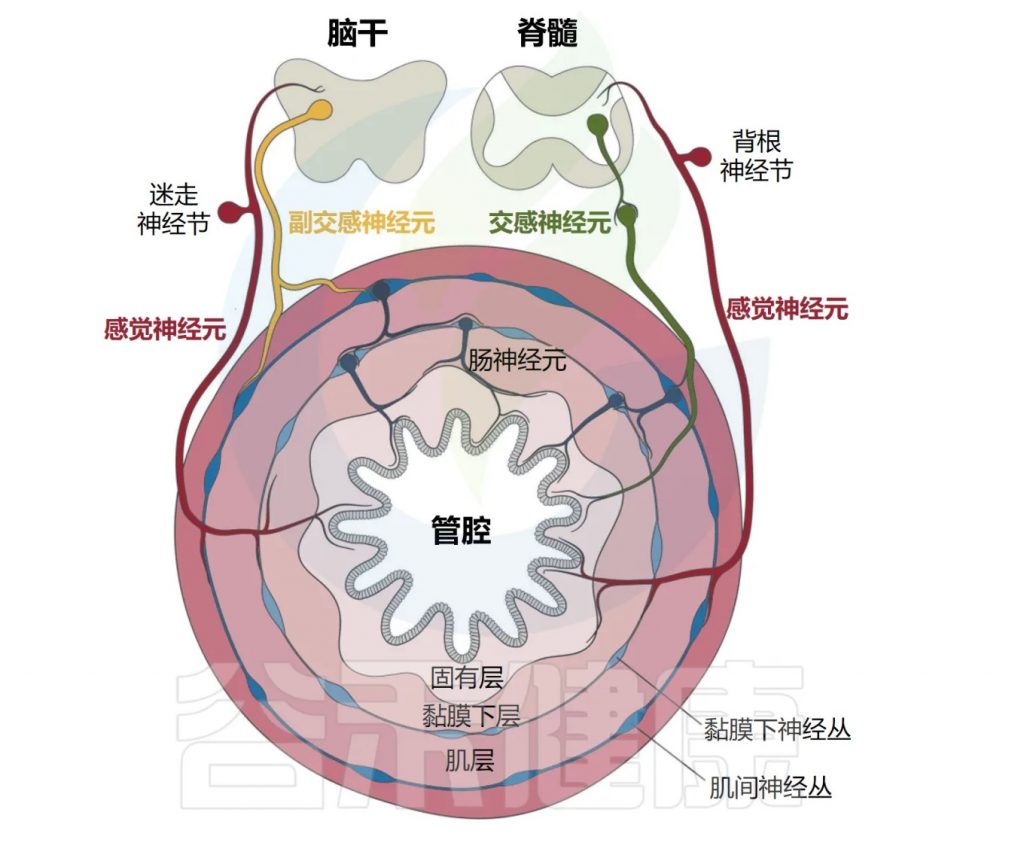
Yang et al. Cell Mol Immunol, 2023.
肠道外源性感觉神经元位于结节/颈静脉迷走神经节(VG)和背根神经节(DRG)中,分别将信号从肠道传递到脑干和脊髓。
自主神经神经元也支配肠道,包括迷走神经传出副交感神经运动神经元和位于自主神经节中的交感神经元。
肠道还拥有自己的内在和自主神经系统,由肠道神经元组成,它们的细胞体位于肌间神经丛和粘膜下神经丛中(如下图)。
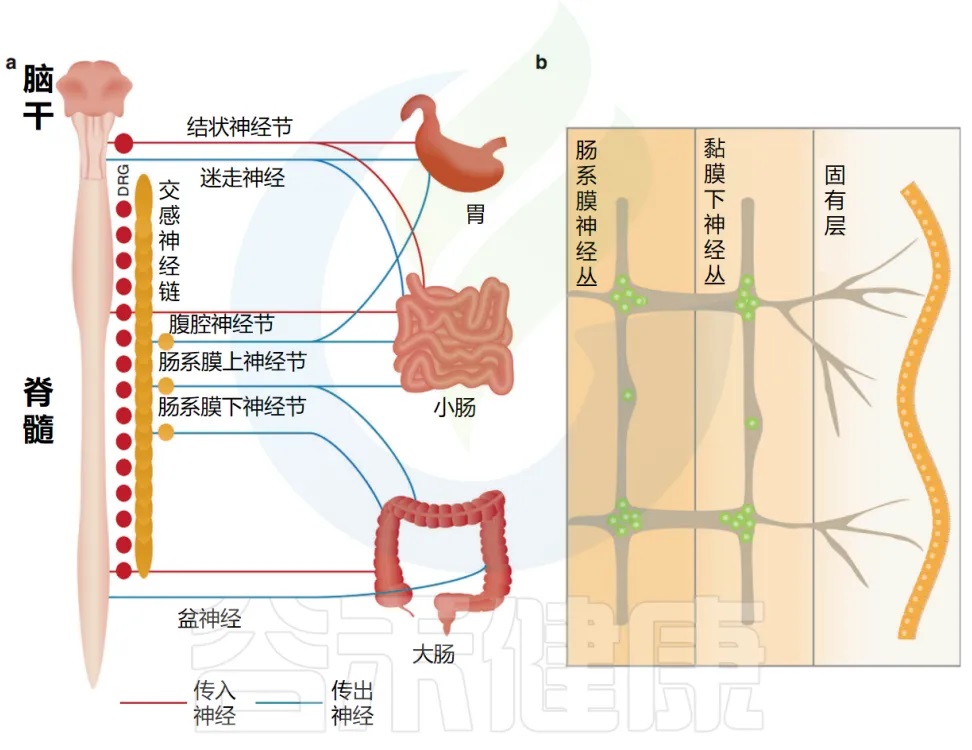
doi.org/10.1038/s41385-020-00368-1
交感神经 vs 副交感神经:肠道的刹车和油门
交感神经元和副交感自主神经神经元分别起源于脊髓和脑干,并介导从大脑到肠道的信号转导。
神经支配的地理分布
迷走神经副交感神经元沿前尾方向支配胃肠道,胃的神经支配密度最高,小肠和结肠的神经支配密度降低。
这种分布差异与不同肠段的消化功能需求相关:胃的高密度神经支配支持其机械研磨与酸性环境调控,而结肠的低密度则反映其以水分吸收和粪便塑形为主的生理特性。
交感神经元和副交感神经元都与肌间神经丛中的 ENS 形成连接,形成错综复杂的局部神经回路。
神经元——两根触手
它们能感知什么?
这些感觉神经元群检测营养物质、机械拉伸、管腔威胁和免疫刺激,包括细胞因子。
除了感知,还会“说话”
这些神经元还通过从周围神经末梢释放神经肽在肠道内发出信号(神经肽就像”化学信号”,用来和周围的细胞交流。)。迷走神经节神经元主要支配近端小肠,而 DRG 神经元支配整个胃肠道。
肠道神经网络的双层架构
肠道神经元完全驻留在胃肠道内,并组织成环绕肠管的神经节网络,并在空间上分为两层:肌间神经丛,位于圆形和纵向肌肉层之间,以及粘膜下层的粘膜下神经丛。
这两个神经丛通过中间神经元、运动神经元和肠神经胶质细胞紧密相连。它们一起形成介导蠕动和分泌功能的反射回路。
此外,它们还整合来自外源性感觉、副交感神经和交感神经神经元的信号,以介导肠道生理学。
肠道神经和免疫的共同语言
神经系统和免疫系统已经进化出一种共同的语言,在它们对环境损伤的每一步反应中进行交流,从起始到解决。
神经系统和免疫系统:互相听懂语言
微生物:神经-免疫对话的调节员
神经系统与免疫系统之间的交流机制从进化角度来看是有道理的,因为这种机制减少了应对某些损伤的代价,并使两个系统能够协调复杂的宿主反应。微生物组在调节神经元激活和免疫发育中也起着关键作用。
鉴于免疫细胞和神经元都可以直接或间接感知微生物,微生物组的组成在神经元分化或成熟中起着关键作用,以调节内脏疼痛、肠道蠕动和肠道生理的其他方面。
中枢神经系统的调节
短链脂肪酸它如何发挥作用?
尽管生物屏障严重限制微生物进入 CNS,但是某些肠道微生物代谢物,如短链脂肪酸(SCFA),可以穿过血脑屏障并起神经调节剂的作用。例如,乙酸盐优先被下丘脑吸收,下丘脑是参与食欲控制的大脑中枢,直接抑制摄食行为 。
尽管 SCFA 受体在大脑中通常以低水平表达,但这些纤维发酵产物可以通过抑制组蛋白脱乙酰酶来调节神经元基因表达。
4-乙基苯基硫酸盐,参与情绪处理的大脑区域
除了 SCFAs,最近有报道称微生物代谢物 4-乙基苯基硫酸盐可以改变参与情绪处理的大脑区域,例如海马体和杏仁核,并诱导小鼠的焦虑样行为。由于无菌动物在基线时表现出异常的大脑化学和结构,这些改变发生的时间已成为一个关键的研究重点。目前越来越多的工作揭示了母婴肠道微生物组对早期神经发育结果的影响。
免疫细胞的调节
在皮肤、肺和肠道等屏障组织中,免疫细胞和神经纤维紧密相邻,它们经常互相聊天,交换神经免疫调节分子来保护身体健康。
为什么要这样合作?
这种神经免疫轴在面对感染、过敏原或毒素时尤为重要,因为这些情况需要快速的组织保护反应,然后进行行为适应以避免未来再次遭遇。
具体怎么合作?
– 食物过敏的例子:
通过食物过敏的动物模型,两项最近的研究发现,肠道里的肥大细胞发现过敏原,它们向大脑发送特定信息,大脑记住这种食物,下次就会产生回避行为。
– 皮肤过敏的例子:
皮肤中的γδ T细胞受到微生物调节,它们能调节感觉神经元的活动,控制过敏反应的强度。肠道黏膜γδ T细胞是否参与神经元信号传递仍有待确定。
免疫细胞的远程通讯:如何向大脑发送消息?
免疫细胞不只是在局部工作。它们还有两种方式向大脑汇报:
方式一:血液快递
免疫细胞把细胞因子释放到血液中,就像发快递一样,把信息送到大脑。
方式二:亲自出差
肠道中某些免疫细胞,例如IgA+浆细胞(专门产生抗体)和自然杀伤细胞(专门杀死异常细胞),也能搬家到大脑或脑膜,从而在中枢神经系统中发挥作用。
肠道细菌的重要作用
这些细胞的功能成熟很大程度上依赖于来自肠道的微生物信号。
– 实验证据:
无菌动物(没有肠道菌群的动物)大脑中的IgA+浆细胞和“激活”的自然杀伤细胞数量会减少。
大脑常驻免疫细胞也会受到肠道细菌的影响
例如小胶质细胞和T细胞,也会受到来自肠道菌群的信号影响。 在这方面,细胞因子IL-17,特别是来自脑膜γδ T细胞的IL-17,作为肠道菌群和行为之间潜在的联系受到了广泛关注。
神经内分泌细胞的调节
下丘脑:身体的应激总指挥
下丘脑也是通过下丘脑-垂体-肾上腺(HPA)轴调节身体应激反应的关键指挥者。这个主要的神经内分泌系统包含几个严格调控的激素级联反应(就像接力赛一样,一个传一个),促进器官间的稳态。
肠道细菌影响压力反应
无菌动物具有夸大的HPA反应,并伴有应激诱导的糖皮质激素水平升高。
早期接触共生微生物对HPA轴的正常调节非常重要。简单说,婴儿期的肠道细菌会影响我们一生应对压力的能力。
肠内分泌细胞:肠道里的激素工厂
肠道也包含其自身的神经内分泌细胞群,称为肠内分泌细胞 (EECs):
这些激素调节消化、葡萄糖稳态、食欲。虽然主要在营养感知的背景下进行研究,但 EECs 越来越被认为是肠道菌群的关键传感器和肠-脑信号传导的介质。
肠道激素:连接肠道与大脑的信使
肠道菌群会影响多种循环激素的分泌:
这些激素作用范围很广
这些激素中的大多数在胃肠道神经纤维、下丘脑和其他大脑区域都有靶点。
由于这些激素及其前体也由身体的各种神经元和非神经元细胞产生,因此了解 EEC 来源的信号对动物行为的具体贡献一直是一个重大挑战,近年来随着基因工具的进步,解决这一问题成为可能。
外周神经元的调节
第四条高速路:外周神经系统的闪电传输
肠道微生物与大脑之间的第四个联系是外周神经系统 (PNS),特别是自主神经系统 (ANS),它具有副交感神经和交感神经两个分支。
神经传输有什么特点?
与前面提到的激素传输或细胞迁移不同,神经系统传输信息超级快:
肠道的双重神经网络:外在 vs 内在
– 外在
作为一种内脏器官,胃肠道由“外在”传入和传出神经纤维支配,其细胞体位于大脑或脊髓区域,分别介导肠道到大脑和大脑到肠道的信号传递 。
– 内在
“内在”肠神经系统 (ENS) 的神经纤维也分布在胃肠道中,其细胞体位于肠壁外层。它们在很大程度上自主地执行基本的肠道功能,并接收来自微生物组和中枢神经系统的输入。
迷走神经:肠脑对话的专线电话
迷走神经作为副交感神经系统的主要分支,尤其与肠-脑通讯密切相关,具有传入和传出神经纤维。它在维持肠道稳态以及调节情绪、食欲和能量平衡方面发挥重要作用。
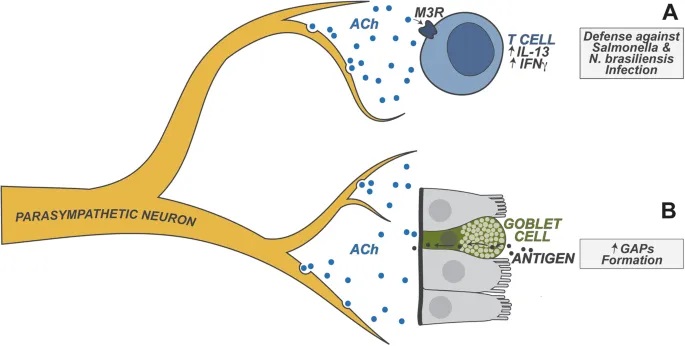
doi.org/10.1038/s41423-023-01054-5
实验证据
在迷走神经切断动物(即接受了迷走神经切断术的动物)中,肠道菌群的许多效应都会消失。然而,微生物信号是否能直接调节体内迷走神经的活动,目前证据仍然有限。
脊髓传入神经:疼痛信号的传递者
脊髓传入神经通过脊髓将感觉信息从肠道分别传递到大脑。我们对微生物组通过脊髓神经发出信号的许多了解都与内脏疼痛有关,因为许多这些纤维都是疼痛感应的。无菌动物表现出对结直肠扩张的超敏反应,而益生菌治疗可以缓解这种反应。共生微生物是否通过脊髓通路影响大脑生理或行为,目前仍不清楚。
交感神经系统:应激反应的调节者
交感神经系统调节多种胃肠道功能,尤其是在应对急性应激时。无菌小鼠的交感神经活动长期升高,这与这些动物体内HPA轴反应的增强相呼应。有趣的是,微生物群对交感神经活动的调节依赖于迷走神经传入纤维的信号,突显了周围神经系统相互关联的性质。
肠道神经元:免疫系统的调度员
肠道神经元是异质性的,能释放两大类物质来调节免疫功能:
– 细胞因子:
IL-18:调节抗菌肽的杯状细胞表达,抗菌肽介导宿主对肠道鼠伤寒沙门氏菌感染的保护
IL-6:抑制结肠中 RORγ+ 调节性T细胞的分化
– 神经肽:
NMU(神经调节素U)
CGRP(降钙素基因相关肽)
VIP(血管活性肠肽)
神经元与先天淋巴细胞的密切合作
肠道神经元还协调肠道先天淋巴细胞 (ILC) 的功能方面也起着重要作用。ILC 是协调下游适应性免疫的早期反应先天淋巴细胞。
– 空间优势
肠道神经元靠近 ILC,为这些神经元调节 ILC 功能奠定了细胞基础。
– ILC2的调节:过敏反应控制
ILC2 高度表达 NMUR1,NMUR1 是神经肽神经中介U(NMU)的受体。肠道感觉神经元的一个亚群表达 NMU,NMU 在过敏情况下释放。
– ILC3的调节:昼夜节律与宿主防御
肠道神经元在调节肠固有层 3 型 ILC (ILC3) 的功能中也起着关键作用。ILC3 表达高水平的 VIPR2,VIPR2 是神经肽 VIP 的受体。
肠道神经元的一个子集(以及迷走神经感觉神经元)表达高水平的 VIP,并且已发现它们在稳态和宿主防御期间调节 ILC3 功能。
– 具体调节过程
进食触发:食物消耗以昼夜节律方式触发VIP的神经元产生;
抑制作用:VIP抑制ILC3介导的IL-22产生,消除抗菌肽的肠道表达;
实验验证:VIP+神经元的化学激活导致IL-22+ ILC3比例降低,使宿主易受口腔啮齿柠檬酸杆菌感染。
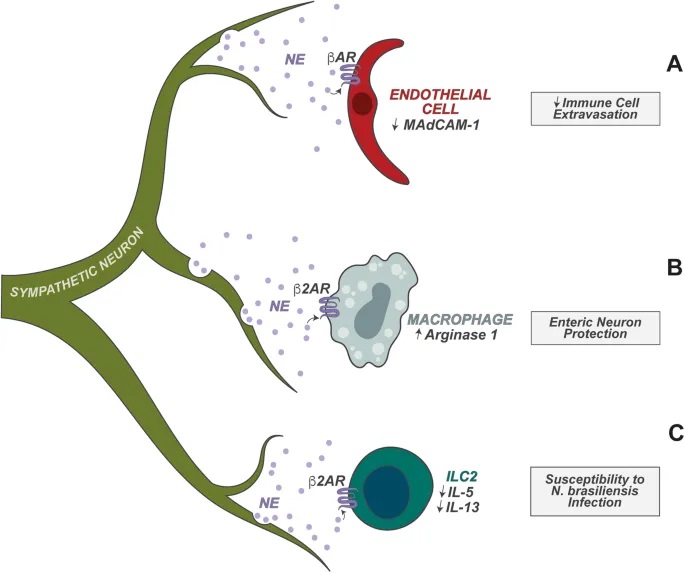
doi.org/10.1038/s41423-023-01054-5
肠道上皮每天都要面对来自食物和肠道菌群的各种化学物质。有时,有害刺激物和病原体会进入胃肠道,需要迅速采取损害控制措施。
为了理解管腔环境并区分“好”和“坏”,EEC(肠内分泌细胞) 和周围神经共同形成了一个广泛的肠道感觉网络。
信息处理:局部处理 vs 上报大脑
这些感觉信息有两种处理方式:
同时,大脑也会向肠道发送指令,引起特定的器官间反馈反应。
肠道神经上皮界面的肠道微生物群到大脑通路
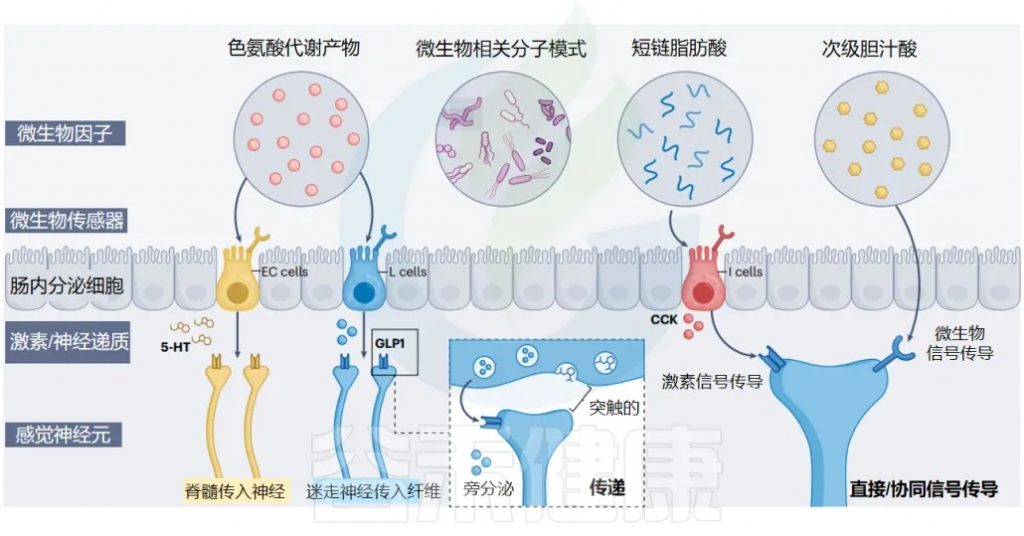
Ohara et al. 2025. Nat Rev Microbiol
肠内分泌细胞:肠道的化学传感器
肠内分泌细胞 (EECs) 是肠道的主要化学感应上皮细胞,通常根据其主要激素产物进行分类。产生 CCK、GLP1/PYY 和 5-HT 的 EEC 分别称为 I 细胞、L 细胞、肠嗜铬细胞(EC)。
在 EEC 家族中,这三个亚群最密切地参与肠-脑通讯:
EECs的灵活性
一些 EEC 在其生命周期中分泌多种不同的激素或经历激素转换,这表明 EEC 亚型并非完全固定。
重要的是,微生物组感应受体在远端肠道的 L 细胞和 EC 细胞中富集,这个区域正好是细菌载量最高的地方,并且主要被认为发生微生物-EEC 信号传导。
简单说,细菌最多的地方,正好是感应细菌信号的传感器最多的地方。
微生物相关分子模式 (MAMP)
MAMP
微生物相关分子模式(MAMP)就想是细菌身上的身份标识牌,是微生物上进化上保守的结构,就像每个细菌都带着固定的身份证。宿主细胞可以通过模式识别受体来读取这些身份信息,特别是先天免疫细胞,它们是识别细菌身份的专家。
Toll样受体
在模式识别受体中,Toll 样受体(TLR)在维持肠上皮细胞稳态中起着至关重要的作用。
肠内分泌细胞表达不同的TLR
体外和体内研究表明,肠内分泌细胞 (EECs) 表达几种不同的功能性 TLR,包括:
TLR信号如何影响激素分泌?
肠道中的 TLR 信号传导与 CCK(胆囊收缩素)、GLP1(胰高血糖素样肽1) 、5-HT(血清素)分泌的调节有关,但这仍有待进一步验证。
TLR4 也在感觉传入神经元中表达,但其与微生物组感应的相关性尚不清楚。
短链脂肪酸(SCFA)
短链脂肪酸(SCFA)是膳食纤维发酵的最终产物,由厌氧菌在结肠中大量产生。
特定的支链短链脂肪酸,如异戊酸盐和异丁酸盐,由肠道细菌通过支链氨基酸发酵制成。特征最明显的 SCFA 受体是游离脂肪酸受体2 (FFAR2)和 FFAR3,它们都在多个 EEC 亚群中表达,说明很多肠内分泌细胞都能听到SCFA的信号。
FFAR受体:如何传递SCFA信号?
FFAR 是一种 G 蛋白偶联受体,当被激活时,它与几个下游信号级联反应相连,就像按下按钮后,触发一连串的反应。
– 对L细胞的影响
SCFA 与 L 细胞上的 FFAR2 和 FFAR3 结合会触发细胞内钙动员(也就是钙离子在细胞内快速移动)以及 GLP1 和 PYY 的释放。
EC细胞:用嗅觉受体来感应SCFA
在结肠中,EC 细胞也通过 FFAR 以及嗅觉 G 蛋白偶联受体 OLFR78 和 OLFR558(refs)受到 SCFA 的调节。
不同种类的SCFA有不同的分工
尽管FFAR3在 I 细胞中广泛表达,但尚不清楚 SCFA 是否调节CCK的产生。FFAR2 和 FFAR3 在肠道支配感觉神经元中也有功能表达,表明传入神经纤维可能直接对SCFA做出反应。
次级胆汁酸
次级胆汁酸是肠道微生物群产生并被宿主识别的另一类重要代谢物。最初是肝脏产生的初级胆汁酸,这些初级胆汁酸到达远端肠道后,被肠道细菌进行”二次加工“,变成了次级胆汁酸。
简单说,这是肝脏和肠道细菌合作的产物。
主要的次级胆汁酸:两大明星分子
脱氧胆酸(DCA)和石胆酸是两种含量最丰富的次级胆汁酸,能够通过多种宿主受体发出信号,特别是 TGR5(也称为 G 蛋白偶联胆汁酸受体 1)和法尼醇 X 受体。两种受体都在 L 细胞中表达,并参与 GLP1 和 PYY 释放的调节,这就解释了为什么肠道细菌的变化会影响我们的血糖控制和食欲调节。
对EC细胞的影响:调节血清素产生
次级胆汁酸还向 EC 细胞发出信号,通过 TGR5 和可能通过 Tph1 的下游转录指导 5-HT 的产生,Tph1 编码 5-HT 生物合成的限速酶。
目前尚不清楚次级胆汁酸是否作用于 I 细胞,但这些胆汁酸的一部分可以通过肠肝循环到达近端肠道,并且表达 CCK A 型受体的迷走神经传入神经亚群以 TGR5 依赖性方式对 DCA 有反应。
色氨酸和吲哚衍生物
色氨酸是一种从膳食蛋白质中获得的必需氨基酸,人体无法自己制造,其分解产物代表了另一类有助于宿主健康的微生物代谢物。
吲哚途径:细菌的化学加工厂
在色氨酸降解的三个主要途径中,吲哚途径由肠道中的许多细菌物种进行,将色氨酸转化为吲哚及其衍生物,如吲哚-3-乙酸(IAA)和吲哚-3-醛。
吲哚类物质如何影响EECs?
吲哚是 L 细胞中 GLP1 分泌的已知诱导剂。也就是说,吲哚能够刺激L细胞释放GLP1。
在斑马鱼中,吲哚和吲哚-3-醛强烈激活 EEC 并通过瞬时受体电位锚蛋白 1 通道触发 5-HT 释放。
瞬时受体电位锚蛋白1:多功能的感应通道
瞬时受体电位锚蛋白 1 不仅能感应吲哚类物质,还有其他身份,它也是环境刺激物的传感器,比如能感应芥末油(这就解释了为什么吃芥末会有刺激感)。
瞬时受体电位锚蛋白 1 在哺乳动物EC细胞和感觉神经元中高度表达,可能是促进胃肠道蠕动和清除摄入毒素的机制。
在检测到微生物群衍生因子后,肠道感觉网络将此信息传递给CNS。这种传输究竟是如何发生的,特别是在脑-身体通信的背景下,是目前积极研究的一个领域。
新兴的经典肠道神经上皮通路涉及:
肠道感觉网络
肠内分泌细胞(EEC)和肠道支配感觉神经元在肠粘膜屏障处共同形成一个复杂的感觉网络,能够感知和响应各种微生物结构和代谢物。这些包括色氨酸代谢物、微生物相关分子模式、短链脂肪酸和次级胆汁酸。
结肠中的两大主力
在结肠中,有两类重要的EEC:
这两类细胞都表达这些微生物信号的受体,能够直接听到细菌的声音。
I细胞主要位于小肠中,生产胆囊收缩素(CCK),同样表达微生物传感器。
信号传递的两种方式
当EEC被激活时,它们会通过两种方式释放信号分子:
EEC会释放:
传递给:
不仅影响EEC,还直接影响神经
微生物输入还可以直接调节感觉神经纤维的敏感性,从而增强 EEC-神经荷尔蒙信号传导。
不同信号走不同高速路
根据所涉及的微生物传感器、EEC 亚群、神经肽和感觉神经元类型,不同的微生物线索可以通过不同的肠道神经上皮途径输送,最终对大脑功能和行为产生不同的影响。
感觉细胞多样性
肠道里的神经元是怎么工作的?
肠道中有两大类感觉传入神经负责不同的监测任务:
最近对迷走神经和脊髓神经元的分析发现了多种感觉神经元细胞类型,甚至在化学感受器和机械感受器中也是如此。
为什么需要这么多不同类型的神经元?
结合遗传的研究方法,得出一个研究的共识,即单个感觉神经元之间存在很大的分工。每种神经元都有自己的专业领域,就像专科医生一样。
这些神经元到底分工有多细?
一些具体的例子:
复杂分工的深层原因:系统的精密设计
这种刺激特异性神经元反应可能反映了肠道神经上皮水平信息感知和传递方式的复杂性,部分原因是 EEC 和感觉神经元群的异质性。这种精密的设计确保了肠道能够准确识别和传递各种不同的信号。
未来:寻找微生物组专属神经元
这些观察结果提出了一个有趣的问题,即是否有专门的“微生物组响应”感觉神经元来支配肠道,以及是否存在基于微生物刺激的亚型。
当然,GPR65 + 迷走神经神经元是不错的候选者,因为它们是在整个胃肠道中具有致密粘膜神经末梢的化学感受器。
然而,随着迷走神经支配沿结肠长度向远端减少,脊神经可能同样有助于将微生物线索传递给 CNS。
旁分泌传递与突触传递
传统方式:EEC的广播信号传递
当EEC受到刺激后,它们会采用最常见的信号传递方式:
这通常被认为以旁分泌方式发生——即最接近 EEC 范围,只要表达相关受体的纤维,就能接收信号并传播给大脑,也就是“近水楼台先得月”。
新发现:EEC的专线连接方式
科学家们发现了一种更直接的连接方式!研究发现了一种独特的 I 细胞和 L 细胞亚群,被称为”神经足”细胞。
– 什么是”神经足”细胞?
更多证据:EC细胞也有类似的专线
对于 EC 细胞和脊髓传入纤维提出了类似类型的连接。支持这种突触连接的证据:
然而,最近的高分辨率成像研究尚未发现令人信服的证据证明 EEC 和传入神经之间存在突触接触,这表明神经足细胞要么非常罕见,要么仅存在于某些 EEC 亚型中。另一种解释是,考虑到大多数 EEC 的寿命较短,EEC-神经突触是高度动态的。
了解 EEC 的特定子集是否可以直接进入大脑很有价值,因为它们将是影响与肠道微生物群相关的情绪和行为变化的候选者。
协作微生物-宿主信号传导
到目前为止,我们已经将肠道神经上皮回路描述为一条线性通路,信号在到达 CNS 之前从肠道微生物群传递到 EEC,再传递到内脏传入神经。
微生物群 → EEC → 内脏传入神经 → 中枢神经系统
新发现:微生物的捷径通道
一些微生物因子,包括 SCFA、次级胆汁酸、蛋白酶,可以绕过上皮层,并直接作用于感觉传入神经。
协同作用:1+1>2的效果
感觉神经纤维如何整合微生物和宿主来源线索的细节开始浮出水面。
– 例子1:DCA + CCK的强强联合
注:它是一种次级胆汁酸,由肠道菌群代谢初级胆汁酸而产生。
– 例子2:丙酸盐增强CCK效果
这些发现表明,微生物代谢物可以与肠道激素合作以影响感觉神经放电。
复杂的生物网络系统
鉴于最近对免疫细胞在协调脑-身体回路和肠胶质细胞在塑造肠道神经活动中的作用的见解,微生物群-神经上皮相互作用可能涉及多个细胞输入的影响,这个系统作为更大的互连生物系统网络的一部分,远比简单的线性通路复杂。
简单说,肠脑通讯不是一条高速公路,而是一个复杂的交通网络,有多条道路、多个路口,各种车辆(不同的信号分子和细胞)在其中协调运行。
肠道感觉网络收集的有关微生物组的信息,在组织本身、脑干和脊髓以及高级大脑区域内进行整合和处理。
大脑处理完信息后会做什么?
中枢神经系统的效应肢体会积极响应,主要包括:
它们的任务是对动态变化的肠道环境做出反应,调节胃肠道生理学的各个方面。
近年来,宿主通过局部和远程信号传导机制对肠道微生物群的定向作用受到了相当大的关注。
肠神经上皮界面的脑到肠道微生物群通路
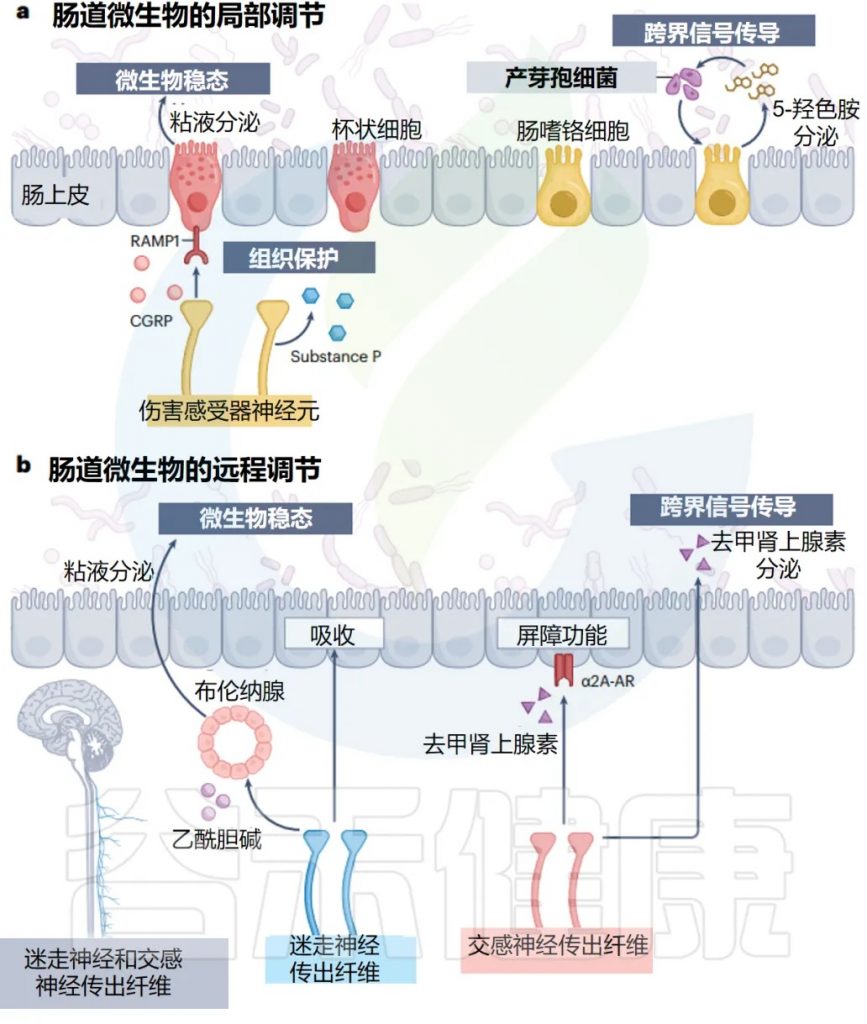
doi.org/10.1038/s41579-024-01136-9
局 部 调 控
传统认知:感觉神经只负责”上报”信息
传统上,感觉神经是将信息传递到 CNS 的传入纤维,就像信息传递员一样,只负责把肠道的情况报告给大脑。
新发现:感觉神经还有”管理”功能
现在人们普遍认识到,感觉神经元还通过在屏障组织局部释放各种神经肽和神经递质来执行传出功能。
– 管理方式:
通过作用于附近的免疫和非免疫细胞,感觉传入神经是维持组织健康不可或缺的一部分。
肠道中的疼痛神经:伤害感受器
在肠道中,许多具有局部效应功能的感觉神经元是伤害感受器,它们通常在皮肤中介导疼痛感。
– 伤害感受器:微生物管家
尽管它们的确切特征和功能正在阐明,但最近的两项互补研究发现,伤害感受器在调节肠道微生物稳态方面具有新作用。
– 实验证据:
在没有功能性伤害感受器的情况下,小鼠以微生物组依赖性方式更容易患结肠炎。
伤害感受器的保护机制:释放保护性分子
伤害感受器通过释放 P 物质和降钙素基因相关肽来促进组织保护,这些肽向邻近的肠道杯状细胞发出信号以驱动粘液分泌。
有趣的是,伤害感受器释放的 P 物质和降钙素基因相关肽受共生信号调节。因此,感觉神经元同时监测和调整肠道菌群的组成以支持肠道稳态。
EC细胞与5-HT的调节系统
一个显著的例子是 EC 细胞,它在压力、机械压力和迷走神经刺激下将 5-HT 释放到肠腔中。
– 微生物的影响:
微生物的策略:操控宿主为自己服务
因此,孢子形成细菌识别肠腔中的 5-HT,并通过结肠中的 EC 细胞进一步诱导宿主 5-HT 的产生,来促进自身在微生物组中的成员身份。
这种微生物群-EEC 串扰是孢子形成者独有的,还是其他细菌物种参与界间信号传导仍有待确定。
远 端 调 节
宿主调节微生物的双重策略:局部 vs 远程
宿主有两套不同的调节策略:
策略1:局部信号调节——就地解决问题
策略2:远程肠脑回路调节——统筹全局管理
ANS 的两个主要分支——迷走神经和交感神经,通过它们在胃肠道中的不同功能输出,来协调这种反馈反应。
迷走神经:身体休息和消化时的管家
虽然大多数迷走神经纤维将感觉信息传递到大脑,但有些也向肠道提供副交感神经流出,主要支配 ENS 并促进肠道蠕动和上皮分泌物,作为身体“休息和消化”反应的一部分。
最近的证据表明,迷走神经传出纤维在通过近端小肠 Brunner 腺调节肠道微生物群方面,具有惊人的作用。
– 对特定微生物的影响:
乳酸菌属对这种神经腺回路的扰动特别敏感,在迷走神经刺激时扩大,并在参与压力信号时丰度降低。
迷走神经传出神经元的活动,也极大地影响了肠上皮的吸收能力,可能会改变饮食-微生物群动力学和微生物代谢物对宿主的获取。
交感神经:压力状态下的应急管理员
– 交感神经的基本功能
交感神经为肠道提供肾上腺素能神经纤维,在那里它们支配 ENS 和肠粘膜,并释放去甲肾上腺素,尤其是在应对压力时。
– 对微生物群的具体影响
交感神经激活导致粘蛋白降解剂(如Akkermansia)增多,Turicibacter spp137 减少。
这些微生物组的变化伴随着粘液产生、抗菌基因表达和上皮周转率的变化,揭示了交感神经、上皮细胞和肠道细菌之间的密切关系。
交感神经的化学武器:去甲肾上腺素的直接作用
– 直接的化学信号传递
交感传出神经元影响微生物组的另一种机制是,通过将去甲肾上腺素释放到肠腔中。
– 跨界信号传导的例子
QseC 组氨酸激酶对宿主来源的儿茶酚胺(如肾上腺素和去甲肾上腺素)的细菌感应,是王国间信号传导的另一个例子。
– 对病原菌的影响
在某些大肠杆菌菌株中,儿茶酚胺可以改变毒力基因表达和致病性。有趣的是,肠腔中游离儿茶酚胺的水平部分受肠道微生物群的调节。
这可能具有临床意义,因为 GLP1 受体激动剂利拉鲁肽是一种常见的抗糖尿病药物,被发现可以激活交感神经传出纤维,触发去甲肾上腺素释放到肠腔中,并诱导大肠杆菌的扩增 。
总的来说,这些研究表明,交感神经可以直接影响肠道细菌定植。
神经免疫学是一个快速发展的领域。最近在不同的神经元亚群如何调节肠道免疫反应方面的突破,加深了我们对生理和病理条件下肠道免疫的理解。
除了被动接受和应对有害的威胁外,免疫系统还向神经系统发出信号以启动防御性反应。同时,神经系统在对潜在威胁的预期和感知下,积极调节肠道中的免疫反应。神经系统和免疫系统之间的协调使宿主能够正确处理复杂的刺激和不断变化的环境。
肠道微生物群也是调节肠脑轴中神经元和免疫激活的关键臂。结合微生物组、转录组、蛋白质组的多组学研究,配合光遗传学和化学遗传学等新兴技术,将深化我们对神经元如何塑造肠道生态系统的理解。
肠道菌群检测技术的应用将成为连接基础研究与临床实践的重要桥梁。基于微生物组构成和神经反应模式的个体化治疗将成为现实,通过功能性微生物组分析,结合肠道菌群检测报告中的神经递质等相关指标,实现疾病风险预测和治疗效果的个性化评估。自迷走神经电刺激在减轻炎症方面的发现以来,生物电子医学在临床应用中展现出广阔前景,无创迷走神经刺激已在克罗恩病临床试验中显示疗效。
神经递质和神经肽受体信号传导的治疗靶向为药物创新提供了新思路。β-肾上腺素能受体拮抗剂和CGRP受体拮抗剂等现有药物,凭借其调节肠道免疫的能力,可重新用于胃肠道功能障碍治疗,同时基于微生物代谢物的新药开发和靶向EEC的小分子化合物研究正在兴起。
这些突破将更大地改变焦虑、抑郁、自闭症、帕金森病等神经疾病以及肠易激综合征、炎症性肠病等消化系统疾病的治疗策略。通过微生物疗法、肠道靶向神经调节和神经-免疫平衡调节的联合治疗,未来,临床医生可能会根据患者的肠道菌群特征、免疫状态和神经系统表型制定个性化治疗方案。
医学正从标准化治疗转向个体化精准医疗,肠道-菌群-免疫-神经将成为未来疾病治疗的重要方向。短链脂肪酸、色氨酸代谢物以及其他菌群代谢产物正被开发为新型神经调节剂,它们能通过血脑屏障或迷走神经途径影响中枢神经系统功能。
早期干预肠道菌群失调可能成为预防神经精神疾病的关键途径,特别是对具有遗传风险的人群。肠道健康将成为整体健康管理的重要组成部分。
主要参考文献
Jacobson, A., Yang, D., Vella, M. et al. The intestinal neuro-immune axis: crosstalk between neurons, immune cells, and microbes. Mucosal Immunol 14, 555–565 (2021).
Ohara, T.E., Hsiao, E.Y. Microbiota–neuroepithelial signalling across the gut–brain axis. Nat Rev Microbiol 23, 371–384 (2025).
Yang, D., Almanzar, N. & Chiu, I.M. The role of cellular and molecular neuroimmune crosstalk in gut immunity. Cell Mol Immunol 20, 1259–1269 (2023).