-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
慢性低度炎症像一把“不易被察觉的火”,燃烧得不剧烈,却足以长期损伤机体。其特征包括循环或局部组织中促炎介质(如 TNF-α、IL-6、IL-1β)、黏附分子与氧化应激标志物的轻度持续升高,以及肠屏障功能受损导致的低水平内毒素血症。
若不及时干预,免疫与代谢系统将在不知不觉中受损,并推动疾病进展。研究已发现慢性低度炎症与代谢综合征(肥胖、胰岛素抵抗、血脂异常、高血压)正相关,并关联动脉粥样硬化、非酒精性脂肪性肝病、2型糖尿病、认知退化及多器官慢病风险上升。
目前对炎症性疾病的研究往往集中在疾病的晚期,然而,在炎症发作后的干预往往侧重清除促炎因素,恢复平衡更为缓慢。通过早期营养干预来对抗慢性低度炎症(显性疾病之前的一个阶段)可能是一种更好的替代方法。在本文中我们将系统地评估饮食如何通过几个生理过程调节慢性低度炎症。
我们建议针对疾病不同阶段制定三种干预策略:
(i)促进普通人群的抗炎饮食模式:
对于尚无临床症状的一般人群与亚健康状态,优先以可复制的基础饮食模式打底:增加可发酵膳食纤维,促进短链脂肪酸尤其是丁酸的生成,强化紧密连接蛋白表达、降低肠屏障通透性;增加茶、浆果、可可等多酚来源,增加双歧杆菌与产丁酸菌,抑制条件致病菌,提升菌群多样性;并减少超加工食品与精制糖、配合体重管理、规律运动与充足睡眠,形成稳定的低炎症基线。
(ii)针对高危个体的炎症生物标志物实施精准营养:
对于患有肥胖、胰岛素抵抗、血脂异常或家族史等高危人群,应以生物标志物驱动的精准营养为核心,围绕高敏C反应蛋白(hs‑CRP) 、脂多糖指标与粪便丁酸盐等进行剂量与组合的动态优化。在控制总能量与进食时序的基础上,优先补足可发酵纤维与抗性淀粉以提升丁酸生成,强化不饱和脂肪酸供给(鱼类或藻油),并定向组合益生元(低聚果糖、低聚半乳糖、菊粉)与多酚,优化 F/B 比值,从而更快速、稳定地降低炎症张力。
(iii)利用饮食疗法辅助治疗现有炎症:
对于已存在慢性炎症或患非酒精性脂肪性肝病、动脉粥样硬化、2型糖尿病等慢病者,营养干预应作为医疗治疗的有力补充:以高纤维、富含不饱和脂肪酸、低加工、适度能量限制的抗炎饮食为主轴,按期监测脂多糖、hs‑CRP、肝酶、血脂与餐后血糖等指标;在医生指导下强化微生态调节,必要时配合特定菌株以提升菌群功能冗余与屏障稳态,重建“饮食—微生物—屏障—免疫”轴的系统性稳态。
相比病后干预,更应尽早实施营养策略,以主动维持内环境稳态,这往往是更实用且更易行的健康之道。总体而言,面向不同阶段与人群的营养策略是一套“定量—定时—定向”的组合干预,并以生物标志物反馈持续微调,实现早识别、早干预、可追踪的闭环管理,让慢性低度炎症不再悄然侵蚀健康,而是被前瞻性地重塑与管控。
什么是慢性低度炎症?
炎症既是“朋友”也是“敌人”:作为先天免疫的关键机制,它清除病原、修复损伤,保护宿主免受病毒、细菌与毒素侵害。当炎症未及时消退或长期处于促炎刺激下,急性可转为慢性。
慢性低度炎症(CLGI)是一种全身性、低强度且隐匿的持续炎症,表现为 hsCRP、IL‑6、TNF‑α 等循环炎症标志物轻度长期升高,免疫细胞持续活化,NF‑κB、JAK–STAT、NLRP3 等通路被持续驱动。
关键特征
-长期、亚临床、系统性炎症,非感染性触发为主。
-以免疫代谢失衡为核心:能量代谢、氧化还原状态、激素与神经轴与免疫反应耦合紊乱。
-与肠屏障功能受损和肠道菌群失调密切相关,存在“肠–免疫–神经”跨器官通信。
-可被饮食模式与早期营养干预调节,是重要的可改变危险因素与治疗窗口。
可能造成的危害
慢性低度炎症(CLGI)是一种持续而全身性的低强度炎症,常呈亚临床状态,却因免疫—代谢—神经—内分泌网络长期失衡而驱动多系统疾病的发生与进展。下面是谷禾根据文献总结的慢性低度炎症可能导致的一些危害:
1–心血管及代谢疾病
二十余年来,炎症在动脉粥样硬化等血栓事件早期病理生理中的作用已得到证实。白细胞被招募至受损动脉的内皮下,触发由其释放的炎症介质所驱动的级联反应。尤其是,趋化因子与细胞因子通过以下途径推动动脉粥样硬化:
(1)上调趋化因子与内皮黏附分子,促进更多白细胞募集;
(2)促进脂质负载并形成泡沫细胞;
(3)诱导平滑肌细胞增殖;
(4)造成斑块不稳定并最终破裂。
随后发生的血栓形成在很大程度上也取决于破裂斑块的炎症状态。
①增加动脉粥样硬化与血栓风险
机制:oxLDL/oxPL、AGEs、FFAs 促使内皮功能障碍、泡沫细胞形成与斑块不稳定;IL-6、TNF-α等维持炎症微环境。
后果:冠心病、脑卒中、外周动脉疾病风险上升。
②诱发胰岛素抵抗与2型糖尿病
机制:NF-κB、JNK、IKKβ 激活干扰胰岛素信号;脂肪组织M1极化与肝脏炎症加剧。
后果:糖耐量受损进展为2型糖尿病,伴并发症风险增加。
③导致代谢相关脂肪性肝病
机制:内毒素血症、脂滴过载与氧化应激触发肝巨噬细胞和星状细胞活化。
后果:肝纤维化、肝硬化及肝细胞癌风险提升。
④加重肥胖及其并发症
机制:脂肪组织低氧与纤维化、促炎细胞因子回路促进食欲调控紊乱与能量失衡。
后果:睡眠呼吸障碍、骨关节问题、血压升高等。
2—神经系统与脑健康
全身免疫系统与中枢神经系统(CNS)之间的沟通是组织损伤、疾病或炎症反应中至关重要却常被忽视的一环。
慢性低度炎症通过持续激活中枢免疫细胞与促炎介质,扰动免疫—神经—内分泌网络,导致轻度但广泛的中枢炎症及“疾病行为”相关的疲劳、快感缺乏、抑郁与轻度认知下降,并伴随体温与自主神经反应的改变。
①认知下降与神经退行性变
机制:外周炎症经血—脑屏障、迷走神经与细胞外囊泡影响小胶质细胞活化;肠—脑轴代谢物(TMAO、胆汁酸谱、色氨酸—吲哚通路)失衡。
后果:阿尔茨海默病、帕金森病风险增加或进展加速。
②情绪与精神健康负担
机制:炎症因子影响单胺代谢、神经营养因子与下丘脑—垂体—肾上腺(HPA)轴。
后果:抑郁、焦虑、疲劳综合征等发生率升高。
3—免疫系统与感染易感
①免疫失衡与感染风险上升
机制:先天免疫持续激活导致获得性免疫功能低下与免疫衰老。
后果:呼吸道、肠道感染更易发生且恢复慢,对疫苗应答下降。
②自身免疫与过敏性疾病加重
机制:屏障破坏与肠道菌群失调诱导抗原暴露与异常共刺激。
后果:类风湿、炎症性肠病、哮喘等病情波动或进展。
4—肠道微生态与屏障受损
①肠屏障受损与代谢性内毒素血症
机制:紧密连接蛋白下调,脂多糖入血激活 TLR4–NF-κB/NLRP3。
后果:全身低度炎症正反馈,心代谢与肝病恶化。
②微生物组功能衰退
机制:产丁酸菌减少、耐药基因与机会致病菌扩张,SCFA下降、特异性促炎症消退介质(SPMs)不足。
后果:营养代谢、胆汁酸循环与神经免疫调控受损。
5—组织与器官结构性改变
①纤维化与器官功能退化
机制:TGF-β、SASP(衰老相关分泌表型)驱动成纤维细胞活化与基质沉积。
后果:肝、心、肾等器官纤维化和功能衰竭风险增加。
②肌肉量减少与体能下降
机制:肌因子平衡破坏、线粒体功能受损与胰岛素抵抗。
后果:老年综合征、跌倒风险上升,运动能力下降。
6—生殖与内分泌轴
①生殖健康受损
机制:慢性低度炎症与氧化应激影响卵巢—子宫环境与精子质量。
后果:不孕不育、妊娠并发症风险增加。
②增加动脉粥样硬化与血栓风险
机制:炎症因子影响激素合成、转换与受体敏感性。
后果:代谢率波动、情绪与体重异常。
7—肿瘤发生与进展
①促癌微环境形成
机制:ROS/oxLDL/AGEs 与慢性细胞损伤引发DNA损伤、表观遗传改变;NF-κB、STAT3 常态化激活促进增殖与侵袭。
后果:肝癌、结直肠癌、胰腺癌等多种肿瘤风险上升或进展加速。
8—衰老与寿命
①炎症性衰老会导致健康寿命缩短
机制:免疫衰老、细胞衰老累积与SASP放大,干扰组织修复与再生;下丘脑炎症重设全身代谢与行为阈值。
后果:多病共存增加、恢复力下降、死亡风险上升。
慢性低度炎症可促进与年龄相关的疾病
Ren J,et al.Front Pharmacol.2023
慢性低度炎症(CLGI)的发生通常并非单一因素所致,而是多重生活方式、环境暴露与个体易感性长期叠加的结果。其核心机制是炎症“启动—放大—消退”环路的失衡。
可能导致慢性低度炎症的因素主要有以下这几类:
1
饮食模式与营养失衡诱发CLGI
不健康的饮食是慢性低度炎症(CLGI)的关键驱动因素,其本质在于“过剩与缺失并存”的营养失衡。
饮食模式和炎症
Tristan Asensi M,et al.Nutrients.2023
▸ 西式饮食(高饱和脂肪、精制碳水、低纤维)存在健康风险
过量饱和脂肪与糖负荷会导致脂毒性、线粒体活性氧(ROS)上升,形成促炎性DAMPs(如氧化磷脂 oxPLs、氧化 LDL),激活 TLR4、NLRP3 与 NF-κB,促进多器官炎症与斑块不稳定。
精制碳水与高果糖摄入促进脂肪生成、肝脂沉积与AGEs形成,AGE–RAGE 轴驱动慢性低度炎症。
低纤维使短链脂肪酸(乙酸、丙酸、丁酸)产生不足,调控 Treg、上皮紧密连接与抗炎基因表达的能力下降。
▸ 超加工食品促进慢性低度炎症
超加工食品(UPF)通过多重途径促进慢性低度炎症:其高糖、高盐、饱和脂肪与反式脂肪构成可提高餐后血糖与胰岛素、上调炎症标志物(如hs-CRP、IL‑6、TNF‑α);脂肪酸谱失衡(ω‑6/ω‑3比升高)增强促炎倾向;非营养成分与添加剂及加工副产物可能损伤肠屏障、诱发肠道菌群失衡与代谢内毒素负荷上升;同时对水果、蔬菜与膳食纤维等抗炎食物的替代导致微量营养素不足(如镁、维生素C、D、锌、烟酸),共同维持全身性的低度炎症并增加慢病风险。
超加工食品与低度炎症之间的联系
Tristan Asensi M,et al.Nutrients.2023
▸ 蛋白质与氨基酸失衡与微量营养素缺乏
过多支链氨基酸(BCAAs)与甲硫氨酸代谢失衡可激活 mTOR、JNK,促进胰岛素抵抗与炎症。
维生素 D、E、C、A,矿物质(镁、锌、硒)与多酚等抗氧化/免疫调控分子缺乏,降低抗炎能力与分辨过程。
2
肠道微生物群与肠屏障异常诱发CLGI
▸ 肠道菌群失调
有益厌氧菌的数量下降,尤其是以产丁酸为特征的菌群(如 Faecalibacterium、Roseburia)明显减少,同时条件致病菌的扩张与耐药基因负载的上升并行发生,逐步侵蚀微生态的功能稳定性。随着这些变化累积,黏膜免疫调节能力减弱,抗炎与促炎信号失衡,最终使原本维持平衡的炎症稳态被打破并更易向慢性低度炎症倾斜。
▸ 肠屏障受损与通透性增加(“肠漏”)
由于紧密连接蛋白表达与功能下降,肠上皮屏障变得脆弱,细菌来源的内毒素脂多糖更易透过上皮进入血液循环,进而诱发持续低水平的代谢性内毒素血症。这一过程可持续激活先天免疫识别与信号转导,触发并放大 TLR4–NF-κB 通路以及 NLRP3 炎性小体的活化,促进促炎介质释放与全身低度炎症的维持。
有害代谢物破坏肠道屏障导致慢性低度炎症
Ren J,et al.Front Pharmacol.2023
▸ 微生物代谢物失衡
短链脂肪酸缺乏:影响 Treg 分化、GPR43/109A 信号、HDAC 抑制与抗炎基因表达。
次级胆汁酸谱改变:FXR/TGR5 信号紊乱,影响葡萄糖–脂质代谢与炎症。
吲哚类与色氨酸代谢紊乱:AhR 信号受损,黏膜免疫调控下降。
氧化三甲胺(TMAO)升高:促进内皮炎症与动脉粥样硬化。
▸ 感染后与抗生素暴露
抗生素削弱微生物多样性与定殖抗性,打乱群落结构与生态平衡;同时促使耐药基因负载上升与机会致病菌扩张,增强定殖与侵袭能力,进而长期维持并放大小幅度的低度炎症反应。
3
生活方式与环境诱发CLGI
▸ 缺乏运动或运动过量
缺乏运动使运动诱导的抗炎肌因子产量不足,包括 IL-6 的急性抗炎效应减弱,以及 Irisin 与 FGF21 水平下降;同时,肌细胞的线粒体适应性与生物能量重塑受限,自噬过程减弱,整体抗炎与代谢调节能力随之下降。
而当运动量、强度或频率长期超出机体恢复能力阈值(如长期高强度训练、缺乏周期化与充足睡眠/营养配合),肌纤维、结缔组织与肌腱在高负荷下反复受损,促炎因子(TNF‑α、IL‑6、IL‑1β)与趋化因子长期轻度升高,急性保护性的炎症反应会转化为持续的低度炎症。
▸ 社会心理压力与抑郁
当长期压力过大或抑郁时,HPA 轴与交感–免疫耦合出现持续性异常,内分泌与免疫调控失去精细平衡;与此同时,儿茶酚胺与糖皮质激素水平失衡加剧信号紊乱,促炎通路由短暂活化转为长期慢性激活。
▸ 环境污染
空气污染物、二手烟雾以及内分泌干扰物(如邻苯二甲酸酯与 BPA)能够通过引发氧化应激、产生过量活性氧并干扰抗氧化防线,同时诱导表观遗传层面的 DNA 甲基化与组蛋白修饰改变,从而持续促进炎症反应。
▸ 衰老
免疫衰老与细胞衰老加剧,伴随 SASP(衰老相关分泌表型)持续释放多种促炎因子,放大局部与全身炎症;同时线粒体功能逐步下降,能量代谢与应激耐受减弱,“无菌性”DAMPs 积累增多,进一步驱动慢性促炎信号。
▸ 吸烟与饮酒
吸烟与饮酒都会通过多通路共同推动慢性低度炎症:烟草烟雾中的颗粒物与氧化性化学物诱发氧化应激,激活 NF-κB/NLRP3 等促炎通路,损伤内皮、加重血管炎症,并提高CRP、IL‑6、TNF‑α等基线水平。
长期饮酒则通过乙醇及乙醛导致肠屏障通透性增加与内毒素血症,激活肝脏库普弗细胞与全身免疫反应,同时引发脂肪肝、线粒体功能障碍与激素/代谢失衡;二者还会叠加扰乱睡眠与自主神经平衡,促进脂毒性与胰岛素抵抗,最终维持低度、持续的全身性炎症状态。
▸ 生命早期因素
剖腹产分娩、母乳喂养不足以及婴幼儿期的早期抗生素或不利饮食暴露,会扰乱肠道微生态的建立与演替,导致不利微生物定植与多样性下降,并由此增加黏膜免疫失衡与低度炎症的长期易感性。
▸ 社会经济与地理差异
城市化/西方化饮食、抗生素可及性与监管不足、感染负担与卫生条件差等也会增加炎症负担。
4
代谢与内分泌失衡诱发CLGI
▸ 胰岛素抵抗与高胰岛素血症
胰岛素抵抗与高胰岛素血症会导致JNK、IKKβ 与 mTORC1 被持续激活,导致组织对胰岛素的信号传导与代谢反应进一步下降,同时促炎细胞因子水平(如 IL‑6、TNF‑α)明显上升,强化全身性炎症状态。
▸ 肥胖与脂肪组织扩张
低氧、纤维化与免疫浸润(巨噬细胞、Th1)驱动持续炎症;脂肪来源乳酸与脂肪因子(如瘦素抵抗)进一步放大炎症信号。
▸ 激素与昼夜节律紊乱
皮质醇分泌节律异常、持续性睡眠不足以及昼夜节律错位协同作用,进一步放大全身炎症反应,并加剧代谢失衡与内分泌紊乱。
5
脂质代谢异常诱发CLGI
▸ 脂质堆积放大促炎反应
游离脂肪酸(FFA)溢出可激活 TLR 信号通路,诱导巨噬细胞向 M1 表型极化并放大促炎反应,同时推动脂肪组织内的慢性低度炎症持续化与扩散。
▸ 氧化应激与脂质过氧化
线粒体活性氧以及氧化LDL/磷脂(oxLDL/oxPLs)共同驱动泡沫细胞形成,进一步削弱动脉粥样斑块的稳定性,并持续触发全身炎症反应,从而加重系统性炎症负担。
慢性炎症过程中脂质生物标志物的变化
Wang Z,et al.Trends Endocrinol Metab.2025
▸ 促炎脂质介质网络
花生四烯酸代谢通路倾向产生促炎性前列腺素和白三烯,放大炎症信号与组织反应;同时分辨素与保护素生成不足,使炎症缺乏有效的消退与终止阶段,导致“炎症难以顺利结束”。
6
跨器官间通信失调诱发CLGI
▸ 下丘脑–交感–外周组织轴
神经炎症重塑脂肪、肝脏与骨骼肌的免疫代谢设定点,改变其稳态与反应阈值,并由此放大局部与全身的炎症信号,加速系统性炎症进程。
▸ 细胞外囊泡(EVs)与循环因子
携带 miRNA、蛋白与氧化脂质的 EVs 在器官间传递促炎信号;相反,健康状态下的 EVs(如脂肪来源 eNAMPT)可支持 NAD+ 与抗炎。
▸ 骨骼肌/骨/脂肪的内分泌功能异常
肌因子与骨源性激素出现失衡,削弱机体的能量消耗能力,并抑制多条抗炎信号通路,进而降低整体抗炎效应。
代谢紊乱(肥胖、胰岛素抵抗、脂毒性)、不良饮食(超加工食品、精制糖与反式脂肪、不足的膳食纤维与微量营养素)、久坐与睡眠不足、心理社会压力与昼夜节律紊乱、慢性或隐匿感染与肠道菌群失衡,以及污染物与烟酒等外源刺激,持续为免疫系统提供低水平的危险信号;在遗传与表观遗传背景、年龄增长与组织衰老(炎症性表型)共同作用下,先天与适应性免疫被低度但长期激活,促炎介质与信号通路(如 NF-κB、JAK–STAT、NLRP3)维持活跃,最终形成广泛而隐匿的全身慢性低度炎症。
慢性低度炎症是慢性疾病的核心病因,其特征是持续性亚临床炎症,并伴有自我持续性进展,由饮食、环境触发因素和代谢失调等多因素相互作用引起。
人群大规模研究证实,抗炎饮食可降低全身炎症,营养干预与慢性低度炎症的关系日益受到重视。事实上,从低度炎症到临床发病之间存在关键干预窗口,可在生物标志物支持下,靶向相关炎症通路,延缓或预防临床表现。
食物营养物质被细胞代谢、吸收后,其成分参与免疫调节,直接影响炎症。这些成分还可在细胞内环境中改变细胞间的生化反应(如氧化反应),从而调控促炎或抗炎因子的生成。
本节将阐述慢性低度炎症早期营养干预的分层机制,涵盖五个环节:消化与吸收、肠道微生物群、生化反应、信号通路及细胞成分。为验证其有效性,我们同时提供了临床证据,展示相关指标如何被有效调控。
慢性低度炎症的营养干预
Wang Z,et al.Trends Endocrinol Metab.2025
▸ 胃肠道代谢与吸收
消化与吸收是营养摄入后的首要环节,将碳水化合物、脂质和蛋白质分解为单糖、脂肪酸与氨基酸等可吸收代谢物。
▸ 任一营养素缺乏或过量都会扰乱代谢平衡
膳食脂肪酸可能通过影响体重和脂肪组织质量以及影响膜和脂筏组成和功能来影响炎症过程。而餐后血糖是糖尿病和心血管疾病的独立预测因子,这种作用可能通过氧化应激和炎症介导。
脂筏:是质膜上富含胆固醇和鞘磷脂的微结构域。
任一常量营养素过量都可能经糖异生等相互转化途径扰乱代谢平衡。矿物质及少量低分子化合物(如植物化学物)亦可被吸收,但其生物利用度常受限。
被吸收成分可通过与膜受体作用或跨膜转运等途径影响细胞代谢;不可吸收成分如不溶性纤维则由微生物转化为免疫调节代谢物(如短链脂肪酸)。不同营养素的代谢去向各异,因而通过不同机制影响炎症。
▸ 增加抗炎营养素的摄入,减少促炎基质
脂肪酶抑制剂可减少餐后脂质吸收。一项双盲试验显示,芝麻粉提取物(胰脂肪酶抑制剂)使健康人高脂餐后血清甘油三酯增量下降16.8%。对促炎成分(如饱和脂肪)应尽量抑制吸收;对抗炎营养素则促进吸收。
食物基质对营养效应至关重要,近期研究提示油相成分能调节微量营养素吸收。由此,饮食干预可双向发力:抑制促炎成分摄取并增强抗炎成分(如维生素)利用。然而,单纯通过调整食物基质来限制吸收或提高生物利用度并非通用策略,普遍可行的做法仍是减少促炎成分、增加抗炎营养素的摄入。
▸ 未消化营养物质的微生物转化
未被吸收的营养需经肠道微生物群生物转化方能发挥作用。发酵食品可提升微生物多样性并降低炎症介质,更可能通过重塑内源微生物组而非外源定植实现。
▸ 构建平衡的肠道微生物群有助于缓解慢性炎症
健康饮食干预显示,重建微生物群有望缓解慢性炎症。多糖、多酚等生物活性成分可选择性富集双歧杆菌等有益菌,经酶解生成短链脂肪酸等抗炎代谢物。益生元作为能量来源促进有益菌增殖,占据肠道生态位并抑制有害菌定植。
例如,铁皮石斛多糖富集狄氏副拟杆菌(Parabacteroides distasonis),产生烟酸激活GPCR109a,改善屏障功能与胰岛素敏感性;抗性淀粉可增加青春双歧杆菌(Bifidobacterium adolescentis)与溴瘤胃球菌(Ruminococcus bromii),抑制TLR4/NF-κB并上调紧密连接蛋白,从而减少肥胖与全身炎症。
与婴儿相比,成人微生物组表现出较低的可塑性。因此,持续的饮食策略对于在慢性炎症进展期间维持微生物群稳态至关重要。
▸ 同一食物在不同环境中可能表现出促炎和抗炎两种特性
需要注意的是,饮食的效果依赖环境。富含胆碱和肉碱的肉类与贝类会生成三甲胺,并在肝脏转化为促炎的氧化三甲胺;相反,肉类蛋白也可产生具抗炎作用的支链短链脂肪酸,体现食物成分的双重性。因此,单一食物可能同时含有促炎与抗炎成分,如何权衡其相反影响仍需进一步机理研究。
▸ 吸收营养物质的细胞生化反应
吸收的营养物质直接参与细胞生化反应。膳食碳水和脂质经糖脂代谢供能;通过限能或选择低热量来源可调控能量摄入并缓解慢性炎症。
▸ 膳食抗氧化剂减轻炎症
糖脂代谢依赖多种酶,调节其活性可抑制脂质堆积,例如脂肪酸酰胺水解酶(FAAH)。体内关键的氧化还原反应亦参与炎症:线粒体氧化磷酸化产生活性氧,诱发脂质过氧化并放大炎症信号;膳食抗氧化剂可清除反应性物质并激活内源防御以抵消该过程。
非酶促糖基化同样重要:葡萄糖与氨基结合形成AGEs,激活RAGE通路;地中海饮食可减弱此过程。前瞻性队列研究显示,高血糖指数食物与糖尿病风险增加15%显著相关,高血糖负荷与风险增加21%相关,且在高BMI人群中关联更强。
▸ 脂质是炎症介质的前体
亚油酸可转化为花生四烯酸,再生成前列腺素H2,供环氧合酶催化形成炎性前列腺素。另一方面,肠道微生物可将亚油酸异构化为共轭亚油酸,通过HNF4γ依赖机制促进CD4+CD8αα+上皮内淋巴细胞,发挥抗炎作用。
由此可见,亚油酸的免疫效应取决于生物转化背景,不应被单一地定义为促炎;其从机制到临床的研究仍需深化。总体而言,鉴于生化网络复杂,营养素在不同状态与情境下的作用亟待进一步阐明。
▸ 营养介导的信号通路调控
吸收的营养及其代谢物可与细胞受体(如 TLR)结合并触发促炎通路。TLR 作为跨膜模式识别受体,识别细菌脂多糖等 MAMPs 后,启动 NF-κB 介导的转录激活与翻译后调控,形成前馈回路,提升 NLRP3 等免疫调节因子的表达。
NLRP3 既是核转录因子又是炎性小体传感器,其激活促使炎性小体装配,并将前半胱天冬酶‑1 裂解为活性形式,继而加工 IL‑1β 前体,放大炎症反应。因此,NLRP3 炎性小体是整合先天免疫转录与翻译后控制的关键平台。
▸ 小分子营养素和肠道菌群代谢物可调节炎症信号
多种小分子营养素可调节炎症信号。白藜芦醇通过抑制 FXR–SR‑B1 轴调控脂质稳态。衰老呈慢性炎症表型,SASP 与 NF‑κB 等通路相关;多酚(如橄榄酚、白藜芦醇、芹菜素)可抑制这些通路的促炎细胞因子。
此外,肠道微生物代谢物也具免疫调节作用:异丁酸(蛋白质代谢产物)可促进 SCFAs 和 3‑羟基丁酸生成,并抑制 TLR4/MyD88/NF‑κB 通路以减轻肠炎。尽管此类调控已被大量报道,不同营养素之间的系统比较仍然缺乏,而这对膳食选择至关重要。
在信号机制不断被验证的同时,研究正将其与临床证据关联。最新结果显示,八种常见健康饮食模式及其蛋白质组学特征与较低的糖尿病、心血管、慢性呼吸与肾病以及全因死亡风险显著相关,这些特征富集于脂质代谢、动脉粥样硬化与免疫调节途径。
▸ 营养合成的细胞结构
历经体内运输后,部分营养素成为细胞不可或缺的组成。膳食氨基酸被直接吸收,蛋白质既具结构也具调节功能。例如,乳清来源的支链氨基酸(如亮氨酸)可激活 mTOR 通路,促进肌蛋白合成。
▸ 微量营养素的平衡会影响炎症程度
微量元素同样关键。硒是谷胱甘肽过氧化物酶的辅因子,可增强抗氧化能力、减少氧化应激。脂质方面,常食海鲜者的二十二碳六烯酸与二十碳五烯酸水平显著更高;相反,长期摄入富含亚油酸的油脂会增加膜磷脂中 n‑6 多不饱和脂肪酸的掺入,易触发促炎性二十烷酸级联。
补充油酸酯可降低多不饱和脂肪酸化的磷脂酰乙醇胺并扩大单不饱和脂质库;补充丝氨酸则促进半胱氨酸合成,抑制铁死亡,减轻肝脂肪变性。
膜脂脂肪酸的组成影响器官功能与器官间通讯;脂肪组织脂解释放的游离脂肪酸会加重肝脂积累并提高慢性低度炎症风险。总体而言,生命早期充足且适宜的必需营养摄入有助于塑造健康的体成分,为后续生理功能与健康打下坚实基础。
小结
持续的精准营养干预通过五个层面发挥抗炎作用:胃肠道消化吸收(优化促炎与抗炎成分的摄取)、肠道微生物重塑(益生元/发酵食品促进SCFAs等有益代谢物)、细胞内生化反应调控(限能与抗氧化抵消ROS、抑制AGEs形成)、炎症信号通路下调(干预TLR–NF‑κB–NLRP3轴,多酚与微生物代谢物参与)、以及细胞结构组成优化(膜脂与氨基酸、微量元素塑造器官功能与免疫稳态)。
临床证据支持健康饮食模式可降低多系统疾病与全因死亡风险,但不同营养素在炎症各阶段的差异化效应与直接通路仍需进一步机制与转化研究。
适宜的营养干预应因健康状态而定。多项观察研究、临床试验与动物实验表明,早期营养干预可有效促进健康:高纤维与发酵食品有助于重塑肠道微生物群,降低血清炎症蛋白与趋化因子。
▸ 健康人群的早期营养干预
▸ 植物性饮食中的生物活性成分具有较好的抗炎效果
大型队列与代谢组学研究显示,标准健康饮食模式减轻慢性炎症,且对植物性饮食的高依从与全身炎症生物标志物呈负相关;随访数据同样支持富含植物化学物的饮食可降低不同人群的炎症水平。相比以限能为核心的策略(如健康低碳或低脂),植物性饮食在多项队列分析中展现更显著的健康获益,提示优先强调生物活性成分(植物化学物、膳食纤维)可能更能优化抗炎效果。
▸ 健康饮食有助于防止慢性低度炎症
地中海饮食作为全球公认的健康模式,与抗炎密切相关,可提高胰岛素敏感性、降低HbA1c与糖尿病风险,并改善血压、血脂与循环炎症标志物。
总体而言,早期且持续的健康饮食有助于维持代谢稳态、防止慢性低度炎症发展,亦是一种具有成本效益、可实践的公共卫生策略。
不同健康状态下的饮食干预需求及常见临床指标
Wang Z,et al.Trends Endocrinol Metab.2025
▸ 慢性低度炎症的营养干预
当前正从疾病治疗转向主动健康管理,强调针对慢性低度炎症的早期营养干预。美国“食品即药物”倡议即体现了以营养对抗炎症性疾病的这一转变。糖尿病前期是血糖高于正常但未达糖尿病阈值的代谢状态,是发展为2型糖尿病的重要风险因素。
▸ 早期调节营养以减轻并改善炎症
针对糖尿病前期的研究显示,无论地中海饮食还是个性化餐后血糖靶向饮食,6个月干预均可改善血糖并伴随肠道菌群变化;其中个性化方案在血糖管理上优于地中海饮食。12周地中海饮食可使内脏脂肪约降61%;低脂饮食可降低肝脂(约17%)与内脏脂肪(约76%),并改善肝功能与胰岛素抵抗。上述结果显示,单纯饮食在疾病后期的疗效有限,更需在早期实施营养策略。
顺应个体化需求,精准营养模型通过系统评估个体健康状况并结合代谢网络等定量工具,提供个体化饮食建议,并可在病理状态下为特定营养需求人群实施精确干预。然而,健康人群与慢性炎症患者之间的干预差异仍然存在,尚需更多临床证据加以验证。
▸ 炎症性疾病的辅助治疗
药物仍是临床管理的首选手段,但将“特殊医疗用途配方食品”作为辅助治疗的应用日益增多。新证据显示,此类食品可提供靶向既有炎症通路的生物活性成分(如免疫调节肽、多酚),从而辅助慢性炎症性疾病管理。
▸ 特殊医疗用途配方食品逐渐兴起
在这些配方中,营养素是关键组成,能支持疾病状态下的代谢与炎症控制。部分代谢/炎症性疾病患者存在吸收受损,需生物利用度更高的制剂以维持能量稳态。
临床指南优先推荐中链甘油三酯(占脂肪摄入量>40%)以促进快速供能,并帮助恢复炎症性肠病的肠屏障。尽管药物仍是治疗基石,一些功能性食品成分(如DHA、EPA)同样重要,且可能提供更安全的补充方案。
一项为期12周的随机对照试验显示,EPA(3.0 g/d)或DHA(1.4 g/d)可提高抗炎性脂氧合酶/CYP450代谢物水平,并与抑郁严重度呈负相关。然而,功能性营养素作为单独干预(不合并药物)的临床应用仍不足。
▸ 病后干预效果不如未发病时的营养调整
相比病后干预,建议尽早实施营养策略以维持内环境稳态;延迟干预(尤其在炎症发作后)往往侧重清除促炎因素,恢复平衡更为缓慢。尽管缺乏系统性研究直接比较不同炎症阶段的营养疗效,但单纯饮食在炎症性疾病期的效应总体有限,作为晚期独立策略时尤甚。
受限于临床证据与结局解读,目前难下定论;现实中,饮食管理很少被作为糖尿病等炎症性疾病的主治疗。相较被动治疗,主动健康管理更具成本效益,“食物即药物”倡议通过定制化饮食干预,强化营养、管理慢病并降低医疗成本。
大量研究表明,多种食物、营养素与非营养成分可通过调节肠道菌群缓解慢性低度炎症。饮食模式、特定食物以及单一营养/非营养素对慢性低度炎症的影响已有系统综述。
健康饮食指数、替代健康饮食指数、素食与地中海饮食等健康模式与较低的循环炎症标志物(如CRP及多种细胞因子)相关。这类饮食因富含酚类化合物与膳食纤维、全谷物、蔬果、坚果及鱼类,而与更低炎症与更佳总体健康相关,并通过影响微生物群预防非传染性疾病。
多酚可促进双歧杆菌、乳杆菌、阿克曼氏菌、克里斯滕森氏菌与疣微菌等有益菌生长,并具潜在抗衰老效应;如柠檬多酚可降低与衰老相关的菌群丰度。膳食纤维可产生关键代谢物如短链脂肪酸,改善代谢调控并塑造肠道菌群。
下面跟着谷禾一起深入地了解并学习当下主流的健康饮食方式,以及这些饮食中的关键食物成分是如何协同作用、有效降低炎症走向的。
1
地中海饮食
地中海饮食(MD)被认为是一种健康的饮食方式,可以降低患心血管和代谢疾病以及癌症的风险。饮食模式包括食用全谷物、豆类、新鲜蔬菜和水果、橄榄油、坚果、种子、适量鱼类以及少量乳制品和肉类。
▸ 地中海饮食具有抗炎、降脂、抗氧化的特性
MD的有益健康特性包括降脂、抗炎、抗氧化和抗癌。最近的研究表明,MD还通过影响肠道微生物群来影响新陈代谢。MD调节肠道菌群的组成,减少内毒素血症。
在代谢综合征肥胖男性中,连续两年遵循地中海饮食使拟杆菌与普雷沃氏菌增加,并提升多种产丁酸/糖解菌(如Praecalibacterium prausnitzii)。
▸ 地中海饮食有助于提升产丁酸及糖酵解菌丰度
对超重与肥胖者的8周地中海饮食干预同样提高Faecalibacterium prausnitzii,降低Ruthenibacterium lactatiformans、Flavonifractor plautii、Parabacteroides merdae、Ruminococcus torques与R. gnavus,且粪便短链脂肪酸升高;微生物基因多样性更高者hsCRP显著下降。
与西方饮食相比,MD在8周内增加Roseburia及R.hominis,并提升嗜黏蛋白阿克曼氏菌;同时降低血浆花生四烯酰乙醇酰胺(AEA),可能通过增强肠屏障紧密性发挥抗炎作用。
地中海饮食对菌群的关键影响因素包括膳食纤维、以植物蛋白优先的蛋白结构、不饱和脂肪酸与多酚。
2
素食占比较高的饮食
多项研究显示,以植物性食物为主、而非完全排除所有动物性食品的饮食模式,整体有利于心血管代谢健康,可降低心血管疾病、2型糖尿病、部分癌症与代谢综合征的风险。同时,这类饮食会影响肠道微生物群结构与代谢功能,但具体结论仍存在差异,需结合人群与饮食。
▸ 素食占比较高者的普雷沃氏菌/拟杆菌比例更低,炎症指标亦更低
与典型西式饮食相比,高纤维、富含抗性淀粉的植物性为主饮食常见普雷沃氏菌/拟杆菌(P/B)比例更低;拟杆菌门相对增加、厚壁菌门下降,这一谱系改变与体重管理和肥胖防控更为一致。
植物性为主饮食人群中,双歧杆菌水平有时偏低,同时可观察到粪杆菌、梭菌及 Roseburia 较为丰富;这些产丁酸菌有助于增强肠屏障完整性,降低血清指标暴露,并与更低的CRP、TNF‑α 等炎症指标相关。
注:一些研究未见纯素与杂食人群在短链脂肪酸总量上的显著差异,但植物性摄入较高者的粪便 pH 与氨含量往往更低,提示代谢环境更趋向于有利于屏障和免疫稳态。
▸运动员和营养缺乏者需要补充足够的蛋白质
但动物性食物不必完全剔除,特别是运动员与高体力活动者:在高纤维饮食基础上,确保足量优质蛋白摄入(如鱼、蛋、乳或与大豆、全谷、坚果的互补蛋白组合),以支持肌肉合成与恢复。
此外营养不足或食欲下降的老年人:在保证纤维与多酚的同时适度提高蛋白密度,可选择易消化的乳清蛋白、鱼类或强化的大豆制品,并关注维生素 B12、维生素 D、钙、铁、锌的充足性。
总体而言,“植物占比高”的饮食模式能在不强制完全素食的前提下,兼顾肠道微生态、代谢健康与营养充分性;在运动员与营养脆弱的老年人等人群中,通过补足优质蛋白与关键微量营养素,可获得更均衡、更可持续的健康收益。
缓解慢性低度炎症的常见健康饮食模式的主要营养素
Wang Z,et al.Trends Endocrinol Metab.2025
3
无麸质饮食
近年来,无麸质饮食(GFD)的使用变得非常流行,但其使用的医学适应症仅是乳糜泻和非乳糜泻麸质敏感性。
▸ 无麸质饮食可改善乳糜泻患者的菌群失衡,并可能对健康人具有抗炎作用
肠道菌群失调发生在不使用 GFD 的乳糜泻患者中,其双歧杆菌和厚壁菌门的水平低于健康人。使用 GFD 的乳糜泻患者细菌的物种多样性较低,然而,该组的短链脂肪酸浓度与健康人相似。尽管使用了 GFD,但在有和没有乳糜泻相关胃肠道症状的人群中观察到肠道微生物群组成的差异。在有胃肠道症状的组中,与无症状人群相比,普雷沃氏菌的含量更高,拟杆菌门和厚壁菌门的数量也较少。
健康人使用无麸质饮食可能具有益生元特性,促进健康的细菌的生长,并有助于降低炎症。
4
高纤维饮食
植物性饮食之所以更有益健康,主要因其膳食纤维高于西式饮食。纤维主要是纤维素、果胶、糊精、蜡和木脂素,一些纤维部分被归类为益生元。纤维主要存在于全谷物、豆类、水果和蔬菜中。
▸ 高纤维饮食人群微生物多样性更高,尤其是双歧杆菌和乳杆菌
纤维在小肠中没有被完全消化。在大肠中,它被肠道细菌发酵。它刺激多种细菌的生长,是合成后生元的主要底物,如短链脂肪酸。在一项系统评价和荟萃分析中,根据涉及近1900人的 59 项研究,观察到双歧杆菌属的数量显著增加。涉及约850人的28项研究中,乳杆菌属的数量有所增加。
在一项针对老年人的研究表明,与饮食高脂肪和低纤维的人相比,在食用纤维含量较高的饮食组中,微生物群的多样性明显更高。低纤维饮食组的炎症参数,如CRP、IL-6和TNF-α显著升高。
5
益生元
益生元已被证明有助于调节肠道菌群,从而改善慢性低度炎症。通过促进有益菌增殖与代谢平衡,它们可以优化微生态环境,进而缓解机体持续的轻度炎症状态。下面我们将罗列一些较为常见且具有实用价值的益生元功效,并对其进行简要说明:
益生元对特定细菌和炎症的影响
doi: 10.3390/nu13113839.
▸ 低聚果糖
低聚果糖(FOS)的天然来源包括朝鲜蓟、洋葱、芦笋、小麦、香蕉、土豆和蜂蜜。补充低聚果糖可显著促进双歧杆菌和乳杆菌生长;在克罗恩病患者中,补充后粪便双歧杆菌水平明显上升。
小鼠研究显示,低聚果糖可降低 IL‑6、TNF‑α 等炎症指标,并显著提升血清与粪便中短链脂肪酸浓度。
▸ 低聚半乳糖
低聚半乳糖(GOS)天然存在于扁豆、鹰嘴豆等豆类中,可由大豆和乳糖合成。其对肠道菌群的积极作用在新生儿和婴儿尤为显著,常与低聚果糖共同添加于配方奶中,以增加乳酸杆菌和双歧杆菌数量。
GOS还能抑制致病性梭菌,提高IL‑10与IL‑8并降低IL‑1β。老年人连续10周每日补充5.5 gGOS,可导致他们的肠道微生物群组成发生变化:乳杆菌-肠球菌属、双歧杆菌属的数量有所增加;大肠杆菌、拟杆菌属、脱硫弧菌属和溶组织梭菌组的数量减少。同时NK细胞活性与IL‑10上升,IL‑1β、IL‑6、TNF‑α下降,显示其抗炎效应。含FOS与GOS的联合益生元效果最佳。
▸ 菊粉
菊粉是一种果聚糖,存在于朝鲜蓟、大蒜、洋葱、青葱、韭菜、丹参、鸦葱、芦笋、菊苣和香蕉中。由于其对胃部健康有积极作用,它是功能性食品的一种成分。
一项为期2周、平均摄入15 g/天菊粉的研究显示,双歧杆菌增加约三倍,草酸杆菌科呈下降趋势;干预结束3周后粪菌量恢复基线。其他研究每日给予5 g菊粉观察到双歧杆菌显著上升,且乳杆菌/肠球菌比值增加。
健康便秘成年人每日摄入12 g菊苣菊粉4周,Anaerostipes 与双歧杆菌增加,Bilophila 减少,并伴随便秘发生率下降。动物研究表明,菊粉可下调促炎相关基因(IL‑1β、IL‑6、TLR4、树突状细胞标志物 CD11c、IKKε)表达。在2型糖尿病小鼠中,连续6周补充菊粉降低 LPS、IL‑6、TNF‑α,并提高抗炎性 IL‑10;同时蓝藻门与拟杆菌门相对丰度上升、反胃梭菌下降,且蓝藻门与拟杆菌门与 IL‑10 正相关。
▸ 多不饱和脂肪酸
共轭亚油酸(CLA)和多不饱和脂肪酸(PUFA)也被归类为益生元。CLA 存在于牛奶、乳制品和肉类中,PUFA则丰富于油料植物、食用油和鱼类。
小鼠研究显示,摄入CLA可改变肠道菌群,促进拟杆菌/普雷沃氏菌及黏蛋白降解菌的生长,并激活黏蛋白酶。补充EPA、DHA或食用植物油、鱼类,可增加双歧杆菌、颤螺菌属与阿克曼氏菌的丰度,同时降低肠杆菌及部分致病菌(如大肠杆菌、链球菌、梭状芽孢杆菌)。
在肠造口术早产儿中,肠内补充鱼油与红花油提高了细菌多样性并降低肠杆菌科、链球菌、梭菌及多种病原体水平。n‑3 PUFA还能改善肠道屏障通透性;孕妇摄入更多EPA/DHA与较低的血清连蛋白相关。
此外,n‑3 PUFA抑制脂多糖与NF‑κB通路介导的促炎因子,促进IL‑10释放,并通过诱导Tregs、减少IL‑17而缓解肠道炎症。相反,n‑3/n‑6摄入失衡可致菌群紊乱,显著升高F/B比值,增加超重与肥胖风险;过量ω‑6还可能提升产LPS和促炎菌比例。
▸ 多酚
多酚是一种重要的益生元,包括酚酸、类黄酮、二苯乙烯和木脂素。这些化合物存在于蔬菜、水果、茶、咖啡和葡萄酒中,具有抗氧化、抗炎和抗癌特性。
研究表明,多酚对肠道微生物群的组成有积极影响。它们促进乳酸杆菌与双歧杆菌生长,并抑制潜在致病菌如葡萄球菌。在代谢综合征肥胖者中,连续30天摄入红酒多酚使大肠杆菌与肠杆菌下降,粪便中双歧杆菌、乳杆菌、普氏粪杆菌与罗氏菌属上升;其中双歧杆菌增加与血中脂多糖降低相关。
注:小鼠连续4周饮用富含多酚的乌龙茶亦提高菌群多样性,显著提升拟杆菌门并降低厚壁菌门。
▸ 抗性淀粉
抗性淀粉(RS)由α‑连接的葡萄糖组成,因抗消化淀粉酶而在小肠不被水解。其主要类型包括全谷物与豆类中的RS、直链淀粉含量高的淀粉,以及逆行淀粉(如煮熟冷却的马铃薯)。
在一项为期14周、46名健康受试者参与的研究中,高NSP且富含RS的饮食使Ruminococcus bromii显著增加。一项安慰剂对照试验显示,连续12周补充马铃薯RS可在70岁以上与30–50岁人群中均显著提升双歧杆菌;老年组粪便丁酸盐亦升高。慢性肾病患者摄入RS同样改善菌群,拟杆菌、双歧杆菌、乳酸杆菌与Ruminococcus bromii增加。
小鼠高脂饮食合并RS补充则减少多种菌(如幽门螺杆菌、乳杆菌等),并降低血清与粪便中反映屏障通透性的LPS指标;炎症亦减轻(结肠IL‑2、肝脏IL‑4与TNF‑α下降),同时结肠短链脂肪酸浓度上升。
早期饮食干预与肠道微生物群调节可协同降低慢性低度炎症水平。首先,调整膳食脂肪酸谱具有直接的免疫代谢效应:提高n-3多不饱和脂肪酸(EPA、DHA)摄入、相对降低n-6摄入可通过竞争花生四烯酸代谢途径,减少促炎性二十碳烷类产物,增加分辨素与保护素等促炎症消退介质,并抑制 LPS‑TLR4 触发的NF‑κB活化,从而降低 CRP、IL-6 等炎症标志物。
其次,增加可发酵膳食纤维与抗性淀粉(RS)(如全谷物、豆类)可被结肠菌群发酵产生短链脂肪酸(丁酸、丙酸、乙酸)。其中丁酸既是肠上皮主要能量底物又是 HDAC 抑制剂,可上调紧密连接蛋白、降低屏障通透性,抑制 NF‑κB 并提升 IL‑10,同时经 GPR41/GPR43 与 Tregs 诱导,降低全身炎症。
此外,生物活性成分如多酚(类黄酮、二苯乙烯、酚酸)通过抑制微生物 β‑葡萄糖醛酸苷酶与调节芳香化合物代谢,促进双歧杆菌、乳杆菌等有益菌生长并抑制条件致病菌。综合使用益生元(低聚果糖、低聚半乳糖、菊粉等)、富含多酚食物(茶、浆果、可可、葡萄制品)与优质 n‑3 来源(深海鱼、藻油),与 F/B 比优化、阿克曼氏菌与产丁酸菌增加、脂多糖与促炎细胞因子下降相关,提示“饮食—微生物—屏障—炎症”轴协同修复。
实践层面,建议如下:
1.将n-6:n-3 比值控制在约 3–5:1,每周摄入≥2 次富含 EPA/DHA 的鱼类或每日补充250–500mg DHA+EPA;
2.将膳食纤维提高到 ≥25–35 g/日,其中至少 10–15 g 为可发酵纤维与抗性淀粉;以全谷、豆类、坚果、蔬果作为主力碳水与多酚来源,减少超加工食品、反式脂肪与精制糖;
3.关注餐后代谢峰值与昼夜节律(如限时进食 8–10 小时窗),以降低餐后内毒素移位与氧化应激波动。配合体重管理、规律运动与充足睡眠,可进一步降低炎症基线。
未来,需要更高质量、长期、多组学整合的随机对照试验来建立不同饮食模式、特定益生元/多酚—反应关系与个体化响应特征,发展以肠道微生物学与代谢组标志物(如短链脂肪酸、次级胆汁酸谱、脂多糖活性)为终点的分层干预模型。
随着“食物即药物”理念与微生物组精准营养的发展,基于个体微生物生态与代谢指纹的处方式饮食干预有望成为降低慢性低度炎症与慢病风险的核心工具,使炎症从“隐形威胁”转变为可监测、可干预、可逆转的生理变量。
主要参考文献
Wang Z, Yuan C, Huang T, Lu B. Early nutritional interventions for chronic low-grade inflammation. Trends Endocrinol Metab. 2025 Jun 27:S1043-2760(25)00124-9.
Ren J, Li H, Zeng G, Pang B, Wang Q, Wei J. Gut microbiome-mediated mechanisms in aging-related diseases: are probiotics ready for prime time? Front Pharmacol. 2023 Jun 1;14:1178596.
Minihane AM, Vinoy S, Russell WR, Baka A, Roche HM, Tuohy KM, Teeling JL, Blaak EE, Fenech M, Vauzour D, McArdle HJ, Kremer BH, Sterkman L, Vafeiadou K, Benedetti MM, Williams CM, Calder PC. Low-grade inflammation, diet composition and health: current research evidence and its translation. Br J Nutr. 2015 Oct 14;114(7):999-1012.
Potrykus M, Czaja-Stolc S, Stankiewicz M, Kaska Ł, Małgorzewicz S. Intestinal Microbiota as a Contributor to Chronic Inflammation and Its Potential Modifications. Nutrients. 2021 Oct 28;13(11):3839.
Minihane AM, Vinoy S, Russell WR, Baka A, Roche HM, Tuohy KM, Teeling JL, Blaak EE, Fenech M, Vauzour D, McArdle HJ, Kremer BH, Sterkman L, Vafeiadou K, Benedetti MM, Williams CM, Calder PC. Low-grade inflammation, diet composition and health: current research evidence and its translation. Br J Nutr. 2015 Oct 14;114(7):999-1012.
Ruiz-Núñez B, Pruimboom L, Dijck-Brouwer DA, Muskiet FA. Lifestyle and nutritional imbalances associated with Western diseases: causes and consequences of chronic systemic low-grade inflammation in an evolutionary context. J Nutr Biochem. 2013 Jul;24(7):1183-201.
Guo A, Ludvigsson J, Brantsæter AL, Klingberg S, Östensson M, Størdal K, Mårild K. Early-life diet and risk of inflammatory bowel disease: a pooled study in two Scandinavian birth cohorts. Gut. 2024 Mar 7;73(4):590-600.
Ajoolabady A, Pratico D, Vinciguerra M, Lip GYH, Franceschi C, Ren J. Inflammaging: mechanisms and role in the cardiac and vasculature. Trends Endocrinol Metab. 2023 Jun;34(6):373-387.

谷禾健康
自闭症谱系障碍(ASD)是一种神经发育障碍,越来越多的研究表明它与“微生物群-肠道-大脑轴”的功能失调有关,但其中起因果作用的微生物介质和分子机制仍不清楚。
2021年,谷禾团队参与构建并分析包含上千名中国儿童的大规模ASD队列,证实ASD儿童的肠道菌群发育早期即发生偏离,该研究成果发表于《Gut》期刊上。
近日,刘星吟教授研究团队基于之前发表的ASD队列研究,发现患有ASD的儿童体内乳酸杆菌属(Lactobacillus)的减少与更严重的肠胃道症状和社交缺陷相关。孕期母体免疫激活(MIA)已被确定为ASD的一个关键环境风险因素。在MIA诱导的ASD小鼠模型中,补充植物乳杆菌(Lactobacillus plantarum)或其衍生物苯甲酸钠(NaB),能够减轻自闭症小鼠的肠道菌群失调,改善其社交行为缺陷、谷氨酸-谷氨酰胺水平以及神经元活动异常。
单细胞RNA测序显示,苯甲酸钠(NaB)恢复了自闭症小鼠星形胶质细胞中Cxcl16等基因的表达,这与神经元和星形胶质细胞之间的谷氨酸代谢活动有关。该研究成果近日发表《Molecular Psychiatry》。
该研究构建了一个完整和严谨的证据链,从大规模人群的菌群分层观察,到代谢物鉴定,再到动物模型的因果验证和分子机制探索。它成功地回答了“是什么”(菌群差异)、“产生了什么”(苯甲酸钠)、以及“如何起作用”(调节星形胶质细胞等方面)的完整科学问题,是肠-脑轴领域从关联性研究向因果机制研究转变的典范。
本文将带大家深入了解这项研究及其对自闭症儿童未来基于菌群治疗干预的潜在价值。
为了实现上述目标,研究团队设计了严谨的多层次研究方案,并在方法学上展现出显著的创新性。
队列设计与分层策略
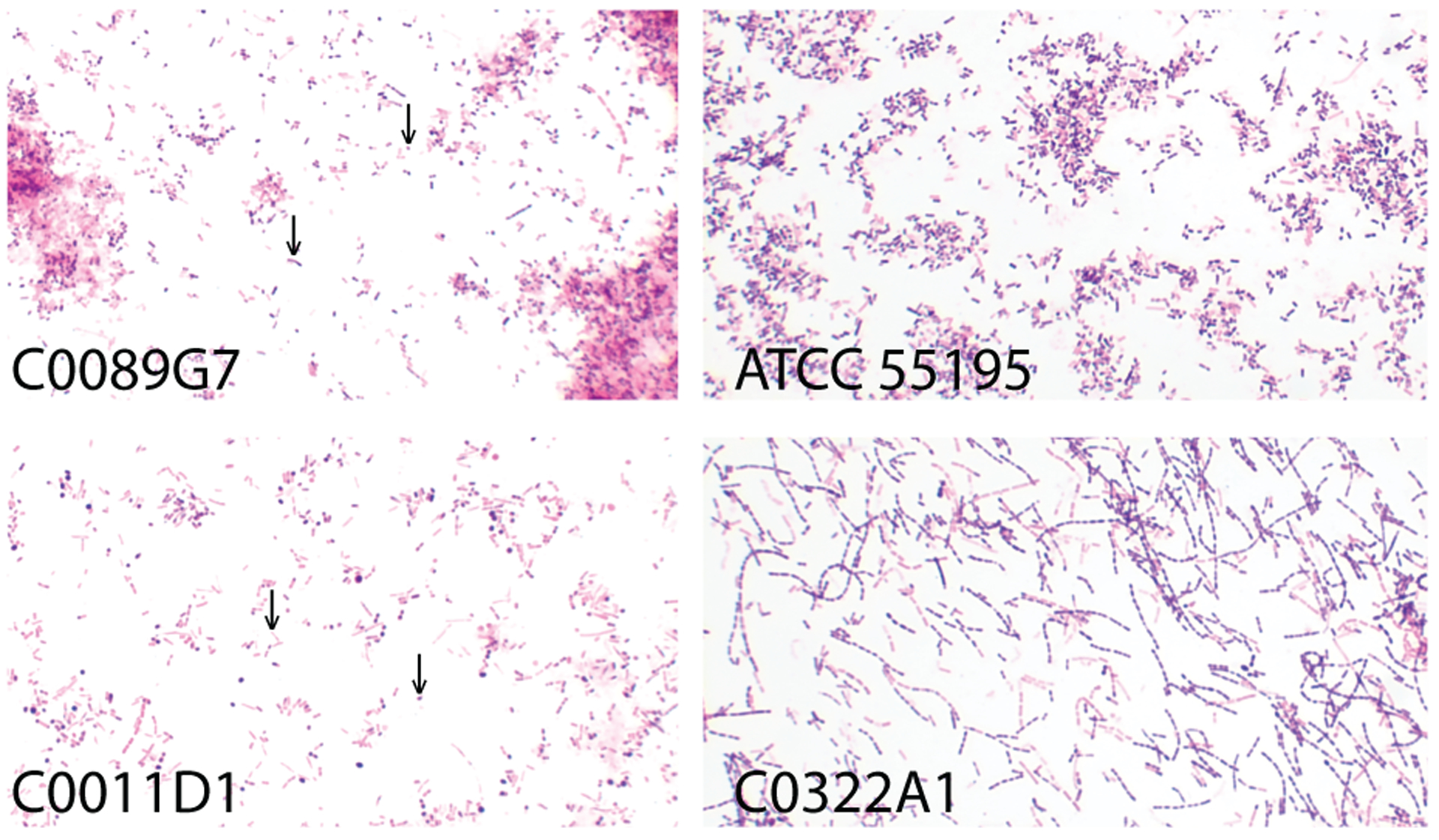
该研究利用了前期已建立的大规模队列,包括773名ASD儿童和448名年龄、性别匹配的正常发育(NT)儿童。
研究者基于16S rRNA测序数据,检测了每位受试者肠道中乳杆菌的相对丰度。他们定义了一个阈值(例如,相对丰度 > 0),将773名ASD儿童分为两个亚组:
这一分层策略在于,它将宏观的“ASD菌群失调”问题,转化为一个更具体、更可控的比较生物学问题,即比较NT、ASD-L和ASD-WL三组之间的差异,更精准评估乳杆菌在ASD肠道微生态中的独特作用。
多组学分析与网络构建
研究团队采用了多种先进的分析方法来揭示菌群结构和功能的改变:
PM2RA微生物网络分析
采用自主研发的PM2RA分析框架,构建并比较了三组(NT, ASD-L, ASD-WL)的微生物互作网络,揭示了乳杆菌作为对网络稳定性的影响。
宏基因组功能分析
在明确了网络结构差异后,研究进入功能层面。利用PICRUSt2等工具,分析了与肠道菌群相关的肠-脑功能模块(GBMs)和肠道代谢模块(GMMs)的活性变化,锁定了与神经递质和能量代谢相关的差异通路。
注:GBMs特指那些与神经递质合成、代谢(如多巴胺、GABA、色氨酸代谢)相关的通路,是连接肠道与大脑功能的桥梁。
靶向代谢组学验证
在功能预测的基础上,采用靶向气质联用(GC-MS)技术,直接定量检测了粪便和脑组织样本中关键代谢物(如苯甲酸钠)的浓度,实现了从“功能预测”到“实测验证”。
动物模型的功能验证
为了探究因果关系和分子机制,研究团队使用了母体免疫激活(MIA)小鼠模型。
注:该模型通过在母鼠孕期注射Poly(I:C)来模拟病毒感染,其后代会表现出类似ASD的核心行为缺陷。
益生菌与代谢物干预
对MIA模型小鼠分别灌胃植物乳杆菌(L. plantarum)或其代谢产物苯甲酸钠,并评估其对肠道菌群、肠道通透性及ASD样行为(社交缺陷、重复刻板行为)的改善效果。
单细胞转录组测序 (scRNA-seq)
对不同处理组小鼠的海马组织进行10x Genomics单细胞测序,以细胞类型特异性的方式解析苯甲酸钠对大脑基因表达谱的影响,从而锁定关键的细胞亚群(星形胶质细胞)和靶基因(Cxcl16)。
机制探索与功能验证
在证明苯甲酸钠能够改善行为后,研究者进一步探索其作用机制。他们检测了苯甲酸钠是否能穿过血脑屏障,并分析了其对大脑特定脑区(如下丘脑、前额叶皮层)中与社交行为密切相关的基因表达的影响。
这一系列从人体观察到动物模型验证,再到细胞、分子及表观遗传机制的深入探索,为揭示苯甲酸钠在肠-脑轴中的关键作用提供了强有力的证据。
该研究的核心发现层层递进,描绘了从菌群定植到行为改善的完整路径。
与没有乳杆菌定植的ASD儿童(ASD-WL)相比,ASD-L组携带有益共生菌(如双歧杆菌)的可能性更高,携带机会性致病菌(如Odoribacter)的可能性更低。
1
人群发现:乳杆菌缺失加剧ASD儿童肠道生态失调与功能异常
研究的第一个重要发现是,在ASD儿童群体中,乳杆菌的定植与否,是决定其肠道微生态网络结构和功能的关键变量。通过PM2RA网络分析,研究者发现:
菌群结构失调
与健康对照组(NT)相比,ASD-WL组(无乳杆菌)的微生物网络表现出最严重的失调,其网络复杂性和稳定性均显著降低,节点间的连接变得稀疏和脆弱。这表明缺乏乳杆菌的肠道生态系统更为混乱和不稳定。
改变的微生物群落网络:
ASD-WL与NT 和 ASD-L与NT
红色节点代表ASD组中上调的微生物群,绿色节点代表自闭症谱系障碍组中下调的微生物群。
ASD-L、ASD-WL和NT的微生物网络改变程度
ASD-L组(有乳杆菌)的网络结构则呈现出一种介于NT组和ASD-WL组之间的“中间态”或“恢复态”,乳杆菌的定植可能部分“纠正”或“缓冲”了ASD状态下的严重生态失调,使其网络结构向健康状态靠近。
代谢功能异常
功能层面的分析(GBM和GMM)进一步揭示了这种结构差异背后的功能后果。
在ASD-WL组中,多个与神经系统功能密切相关的肠-脑模块(GBM)出现显著异常。
更重要的是,这种代谢功能的失衡与ASD核心症状的严重程度(如ADOS评分)以及胃肠道不适(如便秘)显著相关。
而在ASD-L组中,这些与神经递质和胃肠道功能相关的代谢通路则与NT组无显著差异。
这些结果首次在大型队列中证实,乳杆菌的缺失与ASD儿童更严重的神经-胃肠道共病表型紧密相连,其机制可能在于调节了整个菌群的代谢产出。
乳杆菌定植和GMM及其与肠道不适的关系
这些发现的意义在于,它超越了简单地将乳杆菌视为一个有益菌的层面,而是揭示了乳杆菌作为网络核心,能够重塑整个生态系统的结构。这为理解益生菌如何发挥作用提供了全新的网络视角。
2
动物模型验证:植物乳杆菌及其关键代谢产物苯甲酸钠可逆转ASD样行为
为了验证人群中的关联发现并探究因果关系,研究者在MIA诱导的ASD小鼠模型中进行了干预实验。
首先,他们给MIA小鼠灌胃了在人群研究中富集的植物乳杆菌(L. plantarum)。结果显示:
菌群与代谢重塑
植物乳杆菌干预改变了小鼠的肠道菌群组成,能显著逆转MIA模型引起的肠道菌群结构失调。
功能通路富集分析显示,植物乳杆菌恢复了MIA小鼠中异常的氨基酸代谢通路。
行为改善
这种肠道层面的改善直接转化为了行为上的获益。植物乳杆菌干预显著改善了MIA小鼠的重复刻板行为(图G)和社交缺陷(图H,I)。
那么,植物乳杆菌是通过什么物质来发挥作用的呢?
研究团队通过代谢组学分析其培养上清液,发现其中富含一种神经活性代谢物——苯甲酸。随后,他们直接给MIA小鼠灌胃其更稳定、易于使用的盐式——苯甲酸钠(NaB),发现苯甲酸钠同样能够显著改善MIA小鼠的社交新颖性偏好和重复刻板行为(下图I, J)。
研究发现,粪便中苯甲酸钠的水平与ASD的核心症状严重程度(通过ADOS和ABC量表评估)呈现显著的负相关。也就是说,苯甲酸钠水平越高的ASD儿童,其社交障碍和重复刻板行为的症状越轻。
这一结果有力地证明:
苯甲酸钠是介导植物乳杆菌改善ASD样行为的关键效应分子之一。
3
机制解析(一):苯甲酸钠修复肠道屏障、穿透血脑屏障并纠正脑内神经病理
为了厘清苯甲酸钠的作用路径,研究者首先考察了它对肠-脑连接的影响。研究发现,苯甲酸钠通过两个关键步骤连接肠道和大脑:
MIA小鼠表现出肠道通透性显著增高,即“肠漏”现象,这可能导致肠道内有害物质进入血液。
而苯甲酸钠(NaB)干预能够有效降低MIA小鼠异常增高的肠道通透性,修复受损的肠道屏障功能,从源头上减少了潜在的负面影响。
作为一种小分子代谢物,苯甲酸钠(NaB)能够成功穿过血脑屏障,并在脑组织中有效富集。
这一发现至关重要,它打通了从肠道到大脑的直接物理通路,证实了肠道微生物代谢产物可以直接进入中枢神经系统发挥作用。
▶▷
进入大脑后,苯甲酸钠对MIA小鼠的神经病理状态产生了广泛的纠正作用。MIA小鼠表现出典型的神经病理特征,包括:
而补充植物乳杆菌或其代谢产物苯甲酸钠,均能显著缓解这些神经病理学上的异常现象,使大脑从一种“应激”和“失衡”的状态中恢复过来。
3
机制解析(二):苯甲酸钠通过调控星形胶质细胞Cxcl16,恢复谷氨酸稳态
为了找到苯甲酸钠在大脑中发挥作用的具体靶点,研究者利用单细胞RNA测序技术,高精度地解析了苯甲酸钠对海马区不同细胞类型的影响。结果清晰地指向了一类关键的非神经元细胞——星形胶质细胞。在MIA小鼠中,这类细胞的基因表达谱发生紊乱,而苯甲酸钠处理能够特异性地“纠正”这种紊乱。在众多被纠正的基因中,Cxcl16基因的变化最为显著。
与人群研究中观察到的谷氨酸代谢通路异常相呼应,MIA小鼠脑组织中的兴奋性神经递质谷氨酸(Glu)和谷氨酰胺(Gln)水平异常升高,提示大脑处于过度兴奋状态。而植物乳杆菌和苯甲酸钠干预均能显著降低其水平,使其恢复至正常。
星形胶质细胞正是调控脑内谷氨酸循环的关键。
一系列精巧的实验证实了Cxcl16的核心地位:在MIA小鼠海马的星形胶质细胞中特异性地过表达Cxcl16,可以直接恢复其社交缺陷和异常的神经元活动模式。
星形胶质细胞中的Cxcl16是介导肠道代谢物苯甲酸钠改善社交行为的关键分子。
3
机制解析(三):苯甲酸钠通过H3K27表观遗传修饰诱导Cxcl16表达
最后,来自肠道的代谢物苯甲酸钠,是如何在大脑中调控Cxcl16基因表达的?研究揭示了一个全新的表观遗传学通路。
研究发现,苯甲酸钠(NaB)可以作为底物,参与一种新型的组蛋白翻译后修饰——组蛋白H3第27位赖氨酸的苯甲酰化(H3K27bz)。
苯甲酸钠处理显著提升了星形胶质细胞内H3K27bz的水平,并且这种修饰特异性地富集在Cxcl16基因的调控区域,从而打开了该基因的转录。
这一发现首次将肠道微生物代谢物与宿主大脑中的新型表观遗传修饰直接联系起来,为理解肠-脑轴的调控深度提供了开创性见解。
科 学 意 义
提出ASD分层干预的新范式
该研究强调了ASD的异质性,并提出基于微生物特征(如乳杆菌定植)进行分层的精准医疗概念。这提示我们,未来的干预措施可能不适用于所有ASD患者,而是需要为具有特定肠道微生物特征个性化定制。“ASD-L”和“ASD-WL”的分组,可能代表了两种不同的病理生理亚型,需要不同的干预策略。
发现内源性神经调节剂
苯甲酸钠作为一种由特定菌群结构产生的、能够调节大脑关键社交通路的内源性分子,为我们理解共生微生物如何塑造宿主行为提供了全新的视角。未来可以挖掘更多能够调节宿主神经系统的神经活性代谢物(Neuroactive Metabolites)。
局 限 性
研究虽有重大突破,但仍有一些问题有待未来研究深入探讨:MIA小鼠未能完全模拟ASD;需在其他遗传模型验证NaB效果,评估其高浓度安全性;NaB仅部分改改善ASD行为,该益生菌产生的其他代谢物(如吲哚-3-乳酸)可能也发挥了协同作用;其作用机制和Cxcl16染色质可及性等都需进一步研究。
实 际 应 用
开发新型益生菌或合生元
针对缺乏乳酸杆菌的ASD-WL亚群,开发能够高效定植并产生苯甲酸钠的下一代益生菌或合生元产品,将成为极具前景的治疗策略。
苯甲酸钠作为潜在治疗药物
苯甲酸钠本身是一种FDA批准的食品防腐剂和临床药物,其安全性已得到广泛验证。这意味着将其重新定位为治疗ASD社交缺陷的药物,其临床转化路径可能相对较短。
诊断与分层标志物
肠道菌群健康检测,可以测粪便中的乳杆菌定植情况,有望成为筛选适合接受特定微生物疗法或苯甲酸钠疗法的ASD儿童的生物标志物,从而实现精准干预。
参考文献:
Li T, Chen J, Mi K, Lei J, Ning Z, Lu L, Su Z, Zhu Q, Lin M, Wang Y, Wang J, Xu R, Khaib L, Knight R, Hu Z, Liu X. Probiotics derived sodium benzoate improves social behavior of offspring exposed in the maternal immune activation through regulation of histone lysine benzoylation in astrocytes. Mol Psychiatry. 2025 Aug 25.
Lou M, Cao A, Jin C, Mi K, Xiong X, Zeng Z, Pan X, Qie J, Qiu S, Niu Y, Liang H, Liu Y, Chen L, Liu Z, Zhao Q, Qiu X, Jin Y, Sheng X, Hu Z, Jin G, Liu J, Liu X, Wang Y. Deviated and early unsustainable stunted development of gut microbiota in children with autism spectrum disorder. Gut. 2022 Aug;71(8):1588-1599.
谷禾健康
阴道微生物组在女性阴道健康方面起着重要作用。使用高通量宏基因组和16S rRNA 测序,已在人类阴道中鉴定出250多种细菌。其中,乳杆菌是健康阴道中最常检测到的微生物,其中包括卷曲乳杆菌(Lactobacillus crispatus)、惰性乳杆菌(Lactobacillus iners)、詹氏乳杆菌(Lactobacillus jensenii)和格氏乳杆菌(Lactobacillus gasseri)。
乳杆菌被认为通过产生有机酸、过氧化氢 (H2O2)、细菌素和其他抗菌化合物来防止病原体入侵,从而对阴道生态有益。月经、怀孕、性行为、阴道冲洗和不受控制地使用抗生素等因素会迅速改变微生物群落。阴道生态系统的破坏的特征是乳杆菌物种的枯竭和非乳杆菌微生物的过度生长。
如果把阴道微生态比作一座城市,惰性乳杆菌(Lactobacillus iners)就像那位“随时上线的值班员”:它无处不在、反应灵敏,却不总是最强的守护者。与经典的“稳定派”L.crispatus不同,L.iners 更像过渡期的掌舵者——在月经、性行为、抗生素、妊娠激素等因素影响时占据主导地位,帮助群落从一种状态向另一种状态转变。
但这份灵活也带来代价:它产酸与抑菌能力较弱,黏附与免疫调控独具一格,因而既能伴随健康,也常与生态失调、细菌性阴道病、性传播感染、妊娠不良风险相伴。认识并理解这位“双刃剑”角色,或许是我们走向更精准的女性生殖健康管理、重塑“好菌优势”的关键一步。
惰性乳杆菌(Lactobacillus iners)是阴道微生物群中最普遍的成员,然而,其在复杂的阴道微环境中的作用尚不完全清楚。鉴于其在乳杆菌中具有独特属性,且对多种不良生殖结局的影响差异明显,了解其基本特征有助于更全面地认识其在女性健康中的作用。
惰性乳杆菌(L.iners)于1999年才首次在阴道和泌尿道标本中被发现;因无法在常规MRS琼脂的标准条件下像其他乳杆菌那样生长而长期被忽视。
1
形态特征
• 革兰氏染色具有可变性
惰性乳杆菌(L.iners)起初被归为革兰氏阳性、杆状、非孢子形成的兼性厌氧菌,但多项研究表明其并非总呈典型的革兰氏阳性染色,形态亦常似球杆菌。一些报道其多呈革兰氏阴性、短小杆状,耐酸性弱(在pH3培养基中不可存活),这或致其早期在培养与显微观察中被忽视。
L. iners 出现“时而革兰氏阳性、时而革兰氏阴性(或变异性)”主要有以下原因:
–细胞壁肽聚糖层很薄:电镜研究显示其PG层显著薄于典型乳杆菌,导致在革兰染色中难以稳定保留结晶紫,呈现革兰阴性或“变异性”外观(可见杆菌或球菌样形态)。
-形态可塑性与菌株差异:同一菌株内及不同分离株之间均可见细胞形态与染色表现的变动,提示菌株层面的结构与功能差异会影响染色结果。
-环境与基因表达的影响:在不同阴道微环境(如细菌性阴道病样环境 vs. 乳杆菌占优势环境)中,L.iners 的基因表达(如调控细胞形态的rodZ等)会改变细胞形态与壁性质,从而影响革兰染色表现。
-方法学与判读偏差:Nugent评分依赖革兰染色形态计分,而L. iners 的“革兰阴性样”表型易被误判为加德纳菌等阴性形态,导致分类偏差,放大了其“阴性”出现的频率。
L. iners 培养分离株的革兰氏染色
Holm JB,et al.Curr Infect Dis Rep.2023
• 厌氧条件下生长能力显著强于其他乳杆菌
该菌在血琼脂上厌氧孵育 24 小时可形成小而光滑、圆形、半透明、无色素的菌落;在添加1–5%绵羊或人血的MRS琼脂上多数分离株亦可生长。
研究证实,L. iners 在厌氧条件下可在MRS琼脂上持续生长至少7天,显著长于其他乳杆菌。
2
基因组和功能
• 较小的基因组对环境波动适应能力较差
惰性乳杆菌(L.iners)的基因组很小,平均为1.28 Mbp,而L.crispatus为2.25 Mbp,这已经处于乳杆菌属的较低基因组大小范围内。相应地,L.crispatus泛基因组计数4300个基因,而L.iners的基因组为2300个基因,平均GC含量为 ~33.3%。
如此低的基因组大小强烈表明一种寄生性、宿主依赖性的生活方式。此外,人们认为较小的基因组预示着对环境波动的脆弱性更高。
• 碳水化合物和氨基酸代谢基因减少
基因组分析表明,L. iners碳水化合物和氨基酸代谢相关的基因数量严重减少,而它维持了主要核心代谢蛋白的保守基因和来自宿主或群落的必需化合物的膜转运基因。确定了三个潜在的核心基因(inerolysin、ZnuA 和 hsdR)与L.iners对阴道环境的特异性适应密切相关。
inerolysin是一种异常的成孔型胆固醇依赖溶素,在酸性环境中活性高,能在膜上形成孔洞,或为稳定获取宿主营养所必需;高亲和力锌摄取蛋白 ZnuA 维持金属离子稳态,可能介导对阴道上皮的强黏附;I 型限制性内切酶亚基 hsdR 被认为在细菌性阴道病期间参与抗噬菌体防御。
• 独特的肽聚糖层可能有助于吸收营养
此外,L. iners 携带完整的肽聚糖(PG)合成与水解酶基因。与其他乳杆菌物种相比,惰性乳杆菌细胞膜独特而薄的肽聚糖(PG)层可能更容易吸收营养或分泌蛋白质,从而提供必需的营养物质或应对阴道环境的快速变化。
3
产酸和过氧化氢能力较弱
• 相较其他乳杆菌抵抗病原体能力较弱
乳杆菌是阴道主要产酸者,能降低pH并抑制潜在致病菌。但不同物种的产酸能力存在差异:L.crispatus、L.gasseri、L.jensenii可由糖原发酵生成D-乳酸与L-乳酸;而L.iners缺乏D-乳酸脱氢酶,仅产L-乳酸,因此其L/D比值最高。
乳酸异构体对宿主免疫的影响不同;较高的L/D比值可上调 EMMPRIN 并激活 MMP-8,促进细胞外基质分解,利于细菌穿越宫颈并诱发上行感染。此外,D-乳酸对外源细菌的抑制强于L-乳酸,说明L.iners在防御病原入侵方面较弱。
• L.iners为主时阴道pH值偏高
研究发现,L.crispatus优势时阴道pH持续偏低;而 L.iners过度生长并不能维持低 pH,且在低 pH 环境中表现较弱。细菌性阴道病常伴随 pH 升高,此时多见加德纳菌与L.iners共存而少见其他乳杆菌。
L.iners 亦缺乏通过丙酮酸氧化产生 H2O2 的机制,而 H2O2 被认为有助于抑制厌氧菌定植。因此,当病原菌挑战阴道环境时,L.iners无法抵抗病原菌的过度生长和pH值的升高,而它可能会持续存在生态失调。
4
营养需求
L. iners基因组异常小、代谢受限,却有更复杂的营养需求,使其能适应多样阴道生态位。激素和其他因素的波动可能会影响阴道环境,导致粘液和糖原产生、pH 值和微生物种类发生变化,这可能为L.iners提供必需的营养。
• 主要对葡萄糖、麦芽糖进行糖酵解
基因组分析表明,除能从葡萄糖、麦芽糖、海藻糖和甘露糖产生酸外,这些菌株不能从L-阿拉伯糖、D-阿拉伯糖醇、环糊精、糖原、N-乙酰葡糖胺、乳糖、甘露醇、松三糖、蜜二糖、甲基β-D-吡喃葡萄糖苷、普鲁兰、棉子糖、核糖、鼠李糖、山梨糖醇、蔗糖、塔格糖、海藻糖或D-木糖产生酸。
• 编码inerolysin使其在失调环境下更具竞争优势
惰性乳杆菌(L.iners)对外源氨基酸的依赖性更高。并且L.iners已被证明是迄今为止已知的唯一编码一种形成孔的溶细胞毒素 inerolysin 的乳杆菌物种。
L.iners产生 inerolysin 的能力可能是影响其从阴道环境中获取营养能力的最重要因素之一。与在平衡的微生物环境中相比,超过10%的编码L.iners中 inerolysin 的基因在生态失调中的表达更高。该毒素可直接从宿主组织/细胞释放资源,使L.iners在营养匮乏和不利条件(如细菌性阴道病,其他乳酸杆菌难以定植)下具竞争优势。
注:尽管在乳杆菌中没有发现铁摄取系统,但在乳杆菌中检测到了能够催化亚铁离子并结合原卟啉IX形成血红素的铁螯合酶。
5
粘附能力
惰性乳杆菌(L.iners)对宿主细胞的粘附被认为通过阻断病原微生物在阴道上皮细胞的结合位点的机制在排除病原微生物方面发挥作用。
• 中性pH值下L.iners与人纤连蛋白的结合强于其他乳杆菌
尽管L.iners缺乏乳杆菌属的大部分主要粘附分子,但它仍然对阴道上皮细胞表现出很强的粘附能力。纤连蛋白是阴道上皮细胞外基质中的一种不溶性糖蛋白。L.iners基因组编码一种纤连蛋白结合蛋白,该蛋白含有金黄色葡萄球菌致病菌株共有的基序(纤连蛋白结合蛋白 A),从而介导金黄色葡萄球菌对宿主细胞的粘附和侵袭。研究证明,在更中性的 pH 值下,L.iners与人纤连蛋白的结合明显强于其他乳杆菌物种,这可能导致L.iners在阴道中持续存在,尽管存在病原体或用抗生素治疗。
• L.iners独特的粘附能力会影响其保护作用
一项体外研究报告说,L.iners可能会增加引起细菌性阴道病(BV)的G.vaginalis的粘附。研究还证明,L.iners产生溶孔素,这是一种常见于病原菌中的成孔蛋白,可以增强粘附能力。这些发现表明,L.iners独特的粘附功能降低了对健康阴道微生物组免受病原菌侵害的保护。
6
抗菌和免疫特性
L.iners是最常见且持久的阴道共生乳杆菌,能高度适应复杂且动态的阴道环境。环境波动时,其他乳酸杆菌或难以存活,而 L.iners 借助基因组层面的灵活调控——如特异性碳水化合物摄取、纤连蛋白结合、噬菌体防御与惰性溶血素合成——维持稳定丰度。其在多种条件下的生存优势使其在微生物组过渡期常成优势种。
• L.iners在不同环境下可能存在免疫保护也可能扰乱稳态
多项研究已证实 L.iners 具备多种免疫特性,其细胞因子调控、外源营养摄取和噬菌体防御等特性,有助于在不利条件(包括 BV)下生存。L.iners还能限制有害菌获取铁等关键营养,并通过激活上皮先天免疫抑制其生长;此外,通过阴道上皮细胞之间的特定分子相互作用观察到 L.iners 的抗炎作用。
以 L.iners 为主的阴道微生物组与上皮应激反应的诱导相关。研究发现,L. iners(而非 L. crispatus)显著上调人原代阴道上皮的模式识别受体通路并提升 TNF mRNA,显示其对宿主免疫的物种特异调节。有人提出,L. iners 在压力下可激活 TLR 信号、提高 HSP70、抑制自噬,从而扰乱上皮稳态并削弱对潜在病原的识别与应答。相反,多种参与上皮抗菌防御的分子(如 NGAL、钙卫蛋白、透明质酸)又更易被其诱导。
综上,L.iners 既能对抗非生理威胁、促进恢复至更健康状态,又表现促炎特性,且在不同环境下并不总是共生角色。
阴道微生物群在维持女性健康的阴道微环境方面起着重要作用,其组成受种族、年龄、妊娠、阴道疾病等多种因素的影响。作为全球育龄女性阴道微生物组中最常见的乳杆菌成员,Lactobacillus iners兼具“普遍性”与“复杂性”。
一方面,乳杆菌总体被视为女性阴道健康的关键守护者,通过乳酸与抗菌物质产生抑制病原体、维持低pH与生态稳态;另一方面,L.iners又与经典的有益乳杆菌(如L.crispatus、L.jensenii、L.gasseri)显著不同:其基因组较小、代谢能力相对受限、主要产生L-乳酸、能在高低pH及BV阳/阴性环境中存活,因而常被视为生态扰动后的“过渡型”定植者。
流行病学与多组学研究提示,L. iners主导的微生物群(CST III型)在多个人群中广泛存在,较缺乏乳杆菌的多样化菌群仍具一定保护性,但与L.crispatus主导状态相比,其对病原体(包括念珠菌)定植与部分不良结局(如阴道生态失调、性传播感染及妊娠不良)的防护可能次优;同时,行为与社会学因素(如无保护性行为、性伴数增加)可能与其主导状态相关。
阐明L.iners在阴道健康与疾病中的双刃剑角色,并识别可干预的致病特征与潜在生物标志物,至关重要且紧迫。
1
L.iners与阴道生态失调
证据强度:较高
与肠道菌群相比,健康个体阴道微生物环境的一个典型特征是其细菌多样性极低。健康绝经前妇女有五种主要的群落状态类型(CST),即L.crispatus 主导的 CST I、L. gasseri 主导的 CST II、L.iners 主导的 CST III 和 L. jensenii 主导的 CST V,而 CST IV 的特征是缺乏乳杆菌属。阴道生态失调以细菌多样性高和厌氧菌混合物为特征,经常与多种妇科疾病有关。
• L.iners在孕妇中占比均较高,但健康孕妇中更多
一项研究从中国广州中山大学附属第六医院招募了一组 95 名孕妇。该队列包括 34 名健康孕妇(健康)和 61 名患有至少一种疾病的孕妇。
参与者患有的疾病也被分为妊娠糖尿病(GDM)(n=21)、母体相关不良妊娠结局(MAPO, n=29)、胎儿相关不良妊娠结局 (FAPO, n=13)、阴道感染(n=6)、肝脏或肾脏异常(n=14)、贫血(n=8)、血栓形成倾向(n=4)和辅助受孕(n=11)。
中国孕晚期孕妇阴道微生物组组成及结构
Wang X,et al.NPJ Biofilms Microbiomes.2025
研究发现,在物种层面,健康孕妇的阴道微生物组呈现出独特的分布模式,其中L.iners主导的CST-III型占比高达50%,显著高于疾病组的31.15%,但在所有组中,L.iners所主导的分型占比均不低。
• L.iners为主的阴道菌群保护性不及L.crispatus
L.iners常见于健康女性、阴道生态失调(如 BV)患者,甚至抗菌治疗者。多项研究表明,L.crispatus与健康相关,而以L.iners为主的群落有时难以提供足够保护以预防失调。
L.iners的存在与较高水平的促炎因子有关,例如白细胞介素1α、白细胞介素18、巨噬细胞迁移抑制因子和肿瘤坏死因子α,它们负责激活阴道炎症反应。
• L.iners适应能力较强,BV患者丰度可能也不低
尽管L.iners的作用仍有争议,但其丰度相对稳定,不易被病原体替代。细菌性阴道炎时,L.iners常与潜在有害菌共存,而L.crispatus则很难做到。
其基因组支持对失调环境的适应,可能与代谢、细胞溶解及抗噬菌体防御基因随阴道环境变化而调控有关。其在多种条件下的强生存力提示其既是宿主防御的重要成员,也是可维持与恢复阴道微生物组的持久共生乳杆菌。
2
L.iners与细菌性阴道病
证据强度:较高
细菌性阴道病(BV)是育龄妇女中最常见的阴道炎类型。它的特点是乳杆菌属显著减少或消失,伴随着以厌氧菌和兼性细菌为主的更多样化的微生物群的出现,如加德纳菌属、普雷沃氏菌属和阴道曲霉属。
• L.iners是能在细菌性阴道病中存在的乳杆菌
L.iners通常是唯一可以在细菌性阴道病(BV)期间检测到的与BV相关细菌共存的阴道乳杆菌物种。凭借对基因组功能的动态调控,它能在剧变的阴道环境中持续存在;L.iners基因表达的增加可能导致琥珀酸和其他短链脂肪酸的产生以及 BV 环境中 pH 值的增加。
为了适应BV环境,L.iners可以增加inerolysin和粘蛋白的表达,促进甘油的产生和相关代谢酶的表达,从而保证其从外源获取营养物质。此外,噬菌体是导致 BV 期间乳杆菌种类突然减少的原因之一,而 L.iners 可以上调I型 RM 系统和 CRISPR 等防御系统,以及其特异性 hsdR 基因,以抵抗 BV 期间噬菌体的入侵。
最近的一项研究发现了三种由名为Lactobacillus paragasseri的人类肠道菌株产生的细菌素活性肽。这些细菌素对乳杆菌具有很强的选择性抑制活性,而L. crispatus、L. jensenii和L. gasseri仅受到轻微抑制,表明这些乳杆菌衍生的抑制剂可以与甲硝唑联合使用,以改善目前的BV治疗。
• L.iners有助于预测细菌性阴道病的状态
由于 L.iners 在 BV 中的共存与其他乳杆菌物种不同,因此L.iners的流行率可以作为微生物指标来预测BV的发作或中间状态。此外,L.iners对甲硝唑具有耐药性,并且被发现它是主要的乳杆菌物种,即使在用甲硝唑处理BV后也是如此。
与BV期间几乎缺失的保护性乳杆菌相比,L.iners竞争力更强,能在失衡微生物组中共存。有人认为它促成 BV 与非 BV 状态的过渡。值得注意的是,治疗后微生物组常仍以L.iners为主,而未转为L.crispatus优势。因此,L.iners持续存在或致长期阴道失调,尤见于反复治疗后。但仍需研究其究竟是转化生物标志物,还是 BV 的促成因素。
3
L.iners与早产
证据强度:一般,存在矛盾结果
在怀孕期间维持阴道微生物组中乳杆菌属的自然健康平衡尤为重要。早期的研究证实,怀孕期间阴道内的高雌二醇水平和随之而来的高糖原水平导致更强的阴道酸化,从而随着妊娠的进展促进乳杆菌物种的流行。
• L.iners的丰度在孕中期和晚期显著下降
许多研究表明,以惰性乳杆菌(L.iners)为主的阴道微生物组更有可能在怀孕期间转向生态失调。在之前的研究中,发现健康孕妇的L.iners丰度在妊娠中期和晚期显著下降,而 L.crispatus 的丰度在妊娠中期与孕早期相比有所增加。
此外,研究发现,阴道清洁度和白细胞酯酶活性阳性的升高与 L.iners 而非 L.crispatus 的丰度增加相关。
• L.iners的丰度与早产之间存在一定联系
越来越多证据表明,细菌性阴道病(BV)是不良妊娠结局的重要病因,尤以早产(PTB)为甚。以L.iners占优势的“中间微生物群”被视为 PTB 的潜在风险因素。
有研究人员认为,在怀孕早期健康女性的阴道涂片中检测到的L.iners可能与早产(PTB)有关。另有研究也证明了这一点,报告说,妊娠16周时以L.iners为主的阴道微生物组是短宫颈和早期 PTB(<34 周)的危险因素,而 L.crispatus 优势在种族更多样化的队列中对 PTB 具有保护作用。
来自不同国家的最新研究表明,L. iners 与早产患病率增加之间存在关联。L. iners也被证明是黑人孕妇中最丰富的乳杆菌物种。然而,大多数研究并未确定乳杆菌占主导地位的阴道微生物组与黑人孕妇的 PTB 之间存在显著关系。
相反,三项研究报告说,L.iners与降低 PTB 风险有关。因此,L. iners 与 PTB 风险之间的关联还存在争议(表1)。此外,有限的样本量、样本采集时间、PTB 定义的差异、种族和地理差异、菌株鉴定方法的差异,以及遗传异常或 PTB 病史等复杂的临床条件,都是影响结果的混杂因素。
L.iners和早产的研究主要结果
Zheng N,et al.Front Cell Infect Microbiol.2021
基于L.iners的特性及其在作为唯一乳杆菌时对病原体保护不足,一些研究者认为它并不直接致孕期感染。事实上,L.iners优势的阴道微生物组较不稳定,孕期易向与BV相关的CST-IV转变;其还可能通过调节局部炎症与影响宫颈完整性,削弱化学与机械黏膜屏障,从而增加早产风险。但仍需进一步研究阐明二者的潜在机制。
4
L.iners与生物膜形成
证据强度:一般
生物膜是紧密附着在表面上的细菌结构,已知它们比浮游细胞对宿主免疫反应和抗生素治疗更具抵抗力。阴道上皮的生物膜与感染密切相关;大量证据显示BV伴随致密的多菌生物膜,其中加德纳菌(G.vaginalis)为主导菌。一般认为,加德纳菌启动生物膜形成并促进其他 BV 相关菌附着,进而增厚生物膜;其生物膜还能阻挡抗生素渗透,保护其他菌株。BV 的高复发被广泛归因于此类生物膜既能保护细菌免受抗生素治疗,甚至作为病原体再生的宿主。
• L.iners对病原菌的粘附抑制不如其他乳杆菌
阴道本土乳杆菌被认为可以通过空间位阻或粘膜中的受体掩蔽来防止病原菌的定植。先前的研究使用乳杆菌益生菌方法试图清除多微生物生物膜,从根本上阻止细菌毒力并抑制人体阴道感染。
据报道,植物乳杆菌(Lactobacillus plantarum)可显著降低 HT-29 细胞系中大肠杆菌、鼠伤寒沙门氏菌、金黄色葡萄球菌和铜绿假单胞菌的粘附,这使其成为治疗 BV 的潜在抗生物膜剂。体外生长的阴道加德纳菌生物膜被罗伊氏乳杆菌RC-14取代,并在有限程度上被L.iners取代。
研究发现,L.crispatus大大降低了G.vaginalis菌株对宫颈上皮细胞的粘附,包括来自健康女性和患有BV的女性。有趣的是,L.iners显著降低了健康女性对G.vaginalis菌株的粘附,但却增强了致病性G.vaginalis的粘附,表明L.iners可能可以与BV相关的G.vaginalis共存,并可能有助于G.vaginalis主导的生物膜形成。
此外,众所周知,念珠菌属,主要是白色念珠菌,可以形成厚而坚韧的生物膜,这大大增加了治疗复发性外阴阴道念珠菌病期间对抗真菌药物的耐受性。有研究报道了各种乳杆菌在共培养时抑制白色念珠菌生物膜形成和生物膜相关基因表达的能力。鼠李糖乳杆菌可下调白色念珠菌生物膜相关基因表达。相反,与 L.iners 共培养导致生物膜相关基因表达(ALS3 和 ECE1)上调,表明 L.iners 的存在可能表明阴道生态失调的转变;因此,它不应用作白色念珠菌感染的益生菌干预措施。
进一步了解阴道共生乳杆菌与生物膜结构和功能之间的相互作用对于确定生物膜相关感染的新治疗方法极为重要。
5
L.iners与性传播感染
证据强度:低
先前的研究报告称,以L. crispatus为主的阴道微生物组与较低的性传播感染患病率有关,而细菌性阴道病与性传播感染风险升高有关,例如沙眼衣原体、人类免疫缺陷病毒(HIV)、淋病奈瑟菌、巨细胞病毒和单纯疱疹病毒2型感染。
• 以L.iners为主的阴道微生物群受病原体感染风险更高
有研究报告说,基线时以L.iners为主的阴道微生物组显著增加了一年后感染沙眼衣原体的风险。以乳杆菌为主的阴道微生物组中缺乏D-乳酸可能会通过调节宫颈完整性来增加 HIV 横贯宫颈阴道粘液的能力。
许多研究报告称,HPV阳性女性的阴道微生物多样性较高,乳杆菌种类丰度较低。与L.crispatus相比,以L.iners为主的阴道微生物组与高危 HPV 感染相关。可以推测,阴道生态失调可能会影响宿主对 HPV 感染的先天免疫力,导致发育不良/宫颈癌。
这些发现表明,L.iners可能表现出类似于BV的阴道微生物组组成的快速变化,并且可能是性传播感染下动态阴道环境的有价值的生物标志物。
6
L.iners与不孕症
证据强度:较低
阴道生态失调,包括pH值升高、菌群多样性增加、细菌性阴道病、外阴阴道念珠菌病和滴虫性阴道炎,被认为是不孕症的危险因素。还有研究报告说,L.iners的丰度与不孕率增加有关。
• L.iners丰度可能对怀孕率存在影响
近期有研究报道,以L.iners为主的阴道微生物组与输卵管性不孕和沙眼衣原体感染相关。作为过渡物种,L.iners可能在治疗或体外受精(IVF)所致的高雌激素环境下,促使异常与正常微生物组相互转换。
7
L.iners与月经周期
证据强度:一般
人类微生物组项目显示,包括阴道在内的各部位微生物群在同一受试者内的时间变化小于个体间差异。月经周期是扰动阴道微生物多样性的关键因素。L.crispatus通常在育龄妇女的阴道中占主导地位,而 L.iners 在月经周期中过度生长并取代L.crispatus。
• L.iners在月经期间明显增加,有助于判断月经时间点
最近的一项研究报告说,L. iners是卵泡期复发最频繁的微生物;L.iners和CST IV型在围排卵期占主导地位;在黄体期,最常见的类型是 CST IV。事实上,L.iners的丰度在月经期间显著增加,通常与G.vaginalis或Atopobium vaginae的增加同时;然而,在没有干预的情况下,它们随后在月经后减少。
由于阴道生态的动态变化是在同一个体月经周期的不同时间点表征的,因此相对于月经周期的采样时刻对于阴道微生态分析非常重要。
L.iners作为改善生殖健康的靶点
鉴于L. iners在阴道微生物组中的高检出率、其在多种阴道环境状态中的存在以及其功能可塑性(无论是通过遗传多样性、维持多菌株、差异基因表达还是两者兼有),特定的L. iners菌株、基因或产物可能成为治疗或预防性调节阴道微生物群的广泛适用靶点。
在关于阴道乳杆菌对半胱氨酸依赖性的报告中证明,L.iners缺乏L.crispatus、L.gasseri和L.jensenii中存在的外源性半胱氨酸摄取转运系统。相反,L.iners依赖于摄取外源性L-胱氨酸,然后在细胞内将其转化为半胱氨酸。在模拟细菌性阴道病(BV)样菌群的体外实验中,使用胱氨酸摄取抑制剂和甲硝唑处理促进了L.crispatus的生长,而单独使用甲硝唑处理则导致L.iners的扩增。因此,胱氨酸摄取抑制剂或其他特异性抑制L.iners的试剂未来可能作为细菌性阴道病治疗方案的补充,以调节微生物群组成,促进非L.crispatus乳杆菌属的扩增。
总的来说,卷曲乳杆菌(L.crispatus)与最佳阴道健康状况相关,部分原因在于其全球普遍存在以及与积极健康结果的相关性。然而,由于宿主生理或免疫学原因,卷曲乳杆菌的优势状态可能并非某些个体能够合理实现的状态。确实存在稳定的以无害乳杆菌(L.iners)为主的微生物群,这些微生物群可能具有特定的菌株水平特征,即宏基因组亚种,并且可能对某些个体而言是最优的。
一种新的干预措施可能是将与细菌性阴道病(BV)风险增加相关的不稳定乳杆菌微生物群调节为由对变异有抵抗力的无害乳杆菌菌株组成的稳定微生物群。
本文涵盖了L. iners的主要特性、健康影响及其在未来女性健康中的潜在作用:
一、L.iners的主要特性
普遍性与过渡性:是育龄女性阴道中最常见的乳杆菌之一,常出现在生态扰动后的过渡阶段,可在健康与失调状态(如BV)中共存。
基因组与代谢:基因组最小(约1.28 Mbp),代谢能力受限,依赖宿主营养;缺乏D-乳酸脱氢酶,仅产L-乳酸,产酸与过氧化氢能力弱于L.crispatus。
特异功能基因:携带inerolysin(成孔毒素)、ZnuA(高亲和锌摄取)和hsdR(I型限制性内切酶亚基)等,有利于在酸性、营养匮乏和噬菌体压力下生存。
免疫调控:可上调上皮PRR通路与炎症因子(如TNF),在不同环境下呈现抗炎与促炎双重效应。
二、对女性健康的影响
阴道生态:以L.iners为主(CST III型)的群落相较L.crispatus主导状态保护性较弱;在细菌性阴道病中常与厌氧菌共存,能耐受甲硝唑并在治疗后持续占优,或与生物膜形成、复发相关。
生物膜与病原体黏附:对G.vaginalis的黏附抑制弱,甚至增强致病株黏附;与白色念珠菌共培养可上调ALS3/ECE1,提示其不宜作为念珠菌感染的益生菌干预。
妊娠与早产:孕期以L.iners为主的群落较不稳定,易向BV相关CST-IV转变;可能通过局部炎症与宫颈完整性影响,增加早产风险(证据存在异质性)。
性传播感染(STI)与HPV:L. iners主导与较高的STI风险和高危HPV相关;多样性升高、乳酸杆菌减少的状态或削弱对HPV的先天免疫。
月经周期动态:卵泡期与围排卵期更易见L.iners增多,提示其对激素与环境波动高度敏感。
三、未来在女性健康中的作用与方向
风险分层与生物标志物:作为生态扰动与STI动态环境的指示菌,用于BV“中间状态”、治疗后复发风险及HPV/早产风险的预测与监测。
精准干预靶点:围绕其特征通路(inerolysin、金属离子摄取、CRISPR/限制修饰系统、黏附因子)设计干预,限制致病性而非简单清除。
益生策略优化:更倾向于重建L. crispatus优势的“功能性益生”与微生态移植;避免在念珠菌感染等场景使用L. iners相关干预。
个体化管理:结合月经周期、妊娠阶段、性行为模式与种族/地域差异,动态评估菌群状态,制定个体化预防与治疗方案。
总而言之,惰性乳杆菌(Lactobacillus iners)在波动环境中具生存与一定保护能力,但其较弱的产酸/抗菌功能与独特黏附、免疫调控特性,关联BV、STI、HPV风险升高以及妊娠不良与不孕。未来应将其作为风险标志与精准干预靶点,聚焦功能替代与群落重建,推动女性生殖健康的个体化管理与预防治疗升级。
主要参考文献
Wang X, Jiang Q, Tian X, Chen W, Mai J, Lin G, Huo Y, Zheng H, Yan D, Wang X, Li T, Gao Y, Mou X, Zhao W. Metagenomic analysis reveals the novel role of vaginal Lactobacillus iners in Chinese healthy pregnant women. NPJ Biofilms Microbiomes. 2025 May 30;11(1):92.
Zheng N, Guo R, Wang J, Zhou W, Ling Z. Contribution of Lactobacillus iners to Vaginal Health and Diseases: A Systematic Review. Front Cell Infect Microbiol. 2021 Nov 22;11:792787.
Holm JB, Carter KA, Ravel J, Brotman RM. Lactobacillus iners and genital health: molecular clues to an enigmatic vaginal species. Curr Infect Dis Rep. 2023 Apr;25(4):67-75.
Kim H, Kim T, Kang J, Kim Y, Kim H. Is Lactobacillus Gram-Positive? A Case Study of Lactobacillus iners. Microorganisms. 2020 Jun 29;8(7):969.
Novak J, Ravel J, Ma B, Ferreira CST, Tristão ADR, Silva MG, Marconi C. Characteristics associated with Lactobacillus iners-dominated vaginal microbiota. Sex Transm Infect. 2022 Aug;98(5):353-359.
Bautista C. T., Wurapa E., Sateren W. B., Morris S., Hollingsworth B., Sanchez J. L. (2016). Bacterial Vaginosis: A Synthesis of the Literature on Etiology, Prevalence, Risk Factors, and Relationship With Chlamydia and Gonorrhea Infections. Mil. Med. Res. 3, 4.
Alonzo Martinez M. C., Cazorla E., Canovas E., Martinez-Blanch J. F., Chenoll E., Climent E., et al. (2021). Study of the Vaginal Microbiota in Healthy Women of Reproductive Age. Microorganisms 9 (5):1069.
Borgdorff H., Armstrong S. D., Tytgat H. L., Xia D., Ndayisaba G. F., Wastling J. M., et al. (2016). Unique Insights in the Cervicovaginal Lactobacillus Iners and L. Crispatus Proteomes and Their Associations With Microbiota Dysbiosis. PloS One 11 (3), e0150767.
Campisciano G., Florian F., D’Eustacchio A., Stankovic D., Ricci G., De Seta F., et al. (2017). Subclinical Alteration of the Cervical-Vaginal Microbiome in Women With Idiopathic Infertility. J. Cell Physiol. 232 (7), 1681–1688.

谷禾健康
麦角硫因 (EGT) 是一种含硫的抗氧化剂,由某些微生物合成,大量存在于蘑菇、发酵食品和其他膳食产品中。人体无法自主合成,需要通过饮食摄取和积累。
麦角硫因(EGT)由哺乳动物细胞输入,可以在哺乳动物组织中积累到低毫摩尔浓度,在那里它与保护健康作用有关。 同样,许多宿主相关微生物输入EGT,EGT通过其抗氧化特性增强细胞内氧化还原稳态。某些细菌物种也编码降解 EGT 的酶。事实上,最近的研究发现 EGT 可以被人类粪便细菌的复杂群落代谢。 粪便群落的 EGT 代谢因人而异,表明微生物组组成的个体间差异可能影响 EGT 代谢。
许多与宿主相关的微生物都会吸收EGT,通过其抗氧化特性增强细胞内氧化还原稳态。某些细菌物种也编码降解 EGT 的酶。因此研究人员提出假设并进行验证:EGT是否会先被部分菌种代谢生成某种可用物质,再由后续菌种接力还原,从而获能(促进ATP合成与生长)?
为此,研究人员结合群落模型、分离菌株和共培养实验、代谢物时间序列实验、多队列宏基因组数据再分析等技术进行了研究和验证。完整重现了Clostridium symbiosum和Bacteroides xylanisolvens这两种细菌在厌氧环境下”EGT→TUA(thiourocanic acid)→还原产物(3-(2‑thione‑imidazol‑4‑yl)‑propionic acid)”的代谢接力过程。在对24份健康人粪便群落进行48小时培养的功能表型测试中,有18/24样本显示EGT代谢活性并产生TMA,且其中11/18检测到还原TUA产物;相应的宏基因组分析显示,具EGT代谢活性的样本中ergothionase基因显著富集。在四个独立结直肠癌队列的粪便宏基因组数据分析中,发现ergothionase基因在其中两队列中显著富集,在另外两队列中呈增加趋势。
这些发现揭示了饮食抗氧化分子在肠道微生物能量代谢与潜在疾病风险差异中的功能纽带,为未来通过调控微生物EGT代谢改善肠道健康提供了方向。
1
确定麦角硫因代谢菌和酶
已知麦角硫因酶(EGT trimethylammonia lyase)可将EGT裂解为TMA与TUA。Treponema denticola SP33 ergothionase (TdETL) 是已被表征的“参照”,用其氨基酸序列做同源搜索,在人肠道可培养菌株库里寻找麦角硫因(ergothionase)同源物,从而锁定了C. symbiosum CLOSYM_01531和C. symbiosum CLOSYM_03165。
通过LC-MS/LC-MS-MS对C. symbiosum+EGT-d9的培养上清与细胞组分进行非靶与靶向代谢组学分析,验证其将EGT裂解为TMA与TUA,并显示TUA主要分泌到胞外。异源表达验证实验(将CLOSYM_01531这个基因装进E. coli里表达),观察到EGT-d9在约6小时内被完全转化为TMA-d9与TUA。
2
小鼠粪便菌群
来自不同来源的雌性6周龄的C57BL/6小鼠(JAX、TAC、CR)做粪便群落48小时厌氧培养+EGT-d9,比较EGT代谢能力差异。对CR群落做非靶代谢组学,鉴定得到新的代谢物(m/z 173.0379),经标准品比对,确认为还原的TUA产物3-(2‑thione‑imidazol‑4‑yl)‑propionic acid
3
细菌共培养
通过对CR 和 TAC 粪便微生物组的16S rRNA 测序分析,发现CR群落中Bacteroides acidifaciens富集。研究人员选取与 B. acidifaciens 亲缘关系较近、且在人肠道常见并已知具备多糖与宿主营养代谢能力的代表物种 B. ovatus 与 B. xylanisolvens 作为候选,检验其是否具有将 TUA 还原为 3-(2thioneimidazol4yl)propionic acid 的活性。并测试还原过程对能量代谢与生长的影响。
单培养与共培养添加EGT-d9的C.symbiosum和B.xylanisolvens时,进行长时间跟踪。同时用表达CLOSYM_01531的工程E.coli替代C.symbiosum重复共培养过程。进一步证明接力关键在于EGT产生的胞外TUA与下游还原步骤的耦合。
4
健康人队列粪便菌群
对24份健康粪便样本做48小时厌氧培养+EGT-d9,查看EGT代谢能力和产物,发现有18/24个样本把EGTd9代谢掉了。在这18个样本中,对其中3个TUA还原能力强的样本做了时间跟踪,还原代谢轨迹。同时将其中23份宏基因组数据分为两组(有代谢活性 vs 无代谢活性),做配对分析,查看ergothionase基因富集情况。
5
结直肠癌队列宏基因组功能分析
基于EGT稳态与结直肠癌(CRC)的文献线索,汇总四个已发表CRC粪便宏基因组数据集,采用统一流程定量ergothionase基因丰度,然后进行组间差异分析。
▸ C.symbiosum可将EGT代谢为TMA与TUA,且TUA主要分泌到胞外
如上图所示,经EGT-d9处理的培养物的细胞沉淀物(C. symbiosum ATCC 14940)中检测到EGT-d9和TMA-d9,表明C. symbiosum ATCC 14940导入并代谢EGT。
在C. symbiosum ATCC 14940培养上清液中检测到一种单一的代谢物(m/z 171.0223,图C),对比未经EGT-d9处理的样品,m/z 171.0223显著上调(Log2(fold change) ≥ 2, p ≤ 0.05) ,经标准品对比(图D、E),确认为TUA。用或不用EGT-d9处理C. symbiosum培养物48小时后的EGT-d9、TMA-d9和TUA含靶向定量结果显示(图F),EGT‑d9下降与TMA‑d9、TUA上升在计量上匹配,符合EGT代谢为“两段”——TMA与TUA的表现。
将CLOSYM_01531异源表达于E. coli(图C),发现其可在约6小时内将EGT‑d9完全转为TMA‑d9与TUA(图D),空载对照(Ec_EV)无此活性(图G)。此外,C. symbiosum中还鉴定到第二个同源物CLOSYM_03165,异源表达同样具活性。
▸ 小鼠粪便菌群的代谢组学分析鉴定出“还原产物”
不同来源小鼠展现出群落差异,如图A,发现CR群落48小时内可将EGT‑d9完全代谢为TMA‑d9,TAC群落仅中等程度代谢并积累TUA,JAX群落则基本无代谢。
编辑
但在CR培养物上清液中并未检测到TUA,而是发现了一个新的代谢物(m/z 173.0379),且呈显著上调(log2(fold change) ≥ 3, p ≤ 0.05),经标准品比对,确认是3‑(2‑thione‑imidazol‑4‑yl)‑propionic acid,由TUA进行2e−/2H+加氢还原所得(图E)。CR群落可将外源TUA完全转为该还原产物,而JAX、TAC不能(图G)。
▸ TUA还原增强了B.xylanisolvens在厌氧条件下的ATP合成和生长
16S rRNA 分析CR和TAC样本的菌群,发现它们具有相似的菌群多样性(图A、B),且Bacteroides acidifaciens在CR群落中显著富集(图C)。研究人员又提出假设, B. ovatus和B. xylanisolvens或许可以将TUA还原为3‑(2‑thione‑imidazol‑4‑yl)‑propionic acid。
事实也的确如此,在添加了TUA的培养基中于厌氧条件下培养这两种菌48h,定量结果显示两种菌株都消耗了培养基中的TUA,并产生了等量的3‑(2‑thione‑imidazol‑4‑yl)‑propionic acid(下图A)。B. xylanisolvens约6小时内可将TUA完全转化,且产物主要在胞外(上图E、F)。在缓冲体系中,B. xylanisolvens因TUA或TUA+甲酸钠而ATP合成约提升4倍(下图B),并伴随还原产物累积(下图C);在厌氧环境中且缺乏其它电子受体(也就是能增强ATP合成的化合物)的最小培养基中,发现TUA显著提升其生长(下图D)。
▸ C.symbiosum和B.xylanisolvens互相利用EGT的代谢产物
鉴于C. symbiosum和B. xylanisolvens可以分别代谢EGT和TUA,研究人员先假设这两个菌种可以共同将EGT转化为3‑(2‑thione‑imidazol‑4‑yl)‑propionic acid,然后通过共培养实验进行验证。验证结果显示,C.symbiosum在单独培养时会将EGT‑d9转为TMA‑d9和TUA,不产生3‑(2‑thione‑imidazol‑4‑yl)‑propionic acid,这表明C. symbiosum不能还原TUA。B.xylanisolvens则对EGT‑d9无作为。两者共培养时,EGT‑d9消耗程度与C.symbiosum单独培养时相当,但TUA几乎不积累,反而是还原产物显著积累。(图E培养4天、图F培养7天)
代谢组火山图显示细胞沉淀和培养上清液中分别仅富集TMA‑d9与还原产物,符合跨物种接力还原产物的代谢模式“EGT→TUA→3‑(2‑thione‑imidazol‑4‑yl)‑propionic acid”(图I、L)。
用表达CLOSYM_01531的E.coli与B.xylanisolvens共培养,也再现了“EGT→TUA→3‑(2‑thione‑imidazol‑4‑yl)‑propionic acid”反应(图G)。
▸ 人群普遍性和个体差异
研究人员筛选了24名健康成人,获得其粪便样本。在添加EGT-d9培养基中共同培养48小时,观察EGT代谢活性差异。发现24个样本中,有18个样本在48小时内显著代谢EGT‑d9,且均产生TMA‑d9(图A-D),这表明麦角硫因介导的EGT代谢的一个特征是消除TMA。虽然在24个样本中都没有检测到TUA,但能够代谢EGT‑d9的18个样本里,有11个样本积累了还原产物(图D)。
对3个TUA还原能力强的样本做时间序列分析,发现6–12小时内TUA短暂出现并随EGT‑d9下降而上升,随后被转化为还原产物,这直接展示了跨物种接力还原产物的代谢模式。
▸ 肠道EGT稳态的改变可能与结直肠癌有关
编辑
研究人员量化了来自四个独立结直肠癌队列和健康对照队列的粪便宏基因组数据集中ergothionase基因的相对丰度,发现有两个CRC组存在ergothionase基因显著富集的现象,另两队列呈上升趋势,这提示EGT代谢能力可能是癌症相关肠道菌群的功能特征之一。
过去更多讲的是“单个细菌把EGT彻底分解”,现在发现EGT还能被“分工协作”重塑成能增强ATP合成的化合物。这项“分工协作“的主角分别是C. symbiosum和B. xylanisolvens,重点工作内容是,C.symbiosum将EGT代谢为TUA和TMA-d9,B.xylanisolvens将TUA还原为3-(2-thione-imidazol-4-yl)-propionic acid,同时提高了自己的ATP产量,促进了自己的生长。B. xylanisolvens作为一种益生菌,目前被认为与宿主健康密切相关。根据现有发现,通过添加TUA或在有“产TUA菌”背景下添加EGT,理论上有助于B. xylanisolvens的定植。
研究中虽然提示EGT→TUA轴与疾病生态有关,但当前缺乏动物与人体定植/功能结果的直接验证。
总而言之,如果在合适的群落背景下提升B.xylanisolvens的定植或TUA还原能力,理论上可以带来:更稳的肠道生态位占据、更高效的厌氧能量代谢、潜在更好的底物利用与有益代谢物输出,并可能通过改变供给-利用格局而影响与疾病相关的微生态失衡。
主要参考文献
Zhou Z, Jiang A, Jiang X, Hatzios SK. Metabolic cross-feeding of a dietary antioxidant enhances anaerobic energy metabolism by human gut bacteria. Cell Host Microbe. 2025 Aug 13;33(8):1321-1332.e9.