-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

人体需要必需的成分来维持其生命活动和身体的发育。缺乏可能导致营养不良、慢性健康问题甚至死亡。
良好的营养对于儿童快速合成新组织、器官发育和身心成长是必要的。在营养学上,需要两种不同的关键成分,即宏量营养素和微量营养素。
我们体内需要大量的常量营养素,也称为宏量营养素,以提供能量和预防健康疾病。
我们体内需要少量的微量营养素来促进生理发育和维持健康益处。
营养过剩和营养缺乏都会对人类生活产生健康影响。
影响个体食物选择和营养需求的因素包括:
-遗传
-营养习惯
-成长/发展
-食品质量
-食物数量
-经验
-消化系统效率
-个人偏好
-生化可用性
-教育
-疾病
-家庭
-女性地位
-营养缺乏
-人员的活动水平
-成瘾习惯
安托万·拉瓦锡(Antoine Lavoisier)—被称为化学和营养学之父,发现了营养学。营养学是研究生物体和食物之间相互作用的学科。
根据词典的解释,营养的意思是”将食物摄入体内并吸收这些食物中营养素的过程”。
食物中的营养素被称为营养供身体使用。此外,它是消耗、吸收和利用食物中营养素的过程。
在饮食中适当维持天然食物的营养有助于保持你的生活健康和运作。
如果人们不摄入适当的饮食,那么可能会导致许多疾病,如心脏病,癌症,抑郁症,胃痛,认知能力下降等。
★食物中存在的有机和无机复合物称为营养物质
营养素在我们身体的功能中起着至关重要的作用。食物为我们的身体提供超过50种不同的营养物质,每种营养素都有其特定的作用和功能。
食物中的营养成分主要分类是:
宏量营养素(产生能量)
-碳水化合物
-蛋白质
-脂肪
-水
微量营养素(保护性)
-矿物质
-维生素
宏量营养素(Macronutrients)中“Macro”这个词的意思是大,人类需要大量的宏量营养素。
每种宏量营养素都有其特定的途径和功能,它们为我们的身体提供能量。
正常人宏量营养素的总能量摄入大约是碳水化合物(60-80%)、脂肪(10-30%)和蛋白质(7-15%)。
它们还有助于身体软组织、细胞膜、激素的结构成分以及递质分子受体和炎症介质等的信号传导和发育。
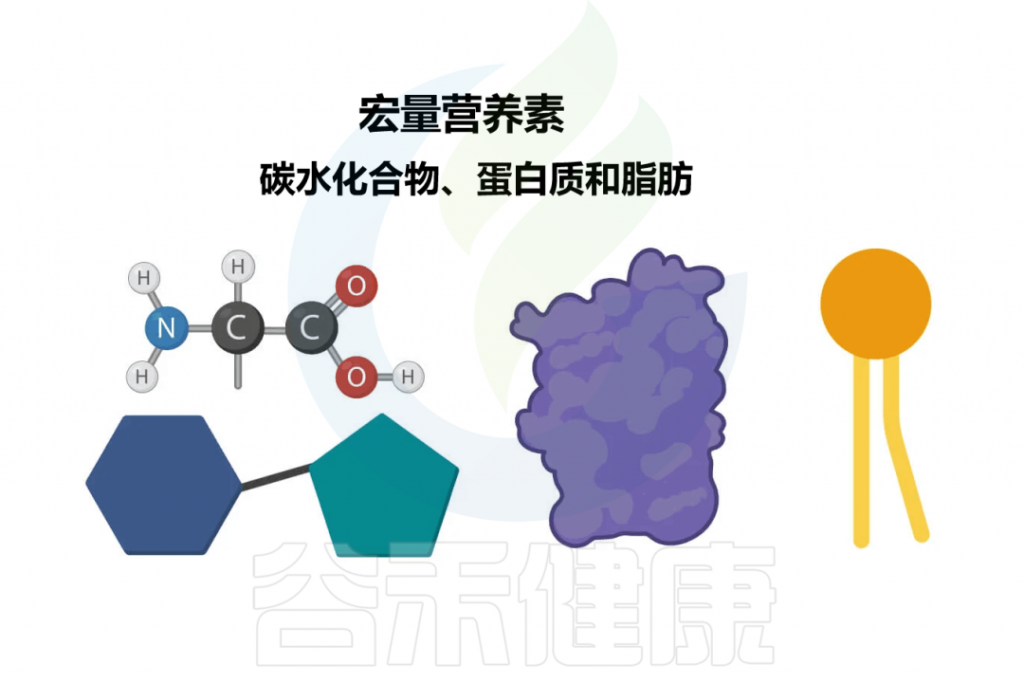
碳水化合物是最丰富的有机物质,主要由含有碳(C)、氢(H)和氧(O)原子的分子组成,并且具有通式C6H12O6。
能量的来源是碳原子。它可以氧化脂肪和合成非必需氨基酸。
碳水化合物是水果和蔬菜的组成部分,在光合作用过程中由绿色植物或植物性食物形成,它是一种能源。例如水果、蔬菜、牛奶、坚果、谷物、种子、豆类等。
▸ 碳水化合物主要可分为四类,它们是:
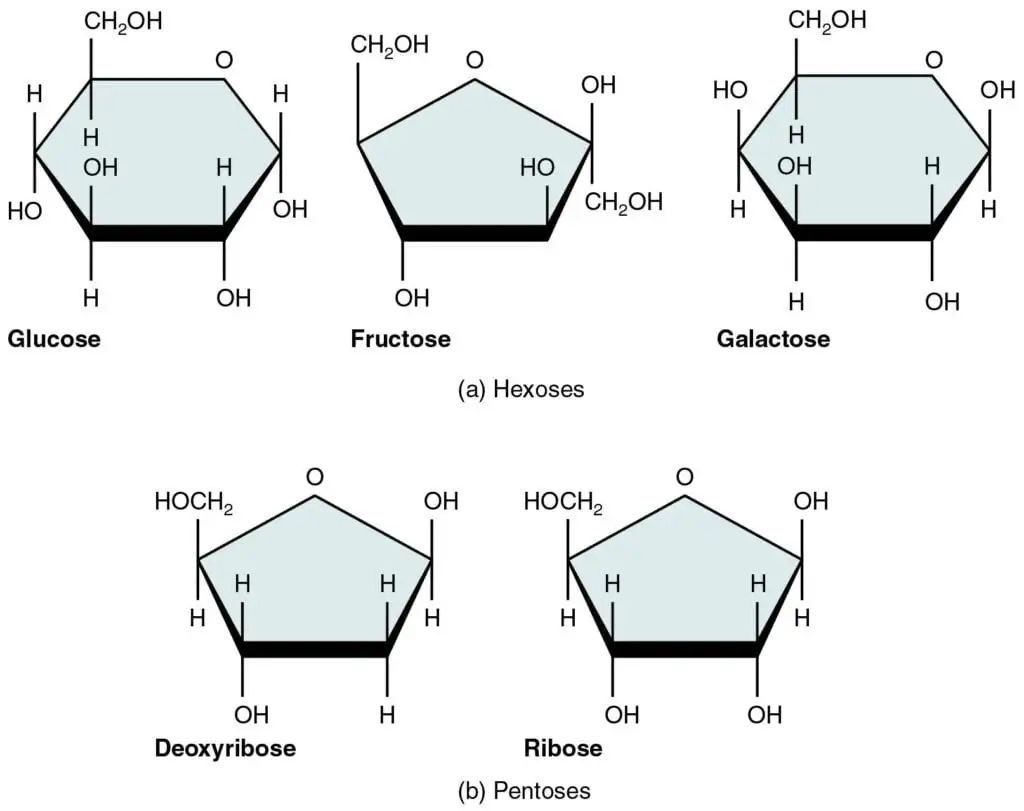
单糖:果糖、葡萄糖、阿拉伯糖、木糖;
二糖:蔗糖、乳糖、麦芽糖;
低聚糖:三糖、棉子糖、四糖水苏糖;
多糖:淀粉,糖原,纤维素,半纤维素
碳水化合物的详细分类(碳水化合物的类型)

来源:microbenotes
1
单糖
最简单的碳水化合物组,通常称为单糖,因为它们不能进一步水解。单糖是还原糖。
它们是糖,味道甜,溶于水,不溶于非极性溶剂。它们以直链或环状形式存在。
它们被用作呼吸的能量来源。
它们是大分子的重要组成部分。
单糖 – 结构、性质和示例
图片来源:pressbooks.bccampus.ca
2
二糖
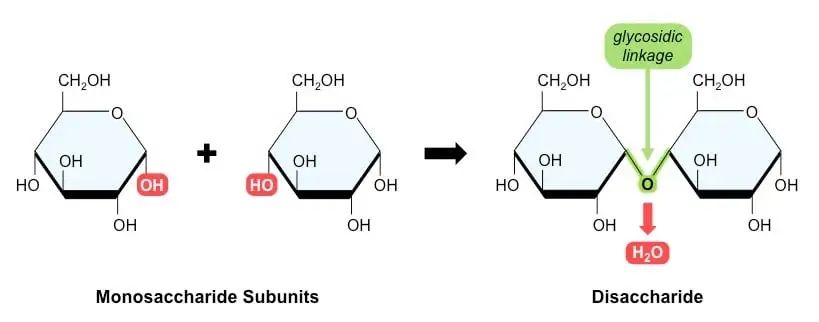
二糖由两个通过缩合反应连接在一起的单糖组成。
二糖 – 结构、性质和示例
图片来源:pressbooks.bccampus.ca
缩合反应是两个分子结合形成新的化学键,当键形成时释放出水分子。在两个单糖之间形成糖苷键。如果一种单糖上的碳1与另一种单糖上的碳4结合,则称为1,4-糖苷键。
示例:
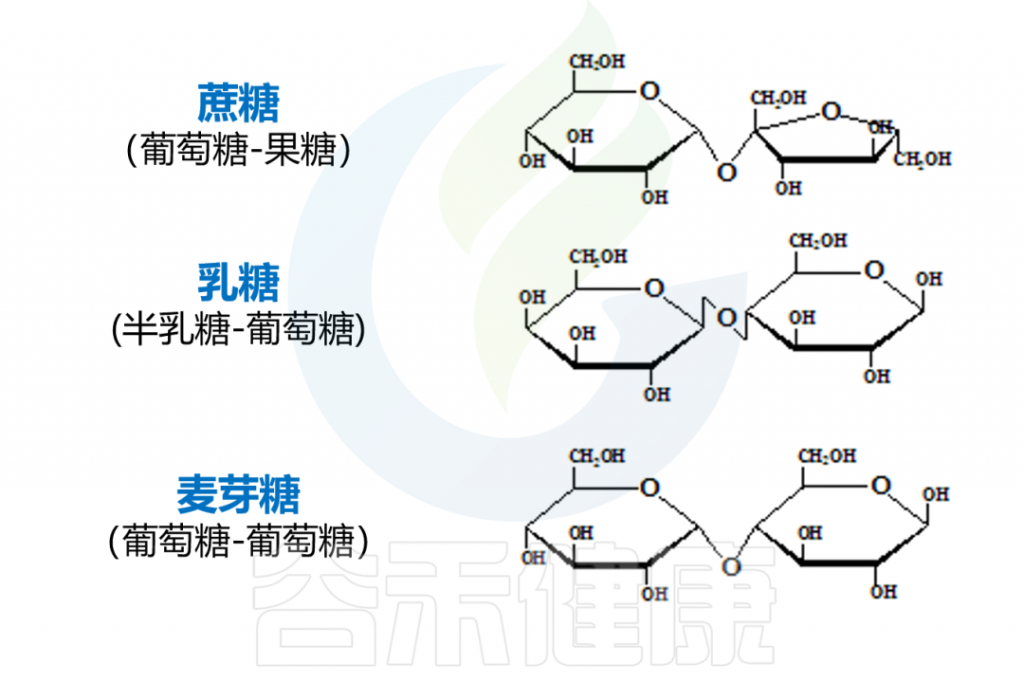
麦芽糖由两个葡萄糖分子通过糖苷键连接在一起形成;
蔗糖是由葡萄糖分子和果糖分子之间的缩合反应形成的;
乳糖由葡萄糖和半乳糖分子形成。
通过添加水分子来破坏糖苷键,可以将二糖分裂成两个单糖,这称为水解反应。水提供羟基(-OH)和氢(-H),这有助于糖苷键断裂。
蔗糖是运输糖,乳糖是牛奶中的糖,牛奶是年轻哺乳动物饮食的重要组成部分。
3
低聚糖、多糖
具有3-10个糖单元的分子称为低聚糖,而含有11个或更多单糖的分子是真正的多糖。
低聚糖的例子包括棉子糖和水苏糖。
多糖尝起来不甜。并且因为它们的分子非常巨大,所以大多数多糖不溶于水。
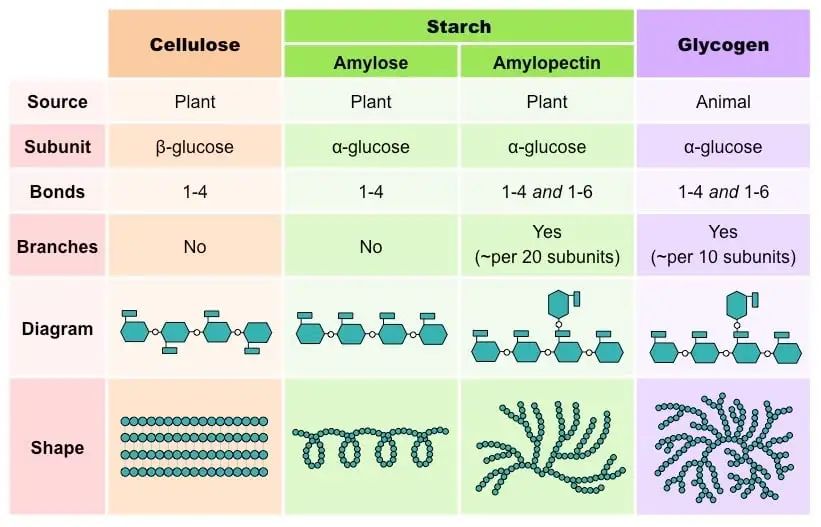
来源:microbenotes
多糖在其重复出现的单糖单元的身份、链的长度、键连接单元的类型和支链的程度上彼此不同。主要关注两个重要功能,即结构功能和能量储存。
它们根据水解产生的分子类型进一步分类。可以是同多糖,包含相同类型的单糖;或异多糖,即包含不同类型的单糖。
同多糖的例子是淀粉、糖原、纤维素、果胶。
异多糖的例子是透明质酸、软骨素。
淀粉由α-葡萄糖(直链淀粉和支链淀粉)的长链组成。糖原由通过糖苷键连接在一起的α-葡萄糖组成。纤维素也由许多β-葡萄糖分子组成,这些分子通过碳1和碳4之间的糖苷键连接。
淀粉是植物中主要的储能材料。
糖原是动物体内的主要储能材料。
纤维素是植物细胞壁的主要成分。
–淀粉
淀粉(amylum)是植物的天然成分,是一种复杂的碳水化合物。它是由葡萄糖分子长链组成的天然聚合物。
有两种类型:直链淀粉和支链淀粉。
直链淀粉是一种线性聚合物,它是无定形或固体。
支链淀粉是一种支链聚合物,它是结晶的。它存在于许多食物中,如谷物,蔬菜和水果(苹果,浆果,甜瓜)。
血糖保持稳定,因为身体需要较长时间来分解这种复杂的碳水化合物。
–纤维
纤维是一种复杂的健康碳水化合物或非淀粉多糖,不会分解成葡萄糖。
纤维可以通过肠道并刺激消化。它存在于植物性食物中,如蔬菜,水果和全谷物。根据(食品和药物管理局),女性每天应摄入28克,而男性应摄入34克。
它们有两种类型:可溶的和不可溶的。
可溶性纤维能溶于水,而不溶性纤维则不能。它有助于调节血糖水平,喂养肠道中的有益细菌,帮助减缓消化,软化粪便,降低胆固醇。
高纤维食物的例子有豆类(黑豆、鹰嘴豆、小扁豆、利马豆、花生和平托豆)、水果(苹果、种子和桃子)、坚果和种子(杏仁、核桃、南瓜籽和向日葵籽)和蔬菜(玉米、花椰菜、甘蓝和南瓜)。
碳水化合物的功能
碳水化合物是主要能量来源
生物体使用碳水化合物作为可获取的能量来推动细胞反应,它们是所有生物最丰富的膳食能量来源。
我们人体也更喜欢碳水化合物作为主要能量来源,每克含有约4卡路里的热量。它为大脑和多种身体组织提供主要能量来源。
碳水化合物在被人体消耗时会被分解成单个葡萄糖分子,从而提供快速的能量来源。
未立即消化的碳水化合物以糖原的形式储存在肝脏和肌肉中,在体育锻炼期间会消耗殆尽。
碳水化合物的摄入量取决于基础代谢率(BMR)、体力活动水平、生长过程和饮食诱导的产热(DIT)。按照建议,人体每天需要食物中45– 65%的碳水化合物。
与脂肪和蛋白质结合形成结构保护成分
碳水化合物与脂质和蛋白质结合,形成表面抗原、受体分子、维生素和抗生素。RNA和DNA结构框架(核糖核酸和脱氧核糖核酸)的形成。
它们形成结构和保护成分,就像植物和微生物的细胞壁一样。细菌(肽聚糖或胞壁蛋白)、植物(纤维素)和动物(几丁质)中的结构元件。在动物中,它们还是结缔组织的重要组成部分。
调节神经、消化、免疫系统
富含纤维的碳水化合物有助于预防便秘;碳水化合物还有助于调节神经组织,是大脑的能量来源。此外,它们还有助于调节免疫系统。
蛋白质是人体结构的组成部分,具有无数功能,例如大脑形成、神经系统和血液的调节以及肌肉、皮肤和头发的生长。
它还充当铁、矿物质、维生素、脂肪和氧的运输机制,并平衡液体和酸碱。
蛋白质还形成用于某些化学反应的酶和抗体来抵抗感染和疾病。
过量和缺乏都会导致健康问题
过量的蛋白质饮食和蛋白质缺乏均与各种健康问题有关,例如高蛋白饮食可能导致体重增加、肾脏损伤、患结直肠癌、乳腺癌和前列腺癌的风险、心血管疾病、钙流失、脱水、便秘和腹泻。
蛋白质缺乏可能导致儿童生长不良、伤口和割伤愈合缓慢、易快速感染、水肿、头发和皮肤稀疏、体力肌肉和脂肪松弛以及内脏器官虚弱。
人体大约需要0.8克/公斤,符合膳食参考摄入量(DRI)的建议。
推荐的蛋白质量可能足以预防蛋白质缺乏症,但这取决于个人的年龄、活动水平、肌肉质量和健康状况等因素。
蛋白质的结构和来源
蛋白质,是一种有机化合物,由具有C、H、O和N原子的氨基酸组成。人体蛋白质中有20种氨基酸。
蛋白质的类型
蛋白质有两种类型,分别是完全蛋白和不完全蛋白。
a.完全蛋白:
完全蛋白质是含有必需氨基酸的蛋白质。
例如动物性食物,例如肉、鱼、奶和蛋。
植物性食物不含完全蛋白质。
b.不完全蛋白:
不完全蛋白质是包含所有必需和非必需氨基酸的蛋白质。
例如蔬菜类食物,例如谷物、豆类和花生。
蛋白质的功能
它有助于身体发育、生长、维护和修复细胞;
它有助于形成必需成分,如激素、酶、免疫细胞、免疫球蛋白和血红蛋白;
它通过控制化学离子进出细胞来帮助调节酸碱平衡;
它通过控制渗透压来帮助调节血液的液体运动;
它也可以产生能量(1克等于4大卡);
它促进体内最适合饮食的饱腹感。
它有助于维持肌肉质量。
脂肪是能量密度最高的大分子,每克提供9卡路里,即比碳水化合物和蛋白质多2.25倍。
脂肪也称为脂质,极易溶于有机溶剂,难溶于水。
脂肪在人体中的主要功能是它为细胞提供结构,有助于绝缘和神经传递,减少炎症,保持大脑健康,在器官中产生不同的激素以及维生素和矿物质的吸收。
我们的饮食不需要大量的脂肪,因为大多数脂肪分子可以由我们的身体从碳水化合物和蛋白质中合成。
脂肪的推荐膳食参考摄入量(DRI)为每天250至500毫克。
但是一些脂肪,如饱和脂肪和反式脂肪,对人类健康有风险,如动脉堵塞、增加患心脏病的风险和增加坏胆固醇水平。
脂肪的结构和来源
脂肪是由3种脂肪酸和1种甘油分子(水溶性碳水化合物)组成的甘油三酯。
脂肪的来源
动物来源:酥油、黄油、肉脂肪、鱼油等。
蔬菜来源:花生油、姜油、芥末油、棉籽和坚果油等。
脂肪的种类
脂肪一般可分为三种类型。他们是:饱和脂肪、不饱和脂肪、反式脂肪。
1.饱和脂肪
饱和脂肪(室温下的固体)是非必需脂肪酸,包括丁酸、棕榈油酸和硬脂酸。它是来自所有动物性食物的营养素,例如动物脂肪、椰子和棕榈油。
例如肉制品(香肠、培根、牛肉、汉堡包)、比萨饼、乳制品(奶酪、全脂和减脂牛奶、黄油和乳制品甜点)、饼干、谷物甜点、椰子油、棕榈油和果仁油以及混合快餐菜肴富含饱和脂肪。
2.不饱和脂肪
不饱和脂肪,在室温下呈液体,是必需的和非必需脂肪酸,包括亚油酸、α-亚麻酸、EPA和DHA、GLA和油酸。
不饱和脂肪存在于橄榄油、花生油、菜籽油、鳄梨、坚果(杏仁、榛子、山核桃)和种子(南瓜、芝麻)等。
不饱和脂肪酸对我们的健康无害,因为它们有助于降低甘油三酯水平、提高高密度脂蛋白(好)胆固醇、降低血压并降低过早死亡的风险。
3.反式脂肪
反式脂肪,不健康的脂肪,在室温下是固体。它的味道令人满意;然而,它会损害我们身体的健康。
反式脂肪存在于加工食品(人造黄油酱、花生酱、薯片、饼干、非乳制奶精、预制蛋糕糖霜、植物起酥油、糖果棒)、甜甜圈、馅饼、油炸和快餐(糕点、早餐食品、饼干)、天然存在的反式脂肪(牛肉、羊肉、黄油、奶酪、酸奶)。
它可以提高血液中的低密度脂蛋白(坏)胆固醇水平和降低高密度脂蛋白(好)胆固醇水平。
脂肪的功能
-促进脂溶性维生素的吸收;
-可以绝缘和控制体温;
-通过缓冲有助于保护身体的器官;
-稳定心律并降低心脏病发作和中风的风险;
-改善皮肤和头发健康;
-帮助吸收维生素 A、D、E 和 K;
-减少炎症;
-有助于保持大脑健康
-降低患癌症和动脉僵硬的风险;
-有助于减少血液的凝固时间;
-有助于改善胰岛素抵抗综合征状态。
微量营养素(Micronutrients),micro这个词的意思是小,人类需要少量的微量营养素。但每种微量营养素都有其特定的途径和功能。
微量营养素有两种形式。它们是矿物质和维生素。
1
矿物质
矿物质是必不可少的无机元素。它也是必需的营养物质,包括铁、钾、钠、钙、镁、锌、锰、铜、硒等。
如果人们没有摄入适量,可能会导致疾病。
它们有两种形式:
1.主要矿物
2.微量元素
主要矿物
主要矿物质是钙、磷、钠、氯、钾、镁和硫。
成年人应每天摄入4700毫克钾。例如鳄梨、椰子水、香蕉、干果、南瓜、豆类和扁豆。
钠是一种流行的调味品,是一种食盐。最新指南人们的钠摄入量应低于6毫克/天。
钙对我们的身体至关重要。成人应摄入1000毫克/天的钙,而女性(51岁及以上)应摄入1200毫克/天。例如乳制品、豆腐、豆类和绿色绿叶蔬菜。
成人应摄入700毫克/天的磷。例如乳制品、鲑鱼、扁豆和腰果。
女性应摄入320毫克/天的镁,而男性应摄入420毫克。例如坚果、菠菜和豆类。
微量元素
微量元素是铁、锌、碘、硒、锰、铬和铜。
铁,在育龄期,女性应摄入18毫克/天的铁。例如强化谷物、扁豆、牛肝、菠菜和豆腐。
锌的食物来源例如强化谷物、牡蛎、牛肉和烤豆。
锰,例如贻贝、榛子、糙米、鹰嘴豆和菠菜。
硒:巴西坚果、菠菜、燕麦片、烤豆、金枪鱼、火腿和浓缩通心粉
铬:全谷物、奶酪、豆类、酵母
矿物质的功能
钾有助于正常维持/执行肾脏、心脏、肌肉和神经。
钠有助于维持神经和肌肉功能。它还调节体内的液体水平。
钙有助于形成骨骼和牙齿。它有助于肌肉放松和收缩。它有助于释放荷尔蒙并支持神经系统和心血管健康。它有助于酶功能。
磷对骨骼和牙齿有好处。它有助于酸碱平衡。它有助于能量代谢。
镁有助于调节血压并产生蛋白质、骨骼和 DNA。它有助于调节心跳。
锌有助于维持免疫系统和愈合伤口。
铁有助于形成红细胞、结缔组织和激素。它有助于将氧气从肺部输送到组织和肌肉。
锰有助于血液凝固并产生能量。它维持免疫系统。
铜有助于形成结缔组织和血管。它有助于脂质代谢。
硒可防止细胞损伤。它具有抗氧化特性。它降低了患癌症的风险。它可以防止 HIV 复制。
铬有助于激活酶作用。它从血液中去除葡萄糖。
矿物质的高摄入量和低摄入量效果
高钾摄入量可能导致肾脏疾病,而低钾摄入量可能导致高血压、中风和肾结石。
低钠摄入量可能导致低钠血症,而高钠摄入量可能导致高血压、中风和心血管疾病。
大量摄入钙可能会导致便秘和肾结石。摄入量低可能导致骨骼和牙齿脆弱。
磷摄入不足可能会导致骨骼疾病、贫血和皮肤灼热感。它可能会影响食欲和肌肉力量。
低镁摄入量可能会导致虚弱、恶心、疲倦和不安的睡眠状况,而高摄入量可能会导致心脏问题。
锌摄入量低可能会导致脱发、皮肤溃疡和腹泻,而锌摄入量高可能会导致消化问题和头痛。
铁摄入量低可能会导致缺铁,例如贫血疾病和虚弱,而铁摄入量高可能会导致消化问题。
锰摄入量低可能会导致儿童骨骼脆弱、皮疹和情绪波动,而锰摄入量高可能会导致震颤和肌肉痉挛。
高铜摄入量可能会导致肝损伤、腹痛、恶心和腹泻,而低摄入量可能会导致疲倦、皮肤变浅和高胆固醇。
高硒摄入量可能会导致腹泻、易怒、皮疹和头发或指甲变脆,而低摄入量可能会导致心脏病、男性不育和关节炎。
2
维生素
维生素,有机化合物,是我们身体必需的营养素。维生素有两种类型:水溶性维生素和脂溶性维生素。
脂溶性维生素
它包括维生素A、D、E和K。
维生素A:
维生素A以两种形式存在:视黄醇(肝脏、肉类、肥鱼、鸡蛋和乳脂)和β-胡萝卜素(深绿色蔬菜和亮黄色水果)。
维生素D:
人体必需的两种维生素D是维生素D2(从植物甾醇和麦角甾醇中获得的骨化醇)和维生素D3(存在于动物脂肪和鱼油中的胆钙化醇)。
成人每天应摄入2.5微克维生素D。阳光可以通过将体内胆固醇转化为维生素D来提供维生素D。
来源:例如肝脏、蛋黄、黄油、奶酪和一些鱼类。
维生素E:
它也被称为生育酚。它是一种抗不育维生素。
成人应每天摄入10毫克维生素E。
来源:例如植物油、氢化脂肪、深绿叶蔬菜、坚果、全谷物、豆类和富含多不饱和脂肪酸的食物。
维生素K:
它是一种抗出血维生素。它是酶的辅助因子,称为凝血酶原。
它们有两种类型:叶绿醌-K1(新鲜和深绿叶蔬菜)和马萘醌-K2(由肠道中的细菌合成形成)。
来源:新鲜和深绿叶蔬菜、水果、卷心菜、花椰菜、牛奶。
水溶性维生素
它包括维生素B组(B1、B2、B3、B12、叶酸)和维生素C。
维生素B1:
它也被称为硫胺素,对碳水化合物的利用至关重要。成人应每天摄入1-2毫克维生素B1。
来源:未碾磨的谷物、豆类、坚果和肉、鱼、蛋、肝、深绿叶蔬菜、水果、干酵母、牛奶。
维生素B2:
也被称为核黄素。成人应每天摄入1-2毫克。
来源:牛奶和奶制品、鸡蛋、肝脏、绿叶蔬菜、小麦、小米和豆类。
维生素B3:
它也被称为烟酸。成人应每天摄入20毫克。
来源:全麦谷物、坚果、豆类、肉类、肝脏、鸡肉、干酵母、花生和玉米。
维生素B6:
它也被称为吡哆醇。成人应摄入2毫克/天的吡哆醇,而在怀孕和哺乳期间应摄入2.5毫克/天。
维生素B12:
维生素B12是一种具有钴原子的复杂有机金属化合物。
来源:肝脏、鸡蛋、鱼和牛奶。
叶酸:
成人应摄入100μg/天。
来源:绿叶、蔬菜、肝脏、鸡蛋、豆类、谷物、坚果、全谷物和油籽。
维生素C:
也被称为抗坏血酸,对热敏感。成人应每天摄入40毫克维生素C。
来源:柑橘类水果、西红柿、绿叶蔬菜、卷心菜、发芽的豆类、肝脏和肾脏。
维生素的功能
维生素A是正常视力所必需的,因为它会产生视网膜色素。它有助于骨骼生长。它可以预防支气管癌。它起到抗感染剂的作用。它有助于重建腺体上皮组织。
维生素D有助于促进肠道对钙和磷的肠道吸收。它还刺激正常的矿化,增强骨骼重吸收,并影响胶原蛋白的成熟。
维生素D有助于改善骨骼。它有助于体内钙的吸收。
维生素E具有抗氧化特性。它有助于降低退行性疾病的风险。它可以防止脂质氧化并保持细胞完整性。
维生素K可防止血液凝固,它有助于肝脏功能。
维生素B1有助于神经系统的功能。它有助于碳水化合物的新陈代谢。
维生素B2有助于形成能量。它有助于合成糖原和红细胞生成。
维生素B3有助于 DNA 合成和修复。它有助于控制血液中的胆固醇和脂质。
维生素B6有助于氨基酸、脂肪和碳水化合物的新陈代谢。
维生素B12有助于合成 DNA 和脂肪酸。
维生素C有助于氧化组织。它有助于形成胶原蛋白。
叶酸有助于合成 DNA。它有助于制造红细胞。
维生素缺乏的危害
维生素A缺乏可导致夜盲症、结膜干燥症、偏心斑、角膜软化症、角膜溃疡和角膜干燥症。
维生素D缺乏会导致佝偻病和骨软化症。它可能导致骨骼退化。
维生素E缺乏可能会减少红细胞并增加肌酸排泄,表明肌肉受损。
维生素K缺乏可能导致内出血和无法控制的出血。
维生素B1缺乏导致脚气病,韦尼克脑病。
维生素B2缺乏可引起局限性皮肤、鳞屑性皮炎、角膜周围血管形成和角膜炎。
维生素B3缺乏可引起胃肠道疾病、腹泻、食欲不振、恶心、呕吐、神经系统表现、记忆力减退和色素沉着鳞状皮肤。
维生素B12缺乏可引起巨幼红细胞性贫血问题和脊髓脱髓鞘神经病变。
维生素C缺乏会导致坏血病和伤口愈合不良。
肠道菌群在人体营养代谢中发挥着重要作用。它们能够参与碳水化合物、蛋白质、脂肪等大分子营养的代谢,产生多种代谢产物,如短链脂肪酸等,为宿主提供能量支持。同时,菌群还能影响机体对微量营养素的吸收利用。
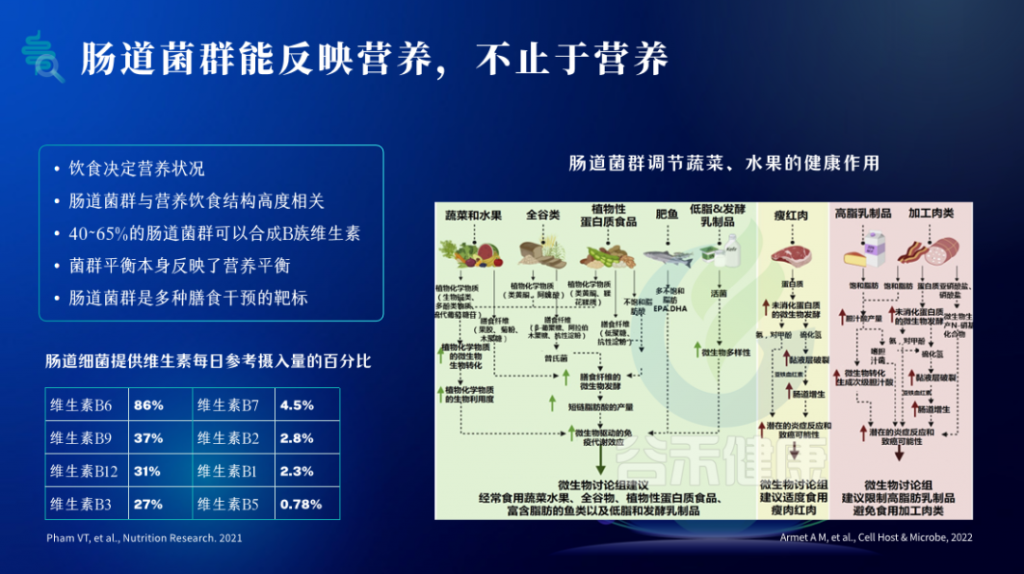
人体肠道菌群的组成和多样性受饮食营养的影响,不同的膳食营养结构会选择性地促进某些菌群的生长。

肠道菌群失衡会增加机体代谢紊乱的风险,导致营养吸收利用障碍,进而引发肥胖、2型糖尿病、心血管疾病等代谢性疾病。同时,肠道菌群紊乱也与肠道营养吸收不良、肠道炎症等相关疾病的发生发展密切相关。
评估人体的宏量营养元素是一个复杂的过程,宏量营养素之间需要保持平衡,并且由于宏量营养素提供能量,因此摄入过多的任何一种营养素可能会提供比身体每天消耗的更多的卡路里。
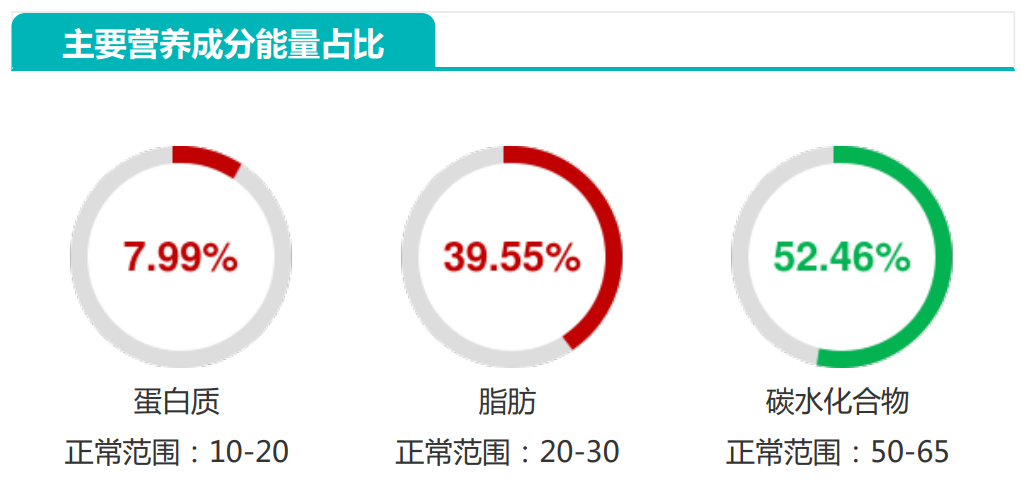
谷禾的健康检测报告评估的3大宏量营养元素:蛋白质,脂肪,碳水化合物是一个百分比的结构,其中一个营养元素太高,其它就会低。
以前我们分享过:
掌握饮食健康:了解你的宏量营养素摄入 如何用宏量营养素创造均衡饮食。
谷禾利用高通量测序和大数据机器学习等相关技术,依托积累的大量菌群和研发数据,为营养评估提供技术支持。
本文内容仅供学习和交流目的,不构成任何形式的医疗建议。
主要参考文献
Costa-Pinto, R., & Gantner, D. (2020). Macronutrients, minerals, vitamins and energy. Anaesthesia & Intensive Care Medicine.
Giovanni Savarino;Antonio Corsello;Giovanni Corsello; (2021). Macronutrient balance and micronutrient amounts through growth and development . Italian Journal of Pediatrics, (), –.
Venn, Bernard J. (2020). Macronutrients and Human Health for the 21st Century. Nutrients, 12(8), 2363–.
Lehninger, A. L., Nelson, D. L., & Cox, M. M. (2000). Lehninger principles of biochemistry. New York: Worth Publishers.
Madigan, M. T., Martinko, J. M., Bender, K. S., Buckley, D. H., & Stahl, D. A. (2015). Brock biology of microorganisms (Fourteenth edition.). Boston: Pearson.
Rodwell, V. W., Botham, K. M., Kennelly, P. J., Weil, P. A., & Bender, D. A. (2015). Harper’s illustrated biochemistry (30th ed.). New York, N.Y.: McGraw-Hill Education LLC.

谷禾健康

2021年6月份,我们分享过一篇“全面认识——肺炎克雷伯菌(Klebsiella pneumoniae) ”的文章,当时也是发现该菌在肠道的人群检出率较高,基于想全面了解该菌,我们查阅整理了很多资料,包括统计了谷禾健康数据库中肺炎克雷伯菌的检出率等,向大家介绍了关于该菌的基本知识,人群分布,感染的症状,分类及来源,传播和易感因素,诊断方法以及治疗及预防。
本文我们要介绍的产气克雷伯菌(Klebsiella aerogenes),是肺炎克雷伯菌(Klebsiella pneumoniae) 的近源菌种,该菌是最近更名的,原来是叫产气肠杆菌。
革兰氏阴性菌的肠杆菌科(Enterobacterales)最初分为三个属:埃希氏菌属(Escherichia)、气杆菌属(Aerobacter)、克雷伯氏菌属(Klebsiella);其中气杆菌属包括A. aerogenes 和阴沟肠杆菌(A. cloacae)。
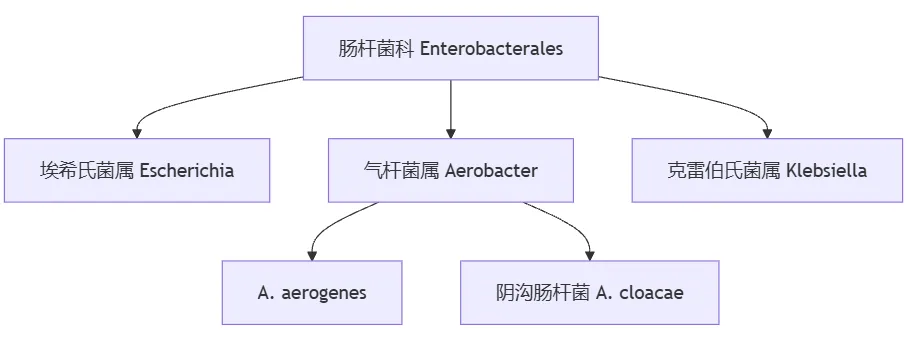
到 1960 年,Aerobacter 已被重新命名为肠杆菌属(Enterobacter)。最近,基于全基因组序列的比较细菌系统发育学表明,产气肠杆菌(E.aerogenes)与肺炎克雷伯菌(K.pneumoniae)的亲缘关系比与肠杆菌属的关系更密切。因此,以前称为产气肠杆菌的细菌更名为产气克雷伯菌(K.aerogenes)。
使用平均核苷酸同一性(ANI)将肠杆菌属的其余成员分为 22 个不同的系统发育组。这 22 个系统发育组统称为阴沟肠杆菌复合体(Ecc)。尽管细菌比较基因组学已经证明产气克雷伯菌和 Ecc 属于不同的系统发育组,但这些遗传差异的临床影响尚不清楚。
本文简单介绍和认识下产气克雷伯菌(K. aerogens) 的作为机会病原体的一些发现,其他着重分享一个有意思的研究结果,即肠道产气克雷伯菌产生高组胺,诱发IBS患者腹痛的证据,原因和干预建议。
K. aerogens
基本特征与临床意义
产气克雷伯菌(K.aerogens),属于肠杆菌科,是一种兼性革兰阴性厌氧菌。它广泛分布于环境中,存在于人体胃肠道中,也是医院常见的机会性病原体。当宿主免疫系统受损或肠粘膜受损时,可能导致呼吸系统、循环系统或泌尿生殖系统感染。
近年来,尽管关于大肠埃希菌和肺炎克雷伯菌的致病性和耐药性的报道越来越多,但关于产气克雷伯菌的报道很少。 既往关于该细菌的临床报告主要为呼吸道、胃肠道、泌尿道和血液感染。与其他肠杆菌科物种相比,产气克雷伯菌更容易导致患者感染性休克甚至死亡。
致病机制与毒力因子
与其他肠杆菌科病原体一样,克雷伯菌的毒力和耐药性很复杂,并受多种因素影响。产生的毒力因子和耐药基因可能因感染部位而异。
克雷伯菌产生的粘附素有助于其进入宿主细胞,细胞表面的荚膜多糖和脂多糖帮助细菌从吞噬作用中逃脱,而毒素或其他细胞外成分则引起粘膜损伤并通过循环传播。
耐药性与治疗策略
近年来,由于抗生素的过度使用,越来越多的克雷伯菌种出现了多药耐药性。不断有报道称,这种新兴病原体的爆发频率很高,其中一些与高死亡率有关,在世界各地的不同临床环境中,例如新生儿、老年和重症监护病房。
根据药敏试验结果表明,产气克雷伯菌分离株是对碳青霉烯类的非耐药细菌,对作为抗感染治疗的美罗培南特别敏感。此外,分离的产气克雷伯菌在亚胺培南中处于中间位置。然而,他们被发现对青霉素耐药,例如氨苄西林和阿莫西林。
一般克雷伯菌相关感染发展迅速,导致多器官衰竭甚至死亡,容易出现耐药菌株。因此,应尽早选择有效的抗生素,并确定剂量和疗程,以尽量减少副作用的发生。
本文主要的分享是基于基于目前发表于科学转化医学《Science Translational Medicine》上的一项有趣的研究,结合谷禾肠道菌群的检测实践检验综合分享。
先说该研究的主要结论:
1. 发现肠道细菌生产的组胺,可以诱发一部分 IBS 患者的腹痛
2. 确定了产气克雷伯氏菌是肠道组胺的主要产生者
组胺可以由许多细菌分泌,但到现在,导致肠道中组胺过量产生的特定微生物一直是个谜。
组胺是免疫细胞释放并参与局部免疫反应的化合物。它也是已知的疼痛介质。近年来,组胺与肠易激综合征(IBS)的关系越来越密切。人们还认为,“组胺不耐受”的各种症状特征可能是由于肠道中组胺分泌过多,压倒了身体分解和代谢组胺的能力。
在本文中,谷禾将带大家了解这些新发现并讨论其影响。首先,简单介绍一下背景知识,解释一下这项最新研究的动机。
一般低 FODMAP 饮食可减少 IBS 患者的尿液组胺。
低 FODMAP 饮食长期以来一直被认为能够帮助缓解 IBS 患者的症状。然而,这些碳水化合物加重肠道症状的确切机制尚不清楚。
2017 年,加拿大麦克马斯特大学的一组研究人员随机分配 IBS 患者食用低或高 FODMAP 饮食。饮食干预后,测量了尿液中的各种代谢物,发现,大约 1/3 的 IBS 患者在基线时尿组胺水平较高,而在低 FODMAP 饮食后,尿组胺水平降低了 8 倍。
饮食–微生物群相互作用导致肠道敏感性增加
基于他们最新研究的这些发现,研究人员将一名尿组胺含量高的 IBS 患者,一名尿组胺含量低的 IBS 患者,一名健康的对照受试者的肠道微生物群移植到三组独立的无菌小鼠中。
经过一段时间的定植期后,让微生物群在小鼠中扎根,它们进一步将每组小鼠一分为二,以接受低或高可发酵碳水化合物饮食。
结果发现只有用高尿组胺的 IBS 患者的微生物群定植并喂食高可发酵碳水化合物饮食的小鼠组增加了肠道敏感性。
产气克雷伯菌是IBS患者的主要组胺产生者
然后,研究人员回去更仔细地分析供体的粪便。尿组胺含量高的 IBS 患者的肠道微生物组产生组胺明显更多。他们着手确定哪些微生物可能是罪魁祸首。
研究人员总共分离了 164 种不同的肠道微生物,并测试了它们产生组胺的能力。
作者报告说:
在尿组胺水平高的 IBS 患者中,产气克雷伯菌是主要的组胺产生者。事实上, 产气菌产生的组胺比任何其他细菌分离物多 100 倍。
在 IBS 患者和低尿组胺患者中,屎肠球菌(Enterococcus faecium)和粪肠球菌(Enterococcus faecalis)是组胺的主要产生者。
但该论文没有包括测试的细菌及其产生组胺的能力的完整列表。例如,以前的研究强调Morganellamorganii、Raoultella planticola、 Raoultella ornithinolytica是肠道组胺的潜在生产者,但在结果或讨论中没有提到这种微生物。
在选择测试的微生物时,其他组胺生产者(也许是那些不太容易培养的)也完全有可能被遗漏。尽管如此,产气克雷伯菌(K.aerogenes) 在 IBS 患者的三个不同队列中含量很高,并且在低 FODMAP 饮食中减少。此外,用产气克雷伯菌定植的无菌小鼠产生的组胺是用另一种克雷伯氏菌定植的小鼠的 77 倍。
pH值很重要:为什么结肠酸度必不可少?
产气克雷伯菌是如何产生组胺的呢?查阅发现该菌使用一种称为组胺脱羧酶(HDC)的酶。HDC酶将组氨酸(饮食中的一种必需氨基酸)转化为组胺。(谷禾以前文章可以关注看下)
由于以前的研究发现这种酶的活性受 pH 值的影响,研究人员决定测试产气克雷伯菌产生的组胺是否取决于环境的酸度。
产气克雷伯菌在pH值为7.0时产生最多的组胺,而在pH值低于6.0或高于8.0时几乎没有组胺。
应该这是关键,因为结肠的 pH 值在 5.5 到 7.5 之间,具体取决于发酵水平。pH 值处于此范围的下限通常与更好的预防症状有关。换句话说,降低结肠的 pH 值(增加其酸度)可能是减少产气克雷伯菌产生肠道组胺的一种方法。
乳酸杆菌:一种防止克雷伯氏菌的方法
结肠 pH 值的主要决定因素之一是乳酸水平。当研究人员查看“人源化”小鼠的肠道样本时,他们发现从尿组胺含量高的 IBS 患者那里获得微生物群的小鼠的乳酸水平要低得多。与此同时,乳酸杆菌等产乳酸菌的水平较低。
为了进一步检查这种关系,研究人员培养了有或没有乳酸杆菌混合物的产气克雷伯菌。正如预期的那样,乳酸杆菌减少了组胺的产生,该实验室还在小鼠模型中证实了这些结果。
但本研究中使用的两种乳酸杆菌没有得到很好的表征。第一种是动物乳杆菌(L.animalis) 或鼠乳杆菌(L.murinus)的菌株,而第二种与嗜酸乳杆菌 (L.acidophilus) 和乳酸乳杆菌(L.lactis) 的关系更密切。
尽管如此,这表明一些乳酸杆菌可以调节产气克雷伯菌产生组胺,很可能是通过产生乳酸,从而降低pH值和组胺脱羧酶的活性。
但是要注意,许多乳酸杆菌对于有组胺不耐受或肥大细胞活化症状的人来说可能也是有问题的。稍后会详细介绍。
到目前为止,我们一直在谈论结肠中的克雷伯氏菌活动。但是小肠中的克雷伯氏菌呢?
小肠中的克雷伯氏菌
虽然一般小肠通常不会含有太多克雷伯氏菌,但至少有一项研究表明,克雷伯氏菌在有胃肠道症状的个体的十二指肠(小肠的上三分之一)中更为普遍,且它们可以破坏整体小肠微生物群结构。
初步证据表明,其中一些克雷伯氏菌可能起源于口腔。换句话说,唾液可能成为克雷伯氏菌持续传播到肠道的储存库,如果肠道环境允许,它们有机会将在那里蓬勃发展。
小肠部分的酸性也比结肠低得多。回肠(小肠最远端的部分)的 pH 值高达 7.4-7.8,这个水平可以支持产气克雷伯菌产生组胺。
也许小肠中产气克雷伯菌的机会性过度生长可能导致总体高水平的组胺。
细菌组胺将肥大细胞吸引到肠道
研究人员再次转向小鼠,以确定细菌组胺如何引起内脏疼痛。
他们发现细菌组胺通过组胺H4 受体发出信号,激活肥大细胞并将其吸引到结肠。这些肥大细胞贡献了更多的组胺和其他疼痛信号分子,触发肠道中的神经细胞并引起腹痛(详细可以看谷禾以前关于组胺的文章)。
因此,阻断 H4 受体可能代表了一种减轻高组胺患者症状的策略。这将防止肥大细胞募集到结肠和宿主产生额外的组胺。
如何检测细菌性组胺相关 IBS?
说到这,大家最感兴趣的应该如何知道你是否属于 IBS 患者的特定亚群呢?虽然需要更多的研究来准确定义此类 IBS 的特征,但指标可能包括:
有哪些干预措施?
以下我们整理了一些可能对患有这一特定 IBS 的人有帮助的潜在干预措施建议。(注意:此信息不应被视为医疗建议)。
低 FODMAP 饮食:低可发酵低聚糖、双糖、单糖和多元醇(FODMAP) 的饮食可以迅速降低肠道组胺水平,减少产气克雷伯菌的丰度,并暂时缓解腹痛。
恢复肠道酸度:较低的 pH 值被证明可以显著减少产气克雷伯菌产生的组胺。
以下可能对增加肠道酸度最有效,但组胺敏感个体可能无法耐受;仅在耐受性良好的情况下使用:
组胺敏感个体可能耐受性更好的其他干预措施:
1)肠道微生物群是组胺的重要来源:虽然传统上肥大细胞被认为是组胺的主要来源,但研究结果表明肠道微生物群是一个重要的来源。
2)产气克雷伯菌(Klebsiella aerogenes, K. aerogenes) 是 IBS 患者组胺升高的主要生产菌。产气克雷伯菌可以在肠道中募集和激活肥大细胞,导致腹痛,也可能参与以高组胺水平为特征的其他疾病,但需要更多的研究。
3)对于一部分组胺水平较高的肠易激综合征(IBS)患者来说,通过靶向治疗降低体内产气克雷伯菌的水平,可能会带来临床症状的改善。 产气菌或抑制组胺信号传导:将产气克雷伯菌或具有类似 HDC 活性的细菌鉴定为肠道中组胺的来源,可以指导饮食推荐、微生物群定向疗法或在患有慢性腹痛的 IBS 患者中使用H4 受体拮抗剂。
本文内容仅供学习和交流目的,不构成任何形式的医疗建议。
主要参考文献
De Palma, G. et al. Histamine production by the gut microbiota induces visceral hyperalgesia through histamine 4 receptor signaling in mice. Science Translational Medicine 14, eabj1895 (2022).
McIntosh, K. et al. FODMAPs alter symptoms and the metabolome of patients with IBS: a randomised controlled trial. Gut 66, 1241–1251 (2017).
Barcik, W. et al. Bacterial secretion of histamine within the gut influences immune responses within the lung. Allergy 74, 899–909 (2019).
Barcik, W. et al. Histamine-secreting microbes are increased in the gut of adult asthma patients. Journal of Allergy and Clinical Immunology 138, 1491-1494.e7 (2016).
Lucy et al. The gut bacteria that produce histamine in IBS – revealed. Lucymailing. 2022.
Barlow, J. T. et al. Quantitative sequencing clarifies the role of disruptor taxa, oral microbiota, and strict anaerobes in the human small-intestine microbiome. Microbiome 9, 214 (2021).
Atarashi, K. et al. Ectopic colonization of oral bacteria in the intestine drives TH1 cell induction and inflammation. Science 358, 359–365 (2017).
Koziolek, M. et al. Investigation of pH and Temperature Profiles in the GI Tract of Fasted Human Subjects Using the Intellicap(®) System. J Pharm Sci 104, 2855–2863 (2015).
Wesevich A, Sutton G, Ruffin F, Park LP, Fouts DE, Fowler VG Jr, Thaden JT. Newly Named Klebsiella aerogenes (formerly Enterobacter aerogenes) Is Associated with Poor Clinical Outcomes Relative to Other Enterobacter Species in Patients with Bloodstream Infection. J Clin Microbiol. 2020 Aug 24;58(9):e00582-20.
Gu, H., Cai, Q., Dai, X. et al. A case report of Klebsiella aerogenes-caused lumbar spine infection identified by metagenome next-generation sequencing. BMC Infect Dis 22, 616 (2022).
Morgado, S., Fonseca, É., Freitas, F. et al. In-depth analysis of Klebsiella aerogenes resistome, virulome and plasmidome worldwide. Sci Rep 14, 6538 (2024).
Niedzielin, K., Kordecki, H. & Birkenfeld, B. A controlled, double-blind, randomized study on the efficacy of Lactobacillus plantarum 299V in patients with irritable bowel syndrome. Eur J Gastroenterol Hepatol 13, 1143–1147 (2001).
Arellano, K. et al. Safety Evaluation and Whole-Genome Annotation of Lactobacillus plantarum Strains from Different Sources with Special Focus on Isolates from Green Tea. Probiotics Antimicrob Proteins 12, 1057–1070 (2020).
Shen, F. et al. Vinegar Treatment Prevents the Development of Murine Experimental Colitis via Inhibition of Inflammation and Apoptosis. J. Agric. Food Chem. 64, 1111–1121 (2016).
Wang, C. C. et al. Sodium butyrate enhances intestinal integrity, inhibits mast cell activation, inflammatory mediator production and JNK signaling pathway in weaned pigs. Innate Immun 24, 40–46 (2018).
Diakos, C. et al. n-Butyrate inhibits Jun NH(2)-terminal kinase activation and cytokine transcription in mast cells. Biochem Biophys Res Commun 349, 863–868 (2006).
Lewis, S. J. & Heaton, K. W. Increasing butyrate concentration in the distal colon by accelerating intestinal transit. Gut 41, 245–251 (1997).
Paulose, J. K., Wright, J. M., Patel, A. G. & Cassone, V. M. Human Gut Bacteria Are Sensitive to Melatonin and Express Endogenous Circadian Rhythmicity. PLOS ONE 11, e0146643 (2016).
Yang, C.-C. et al. Quercetin inhibits histamine-induced calcium influx in human keratinocyte via histamine H4 receptors. International Immunopharmacology 96, 107620 (2021).
谷禾健康
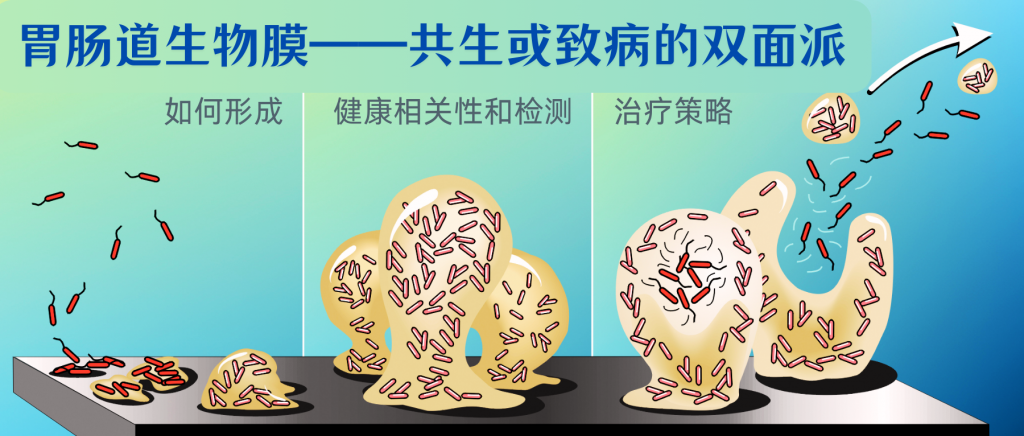
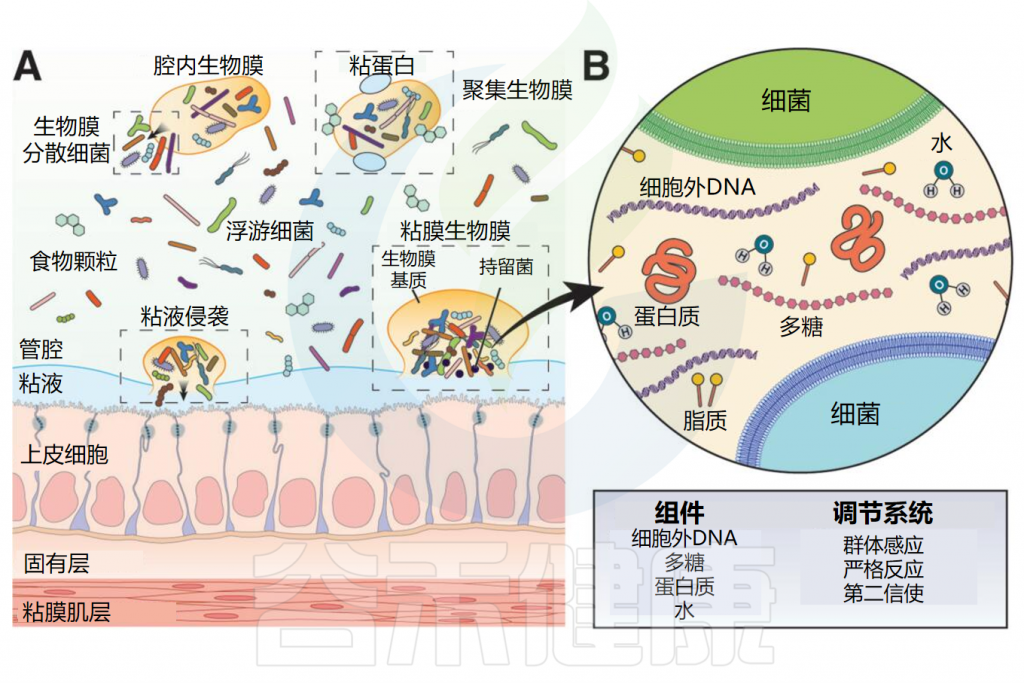
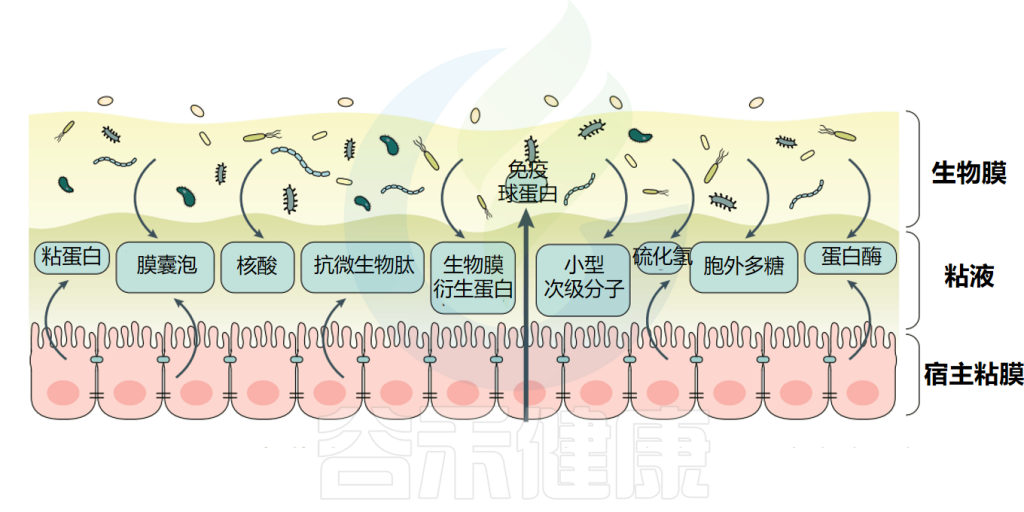
胃肠道是众多微生物的栖息地,这些微生物既相互关联又各具特点。部分微生物以自由漂浮的形式存在于管腔中,另一些则聚集和吸附在粘膜或组织表面形成生物膜这一结构。
胃肠道生物膜是基质封闭、高度异质性和空间组织化的多微生物群落,由微生物群体及其包被的细胞外聚合物和基质网组成,它们彼此黏附或者黏附到组织或器官的表面,可以覆盖胃肠道大面积区域。
胃肠道疾病的发生与致病性生物膜有关,例如炎症性肠病、肠易激综合征、消化性溃疡病、胃炎、胃酸缺乏和胃肠道癌症。形成与疾病相关生物膜的细菌菌株包括脆弱拟杆菌、艰难梭菌、致病性和肠粘附性大肠杆菌、活泼瘤胃球菌和幽门螺杆菌。除了引起胃肠道疾病外,致病性生物膜还可能导致肠道微生物群失调、粘液破坏和上皮细胞受损。
生物膜在溃疡性结肠炎和肠易激综合征患者中非常普遍,可以在肠镜检查期间观察到这种生物膜,但许多医师可能还没有意识到它们的生物学和临床重要性。胃肠道生物膜具有保护性的细胞外基质,这使得它们对抗生素耐药性增强,变得难以治疗。
但并非所有胃肠道生物膜都是致病性的,共生生物膜使宿主获取营养效率提高,有助于肠道吸收;能够利用体内老化细胞并产生能量;还能够通过物理结构、化学成分和特定代谢活动,作为对抗环境分子、免疫细胞、捕食性原生动物和其他病原微生物的保护屏障,来限制病原菌的定植和侵袭。这种保护机制有助于维持肠道微生物群落的稳定性和抵抗力。
生物膜有希望作为胃肠道疾病和内窥镜病理检测的新型生物标志物。因此,清楚地了解体内的生物膜,然后对致病性生物膜进行治疗或对共生生物膜进行保护和修复对人体肠道健康甚至全身健康都非常重要。
本文涵盖胃肠道生物膜的形成、外观和检测、生物膜的疾病和临床相关性以及目前的一些治疗方法。未来对生物膜性质、组成和临床相关性的研究将为肠道生理学提供新的认识,并为胃肠道疾病的治疗提供潜在的新选择。
1
什么是生物膜?
胃肠道微生物的生物膜是由微生物群体及其包被的细胞外聚合物和基质网组成,它们彼此黏附或者黏附到组织或器官的表面,以此在生长过程中适应生存环境,是一种特殊的细菌生存形式。
▸ 肠道粘膜表面三种细菌生活方式
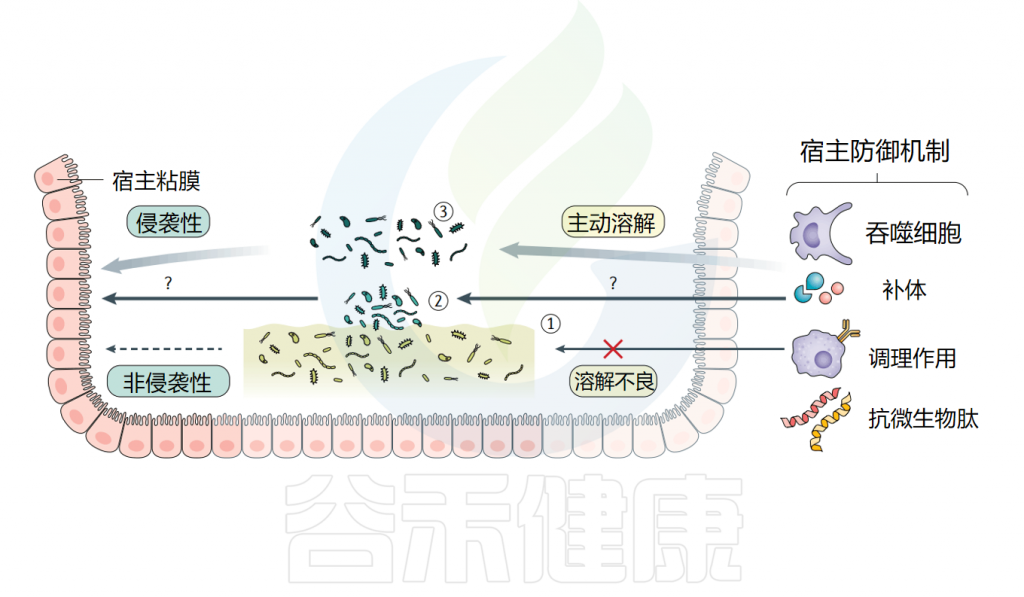
生活在胃肠道表面的微生物可能会采取三种不同的生活方式之一。
生活方式1:它们可以组织成一个交流细胞网络,导致一种群落行为,称为生物膜表型。
生活方式2:它们可以从生物膜中分散,并向管腔或宿主迁移,称为生物膜分散。
生活方式3:或者他们可以作为自由生活、自由漂浮的浮游表型。
细菌生活方式及其与宿主的关系
doi: 10.1038/s41575-020-00397-y.
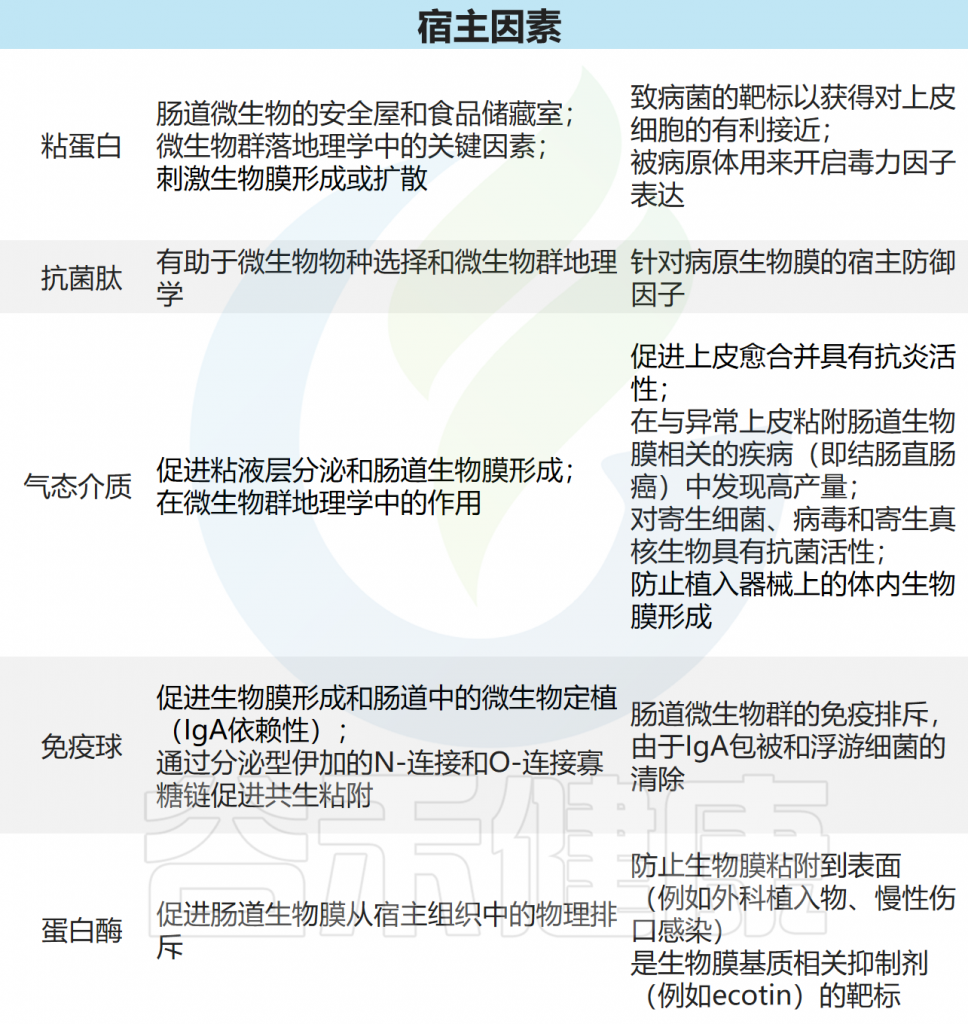
这些微生物群的生活方式与固有特性(运动,粘附性和代谢)可以影响宿主对它们的不同反应。
2
生物膜的构成
生物膜基质主要由水和生物聚合物组成,包括多糖、蛋白质、脂质和细胞外DNA,形成水凝胶状结构。
细菌细胞嵌入该基质中,共同形成生物膜。生物膜使用高效的细菌调节途径,如群体感应、严格反应和第二信使来调节生物膜的组织、结构和行为。
胃肠道生物膜外观和基质组成
Jandl B,et al.Gastroenterology.2024
(A)肠道细菌和生物膜外观;(B)生物膜基质组成
▸ 沿着胃肠道,生物膜的数量和厚度逐渐增加
在整个消化道中,生活在粘膜表面的共生微生物群由沿着纵向(中左)和横向(中右)轴的生物分层的群落组成。从胃到结肠,微生物密度和多样性增加。
粘膜微生物群在消化道形成大小不一的生物膜聚集体,在小肠中有更松散的粘附聚集体,在大肠起始处形成较为密集均匀的生物膜群落,在结肠中形成一个连续的凝胶形成层。在整个消化道中,微生物生物膜与粘蛋白聚集体和食物颗粒密切相关。
胃肠道生物膜表现为(1)具有富含粘蛋白基质的粘膜生物膜;(2)粘蛋白聚集体周围的生物膜簇;(3)粘附在食物颗粒上的生物膜;(4)这些形式的混合版本。
微生物群生物膜遍布胃肠道
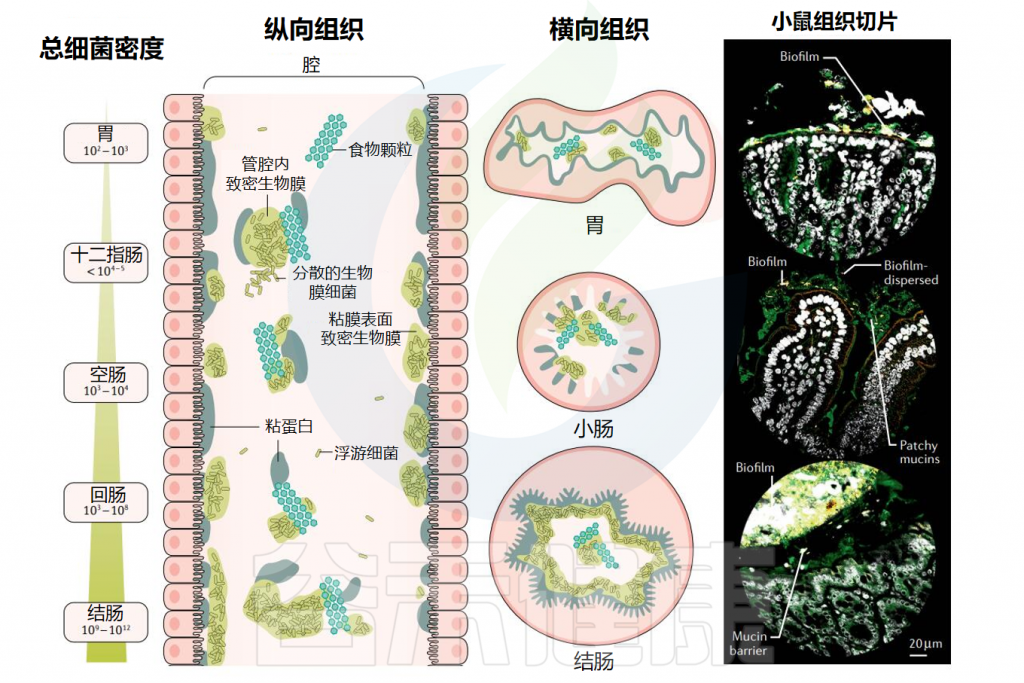
doi: 10.1038/s41575-020-00397-y.
3
生物膜对宿主的影响
生物膜的一些特性
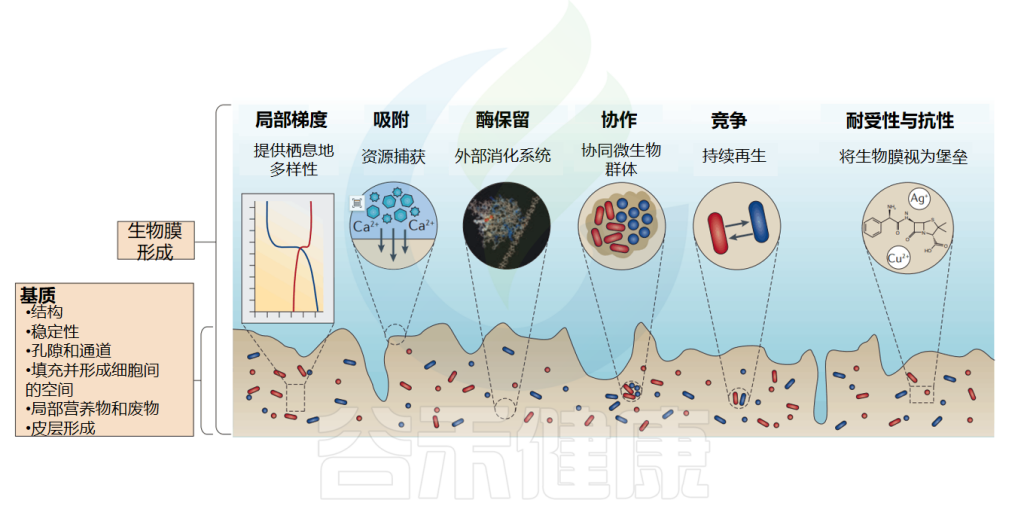
doi: 10.1038/nrmicro.2016.94.
① 细菌抗生素耐药性增强,消除病原菌更困难
与自由生活的细菌细胞相比,生物膜的一大特点是对抗生素和其他抗菌素的耐药性或耐受性增强。
生物膜可以以一种称为扩散反应抑制的形式,淬灭通过生物膜扩散的抗菌物质的活性,这种抑制形式可能将抗微生物药物的有效浓度降低到不致死浓度。
受基质扩散反应抑制的抗菌剂包括有毒金属,如铜,其与Erwinia amylovora生物膜基质中的多糖络合以保护细菌免受铜胁迫。
生物膜包含大量处于”静止期”的细胞,这些细胞对许多依赖细菌细胞代谢来获得活性的抗微生物药物的敏感性降低。对于处于静止期的生物膜中的细菌,至少有1%对抗生素产生抗药性。随着时间的推移,生物膜中大量的细胞进入静止期。随着生物膜的老化,一些抗生素(万古霉素)的杀伤效率显著降低。
生物膜中细胞对抗菌剂的抗性增强另一种机制是通过水平基因转移抗性基因。例如,对几种抗生素具有抗性的基因质粒很容易转移到大肠杆菌(E.coli)和P.putida中。
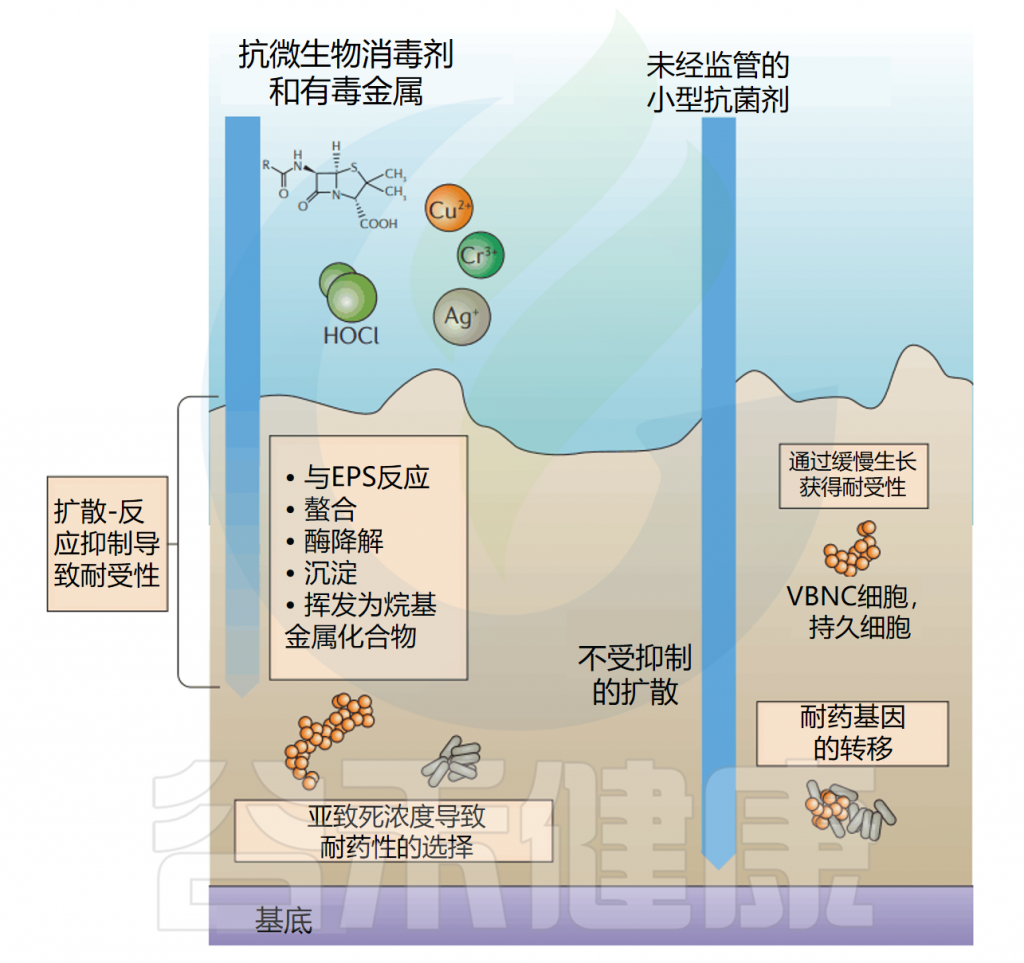
doi: 10.1038/nrmicro.2016.94.
生物膜中的细菌对抗生素的耐药性增强,使得临床上治疗一些能够形成生物膜的致病菌感染更加困难。
② 获取营养效率提高,可能有助于肠道吸收
营养获取是所有生物的基本过程,生物膜具有一种非常有效的营养获取策略,超过了自由生活的细菌。
生物膜是复杂的吸附系统,在生物膜的细胞质、细胞壁和基质的胞外聚合物(EPS)中具有不同的吸附机制和结合位点,这意味着生物膜中的细胞可以捕获和积累非常广泛的营养物质,即使浓度很低。这种强大的获取能力使生物膜即使在高度缺营养的环境中也能生长。
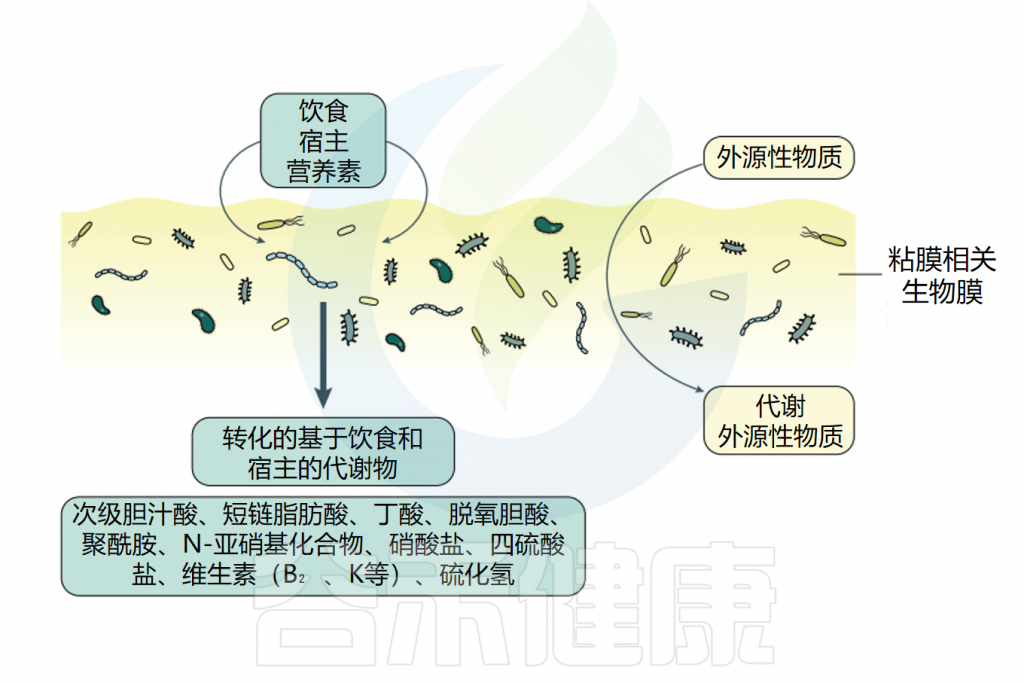
doi: 10.1038/s41575-020-00397-y.
注意:强大的捕获能力使有毒物质也更易积累!
但生物膜的吸附不是化合物特异性的,这意味着不仅营养物质,而且有毒物质都可以在生物膜中积累,在胃肠道生物膜中发现了红霉素琥珀酸乙酯、乙酰氨基酚、酸性药物、甾体激素和4-壬基酚合物等化合物。
③ 回收裂解细胞并产生能量,有效利用体内老化细胞
当细胞腐烂和分解时,它们的碎片留在基质中,被存活的细胞作为营养物质“蚕食”。这一过程已经在枯草芽孢杆菌(B.subtilis)生物膜中进行了详细的研究。
结果表明,裂解细胞中的DNA是磷、碳和能量的来源。铜绿假单胞菌(Pseudomonas aeruginosa)已被证明能够在生物膜中特异性地产生细胞外DNA酶,利用裂解细胞中的DNA作为营养来源。生物膜可以被视为一个高效的细胞碎片回收利用场。
④ 作为一种保护屏障,有助于人体肠道健康
生物膜是一种具有化学成分和特定代谢的物理结构,起着保护屏障的作用,可以抵御环境分子、免疫细胞、捕食性原生生物和细菌。
无论是微生物、膳食分子、污染物还是外来生物,要么可以自由地扩散穿过生物膜并到达宿主上皮,要么被生物膜阻断,生物膜作为一个紧密的屏障。这些腔内化合物可以被生物膜过滤,生物膜只允许某些分子通过,从而起到选择性过滤器的作用。
生物膜中的细菌拥有许多竞争策略,例如快速生长以获得营养,直接攻击以将其他竞争物种排除在环境之外,从其他竞争物种中获益或剥削其他竞争物种。
这种生物膜诱导的对入侵者的保护作用可以通过肠道微生物群对肠道病原菌的定殖抗性来证明。这种抗性在小鼠体内通过直接机制(如细菌素的产生、短链脂肪酸的产生、胆汁酸的转化和VI型分泌系统的表达)和间接机制(宿主生理和免疫的调节)介导。
生物膜通过物理结构、化学成分和特定代谢活动,作为对抗环境分子、免疫细胞、捕食性原生动物和其他细菌的保护屏障。这种保护机制有助于维持肠道的稳定性和抵抗力。
⑤ 多微生物相互作用,维持生态平衡
胃肠道表面的微生物群包含古细菌、原核生物和真核生物和病毒。肠道生物膜内的微生物相互作用,并与人体细胞相互作用。这些跨“区域”的相互作用可能在维持消化系统健康方面起着重要作用,当这些体内平衡相互作用被破坏时,可能在疾病中起着重要作用(称为失调)。
越来越清楚的是,这些微生物群与宿主的相互作用高度依赖于细菌群落作为生物膜结构的性质和空间组织。
⑥ 影响药物的活性,可能导致失效或效率提高
治疗药物可改变动物模型和人类肠道微生物群的组成,但肠道微生物群本身也参与药物加工。这种代谢功能对药物的有效性和安全性有重要影响。
肠道微生物群确实可以直接代谢外源性物质(例如胺碘酮、他克莫司、地高辛等),从而改变其化学性质、稳定性、生物利用度和潜在的生物效应。
因此,由微生物群驱动的外源性物质加工可能会导致不必要的不良反应,导致分子失效,或相反地导致更具活性和效率的分子。这一观察结果对人类使用药物的建议和剂量提出了严重的问题,特别是考虑到其中一些药物由于毒性而必须仔细监测。
胃肠道内的不同环境导致不同的生物膜分类组成以及不同的代谢过程。这一观察结果增加了试图解决微生物群对外源或药物加工的影响的复杂性。
4
生物膜的生命周期
生物膜生命周期
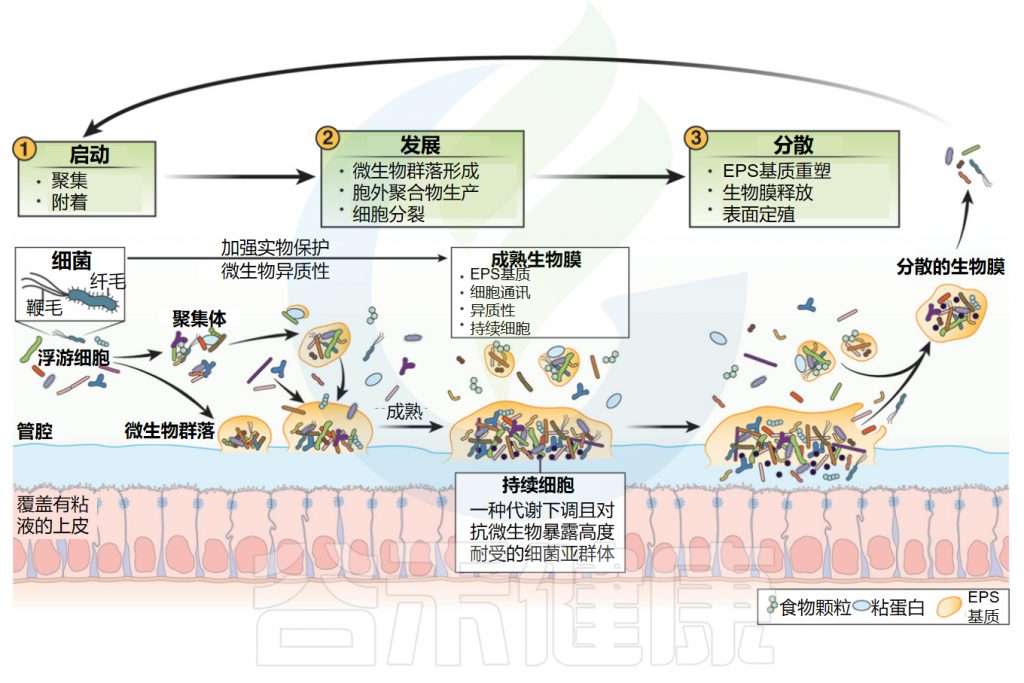
Jandl B,et al.Gastroenterology.2024
生物膜的形成、生长和增殖是生物膜生命周期的关键部分。生物膜生命周期的三个阶段包括以下内容。
(1)起始:细菌使用表面表达的粘附蛋白、鞭毛和菌毛附着在粘膜表面或聚集体(彼此或管腔内容物),如未消化的食物颗粒或宿主粘蛋白上,形成微菌落。
(2)发育:粘液附着的微菌落开始细胞分裂并建立由胞外聚合物(EPS)组成的EPS基质,该基质具有支持细菌共存和有效通讯的异质化学和物理微环境。
生物膜生长和发育是一个动态过程,其中管腔浮游细菌可以迁移到已建立的生物膜结构中,管腔细菌生物膜聚集体通过团聚膨胀,非表面附着的聚集体附着在粘膜生物膜上。持久性细胞形成于营养缺乏区域,通常位于成熟生物膜的核心,对环境压力和抗菌素暴露表现出高度耐受性。
(3)扩散:胞外聚合物(EPS)基质重塑有助于释放生物膜分散的聚集体,这些聚集体可以在未感染的粘液中定植。由于肠道蠕动,肠道中的扩散方向从近端区域到远端区域发生。分散的生物膜是一种独特的表型,有助于生物膜沿肠道扩展。
生物膜在肠道和整体健康中发挥重要作用,通过提供物理屏障、维持生态平衡、促进营养竞争和参与代谢过程等机制,有助于维持健康。
但生物膜相关感染在临床上具有重要意义,因为大多数持续性感染源于生物膜。研究发现生物膜与炎症性肠病(IBD)、癌症和胃肠道感染相关,并与分类学组成变化、抗生素耐药性提高以及病原体的生物膜分散有关。
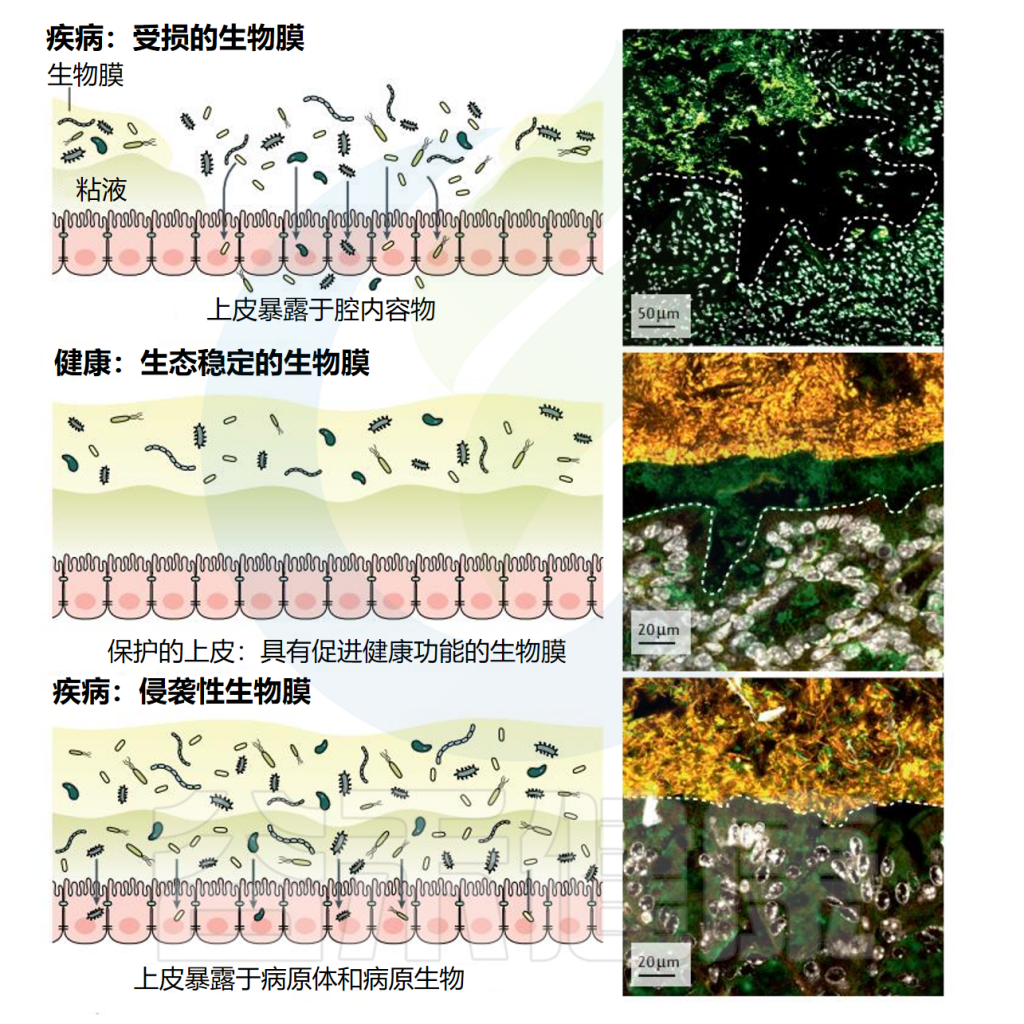
编辑
doi: 10.1038/s41575-020-00397-y.
研究生物膜在疾病中的作用,可能会为胃肠病学带来重要的临床发现。
1
胃肠道感染
人类胃肠道可被各种肠道病原体定植,这些病原体可导致各种疾病,从无症状定植(如幽门螺杆菌)到轻度症状和自限性(如弯曲杆菌、螺旋体门和幽门螺杆菌),以及潜在的危及生命的慢性感染(如耐药肠球菌和艰难梭菌引起的相关感染)。
◮ 病原体可以形成有害生物膜并释放毒素
多项研究表明,这些肠道病原体(如幽门螺杆菌、肠球菌、艰难梭菌和艰难梭菌)在能够有效形成生物膜。胃肠道感染的动物模型显示出有害生物膜菌落的组织学特征,这些菌落密集堆积并粘附在上皮表面,例如胃中的幽门螺杆菌生物膜,以及大肠中的空肠弯曲菌和艰难梭菌生物膜。
这些病原体在生物膜中可能释放毒素,导致局部组织的炎症和损伤,进而引发发热、溃疡等并发症。
◮ 生物膜内的病原体耐药性更强,导致持续感染
生物膜内的细菌通常对抗生素具有更高的耐药性,治疗效果降低,增加了治疗的复杂性。并且生物膜中的病原体能够抵抗宿主免疫系统的攻击,使感染难以清除,导致慢性或反复感染。
在人类肠道活检样本中,微生物群的组织学和显微镜染色显示存在致密的粘膜相关生物膜覆盖组织(例如胃溃疡中的幽门螺杆菌生物膜和直肠中的螺旋体生物膜)。
虽然研究已经确立了形成生物膜的肠道病原体与感染之间的联系,但生物膜生活方式本身对感染的慢性和持续性尚未得到充分了解,对抗这种情况的生物膜特定战略仍有待充分评估。
2
炎症性肠病
越来越多的证据支持炎症性肠病(IBD)特异性粘膜生物膜通过多种途径在宿主组织中引发促炎反应。
◮ 炎症性肠病患者形成生物膜的能力更强
分类差异和粘膜相关微生物群的多样性降低与炎症性肠病相关,具体表现为克罗恩病中普拉梭菌丰度降低,而毒力大肠杆菌丰度增加;同时,溃疡性结肠炎和克罗恩病中肠毒性脆弱拟杆菌和铜绿假单胞菌的丰度也有所增加。
炎症性肠病患者的活检样本中,上皮粘附生物膜的患病率高于健康对照者。与健康组织的微生物群相比,IBD患者的粘膜微生物群在体外产生更大的生物膜。此外,肠球菌和从克罗恩病患者分离的粘附侵袭性大肠杆菌在肠上皮细胞系培养物上形成生物膜的能力更强。
◮ 炎症性肠病相关生物膜的细菌可以作为病原体
此外,来自炎症性肠病相关生物膜的生物膜分散细菌可以在体内和体外成为侵袭性病原体,这一现象可能在IBD的病理生理中起致病作用。
黏液共生微生物(如嗜黏蛋白阿克曼菌和瘤胃球菌科)的丰度改变和释放蛋白酶和糖苷酶的细菌(如卟啉单胞菌、粘附侵入性大肠杆菌和拟杆菌)的生物地理重新定位也可能促进邻近共生微生物进入肠上皮表面。
来自新发儿科克罗恩病患者多个胃肠道位置的样本显示细菌过度生长,包括肠杆菌科、巴氏杆菌科、韦荣氏菌科和梭杆菌科,以及丹毒菌门、拟杆菌门和梭状芽胞杆菌门的丰度降低,与疾病类型相关。
与健康对照相比,上皮粘附细菌越来越多地出现在IBD患者中,IBD患者微生物群产生的生物膜在大小和细胞数量上比健康受试者更突出。
◮ 可能成为炎症性肠病的生物标志物
一项对1426名溃疡性结肠炎(UC)和肠易激综合征(IBS)患者的研究发现,这些患者具有独特的生物膜特征,IBS患者的生物膜发生率为57%,UC患者的发生率为34%,而对照组仅为6%。
此外,生物膜检测呈阳性的患者钙卫蛋白水平较高,生物膜中胆汁酸积聚,这表明炎症和腹泻更严重。在显微镜下,IBD患者来自回肠、升结肠和乙状结肠的活检标本显示细菌浓度显著更高。
随着临床研究的深入,生物膜可能成为内窥镜检查和活检信号易感性及疾病严重程度更具代表性的标志物。
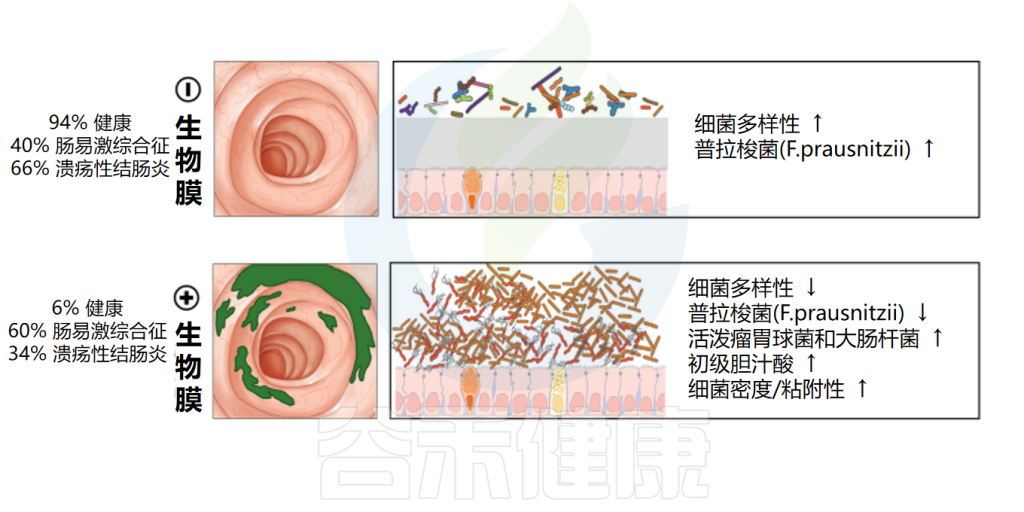
doi: 10.1053/j.gastro.2021.06.024.
◮ 产短链脂肪酸的益生菌抑制病原菌的生物膜
益生菌的突然下降,尤其是那些产生丁酸盐的益生菌,改变了细菌生长模式,从而促进了生物膜的产生。
体外实验表明,短链脂肪酸(SCFA)抑制生物膜的形成,包括大肠杆菌、鼠伤寒沙门氏菌、表皮葡萄球菌和戈登链球菌。并且,随着IBD的进展,SCFA的活跃生产者大大减少。因此,我们认为SCFA是生物膜形成的合理天然抑制剂,有助于解释抗生素治疗对IBD患者的双重影响。
◮ 生物膜的形成使病原菌持续存在,并加速黏膜损伤
在炎症性肠病(IBD)患者活检中经常发现的一种可能病原体是粘附侵袭性大肠杆菌(AIEC)。AIEC可以通过用蛋白酶促进粘蛋白降解来穿透粘液层。然后,它们中的很大一部分通过增加氧化代谢物的使用来竞争肠道中的共生体,这可能会引发慢性炎症和纤维化。一小部分已被证明侵入和复制人巨噬细胞和中性粒细胞,以侵入免疫反应或诱导自噬。
生物膜的形成能力可以将这些过程联系起来。首先,最近的研究显示AICE中的IV型分泌系统(T4SS)在克罗恩病中显著上调,这有助于在上皮细胞表面构建生物膜。
除了粘附和运动外,生物膜还可能与sfa/focDE和ibeA等毒力基因的表达有关。对克罗恩病相关菌株 AIEC LF82 的研究表明,巨噬细胞是生物膜样细菌群落的家园。因此,生物膜的形成使 AIEC 能够在炎症环境中持续存在,加速粘膜损伤,并产生免疫细胞相关的慢性感染库。
3
慢性胃炎
在大多数情况下,慢性胃炎是消化性溃疡和胃癌的主要原因。幽门螺杆菌与胃炎在胃恶性肿瘤的发展中存在密切联系。幽门螺杆菌感染是成人慢性胃炎发展的公认病因因素(在90%以上的病例中)。
◮ 生物膜使幽门螺杆菌能在恶劣环境下生存
最初于2006年在消化性溃疡和尿素酶阳性的个体中,在胃粘膜中拍摄了胃幽门螺杆菌生物膜,胃是生物膜生长的理想环境。生物膜中的幽门螺杆菌细胞在长时间的体外培养下经历形态变化,最终进入球状物状态(幽门螺杆菌的休眠状态),表明生物膜使幽门螺杆菌能在恶劣环境中耐受生存。
虽然在患者中发现的大多数幽门螺杆菌对治疗有反应,但一小部分细菌可能会抵抗它们的作用,导致感染继续。随着抗生素浓度的下降,幽门螺杆菌从球状恢复到螺旋状,重新填充生物膜或引起扩散。
◮生物膜使幽门螺杆菌耐药性增强,不利于彻底根除
在慢性胃炎中,幽门螺杆菌生物膜作为外部因素的物理屏障,它响应降钙素等药物改变其表面结构,从而提高环境适应能力,这可能部分解释了吞噬细胞无法根除在生物膜中发育的细菌的原因。
幽门螺杆菌在处于生物膜状态时对抗生素的耐药性增加,对克拉霉素、阿莫西林和甲硝唑表现出增强的耐药性。
此外,eDNA 可以促进微生物粘附和螯合阳离子以抑制抗生素扩散。除了上述机制外,幽门螺杆菌的表面内毒素和外膜结构可以在免疫系统的恒定压力下通过生物膜形成过程中的基因交换而改变,最终导致幽门螺杆菌疏水性降低,这进一步阻碍了生物膜的药物渗透。
临床信息进一步支持生物膜和疾病发展相关的观点。在幽门螺杆菌患者的治疗过程中,在常规治疗前用生物膜破坏剂N-乙酰半胱氨酸治疗幽门螺杆菌患者导致实验组根除幽门螺杆菌,而常规治疗组没有表现出相同的结果。
4
癌症
生物膜与胃、小肠和结肠的癌症发生和发展有关。
◮ 结直肠癌患者中的生物膜比健康人更普遍
在健康的人结肠组织中,通过显微镜可以看到附着在肠上皮上的生物膜。尽管如此,厚的微生物生物膜在结直肠癌患者中比健康人更普遍,在50%的结直肠癌(CRC)患者中观察到粘液侵袭性细菌生物膜,但仅在13%的健康个体中观察到。
有趣的是,在89%的右侧结直肠肿瘤中检测到生物膜,但仅在12%的左侧结直肠肿瘤中检测到生物膜。
结直肠癌患者的生物膜相关微生物群包含多种菌株,包括具核梭杆菌(Fusobacterium nucleatum)、产肠毒素脆弱拟杆菌、产生基因毒素的大肠杆菌和解没食子酸链球菌。
◮ 生物膜通过影响炎症环境或基因诱导致癌
关于生物膜对结直肠癌的临床贡献,使用小鼠模型和人类结肠组织的研究表明,生物膜可以直接致癌,但也可以在炎症环境和遗传易感宿主的背景下参与组织转化。
对无菌小鼠的研究表明,侵袭性生物膜通过改变宿主mRNA或microRNA而致癌,特定类群的贡献对致瘤复制至关重要。具核梭杆菌可以通过在遗传易感个体中募集肿瘤浸润免疫细胞直接促进结直肠癌的发生。
产肠毒素的脆弱拟杆菌可能促进结直肠癌的发生,部分原因是通过分泌金属蛋白酶毒素导致辅助T17(Th17)细胞依赖性反应的过度激活和基因毒性氧自由基的产生。生物膜诱导致癌的其他潜在机制包括多胺(精胺和亚精胺)宿主途径的代谢组学变化,以及对粘膜相关微生物组功能变化。有益的共生微生物被更适应肿瘤微环境的机会性病原体所淘汰。
◮ 其他癌症组织附近也有异常粘附的生物膜
家族性腺瘤息肉病患者在息肉附近也有异常粘附的细菌生物膜,这些生物膜主要由编码大肠杆菌素的大肠杆菌菌株和产肠毒素脆弱拟杆菌组成。有趣的是,在该研究中,这些遗传生物膜的分类组成似乎不同于在散发性结直肠癌或健康宿主中检测到的生物膜(与散发性结直肠癌相比,明显富含黏液侵入性变形杆菌和拟杆菌)。
微生物群诱发的癌症可能不是由单一微生物引起的,而是需要一个复杂的细菌群落聚集在生物膜环境中,其中有益的共生体被病原体(如前面讨论的那些)取代,这些病原体更适应肿瘤微环境,可以发挥关键病原体的致病作用。
!
Tips
并非所有肠道生物膜都是致病性的,共生生物膜有几个例子。共生生物膜可以通过竞争肠腔中的空间和营养物质以及释放抑制性代谢物(如乙酸盐或丁酸盐)来限制病原菌的定植和侵袭。
生物膜-宿主相互作用
doi: 10.1038/s41575-020-00397-y.
生物膜的共生性或致病性有时取决于单个基因(例如,翻译促炎或致癌功能)、细菌菌株上具体的生物膜内源性因子或是宿主免疫反应。

doi: 10.1038/s41575-020-00397-y.
知道了生物膜在健康和疾病中的作用后,想必迫切地需要了解目前有哪些方法可检测和控制体内生物膜,并治疗致病性生物膜。那让我们接着往下看。
▸ 临床上用内窥镜可以看到生物膜,但不易分辨
目前临床上有经验的医师会在内窥镜检查期间看到生物膜。炎症性肠病(IBD)患者和肠易激综合征(IBS)患者在内窥镜检查下发现普遍存在生物膜。
肠道生物膜在医学界仍然是一个相当新颖的概念,生物膜经常被忽视或被认为是不完整的肠道准备。
区分生物膜和肠道残留物对于指导诊断和治疗至关重要,一般可以通过以下方式进行评估:
(1)如果可以用喷射清洗机轻松去除多余的层,则很可能是残留物;
(2)如果清洁程序很困难并且该层像膜一样粘在回肠壁上,则很可能是生物膜;
(3)由于重力,残留物通常与液体一起积聚在底部,而生物膜通常在整个肠壁周围形成360°附着层。
◮ 内窥镜会对肠道菌群平衡产生一定干扰
内窥镜等一些侵入性的方法,会对肠道菌群产生一定的干扰和影响。
谷禾通过真实案例检测并对比了做肠镜前后的肠道菌群变化:原本肠道内占极高比例的黄色拟杆菌属比例大幅压缩,罗氏菌属几乎消失不见。对应的普雷沃氏菌属以及埃希氏菌属(主要是大肠杆菌)比例快速增加,另外除了这些菌外还有大量的原占比很低的其他菌属出现。

而更大的变化出现在完成肠镜检查后,核心菌属变为埃希氏菌属、韦荣氏球菌属、梭杆菌属和瘤胃球菌属。原来的三大核心菌属占比被压缩到了5%左右。
与抗生素杀死菌群的情况类似,服用泻药将大量菌群排出同样也会导致菌群数量和丰度下降,和抗生素不同的是肠道不同部位的菌可能清除比例存在差异。肠道菌群平衡这项指标明显下降,菌群多样性也随之下降。有益菌减少,有害菌上升(虽然这可能只是暂时的)。
▸ 拓展:其他生物膜检测方法
此外还有一些方法被用于检测及了解生物膜。
聚合酶链反应(PCR):用于直接在临床样本中检测生物膜形成的病原体。通过扩增特定区域,提供高特异性和敏感性。
荧光原位杂交:结合短荧光标记的寡核苷酸,与目标微生物的特定核糖体RNA结合,通过显微镜分析样本。
宏基因组学:通过分析整个微生物群落的基因组,识别生物膜形成的病原体。宏基因组中有大量的基因信息,对于生物膜描述更准确。
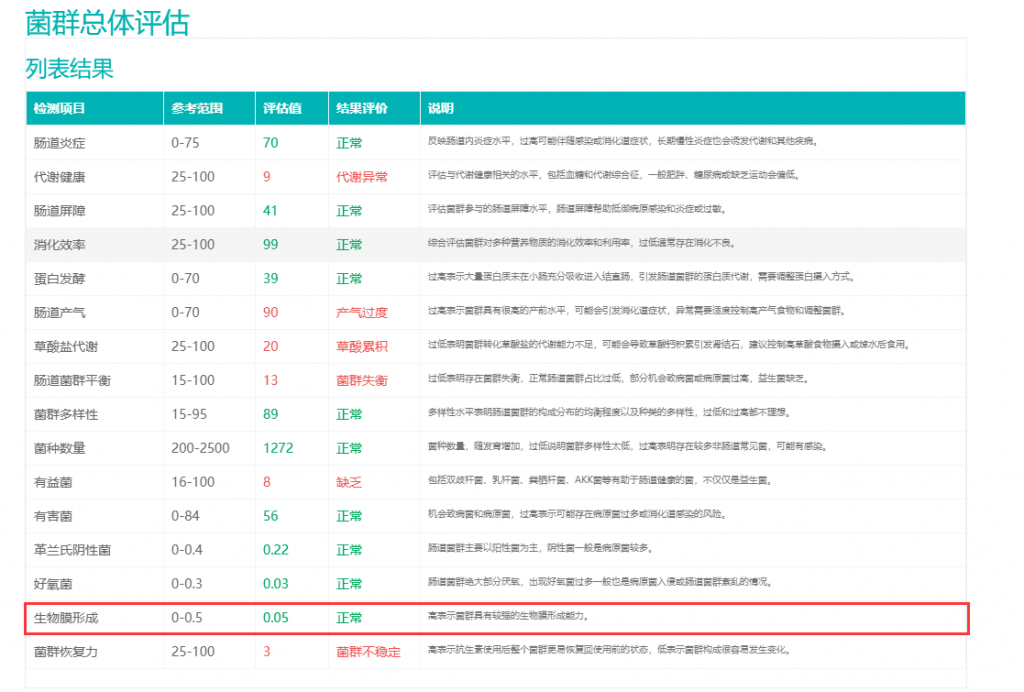
谷禾的宏基因组检测报告中,对生物膜的形成能力进行了分析评估。
刚果红琼脂试验:特别适用于检测金黄色葡萄球菌生物膜生产者。
微生物生物膜在胃肠道内稳态的多个方面发挥重要作用。然而,在某些临床情况下,当这些生物膜受到破坏时,需要对其进行保护或修复;或在其他情况下,对于某些附着于上皮的病原体生物膜,则可能需要将其彻底清除。
因此,在开发针对生物膜的治疗性控制策略时,目前的干预措施主要可分为以下几类:(1)抑制细菌粘附;(2)抑制生物膜的形成;(3)清除成熟生物膜。
针对胃肠道生物膜的治疗干预方法
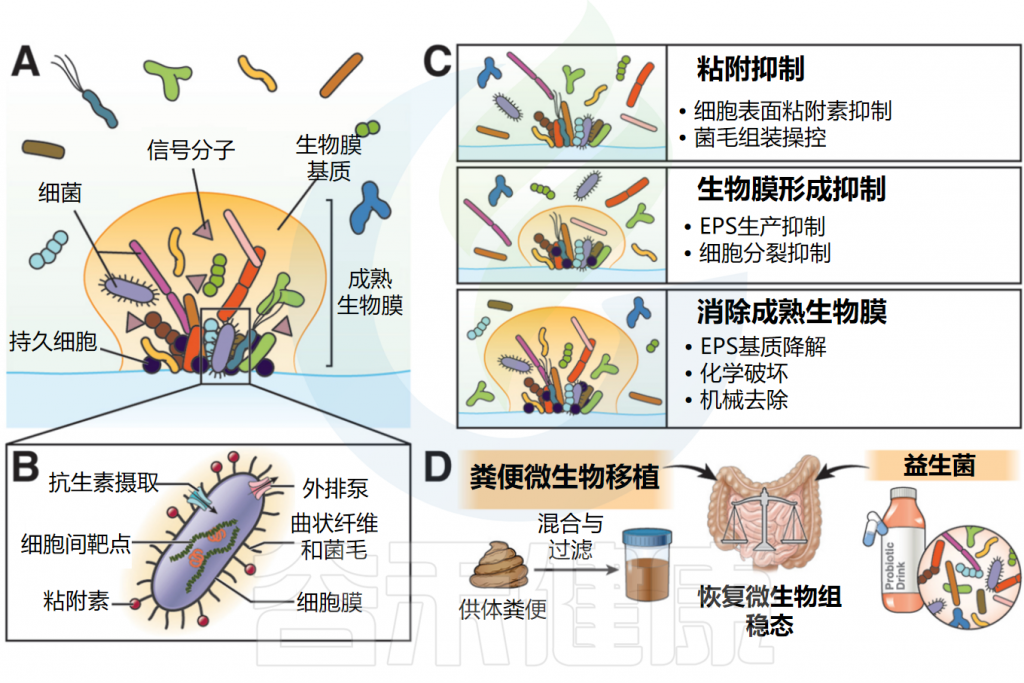
Jandl B,et al.Gastroenterology.2024
▸ 使用药物抑制细菌粘附素的表达
病原体生物膜预防策略主要侧重于抑制细菌粘附。方法包括通过引入细胞表面改变或抑制细菌粘附素表达(如curli或pili)来靶向细菌表面特性,调节生物合成,是抑制粘附的有前景靶点。
菌毛生物发生的小分子抑制剂成功地破坏了这一途径并干扰了细菌表面粘附。例如,黄烷醇杨梅素是一种具有代表性的化合物,可抑制生物膜形成。其他方法包括使用甘露糖苷等抗粘附剂来抑制粘附素的产生并减少胃肠道定植。
抗粘附素的一个关键优点是此类化合物不会影响细菌的活力,也不会根除共生细菌。然而,这种抗粘附策略的大多数体内数据是在肺部感染或伤口感染的动物模型中生成的, 其对肠道生物膜的有效性还有待研究。
▸ 使用抗生素杀死病原菌
也可以使用抗生素直接杀死病原菌,但这可能无法完全根除体内生物膜,并可能导致生物膜的持续存在和耐药性。在这种情况下,细菌虽能存活但不一定生长。
并且这可能为抗生素耐药性的产生提供条件,如通过诱变和自然选择形成的外排泵挤出抗菌剂。肠道作为复杂的多微生物环境,是遗传转移和可变亚群选择的理想场所。生物膜对抗生素治疗的持续耐受可能与慢性胃肠道感染密切相关。
▸ 使用天然化合物抑制生物膜形成
抑制胞外聚合物(EPS)基质的产生是另一种治疗策略。天然产物和小分子可以抑制基质的形成并减少细胞之间的细菌粘附和聚集。
例如,大蒜、肉桂、生姜、银杏、蔓越莓和柑橘类水果的各种提取物具有抗生物膜特性。天然衍生的生物表面活性剂也显示出抗生物膜特性。例如,鼠李糖脂包含一个与烷酸脂肪酸链相连的鼠李糖部分,可以抑制几种病原体的生物膜形成,包括变形链球菌(S.mutans)和血链球菌(Streptococcus sanguinis)。Zerumbone和α-humulene是其他天然产物,通过下调不同的外排泵相关基因和抑制生物膜形成。
氨基酸也显示出有趣的抗生物膜效应。例如,L-半胱氨酸、d-亮氨酸、d-蛋氨酸、d-色氨酸和d-酪氨酸可以单独减少生物膜生长并触发成熟生物膜的生物膜扩散。此外,当与环丙沙星共同给药时,天冬氨酸和d-谷氨酸可以抑制生物膜的形成并分散成熟的生物膜。
▸ 天然抗菌肽消除生物膜和感染
天然来源的抗菌肽(AMP)是另一类重要的抗生物膜药物,因为它们具有巨大的化学、结构和机制多样性,以消除生物膜和感染。
例如,Indolicidin是一种AMP,来源于牛中性粒细胞的细胞质颗粒,可渗透细胞壁而不破坏其完整性以抑制细菌DNA合成。
另一个例子是cathelicidin衍生的人类宿主防御肽LL-37,它可以防止细菌粘附并下调群体感应(QS)的基因。
总体而言,抗菌肽通过调节宿主免疫反应来有效地对抗生物膜。通过β-防御素1的防御素片段修饰进行优化,抗菌肽(AMP)Pam-3的开发,该肽能有效对抗胃肠道致病生物膜,而不会伤害共生菌。但抗菌肽(AMP)的一个缺点是由于酶的快速降解,其肠道稳定性较差。
▸ 使用益生菌形成“保护型”生物膜
另一种对抗胃肠道生物膜的治疗方法包括使用益生菌。
益生菌菌株的理想特性包括对肠道表面的良好粘附和在胃肠道中停留时间长,这是恢复健康的肠道微生物群和促进肠道稳态所必需的。益生菌在肠道粘膜表面形成无害的生物膜,从而可能防止病原菌的(再)定植、生物膜的形成和粘膜屏障的浸润。
例如,益生菌大肠杆菌 Nissle 1917 是治疗由肠致病性或肠毒素性大肠杆菌感染引起的胃肠道疾病的一种有前景的策略,其非致病性表现出优于病原菌株的生物膜形成能力。经过基因工程改造的大肠杆菌 Nissle 1917已被证明能够促进肠道屏障功能和上皮修复,从而增强肠道上皮完整性。
注:一些益生菌对胃肠道疾病显示出有益作用,例如感染性腹泻、抗生素相关性腹泻、肝性脑病、溃疡性结肠炎和肠易激综合征。
此外,某些具有益生菌特性的乳酸菌物种会分泌抗菌、抗粘附和抗生物膜分子,使它们能够对抗病原生物膜的定植。
▸ 使用噬菌体削弱生物膜
噬菌体是感染细菌并最终通过裂解杀死细菌的病毒。它们可以消除医疗设备上的生物膜,并且已经在各种体内感染模型中进行了研究(例如皮肤、肺和骨感染,以及败血症)。T7噬菌体通过基因工程促进糖苷酶的表达,比单独的非酶噬菌体更有效地根除大肠杆菌生物膜。
噬菌体似乎是对抗生物膜感染的有希望工具,但在应用这种工具对抗肠道中有害的生物膜之前,仍有许多问题需要解决。这些问题包括缩小噬菌体的宿主范围(如确定哪种噬菌体对特定菌株的作用更好),了解噬菌体耐药性的风险,确定宿主因子是否会使噬菌体特性失活,以及确定噬菌体制剂在人类中的长期安全性)。
▸ 纳米医学可能成为新型抗生物膜疗法
纳米医学的技术进步也可能有助于开发抗生物膜药物,因为它们解决了药物输送和疗效的挑战。纳米颗粒的大小通常在1-100nm 之间,有望用于治疗应用,尤其是肠道特异性作用。它们可以用作药物载体或直接发挥抗生物膜作用,例如基于银、铁、铜、锌、镁和稀土金属的金属基纳米颗粒。
胃肠道生物膜是一种特殊的细菌生存形式,它们彼此黏附或者黏附到组织或器官的表面,以此在生长过程中更适应生存环境。临床上通过内窥镜在回结肠区域下可见,并且在一些炎症性肠病、肠易激综合征以及胃癌和结直肠癌患者中更为常见。
但它不应该仅被视为一种病理性的慢性感染,而且还是微生物生活在粘膜表面的一种普通生活方式。微生物生物膜是许多肠道疾病病理生理的核心,但同时它们也是肠道稳态发展的关键贡献者。
需要充分表征体内肠道生物膜的组成和性质,以便更好地了解疾病相关生物膜与健康生物膜的不同结构和功能特征。这将有助于确定宿主采用何种方式以及如何应对这些生物膜。
这些微生物聚集体会不断相互作用,就像与宿主细胞相互作用一样。未来的研究必须更好地了解肠道生物膜中微生物的多样性和复杂性。通过对粪便微生物的测序可以从一定程度上反映肠道微生物群的表型以及与肠道粘膜组织的相互作用。这对于评估生物膜的病理生理作用至关重要,并可能有助于识别生物标志物以实现早期诊断和干预。这是开发更好的肠道疾病生物标志物和治疗方法的必要步骤。
主要参考文献
Jandl B, Dighe S, Baumgartner M, Makristathis A, Gasche C, Muttenthaler M. Gastrointestinal Biofilms: Endoscopic Detection, Disease Relevance, and Therapeutic Strategies. Gastroenterology. 2024 Nov;167(6):1098-1112.e5.
Wang Y, Xu S, He Q, Sun K, Wang X, Zhang X, Li Y, Zeng J. Crosstalk between microbial biofilms in the gastrointestinal tract and chronic mucosa diseases. Front Microbiol. 2023 Apr 13;14:1151552.
Baumgartner M, Lang M, Holley H, Crepaz D, Hausmann B, Pjevac P, Moser D, Haller F, Hof F, Beer A, Orgler E, Frick A, Khare V, Evstatiev R, Strohmaier S, Primas C, Dolak W, Köcher T, Klavins K, Rath T, Neurath MF, Berry D, Makristathis A, Muttenthaler M, Gasche C. Mucosal Biofilms Are an Endoscopic Feature of Irritable Bowel Syndrome and Ulcerative Colitis. Gastroenterology. 2021 Oct;161(4):1245-1256.e20.
de Vos WM. Microbial biofilms and the human intestinal microbiome. NPJ Biofilms Microbiomes. 2015 Mar 25;1:15005.
Srivastava A, Gupta J, Kumar S, Kumar A. Gut biofilm forming bacteria in inflammatory bowel disease. Microb Pathog. 2017 Nov;112:5-14.
Motta JP, Wallace JL, Buret AG, Deraison C, Vergnolle N. Gastrointestinal biofilms in health and disease. Nat Rev Gastroenterol Hepatol. 2021 May;18(5):314-334.
Flemming HC, Wingender J, Szewzyk U, Steinberg P, Rice SA, Kjelleberg S. Biofilms: an emergent form of bacterial life. Nat Rev Microbiol. 2016 Aug 11;14(9):563-75.
Sinha S, Aggarwal S, Singh DV. Efflux pumps: gatekeepers of antibiotic resistance in Staphylococcus aureus biofilms. Microb Cell. 2024 Nov 11;11:368-377.
Silva NBS, Marques LA, Röder DDB. Diagnosis of biofilm infections: current methods used, challenges and perspectives for the future. J Appl Microbiol. 2021 Nov;131(5):2148-2160.
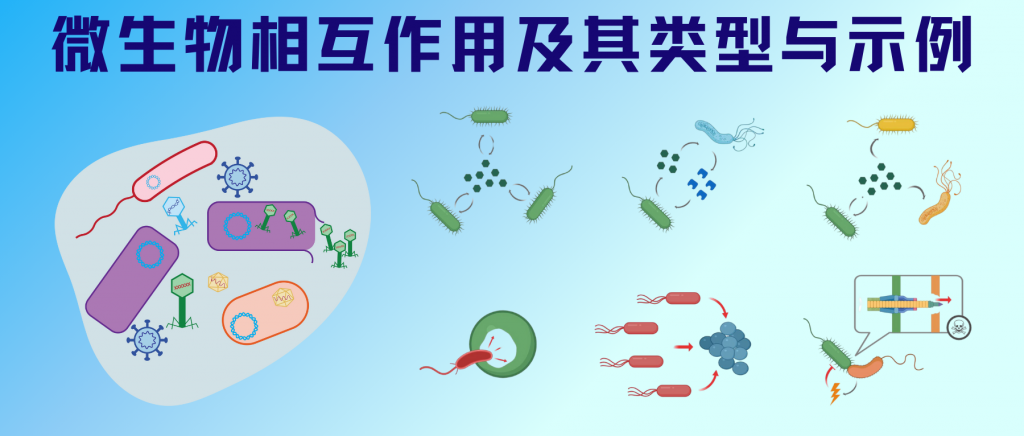
在自然界中,微生物之间的相互作用构成了一个复杂而精密的网络系统。这些相互作用不仅存在于任何生物群落中,更在全球生物地球化学循环中扮演着不可或缺的角色。从互惠共生的地衣,到肠道中的营养互补,从土壤中的捕食关系,到水体中的共营养现象,微生物间的相互作用无处不在、形式多样。
随着微生物学研究的深入,科学家们逐渐认识到这些相互作用的复杂性和重要性。这些互动可能是互惠互利的,如互惠共生和原始合作;也可能是单向获益的,如共生关系;甚至可能是竞争或对抗性的,如偏害共生和寄生关系。
微生物系统中最常见的合作互动是互惠互利的。根据两个种群和其中一个种群是否从关联中受益,或者一个或两个种群都受到负面影响,对两个种群之间的交互作用进行分类。

来源:microbenotes
理解这些相互作用不仅有助于我们更好地认识微生物世界的运作机制,也为解决环境保护、疾病防控等实际问题提供了新的思路和方法。
本文将系统地探讨微生物之间的各种相互作用类型,深入分析它们的特征、机制及其在生态系统中的重要作用,以期为相关领域的研究和应用提供参考。
共生是指相互作用中的每个生物体从关联中受益的关系。这是一种强制性的关系,其中互惠论者和宿主在代谢上相互依赖。
这种互惠关系是非常具体的,其中“协会”的一个成员不能被另一个物种取代。
共生关系要求相互作用的生物体之间有密切的物理接触。
共生关系允许生物体存在于任何一个物种都无法单独占据的栖息地中。
生物体之间的共生关系使它们能够作为一个单一的生物体行事。
共生的例子:
地衣
地衣是互惠共生的极好例子。
它们是特定真菌和某些藻类属的复合体。因为藻类生物是光合自养生物,所以真菌直接从藻类伙伴那里获得有机碳,反过来真菌保护藻类免受极端条件的影响,并为藻类提供水和矿物质。
地衣生长非常缓慢,但能够在不允许其他生物生长的栖息地聚集。大多数地衣耐高温和干燥。
草履虫-小球藻
草履虫(原生动物)可以在其细胞质中寄生小球藻(藻类)。
藻类小球藻为原生动物伙伴提供有机体碳和 O2,反过来原生动物提供CO2和其他生长因子。
只要有足够的光线,草履虫中小球藻的存在有助于原生动物在厌氧条件下存活。
在这种关联中,一种生物体的生长要么依赖于另一种生物体提供的基质,要么由另一种生物体提供的基质来改善。
在互生中,两种相关的生物体都可以从彼此中受益。
在这个互生理论例子中:
例如:Lactobacillus arobinosus、Enterococcus faecalis(粪肠球菌)。
在最小培养基中,两种菌必须共同生长,单独都无法生存。
这是一个典型的互补型营养共生关系。
在这种关系中,一个协会中的有机体彼此互惠互利。
这种互动类似于互惠互利,但原始合作中生物之间的关系并不像互惠互利那样是强制性的。
原始合作是一种生物间的互利关系,其中参与的生物体都能从这种关系中获益。
与互利共生的区别:
举例说明:
脱硫弧菌(Desulfovibrio)和Chromatium的关系,这是碳循环和硫循环之间的原始合作关系。
两种细菌通过各自的代谢活动互相促进,但并非完全依赖。
此外,参与生物地球化学循环的细菌,固氮菌与纤维素分解菌(如Cellulomonas)的互动。
两者通过各自的代谢活动互相促进生长,但都能独立存在。
在这种关系中,协会中的一个生物体(共生体)受益,而协会的另一个生物体(宿主)既没有受益也没有受到伤害。
它是一个单向的关联,如果共生体与宿主分离,它就可以存活。
共生的例子:
a. 人类肠道中的非致病性大肠杆菌:大肠杆菌是一种兼性厌氧菌,它使用氧气并降低肠道中的 O2 浓度,从而为拟杆菌等专性厌氧菌创造合适的环境。大肠杆菌是不受拟杆菌影响的宿主。
b. 黄杆菌(Flavobacterium)(宿主)和嗜肺军团菌(Legionella pneumophila)(共生):黄杆菌排泄嗜肺军团菌使用的胱氨酸,并在水生栖息地中存活。
c. 韦荣氏球菌和链球菌利用其他婴儿肠道细菌的碳水化合物发酵的最终产物(如乳酸)产生丙酸,形成重要的营养链。
d. 硝化作用中亚硝化单胞菌(Nitrosomonas)(宿主)和 硝化杆菌(Nitrobacter)(共生菌)的结合 :亚硝化单胞菌将氨氧化成亚硝酸盐,最后,硝化杆菌使用亚硝酸盐获取能量并将其氧化成硝酸盐。
当一个微生物种群产生对其他微生物种群具有抑制性的物质时,这种种群间关系称为偏害共生(Ammensalism 或 Antagonism)。
这是一种负向关系。
第一个产生抑制性物质的种群不受影响,或者可能会获得竞争并在栖息地中生存,而其他种群则受到抑制。这种化学抑制被称为抗生作用。
偏害共生的例子(amensalism):
竞争代表了两个微生物种群之间的负相关关系,其中两个种群的生存和生长都受到不利影响。
当两个种群使用相同的资源(例如相同的空间或相同的营养)时,就会发生竞争,因此,微生物种群的最大密度或增长率较低。
微生物种群争夺任何限制生长的资源,如碳源、氮源、磷、维生素、生长因子等。
竞争抑制了两个种群占据完全相同的生态位,因为一个将赢得竞争,另一个将被淘汰。
示例:
尾草履虫(Paramecium caudatum)和金草履虫(Paramecium aurelia)之间的竞争:当这两种原生动物被放在一起时,它们都以相同的菌群为食。由于竞争的结果,金草履虫比尾草履虫具有更好的生长速率。
在这种关系中,一个种群(寄生体)受益,并从受到伤害的协会中的其他种群(宿主)那里获得营养。
宿主-寄生体关系的特点是接触时间相对较长,这可能是物理的或代谢的。
一些寄生虫生活在宿主细胞之外,称为外寄生虫,而其他寄生虫生活在宿主细胞内,称为内寄生虫。
寄生的例子:
a. 病毒:病毒是一种专性细胞内寄生虫,表现出极强的宿主特异性。有许多病毒是细菌(噬菌体)、真菌、藻类、原生动物等的寄生虫。
b. 蛭弧菌(Bdellovibrio):蛭弧菌是许多革兰氏阴性菌的体外寄生虫。
当一种生物(捕食者)吞噬或攻击其他生物(猎物)时,这是一种普遍的现象。
捕食的例子:
未来的研究方向可能会更多地关注这些相互作用在分子水平的调控机制,特别是在肠道微生态系统中各种微生物之间的信号交流网络。
在实践层面,这些知识为微生物组的调控、疾病防治等领域提供了重要的理论指导。例如,通过理解肠道菌群中的共营养关系,我们可以更好地调节人体微生物组的平衡;通过了解偏害共生机制,可以开发新的抗菌策略。
随着研究技术的进步,特别是高通量测序和生物信息学等技术的发展,我们有望对微生物间的相互作用有更深入的认识,从而为人类的健康管理提供新的解决方案。
主要参考文献:
microbialinteraction.conferenceseries.com/2017/call-for-abstracts.php#collapse12
microbialinteraction.conferenceseries.com/2017/call-for-abstracts.php
Sagar Aryal. 2022. Microbial interaction and its types with examples.Edited By: Sagar Aryalmicrobenotes

谷禾健康

群体感应(Quorum Sensing,QS)是一种细胞间的通讯机制,广泛存在于细菌、微生物以及某些多细胞生物中。通过这种机制,细胞能够感知周围环境中同类细胞的密度,并根据细胞数量变化调节基因表达和行为,这种现象在细菌中尤为显著。
在胃肠道等竞争激烈且不断变化的环境中,微生物群已经开发出独特的相互交流方法。肠道菌群产生的群体感应分子调节多种细胞功能,例如毒力基因的表达、生物膜的形成、能力和孢子形成,通常仅在细胞数量达到一定密度时启动这些过程。
肠道细菌产生的群体感应分子在肠道微生物组内建立物种和菌株水平结构方面很重要,但也用于与宿主交流。
微生物之间的对话各不相同,范围从种间交流、自我对话或种内交流到来自一个属的细胞对另一个属产生的信号做出反应。无法产生自身通信信号的细胞正在“监听”其他细胞产生的信号,这种现象类似于为“窃听”。
肠道微生物群使用某些代谢物作为群体感应分子与肠上皮细胞(IEC)进行通讯。例如,金黄色葡萄球菌分泌多种毒力因子,这些因子操纵宿主的免疫系统以保护自身的生存。这些生存策略对宿主的影响通常表现为:
虽然我们目前还不知道哪些群体感应分子与肠道和感觉神经元有最直接的相互作用,但很多证据显示它们会影响我们的生理和心理健康。
例如细菌产生的信号多种多样,包括自诱导剂 (AI)、高丝氨酸内酯(HSL)、喹啉、肽、毒素和蛋白酶。这些信号分子激活细菌细胞壁中的特定受体,并触发细胞质中调节基因表达的传感器。
注:自诱导剂(sAutoinducers)是细菌在群体中相互交流的一种信号分子。它们通过细菌的分泌进入环境,并在细菌密度达到一定水平时被其他细菌重新摄取。它使细菌能够协调其行为,例如生物膜的形成、毒素的产生和其他群体行为。
高丝氨酸内酯(Homoserine Lactones, HSL)是一类特定类型的自诱导剂,主要在革兰氏阴性细菌中发现。当HSL达到一定浓度时,它们会与细菌细胞内的特定受体结合,激活基因表达的调节机制。这种调节可以影响细菌的生长、代谢和致病性等多种生物学过程。
目前,研究很多研究已经建议可以将群体感应分子可用作辅助诊断的生物标志物:
未来,应该有可能使用 QS 生物标志物来诊断神经和精神疾病,例如:焦虑和抑郁、重度抑郁症、精神分裂症、双相情感障碍、自闭症、强迫症等。
微生物群体感应(QS)可以被视为微生物群之间的伙伴关系或协议,本文主要分享和讨论了QS在肠道细菌和肠壁中带来的变化,并探讨和总结这些通信可能对中枢神经系统和心理健康产生的影响。
Interbacterial Communication
革兰氏阴性菌(Gram-Negative Bacteria)
细菌是一类单细胞微生物,它们需要通过各种方式来感知周围环境,并协调自身的行为。革兰氏阴性细菌就利用一类称为自诱导剂 (Autoinducers, AI) 的小分子物质来实现这种细胞间通信。
AHL:细菌间的通用密码
其中最著名的自诱导剂是AHL(N-酰基-高丝氨酸内酯N-Acyl,Homoserine Lactones, AHL)。AHL是一种小的中性脂质分子,由高丝氨酸内酯(Homoserine Lactone, HSL) 部分和4到18个碳原子的酰基侧链组成。
不同细菌产生的AHL可能有不同的酰基侧链长度和取代基,这使得细菌能够区分彼此释放的信号分子。
AHL的合成
AHL的合成需要依赖于S-腺苷甲硫氨酸(S-Adenosyl Methionine,SAM)作为底物,由LuxI或LuxM等合成酶催化产生。有些细菌只有一种AHL合成酶,而另一些细菌则拥有多种AHL合成酶,能够产生多种形式的AHL。
AHL的产生水平受到严格调控,取决于底物的可用性
一些缺乏LuxI型合成酶的细菌会拥有”孤儿”的LuxR型受体,这些受体能够检测到同一环境中其他细菌释放的AHL信号。例如,大肠杆菌(Escherichia coli) 中的SdiA和铜绿假单胞菌(Pseudomonas aeruginosa)中的QscR就是这类孤儿受体的代表。
这些LuxR型受体在不同细菌中高度保守,序列同一性可达67%-84%。它们不仅存在于大肠杆菌,还广泛分布于其他肠道细菌,如肠杆菌(Enterobacter)、柠檬酸杆菌(Citrobacter)、克罗诺杆菌(Cronobacter)、克雷伯菌(Klebsiella)、沙门氏菌 (Salmonella) 、志贺氏菌(Shigella) 中。
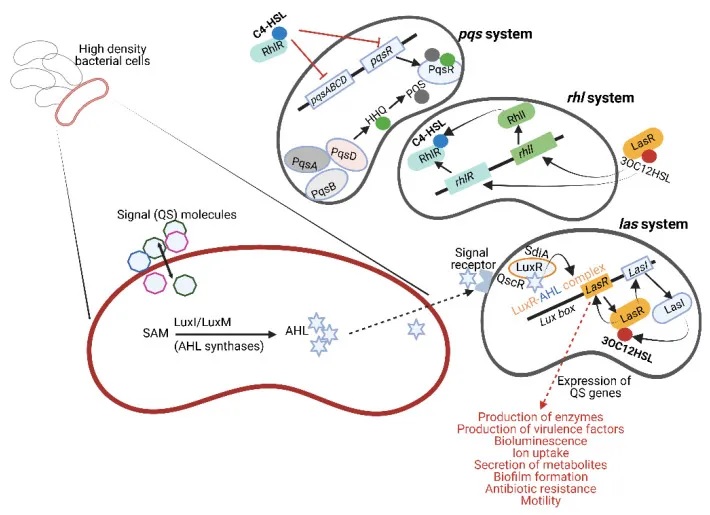
doi.org/10.3390/microorganisms10101969
大肠杆菌的多种群体感应系统及其生理调控
以致病性大肠杆菌(E. coli)为例,它利用多种QS系统来调控自身的生理过程:
其中,大肠杆菌的SdiA蛋白可以被铜绿假单胞菌产生的AHL信号分子激活。这种SdiA/AHL复合物能够增强大肠杆菌中与耐酸性相关基因的表达,对于肠出血性大肠杆菌(EHEC)在胃肠道低pH环境中存活至关重要。
此外,大肠杆菌还利用QS系统调控其毒力基因的表达、生物膜的形成、细菌运动性、III型分泌系统的活性,以及毒素和细菌纤毛的产生。
类似地,沙门氏菌的QS系统也参与调节其致病性,影响侵袭性基因的表达、鞭毛形成,以及与拉链侵袭机制相关的基因。
总之,细菌利用这些精细的群体感应系统,能够在复杂的环境中有效地感知周围情况,并协调自身的生理活动,从而增强其生存和致病能力。这种细菌间的通信机制对于理解细菌的生态和致病机制具有重要意义。
革兰氏阳性菌(Gram-Positive Bacteria)
除了革兰氏阴性菌使用自诱导剂(Autoinducer,AI)进行群体感应(Quorum Sensing, QS)外,革兰氏阳性菌也采用了一种独特的QS机制。
革兰氏阳性菌的独特群体感应机制
革兰氏阳性菌使用由5-17个氨基酸组成的小线性或环状寡肽(Quorum Sensing Peptide, QSP)进行细胞间通信。
其中,研究最多的是芽孢杆菌产生的QS系统,包括能力孢子形成因子(CSF)、五肽和七肽SDLPFEH(PapRIV)等。这些七肽是由48个氨基酸的前体肽经过NprB蛋白酶的裂解而形成的。
QSP在细胞膜上的ATP结合盒转运蛋白的帮助下被分泌到细胞外,并与膜结合的受体或细胞质传感器(如Rap、NprR、PlcR和PrgX蛋白)发生相互作用。
QSP系统在细菌中的实例
以金黄色葡萄球菌为例,其辅助基因调节因子(Agr)就是一个编码肽信号分子Agr的四基因操纵子,起到膜结合传感器的作用。Agr调节多种基因的表达,包括毒力因子、蛋白酶和成孔毒素等。
缺失agr基因(Δagr)的金黄色葡萄球菌菌株会形成生物膜,更容易引起慢性感染和菌血症。
另一种革兰氏阳性菌肠球菌也使用Fsr-QS系统,该系统由四个基因位点fsrABDC控制。一旦肽被裂解激活,就会通过跨膜激酶在细胞内进行磷酸化级联反应,从而诱导靶基因的表达。
总的来说,革兰氏阳性菌利用这种基于寡肽信号分子的QS系统,能够感知周围细菌的数量,并协调自身的生理活动,如毒力因子的表达、生物膜的形成等。这种细菌间的通信机制对于理解它们的生态和致病机制具有重要意义。
革兰氏阳性菌使用的群体感应的一般表示
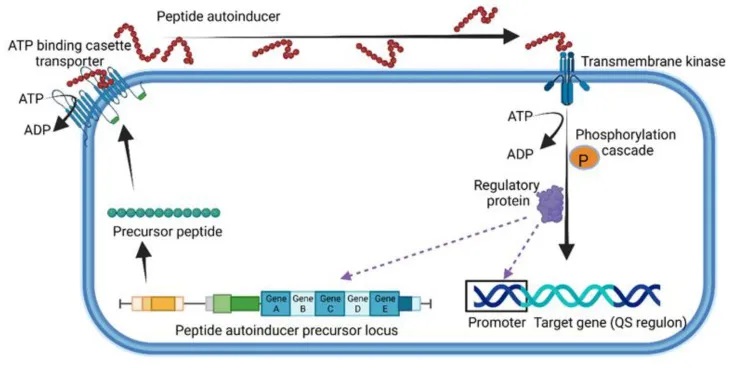
doi.org/10.3390/microorganisms10101969
Interspecies Communication
自身诱导剂-2 (Autoinducer-2, AI-2)是一种广泛存在于细菌中的信号分子,在细菌间的种间通讯和调节特定生物行为中起着关键作用。
AI-2的的合成途径
AI-2是一种呋喃硼酸酯二酯,既可以被革兰氏阴性菌,也可以被革兰氏阳性菌产生。它的合成受到luxS基因的调控。在这个过程中,首先S-腺苷同型半胱氨酸(SAH)被SAH水解酶(SahH)转化为同型半胱氨酸,然后经过Pfs和LuxS两步反应,形成中间体4,5-二羟基-2,3-戊二酮(DPD),最终重排成AI-2分子。
AI-2在细菌中的广泛分布
值得注意的是,在超过三分之一的细菌基因组中都能检测到编码luxS同源物的基因,包括大肠埃希菌(Escherichia coli)、粪肠球菌(Enterococcus faecalis)、空肠弯曲杆菌(Campylobacter jejuni)、金黄色葡萄球菌(S.aureus)、艰难梭菌(Clostridium difficile)、芽孢杆菌属(Bacillus)、链球菌属(Streptococcus)、福氏志贺氏菌(Shigella flexneri)、幽门螺杆菌(Helicobacter pylori)、鼠伤寒沙门氏菌血清型、伤寒沙门氏菌血清型、双歧杆菌属(Bifidobacterium)、乳酸菌属(Lactobacillus)、真杆菌属(Eubacterium)、罗氏菌属(Roseburia) 和瘤胃球菌属(Ruminococcus) 。
这表明:
AI-2系统在细菌的种间通讯中扮演重要角色
例如,大肠杆菌、肺炎链球菌等细菌就利用AI-2系统来调节编码细菌素产生的基因表达。
双歧杆菌也使用AI-2信号来对抗沙门氏菌的感染。此外,AI-2还可能参与调节细菌的运动性、生物膜形成等行为。
有趣的是,在肠道微生物群落中,AI-2信号也被用来帮助细菌应对胃肠道中的各种应激条件。研究发现,通过调控AI-2水平,可以在抗生素治疗后帮助恢复肠道微生物的平衡。但这需要谨慎控制,因为AI-2的细胞内水平受到LsrK激酶的调节。
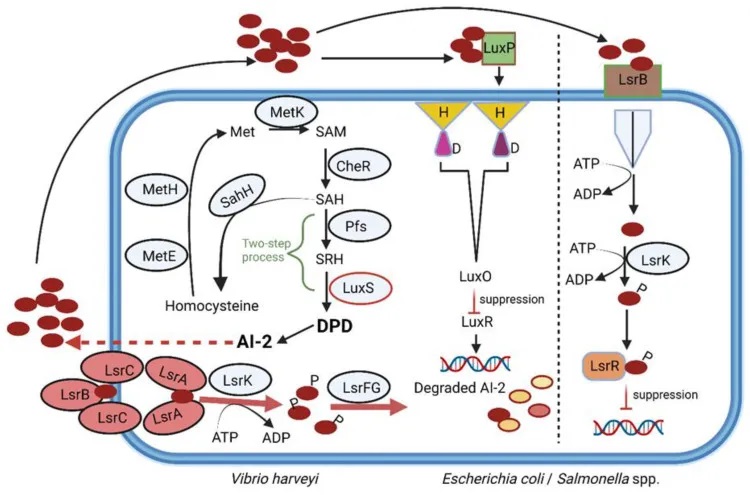
doi.org/10.3390/microorganisms10101969
AI-2在调节肠道微生物群中的应用
一种经改造的大肠杆菌菌株随着 AI-2 的产生增加,导致链霉素抑制的厚壁菌门恢复,并抑制拟杆菌门的生长。从这些发现可以推断,AI-2 可用于在抗生素治疗后恢复肠道微生物群的平衡。如果遵循这种策略,则必须仔细控制,因为 AI-2 的细胞质水平受 LsrK 激酶调节。
厚壁菌门和拟杆菌门种群的变化会改变 SCFA 的水平和组成,进而影响基因表达、细胞因子分泌和调节性 T 细胞诱导。所有这些变化都会影响炎症反应。因此,AI-2 水平的增加可以恢复厚壁菌门和拟杆菌门之间的平衡,并预防或逆转菌群失调、IBD、肥胖、自闭症和压力相关疾病。
利用AI-2来维持肠道微生物平衡,可以但需谨慎
一方面,AI-2确实可以帮助调节肠道细菌的行为,如影响细菌素的产生、生物膜的形成等。但另一方面,高浓度的AI-2也可能上调某些细菌的毒力因子,如增加粪肠球菌噬菌体的释放和基因转移。
在小鼠实验中,AI-2的给药虽然没有影响细胞因子的表达,但却加重了铜绿假单胞菌的肺部感染。这表明,单纯依赖AI-2来维持肠道稳态的做法可能会带来意想不到的后果。
AI-2受体的多样性及其生理影响
目前已经确定了两类AI-2受体,分别是LuxP和LsrB。这两种受体在结构上存在差异,序列相似性仅为11%。它们广泛分布于变形菌门、芽胞杆菌等细菌中。
其他肠道细菌可能也使用类似的受体来感知AI-2信号。有趣的是,有些细菌即使没有这些典型的AI-2受体,也能对AI-2产生反应,这可能涉及其他未知的感知机制。
此外,AI-2信号还可能影响细菌的耐药性等重要生理过程。同时,在结直肠癌相关肿瘤中也检测到AI-2水平的升高,这与肿瘤相关巨噬细胞中TNFSF9基因表达的增加相关。这提示AI-2可能是结直肠癌的一个重要生物标志物,值得进一步研究。
Interkingdom Communication
细菌利用复杂的群体感应系统来感知周围环境,并协调自身的生理活动。除了前面提到的自身诱导剂-2(AI-2)外,细菌还使用其他类型的信号分子进行细胞间通讯。
doi.org/10.3390/microorganisms10101969
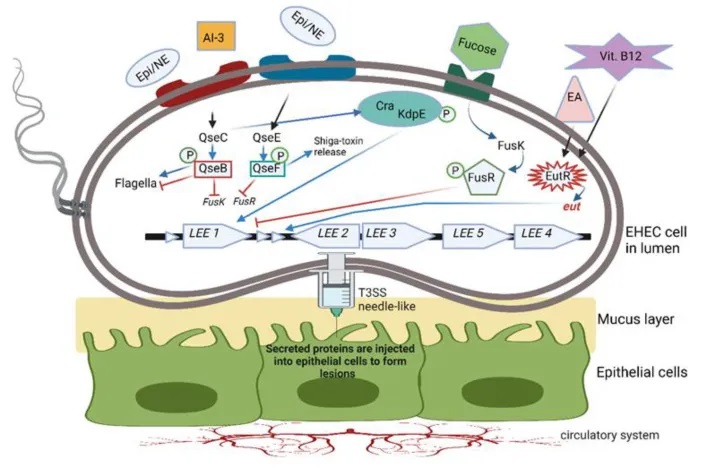
AI-3信号系统在肠道病原体中的作用
其中,自身诱导剂-3(AI-3)/肾上腺素(Epi)/去甲肾上腺素(NE)界间信号系统在一些重要肠道病原体中发挥关键作用。这种信号系统可以促进鼠伤寒沙门氏菌、啮齿柠檬酸杆菌和肠出血性大肠杆菌(EHEC)等细菌的毒力基因表达。
以EHEC为例,它利用一种双组分QS系统(TCS)来感知和响应这些环境信号分子。该系统由QseBC和QseEF两个TCS组成。当EHEC感知到Epi、NE、AI-3、岩藻糖或乙醇胺等信号分子时,会激活跨膜组氨酸激酶受体,进而激活或抑制相应的反应调节因子。
例如,QseC组氨酸传感器可以激活QseB,QseB则调节鞭毛基因的表达,同时抑制参与岩藻糖代谢和毒力基因表达的fusK/-R基因。
QseC还可以磷酸化KdpE反应调节因子,与Cra蛋白一起刺激LEE操纵子中的基因,从而促进EHEC的黏附和毒力因子的注射。此外,QseC还可以激活QseF,进而诱导志贺毒素的产生。
细菌群体感应系统对宿主免疫的影响
另一方面,铜绿假单胞菌(P. aeruginosa)产生的 3-oxo-C12-HSL(下图)在上皮细胞和免疫细胞中积极转运,并通过抑制编码紧密连接蛋白(TJ)的基因表达来破坏肠壁的通透性。这导致occludin、tricellulin、ZO-1、ZO-3、JAM-A、E-cadherin、β-catenin的重新排列(错位),并阻止粘蛋白的产生。
这不仅使上皮细胞受到感染,还会激活粘膜免疫系统,导致白细胞增加和促炎细胞因子的积累。此外,3-oxo-C12-HSL 还抑制肿瘤坏死因子 TNF-α 和 IL-12 的产生,导致 T 辅助细胞-1(Th1)反应功能障碍,并刺激 Th2 产生免疫球蛋白 G1。
抑制 Th1 和 Th2 T 淋巴细胞分化会增加细胞因子的产生 ,加剧氧化应激,刺激细胞凋亡并灭活线粒体。这些细菌间通信机制的研究,有助于我们更好地理解和预防细菌性疾病的发生。
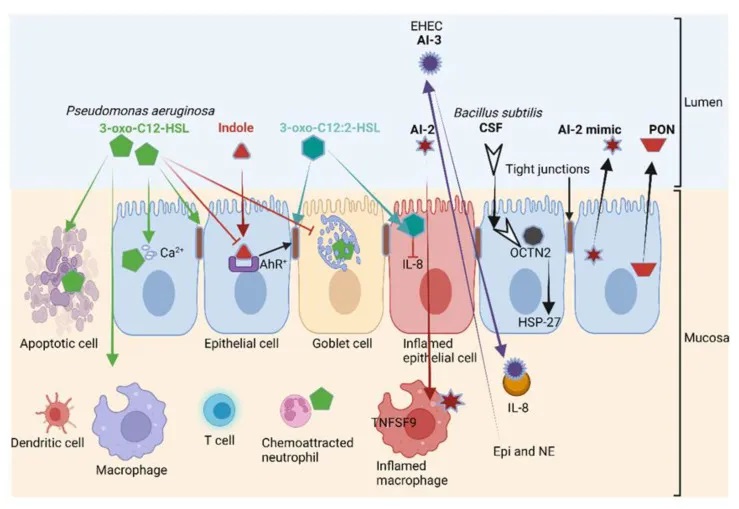
doi.org/10.3390/microorganisms10101969
铜绿假单胞菌产生的 3-oxo-C12-HSL诱导各种细胞类型(包括上皮细胞)的细胞凋亡;破坏紧密连接并减少粘蛋白的产生。
3-oxo-C12-HSL与3-氧代-C12:2-HSL对肠壁影响相反
结构相似的 3-oxo-C12-HSL、3-oxo-C12:2-HSL 对肠壁具有相反的作用。
3-oxo-C12:2-HSL不是破坏上皮细胞的稳定性,而是保护紧密连接蛋白occludin和tricellulin以及细胞质ZO-1免受促炎细胞因子(如干扰素-γ γ)、TNF-α和IL-8的侵害。
3-oxo-C12:2-HSL在肠道免疫细胞中的作用及对IBD的潜在影响
除了一些开创性研究外,3-oxo-C12:2-HSL 对人类肠道免疫细胞的影响在很大程度上仍然未知。
在诊断为IBD的患者中,3-oxo-C12:2-HSL的浓度要低得多。这表明 3-oxo-C12:2 HSL 在保护暴露于免疫冲击的上皮细胞中起重要作用。需要进一步的研究来确定 3-oxo-C12:2-HSL 是否可以用于治疗 IBD。这也需要更好地了解 3-oxo-C12:2-HSL 群体猝灭、AHL 裂解和高丝氨酸内酯(HSL)环水解所涉及的过程。
到目前为止,已在人类和其他哺乳动物的GIT中鉴定出三种参与HSL环水解的对氧磷酶(PON1、PON2和PON3)。其中,PON2 最活跃,主要在空肠中表达 。PON1 和 PON3 在诊断为克罗恩病和溃疡性结肠炎患者中的表达水平较低 。
因此,这些胃肠道疾病有可能通过恢复 PON1 和 PON3 水平来逆转。需要深入研究对氧磷酶在 GIT 不同领域中的作用,以及它们在治疗胃病中的可能应用。
肠道是人体与外界环境直接接触的重要器官,也是细菌与宿主细胞进行密切交流的场所。除了前面提到的自身诱导剂-2(AI-2)和自身诱导剂-3(AI-3)等细菌信号分子外,肠道细胞还能感知和响应其他细菌代谢产物。这些相互作用对维持肠道健康至关重要。
宿主对细菌信号的感知机制
首先,肠道细胞表达一些重要的受体,如:孕烷X受体(PXR)、过氧化物酶体增殖物激活受体(PPAR),这些受体能够感知细菌代谢物,并调节宿主细胞的基因表达,参与解毒、代谢和炎症反应的调控。
例如,PPARγ可以抑制巨噬细胞的活化,减少炎性细胞因子的产生,从而有助于缓解炎性肠病。
细菌-宿主信号相互作用网络
另一方面,细菌也能感知和利用宿主细胞的信号分子。例如,假单胞菌产生的PQS和HHQ信号分子,能够与淋巴细胞、树突状细胞和巨噬细胞相互作用,抑制宿主的先天性和适应性免疫反应。
作为应对,宿主细胞则通过激活芳烃受体(AhR)来感知这些细菌信号,并启动有益的免疫反应,如IL-22和IL-17的表达。
此外,枯草芽孢杆菌产生的CSF信号分子,能够与肠道上皮细胞表面的OCTN2转运蛋白结合,激活HSP-27,从而促进肠道屏障的完整性。一旦进入细胞,CSF还可以作为一种”报告器”,监测肠道微生物群的变化。
总结下,肠道细胞与细菌之间存在复杂的信号交流网络。宿主细胞通过感受细菌代谢物来调节自身的生理活动,而细菌也能利用宿主信号分子来调控自身的行为。这种跨界的“窃听”行为,体现了宿主-微生物之间精细的相互调控机制,对维持肠道健康至关重要。进一步研究这些相互作用过程,有助于我们更好地理解和调控肠道微生态平衡。
PapRIV
由芽孢杆菌产生的 PapRIV 穿过胃肠道,尽管速度很慢,并进入循环系统,大多数肽(87%)从那里以单向方式穿过 BBB(血脑屏障)。从体外研究中可以推断,PapRIV 激活小胶质细胞,因此可能在肠-脑相互作用中发挥作用。
氨基酸
根据2020比利时一项研究,氨基酸天冬氨酸和脯氨酸在小胶质细胞的激活中起关键作用。apRIV还诱导促炎细胞因子IL-6和TNFα的产生,增加细胞内ROS并刺激阿米巴样细胞的增加。丙酮丁醇梭菌(Clostridium acetobutylicum)产生的自体诱导肽(AIP)比肺炎链球菌产生的 AIP 更容易穿过(血脑屏障)。

自诱导肽 AIPs
自诱导肽(Autoinducer peptides, AIPs)是细菌用于细胞间通信的一类信号分子。它们在细菌群体感应中起重要作用。
革兰氏阳性菌穿过肠壁产生的AIPs已在Caco-2细胞的体内研究中得到证实。该研究表明,胃肠道中葡萄球菌(Staphylococcus)、链球菌(Streptococcus)、乳酸杆菌(Lactobacillus)和芽孢杆菌(Bacillus)产生的AIPs对肌肉细胞具有促炎和抗炎作用。
这些屏障的穿越似乎取决于肽的结构和大小。信号肽降解过程中产生的可扩散小分子,称为可扩散信号因子(DSF),也可能起到自诱导剂的作用。
肠道细菌产生的信号由肠壁中的特殊细胞记录(下图),导致身体或心理健康发生暂时或持久的变化。这些细胞通过使用模式识别受体 (PRR)区分本地(地方性)和外来、潜在致病性微生物群产生的信号。
AHL
细菌在生长过程中会产生各种化学信号分子,比如AHL(丙酰基-亮氨酸同系物)。这些信号分子可以被宿主细胞感知到,并引发一些生理反应。
比如,AHL可以增加中性粒细胞的活性,促进成纤维细胞向肌成纤维细胞的转化。这些变化对于组织的修复和再生非常重要。
宿主细胞有一些专门的受体,可以识别这些细菌信号分子。其中包括Toll样受体(TLR)和Nod样受体(NLR),它们可以感知细菌细胞壁的成分。还有一些G蛋白偶联受体(GPR),它们可以感知一些与激素相关的信号分子。
这些受体广泛存在于肠道的免疫细胞、上皮细胞和间质细胞等,在调节炎症反应和维护肠道屏障功能中起重要作用。
总的来说,细菌通过释放各种化学信号分子,可以与宿主细胞进行”对话”(下图),影响宿主的免疫反应和组织修复。这种细菌-宿主之间的相互作用,对于维持肠道健康非常关键。我们需要进一步研究这些复杂的交互机制,以更好地理解和调控肠道微生态平衡。
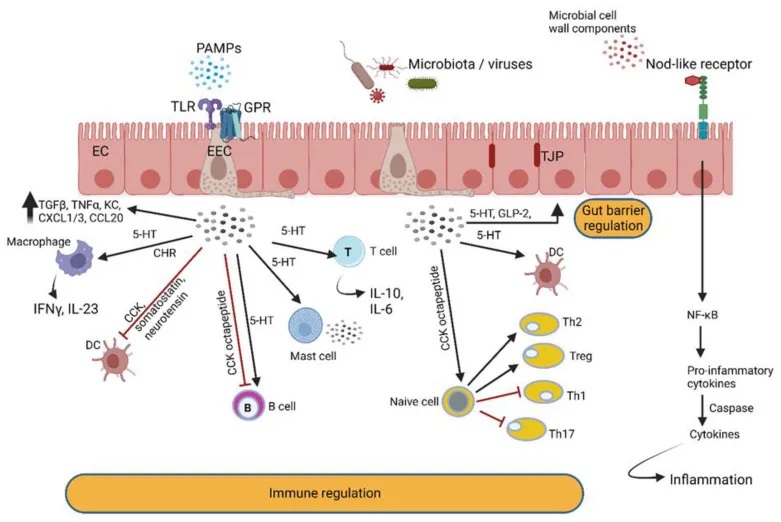
doi.org/10.3390/microorganisms10101969
肠壁中的肠内分泌细胞 (EEC) 检测肠道细菌和微生物代谢物,并通过分泌与免疫细胞反应的肽激素和细胞因子来做出反应。EEC 产生的激素调节肠道屏障功能并与肠神经反应。后者通过迷走神经与中枢神经系统进行交流。
芳香烃受体 AhRs
AhRs 调节免疫反应和发病机制(下图)。大量的AhR由肠上皮细胞和免疫细胞(如先天性淋巴细胞、上皮内淋巴细胞、TH17细胞和Treg细胞)表达,但也存在于肝脏、肺、膀胱和胎盘中。AhR 的关键功能之一是恢复屏障稳态,这是 IBD 中突出的现象。
芳烃受体(AhR) 通路总结
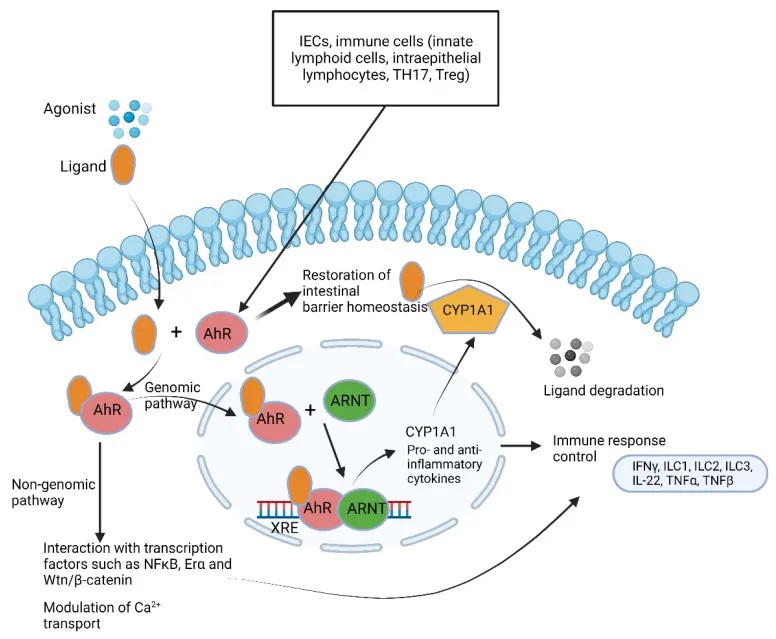
doi.org/10.3390/microorganisms10101969
AhR
芳香烃受体在维护肠道健康中的关键作用
芳香烃受体(Aryl hydrocarbon Receptor, AhR)是一种重要的细胞内受体蛋白,在人体内广泛分布,尤其集中于肝脏、肠道和免疫细胞等组织。
AhR的基本功能
AhR能够感知和结合各种芳香烃类化合物,包括细菌代谢产物、环境污染物等。
当AhR与这些化合物结合后,会进入细胞核内,调控一系列基因的表达,参与解毒代谢、免疫调节、细胞分化等重要生理过程。
AhR与疾病的关联
例如,AhR可以感知细菌产生的PQS信号分子,并激活一些有益的免疫反应,如促进IL-22和IL-17的表达,增强肠道屏障功能,维持肠道微生态平衡。
研究发现,在炎症性肠病(IBD)、代谢综合征或乳糜泻等疾病患者中,粪便中AhR配体的浓度较健康人明显降低,AhR活性也相应降低。而在艰难梭菌感染患者中,则检测到更高的吲哚浓度。
AhR可以被多种细菌代谢产物激活,包括色氨酸降解产物(吲哚、吲哚并[3,2-B]咔唑、吲哚乙酸等)以及假单胞菌产生的2,4-二羟基喹啉、喹诺酮衍生物等。
这些AhR配体的浓度在炎症性肠病、代谢综合征和乳糜泻患者中较健康人有所降低,提示AhR活性的降低可能与这些疾病的发生有关。
AhR在调节肠道屏障和免疫稳态中的作用
AhR参与调节肠道屏障完整性、免疫稳态、上皮内淋巴细胞的产生和存活、炎症反应以及肠道菌群密度等多个关键过程。
通过调节紧密连接蛋白的表达、促进IL-22和IL-10的产生、诱导抗菌肽分泌等,AhR在维持肠道健康中发挥重要作用。
在炎症性肠病患者中,AhR水平降低,尤其是在回肠部位,可能导致ILC1细胞增多,进而促进炎症因子IFN-γ和TNF-α的产生,破坏肠屏障。
AhR配体的来源与饮食影响
色氨酸是AhR配体的重要来源,但人体无法自行合成,需要从饮食中摄取。富含色氨酸的食物包括腰果、向日葵籽、奶酪、鸡胸肉和煮鸡蛋等。
因此,饮食中色氨酸的摄入量可能影响AhR配体的水平,进而影响肠道健康。
耐药菌与群体淬灭技术的兴起
五年前,世界卫生组织公布了一份对目前使用的抗菌剂最具耐药性的病原菌清单。下列物种在名单上名列前茅:
这促使许多科学家研究使用抗QS疗法(称为群体淬灭(quorum quenching,QQ)来预防或控制细菌感染的可能性。近年来,许多已发表的文章报道了有希望的结果,表明与抗生素共同处理时,可以降低微生物的致病性并且更容易根除。

2020年,天津大学的研究团队发现,可以利用QS信号分子丙酰基-亮氨酸同系物(AHL)来控制革兰氏阴性细菌引起的感染。这种方法的关键是要破坏QS对细菌毒力基因表达的调控作用。
群体淬灭的应用效果与风险
当应用群体淬灭时,粘膜相关病原体减少了约60%,主要是梭菌属(Clostridium)。尽管从感染管理的角度来看很有希望,但这种剧烈的变化可能导致促炎性疾病的发展,如囊性纤维化、硬化症和IBD,以及肠球菌(Enterococcus)和艰难梭菌(C. difficile)细胞数量的增加。
也许最令人担忧的是,在luxS QS系统功能失调或缺失的细菌中,细胞聚集和生物膜形成增加的证据,如幽门螺杆菌、霍乱弧菌(Vibrio cholerae)、放线菌集聚杆菌(Aggregatibacter actinomycetemcomitans)、胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae)、副猪嗜血杆菌(Haemophilus parasuis)、金黄色葡萄球菌(S. aureus)、表皮链球菌(S. epidermidis)、变形链球菌(Streptococcus mutans)、粪肠球菌(Enterococcus faecalis)、蜡样芽孢杆菌(Bacillus cereus)。美罗培南和左氧氟沙星刺激鲍曼不动杆菌(A. baumannii)外排泵的表达,促进AHL的释放,导致QS介导的生物膜形成增加。
群体淬灭技术的局限性与挑战
实际应用中也存在一些挑战。有研究报告,使用群体淬灭方法治疗铜绿假单胞菌和金黄色葡萄球菌感染的效果有限,特别是在生物膜相关感染中。这可能是因为QQ会导致细菌群落结构的剧烈变化,反而促进了一些致病菌的生长,如艰难梭菌等。
此外,一些细菌在缺失LuxS等QS系统时,反而表现出更强的细胞聚集和生物膜形成能力,这可能导致难以根除的持久性感染。一些抗生素如美罗培南和左氧氟沙星,也可能通过刺激细菌外排泵表达,促进AHL释放,增强QS介导的生物膜形成。
因此,单纯使用群体淬灭技术可能并不能完全解决细菌感染问题。研究人员建议,在使用群体淬灭疗法时,还需要结合具体的细菌感染情况,评估其与抗生素联合使用的效果。
此外,细菌也可能通过一些机制,如外排泵基因突变,对群体淬灭疗法产生耐药性。这可能导致难以根治的持久性感染。
群体感应分子对中枢神经系统的影响研究不足。几种QS peptides(群体感应肽分子,QSP)可通过肠粘膜扩散并进入循环系统,从那里它们可以穿透血脑屏障(BBB)。基于这些发现,QSP 可能在肠道微生物组和大脑之间的交流中发挥关键作用。如果是这种情况,QSP 可能会影响神经发育并引发神经退行性疾病。需要进一步的研究来证实这些发现。
金黄色葡萄球菌外毒素对神经系统的影响
金黄色葡萄球菌产生的外毒素激活转录因子辅助基因调节因子(Agr)A,该调节多种基因的表达,包括毒力因子、成孔毒素(PFT) 和细菌蛋白酶。这些毒素会增加细胞内的钙水平,导致感觉神经元的激活。
金黄色葡萄球菌产生的一种毒素叫做PSMS,它能特异性地结合到宿主细胞表面的一种受体叫做FPR(甲酰肽受体样蛋白)。
FPR与另外两种受体b-防御素和MRGPRX2(mas相关G蛋白偶联受体X2)的配体有结构相似性。这表明,MRGPRX2可能也参与了PSMS引起的皮肤过敏等症状。
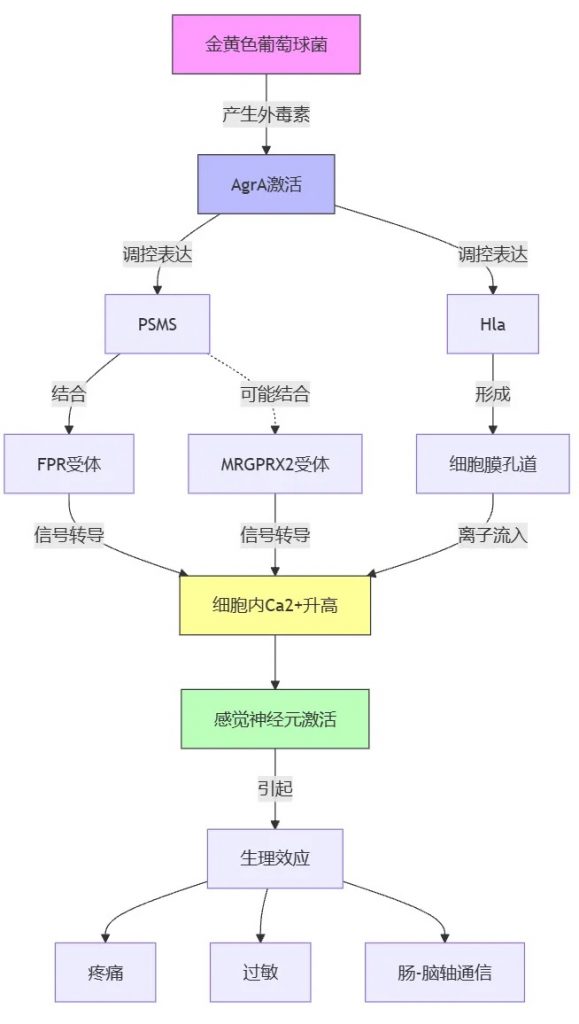
此外,FPR在肠道感觉神经节和背根神经节中有广泛表达,并与肠-脑轴(GBA)中涉及群体感应依赖性通路有关。
此外,金黄色葡萄球菌产生的毒素叫做α-溶血素(Hla),它也能通过增加细胞内钙的转移来激活神经元。与PSMS相比,Hla在细胞膜中形成的孔更小、破坏性也更小。
总之,肠道病原菌类似于金黄色葡萄球菌产生的这些毒素,通过作用于宿主细胞表面的不同受体,如FPR和MRGPRX2,从而引起神经元的激活,导致疼痛、过敏等症状。这些毒素在肠-脑轴通信中也可能发挥重要作用。

根据英国和澳大利亚联合的一项研究结果表明:与PSMS相比,Hla在细胞膜中产生更小、破坏性更小的孔。作者还观察到了 Adam10 的表达,Adam10 是一种在感觉神经元中产生的膜结合金属蛋白酶,Hla 与该酶结合。外毒素在肠脑轴通信中的重要性尚不清楚。
然而,由于金黄色葡萄球菌(S. aureus)与肠易激综合征和食物有关,这些QS分子有可能直接调节肠-脑通讯和肠道反射。

上面这篇研究在6种不同的神经元细胞系上筛选了85个群体感应肽,发现了22个可能对肠脑轴有影响的肽。其中,4 个肽诱导神经突生长,2 个肽抑制神经生长因子(NGF)诱导的神经突生长,8 个肽诱导人 SH-SY5Y 神经母细胞瘤细胞的神经突生长。2 个肽杀死 SH-SY5Y 细胞,6 个肽诱导 IL-6 表达或一氧化氮(NO)产生。
细胞壁成分在肠脑轴中的作用
已经发表了几篇关于细胞壁成分(如脂多糖、多糖和肽聚糖)在神经元激活和肠脑轴中的作用的报道。细胞壁成分还诱导神经肽、ATP 和细胞因子的释放。短链脂肪酸、色氨酸、微量胺和外毒素也具有神经调节剂特性。
5-羟色胺和组胺刺激神经末梢附近的肥大细胞。
阿尔茨海默病(AD)、自闭症谱系障碍(ASD)、多发性硬化症(MS)、帕金森病(PD) 和肌萎缩侧索硬化症(ALS)等神经元疾病与功能失调的小胶质细胞有关。
将患有注意力缺陷多动障碍(ADHD)、阿尔茨海默病和帕金森病的人类粪便移植到小鼠身上,激活了大脑中的小胶质细胞,并加剧了认知和身体损伤。
这些发现以及更多证据表明微生物群失调与神经发育、神经退行性和精神疾病(如自闭症谱系障碍、精神分裂症、阿尔茨海默病、重度抑郁症和帕金森病)之间存在明确联系,促使研究人员更仔细地研究肠脑轴。
有关肠道细菌和神经递质的更多信息,读者可关注谷禾健康以往其他分享文章。
扩展阅读:
肠道菌群检测报告解读——肠道菌群代谢产物包括激素,神经递质等
胃肠道特殊的环境下生存着海量的细菌微生物,因此它们已经开发出与宿主细胞交流的机制也就不足为奇了。
一些群体感应分子是属特异性的,但少数被革兰氏阴性菌和革兰氏阳性菌使用。Epi 和 NE 等激素以及某些碳水化合物(例如岩藻糖和 EA)激活细菌中的特定受体,进而触发细胞质中的传感器以调节基因表达。
在健康的胃肠道中,这些信号分子对于维持稳态状态很重要。一些 QS 分子,如 3-oxo-C12:2-HSL,保护紧密连接蛋白,在治疗肠漏综合征中可能很重要。
一些 QS 分子刺激肿瘤生长并与特定癌症的发展密切相关,而另一些则与神经系统疾病有关。穿透血脑屏障(BBB)的 QSP 构成了一个值得更多研究的领域,特别是因为肠道微生物组越来越被认为是神经精神病学的关键参与者。
通过更深入地了解肠道细菌产生的不同 QS 系统,未来可能能够开发可用于诊断神经和精神疾病的生物标志物,例如焦虑和抑郁、MDD、精神分裂症、双相情感障碍、自闭症和强迫症。
主要参考文献:
Dicks LMT. How does Quorum Sensing of Intestinal Bacteria Affect Our Health and Mental Status? Microorganisms. 2022 Oct 5;10(10):1969.
Janssens Y., Debunne N., De Spiegeleer A., Wynendaele E., Planas M., Feliu L., Quarta A., Claes C., Van Dam D., De Deyn P.P., et al. PapRIV, a BV-2 microglial cell acti-vating quorum sensing peptide. Sci. Rep. 2021;11:10723.
De Spiegeleer A., Elewaut D., Noortgate N.V.D., Janssens Y., Debunne N., Van Langenhove S., Govindarajan S., De Spiegeleer B., Wynendaele E. Quorum sensing molecules as a novel microbial factor impacting muscle cells. Biochim. Biophys. Acta (BBA) Mol. Basis Dis. 2019;1866:165646.
Miller M.B., Bassler B.L. Quorum Sensing in Bacteria. Annu. Rev. Microbiol. 2001;55:165–199.
Coquant G., Aguanno D., Pham S., Grellier N., Thenet S., Carrière V., Grill J.-P., Seksik P. Gossip in the gut: Quorum sensing, a new player in the host microbiota interactions. World J. Gastroenterol. 2021;27:7247–7270.
Yashiroda Y., Yoshida M. Intraspecies cell–cell communication in yeast. FEMS Yeast Res. 2019;19:foz071.
Prescott R., Decho A.W. Flexibility and Adaptability of Quorum Sensing in Nature. Trends Microbiol. 2020;28:436–444.
Tam K., Torres V.J. Staphylococcus aureus Secreted Toxins and Extracellular Enzymes. Microbiol. Spectr. 2018;7:GPP3-0039-2018.
Fülling C., Dinan T.G., Cryan J.F. Gut Microbe to Brain Signaling: What Happens in Vagus…. Neuron. 2019;101:998–1002.
Krasulova K., Illes P. Intestinal interplay of quorum sensing molecules and human receptors. Biochimie. 2021;189:108–119.
Galloway W.R.J.D., Hodgkinson J.T., Bowden S.D., Welch M., Spring D.R. Quorum Sensing in Gram-Negative Bacteria: Small-Molecule Modulation of AHL and AI-2 Quorum Sensing Pathways. Chem. Rev. 2010;111:28–67.
Wu S, Liu J, Liu C, Yang A, Qiao J. Quorum sensing for population-level control of bacteria and potential therapeutic applications. Cell Mol Life Sci. 2020 Apr;77(7):1319-1343.
Krzyżek P. Challenges and Limitations of Anti-quorum Sensing Therapies. Front. Microbiol. 2019;10:2473.
Wu S., Liu J., Liu C., Yang A., Qiao J. Quorum sensing for population-level control of bacteria and potential therapeutic applications. Cell. Mol. Life Sci. 2019;77:1319–1343.
Janssens Y, Wynendaele E, Verbeke F, Debunne N, Gevaert B, Audenaert K, Van DeWiele C, De Spiegeleer B. Screening of quorum sensing peptides for biological effects in neuronal cells. Peptides. 2018 Mar;101:150-156.
谷禾健康
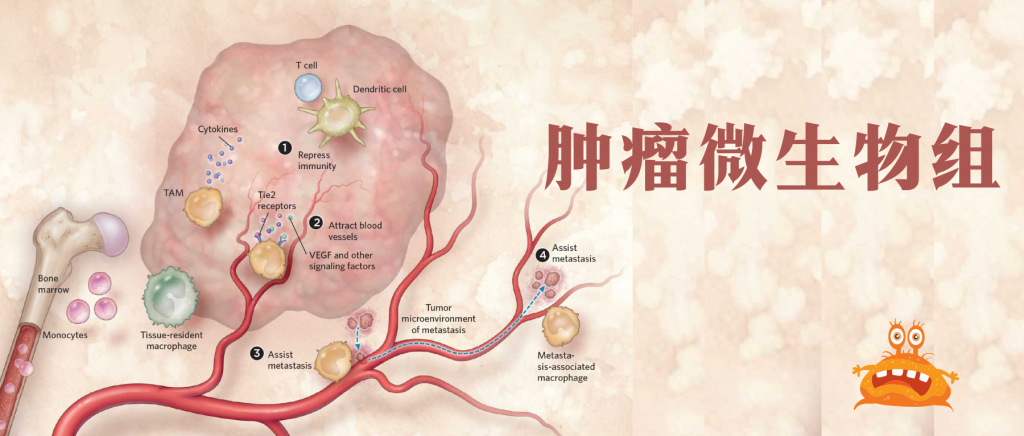
通常认为人类体内微生物群存在于与外部环境接触的体腔和器官中,例如胃肠道、皮肤、口腔、上呼吸道(尤其是鼻咽)和泌尿生殖道。然而在过去十年中,越来越多的研究确定了肿瘤内存在着低生物量而独特的微生物群落(瘤内微生物群)。
在肿瘤内,细菌、真菌、病毒和古菌等微生物形成了肿瘤微生物群,主要存在于肿瘤细胞、免疫细胞和细胞间基质中。这些微生物群落构成了肿瘤微环境(TME)的一部分,影响免疫调节、炎症和代谢控制等过程,这些过程与肿瘤的发生和进展密切相关。迄今为止报道的证据表明,肿瘤微生物组存在于33种主要癌症类型中。
大量证据表明,多达20%的癌症与微生物感染有着错综复杂的联系。最初在伯基特淋巴瘤中发现了EB 病毒(EBV)。从那时起,病毒感染就被认为是导致人类癌症的重要因素,包括确定人乳头瘤病毒(HPV)是导致宫颈癌的原因,乙型肝炎病毒(HBV)是导致肝癌的原因,以及人T细胞嗜淋巴细胞病毒是导致白血病和淋巴瘤的主要原因。
伯基特淋巴瘤(Burkitt淋巴瘤)是儿童恶性淋巴瘤中最常见的类型,起病急,进展快,侵袭强和恶性度高。1964年首先从非洲儿童Burkitt淋巴组织中分离出EB病毒。
1982年,就在胃中发现幽门螺杆菌(Helicobacter pylori)证实了其作为消化性溃疡和胃癌病原体的作用。2020年,对来自七种常见实体瘤(包括乳腺癌、肺癌、卵巢癌、胰腺癌、黑色素瘤、骨癌和脑肿瘤)的超过1526个样本进行了分析,发现大多数实体瘤含有细菌,其中许多是存活在癌细胞内的细胞内细菌。随后,在各种人类癌症标本中也发现了真菌,包括胰腺癌、肺腺癌和结直肠癌。
本文介绍了肿瘤微生物组的相关概念、来源和特征及检测方法。然后,我们描述了常见肿瘤中肿瘤微生物组的组成及其在塑造肿瘤微环境中的作用。肿瘤微生物组和免疫系统之间的相互作用可以调节宿主的抗肿瘤免疫,影响肿瘤治疗的疗效。理解肿瘤微生物组与肿瘤之间的相互关系,有助于为肿瘤的早期诊断和治疗带来新的突破。
▸ 肿瘤微生物的定义
“肿瘤微生物”,其定义为在肿瘤组织中发现的可影响癌症易感性和治疗反应的微生物。国际癌症登记协会(IARC)将11种微生物归类为人类致癌物。
其中包括7种病毒,即乙型肝炎病毒(HBV)、丙型肝炎病毒、人类嗜T细胞病毒、人乳头瘤病毒(HPV)、EB病毒、卡波西肉瘤相关疱疹病毒(KSHV)和默克尔细胞多瘤病毒(MCV);三种寄生虫,即华支睾吸虫、埃及血吸虫和Clonorchis mukusicus;和一种细菌,幽门螺杆菌(Helicobacter pylori)。
术语“瘤内微生物群 ”和 “瘤内微生物组 ”经常被人们混用。在本文中,我们将前者定义为肿瘤组织内所有微生物(包括细菌、病毒、真菌、原生动物和古细菌)的集合,而后者包括肿瘤组织内所有微生物的基因组和产物,包括所有分泌毒素(如来自脆弱拟杆菌和具核梭杆菌的毒素)、代谢物(如短链脂肪酸)和氧化还原活性小分子(活性氧、活性氮)。
并且在本文的术语中,“肿瘤”主要是指癌症(恶性肿瘤)。尽管良性肿瘤(如子宫肌瘤)也含有微生物群,但关于良性肿瘤的微生物群和微生物组的研究较少。此外,良性肿瘤不具有转移特性,限制了对微生物组在转移中作用的探索。
▸ 肿瘤微生物的来源
肿瘤微生物群的来源可分为两类。第一类是“常驻”生物,它们栖息在人类生态位中,在正常情况下通常不会引起疾病。然而,在微生物组的整体扰动导致生态失衡(生态失调)之后,共生微生物群的比例被破坏,导致共生微生物易位,从而诱导肿瘤形成。
第二类由“外来入侵者”组成,例如致癌微生物和其他病原微生物。入侵的肿瘤微生物群可以根据入侵途径进一步分为三种类型。
(一)微生物通过粘膜屏障侵入
微生物群落栖息在人体的各种粘膜表面,形成不同的微生物组生态位。在健康状态下,微生物群保持动态平衡,调节免疫系统以抵抗外部病原体的定植,并抑制内源性微生物的致病潜力。
然而,微生物组成的破坏或这些群落的位移会导致生态位间微生物串扰,从而可能影响癌症进展。在肿瘤发生过程中,粘膜屏障的损伤(无论是由细菌还是其他因素引起)可能使粘膜微生物有机会侵入肿瘤组织,从而导致结直肠癌、胰腺癌、肺癌和宫颈癌等癌症的发展。
(二)源自邻近健康组织的微生物
一些研究发现,肿瘤组织的微生物群组成与邻近正常组织的组成非常相似。胰腺癌患者肿瘤组织和十二指肠组织之间的细菌DNA谱相似性表明胰腺组织中的细菌可能起源于十二指肠。
起源于口腔的具核梭杆菌(Fusobacterium nucleatum)可进入肠道并在结直肠癌内增殖,从而在肿瘤微环境(TME)内诱导免疫细胞激活。小鼠模型显示,具核梭杆菌通过将其粘附素Fap2与结直肠癌细胞上表达的糖分子Gal-GalNAc结合来定植结直肠癌组织,而Fap2缺陷细菌在这些小鼠中的定植受损。
同样,发现口服荧光标记的粪肠球菌(Enterococcus faecalis)从肠道转移到肿瘤外围,改变了肿瘤微生物组的基因组特征并调节免疫功能。
此外,与正常组织相比,肿瘤微环境(TME)的特点是免疫抑制和缺氧,这些条件更有利于微生物定植,因此假设肿瘤微生物群可能起源于正常组织。
(三)微生物通过血液迁移到肿瘤
血液是肿瘤微生物组的另一个潜在来源。由于肿瘤组织的丰富血管化,它们为微生物的生存和传播提供了合适的环境。红细胞在细菌易位中起着至关重要的作用,有助于免疫逃避。使用 16S rDNA 定量聚合酶链反应测定和 MiSeq 测序(16S 靶向宏基因组测序)证实了健康人血液中存在细菌,并且在红细胞中检测到的细菌 DNA 浓度高于血浆。
活细菌,如肺炎链球菌和金黄色葡萄球菌,已被证明存在于红细胞中。
源自口腔、肠道、呼吸道和其他区域的微生物可以通过血流运输到肿瘤部位,通过受损的血管浸润肿瘤。坏死肿瘤细胞碎片的趋化梯度可能引导从身体不同部位进入血液的微生物迁移到肿瘤。
例如,金黄色葡萄球菌(Staphylococcus aureus) 的肺部感染已被证明会影响乳腺癌转移。结肠中的大肠杆菌(Escherichia coli)在结直肠癌期间破坏肠道血管屏障,进入血液,随后定植于肝脏,诱导转移前生态位的形成并促进肝转移。
★ 不同类型的癌症微生物群组成不同
许多研究已经确定了肿瘤组织内微生物组的存在,并强调了癌症微生物群的异质性。癌症微生物群是多种多样的,癌症微生物群的组成在不同类型的癌症之间,甚至在同一癌症的不同病理亚型之间也不同。
例如厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是结直肠癌中最丰富的物种,而变形菌门(Proteobacteria)在胰腺癌的微生物群中占主导地位。肝细胞癌富含变形菌门、拟杆菌门和Patescibacteria。
不同的癌症类型承载着不同的微环境,具有不同的氧分压、血管生成能力和周围组织的微生物群,这会影响肿瘤微生物群的组成并产生肿瘤类型的异质性。
不同肿瘤类型中微生物群的组成



Ma Y,et al.Microb Pathog.2024
★ 癌症不同阶段的微生物群也存在变化
除了类型异质性外,癌症微生物群还表现出位点异质性和分期异质性。前者是指肿瘤组织和非肿瘤组织之间微生物群组成的差异,主要包括特定个体微生物的存在或生态失调。肿瘤组织中的微生物群多样性通常低于非肿瘤组织,这可能与肿瘤微环境中特定微生物的选择性扩增有关。
后者是指癌症发展不同阶段肿瘤微生物群的变化。在口腔鳞状细胞癌的进化过程中,癌前阶段(癌前病变)显示链球菌(Streptococcus)和罗氏菌(Rothia)的高富集。而在晚期癌症中,Capnocytophaga在肿瘤组织中富集。
★ 癌症微生物组与宿主之间存在双向作用
肿瘤微生物组和宿主之间的相互作用是双向的。
这种影响主要体现在两个方面:
首先,细胞内和细胞外肿瘤环境之间的生化和生物差异与细胞内和细胞外肿瘤微生物组之间的功能变化有关。例如,某些细菌可以在癌细胞侵袭过程中调节RhoA-GTP酶-Rock-肌动蛋白细胞骨架重塑途径,从而促进携带细菌的癌细胞远处转移——这是细胞内肿瘤微生物组特有的作用。
其次,肿瘤微环境对肿瘤微生物组产生选择性影响。不同微环境中血管生成、氧水平、微生物来源、内吞作用和胞饮作用活性的变化导致肿瘤内的微生物组成不同。
让我们一起来看下不同癌症中的肿瘤微生物组与宿主之间可能存在的相互作用。
结直肠癌(CRC)是全球最常见的肿瘤之一,也是与肿瘤微生物组密切相关的肿瘤之一。
菌群失调可能是结直肠癌的诱因之一
动态平衡的微生物群对人类健康有益,但菌群失调可能导致结直肠炎症、炎症性肠病,甚至结直肠癌。
一项对423名I-IV期结直肠癌患者的肿瘤组织和正常粘膜进行 16S rRNA 测序的研究发现,与正常肠粘膜相比,结直肠癌组织的α多样性降低,β多样性增加。
变形菌门、梭菌门、弯曲杆菌门在肿瘤组织中的含量增加,而拟杆菌门、厚壁菌门、疣微菌门、放线菌门和古细菌减少。
有益菌和有害菌在结直肠癌环境中的作用
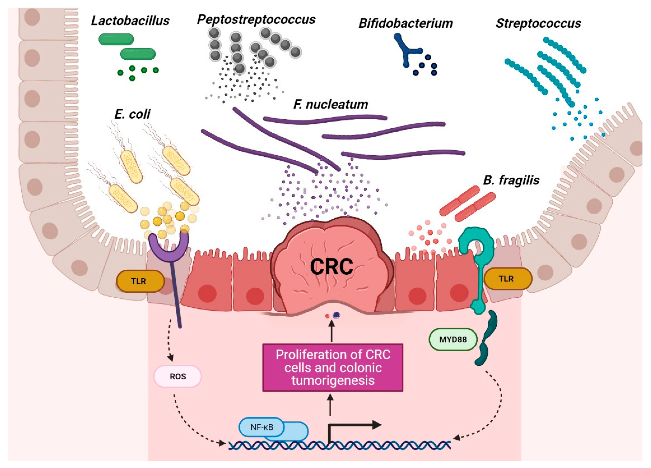
Torres-Maravilla,et al.Microorganisms.2021
产生毒素的特定细菌诱导肿瘤的进展
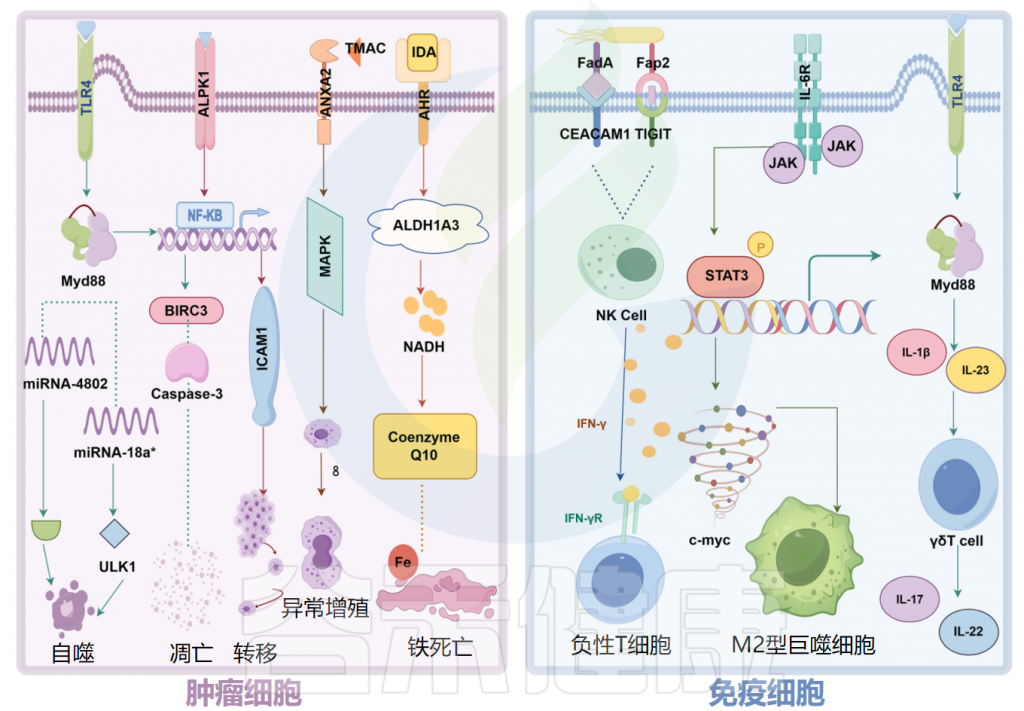
结直肠癌患者富含特定菌群,包括产生肠毒素的脆弱拟杆菌(B.fragilis)、肝螺杆菌(Helicobacter hepaticus)、败血梭菌(Clostridium septicum)、粪肠球菌(Enterococcus faecalis)、具核梭杆菌(F.nucleatum)、大肠杆菌、无乳链球菌和幽门螺杆菌。
这些细菌可通过释放破坏宿主细胞基因组的毒素,激活STAT3、NF-κB、Wnt和SREBP-2途径、诱导COX-2表达、与TRL2和TRL4相互作用、刺激促炎细胞因子(IL-1β、IL-6、IL-8、IL-17、TNF-α和IFN-γ)产生、调节NLRP3炎症体活性,通过氧化应激活性氧(ROS)和活性氮(RNS)DNA损伤来促进肿瘤中炎性微环境的形成并导致免疫逃逸来影响肿瘤的发展。
由于肿瘤粘膜微生态中的病原体网络与肿瘤突变和代谢特征相关,我们预计肿瘤微生物群组成的分析可以预测接受切除的结直肠癌患者的预后。
肺癌是常见的恶性肿瘤之一,肺癌的发生与下呼吸道以及口腔、鼻腔、胃肠道的微生物群密切相关。
肺癌患者中Gemmiger、Blautia等菌增加
普雷沃氏菌属(Prevotella)、链球菌属(Streptococcus)和韦荣氏球菌属(Veillonella)常见于口腔中,在肺癌中的含量增加。
并且与良性肺病患者相比,肺癌患者发现的菌群之间存在高度差异,Capnocytophaga、Sediminibacterium、吉米菌(Gemmiger)、Blautia和颤螺菌属(Oscillospira)这几个细菌相对丰富。
与肺癌可能相关的微生物
从全球角度来看,假单胞菌、链球菌、葡萄球菌、韦荣球菌属和莫拉克斯氏菌属经常被报道为与肺癌最相关的微生物群。

Liu NN,et al.NPJ Precis Oncol.2020
通过qPCR确定,二氧化碳嗜纤维菌(capnocytophaga)和韦荣氏球菌在肺癌患者的唾液样本中含量更高,而奈瑟菌属的丰度相对较低,它们有可能用作肺癌早期检测的生物标志物和微生物组治疗的靶标。
对30项相关研究的荟萃分析发现,肺部感染结核分枝杆菌、非结核分枝杆菌和其他病原体会增加患肺癌的风险。
胰腺癌是一种主要起源于胰腺导管上皮及腺泡细胞的恶性肿瘤,起病隐匿,早期诊断困难,进展迅速,生存时间短,是预后最差的恶性肿瘤之一,被称为“癌中之王”。
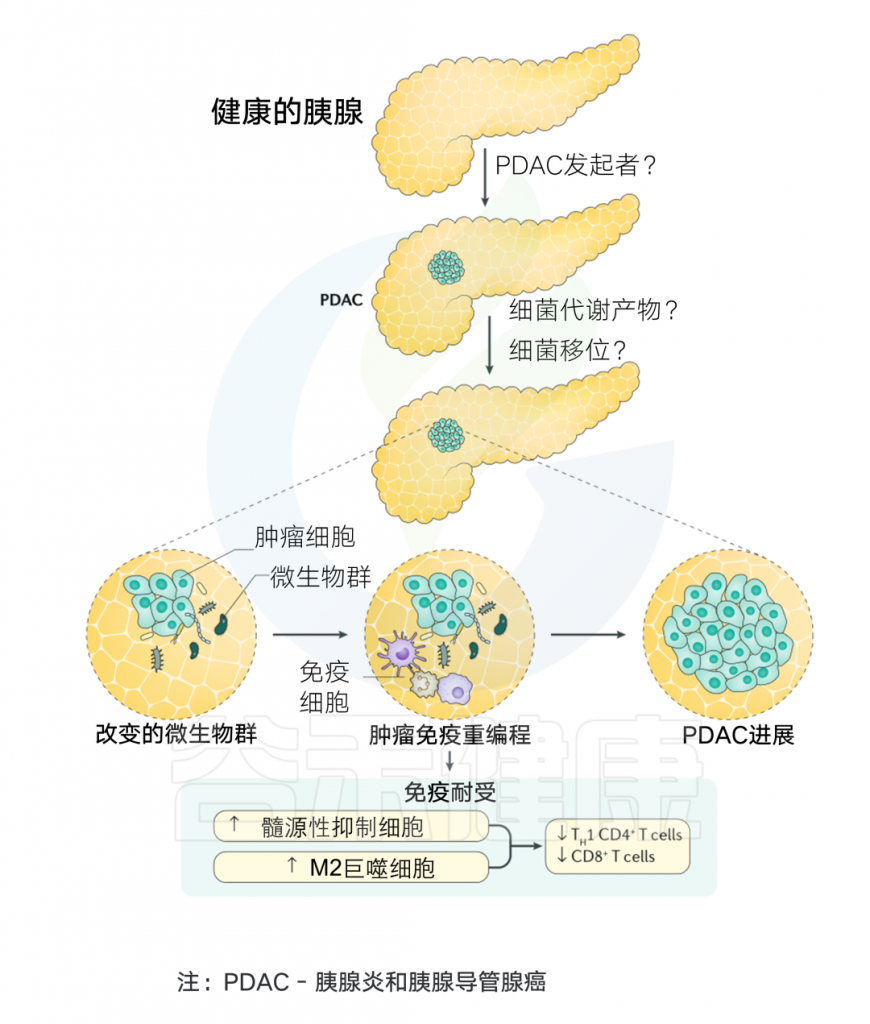
胰腺中存在细菌,胰腺癌患者细菌更多
胰腺以前被认为是一个完全无菌的器官。然而,在2017年,在人胰腺癌组织中发现了γ-变形杆菌。随后,其他研究通过 16S rRNA 测序、NGS 和免疫荧光鉴定了胰腺癌中的肠杆菌科、假单胞菌属和变形杆菌科等细菌。
用16S rRNA基因特异性PCR对胰腺囊肿标本进行分析,发现优势菌:氨基酸球菌属(Acidaminococcus),埃希氏菌属(Escherichia),拟杆菌属(Bacteroides),志贺氏菌(Shigella)。
最近,对胰腺癌样本进行的16S rRNA荧光探针和qPCR实验都证实,与正常人相比,胰腺癌患者中存在的细菌约为正常人的1000倍。
肿瘤微生物可引发炎症,促进胰腺癌变
此外,胰腺组织中的真菌组相比正常组织富集度增加了3000倍,主要成分为马拉色菌(Malassezia)。研究表明,马拉色菌属激活并结合甘露糖结合凝集素(MBL)蛋白,触发诱导胰腺癌的补体级联反应。
此外,肿瘤微生物组中的代谢物可以引发炎症和免疫抑制反应,并产生有利于肿瘤进展的免疫抑制微环境,促进胰腺癌变。
微生物组与胰腺癌发生的关系
Thomas R M, et al.Nature Reviews Gastroenterology & Hepatology.2019
乳腺癌是常见的癌症之一,也是全球女性癌症相关死亡的主要原因。
乳腺癌组织中的微生物稳态受到破坏
与正常乳腺组织相比,乳腺癌组织中的细菌 DNA 总水平较低,并且这些水平随着癌症的进展而持续下降,这表明癌症可能会破坏微生物组稳态。此外,已经确定肠道微生物群中预先存在的干扰增加了乳腺癌细胞转移,但还需要更多的研究来确定这些发现在临床环境中的相关性。
进一步表征乳腺组织中的正常微生物群和乳腺癌组织中的群落结构变化,可能会确定乳腺癌预防和诊断的新靶点。
阴道微生物组影响卵巢癌、子宫内膜癌和宫颈癌的发生和进展。研究表明,阴道细菌多样性的增加和乳杆菌丰度的降低可能导致持续的HPV感染。
阴道微生物组与HPV感染、宫颈上皮内瘤变相关
评估了250名女性的阴道菌群,证明了阴道微生物组、HPV感染与宫颈上皮内瘤变之间存在联系。阴道微生物群以阴道加德纳菌为主,其次是 Lactobacillus iners、Lactobacillus crispatus、Lactobacillus taiwanensis。
与健康女性相比,子宫肌瘤(UF)患者的宫颈和阴道微生物群相互作用和相对微生物丰度发生了改变。Erysipelatoclostridium、Mucispirillum、Finegoldia相对丰富,而Finegoldia的丰度降低,这表明子宫肌瘤患者可能存在宫颈和阴道微生物群的生态失调。
促炎微生物群与前列腺癌有关
前列腺癌是男性人群中常见的癌症,前列腺癌和非前列腺癌患者的尿液测序显示,促炎微生物群与泌尿生殖系统感染和前列腺癌有关。
研究报告了前列腺癌中促炎拟杆菌和链球菌丰度的显著差异,叶酸和精氨酸途径显著改变。对前列腺肿瘤微环境的分析显示,与非肿瘤组织相比,肿瘤/肿瘤周围组织中的葡萄球菌(Staphylococcus)明显更多,而丙酸菌属(Propionibacterium)在所有测试的肿瘤/肿瘤周围和非肿瘤组织中最为丰富。
病例对照研究还发现,良性对照受试者和前列腺癌男性的肠道微生物组的组成有很大不同,这可能适应前列腺癌的发病机制和对其危险因素的进一步研究。特别是,与对照组相比,前列腺癌病例中Bacteroides massiliensis的相对丰度较高,而对照组中普氏栖粪杆菌(Faecalibacterium prausnitzii)和直肠真杆菌(Eubacterium rectalie)的相对丰度较高。
超过700种不同的微生物定植于人类口腔,健康人的口腔微生物群保持相对稳定。而口腔癌患者的口腔微生物群发生了变化。
口腔癌患者丰度和多样性比正常人群更高
对121例患者的分析显示,与健康个体相比,口腔癌患者的戴阿利斯特杆菌属(Dialister)含量显著增加,放线菌属、乳酸菌属和链球菌属丰度显著降低。牙龈卟啉单胞菌和核镰刀菌等主要牙周病原菌的慢性感染可增强IL-6-STAT3 轴信号传导并诱导口腔鳞状细胞癌。
使用16S rDNA测序来表征口腔鳞状细胞癌(OSCC)组织的微生物群,肿瘤部位细菌的丰度和多样性显著高于来自同一患者的正常组织样本。在OSCC样本中检测到梭杆菌属、卟啉单胞菌属、消化链球菌科、Flavobacteriaceae、Prevotellaceae和Campylobacteraceae,可能是诊断标志物和治疗靶点。
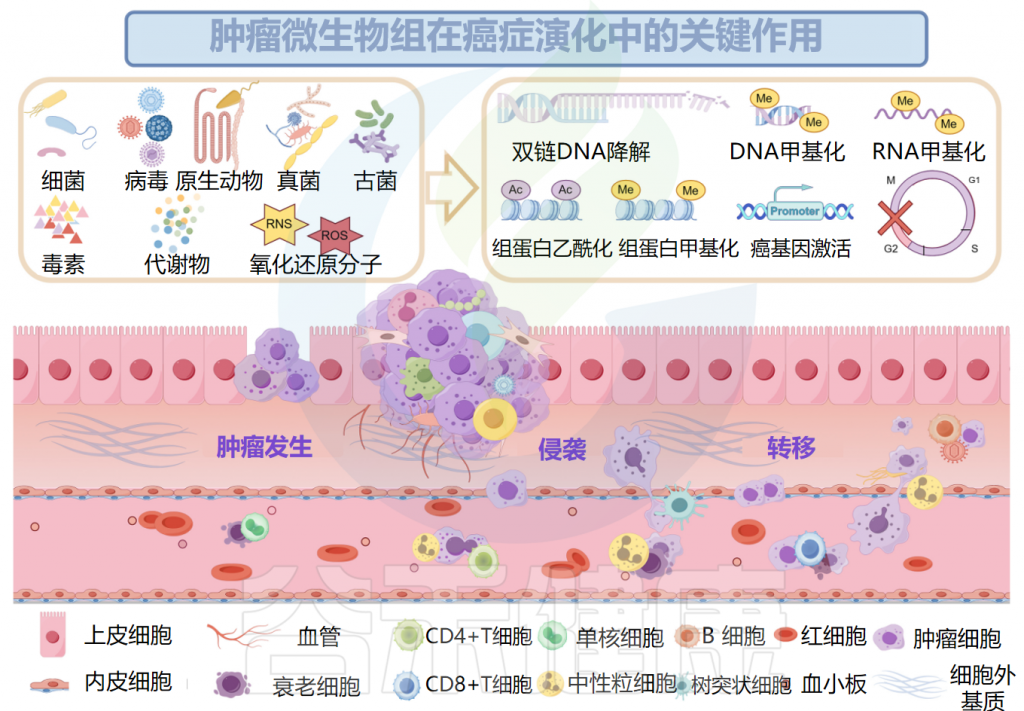
肿瘤微生物组与肿瘤发生、发展和转移密切相关,研究人员认为可以将多态性微生物组列为肿瘤的标志。接下来,我们将讲述肿瘤微生物组与肿瘤之间关系的代表性机制。
肿瘤微生物组与肿瘤密切相关
Ma Y,et al.Microb Pathog.2024
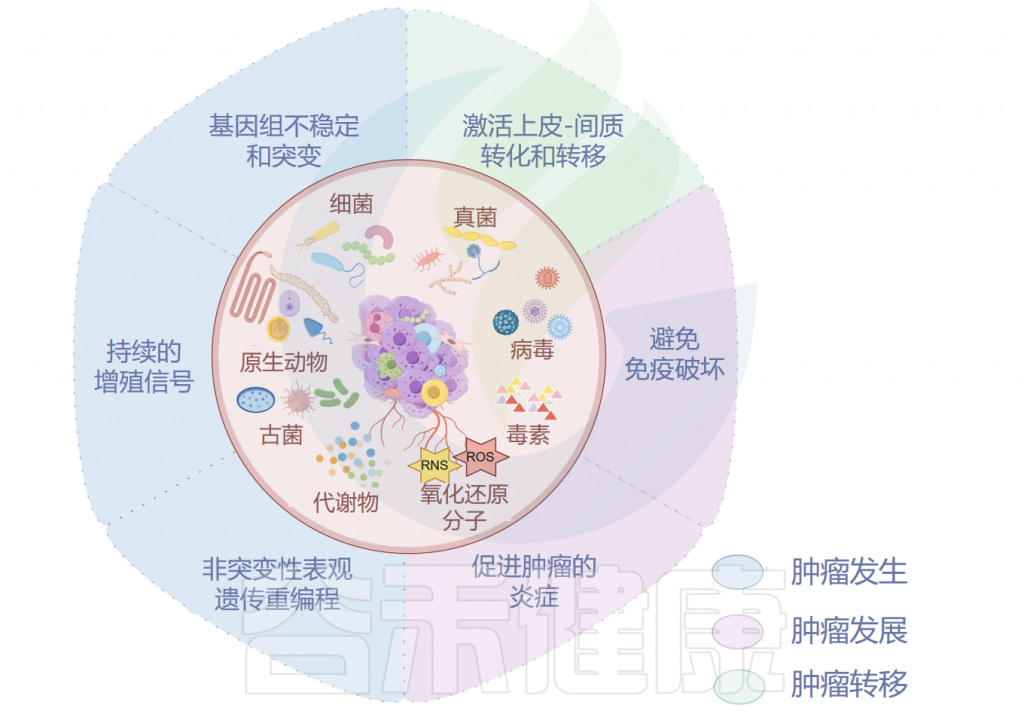
▸ 与肿瘤发生之间的关系
已被证明有助于肿瘤发生的肿瘤微生物组成分包括毒素、代谢物、酶和触发氧化应激的反应性小分子。这些物质可通过诱导基因组不稳定、表观遗传修饰和刺激宿主细胞的持续增殖而导致癌症。
细菌产生的毒素破坏基因稳定性并导致氧化应激
例如,由聚酮合酶阳性(pks+)大肠杆菌产生的大肠杆菌素和空肠弯曲菌分泌的细胞致死性膨胀毒素(Cdt)具有DNA酶活性,可以直接降解双链DNA,也可以导致DNA烷基化,从而在表观遗传水平上破坏基因组的稳定。
毒素介导的对DNA结构的间接损伤也可能是由反应性小分子的失衡引起的,例如脆弱拟杆菌毒素(BFT),它通过增加活性氧(ROS)的水平来诱导宿主细胞中的氧化应激。
此外,许多研究证实了肿瘤发生与癌微生物群产生的代谢物之间的联系。黄曲霉毒素B1(AFB1)是黄曲霉的代谢产物,可与DNA中的鸟嘌呤残基形成DNA加合物并诱导DNA损伤,最终致癌。在肝脏中,细胞色素P450酶参与AFB的代谢,它经历环氧化并转化为具有遗传毒性的8,9-环氧化物。8,9-环氧化物随后形成DNA加合物并促进突变,导致肝细胞癌的发展。
丁酸表达异常可能导致上皮细胞过度增殖
丁酸盐是一种短链脂肪酸,由结肠中的细菌发酵可溶性纤维衍生而来,是首选的宿主能量底物,可抑制结肠癌的发展。
丁酸抑制组蛋白脱乙酰酶(HDACs)和 DNA 修复蛋白的表达,在表观遗传水平上调节细胞增殖和凋亡,并减轻淋巴瘤。然而,在错配修复缺陷(dMMR)小鼠模型中,丁酸与结肠上皮细胞的过度增殖有关。
除了遗传起源外,表观遗传,包括由DNA甲基化、组蛋白甲基化和组蛋白乙酰化驱动的表观遗传,可以驱动宿主细胞恶性转化为癌细胞。
致癌微生物会驱动肿瘤的发生
EB病毒(EBV),也称为人类疱疹病毒4型(HHV-4),是一种致癌病毒,可诱导表观遗传变化以驱动肿瘤发生。溶原性EBV可诱导基因组不稳定并改变免疫逃逸,而潜伏的EBV有助于肿瘤细胞获得干性。
注:肿瘤干性被认为是肿瘤发展的关键组成部分
具核梭杆菌(F.nucleatum)通过钙黏附蛋白(E-cadherin)和粘附A蛋白(FadA)与癌细胞或免疫细胞结合,并激活β-catenin和Wnt信号通路以促进癌细胞增殖。
微生物组产生的炎症反应会增加对肿瘤的易感性
肿瘤微生物组产生炎症反应,以增加宿主对肿瘤的易感性。肿瘤微生物群的抗原表位被肿瘤微环境(TME)中的模式识别受体(如Toll样受体)识别,并导致活性氧、细胞因子和趋化因子等炎症介质的诱导,触发促进血管生成、癌细胞增殖以及肿瘤生长和进展的信号级联反应。
口腔牙龈卟啉单胞菌在癌症和胰腺导管腺癌中定植,促进CXCR2介导的中性粒细胞浸润,增强中性粒细胞弹性蛋白酶分泌,重塑肿瘤的炎症微环境,从而导致癌症进展。结直肠癌中,牙龈卟啉单胞菌激活造血NLRP3炎症小体,招募髓细胞,创造促炎微环境,与结直肠癌的发展和不良预后相关。
Ma Y,et al.Microb Pathog.2024
!
代谢物可能促癌也可能抑制癌症
重要的是要注意,代谢物的活性取决于肿瘤类型。色氨酸是变形杆菌和放线菌的能量来源,其代谢衍生物吲哚-3-醛激活肿瘤相关巨噬细胞中的芳烃受体(AHR),改变炎症基因的表达,随后可能诱发结直肠癌。
相反,在黑色素瘤中,罗伊氏乳杆菌代谢产生的吲哚-3-醛通过IFN-γ激活CD8+T 细胞中的AHR并增强免疫检查点抑制剂的疗效,从而促进肿瘤治疗。
▸ 与肿瘤发展之间的关系
肿瘤微生物群及其结构成分调节宿主代谢和免疫力,从而影响肿瘤的发展。
抑制自然杀伤细胞并促进肿瘤发展
除了激活长链非编码RNA ENO1-IT1的转录并影响组蛋白修饰外,具核梭杆菌(F.nucleatum)还调节结直肠癌细胞中的糖酵解途径,抑制自然杀伤细胞的活性并促进肿瘤发展。
肿瘤微生物的作用在不同肿瘤中可能有所不同,而不同生物体也可能在肿瘤中产生相同的生理效应。
例如,食管癌中的具核梭杆菌(F.nucleatum)以趋化因子(CCL20)依赖性方式促进Treg淋巴细胞浸润到肿瘤中,从而增强了肿瘤的侵袭性。在结直肠癌中,具核梭杆菌通过CCL20诱导巨噬细胞M2型极化参与肿瘤转移。
口腔鳞状细胞癌(OSCC)是一种起源于口腔粘膜复杂鳞状上皮的恶性肿瘤。具核梭杆菌激活自噬途径可促进体内癌细胞的迁移和侵袭。
同样,产气荚膜梭菌肠毒素诱导紧密连接蛋白Claudin 4(CLDN4)的核转位,增强OSCC细胞的增殖、迁移和侵袭,抑制YAP1磷酸化,促进YAP1表达以驱动肿瘤进展。
▸ 与肿瘤转移之间的关系
癌症转移是指肿瘤从原发部位迁移到远端器官的复杂过程,形成继发性肿瘤,是恶性肿瘤的一个重要标志。在发现癌微生物组作为肿瘤成分后,多项研究表征了癌微生物组在肿瘤转移中的作用。
调节上皮-间充质转化的激活
上皮-间充质转化(EMT)是将上皮细胞转化为间充质细胞的过程,其特征是细胞间极性和粘附丧失,运动和迁移增加。EMT的激活是肿瘤适应恶劣环境以促进侵袭和转移的关键策略,也可以由肿瘤微生物组调节。
在口腔癌小鼠模型中,具核梭杆菌(F.nucleatum)分泌的外膜囊泡调节EMT相关蛋白的表达,上调波形蛋白和神经钙网蛋白(N-cadherin)的表达,下调E-钙网蛋白(E-cadherin)的表达,从而促进口腔癌转移。
白色念珠菌是口腔癌菌群的主要组成部分,分泌蛋白酶诱导上皮细胞整合素的变化,增加E-钙粘蛋白表达,增强口腔癌的EMT表型,并促进侵袭和转移。
定植于乳腺导管腺癌的产肠毒素脆弱拟杆菌(ETBF)分泌的毒素可影响 Slug 和 Twist(EMT 标志物)的表达,并激活 β-catenin 和 Notch1 信号通路,促进肿瘤转移。
驱动细胞因子产生刺激癌细胞增殖和迁移
在胰腺癌中,具核梭杆菌(F.nucleatum)通过Fap-2依赖性途径靶向胰腺癌细胞紧密连接。这种相互作用驱动细胞因子的产生,这些细胞因子刺激癌细胞增殖并促进通过自分泌和旁分泌途径的迁移,最终驱动恶性肿瘤进展。
此外,紧密连接的破坏会激活YAP信号转导,从而抑制FOXD3的表达,从而降低m6A甲基转移酶甲基转移酶样3(METTL3)的表达。这随后降低了m6A甲基化,并促进了靶驱动蛋白家族成员26B的表达,从而驱动结直肠癌转移。
分泌细胞外囊泡,促进胰腺癌转移
最后,胰腺肿瘤微生物群可以分泌小的细胞外囊泡(sEVs),这些囊泡重塑细胞外基质,促进血管生成,并形成转移前生态位,促进胰腺癌转移。
与转移相关的肿瘤微生物群的研究

doi.org/10.1016/j.tcb.2022.11.007
对肿瘤微生物组及其异质性的研究发现了其在肿瘤诊断、预防和治疗方面的重要作用。
★ 有助于作为早期癌症的诊断标志物
迄今为止的研究表明,肿瘤微生物组可用作早期癌症诊断的标志物。幽门螺杆菌、梭杆菌、肠球菌属、沙门氏菌属、假单胞菌属和双歧杆菌属在特定的肿瘤部位富集,它们的检出可能用于诊断。
例如在原发性人类结肠癌和远处转移中检测到梭杆菌门(Fusobacteria),而使用甲硝唑抗生素治疗可以消除梭杆菌,并减缓肿瘤生长速度。
肝脏中Stenotrophomonas maltophilia丰度的增加诱导了肝星状细胞的细胞衰老相关的分泌表型(SASP),从而促进了肝癌发生。
微生物组对肿瘤细胞和免疫细胞的特异性机制
Ma Y,et al.Microb Pathog.2024
测序技术的广泛使用大大提高了我们研究肿瘤微生物组的能力。这些测序技术包括16S rRNA测序、DNA测序、下一代测序技术(NGS)、表观遗传学测序(例如染色质免疫沉淀测序和DNA/RNA甲基化测序)和三维(3D)基因组技术。
肿瘤内微生物的生物量相对较低,这导致了多路复用16S rRNA 测序方案的开发,以最大限度地减少污染并准确表征癌微生物组。
例如,利用qPCR和16S测序技术从肿瘤组织获取测序数据,并构建了一个表征肿瘤微生物组的数据库,实现了检测灵敏度103-104每克组织对应的细菌数。
宏基因组是一种针对样本中所有DNA的非靶向测序方法,包括微生物群落的全基因组序列,广泛应用于复杂微生物组的分析。宏基因组的分辨率更高,可以达到物种甚至菌株水平。此外,宏基因组学可以提供功能信息。最近的研究表明,宏基因组数据涵盖了更多类型的癌症,这可能促进肿瘤内微生物群领域的新进展。
代谢组学,特别是质谱法,可以检测和表征人类微生物群产生的小分子,并了解这些微生物代谢物的功能作用。这提高了我们研究肿瘤微生物群的能力,并可能开发出非侵入性的诊断性肿瘤生物标志物。
微生物产生的多种细胞毒性代谢物在肿瘤发生和发展中起着至关重要的作用。单一的实验技术可能不足以完全解释肿瘤和微生物之间的复杂相互作用,需要基因组学、转录组学、蛋白质组学和代谢组学的组合来了解各种代谢物在调节肿瘤发生和发展中的作用。
肿瘤微生物组检测技术

Ma Y,et al.Microb Pathog.2024
▸ 微生物组在癌症治疗中的作用
现有的癌症疗法很多,化疗、放疗等方式虽然有效,但副作用较多;免疫疗法有其局限性,有效率低且针对癌症类型有限。
靶向肿瘤微生物组的治疗方法可能通过增强宿主抗肿瘤免疫、诱导肿瘤细胞焦亡、促进CD8+ T 细胞活性以及避免干扰健康组织及其相关微生物群来改善肿瘤的治疗。
肿瘤微生物组在肿瘤治疗中的应用
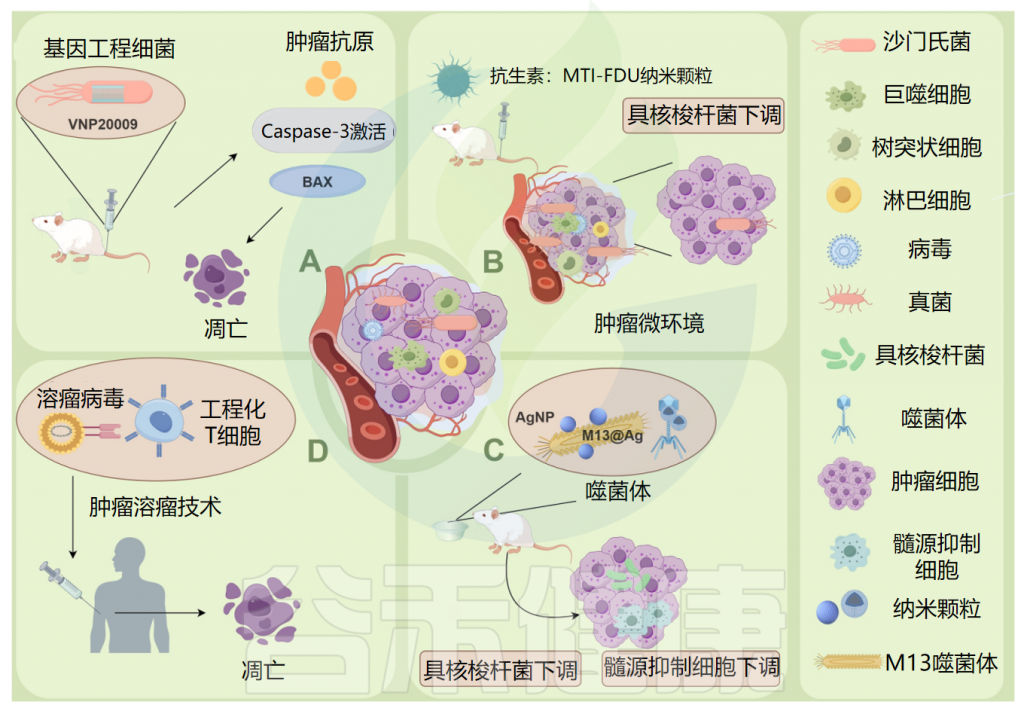
Ma Y,et al.Microb Pathog.2024
例如:(A)将基因工程减毒细菌菌株VNP20009直接递送到肿瘤发生部位,以及caspase-3凋亡酶活性的增加和促凋亡蛋白 Bax 的表达,显著诱导小鼠胰腺肿瘤细胞坏死,可作为杀死胰腺肿瘤的有效药物。
(B)甲硝唑-氟尿嘧啶利用增强的渗透性和保留作用,靶向肿瘤中的微生物群和肿瘤细胞,可以有效地从结直肠癌癌症组织中去除具核梭杆菌(F.nucleatum),具有低毒性和副作用。
(C)ONCOTECH(溶瘤病毒T细胞嵌合体)递送技术不仅增强了溶酶体病毒的靶向递送,而且改善了肿瘤微环境,能够在肿瘤中诱导长期免疫记忆。
(D)M13噬菌体特异性结合具核梭杆菌,在其表面外壳蛋白上静电组装银纳米粒子(AgNP)(M13@Ag),从肿瘤中去除具核梭杆菌,导致肿瘤部位髓系衍生抑制细胞(MDSC)减少。
除此之外,许多研究和谷禾的检测数据发现肠道微生物群可以调节癌症治疗,针对性地提高治疗效果并预防不良反应。
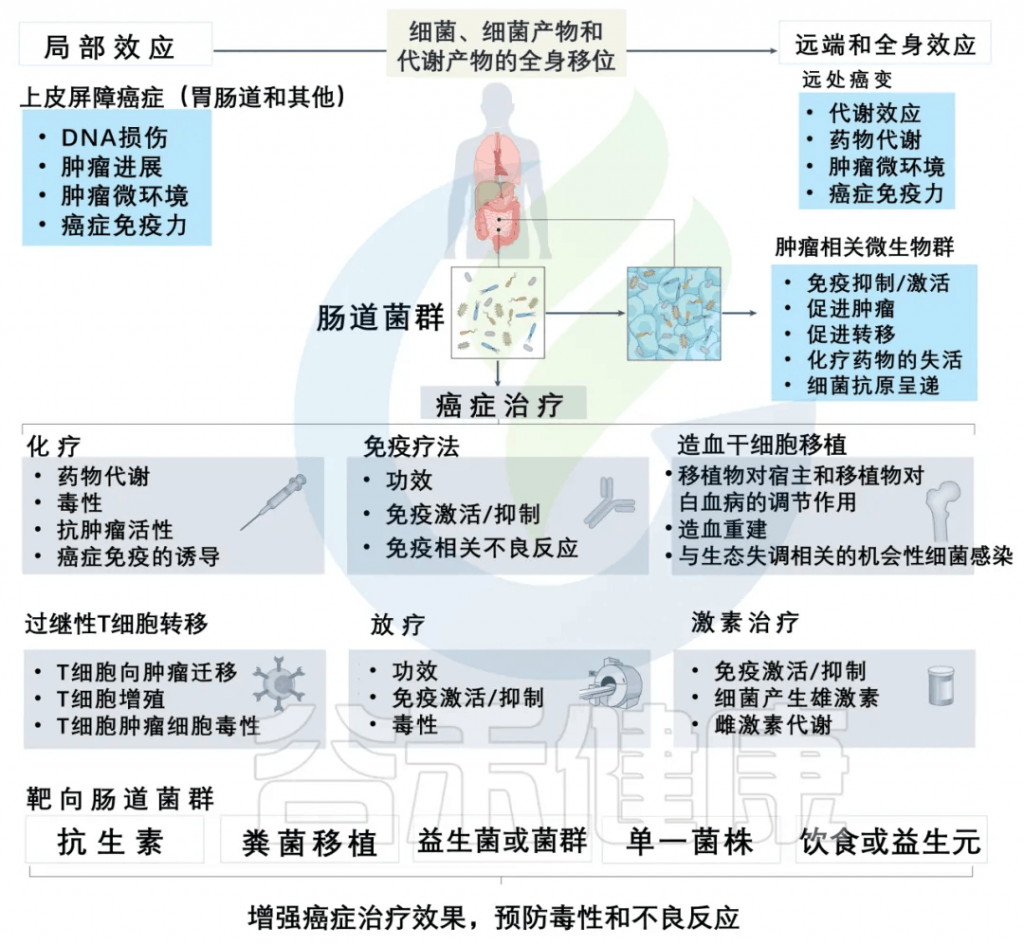
减轻化疗副作用,提高治疗效果
一些证据清楚地表明,调节肠道菌群可以减轻化疗药物的副作用,提高治疗效果。

减轻放疗毒性
在进行异基因造血干细胞移植预处理过程中,观察到患有白血病的患者的粪便样本中存在着毛螺菌科(Lachnospiraceae)和肠球菌科(Enterococcaceae)。这些患者在接受全身放疗治疗时出现的肠道毒性较轻。
几项研究表明,产生短链脂肪酸的益生菌,如乳酸杆菌和双歧杆菌,可以预防全身放疗治疗毒性。可能对癌症免疫和治疗毒性产生复杂影响,包括粘膜保护作用,部分由ANGPTL4、IL-18和IL-22的诱导介导,以及通过Treg细胞诱导和抑制树突状细胞功能介导的对立的免疫调节效应。
影响免疫疗法的效果
当前的癌症免疫疗法集中于利用特异性抗体来自我调节癌症免疫周期,这确保了应答的传播而没有生物中断。
微生态的改变会中断和削弱化学信号,导致致病状态,包括与炎症相关的疾病和癌症。
肠道微生物群对抗癌免疫反应的调节活性也与通过微生物群影响PD-L1和CTLA-4抑制剂的疗效有关。当与双歧杆菌的口服给药相结合时,PD-L1特异性抗体疗法的给药可以显著调节肿瘤的发展,在小鼠模型中肿瘤的生长几乎被消除。
我们预计肿瘤微生物组的研究将继续引起关注。然而,肿瘤微生物组在肿瘤预防和诊断中的应用,还存在着一些挑战。包括以下几点:
(一)人类微生物组在健康人群中的差异
同一个体在不同年龄的微生物组组成是可变的,更不用说不同个体中的微生物组成差异。部分原因是微生物组受饮食习惯、生活环境、药物暴露、生活方式和其他因素的影响。
因此,一个重大的挑战是根据微生物组的变化来确定个体的健康状况和癌症风险。未来,研究应探索肿瘤微生物组与环境、饮食和个人因素之间的相互作用。
(二)肿瘤微生物组的内容非常多样化
迄今为止已发表的大多数研究主要集中在细菌组上,而分析真菌组或病毒组的研究较少。此外,缺乏关于微生物组在非粘膜器官来源的肿瘤发展中的作用的数据。对肿瘤微生物组中微生物之间的关系也了解有限。例如,目前尚不清楚肿瘤微生物组中不同种类的细菌和真菌以及不同的病毒家族是相互独立的、协同的还是拮抗的。
(三)缺乏微生物代谢物等机制细节
尽管一些研究已经阐明了微生物改变肿瘤发生和发展的机制,但大多数仅具有相关性,缺乏与肿瘤发生因果关系的直接证据。特别是,其中许多研究无法确定微生物在肿瘤中定植的时间点。并且缺乏机制细节,主要集中在微生物种类的检测上,而忽略了分泌的毒素、代谢物和其他产物的功能。
未来的临床进展需要更精确地鉴定细菌分类单元对癌症早期诊断和治疗的因果关系,并了解其作用机制,因此需要进行更广泛的试验。改进的细菌可能作为抗癌药物,甚至可被改造成“微型机器人”用于药物传递。
总体而言,这一领域的发展为癌症患者提供了新的治疗选择和希望,但也需谨慎评估和监测以确保安全性和有效性。
微生物群在开发癌症诊断和抗癌策略中的重要性和潜力值得强调,将微生物调节疗法纳入癌症管理的整体方法很有必要。未来,我们有望实现更精准和个性化的菌群调节策略,为癌症治疗带来更大突破。
主要参考文献
Ma Y, Chen T, Sun T, Dilimulati D, Xiao Y. The oncomicrobiome: New insights into microorganisms in cancer. Microb Pathog. 2024 Oct 29;197:107091.
Azevedo MM, Pina-Vaz C, Baltazar F. Microbes and Cancer: Friends or Faux? Int J Mol Sci. 2020 Apr 28;21(9):3115.
Wong-Rolle A, Wei HK, Zhao C, Jin C. Unexpected guests in the tumor microenvironment: microbiome in cancer. Protein Cell. 2021 May;12(5):426-435.
Gagliani N, Hu B, Huber S, Elinav E, Flavell RA. The fire within: microbes inflame tumors. Cell. 2014 May 8;157(4):776-83.
Nejman D, Livyatan I, Fuks G, Gavert N, Zwang Y, Geller LT, Rotter-Maskowitz A, Weiser R, Mallel G, Gigi E, Meltser A, Douglas GM, Kamer I, Gopalakrishnan V, Dadosh T, Levin-Zaidman S, Avnet S, Atlan T, Cooper ZA, Arora R, Cogdill AP, Khan MAW, Ologun G, Bussi Y, Weinberger A, Lotan-Pompan M, Golani O, Perry G, Rokah M, Bahar-Shany K, Rozeman EA, Blank CU, Ronai A, Shaoul R, Amit A, Dorfman T, Kremer R, Cohen ZR, Harnof S, Siegal T, Yehuda-Shnaidman E, Gal-Yam EN, Shapira H, Baldini N, Langille MGI, Ben-Nun A, Kaufman B, Nissan A, Golan T, Dadiani M, Levanon K, Bar J, Yust-Katz S, Barshack I, Peeper DS, Raz DJ, Segal E, Wargo JA, Sandbank J, Shental N, Straussman R. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science. 2020 May 29;368(6494):973-980.
Poore GD, Kopylova E, Zhu Q, Carpenter C, Fraraccio S, Wandro S, Kosciolek T, Janssen S, Metcalf J, Song SJ, Kanbar J, Miller-Montgomery S, Heaton R, Mckay R, Patel SP, Swafford AD, Knight R. Microbiome analyses of blood and tissues suggest cancer diagnostic approach. Nature. 2020 Mar;579(7800):567-574.
Narunsky-Haziza L, Sepich-Poore GD, Livyatan I, Asraf O, Martino C, Nejman D, Gavert N, Stajich JE, Amit G, González A, Wandro S, Perry G, Ariel R, Meltser A, Shaffer JP, Zhu Q, Balint-Lahat N, Barshack I, Dadiani M, Gal-Yam EN, Patel SP, Bashan A, Swafford AD, Pilpel Y, Knight R, Straussman R. Pan-cancer analyses reveal cancer-type-specific fungal ecologies and bacteriome interactions. Cell. 2022 Sep 29;185(20):3789-3806.e17.
El Tekle G, Garrett WS. Bacteria in cancer initiation, promotion and progression. Nat Rev Cancer. 2023 Sep;23(9):600-618.
谷禾健康
随着测序技术和生物信息学的快速发展,微生物组研究变得越来越复杂和多样化。现有研究表明,DNA提取、文库构建、测序平台和生物信息学分析方法的选择对结果有显著影响。不同的实验条件和方法组合可能导致结果的变异性,影响对微生物群落组成的准确评估。所以尽管有许多可用的分析方法,但由于缺乏统一的标准化流程,这导致不同研究之间的结果难以比较,同时缺乏对整个实验室过程和后续数据分析的综合评估。
如何标准化实验室和生物信息学步骤以获得可靠的结果,以及如何在不同研究中比较数据,是该文的主要研究难点。
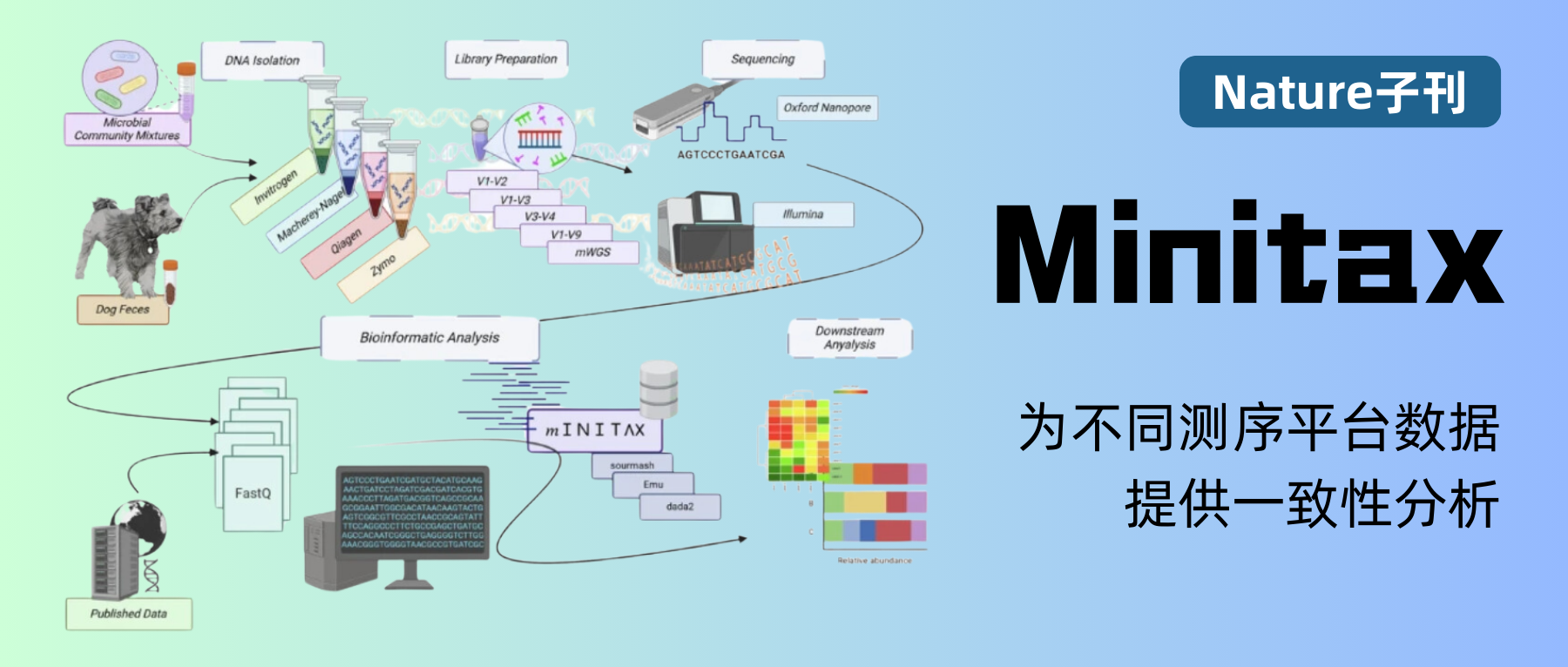
为此,来自匈牙利赛格德大学医学院的研究人员开发了一个软件工具——Minitax,于近期发表在《Nature Communications Biology》期刊上。

Minitax主要用于处理和分析不同的宏基因组数据,并提供一致的分类结果,减少由于不同测序平台和方法引起的偏差,从而确保在多种实验条件下的可靠性和一致性。
研究人员使用三种不同的样品类型来评估四种不同 DNA提取试剂盒的性能,这些样品包括狗粪便(n=6)和两种不同的标准微生物群落混合物 MCS 和 GMS(分别包括 8 种和 18 种细菌菌株)。
研究中湿实验部分的工作流程
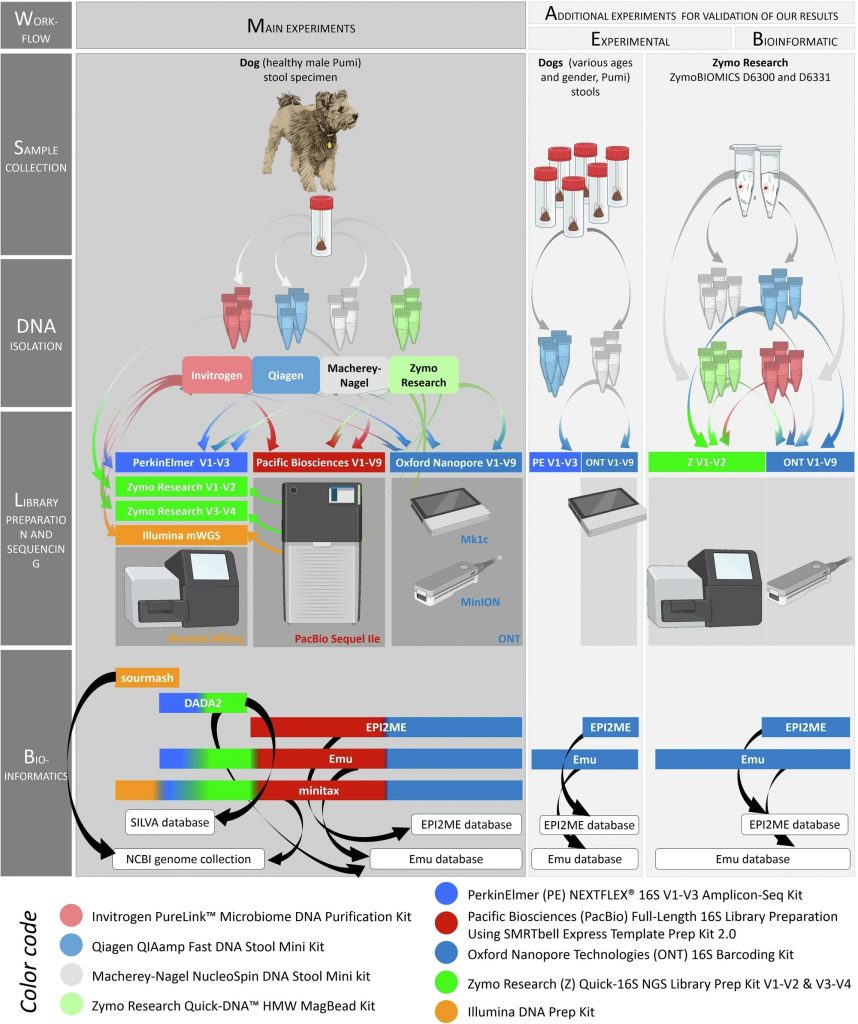
使用狗粪便是由于已有研究表明犬类和人类的肠道微生物组在基因组成和功能上有许多相似之处。
研究中DNA提取、文库构建用到的试剂以及测序平台的详细信息如下图:

在DNA提取比较实验设计中,每种试剂盒做了四次重复,以确保结果的可靠性。然后评估提取的DNA的数量、质量和可重复性,包括DNA的产量、片段长度和微生物与宿主DNA的比率。
在文库制备方法比较实验设计中,评估文库的质量、体积和一致性,确保文库准备过程中的每一步都能产生高质量的样本。
在测序平台比较实验设计中,使用多种生物信息学工具(如DADA2、sourmash、Emu和新开发的minitax)比较不同测序平台生成的数据质量和微生物组组成的差异。
研究中测序数据分析的工作流程
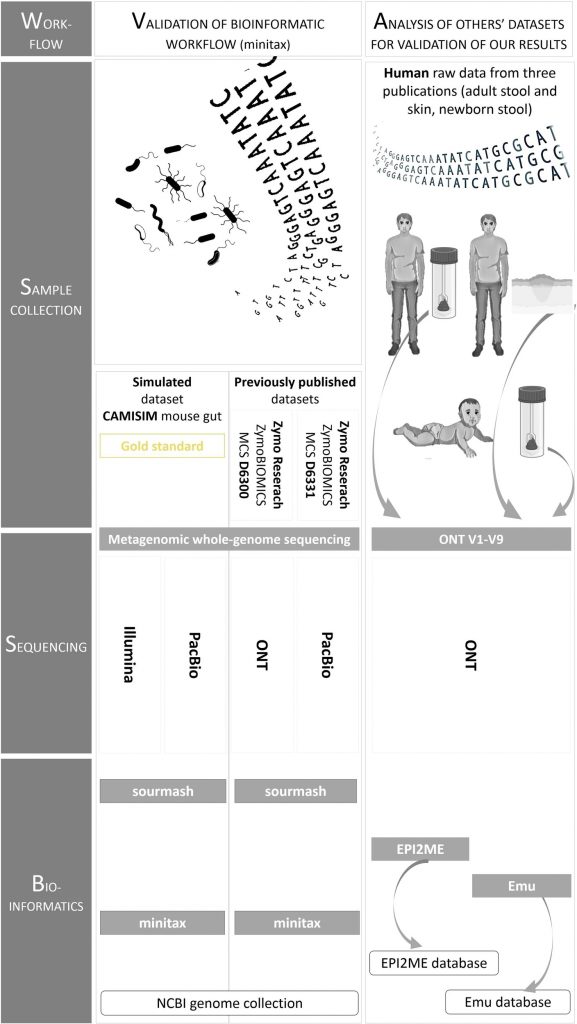
在下游数据分析中:
使用α和β多样性分析评估和比较微生物群落的多样性以及差异;
使用PERMDISP方法分析样本的组内变异性,以评估不同处理方法对微生物群落组成的影响;
ANOVA分析后,使用Tukey HSD检验进行事后比较,确定哪些特定组之间存在显著差异;
使用卡方检验评估观察到的微生物组成与理论组成之间的差异,确定不同方法的准确性等。
1
来自真实肠道微生物群的湿实验结果
DNA提取试剂
Zymo Research的试剂盒在提取狗粪便样本的DNA方面表现最佳,提供了高质量和高产量的DNA;
Qiagen试剂盒则表现最差,导致较低的DNA产量和较高的宿主DNA污染。
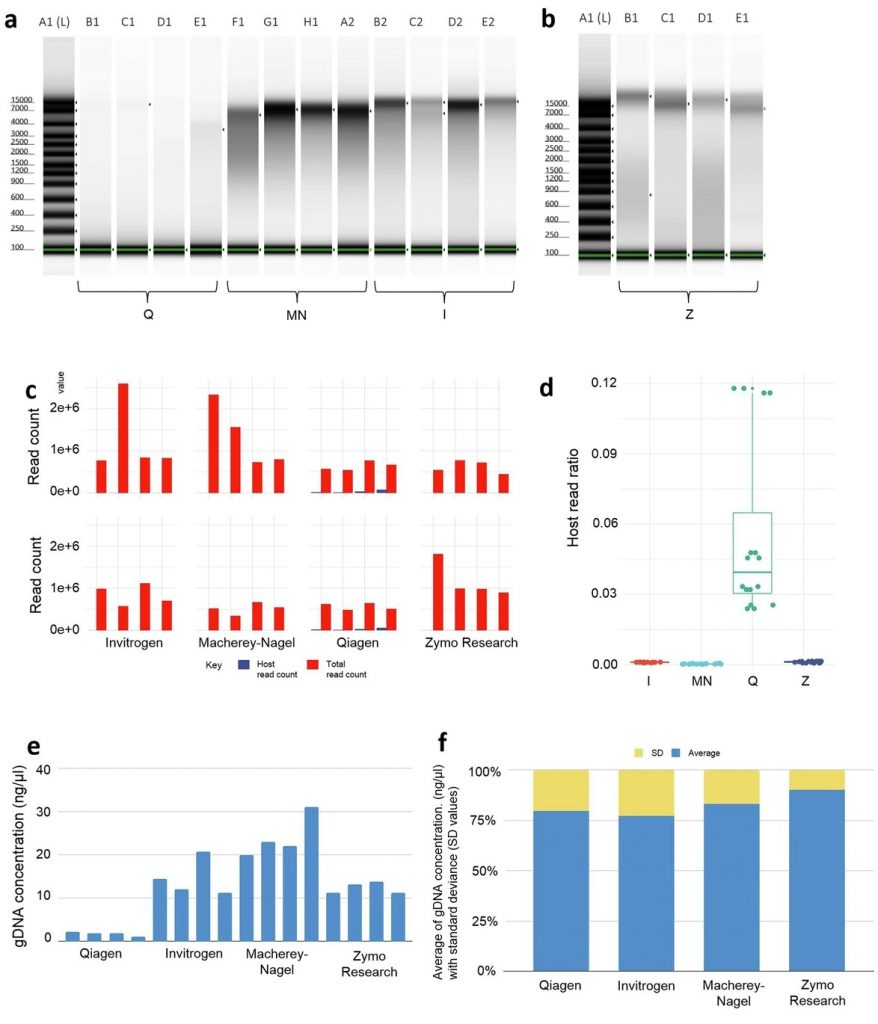
如图a-f:
Z和MN试剂盒在提取的DNA片段长度上表现较好,
Z试剂盒的片段长度最长,MN试剂盒的片段长度稍短。
Q试剂盒的片段长度最短,显示出其在DNA完整性方面的不足。
在Z试剂盒中也产生了最高的DNA产量和最长的DNA片段长度,显示出其在提取高质量DNA方面的优越性,单因素方差分析(ANOVA)对不同试剂盒的表现进行了比较,结果显示不同试剂盒之间的差异显著,Q试剂盒的F值为511.63,p值小于0.0001。
在微生物组成的分析中,使用Z和MN试剂盒的样本在不同的文库准备方法下表现出相似的微生物组成,而Q试剂盒的样本则表现出明显的差异,准确性最低。
使用 I 试剂盒 的样本在微生物组成的准确性方面表现中等,且在不同样本之间的变异性较高。
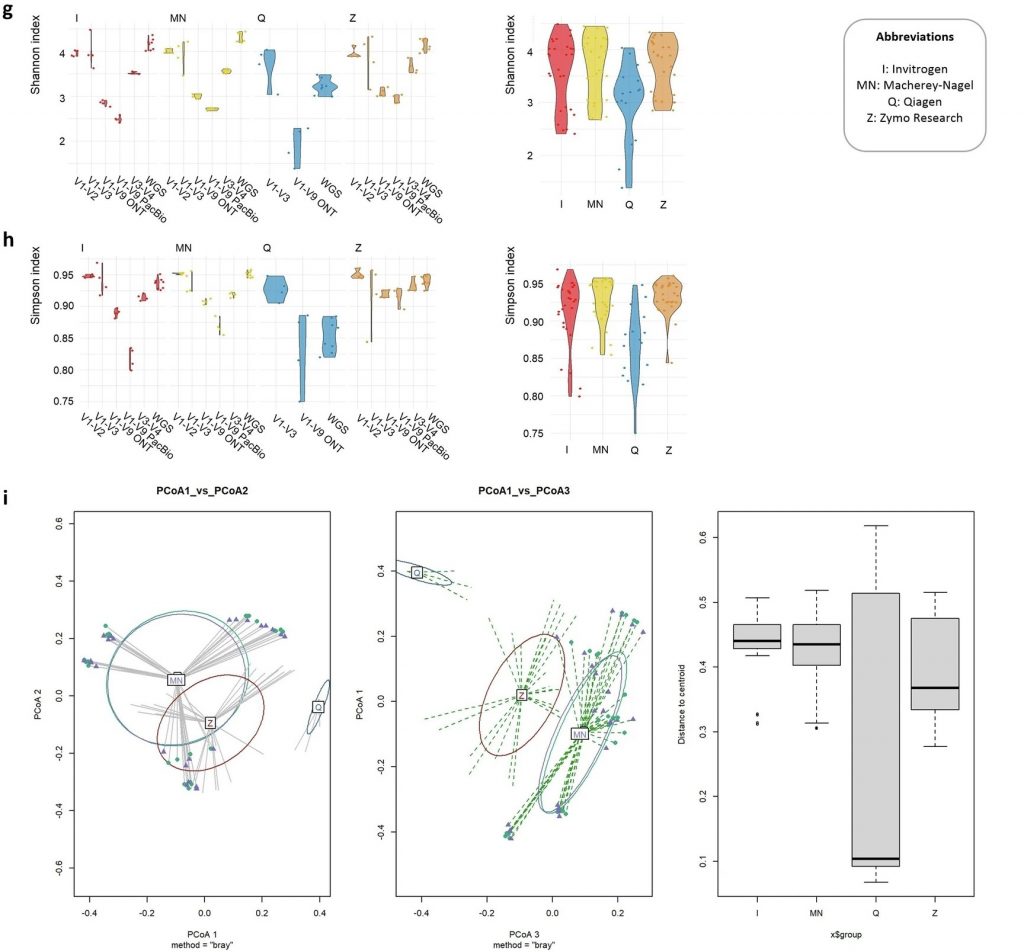
如图g-i,α多样性分析显示Q试剂盒提取的样本在Shannon指数和Simpson指数上显示出显著的多样性降低,β多样性分析Q试剂盒的样本在多样性分析中表现出较大的离散性,这些发现强调了选择合适的DNA提取方法对微生物组研究结果的重要性。
文库制备
文库制备方法比较发现,对比DNA提取方法,选择合适的文库准备和测序方法对于获得可靠的微生物组分析结果更为重要。
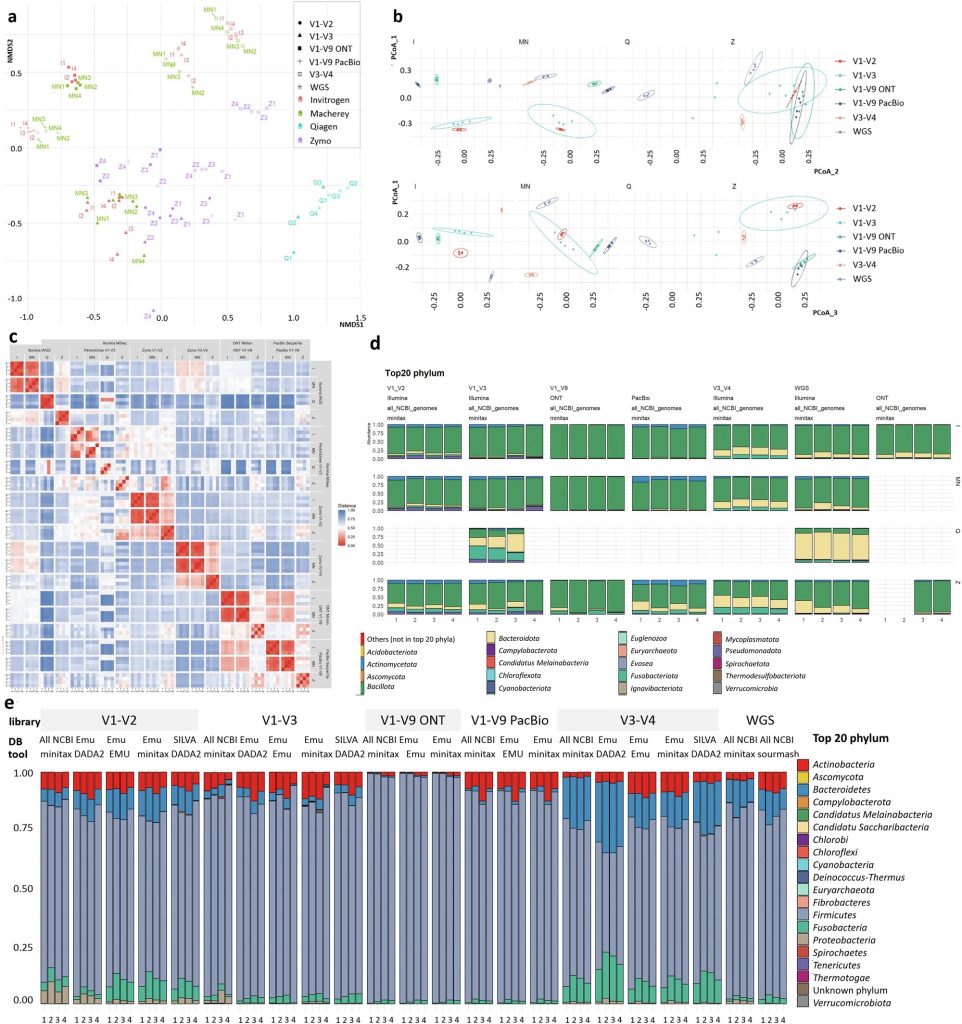
如图a,α多样性分析显示,在短读长(SRS)文库中,除了Qiagen方法外,其他三种方法的丰富度和均匀度指标相似。在长读长(LRS)文库中,Invitrogen方法显示出较低的多样性,而Zymo和Macherey-Nagel方法则表现出较高的多样性。
图b,β多样性分析显示,样本的聚类更倾向文库制备而非DNA提取方法,V3-V4组与V1-V3组之间存在明显的分离,PERMANOVA结果显示,文库制备是决定微生物群落结构的主要因素,占总观察变异的59.4%,而“文库”因子占 20.1%,剩下 20.4% 的变异未解释。PERMDISP分析也显示(图d),样本的离散性在不同文库制备方法中表现出明显的变化。
图c 也进一步强调了文库制备对微生物群落分析结果的影响,表明文库制备对微生物群落的影响显著。
测序方法
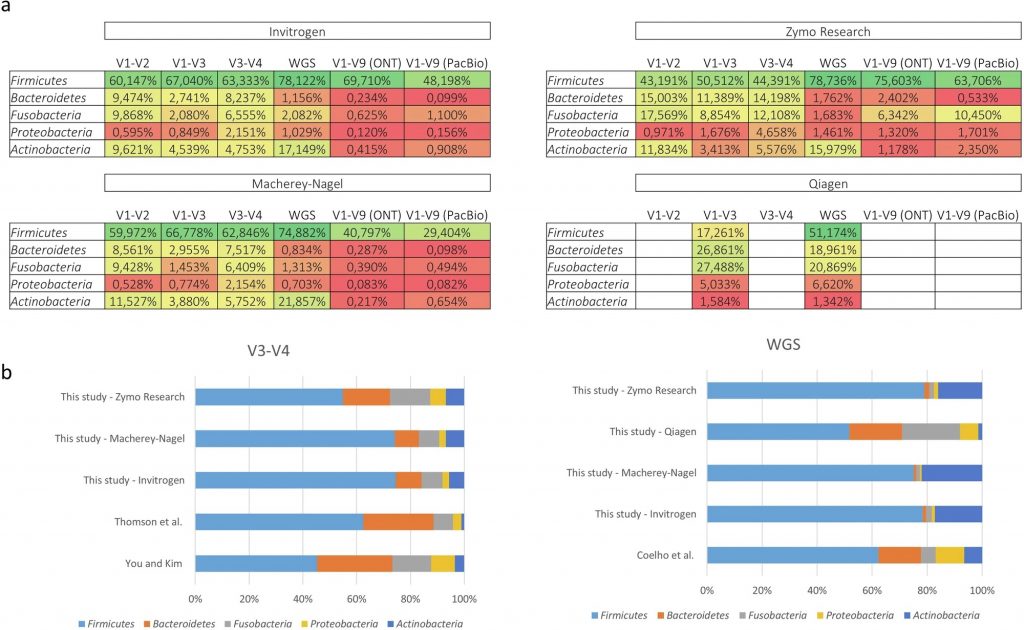
在对门水平细菌组成的比较分析中发现使用I样本的V1–V3文库显示,Bacillota(以前称为Firmicutes)的比例最高,而Bacteroidota(以前称为Bacteroidetes)和Fusobacteriota(以前称为Fusobacteria)的比例较小。相比之下,V1–V2和V3–V4文库显示出更均衡的分布,Bacteroidota和Fusobacteriota的比例更为接近。结合补充数据(与其他相关研究的数据进行了比较),强调了不同测序方法对微生物群组成分析结果的影响。
DNA 提取方法
为了测试哪些 DNA 提取方法会表现出对革兰氏阴性细菌(G−)的偏好性或者是革兰氏阳性菌(G+),研究人员根据它们的细胞壁染色特征汇总了物种丰度并进行了分析。如下图,发现不同的DNA提取方法对G+和G−细菌的相对丰度有显著影响。
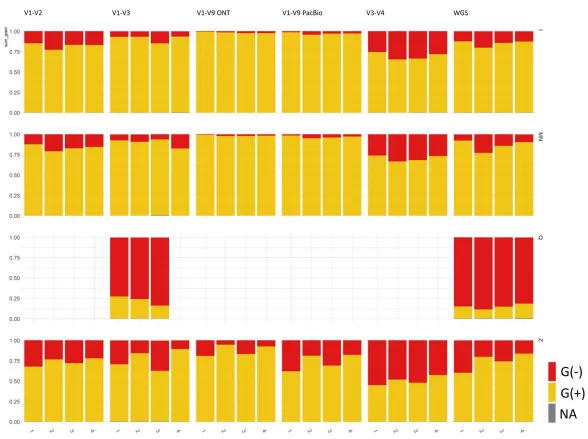
具体而言,只有I和MN这两种方法产生了近乎相同的G+与G−细菌比例,而其他方法则显示出明显的比例差异。这些差异主要归因于细胞壁对处理的不同抵抗力。
此外,在不同文库准备方法之间也观察到了显著的差异,尤其是V3-V4区域的比较结果尤为突出。这些发现强调了选择合适的DNA提取和文库准备方法对于准确反映微生物组成的重要性。
2
来自标准微生物群落的湿实验结果
同狗粪便样本的实验设计,在DNA产量方面,Z 和 MN 试剂盒在两种样品类型中均表现出优异的性能,尤其是与 Q 和 I 试剂盒相比,在DNA片段长度方面,Z试剂盒产生平均长度最长,都超过 60,000 bps(下表数据)。
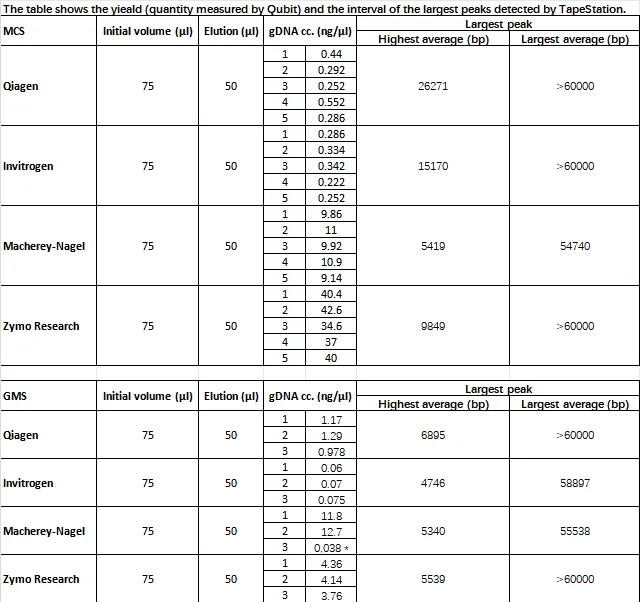
在文库制备方面,与粪便 DNA 样品中观察到的结果一致。在微生物组成分析中,发现Z方法在MCS样本中识别的物种数量最少,显示出与理论组成的高度一致性,而I方法在GMS样本中表现不佳,显示出较高的偏差(如图a)。
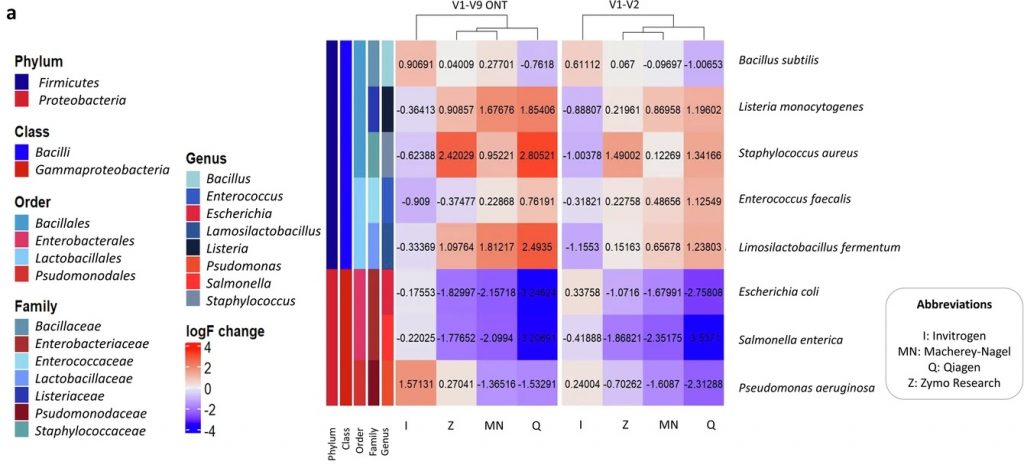
在不同的DNA提取方法对G+和G−细菌的影响方面,发现Q方法在MCS样本中倾向于高估G−细菌,而MN方法没有该趋势,但MN方法在粪便样本中具有该趋势,因此,研究人员认为MN方法虽然更倾向于提取G−细菌的DNA,但在复杂的粪便样本中,这种偏差可能会被掩盖,从而影响对G+和G−细菌的裂解。
对于这两种方法,被低估的G+细菌属主要为Lactobacillus和Limosilactobacillus,而高估的G−细菌属主要为Escherichia和Salmonella。因此研究人员建议,在GMS样本中,I方法则低估了G−细菌,MN、Q和Z方法的丰度则接近理论值。
3
评估minitax在不同测序数据之间的表现
minitax是一款专为处理多种测序数据类型而设计的灵活的分类工具,旨在为多样化的测序数据提供一致的分析结果。它能够在不同的测序平台(如ONT、PacBio和Illumina)和文库类型(包括mWGS和16S rRNA)中进行分类分析。
核心功能包括:
1. 基于标准菌株DNA样品的ONT V1-V9 测序比较 minitax 与 Emu工具
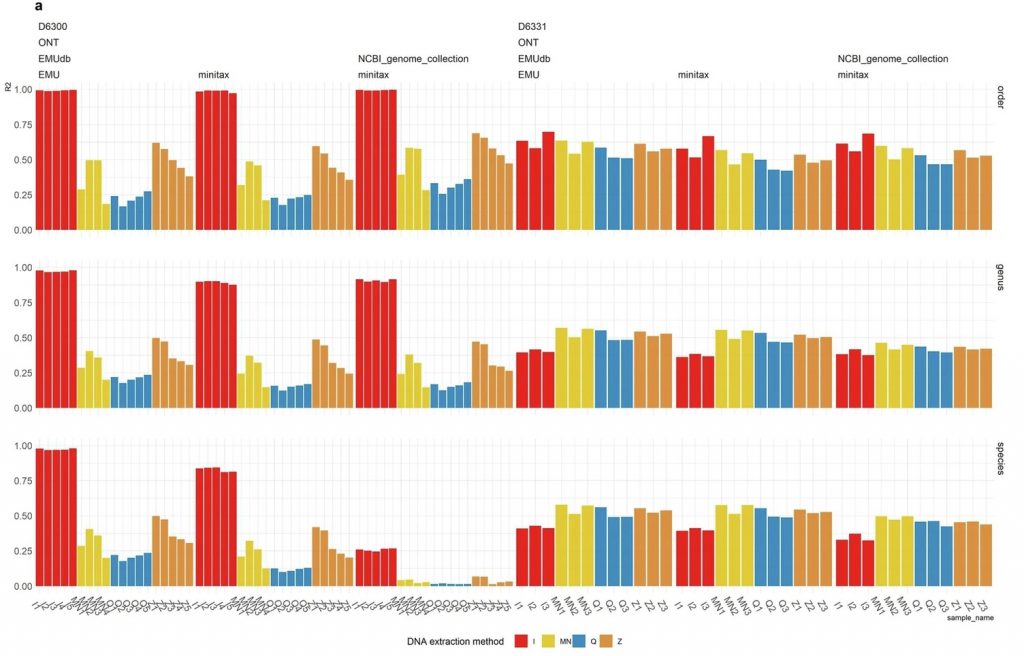
图中y轴表示Pearson相关性r²值,结果显示,两者在使用相同数据库(Emu db)时的性能相似,表明minitax具有良好的稳健性。
卡方检验结果表明,仅在MCS 的 I 方法的情况下,使用 Emu 或 minitax(使用 Emu db)重建的微生物组成与理论组成没有显著差异。
因此观察到的差异可能更多地归因于DNA提取方法和其他因素,而非生物信息学工具或数据库选择。
2. 基于MCS样品 的 Illumina V1-V2 测序比较 minitax 、Emu 和 DADA2
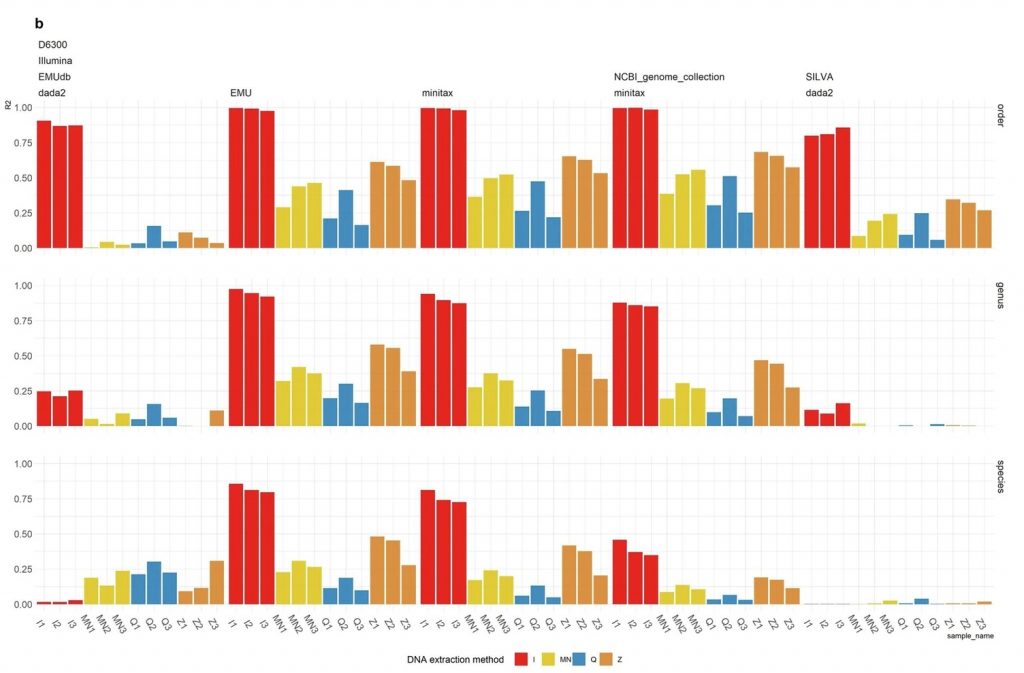
研究发现Emu和minitax的工作流程在属级和物种级别上均显著优于DADA2。
虽然在物种级别上,Emu(使用Emu数据库)提供的r²值略高于minitax,但在MCS样本的V1-V2区域中,卡方检验结果表明,Emu和minitax重建的微生物组成与理论组成之间没有显著差异,这与ONT V1-V9测序结果一致。表明minitax在微生物组分析中的有效性和可靠性。
3. 基于MCS样品的PacBio HiFi WGS 测序数据比较 minitax 和 sourmash
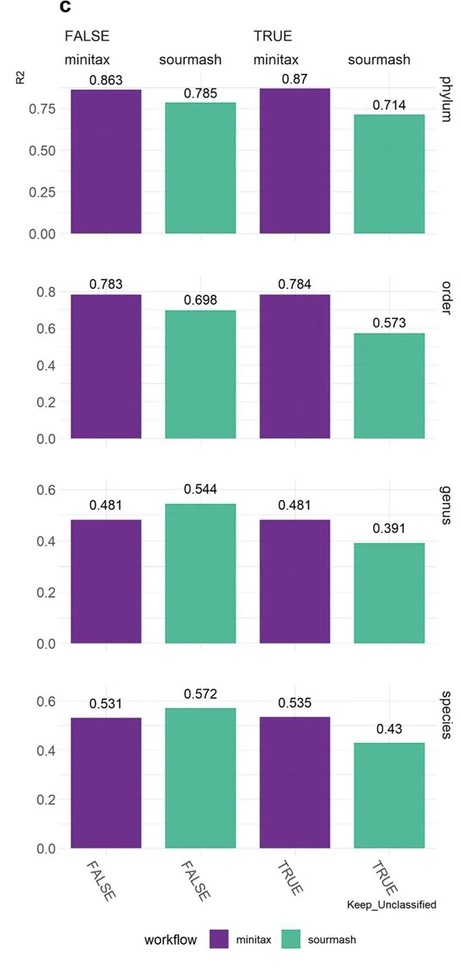
结果发现,当包含未分类的reads时,minitax在丰度估计方面优于sourmash。然而,当排除未分类的reads时,minitax在种水平的表现略差一些,因为这会改变已识别分类的相对丰度。
通过使用三种不同的物种检测阈值进行的卡方检验表明,在使用0.1%和0.01%检测阈值时,minitax的结果与理论分布之间没有显著差异。
这些发现表明,minitax在处理包含未分类reads的数据时表现更佳,而在严格的物种级别分析中,可能需要考虑未分类reads的会造成的影响。
4. Minitax在模拟小鼠肠道数据集上的表现
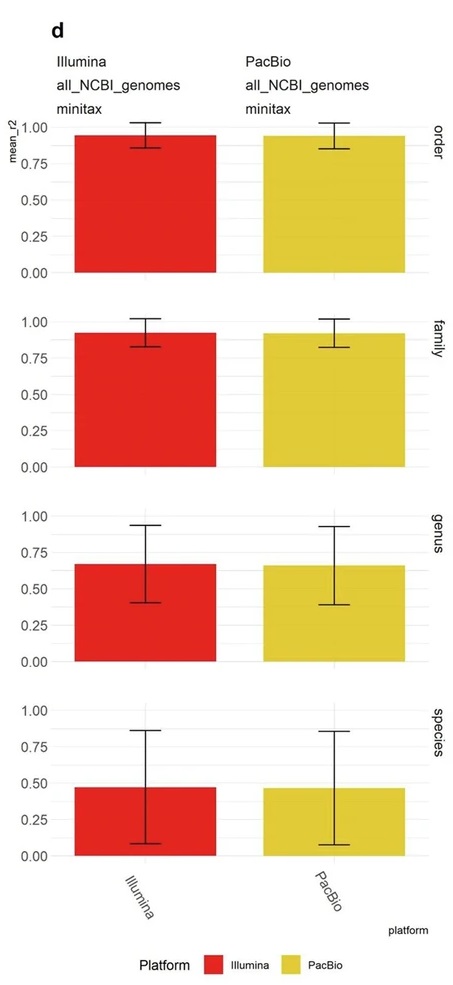
CAMISIM小鼠肠道项目的模拟数据集包含来自PacBio和Illumina的各10个样本。在这两种数据类型中,minitax在门水平达到了r²=0.96,而在种水平,r²分别降至0.46和0.55。
这表明minitax在较高的分类水平上能够有效重建微生物组成,但在种水平上的表现略差,这也显示出不同测序平台对结果的影响。
4
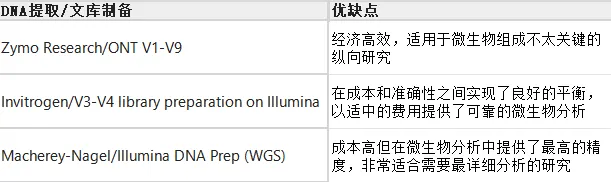
研究中不同试剂方法的优缺点整理
1. 各种DNA提取试剂盒的优缺点,包括DNA产量、片段长度、污染水平以及在不同样本类型中的总体表现

2. 文库制备方法的优缺点,包括每种制备技术相关的测序质量、一致性、实验复杂度和成本的优缺点

3. 推荐的湿实验流程
该文通过对狗粪便样本和标准微生物群落的综合评估,呈现了湿实验过程中不同条件下产物的差异,同时比较和验证了新开发的生信分析工具minitax在肠道微生物分析中的可靠性和优势。
综合评估下,在DNA提取过程中,Zymo Research Quick-DNA HMW MagBead Kit在狗粪便样本和标准微生物群落样本(MCS、GMS)中表现最佳,具有高DNA产量、长片段、低宿主DNA污染、一致性好的优势。
在文库构建和测序过程中,Illumina MiSeq与Illumina DNA Prep的组合在数据质量和准确性方面表现最优异,具有高质量、高准确性、应用广泛的优势。文中还提出了一个重要的观点,认为文库制备方法的选择对样本聚类的影响大于DNA提取方法,强调了选择合适文库准备方法的重要性。
在生物信息学分析方面,研究人员将minitax与其他工具(如Emu和DADA2)进行了比较,结果显示minitax在不同测序数据类型中表现良好,能够提供一致的结果。
但minitax的局限性在文中也有展露,例如在使用NCBI数据库进行物种级别的分类时,minitax的精确度显著下降。这表明在物种识别方面,选择合适的数据库对结果的影响很大;minitax的有效性可能因样本类型而异,某些方法组合在特定样本中表现良好,但在其他样本中可能不够理想;在处理包含未分类reads的数据时,minitax的性能可能受到影响,尤其在种水平分析中;尽管minitax能够处理长读长数据,但在某些情况下还是不如专门为长读长数据设计的工具(如sourmash)。
不过对于这些局限性,研究人员在文中提出以下建议,对于需要跨平台比较和分析的研究,还是建议使用minitax与NCBI基因组集合,因为它在扩增子和宏基因组WGS测序数据的多样化研究中是稳健的;建议在扩增子测序中使用Emu以获得最佳效果;建议在宏基因组全基因组测序 (WGS) 中使用Sourmash以获得最佳效果。
总体而言,文章强调了在微生物组分析中优化实验和生物信息学流程的重要性,以确保结果的准确性和可重复性。
主要参考文献
Gulyás, G., Kakuk, B., Dörmő, Á. et al. Cross-comparison of gut metagenomic profiling strategies. Commun Biol 7, 1445 (2024).

谷禾健康

生物医学领域每天都在产生海量的研究文献,这些文献就像一座巨大的知识宝库,蕴含着推动医学进步的重要信息。传统上,科研人员需要通过人工阅读和整理这些文献,从中提取重要的生物医学信息,并将其汇总到专业数据库中(如KEGG和Reactome等知识库)。这些知识库就像是精心整理的图书馆,为生物学研究和临床医生的决策提供重要参考。
然而,随着科技发展,生物医学研究论文的数量呈现爆炸式增长。仅靠人工来阅读、筛选和整理这些文献已经变得异常困难,不仅耗时耗力,还需要投入大量人力和财力资源。这就像是要用手工方式来整理一个永远不停增长的图书馆,这项工作变得越来越具有挑战性。
值得欣喜的是,人工智能(AI)技术的快速发展为解决这一难题带来了曙光。现代AI技术,特别是自然语言处理和机器学习算法,可以像训练有素的助手一样,自动阅读和理解文献内容,快速识别关键信息,并将这些信息系统地整理归类。这不仅大大提高了文献知识管理的效率,还能帮助研究人员更好地发现和利用已有的研究成果,推动生物医学研究的创新和发展。
本文将分享人工智能,包括ChatGPT在检索生物医学知识,汇总和撰写文章、回答问题和模仿人类对话的能力的一些方法特点,并强调使用自动程序中管理生物医学实体和关系的巨大潜力,同时注意一些局限性。
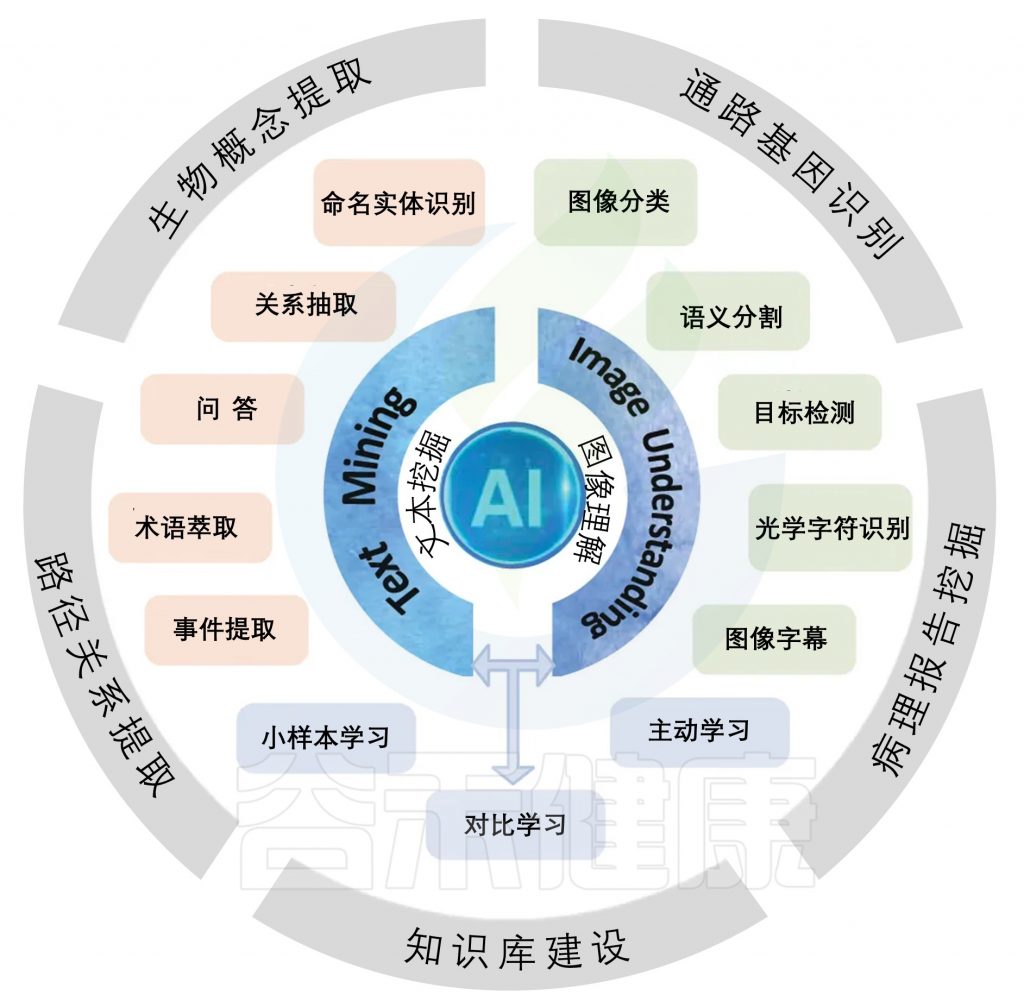
基因、蛋白质和它们之间的关系在生物医学文献中有报道。基于AI的文本挖掘工具利用自然语言处理(NLP)来促进实体识别和关系提取。
AI技术在生物医学文献挖掘中的应用范围
doi.org/10.1515/mr-2023-0011
该图包括两个面板,展示了人工智能(AI)在文本挖掘(左侧)和图像理解(右侧)中的不同方向和应用。
命名实体识别
命名实体识别(Named Entity Recognition,NER)是自然语言处理的一个典型任务,它是从生物医学文献中标注和识别生物概念的名称,如蛋白质、基因、化合物、药物、疾病等。
◆ NER有助于从科学文章中提取关键的生物学概念,帮助建立生物本体和知识库
例如,给定句子“BRCA 1中的突变与乳腺癌和卵巢癌的风险增加有关”,NER工具可以将单词“BRCA 1”标记为基因,并将单词“乳腺癌”和“卵巢癌”标记为疾病。
◆ NER的一个主要瓶颈是,同一个生物医学实体可能会使用非标准的缩写和术语
例如,转录因子“C/EBP-β”也被称为“NF-IL6”;蛋白质“Arnt”有时被称为“HIF1-β”。
◆ 一些实体还嵌套其他实体
例如,蛋白质实体“丙氨酸氨基转移酶”含有化学实体“丙氨酸”。
为了解决上述挑战,可以使用生物医学实体链接(也称为实体规范化或实体接地)来将模糊实体映射到来自本体(诸如基因本体)的规范化的唯一标识符。
关系抽取
关系提取(RE)是建立在NER基础上的,它涉及识别先前发现的实体之间的关系。
关系提取专注于揭示连接,例如蛋白质-蛋白质相互作用、基因-疾病关联、基因型-表型关系、化学-蛋白质相互作用和药物-药物相互作用。
关系提取是通过在给定的句子中识别实体对和关系类型来制定的。
典型的文本挖掘技术
基于人工智能的NER方法可以:
学习上下文并对单词语义进行建模,以区分具有生物学意义的概念与其余单词
例如,PubTator被设计用于标记六种类型的生物学概念,包括基因/蛋白质,基因变体,疾病,化学物质,物种和其他生物学出版物的摘要或全文。
传统上,标记的生物实体可以通过执行模糊字符串匹配来映射到它们的标准形式。与此同时,最近的研究在神经网络构建的潜在空间(嵌入)中改进了这种映射。
其他一些基于AI的RE技术采用生物医学句子的上下文表示来检测生物医学实体关系。它们从语义和句法方面以及从多个角度提取和聚合句子的特征以识别关系。沿着这条路线,最近的研究将关系挖掘从句子级别移动到文档级别,以进一步丰富知识提取结果。
预训练模型
基于人工智能的文本挖掘通常依赖于通过自监督学习在大规模Web语料库上预训练模型的鲁棒语义表示。预训练的模型可以用相对较小的数据集针对特定任务进行进一步微调。一些著名的NLP模型包括BERT、T5和GPT。
► BioBERT 是一种广泛使用的特定于领域的语言表示模型,从通用BERT模型开始,在大规模生物医学语料库(PubMed摘要和PMC全文文章)上进行预训练。BioBERT能够扩展到生物医学NER,RE和问答(QA)。
●双向编码器表示:
BioBERT采用双向Transformer架构,利用注意力机制学习输入文本的上下文信息,从而生成高质量的语言表示。这种双向表示方式使得BioBERT在处理复杂的生物医学文本时表现优异,能够更好地理解单词在不同上下文中的含义。
●开放源代码:
项目完全开源,允许开发者和研究人员自由使用、修改和分发。
●预训练模型可用:
提供预训练模型,开发者可以直接用于下游任务,无需从头开始训练。
●易于集成:
兼容Hugging Face的transformers库,方便与其他自然语言处理工具包整合。
► PubMedBERT 是使用PubMed的摘要和PubMedCentral的全文文章从头开始进行预训练。
► SciFive 是一个在大型生物医学语料库上预训练的特定领域T5模型,用于文本理解任务(即,NER、RE和QA)和生物医学文本生成。
它在多种生物医学NLP任务上取得了出色的表现,特别是在问答任务上明显优于BERT系列模型。SciFive的预训练语料选择也具有灵活性,可以根据不同任务需求进行调整。
作为一个文本生成模型,SciFive还可以应用于更复杂的任务,如文档摘要和文章生成等,为生物医学领域的知识获取和内容创作提供支持。
► BioGPT 从头开始使用1500万个PubMed摘要预训练GPT-2模型,以生成生物医学术语的流畅描述。
它可以应用在哪些方面?
● 药物发现:
BioGPT击败了所有以前的语言模型,用于实体(药物,疾病和蛋白质)之间的关系提取。BioGPT可以帮助自动分析不断扩大的科学文献,更好地了解疾病机制并识别潜在药物靶点。
● 精准医疗:
它涉及根据个体患者的基因组成、生活方式和环境因素,为他们的特定需求量身定制医疗。BioGPT可以帮助研究人员从大型数据集中识别基因突变、疾病途径和其他相关信息,从而为患者制定个性化的治疗计划。
● 提高药物安全性:
BioGPT在预测药物相互作用方面击败了其他模型,可以帮助临床医生预测药物组合的潜在副作用并提高药物安全性。
● 临床试验设计和分析:
BioGPT可用于提取和分析临床试验数据,帮助研究人员设计更有效的试验,并更准确地分析试验结果。
●竞争对手分析:
BioGPT可用于分析科学文献和专利数据库,以识别潜在竞争对手并评估竞争格局。
● 科学交流:
BioGPT可用于生成科学文献和其他信息来源的摘要,使业务开发专业人员更容易快速理解和交流关键见解。帮助医疗保健专业人员跟上最新的研究和临床发现。
● 疾病诊断和管理:
BioGPT可用于分析患者数据、医疗记录和科学文献,以帮助更有效地诊断和管理疾病。
基于AI的生物医学文献挖掘方法

doi.org/10.1515/mr-2023-0011
除了文本,生物医学文献还以数字的形式包含有价值的知识。研究人员经常使用图表(例如生物学途径)来总结他们在出版物中关于导致生物过程或疾病的分子事件的发现。
基于人工智能的图像理解技术的进步提高了我们从路径图中提取实体和关系的能力,这些能力可用于补充从文本中提取的相同知识。

doi.org/10.1515/mr-2023-0011
从路径图中挖掘生物实体
早期基于AI的方法使用光学字符识别(OCR)技术提取生物医学实体,以从路径图中恢复基因名称。由于非标准缩写和术语的挑战,这种方法需要领域专家手动创建一些实体规范化规则来为基因名称提供基础。一项研究将这种方法应用于过去25年出版物中的通路图,并识别出通路数据库中缺失的数千个基因。
从路径图挖掘生物相互作用
Pathway Curator 旨在从途径图中提取分子实体及其相互作用。
管道集成了图像理解模型和图像处理策略,以捕获图中路径实体的位置,名称和相互作用。
管道可以使用符号识别基因,并使用箭头(用于上调)或T形条(用于抑制)识别基因关系。
技术特点:
输出展示:
实用优势:
Pathway Curator为生物文献挖掘中的文本挖掘提供了一种补充方法,并在多个出版物中全面了解疾病途径。方法可以扩展到其他RE任务的数字,如microRNA基因和化学蛋白质的相互作用。
尽管人工智能技术,特别是深度学习算法,已经显示出在自动程序中管理生物医学实体和关系的巨大能力,但人工智能技术的一些局限性仍然阻碍着人工文献管理的替代:
1)来自生物医学文献的有限注释数据。由于大量的出版物和使用的表达方式的多样性,为人工智能训练注释足够的生物医学概念和关系是具有挑战性的。在生物医学文献挖掘中,标记数据的数量和质量对AI模型的鲁棒性起着至关重要的作用。
2)当前人工智能从已建立的词汇表中发现对象的能力的局限性。目前,大多数人工智能方法都是建立在预定义的语料库或预先标记的数据集上。这种数据依赖性限制了AI技术挖掘词汇表之外对象的能力。
3)当前人工智能在处理文献不一致性方面的能力有限。生物医学文献包含过时或不正确的陈述,这可能会误导人工智能方法。
人工智能技术的快速发展,特别是深度学习方法,为管理生物医学知识创造了新的机会。OpenAI推出的基于人工智能的聊天机器人(ChatGPT)以其撰写文章、回答问题和模仿人类对话的能力给用户留下了深刻印象。
ChatGPT拥有全面的知识库,可根据用户的要求检索生物医学知识,为生物医学领域更高效、更准确的知识挖掘铺平道路。虽然ChatGPT目前经常提供不正确或不可复制的信息,但不断升级和更好的快速学习技术为更准确和可靠的生物医学知识挖掘提供了潜力。
ChatGPT还可以进行更多的训练/调整,以针对生物医学领域,特别是建立假设,寻找新的药物靶点,并生成新的小分子和抗体。它有望改变掌握知识和技能的方式,辅助医生进行临床决策,减少医疗差错。
几种新的人工智能方法具有很大的潜力,可以从文本和图形两种形式推进文献挖掘。主动学习允许使用新标记的数据迭代地训练模型,这为针对有限的注释数据逐步升级AI模型提供了机会。根据人类反馈的强化学习(RLHF)通过将预测与人类价值观和偏好对齐来增强人工智能算法的鲁棒性和通用性。通过整合人类反馈,RLHF可以提高AI预测的准确性和可靠性,超越注释数据的限制。
此外,针对多模态的对比学习(即文本和图像)使得能够学习相应文本和图像之间的公共(联合)语义表示,例如,一个基因名称’AKT’在文本和图像片段包含’AKT’更好的性能。此外,元学习和少量学习策略也有望将大规模通用语料库上的AI技术建模推广到生物医学特定领域。
在临床实践中,各种临床文件,如电子健康记录(EHR)和病理报告(PR),包含重要的生物医学和病理信息,这些信息可以从应用人工智能技术进行大规模管理中受益。一些研究已经为EHR 和PR开发了基于AI的挖掘工具,这些工具利用与文献挖掘中使用的技术类似的技术来识别诊断实体和非结构化文本和生物医学图像的关系。
整合生物医学文献和临床文档的挖掘结果可以促进临床研究和精准医学。这种方法为未来的医学研究和患者护理带来了巨大的希望。
生物医学文献的快速增长为生物医学知识挖掘带来了机遇和挑战。随着前沿人工智能技术在生物医学文献挖掘中的应用,生物医学研究和临床实践的相关注释、预测和知识库建设步伐将加快。
主要参考文献
He F, Liu K, Yang Z, Hannink M, Hammer RD, Popescu M, Xu D. Applications of cutting-edge artificial intelligence technologies in biomedical literature and document mining. Med Rev (2021). 2023 Jun 27;3(3):200-204.
da Silva, R.G.L. The advancement of artificial intelligence in biomedical research and health innovation: challenges and opportunities in emerging economies. Global Health 20, 44 (2024)
Hosseini, M., Hosseini, M. & Javidan, R. Leveraging Large Language Models for Clinical Abbreviation Disambiguation. J Med Syst 48, 27 (2024).
Luo R, Sun L, Xia Y, Qin T, Zhang S, Poon H, Liu TY. BioGPT: generative pre-trained transformer for biomedical text generation and mining. Brief Bioinform. 2022 Nov 19;23(6):bbac409.

谷禾健康

副萨特氏菌属(Parasutterella)是一种革兰氏阴性,严格厌氧菌,在谷禾的人群肠道样本数据库中检出率为84.13%,说明这个菌在大部分人肠道存在,甚至长期定植共生。
Parasutterella属占据特定肠道生态位,影响宿主代谢:来自小鼠、大鼠和人的Parasutterella均不能降解糖,也无法还原硝酸盐或产生吲哚,但能合成琥珀酸盐,并且该菌可能参与人体胆汁酸稳态维持和胆固醇代谢。同时肠道内芳香族氨基酸、胆红素、嘌呤和胆汁酸衍生物等代谢物也受该菌的影响。
作为肠道共生菌成员之一,Parasutterella的相对丰度与不同的宿主健康结果有关,例如在肥胖、2型糖尿病、焦虑和抑郁、炎症性肠病患者中,Parasutterella的丰度增加;但是又有一些研究发现Parasutterella可以降低危重肺炎风险,并对肾上腺功能有一定的影响。副萨特氏菌属(Parasutterella)可能根据具体情况发挥二分作用。
在人体研究和动物试验中,发现Parasutterella对抗生素给药和其他饮食干预(如益生元和抗性淀粉补充剂)有反应。过量食用高脂、超加工食品,缺乏维生素A会导致Parasutterella丰度增加,而食用虫草素、小麦麸质、白藜芦醇、阿拉伯半乳聚糖、发酵豆乳等可以降低Parasutterella丰度。
副萨特氏菌属(Parasutterella)是β变形菌门下的一个属,与萨特氏菌属(Sutterella)相似但又有所不同。是一种革兰氏阴性,严格厌氧的球菌或球杆菌,不产生孢子,大小为0.5-0.8×1.0-1.5微米。
在37°C的GAM琼脂上培育72小时后,Parasutterella菌落呈完整、圆形、凸面、半透明,直径为0.5-0.7mm。
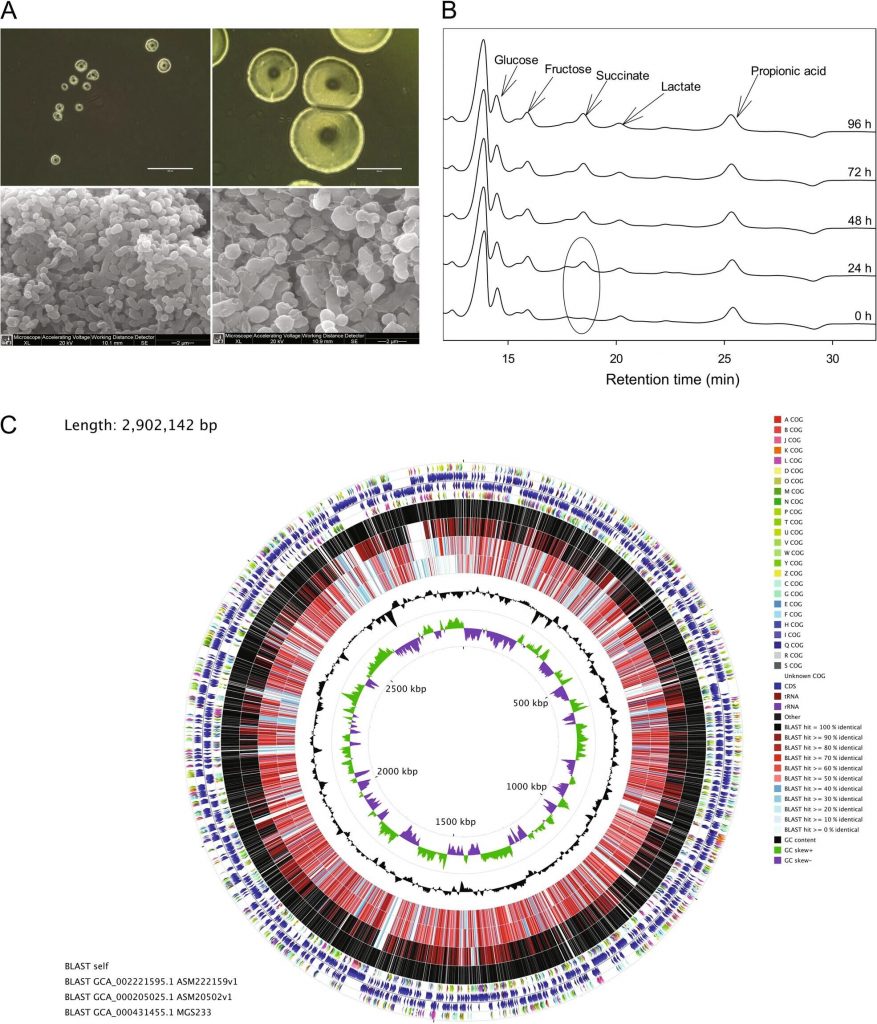
doi: 10.1038/s41396-019-0364-5.
物种与分布
Parasutterella属包含两种类型的菌株,Parasutterella excrementihominis YIT11859和Parasutterella secunda YIT12071,它们首先从人类粪便中分离出来。
Parasutterella excrementihominis是该菌属的模式物种。
Parasutterella属的成员也存在于其他物种中,包括小鼠、大鼠、狗、猪、鸡、火鸡和小牛。
生长与代谢
Parasutterella可在37°C厌氧环境下生长,这与人体肠道内的环境相似,并且在谷禾的检测报告中,Parasutterella有较高的检出率,说明Parasutterella是肠道菌群的共生成员。
来自小鼠、大鼠和人的Parasutterella均不能降解糖(肉汤培养物中未检测到葡萄糖、果糖或乳酸的变化),并且未检测到短链脂肪酸作为代谢的最终产物,此外对硝酸盐还原、吲哚生成、过氧化氢酶、脲酶和氧化酶活性以及七叶苷和明胶水解呈阴性。
但该菌能合成琥珀酸盐,其的定植还可引起小鼠肠道内芳香族氨基酸、胆红素、嘌呤和胆汁酸衍生物等菌群代谢物的改变。
胆汁酸的变化伴随着回肠胆汁酸转运基因、肝脏胆汁酸合成基因表达的改变,证明该细菌可能参与胆汁酸稳态维持和胆固醇代谢。
注:Parasutterella的丰度在发酵过程中降低,与氨的产生呈正相关。天冬酰胺是GAM肉汤中Parasutterella代谢最迅速和首选的氨基酸。
基因组信息
Parasutterella的完整基因组大小为2.8 Mb,G+C含量为44.1mol%。预测包含2648个独特基因,缺乏转运和代谢外源糖的基因。
具有编码L-天冬酰胺酶、天冬氨酸氨裂解酶和天冬氨酸脱氢酶的基因,表明天冬酰胺是其最快速和首选的氨基酸代谢物。
doi: 10.1038/s41396-019-0364-5.
此外,在Parasutterella mc1的基因组中没有鉴定出毒素毒力因子相关基因,这表明Parasutterella可能是肠道菌群的共生成员。但最近有许多研究和谷禾的检测报告中发现Parasutterella的丰度异常与一些疾病存在关联,让我们一起继续深入了解。
作为肠道微生物群中的一员,研究发现Parasutterella与炎症性肠病、肥胖、2型糖尿病、自闭症和肾结石等健康结果相关。
肥胖和2型糖尿病患者中增多 ↑↑
研究纳入了1544名受试者,分析肠道菌群组成,发现Parasutterella丰度与BMI以及2型糖尿病呈正相关,与膳食中碳水化合物摄入量呈正相关,但与肥胖中微生物组α/β多样性减少和低度炎症无关。
高丰度的Parasutterella与人体脂肪酸合成途径的激活有关,减肥干预试验中Parasutterella的丰度显著降低,Parasutterella增加或是影响体重增加的一个机制。
在代谢组学检测的126种血清代谢物中,L-半胱氨酸在Parasutterella丰度高的受试者中显著降低,因为Parasutterella是已知的高L-半胱氨酸消费者。
综上所述,Parasutterella在人类2型糖尿病和肥胖症中起一定作用,其中与L-半胱氨酸的联系可能与2型糖尿病的发展有关,并与肥胖症发展过程中富含碳水化合物的饮食导致体重增加的脂肪酸生物合成途径有关。
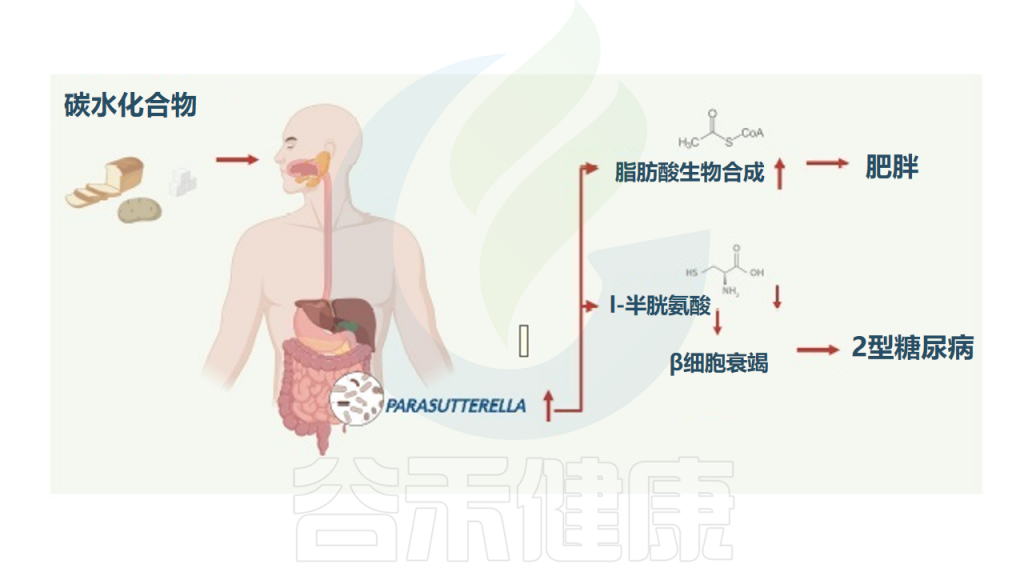
Henneke L,et al.Gut Microbes.2022
焦虑和抑郁人群中增加 ↑↑
与健康个体相比,社交焦虑症(SAD)患者体内的Parasutterella的丰度增加。

同时,16S rRNA分析发现,应激小鼠肠道中Bacteroides、Alistipes和Lactobacillus丰度降低,Parasutterella和Rikenellaceae_RC9_gut_group丰度升高。
KEGG通路分析表明,差异代谢物主要参与α-亚麻酸代谢、味觉传导、半乳糖代谢等下调通路。多种代谢物与Alistipes和Bacteroides呈正相关,而与Parasutterella呈负相关。
此外,Parasutterella的绝对丰度与身体不满意度呈正相关。
炎症性肠病患者中增加↑↑
在肠易激综合征(IBS)患者肠道菌群中,发现15个基因表达显著差异,Parasutterella的表达在筛选和验证实验中均显著不同,并与慢性肠道炎症相关,因此被认为与IBS的发生和发展有关。
Rnase4作为肠道抗菌蛋白在调节肠道微生物群和代谢物稳态中起关键作用,但在炎症性肠病(IBD)患者的肠道组织和粪便中观察到Rnase4水平降低,与Parasutterella的增加有关。
Parasutterella在小鼠体内定植虽然不会对整体微生物结构有明显影响,但会显著改变肠道代谢物,尤其是色氨酸代谢。
在肠上皮细胞和免疫细胞中表达的吲哚胺-2,3-双加氧酶1(IDO1)通过催化色氨酸转化为犬尿氨酸和其他下游代谢物,在肠道健康中发挥关键作用。这些代谢物具有免疫调节作用,并有助于维持肠道稳态,其产生失衡与IBD有关。
骨质疏松症患者中丰度改变
针对继发性骨质疏松症,研究发现酒精性骨质疏松大鼠厚壁菌门(Firmicutes)/拟杆菌门(Bacteroidetes)比例显著降低;高脂饮食诱导的骨质疏松小鼠肠道中双歧杆菌属(Bifidobacterium)、副萨特氏菌属(Parasutterella)和Odoribacter数量显著减少。
但最新的一项研究又发现了矛盾的结果,通过16S rDNA基因测序分析,发现骨质疏松症患者肠道微生物在属水平上的组成和结构明显不同。其中,uncultured_bacterium_f_Muribaculaceae,Allobaculum和Parasutterella丰度显著升高,Akkermansia显著降低,这可能对骨质疏松症(OP)的进展有显著影响。
其他疾病中的丰度变化
// 便秘患者中丰度增加
Parasutterella丰度与便秘大鼠中的炎症呈正相关。便秘是帕金森病患者常见的非运动症状,并在诊断为帕金森病的患者肠道内表现出升高的丰度,并与神经炎症和运动功能密切相关。
// 急性心肌缺血患者中丰度增加
与正常对照组相比,急性心肌缺血(AMI)患者中Parabacteroides、Butyricimonas、Odoribacter、Escherichia和Parasutterella的相对丰度显著增加。
// 酒精性肝病患者中丰度降低
研究也发现,酒精暴露导致小鼠肠道菌群结构显著改变,表现为Firmicutes丰度增加,Parasutterella丰度减少。这表明肠道菌群在酒精性肝病(ALD)的进程中起关键作用。
// 肾结石患者中丰度降低
肾结石患者中显著降低的菌群有:霍氏真杆菌、多尔氏菌属、啮齿杆菌、厌氧棒菌属、Ruminiclostridium_5、霍尔德曼氏菌属(Holdemania)、Fusicatenibacter、罕见小球菌属(Subdoligranulum)、戴阿利斯特菌属、Parasutterella、嗜胆菌属。
并且肾结石患者肠道中的Parasutterella菌属与血钠浓度呈负相关。
尽管Parasutterella丰度变化可能与某些疾病进展相关,但作为肠道共生菌,它也可能具有一些有益作用,如下所示。
可能降低危重肺炎风险 ↓↓

一项研究探讨了肠道菌群对危重肺炎的影响,分析了大规模肠道微生物群数据(n=18340)和危重肺炎基因组数据(病例n=2758和对照n=428607)。
结果显示,疣微菌科(Verrucomicrobiaceae)、嗜黏蛋白阿克曼菌属(Akkermansia)、Lachnospiraceae FCS020group、Parasutterella属、Prevotella7属和蓝细菌门与重症肺炎风险降低相关,而肠杆菌科、瘤胃球菌属UCG003和一些其他肠杆菌目则与风险增加相关。
影响肾上腺功能

研究表明Parasutterella与肾上腺球状带和束状带的功能之间存在因果关系,这会影响醛固酮和皮质醇水平。
Parasutterella生物学特性的研究发现,它显著调节胆汁酸和胆固醇。胆固醇是类固醇激素合成的主要底物,类固醇激素对肾上腺皮质激素的合成至关重要。胆汁酸还促进肠道对膳食胆固醇的吸收,肝脏中胆固醇的合成与胆汁酸的肠肝循环密切相关。
因此,Parasutterella对胆汁酸和胆固醇代谢的调节作用可能是影响肾上腺皮质激素(醛固酮和皮质醇)水平的重要途径。
对甲状腺疾病的保护作用
此外,还有研究发现Parasutterella对毒性单甲状腺结节(TSTN)的甲状腺毒症具有保护作用。
除了疾病外,其他生理状态或因素也会影响Parasutterella的丰度,我们在此列出了一些调节措施。
◮ 女婴中Parasutterella丰度更高
男婴肠道中的2种菌属——另枝菌属(Alistipes)和Anaeroglobus的平均相对丰度更高;而副萨特氏菌属(Parasutterella)、优杆菌属(Eubacterium)、Peptoniphilus和Anaerosporobacter在女婴肠道中的平均相对丰度更高。
◮ 孕妇肠道中Parasutterella增加
研究发现,在早孕期(孕10~15周),正常健康孕妇的肠道菌群拥有较高的α多样性,门水平主要由拟杆菌门、厚壁菌门和变形菌门组成,拟杆菌门为主要优势菌门;属水平上,主要由较多Parasutterella、Parabacteroides、Megasphaera、Dialister和Ruminococcaceae UCG 002/003/005组成。
◮ 缺乏维生素A会导致Parasutterela增加
维生素A缺乏使毛螺菌属_NK4A136组、颤杆菌的数量减少;然而,Parasutterela呈上升趋势。
◮ 高脂、超加工食品导致Parasutterella增加
与对照组相比,超加工食品组中Parasutterella的丰度更高,而Bacteroidetes和Rosebunia的丰度较低。
此外,与对照组相比,高脂高胆固醇饮食组小鼠Escherichia_shigella、Parasutterella和Allobaculum属相对丰度增加。这可能也是肥胖和2型糖尿病人群中Parasutterella较多的一个原因。
◮ 食用抗性马铃薯淀粉Parasutterella丰度增加

在食用抗性马铃薯淀粉(RPS) 的个体的肠道微生物组中,副萨特氏菌属(Parasutterella)的丰度趋于增加,并且副萨特氏菌的增加与服用RPS而不是安慰剂的参与者的低密度脂蛋白(LDL)水平降低相关。
将低密度脂蛋白(LDL)水平下降的RPS消费个体与没有降低的个体分开,发现低密度脂蛋白应答者在基线和服用RPS 12周后的Parashutterella水平明显较高。
▷ 黄莲解毒汤减少Parasutterella

传统中草药制剂黄莲解毒汤剂(HLJD)临床用于治疗腹泻和结肠炎。2和4g/kg剂量的HLJD通过抑制与集落刺激因子1受体(Csf1r)/Src通路相关的结肠组织中巨噬细胞活性受损来抑制炎症,从而缓解慢性结肠炎。
此外,黄莲解毒配方可以通过减少拟杆菌属、Odoribacter、Clostridium_sensu_stricto_1 和 Parasutterella 的丰度来改变肠道微生物群概况。
▷ 虫草素调节Parasutterella,改善肠道炎症

源自真菌的虫草素(CRD)具有抗炎和抗氧化特性,显示出对抗肥胖的潜力。CRD干预减轻了高脂饮食诱导的肠道炎症,改善了血糖水平,减少了脂肪堆积。
此外,冬虫夏草虫草素补充剂被证明能够通过调节关键代谢物的水平来调节内源性代谢紊乱,包括 DL-2-氨基辛酸、肌醇和6-脱氧法戈明。
虫草素影响了 Parasutterella、Alloprevotella、Prevotellaceae_NK3B31_group、Alistipes、unclassified_Clostridia_vadinBB60_group和 unclassified_Muribaculaceae等重要微生物群的丰度,最终导致内源性代谢的调节和肠道菌群紊乱的改善。
▷ 小麦麸油降低Parasutterella,改善脂肪堆积

麦麸是小麦的副产品,它含有膳食纤维、B族维生素、矿物质、酚类化合物和其他被认为对健康有益的植物化学物质。研究表明,麦麸对预防肥胖、心血管疾病、胃肠道疾病和一些癌症有积极作用
该研究发现小麦麸油(WBO)减少了体重增加、脂肪和脂质积累,并改善了肝脏脂肪变性和炎症。WBO处理增加了Romboutsia和 Allobaculum 的相对丰度,降低了Candidatus_Saccharimonas、Alloprevotella, Rikenellaceae_RC9_gut_group, Alistipes, Parabacteroides、Helicobacter、Colidextribacter 和 Parasutterella 的相对丰度。
▷ 世神丸调节肠道菌群,缓解肾阳虚腹泻
世神丸(SSP)是一种中药处方,通过调节肠道菌群、下调胆碱-三甲胺裂解酶(CutC)活性以及降低TMAO和炎症因子水平,显著缓解肾阳虚综合征腹泻症状。
相关性分析显示,CutC活性与粪杆菌属和Chryseobacterium呈正相关,与Prevotellaceae UCG-001、Rikenella、Acinetobacter、Parasutterella和Lacticaseibacillus呈显著负相关。
TNF-α 水平与Lacticaseibacillus、Prevotellaceae UCG-001、Parasutterella和Candidatus Saccharimonas呈显著负相关。
IL-6水平与Rikenella、Acinetobacter、Prevotellaceae UCG-001、Lacticaseibacillus和 Parasutterella呈显著负相关,并且与Faecalibaculum和Chryseobacterium呈显著正相关。
此外,还存在一些可以降低Parasutterella丰度的措施:
白藜芦醇
白藜芦醇(RSV)处理高脂饮食喂养的小鼠后,Parabacteroides 的丰度增加,而Parasutterella的丰度降低。
阿拉伯半乳聚糖
作为L-半胱氨酸的高消耗者,副萨特氏菌(Parasutterella)的定植可显著增加牛磺酸和N-乙酰蛋氨酸的水平。
而阿拉伯半乳聚糖(LBP-3)治疗显著降低了副萨特氏菌(Parasutterella)的相对丰度,从而降低了半胱氨酸、牛磺酸和炎性细胞因子(如TNF-α和IL-1β)的水平,从而有助于减轻溃疡性结肠炎(UC)的症状。
低FODMAP黑麦面包
一项随机临床试验比较低FODMAP黑麦面包与普通黑麦面包对肠易激综合征患者肠道菌群的影响,结果显示食用低FODMAP黑麦面包减少了拟杆菌、Flavonifractor、Holdemania、Parasutterella和克雷伯菌的丰度,并显示出双歧杆菌增加的趋势。
发酵豆乳
摄入发酵豆乳(FSM)可使Parasutterella、Turisibater和Bacteroide的相对丰度分别降低75%、62%和50%,而有益菌Akkermansiaceae、Lachnospiraceae、Alloprevotella和Dubosella的相对丰度分别增加28%、50%、80%和63%。
在动物实验中,经阿斯巴甜处理后,厚壁菌门和柔嫩梭菌属(Clostridiumleptum)的丰度较高,肠球菌和副萨特氏菌(Parasutterella)的丰度较低。
富含氢气的水(HRW)被发现减少了某些可能的致病性肠道微生物(Frisingicoccus和Parasutterella)。
主要参考文献
Ju T, Kong JY, Stothard P, Willing BP. Defining the role of Parasutterella, a previously uncharacterized member of the core gut microbiota. ISME J. 2019 Jun;13(6):1520-1534.
Henneke L, Schlicht K, Andreani NA, Hollstein T, Demetrowitsch T, Knappe C, Hartmann K, Jensen-Kroll J, Rohmann N, Pohlschneider D, Geisler C, Schulte DM, Settgast U, Türk K, Zimmermann J, Kaleta C, Baines JF, Shearer J, Shah S, Shen-Tu G, Schwarz K, Franke A, Schreiber S, Laudes M. A dietary carbohydrate – gut Parasutterella – human fatty acid biosynthesis metabolic axis in obesity and type 2 diabetes. Gut Microbes. 2022 Jan-Dec;14(1):2057778.
Yan H, Kuerbanjiang M, Muheyati D, Yang Z, Han J. Wheat bran oil ameliorates high-fat diet-induced obesity in rats with alterations in gut microbiota and liver metabolite profile. Nutr Metab (Lond). 2024 Oct 25;21(1):84.
Liu T, Ji H, Li Z, Luan Y, Zhu C, Li D, Gao Y, Yan Z. Gut microbiota causally impacts adrenal function: a two-sample mendelian randomization study. Sci Rep. 2024 Oct 7;14(1):23338.
Su S, Liu T, Zheng JY, Wu HC, Keng VW, Zhang SJ, Li XX. Huang Lian Jie Du decoction attenuated colitis via suppressing the macrophage Csf1r/Src pathway and modulating gut microbiota. Front Immunol. 2024 Sep 26;15:1375781.
Li Y, Fang M, Li D, Wu P, Wu X, Xu X, Ma H, Li Y, Zhang N. Association of gut microbiota with critical pneumonia: A two-sample Mendelian randomization study. Medicine (Baltimore). 2024 Oct 18;103(42):e39677.
Fu Y, Wang Q, Tang Z, Liu G, Guan G, Lyu J. Cordycepin Ameliorates High Fat Diet-Induced Obesity by Modulating Endogenous Metabolism and Gut Microbiota Dysbiosis. Nutrients. 2024 Aug 27;16(17):2859.
Xue S, Shi W, Shi T, Tuerxuntayi A, Abulaiti P, Liu Z, Remutula N, Nuermaimaiti K, Xing Y, Abdukelimu K, Liu W, Gao F. Resveratrol attenuates non-steroidal anti-inflammatory drug-induced intestinal injury in rats in a high-altitude hypoxic environment by modulating the TLR4/NFκB/IκB pathway and gut microbiota composition. PLoS One. 2024 Aug 12;19(8):e0305233.

谷禾健康

谷 氨 酰 胺
现代社会很多人都在持续食用低质量、高碳水化合物、低纤维的加工食品,饮食摄入可能影响他的肠道通透性。例如,某些饮食成分,如高脂肪或高糖饮食,与肠道通透性和炎症增加有关。
其他因素包括压力、微生物入侵和对感染的免疫反应,都可能会给肠道带来不同程度的伤害。
肠道疾病带来的损伤
一些肠道疾病包括炎症性肠病(如克罗恩病和溃疡性结肠炎)、肠道感染、肠道功能障碍等,通常会对肠道黏膜造成不同程度损害。
炎症性肠病的主要特征是肠道黏膜出现持续性炎症。这些病理改变会破坏肠道黏膜屏障的完整性,增加肠道通透性,从而导致细菌和毒素进入机体,引发全身性炎症反应。
注:在克罗恩病中,炎症可波及整个消化道,导致黏膜水肿、糜烂和溃疡形成。而在溃疡性结肠炎中,炎症主要局限于结肠和直肠,也会造成黏膜损害。
肠道感染如细菌性痢疾、病毒性胃肠炎等。这些感染通常会引起肠道黏膜的炎症反应,导致黏膜水肿、充血、出血等表现。严重时还可能出现黏膜糜烂和溃疡。这些病理改变会破坏肠道屏障功能,增加肠道通透性,引发继发性全身症状。
此外,一些功能性肠道疾病,如肠易激综合征,也可能伴有不同程度的肠道黏膜损害。这些疾病的发病机制复杂,往往涉及消化道、神经、内分泌、免疫等多个系统的失调,最终导致肠道黏膜屏障功能紊乱。
黏膜屏障功能受损、炎症→ 需要合适的干预
肠道疾病导致黏膜屏障功能受损,增加肠道通透性,使得细菌、毒素等有害物质进入机体,引发全身性炎症反应,从而恶化疾病。肠道通透性升高也会损害上皮细胞功能并降低营养吸收效率。因此,在肠道疾病治疗中,维护和修复受损的肠道黏膜屏障功能至关重要。
相比传统药物,营养补充剂如谷氨酰胺更温和
一些抗生素、止泻药等可以帮助加速修复肠道粘膜,缓解炎症反应,预防再次感染,但是,这些传统药物疗法往往存在一些问题,比如可能导致胃肠道副作用、干扰肠道微生态平衡、长期用药引发依赖性等。
相比之下,营养补充剂如谷氨酰胺,能够更加温和地调节肠道功能,修复受损的肠道粘膜屏障,同时也有助于维护肠道微生态平衡。
谷氨酰胺(Gln)是一种α-氨基酸,是核苷酸合成的重要前体之一。谷氨酰胺广泛参与机体的各种生物活动,是体内最丰富的游离氨基酸,约占总游离氨基酸的50%。谷氨酰胺是条件性必需氨基酸,在应激状态下(如压力、炎症、感染、创伤等)需要靠外部摄取满足。
根据发表在《国际分子科学杂志》上的一项研究显示,谷氨酰胺是血液和细胞中最常见的氨基酸之一,是肠道细胞的首选能量来源。谷氨酰胺补充剂可以保护肠道内壁并帮助其保持强大的肠道屏障,降低肠道通透性(即肠漏),刺激肠上皮细胞增殖,增强免疫细胞功能,在减少炎症反应的同时支持免疫系统,从而有助于促进受损肠道的快速修复,并最终改善疾病预后,这使其成为一种更加安全有效的肠道粘膜修复策略。
因此有研究提出,给予危重症患者适量的谷氨酰胺对于维持其正常肠屏障功能、降低炎性介质水平是有益的。但对于危重症患者应用谷氨酰胺是否能获益目前尚存在争论。
本文我们来了解一下谷氨酰胺是什么,其过量或缺乏会带来什么影响,为什么谷氨酰胺可以帮助修复肠道黏膜修复及缓解炎症,使用谷氨酰胺应该注意什么等,从而了解谷氨酰胺的作用及相关应用。
什么是谷氨酰胺?
谷氨酰胺是一种是一种条件性必需氨基酸,由谷氨酰胺合成酶在各种器官中从头合成,在人体多个系统包括肠道、免疫等发挥重要作用。它是血液中最丰富的游离氨基酸,是肠道细胞的重要底物,谷氨酰胺可以有效增强小肠肠内皮细胞的功能、增殖和生命周期。
为什么说谷氨酰胺是一种条件性必需氨基酸?
虽然人体可以自行产生谷氨酰胺,但在某些特定的高代谢状态下,例如生病、创伤、烧伤、压力、感染期间,其自身合成可能不足以满足需求,可能需要从外部食物中获取。
谷氨酰胺与谷氨酸有什么区别与关联?
谷氨酸和谷氨酰胺是两种对人体健康至关重要的氨基酸。
谷氨酸也是一种非必需氨基酸,也就是说人体可以自行产生谷氨酸。然而,它也存在于许多食物中,如肉类、家禽、鱼类、蛋类和乳制品。谷氨酸也以味精的形式用作食品添加剂。它可以完整或以结合形式提供。
但在体内,它也可以作为多种化合物的分解产物——比如来自谷氨酰胺,也来自叶酸和葡萄糖。谷氨酸广泛存在于肌肉中所有的蛋白质储存中。因此,从某种意义上说,它们需要彼此来帮助人体。虽然谷氨酰胺被视为发挥修复肌肉和治疗某些疾病作用的主要氨基酸,但谷氨酸却在幕后发挥作用,为谷氨酰胺发挥其作用做出一切正确的行动。
关于谷氨酸详见我们之前的文章:兴奋神经递质——谷氨酸与大脑健康
谷氨酰胺合成代谢:
具体来说,谷氨酰胺代谢主要通过两个步骤进行:
哪些部位含有谷氨酰胺?
谷氨酰胺存在于人体所有细胞中,但在肌肉细胞中含量尤其丰富。谷氨酰胺也存在于血液、消化道、肝脏、大脑中。
谷氨酰胺在人体各组织器官中的分布呈现出显著的浓度梯度特征。具体来说:
哪些食物含有谷氨酰胺?
谷氨酰胺存在于许多食物中,包括:
一般来说,牛肉的谷氨酰胺含量最高,其次是豆腐和鸡蛋。
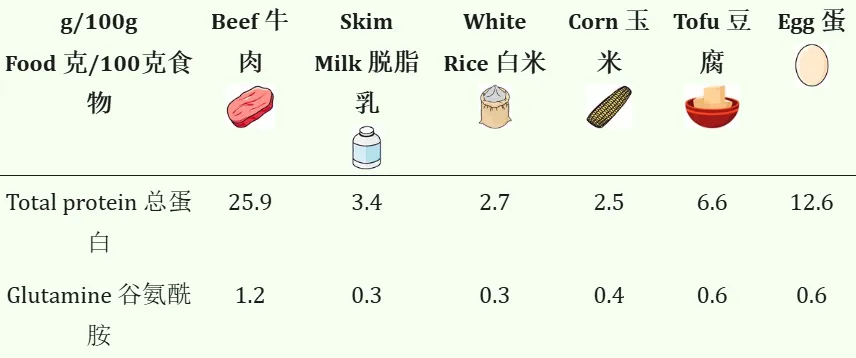
doi:10.3390/nu10111564
单独补充剂
谷氨酰胺也存在于食品中,并作为膳食补充剂在非处方药(OTC)中出售,也称为 L-谷氨酰胺。
L-谷氨酰胺与谷氨酰胺相同吗?
一般来说,“谷氨酰胺”在科学文献、营养信息和补充剂标签中通常用作L-谷氨酰胺的简写。这是因为L-谷氨酰胺是人体和大多数其他生物体中氨基酸的生物学相关形式。
虽然D-谷氨酰胺存在,但它通常在自然界中并不大量存在,并且在人类中具有有限的生物活性。对于消费者、运动员和大多数医疗从业者来说,术语“谷氨酰胺”和“L-谷氨酰胺”在实际用途上可以被认为是相同的,可以互换使用。
谷氨酰胺在人体内的关键作用
谷氨酰胺约占骨骼肌游离氨基酸库的 60%,占总循环氨基酸的 20% 以上。谷氨酰胺主要在骨骼肌中合成,在骨骼肌中含量最高,剩余部分存在于肺、肝、脑、肾脏、脂肪组织、血液、肠道中。
在正常情况下,身体可以在运动后补充谷氨酰胺水平。每天多次过度训练、每周训练 7 天并参与剧烈运动,或进行极限运动、训练、竞技赛事或活动,和/或一天内进行多次训练的专业运动员患谷氨酰胺消耗的风险更大。休闲健身房用户通常不需要补充谷氨酰胺,因为他们不会以精英运动员的强度进行锻炼。然而,精英运动员可能会从谷氨酰胺补充剂中受益。
谷氨酰胺对于维持肠道内壁的健康和完整性至关重要。它是消化道内壁细胞的主要能量来源,有助于修复受损组织。
这在后面的章节我们会详细阐述。
免疫系统中的白细胞由谷氨酰胺提供动力。白细胞因疾病或疾病而增加。因此,需要增加谷氨酰胺来帮助为这些细胞提供燃料。如果血液中循环的谷氨酰胺不足,则可以从肌肉储备中释放谷氨酰胺,以帮助为肠道内壁的吸收细胞提供燃料。
谷氨酰胺在组织之间的氮运输中发挥作用。它是氮的重要载体,对各种代谢过程至关重要。蛋白质分解产生的所有氮中约有30- 35%以谷氨酰胺的形式运输。
谷氨酰胺可以在体内转化为葡萄糖,提供能量来源,特别是对于免疫系统和消化道中快速分裂的细胞。
什么情况下谷氨酰胺可能缺乏?
肾脏是谷氨酰胺的主要消费者,谷氨酰胺分解出的氨在这里起作用,以维持身体的酸碱平衡。哪里有氨,哪里就有谷氨酰胺。随着代谢性酸中毒的增加,如对高强度训练或高蛋白饮食的反应,肾脏对谷氨酰胺的摄取飙升。一项研究发现,仅仅四天的高蛋白、高脂肪饮食就足以导致血浆和肌肉组织中谷氨酰胺水平下降25%。
如果所有这些相互竞争的用途开始超过你的身体产生谷氨酰胺的能力,那么你可能会开始出现缺乏的迹象,包括肌肉萎缩,能量耗尽,以及对感染的易感性增加。
当人体缺乏足够的谷氨酰胺时,会对胃肠道的正常生理功能产生不利影响。谷氨酰胺是快速增殖细胞(如肠上皮细胞)的重要能量底物,在维持肠道上皮细胞的分裂和更新中起着至关重要的作用。缺乏谷氨酰胺会导致肠上皮细胞增殖和分化受阻,从而影响肠道屏障的完整性。
进一步研究发现,谷氨酰胺可通过多重机制来增强肠道屏障功能,改善肠道通透性。下面重点讲述。
在以高速率使用谷氨酰胺的各种组织中,肠道利用约30%的总谷氨酰胺,表明它是肠道的关键营养素。
► 小肠和大肠都能够代谢饮食和/或血液中提供的大量谷氨酰胺。
在健康成人中进行的研究表明,肠内提供的谷氨酰胺有四分之三被吸收到内脏组织中,大部分吸收的谷氨酰胺在肠道内代谢。当血浆谷氨酰胺通过器官时,四分之一的血浆谷氨酰胺被小肠吸收。肠道与其他组织竞争来自体内氨基酸库和膳食来源的谷氨酰胺。
► 谷氨酰胺对肠道的作用在数量上比葡萄糖作为能量底物更相关。例如,在肠上皮细胞中,谷氨酰胺碳可以通过两个主要途径代谢,即:
i) 通过形成 δ1-吡咯啉-5-羧酸盐;
ii)通过转化为α-酮戊二酸作为Krebs循环中的中介。
第一个途径通过使用肠道中发现的大约 10% 的氨基酸浓度,能够从谷氨酰胺碳中形成脯氨酸、鸟氨酸和瓜氨酸。
另外 10-15% 的谷氨酰胺被掺入组织蛋白中;其中最高比例(约 75%)在Krebs循环中被代谢用于能量生产。
知道了谷氨酰胺在肠道中的代谢特点后,我们就可以进一步探讨它在支持肠道健康方面的具体作用机制了。
研究表明谷氨酰胺在支持肠道健康和功能方面也扮演着关键角色。具体来说,谷氨酰胺通过三个主要机制发挥作用:
有助于改善肠道微生态平衡
优化的肠道微生态更有可能更有效地进行神经递质合成和其他功能。因此,谷氨酰胺通过调节肠道菌群比例,可能在肥胖和代谢紊乱的治疗中发挥一定作用。
厚壁菌门/拟杆菌门↓——改善肥胖
2015年的一项研究中,研究人员随机将33名肥胖受试者分为两组,一组补充谷氨酰胺,另一组补充丙氨酰。
经过14天的补充治疗后,补充谷氨酰胺的组别其肠道中厚壁菌门与拟杆菌门的比例显著降低。这一结果与体重减轻方案中的观察结果一致。
梭菌、肠杆菌科↓——改善化疗药物副作用
既往研究记录了一系列与各种化疗药物相关的胃肠道细菌感染。
在结肠癌大鼠模型上进行的一项实验,研究结果表明,谷氨酰胺治疗可以防止化疗药物伊立替康给药后,β-葡萄糖醛酸酶阳性细菌的丰度降低(Clostridium cluster XI 、肠杆菌科Enterobacteriaceae)。作者建议,谷氨酰胺补充可能在改善化疗引起的盲肠内β-葡萄糖醛酸酶活性增加中发挥作用。
拟杆菌门、放线菌门↑——改善便秘
提供氮源、助合成蛋白质——改善便秘
一项研究中,便秘动物补充了谷氨酰胺,拟杆菌门和放线菌门有所增加。
补充谷氨酰胺可以通过调节肠道微生物群来改善便秘和改善肠道功能。除了帮助厚壁菌门更好地获取能量外,谷氨酰胺对便秘的影响机制还涉及为小肠细菌提供氮源,帮助细菌合成蛋白质。
肠道微生物群的组成和功能会因饮食和营养状况而改变。因此,谷氨酰胺补充剂已被提议作为缓解便秘的潜在治疗方法。
有助于增强肠道屏障
肠道黏膜细胞更新
肠上皮细胞自发性凋亡对于维持其正常结构至关重要。然而,由外源性因素或细胞内刺激诱导的许多细胞应激(包括内毒素血症、营养剥夺和生长因子缺乏)会扰乱增殖和细胞凋亡之间的平衡。由于持续的凋亡细胞死亡,增殖和凋亡之间的这种不平衡会触发肠道病理状况。
因此,抑制肠上皮细胞凋亡以预防肠道病理状况至关重要。谷氨酰胺已被证明在肠道中显示出抗凋亡特性。
在大鼠肠上皮(RIE-1)细胞中,谷氨酰胺剥夺导致细胞凋亡。同样,补充谷氨酰胺可有效减少人肠上皮 T84 细胞中毒素诱导的细胞凋亡,以及月桂酸钠诱导的 RIE-1 细胞凋亡,共同表明谷氨酰胺对抑制细胞凋亡至关重要。
2017年的一篇综述讨论了谷氨酰胺如何支持肠道功能。肠黏膜细胞的生命周期相对较短,大约每5天就会更新一次。研究发现,谷氨酰胺可以激活蛋白激酶,促进肠道干细胞分化和增殖,形成肠细胞、杯状细胞等。
谷氨酰胺通过最大化表皮生长因子和胰岛素样生长因子-I等生长因子的作用,来增加肠道肠细胞的增殖。这些生长因子负责影响肠黏膜细胞的DNA、RNA和蛋白质合成,以及细胞复制。
谷氨酰胺在维持肠道黏膜细胞的更新和增殖方面发挥了关键作用,有助于支持肠道的正常功能。
紧 密 连 接
肠道紧密连接受损 → 肠道通透性增加
紧密连接(tight junctions)是形成于胃肠道壁细胞间的蛋白质结构。这些连接在决定吸收底物和阻隔病原体进入方面起着关键作用。
该保护层的完整性容易受到食物、炎症肽(如细胞因子)和压力造成的损害。
紧密连接功能的受损会导致肠道通透性增加,允许更大的蛋白质渗入血液,从而引发全身性炎症反应。
生活方式和饮食习惯可以影响肠道紧密连接的通透性。
谷氨酰胺可以调控紧密连接蛋白的表达
细胞缺乏谷氨酰胺时,用于紧密连接形成的蛋白表达减少,通透性增加,但补充谷氨酰胺可以逆转这一过程。
谷氨酰胺通过促进紧密连接蛋白的磷酸化,从而激活和维持它们的功能。因此,谷氨酰胺补充可能成为治疗乳糜泻和炎症性肠病的一种有效的营养支持方式。
总之,谷氨酰胺通过调节肠道紧密连接蛋白的表达和功能,从而影响肠道通透性,这为其在相关肠道疾病治疗中的应用提供了理论依据。
短期补充高剂量谷氨酰胺显著降低肠道通透性
一项荟萃分析检索了四个主要数据库中的相关研究,纳入的10项研究发表于1998-2014年间,包括216名干预组和212名对照组受试者,结果发现每天补充超过30克谷氨酰胺且持续时间不超过2周时,可显著降低肠道通透性(WMD: -0.01)。
谷氨酰胺对肠道通透性影响的敏感性分析
doi.org/10.1007/s00726-024-03420-7
其他亚组分析也显示,在某些特定条件下,谷氨酰胺补充可改善肠道通透性。
但总体而言,谷氨酰胺对肠道通透性的影响存在一定差异,需要进一步探索不同剂量和持续时间的作用。
抑制炎症反应
克罗恩病或溃疡性结肠炎涉及炎症途径。炎症反应引起级联效应,导致促炎细胞因子的产生,从而刺激炎症反应。
谷氨酰胺补充剂最常用于帮助治疗炎症性肠病,例如溃疡性结肠炎和克罗恩病。这些情况会导致消化道出现疼痛性溃疡,以响应肠道自身免疫攻击。
《国际分子科学杂志》研究表明,L-谷氨酰胺可以阻断两种促炎介质的激活,从而减少炎性细胞因子的表达。换句话说,它可能有助于减少炎症。
同一篇文章回顾了其他研究,并指出谷氨酰胺补充剂通常似乎有助于调节肠道细胞的生长,维持肠道的紧密连接,影响炎症级联反应,并防止细胞死亡和压力。
谷氨酰胺可以调控紧密连接蛋白的表达
谷氨酰胺可能通过增加热休克蛋白的活性来抑制这一过程的启动。这些蛋白降低 NF-κB 转录因子的表达,NF-κB 转录因子刺激与炎症和免疫反应相关的基因。
短期补充谷氨酰胺支持 NF-κB 的转录因子显著减少。
此外,谷氨酰胺还抑制其他炎症转录因子(STAT 蛋白)的激活。
一氧化氮也是炎症的必要成分;但如果合成过量,则可能是有害的。谷氨酰胺可使一氧化氮产生正常化,从而减轻高水平炎症。
富含谷氨酰胺的饮食可以改善创伤患者的免疫功能,并改善化疗后患者的粘膜炎。作者确定了临床结果:克罗恩病 21 克谷氨酰胺/天,持续 28 天,短肠综合征 42 克/天,持续 21天。
在一项随机对照试验中发现,在缓解期的克罗恩病患者中,补充谷氨酰胺(0.5g/kg BW;2个月)降低了肠道通透性和形态。
肠道疾病
肠易激综合征(IBS) 是一种影响消化系统的慢性疾病。诊断具有挑战性,症状可能因人而异。症状通常包括腹痛以及排便变化(便秘和/或腹泻)等。
补充L-谷氨酰胺可以改善IBS症状
在一项小型研究中,患有以麸质为主的IBS的成年人被随机分配每天服用15克谷氨酰胺或安慰剂,持续8周。几乎80%服用谷氨酰胺的患者的IBS严重程度评分系统(IBS-SS)评分至少提高了50分。
谷氨酰胺还与改善每日排便频率、腹痛和生活质量相关。
在另一项研究中,患有IBS的成年人遵循低FODMAP饮食,补充或不补充谷氨酰胺六周。那些遵循饮食并每天服用谷氨酰胺(每天15 g)的人比那些只遵循低FODMAP饮食的人在IBS症状方面有更显著的改善。
虽然有这些积极的结果,但这两项研究的持续时间都很短,并且没有涵盖所有类型的IBS,需要更多的研究来加强这一证据。
循环谷氨酰胺水平升高可降低结肠炎、结肠癌和IBD的风险
一项研究利用孟德尔随机化(MR)方法,分析来自114,751名欧洲人群的GWAS数据,研究发现谷氨酰胺水平与结肠癌、结肠炎和IBD(特别是克罗恩病)呈显著负相关。
研究采用52个严格选择的SNPs作为遗传工具变量进行MR分析:
这些发现为深入研究潜在的分子机制、流行病学监测和公共卫生决策奠定了基础。
癌症治疗,包括化疗和放疗,通常会对胃肠道产生不利影响,导致粘膜损伤、屏障功能受损和肠道炎症。
谷氨酰胺有助于维持肠道内壁的结构完整性并支持受损粘膜细胞的再生。通过促进肠上皮细胞的增殖和增强粘蛋白合成。
谷氨酰胺补充剂可减轻胃肠道毒性和降低治疗引起的副作用的严重程度。这有助于增强抗癌治疗的耐受性并改善患者的整体生活质量。
此外,谷氨酰胺作为必需抗氧化剂谷胱甘肽的前体,有助于减轻氧化应激并降低化疗引起的神经毒性(如周围神经病变)的风险。
谷氨酰胺可以通过潜在影响肠道微生物代谢来改变微生物群的组成或功能,包括促进/抑制肿瘤的肠道微生物组产生的代谢物、导致细胞外酸中毒的代谢物以及为结肠上皮细胞提供能量的短链脂肪酸(SCFAs)。
谷氨酰胺补充剂因其增强免疫功能的潜力而受到广泛关注,免疫功能是人体防御癌症的关键方面。对接受放化疗的食管癌患者的研究报告称,大剂量口服谷氨酰胺补充剂(30 克/天)可以恢复淋巴细胞计数并增强淋巴细胞有丝分裂功能。这表明癌症治疗期间对免疫功能有积极影响。
癌症患者补充谷氨酰胺(Gln)的临床试验

doi.org/10.3390/cancers16051057
除肠道外,谷氨酰胺减轻与口腔粘膜炎相关疼痛
化疗通常会破坏粘膜组织,引起口腔和咽喉溃疡,称为粘膜炎。一些研究报告减少了与放疗和化疗相关的疼痛性粘膜症状和溃疡。
一项荟萃分析涉及 988 名受试者,谷氨酰胺没有降低口腔粘膜炎的发生率(RR 0.94),但它降低了口腔粘膜炎的严重程度(SMD-0.73)和严重口腔粘膜炎的发生率(RR 0.41)。
谷氨酰胺降低了口腔粘膜炎引起的阿片类镇痛药使用(RR 0.84)、饲管使用(RR 0.46)、住院(RR 0.39)和治疗中断(RR 0.49)的发生率。谷氨酰胺有效改善了接受化疗和/或放疗的癌症患者的口腔粘膜炎并减少与口腔粘膜炎相关的不良反应。
谷氨酰胺补充剂的潜在益处不仅限于免疫调节和肠道毒性缓解,还包括癌症治疗期间患者健康状况的更广泛方面。这些针对不同类型癌症患者/治疗的临床研究的积极结果包括癌症恶病质相关蛋白的减少、蛋白质合成的改善、去脂质量和血清白蛋白的显著改善、瘦身的维持以及预防辐射引起的损伤和体重减轻。接受强化治疗的癌症患者保持足够的营养状况对于维持能量水平、保持肌肉质量和支持整体健康至关重要。
谷氨酰胺作为蛋白质合成的关键底物和人体抗氧化防御的重要组成部分,已在实验和临床研究中显示其减少治疗引起的体重减轻和改善营养参数的潜力。
■ 靶向肿瘤中的谷氨酰胺代谢
肿瘤微环境中谷氨酰胺代谢竞争对抗肿瘤免疫十分重要,在2023年8月3日的《自然》杂志上,Guo等人表明谷氨酰胺是癌症和免疫细胞之间的细胞间代谢检查点。靶向肿瘤微环境中的谷氨酰胺代谢是改善抗癌治疗的有前途的策略。
免疫逃避释放了癌细胞茁壮成长的能力,使它们能够避免被免疫系统识别和清除。肿瘤通过各种策略逃避免疫系统。有人提出,肿瘤微环境内的代谢竞争可能是免疫抑制微环境的重要因素。
研究发现,肿瘤细胞通过高表达SLC38A2转运体大量摄取谷氨酰胺,导致微环境中谷氨酰胺水平降低,从而抑制了树突状细胞(cDC1s)的功能和T细胞的抗肿瘤活性。
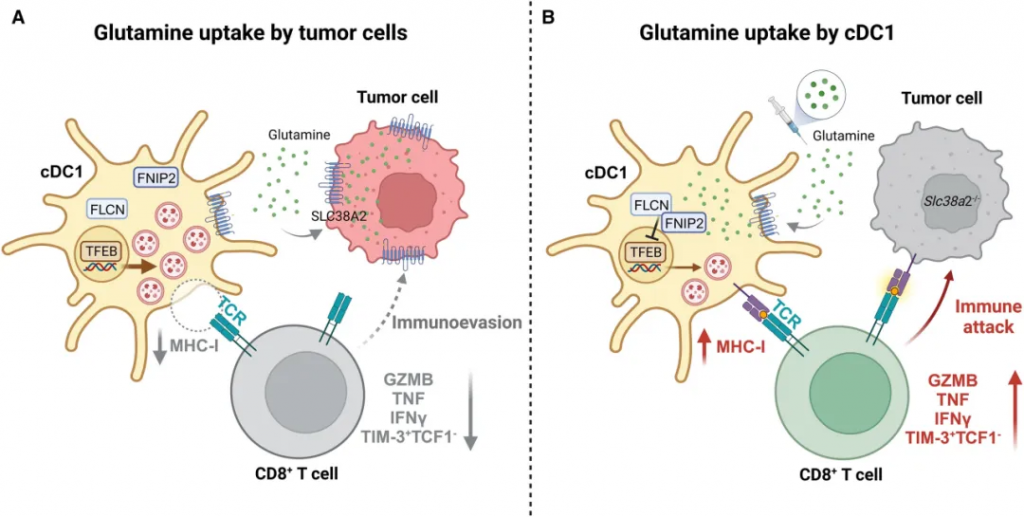
doi: 10.1016/j.chembiol.2023.08.012
通过补充谷氨酰胺或抑制肿瘤细胞的谷氨酰胺摄取,可以恢复免疫系统的抗肿瘤功能,这为癌症免疫治疗提供了新的治疗策略。
在癌症中靶向谷氨酰胺代谢的利与弊
doi.org/10.3390/cancers16051057
■ 谷氨酰胺在肿瘤耐药中的机制
谷氨酰胺代谢在肿瘤发生发展中所产生的作用,尤其是在肿瘤耐药方面的作用机制已成为近年来研究的热点。
谷氨酰胺代谢通路靶点与肿瘤化疗药物耐药机制汇总

doi.org/10.3724/zdxbyxb-2021-0040
从谷氨酰胺的转运到谷氨酰胺代谢为各种终产物,中间任一环节变化都有可能是导致肿瘤细胞产生耐药的原因。深入了解谷氨酰胺在肿瘤耐药中的机制,有助于开发或是改进针对谷氨酰胺代谢靶点抗肿瘤药物的治疗效果。同时,由于肿瘤的异质性以及肿瘤患者的个体差异等造成谷氨酰胺代谢特点在不同肿瘤甚或同一肿瘤中存在明显差异,在今后的研究中需要着重关注这些差异,以便于针对不同的患者进行个体化的药物治疗。
在探讨了谷氨酰胺在肿瘤耐药中的重要性之后,我们以乳腺癌为例,来看一下谷氨酰胺在这一具体类型肿瘤中的作用。
■ 乳 腺 癌
乳腺癌是女性最常见的恶性肿瘤,其代谢重编程和免疫逃避是其关键特征。谷氨酰胺代谢在乳腺癌发展中起着重要作用。
涉及多个关键转运蛋白和代谢酶的调控
SLC1A5、SLC6A14、SLC7A5 和 SLC7A11 是乳腺癌中重要的氨基酸转运蛋白,其表达与预后相关。
谷氨酰胺代谢与细胞凋亡、铁死亡等程序性细胞死亡密切相关。
不同癌症“偏好”不同
比如三阴性乳腺癌特别”钟情”于谷氨酰胺,而其他类型的乳腺癌(如Luminal A型) 虽然也消耗大量谷氨酰胺,但对谷氨酰胺的依赖程度较低。有些癌症甚至可以通过其他途径(如葡萄糖)来弥补谷氨酰胺的不足。
与正常细胞相比,肿瘤细胞对营养的需求更大,分解代谢物的速率也更快。因此,营养剥夺可能是一种可行且成功的治疗选择。靶向谷氨酰胺代谢可能是一种潜在的成功治疗方法,可以抑制乳腺癌,尤其是三阴性乳腺癌,因为谷氨酰胺是细胞增殖的关键成分,其代谢与程序性细胞死亡和肿瘤免疫直接相关。
靶向谷氨酰胺的药物
在耐药乳腺癌细胞中,谷氨酰胺转运蛋白(如 SLC6A14 和 SLC1A5)的表达升高。靶向这些谷氨酰胺转运蛋白的药物可以提高耐药乳腺癌的治疗效果。
早期开发的抑制剂如谷氨酰胺类似物,硝化酶和阿昔洛维辛,这些药物存在细胞毒性高、影响范围广等问题。
新型变构抑制剂,如选择性谷氨酰胺酶抑制剂CB-839,对三阴性乳腺癌特别有效,显著抑制细胞增殖,降低谷氨酰胺消耗,减少谷氨酸合成,降低谷胱甘肽水平。与紫杉醇联合使用能提高治疗效果,有助于克服耐药性。
然而,谷氨酰胺的应用价值并不仅仅局限于肿瘤治疗。这种关键的氨基酸在改善整体健康状况方面也显示出广泛的潜力。
创伤,包括严重烧伤、手术或其他损伤,会降低谷氨酰胺水平。
烧伤是一种严重的分解代谢状态,会导致血浆和肌肉中谷氨酰胺水平显著降低。研究表明,烧伤患者谷氨酰胺耗竭与免疫系统功能减弱相关,影响伤口愈合和预后。
摄入额外的谷氨酰胺对重病或受伤的人有益
一些研究表明,服用谷氨酰胺可以预防或减少手术后的感染。它可以防止严重烧伤后对器官造成更广泛的损害。证明谷氨酰胺在这些情况下益处的研究通常涉及提供者在医院将谷氨酰胺添加到一个人的饲管中。
来自 11 项荟萃分析的 33 项原始干预试验。早期肠内营养可以显著降低总死亡率、住院时间和败血症风险。
▸ 谷氨酰胺显示住院时间显著缩短(MD:-6.23, 95% CI: -9.53, -2.94, GRADE = 低质量)。
荟萃分析纳入了 22 项试验,共随机分配了 2170 名患者。
▸ 合并后,谷氨酰胺补充剂缩短了住院时间(加权均数差 [WMD] = -7.95,95% 置信区间 [CI] -10.53 至 -5.36,I2 = 67.9%,16 项试验)。
▸ 谷氨酰胺补充剂改善了合并伤口愈合率(WMD = 9.15,95% CI 6.30 至 12.01,I2 = 82.7%,6 项研究)和伤口愈合时间(WMD = -5.84,95% CI -7.42 至 -4.27,I2 = 45.7%,7 项研究)。
▸ 谷氨酰胺补充剂减少了伤口感染(风险比 [RR] = 0.38,95% CI 0.21 至 0.69,I2 = 0%,3 项试验)。
谷氨酰胺补充对烧伤患者的效果仍存在争议
一项大型双盲随机对照试验(1209名烧伤患者)显示,谷氨酰胺补充对出院时间无显著影响。
10 项随机对照试验(1577 名患者)谷氨酰胺补充剂对总体死亡率(RR,0.65,95% CI,0.33–1.28;p = 0.21)、感染并发症(RR,0.83;95% CI,0.63–1.09;p = 0.18)或其他次要结果没有显著影响。
目前尚不清楚受伤后服用谷氨酰胺是否对每个人都有效。在实际应用中,应该根据患者具体情况制定个体化补充方案,并密切监测不良反应。
谷氨酰胺联合益生菌减轻烧伤大鼠肠道炎症和氧化应激
严重烧伤可能与肠道炎症和氧化应激相关。一项研究发现,谷氨酰胺和益生菌一起显著抑制一氧化氮(NO)含量;降低炎症因子TNF-α、IL-6和IL-8的水平;并改变氧化应激因子(包括活性氧自由基和超氧化物歧化酶)的表达。
谷氨酰胺可促进伤口愈合,部分原因是它增加了精氨酸和瓜氨酸(精氨酸的前体)的浓度。因此,谷氨酰胺允许在单核细胞和巨噬细胞中没有细胞外精氨酸的情况下产生NO。这种氨基酸还可以减少肠道萎缩,并限制肠道通透性,间接减少促炎细胞因子的产生。
系统综述和荟萃分析表明,补充谷氨酰胺对氮平衡(p<0.0001)、患者死亡率(p=0.0004)、L/M比值(p<0.00001)、LOS(p<0.000001)、CRP(p<0.0.00001)、IL-6水平(p=0.0001)和TNFα水平(p<0.00000)有显著影响。然而,补充谷氨酰胺对T细胞淋巴细胞的影响没有达到显著性(p=0.07)。
静脉注射(IV)谷氨酰胺联合静脉营养可能会减少患者术后住院天数,尤其是腹部大手术。它还可能降低医院手术后的感染率,但不会影响任何类型手术后的死亡风险。
住院与恢复研究
手术会消耗肌肉中的谷氨酰胺并减少肌肉蛋白质合成。
在腹部手术后患者中,补充谷氨酰胺组的肌肉谷氨酰胺减少幅度小于对照组。此外,治疗组的蛋白质合成没有变化,而对照组则下降了。
与对照组相比,胃部手术前一周每日补充谷氨酰胺可改善术后抗氧化状态和肝功能。
接受谷氨酰胺的患者发现谷胱甘肽(体内的一种抗氧化剂)减少较少,住院时间有缩短的趋势。
感染、手术、放疗、化疗通过破坏蛋白质来消耗体内的氮水平。在接受骨髓移植的患者中,将氮保留在体内的因子可减少临床感染、缩短住院时间并减少有害微生物菌落的形成。
在一项针对 24 名骨髓移植患者的研究中,补充谷氨酰胺提高了身体保留氮的能力。然而,并非所有接受骨髓移植的患者都会得到改善。
谷氨酰胺还改善了胃部手术患者的氮潴留。
扩展阅读:
心脏手术通常会对心肌造成称为缺血/再灌注(I/R)的损伤。缺血是由于低氧水平引起的,而再灌注是由于低氧水平后氧气回流。
已经表明,I/R 损伤会导致肌钙蛋白 I、肌酸激酶-MB 和肌红蛋白水平升高。这些蛋白水平升高与死亡率和发病率增加有关。
在一项对 14 名患者的研究中,接受心脏手术的患者在 24 小时和 48 小时时肌钙蛋白 I 和肌酸激酶-MB 水平降低。肌红蛋白仅在 24 小时后降低。因此服用谷氨酰胺的患者减少了心脏损伤和并发症。
扩展阅读:
急性肾损伤可能由脓毒症和肾毒素等损伤以及肾缺血/再灌注损伤引起。谷氨酰胺通过调节肾小管上皮细胞的氧化应激和细胞凋亡,来预防急性肾损伤。
保护作用
谷氨酰胺可显著减轻急性肾损伤程度,改善肾功能,减少肾小管上皮细胞损伤,降低炎症反应。谷氨酰胺主要通过谷氨酰胺γ-谷氨酰转移酶2(Tgm2)和凋亡信号调节激酶(Ask1)这两个靶标来发挥抗凋亡作用。
研究证据
缺血再灌注损伤模型中,谷氨酰胺处理可降低血肌酐和尿素氮水平,改善肾小管损伤评分,提高肾脏血流量。
细胞实验:在体外炎症或缺氧条件下,谷氨酰胺可提高肾小管上皮细胞存活率,改善线粒体功能。
谷氨酰胺给药可减轻 IRI 诱导的 AKI 期间的
肾脏损伤并改善肾功能
doi.org/10.1172/jci.insight.163161.
谷氨酰胺补充可能成为有效的治疗策略,特别适用于缺血再灌注相关的急性肾损伤,可能对危重症患者的肾脏保护有益。
谷氨酰胺是最常见的神经递质 GABA 和谷氨酸的基本前体。研究表明,谷氨酰胺补充剂可以通过影响可利用的 GABA 和谷氨酸的量来影响认知功能。
阿尔茨海默病
阿尔茨海默病是一种严重的神经退行性疾病,全球患病率超过2400万,预计到2040年将翻倍增长。
一项研究采用双样本孟德尔随机化方法,循环谷氨酰胺每增加1个标准差,阿尔茨海默病风险降低17%(OR=0.83,P=0.02),谷氨酰胺可能通过跨越血脑屏障,在压力时期提供更多底物而起到神经保护作用。
动物研究表明,谷氨酰胺代谢改变可能在淀粉样斑形成之前就已发生,通过调节外源性谷氨酰胺可能为预防和治疗阿尔茨海默病提供新思路。
自闭症
一项研究通过对自闭症谱系障碍患者(ASD)及其家庭成员进行大规模代谢组学研究分析 1099 个血浆样本中的 14342 个特征,发现了NLGN1基因变异与血浆谷氨酰胺水平之间存在显著关联。血浆谷氨酰胺水平与自闭症患者的重复性和限制性行为严重程度呈负相关,提示血浆谷氨酰胺可能作为一种内表型,在NLGN1基因致病机制与自闭症表型之间建立联系。这一发现为理解自闭症的遗传学基础及开发潜在治疗靶点提供了新的思路。
扩展阅读:
儿童神经发育异常的脑肠轴视角 – 自闭症早期风险判别和干预新路径
脂肪肝
在美国肝病的主要原因之一是脂肪肝和非酒精性脂肪性肝炎,也是肝移植需求的主要原因之一。患有这种疾病的人还可能有血糖问题、心脏病、代谢综合征和/或肥胖。
最近一项研究的数据表明,服用谷氨酰胺补充剂的小鼠可以避免患上非酒精性脂肪性肝炎。先前的文献表明,谷氨酰胺可能有助于完全预防非酒精性脂肪性肝炎的发展,但需要更多的研究来证实这些发现。
肝损伤
研究发现,抗生素预处理可以通过改变肠道菌群组成和代谢产物,特别是谷氨酰胺和α-酮戊二酸来减轻肝脏肝缺血/再灌注损伤。抗生素处理导致肠道微生物群的多样性降低,但促进了谷氨酰胺的产生。肠源性谷氨酰胺经过分解产生α-酮戊二酸,后者可促进巨噬细胞M2极化。
扩展阅读:
科学家认为免疫细胞,如淋巴细胞、巨噬细胞和中性粒细胞需要谷氨酰胺。这些细胞周围存在谷氨酰胺,使这些白细胞得以生长。
谷氨酰胺在一定程度上增加了全身炎症反应综合征 (SIRS,一种对感染、创伤或烧伤的严重且可能危及生命的炎症反应)患者的 B 和 T 淋巴细胞水平。
在一项针对 30 名 SIRS 患者的研究中,谷氨酰胺补充剂减少了炎症并改善了预后。
在 22 例接受结直肠手术的患者中,补充 L-谷氨酰胺增加了 T 淋巴细胞,T 淋巴细胞是保护身体免受细菌入侵的细胞。
一项纳入 45 例接受骨髓移植患者的研究显示,接受谷氨酰胺补充剂的患者发生较少感染。
我们知道,超过 70% 的免疫系统生活在肠道中。因此,谷氨酰胺补充剂可能会影响自身免疫性疾病(桥本氏甲状腺炎、纤维肌痛和许多其他疾病)。
扩展阅读:
伴随 ICU 患者危重病情的代谢亢进和代谢亢进综合征的发展与谷氨酰胺浓度的降低有关,尤其是在血浆和肌肉中。这个过程可能会持续相当长的时间,并导致许多并发症,甚至致命的结果。
有证据表明,谷氨酰胺可能会防止细菌在重大受伤或手术后从肠道扩散到身体的其他部位。它还可能降低危重患者发生医院获得性感染的风险,尤其是静脉注射时。然而,它可能不会降低该人群的死亡风险。
补充谷氨酰胺→增加热休克蛋白→ ICU 住院时间的减少↓↓ 死亡率↓↓
热休克蛋白(HSP)是一组响应细胞应激而释放的蛋白质,有助于保护其他蛋白质免受损伤或重组已经受损的蛋白质。它们是压力反应不可或缺的一部分,几乎存在于所有生物体中。
在创伤患者中,HSP-70 水平升高与死亡率降低相关。
在一项针对 29 名危重患者的研究中,补充谷氨酰胺使 HSP-70 水平比基线水平增加了 3.7 倍。
在多项研究中,应激动物模型表明,补充谷氨酰胺会增加关键热休克蛋白的水平。然而,完全缺乏适当的人体研究。
此外,HSP-70 增加的幅度与 ICU 住院时间的减少相关。
补充谷氨酰胺→炎症标志物CRP↓↓
谷氨酰胺补充剂对肠内或肠外喂养的危重患者炎症标志物的影响,研究发现,谷氨酰胺补充剂可能对急性情况下的CRP有重要影响,而对急性情况下的IL-6和TNF-α没有显著影响。
一项荟萃分析纳入了 2728 项符合条件的研究,最后招募了10项符合条件的病例对照研究,干预前和干预后CRP水平有统计学意义上的降低(标准化平均差[SMD]= -0.38mg/L;95%CI,-0.72至-0.03)。
与对照组相比,EN/PN 中补充 L-谷氨酰胺与IL-6(SMD = -0.58pg/ml; 95%CI,-2.15至0.99)和TNF-α(SMD = 2.69pg/ml; 95%CI,-9.66至15.03)之间没有显著关联。
手术患者降低死亡率,改善病情
系统评价和荟萃分析选择的不同国家的随机双盲、安慰剂对照试验,大多数报告指出,在手术患者的营养和代谢疗法(NMT)中加入谷氨酰胺二肽可降低感染并发症的频率和严重程度,降低死亡率,减少在 ICU 和一般医院的住院时间,改善反映患者病情的生化参数,并降低治疗费用。因此,进行的系统评价和荟萃分析证实,使用肠外形式的谷氨酰胺二肽(Dipeptiven 20%)作为平衡标准肠外营养的一部分是外科 ICU 患者 NMT 的临床和药物经济学上合理的策略。
扩展阅读:
病毒感染的宿主细胞显著增加谷氨酰胺的利用和代谢,这种代谢变化主要服务于病毒复制的需要,感染细胞对谷氨酰胺的需求明显上升。
谷氨酰胺在病毒复制中的作用
免疫系统相关影响
谷氨酰胺代谢在病毒感染过程中扮演着重要角色,既参与病毒复制又维持免疫功能,这种双重作用使其成为一个复杂但有潜力的治疗靶点。
COVID-19
多项代谢组学研究发现了COVID-19患者体内谷氨酰胺的重要变化:
重症患者的谷氨酰胺水平与多个指标相关:
doi.org/10.3390/ijms24087593
预防和治疗意义:较高的谷氨酰胺水平可以降低COVID-19感染风险以及重症风险。
生物信息学研究显示:在26000多种FDA批准的药物中,谷氨酰胺被认为是最有前景的候选药物之一,可能通过逆转冠状病毒导致的基因表达改变发挥作用,提示恢复患者体内谷氨酰胺水平可能是一个重要的治疗方向。
扩展阅读:
阳康后是否会二次感染,长新冠与肠道菌群的关联,多种潜在的相关干预措施
一些研究表明,谷氨酰胺补充剂可以帮助艾滋病患者。谷氨酰胺可以帮助人们恢复自感染 HIV 以来减轻的体重。谷氨酰胺还可能有助于治疗 HIV 的抗病毒药物更好地发挥作用。
口服谷氨酰胺可能会改善 HIV/AIDS 患者的营养吸收和体重增加。高剂量(每天约 40 克)可能是最有效的。
但研究正在进行中,是否应该推荐谷氨酰胺补充剂有待进一步研究确认。
谷氨酰胺和亮氨酸给药可减轻脓毒症患者的肌肉萎缩。
一项研究发现,谷氨酰胺和/或亮氨酸给药可减少脓毒症诱导的肌肉退化并促进生肌基因表达。单独使用亮氨酸治疗对脓毒症期间维持肌肉质量的影响更为明显。谷氨酰胺和亮氨酸的组合未能显示出缓解脓毒症诱导的肌肉萎缩的协同作用。
在镰状细胞病中,红细胞会变得坚硬和粘稠。它们也会改变形状,看起来像一把镰刀。发生这种情况时,血管会阻塞,阻塞血液流动,更容易受到感染、贫血和其他严重并发症。
谷氨酰胺补充剂有助于减少红细胞损伤,防止变得粘稠和畸形。这有助于血液正常流动。
唯一获得 FDA 批准的谷氨酰胺疗法是针对所有年龄段的镰状细胞病患者,基于一项 III 期临床试验,其中 L-谷氨酰胺耐受性良好,减轻了疼痛危象。
特发性肺纤维化
特发性肺纤维化病因不明,治疗效果有限,预后不良,其特征是持续性急性肺损伤,随后出现瘢痕形成和终末期肺病。多种形式肺损伤,包括体液自身免疫、内皮功能障碍、肉芽肿形成或肺泡巨噬细胞活化,都可能导致纤维化表型的进展。
特发性肺纤维化患者AT2细胞中负责谷氨酰胺分解代谢的催化酶表达下调,导致谷氨酰胺积累无法被利用,影响肺泡上皮的修复和再生。
谷氨酰胺代谢是肺泡上皮再生所必需的,通过影响AT2细胞的增殖和分化发挥作用,与肺泡上皮的能量供应密切相关。
急性呼吸窘迫综合征
谷氨酰胺治疗可以减轻炎症,降低内毒素的释放,具有保护作用。
谷氨酰胺可能成为肺部疾病的治疗靶点,有助于上皮修复和再生,可能改善预后。
研究人员研究了谷氨酰胺是否可以提高运动表现。一些研究表明,谷氨酰胺可以减少高强度运动后的肌肉酸痛,并降低生病的风险,对减肥有显著影响。尽管如此,没有足够的证据表明服用谷氨酰胺始终提供这些好处。研究不支持谷氨酰胺可以帮助运动员增加肌肉质量的观点。
系统评价共纳入 47 项研究,其中 25 项试验符合荟萃分析的纳入标准。根据荟萃分析,谷氨酰胺对减肥有显著影响(WMD = -1.36 [95% CI:-2.55 至 -0.16],p = 0.02)。此外,摄入大于 200 mg/kg 体重的谷氨酰胺后,中性粒细胞数量减少(WMD = -605.77 [95% CI:-1200.0 至 52.1];P = 0.03)。此外,补充谷氨酰胺二肽导致运动后血糖升高(WMD = 0.51 [95% CI:0.18,0.83] mmol/l;P = 0.002)。
一个例外是在极限耐力运动中,例如马拉松训练。补充谷氨酰胺(马拉松比赛后立即服用5克,后2小时服用)可显著降低下周患感冒的几率。

这些积极作用都为谷氨酰胺在临床应用中的广泛价值提供了依据。那么如何补充谷氨酰胺,以及在补充过程中需要注意哪些事项,我们来看下一章节。
首先,谷氨酰胺可以通过饮食来获取。富含蛋白质的肉类、鱼类、蛋类、乳制品以及一些谷物和蔬菜都是良好的天然来源。
详细来说:
◖动物蛋白质:
◖植物蛋白:
◖蔬菜:
◖坚果和种子:
◖谷物:
◖发酵食品:
为了最大限度地增加谷氨酰胺的摄入量,请考虑结合不同的食物来源。举例来说:

谷氨酰胺补充剂并非所有人都需要,健康人一般无需补充。对于一些特定疾病或情况下需要补充谷氨酰胺的患者,也可以选择谷氨酰胺补充剂,包括片剂、粉末和胶囊等剂型。
谷氨酰胺的最佳形式是粉末形式;
胶囊形式通常含有不需要的添加剂,如服用谷氨酰胺胶囊,则必须大量服用才能达到有益剂量。
避免购买带有蛋白粉的谷氨酰胺,因为某些氨基酸会与谷氨酰胺竞争吸收。
购买时,质量应该是需要考虑的重要因素:
通常谷氨酰胺的剂量,每天两次,每次2-5克。
每天高达20-30克剂量在短期内是安全使用的。
有研究认为:
谷氨酰胺如果将其与水混合并空腹慢慢啜饮,效果最好。
在临床研究中,谷氨酰胺的剂量通常从每天几克到几十克不等。具体剂量应取决于医疗状况、患者体重和医生规定的治疗要求。请始终遵循医生的剂量说明。
谷氨酰胺补充剂的临床证据探索
谷氨酰胺补充剂的最佳递送方法、浓度和化学稳定性的临床证据仍然是一个持续探索的领域;治疗效果会受到溶解度和吸收等因素的影响。
谷氨酰胺的补充挑战
谷氨酰胺溶解度低(25 g/L);因此,局部、口服和肠内补充需要混悬液;添加双糖可以促进粘膜摄取。控制谷氨酰胺水平具有挑战性,因为谷氨酰胺在体内含量丰富,因为研究表明,即使在反复高剂量补充后,血浆谷氨酰胺水平的变化也很小。此外,监测局部谷氨酰胺浓度可能很困难,因为一般来说,血浆浓度和组织浓度之间的相关性很差。
此外,无论是口服、静脉注射还是局部给药,谷氨酰胺补充剂的生物利用度和有效性可能会有所不同。确定补充剂的最佳剂量和持续时间并确定获得最大益处的患者群体是完善谷氨酰胺补充剂在癌症治疗中临床应用的关键考虑因素。
谷氨酰胺二肽的应用前景
已经探索了通过游离和二肽形式递送谷氨酰胺,重点关注谷氨酰胺二肽的功效。谷氨酰胺二肽,特别是 l-丙氨酰-l-谷氨酰胺(Ala-Gln),已显示出减少危重患者感染并发症、住院时间和死亡率的功效,临床和实验研究支持。 游离谷氨酰胺和谷氨酰胺二肽之间的选择取决于患者的分解代谢情况和给药途径。
因此,在决定谷氨酰胺补充剂的途径、剂量和形式时,考虑患者的具体因素至关重要。
常见副作用包括:
更严重副作用包括:
头晕、昏厥、小便时疼痛、小便比平时多或小便突然减少、下背部或侧面疼痛、心跳加速、呼吸困难、面部、嘴唇或舌头肿胀等。
长期副作用包括:
高摄入量可能会改变身体使用氨基酸的方式,包括谷氨酰胺本身。这种变化的长期影响尚不清楚,但它可能会增加健康问题的风险。
例如,服用谷氨酰胺补充剂可能在短期内支持免疫系统,但其对免疫系统的长期影响仍然未知。一些证据表明,它可能以增加代谢综合征、糖尿病和冠状动脉疾病风险的方式影响新陈代谢。
对于患有消化系统疾病、进行剧烈运动、感染疾病、接受癌症治疗(包括放疗和化疗)、患有免疫疾病、慢性胃肠道疾病的人群,可能需要额外补充谷氨酰胺。
以下情况需遵医嘱:
没有足够的证据证实谷氨酰胺对孕妇或哺乳期女性是安全的。尽量遵医嘱。
L-谷氨酰胺可以降低血糖水平。谷氨酰胺可能可以改变一些糖尿病患者所需的药物量。如果您服用胰岛素,请务必在服用 L-谷氨酰胺补充剂之前咨询医生。
关于它在癌症患者中的使用存在一些争议。一些研究表明它有助于癌症的恢复,其他研究表明它可能会为癌细胞提供燃料。虽然人们担心谷氨酰胺对肿瘤生长的影响,但接受放化疗的患者每天摄入 10 – 30g 谷氨酰胺不会显著影响肿瘤大小或癌症相关临床结果,证明了摄入谷氨酰胺的安全性。癌症患者需更多了解结合实际情况和医生建议。
一些研究表明谷氨酰胺可能对肾病患者构成风险。老年人的肾功能通常下降,可能需要服用较低剂量的谷氨酰胺。
但也有一项研究发现,补充谷氨酰胺有助于改善肾功能,它甚至可以减少与心脏手术相关的肾损伤。因此还需要更多的研究。
如果患有瑞氏综合征,则应避免服用谷氨酰胺补充剂。
就药物相互作用而言,一些人认为谷氨酰胺可以降低乳果糖的降氨作用。这意味着,肝硬化和肝性脑病患者在服用 L-谷氨酰胺之前应该咨询医生,并且尽可能希望避免它。
摄入足够的 B 族维生素是有意义的,尤其是维生素B12,因为它们有助于身体代谢和使用谷氨酰胺等氨基酸。
总的来说,谷氨酰胺具有这些作用:
◆ 谷氨酰胺是胃肠道细胞的“食物”
谷氨酰胺是胃肠道管腔细胞的基本能量来源,以维持肠道粘膜结构的完整性。当我们处于某些疾病或应激状态时,谷氨酰胺被大量消耗,肠道粘膜处于“饥饿”状态,肠道粘膜萎缩、绒毛变稀、变短甚至脱落,导致肠道粘膜免疫屏障受损,通透性增加,细菌及内毒素趁机侵占肠道,发生细菌易位及菌血症。
谷氨酰胺还在癌症治疗期间发挥益处,如减轻胃肠道毒性、改善营养状况和生活质量等。
◆ 促进蛋白质的合成
谷氨酰胺是身体中氨和氮元素营养来源的一种直接关键物质,是合成氨基酸、蛋白质、核酸的前体物质。
◆ 抑制高分解代谢,防止肌肉分解
及时适量地补充谷氨酰胺能有效地防止肌肉蛋白的分解,并可通过细胞的水合作用,增加细胞的体积,促进肌肉增长。
◆ 免疫系统的重要燃料,增强免疫系统功能
谷氨酰胺具有重要的免疫调节作用,它是淋巴细胞分泌、增殖及其功能维持所必需的。
未来,需要进一步探索谷氨酰胺补充在不同人群和疾病中的最佳剂量、给药途径及持续时间,以制定更加合理的补充指南。同时,也应关注谷氨酰胺二肽等新型制剂的应用前景,它们可能具有更佳的溶解度和生物利用度。通过深入研究谷氨酰胺在肠道健康维护和疾病治疗中的作用机制,以及结合肠道菌群检测等手段,能够更好地发挥其的临床应用价值。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Ortiz-Reyes, Luis MSc1; Lee, Zheng-Yii PhD2; et al., The Efficacy of Glutamine Supplementation in Severe Adult Burn Patients: A Systematic Review With Trial Sequential Meta-Analysis. Critical Care Medicine 51(8):p 1086-1095, August 2023.
Tang G, Huang W, Zhang L, Wei Z. Role of Glutamine in the Management of Oral Mucositis in Patients with Cancer: A Meta-Analysis of Randomized Controlled Trials. Nutr Cancer. 2022;74(2):482-495.
Arribas-López E, Zand N, Ojo O, Snowden MJ, Kochhar T. The Effect of Amino Acids on Wound Healing: A Systematic Review and Meta-Analysis on Arginine and Glutamine. Nutrients. 2021 Jul 22;13(8):2498.
Hou YC, Wu JM, Chen KY, Wu MH, Yang PJ, Lee PC, Chen PD, Yeh SL, Lin MT. Glutamine and leucine administration attenuates muscle atrophy in sepsis. Life Sci. 2023 Feb 1;314:121327.
Petrus P, Lecoutre S, Dollet L, Wiel C, Sulen A, Gao H, Tavira B, Laurencikiene J, Rooyackers O, Checa A, Douagi I, Wheelock CE, Arner P, McCarthy M, Bergo MO, Edgar L, Choudhury RP, Aouadi M, Krook A, Rydén M. Glutamine Links Obesity to Inflammation in Human White Adipose Tissue. Cell Metab. 2020 Feb 4;31(2):375-390.e11.
Ramezani Ahmadi A, Rayyani E, Bahreini M, Mansoori A. The effect of glutamine supplementation on athletic performance, body composition, and immune function: A systematic review and a meta-analysis of clinical trials. Clin Nutr. 2019 Jun;38(3):1076-1091.
Bornstein R, Mulholland MT, Sedensky M, Morgan P, Johnson SC. Glutamine metabolism in diseases associated with mitochondrial dysfunction. Mol Cell Neurosci. 2023 Sep;126:103887.
Thomas K, Zondler L, Ludwig N, Kardell M, Lüneburg C, et al.,Glutamine prevents acute kidney injury by modulating oxidative stress and apoptosis in tubular epithelial cells. JCI Insight. 2022 Nov 8;7(21):e163161.
Corrado M, Frezza C. Glutamine availability unleashes dendritic cells’ anti-tumor power. Cell Chem Biol. 2023 Sep 21;30(9):1012-1014.
Hirabara SM, Gorjao R, Levada-Pires AC, Masi LN, et al., Host cell glutamine metabolism as a potential antiviral target. Clin Sci (Lond). 2021 Jan 29;135(2):305-325
Gong ZY, Yuan ZQ, Dong ZW, Peng YZ. Glutamine with probiotics attenuates intestinal inflammation and oxidative stress in a rat burn injury model through altered iNOS gene aberrant methylation. Am J Transl Res. 2017 May 15;9(5):2535-2547.
Gholamalizadeh M, Tabrizi R, Rezaei S, Badeli M, Shadnoush M, Jarrahi AM, Doaei S. Effect of glutamine supplementation on inflammatory markers in critically ill patients supported with enteral or parenteral feeding. JPEN J Parenter Enteral Nutr. 2022 Jan;46(1):61-68.
Dmitriev AV, Machulina IA, Shestopalov AE. Glutamin kak komponent nutritivno-metabolicheskoi terapii patsientov khirurgicheskogo profilya v usloviyakh ORIT [Glutamine as a component of nutritional and metabolic therapy for surgical patients in ICU]. Khirurgiia (Mosk). 2021;(8):98-106. Russian.
Lee IH, Walker DI, Lin Y, Smith MR, Mandl KD, Jones DP, Kong SW. Association between Neuroligin-1 polymorphism and plasma glutamine levels in individuals with autism spectrum disorder. EBioMedicine. 2023 Sep;95:104746.
Tao W, Xu G, Zhou J, Luo Y, Li PS. Glutamine Supplementation on Burn Patients: A Systematic Review and Meta-analysis. J Burn Care Res. 2024 May 6;45(3):675-684.