-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

随着一日三餐米面肉蛋菜等一些列食物的食用,数百种化学成分会进入我们的消化道。在那里,它们被肠道微生物组进一步代谢,这是数千种微生物物种的独特集合。
因此,肠道微生物组在决定营养如何影响健康方面发挥着重要作用。然而到目前为止,微生物组中的许多微生物的代谢能力仍然是未知的。这意味着我们不知道它们以什么物质为食,以及它们是如何处理这些物质的。
近期,来自普林斯顿大学的研究人员在《CELL》期刊上发表了最新的文章:
“Gut bacterial nutrient preferences quantified in vivo”,研究人员使用同位素追踪定量研究了小鼠肠道微生物群的输入和输出。
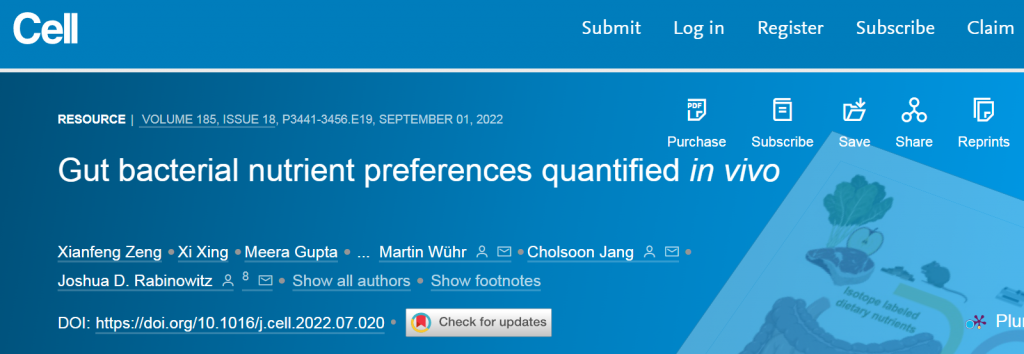

微生物碳水化合物发酵的主要输入是膳食纤维,支链脂肪酸和芳香代谢物的主要输入为膳食蛋白质。此外,循环宿主乳酸、3-羟基丁酸和尿素(但不是葡萄糖或氨基酸)为肠道微生物群提供食物。
肠道菌群拥有巨大的酶多样性,超过哺乳动物基因组的数量100多倍。这些酶的能力能使摄入的膳食营养物质加工成一些列微生物代谢物。
为了复制自身和释放代谢产物,肠道细菌需要营养输入。这些形式包括摄入的食物、宿主合成的肠道粘液和宿主循环代谢物。
//
在本文中,研究人员通过对肠道菌群及其进入宿主循环系统的代谢物进行了大规模的定量评估。
研究了膳食淀粉、纤维和蛋白质的贡献以及宿主粘液的贡献,也研究了大多数主要的循环宿主营养素,发现乳酸、3-羟基丁酸和尿素在从宿主传递到肠道微生物群中表现突出。基于对细菌特异性肽序列的测量,评估了不同细菌属的营养偏好,并表明这些偏好与响应改变饮食的微生物组分变化一致。
同位素追踪能够定量测量代谢物和生物量的输入。与质谱检测相结合的稳定同位素示踪剂,使得能够测量特定下游产物的标记。通过注入氮标记的苏氨酸来标记宿主粘液,研究人员能够比较饮食和粘液蛋白对肠道微生物群的贡献,并观察到喂食低蛋白饮食的小鼠中粘液贡献的变化。
从小鼠尾部静脉抽取血样;
使用注射器从小鼠膀胱采集尿液;
所有血清样品在没有抗凝剂的情况下置于冰上 15 分钟,并在 4°C 下以 16,000 x g 离心 15 分钟。
用预冷的Wollenberger钳在液氮中快速分离并快速冷冻(< 5秒)获得组织;夹紧前取出肠内容物;盲肠内容物取样时,先将小鼠盲肠取出并在表面切开,然后用镊子将盲肠内容物挤出。
取新鲜粪便,轻揉小鼠腹部诱导排便。将血清、组织和粪便样本保存在 -80 ºC 直至进一步分析。
为了测定血清和组织样本中的代谢物浓度,进行了同位素标配(isotope spike-in)或标准标配(standard spike-in )。
对于前者将已知浓度的同位素标记标准品加入血清或组织提取液中,通过标记与未标记代谢物的比值计算浓度。
当没有同位素标准品时,加入连续稀释的非标记标准品,测量的总离子计数与加入的标准品浓度之间产生线性拟合。然后通过拟合线的x截距确定内源代谢物的浓度;蛋白质氨基酸组成采用酸水解法测定。
首先,使用13C同位素标记的不同营养物质,通过口服管饲法对小鼠进行灌胃采集小鼠的血清、组织和粪便样本。对粪便和肠内容物进行16S rRNA测序获得细菌分类。
首先使用代谢组学方法测定盲肠内容物中游离氨基酸13C-或15N标记。
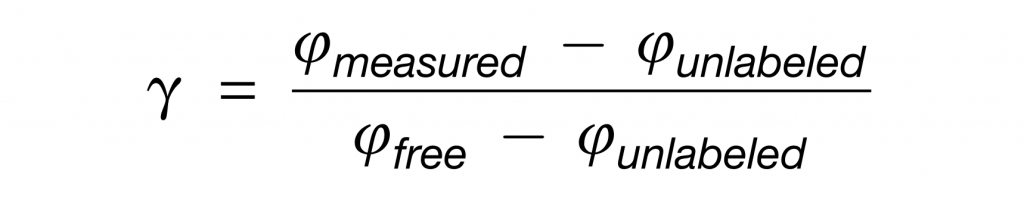
然后,对于每个肽,模拟了未标记(Iunlabeled)和由游离盲肠氨基酸(Ifree)合成的肽的同位素包膜模式。标量γ可以通过将测量的肽同位素分布(Imeasured)与Iunlabeled和Ifree的线性组合拟合来确定。
注意,当一个菌属使用的特定营养素超过该营养素对盲肠游离氨基酸的贡献时,γ将大于1。
具体来说,测量的每个肽的γ如下:

对于细菌属水平的原料贡献程度的测量,分析中只保留测量超过3个肽的属,多肽的中位数为γ-genus。
对于细菌科水平,仅分析在蛋白质组学中始终检测到的属,以及在 16S rRNA 基因扩增子测序中检测到 (> 0.5%) 的属的上一级科。
每种营养物质对菌属的贡献程度的定量公式如下:
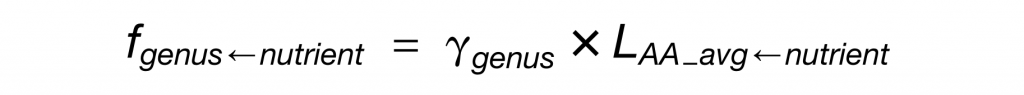

LAA_avg-nutrient为各营养物质对细菌蛋白质的贡献程度,其计算公式如下:
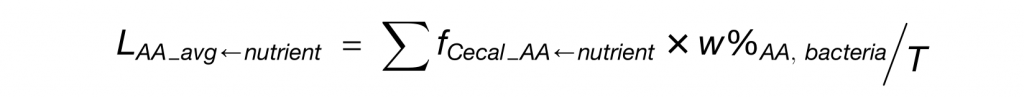

1 微生物组消耗较少的可消化膳食成分
微生物群影响宿主生理学的主要机制是通过分泌代谢产物。研究人员在门静脉和体循环以及盲肠内容物中测量了微生物衍生的50多种代谢产物的绝对浓度。
微生物群相关代谢物的绝对浓度和来源
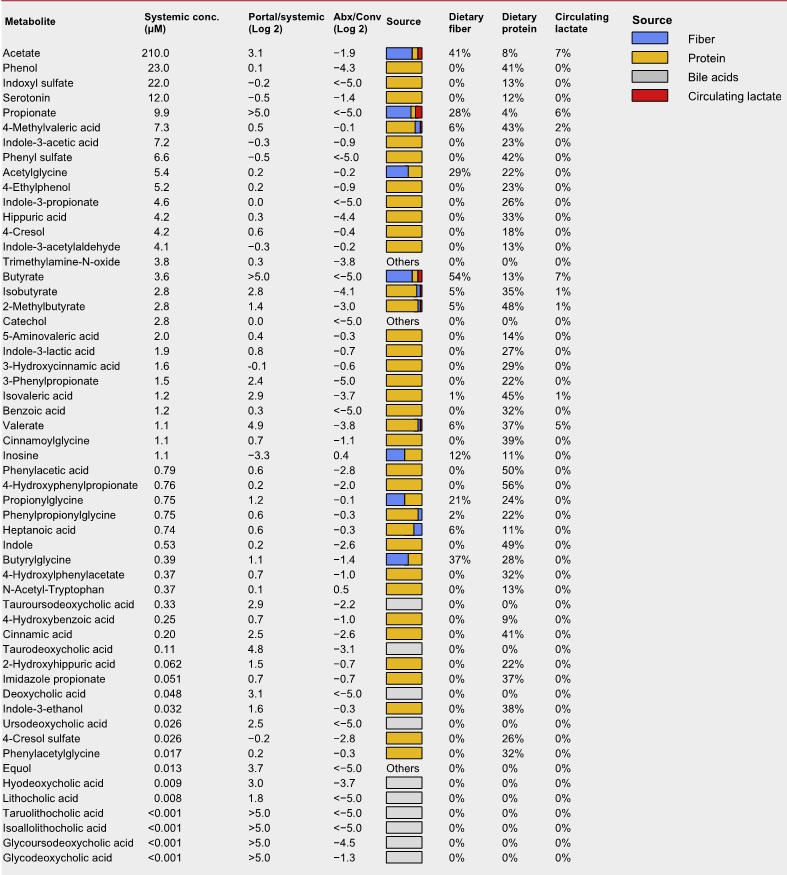
上表可以看到,与全身血液相比,大多数在门静脉循环中升高,除两种(肌苷和N-乙酰色氨酸主要来源于宿主)外,其余均被抗生素治疗耗尽。
门静脉血中主要排泄产物是短链脂肪酸。
其他相对丰富的微生物群产物是芳香族氨基酸发酵产物(苯酚、吲哚硫酸盐和3-苯丙酸盐)和支链脂肪酸(戊酸盐、异戊酸盐,4-甲基戊酸、异丁酸盐和2-甲基丁酸盐)。
探索肠道微生物产物的膳食输入:淀粉、菊粉
研究人员通过口服管饲法、淀粉(易消化葡萄糖聚合物)和菊粉(易消化果糖聚合物,即可溶性纤维)喂养小鼠:
13C淀粉灌胃后,标记的葡萄糖、乳酸和丙氨酸迅速出现在门脉循环中,并占大多数淀粉碳(约75%)。
13C菊粉和13C淀粉有什么不同?
13C菊粉灌胃后,没有观察到大量标记的果糖、葡萄糖、乳酸和丙氨酸,取而代之的是标记的门静脉代谢产物以短链脂肪酸的形式缓慢出现,约40%的菊粉碳成为短链脂肪酸,其余未消化并随粪便排出。
膳食菊粉,而不是淀粉,在盲肠内容物中广泛标记糖酵解和TCA中间体和氨基酸。
藻类蛋白大量标记了微生物群衍生的门静脉代谢物:短链脂肪酸、支链脂肪酸和芳烃(吲哚、吲哚-3-丙酸盐和3-苯丙酸盐)。
“难以消化的碳水化合物和蛋白质直接为微生物组提供营养,并通过微生物产物间接为宿主提供营养。”
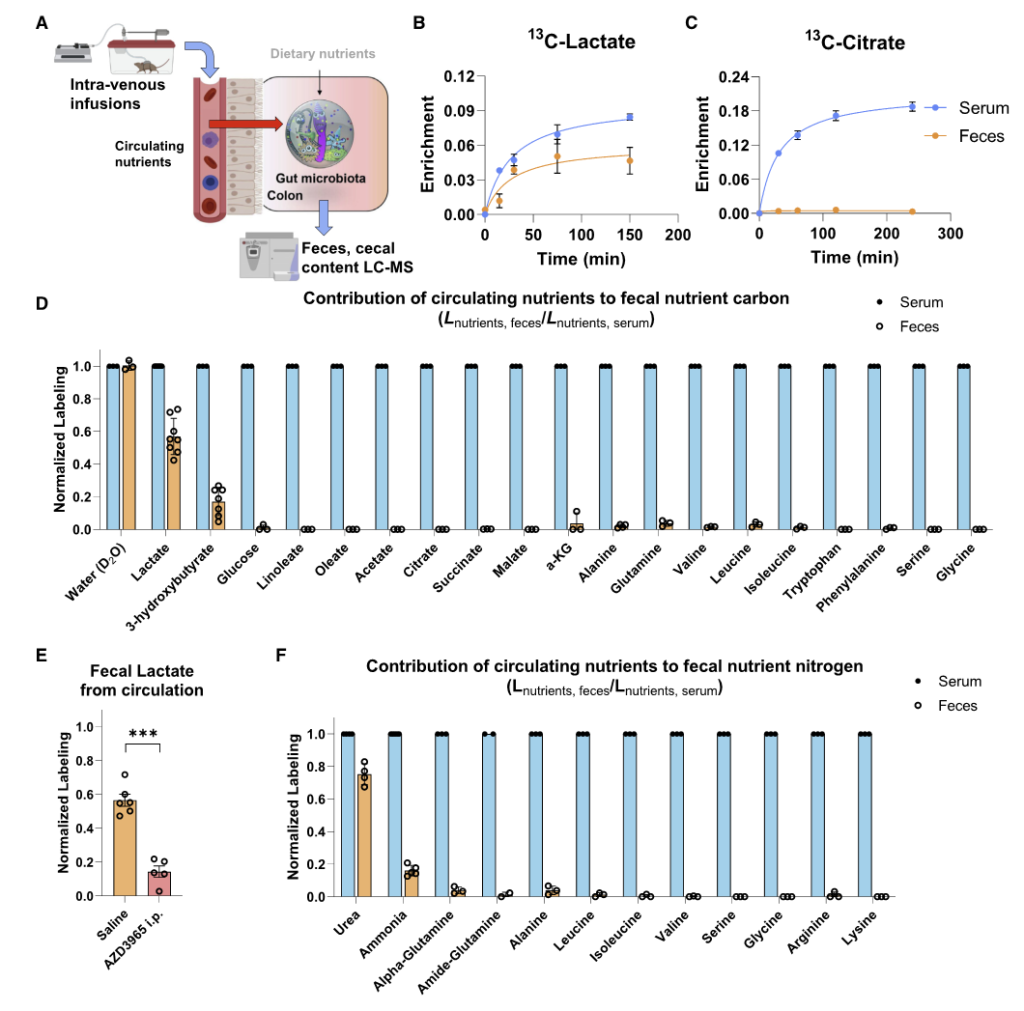
研究中发现宿主循环系统中的乳酸,3-羟基丁酸以及尿素能为肠道细菌提供营养。
如图A,将同位素标记的营养物质通过静脉输注到小鼠的全身血液循环中。 2.5 小时后收集血清和粪便以量化每种营养物质对相应菌群代谢物的碳贡献。
图BCD表示了13C标记的各种营养物质在小鼠的血液和粪便中的含量,可见乳酸和 3-羟基丁酸有进入肠道菌群中,而其余大部分营养物质如柠檬酸盐、葡萄糖、氨基酸等都没有进入到肠道菌群中。
图F为15N标记的营养物质,可见尿素也同样被菌群大量利用。
为了定量确定微生物代谢物的来源,研究人员给小鼠喂食部分纤维、脂肪或蛋白质13C标记的标准食物,盲肠标记在12小时内达到稳定状态。
为了说明循环营养输入,研究人员还注入了13C乳酸或3-羟基丁酸。
这些研究确定了大多数微生物群中心代谢物中的碳供给:
接下来,研究人员检查了微生物组游离氨基酸的输入,并用15N标记的膳食蛋白和注入的尿素进行追踪。
与哺乳动物不同,大多数肠道细菌具有合成所有20种蛋白质氨基酸的生物合成能力。
然而,研究人员观察到“必需氨基酸”主要来源于膳食蛋白质,哺乳动物无法制造,需要在细菌中表达广泛的生物合成途径。
“非必需氨基酸”主要在肠道微生物群中合成,使用膳食菊粉和循环乳酸作为碳源。
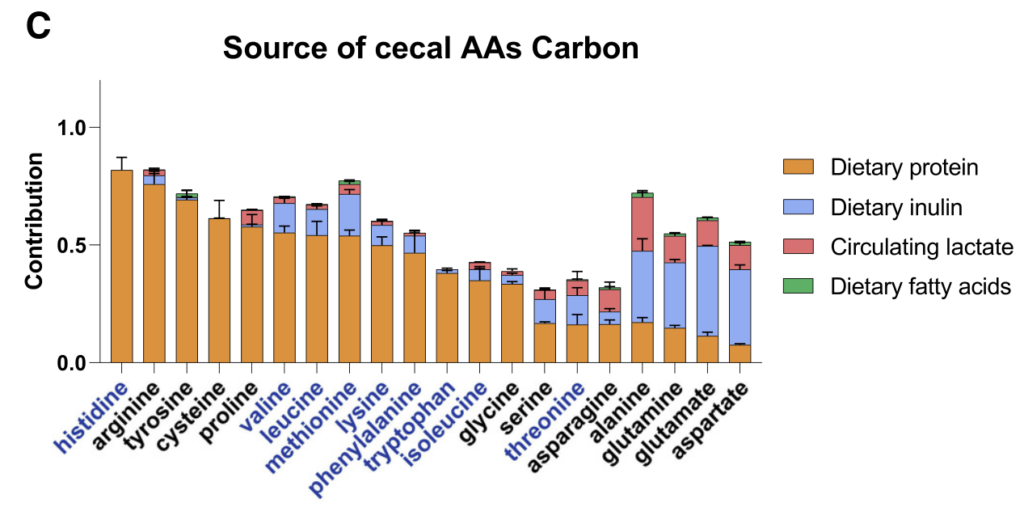
抗生素或无菌小鼠中的微生物群消耗有利于盲肠中氨基酸的积累(基于同位素追踪研究),这些氨基酸主要来自膳食蛋白质和微生物合成的氨基酸的消耗。
膳食蛋白质是必需氨基酸和非必需氨基酸的主要氮源,宿主尿素对非必需氨基酸也有很大贡献。
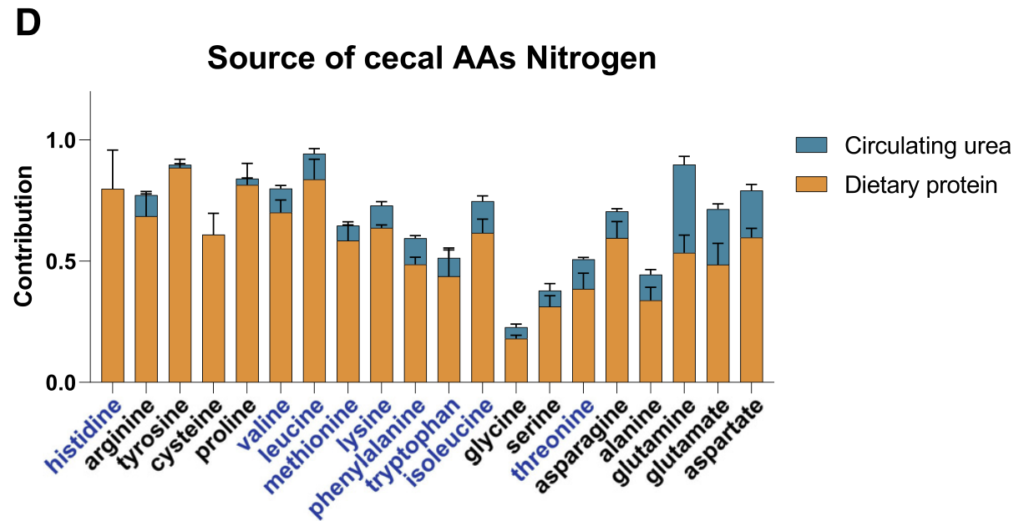
研究人员的发现如下:
【1】必需氨基酸,尽管能够由微生物群合成,但主要来自饮食,不经历任何碳重排;
【2】与TCA连接最紧密的非必需氨基酸基本上由微生物群合成,使用来自纤维的碳,通过中心代谢反应与其他碳争夺;
【3】转氨反应部分地将来自饮食衍生氨基酸的氮与来自宿主尿素的氮混合。
研究人员发现,许多微生物来源的代谢物来源于到达结肠的未吸收膳食蛋白。假设这些代谢物的循环水平将取决于膳食蛋白质到达结肠微生物群的程度。
为了控制这一点,研究人员给小鼠喂食的食物中,一部分蛋白质(酪蛋白,部分到达结肠微生物群)被游离氨基酸(基本上在小肠中完全吸收)取代。
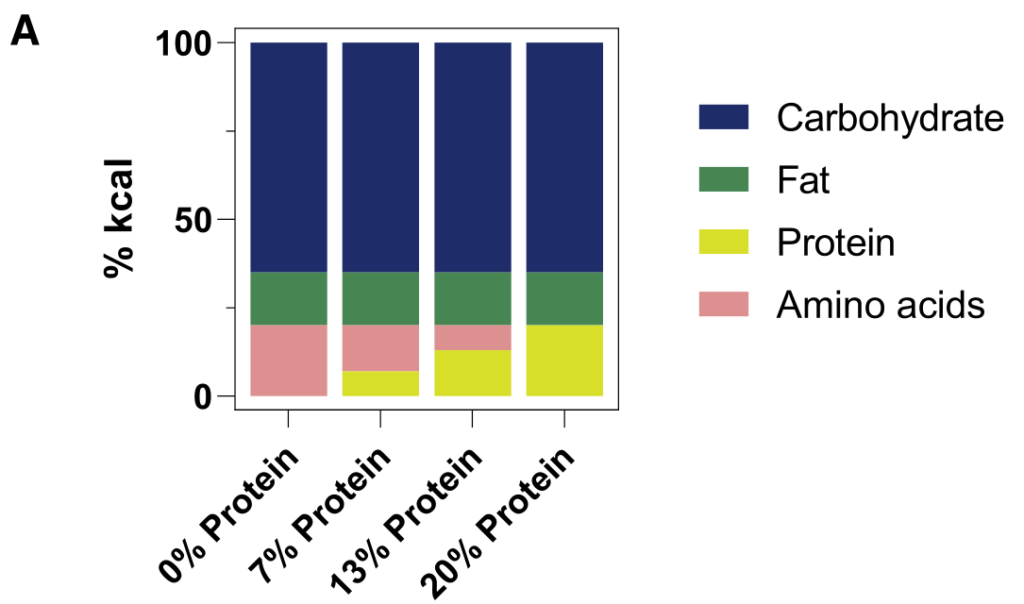
2周后对全身血液进行代谢组学研究。含有较少完整蛋白质和更多游离氨基酸的饮食往往会增加循环氨基酸水平。
重要的是,蛋白质衍生的循环微生物代谢物(酚类、吲哚类和酰基甘氨酸)串联下降。
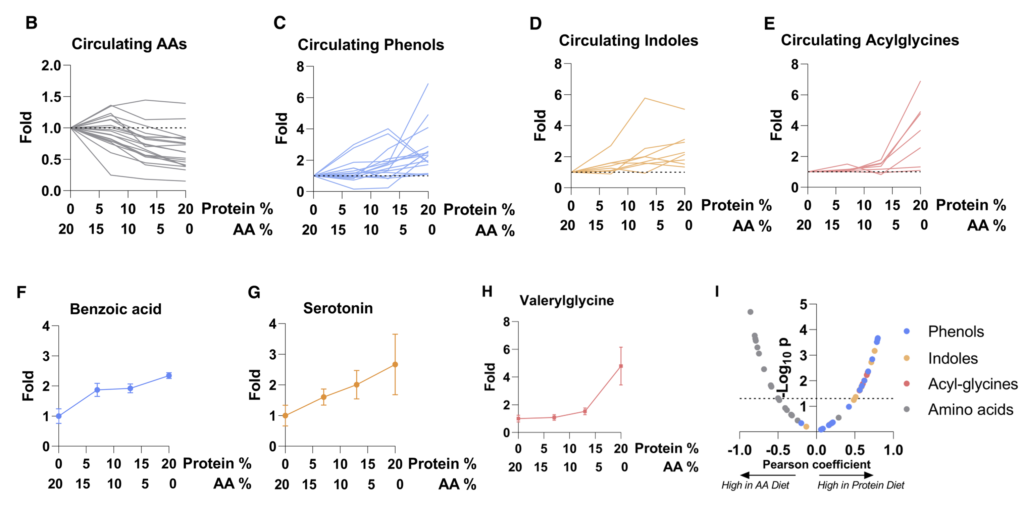
“微生物代谢物营养来源的知识可用于操纵其系统水平。”
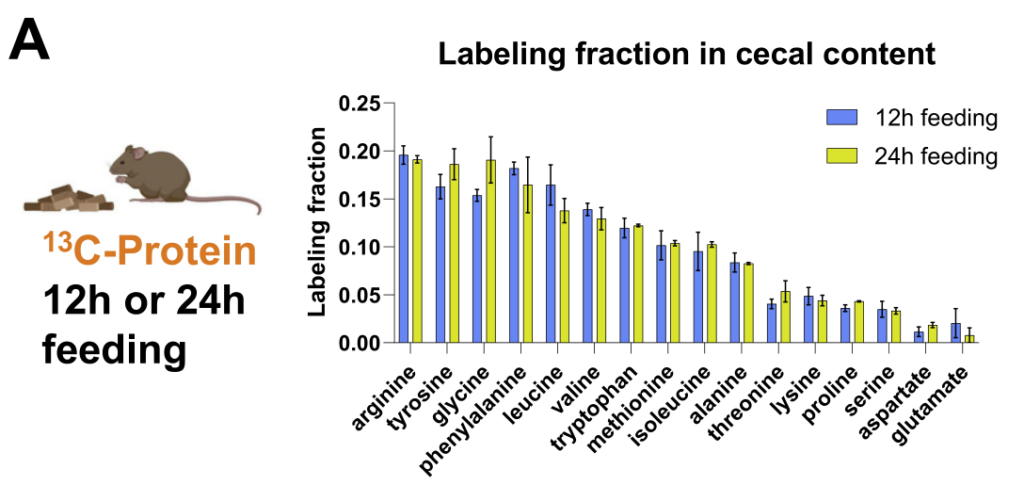
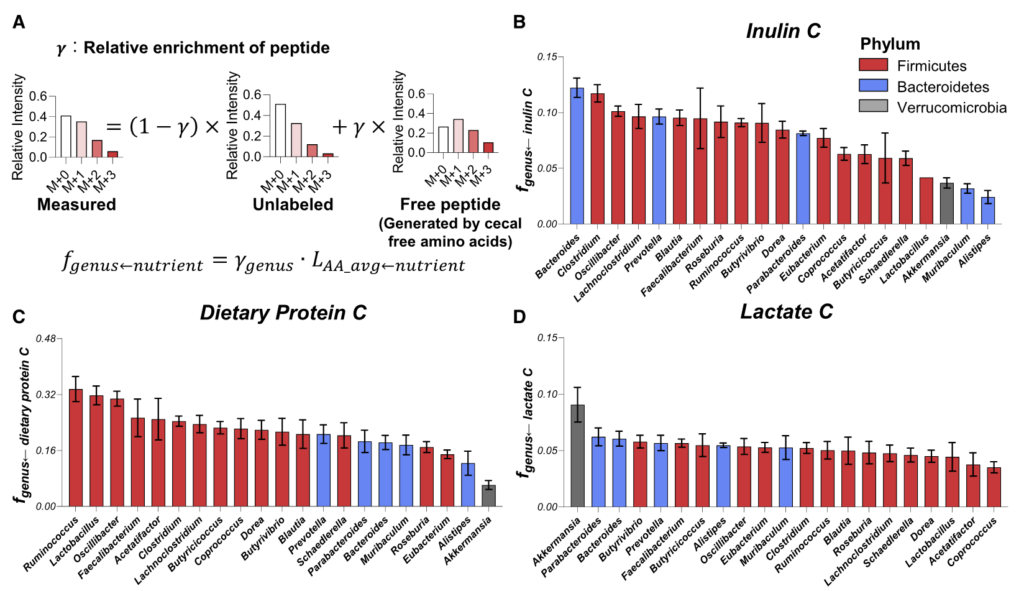
研究人员通过结合13C营养标记和蛋白质组学来定量不同微生物的碳原料。
每种13C标记的营养素(膳食菊粉、膳食藻蛋白或循环乳酸)提供24小时,这足以在肠道细菌中实现稳态标记。
如同B-D,分别计算了在膳食中使用的菊粉和蛋白质以及乳酸在各细菌内的喜好程度,这个喜好程度也就是将在细菌特异性肽上被同位素标记的程度进行了量化。
结果可见:
拟杆菌属和梭状芽胞杆菌利用菊粉的程度是 Akkermansia、Muribaculum 或 Alistipes 的 4 倍多。
总体而言,厚壁菌门下的菌属比拟杆菌门的使用膳食中的蛋白质(厚壁菌0.237±0.052;拟杆菌0.175±0.031,p=0.02)。
Akkermansia通常被认为是一种促进健康的肠道微生物,使用的菊粉和蛋白质最少。相比之下,它使用了来自宿主的循环乳酸最多。
为了知晓这些细菌的营养偏好是否能预测饮食变化后的肠道菌群的组成变化。研究人员给小鼠喂食富含菊粉或藻类蛋白的饮食 2 天,并通过 16S rRNA 测序测量微生物组的组成。
结果如图F和I:
利用最多菊粉的拟杆菌属在高菊粉饮食后增加了4倍;
另一种利用较多菊粉的梭状芽胞杆菌也增加了2倍;
利用较少菊粉的菌属要么没有变化,要么略有下降;
富含藻类蛋白饮食的实验结果同理。
图G和J计算了这两种营养物与对其利用程度最高的前两名菌属相对丰度的相关性,p<0.05呈显著相关。
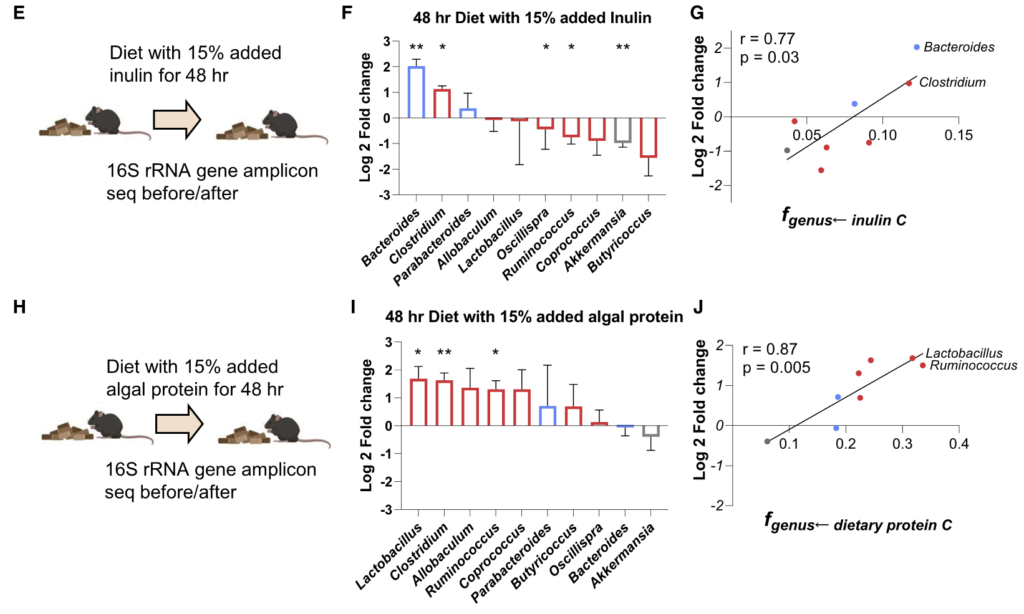
“不同肠道细菌的营养偏好有助于解释饮食操作后微生物组分的变化。”
最后,研究人员转向不同肠道细菌的氮源偏好,比较15N标记的膳食蛋白喂养和15N尿素输注。
高度利用膳食蛋白质中碳的细菌属也高度利用膳食蛋白中的氮,这与细菌蛋白质组中完整吸收的膳食蛋白质中的氨基酸一致。
厚壁菌喜欢从膳食蛋白质获取氮
在厚壁菌门成员中,偏好尿素氮的属往往是菊粉的疯狂使用者,即使用菊粉和尿素合成自己的氨基酸。这包括一些脲酶阴性菌属,它们可能通过交叉喂养获得尿素氮。
此外,在厚壁菌中也看到了一些属更喜欢从膳食蛋白质中获得氮,而其他属更喜欢循环尿素。
静脉注射尿素以提高循环尿素浓度后,偏好尿素的厚壁菌以及阿克曼菌的丰度大幅增加。
拟杆菌喜欢从宿主分泌的蛋白质中获取氮
与厚壁菌相比,拟杆菌对膳食蛋白质和循环尿素氮的利用率较低,这提出了一个关键问题:
拟杆菌如何获得氮?
肠道微生物群的一些成员(如拟杆菌和阿克曼菌)能够消化宿主分泌的蛋白质,如粘蛋白。
假设宿主分泌的蛋白质是拟杆菌氮的关键来源。为了探索这种可能性,研究人员进行了长期15N标记的赖氨酸和精氨酸输注(12、18和36小时),以标记结肠中的宿主蛋白。
尽管没有直接给微生物组喂食,但在36小时输注后,赖氨酸和精氨酸确实起作用,这与通过宿主蛋白进行的标记一致。这种标记优先发生在拟杆菌和阿克曼菌中。
膳食和分泌宿主蛋白的氮贡献呈负相关,与某些肠道细菌优先消耗膳食蛋白和其他宿主蛋白一致。
“膳食蛋白质和循环尿素是厚壁菌的主要氮原料,而分泌的宿主蛋白质为拟杆菌提供氮。”
研究人员开发了定量同位素追踪方法来测量肠道细菌的营养偏好。除了膳食纤维和分泌的宿主蛋白外,还将膳食蛋白和循环宿主乳酸、3-羟基丁酸和尿素确定为喂养肠道细菌的重要营养素。排除了其他循环宿主营养素(如葡萄糖和氨基酸)对结肠微生物群的直接贡献。
一项关键技术成就是能够从不同碳源和氮源追踪到细菌特异性肽,从而揭示复杂和竞争性肠腔环境中不同细菌的营养偏好。
厚壁菌门倾向于从膳食蛋白质获得氨基酸,而拟杆菌门更多地依赖宿主分泌蛋白。同样,一些厚壁菌门(如梭菌属)大量利用纤维(菊粉),而其他厚壁菌门则不利用纤维。
动物饮食干预实验发现,拟杆菌属和梭菌属是转化纤维最活跃的菌属。宿主循环代谢物水平也可能影响微生物组的营养获取和最终组成。
本文提供了关于哪些营养素喂养肠道微生物群以及哪些细菌更喜欢哪些营养素的基础知识。
文中所开发的方法具有广泛的应用前景,最终将有助于全面和定量地了解饮食-微生物-健康的关系。
参考文献:Zeng X, Xing X, Gupta M, Keber FC, Lopez JG, Lee YJ, Roichman A, Wang L, Neinast MD, Donia MS, Wühr M, Jang C, Rabinowitz JD. Gut bacterial nutrient preferences quantified in vivo. Cell. 2022 Sep 1;185(18):3441-3456.e19. doi: 10.1016/j.cell.2022.07.020. PMID: 36055202; PMCID: PMC9450212.
谷禾健康
儿童呼吸系统疾病,包括呼吸道感染、反复喘息和哮喘,是儿童及其以后年龄发病和死亡的重要原因。
而哮喘是其中比较典型的一种,哮喘是全球最常见的慢性疾病之一,是一种复杂的、异质性的免疫介导的紊乱集合,以气道重塑和慢性气道炎症为特征。
▸ 哮喘的危险因素
哮喘的发病机制仍不清楚,但该疾病与多种遗传、环境、感染和营养因素有关。
哮喘的许多危险因素,包括生命早期的抗菌素暴露、配方奶喂养、以及母体接触抗生素怀孕期间,集中在产前和产后早期,儿童过敏性哮喘的发生可能与微生物和免疫发育关键时期的早期肠道微生物群落有关。
动物模型提供的证据表明,生命早期肠道微生物群的组成可能会影响呼吸道免疫以及对哮喘和呼吸道感染的易感性。
在这里我们总结了婴儿(0-12 个月大)肠道微生物群组成与儿童(0-18 岁)呼吸道疾病(即呼吸道感染、喘息或哮喘)之间的关联。
谷禾健康希望通过研究数据,找到更利于儿童健康的菌群数量与种类,有助于为未来的干预研究提供信息和构建更好的健康。
本文主要内容
●生命早期的肠道微生物
●生命早期肠道微生物群对儿童呼吸道疾病的影响
●早期肠道微生物的调理方法
●青少年哮喘的预防与治疗
每个人都可以被视为一个岛屿,由各种栖息地组成,这些栖息地被微生物群落定殖,并遵循创造和塑造当地组合多样性的规则。
不同婴儿身体部位的微生物群组成
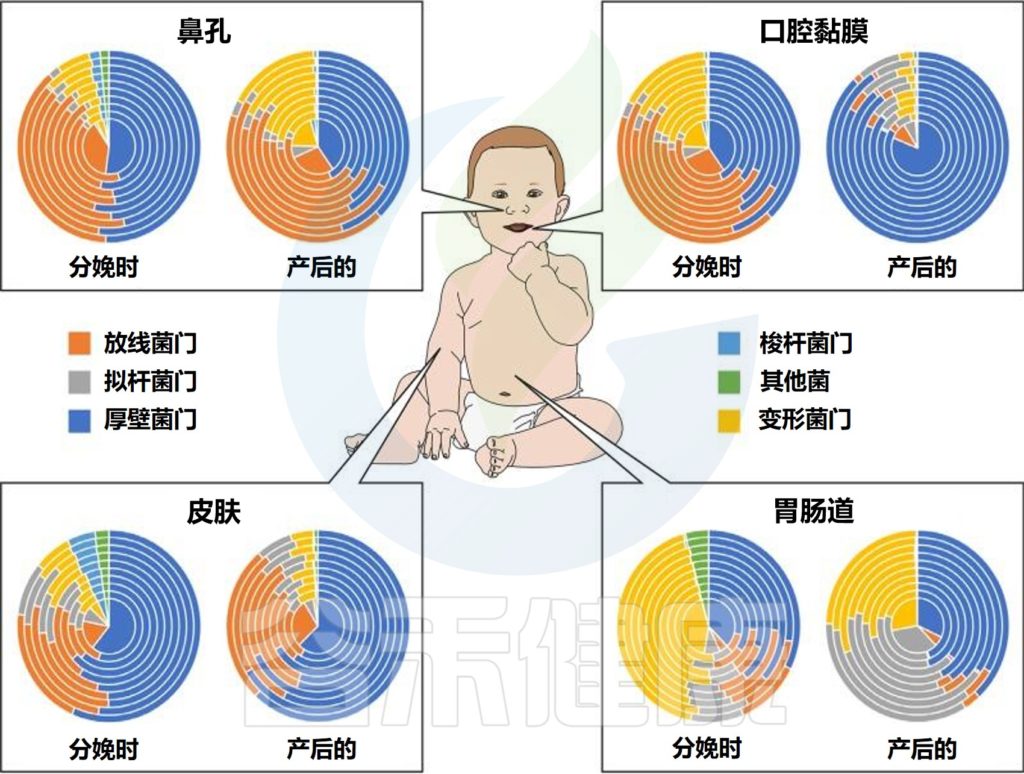
Milani C,et al.Microbiol Mol Biol Rev.2017
该图显示了婴儿微生物群组成的关键门在不同身体部位和生命早期不同阶段的相对丰度的全局概览。同心饼图示意性地表示个体间的可变性。
肠道微生物群是体内最大和最多样化的微生物群,包含数十亿细菌(主要生物)、古细菌、真核生物和病毒。
肠道菌群定植从出生时就开始了,在生命的最初几年是高度动态的,在1-3年后趋于稳定。
婴儿肠道核心微生物群
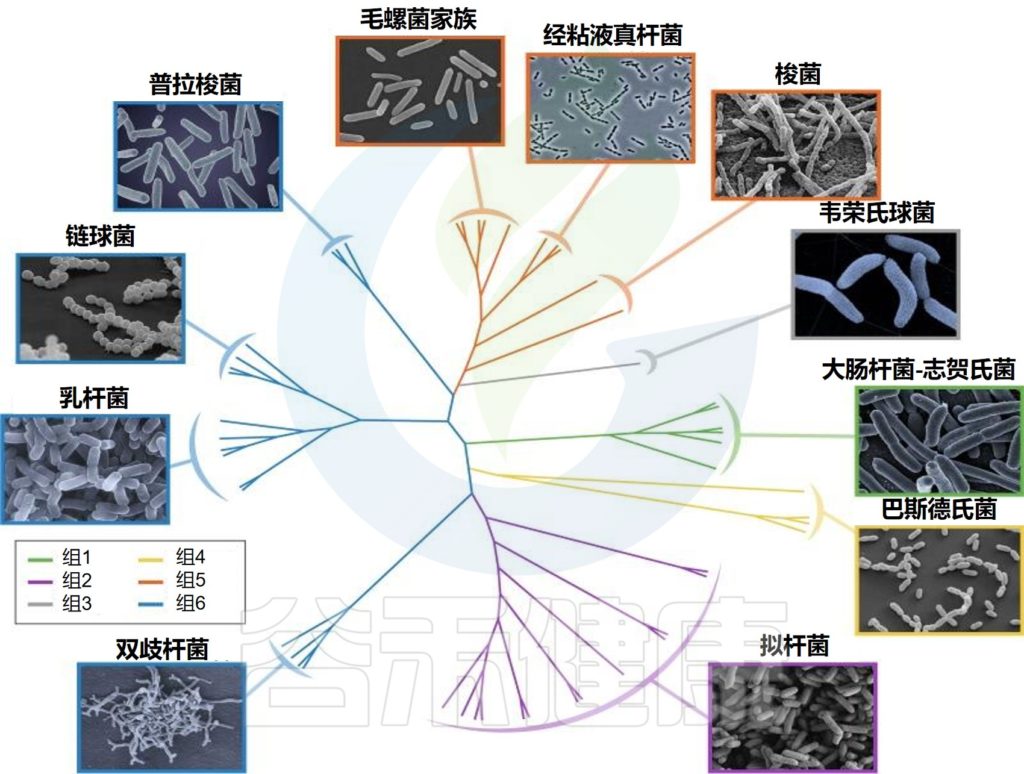
Milani C,et al.Microbiol Mol Biol Rev.2017
该图显示了涉及婴儿细菌核心微生物群的基于 16S rRNA 基因的树。树枝的颜色表示婴儿肠道微生物群的六个主要系统发育组。显示树的每个分支的关键婴儿肠道细菌分类群的电子显微镜图像。
相对于成人或年龄较大的儿童(>1岁)的肠道菌群,婴儿肠道菌群的多样性较低,菌群结构通常不稳定且高度动态。
双歧杆菌通常大量存在于婴儿,特别是母乳喂养的婴儿中,因此被认为是婴儿肠道微生物群的关键成员 。
尽管从婴儿肠道微生物群的初始组合到成人肠道微生物群的建立期间,个体水平的差异很大,但婴儿肠道微生物群可分为六种主要类型。
这种婴儿肠道微生物群的类型是根据肠道微生物群的组成和优势菌群的出现来确定的。详细地说,这些主要群体包括以下:
第1类,由肠杆菌目组成;
第2类,由拟杆菌目和疣微菌目组成;
第3 类,包括Selenomonadales以及梭菌目Pseudoflavonifractor、Subdoligranum和Desulfovibrio的成员;
第4类,包括所有巴斯德氏菌目;
第5类,包括大多数梭菌目;
第6类,包括梭状芽孢杆菌属、厌氧菌属和粪杆菌属、乳酸杆菌属和双歧杆菌属。
Bifidobacterium, Veillonella,
Streptococcus, Citrobacter,
Escherichia, Bacteroides, Clostridium
以上这些菌群在不同个体中主导婴儿肠道微生物群,它们在成人肠道微生物群中也很丰富。
▸ 梭状芽孢杆菌
梭状芽胞杆菌属的成员最近被重新分类为几个属,它们都属于梭状芽胞杆菌纲。这些物种通常存在于婴儿肠道微生物群中的微生物类群中。
▸ 拟杆菌
拟杆菌属。拟杆菌属的成员是成人肠道微生物群的主要成分,尽管它们也可能存在于婴儿肠道微生物群中,它们的存在似乎受到母乳低聚糖(HMO)的调节,其方式类似于双歧杆菌。
母乳低聚糖(HMO)——是母乳中第三丰富的固体成分(仅次于脂肪和乳糖),含量为5~15g/L,具有调节免疫,帮助大脑发育及调节肠道菌群等功能,有助于婴幼儿成长发育。
在小鼠实验中,已显示拟杆菌属的肠道定植。是宿主免疫系统识别和选择的结果,通过Toll样受体 (TLR) 和其他特定微生物-宿主相互作用。该属的成员被归类为能够代谢宿主产生的聚糖(例如HMO和粘蛋白)以及复杂的植物多糖(例如淀粉、纤维素、木聚糖和果胶)的糖破碎细菌。
●拟杆菌的作用
由于细胞外蛋白酶的作用,拟杆菌属物种通常具有蛋白水解活性。拟杆菌属成员利用的其他关键代谢功能包括胆汁酸的去结合。
在拟杆菌属中,脆弱拟杆菌被描述为可以产生多种荚膜多糖的成员,称为多糖A(PSA),是肠道菌群定植、宿主-微生物串扰或免疫调节的重要介质。
在各种拟杆菌属物种中,预计荚膜多糖会改变细胞表面的物理特性,并在宿主细菌共生中发挥关键作用。
▸ 韦荣氏球菌和链球菌
韦荣氏球菌和链球菌是婴儿肠道微生物群的一个次要成分。
这些细菌具有糖分解作用,利用其他婴儿肠道细菌(如链球菌和双歧杆菌)的碳水化合物发酵的最终产物(如乳酸)产生丙酸,形成重要的营养链。
这种短链脂肪酸被认为是肠道菌群的有益产物,因为它表现出抗炎特征,影响葡萄糖和能量稳态,增加胰岛素敏感性。
链球菌属的特定成员也构成婴儿肠道核心微生物群的一部分,并且是婴儿肠道中最早建立的细菌之一,可以在出生后的最初24小时内被识别出来。
▸ 乳酸杆菌
已知乳酸杆菌存在于婴儿肠道微生物群中,尽管它们在大肠中的数量低于上述细菌属,但在分娩后不久就存在。
乳酸杆菌的后续研究表明,与阴道分娩婴儿相比,剖腹产婴儿在生命的前6个月内的不同时间点的乳酸菌属检出率显著降低。
▸ 阿克曼氏菌
阿克曼氏菌自生命早期就存在于人类肠道中,但是水平非常低,阿克曼氏菌的存在与肠道完整性相关,已知其相对丰度和绝对数量会随着年龄的增长而迅速增加,特别是在断奶后。
小鼠实验证实了阿克曼氏菌对肠道屏障功能的影响,并证明其给药可防止饮食引起的肥胖。最近,还提供了涉及通过特定菌毛相关蛋白的TLR信号传导的机制解释。
临床、母体、喂养方式和环境因素共同塑造了生命早期的肠道微生物群。 对身体更方面都产生了一定影响。
考虑了生命早期肠道微生物群与儿童呼吸道疾病(包括呼吸道感染)之间的关联,在这里汇总了一些之前对肠道菌群与呼吸道疾病直接关联的研究。
肠道微生物的测量:通常通过收集粪便样本来测量,并且可以从多样性和丰度方面进行广泛描述。多样性描述了社区内不同分类群的数量。
探索哮喘或特应性喘息的研究
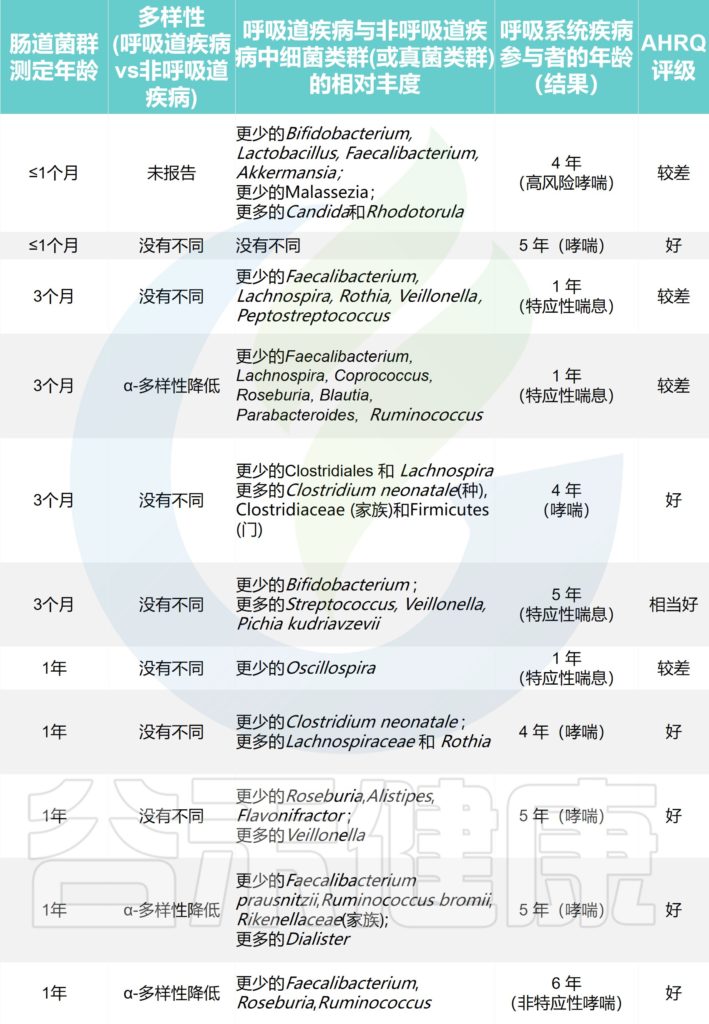
Alcazar CG,et al.Lancet Microbe.2022
探索呼吸道感染的研究

Alcazar CG,et al.Lancet Microbe.2022
喘息是与感染、过敏或后来的哮喘诊断相关的呼吸道症状。我们发现较高的α多样性与的喘息之间存在关联,这主要发生在阴道分娩的婴儿中。
α-多样性是指每个样本检测到的分类群数量,而β-多样性表示样本之间的组成差异。更细微的比较确定了不同分类水平下细菌或真菌的特定相对丰度。
大型研究(>700 名参与者)报告说,高 α 多样性对哮喘和喘息有保护作用。
探索了α-多样性与哮喘或特应性喘息之间的直接关联:与较低的α-多样性相比,生命第一年较高的肠道微生物群α-多样性与1岁时没有特应性喘息显著相关,并且在5岁和6岁时没有哮喘。
一项研究报告称,5周龄时肠道微生物群成熟度增加,肠道微生物群成熟度下降与6-11岁的哮喘高风险相关;还有两项研究报告了12个月时未成熟的肠道微生物群与5-6岁时哮喘风险增加之间存在一定关联。
基于细菌类群组成随时间的变化探索了健康参与者肠道微生物成熟度,并将该微生物群成熟度与儿童呼吸道疾病参与者的微生物群成熟度进行了比较。
总体而言,有证据表明双歧杆菌在3个月前婴儿的粪便中的相对丰度较低,与1岁时的呼吸道感染和4-5岁时的哮喘有关。
在3-12个月时的粪便样本中粪杆菌属、罗氏菌属和瘤胃球菌的丰度较低,与1-6岁时的哮喘和特应性喘息有关。
注意
然而,存在重要的研究限制,包括异质的结果定义和随访时间、残余混杂、小样本量以及异质的生物信息学和统计方法,大多数研究没有报告效果估计。
还有一些研究报告说,在1周龄时,非共生肠道细菌(如克雷伯氏菌和肠球菌)的相对丰度较高与1岁时的呼吸道感染有关; 3 个月时链球菌的相对丰度与 5 岁时的特应性喘息有关;1岁时Rothia或Dialister的高相对丰度与4-5岁时哮喘相关。但是具体作用机制目前还不清楚。
▸ 双歧杆菌增强呼吸道的免疫
双歧杆菌属(Bifidobacterium)是出生后4个月内儿童肠道中最丰富的细菌之一。并且已被证明通过体外和体内的表面相关分子和微生物群衍生代谢物调节个体的全身免疫反应。
在哮喘和呼吸道感染小鼠模型中,特定的双歧杆菌已被证明会影响呼吸道疾病的易感性。
一项研究表明,婴儿双歧杆菌的肠道定植可调节Th1和Th2反应之间的平衡,从而减少诱导小鼠模型中特应性哮喘的症状。
Th1(辅助型T淋巴细胞1)主要是增强吞噬细胞介导的抗感染免疫,特别是抗胞内病原体的感染。
Th2(辅助型T淋巴细胞2)Th2细胞的主要效应是辅助B细胞活化,其分泌的细胞因子可以促进B细胞增殖、分化和抗体的生成。
另一项研究报告称,当受到流感病毒的攻击时,与肠道丰度较低的小鼠相比,肠道丰度较高的双歧杆菌和拟杆菌的小鼠通过增强的CD8 T细胞和调节良好的巨噬细胞反应来提高流感存活率,从而防止过多的气道中性粒细胞流入。
▸ 梭状芽胞杆菌降低呼吸道炎症
Faecalibacterium、Ruminococcus、Lachnospira、Roseburia和Veillonella属于梭状芽孢杆菌类,在4-6个月大的儿童肠道中丰度较高。
已经描述了Roseburia和Faecalibacterium的潜在免疫调节机制,它们产生丁酸盐。
丁酸盐——一种在动物和体外模型中具有抗炎特性的细菌代谢物。
研究发现上呼吸道感染与婴儿粪便样本中丁酸梭菌的丰度降低有关。梭状芽胞杆菌可促进调节性T细胞产生并抑制炎症细胞因子,其中一些与人类全身感染有关。因此,丁酸梭菌对婴儿对感染的免疫反应的潜在抑制作用需要进一步研究。
另一项研究表明,给无菌小鼠接种毛螺菌属、韦荣氏菌属、粪杆菌属和罗氏菌可改善这些小鼠成年后代的气道炎症,但是这些细菌在呼吸系统疾病中的机制作用了解还是较少。
▸ 韦荣氏球菌刺激免疫分化
在我们的研究中,韦荣氏球菌,特别是小韦荣氏球菌(Veillonella parvula),与上呼吸道感染呈正相关,尤其是剖宫产婴儿。Veillonella parvula常见于口腔菌群中,它在口腔和肠道生态系统中都可以观察到。
一项针对120名荷兰婴儿的前瞻性研究发现,在1周大的婴儿中使用 16S V4 rRNA 测序发现了大量的韦荣氏菌操作分类单位,这与出生后第一年的呼吸道感染数量增加有关。
在研究中,Veillonella parvula在人体肠道中产生丙酸盐,这可能会刺激产生IL10的调节性T细胞分化;在小肠中,它会诱导产生IL-8、IL-1β、IL-10和 TNF- α37来影响呼吸道以至于全身的免疫。
▸ 棒状杆菌为呼吸道的致病菌
在剖宫产婴儿中,较高的棒状杆菌属(Corynebacterium)物种相对丰度与较高的上呼吸道感染风险相关。
棒状杆菌属物种通常被列为呼吸道中的致病菌。病例系列表明,痰中的假白喉棒状杆菌是肺部感染的驱动因素,一项来自法国的鼻咽微生物组病例对照研究发现,与健康对照组相比,病毒性呼吸道感染患者的假白喉棒状杆菌富集。
在3个月和1岁收集的粪便中,Faecalibacterium、 Roseburia和Ruminococcus相对丰度较低,与1-6岁的哮喘和特应性喘息相关。
3个月时Lachnospira的相对丰度较低,但1岁时的相对丰度增加也与1-6岁时哮喘和特应性喘息相关。
一项研究显示3个月时Veillonella的相对丰度较低与1岁时的特应性喘息相关,而两项研究报告称3个月和1岁时Veillonella的相对丰度较高与5岁时的哮喘和特应性喘息相关。
✦真菌与哮喘的关系
三项研究探索了真菌和哮喘之间的关系。
在一项研究中,在 1 个月大时测量的念珠菌和红酵母菌的相对丰度较高,而马拉色菌类群的丰度较低。
在另一项研究中,3月龄时Pichia kudriavzevii的相对丰度增加,与4-5岁时的哮喘和特应性喘息相关。
第三项研究却发现真菌成熟度与6岁儿童哮喘之间没有关联。
肠道菌群对哮喘的影响至少部分是由细菌代谢物介导的,这些代谢物可能会影响身体远端的免疫反应。
✦短链脂肪酸降低哮喘致敏性
在人类气道炎症中具有保护作用的最知名代谢物是 短链脂肪酸。1岁时粪便中含有大量丁酸盐和丙酸盐的儿童的特应性致敏性显著降低,并且在3至6岁之间不太可能患哮喘。
✦组胺和氧化脂质影响肺部炎症
与非哮喘志愿者相比,哮喘患者粪便样本中分泌组胺的细菌数量显著高于非哮喘志愿者。
此外,分泌组胺的细菌数量与疾病严重程度相关。然而,在过敏性气道炎症模型中,细菌来源的组胺降低了支气管肺泡液中的总细胞数和肺匀浆中IL-4、IL-5和IL-13的量。
相反,在蟑螂抗原小鼠气道炎症模型中,用12,13-diHOME(一种氧化脂质)对小鼠进行腹腔内治疗会减少肺部调节性T细胞的数量并增加肺部炎症。
建议
越来越多的证据表明细菌在哮喘中的作用,但需要进一步的研究来更清楚地定义所涉及的最重要的物种,并了解哮喘背景下的细菌生态失调是否是疾病的原因或影响。
有必要进行更详细的机制研究,以充分了解生命不同阶段肺和肠道微生物群组成和代谢与特定类型的哮喘炎症之间的复杂关联。
最后,未来的工作应该集中在继续详细描述在哮喘中介导细菌与宿主之间交流的细胞和分子机制。
通常用于预防或治疗不一定由特定病原体引起的感染的抗生素可以有效地消耗肠道微生物群。患有 NEC的新生儿感染肠道微生物的风险很高,抗生素通常用于预防或治疗这些感染。
NEC——新生儿坏死性小肠结肠炎(NEC)为一种获得性疾病,是多种原因引起的肠黏膜损害,使之缺血、缺氧,导致小肠、结肠发生弥漫性或局部坏死的一种疾病。
对于儿童炎症性肠病的治疗,使用单一抗生素对有并发症的患者有益,例如瘘管和脓肿,而广泛的抗生素组合可能会改善临床结果。
注意
在幼儿中使用抗生素存在很大风险。大量证据表明,抗生素会影响我们抵抗感染的能力、免疫系统的功能以及我们加工食物的能力。
肠道微生物群的破坏可能导致长期的健康后果,包括维生素产量减少、营养吸收减少以及糖尿病、哮喘、肥胖和感染风险增加。
口服益生元和益生菌是影响生命早期肠道微生物群发育的最常见方法。
益生元被定义为“选择性刺激肠道微生物群中一种或多种微生物属或物种的生长和活性,从而为宿主带来健康益处”的化合物,而益生菌被定义为“赋予宿主健康益处的活微生物”。摄入足量时会对宿主产生健康影响。
目前可用的益生元包括人乳低聚糖、菊粉、低聚果糖和低聚半乳糖;可用的益生菌包括双歧杆菌和乳酸杆菌属。
✦益生元和益生菌的作用
通过调节肠道微生物群,益生元对宿主产生健康影响。益生菌通过对粘膜和上皮的竞争性粘附、粘膜 IgA反应、抗菌物质的分泌、促炎途径的下调、抗炎细胞因子的产生和免疫系统的调节来增强肠道上皮屏障。
最近的研究表明,益生菌可以预防儿科疾病和障碍的进展,包括过敏、胃肠道感染、肥胖,甚至上呼吸道感染。
干预研究进一步表明,益生菌可以减轻某些疾病的严重程度,但对每种疾病的最佳干预仍然知之甚少。
虽然益生菌在某些情况下可以缓解过敏症状,但它们通常不能有效调节肠道微生物的组成。有证据表明,嗜热链球菌和双歧杆菌的组合可有效预防儿童抗生素相关性腹泻。
此外,合成生物学使益生菌和共生微生物的工程具有新的治疗功能。例如,融合蛋白HSP65-6P277的表达减少了非肥胖糖尿病小鼠中1型糖尿病的发病,而在非肥胖糖尿病鼠中口服重组乳酸乳球菌可改善糖耐量并显著减少胰岛素炎。
建议
尽管益生元和益生菌的应用前景不错,但在未来的研究中,应讨论益生菌和益生素的施用时间、不同菌株和菌株组合的效果、工程、安全性以及这些益生菌与益生素组合是否更有效的确定。
营养素可以通过塑造微生物菌群的组成,对婴儿肠道微生物的定植模式产生短期和长期影响。
越来越多的证据表明,摄入的膳食成分与炎症性肠病、2型糖尿病和动脉粥样硬化的发展有关。肠道菌群的最大变化发生在固体食物的引入,这表明饮食应被视为肠道菌群的核心决定因素。
✦饮食疗法
有趣的是,在中医中,早就有“药食同源”的概念。该概念的一个方面是食物是一种药物,适当的饮食或某些食物可以维持身体的平衡和健康,并预防或减轻某些疾病的发展。
在现代医学中,饮食改变越来越被认为是一种通过改变肠道微生物群来改变全身炎症的相对简单的方法。
早期肠内营养 (EEN) 是一种饮食疗法,已被用作儿童克罗恩病的一线疗法,通过用仅由液体营养素组成的配方代替正常饮食成分,旨在使炎症标志物正常化并诱导临床缓解。
✦高膳食纤维可以减轻呼吸道疾病
此外,另一项研究报告称,喂食高纤维饮食的小鼠可以产生独特的肠道微生物群,从而导致短链脂肪酸乙酸酯水平升高。
高纤维或醋酸盐喂养通过减少与人类哮喘和小鼠哮喘模型相关的某些基因在小鼠胎肺中的表达,显著抑制过敏性气道疾病。
此外,发现肠道微生物不仅与哮喘有关,而且还降低了与哮喘严重程度和炎症表型相关的气道微生物群的多样性和群落组成。
抗炎特性
此外,最近的一些研究证明,膳食纤维具有抗炎特性,这可以部分解释纤维对肠道微生物菌群的影响。 使用临床前模型的几项研究表明,可发酵纤维补充剂通过微生物群诱导的特定抗炎代谢物产生的变化来改变疾病结果。
然而,还需要更多的研究来增加我们对不同饮食如何塑造微生物群和改变健康结果的理解。
粪便微生物群移植(FMT)被定义为将健康供体的粪便悬浮液输注到受体患者的胃肠道中,以恢复肠道微生物群的正常多样性和功能。
粪菌移植的方式:粪便微生物群可通过结肠镜检查、鼻胃管或鼻十二指肠管、灌肠剂或口服胶囊置于患者体内。
由于肠道微生物群宏基因组测序的技术进步以及对其组成和功能的日益了解,粪菌移植近年来引起了越来越多的兴趣和关注。尽管粪菌移植仍然知之甚少,但它不再被认为是一种“替代”和最后的医疗实践,现在作为一种具有生物学合理性的有价值的疗法正在获得主流接受。
此外,这种疗法已被证明能够重建正常运作的微生物群落。通过为患者提供来自合适供体的平衡微生物群,纠正了在艰难梭菌感染 (CDI)发病机制中起重要作用的不平衡肠道微生物菌群。
在一系列关于复发性CDI的研究中,85%接受粪菌移植的患者出现症状缓解。此外,考虑到肠脑轴和肠道微生物之间的相互作用,粪菌移植被认为是治疗某些精神疾病的可能方法,例如自闭症谱系障碍。
建议
然而,粪菌移植的微生物组成尚未完全确定。因此,需要澄清与改善临床结果相关的微生物结构或功能特征,以确定优选的组合。
未来的研究应侧重于确定“健康”微生物菌群的范围以及制定评估最佳组成的标准。
5岁至14岁的哮喘患病率约为10%,使其成为全球儿童时期最普遍的慢性病。尽管下呼吸道感染带来了巨大的健康负担,但目前还没有专门针对它们或儿童哮喘被广泛许可的预防策略,所以暂时只能用一般呼吸道疾病的方法来预防。
✦注意空气卫生
注意室内的清洁和空气流通,因为空气中的灰尘和细菌是哮喘病发的主要致敏原,所以应该勤加打扫,减少空气中的尘埃。尽量减少暴露于空气污染的室内和室外。
✦良好饮食习惯
坚持每天喝水,喝水是排出身体毒素的最佳的方法。在日常生活中注意饮食习惯,一日三餐要按时就餐,少吃油腻。
✦良好生活,避免螨虫
哮喘病人要在日常生活中每天要保持良好的生活态度,放松心情。不要在家里养猫、狗、花、鸟等。经常晾晒被褥、换洗床单,避免螨虫孳生。
✦加强自我管理
对于5岁及以上被诊断为哮喘的儿童或青少年,提供哮喘自我管理计划,包括书面的个性化行动计划和教育。
说明污染会引发或加剧哮喘,并在个性化的行动计划中包含尽量减少暴露于室内和室外空气污染的方法。
注:哮喘好发于青少年和儿童,一旦患病,如防治不当,很容易反复发病,随着发病频度的增加,病情会逐渐加重,必将严重影响生活质量和学习工作能力,给个人家庭和社会造成沉重负担。
我们结合当前的研究与认知,提出了一些适用于儿童和青少年新诊断哮喘或当前治疗无法控制哮喘的治疗建议。
✦药物治疗
•SABA
β2受体激动剂(SABA)是一类能够分布在气道平滑肌上的β2受体产生支气管扩张作用的哮喘治疗药物。这类药物属于支气管扩张药,是哮喘急性发作(气道痉挛)的首选药物,能够迅速改善哮喘急性发作时的呼吸困难、咳嗽等的症状。
对新诊断为哮喘的儿童和年轻人(5至16岁),可以提供SABA作为缓解疗法。
对于患有哮喘的儿童和青少年(5至16岁),他们很少出现短暂的喘息和正常的肺功能,也可以考虑单独使用SABA缓解疗法进行治疗。
•ICS
吸入性糖皮质激素(ICS)是目前控制哮喘病的气道炎症最有效的药物,以定量气雾剂、干粉剂或溶液吸入。
在哮喘炎症表型中,通常接受高剂量吸入性皮质类固醇 (ICS) 的中性粒细胞性哮喘患者表现出较少的细菌负荷,其中嗜血杆菌和莫拉菌属、变形杆菌门的成员相对富集,而链球菌的相对丰度降低。
ICS已经成为目前哮喘治疗的第一线治疗,对病人是最为重要的治疗,任何哮喘患者,只要诊断正确,都应该接受ICS的治疗,这是一个长期维持治疗,可以起到气管局部抗炎的效果,改善病情,预防哮喘急性发作。
为儿童和青少年(5至16岁)提供儿科低剂量ICS作为一线维持治疗。
就诊时出现明显表明需要维持治疗的症状(如导致夜间醒来)或单独使用SABA无法控制的哮喘也应使用ICS治疗。
✦风险分层
同时使用风险分层来识别预后不良风险增加的哮喘患者,并使用此信息优化他们的护理。
根据诸如不依从哮喘药物、心理社会问题和反复发作的哮喘计划外护理等因素进行风险分层。
总体而言,有观察证据表明,在生命的第一年,肠道共生细菌属的低α多样性和相对丰度与随后的呼吸系统疾病,尤其是哮喘有关。因此在婴儿早期关注和了解肠道菌群状况对于后面哮喘发生和预防非常重要,进一步研究哮喘患者的肠道和下呼吸道微生物群可能有助于开发更有效的方法来预防和治疗哮喘。
主要参考文献
Alcazar CG, Paes VM, Shao Y, Oesser C, Miltz A, Lawley TD, Brocklehurst P, Rodger A, Field N. The association between early-life gut microbiota and childhood respiratory diseases: a systematic review. Lancet Microbe. 2022 Aug 18:S2666-5247(22)00184-7. doi: 10.1016/S2666-5247(22)00184-7. Epub ahead of print. PMID: 35988549.
Milani C, Duranti S, Bottacini F, Casey E, Turroni F, Mahony J, Belzer C, Delgado Palacio S, Arboleya Montes S, Mancabelli L, Lugli GA, Rodriguez JM, Bode L, de Vos W, Gueimonde M, Margolles A, van Sinderen D, Ventura M. The First Microbial Colonizers of the Human Gut: Composition, Activities, and Health Implications of the Infant Gut Microbiota. Microbiol Mol Biol Rev. 2017 Nov 8;81(4):e00036-17. doi: 10.1128/MMBR.00036-17. PMID: 29118049; PMCID: PMC5706746.
Zhuang L, Chen H, Zhang S, Zhuang J, Li Q, Feng Z. Intestinal Microbiota in Early Life and Its Implications on Childhood Health. Genomics Proteomics Bioinformatics. 2019 Feb;17(1):13-25. doi: 10.1016/j.gpb.2018.10.002. Epub 2019 Apr 12. PMID: 30986482; PMCID: PMC6522475.
Barcik W, Boutin RCT, Sokolowska M, Finlay BB. The Role of Lung and Gut Microbiota in the Pathology of Asthma. Immunity. 2020 Feb 18;52(2):241-255. doi: 10.1016/j.immuni.2020.01.007. PMID: 32075727; PMCID: PMC7128389.
Ver Heul A, Planer J, Kau AL. The Human Microbiota and Asthma. Clin Rev Allergy Immunol. 2019 Dec;57(3):350-363. doi: 10.1007/s12016-018-8719-7. PMID: 30426401; PMCID: PMC7449604.
Moroishi Y, Gui J, Hoen AG, Morrison HG, Baker ER, Nadeau KC, Li H, Li Z, Madan JC, Karagas MR. The relationship between the gut microbiome and the risk of respiratory infections among newborns. Commun Med (Lond). 2022 Jul 14;2:87. doi: 10.1038/s43856-022-00152-1. PMID: 35847562; PMCID: PMC9283516.

谷禾健康

在过去的几十年里,肥胖患病率的持续快速增长。成为了许多国家的主要医疗保健问题,尤其是在2019年新冠状病毒时代以来。
肥胖是包括心血管疾病在内的一系列疾病不断扩大的风险因素。2型糖尿病、慢性肾病、非酒精性脂肪肝病, 负重过大导致的关节炎,甚至许多癌症都与肥胖有关。
▸ 肥胖的定义
肥胖定义为身体脂肪过度积累到可能对健康产生不利影响的程度。
一般使用体重指数(BMI;体重(千克)除以身高(米)的平方)进行评估。
我国规定的BMI正常范围在18.5-23.9之间,24-27.9为超重,超过28则为肥胖。
肥胖不是单纯的体重增加,而是体内脂肪组织积蓄过剩的状态。肥胖是指一定程度的明显超重与脂肪层过厚,是体内脂肪,尤其是甘油三酯积聚过多而导致的一种状态。
主要原因是由于能量摄入过多或机体代谢的改变而导致体内脂肪积聚过多造成体重过度增长并引起人体病理、生理改变或潜伏。
▸ 引起肥胖的因素
肥胖是一个多因素问题,不仅限于饮食或缺乏运动的原因,还包括遗传、环境和心理社会因素,这些因素通过能量摄入和消耗的生理介质起作用。
肠道微生物组是这些环境因素之一;大约 20年前,在小鼠研究中已经确定了脂肪储存和肠道微生物组之间的联系。粪便微生物群移植研究提供了更切实的证据。
本文结合了最新的学术研究和谷禾健康数据库,涵盖了不同的角度,既关注单个细菌的作用,也特别强调整个微生物组的组成,以试图解开肠道微生物组与肥胖的关系。
让人们更好地了解肥胖以及其发病机制,在此基础上提出一些预防和治疗肥胖的建议,使人们拥有更健康的生活。
本文主要从以下几个方面讲述
●肠道微生物对肥胖发病机制的影响
●菌群代谢物对肥胖的影响
●健康与肥胖人群中的细菌比例
●肥胖与肠道微生物的研究分类
●微生物多样性与人体健康有关
●肥胖与肠道微生物的未来研究方向
●预防和治疗肥胖的一些建议
学术专业用词缩写
PRR—模式识别受体
NOD2—核苷酸结合寡聚化结构域2
FXR—法尼醇X受体
TLR5—TOLL样受体5重组蛋白CDI—复发性艰难梭菌感染
BSH—胆盐水解酶
GLP1—胰高血糖素样肽-1
GPR—G蛋白偶联受体
01
肠道微生物对肥胖发病机制的影响
研究肥胖的发病机制,有助于我们更好地了解肥胖,并以此制定相应的治疗方案。实验研究发现肠道微生物对肥胖的发病机制存在一定的影响。
许多研究已经确定了肠道微生物群与宿主免疫系统之间的关联。其中一个发现是肥胖与肠道微生物引起的慢性低度炎症有关。
肠道微生物群和肠道细胞之间的密切接触是由微生物相关分子模式介导的,这些分子模式可以与上皮细胞和免疫细胞中的模式识别受体 (PRR) 结合。
这些识别受体属于先天免疫系统,控制炎症和免疫反应。PRR还可以检测宿主细胞释放的损伤相关分子模式。
✦革兰氏阴性菌中的脂多糖易引起炎症
脂多糖 (LPS)是革兰氏阴性菌外膜的一种特有成分,由脂质和多糖构成,似乎会引起小鼠的低度炎症。
在这里列举了一些常见的革兰氏阴性菌:
大肠杆菌、变形杆菌、痢疾杆菌
肺炎杆菌、布氏杆菌
需要注意的是,大部分革兰氏阴性菌对人体都有害
在一项人体研究中进行了类似的观察,其中能量摄入与内毒素血症和伴随的炎症有关。
事实上,与健康对照组相比,在患有2型糖尿病的受试者中,革兰氏阴性菌的数量明显更多。
脂多糖通过脂多糖分化受体14(CD14)和辅助受体 toll样受体 (TLR4)引起炎症,这反过来又导致脂肪细胞产生的促炎细胞因子增加。
●饮食在脂多糖中起重要作用
果胶可抑制脂多糖诱导的单核细胞或树突状细胞中的TLR4活化,而果糖或高脂肪饮食导致含有脂多糖的变形菌增加,瘦素信号与饱腹感和能量平衡紊乱有关,因此失调。
在此列举了一些高果糖高脂食物:
1.蜂蜜和市面上一些甜的饮料果糖含量较高;
2.淀粉类:经油炸加工的馅饼、油条、葱油饼、油糕等食物中,含有大量脂肪与糖分;
2、肉类:用糖汁、糖煎、糖烧的方法进行烹调的红烧肉、炸鸡等,也为高糖高脂食物;
3、奶油制品食物:如奶油蛋糕、奶茶、泡芙等甜品,主要原材料为淀粉与黄油等物质,所以也有较高的糖分与脂肪。
同时还表明,分泌型脂蛋白脂肪酶(LPL)抑制剂血管生成素样蛋白4(一种禁食诱导的脂肪因子)可被微生物群抑制,进而导致分泌型脂蛋白脂肪酶活性增加和白色脂肪组织中的脂肪储存。
✦肽聚糖影响体内平衡
另一个例子是肽聚糖,它是细菌细胞壁的一种成分,对人体内平衡很重要。
核苷酸结合寡聚化结构域2 (NOD2) 是肽聚糖的产物,是一种位于上皮细胞和免疫细胞内的胞质 ,能够感知胞壁酰二肽。
这种胞质对于病原体入侵和几种炎症性疾病期间的免疫反应至关重要,从而调节粘膜细菌定植。
// 一些关于NOD2的研究案例
NOD2缺乏的小鼠在高脂饮食期间显示出脂肪组织、肝脏炎症和胰岛素抵抗增加。因此经常用于糖尿病研究。
在具有功能性NOD2受体的肥胖小鼠中,胞壁酰二肽识别显示可减少脂肪炎症和胰岛素抵抗,而不会减轻体重或改变肠道微生物群组成。
上述案例在一定程度上可以说明NOD2对于减轻肥胖和肠道微生物群稳定具有一定作用。
✦Toll样蛋白受体影响免疫
——Toll样受体5(TLR5)重组蛋白是免疫系统的关键成分,还是单体鞭毛蛋白的传感器,可以检测细菌感染并启动宿主抗菌的防卫反应。
肠道微生物群也通过位于上皮细胞上的TLR5与免疫系统相关联。
免疫系统通过TLR5感知肠道微生物群的组成和肠道微生物群的定位,以避免共生肠道微生物群传播到肠外器官、产毒成员的过度生长以及机会性病原体的过度生长和入侵。TLR5检测鞭毛蛋白会导致白细胞介素-22的产生,从而预防与肠道炎症相关的疾病。
// 关于TLR5影响免疫在小鼠中的研究
与野生型无菌小鼠相比,TLR5缺陷小鼠的胰岛素抵抗和肥胖水平增加。肠道微生物群从这些TLR5缺陷小鼠转移到野生型无菌小鼠也导致这些野生型小鼠代谢综合征的相似特征转移。
一项调查缺乏TLR5受体的小鼠的研究,观察到鞭毛蛋白特异性免疫球蛋白的丢失导致鞭毛细菌增加,包括许多变形杆菌,以及粘膜屏障破坏和炎症增加。
肠道微生物影响宿主免疫的推定机制
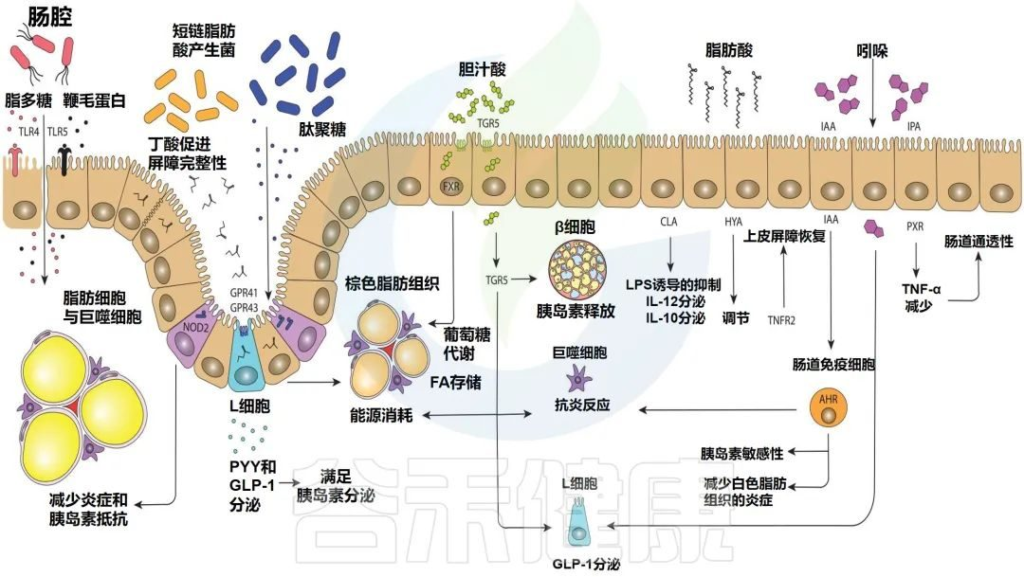
Levin E,et al.Therap Adv Gastroenterol.2022
部分肠道微生物群的鞭毛蛋白和脂多糖可以与toll样受体重组蛋白结合,而细胞内NOD2感知肽聚糖。几种短链脂肪酸的产生可以与GPR41和GPR43(2种特异性短链脂肪酸受体)结合,导致PYY(肽YY(一种新的胃肠道激素,具有抑制胃肠运动和胃酸分泌等作用))和GLP-1(胰高血糖素样肽-1)的表达增加。
胆汁酸激活TGR5和FXR(一种胆汁酸的受体)),影响脂质和葡萄糖代谢。脂肪酸,如HYA,调节TNFR2,参与上皮屏障恢复。吲哚通过GLP-1调节和AHR的激活以及与PXR 的结合影响宿主。
注意
事实上,与瘦的人相比,肥胖的人往往有的粪便鞭毛蛋白、更少的粪便抗鞭毛蛋白IgA和更高水平的慢性肠道炎症。
02
菌群代谢物对肥胖的影响
短链脂肪酸
短链脂肪酸(SCFA)主要是微生物厌氧发酵的衍生终产物,对宿主具有多种影响。它是一组少于六个碳的羧酸,包括乙酸盐、丙酸盐和丁酸盐。这些短链脂肪酸及其比例在几种不同的组织中具有多种有益的作用。
✦短链脂肪酸有利于肠道环境的稳态
短链脂肪酸被认为是人类宿主的能量来源和能量调节剂,但它们也有助于维持肠道环境的稳态。短链脂肪酸的细胞外活性主要由G蛋白偶联受体(GPRs)介导。
这些受体在多种细胞上表达,包括肠上皮细胞、脂肪细胞、肠内分泌L细胞、先天免疫细胞和体细胞感觉神经节的神经元。
✦短链脂肪酸会影响饱腹感
短链脂肪酸参与L细胞产生的肽YY和胰高血糖素样肽1(GLP1) 激素的调节。这两种激素都调节神经系统的饱腹感,GLP1在葡萄糖刺激的胰岛素敏感性和分泌中也起作用。
饱腹感也由丙酸盐通过激活脂肪细胞中的游离脂肪酸受体3(FFAR3)来控制,因为这些脂肪细胞会产生瘦素。微生物衍生的丁酸盐和丙酸盐都会诱导肠道糖异生,进而诱导对葡萄糖和能量稳态的有益影响。
✦短链脂肪酸促进能量消耗
研究显示丁酸盐通过游离脂肪酸受体2(FFAR2)的活化刺激棕色脂肪组织的活化,从而显著促进能量消耗。并且脂肪积累被丁酸盐诱导的白色脂肪组织中的游离脂肪酸受体2活化抑制。最后,丁酸盐通过降低肠屏障的通透性来减少上皮细胞中的细菌易位。
在肠道内,短链脂肪酸的产生通过各种中间体发生。不同的物种,在产生这些中间体和最终产物的每个步骤中使用不同的酶,都参与了这个过程。
●2型糖尿病中产丁酸盐菌丰度较低
在2型糖尿病中,许多研究看到的一个共同趋势是,糖尿病患者的丁酸盐生产者(如Roseburia和Faecalibacterium)的丰度低于对照组,这可能取决于饮食。
在肥胖症中也可能如此,短链脂肪酸的过量生产可能会导致更高的能量可用性和摄入量。
事实上,一项比较肥胖与瘦的受试者的研究表明,肥胖者的总短链脂肪酸水平较高,但必须指出,肥胖与丙酸盐水平特别相关。
胆汁酸
胆汁酸是胆汁的重要成分,在脂肪代谢中起着重要作用。 胆汁酸主要存在于肠肝循环系统并通过再循环起一定的保护作用。
许多研究报告了肠道微生物组、胆汁酸和肥胖或肥胖相关疾病之间存在联系。
初级胆汁酸通过两种途径在肝细胞中产生:
产生大部分胆汁酸的经典途径是由细胞色素P450中的胆固醇7α-羟化酶启动的。
替代途径由细胞色素P450中的27α-羟化酶启动。
注:细胞色素P450——一个很大的可自身氧化的亚铁血红素蛋白家族,属于单氧酶的一类,因其在450纳米有特异吸收峰而得名。它参与内源性物质和包括药物、环境化合物在内的外源性物质的代谢。
7α-羟化酶和27α-羟化酶都属于细胞色素P450中的成员。
经典途径中的一种中间体胆固醇7α-羟化酶与总血浆甘油三酯浓度相关,表明肝胆汁酸合成对于调节肥胖者的血浆甘油三酯水平很重要。
胆汁酸的作用途径
产生的初级胆汁酸是胆酸、鹅去氧胆酸和猪胆酸。这些初级胆汁酸与甘氨酸或牛磺酸结合。餐后,这些结合物被分泌到胆汁中并释放以促进膳食脂肪的溶解和吸收。
此后,肠道微生物群使用胆盐水解酶(BSHs)去结合初级胆汁酸。
Bifidobacterium spp., Lactobacillus spp., Enterococcus spp.和Methanobrevibacter spp.,这些细菌中都含有这些胆盐水解酶。
接下来,这些去结合的初级胆汁酸随后被转化为次级胆汁酸。
注:这是通过肠道微生物群的脱氨基作用和7α-羟化酶的脱羟基化来完成的。
在最后阶段,胆汁酸被回肠远端吸收,完成肠肝循环。产生的次级胆汁酸是脱氧胆酸和石胆酸。这些胆汁酸参与调节能量消耗,以及炎症和葡萄糖代谢和脂质代谢。
这表明这些胆汁酸在肥胖的病理生理学中非常重要,因为与肥胖相关的肠道微生物群的改变包括胆汁酸池大小和组成的变化。
✦不同胆汁酸具有不同的作用
不同的胆汁酸对各种肠道受体具有不同的亲和力,例如与膜结合的蛋白偶联受体(TGR)以及法尼醇X受体(FXR) 。
注:TGR5—是一种G蛋白偶联受体,不仅是胆汁酸的受体,也是多种选择性合成激动剂的受体。
法尼醇X受体(FXR):一种胆汁酸受体,被特定胆汁酸代谢物激活后发挥转录因子作用,参与调控胆汁酸的合成和肠肝循环,影响机体的糖脂代谢。
在小鼠中,已经表明肠道菌群通过FXR受体促进饮食诱导的肥胖。
在脂肪组织中,脂肪细胞分化受FXR通过促进过氧化物酶体增殖物激活受体γ活性,进而调节脂肪酸储存和葡萄糖代谢。
在棕色脂肪组织中,能量消耗因胆汁酸与TGR5结合而增加,随后产生的环磷酸腺苷会增加参与能量稳态的甲状腺激素活化。
在巨噬细胞中,胆汁酸激活TGR5会导致抗炎反应,因为抑制了NF-κb通路和NLRP3依赖性炎症小体活性。FXR和TGR5受体都存在于相似的细胞中,例如胰岛β细胞和肠内分泌L细胞。
在胰岛β细胞中,正向调节合成和葡萄糖诱导的胰岛素分泌。在肠内分泌L细胞中,观察到相反的效果。FXR的激活导致GLP-1分泌的抑制,而TGR5的激活诱导GLP-1的分泌。
✦饮食会影响胆汁酸的含量
几项研究已经将特定的肠道微生物群改变以及胆汁酸成分的改变与肥胖联系起来,同时考虑到饮食的类型。
与富含精制谷物的饮食相比,富含全谷物的饮食导致血浆胆汁酸含量显著增加,包括牛磺鹅去氧胆酸、甘胆酸和牛磺石胆酸。
这被假设为激活FXR和TGR5受体并影响葡萄糖稳态。事实上,高膳食纤维的纯素饮食与Prevotella丰度较高相关被证明可以增强法尼醇X受体的信号通路
与杂食动物相比,纯素食者的粪便胆汁酸含量也显著降低。当杂食动物的饮食中膳食纤维增加时,观察到粪便胆汁酸显著减少。
//研究证明高脂饮食胆汁酸水平升高
在小鼠中,高脂饮食引起的肥胖导致粪便中脱氧胆酸水平升高。此外,高脂肪饮食略微增加总胆汁酸池,特别是增加肝脏和血浆中的脱氧胆酸和牛磺脱氧胆酸水平。
这些变化与以下菌群的丰度增加相关:
Blautia ↑↑↑
Coprococcus ↑↑↑
Intestinimonas ↑↑↑
Lactococcus ↑↑↑
Roseburia ↑↑↑
Ruminococcus ↑↑↑
另一项小鼠研究调查了胆盐水解酶对法尼醇X受体胆汁酸拮抗剂牛磺-β-鼠胆酸的影响,因为法尼醇X受体抑制会导致对肥胖的抵抗。他们发现,乳酸杆菌水平降低与BSH水平降低相关,因此与牛磺酸-β-鼠胆酸水平升高相关。
事实上,从小鼠盲肠中分离出的L.johnsonii被发现表达产生胆盐水解酶的基因,这些基因专门针对牛磺-β-鼠胆酸,提供了肠道微生物群变化与调节法尼醇X受体和胆盐水解酶基因表达之间的机制联系。
然而,与其他产生类似胆盐水解酶的肠道微生物相比,乳酸杆菌对法尼醇X受体拮抗剂浓度的贡献仍不清楚。
一项调查肥胖受试者的人体研究发现了毛螺菌科的瘤胃球菌家族与甘氨脱氧胆酸的比例和血浆中次级胆汁酸与初级胆汁酸的比例呈正相关。
除此之外,Faecalibacterium prausnitzii与粪便中的异石胆酸水平呈负相关。
一项调查肥胖受试者的研究发现,该组的非12-OH胆汁酸比例降低。在同一项研究中,高脂饮食抗肥胖小鼠的这些非12-OH胆汁酸水平升高。
在高脂饮食易肥胖的小鼠中,这些胆汁酸减少并与肠道微生物群的改变有关。在这里,梭状芽孢杆菌减少的很明显,肥胖与肠道微生物群通过胆汁酸池的大小和组成有关,但在单个细菌、特定胆汁酸剖面和肥胖表型之间还没有明确的联系。
因此,还需要进行更多的研究,以将肥胖与胆汁酸谱和胆汁酸池大小与特定细菌组成谱联系起来。
脂肪酸
除了产生胆汁酸外,一些细菌,包括Lactobacilli和Bifidobacteria,还通过多不饱和脂肪酸的饱和代谢产生代谢物。这会产生中间脂肪酸,如羟基、氧代、共轭和部分饱和反式脂肪酸。
结果表明,与无菌小鼠相比,无特定病原体小鼠的羟基脂肪酸水平要高得多,这表明肠道微生物组的脂质代谢会影响宿主体内的脂肪酸组成,因此会影响宿主的健康。
✦增强抗炎能力,促进屏障恢复
此外,共轭脂肪酸组中的一些脂肪酸对健康有益。体外对树突状细胞的实验表明,共轭亚油酸的异构体抑制脂多糖诱导的白细胞介素12产生并增强抗炎细胞因子白细胞介素10的产生。
一个例子是10-hydroxy-cis-12-octadecenoic acid(HYA),因为它部分调节肿瘤坏死因子受体2 (TNFR2),从而促进上皮屏障恢复作用。
注:HYA是不饱和脂肪酸的代谢过程中,肠道微生物产生的中间体游离脂肪酸。HYA能够改善与一些细胞中成熟标志物表达相关的抗氧化/解毒防御能力。
✦保护宿主,减少肥胖
另一项研究展示了HYA如何通过G蛋白偶联受体40(GRP40)和G蛋白偶联受体120(GRP120)分泌胰高血糖素样肽-1来减轻高脂饮食诱导的小鼠肥胖。
此外,他们还证实了几种乳酸杆菌属,如
Lactobacillus salivarius和
Lactobacillus gasseri,能够产生相似水平的 HYA,保护宿主免受高脂饮食引起的肥胖。
吲哚
吲哚是吡咯与苯并联的化合物,细菌产生吲哚对人体健康具有重要意义。
✦饮食类型影响吲哚的产生
吲哚是通过降解肠中芳香族氨基酸如酪氨酸、苯丙氨酸和色氨酸的分解代谢产生的。因此,肠道吲哚水平取决于饮食类型。
富含蛋白质的饮食会促进吲哚的产生。然而,富含糖的饮食可能会降低吲哚合成,因为过度消耗糖可能会导致小肠饱和,从而导致更多剩余的糖进入大肠。
由于碳水化合物发酵优于蛋白水解活性,因此抑制色氨酸酶活性导致吲哚合成速率降低。吲哚通过以下途径影响宿主代谢L细胞对GLP-1分泌的调节,表明在2型糖尿病等代谢疾病中发挥作用。
吲哚丙酸(3-Indolepropionic acid)由Clostridium sporogenes产生,它与膳食纤维摄入量呈正相关。
•2型糖尿病会影响吲哚水平
事实上,一项研究发现较高的血浆吲哚丙酸水平与降低患2型糖尿病的风险之间存在关联。
另一项研究发现,与瘦对照相比,患有2型糖尿病的肥胖受试者的吲哚丙酸水平降低。吲哚丙酸显示通过与孕烷X受体结合并随后下调肿瘤坏死因子α来调节炎症。
✦吲哚具有抗肥胖等特性
研究显示吲哚丙酸可降低饮食诱导的肥胖小鼠的肠道通透性。吲哚丙酸也被证明在小鼠中具有抗肥胖活性。
在肠道中,色氨酸可以被肠道菌群用作底物来产生吲哚,但也可以被宿主代谢。在低度肠道炎症(肥胖的一种慢性症状)期间,巨噬细胞中的吲哚胺2,3-双加氧酶活性增加,导致犬尿氨酸的产生水平升高,从而将生产从微生物衍生的吲哚转移。
注:吲哚胺2,3-双加氧酶是人体内色氨酸代谢中的关键酶,可通过介导色氨酸耗竭及其代谢产物调节机体抗肿瘤免疫。
与正常饮食的小鼠相比,高脂肪饮食的小鼠显示出吲哚胺2,3-双加氧酶活性增加。然而,与高脂饮食的野生型小鼠相比,在这种酶被敲低的小鼠中观察到胰岛素耐受性有所改善。
微生物衍生的吲哚,如吲哚乙酸激活芳烃受体,但犬尿氨酸抑制其激活。微生物衍生的吲哚乙酸进一步限制了巨噬细胞中脂肪酸的积累和炎症标志物的产生。
谷氨酸
除了吲哚,谷氨酸也可以影响人体。
——谷氨酸是一种多功能氨基酸,谷氨酸在生物体内的蛋白质代谢过程中占重要地位。除此之外,谷氨酸也是人体兴奋神经递质,不仅参与消化系统和免疫系统,还是大脑健康密切相关。现在强有力的证据表明肠道微生物产生神经活性分子,如神经递质(即去甲肾上腺素、多巴胺、血清素、GABA 和谷氨酸)和代谢物(即,色氨酸代谢物,短链脂肪酸等)维持宿主和细菌之间跨界跨区域交流。谷氨酸代表了在这种跨界交流中活跃的众多神经活性分子之一。
根据对肥胖和瘦受试者的队列进行的全基因组关联分析显示,谷氨酸盐具有潜在危害。
通过进行途径分析,谷氨酰胺/谷氨酸转运系统在肥胖个体中高度富集。这与拟杆菌属(包括B.thetaiotaomicron)的物种呈负相关。事实上,与瘦受试者相比,肥胖者体内这种细菌的数量减少。因此谷氨酸与人体之间也存在一定联系。
•拟杆菌的在高脂饮食中的研究
对多形拟杆菌(B.thetaiotaomicron)在高脂饮食小鼠中的作用的研究表明,编码参与脂肪生成的蛋白质的基因表达较低,而编码参与脂肪酸氧化和脂肪分解的蛋白的基因表达较高。此外,炎症相关标志物的表达也降低。
关于发现与肥胖相关的B.thetaiotaomicron,其效应可能是由于与某些其他物种的相互作用,例如B. uniformis,已知其部分恢复了高脂肪饮食诱导的肥胖效应。
03
健康与肥胖人群中的细菌比例
有研究发现,健康人群和肥胖人群中的拟杆菌门和厚壁菌门比例存在不同。但是将健康受试者与肥胖受试者用拟杆菌与厚壁菌的比例区分开来的一个有争议的话题。
•支持的证据
一项研究调查了遗传易感肥胖小鼠及其接受相同多糖饮食的正常野生型同胞的盲肠微生物群之间的差异。
在肥胖小鼠中,拟杆菌数量减少,而厚壁菌的相对丰度较高。一年后,在比较肥胖和正常时发现了类似的结果。
•反对的证据
然而,同一组在比较正常人和肥胖人双胞胎时观察到了有争议的结果。然而,此处观察到拟杆菌显著减少,与厚壁菌没有关联。
除此之外,使用16s rRNA基因的类似管道和区域重新分析前面提到的文章的数据集和其他公开可用的数据也导致了与拟杆菌与厚壁菌比率相关的矛盾结果。
鉴于人类肠道中这两个门所代表的目、科、属的物种众多,这些门水平上相互矛盾的肠道微生物群结果并不令人惊讶。
另一方面,厚壁菌门是如此广泛,以至于说某个菌属于厚壁菌门,但是不同菌的功能差别很大。
此外,这些门中分类上不同的细菌具有截然不同的属性。拟杆菌门中最重要的例子是普氏杆菌属和拟杆菌属,它们往往相互排斥。当比较多个研究时,将每个门的细菌汇集在一起时,预计会出现相互矛盾的结果。
因此,目前还不鼓励使用拟杆菌与厚壁菌的比例来区分健康人群与肥胖人群。我们在检测实践中也发现部分肥胖人群拟杆菌比例较高。
Prevotella与Bacteroides的比例
在引入肠型后,在拟杆菌门内做出了更合适的区分,即Prevotella和Bacteroides的比率。
与Bacteroides相比,Prevotella个体在食用左旋肉碱时血浆氧化三甲胺浓度较高。
以Prevotella为主的肠道微生物群往往与素食主义或非工业化的富含膳食纤维的饮食有关。这些例子可以在非洲、南美洲或者东南亚狩猎采集者或农村人口进行的几项研究中找到。
✦Prevotella与Bacteroides更利于减肥
研究很好地说明了饮食和环境导致的从普氏杆菌向更为拟杆菌主导的肠道微生物群的转变,来自泰国农村的人移民到了美国。不出所料,这种转变也伴随着体重的增加。
关于减肥方案,这一比例很重要,因为普氏杆菌与拟杆菌比例较高的受试者在膳食纤维含量较高的情况下更容易减肥。
研究发现,给予辣椒素时,拟杆菌量较多的受试者体重减轻更多,在此强调了个性化营养的必要性。
04
肥胖与肠道微生物的研究分类
为了更好更有条理地研究肥胖与肠道微生物之间的关系,需要将微生物进行研究分类。
大多数关于肥胖与肠道微生物群之间关系的研究通常将个体分类群与病理生理途径联系起来,以建立与肥胖的联系。
影响微生物的因素
细菌并不存在于真空中,所以它们的生长速度以及它们能够进行的代谢活动取决于外部环境因素。
这些外部因素包括pH、胆汁酸和底物可用性。所有这些反过来又取决于微生物组分本身;这意味着一种细菌的功能受其周围所有其他细菌的影响。
更直接地说,各种细菌种类依赖于其他细菌种类为它们提供中间底物(其他细菌的废物),并且反过来,依赖于将消耗其自身废物(发酵产物)的其他细菌,以使其从中获得能量的生化转化在能量上有利。
同一物种的不同菌株可能存在很大差异
通常使用不同的分类水平(门/科/属/种)来归因特定的特征和关联,而物种的功能甚至在同一属内,甚至是目前被认为属于不同菌株的细菌。相同的物种,可以有很大的不同。
因此,旨在通过查看更高的分类级别来限制分类组数量的降维策略通常应该优选地限制在类属级别。
同一物种的不同菌株可能具有也可能不具有归因于它们的特定功能,正如在碳水化合物活性酶中观察到的那样。如果高度相似的基因存在于多种细菌中,则可能还会出现冲突模式。
越来越多的研究人员在过去几十年中得出结论,与肥胖相关的有益影响应归因于肠道微生物群中的多个参与者协同工作。而这种关联的紊乱可以被视为生态失调的一种形式。
微生物成员分组
——由于上述个体分类群分析的缺陷使得难以找到特定于健康结果的具有生物学意义的模式,因此创造了两个不同的术语来将个体微生物组成员分组。
▸ 微生物“聚类”
应用了“guild”这个术语,这在宏观生态学中已经众所周知。它包括“以类似方式利用同一类环境资源的一组物种”,后来成为“功能组”的同义词。
通过构建基于微生物丰度协变的共丰度组,给出了一个框架,以更生态有意义的方式解开肠道微生物组与人类健康之间的关系。这将克服目前对基于分类单元的分析和以基因为中心的分析存在问题的各种缺点。
▸ 营养网络
另一个术语称为“营养网络”,营养网络被定义为微生物种群形成代谢相互依赖的生物体的食物网,随着时间的推移以相关的方式稳定地建立。
小结
通过观察微生物聚类或特定的营养网络,可以实现对与健康和肥胖相关的肠道生态学的更有意义的解释。
此外,将数百个分类群聚集到有限数量的微生物聚类或营养网络中将有助于降低维度,从而有可能应用经典统计数据来限制与校正多重测试相关的问题。
尽管基于微生物聚类的方法似乎是一种有前途的方法,在了解肥胖儿童的体重调节方面观察到了附加价值,但与肥胖本身的相关性仍有待阐明。
05
微生物多样性与人体健康有关
α多样性与疾病状态有关
——在区分肥胖受试者和健康受试者时,一个常见的观察结果是他们平均较低的α-多样性。
在许多其他疾病中也观察到相同的情况,例如克罗恩病、肠易激综合征和结肠直肠癌。因此,微生物多样性的丧失通常与各种疾病状态有关。可以说,断奶后肠道α多样性降低是与各种人类状况相关的普遍特征。
在成年人中,较高丰度的细菌(如Akkermansia muciniphila和F. prausnitzii)通常与较高的α多样性相关。
丰富的A. muciniphila与BMI、炎症标志物、脂质合成和总脂肪组织重量呈负相关。
▸ α多样性是什么?
α多样性主要关注局域均匀生境下的物种数目,因此也被称为生境内的多样性。α-多样性是由扩散、局部多样化、环境选择和生态漂移共同形成的。
多样性本身不仅仅是健康的指标,因为多种高丰度的病原体持续存在一般不会让肠道感觉 “幸福”。
相反,更高的α多样性应该被视为存在发育良好和扩展的微生物营养网络,它们共同导致发酵能力的提高。
✦低α多样性下的肠道微生物
富含拟杆菌的微生物群倾向于具有较低的α-多样性值、较简单的营养网络,并且更容易下降。
这种低α-多样性组合物通常富含诸如肠杆菌科、梭杆菌属、链球菌属、瘤胃球菌属和各种拟杆菌属物种的物种。
这种益生菌组合物在肠型方面与拟杆菌2肠型最为相似,最终会是肥胖和2型糖尿病的危险因素。
营养网络被破坏导致α多样性减低
研究表明营养网络的彻底破坏以及由此导致的α-多样性、基因丰富度和肠道发酵能力的极大降低。
调查了(抗生素治疗)危重儿童的肠道微生物群、粪便短链脂肪酸和胆汁酸谱。由于缺乏代谢和发酵能力,这些儿童的初级胆汁酸与次级胆汁酸的比例较高,但短链脂肪酸的产量极低,而碳水化合物发酵的中间产物,如乳酸盐和琥珀酸盐与健康对照儿童相比含量增加。
后一项发现,加上剩余的未发酵糖组分、较高水平的未接触蛋白质和更松散的粪便,突出了肠道中剩余的发酵仍然处于糖分解阶段。
Christensenellaceae营养网络
——一个与高α-多样性和健康相关的特定营养网络
与肥胖受试者相比,体重指数正常的健康受试者的Christensenellaceae水平更高。
Christensenellaceae和寄主BMI之间的关联被认为是最稳健的关联之一。在无菌小鼠体内移植来自人类供体的富含菊苣科植物的粪便可减少肥胖。在富含瘤胃球菌科或厚壁菌的肠型的人中,Christensenellaceae通常很丰富。
如上所述,不应将Christensenellaceae视为一个独特的独立实体,因为它始终与其他细菌和古细菌形成营养网络。
✦Christensenellaceae与古细菌的关联
Christensenellaceae与一种古细菌——Methanobrevibacter smithii 的关联可能是这一营养网络最典型的部分。
M.smithii 从微小梭菌产生的氢气中产生甲烷。如果这种营养网络与低BMI之间存在因果关系,则仍然相当不确定。
除了M. smithii是这一营养网络的一部分外,一项比较意大利瘦弱和肥胖老年人的研究发现,Christensenellaceae、Rikenellaceae和Porphyromonadaceae之间存在相关性。
在日本的一个队列中,调查了不同地区健康成年人的粪便样本,Christensenellaceae与各种其他细菌也与BMI呈负相关。
注意
鉴于α-多样性、瘦弱性和Christensenellaceae细菌营养网络之间的紧密联系,未来将继续从机制上研究这种联系。还应注意的是,该营养网络对于短链脂肪酸生产的重要性尚未确定。
虽然Christensenellaceae和Methanobrevibacter可能仅占总微生物群的一小部分,但它们所代表的核心指示物种的营养网络在不同种族中绝不是一个小角色。这种营养网络,其中各种物种彼此之间非常密切相关,具有肠型定义潜力。
Prevotella stercorea营养网络
另一个营养网络,通常在工业化国家的人们中代表性不足,是Prevotella stercorea营养网络,它可以被视为Prevotella肠型组成中的一个重要因素。
这个营养网络的建立首先是通过观察冈比亚儿童正在发育的肠道微生物群来广泛描述的。P. stercorea与Succinivibrio dextinosolvens和Paraprevotella xylaniphila等形成一个大型营养网络,并且类似地与高α-多样性相关。
✦肠道Prevotella的特征
肠道普雷沃氏菌是一个完美的例子来展示微生物“聚类”和营养网络之间的区别。
在人群范围内的研究中,例如使用多民族队列研究的数据,被定义为肠型普氏杆菌的人通常具有非常高的P. stercorea水平和与P.stercorea营养网络相关的高水平物种。
当在分层聚集的热图中可视化时,P.copri和P.stercorea营养网络中的物种聚集在一起。然而,这种共同发生主要是由于粪便中的Prevotella(包括P.copri、P.stercorea和其他许多普氏杆菌属)和Bacteroides/Phocaeicola.之间的强烈拮抗作用。
P.copri和P.stercorea营养网络在同一环境中表现良好(Bacteroides贫乏),但P.copri的高丰度完全独立于P.stercorea营养网络发展,这可以通过跟踪儿童在前3个年的肠道微生物群成熟情况看出多年生活在一个每个人都会发展出富含Prevotella的肠道微生物群的环境中。
12个月后,P.copri成为优势种并保持优势,而与P.stercorea营养网络相关的物种丰度在生命的前30个月以相互依赖的方式缓慢增加,直到达到稳定水平。推测在P. stercorea的营养网络中存在着各种代谢产物的交换,值得进一步研究,特别是与Prevotella肠型生产短链脂肪酸的能力增加有关。
✦Prevotella与健康相关
与肥胖率上升最快的工业化国家相比,肠型拟杆菌相关的拟杆菌和种类在冈比亚并不多见。
肠道中的Prevotella本身也与较低的BMI相关,并且已观察到低密度脂蛋白胆固醇与肠道Prevotella呈负相关,这表明在非工业化国家,肠道Prevotella与健康有关。
06
肥胖与肠道微生物的未来研究方向
尽管使用大型队列的关联研究对于试图解开与肥胖相关的肠道微生物组的极端复杂性至关重要,但其他几种研究途径也具有潜力,其中一种是粪菌移植。
粪菌移植
▸ 定义
粪菌移植,是将粪便从瘦供体转移到受体。也称为“人类肠道微生物群转移”、“粪便移植”和“粪便细菌疗法”。
✦粪菌移植的作用
粪菌移植已被证明是比抗生素更有效的复发性艰难梭菌感染 (CDI) 治疗方法。然而,与肥胖不同,从病理学的角度来看,CDI是一种相对简单的疾病,其中肠道微生物群的因果关系是明确的。
在一项对患有胰岛素抵抗的肥胖受试者进行的粪菌移植试验中。受试者接受自己的粪便(自体)或瘦供者粪便(同种异体)。短期内在接受瘦供体粪菌移植的受试者中观察到对胰岛素敏感性的有益影响。
进一步研究表明基线肠道菌群有利于粪菌移植的成功。在这里,当接受同种异体粪菌移植时,在α-多样性降低的受试者中,粪菌移植成功率更高。
总的来说,与那些肠道微生物组组成尚未严重恶化的受试者相比,那些α-多样性较低的受试者有更大的改进空间。
✦其他影响粪菌移植的因素
一项研究,其中包括几个调查不同疾病的粪菌移植队列,显示生态变量(如低α-多样性)与临床变量(如抗生素治疗和灌洗)一起在植入成功中发挥作用。
他们进一步表明,通过合并供体样本来增加α-多样性预计不会增加供体菌株的植入,这表明合并供体样本在功能上并不等同于单个高α-多样性供体样本。
对队列进行的分析表明,P.copri对接受同种异体粪菌移植的受试者具有有益的影响。P.copri与BMI、C反应蛋白和空腹胰岛素水平进一步呈负相关。
此外,肠道微生物群的变化可能与特定血浆代谢物水平和血浆单核细胞中DNA甲基化的变化有关,为肠道微生物群影响肥胖相关疾病的机制提供了额外线索。
验证细菌植入的生物学工具
最近开发了几种工具来帮助解开粪菌移植中肠道微生物组与肥胖之间的关系。
为了验证来自瘦供体的菌株是否已移植到受体中,需要进行菌株跟踪分析。比较了七种不同的生物信息学工具,用于在数据集上进行应变跟踪。
减轻肥胖和相关疾病负担有前景的方法
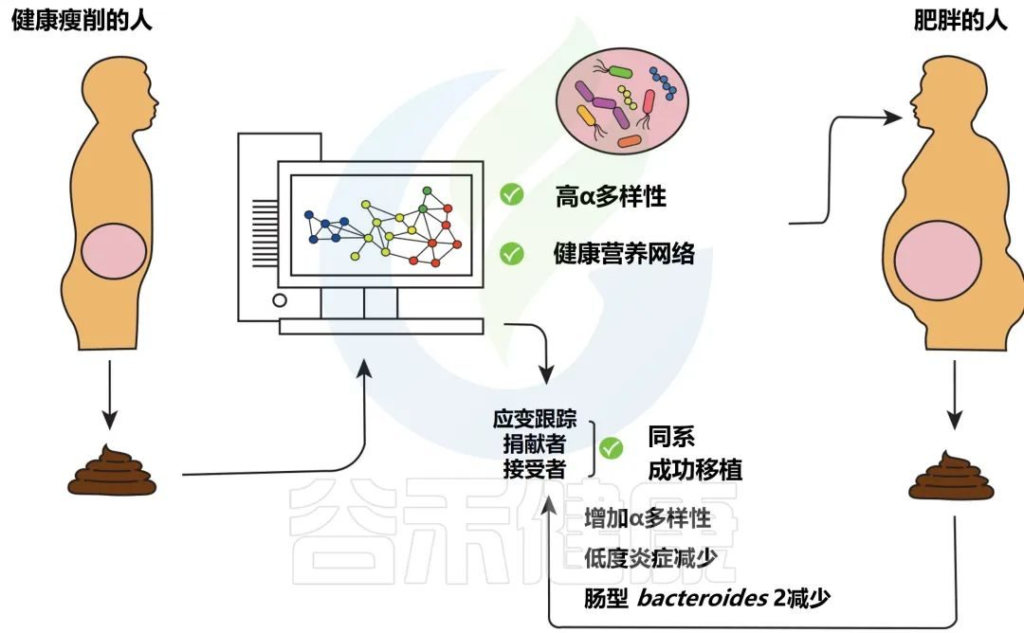
Levin E,et al.Therap Adv Gastroenterol.2022
分析健康瘦供体粪便的微生物组成,以选择具有高 α 多样性(以及其他)的供体,这可以被视为存在复杂的健康相关营养网络的标志。
如果合适,然后将高α多样性供体的粪便转移到肥胖的接受者身上,这可能会减轻低度炎症。在粪菌移植之后,使用菌株追踪在接受者的粪便中追踪肠道微生物群基因组中特定位置的特定SNP的供体菌株验证。
在这里,观察到概率工具在宏基因组测序数据上表现最好。然而,随着最近开发的两种新的应变跟踪工具,这一技术领域仍在快速发展。
其中一个工具是基于物种特异性标记基因中的单核苷酸变体跟踪菌株,另一个是先前发布和改进的进一步构建工具,应用应变跟踪方法。
在接受粪菌移植后调查了受体中的菌株植入,观察到供体和受体特异性菌株可以共存。与此同时,发现肥胖受试者的粪菌移植胶囊会导致微生物群落组成发生变化,从而导致受试者从一种肠型转变为另一种肠型。这随后改变了菌群的代谢潜力。微生物组向供体的转变与α多样性呈正相关。
此外,肠道微生物群组成的变化在治疗后持续26周。本研究结合了多个供体的粪便,并表明一些供体具有用于移植的高效微生物群,这意味着供体粪便的组成和整个营养网络的转移,而不是添加单个分类群的重要作用。
07
预防和治疗肥胖的建议
预防肥胖
——鉴于肥胖症如此普遍,并且考虑到治疗的难度,预防尤为重要。
为预防超重和肥胖,人们应该根据自己的营养需求进食和饮水,定期锻炼,定期检查体重。
•少吃高热量食物
就营养而言,他们应该少吃高能量密度的食物,多吃低能量密度的食物。由于水分或纤维含量高而能量密度低的食物,如全麦制品、水果和蔬菜,相对来说更能饱腹,能量含量也较低。地中海饮食有助于预防超重和肥胖。
还应减少酒精、快餐和含糖饮料的消费。快餐通常含有高比例的脂肪和糖,因此能量很高。不仅是加糖的饮料,还有果汁和果汁饮料,含糖量也很高。
•避免久坐或不活动
经常坐着看电视或上网和类似活动的不活跃生活方式会促进体重增加。在日常活动和休闲活动中进行锻炼具有预防作用。这个目标最好通过每周2小时以上的以耐力为重点的体育锻炼(使用大肌肉群)来实现。
肥胖的治疗方法
✦饮食疗法
为了减轻体重,目标应该是遵循减量饮食,这将产生约500kcal/天的热量缺口,或在个别情况下更多。
每天500至600kcal的能量缺口将使体重减轻,以约0.5kg/周的速度发生,持续12周最多24周。
低碳水化合物饮食在开始时会比其他饮食导致更剧烈的体重减轻,但一年后就看不到差异了。过去几年的几项大型研究表明,常量营养素组成(脂肪、碳水化合物和蛋白质的比例)与减肥无关。各种减脂饮食可在1至2年内减掉约4公斤。个人经验、知识和资源比营养关系更重要。
✦益生菌帮助减肥
已经证明几种益生菌,单独使用或以共生混合物的形式使用,能够通过物种和菌株特异性机制(例如,肠道微生物群调节、降低胰岛素抵抗、更强的饱腹感)来治疗肥胖。
更具体地说,乳酸杆菌和双歧杆菌物种由于其低致病性和低水平的抗生素耐药性而已成功用于成熟的肥胖动物模型。
益生菌对减肥作用的一些实验
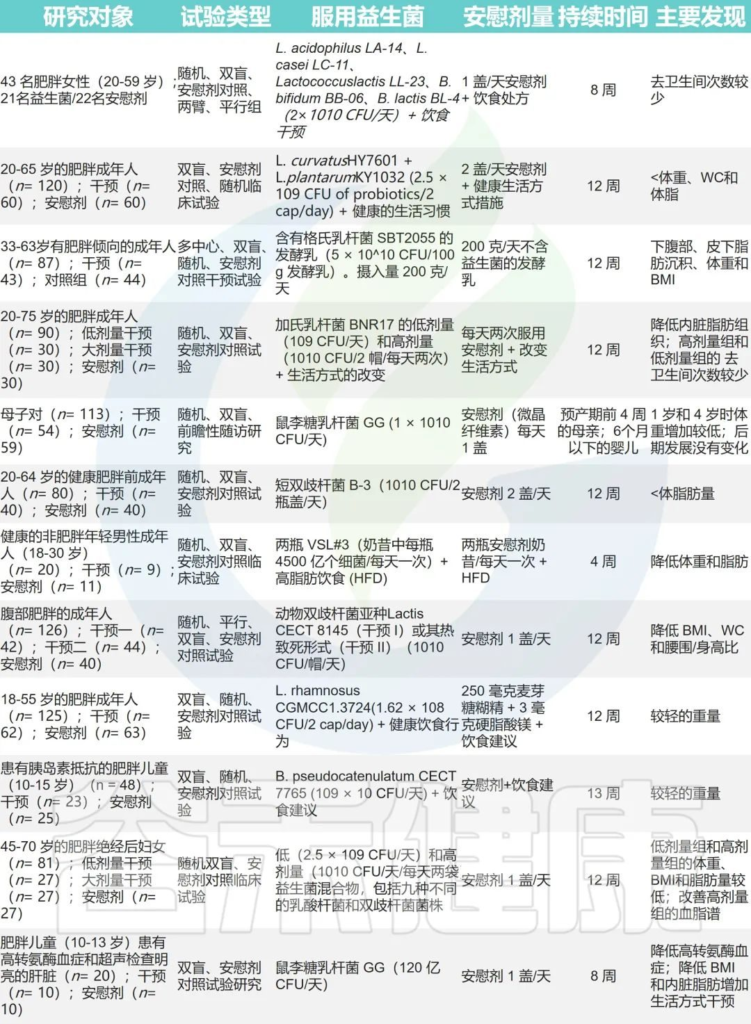
Abenavoli L, et al. Nutrients.2019
与安慰剂组相比,这些治疗导致不同程度的体重增加减少和脂肪累积减少。
所以在一些时候,我们可以利用例如乳酸杆菌等益生菌来帮助我们减肥。
✦增加运动
有效的减肥需要>150分钟/周的运动,能量消耗率为1200至1800kcal/周。单独的力量训练对于减轻体重作用不大。
运动中消耗的能量常常被高估。当使用大肌肉群,强度适中到高,运动时间长时,体重减轻是可以预期的。对照良好的研究和荟萃分析显示,在6至12个月内体重减轻了约2公斤,腹部脂肪减少了约6%.
应该向超重和肥胖的人解释运动的健康益处(代谢、心血管和社会心理),无论体重减轻如何,这些益处都会产生。即使在肥胖个体中,增加运动的健康价值也不仅仅体现在体重减轻上。
✦行为矫正干预
在团体或个人中,基于行为方法的干预应成为减重计划的一部分。
干预的主要目的是改变营养和运动方面的生活方式,并且可以由合格的非心理治疗师进行。如果伴随超重或肥胖的症状更严重,精神科医生或心理治疗师应参与患者管理,并应支持患者进行饮食治疗和锻炼。
08
结语
肥胖和肠道微生物群以多种方式交织在一起。饮食的类型及其数量会影响能量的可用性并因此影响肥胖,但也会强烈影响肠道微生物组,这反过来又可以放大饮食的致肥胖特性,或另一方面提供各种保护性益处。
许多微生物衍生的代谢物,包括短链脂肪酸、胆汁酸、吲哚和其他氨基酸,对健康同样至关重要。过量或缺乏这些,或者更具体地说,在任何这些方式中改变的整体组成,都可能是致肥胖的。
通过本文更好地了解肥胖以及其发病机制与微生物组之间的关系,有助于在日后的生活中更好地应对肥胖,使人人都有一个健康的身体。
主要参考文献
van der Vossen EWJ, de Goffau MC, Levin E, Nieuwdorp M. Recent insights into the role of microbiome in the pathogenesis of obesity. Therap Adv Gastroenterol. 2022 Aug 9;15:17562848221115320. doi: 10.1177/17562848221115320. PMID: 35967920; PMCID: PMC9373125.
Canfora, EE, Meex, RCR, Venema, K, et al. Gut microbial metabolites in obesity, NAFLD and T2DM. Nat Rev Endocrinol 2019; 15: 261–273.
Abenavoli L, Scarpellini E, Colica C, Boccuto L, Salehi B, Sharifi-Rad J, Aiello V, Romano B, De Lorenzo A, Izzo AA, Capasso R. Gut Microbiota and Obesity: A Role for Probiotics. Nutrients. 2019 Nov 7;11(11):2690. doi: 10.3390/nu11112690. PMID: 31703257; PMCID: PMC6893459.
GBD 2015 Obesity Collaborators . Health effects of overweight and obesity in 195 countries over 25 Years. N Engl J Med 2017; 377: 13–27.
Chauhan, S, Jena, KK, Mehto, S, et al. Innate immunity and inflammophagy: balancing the defence and immune homeostasis. FEBS J. Epub ahead of print 26 November 2021.
Beukema, M, Faas, MM, de Vos, P. The effects of different dietary fiber pectin structures on the gastrointestinal immune barrier: impact via gut microbiota and direct effects on immune cells. Exp Mol Med 2020; 52(9): 1364–1376.

谷禾健康

每个人的一生都会经历很多,从出生到长大,健康到衰老疾病。你的出生、遗传、家庭环境、很大程度上决定的人生起点,日常的饮食、行为习惯决定你的身体成长,一些不同的选择或意外的事件又会让人生有很多起伏和不同。
每个人的菌群和我们的人生一样也是独一无二的,我们菌群的特点反映着不同人各自生活的烙印。从母亲的腹中开始影响和决定了我们最初的菌群,出生方式、喂养的食物、用药等都决定了我们的菌群基数。当我们开始从喝奶到开始摄入辅食,我们的菌群也同样迎来巨大的演变。当我们生病、感染、运动、饮食、社交、虚弱、衰老这些同样反映在我们菌群的变化和演替上。
相对的,当我们更多的了解我们的菌群,善待和改善它们,同样的变化也会出现在我们的身体和生活中。
越来越多的证据表明,年龄与人类微生物群之间的关联很大,肠道微生物群是许多年龄相关变化的核心,包括免疫系统失调和疾病易感性。几个身体部位的微生物组成可以相对准确地预测人类的年龄。
谷禾健康肠道菌群检测数据库中,也有关于肠道年龄预测:
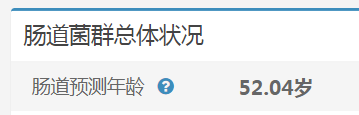
谷禾健康-肠道年龄预测模型图
<来源:谷禾健康肠道菌群数据库>
可以看到,肠道年龄和生理年龄基本是符合的。健康人的肠道菌群年龄恰恰是最符合真实年龄的,与真实年龄差异大意味着肠道菌群出现偏离。
健康的人存在更多样化且平衡的肠道菌群。微生物群中与年龄相关的变化归因于生理,生活方式和健康状况。这些因素中的每一个都与某些菌群的相对丰度变化有关。
例如,饮食、卫生、兄弟姐妹、宠物、过敏、儿童疾病和抗生素是影响儿童微生物组的一些突出因素。到了成年期微生物群相对稳定,而到了老年期,一些有益菌开始逐渐下降,菌群又向另一个阶段过渡。
在从出生到死亡和分解的每个生命阶段,微生物群落都是身体的动态组成部分。研究微生物群的自然和诱导变化有可能彻底改变我们对人类生物学的理解。
本文介绍了健康人的微生物群在一生中的变化,讨论了从出生时菌群构成,到疾病或抗生素使用时的变化,再到死亡时的微生物扩展的各个阶段,以及这些阶段在身体部位和组成(细菌、真菌或病毒)上的差异。了解微生物群与年龄关系的未来研究方向,以此对人体微生物群及基于此的干预有更好的了解。
微生物群落存在于人体的每个粘膜表面,人的每个身体部位都有一个独特的生态学。每个人的微生物群像指纹一样,都是独特的。
在个体内,特定的身体部位、地理位置和个体的年龄与健康微生物群具有极强的关系。年龄驱动人类微生物群的α多样性和β多样性。
在了解各个阶段的微生物群变化之前,我们先了解一个概念:微生物演替。
微生物演替是指微生物群落中一种或多种生物的存在、相对丰度或绝对丰度的变化。
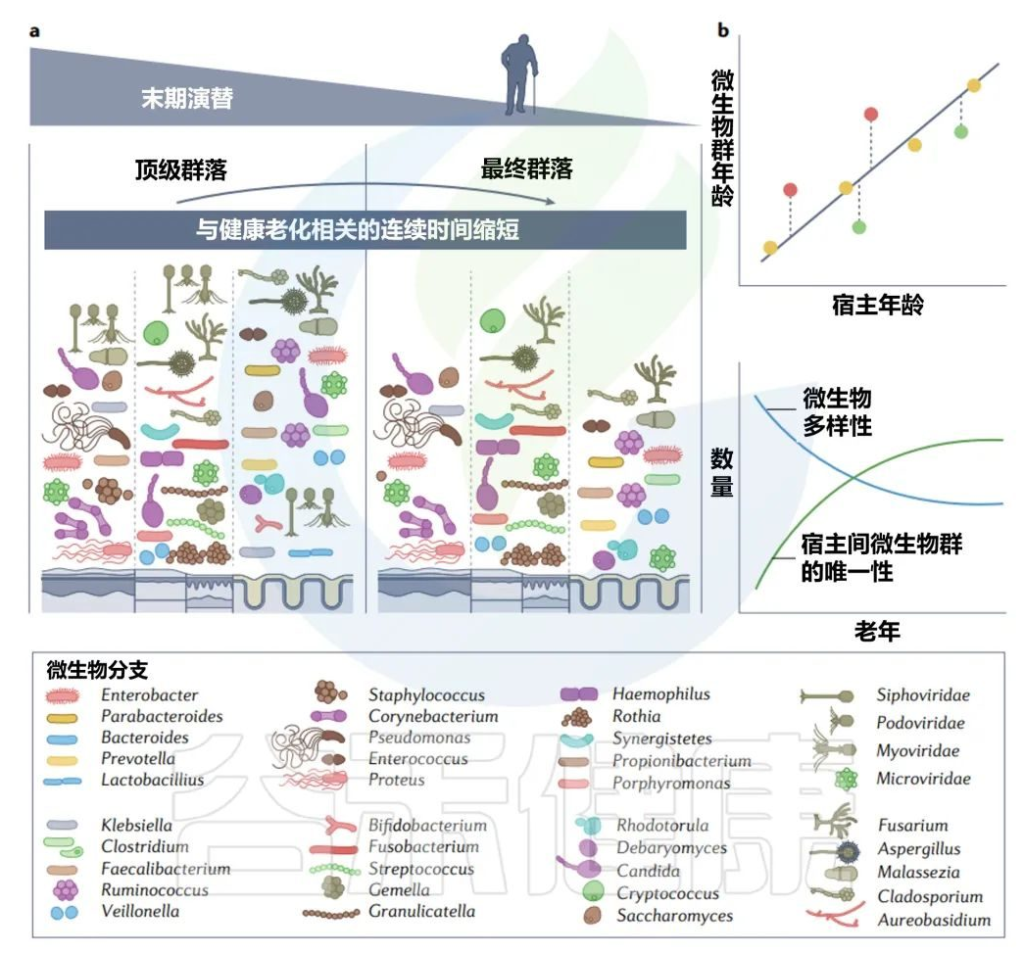
在正常或健康衰老期间,微生物演替的三个主要阶段自然发生在人类生活中。
✦初级演替(出生时先锋菌群定植,快速变化直到童年晚期)
第一阶段,初级演替,从先锋物种首次建立群落时开始,随后微生物群落发生快速变化。从出生到童年,变化率降低,许多中间物种存在于出生到童年晚期之间。
初级演替结束于顶级群落的形成,在青春期实现,并在很大程度上持续到成年;该群落的特征是其相对稳定。
虽然成年期的微生物群比儿童期更稳定,但仍然存在变异,这引发了关于人类微生物群中是否存在顶级群落的争论。成年微生物群的自然变异存在于小时(昼夜节律)到年(老化)的时间尺度上,但微生物群相对稳定,除非存在干扰,如饮食或药物的改变。
✦次生演替(菌群的改变,重建)
下一个阶段,即次生演替,发生在一个先前存在的稳定群落一部分被改变或移除之后,然后群落再生到相同的状态或不同的状态。这可以通过抗生素等医疗手段人为实现,也可以通过霍乱弧菌感染等疾病自发实现。
人类的次生演替的特征是至少有一段时间的随机过程占主导地位。在诱导条件下,如单疗程抗生素,群落遵循类似于初级演替的过程,其中现有微生物群落的一部分充当“微生物记忆”,帮助重建一个类似于以前存在的群落。
这一过程被认为是由核心微生物群驱动的,而不是驱动初级演替的先锋微生物。
✦末期演替(自然衰老和死亡阶段)
最终的末期演替是宿主自然衰老和死亡的一部分。在老年期间,微生物群落再次以更高的变化率,成功产生了一个由更少成员组成的群落,通常变形菌门(也称为假单胞菌)的相对丰度增加,有时占总优势。
研究演替的每个阶段使研究人员能够解决与人类相关的微生物群落是如何形成和维持的。通过了解这些过程,我们可以更好地了解微生物群随着年龄的增长的变化及其与人类健康的关系,了解如何管理微生物群。
人类相关微生物群从受孕到死亡的变化
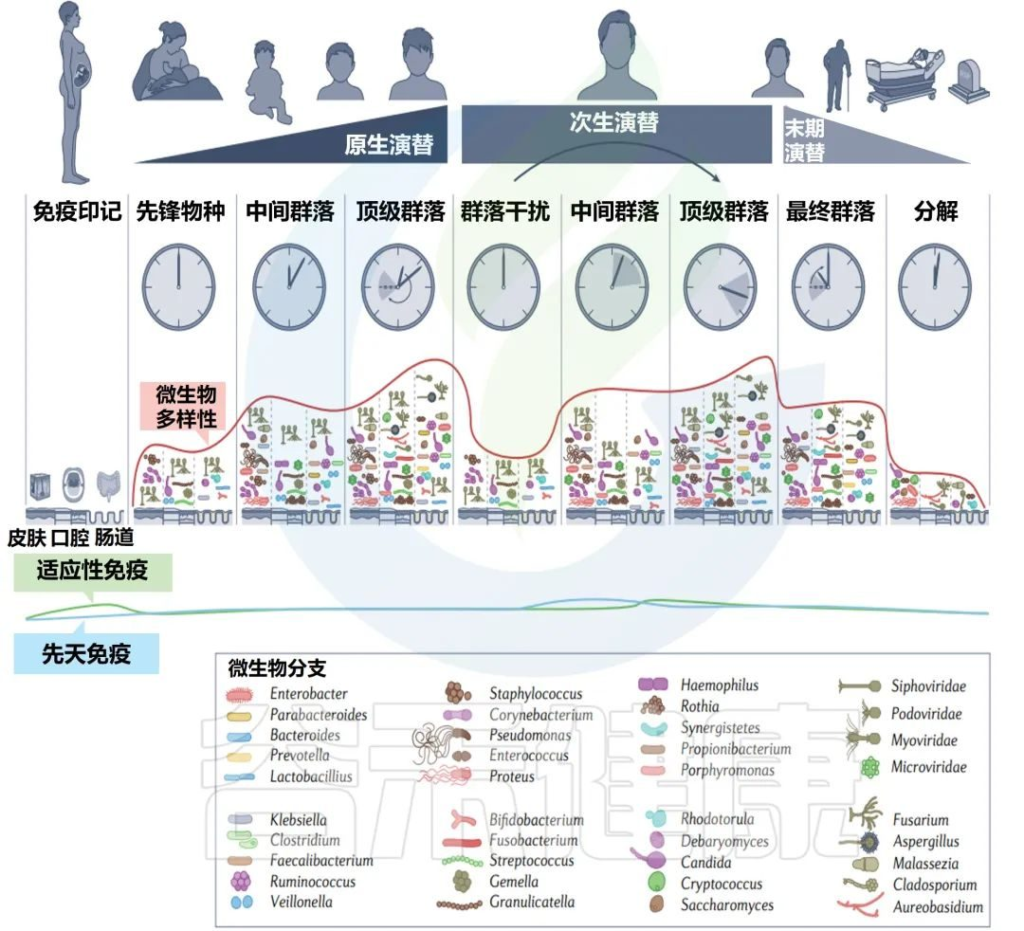
Martino C,et al.Nat Rev Microbiol.2022
常驻细菌、真菌和病毒的多样性在人类生命的各个阶段都会发生变化。模拟时钟代表每个微生物群落阶段发育的宿主年龄的相对时间。
免疫印记在出生前通过母亲的微生物群及其代谢物开始(第一栏)。先锋物种的初始定殖始于出生,身体部位特定的微生物群落出现(第二栏)。这些群落的复杂性不断增加,直到它们达到相对稳定的群落结构(第三列和第四列)。
这些微生物群落的次生演替可能来自内部和外部扰动(第五栏)。中间微生物重新建立初始群落,并再次达到稳定状态(第六列和第七列)。
在晚年,随着寄主接近自然死亡,群落经历了最后的演替和变化(第八栏)。微生物演替的最后阶段发生在腐败和分解阶段。在此阶段,多样性进一步下降,在最初的24-48小时内,许多人类微生物群结构保持不变,但随后很快开始侵蚀分解(第九栏)。
绿线和蓝线分别显示了微生物演替不同阶段的适应性免疫和先天免疫的相对强度。
不同年龄段的细菌多样性测量
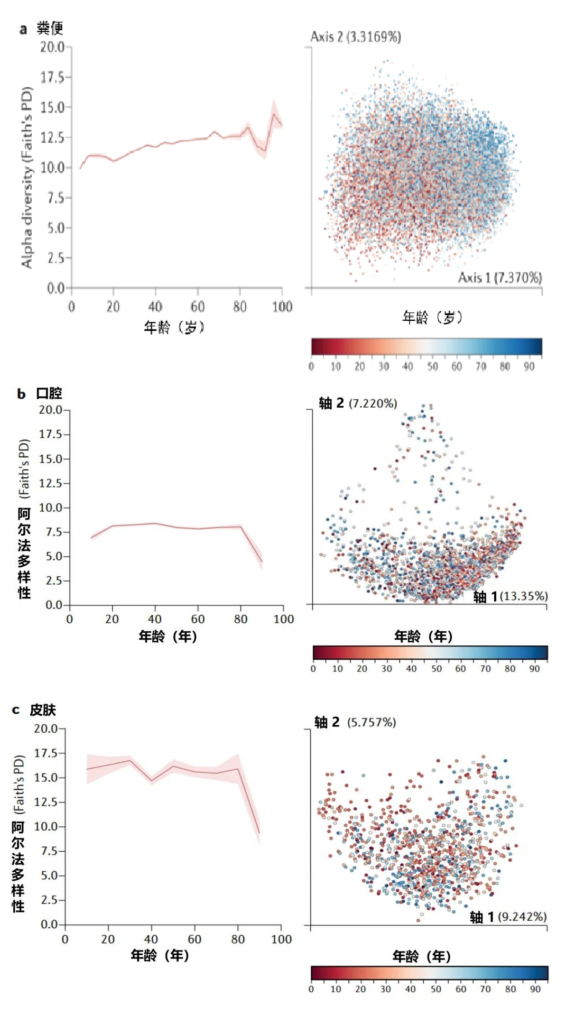
Martino C,et al.Nat Rev Microbiol.2022
美国一个肠道项目集中测量了从儿童到老年的人类粪便(a部分)、口腔(b部分)和皮肤(c部分)微生物群的细菌多样性和系统发育史,该项目包含21919个粪便、1920个口腔和998个皮肤微生物群样本,带有16S核糖体RNA基因扩增子序列。
α多样性,一种对样本中不同类型微生物数量的定量测量,通过Faith的系统发育多样性(PD)α多样性度量跨年龄测量。
UniFrac β多样性主坐标分析,一种用于比较微生物群落相似性的方法,其中空间上接近的点表示相似的样本,空间上远离的点表示不同的样本,按年龄着色。
✦胎儿时期——菌群及代谢物影响免疫发育
塑造人类微生物群的第一个因素来自胎儿发育过程中的母亲。
胎儿通过胎盘接触到母亲微生物群落产生的代谢物,这些代谢物会影响其免疫系统,并会影响正常微生物群和后期病理学的各个方面。代谢物,如短链脂肪酸(乙酸盐)和其他微生物化合物,可以通过胎盘转移到胎儿体内,并影响免疫发育。母亲的饮食和健康也会影响这些代谢物。
胎儿组织中的乙酸盐影响与成人调节性T细胞生成相关的表观遗传印记,其与防止生命后期哮喘的发展相关。
✦出生后——菌群受出生模式,饮食,环境等影响
出生后,微生物群落根据身体部位迅速分化。
在最初的时候,先锋物种和未来4年的群落发展可能会受到出生模式和妊娠时间的影响。中间群落由饮食影响,如母乳或配方奶粉的消费,以及环境。
最后,饮食和环境再次塑造了稳定的顶级群落。主要由真菌、细菌和病毒组成。
子宫内和生命早期的主要演替
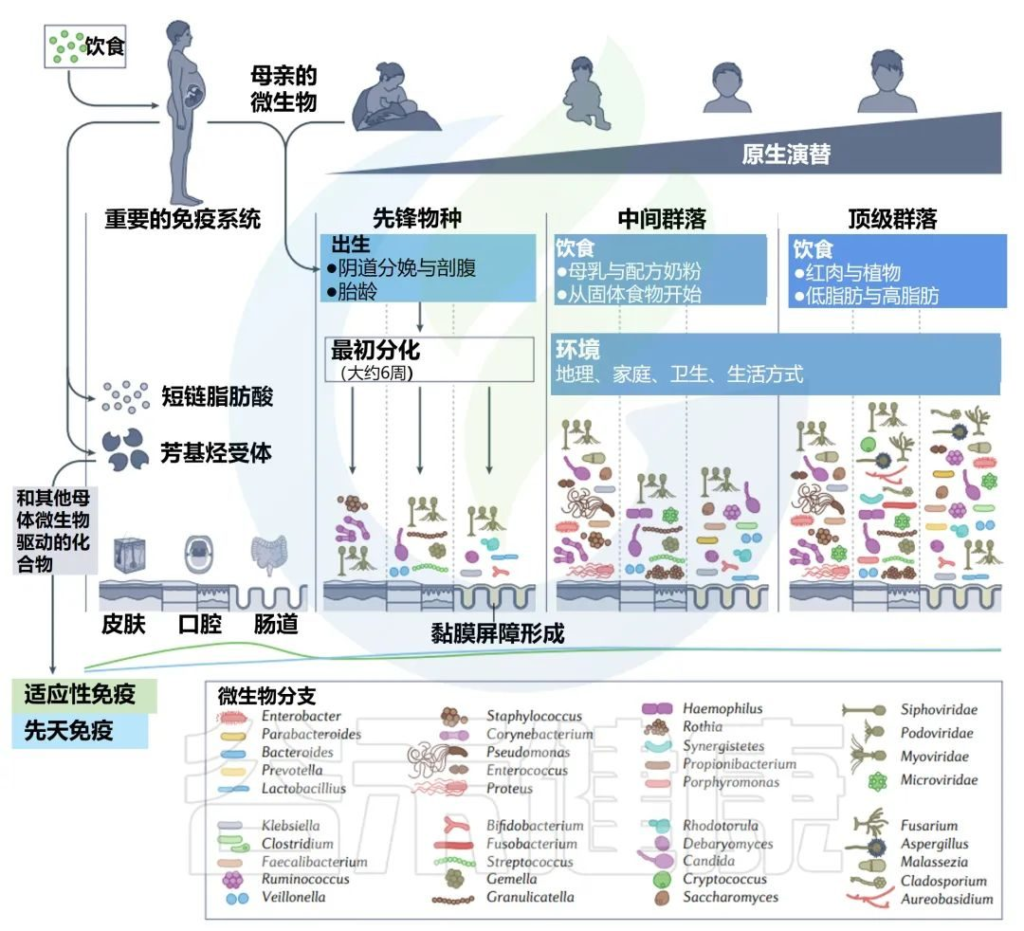
微生物代谢物和配体调节宿主芳基烃受体,这有助于塑造新生儿微生物和免疫发育。母亲使用抗生素和胃肠道相关疾病,如炎症性肠病,也被认为会通过胎儿免疫系统的印记增加后代的病理风险。
然而,这些联系仅在非人类实验中研究过。在一个案例中,由患有炎症性肠病的孕妇或其新生儿的微生物群所定殖的无菌小鼠继续发展出异常微生物群和指示炎症性肠病的免疫发育。
✦怀孕期间母体的微生物群与免疫系统的变化
在怀孕期间,母亲的微生物群和免疫系统也发生了改变。母亲的阴道微生物群变得更加多样化,通常由在其他身体部位发现的许多微生物群组成。
孕期母体免疫系统与胎儿形成协同作用,包括通过胎盘转移IgG抗体。
关于出生时获得的微生物群是否通过混合来源于阴道和粪便,或者阴道微生物群本身在出生时是否具有多能性,是否是微生物先驱的主要来源,存在一些争议。
无论确切的母体来源如何,这一阶段的特征是先锋细菌种类。包括下列菌群:
然后这些细菌定居在常规身体部位:肠道、口腔和皮肤。
许多先锋细菌是兼性厌氧菌,它们会消耗氧气,从而使专性厌氧菌能够在以后的每个环境中定居。起初,新生儿的每个身体部位都相对未分化,但先锋微生物很快开始启动身体部位依赖性微生物多样性的级联,至少在生命的第4到第6周,每个部位的细菌都可以很容易地区分。
先锋细菌进驻后,生命早期的微生物群逐渐开始形成。接下来的章节我们来了解生命早期的肠道,口腔,皮肤等各部位的微生物群(包括细菌、真菌、病毒等)。
✦肠道细菌群——双歧杆菌主导
人类肠道细菌群落的发展已经得到了很好的研究。
双歧杆菌属一直占主导地位,直到在生命的第一年结束时,它们被双歧杆菌、梭状芽孢杆菌和拟杆菌属的组合所取代。拟杆菌属的丰度增加,而双歧杆菌属等物种的丰度相对减少。
双歧杆菌分解母乳低聚糖,开始终生影响免疫系统
最近,一项研究发现,双歧杆菌等细菌含有母乳低聚糖分解代谢所需的基因,与婴儿免疫发育之间存在功能联系。特别是,接受Bifidobacterium infantis EVC001极化初始T细胞的婴儿的粪便水与来自对照组的粪便水平不同,其方式与减少肠道炎症有关。
其他菌属也可降解母乳低聚糖(如拟杆菌、阿克曼菌)
到3-6岁时,肠道细菌群落汇聚到整个成年期持续的顶级群落。这一微生物群是已知的密度最大、多样性最强的生态群落之一。通常,在这段时间内,普通健康人中只有两个细菌门占优势:厚壁菌门和拟杆菌门。
✦肠道其他微生物群——真菌、古细菌、病毒
在人类肠道发育过程中,对病毒组、真菌组和古菌组的研究远远少于细菌组。在整个生命周期中,真菌群落所占的总数远远少于细菌组或病毒组。
//真菌群落
真菌群落在生命的最初几天含有大量的Rhodotorula和Debaryomyces,接下来的一个月则是CandidaCryptococcus和Saccharomyces spp.。
到成年时,主要的真菌属是Aspergillus, Candida和Saccharomyces。
//古细菌群落
发育期间肠道的古细菌群落尚不清楚,但古细菌是一些最早的移生菌落,但丰度较低。
早期定植的古细菌包括Methanosphaera和Methanobrevibacter。
// 病毒群落:噬菌体家族在出生后就开始流行
主要由噬菌体组成的病毒群落在出生后的第一周数量众多。噬菌体家族Siphoviridae、Podoviridae和Myoviridae在出生后立即流行,主要以溶原形式整合到细菌基因组中。
到生命的第四个月,有尾噬菌体目大量生长,成员更常为裂解型(传染性噬菌体颗粒或主动复制的噬菌体)。
在成人中,Caudovirales和Microviridae在肠道噬菌体群落中占主导地位,但噬菌体肠道病毒组对个体具有高度特异性,其演替仍有许多未知之处。
与噬菌体不同,感染真核病毒的肠道病毒组主要与儿童和成人的病理相关。最近,在健康儿童和健康成人中也观察到一些感染真核细胞的病毒丰度较低,但其发生时间和流行率尚不清楚。
✦口腔细菌群:出生后几个月逐渐趋于稳定,牙齿形成后再次转变
在出生时,口腔细菌群在以下菌属中的流行率很高:
在接下来的几个月里,Lactobacillus和Fusobacterium也开始流行。Staphylococcus的丰度在出生后3个月左右达到峰值,然后稳步下降,让位与更高丰度的GemellaGranulicatella, Haemophilus和Rothia spp.
牙齿形成后,口腔微生物群再次转变,在成年期具有更高丰度的梭杆菌门, Synergistetes, Tenericutes, Saccharibacteria (TM7), SR1 。
✦口腔其他微生物:成年口腔含产甲烷菌,最常见的噬菌体群是尾状病毒
口腔真菌群落被认为比皮肤和内脏的真菌多样性少。Candida spp.是口腔的第一批真菌定植菌。对中级口腔真菌群落知之甚少,但成年人CandidaCladosporiumAureobasidium
AspergillusFusarium和Cryptococcus spp.的丰度较高。
发育过程中的口腔古菌体尚不清楚,但成年口腔中含有许多古菌产甲烷菌,包括甲烷杆菌属。
目前对人类婴儿口腔中病毒的知之甚少。在成年人中,与肠道类似,最常见的噬菌体群是尾状病毒。
口腔病毒群在本质上通常被视为病理性的(例如柯萨奇A病毒、麻疹病毒、红疹病毒和人乳头瘤病毒),并且没有对病毒群落组成进行纵向研究。然而,在无症状和健康成人中也观察到许多真核病毒分类群。
✦皮肤细菌群落:出生时母亲阴道乳杆菌属占据较多,4-5周与成人相似
皮肤细菌群落在出生时含有大量的母亲阴道乳杆菌属。到第4-5周,婴儿皮肤微生物群与成人皮肤微生物群相似,但在青春期继续变得更具位点特异性。
Staphylococcus和Corynebacterium在不同位点PseudomonasEnterobacterEnterococcus,
Proteus和Klebsiella在特定位点(如腋窝与前臂)。
✦皮肤其他微生物:马拉色菌占比较高,古细菌占4%左右
在皮肤真菌群落中,MalasseziaCandida和 Saccharomyces在生命的前30天最为普遍。对于中间群落的确切组成知之甚少,但成年真菌群落中Malassezia的丰度通常很高,估计约占真菌群落总组成的75%至90%。
关于皮肤古细菌群落的发育情况了解较少,但古细菌约占成年人菌群的4%。大体上,成年人皮肤古细菌群由Thaumarchaeota门和Euryarchaeota门代表。在成人皮肤上也发现了Halobacteriaceae和 Methanobrevibacter。
与肠道和口腔不同,健康的皮肤微生物群拥有相对较少的已知病毒多样性,很少有对其进行研究,可能是由于与低生物量样本相关的技术限制。不过,皮肤上有一些自然存在的病毒群。
以上了解关于生命早期肠道、口腔、皮肤的微生物群,那么哪些因素会给生命早期的微生物群发展带来影响?
在生命的最初几年中,有几个因素塑造并区分了微生物群落的发展。
✦出生方式和母体抗生素的使用
出生方式和母体抗生素的使用是影响人类微生物群落的研究最好、最清楚的因素之一。然而,微生物的发育可能会导致独特的结果,即使是在同居的同卵双胞胎中,这可能是由于许多未知或随机的过程。
通过剖腹产和围产期和新生儿抗生素暴露,自然微生物群落的建立过程可能会在所有身体部位受到干扰。这一发现突出了阴道微生物群落的重要性,阴道微生物群落自然含有大量Lactobacillus spp.,但在青春期发生改变,对女性健康至关重要。
一些最佳样本的婴儿发育研究,通常缩写为DIABIMMUNE ECAM和TEDDY,在婴儿出生后的前2年和3年进行了随访,重点关注抗生素使用或出生方式的影响。
在上述所有研究中,阴道分娩的婴儿的拟杆菌属相对丰度高于剖腹产婴儿。
由于缺乏建立微生物群落的天然先锋微生物群,导致可变的群落组成被认为是由随机过程而不是确定性过程驱动的,出生模式对微生物群落组成的影响直到生命的第四年仍然可见。
出生模式影响的一个例外是早产,可能是由于在出生后的头几天大量使用抗生素,其特点是无论出生模式如何,微生物发育都不稳定。婴儿微生物群自然发育的这种改变与感染、免疫疾病、肥胖和神经内分泌异常的风险增加相关。
✦母乳喂养:母乳低聚糖给菌群带来稳定性
其次,与其他因素相比,母乳喂养对微生物群的发育有很大影响。与母乳喂养相比,配方奶粉的使用导致了更高的多样性和更不确定的微生物群落。
例如,考虑到出生时肠道中双歧杆菌科的自然优势,缺乏某些母乳低聚糖作为主要营养源可能会导致初始定植的不稳定性。然而,微生物群、牛奶代谢组和免疫系统发育的多组学整合是一个活跃且快速发展的研究领域。
除了母乳低聚糖,母乳还含有其他免疫调节化合物,例如革兰氏阴性细菌的脂多糖、分泌性IgA、先天免疫因子、抗菌肽和益生元因子。
最后,所有这些因素都会影响人类免疫发育。微生物相关分子模式识别受体与微生物群衍生分子相互作用,代谢物如短链脂肪酸(与GPR43、GPR41和GPR109相互作用)和次级胆汁酸(与FXR相互作用)直接影响免疫发育。
//
这些因素加在一起,有助于形成一个独特的、相对稳定的细菌、真菌和病毒微生物群落,这种微生物群落在人类生命的大部分时间都持续存在。
前面章节了解了婴儿期初级演替期间发生的巨大变化,与之相比,成年期微生物群基本上是稳定的(15-65岁),但该群落可能会受到干扰,因此本章节从以下三方面展开讨论:
健康成年人中某些细菌的基因组随着时间的推移而进化,表明在次生演替中,功能和组成进化以稳定状态发生。
• 昼夜节律影响菌群变化
成人微生物群也会发生自然的短期变化,时间尺度为一天到数月或数年。
短期变化的一个典型例子是微生物群落组成的昼夜节律。与昼夜节律相关的人类基因表达和免疫激活,以及肠道微生物群中细菌的丰度和组成也遵循这种模式。
在小鼠中表现出昼夜循环的细菌家族包括瘤胃球菌科、毛螺菌科、Muribaculaceae和疣微菌科,但对人体的等效周期知之甚少。
青春期和成年生活中的二次演替
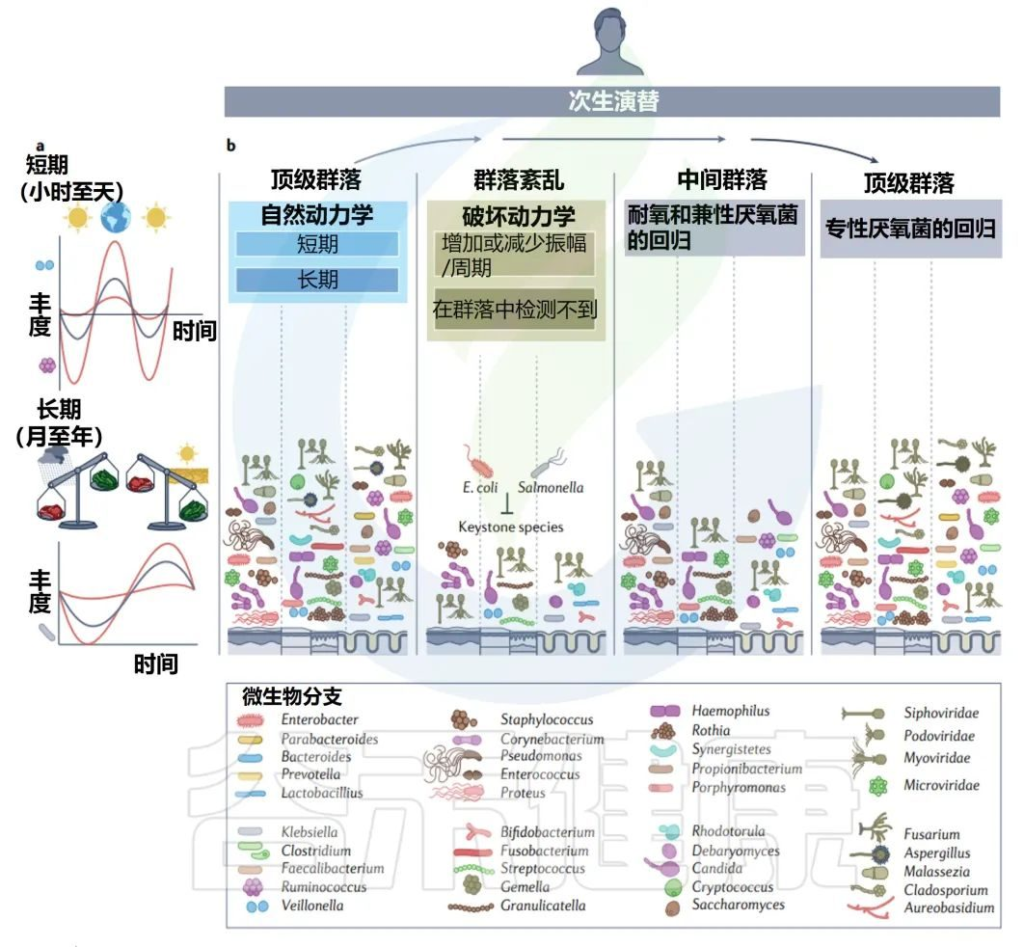
Martino C,et al.Nat Rev Microbiol.2022
• 口腔和皮肤的微生物群随清洗而变化
在口腔中,整组真菌和细菌的每日振幅与刷牙频率一致。在皮肤上,真菌和细菌每天的变化也与洗涤频率一致,并依赖于个人护理产品。
• 饮食会影响肠道微生物群
一个经过充分研究的发生在几周到几年范围内的变化的例子是饮食驱动的肠道微生物群的改变。饮食对微生物群落有很大影响,可以包括群落中的自然和可逆变化。
例如,坦桑尼亚哈扎部落在旱季食用富含肉类和块茎的饮食,但在雨季食用富含蜂蜜和浆果的饮食,在拟杆菌等属中表现出较大的季节波动。
饮食对微生物群形成的巨大影响也可能在人类健康中发挥作用,许多工作致力于了解特定的饮食成分和总体饮食模式如何影响微生物群及其对健康的影响。
肠道细菌喜欢大量的水果、蔬菜、全谷物、橄榄油等健康食物。研究表明,饮食主要由富含纤维的食物(如地中海饮食)组成的人具有更大的微生物组多样性,并且通常更健康。
此外例如,西方饮食中红肉含量高,这与全因死亡率有关。肠道微生物群可能以有害的方式将红肉中富含的左旋肉碱转化为三甲胺,而肝脏则将三甲胺转化为三甲胺氮氧化物,据推测这会促进动脉粥样硬化。
肠道微生物群也可以起到保护作用,例如,在红肉被肠道吸收之前将其分解,以防止炎症。除了饮食,还有许多其他因素有助于形成成年微生物群,包括遗传学、地理、宿主因素,如代谢病和药物。
扩展阅读:深度解析 | 炎症,肠道菌群以及抗炎饮食
• 抗生素对微生物群的影响巨大
由于微生物群的破坏而发生的次生演替已被广泛研究和审查。在破坏微生物群的众多因素中,抗生素是最强的,治疗后的恢复率往往各不相同。
抗生素治疗后肠道微生物群反弹的能力被认为取决于特定的群落成员,如拟杆菌和青春双歧杆菌。
扩展阅读:抗生素对微生物组及对人体健康的影响
细菌的天敌抗生素,如何用好这把救命的双刃剑?
疾病本身也会破坏微生物群,无论这种变化是由微生物群落内部、宿主还是多种因素共同引起的。
• 疾病破坏菌群
——肠道:炎症破坏菌群
肠道中的许多其他疾病,如炎症性肠病,破坏了微生物群落,但没有达到新的稳定群落组成,而是在没有干预的情况下继续长期不稳定。
——皮肤:炎症引起金黄色葡萄球菌大量增殖
在皮肤上,特应性皮炎的特征是免疫介导的炎症引起的金黄色葡萄球菌大量繁殖和细菌多样性减少。在金黄色葡萄球菌大量繁殖期间观察到马拉色菌属的数量减少,反之亦然,真菌数量增加导致金黄色葡萄菌数量减少,这部分可能是由于真菌产生蛋白酶的能力,蛋白酶消化金黄色葡萄球菌生物膜并降低细菌逃避免疫系统的能力。
——口腔:细菌和真菌间的竞争和协同
口腔中也存在类似的跨界相互作用;例如,真菌白色念珠菌的定殖依赖于细菌生物膜,但同时,Pseudomonas和Staphylococcus等细菌属分别形成竞争和协同关系。
这些例子强调了微生物群落的相互作用和演替是如何跨域和与宿主作用的,但由于其高阶相互作用的复杂性质,仍然没有完全理解。
干扰后微生物群落恢复的障碍导致许多研究人员探索有针对性地恢复微生物群落的干预措施的可能性。微生物群落恢复包括定向重新播种或某些物种的富集或耗竭,旨在促使微生物群落恢复到接近扰动前的水平。
这可以通过益生菌、益生元、抗生素或其他药物、从健康个体移植完整的微生物联合体或这些的组合来尝试。
尽管这些疗法在某些特征明确的环境中可以非常有效地恢复健康的微生物群落,但它们往往因缺乏与现有群落相互作用的机理知识,或因其仅短暂移植的能力而受到限制。
为了解决这些,研究集中在两个领域:
第一个领域涉及更好地了解群落是如何组合的。例如,对人类发育的研究有助于确定微生物群落在发育过程中如何聚集,以及这种聚集在生命后期的影响。
其次,正在开发新方法,通过探索微生物群落相互作用来确定机制,包括计算和实验,包括高通量共培养和微生物群落的基因组编辑。
为了解决瞬时性问题,采用了两种主要方法:
首先,微生物群疗法的短暂和个性化影响是由每个人的微生物群的个体性质决定的。因此,精准医学将群落改变的目标定位于每个人独特的微生物群,前景广阔。例如,基于微生物群落组成的个性化营养在盲法随机对照干预中有效地改善了餐后血糖。
另外,超越细菌组,探索病毒组和真菌群落及其之间的相互作用,具有巨大的前景。例如,噬菌体疗法已经用于严重的耐药细菌感染,并且对目标细菌菌株具有高度特异性。但大多数此类干预措施仍处于初步研究阶段,且规模成本高昂。
前面章节我们了解了成年微生物群的变化,以及变化后的恢复情况等,成年稳定微生物群在老年时转变为最终群落,本章节来详细了解老年微生物群。
“老年”的确切时间尺度取决于其他几个与宿主相关的因素,如疾病,但迄今为止大多数文献将“老年人”定义为65岁及以上的人。
接近寿命终点的晚期演替
由于生物编程和生命中损伤的累积而导致的衰老影响细胞功能的各个方面,微生物群也不例外。随着年龄的增长,肠道微生物群α多样性减少,β多样性增加。
关于老年微生物群,仍有许多未知之处,而文献也有些矛盾(一项报告称65岁及以上成年人拟杆菌数量增加,与其他研究相矛盾),大多数研究都集中在肠道细菌上。
老年微生物群:年轻优势菌丰度减少
一般而言,肠道中观察到的群落演替是年轻成年人中占优势和普遍的细菌属丰度减少,如Bifidobacteria, Bacteroides, Lactobacillus, 抵御机会细菌爆发的能力降低。
• 皮肤
在65岁及以上的人群中,genera Cutibacterium和Staphylococcus的皮肤细菌数量减少,同时观察到的Corynebacterium。
• 口腔
在口腔部位,Rothia和Streptococcus spp.是核心口腔细菌群落,PorphyromonasTreponema和Faecalibacterium spp.的数量持续减少。
• 肠道
老年期肠道真菌群落的特征是Penicillium, CandidaAspergillus和Saccharomyces spp.的优势度增加。
在皮肤和口腔部位的研究很少,但老年期皮肤上的Malasseziaspp.和口腔内的Candidaspp.丰度减少。
在肠道噬菌体中,成年期的Siphoviridae占主导地位,而老年期的Microviridae和Podoviridae则占主导地位。与肠道细菌、真菌和噬菌体群体相比,真核病毒的多样性在童年后和整个余生中保持不变。
研究重点
由于个体之间的高度变异性,老年微生物演替的研究重点主要是比较健康和不健康的衰老。
目前尚不清楚微生物群是否在健康衰老中起着机械作用,还是仅仅是其他变量的一个有力指标,如饮食、运动和药物。然而,在那些长寿健康的人中,可以观察到在健康成年人中高度流行的菌群的持续保留方面的共同点。
然而,百岁老人表现出更独特的微生物群,α多样性增加,群落组成的个体间差异更大,使“健康”和“不健康”年龄之间的比较复杂化。次生胆汁酸在百岁老人中含量丰富,也可能在健康老龄化中发挥作用。尽管前景看好,但这一研究领域仍处于起步阶段。
扩展阅读:肠道菌群与健康长寿
• 微生物的演替不会随着个体的死亡而结束
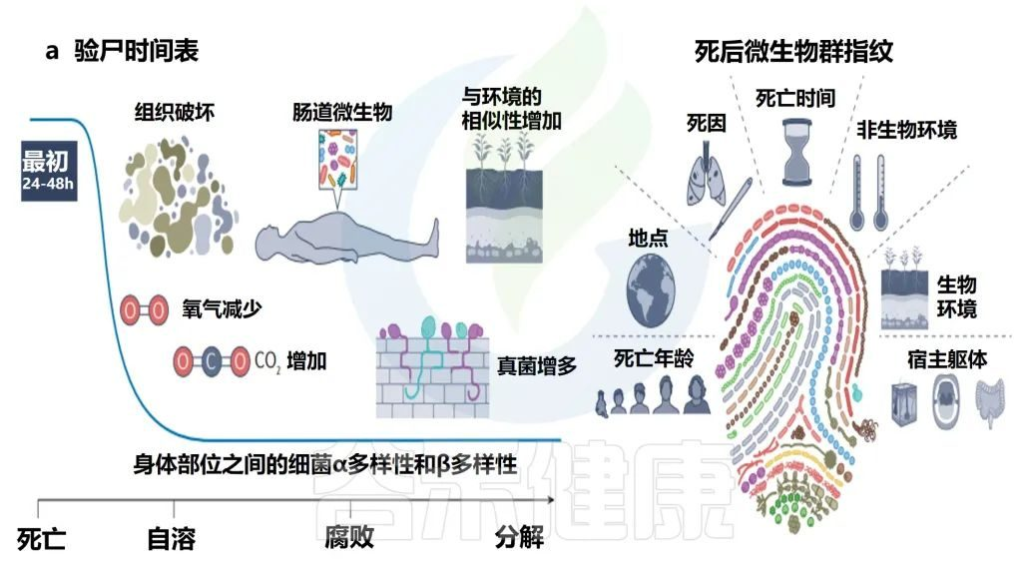
宿主的死亡可以视为微生物群的生态干扰。心脏停止后,组织立即因缺氧而开始分解。细胞功能持续,直到所有剩余的氧气耗尽,二氧化碳不再能够从组织中运输为止。细胞内二氧化碳的积累创造了一个缺氧的酸性环境,导致细胞破裂。
细胞成分,例如酶会泄漏到周围环境中,在被称为“自溶”的过程中进一步促进组织分解。自溶通过消除免疫系统、松开细胞连接并为微生物群提供营养,触发了一系列负责组织分解的微生物过程。
死亡后的微生物群
Martino C,et al.Nat Rev Microbiol.2022
• 死亡后微生物群分解
人类微生物群在死亡后的前24-48小时内相对稳定,具有不同的身体部位微生物生态、年龄的α多样性模式和可识别的个性化皮肤微生物群特征。
在分解的最初几天到几周内,腐败主要由细菌进行,但随着分解的进行,真菌的作用增加。然而,在这个过程中,对病毒组的演替和功能作用了解甚少。
随后,环境变化促进了微生物的演替,改变了人体和微生物群,不再像活着的个体(除非身体被冷冻)。
由于缺乏宿主生活中先前遇到的环境限制,使得微生物的相对丰度发生了快速变化以及在身体各部位的移动。迁移的细菌群成为从肠道转移到肠外部位的先锋物种,根据身体部位参与初级演替或次级演替。
• 死亡微生物群——生物指示器
死亡微生物群因其对法医调查的影响而引起了越来越多的关注。与多个个体和身体部位相关的一致的时间序列模式证明,死后微生物群可以作为死后间隔的生物指示器。
每个尸体的死后微生物群都是独一无二的,并且根据死亡时间、死因、环境、死亡地点和年龄以及开始时身体部位之间的差异,尸体之间的微生物群是不同的。
当微生物演替包括群落成员的快速更替时,在分解的早期阶段(即死亡后的前2-3周),死后时间间隔估计更为准确,但在分解的后期阶段(例如骨骼)仍然有用,因为几乎没有证据可以估计死后时间间期。
• 死亡原因与微生物群存在联系
还证明了与死亡原因和微生物群存在的联系。例如,在死于心脏病的个人的口腔微生物群中发现了的Rothia spp.。
此外,皮肤微生物群脱落可能通过将个人与他们接触过的物品联系起来,从而有助于追踪证据;然而,这一独特特征能够准确匹配到个体的时间取决于对象的材料和用途。
人类微生物群是动态的。考虑到这一点,设计一种能够捕捉微生物群的时间和空间变异性的采样策略非常重要,特别是当这些波动与所提出的科学问题相关时。
✦测量时间不同:多个时间点的样本采集
横断面研究从每个个体收集一个样本,而重复测量研究在多个时间点或身体部位收集样本。随着时间的推移,采样频率应该调整到研究人员试图观察的现象。
例如,小鼠昼夜节律研究通常每2-4小时收集一次粪便样本;而在炎症性肠病中,在一周内对患者进行三到五次采样可以改善疾病分类。
在其他应用中,例如研究特定治疗对个体微生物群的影响,这可能与进行“一对一”研究有关,在该研究中,同一参与者被反复检测其微生物群的结果变化;治疗前采集的样本被视为个体水平的对照。
✦测量空间不同:城市化/农村环境不同
同样重要的是要考虑到人口的微生物群高度依赖于地理和种族。
例如,在一个大型中国群体中,一种与年龄高度相关的微生物在一个美国大型群体中根本没有检测到。
另一个具体的例子涉及城市化社会的“建筑环境”;城市化人群通常较少接触环境微生物,更多地使用家用抗菌剂,与来自农村社会的人类微生物群相比,这导致了重大变化。
这些考虑因素与微生物群领域尤其相关,因为大多数公共微生物群数据来自城市化的北美和欧洲人。因此,现有数据集的结论可能无法很好地推广到全球人口。
从人类微生物群和微生物群研究中生成的测序数据的主要类别是扩增子测序数据和鸟枪测序数据。
✦扩增子测序
在扩增子测序中,对已建立的高变区的PCR产物(扩增子)进行深度测序,从而能够通过与个体“条形码”匹配来识别和测量群体成员。
这里有两种选择:要扩增的基因和该基因的哪一部分要扩增。微生物基因组的常见扩增区域包括:细菌的16S核糖体RNA基因、真核微生物的18S核糖体DNA基因和真菌的内部转录间隔区。
每个特定基因中高变区的选择取决于要捕获的特定微生物,但广泛使用的高变区包括来自地球微生物组项目的V4区。
✦肠道微生物群参与人体的调节
在鸟枪测序中,所有微生物DNA都被测序,而不仅仅是PCR产物,从而能够对微生物进行更具体的分类。由于鸟枪测序不依赖于任何标记基因,因此与扩增子测序相比,它对某些微生物的偏向性较小。
然而,鸟枪测序的成本要高得多,并且需要更大的计算能力,这使得在不需要提高鸟枪序列分辨率的情况下,扩增子测序具有吸引力。
结合其他技术进行扩增子或宏基因组测序可以丰富对微生物群和宿主的理解。定量PCR和荧光激活细胞分选等技术通过将相对丰度锚定到可靠的绝对丰度测量值,为相对丰度提供了更多的背景。
酶联免疫吸附试验和单细胞测序可以通过提供宿主细胞类型或宿主免疫信息与宏基因组测序很好地配对。
培养组学使研究人员能够通过实验验证功能或活性的基因组预测,并将微生物转化为益生菌。微生物产生的代谢物或蛋白质,即微生物群的下游效应物,可以分别通过代谢组学和蛋白质组学进行探测。
最后,宿主基因组学和转录组学越来越多地与扩增子或宏基因组学数据配对,以深入了解宿主基因表达和微生物群之间的联系。
最后,从被调查的参与者那里收集数据至关重要。一般微生物群研究的一些重要元数据类别包括人口统计、临床信息和饮食信息;然而,使用的确切元数据因研究而异。应采用产生标准化元数据的实践,以便结果可重复使用和再现。
本文描述了目前对不同年龄和不同身体部位的人类常驻微生物群落组成的研究现状。
人类健康与微生物群组成之间存在许多联系,对肠道菌群的干预可能改善健康。侧重于整个微生物群而不是单一物种的富集或消除的干预措施,需要了解这些群落是如何形成和维持的。
不同人群年龄,不同部位的微生物群需要依托于大样本数据库的构建,这为微生物群研究的准确性提供了保障。
通过研究人类整个生命周期中的微生物群,我们可以更好地了解这些微生物群复杂的相互作用,以及如何有效地将微生物群推向宿主所需的组成。此外也正应用于除人类健康外的其他领域,如法医学。随着微生物群的相关研究不断突破,将给人类生命健康和生产生活带来巨大的影响。
主要参考文献:
Martino C, Dilmore AH, Burcham ZM, Metcalf JL, Jeste D, Knight R. Microbiota succession throughout life from the cradle to the grave. Nat Rev Microbiol. 2022 Jul 29. doi: 10.1038/s41579-022-00768-z. Epub ahead of print. PMID: 35906422.
Lim, A. I. et al. Prenatal maternal infection promotes tissue-specific immunity and inflammation in offspring. Science 373, eabf3002.
Al Nabhani, Z. & Eberl, G. Imprinting of the immune system by the microbiota early in life. Mucosal Immunol. 13, 183–189.
Helve, O. et al. 2843. Maternal fecal transplantation to infants born by cesarean section: safety and feasibility. Open. Forum Infect. Dis. 6, S68.
Seppo, A. E. et al. Infant gut microbiome is enriched with Bifidobacterium longum ssp. infantis in old order mennonites with traditional farming lifestyle. Allergy 76, 3489–3503.
谷禾健康
Blautia (经黏液真杆菌属)
Blautia 是一种最近发现的细菌属,是将几种丰富的胃肠道细菌归类,这些细菌以前属于 Ruminococcus 属。基于表型和系统发育分析,梭菌属和瘤胃球菌属中的一些物种也已被重新归类为Blautia.
Blautia 作为毛螺菌科的一个属,自成立以来,因其对缓解炎症性疾病和代谢疾病的贡献以及对特定微生物的抗菌活性而备受关注。最近的几份报告表明,肠道中Blautia菌的组成和变化与宿主年龄、地理、饮食、基因型、健康状况、疾病状态和其他生理状态等因素有关。
研究人员发现:该属中的物种水平在老年患者中经常减少,在结直肠癌患者的黏膜样本中水平降低,在肠易激综合征 (IBS) 患者中水平升高。
此外,Blautia与内脏脂肪面积负相关,内脏脂肪面积被认为是心血管和代谢疾病风险的肥胖生物标志物。研究还确定了Blautia luti 和Blautia wexlerae 的减少与肥胖个体的胰岛素抵抗有关。Blautia菌通过产生细菌素来防止病原体的定植,并通过上调调节性 T 细胞和 SCFA 的产生而表现出抗炎特性和维持葡萄糖稳态作用。
Blautia. 图片来源:microbiomology
Blautia 属严格厌氧,不能运动,是哺乳动物肠道内重要的核心菌属。Blautia 能够使用氢气和二氧化碳来制造乙酸盐。乙酸是肠上皮细胞的次要能力来源,也是肌肉和脑组织的能量来源,可以抑制病原菌,有抗炎作用。
Blautia菌通常为球形或椭圆形,成对或成股出现,大多数菌株无孢子。Blautia广泛分布于哺乳动物的粪便和肠道中。大多数Blautia菌株的最适温度和 pH 值分别为 37°C 和 7.0。DNA的GC含量约为 37-47 mol%。
培养实验表明,所有Blautia菌株都可以利用葡萄糖,但不同菌株对蔗糖、果糖、乳糖、麦芽糖、鼠李糖和棉子糖的利用能力不同。Blautia发酵葡萄糖的最终产物是乙酸、琥珀酸、乳酸和乙醇,主要生化试验显示卵磷脂、脂肪酶、过氧化氢酶和吲哚的阴性结果。
Blautia菌株的碳水化合物利用特性
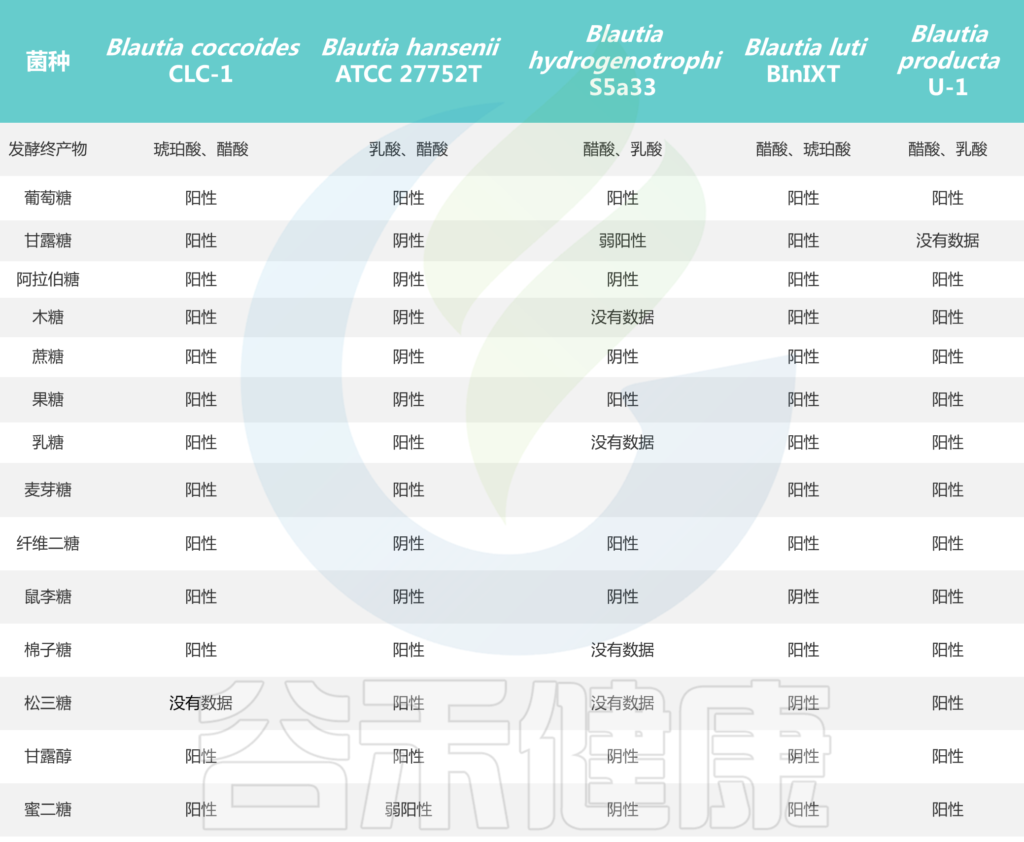

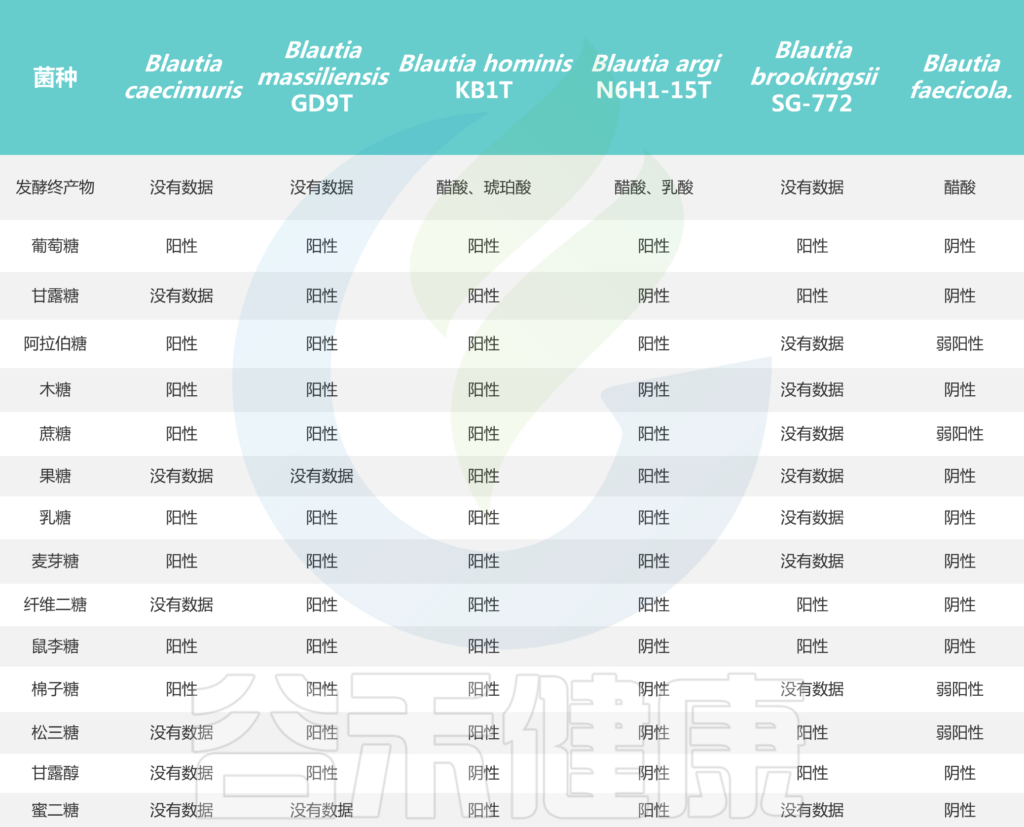
Liu X, et al., Gut Microbes. 2021
Blautia属目前根据公布的有效名称物种共计20个,包括:
它们最初被错误分类为Ruminococcus、梭菌属或瘤胃球菌属。
文献中报道的Blautia的所有种
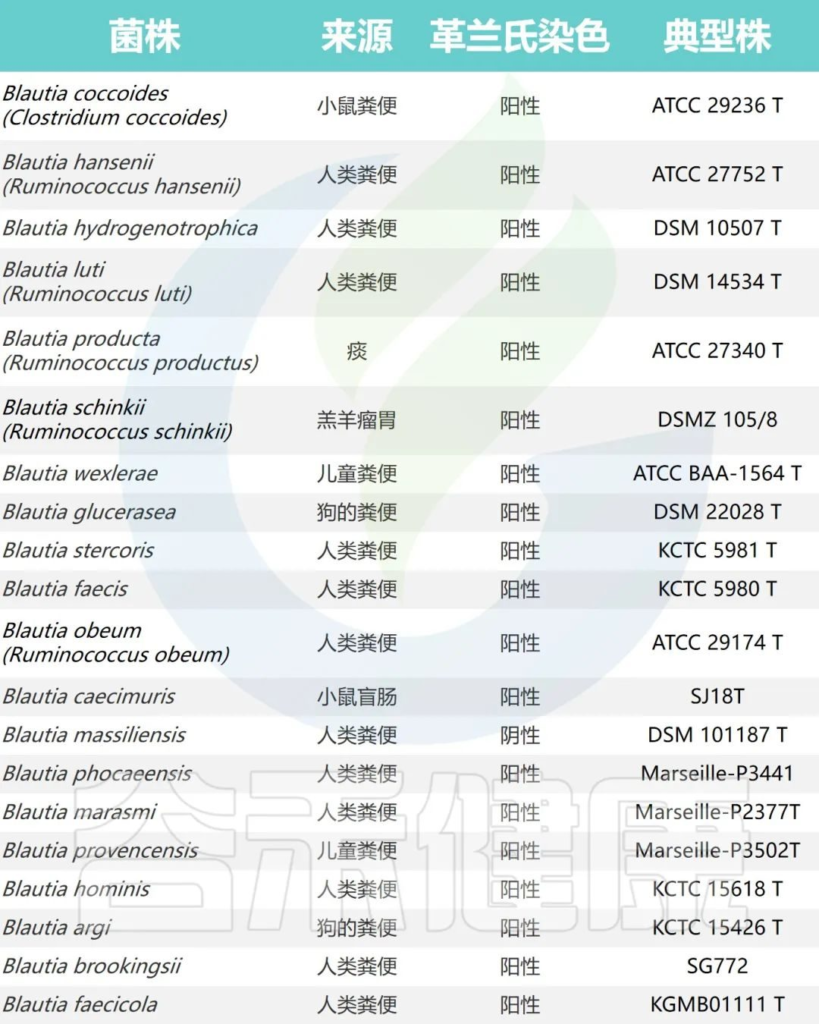
Liu X, et al., Gut Microbes. 2021
该属的组成通过增加新的种和品系而不断更新,但总的来说,Blautia中的种仍形成一个相对稳定和连贯的单系分支。
不同物种首次发现的来源不同,但是主要物种都是从人粪便分离出来的。
例如:Blautia hydrotrophica (B.hydrotrophica)和Blautia stercoris (B. stercoris) 首先是从人类粪便中分离出来的。
B.hydrotrophica 的代谢途径
Blautia hydrotrophica 是革兰氏阳性、无芽孢、球杆菌状细菌,平均大小为 0.7-0.6 毫米。Hydrogenotrophica,意为以氢为食,是指生物体利用 H2 和 CO2 作为生长能源的能力。它将 H2 和 CO2 代谢形成乙酸盐作为唯一代谢物自养生长。该生物体还能够使用几种不同的有机化合物作为底物异养生长。通过葡萄糖和果糖的发酵,乙酸是主要产物,但也可以形成乙醇、乳酸以及较小程度的异丁酸和异戊酸。
B.hydrotrophica的生存环境
B.hydrotrophica的最佳栖息地pH范围为6.0-7.0,温度为35-37˚C。B.hydrotrophica也可能是一种重要的微生物,可替代反刍家畜体内的产甲烷菌,以限制释放的甲烷量。
B.hydrotrophica栖息在哺乳动物的内脏中,有助于分解宿主饮食中原本难以消化的部分,主要是植物材料。膳食多糖和蛋白质的分解是通过微生物群在厌氧肠道环境中发酵完成的。这些微生物群是共生的,这意味着它们的相互作用创造了一个相互关联的食物网。这种代谢食物网的产物是短链脂肪酸,例如乙酸盐、其他有机酸以及 H2 和 CO2 气体。H2 气体的积累实际上可以抑制 NADH 的再氧化,从而减少 ATP 和短链脂肪酸的产生量。据估计,这些短链脂肪酸的代谢产生了人类所需能量的 5%-10% 。Blautia hydrotrophica在宿主新陈代谢中发挥重要作用,因此更好地了解这些微生物可能会导致能够操纵人体能量平衡。
B. wexlerae和B. luti 是Blautia中最丰富的物种,是人类肠道的主要物种之一。
B. wexlerae 治疗代谢疾病
Blautia wexlerae ( B. wexlerae ) 是主要的丁酸盐生产者。动物实验表明,丁酸盐可以改善胰岛素抵抗,减少脂肪堆积。因此,这可能是B. wexlerae抗肥胖的机制之一。B. wexlerae在治疗代谢疾病方面具有发展潜力。
B. faecis DSM33383 菌株预防管理呼吸道疾病
Blautia faecis也是从人粪便分离出来的,细胞染色呈革兰氏阳性、严格厌氧。研究人员已经确定了B. faecis DSM33383 菌株,该菌株降低了 TNF 诱导的肠上皮细胞系 HT-29 产生的 IL-8。在流感后的两个临床前模型中进一步研究了该菌株的作用表明该菌株胃内给药可保护感染了肺炎链球菌的小鼠,并在较小程度上保护鼠伤寒沙门氏菌继发感染。该研究表明,粪杆菌DSM33383 可能是预防和管理呼吸道传染病的有希望的候选者。
B. coccoides参与促炎途径
B. coccoides最初是从喂食高乳糖饮食的小鼠的粪便中分离出来的;Blautia coccoides已通过免疫调节和促炎途径参与多发性硬化,包括与抗原呈递、B 和 T 细胞活化以及补体活化相关的基因的上调。
B. hydrogenotrophica,以前称为 Ruminococcus hydrogenotrophicus,是一种在哺乳动物(人类和反刍动物)的肠道内发现的物种。
B. glucerasei从狗的粪便中分离出来。
另外的物种如B. producta和B. schinkii甚至从痰液、污水和瘤胃中分离出来。
这些发现表明Blautia在肠道和其他微环境中的生存和进化的重要性。
当细菌从膳食成分中产生的代谢物作为底物支持其他物种的生长时,称为交叉喂养。交叉喂养是肠道微生物群中厌氧菌之间的重要相互作用,可影响其代谢途径并有助于其稳定性和生产力。
作为厌氧菌的一个属,Blautia与其他细菌的交叉喂养也在一定程度上有助于代谢调节。
Blautia & R. bromii
一项研究发现,通过使用 0.2% 的抗性淀粉作为能量来源,布氏瘤胃球菌(R. bromii)在 RUM-RS 培养基上可以产生大致相等摩尔比的甲酸、乙醇和乙酸。
注:布氏瘤胃球菌(R. bromii)是存在于人类肠道中的降解抗性淀粉的细菌,富含抗性淀粉的饮食可以增加它的丰度。
然而,在淀粉上与产乙酸细菌B. hydrotrophica进行批量共培养导致甲酸消失,乙酸水平增加。产生甲酸的物种和产生乙酸的物种之间的交叉喂养可能在结肠中短链脂肪酸的形成中起重要作用,并有助于大量产生乙酸。
Blautia & Dorea
在肠易激综合征 (IBS) 患者中观察到 Blautia 菌种水平升高,研究人员推测可能由于由高丰度的Dorea菌产生的较高气体水平,Dorea 是一种可以被 Blautia 使用的细菌。
Blautia & B. bifidum
Blautia hydrotrophica消耗 H2和 CO2通过 Wood-Ljungdahl 途径产生乙酸——当与双歧双歧杆菌共存时,该途径显着激活。B. bifidum (双歧双歧杆菌)作为一种特殊的碳水化合物发酵物种并产生 CO2,它是 Wood-Ljungdahl 途径中的固定底物。因此,在 Blautia hydrotrophica 中观察到的 Wood-Ljungdahl 途径的变化可能是B. bifidum交叉喂养的结果。
备注:Wood-Ljungdahl 途径又称为厌氧乙酰辅酶 A 途径,存在于产甲烷菌、硫酸盐还原菌和产乙酸菌等化能自养的厌氧细菌和古生菌中。
饮食是驱动肠道菌群组成和代谢活动的主要因素,不同种类和数量的饮食以及主要营养素之间的平衡对肠道微生物有显着影响。
酒曲通过糖基神经酰胺作为 Blautia coccoides 的益生元
传统的日本烹饪方法和食,其中包含用非致病性真菌酒曲制备的发酵食品,与日本人的长寿密切相关。一项研究报道,酒曲中含有大量的糖基神经酰胺,并表明在小鼠饮食中添加 1% 纯化的糖基神经酰胺作为益生元1周可以提高小鼠肠道中球状芽孢杆菌的丰度,减少其血液糖水平,并上调其肾腺激素水平。同时发现Blautia coccoides可以将糖基神经酰胺降解为神经酰胺,然后将神经酰胺代谢为脂肪酸和鞘氨醇碱,它们被肠道吸收并产生有益作用。
玉米中提取的膳食纤维F-FOP增加Blautia
将从玉米中提取的膳食纤维 (F-FOP) 添加到喂食高脂肪 (HF) 饮食的小鼠的饮食中,显着增加了小鼠粪便中Blautia的丰度。与 HF 饮食的小鼠相比,F-FOPs + HF 饮食的小鼠表现出体重和组织重量的损失,结果显示Blautia的丰度与肥胖相关代谢紊乱的标志物呈负相关。
低聚果糖、冻干豆浆增加Blautia
在喂食高脂饮食的大鼠中添加 20% 的冻干豆浆会导致大鼠粪便中的Blautia含量增加。
在一项研究中,将 30 只雌性大鼠分为六组,分别喂食酪蛋白或大豆分离蛋白,每组都含有纤维素、棉子糖或低聚果糖 (FOS)。结果表明,两种来源的日粮蛋白质都可以改变大鼠粪便中乙酸浓度和乳酸杆菌的丰度,但无论膳食蛋白质来源如何, FOS都会增加Blautia的丰度。
研究还表明,大鼠肠道酸化可能会抑制次级胆汁酸的形成。
omega-3增加Blautia
在另一项研究中,一名 45 岁的男性志愿者每天摄入 600 毫克 omega-3,持续 14 天,该志愿者的整体肠道微生物多样性下降,尤其伴随着粪杆菌丰度的降低和Blautia丰度的显着增加。
交替饮食和自助饮食增加Blautia
除了食物,人们的饮食方式也会塑造肠道菌群。与普通饮食相比,交替饮食和自助饮食可以提高肠道菌群中Blautia菌属和瘤胃球菌的丰度,此外还会引起一些宿主代谢相关参数的变化。随着全基因组测序的发展,未来的研究可以检验各种饮食如何调节Blautia的代谢活动并改善宿主健康。
在生命的不同阶段(即从童年到成年再到老年)的过渡期间,肠道微生物群会发生显着变化。使用高通量测序对 367 名 0-104 岁健康日本受试者的粪便样本进行的横断面研究报告称,日本成年人(21-69 岁)的肠道微生物群含有高丰度的Blautia和Bifidobacterium和低丰度Bacteroides。此外,与成年人相比,老年人的微生物组多样性和个体微生物丰度降低,包括Blautia丰度降低。这种现象可能与年龄相关的免疫功能下降(称为免疫衰老)有关,并伴有许多与年龄相关的疾病,包括慢性低水平炎症。
Blautia wexlerae和Bifidobacterium pseudocatenulatum的丰度在成人型肠道微生物群中显着更高,而在老年型肠道微生物群中观察到兼性厌氧菌(如大肠杆菌)的丰度更高。这些发现表明,通过增加会随着年龄增长而减少的菌群,将肠道微生物群从老年人型转变为成人型,可以预防与年龄相关的疾病的风险。
最近的一项研究分析了来自亚洲温带和热带地区五个国家的城市或农村地区的 303 名学龄儿童粪便样本中的微生物群落特征。儿童肠道菌群分为普氏菌属(P型)和双歧杆菌/拟杆菌属(BB型)两组。中国(包括台湾地区)、日本等温带地区儿童肠道菌群多为BB型,泰国、印度尼西亚等热带地区儿童肠道菌群多为P型。值得注意的是,Blautia 在 BB 型肠道菌群中显着富集,占总 BB 型细菌组成的 10%,但仅占总P的 5%。
一项研究指出,日本人的主要肠道菌属是双歧杆菌和梭状芽孢杆菌。在美国人、中国人、法国人和西班牙人中存在拟杆菌属;在澳大利亚人中是Blautia。据报道,地理位置之间人类肠道微生物多样性的差异在很大程度上与遗传、生活方式和饮食有关。
有趣的是,据报道Blautia在双胞胎遗传中具有很强的分类关联。一项研究收集了七种宿主的粪便样本,包括人类、猪、牛、鹿、狗、猫和鸡,并对 16S rRNA 基因的 V6 区域进行了测序。发现Blautiaoligotypes可以准确识别不同的宿主来源,表明该属具有宿主特异性和宿主偏好。
近年来,Blautia对草本植物和功能性食品的生物转化和代谢的研究引起了研究关注。
多甲氧基黄酮 (PMF) 是从山奈和柑橘类水果中分离出来的黄酮类化合物,具有抗癌、抗炎、抗病毒和抗凝血等生物学功能。
研究表明,Blautia菌属通过将 5,7-二甲氧基黄酮 (5,7-DMF) 和 5,7,4-三甲氧基黄酮 (5,7,4-TMF)分别转化为具有生物活性的白杨素和芹菜素,对芳基甲基醚官能团具有水解作用。该菌还具有去糖基化能力,它可以将异黄酮、黄酮和类黄酮代谢成相应的苷元。
作为黄酮类化合物的另一个例子,姜黄素在治疗某些疾病,包括癌症、心血管疾病、糖尿病、肝病和神经退行性疾病方面表现出抗氧化、抗炎、抗病毒、抗菌的有益作用,受到了广泛的关注。
由于姜黄素结构中含有β-二酮,该化合物具有高的疏水性、低的溶解性和“生物利用度”,因此,每天大量摄入姜黄素,可以观察到对健康的促进作用。不幸的是,大量摄入姜黄素可能会产生有害影响并降低疗效,这会导致限制了姜黄素在疾病预防中的应用。
由肠道细菌产生的姜黄素代谢物具有生物效应,而不是姜黄素的原始形式。
据报道,姜黄素是由人肠道细菌Blautia 菌株MRG-PMF1通过甲基芳醚裂解,转化为去甲基姜黄素和双去甲基姜黄素的。有证据表明,未被吸收的姜黄素可以间接调节结肠微生物群,通过产生额外的生物可利用和生物活性分子(如二氧去甲基姜黄素和二甲氧基姜黄素)对多种疾病产生有益的影响。
此外,Blautia sp AUH-JLD56 菌株已被证明可特异性且有效地将牛蒡子苷或牛蒡子苷元生物转化为具有良好自由基清除活性的 (-)-3′-去甲基牛蒡子苷元。 B. glucerasei sp. 产生一种特定的细胞外葡萄糖神经酰胺酶,将葡萄糖神经酰胺水解成功能性物质,对结肠癌具有特定的预防作用。
但是值得提醒的是,Blautia的某些生物转化可能无益,甚至可能有害。某些Blautia物种可以对初级胆汁酸进行 7-α-脱羟基化,并将其转化为次级胆汁酸,如石胆酸和脱氧胆酸。这些物质是诱发结肠癌的致癌物,在溃疡性结肠炎、发育不良或癌症患者的粪便中发现这些物质浓度高。
一般来说,肠道中的细菌代谢不涉及氧气,而是还原和水解,导致形成非极性低分子量产物。在类黄酮转化过程中,Blautia菌种催化的反应包括去甲基化、脱羟基化、O-和 C-去糖基化和 C-环裂解,这可能是由于其相应的酶,如 β-葡萄糖苷酶和 O-糖苷酶。因此,深入开发Blautia对生物转化的探索对于开发用于食品补充剂的新酶和生物活性代谢物至关重要,并为人体肠道微生物组的代谢组学研究提供有价值的视角。
次级代谢产物是微生物在生长代谢过程中产生的具有生物活性的化合物,广泛用于抗菌抗癌药物、除草剂、杀虫剂等,也是微生物药物开发的重要来源。如双歧杆菌产生的细菌素对单核细胞增生李斯特菌、产气荚膜梭菌和大肠杆菌等病原微生物具有抗菌活性。
Blautia通常具有生产细菌素的能力。通过antiSMASH数据库对次生代谢物的注释,将74株Blautia菌株注释为7类共261个次生代谢生物合成基因簇(BGCs),包括NRPS、sactipeptide、lanthipeptide、bacteriocin、lassopeptide、betalactone、transat-pks。
NRP、sactipeptide、lanthipeptide 通常分布在所有菌株中。NRP 和 PK 是具有多种功能的最丰富的次级代谢产物家族之一,包括参与铁清除的铁载体、提供针对一系列压力因素的保护的色素,以及营养获取、化学通讯和防御反应。
备注:antiSMASH数据库可实现基因组与基因组之间的相关天然产物合成基因簇的查询和预测。临床上使用的大部分抗生素和药物均来自植物或微生物的天然产物。近二十年来,基因组数据的不断增加,使通过基因组挖掘来获取化合物的生物合成簇成为可能。antiSMASH是该领域最流行的工具之一。自2011年首次发布以来,antiSMASH已成为次级代谢产物基因组挖掘的标准工具,antiSMASH数据库为许多公开可用的微生物基因组提供预先计算的antiSMASH结果,并允许进行高级跨基因组搜索。
Blautia产生的细菌群具有抑制肠道内病原菌定植的潜力,并且它还可以影响肠道微生物群的组成。研究显示B. obeum和B. producta可以抑制产气荚膜梭菌和耐万古霉素肠球菌的增殖,使其成为潜在的益生菌,发挥益生菌功能。
肠道微生物群是一个复杂的生态系统,与宿主疾病的发展、药物代谢、免疫系统调节和其他过程有关。Blautia 作为肠道微生物群中的优势菌属,与宿主生理功能障碍具有显着相关性,例如肥胖、糖尿病、癌症和各种炎症性疾病。
一项研究观察到连续 3 周食用低热量和高蛋白饮食的超重/肥胖非酒精性脂肪肝患者的肠道微生物群组成发生变化和Blautia丰度增加。在另一项研究中,无论是否存在非酒精性脂肪性肝炎,肥胖儿童的肠道拟杆菌属丰度较高,同时Blautia和粪杆菌丰度较低。
在一项基于人群的横断面研究中,研究人员调查了 20-76 岁日本男性和女性的内脏脂肪积累和体重指数与按性别分层的肠道微生物群的关系。发现Blautia是唯一一个其丰度与日本人的内脏脂肪积累呈显着负相关的属,无论性别如何。
Blautia是肠道中常见的乙酸生产者,可通过激活 G 蛋白偶联受体 GPR41 和 GPR43 来抑制脂肪细胞中的胰岛素信号传导和脂肪积累,进而促进其他组织中未结合的脂质和葡萄糖的代谢,从而减轻肥胖相关疾病。
Blautia是有效减肥组女性肠道菌群中的优势菌属,但在减肥无效组中则不然。在另一项研究中,与健康儿童相比,糖尿病儿童的Blautia丰度显着下降。一项横断面研究表明,Blautia,特别是B. luti和B. wexlerae,可能有助于减少与肥胖相关并发症相关的炎症。
肥胖组的Prevotella、巨型单胞菌(Megamonas)、梭杆菌属和Blautia显著增加。
Blautia作为共生的专性厌氧菌属,通过上调肠道调节性T细胞和产生短链脂肪酸,在维持肠道生态平衡和预防炎症方面发挥着重要作用。
IBD患者和健康人的粪便和黏膜菌群分析表明,CD患者盲肠黏膜菌群中Blautia的丰度显着降低。在结直肠癌患者的黏膜粘连菌群中,同样报道了Blautia的丰度降低。
霍乱弧菌通常会导致人类腹泻,但人们对病原体的易感性不同,这可能是由人际微生物组变异驱动的。
发现霍乱患者的肠道菌群与健康个体存在显着差异,其中Blautia obeum与霍乱弧菌的定植呈显着负相关。进一步研究表明,B. obeum基因组中编码胆汁盐水解酶(BSH)的基因可以降低霍乱弧菌tcpA基因的表达,抑制其定植,缓解腹泻。
一项生物标志物分析研究表明,接受异体 BMT 的患者肠道微生物群多样性增加,特别是Blautia属共生细菌的丰度增加,与致死性移植抗宿主病的减少和总生存期的增加有关。
少数研究也报道了Blautia丰度降低与回肠袋-肛门吻合和肝硬化的关系。Blautia作为共生的专性厌氧菌属,通过上调肠道调节性 T 细胞和产生短链脂肪酸,在维持肠道环境平衡和预防炎症方面发挥重要作用。
上述研究表明,Blautia的丰度与某些疾病呈负相关。然而,与健康个体相比,在肠易激综合征和溃疡性结肠炎患者的粪便微生物群中发现了更高丰度的Blautia.
尽管Blautia在各种疾病中的潜在机制尚不明确,但 Blautia丰度仍可作为相关疾病早期诊断或治疗的潜在工具。
老年人特别容易出现食欲不振和营养不良。这可能部分是由于肠道微生物群老化。Blautia属的较低丰度可能与营养不良有关,而来自毛螺菌科、瘤胃球菌科 UCG-002、Parabacteroides merdae和Dorea formicigenerans 的分类群丰度较高与食欲不振相关。食欲不振或营养不良的参与者的粪便乙酸水平降低。
Blautia丰度减少可能会增加慢性低度炎症,并降低通过发酵从饮食中摄取的能量。该结论需要进一步的研究支持。
与对照组相比,来自虚弱组的粪便样本下列菌群具有较高的水平:
Akkermansia, Parabacteroides, Klebsiella
而共生属较低水平菌群如下:
Blautia, Megamonas, Faecalibacterium, Prevotella, Roseburia
在自闭症谱系障碍患有功能性肠胃疾病的儿童中观察到几种与粘膜相关的梭菌显着增加,而 Dorea 和Blautia以及 Sutterella的显着减少。
此外,帕金森病患者子中发现在属的分类水平上,来自 Blautia、Coprococcus 和 Roseburia 属的推定“抗炎” 丁酸盐产生菌在对照组的粪便中明显多于帕金森病患者。
肌肉减少症是一种症状性病症,其特征是由于骨骼肌质量随着年龄的增长而过度损失,导致肌肉力量和身体机能下降。
肌肉减少症伴随着身体平衡差、步态障碍、使用拐杖和跌倒。研究发现与附肢骨骼肌质量/体重 (ASM/BW)与 ASM/BW 呈正相关的Blautia、Bifidobacterium可能有助于增加骨骼肌质量。
Blautia coccoides可能会通过免疫调节和促炎途径参与多发性硬化,包括与抗原呈递、B 和 T 细胞活化以及补体活化相关的基因的上调。与其他疾病一样,在多发性硬化中,肠道菌群失调会增加肠道通透性,从而促进 LPS 的进入。
如何增加(来自文献,证据不是很充分)
食物:
富含 Omega-3 的食物
糙米
大麦
迷迭香
黄酮类
高谷物饮食
益生元或药物:
二甲双胍
黄连素
小檗碱
红花油
丁酸钠
抗性淀粉(II、IV型)
橙子(果胶/黄烷酮)
葡萄籽多酚/酒
亚麻籽
维生素 D3
益生菌:
枯草芽孢杆菌
布拉酵母菌
德氏乳杆菌
鼠李糖乳杆菌GG
长双歧杆菌 BB
例如:一项研究指出富含阿拉伯木聚糖的麦麸提取物会提高Blautia物种的比例 ,这表明有可能设计基于饮食的干预措施,以增加肥胖儿童体内耗尽的这些细菌物种的肠道生态系统。需要对B. luti和B. wexlerae菌株进行临床前和临床干预试验,以明确证明它们对肥胖和糖尿病前期状态的潜在保护作用。
减少Blautia
人类肠道微生物研究的不能忽略的关注之一是研究核心微生物群。拟杆菌、普雷沃氏菌、瘤胃球菌、经黏液真杆菌属(Blautia)、考拉杆菌、罗伊氏菌、吉米菌、粪杆菌、毛螺菌以及梭菌等是世界代表性人群的核心肠道菌群。在目前谷禾健康超过60万的肠道菌群数据库中,肠道微生物群的几个核心肠道细菌普遍存在于超过90%人群粪便中。
Blautia作为一个重要的核心菌属,在肠道中占比丰度,是短链脂肪酸尤其乙酸的主要生产者,对于减肥和抗炎均有重要的积极作用。此外,其属下某些菌株分泌的细菌素可以抑制特定病原菌,这对于当下耐药性问题无疑看到了新方向。
但是经黏液真杆菌属(Blautia)作为一种严格厌氧的细菌,需要苛刻的培养条件和严格的操作程序。因此,将属于该属的细菌用作商业益生菌并不容易。相反,Blautia的益生元底物可以用于健康维护。一些食物成分,例如低聚果糖、乳果糖和日本酒曲糖基神经酰胺,均表明可以增加小鼠体内的Blautia丰度。然而,需要注意的是粪便微生物群的益生元作用也会因人而异。
主要参考文献:
Liu X, Mao B, Gu J, Wu J, Cui S, Wang G, Zhao J, Zhang H, Chen W. Blautia-a new functional genus with potential probiotic properties? Gut Microbes. 2021 Jan-Dec;13(1):1-21.
Benítez-Páez A, Gómez Del Pugar EM, López-Almela I, Moya-Pérez Á, Codoñer-Franch P, Sanz Y. Depletion of Blautia Species in the Microbiota of Obese Children Relates to Intestinal Inflammation and Metabolic Phenotype Worsening. mSystems. 2020 Mar 24;5(2):e00857-19.
Stanley D, MS G, SE D, VR H, TM C, RJ H, RJ M. Identification of chicken intestinal microbiota correlated with the efficiency of energy extraction from feed. Vet Microbiol. 2013;164(1–2):85–21.
Biddle A, Stewart L, Blanchard J, Leschine S. Untangling the genetic basis of fibrolytic specialization by lachnospiraceae and ruminococcaceae in diverse gut communities. Diversity. 2013;5(3):627–640.
Chakravarthy SK, Jayasudha R, Prashanthi GS, Ali MH, Sharma S, Tyagi M, Shivaji S. Dysbiosis in the gut bacterial microbiome of patients with uveitis, an inflammatory disease of the eye. Indian J Microbiol. 2018;58(4):457–469.
Milani, C.; et al. The first microbial colonizers of the human gut: composition, activities, and health implications of the infant gut microbiota. Microbiology and molecular biology reviews. 2017, 81(4): e00036-17.
Luu TH, Michel C, Bard JM, Dravet F, Nazih H, Bobin-Dubigeon C. Intestinal Proportion of Blautia sp. is Associated with Clinical Stage and Histoprognostic Grade in Patients with Early-Stage Breast Cancer. Nutr Cancer. 2017 Feb-Mar;69(2):267-275
Chen, W., Liu, F., Ling, Z. et al. “Human Intestinal Lumen and Mucosa-Associated Microbiota in Patients with Colorectal Cancer.” PloS ONE. 7(6): e39743; doi: 10.1371/journal.pone.0039743
Grisham, J. “Bacteria May Hold the Key to Preventing Dangerous Side Effect of Transplants.” Memorial Sloan Kettering Cancer Center. (2014). Memorial Sloan Kettering Cancer Center
Jenq, R.R., Taur, T., Devlin, S.M. et al. “Intestinal Blautia is Associated with Reduced Death from Graft-versus-Host Disease.” Biology of Blood and Marrow Transplantation. (2015). 21(8) 1373-83; doi: http://dx.doi.org/10.1016/j.bbmt.2015.04.016,/p>
Murat Eren, A., Sogin, M.L., Morrison, H.G. et al. “A single genus in the gut microbiome reflects host preference and specificity.” The ISME Journal. (2015). 9: 90-100; doi: 10.1038/ismej.2014.97
Rajilić-Stojanović, M., de Vos W.M. “The first 1000 cultured species of the human gastrointestinal microbiota.” FEMS Microbiology Reviews. (2014). 38(5) 996-1047; doi: 10.1111/1574-6976.12075
Horigome A, Hashikura N, Yoshida K, Xiao JZ, Odamaki T. 2′-Fucosyllactose Increases the Abundance of Blautia in the Presence of Extracellular Fucosidase-Possessing Bacteria. Front Microbiol. 2022 Jun 2;13:913624.

谷禾健康


宫颈癌、卵巢癌和子宫内膜癌是最常见的妇科癌症。根据最新的全球癌症数据,女性宫颈癌的发病率和死亡率分别居第四位和第六位,而卵巢癌的死亡率居第五位,居妇科恶性肿瘤之首。
此外,随着人类生活水平的提高,肥胖、内分泌失调、环境污染也可能增加妇科癌症的发病率和死亡率。
研究表明,妇科恶性肿瘤患者在发病前和治疗期间表现出肠道菌群的变化,表明肠道菌群与妇科恶性肿瘤之间存在相关性。深入研究妇科癌症患者的肠道菌群变化,可用于妇科癌症的筛查,改善妇科癌症的治疗,改善不良预后。
本文从肠道菌群这个角度出发,介绍肠道菌群与绝经后状态以及妇科恶性肿瘤之间的潜在关系,肠道菌群与早期筛查以及治疗方面的关系,此外还描述了益生菌在妇科恶性肿瘤预防、治疗和预后中的作用。
健康稳定的肠道菌群会抑制癌症的发展,而失调的肠道菌群对身体的保护作用有限,可能会促进癌症的发展,也会对癌症免疫、化疗疗效和预后产生不利影响。
绝经后女性的菌群变化
大多数妇科恶性肿瘤好发于绝经后和老年女性;因此,有必要探讨绝经后女性肠道菌群的变化及相关疾病。
绝经后女性缺乏内源性雌激素会引发一系列问题,例如心血管疾病、骨质疏松症、肥胖、糖尿病、乳腺癌和其他妇科癌症的发病率增加。在绝经过渡期间发现肠道通透性增加;此外,肠道通透性增加与炎症发展之间存在关系。
✦绝经前后女性的菌群变化
绝经后女性的粪便样本显示出与内分泌失调和骨质疏松症相关的菌群变化。
下列菌群减少:
下列菌群增加:
用于对抗这些疾病的激素替代疗法可能会增加雌激素相关癌症的发病率,包括乳腺癌和卵巢癌。因此,有必要分析微生物对雌激素水平的影响,创新微生物辅助疗法或减少激素替代疗法的副作用。
先前的研究报道,非卵巢系统性雌激素水平与肠道菌群的丰度和α多样性直接相关,并可能通过肠肝循环影响其水平。
由此引发思考,是否可以通过人为干预绝经期和绝经后女性的肠道微生物,从源头上控制疾病,降低疾病的发病率。
此外,绝经后女性的阴道干燥和组织萎缩显著影响生活质量。阴道环境状况的改变可能使病原菌更容易从阴道侵入,导致阴道生态失调和妇科恶性肿瘤。
✦ 卵巢和肠道微生物存在直接相互作用
在一项实验中,将卵巢完整且多产的雌性小鼠的粪便微生物移植到卵巢切除的阴道萎缩小鼠体内,萎缩症状显著改善。
这表明卵巢和生殖道状态以及肠道微生物之间存在相互作用。此外,通过粪菌移植改善阴道上皮萎缩症状,可能通过改善阴道上皮萎缩相关的保护作用,对预防妇科恶性肿瘤产生影响。
总之,研究绝经后妇女肠道微生物的变化及其在疾病发展和治疗中的作用,将对绝经后妇女的健康和生活质量产生前所未有的影响。
▸ 宫颈癌
宫颈癌是威胁女性生命和健康的最常见的妇科恶性肿瘤之一。目前对肠道菌群与宫颈癌关系的研究主要集中在宫颈癌患者放疗后肠道微生物及相关肠道疾病的变化。
大多数学者对宫颈癌患者的肠道微生物改变持相似观点。然而,肠道生物标志物的研究存在争议,缺乏相关生物学机制的研究。
✦ 宫颈癌患者与健康个体的肠道微生物差异
通过16S rRNA测序比较,学者们注意到宫颈癌患者和健康个体之间肠道微生物的差异。根据最新研究,下列菌群是鉴定宫颈癌的潜在生物标志物:
然而,不久之后的另一项研究显示了不同的结果。研究结果将下列菌群确定为预测早期宫颈癌的生物标志物:
上述研究为未来宫颈癌早期预测和诊断方式的升级提供了未来方向和催化剂。
✦ 短链脂肪酸能抗肿瘤,产短链脂肪酸菌减少
研究人员发现早期宫颈癌患者肠道中产生丁酸盐的细菌Ruminococcus和Clostridium减少了。
微生物代谢产生的丁酸等短链脂肪酸具有良好的抗肿瘤活性,影响各种有益的过程,如癌细胞的免疫和凋亡。
从而提示肠道菌群与癌症发展之间可能通过特定属的存在或缺失以及数量的改变而间接联系。需要更多的实验来验证肠道微生物和宫颈癌发生之间的相互关系及其在筛查和诊断中的作用。
腹部不适是卵巢癌的标志性症状,且治疗期间胃肠道不良反应明显,因此研究肠道微生物与卵巢癌之间的关系具有重要意义。
肠道微生物的失调与卵巢癌的发展密切相关。肠道微生物疾病促进肿瘤生长并导致异种移植小鼠的上皮-间质转化。
✦菌群失调➝肥胖和雌激素失衡➝卵巢癌
肠道微生物的不平衡与肥胖和雌激素水平相关;肥胖和雌激素失衡是卵巢癌发病的危险因素。这表明失调的肠道微生物可能导致肥胖和雌激素失衡触发卵巢癌。
此外,非肥胖者应调节饮食。高油、高脂肪和高盐的饮食也是不可取的。一项对接受高脂肪饮食的动物的研究报告称,这种饮食可能通过破坏炎症因子的水平来促进卵巢癌的发展。因此,不良的饮食习惯和健康习惯是癌症发生的关键危险因素。
✦肠道菌群影响人对铂类药物的敏感性
对卵巢癌治疗的研究表明,肠道微生物会影响人体对铂类药物的敏感性。化疗会对肠道微生物产生不利影响,例如菌群失调,在患有卵巢癌的患者和动物模型中更为普遍。
此外,与铂类敏感患者相比,铂类耐药患者的肠道微生物菌群失调更为明显,健康相关菌群减少,产乳酸菌的比例增加,包括Coriobacteriaceae和双歧杆菌。
✦失调菌群促进肿瘤生长,降低存活率
除了降低对铂的敏感性外,动物研究还表明,肠道微生物的破坏促进卵巢恶性肿瘤的生长并降低小鼠的存活率。同时也表明肠道微生物的完整性和稳定性调节化疗药物的疗效。
胆汁酸等肠道菌群代谢物可以与宿主药物代谢酶相互作用,从而影响药物配置、药代动力学和药效学。
✦肠道菌群及其产物可能有助于治疗卵巢癌
肠道微生物潜在特征的发现可能为未来上皮性卵巢癌的早期检测、治疗甚至预后提供新思路。肠道微生物及其产物也可能有助于治疗卵巢癌。
分离出四株芽孢杆菌从健康人和癌症患者的粪便中观察到细菌产物抑制卵巢癌细胞的增殖,可能是通过引起细胞凋亡,这些细菌产物将来可能被优化为抗癌药物。
✦肠道菌群有利地影响抗癌药物
此外,一项使用小鼠模型的研究发现,抗癌药物对 肠道微生物有一定的作用,导致革兰氏阳性细菌转移到次级淋巴器官并产生免疫反应。这表明肠道微生物群有利地影响抗癌免疫反应的形成和化疗的疗效。
还应注意卵巢癌治疗后肠道微生物的变化。与卵巢癌术前粪便样本不同,术后粪便样本中拟杆菌门和厚壁菌门的丰度显著降低,而变形菌门的丰度显著升高。化疗组也有类似的变化。这意味着卵巢癌的治疗对肠道菌群有显著影响,肠道菌群与卵巢癌患者的临床预后之间可能存在潜在的相关性。
▸ 子宫内膜癌
子宫内膜癌是一组子宫内膜上皮恶性肿瘤,最常见于围绝经期和绝经后妇女。子宫内膜癌的危险因素包括肥胖、糖尿病和高血压。
子宫内膜癌的发病率不仅在绝经前和绝经后妇女之间存在显著差异,而且在不同发展程度的国家之间也存在着差异。欧洲和北美的发病率高于发展中国家。
研究人员推测,子宫内膜癌的发展可能与由于生活质量和人们饮食改善而导致的荷尔蒙异常和超重的不良后果有关。
✦ 影响子宫内膜癌的发病因素
肠道微生物失调引起的消化吸收中断可能导致肥胖,肥胖的发生可能导致高血压、糖尿病和激素紊乱。这表明肠道微生物与子宫内膜癌之间存在关系。
此外,子宫内膜癌的发病与月经、婚育、吸烟、饮酒等因素有关。不同国家的饮食习惯、婚恋政策和风俗习惯,环境污染,甚至种族差异都可能导致不同的子宫内膜癌发病率。
✦ 肠道菌群能调节女性的全身雌激素水平
由雌激素编码的β-葡糖苷酸酶和β-葡糖苷酸,例如双歧杆菌、梭状芽孢杆菌和乳酸杆菌能够在肠道中发挥作用,调节循环雌激素水平,去除通过胆汁排泄的结合雌激素的葡糖苷酸,以获得游离的雌激素分子。
此外,羟基类固醇脱氢酶也广泛存在于人体肠道中,并参与从胆固醇前体合成雌激素的部分还原过程。
尿液和血清雌激素水平与肠道微生物多样性呈正相关。肠道微生物还赋予外来雌激素样化合物生物活性。例如,肠道微生物能够催化大豆苷元以雌马酚或O-去甲基安果胶的形式代谢。木脂素的有益作用还取决于肠道微生物代谢物肠二醇和肠内酯的活性。
因此,除了女性遗传差异和身体条件改变以及环境雌激素暴露的直接影响在激素水平上,由于不良生活方式、饮食和抗生素滥用导致的肠道微生物生态失调也间接影响雌激素水平,进而促进子宫内膜癌的发生。
最近关于肠道菌群、肥胖、绝经状态、雌激素和子宫内膜癌之间潜在关系的综述也表明,更年期和肥胖可以通过引起肠道菌群失衡引起的雌激素变化来调节子宫内膜癌的发展。
✦ 肥胖导致子宫内膜癌的风险增加和预后更差
一项研究发现,肥胖妇女的子宫内膜上皮细胞显示出大量甲基化变化,与I期子宫内膜癌存在54个重叠的差异甲基化区域。
这表明肥胖通过影响DNA甲基化并导致相关代谢途径的失调而促进子宫内膜癌的发生。肥胖对子宫内膜癌的影响引发了人们的猜测,即减肥手术是否可以通过稳定肠道微生物和雌激素水平来帮助改善肥胖,甚至可能在未来促进子宫内膜癌治疗。
一项相关研究报告称,减肥手术会导致肠道微生物发生变化,产生有益的影响,但不会影响激素水平,而且减肥手术与子宫内膜癌发病率之间没有直接关系。然而,深入研究减肥手术在子宫内膜癌中的潜在作用可能会在未来的癌症研究中有前所未有的应用。
影响肠道微生物的因素及其在妇科癌症中的潜在作用机制
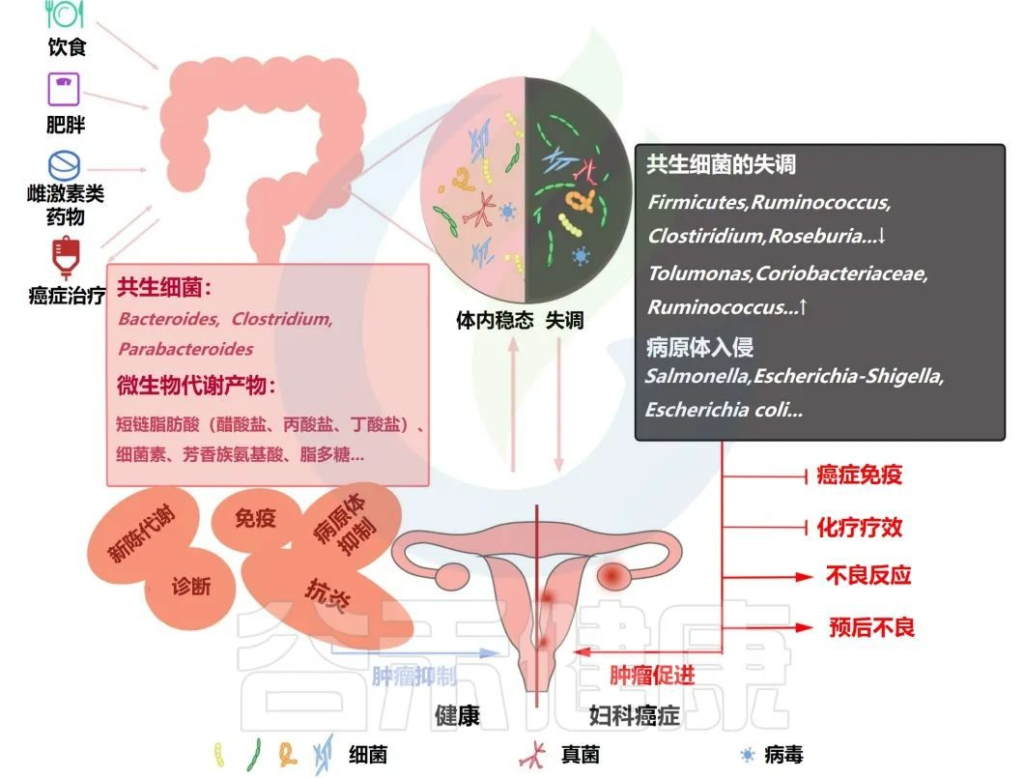
Han M,et al.Front Oncol.2022
不健康的饮食、肥胖、雌激素药物滥用和癌症治疗都会影响肠道微生物的体内平衡,共生菌减少,病原菌增加。
益生菌是在一定剂量范围内对身体有益的微生物。可以在一定程度上改善肠道微生物的生态失调,进而通过影响雌激素水平、癌症免疫、癌细胞增殖和凋亡、耐药性等对妇科癌症产生有益的影响。
益生菌和粪菌移植在妇科癌症中的意义
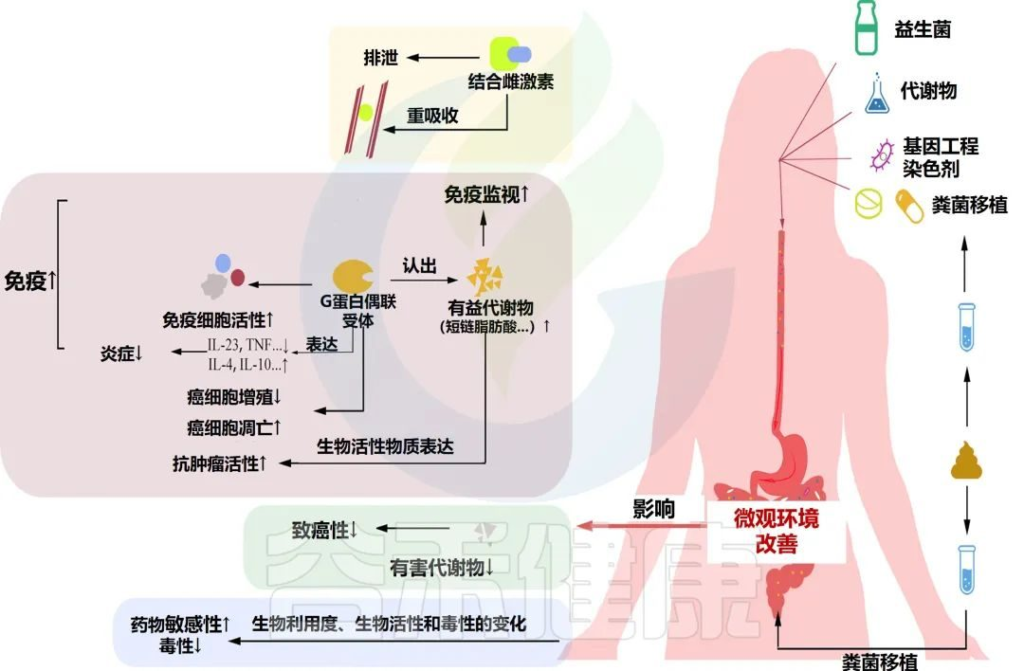
Han M,et al.Front Oncol.2022
益生菌及其代谢物、基因工程菌株和粪菌移植可以改善肠道微生物环境。肠道微生物环境的改善可以影响雌激素水平,提高癌症免疫力和化疗疗效,增加癌细胞的凋亡,减少癌细胞的快速增殖和药物副作用。
鼠李糖乳杆菌(Lactobacillus rhamnosus)是益生菌领域的一个明星属,具有广泛的应用。鼠李糖乳杆菌在癌症中的潜在作用广泛分为以下几部分。
● 鼠李糖乳杆菌帮助恢复肠道屏障功能
首先,鼠李糖乳杆菌通过增强健康肠道通透性相关基因的表达,调节肠道菌群的动态平衡,保护粘膜并恢复肠道屏障功能,上文也已经提到了肠道菌群对妇科恶性肿瘤的稳态作用。
● 鼠李糖乳杆菌调节免疫
其次,关于人的自我保护,鼠李糖乳杆菌潜在地调节免疫,通过激活或抑制细胞因子表达和病原体入侵引起癌细胞凋亡和抗炎作用。
最终,鼠李糖乳杆菌还可以保护身体免受放射疗法和其他治疗方法的毒性和副作用。
从分泌物或排泄物中分离的细菌(益生菌特性)
一些研究记录了从人和动物的分泌物或排泄物中分离出的某些细菌的抗癌活性。
从母乳中分离的三种潜在益生菌菌株:
还有从猪肠道食物中分离的Enterococcus faecalis por1
以上这些菌群具有益生菌特性,并且可以通过靶向癌基因、防止癌细胞生长、诱导凋亡或调节免疫应答能力来抑制癌症的发展。
研究发现,从Bacillus thuringiensis 4R2中分离出来的parasporin-2Aa1被蛋白酶K激活,诱导来自不同组织的各种人类癌细胞的凋亡,包括子宫内膜癌细胞,但它不影响正常细胞。由于其良好的特性,parasporin-2Aa1可在未来与化疗药物联合使用以减少对正常细胞的杀伤。
益生菌混合物和基因工程益生菌通过靶向免疫系统来促进癌症治疗。
研究发现,经鼻内给药的Lactococci 被设计为表达HPV-16 E7抗原,可刺激细胞介导(分泌IL-12和IFN-γ)和体液免疫系统(产生E7抗体),以预防HPV相关宫颈癌。
此外,口服含有特定鼠李糖乳杆菌、嗜酸乳杆菌和乳铁蛋白RCXTM的益生菌混合物可调节阴道和全身的先天性和适应性免疫反应,削弱Gardasella vaginalis诱导的阴道病,并预防由炎症引起的妇科癌症。
● 雌激素过多或过少都可能影响妇科癌症
雌激素缺乏会影响女性的健康,然而,不适当的雌激素补充也可能导致包括乳腺癌和子宫内膜癌在内的疾病。因此,益生菌与激素相关药物联合用药是未来雌激素缺乏研究的热点。
具有选择性雌激素受体亲和力的生物可利用异黄酮在预防和治疗因雌激素缺乏引起的骨质疏松症方面具有潜力,同时最大限度地减少或消除其致癌副作用。
● 益生菌调节癌症治疗副作用的预防和管理
通过放射疗法治疗宫颈癌的一种可能的急性副作用是辐射引起的腹泻。许多实验表明,补充益生菌包括乳酸乳杆菌、动物双歧杆菌和嗜酸乳杆菌可以最大限度地降低宫颈癌患者放射引起的腹泻的发生率和严重程度。
上述研究大多基于现象,需要深入研究来证明结论的准确性。益生菌在妇科肿瘤治疗中的作用机制研究尚缺乏,有待进一步探索。
微生物本身没有好坏之分;它们分为对宿主有益和有害的细菌,导致微生物对宿主产生双重作用。
菌群失调和病原菌入侵促进癌变,不利于妇科恶性肿瘤的后期治疗。然而,维持菌群稳态和益生菌的应用可以抑制癌症。
肠道微生物的有效利用对妇科恶性肿瘤的未来具有重大影响。以上研究促进了妇科恶性肿瘤微生物学方面的进步;但是,还存在样本量小和机制研究不完整等缺点。
更多研究应增加样本量,考虑影响结果的所有相关参数,并侧重于研究机制和临床效果,以便更好地延长妇科恶性肿瘤患者的生存时间,提高生存率和生活质量。
关于妇科癌症预防治疗的建议
▸避免或减少肉类、乳制品和饱和脂肪
总体而言,病例对照研究发现,尤其是与红肉相关的子宫内膜癌风险增加。一项研究队列发现血红素铁(在红肉和白肉中都存在)与肝脏消耗和子宫内膜癌之间存在显着关系。对脂肪摄入和子宫内膜癌的剂量反应分析得出结论,将总脂肪摄入量增加 10% 的卡路里会使患这种癌症的风险增加 5%。
然而,饱和脂肪摄入量增加 10 克/1000 大卡与更大的风险相关(17%)。也就是说饱和脂肪对增加子宫内膜癌风险的影响是其他类型脂肪的三倍以上。
▸避免生的或未煮熟的海鲜
化疗会影响女性的免疫系统和抵抗感染的能力,因此不应食用可能含有细菌的生的或未煮熟的海鲜或肉类,因为受损的免疫系统更难抵抗食源性感染。在手术或化疗期间发生感染可能会导致癌症治疗延误。
▸限制含有丙烯酰胺的食物(油炸食品)
包括国际癌症研究机构在内的多个来源都认为,饮食中的丙烯酰胺是一种“可能的致癌物”。膳食丙烯酰胺是高温烹饪某些淀粉时产生的化学副产物。它存在于深度加工和油炸食品中,例如:薯片、炸薯条、某些加工过的谷类食品和零食等都可能含这种物质。
▸多吃水果、蔬菜
先前的研究表明,蔬菜水果可能与降低风险的程度有关,可达50-60%。在美国癌症协会的癌症预防研究II营养队列(超过41,000名女性)中,蔬菜和水果(分别降低20%和25%的风险)对食用这些食物最多的人的保护作用仅在从未使用激素治疗的女性中确定。例如苹果、西兰花、蓝莓、草莓、辣椒等。
尤其是所有的十字花科蔬菜,如西兰花、芥菜和球芽甘蓝,都有抗癌作用。这些蔬菜中存在的一种叫做萝卜硫素的化学物质会产生一种减少肿瘤生长的酶。
另一种化合物 Indole-3-carbinol 在对抗癌细胞方面也很不错。
β-葡聚糖是一种存在于某些蘑菇中的化合物,在抗癌方面很受欢迎。
在水果中,葡萄具有巨大的健康益处。它们含有抗氧化剂,可以防止自由基破坏身体的健康细胞。葡萄皮含有白藜芦醇,这是另一种具有抗癌特性的化合物。
▸避免糖和高血糖指数碳水化合物
研究发现,饮用含糖饮料多的女性患子宫内膜癌的风险要高出 78%。一项荟萃分析比较了饮食中血糖负荷最高的女性与血糖负荷最低的女性,发现前者的风险高出约20%.
▸尽可能吃完整的、未加工的食物
子宫内膜癌主要与体内高水平的无拮抗雌激素有关。包装食品不仅缺乏营养,还含有人造防腐剂和化学物质,以及包装中的塑料,导致雌激素循环增加。
对于子宫内膜癌患者来说,理想的饮食需要包含大量的天然食品,并且应该不含高度加工的食品。糙米、燕麦片、豆类和麸皮等全谷物提供足够的纤维,有助于定期排除体内的毒素。
许多非有机食品中的杀虫剂会增加体内的雌激素。吃完整的有机食品可能对其预防和管理特别重要。
▸喝咖啡和绿茶
研究发现,喝咖啡量相对较多的女性患子宫内膜癌的风险降低20%,而喝咖啡量高从未接受过HRT治疗的女性,患子宫内膜癌症的风险降低40%。
可能是由于咖啡中的咖啡因和其他甲基黄嘌呤能够增加性激素结合球蛋白(SHBG)并增加胰岛素敏感性。
同样,喝绿茶的人患子宫内膜癌的风险在最高摄入量组低近20%。其作用可能包括促进细胞凋亡、细胞周期阻滞、上调谷胱甘肽- s转移酶,使致癌物失活,以及抗雌激素作用。
▸适度饮酒
酒精摄入与子宫内膜癌风险之间似乎存在J型关系。研究发现,与不喝酒或偶尔喝酒的女性相比,每天喝半杯到一杯的女性风险降低4-7%,而每天喝2.5杯或超过2.5杯的女性风险分别高出14%和25%。
▸补充维生素
据《营养杂志》报道,每天服用 500mg 维生素 C和 400 国际单位的维生素 E 可以将患卵巢癌的风险降低 68% 。斯坦福大学的科学家说,这两种营养素都有助于关闭为异常细胞生长提供燃料的酶。
▸可能预防卵巢癌的食物
密歇根大学的研究人员认为,生姜的活性化合物(姜酚)破坏卵巢癌细胞。
番茄汁的细胞壁在加工过程中被分解,更容易吸收。研究人员报告称,每天只需喝八盎司番茄汁就能将患卵巢癌的风险降低一半。
一项针对人体细胞的妇科肿瘤学研究发现,一种仅存在于鱼类中的 omega-3 脂肪酸 DHA 可抑制卵巢癌的生长。
发表在BMC Cancer上的研究表明,含有矿物质硒的食物可能会降低卵巢癌的风险。它在体内充当抗氧化剂,降低破坏细胞的自由基水平。高蛋白食物中很多富含硒,例如瘦肉、鱼(金枪鱼)、虾、豆类、坚果等。
▸其他营养和生活方式建议
限制高能量密集型食物和高盐(或高钠食物)、定期运动和保持健康体重可能会降低癌症风险。
与其他饮食模式相比,遵循植物性饮食提供更高的饮食质量,有助于实现健康体重。
▸疫苗接种
HPV 疫苗可以帮助预防导致大多数宫颈癌病例的HPV 类型的感染,最好在青少年时期就接种。
▸肠道菌群健康检测
随着深入研究体内微生物群与妇科恶性肿瘤发生发展的关系,利用菌群预测癌症的早期阶段成为可能。
通过及时调整饮食、生活方式、配合益生菌的使用等干预手段,尽可能避免疾病发展。
主要参考文献
Han M, Wang N, Han W, Ban M, Sun T, Xu J. Gut Microbes in Gynecologic Cancers: Causes or Biomarkers and Therapeutic Potential. Front Oncol. 2022 Jul 13;12:902695. doi: 10.3389/fonc.2022.902695. PMID: 35912194; PMCID: PMC9326394.
Avgerinos KI, Spyrou N, Mantzoros CS, Dalamaga M. Obesity and Cancer Risk: Emerging Biological Mechanisms and Perspectives. Metabolism (2019) 92:121–35. doi: 10.1016/j.metabol.2018.11.001.
Tong J, Zhang X, Fan Y, Chen L, Ma X, Yu H, et al. Changes of Intestinal Microbiota in Ovarian Cancer Patients Treated With Surgery and Chemotherapy. Cancer Manag Res (2020) 12:8125–35. doi: 10.2147/CMAR.S265205.
Ding K, Hua F, Ding W. Gut Microbiome and Osteoporosis. Aging Dis (2020) 11(2):438–47. doi: 10.14336/AD.2019.0523.
Garcia-Gutierrez E, Narbad A, Rodriguez JM. Autism Spectrum Disorder Associated With Gut Microbiota at Immune, Metabolomic, and Neuroactive Level. Front Neurosci (2020) 14:578666. doi: 10.3389/fnins.2020.578666.

谷禾健康
在这个充满压力、紧张和焦虑的快节奏世界中,人人都容易患上许多身心疾病。
根据世界卫生组织 (WHO) 的数据,世界上每 8 人中就有 1 人患有精神障碍,其中焦虑症和抑郁症最为常见。尤其经历疫情,仅2020年,全球重度抑郁症患者增加27.6%(95%不确定区间(UI):25.1-30.3),焦虑症患者增加25.6%(95%不确定区间:23.2-28.0).

情绪健康对身体健康有直接影响,反之亦然。这背后的原因离不开肠道和大脑之间的双向交流,这两者之间的对话主要是由肠道微生物群介导的。
也就是说,肠道微生物群在神经精神疾病的发病机制中起着至关重要的作用。
精神障碍,包括抑郁、焦虑、恐惧、双相情感障碍、精神分裂症和其他精神病、痴呆、以及自闭症和创伤后应激障碍等,都有一系列症状,比如:异常的思想、感知、情绪、行为和人际关系等。

哪些因素会引发精神疾病?
大多数精神疾病是由环境、心理和生物因素共同引起的。遗传、脑损伤、微生物感染、药物滥用、营养不良或暴露于环境污染物都可能在精神障碍的发展中发挥重要作用。
环境污染物影响精神疾病易感性
随着世界各地工业流程和技术的进步,现代文明产生的各种环境污染物已大大增加。人们在日常生活中会接触到各种各样的污染物,这些污染物会影响肠道微生物群并操纵肠道和大脑之间的双向交流,从而导致精神或神经系统疾病的易感性。
精神益生菌:有助大脑健康的下一代益生菌
精神益生菌是一种能够影响肠-脑轴的益生菌菌株,对改善微生物群以及缓解中枢神经系统疾病的某些症状具有积极作用。常见的精神益生菌包括:乳酸杆菌、链球菌、双歧杆菌、大肠杆菌、肠球菌等。
//
本文讨论了各种环境污染物(重金属、邻苯二甲酸盐、双酚 A 、颗粒物等)如何影响错综复杂的微生物群-肠-脑轴,从而影响神经和整体心理健康,总结了精神益生菌如何通过菌群有效缓解多种中枢神经系统疾病的症状及改善心理健康。
本文涉及的专业术语
CNS—中枢神经系统
ENS—肠神经系统
HPA—下丘脑-垂体-肾上腺
GBA—肠脑轴
MGBA—微生物-肠-脑轴
GABA—一种中枢神经系统抑制性神经递质
VN—迷走神经
BDNF—脑源性神经营养因子
在了解环境污染物如何引发精神疾病之前,我们先来了解一下:微生物群-肠-脑轴。
微生物群-肠-脑轴是如何运作的?
它负责协调肠神经系统(ENS)和中枢神经系统(CNS)之间的双向交流,将外周消化活动与大脑的情绪、行为和认知中心联系起来。
微生物群-肠-脑轴 (MGB) 的双向交流
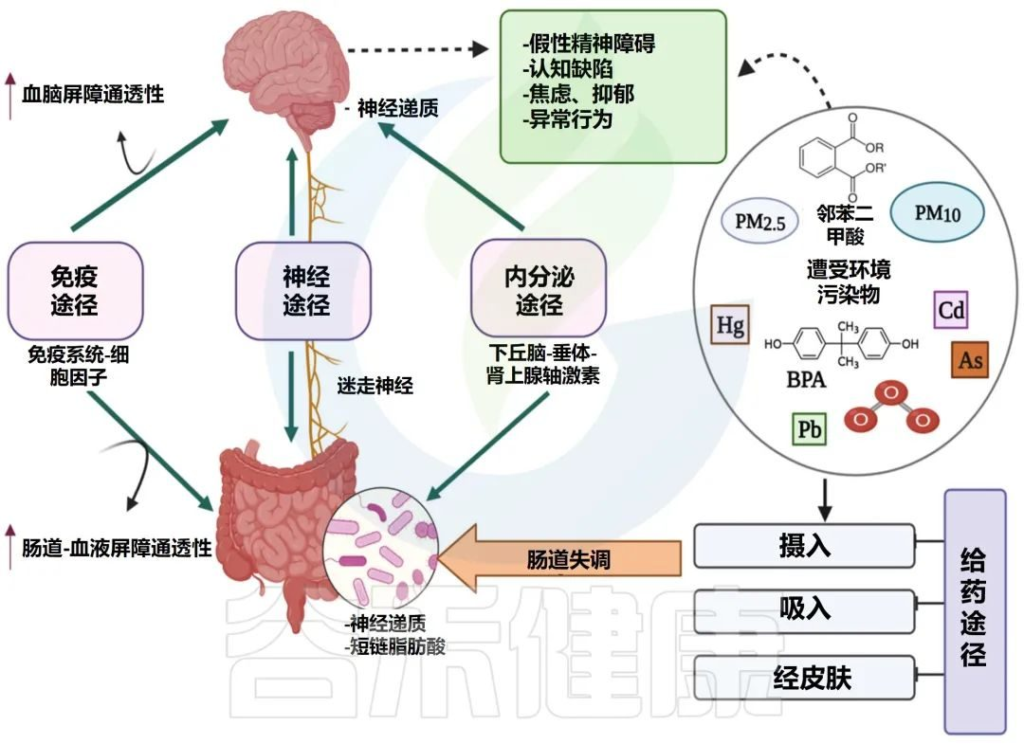
Singh S,et al., Microorganisms.2022
这种关联受皮质醇和下丘脑-垂体-肾上腺(HPA)激素、迷走神经(VN)系统和免疫反应等激素的调节。迷走神经是副交感神经系统的主要组成部分,可将肠道信号传递到中枢神经系统并刺激反应。
肠道菌群在肠-脑轴中如何发挥作用?
肠道菌群可以通过多种潜在机制改变大脑功能:
同时并产生具有神经活性特性的代谢物,例如短链脂肪酸、支链氨基酸、肽聚糖等。
这在我们之前的文章也有详细阐述过:
深度解读 | 肠道菌群和中枢神经系统的关系
微生物群-肠-脑轴如何影响压力、焦虑等?
肠-脑轴的作用已在几个生理过程中得到证实,例如饱腹感、食物摄入以及脂肪和骨代谢、葡萄糖调节和胰岛素分泌。
此外,宿主行为受肠神经系统和中枢神经系统与肠脑轴相关性的影响。这些系统活动的减少与压力或焦虑增加有关。
已经确定肠脑轴活性受降钙素基因相关肽(CGRP)的调节。当增加的病原微生物破坏肠道微生物群时,神经元可以产生CGRP并将其释放到肠道中。感染可诱导CGRP的分泌,进而激活宿主防御和降钙素受体的相应免疫反应。
微生物-肠-脑轴的存在表明,通过饮食、宿主衍生代谢物和不同环境污染物改变肠道微生物的组成和数量,可以影响中枢神经系统和肠神经系统,从而影响精神疾病的发生和发展。
菌群代谢产物——短链脂肪酸
有助于调节中枢神经系统
短链脂肪酸可以通过单羧酸盐转运蛋白穿过血脑屏障(BBB),通过过度表达紧密连接蛋白并保持血脑屏障的完整性。
短链脂肪酸可以调节神经营养因子 (BDNF) 的水平,促进神经发生,影响神经胶质细胞的形态和功能,有利于血清素形成并改善神经元稳态和功能,所有这些都有助于调节中枢神经系统中的神经炎症。
短链脂肪酸与这些肠-脑网络的结合可以直接或间接地改变认知、情绪和精神障碍的病理生理学。
通过调节途径(包括犬尿氨酸途径)改变神经递质活性,以及大脑中短链脂肪酸的可用性和影响的变化,都可能对脑源性神经营养因子(BDNF)功能产生影响,包括中枢神经系统中的神经元存活和分化。
如肽酪氨酸酪氨酸 (PYY)、胆囊收缩素(CCK)和胰高血糖素样肽-1(GLP-1)从表达游离脂肪酸受体(FF-R)的肠粘膜肠内分泌细胞中的释放。在啮齿动物中,血源性PYY和GLP-1会渗透到大脑中,并对神经递质和行为产生显著影响。
每天接触各种环境污染物会影响肠道微生物群,损害肠脑轴,它们是如何导致抑郁、焦虑等心理健康问题的?下一章节我们展开讨论。
我们知道,人体各类疾病(免疫性疾病、胃肠道疾病和神经行为疾病)可能是由于微生物群的变化而产生的,微生物群失调后致病菌增多,产生毒力因子,如脂多糖,从而引发一系列导致“肠漏”的过程。
所谓“肠漏”,即肠黏膜通透性增加,这可能使细菌、细菌毒素和其他小分子物质泄漏到血液中并引起全身炎症。
关于肠漏详见:什么是肠漏综合征,它如何影响健康?
细菌毒素因子和代谢物能够转移到远处的目标区域,例如大脑。激素合成、细菌产生的代谢物、模仿宿主产生的因子和表观遗传突变都是肠道菌群失调影响宿主的潜在机制。
✦ 环境污染物通过干扰菌群影响宿主
暴露于环境污染物会针对宿主和常驻肠道微生物群,其干扰可能会产生系统性影响,包括通过微生物群-肠-脑轴改变中枢神经系统的功能。
重金属、有机溶剂和空气污染物是研究最多的与人类精神疾病和心理功能有关的人造和天然毒物类型。
研究人员发现那些生活在土壤中重金属和重金属浓度较高的地区的人,患精神疾病的可能性更高。即使较低的水平也会导致肠道失调和对心理健康的负面影响。
重金属类型:
铅 (Pb)、镉 (Cd )、汞( Hg )等。
重金属可能以四种方式进入人体:
▸ 重金属如何对人类健康的不利影响?
在重金属到达大脑之前,初步的环境暴露预计会与肠道微生物群相互作用。
当重金属到达胃肠道系统时,重金属毒性可能由肠道微生物组通过代谢氧化或还原过程介导。另一方面,重金属会引起氧化应激,改变肠道屏障的通透性,扰乱人体健康的微生物群,导致菌群失调。肠道菌群失调提高了重金属和氧化应激的潜在破坏性影响,这与精神疾病有关。
肠道菌群对重金属的吸收和代谢的直接影响
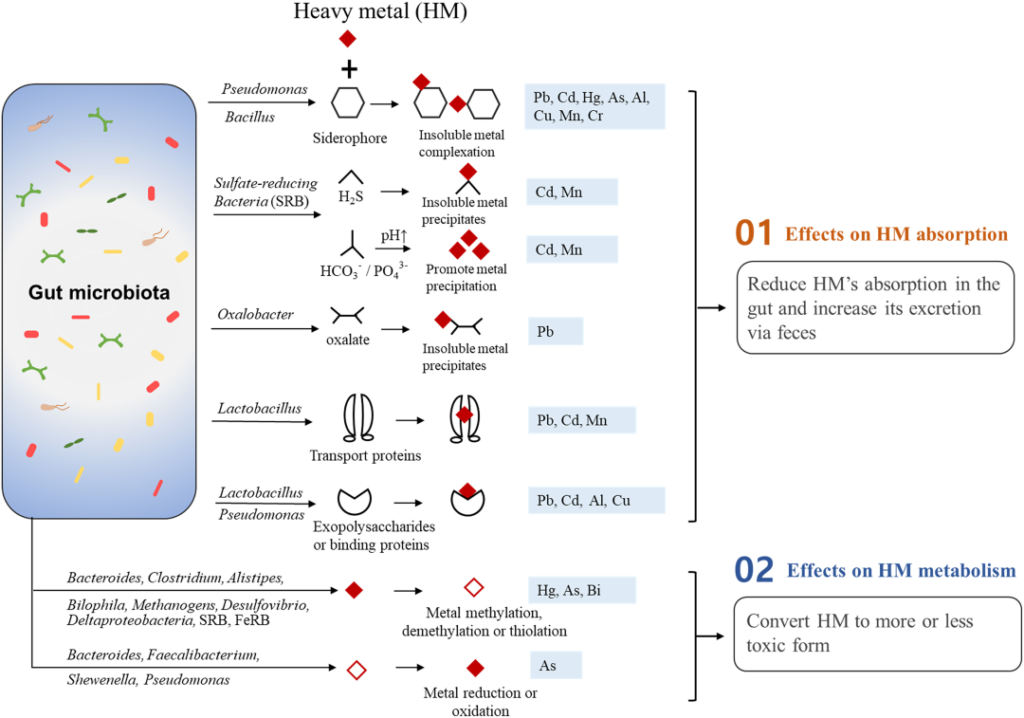
Duan H, et al., Sci Total Environ. 2020
【 铅 】
铅是一种众所周知的神经毒素,它对单胺信号传导 、下丘脑-垂体-肾上腺(HPA)轴和其他几个大脑系统的影响与情绪障碍有关。
几项动物研究表明,接触铅会导致HPA轴永久功能失调。
▸ 重金属导致线粒体功能障碍,与精神疾病有关
在某些精神疾病的病理生理学中,铅和镉等重金属可能导致线粒体生化级联反应发生故障。研究人员记录了 19 例线粒体疾病,这些疾病还伴有抑郁和焦虑等精神问题,确立了线粒体功能障碍和精神疾病之间的联系。
乳酸菌产生的支链氨基酸可以穿过血脑屏障,并通过增强线粒体生物合成来改变宿主生理,从而提高对活性氧的抗氧化作用。这就提供了重金属暴露、肠道微生物组和心理健康之间的重要联系。
根据肠道微环境因素,如 pH 值、氧化还原电位、氧气可用性、易感/耐药微生物的流行程度以及微生物群的总体多样性和代谢活动,推测肠道中有害金属的暴露会对常驻菌群产生不同的影响。
【 汞 】
汞中毒是第二大常见的重金属毒性。有几起因汞中毒引起的精神疾病的报告。汞的神经精神毒性主要涉及元素汞(Hg2+),它是通过甲基汞通过血脑屏障去甲基化而形成的。
▸ 汞积累可能引发脑损伤
由于大脑是汞的主要靶点,因此其产前暴露会导致人类和实验动物的大脑萎缩、大脑皮层和基底神经节损伤、细胞死亡、脑层紊乱和神经胶质增生。
由于Me-Hg中毒与年龄有关,因此汞中毒和汞沉积的症状因人在接触时的年龄而有很大差异。
▸ 过多接触汞的胎儿存在思维问题
在子宫内暴露于Me-Hg的儿童,可能在认知思维、记忆力、注意力、语言技能、肌肉控制和视觉空间技能方面存在问题。
急性Me-Hg暴露也改变了大鼠肠道微生物群的结构和功能,包括脱硫弧菌目、消化球菌科和幽门螺杆菌,所有这些都与特定的神经代谢物有关,如谷氨酸和γ-氨基丁酸 (GABA)。
在成熟的中枢神经系统中,谷氨酸和γ-氨基丁酸分别是主要的兴奋性和抑制性神经递质。它们的不平衡可能导致不同的精神和神经问题。
关于谷氨酸与肠道菌群详见:兴奋神经递质——谷氨酸与大脑健康
在鱼类中,Me-Hg处理增加了下列菌群:
Xanthomonadaceae,Pirellula,Cloacibacterium,
Comamonadaceae,Deltaproteobacteria FAC87
所有这些都参与了异生物质代谢和金属去除。有机和无机形式的汞通过胃肠道吸收并影响其他系统,包括中枢神经系统,引发心理问题。
【 砷 】
砷,也会导致认知功能障碍和易患情绪障碍,主要是通过破坏血清素和多巴胺代谢。
由于已知有几种肠道微生物有助于这些神经递质的生物合成,因此微生物群中的任何干扰都可能是导致肠脑串扰改变的可能原因。
▸ 砷处理小鼠:拟杆菌↑↑,厚壁菌↓↓,短链脂肪酸↓↓
在几项研究中,小鼠肠道微生物群中砷暴露的时间和剂量依赖性变化被确定为拟杆菌门的增加和厚壁菌门的减少。
研究还发现砷处理促进了与脂多糖产生、多重应激反应、DNA 修复和维生素生物合成有关的细菌基因转录,同时减少了短链脂肪酸生物合成有关的基因转录。
短链脂肪酸减少引起了:
慢性炎症、肠道通透性增加、条件致病菌增殖、金属摄入增加和血脑屏障功能障碍增加。
▸ 砷暴露的人类研究:致病菌↑↑ 共生菌↓↓
一项对尼泊尔人的研究发现,砷暴露通过富集挥发性细菌和致病菌,同时消耗肠道共生菌,从而改变了肠道微生物群组成。
此外,代谢组学分析显示了伴随的影响,几种肠道微生物群相关的代谢物在各种生物基质中被破坏。砷暴露不仅使肠道微生物群在丰度方面变化,还在代谢特征和功能方面也发生了变化 。
下列菌群因接触砷而发生显著变化,并可能与接触砷引起的疾病直接相关:
胃肠道上皮内的重金属离子相互作用或积累导致氧化应激、微生物群失调、细胞损伤和兼性厌氧菌丰度增加(包括变形杆菌和杆菌在内)。因此,上皮细胞可利用的氧气量增加,消耗产生短链脂肪酸的厌氧细菌,并降低抗炎和抗氧化代谢物的产生,这可能进一步破坏血脑屏障的完整性并减少神经发生,导致大脑功能紊乱。
重金属与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
小结
总体而言,重金属暴露会改变微生物组成,从而导致肠道微生物群的代谢改变,从而影响人体新陈代谢。
为了消除外源金属,需要一个稳定有效的肠道微生物群。预计膳食有毒金属缓解治疗可减轻有益肠道菌群的炎症负担,从而减轻精神疾病的发展。
一旦重金属进入人体,一些食物就会与它们螯合。水果和蔬菜提供了大量的抗氧化剂,能够减少重金属的损害。香菜、野生蓝莓、大蒜、柠檬水、小球藻、螺旋藻、咖喱、绿茶、大西洋海藻、大麦草、西红柿和益生菌是可以帮助逐渐去除体内金属的食物或补充剂。
重金属可能存在于:
– 处理过的木材中的防腐剂(砷和铜)
– 家用消毒剂(汞、铜和银)
– 厨具,如锅、锅、刀、汤匙和叉子(铝、铜和铅)
– 油漆(铅、汞、镉、锑)
– 杀虫剂、除草剂和杀菌剂(砷、锑和镉)
– 灭鼠药(铊)
– 鱼(汞)
– 大米(砷)
– 化妆品、染发剂(汞、铅)
– 纹身(汞)
– 地板蜡/抛光剂、织物柔软剂、汞合金填充物(汞)
– 巧克力、汽油、烟草烟雾(铅、镉)
– 罐头食品(铝、铅)
– 发酵粉、面粉、除臭剂、牙膏、胃抗酸剂、铝箔、泻药(铝)
– 自来水(铝, 镉)
– 含铅管道 (铅)
– 空气污染 (柴油机尾气、燃煤厂、钢铁和金属铸造厂、化肥公司)
邻苯二甲酸盐是存在于大量产品中的增塑剂,特别是润滑剂、地板材料和个人护理用品,如洗发水和肥皂。在产品使用和储存过程中,它们的浸出、迁移和氧化会污染各种水源、空气和土壤。
人类通过以下方式暴露于邻苯二甲酸盐:
对多个物种的研究表明,发育中的生物暴露于邻苯二甲酸盐会影响肠道微生物群,降低其多样性,特别是改变细菌代谢物的数量,这可能对健康产生严重影响。
✦ 邻苯二甲酸引起菌群失调:罗氏菌属和长双歧杆菌减少
新生儿的肠道微生物群受到早期药物治疗中接触邻苯二甲酸二酯 (DEHP) 的影响,这可能会影响他们以后的免疫反应。当婴儿静脉注射DEHP 时,会出现暂时的肠道微生物失调。DEHP暴露改变了细菌群落的组成和多样性,包括罗氏菌和长双歧杆菌的减少。
在小鼠中,DEHP暴露会导致肠道微生物群落结构以及粪便代谢物谱和雌性生殖毒性的改变。DEHP暴露引起的肠道菌群失调改变了微生物代谢物的水平,例如短链脂肪酸、支链氨基酸和单糖,它们是微生物群-肠-脑轴的重要组成部分。
对319 名在1999 年- 2006 年间在市中心分娩的不吸烟女性进行了研究,其中检测到了四种邻苯二甲酸酯代谢物:
其中三种邻苯二甲酸酯(DnBP、DiBP和BBzP)与一系列行为问题有关,包括焦虑、抑郁、躯体不适和退缩行为。
▸ 产前邻苯二甲酸酯暴露对儿童的神经发育产生负面影响
这些负面影响包括精神运动、认知和行为结果。通过干扰神经内分泌系统,这种污染物可能会损害神经元的分化和成熟,增加行为和认知缺陷的风险。
✦ 情绪问题通常与HPA轴有关
它会被邻苯二甲酸盐和双酚A等激素破坏。研究记录了青春期和成年小鼠在围产期暴露与DEHP时的焦虑和抑郁行为。在这些试验中,增加的焦虑相关行为与功能失调的HPA轴相关,表现为ACTH增加、皮质酮水平降低以及下丘脑GR水平升高。
▸ DEHP暴露后,小鼠菌群代谢物对甲酚上调
在年轻小鼠中,DEHP暴露通过增加合成代谢物前体的物种的丰度,来抑制丁酸盐合成并上调对甲酚的产生,对甲酚是一种与神经发育和行为问题相关的细菌代谢物。这证明了DEHP的神经毒性作用与肠道菌群失调之间的联系。
双酚A(BPA)是一种内分泌干扰化学品(EDC),用于生产聚碳酸酯塑料。饮食、空气、水和灰尘都是人类接触双酚A的可能来源。
由于双酚A的广泛使用,它的暴露正成为一个值得关注的问题。根据最近对暴露于双酚A的发育或成年动物调查,双酚可以改变一系列物种的肠道微生物群。
▸ 双酚A暴露减少了双歧杆菌,AKK菌,导致炎症,引发精神障碍
在一项研究中,肠道变化如下:
小鼠产前双酚A暴露减少了双歧杆菌,双歧杆菌已知具有抗炎特性,这可能导致全身炎症,从而导致各种健康问题,包括精神障碍。
▸ 产前母亲尿液双酚A浓度高的孩子,具有更高水平的焦虑和认知异常
各种实验和流行病学调查已将产前母亲尿液双酚A浓度的增加与儿童行为,空间学习和记忆结果联系起来。
更多的研究表明,通过过度激活HPA轴并破坏其基础和压力诱导,产前暴露于双酚A的动物具有更高水平的焦虑和认知异常,通过减少海马 GR 介导的反馈介导的HPA轴抑制,可能会增加在以后的生活中出现压力相关问题的风险。
数据表明,产前双酚A暴露和精神障碍持续增强通过重编程诱导的HPA轴激活联系起来。雌激素EDC已被证明以时间、性别和暴露依赖的方式影响大脑,尤其是下丘脑。
▸ 双酚A降低短链脂肪酸的水平,诱发炎症,损害认知
根据16SrRNA 扩增子测序分析,暴露于双酚A会导致β多样性的差异,而短链脂肪酸生产者的相对丰度显著下降。双酚A还降低了粪便短链脂肪酸的水平,同时增加了氧化应激 、全身脂多糖水平和肠道通透性,所有这些都是炎症引起的慢性疾病的早期迹象。
根据最近的一项调查,小鼠中双酚A暴露引起的神经毒性可能部分归因于MGBA的破坏。暴露于双酚A的雄性小鼠的结果表明,增加的神经炎症损害了它们的认知功能。神经递质血清素、其前体色氨酸及其代谢物5-羟基吲哚乙酸 (5-HIAA) 的脑、结肠和血清水平在暴露于双酚A后都会降低。
▸ 双酚A诱导的肠道菌群变化使粘蛋白、丁酸、血清素降低
随着肠道微生物群的改变,发现结肠中的粘蛋白水平和粘液分泌降低,丁酸水平也是如此。双酚A诱导的肠道菌群变化部分地调节了双酚A对心理和代谢健康的负面影响。
双酚A降低了粪便中短链脂肪酸和大脑中血清素水平,以及参与色氨酸代谢的不同类型的微生物,导致神经递质信号发生变化。双酚A改变了肠血屏障(GBB)和血脑屏障(BBB)的完整性,这可能与肠道和大脑的生态失调、认知能力下降和炎症增加有关。
内分泌干扰物与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
空气污染中最常见的化学物质包括一氧化碳、颗粒物、臭氧、二氧化氮和其他构成固体和液体成分(包括道路灰尘、车辆尾气和风吹土壤)。
▸ 空气污染物影响肠道菌群,诱发炎症,损害神经认知
空气污染已被证明会改变肠道微生物群的组成和功能,导致有害代谢物的产生,调节免疫反应,影响代谢途径,引发局部炎症,最后破坏肠血屏障,所有这些可能会进一步破坏血脑屏障并改变大脑功能。
空气污染会产生严重的神经认知后果,从行为改变到神经退行性疾病,这些后果可能会产生可怕的心理健康后果。
研究人员发现了长期和短期暴露于空气污染物(CO、PM10、PM2.5、NO2、SO2和O3)和精神障碍,如注意力缺陷多动障碍、抑郁症、自杀,焦虑和各种行为问题有关。
颗粒物与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
▸ 氧化应激升高和促炎细胞因子的产生
对PM、NO2和SO等空气污染物暴露的几项研究在各种动物模型中报告了氧化应激升高和促炎细胞因子的产生,以及脑组织中抗氧化活性降低导致精神障碍,这意味着空气污染暴露与心理健康问题之间存在关系。
▸ 通过血脑屏障或沿嗅觉神经易位到达大脑,引发促炎反应
根据人体尸检发现和动物实验研究,空气污染物,特别是细颗粒和超细颗粒,能够通过血脑屏障或沿嗅觉神经易位到达大脑。通过破坏血管调节过程,这些颗粒还可以在大脑中引发促炎反应。
通过改变肠道菌群的组成并通过活性氧产生和核因子NF-kB激活在体内引起持续的促炎倾向,空气污染物对肠道菌群产生有害影响。污染物通过破坏结肠上皮细胞中的紧密连接蛋白而导致肠道通透性增加。
▸ PM和臭氧:激活HPA轴
PM和臭氧是两种具有不同特性和反应性的常见污染物,已在实验中显示可激活HPA轴并释放糖皮质激素应激激素作为神经内分泌应激反应的一部分。这可能通过与肾上腺素能受体的作用相当的受体来调节肠道菌群的组成。
根据一项结合多组学和多指标技术进行的流行病学研究,PM2.5可能通过改变肠道菌群、色氨酸代谢、炎症因子和关键HPA轴激素来激活肠脑轴,从而导致神经和心理功能障碍。
▸ 空气污染导致的菌群及其代谢物变化
空气污染成分与增加和促炎细胞因子释放到肠道有关,以及拟杆菌门、厚壁菌门和疣微菌的相对数量发生显著变化,导致体内炎症水平升高,这与几种精神疾病的开始和发展有关。
短链脂肪酸的产生在接受治疗的小鼠中也发生了变化,盲肠中的支链脂肪酸(如异丁酸和异戊酸)丰度增加。它还导致丁酸盐耗竭,这与屏障功能的降低和对粘膜炎症的更易感性有关。
由于微生物代谢物从肠道迁移到体循环,空气污染物引起的肠道通透性增加,可能在增加全身炎症水平方面发挥重要作用,这将对中枢神经系统产生影响并促进精神疾病的发展。
考虑到微生物群-肠-脑轴在中枢神经系统功能中的重要性,调节微生物群-肠-脑轴的干预措施是改善心理健康的有希望的方法。
肠道微生物群已成为心理健康的重要渠道和前瞻性干预目标。益生菌、益生元、合生元和后生元都可以作为精神益生菌,其中一些是精神障碍的治疗干预措施。
“精神益生菌”:益生菌、益生元和所有微生物群靶向干预措施,它们可以操纵微生物群-肠-脑信号并对情绪、认知和焦虑等神经功能产生积极影响。
精神益生菌对心理的积极影响

Oroojzadeh P,et al.J Mol Neurosci.2022
➤ 益生菌
许多研究表明,以合适剂量服用益生菌可以减轻健康人群的压力、焦虑和抑郁。乳酸杆菌和双歧杆菌是用于精神心理研究最多的菌株。各种益生菌菌株的混合物也可用于产生协同效应或提高功效。
益生菌会影响血清素、脑源性神经营养因子、多巴胺和中枢神经系统抑制性神经递质的水平。迷走神经和肠神经系统在这方面起着至关重要的作用。益生菌还通过产生包括色氨酸和短链脂肪酸在内的代谢物间接改变中枢神经系统功能。
➤ 益生元
当宿主微生物有选择地利用益生元时,它会给宿主带来健康益处。具有双歧化特性的益生元,如低聚果糖、低聚半乳糖和短链低聚果糖,都已因其心理生物效应而受到研究。
除了这些多酚,Omega-3脂肪酸和母乳低聚糖,如具有益生元特性的 3’唾液酸乳糖 (3’SL) 或 6’唾液酸乳糖 (6’SL),在适量服用时显示出对心理健康的益处。
益生元可以通过增加双歧杆菌和减少致病菌来恢复肠道中的益生菌状态,从而潜在地缓解焦虑和抑郁等心理健康问题。
例如,短链脂肪酸对细胞系统的影响是通过免疫系统和内分泌途径以及神经和体液途径介导的。短链脂肪酸激活游离脂肪酸受体并与免疫和肠上皮细胞相互作用,从而影响肠黏膜的安全性和功能。
在环境方面,它还分别通过分泌白细胞介素和控制小胶质细胞的形态和功能来影响全身炎症和神经炎症。它还诱导肠道激素如胰高血糖素样肽1的分泌,这些激素通过迷走神经和全身通路将间接信号传递到大脑。所有这些途径最终都会影响学习、情绪和记忆。
➤ 合生元
合生元正在发展为通过调节肠道微生物群来改变情绪和行为的另一种方式。在多项研究中,合生元已被证明可以减轻特定人群的压力和焦虑样行为。
➤ 后生元
后生元,或故意灭活的全细胞或其成分,通过微生物群的变化、改善肠道屏障功能、调节代谢或免疫反应或神经系统信号传导来提供健康益处。
几项关于人类和动物模型的研究表明,后生元具有抗抑郁和抗焦虑作用。
对精神益生菌在人体的研究
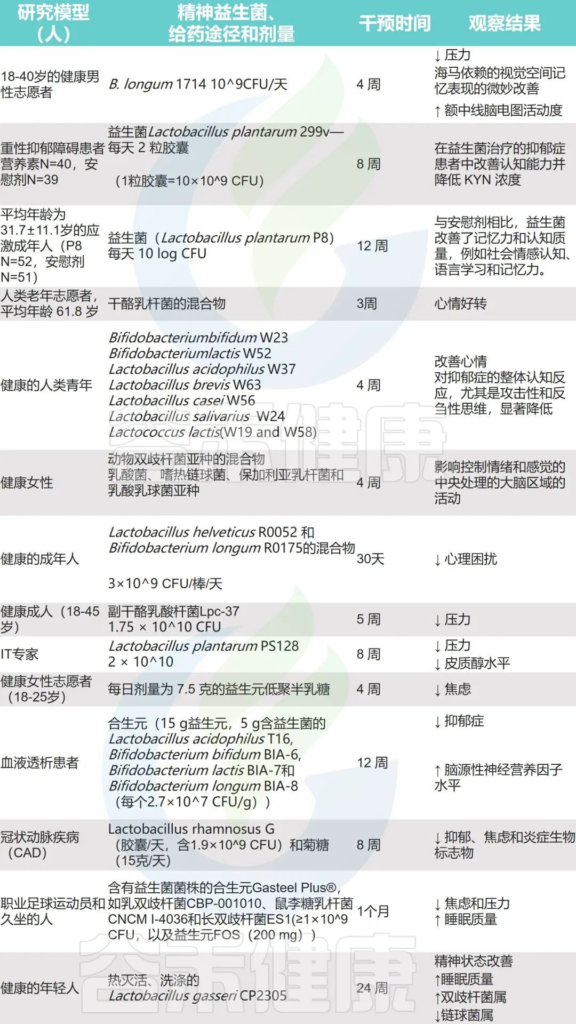
Singh S,et al.Microorganisms.2022
对精神益生菌的动物研究

Singh S,et al.Microorganisms.2022
精神益生菌的可能作用方式
HPA轴的调节、免疫反应和炎症的调节以及神经激素和神经递质的产生是精神益生菌发挥作用的主要机制。
精神益生菌通过恢复肠道中的益生菌状态和减轻精神障碍来影响细菌-肠道-大脑的关系。
✦ 精神益生菌调节神经递质,影响情绪
心理、智力、生理和神经元指数的变化是精神益生菌抗精神病作用的特征。精神益生菌可以调节神经递质和蛋白质,例如儿茶酚胺、乙酰胆碱、血清素和脑源性神经营养因子。它们影响情绪、认知表现、学习和记忆,以及维持大脑中的兴奋-抑制平衡。
当肠道中神经递质浓度升高时,血浆色氨酸水平下降,导致肠道细胞将化学物质释放到大脑中,从而缓解精神疾病。通过G-蛋白偶联受体产生主要作用的短链脂肪酸是精神益生菌对双向肠脑轴的另一个重要的拟议作用途径。短链脂肪酸可能通过加强血脑屏障、改变神经传递、改变神经营养因子水平和帮助记忆巩固来直接影响大脑功能。
精神益生菌的潜在作用模式
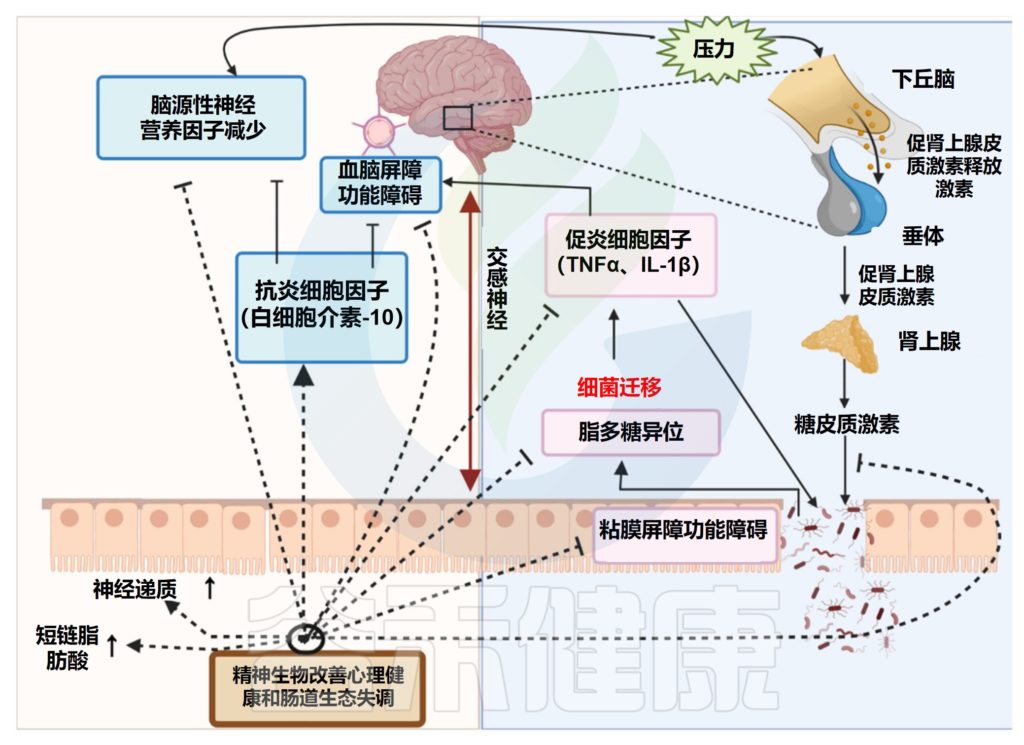
Singh S,et al.Microorganisms.2022
✦ 精神益生菌调节激素,改善认知
通过激素途径作用于大脑,影响身体的应激反应系统,即HPA轴,涉及肾上腺和大脑;当这种情况发生时,它会破坏压力荷尔蒙的产生和功能。这很可能是导致认知问题的主要因素。
精神益生菌可以通过调节HPA轴来降低糖皮质激素水平。糖皮质激素会破坏肠道屏障功能,降低上皮完整性,将细菌向外移动并引发炎症免疫反应。
✦ 精神益生菌调节免疫系统
精神益生菌可以通过直接减轻促炎细胞因子或通过增加抗炎细胞因子以迂回的方式减少炎症和恢复血脑屏障完整性来调节免疫系统的功能。管腔外的细菌迁移也可以通过增加促炎细胞成分的水平直接影响炎症。
✦ 调节肠脑轴中特定神经化学受体的表达,抗抑郁
一些可以产生中枢神经系统抑制性神经递质、去甲肾上腺素和血清素等神经递质的肠道微生物有:
嗜酸乳杆菌、干酪乳杆菌、婴儿双歧杆菌、长双歧杆菌、大肠杆菌、芽孢杆菌、酵母菌、念珠菌、链球菌、肠球菌。
这些可以通过调节肠脑轴中特定神经化学受体的表达来产生抗焦虑和抗抑郁作用。尽管对人类微生物组的研究仍处于初期阶段,但研究结果表明肠道微生物可能会影响人们的认知健康、行为和情绪。
一些能产生神经递质或神经激素的肠道微生物

Oroojzadeh P,et al.J Mol Neurosci.2022
生活方式、饮食、衰老和遗传等一系列因素促成了神经退行性疾病的发生和发展。益生菌对肠脑轴的影响可以通过影响中枢神经系统来实现。
肠道微生物群对神经系统疾病的影响
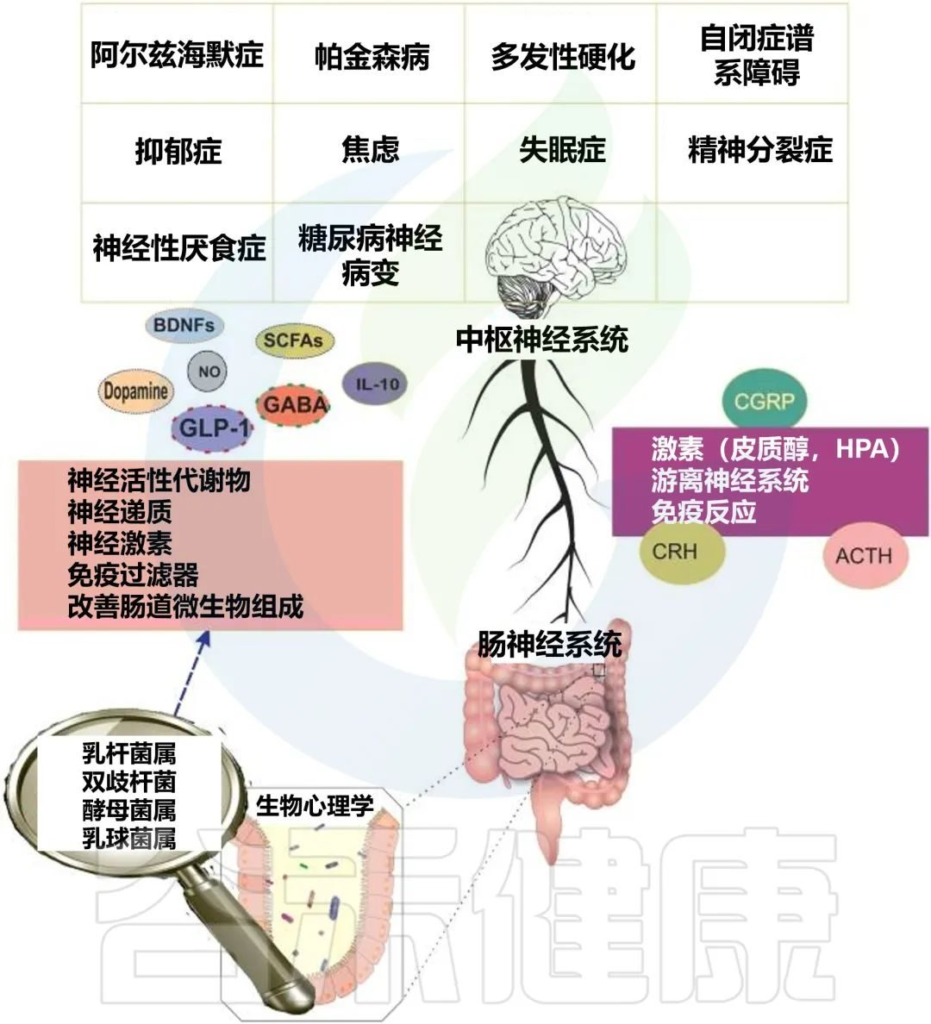
Oroojzadeh P,et al.J Mol Neurosci.2022
阿尔兹海默病是神经系统疾病中痴呆的主要原因。痴呆症通常发生在 60岁以上的人群中。这种疾病没有明确和有效的治疗方法。
研究表明,阿尔茨海默病的主要表现与细胞内Tau 神经原纤维缠结和细胞外淀粉样斑块的产生有关。
更好地了解这种疾病所涉及的生理机制可以帮助确定有效的治疗方法。
肠道微生物与阿尔茨海默症
鉴于肠道微生物群的损害可能与阿尔茨海默症等神经退行性疾病有关,因此调节肠道菌群是治疗阿尔茨海默症的一种可能方法。
炎症和氧化应激会破坏中枢神经系统中的神经细胞,从而导致阿尔茨海默症。
预防胆碱能神经元破坏以及大脑中乙酰胆碱水平的增加是成功治疗阿尔茨海默症所需要的。
已经证明,持续应用D-半乳糖可能会通过增加氧化应激和活性氧物质而导致认知异常和记忆障碍。
一些益生菌,包括植物乳杆菌,能够产生乙酰胆碱,并且可以保护由D-半乳糖消耗引起的记忆缺陷。
几种关于益生菌菌株补充的研究:
关于阿尔茨海默病与肠道菌群详见:阿尔茨海默病de饮食-微生物-脑轴
阿尔兹海默症与2型糖尿病
阿尔兹海默症的一个重要危险因素是2型糖尿病。胰高血糖素样肽-1(GLP-1)在肠道和中枢神经系统(尤其是脑干)中产生,并与神经保护以及认知功能和葡萄糖代谢有关。
GLP-1受体在不同组织(肾、肺、心脏、中枢神经系统等)中表达,可以上调参与脑细胞修复和分化的各种基因的表达。GLP-1还可以促进高血糖状态下的胰岛素分泌。
以前的研究表明,GLP-1在中枢神经系统中作为神经保护因子,可诱导神经细胞增殖/凋亡,改善学习和记忆,降低Aβ斑块沉积,保留多巴胺能神经元,刺激神经再生。
▸ GLP-1工程益生菌减少记忆障碍
研究人员研究了GLP-1工程益生菌(Lactococcus lactis MG1363)口服给药后对AD小鼠模型的影响。脂多糖和1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)分别诱导记忆障碍和运动功能障碍。
结果表明,工程菌株能够通过两种信号通路减少记忆障碍和运动功能障碍。此外,工程益生菌降低了病原体的丰度,并增加了Akkermansia muciniphila的丰度。
还观察到炎症反应下调、阻断NF-κB信号和 MAPKs/PI3K/AKT。已确定GLP-1和GIP(葡萄糖依赖性促胰岛素多肽)作为神经保护因子对2型糖尿病治疗的有效性。
探讨GLP-1/GIP/胰高血糖素三位一体治疗(30天)对AD小鼠认知行为的影响。结果表明,该治疗通过减少认知障碍和病理变化对阿尔茨海默病产生有益影响。
小结
总的来说,这些信息阐明了在阿尔兹海默症中用益生菌操纵肠道微生物群可以改善葡萄糖代谢受损、延缓阿尔兹海默症进展并减少神经炎症,从而有利于胰高血糖素样肽1的作用。
帕金森病是第二种常见且主要的神经退行性疾病。该疾病与突触核蛋白积累和多巴胺能神经元的进行性丧失有关,并以运动和非运动症状为特征。肠道功能异常的非运动症状主要是体重减轻、胃轻瘫、便秘和排便功能障碍。
目前,在治疗帕金森病时,服用精神生物药物备受关注。报告说,食用益生菌混合物对释放多巴胺的神经元提供有效保护,并随后减少小鼠的运动功能障碍恶化。
✦ 补充益生菌能改善帕金森病的相关症状
研究确定了益生菌副干酪乳杆菌对帕金森病大鼠运动障碍的影响,并且与对照组相比,有益生菌的大鼠运动障碍更少。
在一项临床研究中,评估了含有的L.casei Shirota发酵乳对帕金森病患者5周的效果,并报告了腹胀减少、便秘减少和腹痛减少。
每天一次服用含有多种益生菌菌株和益生元的发酵乳,持续4周,并报告改善了帕金森病患者的便秘。
每片使用60毫克两种益生菌:嗜酸乳杆菌和婴儿双歧杆菌,每天两次,持续3个月,40名帕金森病患者腹痛和腹胀缓解。
报告称,在接受8×10^9 CFU/天益生菌12周的帕金森病患者中,过敏反应降低,丙二醛水平降低,谷胱甘肽水平升高。
关于帕金森与肠道菌群详见:肠道微生物与帕金森以及相关影响因素
多发性硬化症是一种涉及中枢神经系统的自身免疫性疾病,其中髓鞘覆盖的轴突被破坏。
遗传和环境因素以及病毒感染被认为是多发性硬化症发展的主要风险因素。然而,这种疾病的确切原因尚不清楚。
✦益生菌可以改善多发性硬化症
越来越多的证据表明,益生菌可以通过改变肠道微生物组、抑制炎症通路和调节免疫系统来改善多发性硬化症患者的免疫系统。
评估了含有发酵乳杆菌、干酪乳杆菌、嗜酸乳杆菌和双歧杆菌的益生菌菌株的效果对接受益生菌混合物12周的多发性硬化症患者的心理健康、残疾和代谢状况的影响。
证明益生菌菌株增加了多发性硬化症小中抗炎细胞因子包括IL-4、IL-5、IL-10的表达,并减少了促炎 IFN-γ和IL-1β的分泌。
自闭症谱系障碍是社会交流、感觉运动行为和有限兴趣方面的一系列缺陷。
自闭症谱系障碍的表现始于儿童早期。自闭症患者表现出胃肠道症状。自闭症儿童的胃肠道功能障碍通常与攻击性行为、易怒和睡眠障碍有关。
✦益生菌对自闭症的有益影响
报告了益生菌对自闭症患者行为和胃肠道表现的有益影响。使用含有嗜酸乳杆菌、鼠李糖乳杆菌和长双歧杆菌的益生菌菌株治疗孤独症儿童3个月后,双歧杆菌和乳酸杆菌的数量增加,体重减轻,胃肠道症状改善。
此外,接受益生菌菌株1个月的自闭症儿童的自闭症核心症状有所改善,腹部症状有所减轻。
扩展阅读:自闭症,抑郁症等与维生素缺乏有关
抑郁症和焦虑症是常见的疾病之一。这两种疾病大多同时发生。抗抑郁药、抗焦虑药和催眠药通常用于治疗。临床上,抑郁与下丘脑-垂体-肾上腺失调之间存在关联。
研究表明,健康个体和重度抑郁症患者的肠道微生物群是不同的。重度抑郁患者双歧杆菌和乳杆菌减少,同时梭菌、链球菌、克雷伯菌、颤杆菌和Allistipes增加。
胃肠道细菌通过迷走神经通路激活压力回路。长期暴露于压力源会导致去甲肾上腺素的长期分泌,这会改变肠道微生物群并使肠道对细菌和毒素更具渗透性,然后是HPA轴的压力反应。
✦益生菌能降低压力改善焦虑
研究了益生菌菌株B. breve CCFM1025对粪便微生物组成和脑神经系统改变以及皮质酮、细胞因子和短链脂肪酸的血清水平的影响。总体而言,抑郁和焦虑样行为减少了。
研究指出,益生菌菌株B. longum 1714 能够降低压力水平并改善健康志愿者的记忆力。
评估了鼠李糖乳杆菌HN001对423名孕妇产后焦虑和抑郁表现的影响,并指出益生菌治疗组的抑郁状况显著降低。
益生菌菌株L. plantarum 299v可降低犬尿氨酸水平并增强重度抑郁症患者的认知功能。然而,其他调查并未报告接受益生菌的患者与对照组在焦虑和幸福感评分方面有任何显著差异。
有学者指出益生菌菌株长双歧杆菌NCC3001可以提高肠易激综合征患者的生活质量,并可以减少这些病例的抑郁症。
关于抑郁症与肠道菌群详见:抑郁症,恐惧,压力和肠道微生物群脱不开的关系
失眠
充足的睡眠是影响生活质量的关键因素。肠道菌群通过微生物-肠-脑轴影响宿主的精神状态和睡眠状态。
宿主的昼夜节律和睡眠质量取决于微生物组谱和代谢特性。益生菌被认为可以改善睡眠健康。GABA 是一种抑制性神经递质,能够通过减少焦虑来促进放松。
L.brevis DL1-11 是一种具有高GABA生产能力的益生菌菌株,其改善小鼠睡眠的潜力已得到证实。
关于睡眠与肠道菌群详见:肠道菌群与睡眠:双向调节
精神分裂症
精神分裂症是一种慢性衰弱性疾病。研究表明,肠道微生物群的破坏会增加全身炎症。因此,神经炎症会导致精神分裂症。
精神分裂症患者通常患有营养状况受损、压力反应高、炎症状态增加和乳糖不耐症。具有抗炎和免疫调节特性的益生菌可能有助于减轻精神分裂症患者。
✦ 益生菌减轻精神分裂症症状
报道了丁酸梭菌、粪链球菌和肠系膜芽孢杆菌的益生菌混合物可以减轻精神分裂症的症状。研究表明,益生菌菌株B. lactis Bb12 亚种的组合B. lactis Bb12 GG和鼠李糖乳杆菌菌株可以减少精神分裂症患者的肠道障碍。
研究了鼠李糖乳杆菌菌株GG和动物双歧杆菌乳亚种在慢性精神分裂症的可能免疫调节作用。报告称,血管性血友病因子浓度显著降低,同时脑源性神经营养因子、巨噬细胞炎性蛋白-1β、单核细胞趋化蛋白-1和RANTES(受激活、正常T细胞表达和分泌的调节)水平升高。因此,精神分裂症患者服用益生菌补充剂可能会改善胃肠道渗漏。
B. lactis Bb12有助于使男性患者的白色念珠菌抗体水平和白色念珠菌相关肠道不适正常化。
糖尿病性神经病变是一种与轴突萎缩、脱髓鞘疾病、再生能力下降、神经元炎症和周围神经病变有关的营养性神经退行性疾病。
糖尿病神经病变可通过神经元肠脑轴、门静脉(调节中枢神经系统中的能量代谢)和外周神经元传导丧失改变血糖调节以及肠道葡萄糖吸收不良。
2型糖尿病的特征是葡萄糖代谢失调,导致空腹和餐后高血糖。胰岛素和胰高血糖素分泌和功能受损是这种疾病的主要原因。
▸ 胰高血糖素样肽1(GLP-1)
GLP-1是肠细胞响应葡萄糖而分泌的一种肠促胰岛素激素,用于2型糖尿病治疗。它通过特定受体激活肠道神经元并调节肠道转运,增加胰岛β细胞的增殖,增强葡萄糖依赖性胰岛素分泌,减少胰岛α细胞的胰高血糖素分泌。
因此,它会降低2型糖尿病患者的血糖和食物摄入量。当 GLP-1被激活时,它会向迷走神经传递一个神经信息,该信息通过肠脑轴参与血糖调节。GLP-1 还具有神经保护和神经源性潜力,研究表明它在来自背根神经节的神经元的原代培养物中诱导轴突。因此,它可以有效地治疗糖尿病神经病变。
✦ 益生菌增强胰岛素分泌,改善肠神经系统
研究发现益生菌通过上调G蛋白偶联受体 、胰高血糖素原和转化酶原活性,通过葡萄糖触发的GLP-1 分泌来增强胰岛素分泌。
已经确定,当无菌小鼠被健康的肠道微生物群稳态定植时,肠神经系统和迷走神经的神经元活动得到恢复,但糖尿病小鼠的肠道微生物群却没有。
研究发现用罗伊氏乳杆菌喂养大鼠9天可以通过靶向肠道感觉神经中的钙依赖性钾通道来改善肠神经系统。
一些乳酸杆菌菌株(L. farciminis, plantarum, fermentum)可以产生一氧化氮作为神经递质,它能够影响神经元对GLP-1和葡萄糖代谢的反应。
✦ 益生菌降低胰岛素抵抗,增加抗氧化能力
研究了GLP-1在2型糖尿病大鼠体内,白藜芦醇和益生菌作用。给大鼠喂食各种益生菌,包括植物乳杆菌、保加利亚乳杆菌、干酪乳杆菌、婴儿双歧杆菌、嗜酸乳杆菌、长双歧杆菌、短双歧杆菌,剂量为 50 × 10^9 4周。发现与糖尿病组相比,这些益生菌和白藜芦醇可以降低葡萄糖和胰岛素抵抗(p < 0.001),并增加GLP-1以及总抗氧化能力(p < 0.001)。
发现两种菌株,L. kefiranofaciens M 和 L. kefiri K可以通过诱导GLP-1分泌,抑制细胞因子产生(促炎和炎症因子),增加IL-10的产生,改变肠道菌群向LAB和双歧杆菌的方向发展,减少产气荚膜梭菌和大肠菌群,从而降低小鼠模型中T1D的进展。
这些结果揭示了益生菌在增加GLP-1水平中的作用,这可以随后缓解高血糖症,并可能被认为是糖尿病治疗的潜在候选者。
关于2型糖尿病和肠道菌群详见:2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
神经性厌食症是另一种重要的精神障碍,与严重的体重减轻、精神合并症、对肥胖的恐惧和饮食限制有关。
根据对肠脑相互作用的深入了解以及益生菌对该轴的积极作用,可以为神经性厌食症治疗提供几种新的治疗策略。
✦ 益生菌改善神经性厌食症中的胃肠道不适
分析了益生菌对神经性厌食症患者的疗效,并通过分析血清和粪便样本测量了体重指数、心理/神经心理参数。他们报告了神经性厌食症中肠道微生物群落的正调节,以改善体重增加、胃肠道不适和炎症减少。
通过低聚果糖1.67g/天和益生菌(Saccharomyces boulardii 5×10^8 CFU)干预评估益生菌对神经性厌食症的影响。饮食限制后,与健康状态相比,总微生物群和代谢物减少,但补充低聚果糖和布拉式酵母通过改变以下菌群来恢复微生物群落。
研究显示了两种饮食(酸奶或牛奶)的积极作用,包括保加利亚乳杆菌和嗜热链球菌,它们能够诱导IFN-γ产生对抗儿童腹泻和神经性厌食症患者的感染。
值得注意的是,抗生素和25%的药物可能会影响微生物群,患者需要基于益生菌治疗来实现主要目标,如能量收集、体重增加、降低肠道通透性、炎症过程以及肠道微生物组群的改变等。
益生菌的作用主要是增强肠道健康。食用含有益生菌的健康食品在预防中枢神经系统疾病和通过调节肠道微生物群控制相关症状方面具有重要作用。这种效应通过微生物群-肠-脑轴发生,可以整合到临床试验中。
酸奶、开菲尔、豆豉和泡菜等发酵食品富含益生菌。一些益生菌产生活性神经元化合物或充当载体。一些双歧杆菌和乳酸杆菌菌株分泌γ-氨基丁酸 (GABA)。此外,对健康人的粪便样本进行分析,发现拟杆菌属、副拟杆菌属和埃希氏菌属物种能够调节产生GABA的途径。
GABA的功能障碍与抑郁和焦虑有关。GABA 是乳酸菌 (LAB) 的分泌代谢产物之一。它是哺乳动物中枢神经系统中抑制性传播的主要介质。食品工业通过生产含有能够产生 GABA 的益生菌物种的功能性食品,在减少抑郁和焦虑方面发挥着关键作用。
开菲尔颗粒含有Acetobacter aceti, L. fructivorans, Acetobacter sp., Enterococcus faecium, Leuconostoc spp., L. delbrueckii delbrueckii, L. fermentum, L. kefiranofaciens, Candida famata, Candida krusei.
益生菌菌株L. helveticus从发酵乳中分离得到,可以改善老年人和中年人的认知功能。
用短乳杆菌L. brevis BJ20浓缩发酵海带, 以确定其对老年人体质和短时工作记忆的影响。研究人员说,食用这种发酵食品可以为老年人的痴呆症提供保护机制。
由于包括牛奶、乳制品和豆制品在内的发酵产品的广泛使用,其他研究表明,含有干酪乳杆菌的发酵乳可以改善学生的情绪、增加粪便中的血清素并降低压力水平,瑞士乳杆菌影响认知功能。
含有发酵乳杆菌、干酪乳杆菌混合物的发酵牛奶降低了小鼠的亚硝化应激参数。含有B. lactis BB12和L. acidophilus LA5益生菌的酸奶可显著增强整体健康并减轻焦虑、抑郁和压力。
使用含有短乳杆菌L. brevis FPA 3709的发酵黑豆浆能够产生 GABA 在小鼠中显示出抗抑郁活性。
个体微生物组会受到宿主条件和环境的影响。肠道微生物群的紊乱会对宿主的生理反应和整体健康产生巨大影响。
大量证据表明,环境污染物与微生物群相互作用,而微生物群在肠脑轴中发挥着关键作用。长时间处于污染环境下,肠道生态失调,对宿主造成系统性和长期的影响。
精神益生菌在控制中枢神经系统疾病症状方面具有有效的特征,或将辅助治疗各类疾病。然而神经精神类疾病病情复杂,原因不一,有些益生菌也并不一定对所有患者有效,通过肠道菌群检测,可以了解个体肠道菌群,从而有针对性地采取相关干预措施。
主要参考文献
Singh, S.; Sharma, P.; Pal, N.; Kumawat, M.; Shubham, S.; Sarma, D.K.; Tiwari, R.R.; Kumar, M.; Nagpal, R. Impact of Environmental Pollutants on Gut Microbiome and Mental Health via the Gut–Brain Axis. Microorganisms 2022, 10, 1457. https://doi.org/10.3390/microorganisms10071457.
Oroojzadeh P, Bostanabad SY, Lotfi H. Psychobiotics: the Influence of Gut Microbiota on the Gut-Brain Axis in Neurological Disorders. J Mol Neurosci. 2022 Jul 18:1–13. doi: 10.1007/s12031-022-02053-3. Epub ahead of print. PMID: 35849305; PMCID: PMC9289355.
Liu, L.; Huh, J.R.; Shah, K. Microbiota and the gut-brain-axis: Implications for new therapeutic design in the CNS. eBioMedicine 2022, 77, 103908.
Long, D.; Liu, M.; Li, H.; Song, J.; Jiang, X.; Wang, G.; Yang, X. Dysbacteriosis induces abnormal neurogenesis via LPS in a pathway requiring NF-κB/IL-6. Pharmacol. Res. 2021, 167, 105543.
Duan H, Yu L, Tian F, Zhai Q, Fan L, Chen W. Gut microbiota: A target for heavy metal toxicity and a probiotic protective strategy. Sci Total Environ. 2020 Nov 10;742:140429. doi: 10.1016/j.scitotenv.2020.140429. Epub 2020 Jun 25. PMID: 32629250.
Briffa J, Sinagra E, Blundell R. Heavy metal pollution in the environment and their toxicological effects on humans. Heliyon. 2020 Sep 8;6(9):e04691. doi: 10.1016/j.heliyon.2020.e04691. PMID: 32964150; PMCID: PMC7490536.

谷禾健康

膀胱癌主要是老年人的疾病,约75%的新诊断发生在65岁以上的患者,约45%发生在75岁以上的患者。膀胱癌对男性和女性的影响比例为3:1,但随着年龄的增长,男性和女性的发病率都显著增加。
年龄增长与膀胱癌的发病率和死亡率升高有关。高龄还与慢性炎症标志物升高以及肠道和尿液微生物群紊乱有关。
老年人膀胱癌发病率和死亡率增加的一个原因可能是,微生物组中与年龄相关各种变化,引起全身代谢变化,导致免疫失调,具有潜在的致癌作用。
膀胱癌患者的肠道和尿道微生物群可能失调,尽管这些变化的影响尚不清楚。
提高对免疫系统、肠道和尿液微生物群的年龄相关改变的理解,可能有助于深入了解老年人膀胱癌发生和发展的风险。在膀胱癌患者中,提高对微生物群的认识也可能为治疗干预提供潜在的靶点。
目前的数据支持炎症、免疫和微生物失调可能是已知的与衰老相关的膀胱癌发病率增加的原因,但需要在这一领域开展工作,以直接检验这一假设,以及更好地了解肠道中微生物成分的组成,膀胱癌期间膀胱和膀胱肿瘤微生物组及其对免疫系统的影响。
从这个角度出发,本文讨论了炎症、免疫、衰老和癌症之间的复杂联系。研究了表明老龄化和炎症可促进膀胱癌发展的数据,老龄化如何导致或促进多个区域的菌群失调,以及菌群失调如何影响对膀胱癌治疗的反应。
本文主要从以下几个方面讲述
本文出现的专业名词缩写
非肌肉浸润性膀胱癌——NMIBC
肌肉浸润性膀胱癌——MIBC
肿瘤坏死因子——TNF
损伤相关的分子模式——DAMPs
病原相关的分子模式——MAMPs
血清中性粒细胞:淋巴细胞比值——NLR
免疫组织化学——IHC
肠血管屏障——GVB
高龄不仅与患膀胱癌的风险增加有关,还与发生侵袭性肿瘤有关,这些肿瘤复发和发展为侵袭性疾病的可能性增加。
这些数据很复杂,因为“年轻”和“老年”的定义在研究中高度可变,可以作为连续或分类报告变量。此外,癌症特异性生存率增加背后的原因可能是多因素的,但仍然包括这样的事实:年轻患者通常比老年患者的肿瘤侵袭性更小、级别更低。
✦ 非肌肉浸润性膀胱癌:年轻患者肿瘤侵袭性更小,级别低,不易复发
年轻患者,如年龄小于30岁的患者,其乳头状、低级别Ta、非肌肉浸润性膀胱癌(NMIBC)的发病率高于年龄大于30岁的患者,其肿瘤通常较小、单发且不太可能复发。
尽管数据表明年轻患者和老年患者的肿瘤分期相似,即使按年龄<30岁或>30岁分组。膀胱癌基因表达数据的荟萃分析结果表明,在多个肿瘤亚型中,年轻化与激活成纤维细胞生长因子受体(FGFR)突变率增加相关,这一发现与Ta肿瘤相关,Ta肿瘤比高级别肿瘤具有更有利的预后。
在晚期膀胱癌中,与FGFR激活突变相关的有利结果丢失,因为FGFR3在化疗背景下可能与较差的结果相关。
在对肿瘤亚型的同一荟萃分析中,与老年患者相比,年轻患者的肿瘤中claudin的表达水平比老年患者高,claudin是一种肿瘤转移的反向标记物。
✦ 肌肉浸润性膀胱癌:发病率随年龄增长而增加
相比之下,在普通人群中,肌肉浸润性膀胱癌(MIBC)的发病率随着年龄的增长而增加。85岁以上的患者中有30%以上发生MIBC,而10岁以下的患者中有23%发生MIBC。
随着年龄的增长,肿瘤抑制因子TP53、APC和PTEN12突变的可能性增加,这在MIBC中很常见,并与不良预后相关。
最后,随着人类年龄的增长,他们通常会累积共病和虚弱指数增加,这导致了与年轻患者的总体预后差异,特别是与使用根治性膀胱切除术的手术干预有关。
有证据表明,当仔细选择时,许多老年患者是手术治疗的合适人选,但老年患者较不积极的治疗也会影响预后。
所有这些数据都广泛支持这样一种观点,即年轻患者的膀胱癌出现在疾病的较低阶段,临床上侵袭性较低,最终,年轻患者比他们的老年对手更有可能存活。
膀胱癌中与年龄和微生物组相关的变化
在衰老过程中,炎症系统和肠道和尿道中的微生物都发生了大量的变化。
✦ 膀胱癌
•老年患者的膀胱癌预后比年轻患者差,年轻患者通常表现为低级肿瘤。
•在膀胱癌亚型中,年轻患者比老年患者表达FGFR3突变的比例更高,连接蛋白水平也更高
•在膀胱癌亚型中,老年患者更有可能发生肿瘤,肿瘤抑制蛋白p53, APC和PTEN突变
•在24个月的随访点,老年患者(80岁以上)的非肌肉浸润性膀胱癌患者对卡介苗的反应低于年轻患者(61-70岁) (39%对61%的绝对反应率)
✦ 肠道微生物组
• 老年个体(90岁以上)β-多样性较年轻个体减少,α-多样性没有变化
• 老年个体(90岁以上)与年轻个体相比肠道中以下菌群丰度增加:
Akkermansia ↑↑↑
Escherichia ↑↑↑
Bifidobacterium ↑↑↑
Christensenellaceae ↑↑↑
• 老年个体(90岁以上)与年轻个体相比肠道中以下菌群丰度降低:
Faecalibacterium ↓↓↓
Bacteroides ↓↓↓
Lachnospiracae ↓↓↓
• 百岁老人(100岁)比非百岁老人群体有的Akkermansia,通常与改善健康状况有关。
关于AKK菌详见:AKK菌——下一代有益菌
✦ 尿液微生物群
• 70岁及以上的个体与年轻个体相比尿道中:
saccharofermentans ↑↑↑
Proteiniphilum ↑↑↑
Jonquetella ↑↑↑
Parvimonas ↑↑↑
• 70岁及以上的男性比年轻男性有的细菌属
• 70岁及以上的男性比年轻男性体内的细菌总数要少
• 与年轻女性相比,70岁以上的女性在细菌种类或数量上没有差异
✦ 肠道上皮屏障
• 与4或12月龄小鼠相比,21月龄小鼠血清脂多糖增加与肠道通透性增加相关
• 在老年小鼠模型中,IL-6和肿瘤坏死因子随肠道通透性线性增加
• 与10岁及以下的狒狒相比,18岁及以上的狒狒IL-6、IL-1β和IFNγ水平显著升高
• 18岁及以上的狒狒与10岁及以下的狒狒相比,occludin、claudin和紧密连接分子减少
• 与年轻人相比,老年人的短链脂肪酸(如丁酸、丙酸、乙酸)水平较低,这些脂肪酸被认为可以保持粪便中的肠道-上皮完整性
先天和适应性免疫系统在衰老过程中都出现失调。
衰老主要通过两种途径导致免疫系统失调事件:
在膀胱癌患者中,先天免疫活性的血清和组织标志物升高预后较差,可能与肿瘤生长有关。
适应性免疫系统在膀胱癌中的作用尚不清楚,基于所研究免疫细胞的差异、其相对丰度和抗原肿瘤标记物的存在,结果相互矛盾。
先天免疫系统和适应性免疫系统都可能影响膀胱癌的进展,与衰老相关的免疫系统变化会对肿瘤清除产生有害影响。
衰老:免疫系统逐渐破坏、炎症增加
随着年龄的增长,细胞分解的无菌产物的积累,包括代谢废物,如细胞游离DNA或错误折叠或氧化的蛋白质,以及异常分布的病原相关的分子模式(MAMPs),如脂多糖(LPS),长期激活先天免疫系统。
当衰老伴随着其他对人类健康有害的问题,如营养过剩、慢性惰性感染、癌症或肠道失调时损伤相关的分子模式(DAMPs)和错误折叠蛋白的积累会加速,并导致免疫系统中与衰老相关的破坏。
这种破坏至少部分是由巨噬细胞和中性粒细胞中的细胞信号传导介导的:巨噬细胞上进化保守的toll样受体(TLRs)识别升高的内源性MAMPs和DAMPs。
在衰老过程中,MAMPs和DAMPs在组织中积累,检测它们诱导IL-6、IL-8和tnf等细胞因子的表达,导致先天免疫活性升高,并从常驻免疫细胞向组织释放活性氧(ROS)。
临床前癌症模型支持这一观点,即局部炎症的增加会导致细胞因子的产生和导致DNA损伤的局部活性氧水平的增加,并可能会在某些肿瘤中刺激肿瘤生长和进展。
异常的DNA修复和增强的炎症也与老年小鼠中与肿瘤形成增加相关的DNA损伤有关。
先天免疫信号升高——膀胱癌不良预后
临床上,先天免疫信号升高似乎与NMIBC和MIBC患者的不良预后相关。这种作用不仅限于膀胱癌,因为肿瘤相关的巨噬细胞(TAMs)和肿瘤浸润性中性粒细胞(TINs)可能促进结直肠癌和肺癌的发生。
在膀胱癌中,使用免疫组织化学(IHC)对296个肿瘤的泛巨噬细胞标志物CD68和泛T细胞标志物CD3的组织芯片分析表明,巨噬细胞与T细胞的比例是不良生存的最大预测因子。
CD163+TAMs的存在:复发率增加
一项对13项来自人类膀胱组织的meta分析结果显示,CD163+TAMs的存在与复发率增加相关,而CD68+TAMs的存在与复发率无关。
值得注意的是,这一发现可能与这些巨噬细胞的炎症状态有关,因为CD163是抗炎巨噬细胞的标志,与肿瘤免疫逃逸相关。相比之下,CD68并不能描述巨噬细胞的炎症状态,并由大多数巨噬细胞亚型表达。
TINs水平升高:预后不良,生存率较差
对102个人膀胱癌肿瘤的免疫组化分析表明,TINs水平的升高与NMIBC复发率的升高和较差的总生存率呈正相关。
此外,在MIBC患者中,TIN水平升高与总生存期降低和化疗反应不良相关。然而,所有这些研究都使用了免疫组化相关分析,限制了推断因果关系的程度。
由于肿瘤浸润免疫细胞的测量需要在组织中进行评估,因此确定系统性炎症标志物是否可以作为组织相关炎症蛋白或细胞的替代物是有用的。
NLR高分与无复发和无进展生存期相关
系统性炎症的一个指标,血清中性粒细胞:淋巴细胞比率(NLR),可以预测NMIBC和MIBC的疾病复发和进展。
在MIBC中,两项回顾性研究结果显示,NLR评分大于3.0和2.5的患者5年无复发较差(HR 1.49;95% CI 1.12-2.0),总体(危险比1.67;95% CI 1.17-2.39)和无病生存期(危险比1.946;95% CI 1.03-3.66)高于NLR评分较低的患者。
在NMIBC中,对6项回顾性研究的荟萃分析结果显示,NLR高分与无复发和无进展生存期相关。
在一项对899例NLR分界点为2.7的MIBC患者的大型回顾性研究中,年龄的增加与NLR评分的增加相关,年龄的增加与免疫功能障碍的增加有关。
免疫变化在 NMIBC 中任何年龄都可能很重要
NMIBC的研究结果大部分显示膀胱癌患者的年龄与NLR评分之间没有显著的相关性,但仍显示NLR可以预测结果,这表明在NMIBC中,无论年龄如何,免疫改变可能都是重要的,年龄、NLR和预后之间的联系在MIBC中比在NMIBC中更强。
一项针对NMIBC患者的单一前瞻性研究发现,校正年龄后,NLR与无复发和无进展生存期之间的差异消失,这表明年龄是主要决定因素,应与NLR状态一起测量和校正,这进一步复杂化了高龄、NLR和膀胱癌预后之间的潜在关系。
当考虑到先天免疫系统在肿瘤微环境中的潜在致瘤作用时,显然,需要进一步的研究来确定膀胱局部先天免疫信号是否与系统性免疫失调相关,这可以很容易地测量和潜在地用于预后。
年龄、NLR和预后在MIBC中的相关性似乎比NMIBC更强,这并不奇怪,因为MIBC由于侵袭组织而被认为是更具有炎症性的疾病。
先天免疫调节膀胱癌:活性氧产生,增强致癌性
来自小鼠模型的数据支持先天免疫调节膀胱癌的观点。在膀胱癌模型中,与仅用亚硝胺(BBN)治疗的小鼠相比,致癌物n-丁基-n(4-羟基丁基)亚硝胺(BBN)和膀胱内脂多糖治疗的小鼠体内活性氧浓度与肿瘤发生增加呈正相关。
脂多糖注射促进了大鼠模型膀胱癌的形成,支持了先天免疫激活增加有助于肿瘤发展的观点。
脂多糖激活的中性粒细胞增强大鼠尿路上皮细胞系的恶性转化,这与脂多糖在其他肿瘤中的致瘤作用的数据一致,表明先天免疫系统产生的活性氧可以通过氧化应激和基因突变促进肿瘤的形成。
在缺乏铜/锌超氧化物歧化酶的老年小鼠中进行的研究结果表明,与年龄匹配的对照组相比,这些小鼠在肝癌模型中活性氧水平和致癌性增加,这支持了先天免疫系统不受控制的活性氧产生可增强致癌性的观点。
先天免疫系统与免疫疗法的复杂作用
在治疗上,炎症抑制剂,如塞来昔布,可以阻断促炎前列腺素的形成,减少大鼠膀胱癌模型中的肿瘤数量和体积,并减少体外细胞系中的细胞增殖。
在膀胱癌小鼠模型中,先天免疫系统似乎也调节了卡介苗的反应;在膀胱癌小鼠原位模型中,中性粒细胞减少消除了卡介苗介导的免疫治疗的反应。
这些数据表明,先天免疫系统的作用可能是复杂的,因为它可能需要通过启动免疫反应对卡介苗免疫疗法作出适当反应,但如果不加以检查,也会促进癌症的进展,这取决于肿瘤微环境和肿瘤的状态。
值得注意的是,这种效应在本研究中归因于中性粒细胞,但这一结论是在发现用于消耗中性粒细胞的抗体也会消耗单核细胞之前得出的,因为该抗体识别单核细胞上的LY6C和中性粒细胞上的LY6C和LY6G。
因此,单核细胞也可能影响模型中免疫治疗的疗效,突出了改善治疗结果的另一个潜在调控靶点。事实上,区分中性粒细胞和单核细胞在膀胱癌中的作用可能是增强患者免疫治疗和了解疾病进展的一种手段。
总之,这些数据支持这样一种观点:
在多种实体肿瘤类型中,与衰老相关的异常先天免疫导致了致瘤前表型。
然而,目前还缺乏利用解决潜在机制的转化模型来理解浸润肿瘤的先天免疫细胞在膀胱癌中的作用。这些模型是有根据的,因为阻断中性粒细胞募集也可以减少肿瘤的生长和其他肿瘤的转移进展,如乳腺、结肠和肝脏。
通过使先天免疫系统的慢性激活正常化,减少老年先天免疫过度刺激的新方法可能是减缓膀胱肿瘤发病率和复发的潜在手段,特别是在炎症指数自然增加的老年患者中。
先天免疫反应可以在老年时被长期激活,但适应性免疫的组成部分,如初始CD4和CD8 T细胞,由于免疫衰老而数量下降,这是由细胞衰老引起的免疫细胞随时间的变化,整体多样性下降。
随着年龄增长,老年人适应性免疫反应受损,肿瘤的感知和清除能力下降
随着个体年龄的增长,他们的初始T细胞逐渐减少,T细胞受体多样性减少,T细胞上的共刺激效应分子CD28的水平也比年轻的T细胞上的CD28低。这些变化损害了老年人的适应性免疫反应。
随着适应性免疫反应的下降,肿瘤的感知和清除能力也在下降。这些改变在很大程度上导致了观察到的免疫差异。
将适应性免疫细胞蛋白(如CD3和CD8)和肿瘤浸润淋巴细胞(TILs)浓度与临床结果相关联的尝试产生了相互矛盾的结果。
免疫组化分析显示,肿瘤突变负担增加的膀胱肿瘤CD8效应因子评分相应增加,T细胞浸润增强。对膀胱切除术后MIBC肿瘤的研究结果,支持CD3+或CD8+ TILs的增加与生存率的提高相关的观点。
MIBC中TILs的存在是否受年龄的影响尚不清楚。在一项对>50岁患者的MIBC膀胱切除术样本的研究中,没有发现患者的年龄、性别或T细胞标记CD4、CD8或CD56存在相关性。
然而,从更广泛的免疫衰老和衰老意义上来说,所使用队列中的患者的年龄范围相当有限,并没有在特定年龄组之间进行比较。
在更有针对性的比较队列(<40岁和>80岁)中,需要了解免疫衰老的变化如何影响免疫治疗,以提高对膀胱癌中衰老对适应性免疫的影响的理解。
衰老与基础先天免疫活动的增加有关,数据表明,在人类组织和小鼠模型中,先天免疫细胞(如中性粒细胞)的增加是肿瘤形成的促进剂。
然而,尽管T细胞在肿瘤免疫中的非常重要,但是适应性免疫反应在衰老和肿瘤发生中的作用仍不清楚。还需要确定炎症如何促进膀胱癌的决定性实验。
肠道微生物群
人体的肠道微生物组估计有超过1000种不同的细菌和100万亿个单独的细菌细胞。
这些不同菌群的代谢产物通过一层肠细胞、肠道粘液和微折叠免疫细胞与全身循环分离。肠道微生物的产物被腔细胞摄取后,运输到全身,对全身免疫系统产生广泛影响。
由肠道菌群组成的变化引起的宿主和肠道菌群间稳态的破坏,是菌群失调,会导致炎症、肿瘤进展和肿瘤对乳腺癌、肺癌和结直肠癌治疗的反应。
菌群失调如何影响免疫
菌群失调破坏肠道屏障,导致释放促炎症的MAMPs,如脂多糖和未甲基化的CpG DNA,加速年龄相关的免疫系统失调。
肠道物质的泄漏也发生在肠道血管屏障(GVB)。对肝脏疾病的研究表明,酒精性和非酒精性脂肪性肝炎等情况可破坏肠血管屏障,导致微生物物种的全身传播。
我们知道,衰老会导致上皮完整性屏障的破坏,因此,除了肠道-上皮完整性的丧失外,肠血管屏障的完整性的丧失可能是肠道功能障碍中微生物或微生物组分系统性传播的一个尚未被充分研究的方面。据推测,这些物质的泄漏会以对人体健康有害的方式广泛影响免疫力。
膀胱癌中的微生物群及其的潜在联系
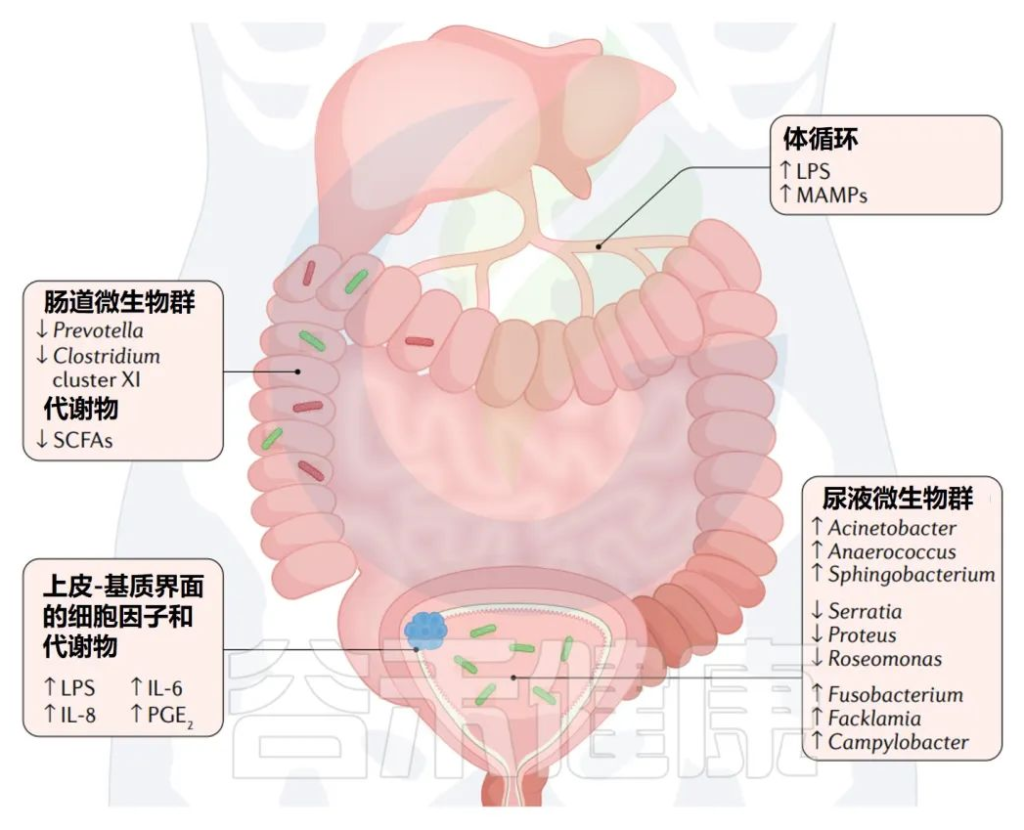
Martin A,et al.Nat Rev Urol.2022
多种微生物群可能会影响或被膀胱癌的形成所改变,包括肠道微生物群的改变、尿液微生物群的改变和上皮基质界面的改变。
与健康人相比,膀胱癌肠道微生物群的变化包括Prevotella和Clostridium的丰度降低。
膀胱癌患者尿微生物组中以下菌群的丰度高于健康人群:
同时以下三个菌群的丰度较健康人群偏低:
肠道失衡与结直肠癌之间的正相关已经得到了很好的证实,但是肠道失衡在多大程度上影响其他肿瘤的进展,包括膀胱癌,还不清楚。
此外,肠上皮完整性的破坏在多大程度上是由肠道菌群的非共生变化驱动的,反之亦然,这一点也存在争论。
膀胱癌患者:普雷沃氏菌、梭菌属减少,丁酸水平降低
一项研究包括26名膀胱癌患者和16名年龄匹配的健康参与者通过定量PCR分析证明,普雷沃氏菌和梭状菌群显著减少 。
在同一研究中,膀胱癌患者粪便中的丁酸盐(一种短链脂肪酸)水平降低,而血清中的脂多糖水平升高。鉴于丁盐酸的抗肿瘤作用以及脂多糖和其他与肠道功能障碍相关的MAMPs的促肿瘤作用,这些数据表明微生物群的变化可能是疾病发生的相关因素。
迄今为止只进行了这种单一的、小规模的试验。这些发现是否代表肠道失衡、炎症和膀胱癌发生之间的潜在因果联系,或仅是相关的,还需要进一步的研究来确定。
需要在临床前模型中采用直接介入方法来了解短链脂肪酸在肠道失衡和膀胱癌中的作用,更重要的是,需要进行更大规模的试验,在膀胱癌患者的分子水平上调查肠道功能障碍,以验证任何发现。
需要进一步调查来确定,这些发现是否代表肠道菌群失调、炎症和膀胱癌肿瘤发生之间的潜在因果关系。
年龄相关的失调机制和对系统性炎症标志物的影响
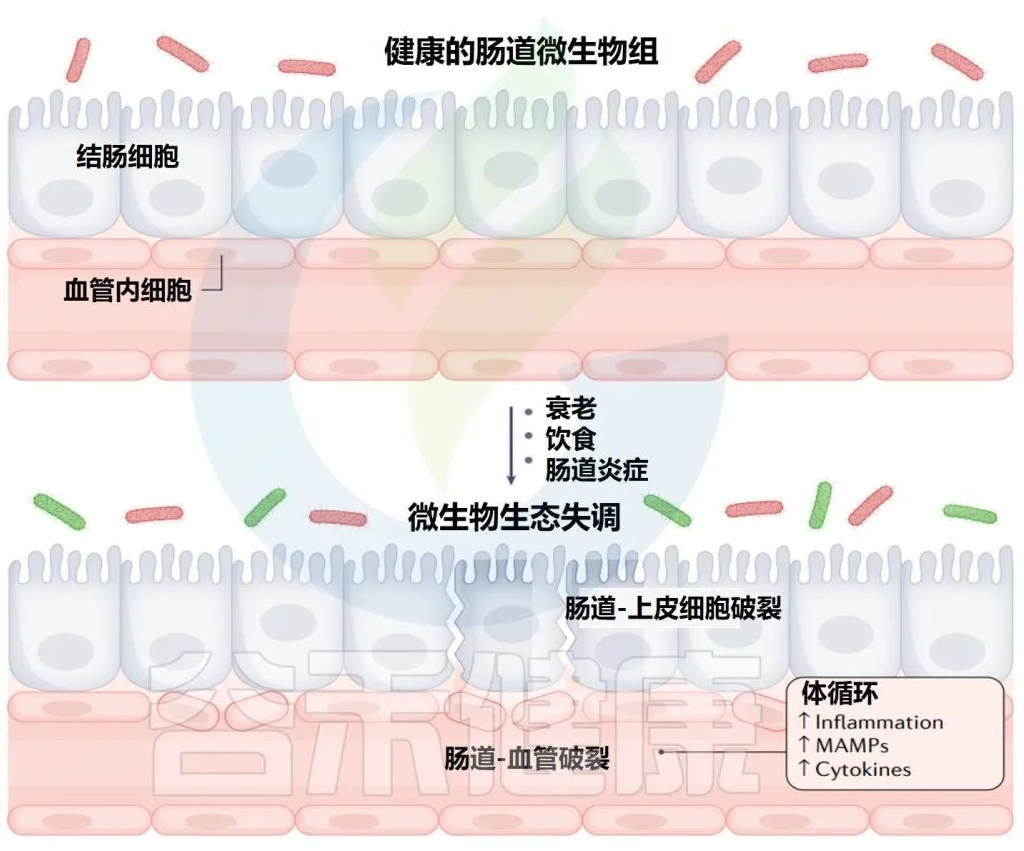
Martin A,et al.Nat Rev Urol.2022
衰老和饮食都可以影响肠道微生物群,导致微生物失调和肠道上皮细胞的破坏。
这种分解导致微生物相关分子模式(MAMPs)的释放增加和短链脂肪酸(SCFAs)的产生减少,并可导致体循环中MAMP和细胞因子的炎症增加。
大多数研究的结果都认为,当肠道菌群失调发生时,肠上皮细胞的分解通常与之相关,尽管特定细菌亚群的变化及其与肠上皮细胞的相互作用并不完全清楚。了解这些变化对于确定哪些菌群可能对免疫系统产生负面的全身影响非常重要。
首先出现的问题是菌群失调或上皮破裂,这一点很复杂,因为它们之间可能有着不可分割的联系,因此,一个或另一个的刺激可能会促成这两个事件。
对健康百岁老人肠道菌群的研究,为通过恢复肠道健康进行治疗干预提供了潜在的途径。这一观点得到了一项研究的支持,该研究显示,健康状况良好的30-100岁人群的微生物含量具有很强的相似性,这表明存在健康的微生物组,并可能对不符合这一类别的患者进行调节。
到目前为止,结果还没有表明任何特定细菌种类的丰度与长寿是绝对相关的。
相反,尽管老年人有效对抗感染的能力明显下降,但长寿的人会形成促炎和抗炎细菌的平衡。
对27项研究的系统综述结果表明,长寿个体在β-多样性(微生物环境间的多样性程度)方面与年轻个体存在差异;然而,通常不会观察到 α 多样性的差异,即每个微生物系统的多样性程度。
总的来说,8项研究涉及百岁老人,4项研究比较了高龄人群和59-85岁人群,4项研究中有2项报告了高龄人群和低龄人群微生物环境多样性程度的差异,而没有研究发现α-多样性的差异。
▸ 老年人的菌群丰度
与年轻个体相比,老年人至少有两个菌群的丰度更高:
与此同时下列菌群的丰度更低:
然而,研究设计存在相当大的差异,关于哪些菌群构成良好的健康,以及老年人存在哪些变化仍未确定的一致意见。
▸ 长寿老人:AKK菌丰度高
值得注意的是,在系统综述中,Akkermansia在高龄人群(99岁以上)中最常见,这可能与此相关,因为该菌在适当水平时与肠道通透性降低、内毒素血症减少和对癌症治疗的免疫反应改善有关。
阿克曼菌(Akkermansia,简称AKK菌)还促进Treg分化,限制肠道功能障碍高脂饮食模型中细胞因子的产生,并通过类似机制预防衰老相关炎症。没有保留阿克曼菌的患者可能会增加疾病发展的风险,包括膀胱癌,或者可能对化疗反应不好。
▸可能存在:AKK菌促进健康的“正确”水平或必要的平衡
抗生素的使用与免疫治疗的不良结果相关,矛盾的是,与不使用抗生素的患者相比,许多服用抗生素的患者AKK菌增加,而且,AKK菌高水平的存在与总生存率呈负相关(使用抗生素的患者P = 0.011,不使用抗生素的患者P = 0.018)。
然而,AKK菌只是可能对微生物功能至关重要的许多不同实体之一,单一实体治疗不太可能像基于平衡微生物组的更强大的改变(如粪菌移植)那样有效。
肠道菌群随年龄或并发疾病的变化可能是膀胱癌的危险因素,可通过直接给予益生元和益生菌或通过粪菌移植减轻。
▸ 短链脂肪酸
短链脂肪酸(SFCAs)由肠道细菌产生,是肠细胞的主要能量来源,是G蛋白偶联的游离脂肪酸受体配体。作为组蛋白去乙酰化酶抑制剂,可通过预防致瘤前表观遗传变化直接限制肿瘤生长。
短链脂肪酸主要存在于肠道中,但它们也可能对治疗膀胱癌有用。在体外,短链脂肪酸在很大程度上抑制先天免疫系统。
由于它们的多种作用和潜在的抗肿瘤活性,产生有益的短链脂肪酸可能是肠道维持健康环境的一种手段,也可能有助于预防结肠癌。
丁酸盐减少癌细胞生长,帮助维持健康的上皮屏障
由于癌细胞与非恶性细胞之间代谢的Warburg效应型变化(有氧糖酵解),丁酸盐通过氧化代谢和能量产生促进非恶性细胞的生长,但减少了癌细胞的生长,因为癌细胞不能有效代谢丁酸盐,丁酸盐在细胞核中积累,在细胞核中发挥组蛋白去乙酰化酶抑制剂的作用。因此,丁酸盐可以帮助维持健康的上皮屏障。
百岁老人肠道菌群中的短链脂肪酸水平上调
在一项研究中,80-99岁的老年人群中健康的老人总短链脂肪酸浓度升高;另一项研究结果显示,与老年患者相比,百岁老人的肠道菌群中产生短链脂肪酸的代谢途径(如乙酸和丙酸)表达水平上调。
除了存在一些与短链脂肪酸产生相关的细菌外,与小于80岁的人群相比,老年人粪便中的细菌数量通常减少。短链脂肪酸水平随着年龄的增长逐渐下降,而百岁老人开始恢复Akkermansia水平。
粪菌移植期间补充Akk菌可能有助于短链脂肪酸的保留
另一项研究的结果表明,在粪菌移植期间用巴氏消毒Akkermansia治疗小鼠,会导致肠道中短链脂肪酸的形成短暂增加,因此,如果这项技术能够完善,在粪菌移植期间补充Akkermansia或其他产生短链脂肪酸的细菌可能有助于改善短链脂肪酸的保留,并预防或治疗癌症。
在脂多糖处理的骨髓源性巨噬细胞中,丁酸、丙酸和乙酸均以剂量依赖的方式降低IL-6和IL-12的产生。丁酸和丙酸也会降低脂多糖处理单核细胞中单核细胞趋化蛋白-1的表达。
通过这些作用,短链脂肪酸可能缓和过度的免疫激活,促进免疫调节。
短链脂肪酸体外作用似乎具有抗炎作用,但其对膀胱癌适应性免疫系统的作用尚不清楚。
特别是丁酸盐,通过诱导调节性T细胞产生IL-10和激活 FAS 介导的T细胞凋亡,下调适应性免疫反应。
短链脂肪酸高可能影响免疫治疗效果
丁酸盐和丙酸盐均通过抑制抗原呈递细胞产生IL-12来抑制CD8+T细胞活化,全身水平的短链脂肪酸高与转移性黑色素瘤细胞毒性T淋巴细胞抗原4(CTLA4)免疫治疗的不良结果有关。
直接通过短链脂肪酸或间接通过前列腺素E2下调T细胞对免疫治疗和顺铂化疗均有不利影响,因为传统的肌肉浸润性膀胱癌新辅助顺铂化疗会刺激效应T细胞。因此,降低T细胞的疗效也可能改变化疗。
这些观察结果可以部分解释在肿瘤床上升高的前列腺素E2表达与不适当抑制的免疫反应和化学耐药性有关。
总之,这些发现表明短链脂肪酸在宿主免疫功能中参与发挥抗炎作用,尽管这一假设可能过于简单化,短链脂肪酸还可以刺激中性粒细胞趋化,因此可能有其他重要的调节作用。
然而,文献强烈支持短链脂肪酸的抗肿瘤作用,尤其在结直肠癌中,可能是因为短链脂肪酸在结肠中的浓度增加,以及介导丁酸差异效应的代谢变化,对癌细胞具有直接作用。
在衰老过程中,维持体内稳态需要抗炎和促炎信号,而短链脂肪酸除了自身具有抗肿瘤作用外,还可能是调节这一系统的一种手段。这些发现已经在体外和体内观察到,但迄今为止没有研究将人类短链脂肪酸水平与膀胱癌结果直接相关。
鉴于与肠道和全身短链脂肪酸水平相关的多种影响,短链脂肪酸可能充当免疫调节剂,因此,塑造使短链脂肪酸产生正常化的微生物含量,是增强或促进免疫治疗的潜在手段。
肠道微生物群的变化可能成为膀胱癌和其他癌症的治疗靶点。应该在这些群体和其他群体之间进行更广泛的比较,以了解哪些类型的微生物生态系统对人类的健康和寿命最有益。
当前的数据支持这样一种观点,即与年龄相关的微生物群变化可能最终影响疾病进展、结果或治疗反应等因素。
衰老在肠道微生物变化中的作用尚不清楚;此外,一些证据表明,环境因素对肠道微生物群有实质性的影响。
一项包括来自中国同一小区域的1000多名极健康个体的研究结果表明,当研究人员试图控制总体健康时,30至100岁的个体粪便微生物群组成几乎没有变化,虽然在30岁以下的个体和30岁以上的个体中发现了相当大的差异。
通过主成分分析评估,30-100岁非常健康的个体的粪便微生物群高度一致,支持了其他研究的结果,这些研究表明环境,而不是年龄或遗传,是微生物组的主要影响者。
值得注意的是,该研究的入选标准具有极高的选择性,通过严格的生活方式分析,几乎99%的患者被拒绝入选;选择标准包括吸烟状况、饮酒、饮食和其他与肠道功能障碍相关的因素。
因此,尽管这些数据表明年龄是肠道微生物群变化的促成因素,但这一观察结果可能仅与这些高选择性标准所代表的一小部分人有关。然而,本文提出了一个假设,即衰老本身可能不如与衰老相关的饮食变化或生活方式变化重要。
在小鼠、狒狒和果蝇模型中,肠道菌群的变化与年龄有关,并与肠道屏障完整性的破坏有关。
在小鼠中,用荧光素异硫氰酸酯(FITC)标记的葡聚糖测量肠道通透性,其血清水平与IL-6和肿瘤坏死因子(TNF)水平一起随年龄线性增加。
肠道菌群组成——肠道屏障功能障碍
在果蝇中,观察到老年果蝇肠道中细菌组成的改变和细菌总负荷的增加,与年轻果蝇相比,肠道中不可吸收蓝色染料(肠道屏障功能障碍的替代品)浓度也相应增加。
结肠完整性的破坏——年龄
在狒狒中,结肠完整性的破坏与年龄有关,与10岁以下的狒狒相比,年长的狒狒(年龄≥18岁)结肠组织的免疫组化分析显示封闭蛋白(occludin)、连接蛋白(claudin)和紧密连接粘附分子减少,同时大分子辣根过氧化物酶(肠通透性的另一标志)在结肠上皮的通量增加。
此外,18岁狒狒的结肠活检中IL-6、IL-1β和IFNγ水平高于10岁灵长类动物。
肠道功能障碍——细菌成分的全身释放
另一项比较21月龄小鼠与4或12月龄小鼠肠道通透性的研究结果显示,老年小鼠血清FITC-右旋糖酐水平的增加与体循环中脂多糖水平的增加相关,将肠道功能障碍和细菌成分的全身释放联系起来。
LPS 和其他 MAMP 与 IL-1β、IL-6 和 TNF 等细胞因子的增加密切相关,提供了肠道菌群失调、慢性炎症和肿瘤发生之间可能的机制联系。
所有这些数据都支持这样的观点,即肠道功能障碍随着年龄的增长而增加,与其他哺乳动物的饮食或生活方式的变化无关,但由于适当控制人类饮食的复杂性,尚未在人类中进行评估。
免疫功能障碍——衰老——微生物群
衰老过程中,循环细胞因子的增加在具有14个月或以上老年动物的微生物群的小鼠模型中加剧,将免疫功能障碍与衰老和微生物群联系起来。
相比之下,无菌小鼠在衰老过程中通常不会表现出,老年特异性无病原体小鼠所表现出的循环细胞因子的增加,并且在很大程度上可以防止衰老相关炎症和巨噬细胞功能障碍,除非它们再次暴露于微生物群。
衰老——肠道通透性——炎症——菌群
将无菌小鼠暴露于14月龄动物的菌群中,比无菌小鼠暴露于幼龄小鼠的菌群中更能促进肠道通透性和细胞因子释放。
这一机制依赖于肿瘤坏死因子,使用抗肿瘤坏死因子拮抗剂治疗可以改善衰老引起的微生物群的变化。因此,由肠道功能障碍介导的MAMP或DAMP释放与老年炎症表型之间发生了实质性的相互作用,从而导致炎症系统的慢性全身激活。
为了将这些发现转化为膀胱癌,除了了解局部微生物群(包括尿液微生物群和肿瘤本身)之间的联系外,还需要进一步了解膀胱癌背景下的肠道微生物群。
到目前为止,对尿液微生物群的研究还缺乏一个关于什么是正常尿液微生物群的明确共识:由于收集方法的差异和相对较小的样本量,目前关于健康尿液微生物群的定义存在很大差异。
目前对尿液和膀胱微生物群及其改变的了解有限。局部微生物环境的失衡与多种上皮性癌症的肿瘤进展有关,包括乳腺癌、宫颈癌和子宫内膜癌。
健康的尿液微生物群
目前的初步研究一致认为,健康成年志愿者的尿液微生物中至少包含四种细菌种群:乳酸菌和链球菌是尿液微生物中最稳定存在的属,与年龄和采样方法有关,而厚壁菌门和不动杆菌门是两性尿液微生物中最丰富的门。表明这些是该人群中最有可能构成健康尿液微生物组的成分。
女性尿液中乳酸杆菌种类的含量高于男性
根据对健康志愿者进行的两项独立研究的结果,尿液微生物群的性别差异很明显。研究表明,女性尿液中乳酸杆菌种类的含量高于男性尿液中的含量。
我们还不清楚这一观察结果与癌症的关系,但这一发现的一个潜在的重要方面是,男性与女性泌尿系统微生物群的差异或女性泌尿系统微生物群的个体间差异可能与女性泌尿系统感染的流行有关,或她们膀胱癌发病率的降低,因此可能会影响膀胱的整体微环境。
菌群在不同年龄的差异
在同一项包括23名健康成年人的研究中,下列四种菌群仅在>70岁的个体中发现:
此外,在男性中,属的数量会随着年龄的增长而增加,而细菌总数减少。性别或年龄差异会影响尿液微生物群。
尿液微生物:个体间差异极高
研究结果还表明,个体间差异极高,限制了更深入的分析。由于这种高变异性,对泌尿系统微生物的调查缺乏类似的大型多种族和多种族肠道微生物群研究的力量,因此饮食、基因、男性和女性短期或长期激素变化的重要性,以及泌尿系统微生物的卫生还没有确定。
需要大型的、多中心的、多种族的、具有共识方法论和清晰统一的分析管道的研究来完善该领域的假设并产生共识。
多项研究报道尿失禁、间质性膀胱炎和泌尿生殖系统癌患者尿液微生物群落的物种多样性和相对丰度存在差异。
健康人群与膀胱癌人群的微生物组差异
在膀胱癌方面,一项包括12例膀胱癌患者和11名年龄匹配的志愿者的研究结果显示,与健康成年人相比,膀胱癌患者富集了以下四种菌群:
与间质性膀胱炎和慢性前列腺炎等疾病相比,使用Simpson指数测量的健康成人和膀胱癌患者之间的物种多样性(α-多样性)在种或科水平上没有总体差异,这表明膀胱癌的尿液微生物群可能不像其他炎症性疾病状态那样受影响,尽管这一观察结果可能是因为该研究力量不足。
然而,在特异性操作分类单元(OTUs)水平上进行差异分析,可以减少测量参数的数量,从而识别差异,表明相互关联的物种可能在肿瘤发生中发挥作用。
一项针对31名膀胱癌男性的研究结果显示,与18岁匹配的健康个体相比,下列三种菌群的丰度增加:
同时下列几种菌群降低:
由于个体数量少,这些研究不足以完全确定特定细菌种群的变化。对于尿液微生物菌群研究在多大程度上反映了膀胱内的微生物群也知之甚少。
Andolfi C, et al., Bladder Cancer. 2020
关于膀胱肿瘤微生物组的研究仅限于两项研究。两者的结果都表明,肿瘤与非恶性组织中的 α 多样性导致物种丰富度相对降低。一项研究发现,膀胱微生物组的门(如厚壁菌门和放线菌门)的相对丰度与之前在其他研究中报道的尿液微生物组值相似。
联合测量来自同一患者尿液和膀胱肿瘤样本的微生物群目前在文献中还没有。这些因素支持了对肿瘤分级或分期与泌尿系统微生物组之间差异的调查,以及使用更大的患者队列进行明确的、多机构的、控制良好的研究的必要性。
尿液微生物群的影响尚不完全清楚,衰老和肠道生态失调导致的免疫失调的直接影响可能会增加膀胱癌的发病风险。
然而,没有研究直接比较同一患者的尿液微生物群和肠道微生物群的变化。需要进行研究来评估与衰老和炎症相关的肠道生态失调是否也发生在泌尿系统的微生物群水平上,或任何其他含有微生物的解剖部位。
如果存在潜在的机制,尿液微生物的失调可能是衰老、炎症、失调和膀胱癌风险之间的联系。
系统性炎症、尿路上皮增生与膀胱癌之间的假设联系

Martin A,et al.Nat Rev Urol.2022
衰老引起的炎症变化以及肠道上皮完整性的降低可导致循环促炎介质水平的增加,例如细胞因子和微生物激活分子模式 (MAMP).
LPS介导的toll样受体4 (TLR4)激活可导致骨形态发生蛋白4 (BMP4)、音猬因子 (SHH)、WNT -β-catenin和STAT3通路的激活,促进尿路上皮的增殖。BMP4、SHH、WNT -β-catenin和STAT3通路在膀胱癌中调控异常,但还没有研究直接将LPS或MAMP介导的BMP4、SHH、WNT -β-catenin和STAT-3的激活与膀胱癌的发生联系起来。当转化发生时,带有肿瘤相关巨噬细胞(TAMs)和肿瘤浸润性中性粒细胞(TINs)的尿路上皮的慢性炎症阻止了适当的免疫反应和肿瘤清除,并可能通过释放细胞因子、生成活性氧(ROS)和促进免疫抑制环境进一步加剧肿瘤的形成。PGE2,前列腺素E2.
由尿路上皮细胞和局部感染性细菌引起病原相关分子模式(MAMPs)驱动和损伤相关分子模式驱动炎症可能是年龄、肠道上皮破坏和在许多膀胱肿瘤中发现的先天免疫信号之间的一种机制联系。
脂多糖增加炎症因子的释放
在体外人类和小鼠模型中,来自尿路致病性大肠杆菌的脂多糖通过TLR4信号通路增加尿路上皮细胞中IL-6、IL-8和PGE2细胞因子的释放。
此外,脂多糖激活尿路上皮细胞上的电压门控钾通道,介导IL-6释放。脂多糖通过磷酸化途径激活巨噬细胞和泌尿黏膜中的TLR4,这与膀胱癌的发展和化疗耐药有关。
STAT3促肿瘤
免疫组织化学(IHC)分析发现,与非侵袭性发光型肿瘤相比,局部侵袭性肿瘤中STAT3磷酸化水平升高,抑制STAT3可降低膀胱癌细胞系的增殖。在小鼠中,阻断尿路上皮细胞中的 STAT3 可降低膀胱癌的发生和侵袭性。
IL-8和PGE2促肿瘤
脂多糖介导的尿路上皮IL-8和PGE2的增加在膀胱癌中也具有促肿瘤作用。在经尿道膀胱肿瘤标本切除的新鲜冷冻组织中,与非侵入性肿瘤相比,浸润性肿瘤中IL-8和基质金属蛋白酶9水平升高。
前列腺素E2促肿瘤
此外,前列腺素E2增加高级别膀胱癌细胞系的增殖,在接受吉西他滨和顺铂标准化疗方案治疗的小鼠中使用塞来昔布抑制前列腺素E2,产生了持续的治疗反应,并通过消除患者来源的肿瘤异种移植模型中CK14+细胞的形成克服了化疗耐药性。
这些研究表明尿路感染期间脂多糖相关炎症与膀胱癌进展之间存在多种趋同途径。
尿路感染后信号通路的改变
重要的是,对尿路感染的生理尿路上皮反应受到音猬因子重组蛋白(SHH)、骨形态发生蛋白4 (BMP4)和WNT -β-catenin信号通路的高度调控,这些信号通路在恶性转化过程中经常发生改变。
尿路感染后的尿路上皮再生是由尿路上皮基底层分泌SHH的干细胞增殖驱动的。感染后,下游SHH信号通路通过BMP4和WNT-β-catenin信号通路诱导尿路上皮和基质细胞增殖和终末分化。
这种作用在前列腺素合成抑制剂治疗后被逆转。
这些再生途径中的每一个的丧失或改变都与膀胱癌发生有关。在 BBN 小鼠模型中,SHH 阳性基底细胞是膀胱癌的主要祖细胞。SHH 的丧失和进展为膀胱癌可能是通过 BMP 基质信号传导的丧失而发生的。
免疫组化分析显示,与非恶性尿路上皮黏膜相比,在人膀胱癌肿瘤中观察到WNT糖蛋白活性升高。这一发现在小鼠模型中得到了进一步的支持,在功能获得突变体中β-连环蛋白的构成性激活导致了12周后30%的小鼠发生低级别膀胱肿瘤。
有趣的是,在具有构成型活性β-连环蛋白的小鼠中,肿瘤的发生是性别依赖的,45%的雄性小鼠发生肿瘤,而雌性小鼠只有3%,这最终与雄激素受体(AR)信号有关。
在人类和普通小鼠模型中都发现了膀胱癌的性别二态,但其原因是多因素的,也与表观遗传机制中的染色体差异有关。
这些发现呈现了尿路上皮在响应急性脂多糖介导的炎症反应和尿路上皮癌的发展之间呈现出许多重叠特征。
年龄相关的肠屏障破坏,诱发炎症;免疫系统变化,增加肿瘤风险
然而,尿路感染与膀胱癌风险的增加并没有特别的关联。当与衰老和肠上皮完整性丧失相结合时,由于与年龄相关的肠屏障破坏,长期暴露于基底尿路上皮层的脂多糖或其他损伤相关分子可能会诱发慢性膀胱炎症,并增加细胞周转,以及与年龄相关的免疫系统变化,增加肿瘤转化的可能性。
慢性膀胱炎症诱导的肿瘤转化可能是女性特有的一种机制,因为尿路感染在女性中更为突出,而膀胱癌在男性中更为常见。
关于衰老相关炎症、微生物群和膀胱癌发生的研究仍然不完整,需要更多的假设检验来确定这些不同实体(衰老、微生物功能障碍、炎症改变)在这一过程中导致的具体变化和肿瘤相关结果。
研究肠道和尿液微生物群对浅表性癌症治疗反应的影响,可能为微生物群和膀胱癌进展提供额外的见解。
新的证据表明,浅表膀胱癌治疗受到肠道和尿道微生物群的影响。
目前,高级别非肌肉浸润性膀胱癌的一线治疗是细菌疫苗株卡介苗。卡介苗的疗效随着年龄的增长而降低,早期数据表明,疗效还受尿微生物中变形菌群丰度的影响。
一项包括1106例患者的卡介苗干扰素膀胱内治疗的II期多中心试验的数据表明,年龄在61-70岁的患者在卡介苗干扰素治疗后的无癌生存期优于80岁或以上的患者(3 年无癌生存率为 65%对 47% ,P = 0.036)或卡介苗单药治疗(3 年无癌生存率 55% 对 32%,P < 0.003)。
令人惊讶的是,在这项研究中,小于50岁的患者的预后较差;然而,在多变量分析中,年龄仍然是反应的独立危险因素。
在一项包括805名Ta、T1或CIS高分级患者的独立研究中,年龄为>70岁的患者的无癌生存期低于年龄<70岁患者(37% 对 27%,P = 0.005)。
在接受益生元或益生菌治疗的个体中,非肌肉浸润性膀胱癌复发减少。最后,肠道菌群介导了实体肿瘤(如黑色素瘤)中对PD1治疗的反应,这可能与晚期膀胱癌中免疫治疗具有共同机制。
关于卡介苗抑制肿瘤复发的机制尚不清楚,一种假设是卡介苗诱导膀胱内的局部促炎性先天免疫反应,进而刺激对卡介苗和肿瘤抗原的适应性免疫反应。
在治疗后的前3年,由于未知的原因,卡介苗未能阻止肿瘤复发的患者占30%,年龄可能是无反应的原因之一。
年龄越大,卡介苗疗效越差
接受卡介苗治疗后,61-70岁的患者中有61%在24个月时无复发,而>80岁的患者中有39%无复发。
这些结果得到了另一项研究的支持,该研究表明70岁以下(27%)和70岁以上(37%)患者5年后无病生存率的绝对差异为10%;然而,这两个年龄组中与年龄相关的死亡风险没有报道。
因此,年龄可能是非肌肉浸润性膀胱癌复发的独立危险因素,但与年龄相关的免疫系统衰退是否相关尚不清楚。
卡介苗应答取决于多种因素,不止年龄
在一项小型研究中,31名卡介苗应答者与32名卡介苗无应答者进行了比较,结果表明,肿瘤PDL1状态而不是T细胞PD1状态是卡介苗应答的决定因素,这表明卡介苗的总体应答可能取决于许多不同的因素,而不仅仅是年龄。
尿液微生物群也可能在卡介苗反应中起作用
在一项包括31例接受卡介苗治疗的高危非肌肉浸润性膀胱癌患者的研究中,观察到卡介苗应答者和无应答者在OTU水平上的尿液微生物群差异。
卡介苗治疗6个月后无病的患者比复发患者尿厚壁菌门(如乳杆菌和变形杆菌)丰度更高。
鉴于非肌肉浸润性膀胱癌中益生菌和饮食的潜在保护作用,对卡介苗有反应的人群中乳酸杆菌丰度的增加尤其引人注目。
年龄、免疫状态和尿液微生物组与卡介苗反应之间的确切联系尚未确定。
考虑到有相当多的非肌肉浸润性膀胱癌患者最终会进行膀胱切除术,对年龄相关卡介苗反应降低的机制进行更好的了解,将对评估复发风险和改善对现有治疗的反应非常有益。
在日本,肠道微生物组长期以来一直是浸润性膀胱癌治疗的目标,部分原因是发酵乳制品中广泛使用的乳酸菌,以及报道的小鼠口服乳酸菌制剂的抗肿瘤特性。
★ 乳酸杆菌
乳酸杆菌与膀胱癌复发减少或低发病率相关
一项包括138名患者的双盲随机对照试验结果显示,口服干酪乳杆菌制剂与安慰剂相比,男性和女性浸润性膀胱癌复发减少。
这些结果得到了一项病例对照研究的支持,该研究包括180名膀胱癌患者和445名年龄和性别匹配的健康志愿者,他们有10-15年的发酵牛奶的习惯摄入史(发酵奶是高脂肪的天然来源),每周1-2次乳酸杆菌(OR 0.46,95 % CI 0.27–0.79)或3-4次乳酸杆菌(OR 0.61,95% CI 0.38–0.99)与膀胱癌发病风险的降低有关。
这些发现得到了一项前瞻性试验结果的进一步支持,该试验包括202例经尿道膀胱肿瘤切除术后的浸润性膀胱癌患者,他们被随机分为两组,一组接受六次膀胱内表阿霉素治疗,另一组接受六次膀胱内表阿霉素治疗,外加每日3克干酪乳杆菌口服制剂,为期1年。
接受表阿霉素加每日制剂乳酸杆菌的患者3年无复发生存率为74.6%,而单独表阿霉素组仅为59.9% 。
这些研究没有调查粪便微生物组是否发生了变化,因此可以推断因果关系的程度有限。需要通过研究确定益生菌相关的变化,以及这些变化如何影响膀胱癌相关结果,来验证这些发现。
乳酸杆菌与肠道黏膜炎症减少有关
然而,在葡聚糖硫酸钠诱导的小鼠结肠炎症模型中,乳酸杆菌种类与肠道黏膜炎症减少有关。
在体外实验中,唾液乳杆菌降低肠上皮细胞系中TLR受体的激活,导致上皮细胞之间紧密连接的组装增加,可能减少系统性脂多糖和慢性炎症。
还需要在膀胱癌动物模型中进行更多的研究,以直接确定全身的病原相关分子模式水平是否也与全身炎症相关。
扩展阅读:如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍
★ 萝卜硫素
除了乳酸菌,萝卜硫素也可能在恢复肠道屏障健康和降低膀胱癌发展风险方面发挥保护作用。
萝卜硫素饮食的小鼠丁酸水平增加
用亚硝基胺(BBN)治疗的小鼠和喂食高萝卜硫素饮食的小鼠丁酸水平增加,但与单独用亚硝基胺治疗的小鼠相比没有表现出增加的存活率。
肿瘤发生时间延长,发病率降低
然而,有趣的是,饲喂西兰花提取物(萝卜硫素的主要来源)的大鼠在暴露于亚硝基胺8周后,与未接受西兰花提取物的大鼠相比,肿瘤的发生时间延长了24周,其膀胱肿瘤发病率降低了58%.
重要的是,口服西兰花提取物导致小鼠在喂食12小时后尿液中生物活性异硫氰酸盐(包括萝卜硫素)的浓度比血清中高70% 。
这些化合物也会干扰亚硝基胺的代谢,由于它们在尿液中积累,其功能主要是通过改善肠道健康还是直接作用于尿路上皮细胞的其他机制尚不清楚。需要新的研究来调查它们对肠道健康、随后的炎症和微生物差异的影响,以改进对确切机制的定义。
总之,这些研究的结果表明,改变饮食,无论是口服乳酸杆菌或萝卜硫素,都可以降低膀胱癌的风险。这两种方法都与血清中细菌脂多糖浓度的降低相关,脂多糖是小鼠模型中肠道炎症的系统性标记物。
然而,关于乳酸杆菌或萝卜硫素在多大程度上诱导与治疗反应相关的肠道或尿液微生物组的积极改变,目前还缺乏数据。
菌群失调对PDL1-PD1轴的影响是一个有趣的话题。2016年首次批准PD1抑制剂用于顺铂难治性晚期膀胱癌。
总的来说,阿克曼菌Akkermansia、肠球菌、梭状芽孢杆菌、瘤胃球菌、粪杆菌和双歧杆菌的丰度增加与肺癌、肾癌和黑色素瘤等癌症对PDL1治疗的反应改善有关。
在转移性黑色素瘤患者中,研究中定义的患者粪便中“有益”与“无益”OTU数量的增加与抗PD1治疗反应的改善呈正相关。
PD1响应者粪菌移植的小鼠有更强的抗肿瘤反应
在对肠道微生物组和免疫治疗反应的三项独立研究中,从PD1治疗反应者到无菌小鼠的粪便移植产生了比无菌小鼠更强的抗肿瘤反应。
在一项研究中,研究了转移性黑色素瘤患者肠道微生物组和肿瘤微环境之间的相关性,以评估肿瘤微环境的发现是否可以预测对PD1免疫疗法的治疗反应。
对肿瘤活检的免疫组化分析显示,对PD1免疫治疗反应良好的患者,其肿瘤床上的CD8+ T细胞密度更大,调节性T细胞更少。
此外,响应者的物种多样性和瘤胃球菌科细菌的相对丰度高于无响应者。考虑到准确定义和匹配供体材料的重要性,必须了解粪菌移植如何改善抗免疫抑制分子或抗PDL1治疗的反应。
鉴于这些变化,作者得出结论,为 FMT 和其他微生物疗法准确匹配和定义微生物群可能需要额外的匹配,如年龄和性别,并准确定义理想的供体-宿主关系。
总之,这些发现强烈表明,在PD1免疫治疗的情况下,肠道微生物群可能会影响对癌症的全身免疫反应。
所有关于肠道微生物组和对PD1抑制剂的反应的初步研究都比较了相对物种丰度和处理反应。这种方法不能解释细菌总负荷的变化以及体循环中代谢物浓度的潜在差异。
微生物组是否通过直接的抗原相互作用对免疫系统产生影响,或者微生物组的代谢产物,包括潜在的有益成分和潜在的有害成分,是否间接地影响免疫系统,目前尚不清楚。
这种区别很重要,因为如果微生物组的主导作用是通过体循环中的代谢物间接发生的,那么微生物组可以被广泛地认为是一个更大的代谢产物网络的代表。
在这个模型中,许多不同的细菌组合有可能创造一个治疗性代谢网络,这与结果一致,表明促炎和抗炎成分对健康的老龄化都是必要的。
如果微生物组主要通过直接的免疫原性相互作用发挥作用,使免疫细胞对抗特定抗原,那么某些细菌种群的丰度是至关重要的。
膀胱癌的发病率与衰老密切相关。在老年患者中常见的炎症导致先天免疫系统失调,持续激活与活性氧表达和细胞因子释放相关的细胞。
与年龄相关的肠道微生物组变化可能有助于防止老年患者肿瘤的发生和肿瘤的治疗,但这些变化是否在功能上与老年患者的致瘤性炎症特征有关还有待确定。
许多膀胱癌患者以及其他尿道疾病患者与健康人群相比,尿液微生物群出现紊乱。需要更多大样本的基础研究,来确定膀胱癌或尿道疾病相关的菌群变化机制,从而更好地帮助治疗疾病。
没有确定的方法可以预防膀胱癌。但可以做一些有助于降低风险的措施。
虽然说没有一种食物本身可以绝对防止患癌症。但研究表明 ,富含各种水果、蔬菜、豆类、全谷物和其他植物性食物的饮食可以降低患多种癌症的风险,包括膀胱癌。
绿叶蔬菜
根据BCAN的数据,研究人员将每份蔬菜与膀胱癌风险减少10%联系起来。绿叶蔬菜含有抗氧化剂,抗氧化剂修复细胞损伤,同时还具有抗炎特性,甚至可以帮助预防癌症。例如:西兰花、卷心菜、南瓜、小麦胚芽、菠菜、羽衣甘蓝等
水果
研究人员还认为水果可以降低10%的膀胱癌风险。柠檬、橙子、葡萄柚和酸橙等柑橘类水果具有抗氧化特性,可以起到保护作用。其他还包括浆果,梨,苹果等。
茶
BCAN 表示,每天喝一杯茶,患膀胱癌的风险降低 6%,对动物的研究表明,多酚化合物会阻碍膀胱肿瘤的生长。绿茶中含有表没食子儿茶素-3-没食子酸酯,具有抗癌特性。
注意:红肉等加工食品中的化学物质会加剧膀胱癌的病情,此外还应避免酒精,零食等。尽可能均衡、健康地饮食。
西兰花芽丸、绿茶或姜黄素补充剂已经成为接受膀胱癌治疗的流行天然补充剂。然而,研究未能提供它们对人类有益的结论性证据。
在膀胱癌治疗期间服用姜黄素补充剂似乎可以使小鼠的肿瘤减小。
西兰花芽提取物对膀胱癌细胞的体外生长有抑制作用。
维生素E
据MayoClinic称,大量摄入富含维生素E的食物可以降低膀胱癌恶化的风险。
硒
硒是指一种具有抗氧化特性以防止细胞损伤的矿物质。因此,专家认为通过食用富含硒的食物可能帮助控制膀胱癌。如巴西坚果、核桃和燕麦片等。
限制场所
化工场所包括橡胶、皮革、印刷材料、纺织,油漆,铝,芳香胺、砷,染料,地毯,美发,打印等行业,接触时间过长可能患膀胱癌的风险更高,如在这些行业工作,尽可能遵守安全规则,做好防护措施。
尽可能减少吸烟
吸烟的人患膀胱癌的可能性至少是不吸烟的人的 3 倍。
多喝水
多喝水可能降低患膀胱癌的风险。如果喝白开水有困难,可以在水中加入新鲜柠檬片等来保持水分。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Martin A, Woolbright BL, Umar S, Ingersoll MA, Taylor JA 3rd. Bladder cancer, inflammageing and microbiomes. Nat Rev Urol. 2022 Jul 7. doi: 10.1038/s41585-022-00611-3. Epub ahead of print. PMID: 35798831.
Babjuk M. Bladder Cancer in the Elderly. Eur Urol. 2018 Jan;73(1):51-52. doi: 10.1016/j.eururo.2017.04.018. Epub 2017 May 4. PMID: 28478044.
Andolfi C, Bloodworth JC, Papachristos A, Sweis RF. The Urinary Microbiome and Bladder Cancer: Susceptibility and Immune Responsiveness. Bladder Cancer. 2020 Sep 21;6(3):225-235. doi: 10.3233/BLC-200277. PMID: 33195783; PMCID: PMC7605348.
Kacew A, Sweis RF. FGFR3 Alterations in the Era of Immunotherapy for Urothelial Bladder Cancer. Front Immunol. 2020 Nov 5;11:575258. doi: 10.3389/fimmu.2020.575258. PMID: 33224141; PMCID: PMC7674585.
Palumbo C, Knipper S, Pecoraro A, Rosiello G, Luzzago S, Deuker M, Tian Z, Shariat SF, Simeone C, Briganti A, Saad F, Berruti A, Antonelli A, Karakiewicz PI. Patient frailty predicts worse perioperative outcomes and higher cost after radical cystectomy. Surg Oncol. 2020 Mar;32:8-13. doi: 10.1016/j.suronc.2019.10.014. Epub 2019 Oct 25. PMID: 31683158.
Zhang Y, Hou Q, Ma C, Zhao J, Xu H, Li W, Wang Y, Ma H, Zhang H, Sun Z. Lactobacillus casei protects dextran sodium sulfate- or rapamycin-induced colonic inflammation in the mouse. Eur J Nutr. 2020 Jun;59(4):1443-1451. doi: 10.1007/s00394-019-02001-9. Epub 2019 May 23. PMID: 31123864.

谷禾健康


饮食可以调节人体肠道微生物群的组成和功能,以维持宿主微生物群的互惠共生。
谷物富含特定的功能元素,是维持人类健康的重要膳食成分。谷物可以改变肠道微生物群,并可能改善能量和葡萄糖稳态,干扰宿主能量稳态、食欲、血糖调节、胰岛素敏感性和宿主代谢的调节。
什么是全谷物
全谷物是禾本科植物的可食用种子,由胚(或胚芽)、胚乳和外部麸皮组成。
全谷物是一种富含膳食纤维的食物,而膳食纤维可以调节肠道微生物群,从而调节人体的特定生物过程,例如调节免疫、炎症、碳水化合物和脂肪代谢以及肠-脑神经回路。
全谷物是营养和植物化学物质的极好来源,可能对心血管疾病、高血压、糖尿病、不同类型癌症和肥胖症等多种慢性疾病具有保护作用。
全谷物的摄入还与健康肠道微生物群的增加有关,这一点可以从它们的丰富度和多样性以及短链脂肪酸的产生中看出。
短链脂肪酸,作为发酵终产物并促进有益细菌的生长。短链脂肪酸还可以降低结肠 pH 值,防止病原菌生长,并改善结肠上皮细胞的完整性。
本文讨论了不同谷物如何通过调节肠道微生物群对宿主产生有益的健康影响。主要从以下几个方面讲述:
• 谷物通过调节肠道菌群在动脉粥样硬化中的作用
• 谷物通过调节肠道菌群在高血压中的作用
• 谷物通过调节肠道菌群在肥胖中的作用
• 谷物通过调节肠道菌群在II型糖尿病中的作用
• 谷物通过调节肠道菌群在结肠健康中的作用
动脉粥样硬化是一种以胆固醇积聚和巨噬细胞聚集到动脉壁为特征的状态,它是心血管疾病的主要危险因素。
肠道微生物群组成的平衡很重要,平衡一旦破坏可能会导致毁灭性的病理生理后果。
在高脂饮食的Apo E−/−小鼠中,某些菌群的丰度,如Bilophila和Mucispirillum,与动脉粥样硬化斑块大小呈正相关。
物种丰富度也是肠道健康的一个主要标志,因为高细菌丰富度和多样性往往反映了生态系统的稳定性和复原力,以及疾病与粪便样本中物种数量减少之间的一致联系。
▸野生稻:具有抗脉粥样硬化作用
野生稻主要作为全谷物食用,食用后对健康有很多好处。野生稻含有抗性淀粉,可以作为益生元。
野生稻具有显著的抗动脉粥样硬化作用,但其作用机制尚不清楚。这些影响可能是由于血浆胆固醇水平的降低。
细菌代谢产物如短链脂肪酸和三甲胺-N-氧化物(TMAO)是动脉粥样硬化中的重要化合物。
▸抗动脉粥样硬化作用可能与肠道菌群改变有关
最近的研究还发现,肠道微生物群与动脉粥样硬化的形成之间存在关联。短链脂肪酸主要参与碳水化合物、脂肪和胆固醇代谢,其免疫调节功能可能有助于心血管疾病的治疗。动脉粥样硬化斑块中细菌DNA的存在为肠道微生物群与动脉粥样硬化的相关性提供了证据。
▸野生稻:影响菌群丰度和多样性,预防动脉粥样硬化
另一项研究调查了野生稻对小鼠粪便细菌物种丰度和多样性的影响。结果表明,在低密度脂蛋白受体基因敲除(LDL-r-KO)的小鼠中,长期食用60%的野生稻与预防动脉粥样硬化有关。
参与预防的机制可能是粪便细菌数量和多样性的显著改变,以及几种炎症和代谢生物标志物的显著变化。
与对照组相比,在野生稻喂养的小鼠粪便中发现了下列菌群丰度更高:
治疗组和对照组小鼠血浆中的细胞因子谱存在显著差异。白细胞介素-10(IL-10)和促红细胞生成素(EPO)水平的升高可以解释野生稻的抗动脉粥样硬化特性。然而,需要使用动物模型进行额外的研究支持该结果。
许多研究表明,维持健康的心血管系统可能有助于维持认知功能,因为一些心血管疾病与认知障碍和阿尔茨海默病的风险增加有关。
▸ 燕麦和燕麦制品:降胆固醇,产生短链脂肪酸,调节菌群,降低肠道通透性,抑制炎症
燕麦和燕麦制品是谷物纤维的其他重要来源,它们富含β-葡聚糖。β-葡聚糖是一种粘性和可溶性纤维,具有有益的降胆固醇潜力。
动物研究表明,燕麦纤维可以上调肝组织中低密度脂蛋白(LDL)受体的表达。
研究表明,膳食燕麦纤维可延缓动脉粥样硬化所致小鼠认知功能障碍的进展。燕麦纤维通过为人体产生短链脂肪酸,很好地恢复了微生物群的丰度和多样性。这些短链脂肪酸可降低肠道通透性,抑制神经系统的神经炎症。
▸ 小米:保护肠道屏障,重塑肠道菌群,防止动脉粥样硬化
另一种越来越受消费者欢迎的谷物是小米。使用喂食高脂肪饮食的Apo E−/−小鼠研究小米壳多酚的抗动脉粥样硬化潜力。
结果表明,小米壳多酚通过保护肠道屏障和重塑肠道菌群,防止主动脉粥样硬化斑块的形成。
微生物群组成的特征是颤螺菌属(Oscillospira)和瘤胃球菌(Ruminococcus)丰度较高,以及Allobaculum丰度降低,抑制动脉粥样硬化斑块的形成。
大多数以动脉粥样硬化为研究重点的体外、动物和人体研究报告的结果不一致,这可能是由于实验对象的数量有限(包括研究中人体受试者的数量较少),以及实验对象的性质(实验对象之间存在的可变性会影响结果),如采样技术,也可能是由于饮食成分的相互作用的影响。
相关阅读:
高血压是心血管疾病的重要危险因素,受遗传易感性和环境因素的影响。
近年来,对肠道菌群与高血压的关系进行了研究。研究对象是老鼠和人类。在两个实验对象中都观察到了肠道菌群的改变。
▸ 高血压患者:梭状芽胞杆菌大量存在
梭状芽孢杆菌在小鼠和人类高血压患者体内都发现大量存在。此外,高血压人群中Bacterodiales增加,但在小鼠中与血压呈负相关。
在饮食中加入富含纤维的食物,如谷物,可以改变肠道菌群的组成。膳食纤维的降血压机制尚不完全清楚。
▸ 短链脂肪酸降压:通过激活受体
有研究发现,发酵产生的短链脂肪酸可以激活在肾脏和血管中的G蛋白偶联受体和嗅觉受体,这些受体抑制肾素的释放,从而降低血压。
▸ 纤维:通过短链脂肪酸,促进有益菌生长,加强肠道屏障完整性
一项研究表明,健康女性在怀孕过程中,纤维摄入量越高,可以缓解肠道通透性增加的程度。
可发酵纤维促进有益菌的生长,并产生短链脂肪酸作为发酵最终产物。短链脂肪酸可以通过降低结肠pH值来阻止致病菌的生长。
此外,短链脂肪酸还可以提高结肠上皮细胞紧密连接的完整性。这加强了肠道壁屏障的完整性,降低了肠道通透性。
然而,纤维摄入并不影响未来妊娠高血压疾病女性的肠道渗透性。这项研究表明,纤维干预可能不会通过改善肠道屏障功能来阻止高血压疾病的发展。
大部分的研究都是研究分离纤维对高血压的影响;需要更多的研究来了解习惯性纤维摄入通过调节肠道菌群对高血压的影响。
短链脂肪酸对宿主代谢的有益作用
Kulathunga J,et al.Curr Nutr Rep.2022
▸ 燕麦麸(谷物分离物):降血压,菌群改变
对谷物分离物的研究也将为营养保健品和功能性食品开辟新的途径和机会。研究对象为食用燕麦麸12周的参与者(30 g / 天)。结果显示,摄入膳食纤维的参与者的收缩压和舒张压低于对照组。与对照组相比,双歧杆菌(Bifidobacterium)和螺旋菌(Spirillum)等细菌物种的丰度显著升高。
需要进一步的研究来阐明本研究的现有发现。例如,研究人员没有量化短链脂肪酸水平,对于双歧杆菌和螺旋菌的变化是否与短链脂肪酸的变化有关不清楚。
▸ 藜麦蛋白降压(动物研究)
在动物模型研究中,研究了藜麦蛋白摄入对自发性高血压大鼠的降压作用。结果显示血压显著降低,肠道中Turicibacter和Allobaculum属的丰度与血压呈负相关。
血压与肠道菌群之间存在双向关系。血压水平及相关病理状态导致微生物群变化,微生物来源的代谢物有助于调节血压。然而,大多数谷物蛋白的体内降压作用尚不清楚,需要更广泛的研究。
相关阅读:认识肠道微生物及其与高血压的关系
已知肠道微生物群参与控制体重、代谢改变和与肥胖相关的炎症性疾病。
文献表明,肥胖的发病机制与下列菌群正相关:
肥胖的发病机制与下列菌群负相关:
肥胖症与肠道菌群代谢产物之间的关系尚不完全清楚。然而,提出了以下假设。据估计,短链脂肪酸等微生物的代谢物对人体能量平衡的贡献高达约200千卡/天,并有助于脂肪细胞中的脂肪生成和积累,从而获得能量。
▸ 高粱多酚:可能增加有益菌丰度
使用不同体重等级(正常和超重)的人类受试者评估高粱多酚对肠道微生物群的影响。结果表明,正常体重和超重/肥胖组之间的短链脂肪酸总产量没有显着变化。
一项最新营养学报告研究发现,高粱多酚和低聚果糖的组合可增加双歧杆菌和乳酸杆菌的数量,高粱多酚可独立增加罗氏菌属(Roseburia)和普雷沃氏菌属(Prevotella)的丰度。
关于罗氏菌属详见: 肠道重要基石菌属——罗氏菌属(Roseburia)
普雷沃氏菌属详见:肠道重要基石菌属——普雷沃氏菌属 Prevotella
▸可溶性玉米纤维:使变形菌减少,厚壁菌增加
在小鼠中添加可溶性玉米纤维长达8周的高纤维饮食表明,变形菌(Proteobacteria)数量减少,这种细菌门通常与肥胖呈负相关。
厚壁菌的增加抵消了高纤维饮食,并诱导了与肥胖相关的菌的增加,如瘤胃球菌、嗜胆汁菌Bilophila、脱硫弧菌Desulfovibrio、颤螺菌属Oscillospira和Paenibacillus.
关于瘤胃球菌属详见:瘤胃球菌属——消化降解关键菌?炎症标志菌?
脱硫弧菌详见: 肠道有害菌——脱硫弧菌属(Desulfovibrio)
▸麦麸:补充影响菌群变化,或与减肥相关(多项研究结果不一)
在一项动物研究中,添加5%麦麸的高纤维饮食增加了微生物群的多样性和某些细菌物种的丰度。Akkermansia muciniphilia的数量增加,这与体重增加有关。此外,双歧杆菌物种的丰度增加。已知包括短双歧杆菌在内的双歧杆菌可防止脂肪积聚。
在另一项研究中,连续8周麦麸补充剂(7.5%)可以减轻体重和肥胖,这与乳酸菌丰度降低有关。
然而,在另一项研究中,麦麸补充量的增加表明盲肠乳酸菌的增加,尽管体重或肥胖没有变化。
▸含有抗性淀粉的全麦面粉:减少腹部脂肪
最近的研究发现,在肥胖的糖尿病脂肪大鼠中,含有抗性淀粉的全麦面粉,比分离的抗性淀粉产生更大的发酵,更大的发酵会产生不同的微生物群,减少腹部脂肪,提高胰岛素敏感性。
肥胖大鼠服用抗性淀粉可增加拟杆菌门与厚壁菌门的比率,并可能导致胰岛素敏感性的改善。
▸玉米抗性淀粉:调节菌群,影响体脂等指标
在临床研究中,向人类志愿者提供玉米抗性淀粉饮食可显著增加链球菌和Ruminococcaceae_UCG-005的丰度,并降低厌氧菌、拟杆菌、Blautia的丰度,它们可有效调节体脂、短链脂肪酸、早期胰岛素和胰高血糖素样肽-1(GLP-1)的分泌。
由于人与人之间肠道微生物群的差异,补充抗性淀粉的饮食对人的影响不同。补充抗性淀粉会增加粪便丁酸盐浓度。然而,对抗性淀粉补充剂的反应因个人而异。
因此,为了有效地设计人体试验,应该考虑几个限制因素。根据性别、饮食习惯、健康和生活方式的不同,不同个体的微生物群组成有显著差异。
▸ 小米:增加有益菌,改善葡萄糖耐量,但不影响体重增加
小米补充剂的摄入增加了有益菌丰度,包括乳酸杆菌、双歧杆菌、阿克曼菌和罗氏菌属(Roseburia),小米改善了葡萄糖耐量,抑制了血清胆固醇和血脂参数的增加,但不影响体重增加。
这类研究的结果取决于谷物品种的性质及其生物活性成分的组成。此外,谷物成分在很大程度上取决于生长位置、农艺措施和其他生长因素,如温度和施肥。
相关阅读:体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
关于谷物通过调节肠道微生物群的降血糖作用的研究较少。
肠道微生物群在宿主的大多数代谢功能中起着至关重要的作用,如氨基酸合成、膳食脂肪和脂溶性维生素的吸收、短链脂肪酸的产生、葡萄糖稳态的激活、脂质能量代谢、热量去除和调节胆汁酸转化等。
▸ 糖尿病患者的菌群特征
与瘦人相比,II型糖尿病患者的微生物群多样性和普拉梭菌(Faecalibacterium prausnitzii)丰度显著降低。II型糖尿病与厚壁菌门丰度较低有关,而拟杆菌门和变形菌门丰度较高。
▸ 高直链玉米淀粉:降低II型糖尿病风险
最近利用动物模型进行的研究发现,食用高直链淀粉玉米会增加拟杆菌和某些厚壁菌分类群(乳酸杆菌和Erysipelotrichaceae)。此外,这种饮食可以增强肠道免疫和内分泌反应,从而降低II型糖尿病的风险。
▸谷子:降血糖作用
最近的一项研究,评估谷子在高脂饮食和糖尿病大鼠中的降血糖作用。根据结果,乳酸杆菌和瘤胃球菌的相对丰度增加,与空腹血糖和2小时血糖呈负相关。
▸可溶性玉米纤维:改变菌群,产生短链脂肪酸
另一项研究侧重于在人类饮食中添加10克或20克纤维,其中含有85%的可溶性玉米纤维,持续4周,导致较高比例的菌群,如:
已知这些细菌会消化淀粉并产生短链脂肪酸,而健康的老年人在每天补充6克可溶性玉米纤维3周后,Parabacteroides的丰度有所增加。
▸抗性淀粉(RS2)降血糖
开展了多项研究,以评估小麦抗性淀粉II型(RS2)对血糖反应和肠道微生物群的影响。
在一项研究中,评估了食用富含II型抗性淀粉的小麦卷1周的效果,结果表明,富含II型抗性淀粉的小麦卷可以降低餐后葡萄糖和胰岛素反应。
粪便内容物中的瘤胃球菌属和Gemmiger比例增加,反映了远端肠道的组成。抗性淀粉干预还降低了肠道微生物群落的生物多样性和丰富度。
关于抗性淀粉详见:你吃的膳食纤维对你有帮助吗?
▸抗性淀粉(RS2)增加氢气和甲烷
此外,在食用富含II型抗性淀粉的小麦期间,空腹呼气中,氢气和甲烷增加。氢气和甲烷气体是微生物代谢产物,是微生物发酵的标志物。
关于肠道气体详见:肠道气体带来什么影响,饮食如何对其产生作用?
▸抗性淀粉(RS2):短链脂肪酸与菌群变化呈正相关
对照组和添加抗性淀粉的小麦卷消耗量之间的粪便短链脂肪酸浓度没有显著变化,但丁酸盐和总短链脂肪酸与下列菌群的相对丰度呈正相关:
▸短链脂肪酸能调节与肥胖相关的脂肪因子的表达,降低血糖,提高发酵活性
短链脂肪酸浓度与胰岛素敏感性有关。丁酸可降低胰岛素敏感性。短链脂肪酸还刺激肠内分泌L细胞产生饱腹激素,如肽YY(PYY)和胰高血糖素样肽(GLP-1)。
此外,短链脂肪酸调节瘦素、脂联素和抵抗素等脂肪因子的表达。它们通过调节肠道和全身炎症间接导致肥胖,促进或加剧心脏代谢功能障碍。
这些影响表明,与野生型小麦相比,食用富含II型抗性淀粉的小麦可以降低餐后血糖,改变肠道微生物组成,提高发酵活性。
▸ 小麦胚芽:产短链脂肪酸菌的种类显著增加,提高免疫力
现有文献表明,在饮食中补充小麦胚芽可以改善小鼠的肠道微生物群。此外,与对照组相比,拟杆菌门水平减少,厚壁菌门水平增加。产生短链脂肪酸的细菌种类显著增加:
其中,Roseburia的百分比增加了三倍以上。
此外,细胞因子和免疫球蛋白的变化与肠道微生物群有关。小麦胚芽可以提高免疫力,作为一种增强免疫力的功能性食品具有潜在的应用价值。
▸ 短链脂肪酸促进食欲刺激激素,葡萄糖刺激的胰岛素分泌增加
另一项研究发现,血液中较高水平的乙酸盐会导致胰岛素抵抗并增加胃中生长素释放肽(一种食欲刺激激素)的产生,而丁酸盐水平的降低也会促进胰岛素抵抗。
此外,啮齿动物肠道菌群改变导致乙酸盐的产生增加,会导致副交感神经系统激活,从而促进葡萄糖刺激的胰岛素分泌增加、生长素释放肽分泌增加、食欲过盛、肥胖和相关后遗症。
还需要开展额外的研究工作来确定肠道微生物群在帮助预防2型糖尿病方面的遗传和代谢潜力。此外,任何未来的研究都应该明确定义,可以通过在2型糖尿病患者的饮食中加入不同谷物来调节的菌群种类。此类研究还应解决这种调节是否与谷物剂量有关。
相关阅读:2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
▸米糠:调节肠道菌群代谢,促进益生菌生长
米糠具有益生元特性,对结肠健康有益。米糠含有大量的生物活性化合物,包括各种氨基酸、小肽、脂类、核苷酸、维生素和辅助因子,以及可供宿主消化和不可消化的植物化学物质。
肠道微生物群可以在动物和人类体内发酵米糠碳水化合物、植物化学物质、脂质和氨基酸。
研究发现,米糠成分有助于调节宿主和肠道微生物代谢,与对照组相比,摄入米糠显著促进肠道益生菌菌株的生长。然而,还需要更多的研究来提高对米糠发酵如何影响结肠组织微生物群的理解。
▸大米:减缓肿瘤和病原体生长
大米可以通过改变细胞增殖、对抗氧化应激、减少炎症、调节肠道微生物组和代谢来减缓肿瘤和病原体的生长。
研究了大米抗性淀粉(RS)和脂肪水平对C57BL/6小鼠肠道微生物群的影响。处理是三个品种的三个水平的抗性淀粉作为碳水化合物的主要来源,两个脂肪水平,低(10%)和高(39%)。
抗性淀粉导致厚壁菌与拟杆菌的比率降低,增加拟杆菌科和S24-7的短链脂肪酸产量。
米饭中的抗性淀粉含量(0.44%)可以调节小鼠的肠道微生物群,并且与防止肥胖饮食的有害影响有关。
此外,微生物类群与碳水化合物和脂质代谢相关的组织基因表达之间存在相关性。
▸ 米糠和槲皮素等组合:有利于排除肠道病原体
另一项研究发现,槲皮素和米糠的联合作用减少了致病性肠杆菌科细菌的数量,并且减少量与丙酸水平高度相关。
因此,米糠和槲皮素等底物的组合将有助于排除肠道内的肠道病原体。
▸ 麦麸:增加有益菌,改善肠道完整性,减少炎症
麦麸是面粉加工的另一个重要副产品,也是膳食纤维最丰富的来源之一。麦麸中的膳食纤维可改善矿物质代谢基因表达和肠道功能,并增加体内促进健康的细菌数量。
膳食中添加麦麸可以改变肠道微生物群,从而改善肠道完整性,减少炎症。麦麸补充水平的增加表明盲肠乳酸菌数量增加,肠道炎症减少,补充麦麸后炎性细胞因子TNF-α和IL-6减少,与内毒素血症和抗炎细胞因子减少相关的紧密连接蛋白增加。
需要进一步研究以了解谷物和肠道微生物群在维持结肠健康方面的相互作用。特别是,适当控制饮食干预的人类干预试验可以证实全麦谷物对肠道相关健康的益处,并允许在个人基础上得出更有效的结论。
谷物通过调节肠道菌群发挥健康益处的研究总结


Kulathunga J,et al.,Curr Nutr Rep.2022
肠道微生物群在日常饮食和健康状况之间起着重要作用。大多数研究报告了谷物通过调节肠道微生物群对调节代谢疾病的有益作用。
膳食摄入谷物可以预防动脉粥样硬化、高血压、防止体重增加和脂肪积累、改善血糖耐受性和血脂水平、通过调节肠道微生物群组成减少全身炎症,并促进包括短链脂肪酸在内的不同代谢物的释放。
通过调节肠道菌群健康检测,了解适合的饮食方式,合理调整膳食,可以在预防慢性病方面起重要作用。
主要参考文献
Kulathunga J, Simsek S. A Review: Cereals on Modulating the Microbiota/Metabolome for Metabolic Health. Curr Nutr Rep. 2022 Jun 3. doi: 10.1007/s13668-022-00424-1. Epub ahead of print. PMID: 35657489.
Marcelino G, Hiane PA, Freitas KC, Santana LF, Pott A, Donadon JR, Guimarães RCA. Effects of olive oil and its minor components on cardiovascular diseases, inflammation, and gut microbiota. Nutrients. 2019;11:1826.
Toral M, Robles-Vera I, de la Visitacion N, Romero M, Sanchez M, Gomez- Guzman M, Rodriguez-Nogales A, Yang T, Jimenez R, Algieri F, Galvez J, Raizada MK, Duarte J. Role of the immune systemin vascular function and blood pressure control induced by faecal microbiota transplantation in rats. Acta Physiol. 2019;227:e13285.
Zhang L, Ouyang Y, Li H, Shen L, Ni Y, Fang Q, Wu G, Qian L, Xiao Y, Zhang J, Yin P, Panagiotou G, Xu G, Ye J, Jia W. Metabolicphenotypes and the gut microbiota in response to dietary resistant starch type 2 in normal-weight subjects: a randomized crossover trial. Sci Rep. 2019;9:4736.

谷禾健康

帕金森综合征
帕金森病(Parkinson’s disease,PD)是全球增长最快的神经系统疾病之一,原因有很多,包括人口老龄化和环境影响。老年人多见,平均发病年龄为60岁左右,40岁以下起病的青年帕金森病较少见。
我国流行病学调查显示,65岁以上人群帕金森病的患病率大约是1.7%。估计全国每年新发患者数达10万以上,我国现有帕金森病患者人数近300万。大部分帕金森病患者为散发病例,仅有不到10%的患者有家族史。
帕金森病最主要的病理改变是中脑黑质多巴胺(dopamine, DA)能神经元的变性死亡,由此而引起纹状体多巴胺含量显著性减少而致病。
虽然这种神经退行性疾病目前主要由临床运动特征(运动迟缓、僵硬和静止性震颤)来定义,但非运动特征,如自主神经功能障碍、认知行为问题和睡眠障碍,大大增加了总体疾病负担。
200多年前,詹姆斯·帕金森首次正式描述帕金森病时,胃肠功能障碍被认为是帕金森病临床表现的一部分。值得注意的是,他还推测帕金森病可能起源于胃肠系统,并评论道“胃肠紊乱状态可能会导致脊髓的一部分发生病态行为”。
肠道微生物群对神经系统过程(如神经发生、髓鞘形成和小胶质细胞激活)至关重要,能够调节行为和认知,并越来越多地参与调节神经退行性疾病和神经精神疾病的易感性和进展。
帕金森发病过程中肠道和大脑之间的串扰被认为受到肠道微生物失衡(失调)以及由此引起的细菌代谢活性改变的重大影响。
本文概述了帕金森病的肠-脑轴,包括迷走神经、肠神经系统中的α-突触核蛋白、改变的肠道通透性和炎症以及肠道微生物及其代谢活动的潜在作用和相互关系。阐述了肠道相关因素(包括肠道菌群)在帕金森病治疗进展中的作用和作为治疗靶点的作用,并基于研究文献讨论了常见的一些帕金森疗法。
关键词解释
α-突触核蛋白
是一种在中枢神经系统突触前及核周表达的可溶性蛋白质,它与帕金森病的发病机制和相关功能障碍密切相关,是路易小体的主要成分。
路易小体
是以帕金森病为代表的路易体病患者脑内的特征性标志物。显微镜下为圆形粉红色均质状结构。
▸ 震颤
震颤通常始于手或手指,其他包括手臂、腿、下巴或头部都可能出现震颤。可能会来回摩擦拇指和食指,类似弹丸滚动的震颤。手在休息时可能会颤抖。
▸ 肌肉僵硬
肌肉长时间保持收缩。尤其是在疾病的早期阶段,可能被误认为关节炎或骨科问题。
▸ 运动缓慢
随着时间的推移,帕金森病可能会让人减慢运动速度,使简单的任务变得困难且耗时。走路时步数可能会变短,可能拖着脚。可能很难从椅子上站起来。
▸ 平衡和协调受损
可能会变得弯腰,或者可能因帕金森病而出现平衡问题,有时会导致跌倒。
▸ 认知变化
一项研究发现,认知障碍是帕金森病常见且进展迅速的症状。在平均患有帕金森病五年且在研究开始时认知正常的参与者中,约有一半在确诊帕金森病后的六年内(约11年)出现轻度认知障碍。
少数出现轻度认知障碍的患者在五年内发展为痴呆。帕金森痴呆症患者可能有严重的记忆和思维问题,影响日常生活。
▸ 抑郁、焦虑等
可能会经历抑郁症,有时是在非常早期的阶段。
大约 40%-50% 的帕金森患者会出现抑郁症。可能还会经历其他情绪变化,例如恐惧、焦虑或失去动力等。也包括可能出现的精神病,例如幻觉或妄想。
▸ 吞咽、咀嚼和说话困难
由于吞咽缓慢,唾液可能会积聚在口腔中,导致流口水。晚期帕金森病会影响口腔中的肌肉,使咀嚼变得困难。这会导致窒息和营养不良。
▸ 排尿问题或便秘
帕金森病可能会导致膀胱问题,包括无法控制尿液或排尿困难。许多帕金森病患者出现便秘,主要是由于消化道较慢。
▸ 睡眠问题
帕金森病患者经常有睡眠问题,包括整夜频繁醒来、早起或白天想睡觉。
▸ 其他影响
其他还包括嗅觉障碍、疲劳、皮肤问题(黑色素瘤)、性功能障碍、疼痛、头晕目眩、眼睛和视力问题、体重减轻等问题。
帕金森氏症的症状和进展速度因人而异。这种疾病的早期症状很微妙,并且逐渐发生。例如:
有时候朋友或家人可能是第一个注意到早期帕金森氏症患者的变化的人。他们可能发现患者:
当疾病发展到晚期帕金森病时,症状变得更加严重且相当复杂,行动变得局限。其中包括:
从1980年代帕金森病患者肠道神经系统(ENS)中发现α-突触核蛋白沉积开始,进行了尸检研究,提出突触核蛋白病起源于迷走神经背运动核(DMNV)和前嗅核,帕金森病病理学肠-脑传播的“上升解剖学理论”获得了广泛的关注。
根据这一理论,作用于肠道的损伤会触发α-突触核蛋白的错误折叠和聚集,α-突触核蛋白开始于肠上皮细胞,然后通过朊病毒样细胞间转移传播到大脑。
这些结果表明,需要进一步的研究才能得出α-突触核蛋白的肠-脑支持是否是帕金森病的关键致病步骤。
鉴于帕金森病的复杂性和异质性以及肠-脑相互作用的多方面性质,目前的观点是,这种相互作用可能在帕金森病中起作用,但在个别患者中的作用程度不同。
▸▸
在过去十年中,多项临床和临床前研究提供了帕金森病患者肠道通透性改变(“肠道渗漏”)和炎症的证据。
Toll样受体4(TLR4)信号通路可感知受损或坏死组织释放的革兰氏阴性细菌脂多糖和内源性分子,被认为在帕金森病的肠道和脑部炎症中起着至关重要的作用。
虽然研究普遍显示帕金森病患者存在肠道炎症的证据,但这些变化仅在一部分患者中明显,胃肠道通透性研究的结果也具有高度异质性。
肠道相关因素在某些但并非所有患者的神经退行性变中起着重要作用。已知炎症可导致肠屏障功能障碍,在炎症性肠病(IBD)患者中,抗肿瘤坏死因子(anti-TNF)治疗可抑制肠道炎症,使胃肠道通透性恢复正常。
然而,屏障缺陷有时可以作为疾病的早期事件发生,与炎症无关。
一些支持和反对肠道优先参与PD的证据
▸流行病学研究
支持证据:
• 便秘、胃食管反流和胃轻瘫等胃肠道症状可先于帕金森病运动症状几十年。
• 大量研究表明,完全切断迷走神经干与显著降低帕金森病的发病风险相关。
反对证据:
• 胃肠功能障碍等非运动特征可能比运动特征更早出现,因为副交感神经系统(PNS)和肠神经系统(ENS)对神经退行性变的补偿能力不如中枢神经系统(CNS)。
• 一项大型纵向研究发现迷走神经切断术后帕金森病风险没有显著降低。
▸神经病理学研究
支持证据:
• 尸检研究表明,几乎所有帕金森病患者的肠神经系统中都存在突触核细胞病变。
• 在帕金森病诊断前20年,在食道、胃、小肠和结肠的活检中检测到α-突触核蛋白沉积。
反对证据:
• 对老年人的尸检研究发现,在没有脑α-突触核蛋白参与的情况下,没有“仅肠道”路易病理学,尽管不能排除在胃肠道迅速传播或高度局限性病理学的可能性。
• 其他活检研究发现,神经健康个体的胃肠道中存在α-突触核蛋白积聚。
▸动物研究
支持证据:
• 在啮齿动物模型中已经证明,肠-脑α-突触核蛋白传递,伴有黑质多巴胺能神经变性和帕金森病样运动和非运动症状,可能与年龄有关。
• 在鱼藤酮帕金森病小鼠模型中,半迷走神经切断术阻止了α-突触核蛋白在迷走神经背侧运动核(DMNV)中的积聚以及与该方法同侧的黑质多巴胺能细胞死亡。
•暴露于胃肠道中的微生物淀粉样蛋白(CULLI)会增加老年大鼠肠道和大脑中的α-突触核蛋白病理学和炎症,以及转基因α-突触核蛋白过度表达的小鼠,并伴有相应的运动缺陷。
反对证据:
• 涉及将大量α-突触核蛋白注射到胃肠道的动物模型可能无法准确再现人类帕金森病。
• 中枢神经系统紊乱也会改变肠道功能;例如,大鼠的黑质病变导致肠道运动障碍、炎症和微生物组改变。
半透性肠道屏障调节营养吸收,允许免疫感应,同时限制有害物质的运输。
在帕金森病中,“渗漏”的肠道允许微生物和分子(包括细菌和毒素)通过肠道上皮细胞的流量增加。表达脂多糖(LPS)的失调的肠道微生物群可以激活上皮细胞、免疫细胞和肠胶质细胞上表达的Toll样受体,并促进肠道渗漏以及肠道和脑炎症。
正如在患者结肠活检和粪便样本中观察到的那样,肠道炎症部分通过系统机制驱动疾病发病,包括细胞因子产生增加、血脑屏障破坏、炎性细胞迁移到大脑和小胶质细胞激活,最终导致神经功能障碍或丢失。
恶性循环可能发生,生物失调、通透性增高、炎症和α-突触核蛋白聚集相互延续。
这些因素的重要性和时间顺序可能因患者而异,这取决于环境影响(如影响微生物组的饮食)、衰老和宿主遗传学,导致不同的途径更容易出现功能障碍。
α-突触核蛋白参与先天性和适应性免疫
炎症环境增强了α-突触核蛋白的表达、错误折叠和聚集,进而诱导局部促炎免疫反应,从而形成促进α-突触核蛋白扩散的反馈环。
帕金森患者肠道屏障、炎症和α-突触核蛋白聚集
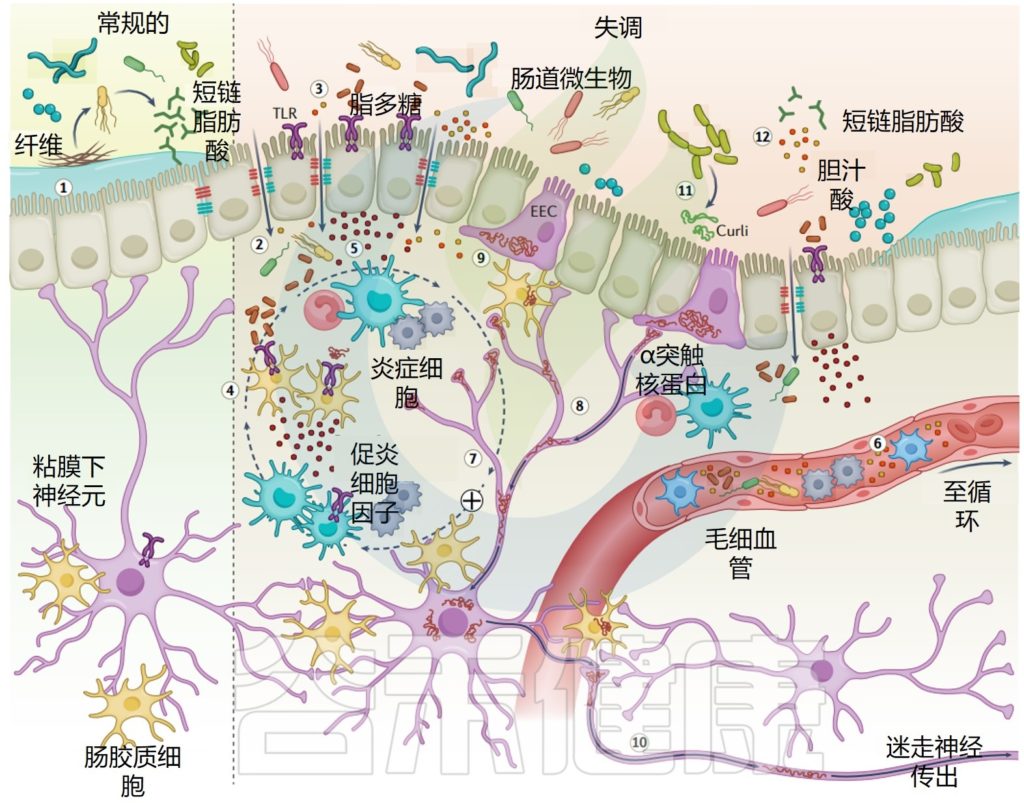
Tan AH, et al.,Nat Rev Neurol. 2022
值得注意的是,轴突终止于肠腔的粘膜下神经元和具有直接管腔和神经连接的肠内分泌细胞可以表达α-突触核蛋白,可能是α-突触核蛋白聚集的来源,并通过迷走神经扩散到大脑。微生物卷曲被建议在肠道中模板α-突触核蛋白聚集。
虽然肠道炎症和α-突触核蛋白表达可能是常见事件,但人们认为只有在存在其他促发因素(如宿主遗传脆弱性或衰老)时,帕金森才会发生。潜在有益的肠道代谢物的改变,如短链脂肪酸也可能在帕金森病发病中发挥作用。
帕金森病中微生物-肠-脑轴的示意图
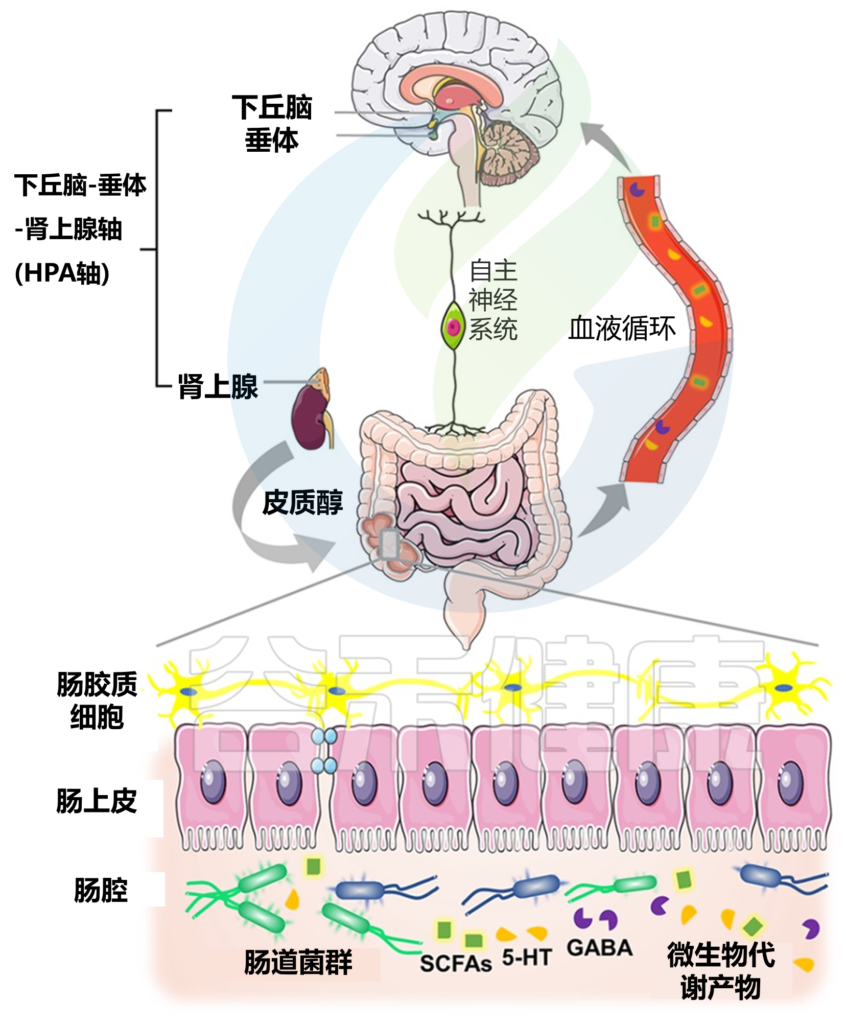
Wang Q, et al., Brain. 2021
在肠神经系统中,肠道菌群通过释放各种信号分子来调节大脑功能,这些信号分子可能进入体循环并到达目标部位。
中枢神经系统通过自主神经系统 (ANS) 下丘脑-垂体-肾上腺 (HPA) 轴在生理上支配胃肠道;反过来,肠道向大脑提供反馈以建立双向交流。
肠道微生物与宿主共同进化,形成复杂的互惠关系:胃肠道为其微生物群落提供滋养环境,而微生物群发挥着广泛的重要功能,影响宿主的生理机能。
在解释与疾病相关的肠道微生物组组成和功能改变时,宿主-微生物组相互作用的多维度和微生物组的个体变异是需要考虑的重要因素。
各种内在和外在因素改变了肠道微生物组,导致微生物组成的显著个体间差异。
影响肠道菌群的因素
Tan AH, et al.,Nat Rev Neurol. 2022
微生物组适应环境和宿主因素的变化并不总是产生有害后果,宿主-微生物和微生物-微生物相互作用的动力学是整个肠道微生物组成和功能的重要决定因素。
事实上,健康个体之间的微生物组成可能差异很大,但仍保持着非常相似的功能能力,这为肠道健康提供了更好的衡量标准。因此,对肠道失调的研究不仅应关注与疾病相关的微生物组成变化,还应考虑影响疾病病因、发病机制、诊断、预后和治疗的功能变化。
衰老是帕金森病病理生理学的一个重要因素,并对肠道微生物生态系统有重要影响。在讨论PD相关变化之前,我们先概述与年龄相关的肠道微生物组变化。
与年龄相关的肠道菌群变化可归因于肠道生理衰老(例如,黏膜变薄、屏障破坏、肠道运动能力下降和免疫衰老)、生活方式的改变(例如,饮食、生活条件和体育活动)和健康状况(例如,共病、药物和虚弱)。
关于肠道微生物群在衰老过程中发生变化详见我们之前的文章:
肠道微生物群的老化及其对宿主免疫力的影响
健康长寿的步伐永不停歇
值得注意的是,肠道菌群具有调节炎症信号和与其他器官相互作用的能力,越来越多地认为它在“炎症”中发挥着核心作用。
来自ELDERMET联盟的开拓性研究表明,老年人肠道微生物组个体间具有高度的差异性,居住在社区的老年人与居住在长期护理机构的老年人之间存在显著差异,后者的微生物组多样性和时间稳定性较差。
长期护理患者的微生物组变化也与饮食因素、营养状况受损以及炎症和虚弱标志物的增加有关。
▸ 百岁老人的肠道菌群多样性较高,有益菌富集
在寻找健康老龄化和长寿的微生物标志的过程中,对百岁老人和超级百岁老人的研究几乎无一例外地揭示出,与其他老年人和年轻人相比,他们的微生物组多样性水平很高,不同地域不同人群研究表明长寿个体会富集例如瘤胃球菌(Ruminococcaceae)和阿克曼菌(Akkermansia)在内的几个细菌类群,同时,两组shotgun宏基因组的功能分析表明,长寿人群的微生物群具有较高的碳水水化合物和脂类代谢能力,以及外源生物降解能力。
▸ 炎症变化导致菌群变化
随着年龄的增长,可能出现相关炎症,引起肠道生理和营养环境变化,这时候,能够适应炎症的肠道环境的菌群,具有竞争优势,而其他微生物可能在炎症状态下丢失。
整合了来自 11 个国家的 30 项独立病例对照 NGS 研究,几乎所有的研究都发现,帕金森病患者和对照组之间的总体肠道微生物组组成存在显著差异。
重要的是,一些研究发现了可能影响肠道微生物组的潜在混杂因素,包括年龄、饮食因素(可能受到吞咽困难或 PD 嗅觉和味觉改变的影响)、便秘、虚弱和帕金森病药物(COMT 抑制剂和左旋多巴),虽然在控制这些因素后,帕金森病患者和对照组之间的差异仍然很大,不过这些差异的影响大小是在适度范围内的。
事实上,研究方法和地理位置可以解释微生物组组成中比PD状态更大的方差比例(在18-54%之间)。与之前关于微生物多样性减少与不健康衰老之间关系的观点相反,大多数研究发现帕金森病患者与对照组相比要么没有差异,要么总体多样性增加。
帕金森病:AKK菌、双歧杆菌、乳酸杆菌增加
据报道,帕金森病患者与对照个体之间至少有42科、102属和44种细菌存在差异。然而,只有大约四分之一的研究结果在一项或多项研究中得到了重复。
帕金森病最一致的发现是阿克曼菌(Akkermansia)的丰度增加(30项研究中的14项),该属属于疣状菌科(12项研究中也发现帕金森病增加)。
其他组成特征包括双歧杆菌(Bifidobacterium)属和乳酸杆菌(lactobacillus)属的丰度增加,丁酸生产菌(Roseburia)、粪杆菌属和布劳特氏菌(Blautia)的丰度减少。
帕金森病患者在物种或亚种水平上的研究仍然很少,在两项鸟枪式宏基因组研究和一些具有较高测序分辨率的16S rRNA研究中进行了初步探索。
Akk菌增加可能的原因
阿克曼菌(Akkermansia)、双歧杆菌(Bifidobacterium)和乳酸杆菌(lactobacillus) 被广泛视为“有益”细菌,后两个属通常包含在益生菌制剂中。
它们在帕金森病含量增加的原因尚不清楚,但可能与它们在改变的肠道环境中生存的适应性更强有关。值得注意的是,Akkermansia的增多与结肠运输缓慢和体重或脂肪量低有关,这两个特征在帕金森病患者中普遍存在。
其他神经系统疾病中也有Akkermansia丰度增加的报道,包括多系统萎缩(MSA)、进行性核上性麻痹、阿尔茨海默病和多发性硬化症,表明这一特征并非帕金森病特有。
扩展阅读:Nature | AKK菌——下一代有益菌
引人注目的是,对跨越十种疾病的28项病例对照研究进行的荟萃分析发现,与疾病相关的细菌属之间存在明显的重叠,表明某些变化代表了对健康和疾病的共同反应。
菌株特异性
细菌的功能可能具有菌株特异性,同一物种的不同菌株可能产生相反的作用。因此,根据目前在属和种水平上的知识推断细菌在帕金森病中的潜在作用可能信息不足。
此外,人类肠道微生物群中的大多数基因尚不能进行功能分配,其动态转录和翻译活动尚待阐明。
在统一的人类胃肠道基因组目录中,从超过200000个人类微生物基因中鉴定出的物种中,有70%以上仍有待培养或实验鉴定,对这些物种内的菌株和功能变异性的了解仍极为有限。
至关重要的是,单一微生物分类群的作用不能在隔离中看待,但应在社区环境中考虑,考虑到具有类似代谢功能的微生物与具有对抗作用的微生物的净效应,以及微生物-微生物和微生物-宿主相互作用。
因此,使用粪便转录组学、代谢蛋白质组学和代谢组学对代表肠道菌群集体功能输出的活性细菌代谢途径和产物进行直接测量,可能比细菌分类学描述更具相关性,以便更深入地了解肠道菌群在健康和疾病中的作用。
帕金森病患者:短链脂肪酸下降
帕金森病患者粪便短链脂肪酸的水平(乙酸盐,丙酸盐,丁酸盐)一直在下降。短链脂肪酸在微生物群-肠-脑串扰中发挥关键作用,部分通过调节肠道和血-脑屏障的完整性、炎症级联、内分泌信号和神经元存活。
除了作为结肠上皮的主要基质外,实验性帕金森模型中还发现丁酸通过组蛋白脱乙酰酶抑制发挥神经保护作用,包括减轻运动损伤和多巴胺能细胞死亡。
在MSA中也发现粪便短链脂肪酸和胆碱代谢产物水平降低,表明这种情况与帕金森病之间存在共同的微生物反应。
帕金森病患者肠道微生物组和代谢物的临床相关性在后面章节关于帕金森病风险和进展中的肠道相关因素中进行了讨论。
在几种帕金森病啮齿动物模型中已证实肠道微生物群的改变,包括:通过腹腔注射或皮下注射的神经毒素模型等,大多数研究还发现,与野生同窝鼠相比,患病啮齿动物的胃肠道(肠道运动障碍、炎症、屏障破坏和神经功能丧失)或大脑(运动功能障碍、炎症和多巴胺能细胞丧失)发生病理生理学变化。
在其中一些研究中,观察到肠道变化先于帕金森病样运动特征的出现;然而,肠道微生物对观察到的变化的贡献尚不清楚。
与帕金森病相关的菌群改变的因果关系推断
几项使用无菌小鼠(出生和饲养时未接触活微生物)、粪便微生物移植(FMT)或使用广谱抗生素治疗的研究,可以推断出与人类帕金森病相关的微生物组改变的因果关系。
与无菌ASO小鼠相比,含有复杂微生物群的ASO小鼠运动功能和便秘更差,伴有明显的神经炎症反应和脑内α-突触核蛋白沉积。
值得注意的是,帕金森病患者肠道微生物群的移植加剧了无菌ASO小鼠的运动功能障碍。有趣的是,补充短链脂肪酸(SCFA)通常被认为是有益的,与无菌ASO小鼠中的小胶质细胞激活和α-突触核蛋白聚集有关。
然而,无菌小鼠小胶质细胞缺陷的观察结果使这些发现与人类帕金森病的解释复杂化。短链脂肪酸的作用也可能取决于剂量和类型;肠道中不同短链脂肪酸浓度和比率的差异可能导致不同的健康结果。
在另一项研究中,长期口服鱼藤酮会导致常规饲养小鼠的肠道通透性增高和运动功能障碍,但在无菌小鼠中则没有。
在另外两项针对啮齿动物的研究中,抗生素治疗耗尽了肠道微生物负荷和多样性,似乎可以减轻MPTP和六羟基多巴(6-OHDA)诱导的多巴胺能神经毒性。
综上所述,这些实验模型提供了证据,证明肠道微生物的存在、组成和代谢产物在帕金森病样发病机制中具有致病或促进作用。
肠道微生物及其代谢产物的高度个人化和复杂性质使微生物组因果成分的鉴定变得复杂,这些微生物及其代谢产物可能单独发挥作用,或在微生物群中发挥增强或抵消作用。
此外,大多数研究中使用的供体数量较少,无法捕获人类肠道微生物群的广泛个体间差异。至关重要的是,未能解释宿主-微生物相互作用和内环境平衡及其在个人整个生命周期中的演变,以及饮食、生活方式、衰老和其他因素的变化,是这些实验的主要限制。
几项大型流行病学和临床研究将肠道疾病、肠道干预和饮食因素与随后的帕金森病发展和恶化风险联系起来。
便秘是帕金森病的典型前驱症状,20多年前发表了第一项基于社区的长期研究,证明患有这种疾病的个体患帕金森病的风险升高。
帕金森病的便秘是由一系列因素引起的,包括结肠传输缓慢和肛门直肠功能障碍。2021发表的一项研究表明,便秘的不同亚型与帕金森病的不同发病风险相关,慢传输比排便协同障碍的发病风险略高。
便秘也预示着帕金森病的恶化趋势
一项针对465名社区帕金森病患者的研究发现,患者在发病时便秘的存在和严重程度与痴呆更快进展之间存在关系。
这些患者从诊断开始就接受了长达8年的监测。严重便秘患者平均得痴呆症的时间为6.0年,而无便秘的患者则为7.5年。排便协同障碍是便秘患者排便过程中出现的一种反常肛门括约肌收缩障碍。
同样,使用来自帕金森病进展标志物倡议423名新诊断帕金森病患者的数据,这些患者接受了长达5年的监测发现,胃肠道症状的综合得分越高(肠蠕动、大便硬和失禁的频率越低),认知能力越差,轻度认知障碍和痴呆的发生率越高。
在这两项研究中,认知功能与非胃肠道自主症状无关,这表明这种关联是胃肠道系统特有的,而不是自主功能障碍本身。
帕金森病患者便秘的相关因素
在一个单独队列的3年随访研究中,基线便秘严重程度与体脂质量损失独立相关。反过来,帕金森病患者的体重减轻与营养不良、骨折、压疮和死亡的风险增加有关。
2021发表的一项粪便代谢组学研究发现,帕金森病患者的便秘严重程度与丁酸盐(一种潜在有益的SCFA)水平降低相关。
另一项初步研究发现,帕金森病和便秘患者外周血中辅助性T细胞的数量增加。这种具有强大炎症潜能的CD4+T辅助细胞亚群可由特定的肠道细菌诱导,并与帕金森病(以及炎症性肠病)的发病机制有关。
长期以来,人们推测结肠淤滞会导致细菌产物和其他毒素更多地转移到循环中;尽管这一点尚未得到令人信服的证明,但粪便稠度被认为对肠道微生物群组成有重大影响。
如上所述,炎症与帕金森病的发病机制有关,帕金森病患者的一些结肠活检和粪便结果与炎症性肠病患者相似。
迄今为止最大的一项研究调查了美国1.7亿多人的索赔数据,发现炎症性肠病患者的帕金森病发病率增加了28%。
荟萃分析表明,当分别分析克罗恩病患者和溃疡性结肠炎患者时,帕金森病风险的增加仍然显著。研究人员还发现,抗TNF疗法可以显著降低这种风险,这表明炎症性肠病的有效治疗可能会降低帕金森病的发病风险。
一项利用瑞典全国组织病理学数据库进行的研究还发现,显微镜下结肠炎(另一种慢性肠道炎症疾病)与帕金森病之间存在强烈的相关性。
遗传学研究表明,帕金森病和炎症性肠病患者(尤其是克罗恩病)的发生有共同的生物学机制。LRRK2基因中的突变是单基因(常染色体显性)帕金森病最常见的原因之一。
随后的几项研究确定了LRRK2变异体与散发性帕金森病和克罗恩病之间的关联,还报告了帕金森病和炎症性肠病的其他重叠风险位点。这些位点进一步暗示了免疫反应和微生物感应(例如,NOD2基因和HLA位点),以及溶酶体功能障碍,这是两种情况下的常见机制。
约有50个和10个基因分别与单基因炎症性肠病和帕金森病相关,但导致这两种疾病的单基因形式的罕见变异迄今尚未报道。
最后,在2022年发表的一项研究中,与无结肠炎的小鼠相比,患有结肠炎的小鼠的运动功能降低,多巴胺能神经元丢失加重,进一步支持LRRK2、结肠炎和帕金森病之间的联系。
肠易激综合征(IBS)症状,如腹痛和肠道习惯改变,在帕金森病患者中很常见,并与粪便微生物群的变化相关。
在肠易激综合征患者身上观察到的病理生理变化,包括失调、肠道通透性增加和轻度粘膜炎症,可能会使胃肠道更容易受到帕金森病病理的影响。
肠易激综合征与帕金森病之间的关联
在一项来自台湾的全国性注册研究中,涉及约120000人,肠易激综合征与帕金森病风险增加相关。
然而,在芬兰进行的一项类似研究中,在前2年的随访中,风险显著升高,导致作者得出结论,肠易激综合征与帕金森病之间的关联可归因于反向因果关系(即帕金森病的前驱胃肠道症状被误解为肠易激综合征症状);或检测偏差(即,对肠易激综合征症状患者进行更密切的临床监测可提高诊断帕金森病的可能性)。
韩国的一项研究包括约285000名受试者,他们接受了长达11年的监测,发现患有肠易激综合征的老年人(65岁及以上)患帕金森病的风险增加。
迄今为止最大的一项涉及瑞典170万参与者的研究发现,专家诊断肠易激综合征与帕金森病风险增加相关。
然而,在同一研究者进行的补充队列研究中,肠易激综合征的诊断基于自我报告的症状,结果没有统计学意义。因此,这种常见的肠-脑相互作用障碍(影响全球十分之一的人)与帕金森病之间的可能联系仍然没有定论。
迷走神经
迷走神经起源于延髓,在腹腔内为胃、小肠和大肠提供副交感神经支配,直至脾曲。
在两项大型研究中,完全躯干(但非选择性)迷走神经切断术与患帕金森病的风险显著降低相关。
另一项研究分析了相同的丹麦数据库,但包含了较长时间内的大量病例,并使用了不同的编码分类和统计方法,发现躯干或其他类型的迷走神经切断术没有显著降低风险。
相互矛盾的结果可能部分归因于迷走神经切断术的混合效应:虽然这种干预可能限制α-突触核蛋白病理学从肠道向大脑的传播,但由于胆碱能抗炎途径的破坏,它也可能导致免疫稳态向促炎反应的转变。
阑尾切除术
虽然阑尾以前被认为是一个退化器官,但现在人们认识到它富含多种免疫细胞,可以影响胃肠道的炎症和自身免疫,它还充当肠道微生物组的蓄水池和调节器。
研究发现,除了迷走神经背侧运动核的密集神经支配外,阑尾在帕金森病发病机制中的可能作用还表现在该器官中大量聚集的α-突触核蛋白。
在一项研究中,发现年轻人和老年人(从婴儿到84岁)的阑尾中都有大量截短形式的α-突触核蛋白,这些截短形式的α-突触核蛋白是路易小体的主要成分,在实验模型中被证明是α-突触核蛋白聚集的有效种子,包括那些没有神经系统疾病的人,表明阑尾是α-突触核蛋白致病形式的储库。
在2021发表的一项研究中,53%的帕金森病患者和8%的对照组患者的CT扫描显示有慢性阑尾炎的病变。
一小群7名患者接受了阑尾切除术,对切除组织的组织病理学分析显示,阑尾粘膜和粘膜下层存在α-突触核蛋白聚集。
在一些研究中,阑尾切除术与帕金森病风险降低相关,但在大多数研究中,未发现任何影响,甚至风险轻度升高。
有趣的是,一项针对12名帕金森病患者的小型研究采用多组学方法研究了阑尾微生物群,发现了脂质和胆汁酸代谢紊乱的证据,包括阑尾中微生物源性(次生)胆汁酸升高5.6–18.7倍。这些胆汁酸具有毒性作用,并与肠道炎症有关。
与上文所述的对帕金森病下消化道失调的理解的扩展相反,关于帕金森病上消化道失调的研究主要集中在幽门螺杆菌感染和小肠细菌过度生长(SIBO)。
有幽门螺杆菌感染史的人帕金森风险高
幽门螺杆菌感染与帕金森病之间的联系始于20世纪60年代,一项观察性研究显示,患有这种疾病的患者中消化性溃疡的发生率很高,通常在8-10年前出现帕金森症状。
一项来自台湾的研究发现,有感染史的人患帕金森病的风险增加了一倍。
来自丹麦的另一项研究发现,患者根除幽门螺杆菌的治疗史与5年或更长时间后患帕金森病的风险增加45%相关。
帕金森病患者的幽门螺杆菌感染率在不同地理区域的研究中有所不同,从呼吸和粪便抗原检测的25-33%到血清学检测的48-50%不等。这些比率与当地人口的比率相当。
帕金森患者的小肠细菌过度生长患病率范围广
小肠细菌过度生长可作为幽门螺杆菌诱导的胃酸过少的后遗症;其他原因包括使用质子泵抑制剂、小肠运动障碍和免疫反应受损。
研究发现,帕金森病患者的小肠细菌过度生长患病率范围广泛(25–67%),这可能是由于研究参与者的异质性和呼吸测试协议,这些协议提供了小肠细菌过度生长的间接评估,准确性有限。
幽门螺杆菌感染和小肠细菌过度生长均与更严重的运动严重性和更严重的运动反应并发症(延迟和缩短时间)相关。
致病原理
幽门螺杆菌感染和小肠细菌过度生长可能通过降低左旋多巴的生物利用度,或通过诱导慢性外周炎症状态来加剧神经退行性变过程,从而导致帕金森病患者的运动功能障碍。
例如,幽门螺杆菌诱导的细胞毒素可以改变宿主的免疫反应并触发大量促炎物质的释放,这可能导致血脑屏障的破坏、小胶质细胞的激活,最终导致神经元损伤和死亡。
在一项小型研究中,幽门螺杆菌阳性的帕金森病患者被发现对神经功能至关重要的蛋白质的自身抗体水平升高,包括核因子I亚型A、血小板衍生生长因子B和真核翻译起始因子4A3。
另一方面,肠道运动障碍(以及更普遍的自主神经功能障碍)可能是严重帕金森病的表现,并可能导致小肠细菌过度生长,导致观察到这些疾病之间的关联。
几项研究调查了肠道微生态系统与帕金森病风险或前驱症状之间的关系,包括睡眠行为障碍(RBD),它可能在 PD 运动诊断之前 20 年或更长时间。
肠道菌群
对来自德国和日本的队列(包括46名特发性睡眠行为障碍(RBD)患者、223名帕金森病患者和137名对照个体)进行的荟萃分析表明,睡眠行为障碍患者与帕金森病患者具有不同的微生物成分,尽管观察到一些重叠(例如,两种情况下Akkermansia的丰度增加)。
有趣的是,与对照组相比,在一小群睡眠行为障碍患者中,产生短链脂肪酸的细菌数量并没有减少,
作者认为短链脂肪酸可能在孤立性快速眼动睡眠行为障碍向帕金森病的转化中发挥作用。同时,在包括666名个体的大趋势队列研究中,一些帕金森病的风险或前驱标记物与微生物组组成的改变相关,尽管其影响很小。
如上所述,病例对照研究已经确定了帕金森患者中存在大量差异丰富的菌群。然而,在单独的研究中,只有少数与运动特征(MDS-UPDRS评分、运动反应并发症或姿势不稳定和步态困难(PIGD)表型)或非运动特征(认知、抑郁、焦虑或便秘)相关。
在一项研究中,肠杆菌科细菌的丰度与更严重的运动表型相关,这与大肠杆菌通过产生脂多糖和卷曲菌毛在帕金森病发病机制中的可能作用有关。
纵向研究的结果也不一致。在25名新发PD患者的3年随访研究中,更快的PD运动进展(使用Hoehn和Yahr评分量表或UPDRS测量)与较低的基线Roseburia丰度相关;在36名PD189患者的2年随访研究中,使用19种细菌分类群的定量PCR,与双歧杆菌和Atopobium 的基线丰度相关。
短链脂肪酸
帕金森病患者肠道微生物群衍生代谢的临床研究仍然很少。低水平的粪便丁酸盐与较差的认知功能和步态困难评分以及更早出现运动和非运动症状相关,而低水平的粪便乙酸盐与低BMI和排便频率降低相关。
帕金森病患者的血浆乙酸盐和丙酸盐水平高于对照组。一些研究人员推测,由于肠道屏障破坏和结肠上皮细胞对肠道短链脂肪酸的利用或清除减少,肠道短链脂肪酸会泄漏到体循环中。
血浆丙酸水平与运动严重程度呈负相关,这与短链脂肪酸对帕金森病有益的总体临床趋势一致。
氧化三甲胺(TMAO)
另一种对帕金森病越来越感兴趣的肠道代谢物是氧化三甲胺(TMAO),根据实验研究,氧化三甲胺可以通过促进正确的蛋白质折叠和防止病理性不溶性纤维的形成来防止神经变性。
如上所述,一些研究发现帕金森病患者粪便和血浆样本中的氧化三甲胺水平均降低,尽管其他研究发现帕金森病患者的血浆氧化三甲胺水平高于对照组。血浆氧化三甲胺水平与帕金森病进展之间的相关性也得到了相互矛盾的结果。
饮食是决定微生物组成和功能的关键因素。肠道微生物将摄入的营养物质用于基本的生物过程,反过来,它们的代谢产物被认为对人类健康有重要影响。
尽管每种主要的宏量营养素和微量营养素都能改变肠道微生物群,但为大肠微生物提供主要能量来源的不可消化碳水化合物(例如纤维和抗性淀粉)在饮食-微生物群相互作用中发挥着特别突出的作用。
这些聚糖的低消耗与微生物多样性降低、短链脂肪酸产量减少以及肠道微生物对粘液的觅食增加有关,导致肠道屏障完整性中断。
许多研究调查了帕金森病风险与饮食成分(包括大量营养素、微量营养素、特定食物和饮食模式)之间的关系。
饮食与帕金森病风险和进展

Tan AH, et al.,Nat Rev Neurol. 2022
研究结果往往相互矛盾,前瞻性研究和病例对照研究之间存在差异。虽然前瞻性研究比病例对照研究更好地确定饮食和疾病之间的因果关系,但它们不能完全消除反向因果关系,即患者因疾病早期迹象改变饮食习惯。
此外,病例对照研究受到选择和饮食回忆偏差的限制。然而,令人惊讶的是,咖啡因研究的结果具有显著的可重复性,这使得咖啡因成为最能降低帕金森病风险的环境暴露之一。
地中海饮食
近年来,地中海饮食已成为一种潜在的“健康”饮食模式,与降低慢性病(包括帕金森病)的风险相关,以及几项前瞻性研究中的总体死亡率减低。
这种饮食通常包括相对较高的水果、蔬菜、全谷物和不饱和脂肪的摄入量,相对较低的肉类(包括家禽)和乳制品的摄入量,以及适度的酒精摄入。
据推测,地中海饮食的有益健康效应部分是通过保护机体免受氧化应激和炎症的影响,以及通过肠道微生物代谢产物改善宿主代谢的调节来实现的。
与其他慢性病一样,大量研究与缺乏减少帕金森病发展或进展的决定性饮食建议之间仍存在明显差距。对饮食化合物反应的个体间差异,可能源于肠道微生物群和宿主基因组成的差异,进一步使饮食与疾病之间的关联复杂化,基于人群的研究结果可能对个别病例的普遍性有限。帕金森的饮食干预研究仍处于起步阶段,将在后面的治疗策略部分进行讨论。
前面介绍了LRRK2基因、帕金森病和炎症性肠病之间相互关系的概念。LRRK2蛋白在免疫细胞中高度表达,并在接触微生物病原体后上调。
与克罗恩病患者的非炎症结肠组织相比,炎症结肠组织中检测到更高水平的LRRK2,与匹配对照组相比,散发性帕金森病患者的外周免疫(血单个核)细胞中检测到更高水平的LRRK2。
LRRK2过度表达也显示出增加结肠炎的严重程度,因此,LRRK2被认为在一定程度上通过介导肠道中的异常炎症反应参与帕金森病的发病机制。然而,其他作者推测,通过增强肠道细菌清除和减轻肠道炎症,增加LRRK2激酶活性会产生有益的效果。
免疫细胞中高水平的LRRK2是否对帕金森病产生保护作用或有害作用,目前尚不清楚。
就动物模型而言,缺乏PTEN基因诱导的假定激酶1(PINK1)的小鼠的肠道革兰氏阴性细菌感染,该激酶参与线粒体内环境平衡,并由帕金森病的某些单基因形式突变的基因编码,触发外周和大脑中自反应性线粒体特异性细胞毒性CD8+T细胞的产生,导致纹状体多巴胺能丧失和运动障碍。
左旋多巴是帕金森病的主要治疗药物,必须到达原代小肠才能被吸收。
胃轻瘫是一种在没有机械阻塞的情况下胃排空延迟的情况,导致左旋多巴留在胃中并转化为多巴胺,而多巴胺不能穿过血脑屏障进入大脑。
反过来,胃中的多巴胺可能进一步损害胃运动。通过使用无线运动胶囊(“智能药丸”),这是一项相对较新的技术,35%患有各种胃肠道症状的帕金森病患者发现胃排空时间延长,20%有小肠传输延迟,8%有合并传输异常。
胃轻瘫通过降低左旋多巴的生物利用度,导致反应波动,如延迟开启状态,甚至剂量失效。因此,胃轻瘫的治疗,以及“绕过”胃的新疗法,可能会缓解帕金森病的运动波动和症状。
饮食蛋白质限制可以减少摄入的氨基酸和左旋多巴之间的竞争,以实现通过肠道上皮和血脑屏障的可饱和主动运输;然而,由于人们认识到体重减轻、营养不良、肌肉减少和骨质疏松症在帕金森病中已经很常见,并且可能被这种方法放大,因此现在人们往往不鼓励这种做法。
胃肠功能和左旋多巴药代动力学
Tan AH, et al.,Nat Rev Neurol. 2022
该图说明了胃轻瘫和小肠微生物活性对帕金森病患者左旋多巴药代动力学的影响,并概述了改善胃肠功能和提高左旋多巴生物利用度的治疗策略。
促动力药物,尤其是多潘立酮,是治疗帕金森病相关胃轻瘫的主要药物,临床试验证明了DA-9701和Camicinal (胃动素受体激动剂)等新型促动力药物的潜在益处,而其他药物,如5-羟色胺5-HT4受体激动剂莫沙必利和普鲁卡因丙利、组胺激动剂尼扎替丁和胃饥饿素(ghrelin)激动剂对帕金森病的益处的证据仍然有限。
从食物中单独口服左旋多巴或与大剂量卡比多联合使用可以帮助提高左旋多巴的生物利用度。一些临床研究探讨了幽门螺杆菌感染、小肠细菌过度生长(SIBO)和便秘治疗对左旋多巴生物利用度和帕金森病运动反应并发症的影响。
肠道微生物在左旋多巴代谢中的作用也得到强调,并可能开辟新的治疗途径来改善帕金森病药物的吸收。绕过胃肠道的策略,包括非口服形式的多巴胺替代品和DBS,是治疗帕金森病运动症状的可能选择。
高度多样化的肠道微生物群及其丰富的酶库可以将许多药物转化为活性更高或活性更低的代谢物,现已被认为是药物药理、疗效和毒性个体间差异的主要因素。
在一项开创性的研究中,在271种不同的口服药物中,三分之二的药物被76种人类肠道细菌分离物中的至少一种显著耗尽,每种菌株代谢11-95种不同的药物。
细菌酪氨酸脱羧酶的发现可以在小肠中将左旋多巴转化为多巴胺,从而限制其生物利用度并可能导致外周多巴胺能不良反应,这为帕金森病患者对左旋多巴观察到的显著个体间反应提供了一种解释。
粪肠球菌(Enterococcus faecalis)是负责左旋多巴脱羧的主要微生物。考虑到小肠细菌过度生长与运动严重程度和波动之间的关联,推测小肠中的细菌过度生长会导致酪氨酸脱羧酶或其他代谢左旋多巴的细菌酶的产生增加。
值得注意的是,左旋多巴肠道细菌代谢产生的多巴胺也会损害肠道运动,可能导致恶性循环,增加小肠细菌过度生长。
然而,目前几乎没有直接证据支持这些观点,部分原因是进入小肠的技术困难。帕金森病的所有研究都使用呼吸试验评估小肠细菌过度生长,如前所述,缺乏标准化。
一项针对18名帕金森病患者的小型研究发现,使用利福昔明进行西博治疗不会影响左旋多巴的药物动力学,但会改善治疗的及时性(但6个月后复发率为43%)。
肠道微生物也可以通过间接机制与左旋多巴相互作用,包括肠道环境的变化(例如,粘膜损伤和炎症),导致细菌降解产物与左旋多巴之间的无效吸收和竞争,以在小肠中进行主动转运。
例如,幽门螺杆菌相关性胃十二指肠炎伴胃低氯酸盐被认为可减少左旋多巴的吸收,左旋多巴在酸性降低的环境中溶解性较低。然而,幽门螺杆菌感染对左旋多巴药代动力学的影响尚不清楚。
一项小型研究(n=34)发现根除幽门螺杆菌后左旋多巴药代动力学得到改善;然而,另一项较大的研究(n=73)没有发现帕金森病幽门螺杆菌阳性和阴性患者之间左旋多巴的药代动力学有任何差异。
此外,尽管几项小型开放标签研究发现根除幽门螺杆菌后运动结果显著改善,但2020年发布的一项双盲、安慰剂对照、随机临床试验(DBPC-RCT)在短(12周)或长(52周)随访后,未发现运动功能或运动波动(使用MDS-UPDRS和可穿戴传感器评估)或生活质量的改善。小肠细菌过度生长状态不影响本研究的结果。
虽然在本研究中根除幽门螺杆菌与任何临床意义的改善无关,但从长远来看或在疾病早期阶段,仍有可能改变根除幽门螺杆菌对帕金森病的影响。
各种微生物导向疗法有望在各种情况下进行症状管理或疾病治疗,但临床试验患者人数相对较少。
最好的证据来自粪菌移植(FMT)对严重梭状芽胞杆菌感染的治疗,证明了约90%的疗效,并为这些方法的临床应用提供了概念证明。
前面我们已经知道,饮食可以通过微生物群-肠-脑轴影响肠道微生物群的组成和中枢神经系统的神经活动。
★ 地中海饮食
前面已经提到,地中海饮食与帕金森的关联。
也有研究表明,坚持地中海饮食与前驱帕金森病的低发病率显着相关。
最近的一项随机临床试验调查了地中海饮食对帕金森病患者认知功能的影响,发现坚持地中海饮食可显着提高执行功能、语言、注意力、记忆力并改善认知功能。因此,地中海饮食可能是减少帕金森病发病和发展的有前景的干预策略。

地中海饮食
地中海饮食是以大量植物性食物为特征的健康饮食模式,如水果、蔬菜、谷类、豆类、坚果等,中低量的乳制品,以橄榄油为主,少量和中等量的鱼和肉,以及少量的红肉,用香料代替盐。
高膳食纤维是地中海饮食的特点之一。膳食纤维结构的细微变化可能强烈影响肠道微生物群的组成和功能。
扩展阅读:你吃的膳食纤维对你有帮助吗?
将富含抗氧化剂的食物(对整体大脑健康很重要)加入饮食中。包括颜色鲜艳的和深色的水果和蔬菜。前瞻性研究发现膳食维生素 E 和胡萝卜素的摄入可以降低患帕金森病的风险。这些抗氧化剂可以中和氧自由基的作用,减少氧化损伤。
橄榄油是地中海饮食的主要脂肪来源,主要含有单不饱和脂肪酸,具有抗氧化活性并抑制α突触核蛋白聚集。橄榄油中的酚类化合物具有抗炎、抗氧化、神经保护和免疫调节活性。
补充水分,每天至少应饮用 8 杯水。
需要限制或避免摄入的:
避免食用含有大量胆固醇或饱和脂肪的食物,少吃肉类(尤其是红肉类)也很重要。
糖、盐、饮料的摄入量也应该严格限制。
尽量限制加工食品的摄入。
★ 禁食疗法
除了我们熟悉的地中海饮食,与预防或治疗帕金森病相关的饮食疗法还包括禁食疗法。
模拟禁食的饮食可以减少 MPTP 诱导的帕金森病小鼠黑质中多巴胺能神经元的损失。
间歇性禁食可以保护疾病动物模型中的神经元,减少多巴胺能神经元的数量并改善帕金森病的运动功能。
关于间歇性禁食详见我们上一篇文章:
间歇性禁食 & 肠道菌群 & 心血管代谢疾病
药物治疗时需要注意避免混合在一起的:
在服用药物治疗帕金森氏症时最好避免饮酒,因为酒精可能会干扰药物治疗。
对于一些帕金森病患者来说,如果服药时间与蛋白质或铁(以铁补充剂的形式)的摄入时间接近,那么服药时间的安排尤其成问题。这些人对药物的吸收很敏感。
总之,饮食可以调节肠道菌群的改变,并通过抗炎、减少氧化应激和神经保护作用对大脑产生影响。饮食介导的治疗可以作为治疗和预防帕金森病的新策略。
益生元主要是不易消化的碳水化合物,短链脂肪酸是由其发酵产生的。益生元是宿主微生物(或施用的益生菌菌株)利用的基质,具有健康益处。
在一项小型开放标签研究(n=19)中,富含不溶性纤维(一种常见益生元食物来源)的饮食改善了便秘、血浆左旋多巴生物利用度和运动功能。
此外,一项有87名参与者参与的开放性研究报告称,在接受益生元干预的帕金森病患者中,使用抗药性进行益生元干预后,非运动症状评分得到改善,粪便丁酸显著增加,粪便钙卫蛋白水平降低。
在仅接受饮食指导的患者中未观察到此类变化,并且两种干预措施均未导致微生物成分或便秘严重程度的显著变化。
帕金森病肠道微生物组的治疗调节
Tan AH, et al.,Nat Rev Neurol. 2022
益生菌是活的微生物,当剂量足够时,可带来健康益处。
两项研究为多系列益生菌的价值提供了I级证据(作为添加益生元纤维的发酵乳服用(n=120)或作为每日一次的胶囊配方(n=72))用于治疗帕金森病便秘,据报道,肠道频率和粪便组成有所改善。
益生菌配方中包括各种乳酸杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)和肠球菌(enterococcus)菌株。由于这两项研究的干预持续时间仅为4周,因此需要进一步研究,以检查益生菌治疗帕金森病的长期疗效和安全性。
事实上,大多数益生菌制剂中都含有双歧杆菌和乳酸杆菌,但它们是帕金森病患者中已经普遍升高的两个属。肠球菌有时也包括在益生菌中,但已显示出强大的左旋多巴降解能力,强调在PD患者中使用这些益生菌时需要谨慎。
粪菌移植(FMT)对肠道微生物群的调节作用可能通过免疫、内分泌、代谢和神经通路对神经系统疾病的症状或进展产生影响。
粪菌移植在帕金森病患者便秘治疗中的潜在价值已在6名患者的病例系列和11名患者的开放标签研究中显示。
从供体向患者传播传染病或其他微生物介导的特征是与这种方法相关的潜在风险。
在两项研究中,供体粪便菌群均采用内窥镜管理,无重大不良事件发生。目前正在研究粪菌移植(FMT)对帕金森病运动和非运动症状的影响。
抗菌剂减少了许多肠道微生物的数量,可能无法区分有害微生物和有益微生物。此外,反复治疗(例如,反复出现的小肠细菌过度生长)也有产生抗生素耐药性的风险。
上文讨论了根除幽门螺杆菌或治疗帕金森病SIBO的抗生素。尽管在研究后1年的随访中,根除幽门螺杆菌并没有改善临床特征,但潜在的疾病改善效应仍然存在。
在几项研究中发现的安慰剂干预后小肠细菌过度生长状态的自发变化和治疗后相对较高的复发率突出了与研究和试图根除帕金森病患者小肠细菌过度生长相关的挑战。
后生元是指赋予健康益处的无生命(杀死的)微生物和/或其成分的制剂。作用于肠道相关靶点的小分子、生物制剂或代谢物可能包括抑制肿瘤坏死因子、Toll样受体或富含亮氨酸的重复激酶2信号、短链脂肪酸和肠道屏障恢复治疗,如紧密连接调节剂或粘液稳定剂。
其他有可能使帕金森病患者受益的微生物导向药物,包括小分子药物和生物制剂,尚未在临床环境中进行广泛探索。
给予短链脂肪酸和靶向抑制左旋多巴代谢细菌酶似乎具有特别的前景,但仍需在人类干预研究中进行测试。
免疫调节和肠道屏障恢复方法也值得进一步关注。抗TNF治疗可降低炎症性肠病患者的帕金森病发病率,已证明可使炎症性肠病患者的粪便微生物群组成向健康人的粪便微生物群组成转变,丁酸盐和相关底物的粪便水平与临床缓解有关。
针对肠道神经系统中帕金森病相关分子发病机制(例如,涉及α-突触核蛋白或葡萄糖脑苷酶)的策略可能代表另一个新的前沿;在一项开放性试验中,口服角鲨胺(建议以静电方式取代肠道神经元中的α-突触核蛋白聚集体)是安全的,并能显著改善帕金森病患者的便秘症状。
发表在《神经病学》杂志上的一项研究发现,患有早期帕金森病的人每周两次定期通过散步或园艺等活动进行一到两个小时的适度体育锻炼,他们的平衡、行走能力、力量和耐力可能会有所改善。
五年以上经常锻炼的早期帕金森患者,在认知测试中表现更好,症状进展较慢。
每周至少进行4小时中等强度到剧烈运动(比如走路或跳舞)的人,与没有进行那么多运动的人相比,平衡能力下降的速度要晚5年。
有规律的活动,即使是小量的活动,也会有产生影响。
不同形式的体力活动似乎有不同的效果:
研究表明,89% 的帕金森病患者会出现言语和声音障碍,包括声音轻柔、单调、呼吸沙哑和发音不确定。因此,患有帕金森的人不太能参与正常对话,或者对社交环境没有信心。
言语障碍会逐渐降低帕金森患者的生活质量。一个人越早接受基线言语评估和言语治疗,就越有可能随着疾病的进展保持沟通技巧。沟通是帕金森患者生活质量高、充满信心的关键因素。
音乐疗法作为一种发展相对成熟、安全、方便实施而又成本低廉的非药物干预方法,被广泛应用于帕金森病人的康复中。
★ 措施
根据音乐疗法的性质及其应用方式可将音乐疗法分为 3 种类型:
① 主动音乐疗法:
大多采用治疗师与病人合作的方式,通过让病人唱歌、跳舞等形式调节病人情绪,逐步提高病人适应外界的能力,是国外康复机构主要治疗方法之一。
② 被动音乐疗法:
多注重治疗师的引导作用,常在病人休息时进行,让病人在欣赏和感受音乐的过程中,通过音乐的节奏、音色等因素影响人的神经系统,从而达到治疗的作用。
③ 综合疗法:
综合疗法往往是主动、被动双管齐下,并不限于哪种方法的使用,如在绘画时听音乐以陶冶情绪,或用音乐导引练习气功等。通过综合考虑音乐风格、人格类型、文化背景 、兴趣爱好 、职业等因素开出音乐处方实行辨证施乐。
★ 效果
改善运动障碍,增加运动协调性
对11例男性帕金森病人实施音乐疗法方案,用维也纳测试系统(VTS)测量病人在听音乐前后的身体运动协调性,研究发现实施音乐疗法后病人肢体瞄准和直线追踪方面有显著改善。
从华盛顿大学医学院招募了 23 例帕金森病人进行音乐疗法实验,研究者让病人边走边唱自己熟悉且韵律感强的歌曲,结果发现当病人以与舒适的步态步调相匹配的节奏唱歌时,可以改善步态的协调性和稳定性,同时还增强了病人的语言清晰度和声音强度。
18 例帕金森病人随机分为干预组和对照组,干预组采用音乐疗法,病人根据音乐节拍做一些特定的舞蹈动作或跟着音乐唱歌,对照组则采用传统理疗方式,结果显示干预组病人在身体灵活性、步态等方面较对照组有显著改善,病人的跌倒次数也显著减少。
研究平板训练联合音乐疗法对帕金森病人冻结步态的影响,结果显示平板训练联合音乐干预能够显著缓解帕金森病人冻结步态,减少摔跤次数。
提高认知能力,改善吞咽功能和言语障碍
有研究招募了 25 例帕金森病高龄病人为研究对象,实验组病人接受音乐疗法 24 周,对照组不进行任何干预,结果发现实验组病人认知能力、处理速度、注意力、记忆能力较对照组有明显改善。
美国一项研究对 27 例帕金森病人进行音乐疗法干预后,病人吞咽功能明显改善,同时说话吐字也更加清晰,但在实验干预的过程中使用多个研究人员进行干预和评估,无法保证被测病人的 2 次评估是由相同的研究人员完成,因此不同的评估者的主观因素可能会影响评估结果。
对 4 例帕金森病人进行了为期 1 个月的音乐干预,结果显示音乐疗法提高了帕金森病人的声音强度和语言清晰度。和谐而又有节奏感的音乐能够有效改善帕金森病人的认知能力,同时也有利于病人的言语康复。
改善负面情绪,提高病人生活质量
将80 例帕金森病人随机分为对照组和实验组各 40 例,对照组接受常规治疗,实验组病人在常规治疗的基础上接受音乐干预,通过汉密尔顿抑郁量表评估干预后的效果,结果显示实验组抑郁评分明显下降,并激发了病人积极的情绪状态。
对 32 例帕金森病人进行为期 3 个月的随机对照实验发现,接受音乐干预的帕金森病人调节情绪的能力明显提高,同时病人也对音乐疗法提供的社交和创造性的交流方式表达了欣赏和喜爱,幸福指数也明显增高。
镁
矿物镁的摄入量低会使过量的重金属和毒素在大脑中沉积,从而导致帕金森和阿尔茨海默病。
当有足够的镁存在时,重金属不能在小肠中被吸收。镁在保护神经元免受铝和汞中毒的致命影响方面起着至关重要的作用。
镁也是治疗震颤最重要的自然疗法之一。研究人员发现,每天服用镁补充剂可以缓解手部震颤的症状。
富含镁的食物:
B族维生素
缺乏维生素 B9 和 B12可能导致最初表现为抑郁、焦虑甚至精神病的大脑问题。其他 B 族维生素可用于防止与年龄有关的脑萎缩,并可能防止记忆丧失。
谷胱甘肽
谷胱甘肽是抗氧化剂,能有效中和自由基损伤,并大大减少破坏神经元的氧化应激。
葡萄籽提取物
具有超强抗氧化作用,可减少大脑中的 DNA 碎片。它能够进入大脑,保护脑细胞免受自由基损伤。
帕金森病微生物组研究的当前差距和未来方向
Tan AH, et al.,Nat Rev Neurol. 2022
帕金森病微生物组研究重点正在从研究微生物组结构和潜力(即肠道中存在哪些微生物及其相对丰度和代谢潜力)转向通过使用多组学平台和机理研究来了解微生物功能。
根据观察性研究和基本机制研究的结果,以回答有关肠道微生物和代谢物在帕金森病发病、维持和进展中的作用的基本问题,该领域有望发展到微生物导向疗法的临床试验,从而将微生物组学转化为这种疾病患者的临床现实。
目前,有关肠道相关因素与人类帕金森病之间关系仍然存在很大的相关性,现在需要从观察性研究设计过渡到干预性研究设计。
然而,一些问题仍然存在,确定改变是否是疾病过程的因果关系或促成因素将是至关重要的。例如,与肠道微生物组分的相关性——可能反映了对疾病因素(如转运时间改变或炎症)的次要或共同的非特异性反应。
总之,关于胃肠道参与神经退行性路径,许多疑难杂症仍有待解开。我们希望这一领域的科学进步可以给人们带来新的诊断、预后和治疗方法,最终将改善帕金森病患者及其家人的生活质量。主要参考文献:
Tan AH, Lim SY, Lang AE. The microbiome-gut-brain axis in Parkinson disease – from basic research to the clinic. Nat Rev Neurol. 2022 Jun 24. doi: 10.1038/s41582-022-00681-2. Epub ahead of print. PMID: 35750883.
Wang Q, Luo Y, Ray Chaudhuri K, Reynolds R, Tan EK, Pettersson S. The role of gut dysbiosis in Parkinson’s disease: mechanistic insights and therapeutic options. Brain. 2021 Oct 22;144(9):2571-2593. doi: 10.1093/brain/awab156. PMID: 33856024.
Menozzi, E., Macnaughtan, J. & Schapira, A. H. V. LRRK2 parkinsonism: does the response to gut bacteria mitigate the neurological picture? Mov. Disord. 36, 71–75 (2021).
Nishiwaki, H. et al. Short- chain fatty acid- producing gut microbiota is decreased in Parkinson’s disease but not in rapid- eye-movement sleep behavior disorder. mSystems 5, e00797-20 (2020).
Vascellari, S. et al. Clinical phenotypes of Parkinson’s disease associate with distinct gut microbiota and metabolome enterotypes. Biomolecules 11, 144 (2021).
马春潮.帕金森的防治[J].开卷有益-求医问药,2021(09):35.
Koutzoumis,D.N. et al. Alterations of the gut microbiota with antibiotics protects dopamine neuron loss and improve motor deficits in a pharmacological rodent model of Parkinson’s disease. Exp. Neurol. 325, 1 13159 (2020).