-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
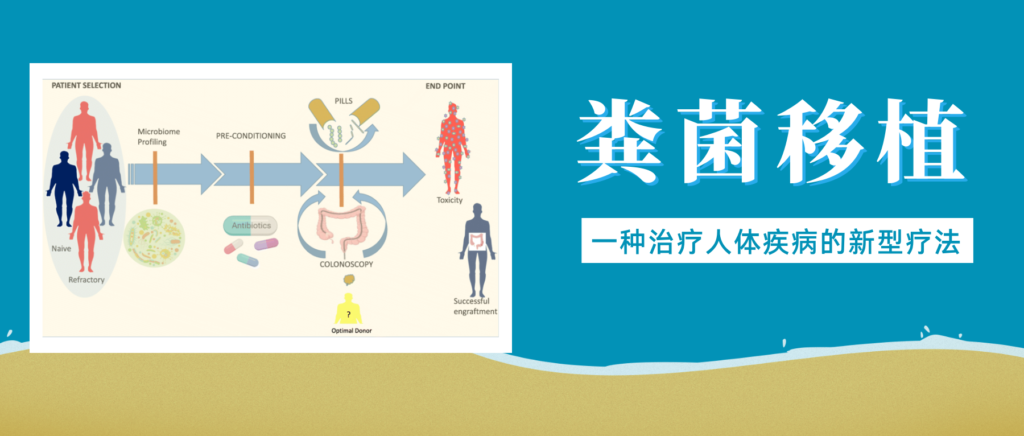
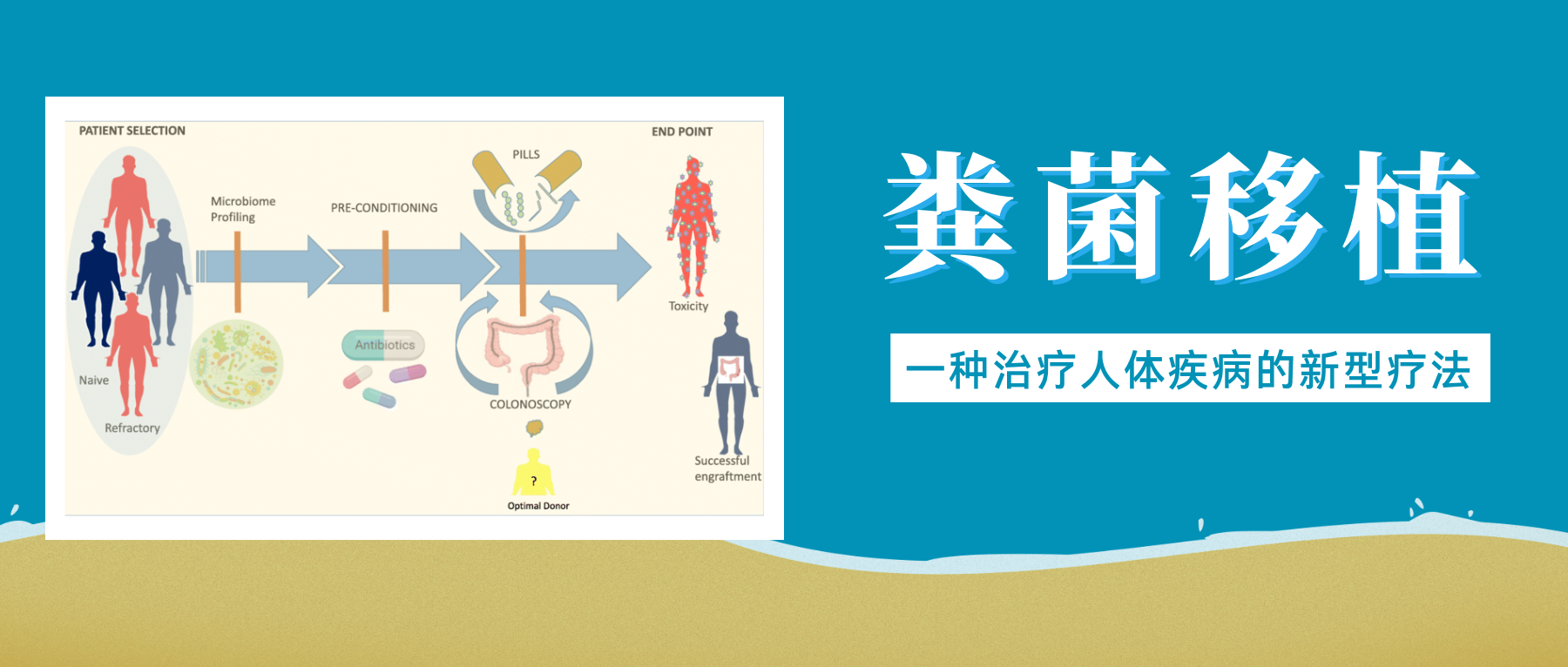
粪菌移植是一项近年来备受关注的医疗技术,它涉及将健康捐赠者的粪便物质转移至患有疾病或障碍患者的胃肠道。

简单来说就是选择健康合适的人粪便,通过科学方法提取出有用的微生物,去除有害与无用的部分,然后制成制剂,给病人口服或者直接注入肠道,目的是恢复健康的肠道微生物群并改善整体健康状况。
粪菌移植的历史悠久
粪菌移植在传统中医中已有数百年的应用,粪菌移植的第一个记录可以追溯到四世纪的中国,当时人类粪便被称为黄汤,用于治疗严重腹泻的患者。
15到16世纪的中国明朝,有关于将新鲜或发酵的粪便悬浮液用于治疗腹泻、便秘和腹痛等胃肠道疾病的记载。
但直到20世纪50年代晚期,它才首次用于现代医学,以治疗由抗生素耐药菌引起的严重腹泻。
在20世纪80年代和90年代,粪菌移植主要用于治疗反复发作的艰难梭菌感染。然而,随着肠道微生物群的发现及其在健康和疾病中的作用,粪菌移植开始被探索作为治疗其他疾病的潜在方法,包括炎症性肠病、肠易激综合征甚至神经系统疾病等。

粪菌移植在未来拥有巨大前景
近年来,粪菌移植受到医学界和公众越来越多的关注,许多临床试验和研究正在进行,以评估其疗效和安全性。
粪菌移植的疗效已经在多种肠道疾病中得到证实,如艰难梭菌感染、肠炎、炎症性肠病等。粪菌移植的出现,为肠道微生物失调带来了新的治疗思路和方法,也为人类健康提供了新的希望。
随着我们对肠道微生物群研究的不断发展,粪菌移植很可能成为治疗其他疾病越来越重要的工具。谷禾在本文中将为大家介绍粪菌移植。
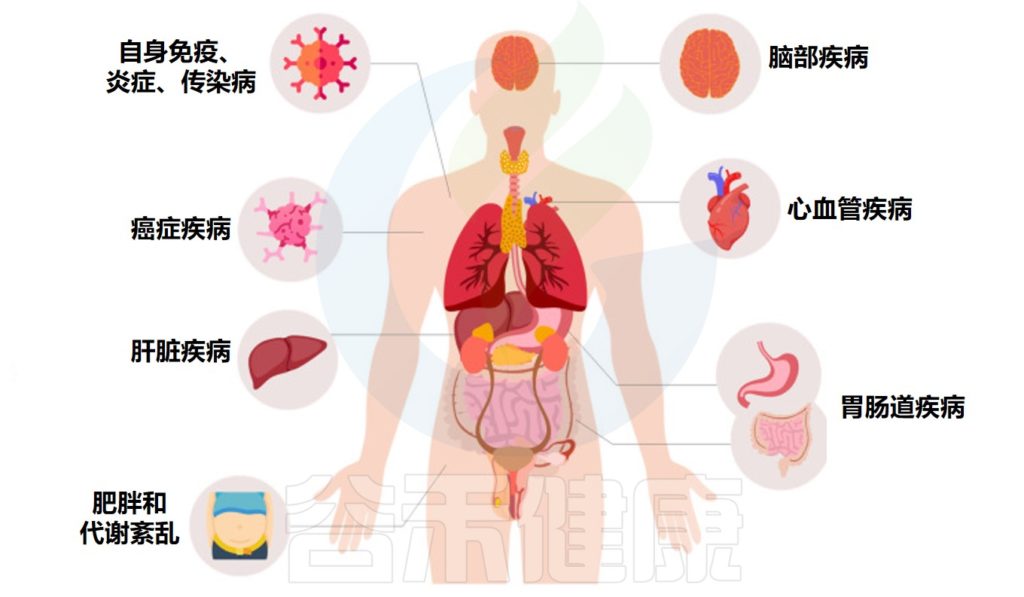
粪便微生物群移植 (粪菌移植) 是一种医疗程序,涉及将粪便从健康供体转移到受体的胃肠道中。已发现粪菌移植可有效治疗各种胃肠道疾病,包括艰难梭菌感染、炎症性肠病和肠易激综合征。
来自大量临床试验的数据表明,粪菌移植也可能对许多其他疾病具有治疗潜力,从胃肠道到肝脏疾病,神经系统疾病、自身免疫性疾病、皮肤疾病、心血管疾病、脑部疾病、肥胖和代谢综合征。
根据这些相关研究,谷禾带大家了解粪菌移植在治疗人体疾病中的作用。
人类疾病中的粪菌移植
Biazzo M,et al.J Clin Med.2022
▼
粪菌移植主要用于治疗反复发作的艰难梭菌感染(CDI),这是一种细菌感染,会引起严重的腹泻和结肠炎症。
√粪菌移植对治疗艰难梭菌感染特别有效
研究表明,粪菌移植在治疗复发性艰难梭菌感染方面特别有效,已发现粪菌移植在治疗艰难梭菌感染方面的成功率超过90%,而且几乎没有副作用。
▼
粪菌移植已被证明是治疗多种胃肠道疾病的有效方法,包括炎症性肠病(IBD)、肠易激综合征(IBS)。
炎症性肠病是一种复杂的炎症和慢性疾病,其特征是免疫失调,最终导致消化道免疫介导的损伤,包括溃疡性结肠炎(UC)和克罗恩病(CD)。肠道微生物群失调被认为是炎症性肠病发展中的关键调节事件,因此粪菌移植代表了一种可能的治疗策略。
√缓解溃疡性结肠炎患者症状
最近一项随机对照试验的荟萃分析发现,粪菌移植可有效诱导溃疡性结肠炎患者症状缓解,缓解率为36%,而对照组仅为9%。对核糖体 16S RNA 的分析表明,粪菌移植后微生物多样性增加并持续存在。
对活动期溃疡性结肠炎的儿科患者(4至17岁)进行了随机临床试验。粪菌移植组中92%的患者在第6周实现了小儿溃疡性结肠炎活动指数的改善(与安慰剂组的50%相比)。
√短期内改善了克罗恩病患者症状
评估了25名患有腹腔内炎症性肿块的克罗恩病患者使用多种新鲜粪菌移植(初始粪菌移植随后每三个月重复粪菌移植)的疗效和安全性。
超过一半的患者在第一次粪菌移植后三个月表现出临床反应的缓解,这一比例在12个月和18个月时有所下降。
注:这表明尽管粪菌移植在短期内缓解了临床症状,但未能产生持久的临床效果。
√对肠易激综合征有积极影响
六项不同的临床试验发现粪菌移植对肠易激综合征症状有积极影响:
(1) 在一项只有10名患者入组的小型临床试验中,在粪菌移植后4周,6 名患者有所改善;有趣的是,作者发现报告改善的患者接受了来自双歧杆菌含量高于无效供体的粪菌移植,这表明富含双歧杆菌的粪便供体可能是粪菌移植成功的预测因素。
(2)观察到65%的患者在通过结肠镜检查接受粪菌移植治疗三个月后症状缓解以及粪菌移植之后微生物特征向供体特征的转变,包括增加的α和β多样性。
(3)报告了腹泻型肠易激综合征患者的症状和生活质量的改善,这些患者通过胃镜接受新鲜粪便,并且(在连续分析中)增加了短链脂肪酸。
(4)报告显示,在接受来自健康供体(同种异体移植)或来自他们自己(自体移植)的粪便材料的患者中,肠易激综合征症状出现短暂改善;接受同种异体移植的患者抑郁评分有所下降。
(5)使用仅从一名健康、特征良好的供体获得的粪便样本通过胃镜粪菌移植治疗肠易激综合征患者,发现了疲劳和生活质量的改善以及细菌微生物群概况的变化、粪便短链脂肪酸的变化。
(6)在最近的一项临床试验中,招募了难治性肠易激综合征患者,主要是腹胀,并通过鼻空肠给药接受一次粪菌移植治疗;粪菌移植一年后,56%的患者报告肠易激综合征症状和生活质量有所改善。
▼
复发性肝性脑病是肝硬化的并发症(与饮酒无关),由肝功能衰竭和肠-肝-脑轴受损引起,可导致意识障碍和昏迷 。
√粪菌移植改善肝性脑病患者认知和微生态失调
粪菌移植最近被研究为一种可能的新治疗工具。第一项试验描述,通过灌肠递送的单一粪菌移植在短期内减少了肝性脑病患者的住院时间,改善了他们的认知和微生态失调。
粪菌移植治疗后一年内,与对照组相比,降低了住院率并改善了认知功能。
√粪菌移植展现出肝病的治疗潜力
广泛的研究支持粪菌移植作为一种控制肝病的疗法。粪菌移植改善了高脂肪饮食引起的肝损伤和脂质代谢,同时增加了小鼠肠道微生物群的多样性。来自对酒精性肝病有抵抗力的供体小鼠的粪菌移植可以预防酒精性肝损伤。
此外,粪菌移植已经用于慢性肝病患者。最近一项针对严重酒精性肝炎患者的初步研究表明,粪菌移植与存活率提高和腹水消退有关。
▼
多项研究探索了粪菌移植在治疗神经系统疾病方面的潜在益处,例如帕金森病、多发性硬化症和自闭症谱系障碍。
√改善帕金森病患者症状
发表在《神经病学》杂志上的一项研究发现,粪菌移植改善了帕金森病患者的症状,如便秘和睡眠障碍。
在帕金森病小鼠模型中,来自正常小鼠的粪菌移植可以减少黑质的病理特征并减轻身体损伤。
√改善多发性硬化症患者症状
发表在《神经炎症杂志》上的另一项研究发现,粪菌移植改善了多发性硬化症患者的症状,例如疲劳和抑郁。
√影响抑郁症、阿尔兹海默症状态
此外,来自重度抑郁症患者的粪菌移植在正常小鼠中诱导了抑郁症的行为/生理特征。
最后,在阿尔茨海默病小鼠模型中,源自正常对照小鼠的粪菌移植改善了认知功能。
▼
除神经系统疾病外,粪菌移植在治疗其他非胃肠道疾病(如肥胖、糖尿病和代谢综合征)方面也显示出前景。
√改善代谢综合征患者胰岛素敏感性
几项临床试验研究了粪菌移植对代谢综合征患者的的影响,显示出改善:报告说,患有代谢综合征的男性参与者接受了来自健康人群的肠道微生物群输注六周后胰岛素敏感性增加。
研究人员概括了关于胰岛素抵抗增加的发现,并补充说它取决于粪菌移植后肠道微生物群的变化。
最后,与移植正常供体粪便的受试者相比,使用代谢综合征供体粪便移植肥胖和胰岛素抵抗的男性受试者时,胰岛素敏感性降低,从而显示代谢综合征中胰岛素敏感性和微生物群之间的因果关系。
发表在《胃肠病学》杂志上的一项研究也发现,粪菌移植改善了代谢综合征患者的胰岛素敏感性。
注:代谢综合征是糖尿病的前兆。
除了这些已经确定的应用,粪菌移植还有一些新兴的用途。例如,粪菌移植被探索作为治疗肥胖和2型糖尿病的潜在方法。
▼
在过去的几年中,肠道微生物群在致癌过程中的作用已得到越来越多的认可。肠道微生物失调和个别细菌可以通过激活致瘤途径、诱发炎症和破坏宿主DNA来诱发癌症或影响癌症进程。
细菌影响癌症的具体机制
几种细菌拥有或产生促进β-连环蛋白与E-钙粘蛋白分离的蛋白质,激活参与癌发生的β-连环蛋白信号通路。
肠道生态失调导致细菌衍生的短链脂肪酸的产生减少。肠道生态失调通过Toll 样受体 (TLR) 的微生物相关分子模式发挥促炎作用,增加细胞产生促炎因子,从而增加致癌作用。
除了诱发炎症外,许多细菌还能够通过释放特定代谢物来破坏DNA,从而促进癌症进展。
β-连环蛋白(β-catenin)是一种细胞骨架蛋白,主要位于细胞膜,在乳腺上皮中,β-catenin游离量较少,通过介导与E-cadherin的相互作用,将细胞外黏附因子与细胞质内细胞骨架相互连接,以保持质膜的完整性,并参与细胞的黏附、迁徙与转移等过程。
β-catenin异常表达时脱离细胞间连接进入细胞质或细胞核,将失去介导细胞间链接、黏附的功能,并引起某些癌基因的表达,导致细胞癌变、转移。
β-catenin还是介导Wnt信号传导的关键分子,其在细胞核中决定着Wnt信号通路的开放或关闭,通过调节基因表达过程,在乳腺发育以及肿瘤发生的调控中起到了重要的作用。
细胞膜中β-catenin的丢失以及细胞质、细胞核中β-catenin的高表达都可以经过不同的调节途径独立发生,诱导乳腺癌的发生,并影响乳腺癌的预后。
E-钙粘蛋白(E-cadherin)是钙黏蛋白家族成员,在上皮细胞中连接细胞骨架与细胞外环境,参与细胞信号传导。在正常乳腺组织中,E-cadherin在肌上皮中呈颗粒状膜阳性,在腺上皮细胞中呈细胞膜强阳性,是区分DCIS和小叶原位癌的标志物;E-cadherin几乎在所有的DCIS细胞上呈线状膜染色,而小叶原位癌的细胞膜大多不表达E-cadherin。
令人惊讶的是,特定的微生物群物种具有调节癌症治疗的功效,显著影响癌症患者的临床预后。
√粪菌移植有助于治疗黑色素瘤
黑色素瘤是一种皮肤癌,涉及产生黑色素的黑色素细胞。最近,新工具利用免疫检查点抑制剂来增强患者对肿瘤的免疫反应(这种治疗方法称为“癌症免疫疗法”),并且有趣地发现肠道微生物组调节这种反应。
注:谷禾前面的文章中也有讲过癌症免疫疗法。
在两个具有不同肠道微生物组成的小鼠中,黑色素瘤的生长及其对抗程序性死亡配体1(PD-L1)免疫疗法的反应显著不同。
如果将来自对抗PD-1治疗有积极反应的黑色素瘤患者的粪便样本移植到无菌小鼠体内,则PD-1阻断的抗肿瘤作用会得到改善。
粪菌移植似乎有望通过转移有利的肠道微生物群来增强黑色素瘤患者的抗肿瘤免疫力。
通过粪便微生物群移植治疗癌症
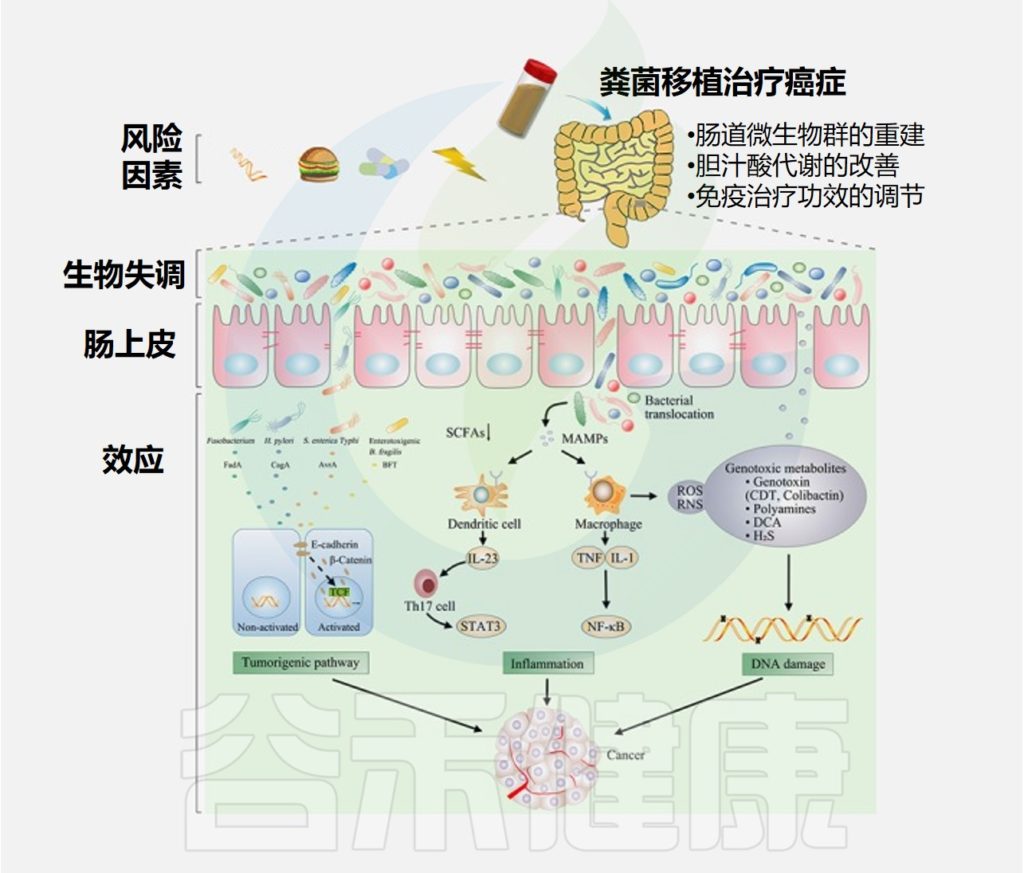
Chen D,et al.Int J Cancer.2019
▼
根据最近的研究,粪菌移植可能是治疗各种皮肤病症(包括湿疹和牛皮癣)的潜在治疗选择。人体肠道微生物群在免疫调节中起着至关重要的作用,肠道微生物群的改变与各种皮肤病有关。
一些案例报告了湿疹和牛皮癣患者经粪菌移植后成功治疗。
√改善了牛皮癣患者的严重程度
在研究皮肤病学杂志上发表的一项研究中,研究人员发现粪菌移植改善了四分之三的牛皮癣患者的严重程度。
√湿疹症状有了显著改善
此外,发表在美国皮肤病学会杂志上的一项研究报告说,粪菌移植使三分之二的患者的湿疹症状有了显著改善。
总之,粪菌移植显示出作为治疗湿疹等皮肤病的巨大潜力。同样重要的是要注意粪菌移植具有潜在的风险,包括感染和不良反应。
需要更多的研究来确定粪菌移植治疗皮肤病的最佳频率和剂量。因此,在考虑将其作为皮肤病的治疗选择之前,必须彻底评估粪菌移植的潜在益处和风险。
▼
关于微生物群和粪菌移植干预在心血管疾病中的作用,只有有限的证据可用,而且大多是在动物模型中获得的。
√菌群影响房颤的易感性
最近提出了老年人肠道菌群失调在房颤发病机制中的因果作用。研究表明,将患有心房颤动的老年大鼠粪菌移植移植到年轻大鼠体内会导致更高水平的脂多糖和更高的疾病易感性。
√菌群移植改善了心肌损伤
仍然在动物模型中,实验性自身免疫性心肌炎(EAM)小鼠模型中对照小鼠的粪菌移植增加了微生物的丰富度,包括厚壁菌门/拟杆菌门的比例增加,并且由于炎症减轻而改善了心肌损伤。
尽管科学文献中很少有证据表明粪菌移植策略在心血管疾病中有治疗价值,但在动物模型和人类中获得的这些数据肯定会为进一步研究提供坚实的基础。
本章小结
未来,粪菌移植也可能用于治疗自身免疫性疾病,如类风湿性关节炎和红斑狼疮,以及精神健康状况,如抑郁症和焦虑症。
值得注意的是,这些新兴应用仍处于研究的早期阶段,需要进一步的研究来确定它们的疗效和安全性。
总的来说,目前粪菌移植主要用于治疗反复发作的艰难梭菌感染和一部分胃肠道疾病,但它在治疗其他疾病和障碍方面具有巨大的潜力,正在进行研究探索其在各个医学领域的潜在应用。
▼
移植所需的粪菌来自经过严格筛查的供体,供体捐赠样本后,用一套全自动化的机器进行分离,经过注水、搅拌、过滤、离心、沉淀等步骤,得到纯化的细菌。
粪便菌群移植过程示意图
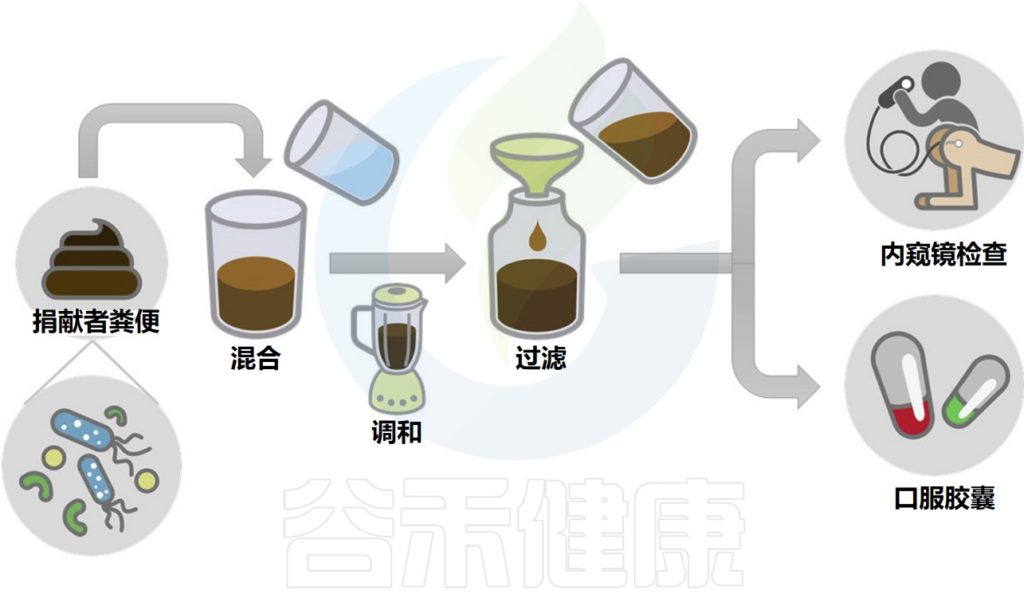
Wang JW,et al.J Formos Med Assoc.2019
其中单单过滤的步骤就要重复数次,每一道过滤用的滤网孔径都比前一道滤网的孔径更小,最后一道滤网的孔径只有0.07毫米,基本上可以把所有的杂质去除,只剩下细菌这些微生物。
分离出来的粪菌再用生理盐水制成混悬液供移植使用。
▼
“移植”过程不是简单粗暴的将一个人的粪便直接注入患者的肠道,主要是将健康供体的粪便离心纯化,获得功能菌,然后通过上消化道、中消化道和下消化道转移至受体肠道。从而重建稳定的肠道微生态环境,缓解相关症状,治疗疾病。
★ 粪菌移植的途径与治疗目的有相关性
例如,想要治疗溃疡性结肠炎可以采取经结肠镜灌肠。要治疗慢性乙型肝炎,则是经上消化道,可以采取:经麻醉胃镜、普通胃镜、经鼻饲管,或者用粪菌胶囊,经典方式是通过麻醉胃镜。
粪便微生物群移植的方法
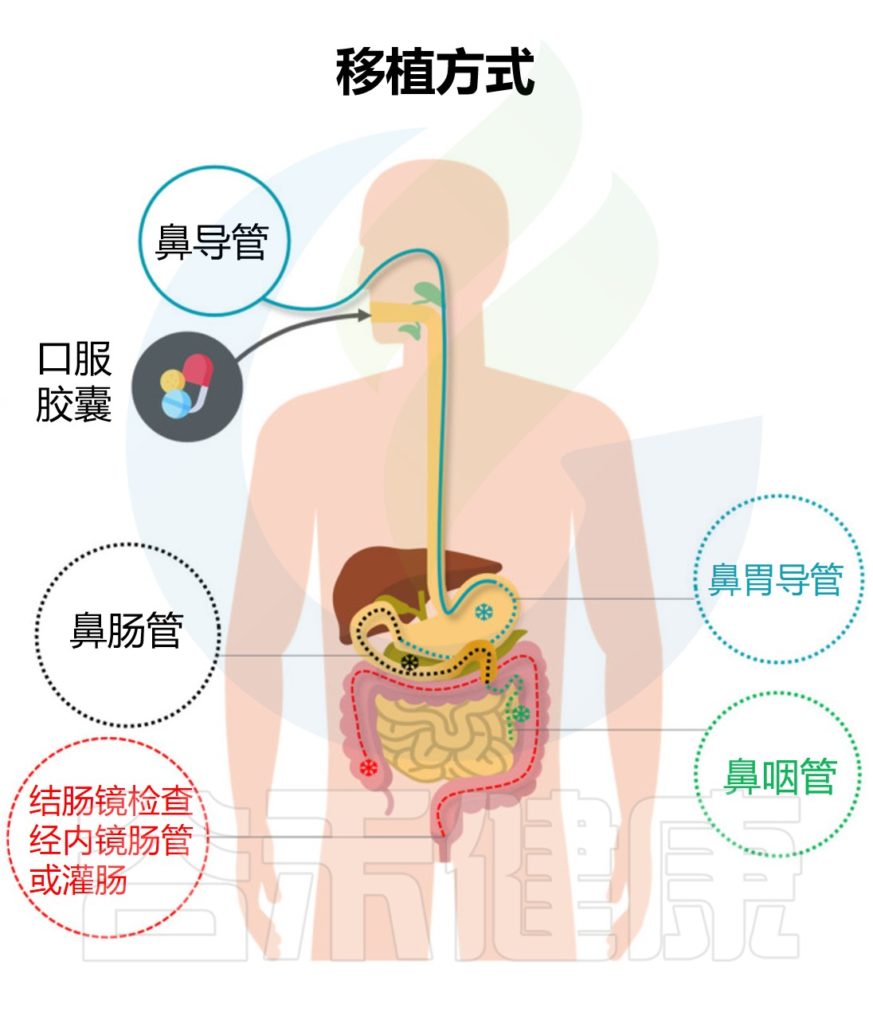
Biazzo M,et al.J Clin Med.2022
不同的粪菌移植方式具有各自的优缺点,下面谷禾具体来讲述经不同部位消化道进行粪菌移植的特点。
▸ 上消化道
操作简单,总体风险较低
上消化道途径中,口服给药和鼻胃管应用广泛,操作简单,总体风险较低。但在此过程中,可能会因菌液反流或吸出而导致窒息,如果机体本身存在梗阻,则移植的菌液可能无法准确到达肠道。
其中,口服途径主要指包封粪菌材料,通过将提取的粪菌与冷冻保护剂(主要是甘油)混合制备,然后进行多重包装以保护粪菌移植材料免受胃肠道环境的影响。同时,操作人员可以根据预期的释放位置进一步选择胶囊壳的材料。目前,市售的胶囊壳通常针对胃或结肠的释放,并被配制以确保细菌的存活率和定植。
降低潜在疾病传播的概率
此外,在制作胶囊的过程中,也可以去除无症状供体中可能存在的真菌、寄生虫、病毒和部分炎症介质,以降低潜在的疾病传播概率。
总的来说,通过上消化道途径的粪菌移植具有无需昂贵器械、重复使用对患者损伤小、患者耐受性好等优点。该途径适用于不能耐受鼻肠管和胃镜移植的患者,以及需要口服定制菌的患者。
▸ 中消化道
减少移植时的细菌位移
中消化道途径主要是指鼻肠移植和经内镜肠道植管术,能够实现全肠道给药。其中鼻肠管通过导丝拉伸拉直,在胃肠蠕动正常的情况下自动通过幽门,进一步减少粪菌移植时的细菌移位。
在一项随机对照试验中报道,通过鼻肠管的粪菌移植优于单独使用万古霉素治疗艰难梭菌感染,但粪菌移植组患者也出现了腹泻、痉挛和便秘等不良事件。
什么是经内镜肠道植管术?
经内镜肠道植管术(TET)具体指的是在内镜下辅助植入固定管并固定在肠道深处,同时外端沿肠道与外部相通。TET主要包括结肠途径介导的TET和中胃肠道途径介导TET。
结肠通路介导的TET需要应用结肠镜检查,并且使用这种途径进行重复粪菌移植是昂贵的。相比之下,中胃肠道途径介导的TET更方便,更容易维持。
由于中胃肠道介导的TET不需要在内镜手术后通过X射线或其他医疗仪器进一步确认肠道位置,对于无法进行结肠镜检查肠道准备的患者,或需要重复粪菌移植的患者,中胃肠道中介导的经内镜肠道植管术也是主要选择。
▸下消化道
下消化道通路主要指灌肠、结肠镜检查、结肠通路介导的经内镜肠道植管术等操作。
灌肠侵入性较小且相对简单
其中,灌肠是一种侵入性较小且相对简单的操作。灌肠法患者耐受性好,不需要昂贵的器械,有效降低了手术风险。但这种方法需要将输注的粪悬液保留较长时间,患者保持仰卧位以减少粪便排泄,同时反复灌肠易于被患者接受。
注意:粪菌移植的细菌是否可以通过灌肠的方式保留在肠段的命题尚不明确,而且这种方式也伴随着无法到达结肠和脾曲的风险,需要多次灌注才能获得疗效和更长的手术时间,以弥补肠道菌群保留率低的缺陷。同时,由于细菌液的滞留,这种方法可能不适用于肛门括约肌松弛或尿失禁的患者。
此外,在结肠镜检查和结肠通路介导的经内镜肠道植管术方面,它具有多种优势,主要包括:
(1)能够完整显示结肠和活检可疑组织的情况,有利于疾病的诊断、识别和分期;
(2) 允许操作人员直接评估肠道炎症,并在适当的部位注入足量的供体粪便细菌;
(3) 可将肠道菌群准确移植到受影响的肠段,并进一步将细菌保留在目标肠段;
(4)可以准确地输入足量的供体粪便菌,可以在一定程度上提高治疗效率。
然而,这些手术也伴随着部分不良事件,包括加重肠道反应。
粪菌移植的主要操作方式及优缺点


Zhang YW,et al.J Bone Miner Metab.2022
▼
粪菌移植的安全性主要与两方面因素有关,即供体的生物安全性、移植的操作安全性。
•供体的生物安全性
供体不仅要筛查排除乙肝、丙肝、梅毒、艾滋病、这些已知传染病,还要排除寄生虫、条件致病菌感染,甚至连饮食习惯、排便习惯、情绪状态、肿瘤家族史都要进行调查,不符合要求的都要排除。
供体的筛查可以说是“百里挑一”,要成为一个合格的供体是非常困难的。所有这些筛查工作都是为了保证供体的生物安全性。
•移植的操作安全性
移植的操作安全性主要与移植的方式有关。经胃镜、结肠镜的移植操作风险与常规胃镜、结肠镜检查的风险基本一致。
注:在后面的章节我们会详细讲述粪菌移植操作的具体要求。

为了评估粪菌移植的安全性,上海同济粪菌移植工作组主任等研究人员对8547名采用过粪菌移植的患者进行跟踪研究,得出以下结论:
1、回顾性分析数据表明,粪菌移植的短期和长期(从2周到5年)安全性都是比较好的,患者不要担心;
2、短期不良事件与粪菌移植给药方法有关,多为轻中度、较短暂,包括恶心、呕吐、腹泻等,只有42名(0.5%左右,很低比例)患者发生胃肠症状恶化;
3、长期随访期间的新发疾病主要是胃肠道和呼吸道疾病,发病率与一般人群无异;
4、 随访期间无粪菌移植相关感染传播事件,11例死亡与粪菌移植无关;
5、通过规范适应症和给药时机后,短期安全性和患者满意度升高。
所以,粪菌移植还是比较安全的。
粪菌移植已被证明是治疗多种胃肠道疾病的有效方法,然而,粪菌移植的潜在长期影响以及粪菌移植的最佳频率和剂量仍未得到很好的了解。
本章节旨在回顾有关粪菌移植潜在长期影响的现有文献,并为未来的研究和临床实践提供建议。
▼
虽然粪菌移植已被证明在短期内有效,但对粪菌移植长期影响的研究有限,粪菌移植对肠道微生物组和整体健康的长期影响仍不清楚。
✦可能导致抗生素抗性基因的转移
粪菌移植是一种医疗程序,它将健康捐赠者粪便中的微生物移植到受体的肠道中,以恢复或改善肠道微生物平衡。虽然粪菌移植已被证明在治疗某些疾病方面非常有效,但它的使用也存在一定争议。
一些研究表明,粪菌移植可能会产生意想不到的后果,例如抗生素抗性基因的转移或致病菌的引入。
✦病毒或其他感染因子可能通过粪菌移植传播
此外,人们还担心病毒或其他感染因子可能通过粪菌移植传播。需要更多的研究来充分了解粪菌移植的长期影响,并制定安全有效地使用该程序的指南。
▼
✦粪菌移植的监管
粪菌移植的监管因国家而异,一些国家如美国对其使用采取更为严格的方法。在美国,粪菌移植被美国食品药品监督管理局作为生物制品进行监管,只批准用于治疗未对其他治疗方法产生反应的复发性艰难梭菌感染。
在欧洲,粪菌移植通常被视为医疗程序,并由国家卫生部门进行监管。
✦粪菌移植的伦理问题
粪菌移植的伦理考虑包括知情同意、捐赠者选择以及对捐赠者和受体的潜在风险。捐赠者必须接受广泛的筛查,以确保他们健康且没有传染病,并且必须同意他们的粪便用于粪菌移植。
受体也必须提供知情同意,并且必须完全了解该程序的潜在风险和好处。粪菌移植的主要争议之一是该程序缺乏标准化。目前没有粪菌移植的标准化方案,粪便成分在捐赠者之间可能会有很大的差异。
▼
✦粪菌移植的剂量会影响其疗效
目前,粪菌移植的最佳频率和剂量仍不确定。一些研究表明,粪菌移植的剂量可能会影响其疗效,但目前还没有确定最佳剂量的标准。
✦一般需要多次粪菌移植
关于粪菌移植的频次,目前尚无明确的建议。一些研究表明,单次粪菌移植可能无法完全恢复肠道微生物群的平衡,需要多次粪菌移植才能达到最佳疗效。
单次粪菌移植可以有效治疗某些疾病,如复发性艰难梭菌感染。然而,对于其他疾病,可能需要多次粪菌移植才能获得最佳效果。
但是,多次粪菌移植也可能增加感染和其他不良反应的风险。因此,粪菌移植的频次应根据患者的具体情况和病情进行个体化的决策。
总之,粪菌移植的最佳频次和剂量应根据患者的具体情况和病情进行个体化的决策,同时应注意监测和预防不良反应的发生。
需要更多的研究来确定粪菌移植的最佳频率和剂量,以便在临床实践中更好地使用该程序。
根据《上海市菌群移植技术管理规范(2021年版)》,以下是部分粪菌移植操作要求:
▼
(一)严格遵守粪菌移植治疗操作规范和诊疗指南,严格掌握粪菌移植治疗适应证和禁忌证。
▷粪菌移植适用于治疗以下消化系统疾病
(1)艰难梭状芽胞杆菌感染:复发性/难治性艰难梭状芽胞杆菌感染。
(2)其他消化系统疾病:溃疡性结肠炎、克罗恩病、功能性便秘、肠易激综合征、菌群紊乱相关腹泻等。
▷粪菌移植治疗的其他疾病
(1)神经系统疾病:帕金森病、阿尔兹海默症、癫痫等。
(2)精神疾病:自闭症、情绪障碍、多动症、抽动症等。
(3)代谢相关疾病:代谢综合征、糖尿病等。
(4)肿瘤相关疾病:免疫治疗及放化疗所致肠炎等。
(二)除复发性/难治性艰难梭状芽胞杆菌感染外,出于其他治疗目的使用粪菌移植治疗均须以临床研究形式开展,并通过本机构伦理审查与备案。
(三)实施粪菌移植治疗前应当向患者及其家属告知治疗目的、风险、注意事项及可能发生的并发症等,并签署知情同意书。
(四)医疗机构应当建立完整的电子化临床数据库及严格的术后随访制度,在完成每例粪菌移植治疗后应当按照有关规定将治疗相关信息上报卫生健康行政部门。
▼
(1)有明确与肠道菌群紊乱有关的肠道内疾病,如肠功能障碍性疾病、肠道感染性疾病(复发性艰难梭菌感染)、肠道炎症性疾病及假性和麻痹性肠梗阻等;
(2)有明确与肠道疾病或者肠道菌群紊乱有关的肠道外疾病,如便秘合并帕金森病、便秘或腹泻合并自闭症、便秘或腹泻合并过敏性皮炎;
(3)患者需充分理解粪菌移植治疗过程及机制,并签署知情同意书。
!
出现以下情况之一不宜进行粪菌移植:
(1)肠道大面积溃疡、出血;
(2)移植通道梗阻;
(3)移植操作本身(内镜、置管、灌肠、经口饮食)的禁忌证;
(4)未通过伦理审核的临床试验或患者拒绝接受粪菌移植。
(5)生命体征(体温、心率、血压、呼吸)不稳定;
(6)严重免疫系统紊乱;
(7)孕妇或哺乳期妇女;
(8)代偿或者失代偿肝功能障碍。
▼
(1)个人情况:作息规律,饮食健康,家庭和睦,无不良性交,无吸烟、饮酒、吸毒等嗜好,无药物成瘾,近6个月未接种过疫苗或参加药物试验,近6个月未接受纹身或出现皮肤破损,近6个月无热带地区旅居史;无胃肠道病变家族史,无恶性肿瘤家族史,无传染病家族史;非孕期,非经期。
(2)开展病史和身体检查,评估供体的健康状况和是否符合粪菌移植的供体资格;选择无传染病史、无抗生素使用史、无消化系统疾病等方面的供体。
身体状态:年龄18-30周岁,体重指数(BMI)18.5-23.9 kg/m2,儿童医院开展粪菌移植,供体要求可放宽至15-30周岁。
心理状态:心理科医师或心理咨询师访谈认定心理状态良好;抑郁自评量表(SDS)、焦虑自评量表(SAS)、匹兹堡睡眠质量指数(PSQI)等评分正常。
(3)进行多项检测,如血液化验、粪便检测、病原菌检测、URTI检测等,确保找到适合的健康供体;以确保其不携带有害微生物和多重耐药菌。同时,需要考虑供体的肠道微生物组成和短链脂肪酸水平,以选择最适合的供体。
血液学检测:包括血常规、肝肾功能、电解质、C反应蛋白正常,肝炎病毒、HIV、梅毒、EB病毒、巨细胞病毒、COVID-19抗体、线虫、阿米巴等病原检测阴性;
粪便检测:粪便常规检查正常,隐血实验阴性,艰难梭菌、弯曲菌、沙门菌、志贺菌、产志贺毒素大肠杆菌及虫卵、小肠结肠耶尔森菌、致病性弧菌(副溶血弧菌、霍乱弧菌)、气单胞菌、阿米巴、孢子、诺如病毒、轮状病毒和新型冠状病毒(COVID-19)等病原学检测阴性。
(4)评估供体的肠道微生物组成,多样性和稳定性,包括菌群、真菌群和病毒群,并建立数据库;在选择供体时,除了肠道微生物群的总体多样性外,还应考虑到益生菌的丰富度,如乳酸菌、双歧杆菌等,选择粪便丁酸浓度高的供体微生物组。
(5)根据评估结果选择合适的供体,注意进行家族成员偏向,判别成熟度和完整性,同时避免与患者组群共同优势菌种重合等;一些研究表明,供体微生物组成与受体的微生物组成相似,可以提高移植成功率。
(6)移植前需对受体进行评估和准备,包括清洁肠道和停用抗生素等;为了提高移植效果,一些研究还使用抗生素预处理和肠道灌洗等方法来增强供体菌株的移植。
限食耐受性:通过限食实验完成。部分受体存在食物过敏及食物不耐受(如鸡蛋、牛奶等),根据受体要求,供体需在捐赠粪便前5天限制食物种类,如该供体不可耐受,则不可作为本次移植的捐赠者。
(7)进行移植后,对受体的微生物组成进行多次采样和分析,以评估移植效果和持续时间;
①每2个月复查以上条目,仍然符合上述要求;
②每次捐赠的粪便均留样行宏基因或者16s rDNA测序(根据各自单位检测能力),保证菌群组成及多样性稳定;
③每次捐献粪便应留样行代谢组学检测。
(8)监测受体的生理状况和不良反应,及时采取措施进行处理。
▼
(1)粪便采集:应采用无菌容器采集,粪便重量不少于100g,性状为Bristol评分标准中3-5分方为合格,立即进入菌液制作流程,或立即密封后2-8℃保存。
(2)制作流程:每次需取不少于50g粪便与无菌生理盐水以1∶3比例混合,充分搅拌混匀后过滤,从粪便排出体外至菌液制作完成应保证在2小时以内,整个处理过程应在无菌环境下操作。
注:为了避免感染窗口期的问题,菌液或胶囊制备后应待21 天后经过病毒细菌等检验合格后出库,每批产品留样至少6个月以供追溯。
(3)冻存与复融:菌液制备完成后置于-80℃保存,6个月之内使用不影响疗效;如置于-20℃保存,应在1-4周内使用。使用前置于室温复融,6小时内输注;如使用水浴锅复融,则水温不得超过37℃。
(4)质控标准:每次制作完成的菌液应随机抽样,进行致病菌监测、细胞计数及宏基因或16s rDNA菌群测序。
每50mL菌液中活细胞数应不小于2.5×10^12个,同供体同批次样本应达到菌群组成一致,6个月内同供体不同批次样本应达到菌群组成差异无统计学意义。
制作完成的菌液应有独立包装与标签。如制作胶囊,还应取胶囊内容物进行细菌活性监测与活细胞计数,其中细菌活性应不低于85%,每克内容物包含活菌数不小于10^9CFU。
▼
(1)菌液输注前需结合患者自身情况及疾病种类行肠道准备。
(2)应根据指南及操作规范选择上消化道或下消化道进行菌液输注。
(3)操作时应观察患者耐受情况,并及时处理不良反应。
▼
(1)管理原则:医疗安全(不良)事件的管理,遵循预防为主、紧急处理、合理控制、防微杜渐、持续改进的原则。
(2)上报要求:凡科室职工均有权上报医疗安全(不良)事件,可通过网络、书面、电话上报,上报时限要求在不良事件发生后24小时之内。
(3)审核、处置要求:科室负责人24小时内审核、处置科室发生的不良事件,并呈报至相关职能部门。
注意:主管职能部门自接报之日起,24小时内审核、处置不良事件;对于接报的Ⅱ级及以上不良事件,应呈报至主管院领导。
主管院领导对于接报的Ⅱ级及以上不良事件,必要时组织委员会进行讨论分析,并提交院务会。
▼
(1)每次菌液输注后密切观察患者耐受情况24小时,如有不良反应立刻处理并及时上报。
(2)1个疗程治疗结束后4周内应对患者症状学和肠道菌群改善情况进行评估,粪菌移植治疗疾病的随访及疗效判断指标主要遵循原发疾病的治疗指南。移植前后重复检测粪便及血液中传染病相关指标,有条件者可行免疫相关检测。
注意:如第1个疗程结束3周后病情无改善,可尝试更换供体,重新给予1个疗程粪菌移植,若有效可继续治疗,若仍无效则应视为粪菌移植无反应性,此时不应继续给予粪菌移植,以免耽误病情;如患者接受粪菌移植治疗后症状明显改善,可重复3-5次粪菌移植后结束治疗。
随访至末次粪菌移植结束后至少8周,有条件者应进行大于1年甚至5年以上的长期随访。
随着对微生物与宿主相互作用的了解不断加深,肠道微生物群的参与已成为一种新颖、巧妙且不可忽视的调节宿主健康的方式。
粪菌移植是一种治疗胃肠道疾病的有效方法,还有望治疗其他更多疾病。未来的研究应该重点关注粪菌移植对肠道微生物组和整体健康的长期影响,并制定安全有效地使用该程序的指南。
此外,需要进一步研究如何提高粪菌移植的改善效果,供体和受体的配型以及移植肠道菌群的定植和效果的长期性,以便在临床实践中更好地使用。
主要参考文献:
Zhang YW, Cao MM, Li YJ, Zhang RL, Wu MT, Yu Q, Rui YF. Fecal microbiota transplantation as a promising treatment option for osteoporosis. J Bone Miner Metab. 2022 Nov;40(6):874-889.
Biazzo M, Deidda G. Fecal Microbiota Transplantation as New Therapeutic Avenue for Human Diseases. J Clin Med. 2022 Jul 15;11(14):4119.
Quaranta G, Guarnaccia A, Fancello G, Agrillo C, Iannarelli F, Sanguinetti M, Masucci L. Fecal Microbiota Transplantation and Other Gut Microbiota Manipulation Strategies. Microorganisms. 2022 Dec 7;10(12):2424.
Vendrik KEW, Ooijevaar RE, de Jong PRC, Laman JD, van Oosten BW, van Hilten JJ, Ducarmon QR, Keller JJ, Kuijper EJ, Contarino MF. Fecal Microbiota Transplantation in Neurological Disorders. Front Cell Infect Microbiol. 2020 Mar 24;10:98.
Wang JW, Kuo CH, Kuo FC, Wang YK, Hsu WH, Yu FJ, Hu HM, Hsu PI, Wang JY, Wu DC. Fecal microbiota transplantation: Review and update. J Formos Med Assoc. 2019 Mar;118 Suppl 1:S23-S31.
Chen D, Wu J, Jin D, Wang B, Cao H. Fecal microbiota transplantation in cancer management: Current status and perspectives. Int J Cancer. 2019 Oct 15;145(8):2021-2031.
Stallmach A, Steube A, Stallhofer J, Grunert PC, Merkel U, Hartmann M. Fäkaler Mikrobiomtransfer – Indikationen, Risiken und Chancen [Fecal microbiota transplantation: indications, risks and opportunities]. Inn Med (Heidelb). 2022 Oct;63(10):1036-1042. German.

谷禾健康
健康的肠道微生物群特点是氧气含量低,并且存在大型专性厌氧菌细菌群落,这些共生菌通过限制肠道病原体的扩张为宿主提供益处。
那么是什么导致肠道健康走下坡路,是什么原因引起肠道菌群失调,在科学界一直有2种观点:
■ 一种是“营养生态位假说”
大肠内多种微生物的共存要求群落中的每个成员,都能够比所有其他成员在少数有限资源条件下,能更快地生长。
■ 另外一种是“氧气假说”
氧气增加将中断或抑制厌氧菌群的生长繁殖,同时导致将赋予兼性厌氧菌甚至需氧菌生态选择优势,使它们变得更具竞争力并可能过度生长。相反,对氧气敏感并因其存在而受到伤害的专性厌氧菌将处于不利地位。
当我们有肠道炎症时会发生什么?
上皮细胞,即肠道内的细胞,开始发炎,它们开始将氧气泄漏到肠道中。当这种情况发生时,许多机会性病原体如大肠杆菌、沙门氏菌和肠球菌属(Enterococcus)等喜欢氧气的菌,可以在有氧条件下利用氧气作为电子受体代替其他代谢途径,从而获得更多的能量和生长优势。
在不同的慢性疾病中,常常观察到兼性厌氧菌的过度生长,这些微生物可以在氧气存在时使用它们,并且会“竞争”,消耗其他有益微生物所需的营养物质,包括一些对维持肠道屏障非常重要的产丁酸菌,如毛螺菌科、梭状芽孢杆菌、真杆菌属、罗氏菌属、普拉梭菌等,导致肠道菌群失衡,从而引起多种消化系统问题和慢性疾病。
人体需要氧气才能生存。几乎人体内的每个细胞都需要氧气。
然而地球上大部分微生物却不能很好地耐受氧气,例如肠道的大多数微生物细胞在缺氧的环境中才可以茁壮成长。在健康状态下,结肠是一个低氧环境。如果肠道状态受到干扰,比如使用抗生素,发炎,氧气泄漏到肠道中,它会加剧细菌失衡和炎症,从而开始肠道生态失调、细胞处理能量饥饿和炎症的恶性循环中。
本文我们将重点讨论氧气与肠道菌群失调之间的联系,并分享总结氧气对肠道治疗的潜在影响。
# 1
健康的人类结肠含有估计超过30万亿个细菌细胞,这些细菌很重要,可以分解复杂的碳水化合物,蛋白质等,产生重要的肠道代谢物(如短链脂肪酸)等。然而这些细菌中大部分只能在缺氧的环境中生长和繁殖,属于专性厌氧菌。
婴儿时期,低氧环境利于专性厌氧菌定植
在婴儿的“经典”定植模式中,第一步涉及兼性厌氧菌,例如大肠杆菌(Escherichia coli)和肠球菌(Enterococcus)。
兼性厌氧菌在胃肠道的定植发生在,出生后立即发生氧化还原电位 (简称Eh) 高或呈阳性的肠道环境中。兼性厌氧菌的增加导致可用氧的消耗,从而产生一个氧气减少的环境,有利于出生后几天内专性厌氧菌的到来。然后,与氧气浓度相关的 Eh 降低到一个低水平,类似健康成人的肠道那样。
氧化还原状态通过创造抑制竞争者和潜在肠道病原体的生理环境来参与抵抗肠道定植。未经处理的小鼠大肠中的 Eh 约为 -200 mV。用链霉素处理后,脂肪酸水平下降,氧化还原态变为 +200 mV,同时沙门氏菌数量增加。
健康成人的肠道内:大量专性厌氧菌
在健康成人中,胃肠道远端的特点是低氧张力,通常含有大量专性厌氧菌群落:
大部分胃肠道的细菌在体外很难或还没有被培养出来,部分原因是它们的厌氧或对氧气的敏感性,及时培养出来的也需要长时间和费力的技术。
在过去的几十年中,健康人肠道微生物群的组成已经通过独立于培养的技术进行了探索,并通过测序分析进一步描述,在大人群水平的微生物群中鉴定出超过 20个门。两个主要的门,厚壁菌门和拟杆菌门,占肠道细菌的 90%,主要是专性厌氧菌。
在较低的分类学水平上,一个个体通常存在多达一千种。在个体间变异中,个体间共享的物种少于 60 种。这些物种代表了核心肠道微生物群。
肠道核心菌属
人体肠道菌群中的核心菌属是指在不同人群中普遍存在、数量相对较高、对人体健康具有重要作用的菌属。
目前对于核心菌属的定义还没有统一标准,但一般认为核心菌属应该具备以下特征:
1. 在不同人群中普遍存在:核心菌属应该在不同人群中都能够被检测到,而不是仅存在于某些特定人群中。
2. 数量相对较高:核心菌属应该在肠道菌群中占据较高的比例,而不是仅占据极小的比例。
3. 对人体健康具有重要作用:核心菌属应该对人体健康具有重要作用,如参与食物消化、维持肠道屏障功能、调节免疫系统等。
谷禾健康基于庞大的60万人肠道菌群检测样本数据,给出了人体肠道菌群核心菌属的标准:
在90%人群检出,人群平均丰度1%以上的菌属为核心菌属(双歧杆菌和乳杆菌作为益生菌相对丰度低于1%但是重要性很高)。
核心菌属及有益菌累加占总肠道菌群比例低于60%就可能出现肠道菌群紊乱。
# 2
现在,“肠道菌群失调”通常是指肠道微生物群的状态改变,一般与疾病有关。在肠道生态失调期间观察到的最一致和最强大的生态模式可能是属于变形菌门的兼性厌氧细菌的扩张。
变形菌门是人类肠道中常见的五种主要细菌门之一。它包括多种属,包括埃希氏菌属、志贺氏菌属、沙门氏菌属、螺杆菌属、弧菌属、耶尔森氏菌属、假单胞菌属、弯曲杆菌属和脱硫弧菌属,其中大多数被认为是机会性病原体。
关于变形菌门详见:
氧气的存在使变形菌门有了生存优势
在平衡的生态系统中,低丰度时无害的微生物,但当环境变得特别适合它们的生长时,它们会迅速扩散并引起问题。
导致变形杆菌快速扩张的一个环境因素是——氧气。大多数变形菌是兼性厌氧菌,这意味着它们可以在氧气存在的情况下生存和繁殖。这使它们在含氧环境中比有益的专性厌氧菌具有显着的竞争优势。
变形菌扩张的同时,产丁酸菌减少
值得注意的是,变形杆菌的扩张几乎总是伴随着产丁酸盐细菌丰度的减少。高变形菌和低产丁酸菌这种组合,是微生物群失调特征,并与许多慢性疾病有关,包括:炎症性肠病、肠易激综合症、结直肠癌、憩室炎、组胺不耐受、2 型糖尿病、肥胖等。
这个特征还表明,存在潜在的上皮功能障碍,这个后面会讲到。
# 3
专性厌氧菌产生的一种代谢物是丁酸盐。丁酸盐是这些细菌在结肠中代谢膳食纤维时产生的短链脂肪酸之一。我们之前写过丁酸盐对健康的好处,包括它能够减轻神经炎症、预防结肠癌和帮助维持肠道屏障功能。
丁酸盐给结肠细胞提供能量,该过程耗氧量大,由此导致的低氧对维持肠道稳态很重要
在健康的肠道中,丁酸盐提供结肠细胞所需能量的大约 70%。这些结肠细胞排列在结肠上,形成肠道屏障。被结肠细胞摄取后,丁酸盐和其他短链脂肪酸通过β 氧化途径在线粒体中分解。该过程使用大量氧气。事实证明,这种结肠细胞耗氧量对于维持肠道稳态非常重要。
2015 年,科罗拉多大学研究小组证明,丁酸盐的肠道代谢是维持结肠“生理性缺氧”所必需的。通过一系列实验,他们证明了丁酸盐以及较小程度上的短链脂肪酸丙酸盐和乙酸盐会耗尽结肠细胞中的氧气水平。低氧导致缺氧诱导因子 (HIF)的蛋白质稳定,它在细胞中充当一种“氧传感器”。
氧气含量高低如何影响HIF?
当氧气水平低时,HIF 会促进有助于协调肠道屏障保护的基因的表达。如果氧气水平升高,HIF 将不再稳定,这些肠道保护基因将不再表达。
抗生素是否会影响缺氧,从而影响肠道屏障?
研究人员仅使用三天广谱抗生素后,丁酸盐水平急剧下降,肠道含氧量上升,上皮缺氧状态消失。氧气传感器 HIF 不再稳定,肠道保护基因不再表达,导致肠道屏障功能丧失。
这不仅仅是因为缺乏纤维(纤维是生产丁酸盐的基质),抗生素治疗小鼠的肠道菌群,完全丧失了从膳食可发酵纤维中产生丁酸盐或其他短链脂肪酸的能力。不过好在他们又发现,补充丁酸盐能够挽救“生理性缺氧”,修复肠道屏障功能。
# 1
上皮细胞是排列在肠道壁上的细胞,是宿主与微生物通讯的主要界面。
正常代谢过程,正反馈循环维持稳态
当肠道健康且处于体内平衡状态时,结肠细胞主要通过利用大量氧气的过程代谢丁酸等脂肪酸。由此导致的肠道粘膜缺氧有助于维持以专性厌氧菌为主的肠道微生物群。
这些专性厌氧菌反过来通过将纤维发酵成短链脂肪酸(如丁酸盐)来促进健康,短链脂肪酸被结肠上皮细胞吸收。这种正反馈循环可维持肠道健康状态。
异常:结肠细胞从其他途径获取能量带来的问题
然而,当干扰使结肠上皮细胞的代谢远离脂肪酸的 β 氧化时,系统就会崩溃。能量匮乏的结肠细胞必须寻找其他能量来源,最终从血液中提取葡萄糖并将其发酵成乳酸,这个过程不使用氧气。由此产生的炎症也会导致硝酸盐的产生增加。由于没有其他地方可去,氧气、乳酸盐和硝酸盐会“泄漏”到肠道粘膜中。
那么氧气泄露到肠道粘膜后会发生什么呢?
这种变化有利于变形杆菌门中的病原体茁壮成长。例如沙门氏菌、克雷伯氏菌、柠檬酸杆菌和大肠杆菌,它们可以耐受氧气并依靠乳酸和硝酸盐。
同时,结肠的氧合作用抑制了专性厌氧菌的生长,包括非常重要的产丁酸菌。换句话说,“结肠细胞的新陈代谢充当肠道微生物群的控制开关,调节群落在稳态和失调之间的转变。”
兼性厌氧菌:有氧也可以生长,包含许多肠道病原体,引发炎症
健康的结肠还可能含有少量兼性厌氧菌,它们能够在有氧或无氧环境中生长和繁殖。兼性厌氧菌包括许多肠道病原体。健康肠道的低氧浓度和丰富的专性厌氧菌都会抑制这些兼性厌氧菌的生长。
所以一般来说,兼性厌氧菌往往更容易发炎,所以它们往往会给肠道带来压力,引起炎症、结肠上皮细胞缺氧,肠道通透性增加,并且还会直接使肠道上皮细胞发炎,然后导致肠道产生更多的氧气。
病原菌破坏肠道菌群,继续扩张,形成恶性循环
因此,这些病原体几乎可以破坏肠道新陈代谢,为自己提供生存所需的底物,开始扩张,然后形成了一个恶性循环。兼性厌氧菌大多数都属于变形菌门,特别是肠杆菌科在这种氧气泄漏增加的情况下最常见,如在IBD中那样,潜在有害的变形菌,尤其是肠杆菌科的大量繁殖,也就是增强炎症反应。一些粘附侵入性大肠杆菌 (AIEC) 在 IBD 发病机制中发挥重要作用(关于IBD中肠道菌群变化与氧气相关在后面章节有详细介绍)。
这些观察结果表明变形杆菌的生态失调扩张是肠道菌群失调和上皮功能障碍的潜在诊断微生物特征。
# 2
抗生素介导的肠道微生物群破坏,会增加感染沙门氏菌引起的胃肠炎的风险,它会增加患者肠道携带沙门氏菌血清型的持续时间,并且偶尔会导致复发。
使用一种特殊的染色技术,有研究人员证明,抗生素治疗增加了结肠细胞的氧合作用并导致肠道粘膜缺氧的丧失(也就是说进去了些氧气)。这种缺氧丧失导致沙门氏菌和其他兼性厌氧菌在氧气驱动下扩张。
链霉素 -> 肠道菌群破坏 -> 兼性厌氧菌扩张
链霉素介导的小鼠肠道菌群破坏,与兼性厌氧肠杆菌科(例如共生大肠杆菌)或致病性肠沙门氏菌不受控制的扩张有关。
注:实验室特别选择了链霉素,因为它在消除梭状芽孢杆菌方面特别有效,这样他们就可以研究丁酸盐消耗对结肠代谢的影响。链霉素通常不用于人体口服;然而,已知许多其他广谱抗生素会影响产生丁酸盐的细菌,因此 1-2 周的其他抗生素疗程可能也会通过相同的机制促使氧气泄漏到肠道中。
链霉素治疗 -> 耗尽产短链脂肪酸菌 -> 短链脂肪酸降低
链霉素治疗,优先耗尽肠道相关微生物群落中属于梭状芽胞杆菌纲(Clostridia)的细菌。链霉素处理后恢复定植抗性的尝试表明,转移梭状芽胞杆菌(Clostridia)在防止小鼠肠道内共生大肠杆菌扩张方面最有效。
梭状芽胞杆菌是肠道相关微生物群落中短链脂肪酸的重要生产菌。链霉素治疗与大肠中短链脂肪酸浓度的显着降低有关。由于短链脂肪酸可在体外阻碍大肠杆菌或肠道沙门氏菌(S. enterica)的生长,因此有人提出短链脂肪酸这些代谢物的存在,通过代谢排斥限制了大肠中肠杆菌科的生长。
也有人认为,短链脂肪酸的代谢排斥不足以解释问题
然而,有的研究者认为,短链脂肪酸的代谢排除,无法解释共生肠杆菌科在健康个体中保持低丰度,因为过多的抑制物会导致它们被消除,而过少的抑制物会导致它们的扩张,直到另一种资源变得有限。将肠杆菌(Enterobactericeae)维持在恒定的低水平需要持续保持一种精确的抑制剂浓度,这与体内发生的短链脂肪酸浓度波动不相容。
一个更强大的抗定植概念框架:营养生态位假说
它提出大肠内多种微生物物种的共存,要求群落中的每个成员都能够比所有其他成员在少数有限资源上更快地生长。
为了解释抗生素治疗后肠杆菌科不受控制的扩张,营养生态位假说预测,抗生素介导的肠道微生物群破坏,增加了通常限制肠杆菌科生长的关键资源的可用性。
因此,要了解定殖抗性,揭示此类有限资源的特性,并阐明抗生素处理后它们的丰度升高的原因至关重要。
抗生素介导的肠道菌群消耗,增加了唾液酸和岩藻糖的可用性
肠道相关微生物群落中的糖分解细菌可以从复杂的碳水化合物中释放出这些糖分,并随后消耗它们。链霉素治疗提高了唾液酸和岩藻糖的可用性,这有助于链霉素治疗小鼠肠腔扩张。
链霉素处理后在小鼠盲肠粘膜中观察到的另一个变化是,诱导型一氧化氮合酶(iNOS)的合成增加,一种宿主酶,可催化l-精氨酸产生一氧化氮 (NO)。
源自一氧化氮的活性氮物种可以氧化单糖,例如半乳糖和葡萄糖,分别产生葡糖二酸和半乳糖二酸,这在链霉素处理的小鼠的生长过程中赋予大肠杆菌和鼠伤寒沙门氏菌的管腔适应性优势。
总的来说,这些数据表明糖是肠道中的关键资源,但目前尚不清楚为什么肠杆菌科在这些有限资源上,比肠道微生物群的所有其他成员生长得更快。
最近的数据表明,肠杆菌科可以在可用碳源上生长得更快,因为抗生素介导的微生物群落破坏,通过改变宿主生理学提高了呼吸电子受体的可用性。
在这方面特别重要的一种微生物代谢物是短链脂肪酸丁酸盐。肠道微生物群通过乙酰辅酶 A 途径、戊二酸途径、4-氨基丁酸途径或赖氨酸途径产生丁酸,编码这些途径的大多数细菌都是梭状芽胞杆菌纲的成员。
丁酸盐是结肠细胞的重要能量来源。结肠的主要功能是通过吸收钠 (Na + )产生渗透梯度来吸收水分。Na +通过位于表面结肠细胞顶膜中的通道沿着电化学梯度扩散,然后被位于其基底外侧膜中的 Na +泵(Na + K + ATP 酶)主动挤出。
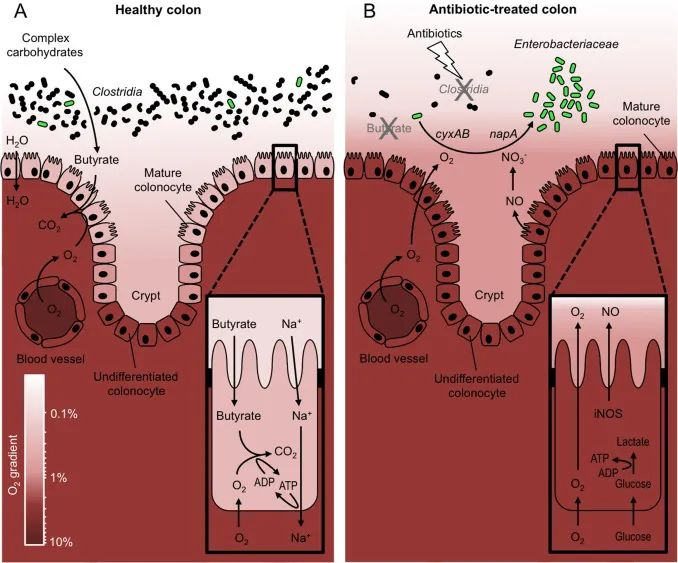

DOI: 10.1016/j.freeradbiomed.2016.09.022
表面结肠细胞激活 Na+ 所需的 ATP运输来自微生物群衍生的丁酸盐氧化成二氧化碳 (CO2)。这种新陈代谢消耗大量氧气,从而使表面结肠细胞缺氧,这对应于小于 7.6 mmHg(<1% 氧气)的氧分压 (pO2)。相比之下,含氧量正常的宿主组织的 pO2在 23 和 70 mmHg 之间(即含氧量在 3% 和 10% 之间)。
# 3
某些病原体也可能利用这种结肠细胞转换在肠道中获得竞争优势。如果你曾经因急性食物中毒而倒下,之后又出现肠道健康问题,这可以解释原因。
在前面中提到的某些沙门氏菌菌株(特别是肠沙门氏菌血清型鼠伤寒沙门氏菌,以下缩写为S. Tm)可以操纵宿主上皮细胞以促进肠道菌群失调。
S. Tm 是一种特别有毒的细菌,它会侵入宿主粘膜,引起严重的炎症。这种炎症导致产生丁酸盐的梭状芽胞杆菌耗尽,进一步增强了S. Tm 在肠道中增殖的能力。换句话说,这表明某些病原体可能会“破坏”肠道新陈代谢以增加自身健康,从而损害健康细菌。
值得注意的是,丁酸盐生产者的消耗似乎比抗生素治疗更缓慢,大约需要 1-3 周,但恢复速度也慢得多。感染后 4 周,梭菌的丰度仍比基线水平低两个半数量级。
由S. Tm 引起的炎症还导致活性氧和氮物质释放到肠道中,它们与单糖反应形成底物,选择性地喂养S. Tm 和肠杆菌科(变形杆菌门)内的其他微生物。
这不仅适用于S. Tm。在小鼠模型中证明,柠檬酸杆菌(Citrobacter)和空肠弯曲杆菌(Campylobacter jejuni)感染也能够引起宿主肠道炎症并驱动肠杆菌科过度生长。
空肠弯曲杆菌详见:细菌大盘点(二) | 葡萄球菌、沙门氏菌、弯曲杆菌
总的来说,这表明肠道感染可能有助于结肠的氧合作用并促进肠道生态失调的长期状态。因此,清除现有感染可能是恢复肠道上皮细胞正常代谢和健康肠道微生物群的关键步骤。

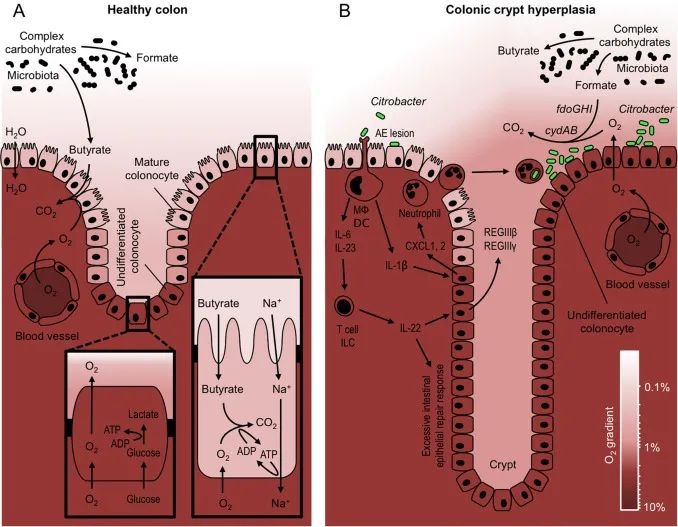
DOI: 10.1016/j.freeradbiomed.2016.09.022
(A) 专性厌氧菌降解复合碳水化合物产生发酵产物,如甲酸盐和丁酸盐。成熟的结肠细胞通过将丁酸氧化成二氧化碳 (CO2 ) 来产生能量 (ATP),这会导致粘膜表面缺氧。相反,位于隐窝中的未分化结肠细胞通过将葡萄糖发酵成乳酸来获取能量。
(B) 病原体C. rodentium ( Citrobacter ) 利用其毒力因子紧密附着在结肠细胞表面(AE 损伤)。树突状细胞 (DC) 和巨噬细胞 (MΦ) 引起的宿主反应导致产生作用于结肠细胞和淋巴细胞(T 细胞和 ILC)的细胞因子(IL-6、IL-23 和 IL-1β),从而诱导合成嗜中性粒细胞趋化因子(CXCL1, 2) 和 IL-22,可激活上皮增殖。
过度的上皮增殖导致隐窝伸长和粘膜表面未分化的含氧量正常的结肠细胞的积累。由此产生的氧气扩散到肠腔的增加,使用cydAB基因驱动C. rodentium的有氧扩张,编码高亲和力细胞色素bd氧化酶。由fdoGHI基因编码的氧依赖性甲酸脱氢酶使病原体能够消耗微生物群衍生的甲酸。
右下角显示的色标表示原理图着色方案表示的氧浓度。
#4
到目前为止,我们已经看到两个例子,其中丁酸盐耗尽导致肠道氧合和生态失调。鉴于丁酸盐的第一大来源来自膳食纤维,从理论上讲,低纤维饮食很可能可以通过相同的机制促进变形菌的扩张。
如果膳食纤维摄入量低,丁酸盐和其他短链脂肪酸的产生水平将无法满足结肠细胞的能量需求。结肠细胞将转向厌氧葡萄糖代谢。无氧代谢会消耗更少的氧气,并导致更多的氧气泄漏到肠道中。
虽然这种机制中的所有步骤并没有像低纤维饮食对抗生素和肠道感染的影响那样有序地得到证明,但一些研究确实将低纤维摄入量与较高水平的变形杆菌联系起来:
那么低纤维生酮饮食是否也如此?
正如之前讨论的,酮体乙酰乙酸和 β-羟基丁酸可以补充丁酸作为肠道上皮细胞的燃料来源。因此,低纤维生酮饮食不太可能激活这种机制来驱动肠道菌群失调。事实上,酮可能有助于恢复上皮缺氧。
#5
有趣的是,所有这些肠道菌群失调的驱动因素,包括抗生素、肠道感染和低纤维加工饮食,都与肠道炎症有关。
肠道炎症
2007 年,在动物模型中证明,肠道炎症本身足以破坏肠道微生物群并促进肠杆菌科的过度生长。通过敲除 IL-10,无论是接触葡聚糖硫酸钠(一种破坏肠道屏障完整性的化学物质),还是严重的遗传易感性,都能够导致肠道菌群失调。
其他更温和的炎症因子也可以促进这些炎症细菌的扩张。2015的一项研究表明,给小鼠喂食羧甲基纤维素和聚山梨醇酯 80(加工食品中常用的两种乳化剂),12 周会降低微生物多样性并导致粘膜相关变形菌增加。同样,发现给小鼠喂食无热量甜味剂阿斯巴甜 8 周会导致肠杆菌科细菌增多。
关于食品添加剂与肠道菌群详见:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
心理压力
压力还会促进炎症和肠道菌群失调。研究报道了在慢性社会心理压力的小鼠模型中变形杆菌的扩张。
食物不耐受
未被识别的食物不耐受也可能导致肠道炎症、结肠细胞代谢改变和肠道生态失调,尽管需要更多的研究来证实这一点。
以上,我们已经回顾了一些可能导致肠道缺氧和导致肠道菌群失调的因素。
在患有 IBD 的患者中观察到微生态失调。反复观察表明专性厌氧菌(F. prausnitzii)减少,兼性厌氧菌(肠杆菌科)增加,甚至出现需氧菌。加上远端肠道的正常厌氧肠道生理学,这些观察结果支持了细菌群落变化的假设,该变化是由氧气增加引起的,从而改变了胃肠道中的 Eh。
F. prausnitzii对氧气极其敏感,但仍可以看到粘附在氧气从上皮细胞扩散的肠道粘膜上。为了解释这个悖论,2012有研究报道说F. prausnitzii可以在低氧环境下生长。他们表明F. prausnitzii 利用黄素和硫醇的细胞外电子穿梭将电子转移到氧气。然而,存在于健康人体肠道中 的黄素和硫醇是普拉梭菌在氧气存在下存活所必需的,而在IBD患者的受损组织中可能并非如此。
IBD 患者中的肠道微生态失调
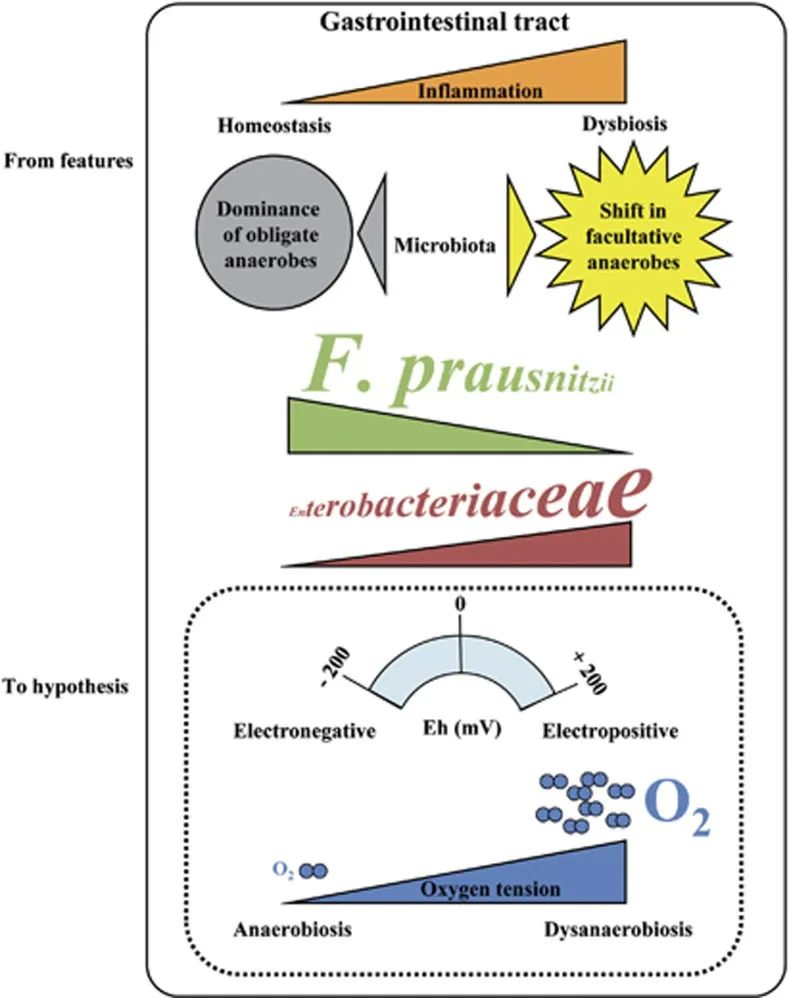

doi: 10.1038/ismej.2013.80
肠道微生物在肠道中的氧依赖性变化
研究在小肠移植和回肠造口术后监测微生物成分,肠道细菌群落从专性厌氧菌转变为以兼性厌氧菌为主的群落,并且肠杆菌科增加,就像 IBD 患者的微生物群一样。
在回肠造口关闭后,假设它提供了氧气入口,转变被逆转,专性厌氧菌再次占主导地位。
这些研究作者提出,氧气是菌群从专性厌氧菌转变为兼性厌氧菌或需氧菌的原因。
虽然肠杆菌科增加,但在大多数患者中未观察到炎症。与 IBD 菌群失调形成鲜明对比的是,乳酸杆菌也大量繁殖,后者很少见乳酸菌增加的报道。研究表明,乳酸杆菌及其细胞壁成分具有抗炎特性,这表明调节或补充乳酸杆菌可能会限制 IBD 患者的炎症反应。
菌群失调与炎症和氧气增加相关
在 IBD 中,氧气浓度的增加可能是由于血液进入胃肠道引起的,这种情况在慢性炎症期间经常观察到,这会促使携带氧气的血红蛋白在肠道细菌所在的肠粘膜和内腔中释放。小鼠模型表明,炎症可能导致微生物群失调,并促进肠杆菌科的过度生长。
一项初步研究评估了克罗恩病中抗肿瘤坏死因子-α 抗体治疗对粪便微生物群的组成和活性的影响,并报告了Faecalibacterium的适度增加, 这表明阻断炎症反应可能会促进这些菌增加。
氧气条件的变化也可能是由于炎症反应本身,导致肠道组织氧化爆发,例如,通过中性粒细胞释放活性氧。有趣的是,活性氧可以与内源性腔内硫化合物反应,形成肠道沙门氏菌使用的呼吸电子受体血清型 Typhimurium(一种好氧物种和属于肠杆菌科的肠道病原体),赋予沙门氏菌相对于专性厌氧菌的竞争性肠道微生物群的生长优势。
“
——丁酸盐有助于恢复肠道菌群
第一步只是确保有基本的健康。我们可以讨论各种先进的肠道干预措施,但最基础的永远都是要从源头上开始,比如说健康的饮食、锻炼、睡眠和压力管理等方式,如果饮食等很糟糕,那么再多肠道治疗,先进的疗法改变肠道和健康状况都不会持久。所以这是第一步。
健康的饮食对于不同人有不同的定义
是的。我们并不完全知道对肠道微生物组最好的饮食是什么,而且并没有一种所谓对肠道微生物组最好的饮食。每个人的微生物组都不同,大家知道,有些人可能对生酮饮食反应非常好,而有些人可能对包含更多植物性食物的饮食效果更好。
建议大家可以从自己身上进行健康探索,比如某一阶段进行某种健康的饮食或生活方式,坚持一段时间后进行肠道菌群检测,配合自身感受,更多角度更细微层次地去了解自己的身体状况。
假如说肠道真的发炎了,做一个短期的低过敏性饮食(比如自身免疫方案)可能是有益的,去除一些更容易引起炎症的食物,至少在一段时间内促进康复。减少炎症将从根本上阻止导致菌群失调的氧气泄漏。
如果变形菌过多和氧气失调的情况发生怎么办?它的典型症状是什么?
通过我们多年研究发现这个可以以很多不同的方式表现出来。基本上这种高变形杆菌和低产丁酸盐的微生物特征存在于各种不同的疾病中:炎症性肠病、肠易激综合症、结直肠癌,也可能是2型糖尿病、肥胖症、过敏以及牛皮癣等。
像这样情况的人通常倾向于腹泻或大便不成形?
不一定。在持续腹胀和胀气的患者身上看到了很多。这是看到的一个非常常见的问题,但它也可能因谷禾目前客户群体而有所偏差。
扩展阅读:“肚子像气球?”“好像怀孕?”——可能是腹胀惹的祸
建议补充丁酸盐可能会扭转这种生态失调状态?
是的,当然并不是单靠补充丁酸盐就一定能够解决这种生态失调。因此,本文概述了一些不同的因素,包括饮食和生活方式因素,以及可能有助于防止氧气泄漏到肠道并恢复体内平衡状态的补充因素,丁酸盐是其中的重要方式之一。
如果没有丁酸盐,氧气没有得到利用,就会溢出肠腔喂养病原体
基本上发生的氧气泄漏的部分原因是肠道内的上皮细胞缺乏能量。当极度缺乏能量时,如果它们没有丁酸盐,就不会代谢丁酸盐。所以从血液中提取葡萄糖,基本上发酵成乳酸,然后乳酸渗入肠道,除了通常通过丁酸代谢使用的氧气。所以实际上如没有丁酸盐存在,就意味着从血液流入上皮细胞的氧气没有得到利用。那就是它最终溢出到肠腔并喂养病原体的时候。
因此,从本质上讲,提供补充丁酸盐就是提供的是上皮细胞喜欢的能量。它们将使用更多的氧气作为丁酸代谢的一部分,并且基本上不需要进行厌氧葡萄糖发酵。这会产生乳酸,最终不会耗尽氧气,这意味着氧气和乳酸会渗入肠道,并喂养沙门氏菌、肠杆菌科和许多不同的变形菌。
抗生素治疗期间补充丁酸盐——雪中送碳
2019 年,在小鼠模型中证明,同时给予丁酸盐和抗生素可以减轻艰难梭菌引起的结肠炎。艰难梭菌是一种革兰氏阳性、形成孢子的细菌,是使用抗生素后肠道感染的常见原因。
在使用抗生素前一天开始补充丁酸盐,并在整个抗生素疗程和 5 天感染挑战期间持续使用。有趣的是,丁酸盐对艰难梭菌定植或毒素产生没有影响,但通过稳定 HIF-1 和增加肠道屏障的完整性,丁酸盐减少了肠道炎症和细菌穿过肠道屏障的运动。
研究人员继续测试另外两种提供丁酸盐的策略。在感染前后的三天内给予高剂量三丁酸甘油酯与丁酸盐具有同样的保护作用,就像在感染前服用抗生素后喂食高纤维饮食(含有高达25%的菊粉)一样。
显然,丁酸盐可以防止抗生素后病原体的扩张。但丁酸盐能否通过支持结肠细胞代谢来预防与抗生素相关的所有生态失调,这仍有待在对照研究中确定。
1
在分子生物学领域,过氧化物酶体增殖物激活受体 (PPAR) 是一组核受体蛋白,作为转录因子调节基因的表达。PPAR 在调节细胞分化、发育和代谢(碳水化合物、脂质、蛋白质)以及肿瘤发生中起着重要作用。
PPAR-γ:一个具体的结肠细胞代谢“开关”
如果说前面一直在抽象地谈论导致肠道菌群失调的结肠细胞代谢“开关”,那么这里来个具体的。研究人员已经确定了一种特殊的基因 PPAR-γ,它似乎可以调节这种转换。PPAR(过氧化物酶体增殖物激活受体的缩写)是一组与 DNA 结合以直接影响基因表达的蛋白质。PPAR-γ 在许多细胞中表达,但在脂肪(脂肪)组织和结肠中表达最高。
健康肠道:
丁酸盐 ⇔ PPAR-γ:互相促进,正向循环
在健康的肠道中,丁酸盐不仅可以为结肠细胞提供能量,还可以增强 PPAR-γ 的激活。这起到了一个正反馈循环的作用:PPAR-γ 激活了增加丁酸盐和其他脂肪酸代谢的基因。这会降低上皮细胞和肠粘膜中的氧气浓度,从而抑制致病性变形菌的生长,并促进有益的、产生丁酸盐的细菌的生长。
失调肠道:没有足够丁酸盐→ 较低的 PPAR-γ 表达→ 致病菌生长
然而,在失调的肠道中,没有足够的丁酸盐或其他底物来激活 PPAR-γ。较低的 PPAR-γ 表达导致 Nos2 的表达增加,Nos2 是编码诱导型一氧化氮合酶 (iNOS) 的基因,并且增加了硝酸盐释放到肠道中。这与厌氧糖酵解产生的乳酸和氧气一起促进了致病菌的生长。
PPAR-γ 激活对于维持肠道先天免疫也至关重要
2010 年发表在PNAS杂志上的一项研究通过一系列实验证明,PPAR-γ 有助于维持抗菌肽β-防御素的持续表达,后者调节结肠的微生物定植。缺乏 PPAR-γ 的小鼠表现出对白色念珠菌、脆弱拟杆菌、粪肠球菌和大肠杆菌的免疫防御缺陷。
分泌型 IgA 的产生也需要 PPAR-γ 。
IgA 详见:对抗病原菌,帮助共生菌定植的“重要开关”
2
多项研究表明,PPAR-γ 激活可能会预防或逆转与免疫激活相关的肠道菌群失调和组织损伤。例如,PPAR-γ 表达在炎症性肠病 (IBD) 中显着降低。
药物激活PPAR-γ :罗格列酮(不适合长期使用)
罗格列酮是一种与 PPAR-γ 结合并增加其活性的药物,在动物模型中已被证明在急性给药时可预防生态失调并减轻结肠炎的症状。虽然这种药物有时仍被用作抗糖尿病药物,但它有一些不良副作用,不适合长期使用。尽管如此,它证明了该途径对肠道微生物群产生重大变化的能力。
药物激活PPAR-γ :美沙拉嗪 (目前使用较多)
研究人员一直在寻找其他方法来刺激这一途径。另一种药物美沙拉嗪也可以激活 PPAR-γ,但程度适中。它在肠道中具有更多的局部作用,因此相对具有更少的全身副作用。这种药物现在被用作 IBD 的一线治疗药物。这种药物的抗炎作用是通过其上调 PPAR-γ 的能力介导的。此外,对照研究表明,美沙拉嗪处理可降低变形杆菌的丰度并增加粪杆菌和双歧杆菌的丰度。
药物激活PPAR-γ :丹参素冰片酯(激活程度小,但仍然提供显著保护作用)
北京的一组研究人员还发现丹参素冰片酯(DBZ)是一种 PPAR-γ 激动剂,具有预防或逆转肠道菌群失调的潜力。DBZ 是传统中药复方丹参中天然存在的两种化合物的合成版本。与罗格列酮和其他经典噻唑烷二酮类药物相比,DBZ 被发现对 PPAR-γ 的激活程度更小,但仍然能够在小鼠饮食模型中提供显着的保护作用,防止肠道菌群失调、肠屏障功能障碍、胰岛素抵抗和体重增加-诱发肥胖。
丁酸盐补充剂也可能参与激活
丁酸盐补充剂也被证明可以改变人类的肠道生态系统。一项针对 49 名 IBD 患者的前瞻性、随机、安慰剂对照研究发现,每天 1800 毫克的丁酸盐不仅可以减轻炎症并改善生活质量,而且还会增加产丁酸菌的数量。
经过两个月的补充,患有克罗恩氏病的人的丁酸球菌和Subdoligranulum丰度增加,而患有溃疡性结肠炎的人的毛螺菌科则大量增加。虽然研究人员没有直接测量 PPAR-γ,但考虑到产丁酸菌和炎症标志物的丰度发生了如此巨大的变化,这一途径可能参与其中。
▼
总而言之,这是一个非常有趣的研究领域,在未来几年无疑会受到更多关注。
《科学》杂志上的评论中写道:“结肠细胞的代谢重编程以恢复上皮细胞缺氧,代表了一种有前途的新治疗方法,可以在广泛的人类疾病中重新平衡结肠微生物群”。
换句话说,如果能够靶向结肠细胞的新陈代谢,我们就可以恢复肠道中的低氧环境,并有可能逆转肠道微生态失调。
谷禾也正积极开展研究合作,以确定丁酸盐和其他 PPAR-γ 激动剂是否可以预防抗生素引起的各种菌群失调。
3
以下是可能增加肠道 PPAR-γ 活性以支持肠道缺氧的干预措施的总结。可能有助于解决对其他治疗没有反应的肠道菌群失调疑难病例,尤其是那些以高变形杆菌和低丰度产丁酸菌为特征的肠道菌群失调。
首先应该关注的地方依然是日常能做到的,比如说健康的饮食,定期锻炼,充足的睡眠、阳光和健康的社交互动。
其他疗法包括:
美沙拉嗪 (5-ASA):该药物通常用作 IBD 的一线治疗药物。它的抗炎作用已被证明是通过其上调 PPAR-γ 的能力介导的。
丹参素冰片酯(DBZ):这种化合物来源于丹参酚和冰片,存在于中药复方丹参中。它上调 PPAR-γ,并已证明具有减轻微生态失调的潜力。注意:草药的来源和剂量应谨慎,最好是在草药方面经验丰富的医生的指导下。
丁酸盐:一种短链脂肪酸和 PPAR-γ 的有效刺激剂。即使是低浓度的丁酸盐也能将 PPAR-γ 蛋白表达增加 7 倍。
酮类: β-羟基丁酸和乙酰乙酸会激活肠上皮细胞中的 PPAR-γ,就像丁酸一样。生酮饮食已被证明可以在许多组织中上调 PPAR-γ,还可以为 β 氧化和上皮能量产生提供底物。希望能有更多支持这方面的研究。
禁食/热量限制:一项研究发现,在热量限制期间,交感神经系统激活需要肠道 PPAR-γ。然而,禁食或热量限制在多大程度上在肠道中诱导该通路仍不清楚。
运动:一个研究小组发现,在结肠炎模型和饮食诱导的肥胖模型中,自愿运动对肠道的保护作用是由运动增加肠道内源性糖皮质激素和上调 PPAR-γ 的能力介导的。
压力管理:压力会降低肠道中 PPAR-γ 的表达。
大麻素:大麻二酚 (CBD) 降低了溃疡性结肠炎患者直肠活检中的 iNOS 活性,这种作用是通过激活 PPAR-γ 介导的。
萝卜硫素:2008 年发现这种来自十字花科蔬菜的植物化学物质通过激活 PPAR-γ 增强先天免疫成分。
姜黄素:一项研究发现姜黄素通过激活 PPAR-γ 抑制小鼠化学诱导的结肠炎。达到这些效果所需的口服剂量尚不清楚。
其他草药:洋甘菊、当归、水飞蓟素、甘草根和柠檬香脂都是 PPAR-γ 的部分激活剂。
脂肪酸:共轭亚油酸 (CLA) 和 omega-3 脂肪酸 (DHA) 均可增强 PPAR-γ 的表达。
益生菌:对结肠细胞的体外研究表明,布拉酵母菌(Saccharomyces boulardii)具有增加 PPAR-γ 表达的能力。
益生元:对结肠细胞的体外研究表明,低聚糖 alpha3-唾液酸乳糖和 FOS 的抗炎作用是通过它们诱导 PPAR-γ 的能力介导的。
维生素 A:视黄酸是维生素 A 的一种形式,是 PPAR-γ 的激活和功能所必需的。维生素 A也称为“抗感染素”。
注:本账号内容仅作交流参考,不应将以上信息视为医疗建议。采取干预措施前请咨询医生,了解治疗是否适合。
主要参考文献
Bradley PH, Pollard KS. Proteobacteria explain significant functional variability in the human gut microbiome. Microbiome. 2017 Mar 23;5(1):36. doi: 10.1186/s40168-017-0244-z. PMID: 28330508; PMCID: PMC5363007.
Lucy Mailing. The oxygen-gut dysbiosis connection(What causes gut health to go downhill, and how to break the cycle of gut inflammation, dysbiosis, and epithelial energy starvation). 2019,11.14, lucymailing.
Rigottier-Gois L. Dysbiosis in inflammatory bowel diseases: the oxygen hypothesis. ISME J. 2013 Jul;7(7):1256-61. doi: 10.1038/ismej.2013.80. Epub 2013 May 16. PMID: 23677008; PMCID: PMC3695303.
Henson MA, Phalak P. Microbiota dysbiosis in inflammatory bowel diseases: in silico investigation of the oxygen hypothesis. BMC Syst Biol. 2017 Dec 28;11(1):145. doi: 10.1186/s12918-017-0522-1. PMID: 29282051; PMCID: PMC5745886.
Byndloss MX, Olsan EE, Rivera-Chávez F, Tiffany CR, Cevallos SA, Lokken KL, Torres TP, Byndloss AJ, Faber F, Gao Y, Litvak Y, Lopez CA, Xu G, Napoli E, Giulivi C, Tsolis RM, Revzin A, Lebrilla CB, Bäumler AJ. Microbiota-activated PPAR-γ signaling inhibits dysbiotic Enterobacteriaceae expansion. Science. 2017 Aug 11;357(6351):570-575. doi: 10.1126/science.aam9949. PMID: 28798125; PMCID: PMC5642957.
Roudsari NM, Lashgari NA, Zandi N, Pazoki B, Momtaz S, Sahebkar A, Abdolghaffari AH. PPARγ: A turning point for irritable bowel syndrome treatment. Life Sci. 2020 Sep 15;257:118103. doi: 10.1016/j.lfs.2020.118103. Epub 2020 Jul 15. PMID: 32681913.
What Is Dysbiosis? Written by WebMD Editorial Contributors. Medically Reviewed by Dan Brennan, MD on December 06, 2022
Yajie Wang, Yue Chen, Xiaoyu Zhang, Yangpeng Lu, Haixia Chen, New insights in intestinal oxidative stress damage and the health intervention effects of nutrients: A review, Journal of Functional Foods,2020. Volume 75,104248,
Shelton CD, Byndloss MX. Gut Epithelial Metabolism as a Key Driver of Intestinal Dysbiosis Associated with Noncommunicable Diseases. Infect Immun. 2020 Jun 22;88(7):e00939-19. doi: 10.1128/IAI.00939-19. PMID: 32122941; PMCID: PMC7309626.
谷禾健康
健康是人生命活动的根本,而肠道健康更是其中的重要部分。随着现代生活方式改变,炎症性肠病发病率增加。
炎症性肠病是一种严重影响患者生活质量的疾病。在全球范围内影响数百万人,发病率高,给卫生保健系统带来了沉重负担。
●炎症性肠病的病因
炎症性肠病的病因尚不明确,可能与肠道免疫反应异常有关。但与其他炎症性疾病一样,炎症性肠病的病因是多因素的,涉及遗传和环境因素的参与。这些病因大多影响肠道菌群组成,说明微生物群在炎症性肠病发展中发挥重要作用。
肠道微生物群在维持宿主生理和免疫稳态方面发挥着关键作用。维持健康的肠道菌群对免疫平衡至关重要,多项研究证明,肠道菌群失调(菌群组成改变)与炎症性肠病有关。
●炎症性肠病引起的其他疾病
慢性结肠炎不及时治疗有可能引起肠穿孔、肠狭窄、大量便血、中毒性肠扩张甚至结肠癌等疾病,不过结肠癌的可能性是比较小的。
慢性结肠炎引起的并发症也是比较多的,有可能引起关节炎、肝功能障碍、皮肤病变等一系列并发症。
近年来,在健康和疾病中肠道微生物组成,以及通过使用益生菌调节肠道微生物群方面取得了实质性进展。通过益生菌或粪菌移植调节肠道菌群后,患者的炎症性肠病缓解,为肠道炎症疾病的治疗开辟了新的前景。
了解并关注肠道健康非常重要。本文带大家了解慢性肠道炎症的病因和机制,重点关注肠道失调在这一复杂疾病的免疫病理学中的作用。
同时还介绍了目前可用的肠道菌群导向治疗炎症性肠病的方法,并讨论了其对炎症性肠病长期缓解的作用。希望大家拥有更健康的肠道。
本文主要从以下几个方面讲述
●炎症性肠病的症状和病因
●炎症性肠病中的免疫
●炎症性肠病患者体内的菌群
●肠道微生物群失调与免疫失调
●慢性肠道炎症的治疗
炎症性肠病是肠道的一种慢性炎症状态,也可能影响其他器官,如果不治疗,会导致高发病率和死亡率。炎症性肠病可通过不同的临床表现发生,其主要亚型为克罗恩病和溃疡性结肠炎。
✦临床症状
克罗恩病和溃疡性结肠炎表现出明显的临床特征。
克罗恩病
在克罗恩病中,炎症病变是跨壁的(可能涉及肠壁的所有层),也不连续,正常的肠区与受影响的肠区交替出现。
虽然在大多数克罗恩病例中,病变发生在回肠或结肠的第一部分,但也可能位于胃肠道的其他区域(从口腔到肛门)。
溃疡性结肠炎
溃疡性结肠炎的炎症病变是连续的,通常累及直肠和近端结肠。与克罗恩病相反,溃疡性结肠炎只影响肠道上皮层。
两种炎症性肠病症状相似,包括腹泻、腹痛和直肠出血,通常伴有体重减轻、疲劳和发烧。
然而,在克罗恩病中,肉芽肿更常见于炎症区域,也可能出现脓肿,阻塞肠道狭窄和不同肠道区域之间以及皮肤和其他器官之间的瘘管(炎症连接)。
溃疡性结肠炎患者通常在诊断时表现为中度症状,但炎症病变的范围与疾病严重程度相关,而胰腺炎与更严重的疾病相关。
•肠道外的一些表现症状
肠外表现在克罗恩病和溃疡性结肠炎中都很常见,25%–40%的炎症性肠病患者都有肠外表现。
虽然这些表现可能出现在几乎所有的器官和系统中,但主要影响眼睛、皮肤、肝脏和关节。肺、胰腺和血管系统不太常见。
一些肠外表现与疾病活动有关,并通过治疗得到改善,如少关节炎和口腔溃疡。其他则是非依赖治疗的,如葡萄膜炎和强直性脊柱炎。
✦治疗方法
大多数溃疡性结肠炎患者只需要医疗,其中20%-30%需要手术治疗。克罗恩病通常是进行性的,约50%的患者在确诊后10年内需要手术治疗。
克罗恩病患者的死亡率是健康人群的1.3-1.5倍,不受影响区域的影响,主要由结直肠癌、低血容量、营养不良、贫血引起。
由于目前尚无完全治愈方法,炎症性肠病的治疗旨在改善症状和缓解疾病。
不同疾病类型和严重程度抗炎药的使用
溃疡性结肠炎的治疗
在活动期溃疡性结肠炎中,首先口服类固醇,然后是氨基水杨酸盐(ASA)。对于左侧结肠炎,通常使用外用制剂(栓剂或灌肠剂),而对于横向和上行结肠炎,口服制剂有时结合外用给药是有效的。
对于这种治疗无效的溃疡性结肠炎患者,考虑使用单克隆抗体,通常是英夫利西单抗(IFX)阻断炎症细胞因子肿瘤坏死因子α。为了保持病情缓解,ASA是首选药物。然而,对于ASA不能维持缓解的患者,也可以使用硫唑嘌呤(AZA)或IFX。
克罗恩病的治疗
对活动性克罗恩病的治疗可能遵循“自上而下”或“加速”策略。在自上而下的治疗中,治疗从高剂量免疫调节剂或生物制剂开始,剂量随症状改善而调整。
在强化治疗中,先用低剂量的低效药物,如果无效,则调整治疗以达到缓解,方法是使用未定义的更有效药物。
类固醇、氨基水杨酸盐和抗生素可以联合使用以达到缓解。如果出现肠梗阻、脓肿或瘘管等并发症,也可进行手术。
硫唑嘌呤通常用于维持治疗,有时与甲氨蝶呤联合使用。对这些方案无效的克罗恩病患者,需要进行生物治疗,单独使用英夫利西单抗或与之前的药物联合使用。
炎症性肠病被描述为一种多因素疾病,可能是由遗传物质和环境特征等不同易感因素造成的,这些因素反过来可能影响基因调控的表观遗传机制。
炎症性肠病的病因
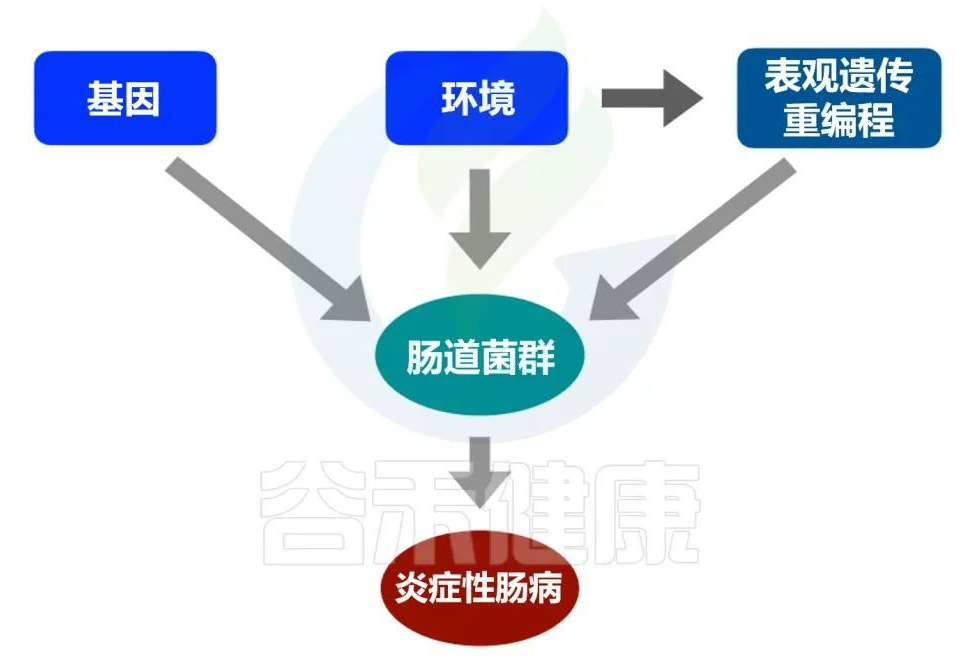
编辑
Amelia S,et al.Elsevier.2022
基因和环境(在表观遗传调控的参与下)都可能影响微生物群的组成,进而可能触发炎症性肠病。
✦遗传因素影响炎症性肠病
遗传因素对炎症性肠病的重要性早已被提出。事实上,多达12%的患者有炎症性肠病家族史。在亲属中,炎症性肠病患病率明显高于普通人群,在兄弟姐妹中发现克罗恩病的易感性风险最高(30%-35%)。
注:全基因组关联研究有助于剖析炎症性肠病的遗传背景,迄今已确定240多个易感位点。克罗恩病和溃疡性结肠炎以及其他炎症性疾病共享大多数基因座。然而,除了非常早发病的炎症性肠病外,这些易感基因座仅占炎症性肠病估计遗传风险的一小部分(约20%)。
许多风险相关基因座参与了早期免疫应答期间宿主和微生物之间的相互作用,表明宿主-微生物相互作用和先天免疫在炎症性肠病的发展中起着核心作用。
影响炎症性肠病的基因
1996年确定的第一个与炎症性肠病(IBD)相关的遗传位点被指定为IBD-1。后来,在IBD-1位点发现了一个基因,该基因参与细胞内对细菌细胞壁成分胞壁二肽的传感。该基因被命名为“核苷酸结合寡聚化域-2”或“半胱氨酸天冬氨酸蛋白酶募集域15”(NOD-2/CARD-15)。
在NOD-2基因中发现了三种易感变异体,它们都导致核因子kB(NF-kB)激活功能丧失,这是一种参与促炎细胞因子表达的转录因子,对细胞内细菌的免疫发展很重要。尽管迄今为止,NOD-2风险变体在高加索人群中与回肠克罗恩病的相关性最强,但只有少数回肠疾病患者具有风险变体,而亚洲克罗恩病患者几乎没有这些变体。
影响先天免疫应答的其他遗传风险变体的例子包括ATG16L1(“自噬相关16样-1”)、LRRK2(“富含亮氨酸重复激酶-2”)和IRGM(“免疫相关GTPase M00”)基因,这些基因在自噬中起作用。
✦表观遗传(性状)与炎症性肠病有关
基因表达的表观遗传修饰也与炎症性肠病有关。影响基因表达的三个主要表观遗传过程是DNA甲基化、组蛋白修饰和非编码RNA。
DNA甲基化是指在胞嘧啶核苷酸中添加甲基(主要是CpG基序)。
其中,DNA甲基化和非编码RNA的作用在炎症性肠病中得到了最广泛的研究。这个过程影响基因的转录活性和表达水平。与健康对照受试者相比,炎症性肠病患者的基因甲基化程度增加。微RNA(miRNA)在转录和转录后水平介导RNA沉默和基因表达。
这些过程可能会干扰T细胞分化、Th17信号传导和自噬。与健康对照组相比,炎症性肠病患者以及活动性与非活动性疾病患者的miRNAs表达不同。
注意:在其他炎症性疾病中,如系统性红斑狼疮和类风湿性关节炎中发现了一些重叠的miRNA特征。环境因素强烈影响表观遗传调控,因此表明表观遗传是环境暴露和基因表达之间的联系。
✦环境因素
已确定炎症性肠病风险的不同环境决定因素,如吸烟、城市与农村生活、空气污染和饮食。
// 工业化与吸烟增加了风险
欧洲和北美的炎症性肠病发病率最高,但自21世纪初以来似乎趋于稳定。相反,在非洲、亚洲和南美洲的新兴工业化国家,随着这些国家进入更加西化的生活方式,炎症性肠病的发病率仍在增加。
吸烟似乎会增加炎症性肠病(尤其是克罗恩病)的风险,并与肠道通透性丧失有关。
// 饮食会影响炎症性肠病的风险
一些基于多中心欧洲前瞻性队列研究的研究试图将饮食习惯与炎症性肠病风险联系起来。
最近的一项文献荟萃分析也确定了炎症性肠病的其他环境风险因素:阑尾切除术或扁桃体切除术(CD)、软饮料消费(UC)、抗生素暴露、口服避孕药使用、维生素D缺乏和肠肝螺杆菌(enterohepatic Helicobacter)(IBD)。
// 微生物可能导致发病或炎症
环境因素也可能直接或间接影响肠道微生物群的组成。
长期以来,人们认为微生物在炎症性肠病发病中起着重要作用。并对炎症性肠病中特定致病生物的定植和肠道菌群组成进行了广泛研究。
禽分枝杆菌(Mycobacterium avium)的定植,副结核分枝杆菌(Mycobacterium tuberculosisycobactins)或带有大肠杆菌粘附侵袭性变体的副结核分枝杆菌似乎会促进易感宿主的慢性炎症,可能导致炎症性肠病的发展(尤其是克罗恩病)。
此外,肠道微生物群组成的改变(失调)可能使代谢失衡,导致炎症反应缺乏调节。
除环境因素外,宿主遗传也影响微生物群落组成。事实上,单卵双胞胎比双卵双胞胎显示出更相似的微生物群。炎症性肠病风险等位基因与肠道微生物群组成的关联研究表明,炎症性肠病的高遗传风险与罗氏菌属(Roseburia)的丰度较低相关,而肠杆菌科(Enterobacteriaceae)的丰度较高。
固有免疫是机体在种系发育和进化过程中形成的天然免疫防御功能,即出生后就已具备的非特异性防御功能,也称为非特异性免疫。
✦上皮细胞
上皮层和相关的抗菌机制对于限制肠道微生物群进入肠粘膜至关重要。当第一道防线受损时,就会发生微生物移位,并建立炎症机制。
覆盖肠上皮的粘液层在保持肠道微生物和上皮细胞之间的低接触方面起着重要作用。它由凝胶形成粘蛋白聚合而成,主要由特殊上皮细胞(即杯状细胞)分泌。
这些粘蛋白聚合物由于能够结合水而在肠腔中膨胀,形成肠粘液。小肠粘液由一层薄而不连续的粘液层组成,结肠粘液由两层密度不同的粘液组成:外层更疏松,细菌更易渗透,内层更坚固,通常无菌。
●粘蛋白缺少会增加结肠炎风险
小鼠粘蛋白2敲除被证明会发展为结肠炎并增加结直肠癌的风险。在这些小鼠中,发现许多细菌与上皮细胞直接接触。研究发现,克罗恩病患者的结肠中,黏蛋白表达减少,炎症区域MUC1表达减少,非炎症区域MUC3、MUC4和MUC5B表达降低。
黏蛋白(MUC)是一类主要由黏多糖组成的糖蛋白
最近,一项荟萃分析证实克罗恩病患者肠道中粘蛋白表达降低。黏液蛋白表达受损可能导致肠道微生物群与上皮衬里之间的接触增加,从而导致炎症。
•肠上皮细胞有助于维持稳态
肠道上皮细胞分泌抗菌肽(AMPs),在限制肠道病原体感染方面发挥重要作用,并有助于维持肠道内稳态,保持共生细菌和上皮细胞之间的低接触。
抗菌肽(AMPs)的例子包括再生蛋白、免疫球蛋白(Ig)A和防御素。在人类中,已经确定了十种防御素,分为两类:a-防御素(HD),主要由小肠的潘氏细胞、中性粒细胞和某些巨噬细胞群分泌;b-防御素(HBD),由上皮细胞分泌,以响应细胞因子或模式识别受体(PRR)的微生物识别。
克罗恩病中描述了防御素生产的失调。事实上,携带NOD2移码敏感变异体的回肠克罗恩病患者HD5和HD6的潘氏细胞表达降低。这可能导致微生物与上皮层接触增加,部分解释了克罗恩病敏感性增加的原因。相反,据报道,HBD2在结肠克罗恩病和溃疡性结肠炎的炎症区域表达增加,这可能是通过炎症刺激调节HBD2表达。
✦微生物分子的识别
通过上皮层里易位的微生物进入下层肠粘膜,被吞噬细胞(主要是单核细胞、巨噬细胞和树突状细胞)吞噬,并在吞噬小体中被进一步清除。这些细胞通过属于不同膜或细胞溶质蛋白家族的模式识别受体识别病原体相关分子模式(PAMP)。
PAMP是进化保守的微生物抗原
一旦识别,信号转导途径就会发生,导致转录因子的核移位和炎症细胞因子的产生。Toll样受体是一类广泛的模式识别受体,是肠道微生物群的关键免疫传感器,是通过PAMP识别的免疫系统的哨兵。它们在吞噬细胞的细胞质或内体膜以及肠上皮细胞和基质细胞中表达,激活后二聚并导致下游信号级联,导致NF-kB激活,推动参与树突状细胞成熟和T淋巴细胞增殖和激活的关键细胞因子的产生。
●炎症性肠病患者识别功能受到影响
炎症性肠病患者TLR信号似乎受到影响。与健康对照组相比,在活动期溃疡性结肠炎患者中,TLR2、TLR4、TLR5、TLR8和TLR9表达上调,而在静止期溃疡性结肠炎患者中,TLR5表达下调。
在结肠炎小鼠模型中,TLR2/6的抑制减缓了疾病进展,表明其与病理有关。据报道,在炎症性肠病患者的肠道中TLR6过度表达,可能会加剧T辅助因子Th1和Th17反应。
由于TLR3、TLR5和TLR7的多态性与更高的溃疡性结肠炎严重程度相关,其他TLR受体的失调似乎也会导致炎症性肠病。TLR下游信号传导导致细胞因子分泌,这可能对肠道内稳态有利或有害。
TLR诱导的细胞因子有助于肠道内稳态的例子包括IFN-a和b(后者诱导溃疡性结肠炎缓解、白细胞介素-15(通过调节性T细胞诱导控制肠道炎症和白细胞介素11(其刺激对溃疡性结肠炎有益)。
另一方面,TLR信号也可诱导促炎细胞因子,如IL-1b、IL-6、IL-8、TNF-a和IL-18(抑制杯状细胞成熟,促进溃疡性结肠炎病理。
✦炎性小体
——也称炎症小体,是由胞浆内模式识别受体(PRRs)参与组装的多蛋白复合物,是天然免疫系统的重要组成部分。
炎症小体激活异常也与炎症性肠病的发展有关。NLRP3炎性小体是细胞质模式识别受体的NLR家族成员,是肠内稳态的重要调节器。
NLRP3可在各种细胞类型中表达,如粒细胞、抗原呈递细胞(APC)、T和B淋巴细胞,其激活可在识别外源微生物抗原或内源性危险信号时触发。一旦触发,NLRP3介导炎症小体复合体的组装。
作用机制
在这个复合物中,caspase-1被激活,将白介素1β前体和白介素18前体分别裂解为分泌的IL-1b和IL-18。激活的半胱氨酸天冬氨酸蛋白酶1与半胱氨酸蛋白酶11一起裂解胃泌素D,使其发生聚合,从而导致细胞质膜孔的形成并导致细胞溶解,这是一种称为细胞凋亡的细胞死亡过程。
细胞溶解后,细胞内成分的释放诱导炎症细胞的募集,促进炎症。炎症激活分为两个步骤:在第一启动步骤中,NF-kB被激活,导致NLRP3和白介素1β前体合成的转录诱导;由微生物或危险信号触发的第二个激活步骤导致NLRP3炎性小体复合体的组装。
●炎症小体缺乏可能导致炎症恶化
NLRP3表达和炎症小体激活对维持肠道内稳态至关重要,因为据报道,NRLP3和炎症小体表达缺陷的小鼠对右旋糖酐硫酸钠(DSS)诱导的结肠炎的敏感性增强,病情恶化,死亡率更高。
然而,炎症小体激活的持续上调也可能导致白细胞介素1β和白细胞介素-18的过度生成,以及细胞凋亡的增加,从而导致炎症性肠病中观察到的炎症恶化。
事实上,60%的克罗恩病患者检测到NLRP3炎性体激活,并与长期溃疡性结肠炎疾病相关。据报道,克罗恩病患者中白细胞介素-18分泌增加,白细胞介素1β水平升高与炎症性肠病严重程度增加相关。此外,在携带TLR2风险等位基因的炎症性肠病患者中,共生肠道微生物诱导了细胞凋亡,使病情恶化。
注意
尽管有这些发现,NLRP3炎症组在炎症性肠病发病机制中的作用仍然存在争议,因为其他小鼠和人类研究也表明过度活跃的炎症组具有保护作用。
✦自噬
自噬是一种细胞更新过程,其中起源于内质网的小泡包围老化的细胞器和蛋白质,通过溶酶体融合促进其降解。
自噬机制影响其他细胞过程,如肽分泌和细胞内病原体降解。
●自噬损伤会使炎症失控
自噬相关克罗恩病易感性等位基因的存在导致自噬损伤。患有自噬相关风险变异体的克罗恩病患者的潘氏细胞表现出颗粒异常,可能影响其抗菌肽分泌途径,导致微生物增殖增加和炎症失控。自噬缺陷的巨噬细胞和树突状细胞清除细胞内病原体的能力较低,并可能通过炎症小体激活促进炎症。
✦固有淋巴细胞
固有淋巴细胞(ILC)是指不表达任何T、B或髓细胞标记物,但同时表达白细胞介素2和白细胞介素7受体的淋巴细胞。
它们在抵御微生物病原体方面起着核心作用,并且在组织内稳态方面很重要。固有淋巴细胞作用于先天免疫和适应性免疫之间的串扰,并对多种细胞类型分泌的细胞因子作出反应。
由于固有淋巴细胞作用于第一道防线,因此它们战略性地位于外部因素和传染源暴露程度较高的位置,如肠粘膜、皮肤和肺部。
固有淋巴细胞的三个主要亚组
ILC1细胞(Th1样细胞)表达转录因子T-bet,能够分泌IFN-g和TNF-a,并对抗细胞内病原体——这一亚群还包括NK(“自然杀伤”)细胞。
ILC2(Th2样细胞)表达GATA-3(“谷氨酰胺基tRNA转氨酶结合蛋白-3”)转录因子,分泌IL-4、IL-5、IL-9和IL-13,在抵御蠕虫方面很重要,也在过敏反应中起作用。
ILC3(Th17样细胞)表达转录因子RORgt,分泌IL-17、IL-22、GM-CSF(“粒细胞-巨噬细胞集落刺激因子”)和TNF-a,对细胞外病原体侵入粘膜部位具有重要作用。
然而,这些不同的表型保留了相当大的可塑性。粘膜ILC3细胞的主要功能是维持屏障完整性。
●固有淋巴细胞对调节稳态至关重要
如上所述,肠道粘膜巨噬细胞和树突状细胞对微生物的TLR感应导致下游释放促炎细胞因子,如白细胞介素1β和白细胞介素23。黏膜ILC3细胞通过分泌IL-22、GM-CSF和IL-17对这些介质作出反应。IL-22也由Th17和Th22细胞分泌,在体内稳态控制中发挥重要作用。
事实上,IL-22作用于上皮细胞,改善屏障完整性,从而防止细菌移位。该细胞因子还促进抗菌肽(如b-防御素)的产生和分泌,影响小鼠的微生物群组成,并增加宿主对病原微生物的耐药性。
除了产生白细胞介素22,ILC3细胞还能够通过直接接触和抗原递呈调节其他免疫细胞(如CD4+T细胞)的活性,因为这些细胞表达II类主要组织相容性复合物分子(MHC-II)。
克罗恩病中描述了ILC1和ILC3的肠道过度积累,在溃疡性结肠炎中观察到固有淋巴细胞活性增加。在小鼠中,由抗原呈递细胞分泌的白细胞介素1b和白细胞介素23诱导的ILC3刺激导致肠内累积的白细胞介素17和IFN-g分泌增加。缺乏ILC3细胞的小鼠未发生右旋糖酐硫酸钠诱导的结肠
这种免疫只针对一种病原体。它是人体经后天感染(病愈或无症状的感染)或人工预防接种(菌苗、疫苗、类毒素、免疫球蛋白等)而使机体获得的抵抗感染能力。
✦作用机制
巨噬细胞和树突状细胞消化吞噬微生物的抗原,并将其与MHC1类或2类分子结合,呈现给效应T细胞。
细胞膜标记物CD11b、CD11c和CD103的表达定义了树突状细胞的独立亚群,从而影响随后的T细胞反应。
T细胞是适应性免疫反应的关键参与者,根据周围组织环境的细胞因子特征,可以分化为效应器或调节亚型。抗原呈递细胞与T细胞相互作用的性质和调节促使Th细胞分化为不同的亚群,每个亚群都发挥着特定的作用:
Th1是产生IFN-g的细胞,对细胞内细菌和某些原生动物的免疫很重要;Th2是产生IL4、Il-5和Il-13的细胞,参与对蠕虫和寄生虫的免疫;Th17是IL-17A、IL-17F、IL-21和IL-22的产生者,参与中性粒细胞反应;Th1/Th17细胞同时产生IFNg和IL-17A,具有Th1和Th17细胞的特征。
虽然暴露于肿瘤生长因子-b(TGF-b)可促进调节性T细胞分化,但Th1细胞主要由IL-12和IFN-g诱导,而IL-4在IL-6存在的情况下可促进Th2细胞和TGF-b的分化,从而促进Th17细胞的分化。
✦炎症性肠病患者适应性免疫出现异常
在克罗恩病患者中,检测到巨噬细胞产生较高的白细胞介素12,以及白细胞介素12和白细胞介素18诱导的异常Th1免疫应答。此外,在炎症性肠病患者的肠道固有层中检测到Th17和Th1细胞群的丰度增加。
•促炎细胞因子增加
体外培养的克罗恩病和溃疡性结肠炎患者的活检均分泌了相当数量的IFN-g。这种细胞因子促进肠细胞凋亡和巨噬细胞活化,增加巨噬细胞产生肿瘤坏死因子,进一步加剧炎症。
炎症性肠病患者炎症粘膜的体外培养也报告了白细胞介素17A转录水平的升高和白细胞介素17A分泌的增加。白细胞介素17A诱导中性粒细胞向炎症部位募集,并介导炎症分子的上调,如诱导型一氧化氮合酶和白细胞介素1β。此外,白细胞介素17A诱导巨噬细胞产生促炎细胞因子。
注意
患有活动性疾病的炎症性肠病患者血液中的调节性T细胞减少,而肠粘膜中的调节性T细胞增加,功能正常。然而,肠固有层T细胞在炎症性肠病中对调节性T细胞功能无反应,这可以说明Th细胞缺乏调节。
胃肠道内微生物种群的建立是一个复杂的过程,涉及微生物和宿主的相互作用,最终形成稠密和稳定的种群。
✦肠道微生物与宿主互惠互利
肠道微生物群落或肠道内的微生物群落与宿主建立了共生关系,在健康环境中互惠互利。宿主提供了一个稳定且营养丰富的栖息地,而微生物群给宿主带来了重要的益处,例如未消化的饮食成分和肠粘膜产生的内源性粘液的发酵,以及短链脂肪酸、氨基酸和维生素的产生。
此外,微生物群通过防止外来生物入侵,例如通过产生代谢物和细菌素,抵抗病原体定植,并影响肠上皮和免疫系统的发育和内稳态。
肠道微生物群的组成受宿主因素的影响,如年龄、遗传、分泌产物(如胃酸和胆汁)、蠕动和肠道转运时间。另一方面,环境因素(如饮食)在生命周期内对宿主产生影响,不断调节微生物群落。
尽管肠道中的大多数微生物都存在于肠腔内,但与粘膜相关的微生物群对宿主来说非常重要,因为它对上皮和粘膜功能的影响比肠腔细菌更大,对炎症性肠病的发病机制的影响更大。
注意:由于采样限制,大多数人体肠道微生物群研究,包括炎症性肠病患者的研究,都分析粪便样本。尽管粪便样本可能不能准确反映整个胃肠道的微生物群落组成,但大多数微生物都是通过粪便途径离开的。因此,粪便微生物群组成的变化反映了胃肠相关效应。
健康成年人大肠粘膜微生物群的组成是一致的,但与同一个人的粪便微生物群不同。因此,对炎症性肠病患者粘膜相关微生物群的研究证实,远端胃肠道不同解剖部位的微生物组成没有显著差异。另一方面,比较炎症性肠病患者粪便微生物群相关粘膜的研究报告了不同的结果。
✦炎症性肠病患者肠道菌群多样性较低
与健康对照组相比,克罗恩病和溃疡性结肠炎患者的肠道菌群多样性较低。与健康个体相比,这种变化伴随着物种丰富度的降低(一种群落中物种总数的测量方法),在克罗恩病患者中尤为明显。
对大多数炎症性肠病患者的报告了厚壁菌门(Phylum Firmicutes)、拟杆菌门(Bacteroidetes)和变形杆菌门(Proteus)内特定细菌类群的丰度变化,随着被认为具有攻击性的菌群(如变形杆菌(Proteus)、梭杆菌属(Fusobacterium)和瘤胃球菌(Ruminococcus)的扩大,同时具有保护性的菌群(例如Faecalibacterium、罗氏菌属(Roseburia) 、毛螺菌科(Lachnospiraceae)和双歧杆菌属(Bifidobacterium spp.))的减少。
在厚壁菌门和梭状芽孢杆菌类中,属于Faecalibacterium、罗氏菌属(Roseburia) 、颤螺菌属(Oscillibacter)和粪球菌属(Coprococcus)的丁酸盐产生菌在炎症性肠病患者中普遍减少。
丁酸是一种短链脂肪酸,可被肠粘膜吸收,是结肠细胞的主要能量来源,提供高达70%的需求量。此外,丁酸具有抗炎作用,并积极调节肠道内稳态。
✦梭状芽孢杆菌缺乏可能引起肠道炎症
梭状芽孢杆菌(Clostridia)类成员的缺乏可能会使某些个体易于继发肠道炎症。相比之下,炎性多糖的产生菌——瘤胃球菌(Ruminococcus)(也属于梭状芽孢杆菌类)在炎症性肠病患者中富集。
✦肠道炎症患者拟杆菌、疣微菌等丰度减少
在拟杆菌门(Bacteroidaceae)中,克罗恩病和溃疡性结肠炎患者的拟杆菌丰度低于健康人。拟杆菌在活动性克罗恩病和溃疡性结肠炎患者中的减少比缓解期更明显。
在变性菌门变形菌门(Proteobacteria)内,肠道微生物群中的γ-变形菌纲(Gammaproteobacteria)、肠杆菌科( Enterobacteriaceae )成员的富集与炎症性肠病密切相关。
另一方面,在疣微菌门(Verrucomicrobia)内,炎症性肠病患者粪便样本中的嗜黏蛋白阿克曼菌(Akkermansia muciniphila)减少。在含有人类肠道微生物群的动物模型中,嗜黏蛋白阿克曼菌的存在降低了结肠组织学损伤和促炎介质的组织mRNA表达。
尽管一些研究表明炎症性肠病患者存在肠道微生物群失衡,但与克罗恩病和溃疡性结肠炎相关的失调似乎是特定疾病。
据报道,克罗恩病、溃疡性结肠炎和非炎症性肠病患者之间存在明显的微生物特征,无论炎症性肠病患者体内粘膜相关微生物群的稳定性如何。
炎症性肠病患者的粪便和粘膜真菌群均不平衡。与健康个体类似,炎症性肠病患者的真菌群主要由担子菌门(Basidiomycota)和子囊菌门(Ascomycota)两个门以及伞菌纲(Agaricomycetes)和酵母菌纲(Saccharomyces)两个类别组成。
✦克罗恩病中念珠菌占主导地位
主要差异在于较低的分类学水平。特别是对于克罗恩病, 念珠菌(Candidaspp)的丰度普遍增加,尽管研究中的优势种有所不同。
Candida tropicalis和Candida glabrata在克罗恩病患者中占主导地位,而 Leptosphaeria减少。
与健康受试者相比,克罗恩病中炎症和非炎症粘膜中的总真菌负荷显著增加。
Filobasidium uniguttulatum和Saccharomyces cerevisiae均与克罗恩病患者的非炎症粘膜相关,而Xylariales(子囊菌门)与炎症粘膜相关。
患有炎症性肠病的儿科患者有机会帮助研究疾病发病机制的生物学成分,尤其是在诊断过程中获得的样本。
–1 炎症性肠病中微生物群总体减少
一项研究分析了最近诊断为炎症性肠病的儿科患者粘膜相关菌群的主要细菌组成,报告了一些潜在有害细菌群的优势,或有益细菌种类的减少。
肠易激综合征患儿的粘膜与更多的需氧和兼性厌氧菌相关,而克罗恩病和溃疡性结肠炎中属于正常厌氧肠道微生物群的物种或组的总体减少,尤其是普通拟杆菌。
随后,通过细菌16S rRNA基因和真菌小亚单位核糖体区域的焦测序分析了治疗初期克罗恩病儿童的粘膜。虽然与对照组相比,罗氏菌属(Roseburia) 、Eubacterium和 Subdoligranulum、梭状芽孢杆菌类成员在克罗恩病中的丰度较低,但萨特氏菌(Sutterella)的丰度明显较高。
–2 特定细菌的丰富程度与疾病状态呈正相关
大型儿科新发克罗恩病队列研究,包括代表各种疾病表型的受试者,在开始治疗之前,调查了多个胃肠道位置的粪便和粘膜相关微生物群。
微生物群分析表明,粘膜相关生物并不局限于任何肠道位置,总体微生物组成主要通过样品类型和微生物多样性与对照组进行区分。疾病表型不足以区分患者。
在炎症性克罗恩病条件下,粘膜相关微生物群与物种多样性的总体下降和几个分类群丰度的变化密切相关。
E.coli、Pasteurellaceae、Veillonella parvula、Eikenella corredens和Fusobacteriaum nucleatum中特定细菌种类的丰富程度与治疗前新诊断的克罗恩病儿童的疾病状态呈正相关,该研究支持以上菌群为炎症性肠病进展驱动因素。
与克罗恩病呈负相关的菌群常见于:
长双歧杆菌(Bifidobacterium Longum) ↓↓↓
青春双歧杆菌(Bifidobacterium adolescentis) ↓↓↓
普拉梭菌(Faecalibacterium prausnitzii) ↓↓↓
罗氏菌属(Roseburia) ↓↓↓
直肠真杆菌(Eubacterium rectale) ↓↓↓
普通拟杆菌( Bacteroides vulgatus) ↓↓↓
Bacteroides caccae ↓↓↓
巴氏杆菌科(Pasteurellaceae)和奈瑟氏菌科(Neisseriaceae)在10岁以下患者中的丰度较高,但随着年龄的增长而减少。在诊断时收集的粪便中仅微弱地反映出新发的粘膜相关失调,这表明粘膜失调可能先于临床疾病,并独立于长期炎症发展。
–3 环境因素影响微生物的反应
一项关于儿童克罗恩病的前瞻性研究分析了患者在开始治疗之前和之后的粪便样本,首先使用抗生素,然后在8个月期间使用规定的配方食品或抗肿瘤坏死因子抗体。
在诊断时,肠道微生物群表现出特定细菌和真菌的变化,即埃希氏菌属(Escherichia)和韦荣氏球菌属(Veillonella)增加,阿克曼菌属( Akkermansia)、罗氏菌属(Roseburia) 、普雷沃氏菌(Prevotella)和真菌(包括念珠菌属)减少。
降低了肠道炎症反应中的失调。炎症、抗生素暴露和饮食独立影响肠道微生物群落的不同分类群。例如,真菌负荷随着疾病和抗生素的使用而增加,但随着饮食治疗而减少。
因此,虽然肠道内的失调在克罗恩病中很常见,但微生物的反应取决于环境因素。
✦开始治疗前的微生物群特征
在开始治疗之前,新诊断的溃疡性结肠炎儿科患者的粘膜微生物群也有特征。除了溃疡性结肠炎患者中疣微菌门(Verrucomicrobia)显著减少外,其他细菌种类的丰富程度与健康儿童相似。此外,在属水平上,溃疡性结肠炎患者中罗氏菌属(Roseburia)的相对丰度显著降低,而嗜血杆菌(Haemophilus)的相对丰量增加。
●疾病活动与部位影响肠菌群的组成和功能
肠菌群组成和功能的改变似乎与炎症性肠病患者的疾病活动、疾病行为和病变部位有关。尽管在研究之间或与疾病活动相关的研究中,微生物群组成的确切差异没有得到一致复制。
但已经观察到,在所有形式的克罗恩病中,下列菌群持续减少:
而下列菌群增加:
✦儿童患者的肠道菌群特征与成人患者相似
新发炎症性肠病儿童和成人常见的肠道菌群主要偏差
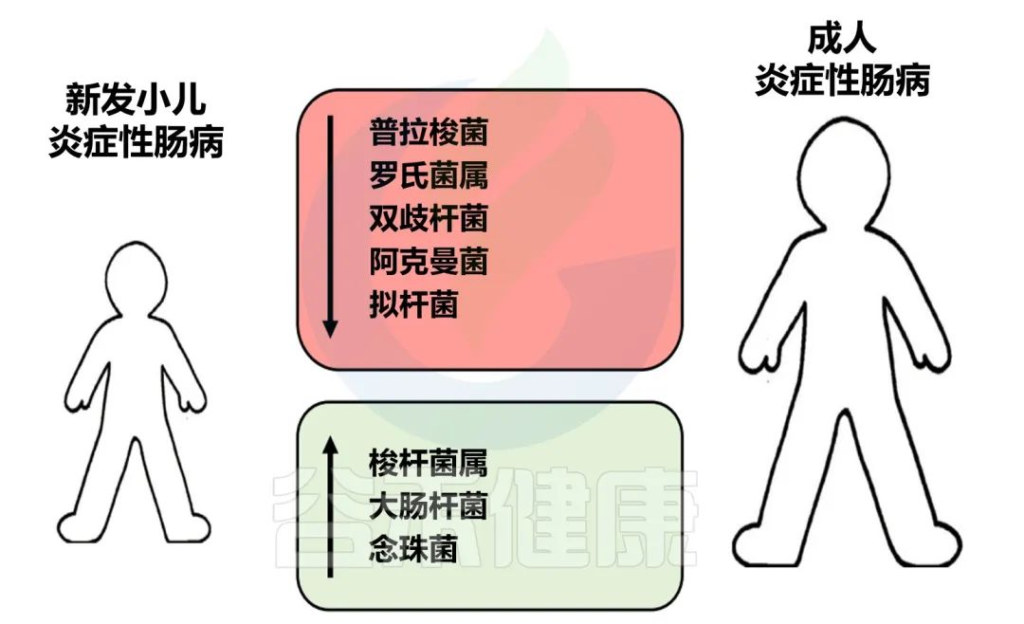
Amelia S,et al.Elsevier.2022
炎症性肠病患儿的肠道菌群特征与成人患者相似。因此,成人型炎症性肠病患者的生态失调可能在儿童期就已确立。
●肠道微生物失调反应炎症的严重程度
对儿科患者(包括治疗前新诊断的儿童)的研究得出结论,肠道生物失调反映了炎症的存在和严重程度。然而,虽然肠道微生物群的变化可能在炎症性肠病早期发生,并可能导致疾病的发生,但随着时间的推移,环境因素,包括炎症本身,可能通过改变肠道的代谢条件,进一步导致失调。
人类肠道微生物群失调是真正的致病因素还是仅仅是肠病炎症的后果,这个问题尚不清楚。但是肠道微生物被证明是炎症性肠病相关肠道炎症的重要因素。
在健康状态下,宿主对肠道微生物群的免疫反应仅局限于粘膜表面。据报道,炎症性肠病患者的粘膜相关微生物密度较高,在促进肠道炎症方面,被认为比粪便微生物群发挥更大的作用。
注意:比较炎症性肠病患者结肠粘膜炎症和非炎症区域的微生物群组成的研究试图阐明居民肠道微生物群对炎症免疫反应的可能影响,但结果相互矛盾。
一项研究发现,炎症性肠病患者体内粘膜炎症和非炎症区域的微生物群落组成没有显著差异。不过该项研究未根据炎症性肠病类型进行区分。
其他研究分析了克罗恩病和溃疡性结肠炎患者炎症和非炎症粘膜活检中的微生物群,发现同一个体内的微生物特征相似,但个体间差异很大。
✦克罗恩病患者中变形菌丰富
与溃疡性结肠炎患者或健康受试者相比,克罗恩病患者的变形菌门(Proteobacteria)显著增加。还报告说,在炎症克罗恩病组织中,埃希氏菌(Escherichia)和志贺氏菌(Shigella)更为丰富,而在非炎症克罗恩病组织里,Pseudomonas更为广泛。大肠杆菌和梭杆菌能够粘附粘膜,侵入肠上皮细胞,并可能加剧炎症。
拟杆菌和梭杆菌更常见
具核梭杆菌通过破坏上皮屏障和诱发异常炎症而加重结肠炎。相对于炎症性溃疡性结肠炎,拟杆菌门(Bacteroidetes)在克罗恩病炎症粘膜中更常见。克罗恩病粘膜活检中最常见的是普通拟杆菌(Bacteroides vulgatus),克罗恩病患者中脆弱拟杆菌(Bacteroides fragilis)的数量明显高于溃疡性结肠炎患者或健康受试者。脆弱拟杆菌与产生白细胞介素10的调节性T细胞的增加有关,这限制了促炎机制,从而有助于减少炎症。
除了拟杆菌外,梭杆菌门(Fusobacteria)在克罗恩病患者的炎症粘膜中比溃疡性结肠炎患者的炎症黏膜中更常见。相反,在发炎的溃疡性结肠炎粘膜中更频繁地检测到厚壁菌门(Phylum Firmicutes)和变形菌门(Proteobacteria)。与大肠杆菌类似,梭杆菌能够粘附粘膜,侵入肠上皮细胞,并可能加剧炎症。尤其是具核梭杆菌刺激结肠上皮细胞中肿瘤坏死因子的表达。
总的来说,这些研究结果表明,由于同一参与者的微生物群分布几乎没有变化,无论炎症状况或取样位置如何,因此粘膜相关微生物群没有发生明显的局部变化。
此外,根据引用的研究,粘膜微生物组成更依赖于个体间的变异,而不是疾病类型。
事实上,肠道微生物群组成的变化导致微生物代谢物的改变,这可能在炎症性肠病发病机制中起作用。
✦短链脂肪酸
短链脂肪酸是肠道微生物群通过发酵未消化的饮食成分和肠粘膜产生的内源性粘液而产生的。
短链脂肪酸影响肠上皮细胞生物能量学、微生物增殖、屏障和炎症功能。
短链脂肪酸影响受体激活与信号传导
短链脂肪酸被吸收到血液循环中,在那里它们可能与白细胞上的G蛋白偶联受体GPR43结合,阻碍其激活。GPR43信号传导抑制炎症反应,包括粘附分子和炎症介质的表达,以及白细胞趋化性。
缺乏GPR43的小鼠炎症反应加剧,外源性给予野生型小鼠短链脂肪酸对临床有益。短链脂肪酸还抑制NF-kB信号传导,在相对高浓度下,丁酸抑制I类组蛋白脱乙酰酶,后者是免疫和炎症的重要调节因子。
微生物群影响免疫细胞的激活
颤螺菌属 (Oscillospira)被认为是一种利用宿主衍生聚糖或从富含糖蛋白的饮食中获得的聚糖的丁酸生产菌。
在炎症性疾病中,尤其是克罗恩病中,颤螺菌的含量减少。微生物群似乎控制先天性和适应性免疫细胞激活的系统阈值。因此,持续接触常驻细菌发酵产物和代谢物对外周免疫系统的正确功能至关重要。
然而,不能排除常驻微生物在控制局部免疫中的直接作用,因为在其他研究中,粘膜炎症状态与局部粘膜相关微生物群的扰动有关,即同一炎症性肠病患者体内炎症粘膜和非炎症粘膜的微生物群组成差异。
✦色氨酸代谢物
对宿主的免疫反应至关重要的另一类代谢物是色氨酸代谢物。
色氨酸又称β-吲哚基丙氨酸,是人体的必须氨基酸之一。
缺乏色氨酸会导致结肠炎
使用小鼠进行的营养研究表明,饮食中缺乏色氨酸会导致结肠炎,并补充色氨酸以防止发炎。将失调的微生物组从喂食色氨酸缺乏饮食的小鼠转移到喂食正常饮食的无菌受体,足以引起结肠炎。
在小鼠中,色氨酸代谢菌株罗伊氏乳杆菌(Lactobacillus reuteri)可预防结肠炎。当它将色氨酸代谢成吲哚丙烯酸时,它是通过增强上皮屏障功能和减少炎症反应而起作用的芳烃受体的配体。
色氨酸影响上皮免疫
膳食色氨酸还可以通过增加调节微生物组组成并防止机会病原体感染的抗菌肽的产生来影响上皮免疫性。与炎症性肠病相反,在多发性硬化的鼠模型中,缺乏饮食色氨酸可防止中枢神经系统自身免疫,这是由于致脑病的T细胞反应受损和微生物组发生了深远的变化。
值得注意的是,饮食中色氨酸限制的保护作用在无菌小鼠中被取消,并且与色氨酸代谢物的原型传感器无关,这表明这些保护作用可以通过微生物组的代谢功能来介导。
✦结肠炎患者炎症部位细菌减少
研究表明,尽管溃疡性结肠炎和克罗恩病患者的成对活检样本之间的微生物群落组成具有高度的个体间变异性,但在每个疾病队列中,结肠发炎区域的细菌负荷通常低于非发炎区域。
克罗恩病和溃疡性结肠炎患者的炎症部位和非炎症部位所含的厚壁菌(以及相应的更多拟杆菌)均比非炎症性肠病对照样品少,但仅溃疡性结肠炎患者显著减少。
另一方面,在研究中包括的克罗恩病患者的大多数成对活检样本中检测到肠杆菌科成员,与溃疡性结肠炎和非炎症性肠病样本相比,肠杆菌属成员占克罗恩病总微生物群的比例增加了10倍。
肠杆菌科相对丰度的增加与NOD2风险等位基因计数呈正相关。NOD2基因内的多态性损害了这种细胞内受体作为细菌细胞壁成分的传感器在先天免疫中的作用,增加了克罗恩病的发病风险。
由于先天免疫受体(如NOD2和TLR4)的遗传多态性被认为是炎症性肠病发展的主要风险因素,宿主自身常驻微生物群的异常免疫反应被认为在促进炎症疾病进展方面起着关键作用。
✦白细胞介素放大炎症过程
与正常组织相比,在活动性炎症的溃疡性结肠炎组织中,厚壁菌门的数量较少,这主要是由于粪杆菌属(梭状芽孢杆菌目)的减少。事实上,白细胞介素22、白细胞介素17细胞(Th22细胞)和Th1细胞与厚壁菌门正相关。
白细胞介素17细胞渗入炎症性肠病患者的炎症肠道,在那里产生白细胞介素17A和其他细胞因子,触发并放大炎症过程。虽然Th17细胞因子在炎症性肠病发病机制中可能很重要,但Th17细胞也可能具有组织保护作用,主要取决于其通过产生白细胞介素22增强上皮屏障功能和反调节机制的能力。
✦结肠炎期间宿主-肠道微生物氧交换加强
事实上,众所周知,粪便细菌通过炎症细胞因子调节或刺激白细胞介素10的产生而表现出保护作用。相比之下,由于不动杆菌属的差异,蛋白杆菌门在炎症粘膜中更为丰富,这与Th22细胞和Th1细胞的数量呈负相关。
因此,在活动性炎症的溃疡性结肠炎患者的活检组织中,严格需氧不动杆菌属也扩大了,这表明结肠炎期间粘膜上皮的损伤可能会增加宿主-肠道微生物群的氧交换。
事实上,活动性炎症期间的生物失调状况可能与肠道内存在的径向氧梯度有关,这种氧梯度从较需氧粘膜界面延伸到大部分厌氧肠腔。宿主的氧合影响肠腔氧合,氧从宿主组织扩散到肠腔。在宿主组织恢复常氧后,腔氧浓度也降低,这表明氧气正被靠近粘膜界面的肠道微生物群消耗。粘膜较高的耐氧性和过氧化氢酶表达可能有利于肠道生态系统中的微生物竞争,因此,粘膜可能有利于耐气细菌群落的定植,尤其是来自蛋白质杆菌门的细菌。
与粪便微生物群相比,溃疡性结肠炎患者活检样本中富集的一些细菌类群在无胃肠道症状的研究对象的粘膜中也较高。
因此,在结肠炎活动性炎症期间扩张的细菌很可能在健康人的肠道菌群中正常存在,数量较少。例如,梭状芽孢杆菌和瘤胃球菌科在肠腔菌群中更为丰富,但与活动性结肠炎的样本相比,这些分类群在正常非炎症组织中也更为丰富。
✦炎症和肠道菌群失衡直接可能存在联系
内源性或外源性因素(如饮食、压力或感染)或它们的组合可能会引发亚临床肠道粘膜炎症,这取决于个体的遗传易感性,可能有利于特定促疾病肠道细菌的生长。
这些机会性微生物随后加剧了形态学和功能变化,导致病理后果,导致宿主的慢性炎症和临床症状。这些结果可能支持这样的假设,即炎症性肠病患者中观察到的整体生物失调在某种程度上可能是肠道环境紊乱的结果,而不是疾病的直接原因。
例如,作为炎症反应副产物生成的电子受体促进兼性厌氧菌(如肠杆菌科)的生长。因此,慢性炎症可能形成肠道微生物群,并进一步导致失调。
急性胃肠道粘膜感染的特点是与微生物群的显著变化相关的失调,以及具有增强的侵袭性和炎症特性的细菌的优势,这些特性可以直接加剧炎症和组织损伤,如γ-变形菌。
✦通过肠道菌群判断炎症状态
已有研究显示不同的肠道菌群可以通过免疫反应、影响肠道屏障以及通过胆汁酸转化等代谢途径影响免疫细胞相互作用,从而影响免疫调节。
借助这些方面的研究和临床数据,我们可以通过肠道菌群从几个方面来反映和了解免疫系统及自身的炎症状态。
病原菌的存在很大程度上会激发免疫系统的炎症,因此首先评估肠道菌群中是否存在异常的病原菌超标情况。
来自谷禾健康肠炎临床患者肠道菌群检测报告,结果显示血液链球菌(Streptococcus)及衣氏放线菌(Actinomyces israelii)超标,如下:
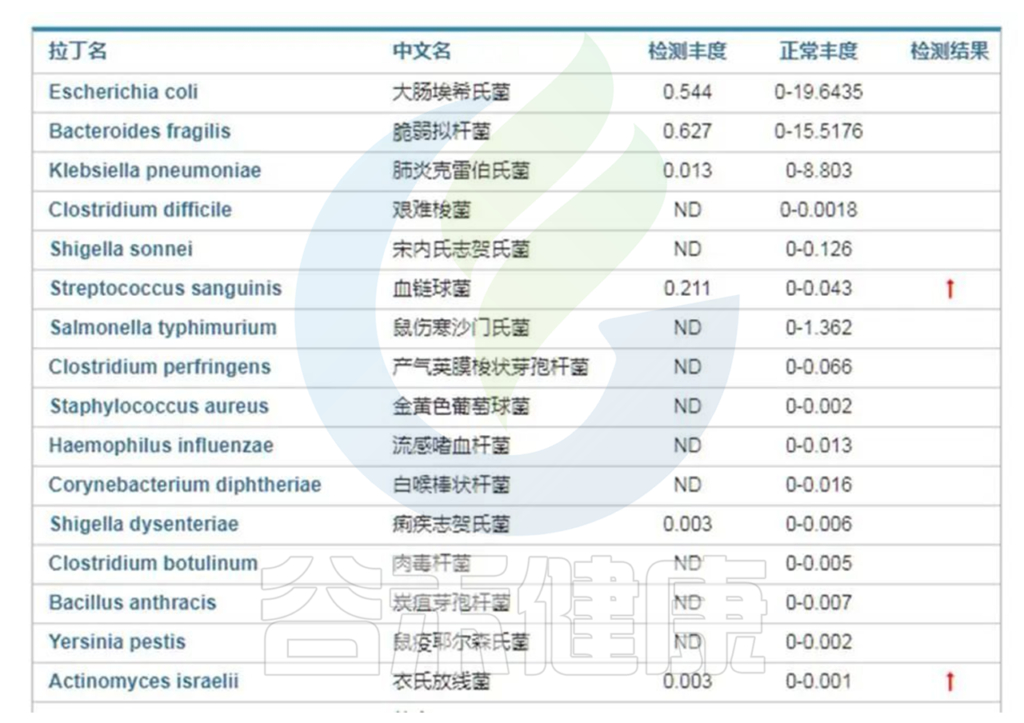
<来源:谷禾健康数据库>
类似的病原菌超标在没有严重导致感染症状的情况下也会诱发或刺激免疫系统炎症,如果免疫力低下就可能导致病原菌感染,如果持续存在超标也可能导致慢性炎症。
真菌微生物群在肠道炎症中的作用日益被认识。炎症性肠病患者和健康人之间的菌群组成不同,真菌菌群也不同,炎症粘膜中的真菌群与非炎症区域的真菌群是可以区分的。
✦炎症区域和非炎症区域真菌差异很大
白色念珠菌(C. albicans)和热带念珠菌(C.tropicalis)在炎症区域特别丰富,而在非炎症粘膜中则不存在。相比之下,S. cerevisiae和Saccharomyces castellii在炎症粘膜中较少出现。
光滑念珠菌(C.glabrata)也在克罗恩病粘膜中富集。光滑念珠菌是最重要的真菌机会性病原体之一,通过适应和免疫逃避策略促进炎症反应,这表明它可能在肠道炎症中起作用。
白色念珠菌也与炎症性肠病患者的粪便真菌有关。白色念珠菌可能是炎症性肠病中观察到的炎症过程的发起者,通过几种途径与酵母菌的主要成分和先天免疫反应的主要受体相结合。
此外,炭角菌目在炎症粘膜上更为丰富,而酿酒酵母在非炎症粘膜中更为丰富。炭角菌目的许多物种产生具有抗菌特性的化合物,可对抗人类病原体,如结核分枝杆菌、耶尔森菌、李斯特菌和沙门氏菌,以及具有细胞毒性和抗氧化活性的代谢物。因此,炭角菌目成员的存在可能反映了对炎症环境的适应。
✦真菌影响受体与免疫,导致炎症
真菌细胞壁成分与宿主免疫反应相关。与病原菌平行,真菌可以穿透被破坏的粘膜屏障,并通过其细胞壁成分激活TLR受体、Dectin-1(C型凝集素受体)、清道夫受体家族成员和固有层的补体系统。
这些受体的感应导致信号事件,依赖于白细胞介素17、白细胞介素22、CARD9(Caspase募集域家族成员-9)、ITAM(免疫受体酪氨酸基激活基序)、NFAT(活化T细胞的核因子)和NF-kB,导致严重的炎症表型。
由于文化传统、农业做法、社会经济地位和生活方式的改变,饮食本身在世界各地都在发生变化。炎症性肠病发病率的快速增加与工业化和暴露于环境因素,特别是饮食改变有关。营养和饮食模式影响免疫系统稳态,并可能通过不同的机制导致肠道炎症,包括肠道微生物群的调节。
饮食对肠道菌群组成有很大影响。目前关于饮食策略作为炎症性肠病主要治疗方法的证据越来越多。过去几年,针对炎症性肠病的潜在治疗效果,提出了几种饮食干预措施,即特定碳水化合物饮食、无麸质饮食、抗炎饮食。
然而,这些饮食要么不耐受,要么限制性很强,要么缺乏证据证明其对炎症性肠病的疗效。炎症性肠病的饮食干预研究最多的是独家肠内营养,这在儿科克罗恩病中常用,但饮食发挥其作用的确切机制尚不清楚。
独家肠内营养包括使用营养全面的液体饮食,而不是通常的固体和液体,通常长达8周,这是非常严格的,特别是在长期使用期间,可接受性有限。
✦抗炎饮食
你吃的食物在控制慢性炎症方面可能起到积极和消极的作用。
▸ 什么是抗炎饮食?
国际食品信息理事会基金会(International Food Information Council Foundation)营养传播副主任将其描述为一种饮食,重点关注高营养的食物,任何“营养密集”,“天然来源的维生素,矿物质和色素很多”的食物都是这种饮食的理想成分。
尤其是抗氧化剂, “它的主要参与者是水果,蔬菜,豆类,健康脂肪等食物,例如橄榄油和牛油果,包括鱼类,坚果和浆果等。
但是,抗炎饮食不仅是您的饮食,而且与食物的烹饪方式有关。应限制或避免高盐,饱和脂肪,糖和精制碳水化合物的食物。
在这里列举了一些抗炎食物和促炎食物,可以帮助更好地进行抗炎饮食。
•抗炎食物
很多种食物均具有抗炎特性,其中包括抗氧化剂和多酚含量高的食物。
1 浆果
浆果是小果实,富含纤维,维生素和矿物质
2 深海鱼
深海鱼是蛋白质和长链omega-3脂肪酸EPA和DHA的重要来源。
3 西兰花
西兰花是萝卜硫烷的最佳来源之一,萝卜硫烷是一种具有强大抗炎作用的抗氧化剂,可通过减少引起炎症的细胞因子和NF-kB的水平来对抗炎症。
4 牛油果
牛油果可能是少数值得冠以的超级食品之一,提供各种有益的化合物,可防止发炎并降低癌症风险。
5 辣椒
甜椒和辣椒中富含维生素C和抗氧化剂,具有强大的消炎作用。
6 蘑菇
蘑菇的热量非常低,并且富含硒,铜和所有B族维生素。它们还包含提供抗炎保护的酚和其他抗氧化剂。
7 葡萄
葡萄含有花青素,可减少炎症。此外,它们还可以降低多种疾病的风险,包括心脏病,糖尿病,肥胖症,阿尔茨海默氏病和眼疾。
8 姜黄
姜黄素是一种强大的抗炎营养素,因此受到了广泛的关注。姜黄可减轻与关节炎,糖尿病和其他疾病相关的炎症。
9 特级初榨橄榄油
特级初榨橄榄油是可以吃的最健康的脂肪之一。
它富含单不饱和脂肪,是地中海饮食中的主要食物,具有许多健康益处。
•促炎食物
在受伤或感染期间,身体会释放化学物质以帮助保护它并抵抗任何有害生物。但是,食用过多的促炎食物可能会导致慢性低度发炎。
1 糖和精制碳水化合物
摄入过多的糖和精制的碳水化合物与体内炎症增加以及胰岛素抵抗和体重增加有关。
2 人造反式脂肪
人造反式脂肪可能是您可以食用的最不健康的脂肪。它们是通过将氢添加到液态不饱和脂肪中而产生的,以使其具有更固态的脂肪的稳定性。
3 过量饮酒
虽然适度饮酒可带来一些健康益处。但是,较高的用量会导致严重的问题。大量饮酒可能会加剧炎症并导致“漏泄的肠道”,从而在整个身体内引发炎症。
4 植物油和种子油
概要一些研究表明,大量食用植物油中的omega-6脂肪酸含量可能会促进炎症。但是,证据不一致,需要更多的研究。
6 加工肉
加工肉富含AGEs等炎性化合物,其与结肠癌的强烈关联可能部分归因于炎症反应。食用加工肉会增加患心脏病,糖尿病,胃癌和结肠癌的风险。
✦FODMAP饮食
前不久提出了一种更有前景的直接针对肠道微生物群的营养方法,包括低可发酵低聚糖、双糖、单糖和(FODMAP)的饮食。
FODMAP是极易发酵但吸收不足的物质,分子量小,高渗效应导致肠道通透性增加。这些特性增强了肠道微生物群的发酵作用。
•FODMAP饮食的负面作用
富含FODMAP的饮食相关的症状是产气、腹痛、腹胀、抽筋、腹胀和腹泻。另一方面,近端结肠中FODMAP的快速发酵导致内腔中短链脂肪酸和乳酸的大量生成,进而影响粘膜屏障。
// 容易营养缺乏
尽管静止性炎症性肠病患者的胃肠道症状有潜在改善,但低FODMAP饮食与负面影响相关。由于饮食限制,营养缺乏的风险很高。
// 对肠道微生物有负面影响
另一方面,低FODMAP饮食意味着限制食品中天然存在的益生元,如果聚糖和低聚半乳糖,通过减少糖化细菌,特别是双歧杆菌,对肠道微生物群组成产生负面影响。
// 菌群数量减少
观察到,在静止期炎症性肠病患者中,低FODMAP饮食后,长双歧杆菌、青春期双歧杆菌和普氏双歧杆菌的数量减少。
由于双歧杆菌优先发酵果聚糖和低聚半乳糖,而普拉斯尼茨革兰阴性杆菌通过交叉喂养间接利用它们,因此,这种减少可能是由于到达肠道的可发酵底物数量的变化造成的。
在静止期克罗恩病患者中,低FODMAP饮食导致产生丁酸盐的梭状芽孢杆菌簇和嗜粘杆菌数量减少,这对粘膜相关微生物群的健康很重要,并且黏液溶解度瘤胃球菌扭矩的相对丰度增加,通常在克罗恩病患者中减少。
注意
长期服用低FODMAP饮食引起了一些担忧。除了评估饮食对炎症标记物或疾病活动的影响外,还需要对炎症性肠病患者低FODMAP饮食的充分性和安全性进行更多研究。
此外,关于低FODMAP饮食影响的少数研究样本量小,饮食应用的设计和时间不同,可能会影响结果的显著性。
营养干预可能在炎症性肠病症状管理和延长病情缓解方面发挥重要作用。然而,需要进一步的研究来更好地描述饮食、肠道微生物群和炎症性肠病之间的关系。
小结
饮食干预可能是挽救生命和降低医疗费用的可持续且具有成本效益的方式。但是,这些饮食干预措施的长期成功因人而异。成功与否取决于每个人的饮食建议是否可行,以及这些措施是否确实产生了预期的生理变化。
益生菌被定义为当摄入足够量时对宿主健康有益的活微生物。
益生菌作为操纵肠道微生物群内物种组成和代谢活动的一种手段,已被大量研究,以促进健康,预防或管理肠道疾病。
益生菌的作用可以是直接的,也可以是间接的,通过调节居民的微生物群或免疫系统。它们可以增强上皮屏障功能,增加对肠粘膜的粘附力,同时抑制病原体,促进对病原菌的竞争性排斥,产生抗微生物物质,并调节宿主的免疫系统。
例如,在感染或炎症状态下,益生菌可能会增加肠上皮细胞之间紧密连接的完整性,并防止肠细胞凋亡。此外,益生菌会产生短链脂肪酸和乳酸,降低肠上皮细胞的促炎反应,抑制潜在致病微生物的生长。
✦益生菌在炎症性肠病的作用
因此,使用益生菌调节肠道菌群,以对症和明确管理炎症性肠病具有巨大的治疗潜力。益生菌应从人类的肠道菌群中选择,不应对抗生素产生固有的耐药性。乳杆菌属(Lactobacillus)和双歧杆菌属(Bifidobacterium)的成员通常被认为是安全的,是功能性食品和补充剂中使用最多的益生菌,因为它们被证明对健康有益。
•益生菌对克罗恩病的作用暂不明确
使用益生菌治疗克罗恩病产生了相互矛盾的结果。一些研究已经成功地用益生菌治疗克罗恩病,如大肠杆菌(Escherichia coli)、鼠李糖乳杆菌( Lactobacillus rhamnosus)和布拉迪酵母菌(Saccharomyces cerevisiae boulardii)。
相反,也有报道称,鼠李糖乳杆菌未能维持克罗恩病的缓解。由于该研究领域缺乏精心设计的随机对照试验,目前关于益生菌诱导克罗恩病缓解的疗效和安全性的证据的确定性较低。
然而,最近公布的克罗恩病患者报告称,定期服用含有乳酸菌菌株组合(戊糖乳杆菌、短乳杆菌、植物乳杆菌、发酵乳杆菌、凯氏乳杆菌和林德纳乳杆菌)的产品导致其粪便中凯氏乳球菌丰度更高,症状的减轻和生活质量的提高。
L. kefiri具有很强的调节肠道微生物群组成的能力,导致与炎症反应和胃肠道疾病发病直接相关的几个细菌属显著减少。
✦益生元与合生元在炎症性肠病中的作用
益生元被定义为“通过选择性刺激结肠中一种或有限数量细菌的生长或活性,从而对宿主产生有益影响的非消化性食品成分,从而改善宿主的健康”。
益生元与短链脂肪酸(主要是醋酸盐、丙酸盐和丁酸盐)的生成增加有关,这可能有助于维持结肠内稳态。合生元是益生菌与益生元的结合,可能有利于活性克罗恩病患者,是治疗该疾病的潜在疗法。长期研究表明,服用合生元对活性克罗恩病有很好的疗效。
对最初接受氨基水杨酸盐和泼尼松龙治疗方案但未能缓解的患者进行合生疗法试验。合生元包括高剂量的益生菌短双歧杆菌、长双歧杆菌和干酪乳杆菌,以及作为益生元的木薯。
// 一定程度上改善克罗恩病症状
大多数患者的临床症状有所改善。车前草已被证明有助于腹泻患者,改善粪便粘稠度和黏度。其他随机对照试验评估了克罗恩病患者服用含有长双歧杆菌与商业益生元组合的合生元后,临床症状和组织学评分得到了有效改善,肠粘膜中的长双歧杆菌和其他种类的双歧杆菌定植增加。
此外,在3个月时,治疗组对粘膜白细胞介素18、干扰素(INF-g)和白细胞介素1b的影响不大,而TNF-a的表达在6个月时显著降低。粘膜中双歧杆菌物种的更高丰度可促进与参与调节促炎细胞因子途径的致病物种的竞争,从而刺激更具免疫调节性和耐受性的免疫反应。
// 缓解溃疡性结肠炎
大肠杆菌Nissle 1917是一种非致病性大肠杆菌菌株,可防止和对抗病原菌的定植。它减少结肠粘膜损伤,降低上皮通透性,有效维持溃疡性结肠炎缓解。
混合益生菌VSL#3由8株细菌组成,包括嗜酸乳杆菌、保加利亚乳杆菌、植物乳杆菌、干酪乳杆菌、嗜热链球菌、短双歧杆菌、婴儿双歧杆菌和长双歧杆菌。它下调宿主免疫反应,改善上皮屏障功能,增加粘液生成。
综合分析显示,VSL#3与安慰剂相比,在诱导缓解方面有显著益处的趋势,而与美沙拉秦相比,大肠杆菌Nissle 1917在维持缓解方面表现出非劣效性。
一种类似的合生元被证明在溃疡性结肠炎治疗中有用。肿瘤坏死因子、白细胞介素1a是驱动炎症和诱导防御素表达的炎症细胞因子,治疗后也显著降低。试验组的活检减少了上皮组织的炎症和再生。肿瘤坏死因子在活动性溃疡性结肠炎的发病机制中起着关键作用。因此,抑制炎症溃疡性结肠炎粘膜中肿瘤坏死因子的分泌是治疗疾病和预防复发的主要目标。
小结
虽然益生菌或合生元的使用对溃疡性结肠炎的治疗和维持有积极作用,但在克罗恩病中,只有合生元显示出明显的效果。
益生菌疗法可以通过与促进结肠中益生菌生长的益生元结合而潜在地得到改善。使用合生元的另一个优点是,益生元成分可以促进肠道内具有益生菌特性的本地生物体的生长。使用益生菌调节肠道细菌组成,并可能减少炎症或激活先天免疫,可用于治疗策略中,以恢复宿主肠道微生物群。
益生菌可能通过操纵微生物群来增加有益微生物的数量,减少可能有害的细菌,从而减少炎症触发因素,从而增加肠道生物多样性,改善炎症性肠病患者的症状。不过,不同微生物菌株和临床环境的益生菌效果不同。因此,对于大多数炎症性肠病患者来说,很难实现一般益生菌配方。
目前用于炎症性肠病的治疗策略会严重抑制免疫系统,从而导致严重感染和恶性肿瘤等风险。最近开发了一种基于微生物的免疫疗法,利用正常肠道微生物群的固有免疫调节特性,通过恢复免疫功能来治疗免疫相关疾病。
这种新的方法涉及位点特异性免疫调节剂,它是一种复杂的生物制剂,旨在以靶向、器官特异性的方式激活先天免疫应答。
▸ QBECO治疗
QBECO是一种来源于临床肠致病性大肠杆菌灭活分离物的试验性位点特异性免疫调节剂。
QBECO针对激活的巨噬细胞向胃肠道募集,大肠杆菌菌株通常会导致感染。免疫调节剂包含来自单个灭活微生物物种的成分,免疫系统将其识别为特定器官或组织中感染的常见原因,刺激新一波激活的固有免疫细胞的募集,并清除非生产性炎症的慢性来源。
因此,QBECO治疗不是抑制免疫功能,而是通过新免疫细胞的产生和动员,优化异常免疫反应,重建正常屏障功能和粘膜稳态,从而克服胃肠道免疫失调。
✦QBEOO减轻了炎症性肠病的病理
QBECO已经在诱导性结肠炎和炎症性肠病患者的实验模型中进行了测试。服用QBECO后,小鼠结肠炎的严重程度总体降低。该疗法减弱了肠道病理,改善了粘膜完整性,从而减少了胃肠粘膜的免疫细胞浸润,尤其是中性粒细胞的数量。
// 溃疡性结肠炎患者症状改善
在同一研究中,大多数接受QBECO治疗的UC患者在接受16周治疗后,其疾病在临床、内镜和组织学方面均有改善,粘膜完整性也有所改善。此外,治疗后1周内直肠出血明显减少。QBECO治疗还降低了结肠粘膜UC患者中中性粒细胞的数量,正如在诱导性结肠炎小鼠中观察到的那样。
// 克罗恩病患者症状也有改善
接受微生物QBECO治疗的克罗恩病患者也报告症状改善。在第一种临床方法中,十分之七的患者在至少三个月的治疗期间症状完全缓解。三名患者在停止药物治疗和QBECO治疗后持续出现临床病情缓解。此外,研究期间未报告严重不良事件。
最近对68名中重度克罗恩病患者进行的随机对照试验(RCT)评估了QBECO的安全性、疗效和耐受性。接受QBECO治疗的患者对治疗有良好的耐受性。
与安慰剂相比,到第8周时,疾病活动显著减少。之前接受肿瘤坏死因子抑制剂治疗的患者在第8周对QBECO反应的可能性较小,但随着治疗持续到第16周,症状有所改善,这表明可能需要更长的疗程才能在这些受试者中取得最佳结果。
此外,在随机对照试验期间QBECO治疗改善的克罗恩病患者产生IL-18,血清IFNg、IL-12p70和IL-17A水平较高,证实了对细菌刺激的有效免疫反应。
小结
利用基于微生物的免疫疗法,如QBECO,其功能是有效激活而不是抑制粘膜免疫功能,这是一种新的炎症性肠病治疗思路。然而,还需要进一步研究来评估这种新型免疫治疗方法在溃疡性结肠炎和克罗恩病治疗中的安全性和疗效。
用捐赠的粪便或纯化的粪便培养物进行粪便微生物群移植是目前治疗复发性艰难梭菌感染的常规方法。越来越多的人认识到微生物群失调在炎症性肠病发病机制中的作用,促使人们研究粪便移植作为一种潜在的炎症性肠病新疗法。
粪便移植改善炎症性肠病的证据进展迅速,前景看好。然而,关于这种治疗的疗效,有报道称结果相互矛盾。
注意:结果的多样性可能与不同的实验设计和方法学问题有关,包括供体选择、粪便类型、分娩方法、移植前准备、供体粪便处理方法、供体样本汇集以及给药频率和时间。
例如,粪便捐赠者样本的厌氧处理可保存可存活的厌氧菌用于移植,并可能影响临床结果。
最近的一项短期随机对照试验得出结论,使用经厌氧处理的供者样本进行粪便移植,与使用自体样本相比,8周后病情缓解的可能性更高,并且与本研究中观察到的治疗反应呈正相关的所有生物体都是厌氧菌(主要是专性厌氧菌)。Anaerofilum pentosovorans和粪拟杆菌物种的增加与治疗后疾病的改善密切相关。然而,从基线检查到第4周,微生物的数量发生了显著变化,在第8周之前保持稳定,但在12个月后发生了变化。
✦粪菌移植在溃疡性结肠炎中的作用
// 胃肠道症状改善,微生物群与健康者相似
一项前瞻性研究调查了溃疡性结肠炎患者粪便微生物群移植的临床疗效,结果表明,治疗后胃肠道症状改善,健康肠道微生物群重新繁殖。移植后,微生物群逐渐与健康献血者相似。克雷伯菌属和链球菌属的相对丰度下降,普氏菌属的相对丰度增加,表明这些属的变异可能是导致溃疡性结肠炎发病的重要因素。
// 微生物多样性显著增加
另一项研究表明,多次给药6周的多捐赠者密集剂量粪便微生物群移植是活动性溃疡性结肠炎患者的有效治疗方法。移植与微生物多样性显著增加相关,持续至治疗结束后8周。
此外,特定分类群与粪便微生物群移植结果相关。虽然梭状芽孢杆菌和Blautia属与治疗益处相关,但其他属(包括梭杆菌属和Sutterella属)的结果一直为阴性,这些属被认为与溃疡性结肠炎的发病机制有关。
粪便移植后病情缓解的溃疡性结肠炎患者粪便中的霍氏真杆菌(Eubacterium hallii)和inulivorans Roseburia富集,粪便样本中的短链脂肪酸水平升高。此外,未获得缓解的患者 Fusobacterium gonidiaformans、Sutterella wadsworthensis和埃希氏杆菌的富集。
建议
需要进一步研究来评估炎症性肠病患者粪便微生物群移植的长期缓解维持和安全性。
根据个体特征,使用各种特定肠道保护微生物菌株或其代谢物组合,可能比整个粪便微生物群移植更有效、更安全。
肠道微生物群失调似乎在炎症性肠病的发展中起着重要作用。发现可能导致慢性炎症的肠道微生物特征至关重要。
近年来,在鉴定不同微生物类群之间的健康平衡方面取得了重大进展。厚壁菌门和拟杆菌门中包含的某些微生物类群的丰富程度与健康肠道相关,有益或有害微生物之间的平衡强烈影响宿主健康。
影响宿主微生物群的遗传和环境因素需要进一步研究。为了开发个人定向治疗,还迫切需要更广泛地鉴定促进健康的微生物类群。
未来的另一个主要目标是选择个性化的益生菌或合生元疗法(或微生物特异性粪便移植)来治疗单个炎症性肠病患者,为实现长期缓解甚至完全治愈炎症性肠病做出巨大贡献。
主要参考文献:
Adamji, M., Day, A.S., 2019. An overview of the role of exclusive enteral nutrition for complicated Crohn’s disease. Int. Res. 17, 171–176.
Borisova, M.A., Achasova, K.M., Morozova, K.N., et al., 2020. Mucin-2 knockout is a model of intercellular junction defects, mitochondrial damage and ATP depletion in the intestinal epithelium. Sci. Rep. 10, 21135.
Buisson, A., Douadi, C., Ouchchane, L., et al., 2019. Macrophages inability to mediate adherent-invasive E. coli replication is linked to autophagy in Crohn’s disease patients. Cells 8, 1394.
Caldeira, L. de F., Borba, H.H., Tonin, F.S., et al., 2020. Fecal microbiota transplantation in inflammatory bowel disease patients: a systematic review and meta-analysis. PLoS One 15, e0238910.
Cox, S.R., Lindsay, J.O., Fromentin, S., et al., 2020. Effects of low FODMAP diet on symptoms, fecal microbiome, and markers of inflammation in patients with quiescent inflammatory bowel disease in a randomized trial. Gastroenterology 158, 176–188.e7.

谷禾健康

随着高通量多组学技术的快速创新推动,微生物群,尤其是肠道菌群失调已被明确与许多人类疾病有关,包括 2 型糖尿病和炎症性肠病。
多组学数据的综合分析,包括宏基因组学和代谢组学以及宿主指标的检测和细菌物种的分类,已经确定了许多与疾病相关的细菌和细菌产物。然而,深入了解微生物影响肠道健康的机制需要从关联拓展到因果关系。
目前对肠道微生物群对疾病因果关系的贡献的理解仍然有限,这主要是由于微生物群落结构的异质性、疾病进化的个体差异以及对将微生物群衍生信号整合到宿主信号通路中的机制的不完全理解。
最近,德国慕尼黑工业大学从事肠道菌群和营养研究的Haller 教授团队在《Nature reviews gastroenterology & hepatology》 (自然评论胃肠病学和肝病学)发表评论文章,系统讨论了目前已知的炎症和代谢紊乱相关微生物组的特征和认知,并讨论提高对其作用机制理解的困难所在。
在这里我们将文章整理与大家分享。


关键信息
1、肠道菌群组成的改变和细菌衍生代谢物经宿主加工后的变化与 IBD 和 T2DM 相关,并提供了共同的潜在致病机制。
2、益生菌与 IBD 或 T2DM 之间的因果关系已通过无菌小鼠实验和综合多组学研究明确。
3、对于疾病特异性生物标志物发现的挑战,包括确定观察到的变化的因果关系,了解它们在疾病机制中的功能以及肠道微生物群的地理和种族差异。
4、特定细菌菌株、其编码基因和代谢副产物的大数据细化、测试和验证对于识别疾病生物标志物是必要的。
文章内容
人体消化道含有一系列复杂的微生物,包括细菌、古细菌、病毒和真菌。由于消化道及其微生物组被认为位于免疫和代谢过程的交叉点,本文重点关注炎症性肠病 (IBD) 和 2 型糖尿病 (T2DM) 作为微生物群相关疾病的范例。
IBD 和 T2DM 都被认为是多因素疾病,随着工业化的进展其发病率在全球范围内呈上升趋势。病因涉及遗传易感性、环境诱因和城市生活方式相关因素的复杂相互作用。
在这种共同的背景下,代谢疾病(如 T2DM)的另外特征是肝脏、脂肪组织、肌肉、胰腺和肠道的慢性亚临床炎症,而炎症性胃肠道疾病,如克罗恩病(CD)和溃疡性结肠炎(UC) ,也与炎症驱动的代谢改变有关。
环境触发因素的重要性(肠道菌群)
全基因组关联研究已经确定了大量的遗传变异与 T2DM (143 位点) 或 IBD (>240 位点)的易感性增加相关。然而,这些变异共同解释了这些疾病的一小部分遗传性:T2DM < 10 %,UC < 15 % 和 CD < 50 % 。这种情况表明环境触发因素的重要性,特别是肠道微生物组,作为这些疾病病因的主要贡献者。对大型人群研究和 IBD 或 T2DM 患者队列的多项分析已经确定了与特定疾病表型、复发风险和治疗反应相关的微生物组特征。
IBD 和 T2DM 都与特征性微生物改变有关,特别是随着有益微生物的减少和病原菌的增加而降低群落多样性。尽管它们的病理学不同,IBD 和 T2DM 有几个共同的机制特征。T2DM 的代谢特征伴随着慢性低度炎症和肠道屏障的破坏,IBD 患者的复发性炎症发作与细胞和全身水平的代谢改变共同发生。
这些复杂疾病的治疗仍然具有挑战性,但粪便微生物群移植(FMT) 的对照试验已显示出对T2DM和IBD的临床疗效,包括UC以及较轻的 CD。
FMT对炎症、免疫和代谢疾病有效果但存在差异
FMT 的临床试验还提供了肠道菌群与其他炎症、免疫或代谢疾病之间存在因果关系的证据。例如,FMT 在治疗大约 90% 的艰难梭菌(以前的艰难梭菌)感染患者方面非常有效并已被评估为治疗肥胖和移植物抗宿主病。
在四项随机临床试验中,FMT 在 28% 的 UC 患者中诱导了临床缓解。但很少有临床试验检查过 FMT 在 CD 患者中的疗效,而且结果相当不同。
在一项对 174 名接受 FMT 治疗的 CD 患者进行的研究中,20% 的患者获得了临床缓解,总体而言,43% 的患者获得了临床缓解。
一项单独的随机对照试验发现 FMT 对 CD 患者的临床缓解率没有影响,但供体微生物群的植入增加与维持缓解有关。相反(尽管大量研究表明,特定的菌群失调或特定的微生物群谱与代谢紊乱有关),FMT 对代谢性疾病患者有益的证据尚不明确。具有里程碑意义的研究表明,从较瘦、健康的捐赠者那里接受 FMT 的代谢综合征患者的代谢改善以及肠道微生物组的有益变化。然而,这些影响是不一致和短暂的,这可以通过供体微生物群的有限移植或基线时供体粪便微生物多样性的变化来解释。
有趣的是,口服 FMT 后补充低发酵性纤维可改善肥胖和代谢综合征患者的胰岛素敏感性、增加微生物多样性,并延长供体微生物定植。这些数据强调了微生物调节疗法在逆转代谢功能障碍中的价值。
与这些发现一致,来自代谢受损的肥胖供体的 FMT 会暂时恶化代谢综合征受体的胰岛素敏感性,而胃旁路术后健康供体的 FMT 会导致代谢综合征受体的胰岛素敏感性略有增加。
几项大型队列研究(表 1、表2)通过分析 IBD 患者的肠腔和黏膜微生物群落,研究了肠道微生物群的改变。
总体而言,活跃期IBD 与某些菌群的数量过多有关,如:
肠杆菌科Enterobacteriaceae
梭杆菌属Fusobacterium
咽峡炎链球菌Streptococcus anginosus
肠球菌Enterococcus
巨球菌Megasphaera
弯曲杆菌Campylobacter
Gammaproteobacteria
Deltaproteobacteria
相反,IBD 与有益菌群的缺失有关,例如:
Faecalibacterium prausnitzii
Christensenellaceae
Collinsella
Roseburia
Ruminococcus
其他产丁酸盐的细菌
在我们检测的炎症性肠病的菌群报告中也发现,炎症性肠病风险高的人群中,炎症水平很高,肠杆菌科Enterobacteriaceae,梭杆菌属Ruminococcus gnavus偏高,而Faecalibacterium prausnitzii和Roseburia丰度普遍降低或者缺乏。


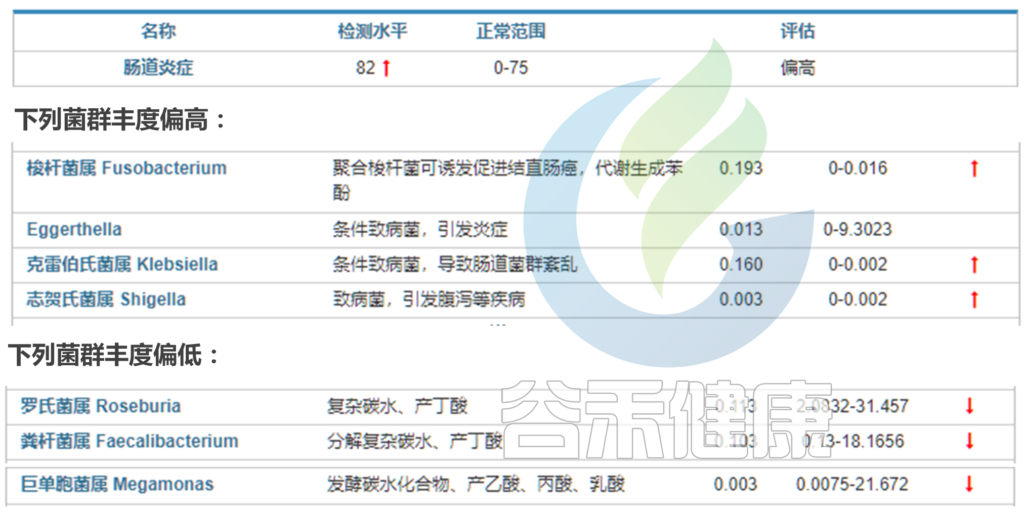
< 选自:谷禾肠道菌群健康检测报告 >
菌群代谢功能
粪便样本的宏基因组学为 IBD 中发生的功能失调和代谢途径的扰动提供了更全面的观点。这些研究表明,参与含硫氨基酸合成、核黄素代谢、谷胱甘肽转运蛋白、氧化应激和营养转运的代谢途径均被上调。
一项能够将微生物群落分解到物种内单个菌株水平的研究显示,与健康对照相比,IBD 或肠易激综合征 (IBS) 患者粪便样本中致病菌的菌株多样性增加,而有益微生物的菌株多样性降低。深入分析表明,219个类群(包括152种)与CD相关,102个类群(包括93种)与UC相关。
CD的主要特征是属于毛螺菌科和瘤胃球菌科的分类群减少和属于肠杆菌科的分类群增加,而对于UC观察到属于拟杆菌科的分类群减少和属于毛螺菌科的分类群增加。与这种异质性一致,在不同的 IBD 研究中仅存在少数物种的共同变化,这表明尽管疾病表型和病程相似,但在 CD 患者群体中仍存在个体间差异。
IBD和肠道菌群的因果关系探究
肠道微生物群在 IBD 中的致病作用的首批临床证据之一源于实验表明,从 CD 患者的小肠发炎段转移粪便流可改善疾病症状。粪便流的恢复和新末端回肠术后暴露于肠腔内容物会诱发炎症,这表明肠道微生物群会引发 CD的术后复发。此外,抗生素治疗对活动性 CD 患者亚群的疗效强调了肠道细菌和 IBD 之间的因果关系。
急性和慢性肠道炎症小鼠模型的机制研究为微生物失调与 IBD 之间因果关系的提供了进一步证据。例如,将IBD 患者的菌群移植到无菌受体小鼠,会将IBD 表型转移到无菌小鼠中。而具有 IBD 遗传易感性的小鼠在无菌条件下不会发生自发性炎症。
免疫响应
IBD 发病的遗传易感小鼠的失调菌群,能够将这种疾病症状转移到无菌受体小鼠。将 IBD 微生物群转移到无菌的野生型小鼠体内会导致肠道 T 细胞反应失衡,肠道 T 辅助 17 (TH17) 细胞和 TH2 细胞数量增加,RORγt +数量减少。同样,肠道微生物群的人类共生细菌脆弱拟杆菌对无菌小鼠的定植诱导CD4 + T 细胞转化为产生IL-10的FOXP3 + T reg细胞,这表明微生物群驱动的存在IBD 的发病机制。
在 T2DM 中也发现了几种细菌类群的丰度变化很大。
例如,据报道,2型糖尿病患者中下列菌相对丰度增加:
大肠杆菌E. coli、
韦荣氏菌属Veillonella、
布劳氏菌属Blautia、
厌氧菌属Anaerostipes、
乳杆菌属Lactobacillus、
粪杆菌属Faecalibacterium、
梭状芽胞杆菌属Clostridiales(等)
相反,下列菌丰度降低:
拟杆菌属Bacteroides
双歧杆菌属Bifidobacterium、
副拟杆菌属Parabacteroides、
颤螺菌属Oscillospira
可降解粘蛋白的阿克曼菌Akkermansia muciniphila
2019 年发表的一项宏基因组和宏蛋白质组学研究分析了来自 254 名中国个体的粪便样本中的肠道微生物群组成和功能,其中包括 77 名未接受治疗的 T2DM 患者、80 名糖尿病前期患者和 97 名葡萄糖耐量正常的对照个体。与代谢健康的对照组相比,T2DM 患者和前驱糖尿病患者的梭菌目Clostridiales细菌丰度较低,而埃氏巨球形菌Megasphaera elsdenii的丰度较高。
菌群代谢功能
在 T2DM 患者和糖尿病前期患者的微生物组中观察到功能差异。与对照个体相比,糖尿病前期个体的肠道微生物群显示出与糖磷酸转移酶系统、细菌分泌系统和氨基酸的 ATP 结合盒 (ABC) 转运蛋白有关的途径富集。这些发现表明,在糖尿病前期患者转变为 T2DM 之前,可以检测到肠道微生物组的疾病特异性变化。
环境因素影响
细菌种类和代谢基因簇谱的差异已被用于确定一组具有正常葡萄糖耐量或 T2DM 的个体的糖尿病状态。然而,包括地理位置、种族、健康状况和用药史在内的混杂因素导致在识别与 T2DM 相关的微生物变化方面不同研究存在不一致。
因果关系研究
几项研究提供了肠道微生物群特定成员与 T2DM 发病机制之间因果关系的证据。例如,A. muciniphila属于在人类和小鼠研究中显示对代谢紊乱具有保护作用的分类群。有趣的是,补充益生元使A. muciniphila的丰度正常化并改善了人类的代谢健康。同样,对喂食高脂肪饮食的小鼠施用A. muciniphila可逆转其增加的脂肪量、代谢性内毒素血症、脂肪组织炎症和胰岛素抵抗。
此外,产生丁酸盐的细菌Anaerobutyricum soehngenii(以前称为Eubacterium hallii菌株 L2-7)显示出丰度增加,这与来自瘦供体的FMT受体的外周胰岛素敏感性改善相关。
对T2DM 患者A. soehngenii菌水平进行管理,在治疗 4 周后改善了外周胰岛素敏感性,这些益处伴随着微生物群组成的改变和胆汁酸代谢的变化。
奇怪的是,特定的细菌分类群在 IBD 和 T2DM 中表现出相似的变化,这表明免疫介导和代谢疾病的共同特征导致微生物群的相似适应。
下列菌丰度下降:
梭状芽孢杆菌属 Clostridium spp.
粪杆菌属 Faecalibacterium
瘤胃球菌属 Ruminococcus
阿克曼氏菌属 Akkermansia
柯林斯氏菌属 Collinsella
罗斯氏菌属 Roseburia
下列菌丰度增加:
肠杆菌科 Enterobacteriaceae
大肠杆菌 E. coli
具核梭杆菌 Fusobacterium nucleatum spp.
这为定义疾病特异性标志物提出了挑战(下图)


Metwaly et al.,Nat Rev Gastroenterol Hepatol. 2022.
例如,一项针对 2,045 名 IBD 患者的研究的作者确定了 8 个分类群的特征,包括克里斯滕森菌科Christensenellaceae和梭杆菌属Fusobacterium的未知成员,它们可以区分 CD 患者和健康个体。
然而,Christensenellaceae 的丰度增加与低 BMI 和体重减轻有关,这是一种在 IBD 患者中经常观察到的分解代谢状况。同样,梭杆菌的富集被认为是转移性结直肠癌患者预后不良的标志。鉴于 IBD 患者患结直肠癌的风险增加,这一提议的微生物组特征可能是一种附带现象,与潜在的疾病机制没有因果关系。
对来自 132 名个体的微生物组、代谢组和转录组数据集的综合网络分析确定了连接关键细菌分类群(即F. prausnitzii 、未分类的Subdoligranulum、Alistipes、大肠杆菌、Roseburia)的某些代谢物(短链脂肪酸、辛酰肉碱和几种脂质)。有趣的是,有和没有 IBD 的研究参与者之间的差异在粪便代谢组中,比在粪便宏基因组、粪便宏转录组或粪便蛋白质组中更明显。
在综合个人组学分析研究 (iPOP) 中,血浆代谢物与来自 106 名个体的纵向样本中的胰岛素抵抗密切相关,这表明宿主代谢组和肠道微生物组之间的相互作用在胰岛素抵抗个体中受到干扰。
许多研究调查了微生物改变作为疾病生物标志物的效用,特别是在 CD 或 UC 患者中。最初试图定义可以作为疾病活动指标的单一细菌分类群。
例如,F. prausnitzii (一种产生丁酸盐的厚壁菌)在 CD患者中被耗尽。CD 患者回肠黏膜活检样本中这种细菌丰度的降低与回肠切除术后内镜下复发风险的增加密切相关。相反,粘附的侵袭性大肠杆菌丰度增加与回肠 CD相关。
然而,由于大多数细菌物种由许多个体菌株组成,这些菌株可以表现出相当大的基因组和蛋白质组变异,因此菌株多样性具有重要的功能,特别是在确定致病性方面。
例如,R. gnavus和大肠杆菌的亚种都与 IBD 的严重程度增加有关。此外, R. gnavus的一个特定亚种表明,来自 IBD 患者的粪便样本中丰度增加含有菌株特异性基因(与改善的细菌定植有关)。这些基因涉及诸如氧化应激反应、细菌粘附、铁获取和宿主粘液利用等功能。同样,不同的脆弱拟杆菌菌株表现出功能差异,导致 IBD 相关小鼠模型中 IgA 诱导水平不同。这些遗传上不同的脆弱拟杆菌菌株在接种到受体小鼠时也表现出不同的致结肠和免疫调节作用。在一项旨在定义用于监测 IBD 患者疾病活动的关键菌群失调的研究中,使用定量 PCR 计算了F. prausnitzii和大肠杆菌的绝对丰度比(也称为 F-E 指数)。F-E 指数的使用提高了 UC 和 IBS 患者与 CD 患者的区分,并有助于区分结直肠癌与其他肠道疾病。然而, F-E 指数无法区分 IBD亚型,这表明单一分类群指标在分类疾病亚型方面的效用有限。
大规模生物标志物分析
基于微生物特征的判别模型
几项研究已经使用机器学习算法来验证横截面和纵向患者队列中复杂的微生物组特征。
例如,2017 年发表的一项研究使用 16S rRNA 微生物群来分析来自大量 IBD 患者和没有 IBD 的对照个体的粪便样本。研究人员使用序列聚类算法根据八种细菌类群的丰度来识别 CD 特异性微生物特征。
此外,另一组研究表明,基线肠道微生物组组成的特征可以预测 IBD 患者在治疗开始后14周对抗整合素治疗的反应。由深度神经网络生成的微生物组特征的受试者工作特征曲线 (AUC) 下面积为 0.87,而基于临床协变量的模型的 AUC 为 0.62。研究小组还评估了微生物组特征作为 IBD 和 T2DM 生物标志物的效用。
在一项研究中,检查了 29 名接受过自体造血干细胞移植的 CD 患者的独特队列中的疾病活动性和对治疗的反应。来自人类供体和人源化小鼠的微生物组和代谢组风险概况的整合将疾病结果的预测模型的性能从 AUC 0.79 提高到 0.96,并确定了与硫代谢相关的疾病相关细菌和代谢物网络。
这些发现听起来很有前景,但重要的是要承认微生物组风险概况是基于来自前瞻性队列研究中的人群或患者组的预测模型,因此比起对于个人的预测结果,对于相似患者组(人群或队列)可能更准确。重要的是记住,预测的风险可能不会直接转化为个体患者,这可能是由于在异质环境中风险概况的普遍性有限。
不忽略混杂变量
另一项研究调查了以德国人群为基础的 1,976 人队列中的代谢健康和肠道微生物群的昼夜节律性。粪便微生物群分析确定了 13 个微生物分类群的风险特征,这些分类群显示 T2DM 患者的昼夜节律性受到破坏。基于这种心律失常风险特征的预测模型成功识别出有患 T2DM 风险的个体,当模型中包含 BMI 时,AUC 为 0.78。
这些例子为微生物组特征在用于诊断和治疗目的的生物标志物发现中的作用提供了证据。然而要注意,生态失调指数不是独立的测量值,需要整合到额外的宿主衍生数据和临床数据中。这些指标的标准化和验证需要大规模究研,包括对潜在生物标志物的纵向评估,并考虑可能的混杂变量,例如饮食、年龄、种族、病史和最后的排便时间,所有这些因素都会影响微生物组的改变。
在寻找疾病生物标志物时,代谢物作为疾病活动的最接近指标,并且与作为疾病机制基础和调节疾病机制的调节信号密切相关。事实上,代谢组和微生物组都随着饮食、环境、衰老和整体健康状况等内源性和外源性因素而波动。
许多研究报告了 IBD或 T2DM患者的肠道代谢物谱的显着变化。
例如,已在 IBD 患者的粪便代谢组中发现中链脂肪酸(如戊酸和己酸水平降低)和 B 族维生素水平降低。相反,据报道,成人和儿童 IBD 患者的粪便和血清中氨基酸、胺和肉碱的含量分别增加。
一项具有里程碑意义的研究结果表明,代谢物分析可以区分 IBD 患者和健康个体。该报告之后有许多其他人一致表明 IBD 患者的代谢物表型与健康个体的不同。有趣的是,代谢物分析还可以区分不同形式的 IBD,例如 CD 和 UC,并且可以进一步将 CD 患者分类为患有回肠或结肠炎症。同样,T2DM 患者的代谢物分析表明代谢途径的活性发生了改变。
在多份报告中,支链和芳香族氨基酸(如亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸、酪氨酸和色氨酸)的血清水平与胰岛素抵抗、肥胖和发生 T2DM的风险相关。
T2DM 患者的代谢物分析还揭示了特定细菌代谢物水平与疾病发作之间的强关联。
例如,色氨酸代谢途径包括几个候选代谢物生物标志物,这些生物标志物由于与人类和小鼠研究中炎症和代谢疾病的发展相关而引起了研究关注。色氨酸是一种从饮食中获得的必需氨基酸,主要在小肠中吸收,尽管一小部分在结肠中分解代谢为吲哚代谢物。
一项纵向队列研究证实,在 213 名中国个体(包括 51 名继续发展为 2 型糖尿病和 162 名保持代谢健康的个体)中,高基线空腹血清色氨酸浓度与患 T2DM 的风险增加有关。此外,色氨酸水平作为生物标志物的预测能力与五种现有氨基酸在区分患有和未患 T2DM 的个体方面的预测能力相当 。
值得注意的是,先前的报告表明,几种氨基酸的血清水平可以以不同的准确性识别来自不同人群的 T2DM 患者。例如,苯丙氨酸和缬氨酸在美国人群中表现最好,而酪氨酸在南亚人群中最准确。这些发现指出了识别区域特异性生物标志物在实现最佳诊断准确性方面的重要性。
有价值的生物标志物必须为从临床信息中获得的分类能力提供额外的分类能力。因此,粪便生物标志物是粘膜疾病诊断标志物的明显来源,因为粪便流与肠粘膜直接接触。
钙卫蛋白
粪便钙卫蛋白是一种可在粪便中检测到的粒细胞衍生的细胞溶质蛋白,由于炎症严重程度与粪便钙卫蛋白水平之间的相关性强,它是最广泛使用的用于炎症性疾病的粪便生物标志物。
两份报告证实了粪便钙卫蛋白水平检测内窥镜炎症的能力,报告的敏感性为70-100% ,特异性为44-100%。这些值的广泛范围可以通过每项研究中应用的截止阈值的变化来解释。
然而,粪便钙卫蛋白水平升高并不是 IBD 特有的,而是反映了肠道炎症状况,这也与其他肠道和代谢疾病(包括 IBS、胃肠道恶性肿瘤、肥胖和 T2DM)有关。
例如,对来自 1,792 个人的粪便样本中肠道微生物群的鸟枪宏基因组分析能够区分 IBD 和 IBS,与单独的粪便钙卫蛋白水平 (AUC) 相比,机器学习算法显着提高了这些预测模型的准确性 (AUC 0.91>0.80)。
重要的是,具有最高预测准确度 (AUC 0.93) 的模型包括粪便钙卫蛋白水平以及前 20 个选定分类群的宏基因组分析。这些结果表明,临床和微生物生物标志物的整合提高了诊断的准确性。这种综合方法已被用于预测 IBD 患者对治疗的反应。
在这项研究中,基线临床数据(包括血清学、内窥镜和临床生物标志物)不足以预测缓解(AUC 0.62),而添加分类学和代谢谱将诊断能力分别提高到 AUC 0.72 和 AUC 0.74。
此外,仅粪便钙卫蛋白水平就能够区分储袋炎患者和无储袋炎患者 (AUC 0.63)。相比之下,微生物组物种模型(有或没有粪便钙卫蛋白水平作为额外的预测因子)实现了 0.78 的 AUC,证实微生物分析在识别储袋炎方面具有优于仅粪便钙卫蛋白水平的诊断性能。
用于诊断 T2DM 的葡萄糖代谢受损的血清学生物标志物包括空腹血糖水平、75g口服葡萄糖激发后 2 小时血糖水平(口服葡萄糖耐量试验)和糖化血红蛋白水平。
一项使用来自两个瑞典队列136数据的研究确定了预测 T2DM 进展的血清学和微生物组生物标志物的组合。
在这项研究中,多变量分析表明胰岛素抵抗程度与微生物组变异之间存在很强的相关性。
有趣的是,使用基于微生物组的机器学习模型来区分验证队列中胰岛素抵抗程度最低和最高的个体的 AUC 为 0.78,这表明肠道微生物群是 T2DM 进展的重要调节因子。
事实上,尽管已经为 T2DM 提出了广泛的诊断生物标志物,但它们中的大多数未能捕捉到这种疾病的复杂性或掌握微生物和代谢的变化。在这方面,已将代谢物生物标志物与已确定的临床风险因素结合使用,以显着改善疾病分类。
微生物特征
了解单个细菌类群(病原菌)和/或复杂微生物群落(生态失调)变化的功能作用和特异性对于解决IBD或T2DM中微生物-宿主相互作用的发病机制至关重要。在这种情况下,肠道微生物组的功能改变可能代表宿主适应的结果。

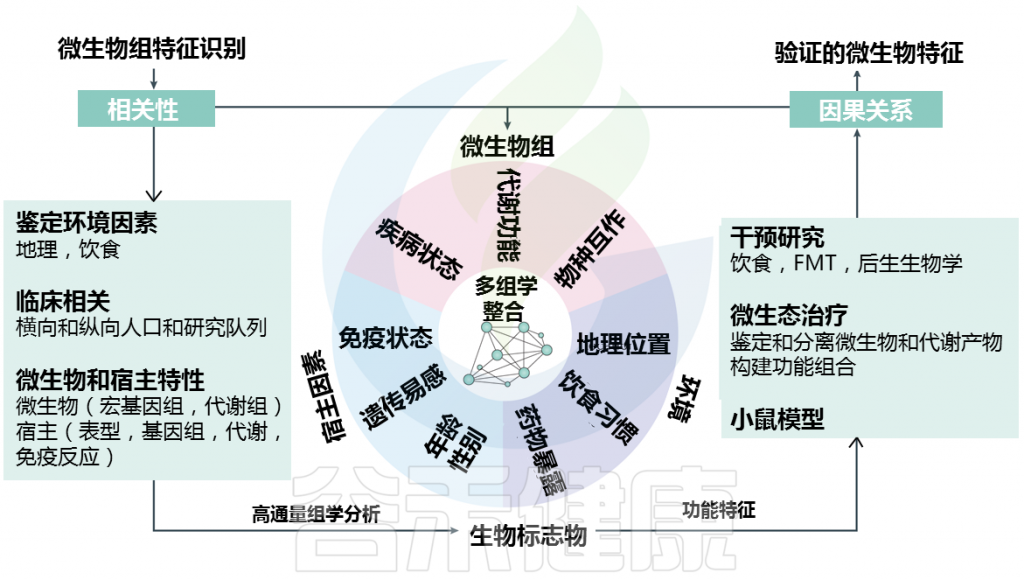
Metwaly et al.,Nat Rev Gastroenterol Hepatol. 2022.
肠道微生物群与多种疾病之间存在因果关系,已在小鼠实验中得到证实。无菌小鼠模型可以选择性地用单一细菌菌株、最小细菌聚生体或来自人类粪便或其他供体材料的定义复杂的肠道微生物生态系统进行定植,以研究它们对宿主表型的影响。在 IBD 中,无菌小鼠模型的单菌株定植有多种共生细菌,包括大肠杆菌、粪肠球菌、普通拟杆菌和Bilophila wadsworthia使我们能够了解疾病引发或保护的一些潜在机制。已有的研究工作表明,肠道菌群是驱动结肠炎小鼠模型炎症所必需的,而这些细菌与 CD患者的复发风险相关。肠道微生物群移植到无菌小鼠体内导致了几种疾病状态,从而揭示了与炎症有关的共享功能代谢途径。同样,以前的工作表明葡萄糖耐量和胰岛素抵抗受肠道微生物组组成的影响,已通过一系列 FMT 研究得到证实。
在过去的二十年里,人类和小鼠研究的证据揭示了肠道微生物组在炎症和代谢疾病(如 IBD 和 T2DM)的发病机制中的基本作用。肠道微生物生态系统结构和功能的变化(失调),与这些疾病患者的疾病活动、复发风险或对治疗的反应有关。然而,大多数这些疾病的复杂性和多因素发病机制,以及人类研究中存在多种混杂因素,依然对微生物组特征在诊断、预测预后和治疗决策中的临床应用提出重大挑战。
当前的微生物组研究不仅仅局限于描述微生物群落结构和疾病关联,还在了解肠道菌群在复杂慢性病发病机制中的致病作用方面取得进展。预计这些努力将增强微生物组建模,并推进可用于临床环境的基于菌群特征和/或疾病风险的模型开发。
参考文献:
Metwaly A, Reitmeier S, Haller D. Microbiome risk profiles as biomarkers for inflammatory and metabolic disorders. Nat Rev Gastroenterol Hepatol. 2022 Feb 21. doi: 10.1038/s41575-022-00581-2. Epub ahead of print. PMID: 35190727.
谷禾健康
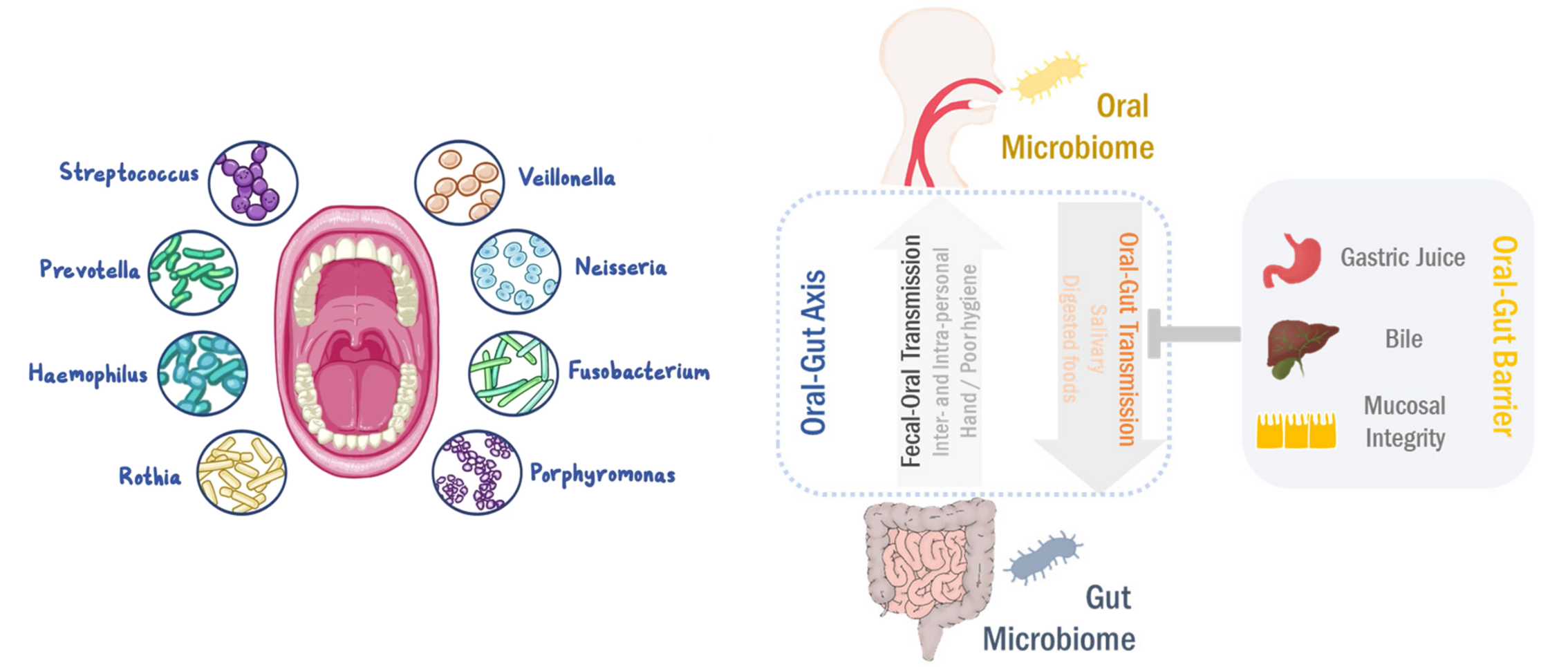
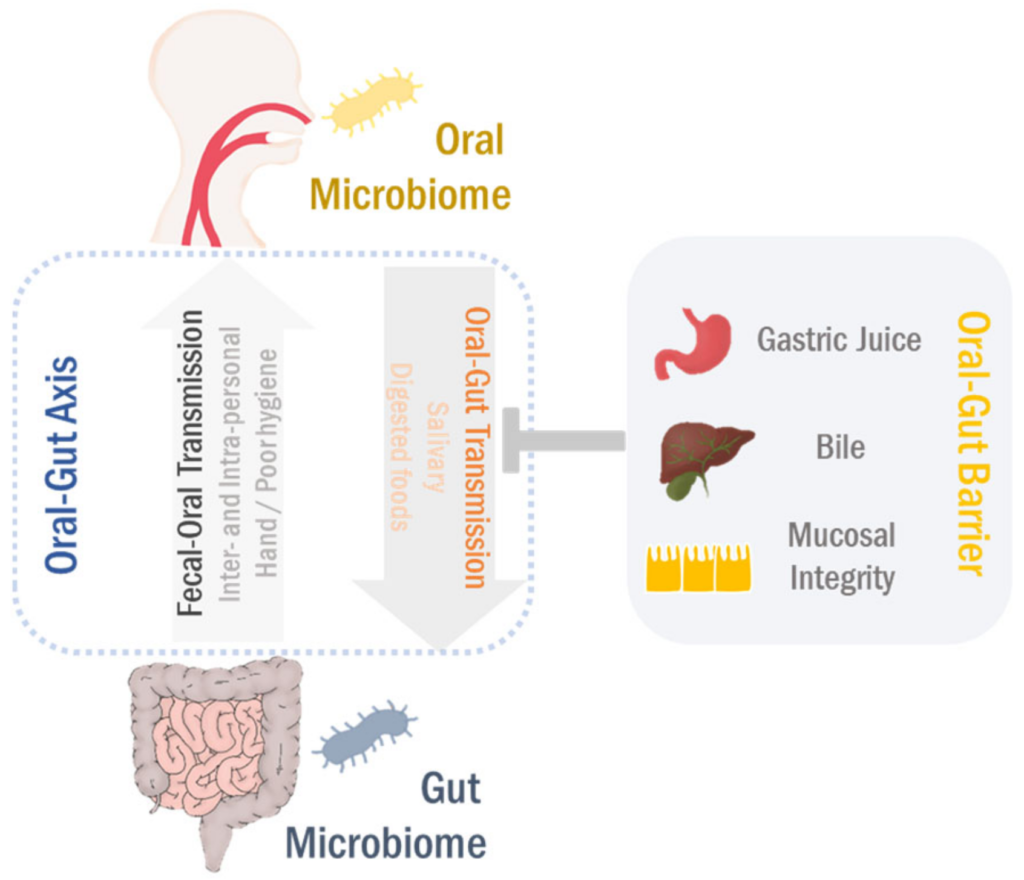
微生物群失调与人体中的多种疾病有关。在个体中,每个微生物栖息地都表现出不同的微生物种群模式。迄今为止,关于微生物组相关疾病的研究集中在器官特异性微生物组上。然而,器官间微生物网络正在成为生理功能和病理过程中的重要调节剂。
口-肠
口腔和肠道是两个最大的微生物栖息地,在微生物组相关疾病中起主要作用。即使口腔和肠道是通过胃肠道相连的连续区域,由于口腔-肠屏障的原因,口腔和肠道的微生物群分布很好的分离。
然而,在口腔-肠道屏障功能障碍的情况下,口腔微生物群可以转移到肠粘膜。相反,肠道至口腔的微生物传播也以人际和社区传播发生。
最近,有报道说口腔和肠道微生物组相互依赖地调节生理功能和病理过程。口腔到肠道和肠道到口腔的微生物传播可以塑造和/或重塑两个生境中的微生物生态系统,最终调节疾病的发病机理。
在这里,我们将讨论总结口腔-肠道微生物组轴在胃肠道疾病和癌症中的作用, 更好地了解肠道-肠道微生物组轴在发病机理中的作用将有利于精确的诊断/预后和有效的治疗。

人体消化系统由胃肠道和包括肝和胰腺在内的辅助消化器官组成。 胃肠道的粘膜排列整齐,从口腔开始,直到肠道(更准确地说是肛门)结束。 因此,口腔和肠道是通过胃肠道连接的解剖学连续区域。
此外,由于唾液和消化后的食物都通过胃肠道,因此这两个位置也是化学相连的。
通常,由于中空的运河结构,胃肠道被认为在人体外部。 口腔是消化道的通道,直接暴露于外部环境,例如微生物,营养物和其他外源性物质。 在这方面,口腔和肠道都为不同的微生物繁衍提供了适当的环境。
HMP(第一阶段人类微生物组计划)揭示了人体中一半以上的细菌位于胃肠道(29%)和口腔(26%)中。 除了这些丰富的生物外,口腔和肠道微生物群也高度多样化,并同时显示出与每个生境区分开的独特特征。
根据人类口腔微生物组数据库(HOMD),口腔中大约有700种微生物。口腔中的共生菌包括厚壁菌门、变形杆菌门、拟杆菌门、放线杆菌门、梭杆菌门、奈瑟菌门和TM7。口腔有几种不同的微生物环境,包括:颊粘膜、龈下菌斑、龈上菌斑、角化牙龈、硬腭、唾液、扁桃体、舌头和喉咙。口腔和腭粘膜的多样性低于其他口腔栖息地。
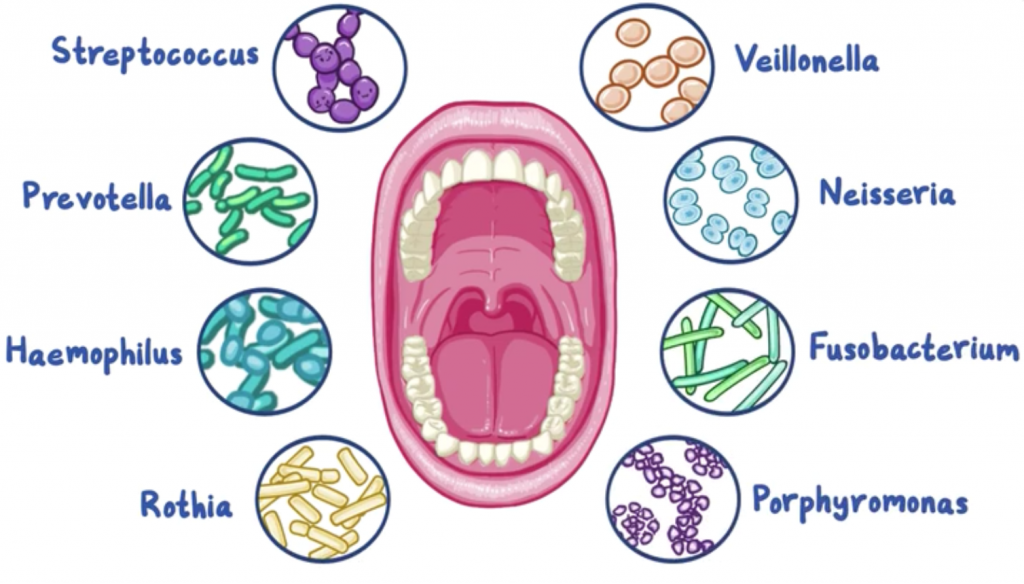

无论小生境的位置如何,健康受试者的所有口腔部位在属水平上的菌如下:
双歧杆菌 Gemella链球菌 Streptococcus
韦荣氏菌 Veillonella嗜血杆菌 Haemophilus
奈瑟菌 Neisseria卟啉单胞菌 Porphyromonas
放线菌 Actinomyces梭菌 Fusobacterium
普雷沃氏菌 Prevotella
除了这些常见的细菌进化枝外,每个小生境还具有分化良好的细菌组成。
根据微生物群落结构,口腔生态位可分为三组:
第一组:颊粘膜、角化牙龈和硬腭
第二组:唾液、舌头、扁桃体和喉咙
第三组:龈下和龈上菌斑
生态位对口腔微生物组的隔离可能归因于多种因素,例如pH,盐度,氧化还原电位,氧气和营养。 此外,牙齿卫生是影响口腔微生物组的另一个重要因素,因为口腔是直接向外界开放的。
肠道是人体内最大、最具特征的微生物生态系统,在50多个不同的门中有大约500到1000个物种。
由五个主要的拟杆菌门、厚壁菌门、放线菌门、变形菌门和疣状菌门组成,但以两个拟杆菌和厚壁菌门为主,占90%以上。
在属的水平上,拟杆菌是最丰富的。已知人类肠道微生物群在生命早期就已建立,然后可以随着年龄和环境(如饮食和营养)而改变,类似于人类口腔微生物群。因此,口腔和肠道微生物组直接反映了宿主的健康状况。
尽管肠道与口腔相连,但肠道微生物群的组成可与口腔微生物群的组成区分开来。在门的水平上,口腔主要由厚壁菌门控制,而粪便微生物群主要富含拟杆菌。这种分离可归因于胃中的胃酸和十二指肠中的胆汁酸。
据报道,长期使用质子泵抑制剂(PPI)会增加肠道感染的风险。值得注意的是,PPIs降低胃酸可以减少肠道微生物生态系统的多样性,改变肠道微生物组的组成。
此外,胆汁酸可引起肠细菌膜和/或DNA完整性的破坏,在口腔和肠道之间起有效的抗菌屏障作用。 因此,胃酸度和胆汁酸池负责肠道和口腔微生物组的独特模式。
人类肠道微生物组的概况可以根据健康状况,环境因素,遗传学甚至生活方式而改变。
宏基因组学分析表明,人类肠道菌群调节代谢途径,例如碳代谢和氨基酸合成。微生物显示出保守的分子基序,称为微生物相关的分子模式和病原体相关的分子模式(PAMP),宿主可通过模式识别受体(PRRs)识别这些基序,如toll样受体。
这种微生物与宿主的相互作用可以刺激人体的免疫系统和炎症反应。 这意味着肠道菌群可以调节人体的主要生物学功能,新陈代谢和免疫力,因此肠道菌群失调与多种人类疾病有关,从传染病到阿尔茨海默氏病。然而,要证明肠道微生物群是人类健康状况的原因还是后果是一个挑战。
另外,无菌(GF)动物为肠道微生物组的生理功能提供了深刻的线索。与无特定病原体(SPF)的小鼠相比,GF小鼠的肠重量减少,绒毛更短,小肠的总表面积减少,表明胃肠道发育存在缺陷。
与此相一致,GF小鼠显示出代谢异常,例如胆固醇代谢改变和肠道内短链脂肪酸的减少,短链脂肪酸是重要的能量来源之一。
因此,与SPF小鼠相比,GF小鼠显示出较低的体内脂肪含量和对高脂饮食诱导的体重增加的抵抗力。 但是,通过应用SPF小鼠的盲肠含量,通过GF小鼠的常规化可以恢复体内脂肪含量。
在免疫方面,GF小鼠在Peyer斑块和肠系膜淋巴结发育方面存在缺陷,CD4,CD8和Foxp3 T细胞数量减少,B细胞分泌的免疫球蛋白A产生减少。
通过与SPF小鼠共栖或口服SPF小鼠粪便中的成分,可以通过微生物群重建来恢复这些疾病。 两者合计,很明显,肠道菌群在维持生理稳态方面起着至关重要的作用,主要是代谢和免疫。
尽管口腔是人体第二大的微生物栖息地,但是累积的知识不足以完全了解口腔微生物组对人类健康的影响。 毫无疑问,口腔微生物组与牙齿健康直接相关。
口腔疾病中有许多已被确认的关键病原体,如龋齿的变形链球菌(Streptococcus mutans )和牙周炎的牙龈卟啉单胞菌(Porphyromonas gingivalis)。此外,与健康受试者相比,口腔鳞状细胞癌患者的口腔微生物组发生了改变。根据口腔微生物群分析,口腔鳞状细胞癌(OSCC)患者中的梭杆菌属(Fusobacterium)水平较高。
口腔微生物组会影响全身健康状况,而不仅限于牙齿健康(下图)。
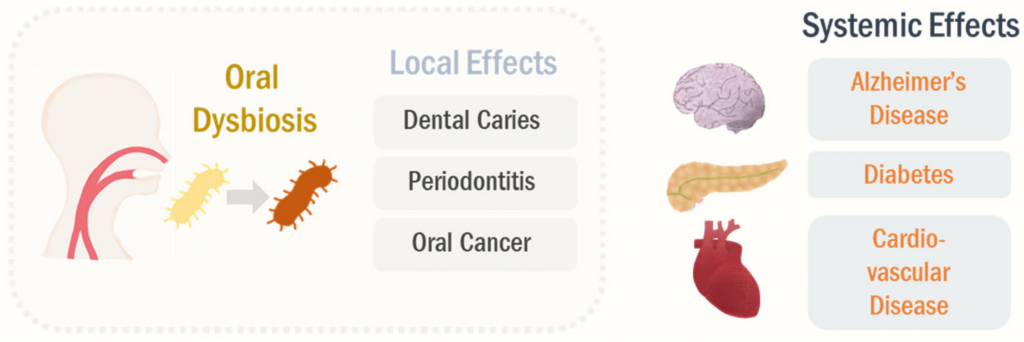

Park Se-Young, et al., Cancers (Basel),2021
流行病学和实验证据支持口腔菌群失调与全身性疾病密切相关,包括阿尔茨海默氏病,糖尿病和心血管疾病。 与此相符,阿尔茨海默氏病的口腔微生物群特征发生了显着变化,例如莫拉氏菌属(Moraxella),纤毛菌属(Leptotrichia)和鳞球菌属(Sphaerochaeta)的患病率。口腔不良反应的改变与阿尔茨海默氏病的进展有关。
I型糖尿病患者的放线菌门和厚壁菌门的丰度更高。此外,据报道,在有症状的动脉粥样硬化患者的口腔微生态环境中,厌氧菌属的富集已被报道。
在牙周炎(一种口腔失调疾病)的情况下,其标志性病原体牙龈卟啉单胞菌(P. gingivalis)感染可引起局部以及全身慢性炎症。
此外,口腔异位症可以诱导PAMP信号的产生,例如脂多糖(LPS),导致系统性刺激先天免疫应答和炎症转录因子,包括核因子κB。 这些全身性炎症和免疫反应被认为是主要机制之一,强调口腔微生物组调节远端器官的发病机理。
值得注意的是,口腔微生物群可以转移到其他器官,这被认为是口腔生物失调引起的全身性疾病的另一种机制。
在短期死后阿尔茨海默氏病患者的脑组织中已检测到口腔致病菌牙龈卟啉单胞菌(P. gingivalis)。 口腔病原体直接转移到大脑可以通过诱导神经炎症和神经变性而加剧阿尔茨海默氏病。
此外,在冠心病患者的动脉粥样硬化斑块中检测到许多口腔共生细菌,这进一步表明口腔细菌可能转移到远端器官。 由于物理和化学联系,口腔微生物向胃肠道系统的迁移可能更频繁。
在某些致病条件下,一些口腔细菌类群定居并富含胰腺和肠道,表明口腔和肠道菌群之间存在直接的串扰。
由于存在肠-肠屏障,物理距离以及化学障碍(例如胃酸和胆汁),因此口腔和肠道微生物组被很好地隔离了。 然而,口腔-肠道屏障的损伤会导致器官间的易位和交流。
一般来说,新生儿和老年人体内存在不成熟或功能性障碍较少。双歧杆菌是新生儿肠道中最丰富的细菌属。有趣的是,在新生儿的口液中发现了肠道内的双歧杆菌。
同样,与健康成年人相比,老年人肠道内口腔细菌的检出率也较高,如:
卟啉单胞菌(Porphyromonas)、梭杆菌(Fusobacterium) 和假分枝杆菌 (Pseudoramibacter)。
此外,低胃酸使肠道微生物群的组成向口腔微生物群转移。已在体外证明,通过分别引入人类粪便和唾液微生物群的GF小鼠组,口腔微生物群可以侵入肠道并重塑肠道微生物群。
综上所述,这些数据表明口腔微生物可以在某些情况下克服口腔与肠道之间的物理和/或化学障碍,并有可能转移到肠道中。
值得注意的是,在胃肠道的病理条件下已检测到典型的口腔驻留物种。 例如,炎症性肠病(IBD)患者的肠道粘膜中有大量嗜血杆菌和Veillonella富集,已知它们是口腔共生微生物。
在结肠癌患者中,他们的肠道微生物群包含几种口腔类群,包括梭菌。这意味着正常的人口腔微生物群可以在肠粘膜稳态中破坏并在肠道粘膜中定植,并成为条件致病菌。
而且,这种经口-粪便传播也可以在生理条件下发生,而不仅仅是在病理或屏障破坏的情况下。HMP联盟的数据被划分为每个身体部位的群落类型时,口腔和肠道微生物群类型显示出强烈的关联,尽管它们在分类上不同。
在唾液细菌中,普雷沃氏菌(Prevotella)大量存在于粪便样本中。与此相一致,从同一健康受试者的口腔和粪便样本中同时检测到几个属。通过分析470名个体口腔和粪便微生物群中的310种,唾液和粪便样本中普遍存在125种,包括链球菌(Streptococcus)、韦荣氏球菌属(Veillonella)、放线菌(Actinomyces)和嗜血杆菌(Haemophilus)菌株。
综上所述,很明显口腔微生物群可以比预期更广泛地进入肠道,即使在健康状态下,而不仅仅是在病理情况下。
肠道微生物可通过粪-口途径通过直接接触或通过受污染的液体和食物间接接触传播。人的手部微生物群与口腔和肠道微生物群模式高度重叠,表明人的手是粪便到口腔微生物传播的载体。因此,在发展中国家,由于卫生状况不佳,如缺乏清洁供水和公共卫生系统,微生物的粪-口途径经常被报道。
此外,免疫功能低下的个体也容易通过粪-口传播。在头颈部癌症患者中,放射治疗与革兰氏阴性杆菌的口腔定植高度相关,不良的口腔卫生状况会进一步加剧这种情况。因此,不良的卫生和/或免疫损害条件可能会促进同一个体的粪-口途径。
除了体内传播外,粪-口途径也被认为是病原体在人与人之间传播的重要机制。众所周知,甲型肝炎病毒(HAV)和戊型肝炎病毒(HEV)等肠道病毒通过粪-口途径传播,因此很容易通过人与人之间的接触传播,特别是在不卫生的条件下。
肠道病毒可以直接和间接地与肠道微生物群相互作用,对肠道微生物生态系统造成破坏性影响。据报道,戊型肝炎病毒感染会增加急性肝衰竭患者粪便样本中乳酸杆菌科(Lactobacillaceae)和伽马蛋白杆菌( Gammaproteobacteria)的丰度。
添加益生菌粪肠球菌NCIMB 10415(Enterococcus faecium NCIMB 10415) 可有效促进感染猪的HEV清除。
除了肠道病毒外,幽门螺杆菌(Helicobacter pylori)是严重胃十二指肠疾病的主要致病菌,也可以通过粪-口途径传播,显示出与甲型肝炎感染的相关性。
虽然需要进一步的研究来了解粪-口传播在口腔和肠道微生物群中的作用,但令人信服的是,口腔和肠道微生物群通过口-肠和粪-口途径紧密相连(下图)。
Park Se-Young, et al., Cancers (Basel),2021
这种双向相互作用可以相互塑造和/或重塑两个栖息地的微生物生态系统,最终调节胃肠系统的生理和病理过程。因此,口腔-肠道和粪便-口腔方向在以下中统称为“口腔-肠道微生物群轴”。

IBD代表结肠和小肠的慢性炎症性疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC)。因此,IBD与肠道微生物群失调密切相关。IBD患者的肠道微生物组显示出细菌组成的多样性降低和变化,包括厚壁菌门的丧失和变形菌门和拟杆菌门的丰度增加。在肠道粘膜组织活检中而不是在粪便中更深刻地观察到了这些不良生物事件。与健康受试者相比,在肠黏膜表面,IBD患者经常检测到细菌入侵和生物膜形成,表明肠屏障功能障碍与IBD发病有关。
在健康状态下,由于完整的粘膜屏障,肠道微生物群很少受到来自其他栖息地的微生物的入侵和定植。然而,IBD患者由于粘膜屏障受损而表现出肠上皮通透性增加。
值得注意的是,口腔内细菌菌株是从IBD患者的肠道微生物组中分离出来的,这可能是由于肠道渗漏造成的。具核梭杆菌( Fusobacterium nucleatum )通常存在于口腔中,但很少存在于健康人的肠道中。
有趣的是,IBD患者在肠道中出现了F. nucleatum,比其他F. nucleatum菌株更具侵袭性,表明IBD患者存在肠道-肠道微生物组轴。这一点已在体外通过将口腔微生物群移植到动物模型中得到证实。
在大鼠中,F.nucleatum的侵袭导致肠道微生物组发生转移并加重内脏超敏性。 此外,CD患者的唾液微生物群成功地定居在GF小鼠的肠道中。
克雷伯菌(Klebsiell)是最流行的定植菌,可促进肠道Th1细胞的诱导和炎症,这是IBD发病机理中的关键事件。 这些结果进一步支持了口腔微生物群,无论是共生的还是病原菌,都可以传播到肠道,通过肠道失调促进IBD的发病。
因此,口腔失调可以通过募集口腔-肠轴来直接调节IBD的发病机制。牙周炎是一种慢性炎性口腔疾病,与口腔微生物群的改变密切相关,特别是与其关键性病原体牙龈卟啉单胞菌的过度生长有关。
在C56BL/6小鼠中,口服牙龈卟啉单胞菌通过下调紧密连接蛋白来减弱肠道屏障功能,从而导致肠道微生物组发生重大变化,包括梭菌科的丰富。
此外,接种牙龈卟啉单胞菌的小鼠表现出肠道以及全身性炎症,这可以由牙龈卟啉单胞菌衍生的内毒素例如LPS介导。 与动物实验一致,荟萃分析表明牙周炎分别与IBD,CD和UC的两种主要形式密切相关。
两者合计,口腔病原体可以干扰肠屏障功能并侵入肠粘膜,从而引起肠道失调和慢性炎症,从而导致IBD发病。 值得注意的是,IBD患者以及结肠炎引起的小鼠唾液微生物群组成发生变化,这与炎症反应有关,表明口腔-肠道微生物相互作用可能是双向的。
大肠癌(CRC)是世界上最常见的癌症类型之一,也是导致癌症死亡的第二大原因。IBD是CRC发生和发展的最公认的危险因素。因此,IBD和CRC在发病机理中共享病因,包括肠道微生物组的明显变化。 与IBD相似,CRC与肠道失调密切相关。与健康个体相比,CRC患者在粪便和肠粘膜样品中均显示出不同的微生物组成模式。
一直以来,在结肠炎相关和化学诱导的大肠癌小鼠模型中都发现了肠道微生物群的深刻变化,支持肠道失调和大肠癌之间的关系。使用GF小鼠的研究进一步证明,肠道微生物群的改变可以直接促进炎症相关的结直肠癌的发展。
有趣的是,在大肠癌患者的肠道中发现了几种口腔分类群,包括细小单胞菌(Parvimonas)、消化链球菌(Peptostreptococcus)和梭形杆菌(Fusobacterium),表明大肠癌中存在口腔-肠道微生物群轴。
在这些口腔常驻细菌中,具核梭杆菌 (F.nucleatum)与健康人相比,结直肠癌患者的肿瘤组织和粪便中普遍存在细胞核,这与IBD一致。
在小鼠结肠炎模型中,口服具核梭杆菌(F.nucleatum) 细胞核引起的炎症以及小肠和大肠的肿瘤发生。具核梭杆菌 (F.nucleatum)细胞核似乎很容易附着在表达内皮钙粘蛋白的宿主CRC细胞上,然后刺激促炎症反应和细胞增殖。与IBD相似,结直肠肿瘤显示肠道屏障功能受损,这可能解释了口腔微生物群的肠道定植。
此外,据报道,具核梭杆菌 (F.nucleatum) 与口腔病原体牙龈卟啉单胞菌共聚并共感染。尽管体外方法存在局限性,但牙龈卟啉单胞菌仍侵袭CRC细胞并促进癌细胞增殖,这表明牙周病原体参与了结直肠肿瘤的发生。 与此相一致,牙龈卟啉单胞菌血清抗体水平与CRC患者的死亡率呈正相关。
此外,一项荟萃分析表明,牙周炎与CRC风险增加有关。 综上所述,这些研究可以证明口腔失调,口腔-肠道微生物组轴与CRC发病机理之间存在关联。
肝硬化是由慢性肝脏疾病引起的晚期肝病,例如非酒精性脂肪肝疾病(NAFLD)和非酒精性脂肪性肝炎(NASH)。 健康对照组相比,NAFLD、NASH或肝硬化患者粪便样本中的变形杆菌门显著增加,表明肠道微生物组与肝脏发病机制相关。在这方面,与SPF小鼠相比,GF小鼠免受高脂饮食诱导的脂质在肝脏中的蓄积。此外,定居于NAFLD易感肠道微生物的GF小鼠发生了严重的肝脂肪变性,进一步支持了肠道失调可能是慢性肝病的直接病因。
由于肠道和肝脏通过胆道和门静脉进行物理连接,如果粘膜屏障受损,肠道微生物可以转移到肝脏。胆汁酸具有抗菌活性,在肠道和肝脏之间循环循环,具有屏障和桥梁的双重功能。
慢性肝病通常与胆汁酸形成和/或分泌不良有关,会增加肠道通透性。 因此,胆道梗阻促进了细菌从肠道到肝脏的移位。 在胆结石患者中,与正常对照组(例如富集变形杆菌)相比,胆道和肠道中的微生物组成均发生了变化,这支持了慢性肝病中肠道-肝脏微生物组轴的存在。
通过与肠-肝微生物串扰的融合,口腔-肠道微生物组轴正在成为慢性肝病的重要调节剂。
值得注意的是,宏基因组学分析已证明肝硬化患者肠道内的口腔粘膜有侵袭和定植。另一项研究还显示,酒精依赖型肝硬化患者的肠道中口腔微生物的富集。 这些数据支持口腔微生物的肠道迁移与肝硬化有关。 但是,其潜在机制尚不清楚。如前所述,由于胃酸度低,PPI促进了从口腔到肠道的微生物转化。 同样,PPI治疗改变了肝硬化患者的肠道菌群组成,特别是肠道内口腔细菌的过度生长。 相同的研究小组已经证明了肝硬化患者唾液和粪便微生物组的伴随变化,进一步表明口腔-肠道微生物组轴调控肝脏的发病机制。
因此,口腔失调可能会通过改变肠道微生物组而加重慢性肝病。 确实,牙周炎与NASH,NAFLD和肝硬化显着相关。 在来自NAFLD和与病毒感染相关的肝硬化患者的口腔样本中已经检测到牙龈卟啉单胞菌,一种牙周基石病原体。
在高脂饮食喂养的小鼠中,牙龈卟啉单胞菌的牙源性感染通过脂质积累,纤维化和肝脏炎症促进了NAFLD和NASH的进展。 总体而言,口腔失调可能会通过调节肠道生态系统而加剧慢性肝病。 同时,口腔失调可能反映了由肝病驱动的肠道失调生态系统。
肝细胞癌(HCC)的发展经历了一个逐步的过程,从NAFLD/NASH到肝硬化,最后发展为HCC。在小鼠肝癌发生模型中,SPF小鼠比GF小鼠更易发生肝癌,类似于慢性肝病。
在生态型小鼠模型中,某些类型的肠道细菌,如大肠杆菌和粪链球菌,可显著增加肝肿瘤的发生,表明肠道微生物群直接参与了肝癌的发病机制。与这一观点一致,与健康对照组相比,HCC患者的丁酸产生菌属减少,如反刍球菌(Ruminococcus)、大肠杆菌(Oscillibacter)、粪杆菌(Faecalibacterium)、梭状芽孢杆菌IV(Clostridium IV)和粪球菌(Coprococcus),而LPS产生菌属增加,包括粪便样本中的克雷伯菌(Klebsiella)和嗜血杆菌(Haemophilus )。
此外,随着HCC的发展,肠道失调的水平趋于增加。 在患有肝硬化的HCC患者中,粪便微生物群的成分与没有HCC的肝硬化患者的粪便微生物群成分有所不同,例如大肠杆菌和Fusobacteriia的大量富集。 在化学诱导的HCC小鼠模型中,已在肿瘤内发现了一种肠道细菌肝幽门螺杆菌(Helicobacter hepaticus),它直接引起HCC的发展和进程,进一步支持肠道失调可以诱导HCC的发病机理。 然而,在人类HCC样品中未检测到肝炎性肝炎,而确诊存在其他幽门螺杆菌,例如幽门螺杆菌。因此,肝癌的发展与肠道失调密切相关。
有趣的是,据报道,与健康受试者相比,肝癌患者的口腔微生物群发生了变化。肝癌患者唾液微生物群中嗜血杆菌属、卟啉单胞菌属和Filifactor的丰度较高。在肝硬化的HCC患者中,根据舌苔的微生物组学特征,颤杆菌克属(Oribacterium)和梭形杆菌属(Fusobacterium)普遍存在。
此外,慢性牙周炎与晚期HCC相关,提示口腔失调与HCC相关。值得注意的是,肝硬化HCC患者的口腔和肠道微生物群中都富含梭杆菌,这表明口腔微生物可能通过口腔-肠道微生物群轴调节HCC发病机制,但需要进一步研究。
胰腺是消化系统的一部分,分泌分解脂类、蛋白质和碳水化合物的酶。主胰管与胆总管相结合,两者都与十二指肠相连。在正常健康条件下,胰腺被认为是一个无菌器官。
然而,胰腺导管腺癌(PDAC)患者的细菌数量增加,如肿瘤内的γ-变形菌纲(Gammaproteobacteria)和胰液和胰腺组织中的粪肠球菌(Enterococcus faecalis)。
此外,肿瘤内微生物组多样性与PDAC的预后相关。从更全面的角度来看,PDAC患者在胰腺组织、肿瘤以及粪便样本中表现出不同的微生物群模式,表明肠-胰腺微生物串扰参与了PDAC发病机制。特别是,PDAC患者的肠道和胰腺中同时富集了变形菌(Proteobacteria)。
在实验小鼠中,肠道通透性增加与肠道到胰腺的微生物易位有关,这可能加速PDAC的进展。在肠道菌群清除的小鼠中,用PDAC荷瘤小鼠的粪便菌群重新填充可显著促进胰腺肿瘤的发生,表明肠道菌群对PDAC进展的直接贡献。因此,肠道微生物组似乎与胰腺微生物生态系统密切相关,而胰腺生态系统在PDAC发病机理中起着至关重要的作用。
惊讶的是,口腔微生物组也与PDAC的发病机理有关。 根据元流行病学研究,牙周炎是一种主要的口腔菌群失调疾病,可以显着增加PDAC的风险和死亡率。
携带其关键病原体牙龈卟啉单胞菌与PDAC患者的较高风险和死亡率正相关。 在小鼠PDAC模型中,口服牙龈卟啉单胞菌可加速细胞增殖和上皮-间质转化,最终促进PDAC进程。
有趣的是,细胞内牙龈卟啉单胞菌直接促进人胰腺癌细胞系中肿瘤细胞的生长。 这些表明口腔菌群失调可能是直接的病因,也是诊断和预后PDAC发病机理的有用标志。
与健康受试者相比,PDAC患者的口腔微生物组有明显变化。 值得注意的是,尽管在人类PDAC组织中已发现了一种广为人知的口腔细菌群Fusobacterium,但其与PDAC预后的关系仍存在争议。
此外,PDAC患者的胰腺微生物组与肠道微生物组高度重叠。胰腺和肠道菌群均表现出口腔类群富集细菌和卟啉单胞菌的相对丰度。因此,某些类型的口腔微生物可能迁移到肠道,甚至进一步迁移到胰腺,这可能通过肠道和胰腺微生物群的协调调节促进PDAC的发病。
为了支持这一观点,在PDAC患者的口腔,肠道和胰腺微生物群之间发现了相关性,尤其是口腔起源的F. nucleatum subsp. vincentii亚种的丰度。
这些数据表明,口腔-肠道微生物组轴可以调节PDAC的发病机制,甚至进一步创造口腔-肠道-胰腺的微生物途径。

口腔和肠道是人体内最大的两个微生物栖息地。累积证据表明,口腔微生物群可以通过口腔细菌分泌体的直接易位和/或间接地改变整个肠道微生物生态系统。
肠道到口腔的微生物传播也可能发生,特别是在某些情况下,如卫生条件差和免疫功能低下。总之,口腔和肠道微生物群之间的双向串扰可以形成口腔-肠道微生物群轴,它在调节各种人类疾病的发病机制中起着关键作用,主要是在胃肠道系统(见下表)。
结肠疾病中的口腔-肠道微生物群轴

Park Se-Young, et al., Cancers (Basel),2021
肝脏疾病中的口腔-肠道微生物轴

Park Se-Young, et al., Cancers (Basel),2021
胰腺疾病的口腔-肠道微生物组轴
Park Se-Young, et al., Cancers (Basel),2021
值得注意的是,口腔-肠道微生物组轴改善了胃肠道系统的发病机理和预后的预测。荟萃分析表明,口腔微生物组的变化与胃肠道癌的风险有关,包括CRC,PDAC和HCC,这可能是早期发现的潜在指标。已经验证了PDAC特定的口腔微生物模式作为PDAC生物标志物。两种口腔细菌物种长奈瑟菌Neisseria elongata 和 轻型链球菌Streptococcus mitis
同时富集可以将PDAC患者与健康受试者区分开来。
口腔微生物分析的情况下,所述样品可从棉拭取,唾液和口腔冲洗获得。与肠道菌群的采样方法相比,无论健康状况如何,口腔菌群的收集实际上更为方便和可用,没有任何侵袭或卫生问题。因此,结合肠道微生物组,口腔微生物组还提供了作为诊断/预后工具以及治疗靶标的可行优点。
未来我们谷禾也将考虑口腔和肠道微生物组的相结合,结合口腔和肠道微生物组数据可以显着提高预测和检测息肉和/或肿瘤的敏感性。尽管揭示微生物组与疾病之间的因果关系具有挑战性。
参考文献:
Zhang, Z.; Yang, J.; Feng, Q.; Chen, B.; Li, M.; Liang, C.; Li, M.; Li, Z.; Xu, Q.; Zhang, L.; et al. Compositional and Functional Analysis of the Microbiome in Tissue and Saliva of Oral Squamous Cell Carcinoma. Front. Microbiol. 2019, 10, 1439
Wypych, T.P.; Wickramasinghe, L.C.; Marsland, B.J. The influence of the microbiome on respiratory health. Nat. Immunol. 2019, 20, 1279–1290
Park Se-Young,Hwang Byeong-Oh,Lim Mihwa et al. Oral-Gut Microbiome Axis in Gastrointestinal Disease and Cancer.[J] .Cancers (Basel), 2021, 13
Bathini, P.; Foucras, S.; Dupanloup, I.; Imeri, H.; Perna, A.; Berruex, J.L.; Doucey, M.A.; Annoni, J.M.; Auber Alberi, L. Classifying dementia progression using microbial profiling of saliva. Alzheimers Dement. 2020, 12, e12000.
Seedorf, H.; Griffin, N.W.; Ridaura, V.K.; Reyes, A.; Cheng, J.; Rey, F.E.; Smith, M.I.; Simon, G.M.; Scheffrahn, R.H.; Woebken, D.; et al. Bacteria from diverse habitats colonize and compete in the mouse gut. Cell 2014, 159, 253–266.