-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
微生物市场
当今全球生物医药投资领域,资本的嗅觉正在追逐下一个能够颠覆行业的风口。微生物组疗法正凭借其在慢病治疗领域的巨大潜力,迅速成为最受瞩目的焦点,它为无数传统药物难以解决的健康难题提供了全新的解决方案。
随之而来的,便是对其上下游的巨大需求,一个全新的、千亿级的市场正在悄然形成。
最新数据显示,2025年,全球微生物组制造市场规模预计将达到315.9亿美元,并有望在2034年飙升至约1303.7亿美元(约合人民币9200亿元),预测期内(2025-2034年)的复合年增长率高达17.06%。
这预示着一个新兴的生物技术赛道正在从潜力股转变为绩优股。如此强劲的增长势头并非偶然,其背后是由基础研究的资金支持、创新疗法的监管批准、市场需求的激增、生产能力的全球扩张等多重核心因素共同驱动的结果。
本文,我们基于Precedence Research机构最近出的2025年~2034年微生物制造市场规模及预测报告及其他最新资讯,来了解一下这个充满活力的市场。从占据主导地位的益生菌到潜力无限的活生物治疗产品到微生物检测应用,其产业链的各个环节,并探讨人工智能等前沿技术如何赋能这一变革,以及在迈向千亿市场的征途中,行业必须克服的复杂工艺和高昂成本等挑战。旨在为广大投资者、科研人员和相关产业从业者提供一个全面的微生物制造市场前景分析。
微生物组制造市场涵盖了用于人类健康、营养和诊断的活体微生物疗法、益生菌和微生物群落的开发与规模化生产。
其核心是利用先进的发酵技术和生产系统,在严格受控的环境中培养复杂的微生物群落,以确保产品的效力、稳定性和治疗精度。
该领域的成熟度在监管层面得到了印证。美国食品药品监督管理局(FDA)在2022年和2023年相继批准了Rebyota和Vowst这两款用于治疗复发性艰难梭菌感染的微生物组产品。这两项里程碑式的批准,不仅为活体微生物产品的商业化铺平了道路,也确立了其科学和监管路径。与此同时,欧洲药品管理局(EMA)和加拿大卫生部等机构也纷纷出台支持性框架,标志着全球正在协同推动微生物组产品的应用。
■ 驱动力:慢病高发与个性化需求催生巨大市场
慢病和生活方式相关疾病的日益流行,是推动微生物组制造市场增长的核心引擎。胃肠道疾病、代谢综合征、自身免疫性疾病和肥胖等问题,为基于微生物组的疗法创造了巨大的应用场景。医疗保健正从“对症下药”转向“调节失衡”,即通过靶向调节微生物群来从根源上解决问题。
根据世界卫生组织(WHO)2024年的报告,2022年全球有25亿成年人超重,其中8.9亿人患有肥胖症。此外,美国疾病控制与预防中心(CDC)2024年的数据显示,约有240万~310万美国成年人患有炎症性肠病。这些庞大的患者群体,为微生物组产品的治疗靶点提供了坚实的市场基础。
“微生物组产业有哪些新的市场细分或应用正在打开?
除了肠道健康之外,四个新兴应用领域代表了超越传统肠道健康应用的显著扩张机会,每个领域都针对未满足的临床需求,并拥有不同的监管途径。
“下一代测序和生物信息学成本快速下降
全基因组测序价格从2020年的每样本1万美元下降到2024年低于1000美元,同时计算成本降低了60%,实现了内部分析和患者分层的大众化。鸟枪法宏基因组学的普及使中型生物技术公司能够快速迭代细菌群落,指导个性化剂量,并为预测宿主-微生物药效的机器学习模型提供数据。这些进步降低了试验成本,提高了微生物组治疗市场临床成功的可能性。
“加速风险投资资金和大型制药公司合作
2024 年风险投资承诺额达到 5 亿美元,同比增长 40%,投资者优先考虑具有多适应症潜力的平台。雀巢健康科学的收购 VOWST™权利凸显了大型制药公司的兴趣,并预示着主流市场的广泛接受。战略联盟经常捆绑临床资产和独家生产名额,反映了稀缺发酵产能的需求。
合作伙伴关系现在强调人工智能驱动的发现和菌株级别的知识产权组合,为微生物组治疗市场在 2030 年之前继续保持交易活动奠定了基础。
同时,消费者对肠道健康的认知不断提升,对根据个人需求量身定制的个性化营养解决方案兴趣浓厚,这进一步推动了市场的扩张。
■ 制约:高昂的制造复杂性构成挑战
尽管前景广阔,但微生物组制造的道路并非一帆风顺。其最大的挑战在于高度的制造复杂性。活体生物治疗产品通常需要培养多种微生物菌株,每一种都需要高度受控的生长条件。发酵过程中的微小偏差都可能导致批次间的差异,增加成品不合格的风险,从而对规模化生产构成挑战。此外,高昂的生产和运营成本也可能对盈利能力产生负面影响,制约着市场的发展。
■ 机遇:研发投入激增,加速制造需求
幸运的是,全球对微生物组研发的投资正在以前所未有的力度增长。数十亿美元的资金正涌入微生物基因组学、合成生物学平台和人体临床试验等领域。科技巨头、制药公司和国际组织纷纷资助专注于新型微生物疗法的生物技术初创公司。
例如,美国国立卫生研究院(NIH)在2024年宣布,其超过25%的微生物组相关资金将用于支持活体生物治疗药物的规模化生产和制造准备。欧盟的“地平线欧洲2024”计划也包含了对微生物组项目的专项资助。这些投资不仅推动了生物加工技术的创新,也为满足严格的监管要求提供了保障。
人工智能(AI)正在为微生物制造领域带来一场革命,它使整个价值链的流程变得更智能、更快速、更可靠。
AI的融入,正在显著提升微生物组制造的效率和成功率,为市场的指数级增长注入了强大动力。
■ 按产品类型:益生菌主导,活体生物疗法潜力巨大
2024年,益生菌细分市场占据了主导地位,市场份额高达40%。这得益于其在胶囊、粉剂、饮料等多种剂型中的稳定配方,以及在消化和免疫支持方面得到证实的健康声明。
合生元和后生元绕过了冷链障碍,使它们能够在缺乏强大物流的地区渗透。微生物群衍生的代谢物虽然处于早期阶段,但由于小分子熟悉和可扩展的化学性质,吸引了制药行业的兴趣。
然而,增长最快的将是活体生物治疗药物(Live Biotherapeutics)领域。随着监管先例的建立,针对特定疾病的临床项目预计将大幅增加,其利用AI菌株筛选和厌氧发酵控制等先进技术,有望提高GMP批次的效力和一致性。
■ 按制造工艺:发酵为王,制剂与包装成新增长点
在制造工艺方面,发酵在2024年贡献了最大的收入份额(50%)。通过在受控的生物反应器中培养高密度菌株,制造商能够确保临床和商业批次的一致性。
展望未来,制剂与包装环节预计将以最快的复合年增长率增长。随着行业对活体产品稳定性、保质期和靶向递送的日益重视,对冻干、微胶囊化和控释基质等技术的投资正在增加。
■ 按终端用户:药企领跑,CDMO服务需求激增
制药与生物技术公司是2024年最大的终端用户,占据了55%的市场份额。这些公司已将微生物组发现纳入其药物管线,并拥有结合宏基因组学分析、菌株工程和转化药理学的专业团队。
与此同时,合同开发生产组织(CDMOs)预计将成为增长最快的细分市场。
注:合同开发生产组织(CDMO)是指那些为制药、生物技术和其他行业提供药物开发和生产服务的公司。它们为客户提供从药物研发到商业化生产的全过程外包服务。
由于微生物制造的复杂性,越来越多的公司选择外包服务。像Lonza这样的大型CDMO正在投资建设专用的微生物生产套件和一次性发酵罐,以满足日益增长的GMP级别外包需求。
■ 按技术平台:厌氧发酵是基石,微流控技术是未来
厌氧发酵平台在2024年占据了约45%的最大收入份额,是生产严格厌氧菌和肠道共生菌的核心技术。而基于微流控的培养技术(Microfluidics-based Culturing)则被视为未来增长最快的领域。该技术能够实现高通量分离、单细胞培养和受控的共培养,极大地加速了发现和早期生产过程,特别是在开发个性化和精准微生物疗法方面展现出巨大潜力。
■ 按应用领域:肿瘤学从概念验证转变为流程优先
复发性艰难梭菌感染在2024年占据38.45%的市场份额,成为微生物组治疗市场的商业立足点。真实世界数据显示,30天再入院率从24%下降到不到8%,增强了医疗系统需求。
肿瘤学代表增长最快的应用领域,以36.33%的复合年增长率发展,因为联合组织与检查点抑制剂协同作用并减轻免疫相关不良反应。
黑色素瘤和结直肠癌的II期临床试验结果已促成多中心试验,制药合作伙伴将微生物组调节视为伴随诊断机会。
除了这些基础应用外,炎症性肠病试验利用特定菌株恢复黏膜稳态,而代谢紊乱项目则通过胆酸信号调节胰岛素敏感性。神经系统应用从肠-脑轴数据中获得支持,帕金森病和自闭症研究正进入I期试验。
■ 北美:全球市场规模较大
2024年,北美市场以40%的份额主导了全球市场,其市场规模超过107.9亿美元。美国市场尤为突出,预计将从2024年的75.5亿美元增长到2034年的372.2亿美元。这一领先地位得益于哈佛医学院、斯坦福大学等顶级学术中心的转化研究,以及NIH的大量资金支持。
此外,大型CDMO和设备供应商对厌氧发酵套件、无菌灌装生产线等基础设施的投资,也极大地提升了该地区的生产能力。
■ 亚太地区:增长最快的新兴力量
亚太地区预计将成为预测期内增长最快的市场。2024年,该地区各国政府和机构加大了研发投入、提高了监管透明度并扩大了生产能力。
中国的庞大患者群体加速了试验招募,而海南省的博鳌乐城试验区加速了早期准入计划。
日本药品和医疗器械管理局在2024年采用了以美国食品药品监督管理局为中心的定义,促使他们大型企业获得西方平台许可。
跨国赞助商与区域人才发展的战略联盟,也正在加速技术转让和商业推广,使亚太市场成为不容忽视的新兴力量。
欧洲在绝对收入方面落后,但拥有一个复杂的研究基础。德国和英国是制造中心,利用生物工艺专长和研发税收抵免。监管滞后限制了近期的产品推出,但预计到2027年,欧洲药品管理局的协调将释放被压抑的需求。
2025年1月
Biohm Technologies 宣布将其长寿肠道报告作为其肠道微生物组检测平台的一部分推出。该功能利用人工智能和先进的生物信息学,评估个人肠道微生物组组成如何影响衰老过程。通过分析超过 1000 万个数据点,并识别出与长寿相关的近 100 种关键细菌和真菌类群,该公司开发了一个由机器学习和深度学习技术支持的可预测模型。
2025年2月
肠道微生物组研究领域的新兴公司MicrobioTx推出了一系列新的益生菌,以满足不同的健康需求。在印度微生物组科学家Palok Aich博士的指导下开发的配方旨在满足印度人群独特的微生物组需求。旗舰产品线包括DigesTx、MoodTx、GlucoTx和LeanTx,分别针对消化健康、心理健康、葡萄糖代谢和体重管理。
2025年2月
华大智造(MGI)推出了微生物组代谢编码测序包(MMSP),该包建立在该公司的DNBSEQ-G99和DNBSEQ-E25测序平台上。该新软件包专为全球微生物组研究人员设计,可使用16S/ITS rDNA测序进行全面的群落分析,为微生物分类和功能探索提供了一种高效且经济高效的方法。该技术使科学家能够研究包括人类健康、环境、工业和农业在内的各个领域的微生物多样性、丰度和相互作用。
2025年4月
全球代谢组学领导者Metabolon, Inc.推出了一种先进的微生物组研究解决方案,该解决方案将宏基因组测序与新型微生物组代谢物小组相结合。该集成工具包不仅可以识别微生物种类和遗传潜力,还可以揭示它们的代谢活动和生物活性化合物的产生,从而更深入地了解与诊断、治疗和精准医学相关的宿主-微生物相互作用。
2025年6月
达能北美公司,全球最大的B类认证公司之一,宣布了2024-2025年度肠道微生物组、酸奶和益生菌奖学金计划的获得者。今年,范德比尔特大学的Owen Hale和莱斯大学的Ella Ramamurthy获得了25000美元的研究资助,用于支持旨在深化对酸奶、益生菌和肠道微生物组科学理解的创新项目。
随着科学进步与临床应用的突破,微生物治疗市场的竞争格局正在被重塑。如今,行业领导力取决于跨学科的整合能力、高效的战略合作以及对市场的敏锐洞察——唯此方能驾驭挑战,抓住未来机遇。
全球微生物组制造市场正站在一个历史性的拐点。从不断增长的市场规模,到AI等颠覆性技术的应用,再到日益明朗的监管路径,所有迹象都预示着这个千亿级的蓝海市场正从概念加速走向现实。
与制造端并驾齐驱的是精准检测技术的飞跃。从判别菌群失衡,到评估微生物疗法效果,制造与检测的协同发展,将共同构筑起一个从诊断、生产到治疗的完整产业生态,驱动个性化健康管理的实现。
未来,随着科学研究的不断深入和制造技术的持续革新,我们有理由相信,基于微生物组的创新疗法和健康产品将深刻改变慢性病治疗和大众健康的未来图景。对于身处其中的企业、研究者和投资者而言,这无疑是一个充满挑战与无限机遇的黄金时代。
在微生物组产业的拐点上
告别营销炒作
回归科学实证
创新决定未来
主要参考资料
precedenceresearch. Microbiome Manufacturing Market Driving Innovation in Probiotics and Live Biotherapeutics,Sep 04, 2025
mordorintelligence. Microbiome Therapeutics Market Size & Share Analysis – Growth Trends & Forecasts (2025 – 2030)
谷禾健康
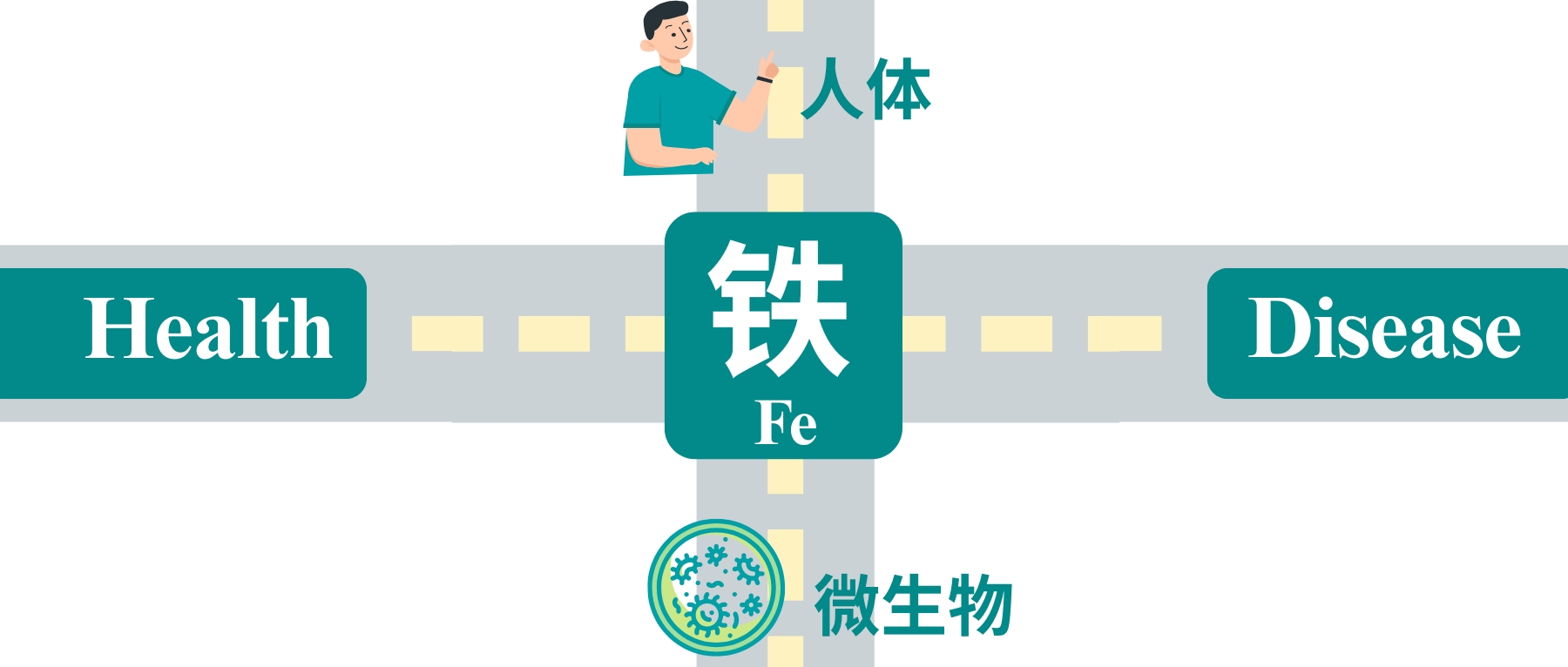
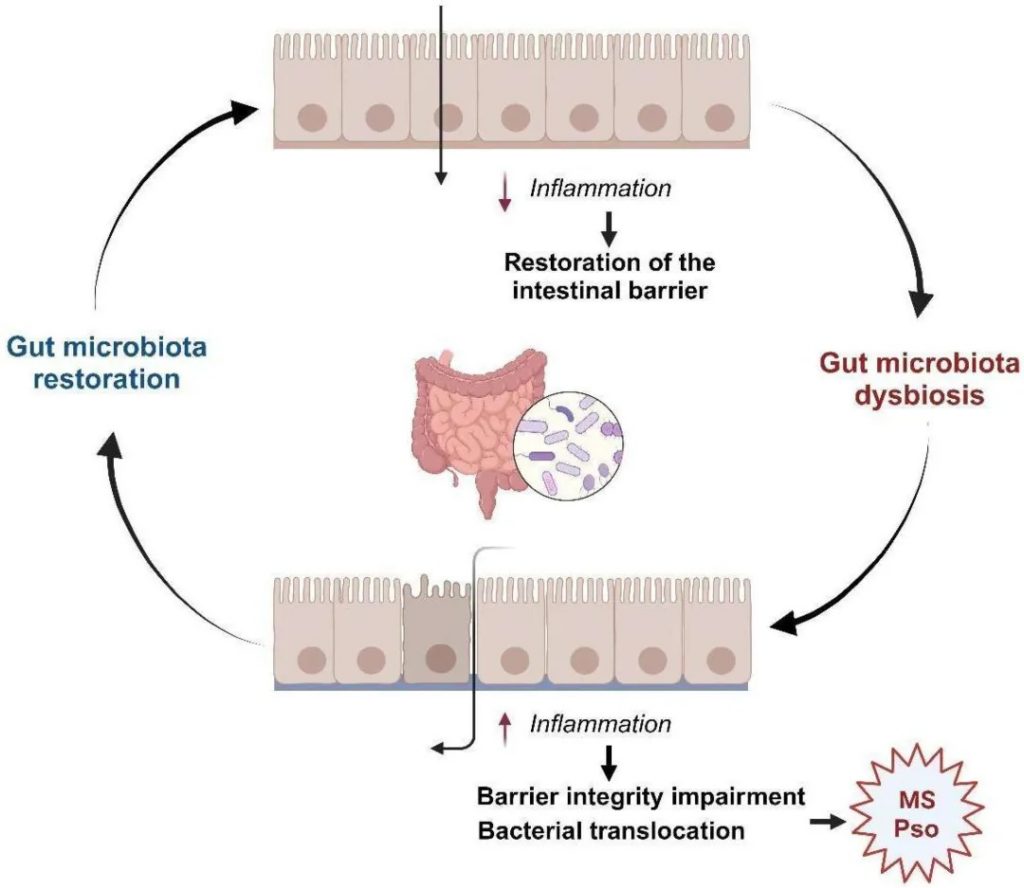
铁是地球上几乎所有生命形式包括人体与微生物不可或缺的微量元素。它不仅支撑着人类的呼吸、免疫和能量代谢,更是肠道微生物争夺的“战略资源”。铁稳态的破坏与肠道菌群失调和多种疾病的发展密切相关。
然而科学家发现,铁在人体与微生物之间也是一把双刃剑:它既能维持生命,也可能通过氧化应激引发DNA损伤和疾病。过量的铁主要通过芬顿反应产生有害的氧化应激,导致DNA、蛋白质和脂质等大分子损伤。因此,人体细胞和微生物系统的铁水平受到复杂机制的严格管控,以维持体内平衡。铁失调可以作为多种人类疾病的原因和结果。更微妙的是,人体与肠道微生物之间围绕铁的“争夺战”,直接决定了我们的健康与疾病状态。
肠道菌群是铁稳态和宿主健康的关键参与者,肠道中未吸收的膳食铁会影响肠道微生物群的组成。铁稳态的破坏可以引发肠道微生态的失调,从而影响宿主的的生理和免疫系统。
近年来,《自然·微生物学》等顶级期刊的研究揭示,铁的动态平衡不仅影响贫血或感染,还与炎症性肠病、癌症等慢性病密切相关。肠道微生物群的组成和功能,甚至药物疗效,都可能被铁的波动彻底改变。本文将从铁的核心作用出发,解析宿主、微生物与铁之间的复杂博弈,并探讨如何通过精准调控铁代谢实现个性化健康管理。
1. 铁的生理功能
铁是血红蛋白和肌红蛋白的核心成分,负责氧气的运输与储存;它也是细胞色素和铁硫簇蛋白的辅因子,参与能量代谢(ATP生成)和DNA合成。人体每天需要约20-25毫克铁,但仅1-2毫克通过肠道吸收,其余来自红细胞回收。
膳食铁分为两类:血红素铁和非血红素铁。
一般来说,血红素铁的生物利用度高于非血红素铁。这是因为,非血红素铁与各种饮食成分复合摄入,抑制其在十二指肠的吸收。虽然铁的还原亚铁形式(Fe2+)是可溶性的能被人类吸收和利用,但亚铁在生理pH值和有氧条件下被氧化为不溶性的三价铁形式(Fe3+)。因此,最常见改善机制是降低环境pH值为酸性条件或通过微生物代谢产物,来改善非血红素铁的溶解度和生物利用率。
2. 铁的毒性风险
游离铁通过芬顿反应(Fenton Reaction)产生活性氧(ROS),攻击脂质、蛋白质和DNA。有研究表明,活性氧水平升高可导致衰老加速,呼吸道和心血管疾病、IBD和癌症的风险增加。总之,这一临床证据突出了维持铁稳态对整体健康的关键作用。
注:芬顿反应是一种基于亚铁离子(Fe²⁺)催化过氧化氢(H₂O₂)产生羟基自由基(•OH)的高级氧化过程,具有极强的氧化能力,广泛应用于环境治理、有机污染物降解等领域。
3. 铁的调控系统
为了维持铁稳态,人体进化出严密的铁调控系统:
图1人类的铁调节
doi.org/10.1038/s41564-025-02001-y
1.宿主的防御策略:营养免疫(Nutritional Immunity)
在急性感染期间,病原体急需铁在宿主内增殖。因此,严格的监管机制,以限制铁的可用性有助于防止感染性疾病的发展。这种宿主防御策略通过调节铁转运蛋白和铁螯合蛋白来执行,被称为“营养免疫”。
案例:
脂质运载蛋白-2能捕获大肠杆菌的肠菌素(Enterobactin),但沙门氏菌通过分泌“隐形铁载体”沙门菌素(Salmochelin)逃逸这一机制,凸显了攻防的进化博弈。
2. 微生物的反击策略
为了克服宿主组织内严重的铁缺乏,病原体已经演化出了各种铁获取机制。最突出的策略就是分泌小的铁螯合分子(铁载体):
图2 细菌在肠道中获取铁的策略
doi.org/10.1038/s41564-025-02001-y
1. 微生物代谢物如何影响铁吸收
肠道微生物通过分泌一系列酶和代谢副产物,这些酶和代谢副产物可以提高或限制膳食铁的利用率,从而影响铁的吸收。
临床意义:高纤维饮食通过增加SCFA改善缺铁性贫血,而长期使用质子泵抑制剂(PPI)因抑制胃酸,可能加剧铁缺乏和肠道菌群失调。
图3 微生物衍生代谢物调节宿主铁吸收
doi.org/10.1038/s41564-025-02001-y
2. 微生物群落结构的铁依赖性
虽然缺铁和铁过量都有风险的记录,但重度缺铁会不可逆地降低微生物的多样性和丰富度,削减宿主健康所需的代谢物(如短链脂肪酸SCFA)。
典型表现为:产SCFA菌(厚壁菌门、罗氏菌属/直肠真杆菌)比例下降;SCFA合成相关基因表达受抑,由于SCFA具备抗炎特性,菌群代谢衰减可能放大缺铁引发的炎症。
图4 铁失调和微生物群失调相关的人类疾病
doi.org/10.1038/s41564-025-02001-y
最新的研究表明,膳食铁是微生物群构成的关键变量,铁-宿主-微生物群的交互作用可显著影响炎症性肠病(IBD)及癌症的病程发展。
1. 炎症性肠病(IBD)
铁代谢失调与感染IBD之间复杂的关联性:
2. 癌症
研究表明,过量摄入红肉中的血红素铁,会损害肠道黏液保护屏障。更关键的是,它会促进一种能分解肠道黏液的细菌——艾克曼菌(Akkermansia) 的生长,从而刺激肠道上皮细胞过度增殖,为癌变埋下隐患。
除了感染和免疫,失衡的铁代谢(尤其是红肉中过量的血红素铁)也是结直肠癌的重要推手。它破坏肠道屏障、喂养有害菌、并直接“喂养”癌细胞。癌细胞还会“劫持”铁调节系统囤积铁,而限制铁供应或调控铁代谢,可能成为抗癌新思路。
长期食用红肉和高脂肪饮食,还与两种有害细菌的滋生密切相关:产肠毒素脆弱拟杆菌(Bacteroides fragilis)和具有基因毒性的特定大肠杆菌(E. coli)。这两种细菌分别产生脆弱拟杆菌毒素(BFT)和大肠杆菌素(colibactin),这些毒素已被证实与结肠癌的发生有直接关联。
不过,有趣的是,高浓度的铁环境本身又会抑制大肠杆菌素(colibactin)的产生。这提示我们,饮食中的铁、肠道致病菌(pathobionts)与结直肠癌发病率之间的具体联系非常复杂,仍需更多研究来阐明。
癌细胞是“铁瘾患者”与铁调控的“劫持者”
癌细胞疯狂生长,对铁元素的需求量巨大。与正常的结肠上皮细胞相比,结直肠癌细胞装备了高效的“铁输入系统”:它们会过量表达铁输入蛋白DMT1(二价金属离子转运蛋白1),导致肿瘤内部铁大量积聚,加速肿瘤生长。
同时,癌细胞还非常“狡猾”。它们会在局部分泌一种名为铁调素(hepcidin)的激素。铁调素的作用是抑制铁输出蛋白膜铁转运蛋白(Ferroportin, Fpn)的功能。这样一来,癌细胞就能成功地将铁囤积在自己内部,进一步促进其生长。实验证据支持这一点:缺乏铁调素能降低肿瘤负担,因为肿瘤细胞内的铁水平下降,进而抑制了其赖以生存的线粒体呼吸作用和合成DNA所需的核苷酸生物合成。
肿瘤微环境中的铁:巨噬细胞角色与治疗潜力
除了癌细胞自身,肿瘤微环境中的其他细胞,特别是肿瘤相关巨噬细胞(TAMs),在调控铁分布和影响癌症进程中可能扮演关键角色。例如,一项转录组研究发现,膜铁转运蛋白(Fpn)的表达水平不仅是肝癌中特定巨噬细胞亚群的标志,还是一个不良预后的指标。
更令人鼓舞的是,另一项研究发现,共生益生菌
植物乳植杆菌(Lactiplantibacillus plantarum)能够促进肿瘤内巨噬细胞表达铁螯合蛋白脂质运载蛋白-2(lipocalin-2),从而增强抗肿瘤免疫力。
这些发现都指向一个极具前景的研究方向:限制肿瘤对铁的获取,或调控铁在肿瘤微环境中的分布,可能具有显著的抗癌治疗潜力。当然,这需要未来更多的研究来深入探索和验证。
3. 感染性疾病
宿主、肠道微生物与铁元素之间复杂的相互作用,给制定人群层面的膳食铁摄入标准和口服铁剂补充方案带来了巨大挑战。早期研究曾指出补铁可能导致菌群失调并增加疾病风险,但后续针对不同地区人群的试验却发现:肠道微生物的初始构成决定了补铁是否引发菌群失调。
饮食结构和微生物组的个体差异,是当前微生物疗法效果不稳定的关键原因。这种差异性要求我们采取个性化医疗策略——根据患者具体情况搭配营养干预和微生物疗法。
过去30年,癌症治疗已实现从“无差别放化疗”到“靶向基因突变”的精准医疗跨越。同样,如果我们能锁定调控铁代谢的核心通路、以及影响铁稳态的特定微生物(如导致感染、炎症性肠病和癌症的菌株),便有望开发出新一代精准疗法。
1. 个性化补铁策略
2. 饮食与药物的协同管理
3. 未来方向:微生物组精准编辑
通过基因工程改造益生菌,使其分泌铁载体拮抗剂或免疫调节分子,或开发“铁载体-药物偶联物”,靶向递送抗生素至病原体。若鉴定出有益菌(如罗伊氏乳杆菌),可开发对应益生菌疗法;对有害菌则可用噬菌体或抑制剂精准清除。
微生物的“双面剑”特性
尽管传统研究聚焦病原体,但共生微生物的作用也同样引发关注。多形拟杆菌、阿克曼菌等“益生菌”在特定环境下可能会助推感染和癌症风险。关键在于解析环境因素(如铁浓度、菌群互作)如何影响微生物行为。
未来研究需突破两大方向:
① 揭示健康/疾病状态下,共生菌、条件致病菌与病原体的互动机制;
② 追踪铁元素如何通过改变微生物代谢通路影响宿主健康。
铁的平衡艺术——迈向精准健康时代
铁不仅是生命的基石,更是宿主与微生物、健康与疾病的交汇点。
微生物组在补铁过程中的“保护 vs 致病”双重角色,解释了为何相同的疗法对不同患者效果迥异。
随着微生物组学、代谢组学和基因编辑技术的进步,我们有望像定制癌症治疗方案一样,为每个人设计铁代谢的个性化蓝图。从饮食调整到微生物干预,科学的铁管理将成为预防和治疗慢性病的核心策略之一。
主要参考文献:
Choi, G., Bessman, N.J. Iron at the crossroads of host–microbiome interactions in health and disease. Nat Microbiol 10, 1282–1293 (2025).
谷禾健康
前几日,南方医科大学深圳医院院长周宏伟教授团队在国际顶尖医学期刊《Nature Medicine》上发表了一项重要研究。首次揭示一种名为活泼瘤胃球菌(Ruminococcus gnavus)的细菌产生的物质——苯乙胺,在肝性脑病发生中的关键作用。

同时谷禾的人群检测数据及相关研究也发现,活泼瘤胃球菌(R.gnavus)广泛存在于人体中,超过90%的人可以检测到。并且在例如肥胖、抑郁症、炎症性肠病、2型糖尿病等疾病患者中丰度偏高。
想必很多人对这个名字比较陌生,可能只知道瘤胃球菌属。虽然其名为活泼瘤胃球菌,但关于其的具体归属还有争议(有一段时间它被归类为Blautia属,但最近又被重新归为Mediterraneibacter属)。
活泼瘤胃球菌(Ruminococcus gnavus)是一种革兰氏阳性、严格厌氧的细菌,属于毛螺菌科,普遍存在于人类和动物的肠道中,是婴儿肠道的早期定植者,并在成年后也持续存在,占健康个体肠道微生物群丰度的0.1%至2%。
拉丁语gnavus的意思是忙碌,R.gnavus具有积极的碳水化合物发酵能力,可以将复杂的淀粉降解成更简单的分子。在淀粉、麦芽糖和岩藻糖基化聚糖等食物消化中具有重要功能。并产生乙酸盐、丙酸盐、甲酸盐和乙醇,但不产生丁酸盐。
虽然R.gnavus能有效利用植物性食物中的糖,但肠道中的糖并非全来自食物,人体自身也会生成糖类,如构成肠道内壁的粘蛋白聚糖。一些菌株依赖这些糖,并进化出策略以持续获取,可能破坏肠道屏障。
活泼瘤胃球菌(R.gnavus)生活在我们的肠道内壁,因此可以很好地感知肠道环境的变化并将其与身体的其他部分进行沟通。这在我们的免疫系统中发挥作用,也会对体内其他器官的功能产生影响。
研究发现R.gnavus能够产生一种炎性多糖,该分子诱导树突状细胞产生炎性细胞因子,如TNFα(肿瘤坏死因子),可能导致人体的炎症反应。并且越来越多的证据表明,R.gnavus的过度生长可能与某些肠道疾病有关,包括炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌。
此外,研究还发现,患有影响身体其他部位的健康问题(包括感染、过敏、肥胖、代谢综合征、2型糖尿病、肝脏疾病和神经系统疾病)的人肠道中活泼瘤胃球菌(R.gnavus)的水平较高,说明R.gnavus与这些疾病之间存在相关性。
注:这种关联并不一定意味着R.gnavus是这些疾病的原因。相反,它可能只是表明这些疾病为R gnavus在肠道中的生长创造了有利条件。
活泼瘤胃球菌(Ruminococcus gnavus)到底是多种疾病的风险标志物还是正常的肠道共生菌?让我们来一探究竟。
活泼瘤胃球菌(Ruminococcus gnavus)是一种革兰氏阳性厌氧菌,属于厚壁菌门。R.gnavus于1974年首次从人类胃肠道的粪便和内容物中分离出来。当时它被描述为专性厌氧、非孢子形成、非运动或运动球菌,具有1-3个鞭毛,以链状或成对出现。
R.gnavus ATCC 35913 的扫描电子显微镜图像

拉丁语gnavus的意思是忙碌,指的是该物种的积极发酵能力。这种细菌具有特殊的酶,可以将复杂的淀粉降解成更简单的分子。在淀粉、麦芽糖和岩藻糖基化聚糖等食物消化中具有重要功能。可以产生乙酸盐和甲酸盐,但不产生丁酸盐。
R.gnavus的细胞壁由一种复杂的葡配甘露聚糖组成,它具有高度的免疫原性,可以在宿主中诱导特异性抗体。
R.gnavus的脂聚糖是一种附着在脂质上的聚糖,也是免疫原性的,可以调节宿主免疫系统。不同品系的R.gnavus具有不同的结构。
R.gnavus的基因组由一条约2.5Mb的圆形染色体和几个不同大小的质粒组成。它编码许多参与碳水化合物代谢的基因。其基因组DNA的G+C含量为43mol%。
虽然R.gnavus ATCC 29149无法在氧气存在下生长,但它确实表现出对大气氧气的一定耐受性,10%-15%的细胞在暴露于氧气1小时后仍保持活力,3小时后下降到0.05%-0.1%左右
该菌株对阿莫西林、替卡西林、头孢噻肟、亚胺培南、普那霉素、万古霉素、利奈唑胺、甲硝唑、利福平、甲氧苄啶/磺胺甲噁唑敏感,对林可霉素、红霉素、左氧氟沙星耐药。
▸ 在生命早期就定植于肠道
活泼瘤胃球菌(R.gnavus)是“正常”人类肠道微生物群的常见成员,多项证据表明其在生命早期就普遍存在。
生命第一年,分娩方式、饮食和遗传等因素都会影响微生物定植。一项针对25名1至24个月大婴儿样本的研究中,确定R.gnavus普遍存在;具体来说,在25个样本中的22个(88%)都检测到了活泼瘤胃球菌(R.gnavus)。
▸ 可能在婴儿消化与代谢中发挥作用
活泼瘤胃球菌(R.gnavus)可能是婴儿肠道的主要物种,其水平与双歧杆菌属相当。通过16S rRNA基因测序分析的研究强调了R.gnavus与母乳喂养或不同配方奶粉之间的饮食关联。
例如,在一项针对90名2个月大婴儿(每组30名)的比较研究中,与喂食牛奶的婴儿中更多样化的微生物特征相比,母乳或山羊奶喂养的婴儿中,毛螺菌科(Lachnospiraceae)的存在仅限于一种物种,即R.gnavus。
在另一项随机对照试验比较了喂食乳糖牛奶配方奶粉(CMF)与广泛水解蛋白配方奶粉(EHF,适用于牛奶蛋白不耐受婴儿)的婴儿粪便微生物群。结果显示,随着时间推移,EHF组中R.gnavus丰度增幅最大,成为区分不同食物喂养微生物组的显著特征。
这些数据表明,R.gnavus可能在肠道微生物群构建中发挥作用,并与婴儿正常体重增长和状态相关。
▸ 淀粉等固体食物会增加R.gnavus丰度
R.gnavus的相对丰度变化可能体现了婴幼儿微生物群的正常“成熟”。一些证据表明,R.gnavus在断奶后相对丰度增加,而其他物种,如双歧杆菌,已知相对丰度降低。
注:最近一项针对怀孕和分娩时婴儿肠道微生物群(脐带血)的研究显示,R.gnavus与产前血浆25-羟基维生素D(25[OH]D)呈正相关,但与脐带25[OH]D呈负相关。
一项研究调查了断奶对605名婴儿微生物群的影响,结果显示首次引入固体食物后,R.gnavus所属的比例显著增加。短链脂肪酸(SCFA)分析也反映了肠道微生物群的变化,数据显示断奶期间丁酸盐的产生发生变化。
对28名尼日利亚婴儿出生后第一年内粪便微生物群的分析显示,母乳喂养婴儿以R.gnavus、Collinsella和Sutterella为主。丁酸盐在断奶开始时(4-6个月大)首次检测到,引入固体食物后乙酸盐和乳酸仍然较高,12月龄时丁酸盐水平较低,与R.gnavus的已知发酵能力一致。
综上所述,这些研究支持R.gnavus在肠道早期定植中的作用。一些R.gnavus菌株能够代谢人乳低聚糖(HMO)和粘蛋白,其结构聚糖相似性进一步支持该物种在其他细菌定植过程中发挥重要作用的假设。
▸ R.gnavus在成年后也持续存在于肠道
R.gnavus在成年后也持续存在;根据对来自北美和欧洲的健康成年人的粪便样本的宏基因组测序,发现它是存在于≥90%的个体中的物种。
最近,在来自中国、埃塞俄比亚、西班牙、美国和瑞典的健康成年人的公开肠道微生物群宏基因组中发现了R.gnavus平均丰度为0.3%。
谷禾多年的检测数据显示,国人活泼瘤胃球菌(R.gnavus)检出率超过95%,表明其在人群中普遍存在,是肠道微生物群的基本组成部分。
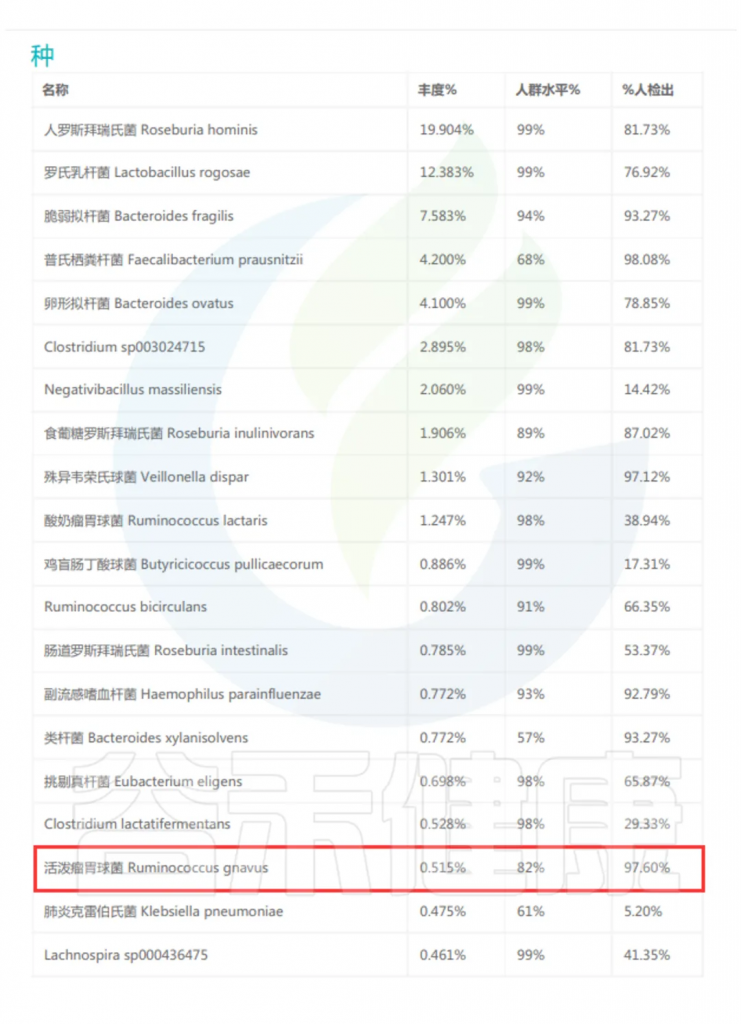
▸ R.gnavus有助于消化复杂的碳水化合物
瘤胃球菌是分解碳水化合物最有效的细菌属之一。我们知道瘤胃球菌是“降解抗性淀粉的关键菌”。瘤胃球菌能有效地分解坚硬的植物物质,如细胞壁,这有助于人体消化水果蔬菜,不太可能引起胃痛。
注:抗性淀粉是在小扁豆、豆类和未加工的全谷物等高纤维食物中发现的复杂碳水化合物。
这种细菌具有特殊的酶,可以将这些复杂的淀粉降解成更简单的分子。这也与它利用一些母乳低聚糖和在粘蛋白聚糖表位上觅食的能力有关。值得注意的是,R.gnavus ATCC 29149具有一种独特的唾液酸代谢途径,专门用于2,7-脱水Neu5Ac。
R.gnavus碳水化合物的最终发酵产物包括乙酸盐、甲酸盐和乙醇,以及丙醇和丙酸盐,但不包括丁酸盐。
尽管活泼瘤胃球菌(R.gnavus)是人类肠道微生物群的组成部分,正常情况下在健康个体的肠道中普遍存在,但许多研究表明,当其丰度过高时,可能与多种疾病的发生发展存在密切关联。这些疾病不仅包括与肠道相关的疾病,如炎症性肠病(IBD)、肠易激综合征、结直肠癌,还涉及一些非肠道相关的疾病,如代谢性疾病和免疫系统紊乱等。
R.gnavus与疾病和潜在分子介质的关联
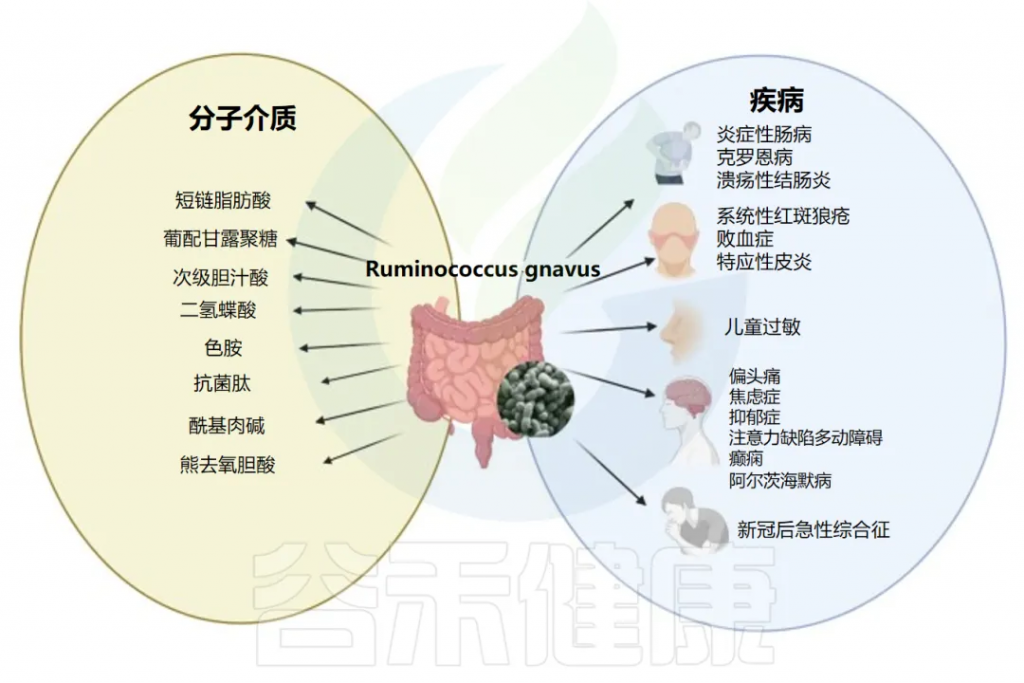
Crost EH,et al.FEMS Microbiol Rev.2023
1
炎症性肠病
克罗恩病(CD)和溃疡性结肠炎(UC)是多因素慢性炎症性肠病,一直与肠道微生物失调有关。越来越多的研究表明R.gnavus与炎症性肠病(IBD)之间存在正相关,尽管因果关系仍有待证明。
▸ R.gnavus在IBD患者中含量增加
分析了炎症性肠病(IBD)患者肠粘膜组织的早期研究表明,粘膜相关细菌的丰度增加。例如,与健康粘膜相比,R.gnavus和R.torques在CD和UC粘膜中含量更高,而主要的粘液降解细菌A.muciniphila在CD和UC粘膜中的含量明显较低。
在一项后续研究中,分析了68名CD患者、84名未受影响的亲属和55名匹配的对照者粪便样本,并使用实时PCR进行定量。结果显示,R.gnavus是五种与菌群失调相关的细菌中唯一在克罗恩病(CD)中丰度增加的物种。
通过内窥镜采集IBD患者粘膜表面样本(43名UC患者、26名CD患者和14名非IBD对照),利用16S rRNA 基因测序分析粘膜相关微生物群落。结果显示,与非IBD对照相比,CD患者变形菌门丰度显著增加,而厚壁菌门和拟杆菌门丰度显著降低。其中,埃希氏菌属、瘤胃球菌属(R.gnavus)、放线杆菌属和肠球菌属显著增加,而粪杆菌属、粪球菌属、普雷沃氏菌属和罗氏菌属显著减少。
▸ R.gnavus能够诱导产生炎性细胞因子

一项研究发现,肠道细菌R.gnavus产生了炎性多糖,其种群在克罗恩病患者的症状发作期间丰度增加。R.gnavus可以合成并分泌具有鼠李糖骨架和葡萄糖侧链的复杂多糖glucorhamnan,它有效诱导树突细胞分泌炎性细胞因子(TNFα),并可能导致R.gnavus与克罗恩病之间的关联。
另一项基于对40对双胞胎的肠道微生物群分析的研究显示,在回肠CD患者中,肠杆菌科和R.gnavus的丰度增加,而粪杆菌属(Faecalibacterium)和罗氏菌属(Roseburia)等核心细菌的消失。
▸ R.gnavus丰度与IBD疾病结果相关
R.gnavus是与克罗恩病相关的菌群,已被确定为导致克罗恩病症状的原因之一。在克罗恩病患者中活泼瘤胃球菌(R.gnavus)的相对丰度升高与症状严重相关。
通过Illumina MiSeq对IBD患者(70名UC,39名CD)及100名健康对照的粪便微生物群分析显示,它们在 IBD中表现出差异丰度。结合20名IBD患者和12名对照的宏基因组分析与R.gnavus分离株的全基因组测序,强调了R.gnavus菌株水平的重要性。
研究还揭示了IBD特异性、菌株特异性的基因,这些基因参与氧化应激反应、粘附、铁获取和粘蛋白利用,可能赋予R.gnavus在IBD患者肠道中的适应性优势。在小鼠模型中,提出了多种支持R.gnavus与 IBD关联的机制。
此外,分析了化疗后接受造血细胞移植和干细胞植入的癌症患者的>10000个纵向微生物群样本,发现R.gnavus的绝对丰度与淋巴细胞率负相关,与其生长速率正相关,表明R.gnavus可能驱动高中性粒细胞与淋巴细胞比率,这一特征与IBD不良预后密切相关。
注:R.gnavus的富集还与CD患者的心理评分呈正相关,与次级胆汁酸TDCA和TLCA呈负相关,进一步表明其与患者心理状态和疾病进展的关联。
综上所述,一些研究人员认为R.gnavus可以作为 炎症性肠病(IBD)的生物标志物,但因果关系仍有待证明。
2
肠易激综合征
肠易激综合征(IBS)是一种慢性异质性疾病,影响约6%的人口。IBS的病理生理学是多因素的,其中包括肠道微生物群的改变。
对IBS患者、健康个体粪便和结肠活检样本,以及小鼠模型样本的细菌测序分析表明,症状和炎症的严重程度可能与粘液相关细菌(如R.gnavus)的变化密切相关。
编辑
▸ 在腹泻型IBS患者中明显更丰富
对80名IBS患者(16-70岁)和65名无IBS对照的粪便进行鸟枪法和16S rRNA 测序显示,R.gnavus和毛螺菌科其他物种在 IBS 中显著更丰富,尤其在腹泻型IBS(IBS-D)患者中,与外周5-羟色胺(5-HT)水平和严重症状相关。
这一现象也在R.gnavus单定植小鼠中得到验证。代谢组学和宏基因组学研究表明,R.gnavus的富集与二氢蝶酸水平降低密切相关,二氢蝶酸是叶酸合成的重要中间体,其失调可能导致IBS病理变化。
此外,在新诊断的初治IBD或IBS患者(13UC、10CD和26IBS)与健康对照中,基于粪便和粘膜微生物群的16S rRNA 基因测序进一步证实了R.gnavus 作为区分疾病表型潜在生物标志物的作用。
3
结直肠癌
多项宏基因组学研究表明,结直肠癌(CRC)与肠粘膜相关微生物群的显著变化有关。
▸ 粘膜菌群失调与肿瘤形成存在关联
异常隐窝病灶(ACF)是CRC患者结肠中最早可识别的形态学病灶。对接受结肠镜筛查或监测个体的粘附细菌分析显示,与正常粘膜相比,ACF的细菌微生物组谱异质性显著更高;KRAS癌基因突变与R.gnavus呈正相关,提示特定结肠细菌与CRC相关突变之间可能存在联系。
这些结果表明,正常粘膜微生物群的扰动可能是早期肿瘤形成的危险因素,粘膜菌群失调可能影响ACF的组织微环境和行为,促进其向高级肿瘤发展。
此外,最近一项研究通过16S扩增子测序分析CRC患者治疗前后肠道微生物群,发现R.gnavus与脂肪细胞因子信号通路和过氧化物酶体通路相关。
4
过敏、免疫和炎症
▸ R.gnavus可能对特应性皮炎有一定保护作用
肠道微生物组失调与儿童过敏密切相关,R.gnavus 是儿童过敏的重要参与者。研究表明,患特应性皮炎(AD)的婴儿肠道微生物群与健康婴儿存在差异。通过对129名婴儿队列中随机选取的40名6个月大婴儿(20名对照组,20名AD患者)的肠道微生物组进行全宏基因组测序,发现与免疫发育相关的功能基因存在差异。AD组中A.muciniphila、R.gnavus和Lachnospiraceae bacterium 2_1_58FAA的定植减少,与免疫发育迟缓显著相关。临床前研究进一步支持了R.gnavus在特应性皮炎模型中的保护作用。
▸ 食物或呼吸道过敏儿童中R.gnavus升高
相比之下,在受食物或呼吸道过敏影响的儿童中观察到R.gnavus(和F.prausnitzii)的丰度更高。在一项前瞻性双胞胎队列的研究中,在过敏表现出现之前观察到粪便微生物群中R.gnavus的丰度增加,并且与呼吸道过敏或呼吸道过敏与特应性湿疹共存有关。
在小鼠模型中,添加R.gnavus ATCC 29149 导致气道高反应性和炎症(哮喘),表现为结肠和肺中辅助T细胞2的扩增,以及嗜酸性粒细胞和肥大细胞浸润结肠和肺实质。
▸ 一些炎症反应中R.gnavus增多
系统性红斑狼疮(SLE)患者中R.gnavus丰度显著增加,且与整体疾病活动呈正比,在狼疮性肾炎患者中尤为明显。狼疮性肾炎患者的粪便中sIgA包被的R.gnavus细菌更多,血清IgG水平升高,主要针对R.gnavus菌株特异性细胞壁脂聚糖抗原。
R.gnavus水平升高也与脊柱关节炎相关,这是一类炎症性风湿病,但其机制尚不明确。此外,COVID-19患者(未使用抗生素)及长期并发症患者的肠道微生物组中R.gnavus水平较高,可能与细菌的肠肺易位或免疫与炎症调节有关。
5
代谢综合征
▸ R.gnavus与体脂率、腰围、血清甘油三酯等指标相关
R.gnavus与代谢综合征的多个特征密切相关,包括体脂百分比增加。这一关联得到了以挪威20-94岁参与者为基础的大型发现队列(n=2875)及两个复制队列(n=999和n=1341)的分析支持。
编辑
在联合队列中,33.7%的参与者检测到R.gnavus,其存在与脂肪量、腰围、血清甘油三酯、C反应蛋白(CRP)、HbA1c增加及HDL降低相关。这些关联在调整混杂因素后依然显著,且在不同性别和年龄(以中位年龄 59.6 岁为界)分层分析中表现一致。
6
肥胖
▸ R.gnavus在肥胖者中更丰富
在一项横断面多种族肥胖表型研究(812 名男性,843名女性,60-77 岁)中,16S rRNA 基因测序显示 R.gnavus与能量调整饮食炎症指数(E-DII)和肥胖表型相关。
另一项研究发现,在41名BMI正常者中,R.gnavus 与内脏脂肪密切相关,并与代谢指标呈正相关。早期研究也表明,R.gnavus在肥胖者中明显更丰富,并在减重期间减少,且与高BMI呈正相关。此外,一项研究显示,R.gnavus在对减肥手术无反应的患者中更为丰富。
注:瘤胃球菌喜欢植物中的多糖。如果肠道中有过多的瘤胃球菌,可想而知细胞会吸收更多的糖,那就不可避免地导致体重增加。
▸ R.gnavus会影响脂质代谢及信号通路
最近的动物研究表明,R.gnavus影响宿主代谢物。在高脂肪饮食小鼠中,R.gnavus影响肝脏的信号通路和下游脂质代谢,特别是降低FGF21表达,增加肝脏甘油三酯水平、血清总胆固醇和低密度脂蛋白(LDL)水平,所有这些都会导致代谢紊乱。
7
冠状动脉和肝脏疾病
▸ 冠状动脉疾病晚期患者R.gnavus相对丰度增加
肠道微生物组的改变与心血管疾病相关。一项病例对照研究通过16S rRNA测序分析了53名晚期冠状动脉疾病(CAD)患者与53名年龄、性别、种族和BMI匹配的对照者的粪便微生物群,发现CAD患者的肠道微生物组丰富度和均匀度降低。R.gnavus是相对丰度增加超过数倍的五个分类群之一,并在调整糖尿病和血脂异常等风险因素后,与晚期CAD的存在显著相关。
▸ 在脂肪性肝病肝硬化中丰度显著增加
宏基因组测序显示,R.gnavus是脂肪性肝病(MASLD)肝硬化和脂肪性肝病-肝细胞癌(HCC)患者中最丰富的五种细菌之一,且在MASLD-HCC患者中丰度最高。
此外,R.gnavus与MASLD-HCC和MASLD肝硬化患者的细胞毒性CD8+ T细胞呈负相关,而在MASLD合并冠心病患者中,其丰度低于仅患冠心病的个体。然而,这些研究未包含MASLD对照组,限制了对MASLD肠道微生物组的理解。
已有研究表明,与健康对照和脂肪性肝病对照相比,脂肪性肝病肝硬化患者的R.gnavus丰度显著增加,暗示其可能与脂肪性肝病向肝硬化的进展有关。
▸ 驱动肝性脑病
高达50-70%的肝硬化患者会发展为肝性脑病(HE),这与肠道菌群失调密切相关,机制尚不清楚。通过构建肠脑模块评估宏基因组数据集中的细菌神经毒素,研究人员发现主要来自R.gnavus的苯丙氨酸脱羧酶(PDC)基因在肝硬化患者中增加了约10倍,在HE患者中更高。
用R.gnavus定植的肝硬化、不健康的小鼠表现出脑苯乙胺(PEA)积累,以及记忆障碍、对称性震颤和皮层特异性神经元丢失,通常见于肝性脑病患者。
8
2型糖尿病
▸ 2型糖尿病患者中R.gnavus较高,而抗炎细菌丰度较低
肠道菌群的变化和慢性低度炎症在2型糖尿病(T2D)发展中起关键作用。一项对T2D患者粪便样本的初步研究发现,R.gnavus、Lactobacillus ruminis、Bacteroides caccae、Butyricimonas 和 Collinsella aerofaciens丰度较高,而抗炎细菌F.prausnitzii和Butyrivibrio丰度较低。
在一项随访的人群队列研究中,R.gnavus被确定为与新发2型糖尿病(T2D)持续相关的四个物种之一。对134名糖尿病前期成年人的分析显示,梭菌目(Clostridiales)和阿克曼菌(A.muciniphila)丰度降低,而R.gnavus丰度增加。一项基于258名T2D患者的研究发现,富含R.gnavus的微生物簇与适中血糖、严重胰岛素抵抗、高胆固醇水平相关。
▸ 与妊娠晚期空腹血糖呈正相关
妊娠糖尿病(GDM)研究表明,R.gnavus与妊娠晚期空腹血糖呈正相关。此外,糖尿病周围神经病变(DPN)研究显示,甘氨酸熊去氧胆酸和牛磺熊去氧胆酸与R.gnavus和Phascolarctobacterium的丰度呈正相关。
9
感染与脓毒症
编辑
▸ R.gnavus可能导致外周感染及血液感染
R.gnavus感染病例包括血液恶性肿瘤和外周感染,如泌尿生殖系统感染。例如,一名患深部浸润性子宫内膜异位症和盆腔炎的女性在双侧输卵管卵巢脓肿中培养出R.gnavus。
R.gnavus血流感染还与憩室病、化脓性关节炎、胆囊穿孔、多发性骨髓瘤和乙状结肠癌化疗患者的肠穿孔以及小肠疝和穿孔引起的粪便腹膜炎相关。这些研究表明R.gnavus感染的致病性与胃肠道损伤密切相关。
10
神经系统疾病
新出现的证据表明,微生物失调可导致神经认知障碍的发生和发展,如精神分裂症、抑郁症、双相情感障碍、焦虑症和痴呆症。
有人认为,饮食、生活方式、遗传因素和外部压力源“合作”调节肠道微生物群组成,从而影响大脑的反应。越来越多的研究报告了患有神经系统疾病的患者R.gnavus水平的变化。
▸ 焦虑症、脑癫痫患者R.gnavus增加
尽管研究规模有限,但焦虑症患者的肠道微生物丰富度和多样性显著降低,同时R.gnavus丰度增加。一项为期8周的临床试验测试了益生菌对抑郁症的治疗效果,结果显示益生菌组和安慰剂组均有症状减轻,但肠道微生物群未发生显著变化。然而,重度抑郁患者的R.gnavus相对丰度显著增加,并与抑郁焦虑压力量表评分呈正相关。
另一项研究发现,R.gnavus与脑癫痫患者的癫痫发作显著正相关,这种神经系统疾病以癫痫发作易感性为特征,与健康对照组相比差异明显。
▸ 阿尔茨海默病和认知障碍患者中R.gnavus丰度增加
随着人口老龄化的加剧,微生物代谢物在神经退行性疾病如阿尔茨海默病(AD)和帕金森病(PD)进展中的作用受到越来越多关注。在AD患者中,主要特征是淀粉样蛋白β(Aβ)在记忆相关脑区的积累。一项基于AD小鼠模型的研究发现,Aβ蛋白的过表达显著影响肠道微生物群,其抗菌活性导致R.gnavus等物种的丰度变化。
另一项研究调查了PD患者的肠道微生物群,并根据疾病严重程度分组。结果显示,路易体痴呆患者中R.gnavus和粪杆菌的相对丰度更高。这与另一项研究的结果一致,该研究发现帕金森病(PD)患者肠道中R.gnavus的丰度显著高于健康对照组。
在易患神经认知障碍的老年人和患有心理症状的克罗恩病患者中观察到R.gnavus的富集。与健康对照相比,中风后认知障碍患者的R.gnavus丰度增加,且与认知测试结果呈负相关。对患偏头痛的老年妇女与健康对照(年龄和BMI匹配)的粪便样本进行宏基因组学分析显示,R.gnavus是偏头痛组中显著富集的物种之一。
综上所述,这些研究表明R.gnavus在神经系统疾病中的丰度增加,尽管因果关系尚未明确。文献倾向于将粘膜相关或粘液溶解细菌的存在与肠道屏障通透性增加或炎症相关联,导致细菌代谢物或分子泄漏,触发炎症并向大脑发出信号。例如R.gnavus ATCC 29149 能够将色氨酸脱羧形成色胺,提高了肠道和中枢神经系统互作的可能性。
然而,目前尚无证据表明R.gnavus能物理改变粘膜屏障。与多形拟杆菌(Bacteroides thetaiotaomicron)或A.muciniphila等物种因其广泛的粘蛋白-聚糖降解能力可分解完整的粘蛋白聚糖链不同,R.gnavus的粘蛋白聚糖降解能力具有菌株特异性,仅限于从上皮屏障外觅食聚糖表位。
R.gnavus与疾病关联的研究
编辑
Crost EH,et al.FEMS Microbiol Rev.2023
▸ 高糖高肉会增加R.gnavus
饮食是肠道微生物群的主要调节因素。在题为“满足欧洲老年人口健康老龄化特定需求的新饮食策略”(NU-AGE)的研究中,调查了饮食、肠道微生物群和认知之间的关联,结果表明R.gnavus和Collinsella spp.与富含动物产品的饮食有关,被称为“促炎物种”。
通过对多种族队列研究(5936名参与者)的粪便样本进行16S rRNA基因测序,确定了饮食质量与肠道微生物组的长期关联。结果显示,R.gnavus的存在与健康饮食指数呈负相关。
健康饮食指数(HEI)由13个组成部分组成,最高100分,包括9个充足性组成部分(总水果、全水果、总蔬菜、蔬菜和豆类、全谷物、乳制品、总蛋白质食品、海鲜和植物蛋白以及脂肪酸)以及四个适度成分(精制谷物、钠、添加糖和饱和脂肪)。大多数成分按每1000大卡摄入量的摄入量评分。2
以羊肉、猪肉等红肉为基础的饮食会增加活泼瘤胃球菌(Ruminococcus gnavus)的丰度。
此外,经常食用糖果、饮料、糕点等,也会导致Ruminococcus gnavus升高,并降低了肠道中某些有益菌。
▸ 富含多酚的食物有助于减少R.gnavus
针对R.gnavus的饮食干预研究较少。一项对23名健康个体的随机交叉试验发现,在高红肉饮食中添加高直链淀粉玉米可降低R.gnavus的比例;补充富含多酚的红树莓可减少糖尿病前期和胰岛素抵抗成人的R.gnavus。这表明针对活泼瘤胃球菌(R.gnavus)的饮食干预可作为促进健康的策略。
▸ 益生菌调节
唾液乳杆菌(Lactobacillus salivarius Ren)显著减少R.gnavus的数量。
Lactobacillus paracasei DG干预后,瘤胃球菌丰度下降55%(P = 0.016)
口服长双歧杆菌BB536 和鼠李糖乳杆菌HN001 1个月后,Ruminococcus gnavus丰度减少。
此外,我们推测多形拟杆菌(Bacteroides thetaiotaomicron)等能够降解碳水化合物的有益细菌可能会与R.gnavus竞争,从而抑制R.gnavus的丰度。
但在注射了乳杆菌的小鼠小肠微生物群中,瘤胃球菌过度生长。
以下的细菌也可能对R.gnavus具有抑制作用
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Bacteroidales
Bacteroides
Porphyromonadaceae
Odoribacter
Parabacteroides
Porphyromonas
Prevotella
Rikenellaceae
Alistipes
Turicibacter
Streptococcus
Clostridiales
Catabacteriaceae
Clostridium
Clostridiales incertae sedis
Peptoniphilus
Clostridiales Family XIII. Incertae Sedis
Lachnospiraceae
Blautia
Lachnospiraceae
Coprococcus
Dorea
Eubacterium
Lachnobacterium
Lachnospira
Roseburia
Lachnospiraceae
Peptococcaceae
Ruminococcaceae
Ruminiclostridium
Acetivibrio
Eubacterium
Faecalibacterium
Oscillospira
Ruminococcus
Acidaminococcus
Dialister
Phascolarctobacterium
Veillonella
Rubrivivax
Alcaligenaceae
Oxalobacter
Bilophila
Desulfovibrio
Campylobacteraceae
Enterobacteriaceae
Escherichia
Erysipelotrichaceae
Erysipelotrichaceae
Holdemania
Akkermansia
▸ 益生元调节
施用低聚半乳糖(GOS)后,R.gnavus丰度下降。
龙舌兰菊粉,3周,随机对照试验,交叉试验,R.gnavus减少。
玉米可溶性纤维21g/d, 3周,随机对照试验,交叉试验,R.gnavus减少。
尽管活泼瘤胃球菌(Ruminococcus gnavus)是人类肠道微生物群的重要组成部分,通常在健康个体的肠道中广泛存在,但研究表明,其丰度的异常升高可能与多种疾病的发生和发展密切相关。这些疾病不仅包括肠道相关疾病,如炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌,还涉及非肠道相关疾病,如神经发育障碍、神经系统疾病、代谢性疾病以及免疫系统紊乱等。
例如,除了最近《Nature Medicine》揭示活泼瘤胃球菌可通过苯丙氨酸脱羧酶及其代谢产物苯乙胺驱动肝性脑病,为肝性脑病提供了潜在诊疗靶点。 今年江南大学王鸿超团队基于机器学习识别关键菌群,发现肥胖个体中肠道共生菌活泼瘤胃球菌的丰度增加,且与临床指标显著相关,且通过调节胆汁酸代谢(如促进次级胆汁酸的生成)对宿主代谢产生不利影响,间接阻碍了体重的下降;并可能导致肝脏损伤。
因此,监测和预防活泼瘤胃球菌丰度的异常升高对于维持肠道菌群平衡和降低疾病风险具有重要意义。然而,要实现这一目标,需要建立可靠的健康人群和疾病人群的肠道微生物数据库,以明确健康状态下该菌的正常丰度范围及其在疾病状态下的异常变化边界。这些数据库应包括不同年龄、性别、生活方式和地理区域的健康人群数据,同时结合疾病人群的微生物组特征,明确活泼瘤胃球菌的丰度变化与疾病的关联模式。通过这些数据的积累和分析,不仅可以更准确地识别活泼瘤胃球菌的异常丰度阈值,还能为个性化的肠道健康管理和疾病预防策略提供科学支持。
主要参考文献
Crost EH, Coletto E, Bell A, Juge N. Ruminococcus gnavus: friend or foe for human health. FEMS Microbiol Rev. 2023 Mar 10;47(2):fuad014.
Juge N. Microbe Profile: Ruminococcus gnavus: the yin and yang of human gut symbionts. Microbiology (Reading). 2023 Aug;169(8):001383.
Grahnemo L, Nethander M, Coward E, Gabrielsen ME, Sree S, Billod JM, Engstrand L, Abrahamsson S, Langhammer A, Hveem K, Ohlsson C. Cross-sectional associations between the gut microbe Ruminococcus gnavus and features of the metabolic syndrome. Lancet Diabetes Endocrinol. 2022 Jul;10(7):481-483.
Henke MT, Kenny DJ, Cassilly CD, Vlamakis H, Xavier RJ, Clardy J. Ruminococcus gnavus, a member of the human gut microbiome associated with Crohn’s disease, produces an inflammatory polysaccharide. Proc Natl Acad Sci U S A. 2019 Jun 25;116(26):12672-12677.
Titécat M, Wallet F, Vieillard MH, Courcol RJ, Loïez C. Ruminococcus gnavus: an unusual pathogen in septic arthritis. Anaerobe. 2014 Dec;30:159-60.
de la Fuente-Nunez C, Meneguetti BT, Franco OLet al. Neuromicrobiology: how microbes influence the brain. ACS Chem Neurosci. 2018;9:141–50.
Fan X, Chen Y, Liu Yet al. First case of bloodstream infection caused by Ruminococcus gnavus in an 85 year old man in China. Lab Med. 2022;53:e36–9.
Hall AB, Yassour M, Sauk Jet al. A novel Ruminococcus gnavus clade enriched in inflammatory bowel disease patients. Genome Med. 2017;9:103.
谷禾健康
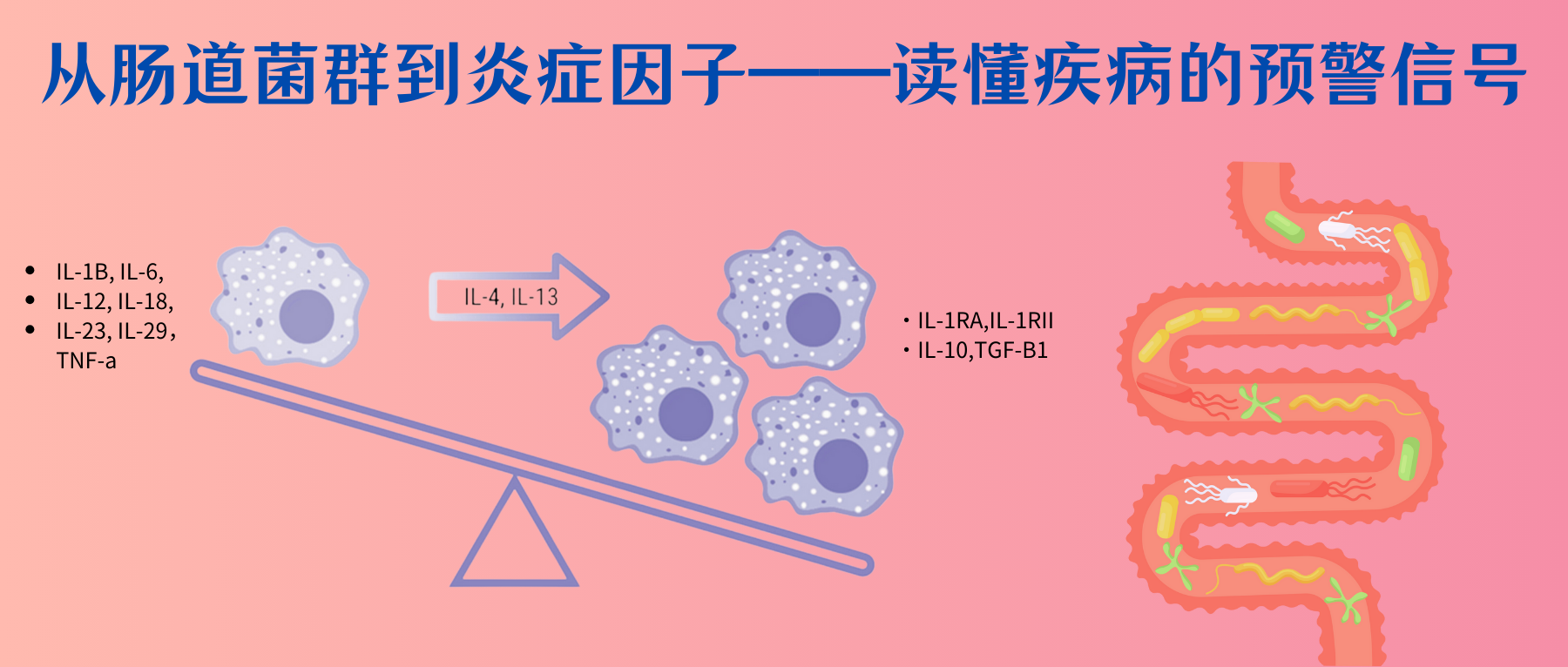
当我们的皮肤被轻微割伤或烧伤时,伤口周围区域可能会变得红肿、发热,甚至伴有疼痛;感冒时,喉咙痛、肿胀;不小心扭伤后,可能会肿胀、疼痛和僵硬…这些都与炎症相关。
炎症,作为身体对损伤或感染的自然防御机制,是一种复杂的生物学过程,涉及到免疫细胞和多种分子介质的相互作用。它可以帮助身体对抗病原体、清除死亡细胞和促进组织修复。然而,当炎症反应过度或持续时间过长时,它也可能成为许多疾病的驱动因素,包括心脏病、糖尿病、某些类型的癌症,自身免疫疾病等。因此,了解炎症及其相关症状对于早期识别和治疗炎症相关疾病至关重要。
你是否想过,在身体出现炎症之前,其实已经有一些潜在的信号出现?炎症这个过程看似简单,但背后却涉及复杂的免疫系统调控,以及多种炎症因子的参与。值得注意的是,在这些可见的炎症症状出现之前,我们体内的炎症因子可能已经悄然发生了改变。
研究表明,肠道菌群的失调往往是最早的预警信号之一。当肠道微生物群的平衡被打破时,会引发一系列连锁反应:有益菌群(如双歧杆菌、乳酸杆菌)数量减少,条件致病菌和致病菌的比例升高。这种失衡会导致肠道屏障功能受损,使得细菌产物(如脂多糖LPS)更容易进入血液循环。
早期的肠道菌群改变会引起炎症因子水平的显著变化。比如说:血清中促炎因子如TNF-α、IL-1β和IL-6的水平开始升高,而抗炎因子如IL-10的水平则呈现下降趋势。同时,由于有益菌群减少,短链脂肪酸等具有抗炎作用的代谢产物的产生也会减少。这些变化都可能发生在明显的炎症症状出现之前。
这种早期的炎症因子改变往往具有预警作用。例如,在动脉粥样硬化的发展过程中,即使尚未出现明显的斑块形成,血液中的炎症因子水平就已经开始发生变化。
本文将带大家了解炎症因子,具体怎么看,它的高低代表着什么,发挥什么作用,探讨炎症因子作为早期诊断生物标志物的价值,以及肠道菌群与炎症因子之间的复杂联系。通过监测肠道菌群的变化和炎症因子水平的波动,我们可以更早地发现潜在的健康问题,为疾病的预防和早期干预提供重要的时间窗口。

◑ 炎症
炎症是身体对外界损伤、感染或内部损伤的一种自然防御反应,旨在清除有害刺激因子、清除死亡细胞和组织碎片,并启动修复过程。它是免疫系统的一部分,涉及多种细胞类型和分子介质,包括白细胞、血管系统、补体系统和各种炎症因子。
日常可见的炎症反应可分为两类:
不健康的生活方式,如吸烟、不良饮食、过量饮酒、久坐不动、压力、体重增加等,都可能导致慢性炎症。
慢性低度炎症——疾病之源
慢性低度炎症是在没有明显感染的情况下,体内炎症介质水平持续升高。这种炎症状态往往不会引起明显的临床症状,但会长期影响人体健康。
慢性炎症可以攻击全身,并在此过程中增加特定区域某些类型疾病和紊乱的风险,如心脏、大脑、关节、胃肠道等。
炎症是如何被触发的?
炎症的触发是一个复杂的过程,感染、损伤、应激、自身免疫反应、坏死细胞、代谢紊乱…这些都可能是炎症触发的途径。
随着损伤信号的识别,免疫细胞如巨噬细胞和树突状细胞迅速响应,受体的激活促使免疫细胞分泌炎症因子,这些炎症因子是炎症反应中的关键分子。
炎症因子的释放不仅放大了炎症信号,还促进了血管的扩张和通透性增加,使得免疫细胞和分子能够更有效地到达受损部位。这些炎症因子的相互作用和级联反应构成了炎症反应的基础,它们共同协调了机体对损伤和感染的防御机制。
接下来我们来深入认识炎症过程中的核心”信使”——炎症因子。
◑ 炎症因子
炎症因子在疾病发展过程中扮演着关键角色,其水平变化不仅反映了疾病的发展态势,更为疾病的早期诊断和预后评估提供了重要依据。研究表明,炎症因子的变化往往早于临床症状的出现,这种特性使其成为疾病发展的重要生物标志物。
我们先看一下,炎症因子是什么?
炎症因子是一类由免疫细胞和其他细胞产生的特殊蛋白质分子,它们在体内发挥着”信使“的作用。也就是说,炎症因子就像是我们身体内的一支特殊”信号部队“,它们负责在炎症发生时传递各种指令,协调免疫系统的行动。
无论是急性炎症还是慢性炎症,炎症因子都扮演着不可或缺的角色,它们决定着炎症反应的强度、持续时间和最终结果。
炎症因子与细胞因子有什么区别?
炎症因子主要是指那些能够引起或加剧炎症反应的分子,而细胞因子则是一类更广泛的信号分子,包括炎症因子在内的多种类型,比如生长因子、趋化因子等,它们参与调节免疫细胞的功能和相互作用。
炎症因子可以被视为细胞因子的一个子集,也就是那些具有促进炎症反应功能的细胞因子。
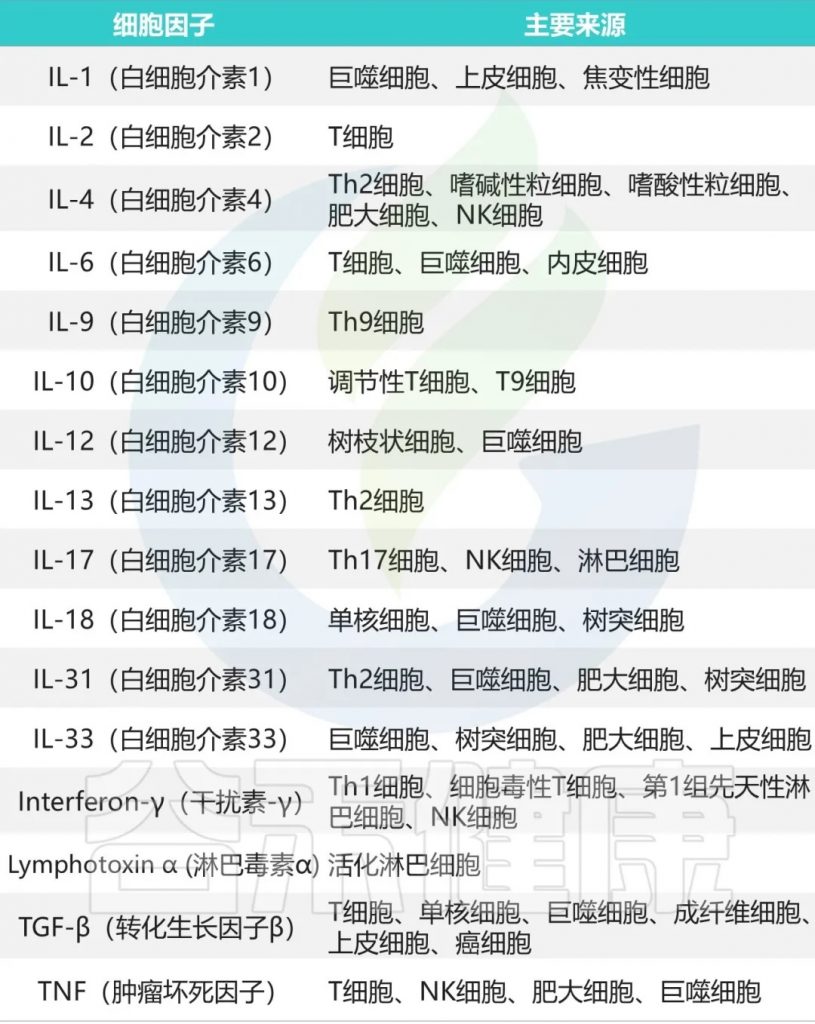
在疾病发展的早期阶段,即使尚未出现明显的临床表现,体内的炎症因子已经开始发生显著变化。
例如,促炎因子TNF-α和IL-6的水平会逐渐升高,而抗炎因子IL-10的水平则呈现下降趋势。这种变化具有明显的时序性和渐进性特征,为疾病的早期预警提供了可能。同时,C反应蛋白(CRP)等急性期蛋白的轻微升高,也常常预示着潜在的健康问题。
主要的促炎因子和抗炎因子有哪些?
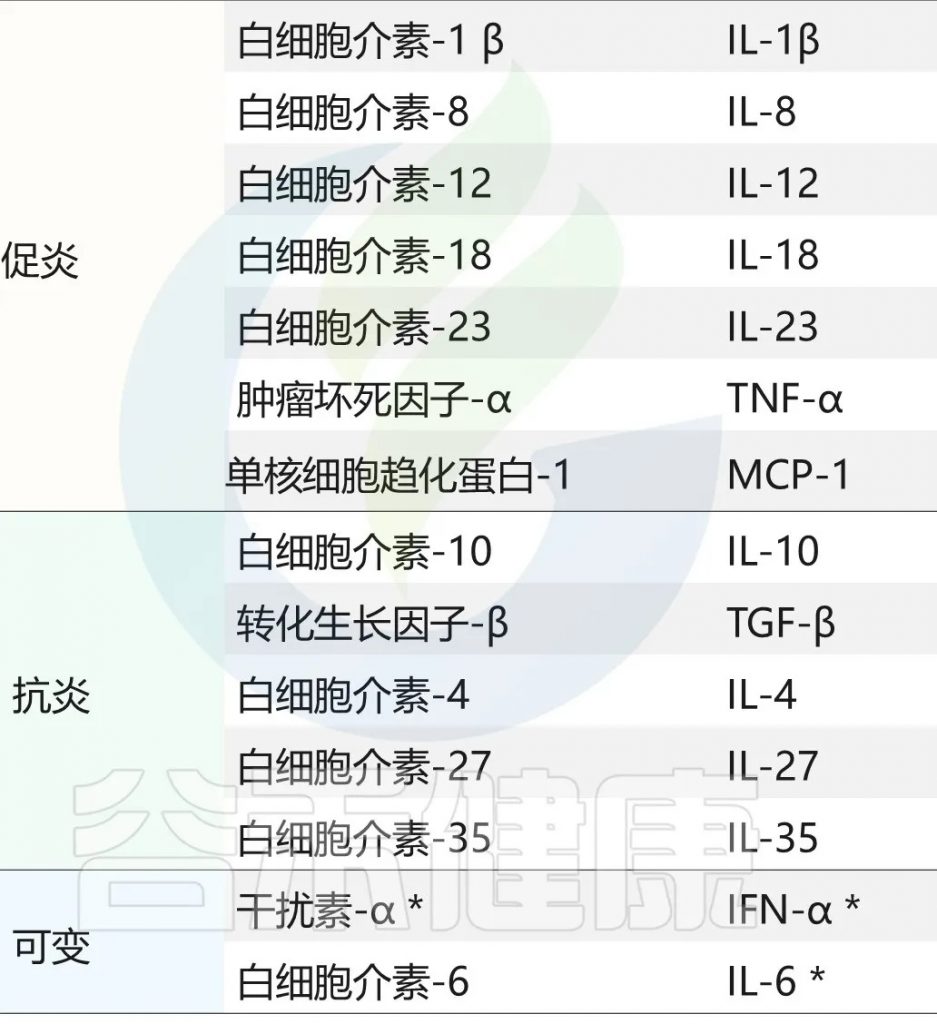
doi:10.3390/ijeph17207618
随着疾病的进展,炎症因子会呈现出不同的变化模式。在急性疾病中,IL-1β和TNF-α等促炎因子会快速升高,同时伴随着中性粒细胞趋化因子的显著增加。而在慢性疾病中,则常常表现为持续的低度炎症状态,多种炎症因子维持在较高水平,形成促炎和抗炎因子的失衡状态。
不同类型的疾病中,炎症因子往往表现出特征性的变化。以心血管疾病为例,患者体内的CRP和IL-6水平通常持续升高,同时伴有粘附分子表达的增加。在自身免疫性疾病中,TNF-α和IL-17的显著升高,以及特异性自身抗体的出现,往往是重要的诊断依据。而在代谢性疾病中,脂联素水平的改变和瘦素抵抗的出现,则与胰岛素抵抗密切相关。
炎症因子作为生物标志物在临床实践中有多重价值
在诊断方面,它可以用于疾病的早期筛查、鉴别诊断和病情评估;
在预后评估方面,能够预测疾病的进展趋势,评估并发症风险,并监测治疗效果;
在治疗指导方面,帮助医生选择合适的治疗方案,调整用药剂量,评价治疗效果。
了解炎症因子的作用机制不仅有助于我们更好地理解炎症过程,也为开发新的治疗策略提供了靶点,通过调节炎症因子的活性来治疗炎症性疾病,那么,如何有效地调节这些炎症因子的活性呢?近年来,越来越多的研究开始关注肠道菌群在调节炎症因子和免疫反应中的作用。
在疾病发展的早期阶段,即使在临床症状尚未显现时,身体内部可能已经发生了微妙的改变。肠道菌群作为人体最大的微生态系统,常常能够最早感知这些变化,并通过多种途径向身体发出预警信号。
我们以前的文章也有很多提及,肠道菌群不仅能影响局部的免疫反应,还能通过多种机制影响全身性的炎症状态,比如说:
代谢产物:
肠道菌群通过发酵膳食纤维产生短链脂肪酸(SCFAs),如乙酸、丙酸和丁酸,这些代谢产物能够调节免疫细胞的功能,特别是对调节性T细胞(Treg)的分化和功能具有重要作用,进而影响炎症因子的产生。
免疫细胞调节:
肠道菌群能够影响树突状细胞(DCs)和巨噬细胞的成熟和功能,这些免疫细胞在调节炎症因子的表达和释放中起着关键作用。
肠道屏障功能:
维持健康的肠道菌群有助于维持肠道屏障的完整性,防止病原体和有害物质的入侵,从而减少炎症因子的激活。
抗炎和促炎平衡:
某些肠道菌群成员能够促进抗炎细胞因子如IL-10的产生,而抑制促炎细胞因子如TNF-α和IFNγ的表达。
肠道菌群发出的预警信号,主要通过代谢产物、免疫细胞调节、肠道屏障功能维持以及抗炎促炎平衡等途径实现,而炎症因子则是传递这些预警信号的关键分子。
通过监测这些早期的分子标志物,我们可以在疾病发展的早期阶段进行干预,从而更有效地预防和控制炎症反应的发生发展。
接下来,我们将深入探讨常见的炎症因子(炎症标志物),包括C反应蛋白、粪便钙卫蛋白、TNF-α、IL-1、IL-6、IL-10、IL-17、IL-22等,这些炎症因子的具体功能,肠道菌群与这些炎症因子的关联等。
C反应蛋白(CRP)是一种重要的由肝脏产生的急性期反应蛋白,是临床上最常用的炎症标志物之一。比如,广泛使用于IBD筛查和评估疾病活动性、临床复发和治疗反应。
什么时候需要做CRP测试?
——急性
CRP水平在体内发生炎症或组织损伤时会急剧上升。比如说,感冒时身体的免疫系统会被激活,C反应蛋白的产生显著增加,反映了身体正在经历一种急性炎症反应,通常伴随着其他症状,如发热、 寒战、喉咙痛、全身乏力、呼吸急促、恶心呕吐等。一般出现这种情况的时候医生会要求抽血,看看CRP指标。
——慢性
除了感染性疾病的早期诊断外,CRP水平的升高还可用于判断疾病的严重程度和监测治疗效果。例如,在风湿性关节炎、狼疮、炎症性肠病、血管炎、哮喘等慢性疾病中,CRP常常作为一种重要的生物标志物,帮助医生评估病情进展及治疗反应。也可用于术后并发症监测。
例如,血液中高水平的hs-CRP与心脏病发作的风险增加有关。如果hs-CRP水平较高,心脏病发作的人更有可能再次心脏病发作。
CRP水平的高低意味着什么?
一般来说,健康人的血液中CRP含量很低。

CRP与肠道菌群有什么关联?
一项研究中,在CRP血浆水平升高的肥胖小鼠中,Akkermansia muciniphila的比例下降。
Phascolarctobacterium属成员的丰度与较低水平的CRP有关。这种关系可能会解释为什么该菌属比例的下降与结肠炎症有关:Phascolarctobacterium是丙酸的生产者,丙酸是一种短链脂肪酸,通过抑制促炎调节因子NFκB的活性来抑制促炎级联反应。同样,粪杆菌的丰度与CRP水平呈负相关。
因此,CRP是一种下游炎症标志物,可以通过特定肠道微生物的抗炎代谢产物的作用下调。
对BMI超过25的健康受试者的基线血清和微生物群数据的评估表明,CRP水平较高的受试者乳杆菌属和双歧杆菌属的细菌丰度明显较低,但大肠杆菌属和拟杆菌属的丰度较高。
钙卫蛋白是一种胞浆蛋白复合物,在中性粒细胞中组成性表达,并在肠道炎症期间迁移至肠粘膜时释放。
在健康状况下,钙卫蛋白具有免疫调节功能,对免疫防御至关重要;在慢性炎症性疾病中,钙卫蛋白可通过细胞因子受体结合和活性氧的产生来促进疾病进程。
钙卫蛋白——非侵入性生物标志物
自20世纪80年代钙卫蛋白的鉴定和表征以来,粪便钙卫蛋白成为一种经过显著验证的非侵入性生物标志物,可用于评估肠道炎症,是短期复发和IBD炎症活动的可靠预测指标。
举个例子:一个人去医院看病,主诉反复腹泻、腹痛、体重下降,有慢性腹泻的病史,过去几个月中症状有所加重,医生考虑他可能与肠道疾病相关,为了确诊,医生可能会开具粪便钙卫蛋白检测进行辅助诊断,帮助区分炎症性肠病和肠易激综合征。
钙卫蛋白水平高低意味着什么?
粪便钙卫蛋白与肠道菌群有什么关联?

一项来自TREND队列的大样本老年人研究发现,在高钙卫蛋白组与低钙卫蛋白组中,几种促炎肠道微生物属显著增加,而产短链脂肪酸菌减少。
在粪便钙卫蛋白升高的组中,几种产短链脂肪酸菌属(如梭菌属、Blautia、Turicibacter)的丰度降低与IBD、帕金森和心血管疾病中的许多发现一致。这些产生SCFA菌减少可能是几种疾病机制的关键,因为SCFA可以防止病原体,调节代谢,内分泌和免疫功能,并影响药物代谢和吸收。
发炎的肠道中较高水平的氧气可以允许肠杆菌科的有氧呼吸,同时抑制专性厌氧菌、拟杆菌和产生SCFA的梭菌的生长。此外,通过与富含脂肪的西方饮食的相互作用,含有促炎脂多糖作为膜成分的革兰氏阴性菌可能会引发炎症和粪便钙卫蛋白水平升高。
血清中,高粪便钙卫蛋白组IL-17 C、CCL 19和毒性代谢产物硫酸吲哚酚升高。这些变化部分由肠道微生物群介导。此外,高粪便钙卫蛋白组显示BMI增加,心脏病发作和肥胖的患病率较高。
在免疫疗法治疗肝细胞癌患者期间,粪便钙卫蛋白显示出与阿克曼氏菌与肠杆菌科比例和肠道微生物群α多样性相反的时间演变,但与zonulin-1和LBP相似。
肿瘤坏死因子-α(TNF-α)是驱动炎症的关键细胞因子。TNF-α在炎症级联反应的上游启动阶段,是Th1信号通路关键的细胞因子,在人体免疫系统中扮演着“紧急呼叫器”的角色。
该分子水平升高与胰岛素抵抗和葡萄糖耐受不良相关,因为TNF-α能够激活各种信号传导途径,包括mTOR途径,使其成为代谢疾病发展中的关键分子。
TNF的“好”
TNF诱导睡眠,并增加非快速眼动睡眠。因此,当我们晚上想入睡时,它提高一些是很好的。TNF在健康人中在夜间自然升高。
TNF是一种直接的脂肪克星,它导致脂肪细胞中的胰岛素抵抗,但也导致肌肉细胞中的胰岛素抵抗。这意味着葡萄糖不能进入这些细胞。
TNF通过抑制食欲素来抑制食欲。因此,高水平的TNF会使你吃得更少,并抑制葡萄糖进入脂肪细胞,从而使你变瘦。如果你减少TNF,会变得更饿,储存更多的脂肪。因此,抗TNF治疗导致体重增加并不奇怪。
TNF的“坏”
TNF通过抑制食欲素让人感到疲劳,降低情绪并降低认知和身体表现。
注:食欲素是一种非常重要的神经递质,对许多身体功能。食欲素在记忆获得和巩固以及长期记忆强化中起着许多关键作用。因此,如果你有炎症升高,它会损害你的认知能力。
TNF可以通过破坏线粒体造成持久的伤害。
TNF还可以降低甲状腺激素,导致“低T3综合征”。它也可以降低睾酮(趋势,但不显著)。
TNF会减缓伤口愈合,这意味着需要更多的时间从运动/受伤中恢复。
TNF可诱导“肠漏”。
长期升高的TNF-α也会扰乱昼夜节律并导致白天疲劳。
与TNF-α相关的疾病:炎症性肠病(IBD)、类风湿性关节炎(RA)、2型糖尿病、肥胖、系统性红斑狼疮、神经退行性疾病、精神分裂症等。
哪些肠道菌群与TNF-α呈负相关?
哪些肠道菌群与TNF-α呈正相关?
TNF-α在不同类型的感染中表现出不同的作用,例如在真菌感染中,TNF-α通过调节Th17/Th2和中性粒细胞/嗜酸性粒细胞的平衡来影响炎症反应。而在克罗恩病患者中,TNF-α的诱导活性与某些革兰阴性菌有关。
肠道菌群通过其代谢产物,如短链脂肪酸,可以影响TNF-α的水平。短链脂肪酸能激活AMPK,减少FIAF(诱导型脂肪因子)的产生,从而抑制脂多糖的活性,进而影响TNF-α的产生。
★ 如何减少TNF-α?
生活方式:运动(骑车)、瑜伽、太极拳、睡眠不足后的小睡、谈恋爱等。
饮食:沙丁鱼、蘑菇、大蒜、蜂蜜、大豆、苦瓜、十字花科蔬菜(西兰花、花菜)、水果(红树莓、蓝莓、黑醋栗果、李子、桃、荔枝、巴西莓)等。
其他补充剂:姜黄素、鱼油、肉桂、精氨酸、甘氨酸、组氨酸、铬、植物淄醇、黄芪、青蒿素、柠檬苷、辅酶Q10、紫锥菊、葡萄糖胺、小檗碱、黄芩、银杏、南非醉茄、槲皮素等。
IL-1是一种重要的促炎细胞因子。促进炎症细胞的招募和活化,增加血管通透性,吸引免疫细胞到达炎症部位。参与调节T细胞和B细胞的活化、增殖和分化,促进发热反应、疼痛、肿胀。同时也可以诱导某些细胞类型的凋亡,参与组织修复和再生。
与IL-1相关的疾病:自身免疫性疾病、感染性疾病、心血管疾病、代谢性疾病、神经退行性疾病等。
哪些肠道菌群与IL-1呈负相关?
哪些肠道菌群与IL-1呈正相关?
肠道菌群代谢产物,短链脂肪酸,通过激活AMPK和抑制PGC-1α,进而影响IL-1的产生。
◆ IL-1β
IL-1β是IL-1家族的重要成员之一,同属于促炎性细胞因子,IL-1β常作为特异性炎症标志物。
IL-1β的“好”
IL-1β是诱导睡眠机制的一部分,并增加非快速眼动睡眠,IL-1β具有昼夜节律,在睡觉前升高,但如果你是夜班工人,它会转移到白天。
IL-1在记忆功能中发挥作用,所以人需要一定水平的IL-1,但要“尽可能低”。
在啮齿动物中,IL-1β增加了催产素和加压素的释放。
IL-1β增加NGF。
NGF和NT-3在刺激神经突起生长方面有些独特,这是NGF、BDNF或NT-4无法单独完成的。IL-1β还会增加GDNF,这再次刺激神经突起的生长。
此外,它可以通过增加bFGF来增加多巴胺促进神经元。
IL-1β的“坏”
如果你的IL-1水平升高,那么这将影响你的情绪、认知功能、清醒程度和动力,需要关注降低慢性炎症。
IL-1与抑郁症有关,可能通过减少雌激素合成、增加黄体酮分解影响情绪,同时降低雄性激素水平。压力可通过IL-1b介导的途径导致抑郁,同时损害认知能力,影响学习和记忆,这可能与脑源性神经营养因子(BDNF)的减少有关。
IL-1通过抑制食欲素引起疲劳,并与焦虑、HPA轴激活、IBS、认知缺陷和多种慢性疾病相关。
IL-1β与低睾酮水平相关,可能通过影响甲状腺激素和皮质醇水平降低性能。它还抑制胰岛素释放,影响血糖水平,降低乙酰胆碱水平,并在肠道中抑制胃酸,可能导致幽门螺杆菌感染失控。
IL-1β与肠道菌群的关联
★ 如何减少IL-1β?
饮食:蔬菜和水果(花青素)、芹菜、生姜、十字花科蔬菜(西兰花、花菜)、燕麦鱼(虾青素)等。
益生菌:植物乳杆菌等
其他补充剂:维生素A、VB2、穿心莲、β-葡聚糖、葡萄籽提取物、水飞蓟素、红景天、黄连素、小檗碱、葡萄籽提取物、鱼油、茶多酚、蜂蜜、黄芩苷、迷迭香酸、丹参、锌(如果缺乏)、苜蓿、白术、紫苏等。
IL-6是与系统性炎症相关的炎症因子,调节免疫反应,参与激活和分化T细胞,促进B细胞分化和抗体产生,促进急性期蛋白的合成,促进中性粒细胞的募集,参与炎症性疾病的发生发展。
IL-6在中枢神经系统中也发挥作用,参与调节神经炎症和情绪反应。
IL-6可以通过两种方式激活细胞:
IL-6在你生病和运动后升高,特别是有氧运动。如果运动增加炎症标志物,那么怎么理解运动是健康的?
当你运动时,肌肉会释放IL-6,这是抗炎的。然而,当免疫细胞(巨噬细胞)释放它时,它是促炎性的。
IL-6还抑制Th1细胞,同时诱导Th2细胞,因此对Th2占主导地位的人来说情况更糟。它还增加了B细胞,这是产生抗体并导致过敏和自身免疫的原因。
不易患自身免疫性疾病的人也可能患有IL-6升高。这是与现代文明病有关的细胞因子。最常见的原因可能是肥胖。
IL-6升高的其他常见原因可能是慢性压力、睡眠太少、吃得太多(特别是吃太多糖或精制食品)、吸烟、过量酒精、运动过多。
IL-6的“坏”
IL-6水平在几乎所有疾病状态中都升高。
它减少了Treg细胞,这反过来又阻碍了我们对摄入的蛋白质产生耐受性的能力-引起过敏。它还增加了中性粒细胞的产生,这是炎症。
IL-6是中年后期认知能力下降的一个很好的预测因子。
IL-6可能会导致情绪恶化,绝望的感觉。IL-6还与暴力自杀、冲动和避免单调乏味相关。
IL-6导致血糖水平升高,增强了应激激素(CRH)对肠道粘膜的影响,导致IBS。IL-6可导致肠漏。
IL-6通过抑制(或超甲基化)对GABA正常工作重要的基因(GAD 67)而导致精神分裂症。
IL-6是CRP最有效的诱导剂,CRP就是我们前面讲的炎症标志物。
它可以通过增加IgG和IgM抗体产生和恶化食物敏感性和自身免疫问题。
IL-6也会导致皮肤问题。IL-6在患有皮肤真菌变色菌的人中升高。IL-6还增加了Th 22细胞,这破坏了皮肤微生物平衡。
IL-6的“好”
IL-6如果升高大多是不好的,但短暂的峰值可能是有益的。
TNF和IL-1β增加IL-6,但IL-6反过来抑制这两种细胞因子,其比IL-6本身更有害。在这种方式下,它是一种抗炎。抑制TNF,分解脂肪细胞并降低胰岛素抵抗。
IL-6在一些细菌、病毒和真菌感染中起保护作用。
IL-6的正常水平是什么?
在健康受试者中,IL-6血液水平几乎检测不到,范围在2-6 pg/ml之间。另一项研究提到,健康人的平均水平为0.5 pg/ml 。
抑郁症患者的IL-6水平比健康人高约1.78 pg/ml。
在患有风湿性关节炎的人中,水平可以增加到1000倍(不常见)。在败血症中,这是非常危险的,它可以增加到一百万倍。
IL-6与肠道菌群有什么关联?
高脂饮食会削弱粘液层的完整性,增加血液中LPS的水平,通过TLR-4传递,导致血液中TNF-α、IL-1、IL-6和PAI-1(纤溶酶原激活抑制剂-1)的水平升高,引起系统性炎症。
坏死的肠道粘膜细胞会刺激巨噬细胞产生IL-6。
★ 如何减少IL-6?
生活方式:情绪积极、睡眠不足后的小睡、听音乐等。
饮食:地中海饮食、燕麦、多酚、坚果(腰果)、豆类、橄榄油、蔬菜、蓝莓、红树莓、蜂蜜等。
其他补充剂:鱼油、植物甾醇、螺旋藻、维生素B2、VB12、VE、镁、铬、锌、精氨酸、组氨酸、甘氨酸、银杏、维生素E、黄芩苷、乳铁蛋白、葡萄籽提取物、黄芪、丹参、紫锥菊、迷迭香酸、牛至、鼠尾草等。
IL-10是一种重要的抗炎因子。
它能抑制促炎细胞因子的产生(如TNF-α、IL-1β、IL-6),降低抗原呈递细胞的活性,减少炎症细胞的募集,有助于炎症反应的消退。抑制Th1细胞的活化,从而调节Th1/Th2平衡。
IL-10的“好”
在自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮等)和移植免疫中,IL-10有助于防止自身反应性T细胞的活化,减少对移植器官的排斥反应。
IL-10抑制COX-2,这是参与偏头痛,疼痛和炎症。COX-2通常被非甾体抗炎药如阿司匹林和布洛芬阻断。
通过抑制肥大细胞,它抵消了这些细胞在过敏反应部位的炎症作用。
IL-10通过减少暴饮暴食并降低下丘脑(控制食欲的腺体)中的胰岛素和瘦素抵抗(通过抑制细胞因子、Nf-kB和ER应激)来减少肥胖。
IL-10的“坏”
IL-10可以阻断对病毒感染的反应,甚至直接增加病毒蛋白的产生,比如说,在慢性疲劳综合征中,IL-10增加;慢性感染的丙型肝炎患者在遗传上倾向于高IL-10产生,对治疗的积极反应较低。
平衡 IL-10 的“好”与“坏”
Th 1免疫系统,特别是CD 8 + T细胞和IFN γ,是人体对抗癌症的机制的一部分。阻断IL-10显示出作为癌症治疗的前景。然而,IL-10在某些情况下也通过促进细胞毒性T细胞活性和IFN-γ产生而发挥保护性抗癌作用。
重要的是认识到全身和癌组织中的IL-10水平之间存在差异。如果IL-10在正常组织中处于健康水平,在癌组织中处于低水平,那么这是比较理想健康的。
血液中IL-10的水平并不一定代表肠道或其他组织中的水平,但通常存在相关性。
在现代环境中,高IL-10水平可能比低IL-10水平更好,因为可以对抗细菌感染。
IL-10与肠道菌群有什么关联?
乳杆菌、双歧杆菌、普氏粪杆菌、某些产丁酸菌:能促进IL-10的产生,从而改善肠道炎症。
益生菌通过促进调节性T细胞(Treg)的分化来增加IL-10的产生。
★ 如何增加IL-10?
生活方式:运动、晒太阳、冥想等。
饮食:芝麻油、肉桂、大蒜、辣椒素、甘草、芥末等。
益生菌:植物乳杆菌、布拉氏酵母菌、干酪乳杆菌、枯草芽孢杆菌等。
益生元:阿拉伯半乳聚糖
其他补充剂:姜黄素、表儿茶素EGCG、Boswellia、橄榄苦苷、褪黑素、白藜芦醇、维生素D3、辅酶Q10、植物甾醇等。
IL-17(白细胞介素-17)是一种重要的促炎细胞因子,在自身免疫和炎症反应中发挥关键作用。IL-17能够促进多种细胞产生炎症因子,如IL-1β、TNF-α和IL-6,促进中性粒细胞募集,加剧炎症反应。
在肿瘤微环境中具有双重作用,既可以促进抗肿瘤免疫反应,也可能促进肿瘤的侵袭和转移。
与自身免疫性疾病、肿瘤、感染性疾病等相关。
IL-17水平的变化可以作为某些疾病预后的生物标志物。
IL-17 C属于IL-17细胞因子家族,由上皮细胞而不是免疫细胞产生。它作为对上皮损伤的快速局部自分泌反应,促进抗微生物保护反应和肠屏障维持。
分节丝状菌(SFB):通过其鞭毛蛋白促进其产生。
青春双歧杆菌(Bifidobacterium adolescentis):能够诱导肠道Th17细胞积累,从而促进IL-17的产生。
IL-22(白细胞介素-22)是IL-10家族的重要成员,主要参与组织修复和黏膜免疫。
具体来说,IL-22在组织损伤后的修复和再生过程中起着重要作用,特别是在肝脏和肠道等上皮组织中。
它是一种促炎细胞因子,但它也能发挥抗炎作用,特别是在抑制过度的炎症反应和促进组织稳态方面。
IL-22能够增强上皮细胞的抗菌肽表达,从而增强机体对细菌和病毒感染的防御能力。
在急性结肠炎中具有保护作用,但在慢性结肠炎中,IL-22与IL-17A协同介导致病性。
分节丝状菌(SFB):通过鞭毛蛋白参与调节其产生,诱导SAA产生来促进IL-22的分泌,刺激树突状细胞促进IL-22的产生。
IFNγ(干扰素-γ)是一种重要的细胞因子,它在免疫反应、抗感染、抗肿瘤和调节免疫应答中扮演着重要角色。
IFNγ是Th1细胞介导免疫反应的关键因子,它能够促进Th1细胞的分化,并抑制Th2细胞的分化,从而调节Th1/Th2平衡。
在某些自身免疫性疾病中,如多发性硬化症和类风湿性关节炎,IFNγ的过度产生与疾病的发生和发展有关。
肿瘤:IFNγ在肿瘤免疫监视中起关键作用,但其在肿瘤微环境中的作用可能更为复杂,包括促进肿瘤免疫逃逸。
TGF-β(转化生长因子-β)是一种多功能细胞因子,在调节免疫反应和促进Tregs细胞的增殖中起作用。
肠道菌群的变化可以影响TGF-β的产生,进而影响Tregs和Th17细胞的平衡。
丁酸梭菌,诱导树突状细胞中TGF-β信号传导,进而诱导调节性T细胞(Treg)的产生。
以上我们了解一些常见的炎症因子的功能,与肠道菌群的关联,基于这一认识,我们将进一步探讨这种异常变化如何表征不同疾病的风险,以及如何通过早期干预来预防和治疗相关疾病。
在探讨肠道菌群与炎症因子异常之间的关系时,我们不得不关注它们在多种慢性疾病中的作用,尤其是那些与炎症密切相关的疾病。
这里我们通过举例分析几种典型疾病(抑郁症、心血管疾病、炎症性皮肤病)中肠道菌群与炎症因子的动态变化特征,更深入地理解肠道菌群如何作为炎症反应的早期指标,为疾病的早期预防和个体化治疗提供科学依据。
抑郁症是一种常见的精神障碍,其特征为情绪低落、食欲不振和高自杀率。研究表明,炎症反应在抑郁症的发病中起着关键作用,炎症水平的紊乱可增加抑郁症的发病率。
调节炎症水平可能是肠道菌群影响宿主健康的途径之一。通过调节特异性肠道菌群和炎症反应,可以实现抑郁症的早期预测、预防和个性化治疗。
➤ 抑郁症
一项研究通过孟德尔随机化分析方法确定了15个与抑郁症相关的肠道菌群分类群和4种细胞因子,并证实了某些细胞因子在肠道菌群对抑郁症影响中的介导作用。
研究发现,Romboutsia、Intestinimonas、瘤胃球菌UCG 011等对抑郁症具有保护作用。
Romboutsia,Ruminococcaceae UCG 011,Intestinimonas都是产丁酸菌,临床研究发现,Romboutsia的丰度与帕金森病患者的抑郁状态呈负相关。同样,应激耐受性较差的小鼠含有较少的Romboutsia,导致对抑郁症的易感性更高。
Intestinimonas与IL-10水平呈正相关,与能够修复肠道损伤的促炎细胞因子DAO、D-LA呈负相关。
瘤胃球菌科UCG 011能够影响促炎细胞Th17的分化,减少促炎细胞因子IL-17的分泌,改善慢性炎症,缓解疼痛和焦虑抑郁症状。
毛螺菌FCS 020、链球菌、Marvinbryantia等被确定为抑郁症的危险因素。
毛螺菌科FCS 020能够诱导炎症反应,与血清脂多糖和细胞因子产生正相关,并且在自闭症儿童中丰度增加。
链球菌是一种与LPS密切相关的促炎性肠道菌群。
Marvinbryantia在慢性轻度应激大鼠中数量增加。
ADA 和 IL-18 R1是抗抑郁的保护性细胞因子。
VEGF_A和TNFSF 14是促进抑郁的危险因子。
抑郁症的严重程度与VEGF_A呈正相关。这可能与VEGF介导的血脑屏障功能障碍有关。许多抗抑郁药物通过调节VEGF_A发挥抗抑郁作用,因此VEGF_A对抑郁症的治疗效果具有预测作用。
TNFSF 14是TNF受体超家族的成员,其通过激活NF-κB信号通路促进促炎细胞因子的产生。TNF损害神经递质的合成并降低5-羟色胺的可用性,导致神经毒性代谢物的积累,这反过来会导致神经系统损伤并导致抑郁症。
循环细胞因子介导的肠道菌群对抑郁症的影响
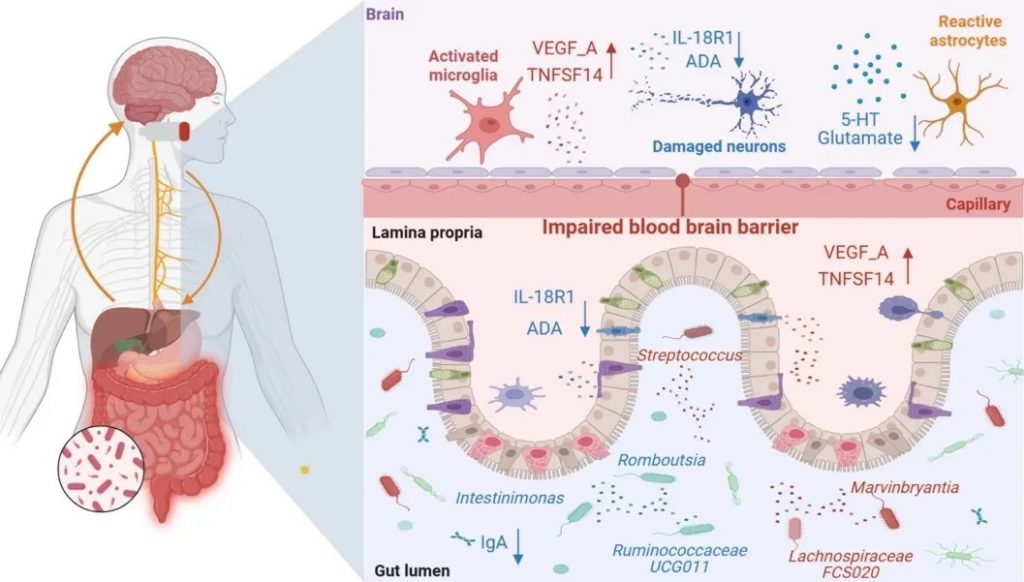
doi.org/10.1007/s13167-024-00379-z
➤ 重度抑郁症(MDD)
一项研究探讨了首发未经治疗的重度抑郁症(MDD)患者的肠道菌群组成与炎症因子和认知功能之间的关系。
研究发现MDD患者的肠道菌群多样性显著降低,某些菌群如拟杆菌属、Alistipes增加;一些菌群如梭菌科、Turicibacter减少。这些肠道菌群的改变与炎症因子(如IL-6、CRP)水平升高以及认知功能障碍(如执行功能、记忆力下降)显著相关。
在MDD患者中,拟杆菌科和拟杆菌属均与hsCRP、CCT1、CCT2呈正相关。
拟杆菌属是嗜酸性和革兰氏阴性的,是存在于人类胃肠道系统中非常丰富的细菌。拟杆菌属的某些菌株由于其许多能力对人类健康有利。然而,当人们经历压力,如休克,虐待,失去家庭成员等。拟杆菌属物种的某些菌株如脆弱拟杆菌可分泌脂多糖(LPS)、细菌淀粉样蛋白、内毒素(如脆弱溶素)和外毒素。这些神经毒素刺激各种细胞类型中TNF-α、IL-1β、IL-8、IFN-γ、CXCL 8和其他炎性细胞因子和趋化因子的释放,导致对这些细菌分子病原体的炎症反应。
活化的炎症反应可以破坏肠粘膜屏障以及血脑屏障,并且进一步地,它们可以活化CNS的小胶质细胞。发现活化的小胶质细胞参与促炎细胞因子的分泌,包括IL-1β、IL-6、TNF-α和TGF-β,从而有助于患有神经障碍的个体中认知障碍的发展。
Alistipes与IL-6呈正相关,与延迟记忆、总分和标准化评分呈负相关。
Alistipes也是促炎细菌,有研究表明,Alistipes属以IL-6依赖性方式参与促进炎症和肿瘤发生。本研究中Alistipes与IL-1、IL-6无显著相关性,与TNF-α呈负相关。因此,Alistipes可以通过炎症反应以外的其他方式加重认知障碍。
扩展阅读:
肠道重要菌属——另枝菌属(Alistipes),调节炎症情绪等的潜力菌
Clostridiaceae、Turicibacterae、Turicibacter与IL-1β和IL-6均呈负相关。
➤ 伴有厌食症的重度抑郁症
与健康个体相比,患有厌食症重度抑郁症患者具有不同的肠道微生物群,具有更高的CRP水平。伴厌食症的抑郁症患者中Blautia含量更丰富,并与CRP、HAMD评分和厌食症呈正相关。肠道菌群可能通过炎症因子CRP影响MDD和厌食症。
粪杆菌、拟杆菌、Roseburia和副拟杆菌与厌食、HAMD评分和CRP水平呈负相关。
短链脂肪酸通过干扰NF-κB通路发挥抗炎作用,补充短链脂肪酸可以减少炎症并缓解抑郁症状。
因此,MDD患者中产短链脂肪酸菌的减少可能会通过炎症反应引起抑郁症。这些炎症分子干扰食欲并促进厌食。下丘脑的炎症通过上调5-羟色胺的可用性,并刺激其在下丘脑中的信号传导途径而引起厌食症。
总的来说,由于肠道生态失调引起的免疫失衡是抑郁症发病的早期风险指标。这为利用无创肠道菌群检测对抑郁症进行早期筛查、及时预防和个性化治疗提供了依据。通过将非侵入性肠道菌群检测与现有方法(如心理问卷)相结合,可以共同预测和评估患抑郁症的风险。
心血管疾病(CVD)对人类健康构成了巨大的威胁。炎症是心血管疾病病理过程的普遍原因,包括免疫细胞的激活、积聚和炎症因子的释放。
➤ 动脉粥样硬化(AS)
动脉粥样硬化是CVD的病因之一。脂质沉积和持续性血管炎症被认为是动脉粥样硬化斑块进展的两个核心因素。
一项基于粪便宏基因组学、临床测量和流行病学的研究表明,日常饮食通过影响肠道微生物群促进动脉粥样硬化的形成,而抗炎反应功能障碍可能是核心过程。
脆弱拟杆菌的增加减少了乳酸杆菌的丰度,增加了脱硫弧菌科的丰度,导致葡萄糖或脂质代谢功能障碍,加重炎症反应。
循环中低密度脂蛋白含量显著增加,斑块中CD 36、F4/80增加,促进主动脉斑块的形成和动脉粥样硬化的进展。
衰老是动脉粥样硬化发展的另一个关键危险因素。
在炎症反应加重的衰老个体中,参与花生四烯酸(AA)代谢途径的组分(如20-HETE、PGF 2 α、花生四烯酸和LTB 4)显著增加。因此,建议肠道微生物群与动脉粥样硬化可能通过“肠道微生物群-代谢物-局部炎症-动脉粥样硬化”轴联系起来。
花生皮提取物(PSE)可降低动脉粥样硬化小鼠的血清TC和LDL-C含量,增加HDL-C含量,从而减缓动脉粥样硬化斑块的形成。
天麻素可以调节肠道微生物种类和丰度,降低促炎细胞因子TNF-α和IL-6的水平,增加抗炎因子IL-10的水平。
通心络干预是一种传统中药,通过增加肠道中益生菌的水平来改变斑块稳定性,从而增加有益代谢产物的含量,如反式阿魏酸,这可以抑制斑块中NLRP 3相关的炎症通路并稳定斑块。
乳酸杆菌的管理减少了来自受干扰的肠道微生物群的毒素,并增加了SCFA的水平,抑制了动脉粥样硬化的进展。
黄酮类化合物通过抑制TMA裂解酶而具有治疗冠心病的作用。
燕麦纤维可以防止动脉粥样硬化的恶化,阻断了TLR 4信号通路,降低了NF-κB p65的表达,并通过影响肠道微生物源性异丁酰-L-肉碱、戊酰肉碱、1-甲基鸟苷和2-甲基鸟苷来维持肠粘膜屏障的完整性。
鱼油衍生的长链单不饱和脂肪酸(LCMUFA),通过降低厚壁菌门和拟杆菌门的比例,增加肠道中阿克曼氏菌的丰度,上调SCFA以及SCFA诱导的一些胰高血糖素样物质来维持肠道微环境的平衡,降低了血清中炎性细胞因子的水平,抑制了动脉粥样硬化病变的进展。
支链氨基酸(BCAA)补充剂可以通过调节炎症来减轻动脉粥样硬化,包括减少巨噬细胞浸润、降低炎症因子的血清水平和抑制炎症相关信号通路。
➤ 慢性心力衰竭(CHF)
对53名慢性心力衰竭患者和41名对照成员的粪便宏基因组分析显示,慢性心力衰竭患者的肠道微生物群组成和代谢特征与对照组有显著差异,提示肠道微生物群功能障碍与慢性心力衰竭密切相关。
当肠道微生物群被破坏时分泌的LPS,以TLR4依赖性方式减少ZO-1紧密连接(TJ),并诱导肠上皮TJ的明显变形,导致肠屏障完整性的破坏。
心力衰竭患者会发生慢性全身炎症反应,血浆中几种促炎细胞因子的水平与疾病的严重程度和预后相关。肠道微生物群破坏和细菌产物(如LPS)易位到血液中是炎症过度状态的主要因素。
LPS是最强的促炎介质之一,可诱导心力衰竭患者血清中TNF-α、IL-1和IL 6的释放。另一方面,LPS通过TLR 4直接诱导心肌细胞损伤。
研究表明,晚期心力衰竭患者心脏中TLR 4的表达增加,与心脏炎性损伤高度相关,而抑制TLR 4可缓解心力衰竭的进展。
然而,一些研究表明,通过适当调节肠道微生物群,从而减轻或逆转心室重塑,可以减轻炎症。
目前有报道称,一些中药,如芪荔强心(QL),可稳定心力衰竭后的肠道菌群,通过减少炎症因子(如NLRP 3、IL-1β和TNF-α)的产生来抑制心肌纤维化和心脏重塑。
严重的心力衰竭总是伴随着肠道功能障碍。因此,重视肠功能的维持,可能会改善心力衰竭患者的预后。
肠道微生物群失衡会加重心血管疾病
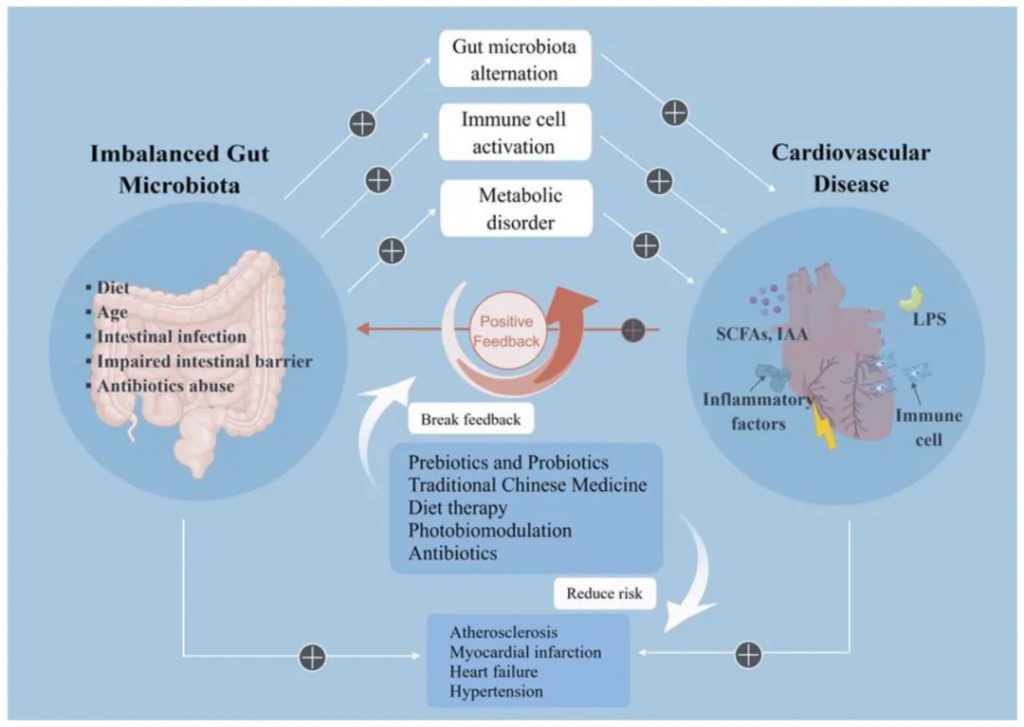
doi.org/10.3390/nu15030607
➤ 高血压
• 高盐饮食与肠道菌群失衡:
高盐饮食导致乳杆菌属减少,这些菌株能够产生肠道吲哚-3-乳酸,进而影响Th17细胞的活化。
• Th17细胞与炎症因子IL-17A:
Th17细胞的活化与IL-17A的产生增加有关,IL-17A通过上调肾脏中的钠转运蛋白(如钠氢交换蛋白3和氯化钠共转运蛋白)促进肾钠再吸收,这可能导致盐敏感性高血压。
• 益生菌治疗与血压调节:
用鼠乳杆菌(Lactobacillus murinus)进行的益生菌治疗可以预防小鼠的盐敏感性高血压,这表明通过调节肠道菌群可以影响血压。
• 高盐饮食与肠道菌群代谢物:
高盐饮食降低了肠道中脆弱拟杆菌和花生四烯酸的水平,这可能增加肠源性皮质酮的产生,进而提高血清和肠道中的皮质酮水平,促进血压升高。
• 饮食中钠的减少与SCFA:
减少饮食中的钠可以增加循环中的短链脂肪酸(SCFA),降低血压,这表明菌群代谢物SCFA可能在血压调节中发挥作用。
• 神经炎症与高血压:
肠道微生物群的紊乱及其代谢产物失调,会刺激巨噬细胞释放过量的炎症因子,加剧高血压的进展。
• 交感神经系统的激活与肠道菌群:
交感神经系统的激活增加了肠粘膜的渗透性,破坏了肠道微生物群的平衡,导致炎症细胞的动员和分化,这些炎性细胞返回大脑后加重神经炎症。
双歧杆菌能够增加eNOS的活性,降低血清过氧化氢酶的活性,这可能有助于维持血管的舒张和降低血压。
高纤维饮食增加了共生细菌的丰度,抑制了机会致病菌的繁殖,例如,产乙酸菌比例的增加有效降低了血压,减轻了心脏肥大和纤维化。
总的来说,维持肠道微生物群的稳定性对CVD的进展具有抑制作用。合适的饮食疗法,如益生菌和益生元补充剂,可以维持肠道微生物群的平衡,这已被证明可以有效降低血液中炎症因子的水平,改善心血管疾病的预后。
炎症性皮肤病代表了一组具有多种病因的疾病,包括遗传因素、感染和免疫失调,涉及先天性和适应性免疫系统中各种免疫细胞和炎症介质的激活。
一项研究首次使用双样本MR分析评估肠道微生物群与炎症性皮肤病之间的双向因果关系。
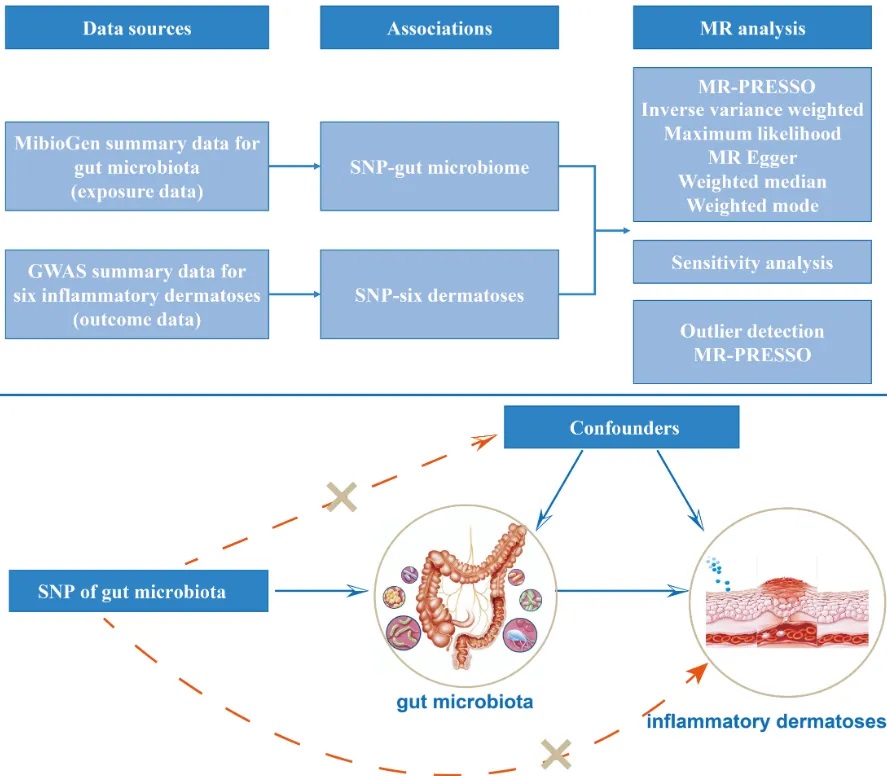
doi.org/10.3389/fimmu.2023.1231848
▸阿克曼氏菌属、瘤胃球菌属、双歧杆菌属、真杆菌属、粪球菌属等:
产生乙酸盐、丙酸盐和丁酸盐,通过GPCR和PPARγ受体调节免疫细胞,减少炎症因子释放,抑制组蛋白脱乙酰酶(HDAC),促进线粒体脂肪酸β-氧化。
▸乳酸杆菌和双歧杆菌:
增加色氨酸(Trp)和Trp代谢物,维持肠道屏障功能,减少痤疮炎症。
▸长双歧杆菌特殊作用:
将Trp代谢为吲哚-3-甲醛(I3C),通过AHR途径抑制Th2细胞,缓解特应性皮炎(AD)。
▸双歧杆菌、乳杆菌、Roseburia:
将多不饱和脂肪酸代谢为共轭亚油酸(CLA),抑制COX-2/5-LOX途径,抑制TLR4/NF-κB信号通路,减轻特应性皮炎皮肤病变。
▸硫酸盐还原菌(SRB):
如Desulfovibrionaceae,产生硫化氢(H2S),干扰丁酸盐氧化,损害肠道屏障,增加炎症因子释放。
以银屑病(牛皮癣)为例
银屑病是一种慢性复发性炎症性皮肤病,其特征是促炎细胞因子的释放增加。
Th-1、Th-17、Th-22细胞的扩增和活化, 一旦活化,这些细胞促进大量促炎介质的产生,包括但不限于来自角质形成细胞、淋巴细胞和其它免疫细胞的TNF-α、IL-6、IL-1、IL-17、IL-22、IL-23、VEGF、IFN-γ。此外,这些细胞促进皮肤病变的免疫发病机制,并在银屑病过程中驱动全身参与。
通过健康的饮食和运动获得的体重减轻能够改善银屑病的临床病程和治疗反应,甚至防止其发生,这种平衡的一个关键因素是肠道微生物群。(这在我们之前的文章中也详细阐述过)
肠道菌群在代谢综合征和银屑病中的多效性作用
doi.org/10.3390/ijms25158098
哪些菌群产生炎症因子,影响银屑病发生发展?
厚壁菌门中,金黄色葡萄球菌(Staphylococcus aureus)产生超抗原如TSST-1,其刺激角质形成细胞和DC分别产生促炎细胞因子和IL-23。这导致Th17细胞活化和IL-17产生,促进银屑病特征。
放线菌门中,纹状体棒状杆菌(Corynebacterium striatum)直接刺激角质形成细胞和DC产生IL-1β、IL-6和IL-23,增强Th17细胞分化。
在变形菌门中,大肠杆菌和粘膜奈瑟氏菌(Neisseria mucosa)通过LPS激活巨噬细胞和DC,触发IL-23、IL-6和IL-1β的产生,从而稳定Th17细胞并促进IL-17的产生。
孢子形成细菌如梭菌和脆弱拟杆菌通过诱导结肠T淋巴细胞和平衡Th1/Th2/Th17细胞来调节免疫应答.
分节丝状细菌(SFB)诱导Th17细胞分化。
在标准治疗的协同作用下,可以建议采用适当的饮食或其他干预措施来调节肠道菌群,从而改善银屑病的临床表现,并降低合并症的发生率。
婴儿双歧杆菌35624和1:1:1的益生菌混合物(即长双歧杆菌CECT 7347、乳双歧杆菌CECT8145、鼠李糖乳杆菌CECT 8361)在8至12周的治疗过程后,要么降低促炎TNF-α和血浆C-反应蛋白,要么降低患者的银屑病面积和严重程度指数。
在用咪喹莫特治疗的BALB/c小鼠中,戊糖乳杆菌GMNL-77显著降低了红斑鳞屑病变和促炎细胞因子如IL-23和IL-27的mRNA水平。
有趣的是,补充短双歧杆菌CCFM683有效地下调了角蛋白16/17、IL-17和TNF-α的表达,通过调节FXR/NF-κB通路和角质形成细胞增殖来改善银屑病。
以上我们了解了炎症因子在多种疾病中的作用机制,以及肠道菌群如何通过影响这些因子的水平和功能来调节炎症反应。炎症因子不仅反映了炎症的状态,还可以作为疾病进展和治疗效果的生物标志物。
为了有效地评估炎症因子的变化,临床上采用了多种检测方法。这些方法能够提供准确的炎症因子水平信息,辅助医生做出及时的诊断和治疗决策。接下来,我们将详细介绍几种常用的检测技术。
检测体内炎症通常需要特定的血液检查,以测量指示炎症反应的各种标志物。
◉ ELISA(酶联免疫吸附测定)
原理:抗原-抗体特异性结合,通过酶标记检测
优点:
灵敏度高、特异性强、可批量检测
缺点:
检测时间较长、操作步骤多、成本较高
适用:
IL-1β、IL-6、TNF-α等细胞因子的定量检测
◉ 化学发光免疫分析
原理:利用化学发光物质标记抗体或抗原
优点:
检测速度快、灵敏度高、自动化程度高
缺点:
仪器要求高、试剂成本高
适用:CRP、PCT等急性期蛋白的快速检测
◉ 免疫比浊法
原理:
抗原抗体形成免疫复合物产生浊度
优点:
操作简单、成本低、检测快速
缺点:
灵敏度较低、易受干扰
适用:CRP、血清淀粉样蛋白等的常规检测
◉ 流式细胞术
原理:通过荧光标记检测细胞因子
优点:
可同时检测多个指标、特异性强、定量准确
缺点:
设备昂贵、要求技术人员专业水平高
适用:细胞内细胞因子和膜表面标志物检测
◉ PCR技术
原理:检测炎症因子的基因表达水平
优点:
灵敏度极高、特异性强、可检测微量样本
缺点:
操作复杂、成本高、易污染
适用:炎症因子基因表达研究
◉ 蛋白质芯片
原理:多种抗原抗体反应的微阵列分析
优点:
可同时检测多个指标、样本用量少、高通量
缺点:
成本高、技术要求高、标准化难度大
适用:多种炎症因子的同时检测
◉ 肠道菌群健康检测
原理:通过分析肠道菌群及其代谢产物的变化情况,间接反映人体的炎症状态
优点:
非侵入性、可重复采样、早期预警、利于干预、反映整体状态、长期监测
缺点:
成本高、技术要求高、数据分析复杂
适用:多种炎症因子的同时检测
通过肠道菌群监测炎症因子的方法虽然存在一些局限性,但其独特的预警价值和非侵入性特点使其成为传统炎症监测方法的重要补充。
随着技术的进步和研究的深入,这种检测方法的局限性正通过多种创新手段得到克服:
这些技术创新显著提升了肠道菌群检测在临床应用中的价值,特别是在精准医疗和预防医学领域,使其成为疾病预警和健康管理的重要工具。
饮食方式
地中海饮食(MD)包括水果、蔬菜、全谷物、橄榄油、红酒等,可能对IBD有益。有证据表明,地中海饮食后可降低IBD和炎症的发生率。地中海饮食有助于抗炎菌群的存活,并防止肠道微生物群的失调发展。
通过调节肠道微生物群,改变肠道微生物组成,增加SCFA水平,降低尿TMAO水平,地中海饮食可以成为阿尔茨海默的潜在治疗干预措施。此外,更严格地遵守地中海饮食会延缓阿尔茨海默的进展,并提供1.5-3.5年的阿尔茨海默防护。
更多抗炎饮食,详见我们之前的文章:
益生菌
益生菌引入人体后,不仅会产生抗炎代谢产物,下调IL-6、IL-12、TNF-α等炎症因子和NF-κB通路等相关信号通路,还有助于抑制病原体的生长,修复肠道屏障,调节初始淋巴细胞的分化和增殖。
在BALB/c小鼠中,引入干酪乳杆菌可以预防肠道和关节炎症,不仅在膝盖,还在肠系膜和腘淋巴结中下调IL-1β、IL-6、IL-17、IL-23、TNF-α。
在一项涉及18名活动性强直性脊柱炎患者的试点研究中,补充嗜酸乳杆菌和唾液酸乳杆菌4周后,巴斯强直性脊柱炎疾病活动指数和视觉模拟量表有所改善。
此外,干酪乳杆菌、嗜酸乳杆菌、罗伊氏乳杆菌、双歧杆菌和嗜热链球菌的组合成功降低了用光受体间类维生素A结合蛋白免疫的C57BL/6小鼠的视网膜组织学评分,这是一种自身免疫性葡萄膜炎的动物模型。
在牙周炎的背景下,引入乳双歧杆菌HN019或罗伊氏乳杆菌显著改善了牙周炎的临床指标,包括减少探诊深度、减少探诊出血和降低手术风险。上述临床试验或动物实验中没有报告严重不良事件。
下一代益生菌,如F.prausnitzii、A.muciniphila,它们对IBD的治疗效果已经得到证实。这些益生菌可以减少浸润的巨噬细胞,抑制NF-κB信号通路,减少IL-8的产生,最终降低结肠炎的严重程度。
考虑到IBD和常见肠易激综合征之间肠道生态失调的相似模式,下一代益生菌在肠易激综合症管理中的应用也可能很有前景。
益生元
益生元是指微生物选择性利用以带来健康益处的底物。菊粉和低聚果糖等益生元的微生物发酵会产生代谢物(如SCFA),进一步调节肠道微生态系统和免疫反应。
在SpA的背景下,据报道,口服长链菊粉和低聚果糖可显著降低HLA-B27转基因大鼠结肠炎和关节炎的发病率。
对于牙周炎的动物模型,口服甘露寡糖成功地防止了牙槽骨丢失,降低了IL-10和IFN-γ的表达,下调了TNF-α和IL-1β的水平,并显著恢复了肠绒毛和隐窝深度。
值得注意的是,益生元具有广泛可接受的安全性,报告的严重不良事件很少。
后生元
在国际益生菌和益生元科学协会的指导下,益生元是指死亡的微生物或其对宿主有益的成分,包括SCFA、SBA等。
在SpA的背景下,直接外源性补充短链脂肪酸可以减轻各种动物模型中的关节炎严重程度。此外,口服短链脂肪酸还可以防止效应T细胞的激活和免疫细胞向脾脏和颈部淋巴结的运输,最终降低C57BL/6J和Kaede转基因小鼠模型中葡萄膜炎的严重程度。
该领域对原发性硬化性胆管炎的研究相对丰富。已经启动了几项为期12-24周的II期临床试验,报告称,无论是去甲熊去氧胆酸(SBA的衍生物)、奥贝胆酸(FXR配体)还是西洛菲索(FXR激动剂),都能显著降低原发性硬化性胆管炎患者(有或没有IBD)血清中的碱性磷酸酶。
此外,在患有IBD相关肝损伤的C57BL/6J小鼠中,添加乳脂球膜(Milk Fat Globule Membrane)与促炎细胞因子减少、Faccalibacumum和Roseburia恢复、结肠炎和肝损伤减轻以及谷胱甘肽转移酶途径的重新激活有关。
对于牙周炎患者,口服热灭活植物乳杆菌L-137有效地减少了同时接受支持性牙周治疗且基线深度不小于4mm的患者的探诊深度。
此外,小檗碱促进丁酸盐的产生,改善肠道屏障,降低循环LPS和促炎细胞因子水平,下调牙槽骨中的促炎细胞,最终改善牙周炎动物模型中的牙槽骨损失。同样,在后生元中也没有报告严重的不良事件。
抗生素
临床上,抗生素用于杀死致病菌或抑制其增殖。
在SpA的背景下,口服美罗培南和万古霉素有效地抑制了BALB/c和SKG小鼠脾脏中Th1和Th17细胞减少的外周附着点炎的发展。
对于葡萄膜炎,甲硝唑或万古霉素已被证明可以缓解葡萄膜炎,并增加用光受体间维甲酸结合蛋白预处理的B10.RII小鼠肠外淋巴组织中Tregs的丰度。
对于原发性硬化性胆管炎患者,应用万古霉素、甲硝唑和米诺环素可改善肝酶和梅奥风险评分。
此外,阿莫西林联合甲硝唑、单独甲硝唑和阿奇霉素可有效改善牙周炎患者的临床结果,其中阿莫西林联合甲硝唑在减少探诊袋深度、探诊出血和提高临床附着水平方面表现最佳。
粪菌移植 (FMT)
FMT是指将健康人类粪便中的微生物群移植到患者消化道中,使肠道微生态系统快速恢复的疗法。FMT的效果受到各种因素的干扰,包括供体的粪便质量、粪便的制备程序、给药方法和频率、FMT前的个体化肠道微生物组成(包括细菌、真菌和病毒)以及操作员技术。
一项试点随机对照研究表明,FMT组的内镜严重程度指数降低,C反应蛋白水平降低,这证明了FMT在维持克罗恩病缓解方面的疗效。
FMT还可以通过改善肠道微生物群的失调来减少肝脏脂肪积聚,从而减少NAFLD。
对FMT在阿尔茨海默病治疗中的作用的系统综述表明,FMT可以恢复SCFA和健康的微生物组,从而破坏阿尔茨海默患者的Aβ寡聚体,从而减少阿尔茨海默的发病机制。进一步机制研究表明,FMT降低了结肠、血清和SN中的LPS水平,抑制了TLR4/MyD88/NF-κB信号通路,使肠道微生物群和SCFA正常化,增加了突触素I的表达,并改善了阿尔茨海默模型小鼠的认知缺陷和Aβ沉积。
在许多慢性疾病中,例如肥胖症、动脉粥样硬化、2型糖尿病、炎性肠病、多发性硬化、类风湿性关节炎等,炎症是主要原因。肠道菌群的结构成分可能引发炎症,这可能引发一系列涉及白细胞介素和其他细胞因子的炎症反应。同样,某些短链脂肪酸和细菌代谢的其他代谢副产物可能有助于抑制炎症反应。因此,肠道菌群改变往往可能是炎症的预警信号,更早于临床症状的出现,其在疾病防治中的价值正逐渐被认识和挖掘。
特别是在当今精准医疗时代,结合人工智能深度学习算法、多组学整合分析等创新技术,肠道菌群检测的准确性和临床应用价值将得到进一步提升。随着检测技术的不断优化、数据分析方法的持续改进,以及临床验证研究的深入开展,肠道菌群检测将在疾病预警、健康管理、个体化治疗,响应监测以及预后评估中发挥越来越重要的作用。
未来,深入了解肠道微生物诱导的炎症因子的信号机制,有助于为肠道微生物诱导的炎症性疾病开发更精确、更有效的治疗方案。
本文内容仅供学习和交流目的,不构成任何形式的医疗建议。
主要参考文献
Chaudhary S, Kaur P, Singh TA, Bano KS, Vyas A, Mishra AK, Singh P, Mehdi MM. The dynamic crosslinking between gut microbiota and inflammation during aging: reviewing the nutritional and hormetic approaches against dysbiosis and inflammaging. Biogerontology. 2024 Oct 23;26(1):1.
Bai S, Bai H, Li D, Zhong Q, Xie J, Chen JJ. Gut Microbiota-Related Inflammation Factors as a Potential Biomarker for Diagnosing Major Depressive Disorder. Front Cell Infect Microbiol. 2022 Mar 15;12:831186.
Wu, J., Ou, G., Wang, S. et al. The predictive, preventive, and personalized medicine of depression: gut microbiota and inflammation. EPMA Journal (2024).
Liu P, Gao M, Liu Z, Zhang Y, Tu H, Lei L, Wu P, Zhang A, Yang C, Li G, Sun N, Zhang K. Gut Microbiome Composition Linked to Inflammatory Factors and Cognitive Functions in First-Episode, Drug-Naive Major Depressive Disorder Patients. Front Neurosci. 2022 Jan 28;15:800764.
Secchiero, P.; Rimondi, E.; Marcuzzi, A.; Longo, G.; Papi, C.; Manfredini, M.; Fields, M.; Caruso, L.; Di Caprio, R.; Balato, A. Metabolic Syndrome and Psoriasis: Pivotal Roles of Chronic Inflammation and Gut Microbiota. Int. J. Mol. Sci. 2024, 25, 8098.
Wang, W.; Zhu, L.-J.; Leng, Y.-Q.; Wang, Y.-W.; Shi, T.; Wang, W.-Z.; Sun, J.-C. Inflammatory Response: A Crucial Way for Gut Microbes to Regulate Cardiovascular Diseases. Nutrients 2023, 15, 607.
Mao R, Yu Q, Li J. The causal relationship between gut microbiota and inflammatory dermatoses: a Mendelian randomization study. Front Immunol. 2023 Sep 27;14:1231848.
Heinzel, S., Jureczek, J., Kainulainen, V. et al. Elevated fecal calprotectin is associated with gut microbial dysbiosis, altered serum markers and clinical outcomes in older individuals. Sci Rep 14, 13513 (2024)
Saedi, S., Derakhshan, S., Hasani, A. et al. Recent Advances in Gut Microbiome Modulation: Effect of Probiotics, Prebiotics, Synbiotics, and Postbiotics in Inflammatory Bowel Disease Prevention and Treatment. Curr Microbiol 82, 12 (2025).
Jukic A, Bakiri L, Wagner EF, Tilg H, Adolph TE. Calprotectin: from biomarker to biological function. Gut. 2021 Oct;70(10):1978-1988.
Zhao M, Chu J, Feng S, Guo C, Xue B, He K, Li L. Immunological mechanisms of inflammatory diseases caused by gut microbiota dysbiosis: A review. Biomed Pharmacother. 2023 Aug;164:114985.
Tie Y, Huang Y, Chen R, Li L, Chen M, Zhang S. Current insights on the roles of gut microbiota in inflammatory bowel disease-associated extra-intestinal manifestations: pathophysiology and therapeutic targets. Gut Microbes. 2023 Dec;15(2):2265028.
Nigam M, Devi K, Coutinho HDM, Mishra AP. Exploration of gut microbiome and inflammation: A review on key signalling pathways. Cell Signal. 2024 Jun;118:111140.
Soares CLR, Wilairatana P, Silva LR, Moreira PS, Vilar Barbosa NMM, da Silva PR, Coutinho HDM, de Menezes IRA, Felipe CFB. Biochemical aspects of the inflammatory process: A narrative review. Biomed Pharmacother. 2023 Dec;168:115764.

谷禾健康

副萨特氏菌属(Parasutterella)是一种革兰氏阴性,严格厌氧菌,在谷禾的人群肠道样本数据库中检出率为84.13%,说明这个菌在大部分人肠道存在,甚至长期定植共生。
Parasutterella属占据特定肠道生态位,影响宿主代谢:来自小鼠、大鼠和人的Parasutterella均不能降解糖,也无法还原硝酸盐或产生吲哚,但能合成琥珀酸盐,并且该菌可能参与人体胆汁酸稳态维持和胆固醇代谢。同时肠道内芳香族氨基酸、胆红素、嘌呤和胆汁酸衍生物等代谢物也受该菌的影响。
作为肠道共生菌成员之一,Parasutterella的相对丰度与不同的宿主健康结果有关,例如在肥胖、2型糖尿病、焦虑和抑郁、炎症性肠病患者中,Parasutterella的丰度增加;但是又有一些研究发现Parasutterella可以降低危重肺炎风险,并对肾上腺功能有一定的影响。副萨特氏菌属(Parasutterella)可能根据具体情况发挥二分作用。
在人体研究和动物试验中,发现Parasutterella对抗生素给药和其他饮食干预(如益生元和抗性淀粉补充剂)有反应。过量食用高脂、超加工食品,缺乏维生素A会导致Parasutterella丰度增加,而食用虫草素、小麦麸质、白藜芦醇、阿拉伯半乳聚糖、发酵豆乳等可以降低Parasutterella丰度。
副萨特氏菌属(Parasutterella)是β变形菌门下的一个属,与萨特氏菌属(Sutterella)相似但又有所不同。是一种革兰氏阴性,严格厌氧的球菌或球杆菌,不产生孢子,大小为0.5-0.8×1.0-1.5微米。
在37°C的GAM琼脂上培育72小时后,Parasutterella菌落呈完整、圆形、凸面、半透明,直径为0.5-0.7mm。
doi: 10.1038/s41396-019-0364-5.
物种与分布
Parasutterella属包含两种类型的菌株,Parasutterella excrementihominis YIT11859和Parasutterella secunda YIT12071,它们首先从人类粪便中分离出来。
Parasutterella excrementihominis是该菌属的模式物种。
Parasutterella属的成员也存在于其他物种中,包括小鼠、大鼠、狗、猪、鸡、火鸡和小牛。
生长与代谢
Parasutterella可在37°C厌氧环境下生长,这与人体肠道内的环境相似,并且在谷禾的检测报告中,Parasutterella有较高的检出率,说明Parasutterella是肠道菌群的共生成员。
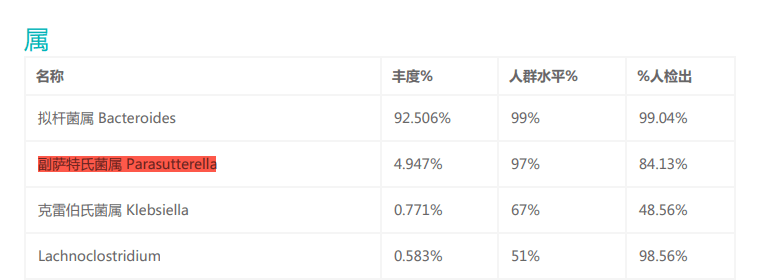
来自小鼠、大鼠和人的Parasutterella均不能降解糖(肉汤培养物中未检测到葡萄糖、果糖或乳酸的变化),并且未检测到短链脂肪酸作为代谢的最终产物,此外对硝酸盐还原、吲哚生成、过氧化氢酶、脲酶和氧化酶活性以及七叶苷和明胶水解呈阴性。
但该菌能合成琥珀酸盐,其的定植还可引起小鼠肠道内芳香族氨基酸、胆红素、嘌呤和胆汁酸衍生物等菌群代谢物的改变。
胆汁酸的变化伴随着回肠胆汁酸转运基因、肝脏胆汁酸合成基因表达的改变,证明该细菌可能参与胆汁酸稳态维持和胆固醇代谢。
注:Parasutterella的丰度在发酵过程中降低,与氨的产生呈正相关。天冬酰胺是GAM肉汤中Parasutterella代谢最迅速和首选的氨基酸。
基因组信息
Parasutterella的完整基因组大小为2.8 Mb,G+C含量为44.1mol%。预测包含2648个独特基因,缺乏转运和代谢外源糖的基因。
具有编码L-天冬酰胺酶、天冬氨酸氨裂解酶和天冬氨酸脱氢酶的基因,表明天冬酰胺是其最快速和首选的氨基酸代谢物。
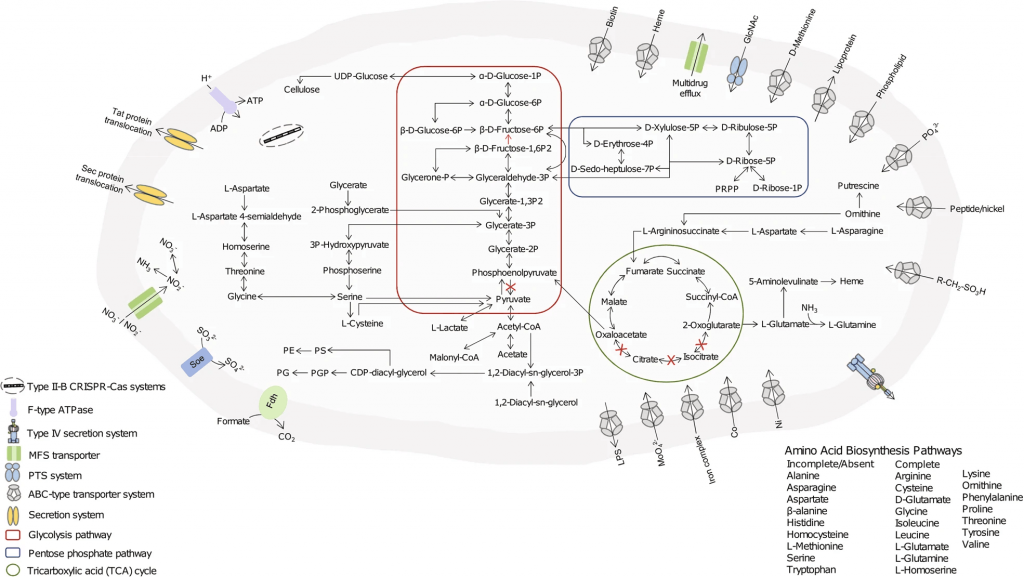
doi: 10.1038/s41396-019-0364-5.
此外,在Parasutterella mc1的基因组中没有鉴定出毒素毒力因子相关基因,这表明Parasutterella可能是肠道菌群的共生成员。但最近有许多研究和谷禾的检测报告中发现Parasutterella的丰度异常与一些疾病存在关联,让我们一起继续深入了解。
作为肠道微生物群中的一员,研究发现Parasutterella与炎症性肠病、肥胖、2型糖尿病、自闭症和肾结石等健康结果相关。
肥胖和2型糖尿病患者中增多 ↑↑
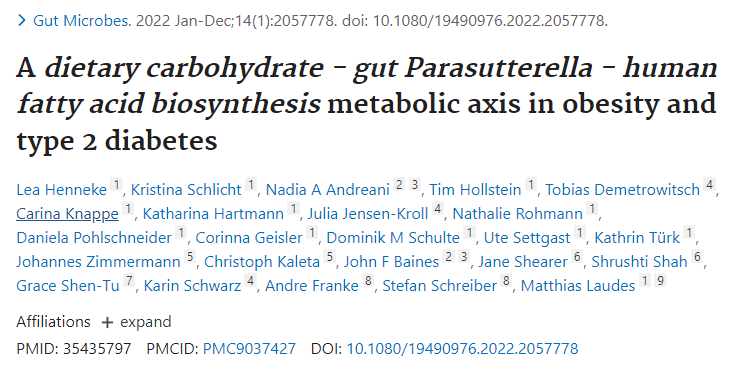
研究纳入了1544名受试者,分析肠道菌群组成,发现Parasutterella丰度与BMI以及2型糖尿病呈正相关,与膳食中碳水化合物摄入量呈正相关,但与肥胖中微生物组α/β多样性减少和低度炎症无关。
高丰度的Parasutterella与人体脂肪酸合成途径的激活有关,减肥干预试验中Parasutterella的丰度显著降低,Parasutterella增加或是影响体重增加的一个机制。
在代谢组学检测的126种血清代谢物中,L-半胱氨酸在Parasutterella丰度高的受试者中显著降低,因为Parasutterella是已知的高L-半胱氨酸消费者。
综上所述,Parasutterella在人类2型糖尿病和肥胖症中起一定作用,其中与L-半胱氨酸的联系可能与2型糖尿病的发展有关,并与肥胖症发展过程中富含碳水化合物的饮食导致体重增加的脂肪酸生物合成途径有关。
Henneke L,et al.Gut Microbes.2022
焦虑和抑郁人群中增加 ↑↑
与健康个体相比,社交焦虑症(SAD)患者体内的Parasutterella的丰度增加。

同时,16S rRNA分析发现,应激小鼠肠道中Bacteroides、Alistipes和Lactobacillus丰度降低,Parasutterella和Rikenellaceae_RC9_gut_group丰度升高。
KEGG通路分析表明,差异代谢物主要参与α-亚麻酸代谢、味觉传导、半乳糖代谢等下调通路。多种代谢物与Alistipes和Bacteroides呈正相关,而与Parasutterella呈负相关。
此外,Parasutterella的绝对丰度与身体不满意度呈正相关。
炎症性肠病患者中增加↑↑
在肠易激综合征(IBS)患者肠道菌群中,发现15个基因表达显著差异,Parasutterella的表达在筛选和验证实验中均显著不同,并与慢性肠道炎症相关,因此被认为与IBS的发生和发展有关。
Rnase4作为肠道抗菌蛋白在调节肠道微生物群和代谢物稳态中起关键作用,但在炎症性肠病(IBD)患者的肠道组织和粪便中观察到Rnase4水平降低,与Parasutterella的增加有关。
Parasutterella在小鼠体内定植虽然不会对整体微生物结构有明显影响,但会显著改变肠道代谢物,尤其是色氨酸代谢。
在肠上皮细胞和免疫细胞中表达的吲哚胺-2,3-双加氧酶1(IDO1)通过催化色氨酸转化为犬尿氨酸和其他下游代谢物,在肠道健康中发挥关键作用。这些代谢物具有免疫调节作用,并有助于维持肠道稳态,其产生失衡与IBD有关。
骨质疏松症患者中丰度改变
针对继发性骨质疏松症,研究发现酒精性骨质疏松大鼠厚壁菌门(Firmicutes)/拟杆菌门(Bacteroidetes)比例显著降低;高脂饮食诱导的骨质疏松小鼠肠道中双歧杆菌属(Bifidobacterium)、副萨特氏菌属(Parasutterella)和Odoribacter数量显著减少。
但最新的一项研究又发现了矛盾的结果,通过16S rDNA基因测序分析,发现骨质疏松症患者肠道微生物在属水平上的组成和结构明显不同。其中,uncultured_bacterium_f_Muribaculaceae,Allobaculum和Parasutterella丰度显著升高,Akkermansia显著降低,这可能对骨质疏松症(OP)的进展有显著影响。
其他疾病中的丰度变化
// 便秘患者中丰度增加
Parasutterella丰度与便秘大鼠中的炎症呈正相关。便秘是帕金森病患者常见的非运动症状,并在诊断为帕金森病的患者肠道内表现出升高的丰度,并与神经炎症和运动功能密切相关。
// 急性心肌缺血患者中丰度增加
与正常对照组相比,急性心肌缺血(AMI)患者中Parabacteroides、Butyricimonas、Odoribacter、Escherichia和Parasutterella的相对丰度显著增加。
// 酒精性肝病患者中丰度降低
研究也发现,酒精暴露导致小鼠肠道菌群结构显著改变,表现为Firmicutes丰度增加,Parasutterella丰度减少。这表明肠道菌群在酒精性肝病(ALD)的进程中起关键作用。
// 肾结石患者中丰度降低
肾结石患者中显著降低的菌群有:霍氏真杆菌、多尔氏菌属、啮齿杆菌、厌氧棒菌属、Ruminiclostridium_5、霍尔德曼氏菌属(Holdemania)、Fusicatenibacter、罕见小球菌属(Subdoligranulum)、戴阿利斯特菌属、Parasutterella、嗜胆菌属。
并且肾结石患者肠道中的Parasutterella菌属与血钠浓度呈负相关。
尽管Parasutterella丰度变化可能与某些疾病进展相关,但作为肠道共生菌,它也可能具有一些有益作用,如下所示。
可能降低危重肺炎风险 ↓↓

一项研究探讨了肠道菌群对危重肺炎的影响,分析了大规模肠道微生物群数据(n=18340)和危重肺炎基因组数据(病例n=2758和对照n=428607)。
结果显示,疣微菌科(Verrucomicrobiaceae)、嗜黏蛋白阿克曼菌属(Akkermansia)、Lachnospiraceae FCS020group、Parasutterella属、Prevotella7属和蓝细菌门与重症肺炎风险降低相关,而肠杆菌科、瘤胃球菌属UCG003和一些其他肠杆菌目则与风险增加相关。
影响肾上腺功能

研究表明Parasutterella与肾上腺球状带和束状带的功能之间存在因果关系,这会影响醛固酮和皮质醇水平。
Parasutterella生物学特性的研究发现,它显著调节胆汁酸和胆固醇。胆固醇是类固醇激素合成的主要底物,类固醇激素对肾上腺皮质激素的合成至关重要。胆汁酸还促进肠道对膳食胆固醇的吸收,肝脏中胆固醇的合成与胆汁酸的肠肝循环密切相关。
因此,Parasutterella对胆汁酸和胆固醇代谢的调节作用可能是影响肾上腺皮质激素(醛固酮和皮质醇)水平的重要途径。
对甲状腺疾病的保护作用
此外,还有研究发现Parasutterella对毒性单甲状腺结节(TSTN)的甲状腺毒症具有保护作用。
除了疾病外,其他生理状态或因素也会影响Parasutterella的丰度,我们在此列出了一些调节措施。
◮ 女婴中Parasutterella丰度更高
男婴肠道中的2种菌属——另枝菌属(Alistipes)和Anaeroglobus的平均相对丰度更高;而副萨特氏菌属(Parasutterella)、优杆菌属(Eubacterium)、Peptoniphilus和Anaerosporobacter在女婴肠道中的平均相对丰度更高。
◮ 孕妇肠道中Parasutterella增加
研究发现,在早孕期(孕10~15周),正常健康孕妇的肠道菌群拥有较高的α多样性,门水平主要由拟杆菌门、厚壁菌门和变形菌门组成,拟杆菌门为主要优势菌门;属水平上,主要由较多Parasutterella、Parabacteroides、Megasphaera、Dialister和Ruminococcaceae UCG 002/003/005组成。
◮ 缺乏维生素A会导致Parasutterela增加
维生素A缺乏使毛螺菌属_NK4A136组、颤杆菌的数量减少;然而,Parasutterela呈上升趋势。
◮ 高脂、超加工食品导致Parasutterella增加
与对照组相比,超加工食品组中Parasutterella的丰度更高,而Bacteroidetes和Rosebunia的丰度较低。
此外,与对照组相比,高脂高胆固醇饮食组小鼠Escherichia_shigella、Parasutterella和Allobaculum属相对丰度增加。这可能也是肥胖和2型糖尿病人群中Parasutterella较多的一个原因。
◮ 食用抗性马铃薯淀粉Parasutterella丰度增加

在食用抗性马铃薯淀粉(RPS) 的个体的肠道微生物组中,副萨特氏菌属(Parasutterella)的丰度趋于增加,并且副萨特氏菌的增加与服用RPS而不是安慰剂的参与者的低密度脂蛋白(LDL)水平降低相关。
将低密度脂蛋白(LDL)水平下降的RPS消费个体与没有降低的个体分开,发现低密度脂蛋白应答者在基线和服用RPS 12周后的Parashutterella水平明显较高。
▷ 黄莲解毒汤减少Parasutterella

传统中草药制剂黄莲解毒汤剂(HLJD)临床用于治疗腹泻和结肠炎。2和4g/kg剂量的HLJD通过抑制与集落刺激因子1受体(Csf1r)/Src通路相关的结肠组织中巨噬细胞活性受损来抑制炎症,从而缓解慢性结肠炎。
此外,黄莲解毒配方可以通过减少拟杆菌属、Odoribacter、Clostridium_sensu_stricto_1 和 Parasutterella 的丰度来改变肠道微生物群概况。
▷ 虫草素调节Parasutterella,改善肠道炎症

源自真菌的虫草素(CRD)具有抗炎和抗氧化特性,显示出对抗肥胖的潜力。CRD干预减轻了高脂饮食诱导的肠道炎症,改善了血糖水平,减少了脂肪堆积。
此外,冬虫夏草虫草素补充剂被证明能够通过调节关键代谢物的水平来调节内源性代谢紊乱,包括 DL-2-氨基辛酸、肌醇和6-脱氧法戈明。
虫草素影响了 Parasutterella、Alloprevotella、Prevotellaceae_NK3B31_group、Alistipes、unclassified_Clostridia_vadinBB60_group和 unclassified_Muribaculaceae等重要微生物群的丰度,最终导致内源性代谢的调节和肠道菌群紊乱的改善。
▷ 小麦麸油降低Parasutterella,改善脂肪堆积

麦麸是小麦的副产品,它含有膳食纤维、B族维生素、矿物质、酚类化合物和其他被认为对健康有益的植物化学物质。研究表明,麦麸对预防肥胖、心血管疾病、胃肠道疾病和一些癌症有积极作用
该研究发现小麦麸油(WBO)减少了体重增加、脂肪和脂质积累,并改善了肝脏脂肪变性和炎症。WBO处理增加了Romboutsia和 Allobaculum 的相对丰度,降低了Candidatus_Saccharimonas、Alloprevotella, Rikenellaceae_RC9_gut_group, Alistipes, Parabacteroides、Helicobacter、Colidextribacter 和 Parasutterella 的相对丰度。
▷ 世神丸调节肠道菌群,缓解肾阳虚腹泻
世神丸(SSP)是一种中药处方,通过调节肠道菌群、下调胆碱-三甲胺裂解酶(CutC)活性以及降低TMAO和炎症因子水平,显著缓解肾阳虚综合征腹泻症状。
相关性分析显示,CutC活性与粪杆菌属和Chryseobacterium呈正相关,与Prevotellaceae UCG-001、Rikenella、Acinetobacter、Parasutterella和Lacticaseibacillus呈显著负相关。
TNF-α 水平与Lacticaseibacillus、Prevotellaceae UCG-001、Parasutterella和Candidatus Saccharimonas呈显著负相关。
IL-6水平与Rikenella、Acinetobacter、Prevotellaceae UCG-001、Lacticaseibacillus和 Parasutterella呈显著负相关,并且与Faecalibaculum和Chryseobacterium呈显著正相关。
此外,还存在一些可以降低Parasutterella丰度的措施:
白藜芦醇
白藜芦醇(RSV)处理高脂饮食喂养的小鼠后,Parabacteroides 的丰度增加,而Parasutterella的丰度降低。
阿拉伯半乳聚糖
作为L-半胱氨酸的高消耗者,副萨特氏菌(Parasutterella)的定植可显著增加牛磺酸和N-乙酰蛋氨酸的水平。
而阿拉伯半乳聚糖(LBP-3)治疗显著降低了副萨特氏菌(Parasutterella)的相对丰度,从而降低了半胱氨酸、牛磺酸和炎性细胞因子(如TNF-α和IL-1β)的水平,从而有助于减轻溃疡性结肠炎(UC)的症状。
低FODMAP黑麦面包
一项随机临床试验比较低FODMAP黑麦面包与普通黑麦面包对肠易激综合征患者肠道菌群的影响,结果显示食用低FODMAP黑麦面包减少了拟杆菌、Flavonifractor、Holdemania、Parasutterella和克雷伯菌的丰度,并显示出双歧杆菌增加的趋势。
发酵豆乳
摄入发酵豆乳(FSM)可使Parasutterella、Turisibater和Bacteroide的相对丰度分别降低75%、62%和50%,而有益菌Akkermansiaceae、Lachnospiraceae、Alloprevotella和Dubosella的相对丰度分别增加28%、50%、80%和63%。
在动物实验中,经阿斯巴甜处理后,厚壁菌门和柔嫩梭菌属(Clostridiumleptum)的丰度较高,肠球菌和副萨特氏菌(Parasutterella)的丰度较低。
富含氢气的水(HRW)被发现减少了某些可能的致病性肠道微生物(Frisingicoccus和Parasutterella)。
主要参考文献
Ju T, Kong JY, Stothard P, Willing BP. Defining the role of Parasutterella, a previously uncharacterized member of the core gut microbiota. ISME J. 2019 Jun;13(6):1520-1534.
Henneke L, Schlicht K, Andreani NA, Hollstein T, Demetrowitsch T, Knappe C, Hartmann K, Jensen-Kroll J, Rohmann N, Pohlschneider D, Geisler C, Schulte DM, Settgast U, Türk K, Zimmermann J, Kaleta C, Baines JF, Shearer J, Shah S, Shen-Tu G, Schwarz K, Franke A, Schreiber S, Laudes M. A dietary carbohydrate – gut Parasutterella – human fatty acid biosynthesis metabolic axis in obesity and type 2 diabetes. Gut Microbes. 2022 Jan-Dec;14(1):2057778.
Yan H, Kuerbanjiang M, Muheyati D, Yang Z, Han J. Wheat bran oil ameliorates high-fat diet-induced obesity in rats with alterations in gut microbiota and liver metabolite profile. Nutr Metab (Lond). 2024 Oct 25;21(1):84.
Liu T, Ji H, Li Z, Luan Y, Zhu C, Li D, Gao Y, Yan Z. Gut microbiota causally impacts adrenal function: a two-sample mendelian randomization study. Sci Rep. 2024 Oct 7;14(1):23338.
Su S, Liu T, Zheng JY, Wu HC, Keng VW, Zhang SJ, Li XX. Huang Lian Jie Du decoction attenuated colitis via suppressing the macrophage Csf1r/Src pathway and modulating gut microbiota. Front Immunol. 2024 Sep 26;15:1375781.
Li Y, Fang M, Li D, Wu P, Wu X, Xu X, Ma H, Li Y, Zhang N. Association of gut microbiota with critical pneumonia: A two-sample Mendelian randomization study. Medicine (Baltimore). 2024 Oct 18;103(42):e39677.
Fu Y, Wang Q, Tang Z, Liu G, Guan G, Lyu J. Cordycepin Ameliorates High Fat Diet-Induced Obesity by Modulating Endogenous Metabolism and Gut Microbiota Dysbiosis. Nutrients. 2024 Aug 27;16(17):2859.
Xue S, Shi W, Shi T, Tuerxuntayi A, Abulaiti P, Liu Z, Remutula N, Nuermaimaiti K, Xing Y, Abdukelimu K, Liu W, Gao F. Resveratrol attenuates non-steroidal anti-inflammatory drug-induced intestinal injury in rats in a high-altitude hypoxic environment by modulating the TLR4/NFκB/IκB pathway and gut microbiota composition. PLoS One. 2024 Aug 12;19(8):e0305233.

谷禾健康

谷 氨 酰 胺
现代社会很多人都在持续食用低质量、高碳水化合物、低纤维的加工食品,饮食摄入可能影响他的肠道通透性。例如,某些饮食成分,如高脂肪或高糖饮食,与肠道通透性和炎症增加有关。
其他因素包括压力、微生物入侵和对感染的免疫反应,都可能会给肠道带来不同程度的伤害。
肠道疾病带来的损伤
一些肠道疾病包括炎症性肠病(如克罗恩病和溃疡性结肠炎)、肠道感染、肠道功能障碍等,通常会对肠道黏膜造成不同程度损害。
炎症性肠病的主要特征是肠道黏膜出现持续性炎症。这些病理改变会破坏肠道黏膜屏障的完整性,增加肠道通透性,从而导致细菌和毒素进入机体,引发全身性炎症反应。
注:在克罗恩病中,炎症可波及整个消化道,导致黏膜水肿、糜烂和溃疡形成。而在溃疡性结肠炎中,炎症主要局限于结肠和直肠,也会造成黏膜损害。
肠道感染如细菌性痢疾、病毒性胃肠炎等。这些感染通常会引起肠道黏膜的炎症反应,导致黏膜水肿、充血、出血等表现。严重时还可能出现黏膜糜烂和溃疡。这些病理改变会破坏肠道屏障功能,增加肠道通透性,引发继发性全身症状。
此外,一些功能性肠道疾病,如肠易激综合征,也可能伴有不同程度的肠道黏膜损害。这些疾病的发病机制复杂,往往涉及消化道、神经、内分泌、免疫等多个系统的失调,最终导致肠道黏膜屏障功能紊乱。
黏膜屏障功能受损、炎症→ 需要合适的干预
肠道疾病导致黏膜屏障功能受损,增加肠道通透性,使得细菌、毒素等有害物质进入机体,引发全身性炎症反应,从而恶化疾病。肠道通透性升高也会损害上皮细胞功能并降低营养吸收效率。因此,在肠道疾病治疗中,维护和修复受损的肠道黏膜屏障功能至关重要。
相比传统药物,营养补充剂如谷氨酰胺更温和
一些抗生素、止泻药等可以帮助加速修复肠道粘膜,缓解炎症反应,预防再次感染,但是,这些传统药物疗法往往存在一些问题,比如可能导致胃肠道副作用、干扰肠道微生态平衡、长期用药引发依赖性等。
相比之下,营养补充剂如谷氨酰胺,能够更加温和地调节肠道功能,修复受损的肠道粘膜屏障,同时也有助于维护肠道微生态平衡。
谷氨酰胺(Gln)是一种α-氨基酸,是核苷酸合成的重要前体之一。谷氨酰胺广泛参与机体的各种生物活动,是体内最丰富的游离氨基酸,约占总游离氨基酸的50%。谷氨酰胺是条件性必需氨基酸,在应激状态下(如压力、炎症、感染、创伤等)需要靠外部摄取满足。
根据发表在《国际分子科学杂志》上的一项研究显示,谷氨酰胺是血液和细胞中最常见的氨基酸之一,是肠道细胞的首选能量来源。谷氨酰胺补充剂可以保护肠道内壁并帮助其保持强大的肠道屏障,降低肠道通透性(即肠漏),刺激肠上皮细胞增殖,增强免疫细胞功能,在减少炎症反应的同时支持免疫系统,从而有助于促进受损肠道的快速修复,并最终改善疾病预后,这使其成为一种更加安全有效的肠道粘膜修复策略。
因此有研究提出,给予危重症患者适量的谷氨酰胺对于维持其正常肠屏障功能、降低炎性介质水平是有益的。但对于危重症患者应用谷氨酰胺是否能获益目前尚存在争论。
本文我们来了解一下谷氨酰胺是什么,其过量或缺乏会带来什么影响,为什么谷氨酰胺可以帮助修复肠道黏膜修复及缓解炎症,使用谷氨酰胺应该注意什么等,从而了解谷氨酰胺的作用及相关应用。
什么是谷氨酰胺?
谷氨酰胺是一种是一种条件性必需氨基酸,由谷氨酰胺合成酶在各种器官中从头合成,在人体多个系统包括肠道、免疫等发挥重要作用。它是血液中最丰富的游离氨基酸,是肠道细胞的重要底物,谷氨酰胺可以有效增强小肠肠内皮细胞的功能、增殖和生命周期。
为什么说谷氨酰胺是一种条件性必需氨基酸?
虽然人体可以自行产生谷氨酰胺,但在某些特定的高代谢状态下,例如生病、创伤、烧伤、压力、感染期间,其自身合成可能不足以满足需求,可能需要从外部食物中获取。
谷氨酰胺与谷氨酸有什么区别与关联?
谷氨酸和谷氨酰胺是两种对人体健康至关重要的氨基酸。
谷氨酸也是一种非必需氨基酸,也就是说人体可以自行产生谷氨酸。然而,它也存在于许多食物中,如肉类、家禽、鱼类、蛋类和乳制品。谷氨酸也以味精的形式用作食品添加剂。它可以完整或以结合形式提供。
但在体内,它也可以作为多种化合物的分解产物——比如来自谷氨酰胺,也来自叶酸和葡萄糖。谷氨酸广泛存在于肌肉中所有的蛋白质储存中。因此,从某种意义上说,它们需要彼此来帮助人体。虽然谷氨酰胺被视为发挥修复肌肉和治疗某些疾病作用的主要氨基酸,但谷氨酸却在幕后发挥作用,为谷氨酰胺发挥其作用做出一切正确的行动。
关于谷氨酸详见我们之前的文章:兴奋神经递质——谷氨酸与大脑健康
谷氨酰胺合成代谢:
具体来说,谷氨酰胺代谢主要通过两个步骤进行:
哪些部位含有谷氨酰胺?
谷氨酰胺存在于人体所有细胞中,但在肌肉细胞中含量尤其丰富。谷氨酰胺也存在于血液、消化道、肝脏、大脑中。
谷氨酰胺在人体各组织器官中的分布呈现出显著的浓度梯度特征。具体来说:
哪些食物含有谷氨酰胺?
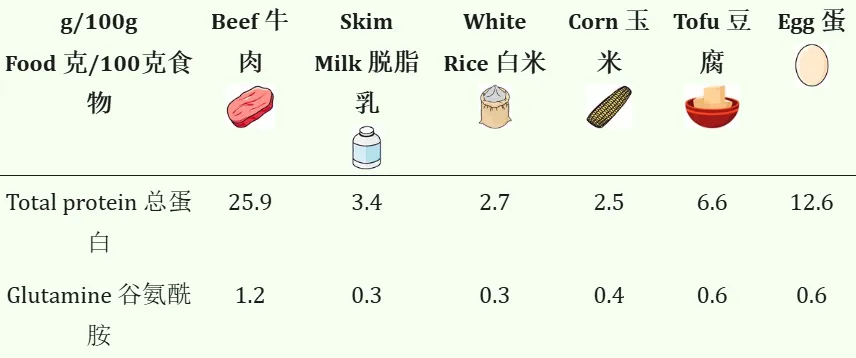
谷氨酰胺存在于许多食物中,包括:
一般来说,牛肉的谷氨酰胺含量最高,其次是豆腐和鸡蛋。
doi:10.3390/nu10111564
单独补充剂
谷氨酰胺也存在于食品中,并作为膳食补充剂在非处方药(OTC)中出售,也称为 L-谷氨酰胺。
L-谷氨酰胺与谷氨酰胺相同吗?
一般来说,“谷氨酰胺”在科学文献、营养信息和补充剂标签中通常用作L-谷氨酰胺的简写。这是因为L-谷氨酰胺是人体和大多数其他生物体中氨基酸的生物学相关形式。
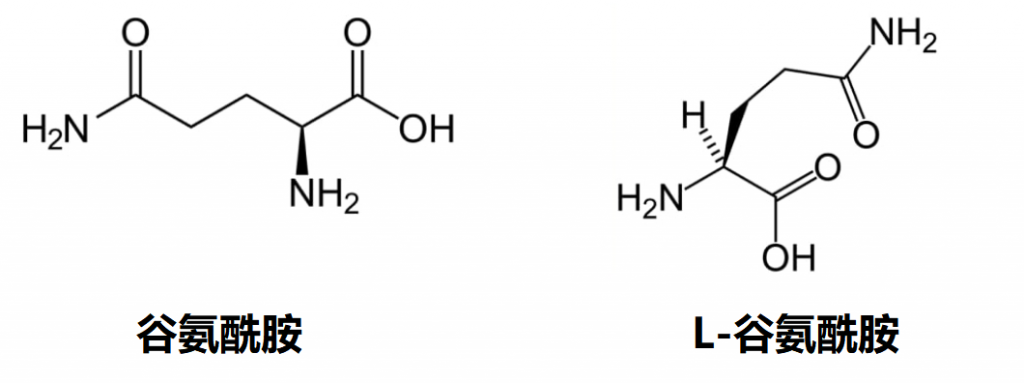
虽然D-谷氨酰胺存在,但它通常在自然界中并不大量存在,并且在人类中具有有限的生物活性。对于消费者、运动员和大多数医疗从业者来说,术语“谷氨酰胺”和“L-谷氨酰胺”在实际用途上可以被认为是相同的,可以互换使用。
谷氨酰胺在人体内的关键作用
谷氨酰胺约占骨骼肌游离氨基酸库的 60%,占总循环氨基酸的 20% 以上。谷氨酰胺主要在骨骼肌中合成,在骨骼肌中含量最高,剩余部分存在于肺、肝、脑、肾脏、脂肪组织、血液、肠道中。
在正常情况下,身体可以在运动后补充谷氨酰胺水平。每天多次过度训练、每周训练 7 天并参与剧烈运动,或进行极限运动、训练、竞技赛事或活动,和/或一天内进行多次训练的专业运动员患谷氨酰胺消耗的风险更大。休闲健身房用户通常不需要补充谷氨酰胺,因为他们不会以精英运动员的强度进行锻炼。然而,精英运动员可能会从谷氨酰胺补充剂中受益。
谷氨酰胺对于维持肠道内壁的健康和完整性至关重要。它是消化道内壁细胞的主要能量来源,有助于修复受损组织。
这在后面的章节我们会详细阐述。
免疫系统中的白细胞由谷氨酰胺提供动力。白细胞因疾病或疾病而增加。因此,需要增加谷氨酰胺来帮助为这些细胞提供燃料。如果血液中循环的谷氨酰胺不足,则可以从肌肉储备中释放谷氨酰胺,以帮助为肠道内壁的吸收细胞提供燃料。
谷氨酰胺在组织之间的氮运输中发挥作用。它是氮的重要载体,对各种代谢过程至关重要。蛋白质分解产生的所有氮中约有30- 35%以谷氨酰胺的形式运输。
谷氨酰胺可以在体内转化为葡萄糖,提供能量来源,特别是对于免疫系统和消化道中快速分裂的细胞。
什么情况下谷氨酰胺可能缺乏?
肾脏是谷氨酰胺的主要消费者,谷氨酰胺分解出的氨在这里起作用,以维持身体的酸碱平衡。哪里有氨,哪里就有谷氨酰胺。随着代谢性酸中毒的增加,如对高强度训练或高蛋白饮食的反应,肾脏对谷氨酰胺的摄取飙升。一项研究发现,仅仅四天的高蛋白、高脂肪饮食就足以导致血浆和肌肉组织中谷氨酰胺水平下降25%。
如果所有这些相互竞争的用途开始超过你的身体产生谷氨酰胺的能力,那么你可能会开始出现缺乏的迹象,包括肌肉萎缩,能量耗尽,以及对感染的易感性增加。
当人体缺乏足够的谷氨酰胺时,会对胃肠道的正常生理功能产生不利影响。谷氨酰胺是快速增殖细胞(如肠上皮细胞)的重要能量底物,在维持肠道上皮细胞的分裂和更新中起着至关重要的作用。缺乏谷氨酰胺会导致肠上皮细胞增殖和分化受阻,从而影响肠道屏障的完整性。
进一步研究发现,谷氨酰胺可通过多重机制来增强肠道屏障功能,改善肠道通透性。下面重点讲述。
在以高速率使用谷氨酰胺的各种组织中,肠道利用约30%的总谷氨酰胺,表明它是肠道的关键营养素。
► 小肠和大肠都能够代谢饮食和/或血液中提供的大量谷氨酰胺。
在健康成人中进行的研究表明,肠内提供的谷氨酰胺有四分之三被吸收到内脏组织中,大部分吸收的谷氨酰胺在肠道内代谢。当血浆谷氨酰胺通过器官时,四分之一的血浆谷氨酰胺被小肠吸收。肠道与其他组织竞争来自体内氨基酸库和膳食来源的谷氨酰胺。
► 谷氨酰胺对肠道的作用在数量上比葡萄糖作为能量底物更相关。例如,在肠上皮细胞中,谷氨酰胺碳可以通过两个主要途径代谢,即:
i) 通过形成 δ1-吡咯啉-5-羧酸盐;
ii)通过转化为α-酮戊二酸作为Krebs循环中的中介。
第一个途径通过使用肠道中发现的大约 10% 的氨基酸浓度,能够从谷氨酰胺碳中形成脯氨酸、鸟氨酸和瓜氨酸。
另外 10-15% 的谷氨酰胺被掺入组织蛋白中;其中最高比例(约 75%)在Krebs循环中被代谢用于能量生产。
知道了谷氨酰胺在肠道中的代谢特点后,我们就可以进一步探讨它在支持肠道健康方面的具体作用机制了。
研究表明谷氨酰胺在支持肠道健康和功能方面也扮演着关键角色。具体来说,谷氨酰胺通过三个主要机制发挥作用:
有助于改善肠道微生态平衡
优化的肠道微生态更有可能更有效地进行神经递质合成和其他功能。因此,谷氨酰胺通过调节肠道菌群比例,可能在肥胖和代谢紊乱的治疗中发挥一定作用。
厚壁菌门/拟杆菌门↓——改善肥胖
2015年的一项研究中,研究人员随机将33名肥胖受试者分为两组,一组补充谷氨酰胺,另一组补充丙氨酰。
经过14天的补充治疗后,补充谷氨酰胺的组别其肠道中厚壁菌门与拟杆菌门的比例显著降低。这一结果与体重减轻方案中的观察结果一致。
梭菌、肠杆菌科↓——改善化疗药物副作用
既往研究记录了一系列与各种化疗药物相关的胃肠道细菌感染。
在结肠癌大鼠模型上进行的一项实验,研究结果表明,谷氨酰胺治疗可以防止化疗药物伊立替康给药后,β-葡萄糖醛酸酶阳性细菌的丰度降低(Clostridium cluster XI 、肠杆菌科Enterobacteriaceae)。作者建议,谷氨酰胺补充可能在改善化疗引起的盲肠内β-葡萄糖醛酸酶活性增加中发挥作用。
拟杆菌门、放线菌门↑——改善便秘
提供氮源、助合成蛋白质——改善便秘
一项研究中,便秘动物补充了谷氨酰胺,拟杆菌门和放线菌门有所增加。
补充谷氨酰胺可以通过调节肠道微生物群来改善便秘和改善肠道功能。除了帮助厚壁菌门更好地获取能量外,谷氨酰胺对便秘的影响机制还涉及为小肠细菌提供氮源,帮助细菌合成蛋白质。
肠道微生物群的组成和功能会因饮食和营养状况而改变。因此,谷氨酰胺补充剂已被提议作为缓解便秘的潜在治疗方法。
有助于增强肠道屏障
肠道黏膜细胞更新
肠上皮细胞自发性凋亡对于维持其正常结构至关重要。然而,由外源性因素或细胞内刺激诱导的许多细胞应激(包括内毒素血症、营养剥夺和生长因子缺乏)会扰乱增殖和细胞凋亡之间的平衡。由于持续的凋亡细胞死亡,增殖和凋亡之间的这种不平衡会触发肠道病理状况。
因此,抑制肠上皮细胞凋亡以预防肠道病理状况至关重要。谷氨酰胺已被证明在肠道中显示出抗凋亡特性。
在大鼠肠上皮(RIE-1)细胞中,谷氨酰胺剥夺导致细胞凋亡。同样,补充谷氨酰胺可有效减少人肠上皮 T84 细胞中毒素诱导的细胞凋亡,以及月桂酸钠诱导的 RIE-1 细胞凋亡,共同表明谷氨酰胺对抑制细胞凋亡至关重要。
2017年的一篇综述讨论了谷氨酰胺如何支持肠道功能。肠黏膜细胞的生命周期相对较短,大约每5天就会更新一次。研究发现,谷氨酰胺可以激活蛋白激酶,促进肠道干细胞分化和增殖,形成肠细胞、杯状细胞等。
谷氨酰胺通过最大化表皮生长因子和胰岛素样生长因子-I等生长因子的作用,来增加肠道肠细胞的增殖。这些生长因子负责影响肠黏膜细胞的DNA、RNA和蛋白质合成,以及细胞复制。
谷氨酰胺在维持肠道黏膜细胞的更新和增殖方面发挥了关键作用,有助于支持肠道的正常功能。
紧 密 连 接
肠道紧密连接受损 → 肠道通透性增加
紧密连接(tight junctions)是形成于胃肠道壁细胞间的蛋白质结构。这些连接在决定吸收底物和阻隔病原体进入方面起着关键作用。
该保护层的完整性容易受到食物、炎症肽(如细胞因子)和压力造成的损害。
紧密连接功能的受损会导致肠道通透性增加,允许更大的蛋白质渗入血液,从而引发全身性炎症反应。
生活方式和饮食习惯可以影响肠道紧密连接的通透性。
谷氨酰胺可以调控紧密连接蛋白的表达
细胞缺乏谷氨酰胺时,用于紧密连接形成的蛋白表达减少,通透性增加,但补充谷氨酰胺可以逆转这一过程。
谷氨酰胺通过促进紧密连接蛋白的磷酸化,从而激活和维持它们的功能。因此,谷氨酰胺补充可能成为治疗乳糜泻和炎症性肠病的一种有效的营养支持方式。
总之,谷氨酰胺通过调节肠道紧密连接蛋白的表达和功能,从而影响肠道通透性,这为其在相关肠道疾病治疗中的应用提供了理论依据。
短期补充高剂量谷氨酰胺显著降低肠道通透性
一项荟萃分析检索了四个主要数据库中的相关研究,纳入的10项研究发表于1998-2014年间,包括216名干预组和212名对照组受试者,结果发现每天补充超过30克谷氨酰胺且持续时间不超过2周时,可显著降低肠道通透性(WMD: -0.01)。
谷氨酰胺对肠道通透性影响的敏感性分析
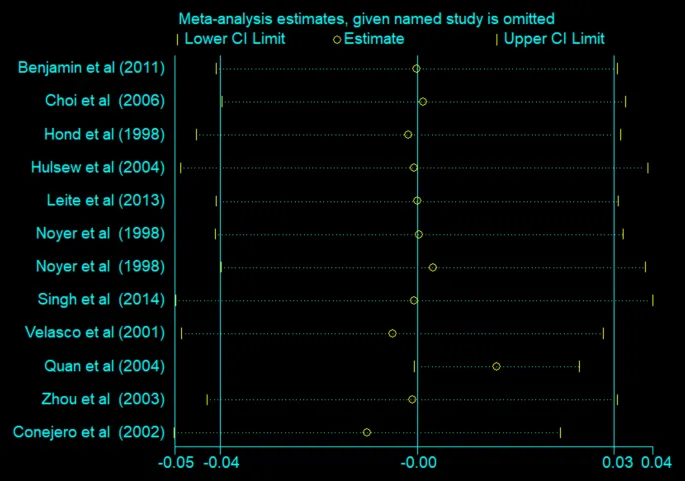
doi.org/10.1007/s00726-024-03420-7
其他亚组分析也显示,在某些特定条件下,谷氨酰胺补充可改善肠道通透性。
但总体而言,谷氨酰胺对肠道通透性的影响存在一定差异,需要进一步探索不同剂量和持续时间的作用。
抑制炎症反应
克罗恩病或溃疡性结肠炎涉及炎症途径。炎症反应引起级联效应,导致促炎细胞因子的产生,从而刺激炎症反应。
谷氨酰胺补充剂最常用于帮助治疗炎症性肠病,例如溃疡性结肠炎和克罗恩病。这些情况会导致消化道出现疼痛性溃疡,以响应肠道自身免疫攻击。
《国际分子科学杂志》研究表明,L-谷氨酰胺可以阻断两种促炎介质的激活,从而减少炎性细胞因子的表达。换句话说,它可能有助于减少炎症。
同一篇文章回顾了其他研究,并指出谷氨酰胺补充剂通常似乎有助于调节肠道细胞的生长,维持肠道的紧密连接,影响炎症级联反应,并防止细胞死亡和压力。
谷氨酰胺可以调控紧密连接蛋白的表达
谷氨酰胺可能通过增加热休克蛋白的活性来抑制这一过程的启动。这些蛋白降低 NF-κB 转录因子的表达,NF-κB 转录因子刺激与炎症和免疫反应相关的基因。
短期补充谷氨酰胺支持 NF-κB 的转录因子显著减少。
此外,谷氨酰胺还抑制其他炎症转录因子(STAT 蛋白)的激活。
一氧化氮也是炎症的必要成分;但如果合成过量,则可能是有害的。谷氨酰胺可使一氧化氮产生正常化,从而减轻高水平炎症。
富含谷氨酰胺的饮食可以改善创伤患者的免疫功能,并改善化疗后患者的粘膜炎。作者确定了临床结果:克罗恩病 21 克谷氨酰胺/天,持续 28 天,短肠综合征 42 克/天,持续 21天。
在一项随机对照试验中发现,在缓解期的克罗恩病患者中,补充谷氨酰胺(0.5g/kg BW;2个月)降低了肠道通透性和形态。
肠道疾病
肠易激综合征(IBS) 是一种影响消化系统的慢性疾病。诊断具有挑战性,症状可能因人而异。症状通常包括腹痛以及排便变化(便秘和/或腹泻)等。
补充L-谷氨酰胺可以改善IBS症状
在一项小型研究中,患有以麸质为主的IBS的成年人被随机分配每天服用15克谷氨酰胺或安慰剂,持续8周。几乎80%服用谷氨酰胺的患者的IBS严重程度评分系统(IBS-SS)评分至少提高了50分。
谷氨酰胺还与改善每日排便频率、腹痛和生活质量相关。
在另一项研究中,患有IBS的成年人遵循低FODMAP饮食,补充或不补充谷氨酰胺六周。那些遵循饮食并每天服用谷氨酰胺(每天15 g)的人比那些只遵循低FODMAP饮食的人在IBS症状方面有更显著的改善。
虽然有这些积极的结果,但这两项研究的持续时间都很短,并且没有涵盖所有类型的IBS,需要更多的研究来加强这一证据。
循环谷氨酰胺水平升高可降低结肠炎、结肠癌和IBD的风险
一项研究利用孟德尔随机化(MR)方法,分析来自114,751名欧洲人群的GWAS数据,研究发现谷氨酰胺水平与结肠癌、结肠炎和IBD(特别是克罗恩病)呈显著负相关。
研究采用52个严格选择的SNPs作为遗传工具变量进行MR分析:
这些发现为深入研究潜在的分子机制、流行病学监测和公共卫生决策奠定了基础。
癌症治疗,包括化疗和放疗,通常会对胃肠道产生不利影响,导致粘膜损伤、屏障功能受损和肠道炎症。
谷氨酰胺有助于维持肠道内壁的结构完整性并支持受损粘膜细胞的再生。通过促进肠上皮细胞的增殖和增强粘蛋白合成。
谷氨酰胺补充剂可减轻胃肠道毒性和降低治疗引起的副作用的严重程度。这有助于增强抗癌治疗的耐受性并改善患者的整体生活质量。
此外,谷氨酰胺作为必需抗氧化剂谷胱甘肽的前体,有助于减轻氧化应激并降低化疗引起的神经毒性(如周围神经病变)的风险。
谷氨酰胺可以通过潜在影响肠道微生物代谢来改变微生物群的组成或功能,包括促进/抑制肿瘤的肠道微生物组产生的代谢物、导致细胞外酸中毒的代谢物以及为结肠上皮细胞提供能量的短链脂肪酸(SCFAs)。
谷氨酰胺补充剂因其增强免疫功能的潜力而受到广泛关注,免疫功能是人体防御癌症的关键方面。对接受放化疗的食管癌患者的研究报告称,大剂量口服谷氨酰胺补充剂(30 克/天)可以恢复淋巴细胞计数并增强淋巴细胞有丝分裂功能。这表明癌症治疗期间对免疫功能有积极影响。
癌症患者补充谷氨酰胺(Gln)的临床试验

doi.org/10.3390/cancers16051057
除肠道外,谷氨酰胺减轻与口腔粘膜炎相关疼痛
化疗通常会破坏粘膜组织,引起口腔和咽喉溃疡,称为粘膜炎。一些研究报告减少了与放疗和化疗相关的疼痛性粘膜症状和溃疡。
一项荟萃分析涉及 988 名受试者,谷氨酰胺没有降低口腔粘膜炎的发生率(RR 0.94),但它降低了口腔粘膜炎的严重程度(SMD-0.73)和严重口腔粘膜炎的发生率(RR 0.41)。
谷氨酰胺降低了口腔粘膜炎引起的阿片类镇痛药使用(RR 0.84)、饲管使用(RR 0.46)、住院(RR 0.39)和治疗中断(RR 0.49)的发生率。谷氨酰胺有效改善了接受化疗和/或放疗的癌症患者的口腔粘膜炎并减少与口腔粘膜炎相关的不良反应。
谷氨酰胺补充剂的潜在益处不仅限于免疫调节和肠道毒性缓解,还包括癌症治疗期间患者健康状况的更广泛方面。这些针对不同类型癌症患者/治疗的临床研究的积极结果包括癌症恶病质相关蛋白的减少、蛋白质合成的改善、去脂质量和血清白蛋白的显著改善、瘦身的维持以及预防辐射引起的损伤和体重减轻。接受强化治疗的癌症患者保持足够的营养状况对于维持能量水平、保持肌肉质量和支持整体健康至关重要。
谷氨酰胺作为蛋白质合成的关键底物和人体抗氧化防御的重要组成部分,已在实验和临床研究中显示其减少治疗引起的体重减轻和改善营养参数的潜力。
■ 靶向肿瘤中的谷氨酰胺代谢
肿瘤微环境中谷氨酰胺代谢竞争对抗肿瘤免疫十分重要,在2023年8月3日的《自然》杂志上,Guo等人表明谷氨酰胺是癌症和免疫细胞之间的细胞间代谢检查点。靶向肿瘤微环境中的谷氨酰胺代谢是改善抗癌治疗的有前途的策略。
免疫逃避释放了癌细胞茁壮成长的能力,使它们能够避免被免疫系统识别和清除。肿瘤通过各种策略逃避免疫系统。有人提出,肿瘤微环境内的代谢竞争可能是免疫抑制微环境的重要因素。
研究发现,肿瘤细胞通过高表达SLC38A2转运体大量摄取谷氨酰胺,导致微环境中谷氨酰胺水平降低,从而抑制了树突状细胞(cDC1s)的功能和T细胞的抗肿瘤活性。
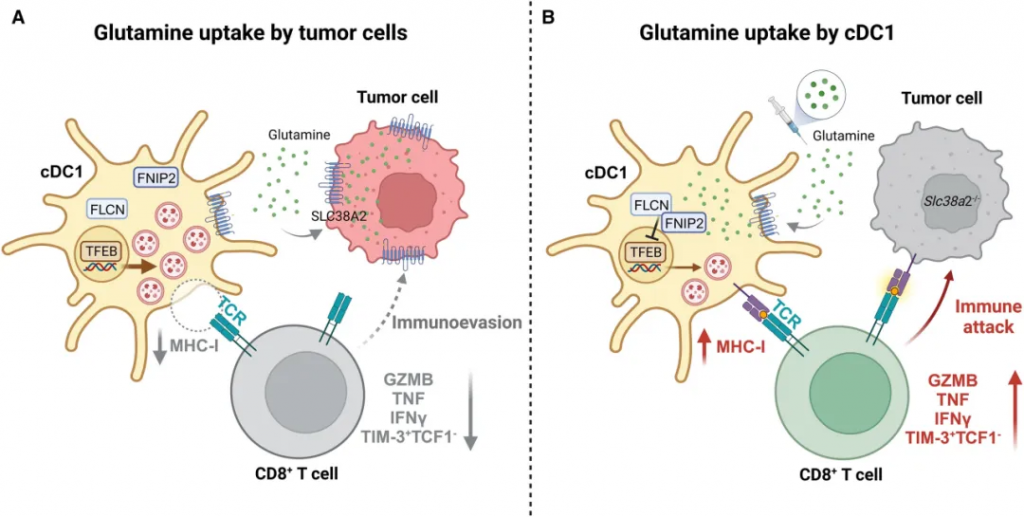
doi: 10.1016/j.chembiol.2023.08.012
通过补充谷氨酰胺或抑制肿瘤细胞的谷氨酰胺摄取,可以恢复免疫系统的抗肿瘤功能,这为癌症免疫治疗提供了新的治疗策略。
在癌症中靶向谷氨酰胺代谢的利与弊
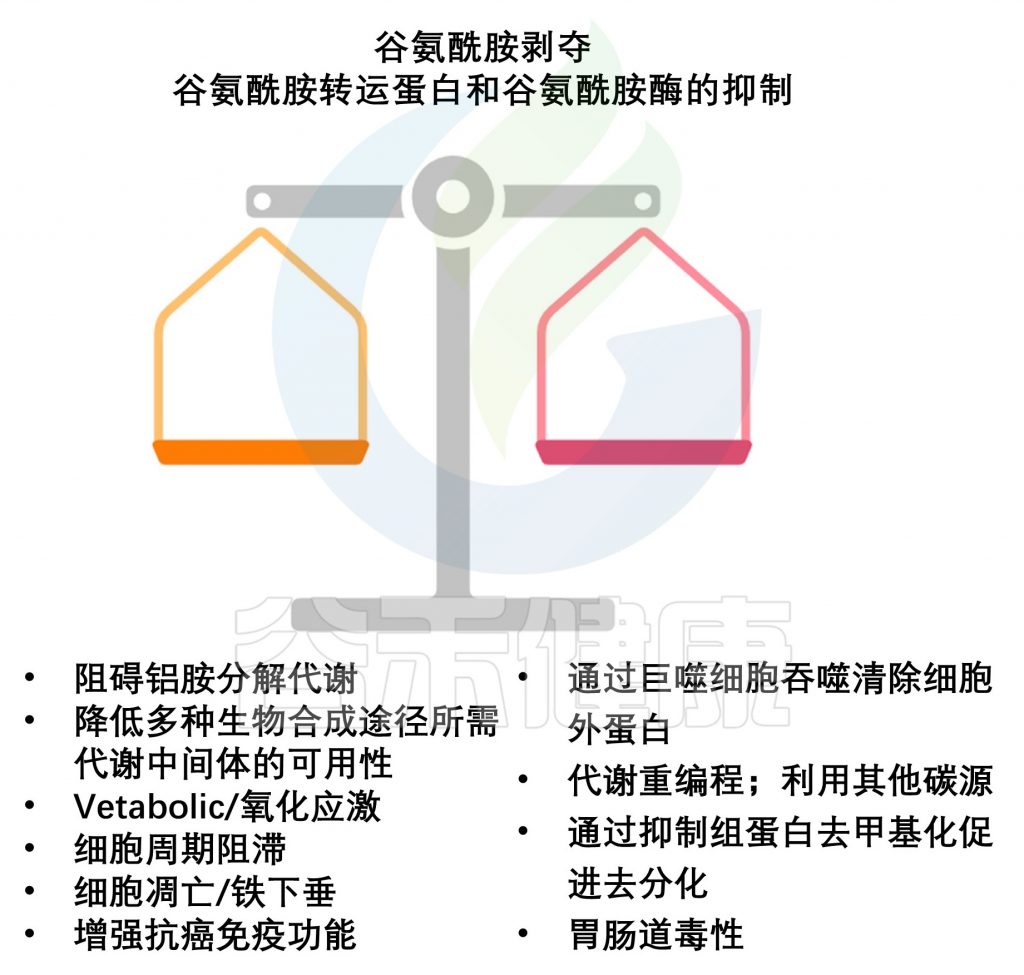
doi.org/10.3390/cancers16051057
■ 谷氨酰胺在肿瘤耐药中的机制
谷氨酰胺代谢在肿瘤发生发展中所产生的作用,尤其是在肿瘤耐药方面的作用机制已成为近年来研究的热点。
谷氨酰胺代谢通路靶点与肿瘤化疗药物耐药机制汇总

doi.org/10.3724/zdxbyxb-2021-0040
从谷氨酰胺的转运到谷氨酰胺代谢为各种终产物,中间任一环节变化都有可能是导致肿瘤细胞产生耐药的原因。深入了解谷氨酰胺在肿瘤耐药中的机制,有助于开发或是改进针对谷氨酰胺代谢靶点抗肿瘤药物的治疗效果。同时,由于肿瘤的异质性以及肿瘤患者的个体差异等造成谷氨酰胺代谢特点在不同肿瘤甚或同一肿瘤中存在明显差异,在今后的研究中需要着重关注这些差异,以便于针对不同的患者进行个体化的药物治疗。
在探讨了谷氨酰胺在肿瘤耐药中的重要性之后,我们以乳腺癌为例,来看一下谷氨酰胺在这一具体类型肿瘤中的作用。
■ 乳 腺 癌
乳腺癌是女性最常见的恶性肿瘤,其代谢重编程和免疫逃避是其关键特征。谷氨酰胺代谢在乳腺癌发展中起着重要作用。
涉及多个关键转运蛋白和代谢酶的调控
SLC1A5、SLC6A14、SLC7A5 和 SLC7A11 是乳腺癌中重要的氨基酸转运蛋白,其表达与预后相关。
谷氨酰胺代谢与细胞凋亡、铁死亡等程序性细胞死亡密切相关。
不同癌症“偏好”不同
比如三阴性乳腺癌特别”钟情”于谷氨酰胺,而其他类型的乳腺癌(如Luminal A型) 虽然也消耗大量谷氨酰胺,但对谷氨酰胺的依赖程度较低。有些癌症甚至可以通过其他途径(如葡萄糖)来弥补谷氨酰胺的不足。
与正常细胞相比,肿瘤细胞对营养的需求更大,分解代谢物的速率也更快。因此,营养剥夺可能是一种可行且成功的治疗选择。靶向谷氨酰胺代谢可能是一种潜在的成功治疗方法,可以抑制乳腺癌,尤其是三阴性乳腺癌,因为谷氨酰胺是细胞增殖的关键成分,其代谢与程序性细胞死亡和肿瘤免疫直接相关。
靶向谷氨酰胺的药物
在耐药乳腺癌细胞中,谷氨酰胺转运蛋白(如 SLC6A14 和 SLC1A5)的表达升高。靶向这些谷氨酰胺转运蛋白的药物可以提高耐药乳腺癌的治疗效果。
早期开发的抑制剂如谷氨酰胺类似物,硝化酶和阿昔洛维辛,这些药物存在细胞毒性高、影响范围广等问题。
新型变构抑制剂,如选择性谷氨酰胺酶抑制剂CB-839,对三阴性乳腺癌特别有效,显著抑制细胞增殖,降低谷氨酰胺消耗,减少谷氨酸合成,降低谷胱甘肽水平。与紫杉醇联合使用能提高治疗效果,有助于克服耐药性。
然而,谷氨酰胺的应用价值并不仅仅局限于肿瘤治疗。这种关键的氨基酸在改善整体健康状况方面也显示出广泛的潜力。
创伤,包括严重烧伤、手术或其他损伤,会降低谷氨酰胺水平。
烧伤是一种严重的分解代谢状态,会导致血浆和肌肉中谷氨酰胺水平显著降低。研究表明,烧伤患者谷氨酰胺耗竭与免疫系统功能减弱相关,影响伤口愈合和预后。
摄入额外的谷氨酰胺对重病或受伤的人有益
一些研究表明,服用谷氨酰胺可以预防或减少手术后的感染。它可以防止严重烧伤后对器官造成更广泛的损害。证明谷氨酰胺在这些情况下益处的研究通常涉及提供者在医院将谷氨酰胺添加到一个人的饲管中。
来自 11 项荟萃分析的 33 项原始干预试验。早期肠内营养可以显著降低总死亡率、住院时间和败血症风险。
▸ 谷氨酰胺显示住院时间显著缩短(MD:-6.23, 95% CI: -9.53, -2.94, GRADE = 低质量)。
荟萃分析纳入了 22 项试验,共随机分配了 2170 名患者。
▸ 合并后,谷氨酰胺补充剂缩短了住院时间(加权均数差 [WMD] = -7.95,95% 置信区间 [CI] -10.53 至 -5.36,I2 = 67.9%,16 项试验)。
▸ 谷氨酰胺补充剂改善了合并伤口愈合率(WMD = 9.15,95% CI 6.30 至 12.01,I2 = 82.7%,6 项研究)和伤口愈合时间(WMD = -5.84,95% CI -7.42 至 -4.27,I2 = 45.7%,7 项研究)。
▸ 谷氨酰胺补充剂减少了伤口感染(风险比 [RR] = 0.38,95% CI 0.21 至 0.69,I2 = 0%,3 项试验)。
谷氨酰胺补充对烧伤患者的效果仍存在争议
一项大型双盲随机对照试验(1209名烧伤患者)显示,谷氨酰胺补充对出院时间无显著影响。
10 项随机对照试验(1577 名患者)谷氨酰胺补充剂对总体死亡率(RR,0.65,95% CI,0.33–1.28;p = 0.21)、感染并发症(RR,0.83;95% CI,0.63–1.09;p = 0.18)或其他次要结果没有显著影响。
目前尚不清楚受伤后服用谷氨酰胺是否对每个人都有效。在实际应用中,应该根据患者具体情况制定个体化补充方案,并密切监测不良反应。
谷氨酰胺联合益生菌减轻烧伤大鼠肠道炎症和氧化应激
严重烧伤可能与肠道炎症和氧化应激相关。一项研究发现,谷氨酰胺和益生菌一起显著抑制一氧化氮(NO)含量;降低炎症因子TNF-α、IL-6和IL-8的水平;并改变氧化应激因子(包括活性氧自由基和超氧化物歧化酶)的表达。
谷氨酰胺可促进伤口愈合,部分原因是它增加了精氨酸和瓜氨酸(精氨酸的前体)的浓度。因此,谷氨酰胺允许在单核细胞和巨噬细胞中没有细胞外精氨酸的情况下产生NO。这种氨基酸还可以减少肠道萎缩,并限制肠道通透性,间接减少促炎细胞因子的产生。
系统综述和荟萃分析表明,补充谷氨酰胺对氮平衡(p<0.0001)、患者死亡率(p=0.0004)、L/M比值(p<0.00001)、LOS(p<0.000001)、CRP(p<0.0.00001)、IL-6水平(p=0.0001)和TNFα水平(p<0.00000)有显著影响。然而,补充谷氨酰胺对T细胞淋巴细胞的影响没有达到显著性(p=0.07)。
静脉注射(IV)谷氨酰胺联合静脉营养可能会减少患者术后住院天数,尤其是腹部大手术。它还可能降低医院手术后的感染率,但不会影响任何类型手术后的死亡风险。
住院与恢复研究
手术会消耗肌肉中的谷氨酰胺并减少肌肉蛋白质合成。
在腹部手术后患者中,补充谷氨酰胺组的肌肉谷氨酰胺减少幅度小于对照组。此外,治疗组的蛋白质合成没有变化,而对照组则下降了。
与对照组相比,胃部手术前一周每日补充谷氨酰胺可改善术后抗氧化状态和肝功能。
接受谷氨酰胺的患者发现谷胱甘肽(体内的一种抗氧化剂)减少较少,住院时间有缩短的趋势。
感染、手术、放疗、化疗通过破坏蛋白质来消耗体内的氮水平。在接受骨髓移植的患者中,将氮保留在体内的因子可减少临床感染、缩短住院时间并减少有害微生物菌落的形成。
在一项针对 24 名骨髓移植患者的研究中,补充谷氨酰胺提高了身体保留氮的能力。然而,并非所有接受骨髓移植的患者都会得到改善。
谷氨酰胺还改善了胃部手术患者的氮潴留。
扩展阅读:
心脏手术通常会对心肌造成称为缺血/再灌注(I/R)的损伤。缺血是由于低氧水平引起的,而再灌注是由于低氧水平后氧气回流。
已经表明,I/R 损伤会导致肌钙蛋白 I、肌酸激酶-MB 和肌红蛋白水平升高。这些蛋白水平升高与死亡率和发病率增加有关。
在一项对 14 名患者的研究中,接受心脏手术的患者在 24 小时和 48 小时时肌钙蛋白 I 和肌酸激酶-MB 水平降低。肌红蛋白仅在 24 小时后降低。因此服用谷氨酰胺的患者减少了心脏损伤和并发症。
扩展阅读:
急性肾损伤可能由脓毒症和肾毒素等损伤以及肾缺血/再灌注损伤引起。谷氨酰胺通过调节肾小管上皮细胞的氧化应激和细胞凋亡,来预防急性肾损伤。
保护作用
谷氨酰胺可显著减轻急性肾损伤程度,改善肾功能,减少肾小管上皮细胞损伤,降低炎症反应。谷氨酰胺主要通过谷氨酰胺γ-谷氨酰转移酶2(Tgm2)和凋亡信号调节激酶(Ask1)这两个靶标来发挥抗凋亡作用。
研究证据
缺血再灌注损伤模型中,谷氨酰胺处理可降低血肌酐和尿素氮水平,改善肾小管损伤评分,提高肾脏血流量。
细胞实验:在体外炎症或缺氧条件下,谷氨酰胺可提高肾小管上皮细胞存活率,改善线粒体功能。
谷氨酰胺给药可减轻 IRI 诱导的 AKI 期间的
肾脏损伤并改善肾功能
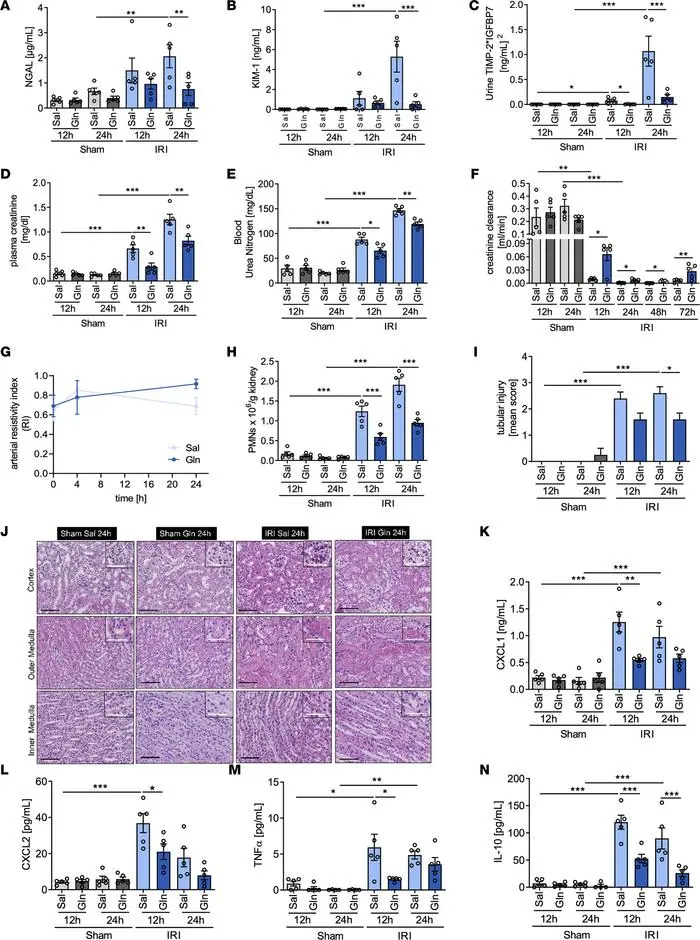
doi.org/10.1172/jci.insight.163161.
谷氨酰胺补充可能成为有效的治疗策略,特别适用于缺血再灌注相关的急性肾损伤,可能对危重症患者的肾脏保护有益。
谷氨酰胺是最常见的神经递质 GABA 和谷氨酸的基本前体。研究表明,谷氨酰胺补充剂可以通过影响可利用的 GABA 和谷氨酸的量来影响认知功能。
阿尔茨海默病
阿尔茨海默病是一种严重的神经退行性疾病,全球患病率超过2400万,预计到2040年将翻倍增长。
一项研究采用双样本孟德尔随机化方法,循环谷氨酰胺每增加1个标准差,阿尔茨海默病风险降低17%(OR=0.83,P=0.02),谷氨酰胺可能通过跨越血脑屏障,在压力时期提供更多底物而起到神经保护作用。
动物研究表明,谷氨酰胺代谢改变可能在淀粉样斑形成之前就已发生,通过调节外源性谷氨酰胺可能为预防和治疗阿尔茨海默病提供新思路。
自闭症
一项研究通过对自闭症谱系障碍患者(ASD)及其家庭成员进行大规模代谢组学研究分析 1099 个血浆样本中的 14342 个特征,发现了NLGN1基因变异与血浆谷氨酰胺水平之间存在显著关联。血浆谷氨酰胺水平与自闭症患者的重复性和限制性行为严重程度呈负相关,提示血浆谷氨酰胺可能作为一种内表型,在NLGN1基因致病机制与自闭症表型之间建立联系。这一发现为理解自闭症的遗传学基础及开发潜在治疗靶点提供了新的思路。
扩展阅读:
儿童神经发育异常的脑肠轴视角 – 自闭症早期风险判别和干预新路径
脂肪肝
在美国肝病的主要原因之一是脂肪肝和非酒精性脂肪性肝炎,也是肝移植需求的主要原因之一。患有这种疾病的人还可能有血糖问题、心脏病、代谢综合征和/或肥胖。
最近一项研究的数据表明,服用谷氨酰胺补充剂的小鼠可以避免患上非酒精性脂肪性肝炎。先前的文献表明,谷氨酰胺可能有助于完全预防非酒精性脂肪性肝炎的发展,但需要更多的研究来证实这些发现。
肝损伤
研究发现,抗生素预处理可以通过改变肠道菌群组成和代谢产物,特别是谷氨酰胺和α-酮戊二酸来减轻肝脏肝缺血/再灌注损伤。抗生素处理导致肠道微生物群的多样性降低,但促进了谷氨酰胺的产生。肠源性谷氨酰胺经过分解产生α-酮戊二酸,后者可促进巨噬细胞M2极化。
扩展阅读:
科学家认为免疫细胞,如淋巴细胞、巨噬细胞和中性粒细胞需要谷氨酰胺。这些细胞周围存在谷氨酰胺,使这些白细胞得以生长。
谷氨酰胺在一定程度上增加了全身炎症反应综合征 (SIRS,一种对感染、创伤或烧伤的严重且可能危及生命的炎症反应)患者的 B 和 T 淋巴细胞水平。
在一项针对 30 名 SIRS 患者的研究中,谷氨酰胺补充剂减少了炎症并改善了预后。
在 22 例接受结直肠手术的患者中,补充 L-谷氨酰胺增加了 T 淋巴细胞,T 淋巴细胞是保护身体免受细菌入侵的细胞。
一项纳入 45 例接受骨髓移植患者的研究显示,接受谷氨酰胺补充剂的患者发生较少感染。
我们知道,超过 70% 的免疫系统生活在肠道中。因此,谷氨酰胺补充剂可能会影响自身免疫性疾病(桥本氏甲状腺炎、纤维肌痛和许多其他疾病)。
扩展阅读:
伴随 ICU 患者危重病情的代谢亢进和代谢亢进综合征的发展与谷氨酰胺浓度的降低有关,尤其是在血浆和肌肉中。这个过程可能会持续相当长的时间,并导致许多并发症,甚至致命的结果。
有证据表明,谷氨酰胺可能会防止细菌在重大受伤或手术后从肠道扩散到身体的其他部位。它还可能降低危重患者发生医院获得性感染的风险,尤其是静脉注射时。然而,它可能不会降低该人群的死亡风险。
补充谷氨酰胺→增加热休克蛋白→ ICU 住院时间的减少↓↓ 死亡率↓↓
热休克蛋白(HSP)是一组响应细胞应激而释放的蛋白质,有助于保护其他蛋白质免受损伤或重组已经受损的蛋白质。它们是压力反应不可或缺的一部分,几乎存在于所有生物体中。
在创伤患者中,HSP-70 水平升高与死亡率降低相关。
在一项针对 29 名危重患者的研究中,补充谷氨酰胺使 HSP-70 水平比基线水平增加了 3.7 倍。
在多项研究中,应激动物模型表明,补充谷氨酰胺会增加关键热休克蛋白的水平。然而,完全缺乏适当的人体研究。
此外,HSP-70 增加的幅度与 ICU 住院时间的减少相关。
补充谷氨酰胺→炎症标志物CRP↓↓
谷氨酰胺补充剂对肠内或肠外喂养的危重患者炎症标志物的影响,研究发现,谷氨酰胺补充剂可能对急性情况下的CRP有重要影响,而对急性情况下的IL-6和TNF-α没有显著影响。
一项荟萃分析纳入了 2728 项符合条件的研究,最后招募了10项符合条件的病例对照研究,干预前和干预后CRP水平有统计学意义上的降低(标准化平均差[SMD]= -0.38mg/L;95%CI,-0.72至-0.03)。
与对照组相比,EN/PN 中补充 L-谷氨酰胺与IL-6(SMD = -0.58pg/ml; 95%CI,-2.15至0.99)和TNF-α(SMD = 2.69pg/ml; 95%CI,-9.66至15.03)之间没有显著关联。
手术患者降低死亡率,改善病情
系统评价和荟萃分析选择的不同国家的随机双盲、安慰剂对照试验,大多数报告指出,在手术患者的营养和代谢疗法(NMT)中加入谷氨酰胺二肽可降低感染并发症的频率和严重程度,降低死亡率,减少在 ICU 和一般医院的住院时间,改善反映患者病情的生化参数,并降低治疗费用。因此,进行的系统评价和荟萃分析证实,使用肠外形式的谷氨酰胺二肽(Dipeptiven 20%)作为平衡标准肠外营养的一部分是外科 ICU 患者 NMT 的临床和药物经济学上合理的策略。
扩展阅读:
病毒感染的宿主细胞显著增加谷氨酰胺的利用和代谢,这种代谢变化主要服务于病毒复制的需要,感染细胞对谷氨酰胺的需求明显上升。
谷氨酰胺在病毒复制中的作用
免疫系统相关影响
谷氨酰胺代谢在病毒感染过程中扮演着重要角色,既参与病毒复制又维持免疫功能,这种双重作用使其成为一个复杂但有潜力的治疗靶点。
COVID-19
多项代谢组学研究发现了COVID-19患者体内谷氨酰胺的重要变化:
重症患者的谷氨酰胺水平与多个指标相关:
doi.org/10.3390/ijms24087593
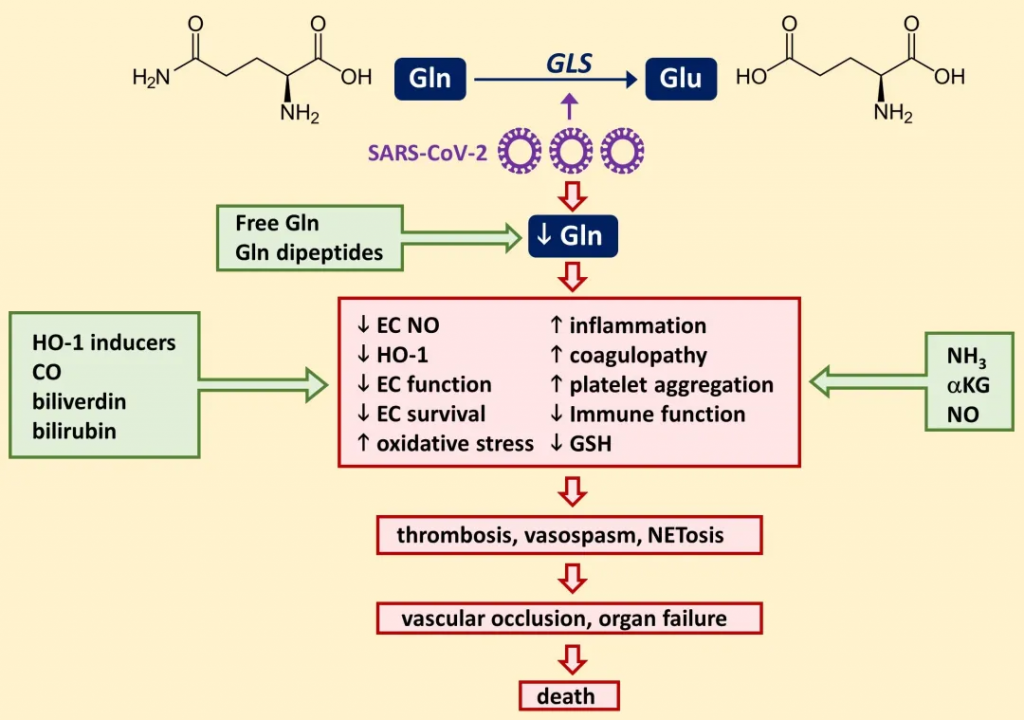
预防和治疗意义:较高的谷氨酰胺水平可以降低COVID-19感染风险以及重症风险。
生物信息学研究显示:在26000多种FDA批准的药物中,谷氨酰胺被认为是最有前景的候选药物之一,可能通过逆转冠状病毒导致的基因表达改变发挥作用,提示恢复患者体内谷氨酰胺水平可能是一个重要的治疗方向。
扩展阅读:
阳康后是否会二次感染,长新冠与肠道菌群的关联,多种潜在的相关干预措施
一些研究表明,谷氨酰胺补充剂可以帮助艾滋病患者。谷氨酰胺可以帮助人们恢复自感染 HIV 以来减轻的体重。谷氨酰胺还可能有助于治疗 HIV 的抗病毒药物更好地发挥作用。
口服谷氨酰胺可能会改善 HIV/AIDS 患者的营养吸收和体重增加。高剂量(每天约 40 克)可能是最有效的。
但研究正在进行中,是否应该推荐谷氨酰胺补充剂有待进一步研究确认。
谷氨酰胺和亮氨酸给药可减轻脓毒症患者的肌肉萎缩。
一项研究发现,谷氨酰胺和/或亮氨酸给药可减少脓毒症诱导的肌肉退化并促进生肌基因表达。单独使用亮氨酸治疗对脓毒症期间维持肌肉质量的影响更为明显。谷氨酰胺和亮氨酸的组合未能显示出缓解脓毒症诱导的肌肉萎缩的协同作用。
在镰状细胞病中,红细胞会变得坚硬和粘稠。它们也会改变形状,看起来像一把镰刀。发生这种情况时,血管会阻塞,阻塞血液流动,更容易受到感染、贫血和其他严重并发症。
谷氨酰胺补充剂有助于减少红细胞损伤,防止变得粘稠和畸形。这有助于血液正常流动。
唯一获得 FDA 批准的谷氨酰胺疗法是针对所有年龄段的镰状细胞病患者,基于一项 III 期临床试验,其中 L-谷氨酰胺耐受性良好,减轻了疼痛危象。
特发性肺纤维化
特发性肺纤维化病因不明,治疗效果有限,预后不良,其特征是持续性急性肺损伤,随后出现瘢痕形成和终末期肺病。多种形式肺损伤,包括体液自身免疫、内皮功能障碍、肉芽肿形成或肺泡巨噬细胞活化,都可能导致纤维化表型的进展。
特发性肺纤维化患者AT2细胞中负责谷氨酰胺分解代谢的催化酶表达下调,导致谷氨酰胺积累无法被利用,影响肺泡上皮的修复和再生。
谷氨酰胺代谢是肺泡上皮再生所必需的,通过影响AT2细胞的增殖和分化发挥作用,与肺泡上皮的能量供应密切相关。
急性呼吸窘迫综合征
谷氨酰胺治疗可以减轻炎症,降低内毒素的释放,具有保护作用。
谷氨酰胺可能成为肺部疾病的治疗靶点,有助于上皮修复和再生,可能改善预后。
研究人员研究了谷氨酰胺是否可以提高运动表现。一些研究表明,谷氨酰胺可以减少高强度运动后的肌肉酸痛,并降低生病的风险,对减肥有显著影响。尽管如此,没有足够的证据表明服用谷氨酰胺始终提供这些好处。研究不支持谷氨酰胺可以帮助运动员增加肌肉质量的观点。
系统评价共纳入 47 项研究,其中 25 项试验符合荟萃分析的纳入标准。根据荟萃分析,谷氨酰胺对减肥有显著影响(WMD = -1.36 [95% CI:-2.55 至 -0.16],p = 0.02)。此外,摄入大于 200 mg/kg 体重的谷氨酰胺后,中性粒细胞数量减少(WMD = -605.77 [95% CI:-1200.0 至 52.1];P = 0.03)。此外,补充谷氨酰胺二肽导致运动后血糖升高(WMD = 0.51 [95% CI:0.18,0.83] mmol/l;P = 0.002)。
一个例外是在极限耐力运动中,例如马拉松训练。补充谷氨酰胺(马拉松比赛后立即服用5克,后2小时服用)可显著降低下周患感冒的几率。

这些积极作用都为谷氨酰胺在临床应用中的广泛价值提供了依据。那么如何补充谷氨酰胺,以及在补充过程中需要注意哪些事项,我们来看下一章节。
首先,谷氨酰胺可以通过饮食来获取。富含蛋白质的肉类、鱼类、蛋类、乳制品以及一些谷物和蔬菜都是良好的天然来源。
详细来说:
◖动物蛋白质:
◖植物蛋白:
◖蔬菜:
◖坚果和种子:
◖谷物:
◖发酵食品:
为了最大限度地增加谷氨酰胺的摄入量,请考虑结合不同的食物来源。举例来说:

谷氨酰胺补充剂并非所有人都需要,健康人一般无需补充。对于一些特定疾病或情况下需要补充谷氨酰胺的患者,也可以选择谷氨酰胺补充剂,包括片剂、粉末和胶囊等剂型。
谷氨酰胺的最佳形式是粉末形式;
胶囊形式通常含有不需要的添加剂,如服用谷氨酰胺胶囊,则必须大量服用才能达到有益剂量。
避免购买带有蛋白粉的谷氨酰胺,因为某些氨基酸会与谷氨酰胺竞争吸收。
购买时,质量应该是需要考虑的重要因素:
通常谷氨酰胺的剂量,每天两次,每次2-5克。
每天高达20-30克剂量在短期内是安全使用的。
有研究认为:
谷氨酰胺如果将其与水混合并空腹慢慢啜饮,效果最好。
在临床研究中,谷氨酰胺的剂量通常从每天几克到几十克不等。具体剂量应取决于医疗状况、患者体重和医生规定的治疗要求。请始终遵循医生的剂量说明。
谷氨酰胺补充剂的临床证据探索
谷氨酰胺补充剂的最佳递送方法、浓度和化学稳定性的临床证据仍然是一个持续探索的领域;治疗效果会受到溶解度和吸收等因素的影响。
谷氨酰胺的补充挑战
谷氨酰胺溶解度低(25 g/L);因此,局部、口服和肠内补充需要混悬液;添加双糖可以促进粘膜摄取。控制谷氨酰胺水平具有挑战性,因为谷氨酰胺在体内含量丰富,因为研究表明,即使在反复高剂量补充后,血浆谷氨酰胺水平的变化也很小。此外,监测局部谷氨酰胺浓度可能很困难,因为一般来说,血浆浓度和组织浓度之间的相关性很差。
此外,无论是口服、静脉注射还是局部给药,谷氨酰胺补充剂的生物利用度和有效性可能会有所不同。确定补充剂的最佳剂量和持续时间并确定获得最大益处的患者群体是完善谷氨酰胺补充剂在癌症治疗中临床应用的关键考虑因素。
谷氨酰胺二肽的应用前景
已经探索了通过游离和二肽形式递送谷氨酰胺,重点关注谷氨酰胺二肽的功效。谷氨酰胺二肽,特别是 l-丙氨酰-l-谷氨酰胺(Ala-Gln),已显示出减少危重患者感染并发症、住院时间和死亡率的功效,临床和实验研究支持。 游离谷氨酰胺和谷氨酰胺二肽之间的选择取决于患者的分解代谢情况和给药途径。
因此,在决定谷氨酰胺补充剂的途径、剂量和形式时,考虑患者的具体因素至关重要。
常见副作用包括:
更严重副作用包括:
头晕、昏厥、小便时疼痛、小便比平时多或小便突然减少、下背部或侧面疼痛、心跳加速、呼吸困难、面部、嘴唇或舌头肿胀等。
长期副作用包括:
高摄入量可能会改变身体使用氨基酸的方式,包括谷氨酰胺本身。这种变化的长期影响尚不清楚,但它可能会增加健康问题的风险。
例如,服用谷氨酰胺补充剂可能在短期内支持免疫系统,但其对免疫系统的长期影响仍然未知。一些证据表明,它可能以增加代谢综合征、糖尿病和冠状动脉疾病风险的方式影响新陈代谢。
对于患有消化系统疾病、进行剧烈运动、感染疾病、接受癌症治疗(包括放疗和化疗)、患有免疫疾病、慢性胃肠道疾病的人群,可能需要额外补充谷氨酰胺。
以下情况需遵医嘱:
没有足够的证据证实谷氨酰胺对孕妇或哺乳期女性是安全的。尽量遵医嘱。
L-谷氨酰胺可以降低血糖水平。谷氨酰胺可能可以改变一些糖尿病患者所需的药物量。如果您服用胰岛素,请务必在服用 L-谷氨酰胺补充剂之前咨询医生。
关于它在癌症患者中的使用存在一些争议。一些研究表明它有助于癌症的恢复,其他研究表明它可能会为癌细胞提供燃料。虽然人们担心谷氨酰胺对肿瘤生长的影响,但接受放化疗的患者每天摄入 10 – 30g 谷氨酰胺不会显著影响肿瘤大小或癌症相关临床结果,证明了摄入谷氨酰胺的安全性。癌症患者需更多了解结合实际情况和医生建议。
一些研究表明谷氨酰胺可能对肾病患者构成风险。老年人的肾功能通常下降,可能需要服用较低剂量的谷氨酰胺。
但也有一项研究发现,补充谷氨酰胺有助于改善肾功能,它甚至可以减少与心脏手术相关的肾损伤。因此还需要更多的研究。
如果患有瑞氏综合征,则应避免服用谷氨酰胺补充剂。
就药物相互作用而言,一些人认为谷氨酰胺可以降低乳果糖的降氨作用。这意味着,肝硬化和肝性脑病患者在服用 L-谷氨酰胺之前应该咨询医生,并且尽可能希望避免它。
摄入足够的 B 族维生素是有意义的,尤其是维生素B12,因为它们有助于身体代谢和使用谷氨酰胺等氨基酸。
总的来说,谷氨酰胺具有这些作用:
◆ 谷氨酰胺是胃肠道细胞的“食物”
谷氨酰胺是胃肠道管腔细胞的基本能量来源,以维持肠道粘膜结构的完整性。当我们处于某些疾病或应激状态时,谷氨酰胺被大量消耗,肠道粘膜处于“饥饿”状态,肠道粘膜萎缩、绒毛变稀、变短甚至脱落,导致肠道粘膜免疫屏障受损,通透性增加,细菌及内毒素趁机侵占肠道,发生细菌易位及菌血症。
谷氨酰胺还在癌症治疗期间发挥益处,如减轻胃肠道毒性、改善营养状况和生活质量等。
◆ 促进蛋白质的合成
谷氨酰胺是身体中氨和氮元素营养来源的一种直接关键物质,是合成氨基酸、蛋白质、核酸的前体物质。
◆ 抑制高分解代谢,防止肌肉分解
及时适量地补充谷氨酰胺能有效地防止肌肉蛋白的分解,并可通过细胞的水合作用,增加细胞的体积,促进肌肉增长。
◆ 免疫系统的重要燃料,增强免疫系统功能
谷氨酰胺具有重要的免疫调节作用,它是淋巴细胞分泌、增殖及其功能维持所必需的。
未来,需要进一步探索谷氨酰胺补充在不同人群和疾病中的最佳剂量、给药途径及持续时间,以制定更加合理的补充指南。同时,也应关注谷氨酰胺二肽等新型制剂的应用前景,它们可能具有更佳的溶解度和生物利用度。通过深入研究谷氨酰胺在肠道健康维护和疾病治疗中的作用机制,以及结合肠道菌群检测等手段,能够更好地发挥其的临床应用价值。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Ortiz-Reyes, Luis MSc1; Lee, Zheng-Yii PhD2; et al., The Efficacy of Glutamine Supplementation in Severe Adult Burn Patients: A Systematic Review With Trial Sequential Meta-Analysis. Critical Care Medicine 51(8):p 1086-1095, August 2023.
Tang G, Huang W, Zhang L, Wei Z. Role of Glutamine in the Management of Oral Mucositis in Patients with Cancer: A Meta-Analysis of Randomized Controlled Trials. Nutr Cancer. 2022;74(2):482-495.
Arribas-López E, Zand N, Ojo O, Snowden MJ, Kochhar T. The Effect of Amino Acids on Wound Healing: A Systematic Review and Meta-Analysis on Arginine and Glutamine. Nutrients. 2021 Jul 22;13(8):2498.
Hou YC, Wu JM, Chen KY, Wu MH, Yang PJ, Lee PC, Chen PD, Yeh SL, Lin MT. Glutamine and leucine administration attenuates muscle atrophy in sepsis. Life Sci. 2023 Feb 1;314:121327.
Petrus P, Lecoutre S, Dollet L, Wiel C, Sulen A, Gao H, Tavira B, Laurencikiene J, Rooyackers O, Checa A, Douagi I, Wheelock CE, Arner P, McCarthy M, Bergo MO, Edgar L, Choudhury RP, Aouadi M, Krook A, Rydén M. Glutamine Links Obesity to Inflammation in Human White Adipose Tissue. Cell Metab. 2020 Feb 4;31(2):375-390.e11.
Ramezani Ahmadi A, Rayyani E, Bahreini M, Mansoori A. The effect of glutamine supplementation on athletic performance, body composition, and immune function: A systematic review and a meta-analysis of clinical trials. Clin Nutr. 2019 Jun;38(3):1076-1091.
Bornstein R, Mulholland MT, Sedensky M, Morgan P, Johnson SC. Glutamine metabolism in diseases associated with mitochondrial dysfunction. Mol Cell Neurosci. 2023 Sep;126:103887.
Thomas K, Zondler L, Ludwig N, Kardell M, Lüneburg C, et al.,Glutamine prevents acute kidney injury by modulating oxidative stress and apoptosis in tubular epithelial cells. JCI Insight. 2022 Nov 8;7(21):e163161.
Corrado M, Frezza C. Glutamine availability unleashes dendritic cells’ anti-tumor power. Cell Chem Biol. 2023 Sep 21;30(9):1012-1014.
Hirabara SM, Gorjao R, Levada-Pires AC, Masi LN, et al., Host cell glutamine metabolism as a potential antiviral target. Clin Sci (Lond). 2021 Jan 29;135(2):305-325
Gong ZY, Yuan ZQ, Dong ZW, Peng YZ. Glutamine with probiotics attenuates intestinal inflammation and oxidative stress in a rat burn injury model through altered iNOS gene aberrant methylation. Am J Transl Res. 2017 May 15;9(5):2535-2547.
Gholamalizadeh M, Tabrizi R, Rezaei S, Badeli M, Shadnoush M, Jarrahi AM, Doaei S. Effect of glutamine supplementation on inflammatory markers in critically ill patients supported with enteral or parenteral feeding. JPEN J Parenter Enteral Nutr. 2022 Jan;46(1):61-68.
Dmitriev AV, Machulina IA, Shestopalov AE. Glutamin kak komponent nutritivno-metabolicheskoi terapii patsientov khirurgicheskogo profilya v usloviyakh ORIT [Glutamine as a component of nutritional and metabolic therapy for surgical patients in ICU]. Khirurgiia (Mosk). 2021;(8):98-106. Russian.
Lee IH, Walker DI, Lin Y, Smith MR, Mandl KD, Jones DP, Kong SW. Association between Neuroligin-1 polymorphism and plasma glutamine levels in individuals with autism spectrum disorder. EBioMedicine. 2023 Sep;95:104746.
Tao W, Xu G, Zhou J, Luo Y, Li PS. Glutamine Supplementation on Burn Patients: A Systematic Review and Meta-analysis. J Burn Care Res. 2024 May 6;45(3):675-684.
谷禾健康

有这样一些病人:经常性的腹痛、拉肚子、甚至便血、人也日渐消瘦,这很有可能是患有炎症性肠病。
炎症性肠病是一种慢性、非特异性的肠道炎症性疾病,因其顽固无法治愈且需要终身治疗的特点,又称为“绿色癌症”。目前全世界有超过1000万人患炎症性肠病。
在我国炎症性肠病的发病率也呈上升趋势,已经成为常见的肠道疾病,预计2025年患病人数将达到150万,且发病人群偏年轻化。如何预防和治疗炎症性肠病,成为了许多病友和大众关注的重点。
肠道微生物群是一个复杂而独特的实体,在宿主免疫、获取营养物质和强化肠道上皮方面发挥着重要的生理作用。与常见胃肠道疾病的预防、发病机制和进展有关。
虽然肠道微生物群主要由细菌主导,但先进的测序技术已经确定了共生真菌群落,统称为真菌群。大量研究和谷禾的检测数据发现,肠道炎症与微生物组成改变有关,称为肠道菌群失调。微生物群落改变与各种病理疾病有关,例如炎症性肠病(IBD),但它们作为炎症的原因或后果的作用仍是正在进行的研究主题。
而饮食在预防和管理各种疾病方面起着至关重要的作用,被认为是全身炎症的重要调节剂。近年来,随着饮食与肠道微生物关系的深入研究,我们逐渐认识到饮食不仅塑造了肠道细菌的组成,同样也在悄然影响着肠道真菌群落的结构和功能,包括真菌发酵中涉及的代谢途径和酶。
本文将探讨饮食如何调节肠道真菌群,并分析这一过程与炎症性肠病(IBD)之间的潜在联系,为未来饮食疗法在IBD治疗中的应用提供新的视角和研究方向。
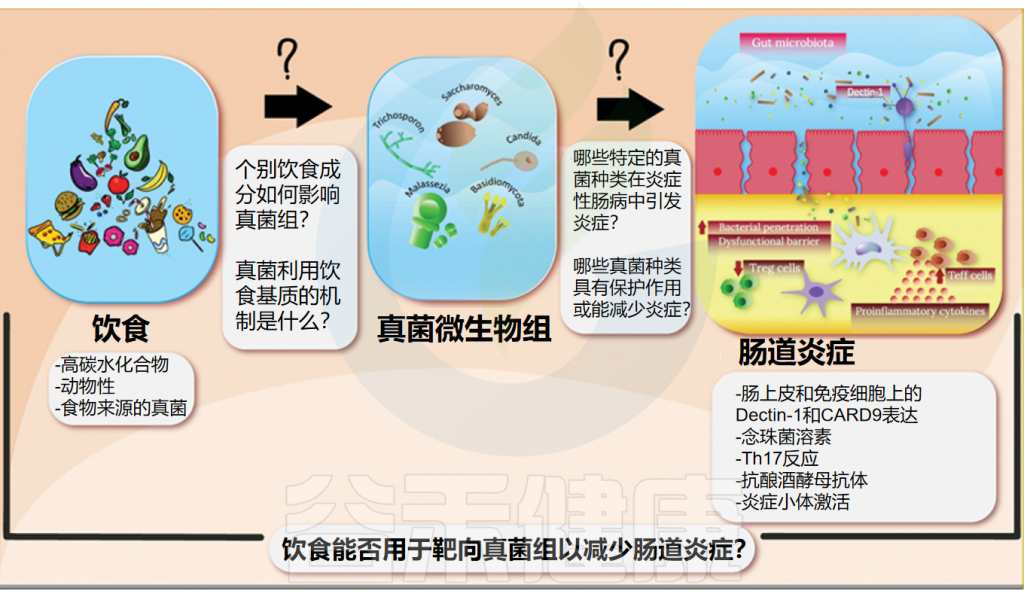
☆ 什么是炎症性肠病?
炎症性肠病(IBD)是一种慢性、非特异性的肠道炎症性疾病。包括溃疡性结肠炎(UC)和克罗恩病(CD)。克罗恩病涉及所有粘膜层,可在胃肠道的任何区域发现,并被细分为穿透性或狭窄性表型。溃疡性结肠炎累及直肠并向近端延伸,涉及粘膜和粘膜下层。
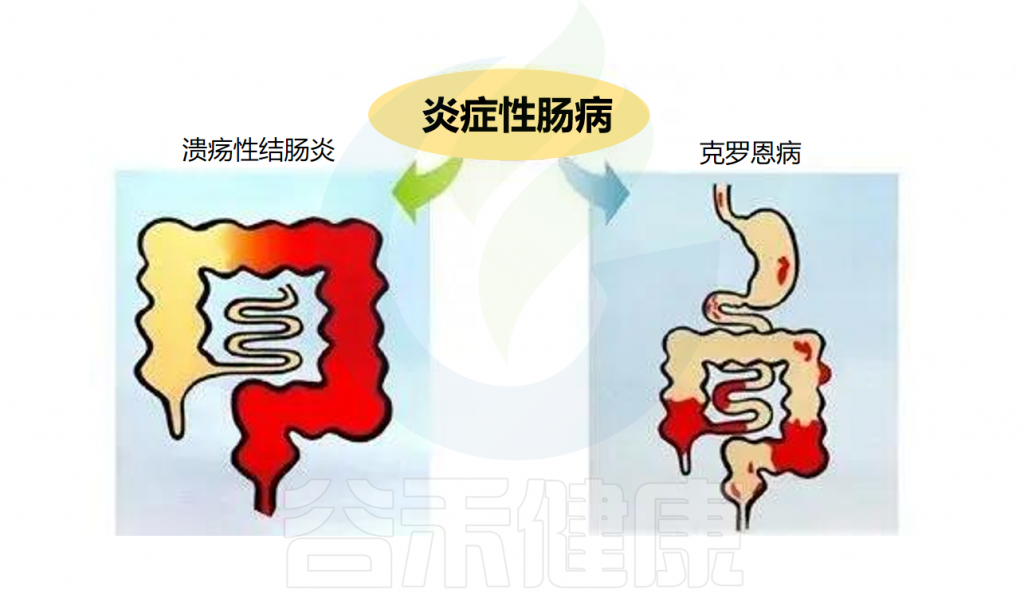
克罗恩病
-主要表现:腹泻、腹痛、大便带血、消瘦、乏力。
-可能还会出现:发烧 、关节痛、关节僵硬、眼睛红肿及疼痛、儿童生长或性发育延迟、皮肤红肿及发痛、口腔溃疡。
–并发症包括:瘘管、狭窄、脓肿、肠穿孔。
溃疡性结肠炎
主要表现:腹泻,多见黏液血便,常常伴发下腹部疼痛尤其以左下腹部疼痛多见。
可能还会出现:腹痛、腹胀、食欲不振、恶心、呕吐、发热、营养不良、关节炎、口腔溃疡。
并发症包括:下消化道大出血,肠穿孔、中毒性巨结肠及癌变。
☆ 炎症性肠病患病率有多高?
近几十年来,炎症性肠病(IBD)发病率逐年上升,目前已成为全球性疾病,具有显著的患者发病率和卫生保健负担。
在全球范围内,IBD的患病人数从1990年的332万例增加到2010年的490万例,增加了47%。据相关数据推测,预计到2025年,全球超过1000万人受到炎症性肠病的影响,我国炎症性肠病患者将达到150万,且以青壮年居多,发病高峰年龄为15至40岁。
注:在欧洲和北美,IBD已经逐步发展为常见疾病。比如在患病率最高的国家,UC和CD的患病率都已高达823/10万。在美国,目前大约有160万UC或CD患者,每年约7万人确诊为IBD。目前中国地区IBD发病率为1.96/10万-3.14/10万左右。
☆ 为什么会得炎症性肠病?
目前暂未明确炎症性肠病的发病机制,可能与多种因素有关:包括遗传因素、感染因素、过度反应的T细胞介导的免疫因素、环境触发因素、生活饮食因素和肠内微生物群因素。
炎症性肠病的日益流行引发了基础科学和临床研究的广泛关注,促使研究者们致力于开发有效的短期和长期治疗方案。这些研究的统一目标是显著减少患者的住院率,并同时提高患者的生活质量,以应对这一日益严重的健康问题。通过不断探索和创新,找到了一些有效的治疗方法,以改善患者的整体健康状况和生活体验。
▸ 药物治疗
抗炎药物短期效果好
炎症性肠病(IBD)的药物治疗是双管齐下的,旨在诱导或维持缓解。包括皮质类固醇和5-氨基水杨酸在内的抗炎药物可以通过多种方式给药,并且在及时诱导活动期病情缓解方面最为有效。
生物制剂可改善长期预后并提高疗效
相比之下,免疫调节剂和生物制剂起效较慢,但可以通过实现长期缓解维持来改变疾病轨迹。生物制剂是基于蛋白质的分子,可以阻断促炎细胞因子。
近年来,生物制剂已成为IBD治疗的基石,有证据表明,在IBD病程早期应用生物制剂可改善长期预后并提高疗效。此外,鉴于生物源化合物耗尽其开放性,生物疗法变得更具成本效益。
注:目前批准了四种不同类别的生物制剂:抗TNF制剂、抗整合素制剂、抗白介素12/23 IgG 1κ制剂和鞘氨醇-1-磷酸(S1P)抑制剂。
生物疗法的出现减少了炎症性肠病(IBD)相关的住院和腹部手术,然而,与IBD相关的总体发病率仍然很高。
▸ 饮食疗法
炎症性肠病(IBD)患者经常询问饮食策略来控制他们的胃肠道症状。饮食调节作为一种非药物疗法,具有显著的益处,其可以调节炎症和促进粘膜愈合并且基本没有副作用。
肠内营养
纯肠内营养(EEN)是一种通过消化道提供全面营养的方法,包括营养全面的流质饮食。在儿科克罗恩病患者中使用纯肠内营养(EEN)显示出与类固醇相似的功效,促进黏膜生长而无相关副作用。
部分肠内营养(PEN),允许一些食物摄入,比EEN耐受性更好,以克罗恩病排除饮食(CDED)为例。避免或减少动物/乳制品脂肪/蛋白质、小麦和食品添加剂的饮食相结合,允许逐渐重新引入水果、蔬菜和豆类以提高食物的灵活性。
特定碳水化合物饮食
一些针对成年IBD患者的饮食,如特定碳水化合物饮食(SCD),已经显示出减轻胃肠道症状的前景。SCD限制IBD患者难以吸收的复合碳水化合物,避免食用谷物、淀粉类蔬菜、乳制品、糖和甜味剂以及某些食品添加剂。
地中海饮食
地中海式饮食最近受到了关注,因为它限制较少,但却和SCD一样有效。这种饮食强调水果、蔬菜、坚果、鱼、全谷物、油性鱼和橄榄油,可以减少炎症,同时限制具有促炎症特性的动物脂肪/蛋白质和食品添加剂。
高膳食纤维并不总是有益
虽然膳食纤维通常被认为对健康有益,但一些炎症性肠病患者,尤其是在疾病活动期,对高纤维食物的耐受性降低。
在活动期疾病患者中证明,某些纤维,特别是低聚果糖(FOS),触发了促炎细胞因子IL-1β。而用来自非IBD或轻度感染患者的微生物群发酵FOS减少了IL-1β的分泌。但这种减少在大多数患有中度或重度IBD患者的微生物群中并不存在,这表明共生微生物群对FOS的发酵不足可能导致异常的免疫反应。
尽管饮食在炎症性肠病(IBD)发病机制中的作用已被认可,但我们对其对IBD进展的影响仍不够深入。目前尚未定义一种能够促进活动性疾病成年患者病情缓解的“IBD饮食”。需要加强对饮食对人类肠道影响的理解,特别是饮食与肠道微生物之间的关系及其在炎症中的作用。
最近的研究表明,肠道微生物群对不同纤维的反应存在相当大的个体间差异。菊粉和欧车前纤维的微生物群组成和功能差异很大,一些个体具有纤维抗性微生物群,而另一些个体具有纤维敏感性微生物群。这强调了个性化饮食建议的必要性,特别是在管理肠道健康和炎症方面。
人类肠道内居住着超过100万亿个微生物,包括细菌、古菌、病毒和真菌。这些微生物统称为肠道微生物群。肠道微生物群是一个复杂而独特的实体,与常见胃肠道疾病的预防、发病机制和进展有重要联系。
☆ 真菌虽然只占肠道微生物群的一小部分,但与多种疾病相关
然而,肠道中超过99%的微生物基因属于细菌,真菌只构成了常驻微生物群的一小部分,在不同的身体部位,包括皮肤、泌尿生殖系统、呼吸道和胃肠道,已经鉴定出390多种真菌。
尽管与细菌相比,真菌的多样性和丰度较低,但真菌的组成和功能与多种疾病有关,包括炎症性肠病、结直肠癌和代谢综合征。
☆ 肠道核心真菌群
然而,微生物组的研究主要集中在细菌上,而对真菌等其他重要的微生物组关注不够。真菌是单细胞或多细胞的异养真核生物,具有惊人的分解和获取营养物质的能力。
早期的研究集中在真菌对肠道健康的潜在危害上,随着人类微生物组项目的出现,真菌物种作为具有共生和互利关系的微生物组的必要组成部分获得了证明。
人体肠道内真菌的多样性和丰度较低,但个体之间存在相当大的可变性,然而,一些真菌物种在个体之间是共享的,这表明可能存在肠道核心真菌群落。
为了描述哪些真菌物种是本地的并有助于肠道健康,真菌群落被分为常驻和非常驻物种。常驻物种具有在缺氧的肠道环境中生长的内在能力,包括子囊菌门、担子菌门和接合菌门中的属,例如假丝酵母菌属(Candida)、马拉色菌属(Malassezia)和枝孢菌属(Cladosporium)。
相比之下,非常驻物种是通过非培养技术在肠道中分离出来的,常见的非常驻物种包括酵母属(Saccharomyces),曲霉属(Aspergillus),以及青霉菌属(Penicillium)等。非常驻物种通常是外部影响的产物,如短期饮食暴露或环境触发因素。这个亚群占分离真菌种类的三分之二。
念珠菌
常驻真菌中最常报道的是假丝酵母菌(Candida),假丝酵母菌又称念珠菌。包括白色念珠菌(C.albicans)、热带念珠菌(C.tropicalis)、近平滑念珠菌(C.parapsilosis),以及光滑念珠菌(C.glabrata)。
具有共生和致病双重特性
白色念珠菌是一种具有共生和致病双重特性,最广为人知的是作为肠道、口腔粘膜、阴道和血液的条件致病菌。它是每年数百万阴道和口腔感染病例的原因,当感染免疫低下的宿主时,导致显著的死亡率。
经历肠道诱导的转变更适合营养吸收
白色念珠菌当暴露于哺乳动物肠道时,会经历“胃肠诱导的转变”,这被认为部分是由于WOR1转录因子,导致更适合短链脂肪酸(SCFA)和N-乙酰氨基葡萄糖营养吸收的表型变化。
白色念珠菌的形态转变机制尚未完全了解,初步研究认为宿主上皮细胞在其中起调节作用。
马拉色菌
马拉色菌属主要以皮肤的定植者和病原体而闻名,也是肠道内第二普遍的真菌种类。其中,M.globosa、M.restricta、M.sympodalis和M.pachydermatis是肠道中最普遍的物种。
马拉色菌经常定植于富含皮脂的区域
几乎所有种类的马拉色菌属不合成脂肪酸,而是依赖外部来源的脂质,这解释了它们在人类皮肤富含皮脂的区域增殖。
在肠道内,脂质可从胆汁盐中获得,胆汁盐由胆汁酸通过肝细胞合成。人们对马拉色菌如何在人类肠道中定植仍然知之甚少,相互竞争的假设包括从人体皮肤间接暴露或由于婴儿期摄入母乳。
在炎症性肠病患者中更多,并可能导致黏膜炎
无论机制如何,马拉色菌都是真菌定植的主要参与者,最近的研究表明它与肠道共生有关。然而,在某些情况下,马拉色菌具有致病潜力,会诱发有害的、异常的免疫反应。
在皮肤上,它与脂溢性皮炎和花斑癣的发病机理有关。与肠道相比,马拉色菌在胰腺导管腺癌组织中的相对丰度更高,通过刺激模式识别受体甘露糖结合凝集素(MBL)与肿瘤发生有关。与健康对照者相比,在炎症性肠病患者中发现的马拉色菌相对比例更高,并且被认为会导致粘膜炎。
酵母菌
酵母菌被认为是人类肠道的非常驻真菌,通常是短暂的定植者和饮食习惯的结果。其中最主要的物种是酿酒酵母。它有助于面包发酵、啤酒酿造,可用作食品添加剂。它在肠道微生物组稳态中的作用经常被忽视。
有助于减轻胃肠道疾病引起的腹泻
最近的研究表明,酵母菌确实可以在肠道中茁壮成长,代谢被称为粘蛋白的高度糖基化蛋白质。布拉氏酵母菌(S.cerevisiae var. boulardii),为酿酒酵母变种,是一种众所周知的益生菌酵母物种,已知有助于解决各种胃肠道疾病,包括旅行者腹泻和抗生素相关性腹泻。研究表明克罗恩病(CD)患者的结肠通透性降低之后,使用布拉氏酵母菌有助于治疗CD。
胃肠道承载着一系列微生物,它们共同形成复杂而动态的生态系统。最近,人们开始关注细菌-真菌的相互作用,因为它们与疾病有关。
细菌-真菌存在互惠共生和竞争
细菌-真菌相互作用可能是互利的,然而,建立特定生态位或营养的竞争可能导致细菌和真菌的失衡。有各种各样的机制参与细菌-真菌的相互作用和拮抗作用。
一项研究表明,纤维发酵过程中细菌产生的短链脂肪酸本身具有抗真菌的特性。另一项研究发现细菌细胞壁合成过程中分泌的肽聚糖片段直接结合并灭活白色念珠菌,阻止其从出芽酵母转变为细长的菌丝。
稳定的肠道细菌群有助于抵抗病原真菌
一个稳定多样的肠道细菌群落调节其真菌对应物。在肠道炎症或长期使用抗生素期间,肠道中的细菌数量减少,使其容易受到侵袭性真菌物种的影响。这在一项涉及用万古霉素治疗的小鼠研究中得到强调,该研究显示在没有细菌种类的情况下存在播散性白色念珠菌感染。因此,病原真菌不仅受宿主免疫的调节,还受各种共生细菌的调节。
真菌和细菌相互作用以优化它们的微环境。肠道微生物产生一种称为生物膜的细胞外基质,以防止抗菌因子。体外研究表明,热带念珠菌(C.tropicalis)、大肠杆菌(E.coli)和粘质沙雷氏菌(Serratia marcescens)共生作用,形成比它们单独产生的能力要厚得多的生物膜。
扫描电子显微镜揭示了这三种生物体之间的密切相互作用,粘质沙雷氏菌使用菌毛将大肠杆菌和热带念珠菌连接在一起。
众所周知,炎症性肠病(IBD)患者体内的微生物群发生了改变,以往的研究主要集中在细菌的相对失衡上。IBD患者的细菌生物多样性降低,来自厚壁菌门的细菌相对减少,来自变形杆菌门的细菌相对增加。
炎症性肠病患者的真菌群落主要由子囊菌门和担子菌门的真菌组成,最常见的属包括酵母属、德巴利酵母(Debaryomyces)、青霉属、曲霉属,以及念珠菌属。
☆ 不同IBD表型真菌群落存在差异
炎症性肠病涉及疾病表型的异质性集合。疾病的表型和炎症的程度与独特的菌群特征有关。在克罗恩病(CD)中,与仅发生在结肠的疾病相比,霉菌种群因累及回肠的疾病而异。特别是,保留回肠的CD显示出较高的念珠菌和德巴利酵母菌,而曲霉菌属(Aspergillus)和毕赤酵母菌(Pichia)在回肠受累的CD中的丰度较高。
在疾病发作期间,与对照组相比,担子菌门与子囊菌门的比率增加。在物种水平上,处于活动发作期的克罗恩病患者显示出念珠菌属、Gibberella moniliformis、Alternaria brassicicola和新型隐球菌(Cryptococcus neoformans)的相对丰度更高。
当根据疾病程度分类时,菌群组成的变化在溃疡性结肠炎(UC)中最为突出。直肠炎患者的青霉菌相对丰度最高,随着疾病程度向近端进展呈负相关。与直肠炎患者相比,毕赤酵母菌(Pichia)在左侧结肠炎患者中的比例过高。
☆ 白色念珠菌增加,导致促炎细胞因子释放
随着与炎症性肠病发作相关的独特微生物组特征得到进一步验证,真菌致病因子在促炎状态中的作用逐渐被认可。
与健康对照相比,炎症性肠病(IBD)患者肠道中白色念珠菌的丰度增加。在菌丝形式中,白色念珠菌上调内皮转化酶1(ECE1)基因,导致ECE1蛋白的丰度更高。这种蛋白质经过蛋白水解加工以释放其活性形式,称为念珠菌溶血素。
念珠菌溶血素是一种31个氨基酸的溶细胞肽,以破坏上皮细胞质膜和刺激编码促炎细胞因子的转录因子而闻名。念珠菌溶血素还损害巨噬细胞的功能,对其抗真菌能力产生负面影响。与健康对照相比,一组克罗恩病患者表现出对念珠菌溶血素特异性的IgA介导的反应水平较低。这表明炎症性肠病患者的高免疫原性真菌病原体没有得到充分控制,并可能导致其促炎状态。
☆ 可作为炎症的替代标志物
作为炎症性肠病中真菌分析的副产品,某些物种已被确定为炎症的替代标志物。与同一克罗恩病(CD)患者体内的发炎组织相比,发现酿酒酵母在非发炎组织中的相对丰度更高。活跃发作的克罗恩病患者表现出更高水平的抗酿酒酵母抗体(ASCA)。
抗酿酒酵母抗体(ASCA)也被用于疾病预测,与对照组相比,在后来诊断为CD的患者中发现的ASCA 水平更高。此外,ASCA已被推断为疾病严重程度的预测指标,与ASCA IgG阴性的CD患者相比,ASCA IgG阳性患者的手术干预率更高。
对患有克罗恩病患者进行定期筛查抗酿酒酵母抗体(ASCA)尚未渗透到临床医学的常规实践中,但它作为一种辅助的、无创的疾病活动和严重程度的衡量方法继续显示出前景。
肠道真菌通过先天和适应性免疫系统影响宿主免疫,这是由真菌细胞壁成分和肠道免疫细胞的模式识别受体(PRR)之间的相互作用引发的。
真菌激活先天免疫和适应性免疫
真菌的吞噬作用导致各种免疫反应的激活,以努力控制真菌的定居。当这些调节机制功能障碍或缺失时,真菌定植不受抑制,导致肠道微生物结构紊乱和肠道炎症。
通过几个检查点,先天和适应性免疫系统可以区分共生真菌或致病真菌。鉴于白色念珠菌可作为共生因子或致病因子,通常用于免疫学分析,以帮助区分这些不同的免疫反应。蛋白质相关分子模式(PAMPs)白色念珠菌和其他真菌与肠道单核吞噬细胞(MNPs)上的toll样受体(TLRs)、C型凝集素受体(CLRs)和NOD样受体(NLRs)相互作用。
例如,巨噬细胞甘露糖受体1(MMR)、树突细胞特异性ICAM3抓取非整合素(DC-SIGN)和巨噬细胞诱导型C-型凝集素(MINCLE)识别某些真菌细胞壁上富含甘露糖的结构。常见的MNPs C型凝集素受体包括dectin-1和dectin-2。dectin-1与真菌β-葡聚糖结合后刺激构象变化,暴露其尾部的免疫受体基于酪氨酸的激活基序(ITAM),随后被SRC家族激酶磷酸化。这一过程使得磷酸化的ITAMs能够与脾酪氨酸激酶(Syk)的SH2结构域结合,激活含有胱天蛋白酶募集结构域的CARD9,并引导Th-17细胞的诱导,动员中性粒细胞进入肠道。
共生和致病形态分别通过不同的免疫途径影响肠道炎症
dectin-1与白色念珠菌或曲霉菌上的β-葡聚糖结合,促进生物活性IL-1β从非活性形式pro-IL-1β通过非经典caspase-8炎性小体激活。重要的是,caspase-8炎性小体的激活不依赖于真菌物质的内化。因此,dectin-1能够在识别外部真菌细胞壁成分后,通过激活IL-1β产生快速有效的反应。IL-1β是IL-1家族的一员,以诱导全身炎症而闻名,同时也能防御外来抗原。作为对真菌识别的反应,IL-1β刺激辅助性T细胞,动员中性粒细胞,并增强吞噬作用,以改善肠道中真菌病原体的清除。
当白色念珠菌处于共生酵母形态时,其负责炎症小体和IL-17通路的PAMPs被隐藏。当它转变为致病菌丝形式时,炎症小体通路和IL-17信号通路被激活。特别是,TLR会分泌细胞因子,如IL-1β、IL-23和IL-6,促进CD4+ T细胞激活进入Th17谱系。Th17细胞则分泌IL-17,招募巨噬细胞、中性粒细胞和抗菌肽,产生有效的抗真菌反应。因此,致病真菌上的PAMPs与宿主树突状细胞上的PRR之间的独特相互作用决定了炎症反应。
共生真菌通过训练免疫系统增加对病原体的抵抗
真菌群在宿主免疫中发挥重要作用。参与真菌识别的巨噬细胞和单核细胞在接触共生真菌(如酿酒酵母)后会获得训练,进一步接触细菌或真菌时,TNF-α和IL-6的产生会增加。
真菌共生菌直接参与稳定肠道稳态,白色念珠菌能够在宿主应激时脱落其致病菌株,保护宿主免受细菌和真菌病原体的侵害。
此外,真菌共生对结肠炎相关的致癌作用也有保护作用。与野生型小鼠相比,真菌耗尽的小鼠在施用氧化偶氮甲烷-葡聚糖硫酸钠(AOM/DSS)后结肠肿瘤发生率更高,而补充外源性IL-18则显著降低肿瘤发生率。因此,真菌共生通过炎症小体途径在预防结肠炎及其相关癌症中发挥重要作用。
鉴于肠道微生物组的广泛多样性及其对人类健康的独特、多模式影响,优化肠道微生物组以改善健康的机制已成为许多新兴研究的焦点。饮食不仅是胃肠道内许多微生物成分的载体,也是其主要营养来源。因此,饮食调节可以通过微生物群组成和功能的变化间接传播起到促炎或抗炎作用。
例如,以植物为基础的饮食与肠道细菌向更具抗炎性的转变有关,其特征是更高的普拉梭菌(Faecalibacterium prausnitzii),直肠真杆菌(E.rectale)和两形真杆菌(Eubacterium biforme),均为丁酸盐生产者。
注:丁酸盐对人体健康的重要性已经在谷禾之前的多篇文章中有过具体讲述。
相反,以肉类为基础的饮食与更易引发炎症的特征相关,这些特征包括活泼瘤胃球菌属(Ruminococcus gnavus)和柯林斯氏菌物种(Collinsella species)的增加。
然而迄今为止,大多数饮食微生物组研究关注点主要集中在细菌种群的组成和功能变化上。鉴于真菌群落在肠道健康中的重要性,有必要进一步研究饮食调节对这一重要群落的影响。这一更广阔的视角会增强我们对饮食如何针对微生物群的所有关键成员的理解,为它们对肠道健康和疾病的影响提供更全面的见解。
可消化的碳水化合物,如单糖、二糖和淀粉多糖,在被身体消化分解为能量并吸收。相比之下,大多数不易消化的碳水化合物或纤维与胃肠道微生物群相互作用,主要在结肠中进行发酵。这个发酵过程产生气体、短链脂肪酸和其他代谢物。
• 念珠菌与近期摄入的碳水化合物呈正相关
研究表明念珠菌与最近的碳水化合物摄入呈正相关。此外,发现高果糖、葡萄糖、麦芽糖和蔗糖的摄入增加了内皮细胞的粘附假丝酵母物种(白色念珠菌,热带念珠菌,以及克柔念珠菌)到上皮细胞。此外,减少饮食中的单糖和淀粉已被证明可以减少肠道中念珠菌的慢性过度生长。
• 高碳水化合物饮食的真菌变化
观察到,与健康的日本人相比,健康的印度成年人的粪便微生物群中含有更高比例的念珠菌和普雷沃氏菌,这可能是由于印度成年人对膳食植物多糖的摄入量较高。
高碳水化合物饮食增加了五个真菌属:
Pleurotus ↑↑↑
Kazachstania ↑↑↑
Auricularia ↑↑↑
Paraphaeosphaeria ↑↑↑
Ustilaginaceae ↑↑↑
并降低了布氏白粉菌属(Blumeria)。
相反,低碳水化合物饮食导致了肠道真菌群落的显著变化,减少了:
Blumeria ↓↓↓
Agaricomycetes ↓↓↓
Malassezia ↓↓↓
Rhizopus ↓↓↓
Penicillium ↓↓↓
增加了Ustilaginaceae。
一些真菌群也可以产生短链脂肪酸,并呈正相关
多项研究表明念珠菌有助于将复杂的碳水化合物发酵成单糖,单糖是其他微生物的能量来源。对猪的研究发现,饮食中碳水化合物含量的差异与不同的真菌种群和短链脂肪酸(SCFA)产量有关。具体来说,低碳水化合物饮食的猪具有较低水平的乙酸盐、丁酸盐和总短链脂肪酸,一些真菌属与这些短链脂肪酸正相关,包括Tomentella,Metschnikowia和Loreleia。
人类研究中膳食碳水化合物调节对肠道真菌的影响


Buttar J,et al.Gut Microbes.2024
因此,膳食碳水化合物的摄入可能会影响肠道真菌种群及其代谢活动,未来的研究应侧重于阐明不同碳水化合物影响真菌群落的确切机制。
肠道微生物群高度参与蛋白水解发酵,产生短链脂肪酸、支链脂肪酸(BCFA)、气体和有害的腐败代谢物,如氨、胺和硫化氢。
• 真菌对氨基酸的高利用率提高其在肠道中的存活率
一项体外研究发现,氨基酸利用率与真菌生长呈正相关。氨基酸可以作为白色念珠菌的碳源,因为这种真菌物种产生蛋白酶并具有寡肽转运蛋白,使白色念珠菌能够通过代谢途径调节适应不同的环境。
在另一项研究中,发现酿酒酵母(S.cerevisiae)和无冠构巢曲霉(Aspergillus nidulans)使用转运蛋白,如氨基酸-多胺-有机阳离子(APC)超家族和主要促进剂超家族(MFS)来利用氨基酸,这可以提高真菌在肠道中的存活率。
• 高蛋白饮食与念珠菌丰度呈负相关,与酵母菌呈正相关
很少有研究评估富含蛋白质的饮食对人类的影响。研究了影响肠道真菌群落稳态的因素,发现乳制品消费是一种高蛋白食物来源,与念珠菌呈负相关,与酵母菌呈正相关。
膳食脂肪主要在小肠中被消化和吸收,并在小肠中代谢,为身体提供能量和各种脂肪酸。一项人类研究表明,脂肪会影响肠道真菌群落。具体来说,证明了念珠菌与总饱和脂肪消耗量呈负相关。
• 脂肪酸可能抑制真菌的生长
体外研究表明,不同真菌物种将脂肪酸和脂肪醇代谢为碳源和能源的效率差异很大。脂肪酸可以抑制真菌的生长。在专注于食品防腐的研究中,发现饱和脂肪酸、不饱和脂肪酸和氧化脂质具有抗真菌特性。
由于缺乏研究调查脂肪对人类肠道真菌群落的影响,这些饮食成分对肠道真菌群落的影响仍然不清楚。然而,在一项小鼠研究中,与喂食标准食物的小鼠相比,喂食高脂肪饮食的小鼠几种真菌类群有所增加,包括Alternaria, Saccharomyces, Septoriella和Tilletiopsis。
动物模型中饮食调节对肠道菌群的影响

Buttar J,et al.Gut Microbes.2024
虽然膳食脂肪对能量代谢至关重要,但它们对肠道真菌群落的影响还不太清楚。未来的研究还需要深入研究膳食脂肪在塑造肠道真菌群落中的作用。
已经发现某些饮食习惯和模式显著影响肠道真菌群落的组成。城市化和饮食习惯的变化会导致中国不同地区人群真菌组成的差异。

这项研究确定了食用酪乳和蓝莓茶与Tetrapissipora blattae、Sugiyamaella lignohabitans、Kazachstania naganishii等的存在之间的相关性。
此外,红茶和猪肉的消费与镰刀真菌属(Fusarium spp.)的四个物种的组成有关。
在另一项研究中,发现杏仁和开心果的摄入与念珠菌和青霉菌属呈负相关。此外,对动物性饮食和植物性饮食进行了比较分析,结果显示动物性饮食组中Neosartorya fischeri(一种源自青霉属的真菌)的丰度更高。
• 素食者体内易出现食源性真菌
研究表明,超过60%的素食者粪便样本中存在食源性真菌,如青霉菌和曲霉菌,以及潜在的致病真菌,如镰刀菌和马拉色菌,但这些真菌类群在食用西方饮食的个体中很少发现。小鼠研究进一步支持饮食调节对真菌群落特征的影响。与标准食物相比,喂食加工饮食的小鼠的总体真菌多样性降低。
• 酵母菌可能随饮食来源进入体内
另一个值得注意的方面是我们的食品中普遍存在常见的肠道真菌,例如酿酒酵母(S.cerevisiae)和汉斯德巴氏酵母菌(Debaryomyces Hansenii)。这些真菌常见于乳制品、面包、果皮(包括葡萄)、普洱茶和奶酪中,因此很难确定这些真菌物种是真的存在于肠道中,还是在自然界中更短暂。
研究发现,食用不含酿酒酵母的饮食导致酿酒酵母水平从基线时的86%大幅降低到无酿酒酵母饮食2天后ITS读数的 0.1%。这表明酿酒酵母的丰度高度依赖于这种真菌物种的饮食来源。
因此,探索特定真菌物种对疾病潜在影响的研究应考虑食物来源的真菌分类群的潜在短暂性。这种考虑很重要,因为它可能会影响这些物种在健康和疾病中的重要性。
• 利于真菌群落稳态和健康的饮食
最近的营养学研究利用Mycobiome 饮食来选择性地改变肠道中真菌的组成。Mycobiome 饮食的特点是消耗瘦肉或植物蛋白、单不饱和脂肪或多不饱和脂肪、富含纤维和抗性淀粉的食物,同时避免加工的高糖食物。
遵循Mycobiome饮食28天导致念珠菌的丰度下降了72.4%,尤其是白色念珠菌和热带念珠菌。此外,Mycobiome饮食增加了一些有益真菌物种的浓度,包括Pichia kluyveri和Galactomyces geotrichum。
这种饮食除了对肠道菌群的有益影响外,还使小肠细菌过度生长患者的细菌过度生长减少,并改善了所有参与者的疲劳、睡眠、腹胀、便秘和腹泻。
尽管研究表明,真菌群落随着饮食而变化,但我们对饮食对这些微生物功能潜在影响的了解仍然有限。据了解,细菌和真菌群落都产生代谢物,这些代谢物不仅形成它们自己的群体,而且对其他群落成员和各种宿主细胞群体施加影响。
作为对高纤维饮食的响应,肠道细菌上调功能途径和酶,使纤维发酵产生短链脂肪酸,特别是丁酸。
真菌作为真核生物,表现出与细菌等原核生物不同的代谢特征。真菌具有发酵植物细胞壁的代谢途径和酶,一些真菌种类在食品工业中用于乙醇生产,并通过发酵果胶、纤维素和木质素等纤维产生乳酸和气体。
真菌在降解纤维素纤维方面优于细菌。真菌产生更多的甲烷、乙酸盐和甲酸盐,而细菌产生更多的丁酸盐和丙酸盐。
重要的是要考虑代谢物在调节肠道细菌和真菌之间的作用。代谢物,如胆汁酸,可以影响微生物的相互作用,因为真菌有能力通过胆汁酸的转化对细菌的生存力产生不利影响。
!
小贴士
饮食对改变真菌群落组成的影响可能不直接归因于饮食成分对肠道真菌的影响。相反,这些影响可能是间接的,源于肠道细菌的调节,进而影响真菌的组成。
由于阐明饮食如何调节肠道真菌群落背后的机制的证据有限,有必要进行进一步的研究来辨别饮食对肠道真菌群落的直接和间接影响。
肠道微生物组是一个复杂而独特的实体,能对环境、饮食和疾病的变化做出反应。它充满了来自各个种群的微生物,通过复杂而动态的关系相互作用。虽然细菌是微生物组稳态中最重要的部分,但真菌在其中也起着不容忽视的作用,参与机会性病原体的调节和原本无法获得的营养物质的发酵。
菌群结构的改变与菌群失调有关,菌群失调是一种与包括炎症性肠病(IBD)在内的各种慢性疾病有关的发炎免疫状态。菌群概况因IBD表型和严重程度而异,菌群标志物有望作为疾病进展的指标。
还需研究饮食对非细菌微生物群的调节作用,以及参与真菌发酵和膳食成分利用的代谢途径和酶的机制。深入了解饮食如何影响肠道菌群的组成和功能至关重要。这些知识将帮助确定饮食疗法是否应该专门针对肠道真菌,从而可能减轻炎症并改善炎症性肠病患者的预后。
主要参考文献
Buttar J, Kon E, Lee A, Kaur G, Lunken G. Effect of diet on the gut mycobiome and potential implications in inflammatory bowel disease. Gut Microbes. 2024 Jan-Dec;16(1):2399360.
Rinninella E, Raoul P, Cintoni M, Franceschi F, Miggiano GAD, Gasbarrini A, Mele MC. What is the healthy gut microbiota composition? A changing ecosystem across age, environment, diet, and diseases. Microorganisms. 2019. Jan 10;7(1):14.
Liang G, Cobián-Güemes AG, Albenberg L, Bushman F. The gut virome in inflammatory bowel diseases. Curr Opin Virol. 2021. Dec;51:190–198.
Nacer S, Haddad F, Tahiri M, Hliwa W, Badre W, Choukri EM, Jai SR, Erguibi D, Boufettal R, Chehab F. P51 predictive factors of surgery in crohn’s disease. Gut. 2022.
Wang R, Li Z, Liu S, Zhang D. Global, regional and national burden of inflammatory bowel disease in 204 countries and territories from 1990 to 2019: a systematic analysis based on the global burden of disease study 2019. BMJ Open. 2023. Mar. 13(3):e065186.
Sigall-Boneh R, Levine A, Lomer M, Wierdsma N, Allan P, Fiorino G, Gatti S, Jonkers D, Kierkuś J, Katsanos KH, et al. Research gaps in diet and nutrition in inflammatory bowel disease. A topical review by D-ECCO working group [dietitians of ECCO]. J Crohns Colitis. 2017.
Raimondi S, Amaretti A, Gozzoli C, Simone M, Righini L, Candeliere F, Brun P, Ardizzoni A, Colombari B, Paulone S, et al. Longitudinal survey of fungi in the human gut: ITS profiling, phenotyping, and colonization. Front Microbiol. 2019. Jul 10;10:1575.
Dalle F, Wächtler B, L’Ollivier C, Holland G, Bannert N, Wilson D, Labruère C, Bonnin A, Hube B. Cellular interactions of Candida albicans with human oral epithelial cells and enterocytes. Cell Microbiol;2010;12(2):248–271. doi: 10.1111/j.1462-5822.2009.01394.x.
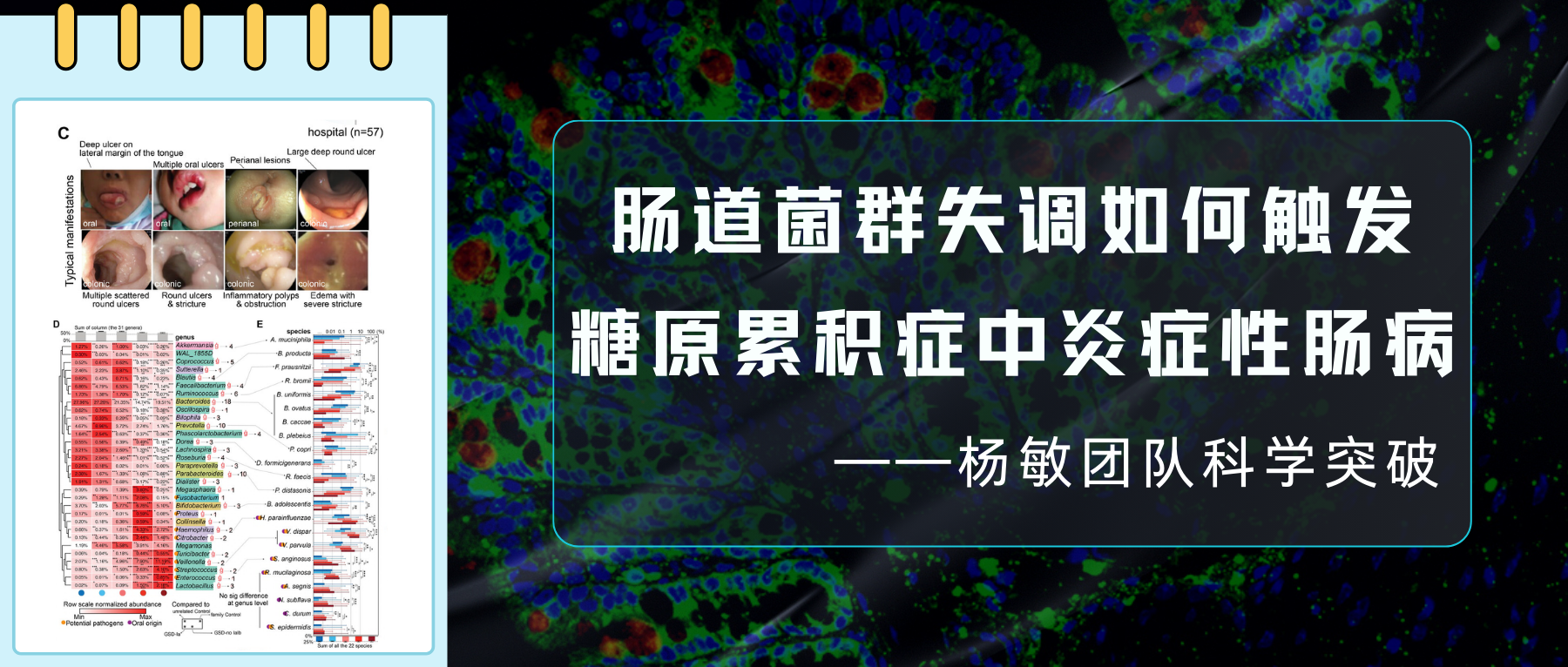
谷禾健康
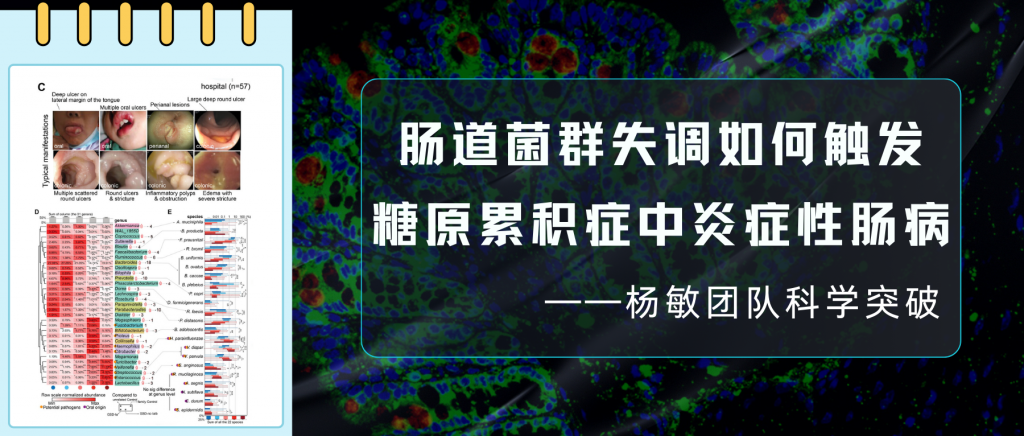
2024年6月19日,广东省人民医院儿科杨敏团队取得了一项备受瞩目的成果。该团队关于“肠道菌群失调通过糖原贮积病中的 CCL4L2-VSIR 轴引发炎症性肠病”,在国际著名期刊《Advanced Science》(影响因子IF=15.1)发表,针对这一通路不仅可以为 GSD 患者提供有益的治疗,还可以为结肠炎和其他形式的 IBD 患者提供有益的治疗。
谷禾健康技术团队参与并支持本研究的菌群测序和分析部分。
这一突破性研究为糖原贮积病及其相关并发症的治疗提供了新的视角,这也是我国儿科在罕见病领域的研究中取得的重大突破。

糖原贮积病(GSD),是一类由于先天性酶缺陷所造成的糖原代谢障碍疾病,多数属常染色体隐性遗传,发病因种族而异。该病类型多样,其中GSD-Ib型患者常伴有炎症性肠病。
在GSD-Ib型患者中,肠道菌群失调通过CCL4L2-VSIR轴影响炎症性肠病(IBD)。研究发现,与典型IBD不同,GSD-Ib患者展现出独特的消化道症状和肠道菌群特征。
肠道菌群失调主要由特定病原菌引起,导致肠道巨噬细胞过度激活,CCL4L2-VSIR轴的过度激活促进上皮细胞特定基因的表达,从而推动IBD的进展。
研究结果表明,靶向肠道菌群失调或CCL4L2-VSIR轴可能成为治疗GSD相关IBD的潜在策略。
糖原是肝脏和骨骼肌中储存的葡萄糖形式,其分解提供稳定的葡萄糖供应。当特定酶的活性缺失时,会导致糖原积累,进而影响组织的功能,导致一系列健康问题,包括低血糖、肌肉痉挛、疲劳、肝脏肿大等。
糖原贮积病的类型多样,根据受影响的酶和组织不同,可以分为几种主要类型。例如:
糖原贮积病的治疗主要是通过调节血糖水平和预防低血糖来管理。对于GSD-Ia和GSD-Ib,过去十多年的治疗方法包括间歇性未煮玉米淀粉或通过胃管给予夜间葡萄糖输注。给GSD-III患者高蛋白饮食,以增加儿童的生长速率。
GSD不仅影响儿童,成人也可能受到影响。未经最佳终身饮食葡萄糖治疗的成人GSD患者的长期预后不佳,可能会出现多种并发症,成人GSD患者常见的并发症包括骨质疏松症和骨折、肾结石、肾盂肾炎等。
▼
正常情况下,人体摄入的碳水化合物会被转化为葡萄糖,一部分葡萄糖会被立即利用以提供能量,而多余的葡萄糖则会在肝脏和肌肉等组织中合成糖原储存起来。当身体需要能量时,糖原又会分解为葡萄糖以供使用。
然而,在糖原贮积病患者中,由于参与糖原合成或分解的某些酶存在缺陷,导致糖原的合成、分解或储存出现异常,从而引起一系列的健康问题,包括低血糖、肌肉痉挛、疲劳、肝脏肿大等。
这类疾病有一个共同的生化特征,即是糖原贮存异常,绝大多数是糖原在肝脏、肌肉、肾脏等组织中贮积量增加。
▼
糖原贮积病是一种罕见病,总体发病率相对较低,但具体的发病率因不同类型的糖原贮积病而有所差异。
《世界胃肠病学杂志》资料显示,发病率约为20000-43000名新生儿中的1人。
由于其症状的多样性和隐匿性,一些病例可能未被准确诊断,实际的发病率可能被低估。
为了调查中国大陆GSD的流行病学和临床特征,杨敏及其团队进行了两项大型多中心研究,并通过问卷调查报告了2020年10月至2021年6月的209例GSD病例(如图)。
关于患者的就医情况,其中最显著的一个特点是超半数家庭(52.4%)为“省级”外来病例,就医的医院主要来自相对发达地区。且就诊地主要集中在上海、北京、广东等医疗资源相对发达的城市。
▼
糖原合成和分解代谢中所必需的各种酶至少有8种,由于这些酶缺陷所造成的临床疾病有15型,其中:
doi: 10.3748/wjg.v29.i25.3932
杨敏团队的调查研究中,主要包括6种类型的GSD,即:
其中最常见的是I型(66.9%)。
▼
不同类型的糖原贮积病临床表现各异,但常见的症状包括:
低血糖、肝肿大、酸中毒(乳酸性酸中毒)、高脂血症、高尿酸血症、疲劳、肌肉无力等。
由于糖原无法正常分解为葡萄糖,患者在空腹或长时间运动后容易出现低血糖症状,如头晕、乏力、出汗、心慌等。
糖原在肝脏中过度积累,导致肝脏体积增大。
长期的低血糖和代谢紊乱可能影响儿童的生长发育,导致身高、体重增长缓慢。
某些类型的糖原贮积病会影响肌肉功能,表现为肌肉无力、疼痛、痉挛等。
如Ⅱ型糖原贮积病可能导致心脏肥大、呼吸肌无力等,严重影响心肺功能。
其中:
口疮性口炎、肛周病变、胃肠炎、呼吸道感染和皮肤感染等症状在I型GSD中更常见;
厌食、呕吐、腹泻、粘液/血便、腹痛和腹胀是 GSD 患者常见的胃肠道并发症,尤其是在 GSD-Ib 组(77.8%)。
造成患者家庭问诊困难的一个主要原因是该疾病表型的复杂,例如下图:
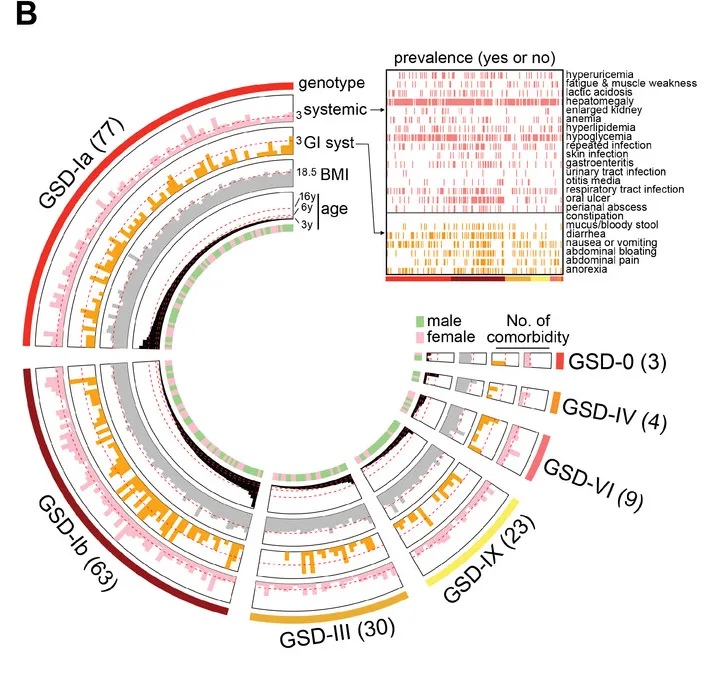
一种奇怪的糖原贮积病亚型:许多GSD-lb患者也患有慢性 IBD
杨敏教授表示,他们关注 GSD相关IBD 已有近10年了。多中心内镜监测研究中,他们招募了 32 名 GSD 患者。这些患者在内镜检查期间表现出活动性胃肠道症状。在这 32 名患者中,27 名患有 GSD-Ib,25 名最初诊断为 IBD。
其中GSD-Ib型患儿消化道症状比例最高(77.8%)且最为特殊,表现为单个或多发散在深圆形溃疡、炎性假息肉、梗阻和狭窄(如下图)。
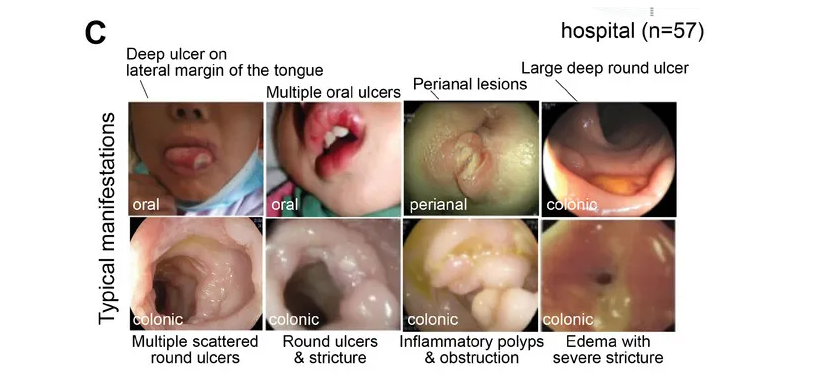
目前人们对 GSD-lb 中 IBD 的发病机制和发病原因知之甚少,超过 70% 的病例会出现严重的消化道症状,而这种症状在其他疾病亚型中偶尔才会出现。
如果不具体了解这些机制以及免疫系统与肠道微生物群之间的关系,科学家将无法开发出针对与 GSD 相关的 IBD 症状的有效治疗方法或干预措施。杨敏及其团队希望改变这一现状,开始了他们的实验探索过程。
▼
为了探究GSD群体消化系统异常,特别是IBD高发的原因,杨敏及其团队在全国23个省份招募了150名GSD患者(共涵盖Ia、Ib、III、IX、VI、IV及0型共7种类型)采集粪便样本, 327个健康对照者的粪便样本。
注:这327个对照样本包括:137 名家庭对照者和 190 名在山东、浙江、湖南等地收集的无关健康对照者。
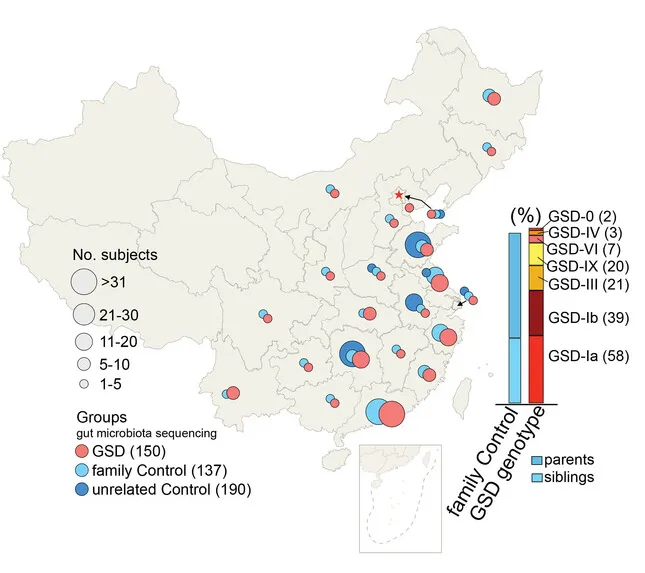
GSD基因型是肠道菌群的主要影响因素
肠道菌群受多种因素影响,包括饮食、地域和医疗条件等。
通过结合个人临床信息与肠道菌群数据的EnvFit分析发现(如下图),共有45个个人因素与肠道菌群的变异显著相关,如疾病情况(基因型)、家庭因素、年龄、身高体重、共患病等等。
值得注意的是,在这个队列中,GSD基因型主要影响肠道菌群组成。总体而言,家庭因素(家庭组配对比较)和居住地区是影响肠道菌群组成的第二和第三重要因素。
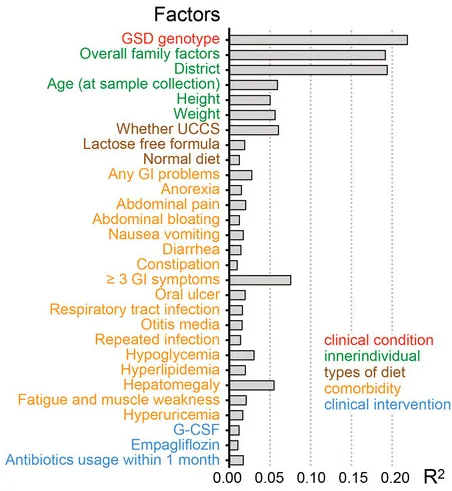
这在肠道菌群研究中颇为少见,因为多数研究认为地域因素极大且显著地影响个体菌群构成。这说明,特殊的基因型对于塑造个体肠道菌群构成起到决定性作用。
具体而言,研究人员将患者分为三组:
GSD-Ia、GSD-Ib、GSD-no IaIb
▼
GSD引起了个体肠道菌群多样性显著降低(下图H)及潜在致病菌显著升高(下图G),特别是GSD-Ia和GSD-Ib。这些肠道菌群的变化在校正性别、年龄、BMI和地域等因素后,仍然存在。
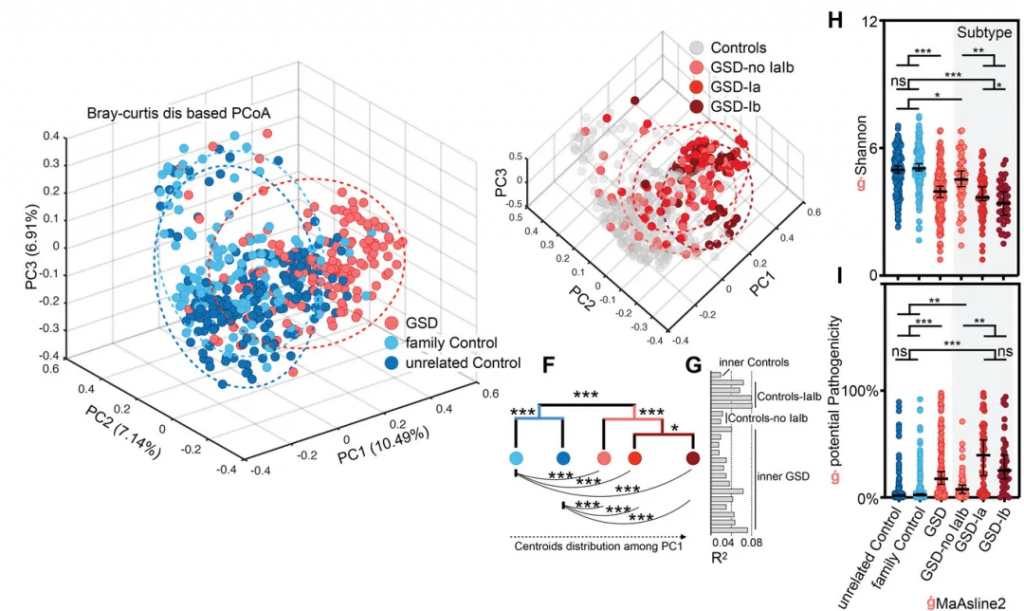
厚壁菌门和拟杆菌门仍是主要菌群;但变形菌门和放线菌门的比例显著增加。
GSD 患者共有31个属发生显著改变。其中18个属减少,而其余13个增加。这31个属中28个属在校正掉性别、年龄、BMI和地域等因素影响后,仍与GSD显著相关(下图D)。
有22物种的丰度和GSD显著关联(下图E),其中10 个增加和12个降低。
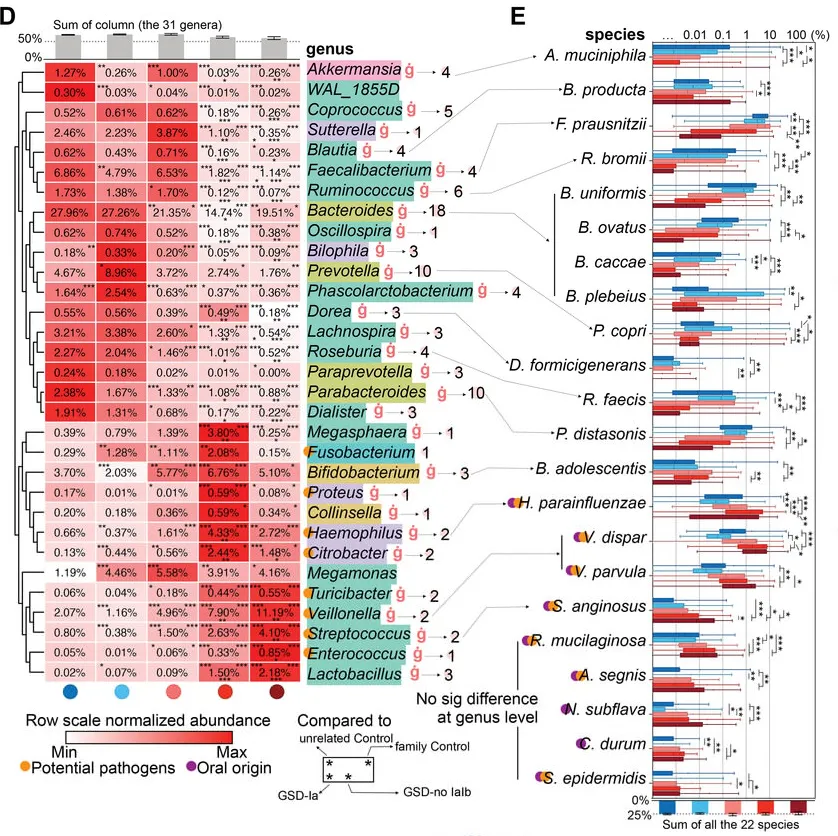
这31个显著改变的属的总丰度在不同分组人群中的总占比达到60-70%,种水平则为~25%,表明这些GSD相关的属种变化,是肠道菌群构成主体的紊乱。
▼
GSD-Ia和GSD-Ib患者表现出更严重的菌群紊乱,特别是那些最常见、功能性的微生物类群在其肠道内丢失,例如下列菌群在GSD-Ia和-Ib几乎完全耗尽:
丁酸可增强上皮氧合,有利于结肠中的低氧微环境并抑制病原体定植。然而,主要丁酸生产菌,如拟杆菌属、粪杆菌属和瘤胃球菌,以及相关代谢途径在GSD中显著降低,这可能导致兼性厌氧病原菌的延伸。
具体到每个菌来说:
AKK菌与肠道屏障的维持和抗炎作用有关,其减少可能会削弱肠道屏障,增加肠道炎症的风险,从而可能与IBD症状的出现有关。
粪杆菌参与肠道内的发酵过程,对维持肠道健康和免疫功能有重要作用。在糖原贮积病患者中,由于糖原代谢异常可能影响了肠道环境,进而影响了粪杆菌的定殖和功能,导致其数量减少。这可能会减少短链脂肪酸的产生,影响肠道健康。
拟杆菌在肠道内参与碳水化合物的分解,产生短链脂肪酸,糖原贮积病患者拟杆菌的减少可能导致肠道炎症反应加剧,与IBD症状的出现有关。
瘤胃球菌是产生短链脂肪酸的重要菌群,对肠道健康和宿主能量代谢有重要作用。瘤胃球菌的减少可能会导致短链脂肪酸的产生下降,影响肠道屏障功能和抗炎作用,从而可能与IBD症状的出现有关。以动物为基础的饮食会增加有害菌Ruminococcus gnavus。
GSD患者中存在口腔源的潜在病原体激增,例如:
口腔中的致病菌可以在肠道中定植和繁殖,说明肠道为这些菌群的生长繁殖提供了条件和环境。
链球菌,已被证明可通过GasderminA依赖性细胞焦亡诱导肠道损伤;可能通过产生超抗原等物质激活宿主T细胞免疫反应进而引发肠道炎症。
肠球菌的成员已显示出促炎作用;肠球菌可以通过分泌金属蛋白酶分解上皮钙黏蛋白破坏肠屏障。
韦荣氏球菌属在IBD中延伸,细小病毒通过产生硝酸盐诱导炎症。韦荣氏球菌属和链球菌的组合抑制了IL-12p70的生物合成,随后增强了IL-8、IL-6和TNFα的炎症反应。
菌群该定植时未定植,该退出时却长期占据
值得注意的是,双歧杆菌、韦荣球菌和乳杆菌这些本应该在健康儿童生命早期保持较高比例的细菌,在GSD患者的肠道中扩张,并且这些细菌在 GSD 患者的整个童年和成年期都会扩增,这可能抑制了其他正常菌群的定植。
▼
GSD患者肠道菌群发育落后于实际年龄
使用微生物组年龄Z分数(MAZ)评估菌群发育状态,随机森林回归和调整的深度神经网络分析均显示GSD患者的MAZ显著降低,特别是在GSD-Ia和Ib患者中。
这表明GSD患者的肠道菌群发育落后于实际年龄,呈现发育延迟状态。
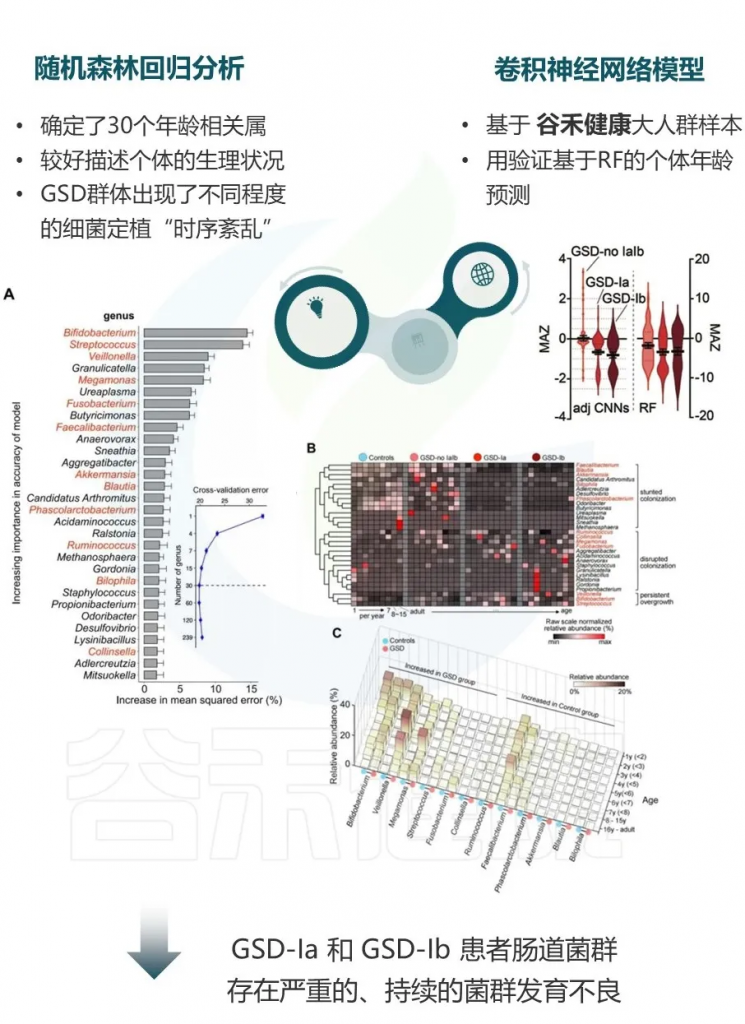
▼
从数据分析的角度,研究团队进一步分析了GSD患病情况、共患病与肠道菌群紊乱的中介关系。
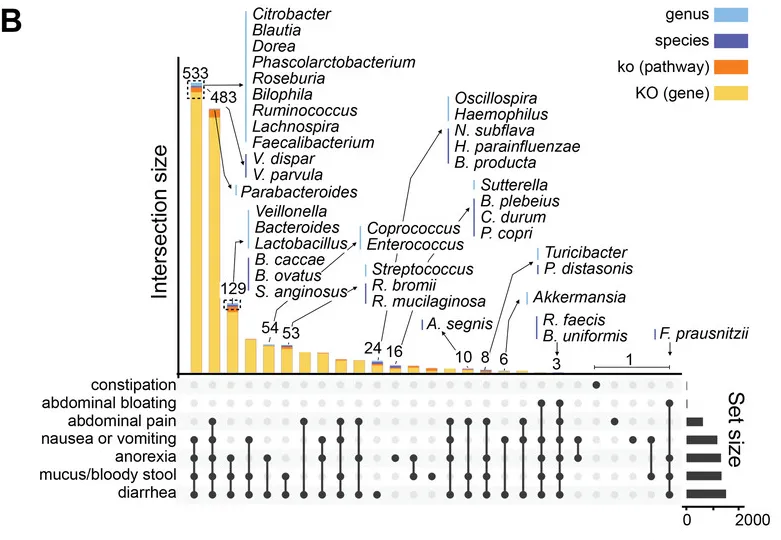
他们用最具代表性的肠道微生物特征和临床元数据构建了一个中介模型,在校正年龄、性别、BMI、地域及特殊治疗性饮食(生玉米淀粉)的影响后,肠道菌群仍然是GSD背景下,患者消化道异常的显著中介因子(下图)。说明GSD会通过影响肠道菌群构成最终造成消化道异常。
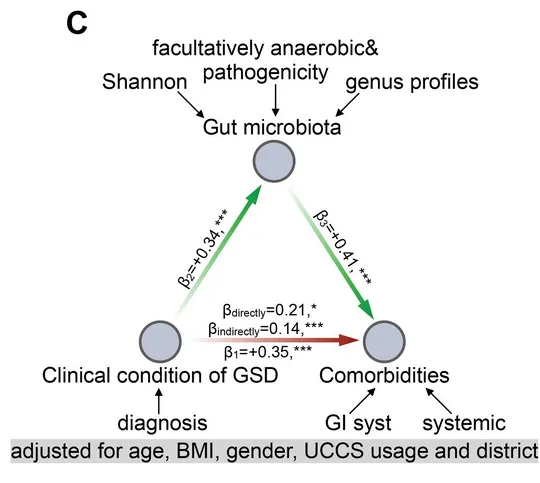
GSD 中这些细菌可能相互依赖资源和生存,形成一个复杂的相互支持网络,肠道菌群失调可能通过细菌的“群体犯罪”引起 GSD 患者的肠道上皮功能障碍。
下面我们来看一下该研究的另一个重要内容——肠道微生物群和免疫细胞之间的“串扰”。
▼
为了明确GSD相关的肠道菌群紊乱,如何引起个体IBD表性的产生。研究者们采集3名GSD-Ib患者的结肠粘膜组织(下图G),并使用单细胞测序技术分析患者结肠粘膜单细胞层面的转录水平变化。通过转录水平注释发现,相较于健康人、典型IBD和结肠炎的肠粘膜组织,GSD-Ib患者肠粘膜上有非常高的巨噬细胞聚集(下图H)。
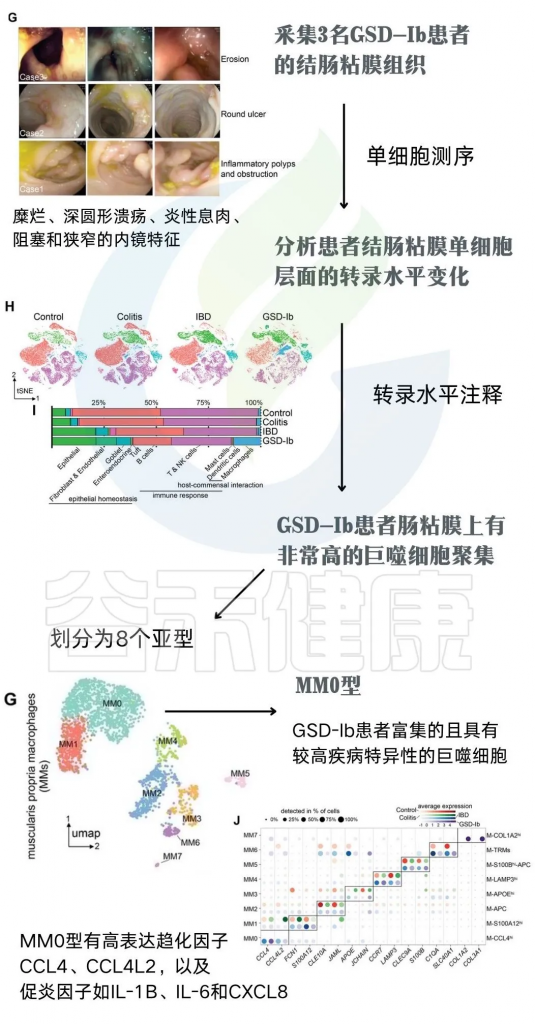
注:巨噬细胞中差异表达基因的KEGG通路注释显示,GSD-Ib中调节抗菌体液免疫反应和趋化因子介导的信号通路的基因集显著富集。GSD-Ib组中上调的基因主要参与环境信息处理和人类疾病。
“
更深入的分析确定了一种巨噬细胞亚型(MM0)的重要性,这种亚型产生一种名为CCL4L2的趋化因子,负责激活其他免疫细胞对抗有害细菌的生长。
虽然CCL4L2的自然功能通常是保护性的,但杨敏及团队怀疑,由于GSD-Ib患者相关肠道细菌的存在,CCL4L2的过度或失调刺激可能是他们出现IBD症状的可能原因。
这一点最初在实验室中得到了支持,其中用有害细菌感染的细胞获得的细胞培养基处理的巨噬细胞,比用对照培养基处理的巨噬细胞更加“激活”。
下面我们来看一下他们选用了哪些菌群进行相关实验,来刺激巨噬细胞:
▼
研究人员选择了三种GSD相关菌群来刺激巨噬细胞,即:
暴露于粪肠球菌、小弧菌和咽峡炎链球菌以及混合感染 (EVS) 的巨噬细胞中 CCL4L2 的表达在 mRNA 和蛋白质水平上显著增加,但不影响 IL-1 β和 IL-6 的表达。
来自EVS感染的条件培养基(CM)与对照组相比,诱导了显著的巨噬细胞迁移趋化性,而这种趋化性部分被CCL4L2中和所减弱。
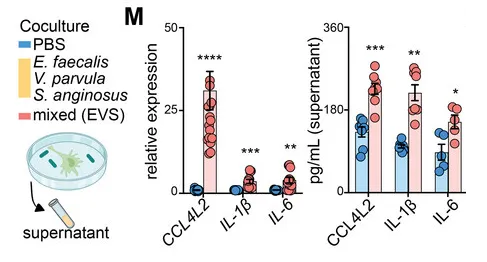
因此,是特定的肠道病原菌(如E. faecalis、V. parvula、S. anginosus)引发了CCL4L2的高表达,那么具体是如何影响炎症性肠病的进展?我们接着看。
“
然后,团队在从GSD-Ib患者取得的活检样本中寻找CCL4L2,并发现CCL4L2蛋白与一种叫做VSIR的受体结合,这种受体存在于肠道细胞壁中。
在IBD的小鼠模型中也发现了类似的结果,科学家们发现与健康对照组相比,巨噬细胞的水平更高,并且在用一种旨在抑制VSIR的抗体处理后,他们发现小鼠的症状加重了。
巨噬细胞通过CCL4L2-VSIR配体-受体信号与肠道上皮细胞相互作用,以促进损伤修复。
具体研究如下:
调节核糖体、氧化磷酸化途径和抗病原体反应的基因集在GSD-Ib上皮细胞中特异性富集。
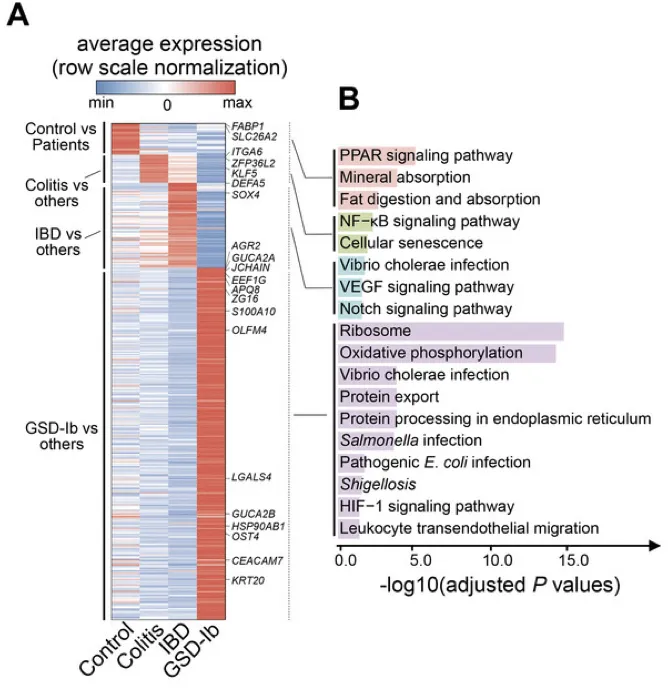
上皮细胞中典型的差异表达基因是AQP8、ZG16、GUCA2C、SLC26A3、AGR2,它们负责吸收、分泌、代谢、上皮屏障完整性、pH稳态、粘液屏障功能。
▼
免疫荧光染色显示GSD-Ib患者肠道组织中CCL4L2和VSIR的显著共定位,进一步验证了CCL4L2在巨噬细胞中的高表达及其与VSIR的相互作用。
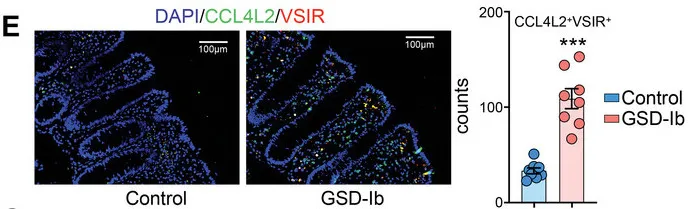
CCL4L2与其受体VSIR形成的CCL4L2-VSIR轴主导参与了MM0型巨噬细胞与其他类型细胞交互,特别是OLFM4+上皮细胞(这类细胞是GSD特异性增加的,同时也被报道在克罗恩病中较高)。
预测MM0巨噬细胞与其他细胞类型之间的相互作用
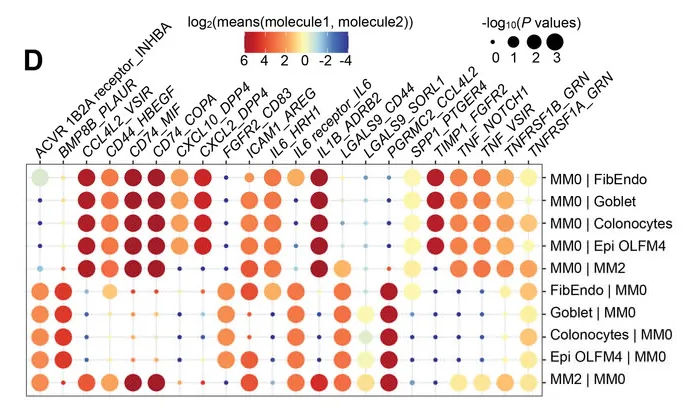
而这些受体细胞的基因表达情况,决定了患者肠道组织的疾病发展方向,如AGR2、ZG16、MUC2等。
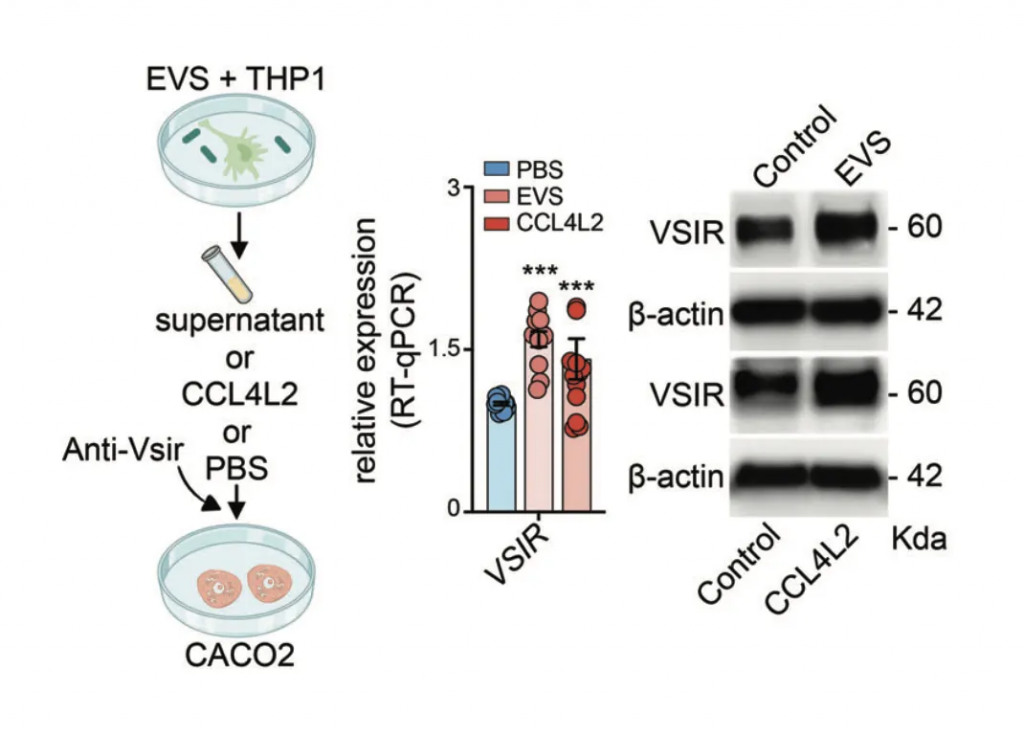
表明GSD相关的肠道菌群紊乱,通过引起肠上皮巨噬细胞高表达趋化因子CCL4L2,激活其他下游细胞膜蛋白VSIR表达,从而引起了GSD独有的消化系统IBD表型。这个现象进一步在C57BL/6小鼠中得到验证。
▼
研究人员在C57BL / 6小鼠中进行了选择性细菌移植,通过口服灌胃的方式将EVS移植到小鼠体内,并用DSS诱导结肠炎。研究发现,抗生素治疗显著降低了EVS灌胃诱导的小鼠血清CCL4L2水平,而抗VSIR则显示出完全相反的趋势。
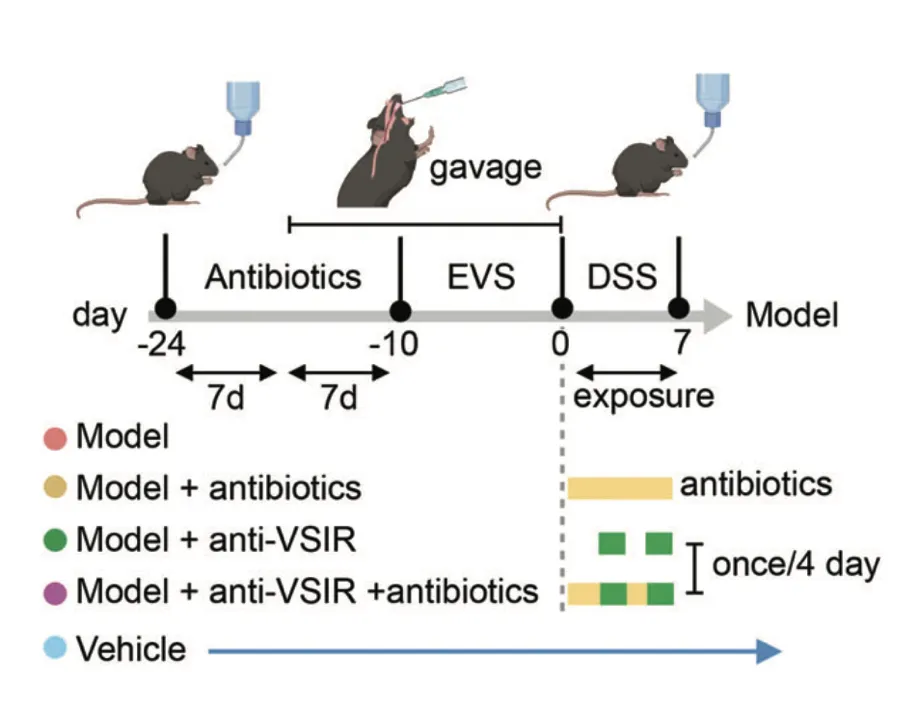
免疫荧光染色显示,模型组中MM0巨噬细胞增强,但在给予抗生素或抗VSIR注射后减少,这进一步导致模型组中肠上皮细胞的MUC2、AGR2和ZG16表达显著下调,引发粘膜损伤。
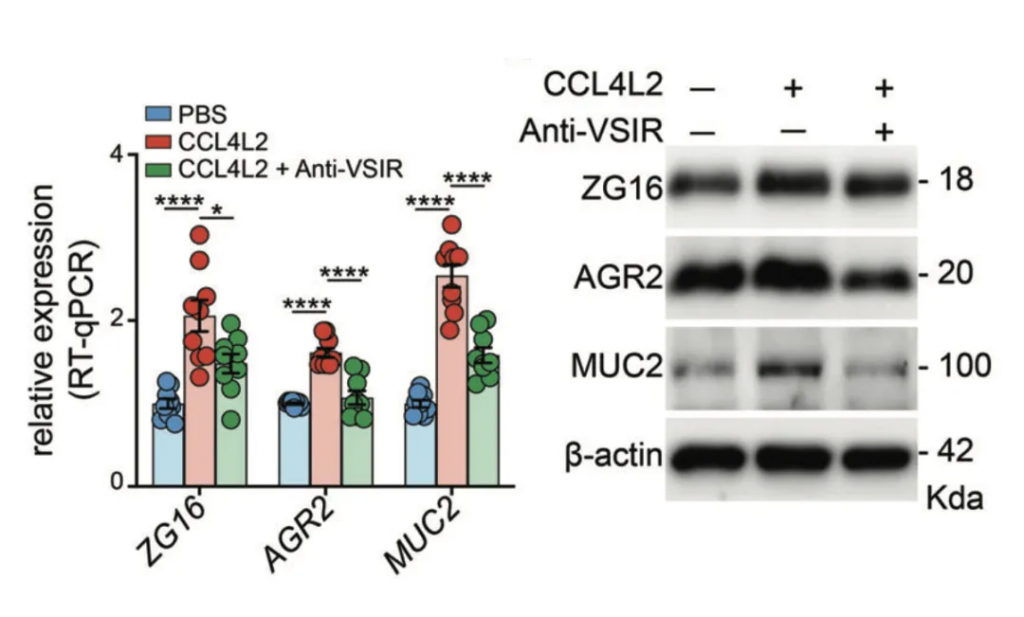
研究结果表明,EVS 增强的 MM0 巨噬细胞可以通过调节 CCL4L2-VSIR 轴来介导结肠肠上皮稳态。因此,靶向CCL4L2-VSIR通路可用于结肠炎和IBD的广泛应用。
肠道驻留免疫细胞和上皮之间的串扰,对于胃肠道稳态、抗原致敏调节、预防感染和 IBD 发展至关重要。在该研究中 GSD相关IBD 与典型的 IBD 相比具有不同的特征,特别是复杂的内镜表现及其特殊的解构:大量巨噬细胞积聚和上皮细胞增殖。
从病因上讲,肠道致病菌激活粘膜巨噬细胞导致胃肠道内形成炎症环境。在 GSD-Ib 中,一群独特的巨噬细胞由致病菌诱导,并表达高水平的趋化因子CCL4L2。
关于CCL4L2的有益方面:
潜在有害方面:
值得注意的是,CCL4L2-VIR通路的激活可能促进严重细胞因子风暴中的T细胞耗竭,这与新冠肺炎的不良预后有关。
靶向CCL4L2-VSIR可以抑制各种炎症性疾病、自身免疫性疾病和肿瘤转移。在这里,研究人员揭示了胃肠道中CCL4L2-VSIR轴的异常激活,最终驱动GSD-Ib中的非典型IBD。该发现为诊断和治疗GSD-Ib以及潜在的GSD相关IBD引入了一个新的靶点,并为VSIR相关研究提供了证据。
总的来说,这项研究证实了在糖原贮积病群体中独有的肠道菌群紊乱,即:
而这样的肠道菌群紊乱会引起个体结肠巨噬细胞高表达CCL4L2,并通过其受体蛋白VSIR介导上皮细胞的异常基因表达,最终造成GSD相关的IBD表型。
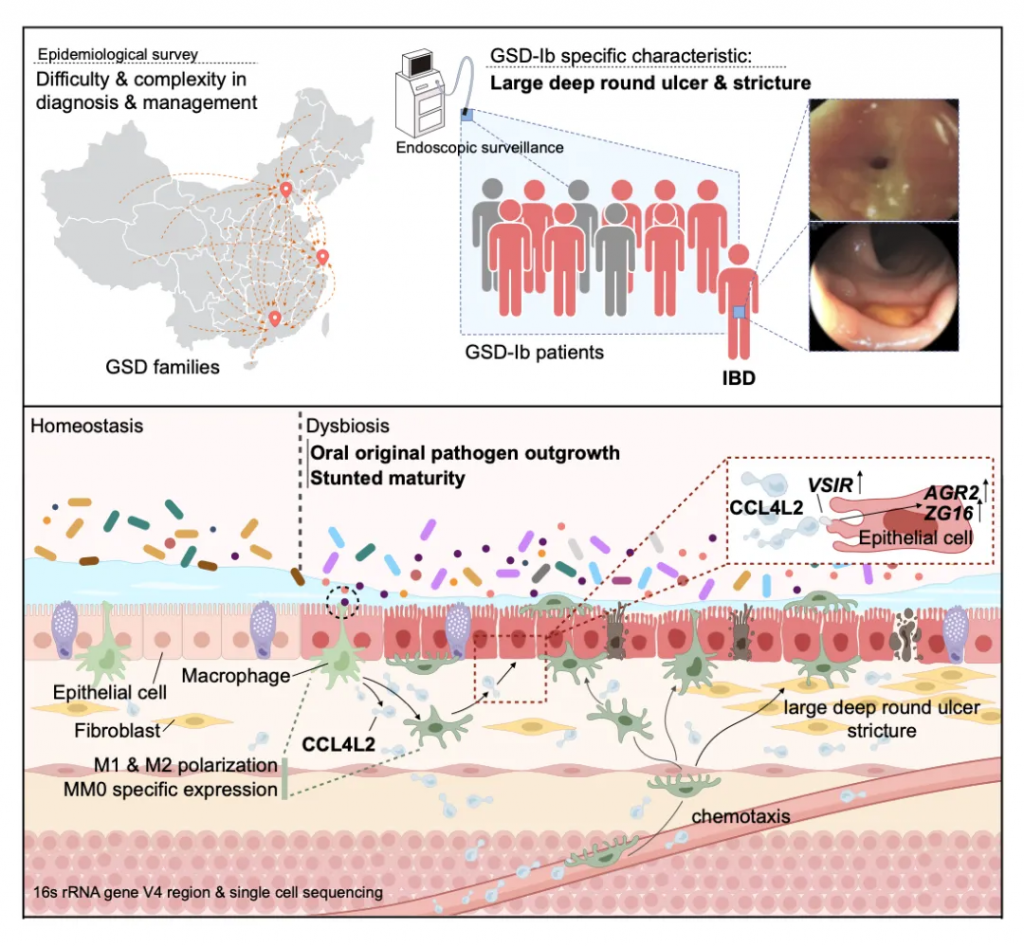
该研究的意义及未来方向:
该研究通过识别GSD-Ib与IBD之间的特定生物学联系,推动了精准医疗在代谢性疾病和消化系统疾病中的应用。
目前杨敏团队正在研究 CCL4L2-VSIR 通路的作用机制,并将探索其在患者治疗中的潜力。该团队预计,针对这一通路不仅可以为 GSD 患者提供有益的治疗,还可以为结肠炎和其他形式的 IBD 患者提供有益的治疗。
CCL4L2-VSIR轴的发现也可能促进新药开发,特别是针对GSD-Ib相关IBD的治疗。
这些研究结果也可应用于个性化治疗方案(基于肠道菌群特征),为患者提供更有效的治疗选择,有助于改善GSD-Ib患者及更广泛消化系统疾病患者的生活质量。
主要参考文献
Lan J, Zhang Y, Jin C, Yang M et al., Gut Dysbiosis Drives Inflammatory Bowel Disease Through the CCL4L2-VSIR Axis in Glycogen Storage Disease. Adv Sci (Weinh). 2024 Jun 18:e2309471.
Gümüş E, Özen H. Glycogen storage diseases: An update. World J Gastroenterol. 2023 Jul 7;29(25):3932-3963.
Hannah WB, Derks TGJ, Drumm ML, Grünert SC, Kishnani PS, Vissing J. Glycogen storage diseases. Nat Rev Dis Primers. 2023 Sep 7;9(1):46.
Zhong J, Gou Y, Zhao P, Dong X, Guo M, Li A, Hao A, Luu HH, He TC, Reid RR, Fan J. Glycogen storage disease type I: Genetic etiology, clinical manifestations, and conventional and gene therapies. Pediatr Discov. 2023;1(2):e3.
Wang Y, Liu H, Dong F, Xiao Y, Xiao F, Ge T, Li D, Yu G, Zhang T. Altered gut microbiota and microbial metabolism in children with hepatic glycogen storage disease: a case-control study. Transl Pediatr. 2023 Apr 29;12(4):572-586.

谷禾健康

俗话说:“病从口入”。饮食是决定个人健康状况的重要因素,饮食与疾病的发展有关,特别是胃肠道(GI)疾病。
与膳食相关的症状发生率很高,例如在吸收不良(如乳糖不耐症)情况下出现的腹痛和腹泻;乳糜泻、食物过敏人群在食用麸质类后出现的腹胀、腹痛、水肿;肠易激综合征患者在摄入一些刺激性食物后(酸、辣)的腹痛、排便异常等。饮食作为胃肠道症状的驱动因素已经逐渐被人们所认识。
然而对出现食物相关症状的机制仍不太清楚。随着对肠道微生物研究的深入,肠道微生物群也被认为是胃肠道疾病的重要影响因素,这促使人们研究微生物作为饮食和宿主生理之间的关键联系。
同样的饮食摄入效果会因人体的健康状况以及肠道个性化的微生物群落而产生的不同的效果。例如低聚果糖(FOS)会加重炎症性肠病(IBD)患者的炎症,但在健康个体中却具有抗炎作用。麸质、小麦、牛奶和大豆等物质直接注射到粘膜下层可以通过激活IBS患者的肥大细胞来引发免疫反应,但在健康受试者中则不然。还有纵向研究报告称,饮食蛋白质摄入量相似,但IBS-D患者的色氨酸和色胺水平(而非吲哚衍生物)高于健康人。另一方面,结肠内乙酸盐可增强对结肠直肠扩张的敏感性。具体影响可能取决于宿主健康和肠道中的整体代谢环境。
近年来,人们越来越认识到个性化的饮食干预在预防和治疗胃肠道疾病中的潜力。个性化饮食不仅考虑到个体的遗传背景、健康状况和生活习惯,还特别关注其独特的微生物群组成。通过分析和调整个体的饮食,可以优化肠道微生物群的平衡,增强其对疾病的抵抗能力。
在本文中,主要关注两种胃肠道疾病:肠易激综合征和炎症性肠病。宿主和肠道微生物群对膳食营养素的利用决定肠道中最终的生物活性代谢物特征以及这些代谢物对胃肠道生理学的生物效应。此外强调了单个代谢物的不同作用如何影响不同的胃肠道疾病,类似的饮食干预对多种疾病状态可能具有不同的影响。
食物在肠道内会被肠道菌群代谢、转化。食物成分本身的性质,加上肠道菌群作用后的代谢产物,共同决定了食物对人体健康的作用。因此,仅考虑食物成分是不够的,还要考虑个人肠道菌群状况,两者结合才能判断食物的健康效应。
例如,传统观点认为,大部分可消化的食物成分会通过小肠表面吸收。剩余的不可消化成分传递到远端,作为肠道微生物群的能量来源,产生如短链脂肪酸(SCFA)等发酵最终产物。
然而,这种观点简化了过程。肠道微生物群不仅依赖于难以消化的膳食成分,还可以从宿主上皮表面粘液层中的糖蛋白和多糖获取营养,尤其是在碳水化合物缺乏的情况下,如低纤维摄入时。
★ 不同的肠道微生物结构造就了独特的代谢
肠道微生物群与营养物质的利用:肠道微生物群如何利用营养物质取决于具体的营养成分和每种微生物的代谢能力。不同微生物有不同的代谢途径,使得营养利用变得复杂,而不是简单的化学计量问题。
微生物群落结构的影响:肠道中的微生物群落结构可以影响宿主和微生物之间的营养合作动态。比如,在体内平衡期间,宿主在小肠中有效吸收氨基酸,从而使得一些微生物无法获得这些氨基酸。
营养物质的竞争:某些细菌(如梭状芽孢杆菌)如果过度生长,就可能在一些情况下(如膳食蛋白质有限时)与宿主竞争氨基酸的吸收。
营养层次与利用率:更高级的营养物质(如单糖和双糖)的增加会降低某些细菌对氨基酸的利用率。这意味着营养物质的可用性对微生物代谢有影响。
调节信号的作用:肠道中的特定信号分子(如短链脂肪酸或肽YY)也能影响宿主对营养物质的利用方式。
在下面小节中,我们重点介绍两个例子(色氨酸和膳食纤维),以说明宿主和肠道微生物群在营养利用上的差异如何影响宿主的生理学。
色氨酸是一种必需氨基酸,是宿主神经递质血清素 (5-HT;胃肠道生理的重要调节剂) 的前体,也是微生物代谢物(如色胺和吲哚衍生物)的前体。色氨酸库很大程度上取决于饮食。
色氨酸被整合到蛋白质中并被宿主利用,通过不同的途径产生5-HT(1-2%)和犬尿氨酸(∼95%)。肠道微生物成员如Ruminococcus gnavus和Clostridium sporogenes含有色氨酸脱羧酶,可将色氨酸转化为色胺,而色胺则是血清素受体4(5-HT 4R)的激动剂。
同时,脆弱拟杆菌(Bacteroides fragilis)和大肠杆菌(Escherichia coli)等细菌含有色氨酸酶,这种酶有助于从色氨酸产生吲哚和吲哚衍生物。如吲哚乙酸和吲哚丙酸,可以通过激活芳烃受体(AHR)对宿主的免疫途径发挥生物学效应。
这些细菌产生的色氨酸衍生生物活性代谢物的水平取决于肠道菌群的组成、肠道细菌利用色氨酸的程度和位置,以及宿主色氨酸利用相关基因的活性。
Jadhav A,et al.Annu Rev Nutr.2023
饮食衍生的代谢物可改变多种生物途径,而这些途径是多种胃肠道(GI)疾病的基础。
a)饮食蛋白质,包括肉类和非肉类(例如谷物、种子和坚果),都含有不同水平的氨基酸,例如色氨酸。可被宿主代谢产生犬尿氨酸和血清素(5-HT)。肠道微生物群还可以通过不同的代谢途径将色氨酸转化为色胺或吲哚和吲哚衍生物。色胺通过激活血清素受体4来增加肠道分泌和杯状细胞的粘液释放,而吲哚和吲哚衍生物是芳烃受体(AHR)的配体,在调节屏障功能和免疫反应中发挥重要作用。
b)膳食纤维包括可发酵[例如低聚果糖、低聚半乳糖和菊粉]和不可发酵(例如纤维素、半纤维素和木质素)纤维。根据肠道细菌的类型和纤维的类型,它们会发酵成不同的短链脂肪酸,例如丁酸盐和乙酸盐。丁酸盐可以增加血清素合成,增强结肠收缩力,缓解内脏过敏,增强屏障。
色氨酸衍生的生物活性代谢物取决于肠道菌群,那么纤维的发酵产物与微生物组成有关吗?
富含膳食纤维的饮食被认为是有益的,因为肠道微生物群会发酵纤维产生丁酸、乙酸和丙酸等短链脂肪酸,这些短链脂肪酸会影响宿主生理学的重要方面,包括代谢、细胞周转和免疫系统。
然而,人类研究表明,个体对纤维摄入量的反应存在显著差异,并且基于纤维类型的差异也很大。这并不奇怪,因为纤维是一个总称,包括具有不同连接和分子结构的不同碳水化合物群体。不同细菌携带的基因使它们能够利用具有特定连接和结构的碳水化合物。
膳食纤维的生物学效应取决于纤维的成分、个体肠道微生物群代谢特定纤维的潜力以及不同发酵最终产物的相对量。
▸ 低聚果糖在健康人体和炎症性肠病患者中作用大为不同
编辑
最近的一项研究发现,低聚果糖(FOS)会加重炎症性肠病(IBD)患者的炎症,而肠道细菌代谢它会减轻其在活动性炎症的IBD患者的炎症作用。
有趣的是,低聚果糖在健康个体中具有抗炎作用。因此,低聚果糖的炎症潜力取决于肠道微生物组成以及宿主疾病状态。
产生的短链脂肪酸的水平和类型可能因纤维组成和肠道微生物群而异。在饮食中添加菊粉会增加丁酸盐,但会降低乙酸盐的产生。相反,在消耗相同纤维量的患者亚组中,粪便丁酸水平较低,这归因于产生丁酸的细菌水平较低。这些结果有助于解释对纤维反应的个体间差异。
鉴于微生物代谢产物对宿主发挥多效性作用,因此,相同的代谢物可以影响多种宿主功能,每种功能都可能与不同的疾病状态相关。
色氨酸代谢物如色胺和5-HT会影响胃肠道转运,这与肠脑轴(DGBA)相关,而色胺和吲哚衍生物可以改变粘液和免疫反应,这对炎症性肠病具有影响。
同样,丁酸等发酵终产物会影响胃肠道运动以及上皮屏障功能,这分别与DGBA和IBD相关。
肠道微生物组的一个重要决定因素是饮食,它会对肠道微生物组产生长期和短期影响,它们会随着个体饮食的变化而变化。
与农业社会相比,工业化社会个体饮食的成分显著改变和肠道微生物多样性减少能证明习惯饮食的长期影响。
▸ 低纤维饮食会导致肠道微生物多样性逐渐减少
研究证明,低纤维饮食会导致人肠道微生物多样性逐渐丧失,这在早期阶段是可逆的,但可能会导致后代特定分类群的灭绝,而仅靠饮食干预是无法恢复的。
这一观察结果为西方人群中观察到的肠道微生物多样性较低提供了一种解释,并强调了微小的变化是如何在几代人的过程中积累起来的。因此,个体的微生物群落结构可能反映了人群的长期饮食模式。
▸ 短期饮食改变也会影响肠道微生物群,但可逆
短期的饮食改变也会改变肠道微生物组。虽然这些变化在不同程度上是可逆的,这取决于人体的基本恢复力和适应性,但短期变化可能在一定程度上解释慢性病患者症状的频率和严重程度不同。
这些短期影响也强调了微生物群导向的饮食干预作为治疗策略的潜力。
肠易激综合征(IBS)是一种常见的疾病,全球患病率约为11.2%。根据过去3个月内每周至少出现一次腹痛、伴有排便或大便频率或形式的变化并在过去6个月内出现症状进行诊断。
IBS一般可分为腹泻型(IBS-D)、便秘型(IBS-C)、混合型和未分类亚型。
胃肠道运输、分泌、感觉、免疫激活、肠道通透性和肠脑轴的改变等生理变化是IBS症状的基础。与IBS相关的危险因素包括宿主遗传、压力、抗生素使用和幼儿期经历,但饮食最常被认为是肠易激综合征的潜在罪魁祸首。基于人群的研究表明,近70%的IBS患者认为自己存在食物不耐受。
饮食引起症状的机制仍在研究中,但最近的研究已经开始阐明IBS中由饮食驱动的症状背后的微生物群独立机制和微生物群依赖机制。
研究发现将食物抗原(例如麸质、小麦、牛奶和大豆)直接注射到粘膜下层可以通过激活IBS患者的肥大细胞来引发免疫反应,但在健康受试者中则不然。
他们进一步表明,肥大细胞激活会引起内脏疼痛,并通过组胺刺激内脏神经元的敏化增加肠道通透性。虽然这项研究证明了一种独立于微生物群的机制,但其他研究发现,富含可发酵寡糖、二糖、单糖和多元醇(FODMAP)的饮食也可以通过Toll样受体4(TLR4)途径激活肥大细胞,这表明肠道微生物群的参与。
据报道,IBS-D患者中受饮食影响的微生物产物(如脂多糖和鞭毛蛋白)的血清水平显著升高。
脂多糖(LPS)是肠道细菌的一组异质细胞壁成分,充当TLR4的配体,在食用高脂肪饮食或高FODMAP饮食的个体中也会增加。除了在肥大细胞激活中的作用外,不同形式的LPS还能促进肠神经元的存活并增强平滑肌收缩力,这表明LPS浓度或结构的差异可能会驱动不同的宿主反应。
除微生物细胞壁成分外,宿主微生物代谢膳食成分产生的代谢终产物也可影响胃肠道生理,从而引发胃肠道症状。乙酸盐、丙酸盐和丁酸盐等短链脂肪酸由特定肠道微生物成员产生,其水平取决于微生物组成和膳食纤维摄入量。
丁酸盐是一种多效性代谢物,可通过G蛋白偶联受体(GPCR)直接发出信号,并通过表观遗传调控改变转录反应。丁酸盐可以浓度依赖性方式改变肠嗜铬细胞中的5-HT合成,通过直接影响肠道神经肌肉装置增加结肠收缩力,增强肠道上皮屏障,并通过与肠道神经胶质细胞相互作用调节内脏高敏感性。
另一方面,结肠内乙酸盐可增强对结肠直肠扩张的敏感性。具体影响可能取决于宿主健康和肠道中的整体代谢环境。
饮食、宿主粘液和微生物代谢都是肠道中氨基酸的主要来源。一项纵向研究报告称,尽管饮食蛋白质摄入量相似,但IBS-D患者的色氨酸和色胺水平(而非吲哚衍生物)高于健康人。
这种差异可能是由于肠道微生物群增加了色氨酸的产生和转化,或由于宿主对其利用率降低。胰蛋白酶激活肠细胞上的5-HT4R,进而增加肠液分泌。
另一项研究发现,IBS患者和健康受试者在结肠组织对色胺的5-HT4R表达或反应方面没有差异,这表明较高的色胺水平可能是腹泻的重要驱动因素。
在腹泻型(IBS-D)患者中,其他饮食和微生物驱动的途径也被描述了。无乳糜泻的IBS-D患者中经常报道麸质不耐症,这似乎部分依赖于宿主基因型和肠道微生物群组成。据报道,与阴性患者相比,HLA-DQ2/HLA-DQ8 阴性的IBS-D患者在无麸质饮食后腹胀显著减轻。
HLA-DQ2和HLA-DQ8基因是导致乳糜泻的主要基因。
其他研究表明,肠道微生物群可以对麸质的消化和免疫原性产生不同的影响。麸质对IBS-D影响的具体机制仍需进一步研究确定。
胆汁酸(BA)在肝脏中合成,储存在胆囊中,用于脂质乳化。膳食脂肪和姜黄是刺激初级胆汁酸释放到小肠中的重要因素。
近95%的初级胆汁酸在远端小肠中被重新吸收,剩余的初级胆汁酸在进入结肠后被肠道微生物去偶联、脱羟基和差向异构化为次级胆汁酸。
初级胆汁酸如鹅去氧胆酸通过氯化物通道增加结肠分泌,并降低健康个体的直肠感觉阈值。在啮齿类动物模型中,鹅去氧胆酸通过激活核受体法尼素X受体、释放神经生长因子和在背根神经节中下游表达瞬时受体电位香草素1(TRPV1),影响内脏敏感性。
▸ IBS-D患者的胆汁酸水平较高
IBS-D患者的粪便胆汁酸水平可能更高,这归因于胆汁酸吸收不良或肠道微生物群减少导致的继发性胆汁酸转化减少。因此,高脂肪饮食可以通过调节胆汁酸的释放,直接或通过胆汁酸的微生物代谢间接改变胃肠道生理学。
除此之外,最近的一项研究发现,感染后IBS-D患者的细菌编码的β-葡萄糖醛酸酶水平较低,这种酶可以解除胆红素的结合。
这些患者的结合胆红素水平较高,导致对宿主蛋白酶的抑制作用降低,肠道通透性增加,从而引发内脏超敏反应。
炎症性肠病(IBD)是一种特发性、慢性、使人衰弱的炎症性胃肠道疾病,包括两种疾病——克罗恩病(CD)和溃疡性结肠炎(UC)。克罗恩病表现为遍布整个胃肠道的斑片状透壁炎症,而溃疡性结肠炎则是结肠的持续性粘膜炎症。
这两种疾病都是由于环境、遗传和免疫因素共同作用下,对肠道微生物信号产生的不受控制的炎症反应引起的。从流行病学角度来看,IBD曾被认为是西方国家的疾病,欧洲和北美的发病率最高。但自20世纪90年代以来,IBD的高发区已大幅向东方扩展,在非洲、亚洲(如印度每10万人9.3例,中国每10万人3.3例)和南美洲的新兴工业化国家中,发病率迅速上升。
▸ 炎症性肠病的风险升高与饮食改变紧密相关
这些流行病的转变与全球饮食模式的转变相吻合,包括引入包装和加工食品;广泛接受和使用食品添加剂、防腐剂和抗生素;推广快餐连锁店,同时减少针对特定地区的当地饮食。
流行病学研究表明,饮食是形成炎症性肠病(IBD)的关键环境因素之一,从低发病地区迁移到高发病地区的人群中,IBD的患病率有所上升。此外,法国和西班牙的南北流行率差异也很微妙。在这些国家的北部地区观察到较高的IBD负荷,那里的个人食用更多的黄油、土豆、火腿、奶酪、香肠和啤酒,而南部地区的个人则遵循地中海饮食,主要由橄榄、新鲜水果和蔬菜、葡萄酒和海鲜组成。
饮食成分不仅可以直接影响炎症性肠病的病理生理学,而且还可以通过其在肠道微生物群中的转化间接影响疾病进程。让我们一起来了解下其中的具体机制。
饮食在炎症性肠病发病机制和预防中的作用
Jadhav A,et al.Annu Rev Nutr.2023
膳食中的大量营养素、微量营养素、添加剂和热量含量之间相互作用复杂;宿主免疫、遗传学和肠道微生物组可能是炎症性肠病(IBD)风险和临床病程的重要决定因素。
▸ 红肉饮食可能加剧炎症性肠病风险

最近一项由125445名参与者组成的大型前瞻性队列研究发现,西方饮食(包括红肉、家禽和加工肉类等动物蛋白)与溃疡性结肠炎发展可能性增加之间存在关联。
此外,红肉加剧炎症性肠病的影响在其他研究中也得到了证实。欧洲癌症和营养前瞻性调查队列表明,红肉摄入增加了亚油酸摄入量,从而使溃疡性结肠炎风险增加超过一倍。
同时,一项法国大型前瞻性问卷研究也支持这一观点。值得注意的是,加工红肉的摄入,与克罗恩病患者死亡率的显著增加有关。
▸ 红肉中的左旋肉碱等物质经微生物转化为氧化三甲胺与炎症呈正相关
红肉主要由蛋白质、脂肪和血红素组成,这些成分水平的增加会改变肠道微生物群的组成,进而对上皮细胞更新和肠道屏障完整性产生负面影响,并加剧肠道炎症。
值得注意的是,红肉中富含左旋肉碱、磷脂酰胆碱和γ-丁甜菜碱,这些物质通过肠道微生物代谢转化为三甲胺。三甲胺在宿主肝脏中通过含黄素单加氧酶形成氧化三甲胺(TMAO)。动物研究和人类流行病学研究表明,TMAO与炎症、心血管疾病、结直肠癌和死亡率之间有很强的正相关关系。
与传统的饮食习惯不同,西方饮食富含简单的精制碳水化合物、饱和脂肪以及超加工食品,而新鲜水果和蔬菜、豆类、全谷物和膳食纤维的含量较低。
超加工食品是在已经加工过的食品基础上再加工的食品,这类食品通常是高糖、高脂、高热量的食品。可涵盖多种食物,包括肉类、淀粉类零食、乳制品、豆类、水果和蔬菜。
研究报告了西方饮食对人类健康的不利影响,并将其与肥胖、糖尿病、炎症性肠病、慢性肾病和其他与生活方式相关的疾病联系起来。食品的(超)加工旨在提高其保质期、适口性以及储存和分销的便利性,其中涉及掺入许多非天然成分和添加剂,例如人造香料、稳定剂、防腐剂和乳化剂。
▸ 超加工食品的摄入量较高与炎症性肠病风险增加相关

最近一项针对来自7个地理区域 21个低收入、中等收入和高收入国家的大型前瞻性队列(116,087名成年人)的研究发现,超加工食品的摄入量较高与炎症性肠病风险呈正相关;然而,未加工的白肉、红肉、乳制品、淀粉、水果和蔬菜的摄入与炎症性肠病的发病率无关。
研究发现,炎症性肠病(IBD)风险与非酒精含糖饮料的消费存在正相关关系。
▸ 含糖饮料摄入过多增加炎症性肠病风险

最近的两项荟萃分析整合了关于饮料摄入量与IBD风险的观察性研究,表明高摄入量的含糖饮料与IBD风险增加相关。实验显示,高膳食糖摄入与炎症诱导和肠道微生态失调有关。一项基于问卷的研究比较了IBD患者与健康人群的饮食模式,发现IBD患者的含糖饮料消费量更高。
阿斯巴甜、糖精、安赛蜜和三氯蔗糖等人造甜味剂因其在不增加额外热量的情况下赋予食物甜味而广泛流行。然而,动物研究和健康人类试验报告称,这些非营养性甜味剂降低了肠道微生物多样性,使肠道炎症永久化,通过增加变形菌门(Proteobacteria)成员和减少有益微生物(如瘤胃菌科、毛螺菌科和梭状芽孢杆菌群XIVa)的比例来改变肠道微生物群,并损害肠道屏障的完整性。
▸ 麦芽糊精会加剧肠道炎症
麦芽糊精(E1400)是一种重要的食品添加剂,可用作加工食品的增稠剂,在小鼠结肠炎模型中,它通过诱导内质网应激和改变粘液层,以剂量依赖性方式加剧肠道炎症。小鼠模型中的报告还表明,麦芽糊精通过调节细菌基因表达,促进克罗恩病相关的粘附侵袭性大肠杆菌形成生物膜。
▸ 防腐剂会降低肠道微生物多样性
加工食品中的防腐剂会加剧有害影响。苯甲酸钠(E211)、亚硝酸钠(E250)和山梨酸钾(E202)这三种最常用的防腐剂会降低肠道微生物多样性,在人类肠道微生物群相关的小鼠模型中,变形菌门增加,梭状芽胞杆菌的减少。
注:尽管人类和动物研究已经提供了关于这些非营养性膳食添加剂对肠道菌群失调和肠道健康的负面影响的机制见解,但仍缺乏评估这些甜味剂对炎症性肠病人群影响的人体随机对照试验。
▸ 乳化剂过量食用会导致肠道微生物失调并促进慢性炎症
类似地,合成乳化剂,如聚山梨酯80和羧甲基纤维素,被用作增强质地和延长保质期的添加剂。在动物研究中,这些乳化剂被广泛认为会导致肠道微生态失调并促进慢性炎症。

▸ 摄入过多的脂肪增加炎症性肠病风险
进行的一项大型前瞻性流行病学研究,基于超过200,000名参与者的食物频率调查问卷,显示ω-6多不饱和脂肪酸的摄入量与溃疡性结肠炎(UC)风险增加之间存在显著关联。
高摄入总脂肪、ω-6多不饱和脂肪酸和肉类会增加患溃疡性结肠炎的风险;高摄入饱和脂肪、ω-6多不饱和脂肪酸和肉类也会增加患克罗恩病的风险。
▸ ω-6脂肪酸在炎症性肠病中具有促炎性
虽然主要的膳食ω-3不饱和脂肪酸,即二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),及其下游类二十烷酸具有抗炎特性,但ω-6多不饱和脂肪酸,如花生四烯酸(AA)及白三烯、羟基二十碳四烯酸、脂氧素和环氧二十碳三烯酸等在炎症性肠病中表现出强烈的促炎活性。
这些介质增强中性粒细胞的趋化性;增强血管通透性;以及炎症细胞因子的产生,例如肿瘤坏死因子(TNF-α)、白细胞介素(IL)-1β、IL-6和IL-8。有趣的是,这些脂肪酸介质的代谢在炎症粘膜中发生了改变,ω-6 花生四烯酸水平较高,ω-3 EPA水平较低,这表明脂肪酸代谢与炎症性肠病之间存在关联。
▸ ω-6促进肠道炎症与肠道微生物失调相关
最近的动物研究和人体试验已经将饮食中的ω-6多不饱和脂肪酸与肠道微生物微生态失调联系起来。γ-亚麻酸水平越高,2型糖尿病的发病率越高;肠道微生物多样性降低;有益微生物如普雷沃菌属(Prevotella)、Odoribacter、粪杆菌属、Paraprevotella、经黏液真杆菌属(Blautia)和丁酸弧菌属,以及梭菌目、Rikenellaceae和Coriobacteriaceae的成员减少。
在断奶阶段补充ω-6高脂肪饮食的小鼠显示,成年期结肠炎症和增生性病变的数量增加,厚壁菌门、梭状芽孢杆菌和毛螺菌属成员显著减少。在衰老小鼠模型中,补充ω-6也有类似效果,高ω-6脂肪饮食减少了厚壁菌门和拟杆菌门的有益成员,并导致肠道炎症。而补充鱼油可以逆转观察到的肠道微生态失调。
饮食成分在肠易激综合征和炎症性肠病等胃肠道疾病的病理生理学中发挥作用,使得通过饮食调节成为一种无创、更日常便利的治疗方法。
然而,目前的饮食策略缺乏特异性,在具有不同病理生理学的胃肠道疾病(如肠易激综合征和炎症性肠病)中也采用类似的方法。最常见的策略是限制、改变或补充营养。
▸ 可发酵碳水化合物不利于肠易激综合征患者的健康
治疗肠易激综合征(IBS)最常见的饮食干预之一是减少FODMAP食物(通常是吸收不良的“可发酵”碳水化合物,包括果糖、乳糖、多元醇、果聚糖和低聚半乳糖)摄入12周,然后缓慢恢复上述食物组。
这类营养素被认为是疾病病理生理学的重要驱动因素。基于这样的观点:FODMAP会增加渗透负荷并产生更高水平的氢,从而导致管腔扩张。这些碳水化合物还会会被结肠中的细菌发酵,并引起肠易激综合征特有的腹胀、胀气和腹痛等症状。
▸ 低FODMAP饮食改善肠易激综合征患者症状

对澳大利亚肠易激综合征患者进行的一项关键研究显示,与西方饮食相比,低FODMAP饮食可显著改善症状。最近的一项荟萃分析纳入了397名患者的七项随机对照研究,结果显示,与对照干预相比,低FODMAP饮食可减轻整体症状。
然而,这项荟萃分析中的三项随机对照试验比较了低FODMAP饮食和严格的对照饮食,这些试验之间的异质性较小,且效应量有限。因此,虽然低FODMAP饮食能够使肠易激综合征患者受益,但数据的整体质量较低。
这一发现表明,几种不同的饮食干预措施都可以改善IBS症状,找到它们之间的共同点将会很有帮助。
▸ 低FODMAP饮食的效果会因肠道微生物组成不同而存在差异
有趣的是,一项针对健康受试者的研究发现,低FODMAP饮食并没有减少结肠体积,这表明症状改善背后可能存在其他机制。低FODMAP饮食的效应是与肠道菌群存在重要联系。
荟萃分析还发现无麸质饮食对肠易激综合征患者无显著益处。如上所述,这种影响可能取决于宿主基因型或其他宿主/环境因素。麸质主要存在于小麦、大麦和黑麦中,它们是高FODMAP饮食的一部分;因此,在部分患者中观察到的改善也可能是限制FODMAP的结果,而不仅仅是麸质的结果。
最近的一项综述显示,炎症性肠病患者中非腹腔麸质敏感性患病率很高;但几乎没有证据支持这些患者采用无麸质饮食。临床前研究发现无麸质饮食可以改善炎症和通透性,但缺乏针对人类受试者的高质量前瞻性研究。关于麸质微生物降解对炎症性肠病和乳糜泻都具有重要意义,是未来研究的重要领域。
地中海饮食(MD)富含水果、蔬菜、面包、谷物、豆类、坚果和初榨橄榄油,以及适量的乳制品、鱼和肉。地中海饮食被认为是一种平衡且健康的长期饮食选择。
地中海饮食和低FODMAP饮食的效果


Jadhav A,et al.Annu Rev Nutr.2023
▸ 地中海饮食的炎症性肠病患者症状减轻
最近的一项前瞻性、随机研究纳入了100名患有轻度至中度疾病的青少年炎症性肠病患者,比较了地中海饮食与常规饮食的疗效,结果显示,小儿克罗恩病活动指数和小儿溃疡性结肠炎活动指数的临床评分显著下降。以及较低水平的炎症标志物,例如血清C反应蛋白、钙卫蛋白、TNF-α、IL-17、IL-12和IL-13。
临床试验,也观察到地中海饮食对炎症性肠病的有益作用。这项研究涉及142名炎症性肠病患者(84名 溃疡性结肠炎和58名克罗恩病)。接受地中海饮食治疗6个月,显著改善了体重指数和腰围,并导致肝脏脂肪变性和营养不良相关参数显著减少。其中40%的轻度至中度克罗恩病患者在接受6-12周的地中海饮食治疗后病情得到缓解。
▸ 地中海饮食与健康有益的微生物特征相关
地中海饮食与有益的肠道微生物特征相关,特别是与膳食纤维代谢物的富集有关,例如普拉梭菌、解纤维素拟杆菌和普雷沃氏菌,以及参与植物多糖降解和短链脂肪酸和次级胆汁酸生产的其他微生物。
地中海饮食富含ω-3不饱和脂肪酸,使得ω-3和ω-6脂肪酸达到平衡。在前瞻性溃疡性结肠炎队列中证明了EPA和其他不饱和脂肪酸的积极作用,其中肠道炎症细胞因子水平与PUFA、EPA和二十二碳五烯酸呈负相关。
▸ ω-3 不饱和脂肪酸有助于对抗肠道相关炎症
涉及ω-3脂肪酸代谢的三个关键基因(CYP4F3、FADS1和FADS2)的单核苷酸多态性与克罗恩病风险增加相关,这显示了炎症性肠病饮食相关调节的额外遗传因素。
ω-3 不饱和脂肪酸可能通过下游脂质介质(例如消解素、保护素和噬消素(maresins))发挥抗炎作用,这些介质可以对抗IBD相关炎症。从机制上讲,ω-3 不饱和脂肪酸已被发现:
(a)降低中性粒细胞和单核细胞对各种化学引诱剂的趋化性;
(b)通过阻断丝裂原激活蛋白激酶释放核因子κB来抑制TLR4表达和NOD2信号传导;
(c)抑制NLRP3炎性体激活并随后阻碍促炎细胞因子的释放;
(d)增加产生丁酸盐的细菌属如双歧杆菌属、罗氏菌属和乳杆菌属以及毛螺菌科成员的丰度。
▸ 地中海饮食通过微生物产生的短链脂肪酸也有助于减轻肠道炎症
由于可发酵碳水化合物含量较高,地中海饮食可导致肠道微生物群产生更多的短链脂肪酸。此外还发现,地中海饮食可改善坚持饮食的肠易激综合征患者的腹胀和腹痛。
膳食纤维、益生元和合生元等营养物质具有促进细菌群落生长的作用,对健康有益,并被证明可以改善宿主肠道炎症。
益生元和合生元在IBS和IBD中的作用




Jadhav A,et al.Annu Rev Nutr.2023
▸ 可溶性膳食纤维有助于改善肠道炎症
对14项随机对照研究(包括906名肠易激综合征患者)进行的荟萃分析发现,可溶性膳食纤维可显著改善症状,但麸皮则不然。
注:但这些研究大多数都使用纤维补充剂;他们中很少有人改变饮食以增加纤维摄入量。尽管有几项研究调查了益生元和合生元,但没有足够的数据来提出建议。
炎症性肠病的临床前模型发现,高纤维(主要是车前草)、低蛋白饮食可增强肠道屏障功能并减少炎症。因此,可溶性纤维似乎对肠易激综合征患者和炎症性肠病患者都有益。
最近的一项荟萃分析还发现,膳食纤维摄入量与克罗恩病风险之间存在线性剂量依赖性关系,每天每增加10克纤维摄入量,克罗恩病风险就会降低 13%。
▸ 补充益生元可以降低疾病活动性
一项针对肠易激综合征患者的随机、平行、双盲研究比较了地中海饮食和益生元补充剂(β-低聚半乳糖)与低FODMAP饮食和安慰剂木糖补充剂的效果,发现肠易激综合征患者的症状有所改善,但补充益生元后肠道微生物群分布更有利。这一发现突显了饮食调整和补充作为胃肠道疾病管理中限制性饮食习惯的替代方案的潜力。
基于食物和补充剂的纤维和益生元干预研究报告指出,富含纤维的半素食、车前子种子、燕麦麸和发芽大麦食品在缓解和显著改善胃肠道症状(如腹痛和反流)方面取得了令人振奋的成果。
在接受低聚果糖(每天15克,持续3-4周)、富含低聚果糖的菊粉(每天两次,每次10克,持续4周)、全麦麸(每天0.5杯,持续4周)、菊粉型果聚糖(每天7.5克,持续9周)和发芽大麦食品补充的活动性疾病队列中也报告了类似的结果,特别是显著降低了疾病活性并提高了生活质量。
▸ 纤维和益生元的益处会因个体健康状况和肠道菌群组成而不同
一项评估纤维摄入量对肠道微生物组组成影响分析表明,与安慰剂/低纤维饮食相比,高膳食纤维摄入与双歧杆菌属和乳杆菌属的丰度显著增加以及粪便丁酸盐含量增加相关。
不过这些研究主要针对成年炎症性肠病患者进行,对儿童的益处尚不清楚。膳食纤维被广泛用于包括一系列复合碳水化合物(包括益生元)。但如上所述,膳食纤维的效果可能会因碳水化合物结构、健康状况和肠道微生物群组成而异。
一些研究表明合生元对成年溃疡性结肠炎患者有益。与安慰剂组相比,补充长双歧杆菌和富含低聚果糖的菊粉4周可改善症状,并降低炎性细胞因子(TNF-α和IL-1β)的表达。
在一项随机对照试验中报告了类似的结果,该试验涉及补充8周由屎肠球菌、植物乳杆菌、嗜酸乳杆菌、嗜热链球菌、乳双歧杆菌、长双歧杆菌和低聚果糖组成的合生元混合物。
纯肠内营养(EEN)已被接受为儿科克罗恩病患者的一线饮食干预措施。特指经消化道途径(包括口服和管饲)提供营养物质的一种营养支持治疗方式,包含所有必需的常量营养素和微量营养素。
▸ 纯肠内营养有助于减轻克罗恩病患者症状
许多研究表明,纯肠内营养(EEN)在诱导轻度至中度克罗恩病儿科患者缓解方面的效果与皮质类固醇相当。例如,在澳大利亚和西班牙的独立试验中,补充EEN8周分别使84%和80%的受试者达到临床缓解。
EEN对患有克罗恩病的围手术期成年患者也有效。两项前瞻性队列研究的荟萃分析显示,术前接受EEN的患者(22%)与未接受EEN的患者相比,术后并发症显著减少。尽管有限,但其他研究已经描述了EEN在治疗穿透性克罗恩病、狭窄性克罗恩病和肠外克罗恩病方面的益处。
▸ 纯肠内营养增强肠道微生物群的抗炎作用
从机制上讲,EEN可能通过改变肠道菌群的组成和功能发挥作用。尽管它反而降低了肠道微生物多样性和通常被认为有益的菌群的丰富度(粪杆菌属、瘤胃球菌属和双歧杆菌属以及丹毒丝科、毛螺菌科的其他成员),但它根据代谢物的变化增强了肠道菌群的功能。
由于EEN的组成简单,降低抗原压力和肠道休息也可能是其重要的作用机制。此外,EEN配方中的活性成分可以改善营养参数,并可能对肠上皮产生抗炎作用。
在成人中,EEN作为二线或三线治疗使用,而皮质类固醇则是主要的诱导治疗,因为这些药物比EEN更有效地诱导临床缓解。
▸ 排除饮食减少肠道微生物的有害变化有助于病情缓解
部分肠内营养(PEN),即补充患者一半的热量需求作为肠内营养和全食物饮食,有助于克罗恩病患者维持病情缓解。
一项儿科克罗恩病队列研究中,无限制的PEN与元素配方结合效果有限;因此,研究人员认为需要一种针对克罗恩病和溃疡性结肠炎的排除饮食,排除某些有害食物。
克罗恩病排除饮食(CDED)与PEN相结合,是一种全食物饮食制度,旨在减少与肠道微生物群有害变化(如变形杆菌的扩张)、屏障完整性受损和胃肠道炎症相关的饮食成分和食物的暴露。
CDED不包含加工食品,并含有有益的纤维,再加上液体配方奶粉,以满足患者的能量需求。一项前瞻性研究报告称,与EEN相比,CDED加PEN在CD队列中具有更好的耐受性和更有效的效果,并且75%的CDED加PEN患者获得了无类固醇的临床缓解。
饮食衍生的代谢物因宿主健康状况和肠道微生物群中不同代谢途径而异,这反过来影响了饮食的生物学效应。因此,同一种食物可能对不同人群的生理功能具有不同的作用,可以影响多种疾病的病理生理,这也解释了相同饮食干预对不同疾病有益。
我们仍处于研究饮食-宿主-肠道菌群相互作用产生的生物活性分子如何影响慢性胃肠道疾病的病理生理和治疗反应的早期阶段。一个重要的考虑因素是,在评估饮食干预的反应时观察到的显著个体间差异。这种差异可能源于饮食中生物可利用营养素的差异(由于成分和加工方式(如烹饪)的差异)、影响宿主代谢途径或免疫状态的基因多态性,以及肠道菌群代谢能力的差异。此外,其他环境和宿主因素也可能影响反应。我们需要考虑所有这些因素,以便能够为患者提供个性化的饮食建议。
编辑
Jadhav A,et al.Annu Rev Nutr.2023
总而言之,饮食与个性化微生物群在胃肠道疾病中的相互作用是一个复杂且充满潜力的研究领域。理解这种相互作用不仅有助于揭示疾病的发病机制,还为个性化医疗和精准营养提供了新的视角和方法。随着科学技术的不断进步,我们有理由相信,通过优化饮食和微生物群的相互作用,可以实现对胃肠道疾病更加有效的预防和治疗。
在应用方面,谷禾专注于高通量检测技术和人工智能的结合,通过精确、便捷、无创的检测方式,以肠道菌群为核心,结合蛋白质及代谢物检测的多组学检测,开发多模态表征和大模型框架。肠菌检测作为一种基于实证的工具,它不仅可以评估个人肠道菌群及营养状况,还可以从整个个性化营养生态的视角出发,多场景、全方位地为疾病预防和健康管理解决方案提供帮助。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Jadhav A, Bajaj A, Xiao Y, Markandey M, Ahuja V, Kashyap PC. Role of Diet-Microbiome Interaction in Gastrointestinal Disorders and Strategies to Modulate Them with Microbiome-Targeted Therapies. Annu Rev Nutr. 2023 Aug 21;43:355-383.
Armstrong HK, Bording-Jorgensen M, Santer DM, Zhang Z, Valcheva R, Rieger AM, Sung-Ho Kim J, Dijk SI, Mahmood R, Ogungbola O, Jovel J, Moreau F, Gorman H, Dickner R, Jerasi J, Mander IK, Lafleur D, Cheng C, Petrova A, Jeanson TL, Mason A, Sergi CM, Levine A, Chadee K, Armstrong D, Rauscher S, Bernstein CN, Carroll MW, Huynh HQ, Walter J, Madsen KL, Dieleman LA, Wine E. Unfermented β-fructan Fibers Fuel Inflammation in Select Inflammatory Bowel Disease Patients. Gastroenterology. 2023 Feb;164(2):228-240.
Dong C, Chan SSM, Jantchou P, Racine A, Oldenburg B, Weiderpass E, Heath AK, Tong TYN, Tjønneland A, Kyrø C, Bueno de Mesquita B, Kaaks R, Katzke VA, Bergman MM, Boeing H, Palli D, Masala G, Tumino R, Sacerdote C, Colorado-Yohar SM, Sánchez MJ, Grip O, Lindgren S, Luben R, Huybrechts I, Gunter MJ, Mahamat-Saleh Y, Boutron-Ruault MC, Carbonnel F. Meat Intake Is Associated with a Higher Risk of Ulcerative Colitis in a Large European Prospective Cohort Studyø. J Crohns Colitis. 2022 Aug 30;16(8):1187-1196.
Narula N, Wong ECL, Dehghan M, Mente A, Rangarajan S, Lanas F, Lopez-Jaramillo P, Rohatgi P, Lakshmi PVM, Varma RP, Orlandini A, Avezum A, Wielgosz A, Poirier P, Almadi MA, Altuntas Y, Ng KK, Chifamba J, Yeates K, Puoane T, Khatib R, Yusuf R, Boström KB, Zatonska K, Iqbal R, Weida L, Yibing Z, Sidong L, Dans A, Yusufali A, Mohammadifard N, Marshall JK, Moayyedi P, Reinisch W, Yusuf S. Association of ultra-processed food intake with risk of inflammatory bowel disease: prospective cohort study. BMJ. 2021 Jul 14;374:n1554.
Khademi Z, Milajerdi A, Larijani B, Esmaillzadeh A. Dietary Intake of Total Carbohydrates, Sugar and Sugar-Sweetened Beverages, and Risk of Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis of Prospective Cohort Studies. Front Nutr. 2021 Oct 1;8:707795.
IBD in EPIC Study Investigators; Tjonneland A, Overvad K, Bergmann MM, Nagel G, Linseisen J, Hallmans G, Palmqvist R, Sjodin H, Hagglund G, Berglund G, Lindgren S, Grip O, Palli D, Day NE, Khaw KT, Bingham S, Riboli E, Kennedy H, Hart A. Linoleic acid, a dietary n-6 polyunsaturated fatty acid, and the aetiology of ulcerative colitis: a nested case-control study within a European prospective cohort study. Gut. 2009 Dec;58(12):1606-11.
Dionne J, Ford AC, Yuan Y, Chey WD, Lacy BE, Saito YA, Quigley EMM, Moayyedi P. A Systematic Review and Meta-Analysis Evaluating the Efficacy of a Gluten-Free Diet and a Low FODMAPs Diet in Treating Symptoms of Irritable Bowel Syndrome. Am J Gastroenterol. 2018 Sep;113(9):1290-1300.

谷禾健康

腹泻是常见的健康问题,相信绝大多数人在生活中都曾遭受过腹泻的困扰。
根据2016年柳叶刀期刊统计,慢性腹泻影响全世界 3%-20% 的成年人。全球每年有17亿儿童腹泻病例,腹泻是五岁以下儿童死亡的第五大原因,每年约有52.5万儿童死亡。儿童时期腹泻还可能与营养不良相关,甚至对健康带来终生影响(后面文中会提到)。

全球对所有腹泻原因中特定类型细菌性腹泻患病率的估计包括大肠杆菌10%-25%、志贺氏菌10%、沙门氏菌3%、弯曲杆菌3%-6%。
我国是15个腹泻高发国家之一。十年纵向监测研究显示,主要病毒病原体来自A型轮状病毒和诺如病毒,主要的细菌病原体来自腹泻性大肠杆菌、非伤寒沙门氏菌。
腹泻的种类多、原因复杂,有病原体感染引起的急性腹泻,也有胃肠道疾病、神经系统疾病、食物过敏等伴随的慢性腹泻。
在腹泻期间肠道环境的短暂氧化,专性厌氧肠道菌群急剧消失,肠道菌群可能出现短暂失调。实际上,每次腹泻对肠道引起的波动不容小觑,人体内的肠道菌群相当于“历了个劫”。
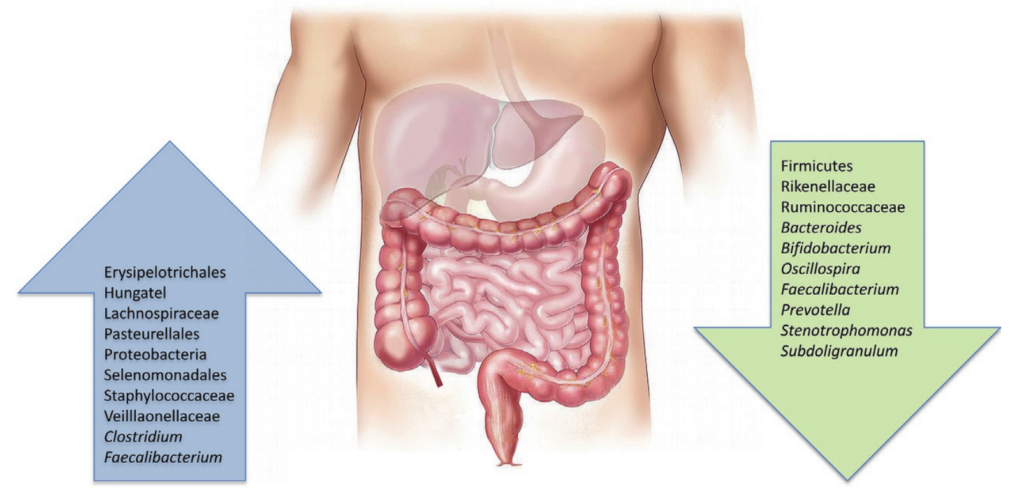
DOI: 10.1016/bs.pmbts.2022.08.002
针对腹泻问题的处理,一般人可能认为偶尔腹泻一两天就过去了没什么,甚至有人还觉得拉肚子有助于减肥…
实际上如果不引起重视没有及时干预,或者说身体免疫系统没有将病原体彻底清除,一些病原体残留在体内,可能引起多次腹泻,反复多次后可能逐渐形成慢性腹泻,甚至悄悄延伸到其他慢性疾病。
我们也有时候会看到这样的现象:
– 有些人在腹泻后疲倦了好一阵恢复不过来…
– 在几次腹泻的一段时间后,突然对某些食物开始过敏了…
– 甚至某一天不明所以地出现了自身免疫疾病…
– 也有人在腹泻后突然爆发了一些大面积的皮肤状况…
本文我们就来详细了解一下关于腹泻的病因,腹泻后的肠道菌群有哪些变化,这些变化会不会与其他疾病相关,在与腹泻相关的疾病中肠道微生物群发挥的作用,以及实际应用中的干预措施。

腹泻一般会出现以下症状:
可能还会伴随着:
腹泻可能引起脱水,如果不及时治疗,有可能危及生命。脱水对儿童、老年人和免疫系统功能低下者来说尤其危险。
成人脱水症状:
婴幼儿脱水症状:
★ 感染
感染可能是由于食用了被某种致病菌污染的食物,或饮用受污染的水,其中可能含有细菌、寄生虫等。
常见的感染有:细菌、病毒、真菌、寄生虫等。
★ 旅行者腹泻
旅行者腹泻是由食用被细菌、病毒或寄生虫污染的食物或饮用水引起的。旅行者腹泻最常见的是急性腹泻。然而,一些寄生虫会引起持续时间更长的腹泻。
部分地方可能很难将废水和污水与烹饪、饮用和洗澡的水分开,就比较容易出现腹泻。
★ 药物
许多药物都可能引起腹泻,包括抗生素、抗酸剂(含镁)、口服糖尿病药物、抗癌药物、降胆固醇药、秋水仙碱等。
★ 食物问题
食物过敏:对牛奶、大豆、谷物、鸡蛋、海鲜等食物过敏可能会导致慢性腹泻。
乳糖不耐受:很多人有这个问题。乳糖是存在于奶类和其他乳制品中的一种糖。有乳糖消化障碍的人在食用奶制品后会出现腹泻。
有些人小时候喝牛奶没事,长大后慢慢出现腹泻的情况了。由于人体内帮助消化代谢乳糖的酶会随着年龄的增长有所减少,乳糖不耐受症的情况也会随着年龄的增长而增多。
其他比如说果糖,天然存在于水果和蜂蜜中,有时,也作为甜味剂添加到一些饮料中。对于有果糖消化障碍的人来说,果糖可引起腹泻。
有些人可能吃含糖、辛辣、高脂肪或油炸食品,也会腹泻。食物中成分刺激胃黏膜和肠道,引起胃肠道炎症和蠕动加快,从而导致腹泻。
★ 慢性疾病
★ 手术
许多人在腹部手术后可能会出现腹泻。腹部手术包括对阑尾、胆囊、大肠、肝脏、胰腺、小肠、脾脏或胃的手术。消化道可能需要一段时间才能恢复从吃的食物中正常吸收营养。
关于围手术期相关知识详见我们之前的文章:
★ 营养不良
腹泻是五岁以下儿童营养不良的主要原因。每一次腹泻都会使他们的营养不良更加严重。
对于大多数感染来说,营养不良和腹泻之间的相互作用是双向的。也就是说,营养状态改变宿主对感染的反应,营养不良会导致对肠道病原体的抵抗力下降,增加腹泻的风险;而反复腹泻则会改变营养状态。当感染频繁时,尤其是复发性腹泻病,宿主营养状况也在相应变化且逐渐恶化,导致营养不良,免疫力下降,发育矮小。
关于儿童营养不良我们之前的文章写过,详见:全球队列显示儿童营养不良关键在肠道菌群
▸ 急性腹泻
持续一到两天的稀稀水样腹泻。这是最常见的类型,通常无需治疗,在几天内自行消失。
大多数急性腹泻病例都有感染性病因。
急性腹泻有没有可能发展为其他疾病?
急性感染性腹泻会导致原有的肠道微生态失调恶化,如果这种情况发生在儿童身上,从长远来看,粘膜免疫系统的发育和成熟以及肠道屏障的完整性可能会受到影响,使儿童更有可能因肠漏而患上自身免疫性疾病。(我们在后面会详细讲到)。
▸ 持续性腹泻
持续约两到四个星期的腹泻。
▸ 慢性腹泻
持续超过四个星期或在很长一段时间内有规律地发作和发作。
慢性腹泻通常是腹腔疾病、慢性胰腺炎、病理性胆汁吸收、慢性炎症性疾病的症状,或是药物、进食、肠道手术、放疗的副作用。慢性腹泻也可能继发于肠易激综合征,其特征是与腹痛相关的排便习惯改变(腹泻和/或便秘)。
功能性腹泻是一种特殊类型的慢性腹泻,根据Roma IV临床标准定义为腹泻性大便,发生时间超过25%,在诊断前3至6个月的时间范围内,肠壁没有任何结构异常。
全球每年有17亿儿童腹泻病例,腹泻是五岁以下儿童死亡的第二大原因,每年约有52.5万儿童死亡。
慢性腹泻影响全世界 3%-20% 的成年人。
全球对所有腹泻原因中特定类型细菌性腹泻患病率的估计包括大肠杆菌10%-25%、志贺氏菌10%、沙门氏菌3%、弯曲杆菌3%-6%。
美国细菌性腹泻约占所有腹泻的31%。 导致食源性腹泻的细菌病原体比例为:沙门氏菌15.4%,弯曲杆菌11.8%,志贺菌4.6%,产志贺毒素的大肠杆菌(STEC)约3%。
我国是15个腹泻高发国家之一。以下是一项对我国长达十年(2009-2018年)的纵向监测研究。

▸在患者中检测到的两种主要病毒病原体:
其次是腺病毒和星状病毒。
▸两种主要的细菌病原体:
其次是志贺氏菌和副溶血性弧菌。
▸年龄对病原体检测的影响:
以上我们了解了关于腹泻的一些基本信息,腹泻作为一种常见的消化系统症状,与肠道微生物群的平衡之间有什么关联呢?下一章节我们详细了解一下。
这里我们从两个方面来了解:
下面要介绍的菌群,如果在肠道菌群检测报告中发现超出正常范围,那么腹泻的发生与这些菌群密切相关,在食物卫生方面需要格外留意。
■气单胞菌属 (Aeromonas)
气单胞菌属细菌更常见于海鲜、肉类,有时也存在于蔬菜中。症状往往在食用受污染食品后不久出现,可以持续几天到2周。除了腹泻,一般没有腹痛,呕吐和发烧可能存在,也可能不存在。
■ 蜡样芽孢杆菌(Bacillus cereus)
“炒饭综合征”,即蜡样芽孢杆菌引起的食源性疾病,具有明显的季节性,多发生在6月到10月;蜡样芽孢杆菌污染的食品,外观一般无明显变化,看不到腐败变质现象。潜伏期在1至16小时之间,在这段时间之后,症状才会变得明显,总体短暂仅持续约1至2天。除了大量腹泻,还有呕吐和腹痛。发烧通常不会发生在由蜡样芽孢杆菌引起的细菌性肠胃炎中。
■ 弯曲菌属(Campylobacter)
弯曲菌常见于乳制品、不同肉类和家禽中。潜伏期为2至4天,之后出现症状。整个病程在5至7天之间。呕吐通常不会发生。不过,腹泻时伴有发热、腹痛。
■ 梭菌属(Clostridium)
通常与食源性感染相关的是艰难梭菌和产气荚膜梭菌。
艰难梭菌感染的潜伏期是可变的。艰难梭菌引起的腹泻症状通常在用抗生素后 5-10 天开始,但也可能在第一天或长达 2个月后出现;艰难梭菌的病程也有很大差异。
艰难梭菌轻中度感染症状:
严重感染时通常会脱水,需要住院治疗。
(关于艰难梭菌感染我们在后面还会详细讲)
产气荚膜梭菌感染的潜伏期通常不超过1天,可以短至几个小时,病程大概仅持续约1天。呕吐一般较轻,通常不发烧,但腹泻时确实会出现腹痛。
■大肠杆菌(E.coli)
虽然我们说大肠杆菌自然存在于人类的肠道中,但一些菌株可能会导致严重的疾病。
不同的腹泻大肠杆菌菌株表现出不同的流行病学,并分为肠致病性大肠杆菌(EPEC,婴儿腹泻的主要原因)、肠出血性大肠杆菌,根据病理类型、定植部位、毒力机制和临床症状,可分为肠毒素性大肠杆菌(ETEC,旅行者腹泻和婴儿腹泻的主要原因)和肠侵袭性大肠杆菌。
在食品中,它通常来源于碎牛肉,但也可能在蔬菜中找到,尤其是当灌溉水被人或动物粪便污染时。肠出血性大肠杆菌潜伏期为1至8天,通常持续约3至6天。
通常不呕吐,可能发烧,也可能不发烧,但腹痛伴有腹泻。产肠毒素大肠杆菌的潜伏期为1至3天,疾病持续约3至5天。低烧伴呕吐、腹痛、腹泻。
■ 李斯特菌属(Listeria)
李斯特菌属细菌常见于牛奶和乳制品中。潜伏期约1天,期间无症状。这种疾病往往会持续3天左右。有些人确实会呕吐,但通常并不常见。出现发烧,腹痛可能也可能不会与腹泻同时发生。
■ 邻单胞菌属(Plesiomonas)
邻单胞菌更常见于海鲜中,食用受污染的牡蛎后容易感染。这种疾病往往在食用受污染的食物后很短一段时间内开始,并可持续2周。除腹泻外,呕吐、发热和腹痛等其他症状可能存在,也可能不存在。
■沙门氏菌属(Salmonella)
沙门氏菌是一种革兰氏阴性兼性厌氧细菌,存在于许多不同的食品中,包括乳制品、鸡蛋、肉类、豆芽、黄瓜等。潜伏期可以是几小时到3天。这种被称为沙门氏菌病的疾病可以持续约2至7天。除了腹泻(水样腹泻),还有呕吐、发烧、腹痛、胃痉挛。粪便颜色可能出现绿色。
大多数沙门氏菌引起的腹泻患者可以完全康复。一些沙门氏菌感染者在感染结束后会出现关节疼痛,称为反应性关节炎。一些患有反应性关节炎的人在排尿时会出现眼睛刺激和疼痛。
■志贺氏菌属(Shigella)
志贺氏菌一般分四类:
志贺菌属引起志贺菌病,这是常见的细菌性痢疾类型之一。痢疾志贺氏菌产生志贺毒素,引起细菌性痢疾。宋内氏志贺氏菌毒性不如其他志贺氏菌,但容易暴发和流行。
如果由患病且不保持良好卫生的人处理,任何食品中都会发现这种病毒。用受污染的水烹制的生鲜食品或用受污水污染的水灌溉的蔬菜也可能是一个问题。
潜伏期最长可达2天。志贺菌病通常持续2至7天。表现为高烧、腹痛伴腹泻,即使肠子空了也感觉还需要排便。呕吐通常不会发生。5 岁以下的儿童最容易患志贺氏菌病,但所有年龄段的人都可能患上这种疾病。志贺氏菌感染中约有 5% 具有广泛耐药性。
志贺氏菌等感染后伴随发烧症状,可能是一些人群的肠道屏障薄弱,致病菌就容易进入到血液,引起发烧。大多数志贺氏菌感染是自限性的。
■葡萄球菌属(Staphylococcus)
食品中的葡萄球菌可能存在于乳制品和肉类中。它也可能出现在蛋黄酱等食品中。潜伏期很短,约2至6小时。这种疾病是短暂的,持续时间仅为1天左右。通常不会发烧。出现呕吐、腹痛和腹泻。
■ 弧菌属(Vibrio)
弧菌属细菌通常存在于牡蛎等海鲜中。较为知名的弧菌种类是霍乱弧菌,它是霍乱的病因。它通常通过受污染的水传播。弧菌感染的潜伏期非常短,最多1天左右。这种病最长可以持续5年。
■ 小肠结肠炎耶尔森菌(Yersinia enterocolitica)
小肠结肠炎耶尔森菌通过未充分煮熟的猪肉传播给人类。它也可能通过受污染的水传播。潜伏期可以持续数小时到6天不等。这种疾病最短可持续1天,最长可达45天。通常症状包括发烧、呕吐、腹痛伴腹泻。
如果在这种急性腹泻的时候进行肠道菌群检测,可以对应相关症状,辅助判别引起本次腹泻的病原菌。如果某些菌群超标,则与腹泻相关。
谷禾长期的肠道菌群检测实践发现,很多的健康人或者是说非腹泻人群的肠道菌群检测报告中,也可能会携带以上这些菌群,这是为什么呢?
有些致病菌可能是一过性的,最近旅行,或者吃的不干净的食物中把这些菌带进去了,但是它在健康的肠道中没有定植成功,又从粪便排出体外,因此肠道菌群检测就检出了这些菌。
致病菌也可能悄悄潜伏在身体内,正常情况下没有反应,但当有时候没睡好太累了免疫力低下的时候,或者其他病理炎症感染的时候,或者服用抗生素之后正常菌群一定程度存在失调,这些致病菌趁虚而入,定植成功,就到了它们发挥作用的时候,腹泻也就随之而来。
以上所提及的菌群与腹泻有直接联系,那么在腹泻期间,整体肠道菌群是否会受到影响呢?
一些菌群的变化是否与细菌性感染或病毒性感染相关呢?
我们接着看。
腹泻早期肠道菌群失调
这里将疾病的早期定义为腹泻症状没有消退的时期,通常是在疾病发作或出现在医院后的前三到五天内。
与年龄、位置匹配的健康个体相比,腹泻导致分类丰富度和多样性显著降低。重复冲洗可能会极大地侵蚀微生物群,腹泻粪便中较高的含水量(较低的排便时间)与较低的α多样性有关。
腹泻发作后,兼性厌氧菌的增殖
腹泻发作后,肠道微生物组发生了显著的分类变化,有利于快速生长的兼性厌氧菌的增殖。变形杆菌(主要是肠杆菌科/大肠杆菌)和链球菌(主要是唾液链球菌和Streptococcus gallolyticus)在早期阶段富集最为显著,在粪便微生物群中的相对丰度可能高达80%。
肠道短暂氧化,专性厌氧肠道共生菌的急剧消失
腹泻期间肠道环境的短暂氧化,促进了这些细菌的繁殖,编码低亲和力细胞色素氧化酶的基因相应升高证明了这一点。这种丰度的增加伴随着专性厌氧肠道共生菌的急剧消失(Blautia、Prevotella、Faecalibacterium、Lachnospiraceae、Ruminococceae等),导致相关代谢产物如短链脂肪酸耗竭。
然而,腹泻细菌通常是短暂的和/或低丰度的(第一天的霍乱弧菌除外)。
并不是在所有腹泻患者中都发生菌群失调
部分感染患者的粪便微生物群与健康对照组的粪便微生物组非常相似。特别是,腹泻儿童的肠道微生物组可以分为四种肠道类型,每种类型都以一个分类单元为主:双歧杆菌、拟杆菌、链球菌或大肠杆菌。
目前尚不清楚这些不同的初始配置如何影响临床结果和恢复,但链球菌的相对丰度较高与住院时间或腹泻持续时间呈正相关。
感染性腹泻下的肠道微生物组演替
doi: 10.1016/j.mib.2022.01.006
F. mortiferum过多可能是肠道失调的一般标志
除了埃希氏菌和链球菌,腹泻粪便微生物群中也发现了其他细菌过多,即使在整个肠道微生态没有失调的情况下也是如此。
在越南的研究强调,其中包括 Fusobacterium mortiferum,以及人类口腔微生物群的几个菌(Granulicatella、Gemella、放线菌、Rothia、具核梭杆菌等)。
厌氧F. mortiferum通常在中国人的胃肠道定植(虽然丰度较低),但在西方人群中没有定植,最近在大肠息肉患者中注意到其增殖。
这些结果表明,F. mortiferum过多可能是肠道失调的一般标志,尤其是在亚洲人群中。
口腔细菌与腹泻肠道微生物群的紧密联系
计算分析表明,根据分类群共丰度模式推断,口腔细菌可能在腹泻肠道微生物群中形成紧密的相关网络。这表明它们可能共存于多微生物生物膜中,与口腔中存在的类似,但它们在腹泻病中的意义目前尚未研究。
对健康个体来说,微生物在口腔-肠道轴上的移位是频繁发生的,而腹泻所产生的生态贫瘠环境可能是这些口腔菌群临时定居的理想条件。
不同腹泻病因的菌群存在一些细微的差异
虽然整体的生态失调模式与不同的腹泻病因无关,但存在一些细微的差异。
这可能表明,病毒感染导致厌氧肠道共生菌减少的程度较低,可能是因为大多数病毒(轮状病毒、诺如病毒)感染的是小肠内壁的细胞,而不是结肠。在小鼠模型中,轮状病毒感染仅在回肠微生物群中导致拟杆菌和阿克曼菌群(均具有粘蛋白降解能力)增加,但这两个分类群在人类轮状病毒感染中过度生长的证据尚不确定。
另一方面,贾第虫引起的腹泻,始终与γ变形菌减少和普雷沃氏菌属富集有关。
痢疾(粘液性/血性腹泻)是一种严重的感染性腹泻,肠道炎症加剧,需要抗菌治疗和更长的住院时间。痢疾腹泻中存在过多的兼性厌氧菌(大肠杆菌、链球菌、肠球菌等),同时具有免疫调节作用的细菌(Lactobacillus ruminis, Bifidobacterium pseudocatenulatum)减少。
这些发现表明,细菌感染和痢疾通常伴随着与健康状况进一步不同的失调状态,这可能是病原体引发的炎症和/或频繁使用抗菌药物的影响。
腹泻后恢复阶段
腹泻后恢复期患者的肠道菌群与疾病早期不同,并向健康人群的肠道菌群趋同。恢复阶段标志着肠道微生物群的分类丰富度和多样性逐渐增加,但微生物群落演替在感染个体中显示出较高的时间变异性。
中期:拟杆菌↑↑,晚期:普雷沃氏菌属,产短链脂肪酸菌↑↑
通过对感染了霍乱弧菌和产肠毒素大肠杆菌的孟加拉国患者的研究,研究人员提出了肠道菌群恢复的逐步(中晚期)演替模型。大肠杆菌/链球菌的扩张最终耗尽肠道环境中的氧气,导致其种群在恢复阶段下降。
中期的特征是拟杆菌数量相当丰富(最早出现在发病后的第7天),而晚期则含有更丰富、更多样的普雷沃氏菌属和产短链脂肪酸的厚壁菌。碳水化合物代谢基因(主要为拟杆菌属)在中期富集最显著,使这些细菌能够灵活地从饮食来源和宿主来源的碳水化合物(分别富含纤维和粘蛋白)中提取能量。
这种按时间顺序排列的微生物组合,类似于服用抗生素后肠道微生物组恢复的情况。大量研究指出,经过抗生素治疗后,拟杆菌大量增殖,而厚壁菌和放线菌则减少了。
拟杆菌成为结肠生态恢复的关键物种
类似地,等渗性腹泻诱发短暂的肠道扰动,冲洗后立即出现明显的拟杆菌繁殖。拟杆菌属,如单形拟杆菌(Bacteroides uniformis),多形拟杆菌(Bacteroides thetaiotaomicron),因其粘蛋白降解能力被确定为初级恢复相关类群。通过利用宿主衍生的营养物质,拟杆菌成为结肠生态恢复的关键物种。
这随后启动了一个复杂的交叉喂食网络,以加快其他厌氧菌和产短链脂肪酸的菌(双歧杆菌、玫瑰杆菌、粪便杆菌等)的重新繁殖,从而建立一个分类学和功能多样性的群落。
患者恢复的微生物群是否恢复到感染前状态?
由于缺乏腹泻队列研究,此类数据有限。一项弯曲杆菌人类挑战研究结果表明,在比较恢复期和感染前的微生物组,显著的成分差异仍然存在,恢复期拟杆菌的丰度归因于抗菌药物的使用。
相比之下,在病毒性肠胃炎的康复过程中,拟杆菌富集期的存在并不突出,这可能是由于其不太严重的失调状态和很少使用抗菌药物。
儿童腹泻带来的长期影响
虽然腹泻大多是急性的,但反复腹泻可能会对儿童健康产生终身影响。长期以来,研究表明,腹泻和营养不良相互影响,使儿童在成年后容易发育迟缓、认知障碍和葡萄糖不耐受。
腹泻→多样性↓↓,与发育迟缓相关
秘鲁儿童的纵向微生物组跟踪表明,腹泻频率的增加,大大降低了肠道微生物组的多样性和丰富度,而发育迟缓儿童的这种影响更为严重。发育迟缓还与微生物群恢复速度较慢有关,而长期的扰动反过来又降低了对随后肠道感染的适应能力,形成了腹泻和营养不良的恶性循环。
口腔菌群→肠道定植,可能引发炎症
非洲发育迟缓的儿童的小肠和结肠中口腔细菌过度生长,口腔细菌占优势,如唾液乳杆菌和链球菌。研究人员推测,反复腹泻增加了移位口腔细菌适应紊乱肠道环境的机会,口腔菌群稳定定植可能会引发炎症并改变微生物组的功能。
无症状携带的肠道病原体也会重塑肠道微生物组
感染弯曲杆菌、诺如病毒或肠聚集性大肠杆菌的儿童具有显著更高丰度的Ruminococcus gnavus,它与克罗恩病密切相关,并产生促炎多糖。与腹泻类似,弯曲杆菌的无症状感染与发育迟缓有关,突出了菌群失调在腹泻之外的重要性。
腹泻:耐药基因水平转移,促进新的耐药性表型
肠杆菌科在腹泻早期的扩张,大大增加了它与攻击性病原体的接触,从而增加了水平基因转移的可能性。实验模型已经证实,由于结肠炎诱导的肠杆菌科细菌增多,质粒很容易从沙门氏菌转移到大肠杆菌。
越南的研究发现,共生大肠杆菌和致病性Shigella sonnei中存在相同的多药耐药质粒,这两种质粒都是从一名腹泻儿童身上分离出来的。这表明,一旦病原体进入肠道感染发生率和抗菌药物使用率高的环境,肠道的肠杆菌科可以成为促进新的多药耐药性表型出现的有效宿主。
腹泻后的肠道微生态失调是短暂且可逆的,但其负面影响在脆弱人群中会被放大。
以上是关于感染性腹泻与肠道菌群之间的关联,实际上研究表明,肠道菌群的失调与慢性腹泻之间也存在密切的联系。接下来,我们从具体疾病中一一来看它们之间的关联机制。
腹泻可能是许多疾病的症状。这里我们介绍一些常见的与肠道菌群相关的包括腹泻症状的疾病,例如肠易激综合征、胆汁酸腹泻、乳糜泻、炎症性肠病、抗生素治疗腹泻、放射性腹泻、酮症腹泻等。
IBS的特征是慢性腹痛或不适以及排便习惯改变,其诊断是根据罗马 IV 标准在临床上确定的,该标准将 IBS 定义为过去三个月内平均每周至少一天发生的复发性腹痛,涉及以下两种或多种相关症状:排便、大便频率的变化或大便外观的变化。
IBS的亚类包括:
什么人群更易出现IBS?
IBS的多种病理生理机制
如运动能力改变、屏障功能受损、免疫激活、内脏过敏和中枢神经系统异常,并可能与个人和环境风险因素有关,包括遗传易感性、压力、抗生素使用、肠道感染、心理困扰、饮食等。
doi.org/10.3390/jcm12072558
脑-肠轴的失调会改变胃肠道系统的运动、感觉、自主和分泌功能,进而改变肠道蠕动、肠道通透性、内脏敏感性和肠道微生物群组成,所有这些都与 IBS 的发病机制有关。
关于内脏敏感详见我们之前的文章:
腹胀、腹痛、肠胃不明原因疼痛?–可能是内脏高敏感,详细了解内脏高敏的原因后果
IBS 中常见的肠道蠕动变化是由血清素代谢改变介导的。肠神经系统的肠嗜铬细胞释放血清素,刺激肠道蠕动并调节分泌和血管舒张功能。肠神经系统失调可导致血清素分泌增加或减少,分别表现为腹泻或便秘。
IBS的肠道菌群变化
IBS-D 的特点是粪便微生物群的微生物多样性总体下降,厚壁菌门显著减少,拟杆菌门增加。

多种类型IBS的菌群变化:
低度炎症和免疫功能障碍在 IBS 中发挥作用
研究发现 IBS 患者的促炎细胞因子水平升高,部分原因可能是压力所致。
10%的IBS病例是在最近患有胃肠道疾病的情况下感染后发生的,这通常会导致粘膜和全身炎症。
IBS症状与心理、生理和神经胃肠道因素有关
肠道微生物组的改变也会导致一些炎症和免疫学变化,这些变化可能会通过增加肠道通透性来损害胃肠粘膜屏障。这反过来可能会干扰胃肠道稳态,并使脑-肠伤害感受通路失调,导致内脏过敏或胃肠道疼痛感增强。
IBS相关干预措施
IBS患者饮食方面要注意,豆类、含乳糖食品和人工甜味剂中存在的可发酵低聚糖、单糖、二糖和多元醇 (FODMAP) 由于其发酵和渗透作用,可能会加剧部分患者的症状。
注:FODMAP 在小肠中吸收不良,导致大结肠中的水分吸收增加和发酵产生气体,这可能会导致与 IBS 相关的几种症状,包括腹痛和腹胀。摄入 FODMAP 的渗透效应也可能导致胃肠道系统扩张,并在肠道蠕动异常中发挥作用。
消除 FODMAP饮食 可以改善 IBS 整体症状,消除饮食涉及短时间(即几天到几周)而不是永久地禁食各种食物。
IBS基于病理生理学的分类和治疗建议

四分之一的 IBS-D 患者实际上患有特发性胆汁酸腹泻,接下来我们来看看胆汁酸腹泻。
胆汁酸腹泻
胆汁酸腹泻(BAD)是一种常见的疾病,其起因是原发性胆汁酸流失增加,并可导致微生物群变化,同时与腹泻型肠易激综合征(IBS-D)有重叠之处。
胆汁酸腹泻患者报告的最常见症状是爆发性腹泻、难闻的气味或水样腹泻(80%)、尿急 (85%) 以及腹胀或肿胀 (54%)。
实际上,25-33%的慢性腹泻患者患有原发性胆汁酸腹泻。继发性胆汁酸腹泻继发于终末期回肠切除或发生在克罗恩病或放射线后。
胆汁酸腹泻是怎么回事?
胆汁酸由肝脏产生并储存在胆囊中。吃脂肪食物时,胆汁酸会释放到小肠中分解脂肪,之后胆汁酸被重新吸收并送回肝脏重新利用。通常,只有很少的胆汁酸最终进入大肠。
胆汁酸的正常肝肠循环
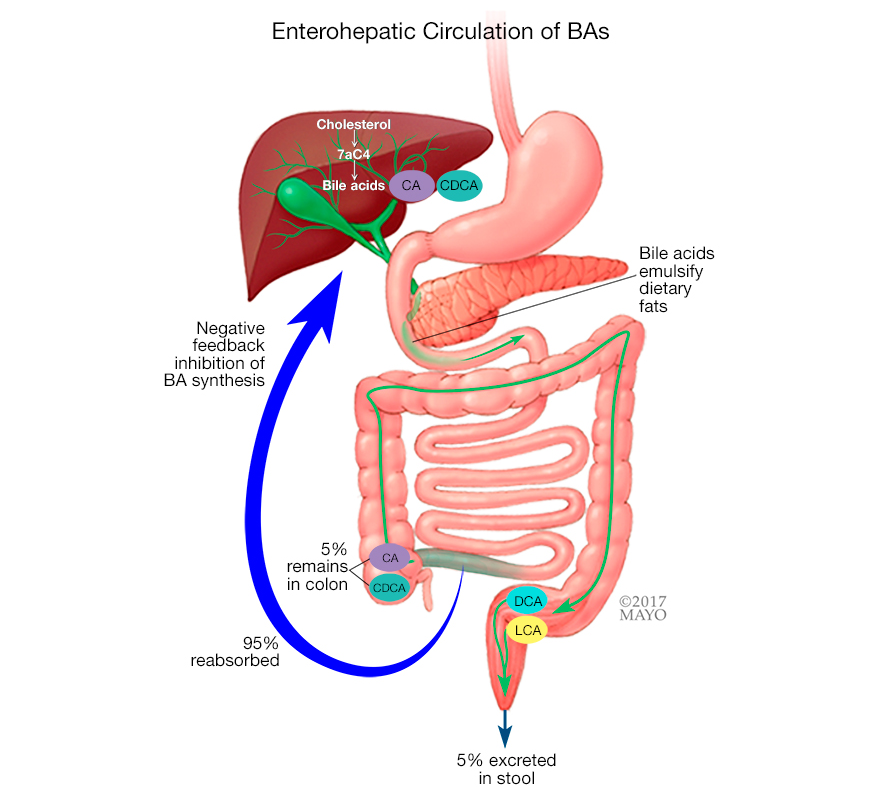
对于 BAD 患者,大量胆汁酸会被冲入大肠。这会导致肠道内液体增加。液体通过肠道的运动速度加快,结果是水样大便。
胆汁酸合成由与肠肝循环相关的负反馈回路调节,该负反馈回路依赖于法尼素X受体和成纤维细胞生长因子。这些反馈回路的中断会导致胆汁酸的过量产生,从而导致胆汁酸腹泻。
低脂饮食可能有助于改善与胆汁酸腹泻相关的症状。
与肠道菌群有什么关联?
由于电解质失衡,胆汁酸的吸收不良或过量产生会导致肠道菌群失调和腹泻。
肠道菌群负责初级胆汁酸的去结合、脱氢、7α脱氢和差向异构化,在胃肠腔产生次级胆汁酸,并介导胆汁酸合成的反馈控制。肠道菌群是胆汁酸的主要调节者,反过来又调节微生物群的组成和丰富度及其特征。
在一组胆汁酸排泄过多的IBS-D患者(BA+IBS-D)中,一种以胆汁酸转化梭菌物种富集为特征的特定肠道菌群能够增强胆汁酸总排泄量,这与粪便胆汁酸和血清7-羟-4-胆甾酮(C4)水平较高有关。
另一项最新研究显示,BAD患者粪便细菌多样性降低,其他菌群变化如下:
BAD患者的初级粪便胆汁酸比例也较高,可能是由于肠道微生物群中双歧杆菌和Leptum减少,大肠杆菌增加所致。这可能会改变胆汁酸对FXR和TGR5的亲和力,从而导致FXR活性降低,胆汁酸向结肠的输送增加。
另有研究表明,双歧杆菌丰度增加的同时,次级粪便胆汁酸减少,从而导致乙酸盐和丙酸盐水平升高。
乳糜泻 (CD) 是一种常见的全身性疾病,是由于人体免疫力对麸质摄入的异常反应而导致的。
注:麸质是一种存在于小麦、大麦、黑麦等谷物中的蛋白质,可溶于酒精。
乳糜泻的发病机制涉及遗传和环境因素的复杂相互作用。肠道微生物群在乳糜泻的发病机制中发挥着复杂的作用。
与乳糜泻相关的微生物群的变化
包括有益菌丰度降低,特别是以其抗炎和免疫调节特性而闻名的双歧杆菌。
还有乳杆菌通过多种机制,包括分泌抗炎细胞因子和改变Th1免疫反应。
某些细菌的过度生长与肠道通透性增加有关,这是乳糜泻的一个标志。具体来说:
肠道微生物群导致乳糜泻的可能发病机制
这里从环境因素的作用、微生物群本身的作用、遗传学因素、围产期因素等几个方面来说。
环境因素的作用:
一种假设是,一些肠道细菌表达模仿麦醇溶蛋白(麸质的一种成分)的表位,可以引发宿主免疫反应。这种反应导致免疫系统激活并产生攻击肠道内壁的抗体。
另一个假设与脂多糖有关,脂多糖是革兰氏阴性细菌外膜中发现的分子。脂多糖可以通过产生IL-15在先天性和适应性免疫系统中发挥相关作用,IL-15可以引发肠道炎症。
一些细菌,例如铜绿假单胞菌,与麸质结合可导致粘膜炎症加剧。这两个因素的结合可能会导致肠道内壁进一步受损,并加剧乳糜泻症状。
最后,病毒感染也可以触发先天免疫系统的激活。具体来说,TLR3是一种可以识别病毒感染并做出反应的受体,导致先天免疫系统激活和肠道炎症。
微生物群本身的作用:
– 通过产生特异性免疫原性或耐受性面筋肽
– 释放影响肠道通透性的连蛋白(zonulin)
– 通过促进上皮粘膜成熟,改变麸质的消化,从而促进乳糜泻发病
– 肠道菌群产生的促炎或抗炎肽和细胞因子也可能通过调节免疫系统发挥作用
微生物群代谢产物的作用:
肠道细菌还可以通过释放短链脂肪酸来调节,具体来说,短链脂肪酸通过促进紧密连接形成、抑制促炎细胞因子的产生以及促进调节性T细胞分化,参与维持肠上皮屏障的完整性。通过这种方式,肠道细菌及其产物的平衡可能会影响宿主对包括麸质在内的膳食抗原的耐受能力,可能导致乳糜泻的发生。
遗传学的作用:
– 乳糜泻家族风险婴儿的基因型(携带HLA-DQ2单倍型的),影响早期肠道菌群的组成
– 有乳糜泻遗传易感性的婴儿肠道菌群组成不同(即拟杆菌比例)
– 出生后前6个月微生物群变化增加了包括乳糜泻在内的自身免疫性疾病的发病风险
患有乳糜泻一级亲属的婴儿的大规模前瞻性出生队列研究,在引入食物(包括麸质)之前,4-6个月大的婴儿中几种链球菌和粪球菌的丰度减少与患乳糜泻的遗传风险有关。发生乳糜泻的标准遗传风险和高遗传风险与拟杆菌和肠球菌种类增加有关。出生后4-6个月时,下列菌群丰度下降:
围产期因素的作用:
剖腹产:由于粪肠球菌增加,拟杆菌属和副拟杆菌属数量减少,导致乳糜泻的风险更高。
喂食类型:婴儿配方奶粉喂养可能是发生乳糜泻的危险因素,但结果不一致。
任何的配方奶粉(无论是纯配方奶粉喂养还是与母乳混合喂养的儿童)都与短双歧杆菌数量减少相关。
抗生素使用:与乳糜泻之间存在关系,这可能是剂量依赖性的。
胃肠道感染:出生后 6-18 个月内的胃肠道感染会因肠道通透性增强而增加患乳糜泻的风险。
肠病毒、腺病毒12型、正呼肠病毒和白色念珠菌也与乳糜泻风险增加有关。
以上所有这些机制凸显了肠道微生物组、麸质和免疫系统在乳糜泻发展过程中复杂的相互作用。
炎症性肠病(IBD)常见症状是腹痛、腹泻和体重减轻。炎症性肠病主要包括:克罗恩病(CD)和溃疡性结肠炎(UC)。
IBD 类型通常通过炎症位置和胃肠道的组织病理学特征来区分。临床上:
这两种情况均源于遗传易感宿主对微生物和/或环境因素的不适当免疫反应。
炎症性肠病患者肠道菌群变化
炎症性肠病患者肠道菌群多样性较低,对大多数炎症性肠病患者的报告了厚壁菌门、拟杆菌门和变形菌门内特定细菌类群的丰度变化,具有攻击性的菌群的增多,如变形杆菌、梭杆菌属、瘤胃球菌,同时具有保护性的菌群的减少,例如Faecalibacterium、罗氏菌属 、毛螺菌科、双歧杆菌属。
当粘蛋白降解细菌(如瘤胃球菌)过度生长时,粘液层开始变薄,肠壁更容易受到肠道微生物的促炎信号的影响。
当这种情况变成慢性时,肠壁中的异常炎症反应似乎成为常态,导致我们在 IBD 中看到的肠壁损伤以及特征性的高粪便钙卫蛋白和FIT。慢性炎症会使肠道菌群失调和肠道屏障功能障碍长期存在,形成恶性循环。
肠道中高水平的具核梭杆菌(一种来自口腔的共生细菌),与炎症性肠病的进展有关。
其他例如普拉梭菌等一些产丁酸菌也减少,丁酸盐有助于肠壁修复和调节炎症。如果肠道丁酸生成量低,肠壁可能会变得渗透性过高,并由于这种微生物介导的愈合机制的丧失而出现慢性炎症。
关于IBD在我们之前的文章有详细阐述其机制,以及肠道微生物群与IBD之间的密切关联,详见:肠道菌群失调与炎症性肠病的关联
抗生素相关性腹泻(AAD)通常是指与服用抗生素相关且无法以其他方式解释的腹泻。腹泻可发生在抗生素治疗期间和治疗停止后长达8周。
发病率:
AAD的临床病程因是否涉及艰难梭菌而异,大多数非艰难梭菌发作。艰难梭菌AAD严重程度轻微,自限性强,仅持续几天。
一项对住院患者抗生素相关性腹泻相关细菌的荟萃分析显示,艰难梭菌、产气荚膜梭菌、产酸克雷伯菌(Klebsiella oxytoca)、金黄色葡萄球菌是全球AAD住院患者中最常见的细菌。
AAD组动物模型中变形菌门和放线菌门丰度较高。更重要的是,模型组乳杆菌的丰度明显低于对照组,而肠球菌的丰度明显高于对照组。
抗生素治疗还增加了柠檬酸杆菌(Citrobacter)、窄养单胞菌(Stenotrophomonas)和谷氨酸杆菌(Glutamicibacter)的丰度,而抗生素降低了支原体和幽门螺杆菌的丰度。
■ 艰难梭菌感染
艰难梭菌是一种革兰氏阳性厌氧芽孢杆菌,是一种重要的医院病原体。艰难梭菌是属于厚壁菌门的正常微生物群的一部分,正常在特定范围内。
近年来,由于抗生素过量使用,艰难梭菌相关性腹泻(CDAD)的发病率有所增加。
艰难梭菌相关性腹泻发展的关键风险因素:
艰难梭菌感染的临床表现各不相同,从无症状或非常轻微的腹泻到严重的伪膜性结肠炎。艰难梭菌感染的发病机制似乎与正常肠道微生物群的破坏有关,主要来自抗生素治疗,如阿莫西林、氟喹诺酮、氨苄青霉素、克林霉素和头孢菌素,这些药物可能导致肠道微生态失调。
注:健康微生物组的共生菌群通过定植抗性控制艰难梭菌等病原体的定植。在抗生素和抗肿瘤或免疫抑制药物对正常肠道菌群产生破坏性影响后,肠道易被艰难梭菌定殖,或者这种影响可能导致肠道环境中预先存在的微生物种群过度生长,从而导致CDAD。
病原体通过粪口途径和孢子传播,一旦摄入,可以在胃酸中存活并定植于结肠,释放肠毒素A和细胞毒素B,这在很大程度上是造成临床严重程度的原因。
与未发生艰难梭菌感染的患者相比,抗生素治疗后艰难梭菌感染患者的微生物群多样性较低。与对照艰难梭菌抗性小鼠相比,发现数量显著增加的初级胆汁酸和某些碳水化合物有利于艰难梭菌的生长。
对于复发性艰难梭菌感染,可以使用粪菌移植FMT治疗,目前临床上有较好的反馈,随着研究的深入和技术的成熟,成功率也越来越高,关于FMT我们在后面章节也会讲到。
有时候常常将食物过敏与食物不耐受混为一谈。虽然这两种情况可能会导致类似的症状,但它们是由不同的机制触发的。
食物过敏是由于免疫系统对特定食物物质的过度反应引起的。食物过敏的主要原因是蛋白质。
蛋白质存在于花生、坚果、鸡蛋、乳制品、鱼、小麦、大豆和虾等贝类中。
牛奶过敏是婴幼儿期常见的食物过敏,牛奶蛋白质分为两大类:酪蛋白和乳清蛋白,所有蛋白质都可能是潜在的过敏原,并且可以诱导IgE 和非 IgE 介导的免疫反应,从而导致广泛的临床表现和不同的表型。
非 IgE 介导的牛奶过敏涵盖多种疾病,包括食物蛋白诱发的过敏性直肠结肠炎、食物蛋白诱发的小肠结肠炎综合征和食物蛋白诱发的肠病。
当身体遇到少量的有害食物时,它都会释放组胺,肠道内布满了具有组胺受体的细胞。当组胺与这些受体结合时,会引起消化系统的肌肉收缩,导致腹部痉挛和腹泻。
患有慢性小肠结肠炎综合征的婴儿表现出更多的慢性症状,如呕吐、慢性腹泻和生长发育不良。
案
例
一名6个月的患者,基本情况:中度营养不良,牛奶蛋白过敏,每日腹泻较多。
肠道菌群检测报告如下:
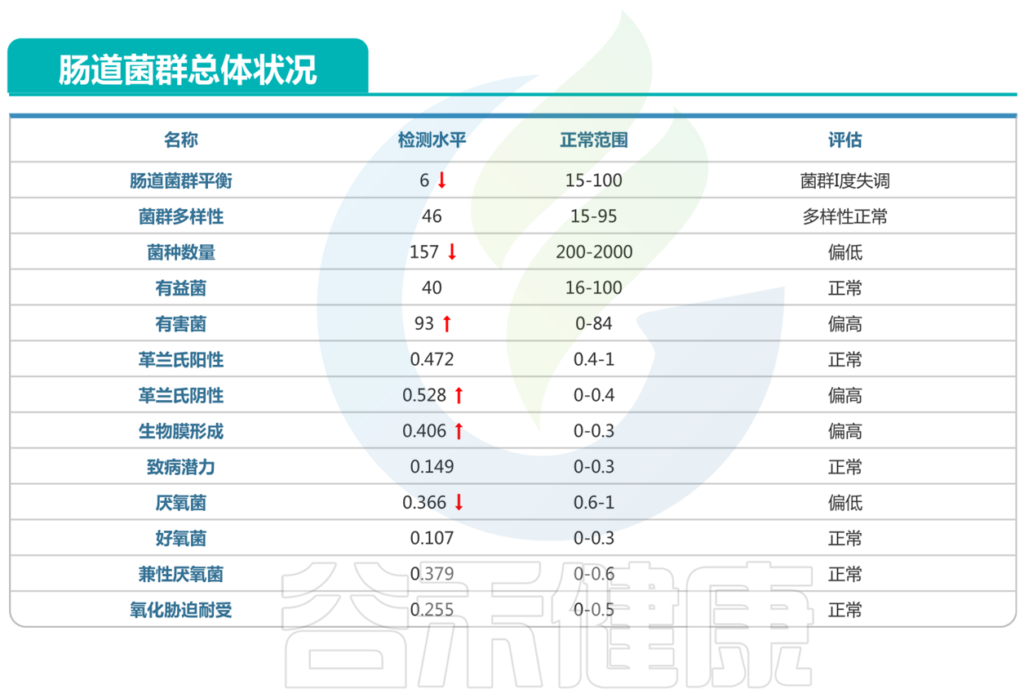
<来源:谷禾健康肠道菌群数据库>
以上我们可以看到:
病原菌中:
对应的菌属中:链球菌属,志贺氏菌属,梭菌属这几类有害菌较多的菌属属于人群中较高。
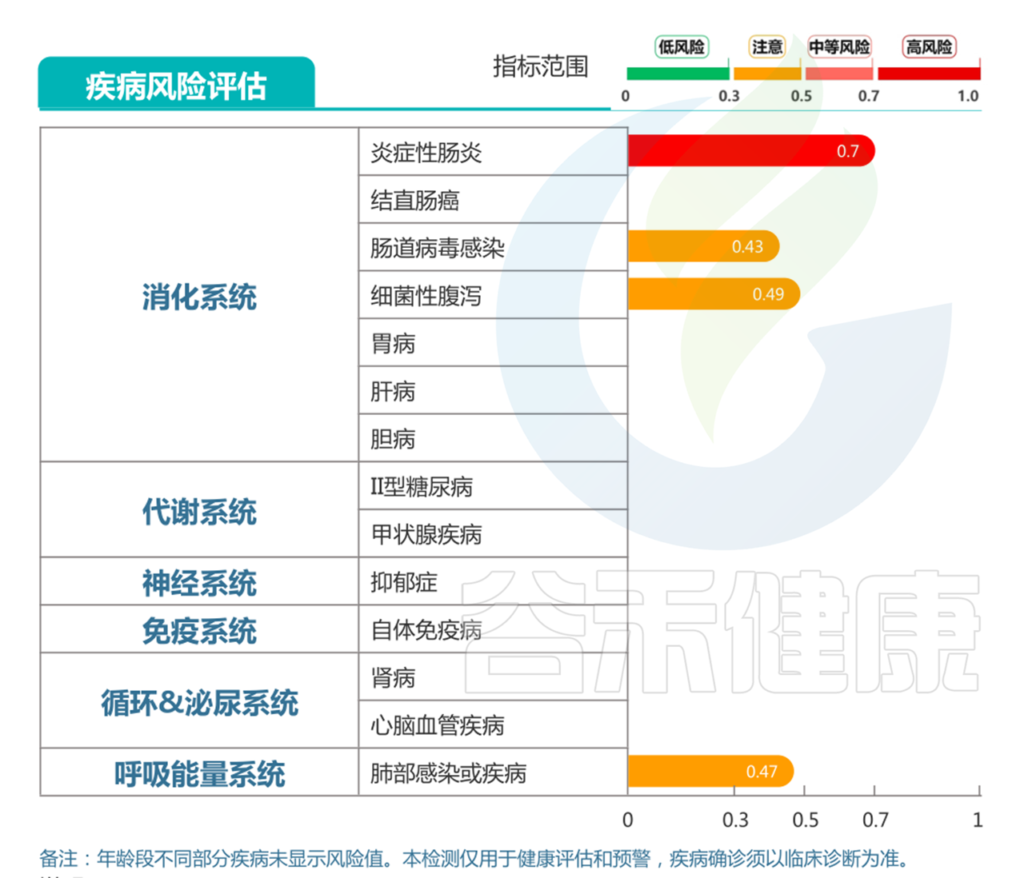
<来源:谷禾健康肠道菌群数据库>
针对牛奶蛋白过敏,以及出现中度营养不良和腹泻的情况,对应报告中:
消化道疾病部分的显示的,肠炎高风险,细菌性腹泻、病毒性腹泻和过敏性腹泻均提示注意。
结合前面病原菌的超标和每日腹泻症状,判断较大可能存在细菌性腹泻的可能。较大可能存在肠炎的情况,并引发肠道屏障损伤,导致乳蛋白过敏的情况。
干预建议:
牛奶过敏暂时可以使用深度水解的奶粉减少过敏。另外可以适当开始摄入米粉等辅食,补充碳水化合物。
基于肠道炎症的情况,可以考虑少量服用姜黄素,并补充益生菌。
扩展阅读:生命早期微生物接触和过敏风险:如何预防
放射性腹泻患者的肠道微生物群落变化比非放射性腹泻患者的肠道微生物群落变化更大,因此,肠道微生物群对于预防放射性腹泻至关重要。
腹泻患者的拟杆菌、Dialister、Veillonella和未分类细菌种类增加,梭菌XI和XVIII、Faecalibacterium、Oscillobacter、Prevotella、Parabacteroides减少。
一些证据还表明,接受放射治疗的患者艰难梭菌感染的发生率很高,这与高死亡率有关。研究表明,肠道微生物群组成可作为放射治疗引起的腹泻和疲劳发展的预测标志。
肠道微生物组对辐射诱导的胃肠道粘膜炎发病机制的影响,是通过调节氧化应激和炎症过程、肠道通透性、粘液层组成、上皮修复和抵抗有害刺激的能力,以及免疫效应分子在肠道中的表达和释放介导的。
肠道微生物组可以通过两种机制影响辐射诱导的胃肠道粘膜炎:易位和微生态失调。
辐射破坏肠道屏障和粘液层,导致细菌移位,从而激活炎症反应。生物失调,无论是由辐射还是其他因素引起,都会影响局部和全身免疫反应。
TLR 具有抗辐射保护作用的另一个潜在机制是激活 NF-κB 信号传导,这对于保护肠道免受辐射诱导的细胞凋亡至关重要。也就是说 TLR 可能通过 NF-κB 途径影响肠道对辐射诱导的上皮损伤的反应。
由于缺乏纤维,便秘往往是生酮饮食的最大问题,但事实上,生酮饮食也会导致腹泻。酮症腹泻可能只是比平时更多的水样大便和/或更频繁地排便。
酮症腹泻的原因可能如下:
脂肪很难消化
一般来说,身体消化脂肪需要更长的时间。在像酮这样的高脂肪饮食中,你会突然比平常吃更多的鳄梨、坚果、种子、肉类、橄榄油和其他脂肪,这会扰乱消化。当你改用这种高脂肪饮食时,可能会导致腹泻。
人工甜味剂和糖醇可能会对胃造成伤害
在生酮饮食中经常摄入更多的糖醇和其他人造甜味剂。这些甜味剂虽然碳水化合物含量低且通常是安全的,但过量食用可能会导致腹胀和腹泻。因此,如果有人食用大量糖醇含量高的酮类产品,他们可能会患酮类腹泻。
破坏肠道菌群
一些小型研究发现,在进行生酮饮食三个月后,肠道菌群发生了很大变化,这可能会导致一些人腹泻。与基线相比,3个月时,脱硫弧菌属统计显着增加(p = 0.025)。脱硫弧菌属与食用动物源性脂肪相关的肠道粘膜炎症状况恶化有关。还需要做更多的研究。
酮症腹泻持续多久?
酮症腹泻并不是一个永久性的问题。通常是暂时的,一般会发生在一开始改变饮食的时候,可能是在身体能够调整之前的第一到四周。
然而,如果高脂肪饮食对一个人的身体来说不容易消化,或者肠道微生物群确实发生了变化,腹泻可能是一个长期的副作用。
如果酮类腹泻持续存在,就值得重新考虑饮食计划。一种饮食计划不太可能适合所有人,其他可能考虑地中海饮食等饮食方式。
关于腹泻相关的干预,我们分三步走:
▼
1. 腹泻未发生 → 预防
预防腹泻相关措施
勤洗手:可以预防感染性腹泻的传播,比如准备食物前后,如厕、换尿布、打喷嚏、咳嗽、擦鼻涕等之后都要洗手。
正确储存食物:在正确的温度下储存食物,并烹饪所有食物直至达到建议的温度。不要冒险食用过期的食物或饮料。
预防旅行者腹泻:到卫生条件不完善的地区旅行时,需要注意食品安全。吃完全煮熟的热食,吃水果要吃可以去皮的,喝原包装的瓶装水,包括刷牙也用瓶装水。避开未经高温消毒的牛奶或果汁产品。合理摄入一些益生元,降低旅行者腹泻的风险。
保持肠道菌群平衡:当我们肠道菌群在一个良好的状态时,可以提高我们的免疫力,甚至能抵抗病原菌的定植,通过均衡饮食、保持良好的作息规律、适度运动、减少压力等各个方面,维持肠道菌群平衡。
当腹泻发生时,首先要判别感染源和感染原因。
如果是急性腹泻,很可能是因为病原体引起的,进行常规的病原物判别,医院可以进行相关检测,当然也可以结合肠道菌群检测,找出感染的原因,进行针对性治疗。
在处理优先级上,首先要解决感染问题
细菌性感染
如果是细菌性感染腹泻,就需要用到相关抗生素治疗。比如说大肠埃希氏菌、沙门氏菌、志贺氏菌等感染,可以考虑β-内酰胺类抗生素,如头孢曲松、拉氧头孢等。
不过需要注意的是,使用抗生素的时候尽量遵医嘱一次性吃到位,如果吃了一天感觉好了就不吃了,没有起到彻底杀菌的作用,则可能出现病情反复,那么这时候也会带来抗生素耐药性问题,即便吃了抗生素药也不一定很快好转。
因此关于抗生素用药需要谨慎,要么不用,要么用到位,尽量避免形成抗生素耐药性问题。如果有进行肠道菌群检测,也可以看到有没有抗生素耐药性问题,如果存在某种抗生素耐药,则可以避免该药物,改用其他抗生素代替。
病毒性感染
如果主要症状是腹泻+呕吐,也可能伴随出现一些腹痛、头痛、发烧、畏寒、肌肉酸痛等情况,则考虑可能是病毒性感染。一般病毒性感染具有自限性。
病毒性感染则需要避免使用抗生素。配合一些补液及益生菌,辅助治疗。
研究表明,鼠李糖乳杆菌GG可减少病毒性腹泻持续时间和每天排便次数。其他包括嗜酸乳杆菌NCFM,可有效增强轮状病毒疫苗效果。
其次,考虑其他功能性问题
肠道感染也是IBS的危险因素,如果是IBS患者,饮食因素可诱发或加重IBS症状。
短期使用利福昔明可以改善IBS的腹痛、腹泻、腹胀症状。洛哌丁胺的随机双盲安慰剂对照研究证实其可以显著降低IBS排便频率。
一些不确定病因的腹泻,比如说腹部绞痛、头痛、持续排出恶臭气体,进食后马上又腹泻,怀疑是否是因为胆汁酸吸收不良引起的腹泻,这时候可能需要配合进行SeHCAT测试、或血清7αC4检测、或粪便胆汁测试等进行相关诊断。一般来说,胆汁酸腹泻在克罗恩病和肠易激综合征患者中比较常见。
医生可能会开出胆汁酸螯合剂来减少胆汁的循环。通常为10-14天。
有些不明原因的腹痛、腹胀、腹泻、各种不适,在进行肠道菌群健康检测后,如果发现存在失调的情况,比如说肠道菌群多样性过低,有益菌缺乏,一些其他有害菌超标,那么需要结合相应的指标去综合判别,纠正可能的诱发因素。
案
例
我们来看一个案例:一名患者50岁,主诉腹泻。

<来源:谷禾健康肠道菌群数据库>
可以看到肠道菌群多样性明显缺乏,且埃希氏菌属明显超标。大肠埃希氏菌在正常情况下对人体无害,但某些菌株也可能引起感染和疾病,导致胃肠道症状,如腹泻、腹痛等。
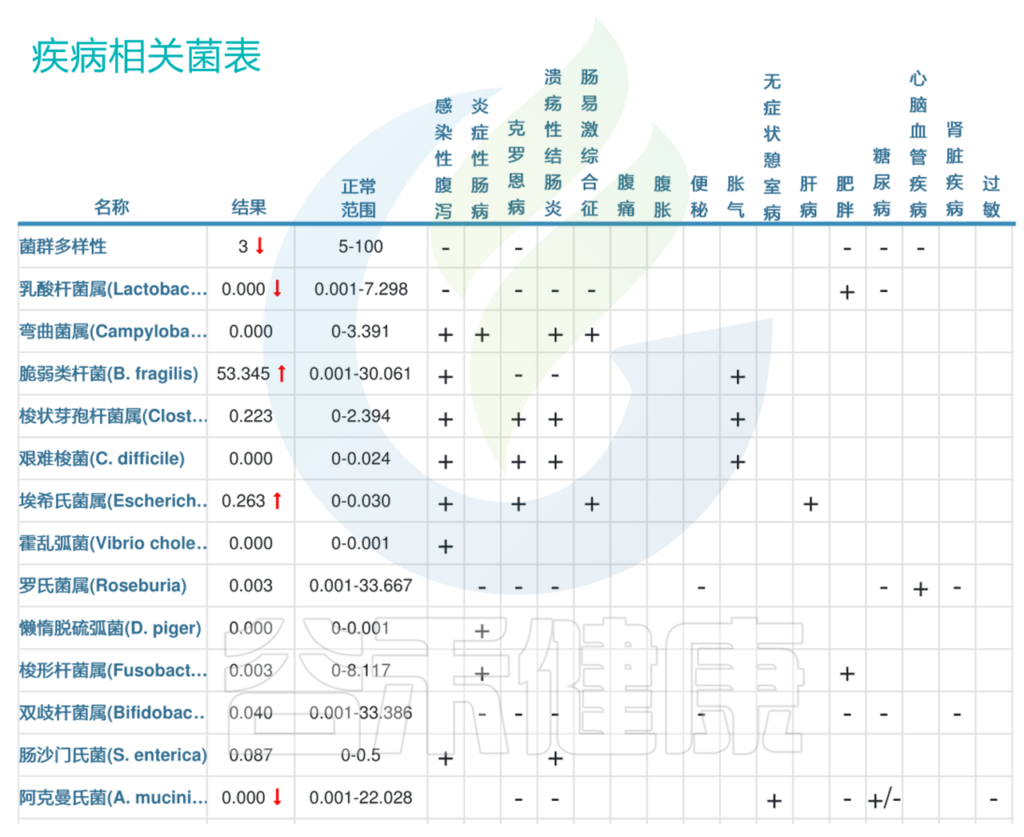
<来源:谷禾健康肠道菌群数据库>
以上我们可以看到最明显的,脆弱拟杆菌53.345,明显超标,脆弱拟杆菌这一行右边第一格显示“+”,说明脆弱拟杆菌丰度与“感染性腹泻”呈正相关,那么脆弱拟杆菌超标也就意味着该患者很有可能存在感染性腹泻。
其他菌群例如第二行乳酸杆菌属,结果0.000,也就是没有检出,低于正常范围。而乳酸杆菌属与“感染性腹泻”、“克罗恩病”、“溃疡性结肠炎”、“肠易激综合征”都呈负相关(都显示“–”)。患者刚好低于正常范围,也就是说乳酸杆菌属低,提示该患者很有可能存在以上这些肠道类疾病。
整体肠道菌群检测结果也与该患者“腹泻”的症状吻合,可以作为临床上的参考。
比如说过敏性腹泻,则应识别过敏源,在过敏源不明确的情况下,应该短期采用限制性食物疗法,排除蛋奶等可能引发过敏的食物,如果在这段时间内症状消失,则可定期有计划地引入单一食物,对于过敏食物进行回避。
在纠正诱发因素后,可以采取措施进行调理,提升免疫力,合理应用微生态制剂,也就到了接下来第三步。
一次腹泻,对于我们肠道来说,就好比打了一场仗,各大菌群忙着争夺领地、占据优势地位,肠道菌群的平衡却遭受了巨大的打击,有益菌可能被削弱,而有害菌则可能过度繁殖,甚至肠粘膜都受损。因此,腹泻后的肠道养护很重要。
我们从两个方面进行养护肠道,营养和菌群。
营 养
腹泻后可以吃什么?
土豆(不带皮),含有维生素B6、维生素C、烟酸和微量矿物质碘等营养成分。不要加黄油那些会刺激肠道的添加物,可以直接吃。
生吃蔬菜可能很难消化。可以通过剥皮、去除种子和彻底煮熟吃更好。
面食,提供膳食纤维和碳水化合物。
燕麦片,很容易消化,并且富含具有治疗作用的抗氧化剂。它还含有维生素 B1、硒和锰,也是可溶性纤维的良好来源。
香蕉,较温和,容易消化,是治疗腹泻的好选择。它们也是钾的良好来源,钾是一种可能因腹泻而流失的重要电解质。
苹果酱,比生苹果更好,因为水果的皮含有不溶性纤维。苹果酱还含有果胶,可以帮助粪便凝固。
腹泻后避免吃什么?
以上只是关于腹泻期间饮食的普适性建议,临床上病人腹泻情况复杂,可能需要根据不同类别的腹泻进行分层管理。
对于 IBS 患者来说,则需额外避免:
对于 胆汁酸腹泻患者来说,其他干预包括:
对于炎症性肠病患者来说,一些干预措施包括:
每个人的身体状况,肠道菌群特征各不相同,并不适用于所有人。比如说有些人吃香蕉后腹泻会更严重,这个就需要避免,根据自身情况而定。
扩展阅读:深度解析 | 炎症,肠道菌群以及抗炎饮食
菌 群
除了上述营养之外,也可以通过对肠道菌群的调理,促进有益菌生长,抑制有害菌过度生长,优化菌群组成;增强肠道屏障功能,加强抵抗病原体入侵后的定植;从根本上改善人体免疫力。
▼ 益生菌
普遍认为,益生菌的功能在于:
一项研究表明,益生菌大肠杆菌抑制其他大肠杆菌菌株,以及病原菌金黄色葡萄球菌和表皮葡萄球菌的生物膜形成。
小鼠研究表明,短双歧杆菌和Bifidobacterium pseudocantenulatum DSM20439 可以抑制肠出血性大肠杆菌产生的志贺毒素的表达。
益生菌的摄入也可以降低住院患者中艰难梭菌相关腹泻和抗生素诱导腹泻的发生率。含益生菌的嗜酸乳杆菌(L.acidophilus)和干酪乳杆菌(L.casei)菌株在预防艰难梭菌相关腹泻方面取得了良好的效果,没有严重的不良反应报告。布拉氏酵母菌也为治疗艰难梭菌相关腹泻提供了很好的前景。
罗伊氏乳杆菌DSM 17938 可能有助于调节肠道微生物群、消除感染以及减轻结肠炎、抗生素相关的胃肠道症状。无论是儿童还是成人,罗伊氏乳杆菌都能缩短急性感染性腹泻的持续时间,并改善结肠炎或炎症性肠病患者的腹痛。
益生菌似乎也能有效治疗痢疾;在接受乳杆菌和双歧杆菌菌株以及一种链球菌菌株组合治疗的患者中,腹泻的血液持续时间和住院时间都显著缩短。
益生菌也可以减轻与抗生素使用有关的肠道微生物群的改变,并可能抑制抗生素耐药性细菌的生长。
▼ 益生元
益生元也可以对腹泻患者产生积极影响。益生元的主要靶标是乳酸杆菌和双歧杆菌。益生元的摄入会增加短链脂肪酸的产生,这对维持肠道屏障的完整性很重要。由于丁酸盐在促进正常细胞增殖和分化方面的作用,它是被认为对肠道健康最有益的短链脂肪酸。
一些益生元,如低聚半乳糖、低聚果糖、菊粉、乳果糖和果胶低聚糖,可以拮抗病原体对上皮细胞的粘附,从而抑制定植并促进肠道病原体的清除。此前的研究表明,益生元可以缩短急性水样腹泻的持续时间,对腹泻有良好的治疗作用。
白术挥发油通过调节肠道菌群缓解急性溃疡性结肠炎。白术挥发油可以有效缓解溃疡性结肠炎小鼠的出血性腹泻、结肠组织损伤和结肠炎症。白术挥发油抑制了潜在的有害细菌(Turicibacter、Parasuterella、Erysipelatoclosstridium)的生长,富集了潜在有益菌(Enterorhabdus、Parvibacter、Akkermansia)。综上,白术挥发油可能作为一种新型益生元缓解溃疡性结肠炎。
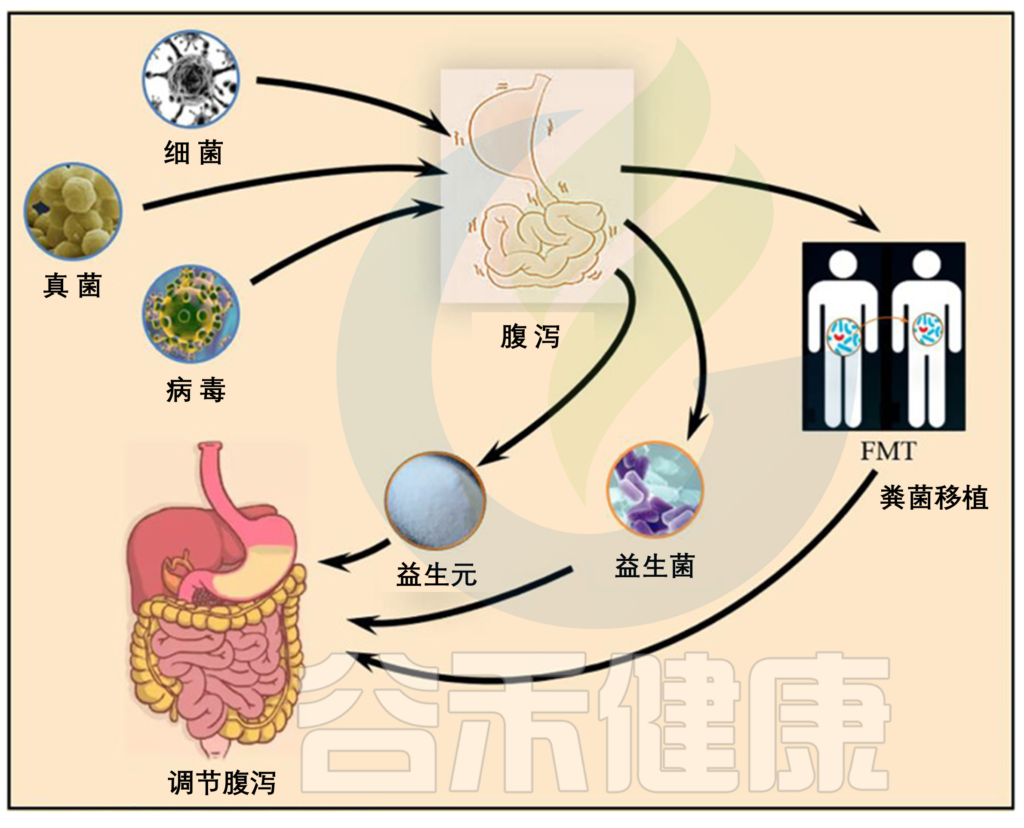
doi.org/10.3389/fcimb.2021.625210
▼ 粪菌移植(FMT)
我们知道一般腹泻用抗生素治疗可见明显好转,但也有些用了抗生素,病情没有好转,反而产生耐药性,形成慢性腹泻,反反复复,那这样的情况就可能需要用到FMT。
在腹泻患者中使用FMT的好处是基于这样一种观点,即通过FMT引入的健康微生物群可以战胜病原体,并将恢复健康肠道微生物组的组成。
在许多研究中,FMT已成功用于治疗难治性艰难梭菌诱导的腹泻。现有文献支持FMT的使用,并将其作为复发性艰难梭菌相关腹泻的安全有效的治疗方法。
此外,FMT在4 周后, IBS患者的生活质量方面显著优于安慰剂(平均差 [MD] = 7.47,95% 置信区间 [CI]:2.05-12.89,p = 0.04)
单臂分析显示,IBS 症状改善的发生率为 57.8%(45.6%-69.9%),IBS-SSS 减少(MD = -74,95% CI:-101.7 至 -46.3)。
一项临床研究表明,FMT可能安全有效地改善慢性放射性肠炎患者的肠道症状和粘膜损伤。此外,FMT 也是缓解急性放射综合症的有效疗法。
扩展阅读:粪菌移植——一种治疗人体疾病的新型疗法
▼ 中 药
越来越多的研究支持:中草药配方通过调节肠道菌群缓解腹泻症状。传统中药方剂,如“四君子汤、痛泻要方、补中益气汤、参苓白术汤”等,广泛用于治疗慢性腹泻。
升姜泻心汤通过改变肠道菌群和肠道代谢稳态来改善抗生素相关性腹泻。升姜泻心汤可以显著提高肠道菌群多样性,显著增加了拟杆菌属的相对丰度(p < 0.01),并降低了埃希氏杆菌属-志贺氏杆菌的相对丰度(p < 0.001)。
升姜泻心汤可以有效预防人类伊立替康引起的迟发性腹泻的发生。增强肠道屏障功能并减轻小鼠结肠炎。改善胆汁酸代谢和氨基酸代谢。
七味白术散(QWBZP)是一种治疗各种原因引起的腹泻的中药配方。七味白术散煎剂和七味白术散总苷,在抗生素相关性腹泻小鼠中,促进乳杆菌的增殖,抑制变形杆菌、梭状芽胞杆菌、真杆菌、Facklamia、埃希氏菌的生长。还增加了脱氧胆酸和 β-鼠胆酸的水平,并降低了牛磺胆酸、牛磺-α-鼠胆酸和牛磺-β-鼠胆酸的水平。乳杆菌是响应七味白术散总苷的关键细菌属。
清化止泻汤可调节肠道微生物群,减少5-羟色胺和血管活性肠多肽,改善腹泻症状。葛根芩连汤具有止泻作用和肠道微生物调节功能。香连丸可能通过恢复肠道菌群和减轻黏膜损伤来治疗抗生素相关性腹泻。经典中草药复方参苓白术可以通过调节结肠腔和粘膜微生物群,恢复肠道离子转运,缓解乳糖诱导的腹泻。
肠安Ⅰ号方治疗IBS-D临床能够明显降低IBS-SSS积分,提高AR应答率,疗效优于安慰剂,临床未发现明确不良反应。
在一项为期28天的双盲、随机、对照初步研究中,香沙六君子汤(XSLJZT)对IBS患者的腹泻(定义为频繁排便)有改善,但对稀便或急便没有改善。
除了中药配方,越来越多的证据表明,中国单一草药,如生姜、人参发酵物、苍术、小檗碱、黄柏提取物还具有止泻特性,恢复不平衡的肠道微生物群。
一项荟萃分析报告称,肠溶薄荷油可改善整体 IBS 症状。
中草药多糖是由单糖组成的天然聚合物,广泛存在于中草药中,是重要的活性成分,作为肠道微生物群的重要能量来源,具有止泻作用。
中草药多糖对慢性腹泻患者肠道微生物群的影响
以上这些都是关于腹泻的相关干预措施。
一次看似偶然的腹泻,实际上可能是我们肠道菌群平衡打破的一声警钟。平衡的肠道菌群可以帮助我们抵抗腹泻病原菌的定植。
当腹泻发生后,我们首先应该去寻找腹泻的原因,传统的医学检查往往需要繁琐的流程和耗时的等待以及不确定的结果,而依托于高通量测序和人工智能等技术的肠道菌群检测,则极大地提高了效率和精确性,在医疗手段飞速发展的时代,“快检、便检”已经逐渐开始成为获得关键医学信息的刚需,便于临床医生能够快速判断疾病类型和严重程度,有针对性地制定治疗方案。
结合个体差异,深入分析肠道菌群变化和疾病发展的关联,更好地了解每个人的疾病风险和治疗响应,可以提升治疗效果,缩短治疗时间,提高生活质量,减轻医疗负担,从而有助于将个性化医学推向前沿。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
相关阅读:
关 于 谷 禾
杭州谷禾健康专注于利用高通量测序技术进行肠道菌群和精准健康检测,是国家高新技术企业。
公司于2012年成立于浙江大学校内,核心创始团队主要来自浙江大学。谷禾在高通量基因测序领域独立研发大量独有技术,已授权包括采样,提取和数据库相关国家发明专利6项,此外还有9项软件和作品著作权。并通过ISO19001认证,并建有II级病原微生物P2实验室,并正在申请更全面的资质。公司为150多家国内顶级医院和医疗以及健康相关机构提供科研和检测服务。
经过多年的积累,已完成检测并构建了超过70万例各类人群样本数据库。自主构建了肠道菌群参考注释数据库,同时建立了基于近7万人群的肠道菌群人群分布及正常范围。在Nature Communications,Gut,PNAS等国际顶级学术期刊发表多项研究论文。支持合作50多项目临床开放基金项目,已发表研究成果20多项。
谷禾更大的数据和人工智能平台意味着可以更可靠和准确地反应您当前的菌群和健康状况。
主要参考文献:
Li Y, Xia S, Jiang X, Feng C, Gong S, Ma J, Fang Z, Yin J, Yin Y. Gut Microbiota and Diarrhea: An Updated Review. Front Cell Infect Microbiol. 2021 Apr 15;11:625210.
GBD 2016 Diarrhoeal Disease Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of diarrhoea in 195 countries: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis. 2018 Nov;18(11):1211-1228.
Chung The H, Le SH. Dynamic of the human gut microbiome under infectious diarrhea. Curr Opin Microbiol. 2022 Apr;66:79-85.
Ramamurthy T, Kumari S, Ghosh A. Diarrheal disease and gut microbiome. Prog Mol Biol Transl Sci. 2022;192(1):149-177.
Moshiree B, Heidelbaugh JJ, Sayuk GS. A Narrative Review of Irritable Bowel Syndrome with Diarrhea: A Primer for Primary Care Providers. Adv Ther. 2022 Sep;39(9):4003-4020.
Xue H, Mei C F, Wang F Y, et al. Relationship among Chinese herb polysaccharide (CHP), gut microbiota, and chronic diarrhea and impact of CHP on chronic diarrhea[J]. Food Science & Nutrition, 2023, 11(10): 5837-5855.
抗菌药物临床应用指导原则修订工作组. 抗菌药物临床应用指导原则[M]. 2015: 21-39
Mada PK, Alam MU. Clostridioides difficile Infection. 2023 Jan 23. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 28613708.
Shaikh SD, Sun N, Canakis A, Park WY, Weber HC. Irritable Bowel Syndrome and the Gut Microbiome: A Comprehensive Review. J Clin Med. 2023 Mar 28;12(7):2558.
Holtmann G J, Ford A C, Talley N J. Pathophysiology of irritable bowel syndrome[J]. The lancet Gastroenterology & hepatology, 2016, 1(2): 133-146.
Farrugia A, Arasaradnam R. Bile acid diarrhoea: pathophysiology, diagnosis and management. Frontline Gastroenterol. 2020 Sep 22;12(6):500-507.
Piovezani Ramos G, Camilleri M. Current and Future Therapeutic Options for Irritable Bowel Syndrome with Diarrhea and Functional Diarrhea. Dig Dis Sci. 2023 May;68(5):1677-1690.
Jay P. Sanford. 桑德福抗微生物治疗指南[M]. 范洪伟译. 北北京: 中国协和医科大学出版社. 2013: 71-76
Camilleri M, Boeckxstaens G. Irritable bowel syndrome: treatment based on pathophysiology and biomarkers. Gut. 2023 Mar;72(3):590-599.
Cheng H, Zhang D, Wu J, Liu J, Tan Y, Feng W, Peng C. Atractylodes macrocephala Koidz. volatile oil relieves acute ulcerative colitis via regulating gut microbiota and gut microbiota metabolism. Front Immunol. 2023 May 2;14:1127785.
Wellens J, Vissers E, Matthys C, Vermeire S, Sabino J. Personalized Dietary Regimens for Inflammatory Bowel Disease: Current Knowledge and Future Perspectives. Pharmgenomics Pers Med. 2023 Jan 12;16:15-27.
何礼贤. 国家抗微生物治疗指南[M]. 北北京: 人民卫生出版社. 2012: 196-210
Elhusein AM, Fadlalmola HA. Efficacy of Fecal Microbiota Transplantation in Irritable Bowel Syndrome Patients: An Updated Systematic Review and Meta-Analysis. Gastroenterol Nurs. 2022 Jan-Feb 01;45(1):11-20.
Altomare A, Di Rosa C, Imperia E, Emerenziani S, Cicala M, Guarino MPL. Diarrhea Predominant-Irritable Bowel Syndrome (IBS-D): Effects of Different Nutritional Patterns on Intestinal Dysbiosis and Symptoms. Nutrients. 2021 Apr 29;13(5):1506.
Saviano A, Brigida M, Migneco A, Gunawardena G, Zanza C, Candelli M, Franceschi F, Ojetti V. Lactobacillus Reuteri DSM 17938 (Limosilactobacillus reuteri) in Diarrhea and Constipation: Two Sides of the Same Coin? Medicina (Kaunas). 2021 Jun 23;57(7):643.