-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
随着人口老龄化的不断加重,骨质疏松症(OP)已成为三大慢性疾病之一。骨质疏松症会导致骨折风险增加,骨骼变性,身体功能受限等。因此,骨质疏松症的防治逐渐成为中老年人健康关注的焦点,减少和治疗骨质疏松症对于减轻医疗负担、缓解社会压力具有重要意义。
数据显示,全球大约每3秒就有一例骨质疏松性骨折发生,大约50%的女性和20%的男性在50岁后患有原发性骨质疏松性骨折。
骨质疏松症是一种慢性疾病,其特征是骨组织微结构恶化和骨量减少。研究表明,体内激素失衡和氧化炎症可影响破骨细胞和成骨细胞的动态平衡,主要表现为骨微结构退化、骨量减少、骨强度下降。骨髓间充质干细胞的成骨分化和骨内血管生成的下降同时发生,导致骨脆性增加和骨折易感性增加。
我们日常的饮食中多酚类物质含量极其丰富,并且可以在自然界的多种植物中找到。多酚在化学上被鉴定为具有酚类结构特征的化合物。多酚的丰富来源包括水果、蔬菜和全谷物,以及其他类型的食物和饮料,如茶、巧克力和葡萄酒。
多酚可以通过影响骨形成和骨吸收而在骨重建中发挥作用。多酚作用于破骨细胞、成骨细胞和骨髓间充质干细胞,调节多个重要信号通路,在骨重塑中发挥重要作用。此外,多酚还通过抗炎、促进骨形成等机制抑制骨质疏松症。
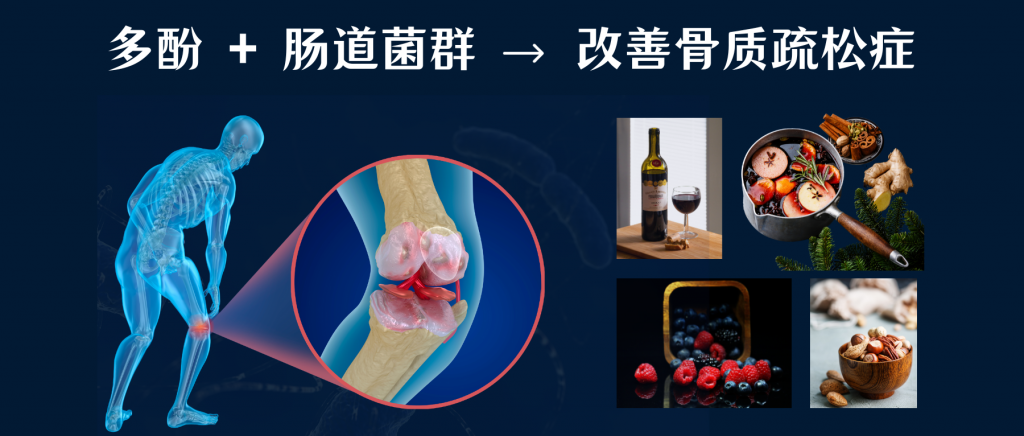
此外,越来越多的研究表明,骨质疏松症患者及相关动物模型的肠道菌群与健康个体的肠道菌群有些不同,骨质流失的严重程度也与肠道菌群的改变有关。这也表明肠道微生物群可能成为预防和治疗骨质疏松症的潜在目标。
通过产生代谢物,肠道微生物影响和调节肠道屏障功能。正常的肠道屏障对于隔离有害物质、促进营养吸收和提供免疫保护非常重要。肠道屏障功能受损被认为是导致骨质疏松症的致病因素之一。
肠道微生物紊乱削弱了肠道屏障功能,导致有害物质进入体内,从而促进激活破骨细胞并导致骨吸收因子的产生,影响骨形成和骨吸收,最终导致骨质疏松。
而多酚等膳食成分还与肠道微生物群存在相互作用。肠道微生物群可以将多酚降解为更容易吸收的代谢物,从而提高其生物利用度。多酚可以塑造肠道微生物群并增加其丰度和活性,增强肠道屏障功能。在两者的协同作用下,可能对骨质疏松症的治疗效果最大化。
Wang K,et al.Front Immunol.2023
随着人口老龄化的不断加重,骨质疏松症(OP)已成为三大慢性疾病之一。这种全身性骨骼疾病的特点是骨矿物质密度(BMD)低,骨组织微结构恶化和骨量减少。
世界卫生组织将骨质疏松症定义为骨密度T值低于相应年龄和种族的健康年轻人平均密度2.5或更多标准差。
骨质疏松症的特点是破骨细胞功能增加,随后骨吸收增加,骨形成相应减少。成骨细胞和破骨细胞失衡是骨密度低和骨愈合不良的标志。成骨细胞是骨骼生长和维持的重要细胞,它们形成骨组织。
★ 年龄增加和女性绝经是骨质疏松的最常见原因
骨质疏松症最常见的原因是绝经和年龄,因为骨重塑过程受到雌激素、甲状旁腺激素、炎症细胞因子和维生素D的调节。
因此,老年女性的患病率(30%)高于老年男性(16%)
研究表明,体内激素失衡和局部氧化炎症也可影响破骨细胞和成骨细胞的动态平衡,主要表现为骨微结构退化、骨量减少、骨强度下降。骨髓间充质干细胞的成骨分化和骨内血管生成的下降同时发生,导致骨脆性增加和骨折易感性增加。
每年估计有890万起骨折是由于骨质疏松症而造成的。
由于骨骼是一种可塑性物质,它会根据生理和体外因素不断进行重塑,因此骨吸收增加以及随之而来的骨质流失,呈现出一种复杂的病理生理学,可能受到年龄、激素水平、遗传倾向,以及药物(如糖皮质激素)、生活方式和饮食的影响。
骨质疏松症分为原发性和继发性二大类。
✦ 原发性骨质疏松症
原发性骨质疏松症是指没有明显的诱因或疾病导致的骨质疏松症。它包括与年龄相关的骨质疏松症和绝经后骨质疏松症以及特发性骨质疏松(包括青少年型)。
老年性骨质疏松症:老年性骨质疏松症是一种与年龄相关的骨质疏松症,通常发生在50岁以上的男性和女性。它是由于骨骼的自然老化和骨形成减少而引起的。
老年性骨质疏松症患者的全身性骨质减少,尤其是脊椎、髋部和前臂骨。因此一些老人在不慎摔倒后特别容易出现髋部骨折。
绝经后骨质疏松症:绝经后骨质疏松症是绝经后女性最常见的骨质疏松症类型。在绝经后,女性体内雌激素水平下降,导致骨质流失加速。
绝经后骨质疏松症主要影响脊椎骨和髋部骨,增加骨折的风险。
特发性骨质疏松症:特发性骨质疏松症是指非目前所知的任何原因引起的骨质疏松。它包括特发性青少年骨质疏松和特发性成年骨质疏松,它们的病因和发病机制有很大不同。特发性青少年骨质疏松是一种比较罕见的病症,而特发性成年骨质疏松较常见。
特发性骨质疏松原因尚未明确,可能的原因是骨量的峰值下降造成骨量与同龄人比相对减少。骨量减少可能在早年就已经开始,并持续至成年。
✦ 继发性骨质疏松症
继发性骨质疏松症是由其他疾病、药物或疗法引起的骨质疏松症。它可以是由以下原因引起的:
激素失衡:某些激素失衡,如甲状腺功能亢进、垂体功能减退、库欣综合征(皮质醇增多症)等,都可能导致骨质疏松症。
药物:长期使用某些药物,如糖皮质激素、抗癫痫药物、抗抑郁药物等,也可能导致骨质疏松症。
慢性疾病:一些慢性疾病,如类风湿性关节炎、炎症性肠病、慢性肾病等,会增加骨质疏松的风险。
营养不良:缺乏足够的钙、维生素D和其他营养素,也可能导致骨质疏松症。
其他原因:骨质疏松症还可能与酗酒、吸烟、久坐不动、低体重指数等因素有关。
骨质疏松症是一种骨骼疾病,其主要特征是骨组织的密度和质量下降,导致骨骼变得脆弱和易碎。但骨质疏松症还可能带来以下其他危害:
✦ 骨折风险增加
骨质疏松症使骨骼变得脆弱,易于发生骨折。常见的骨折部位包括腕部、脊椎、髋部和股骨颈。即使是日常活动中的轻微压力或摔倒,也可能导致骨折,严重影响生活质量。
✦ 身体功能受限
骨质疏松症引起的骨折可能导致疼痛、残疾和功能受限。脊椎骨折可能导致身高减少、姿势异常和背部疼痛,严重影响日常活动和生活质量。
✦ 骨骼变形
骨质疏松症使骨骼弱化,容易发生骨骼变形,如驼背(脊柱前屈)和骨质疏松相关的骨折,这可能导致身体外观的改变和功能障碍。
✦ 慢性疼痛
骨质疏松症可能导致慢性骨痛,尤其是脊椎骨折引起的背部疼痛。这种疼痛可能会影响日常活动、睡眠和心理健康。
✦ 增加死亡风险
骨质疏松症相关的骨折,特别是髋部骨折,与较高的死亡风险相关。骨折还可能导致并发症,如感染、血栓形成和肺栓塞等,严重影响患者的生存率。
✦ 经济负担
骨质疏松症和相关骨折对个人、家庭和社会都带来了巨大的经济负担。治疗骨质疏松症和骨折的医疗费用、康复费用和长期护理费用都很高。
骨质疏松症有多种合适的治疗方法,目前的治疗建议包括锻炼、补充钙和维生素D,以及最终的双磷酸盐治疗。
正确的临床管理需要采取分阶段的方法,并仔细考虑具体干预措施的时机。
许多女性在绝经后会出现骨质减少,但尚未达到骨质疏松症的诊断标准;这可能是开始更保守治疗的理想时机,以防止骨质减少发展为骨质疏松症,并可能获得更好的长期疗效。
临床治疗可分为四个主要领域,其侵入性各不相同,分别为改变生活方式、补充营养、药物干预和手术治疗。
对于有骨质疏松症风险的患者,一致建议改变生活方式以防止骨质流失。充足的钙和维生素D、锻炼、戒烟、预防跌倒咨询和避免大量饮酒都是应注意的生活方式,特别是对于有骨质疏松症家族史的人来说。
高纤维饮食有助于预防骨质疏松症
饮食调整和运动是两种最有益和保守的治疗方法之一。对啮齿动物的研究表明,高纤维饮食以及由此增加肠道微生物群中短链脂肪酸的产量,特别是丁酸。
短链脂肪酸似乎可以防止小鼠绝经后和炎症性骨质流失、修复肠道屏障并预防骨质疏松症的发展。这些结果适用于人群,其中膳食纤维消耗增加与骨矿物质密度之间的关联已被证明。
避免使用促进骨质流失的药物
此外,处于骨质疏松症初始阶段或经历骨质减少的个体应避免使用促进骨质流失的药物,例如糖皮质激素。
在糖皮质激素引起骨质流失的情况下,发现饮食中添加山奈酚(一种在水果和蔬菜中发现的黄酮类化合物)可诱导成骨标志物的更高表达,并且在功能上似乎可以改善愈伤组织骨损伤部位形成并减少骨质流失,有效对抗糖皮质激素对骨骼健康的不利影响。
适度运动可以减少骨质疏松的发生
运动已显示出多种有益的健康效应,包括改善肌肉组织以预防跌倒和改善骨矿物质密度。
关于骨骼健康的运动训练,还发表了一篇有价值的文献,他们采用更多的细胞方法来考虑运动有益效果的机制。无论具体的获益机制如何,生活方式改变的证据表明,运动应该成为一线临床建议,以防止患者从骨质减少进展为骨质疏松症。
营养干预措施比较容易实现,而且相对便宜,应考虑将其作为骨质减少和骨质疏松症临床管理的措施。
增加钙与维生素D的摄入
增加钙摄入量并补充维生素D已被证明可以降低骨矿物质流失率,且不会损害肠道微生物群。膳食钙摄入不足的患者应在膳食中分次补充钙(通常为500至 1000毫克/天),将总钙摄入量提高到约1200毫克/天。
需要注意的是,钙的总摄入量(饮食加补充剂)通常不应超过2000毫克/天,因为钙摄入过高可能会出现不良反应,包括肾结石、心血管疾病、消化不良、铁和甲状腺激素失调以及便秘等。
关于维生素D的剂量存在争议。众所周知,维生素 D3(胆钙化醇)可促进小肠中钙的吸收;因此,确保足够的水平是必要的。
益生菌与益生元有助于钙代谢和骨骼健康
益生元和益生菌已被发现有助于治疗各种慢性炎症性疾病,并且越来越多的证据表明它们还有助于钙代谢和骨骼健康。
此外,向长期接受糖皮质激素治疗的小鼠添加益生菌、抗生素或粘液补充剂可预防糖皮质激素诱导的骨质疏松症的发生。

de Sire A,et al.Cells.2022
除了生活方式和其他保守的干预措施之外,骨折风险高或经历过脆性骨折的患者最有可能受益于药物辅助治疗。
双膦酸盐是一类抗骨吸收药物,自20世纪60年代首次用于治疗骨疾病以来,已被广泛使用。不过,渐进式新一线治疗方法越来越受欢迎,例如狄诺塞麦和合成代谢药物,包括甲状旁腺激素相关肽类似物和抗硬化素抗体。
具体药物需要根据患者的情况进行评估
值得注意的是,尽管有许多药物可以支持骨骼平衡和重塑,但它们的成功通常取决于患者对药物治疗的依从性。因此,最好根据患者的骨折风险设计治疗策略,并结合骨矿物质密度和临床风险因素进行评估。
此外,在开始药物治疗之前,所有患者的血钙和25-羟基维生素D水平应在范围内,如果食物摄入不足,应给予营养干预。骨质疏松症的药物治疗可分为抗吸收剂、合成代谢剂或激素调节剂。
重点来了
然而,还有其他方法可以治疗或预防骨质疏松症,这些方法可能更有效且副作用更少。本文接下来讲述的多酚等膳食成分与肠道菌群的协同作用可能就属于一种新型疗法。
多酚是存在蔬菜、谷物、水果、咖啡、茶等植物性食物中的次生代谢产物,具有潜在促进健康作用。
多酚按结构可分为黄酮类、酚酸类、木脂素类、芪类等。
流行病学研究表明,长期食用植物多酚可以预防心血管疾病、癌症、骨质疏松症、糖尿病和神经退行性疾病。
研究人员广泛研究了多酚类物质的有益作用,已知多酚可以增强骨形成并抑制骨吸收。
✦ 淫羊藿苷促进成骨细胞分化、抑制破骨细胞形成
淫羊藿苷(ICA)是8-异戊烯基黄酮苷。研究发现淫羊藿苷可以促进成骨细胞的分化,增加骨密度。骨形成主要通过成骨细胞的增殖和分化促进骨基质的合成和矿化,成骨细胞在骨形成和骨质疏松中发挥重要作用。
淫羊藿苷具有类似雌激素的药理活性,可以刺激成骨细胞的分化和矿化,调节破骨细胞的分化,并增加成骨细胞分化为成熟成骨细胞的数量。
淫羊藿苷抑制破骨细胞的形成,ICA抑制前破骨细胞向破骨细胞的分化。它还抑制参与破骨细胞形成和骨吸收的各种基因的表达。
研究表明,淫羊藿苷可以通过抑制NF-κB的激活,阻断MCF 7和MDA-MB-231诱导的破骨细胞形成。
✦ 芒柄花素增加骨量、减少骨吸收
芒柄花素(FO)是从黄芪中提取的主要异黄酮之一。研究表明,它可以刺激成骨细胞的形成,从而增加骨量,改善骨的微观结构。
芒柄花素还可以抑制破骨细胞的活化。研究表明,芒柄花素可抑制原代骨髓单核巨噬细胞向破骨细胞的增殖和分化,下调破骨细胞骨吸收功能相关蛋白和基因的表达。
✦ 葛根素对骨吸收也有调节作用
葛根原产于中国,历史悠久,是亚洲最常用的中药之一。由于异黄酮含量高,它已被广泛用作绝经后激素疗法的天然替代品。
研究表明,葛根素(PUE)对骨吸收也有调节作用。葛根素能够下调破骨细胞标志基因CTR、CATH-K、NFATc1和c-fos的mRNA水平,表明PUE抑制破骨细胞功能。
在体外,葛根素减弱骨吸收而不损害破骨细胞活力,并通过抑制骨吸收而不改变骨形成来显著防止骨丢失。此外,随着葛根素浓度的增加,葛根素会在体外抑制RANKL诱导的破骨细胞活化、骨吸收能力和F-肌动蛋白环形成。
白藜芦醇和淫羊藿苷控制成骨分化的分子机制
Wang K,et al.Front Immunol.2023
✦ 抗氧化应激
当活性氧的产生和消除不平衡时,就会发生氧化应激。过多的活性氧会导致细胞损伤和凋亡,影响细胞功能,引发疾病。
氧化应激可以影响骨髓间充质干细胞的功能,从而影响间充质干细胞的骨生长和成骨分化。因此,这可能导致成骨细胞功能受损并加速成骨细胞的形成和分化。
多酚化合物含有大量酚羟基,可作为抗氧化剂,防止活性氧引起的损伤。将单线态氧还原为活性较低的三线态氧,从而降低氧自由基产生的概率,终止自由基引发的链式反应。
有研究证据表明,摄入富含食源性多酚化合物的天然浆果,如蔓越莓和蓝莓,可以通过清除自由基来对抗氧化应激,预防和治疗骨质疏松症。
✦ 抗炎作用
多酚类化合物通过负调节炎症途径,特别是对关键的NF-κB转录因子的调节,发挥抗炎作用。雌激素受体能够参与与NF-κB的蛋白质相互作用,导致复合物的形成以及随后NF-κB与特定反应元件的结合。这些特异性反应元件以细胞类型特异性的方式调节NF-κB依赖性基因的转录,在调节炎症过程中至关重要。
例如,可以通过调节转录因子NF-κB并在HMC-1细胞中作为雌激素受体ERK来抑制脂质过氧化和对抗氧化应激。诱导型一氧化氮合酶表达受损会减少炎症因子TNF-1、IL-6、IL-8和NO的产生和释放。这一过程会产生抗炎作用,并有助于减轻骨丢失。
此外,多酚化合物已被证明通过下调受体激活的NF-κB配体(RANKL)来抑制骨吸收,并通过下调NFATc1和炎症介质来直接抑制成骨细胞的产生,从而降低成骨活性。
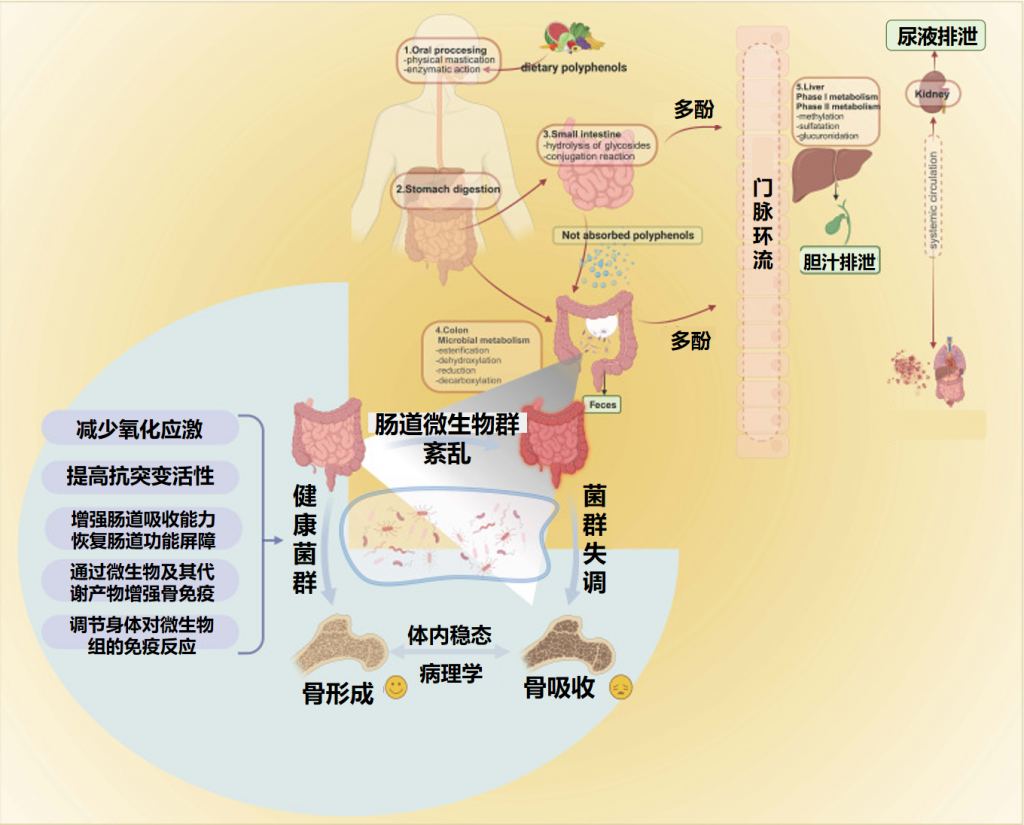
✦ 激活Wnt/β-Catenin信号通路
Wnt信号通路在骨骼发育和代谢稳态的维持中发挥着关键作用。Wnt相关蛋白或因子可以与卷曲基因受体(Fzd)结合并启动下游细胞内级联反应,从而调节β-Catenin、过氧化物酶体增殖物激活受体γ(PPARγ)和RUNX2等靶基因的转录或表达。然后调节成骨细胞形成、分化和成熟的生理过程。
Runx2是成骨细胞特异的转录因子,与成骨细胞的增殖和分化密切相关。
β-Catenin是通路中的关键因子,是Wnt/β-Catenin信号通路的中心调节因子。β-Catenin可以增强碱性磷酸酶(ALP)的活性,同时促进骨骼生长。
在一项研究中,发现淫羊藿苷对大鼠骨髓基质细胞的干预通过刺激β-连环蛋白的激活来增加总β-连环素和核转位。此外,Wnt信号传导成员(β-catenin、Lef1、TCF7、c-jun、c-myc和细胞周期蛋白D)的表达显著上调。
雌激素受体(ERα)的激活可增强成骨基因的表达,从而促进BMSCs的增殖和成骨分化。白藜芦醇是一种非黄酮类多酚有机化合物,具有雌激素样作用。一些研究人员通过白藜芦醇介导的Wnt/β-catenin途径得出结论。白藜芦醇通过刺激Runx2的表达,下调GSK38的表达水平,阻止β-连环蛋白降解复合物的有效形成,确保β-连环素在细胞质中的稳定积累和向细胞核的移位,从而激活Wnt/B-连环蛋白通路,促进成骨分化,提高骨密度,在预防和治疗骨质疏松症中发挥作用。
多酚调节骨形成或骨吸收的多种信号通路
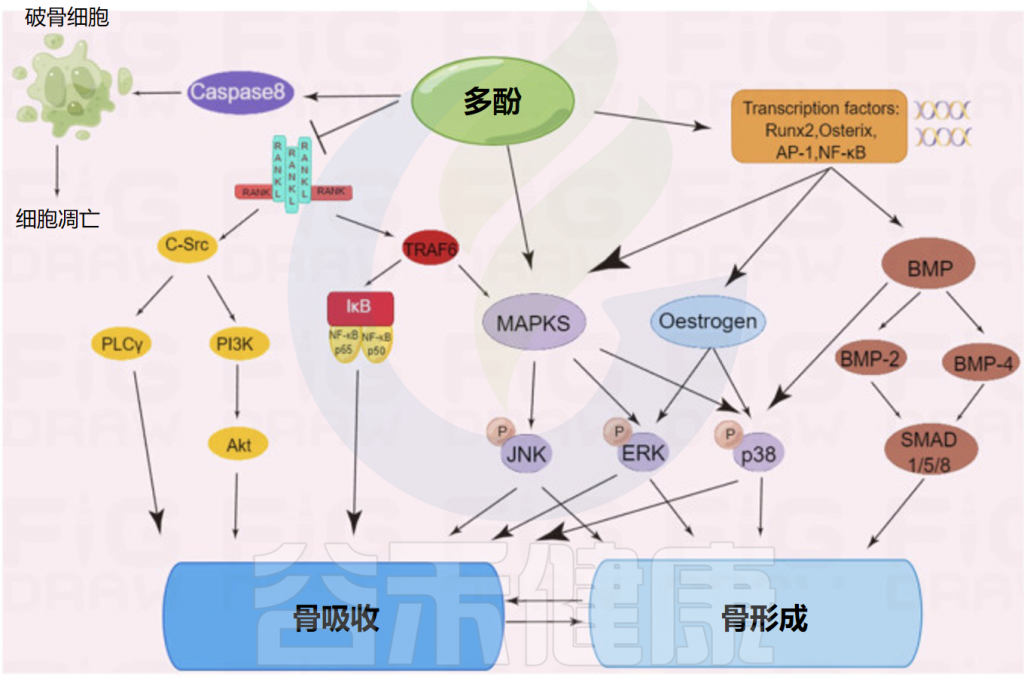
Li Y,et al.Front Pharmacol.2022
✦ 抑制NF-κB通路
NF-κB信号通路在骨代谢中也具有重要作用,并且还可以与其他信号通路相互作用,影响骨质疏松症的进展。
应用芍药苷干预RAW 264.7细胞系分化的破骨细胞模型,观察芍药苷对破骨细胞信号通路的影响。结果表明,芍药苷减弱了p65 NF-κB的磷酸化水平,即抑制了NF-κB信号通路的激活。NF-κB途径是破骨细胞分化的主要生物学途径之一。已经证实,芍药苷通过抑制p65 NF-κB的激活,降低NF-κB信号通路的活性,降低破骨细胞的活性,减少骨吸收,并进一步维持骨稳态。
芍药和蛇籽都是中药,都含有多酚类物质。通过抑制NF-κB信号通路,抑制破骨细胞的产生,来达到骨质疏松的治疗效果。
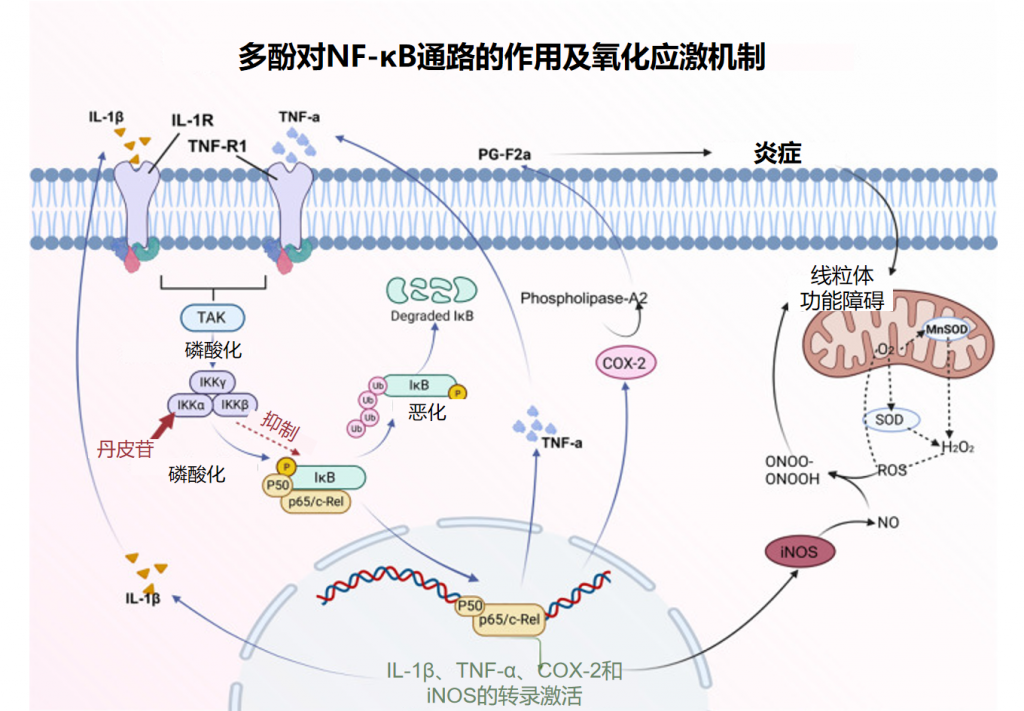
Wang K,et al.Front Immunol.2023
许多研究还揭示了肠道微生物群与骨质疏松症之间的显著联系。肠道微生物群调节骨稳态,并可以通过多种机制影响骨质疏松症。
这些包括调节其代谢物、影响宿主代谢、改变药物代谢以及调节肠道屏障功能的完整性。一些研究还强调了肠道微生物对胶原蛋白特性的改变,这与骨骼脆弱性密切相关。
肠道微生物群组成的变化会导致肠道炎症并破坏免疫调节网络的平衡,许多研究表明这与骨质疏松症有关。
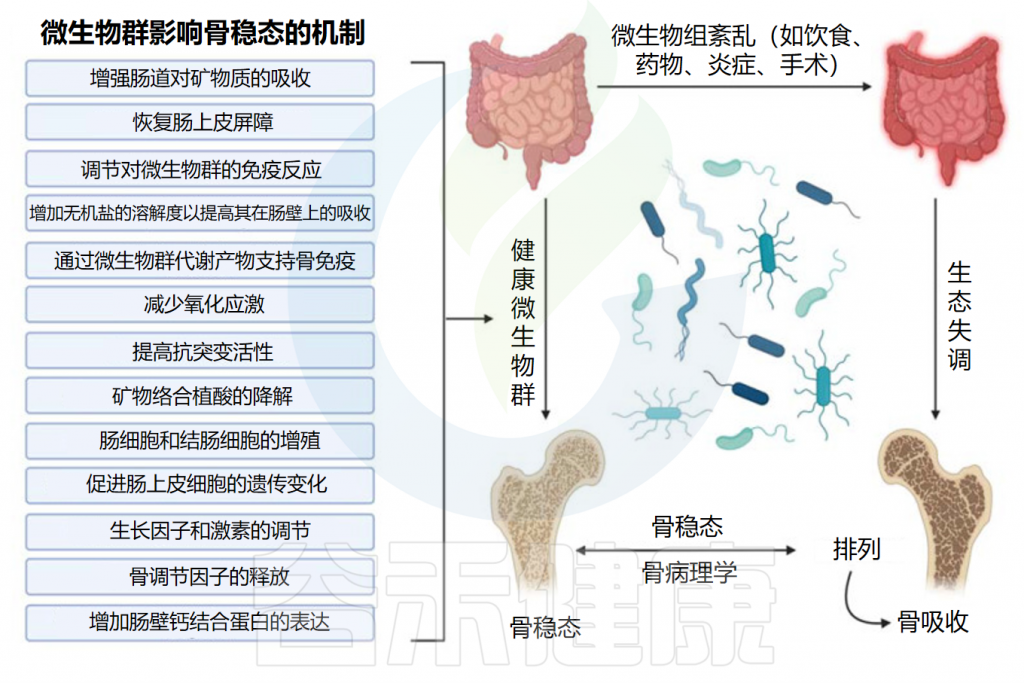
Seely KD,et al.Int J Mol Sci.2021
1.增加无机盐的溶解度,以改善其在肠壁的吸收
磷酸盐等无机盐的可用性对于成骨细胞的骨矿物质沉积和骨稳态至关重要。这种效应可能部分归因于微生物合成植酸酶将矿物质复合植酸代谢为无机磷酸盐和磷酸肌醇衍生物。
2.增强肠道矿物质吸收表面
通过促进肠上皮细胞和结肠细胞的增殖,介导肠道微生物群稳态,并支持肠道矿物质吸收。结肠细胞代谢的增加已被证明可以促进专性厌氧菌的产生,专性厌氧菌可以代谢纤维,从而增加短链脂肪酸,这对于骨稳态以及其他生理功能都至关重要。
3.恢复和维持肠道上皮屏障
肠道微生物群稳态有助于构建肠道上皮屏障,而健康的肠道上皮屏障可以防止因紧密连接受损而导致的通透性过高。通透性过高或“肠漏”会渗出异常高水平的炎症细胞因子,产生全身炎症并导致破骨细胞过度活跃和骨质退化。
4.通过微生物群代谢物增加骨密度
肠道微生物群产生的短链脂肪酸通过抑制活化B细胞的核因子kappa轻链增强子的活化来提供抗炎作用,从而减少自身免疫炎症。此外,短链脂肪酸,特别是丙酸和丁酸,通过下调TRAF6和NFATc1来抑制破骨细胞生成和骨吸收,从而有效增加骨密度,而不直接改变成骨细胞。
5.减少氧化应激
氧化应激被证明会导致过度的骨细胞凋亡,从而导致破骨细胞生成的失衡,导致骨重塑、周转和损失增加。特异性益生菌可以通过产生几种抗氧化分子(如谷胱甘肽、叶酸和胞外多糖)来缓解氧化应激。此外,几种肠道微生物群产生的短链脂肪酸还可以通过促进抗氧化分子的产生来帮助缓解氧化应激。
6.调节免疫反应
肠道微生物群通过影响与骨细胞密切相关的免疫系统,在维持骨骼健康方面发挥着至关重要的作用。在异常状态下,免疫系统对微生物群刺激的反应会通过T细胞的作用导致循环破骨细胞因子增加。它通过利用宿主完全发育的免疫系统来调节整个身体的反应来实现这一点,从而控制骨转换和密度。
7.增加抗诱变活性
尽管这种能力已在癌症领域得到广泛探索,但某些产乳酸微生物群可以有效的结合诱变剂,例如热解产物和杂环胺在肠道中降低这些化合物的诱变活性。减少DNA损伤可以减少炎症、保护肠壁、增加矿物质吸收并抑制骨质疏松症。
8.增加肠壁钙结合蛋白的表达
增加肠壁钙结合蛋白D9k基因的表达可以增加吸收钙的能力,通过抑制甲状旁腺激素的作用,有效抑制骨降解和促进骨沉积。此外,增强钙吸收以及抑制甲状旁腺激素活性和胰岛素样生长因子1的产生也可以改变破骨细胞和成骨细胞的发育。
9.调节生长因子和激素的分泌
肠道微生物群可以被视为基于大量分泌分子的内分泌器官。具体来说,肠道微生物群通过短链脂肪酸介导的途径促进胰岛素样生长因子1(IGF-1)的产生。已知IGF-1可刺激成骨细胞、破骨细胞和软骨细胞的分化。
肠道微生物群也可能通过皮质醇介导的相互作用增强骨降解。肠道微生物群还调节肠道血清素的产生,这是一种与骨细胞相互作用的分子,被认为可以充当骨量调节剂。
人类肠道微生物群和宿主相互作用,影响骨量的动态平衡,以及骨骼生长、骨骼老化和病理性骨质流失的过程,这催生了骨微生物学领域的兴起。
骨微生物学的最新研究将骨表型的变化与肠道菌群的变化联系起来。平衡、健康的微生物组似乎对于防止骨质流失是必要的,这一假设有证据支持,在小鼠的饮食中补充益生菌可逆转骨质疏松症的致病过程。
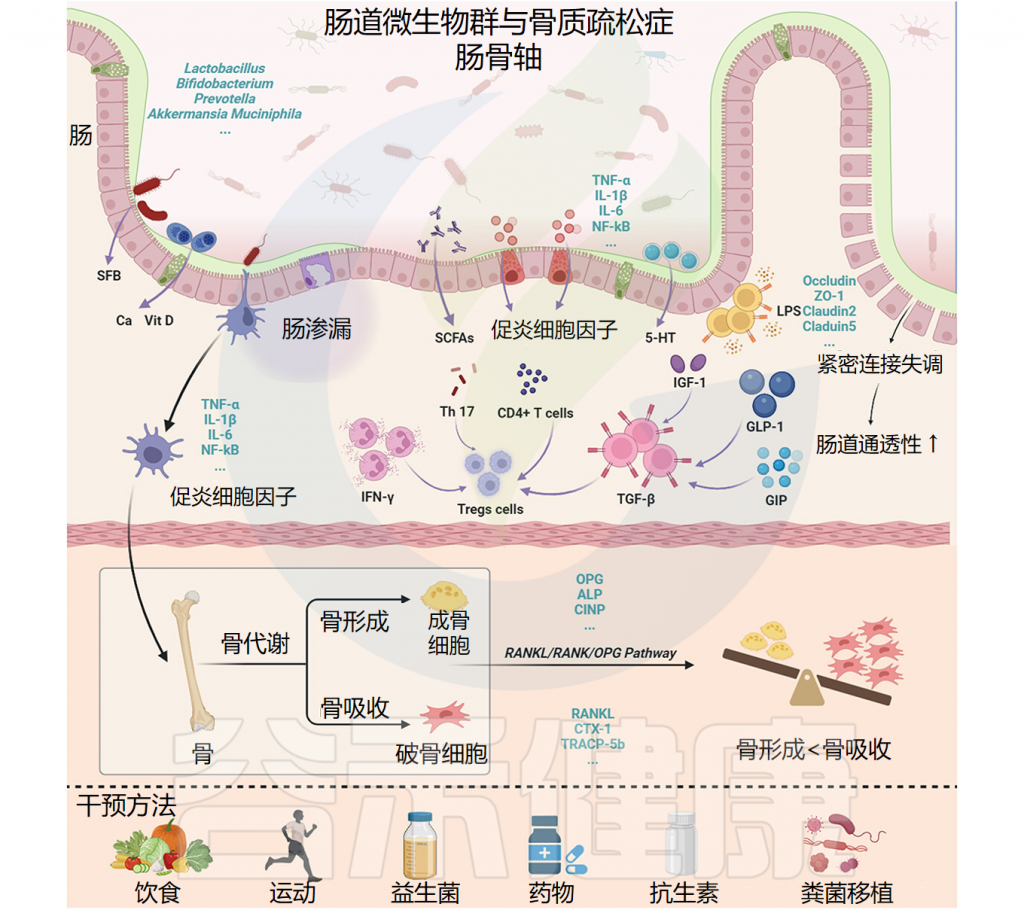
Zhang YW, et al.Gut Microbes.2024
✦ 骨质疏松症患者肠道菌群的多样性减少
评估骨质疏松症患者肠道内细菌种群数量和多样性的几项研究检查表明,骨质疏松症成年人的生物多样性似乎有所减少,某些物种如梭菌属(Fusobacterium),戴阿利斯特杆菌属 (Dialister),Faecalibacterium,甲苯单胞菌属(Tolumonas)以及拟杆菌属(Bacteroides)和罗氏菌属(Roseburia)减少。
注:上述这些基本都是肠道核心菌甚至是对人体健康非常重要的益生菌。
✦ 肠道菌群影响免疫细胞进而影响骨稳态
事实上,肠道微生物群与骨骼愈合和重塑之间的部分关联是由免疫细胞调节的。
免疫细胞成熟和功能所必需的许多细胞信号级联在一定程度上取决于肠道微生物群在整个生命过程中持续的最佳功能和体内平衡。尽管非常复杂,但近期文献中关于整体骨骼健康与肠道微生物组之间联系的主要假设以T细胞和Th17免疫细胞为中心 。在T细胞依赖性机制中,免疫系统对微生物群刺激的反应会增加循环的破骨细胞因子。
此外,虽然其作用尚不完全清楚,但Th17免疫细胞似乎是破骨细胞群的一个组成部分。因此,可以假设肠道微生物群的任何不平衡可能反过来影响骨稳态所需的关键免疫机制。
除了所提出的T细胞介导的相互作用之外,更广泛的免疫系统对微生物组的反应导致产生许多循环细胞因子和基于细胞的免疫效应物,这些效应物对骨细胞具有显著影响,这表明考虑肠道微生物群的健康可能会有益于骨愈合障碍。
✦ 肠道微生物影响微小RNA进而影响骨骼健康
尽管肠道微生物群对宿主免疫系统的影响有着相对较长的记录历史,但这并不是肠道微生物群影响骨骼健康的唯一潜在机制。类固醇激素、甲状旁腺激素和维生素D代谢物都可能受到微生物群的影响。
此外,细菌衍生的化合物(例如维生素)可能会进入血液并直接影响骨细胞活性。或者,肠道微生物群可能通过对宿主微小RNA (miRNA) 的影响来影响骨质疏松症的发展,宿主微小 RNA 是参与基因表达调节的非编码 RNA 分子。
一些 miRNA 可以影响与骨质疏松症中成骨细胞分化相关的转录物,例如 miRNA-33-5p、miRNA-194和miRNA-433-3p。尽管尚未完全了解,但在支持肠道微生物失调的反馈机制中,微生物群可能会影响宿主 miRNA,进而抑制成骨细胞发育,对骨质疏松修复构成障碍。
总的来说,肠道微生物群通过破骨细胞生成影响骨愈合和重塑有多种潜在途径。
益生菌是一类对宿主有益的活性微生物,定植于人体肠道和生殖系统等部位,能够产生精准的健康益处,改善微生态平衡,发挥有益作用。随着生命结构的不断改变,越来越多的益生菌被开发和利用,这与维持机体功能的稳定密不可分。
除了食品之外,益生菌的应用范围也越来越广,牙膏、啤酒等都在添加益生菌。益生菌对骨质疏松症的调节是一个新兴领域,研究益生菌如何改善骨代谢、预防或治疗骨质疏松症已成为研究热点,并已取得一定进展。
✦ 益生菌恢复肠道微生物平衡利于骨骼健康
目前的研究证据表明,补充益生菌以恢复肠道微生物群及其代谢产物的平衡对骨骼健康有益。
具体来说,被诊断患有炎症性肠病或相关疾病的个体由于肠道微环境的变化和随之而来的菌群失调而经常患有骨质疏松症,并研究了乳双歧杆菌BL-99可以作为有益的益生菌制剂来预防骨质疏松症。
最近的研究还表明,益生菌治疗可以通过抑制IL-6的分泌和肠道炎症反应来抑制卵巢切除术(OVX)诱导的小鼠破骨细胞的活性,从而增强骨量。
例如补充Bacteroides vulgatus ATCC 8482可以缓解骨质疏松小鼠肠道微生物群的失衡,下调脂多糖/TLR-4/p-NF-κB通路,改善腰椎的骨丢失和骨微结构破坏,这表明Bacteroides vulgatus ATCC 8482可能是一种具有改善绝经后骨丢失潜力的益生菌。
✦ 同时补充益生菌对改善绝经后女性的骨质疏松比单一常规药物更有效
目前益生菌防治骨质疏松的研究多集中于动物实验,临床试验报道较少。但一项基于人群的试验表明,在治疗绝经后骨质疏松症方面,施用Bifidobacterium animalis subsp. lactis Probio-M8与常规药物/补充剂的组合比单独使用常规药物/补充剂更有效。
在一项双盲、安慰剂对照研究中,75至80岁且骨矿物质密度较低的女性被随机分配每天口服10^10菌落形成单位的罗伊氏乳杆菌 ATCC PTA 6475或安慰剂,并且结果表明,补充罗伊氏乳杆菌 ATCC PTA 6475可能是预防骨质疏松症的新方法。
此外,在一项随机对照试验中,补充罗伊氏乳杆菌 ATCC PTA 6475有可能预防骨密度低的老年女性肠道微生物群恶化和炎症状态,这可能对骨代谢产生有益影响。
由此可见,越来越多的学者开始从补充益生菌的角度探讨调节肠道菌群及其代谢物的深层机制,益生菌也成为预防和治疗骨质疏松症的潜在候选者。
不同食物中营养素的组成和含量显著影响肠道微生物群的组成和丰度,进而影响骨代谢,调节骨质疏松。
因为一些微生物直接利用某些营养物质作为生长物质的来源,而大量摄入此类营养物质可能会导致细菌丰度增加并作用于骨代谢。例如,链球菌(Streptococcus), 芽孢杆菌(Bacillus),丙酸杆菌(Propionibacterium), 拟杆菌(Bacteroides)和梭菌属(Clostridium)等微生物可以利用蛋白质作为氮源,较高的膳食蛋白质摄入量也可以增加其丰度和多样性。
此外,人们还认识到,日常饮食摄入引起的生理环境的变化会影响微生物群落的选择。以膳食脂肪摄入为例,富含脂肪的膳食可能会促进胆汁分泌,以利于脂质的消化,而胆汁酸对细菌的细胞膜有不利影响,这使得胆汁酸对微生物产生强大的选择压力并导致这些肠道微生物群相关代谢物在骨质疏松症的代谢调节中发挥负面作用。
由于多酚抑制炎症因子并参与各种其他机制的能力,多酚已被确定为治疗骨质疏松症和慢性炎症的潜在药物,并且与肠道屏障的功能密切相关。
同时,多酚还可以充当肠道屏障-骨-免疫系统的调节介质和诱导剂。多酚可以通过两种方式影响肠道微生物群,即促进有益细菌的增殖和增加其丰度。
✦ 多酚可作为益生元增加有益菌的丰度
多酚具有益生元的属性并改变人类肠道微生物群组成。富含多酚的食物已被一致证明可以有效改变肠道微生物群。
大多数研究一致证明多酚可以引起肠道微生物群组成的有利改变。具体来说,当个体食用富含多酚的饮食时,人体肠道菌群会发生显著变化,乳杆菌、双歧杆菌、阿克曼氏菌、肠球菌和拟杆菌的数量增加,而梭菌和厚壁菌与拟杆菌的比例显著下降。
富含多酚的食物改变肠道微生物组成的证据
例如,富含多酚的红酒被发现可以刺激肠道微生物群中某些细菌的生长,例如拟杆菌和罗氏菌属。
发酵木瓜汁中发现的某些类型的多酚,例如没食子酸和咖啡酸,可以影响肠道微生物的组成。研究表明,这些多酚可以减少肠球菌、产气荚膜梭菌和艰难梭菌等有害细菌的数量,同时促进双歧杆菌等有益细菌的生长。
此外,某些多酚还可以促进肠道微生物群中真菌的生长。食用富含原花青素的葡萄籽可以增加肠道中乳酸杆菌、梭菌和瘤胃球菌的数量。
蔬菜与水果类似,富含多酚和益生元纤维。摄入胡萝卜中的膳食多酚可以增加拟杆菌和乳杆菌的数量,并减少产气荚膜梭菌、科氏梭菌、球状拟杆菌和肠杆菌。
利用16S rRNA和宏基因组测序分析研究了白藜芦醇对肠道生物屏障的影响。研究结果表明,白藜芦醇对肠道微生物群的多样性和结构具有积极影响。具体来说,它增加了益生菌的丰度并调节肠道微生物群的功能以对抗免疫抑制。


Wang K,et al.Front Immunol.2023
✦ 多酚衍生代谢物具有抗炎作用增强肠道健康
除了上述益生菌作用外,多酚衍生的代谢物可以增强肠道健康和表现出抗炎特性。例如,可可多酚的生物活性代谢物可以增强肠道健康,具有抗炎作用,对免疫系统有积极作用,并降低各种疾病的风险。
摄入多酚可以通过促进短链脂肪酸的产生、增强肠道免疫功能和其他生理过程来改善肠道微生物群的健康效应。
✦ 多酚减少有害细菌的水平
据观察,在含有人类粪便细菌的培养基中加入茶多酚,特别是儿茶素,可以减少有害细菌的水平,包括大肠杆菌、产气荚膜梭菌。
这一发现表明,在肠道环境中引入茶多酚可能对抗这些特定病原菌的增殖。强调了茶多酚对肠道微生物群平衡的积极影响。
还研究了茶多酚对肠道氧化还原状态的影响及其与肠道微生物群的相关性。研究发现螺旋体和拟杆菌属被确定为肠道氧化还原状态的生物标志物,并揭示了茶多酚的益处。
因此,多酚和肠道微生物群之间的协同作用成为治疗骨质疏松症的关键因素。
营养因素也对骨质疏松症有着至关重要的影响,低钙摄入、维生素D缺乏、高磷和钠饮食、过量饮酒以及碳酸饮料的摄入被普遍认为是骨质疏松症的危险因素,而充足的蛋白质摄入有利于骨骼健康。
膳食营养素通过作用于肠道微生物群及其代谢物对骨质疏松症产生影响:
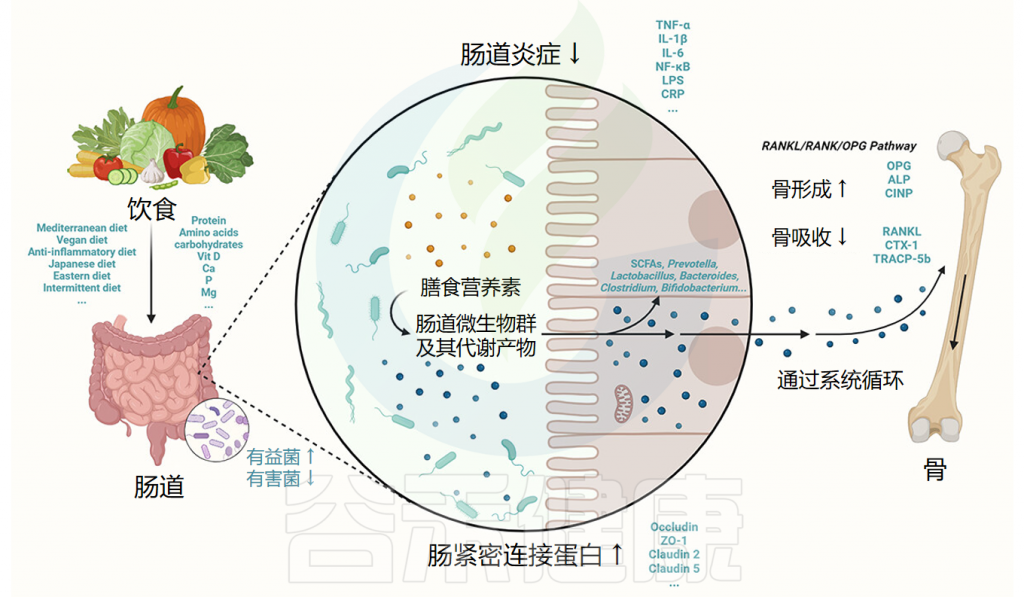
Zhang YW, et al.Gut Microbes.2024
人体的膳食蛋白质摄入可以通过细菌发酵、甲烷化、脱羧反应和硫还原来改变呼吸链中的电子受体,从而对转化为对健康具有不同影响的物质。
✦ 改变细菌生长环境,调整肠道菌群的组成
例如,含硫氨基酸如蛋氨酸和半胱氨酸可以在硫还原作用下生成硫化氢,而氨基酸和肽可以在厌氧菌的作用下通过脱羧反应产生胺类。这些代谢产物改变了细菌的生长微环境,并使细菌获得了一定的生长优势,从而改变了肠道菌群的组成和丰度。
同时,研究表明,高蛋白饮食者的肠道菌群中Bacteroides, Prevotella, Treponema, Fusobacterium, Clostridium perfringens和Bacillus的数量相对于传统饮食者增加,而厚壁菌门的数量减少。这种改变也已被证实与骨质疏松症的逆转一致。
✦ 蛋白质的代谢产物影响骨吸收和骨形成
研究人员揭示,肠道菌群发酵的蛋白质、氨基酸和肽的主要代谢产物是短链脂肪酸,如乙酸、丙酸和丁酸,而短链脂肪酸参与了骨形成和骨吸收的调节。
学者们还发现,肠道厌氧菌能够从甘氨酸、苏氨酸、谷氨酸、赖氨酸、鸟氨酸和天冬氨酸中合成乙酸,从苏氨酸、谷氨酸和赖氨酸中主要合成丙酸。
更重要的是,包括乙酸、丙酸和丁酸在内的短链脂肪酸的调节与骨质疏松症的发生和发展密切相关。与此同时,梭菌属可以利用支链氨基酸(缬氨酸、亮氨酸和异亮氨酸)合成支链脂肪酸,而支链氨基酸和短链脂肪酸也是代谢性疾病如骨质疏松症、肥胖症、2型糖尿病等的潜在调节因素。
膳食脂肪是身体的有效能量来源。先前的研究已表明,膳食脂肪摄入的质量和数量可能会影响肠道微生物群的组成和丰度。
✦ 适量的不饱和脂肪酸可助肠道菌群有益改变
不饱和脂肪酸通过提高拟杆菌门与厚壁菌门的比例来改变肠道微生物群的组成和丰度。Omega-3脂肪酸可导致肠道微生物群的有益改变,包括增加双歧杆菌、乳酸杆菌、链球菌、脱硫弧菌和阿克曼菌。
✦ 高脂饮食会导致骨代谢紊乱和骨质疏松
但大量摄入饱和脂肪酸和反式脂肪酸会增加心血管和骨代谢相关疾病的风险,减少拟杆菌、普雷沃氏菌、乳杆菌和双歧杆菌的丰度,从而可能导致全身炎症、骨代谢紊乱和骨质疏松。
研究发现,长期高脂饮食会导致骨量下降、微生物群失调、肠漏和全身炎症,而低聚果糖或低聚半乳糖的施用可以显著增强肠道微生物群的生物多样性和短链脂肪酸浓度,逆转高肠道通透性和炎症细胞因子,最终预防高脂饮食诱导的骨质疏松症。
研究结果还表明,高脂饮食引起的骨质流失伴随着骨髓脂肪组织的扩张和骨形成的抑制。
高脂饮食对骨骼结构和健康具有至关重要的影响,肠道菌群失衡、肠道屏障恶化、炎症反应、氧化应激、脂肪因子改变和骨髓脂肪组织堆积被认为是潜在的机制。
研究还发现,运动可以预防高脂饮食对男性骨骼健康的多种负面影响,运动引起的肠道微生物群变化(降低厚壁菌门与拟杆菌门的比例)可能表现出一种新的机制,有助于运动诱导的骨骼健康益处。
可消化和不可消化的碳水化合物都可能影响肠道微生物群的组成和丰度,这两者都已被证实可以增加双歧杆菌的数量。各种水果中的可消化碳水化合物(例如葡萄糖、蔗糖和果糖)已被证明会降低拟杆菌和梭菌的丰度。
✦ 高膳食纤维的摄入有助于骨骼健康
难消化的碳水化合物也称为膳食纤维。近年来,随着肠骨轴研究的快速发展,膳食纤维发酵的短链脂肪酸已成为一种重要的介质,重点关注肠道微生物群与骨质疏松症之间的联系。
膳食纤维通过调节拟杆菌门与厚壁菌门的比例来改变肠道微生物群,并改变多种功能途径(包括氨基酸和脂质相关代谢),从而参与骨代谢的调节。研究人员分析了膳食纤维摄入不足的后果,观察到低纤维饮食显著降低了长达三代的微生物多样性,并且补充膳食纤维后微生物多样性无法恢复。
更重要的是,研究人员总结,摄入更多富含纤维的食物(包括粗粮、新鲜水果和蔬菜),再加上充足的运动、适当的饮水和规律的排便,可能有助于维持人体肠道和骨骼的健康,尤其是中老年人,以预防骨质疏松症。因此,食用多种食物中的膳食纤维对维持肠道健康和防止骨质流失至关重要。
肠道菌群在调节宿主健康中发挥着至关重要的作用,不同个体肠道菌群的组成存在显著差异,并受到饮食、环境等多种因素的影响,其中饮食是不可忽视的重要因素。
★ 饮食模式和膳食成分都会影响健康
不同的饮食模式对肠道微生物群的结构、代谢和功能有不同的影响,并参与各种生理活动,如食物消化、营养代谢吸收、能量供应、免疫调节和胃肠道稳态的维持,与骨质疏松症的发生发展密切相关。
此外,饮食不仅会影响肠道微生物群的结构和组成,还会影响其基因和功能。即使是同一属的细菌,在不同饮食模式的影响下,其功能和核心基因也存在显著差异。
纯素食和地中海饮食可以增强肠道微生物群的多样性,促进有益细菌的生长,如双歧杆菌、乳酸杆菌和普雷沃氏菌,而西方饮食可以减少肠道微生物群多样性,增加厚壁菌门与拟杆菌门的比例。
!
不同饮食对骨骼健康的影响
通过阅读相关文献,谷禾在这里为大家整理了不同饮食模式对肠道微生物群、代谢物和骨骼健康的影响,如下图:

Zhang YW, et al.Gut Microbes.2024
多元化的饮食更利于骨骼健康
不同的膳食成分可能以时间依赖性的方式塑造肠道细菌群落,并且不同的膳食成分对肠道微生物群的影响显著不同。
因此,合理的膳食结构、正确的膳食习惯和方法、适当的营养配比是保证人体健康的基础,而不合理的膳食结构则是高血压、糖尿病、骨质疏松等多种慢性病的罪魁祸首。在此基础上,还必须根据肠道菌群及其代谢产物对骨质疏松症的调节影响提出合理的饮食建议。
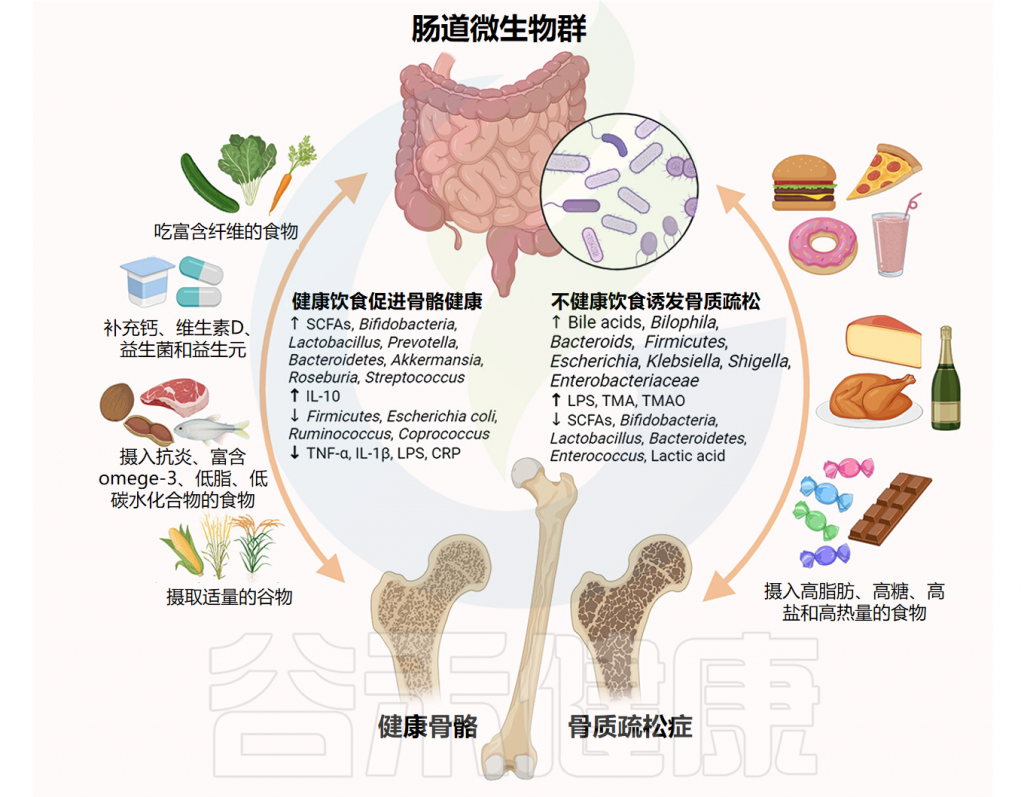
Zhang YW, et al.Gut Microbes.2024
合理的饮食模式融合了地中海饮食、抗炎饮食等健康饮食模式的特点,主要包括食物多样化、高纤维摄入、低糖摄入、低脂肪摄入、高谷物摄入。
合理的膳食结构主要以食物多样化为原则,建议多食用蔬菜、水果、豆类及其制品、鱼类、海鲜,同时少吃红肉和饱和脂肪酸,保证充足的摄入以植物性食物为主,适量动物性食物为主,从而获得种类齐全、数量充足、比例适当的膳食营养素,满足中老年人群维持骨骼健康、预防骨质疏松的生理需要。
合理的饮食模式也为塑造肠道稳态、有益菌繁殖、消除有害菌、维持肠道菌群多样性奠定了坚实的基础。
骨质疏松症作为一种中老年人常见的慢性疾病,在日常生活中如何更好地预防和改善非常重要。
除了常规的日常护理外,肠道微生物群与饮食也起着至关重要的作用。肠道微生物群可以将多酚等膳食成分分解为更容易吸收的有益代谢物,如短链脂肪酸,而多酚可以增加肠道中有益菌的丰度和活性,增强肠道屏障,从而促进骨健康。
两者协同作用下,更大程度地发挥各自的功能和作用,可能作为预防和治疗骨质疏松症的新方法。
主要参考文献:
Zhang YW, Song PR, Wang SC, Liu H, Shi ZM, Su JC. Diets intervene osteoporosis via gut-bone axis. Gut Microbes. 2024 Jan-Dec;16(1):2295432.
Wang K, Hu S. The synergistic effects of polyphenols and intestinal microbiota on osteoporosis. Front Immunol. 2023 Oct 23;14:1285621.
Seely KD, Kotelko CA, Douglas H, Bealer B, Brooks AE. The Human Gut Microbiota: A Key Mediator of Osteoporosis and Osteogenesis. Int J Mol Sci. 2021 Aug 31;22(17):9452.
Zhou RX, Zhang YW, Cao MM, Liu CH, Rui YF, Li YJ. Linking the relation between gut microbiota and glucocorticoid-induced osteoporosis. J Bone Miner Metab. 2023 Mar;41(2):145-162.
Cheung KCP, Jiao M, Xingxuan C, Wei J. Extracellular vesicles derived from host and gut microbiota as promising nanocarriers for targeted therapy in osteoporosis and osteoarthritis. Front Pharmacol. 2023 Jan 6;13:1051134.
de Sire A, de Sire R, Curci C, Castiglione F, Wahli W. Role of Dietary Supplements and Probiotics in Modulating Microbiota and Bone Health: The Gut-Bone Axis. Cells. 2022 Feb 21;11(4):743.
Martiniakova M, Babikova M, Mondockova V, Blahova J, Kovacova V, Omelka R. The Role of Macronutrients, Micronutrients and Flavonoid Polyphenols in the Prevention and Treatment of Osteoporosis. Nutrients. 2022 Jan 25;14(3):523.
Inchingolo AD, Inchingolo AM, Malcangi G, Avantario P, Azzollini D, Buongiorno S, Viapiano F, Campanelli M, Ciocia AM, De Leonardis N, de Ruvo E, Ferrara I, Garofoli G, Montenegro V, Netti A, Palmieri G, Mancini A, Patano A, Piras F, Marinelli G, Di Pede C, Laudadio C, Rapone B, Hazballa D, Corriero A, Fatone MC, Palermo A, Lorusso F, Scarano A, Bordea IR, Di Venere D, Inchingolo F, Dipalma G. Effects of Resveratrol, Curcumin and Quercetin Supplementation on Bone Metabolism-A Systematic Review. Nutrients. 2022 Aug 26;14(17):3519.
Li Y, Li L, Li X, Luo B, Ye Q, Wang H, Yang L, Zhu X, Han L, Zhang R, Tian H, Wang P. A mechanistic review of chinese medicine polyphenols on bone formation and resorption. Front Pharmacol. 2022 Oct 12;13:1017538.

谷禾健康

我们知道,微量营养素在人体健康中发挥着重要作用。然而,在全球范围内,约有3.4亿儿童患有多种微量营养素缺乏症,并伴有高致病性负担和耐多药细菌导致的死亡风险。
这些儿童经常用抗生素治疗营养不良相关疾病。可矛盾的是,由于潜在的微量营养素缺乏,他们的肠道微生物组可能已经为抗生素耐药性做好了准备…
通常,这些缺陷发生在生命早期前1000天,并可能带来即时和终身的健康缺陷。生命早期前1000 天是肠道微生物组成熟的关键时期,扰动会产生直接和长期的后果。
越来越多的研究让人认识到微生物与营养不良之间的密切关联。一些对单一微量营养素缺乏症的动物研究表明,诱导缺乏症后微生物特征发生了改变。例如,锌缺乏的雏鸡变形杆菌和厚壁菌门的丰度增加;妊娠、哺乳和断奶期间的维生素A缺乏症大鼠显示,其幼崽的微生物组成发生了显著变化,特别是厚壁菌门机会性病原体较高。
肠道环境中另一个容易被遗忘的元素是肠道抗性基因组(resistome),它是广泛表达于肠道微生物群栖息地内的共生菌和致病菌中的抗生素耐药基因(ARGs)和机制的完整集合。随着共生菌群的形成,抵抗基因组在婴儿期更加丰富,并在头几个月内高度动态变化。
抗生素耐药性可以是内在的,也可以是后天的。2019年的一份最新报告估计,5岁以下儿童中每5个死亡案例中就有1个是由于耐药细菌引起的。对营养不良微生物群组的理解仍然不完整,干预和治疗策略也可能被误导。
来自不列颠哥伦比亚大学的研究人员使用最近开发的小鼠模型,研究了多种微量营养素缺乏症,即维生素A、B12、叶酸、铁和锌,这是最常见的缺乏症,对成熟的肠道微生物组、结构和耐药性的影响。研究人员发现微量营养素缺乏会显著改变肠道菌群、真菌群、病毒组的组成,并且提供了以前未知的关于微量营养素如何塑造发育中的肠道抗性基因组的数据。

近日其研究成果发表在《Nature Microbiology》上,这为早期微量营养素缺乏症的长远后果提供了重要的见解。解决微量营养素缺乏问题,不仅仅是克服营养不良,也可能是抗击全球抗生素耐药性祸害的关键一步。我们一起来详细了解一下。
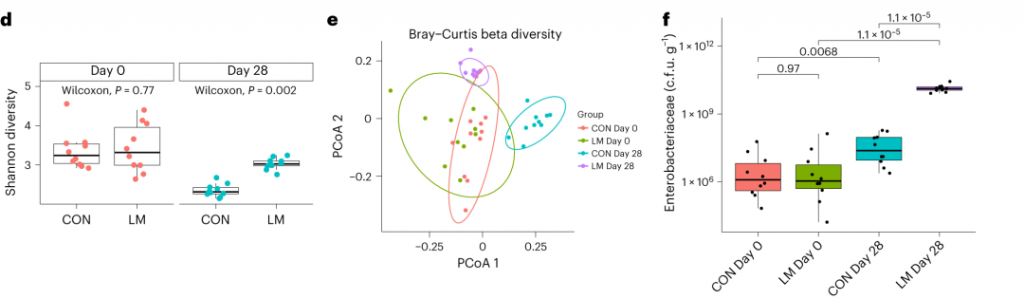
断奶C57BL/6N雄性小鼠接受等热量实验对照或多种微量营养素缺乏(即低锌、叶酸、铁、维生素A和B12)饮食28天。正如预期的那样,实验结束时,低微量营养素(LM)饮食的小鼠体重增加较少,发育迟缓和贫血。这里用鸟枪法宏基因组测序来表征饮食治疗前后的肠道微生物组。
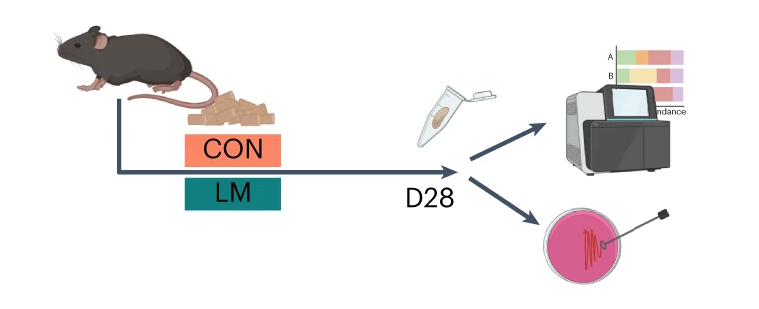
第28天,在LM小鼠中观察到变形菌门、肠杆菌门和Tannerellaceae科的扩增,而CON组的厚壁菌门和丹毒科扩增。LM小鼠中,下列菌群的相对丰度较高:
而下列菌群丧失:
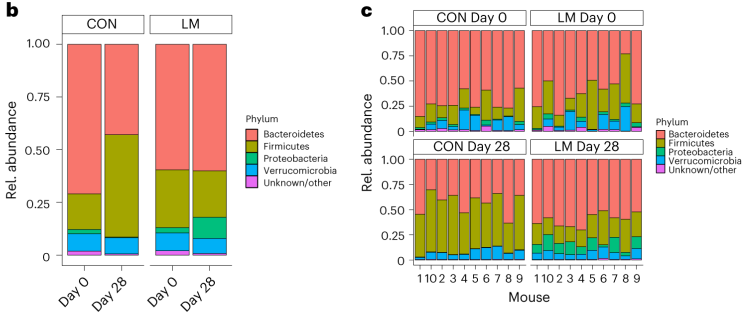
实验结束时,LM小鼠的α多样性较高(Shannon指数,P = 0.002);
PCA图显示,饮食处理后,两组之间存在明显的差异(p=0.001)
第28天,LM组中下列菌群增加:
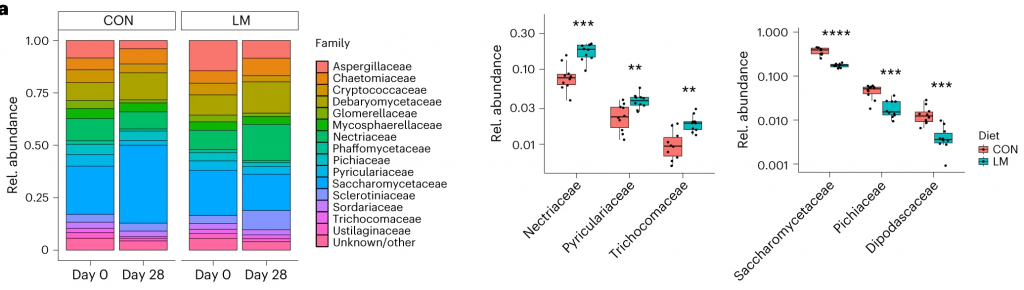
下列菌群丰度降低:
LM小鼠中,下列噬菌体丰度更高:
对照小鼠中,下列菌群的丰度更高:
LM组的β多样性与对照在第28天有显著差异(Bray-Curtis,PERMANOVA,P < 0.01)
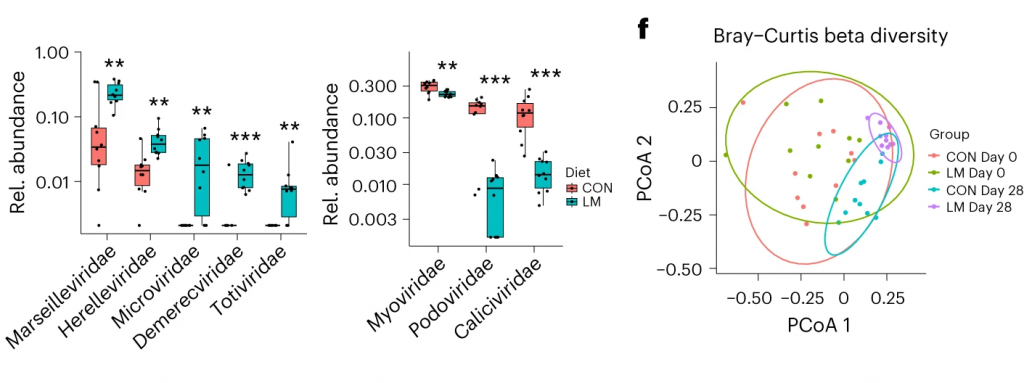
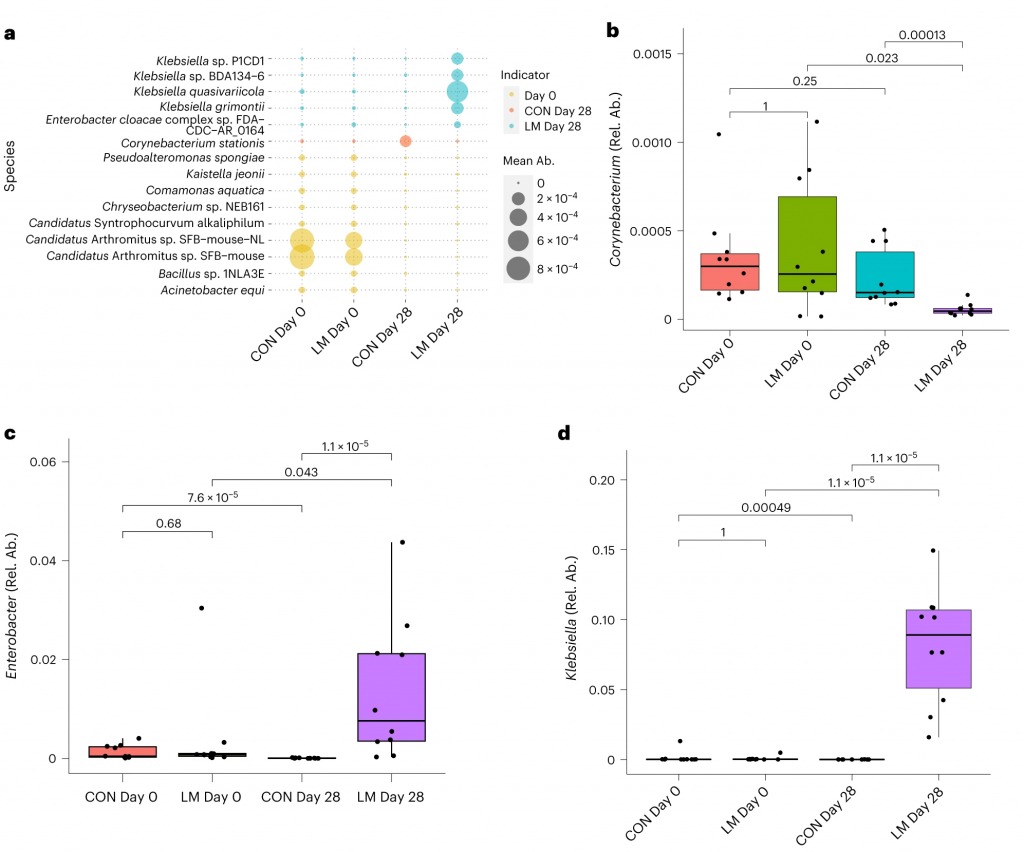
发现了14种指示细菌:
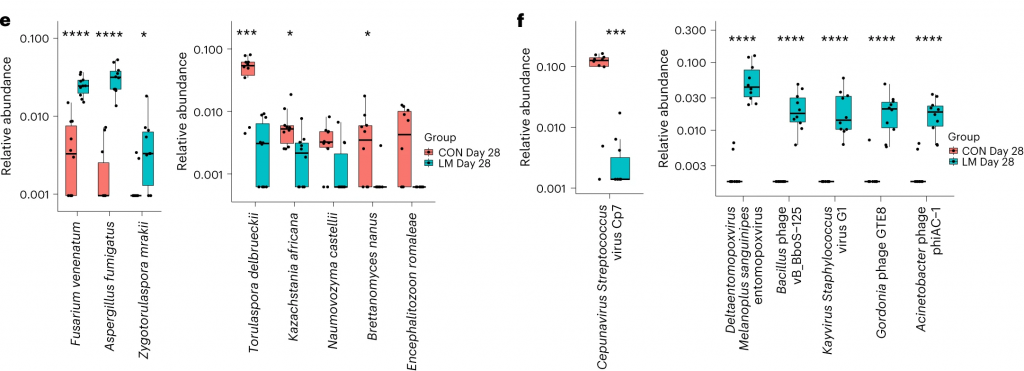
在真菌组和噬菌体组中,LM小鼠中下列相对丰度显著增加:
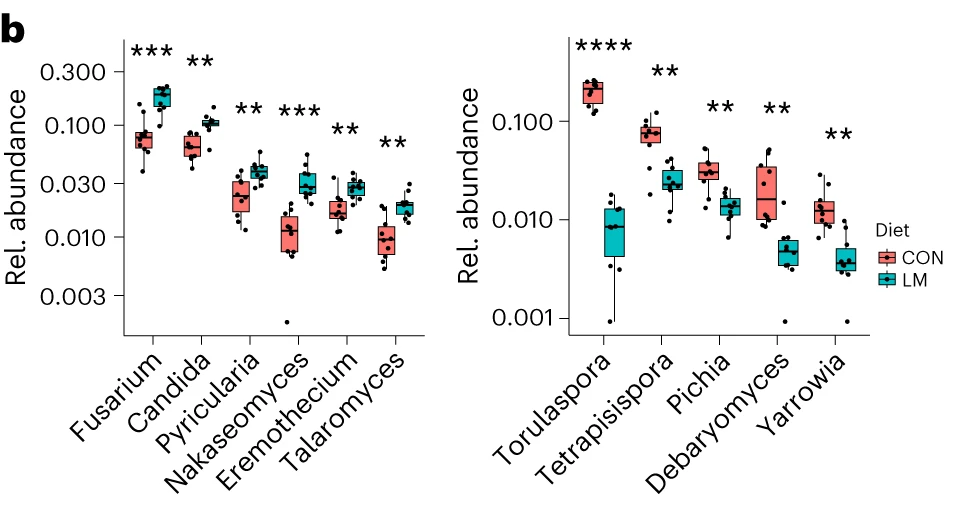
在营养不良的儿童中,机会性细菌的扩张(在不利情况下可能引发危害的微生物)是肠道的常见表型。因此,研究人员将模型中的机会性细菌与常见于营养不良儿童中的细菌进行表型比较。
第28天,LM小鼠中总机会性细菌的相对丰度总体增加(P < 0.0001)。11个分类单元中,有7个在第28天LM组的相对丰度显著增加:
有3个在LM组中丰度减少:
在LM的小鼠真菌群落中,观察到Candida dubliniensis 的相对丰度较高(P < 0.019)。
抗生素耐药性,无论是内在的还是后天的,都是由几个关键机制驱动的。
使用综合抗生素耐药性数据库(CARD)对肠道耐药性组进行分析显示,总ARGs的相对丰度增加(P = 1. × 10−5)。
随后的分析表明,抗生素外排和抗生素失活是改变的最常见的内在耐药性机制。
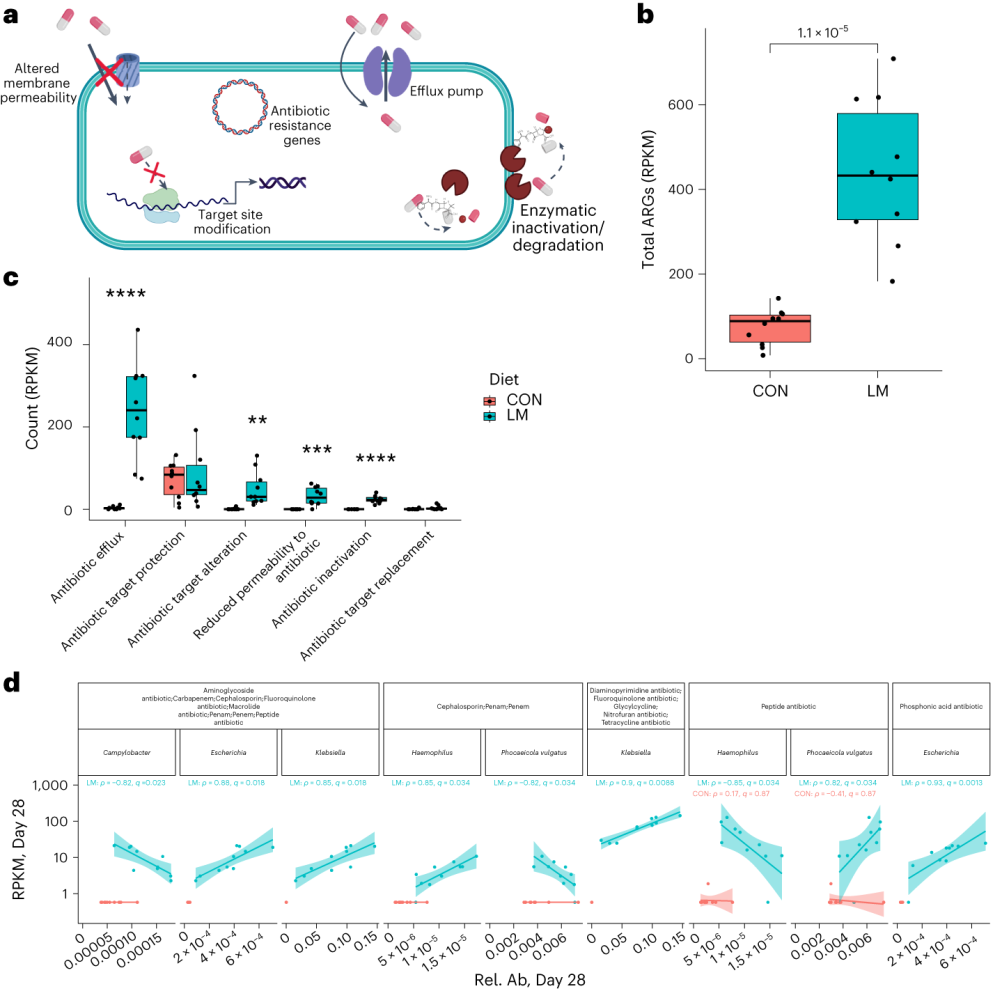
第28天LM组的ARG α多样性显著高于对照组(P = 0.0092)。
基于Bray–Curtis的相异性指标显示,低微量营养素饮食强烈影响了早期肠道抵抗。ARGs的计数显示,绝大多数(73%)ARGs仅在LM第28天组中流行≥30%。
将CARD数据库映射和药物分类分析显示,氟喹诺酮类/大环内酯类/青霉素类抗生素(Q < 0.0001)是LM处理小鼠中最常见的药物耐药机制改变,其次是磷酸酯类(即福氏霉素)(Q < 0.001),以及二氨基嘧啶类/氟喹诺酮类/甘氨环素类/硝呋环酮类/四环素类(Q < 0.001)。
▸ 接下来,研究人员提出是否有药物类别或耐药性机制与任何细菌门或机会性细菌相关?
事实上在LM小鼠中,克雷伯氏菌、嗜血杆菌、埃希氏菌、弯曲杆菌、Phocaeicola vulgatus和几种药物类别之间存在正相关(Q < 0.05)。不出所料,克雷伯菌和大肠杆菌与ARGs药物类别的相关性比其他机会细菌更强。
在个体机会性细菌中,克雷伯菌和弯曲杆菌与外排机制相关,克雷伯菌,志贺菌,弯曲杆菌和埃希氏菌与抗生素失活相关。
肠球菌与外排机制相关,但仅在对照组中。
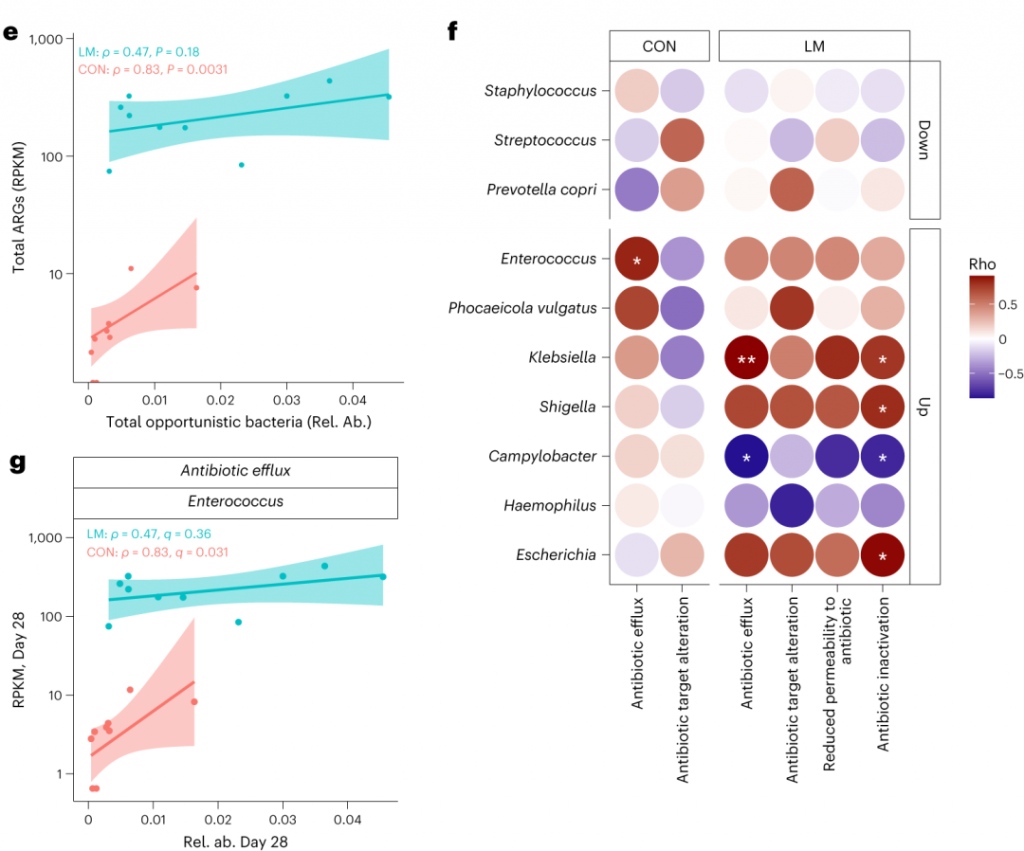
环境压力源,如营养缺乏,已被证明会触发细菌的压力反应,从而诱导抗生素耐药性机制作为生存策略。矛盾的是,细菌也可以产生活性氧(ROS),在致命压力的存在下自毁。
研究人员研究了LM喂养的小鼠的应激反应机制是否发生了改变,以及它们是否与个体ARGs相关。
事实上,在LM小鼠中发现编码氧化应激和氧化应激反应的基因更丰富,总ARGs与氧化应激之间具有很强的相关性(P = 0.0098)。
具体来说,氧化应激反应与下列之间存在强烈的相关性:
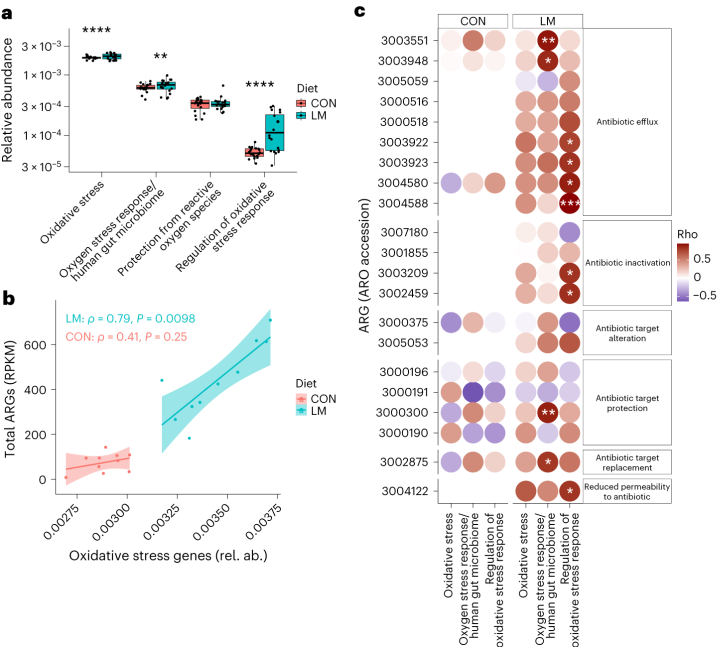
在对照小鼠中,总体氧化应激与嗜血杆菌之间存在强烈的相关性(p<0.05)。
在LM小鼠中,氧化应激反应的调节与克雷伯杆菌、志贺氏菌、弯曲杆菌、大肠杆菌、肠杆菌科菌和变形菌门菌的增加相关。
微量营养素缺乏是一项重要的公共卫生危机,同时也是一个容易忽视的研究领域。该研究基于先前的动物研究,强调了这些微量营养素缺乏如何影响发育中的肠道微生物组。此外还探索了耐药基因组。
低微量营养素 & 肠道微生物组
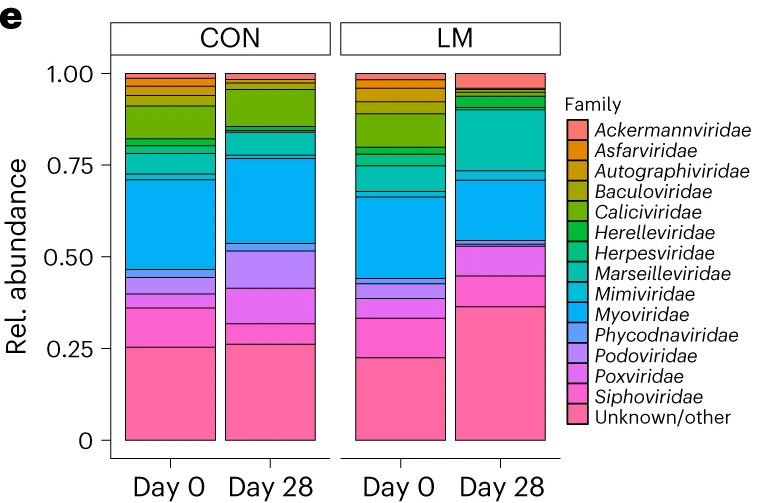
在低微量营养素饮食28天的小鼠体内,细菌、真菌和病毒/噬菌体粪便种群发生了变化 。由于微量营养素不足的影响,变形菌门细菌和机会性细菌,如克雷伯菌、大肠杆菌、志贺菌、衣原体、肠球菌、弯曲杆菌、肠杆菌、Phocaeicola vulgatus富集。
研究表明,饮食扰动确实会破坏肠道中正在发育的真菌生物群落和病毒组/噬菌体。还观察到LM小鼠体内病毒/噬菌体的富集,这表明了一个不成熟(即婴儿)表型和发育延迟。这一特征可能对细菌适应能力和宿主免疫反应产生影响。
真菌组在早期生命发育阶段受到饮食和其他环境因素的影响,可能对短期和终身健康产生影响。两个实验组的真菌携带量随着群落成熟而增加。然而,在第28天,低微量营养素饮食组的小鼠体内明显增加了致病真菌念珠菌,这是一种常见的侵袭性物种。
这些发现与一个在马拉维队列中的研究结果一致。该研究报道了在无锌情况下给予多微量营养素粉剂(MNP)后,马拉维队列的肠道微生物组中原生动物和真菌群落的增加。埃希氏菌-志贺菌也在12个月大的婴儿中富集,这些婴儿接受了补充或不补充锌的MNP,强调了微量营养素在形成营养不良儿童肠道群落组成中的作用。
低微量营养素 & 抗生素耐药性
抗生素耐药性是一项迫切的全球公共卫生威胁,肠道微生物组是耐药基因(抗性基因组)的重要来源。
一项先前的研究发现,健康婴儿的耐药基因组中存在预测超过30类抗生素耐药性的400多个基因。其中,167个基因对多个抗生素表现出表型耐药性。有趣的是,婴儿的耐药基因组中还包括对婴儿之前未接触过的多种抗生素的耐药性。这进一步强调了内在耐药基因组作为当前和新兴抗生素耐药性的病原库的重要性。
在本次研究中,发现低微量营养素饮食的小鼠中富集了参与内在抗生素耐药性机制的基因,这些基因与机会性细菌的存在具有关联性。例如,与氟喹诺酮和膦酸(如磷霉素)耐药相关的基因得到了富集。这对于常见患有多药耐药细菌引起的菌血症的营养不良儿童来说,具有重要的临床意义。
本次研究提供了重要发现,并强调了微量营养素缺乏与肠道抗药基因组之间的重要联系。这些结果表明,我们对营养不良微生物组的认识还不完整,需要进一步研究成熟的抗药基因组。
低微量营养素 & 肠道微生物组 & 耐药性
此外,还展示了微量营养素缺乏引起了肠道微生物组成的显著变化。这导致了变形菌门的扩增、机会性细菌和真菌病原体的增加,进一步促进了多种内在耐药基因的表达。
尤其是发现了细菌氧化应激与抗药基因组之间的显著相关性。确定了微量营养素缺乏引起的细菌应激在营养不良宿主中显著促进内在抗生素耐药性的作用。因此,未来解决营养不良和抗生素耐药性问题的策略应将内在耐药基因组纳入考虑,并与可持续发展目标(良好健康和福祉)相一致,最大程度造福于相关儿童。
本研究的一个局限性是初步的微生物组特征分析中使用了雄性小鼠(基于先前的研究表明雄性对营养不良比雌性更加敏感),研究人员计划在未来探索雌性小鼠。
另一个潜在的局限性是使用了多种微量营养素;然而,这种设计增强了模型,反映了实际应用中与儿童相符的多种微量营养素的复杂协同作用。一个主要的优势是将测序和生物学评估相结合,用于微生物组和抗生素耐药性的特征化。进一步探索数据集可能揭示共存微量营养素缺乏的功能和微生物动态。
未来可以调查肠道生理学以及抗药基因组在致病感染易感性中的作用。进一步探索真菌耐药基因组和该模型中内在抗真菌性能。然而,抗真菌耐药性数据库(MARDy)是目前唯一经过策划的抗真菌耐药性数据库,但更新不够频繁,限制了它的应用。
目前可用的抗生素耐药性分析数据库往往存在高估基因关联性的倾向。数据库的选择取决于研究人员想要回答的问题类型。
CARD数据库的一个局限性是它基于已发表的基因组数据进行策划,可能对经过深入研究的生物体比对少研究的生物体有偏见。不过它的全面列表、专家的定期更新和机器学习算法支持使其成为该领域中的宝贵工具。
编辑
抗生素耐药性通常归因于抗生素的过度使用和误用,但本研究表明,微量营养素缺乏的“隐性饥饿”是一个重要因素。需要进一步加强对营养不良与抗生素耐药性之间关系的研究,增进我们对这一领域的理解。还需要制定和实施综合性的干预策略,以解决儿童营养不良及其对健康的连锁反应,以及抗生素耐药性的双重挑战。总的来说,该研究为减少抗生素耐药性提供新的视角,为这方面的研究带来新的思路,并在全球范围内推动健康和可持续发展目标的实现。
参考文献:
Littlejohn PT, Metcalfe-Roach A, Cardenas Poire E, Holani R, Bar-Yoseph H, Fan YM, Woodward SE, Finlay BB. Multiple micronutrient deficiencies in early life cause multi-kingdom alterations in the gut microbiome and intrinsic antibiotic resistance genes in mice. Nat Microbiol. 2023 Nov 16.
谷禾健康

“唉,昨晚又没睡好!”
失眠已经严重影响着一部分人们的生活。失眠后会引起烦躁、白天嗜睡、精力不足、内分泌系统紊乱、认知功能受损、免疫力下降甚至易得心脑血管疾病。
据中国睡眠研究会等机构统计,中国有超3亿人存在睡眠障碍。其中,19—25岁年轻人经常熬夜至零点以后;19—35岁青壮年是睡眠问题高发年龄段。 并且由于当代社会压力增加,失眠率还在不断攀升。

影响睡眠质量的因素有很多:包括人体的生物钟,环境因素如光照、噪音、温度,还有心理状况,饮食状况及疾病状况。而近年来的研究发现体内有一种物质与睡眠紧密相关——它就是褪黑素。
褪黑素于20世纪50年代首次被发现并表征,从那时起,广泛的研究揭示了它的生产、功能和潜在的治疗应用。
褪黑素作为改善睡眠质量和调节昼夜节律紊乱的补充剂已广受欢迎。除了在睡眠调节中的作用外,褪黑素还被发现具有抗氧化、抗炎、免疫调节和神经保护特性。它影响生殖过程、心血管健康、胃肠功能以及其他生理系统。
近年来,褪黑素和肠道微生物群之间的关系已成为一个令人着迷的研究领域。研究表明褪黑素和肠道微生物之间存在双向作用,强调了肠道微生物群对褪黑激素产生和代谢的潜在影响,以及褪黑激素对肠道微生物组成和功能的影响。
褪黑素(N-乙酰基-5-甲氧基色胺)最早于1958年在牛松果体中发现并分离出来,因其能够美白青蛙皮肤,研究人员一开始认为作为一种“美白因子”,并将其命名为“褪黑素”。
后续的研究才证明了其在调节生物节律和睡眠模式中的作用。
注:褪黑素是一种具有3-胺基和5-甲氧基的吲哚胺,因此具有两亲特性(同时具有亲水性和亲脂性)。
褪黑素的化学结构
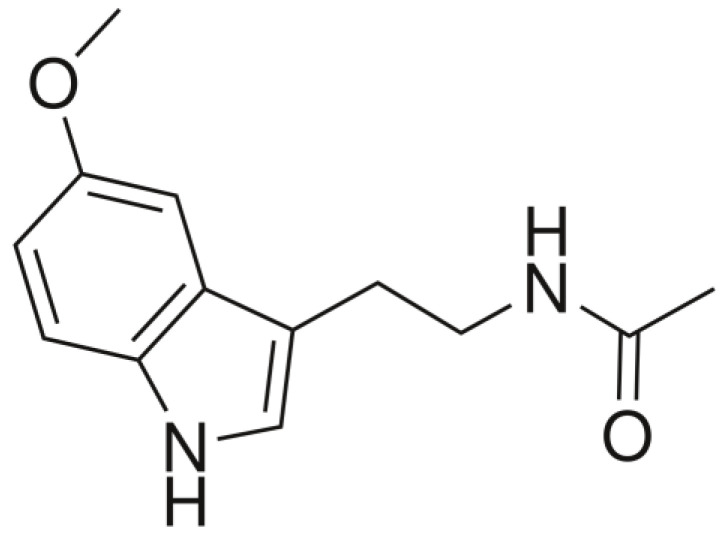
Minich DM,et al.Nutrients.2022
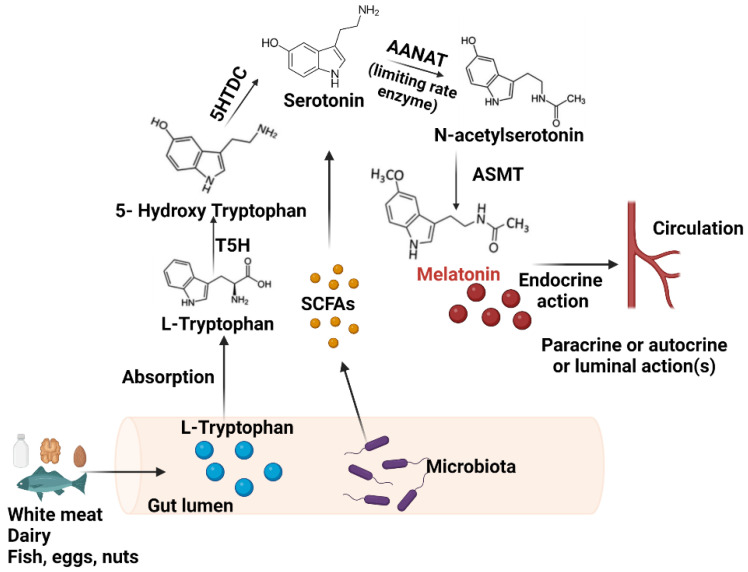
✦ 色氨酸是合成褪黑素的原料
松果体通常在黑暗环境中产生褪黑素,褪黑素生物合成从色氨酸开始,接着色氨酸转化为血清素(5-羟色胺)。5-羟色胺会经历两个酶促反应:首先,N-乙酰基转移酶进行N-乙酰化,产生N-乙酰-5-羟色胺。
然后,通过羟基吲哚-氧-甲基转移酶的作用,甲基从S-腺苷甲硫氨酸转移到N-乙酰血清素的5-羟基。N-乙酰基转移酶是褪黑素合成的限制步骤,它具有昼夜节律,夜间活动是日间活动的50到100倍。
褪黑素的生物合成途径

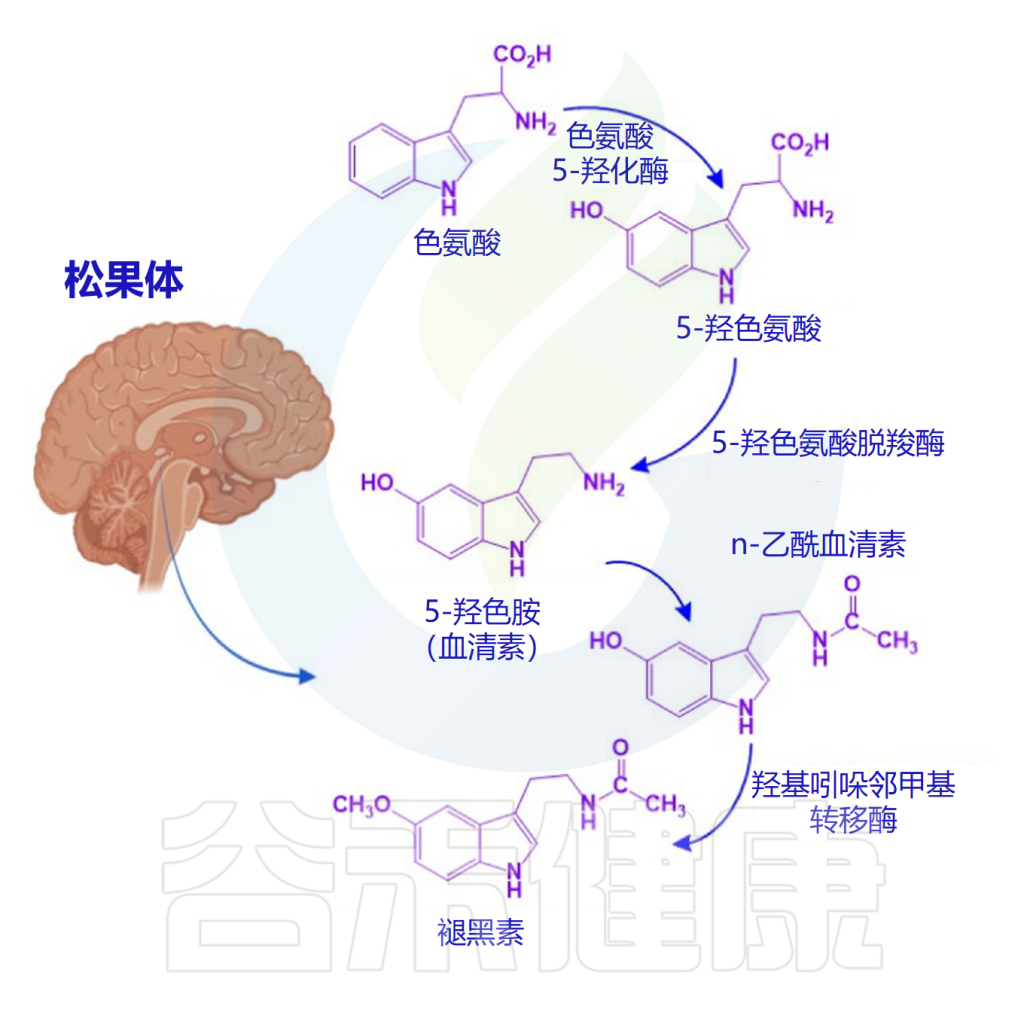
Miranda-Riestra A,et al.Molecules.2022
✦ 其他部位也可以产生褪黑素
值得注意的是,其他组织和器官也会产生褪黑激素,包括视网膜、胃肠道、皮肤和免疫细胞。其在胃肠道中的浓度比血清中的浓度高10至400倍。
注:胃肠道中的褪黑素主要由肠嗜铬细胞、某些类型的免疫细胞和肠道共生细胞产生。肝脏几乎会降解所有褪黑素,这表明胃肠道褪黑素仅限于肠-肝轴,而不是循环到其他器官,并且它在局部发挥作用。
在这些外周组织中,褪黑素的产生可能不会直接受光暗周期调节,但可能受到其他因素(例如饮食和局部信号)的影响。
褪黑素在体内的合成

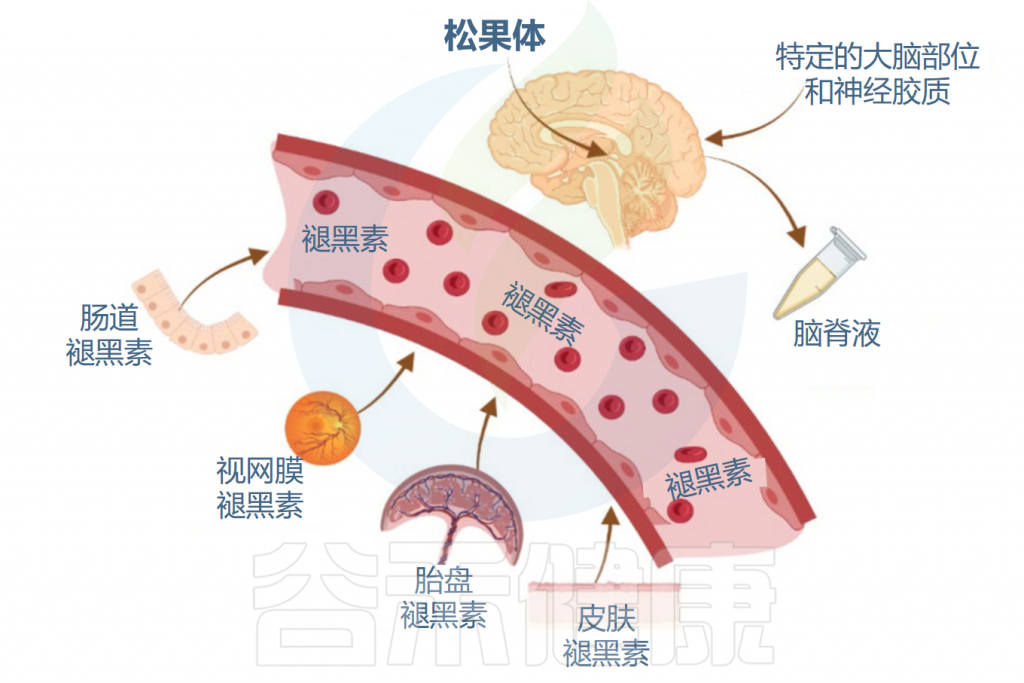
Miranda-Riestra A,et al.Molecules.2022
平均而言,松果体每天产生0.1至0.9毫克褪黑素。但一些因素会影响褪黑素的分泌。
✦光照
光照对于调节褪黑素的产生起着至关重要的作用。视网膜中称为本质光敏视网膜神经节细胞(ipRGC)的特殊细胞可检测光并向下丘脑视交叉上核 (SCN)发送信号。
当暴露于光,特别是蓝光时,这些细胞会抑制褪黑素的产生。这是因为光照会抑制血清素N-乙酰转移酶和N-乙酰血清素O-甲基转移酶的活性,这些酶参与褪黑素合成。

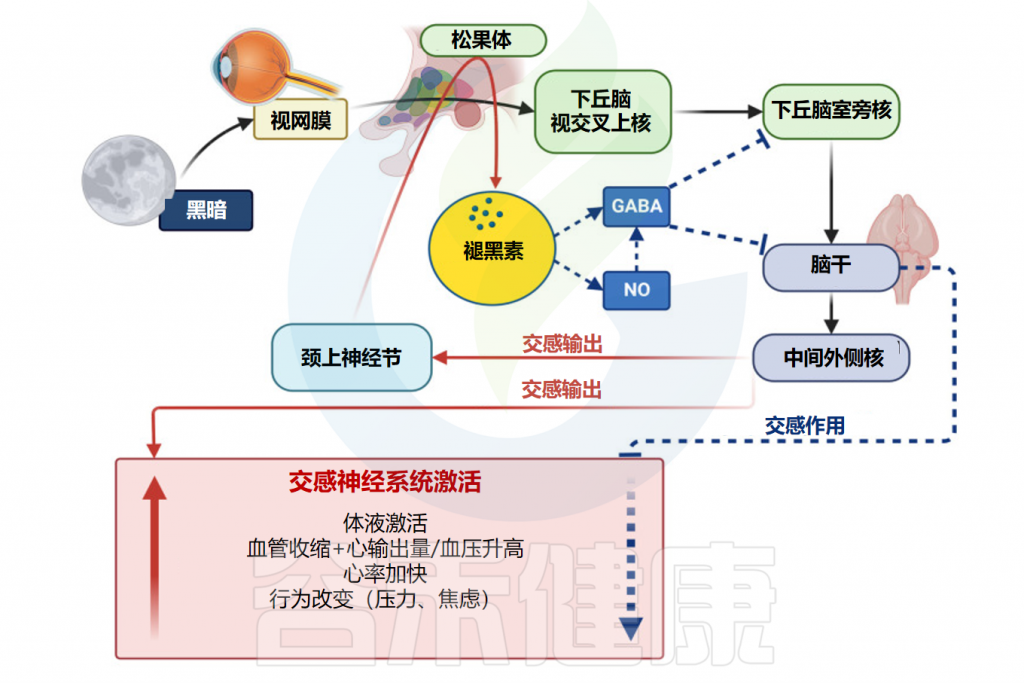
Repova K,et al.Int J Mol Sci.2022
在没有光的情况下,例如在夜间,褪黑素合成的抑制被消除。SCN向松果体发出信号,以增加褪黑素的产生。因此,褪黑素水平上升,促进困倦并帮助调节睡眠-觉醒周期。
✦生物钟
褪黑素的分泌与人体的生物钟密切相关。人体的生物钟是一种内在的生物节律,调节睡眠和其他生理过程。
褪黑素的分泌通常在晚上增加,帮助人们入睡。保持规律的作息时间和良好的睡眠习惯有助于维持正常的褪黑素分泌。

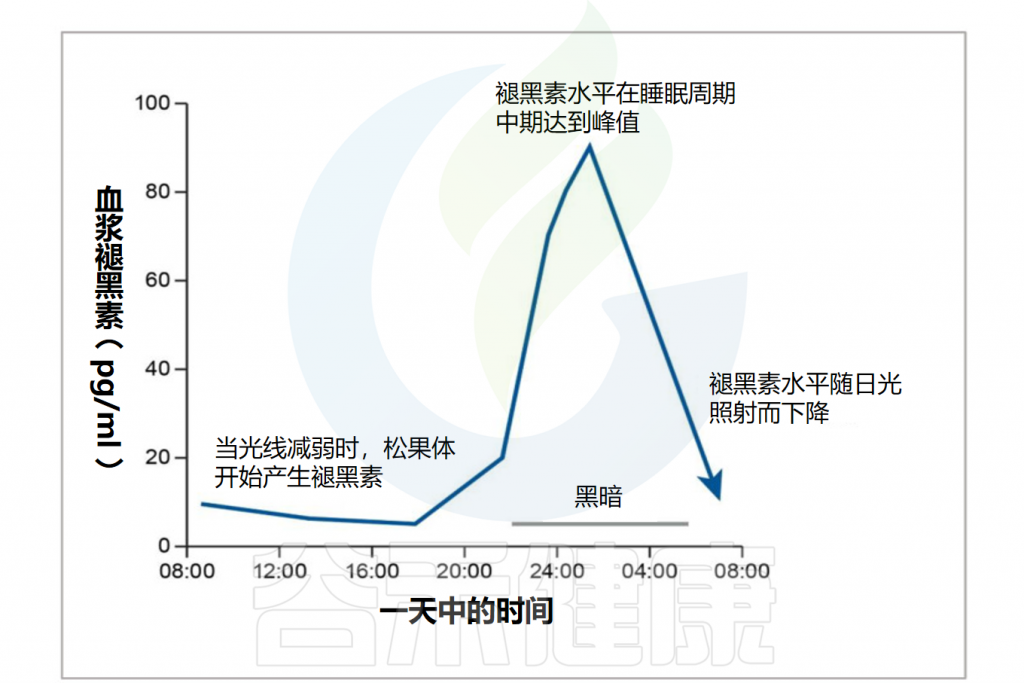
Minich DM,et al.Nutrients.2022
✦年龄
婴儿的褪黑素分泌和昼夜节律要到三个月左右才会发育。母乳喂养的婴儿可以从母乳中获得褪黑素。
从婴儿期到青春期,褪黑素的分泌水平随着年龄增长并达到稳定水平,然后从二十多岁开始随着年龄的增长而缓慢下降。儿童通常比成人产生更多的褪黑素。这也是为什么年长者常常会有睡眠质量下降的问题。

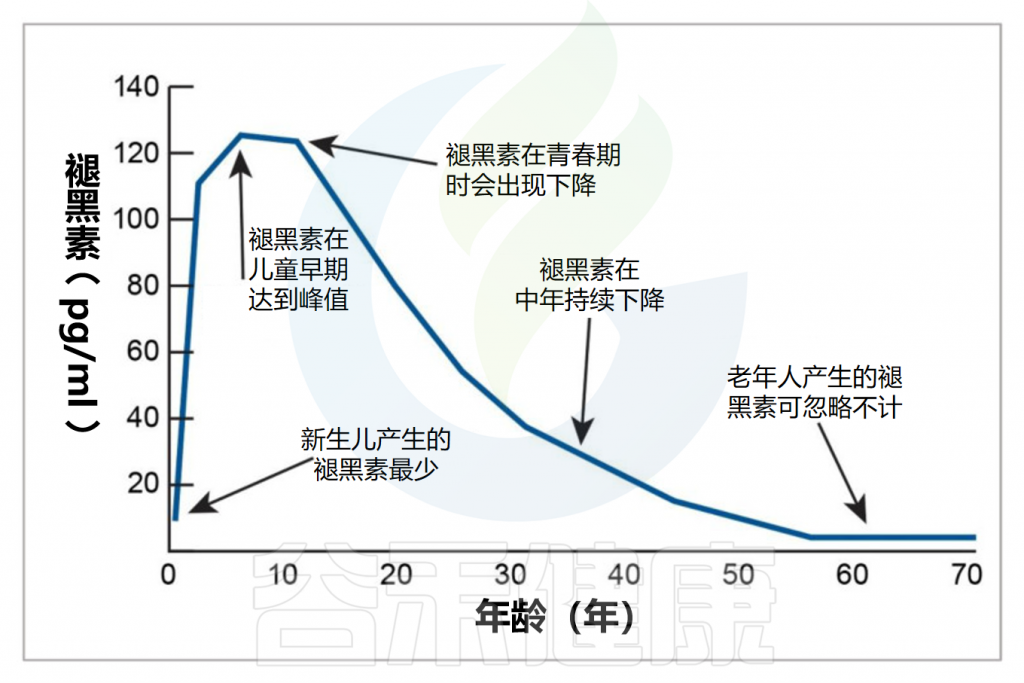
Minich DM,et al.Nutrients.2022
✦色氨酸可用性
色氨酸(褪黑素合成的前体)的可用性也会影响褪黑激素的产生。色氨酸是通过饮食来源获得的,并且可能受到饮食和新陈代谢等因素的影响。
充足的色氨酸对于合成血清素是必要的,血清素进一步转化为褪黑素。
✦药物和化学物质
某些药物和化学物质可能会影响褪黑素的分泌。例如,一些抗抑郁药物、抗高血压药物和咖啡因都可能抑制褪黑素的产生。
✦疾病和身体状况
一些疾病和身体状况也会影响褪黑素的分泌。例如,睡眠障碍、抑郁症、焦虑症和肾脏疾病等都可能干扰褪黑素的正常分泌。
值得注意的是,褪黑素产生的调节是复杂的,涉及多种因素之间的相互作用。昼夜节律紊乱,例如轮班工作、时差反应或夜间暴露在人造光下,可能会影响褪黑素的产生并扰乱睡眠模式。
总体而言,褪黑素的产生主要受到昼夜节律的调节,其中光照在抑制褪黑素合成中起着关键作用。黑暗和色氨酸的可用性促进褪黑激素的产生,有助于调节睡眠-觉醒周期并促进健康的睡眠模式。
褪黑素是一种多功能分子,在人体内具有多种生物学作用。在本节中,将介绍褪黑素对生理活动及人体健康的相关影响。

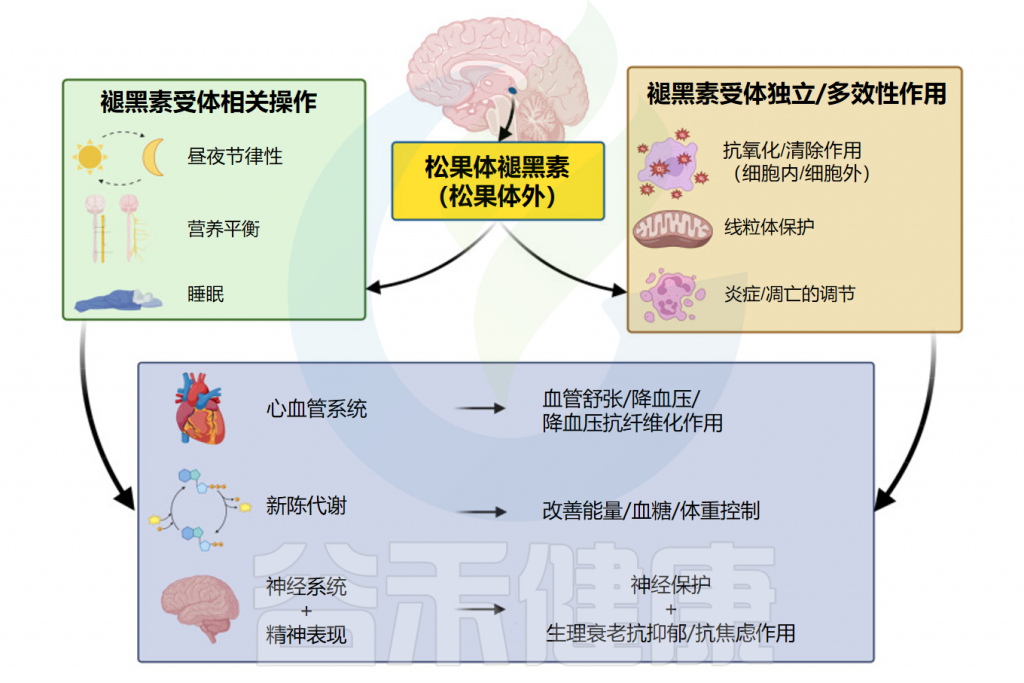
Repova K,et al.Int J Mol Sci.2022
▼
抗氧化、抗炎作用
许多研究已确定褪黑素是一种强大的自由基清除剂,甚至可能是迄今发现的最强的内源性自由基清除剂。体外和体内研究证明了褪黑素在抗氧化防御、减少氧化应激和抗炎过程中的作用。
• 褪黑素具有非常强的抗氧化作用
褪黑素是一种高效的抗氧化剂,因为一个褪黑素分子可以通过与其二级、三级甚至四级代谢物相关的级联机制清除多种活性氧和氮。
褪黑素的双重作用可以抑制促氧化酶(例如黄嘌呤氧化酶),同时还可以增强关键的抗氧化酶,例如超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶,有助于人体的第一道免疫防御和代谢解毒。
• 褪黑素可以抑制促炎性细胞因子
此外,褪黑素可以阻断作用于环加氧酶(COX-2)的促炎过程,并抑制炎症介质如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)。
褪黑素还可以增强异常细胞的程序性细胞死亡(细胞凋亡),这在理论上使其成为一种理想的疾病治疗方法。
▼
调节昼夜节律,改善睡眠质量
人类的昼夜节律主要是由光照引起的,生活方式因素可能导致外在的昼夜节律障碍,如轮班工作或时差障碍,补充褪黑素可以通过提前或延迟来调节昼夜节律。
褪黑素对具有睡眠和昼夜节律紊乱人群的影响已得到充分证实。在失眠患者中,外源性褪黑素对一些睡眠参数有显著影响,如入睡潜伏期、总睡眠时间、早晨警觉性和睡眠质量。

• 缩短了入睡潜伏期
一项针对失眠患者的荟萃分析包含5项原始研究,结果表明睡前2小时服用褪黑素2mg显著缩短入睡潜伏期。
在其他一些目标群体中,也提供了褪黑素在纠正昼夜节律方面的证据。一项针对睡眠觉醒时相延迟障碍(DSWPD)患者的荟萃分析得出的结论是,外源性褪黑激素可提前内源性褪黑激素的发作并缩短入睡潜伏期。
在有时差症状的受试者、轮班工人和非24小时睡眠-觉醒节律障碍中也观察到褪黑素对睡眠参数的改善作用。
• 减少早醒时间,增加深度睡眠时间
最近的一项随机对照试验检查了97名中年失眠患者服用较高剂量的褪黑素(3毫克)4周对睡眠障碍的影响。研究显示褪黑素对睡眠参数有积极影响,例如减少早醒时间和增加深度睡眠百分比。
注:这些是睡眠的重要阶段,对于身体和大脑的恢复和健康至关重要。
▼
缓解焦虑
褪黑素除了对肠道炎症有一定的缓解作用外,多项研究表明,服用褪黑素还能发挥抗焦虑作用。
褪黑素的抗焦虑作用机制尚不完全清楚,可能与直接或间接作用有关。直接作用与大脑中褪黑素受体有关,间接作用与褪黑素调节各种神经体液系统(包括交感神经系统、糖皮质激素和神经递质)的能力有关,从而可能干扰应激反应和昼夜节律,并改变氧化和和炎症。
• 褪黑素用于预防术前和术后焦虑
在人类中,褪黑素已被测试为预防术前和术后焦虑的药物,作为麻醉药和止痛药辅助药物,以及用于预防术后谵妄。
临床研究表明,在接受腹部子宫切除术、静脉局部麻醉期间的手部手术或其他选择性手术的患者中,作为术前用药给予褪黑素可以减少术前焦虑,并且与苯二氮卓类药物的抗焦虑治疗同样有效。
在接受小型择期手术的儿童中,褪黑素与咪达唑仑一样,可以减轻术前分离焦虑和与引入麻醉面罩相关的焦虑。
• 褪黑素可能比一些精神药物更安全
此外,一些临床研究观察到褪黑素在降低术后兴奋、苏醒性谵妄和睡眠障碍发生率方面优于咪达唑仑。褪黑素还可以减轻结直肠手术和腹部子宫切除术患者的术后疼痛,同时减少吗啡用量。
值得注意的是,褪黑素可以有效抵消精神药物引起的代谢副作用。褪黑素可降低抗精神病药物治疗引起的血压、体重增加或胆固醇水平。
褪黑素似乎是苯二氮卓类药物的一种安全替代品,可以缓解儿童和成人与外科手术相关的焦虑,同时被认为是一种安全且耐受性良好的药物。苯二氮卓类药物会损害麻醉后的精神运动和认知功能,但褪黑激素却不会。
此外,褪黑素在人体内还有一些非常重要的功能:
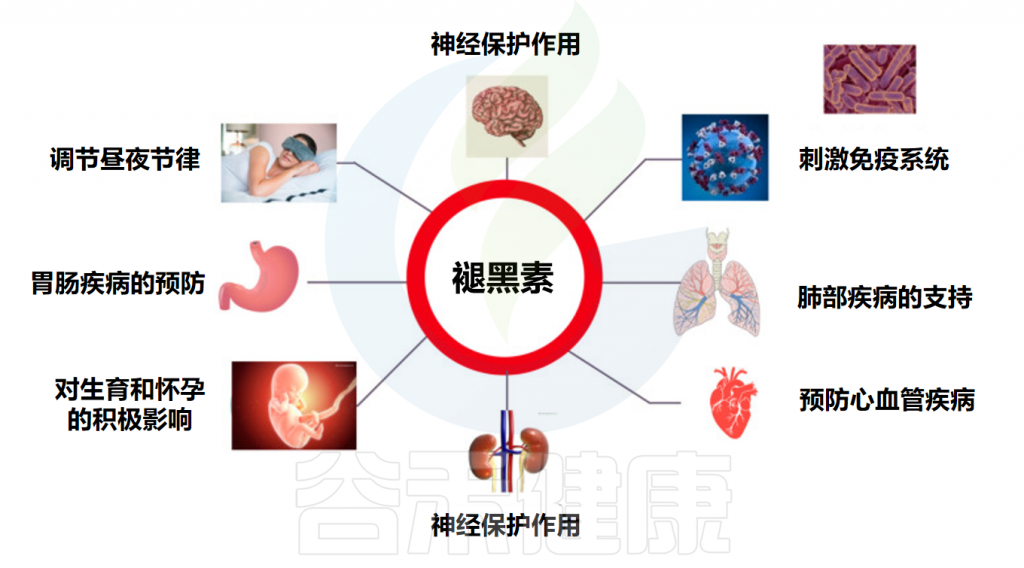

Markowska M,et al.Cells.2023
褪黑素对人体功能具有多种影响




Minich DM,et al.Nutrients.2022
▼
神经保护和神经再生作用
褪黑素的浓度变化与睡眠-觉醒周期紊乱、情绪紊乱、认知能力障碍、神经系统保护等有关。
• 对神经系统具有保护作用
由于其抗氧化特性,褪黑素可作为自由基的清除剂,在分子水平上调节多种反应,包括氧化应激、炎症和细胞凋亡。
它会影响神经营养素或神经递质的浓度。还有文献记载,褪黑素是钙蛋白酶的抑制剂,其活性在许多中枢神经系统疾病的发病机制中具有重要意义。
神经退行性疾病的发病机制与线粒体功能障碍有关。线粒体作为细胞能量来源,也是氧化损伤的目标。线粒体膜的敏感性会受到多种因素的损害,口服褪黑素可能会得到保护。线粒体膜选择性地吸收褪黑素,这是其他抗氧化剂不具备的功能。
初步研究还表明,它可能是淋巴液中的活性成分,有助于清除代谢废物,例如淀粉样蛋白的堆积。理论上,基于这一发现,从治疗角度来看,服用褪黑素可能是值得的,这样患有神经退行性疾病的老年人可以增加脑脊液和类淋巴液的水平。然而,这个概念仍处于起步阶段。
▼
免疫调节和加强监视
褪黑素另一个重要作用是其免疫调节和加强免疫监视的能力。它刺激参与体液免疫和细胞免疫的不同细胞系的产生,例如巨噬细胞、自然杀伤细胞和CD4+细胞,并影响多种细胞因子的合成。
• 褪黑素可以加强免疫调节和免疫监视
褪黑素的直接抗病毒和抗菌作用已被记录。在严重感染期间,服用褪黑激素已被发现具有免疫调节和细胞保护功能,可以降低病毒和细菌炎症的死亡率。
• 褪黑素还曾用于新冠期间的辅助治疗
考虑褪黑素在氧化应激、炎症过程以及免疫反应管理中的作用,对严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的病毒感染患者进行了检查。
研究表明,使用褪黑素作为辅助治疗可能是有益的,在2019年新冠状病毒(COVID-19)期间也使用了褪黑激素。
▼
预防胃肠道疾病
消化系统中的褪黑素除了具有抗氧化作用和刺激免疫系统的能力外,还可以减少盐酸的分泌,增强上皮的再生,并增加微循环。
• 褪黑素有助于预防胃肠道疾病
所有这些功能使褪黑素成为预防不同胃肠道疾病的治疗选择之一,例如结直肠癌、溃疡性结肠炎、胃溃疡和肠易激综合症。
据记载,补充褪黑素可以使胃食管反流病完全缓解。它对影响食道和胃的急性和慢性刺激物具有保护作用。
一些研究还证实,褪黑素在预防非酒精性脂肪性肝炎方面对肝细胞具有很强的支持作用。
▼
改善血压、血糖
• 褪黑素可以降低胆固醇和改善血压
在30名患有代谢综合征的患者中,使用褪黑素(每天5毫克,睡前两小时)短短两个月后,低密度脂蛋白胆固醇和血压就得到了改善,而这些患者三个月的生活方式没有改变。
此外,褪黑素已被证明可以降低夜间高血压,改善收缩压和舒张压,降低颈内动脉搏动指数,减少血小板聚集,并降低血清儿茶酚胺水平。
香港中文大学研究人员最近进行的一项荟萃分析和系统评价得出结论,口服褪黑素补充剂可将睡眠收缩压降低3.57毫米汞柱。
其他研究表明,褪黑素可以改善心力衰竭患者的预后,并被认为是这些患者的预防和辅助治疗措施。
• 褪黑素可能有助于血糖控制
关于褪黑素是否有助于血糖控制的疾病(例如非胰岛素依赖型2型糖尿病)存在一些讨论。最近一项针对男性糖尿病患者的相对小型安慰剂对照研究表明,服用10毫克褪黑素三个月后,胰岛素敏感性降低了12%。
褪黑素对糖尿病人群口服葡萄糖耐量的影响差异可能与褪黑素受体1B基因(MTNR1B)中2型糖尿病相关G等位基因的多态性有关。
▼
对生育的影响
• 褪黑素有助于提高生育能力
已经在动物和人类群体中进行了褪黑素给药对生育影响的研究。研究发现,褪黑素可以提高生育能力、卵母细胞质量、成熟度和胚胎数量。
此外,还提出了在怀孕期间的积极作用。神经发生的保护、对胎盘的支持性影响以及氧化应激的减少是提高生育率和改善胚胎-胎儿发育的关键。
活性氧会在怀孕期间引起干扰,它们也是围产期并发症的罪魁祸首。褪黑素是自由基的清除剂,具有抗氧化和细胞保护能力,这可能对成功怀孕至关重要。
• 褪黑素影响新生儿的健康状况
褪黑素不仅在怀孕期间发挥着重要作用,而且在新生儿病理发生时也需要其支持。褪黑素是脱氧核糖核酸(DNA)甲基化和组蛋白改变过程中的监管者。这样可以避免基因表达的根本性变化。使胎儿受到保护,免受一些疾病的影响。
怀孕期间褪黑素浓度不足可能会在个体发育早期的遗传密码中留下内分泌紊乱,随后在儿童期发生。
▼
对骨骼健康的影响
根据细胞和临床前数据,有人认为褪黑素作用于骨代谢的合成代谢和分解代谢方面。
• 褪黑素增加了绝经后妇女的骨密度
一些临床试验证明了褪黑素在重新平衡围绝经期妇女骨重塑中的作用和增加绝经后骨质减少妇女的骨密度。
具体研究
在这些研究中,使用了多达3毫克的补充褪黑素。根据名为褪黑素微量营养素骨质减少治疗研究的为期一年的临床试验的结果,褪黑素(5毫克)、柠檬酸盐(450毫克)、维生素D3(2000IU/50微克) 的组合与安慰剂相比,能够对绝经后骨质疏松女性的骨标志物(例如骨矿物质密度)产生有利影响。
除了有益地改变骨标志物之外,干预措施还改善了情绪和睡眠质量等生活质量指标。当然,不能因此推断褪黑素是造成这些影响。
研究人员认为褪黑素是与年龄相关的骨骼肌疾病的关键化合物,因为它通过其抗氧化潜力参与线粒体功能。这方面的研究结果可能对恶病质或肌肉减少症患者有帮助。
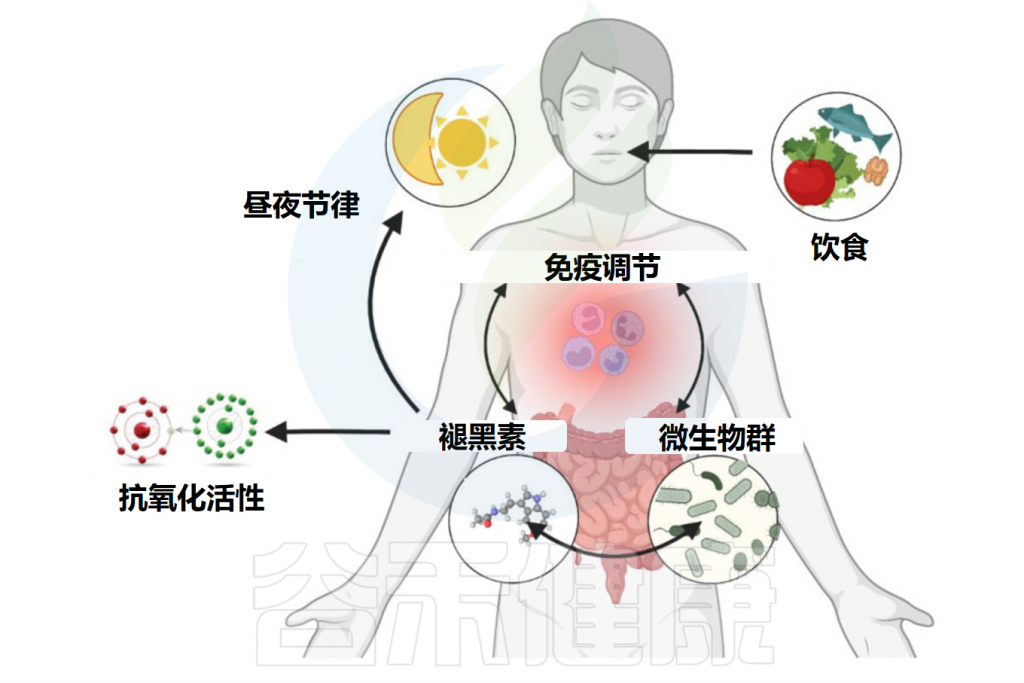
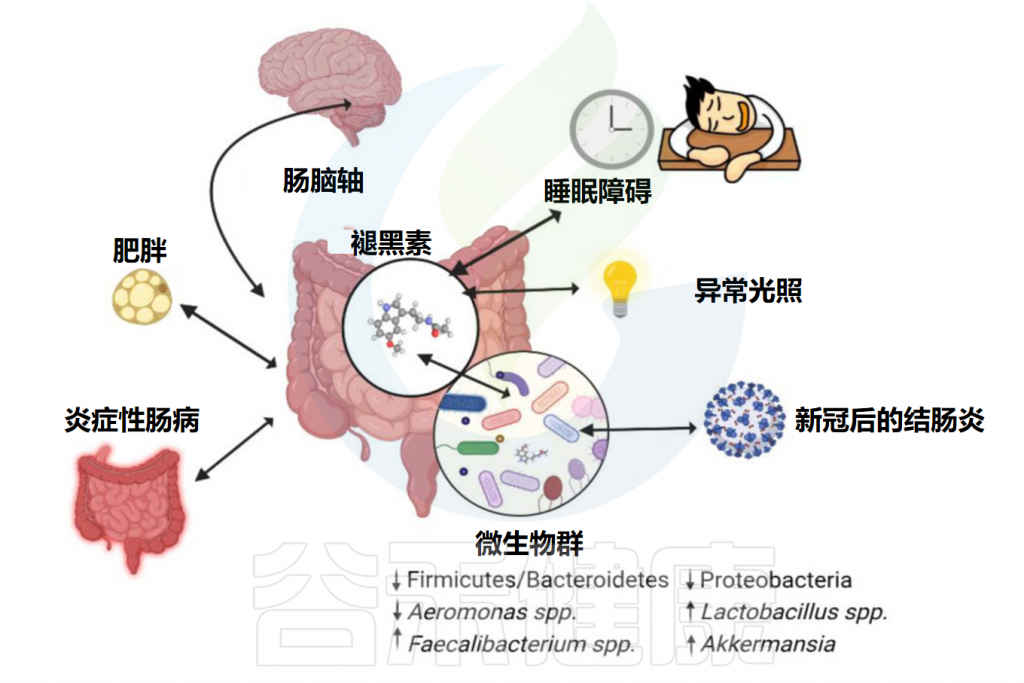
除了上述的影响外,褪黑素与肠道微生物组之间的相互作用也很有趣。肠道中包含着大量的微生物,其与人体健康密切相关,褪黑素已被发现与肠道微生物存在复杂且多样的联系,并可能因此影响人体健康。让我们一起来了解下。
褪黑素主要由两种细胞产生:松果体细胞和肠嗜铬细胞。松果体细胞位于大脑内的松果体中。肠嗜铬细胞位于整个胃肠道的表面,在胃肠道的粘膜内层浓度很高。
与松果体细胞不同,肠嗜铬细胞不受光和暗的调节,但似乎受到食物摄入和消化的影响。
注:肠嗜铬细胞是神经内分泌免疫细胞,对肠道稳态至关重要。
★ 肠道中的褪黑素浓度比血清中高很多
据估计,肠道内的肠嗜铬细胞所含的褪黑素含量是松果体细胞产生的褪黑激素的400倍。肠道褪黑素水平可能比血清中褪黑激素水平高10至100倍。
肠嗜铬细胞中褪黑素的生物合成
Iesanu MI,et al.Antioxidants (Basel).2022
肠道中褪黑素的释放以旁分泌方式发挥作用,增加胃粘膜的活动和循环,并增强胃肠道运动。此外,褪黑素在肠道中具有抗兴奋特性。它可以刺激上皮细胞的再生,并且还被证明对胃肠道内壁具有保护性抗氧化作用。
旁分泌——通过扩散而作用于邻近细胞的激素传递方式。

Iesanu MI,et al.Antioxidants (Basel).2022
值得注意的是,关于松果体产生的褪黑素和肠道来源的褪黑素如何相互关联,是否存在肠道-松果体轴串扰,以及不同的饮食模式甚至特定食物、禁食方案或进餐时间可能相互影响,仍然是推测性的。改变全身褪黑素水平与饮食和肠道产生的褪黑素这一领域还需要通过更多的研究来回答。
褪黑素和肠道细菌之间似乎具有复杂的相互关系。如下所述,微生物可以调节胃肠道中褪黑素的合成;相反,褪黑素与肠道微生物群的组成和动态有关。它们共同形成一个复杂的系统,在多个层面上发挥作用,以维持宿主的体内平衡。
• 肠道菌群影响褪黑素的前体进而影响其水平
肠道菌群可以通过调节其必需的前体色氨酸和5-羟色胺来影响褪黑素水平。色氨酸的可用性可以通过饮食改变或通过改变肠道微生物群组成来改变。
肠道中色氨酸代谢的三种途径都可以受到肠道细菌的调节。关于吲哚途径,微生物组特征决定了吲哚衍生物的类型。这些吲哚衍生物具有广泛的作用,从对肠粘膜和免疫系统的有益结果到肾毒性。
此外,炎症刺激激活的Toll样受体和肠道细菌释放的病原体相关分子模式分子会刺激犬尿氨酸途径。
肠腔中产生的短链脂肪酸刺激肠嗜铬细胞释放血清素并增强褪黑素的产生。内源性孢子形成细菌产生的其他代谢物可以激活肠嗜铬细胞并促进结肠中5-羟色胺的生物合成。
此外,抗生素引起的生态失调会增强吲哚途径,抑制犬尿氨酸途径,并降低动物模型中的结肠5-羟色胺。
• 病原菌感染后褪黑素的分泌减少
多种细菌对肠道合成褪黑素有影响。例如,胃粘膜幽门螺杆菌感染会下调褪黑激素生成酶的表达,并减少胃肠道中褪黑素的产生。感染清除后,褪黑素产量恢复到正常水平。
• 益生菌可能刺激褪黑素的产生
益生菌,对各种与菌群失调相关的疾病有效。研究还表明益生菌在刺激褪黑素产生方面发挥有益作用。
短期施用益生菌鼠李糖乳杆菌可以增加斑马鱼中褪黑素受体基因的丰度,与光周期转变为持续黑暗的结果相似。因此,益生菌似乎有可能影响褪黑素的产生,从而缓解各种疾病状态。
相反,生态失调和随后的肠道损伤可能会降低局部肠道和全身褪黑素水平。
越来越多的证据表明,褪黑素可以调节肠道微生物的组成和丰度,尤其是在各种病理状态下。
如下所述,褪黑素通过其作为抗氧化剂、免疫调节剂和昼夜节律调节剂的特性间接影响肠道微生物群,研究发现其还可能直接影响肠道微生物群。
• 褪黑素影响肠道微生物的昼夜节律
在人类中,褪黑素分泌主要以昼夜节律方式在夜间发生,血浆中最高水平出现在凌晨2至4点左右。
褪黑素的节律性释放由下丘脑前部的视交叉上核调节,代表中枢昼夜节律发生器。视交叉上核神经元的轴突投射到邻近的下丘脑核、丘脑和脑干,并使昼夜节律的一些组成部分同步,例如睡眠/觉醒节律、进食时间表和垂体/肾上腺轴的活动。
胃肠道和微生物群表现出与昼夜节律相关的变化,体外研究表明,多种肠道细菌受光暗循环影响,并与参与生物节律的分子密切相关。昼夜节律失调会引起并加剧炎症性肠病的炎症。
褪黑素含量高时,产气肠杆菌增殖的更快
产气肠杆菌(Enterobacter aerogenes)是人类肠道中普遍存在的细菌,具有昼夜节律,并对白天的褪黑素波动做出反应。
当褪黑素存在时,产气肠杆菌以剂量依赖性方式增殖得更快。此外,当暴露于色氨酸、5-羟色胺或N-乙酰血清素时,没有观察到相同的效果,这突显了褪黑素的重要性和敏感性。
产气肠杆菌主要生存于人类和动物的肠道,为人体内的正常菌群,在人体虚弱的特殊情况下才偶尔引起疾病。
此外,大肠杆菌和肺炎克雷伯菌对褪黑素的敏感性不同。另一项研究表明,高脂肪饮食会损害肠道细菌的日常波动,而褪黑素可以使这些波动正常化,这表明这种重新同步可能具有治疗意义 。
微生物代谢物(例如丁酸盐)的昼夜变化会影响宿主的生物钟。鉴于细菌代谢物的产生是周期性的,微生物功能与宿主的昼夜节律和代谢之间存在隐含的联系。
• 通过氧化还原平衡影响肠道微生物组成
褪黑素的抗氧化活性存在于多种功能中,直接作用是中和自由基,间接作用是通过增加抗氧化酶的水平来发挥作用。
健康的肠道微生物群也具有相当大的抗氧化作用。共生细菌直接参与活性氧的代谢,因为产生乳酸的细菌(例如乳杆菌属)具有乳酸氧化酶、超氧化物歧化酶和丙酮酸氧化酶,这些酶可以去除活性氧,减少氧化应激。
在较高浓度下,活性氧具有潜在毒性并导致生物分子损伤,例如蛋白质、脂质和DNA的氧化,这可能导致多种细胞功能障碍,包括细胞死亡。
结肠健康很大程度上受到肠道抑制过量活性氧产生的能力的影响。值得注意的是,肠道微生物群的组成根据氧化还原平衡而变化。在暴露于氧化应激的小鼠中,肠道微生物群经历了拟杆菌门的增加和厚壁菌门、梭菌目、瘤胃球菌属(Ruminococcus)和颤螺菌属(Oscillospira)的减少。
在衰老模型中,小鼠年龄越大,活性氧产生量越高,梭菌目数量减少,拟杆菌门丰度增加。当肠道损伤和生态失调时,胃肠道的抗氧化活性会受到抑制。例如,在炎症性肠病患者中,共生细菌多样性的减少和微生物群组成的变化与活性氧产生增加和肠粘膜防御系统受损有关。在这些情况下,褪黑素可以发挥其抗氧化活性并重建氧化还原平衡,从而改善肠道微生物群组成。
与其他器官类似,在肠道中,褪黑素不仅清除活性氧,还上调不同的抗氧化酶(GSH-Px、CAT、SOD)并下调促氧化酶。褪黑素可以通过与活性氧相互作用直接发挥其活性,或通过膜和核受体发挥其活性,膜和核受体作为其间接抗氧化作用的介质。
褪黑素激活该通路中的多个应激反应基因(例如AMPK、HIFa、Sirt),进而导致多种抗氧化酶的增加。
因此,通过所有这些褪黑素介导的途径减少肠道微生物群的氧化应激对肠道微环境具有显著影响。
越来越多的证据表明,褪黑素可以调节肠道特性和常驻微生物,以应对压力(例如睡眠障碍)。
当评估褪黑素、睡眠障碍和肠道微生物组之间的相互作用时,在有明显肠道损伤的临床前研究中,血浆和肠道褪黑素水平会降低。
总体而言,在睡眠障碍患者中补充褪黑素可以重建肠道微生物群平衡和肠道屏障的完整性,恢复了肠道微生物群的丰富性和多样性。

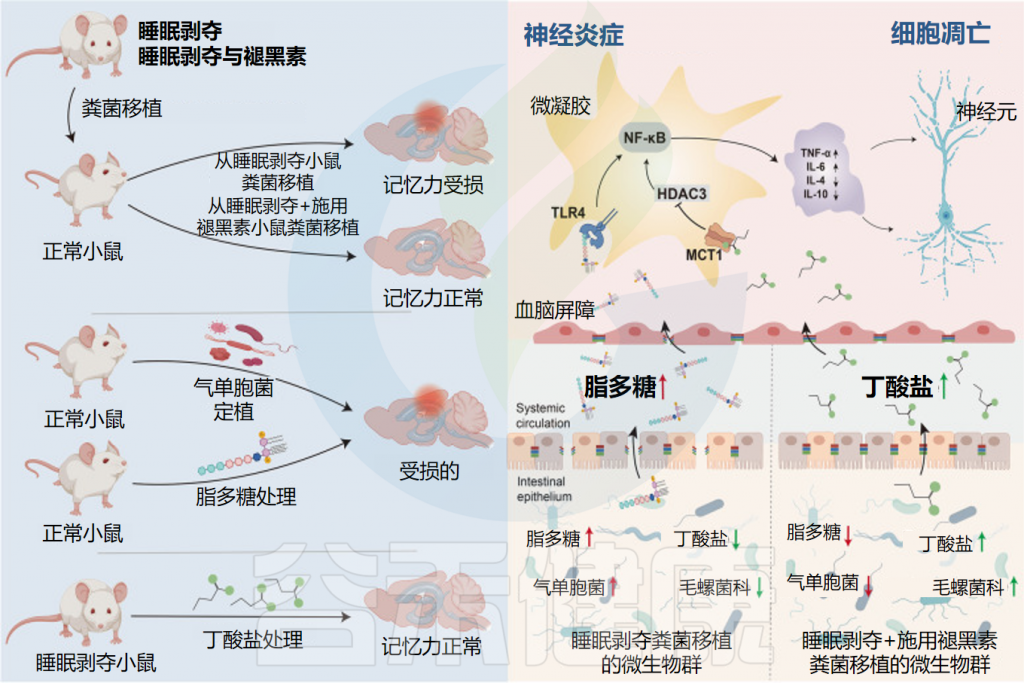
Wang X,et al.Microbiome.2023
• 增加了有益菌的丰度
在属水平上,补充褪黑素增加了阿克曼氏菌、乳杆菌、拟杆菌和粪杆菌(这些已知的有益细菌可以降低炎症),并减少了影响结肠炎的气单胞菌。
显著增加了阿克曼氏菌的丰度
褪黑素显著增加了阿克曼氏菌(Akkermansia muciniphila)的丰度,这种细菌以其在肠道中的有益作用而闻名(例如,增加粘蛋白产生,保持屏障完整性)。
提高了产丁酸盐细菌的丰度
此外,褪黑素通过增加拟杆菌属、乳杆菌属、阿克曼氏菌属和粪杆菌属的丰度,提高了丁酸盐的水平,丁酸盐是肠道微生物群的重要有益代谢物之一。
• 重建肠道屏障完整性
褪黑素还通过恢复因睡眠障碍受损的杯状细胞数量、粘液产生和肠上皮细胞增殖,增加紧密连接蛋白(claudin-1、occludin、ZO-1)和含有半胱天冬酶募集结构域的蛋白9(CARD9)的表达来重建肠道屏障的完整性。
• 降低促炎细胞因子,增加抗炎物质
睡眠障碍也会导致全身产生促炎症状态。褪黑素通过降低促炎细胞因子水平(IL-1β、IL-6、IL-17、TNF-α)同时增加抗炎标志物(IL-5、IL-10、IFN-α、IL-22)来抵消这种影响。
作为一种假定的机制,褪黑素还会下调睡眠剥夺小鼠的TLR4,从而降低长期炎症反应的可能性。
褪黑素在减轻粘膜损伤和生态失调方面发挥着至关重要的作用。这些发现表明,褪黑素可以作为益生元来治疗睡眠障碍相关的肠道损伤,并帮助保持肠道微生物群的平衡。
需要注意的是,褪黑素抑制可能是导致肠道损伤和生态失调的罪魁祸首,而不是睡眠障碍本身造成的应激。
总之,外源性给予褪黑素可恢复由睡眠障碍引起的全身和肠道微生物群改变,这意味着褪黑素在根据健康状况调节微生物群落方面发挥着作用。

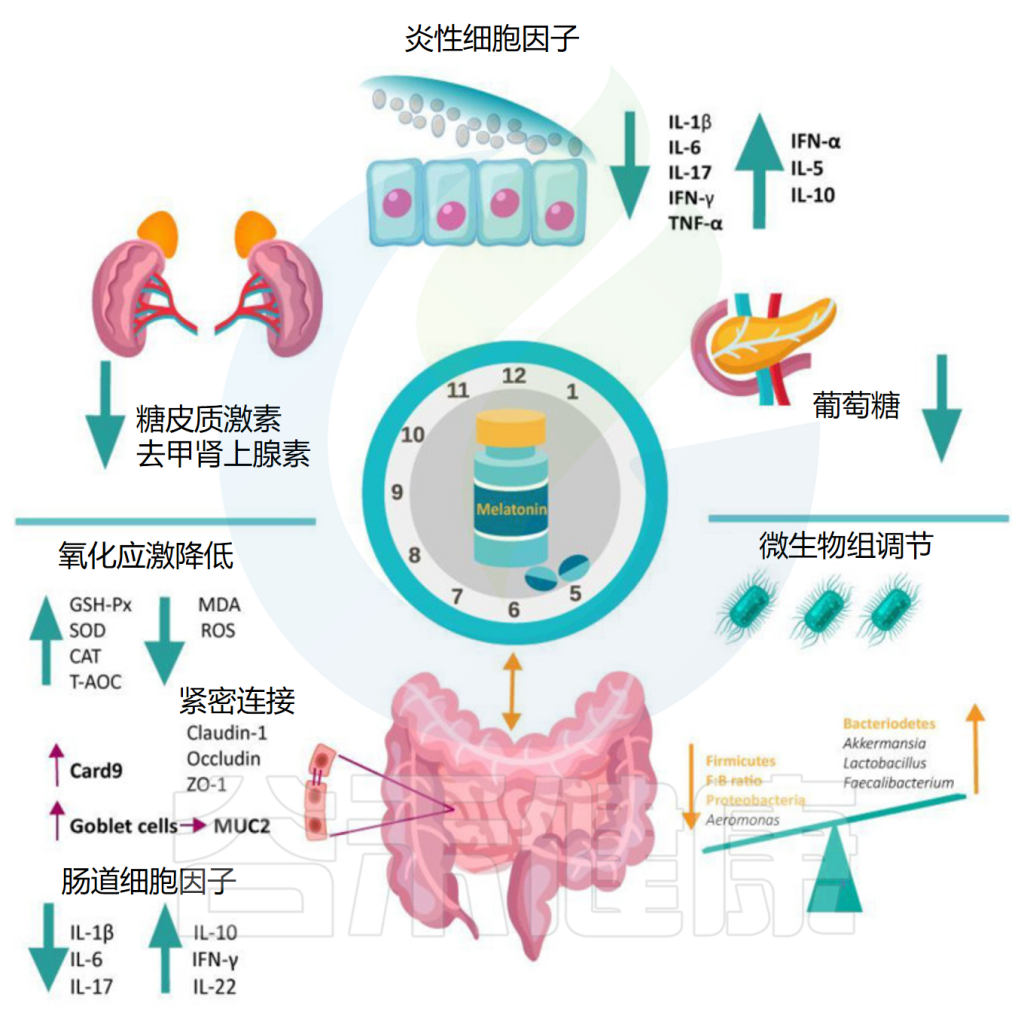
Iesanu MI,et al.Antioxidants (Basel).2022
褪黑素和肠道微生物群之间的相互作用对健康和疾病的各个方面都有潜在影响。大量临床和临床前研究证明了褪黑素对结肠炎的保护作用。
• 结肠炎患者体内褪黑素水平下降
测量了溃疡性结肠炎患者和健康对照的降结肠和乙状结肠中褪黑素的浓度。
与健康对照相比,溃疡性结肠炎患者的褪黑素水平急剧下降。值得注意的是,褪黑素浓度与组织学严重程度之间出现负相关。此外,溃疡性结肠炎患者中褪黑素生物合成途径中的关键酶AANAT和HIOMT的mRNA 水平显著低于健康对照。
这些数据表明溃疡性结肠炎患者的褪黑素水平下降,并且与疾病严重程度呈负相关,表明褪黑素可能参与溃疡性结肠炎的进展。
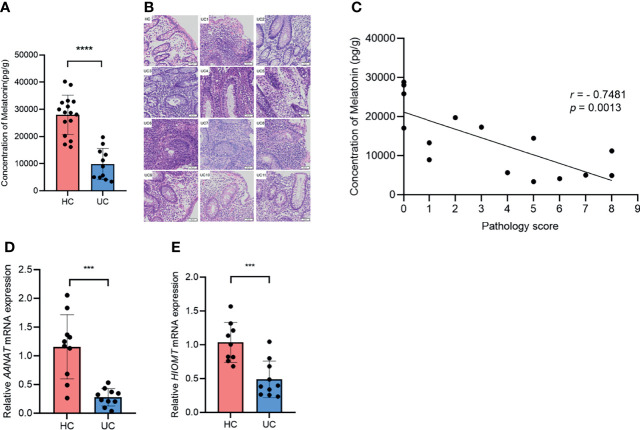
Zhao ZX,et al.Front Immunol.2022
(A)通过ELISA检测健康对照和溃疡性结肠炎患者中的褪黑素浓度;(B)结肠切片的代表性H&E染色(×20);(C)所有溃疡性结肠炎患者和健康对照的褪黑素浓度与组织学严重程度评分的相关性。
• 服用褪黑素可以减轻结肠炎
发现每日服用50毫克/公斤剂量的褪黑素治疗7天可显著改善恶唑酮诱发的小鼠结肠炎,体重减轻较少,结肠长度较长。
H&E染色显示,褪黑素治疗可预防肠道炎症,与对照组相比,褪黑素治疗导致CD11b+ Ly6G +中性粒细胞显著减少,并且炎症细胞因子的产生减少,例如TNF-α和Il-1β。
这些结果表明,褪黑素可以减轻恶唑酮诱发的结肠炎,炎症反应减少,肠道完整性提高。
• 服用褪黑素调节炎症性肠病的微生物组成
褪黑素改变微生物群组成的α和β多样性
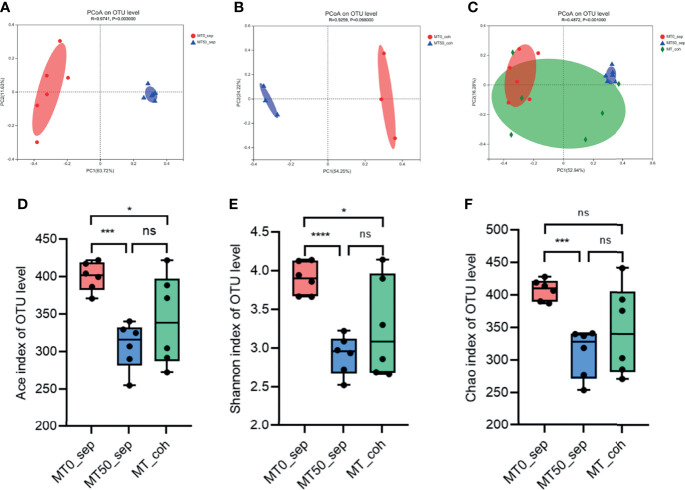
Zhao ZX,et al.Front Immunol.2022
特定的变化与有益菌株的增加和有害菌株的减少有关。例如,褪黑素增加了瘤胃球菌科(Ruminococcaceae)和粪球菌属(Coprococcus)的水平,这两种细菌都是短链脂肪酸产生菌。
它还增加了双歧杆菌的含量,双歧杆菌作为益生菌在炎症性肠病中产生了积极的结果,以及乳杆菌的含量,乳杆菌是该疾病的另一种有前途的辅助疗法。
减少了条件性致病菌
相反,褪黑素给药后,肠道菌群显示出变形菌门显着减少,该门在炎症性肠病发病机制中发挥着重要作用。
链球菌属(Streptococcus)可能代表另一种被褪黑素下调的微生物并与疾病活动相关。另一项研究报告了脱硫弧菌、消化球菌科和毛螺菌科的减少。发现脱硫弧菌和溃疡性结肠炎之间存在明显关联。尽管消化球菌科在炎症性肠病中的研究较少,但在一些研究中与肠道炎症相关。
重要的是,所有这些细菌组成的变化都伴随着明显的临床症状增强——通过多种组织学方法和症状学评估进行量化。这可能表明至少在一定程度上通过微生物群调节来影响褪黑素的效果。
褪黑素在属水平上调节一些微生物群
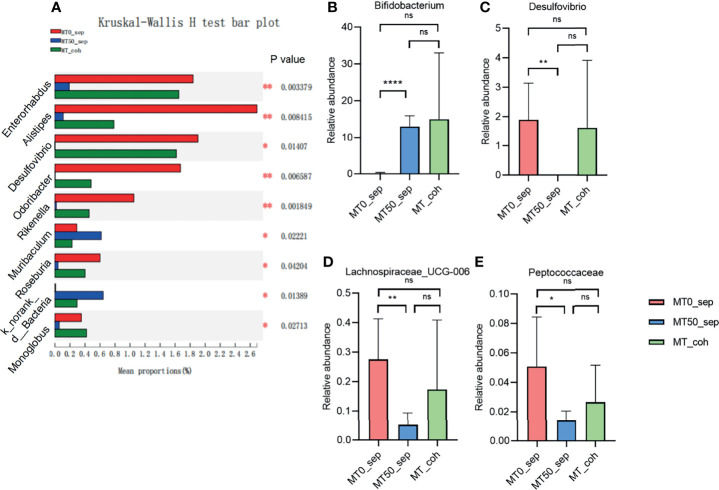
Zhao ZX,et al.Front Immunol.2022
• 褪黑素有利于肠道屏障完整性
总的来说,就肠道微生物群而言,褪黑素不仅具有改变细菌种类组成的能力,而且还能够减少肠道细菌移位。事实上,在结肠炎模型中,褪黑素诱导紧密连接蛋白和闭合蛋白的上调,这些蛋白是肠道屏障的关键组成部分。
细菌易位是一种有害过程,可导致内毒素血症,与炎症性肠病活动呈正相关。
褪黑素对肠道微生物群的调节可能对于缓解结肠炎至关重要。
除此之外,褪黑素还可以逆转高脂肪饮食产生的大多数代谢、形态和肠道微生物组成变化。
• 褪黑素恢复高脂饮食导致的微生物变化
首先,褪黑素成功恢复了因高脂饮食而减少的微生物群多样性,改变了肠道微生物结构,使其类似于正常饮食的小鼠。与对照组相比,褪黑素增加了细菌数量,但它阻止了高脂饮食引起的细菌突然过度生长。
有趣的是,与仅接受高脂饮食的小鼠相比,接受褪黑素的高脂饮食小鼠和对照组的不同类群每日振荡之间存在相似性,证明褪黑素也可以恢复细菌节律性。
它还刺激疣微菌门,包括阿克曼氏菌——一种治疗代谢紊乱的有效益生菌。脱硫弧菌科(产生内毒素的细菌)、Alistipes和Anaerotruncus中的表达下调,这些细菌与肥胖相关。
• 褪黑素改善代谢紊乱,降低脂肪比例
在影响这些微生物组相关的同时,褪黑素显著改善了高脂饮食啮齿动物的代谢紊乱。褪黑素还降低总体重和内脏脂肪比例,促进棕色脂肪组织的产生和产热作用。它还降低炎症、脂肪生成基因表达以及胆固醇和甘油三酯水平。
此外,它重建了时钟基因表达和血清甘油三酯的正常昼夜节律变化,而这些变化被高脂饮食破坏了。它还通过降低血糖和增强胰岛素敏感性来增强葡萄糖代谢。对于肝脏,它可以对抗脂肪变性并抑制 NF-κB信号,该通路与非酒精性脂肪肝病有关。
褪黑素缓解脂质代谢异常的一个特殊机制与抑制大肠杆菌有关。研究人员在时差小鼠模型中研究了与代谢综合征相关的变化,这些小鼠表现出体重增加、回肠脂质摄取增加以及血管生成素样4(脂质代谢调节剂)的减少。同时,观察到大肠杆菌和脂多糖产量增加。褪黑素逆转了所有这些修饰,并且通过下调大肠杆菌和脂多糖的合成,抑制了LPS/TLR4/STAT3等通路,使脂质摄取减少。
肠道微生物群在肥胖和代谢综合征的发展中起着关键作用。褪黑素恢复这种复杂结构正常组成和功能的能力证明了其作为药物治疗这些病症的合理性。
!
注意
需要进一步的研究来充分了解褪黑素–肠道微生物轴对健康和疾病的机制和影响。
然而,它强调了考虑肠道微生物群和褪黑素相互作用在维持肠道健康和整体健康方面的重要性。
褪黑素作为体内最重要的激素之一,过低或过高的含量都会对人体产生一些不利影响。
▸ 褪黑素过低
失眠:褪黑素是调节睡眠的重要激素,过低的褪黑素水平会导致失眠和睡眠质量下降。
生物钟紊乱:褪黑素水平过低可能导致生物钟紊乱,影响日常作息和生理节律。
免疫功能下降:褪黑素具有免疫调节作用,过低的褪黑素水平会导致免疫功能下降,增加感染和疾病的风险。
心理健康问题:褪黑素与神经系统密切相关,低褪黑素含量可能与焦虑、抑郁等心理健康问题有关。
其他健康问题:一些研究表明,褪黑素含量过低可能与肥胖、糖尿病、心血管疾病相关。
▸ 褪黑素过高
通常情况下,人体不会出现褪黑素过高。一般都是在补充了外源性褪黑素的情况下导致体内褪黑素水平过高。

一项研究对2130名患者进行了随机对照试验,发现过量服用褪黑素导致褪黑素水平过高引起的不良事件很少。其中最常报告的不良事件是日间嗜睡、头痛、头晕和体温过低。
除此之外,有一小部分研究发现过高的褪黑素水平可能对性欲和性功能产生负面影响。
由于褪黑素的代谢率较高,补充外源性褪黑素通常被认为是安全且耐受性良好的,大多数负面影响要么在几天内自然消退,要么在停药后立即消退。
褪黑素的分解代谢很快
循环中的褪黑素主要在肝脏和大脑中分解代谢。一般来说,褪黑素的半衰期(即分解一半所需的时间)约为30-50分钟。这意味着褪黑素在体内的浓度会在数小时内迅速降低。
在肝细胞中,褪黑素通过细胞色素P4501A2 (CYP1A2) 进行80%的羟基化;然后,在肾脏中,它被磺基结合(占总分解代谢的70%至80%)或与葡萄糖醛酸结合(占总分解代谢的5%)。
CYP1A2确保肝脏分解代谢。即使在肝脏水平,也存在脱乙酰化和脱甲基化途径。脱乙酰后,褪黑素转化为5-甲氧基色胺,氧化后转化为5-甲氧基吲哚乙酸。
褪黑素对人体如此重要,但经常会因一些外部环境、生活作息或疾病状态导致内源性褪黑素分泌不足,这个时候就需要一些外源性褪黑素来补充。
补充外源性褪黑素也有一些注意事项,包括可用的剂量、最佳服用时间、禁忌症。
除了人体自身会分泌褪黑素外,许多食物中也存在一些天然褪黑素,尤其是植物性食品。
✦ 许多植物性食品中含有褪黑素
自从20世纪90年代中期在植物中首次发现褪黑素(“植物褪黑素”)以来,各种食用植物和草药中的褪黑含量不断被提及。
然而,其浓度范围广泛且不一致,取决于许多因素,例如品种、生长条件、发芽、收获和加工(例如烘烤、干燥)等。
尽管褪黑素存在于大多数植物部位,但植物的生殖器官中的含量通常较高,尤其是种子,可能有助于确保植物的生存并抵御环境压力。
值得注意的是,褪黑素在植物中的众多作用之一是刺激促进健康的植物营养素(如芥子油苷和多酚)产生。
褪黑素已被记录在下列植物性食品和饮料中:


Minich DM,et al.Nutrients.2022
✦ 动物食品中的色氨酸有助于转化成褪黑素
虽然有几个变量需要考虑,但一般来说,动物性食品中的褪黑激素含量相对植物性食品中较少。根据已发表的文献,牛奶和乳制品、鸡蛋、鱼和肉类(牛肉、羊肉、猪肉)含有一定水平的褪黑素。
相反,动物食品往往是比植物食品更好的膳食色氨酸来源,因此可能需要考虑将这些食物最终转化为大量的褪黑素。
如前所述,虽然一些天然食物含有褪黑素,但其含量较低,因此很难获得足够的治疗剂量褪黑素。必须强调的是,几乎所有褪黑素产品都涉及工业加工,因此可能导致一些潜在毒性。
褪黑激素补充剂有多种形式,包括片剂、胶囊、舌下片和液体制剂。
• 褪黑素可能产生副作用和依赖性
在临床应用中,据记录,过多的褪黑素或各种缓释剂型会产生副作用,例如第二天健忘症或“褪黑素宿醉”,发现睡了三到四个小时就睡不好,醒来后无法再入睡。长期高剂量服用褪黑素随着时间的推移,个人可能会产生依赖性。
注:具有某些基因型的人,例如褪黑激素受体1B(MTNR1B)基因多态性,如果补充褪黑素,可能需要监测糖化血红蛋白。
• 补充高剂量的褪黑素会导致体温过低
一项关键研究中,比较了多个剂量:生理剂量(0.3mg)、药理剂量(3mg)和0.1mg的低生理剂量。
研究发现补充0.3毫克/天褪黑素的数据最佳客观。生理剂量(0.3 毫克)可恢复睡眠效率,并将血浆褪黑素水平提高至成年早期的正常水平。药理剂量(3毫克)也能改善睡眠;然而,它会导致体温过低,并导致血浆褪黑素在白天一直保持升高状态。
• 一般补充0.5-3毫克/天为宜
临床上补充褪黑素的剂量通常为每日0.5-3毫克;然而,发现剂量取决于产品类型,在某些情况下较低剂量也同样有效。
剂量参数可能会根据健康状况、睡眠问题类型或相关神经病理学等因素而有所不同,因此还需要根据每位患者提供适当的、个性化的剂量。
• 睡前一小时服用效果较好
从时间角度来看,许多与睡眠相关的研究都表明在睡前三十到六十分钟补充褪黑素效果较好;然而,一些研究表明,提前四个小时服用即可有效。
建议在黑暗环境或较弱光刺激下服用褪黑激素,从而模拟基于明暗模式的生理动力学和昼夜节律。
根据已发表的报告,口服褪黑素大多被认为是安全的,然而,在某些特定情况下可能需要进一步的临床监督。
• 一些药物会影响褪黑素的代谢
早期研究已发现,大部分褪黑素通过细胞色素CYP1A2代谢,小部分通过CYP1A1、CYP1B1和CYP2C19进行较少的代谢活动。
因此,影响这些酶途径的药物将影响褪黑素的代谢。褪黑素与一种或多种药物同时服用时应谨慎;否则,可能会导致不良副作用(如极度镇静)。
例如,最著名的相互作用之一是褪黑素与抗抑郁药物氟伏沙明的相互作用。该药物是一种已知的CYP1A2抑制剂,可通过减少褪黑素的降解来增强褪黑激素水平。同样,咖啡因也通过CYP1A2代谢,并可增加褪黑素水平。
总之,虽然还不全面,但褪黑素可以与具有血液稀释、降血糖、降血压、抗惊厥、镇静、抗抑郁或免疫抑制活性的药物、营养素或草药相互作用或受到影响。
褪黑素的代谢和活性可能会受到许多饮食、补充剂和药物的潜在影响,所有这些都说明了这样一个事实:每个人对褪黑素的个性化反应存在差异,具体取决于他们的饮食和医疗背景。
由于缺乏安全性数据,不建议怀孕或哺乳期的女性补充褪黑素。然而,有一些迹象表明褪黑素在这两个阶段可能都有好处。因此,让这些女性咨询了解患者个性化需求的健康专业人士是关键。同样,被诊断患有任何疾病的人应咨询其健康专业人员并接受医疗监督。
温馨提醒
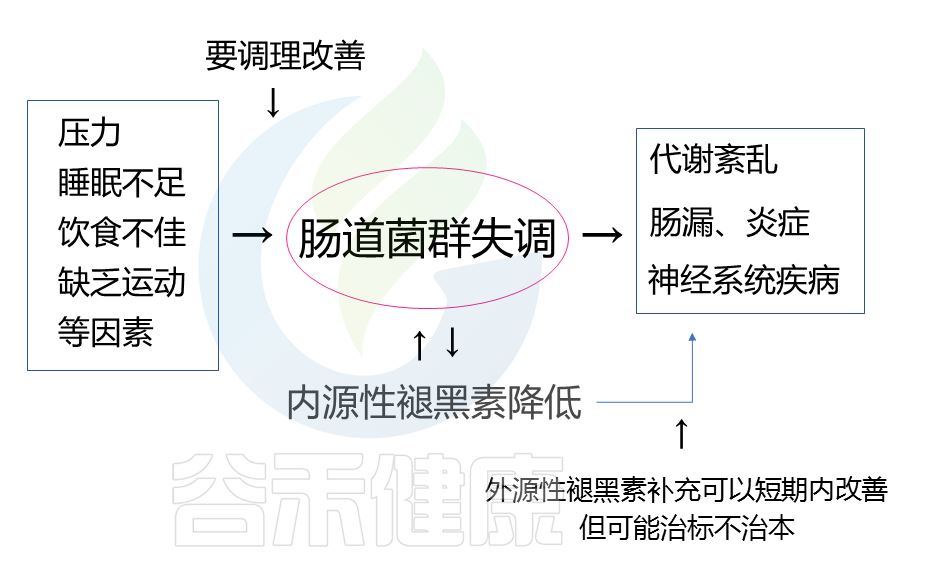
调查发现,有的褪黑素产品月销已超过3万件,说明需要使用褪黑素来帮助改善睡眠的人已不在少数。需要注意的是,虽然补充外源性褪黑素可以在一定程度上改善睡眠质量、代谢健康或降低焦虑,但服用褪黑素存在的副作用使其不能成为长久的选择。
而且补充褪黑素主要是针对一些因工作昼夜颠倒导致的内源性褪黑素分泌不足造成的睡眠障碍,对于其他原因造成的失眠可能效果一般。我们额外补充的这些褪黑素,并不能促进身体去分泌更多的褪黑素。如果停用褪黑素,可能睡眠情况还会回到原样,并不会解决本质问题。
重点还是要从自身生活习惯出发,改善饮食,调节作息规律,增加体育锻炼并定期体检,及时了解自身健康状况。肠道菌群与很多影响睡眠的因素相关,例如压力、消化等,调节肠道菌群可以更全面地从根本上改善睡眠障碍。
改善内源性褪黑素的措施
除此之外,调节内源褪黑素的措施有以下几种:
•控制光照暴露,睡前半小时不玩手机
光线会影响褪黑素的分泌,晚上避免暴露于强烈的蓝光,尤其是来自电子设备的蓝光。蓝光会抑制褪黑素的分泌,影响睡眠质量。
•维持规律的睡眠时间
建立健康的睡眠习惯,如果不是因为工作导致的昼夜颠倒,尽量每天保持规律的睡眠时间,避免熬夜或睡眠不足。
•营造舒适的睡眠环境
保持安静、黑暗和凉爽的睡眠环境,可以使用遮光窗帘、耳塞或眼罩等辅助工具,有助于提高睡眠质量。
•避免过度应激
减少压力和焦虑,通过放松技巧如深呼吸、冥想和瑜伽等来缓解压力,有助于促进褪黑素的分泌。
•适度运动
进行适度的有氧运动,如散步、跑步或游泳等,可以提高睡眠质量和褪黑素的分泌。
•饮食调整
摄入富含色氨酸的食物,如禽肉、鱼类、坚果和豆类,色氨酸是合成褪黑素的必需物质。此外,可以适量摄入富含维生素B6、钙和镁的食物,这些营养素有助于褪黑素的合成和释放。
褪黑素在临床上有多种应用,以下是一些常见的褪黑素临床应用。
•睡眠障碍
褪黑素补充剂通常用于治疗睡眠障碍,如失眠、睡眠时相延迟综合征和非24小时睡眠觉醒障碍。它可以帮助调节睡眠-觉醒周期并提高睡眠质量。治疗睡眠障碍的剂量通常为0.3毫克至10毫克,睡前30分钟至2小时服用。
•时差反应
褪黑素可用于缓解时差反应症状,时差反应是因跨越多个时区旅行而导致的睡眠-觉醒周期暂时中断的症状。
在睡前适当的时间服用褪黑激素,可以帮助调整人体的生物钟,有利于更快地适应新的时区。
•轮班工作睡眠障碍
夜班或轮班工作的人经常会遇到睡眠困难和昼夜节律紊乱。褪黑素补充剂可用于帮助调节睡眠模式并改善白天的睡眠质量。
•神经退行性疾病
褪黑素已被研究其对阿尔茨海默病、帕金森病和亨廷顿舞蹈病等神经退行性疾病的潜在治疗作用。它具有抗氧化和抗炎的特性,可能有助于保护神经元并减轻神经退行性过程。然而,需要进一步研究以确定其功效和最佳剂量。
•情绪障碍
褪黑素补充剂在治疗重度抑郁症和季节性情感障碍等情绪障碍方面显示出良好的前景。它可能有助于调节昼夜节律、改善睡眠并缓解抑郁症状。
治疗情绪障碍的剂量可能会有所不同,咨询医疗保健专业人士很重要。
•癌症
褪黑素已被研究其潜在的抗癌特性。它具有抗氧化、抗炎和免疫调节作用,可能可以抑制肿瘤生长并增强癌症治疗的有效性。然而,需要更多的研究来确定其在癌症治疗中的功效和最佳用途。
关于褪黑素与肠道微生物群相互作用的新兴研究具有重要的临床意义,并为治疗干预带来了希望。
通过益生菌、益生元或粪菌移植调节肠道微生物群组成和功能可能与补充褪黑素在促进肠道健康和治疗炎症性肠病、肠易激综合征和代谢紊乱等疾病方面具有协同作用。
以下是有关褪黑素-肠道微生物轴未来前景的一些要点。
•时间生物学和个性化医疗
褪黑素和肠道微生物群之间的相互作用为个性化医疗增加了时间生物学的维度。考虑褪黑素产生的昼夜节律以及肠道微生物群组成和功能的昼夜变化,有助于优化针对褪黑激素-肠道微生物群轴的干预措施的时间和剂量。
•微生物代谢物和褪黑激素衍生物
肠道微生物群可以将褪黑素代谢成各种代谢物,其中一些可能具有不同的生物活性。探索这些褪黑激素代谢物的作用及其与肠道微生物群的相互作用可以发现新的治疗途径。
•营养干预
饮食在塑造肠道微生物群组成和功能方面起着至关重要的作用。未来的研究可以调查特定饮食成分,例如色氨酸(褪黑激素的前体)和多酚对褪黑激素-肠道微生物群轴的影响。
了解影响褪黑素产生和肠道微生物群的饮食因素可以为肠道健康的营养干预提供信息。

Iesanu MI,et al.Antioxidants (Basel).2022
•挑战和未来方向
尽管研究数量不断增加,但该领域仍存在一些挑战和未来方向。需要对肠道微生物群和褪黑素测量的研究方法进行标准化,以确保研究之间的一致性和可比性。
需要进行长期临床试验来评估针对褪黑激素-肠道微生物轴的干预措施的安全性、有效性和最佳剂量。
主要参考文献
Iesanu MI, Zahiu CDM, Dogaru IA, Chitimus DM, Pircalabioru GG, Voiculescu SE, Isac S, Galos F, Pavel B, O’Mahony SM, Zagrean AM. Melatonin-Microbiome Two-Sided Interaction in Dysbiosis-Associated Conditions. Antioxidants (Basel). 2022 Nov 14;11(11):2244.
Markowska M, Niemczyk S, Romejko K. Melatonin Treatment in Kidney Diseases. Cells. 2023 Mar 8;12(6):838.
Minich DM, Henning M, Darley C, Fahoum M, Schuler CB, Frame J. Is Melatonin the “Next Vitamin D”?: A Review of Emerging Science, Clinical Uses, Safety, and Dietary Supplements. Nutrients. 2022 Sep 22;14(19):3934.
Repova K, Baka T, Krajcirovicova K, Stanko P, Aziriova S, Reiter RJ, Simko F. Melatonin as a Potential Approach to Anxiety Treatment. Int J Mol Sci. 2022 Dec 19;23(24):16187.
Moon E, Kim K, Partonen T, Linnaranta O. Role of Melatonin in the Management of Sleep and Circadian Disorders in the Context of Psychiatric Illness. Curr Psychiatry Rep. 2022 Nov;24(11):623-634.
Zhao ZX, Yuan X, Cui YY, Liu J, Shen J, Jin BY, Feng BC, Zhai YJ, Zheng MQ, Kou GJ, Zhou RC, Li LX, Zuo XL, Li SY, Li YQ. Melatonin Mitigates Oxazolone-Induced Colitis in Microbiota-Dependent Manner. Front Immunol. 2022 Jan 18;12:783806.
Wang X, Wang Z, Cao J, Dong Y, Chen Y. Gut microbiota-derived metabolites mediate the neuroprotective effect of melatonin in cognitive impairment induced by sleep deprivation. Microbiome. 2023 Jan 31;11(1):17.
Miranda-Riestra A, Estrada-Reyes R, Torres-Sanchez ED, Carreño-García S, Ortiz GG, Benítez-King G. Melatonin: A Neurotrophic Factor? Molecules. 2022 Nov 10;27(22):7742.
Zhang B, Chen T, Cao M, Yuan C, Reiter RJ, Zhao Z, Zhao Y, Chen L, Fan W, Wang X, Zhou X, Li C. Gut Microbiota Dysbiosis Induced by Decreasing Endogenous Melatonin Mediates the Pathogenesis of Alzheimer’s Disease and Obesity. Front Immunol. 2022 May 10;13:900132.

谷禾健康

辐射对人体的影响是一个长期以来备受关注的问题。长时间暴露在辐射环境下可能会导致细胞损伤、突变和癌症等健康问题。
辐射包括电离辐射(X光机、CT、伽马刀、钴60治疗机、碘-131)和非电离辐射(手机辐射、微波炉、电热毯、高压电塔、基地转播台等)。
电离辐射在核能发电、核医学诊疗、食品辐照灭菌、高分子材料改性以及环境治理等多个方面具有重要的应用。随着电离辐射在研究和技术中的广泛应用增加,其导致的代谢性疾病、急性造血综合征、胃肠综合征和免疫系统疾病也越来越多。
当核辐射暴露超过安全限度时,可能导致癌症、遗传损伤等健康问题。
其他电离辐射的主要来源包括医疗诊断、放射治疗等,长期暴露于电离辐射可能导致DNA损伤、细胞突变、组织损伤、患癌症、遗传疾病等健康问题的风险增加。
来自医疗暴露、放射性药物应用、切尔诺贝利灾难、环境辐射污染的研究证据表明,肠道菌群与电离辐射引起的损害之间存在着密切的关联。
电离辐射不仅仅对肠道产生直接影响,还对肠道菌群的组成和功能产生影响,如肠道菌群多样性下降、有益菌减少、有害菌如变形菌、梭菌属等富集。
临床上较常见的,放射性肠炎就是电离辐射对健康的不良影响之一,普雷沃氏菌属、巨单胞菌属等在放射性肠炎中显著富集,或成为放射性肠炎的特征菌属。某些重要菌属的缺失可能与较差的预后相关。
特别值得注意的是,《SCIENCE》研究发现,一些肠道菌群有辐射防护的潜力,如Lachnospiraceae和Enterococcaceae,这为临床上放射治疗或其他防辐射领域带来新的希望。
鉴于近期日本核污水的排放,及人们对辐射毒性威胁的关注不断增加,迫切需要了解关于核污水排放的一些小知识,基于此本文向大家介绍一些辐射对人体健康的影响,肠道菌群在其中发挥的防辐射作用,以及基于肠道菌群调节的辐射防护及其机制。充分了解这些信息,应用于临床辅助诊断中,可以帮助确定疾病的类型,指导相关治疗策略。
本文主要内容
01 核污水及辐射相关的小知识
什么是核污水?
核废水和核污水有什么区别?
核污水的主要成分及特点
核污水进入人体的主要途径
辐射有哪几种类型?
辐射对人体健康的影响
02 核辐射对人体健康的影响
03 电离辐射对肠道菌群的影响
电离辐射
电离辐射影响小鼠肠道菌群组成
放射性肠炎
“精英菌群”——电离辐射中保命?
电离辐射和肠道菌群有怎样的机制关联
(短链脂肪酸、芳香氨基酸、吲哚衍生物、胆汁酸等)
04 非电离辐射
紫外线辐射、红外线辐射、激光辐射、
微波辐射、极低频辐射等
05 基于肠道菌群调节的辐射防护及其机制
益生菌、益生元
粪菌移植
生活中抗辐射的食物
其他
(饮食模式、膳食成分、避免食物、运动、生活方式等)
从2011年3月11日海啸引发地震,日本福岛第一核电站发生爆炸。由于爆炸,核电站各种结构破损,辐射过于强大,人不能靠近,也无法清理,所以核电站爆炸至今,一直处理不了。
核燃料一直没有妥善处理,而其又必须不断地进行冷却,事发之后,福岛第一核电站的运营方东京电力公司需要持续注水为反应堆降温,所以,冷却水灌进去后,每天就会产生大概140吨的核污染水,现在装污水的罐子已经快容不下了…
这些冷却过核燃料的水就是我们说的核污水。
核废水只是核电站的冷却水,通过换热系统进行交叉循环,不会与发过电的铀燃料进行直接接触。核废水里的放射性物质,通常只有氢的同位素氚,而氚的半衰期是只有12.43年。
核污水因为经过融化堆芯,含有大量放射性核素,比如碳-14、碘-129、铯-137、锶-90、碘-131、钴-60、铀-238等。这些放射性核素会通过摄入或吸入进入人体,对人体组织产生辐射,增加患癌症和其他放射性疾病的风险。
碳-14的半衰期超过5000年,有些核素目前没有公认有效的净化技术,在国际上没有排放先例。

注:也有人认为,假如日方公布的数据属实,福岛的核污水虽然穿过了堆芯,但是会经过一系列的后续处理,过滤掉绝大多数放射性同位素,只有一种放射性同位素氚没法过滤,把“核污水”中的氚浓度降低至日本国内标准的四十分之一、世界卫生组织规定的饮用水标准七分之一后,才开始正式排放的,才能获得国际原子能机构的背书。基于此那么两者区别不大【这个结论有待商榷,此处不作详细探讨,本文所指的核污水只讨论含有大量放射性核素的核污水】。
放射性成分
核污水中含有放射性物质,包括碳14、碘131、铯137、锶90、钴60、氢3(也称为氚)等。这些放射性成分具有辐射活性,对环境和人体健康产生潜在的危害。
污染范围广泛
核污水的污染范围不仅局限于水体,还可能对大气、土壤和生物体产生影响。
核污水排放到海洋中会对环境产生广泛的影响。首先,核污水中的放射性物质会对海洋生态系统造成严重的影响。这些放射性物质会被水中生物摄取,并逐渐富集在食物链的不同层次中,进而传递给更高级的海洋生物,最终对整个生态系统产生影响。这不仅会破坏海洋生物多样性,还会导致生物畸形、生殖问题以及其他健康问题的出现。
其次,核污水排放到海洋中会对人类健康构成威胁。人类可通过食用海洋生物摄入核污水中的放射性物质,进而受到辐射的影响。这可能导致健康问题,如癌症、先天性缺陷等。此外,核污水中的放射性物质还会通过海洋风、波浪和潮汐等因素,扩散到沿海地区,进一步影响附近居民的健康和安全。
持久性
核污水中的放射性物质往往具有持久性,可能在环境中长时间存在。这意味着核污水的影响也是持久的,对周围环境和生物体造成的潜在危害可能长期存在,即使核污水排放停止,其带来的影响仍会持续存在。
饮用水
如果核污水进入水源并未经适当处理,人们可能通过饮用受污染的水源而摄入放射性物质。
食物链
食物链始于海洋浮游植物,与陆地植物一样进行光合作用的微型植物。这些生物体从周围的海水中吸收放射性污染物。由于浮游植物被食物链上较大的浮游动物、小鱼和较大的动物吃掉,一些污染物最终以粪便颗粒或其他碎屑颗粒的形式沉降到海底。这些颗粒积聚在沉积物中,其中包含的一些放射性同位素可能通过微生物和化学过程重新回到上覆水域。
呼吸道
如果核污水中的放射性物质以气溶胶的形式释放到空气中,人们可能通过呼吸受到污染。这种情况通常发生在核事故或核电站泄漏的情况下。
皮肤接触
如果人们接触到受核污水污染的土壤、水体或其他表面,放射性物质可能通过皮肤进入人体。
当谈到排放核污水时,不可避免地会涉及到辐射对人体的影响。我们先来了解一下辐射。
辐 射
辐射是指能量以电磁波或粒子的形式传播,它可以对人体产生不同程度的影响。
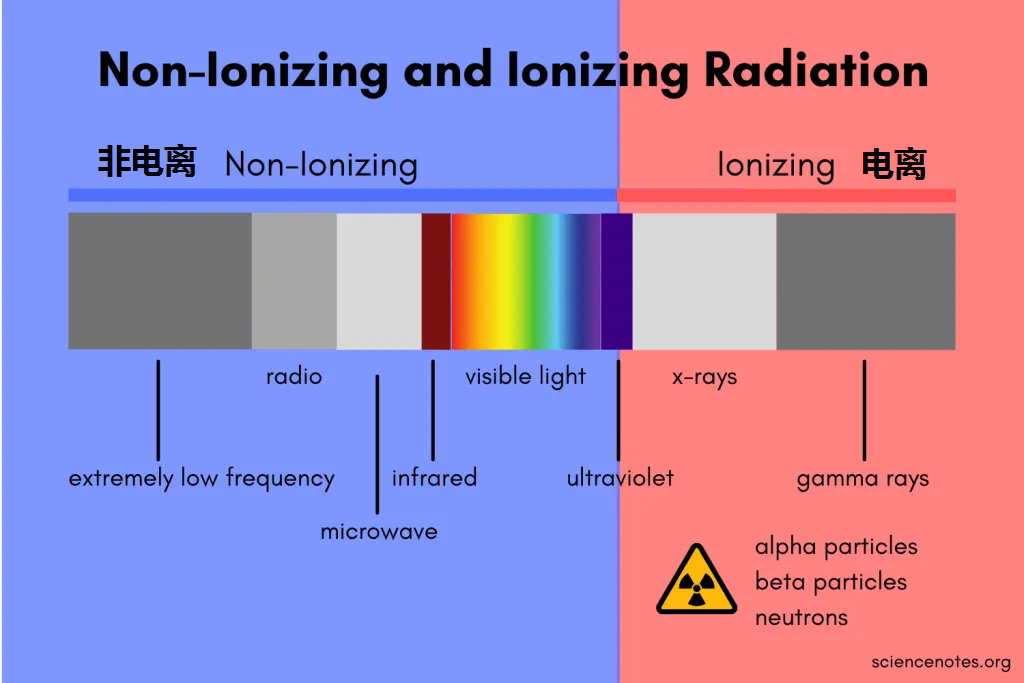
一般情况下,辐射分为电离辐射、非电离辐射。它们有什么区别呢?
电离辐射
波长短,频率高、能量强。使物质发生电离,对健康危害大,有致癌作用。
▸ 生活中可能接触到的比如:
X光机、CT、伽马刀、钴60治疗机、碘-131等。
非电离辐射
波长长,频率低,能量小。它对生物体和物质的穿透能力较弱,这些辐射不具备足够的能量来从原子或分子中剥离电子,因此不会引起电离作用。以热效应为主,没有明确致癌作用。
▸ 生活中比较常见的如:
手机辐射、微波炉、电热毯、高压电塔、基地转播台、近紫外光、可见光、热灯中使用的红外辐射等。
非电离辐射和电离辐射之间的分界线位于电磁波谱的紫外线部分
总的来说:
➩ 高剂量
在非常高的剂量下(超过一定阈值),辐射会损害组织和器官的功能,并产生急性影响,如恶心和呕吐、皮肤发红、脱发、急性辐射综合症、局部辐射损伤(也称为辐射烧伤),甚至死亡。

protein. cell., pwad044, doi.org/10.1093/procel/pwad044
▸ 头发
当暴露于高于 200 雷姆的辐射时,就会出现脱发。
▸ 心脏和大脑
强烈暴露于 1000 至 5000 雷姆的辐射下会影响心脏功能。辐射会杀死神经细胞和心脏小血管,可能导致立即死亡。如果辐射暴露超过 5000 雷姆,脑细胞就会受到影响。
▸ 甲状腺
当暴露于不同类型的辐射源时,某些身体部位会受到特别影响。暴露于放射性碘时,甲状腺可能会受到影响。如果暴露于大量放射性碘,整个或部分甲状腺可能会受到影响。
▸ 血液系统
如果一个人暴露于 100 雷姆,血液中存在的淋巴细胞数量将会减少。这可能会导致一些免疫问题。这被称为轻度放射病。根据长崎和广岛的报告,症状可能会在接触后十多年内出现。
▸ 生殖道
由于生殖道细胞分裂速度很快,即使暴露量不超过 200 雷姆,这些细胞也容易受到影响。
➩ 低剂量长期接触
低剂量电离辐射致癌相关的流行病学研究主要集中在辐射敏感部位发生的癌症,如白血病、甲状腺癌、乳腺癌、肺癌等。
致癌效应
非致癌效应
这里我们先了解一下电离辐射中的核辐射对人体健康的影响。
核辐射对人体健康的影响
美国心脏协会的《高血压》杂志上发表的一项针对俄罗斯核电站工人的研究表明,长期暴露在低剂量的电离辐射下会增加患高血压的风险。
对《英国医学杂志》发表的研究发现,接触低剂量电离辐射与心脏病风险适度增加有关。
……
我们来看一些案例。
在广岛和长崎爆炸事件后的两三年内:
白血病是首个与辐射暴露相关的癌症,从儿童到成年人都有。除了白血病外,乳腺癌、结肠癌和肺癌是报告中人数最多的其他癌症类型,但这些疾病在儿童中暴露的人数更多。
切尔诺贝利事件的长期后果:
研究人员普遍得出结论,由于儿童和青少年时期的辐射暴露而导致患甲状腺癌的风险增加,这是切尔诺贝利事故对健康的主要影响。
研究还证实,在暴露程度最高的人群中,存在以下情况的长期较高风险:
那些在 5 岁以下时暴露于高辐射水平的人最有可能遭受健康后果,包括生长发育不良、牙齿健康状况不佳、免疫紊乱、患甲状腺癌的风险等。
据切尔诺贝利儿童国际组织称,截至 2015 年,1986 年的事件继续影响着今天生活在辐射区的数百万人。超过一百万儿童生活在仍然受到污染的地区。该组织引用的健康风险和影响包括:
电离辐射可以引起造血系统,肠道系统,心脑血管神经系统的多器官损伤,这也意味着癌症放射治疗和意外暴露期间发生的大量未满足的医疗需求。研究人员已经做出大量努力来开发用于常规临床使用的治疗性放射防护剂,但辐射损伤仍然是一个长期存在且未解决的问题。
急性放射综合症或疾病(ARS)发生在部分或全身暴露于电离辐射后,死亡通常归因于造血恢复不良和/或胃肠道(GI)上皮细胞死亡。
胃肠道是更新最快的成人组织,因此对辐射高度敏感。
它还拥有由 10 至 100 万亿个微生物组成的多样化微生物群落,增加了肠道微生物群参与对辐射引起的损伤的反应的可能性。一些研究表明肠道微生物群与辐射引起的损伤之间存在关联。
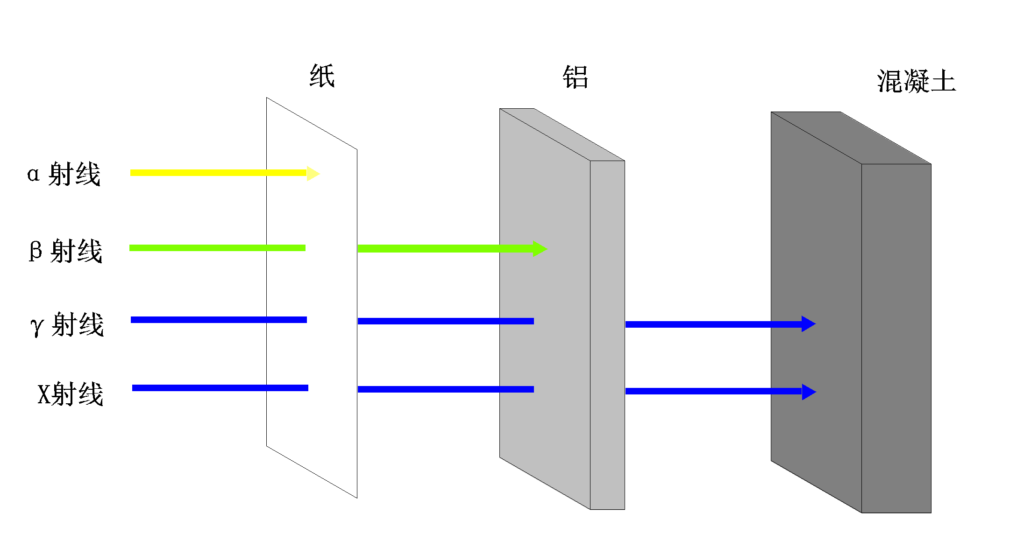
电离辐射可以产生离子化的分子和自由基,对细胞和遗传物质造成损害,进而导致潜在的健康风险。
电离辐射可以是核辐射(如α、β、γ射线)或非核辐射(如X射线、紫外线)。当电离辐射与物质相互作用时,它可以剥离或激发原子或分子中的电子,导致化学和生物效应。不同射线穿透力不一样。
哪些情况可能暴露于电离辐射?
人们可能在不同的情况下暴露于电离辐射,在家里或在公共场所(公共暴露)、在工作场所(职业暴露)或在医疗环境(医疗暴露)。暴露于辐射可能通过内部或外部途径发生。
当放射性核素被吸入、摄入或以其他方式进入血流(例如,通过注射或通过伤口)时,就会发生电离辐射的内部暴露。当放射性核素自发地(例如通过排泄物)或由于治疗而从体内消除时,内照射就会停止。
当空气中的放射性物质(例如灰尘、液体或气溶胶)沉积在皮肤或衣服上时,可能会发生外部暴露。这种类型的放射性物质通常可以通过清洗从体内去除。电离辐射的暴露也可能是由外部来源的辐射引起的,例如 X 射线的医疗辐射暴露。当辐射源被屏蔽或人移出辐射场时,外部照射就会停止。
医学上辐射的应用占人类由人为源头产生的辐射总剂量的98%,也占总人口辐射暴露的20%。全球每年进行超过42亿次诊断放射学检查,进行4000万次核医学检查,进行850万次放射治疗。
电离辐射对身体的损害有哪些?
电离辐射对机体的损伤程度受辐射源、剂量率、暴露时间及机体敏感性等因素影响。
胃肠道系统对电离辐射具有高度的敏感性,辐射影响胃肠道的运动、吸收和分泌功能,常见的胃肠道反应为恶心呕吐、腹泻,病理检测可见小肠绒毛断裂、隐窝塌陷、黏膜上皮受损等。
长期低剂量辐射的影响较难衡量。电离辐射引起的DNA损伤可导致突变,导致癌症,尤其是在细胞分裂率高的组织中,如胃肠道、生殖细胞和骨髓。在生殖细胞中,电离辐射会损害遗传物质并导致代代相传的突变。
电离辐射可以破坏细胞内稳态,通过传输能量和引起细胞内水辐解和线粒体电子泄漏来激活促炎信号通路,释放自由基损伤DNA、蛋白质和脂质,从而导致机体组织损伤。
肠道菌群的特征与电离辐射引起的损伤严重程度有关。电离辐射对大脑、食管、心脏和肺部的损伤也与肠道菌群有关。
电离辐射对肠道菌群的影响
测量切尔诺贝利核灾所产生的人为放射性核素显示,暴露于环境放射性核素会显著影响脊椎动物的肠道菌群。
研究表明,电离辐射会降低小鼠肠道菌群的α和β多样性。
电离辐射会降低优势菌群的丰度,如:
增加某些菌群的丰度,如:
对于非人类灵长类动物,研究发现,电离辐射会使Actinobacillus、Bacteroides、Prevotella、Veillonella等属的丰度增加两倍以上,而Acinetobacter和Aerococcus等属的丰度减少十倍以上。
电离辐射诱导肠道微生物群失调
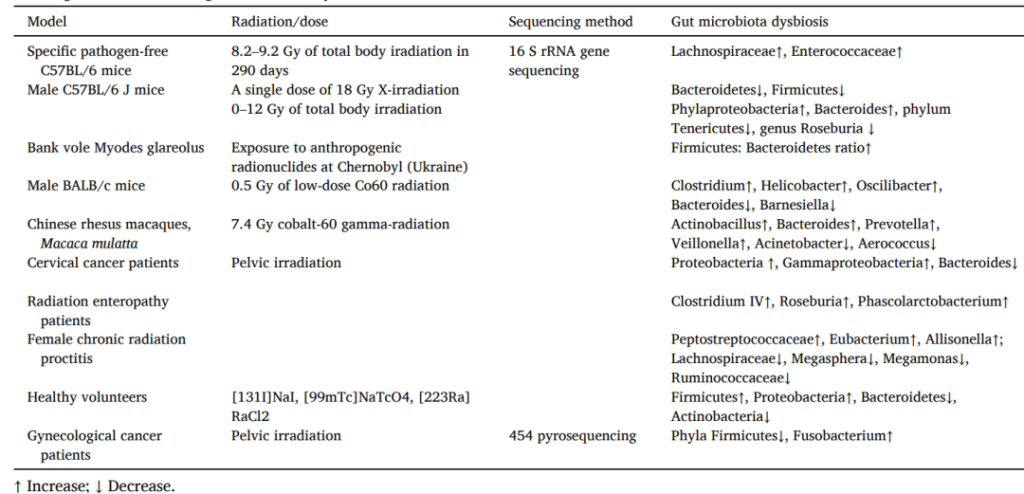
doi.org/10.1016/j.envres.2023.115947
电离辐射对人类肠道菌群也有着类似的影响,其中,放射性肠炎就是其中的影响之一。接下来,我们来了解一下放射性肠炎是如何发生的,肠道菌群在其中发挥怎样的作用。
放射治疗在临床上被广泛用于治疗多种肿瘤。放射治疗可诱导双链 DNA 断裂,导致肿瘤细胞凋亡。肿瘤细胞增殖迅速,对放射线敏感,修复速度比正常细胞慢,因此对多种类型的肿瘤有良好的治疗效果。
放射治疗的副作用
但是由于放射射线不仅可以杀死癌细胞,还会对周围的正常细胞和组织造成损伤。因此放疗经常会引起各种副作用,比如疲劳,恶心和腹泻等。由于放疗照射位置的不同,许多副作用也不同。胃肠细胞对电离辐射敏感,这限制了腹部和盆腔恶性肿瘤的放射治疗。
放射后的肠道损伤很常见
放射治疗造成的肠道损伤会在第一周或第二周导致胃肠道反应,少数发生在放射后几个小时。低剂量辐射引起的肠道损伤通常是可逆的。40%的患者在10~30 Gy的辐射剂量下可出现明显病变,而当剂量超过30 Gy时,这一数字将急剧增加至90%。
放射性肠炎的症状
急性放射性肠炎的临床表现为恶心、呕吐、腹痛、腹泻,大便次数增多,粪便呈粘液、脓血,严重者甚至死亡。
慢性放射性肠炎的临床表现包括慢性肠梗阻、肠穿孔、瘘管和脓肿等。
放射治疗对菌群的影响
辐射会导致肠道菌群失衡,包括有益菌的丰度降低和病原菌的丰度增加。当益生菌数量减少时,条件性致病菌会繁殖并占据生态位,从而抑制益生菌的生长并促进内毒素的释放。
在接受电离辐射和放射性药物治疗后,人类肠道菌群的组成发生改变。
下列菌群丰度减少:
健康肠道中优势菌群如厚壁菌门和拟杆菌门的丰度降低已被证明会削弱肠道对有害细菌的抵抗力,进而加重放射性肠炎的症状,激活促炎信号通路。
下列菌群丰度增加:
梭菌属(Clostridium IV)、Roseburia属和Phascolarctobacterium属的水平升高与放射性肠病相关。
2019 年发表的一项关于微生物群与急性/晚期放射性肠病相关性的临床研究,收集了134名受试者的粪便样本,基于16S rRNA 测序对放疗过程中肠道菌群的总体情况进行了分析。
结果表明,随着放疗进行,患者的肠道菌群多样性逐渐降低,并且表现出与晚期放射性肠病程度成正相关的特征。
放射性肠病患者的下列菌群相对丰度明显增加:
与微生物群调节和肠壁维持相关的稳态肠黏膜细胞因子(IL-7,IL-12/IL-23p40,IL-16,IL-15)明显减少,其中IL-15与罗氏菌属和丙酸杆菌属(Propionibacterium)的丰度呈负相关,表明肠道微生物可能与腹部或盆腔照射引发的急性和晚期放射性肠病有关。
反映放射性肠炎的特征菌属
另一项研究报道了盆腔放疗患者粪便中几种菌属的变化与放射性肠炎的发生密切相关,并可根据几种特定肠道菌属对患者放疗后可能发生肠炎的风险进行预测。
在该研究中,放射治疗导致粪便中菌群α多样性降低,β多样性增加。门水平上,放射性肠炎患者变形菌门相对丰度显著增加;属水平上,拟杆菌属相对丰度明显降低。
下列3种菌属在肠炎患者中显著富集,或可作为反映放射性肠炎的特征性菌属:
在放射性肠炎引起的腹泻中检测到革兰氏阴性杆菌的过度生长。
放疗前、放疗后立即和放疗后两周的微生物群比较表明,腹泻患者的放线菌门增加,梭状芽胞杆菌减少。放射后肠道蠕动受损是革兰氏阴性杆菌在胃肠道定植的主要致病因素。在细菌过度生长期间,肠道迁移运动复合体(MMC)的缺失与革兰氏阴性杆菌大规模定植的存在相关。因此,异常的肠道蠕动和革兰氏阴性杆菌的大量定植是严重晚期放射性肠病发生的重要因素。此外,放疗后对腹泻和其他细菌变化的易感性和保护作用也可能与不同的初始微生物群定植有关。
辐射诱导的肠道菌群失调助推放射性肠炎的发展
在放疗后发展为放射性肠炎的患者其照射前粪便样品中的粪球菌属(Copro⁃coccus)和脱硫弧菌属(Desulfovibrio)明显富集,这2种菌属或可作为特征性菌属对患者进行放射性肠炎发生风险的预测。
辐射导致部分菌属的丰度变化与促炎因子的表达量密切相关,可作为反映放射性肠炎发生发展的特征性菌属。
放射性肠炎患者粪菌液与上皮细胞共培养,诱导了上皮细胞的炎症和屏障功能障碍,使TNF-α和 IL-1β表达增加,进一步说明辐射诱导的肠道菌群失调可能助推放射性肠炎的发展进程。
辐射损害肠道完整性
辐射效应可以直接或间接影响细胞 DNA。DNA损伤导致细胞周期阻滞和细胞凋亡,同时激活炎症信号通路和释放促炎因子。绒毛细胞耗竭导致细胞死亡和肠道感染风险增加。此外,辐射还引发非靶向效应,导致染色体不稳定性。这些过程共同导致肠道屏障的破坏和菌群迁移。
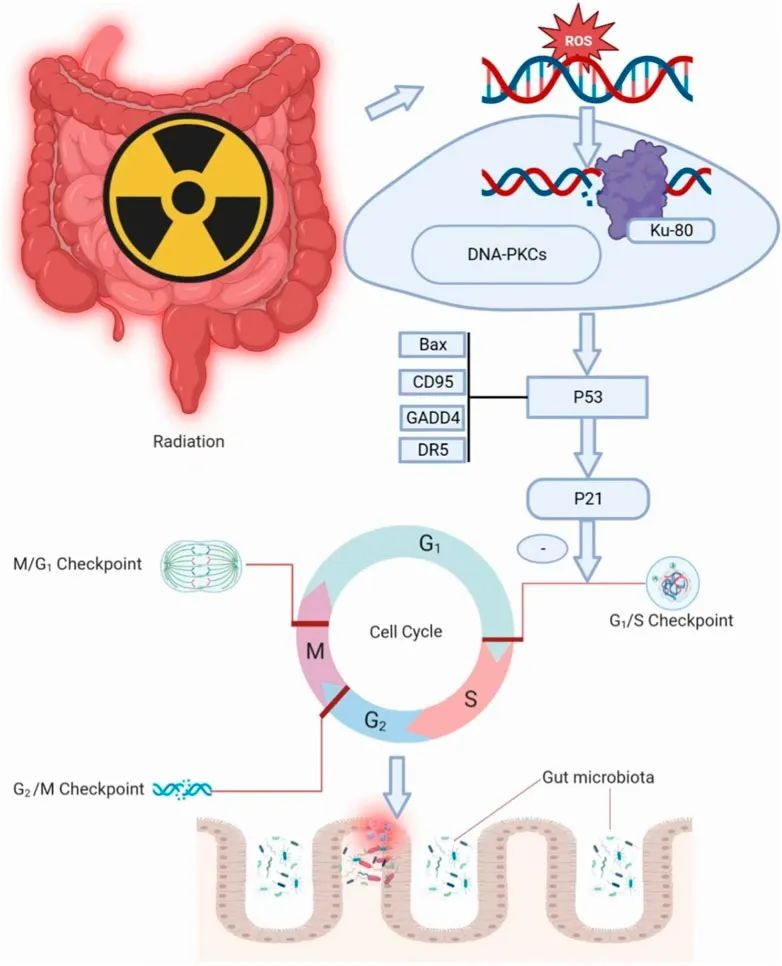
doi.org/10.3389/fphar.2023.1116558
文献中采用的辐射源、辐射方式和辐射剂量各不相同,辐射后菌群的变化特点也存在不一致的情况,一些显著变化的菌的功能及在机体损伤中发挥作用的机制阐述不够。相信这些复杂问题会在未来研究中逐渐解决。
以上是临床上放射性肠炎面临的一些困境以及关于肠道菌群中与放射性肠炎的相关特征菌属。
与此同时,研究人员也发现了一些好消息,肠道菌群并不是总是受害者,其中一些特殊的“精英肠道菌群”,似乎可以帮助我们抵抗辐射的伤害。
2020年,来自美国北卡罗拉纳大学教堂山分校的研究人员在《SCIENCE》上发表的一篇文章,揭示了肠道微生物群及其代谢产物在电离辐射中的保护作用。
该研究一群从高剂量辐射中恢复并过着正常寿命的小鼠。这些“精英幸存者”拥有独特的肠道微生物群,这些微生物群是在辐射后形成的,可以保护无菌和传统饲养的小鼠免受辐射引起的损伤和死亡。

在该研究中发现,毛螺菌科Lachnospiraceae和Enterococcaceae可以保护小鼠抵抗辐射引起的造血系统和肠道系统的损伤,从而在致死剂量的辐射后存活下来。
注:毛螺菌科一般参与多种碳水化合物的代谢,尤其水果蔬菜中的果胶(一种复杂的膳食纤维和益生元)的能力很强。
Lachnospiraceae 详见:肠道核心菌属——毛螺菌属(Lachnospira)
这些“有益菌”通过产生大量的短链脂肪酸和色氨酸代谢通路的代谢产物来促进造血发生以及肠道损伤修复,从而帮组机体抵抗辐射引起的损伤和死亡。
丙酸以及两种色氨酸途径代谢物 I3A 和 KYNA 在精英幸存者中升高,并提供长期的辐射保护。
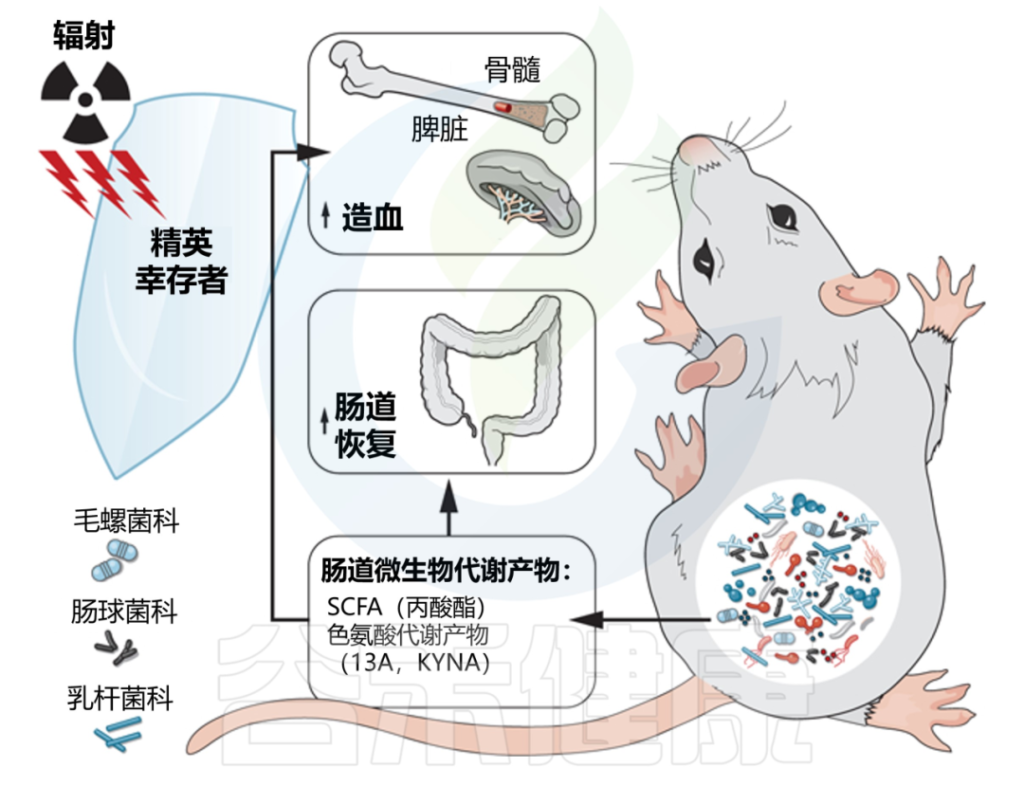
DOI: 10.1126/science.aay9097
这项研究还在白血病患者中进行了临床研究,在轻度腹泻病人中,Lachnospiraceae,Enterococcaceae以及Lactobacillaceae这三种在小鼠中可能的“有益菌”数量明显高于重度腹泻的病人。Lachnospiraceae的数量与病人腹泻时间存在显著地负相关性。
因此,作者推断在人体中,这些可能的“有益菌”也可以帮助病人降低放疗引起的副作用。这些发现为开发针对放射性肠炎的治疗策略提供了新的思路。
DNA双链断裂与NF-κB通路活性
辐射会破坏细胞的DNA结构,导致DNA链断裂,并触发多个蛋白激酶和信号通路的激活。这些激活过程会引发炎症反应。然而,肠道菌群和短链脂肪酸可以通过调节p53和NK-κB通路来减轻辐射损伤。
例如,丁酸可以抑制炎症反应的NF-κB通路。
异鼠李素是一种黄酮类物质,可以促进DNA修复并提高存活率。
肠道菌群代谢产物尿石素A(UroA)也可以抑制炎症反应并保护DNA免受损伤。
氧化应激和炎症效应
水是细胞的主要组成部分,也是高能光子辐射的主要目标。辐射会导致水的辐解,产生有害的ROS和RNS。内源性抗氧化途径可以减轻ROS的过度积累,但Nrf-2缺乏会加重辐射引起的病理变化和炎症反应。肠道菌群产生的代谢物可以缓解辐射的毒性作用。在接受放疗或化疗的患者中,缺乏抗炎菌群可能促进炎症事件的发生。
脂质损伤和铁死亡
辐射损伤DNA和其他细胞分子,引发铁死亡。辐射诱导肠损伤与铁死亡、NF-κB途径有关。激活Nrf-2途径可减轻铁死亡。辣椒素可保护免受铁死亡相关损伤。
辐射引起的旁观者效应
当细胞受到辐射和其他有害物质的影响时,它们会释放一种信号,影响到周围的细胞。周围的细胞可能会受到DNA损伤,增加患癌的风险。这种现象被称为辐射诱导的旁观者效应。
这个效应导致细胞的基因表达改变、DNA修复的激活以及细胞的增殖、凋亡和死亡。这种效应可能是通过氧化应激的影响来实现的。
肠道菌群代谢物功能及对电离辐射的影响
肠道菌群的改变往往伴随多种代谢产物的变化,大量的代谢物驱动着宿主和菌群之间的交流,从代谢层面更好地理解宿主与肠道菌群的相互作用可为基于肠道菌群的治疗干预提供启发。
目前,短链脂肪酸、芳香氨基酸、胆汁酸等已被发现作为菌群和宿主对话的信号分子,参与辐射条件下宿主生理功能的调节过程。
➢ 短链脂肪酸
短链脂肪酸通过与 G 蛋白偶联受体(GPCR)结 合 或 抑 制 组 蛋 白 去 乙 酰 酶(HDAC)调节下游信号通路发挥抗炎、免疫调节等作用。
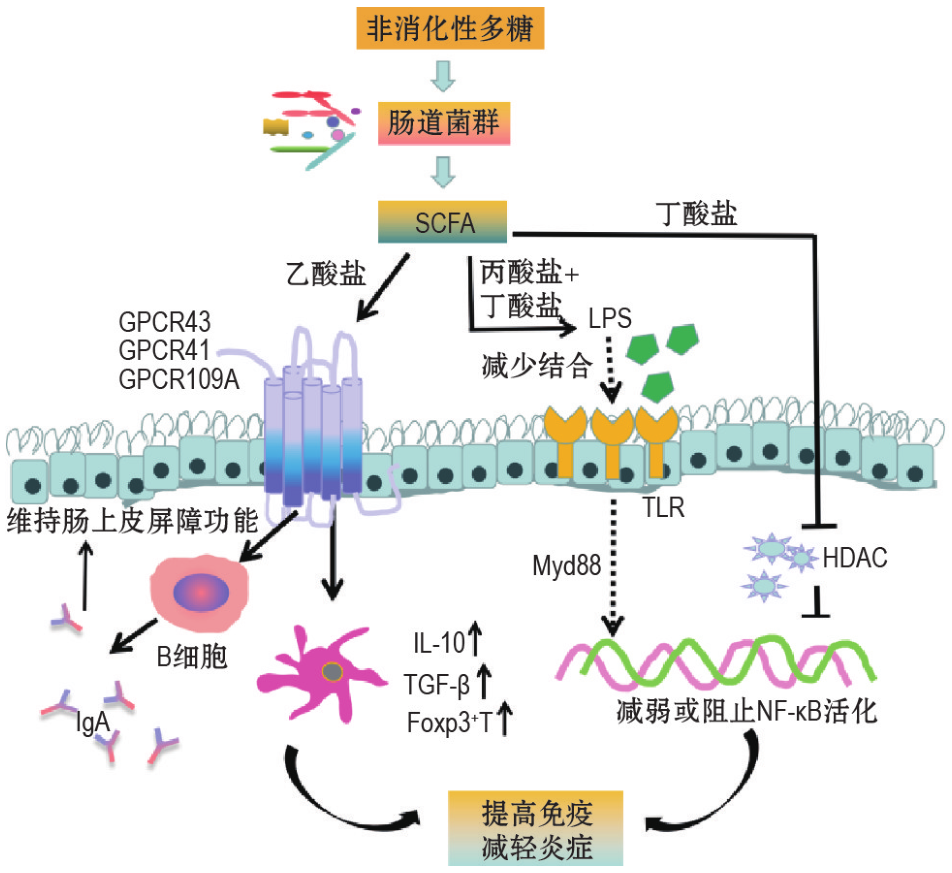
DOI:10.3867/j.issn.1000-3002.2020.07.009
最新研究表明,由肠道菌群代谢产生的戊酸灌胃后提高了辐照小鼠的生存率,保护造血器官损伤和胃肠道功能;高通量测序、同位素相对标记和绝对定量(iTRAQ)结果显示,戊酸可恢复小鼠肠道菌群的分类比例,重建小肠组织的蛋白表达谱。
➢ 芳香氨基酸
芳香氨基酸可由宿主本身和肠道菌群代谢产生。其中肠道菌群分解代谢产生的大量芳香氨基酸代谢物,可能作为宿主生理信号分子,在局部和远处调节宿主的免疫、代谢和神经元反应。大量文献报道了色氨酸吲哚类代谢物对肠道功能和远处器官的调节作用。
色氨酸在胃肠道中有3条主要的代谢途径:
① 饮食色氨酸可被肠道微生物群直接转化为芳香烃受体(AhR)的配体;
② 免疫细胞和上皮细胞中吲哚胺 2,3-双加氧酶(IDO)的犬尿酸通路;
③ 肠嗜铬细胞5-羟色胺(5-HT)合成途径。
AhR信号被认为是肠道屏障免疫反应的关键组成部分,对肠道内稳态至关重要。肠道菌群色氨酸代谢产生的吲哚类化合物可激活AhR,生成 IL-22,维持黏膜表面宿主微生物的稳态。在肠道中,一些吲哚类衍生物可通过AhR/IL-22轴调节上皮完整性和黏膜免疫应答。吲哚也可通过芳基烃受体激活上调固有层淋巴细胞的IL-22 分泌,加速肠干细胞(ISC)上皮细胞的增殖,从而保证组织的稳态。
电离辐射干扰小鼠肠道的微生物代谢。由于与色氨酸相关的吲哚化合物起源于肠道菌群,随后进入肝,因此吲哚化合物浓度的改变可作为辐射损伤的血浆标记。
分析不同辐射剂量的血浆差异性代谢物,证明了电离辐射对肠道微生物色氨酸代谢的抑制作用,表明或可根据辐照后特定时间内给定血液样本中吲哚类化合物浓度来推断可能的全身辐射剂量,这对于核事件后快速评估个人辐射剂量具有重要意义。
辐射对肠道菌群代谢产物的毒性调节
doi.org/10.1016/j.envres.2023.115947
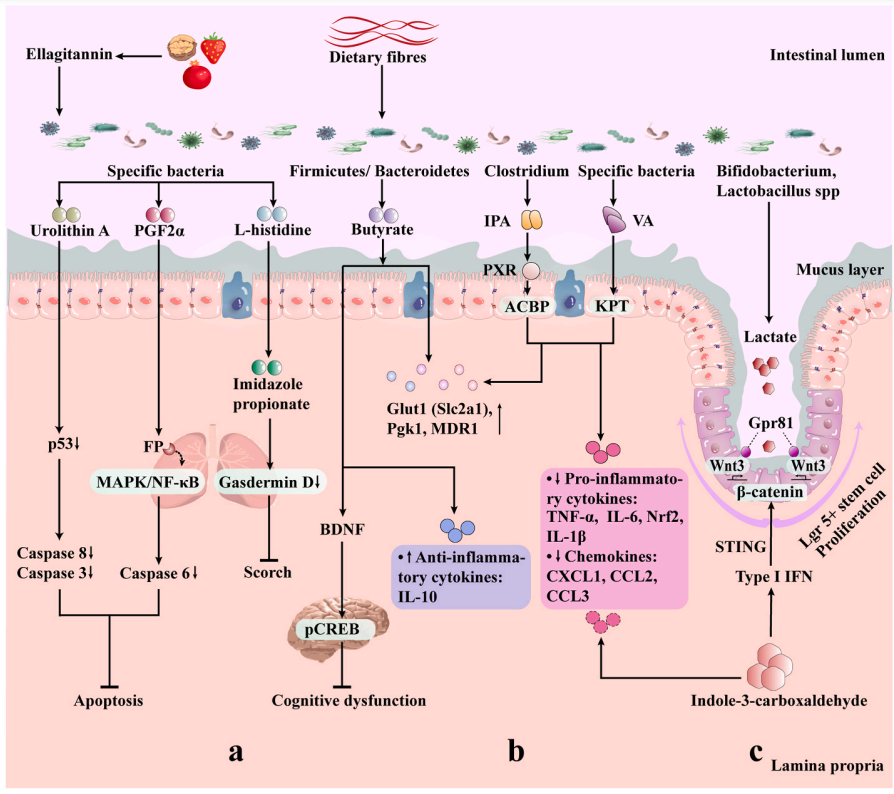
➢ 吲哚衍生物
肠道菌群中色氨酸代谢产生的吲哚或吲哚衍生物可以限制辐射诱导的肠道炎症。
吲哚-3-羧醛(ICA)治疗可以通过1型干扰素(IFN)限制肠道上皮损伤,并且依赖刺激相关的1型IFN响应促进Lgr5+干细胞再生,减少肠上皮细胞间细菌转位和炎症因子的产生。
ICA治疗21天后,辐射小鼠的结肠中显示出减少的隐窝丧失和炎性细胞因子(TNF-α、IFN-γ和IL-6)以及趋化因子(CXCL1、CCL2和CCL3)的表达,从而降低了辐射引起的肠道炎症。
吲哚-3-丙酸(IPA)是Clostridium sporogenes的一个功能代谢产物,在全腹部照射(TAI)辐射小鼠中增加了肠道屏障功能和上皮完整性,提高了Glut1(Slc2a1)、Pgk1和MDR1的表达,同时降低了IL-6和TNF-α的表达。此外,IPA改变了辐射肠道菌群的结构。研究还发现,PXR/酰基辅酶A结合蛋白(ACBP)信号通路支持IPA对抗辐射的作用。
➢ 胆汁酸
辐射影响肠道内胆汁酸水平。大鼠盆腔照射可诱发胆汁酸吸收不良引发腹泻,主要原因是放射治疗影响大鼠胆汁酸稳态和顶膜钠依赖性胆汁酸转运体(Asbt),回肠 Asbt表达下调或Asbt功能降低导致胆汁酸吸收不良,肠道胆汁酸积累导致腹泻。
在溃疡性结肠炎患者体内,肠道菌群失调引发肠道次级胆汁酸水平降低,加重肠道炎症,而放射性肠炎及肠道菌群失调是腹盆腔肿瘤放射治疗的常见不良反应,通过调节菌群带来胆汁酸水平的变化或直接阻断胆汁酸受体可能对减轻辐射损伤有作用。
我们每天都会受到低水平的非电离辐射。
紫外线(UV)辐射是太阳辐射的自然组成部分,同时也会由黑光、日光浴床和电弧照明释放。正常的日常紫外线辐射水平对人体有益,并能产生维生素D。
过多的紫外线辐射可能导致皮肤灼伤、皮肤过早老化、眼睛损伤和皮肤癌。大多数皮肤癌都是由紫外线辐射引起的。
UVR 可通过光化学和热反应造成生物损伤。它具有高光子能谱,并且特别有害,因为通常不会立即出现过度暴露的迹象。 UV-A 和 UV-B 可能对皮肤和眼睛产生有害影响。90% 的早期皮肤老化症状是由紫外线接触造成的。
同样,眼睛的辐射暴露可能是由任何简单的原因引起的,例如水面反射阳光,甚至是相机的闪光灯。过度暴露于紫外线可能会导致严重的风险,包括白内障和黄斑变性。
红外线位于微波和可见光之间。它有一定的波长范围,最接近可见光的波长是近红外线,而“远红外线”则更接近微波区域。近红外波较短、不热且无法检测到,这使得它们对皮肤和眼睛等敏感组织特别有害。
皮肤对红外线照射的反应是以疼痛的形式发出警告信号。
生产环境中,加热金属、熔融玻璃及强发光体等可以成为红外线辐射源。炼钢工、轧钢工、铸造工、锻钢工、烧瓷工、焊接工等可受到红外线辐射。
激光不是天然存在的,是用人工激活某些活性物质,在特定条件下受激发光,在农业中可用于育种、杀虫,也可以用于焊接、打孔、切割等。
长期接触过量会导致白内障并损害视网膜。激光损伤的一个例子是导致中央凹盲点的视网膜损伤。
当存在大量光辐射时,皮肤可能会发生烧伤。
微波辐射(MW)属于波长在1毫米和1米之间(或等效频率范围从300千兆赫到300兆赫)的电磁频谱。它们被用于各种领域,从通信到广播,再到厨房食物的加热或除霜。频率范围从80到800用于电视和调频无线电广播天线。
微波通常由移动电话及其基站和微波链路产生。此外,它还来自无绳电话、蓝牙设备、无线局域网和许多其他应用。
中枢神经系统是一个脆弱的区域,当身体暴露在微波辐射下时,它会发生显著的变化。它会导致睡眠障碍和记忆障碍,一些研究表明,长时间接触移动电话设备(会发射微波)会增加患脑肿瘤风险。
通过无线电发射器和手机接触微波意味着它可以通过皮肤被人体吸收,从而损害组织。
微波可以通过足够高强度的加热来损伤组织。微波的传播深度取决于微波的频率以及受影响的组织的类型。这些影响不会立即显现,因为较低的频率会深入组织,并且身体较深处区域的神经末梢较少。
睾丸特别容易受到温度升高的影响,从而更容易受到微波辐射的影响。将怀孕大鼠暴露于 9.417 GHz 微波会导致其后代(雄性和雌性)表现出与焦虑相关的行为增加,更令人惊讶的是,雄性表现出记忆和学习受损。
流行病学研究表明,暴露于极低频率的电磁场会损害人类健康。这会导致在暴露于此类磁场的环境中生活或工作的人们患上某些形式的癌症、抑郁症和流产。多项研究报告称,身体多个组织暴露于极低频辐射会导致氧化应激。
身体免受极低频辐射暴露的保护措施包括服用维生素 E、MEL、FA等抗氧化剂,以避免暴露于极低频辐射可能产生的不利影响。
乳杆菌属
主要通过胃肠道与远离器官之间的免疫信号交流来调节免疫反应。
嗜酸乳杆菌Lactobacillus acidophilus(L. acidophilus)对受到有限辐射(≤15 Gy)损伤的小肠黏膜有缩短恢复时间的作用,但对超过20 Gy的辐射无效。Lactobacillus acidophilus通过改善肠道干细胞功能和细胞分化来增强肠道上皮功能,从而减轻辐射引起的肠道损伤。
植物乳杆菌Lactobacillus plantarum(L. plantarum)可以通过激活肠上皮细胞中的FXR-FGF15信号来缓解辐射引起的肠道损伤,从而防止小鼠死于辐射。
罗伊氏乳杆菌Lactobacillus reuteri 作为第二代益生菌,通过产生代谢物和释放IL-22来稳定Lgr+5肠道隐窝干细胞的数量和功能,并保护肠道微血管内皮细胞免受死亡的影响,从而直接抑制肠道病原菌的生长。
鼠李糖乳杆菌LGG提高小肠隐窝存活数量,减少上皮细胞凋亡。LGG能释放放射保护性的LTA(TLR2激动剂),通过触发涉及巨噬细胞和分泌PGE2的MSCs的多细胞适应性免疫信号级联来保护上皮干细胞。
Lactobacillus royale通过释放IL-22来预防和减轻辐射毒性。
Akkermansia muciniphila
作为被广泛认可的下一代益生菌,在代谢性疾病和肿瘤免疫治疗中发挥作用。它可以通过上调RORγt+ Treg细胞介导的免疫反应改善结肠炎,并通过减少CD8+细胞毒性T淋巴细胞、TNF-α和PD-1来减轻结肠炎相关结直肠癌。
给辐射小鼠投予Akkermansia muciniphila可以显著缓解肠道毒性,并在肠道毒性更严重的小鼠消化道中稳定定居。然而,在某些特定情况下,A. muciniphila及其相关成分可能加剧病原体感染和肠道炎症,尽管在正常情况下有益于宿主肠道稳态的维持。
普拉梭菌
Faecalibacterium prausnitzii (F. prausnitzii)具有抗炎作用,在治疗炎症性肠病(IBD)和结肠炎方面发挥重要作用。研究发现,与健康人相比,患有IBD的患者中F. prausnitzii的丰度减少。
在局部照射29 Gy后的3天内,在大鼠体内口服F. prausnitzii A2-165菌株可以减轻隐窝形态学变化的严重程度,保护干/祖细胞和增殖上皮隐窝细胞的数量,并增加结肠隐窝上皮细胞产生的IL-18的产量。
益生菌组合
VSL#3的益生菌组合是由八种益生菌混合而成的,广泛安全地用于治疗胃肠疾病。一项双盲安慰剂对照试验证实,与安慰剂组相比,补充VSL#3的患者较少出现放射性肠炎引起的腹泻(77/243,31.6% vs. 124/239,51.8%;P < 0.001),且较少出现3级或4级腹泻(1.4% vs. 55.4%;P < 0.001)。
Dixentil是一种益生元和益生菌的混合物(低聚半乳糖、乳酸杆菌和酸酸乳杆菌),在保护放射性肠炎患者方面显示出积极效果。
宫颈癌患者盆腔放疗前7 d和放疗期间每天口服活的嗜酸乳杆菌和双歧双歧杆菌降低了辐射引起的腹泻的发生率,可减少抗腹泻药物的使用,并能改善患者的大便状态。
复合益生菌,包括嗜酸乳杆菌、鼠李糖乳杆菌、植物乳杆菌、长双歧杆菌和乳双歧杆菌,在小鼠模型的急性放射性肠道损伤中发挥积极作用。嗜酸乳杆菌加长双歧杆菌可以减少RE引起的2-3级腹泻,改善粪便稠度,尤其是在外束盆腔放疗后的盆腔癌患者中。此外,益生菌组的抗腹泻药物使用显著减少(P < 0.05)。
魔芋葡甘聚糖是一种天然大分子和可溶性膳食纤维,用于对抗电离辐射诱导的损伤。口服魔芋葡甘聚糖通过调节肠道微生物群和增加短链脂肪酸来预防电离辐射引起的损伤。魔芋葡甘聚糖作为一种益生元,可以增强肠道微生物群中益生菌数量和短链脂肪酸的产生,维持肠道稳态。魔芋葡甘聚糖还能抑制辐照后人肠上皮细胞的凋亡。
粪菌移植
粪菌移植(FMT)已被应用于难治性艰难梭菌感染的治疗,并在辐射损伤动物和放射性肠炎患者中显示出良好的效果。
研究表明,粪菌移植可以显著提高辐射小鼠的存活率,减轻体质量下降、脾脏萎缩和胃肠道功能异常等辐射损伤症状。粪菌移植还可以维持小鼠肠道菌群的组成,并对小肠中的基因表达谱产生性别特异性的影响。此外,粪菌移植对辐射引起的造血系统损伤也有一定的促进恢复作用。
在临床研究中,FMT被用于治疗常规治疗无效的慢性放射性肠炎患者。研究发现,在接受粪菌移植治疗的患者中,有部分患者的肠道不良反应减轻,卡氏评分降低,并且没有粪菌移植相关的死亡和感染并发症。这为粪菌移植作为治疗慢性放射性肠炎的可行性提供了证据。
此外,研究发现,FMT可以通过逆转肠道细菌分类比例和清除氧化应激来减少胸部局部辐射引起的肺损伤。因此,与抗生素相比,FMT更有效地增强胃肠功能和肠道上皮完整性。
由于缺乏长期随访证据,FMT的长期疗效尚不确定。对FMT前特定供体菌群特征的评估可能使其在治疗由辐射相关肠道菌群失衡引起的疾病时更安全、更有效。
★ 番茄红素
番茄红素在很多红色水果中都有,以番茄中的含量最高,番茄红素是迄今为止所发现的抗氧化能力最强的类胡萝卜素,它的抗氧化能力是维生素E的100倍,具有极强的清除自由基的能力,有抗辐射、预防心脑血管疾病、提高免疫力、延缓衰老等功效,有植物黄金之称。
代表:
番茄、西瓜等红色水果
★ 维生素E、维生素C
各种豆类、橄榄油、葵花籽油和十字花科蔬菜富含维生素E,而鲜枣、橘子、猕猴桃等水果富含维生素C,维生素E和维生素C都属于抗氧化维生素,具有抗氧化活性,可以减轻电脑辐射导致的过氧化反应,就像给我们的皮肤穿上了一层“防辐射衣”,从而减轻皮肤损害。
此外,新鲜的蔬果具有抗辐射作用,还在于它们可使血液呈碱性,溶解沉淀于细胞内的霉素,使之随尿液排泄掉。
代表:
各种豆类、橄榄油、葵花籽油、芥菜、卷心菜、萝卜等十字花科蔬菜;
鲜枣、橘子、猕猴桃等新鲜水果。
★ 维生素A、β胡萝卜素
此类食品富含维生素A和β胡萝卜素,能很好的保护眼睛。天然胡萝卜素是一种强有力的抗氧化剂,能有效保护人体细胞免受损害,从而避免细胞发生癌变。长期食用胡萝卜素,能使人体少受辐射和超量紫外线照射的损害,目前国外还将天然胡萝卜素用于化妆品中,发挥其防辐射,保护、滋润皮肤和抗衰老作用。
代表:
鱼肝油、动物肝脏、鸡肉、蛋黄、西兰花、胡萝卜、菠菜等。
★ 硒
微量元素硒具有抗氧化的作用,它是通过阻断身体过氧化反应而起到抗辐射、延缓衰老的作用,含硒丰富的食物首选芝麻、麦芽和黄芪。
代表:
芝麻、麦芽和黄芪;
酵母、蛋黄、啤酒、龙虾、金枪鱼等海产品;
大蒜、蘑菇等。
★ 脂多糖、维生素A原
如果不习惯喝绿茶,菊花茶也同样有效。现代医学研究证实,绿豆、绿茶中含脂多糖、维生素A原,能帮助排泄体内毒物、加速新陈代谢,可有效抵抗各种形式污染。
此外,茶叶中的茶多酚类化合物具有抗辐射作用,可以吸收90%的放射性同位素,并且加速代谢,减轻对人体的伤害。
代表:
绿茶、绿豆。
★ 胶原弹性物质
海带是放射性物质的克星,可减轻放射性核素、各种射线对机体免疫功能的损害,并抑制免疫细胞的凋亡而具有抗辐射作用。此外,海带还是人体内“清洁剂”,他是一种碱性食物,有利于保持身体处于弱碱性的环境。海带中含有的胶质、动物皮肤、脊髓中的胶原物质都有一种黏附作用,它可以把体内的腐蚀性物质黏附出来排出体外,而且其中动物皮肤所蕴含的弹性物质还具有修复受损肌肤的功能。
代表:
海带、紫菜;动物皮、骨髓。
选择可靠的食品来源
购买来自可靠供应商的食品,特别是海产品。选择经过严格检测和认证的产品,以确保其安全性。
查看食品标签上的信息,特别是有关产地和检测的信息。优先选择标明非受污染区域产地的食品。
饮食方式
保持饮食多样化,不要过度依赖某一种食品。通过摄入多种食物,可以减少单一食品对辐射的潜在影响。
含有ω-3多不饱和脂肪酸(n-3PUFAs)的饮食可以通过增加有益细菌(如乳酸菌、双歧杆菌和产丁酸细菌)来逆转肠道菌群失调。n-3PUFAs通过减少LPS合成和胃中粘液溶解菌的数量来减少炎症和氧化应激,预防和减轻辐射引起的损伤。
以下是一些可能含有较高辐射的食物:
海产品:如海藻、贝类和鱼类,可能吸收海水中的放射性物质,尤其是碘和铯。
野生蘑菇:野生蘑菇可能吸收土壤中的放射性物质,如铀和钍。
某些土壤栽培的农作物:某些农作物,特别是种植在放射性土壤中的农作物,可能含有较高的放射性物质。
食品添加剂中的聚山梨酸酯80和富含蛋氨酸的高蛋白饮食可以破坏肠道菌群的生态平衡,降低微生物多样性,并增加致炎细菌的丰度,这可能会加剧辐射引起的肠道损伤。
藻青蛋白(phyco⁃cyanin)可调节小鼠肠道微生物群组成,增加有益菌,减少有害细菌,进而降低 LPS 水平和抑制TLR4/Myd88/NF-κB通路的激活,下调炎性细胞因子的表达,使小鼠免受高剂量辐射损伤。
DIM是一种天然的小分子化合物,可减轻全腹部辐照引起的小鼠死亡或体质量减轻状况,提高辐照小鼠 Lgr5 +小肠干细胞的存活率及抗氧化酶 Nrf2 的表达,清除 ROS,缓解小肠内DNA损伤和细胞凋亡;DIM也可恢复辐射引起的肠道菌群失调现象,并表现出了通过调节菌群减轻辐射损伤的作用。
戊酸补充显著提高了辐照小鼠的存活率,保护了造血器官,改善了辐照小鼠的胃肠道功能和肠上皮完整性;戊酸对于肠炎的保护作用也不局限于放射性肠炎,还可用于DSS等化学物诱导的其他类型肠炎的保护。
中药复方凉血固元汤能有效调节 11 Gy 60Co-γ 全身照射引起的大鼠肠道菌群结构失调,改善大鼠生存质量。
黄芩素通过重新平衡肠道微生物群和抑制细胞凋亡来改善电离辐射引起的损伤。黄芩素改善了小鼠暴露于红外线后的肠道结构以及增殖和再生的能力,其中肠道微生物组成的重新平衡发挥了重要作用。黄芩素抑制p53的激活以及p53介导的肠道线粒体凋亡和死亡受体凋亡。黄芩素还改善电离辐射引起的造血系统损伤。
当归多糖对SD大鼠电离辐射诱发肠道屏障损伤具有一定的预防作用。当归多糖各组大鼠骨髓有核细胞计数,白细胞计数,Occludin蛋白高于模型组(P<0.05),Nrf2蛋白低于模型组(P<0.05),HE染色可见肠绒毛损伤轻于模型组(P<0.05),肠道菌群失调轻于模型组。
枸杞果实提取物(LBE)重建了辐射小鼠的肠道菌群,提高了潜在有益属的相对丰度,如Turicibacter和Akkermansia,并降低了潜在有害属的相对丰度,如Rikenellaceae。
槲皮素可以通过调节肠道菌群和降低炎症细胞因子水平来减少辐射性肠道疾病。
小球藻是一种单细胞绿藻,叶绿素含量非常高,已被证明可以中和体内的毒素,通常在汞中毒时使用。暴露于辐射时服用推荐剂量的小球藻是加速排毒的好方法。
水果中各种植物化学物质的辐射防护作用研究

编辑
Raghu SV, et al., Food Funct. 2023
低强度运动
与跑步相比,步行是一种更舒适、更可行的运动方式,对于接受放疗的虚弱患者来说可以接受。步行可减轻小鼠辐射引起的胃肠道损伤,受短期步行治疗的小鼠在属水平上表现出Dubosiella、拟杆菌属、A. muciniphila和乳杆菌属的优势,A. muciniphila可能是步行辐射防护的关键,增强步行治疗的辐射防护作用。
减少直接接触时长
避免在受污染区域长时间游泳、潜水、捕鱼等活动。如果必须在这些区域活动,应尽量缩短接触时间,减少潜水深度。
避免直接沾染雨水
放射性的粉尘和水蒸气在大气中随着气流传播,可传播到很远的地方,尤其是进入平流层,通过雨水落到地面。因此,在下雨天,尽量避免直接沾染雨水。
关注官方信息
密切关注官方相关机构发布的关于核污水排放的最新信息和指导方针。这些机构会提供有关食品安全和辐射风险的相关信息。
注意,以上信息是基于引用的研究论文,仅供参考。具体的治疗方案和应用建议应由专业医生或研究人员进行评估和制定。同时,日常生活中尽可能避免食用受污染区域产地的食品。
关于核污水排放:
核污水排放可能对环境和人类健康造成潜在风险。然而我们在担忧的同时,也不必为此陷入过度焦虑。听从中国海洋监测和质检部门的意见,相信他们会严密跟踪中国沿海水质的变化,一旦放射性物质超标,影响海产品的安全,他们会发出警告并采取相应的更为专业的措施。
相信国家监测部门的实时通报,关注相关的科学研究和专业意见,支持环境保护措施的加强。通过健康的饮食、良好的生活习惯和积极的心态来保护自己和家人。重要的是保持平衡,不让担忧阻碍我们享受生活的美好和追求自己的梦想。
关于辐射:
动物模型和临床试验已经用于探索辐射对肠道菌群的影响。辐射引起的菌群失调可以进一步促进宿主的辐射损伤和炎症。因此,肠道菌群的组成、多样性和丰度、有害菌富集等可以作为测量辐射暴露的生物剂量的新潜在生物标志物反应,并为后续辐射环境下的人体健康提供辅助评估和干预指导。
随着肠道菌群研究的深入,未来益生菌/益生元、菌群药物以及粪菌移植等产品及治疗方法,不仅能助健康人(或患者)建立良好的肠道微生态,也有可能达到减轻辐射损伤的目的。这些提示了未来以肠道菌群为基础的精准医疗的必要性。
相关阅读:
分享 | 肠道菌群和粪便菌群移植治疗炎症性肠病 – 罗马共识
主要参考文献
Azizova T, Briks K, Bannikova M, Grigoryeva E. Hypertension Incidence Risk in a Cohort of Russian Workers Exposed to Radiation at the Mayak Production Association Over Prolonged Periods. Hypertension. 2019 Jun;73(6):1174-1184.
Guo H, Chou WC, Lai Y, Liang K, Tam JW, Brickey WJ, Chen L, Montgomery ND, Li X, Bohannon LM, Sung AD, Chao NJ, Peled JU, Gomes ALC, van den Brink MRM, French MJ, Macintyre AN, Sempowski GD, Tan X, Sartor RB, Lu K, Ting JPY. Multi-omics analyses of radiation survivors identify radioprotective microbes and metabolites. Science. 2020 Oct 30;370(6516):eaay9097.
Yu Y, Lin X, Feng F, Wei Y, Wei S, Gong Y, Guo C, Wang Q, Shuai P, Wang T, Qin H, Li G, Yi L. Gut microbiota and ionizing radiation-induced damage: Is there a link? Environ Res. 2023 Jul 15;229:115947.
Fernandes A, Oliveira A, Soares R, Barata P. The Effects of Ionizing Radiation on Gut Microbiota: What Can Animal Models Tell Us?-A Systematic Review. Curr Issues Mol Biol. 2023 May 2;45(5):3877-3910.
Liu D, Zhuang B, Wei M, Yuan T, Li J, Deng P, Du L, Yuan B, Jin Y. Oral konjac glucomannan for prevention of ionizing radiation-induced injury by regulating gut microbiota and increasing short chain fatty acids. Int J Biol Macromol. 2023 Jun 15;240:124402.
郑颖,殷祥昶,赵阳,等.电离辐射对肠道菌群的影响及基于菌群调节的辐射防护研究进展[J].中国药理学与毒理学杂志, 2020, 34(7):10.
Kamiya K, Ozasa K, Akiba S, Niwa O, Kodama K, Takamura N, Zaharieva EK, Kimura Y, Wakeford R. Long-term effects of radiation exposure on health. Lancet. 2015 Aug 1;386(9992):469-78.
Tonneau M, Elkrief A, Pasquier D, Paz Del Socorro T, Chamaillard M, Bahig H, Routy B. The role of the gut microbiome on radiation therapy efficacy and gastrointestinal complications: A systematic review. Radiother Oncol. 2021 Mar;156:1-9.
Raghu SV, Rao S, Kini V, Kudva AK, George T, Baliga MS. Fruits and their phytochemicals in mitigating the ill effects of ionizing radiation: review on the existing scientific evidence and way forward. Food Funct. 2023 Feb 6;14(3):1290-1319.

谷禾健康

微量营养素缺乏或称之为“隐性饥饿”,是目前一个严重的公共卫生问题,会对儿童发育及成人健康造成严重后果。
传统的治疗和预防方法,有些时候并是很有效,并且可能产生不良副作用(例如补铁引起的消化问题)。
★ 肠道细菌与微量营养素间存在重要的相互作用
许多研究发现肠道中的共生细菌可以增加特定微量营养素的生物利用度,特别是通过去除抗营养化合物(例如植酸盐和多酚),或通过合成维生素。
肠道黏膜是抵御病原体的第一道防线。肠黏膜微生物群有助于增强肠上皮的完整性并更好地吸收微量营养素。
细菌代谢还依赖于从肠道环境中获取的微量营养素,常驻细菌可能会竞争或协作以维持微量营养素稳态。因此,肠道微生物群的组成可以通过微量营养素的可用性来调节。

本文汇集了有关微量营养素和肠道微生物群之间双向关系的最新知识,重点关注铁、锌、维生素A和叶酸(维生素B9),因为这些缺乏症是全球范围内的比较严重的公共卫生问题。
目录
1.微量营养素缺乏
2.微量营养素与宿主健康
3.营养素与细菌的相互作用:以铁为例
4.细菌在锌生物利用中的作用
5.微生物群与宿主叶酸间的关联
6.微生物群与维生素A的相互作用
7.改善人体微量营养素的建议
8.结语
微量营养素,包括矿物质和维生素,是每天只需要少量的物质,但对人体代谢至关重要。
▼
微量营养素缺乏在全世界范围内非常普遍,最新估计表明,3.72亿学龄前儿童和1.20亿育龄非孕妇缺乏一种或多种微量营养素。
维生素和矿物质缺乏,也被称为“隐性饥饿”,是一个严重的公共卫生问题,世界各个国家都存在,特别是低收入和中等收入国家的弱势群体。
在全球范围内,三分之二的妇女和儿童(主要来自经济不发达家庭)的饮食中至少缺乏一种微量营养素。全球最普遍的微量营养素缺乏症包括铁、锌、维生素A和叶酸。
★ 微量营养素缺乏会导致不良健康结果
微量营养素缺乏与多种不良健康结果相关,例如儿童发病率和死亡率增加、贫血、发育迟缓和认知缺陷。
虽然存在多种改善个人或人群微量营养素状况的策略,其中主食强化被认为是改善人群微量营养素状况最具成本效益的干预措施。
然而,由于多种原因,应对微量营养素缺乏症的策略并不总是有效。包括可接受性差(例如,孕妇铁补充剂)、强化水平差和质量控制不足(例如,维生素A强化食用油),强化食品未能惠及最贫困人群。
★ 不同营养素的吸收具有差异
微量营养素的吸收主要发生在小肠中,根据微量营养素的不同,具有不同的机制。
例如,锌和铁主要通过特定的运输载体在十二指肠和空肠中吸收,这些运输载体针对每种矿物质及其形式而异,而叶酸不仅在小肠中被吸收,而且在结肠中也被吸收,因为在这两个部位都鉴定出了转运蛋白。
微量营养素的吸收差异很大,例如,铁充足的男性成年人吸收的铁摄入量不到5%,而正常条件下摄入的锌吸收量大于30%。
注:大部分摄入的微量营养素会到达结肠。
★ 微生物群与微量营养素之间存在相互作用
在消化道中,有一个复杂的微生物群落,其浓度和多样性从口腔到结肠不断增加。尽管含有其他微生物(病毒、真菌),但大多数研究都重点关注细菌,其中厚壁菌门、拟杆菌门、放线菌门、变形菌门和疣微菌门是最重要的。
粪便细菌组成在个体之间存在很大差异,并且不仅取决于宿主的遗传学,还取决于包括饮食在内的许多环境因素。
注:大多数关于食物对肠道微生物群影响的研究都集中在大量营养素(脂肪、碳水化合物、蛋白质)上。
然而,细菌需要微量营养素才能生存。例如,细菌需要外部来源的铁,其中一些甚至开发出特定的机制,例如转铁蛋白来竞争铁源。
相比之下,许多细菌可以直接合成维生素,例如叶酸(维生素B9),因此不一定需要外部来源。
细菌影响微量营养素的生物利用度
常驻细菌可能对微量营养素产生直接作用,影响其对宿主的生物利用度,或者产生间接作用,例如通过产生能够改善上皮健康的代谢物,从而导致更好的吸收。
微量营养素影响肠道细菌的组成和功能
微量营养素的消耗反过来会影响肠道细菌的组成和功能。事实上,事实证明,补充铁可以导致潜在致病性肠杆菌科细菌的增加,以及被认为对健康具有积极影响的双歧杆菌科细菌和乳杆菌科细菌的减少。
微量营养素在控制人类健康的新陈代谢和组织功能维持中发挥着核心作用。
然而,尽管人们努力通过补充食品和饮食多样化来增加微量营养素的摄入量,全球微量营养素缺乏症的患病率仍然非常高,包括工业化国家。
推荐营养素摄入量和摄入上限
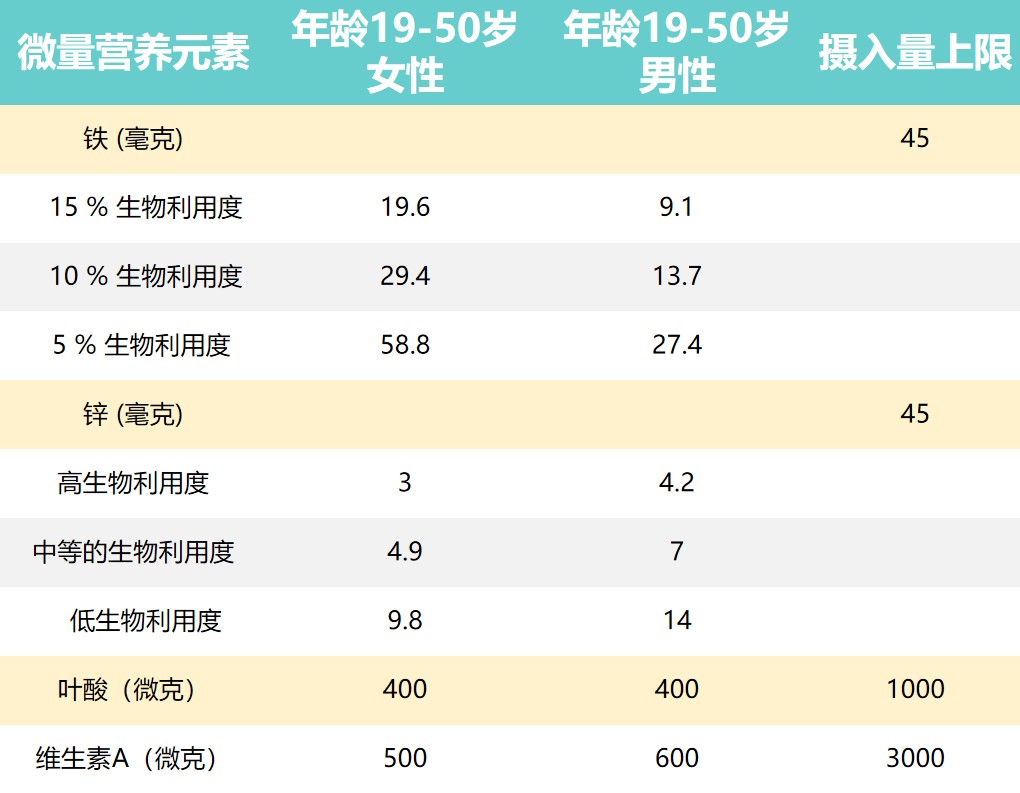
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
上表提出了男性和女性一些推荐营养素摄入量和可耐受的上限摄入水平。
由于维持生长和补偿损失(例如月经)的需求更高,儿童和妇女受到的影响更大。
★ 缺乏微量营养素的症状多样且大部分在晚期
单一微量营养素缺乏的临床症状多种多样,并且通常是具有微量营养素特异性的,但一般发生在缺乏的晚期阶段。例如缺铁性贫血是缺铁的最后阶段。
▼
缺铁被认为是最常见的微量营养素缺乏症,全世界估计有超过20亿人缺铁。它会导致贫血、免疫功能受损、工作能力下降以及内分泌功能受损。
导致铁缺乏的因素包括:
(1)血红素铁摄入量低,其生物利用度高于非血红素铁
(2)富含植酸酶或酚类化合物的饮食会降低生物利用度
(3)慢性炎症,导致铁调素水平升高,下调铁吸收
▼
据估计,全球有超过10亿人缺锌,它与儿童生长迟缓相关,但也会降低免疫能力,从而增加儿童对多种疾病的易感性,包括腹泻、肺炎,也许还有疟疾。
此外,锌缺乏似乎会导致其他微量营养素缺乏。
▼
据估计,低收入和中等收入国家超过20%的育龄妇女缺乏叶酸。
怀孕期间叶酸摄入不足与胚胎最初几周的神经发育缺陷有关。在普通人群中,叶酸缺乏还会导致巨幼红细胞性贫血和神经系统症状,这些症状与维生素B12缺乏症的症状部分重叠。
▼
维生素A缺乏不仅会导致干眼症和失明,还会影响免疫功能的许多方面,导致免疫能力下降以及皮肤和上皮完整性降低。
许多低收入和中等收入国家每半年向5岁以下儿童提供高剂量维生素A补充剂,以降低儿童死亡率,但这种干预措施的有效性受到质疑。
有关铁、细菌和宿主的相互作用,参考了最近的研究,下面总结了这种复杂关系的关键要素。
铁的吸收和稳态受到严格调节
由于人类无法主动排泄铁,因此铁的吸收在十二指肠中受到严格调节。
// 血红素铁
血红素铁和非血红素铁通过两种不同的途径吸收,血红素铁被十二指肠刷膜边缘的血红素载体蛋白1(HCP1) 吸收。
// 非血红素铁
非血红素铁通常呈三价铁形式,不具有生物利用度,必须通过十二指肠细胞色素b(DCYTB) 将其还原为二价铁形式,然后再由二价金属转运蛋白 (DMT1) 转运到十二指肠刷膜上 。
注:二价金属转运蛋白的存在已被描述,铁也在回肠和结肠中被吸收,但这些吸收位点对宿主铁状态的贡献仍不清楚。
铁进入肠上皮细胞后,储存在铁蛋白中,或通过基底外侧铁转运蛋白输出到循环系统中。
铁稳态由激素铁调素调节,铁调素通过不同机制抑制铁释放到血浆中。
铁调素是由肝脏合成并分泌的富含半胱氨酸的抗菌多肽,在免疫过程中能够大量表达参与免疫反应;在机体内铁平衡的调节中起到负性调节的作用。
肠道微生物群在铁吸收中的作用示意图
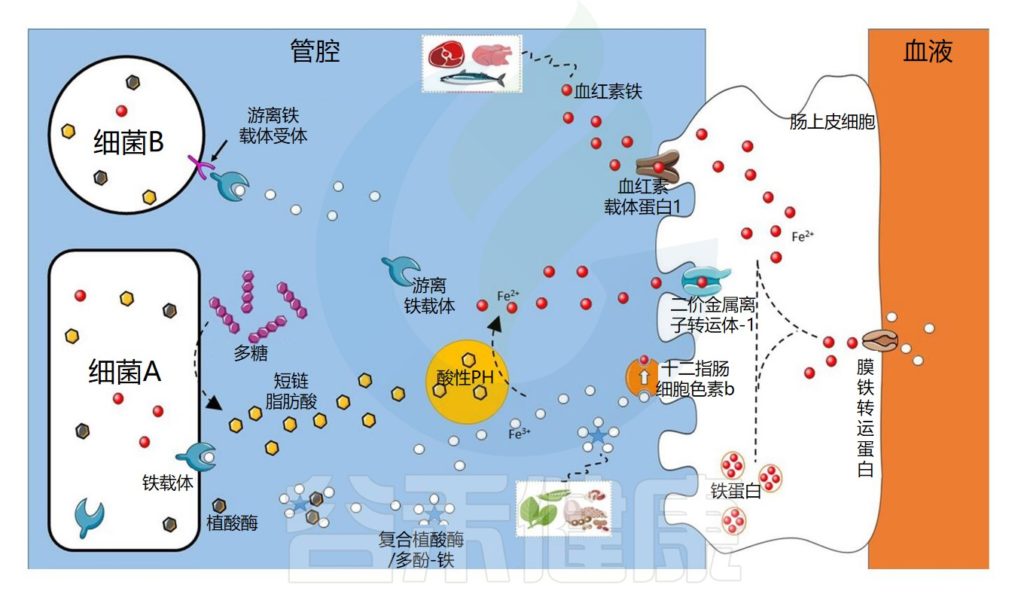
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
细菌可以通过不同的机制获取铁
细菌可以通过不同的机制获取铁,例如使用称为铁载体的铁特异性螯合剂,铁载体是化学性质多样的次级代谢产物,对铁具有高亲和力。
由此产生的铁-铁载体复合物通过特定的外膜蛋白(上图中的细菌A)内化。细菌还可以通过产生具有不同配体结合位点的外膜受体来利用其他细菌产生的铁载体(上图中的细菌B)。
铁载体在细菌缺铁的情况下表达
铁载体在细菌缺铁的情况下表达,因此不在铁充足的环境中表达。在厌氧条件和低pH值下,铁主要以二价铁的形式存在,可以被细菌直接转运,主要通过专用转运系统Feo,由不同的蛋白质。
细菌可以利用宿主铁化合物
细菌还可以利用宿主铁化合物,例如血红素或转铁蛋白,它们通过特定受体转运或直接吸收。此外,尽管牛奶中存在的乳铁蛋白具有抑菌功能,但它也可以被具有特定受体的细菌利用。
铁吸收的调节对于细菌非常重要,因为铁在较高浓度下有毒。在许多细菌物种中,当铁浓度过高时,铁吸收调节蛋白 (Fur) 会抑制与铁吸收相关的基因转录。
研究细菌有助于揭示新的铁吸收途径
值得注意的是,大部分关于细菌铁吸收的知识来自对病原菌的研究。长期以来,人们一直认为一些有益菌,例如乳杆菌科的成员,不需要铁来生长。然而已经在植物乳杆菌(Lactiplantibacillus plantarum)和清酒乳杆菌(Latilactobacillus sakei)中鉴定出了特定的系统。
研究这些细菌可能会揭示新的铁吸收途径。在铁吸收的主要部位十二指肠中,大约有103 个细菌/克,低于空肠(104 个细菌/克),并且远低于结肠,结肠中的细菌数量高达1012 个细菌/克。
此外,乳杆菌科属的成员在铁吸收最多的小肠中数量众多,因此这些细菌对宿主铁吸收的作用应受到更多关注,以确定它们是否在铁的生物利用度中发挥作用。
▼
铁对于许多细菌来说是必需的,它们的生长需要铁。
据计算,结肠中的铁浓度很高,并且远远超过细菌生长的最低要求。但细菌对铁的生物利用度还取决于一系列因素(铁的形式、铁形态、pH值、氧气水平等)。
不同形式的铁可用于补充或强化,例如硫酸亚铁、富马酸亚铁或乙二胺四乙酸铁钠。由于铁补充剂中含有的铁明显多于人体可以吸收的铁,因此大量未吸收的铁会留在消化道内腔中。
•铁补充剂会导致潜在致病菌水平升高
多项人类研究表明,铁补充剂或强化铁会导致潜在致病菌水平升高,并导致通常被认为是有益细菌种类减少,例如乳杆菌科成员。
最近一项针对大鼠的研究还表明,出生后补充铁会导致肠道微生物群发生改变,这种改变会持续到成年期。此外,研究表明,抗生素治疗后服用铁剂会导致肠道细菌的组成和功能发生改变。
铁对于致病细菌至关重要,哺乳动物的免疫系统已经具备了通过表达铁结合蛋白(如脂质运载蛋白-2 或乳铁蛋白)来控制细菌对铁的可用性的能力,这种现象称为“营养免疫”。
研究了补充铁对肠道微生物群的作用,总的来说,根据所使用的模型(体外、动物或人类),结果似乎有很大不同。
事实上,在补充铁期间,乳杆菌科总是减少,这在体外、小鼠和婴儿中均观察到。所用铁的化学形式似乎对细菌组成有不同的影响。此外,出乎意料的是,补充铁的效果与缺铁的效果并不直接相反。
▼
对于细菌和人体来说,非血红素铁的生物利用度低于血红素铁的生物利用度,因为它受到食物基质的成分和管腔的物理化学成分的影响。
•肠道细菌有助于更好地吸收铁
事实上,许多食物基质中的非血红素铁与抑制剂(例如多酚、纤维或植酸盐)相连,这些抑制剂可以被专用细菌酶降解,从而导致更好的铁吸收。
细菌还可以通过发酵饮食中的不可消化碳水化合物来产生短链脂肪酸,这会降低管腔pH值,从而将三价铁还原为二价铁,从而提高其被细菌和宿主的吸收。
其他一些有机酸(例如乳酸)是由许多细菌产生的,存在于整个消化道中。酸化的肠道环境还可以降解螯合微量营养素的复合物并促进铁的吸收。
扩展阅读:
▼
考虑到补铁的依从性低以及腹泻或便秘等副作用,很多研究已经测试和发现其他改善铁状态的策略。
它们包括使用益生菌、益生元和后生元等。
•使用益生菌改善铁状况
例如,将益生菌植物乳杆菌(Lactiplantibacillus plantarum 299v)与铁、抗坏血酸和叶酸一起食用,对健康、非贫血的瑞典孕妇的铁状况是安全的,可减少铁储备的损失并改善铁状况。
在另一项研究中,将果胶组装成铁纳米颗粒作为基质,用于植物乳杆菌(Lactiplantibacillus plantarum CIDCA 83114)的递送。益生菌没有毒性,生存能力没有减弱,这为用替代的铁输送策略对抗缺铁提供了新的视角。
•使用益生元帮助铁的吸收
在大鼠模型中,食用益生元寡糖通过调节肠道微生物群来增强铁吸收。摄入益生元后肠道pH值的降低可以帮助铁的吸收,此外还能以有益的方式改变肠道微生物组成。因此,益生元可以成为改善宿主铁状况的良好选择。
•食用乳铁蛋白增加铁的吸收
在肯尼亚婴儿中,研究表明,与单独服用硫酸亚铁相比,同时食用无铁乳铁蛋白(脱铁乳铁蛋白)和硫酸亚铁能够显著增加铁的吸收。
注:考虑到乳铁蛋白对肠道微生物群的影响,一些学者认为乳铁蛋白可能在婴儿铁配方中有用,因为它可以增加铁的吸收,同时可能减轻未吸收的铁对肠道微生物群的不利影响。
•使用富铁微生物
这些预防和治疗缺铁的新策略可能包括使用富铁微生物,除了从益生菌摄入中获益之外,它还可以为宿主提供大量矿物质。
在贫血小鼠中已显示,食用在铁存在下生长的酵母能够提高小鼠的血红蛋白浓度。在人类中只进行了一些尝试,其中含有富铁酵母的奶酪的吸收效率不如单独含有硫酸铁的奶酪。
注:还应该进行补充研究来评估富铁微生物在人类中的应用的全部潜力。
小结
从上面可以明显看出,肠道细菌在调节宿主铁的生物利用度方面发挥着重要作用。然而,宿主因素可以调节细菌对铁的吸收,例如,在炎症的情况下,脂质运载蛋白将与铁载体结合,从而对抗肠道细菌对铁的捕获。
最近,有人提出,共生细菌不仅使用不同的机制来释放和捕获铁,而且还在它们自己和它们的宿主之间共享铁。事实上,细菌扩散性铁载体生产的例子可以捕获铁,但不能保证这些铁将被生产细菌利用,这表明对可用铁的共同管理。
迄今为止,人类对锌、宿主和肠道微生物群之间相互作用的研究远少于铁。
★ 人体需要每日摄入锌
每日摄入锌补充剂,成人 40 毫克/天,通常被认为是安全的。
锌参与DNA合成、转录和翻译等重要过程。锌的吸收发生在十二指肠,涉及跨膜锌转运蛋白Zip4。然后,锌通过锌调节蛋白ZnT2-10转运至金属蛋白合成位点,或通过锌转运蛋白ZnT1输出至循环系统。
与铁相反,哺乳动物缺乏锌储存机制,每日摄入是必不可少的。如果过量,锌也可以主动排泄,锌通过基底外侧的 Zip5/Zip14 蛋白从循环分配到肠上皮细胞,并通过ZnT5从肠上皮细胞流出到管腔。
肠道微生物群在锌吸收中的作用示意图
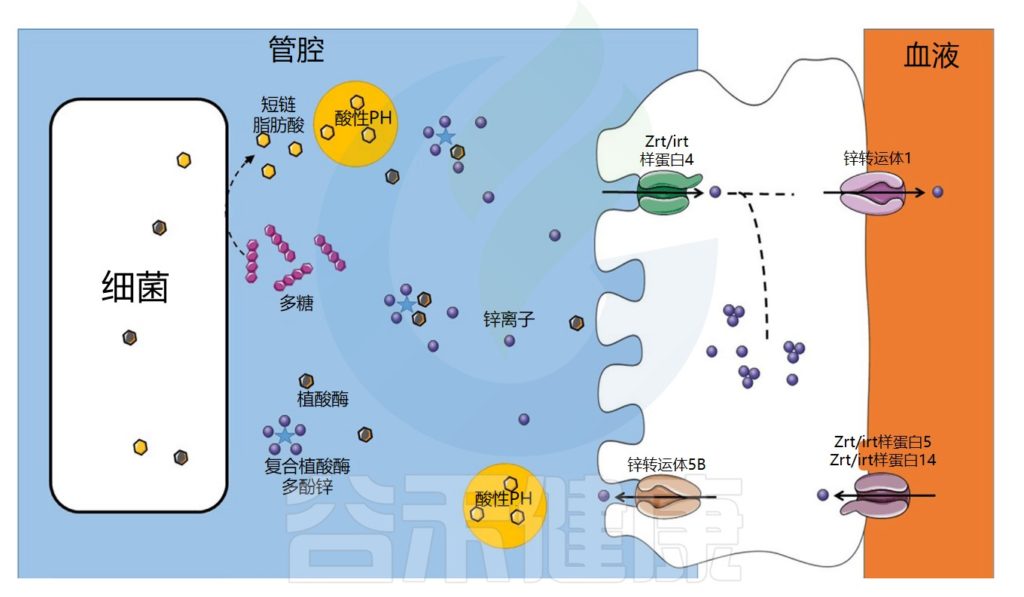
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
锌的转运与吸收过程
在食物中,锌可以与抗营养因子如植酸盐或多酚络合,从而减少其吸收。未被小肠吸收的锌会到达结肠,并可能被结肠细胞吸收,因为锌转运蛋白也在结肠中表达。
在细菌中,锌通过锌伴侣蛋白转运至金属蛋白合成位点。细菌对锌的吸收受锌吸收抑制因子Zur和锌流出抑制因子CzrA的调节。一些病原菌可以通过表达高亲和力转运蛋白(ZnuABC)来克服锌限制条件。
锌浓度过高可能对某些病原菌有毒。与铁的情况一样,宿主和病原微生物之间也存在竞争。事实上,宿主还利用营养免疫来通过产生钙卫蛋白来限制锌的生物利用度。
例如,钙卫蛋白在消化道中结合锌。
▼
锌缺乏与慢性腹泻相关。补锌对肠道微生物群的影响主要在动物模型中进行研究。它已在家禽和养猪业中以药物剂量用于减少胃肠道感染和腹泻。
√锌具有抗菌活性,能够减少腹泻
锌具有抗菌活性,不同的研究强调了高剂量的锌会引起肠道不同部位(从胃到结肠)细菌组成的变化。
在断奶仔猪中,使用低剂量的锌可以通过改善小肠形态和通透性、增强屏障功能,有效促进生长性能并减少腹泻。
此外,锌还能丰富肠道微生物群中的链球菌科(Streptococcaceae)和乳杆菌科(Lactobacillaceae),并减少芽孢杆菌和肠道疾病相关病原体,包括回肠腔中的梭状芽胞杆菌和克罗诺杆菌。
注:如果缺锌小鼠补充锌是有益的,那么过量的锌饮食摄入会改变肠道微生物群并降低对艰难梭菌感染的抵抗力。
√一些菌属可以预测锌的充足性
但研究结果并不一致。事实上,一项针对鸡的研究表明,瘤胃球菌属(Ruminococcus)可以预测宿主体内锌的充足性。但在一项针对小鼠的研究中,黑色素杆菌(Melainabacteria)和脱硫弧菌属(Desulfovibrio)被确定为锌状态的潜在标志物。
▼
尽管许多代谢过程都需要锌,但关于锌状态或补充剂对肠道微生物群影响的研究却很少。
√一些细菌可以作为锌缺乏的生物标志物
最近的研究表明,尽管缺锌和锌充足的学龄儿童之间的细菌多样性相似,但缺锌儿童的个体多样性更高。特别是,粪杆菌(Coprobacter)、醋酸弧菌(Acetivibrio)、副普雷沃氏菌(Paraprevotella)和梭状芽胞杆菌在缺锌组中更为丰富。它们可以用作进一步临床诊断锌缺乏的生物标志物,但需要更多的工作来推广这一结果。
锌的摄入量也会显著增加儿童粪便细菌。在同一项研究中还鉴定出了纳米颗粒抗性细菌的一些代表。
▼
由于补锌会改变肠道微生物群的组成和功能,因此许多研究已经研究了锌与益生菌一起服用的效果。
√锌与益生菌一起补充
例如,在大鼠中,施用在富锌培养基中生长的长双歧杆菌(Bifidobacterium longum CCFM1195)比单独补充锌更能有效地增加血浆锌浓度。
此外,一些细菌群(如乳杆菌科)的丰度随着富含锌的双歧杆菌的消耗而增加。使用富含硒和锌的植物乳杆菌对小鼠进行类似的设计,与对照组或补充硒锌的组相比,能够增加循环锌浓度。这种增加伴随着肠道细菌组成的改变,乳杆菌科(Lactobacillaceae)的比例增加。
√儿童单独补充锌可能更有效
最近总结了研究中获得的数据,对于24个月以下儿童的治疗,单独补充锌可能比益生菌更有效;在学龄前儿童中同时补充锌和植物乳杆菌并不比单独补充益生菌更有效。因此,锌和益生菌联合给药的有效性需要更多的人体研究。
使用益生元似乎效率较低,因为给猪施用锌和马铃薯纤维对大多数分析指标没有显示出任何交互作用。
注:锌源和纤维补充对微生物群生态的影响是独立的。
小结
与铁的情况一样,对锌状态和宿主微生物群的研究主要集中在致病条件上,而对细菌在正常情况下的作用知之甚少。
肠道细菌、锌和宿主之间的关系值得更深入地研究,尤其是在人类中。事实上,富锌益生菌等有前途的工具正在出现,它们代表了治疗锌缺乏症的替代方案。特别是大剂量、长期补锌可能会干扰铁和铜的吸收,导致铁和铜的缺乏。
叶酸,也可以称之为维生素B9,是一种水溶性维生素。叶酸在蛋白质合成及细胞分裂与生长过程中具有重要作用,对正常红细胞的形成有促进作用。
一些共生细菌已被证明可以合成某些维生素,细菌也可以成为宿主叶酸的来源,即使整体贡献的程度不清楚。同时,叶酸的摄入会影响肠道微生物群。
叶酸的转运与吸收过程
饮食中的叶酸以单谷氨酸盐和聚谷氨酸盐形式存在,它们被肠道结合物分解为单谷氨酸盐形式,然后通过特定的转运蛋白偶联叶酸转运蛋白(PCFT)在回肠中吸收。
在肠上皮细胞中,叶酸单谷氨酸转化为活性形式5-甲基四氢叶酸(5-MTHF),它可以被运输到循环系统。
注:细胞叶酸外排可能由多个耐药蛋白(MRPs)家族介导。在结肠中,已经发现了相同的一种受体。
肠道微生物群在叶酸吸收中的作用示意图
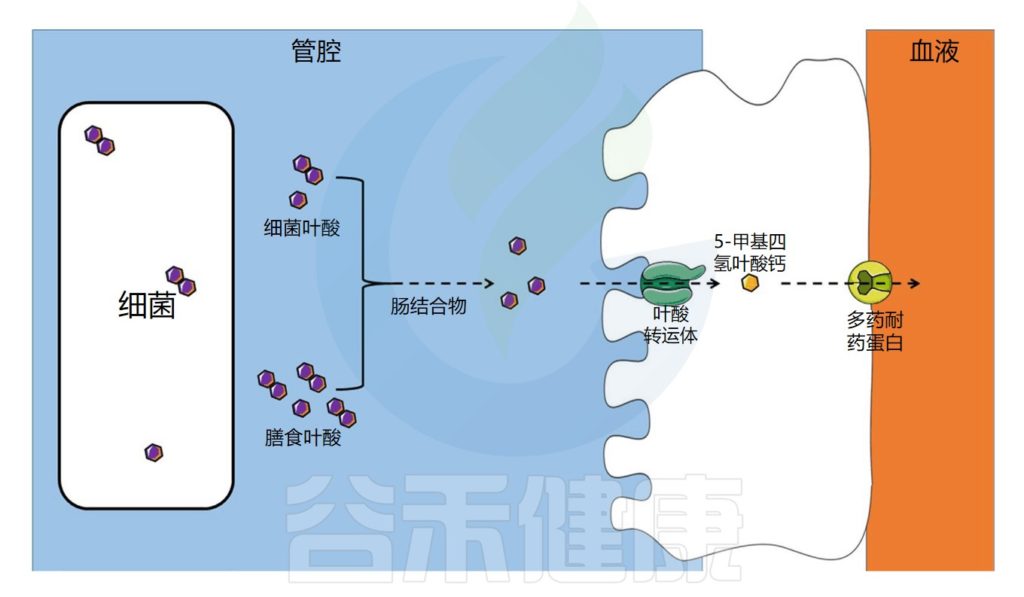
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
▼
细菌的生长需要叶酸,一些细菌是原养型细菌,可以从环境中存在的前体合成叶酸,而营养缺陷型细菌必须从环境中获取叶酸。
✦肠道细菌合成叶酸
大量文献支持细菌叶酸合成对宿主叶酸状态的重要贡献。早期研究报告称,人类粪便样本中的叶酸浓度为300-500µg/天,而饮食摄入量低于100µg/天,表明肠道细菌可以合成叶酸。
事实上,512个细菌基因组的叶酸生物合成能力预测表明,其中13%的细菌基因组包含所有叶酸生物合成相关基因,而39%的细菌基因组可以在外部来源提供额外的对氨基苯甲酸的情况下合成叶酸。
总而言之,这些数据表明肠道微生物群是叶酸的重要来源,并且饮食等不同因素导致的肠道微生物群组成的变化可能会影响叶酸的需求。
✦肠道细菌可以转化叶酸以便更好地利用
由于纤维消耗而改变肠道微生物群组成可能导致结肠内容物或循环中叶酸浓度增加。此外,尽管结肠中的叶酸吸收比小肠中的叶酸吸收慢100倍,但标记的叶酸被专门包裹在结肠中并在结肠中分解,并被纳入宿主组织。
肠道细菌不仅合成可供宿主使用的叶酸,还可以将叶酸转化为更好地被宿主吸收的维生素体,正如秀丽隐杆线虫(Caenorabditis Elegans)模型所证明的那样,其中细菌可以将叶酸转化为四氢叶酸。
✦微生物代谢叶酸的能力与宿主生理状况相关
肠道微生物群的代谢能力不仅取决于其组成,还取决于宿主的生理特征。例如,与成人相比,婴儿和幼儿肠道微生物群中更频繁地发现编码参与叶酸生物合成的酶的基因。
有趣的是,受营养不良影响的儿童的微生物组显示,参与B族维生素代谢的多个途径中的基因丰度显著降低。此外,在肥胖女性中观察到叶酸水平较低,同时产生B族维生素的细菌也减少。
▼
许多产生叶酸的细菌被鉴定并成功用于增加发酵食品的叶酸含量。其中一些细菌还能够改善缺乏叶酸饮食的啮齿动物的叶酸状况。
✦产生叶酸的益生菌改善叶酸状态并调节微生物组成
使用产生叶酸的益生菌可能是改善叶酸状态并调节肠道微生物群的一种方法。在体外发现了有希望的结果,其中产生叶酸的清酒乳杆菌(Latilactobacillus sakei)被证明可以增加短链脂肪酸并改变粪便细菌组成。
在大鼠中,食用使用产生叶酸的植物乳杆菌制备的发酵奶能够恢复正常的叶酸状态,同时广泛改变肠道细菌组成。
▼
叶酸摄入量对肠道细菌的影响并不一致。
✦叶酸缺乏可能影响部分动物的肠道细菌组成
在小鼠身上发现膳食叶酸缺乏不会影响肠道细菌组成,可能是一些细菌可以在缺乏时产生叶酸,叶酸摄入量的波动对肠道微生物群的影响较小。
然而,在其他动物模型中,叶酸摄入改变了肠道微生物群的组成,例如鸡和小猪。
✦叶酸缺乏影响微生物多样性
叶酸缺乏也会影响微生物多样性,因为在限生小鼠中发现,与微量营养素充足的饮食相比,叶酸缺乏的饮食在21天后增加了β多样性,但随后的14天全饮食治疗并没有改变这一趋势。
小结
宿主的叶酸状态、食物或肠道中的叶酸产生细菌之间存在多种关联。这种关联通常是矛盾的,但有利于宿主和细菌区室之间的密切相互作用,这表明需要进行大规模人类研究,以更好地了解与叶酸可用性和改善人群叶酸状态的策略相关的宿主-微生物群相互作用。
叶酸重要天然来源有:
花生(246微克/100克)、葵花籽(238微克/100克)、芦笋(149微克/100克)、生菜(136微克/100克)、一些绿叶蔬菜和柑橘类水果等。
扩展阅读:维生素B9(叶酸)
维生素A在免疫调节中发挥着至关重要的作用,包括调节细胞因子的产生和淋巴细胞归巢至粘膜表面。它通过调节肠上皮中免疫细胞的增殖和分化,直接有助于维持肠道屏障,并在抵抗肠道病原体入侵方面发挥着至关重要的作用。
膳食维生素A以视黄醇和类胡萝卜素的形式存在,分别存在于动物和蔬菜中。
肠道微生物群在维生素A吸收中的作用示意图
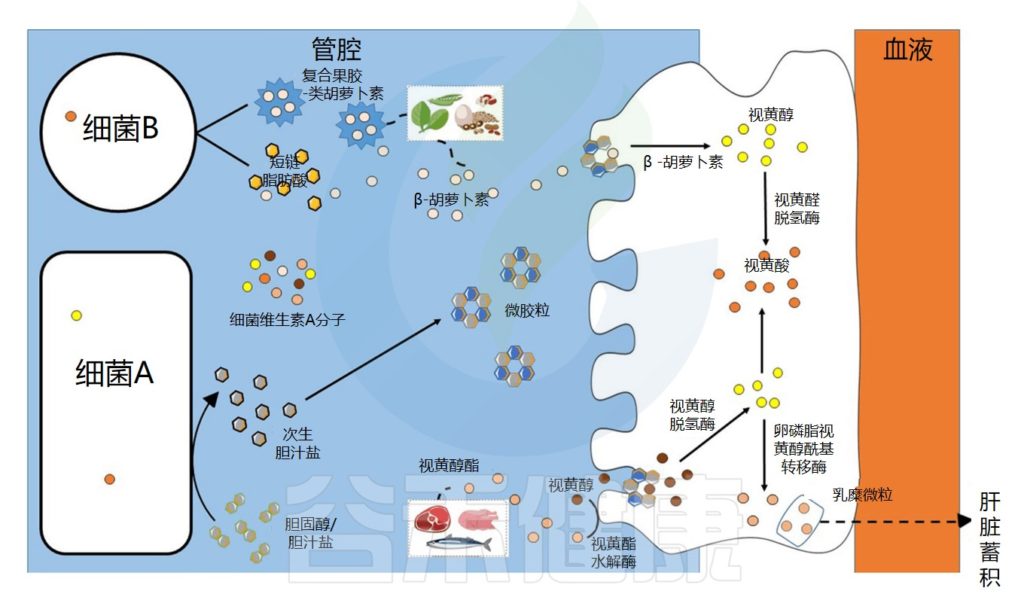
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
维生素A的吸收过程
视黄醇和类胡萝卜素是膳食脂溶性成分,在被肠上皮细胞吸收之前需要通过胶束溶解 。在胃和十二指肠中发生乳化成液滴的阶段,类胡萝卜素和视黄醇的摄取发生在小肠的上半部。
在肠上皮细胞中,类胡萝卜素通过胡萝卜素-15,15′-双加氧酶直接转化为全反式视黄醛。视黄醛可被视黄醛脱氢酶不可逆地转化为具有生物活性的视黄酸分子,或被转化为视黄醇酯,储存在肝脏中。
▼
肠道微生物群在维生素A代谢中的作用可能依赖于特定酶、脂多糖的产生,脂多糖可能有助于胶束形成或直接吸收,以及胆汁稳态。
•微生物通过调节胆汁酸有利于维生素A的溶解和吸收
一项以绵羊为模型的研究表明,宿主微生物群通过调节胆汁酸分泌对维生素A吸收产生影响。在该模型中,胆汁酸水平降低与维生素A吸收减少相关,并与瘤胃球菌科丰度密切相关。
由乳杆菌(Lactobacillaceae)、双歧杆菌(Bifidobacterium)、拟杆菌(Bacteroides)或梭菌属等细菌产生的二级或三级胆汁盐的分泌可能有利于维生素A的溶解并改善其吸收,因为胆汁盐对于胶束化过程至关重要。
•肠道微生物可以直接和间接影响维生素A代谢
肠道细菌的基因组具有在动物和植物中发现的不同酶的类似物,这些酶允许乙酰辅酶A通过甲羟戊酸途径合成类胡萝卜素和类维生素A。
此外,来自拟杆菌(Bacteroides)、肠球菌(Enterococcus)和链球菌(Streptococcus)的细菌具有与宿主BCMO基因相似的brp/blh基因,可以将β-胡萝卜素转化为全反式视黄醇。
因此,肠道微生物组对维生素A代谢的影响既包括直接影响(如类胡萝卜素的合成),也包括间接影响(如调节其生物利用度)。
•肠道微生物合成相关蛋白有助于维生素A转运
类胡萝卜素的生物利用度会受到各种食物成分的影响,其中食物基质中蔬菜的细胞壁结构和组成形成物理屏障,从而限制消化酶的作用。
果胶和一些多酚(例如柚皮素)已被证明可以通过结合管腔中的胆固醇和胆汁盐来降低类胡萝卜素的体外生物利用度,从而抑制胶束的形成。
相反,果胶可以被许多共生细菌降解,并且肠道中的这种降解可能会增加类胡萝卜素的生物利用度。
此外,肠道微生物群合成酶或补体蛋白,例如细菌脂质运载蛋白,这可能有助于将类维生素A转运到肠上皮细胞中。
•肠道细菌调节宿主视黄醇的代谢
肠道微生物群可以消化膳食纤维,从而释放 β-胡萝卜素或其他结合态的微量营养素。
此外,肠道细菌群还可以调节宿主视黄醇的代谢,调节驱动免疫反应的视黄酸的产生。梭状芽胞杆菌类细菌可以通过抑制基因Rdh7的表达来调节肠道上皮中的视黄酸浓度,从而启动视黄醇向视黄酸的转化。
此外,这项研究表明,共生细菌群落降低了视黄酸的产生,视黄酸的产生通过肝脏储存形式的增加来平衡,并有利于视黄酯途径,而潜在致病菌则促进视黄酸的产生。
▼
肠道中维生素A的状态和类视黄醇的可用性可以调节肠道微生物的组成。
•维生素A调节免疫球蛋白的产生帮助保持细菌稳态
类胡萝卜素摄入、免疫功能和肠道细菌稳态之间相互作用的模型,表明维生素A可以通过调节IgA的产生来有助于保持细菌稳态。
在动物中,与未缺乏维生素A的小鼠相比,缺乏维生素A的小鼠的肠道微生物组成中,以下菌属的丰度较低:
另一项研究表明,拟杆菌在维生素A缺乏小鼠中的比例较低,维生素A缺乏组和维生素A充足组之间的几个细菌比例不同。在小鼠模型中,维生素A被证明可以调节分段丝状细菌(SFB)的丰度。
分段丝状细菌是一组能够诱导Th17细胞分化的细菌。
▼
•维生素A的摄入与微生物群多样性相关
类胡萝卜素的摄入量和状态与更大的微生物群多样性和有益细菌丰度的增加有关。
例如,在孕妇中,类胡萝卜素的摄入量和血浆浓度与肠道微生物群的α多样性呈正相关。
•维生素A影响免疫反应
维生素A对肠道微生物群组成的调节可能作为调节肠道免疫反应的间接途径。
例如,维生素A在体外和体内均被证明可以抑制诺如病毒(急性胃肠炎最常见的病毒因子)的复制,并且这种抑制似乎是通过微生物组变化直接或间接发生的,特别是肠道中的乳杆菌科。
•改善疾病患者的微生物组成
在溃疡性结肠炎患者中,摄入维生素A有益,可导致微生物群组成发生显著变化。
在自闭症儿童中,维生素A补充剂增加了拟杆菌目细菌的比例,并减少了双歧杆菌属的细菌比例。
有趣的是,一项针对306名孟加拉国新生儿的研究表明,与安慰剂相比,补充维生素A增加了男孩双歧杆菌的丰度,而这种差异在女孩中并未观察到。
对这些婴儿直至2岁的随访表明,女孩中放线菌相对丰度与血浆视黄醇呈浓度依赖性正相关,但男孩中则不然。
此外,阿克曼菌(一种与粘膜相关的细菌)的相对丰度也与女孩的血浆视黄醇呈正相关。
微生物群在肠道中参与了微量营养素的代谢和吸收,并且可以影响宿主的微量营养素状态。在这方面,给出以下一些建议:
➤ 1
摄入多样化的食物可以为肠道微生物提供更广泛的营养来源,从而促进微生物群的多样性和稳定性。
建议摄入富含膳食纤维的水果、发酵食物、蔬菜、全谷类食物以及富含微量营养素的食物,如坚果和海鲜等。
例如,香蕉钾含量高,还含有大量维生素 B6 和维生素 C。西兰花不仅富含维生素 C,还富含维生素 K、铁、钙和钾。
确保摄入足够的每种维生素和矿物质的一个简单方法就是“彩虹饮食”,彩虹饮食顾名思义就是色彩缤纷的蔬菜和水果,它们含有丰富的微量营养素,是一种健康趋势。每餐可以注意一下,是否有至少三到四种不同颜色的植物性食物,对于孩子,也可以鼓励他们去寻找不同的颜色。

下表列出了常见的维生素的食物来源,可供参考。

➤2
维生素D可以增加肠道对钙的吸收能力,并促进钙的转运到骨骼和其他组织中。
维生素 C 有助于改善植物中铁的吸收,这对于素食者来说尤其重要,可以在菠菜沙拉中添加柠檬汁。维生素C通过提高铁的溶解度或作为十二指肠细胞色素B将铁从铁还原为铁的辅助因子,有助于非血红素铁的生物利用度。
维生素B12和叶酸之间存在相互依赖的关系。维生素B12参与叶酸的代谢和激活,而叶酸则有助于维生素B12的合成和利用。
其他如,维生素E是一种脂溶性维生素,需要脂肪的存在来促进其吸收。摄入适量的脂肪可以提高维生素E的吸收率。
微量营养素之间的相互作用是复杂的,并且还受到其他因素的影响,最好的方式是通过均衡的饮食来获取各种微量营养素,因为食物中的微量营养素通常以复杂的组合形式存在,相互之间的相互作用更加协调和自然。
➤3
益生菌和益生元是一些有益的微生物和它们的营养物质,可以促进肠道的健康和微生物群的平衡。
建议摄入含有益生菌的酸奶、发酵食品、益生元的食物如洋葱、大蒜和麦麸等,以支持肠道微生物的生长和活动。
益生菌和益生元可能有助于微量营养素的最佳生物利用度,减少负面影响
例如,益生元低聚半乳糖减轻了补铁对婴儿肠道的不利影响,而罗伊氏乳杆菌与泻药氧化镁结合使用可以改善儿童的慢性便秘,而不会导致微生物组失衡。
益生元可以改变肠道微生物群,促进产短链脂肪酸的菌产生(如双歧杆菌、乳酸杆菌、真杆菌等),与钙吸收(在人类和动物模型中)、骨密度和强度(在动物模型中)增加相关。
扩展阅读:
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
➤4
一般来说,在小谷物食品的自然发酵中,B族维生素的利用率可能会增加,并且可能会产生一些氨基酸,虽然说谷物含有一些维生素,但在小谷物食品发酵过程中添加乳酸菌或酵母可能会提高维生素水平。
例如,添加乳酸乳球菌N8 和布拉酵母菌Saccharomyces boulardii SAA655可将 idli 面糊中核黄素和叶酸的浓度提高 40-90%。
注:Idli 是印度的一种传统发酵面包,是一种由大米和脱壳黑豆原料的混合物,经过湿磨和传统发酵制成的糕点。
尽管小米主要用于制造面粉,但其加工(发芽和发酵)会增加谷物的铁含量。
➤5
抗生素的滥用可能破坏肠道微生物群的平衡,影响微量营养素的代谢和吸收。
抗生素还可能导致肠道黏膜的炎症反应,进一步干扰微量营养素的吸收和利用。
在使用抗生素时,建议按照医生的指导使用,并且在必要时采取预防措施,如同时摄入益生菌和益生元,以减少对肠道微生物的不良影响。
扩展阅读:
➤6
过度摄入糖或长期的压力和焦虑会对肠道微生物和宿主营养吸收产生不良后果。
深加工食品通常经过多道工序,其中许多有益的营养物质可能被去除或破坏。这些食品通常富含添加剂、防腐剂和高糖分,而这些成分可能会对微量营养素的吸收和利用产生负面影响。
通过减少摄入加工食品、管理压力等干预措施,可以帮助改善营养吸收和维持良好的微量营养素水平。
扩展阅读:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
➤7
运动可以改善血液循环,增加血液流向肠道和其他组织,从而提高微量营养素的输送和吸收。
运动还可以提高新陈代谢,提高能量消耗和细胞代谢的速度。这可能会导致对微量营养素的需求增加,从而促进其吸收和利用。
➤8
定期体检可以帮助发现潜在的营养和健康问题,及早采取措施。
定期进行体检是监测体内微量营养素的一种方法,但它可能无法提供详细的微量营养素水平信息。常规体检通常包括血液检查,可以检测一些关键的营养素水平,如铁、维生素B12、维生素D等。对于有些微量营养素,可能需要进行特殊的检测。
➤9
由于每个人的肠道微生物群和微量营养素状态可能存在差异,个体化的营养咨询和评估可以帮助确定针对个体需求的饮食和营养。
肠道菌群和微量营养素之间存在着紧密的关系和相互作用。肠道菌群中的某些菌种可以帮助合成和吸收微量营养素。这些菌种通过代谢和转化,将食物中的原始形式的微量营养素转化为人体可以吸收和利用的活性形式,提供给宿主机体所需。
同时,适当的微量营养素摄取也对肠道菌群的平衡和健康至关重要。一些微量营养素,如锌、铁等,不仅是肠道菌群的生长和代谢所必需,还能影响菌群的结构和功能。缺乏这些微量营养素可能导致菌群紊乱,而菌群紊乱又可能影响微量营养素的吸收和利用。
肠道细菌对宿主微量营养素状态的影响是一个急需关注的研究领域。同时对微量营养素代谢的研究应该扩大到包括一般肠道微生物组成,而不仅仅是病原菌。
相关阅读:
主要参考文献
Dje Kouadio DK, Wieringa F, Greffeuille V, Humblot C. Bacteria from the gut influence the host micronutrient status. Crit Rev Food Sci Nutr. 2023 Jun 27:1-16.
Amimo, J., H. Michael, J. Chepngeno, S. Raev, L. Saif, and A. Vlasova. 2022. Immune impairment associated with vitamin A deficiency: Insights from clinical studies and animal model research. Nutrients 14 (23):5038.
Baldi, A. J., L. M. Larson, and S.-R. Pasricha. 2020. Balancing safety and potential for impact in universal iron interventions. Global Landscape of Nutrition Challenges in Infants and Children 93:51–62.
Cuisiniere, T., A. Calve, G. Fragoso, M. Oliero, R. Hajjar, E. Gonzalez, and M. Santos. 2021. Oral iron supplementation after antibiotic exposure induces a deleterious recovery of the gut microbiota. BMC Microbiology 21 (1):1–15.
Kang, S., R. Li, H. Jin, H. Y ou, and G. Ji. 2020. Effects of selenium and zinc-enriched Lactobacillus plantarum SeZi on antioxidant capacities and gut microbiome in an ICR mouse model. Antioxidants 9 (10):1028.
Kramer, J., Ö. Özkaya, and R. Kümmerli. 2020. Bacterial siderophores in community and host interactions. Nature Reviews. Microbiology 18 (3):152–63.
McMillen, S., S. Thomas, E. Liang, E. Nonnecke, C. Slupsky, and B. Lonnerdal. 2022. Gut microbiome alterations following postnatal iron supplementation depend on iron form and persist into adulthood. Nutrients 14 (3):412.
Qin H, Wu H, Shen K, Liu Y, Li M, Wang H, Qiao Z, Mu Z. Fermented Minor Grain Foods: Classification, Functional Components, and Probiotic Potential. Foods. 2022 Oct 11;11(20):3155. doi: 10.3390/foods11203155. PMID: 37430904; PMCID: PMC9601907.

谷禾健康
抑郁症·肠道菌群
当一个人面临抑郁症时,一切看似平常的事都会变得很有挑战性。上班、与朋友社交,甚至只是起床都感觉很困难。
抑郁症是如今已是世界上最普遍的精神障碍之一,一直是心理学和医学领域的研究热点。抑郁症是一种需要预防和治疗的疾病——它并不是软弱或失败的表现。
抑郁症影响着数百万计的人们,造成抑郁症的因素有很多,包括创伤、生活压力事件、遗传基因、环境因素、药物滥用和其他心理健康问题。
虽然我们目前仍然不完全了解导致抑郁症的原因,一个新的研究领域涉及微生物群-肠-脑轴,证明可以控制认知功能。微生物组通过内分泌、免疫和神经活性途径影响肠脑通讯。后者包括微生物源性神经递质(例如,γ-氨基丁酸、血清素)和代谢物(短链脂肪酸和胆汁酸),以及脑源性神经营养因子。

本文我们主要来了解一下关于抑郁症与肠道菌群之间的关系,它们之间的相互作用机制可能涉及肠脑轴、免疫调节、代谢途径、肠漏、神经炎症、HPA轴等多种途径,同时也列举了较多关于抑郁症的干预措施,希望为抑郁症的治疗和预防提供新的视角和方法。

-正文-
抑郁症是一种复杂的疾病,有许多影响因素,包括多种生活方式、饮食、遗传和环境因素。
据估计,全世界有超过3亿人至少经历过一次重度抑郁症。18-25 岁人群中重度抑郁发作的患病率最高。
一开始,抑郁发作的症状可能只是感觉忧郁、疲劳或“陷入困境”。因此,学习如何辨别平常的低落一天或只是感到忧郁和抑郁对于知道何时寻求帮助非常重要。
要符合抑郁发作的症状,个人必须在两周内几乎每天、全天经历抑郁情绪或兴趣丧失,以及同时经历其他四到五种症状。
▼
某些类型的抑郁症还可能出现以下症状:
▼
抑郁症的主要诊断标准包括:
然而,请注意,并非所有症状都必须出现才能被诊断为抑郁症:大多数患者仅具有完整“核心”症状的一部分。
▼
包括情绪低落或失去兴趣的症状,大多数情况持续至少两周,影响日常活动。
也称为心境恶劣或心境恶劣障碍,是指持续时间较长(通常至少 2 年)的不太严重的抑郁症状。
指怀孕期间或怀孕后发生的抑郁症。在怀孕期间开始的抑郁症是产前抑郁症,在婴儿出生后开始的抑郁症是产后抑郁症。
是一种随季节变化而出现和消失的抑郁症,症状通常在秋末冬初开始,在春季和夏季消失。
是抑郁症的一种严重形式,患者会出现精神病症状,例如妄想(令人不安的、错误的固定信念)或幻觉(听到或看到别人没有听到或看到的东西)。
其他还有:
以前称为躁狂抑郁症或躁狂抑郁症患者,也会经历抑郁发作,在此期间他们感到悲伤、冷漠或绝望,并且活动水平非常低。但双相情感障碍患者也会经历躁狂(或不太严重的轻躁狂)发作,或情绪异常升高,他们可能会感到非常高兴、烦躁或“兴奋”,活动水平显着增加。
▼
一些可能增加一个人患抑郁症风险的已知因素包括:
▼
神经递质是神经元用来将信号从一个细胞传递到另一个细胞的化学物质。神经递质有 100 多种不同类型,其中最著名的包括血清素、多巴胺和去甲肾上腺素等。
大多数最常见或广泛使用的抗抑郁药物(例如西酞普兰和许多其他药物)通常通过增加大脑中可用的神经递质血清素和去甲肾上腺素的量来发挥作用(即选择性血清素再摄取抑制剂或血清素-去甲肾上腺素再摄取抑制剂,或分别为“SSRI”和“SNRI”)。
注:西酞普兰是一种抗抑郁药,属于选择性血清素再摄取抑制剂(SSRI)类药物。是一种流行且用途广泛的处方药,用于治疗许多精神健康状况,包括抑郁、焦虑和创伤后应激障碍 (PTSD)。它于 2002 年获得 FDA 批准用于治疗抑郁症(成人和青少年)和广泛性焦虑症(成人)。
然而,其他一些抗抑郁药——例如安非他酮(Wellbutrin)——主要作用于多巴胺和去甲肾上腺素(即去甲肾上腺素-多巴胺再摄取抑制剂,或“NDRIs”)。
尽管如此,低水平的血清素或去甲肾上腺素是否直接导致抑郁症仍然是一个悬而未决的问题。许多科学尝试证实抑郁症患者实际上具有异常低水平的这些神经递质,但有时未能完全验证其中的联系。
我们理解的抑郁症的另一个主要方法学局限性是,尽管抗抑郁药已经建立了生化机制(例如抑制单胺氧化酶(MAO),或抑制特定神经递质的再摄取),但抑郁症的诊断和治疗很大程度上基于主观报告症状,而不是特定生化标志物或其他“客观”生物指标的任何离散测量。
换句话说,这并不是通过测量一个人这些化合物的水平,然后得出他们是否“患有”抑郁症那么简单。此外,虽然大多数 SSRI 会立即增加大脑中的血清素水平和活动,但许多患者在服用药物数周或数月后才报告情绪有显著改善。
诸如此类的发现表明血清素水平可能只是与抑郁症共同相关的更为复杂的机制和生物变化链中的一个部分。
虽然抑郁症的“血清素缺乏”假说仍然存在争议,并且并非 100% 被所有研究人员普遍接受,但目前根据迄今为止可获得的总体证据和数据,它通常被认为是最佳的工作假说。也就是说与调节情绪、思维和行为的大脑回路故障有关,大脑化学物质对于健康的神经细胞连接非常重要。
▼
正如识别抑郁症特定生化“标记”的尝试都失败了一样,许多识别导致抑郁症的特定基因或基因突变的尝试也只取得了有限的成功——可能是因为不同的抑郁症病例可能是由许多不同基因的突变以及独特的环境因素综合的。
几项综合研究(包括全基因组关联研究以及家族和双胞胎研究)报告的证据表明,对于某些情况或类型的抑郁症来说,大量个体基因之间的相互作用,以及这些基因与某些环境因素的复杂相互作用,可能只是部分原因。
例如,一项系统性全基因组关联研究(GWAS)报告称,许多与免疫系统功能和炎症相关的基因可能是影响一个人患抑郁症风险的可能遗传因素之一。
据报道,另一项全面的 GWAS 研究确定了许多与血清素功能、昼夜节律和其他神经递质相关的基因可能是抑郁症的遗传风险因素,如下表:
doi.org/10.1016/j.neuron.2014.01.027
对复发性/单相型重度抑郁症(“MDD-RU”)的家庭研究报告称,抑郁症诊断患者的一级亲属可能面临特别高的风险。
血清素转运蛋白基因( SLC6A4 ) 也与重度抑郁症相关。SLC6A4和其他参与大脑血清素能系统的基因现在被认为是抑郁症易感性的“候选基因”,这也符合许多最常见的抗抑郁药物被认为主要作用于该系统的事实。
其他五个与抑郁症风险相关的“候选基因”包括:
▼
肠道菌群与抑郁症之间存在一定的关联。肠道菌群是指人体消化道中的微生物群落,包括细菌、真菌、病毒等。它们与人体的健康和免疫系统密切相关。
微生物群-肠-脑轴
肠道和大脑之间存在着肠脑轴,通过神经、免疫和内分泌系统的相互作用进行沟通。肠道菌群可以通过产生代谢产物、神经递质和炎症因子等影响大脑功能和情绪调节。
炎症反应
肠道菌群失衡可能导致肠道黏膜的炎症反应,释放炎症因子进入血液循环,进而影响大脑功能。慢性炎症反应与抑郁症的发生和发展有关。
神经递质
肠道菌群可以影响神经递质的合成和代谢,如血清素、多巴胺和γ-氨基丁酸等,这些神经递质与情绪调节密切相关。
营养吸收
肠道菌群参与食物的消化和营养的吸收,它们可以合成维生素和其他有益物质,这些物质对大脑和情绪调节有影响。
而肠道菌群又受到多种因素的影响,比如:饮食、抗生素使用、生活方式、环境因素等。接下来章节,我们就肠道菌群与抑郁症展开了解它们之间密不可分的关联。
▼
一些研究发现,中度和重度抑郁症患者的肠道菌群特征是拟杆菌门富集,而重度患者中瘤胃球菌和真杆菌则减少。
抑郁症个体与健康对照组相比,微生物群变化的总结如下:
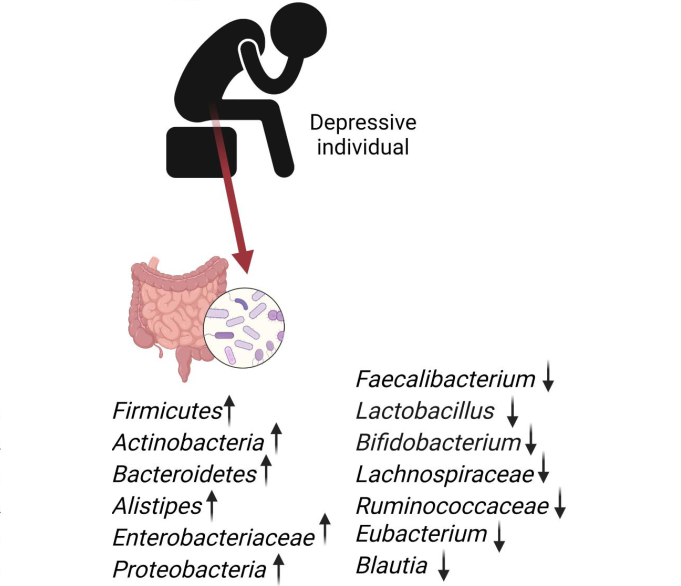
Basiji K, et al., Metab Brain Dis. 2023
▼
根据一项早期的动物研究,在没有肠道细菌的情况下生长的啮齿动物(无菌大鼠和小鼠)缺乏成熟的肠内分泌系统(胃肠道的激素产生系统)。
与具有更典型肠道细菌水平的对应物相比,它们的几种不同主要神经递质的水平和活性也有所不同。
一项初步的动物研究称,没有肠道细菌的小鼠可能会表现出自发运动的增加,该研究的作者将其解释为表明更加焦虑。他们进一步假设,这些行为差异可能是由于某些神经递质,包括血清素、多巴胺和去甲肾上腺素(去甲肾上腺素),在整个大脑中合成和代谢方式的差异造成的。
另一项研究着眼于肠道微生物与早期生活压力之间的潜在关系。在这项研究中,由于早年与母亲分离而经历压力和抑郁样症状的新生大鼠,当在其饮食中添加特定种类的细菌(双歧杆菌)时,其中一些症状会减轻。尽管抑郁相关行为的减少程度小于传统抗抑郁药物西酞普兰造成的减少,但这一初步发现仍然表明,理论上可以通过改变肠道微生物群的组成来“治疗”抑郁症。
其他一些来自动物研究的早期但有趣的证据表明,即使是复杂的行为也可以通过“粪菌移植”从一组小鼠“复制”到另一组小鼠。
一项动物研究报告称,抗生素(通过杀死肠道微生物组中的一些细菌种类来改变肠道微生物组)可能会影响小鼠表现出的“探索行为”的数量,甚至可能会改变大脑中某些重要化合物的水平,如脑源性神经营养因子(BDNF)。
▼
您以前可能听说过“益生菌”——这是指将特定菌株(菌种)引入胃肠道的食品或膳食补充剂。
一些初步证据表明,使用益生菌“修改”人类肠道微生物组可能会产生一些心理影响。例如,据报道,某些益生菌补充剂可以降低健康非老年个体以及诊断为重度抑郁症(MDD)的非老年患者的抑郁症状严重程度评分。
同样,另一项早期研究报告称,定期服用含有瑞士乳杆菌和长双歧杆菌菌株的益生菌可能有助于减少健康志愿者的抑郁症。
最后,另一项初步研究报告称,嗜酸乳杆菌、干酪乳杆菌和两歧双歧杆菌的组合可能有助于部分减轻抑郁症状。
虽然这些作用背后的潜在机制尚不清楚或不明白,但一些研究人员指出,这些“益生菌治疗”可能会导致胰岛素水平降低、胰岛素抵抗和 hs- CRP水平降低,以及谷胱甘肽(一种主要天然物质)水平升高。抗氧化化合物用于重度抑郁症患者。
总的来说,虽然这项早期研究充满希望且令人兴奋,但还需要更多的研究来充分证实这些效应,并找出哪些机制可能导致这些有趣的效应。
▼
“肠-脑轴”是指肠道微生物群与大脑之间假设的“双向”连接。
肠-脑轴可能包括许多不同的潜在机制,包括在许多不同的器官系统和所涉及的单个细菌物种之间产生的各种神经、化学、体液和免疫信号。
虽然许多不同的疾病和健康状况可能受到肠-脑轴的影响,但一些研究人员特别关注肠-脑相互作用在抑郁症发展中可能发挥的作用。
微生物群-肠-脑异常导致抑郁症
DOI: 10.1007/978-981-19-7376-5_10
▼
微生物群-肠道-免疫-神经胶质轴
微生物群对小胶质细胞稳态的重大贡献,无菌小鼠表现出小胶质细胞的整体缺陷,细胞比例改变和不成熟的表型,导致先天免疫特性受损。
值得注意的是,复杂微生物群的重新定殖,部分恢复了小胶质细胞的特征,而微生物群衍生的短链脂肪酸调节了小胶质细胞的稳态。
神经胶质细胞,包括小胶质细胞、星形胶质细胞、少突胶质细胞和室管膜细胞,与神经元相互作用,影响大脑健康和疾病(如抑郁症)。
神经胶质功能可能由肠道微生物群通过神经和化学信号途径驱动。肠道微生物群对小胶质细胞从促炎到抗炎的激活状态具有重要意义,小胶质细胞功能障碍可以触发抑郁症中神经炎症的信号级联反应。
脑功能、脑小胶质细胞(Iba1)和外周炎症细胞因子的改变(如TNF-α、IL− 1β 、IFN-γ,IL-12)。通过肠-脑轴调节小胶质细胞激活状态(M1、M2)可能是治疗抑郁症的一种有前途的治疗方法。
脑神经炎症中脑-肠-微生物轴(Th17/Treg)
许多临床前和临床研究表明,Th17 和 Treg 细胞对抑郁症有显著影响。
注:
TH17细胞是一种产生促炎细胞因子的T细胞亚群,TH17细胞的异常活化和功能异常与多种炎症性和自身免疫疾病的发生和发展有关,Treg细胞主要通过产生抑制性细胞因子和细胞接触来抑制免疫反应。
TH17细胞和Treg细胞之间的平衡是免疫系统正常功能的重要组成部分。当TH17细胞过度活化或Treg细胞功能受损时,可能导致免疫系统失衡,从而引发炎症性和自身免疫疾病。
肠道 Th17 和 Treg 细胞受到肠道微生物群的调节,而大脑相关的 Th17 和 Treg 细胞则维持免疫稳态,以控制怀孕期间的神经炎症、小胶质细胞激活、星形胶质细胞激活和大脑发育。
值得注意的是,Th17 和 Treg 细胞之间的不平衡,或 Th17/Treg 细胞的比例异常,在抑郁症中发挥着关键作用。
Th17/Treg 细胞是脑神经炎症中脑-肠-微生物轴调节所特别需要的。受肠道微生物群调节的 Th17 和 Treg 细胞之间的不平衡可能会赋予机体抵抗力和对压力的敏感性。
特定的肠道微生物群,如分节丝状菌、梭状芽胞杆菌、脆弱拟杆菌、罗伊氏乳杆菌和双歧杆菌,及其代谢产物如短链脂肪酸和ATP,也参与 Th17/Treg 活性,从而形成 Th17 和 Treg 细胞之间的不平衡。
除了脑神经炎症之外,炎症还可以发生在身体其他部位和系统,比如周围炎症,胃肠道炎症等。
▼
抑郁症和炎症的相互作用就像一个互相助长的恶性循环。炎症是抑郁症发展的主导力量之一。长期的神经炎症会影响大脑功能,这可能会决定个人的情绪和行为。
抑郁症的细胞因子假说来自于观察,即抑郁症的几种症状类似于“疾病行为”,例如嗜睡、发烧、食欲下降、对探索行为或性活动的兴趣下降等。
一些研究人员提出,从进化的角度来看,疾病行为可能是有意义的,因为其中许多行为可能有助于治愈或减少疾病的传播。例如,隔离病人可能会降低他们传播感染的几率。
抑郁症相关炎症因子变化
周围炎症与抑郁症密切相关。抑郁症患者的炎症标志物包括:
血清 IL-6、IL-1β、C反应蛋白升高。
肠道炎症性疾病患者抑郁行为的并发率很高
根据一些报告,患有胃肠道炎症等健康问题的人抑郁和焦虑症状的发生率在统计上有所增加。一些研究人员估计,高达 50-90% 的 IBS患者还同时患有某种精神疾病。
根据最近的《自然》杂志评论,尽管存在明显的异质性,但 IBD 抑郁症状(包括克罗恩病和溃疡性结肠炎)的总体患病率超过 20%。随着时间的推移,抑郁症状加剧与活动性IBD的几率增加有关。
前扣带皮层(ACC)可能是大脑中的一个交叉点,它会感知肠道炎症和不适当的反应,从而增加患抑郁症的风险。
用促炎细胞因子引发炎症的同时诱发抑郁
对人类或动物施用促炎细胞因子进行治疗会诱发抑郁症状。虽然 SSRIs(选择性血清素再摄取抑制剂)通常不会直接减轻“疾病行为”,但据报道,它们可以减少促炎细胞因子,并增加抗炎细胞因子,这一机制也与抑郁症的细胞因子假说一致。
给予脂多糖 LPS 会增加细胞因子的血浆浓度,同时诱发抑郁症状。
然而,抑郁症的正式诊断标准(由 DSM 定义)和“疾病行为”本身之间存在一些细微差别,并且关于炎症是否真的导致抑郁症的证据是相互矛盾的。
并非所有炎症患者都患有抑郁症,也并非所有抑郁症患者都具有高炎症标志物,炎症(可能与血清素缺乏相似)可能只是抑郁症的一个诱因,而不是唯一的直接原因。换句话说,炎症细胞因子的异常调节可能只是一个更加复杂的谜题的一部分,并且需要更多的研究来充分探索这些潜在联系所涉及的机制。
▼
肠粘膜屏障和粘膜免疫系统是帮助防止肠腔内的肠道微生物直接与肠道免疫系统相互作用的两个主要机制。如果这些屏障受到损害,细菌可能会易位,激活免疫系统,从而引发炎症。
注:这些屏障受到损害的情况有时非正式地被称为“肠漏”。
一项动物研究报告称,肠道屏障受损的小鼠表现出与焦虑相关的行为增加,并且一旦肠道屏障恢复或引入益生菌后,这些行为就会消退。
根据一项针对人类的初步研究的作者,IgA 和IgM等血清抗体通常会被激活以对抗有害的肠道细菌。因此,这些抗体的存在是肠道屏障受损的一种潜在生物指标,一项研究甚至报告称,这些抗体水平升高可用于识别抑郁症患者,准确率高达 90%。
尽管这种现象背后的机,但一些研究人员认为“坏”肠道细菌可能通过 TLR4 受体引发炎症。
诱发炎症
LPS 与 TLR4 结合激活免疫细胞,激活NF-κB(一种细胞内信号分子),进而促进促炎细胞因子的产生,包括 TNF-α 和 IL-1 以及环加氧酶-2。
加剧炎症
相同的过程还诱导氧化和亚硝化应激途径,通过进一步激活烟酰胺腺嘌呤二核苷酸磷酸氧化酶来增加诱导型一氧化氮的表达和活性氧 (ROS) 的产生。ROS 超载不仅会激活 NF-κB,还会导致 DNA 损伤和细胞死亡,这两个过程都会加剧炎症状态。
促炎循环——抑郁症
包括干扰素-α、IL-6、IL-1β 和 TNF-α 在内的细胞因子以及氧化和亚硝化应激途径可能会导致紧密连接屏障松动,从而在肠道通透性过高和宿主免疫反应之间形成促炎循环。
这个循环至少部分解释了抑郁症患者慢性低度但持续的炎症状态。
总的来说,这些机制及其影响复杂,值得更多的研究来验证这些初步发现。
▼
激素影响我们身体功能的许多方面,包括新陈代谢、生长、性健康和生殖系统功能。我们的心理健康受到激素的强烈影响,因为激素在情绪的调节中发挥着重要作用。这里我们来了解几种常见的和抑郁症相关的激素。
皮质醇
皮质醇是一种压力激素,由肾上腺分泌。这种激素负责通过选择使用哪种底物以及应消耗多少底物来调节能量。如果皮质醇水平过高或过低,可能会开始出现抑郁症。皮质醇水平低与过度疲劳、难以处理压力情况、不可预测和不稳定的情绪以及性欲下降有关。
雌激素
雌激素在大脑中扮演着重要的角色,它们参与调节神经递质的活动,如血清素、多巴胺和去甲肾上腺素等。这些神经递质与情绪调节密切相关,因此,雌激素的变化可能会对情绪产生影响。
女性患抑郁症的风险要高于男性,这与雌激素和孕激素变化有关。在月经周期、孕期和更年期等生理状态的激素波动可能影响情绪和抑郁症发病风险。
使用雌激素治疗抑郁症的疗效和安全性仍存在争议,因此,使用雌激素治疗抑郁症需要谨慎。
黄体酮
黄体酮有助于平衡体内雌激素水平。它还有助于改善睡眠模式,使人感到更平静。如果黄体酮水平不平衡,可能会变得烦躁或晚上无法入睡,这可能影响抑郁症。
▼
// 短 链 脂 肪 酸
短链脂肪酸在肠腔中具有多种功能,如氧化还原平衡、维持肠屏障完整性、肠道激素产生和表观遗传调节。然而研究表明,短链脂肪酸与抑郁症等精神疾病有关。
短链脂肪酸由肠道微生物群合成,主要由AKK菌、双歧杆菌、粪杆菌、毛螺菌科、乳酸杆菌和瘤胃球菌等物种合成。
短链脂肪酸与抑郁症的关联
已知短链脂肪酸调节神经反应的不同途径,如:
短链脂肪酸诱导肠道神经肽的释放,例如YY肽(YYP)和胰高血糖素样肽2(GLP-2)肽,以及参与维持肠道屏障、细胞代谢和饱腹感的激素。
戊酸与抑郁症有关,主要由Oscillibacter产生。缬草酸的结构与GABA,并可与其受体结合,这可能在严重抑郁障碍中发挥重要作用。
在抑郁症患者的粪便中发现了更高量的异戊酸,这表明微生物群和异戊酸与抑郁症有关。
在一项针对有抑郁症状患者的研究中,粪便中的乙酸盐水平与这些患者呈正相关,而丁酸盐和丙酸盐水平则呈负相关。
在一项针对患有抑郁症的波兰妇女的类似研究中,与非抑郁症患者相比,抑郁症患者粪便中的乙酸盐和丙酸盐水平降低,而异己酸含量增加。这些发现表明,为了保持心理健康,特定的短链脂肪酸水平和微生物群之间必须保持平衡。
// 胆 汁 酸
胆汁中的一种重要成分——胆汁酸,是由肝脏中的胆固醇产生的,它们与肠道菌群协同调节胆固醇代谢,帮助脂质消化和吸收。胆固醇通过肝细胞代谢为原代胆汁酸;之后被输送到胆囊,最终在十二指肠中被释放。到达肠道后,肠道细菌从初级胆汁酸中产生次级胆汁酸(脱氧胆酸和石胆酸)。只有一些细菌,主要是梭菌和真细菌,负责次级胆汁酸的合成。
胆汁酸改变了神经递质受体的功能,如M2和M3毒蕈碱乙酰胆碱、GABA和N-甲基-D-天冬氨酸(NMDA)受体。在对培养的下丘脑神经元的体外研究中,鹅去氧胆酸抑制GABA和NMDA受体。
胆汁酸与抑郁症的关联
中国的一项研究表明,与健康对照组相比,重度抑郁症患者的2,3-脱氧胆酸水平较高,而牛磺酸(TLCA)、甘胆酸(GLCA)和3-硫酸胆酸水平较低,这与汉密尔顿抑郁量表(HAM-D)评分呈负相关。
同样在这项研究中,这些菌Turicibacteraceae、Turicibacteriales和Turicibacter与TLCA和GLCA水平呈正相关。
在美国的另一项研究中,与不太严重的抑郁症患者相比,严重抑郁症患者的原发胆汁酸鹅去氧胆酸水平降低。因此,肠道菌群可以通过胆汁酸改变诱导中枢神经系统疾病,如重度抑郁症。
次级胆汁酸合成的减少会导致微生态失调,并改变肠道屏障的通透性,诱导促炎性基调,从而导致抑郁症的发病机制。
▼
肠道细菌是血液中化学物质(代谢物)的主要调节剂。其中一些是在大脑中制造神经递质的“成分”或“构件”(代谢前体)。
换句话说,这意味着肠道细菌可能能够对某些神经递质的水平和活动产生一些影响,这反过来又可能使它们能够影响大脑活动和行为(尽管是间接的)。
肠道细菌可以通过多种方式调节神经递质的产生
首先,肠道细菌可以合成和分解多种神经递质,如γ-氨基丁酸(GABA)、多巴胺、血清素等。这些神经递质可以通过门脉循环影响迷走神经的传入通路,它们在大脑中起到调节情绪、认知和行为的重要作用。
GABA是大脑中的主要抑制性神经递质。
谷氨酸是大脑中最丰富的兴奋性神经递质,负责在神经细胞之间发送信号,其在大脑中的合成取决于神经元和星形胶质细胞之间的合作,肠道中的肠内分泌细胞亚群能够合成谷氨酸,并利用它通过迷走神经将快速信号传输到大脑。关于谷氨酸详见我们之前的文章:
去甲肾上腺素在中枢神经系统内发挥作用,同时充当应激激素。它有助于“战斗或逃跑”反应,并与唤醒、注意力和聚焦机制相关。
多巴胺参与奖励处理和动机以及运动控制。
肠道微生物群对多巴胺代谢副产物的影响
doi: 10.3390/biomedicines10020436
1) 粪球菌属Coprococcus comes和Coprococcus catus与多巴胺合成潜力密切相关
2) 破伤风梭菌对多巴胺具有降解作用,通过多巴胺中间体促进降解为高香草酸
3) 鼠李糖乳杆菌下调MAO
4) 植物乳杆菌DR7下调多巴胺β-羟化酶
5) 梭状芽孢杆菌显示下调多巴胺β-羟化酶
6) 植物乳杆菌PS128给药改善多巴胺代谢并增加去甲肾上腺素水平
血清素,也称为 5-羟色胺 (5-HT),参与调节情绪、食欲、睡眠和其他身体功能。
其次,肠道细菌可以影响神经递质的合成和代谢途径。例如,某些细菌可以产生短链脂肪酸,如丙酸、丁酸和乙酸,这些短链脂肪酸可以促进神经递质的合成和释放。
肠道细菌还可以通过与肠道上皮细胞和免疫系统的相互作用,间接影响神经递质的产生。肠道细菌可以调节免疫系统的活性,影响免疫细胞的分泌和反应,从而影响神经递质的合成和释放。
▼
氨基酸色氨酸是大脑用来产生神经递质血清素的主要“构件”(代谢前体)之一。虽然色氨酸消耗并不总是导致抑郁症,但一些研究人员认为,血清色氨酸偏低有时可能会导致易感人群抑郁症。根据前面,我们可以看出高血清脯氨酸和低血清色氨酸与抑郁症的发展有一定关系。
一些研究表明,某些促炎细胞因子(例如 IFN-α、IFN-γ和TNF-α)水平的增加可能会刺激吲哚胺-2,3-双加氧酶( IDO )的活性,从而在转刺激色氨酸转化为神经毒性化合物,包括犬尿氨酸和喹啉酸。
基于此,一些研究人员认为,可能是这些神经毒性物质,而不是色氨酸消耗本身,可能导致抑郁症的发生。
肠道细菌和炎症可能会影响血清素代谢:
色氨酸代谢途径的犬尿氨酸
DOI: 10.1038/sj.mp.4001600
扩展阅读:
▼
重度抑郁症患者表现出应激反应系统(例如HPA 轴)过度活跃。它主要表现为腺体反应性增加、激素分泌破坏和负反馈失调。这些疾病可能进一步导致肠道炎症、神经元损伤和皮质醇过度产生,所有这些都与抑郁症相关。
此外,HPA 轴功能障碍的解决与抑郁症的缓解(“治愈”)密切相关,表明它们之间存在某种相互联系。
早期生活压力—肠道菌群—应激反应形成
一项针对大鼠的动物研究报告称,将新生儿从母亲身边带走所产生的压力(母亲分离压力)可能会导致后代肠道微生物组发生巨大的长期变化。母亲分离是早期生活压力的一种模式,它通过改变 HPA 轴、免疫系统和氨基酸代谢以及影响微生物群组成来诱发焦虑和抑郁。
早期生活压力可能使人以后对压力更加敏感。
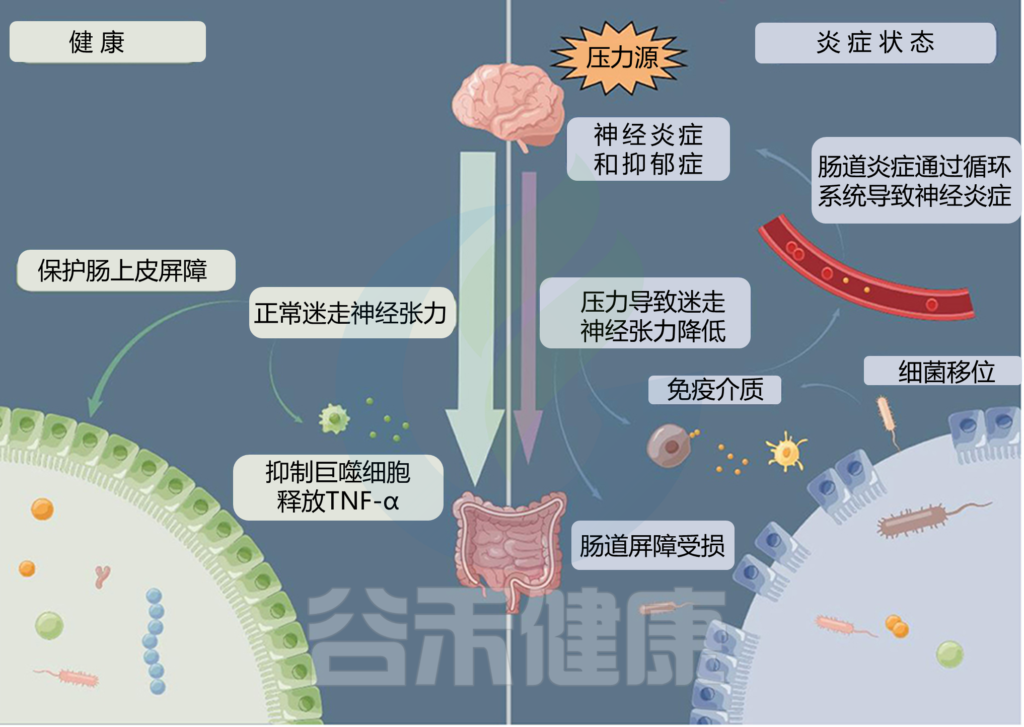
doi.org/10.3389/fneur.2022.1015175
▼
虽然迷走神经无法到达管腔内容物,但它可以通过与肠内分泌细胞的通信间接感知肠道信息。
迷走神经传入将信号从肠道菌群传递到中枢神经系统
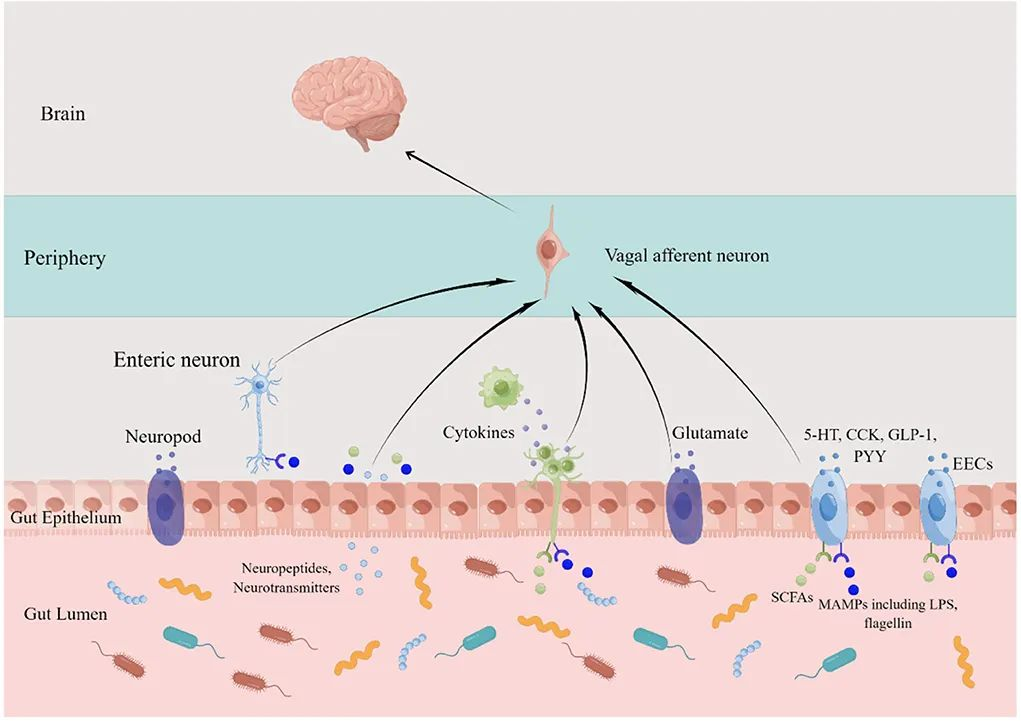
doi.org/10.3389/fneur.2022.1015175
▼
肠道微生物组可能用来与中枢神经系统沟通的其他机制之一是通过肠嗜铬细胞(ECC)和迷走神经。
例如,一些研究人员目前认为肠嗜铬细胞和迷走神经可能参与肠道细菌和大脑之间的通讯,尽管我们仍然不完全了解如何进行。
肠嗜铬细胞感知肠道细菌并分泌血清素
肠嗜铬细胞(ECC) 遍布整个消化道
▼
HPA轴是指下丘脑-垂体-肾上腺轴。HPA轴的功能紊乱可能导致患者出现情绪失调和应激反应的异常。
肠道菌群如何影响 HPA 轴?
肠道菌群失调与炎症之间存在密切关系。这些细胞因子也是 HPA 轴非常有效的激活剂。促炎细胞因子可以干扰皮质醇循环的负反馈,刺激HPA轴的活性。
肠道菌群还可以通过其他能够穿过血脑屏障的介质(例如微生物抗原和前列腺素)刺激 HPA 轴。
除了依赖这些介质之外,细菌还可以直接参与干预过程。例如,LPS和肽聚糖可以通过激活先天免疫系统来激活HPA轴,最终诱发抑郁症)。
还有证据表明,肠道菌群可以直接调节肠道和肾上腺中的类固醇生成,从而增强 HPA 轴反应。
肠道菌群衍生的代谢物也通过体液途径参与调节 HPA 轴。例如,慢性吲哚(拟杆菌属、乳杆菌属和梭菌属)可诱导肾上腺髓质 Pnmt 基因过度表达。它可以与去甲肾上腺素一起增加肾上腺素能系统中儿茶酚胺的生物合成途径。这样,吲哚可以增加小鼠在慢性轻度应激下的脆弱性,最终导致抑郁行为。
除此之外,肠道菌群还可以通过调节 HPA 轴在抑郁症中发挥积极作用。例如,其下游代谢物短链脂肪酸可以降低HPA轴中一些编码蛋白的基因表达,从而减弱HPA轴的应激反应。
最后,肠道菌群还可以影响膈下迷走神经的信号输入。孤束核通过去甲肾上腺素能神经元激活 HPA 轴。
据报道,单胺再摄取抑制剂(MAO-Is) 可以降低糖皮质激素受体抵抗,从而减少 HPA 轴功能障碍。这使得一些研究人员提出,针对大脑 HPA 轴的药物可能是治疗重度抑郁症的潜在有效方法。
▼
如果发现抑郁症的迹象,请及时进行身体检查,帮助确定症状是否可能与抑郁有关,并寻求专业医疗帮助进行抑郁症的诊断和治疗干预。
诊断抑郁症是一个多步骤的过程,通常当有人注意到自己感觉不太像自己时就开始了。在某些情况下,一个人的朋友和家人可能会首先注意到抑郁症的微妙迹象。相关判别方式有:
// 量表
医疗和心理健康专业人员使用既定的、研究支持的指南、筛查工具、检查表和其他标准来帮助他们诊断抑郁症。
DSM-5
心理健康专家可能使用美国精神病学协会出版的《精神障碍诊断与统计手册》(DSM-5) 中列出的抑郁症诊断标准。
注:《精神疾病诊断和统计手册》(DSM)是一本为诊断精神疾病的临床医生提供指南的手册。对每种情况进行分类,并给出一套明确的标准,必须满足这些标准才能做出诊断。
DSM-5 包含了评估自杀风险的新量表:一种针对成人,另一种针对青少年。
要诊断为重度抑郁症,一个人的症状必须符合 DSM-5 中概述的标准。悲伤、情绪低落和对日常活动失去兴趣的感觉必定标志着一个人以前的状态发生了变化,并且持续了至少两周。
这些感觉还必须伴有至少五种其他常见的抑郁症状,包括:
这些症状必定会导致个体出现临床上显著的痛苦或社交、职业或其他重要功能领域的损害。
这些症状不能归因于药物或物质滥用,也不能是由其他身体疾病引起的。
除了DSM-5,还有一些常用的抑郁症量表,用于评估抑郁症的严重程度和症状表现。常见的抑郁症量表包括:
用于评估抑郁症状的程度。
临床评估工具,用于评估抑郁症状的严重程度。
用于评估双相情感障碍,包括抑郁症和躁狂症。
这些量表可以帮助医生更全面地评估抑郁症的症状和严重程度,以指导治疗计划的制定。
抑郁症的诊断主要是基于临床评估和心理评估,其他也包括一些实验室测试来辅助判别。
// 实验室测试
用于识别生物标志物并应用于诊断重度抑郁症的基因组、蛋白质组和代谢分析仍处于起步阶段。
炎症标志物
严重抑郁症与细胞因子或其可溶性受体升高有关,包括:白细胞介素IL-2、可溶性 IL-2 受体 (sIL-2R)、IL-1b、IL-1 受体拮抗剂 (IL-1Ra)、IL -6、可溶性 IL-6 受体 (sIL-6R) 和 γ-干扰素。
一项病例对照研究发现,血清抵抗素(一种细胞因子和代谢标志物)水平与非典型抑郁症症状相关,抑郁症受试者的脂联素水平低于对照组。
BDNF(脑源性神经营养因子)
与对照组相比,抑郁症受试者的血清水平通常较低,并且血清BDNF水平在抗抑郁治疗后升高。血清BDNF可以作为区分单极性和双极性抑郁症的生物标志物。
皮质醇
HPA轴功能障碍已在抑郁症的病因中得到观察。抑郁症患者的高皮质醇血症表现为24小时平均血清皮质醇浓度升高和24小时尿液皮质醇排泄增加。
新型血液测试
一种新的血液测试被描述用于重度抑郁症的诊断。该测试由9种生物标志物组成,包括α-1抗胰蛋白酶、载脂蛋白CIII、BDNF、皮质醇、表皮生长因子、髓过氧化物酶、催乳素、抵抗素、可溶性肿瘤坏死因子αII型,均通过标准免疫测定进行测量。
促甲状腺激素
促甲状腺激素(TSH)被纳入并单独报道,用于评估抑郁症的总体评估中的甲状腺功能减退或甲状腺功能亢进。内源性抑郁症患者的基础血清TSH水平通常较低,从基线到峰值的TSH变化也较低。抑郁症可能与亚临床甲状腺功能减退或轻度甲状腺功能衰竭有关。
肠道菌群健康检测
某些菌群的异常与抑郁症之间可能存在相关性。肠道菌群检测可以在抑郁症的早期进行风险提示,当临床症状不明显或存在疑难病例时,结合肠道菌群检测结果,可以提供更加全面的信息,辅助医生进行准确的诊断。
▼
有时候,我们口头说的“抑郁症”很多情况是短暂的抑郁情绪,还不是重度抑郁症,可以趁抑郁症在早期阶段,通过改变生活方式对其进行干预和管理。
// 饮 食
饮食选择显著影响其他身体系统,例如内分泌、免疫和胃肠道系统。
避免不健康饮食
限制摄入食品添加剂、糖、饱和脂肪酸和精制碳水化合物等。
近年来,研究表明,西方饮食中富含加工或油炸食品、糖、精制谷物和酒精,与抑郁和焦虑症状呈正相关。2020 年的一项研究发现,食用加工食品会引发体内炎症,并对免疫系统产生连锁反应,可能会增加出现抑郁症状的风险。
富含脂肪的饮食可能促进焦虑和抑郁的发展或持续。高脂肪摄入不仅会导致肥胖,还会引起身体系统广泛的炎症。肠道微生物组可能会改变高脂肪饮食的有害影响,改善情绪和行为。
通过避免受污染的食物,改善饮食质量,增强身体的免疫力,并有助于抑郁症的治疗和康复。环境重金属污染的食物可能会含有铅、汞、镉等有害物质,海鲜也是需要格外关注的食物类型,因为海产品往往容易受到汞等重金属的污染。抑郁症患者需要特别留意,避免摄入这些污染物。
高脯氨酸食物与抑郁症相关
来自西班牙巴塞罗那赫罗纳生物医学研究所 (IDIBGI) 和庞培法布拉大学 (UPF) 的研究人员发现,较高的脯氨酸摄入量与抑郁症的发展有关。这项研究的结果发表在《细胞代谢》杂志上。
为了更多地了解饮食是否会导致抑郁症的发生,IDIBGI 研究人员将大约 100 名受试者分为三类:非抑郁症、轻度抑郁症和重度抑郁症。从那里,他们分析了抑郁症诊断与肠道微生物组组成之间是否存在关系。
通过对氨基酸的代谢物分析,研究人员能够将体内脯氨酸与抑郁症评分最紧密地联系起来。
为了了解这种脯氨酸从何而来,研究人员依靠包含参与者饮食信息的调查问卷。脯氨酸再次成为对抑郁症影响最大的饮食因素。
在健康的受试者中,脯氨酸的摄入量是与抑郁评分最相关的项目。在进一步确定小鼠体内脯氨酸/抑郁症的联系后,研究人员试图通过将人类受试者的肠道细菌移植到小鼠体内来证实他们的发现。接受脯氨酸含量最高的细菌的小鼠表现出更多的抑郁症状。
什么是脯氨酸?
我们体内的蛋白质由 20 种特定氨基酸的各种组合组成,其中 9 种被认为是“必需的”。身体无法自行制造这九种氨基酸,我们需要通过饮食摄入它们。
脯氨酸是一种非必需氨基酸,这意味着我们的身体在生命的大多数阶段都可以产生足够的量。然而,在压力、康复或成长时期,这种氨基酸变得至关重要,因为我们的需求量超过了我们身体的制造量。
富含脯氨酸的食物
脯氨酸主要存在于许多动物源食品中。“脯氨酸最重要的来源是明胶和动物皮,这些食物富含胶原蛋白,是这种氨基酸的天然来源。
事实上,脯氨酸约占胶原蛋白总氨基酸的 10%。因此,含有胶原蛋白的食物,如骨头汤、鸡翅(带皮)、猪皮和明胶,是这种氨基酸的丰富来源。
大多数肉类、鱼类和乳制品也含有脯氨酸。
需要避免脯氨酸来降低抑郁风险吗?
根据这些结果,看起来有必要从饮食中去除任何含有脯氨酸的食物,以降低患抑郁症的风险。
根据研究作者和我们经验还是不要那么绝对。毕竟许多富含脯氨酸的食物,包括肉类、鱼类和奶制品,都富含对正常生长、发育和免疫支持至关重要的营养素。
在建议减少饮食中这部分食物之前,我们认为需要进行更多的研究。
当然,关于抑郁症的饮食干预不只是避免某些食物的摄入,而是要建立一个全面健康的饮食习惯。
健康饮食
2019 年的一项研究发现,富含水果、蔬菜、鱼类和瘦肉的健康饮食有助于降低抑郁症的临床水平。
有研究发现西班牙护理学生坚持地中海饮食与心理健康问题之间存在很强的相关性。坚持地中海饮食的参与者比没有坚持的人的焦虑和抑郁分数要低得多。
地中海饮食(主要是纤维、鱼和全谷物),已被证明可以通过增加产短链脂肪酸菌丰度来调节肠道菌群组成,从而减少抑郁症的发作。
也有研究发现强有力的证据表明,适度限制热量的健康饮食有助于改善抑郁症状。
多酚还被证明可以通过抑制参与氧化应激和炎症的丝裂原激活蛋白激酶途径来改善抑郁症状。多酚还作为益生元为微生物提供营养,两者相辅相成。
一项干预性随机临床试验表明,富含类黄酮的橙汁可以通过增加BDNF和毛癣菌科Trichophyton来缓解抑郁症。
总的来说,富含 omega-3 多不饱和脂肪酸 (PUFA) 的食物,大量摄入蔬菜、水果、鱼、橄榄油、大豆、全谷物的健康饮食模式可能与降低抑郁风险相关。
相关阅读:
// 动起来
缺乏身体活动是抑郁和焦虑的常见危险因素。在治疗重度抑郁症方面有大量研究表明,体育锻炼已被证明有助于预防、缓解和治疗症状。
定期锻炼对身体有好处,有助于增强力量和健康,而且对大脑和神经系统也有帮助。在剧烈运动期间,身体会释放内啡肽和多巴胺等神经递质,这有助于增加愉悦感和幸福感。
// 注重睡眠质量
睡眠质量是幸福感的重要指标。80% 的抑郁症患者自我报告存在睡眠障碍。晚上适当的休息(不要太多或太少)是控制抑郁症和保持精力充沛的好方法。为了达到最佳健康状态,建议七到八小时。
除了适当的休息之外,充足的睡眠还有助于注意力、认知、记忆形成和情绪调节。
如果有睡眠问题,请持续保持良好的睡眠习惯。比如收起电子产品,睡前写日记,并制定一个轻松的睡前习惯来放松身心。
如果睡眠无法改善,请寻求医生的帮助。
// 冥想正念
当您处于抑郁状态时,很容易陷入消极的想法和情绪中。正念、冥想和呼吸练习可以成为抵御压力和焦虑、让你的大脑专注于当下的一种方法。还可以将正念应用于创造性追求,其中可能涉及日记、绘画、唱歌、玩耍、跳舞等活动。
从生物学角度来看,冥想对某些生理功能具有积极、显著的影响。练习冥想可以影响大脑结构、大脑网络,保持自主神经系统的稳态,甚至影响我们基因的运作方式。
练习正念也可以导致知觉转变。你的想法和情绪不再被视为压倒性的事件,而是一个有助于洞察和平静的时刻。
// 走出去,感受新鲜空气
抑郁症的症状之一是很难起床,完成基本任务可能需要付出巨大的努力。如果忽视户外活动而更多地待在室内,可能会扰乱睡眠和昼夜节律,并导致维生素D 不足。
维生素D 水平下降与抑郁症之间可能存在关联。尽管研究仍然很少,但越来越多的研究表明维生素D 可以在缓解抑郁症方面发挥治疗作用。然而,它在促进免疫功能健康、细胞生长和维持骨骼健康方面的益处是众所周知的。
为了摆脱抑郁症,充足的自然阳光照射有助于满足每日维生素D。拥抱自然疗法,感受皮肤上的阳光,并在街区周围散步以改变环境。
// 依靠爱的人
当你感到沮丧时,你很容易孤立并拒绝与人交往的尝试。或者你可能在人群中却仍然感到孤独。然而,人类天生就是社会性动物。如果你的社会支持质量下降,它可能会加剧抑郁症状,并产生更多的孤独、内疚、羞耻和疏远感。
建议适当社交,是提高自尊、适应力、爱的途径——所有这些都有助于产生积极的心理健康结果。数十年的研究证明,与社区的较高社会关系质量与降低压力水平和抑郁症状有关。
哈佛大学成人发展研究对幸福进行了一项长期研究,发现人际关系可以产生精神和情感刺激(情绪助推器),并有助于抵消孤立感。哈佛大学的研究人员指出,人际关系是幸福和生活满意度的有力预测因素。
// 尽可能寻找感激之情和欢笑
有可靠的科学证据表明,感恩可以改善认知和情感健康。研究的一项感恩干预措施是使用感恩情,在其中列出几周内每天让你感激的三到五件事。感恩练习有助于增加积极情绪、主观幸福感、生活满意度,并减少抑郁症状。
研究发现幽默可以成为对抗抑郁症状和焦虑的重要应对机制。当你沮丧时,很难从任何事情中找到乐趣。即便如此,寻找令人愉快的活动仍然是件好事,比如观看搞笑的单口喜剧、拥抱宠物、沉迷于一部让人感觉良好的电影、听音乐、犒赏自己一个热水澡,或者点你最喜欢的饭菜。做任何你喜欢做的事都可以带来快乐。
// 尝试摆脱情绪低落的小技巧
-简化生活,管理时间
列出日常任务清单,使用提醒便签,或者使用计划表有助于保持生活有条不紊。尽可能减少责任,为自己设定合理的目标。当感觉情绪低落时,允许自己少做一些事情。当感到沮丧时避免做出重大决定。
-写日记
作为治疗的一部分,可以通过表达痛苦、愤怒、恐惧或其他情绪来改善心情。
-阅读
阅读知名的自助书籍和网站。医生或治疗师会推荐书籍或网站以供阅读。
-战胜拖延
抑郁症的症状,例如疲劳和注意力不集中,很容易拖延。拖延事情会加剧抑郁。它会导致增加内疚、担忧和压力。制定短期目标并努力首先完成最重要的事情。成功完成的每一项任务都会帮你打破拖延的习惯。
-尝试社交或找到有用的团体
尝试参加社交活动,定期与家人或朋友聚会。许多组织支持联盟,提供教育、互助组、咨询和其他资源来帮助治疗抑郁症。参加各种心理小组也可以为心理健康问题提供帮助。抑郁症患者互助组可以与其他面临类似问题的患者建立联系并分享经验。
-避免酗酒
酒精似乎可以减轻抑郁症状,但从长远来看,它们通常会加重症状,使抑郁更难治疗。
▼
可以通过肠道菌群检测,了解整体菌群结构和异常指标,进行个性化干预。
如果发现核心菌属丰度低,有害菌丰度高,菌群结构紊乱,那么可以配合使用抗生素或益生元等抑制过多有害菌,加以改善。
或者通过粪菌移植的方式适当改变菌群结构,从而有效改善。
发现异常菌群,可以针对缺乏菌群,通过补充益生菌,功能性补充剂等方式加以改善。
// 益生菌 & 益生元
益生菌
最近的荟萃分析和系统综述证实了益生菌在临床研究中的抗抑郁功效。相关动物研究也表明,这种作用与肠道菌群结构的调节有关。
研究人员使用罗伊氏乳杆菌(Lactobacillus reuteri )干预CUMS小鼠,发现只有恢复乳杆菌水平才足以改善与应激相关的代谢变化和行为异常。
在另一项研究中,热灭菌的短双歧杆菌可以调节肠道菌群成分,从而预防慢性社交失败压力引起的抑郁症状。这种具有功能性食物成分的菌株可以用作新的疗法。


编辑
doi: 10.7759/cureus.40293
益生元
每天 5 克的低聚半乳糖和 1 克或以下的二十碳五烯酸可以有效缓解抑郁症状。虽然 EGCG 具有潜在的抗抑郁特性,但可能需要 3 克/天的较高剂量才能产生显着效果。
doi.org/10.3389/fnut.2023.1206468
益生菌和益生元联合给药
研究表明,益生菌和益生元的联合给药可以达到更大的抗抑郁效果。益生元的显著营养作用可能会提高益生菌的存活率,从而增强益生菌的抗抑郁能力。
没有相关研究报告益生菌引起的戒断反应和副作用等问题,这似乎是一种很有前途的抑郁症干预措施。益生菌菌株、剂量和方法的最佳组合尚不精确。为了解决这些问题,还需要更多的随机、双盲、安慰剂对照试验来解开这个谜题。
// 粪菌移植
一种直接干扰肠道菌群的方法是粪便微生物群移植(FMT)。它在抑郁症和微生物结构紊乱方面的优异表现使我们看到了新的治疗方向。
在一项动物研究中,NLRP3 KO菌群移植显著改善了受体小鼠的抑郁样行为。在他们的研究中,FMT机制主要依赖于抑制抑郁小鼠中circHIPK2的表达。
在人类受试者中,FMT也显示出类似的效果。在一份FMT作为抑郁症辅助治疗的病例报告中,入选的患者表现出抑郁症状的改善、肠道菌群多样性的增加以及胃肠道症状的缓解。
然而,这种影响并不持久,他们推测FMT的疗效与供体和受体的微生物相似性有关。FMT面临的主要挑战是提高成功率、最佳交付途径、捐赠者选择和其他需要探索的问题。
▼
// 药物
N-乙酰半胱氨酸(NAC)
NAC 通过其抗氧化、抗炎和谷氨酸调节活性,可能在多种精神疾病的治疗中发挥作用。
身体使用N-乙酰半胱氨酸(NAC)来制造自身的抗氧化剂。医学上,NAC用于治疗对乙酰氨基酚中毒;只要在服药过量后的前 8 小时内服用,几乎 100% 有效。
根据对多项单独研究数据(包括 574 名抑郁症患者和健康参与者的数据)的一项审查,据报道,NAC 在使用 3-6 个月内有可能改善抑郁症状和整体日常功能。此外,据报道,抑郁症患者的情绪在 3-4 个月后得到改善。
NAC 还可以通过减少大脑的氧化应激来平衡情绪。例如,一项针对 76 名抑郁症患者的研究报告称,服用 NAC 的患者大脑抗氧化水平较高。
以上益处仅得到有限的小规模临床研究的支持。在 NAC 推荐临床之前需要进行更长时间、更有力度的研究。
选择性血清素再摄取抑制剂(SSRI)
医生通常会先开一种 SSRI 药物。通常认为这些药物更安全,所产生的不适副作用一般少于其他类型的抗抑郁药。SSRI 药物包括西酞普兰(Celexa)、艾司西酞普兰(Lexapro)、氟西汀(Prozac)、帕罗西汀(Paxil、Pexeva)、舍曲林(Zoloft)、维拉佐酮(Viibryd)
血清素-去甲肾上腺素再摄取抑制剂(SNRI)
SNRI 药物包括度洛西汀(Cymbalta)、文拉法辛(Effexor XR)、地文拉法辛(Pristiq、Khedezla)和左米那普仑(Fetzima)
非典型抗抑郁药
这些药物不太适合归入其他任何抗抑郁药类别。这些药物包括安非他酮(Wellbutrin XL、Wellbutrin SR、Aplenzin、Forfivo XL)、米氮平(Remeron)、奈法唑酮、曲唑酮和伏硫西汀(Trintellix)。
三环类抗抑郁药
例如丙米嗪(Tofranil)、去甲替林(Pamelor)、阿米替林、多塞平、曲米帕明(Surmontil)、地昔帕明(Norpramin)和普罗替林(Vivactil)等这些药物可能都很有效,但是副作用往往比新型的抗抑郁药更严重。因此通常不会开三环类药物,除非您已经用过 SSRI,却没有起色。
单胺氧化酶抑制剂(MAOI)
反苯环丙胺(Parnate)、苯乙肼(Nardil)和异卡波肼(Marplan)等 MAOI 药物会产生严重的副作用,因此,一般在其他药物没有疗效的情况下才会开这些药物。使用 MAOI 时需要严格控制饮食,因为这类药物会和某些奶酪、泡菜、葡萄酒等食物以及某些药物和草本补充剂发生相互作用,危险甚至致命。司来吉兰(Emsam)是一种新型 MAOI,可以作为垫片贴在皮肤上,副作用少于其他 MAOI 药物。这类药物不能和 SSRI 药物联合使用。
鼻内艾氯胺酮
新药物,例如鼻内艾氯胺酮,可以快速发挥抗抑郁作用,特别是对于难治性抑郁症患者。以鼻喷雾剂的形式提供,通常在几个小时内迅速起效,缓解抑郁症状。使用艾氯胺酮的人通常会继续服用口服抗抑郁药以维持症状的改善。
多种药物
有时候可能需要尝试几种药物或联合用药,然后才能找到有效的药物。这需要耐心,因为对有些药物而言,完全起效及其副作用随着身体调整而缓解,需要数周或更长时间。
突然停药的风险
抗抑郁药需要一段时间(通常需要 4-8 周)才能发挥作用,睡眠、食欲和注意力问题通常会在情绪好转之前得到改善。
咨询医生前,请不要停止服用抗抑郁药。抗抑郁药一般不会上瘾,但有时会产生身体依赖性(这与上瘾不同)。突然停止治疗或多次漏服药物可能导致类似戒断的症状,突然放弃治疗可能导致抑郁症恶化。配合医生,逐渐安全减小剂量。
// 中药类
早在中国汉代,张仲景就记载了治疗抑郁症的经典方剂,但其具体药理机制尚不清楚。在最近的研究中,一些中药的抗抑郁作用已被证明与肠道菌群相关。
例如,舒肝颗粒可以显著改善慢性约束应激小鼠的异常行为和海马炎症。后续的机制研究表明,其给药丰富了小鼠肠道中的丁酸单胞菌和节疣念珠菌,降低了拟杆菌的丰度,并与PI3K/Akt/mTOR途径密切相关。
五味子可以通过抑制TLR4/NF-κB信号通路来减轻抑郁小鼠的肠道微生态失调。
除了调节炎症,中药还在调节神经递质水平方面发挥作用。
莲心碱治疗可以缩短抑郁小鼠的不动时间,增加海马中的DA、5-HT和NE等神经递质。同时,小鼠结肠中乳酸杆菌的相对丰度也有所增加。
在另一项研究中,特异性抗抑郁药中药的靶点可以集中在嘌呤代谢的调节上。与中药相关的动物研究,如肉苁蓉和藏红花酸,表明它们的抗抑郁作用与肠道菌群的调节密切相关。
除了动物研究,临床研究也提供了相应的证据。对患有抑郁症的癌症患者使用中药复方小柴胡汤进行干预。给药后,受试者的抑郁症状减轻,肠道微生态失调得到部分逆转(特别是减少了副拟杆菌、Blautia和瘤胃球菌科细菌的丰度)。有趣的是,这种抗抑郁的草药也表现出一些抗肿瘤作用,其潜在机制涉及TLR4/MyD88/NF-κB信号传导。
值得注意的是,这些途径在涉及微生物群的抑郁症发病机制中也发挥着重要作用。最近的系统综述和荟萃分析也表明,与抗抑郁药相比,中药可以减少不良事件。鉴于目前的研究数量有限,准确总结中药治疗抑郁症的益处和风险还为时过早。
// 专业治疗
一旦注意到抑郁症的迹象或症状,与心理健康专家交谈将是至关重要的一步。值得信赖的治疗师可以识别模式,帮助情绪调节。
心理治疗
几种类型的心理治疗(也称为谈话疗法或咨询),可以通过教抑郁症患者新的思维和行为方式以及如何改变导致抑郁的习惯来帮助他们。
治疗抑郁症的循证方法包括:
一种谈话疗法,旨在帮助改变任何可能导致或恶化抑郁症的消极思想或行为模式。这种疗法通常也是短期的,重点是解决当前的问题并学习新的应对技巧。
治疗师通过帮助个体识别和处理与人际关系有关的困难,以及改善与他人的交流方式,来促进情绪上的积极变化。 解决几个常见的人际问题,包括失去、冲突、角色变化和人际孤立感。个体可以增强情感的稳定性和归属感,提高应对人际问题的能力。
心理健康服务远程医疗的发展提供了面对面治疗的替代方案,在某些情况下使人们更容易、更方便地获得帮助。对于过去可能对寻求心理健康护理犹豫不决的人来说,远程心理健康服务可能是比传统心理健康服务更容易的第一步。
脑刺激疗法
如果药物或心理治疗不能减轻抑郁症状,脑刺激疗法可能是一种值得探索的选择。
拥有最多证据的脑刺激疗法包括:
ECT 和 rTMS 是使用最广泛的脑刺激疗法,其中 ECT 的使用历史最长。
替代疗法
每日晨光疗法是季节性情感障碍患者的常见治疗选择。光疗设备比普通室内照明明亮得多,被认为是安全的,但患有某些眼病或服用增加对阳光敏感性的药物的人不建议。
抑郁症不仅仅是一种精神疾病,还具有生理和解剖学改变,本文我们了解了抑郁症相关的基本知识,以及肠道菌群在抑郁症发展和症状表现中的重要性。深入了解抑郁症和肠道菌群之间的相互影响将有助于未来开发更有效的治疗策略,并提高患者的生活质量。
我们应该全面认识抑郁症,意识到其不仅仅是一种心理问题,而是一个涉及多个身体系统的综合性障碍。除了对心理状态的影响外,抑郁症还可以引起神经系统、免疫系统、心血管系统以及睡眠障碍等多方面的变化。
目前对于微生物组在口腔-肠道-脑轴中的作用已经有了一定的认识,这是一个重要的研究方向,从病理生理学到调节肠道微生物组对精神疾病产生影响。关于口腔微生物群与精神疾病的关联详见本次推文第二篇:
这些身体系统的紊乱可能进一步加剧抑郁症的症状,并对患者的整体健康状况产生负面影响。
在临床实践中,针对抑郁症的治疗需要不同科室的医生共同合作。未来更多需要整合心理治疗、药物治疗、营养治疗和包括菌群检测在内的综合性健康管理等多个领域的专业知识与技术,实施多学科联合治疗,为抑郁症的治疗提供全新的视角,并为未来研究和改进抑郁症治疗策略提供宝贵的经验。
吾日三省吾身:
每天给予自己足够的关怀和爱吗?
对自己的身心健康变化是否警觉并感兴趣?
是否意识到自己的情绪,并且能够充分处理和接纳它们?
…
希望大家都能健康快乐,远离抑郁。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
相关阅读:
环境污染物通过肠脑轴影响心理健康,精神益生菌或将发挥重要作用
主要参考文献:
Basiji K, Sendani AA, Ghavami SB, Farmani M, Kazemifard N, Sadeghi A, Lotfali E, Aghdaei HA. The critical role of gut-brain axis microbiome in mental disorders. Metab Brain Dis. 2023 Jul 12. doi: 10.1007/s11011-023-01248-w. Epub ahead of print. PMID: 37436588.
Chang L, Wei Y, Hashimoto K. Brain-gut-microbiota axis in depression: A historical overview and future directions. Brain Res Bull. 2022 May;182:44-56. doi: 10.1016/j.brainresbull.2022.02.004. Epub 2022 Feb 11. PMID: 35151796.
Bradlow RCJ, Berk M, Kalivas PW, Back SE, Kanaan RA. The Potential of N-Acetyl-L-Cysteine (NAC) in the Treatment of Psychiatric Disorders. CNS Drugs. 2022 May;36(5):451-482.
Chen Y, Xu J, Chen Y. Regulation of Neurotransmitters by the Gut Microbiota and Effects on Cognition in Neurological Disorders. Nutrients. 2021 Jun 19;13(6):2099. doi: 10.3390/nu13062099. PMID: 34205336; PMCID: PMC8234057.
Smith KM, Renshaw PF, Bilello J. The diagnosis of depression: current and emerging methods. Compr Psychiatry. 2013 Jan;54(1):1-6. doi: 10.1016/j.comppsych.2012.06.006. Epub 2012 Aug 15. PMID: 22901834; PMCID: PMC5502713.
Joe Cohen, BS. How Depression May Be Linked To Gut Microbes. 2022.12.selfhacked.
Major Depressive Disorder Working Group of the Psychiatric GWAS Consortium; Ripke S, Wray NR, Lewis CM, Hamilton SP, Weissman MM, et al., A mega-analysis of genome-wide association studies for major depressive disorder. Mol Psychiatry. 2013 Apr;18(4):497-511.
Zeng Y, Navarro P, Xia C, Amador C, Fernandez-Pujals AM, Thomson PA, Campbell A, Nagy R, Clarke TK, Hafferty JD, Smith BH, Hocking LJ, Padmanabhan S, Hayward C, MacIntyre DJ, Porteous DJ, Haley CS, McIntosh AM. Shared Genetics and Couple-Associated Environment Are Major Contributors to the Risk of Both Clinical and Self-Declared Depression. EBioMedicine. 2016 Dec;14:161-167.
Sharma A. Systems Genomics Support for Immune and Inflammation Hypothesis of Depression. Curr Neuropharmacol. 2016;14(7):749-58.
Flint J, Kendler KS. The genetics of major depression. Neuron. 2014 Feb 5;81(3):484-503. doi: 10.1016/j.neuron.2014.01.027. Erratum in: Neuron. 2014 Mar 5;81(5):1214.
Brundin L, Sellgren CM, Lim CK, Grit J, Pålsson E, Landén M, Samuelsson M, Lundgren K, Brundin P, Fuchs D, Postolache TT, Traskman-Bendz L, Guillemin GJ, Erhardt S. An enzyme in the kynurenine pathway that governs vulnerability to suicidal behavior by regulating excitotoxicity and neuroinflammation. Transl Psychiatry. 2016 Aug 2;6(8):e865.
Lohoff FW. Overview of the genetics of major depressive disorder. Curr Psychiatry Rep. 2010 Dec;12(6):539-46.
González-Arancibia C, Urrutia-Piñones J, Illanes-González J, Martinez-Pinto J, Sotomayor-Zárate R, Julio-Pieper M, Bravo JA. Do your gut microbes affect your brain dopamine? Psychopharmacology (Berl). 2019 May;236(5):1611-1622. doi: 10.1007/s00213-019-05265-5. Epub 2019 May 17. PMID: 31098656.
Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T, Mende DR, Li J, Xu J, Li S, Li D, Cao J, Wang B, Liang H, Zheng H, Xie Y, Tap J, Lepage P, Bertalan M, Batto JM, Hansen T, Le Paslier D, Linneberg A, Nielsen HB, Pelletier E, Renault P, Sicheritz-Ponten T, Turner K, Zhu H, Yu C, Li S, Jian M, Zhou Y, Li Y, Zhang X, Li S, Qin N, Yang H, Wang J, Brunak S, Doré J, Guarner F, Kristiansen K, Pedersen O, Parkhill J, Weissenbach J; MetaHIT Consortium; Bork P, Ehrlich SD, Wang J. A human gut microbial gene catalogue established by metagenomic sequencing. Nature. 2010 Mar 4;464(7285):59-65.
Bercik P, Collins SM, Verdu EF. Microbes and the gut-brain axis. Neurogastroenterol Motil. 2012 May;24(5):405-13.
Mayneris-Perxachs J, Castells-Nobau A, Arnoriaga-Rodríguez M, Martin M, de la Vega-Correa L, Zapata C, Burokas A, Blasco G, Coll C, Escrichs A, Biarnés C, Moreno-Navarrete JM, Puig J, Garre-Olmo J, Ramos R, Pedraza S, Brugada R, Vilanova JC, Serena J, Gich J, Ramió-Torrentà L, Pérez-Brocal V, Moya A, Pamplona R, Sol J, Jové M, Ricart W, Portero-Otin M, Deco G, Maldonado R, Fernández-Real JM. Microbiota alterations in proline metabolism impact depression. Cell Metab. 2022 May 3;34(5):681-701.e10.
David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, Biddinger SB, Dutton RJ, Turnbaugh PJ. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014 Jan 23;505(7484):559-63.
Bailey MT, Dowd SE, Galley JD, Hufnagle AR, Allen RG, Lyte M. Exposure to a social stressor alters the structure of the intestinal microbiota: implications for stressor-induced immunomodulation. Brain Behav Immun. 2011 Mar;25(3):397-407.
Diaz Heijtz R, Wang S, Anuar F, Qian Y, Björkholm B, Samuelsson A, Hibberd ML, Forssberg H, Pettersson S. Normal gut microbiota modulates brain development and behavior. Proc Natl Acad Sci U S A. 2011 Feb 15;108(7):3047-52.
Desbonnet L, Garrett L, Clarke G, Kiely B, Cryan JF, Dinan TG. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience 170: 1179-1188
Bercik P, Denou E, Collins J, Jackson W, Lu J, Jury J, Deng Y, Blennerhassett P, Macri J, McCoy KD, Verdu EF, Collins SM. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology. 2011 Aug;141(2):599-609, 609.e1-3.
Huang R, Wang K, Hu J. Effect of Probiotics on Depression: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients. 2016 Aug 6;8(8):483.
Akkasheh G, Kashani-Poor Z, Tajabadi-Ebrahimi M, Jafari P, Akbari H, Taghizadeh M, Memarzadeh MR, Asemi Z, Esmaillzadeh A. Clinical and metabolic response to probiotic administration in patients with major depressive disorder: A randomized, double-blind, placebo-controlled trial. Nutrition. 2016 Mar;32(3):315-20.
Macpherson AJ, Harris NL.. Interactions between commensal intestinal bacteria and the immune system. Nat Rev Immunol 4: 478-485
Bailey MT. Influence of stressor-induced nervous system activation on the intestinal microbiota and the importance for immunomodulation. Adv Exp Med Biol. 2014;817:255-76.
García Bueno B, Caso JR, Madrigal JL, Leza JC. Innate immune receptor Toll-like receptor 4 signalling in neuropsychiatric diseases. Neurosci Biobehav Rev. 2016 May;64:134-47.
Nugent NR, Tyrka AR, Carpenter LL, Price LH. Gene-environment interactions: early life stress and risk for depressive and anxiety disorders. Psychopharmacology (Berl). 2011 Mar;214(1):175-96.
Ait-Belgnaoui A, Durand H, Cartier C, Chaumaz G, Eutamene H, Ferrier L, Houdeau E, Fioramonti J, Bueno L, Theodorou V. Prevention of gut leakiness by a probiotic treatment leads to attenuated HPA response to an acute psychological stress in rats. Psychoneuroendocrinology. 2012 Nov;37(11):1885-95.
Cryan JF, Dinan TG. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nat Rev Neurosci. 2012 Oct;13(10):701-12.
Bercik P, Verdu EF, Foster JA, Macri J, Potter M, Huang X, Malinowski P, Jackson W, Blennerhassett P, Neufeld KA, Lu J, Khan WI, Corthesy-Theulaz I, Cherbut C, Bergonzelli GE, Collins SM. Chronic gastrointestinal inflammation induces anxiety-like behavior and alters central nervous system biochemistry in mice. Gastroenterology. 2010 Dec;139(6):2102-2112.e1.
Bravo JA, Forsythe P, Chew MV, Escaravage E, Savignac HM, Dinan TG, Bienenstock J, Cryan JF. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci U S A. 2011 Sep 20;108(38):16050-5. doi: 10.1073/pnas.1102999108.
Bercik P, Denou E, Collins J, Jackson W, Lu J, Jury J, Deng Y, Blennerhassett P, Macri J, McCoy KD, Verdu EF, Collins SM. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology. 2011 Aug;141(2):599-609, 609.e1-3.
Mayneris-Perxachs J, Castells-Nobau A, Arnoriaga-Rodríguez M, Martin M, de la Vega-Correa L, Zapata C, Burokas A, Blasco G, Coll C, Escrichs A, Biarnés C, Moreno-Navarrete JM, Puig J, Garre-Olmo J, Ramos R, Pedraza S, Brugada R, Vilanova JC, Serena J, Gich J, Ramió-Torrentà L, Pérez-Brocal V, Moya A, Pamplona R, Sol J, Jové M, Ricart W, Portero-Otin M, Deco G, Maldonado R, Fernández-Real JM. Microbiota alterations in proline metabolism impact depression. Cell Metab. 2022 May 3;34(5):681-701.e10.
Lopez MJ, Mohiuddin SS. Biochemistry, Essential Amino Acids. 2023 Mar 13. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–.
Mokhtari V, Afsharian P, Shahhoseini M, Kalantar SM, Moini A. A Review on Various Uses of N-Acetyl Cysteine. Cell J. 2017 Apr-Jun;19(1):11-17.
Ershad M, Naji A, Vearrier D. N-Acetylcysteine. [Updated 2023 Feb 19]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan-.
Fernandes BS, Dean OM, Dodd S, Malhi GS, Berk M. N-Acetylcysteine in depressive symptoms and functionality: a systematic review and meta-analysis. J Clin Psychiatry. 2016 Apr;77(4):e457-66.
Berk M, Dean OM, Cotton SM, Jeavons S, Tanious M, Kohlmann K, Hewitt K, Moss K, Allwang C, Schapkaitz I, Robbins J, Cobb H, Ng F, Dodd S, Bush AI, Malhi GS. The efficacy of adjunctive N-acetylcysteine in major depressive disorder: a double-blind, randomized, placebo-controlled trial. J Clin Psychiatry. 2014 Jun;75(6):628-36.
Fernandes BS, Dean OM, Dodd S, Malhi GS, Berk M. N-Acetylcysteine in depressive symptoms and functionality: a systematic review and meta-analysis. J Clin Psychiatry. 2016 Apr;77(4):e457-66.
Hasebe K, Gray L, Bortolasci C, Panizzutti B, Mohebbi M, Kidnapillai S, Spolding B, Walder K, Berk M, Malhi G, Dodd S, Dean OM. Adjunctive N-acetylcysteine in depression: exploration of interleukin-6, C-reactive protein and brain-derived neurotrophic factor. Acta Neuropsychiatr. 2017 Dec;29(6):337-346.
Das P, Tanious M, Fritz K, Dodd S, Dean OM, Berk M, Malhi GS. Metabolite profiles in the anterior cingulate cortex of depressed patients differentiate those taking N-acetyl-cysteine versus placebo. Aust N Z J Psychiatry. 2013 Apr;47(4):347-54.
Fekadu A, Demissie M, Birhane R, Medhin G, Bitew T, Hailemariam M, Minaye A, Habtamu K, Milkias B, Petersen I, Patel V, Cleare AJ, Mayston R, Thornicroft G, Alem A, Hanlon C, Prince M. Under detection of depression in primary care settings in low and middle-income countries: a systematic review and meta-analysis. Syst Rev. 2022 Feb 5;11(1):21.
Wickham SR, Amarasekara NA, Bartonicek A, Conner TS. The Big Three Health Behaviors and Mental Health and Well-Being Among Young Adults: A Cross-Sectional Investigation of Sleep, Exercise, and Diet. Front Psychol. 2020 Dec 10;11:579205.
Yates BE, DeLetter MC, Parrish EM. Prescribed exercise for the treatment of depression in a college population: An interprofessional approach. Perspect Psychiatr Care. 2020 Oct;56(4):894-899.
Belvederi Murri M, Ekkekakis P, Magagnoli M, Zampogna D, Cattedra S, Capobianco L, Serafini G, Calcagno P, Zanetidou S, Amore M. Physical Exercise in Major Depression: Reducing the Mortality Gap While Improving Clinical Outcomes. Front Psychiatry. 2019 Jan 10;9:762.
Peirce JM, Alviña K. The role of inflammation and the gut microbiome in depression and anxiety. J Neurosci Res. 2019 Oct;97(10):1223-1241. doi: 10.1002/jnr.24476. Epub 2019 May 29. PMID: 31144383.
Basso JC, Suzuki WA. The Effects of Acute Exercise on Mood, Cognition, Neurophysiology, and Neurochemical Pathways: A Review. Brain Plast. 2017 Mar 28;2(2):127-152.
Worley SL. The Extraordinary Importance of Sleep: The Detrimental Effects of Inadequate Sleep on Health and Public Safety Drive an Explosion of Sleep Research. P T. 2018 Dec;43(12):758-763.
Shen H, Chen M, Cui D. Biological mechanism study of meditation and its application in mental disorders. Gen Psychiatr. 2020 Jul 13;33(4):e100214.
Hölzel BK, Carmody J, Vangel M, Congleton C, Yerramsetti SM, Gard T, Lazar SW. Mindfulness practice leads to increases in regional brain gray matter density. Psychiatry Res. 2011 Jan 30;191(1):36-43.
Ljungberg T, Bondza E, Lethin C. Evidence of the Importance of Dietary Habits Regarding Depressive Symptoms and Depression. Int J Environ Res Public Health. 2020 Mar 2;17(5):1616.
Francis HM, Stevenson RJ, Chambers JR, Gupta D, Newey B, Lim CK. A brief diet intervention can reduce symptoms of depression in young adults – A randomised controlled trial. PLoS One. 2019 Oct 9;14(10):e0222768.
Wong SK, Chin KY, Ima-Nirwana S. Vitamin D and Depression: The Evidence from an Indirect Clue to Treatment Strategy. Curr Drug Targets. 2018;19(8):888-897.
Kaveladze B, Diamond Altman A, Niederhausen M, Loftis JM, Teo AR. Social relationship quality, depression and inflammation: A cross-cultural longitudinal study in the United States and Tokyo, Japan. Int J Soc Psychiatry. 2022 Mar;68(2):253-263.
Matthew Solan.The secret to happiness? Here’s some advice from the longest-running study on happiness.Harvard Health.
Cunha LF, Pellanda LC, Reppold CT. Positive Psychology and Gratitude Interventions: A Randomized Clinical Trial. Front Psychol. 2019 Mar 21;10:584.
Menéndez-Aller Á, Postigo Á, Montes-Álvarez P, González-Primo FJ, García-Cueto E. Humor as a protective factor against anxiety and depression. Int J Clin Health Psychol. 2020 Jan-Apr;20(1):38-45.
Reyes-Martínez S, Segura-Real L, Gómez-García AP, Tesoro-Cruz E, Constantino-Jonapa LA, Amedei A, Aguirre-García MM. Neuroinflammation, Microbiota-Gut-Brain Axis, and Depression: The Vicious Circle. J Integr Neurosci. 2023 May 8;22(3):65. doi: 10.31083/j.jin2203065. PMID: 37258450.

谷禾健康
胆汁酸是一种代谢胆固醇的物质,它具有两个亲和性不同的区域,即一部分能够与水分子相互作用(亲水),而另一部分则不能与水分子相互作用(疏水)。
由于拥有这种两亲性质,胆汁酸能够在生物体内与胆固醇等脂类物质结合并形成混合物,从而起到降低血液中胆固醇水平的作用。
胆汁酸不仅是代谢胆固醇的物质,还有其他重要的功能。胆汁酸可以通过激活肝脏和肠道中的受体,调节血糖水平、胆固醇代谢和免疫信号等。
其中,初级胆汁酸是由肝细胞合成并储存在胆囊中的,而次级胆汁酸则是由肠道中的微生物代谢初级胆汁酸形成的。
随着研究的深入,发现肠道菌群和胆汁酸在人体健康和疾病中发挥着重要的作用。肠道菌群可以代谢胆汁酸,影响其在体内的水平和作用,从而影响脂质代谢、肝胆功能和肠道健康等方面。
同时,胆汁酸也可以影响肠道菌群的组成和功能,维持肠道微生物的平衡和多样性。因此,肠道菌群和胆汁酸之间的相互作用关系对于人体健康和疾病的发生、发展和治疗具有重要的意义。
肠道微生物主要的代谢产物包括:短链脂肪酸、色氨酸、胆汁酸等。
以往我们写过短链脂肪酸(详见:你吃的膳食纤维对你有帮助吗?)、
色氨酸(详见:色氨酸代谢与肠内外健康稳态 )。
本文我们主要阐述胆汁酸及其代谢,与肠道微生物群之间的关联及其在疾病中的作用。
本文目录/contents
Part1:胆汁酸及其代谢
Part2:影响胆汁酸代谢的因素
Part3:肠道菌群与胆汁酸之间的相互作用
Part4:微生物群-胆汁酸相互作用的影响
Part5:微生物与胆汁酸在疾病中的作用
Part6:调节胆汁酸代谢的方法
Part7:结语
本文提及的专业名词缩写
FXR——法尼醇X受体,胆汁酸是FXR的天然配体,因此FXR又称为胆汁酸受体。
SHP——是LRH-1(肝脏受体同源物-1)在肝细胞激活的主要靶基因,胆汁酸通过LRH-1诱导SHP的表达,表达的SHP结合并失活LRH-1,从而抑制胆汁酸合成相关基因及SHP自身的表达。
TGR5——又称G蛋白偶联胆汁酸受体,是一种胆汁酸受体。在外周组织器官如肝、脾、肾、脂肪等多种组织中表达水平较高,能调控脂类和葡萄糖代谢。
GLP-1——胰高血糖素样肽-1是一种由肠道细胞所分泌的激素,属于一种肠促胰岛素。
FXR-Fgf15轴——回肠肠细胞中FXR的激活释放Fgf15(FGF19是人的同源基因),Fgf15通过门静脉循环到达肝细胞,与FGFR4结合并抑制CYP7A1,从而抑制肝细胞胆汁酸的合成。
当胆固醇在肝细胞内代谢时,会产生一种叫做胆汁酸的化合物。胆汁酸可以溶解脂肪,促进脂肪消化和吸收,同时还能帮助排泄体内多余的胆固醇。
胆汁酸一般可分为初级胆汁酸和次级胆汁酸
初级胆汁酸(primary bile acids):
初级胆汁酸是由肝细胞合成并储存在胆汁中的胆汁酸,它是胆汁中最主要的成分。初级胆汁酸的结构比较简单,含有羟基(-OH)和羧基(-COOH)等官能团,因此具有良好的水溶性。初级胆汁酸可以在肠道中与脂肪结合成胆汁酸盐,参与脂肪的乳化和吸收过程。
初级胆汁酸包括胆酸、鹅去氧胆酸、甘氨胆酸、牛磺胆酸、甘氨鹅去氧胆酸、牛磺鹅去氧胆酸。
次级胆汁酸(secondary bile acids):
次级胆汁酸是由肠道中的微生物代谢初级胆汁酸生成的,也称为微生物代谢产物。次级胆汁酸的结构更加复杂,它经过羟化、氧化、甲基化等反应后形成。次级胆汁酸相对于初级胆汁酸来说,具有更强的亲脂性和生物活性。
次级胆汁酸主要有去氧胆酸、石胆酸、甘氨去氧胆酸、牛磺去氧胆酸、甘氨石胆酸、牛磺石胆酸。
胆汁酸的结构有助于它们的功能。胆汁酸一般由一个甾醇核心组成,该核心由三个六元碳环和一个五元碳环组成,通常具有5β-氢和沿前两个稠合环平面的顺式结构。
一般胆汁酸的结构
Collins SL,et al.Nat Rev Microbiol.2023
胆汁酸的种类由与其结合的羟基、羧基、硫酸根和氨基酸基团的数量和位置决定。羟基和羰基面向甾醇核心的同一侧,而甲基面向相反的一侧。这使得胆汁酸具有两亲特性,因为一侧是疏水的,而另一侧是亲水的。
胆汁酸的不同种类

Poland JC,et al.Physiology (Bethesda).2021
胆汁酸的疏水性取决于甾醇环上羟基和硫酸根的数量和位置,以及胆汁酸是否与氨基酸结合,在小鼠中主要是牛磺酸,在人类中主要是甘氨酸。
胆汁酸的肠肝循环是一个精细调节的过程。
初级胆汁酸由肝脏中的胆固醇通过胆固醇7α-羟化酶(CYP7A1)介导途径或固醇27-羟化酶(CYP27A1)介导途径合成。
然后初级胆汁酸与牛磺酸或甘氨酸结合,储存在胆囊中,然后在摄入食物后分泌到十二指肠中,以促进膳食脂质和脂溶性维生素的吸收。
95%以上的胆汁酸会被重吸收
排入肠道的各种胆汁酸约95%以上要被重吸收。回肠部的重吸收是主动重吸收,其余肠段为被动重吸收,并运回肝脏进行代谢回收。
注:虽然少量初级胆汁酸可以通过被动扩散吸收,但有效吸收需要由回肠上皮细胞中表达的顶端胆汁酸转运蛋白 (ASBT) 介导的主动转运。结合的初级胆汁酸主要由回肠胆汁酸结合蛋白 (IBABP) 通过肠细胞转运。
这个过程在人体中每天发生4到12次,并确保维持胆汁酸稳态。
人体胆汁酸的肠肝循环
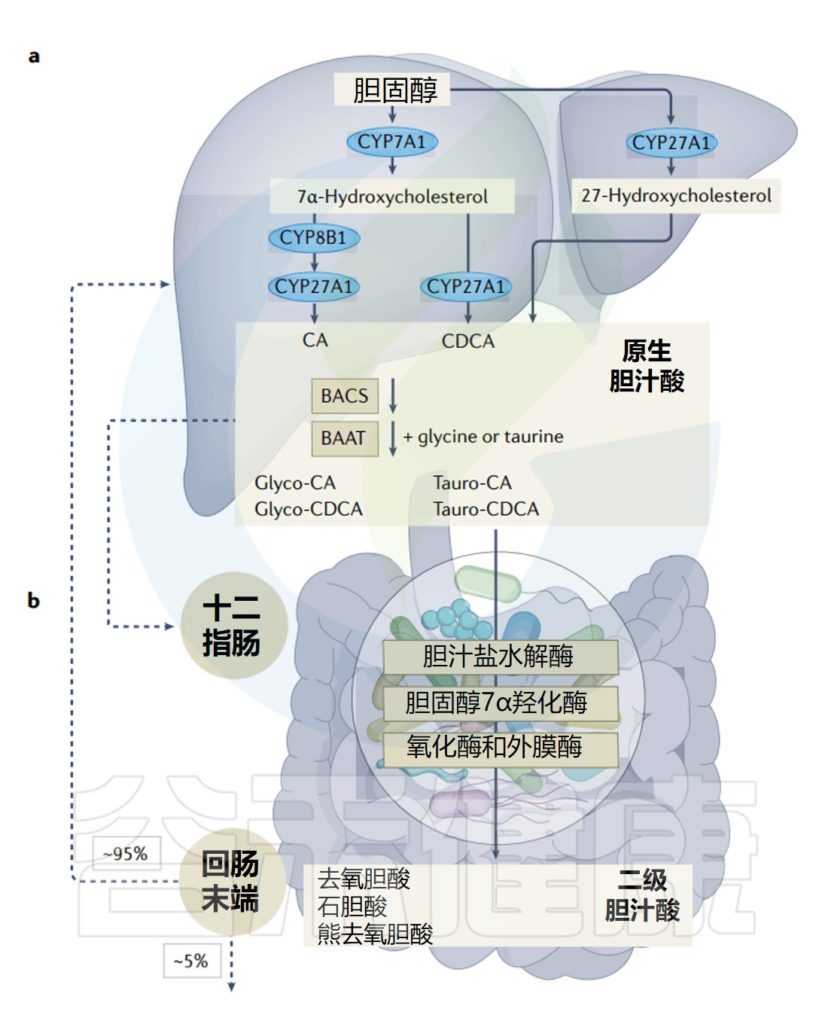
Collins SL,et al.Nat Rev Microbiol.2023
在肠道中,结合的初级胆汁酸受微生物群作用并转化为次级胆汁酸,从而进一步增加胆汁酸库的多样性和整体疏水性。
次级胆汁酸代谢的第一步是通过胆汁盐水解酶(BSH)水解氨基酸部分。胆汁盐水解酶在所有主要的肠道微生物(拟杆菌(Bacteroidetes)、厚壁菌(Firmicutes)和放线菌(Actinobacteria))中都是高度保守的,但由于它们对甘氨酸偶联或牛磺酸偶联的胆汁酸具有优先活性,因此在细菌之间是不同的。
✦细菌对胆汁酸的代谢一般是有益的
细菌胆汁酸去偶联对一般细菌有益,因为它们从氨基酸和宿主那里获得能量,它降低了胆汁酸的毒性。然而,对于胆汁盐水解酶是否对细菌有益存在一些争论。
细菌其他的作用包括氧化,脱硫,酯化和偶联。将在本文后面的章节具体展开描述。
从分类上看,多种细菌都能在体外将氨基酸与胆汁酸结合,其中双歧杆菌(Bifidobacterium)、拟杆菌(Bacteroides)和肠球菌(Enterococcus)的结合量最大。
微生物生产者的胆汁酸代谢

Cai J,et al.Cell Host Microbe.2022
药物、运动、饮食或其他不良状态导致肠道菌群组成或活性的改变都会扰乱胆汁酸代谢。
影响细菌转化胆汁酸的因素
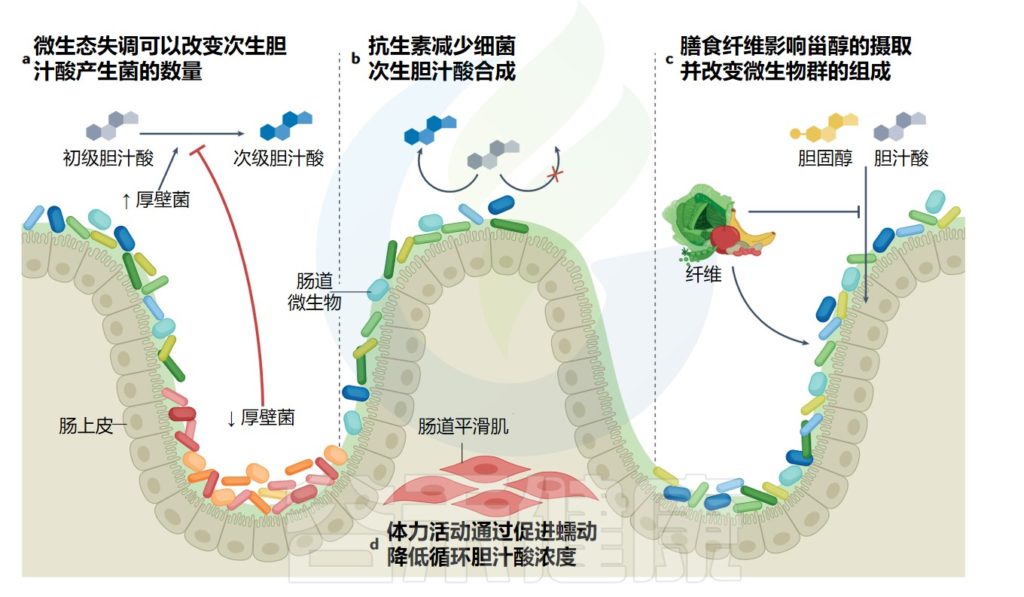
Collins SL,et al.Nat Rev Microbiol.2023
肠道微生物可以代谢胆汁酸,影响其在体内的水平和作用。肠道微生物失调可能会导致胆汁酸代谢紊乱,从而影响脂质代谢、肝胆功能和肠道健康等方面。
具体来说,肠道微生物失调可能会导致以下影响:
•胆汁酸合成减少:肠道微生物可以参与胆汁酸的合成过程,肠道微生物失调可能会导致胆汁酸合成减少,从而影响胆汁酸代谢。
•胆汁酸代谢紊乱:肠道微生物可以代谢胆汁酸,影响其在体内的水平和作用。肠道微生物失调可能会导致胆汁酸代谢紊乱,从而影响脂质代谢、肝胆功能和肠道健康等方面。
•肠道屏障功能受损:肠道微生物失调可能会导致肠道屏障功能受损,从而影响肠道对胆汁酸的吸收和代谢。
•炎症反应增加:肠道微生物失调可能会导致肠道炎症反应增加,从而影响胆汁酸代谢和肠道健康。
因此,保持肠道微生物的平衡和稳定,对于维持胆汁酸代谢的正常和健康具有重要的意义。
抗生素等药物对胆汁酸有着巨大的影响。抗生素治疗对宿主破坏最严重的代谢途径之一是胆汁酸代谢。
•影响次生胆汁酸的水平
随着细菌的耗竭,可用于解除宿主胆汁酸结合的胆汁盐水解酶减少,次级胆汁酸也不再产生。因此,使用抗生素,可观察到共轭胆汁酸和一些次生胆汁酸水平下降。
其他药物,如抗抑郁药物帕罗西汀,也可以扰乱胆汁酸水平。
次级胆汁酸的损失进一步加剧了胆汁酸的失调,因为胆汁酸的生物合成被上调,导致初级胆汁酸库更大。
几项研究将锻炼与不同的胆汁酸联系起来,但结果存在一些矛盾。
•适度运动可增加胆汁酸的排泄
啮齿类动物研究发现,由于胃肠运动或胆固醇摄取增加,适度运动可增加胆汁酸排泄。然而,令人惊讶的是,这些啮齿动物的胆汁酸合成和信号传导不受运动的影响。
•运动可使循环胆汁酸总体减少
在人类中,持续时间的增加和运动的一致性导致血清和粪便胆汁酸的总体减少。这对结直肠癌和非酒精性脂肪性肝病具有意义,其中循环胆汁酸增加与负面结果相关。
注:除了宿主胆汁代谢外,体育活动还可以逆转非酒精性脂肪性肝患者的微生物群失调,这可能导致不同的次生胆汁酸水平。
此外,对运动训练有生理适应的长跑运动员具有较少的诱变性次生胆汁酸。需要更多的研究来阐明体育活动对肠道和肝脏中胆汁酸的影响。
人们早就知道,饮食,尤其是脂肪和纤维的摄入,可以极大地改变微生物群和胆汁酸代谢。
•胆固醇摄入多会提高胆汁酸总体水平
摄入胆固醇会提高人体内胆汁酸的总体水平,因为胆固醇是胆汁酸的前体,并上调胆汁酸的合成途径。
在高脂肪饮食的人群中,由于表达7α-去羟化酶和表达胆汁酸水解酶的细菌数量的增加,次生胆汁酸和非共轭胆汁酸水平特别高。
•纤维诱导胆汁酸的排泄、抑制其吸收
相比之下,膳食纤维可以在胃肠道消化过程中通过吸附作用促进胆汁酸的排泄以及抑制胆汁酸在肠道的吸收。
高脂肪、低纤维饮食的胆汁酸特性与结肠癌患者有关。最近的一篇文章表明,小鼠的热量限制减少了总胆汁酸,包括石胆酸和去氧胆酸,也减少了总微生物群的含量。
•肝胆系统疾病会导致胆汁酸代谢紊乱
肝胆系统疾病如肝硬化、胆囊疾病等可能会影响胆汁酸的合成和代谢,导致胆汁酸代谢紊乱和相关疾病的发生。
肝细胞受到了损伤,就会出现代谢问题,导致患者的总胆汁酸偏高。
•孕妇的总胆汁酸会偏高
怀孕期间孕妇体内的孕激素水平改变会引起胆汁酸代谢异常,从而使得孕妇总胆汁酸偏高
一些遗传因素也可能会影响胆汁酸代谢,特定的宿主基因变异会影响胆汁酸代谢和肠腔内的胆汁酸含量,导致相关疾病的发生。
▼
人类与微生物群的交流部分依赖于宿主受体对微生物代谢物的反应。微生物群通过几种关键的宿主胆汁酸受体调节胆汁酸的代谢和转运。
肠道菌群调节胆汁酸主要体现在生物转化、生物合成和胆汁酸的运输。
胆汁酸信号传导和网络
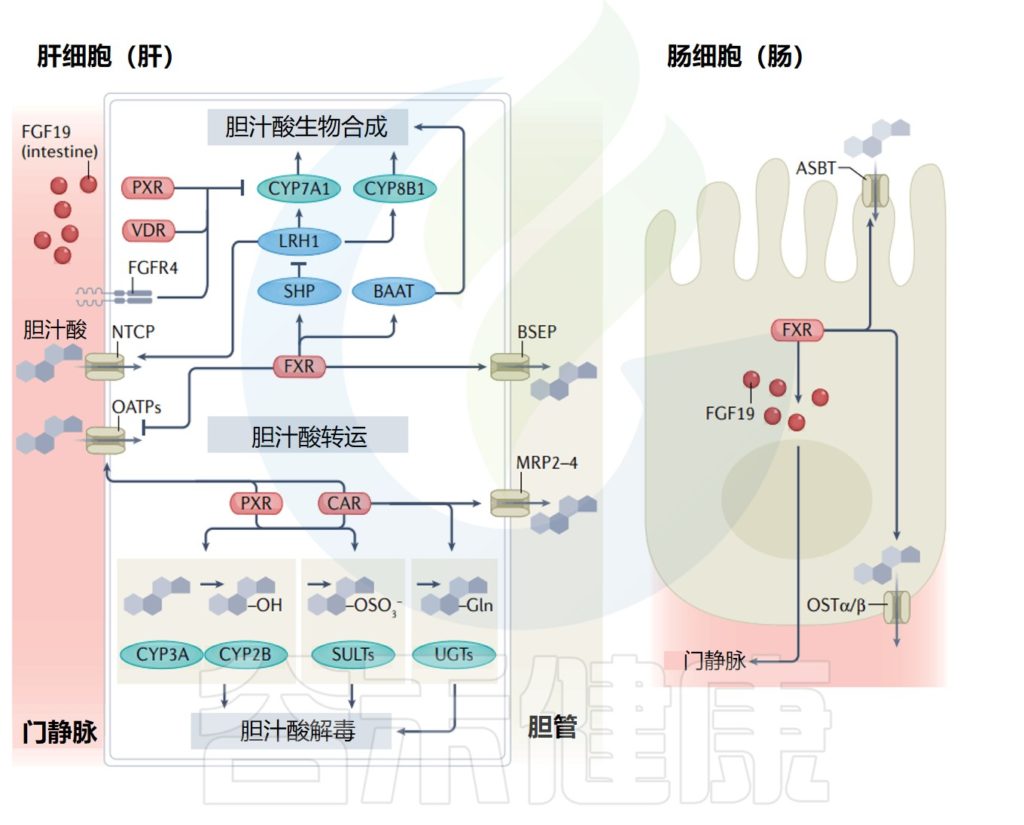
Collins SL,et al.Nat Rev Microbiol.2023
1
肠道菌群调节胆汁酸的生物转化
胆汁酸在肝脏中合成并通过胆道系统释放到肠道,部分释放到远端回肠或结肠,在那里它们被肠道菌群进一步代谢。
✦影响胆汁酸生物毒性和肠道吸收
肠道微生物可以改变胆汁酸,因为它们具有不同的 胆汁酸代谢酶。肠道微生物群通过去结合、7ɑ-脱羟基、异构化、氧化、脱硫和酯化来调节胆汁酸的化学多样性,进而影响其生物毒性和肠道吸收。
去共轭和7ɑ-脱羟基是两个值得注意的反应。
主要通过胆汁酸水解酶进行的微生物去结合是肠道环境中微生物进一步修饰胆汁酸的关键一步。
胆汁酸水解酶编码基因已在各种肠道微生物中检测到并表征,包括双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)、肠球菌(Enterococcus)、梭菌(Clostridium)、拟杆菌(Bacteroides)等。
✦小部分细菌通过脱羟基作用转化胆汁酸
已经表明,怀孕期间分泌胆汁酸水解酶的拟杆菌丰度增加会促进胆汁酸解偶联,从而减少肠细胞胆汁酸的摄取。
胆盐水解酶去结合的胆汁酸随后通过肠道菌群产生的7ɑ-脱羟基作用脱水,并最终转化为次级和三级胆汁酸。
然而,7α-脱羟基作用仅由少数厌氧物种进行,目前的估计表明,只有大约0.0001%的结肠细菌可以进行这种反应,占肠道微生物群总数的不到0.025%。
16S rRNA 序列分析表明,这些细菌主要是梭菌属,包括C.hiranonis、C.scindens、C.hylemonae(簇 XIVa)和C.sordelli(簇 XI)。
在大肠中,梭菌属物种可以通过7α-脱羟基作用将胆酸和鹅去氧胆酸分别转化为去氧胆酸和石胆酸。
✦氧化反应导致差向异构化
氧化和环氧化在胆汁酸的微生物修饰和代谢反应中也受到特别关注,一些肠道微生物合成能够进行可逆氧化还原反应和羟基环氧化的羟基类固醇脱氢酶 (HSDH)。
羟基类固醇脱氢酶(HSDH)活性存在于肠道微生物群的四个主要类别中:
放线菌门(Actinobacteria);
变形菌门(Proteobacteria);
厚壁菌门(Firmicutes);
拟杆菌门(Bacteroidetes)。
这些氧化反应最终会导致差向异构化。然而,由于缺乏合适的分析方法,人们对微生物通过羟基类固醇脱氢酶调节胆汁酸异构化反应的机制知之甚少,但这些反应性胆汁酸的疏水性和毒性是无可辩驳的。
✦肠道微生物的破坏导致胆汁酸代谢紊乱
2019年进行的一项研究支持肠道微生物群的破坏会导致胆汁酸代谢紊乱。这项研究发现,在接受各种抗生素治疗的大鼠的血浆和粪便中,牛磺酸结合的胆汁酸显著增加,而游离胆汁酸减少,胆汁酸的多样性也显著降低。
一项较早的研究还指出,肠道微生物群对胆汁酸有显著影响。无菌小鼠胆汁酸的多样性减少,并且缺乏未结合的和次级胆汁酸。
注:与正常小鼠相比,盲肠、结肠和粪便中的胆汁酸水平降低,但胆囊和小肠中的胆汁酸水平升高。
✦微生物群影响胆汁酸受体信号
实验研究进一步证明了微生物群影响FXR信号。当用tempol处理小鼠时,减少了乳酸杆菌属。及其胆汁酸水解酶改变肠道微生物群的活性,导致厚壁菌门:拟杆菌门比率降低,次级胆汁酸降低,以及牛磺酸-β-鼠胆酸 (T-β-MCA) 积累。
Tempol是一种超氧化物歧化酶(SOD)类似物,可有效中和活性氧。
虽然次级胆汁酸是有效的FXR激动剂,而T-β-MCA是FXR拮抗剂,但抑制胆汁酸受体信号会导致胆汁酸合成增加和胆汁酸库大小增加。
但由于参与胆汁酸脱氢的梭状芽孢杆菌簇XI和XVIa的减少,胆汁酸多样性下降。脱硫弧菌(Desulfovibrionales)也可以逆转这一过程,脱硫弧菌负责从饮食和宿主来源代谢含硫化合物。富含脱硫弧菌的肠道微生物群可以调节胆汁酸的代谢,从而使肠道产生更多的次生胆汁酸。
2
肠道菌群影响胆汁酸的生物合成
✦影响关键酶的表达从而调节胆汁酸的合成
肠道微生物群对胆汁酸形成的调节是复杂的,包括由至少17种不同酶催化的几个反应步骤。然而,更重要的是,肠道微生物群对胆汁酸的代谢会影响许多参与胆汁酸从头合成的关键酶的表达,包括CYP7A1、CYP7B1、CYP8B1和CYP27A1。
在厚壁菌中,可以通过FXR-FGF15/19 反馈机制调节胆汁酸的合成。在肝细胞中,通过来自 SHP/LRH-1/LXRα 的负反馈调节胆汁酸合成。
SHP是LRH-1在肝细胞激活的主要靶基因,胆汁酸通过LRH-1诱导SHP的表达,表达的SHP结合并失活LRH-1,从而抑制胆汁酸合成相关基因及SHP自身的表达。
抑制过程
一旦肝脏FXR被激活,SHP就会立即被触发以抑制LRH转录,从而抑制CYP7A1和CYP8B1转录。在肠道细胞中,FXR通过FXR/FGF19/FGFR4通路抑制胆汁酸合成,其中FXR诱导FGF19/FGF15,后者又与FGFR4和β-klotho复合物结合,触发 MAPK/ERK1/2 通路并最终抑制该基因CYP7A1在肝脏中的表达。
✦没有细菌的情况下无法产生胆汁酸受体激活剂
研究证实肠道在没有细菌的情况下无法产生胆汁酸受体激活剂。肠道微生物群可以通过降低T-MCA水平和促进回肠中FXR依赖性FGF15的表达来抑制CYP7A1和胆汁酸的合成,从而表明肠道微生物群通过FXR-FGF15/19反馈机制调节胆汁酸的合成。
注:正如已经提到的,脱硫弧菌(Desulfovibrionales)衍生的硫化氢除了有利于含7α-脱羟基细菌的生长外,还可以诱导肝脏 FXR 并抑制CYP7A1表达和胆汁酸合成。
3
肠道菌群调节胆汁酸的运输
微生物群还可以通过法尼醇X受体(FXR)反馈机制调节胆汁酸运输。
✦通过影响法尼醇X受体调节胆汁酸的重吸收
肝脏中FXR的激活诱导胆盐输出泵(BSEP)、MRP、OSTα和OSTβ复合物以增强胆汁酸的肝脏消除,同时通过抑制Na+/牛磺胆酸盐对肝细胞中基底外侧NTCP和OATP1B1和OATP1B3的下调来减少胆汁酸重吸收。
肠道中的法尼醇X受体激活上调肠道胆汁酸结合蛋白 ,以促进胆汁盐通过回肠肠细胞,并增强OSTα和 OSTβ表达以帮助胆汁酸从肠道进入门脉循环。
OSTα/β——有机溶质转运蛋白,一种表达在肠上皮细胞基底膜的异二聚体蛋白,主要负责转运胆汁酸入静脉血。
此外,法尼醇X受体可以通过下调ASBT,通过SHP和FGF15/19通路调节肠细胞和胆管细胞对胆汁酸的重吸收。
ASBT——顶端膜钠依赖性胆汁酸转运蛋白
▼
肠道中的胆汁酸被微生物群进一步代谢,进而影响微生物组成。胆汁酸已被证明对肠道微生物群有直接和间接的影响。
胆汁酸是微生物群丰度、多样性和代谢活性的重要决定因素。
1
破坏了胆汁酸不耐受细菌的结构
研究表明,较高的胆汁酸浓度表现出抗菌活性,当胆汁酸不耐受细菌暴露于高浓度胆汁酸时,胆汁酸 会溶解磷脂并分离内在的膜蛋白,导致细胞膜被完全破坏,导致细胞内物质溢出。
除了膜损伤外,胆汁酸还通过干扰RNA二级结构、破坏大分子的稳定性、引起DNA损伤和促进蛋白质错误折叠,从而破坏肠道微生物的组成,从而表现出直接的抗菌活性。
在胆汁酸喂养的大鼠中,厚壁菌门的丰度显著增加,丹毒丝菌(Erysipelotrichi)和梭状芽胞杆菌(Clostridia)中的一些微生物也增加了。
✦胆汁酸的含量对不同细菌作用不同
一般来说,胆汁酸池的减少似乎有利于革兰氏阴性细菌的生长,这些细菌能够产生脂多糖,其中一些具有致病潜力。
相比之下,随着胆汁酸池的增加,观察到革兰氏阳性厚壁菌门的生长,从而促进了次级胆汁酸的产生。
2
影响微生物群的多样性及功能
尽管它们具有毒性作用,但胆汁酸也支持微生物群的多样性。在人体中,牛磺-β-鼠胆酸和牛磺酸胆酸对多种微生物的发展至关重要。
✦胆汁酸的分泌可以提供能量支持微生物多样性
虽然尚未证实其机制,但胆汁酸的分泌可能提供足够的能量来支持大量微生物的多样性。除了成分的改变,胆汁酸还改变了微生物群的功能能力。
例如,去氧胆酸、牛磺胆酸和牛磺酰脱氧胆酸会破坏小鼠中细菌的核苷酸和碳水化合物代谢。
3
抑制细菌的过度生长
研究发现小鼠肠道微生物群落过度增殖和细菌易位,通过使用口服胆汁酸,以诱导法尼醇X受体激活,从而抑制细菌过度生长。
✦胆汁酸受体诱导抗菌肽和宿主免疫反应
这是因为法尼醇X受体可以诱导参与肠道保护的基因,法尼醇X受体诱导抗菌肽产生和宿主免疫反应调节来塑造微生物组。
在回肠中缺乏法尼醇X受体受体表达细胞的小鼠也表现出肠道微生物数量的变化,拟杆菌和厚壁菌的数量分别增加和减少。其主要原因是法尼醇X受体敲低后胆汁酸的合成增加,这表明胆汁酸可以抵消法尼醇X受体信号通路,从而影响肠道微生物的组成。
小结
一般来说,肠道微生物群和胆汁酸之间存在双向相互作用。
肠道微生物群可以调节胆汁酸的合成和代谢,相反,胆汁酸可以改变肠道菌群的组成。
因此,维持胆汁稳态对肠道微生态非常重要。然而,还需要更多的研究来了解胆汁酸对肠道微生物群的功能操作如何影响宿主-微生物群的交流。
微生物群和胆汁酸之间的相互作用会影响肠道屏障功能的维持,调节先天免疫和适应性免疫,并调节定植抵抗力。
胆汁酸对宿主细胞的影响主要由膜相关和胆汁酸受体介导,包括法尼醇X受体(FXR)、G蛋白偶联受体5(TGR5)、孕烷X受体(PXR)和维生素D受体(VDR)。
FXR和TGR5在肝脏、回肠远端和结肠、上皮细胞、内皮细胞和免疫细胞中高度表达。除了在调节胆汁酸合成中的作用外,这两种受体对于维持肠道屏障完整性和限制炎症都是必不可少的。
注:胆汁酸激活TGR5的能力不同,顺序为石胆酸>去氧胆酸>鹅去氧胆酸>熊去氧胆酸>胆酸。
肠上皮细胞形成紧密连接的能力对于肠屏障的形成和维持至关重要。几项研究支持胆汁酸在调节紧密连接功能中的作用。
胆汁酸介导的肠道屏障功能调节
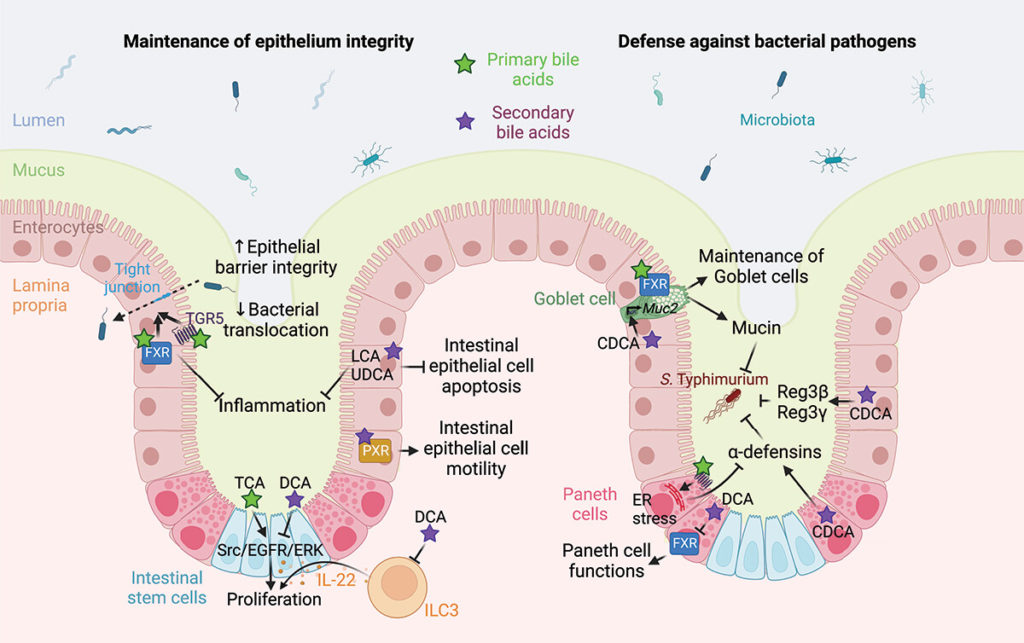
Larabi AB,et al.Gut Microbes.2023
▷肠道通透性与胆汁酸浓度有关
在喂食高脂肪饮食的小鼠和大鼠中,肠道通透性增加和紧密连接蛋白表达减少与盲肠和血浆胆汁酸浓度的改变有关,总胆汁酸库和次级胆汁酸增加。
法尼醇X受体缺失会增加肠道通透性
胆汁酸对肠上皮完整性的调节是由其激活受体的能力介导的。在小鼠和大鼠胆管结扎胆汁流阻塞模型中,法尼醇X受体的缺失增加了肠道通透性和细菌移位,并降低了紧密连接蛋白的表达。
同样,在化学诱导的结肠炎小鼠模型中,法尼醇X受体的激活限制了上皮屏障的通透性并防止了肠道炎症。
法尼醇X受体在肠上皮稳态中的作用是通过FGF蛋白介导的。补充喂食去氧胆酸的小鼠会出现生态失调,这会减少胆汁酸去结合,从而限制FXR-FGF15轴的激活并损害粘膜屏障功能。
G蛋白偶联受体5缺陷小鼠肠道通透性增加
此外,与野生型小鼠相比,G蛋白偶联受体5缺陷小鼠表现出紧密连接的表达改变、肠道通透性增加并且更易患化学诱导的结肠炎,表明这种胆汁酸受体在维持肠道屏障中的作用。
▷诱导上皮细胞增殖
胆汁酸还诱导肠上皮细胞增殖并限制细胞凋亡。在小鼠中,次级胆汁酸石胆酸和熊去氧胆酸可防止肠道炎症并限制上皮细胞凋亡。胆汁酸通过作用于肠道干细胞中的G蛋白偶联受体5受体来促进上皮再生。
牛磺胆酸诱导肠上皮细胞增殖
在体外,化学激动剂对法尼醇X受体的刺激增加了肠上皮细胞的运动和伤口闭合。牛磺胆酸通过表皮生长因子受体(EGFR)和胞外调节蛋白激酶(ERK)激活在体外诱导肠上皮细胞增殖,而去氧胆酸通过法尼醇X受体依赖性机制抑制细胞增殖。
最后,高脂肪饮食诱导的去氧胆酸增加通过减少3型先天淋巴细胞的数量来减少肠道干细胞的增殖和分化,从而减少潘氏细胞和杯状细胞。
▷调节粘液层的形成和组成
胆汁酸还调节粘液层的形成和组成,粘液层由浸泡在抗菌药物(如防御素)中的粘蛋白组成。
补充鹅去氧胆酸粘蛋白转录增加
在化学诱导的结肠炎小鼠模型中,法尼醇X受体的激活可防止产生粘蛋白的杯状细胞的损失。补充鹅去氧胆酸饮食的小鼠表现出潘氏细胞α-防御素的表达增加,杯状细胞Muc2(粘蛋白2-编码基因)的转录增加,回肠上皮C型凝集素Reg3β和Reg3γ的合成增强。
次级胆汁酸去氧胆酸具有刺激作用,而熊去氧胆酸在体外抑制人β-防御素-1和β-防御素-2的表达和分泌,这可能对维持肠道稳态也有影响。
微生物群产生的胆汁酸调节免疫的不同方面,包括诱导炎症基因募集先天性和适应性免疫细胞。
微生物衍生的胆汁酸调节肠道先天性和适应性免疫
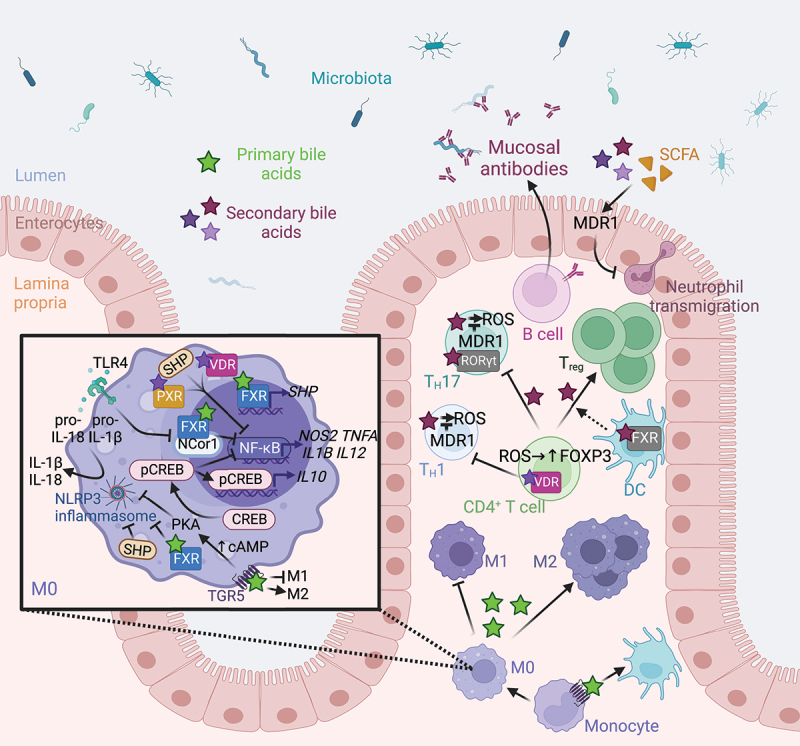
Larabi AB,et al.Gut Microbes.2023
▷调节促炎基因表达
胆汁酸受体FXR、TGR5和PXR调节促炎基因表达。在化学诱导的结肠炎小鼠模型中,FXR缺陷恶化,而FXR激动剂奥贝胆酸治疗可防止粘膜炎症并促进抗菌基因的表达。
胆汁酸受体影响促炎基因的表达
此外,法尼醇X受体可以通过直接结合促炎基因的启动子,以不依赖于SHP的方式调节促炎基因的表达。
病原体相关分子模式激活Toll样受体4会导致促炎基因启动子释放NCor1,从而激活其转录。最后,孕烷X受体和维生素D受体直接抑制NF-κB信号,从而减少促炎反应。
▷限制炎性体的产生
胆汁酸也限制炎症小体的激活。FXR和SHP通过与NLRP3炎症小体和胱天蛋白酶-1的物理相互作用来抑制炎症小体的组装,而TGR5环磷酸腺苷(cAMP)途径的激活通过诱导其泛素化来阻断NLRP3炎性小体的激活,这最终限制了白细胞介素-1β和白细胞介素-18的产生。
施用胆汁酸可减轻部分炎症
将去氧胆酸和石胆酸直肠给药于各种小鼠结肠炎模型可减轻炎症,部分是通过作用于TGR5受体。因此,溃疡性结肠炎患者体内菌群失调引起的次级胆汁酸缺乏可能会促进炎症,而炎症可以通过恢复次级胆汁酸水平得到缓解。
相反,另一项研究报告称,结肠中的去氧胆酸给药可部分通过刺激组织蛋白酶B释放来激活 NLRP3 炎性体,这会增加巨噬细胞分泌白细胞介素-1β并加剧结肠炎。
鉴于结肠炎模型中次级胆汁酸的相反作用,需要进一步的研究来更好地了解其在肠道炎症中的作用。
▷影响免疫细胞的募集和分化
胆汁酸还指导各种免疫细胞的募集和分化。与野生型小鼠相比,法尼醇X受体缺陷小鼠在结肠炎期间表现出炎症细胞募集减少。
接受鹅去氧胆酸补充剂的小鼠表现出向肠粘膜募集的单核细胞、巨噬细胞和嗜中性粒细胞减少,其中鼠伤寒沙门菌(S.Typhimurium)和柠檬酸杆菌(C.rodentium)感染期间B细胞的相对数量增加。
最近的研究表明,次级胆汁酸的氧代、异代和同种异体调节T细胞分化。
在体内,微生物群衍生的IsoDCA通过限制法尼醇X受体活性增加树突状细胞的免疫刺激特性,从而间接促进结肠调节性T细胞的分化。
▷通过抑制中性粒细胞迁移限制肠道炎症
暴露于固有层中的胆汁酸会驱动效应细胞TH1和TH17中的氧化应激。效应T细胞在迁移到回肠时通过上调外源性转运蛋白多药耐药蛋白1(MDR1,也称为P-糖蛋白)的表达来适应,以限制胆汁酸驱动的氧化应激。
胆汁酸与短链脂肪酸协同作用限制了肠道炎症
胆汁酸和微生物群衍生的短链脂肪酸协同作用,调节MDR1的表达,抑制中性粒细胞迁移,从而限制肠道炎症。
总之,肠道微生物组产生次级胆汁酸的能力是调节炎症以及先天和适应性免疫细胞募集、分化和激活的重要因素。
相反,适应性免疫调节微生物群和次级胆汁酸的产生。因此,维持这些因素之间的平衡对于维持肠道稳态是必要的。
微生物群通过竞争资源和产生限制细菌生长的代谢产物,如短链脂肪酸,来保护细菌免受机会性感染。
微生物群衍生的限制细菌生长的代谢产物可以被视为选择最适合环境的代谢特征的栖息地过滤器。微生物群通过与宿主合作来防止机会病原体在肠道定植。
微生物群介导的胆汁酸代谢和对病原体的防御
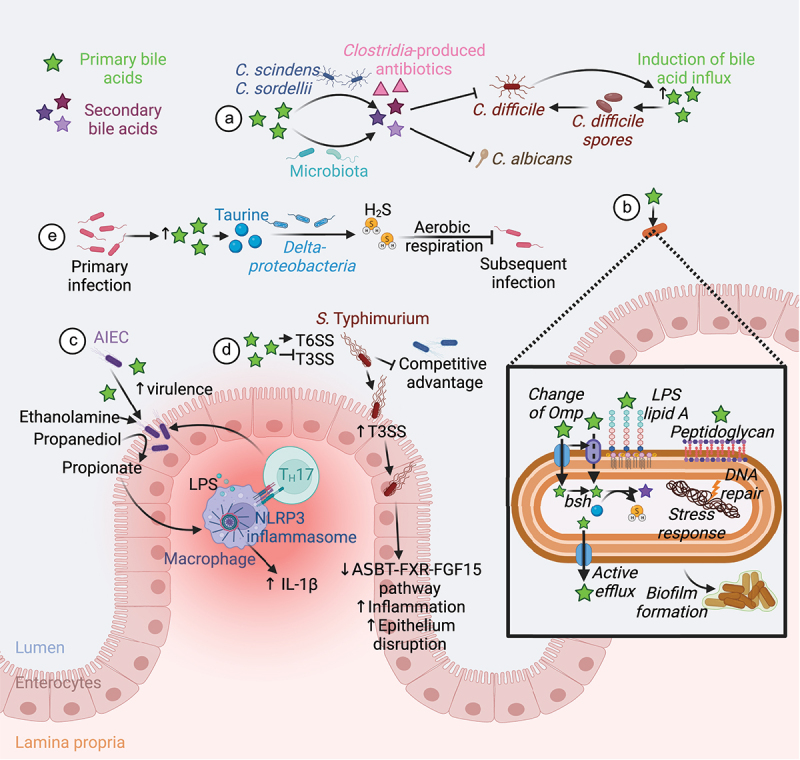
Larabi AB,et al.Gut Microbes.2023
▷增强了对病原体的防御
微生物群对胆汁酸的调节在保护宿主免受致病性感染方面发挥作用。
在人类中,肠道微生物群中胆汁酸水解酶的丰度和活性越高,通过降解激活病原体毒力基因表达的牛磺胆酸,对霍乱弧菌(Vibrio cholerae)感染的抵抗力就越强。
次级胆汁酸对艰难梭菌具有定值抗性
将初级胆汁酸转化为次级胆汁酸的共生细菌提供了对艰难梭菌(C. difficile)的定植抗性。初级胆汁酸可诱导艰难梭菌孢子萌发,而次级胆汁酸对营养细胞有毒。
编码操纵子的共生梭菌通过产生抑制艰难梭菌萌发、生长和毒素产生的次级胆汁酸来保护艰难梭菌不受感染。
石胆酸和去氧胆酸对白色念珠菌具有抵抗性
在体外,次级胆汁酸石胆酸和去氧胆酸对白色念珠菌具有直接的抗真菌活性。相反,通过改变微生物群组成和减少肠道单核吞噬细胞和TH17细胞的数量,向抗生素治疗的小鼠施用牛磺胆酸会加剧白色念珠菌的定植和传播。
因此,微生物群对胆汁酸的作用调节了定植抗性,直接通过抑制病原体生长或间接通过调节粘膜固有和适应性反应。
▷作为致病菌和病原体的环境信号
由于胆汁酸及其代谢产物是肠道环境的关键特征,许多机会性病原体利用这些线索来调节肠道定植所需的毒力因子的表达。
粘附侵袭性大肠杆菌(AIEC) 是一种独特的常驻粘膜相关病理细菌,克罗恩病患者中富含这种细菌。利用特定的肠道环境来增加它们的复制并诱发炎症。
在管腔中,胆汁酸促进AIEC毒力基因的表达,例如有利于细菌在肠道中持久存在的鞭毛蛋白FliC,以及促进细菌与潘氏斑相互作用和生长的长极性菌毛LpF。
此外,胆汁盐的存在激活了次级代谢途径,使AIEC能够使用乙醇胺作为氮源,使用丙二醇作为碳源,从而赋予这些菌株相对于其他共生细菌的竞争优势。但也与脂多糖协同作用,触发白细胞介素-1β的产生和TH17细胞的激活,从而促进T细胞依赖性肠道炎症。
影响病原菌的毒力和运动性
鼠伤寒杆菌(S.Typhimurium)暴露于胆汁会增加其VI型蛋白分泌系统(T6SS)的活性,将具有抗菌活性的效应蛋白输送到邻近细胞,从而杀死共生细菌并成功地在肠道定植。
在霍乱弧菌(V. cholerae)中,初级胆汁酸增加了毒力和运动性。艰难梭菌(C. difficile)在宿主定植过程中诱导胆汁酸快速流入肠道,这有助于孢子萌发和生长。
▷会记住过去的感染,以便在未来更好地抵抗
肠道病原体感染会破坏胆汁酸的回肠吸收和胆汁酸产生的内分泌调节。
表现出更强的定值抗性
实验小鼠在感染假结核耶尔森菌(Y.pseudotuberculosis)数周后,表现出对肺炎克雷伯菌(Klebsiella pneumoniae)更强的定植抗性。
潜在的机制是感染假结核耶尔森菌(Y.pseudotuberculosis),一种侵入回肠派尔氏斑块的肠道病原体,增加了肠道微生物群中Deltaproteobacteria的丰度。
注:Deltaprotoebacteria是一类代谢胆汁酸衍生的牛磺酸的细菌。
Deltaproterobacteria摄入牛磺酸会导致硫化氢的释放,可以通过有氧呼吸抑制肺炎克雷伯菌生长。
Deltaproteobacteria丰度的增加也增强了对柠檬酸杆菌(C.rodentium)的定殖抗性,是一种需要氧气才能在肠道环境中生长的病原体。
这些研究表明微生物群衍生的硫化氢限制了兼性厌氧机会性病原体的生长。
注意
尽管结肠中胆汁酸浓度的增加可能有利于增强定植抵抗力,但胆汁酸浓度过高与炎症性疾病和结直肠癌有关。
因此,需要对胆汁酸代谢进行精细调节,以增强定植抵抗力,同时限制对宿主的有害影响。
肠道菌群和胆汁酸在人体健康和疾病中发挥着重要的作用。肠道菌群可以代谢胆汁酸,影响其在体内的水平和作用,从而影响脂质代谢、肝胆功能和肠道健康等方面。
同时,胆汁酸也会影响艰难梭菌感染、癌变与细胞周期失调。下面谷禾列举了胆汁酸在影响人类疾病中的一些例子。
宿主和微生物群依赖性胆汁酸对人类疾病的影响
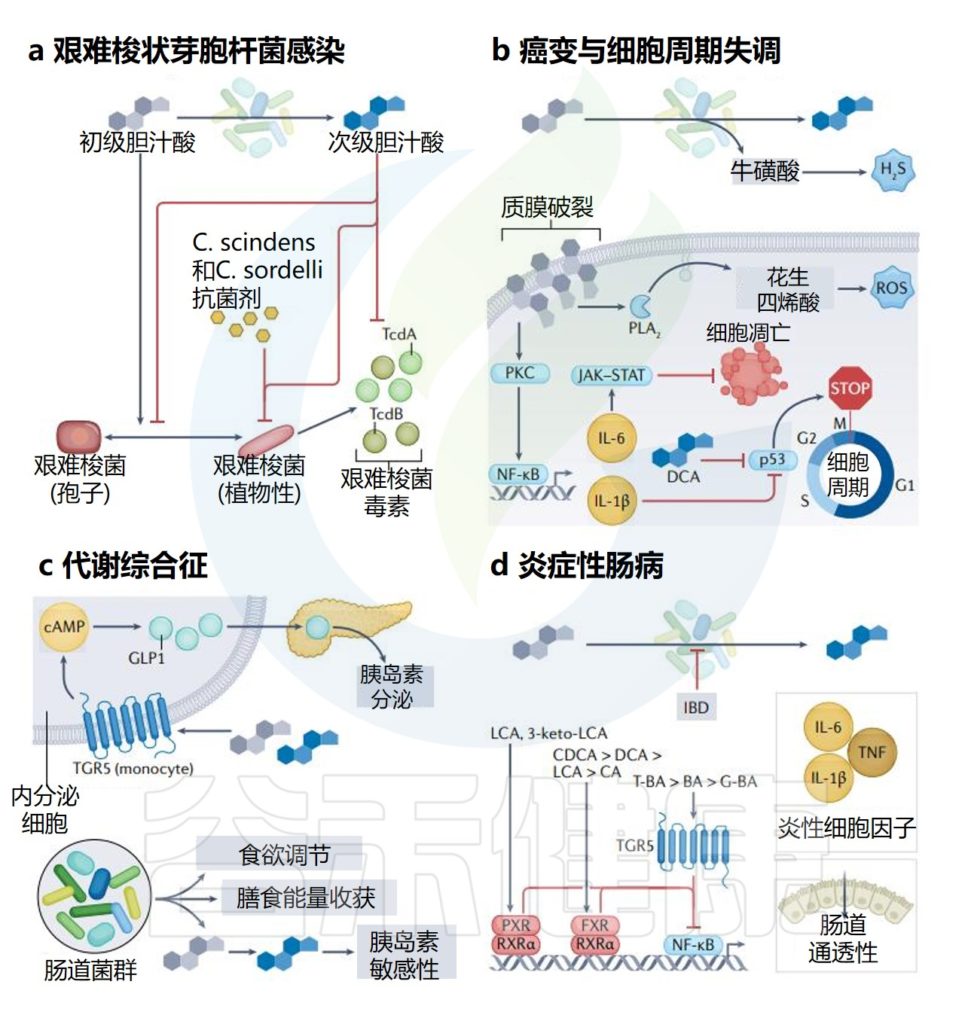
编辑
Collins SL,et al.Nat Rev Microbiol.2023
代谢综合征是指至少有以下三种体征的个体:高血压、肥胖、血液甘油三酯水平升高或血糖水平升高。
患有代谢综合征的人有多种疾病的风险,包括糖尿病、中风、心脏病和结直肠癌。
√肠道菌群改变胆汁酸对代谢稳态非常重要
遗传、饮食和环境都在代谢性疾病中起作用,其中包括微生物群和胆汁酸组成。微生物群通过增加膳食能量收获、调节食欲和改变胆汁酸池对代谢稳态至关重要。
√次级胆汁酸与非酒精性脂肪肝相关
抗生素相关的厚壁菌门细菌丰度减少和次级胆汁酸的消耗与代谢综合征患者胰岛素敏感性降低相一致,而微生物群依赖的次级胆汁酸水平增加与非酒精性脂肪肝相关,强调了微生物群相关胆汁酸对代谢健康的重要性。
√次级胆汁酸影响脂质和葡萄糖稳态
虽然次级胆汁酸可能有助于缓解代谢综合征,但其机制尚不清楚。胆汁酸受体如FXR和TGR5维持脂质(胆固醇和甘油三酯)和葡萄糖稳态。
被胆汁酸激活的受体增加胰岛素敏感性
被胆汁酸激活的TGR5通过诱导胰高血糖素样肽-1(GLP1)的分泌而增加胰岛素敏感性。虽然FXR的激活也会增加GLP1的分泌,但它在代谢性疾病中的作用是复杂的,似乎是特定于环境的。
在一些研究中,激活FXR对胆固醇、甘油三酯和葡萄糖水平有有益的影响。例如,肝脏FXR激活通过抑制SREBP1c脂质生成途径来抑制甘油三酯的产生。
√胆汁酸通过法尼醇X受体活性影响代谢
包括奥贝胆酸在内的强效合成FXR激动剂的临床试验显示,非酒精性脂肪肝患者体重减轻,可能是通过刺激棕色脂肪分化和代谢。
然而,关于奥贝胆酸对非酒精性脂肪肝患者胰岛素抵抗的影响,有相互矛盾的报道。此外,在一些研究中,敲除小鼠体内的法尼醇X受体与激活法尼醇X受体有相似的效果(防止体重增加和增加胰岛素敏感性)。
FXR基因敲除小鼠的益处依赖于微生物群,因为微生物群从这些小鼠转移到无菌小鼠可以减轻体重,降低体脂率和胰岛素敏感性。
因此,在检查胆汁酸对肥胖和代谢性疾病的影响时,应仔细考虑肠道和肝脏FXR活性。
艰难梭菌感染(CDI)是全世界范围内最常见的感染之一,一部分感染者为无症状携带者,严重的患者可能出现腹泻、发烧,甚至会死亡。
当正常的微生物群被抗生素耗尽时,就会出现艰难梭菌感染。抗生素消耗的常驻微生物群减少了分泌抗菌肽的梭状芽胞杆菌(Clostridium spp.)的数量,而梭状芽胞杆菌通常控制艰难梭菌的数量。
√微生物胆汁酸代谢对预防艰难梭菌感染有益
此外,原生微生物群将原发性胆汁酸转化为继发性胆汁酸对于预防艰难梭菌感染至关重要。事实上,抗生素相关的原发性胆汁酸升高和继发性胆汁酸水平降低与复发性艰难梭状芽胞杆菌感染有关。
一些初级胆汁酸会诱导艰难梭菌到产毒状态
微生物胆汁酸代谢对预防艰难梭菌感染的益处是多方面的。某些初级胆汁酸,包括胆酸、牛磺胆酸和甘氨胆酸,可诱导艰难梭菌从孢子萌发到活跃的产毒状态。
次级胆汁酸能直接抑制艰难梭菌的生长
相反,去氧胆酸和石胆酸已被证明能直接抑制艰难梭菌的萌发和生长。这部分解释了为什么编码胆汁酸的梭状芽胞杆菌(如C. scindens)产生次生胆汁酸可以保护艰难梭菌感染。
注:C.scindens和Clostridium也分泌抗艰难梭菌的抗菌剂,与去氧胆酸和石胆酸结合使用更有效。
次级胆汁酸可以降低艰难梭菌毒性
次级胆汁酸也直接结合并隔离艰难梭菌毒素B(TcdB)以降低其毒性。细菌胆汁酸代谢对预防艰难梭菌感染很重要,这一认识可能会提供新的治疗选择。
粪菌移植作为抗生素的替代方法已被证明可以通过恢复次级胆汁酸来成功减轻艰难梭菌感染。
肠道菌群相关的胆汁酸会影响胃肠道炎症和肿瘤的发展。
早在20世纪30年代,去氧胆酸就被证明会引起小鼠注射部位的肿瘤。特别是与高脂肪饮食相结合,两种主要的次级胆汁酸(去氧胆酸和石胆酸)长期以来都与胃肠道癌症有关,特别是结直肠癌和肝细胞癌。
√胆汁酸影响致癌作用
微生物群的组成和胆汁酸合成潜力对炎症和癌症的进展至关重要。
高脂肪饮食更容易发生肝细胞癌
高脂肪饮食喂养的小鼠更容易发生肝细胞癌,部分原因是革兰氏阳性群体增加,它们通过7α-去羟基化酶产生去氧胆酸。
由于其疏水性,次级胆汁酸如去氧胆酸和石胆酸比初级胆汁酸更具有致癌性。在肝细胞癌和结直肠癌中,疏水性胆汁酸的癌症加速是基于它们损伤细胞和诱导炎症的能力。
未结合的疏水性去氧胆酸和石胆酸更容易作为清洁剂破坏细胞膜并诱导细胞损伤反应。
抑制法尼醇X受体活性进一步加剧了次级胆汁酸的致癌潜力。许多研究已经观察到人类结直肠癌中法尼醇X受体激活降低,法尼醇X受体敲除小鼠易患结肠和肝脏肿瘤。
作为胆汁酸的受体,法尼醇X受体是癌症进展过程中脂质代谢和细胞信号中断事件之间的重要联系。
炎症会降低法尼醇X受体的激活从而影响癌变
炎症,特别是通过NF- κB信号通路分泌肿瘤坏死因子和白细胞介素-1β,降低了法尼醇X受体的激活。因此,上述细胞对去氧胆酸和石胆酸的促炎反应会促进癌变。
法尼醇X受体失活还会增加胆汁酸的合成并减少肝细胞的胆汁酸输出,进一步加剧胆汁酸积累介导的损伤和炎症。
细菌水解的牛磺酸偶联胆汁酸的促癌作用的另一种机制已被提出。去偶联释放的牛磺酸最终通过磺酸代谢为硫化氢,这是一种强效致癌物。
√炎症性肠病中胆汁酸代谢失调
炎症性肠病是胃肠道慢性炎症性疾病的集合,最常见的是克罗恩病和溃疡性结肠炎。溃疡性结肠炎只影响结肠,而克罗恩病可以同时影响小肠和结肠。
在炎症性肠病发作期间,肠上皮发炎并失去屏障的完整性。虽然炎症性肠病的病因尚不完全清楚,但与肠道菌群的大规模变化有关。
炎症性肠病中胆汁酸代谢明显失调,特别是当微生物群被破坏时。活动性炎症性肠病患者粪便中共轭胆汁酸水平升高,次级胆汁酸水平降低。
注:一项利用计算预测炎症性肠病患者和健康人微生物群的解偶联和修饰潜能的研究发现,炎症性肠病患者微生物群的胆汁酸代谢潜能受到干扰。
次级胆汁酸受体促进肠上皮再生并预防肠道炎症
次级胆汁酸激活G蛋白偶联受体5(TGR5)可促进肠上皮细胞再生并预防肠道炎症。胆汁酸受体FXR和 TGR5被胆汁酸衍生物或其他激动剂激活,刺激靶向通路以调节肠道稳态,预防炎症和肿瘤发生。
炎症性肠病和结直肠癌中的胆汁酸受体
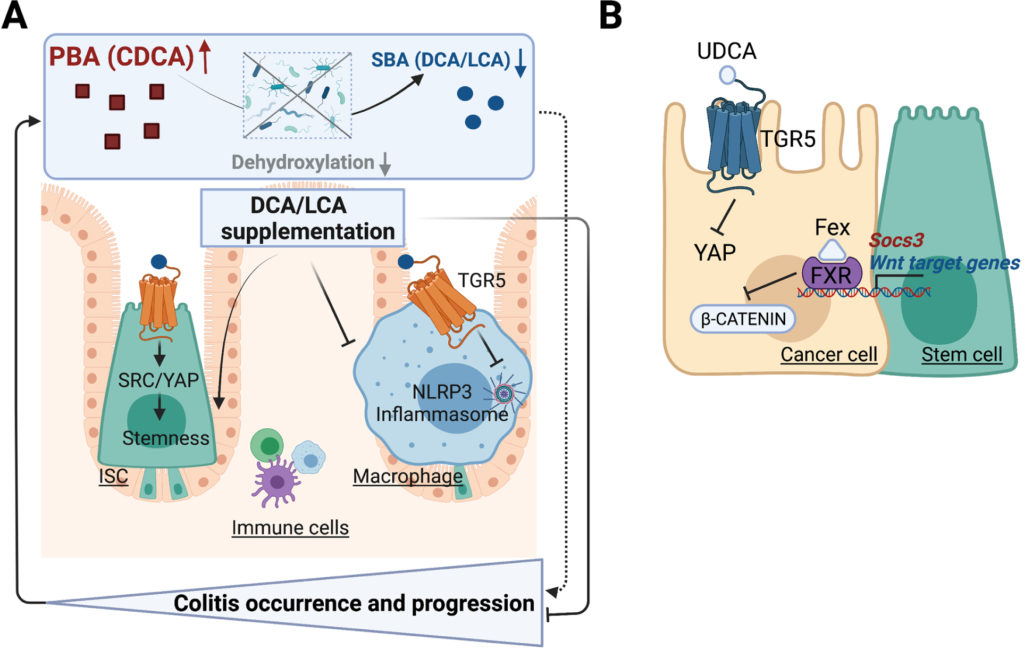
Cai J,et al.Cell Host Microbe.2022
然而,一些因素使胆汁酸、微生物群和炎症性肠病之间的关系复杂化。特别是,活动性炎症性肠病患者肠道转运率的增加减少了总微生物群数量,限制了代谢胆汁酸的足够反应时间。
胆汁酸能预测炎症性肠病的早期缓解
胆汁酸不仅与疾病发生高度相关,而且能够预测炎症性肠病的早期缓解。在最近发表的一项研究中,进行了粪便宏基因组学、血清代谢组学和蛋白质组学,以揭示预测炎症性肠病中抗细胞因子和抗整合素治疗的不同反应的微生物决定因素。
血清胆汁酸,如甘氨石胆酸钠、甘氨脱氧胆酸和熊去氧胆酸的富集可预测接受抗细胞因子治疗的炎症性肠病患者的早期病情缓解。
此外,微生物种类的多样性与与抗细胞因子反应相关的缓解可能性呈正相关,这表明微生物特征可能有利于炎症性肠病的生物治疗反应。
√胆汁酸与结直肠癌发病相关
根据2020年美国癌症协会的统计数据,在美国,结直肠癌是男性和女性癌症死亡的第三大原因。炎症性肠病和结直肠癌密切相关,炎症性肠病被认为是结直肠癌的主要风险因素。
与炎症性肠病类似,结直肠癌也是一种与肠道菌群密切相关的异质性疾病。鉴于肠道微生物群与结肠肿瘤发生之间的联系以及结直肠癌的异质性,多组学技术已被应用于了解疾病的病因学、发现预后或预测性生物标志物以及开发治疗或预防药物。
人体炎症性肠病和结直肠癌中的胆汁酸
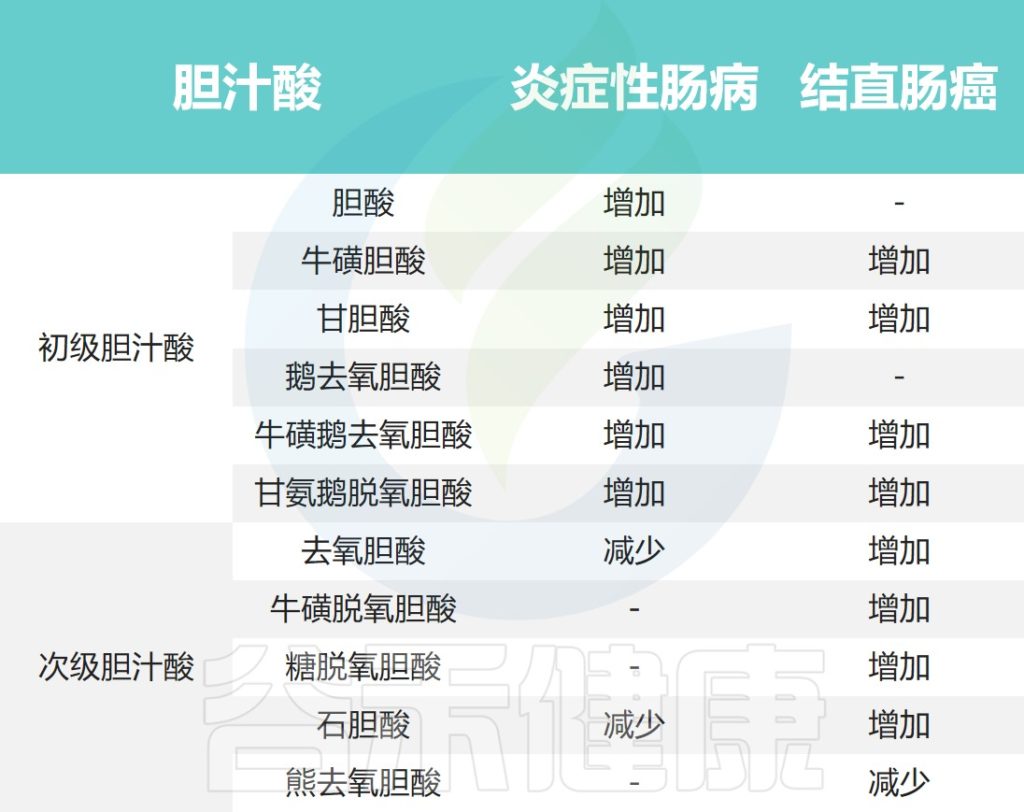
Cai J,et al.Cell Host Microbe.2022
胆汁酸合成基因与结直肠癌显著相关
研究发现胆汁酸合成相关基因的丰度与人类结直肠癌显著相关。
在对来自七个不同国家的八项结直肠癌研究进行的无偏倚荟萃分析中,胆汁酸基因在基因组和转录组水平上都在结直肠癌患者的粪便中高度富集,这可能被用作结直肠癌诊断的替代微生物组标志物。
胆盐水解酶与结直肠癌存在联系
在另一项关于人类微生物组的全球宏基因组研究中,主要来自厚壁菌门的胆汁酸水解酶基因的丰度与结直肠癌呈负相关,这与之前显示结直肠癌患者中厚壁菌门减少的研究一致, 表明胆盐水解酶丰度与人类结直肠癌之间的关系。
胆汁酸含量与肿瘤风险相关的研究:
在一项全基因组鸟枪法宏基因组学和代谢组学研究中,粪便样本取自结直肠肿瘤不同阶段的患者,研究了多步肿瘤发生过程中的微生物组和代谢组学变化。多发性息肉样腺瘤患者的去氧胆酸显著增加。
在欧洲癌症与营养前瞻性调查队列中的一项病例对照研究中,七种血浆胆汁酸的水平,包括甘氨胆酸、牛磺胆酸、牛磺去氧胆酸和甘胆酸等与结肠癌风险呈正相关,而未结合的胆汁酸和三级胆汁酸与癌症风险无关。
其他研究发现,在粪便代谢组学研究中,血清胆汁酸在腺瘤组中升高,并与拟杆菌(Bacteroides)呈正相关而与健康对照相比,结直肠癌患者粪便样本中的熊去氧胆酸有所减少。
一些研究表明去氧胆酸可能有助于结直肠癌的发病机制,不过还需要更多的研究来确定其他胆汁酸,尤其是原发性胆汁酸在人类结直肠癌中的作用。
胆固醇结石病 (GS) 是一种世界范围内流行的疾病,尤其是在西方国家。最近的调查发现,它在中国上海的发病率超过12%。
√胆汁酸分泌异常与胆结石形成相关
导致胆结石的先决生化障碍是胆囊中胆固醇过饱和胆汁的形成。研究中,我们发现胆固醇结石患者和胆结石易感小鼠的粪便中富含脱硫弧菌(Desulfovibrio),诱导胆结石形成。
肝脏胆固醇积聚和胆汁胆固醇分泌增强
我们进一步证明,携带脱硫弧菌与肠道微生物群活化胆汁酸脱羟基作用导致的次级胆汁酸产生增加有关,导致胆汁酸疏水性增加,从而促进肠道胆固醇吸收,导致肝脏胆固醇积聚和胆汁胆固醇分泌增强。
微生物群促进胆固醇结石形成的潜在机制
Hu H,et al.Nat Commun.2022
√易患胆结石的微生物群调节胆汁酸的方式:
易患胆结石的微生物群(富含脱硫弧菌)通过以下方式调节肝胆汁酸代谢:
(1) 增加7α-脱羟基细菌在盲肠中产生更多的次级胆汁酸;
(2) 产生硫化氢并调节肝FXR-CYP7A表达,这些物质影响胆汁酸的合成以及在肝脏中的重吸收;
(3) 导致去氧胆酸增加,进而提高胆汁酸的疏水性指数,抑制肝胆汁酸合成;
(4) 促进肠道胆固醇吸收,导致肝脏胆固醇超载;(5) 促进小管胆固醇分泌到胆汁中并诱导胆固醇胆结石形成。
通过改变微生物群的组成或微生物群代谢某些胆汁酸的能力,或通过施用次生胆汁酸,来控制微生物胆汁酸代谢,具有提供健康益处的潜力。
随着研究阐明了特定胆汁酸对健康的确切影响,治疗可以从更普遍的改变微生物群的方法(例如,粪便移植、益生菌和益生元)转向专门针对单个胆汁酸。
粪便微生物群移植是将健康供体的粪便微生物转移到受体患者,最初是为了恢复完整的微生物群而开发的。
•粪菌移植可以治疗艰难梭菌感染
粪菌移植治疗艰难梭菌感染的成功可能部分是由于恢复了依赖胆汁酸水解酶的次级胆汁酸生产。
尽管一些初级胆汁酸,如牛磺胆酸,促进艰难梭菌孢子萌发,但次级胆汁酸去氧胆酸和石胆酸抑制艰难梭菌生长和艰难梭菌孢子发芽,并且它们的水平在艰难梭菌感染抗性个体中升高。
•减轻肠道炎症等相关疾病
虽然粪菌移植在治疗溃疡性结肠炎方面的效果不一,但石胆酸的衍生物3-oxo LCA的恢复与粪菌移植相关,并表明次级胆汁酸在减轻疾病方面的作用。
减少产生胆汁酸水解酶的细菌缓解肠易激综合征
粪菌移植可以通过减少胆汁酸水解酶活性细菌的数量来缓解与腹泻型肠易激综合征相关的次级胆汁酸过量产生。
•粪菌移植也可用于治疗生态失调
粪菌移植也在小鼠身上进行了研究,以治疗观察到微生态失调的各种其他情况(例如衰老)。
粪菌移植缺乏特异性
粪菌移植广泛应用的主要限制之一是其在调节微生物群方面缺乏特异性,这可能导致意想不到的不良反应。
在完整的细菌群落及其对人类健康的影响尚不清楚的情况下,设计一种成功的粪菌移植治疗方法仍然具有挑战性。
具有明确胆汁酸代谢特性的活微生物可用于改变生态失调和疾病中的胆汁酸库。
•使用益生菌更具针对性
与粪菌移植相比,益生菌的优势在于它们更具针对性,具有明确的作用机制。具有7α-去羟基化活性的梭状芽胞杆菌(Clostridium spp.),特别是C.scindens,被证明可以通过产生抑制性的次级胆汁酸来消除艰难梭菌。
注:通过基因工程,来自具有7α-脱羟基活性的细菌的操纵子已被移植,以将这些益处赋予共生产孢梭菌菌株。这种方法可以将胆汁酸合成归因于各种共生细菌,并精确地生成需要的胆汁酸。
生孢梭菌——能够成为具有发展前景的癌症治疗手段
•益生菌可以调节胆汁酸受体
益生菌的使用可以调节胆汁酸受体如法尼醇X受体、维生素D受体的激活。
•益生菌通过调节胆汁酸降低胆固醇水平
益生菌混合物VSL#3可以治疗肠易激综合征和溃疡性结肠炎,但也含有表达胆汁酸水解酶的细菌,可以增加胆汁酸的解结和排泄。
VSL#3通过抑制FXR-FGF15途径上调肝脏胆汁酸生物合成。这种作用可能有利于降低循环中的胆固醇水平。
•益生菌还可以减少肠道炎症和肿瘤形成
然而,同样的益生菌混合物在结直肠癌患者中可能具有相反的恢复法尼醇X受体激活的效果。事实上,施用VSL#3可防止结直肠癌相关的胆汁酸下调,并减少炎症和肿瘤形成。
另一种活性益生菌,罗伊氏乳杆菌NCIMB 30242,在人类中具有类似的抗炎和降胆固醇作用,这表明这些细菌的有益作用依赖于将共轭胆汁酸转化为次级胆汁酸。
与其给药产生胆汁酸的细菌,不如直接给药具有生物活性的次级胆汁酸,因为它们具有相似的预期效果。
•施用熊去氧胆酸可以抑制胃肠道癌症
熊去氧胆酸主要用作抗胆汁淤积剂,是原发性胆道自身免疫性疾病(如原发性胆道胆管炎)患者的主要治疗选择,但也可能抑制胃肠道癌症(如结直肠癌和肝细胞癌)的进展。
注:熊去氧胆酸减轻结直肠癌的发生是由胆汁酸膜受体TGR5介导的。
•施用次级胆汁酸降低了结肠炎的严重程度
胆汁酸也可能有助于结肠炎患者的症状缓解。石胆酸代谢物通过调节转录因子RORγt和产生线粒体活性氧,支持T细胞分化为调节性T细胞而不是促炎性T辅助17细胞。
这种次级胆汁酸介导的对调节性T细胞分化的促进降低了结肠炎的严重程度,并且部分地解释了细菌联合治疗小鼠结肠炎的益处。
•改善肥胖患者胆固醇及甘油三酯含量
熊去氧胆酸和石胆酸均为法尼醇X受体激动剂,可通过FXR-FGF15途径减轻代谢综合征。由于FXR-FGF15的激活,肥胖小鼠在接受熊去氧胆酸和石胆酸治疗后,胆固醇、血浆甘油三酯和血浆脂肪酸水平降低了。
因此,产生这些次生胆汁酸的细菌,如狄氏副拟杆菌(Parabacteroides distasonis),有助于降低高脂血症。
注:合成的FXR激动剂奥贝胆酸是一种被批准用于治疗原发性胆道胆管炎的药物,并且在治疗非酒精性脂肪性肝炎和肥胖症方面也取得了成功。
提示
虽然直接补充胆汁酸可以产生对致癌、结肠炎和代谢综合征有益的结果,但这些效果可能只在治疗期间持续。相反,改变微生物群以增加胆汁代谢可能有助于延长效果。因此调节肠道微生物群的平衡十分重要。
细菌转化胆汁酸的失衡是代谢性、炎症性、感染性和肿瘤性疾病的重要因素,主要通过胆汁酸受体的失调来实现。
由于许多胆汁酸受体在胃肠道以外的组织中表达(例如,脑,T细胞和平滑肌),因此值得进一步研究胆汁酸在其他部位的影响。
随着对肠道菌群和胆汁酸的深入研究,我们将更好地了解它们在人类健康中的作用机制,以及它们与人类疾病的关系。
同时,我们也将探索更多的方法来维护肠道菌群和胆汁酸的平衡,如饮食、运动、药物等。这些研究将为预防和治疗相关疾病提供新的思路和方法,为人类健康事业做出更大的贡献。
主要参考文献
Collins SL, Stine JG, Bisanz JE, Okafor CD, Patterson AD. Bile acids and the gut microbiota: metabolic interactions and impacts on disease. Nat Rev Microbiol. 2023 Apr;21(4):236-247. doi: 10.1038/s41579-022-00805-x. Epub 2022 Oct 17. PMID: 36253479.
Yu L, Liu Y, Wang S, Zhang Q, Zhao J, Zhang H, Narbad A, Tian F, Zhai Q, Chen W. Cholestasis: exploring the triangular relationship of gut microbiota-bile acid-cholestasis and the potential probiotic strategies. Gut Microbes. 2023 Jan-Dec;15(1):2181930. doi: 10.1080/19490976.2023.2181930. PMID: 36864554; PMCID: PMC9988349.
Cai J, Sun L, Gonzalez FJ. Gut microbiota-derived bile acids in intestinal immunity, inflammation, and tumorigenesis. Cell Host Microbe. 2022 Mar 9;30(3):289-300. doi: 10.1016/j.chom.2022.02.004. PMID: 35271802; PMCID: PMC8923532.
Hu H, Shao W, Liu Q, Liu N, Wang Q, Xu J, Zhang X, Weng Z, Lu Q, Jiao L, Chen C, Sun H, Jiang Z, Zhang X, Gu A. Gut microbiota promotes cholesterol gallstone formation by modulating bile acid composition and biliary cholesterol secretion. Nat Commun. 2022 Jan 11;13(1):252. doi: 10.1038/s41467-021-27758-8. PMID: 35017486; PMCID: PMC8752841.
Poland JC, Flynn CR. Bile Acids, Their Receptors, and the Gut Microbiota. Physiology (Bethesda). 2021 Jul 1;36(4):235-245. doi: 10.1152/physiol.00028.2020. PMID: 34159805; PMCID: PMC8526331.
Larabi AB, Masson HLP, Bäumler AJ. Bile acids as modulators of gut microbiota composition and function. Gut Microbes. 2023 Jan-Dec;15(1):2172671. doi: 10.1080/19490976.2023.2172671. PMID: 36740850; PMCID: PMC9904317.
McCarville JL, Chen GY, Cuevas VD, Troha K, Ayres JS. Microbiota metabolites in health and disease. Annu Rev Immunol [Internet] 2020; 38:147–170.
谷禾健康

消化是人体生命活动的重要组成部分,分解食物提供能量、促进生长发育、参与免疫功能,然而越来越多的人出现了消化不良。
★ 消化不良在人群中很常见
消化不良在全球范围内都是一种常见的疾病,其发病率在不同地区和人群中有所不同。在中国,消化不良的发病率较高,尤其是城市人群中更为常见。据统计,中国城市居民中消化不良的发病率约为20%-30%。
消化不良主要分为器质性消化不良和功能性消化不良(本文主要讲述功能性消化不良)。功能性消化不良其广义上是一种胃肠道多种症状的综合征,主要包括上腹痛或灼热感,餐后饱胀感及早期饱腹感。
随着对功能性消化不良了解的深入,目前研究发现,消化不良病理生理与脑–肠–微生物群轴紊乱、内脏高敏感性、局部低度炎症、胃肠道感染等因素相关。
肠道菌群可以帮助人体消化吸收,同时还可以合成一些对人体有益的物质,在消化过程中扮演着重要角色。肠道菌群作为新的研究切入点,将有助于探索新的改善功能性消化不良的方法。
在了解消化不良前,我们先来看看人体消化的生理过程:
膳食摄入的消化反应

Livovsky DM,et al.Nutrients.2020
在禁食期间,胃肠道会进行周期性的运动,这种运动被称为迁移运动复合体(MMCs)。迁移运动复合体的功能是将残留物从小肠推进到结肠,以便在新的食物进入之前清空肠道。迁移运动复合体包括静止期和强烈的运动和分泌活动期之间的交替,这种刻板模式有助于保持肠道的健康和功能正常。
在进食开始之前,消化系统已经开始做准备工作,例如,预期即将进食的膳食会刺激唾液和胃液的分泌。当食物进入口腔并被吞咽后,消化系统会进入消化间期运动模式。
食物进入胃后,胃壁会收缩并几乎塌陷,这种主动放松被称为胃适应。固体颗粒通过蠕动活动激活胃窦,启动研磨过程,将食物转化为食糜。
餐后阶段胃会逐渐重新收缩,将食糜推入小肠。胃和小肠的活动会适应消化过程的要求,从口腔开始并延伸到末端回肠,食物被消化并随后被吸收。未被吸收的残留物最终到达结肠,成为肠道微生物群的底物,这些微生物会影响宿主的生理和消化功能。
因此,消化系统的正常活动对于人体的健康和营养摄入非常重要。如果消化系统不正常,可能会导致消化问题和其他健康问题。
消化不良是一种常见的临床症状,主要分为器质性消化不良和功能性消化不良。
器质性消化不良是指由某种器官疾病引起的消化不良。一般通过检查,可以明确诊断是由某个器官的病变引起的消化不良症状,例如肝病、胆道疾病、胰腺疾病、糖尿病等。
✦疾病影响消化
这些疾病会影响到消化道内部的消化酶分泌、肠道蠕动、食物吸收等消化过程,导致消化不良症状的出现,如腹胀、腹泻、便秘、恶心、呕吐、胃痛等。

功能性消化不良是最常见的消化系统疾病,大部分消化不良患者都是属于功能性消化不良。功能性消化不良没有明显的器质性病变,但出现了消化不良症状。
由于功能性消化不良患者病情的反复性与迁延不愈,其生活质量明显降低,同时,所带来的社会医疗成本的增加和生产力的下降也不容忽视。
▸ 发病率
在全球范围内,功能性消化不良女性发病率普遍高于男性。不同地区功能性消化不良的患病率也存在明显差异 :西方国家总体较高,约为10%~40%,亚洲国家较低约为5%~30%。
▸高发人群
•饮食不规律的人群:饮食不规律、暴饮暴食、偏食等不良饮食习惯容易导致消化不良。
•长期服用药物的人群:长期服用某些药物,如抗生素、非甾体抗炎药等,可能破坏肠道菌群平衡,导致消化不良。
•精神压力大的人群:精神压力大、情绪波动较大的人群容易出现消化不良症状。
•高龄人群:随着年龄的增长,人体消化功能逐渐下降,高龄人群容易出现消化不良症状。
•婴幼儿:婴幼儿是消化不良的高发人群之一。由于婴幼儿的消化系统尚未完全发育成熟,消化酶的分泌不足,肠道菌群的构成不稳定等因素,使得婴幼儿容易出现消化不良的症状。

▸ 诊断标准与症状
功能性消化不良的诊断标准:
•餐后饱胀感:即在正常量的膳食后感到不舒服;
•早饱:进食后不久即有饱感,以致摄入食物明显减少,无法完成正常量的膳食;
•上腹疼痛或灼痛:上腹胀多发生于餐后,或呈持续性进餐后加重。
注:满足以上一项或多项,并且没有可以解释这些症状的任何结构性疾病(包括上消化道内窥镜检查)的证据;则可以判断为功能性消化不良
根据主要临床症状可大致分为上腹痛综合征和餐后不适综合征两种亚型。
✦持续时间长,并伴有精神症状
在病程中症状也可发生变化,起病多缓慢,经年累月,持续性或反复发作,不少患者有饮食,精神等症状。
早饱和上腹胀常伴有嗳气。恶心、呕吐并不常见,往往发生在胃排空明显延迟的患者,呕吐多为当餐胃内容物。
不少患者同时伴有失眠、焦虑、抑郁、头痛、注意力不集中等精神症状。这些症状在部分患者中与“恐癌”心理有关。
▸ 功能性消化不良和其他胃肠道疾病的关系
伴有肠易激综合征
许多功能性消化不良患者报告伴有肠易激综合征症状,并且这两种症状经常一同出现在更严重的患者中。
注:虽然这两种情况或多或少都与特定的胃肠道症状有关,但没有结构或生化异常可以解释这些症状。
胰腺功能异常
少数但一定人群的功能性消化不良患者存在胰酶异常或胰腺外分泌功能障碍。胰酶异常和胰腺外分泌功能障碍是否直接影响功能性消化不良症状尚不清楚。
肝脏疾病与消化不良直接存在关联
肝脏疾病如肝硬化、肝炎等也可能导致功能性消化不良症状,如腹胀、食欲不振等。这些疾病可能会影响肠道菌群的平衡,导致消化不良。
功能性消化不良的发病机制尚未完全阐明,可能与胃肠运动异常、内脏超敏反应、肠道菌群紊乱、病原微生物感染、遗传因素、社会心理和神经因素、环境因素等多方面调控异常有关。
需要注意的是,肠道菌群数量和紊乱是功能性消化不良的重要病因之一,将在下文中重点讲述。
➤ 1
√功能性消化不良患者胃排空受损
功能性消化不良的发病机制涉及胃调节、胃排空和十二指肠运动的紊乱。
胃排空——食物由胃排入十二指肠的过程称为胃排空。
一项随机、双盲对照研究发现,功能性消化不良患者的症状与胃调节受损之间存在密切关系 。几份报告表明,一些功能性消化不良患者胃排空受损,一项荟萃分析表明,几乎35%的功能性消化不良患者胃排空明显延迟。
√内脏高敏感性影响功能性消化不良
内脏高敏感性是导致功能性消化不良发展的关键病理生理机制。内脏超敏反应可以通过对肠道机械化学刺激的感知增加,这通常表现为疼痛和灼痛感加重。
辣椒素受体(Trpv1)的激活由神经生长因子 (NGF)、热刺激、辣椒素、前列腺素、酸性pH值和炎症介质触发,进一步释放加剧内脏痛觉的神经肽。
那么一般哪些因素会引起或导致人体胃排空受损或内脏高敏感性,常见的原因如下:
1.神经调节失衡:人体内部的神经系统对内脏的感知和调节非常重要。如果神经系统出现失衡,会导致内脏高敏感性,从而引起胃排空受损以及消化不良等症状。
2.饮食不当:食物的种类、质量和摄入量都可能影响胃排空。比如,吃得太快、咀嚼不充分、进食过多或者过少都会导致胃排空受损。
饮食中过多的刺激性食物(如辛辣、油腻的食物)或者过多的咖啡因、酒精等刺激物质,都可能刺激内脏,导致内脏高敏感性。
3.精神压力:长期的精神紧张、焦虑、抑郁等情绪问题,也会影响人体内部神经系统的平衡,进而导致胃排空受损或内脏高敏感性。
4.慢性疾病:一些慢性疾病,如炎症性肠病、胃溃疡等,也会引起胃排空受损以及内脏高敏感性,从而导致消化不良等症状。
5.长期用药:某些药物,如非甾体类抗炎药、抗生素等,长期使用也可能导致内脏高敏感性。
➤ 2
社会心理因素会导致功能性消化不良症状。
√心理对功能性消化不良具有重要影响
一项针对瑞典人群的研究表明,在10年的随访后,焦虑会使患功能性消化不良的风险增加近8倍。在日本,儿童时期的被虐待与功能性消化不良和功能性消化不良症状的严重程度有关。
此外,病理生理学研究表明,社会心理因素和精神障碍可能通过调节大脑中的信号处理在功能性消化不良中发挥作用以及应激激素对痛觉的影响。
社会心理因素和应激激素也会影响胃肠道的其他方面,例如运动、免疫系统激活、渗透性和微生物群。
√功能性消化不良对精神疾病也有反作用
多项研究强调,与健康人相比,功能性消化不良患者的焦虑和抑郁患病率显著增加。这些观察结果表明,精神疾病在功能性消化不良的发病机制中起着重要作用。
另一方面,由于低度肠道炎症中的细胞因子反应,功能性消化不良症状被认为会诱发焦虑或抑郁,这在功能性消化不良患者心理困扰的发展中起着重要作用。
➤ 3
家族史和遗传多态性可能与功能性消化不良相关。许多研究报告了功能性消化不良风险与遗传多态性之间的关联。
遗传多态性是在同一群体中,某个基因座上存在两个或两个以上的等位基因,且等位基因的频率大于0.01的现象。
GNB3 825C>T、SCL6A4 5HTTLPR、CCK-1R 779T>C等基因多态性被认为与功能性消化不良相关。最近的一项荟萃分析发现,GNB3 825C>T中的次要等位基因 (T) 与上腹疼痛综合征亚型的易感性增加有关。
➤ 4
运动不足、睡眠障碍、高脂肪摄入和饮食不规律等生活方式因素与功能性消化不良的病理生理学有关。
√不健康生活方式导致功能性消化不良发病率高
研究发现,睡眠障碍和运动不足与功能性消化不良相关;脂肪摄入过多会加重功能性消化不良的临床症状,不规律的饮食模式也与功能性消化不良相关。
➤ 5
研究表明,沙门氏菌、幽门螺杆菌、空肠弯曲菌、蓝氏贾第鞭毛虫和诺如病毒等病原微生物导致的急性肠胃炎均与功能性消化不良症状有关。
其机制可能与导致胃肠道Cajal间质细胞(ICC)和肌间神经节受损有关,其发生率在功能性消化不良患者约为10%。
√病因微生物感染会加重消化不良症状
最近的一项荟萃分析证实,根除病原体后症状改善比未治疗的对照组效果更好。在持续时间超过4-12周且内镜检查已排除器质性原因的消化不良患者中,成功根除幽门螺杆菌可使症状缓解率提高10%至15%(或至少症状改善)。
➤ 6
来自动物和临床研究的证据表明,肠道菌群在功能性消化不良中起着重要的作用,影响许多致病机制,包括胃肠动力受损、内脏敏感性、免疫激活、粘膜通透性增加和肠脑轴功能改变等。
在人体中,微生物(包括细菌、古细菌、病毒和真菌)的数量远远超过宿主细胞的数量。
微生物组在调节生理功能(包括胃肠运动功能、上皮屏障保护以及肠道和中枢神经系统之间的相互作用)中发挥着重要作用。然而,微生物失调在功能性消化不良患者中非常常见。
•普雷沃氏菌丰度降低
一项研究将功能性消化不良患者的胃液成分与健康对照组进行了比较,报告称与对照组相比,功能性消化不良中普雷沃氏菌属(Prevotella)的频率显著降低。
这种生态失调的原因可能是胃排空延迟,这可能会改变胃的酸度、粘液稠度和部分氧合作用,从而改变胃的细菌定植。
扩展阅读:肠道重要基石菌属——普雷沃氏菌属 Prevotella
•拟杆菌与变形菌比例增加
功能性消化不良患者胃液的微生物群显示拟杆菌与变形菌的比例增加,而未检测到酸杆菌(Acidobacteria)。然而,健康人的胃液中含有酸杆菌,并且拟杆菌与变形菌的比例较低。
•细菌代谢物分泌出现异常
与对照组相比,功能性消化不良患者的胆汁酸阳性胃液样本比例增加更多。由于胆汁酸从十二指肠反流到胃中,生理上发生在胃运动期间,功能性消化不良患者可能会出现胃动力障碍。
物种丰富度的增加表明胃液微生物群的数量和多样性足以使细菌的代谢物和成分影响胃。因此,可能表明肠道的有毒细菌细胞成分,如脂多糖,刺激白细胞产生促炎细胞因子,引发胃部炎症,从而增加粘膜通透性,这可能导致胃肠神经系统功能障碍。
由于脂多糖和胆汁酸会增加粘膜的通透性,因此患者的炎症可能是由含有此类潜在毒性物质的液体回流引起的。
当比较功能性消化不良患者和健康对照组的上消化道微生物组时,功能性消化不良组口腔、食道、胃和十二指肠中的链球菌(Streptococcus)水平较高。
链球菌丰度与上消化道不适呈正相关,表明链球菌与功能性消化不良患者的胃肠道症状之间存在联系。此外,功能性消化不良组表现出更高水平的厚壁菌门。
• 厚壁菌、变形菌丰度增加
根据这些发现,在一项比较功能性消化不良患者和健康受试者十二指肠粘膜微生物群的不同研究中,十二指肠粘膜中最普遍菌属中也有链球菌。
此外,通过分析功能性消化不良和肝郁脾虚综合征大鼠的粪便样本的微生物组成,与对照组相比,该模型中厚壁菌门、变形菌门(Proteobacteria)和蓝藻门(Cyanobacteria)的水平升高,而拟杆菌门的丰度较低。
上述研究表明,功能性消化不良中的微生物改变并不局限于胃肠道中的一个部位,突出了稳态失衡在这些疾病的发病机制中的潜在重要性。
小肠细菌过度生长 (SIFO) 的定义是小肠中存在过量的细菌,并且与胃肠道症状有关。
最近的研究分析了功能性消化不良患者十二指肠的细菌属水平。
链球菌相对丰度增加
澳大利亚的一项研究报道,与对照组相比,功能性消化不良患者的链球菌(Streptococcus)相对丰度增加,尽管不显著(这可能是因为样本量小),并且链球菌的丰度与厌氧属普雷沃氏菌、韦荣球菌(Veillonella)和放线菌(Actinomyces)的丰度之间存在负相关,这些菌群功能性消化不良患者中显著减少。
β多样性发生显著变化
此外,报告的十二指肠的β多样性在患者和对照组之间存在显著差异,而α多样性保持不变,表明该疾病可能涉及更复杂的微生物群结构变化,而不是仅特定属的相对丰度变化。
奈瑟菌和卟啉单胞菌丰度降低
最近的一项研究表明,在使用质子泵抑制剂(PPI)治疗之前,功能性消化不良患者和对照组的十二指肠粘膜奈瑟菌(Neisseria)和卟啉单胞菌(Porphyromonas)丰度降低,但微生物负荷没有差异。
总体而言,研究证实功能性消化不良患者中确实发生了微生物数量和多样性方面的明显变化。
功能性消化不良患者的微生物变化




Brown G,et al.Neurogastroenterol Motil.2022
谷禾还检测了一些功能性消化不良人群的肠道菌群,虽然个体直接存在一定差异,但是共同之处是菌群紊乱,核心菌异常较多,多项病原菌超标。
案例一
基本信息和病症:
1岁3个月,食物过敏,厌食,功能性消化不良,生长发育不良
菌群构成:

重要菌群情况:



注:高亮部分是异常菌属。
总结:菌群失衡,核心菌属异常较多,普雷沃氏菌属(Prevotella)缺乏,多种致病菌超标。
案例二
基本信息和病症:
43岁,每天大便不成形;容易急性肠胃炎;消化不良
菌群构成:

重要菌群情况:
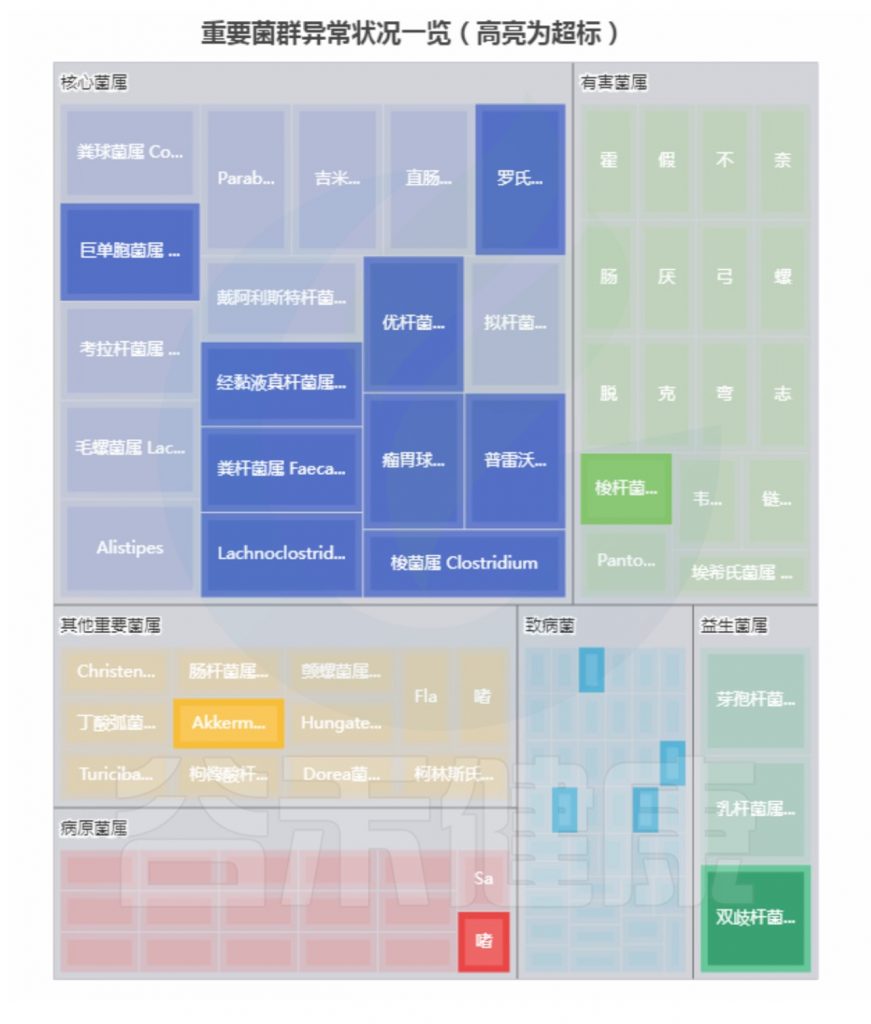



<来源:谷禾健康肠道菌群检测数据库>
总结:菌群失衡,菌群多样性低,核心菌属大量异常,致病菌和病原菌多项超标。
功能性消化不良是一种复杂的多因素导致的功能性胃肠疾病,目前其确切的发病机制尚不明确。
★ 肠道菌群在功能性消化不良中起重要作用
多个研究表明,肠道菌群紊乱在功能性消化不良的发生发展起着重要作用,是功能性消化不良的重要发病机制。影响包括胃肠动力受损、内脏高敏感性、免疫激活、粘膜通透性增加和中枢神经系统疾病。
肠道微生物群参与功能性消化不良发病机制

Tziatzios G,et al.Microorganisms.2020
胃肠运动异常是功能性消化不良的基本病理机制,包括胃排空延迟、胃容受性舒张受损及消化期间移行性复合运动(MMC)III期异常。
✦外来菌的增殖抑制胃肠道蠕动
消化期胃和小肠移行性复合运动可将胃肠内容物和致病菌机械性地迁移向远端肠道,而功能性消化不良患者经常出现非传播性和逆传性活动,这可能诱导或加重近端小肠细菌随反流十二指肠液迁移到胃。
而胃排空延迟又导致反流菌能较长时间保留在胃和十二指肠中,引起菌群分布失调的同时,外来菌的增殖可产生内毒素脂多糖刺激免疫应答,进而,抑制胃肠道蠕动,加重功能性消化不良症状。
✦细菌代谢物是胃肠动力的重要来源
短链脂肪酸是肠道共生菌发酵膳食纤维代谢物,除了作为胃肠动力的重要能量来源,也可直接激活肠神经系统以调控肠内分泌细胞合成和分泌某些胃肠激素,如肠激素肽、胆囊收缩素、胰高血糖素样肽等,进而调节胃肠道动力及胃排空。然而在代谢组学研究中发现功能性消化不良大鼠存在短链脂肪酸水平显著降低。
更准确地说,细菌产生的短链脂肪酸不仅调节功能性消化不良中十二指肠碳酸氢盐的分泌,同时它们在十二指肠的快速吸收也可能影响管腔细菌定植抑制。
5-羟色胺影响胃肠道动力
相关研究证实肠道微生物群在调节5-羟色胺(5-HT)合成中起着关键作用,而5-羟色胺水平是影响胃肠道动力的重要因素之一。
大肠杆菌产生的脂多糖延迟胃排空
此外,已发现大肠杆菌(Escherichia coli)产生的细菌脂多糖会导致胃排空显著延迟 ,而双歧杆菌当用作益生菌使用时时可显著增强小肠蠕动。
由上述研究可知,胃肠动力异常可能诱发菌群失调,而菌群失调可反过来进步一步影响胃肠动力,介导功能性消化不良发生发展,但菌群失调与功能性消化不良的因果关系仍需更深入的研究加以验证。
✦心理因素和肠道炎症相互影响
功能性消化不良患者处于十二指肠低度炎症状态。这种慢性低级别的炎症反应会引起疼痛和敏感性。
此外,焦虑或抑郁等心理学因素似乎与慢性炎症反应相互影响,心理压力和由此产生的皮质醇释放激素分泌也会增加十二指肠的局部炎症和全身炎症反应。
✦炎症状态下肠屏障功能发生改变
多项研究报道了功能性消化不良患者肠道中免疫细胞(如肥大细胞、巨噬细胞和嗜酸性粒细胞)数量的增加。
十二指肠活检切片中嗜酸性粒细胞增多

Hari S,et al.Front Allergy.2022
活化的肥大细胞释放细胞因子、组胺、前列腺素和类胰蛋白酶,它们与肠屏障功能障碍和伤害感受通路的改变有关。
嗜酸性粒细胞影响肠道通透性
在生理条件下,十二指肠屏障由粘液层、上皮和下面的固有层组成。在功能性消化不良中,屏障的功能障碍体现为粘膜完整性丧失和通透性增加。
此外,功能性消化不良中嗜酸性粒细胞的募集和激活也发生,这可能使组织损伤和屏障功能障碍持续存在。
正常与功能性消化不良的屏障功能对比
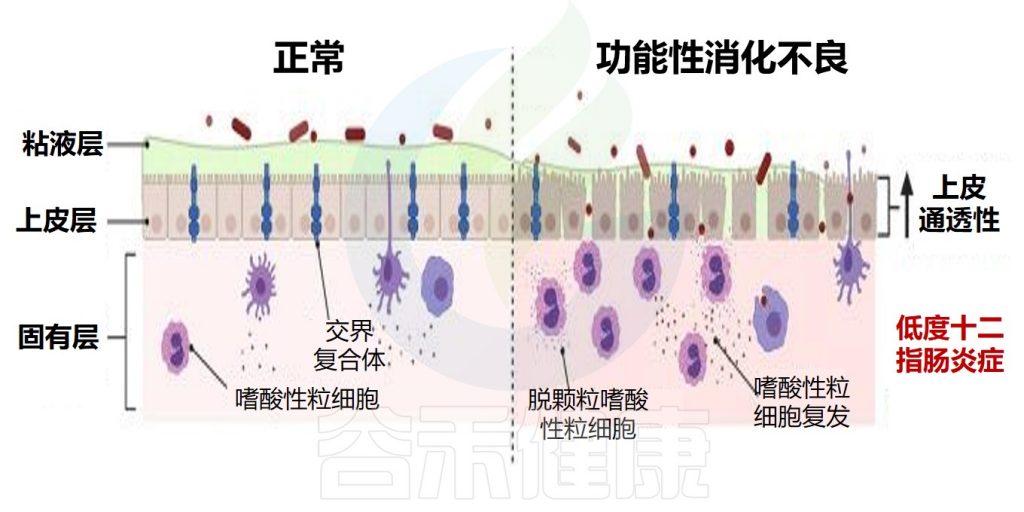

Hari S,et al.Front Allergy.2022
✦肠道菌群也会破坏肠道通透性
肠腔黏膜表面是毒性和免疫原性颗粒面对黏膜相关免疫系统的第一道屏障。肠道微生物菌群失调在功能性消化不良中非常常见。
有害菌破坏紧密连接增加肠道通透性
有研究表明,霍乱弧菌(V.cholera)、艰难梭菌(Clostridium difficile)和产毒素的大肠杆菌的各种菌株已显示可通过直接破坏紧密连接(TJ)、毒素或蛋白酶的产生以及炎症级联反应的活化来增强肠道通透性。
益生菌可以促进屏障完整性
相反,肠道益生菌可以通过增加闭合蛋白、紧密连接蛋白ZO-1和ZO-2的表达来促进屏障完整性。
另外,肠道菌群的某些代谢产物也能够破坏肠道通透性,例如,细菌细胞壁脂多糖易位可以诱导免疫反应和炎症反应,加剧肠道屏障损害并进一步增加肠道的通透性。
扩展阅读:什么是肠漏综合征,它如何影响健康?
除了影响黏膜屏障功能,微生物群也参与调节免疫系统的发育和功能,在先天免疫系统中起关键作用。
✦肠道菌群调节肠上皮免疫功能
研究发现,肠道微生物区系通过激活肠上皮细胞的模式识别受体和内质网应微信号促进免疫系统的发育,从而促进肠上皮细胞的增殖、抗菌肽和黏液的产生,调节与免疫功能相关细胞因子的分泌,如白细胞介素1β、白细胞介素18和白细胞介素25。
✦微生物代谢物也可促进免疫反应
肠道微生物群及其代谢物还通过Toll样受体(TLRs-TLR2、TLR4)干扰信号,并促进促炎细胞因子的产生和免疫反应。
此外,它们的代谢物也可能具有炎症特性或对T细胞分化产生直接影响。
小结
综上所述,肠道菌群失调在影响黏膜生物屏障的同时,可能也导致黏膜机械屏障、化学屏障及免疫屏障等多种屏障功能低下,并可能介导黏膜低度炎症和内脏高敏性的发生。
生物失调的影响
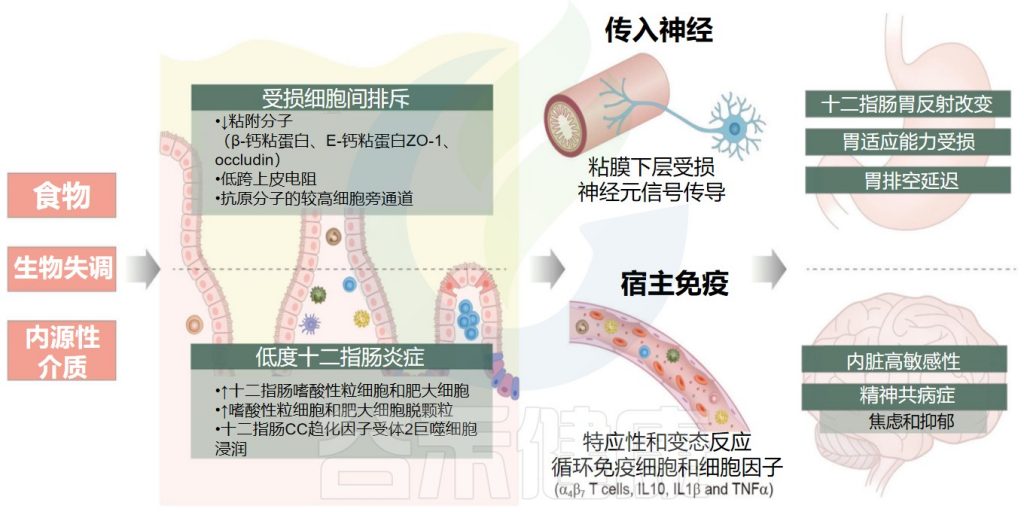

Kim SH.Korean J Gastroenterol.2022
脑-肠轴是连接胃肠道和中枢神经系统的传导通路,包括中枢神经系统、脑和脊髓、自主神经系统、肠神经系统和下丘脑垂体肾上腺轴。
肠道菌群与脑-肠轴存在双向交互作用:
肠道菌群通过神经、内分泌、免疫等至少三种途径与中枢神经系统相通;中枢神经系统调节肠道的运动、分泌及肠道黏膜通透性来影响肠道菌群,或通过肠腔分泌的激素直接调节菌群的基因表达而影响肠道菌群的组成和功能。
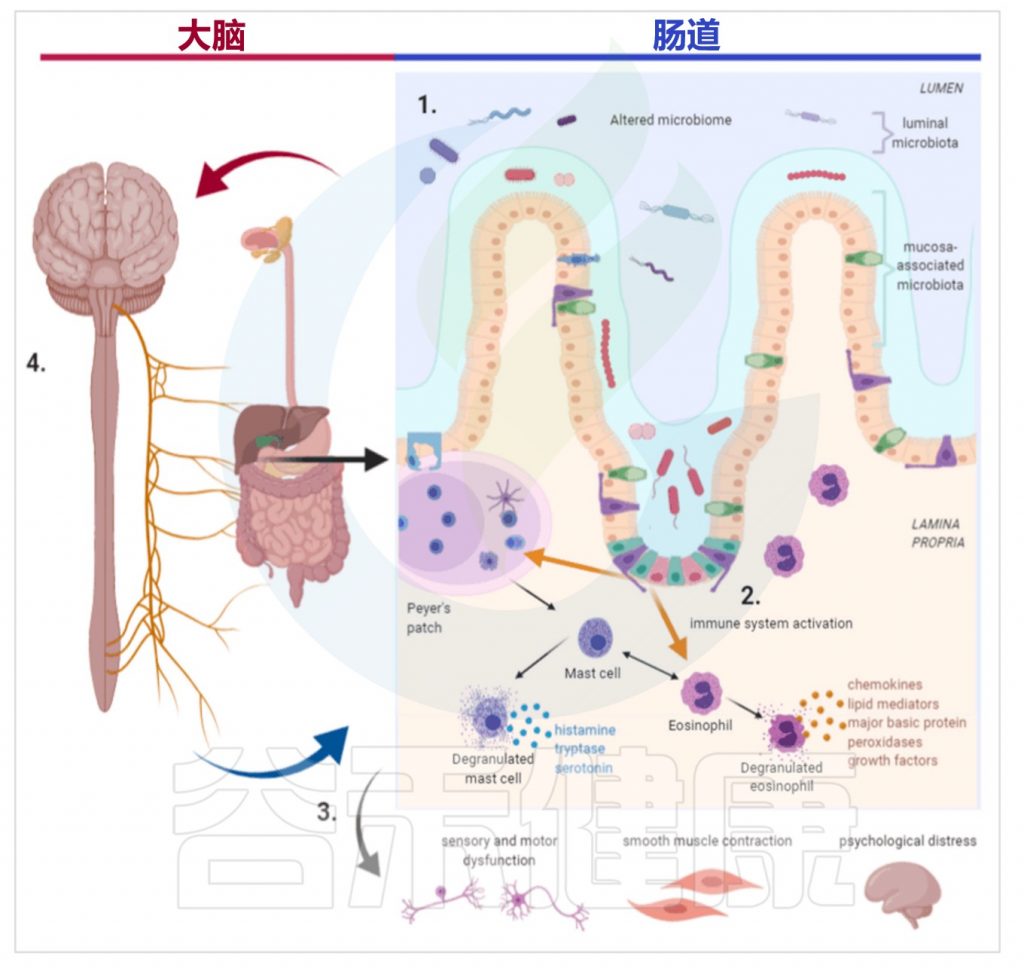

Brown G,et al.Neurogastroenterol Motil.2022
肠道菌群通过肠-脑轴影响5-羟色胺、脑源性神经营养生长因子(BNDF)等神经递质的合成、释放和下丘脑-垂体-肾上腺轴的发育,调节中枢神经系统的发育、功能和行为,影响焦虑、抑郁样情绪障碍和应激反应。
✦功能性消化不良患者伴有精神症状
功能性消化不良属于典型的身心疾病,常有焦虑、抑郁的表现。一项为期12年的前瞻性研究也说明功能性消化不良患者中有1/2~2/3先出现焦虑再有胃肠道症状,提示了功能性消化不良的中枢发病机制。
功能性消化不良患者的中枢神经系统改变
功能性神经影像学,如功能核磁共振,使我们能直接观察到中枢神经系统的改变,证明其与功能性消化不良症状的相关性。
结果显示功能性消化不良患者额叶皮层、感觉皮层、脑岛、前扣带皮层、丘脑、海马体和杏仁核的改变,与功能性消化不良内脏超敏反应、消化不良症状、生活质量及焦虑和抑郁有关。
精神心理应激影响内脏高敏感性
有研究认为功能性消化不良患者在精神心理应激的情况下可通过刺激中枢神经系统的情感活动系统参与患者内脏高敏感性的形成,从而对胃肠道产生影响。
因此,研究人员推测肠道菌群通过脑-肠轴对中枢神经系统的调节,导致消化不良伴焦虑抑郁的发生发展。
✦肠道菌群对肠脑轴具有重要作用
随着研究不断深入,越来越多证据证实肠道菌群与脑-肠-菌群轴功能密切相关。
菌群代谢物影响中枢神经系统信号
一方面,肠道微生物能通过合成和释放短链脂肪酸、次级胆汁酸和色氨酸等代谢物,与肠内分泌细胞,自下而上影响激活内源性中枢神经系统信号机制。
此外,肠道菌群失调会增加脂多糖的产生和分泌,而脂多糖不仅是影响中枢神经系统功能的一个强有力的因素,还会促进其他炎症因子的产生,如肿瘤坏死因子﹣α、白细胞介素﹣1β等,以上炎症因子可影响中枢神经系统的功能, 紊乱神经肽的合成和分泌。
激活肠神经系统信号
另一方面,肠道微生物也可独立完成或促进某些神经活性物质的合成和分泌,如5-羟色胺、γ-氨基丁酸、去甲肾上腺素、多巴胺等,这些小分子物质能通过与肠内分泌细胞相互作用,激活肠神经系统信号机制。
上述研究表明,肠道菌群失调可能诱导脑-肠-微生物群轴功能紊乱,其机制涉及神经、免疫和内分泌信号传导。
✦迷走神经的作用
在生态失调和胃肠道不适的精神状况的背景下,应该注意的一个重要方面是迷走神经的作用。
众所周知,压力会增加肠道通透性并通过各种神经调节剂改变胃肠道微生物组的组成,同时压力可以减少迷走神经活动,这可能会促进胃肠道炎症。
注:虽然目前还没有关于迷走神经刺激对胃肠道微生物组影响的数据,但可以推测迷走神经可能通过其对肠道通透性的影响对肠道微生物组产生影响。
迷走神经的传出可能在肠道中具有抗炎作用,同时降低肠道通透性——这两种作用都可能归因于通过迷走神经活动加强紧密连接。
心理治疗对功能性消化不良患者微生物群和胃肠道症状的影响,也可以用迷走神经的影响来解释。
心理疾病对功能性消化不良的表现有影响
现在人们可能想知道心理疾病的患病率是否在不同的功能性消化不良亚组中有所不同。
已经表明情绪和焦虑障碍在非疼痛主导型功能性消化不良患者中,比在疼痛主导型功能性消化不良患者中更常见。
另一项研究还表明上腹痛与神经质、虐待和躯体化之间存在相关性。
这些发现强调了未来重点关注功能性消化不良患者的心理合并症和特定症状之间的可能联系,研究心理治疗对功能性消化不良患者特别是微生物组的这些有趣影响。
未来随着研究深入,有望更好地理解脑-肠-微生物组轴,功能性消化不良的治疗方法也能更加个性化。
药物经口服途径进入人体,不可避免地与肠道菌群发生相互作用。
多项研究表明,肠道微生物能通过编码多种酶,影响口服药物在体内的吸收、代谢、转化等过程,进而影响药物活性成分的有效性和毒性。
改变微生物群的药物在治疗消化不良中得到了有效证实。
利福昔明是一种广谱抗生素,具有革兰氏阳性、革兰氏阴性、需氧和厌氧覆盖,在胃肠道腔内生物利用度高,全身不良反应极小。
•消化不良症状缓解
在一项随机试验中,利福昔明治疗优于安慰剂治疗,其中79%的患者在服用利福昔明后报告消化不良症状缓解,而安慰剂组在8周时这一比例为47%。
•利于有益细菌生长
在其他胃肠道疾病中,利福昔明治疗已被证明可以保护结肠菌群,增加乳酸杆菌和双歧杆菌(Bifidobacterium)的丰度,从而产生积极效应,利于有益细菌的生长,从而改变整体成分。
扩展阅读:肠道核心菌属——双歧杆菌,你最好拥有它
•益生菌治疗后餐后腹胀改善
益生菌可能在功能性消化不良中发挥治疗作用,三项研究表明,在幽门螺杆菌阳性和阴性消化不良患者中服用益生菌加氏乳杆菌(Lactobacillus gasseri OLL2716)12周后,餐后饱腹感和腹胀症状得到改善。
35.5%的幽门螺杆菌阴性功能性消化不良患者的症状得到了缓解,而安慰剂患者的症状缓解率为17%。
扩展阅读:如果你要补充益生菌 ——益生菌补充、个体化、定植指南
•恢复胃液微生物群
加氏乳杆菌还被证明可以“恢复”功能性消化不良患者异常的胃液微生物群。在服用益生菌12周之前,功能性消化不良患者的胃液显示拟杆菌比变形菌占优势,并且不存在酸杆菌(Acidobacteria),益生菌治疗后,这些比例发生了变化,以反映与健康志愿者相似的微生物群组成。
此外,虽然没有收集小肠细菌数据,但用凝结芽孢杆菌(Bacillus coagulans MY01)和枯草芽孢杆菌(Bacillus subtilis MY02)治疗8周后,功能性消化不良患者的有效率比安慰剂提高了28%。
这些发现提供了初步证据,表明患者症状与肠道微生物群中某些属的丰度有关,这些微生物群可以通过治疗性抗生素和益生菌制剂进行调节。
尽管有这些显著的具体变化,但仍需要对更多不同地理区域的患者群体进行进一步研究,以验证疾病中的微生物组变化。
15项观察性研究和一项随机对照试验的系统回顾发现,高脂肪、小麦、FODMAP(可发酵低聚糖、双糖、单糖和多元醇)和咖啡因等天然食品化学物质含量高的食物与功能性消化不良有关。
扩展阅读:肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
饮酒与功能性消化不良症状的关联尚不明确,可能取决于酒精的类型。
以下是一些饮食调理建议:
•少食多餐:每天分成5-6餐,每餐食量适中,避免暴饮暴食。
•避免过度饮酒和吸烟:酒精和烟草会刺激胃肠道,加重消化不良症状。
•避免食用刺激性食物:如辛辣、油腻、烧烤等食物,容易引起胃肠道不适。
•增加膳食纤维摄入量:膳食纤维可以促进肠道蠕动,缓解便秘症状。建议多食用蔬菜、水果、全谷类食品等富含膳食纤维的食物。
•注意饮食卫生:避免食用过期食品、生冷食物等容易引起胃肠道感染的食物。
•喝足够的水:保持足够的水分摄入可以促进肠道蠕动,缓解便秘症状。
•食用易消化的食物:如米粥、面条、煮熟的蔬菜等,可以减轻胃肠道负担,缓解消化不良症状。
注意:饮食调理虽然可以缓解功能性消化不良症状,但如果症状持续或加重,建议及时就医进行诊断和治疗。
扩展阅读:20种有效改善肠道健康的科学方法
胃酸抑制的主要药物包括两类药物:质子泵抑制剂(PPI)和组胺H2受体拮抗剂。
•上腹痛和反流症状缓解
一项荟萃分析发现,在两到八周内服用标准剂量的质子泵抑制剂,在减少功能性消化不良症状方面优于安慰剂。
注:治疗益处仅出现在有上腹灼痛和反流样疼痛的患者身上,而不出现在有运动障碍相关问题的患者身上。
•消化不良症状的风险降低
组胺H2受体拮抗剂也是功能性消化不良治疗的一种选择。十二项随机对照试验将H2拮抗剂与安慰剂进行了比较,显示消化不良症状的相对风险降低了23%。
对于以进餐相关症状为特征的功能性消化不良伴餐后窘迫综合征的患者,促胃肠动力药可以减轻症状。
对29项比较促动力药(主要是西沙必利)与安慰剂的试验的回顾发现,功能性消化不良的整体症状显著减少。
对功能性消化不良患者的12项随机对照试验的回顾发现,心理治疗(即认知行为治疗和其他形式的心理治疗)比对照组具有统计学上的显著益处。
认知行为疗法:是一种心理治疗方法,旨在通过调整患者的思维方式和行为习惯,来改善其身体和心理健康问题。在功能性消化不良患者治疗中,认知行为疗法可以帮助患者意识到自己不良的思维和行为习惯,如过度焦虑、负面情绪、饮食习惯不当等,从而通过改变这些不良习惯,减轻和预防消化不良症状的发生。
此外,认知行为疗法还可以帮助患者学会应对压力和情绪问题的技巧,提高其身心健康水平。
•症状严重程度、疼痛强度减弱
认知行为疗法 (CBT)导致症状严重程度、疼痛强度减弱,并进一步降低疾病对患者生活的影响。
•胃动力显著增加
此外,与对照组相比,干预组胃排空率显著增加,胃动力参数发生变化。基于这些结果,认知行为疗法可被视为功能性消化不良患者的有效治疗选择。
注:心理治疗不应作为功能性消化不良的一线治疗,因为数据质量低,缺乏盲法心理干预和主观症状评分导致偏倚风险高。如果药物治疗无效,可以考虑心理治疗。
中药具有多成分、多靶点和多途径的优势,目前中医对功能性消化不良肠道菌群的研究仍处于探索阶段。
中药在治疗功能性消化不良方面具有一定的疗效,可以缓解消化不良症状,改善消化功能,提高生活质量。研究证实,中药能逆转肠道菌群失调,维持肠道微生态平衡。
注:中药治疗功能性消化不良应根据患者的具体情况进行个体化治疗,避免不必要的药物过敏或不良反应。同时,中药治疗应在专业医生的指导下进行。
基于菌群干预后,原先消化不良患者的肠道菌群有了好转:







<来源:谷禾健康肠道菌群检测数据库>
从以上菌群评估报告显示,核心菌属和重要菌属没有异常,整体菌群平衡和多样性良好,健康评分显著提升,检测者反馈消化不良症状大幅减轻。
功能性消化不良是一种常见的消化系统疾病,其症状包括腹胀、腹泻、便秘等,给患者带来很大的困扰和痛苦。目前,传统的治疗方法主要是针对症状进行缓解,但效果并不理想。近年来的研究表明,肠道微生物与功能性消化不良密切相关,肠道菌群干预成为了治疗功能性消化不良的新途径。
谷禾的肠道菌群检测经验和研究表明肠道菌群的紊乱和异常特征可以对部分功能性消化不良患者症状背后的病理进行分类和解析,为针对性干预和改善提供了新的可能。对肠道微生物与功能性消化不良之间的关系的进一步深入研究和应用有望带来更有效的治疗方法。
主要参考文献
Singh R, Zogg H, Ghoshal UC, Ro S. Current Treatment Options and Therapeutic Insights for Gastrointestinal Dysmotility and Functional Gastrointestinal Disorders. Front Pharmacol. 2022 Jan 25;13:808195. doi: 10.3389/fphar.2022.808195. PMID: 35145413; PMCID: PMC8822166.
Martinez-Guryn K, Hubert N, Frazier K, Urlass S, Musch MW, Ojeda P, Pierre JF, Miyoshi J, Sontag TJ, Cham CM, Reardon CA, Leone V, Chang EB. Small Intestine Microbiota Regulate Host Digestive and Absorptive Adaptive Responses to Dietary Lipids. Cell Host Microbe. 2018 Apr 11;23(4):458-469.e5. doi: 10.1016/j.chom.2018.03.011. PMID: 29649441; PMCID: PMC5912695.
Shah A, Talley NJ, Holtmann G. Current and Future Approaches for Diagnosing Small Intestinal Dysbiosis in Patients With Symptoms of Functional Dyspepsia. Front Neurosci. 2022 May 6;16:830356. doi: 10.3389/fnins.2022.830356. PMID: 35600619; PMCID: PMC9121133.
Miwa H, Nagahara A, Asakawa A, Arai M, Oshima T, Kasugai K, Kamada K, Suzuki H, Tanaka F, Tominaga K, Futagami S, Hojo M, Mihara H, Higuchi K, Kusano M, Arisawa T, Kato M, Joh T, Mochida S, Enomoto N, Shimosegawa T, Koike K. Evidence-based clinical practice guidelines for functional dyspepsia 2021. J Gastroenterol. 2022 Feb;57(2):47-61. doi: 10.1007/s00535-021-01843-7. Epub 2022 Jan 21. PMID: 35061057; PMCID: PMC8831363.
Mounsey A, Barzin A, Rietz A. Functional Dyspepsia: Evaluation and Management. Am Fam Physician. 2020 Jan 15;101(2):84-88. PMID: 31939638.
Tziatzios G, Gkolfakis P, Papanikolaou IS, Mathur R, Pimentel M, Giamarellos-Bourboulis EJ, Triantafyllou K. Gut Microbiota Dysbiosis in Functional Dyspepsia. Microorganisms. 2020 May 8;8(5):691. doi: 10.3390/microorganisms8050691. PMID: 32397332; PMCID: PMC7285034.
Brown G, Hoedt EC, Keely S, Shah A, Walker MM, Holtmann G, Talley NJ. Role of the duodenal microbiota in functional dyspepsia. Neurogastroenterol Motil. 2022 Nov;34(11):e14372. doi: 10.1111/nmo.14372. Epub 2022 Apr 11. PMID: 35403776; PMCID: PMC9786680.
Hari S, Burns GL, Hoedt EC, Keely S, Talley NJ. Eosinophils, Hypoxia-Inducible Factors, and Barrier Dysfunction in Functional Dyspepsia. Front Allergy. 2022 May 31;3:851482. doi: 10.3389/falgy.2022.851482. PMID: 35769556; PMCID: PMC9234913.
Rupp SK, Stengel A. Bi-Directionality of the Microbiota-Gut-Brain Axis in Patients With Functional Dyspepsia: Relevance of Psychotherapy and Probiotics. Front Neurosci. 2022 Feb 28;16:844564. doi: 10.3389/fnins.2022.844564. PMID: 35295092; PMCID: PMC8919856.

谷禾健康

编辑
癌症一直是全球人类关注的重点,近年来癌症的发病率迅速增加,例如乳腺癌、前列腺癌和肺癌非常普遍。胃肠道癌在发病率和死亡率方面位居首位,并造成重大的社会经济负担。
胃肠道癌症包括胃癌、肝癌、食道癌、胰腺癌和结直肠癌等,占所有癌症的四分之一以上。
▷生活行为影响胃肠道癌症
目前的证据表明,社会经济发展导致生活方式的一些改变。如吸烟和饮酒是癌症最常见的风险因素,越来越多的共识也将饮食习惯列为胃肠道癌症的相关风险因素。这些行为与各种慢性非传染性疾病和胃肠道癌症的出现直接或间接相关。
▷肠道微生物影响胃肠道癌症
肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。大量研究证明肠道微生物群对胃肠道癌症(包括食管癌、胃癌、结直肠癌、肝癌和胰腺癌)具有一定的影响。
在本篇文章中,讲述了胃肠道癌症的一些基本特征,并探讨了在社会进步的背景下,不健康的行为、饮食,及其影响的肠道微生物群变化对胃肠道癌症的影响。希望在未来有助于胃肠道癌症的预防、诊断和治疗。
本文主要分三部分讲述
Part1:胃肠道癌症的一些基本特征
Part2:不良生活方式对胃肠道癌症的影响
Part3:肠道微生物与胃肠道癌症的关系
胃肠道 (GI) 癌症,包括胃癌、肝癌、食管癌、胰腺癌和结直肠癌,胃肠道癌症是全球最常见的癌症,也是导致死亡的主要原因之一,它们的患病率正在持续上升。
疫情前的数据统计,2018年,约有500万例新增胃肠道癌症病例,超过300万例相关死亡。
胃肠道癌症严重危害人们健康
从GLOBOCAN数据库获得的数据估计,2020年食管癌新发病例超过60万例,相关死亡超过50万例。
使用同一数据库,分析估计2020年全球有110万例胃癌新发病例和超过70万例相关死亡。
同样,结直肠癌的发病率一直在以惊人的速度上升,2020年全球估计有190万新病例和90万例相关死亡。
胃肠道癌症已经成为不容忽视的健康问题,下面先来了解一下这些癌症:
▼
食管癌是第四常见的胃肠道癌症。
鳞状细胞癌是食管癌最常见的组织学类型
食管癌有两种主要的组织学亚型:腺癌和鳞状细胞癌 (SCC)。鳞状细胞癌是世界范围内的主要亚型。
我国食管癌90%以上为鳞状细胞癌,少数为腺癌。大多数食管癌患者表现为疾病晚期;因此,平均5年内总生存率仅为18%。
注:腺癌在美国和北欧排名第一(约60%)。
✦食管癌的症状
早期无明显症状
食管癌在早期往往是无明显症状的,偶有表现为胸骨后隐痛不适。随着肿瘤增大,患者会出现进食时吞咽不适或异物感。常表现为进食速度减慢并常需汤水送饭。
病情加重导致肿瘤增大阻塞食管
数月后因肿瘤进一步增大并阻塞食管腔,患者只能进食流质,当肿瘤完全阻塞管腔时,病人表现为“滴水难通”。从症状出现至完全梗阻一般约一年时间。
因此,有可疑症状时应尽早到医院检查。
✦男性食管癌的发病率高于女性
食管癌的男女差异较大,男性患食管癌的比例明显高于女性。食管癌在男性患者中的发生率是女性患者的三倍。
鳞状细胞癌的主要危险因素是饮酒和吸烟,而腺癌的主要危险因素是胃食管反流(尤其是糜烂性食管炎和巴雷特食管)、吸烟和肥胖。
胃食管腔因过度接触(或暴露于)胃液而引起的临床胃食管反流症和食管黏膜损伤的疾病称为胃食管反流。
▼
胃癌是全球第五常见癌症,也是癌症相关死亡率的第三大原因。
✦胃癌的症状
根据癌组织浸润深度分为早期胃癌和进展期胃癌(中、晚期胃癌)。
胃癌早期较难诊断
胃癌及癌前病变的症状隐匿且无特异性,因此早期胃癌很难发现。事实上,中国只有5~10%的胃癌能被早期诊断。
如捉摸不定的上腹部不适、隐痛、泛酸、食欲减退、轻度贫血等部分类似胃十二指肠溃疡或慢性胃炎症状。
随着病情的进展,胃部症状渐转明显出现上腹部疼痛、食欲不振、消瘦、体重减轻和贫血等。后期常有癌肿转移、出现腹部肿块、左锁骨上淋巴结肿大、黑便、腹水及严重营养不良等。
✦胃癌在不同人群中差异很大
非贲门胃癌 (NCGC) 占胃癌病例的近75%。与其他胃肠道癌症类似,非贲门胃癌的流行病学在不同人群中差异很大。
非贲门胃癌在东亚的发病率(韩国每10万人中有34人;日本每10万人中有28人)明显高于欧洲或美国(每10万人中有6人)。
✦影响胃癌的风险因素
除了幽门螺杆菌感染外,胃癌的其他主要危险因素包括年龄增长、性别、种族、饮食摄入类型、社会经济地位、遗传和吸烟。
尽管在过去几十年美国胃癌的发病率有所下降,但50岁或以下人群的非贲门胃癌发病率却出现升高,并且经常出现诊断晚和预后不良的情况。
▼
结直肠癌是常见的消化道恶性肿瘤,也是导致癌症相关死亡的第二大原因,每年全世界约有180万新发病例。
发病多在40岁以后,好发部位为直肠及直肠与乙状结肠交界处,男女比约为2:1。
✦结直肠癌的症状
结直肠癌的临床表现随其病灶大小、所在部位及病理类型而有所不同。
早期症状:
腹部不适:可能表现为腹胀、腹部隐痛等不适症状,疼痛多出现在中下腹部,逐渐加重;
排便习惯的改变:可能出现便频、腹泻或便秘,腹泻和便秘可交替出现,还可能出现腹部隐痛、肛门坠胀感等。
中期症状:
腹部肿块:当肿瘤生长到一定大小后,可能在腹部触及肿块,初期可推动,待到侵袭周围组织后则不易推动;
恶心、呕吐:当肿瘤侵犯胃部时,患者可能出现恶心、呕吐等症状;
晚期症状:
肠梗阻:以左侧结肠多见,由肿瘤向肠壁四周侵袭浸润,导致肠腔狭窄引起肠梗阻,多为慢性不完全性肠梗阻。可先出现腹胀、腹痛、肠鸣音亢进、便秘、粪便变细等;
全身中毒症状:以右侧结肠多见,由于肿瘤消耗体内营养,并造成慢性长期出血,还可继发感染,因此可出现贫血、消瘦、发热、无力、水肿等全身中毒症状;
转移症状:结肠癌晚期时可出现多处转移,肝转移可造成肝大、黄疸、腹水;肺转移可出现咳嗽、气促、血痰或呼吸困难等症状;脑转移可出现偏瘫、昏迷;骨转移可出现骨痛、跛行等。发展到最后可出现恶病质表现,引起全身多器官功能衰竭。
✦影响结直肠癌的风险因素
超过90%的结直肠癌病例是偶发的,这突显了除了癌症相关基因之外,环境风险因素的重要性。例如不健康的饮食模式、超重、肥胖、2型糖尿病、久坐不动、吸烟和饮酒。
正如在其他胃肠道癌症流行病学研究中观察到的那样,不同国家和地理区域之间的结直肠癌发病率差异很大,澳大利亚和新西兰的发病率最高,中南亚的发病率最低。
工业化影响了结直肠癌的发病率
多项研究支持高人类发展指数与结直肠癌发病率和死亡率之间的关系;发达国家通常报告的发病率最高。尽管经济发展和随之而来的工业化有望改善医疗保健的可及性,但这极大地影响了生活方式和不健康习惯。
尽管如此,许多欠发达国家的发病率正在上升,加拿大和巴西等国家的结直肠癌发病率的巨大差异可能不仅与卫生政策有关,还与地区贫困有关。
扩展阅读:结直肠癌防治新策略——微生物群
▼
一般分为肝细胞癌和肝内胆管癌
原发性肝癌一般可分为肝细胞癌(HCC)和肝内胆管癌(ICC),这两种约占肝癌75-85%的病例。
预后不良是该疾病的标志;因此,肝癌的发病率和死亡率密切相关。肝癌在胃肠道癌症中的发病率与死亡率均排名第三。此外,肝癌是全球第六至第七常见的癌症,也是导致癌症相关死亡的第四大原因。
✦肝癌的症状
早期症状:肝癌从第一个癌细胞形成发展到有自觉症状,大约需要2年时间,在此期间,病人可无任何症状或体征,少数病人会出现食欲减退,上腹闷胀、乏力等,有些病人可能轻度肝肿大。
中、晚期症状:肝癌的典型症状和体征一般出现于中、晚期,主要有肝痛、乏力、消瘦、黄疸、腹水等。
转移症状:如果肝癌出现转移,可能出现相对应的症状。肺转移可能出现咳嗽、咳痰等症状,骨转移可能出现疼痛的症状。
✦肝癌的地区差异较大
肝癌的全球分布差异很大,近75%的病例发生在亚洲,其中中国占病例的50%以上,蒙古的发病率最高(93.7/100000)。
在过去的四十年里,一些国家,如美国、加拿大、新西兰和澳大利亚,出现了肝癌病例增加的趋势。
✦影响肝癌的风险因素
病毒性肝炎
乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)以及饮酒被认为是世界范围内肝细胞癌最重要的危险因素。
非酒精性脂肪肝
随着肥胖、糖尿病和相关代谢综合征的高度流行,非酒精性脂肪肝被认为是慢性肝病最常见的原因之一,也是肝细胞癌的相关原因。
工业化进程影响着社会经济环境,人们生活方式的改变,有利于高热量的西方化饮食,并增加了肥胖和糖尿病的发病率。
扩展阅读:
▼
胰腺癌是五种主要胃肠道癌症中最不常见的,累计5年生存率仅为5–15%。
胰腺癌的发病率近年来呈快速上升的趋势,死亡率排在首位,因此也被称为“癌中之王”。
✦胰腺癌的症状
胰腺癌是最致命的癌症之一,其特点是:难发现(发现多为晚期),病程短,发展恶化速度快,中位生存期为3-6个月,正所谓 “无声杀手”。
胰腺癌的早期临床表现往往是无特异性的,与许多其它常见疾病症状相似。中后期主要症状有:不明原因的厌食,消化不良及体重下降;腹部不适或疼痛;黄疸。
✦影响胰腺癌的风险因素
高人类发展指数国家胰腺癌的发病率和死亡率均高出3-4倍,其中北美、欧洲和澳大利亚/新西兰报告的发病率最高,男性患者的发病率略高于女性患者。
高体重指数(BMI)、2型糖尿病,以及酗酒和吸烟是胰腺癌的可变风险因素。关于胰腺癌的风险,发现吸烟者与非吸烟者的发病率比值约为1.74。大量饮酒似乎与胰腺癌有关,是胰腺炎的相关原因,胰腺炎也是胰腺癌的一个既定风险因素。
注:胰腺癌通常具有高度侵袭性,由于非特异性的临床表现而难以诊断。此外,同一国家的国家和地区的诊断准确性差异很大,主要与城市、大都市和高度发达的中心有关。
扩展阅读:“隐藏高手” 胰腺癌的新出路——微生物
中国是全球肝癌、食管癌、胃癌新发病例和死亡人数最多的国家,2020年新增确诊病例121万。中国结直肠癌发病率也在快速上升,占2020年全球发病率的40%以上。
中国胃肠道肿瘤负担沉重,发病率高于世界平均水平。
★ 胃肠道癌症与生活习惯有关
中国近几十年经历了饮食和营养、身体活动及吸烟等生活方式的快速变化。大量证据支持胃肠道癌症与饮食和其他生活行为风险因素有关。
统计与胃肠道癌症风险相关的饮食等生活因素的时间趋势,将有助于衡量由这些因素引起的胃肠道癌症发病的未来趋势,影响预防癌症的公共卫生政策,并优化健康促进的资源分配。
研究团队根据1991年至2011年中国健康与营养调查 (CHNS) 的数据描述和预测了中国饮食和生活方式因素以及相关胃肠道癌症负担的时间趋势。
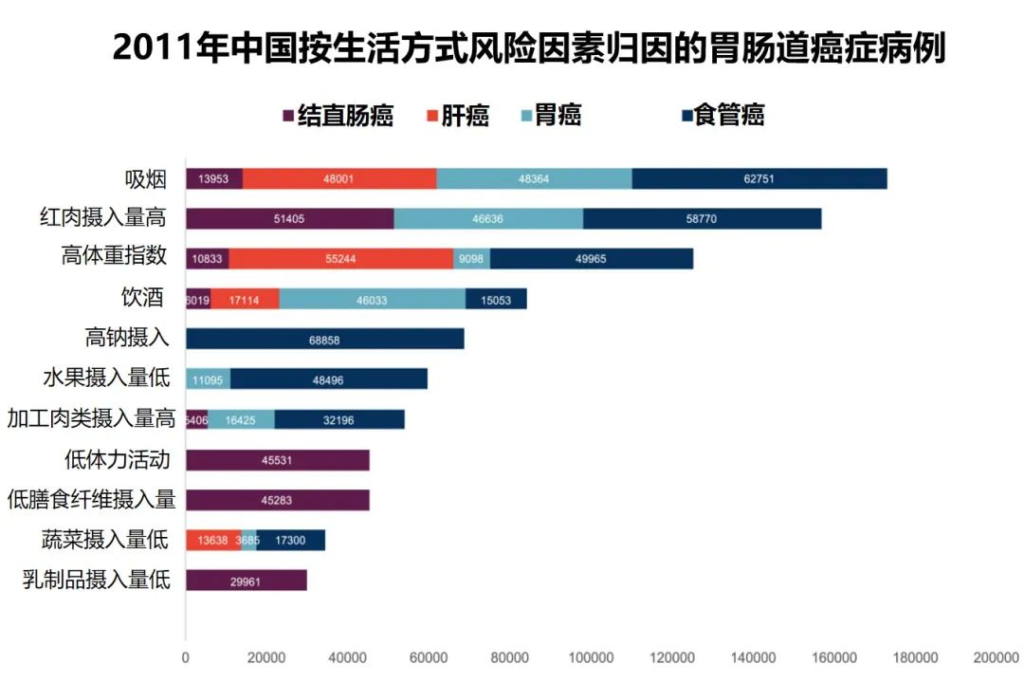
Wu Y,et al.Gastroenterology.2021
下面来讲述一下这些生活方式与胃肠道癌症之间的具体关系:
▼
饮酒是全球疾病负担的主要风险因素,饮酒会增加患癌症的风险。1990年至今,全球成人人均酒精消费量增加,当前饮酒率从45%增加到47%,终生戒酒率从46%减少到43%,预计到2030年这两种趋势将持续。
✦大量饮酒会增加癌症风险
酒精饮料导致近4%的癌症,而最高风险与大量饮酒有关。考虑到不同的饮酒模式,研究表明癌症风险与饮酒频率、每天通常饮酒的量和偶尔大量饮酒之间存在不同的关联,所有这些都与风险增加有关。
教育状况、饮食、吸烟、个人偏好以及地区和宗教习惯是与饮酒或戒酒模式相关的多种生活方式因素中的一部分,可能会混淆当前的研究结果。
几种胃肠道癌症与饮酒有关:
鳞状细胞食管癌与饮酒有关,但与食管腺癌无关。
研究显示关于结直肠癌和胰腺癌的不同结果;胰腺癌的风险似乎与大量饮酒有关,而 结直肠癌的风险与中度或大量饮酒有关。
关于胃癌,世界癌症研究基金会/美国癌症研究所2018年的报告观察到,酒精摄入量 >45 克/天的人群患胃癌风险增加。
肝细胞癌与饮酒直接相关;该关联主要由酒精相关性肝硬化、乙型或丙型肝炎病毒携带者饮酒以及可能大量饮酒驱动。
✦酒精致癌的一些途径
酒精可能通过多种途径促进致癌作用,包括:乙醇及其代谢物乙醛会影响DNA甲基化,导致致癌基因的表达;乙醛形成DNA加合物,损害DNA合成和修复并导致突变。
除此之外,炎症、氧化应激的诱导、叶酸吸收的破坏、免疫系统功能下降、微生物群失调、肝硬化和雌激素调节的变化也可能在癌症发展中发挥作用。
▼
吸烟是多种疾病的主要危险因素,包括胃肠道癌症。
★ 烟草的危害非常大
尽管近几十年来吸烟率有所下降,但与吸烟相关的疾病和死亡仍然是一个令人严重关切的问题,也是一个全球健康问题。
《2019年全球疾病、伤害和风险因素负担研究》确定,就残疾调整寿命而言,吸烟是87个风险因素中的主导因素。
烟草烟雾含有不同的化学制剂,包括活性氧(ROS)和活性氮(RNS)。氧化损伤导致遗传和表观遗传改变、基因失调、调节元件破坏和炎症反应途径激活,在恶性循环中导致活性氧的进一步生成,并可能最终演变为癌症的发生和发展。
✦吸烟者患胃肠道癌症风险更高
食管鳞状细胞癌风险增加
过去几十年的研究支持吸烟与胃肠道癌症之间的关系。吸烟也与食管鳞状细胞癌风险增加20-30%有关,重要的是,注意到烟酒联合使用的具有协同作用。
吸烟人群患胃癌风险较高
数据还表明,吸烟是贲门型和非贲门型胃癌的危险因素。对于其他胃肠道癌症,吸烟率较高的吸烟者患胃癌的风险更高。
荟萃分析还支持吸烟在结直肠癌发展中的作用。 吸烟是肝癌和胰腺癌的公认危险因素。2014年美国卫生部长的报告显示,目前吸烟者因吸烟而患肝癌的风险增加了70%,以前吸烟者增加了40%。
在那些每天吸烟量最大的人中,患胰腺癌的风险最高。荟萃分析研究发现,与不吸烟者相比,当前吸烟者的胰腺癌患者比值升高,但重度吸烟者的比值更高,随着戒烟后的年数成比例下降。
戒烟的好处已经得到了很好的证实。戒烟者的死亡和癌症风险降低。
戒烟和控制烟草消费需要战略规划。成功的戒烟尝试与社会经济地位、教育水平、获得原烟草广告、反烟草运动以及与其他吸烟者一起生活有关。
▼
高脂饮食可显著促进胃肠道肿瘤的发生和发展,主要涉及代谢重编程和多种致癌分子的改变。
高脂饮食与胃肠道癌症的关联
Tong Y,et al.Theranostics.2021
✦高脂饮食下食管癌发病率较高
早在1994年,就发现喂食高脂饮食的小鼠食管癌发病率较高,提示高脂饮食与食管癌之间存在关联。
胆汁酸组成发生变化
高脂饮食可导致小鼠胆汁酸组成发生变化,尤其是牛磺胆酸和牛磺熊去氧胆酸,导致小鼠巴雷特食管和食管癌的发病率增加。
巴雷特食管——食管下段的鳞状上皮被柱状上皮覆盖,可能与反流性食管炎相关,并有发生腺癌的可能。
促炎和致瘤因子增加
喂食高脂饮食的小鼠的食管腺癌具有更高的生长和代谢活性,脂肪组织中促炎和致瘤因子(如瘦素、IGFBP)的表达增加,而抗炎和生长抑制分子减少。
在临床流行病学研究中,发现“肉和脂肪”与食管腺癌和食管鳞状细胞癌密切相关。同时还发现,较高比例的脂肪会加剧食道癌和食道胃腺癌的发生,而碳水化合物会降低食道腺癌的发生。
✦过量膳食脂肪易导致胃癌
许多流行病学研究报告说,膳食脂肪可能是胃癌的危险因素。
瘦素在胃癌中发挥重要作用
瘦素被认为在肥胖相关的胃肠道恶性肿瘤中发挥重要作用,因为它在血管生成、细胞凋亡、细胞增殖和细胞迁移中发挥作用。
瘦素是一种由脂肪组织分泌的激素,它在血清中的含量与动物脂肪组织大小成正比。瘦素作用于位于中枢神经系统的受体,从而调控生物的行为以及新陈代谢。
它还显示通过调节mTOR、STAT3和ERK依赖性途径、PI3K依赖性途径和MAPK依赖性途径来促进粘蛋白产生和胃肠道肿瘤形成。
作用机制
过度的瘦素和瘦素信号激活通过抑制胃肠道上皮细胞中的细胞因子信号3的抑制剂以及增加与肠上皮相关的异位分子如肠粘蛋白2和潘氏细胞标志物PLA2的表达而导致胃肿瘤,以及转录因子SRY-box转录因子2和H+/K+ATP酶的表达降低。
由于瘦素受体(OBR)信号介导的胃上皮细胞器稳态、组织完整性和干性基因表达的破坏,与高脂饮食相关的脂肪毒性会诱发癌前病变。
简而言之,高脂饮食通过上皮细胞中PI3K-Akt通路的上调,促进β-连环蛋白并破坏细胞器稳态,并且可以上调癌症干细胞的特性。
一项研究发现,在高脂饮食喂养的8-20周内,胃壁细胞出现线粒体损伤,并伴有粘膜厚度增加。游离脂肪酸(FFAs)的添加可以复制这种表达并促进后生变化,表明游离脂肪酸的脂质毒性诱导壁细胞死亡和癌前病变的发生。
还有研究发现高脂饮食可以为转移提供足够的能量,并增加O-Glc-N-酰化水平,从而促进脂肪酸受体CD36的转录激活。CD36上调导致癌症细胞脂肪摄取增加,形成促进癌症转移的恶性循环。
✦高脂饮食促进了肝癌
研究证实,高脂饮食可导致疏水性胆汁酸的肝脏滞留显著增加,这与肠道微生物的变化显著相关。同时,肝内胆汁酸的合成和转运紊乱,导致多种炎性细胞因子释放和胆汁酸严重沉积,促进癌症的发生。
此外,调节新陈代谢的各种分子也发生了变化。例如,饮食诱导的肥胖小鼠肝脏中的FGF21和CPT2减少,而FGF15、IRE1α和瘦素上调,然后与其他病理变化联系起来,促进致癌作用。
FGF21减少与过度增殖、TGF-β和Smad信号以及肝脏中上皮-间质转化和Wnt信号通路/β-连环蛋白 信号的异常表达密切相关。
脂肪酸氧化酶CPT2在高脂喂养小鼠体内显著下调,导致酰基肉碱在肝细胞癌组织和血清中蓄积,协同抑制脂肪酸氧化和激活STAT3,共同促进肝癌发生。
高脂饮食产生的代谢变化导致肝脏炎症
长期高脂饮食可降低小鼠香叶基香叶基二磷酸合酶的表达。肝香叶基香叶基二磷酸合酶敲除增强肝激酶B1超法尼基化,通过调节AMPK 活性破坏线粒体功能并促进糖酵解。这些代谢变化导致肝脏炎症,巨噬细胞和促炎细胞因子浸润,进而促进肝脏病理进展。
IRE1α与癌症内质网应激有关,并驱动发病机制。一方面,IRE1α促进NFκB途径的肥胖相关抑制剂的激活,导致肝脏中产生典型的促炎细胞因子,如肿瘤坏死因子和白细胞介素6。
另一方面,它维持STAT3的激活,从而促进肝细胞增殖。瘦素信号通路可以通过下游PI3K/Akt信号激活mTOR,而mTOR间接激活真核起始因子4E,从而刺激编码增殖和抗凋亡因子的mRNA的翻译。
同时,高脂饮食可显著提高血清DPP4水平,促进DPP4/CL2/血管生成的级联反应和DPP4调节的巨噬细胞浸润介导的炎症反应,所有这些都在高脂饮食相关的肝细胞癌进展中起着关键作用。
✦高脂饮食对胰腺癌有影响
高脂饮食降低了上皮对癌症的防御
高脂饮食能促进细胞增殖,抑制异常细胞清除。西方饮食诱导小鼠胰腺上皮细胞过度增殖,并导致突变频率和可能性增加。高脂饮食喂养显著降低了RasV12转化细胞的清除能力,从而损害了上皮对癌症的防御。
高脂饮食可以产生炎症和免疫抑制性肿瘤微环境。发现喂食高脂饮食的小鼠的胰腺组织具有更高的KRAS活性、纤维化基质、更短的存活时间和更高程度的胰腺上皮内肿瘤和胰腺导管腺癌。
高脂饮食导致高胰岛素血症
高脂饮食还可以导致高胰岛素血症并加速胰腺上皮内肿瘤小鼠中的形成和进展。同时发现增加的内源性胰岛素会促进高脂饮食诱发的癌前病变和胰腺癌,这表明可能存在致癌机制。
胰腺导管腺癌发展的机制可能与DNA损伤有关。给 小鼠喂食高糖、高脂肪饮食,高糖处理的正常胰腺细胞系在体外表现出明显的DNA损伤和KRAS突变增加,他们还发现KRAS突变细胞在正常和高糖条件下均具有生长优势环境。
✦高脂饮食促进结直肠癌的发生和转移
对结直肠癌和高脂饮食的流行病学研究证实了它们之间的联系。
高脂饮食促进结直肠癌的发生和转移。伴随着APC基因的杂合丢失和ERK1/2、AKT和mTOR 信号通路的下调。
以下几种途径在高脂饮食促进结直肠癌中发挥关键作用:
JNK通路在肥胖和胰岛素抵抗中起着至关重要的作用并促进致癌转化和细胞增殖。
STRA6通路充当高脂饮食和结直肠癌之间的桥梁,维持结直肠癌干细胞。高脂饮食促进肿瘤组织中STRA6的增加,而STRA6激活转导JAK2-STAT3信号级联。
高脂饮食还可以激活MAPK、ERK和PI3K/Akt信号通路。在一项研究中,高脂饮食引起的肥胖可促进炎症相关结直肠癌的发生,这是由PI3K/Akt途径和肿瘤微环境中IL-12、MCP-1、IL-6和TNF-α的增加驱动的。
关于高脂饮食对细胞因子或肥胖因素的影响,也有许多研究。血清胰岛素、瘦素、TNF-α、IGF1水平升高,以及增殖细胞核抗原、COX-2、细胞周期蛋白 D1、β-连环蛋白和 NFκB 蛋白水平升高表明高脂饮食促进通过炎症和代谢异常形成结肠腺瘤,并影响细胞周期。
▼
慢性心理压力也被认为是包括癌症在内的多种疾病发展的危险因素。
慢性应激刺激下丘脑-垂体-肾上腺轴和交感神经系统,导致应激相关介质的合成和肾素-血管紧张素系统的激活 。
皮质类固醇和儿茶酚胺的过量产生会导致促炎细胞因子的产生和代谢变化,包括胰岛素抵抗的增加和脂肪分解释放游离脂肪酸。
✦慢性心理压力造成炎症环境
总而言之,这些改变似乎创造了一个炎症环境,加剧代谢综合征、糖尿病和胰岛素抵抗的发病机制以及其他非传染性慢性和免疫介导疾病的发展,所有这些都可能由慢性心理压力介导。
在癌症中,肾上腺素能受体在肿瘤细胞和肿瘤微环境中过度表达。肾上腺素能受体的下游激活反过来会抑制细胞凋亡和DNA修复,并具有增强细胞周期进程的原癌效应。
肾上腺素能受体的激活会诱导PI3K/AKT信号通路,从而刺激细胞增殖和血管生成。此外,应激介导的炎症反应和免疫功能改变可能会损害免疫监视机制,进一步促进癌变。
▼
恶性肿瘤的发展是一个多步骤的过程,病毒已被确定为肿瘤促进剂。肿瘤促进剂刺激信号通路和细胞增殖,最终导致癌症。
✦乙肝病毒、丙肝病毒感染易诱发肝癌
乙型肝炎病毒和丙型肝炎病毒感染是目前肝细胞癌最重要的全球危险因素,肝细胞癌是肝癌的主要组织学类型。
注:来自肝细胞癌高患病率地区的患者在诊断时往往比患病率地区的患者更年轻。
乙型肝炎病毒引起的慢性坏死性炎症性疾病会诱发肝细胞突变,估计发生肝细胞癌的风险为10-25%,并且取决于是否存在活动性乙型肝炎病毒感染或肝硬化。
丙型肝炎病毒是一种不整合到宿主基因组中的RNA病毒。丙型肝炎病毒引起的肿瘤发生可能是重复性损伤、再生和纤维化的结果,并且近90%的丙型肝炎病毒相关肝细胞癌之前有肝硬化。
扩展阅读:细菌,真菌,病毒——感染,免疫反应以及治疗用药差异
▼
研究团队应用比较风险评估方法估计归因于每个风险因素的胃肠道癌症的人群归因分数
2011年中国不同生活方式危险因素的胃肠癌归因分数
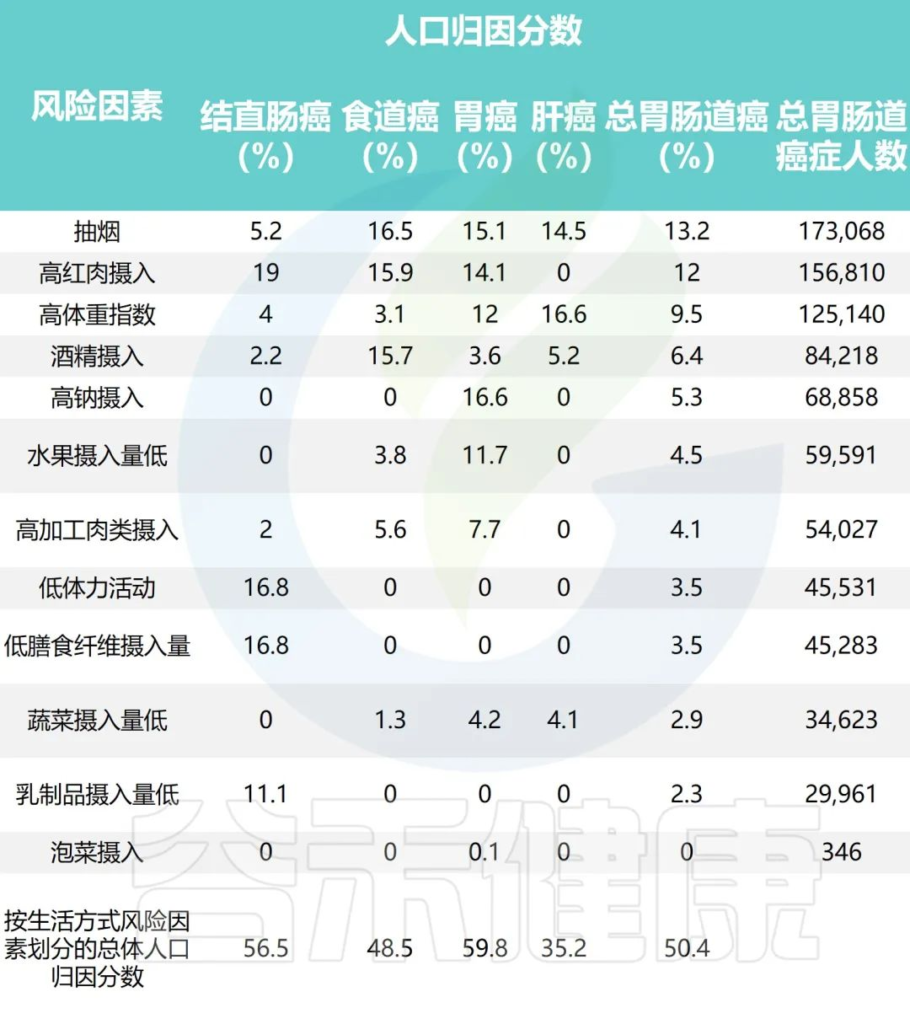
Wu Y,et al.Gastroenterology.2021
•高红肉摄入与51405例结直肠癌病例相关(PAF=19.0%)
•据估计,高身体质量指数(BMI)导致55244例新发肝癌病例 (PAF=16.6%)
•吸烟是食管癌的首要归因危险因素,占48364例病例 (PAF=16.5%)
•高钠摄入量与最多(68,858)例胃癌(PAF= 6.6%) 相关。
研究团队还根据1991年至2011年中国健康与营养调查估计了生活方式因素的时间趋势,同时预测了2011年至2031年生活方式因素的流行程度和胃肠道癌症的相关负担。
1991年至2031年按生活方式风险因素划分的胃肠癌病例的历史和预测趋势
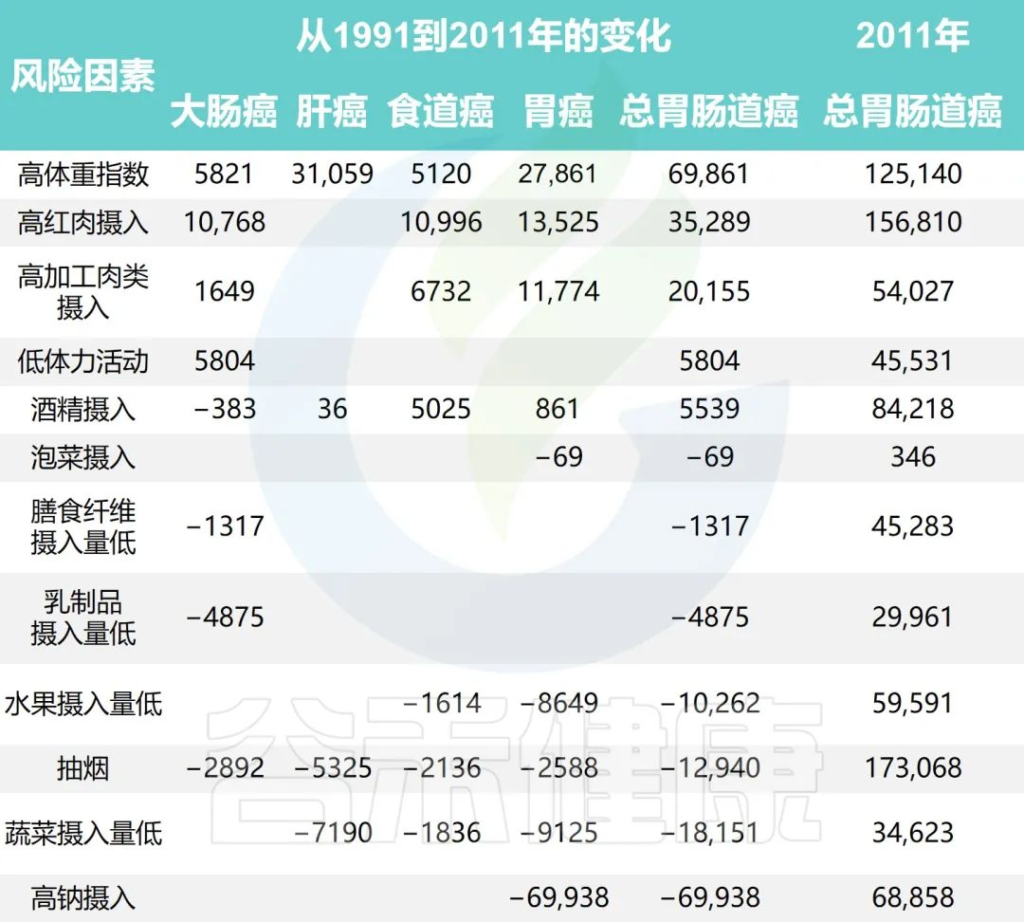
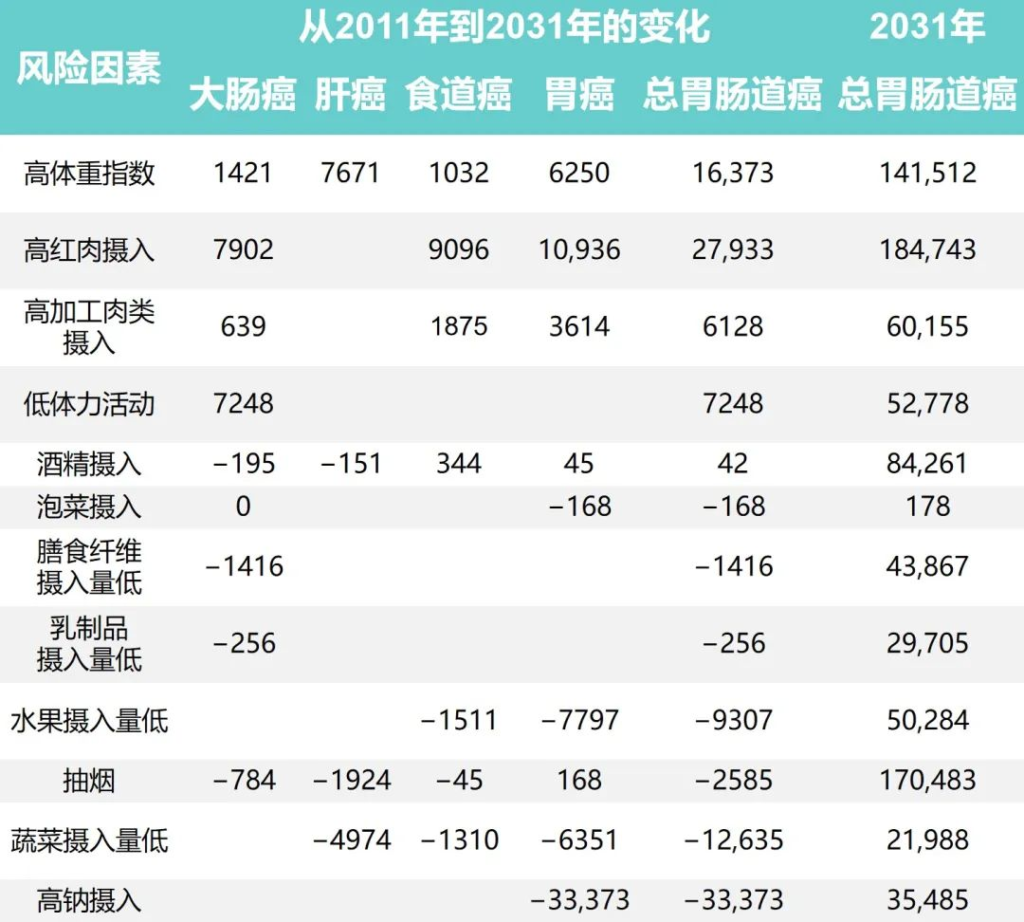
Wu Y,et al.Gastroenterology.2021
•钠摄入量降低减少了胃癌
随着时间的推移,钠摄入量、低蔬菜摄入量、低水果摄入量和吸烟情况有所改善。人口的平均钠摄入量已从1997年的7.5 克/天减少到2011年的5.6克/天,预计到2031年将进一步减少到3.3克/天。
相应的归因胃癌病例估计为138796、68858和 35484,每20年下降约50%。
•蔬菜、水果的摄入增加有助于减少胃肠道癌症
随着平均蔬菜摄入量从252.6克/天上升到323.8克/天,肝癌、食管癌和胃癌的相关数量从1997年的 52774例减少到2011年的34623例。
水果摄入量表现出类似的趋势,1997年总体水果摄入量为18.2克/天,2011年中国人水果消费量为69.6克/天,与1997年相比新增病例减少10262例;到 2031 年,由于水果摄入量增加,预计年发病率将再次下降。
扩展阅读:常见水果对肠道菌群、肠道蠕动和便秘的影响
•吸烟减少胃肠道癌症的发病率也减少
同时,与2011年和1991年相比,吸烟减少与胃肠道癌症事件减少12940例相关,预计2011年至2031年期间将进一步减少。
•饮酒使得胃肠道癌症病例增加
从1997年到2011年,与饮酒相关的胃肠道癌症病例增加了5539例,之后的预测趋势也稳定在每年约84000例。
•锻炼、乳制品和膳食纤维摄入影响结直肠癌
体力活动、乳制品和膳食纤维摄入量仅与结直肠癌有关。据估计,2011年身体锻炼不足与45531例结直肠癌病例相关,预计到2031年还会有7248例病例发生。
1997年、2011年和2031年的预计平均膳食摄入量乳制品分别为5.8克、12.4克和17.6克,膳食纤维分别为10.5克、10.8克和11.1克。2011年,摄入不足分别导致了29961起和45283例结直肠癌病例。
扩展阅读:
人类肠道微生物群在人类的健康和疾病状态中都发挥着重要作用。在过去的十年中,微生物与肿瘤之间的相互作用引起了人们的广泛关注,人们努力了解复杂微生物群落的各种特征,以及微生物群参与癌症预防、致癌和抗癌的可能机制。
大量研究表明,微生物失调通过多种途径促进癌症易感性。肠道微生物主要通过其细菌或分泌的代谢物成分导致消化道肿瘤的发生。
微生物群及其相关代谢产物不仅通过诱导炎症和免疫失调与致癌作用密切相关,还会干扰抗癌药物的药效学。
肠道微生物组与胃肠道癌症的关联
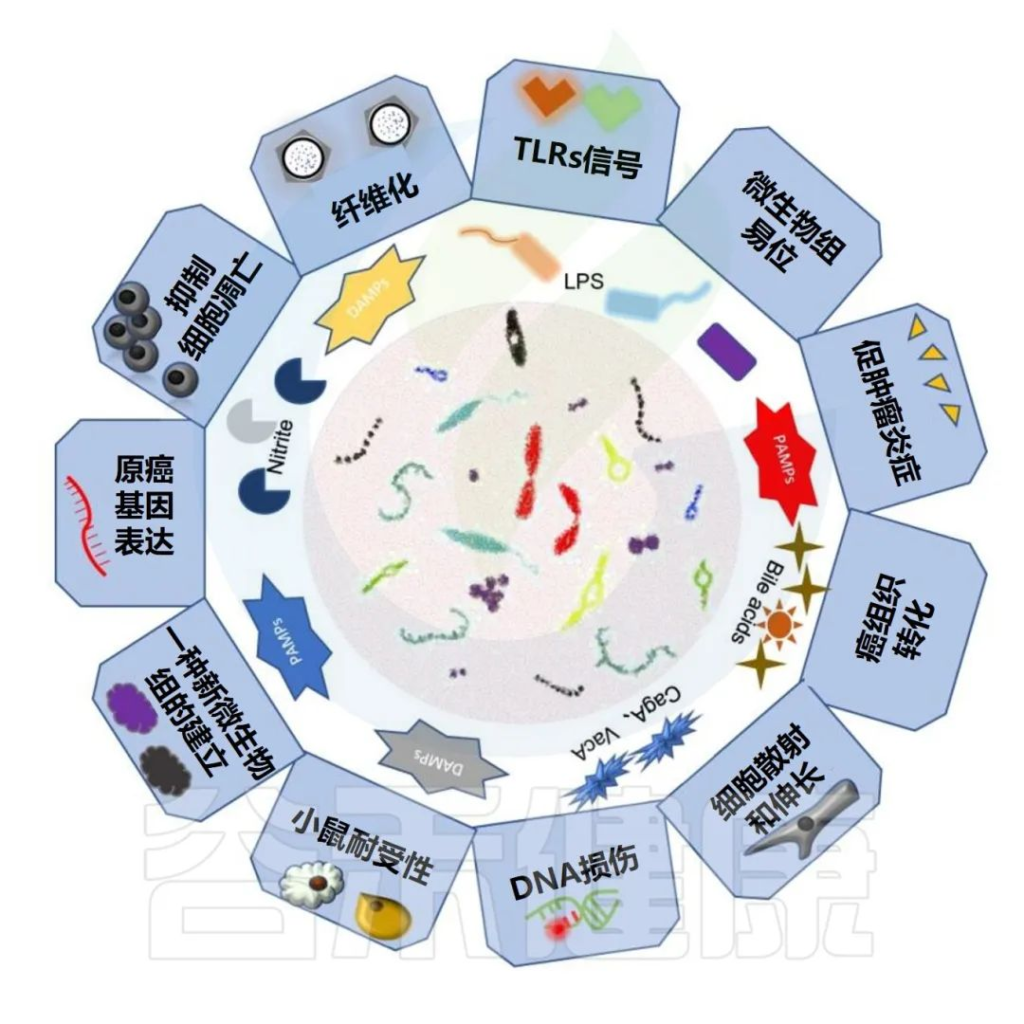
Tong Y,et al.Theranostics.2021
▼
√幽门螺杆菌影响胃癌患病率
胃癌被认为是一种与炎症相关的癌症。幽门螺杆菌(H.Pyloni)感染被称为I类危险因素,可以刺激免疫反应和炎症,调节许多信号通路,并诱发胃酸缺乏、上皮萎缩和发育异常。因此,有效根除幽门螺杆菌可预防胃癌。
癌蛋白细胞毒素相关基因A(CagA)和空泡毒素A(VacA) 是幽门螺杆菌的关键毒力因子。幽门螺旋杆菌感染会显著增加患胃癌的风险。
空泡毒素A可通过直接作用于线粒体 ,导致细胞空泡形成,并在人源性胃上皮细胞内诱导自噬 , 上调 MAP激酶和ERK1/2表达, 激活血管内皮生长因子, 上调细胞生长和分化所必需的 Wnt/β-catenin 信号通路, 抑制GSK3通过PI3K/Akt信号通路。
幽门螺杆菌感染个体中炎症细胞因子增加
在幽门螺杆菌感染个体的胃中发现炎症细胞因子的积累增加,包括干扰素-γ、肿瘤坏死因子、IL-1、IL1β、IL-6、IL-7、IL-8、IL-10和IL-18。
因此,多种类型的免疫细胞受到刺激,包括淋巴细胞、外周单核细胞、嗜酸性粒细胞、巨噬细胞、嗜中性粒细胞、肥大细胞和树突细胞。
包含ERK/MAPK、PI3K/Akt、NF-κB、Wnt/β-catenin以及STAT3的致癌通路的活性随着幽门螺杆菌的感染而上调。相反,肿瘤抑制通路因诱导的P53突变而失活。
此外,幽门螺杆菌感染可导致E-钙粘蛋白和抑癌基因的CpG 岛甲基化,包括编码三叶因子2(TFF2)和叉头盒转录调节因子(FOXD3)的基因,导致显著增加胃癌的风险。
扩展阅读: 正确认识幽门螺杆菌
√其他微生物群
目前的测序技术使研究人员能够深入研究肠道微生物群的复杂性。
幽门螺杆菌阳性个体的微生物群落特征是以下细菌的数量增加:
变形杆菌(Proteobacteria) ↑↑↑
螺旋体(Spirochaetes) ↑↑↑
酸杆菌门(Acidobacteria) ↑↑↑
而以下菌群的数量减少:
放线菌门(Actinobacteria) ↓↓↓
拟杆菌门(Bacteroidetes) ↓↓↓
厚壁菌门(Firmicutes) ↓↓↓
相反,幽门螺杆菌阴性个体携带更丰富的厚壁菌、拟杆菌和放线菌。
√肠道微生物失调增加胃癌发生率
微生物失调也与胃癌发生有关。使用定量PCR,已经表明胃癌患者的微生物群组成非常多样化。
例如卟啉菌属(porphyromonas)、奈瑟菌属(Neisseria)、苍白普氏菌(prevotella pallens)、Streptococcus sinensis的减少,以及大肠杆菌、 肺炎克雷伯菌(Klebsiella pneumoniae)、鲍氏不动杆菌(Acinetobacter baumannii)和毛螺菌科(Lachnospiraceae)的富集。
扩展阅读:
全面认识——肺炎克雷伯菌 (Klebsiella pneumoniae)
来源于幽门螺杆菌的致病成分,如外膜蛋白磷脂酶C-γ2、BAK蛋白和镍结合蛋白,帮助微生物在胃粘膜层定植,然后加剧胃炎的进程,最终增加胃中肿瘤发生的可能性。
肠道微生物与食管癌
据报道,食管癌与常见的潜在危险因素密切相关,如人类乳头状瘤病毒和EB病毒的感染,尽管致病机制仍有争议。除了病毒,细菌感染也会导致食管恶性肿瘤的形成。
√感染幽门螺杆菌的人群食管癌呈下降趋势
在最近20多年来,在感染幽门螺杆菌的普通人群中,食管腺癌的发病率呈下降趋势,尤其是在东部人群中。与此同时,食管鳞状细胞癌的发病率也有所下降。
胃食管反流病是巴雷特食管的主要原因,巴雷特食管是食管腺癌的一种癌前病变。通过抑制壁细胞功能或诱导萎缩性胃炎的发展,慢性幽门螺杆菌感染可以抑制壁细胞分泌盐酸,从而增加胃肠道的pH值,最终导致食管腺癌降低。
√食管炎患者体内肠杆菌丰度较高
与正常人群相比,食管炎和巴雷特食管患者胃中肠杆菌科的相对丰度更高。
有人认为,抗生素可能会改变胃食管反流病患者食道中的微生物组。定植在食管和胃中的肠道微生物群通过质子泵抑制剂(PPIs)的治疗而显著改变。然而,质子泵抑制剂引起的变化是否有益还没有定论。
最新的系统综述和荟萃分析表明,质子泵抑制剂不会减少发育不良和巴雷特食管相关食管腺癌的发展。
√食管中的微生物参与致癌过程
食道传统上被认为是无微生物的部位,只有有限的微生物来自吞咽和胃食管反流。通过应用16S rRNA 测序技术,发现一些特定的微生物栖息在食管粘膜中,包括厚壁菌门、拟杆菌门、变形菌门、放线菌门和梭杆菌门。
此外,与正常食管相比,食管鳞状细胞癌(I-II 期)和食管鳞状异型增生 (ESD) 患者的食管中发现了不同的微生物群落。
与正常胃粘膜微生物群一致,早期食管鳞状细胞癌和食管鳞状异型增生样本中最常见的门是变形菌门、厚壁菌门和拟杆菌门。当食管微生物群失调时,它们参与食管的致瘤过程。
已经发现人类远端食管具有其自身特征性的微生物群。包括厚壁菌门和链球菌在内的革兰氏阳性细菌在正常食管中占主导地位,而革兰氏阴性厌氧菌/微需氧菌,如拟杆菌、变形菌、梭杆菌和螺旋体,主要与食管炎和巴雷特食管有关。
注:脂多糖是革兰氏阴性菌细胞壁的重要组成部分,通过多种机制参与肿瘤发生过程。这些包括激活导致NF-κB激活的先天免疫反应, 促进包括IL1β、IL6、IL8和TNFα在内的炎症相关介质的释放和延迟胃排空。
▼
结直肠中的肠道微生物组是人体中最复杂的群落。细菌种群主要包括厚壁菌门和拟杆菌门和变形杆菌门。
√饮食、微生物代谢物影响结直肠癌
各种因素都会导致结直肠癌,而饮食是与结直肠癌相关的重要环境因素。许多不同的肠道微生物群代谢物具有致瘤或抗肿瘤特性。
在结肠细胞上表达的脂多糖受体抑制细胞死亡,通过Toll样受体2激活细胞免疫反应,然后刺激下游促炎细胞因子信号传导,导致肿瘤发生。
脂磷壁酸是一种来自革兰氏阳性菌细胞壁的元素,被认为是脂多糖的对应物。高脂肪饮食会增加硫酸盐还原菌的相对丰度,例如普通脱硫弧菌,它将初级胆汁酸转化为次级胆汁酸,如石胆酸和脱氧胆酸,具有潜在的致瘤性。
丁酸盐具有抗肿瘤作用
相反,丁酸是一种重要的短链脂肪酸 ,由结肠细菌从饮食中的可发酵纤维中产生,已被证明具有抗肿瘤作用。
参与发酵过程最重要的丁酸盐产生微生物群是普拉梭菌(Faecalibacterium prausnitzii)和直肠真杆菌(Eubacterium rectale)。
丁酸被结肠细胞中的线粒体利用,这有助于维持健康的能量平衡并有益于结肠上皮细胞增殖。GPR109a是一种在免疫细胞上表达的短链脂肪酸受体,主要激活丁酸的配体,然后抑制炎症细胞因子,从而抑制炎症过程。宿主免疫反应通过干扰素γ对抗DNA甲基化介导的GPR109a沉默,从而相应地促进抗癌作用。
丁酸通过诱导P21基因表达、抑制激活蛋白-1(AP-1)信号通路以及增加c-Fos和ERK1/2的磷酸化来发挥各种化学预防作用。此外,尿石蛋白如尿石蛋白A是水果和坚果的肠道微生物群代谢产物,含有大量鞣花酸。据报道,它们可以抑制Wnt信号传导,并显示出对癌症的益处。
扩展阅读:如何通过喂养菌群产生丁酸调节人体健康
√长期炎症容易导致结直肠癌
肠道微生物群引起的通路
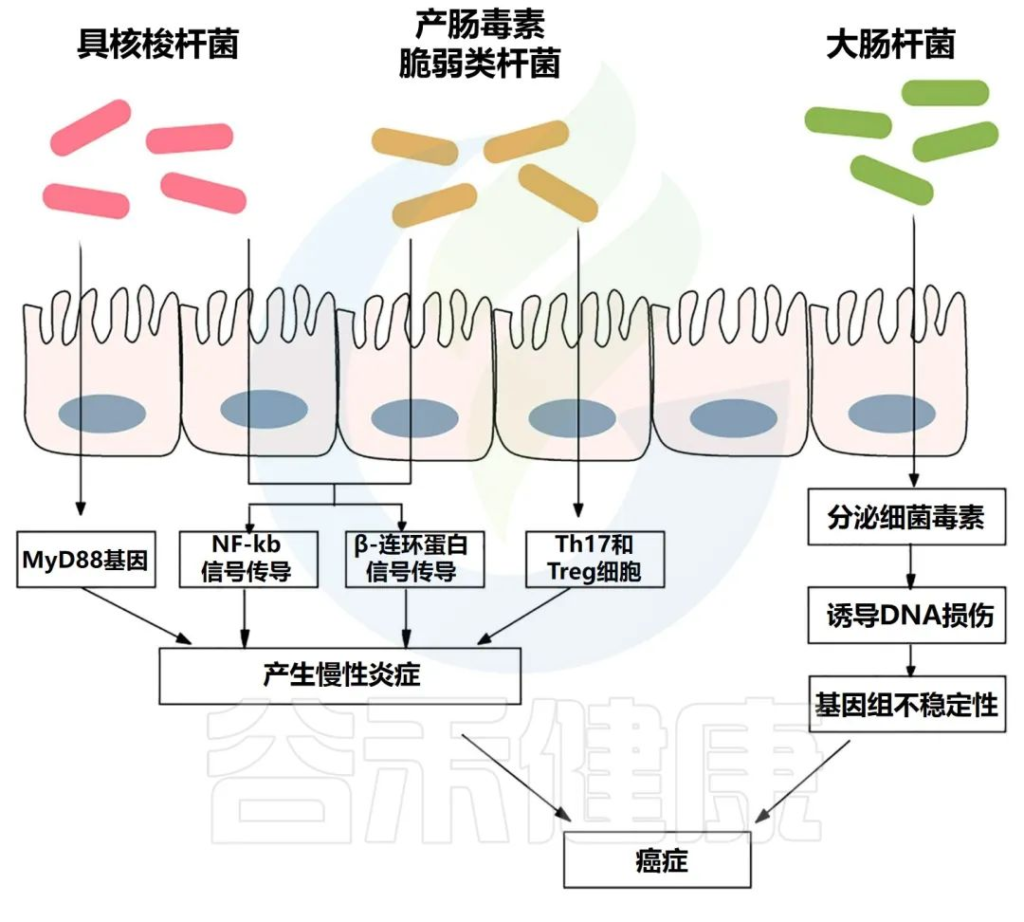
Si H,et al.Semin Cancer Biol.2021
慢性炎症会产生大量炎症介质,如肿瘤坏死因子、白细胞介素6、白细胞介素1b和其他细胞因子,它们会激活NF-κB,从而导致结肠癌发生。
炎症性肠病与更高的结直肠癌风险相关。例如,与局限性结肠炎患者相比,全结肠炎患者患癌症的风险更高。
与健康受试者相比,炎症性肠病患者的肠道微生物群具有较低的多样性和生态失调,其特征是厚壁菌门和拟杆菌门的丰度较低。
产肠毒素脆弱拟杆菌与炎症性肠病的存在显著相关。炎症性肠病和结直肠癌都有一个共同的过程,即转化生长因子-β (TGF-β)、TNFα、NF-κB、ROS 和其他信号分子水平升高,导致肠道微生物失调。
已经证明伴有炎症性肠病的结直肠癌患者比没有炎症性肠病的患者预后更差。
扩展阅读:肠道菌群失调与炎症性肠病的关联
√肠道菌群失调导致结直肠癌风险增加
如果肠道微生物群保持在失调状态,有益共生体的多样性和丰度可以最小化。一旦受干扰的微生物过度生长,它们就会产生积累的外毒素和内毒素。
如大肠杆菌的细胞致死性膨胀毒素和大肠杆菌素,痢疾志贺菌的细胞致命性膨胀毒素,脆弱芽孢杆菌的脆弱芽孢杆菌毒素,粪肠球菌的细胞外超氧化物和过氧化氢等。
这些细菌毒素能够直接或间接诱导DNA损伤、基因组不稳定、肿瘤发生和腺癌的侵袭。
此外,微生态失调导致结肠上皮细胞暴露于致癌物质的增加。未修复的DNA和碱基切除修复(BER)中间体的积累导致基因组不稳定,并最终致癌。
注意:微生物生态失调会使免疫反应失调并增加炎症,导致PIK3CA基因突变,这可能会加速结直肠癌的发生或生长。
//梭杆菌粘附素A可作为生物标志物
梭杆菌粘附素A(FadA)是一种由梭杆菌表达的细胞表面毒力因子,经常在腺瘤性息肉或结直肠癌患者中检测到。
FadA与内皮上的E-钙粘蛋白相互作用,并调节E-钙粘素/β-连环蛋白通路,导致转录因子、癌基因和炎症基因的表达增加。
它还促进梭杆菌粘附并入侵表达E-钙粘蛋白的细胞,从而直接影响上皮细胞的增殖和生长。最近的一份报告表明,结直肠癌组织中梭杆菌的总体丰度是邻近正常组织的400多倍。因此,FadA可能是结直肠癌诊断和治疗的潜在生物标志物。
▼
虽然肝脏通常被认为是无菌的,但肝脏环境受到胃肠道微生物群通过肝门静脉系统产生的病原体或代谢物的极大影响。
肝细胞癌和胆管癌是最常见的肝癌组织学类型。酒精性肝病、非酒精性脂肪肝以及食源性污染物黄曲霉毒素B1、乙型或丙型肝炎病毒感染被认为是肝细胞癌的主要危险因素。
值得注意的是,肠道菌群失调是非酒精性脂肪性肝病的主要诱因之一。
√肠道微生物失调会导致肝癌发生
肝脏通过过滤血流以及代谢和中和肠道微生物产生的毒素对宿主微生物群落产生重要影响。肠道微生物失调会导致肝癌发生,因为微生物群和微生物代谢物可被肝脏常驻免疫细胞检测到,并能够改变肝脏代谢。
肝细胞癌患者粪便中大肠杆菌的丰度远高于健康对照者粪便中的大肠杆菌,而迪茨氏菌科(Dietziaceae),假单胞菌属(Pseudomonas)和草酸杆菌科(Oxalobacteraceae)在胆管癌患者的胆管样本中比非胆管癌个体的样本更丰富。
据推测,肠道微生物的过度生长可能会促进肝癌的发展,这需要进一步探索。
√幽门螺杆菌促进肝癌的生长和迁移
幽门螺杆菌通常栖息在人的胃中。然而,来自肠道的幽门螺杆菌可以通过门静脉的血流到达肝组织,在吞噬消除后幸存下来,或者通过十二指肠反向迁移。
已在肝细胞癌患者的肝组织中发现幽门螺杆菌产生的代谢物 。已经表明,来自幽门螺杆菌的脂多糖通过增加白细胞介素8和转化生长因子β1的水平直接促进肝癌的生长和迁移。
作为螺杆菌科的一员,幽门螺杆菌通过激活NF-κB 和Wnt信号通路、肝细胞更新和氧化应激导致肝细胞癌的发展。
此外,一些螺杆菌属物种,如胆螺杆菌(H.bilis)、H.ganmani和H.hepaticus,与胆管癌特异性相关,但与胆管中的非肿瘤疾病无关。
√肠道微生物代谢物影响肝癌
微生物代谢物会扰乱肝脏中的代谢途径和免疫反应。
Toll样受体4(TLR4)识别来自细菌的脂多糖(LPS),并通过脂多糖诱导的TNF-β和IL-6激活库普弗细胞。它还可以通过上皮调节蛋白等生长因子刺激星状细胞,并启动各种炎症和致癌途径。LPS-TLR4通路可促进肝细胞癌,而去除脂多糖或Toll样受体4 基因失活可降低肝细胞癌的发展。
库普弗细胞——是位于肝脏中的特殊巨噬细胞,是单核吞噬细胞系统的一部分。
胆酸和鹅脱氧胆酸是肝脏产生的主要初级胆汁酸。它们通过增加活性氧的产生而导致DNA损伤,从而诱发肝癌的发展。
此外,胆汁酸也被证实可以调节肠道微生物群。胆汁酸数量减少会导致肠道菌群过度生长并加速炎症。梭菌产生的脱氧胆酸的肠肝循环会导致DNA损伤并在肝星状细胞中引发衰老相关分泌表型。
这个过程涉及许多炎症细胞因子和生长因子,从而导致炎症和肥胖相关的肝细胞癌转变。脱氧胆酸和石胆酸被证明可通过DNA损伤直接促进癌症。
▼
胰腺是胃外消化器官。胰腺导管腺癌(PDAC)是全球最致命的癌症之一,是最常见的胰腺癌类型。越来越多的研究表明,肠道微生物群可能通过促进炎症、激活免疫反应和使癌症相关炎症持续存在来影响胰腺癌发生。
√幽门螺杆菌感染是胰腺导管癌的风险因素
对数百项胰腺癌荟萃分析的回顾表明,幽门螺杆菌感染是胰腺导管腺癌的一个重要危险因素。除胰腺导管腺癌外,幽门螺杆菌还参与急性和慢性胰腺炎以及自身免疫性胰腺炎。
许多源自幽门螺杆菌的致病成分,包括氨和脂多糖,以及由此产生的大量炎性细胞因子,都会损害胰腺。
幽门螺杆菌感染激活NF-κB和AP-1,导致细胞过程失调。白细胞介素8水平升高会加速炎症反应,最终导致胰腺癌发生。
此外,幽门螺杆菌感染持续激活STAT3可通过上调抗凋亡和促增殖蛋白(包括Bcl-xL蛋白、MCL-1、生存素、c-myc和细胞周期蛋白D1)的表达来促进胰腺癌进展。
√炎症及免疫反应与胰腺癌
微生物引起轻微和持续的免疫反应和炎症反应,会导致胰腺癌的形成。
已经进行了许多研究来探索可能的机制。在各种免疫细胞上表达的toll样受体使免疫细胞能够识别多种微生物相关分子模式 (MAMP) 和非感染性炎症损伤相关分子模式 (DAMP),然后激活NF-κB和MAPK信号通路。这些过程引发并延续胰腺炎,最终促进胰腺癌的进展。
NLRs是细胞质模式识别受体(PRRs),参与NF-κB的激活和炎症小体的形成。P38丝裂原活化蛋白激酶(P38 MAPKs)对细胞因子有反应,参与细胞分化、凋亡和自噬,从而加速胰腺导管腺癌的过程。因此,P38抑制剂可能是治疗癌症的药物。
味觉受体2型成员38(TAS2R38)是一种苦味受体。有趣的是,T2R38不仅在口腔细胞中表达,也在胰腺癌细胞中表达。铜绿假单胞菌(Pseudomonas aeruginosa)是T2R38的独特配体,据称可激活 T2R38,诱导多药耐药相关蛋白1(ABCB1),并参与癌症侵袭和转移。
此外,梭杆菌属存在于8.8%的胰腺癌组织中。值得注意的是,梭杆菌属的状态是胰腺癌的一个独立的阴性预后生物标志物。
扩展阅读:梭杆菌属Fusobacterium——共生菌、机会致病菌、致癌菌
√其他肠道微生物对癌症的作用




Tong Y,et al.Theranostics.2021
研究显示生活方式对胃肠道癌症风险的影响越来越大。吸烟、饮酒、饮食构成、肥胖等都是影响胃肠道癌症的重要因素。
肠道微生物群与人类密切相关,在人类健康和疾病中也发挥着重要而独特的作用。肠道微生物群还能够与化学治疗剂和免疫治疗剂发挥协同作用。
基于对肠道微生物群的研究,人们也在探索新的治疗靶点,以及使用人类肠道微生物群的诊断、预测和预后癌症生物标志物。加速肠道微生物组研究在精准医学中的转化。
生活行为及肠道微生物群与胃肠道癌症之间的准确关系需要进一步探索,将对我们的日常生活和临床治疗将产生重大影响。
主要参考文献:
Jardim SR, de Souza LMP, de Souza HSP. The Rise of Gastrointestinal Cancers as a Global Phenomenon: Unhealthy Behavior or Progress? Int J Environ Res Public Health. 2023 Feb 18;20(4):3640. doi: 10.3390/ijerph20043640

谷禾健康

人类肠道微生物组是一个多样化的生态系统,我们已经知道,它在多个器官系统健康中发挥着重要作用,肠道微生态失调可能导致各种常见疾病,如糖尿病、神经精神疾病、癌症等。
新的研究表明,肠道微生物组的改变与眼部疾病相关。
基于小鼠实验,已经开始对人类微生物组及其与眼部病理学的关系进行临床研究。
葡萄膜炎、年龄相关性黄斑变性、青光眼、干眼综合征和霰粒肿等病理学正在探索中,对微生物组的深入研究可能扩展这些疾病的治疗方案。

本文总结目前检查肠-眼轴的临床研究,尤其是改变微生物组来缓解眼部疾病的潜在治疗方法。
研究发现,10% 的炎症性肠病患者会出现眼部疾病(巩膜外层炎、葡萄膜炎、结膜炎等)。肠道和与之相对较远的眼睛之间有什么关联?我们从以下几个方面来看:
▼
视网膜是眼睛后部的一层,里面装满了神经细胞,可以捕获图像并将其发送到大脑。
在所有的眼组织中,从免疫的角度来看,视网膜被认为是一种特权组织。它有三层保护(内部的血液-视网膜屏障;外层血视网膜屏障;以及血水屏障),以及通过“抵抗”和“容忍”策略,来保护它免受来自内部和外部环境的伤害。
这些血液视网膜屏障的变化可能通过募集炎症细胞和随后的眼内炎症导致视网膜疾病的发展,例如葡萄膜炎。
此外,它还受到自身防御系统的保护,如小胶质细胞和补体系统,以维持视网膜稳态。
视网膜由于更新和修复能力差而非常脆弱,因此即使是轻微的损伤也会产生毁灭性的后果。
年龄相关性黄斑变性是一种全身免疫性疾病,局部表现为眼部免疫环境下调所致。免疫反应改变的迹象表现为先在视网膜色素上皮中逐渐积累,后在玻璃膜疣中逐渐积累的沉积物,构成有利于免疫系统显著激活的抗原刺激。
在衰老过程中,所有防御系统的效率都会降低,与年龄相关的形态功能和免疫变化伴随着慢性低水平炎症。“炎症”过程也会导致与年龄相关的视网膜疾病。
▼
眼睛的物理变化被认为是由于肠道内壁的炎症与肠道通透性增加有关。肠道通透性/肠漏综合征的变化允许细菌、毒素或免疫化合物穿过粘膜肠道屏障并传播到不同位置,包括眼睛表面。这些化合物直接影响眼睛或可能通过分子模拟引发眼睛的免疫反应。分子模拟是一种可能引发自身免疫性炎症的机制,因为保护屏障受损以及细菌或毒素的长期存在。
扩展阅读:
▼
在许多层面上,肠道微生物群和免疫化合物与眼睛的视网膜相互作用。不健康、失调的肠道微生物群和活化的免疫细胞会在眼睛中引发炎症,并影响视网膜、眼睛微生物组和眼睛润滑,从而导致眼部相关疾病。
肠道微生物组及其代谢物,尤其是短链脂肪酸,都可以通过直接或间接修改不同细胞类型的表观基因组来调节免疫细胞的关键功能。
损害眼睛的危及视力的免疫反应是眼内炎症性疾病的典型特征。葡萄膜炎、年龄相关性黄斑变性、与干眼症相关的干燥综合征、糖尿病视网膜病变、青光眼和感染性角膜炎与肠道微生物组异常有关。
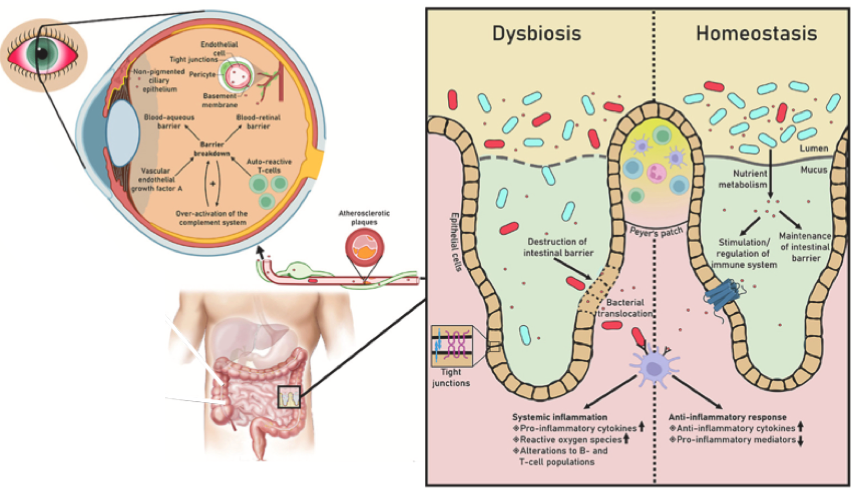
doi.org/10.1016/j.preteyeres.2022.101117
接下来,我们来看一下具体哪些肠道菌群与眼部相关疾病有关。
▼
在糖尿病视网膜病变中,与健康对照组相比,主要的分类门,包括拟杆菌门、放线菌门、粪杆菌门和梭菌门被耗尽。
在两项评估糖尿病视网膜病变队列中微生物组多样性的研究中,发现多样性下降,这与临床前小鼠模型一致。
▼
与对照小鼠相比,Bacteroides caecimuris在患病小鼠中显着增高。受影响的小鼠缺少健康肠道微生物组典型的菌群,如Rikenella,Muribaculaceae, Prevotellaceae UCG-001, Bacilli 等。
肠道微生物组变化与眼部疾病之间的联系可以通过多种机制来解释。肠道生态失调可以有利于增加肠道通透性,允许微生物及其代谢物诱导眼细胞炎症。微生物失衡也可能是血液视网膜屏障破裂和中枢神经系统氧化应激增加的原因。所有这些假设也可以解释视网膜色素变性小鼠模型中的神经炎症,氧化应激和细胞死亡。
▼
年龄相关性黄斑变性( ARMD )是一种多因素疾病,由遗传和环境因素的复杂组合引起。
与改变的肠道微生物群相关的肠道通透性增加,允许肠道代谢物和产物的更高易位,可能调节视网膜特异性免疫细胞。有趣的是,LPS 引起的慢性炎症会加速营养不良 P23H 大鼠的神经变性,导致营养不良视网膜的形态和生理紊乱恶化。
宏基因组测序评估了 ARMD 患者和对照组,研究人员发现 ARMD 患者中以下菌群含量较高 :
而以下菌群在对照组中含量较高:
研究人员推测可能与谷氨酸降解和精氨酸生物合成途径增加有关。谷氨酸是一种众所周知的视网膜兴奋性神经递质,因此其减少可能导致视网膜神经传递不足。
关于谷氨酸代谢详见:兴奋神经递质——谷氨酸与大脑健康
此外,患者也缺乏负责脂肪酸延伸途径的细菌。在这方面,长链多不饱和脂肪酸可能对视网膜生理学产生关键影响,并可能促进ARMD发展。
相比之下,对照组中Bacteroides eggerthii 的丰度可能对该疾病具有保护作用,因为它能够产生短链脂肪酸。这些代谢产物可能通过改变淋巴细胞从肠道向眼睛的迁移来调节眼内炎症。
▼
一项针对12名新生血管性年龄相关性黄斑变性(nAMD)患者的试验发现,与对照组相比,nAMD患者存在“微生态失调”。值得注意的是,研究人员发现了Anaerotruncus的增加,这也与小鼠模型中炎症信号的增加有关,这表明肠道微生物变化和nAMD进展相关的可能作用机制。
▼
在青光眼患者中,研究人员发现肠易激综合征是一种与微生物群失调相关的疾病,会显著增加患青光眼的几率(OR=5.84)。
除了发现青光眼患者与对照组的细菌谱存在差异外,还注意到视觉效果与巨单胞菌和Blautia属的丰度呈负相关。
扩展阅读:
肠道核心菌属——巨单胞菌属(Megamonas),不同人群差异大
肠道核心菌属——经黏液真杆菌属(Blautia),炎症肥胖相关的潜力菌
▼
一项视网膜研究了一组特发性颅内高压患者,再次发现与对照组相比微生物群存在差异。
有趣的是,使用乙酰唑胺治疗的患者发现乳酸杆菌增加,这被认为对肠道微生物健康有益。
总的来说,在眼部病理中,菌群可能发生改变或破坏,见下表:
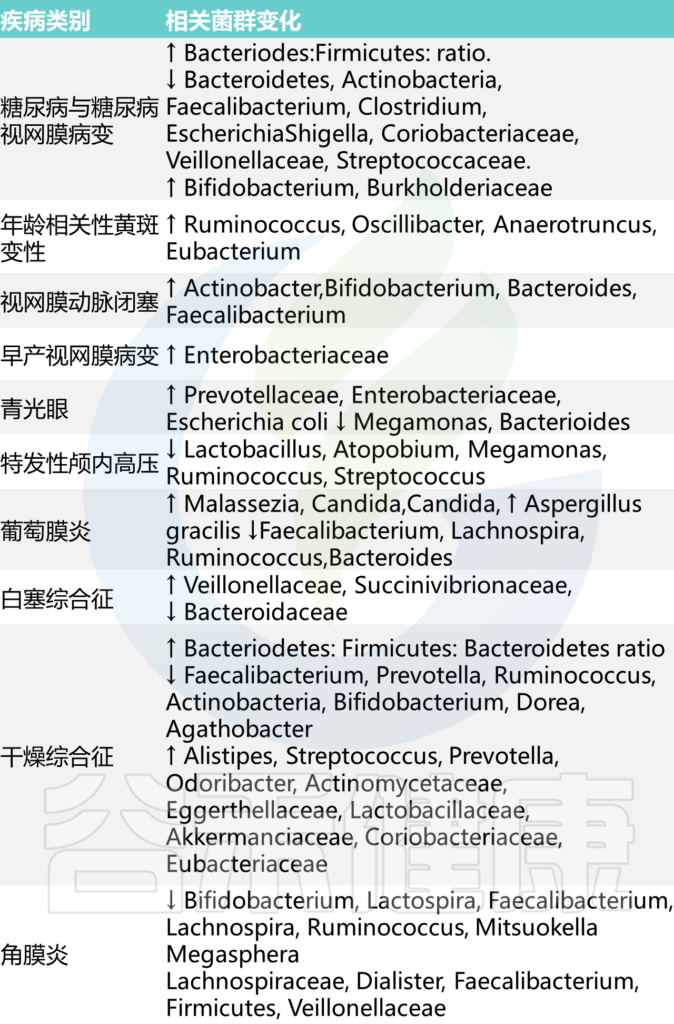
Russell MW, et al., Eye (Lond). 2023
肠道微生物组可以调节炎症信号的变化。因此,如果肠道组织受到影响,导致全身促炎状态,那么眼部后果可能是继发于或平行于肠道炎症轴的,或者可能在主要过程中有所不同。
▼
在葡萄膜炎的情况下检查了肠道失调,发现各种抗炎微生物群减少。但也有研究人员注意到葡萄膜炎的肠道失调,病例和对照组之间的没有显著差异,研究人员认为细菌可能与这种病理状态无关。
进一步探讨这种可能性,有研究人员发现,与对照患者相比,致病性念珠菌属和曲霉菌属增加了。另一项研究发现与对照患者相比,角膜炎患者的肠道失调,这两项研究都发现了标记的细菌群落变化。这些研究也检测了真菌的变化,注意到致病性曲霉、念珠菌和马拉色菌增加的趋势,这些真菌已被证明表现出抗真菌耐药性并参与其他疾病过程。
两项试验检测了白塞病葡萄膜炎患者的微生物群差异,发现病例和对照组之间存在显著差异。白塞病患者的微生物群多样性也显著降低。上述数据表明肠道健康和眼部病理之间可能存在联系。
然而,目前尚不清楚真菌和细菌是否直接介导眼部病理,是否与免疫系统有关,或者是否有其他未发现的途径在起作用。
扩展阅读:膳食真菌在癌症免疫治疗中的作用: 从肠道微生物群的角度
▼
研究人员发现,视网膜动脉阻塞(RAO)患者与健康对照相比,不同分类属的细菌有所增加。这项研究还发现RAO患者的三甲胺-N-氧化物(TMAO)显著增加,TMAO是一种微生物群衍生的代谢产物,已被发现是心血管不良事件、死亡率和血栓形成的独立风险因素。
在这项研究中,TMAO和阿克曼菌Akkermansia丰度呈正相关,表明微生物群和RAO之间存在潜在的机制联系。然而,必须注意的是,在其他研究中,Akkermansia被发现与TMAO浓度呈负相关,这表明TMAO可能不是病因,或者,TMAO本身可以在眼部病理学中发挥中介或主要作用。如上所述,这项研究并不是为了证明一种联系,也不是为了简单地假设一种联系的存在。
肠道微生态失调的眼部临床研究

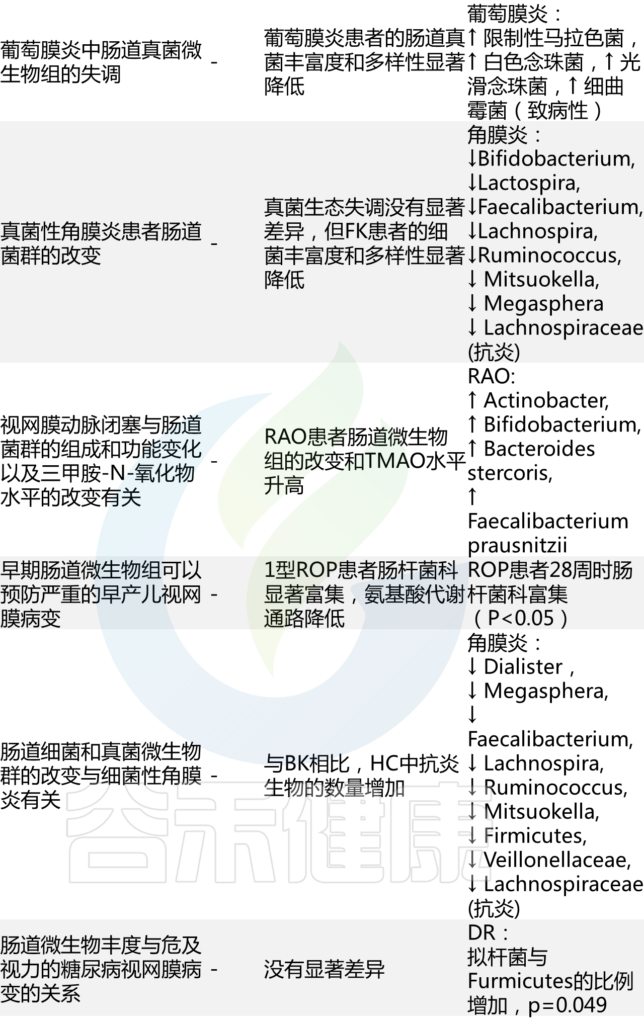
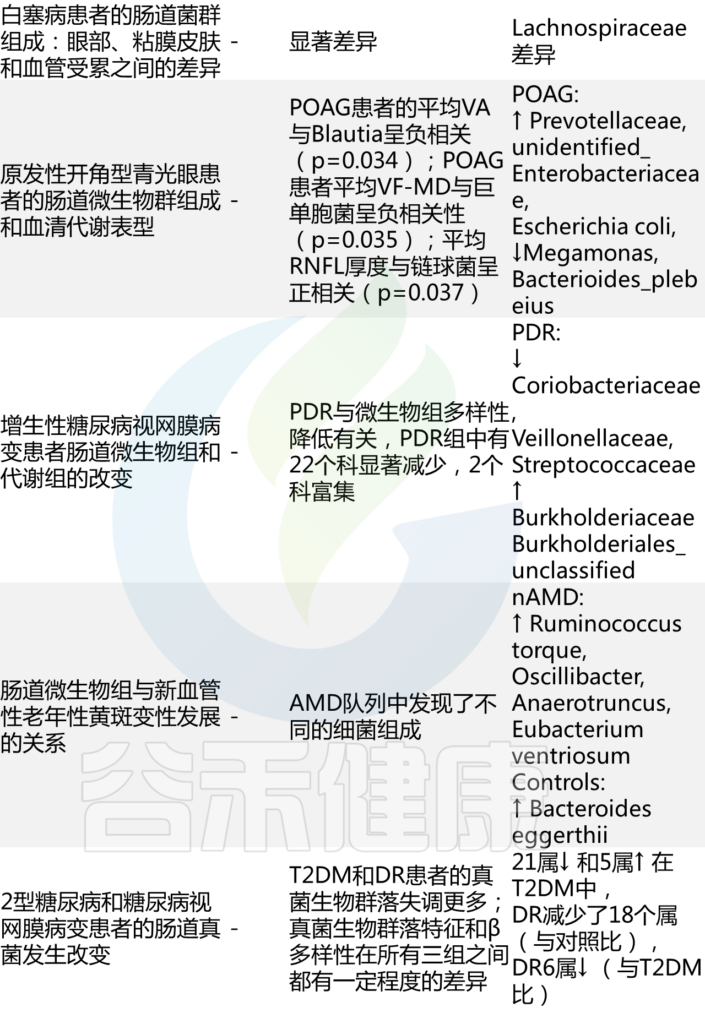
Russell MW, et al., Eye (Lond). 2023
有四项临床研究(≤23名患者)通过粪菌移植(FMT)或益生菌补充靶向肠道微生物群,来治疗眼部疾病。
▼
Watane等人于2021年对10例干燥综合征并发干眼症的患者进行了粪菌移植。粪菌移植后三个月,没有副作用报告,患者自我报告的干眼症症状在一半的队列中减轻了。
▼
Filippelli等人于2021和2022年对10名成人和13名儿童患者的益生菌补充剂及其治疗霰粒肿的疗效进行了研究。在这两项研究中,均使用了含有嗜热链球菌、乳酸乳球菌和德氏乳杆菌的益生菌。所有接受益生菌制剂治疗的成年患者霰粒肿消退时间显著缩短,而这种影响对于只有小于2.0mm的小霰粒肿的儿童来说也是如此。
Napolitano等人于2021报道了一例有三年前葡萄膜炎病史的患者的病例。患者服用了含有乳酸双歧杆菌、两歧双歧杆菌和短双歧杆菌的益生菌补充剂。两个月后,该患者的视觉功能增加,葡萄膜炎的临床症状减少。益生菌配方并不包括患者微生物组中不存在的物种。
扩展阅读:如果你要补充益生菌 ——益生菌补充、个体化、定植指南
除了以上的临床研究外,其他可能的干预措施:
▼
高纤维饮食会促进某些细菌在肠道中占据优势地位,这些细菌会产生短链脂肪酸,促进调节性 T 细胞分化,并降低发生眼部炎症的倾向。一些实验正在直接使用短链脂肪酸来测试它作为肠外自身免疫性疾病的治疗干预,已有研究人员发现,在小鼠身上,它对自身免疫性葡萄膜炎有保护作用。
▼
一项涉及衰老小鼠的研究中,高血糖饮食导致光感受器退化和视网膜色素上皮细胞萎缩,这在喂食正常饮食的小鼠中是看不到的。恢复到低血糖饮食可以逆转疾病的特征,并改变肠道中 AMD 保护因子(包括血清素)的水平。
▼
高脂饮食会导致肠道渗透性增加,从而使细菌产物如脂多糖和其他病原体相关分子模式的分子易位增加,它们通过先天免疫系统的模式识别受体 ( 特别是Toll样受体和Nod样受体)影响促炎信号转导,引起低度全身性炎症,加剧脉络膜新生血管形成,最终加重病理性血管生成。
在一项研究中,在4周龄的C57BL/6小鼠中研究了高脂肪饮食对泪腺功能的影响。结果显示,高脂饮食的小鼠表现出病理变化,包括眼泪分泌水平降低、炎症性CD4+T细胞增加 ,细胞浸润、TNF-α和IL-1β等促炎因子增加以及腺泡和肌上皮细胞凋亡增加。将标准饮食引入之前高脂肪饮食的小鼠后,泪腺的病理变化部分逆转,包括炎症细胞和促炎因子的减少以及抗炎胞质分裂素的上调。
▼
在啮齿动物模型中,在开始隔日禁食方案后的 1 周内,间歇性禁食已被证明可以降低血压和心率,这两者都是 糖尿病性视网膜病变等眼部血管疾病的已知危险因素。
另一项早期限时喂养(从早上 8 点到下午 2 点随意喂养,剩下的 18 小时禁食)被证明可以降低餐后胰岛素、血压、氧化应激和夜间食欲同时增加人类受试者的胰岛素敏感性和 β 细胞功能。这项研究和其他研究进一步支持间歇性禁食的有益作用,并表明它可能通过降低血压和胰岛素敏感性来治疗眼部血管疾病。
连续 7 个月的隔日禁食,增加了产生肠粘液的杯状细胞的数量,并降低了血浆 PGN 的浓度,表明肠血管屏障完整性得到改善。
▼
动物研究表明,锌通过减少氧化应激来改善视网膜的抗氧化过程。特别是,肠道菌群竞争锌的供应,锌对共生代谢途径和细菌毒力因子都很有用。然而,锌缺乏及其过量的存在都会改变微生物组的组成。
▼
膳食补充类胡萝卜素和锌可以预防或延缓眼部疾病的进展,可能是通过它们的抗氧化和抗炎特性。叶黄素和玉米黄质两种叶黄素,它们天然集中在人眼的黄斑中。它们充当蓝光的光学滤光片,并作为常驻抗氧化剂和自由基清除剂,以减少氧化应激引起的损伤。
由于人类无法合成类胡萝卜素,因此供应取决于含类胡萝卜素的食物,例如绿叶蔬菜、西兰花、豌豆、玉米和蛋黄。
▼
大量摄入 omega-3 长链多不饱和脂肪酸 (LCPUFA) 与年龄相关黄斑变性风险降低有关。而大量摄入 omega-6 LCPUFA 与风险增加有关。LCPUFAs高度集中在眼睛中,对视网膜的视觉功能至关重要。此外,它们是对氧化应激的促炎和抗炎免疫反应的重要调节剂。ω-3和ω-6 LCPUF之间的比例似乎对预防慢性低度炎症很重要。可以通过某些富含脂肪的鱼,亚麻籽和藻类等补充。
▼
膳食多酚可减少氧化应激,在视网膜色素上皮细胞中具有抗炎作用,并与各种白细胞介素和信号通路的调节有关。在丁香、浆果、红酒或绿茶中富含。
其他对眼部健康至关重要的营养物质包括:
维生素 A、番茄红素、硫辛酸、维生素 C、姜黄素、白藜芦醇、槲皮素、葡萄籽提取物、绿茶提取物等。
微生物组的复杂性对研究微生物变化有挑战,因为微生态失调可能归因于多种菌群的同时过度生长或损失。目前的文献并没有直接分析出因果关系。
除了目前的试验涉及的非特异性干预之外,其他干预措施也可能有效果。一项对36名患者进行的17周的随机前瞻性研究表明,通过逐步引入发酵食品等相对不那么激烈的措施,可以对免疫功能产生类似的影响。
关于发酵食品详见:肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
也有研究人员认为,应该谨慎采用通过改变微生物组来改善系统健康的干预措施。30名患者使用益生菌增加微生物多样性,然而却因这种补充而患上了小肠细菌过度生长和D-乳酸酸中毒。开始抗生素治疗后,患者症状减轻(P=0.005)。
由于许多原因,选择与疾病相关的正确益生菌并不容易。同一属和种的不同菌株可能对宿主产生完全不同的影响。应充分了解特定细菌菌株的特定特性和特征以及对宿主健康的影响。
因此,需要更大规模的前瞻性临床试验研究益生菌补充剂对各种眼部疾病的影响,对于进一步阐明这些干预措施的疗效至关重要。有必要研究在剂量和配方方面选择更合适的益生菌方案。
为了建立肠道菌群与眼部病变缓解之间的因果治疗关系,未来的研究可能考虑将微生物组-免疫-眼部效应与纯粹的微生物组-眼部效应分离开来。
临床试验检查了肠道微生物群和眼部病理之间的联系,显示了这两个系统之间的联系。
通过饮食、益生元和益生菌以及粪菌移植等方式调节肠道微生物群,可能都会成为预防和/或治疗眼部疾病的有效方案。
充分结合肠道菌群检测全面评估患者的菌群健康状况,可以考虑采用更有针对性的干预措施,而不仅仅是粪菌移植和益生菌补充剂。
大规模的随机对照临床试验可能会进一步证明这种联系,并阐明新的靶点治疗机制。
主要参考文献:
Zysset-Burri DC, Morandi S, Herzog EL, Berger LE, Zinkernagel MS. The role of the gut microbiome in eye diseases. Prog Retin Eye Res. 2023 Jan;92:101117. doi: 10.1016/j.preteyeres.2022.101117. Epub 2022 Sep 6. PMID: 36075807.
Napolitano P, Filippelli M, Davinelli S, Bartollino S, dell’Omo R, Costagliola C. Influence of gut microbiota on eye diseases: an overview. Ann Med. 2021 Dec;53(1):750-761. doi: 10.1080/07853890.2021.1925150. PMID: 34042554; PMCID: PMC8168766.
Russell MW, Muste JC, Kuo BL, Wu AK, Singh RP. Clinical trials targeting the gut-microbiome to effect ocular health: a systematic review. Eye (Lond). 2023 Mar 14. doi: 10.1038/s41433-023-02462-7. Epub ahead of print. PMID: 36918627.
Shivaji S. A systematic review of gut microbiome and ocular inflammatory diseases: Are they associated? Indian J Ophthalmol. 2021 Mar;69(3):535-542. doi: 10.4103/ijo.IJO_1362_20. PMID: 33595467; PMCID: PMC7942081.
Bai X, Xu Q, Zhang W, Wang C. The Gut-Eye Axis: Correlation Between the Gut Microbiota and Autoimmune Dry Eye in Individuals With Sjögren Syndrome. Eye Contact Lens. 2023 Jan 1;49(1):1-7. doi: 10.1097/ICL.0000000000000953. Epub 2022 Nov 11. PMID: 36544282.
Scuderi G, Troiani E, Minnella AM. Gut Microbiome in Retina Health: The Crucial Role of the Gut-Retina Axis. Front Microbiol. 2022 Jan 14;12:726792. doi: 10.3389/fmicb.2021.726792. PMID: 35095780; PMCID: PMC8795667.