-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

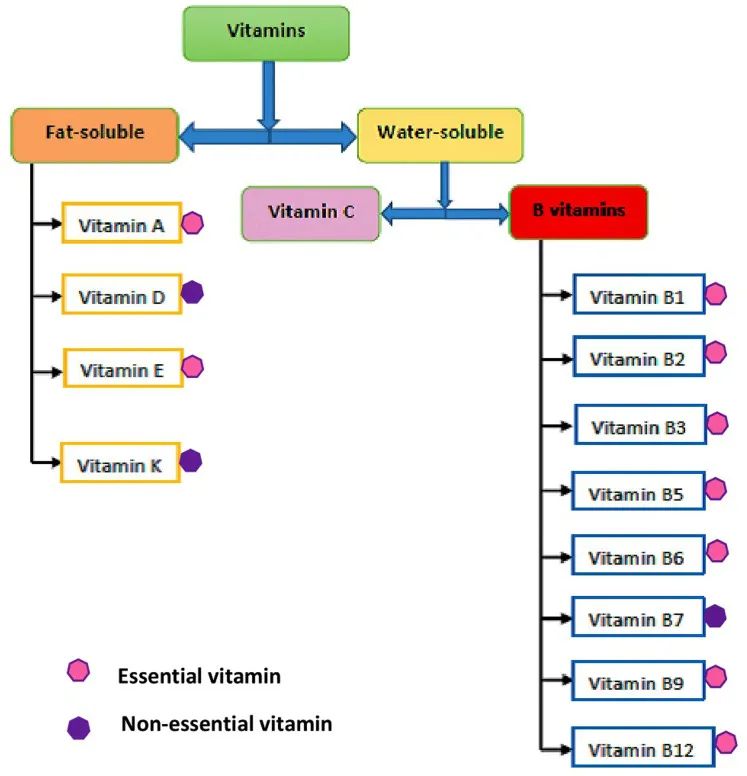
传染病,肠道微生物,营养
传染病和感染目前是许多地区尤其是低收入国家主要死亡原因,也是婴儿和老年人等弱势群体的主要风险。免疫系统在这些感染的易感性、持续性和清除中起着至关重要的作用。由于 70-80% 的免疫细胞存在于肠道中,肠道微生物群、肠上皮层和局部黏膜免疫系统之间存在着错综复杂的相互作用。除了肠道中的局部黏膜免疫反应外,目前越来越多的证据证实:肠道微生物组也会影响全身免疫。
临床医生未来可能会更多地利用关于免疫系统、肠道微生物组和人类病原体之间复杂相互作用的更多知识。现在公认的营养对肠道微生物群组成和免疫系统的影响阐明了营养在改善健康方面可以发挥的作用。
本文将综合介绍维持微生物群、肠道健康、局部免疫反应和全身免疫之间复杂平衡的机制,并将其与一生中的传染病联系起来,并讨论营养在传染病预防和治疗中的影响。

由于卫生条件的改善、疫苗接种和抗生素的使用,传染病的发病率在过去几十年中显着降低。然而,仍有近三分之一的死亡仍与传染病有关,尤其像新冠病毒这样的传播。
此外,感染仍然对婴儿和老年人等弱势群体构成重大风险。上呼吸道感染是医疗保健中的最常见疾病,在老年人中,流感和肺炎仍然是常见的死亡原因 。
世界卫生组织指出,传染性肠道疾病是导致死亡的主要原因之一,根据 2015 年全球疾病负担、伤害和风险因素研究,感染性腹泻是全球主要的死亡原因,尤其是5岁以下儿童。
病原体需要克服三个主要障碍,才能在胃肠道中引起感染:
本小节主要介绍前两个:肠道微生物群和肠上皮层。
肠道微生物群由多物种微生物群组成,由细菌、真菌和病毒组成,它们生活在与宿主协同作用的特定生态位中。肠道微生物和哺乳动物共同进化,因此在微生物获得栖息地繁衍的同时,微生物调节宿主的各种生理功能,包括调节对病原体的保护性免疫。
肠道微生物群的组成受许多因素影响,例如遗传、性别、年龄、社会经济因素、营养、压力、疾病和环境因素(污染物、抗生素等)。
扰乱微生物群落结构和功能的因素,如抗生素的使用,为机会性病原体提供了定殖、生长和持续存在的空间。有几种机制可以确保微生物群防止定植、过度生长、病原体引起的损害以及随后的宿主感染。
定 殖 抗 性
一种机制被称为定殖抗性,其中共生微生物群和入侵微生物在营养或功能空间方面竞争资源可用性或生态位机会。
群 体 感 应
为了允许这种竞争,细菌细胞使用细菌复制过程中积累的信号分子不断地感知环境,从而监测种群密度并相应地调整它们的基因表达,这种机制称为群体感应。
化学信号导致细菌的表型变化,这些变化与粘附、运动和肠道密度或保护性化合物的排泄有关。
群体感应机制被共生体用来确保肠道内稳态,但也被病原体用来最小化宿主免疫反应并增加致病性。可能由饮食、压力、抗生素和药物治疗引起的微生物群落结构或非有益微生物群组成的改变会改变微生物群与宿主之间的整体动态,从而导致低度炎症、降低定植抗性和改变感染易感性。
肠道菌群会影响各种炎症和传染病
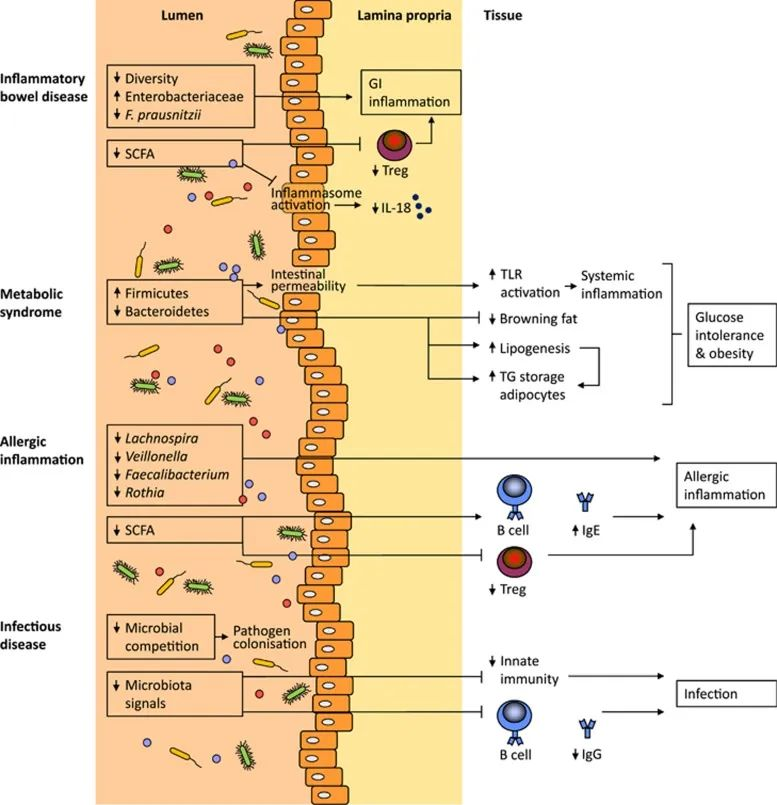
van den Elsen LW et al., Clin Transl Immunology. 2017
除了肠道微生物群,肠道上皮屏障在保护宿主免受病原体感染方面起着至关重要的作用 。
这种将肠道中的共生细菌与下层组织分开的物理屏障是通过紧密连接的蛋白质复合物连接的单层细胞。紧密连接复合物的组装是一个动态过程,某些细菌会通过释放毒素来破坏该过程。
此外,上皮细胞层由一层粘液加强。这种上皮屏障的粘液“衬里”是肠道上皮细胞抵抗细菌入侵的首要防御机制之一,通过防止管腔和粘膜微生物直接与上皮细胞相互作用。
微生物群和抵御感染威胁的肠道屏障
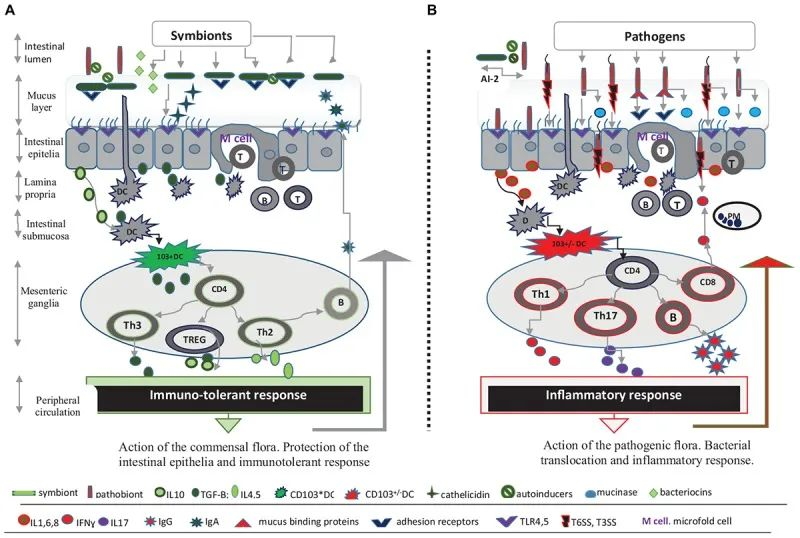
Iacob S, et al., 2019, Front Microbiol.
除了作为生物物理屏障的功能外,粘液还充当宿主产生的抗菌分子(如分泌型 IgA 和防御素)的储存库 。粘液的产生和降解是通过宿主和微生物之间复杂的相互作用来控制的,这种相互作用通过宿主对微生物相关分子模式 (MAMP) 和细菌代谢物的识别来调节,因此容易受到原生微生物群组成变化的影响 。
粘液和微生物之间存在相互关系,宿主炎症状态的变化和微生物群组成的变化都可能导致粘液产生和组成的改变,从而导致感染易感性增加。
短链脂肪酸在抗感染防御中的作用
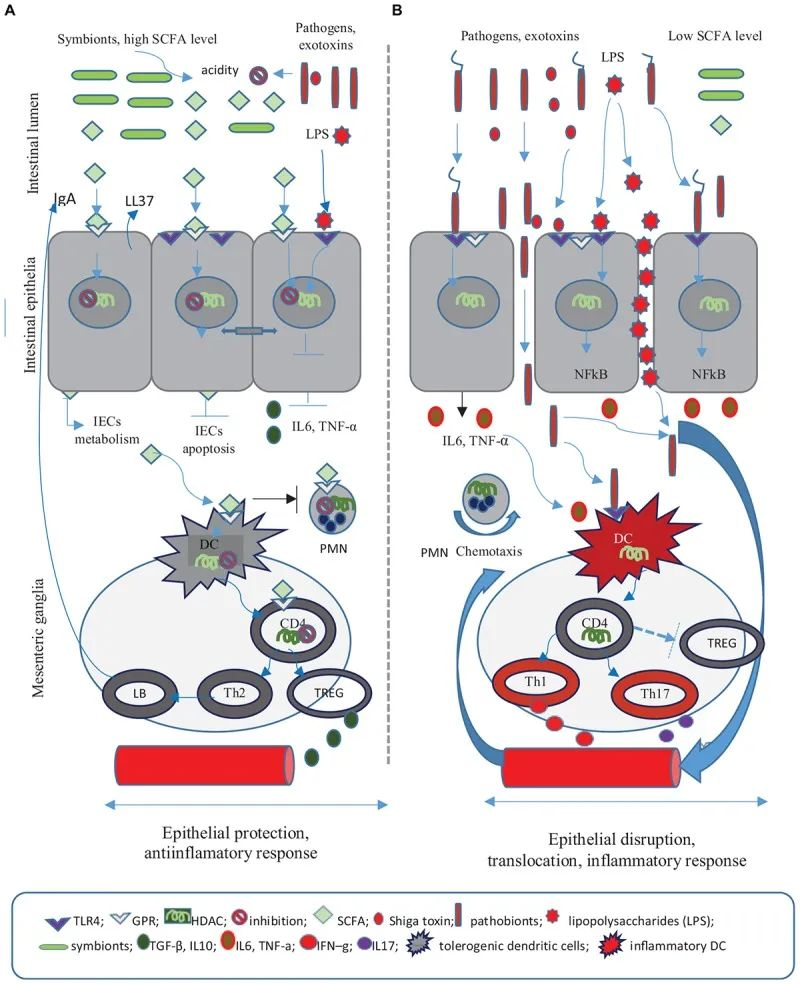
Iacob S, et al., 2019, Front Microbiol.
肠道微生物组成的炎症相关改变导致上皮屏障破坏,使细菌脂多糖能够全身循环。这些代谢变化会导致葡萄糖不耐受和肥胖。
过敏性炎症与特定细菌属的丰度较低有关。耗尽肠道微生物群已被证明会增加 IgE 的产生,这与 Treg 反应减少一起会导致过敏性炎症。
耗尽肠道微生物群会导致肠腔内缺乏微生物竞争已被证明会增加 IgE 的产生,这与 Treg 反应减少一起会导致过敏性炎症。
肠腔内缺乏微生物竞争会导致艰难梭菌定植。
最后,缺乏微生物信号也会降低对微生物的先天免疫和适应性免疫反应,使宿主更容易受到感染。
肠道微生物群和肠道上皮细胞之间的持续相互作用导致持续的免疫信号传导。在共生细菌和入侵病原体存在的情况下,这种免疫反应的调节以及上皮屏障的完整性和通透性对于维持肠道稳态至关重要。如果这个过程受损,可能会导致炎症和感染。
免疫反应在感染的易感性、持续性和清除率中起着至关重要的作用。
免疫系统由两部分组成:
先天免疫系统 通过多种防御机制提供非特异性保护,包括:
适应性免疫系统的细胞,T 和 B 淋巴细胞,识别并响应特定的外来抗原。T 细胞识别已进入宿主细胞的感染因子。这种类型的适应性免疫依赖于细胞的直接参与,因此被称为细胞免疫。
此外,T 细胞在调节 B 细胞功能方面发挥重要作用,B 细胞分泌识别特定抗原的抗体和蛋白质。因为抗体通过体液(即体液)循环,所以由 B 细胞诱导的保护称为体液免疫。
免疫系统的发育和免疫反应的功效与肠道微生物群的发育和组成密切相关
这方面的证据来自比较年龄和性别匹配的没有肠道微生物群的无菌饲养小鼠、相同品系的常规饲养动物和具有特定微生物群的无菌小鼠,即所谓的无菌小鼠。特别是,使用无菌小鼠提高了我们对单一细菌菌株、菌株联合体、特定微生物表达基因和微生物产生的代谢物对肠道稳态以及局部和全身免疫的影响的理解。
这些研究的见解强调,先天免疫在首次识别和响应微生物衍生产物中起着关键作用。
肠道中的先天免疫始于直接暴露于肠腔内容物和微生物产物的单层肠上皮细胞 (IEC)。宿主和微生物之间的关键平衡通过模式识别受体 (PRR) 识别微生物得到安全保护。
PRRs 构成了一个大家族的细胞外和细胞内受体,可识别特定的微生物相关分子模式 (MAMP)。PRR 包括 TLR、C 型凝集素受体 (CLR)、核苷酸结合寡聚结构域 (NOD) 样受体 (NLR) 以及 DNA 和 RNA 的胞质传感器。
MyD88 是 PRR 信号传导下游的重要衔接分子,将 PRR 激活与转录因子 NF-ĸB 的激活联系起来,后者是炎症的主要调节因子。因此,MyD88 的缺乏会导致免疫反应受损和对感染的易感性增加。
然而,PRRs的不当激活可能导致过度的免疫反应,甚至导致炎症性疾病和自身免疫;因此,PRR 反应通过正负反馈回路和交叉调节受到严格调节。
此外,IEC 分泌抗菌肽 (AMP),这是一种具有杀菌、抗炎和抗内毒素特性的先天免疫效应分子。
AMP是先天免疫防御的重要组成部分,可限制病原体与上皮的相互作用。它们的表达可以被某些病原体下调,并因特定微生物的存在而增强,因此,微生物群的组成是形成先天免疫反应的关键。
免疫系统的发育和免疫反应的功效与肠道微生物群代谢产物密切相关
微生物群控制免疫反应的另一种机制是通过肠道微生物群从饮食成分、宿主产物或其他微生物代谢物产生的代谢物的形成。
种类繁多的微生物代谢产物介导了共生细菌的许多保护功能。
具有免疫保护能力的代谢产物包括:
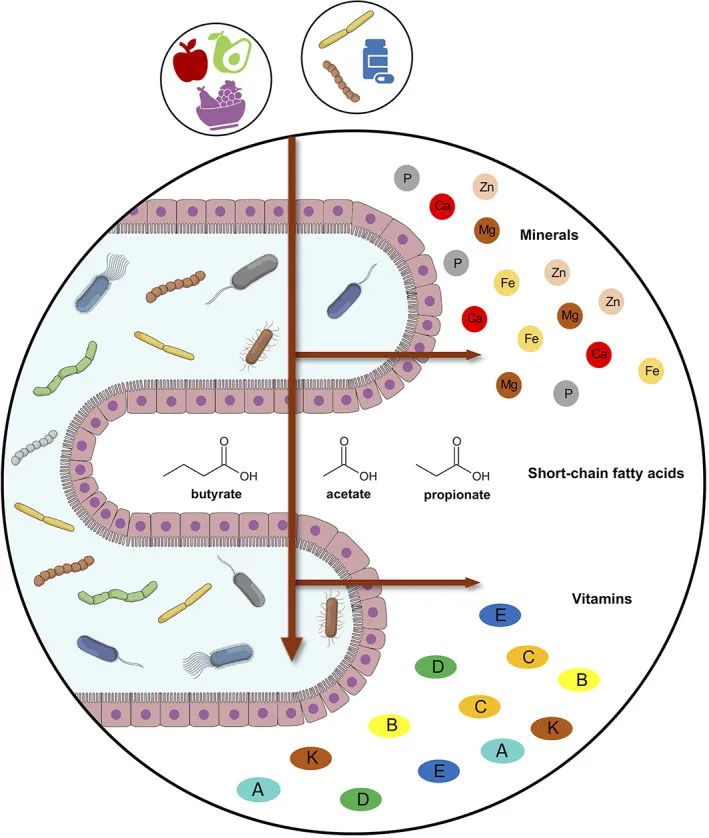
短链脂肪酸、色氨酸代谢物、胆汁酸衍生物等。
➭ 短链脂肪酸
短链脂肪酸通过特殊的肠上皮细胞增强抗菌肽和粘液的产生,并刺激结肠调节性 T 细胞的成熟和扩增,从而抑制对微生物群的局部炎症反应。
短链脂肪酸通过调节上皮屏障来支持结肠内的肠道稳态,并通过诱导这些细胞的增殖和分化来支持肠道细胞的修复 。
短链脂肪酸在先天淋巴细胞 (ILC3) 的增殖中很重要,ILC3 会释放 IL22,这对上皮细胞诱导抗菌分子很重要。
➭ 色氨酸代谢物
色氨酸代谢物,尤其是吲哚类来源于膳食色氨酸的共生发酵,并作为芳烃受体 (AhR) 的配体发挥作用,这是一种对维持肠道稳态很重要的受体,这些代谢物的丢失与炎症性肠病的发生有关疾病。
➭ 胆汁酸衍生物
胆汁酸衍生物通过激活法尼醇 X 受体 (FXR) 和 G 蛋白偶联胆汁酸受体 (TGR5) 来支持肠道稳态并影响大量宿主功能。胆汁酸衍生物是通过特定细菌门表达的细菌胆汁盐水解酶 (BSH) 的作用从胆汁酸代谢而来的,而 BSH 基因丰度的丧失与炎症性肠病的发生有关。
以上表明肠道中的粘膜稳态是肠道微生物群、微生物代谢物和宿主因素之间的微妙平衡。这种持续的相互作用导致严格调节的生理低度炎症状态,维持最佳的宿主防御,从而影响对感染的易感性。
人们越来越认识到,肠道微生物群除了调节局部粘膜免疫系统外,还通过多种机制影响先天性和适应性细胞介导的全身免疫反应。
▸肠道菌群释放微生物可溶性产物,影响外周免疫细胞的激活
一种机制涉及释放微生物可溶性产物,这些产物转移到循环中并影响外周免疫细胞的激活。事实上,肠道远端器官中的常驻免疫细胞可以直接感知循环微生物衍生因子,而微生物群衍生信号分子的缺失会导致免疫功能发生改变,从而导致对全身感染的易感性。
▸肠道菌群对适应性免疫系统(T细胞)的影响
目前,肠道微生物组影响全身免疫反应的最佳表征机制可能是其对适应性免疫系统的 T 细胞室的影响。已经表明,胃肠道微生物群可以影响 T 细胞群分化为 Th1、Th2 和 Th17 细胞或具有调节表型的 T 细胞。
具体而言,丁酸盐作为一种短链脂肪酸可促进外周部位诱导的调节性 T 细胞的这种分化,并且以这种方式能够抑制全身炎症的发展。短链脂肪酸还能够重新编程细胞的代谢活动,从而诱导调节性 B 细胞,并通过戊酸抑制 Th17 细胞的产生,这可能与炎症性肠病和自身免疫性疾病有关。
此外,微生物群来源的 ATP 可以诱导 Th17 细胞的扩增,色氨酸分解产物可以导致上皮内 CD4 + CD8αα + T 细胞的增加,而细菌来源的多糖可以引发调节性 T 细胞。通过其诱导调节群体的能力,微生物组可以支持抑制炎症反应。
▸宿主-病原体相互作用的研究:
结果表明,记忆 T 细胞的共生激活及其向发炎部位的运输,对于防止细菌病原体感染是必要的。
此外,通过共生菌主动控制 IL10 介导的抗炎反应对于防止感染性损伤很重要。这种效应可以使用特定的 toll 样受体 (TLR) 激动剂来重现,这会减少 IL10 的产生,通过增加细菌清除率使小鼠对感染具有更强的抵抗力,并使适当的炎症反应成为可能 。
▸细菌在造血过程中影响调节免疫系统
微生物群释放的信号分子进入循环的能力,也使肠道中的常驻细菌在造血过程中影响免疫细胞发育,调节免疫系统,从而影响对感染的反应。
事实上,短链脂肪酸丁酸盐被证明可以促进骨髓单核细胞从炎症表型分化为更具耐受性的表型。
骨髓细胞也表达多种 PRR(受体),并且对循环中的 MAMP 敏感,其影响由 PRR 表达和 MAMP 可用性决定。例如,在造血干细胞和祖细胞 (HSPCs) 上激活 CLR dectin-1 会导致诱导已经对单核细胞和巨噬细胞进行过训练的免疫。相反,在 HSPCs 上激活 TLR2 会产生具有高抗原呈递共刺激能力的耐受巨噬细胞 。已显示通过 AhR 配体激活 HSPC 可导致产生能够免疫抑制的髓源性抑制细胞。
▸肠道微生物群衍生的信号调节先天免疫防御
除了影响 T 细胞发育和功能外,肠道微生物群衍生的信号被证明还可以通过脾脏中的淋巴刺激、中性粒细胞迁移和功能的调节、巨噬细胞的诱导和活化以及调节自然杀伤 (NK) 细胞的功能来调节先天免疫防御。
▸特定菌群降低皮质酮水平,从而调节炎症反应
最近,研究表明,特定的细菌种类还通过降低血浆皮质酮(肾上腺分泌的皮质醇激素控制炎症“关闭”过程。皮质醇也是身体的减压激素,这个我们下次单独讲)水平来调节炎症反应,这是一种抗炎类固醇,在控制对粘膜损伤的炎症反应中很重要。
综上所述,很明显,肠道微生物群的失调会导致诱导适当的局部和全身免疫反应的能力降低,从而导致局部炎症性疾病,但也会导致远端疾病。
一个远端部位是气道,这两个部位之间的这种特定的直接关系被称为:肠-肺轴。
▸肠道菌群影响肺部:哮喘、过敏性气道疾病、呼吸道感染等,益生菌可改善
事实上,在动物和人类研究中,已经表明抗生素引起的肠道微生物群改变可能与特应性表现、过敏性气道疾病和患哮喘的风险增加有关。
除了影响过敏性气道疾病的发展,已经表明肠道微生物群在防止细菌和病毒呼吸道感染方面发挥着至关重要的作用,因为肠道微生物群直接控制先天性和适应性免疫反应。
事实上,多项人体临床试验表明,使用益生菌可降低呼吸道感染的发生率并改善其健康结果。
▸肠道菌群影响肺部:通过粘膜免疫系统
肠道事件影响肺部疾病的另一种机制是通过常见的粘膜免疫系统,其中在肠道中引发的抗原特异性 B 细胞可以通过胸导管迁移到远端有效部位。
在肠-肺微生物群研究中,确定肠道微生物群变化是疾病的原因还是结果是具有挑战性的。此外,还需要进行纵向研究,以更好地了解肠道微生物群对已确诊肺部疾病的严重程度和病程的影响。
在人群中可以看到,年幼的婴儿和老年人特别容易受到感染。这两个人群的共同点是,在这两个人群中,免疫系统都没有发挥最佳功能。接下来的两个章节,主要介绍婴儿和老年人的免疫系统与肠道菌群的关联。
▸婴儿的免疫系统在出生时受到了极大的抑制,母体抗体提供保护
婴儿的免疫系统在出生时并没有完全发挥作用,这意味着他们的先天和适应性免疫反应都受到了极大的抑制。子宫内环境要求胎儿的免疫系统主动下调并耐受来自母亲的抗原,以避免可能导致终止妊娠的免疫反应。
然而,出生后,暴露于环境抗原,其中许多来自肠道微生物群,需要快速改变免疫反应,以保护婴儿免受病原体入侵。
在生命的最初几个月,母体 IgG 抗体提供了对许多感染的保护,该抗体从母亲转移到婴儿身上;然而,当这些抗体水平下降时,婴儿变得更容易受到感染。
幸运的是,先天免疫细胞提供了抵御入侵病原体的早期第一道防线,在胎儿期就已经发育成熟。但是,这种情况发生在不同的时期,与生命后期相比,新生儿先天免疫所有成分的功能仍然较弱。在抗原暴露的驱动下,适应性免疫系统也在生命的最初几个月迅速发展,从而导致免疫记忆的发展。
▸微生物群和免疫系统密切相关,婴儿的感染率增加也可能与微生物组的变化有关
婴儿最初可能会在子宫内接触细菌,出生后会迅速出现肠道定植。定植模式受以下因素的影响:
有人提出,生命的前 24 个月是建立微生物组的关键发育窗口,甚至可能决定整个生命过程中肠道微生物群的组。由于部分免疫系统发育或成熟需要某些细菌,这两个过程密不可分。
实际上,需要共生微生物来训练免疫系统以区分成为耐受抗原的共生细菌和致病细菌。有缺陷的免疫耐受会加剧自身免疫和炎症性疾病,例如过敏。研究表明,特应性儿童和健康儿童的肠道微生物群组成不同,细菌多样性降低和生态失调与特应性疾病的发展有关。
在年龄范围的另一端,免疫系统也处于次优状态。这种以先天免疫和适应性免疫逐渐下降为特征的免疫系统生物老化是不可逆转的,被称为“免疫衰老”。
▸与年龄相关的免疫系统变化
树突状细胞 (DC) 信号通路中与年龄相关的变化已被证明会影响其功能,从而导致响应病原体的细胞因子分泌模式发生改变。
此外,这些变化会导致吞噬作用降低和呈递抗原的能力受损,并对树突状细胞的迁移能力产生负面影响。同样,研究表明,来自老年人的循环单核细胞、巨噬细胞和迁移性中性粒细胞显示出吞噬功能受损。
在单核细胞、树突状细胞和中性粒细胞中,TLR的表达和功能随着年龄的增长而下降。此外,TLR 的定位受损可诱导细胞因子产生的变化。一个例外是老年人单核细胞上的 TLR5 表达,与年轻人单核细胞中的 TLR5 表达水平相比,它实际上有所增加,并导致老年人中细胞因子的产生增加。
此外,随着年龄的增长,T 细胞会发生复杂的变化,包括表观遗传和代谢变化,这些变化会影响初始 T 细胞、记忆 T 细胞和效应 T 细胞。
此外,T 细胞受体 (TCR) 库减少,功能不活跃的衰老或衰竭 T 细胞的频率增加。与年龄相关的 T 细胞改变的起源可能在于细胞因子产生的调整,因为细胞因子在介导 T 细胞反应中至关重要。确实已经表明,来自老年人的 T 细胞主要表现出 Th2 样表型。
Th17 与调节性 T 细胞的比例似乎也有所增加,这被认为与老年人对感染的反应降低有关。除了 T 细胞区室的变化之外,老年人的 B 细胞库多样性较少,这可能导致老年人更容易受到感染。
▸免疫系统伴随炎症,共同导致慢病
免疫衰老伴随着一种慢性、无菌、低度炎症。有几种先天免疫系统的激活剂会导致炎症。此类刺激包括持续的病毒和细菌感染、细胞分解产物和错误折叠的蛋白质。免疫衰老和炎症共同导致感染、癌症、自身免疫和慢性疾病的患病率增加,以及老年人对疫苗接种的反应不佳。»»»
▸衰老影响肠道菌群稳态
与婴儿肠道微生物群研究以及微生物群对免疫系统的影响相比,较少数量的研究关注衰老过程中肠道微生物群发生的系统发育和功能变化。
尽管老年人的肠道微生物群存在很大差异,但健康的成人肠道微生物群被认为是相当稳定的,直到衰老过程开始影响微生物群的稳态。由此导致的生物多样性减少,尤其是产生抗炎短链脂肪酸的细菌减少,以及肠道微生物群的稳定性受损,通常与感染易感性增加有关。
此外,与肠道菌群变化和免疫衰老相关的慢性低度炎症有利于病菌的生长,病菌是健康肠道菌群的一小部分,在发炎的环境中,可以超过共生菌的生长并导致感染。
▸设计饮食干预实验时,应考虑免疫状态
最近的证据表明,衰老从根本上改变了营养对免疫功能的影响。因此,对调查饮食对免疫功能影响的研究数据的解释在很大程度上取决于受试者的年龄。
在调查膳食成分的功效时,研究设计至关重要,大多数涉及老年人的研究都包括基于病史、实验室测试的严格纳入/排除标准,一般健康状况,通常还有营养状况。
然而,免疫状态很少被考虑在内,但即使在健康的老年人中也可能存在显着差异。有几个明显的例子表明免疫细胞组成、表型和/或功能与年龄相关的变化可以直接改变干预的结果。
随着全球人口迅速老龄化,老年人的健康将越来越受到关注。由于免疫功能下降,与年轻人相比,老年人被认为发生感染的风险增加,严重程度和死亡率增加。尤其是在老年护理机构中,感染容易在居民中传播,预防感染至关重要。
传统上,传染病专家的重点是识别和治疗个体病原体。最有效的治疗策略之一是使用抗生素。然而,抗生素耐药病原体的增加,突出了对替代策略的需求。
▸抗生素破坏肠道菌群结构和功能,给病原体生长的空间
除了刺激耐抗生素病原体的生长外,抗生素还会破坏微生物群的结构和功能,从而使潜在的病原体能够定殖、生长和持续存在。由于对免疫系统、肠道微生物群和病原体之间的复杂平衡和相互作用的认识不断增加,传染病和临床微生物学领域目前正在发生范式转变,临床医生现在开始关注和拓展诊疗和用药信息,这是一个好消息。
▸肠道菌群与传染病之间关系最突出的例子是:抗生素使用后的艰难梭菌感染
在抗生素治疗期间,抗生素敏感细菌被杀死,导致微生物群的信号减少和对艰难梭菌的免疫反应减弱。
此外,由于没有其他细菌,艰难梭菌使用了更多的可用营养物质,这导致在一系列抗生素清除细菌的部位的定植率增加。抗生素的使用与艰难梭菌之间的密切关系使这种感染成为基于微生物组治疗的热门目标。
▸肠道菌群影响病毒感染
同样,多种肠道病毒,包括轮状病毒、诺如病毒(在我们的临床菌群检测报告中也会判别这两种病毒)和脊髓灰质炎病毒,已被证明利用细菌微生物组进行免疫逃避,支持进入肠道并在肠道中复制,从而增加感染率。
使用上述全身免疫机制,肠道微生物组已被证明具有影响全身病毒感染的潜力。例如,微生物群衍生的短链脂肪酸已被描述为通过改变 T 细胞的反应而对流感感染具有保护作用。此外,已证明 HIV 患者肠道内乳酸杆菌目的丰度较高与病毒载量呈负相关,这表明微生物群可以直接或间接地调节 HIV 感染的病理学。
▸ 肠道菌群也可能影响疫苗反应和药物代谢
这是目前有一个非常有意义的领域;然而,这可能也是药物或疫苗特异性的。
在 2017 年一项调查益生元和益生菌对疫苗免疫原性和有效性影响的随机对照试验 (RCT) 的系统评价和荟萃分析中,比较了 13 项使用益生菌的试验和 6 项使用益生元的试验。
然而,应该谨慎解释这项荟萃分析的总体结果,因为它结合了使用不同益生元和益生菌菌株后疫苗反应的数据。查看个别研究中的效果,有时显示没有效果,有时显示干预的积极效果,强调结果高度依赖于干预。
众所周知,营养对肠道微生物群的组成和免疫系统有很大影响,因此可以在健康和疾病的发展中发挥重要作用。
例如,西方饮食通过诱导骨髓祖细胞的表观遗传和转录重编程与炎症反应增强有关,从而直接影响几种非传染性疾病的发展。
增加对肠道微生物群、宿主反应和其他微生物之间关系的理解甚至进一步提供了调节这个三元组的机会。
例如通过营养来帮助维持肠道稳态和抗感染性。应该考虑到不同的膳食成分,如矿物质、碳水化合物、维生素、脂质和蛋白质,都具有特定的特性,它们以不同的方式直接或间接地通过微生物组影响宿主与病原体之间的相互作用。在这些营养素之间建立机制联系,为影响健康提供了多种机会。
饮食干预——
“操纵宿主-微生物轴的宝贵工具”,以帮助维持肠道稳态和感染抵抗力
碳水化合物、脂质、蛋白质、植物化学物质、矿物质和维生素等膳食成分都具有独特的结构和化学(物理化学)特性,可通过微生物组直接或间接影响宿主病原体抵抗力。弥合饮食、宿主和微生物组之间的差距,因为它们与免疫和抗病性有关,是一个多方面的领域,需要了解它们对肠道稳态的综合影响。
饮食促成了微生物群、宿主和病原体之间相互交织的机制的黑匣子
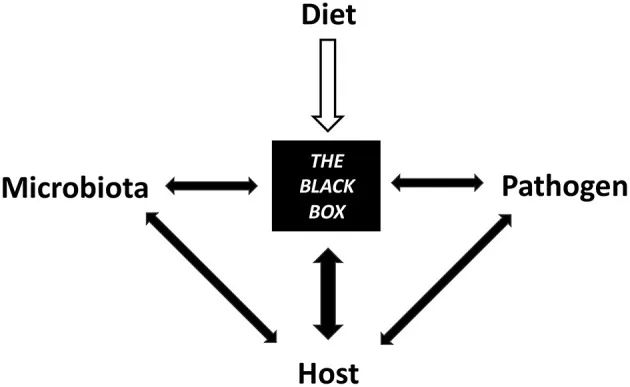
因此,饮食干预应被视为调节传染病风险、防止病原微生物入侵、减轻感染严重程度和支持传染病治疗的宝贵工具;然而,需要在这个迅速兴起的领域进行进一步的研究。
已知有多种营养化合物会对宿主微生物组和免疫系统产生影响,但膳食纤维、益生元和益生菌受到了很多关注。
★ 益生元
益生元是一种不易消化的食物成分,通过选择性地刺激结肠中一种或有限数量的细菌的生长和/或活性来对宿主产生有益的影响。这意味着并非所有的膳食纤维都是益生元,除非有证据表明该纤维被宿主有机体选择性地利用,从而对健康有益。
典型的益生元是人乳低聚糖 (HMO)、菊粉和低聚果糖,以及低聚半乳糖。
★ 膳食纤维
膳食纤维不是典型的益生元,但具有益生元特性,例如,β-葡聚糖、阿拉伯木聚糖 (AX)、果胶和抗性淀粉。益生元和特定的膳食纤维通过充当发酵底物来促进肠道中有益细菌的生长,同时通过排除生态位来抑制病原体的生长。
主要的发酵产物是短链脂肪酸,它们对免疫系统有重大影响,如上所述,因此可以抑制传染病的发展。除了短链脂肪酸,正如 Asadpoor 等人最近审查的那样,益生元和膳食纤维还可以通过排除和抗菌活性直接预防胃肠道感染。
★ 益生元和膳食纤维
益生元和膳食纤维与上皮细胞和免疫细胞的直接相互作用也有助于预防感染。已证明 DFs,如 β-葡聚糖和 AX 可激活 CLR dectin-1,这是一种参与训练免疫诱导的重要受体,可增加对继发感染的免疫反应。
HMO、AX 和果胶还与 TLR 相互作用,从而提高 DC (树突细胞)的功效,通过肠上皮细胞诱导产生耐受性树突系报告,并保护胃肠道免受过度的 TLR 信号传导,但也支持在胃肠道感染后消退炎症。
★ 益生菌
益生菌是活细菌,当以足够的量给药时,可为宿主提供健康益处。使用益生菌的基本原理主要是基于它们改变肠道微生物群的能力,支持共生细菌的生长超过病原菌的生长。
▸ 益生菌通过与病原体竞争营养和功能资源以及产生抗菌物质来塑造微生物群
许多研究调查了益生菌在预防和治疗传染病中的潜在作用;然而,并非所有数据都一致。
✔ 积极作用
在一项关于益生菌在急性腹泻中的疗效的 Cochrane 系统评价中,作者得出结论,益生菌通过缩短急性感染性腹泻的持续时间和减少平均排便频率具有明显的积极作用。
关于呼吸道感染,研究表明,使用益生菌的儿童在出生后第一年的呼吸道感染复发率较低,肺炎和严重急性下呼吸道感染的发生率也有所降低。
○ 单种益生菌未发现积极作用,联合治疗产生效果
一些研究并未发现对下呼吸道感染发病率的影响。例如,一项研究发现接受鼠李糖乳杆菌GG (LGG) 组和对照组之间的中耳炎 (OM) 发生率没有差异。
然而,另一项针对72名婴儿的试验表明,与对照组相比,接受LGG和乳酸双歧杆菌联合治疗的儿童发生OM的几率显著降低。
▸为什么会出现不同的结果?
数据的异质性,主要是由于菌株、剂量、研究环境和测量结果的变化,限制了广泛使用益生菌预防感染的循证建议。
对营养成分(例如益生菌)的影响产生矛盾结果的原因之一,可能是调查营养影响的临床研究通常与调查药物化合物影响的研究类似。这种类似药物的方法可能不适合识别个体对饮食治疗的反应,与药物化合物的靶向作用相比,这可能是多因素的。
如果不报告个体对营养干预的反应,可能会错过对于更好地了解营养、微生物组和宿主之间的相互作用至关重要的信息,而这些信息对于设计个性化的营养方法是必需的。
▸ 有没有什么方法可以深入了解特定营养素对个体特定健康结果的影响?
网络分析、系统生物学和基于机器的学习技术可以整合基于预先存在的大型队列数据集的多个特征(通过多年的积累和持续迭代,谷禾健康已经构建了超过60万例肠道样本数据),可以深入了解特定营养素对个体特定健康结果的影响。
例如,提出了一种机器学习算法来预测对现实生活中膳食摄入反应。然而,由于个人的整体健康结果取决于许多过程和反应,未来还需要调查血液、血糖反应以获得个人健康状况的更多整体情况。
▸ 为什么不同人对营养化合物的反应不同?
个体对营养化合物的反应受个体遗传特征的影响。例如,炎症基因(如 IL1B、IL6 和 TNFA)中的单核苷酸多态性 (SNP) 会导致不同的炎症反应,这可以解释观察到的对营养化合物的反应性差异的部分原因。
还有越来越多的证据表明,个体的遗传特征对于使肠道内的有益细菌定植至关重要,这会影响免疫系统、宿主的整体健康和传染病。
★ 合生元
除了分别使用益生元和益生菌外,还有一些营养概念将益生元和益生菌组合成混合物:合生元。考虑到上述临床研究的局限性,合生元已显示出部分临床上的成功,未来可能有望成为治疗选择之一。
这一点在最近在印度农村进行的一项随机、双盲、安慰剂对照试验中得到印证,该试验显示,在接受为期 7 天的合生元概念干预的新生儿中,败血症和随后的死亡显着减少。
注:败血症是发展中国家新生儿发病率和死亡率的主要原因,这一概念对促进全球儿童健康很有希望。
随着我们更多地了解肠道微生物群影响局部、先天和全身免疫的复杂机制,以及科学家,企业和临床医生开始利用这些信息来开发针对这些过程的方法,以支持改进预防和治疗策略为最终目标的传染性疾病。
目前对抗这些传染原的策略包括疫苗、小分子药物、提高卫生标准和针对特定疾病的干预措施的组合。虽然这些方法有助于大幅降低与感染相关的死亡发生率和人数,但仍需要继续投资于当前战略并开发新的治疗方法,以应对这些全球健康威胁。
这种干预策略应考虑到个体之间微生物组和免疫反应的显着差异,因此需要个性化的方法。饮食干预能够引起微生物组功能和下游免疫反应的快速变化,这一事实可用于开发量身定制的营养概念,从而影响传染病的发展和治疗成功。主要参考文献:
Wiertsema SP, van Bergenhenegouwen J, Garssen J, Knippels LMJ. The Interplay between the Gut Microbiome and the Immune System in the Context of Infectious Diseases throughout Life and the Role of Nutrition in Optimizing Treatment Strategies. Nutrients. 2021 Mar 9;13(3):886.
van den Elsen LW, Poyntz HC, Weyrich LS, Young W, Forbes-Blom EE. Embracing the gut microbiota: the new frontier for inflammatory and infectious diseases. Clin Transl Immunology. 2017 Jan 20;6(1):e125.
Van den Elsen L.W., Poyntz H.C., Weyrich L.S., Young W., Forbes-Blom E.E. Embracing the gut microbiota: The new frontier for inflammatory and infectious diseases. Clin. Transl. Immunol. 2017;6:e125.
Iacob S, Iacob DG, Luminos LM. Intestinal Microbiota as a Host Defense Mechanism to Infectious Threats. Front Microbiol. 2019 Jan 23;9:3328. doi: 10.3389/fmicb.2018.03328. PMID: 30761120; PMCID: PMC6362409.
Kirk M.D., Pires S.M., Black R.E., Caipo M., Crump J.A., Devleesschauwer B., Döpfer D., Fazil A., Fischer-Walker C.L., Hald T., et al. World Health Organization Estimates of the Global and Regional Disease Burden of 22 Foodborne Bacterial, Protozoal, and Viral Diseases, 2010: A Data Synthesis. PLoS Med. 2015;12:e1001921.
Troeger C., Forouzanfar M., Rao P.C., Khalil I., Brown A., Reiner R.C., Jr., Fullman N., Thompson R.L., Abajobir A., Ahmed M., et al. Estimates of global, regional, and national morbidity, mortality, and aetiologies of diarrhoeal diseases: A systematic analysis for the Global Burden of Disease Study 2015. Lancet Infect. Dis. 2017;17:909–948.
Iacob S., Iacob D.G., Luminos L.M. Intestinal Microbiota as a Host Defense Mechanism to Infectious Threats. Front. Microbiol. 2018;9:3328. doi: 10.3389/fmicb.2018.03328.
Lazar V., Ditu L.-M., Pircalabioru G.G., Gheorghe I., Curutiu C., Holban A.M., Picu A., Petcu L., Chifiriuc M.C. Aspects of Gut Microbiota and Immune System Interactions in Infectious Diseases, Immunopathology, and Cancer. Front. Immunol. 2018;9:1830.
Slack E., Hapfelmeier S., Stecher B., Velykoredko Y., Stoel M., Lawson M.A.E., Geuking M.B., Beutler B., Tedder T.F., Hardt W.-D., et al. Innate and adaptive immunity cooperate flexibly to maintain host-microbiota mutualism. Science. 2009;325:617–620
谷禾健康
✦ ✦ ✦
炎症:就是平时人们所说的“发炎”,是机体对于刺激的一种防御反应。炎症,可以是感染引起的感染性炎症,也可以不是由于感染引起的非感染性炎症。
炎症在在各种症状中起重要作用,如脑雾、焦虑和抑郁、腹胀、各种身体疼痛和低血糖水平。为了更好地理解这是如何工作的,需要了解身体的炎症回路。

谷禾在本文中介绍了炎症的一些症状与原因,炎症回路如何影响人体的健康,并有研究发现肠道微生物在炎症回路中起重要作用,这有助于人们更好地认识炎症以及在炎症时做出正确的应对。
✦ ✦ ✦
从本质上讲,炎症是身体对任何类型的压力做出反应的结果。这意味着这可能是由于身体或心理性质的压力。
举例来说,身体压力的一个例子可能是你跌倒摔断了腿,或者你患上了流感。另一方面,心理压力是你情绪的结果,如你在上班路上与路人发生激烈的争吵。
★ 炎症的症状
炎症是身体一系列变化的结果。这些是在分子和细胞水平上产生的信号,可以改变你的正常生理反应。炎症一般有四个症状:
Dolor – pain (疼痛、悲伤)
引起炎症局部疼痛的因素与多种因素有关。局部炎症病灶内钾离子、氢离子的积聚,尤其是炎症介质诸如前列腺素、5-羟色胺、缓激肽等的刺激是引起疼痛的主要原因。
炎症病灶内渗出物造成组织肿胀,张力增高,压迫神经末梢可引起疼痛,故疏松组织发炎时疼痛相对较轻,而牙髓和骨膜的炎症往往引起剧痛;此外,发炎的器官肿大,使富含感觉神经末梢的被膜张力增加,神经末梢受牵拉而引起疼痛。
Rubor – redness (发红)
由于炎症病灶内充血所致,炎症初期由于动脉性充血,局部氧合血红蛋白增多,故呈鲜红色。随着炎症的发展,血流缓慢、淤血和停滞,局部组织含还原血红蛋白增多,故呈暗红色。
Calor – heat (灼热、发热)
热是由于动脉性充血及代谢增强所致,白细胞产生的白细胞介素Ⅰ(IL-1)、肿瘤坏死因子(TNF)及前列腺素E(PGE)等均可引起发热。
Tumor (肿胀、肿瘤)
主要是由于渗出物,特别是炎性水肿所致。慢性炎症时,组织和细胞的增生也可引起局部肿胀。
•身体对抗病原体产生炎症
当涉及到身体自我修复时,炎症是极其重要的,因为炎症过程允许身体对抗和摆脱任何造成伤害的东西。我们感觉到的症状——发红、肿胀、疼痛和发热——是这个过程的副作用。
当我们的身体开始保护自己免受侵入我们身体的毒素和病原体或身体开始愈合时,炎症就开始了。
•炎症影响内分泌
在这个过程中,毛细血管扩张,而血管壁变得更加多孔。这允许白细胞穿过血管壁,从而到达因感染而造成损害的区域。
这些区域的肿胀和相关疼痛是由于液体积聚,进而对这些区域的神经施加压力,从而导致我们感到疼痛和不适。
分子介质(即抗炎分子)也会引发疼痛,增加您的不适感。在炎症过程中感受到的热量是由于流向身体特定区域的血流量增加所致。
// 小结
一般来说,炎症回路会对您体内的任何情况做出反应,以保持自身健康并以最佳状态工作。这是一种自然的生物反应。然而,当炎症不受控制时,就会出现问题。如果您身体的自然炎症反应没有得到抑制和控制,可能是慢性炎症。
•炎症具有防御作用
在炎症过程中,以血管系统为中心的一系列局部反应限制并消除损伤因子,同时也促进受损组织的愈合。液体的渗出可稀释毒素,吞噬搬运坏死组织以利于再生和修复,使致病因子局限在炎症部位而不蔓延全身。
因此,炎症是以防御为主的天然的局部反应,一般而论,是对机体有利的。可以设想,如果没有炎症反应,细菌感染就无法控制,损伤永远也不能愈合,对机体可以造成严重的危害。
•一些情况下炎症是有害的
但是在有些情况下,炎症又是潜在有害的。炎症反应是一些疾病的发病基础,如严重的超敏反应炎症过于剧烈时可以威胁病人的生命。
此外,特殊部位或器官所发生的炎症可造成严重后果,如脑或脑的炎症可压迫生命中枢,声带炎症阻塞喉部导致窒息,严重的心肌炎可以影响心脏功能,此时,应使用抗炎症药物抑制炎症反应。
如上所述,炎症是身体或心理压力的结果。然而,由心理压力引起的炎症通常比由身体(生理)压力引发的炎症影响要小。炎症是对身体所经历的任何威胁的自动反应。
炎症通常可依病程经过分为两大类:急性炎症和慢性炎症。急性炎症起病急骤,持续时间短,仅几天到一个月,以渗出病变为其特征,炎症细胞浸润以粒细胞为主。
慢性炎症持续时间较长,常数月到数年,常以增生病变为主,其炎症细胞浸润则以巨噬细胞和淋巴细胞为主。
✦急性炎症较容易控制
健康人的急性炎症很容易控制。健康身体在感知到威胁时被激活,然后它与感染作斗争并开始修复任何损坏。然而,一旦威胁过去,身体也会恢复正常,让身体再次正常运作。肾上腺分泌的皮质醇激素控制炎症“关闭”过程。
注:皮质醇也是身体的减压激素。
✦慢性炎症易反复发作,治疗较困难
虽然炎症的典型迹象很容易识别(发热、发红、疼痛和肿胀),但慢性炎症的迹象并不那么容易看到。其中包括:腹胀、食物敏感、焦虑、抑郁、肠漏(肠易激)、头晕等等。
多数可以由急性炎症治疗不及时、不彻底,或治疗效果不佳,造成疾病逐渐发展导致,一般持续时间比较长,多数在6周以上,甚至长达数月或数年。并且慢性炎症的治疗比较困难,而且容易反复发作。
✦持续炎症具有负面影响
通常身体对急性炎症的反应相关的短期疼痛是具有长期益处的。然而,当涉及到低度、持续的炎症时,情况并非如此,这种炎症通常是对心理压力和慢性感染的反应,就像莱姆病或EB病毒一样。
这种情况,身体会经历持续的压力状态,导致炎症回路超时工作,结果是一种不平衡的状态,使你的身体更容易感染不同的疾病,并对与衰老过程相关的影响产生负面影响。
莱姆病是一种以蜱为媒介的螺旋体感染性疾病,是由伯氏疏螺旋体所致的自然疫源性疾病。
EB病毒(Epstein-Barr virus,EBV)是疱疹病毒科嗜淋巴细胞病毒属的成员,基因组为DNA。EB病毒具有在体内外专一性地感染人类及某些灵长类B细胞的生物学特性。人是EB病毒感染的宿主,主要通过唾液传播。无症状感染多发生在幼儿,3~5岁幼儿90%以上曾感染EB病毒,90%以上的成人都有病毒抗体。
这种炎症虽然不明显,但在实际表现出来之前已经存在多年。这种炎症状态存在的时间长度不仅直接影响诊断疾病的严重程度,还直接影响预后。在许多情况下,你身体的炎症回路对某些疾病的反应是某些慢性疾病的原因。
注意
尽管炎症不舒服,但也是必要的,身体的设计方式既可以让我们既可以忍受它又可以控制它。研究表明,即使没有身体迹象,慢性低水平压力也会在体内停留一段时间,并对生理和心理健康产生负面影响。
✦许多疾病都伴有炎症
与特定慢性病相关的炎症是局部的。例如:心脏病患者的动脉有局部炎症,糖尿病患者的胰腺有炎症,阿尔茨海默氏症患者的大脑有炎症。
炎症也可能是环境或我们吃的食物中存在或身体代谢出来某些毒素的结果。在这种情况下,这些毒素会影响身体的不同部位,包括局部和全身。
★ 与炎症相关的疾病
有许多疾病和健康问题都包括炎症的一个方面。其中包括:纤维肌痛、狼疮、哮喘、中风、乳糜泻、自闭症、酸回流、对某些感染(病毒、细菌、真菌)的易感性、癌症、关节炎、皮肤问题,以及糖尿病、慢性疼痛、支气管炎、骨质疏松症等
任何能够引起组织损伤的因素都可成为炎症的原因,即致炎因子。可归纳为以下几类:
生物性因子
细菌、病毒、立克次体、支原体、真菌、螺旋体和寄生虫等为炎症最常见的原因。由生物病原体引起的炎症又称感染。
物理性因子
高温、低温、放射性物质及紫外线等和机械损伤。
化学性因子
外源性化学物质如强酸、强碱及松节油、芥子气等。内源性毒性物质如坏死组织的分解产物及在某些病理条件下堆积于体内的代谢产物如尿素等。
坏死组织
缺血缺氧等原因引起的组织坏死是潜在的致炎因子。
免疫反应
免疫反应所造成的组织损伤最常见于各种类型的超敏反应:I型变态反应如过敏性鼻炎、荨麻疹,II型变态反应如抗基底膜性肾小球肾炎,III型变态反应如免疫复合物沉着所致的肾小球肾炎,IV型变态反应如结核、伤寒等;另外,还有许多自身免疫性疾病如淋巴细胞性甲状腺炎、溃疡性结肠炎等。
✦慢性炎症的原因
慢性炎症的原因相较于急性炎症有所不同,主要是炎症回路变得不平衡。其中包括:
•肠道菌群失调
•环境毒素
•生活方式和饮食不健康
•某些药物,例如导致肠道菌群失调的抗生素
✦慢性压力对炎症有重要影响
慢性压力,无论是心理上的还是生理上的,都会导致肾上腺皮质醇的过量产生,从而导致炎症
注:肾上腺疲劳通常被忽视为炎症回路不平衡的原因。
✦炎症回路会及时对压力做出反应
当身体受到任何类型的“压力”时,炎症回路是关键的反应器之一。当对压力做出反应时,炎症反应与其他身体系统和器官协同工作。最直接影响炎症回路的身体系统包括:免疫系统、肠道(胃肠道)以及微生物组。
Medzhitov R.Science.2021
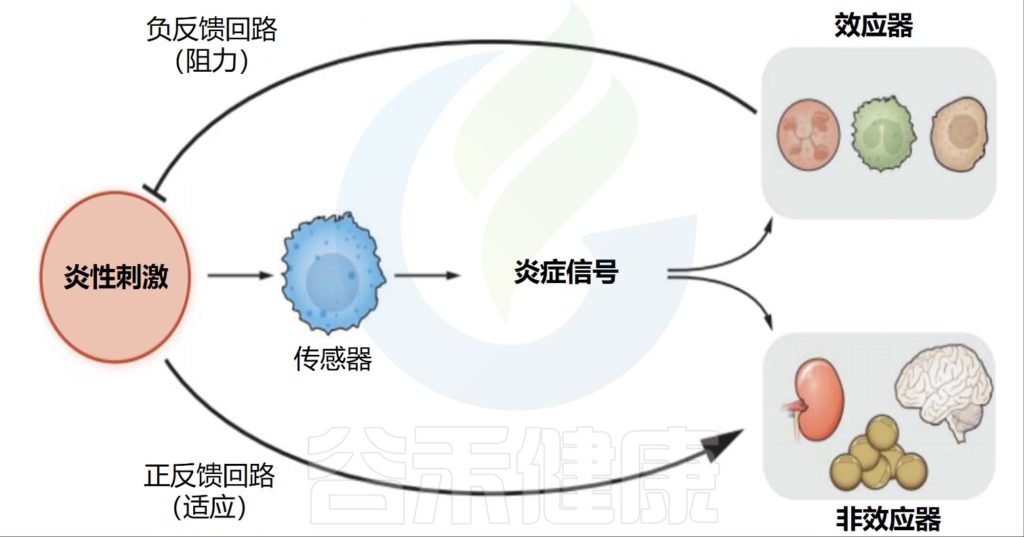
所有炎症反应都包括四个部分。这些信号包括触发反应的炎性刺激、检测它们的传感器、传感器产生的炎症信号以及炎症信号的各种目标。
•负反馈回路直接消除病原体
炎症信号有两种类型的靶点:第一种是效应靶点,它们直接参与了炎症病原体的消除。炎症信号诱导效应细胞的激活、招募和分化。炎症回路的这一部分以负反馈的方式运作。
•正反馈回路调节信号
第二种靶点是不直接参与病原体消除的组织和器官。根据问题是什么(调节、功能或结构的缺失),炎症信号会以与稳态信号相同的“方向”改变这些功能,或者对抗稳态信号。
✦面对病原体激活炎性小体
2023 © Cell Signaling Technology
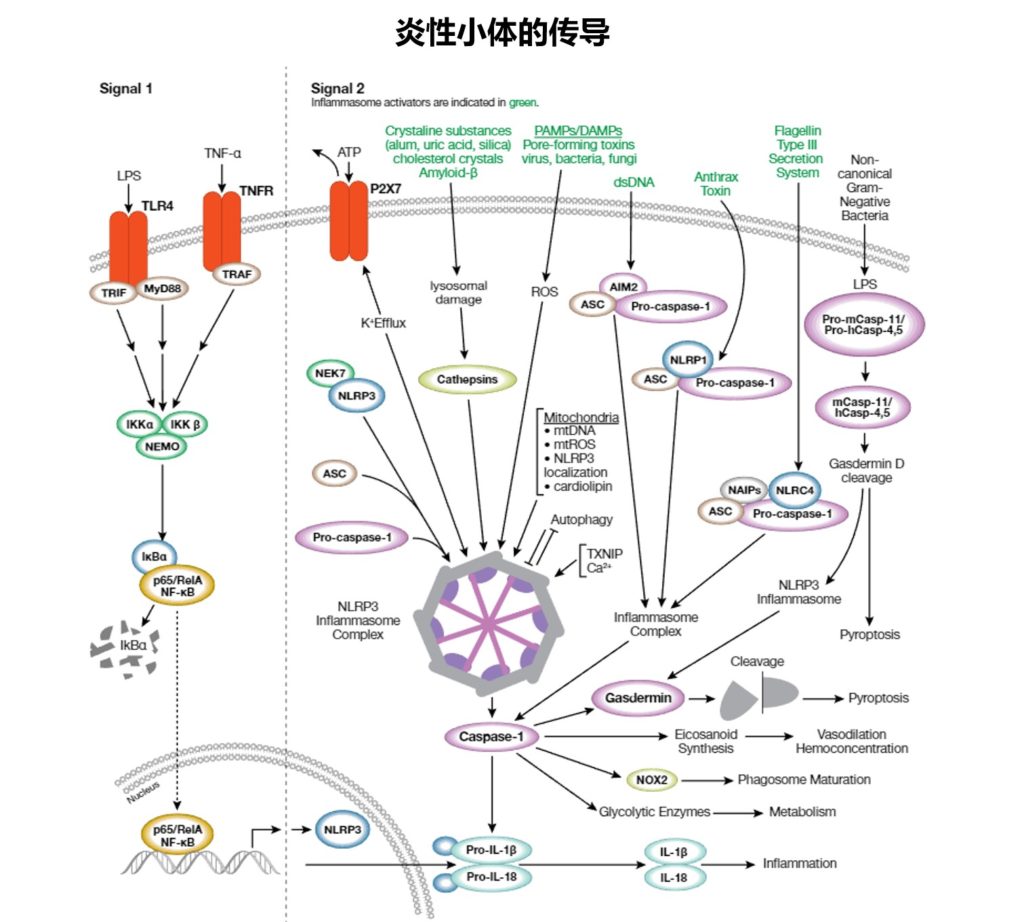
先天性免疫系统是防止病原微生物和宿主源性细胞窘迫信号的第一道防线。这些“危险”信号诱发炎症的一种方式是通过激活炎性体,炎性体是在暴露在病原体相关分子模式 (PAMP) 或危险相关分子模式 (DAMP) 下之后在胞质中组装的多蛋白复合体,并且会激活caspase-1以及后续裂解活化促炎性细胞因子白细胞介素1β和白细胞介素18。
炎性复合体
炎性复合体通常含有胞质模式识别受体(PRR;一种核苷酸结合结构域和亮氨酸富集重复序列 [NLR] 或 AIM2 样受体 [ALR] 家族成员)、接头蛋白 (ASC) 和 pro-caspase-1。
现已检测到许多不同的炎性体复合体,每个复合体有独特的PRR和激活触发物。特征最明显的是NLRP3复合体,它含有 NLRP3、ASC、pro-caspase-1和丝氨酸-苏氨酸激酶NEK7。NLRP3炎性体在2个步骤的过程中被激活。
首先,PAMP或DAMP介导的TLR4或TNFR 激活会诱导 NF-kB 信号转导,导致NLRP3、pro-IL-1β和pro-IL-18表达升高(引导步骤,信号1)。
接下来,大量信号(全病原体、PAMP/DAMP、钾外流、溶酶体损坏的环境因子 [尿酸、硅和明矾]、内源性因子 [淀粉样蛋白 β、胆固醇结晶] 和线粒体损害)会间接激活NLRP3,导致复合体组装和 caspase-1激活(信号2)。
蛋白组分之间的结构域相互作用会形成复合体炎性体结构。其他炎性体通过更直接的方式被激活:双链DNA激活AIM2复合体,炭疽霉素激活NLRP1,细菌flagelllin激活NLRC4。激活的caspase-1会诱导促炎性细胞因子IL-1β和-18的分泌,而且调控代谢酶表达、吞噬体成熟、血管舒张和细胞焦亡(一种炎性程序性细胞死亡)。
炎性体信号转导会导致许多疾病的发作,包括动脉粥样硬化、II型糖尿病、阿尔茨海默病和自身免疫性疾病。
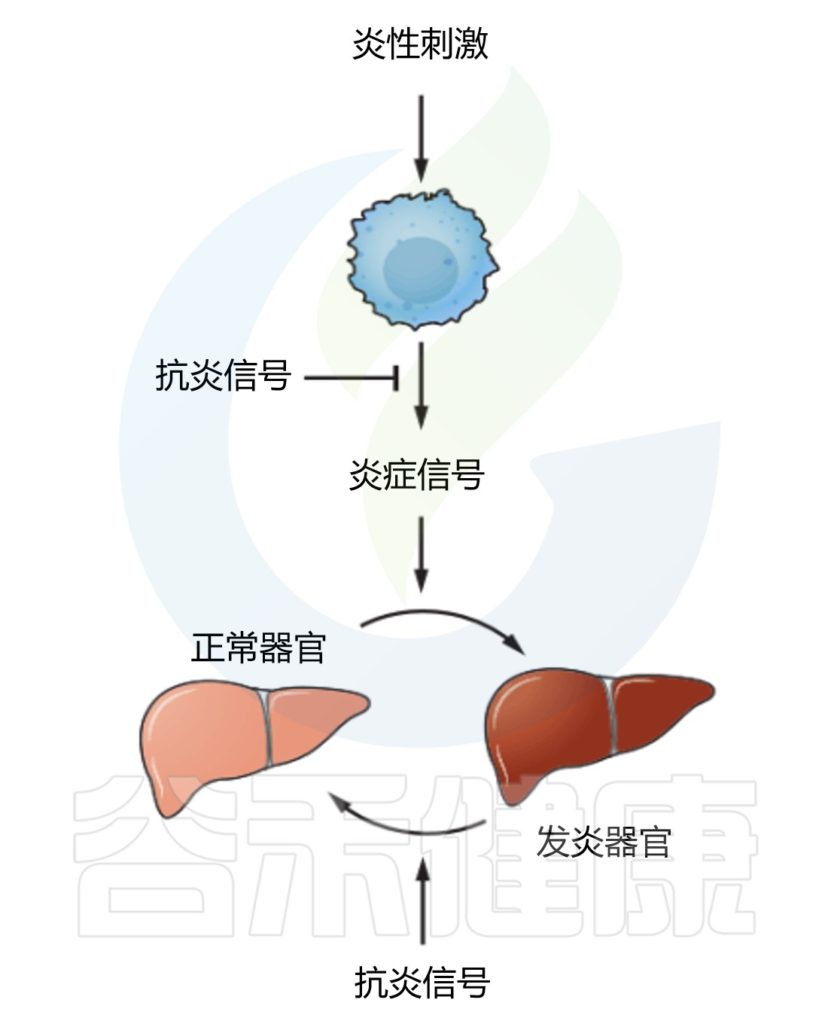
✦抗炎信号调节炎症器官
Medzhitov R.Science.2021
消除病原体本身并不足以控制炎症,在没有负调节因子的情况下,炎症反应总是极端过渡到病理状态。
控制炎症程度的抗炎信号(Anti-inflammatory signals)包括IL-10、TGF-β和糖皮质激素等。如何抑制由炎症反应引起的附带损伤也很重要,一种机制有可能是通过靶组织对炎症信号的反应性不同,使最容易受到炎症损伤的重要组织和器官对炎症信号的反应性较低。
另一种可能机制是通过“反炎信号(counter-inflammatory signals)”将组织的炎症状态恢复到原来的“稳态”状态。控制靶组织的反应程度,将炎症反应成本降到最低。
这些稳态信号很可能纠正机体偏离正常时的炎症状态,例如肾上腺素对支气管平滑肌的影响:组胺和白三烯在炎症反应中诱导支气管收缩,而肾上腺素通过诱导支气管松弛恢复到稳态来抵消这种作用。
目前发现的“反炎信号”(counter-inflammatory signals)有调节性T细胞(Tregs,不仅控制炎症的大小,而且还控制组织稳态)和参与分解的信号分子(脂质素和分解素)。
需要注意的是,抗炎和反炎作用可能由相同的信号来实现。例如,腺苷和TGF-β可能同时具有抗炎(即作用于传感器细胞和效应细胞)和反炎(即作用于所有其他靶组织)来调节炎症的模式。
不足之处
虽然现有的抗炎药物提供了一定的治疗效果,但它们增加了对感染的易感性。激活抗炎途径应该在不损害防御功能的同时,有助于恢复组织和器官的稳态。
抗炎途径的研究未来将是新型治疗方法开发的重要方向,更多抗炎信号的研究可能有助产生炎症领域的有效新药。
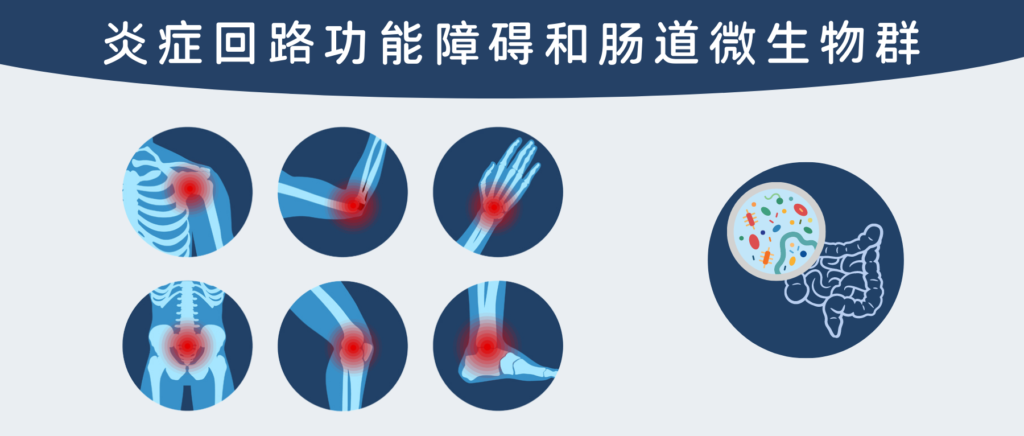
✦大部分炎症性疾病始于胃肠道
大多数不同的炎症性疾病始于身体的肠道(或胃肠道)。从那里扩散到身体的不同部位。肠道内壁是可渗透的,这意味着它允许某些物质通过并进入血液。
•炎性物质可能会扩散到其他器官
然而,当这种渗透性增加时,不需要的物质也会通过,从而触发身体的免疫系统来对抗它。这可能不仅会导致炎症,还会导致过敏和疾病。在某些情况下,这些毒素会进入您的大脑,不仅会导致抑郁症,还会导致某些神经系统问题。
一旦问题成为系统性问题,换句话说,可能会影响整个系统,身体将不再能够正常消化,这使得你的身体很难获得身体所需的不同营养素、维生素和矿物质以有效地工作,无论饮食多么健康。
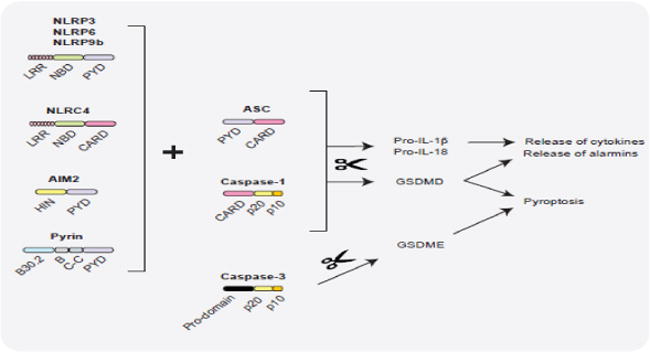
✦炎症小体与肠道稳态相关
Rathinam VAK,et al.Trends Mol Med.2018
宿主和微生物来源的各种信号被不同的炎性体受体感知,导致ASC-CASPASE-1复合物的组装和 CASPASE-1的成熟。在酶促作用下,活性 CASPASE-1通过蛋白水解加工激活pro-IL-1β、pro-IL-18和gasdermin D (GSDMD)。GSDMD通过质膜穿孔执行裂解性细胞死亡,还促进IL-1β、IL-18和警报素释放。
•炎性体影响肠道上皮细胞
炎性体激活的所有这些结果都会在不同程度上影响肠上皮细胞和固有层免疫细胞的功能,从而以依赖于环境的方式协调肠道稳态。
此外,细胞凋亡半胱天冬酶CASPASE-3可以裂解GSDME以响应化疗,从而引发癌细胞焦亡。然而,尚不清楚GSDME诱导的细胞焦亡是否参与肠道稳态。
一旦问题成为系统性问题,换句话说,可能会影响整个系统,身体将不再能够正常消化,这使得你的身体很难获得身体所需的不同营养素、维生素和矿物质以有效地工作,无论饮食多么健康。
下面让我们来看看可能由发炎的胃肠系统引起的一些症状。
食物敏感性和炎症回路
目前面临比较突出的问题越来越多的人正在增加对某些食物的敏感性,尤其是麸质。食物敏感性经常长时间未被诊断的原因是因为这些症状与其他肠道疾病和病症的症状非常相似。他们通常被误认为是另一种疾病。
为什么对麸质敏感的人数增加了这么多?
小麦经过各种加工使其变得更易溶于水,以便与其他成分混合。这意味着我们实际上消耗的小麦数量比我们的祖先曾经做过的要多得多。
食用后,由于酶的作用,麸质会分解成麦醇溶蛋白和麦谷蛋白。一旦它们到达您的肠道相关淋巴组织 (GALT),系统就会对其进行评估,以确定它们是否对您的身体有害。
•酶的攻击使肠道受损
如果您碰巧对麸质敏感,GALT会通过抗体攻击蛋白质。在患有乳糜泻的人中,分解麸质的蛋白质和酶都会受到GALT产生的抗体的攻击。
这种酶的另一个功能是帮助吸收营养。这是通过将肠道的微绒毛保持在一起来实现的。微绒毛是在肠壁中发现的毛发状结构。对这种酶的任何攻击都会导致微绒毛受损——进而对肠壁产生负面影响,使其更容易被毒素渗透,并导致称为漏肠的状况。抗体还可能攻击你自身的器官和组织,例如皮肤和大脑,结果就是发生自身免疫性疾病。
然而,引起炎症的不仅仅是麸质。其他来源是乳制品、含有亚油酸的油,例如花生油、向日葵油、红花油和玉米油,以及海鲜和特定调味品。
可以通过识别和消除敏感的食物来治愈肠道并平息您的炎症回路。慢性炎症与肾上腺疲劳综合征 (AFS) 和神经内代谢 (NEM) 应激反应密切相关。通过调整饮食,您可以帮助自己从肾上腺疲劳中恢复过来,同时降低患胃肠道疾病的风险。
便秘与炎症回路
什么是便秘?
便秘是一种排便不规律的情况,导致排便困难,过程伴随痛苦的。偶尔便秘被认为是正常的,经常便秘可能会导致肠道疾病,从而影响炎症回路。
你可能会问“正常到什么程度才正常?” 它因人而异,但在大多数情况下,每天排便一次或两次在被认为是正常的范围内。超过三天没有排便会导致便秘,因为随着时间的推移大便会变干,使排便变得更加困难和痛苦。
✦便秘会引起其他问题
便秘时上厕所不仅不舒服,而且用力也会引起一系列问题,例如痔疮或憩室病。
✦便秘的原因
便秘的原因有很多。其中包括:纤维含量低的饮食、喝水过少、乳制品含量高的饮食、结肠癌、肠易激综合征、长时间不活动、结肠肌肉或神经问题引起的问题、压力、某些类型的药物、甲状腺功能减退和怀孕。
便秘通常是肾上腺疲劳后期出现的并发症,因为您的身体能量水平降低,难以排便以保存能量。你的消化速度减慢,导致废物留在结肠中。这会增加毒性并导致炎症。
✦便秘的危害
如果不理会,随着肾上腺疲劳的加剧,随着时间的推移,情况可能会变得更糟。体内积聚的毒素压倒了炎症回路,可能导致炎症,进而导致肌肉骨骼系统的崩溃。这还包括内部器官的胶原蛋白结构。随着时间的推移,胃肠道会受到损害,从而导致便秘和消化问题恶化的循环效应。
•便秘容易加重一系列疾病
由于胃不能产生足够的酸来分解食物以吸收营养,这会耗尽细胞,结果是一个循环导致整个系统减速以节省能量。然而,它可能导致以体重大幅减轻为特征的分解代谢状态。
在大多数情况下,甲状腺也会受到损害,会减慢速度以降低新陈代谢率以节省能量。这进一步加剧了疲劳并增加了便秘问题。由于废物堆积,毒素开始影响肝脏和肾脏功能。
•改善肠道菌群有助于调节便秘
如果便秘严重或持续存在,则可能需要干预。这其中包括改善肠道菌群组成,帮助调节肠道运动,有助于改善便秘及相关症状。
腹泻和炎症回路
腹泻会导致脱水并失去电解质。如果持续存在,可能表明存在更严重的问题。
注:如果发现大便中有血或粘液,并且发烧、疼痛或体重减轻,您可能需要尽快咨询医生或就医,因为这些是潜在的、更深层次的问题的迹象。
✦腹泻的病因
腹泻有多种常见原因。这些包括细菌,吃你过敏或敏感的食物,或病毒。其他原因可能包括克罗恩氏病、肠易激综合征 (IBS)、糖尿病、某些癌症、甲状腺机能亢进和吸收不良等。
然而,在大多数情况下,腹泻与这些疾病中的任何一种都无关,而且问题通常可以通过药店买治疗腹泻的药就可以缓解。在大多数情况下,清淡的食物、充足的休息和保持水分会很有帮助。
注意
患有肾上腺疲劳综合症 (AFS) 的人通常更容易患便秘而不是腹泻。另一方面,肾上腺衰竭晚期的人往往会出现非常严重的腹泻。
肠易激综合征和炎症回路
肠道最重要的目的之一是防止毒素、微生物、未消化的食物和外来物质进入血液。健康时,肠道黏膜细胞的连接很紧密,只允许身体所需的营养物质通过。当你的肠道渗漏时,这些连接处就不那么紧密了,毒素和其他颗粒会被允许通过。这些被免疫系统视为外来入侵者。然后你的炎症回路会攻击它们,导致炎症。
✦症状
肠易激综合征 (IBS) 的症状包括:恶心、背疼、尿频、焦虑、疲劳、腹胀、肚子痛、便秘/腹泻、口臭、关节痛、头痛。
当实验室测试排除具有类似症状的其他情况时,通常通过排除过程来诊断肠易激综合征。它本质上是对胃肠道的刺激。
✦病因
许多因素会导致肠易激综合征,例如使用某些药物,抗生素,焦虑,抑郁,荷尔蒙失衡和各种其他因素。压力起着重要作用。
患有肠易激综合征的后期阶段新陈代谢减慢以节省能量。在这个过程中,肠道运动也会减慢。因此,食物以慢得多的速度穿过身体。结果通常是便秘,尽管有时也会出现腹泻。当然,这会增加肠道刺激并恶化与肠易激综合征相关的症状。
建议
某些补充剂,如omega-3脂肪酸、谷氨酰胺、植物甾醇、槲皮素和益生菌益生元,改善饮食等都可能有助于预防肠易激综合征的发生。某些类型的纤维甚至有助于帮助微生物组和加强炎症回路。
微生物组(microbiome )可以描述为体内特定环境中所有不同微生物的所有遗传物质。这是炎症回路的第二部分。
注:不应将术语微生物群与仅指特定环境中的微生物(microbiota),即仅指胃肠道中的微生物这一术语混淆。
据估计,人体中大约90%的细胞都不是人类的。在大多数情况下,它们本质上是原核生物。原核生物是单细胞的,没有线粒体,细胞核没有膜。这些原核细胞是来自1,800多个不同属的 4 万多种不同菌株的结果。而肠道中拥有最丰富的微生物群。
当我们年轻的时候,肠道的微生物组在我们免疫系统的形成中起着极其重要的作用。在免疫系统仍在发育的儿童早期尤其如此。
✦免疫系统影响炎症的产生
小时候,我们的身体免疫系统接触并习惯于抗原,并对它们产生耐受性。一旦达到稳态(平衡)状态,外来微生物和抗原将无法在体内引起炎症反应。
只有当我们的免疫系统较弱或发育不全时,接触外来过敏原才会触发炎症回路中的反应,导致自身免疫性疾病、过敏以及对化学品和某些食物的敏感性问题。
一个很好的例子是老鼠一生都被关在无菌环境中。虽然他们很健康,但他们的免疫系统还没有完全发育。一旦接触到外来微生物,它们往往会发展为自身免疫性疾病和其他健康问题。
✦微生物群对健康有重要影响
研究表明,婴儿的第一个肠道微生物组对他们的健康有着深远的影响。
身体某些部位的不同微生物具有相同的功能。一个例子是,两个人的舌头上有不同的微生物,但在分解糖分时,他们的工作完全相同。就我们所吃的食物而言,微生物需要一个稳定的栖息地。反过来,当它们分解某些被肠道消化的成分时,我们会从释放的热能中受益。
这意味着我们的身体和我们的微生物宿主之间存在明确的、有益的相互作用,并且身体中的某些功能依赖于这些微生物才能保持健康。当由于某种原因,我们的微生物群落失衡时,我们就处于生态失调状态。
•肠道菌群影响炎症回路
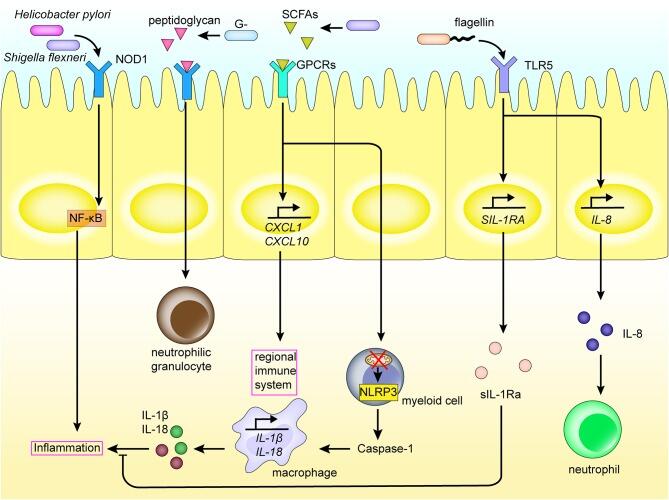
Zhou B,et al.Front Immunol.2020
肠道菌群和代谢物与肠道中的区域免疫系统相互作用。PRRs如NOD1、表达于肠粘膜上皮细胞的Toll样受体,识别肠道菌群的PAMPs和短链脂肪酸,从而激活炎症通路和炎症细胞因子的产生。
这会诱导骨髓细胞的分化、巨噬细胞和中性粒细胞的募集等,引发炎症反应,并激活局部免疫系统。这种相互作用还促进炎症因子的表达。
炎症通常是生态失调的结果。它在许多健康问题中发挥作用,包括糖尿病、肥胖症、哮喘、自闭症和心脏问题等。它还与某些与肠道有关的问题有关,例如克罗恩病。它也可能在大脑中发挥作用,被认为是肠易激综合征 (IBS) 的触发因素之一。这些情况都与肠道生态失调有关。
生态失调的一个常见原因是抗生素。它们会破坏保持系统平衡所需的“好”细菌。当“好”微生物组受到负面影响时,免疫系统也会受到负面影响。
✦肠道菌群失调引起炎症
肠道菌群失调可能引起炎症,进而导致粘膜损伤。当不同黏膜细胞之间的连接受损时,免疫系统会做出相应的反应。
蛋白质、细菌和毒素很容易通过受损的肠壁进入血液,导致所谓的肠漏。与这种情况相关的症状包括:脑雾、抑郁、失眠和疲劳,以及许多其他症状。
健康的肠道细菌与多样化的微生物组相结合,可以形成健康的肠道来支持炎症回路。肠道健康的人通常更健康,感染或复发性疾病的可能性更低,因为他们的身体防御系统更强。
微生物组和神经系统疾病
肠道菌群失调与许多神经系统疾病有关。其中包括自闭症谱系、多发性硬化症 (MS) 和帕金森氏症。帕金森病患者的最初症状通常是便秘,随后是嗅觉和味觉丧失。其他症状,如震颤和摇晃,仅在胃肠道紊乱出现后很久才会出现。
有许多环境因素会影响神经系统状况和炎症回路。其中之一是大脑中没有正确使用蛋白质,导致许多神经退行性疾病。这可能是肠道炎症触发大脑中某些炎症反应的结果,导致蛋白质使用不足和大脑神经细胞退化。
炎症和肠道失衡也可能与某些自身免疫性疾病有关。西方国家的人群有相似的饮食和相应的更高的多发性硬化症发病率。随后的饮食可能会导致炎症,从而破坏肠道中存在的微生物的正常功能。
•压力与饮食通过肠道进而影响炎症回路
帕金森氏症和多发性硬化症患者的肠壁通透性增加,导致针对多种抗原的抗体增加。有证据表明,持续的压力以及其他各种原因是炎症回路失调的原因。
阿尔茨海默氏症和认知功能下降的特点是氧化应激、免疫问题和大脑本身的变化。实验表明,这些都是由于饮食及其对肠道生物群落的影响。神经营养因子是一种保护和促进健康神经元的蛋白质,它依赖于健康的肠道生物群落。阿尔茨海默病患者在这方面表现出明显下降。
微生物组对精神疾病的影响
有证据表明肠道和大脑健康之间存在很强的相关性。这意味着某些心理问题,例如抑郁症,可能是炎症的结果,肠道是最初的煽动者。对动物的研究表明,当某些微生物从抑郁的小鼠身上移植时,健康小鼠的心理会显著下降。
•肠道微生物有助于神经与身体恢复
与肾上腺疲劳综合症相关的两个最常见的症状是焦虑和抑郁。因此,有证据表明,有问题的人必须确保健康的肠道微生物组。它不仅有助于恢复他们的神经处理,还有助于身体恢复。
▸ 小肠细菌过度生长造成危害
当小肠中细菌的生长超出健康限度时,这种情况被称为小肠细菌过度生长 (SIBO)。这些细菌通常存在于结肠中。患有小肠细菌过度生长的人与患有肠易激综合征的人有非常相似的症状,许多人同时患有这两种情况。与该病症相关的症状包括腹痛、便秘、腹胀、胀气和腹泻。
•原因
这种情况发展的原因有很多。最常见的原因包括:
•高糖饮食、富含精制碳水化合物的饮食、酒精过多;
•克罗恩病导致的疤痕会聚集细菌;
•憩室病,其中小肠壁形成袋并收集细菌;
•某些药物,例如对肠道菌群具有破坏性影响的抗生素;
•由于念珠菌、莱姆病和人类疱疹病毒等感染导致炎症回路减弱
•危害
如果小肠细菌过度生长未经治疗,它会对健康产生不利影响,导致慢性腹泻,导致身体所需营养物质吸收不足,最终导致营养不良。
•抵抗外界病原体会触发炎症
炎症是免疫系统的重要组成部分。慢性炎症通常是感染、对自身身体物质的自身免疫反应或来自环境的抗原等的结果。
在慢性炎症的情况下,介质是单核细胞和巨噬细胞,它们是免疫系统的组成部分。也称为白细胞,白细胞在遇到问题时会释放化学试剂,靶向导致炎症回路反应的化学试剂。
•修复自身组织也会触发炎症
然而,问题是这些细胞不仅针对入侵者,还针对您自己的组织,从而造成损害。这些受损组织需要不断修复。慢性感染也是导致您的身体不断发展新血管的原因。
完成的修复工作通常会引起刺激,从而导致炎症过程被重新触发。如果由于某种原因,这变成了一个循环,你的身体就会一直处于炎症状态,从长远来看,它会产生衰弱的影响。
注:现代医学并没有为问题提供长期的解决方案。有时,会开具某些抑制免疫力的类固醇。然而,这些药物通常只能提供短期的症状缓解,并不能解决问题的根本原因。
当处于压力之下时,免疫系统会发现并保护我们免受病原体的侵害,从而引发炎症反应来解决问题。免疫系统因此攻击并清除任何潜在的危险病原体。一个按预期发挥作用的免疫系统可以迅速摆脱某些慢性病原体和感染带来的危险。
✦免疫系统过强和减弱都会导致疾病
尽管免疫系统减弱通常是导致反复感染,甚至是那些难以摆脱的感染的原因,但这不一定是疾病的原因——免疫系统过度活跃也可能是原因。
在“正常”条件下,免疫系统会识别并瞄准敌人的病原体,而将那些被认为是有益的病原体留在一边。然而,有时情况并非如此,炎症回路变得过激,甚至对正常细胞和条件产生免疫反应。
由于强大的免疫系统,炎症回路不一定能正常工作,免疫系统会在过度活跃时导致自身免疫问题。
当这种情况发生时,某些抗体会混淆它们所看到的正常细胞和被认为是病原体的细胞。然后它不分青红皂白地攻击。结果,当这种情况发生时,炎症回路随后会出现与某些自身免疫状况一致的突然发作。
✦导致免疫过度的原因
考虑以下情况,身体可能会将自己的细胞识别为外来细胞并产生自身免疫类型的反应:
•食物敏感性
吃我们敏感的食物会引起炎症,并导致我们的免疫细胞将我们的组织视为异物。免疫反应被激活以摆脱这些不受欢迎的客人。
•微生物组失衡
我们的肠道本身就是一个完整的生态系统。当这个系统失去平衡时,如患有小肠细菌过度生长、胃反流、幽门螺杆菌、肠易激、炎症性肠病、分解代谢状态或肾上腺疲劳晚期胃部减慢的人,可能意味着好的有益细菌被外来的非有益细菌所取代。
外来机会性细菌和隐形病毒从休眠状态转变为活跃状态。这会导致免疫系统超速运转,从而导致慢性炎症。
在这个过程中,免疫系统,特别是在过度活跃的状态下,很容易混淆谁是真正的敌人。外来机会性细菌及其自身同时受到攻击,导致各种自身免疫性疾病。
•HPA轴不平衡
HPA轴又叫下丘脑-垂体-肾上腺轴,是身体的主要压力调节激素轴。皮质醇是主要的抗应激激素。在肾上腺疲劳的晚期阶段,产生的皮质醇不足会导致猖獗的全身炎症,进而导致或引发自身免疫症状。
•肠漏或肠道通透性增加
当食物颗粒穿过胃肠黏膜时,就会引发炎症。未消化的食物应该在胃肠道内。当它进入肝循环和身体其他部位时,免疫系统将其识别为异物,并尽一切努力尝试攻击和中和这些异物。
免疫系统的持续激活会导致免疫细胞与正常细胞发生交叉反应,从而引发自身免疫性疾病
•重金属毒性和化学敏感性
环境毒素无处不在。如果一个人生活在城市世界中,就不可能逃脱。我们体内积累的过多毒素会触发我们的免疫系统在过度活跃的状态下工作,以清除我们身体中这些不需要的物质。那些不能自然而适当地发挥这种功能的人可能会出现自身免疫性疾病的症状。
•慢性和隐形感染
生活中,让我们接触到不断涌现的病毒、真菌、细菌和原生动物等。一些病原体往往会长期伴随我们,处于休眠状态。当我们的免疫系统较弱时,它们会被激活并爆发。这些生物包括伯氏疏螺旋体、小巴贝虫、白色念珠菌、孢疹病毒等。这些病原体引起的疾病会导致免疫系统过度活跃。
与体内正常组织的交叉反应并不少见。这些传染病中的许多都具有自身免疫性疾病的症状,例如肿胀、关节痛、牛皮癣、疲劳和食物过敏。自身免疫实验室标志物可能在血液测试中会升高。
•身体或情绪压力过大
情绪压力持续可能会降低病原体入侵的障碍,触发我们的免疫系统进入超速状态。换句话说,压力会使任何先前存在的临床或亚临床自身免疫性疾病恶化。
注意
由于现有的微生物群失衡、胃肠道刺激或反应性代谢物超负荷而导致身体发炎,很难完全确定是否存在真正的自身免疫性疾病(如原发性桥本氏甲状腺炎或狼疮),或者只是出现类似于自身免疫性疾病的症状。
抗体等测试也可能会混淆。但是注意在这些情况下,它们可能是正常的或临界高,而不是像真正的原发性自身免疫状态那样高。
不幸的是,目前临床医生较少对这种依赖于详细病史进行正确评估的区分保持警惕。当正常或临界高实验室检查伴有疲劳、关节痛、牛皮癣、胃部不适、体重增加、血管炎和肌肉酸痛时,医生的下意识反应是跳到自身免疫性疾病的临床诊断。没有对身体进行全面的整体观察,很难对过度活跃的免疫状态找寻到其根本原因。
因为临床表现相似,所以很少努力将症状追溯到根本原因——无论是主要由病原体驱动、过度活跃的免疫状态驱动,还是两者兼而有之。患者经常服用类固醇和自身免疫药物。短期益处很常见,因为过度活跃的免疫状态会因皮质类固醇的抗炎特性而平静下来。
然而长期服用类固醇可能是有问题的,因为它会降低我们的整体免疫反应,并掩盖在过度活跃的免疫状态是真正原因的情况下代谢产物过多的潜在问题。随着时间的推移,炎症回路会随着时间的推移而缓慢但逐渐恶化,因为它变得功能失调。一个典型的例子是桥本甲状腺炎。
自身免疫性甲状腺炎
✦炎症回路过度运转导致甲状腺出现问题
当身体的炎症回路超速运转时,甲状腺系统通常是最容易因过度活跃的免疫状态而导致功能障碍的器官之一。
甲状腺控制着整体的新陈代谢率,并负责我们的体温调节。甲状腺功能的轻微变化会导致疲劳、体重增加和甲状腺功能减退侧感觉寒冷以及焦虑和心悸。
在过度活跃的免疫状态下,靶向一种或多种甲状腺成分的抗甲状腺自身抗体(也称为抗甲状腺抗体)可能会被激活。最重要的一种是抗TPO抗体。它存在于大约90%的桥本甲状腺炎、10%至20%的结节性甲状腺肿或甲状腺癌以及75%的格雷夫斯病中。
注:TPO抗体是人体针对甲状腺的自身抗体,如果甲状腺相关抗体增高,容易导致甲状腺素分泌增高,引起甲亢或甲状腺炎等疾病。tpo抗体全称是甲状腺过氧化物酶抗体,它是甲状腺自身免疫抗体之一,正常人一般为阴性,如果该抗体升高一般提示可能存在桥本氏甲状腺炎。
甲状腺炎的诊断
临床医生通常根据在疲劳和低能量的临床环境中显示抗TPO抗体的实验室测试来诊断桥本氏甲状腺炎。
此外,应该注意的是,10%到15%的正常个体可以具有更高水平的抗TPO抗体滴度。他们没有像上面提到的那些原发性自身免疫性疾病。当我们的炎症回路处于超速状态时,高滴度可能继发于过度活跃的免疫系统。这些患者可能被错误地诊断为患有临床或亚临床原发性桥本甲状腺炎。通常开始甲状腺替代治疗。很少考虑其他原因,例如炎症回路过载。
根据实验室测试和症状,甲状腺减慢症状被视为自身免疫问题,而实际上,有些时候它代表了处于炎症回路问题的身体。在这种情况下,甲状腺替代疗法只是掩盖了症状。应采用整体方法,以充分理解根本原因并影响全面的长期恢复计划。
炎症回路是人体为克服压力而部署的神经内代谢应激反应的一部分。过度和失调的炎症反应会破坏人类的身体,导致一系列疾病和不良症状。
传统医学解决这个问题的方法是抑制症状。随着时间的推移,这可能会使情况恶化。自身免疫性疾病和过度活跃的免疫状态是常见的后果。由于当身体过度发炎时系统范围内的统一,因此需要从整体的角度了解身体以更好控制炎症。肠道菌群在其中扮演着重要作用,有更多值得被研究和发现的价值。
主要参考资料:
Michael Lam, MPH; Justin Lam, Carrie Lam,
Inflammation Circuit Dysfunction.Drlamcoaching.
Zhou B, Yuan Y, Zhang S, Guo C, Li X, Li G, Xiong W, Zeng Z. Intestinal Flora and Disease Mutually Shape the Regional Immune System in the Intestinal Tract. Front Immunol. 2020 Apr 3;11:575. doi: 10.3389/fimmu.2020.00575. PMID: 32318067; PMCID: PMC7147503.
Ruiz F, Vigne S, Pot C. Resolution of inflammation during multiple sclerosis. Semin Immunopathol. 2019 Nov;41(6):711-726. doi: 10.1007/s00281-019-00765-0. Epub 2019 Nov 15. PMID: 31732775; PMCID: PMC6881249.
Rathinam VAK, Chan FK. Inflammasome, Inflammation, and Tissue Homeostasis. Trends Mol Med. 2018 Mar;24(3):304-318. doi: 10.1016/j.molmed.2018.01.004. Epub 2018 Feb 9. PMID: 29433944; PMCID: PMC6456255.
Amoroso C, Perillo F, Strati F, Fantini MC, Caprioli F, Facciotti F. The Role of Gut Microbiota Biomodulators on Mucosal Immunity and Intestinal Inflammation. Cells. 2020 May 16;9(5):1234. doi: 10.3390/cells9051234. PMID: 32429359; PMCID: PMC7291275.
Hess JM, Stephensen CB, Kratz M, Bolling BW. Exploring the Links between Diet and Inflammation: Dairy Foods as Case Studies. Adv Nutr. 2021 Oct 11;12(Suppl 1):1S-13S. doi: 10.1093/advances/nmab108. PMID: 34632478; PMCID: PMC8502778.
Brennan CA, Garrett WS. Gut Microbiota, Inflammation, and Colorectal Cancer. Annu Rev Microbiol. 2016 Sep 8;70:395-411. doi: 10.1146/annurev-micro-102215-095513. PMID: 27607555; PMCID: PMC5541233.

谷禾健康


卵巢早衰
卵巢早衰(premature ovarian insufficiency,简称POI)在生殖系统疾病中位居首位,这些疾病可能会损害多个功能系统,降低生活质量,最终剥夺女性患者的生育能力。
目前的激素替代疗法不能改善受孕或降低全身并发症的发生率,可部分缓解症状。
日常食物中的营养成分包括碳水化合物、脂肪和脂蛋白、蛋白质和多肽、维生素以及含有植物雌激素的蔬菜或水果。这些是功能性营养素,在更年期期间具有增殖、抗炎、抗氧化和线粒体保护潜力。
除此之外,微生物相关营养物质,包括益生菌、益生元和合生元组合,在支持卵巢活力和调节其他重要生殖功能方面显示出很高的潜力。
本文主要介绍卵巢早衰的症状、发病率、风险因素,发病机制,与肠道菌群及阴道菌群的关联,后面着重介绍现有的关于卵巢早衰的膳食补充研究。
卵巢早衰,也称为原发性卵巢功能不全(简称POI)。


/ 卵巢早衰
健康女性的卵巢会产生雌激素。这种激素控制月经期并让人拥有生育能力(能够怀孕)。随着年龄的增长,卵巢最终会停止制造雌激素。有时,卵巢在预计绝经前很久就会停止工作。
注:绝经的平均年龄是 51 岁。
如果不到 40 岁,卵巢不再产卵,且月经停止,则可能是原发性卵巢功能不全,也就是我们通常所说的“卵巢早衰”。 甚至部分女性在青少年时期就开始了。
卵巢早衰不同于过早绝经。绝经是不可逆的;而有些卵巢早衰的女性,这种功能丧失是暂时的,也就是说,月经会在未来的某个阶段恢复。
对于大多数女性来说,最常见的症状是月经停止(或月经稀少)。
其他症状可能包括:
对于部分卵巢早衰的女性,月经变得不规律,卵巢可能会继续间歇性排卵并产生激素;这些女性可能会在卵巢完全关闭之前继续月经周期数月或数年。
对于大约十分之一的卵巢功能不全 (POI) 女性,她们的月经还没有开始,在很小的时候就出现了 POI,通常不到 20 岁。
什么时候应该怀疑自己可能有 POI?
POI可能在月经期突然停止时突然发生。或者,POI可以在月经停止前随着月经不规律的月份逐渐出现。
对一些人来说,怀孕困难可能是卵巢早衰的最早也是唯一的迹象。当症状被注意到时,通常是由于卵巢功能不良或功能不全导致雌激素分泌不足。
POI还会导致哪些问题?
在过去的几十年中,伴随着生活方式的快速改变和环境的恶化,POI 发病率的急剧上升。
在 40 岁以下的女性中,大约每 100 名女性中就有 1 名患有卵巢早衰。
在 30 岁以下的女性中,大约每 1000 名女性中就有 1 名会发生卵巢早衰。
在大约 90% 的情况下,POI 的确切原因是未知的。
研究表明,POI 与卵泡问题有关。卵泡是卵巢中的小囊,卵子在里面生长成熟。
一种卵泡问题是比正常情况更早地用完了工作卵泡。另一中问题是卵泡不能正常工作。
在大多数情况下,卵泡问题的原因是未知的。
某些因素会提高女性POI的风险:
注:
脆性 X 综合征,是常见的遗传性疾病,造成智力低下。
特纳综合征,指先天性卵巢发育不全。
艾迪生病,一般指肾上腺皮质功能减退症。
POI 的发生率逐渐增加,它与已知的致病基因高度异质,并影响多种生物活动,包括激素信号、代谢、发育、DNA 复制、DNA 修复和免疫功能。目前已知的 POI 基因只能解释一小部分患者。
细胞凋亡与 POI 密切相关,与卵母细胞在从原始卵泡到窦卵泡的成熟过程中丢失相关。
卵巢颗粒细胞凋亡是影响卵巢储备和功能下降的重要机制。女性一生当中只有0.1%卵泡可以发育成熟并完成排卵,其余卵泡在不同阶段发生闭锁,颗粒细胞凋亡是卵泡闭锁的重要因素之一。
正常卵巢与POI卵巢的卵泡生成受损
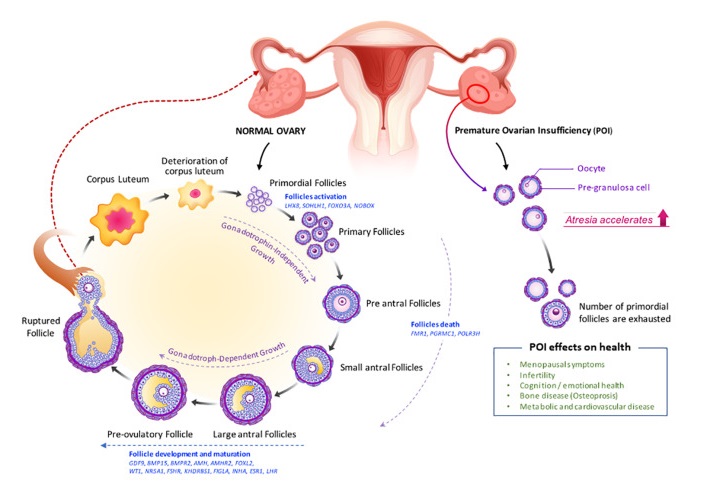
doi: 10.3389/fcell.2021.672890
在卵巢内因子和促性腺激素的调节下,初级卵泡发育成腔前卵泡和早期窦状卵泡,最容易发生闭锁或卵泡死亡。
然后,它们成为排卵前卵泡,导致卵母细胞释放和黄体形成。卵泡发生缺陷(如原始卵泡减少、闭锁增加和卵泡成熟度改变)导致POI。
涉及 DNA 损伤和修复、同源重组 (HR) 和减数分裂的基因中的大量基因突变。
这些基因包括基质抗原3(STAG3)、联会复合体中心元件1(SYCE1)、参与DNA修复的支架蛋白(SPIDR)、蛋白酶体26S亚基ATP酶3相互作用蛋白(PSMC3IP)、ATP依赖性DNA解旋酶同源物(HFM1)、mutS同源物(MSH)4、MSH5、MCM8、MCM9、cockayne综合征B-piggyBac 3(CSB-PGBD3)、核孔蛋白107(NUP107),以及乳腺癌易感基因(BRCA1和BRCA2).
内源性和外源性因素触发原始卵泡中DNA 双链断裂,由于细胞代谢的变化和氧化应激的升高,作为卵巢衰老的一部分,DNA损伤在原始卵泡中积累。在原始卵泡的氧化呼吸过程中,少量氧气首先在线粒体中转化为超氧化物,然后转化为羟基自由基。这些羟基自由基导致DNA单链断裂,如果双链断裂发生在多个相邻病变中,则会导致双链断裂和原始卵泡丢失。
线粒体是个多功能的细胞器,其异常与多种人类疾病相关,卵母细胞和颗粒细胞中的线粒体功能对卵巢的发育、功能维持都十分重要。
线粒体功能障碍可通过多种途径,如线粒体DNA 异常或逐渐积累的损伤、氧化应激、Ca2+ 对线粒体的直接损伤,导致卵子的发育潜能障碍,诱导卵子的凋亡而引起卵巢储备功能下降,进而发展成卵巢早衰。
▸TGF⁃β/ Smad 信号通路
TGF⁃β1/Smad 主要效应分子在卵巢组织中广泛表
达,参与病理性卵巢功能衰退,主要通过下调 TGF⁃β1/Smad3 信号通路因子表达,同时活化卵泡细胞质内 Smad2 表达;在生理性卵巢功能衰退中该信号通路的生物学效应可能与通过 Smad7 代偿性抑制通路的调节有关。
GDF-9 对窦状卵泡阶段的发育主要是通过减弱依赖 FSH的LH受体形成,防止卵泡过早发生黄素化和凋亡,直接决定卵泡池中卵泡数量,反映卵巢储备。
▸PI3-K / AKT 信号通路
磷酸酶和紧张素同系物(PTEN)/磷脂酰肌醇3激酶(PI3-K)/蛋白激酶B(AKT)/叉头转录因子3(FOXO3)信号通路在初级和进一步发育卵泡的卵母细胞的募集中起着重要作用。
PI3-K 和 AKT 过度激活可使原始卵泡过早发育及卵泡过快凋亡,进而发展成为卵巢早衰。
FOXO3a 是 PI3-K / AKT 信号通路下游的重要靶蛋白之一。FOXO3a的下调未能挽救颗粒细胞的凋亡死亡,导致卵母细胞丢失。卵母细胞特异性PTEN缺失导致全球原始卵泡激活,导致POI.
▸Wnt/ β⁃catenin 信号通路
合成类固醇激素是卵巢的重要功能之一。 目前现代医学认为卵巢 Wnt 信号通路可能是促性腺激素信号调节类固醇生成的重要信号途径之一。Wnt2 通过影响 β⁃catenin 的细胞定位来调节颗粒细胞增殖;β⁃catenin 参与合成卵巢甾体激素和黄体生成。
▸ SIRT 信号通路
SIRT1 通过调节氧化还原状态参与卵母细胞的成熟,以此减少氧化应激损伤导致的卵母细胞破坏和卵巢功能下降。
早发性卵巢功能不全患者存在系统性免疫失调,外周血T细胞亚群比例异常,Th1细胞占比显著升高,同时Treg细胞占比显著降低,提示细胞免疫参与早发性卵巢早衰发病。
注:Treg细胞是免疫抑制性淋巴细胞亚群,在维持免疫环境的稳定性和控制自身免疫疾病的发生中起重要作用。
免疫性卵巢早衰可能与辅助性Th17细胞过度活跃关系密切,E2水平低下时Th17细胞可过度激活,使机体免疫应答增强。
研究显示,卵巢早衰患者 Th17/Treg 水平较健康妇女明显增高,Th17和Treg 细胞表达失衡引发免疫调节紊乱,最终导致卵巢组织破坏和衰竭。
■ 为什么说肠道菌群与POI之间存在关联?
▸ 卵巢的自身免疫损伤
卵巢通过 T 细胞亚群的改变、T 细胞介导的损伤、产生自身抗体的 B 细胞的增加、效应抑制/细胞毒性淋巴细胞的减少以及自然杀伤细胞的减少而受到自身免疫的损害。
▸ 肠道菌群在自身免疫过程中发挥关键作用
肠道微生物群产生的肽可能会诱导免疫细胞产生自身反应和交叉激活。肠道微生物群的失调不仅会影响B淋巴细胞的激活和自身抗体的产生,还会诱导先天免疫细胞的异常激活,从而导致促炎细胞因子的上调。
▸ 肠道菌群在卵巢早衰中发挥重要作用
肠道微生物组在POI相关症状中发挥重要作用,包括自身免疫功能障碍、骨骼健康、认知、神经健康等。肠道微生物群及其代谢产物还具有调节炎症途径激活、脑肠肽分泌和胰岛β细胞破坏的能力。
我们具体来看相关的研究 ↓↓

2021年,深圳妇幼保健院检测了部分患者的肠道菌群,卵巢早衰女性(n = 35),健康女性( n = 18).
▸ POI患者中肠道菌群变化
下列菌群在POI女性中较少:
而下列菌群在POI女性中更丰富:
▸ 肠道菌群与自身免疫反应的关联
可以看到,拟杆菌属、双歧杆菌属和普氏菌属的相对丰度在该研究的POI组中均有所增加。这些菌群与自身免疫反应有何关联呢?
注:Th17细胞能够分泌产生IL-17A、IL-17F、IL-6以及TNF-α等,其功能主要就体现在它分泌的这些细胞因子集体动员、募集及活化中性粒细胞的能力上。
▸ 肠道菌群代谢产物诱导免疫调节活性
此外,双歧杆菌属、Blautia、Clostridium、Faecalibacterium、Roseburia和Ruminococcus可在人体肠道中产生短链脂肪酸,短链脂肪酸可以发挥什么作用呢?
综上,POI组肠道微生物组的所有这些变化可能通过某些细菌菌株及其代谢产物诱导免疫调节活性,这可能与自身免疫有关,进而影响POI的发展。
▸ POI肠道微生物群的改变与性激素有关
在这项研究中,在POI受试者中观察到显著较低的E2水平,通过调整BMI,E2水平与拟杆菌属、厚壁菌属和粪杆菌属的比例显著相关。FSH、LH和AMH水平也与某些微生物有关。
▸ 肠道菌群影响雌激素水平,雌激素调节的反应与POI相关
肠道微生物组通过分泌β-葡萄糖醛酸酶影响雌激素水平,使雌激素解凝,影响相关生理过程。
越来越多的研究表明,雌激素调节糖脂代谢、骨形成和炎症反应,其减少可损害雌激素依赖性过程,引发心血管疾病、骨质疏松等。这些症状都与POI有关。
肠道微生物群的失调与POI的发展有关,然而在进一步的研究中,还应考虑大样本量和多中心研究,来探索潜在的因果机制。
■ 为什么说阴道菌群与POI之间存在关联?
研究表明,细菌性阴道病与不孕有关。细菌性阴道病也被证明会改变阴道微生物组。
先前的一项研究表明,阴道微生物组在卵巢早衰的病理生理学中起着重要作用,卵巢早衰患者中乳杆菌属细菌的相对丰度显著低于健康对照组。因此,阴道微生物组和POI之间可能存在关系。
▸ POI患者中阴道菌群变化
下列菌群相对较少:
下列菌群显著增加:
我们具体来看相关的研究 ↓↓

2021年,深圳市妇幼保健院检测了部分患者的阴道菌群,卵巢早衰女性(n = 28),健康女性( n = 12).
▸ 阴道菌群与自身免疫反应的关联
可以看到,POI组中乳杆菌属、Odoribacter和Brevundimonas显著减少,链球菌属显著增加。这些菌群变化与自身免疫反应有何关联呢?
▸ 性激素水平会影响女性生殖道的防御能力和生殖期内的阴道微生物群
激素促进增生并增加糖原生成;糖原可以被阴道中的优势细菌乳酸杆菌转化为乳酸。这有助于保持阴道的酸性环境,抑制病原体的生长,并增强免疫系统。
在这项研究中,乳杆菌的比例与雌激素水平呈正相关,但与FSH水平呈负相关。POI患者的乳酸杆菌丰度和雌激素水平显著下降,FSH水平显著增加。
此外,AMH、FSH、LH、PRL、P和睾酮水平也与一些微生物有关,包括 Streptococcus, Odoribacter, Brevundimonas, Anaerococcus, Atopobium, Peptoniphilus, Prevotella, Veillonella,这增加了阴道微生物群改变与性激素相关的证据。
▸ 雌激素可以调节POI相关症状
越来越多的证据表明,雌激素可以调节POI相关症状,包括GLU和脂质代谢、骨形成和炎症反应。
在该研究中,GLU水平与Odoribacter和普雷沃氏菌属呈负相关。此外,PRL可以抑制FSH和促性腺激素释放激素以促进生育,这与厌氧球菌和嗜酸乳杆菌呈正相关。
▸POI患者阴道菌群的失调与卵巢功能密切相关
由于半乳糖和半乳糖代谢产物的积累,卵巢功能容易受损。先前的一项研究发现,半乳糖抑制了卵巢卵泡的数量和类固醇分泌。半乳糖代谢产物,包括1-磷酸半乳糖、半乳糖醇和尿苷二磷酸半乳糖,在干扰卵巢细胞凋亡和促性腺激素信号传导方面发挥重要作用。
患有POI的女性LACTOECAT-PWY通路的活性显著降低。这表明,患有POI的女性体内可能会积聚半乳糖,从而损害卵巢功能。患有POI的女性ARGONPROST-PWY通路显著富集。L-精氨酸与卵巢功能的调节相关。这可能对卵巢功能不利。
DNA损伤通过激活线粒体凋亡途径导致生殖功能障碍。
该研究结果表明,在POI患者中,许多与核糖核苷酸生物合成相关的途径发生了改变。
其他来自同济医院绝经与卵巢衰老专科门诊的研究数据发现:
双歧杆菌主要定殖在人体肠道中,在阴道中仅以低水平存在。作为一种益生菌,它具有抗炎作用、提高免疫功能和抵抗氧化损伤。临床研究发现,双歧杆菌可以改善绝经后妇女的新陈代谢和心血管功能。
Gardnerella和Atopobium均属于放线菌,在研究中发现 POI 患者显着富集,并且与卵巢储备下降、内分泌紊乱和围绝经期综合征症状显着相关。
阴道微生物组不仅反映了阴道的细菌组成,还反映了宿主的一般状况,包括激素和免疫状态等。阴道微生物群的失调与POI的发展有关,然而在进一步的研究中,还应考虑大样本量和多中心研究,来探索潜在的致病机制。
➔
这些测试可能帮助找到不孕的原因,找出排卵发生的时间,找出月经不规律或停止的原因,确认更年期或围绝经期的开始等。
➔
如果患有与POI相关的疾病,那么也必须对其进行治疗。治疗可能涉及药物和激素。
目前,没有经证实的治疗方法可以恢复女性卵巢的正常功能。但有一些治疗卵巢早衰症状的方法,或者可以降低其风险并解决POI可能导致的疾病:
激素替代疗法(HRT)
HRT是最常见的治疗方法。它给身体提供了卵巢无法产生的雌激素和其他激素。HRT可以改善性健康,降低患心脏病和骨质疏松症的风险。通常需要服用到50岁左右;这大约是更年期开始的年龄。
体外受精(IVF)
如果患有POI并且想怀孕,可以考虑尝试试管婴儿。
有规律的体育锻炼
有规律的体育锻炼,维持健康的体重,可以降低患骨质疏松症和心脏病的风险。
其他相关膳食补充方式,将在下一章节详细介绍。
除了那些遗传、免疫或医源性因素之外,日常饮食和生活方式中的营养摄入对于 POI 患者来说是最容易获得和改变的。
关于不良饮食习惯影响女性生育力和更年期的营养状况和调节的研究较少,这里初步提出了一些主要饮食因素和营养素:
Han Q, et al., Front Microbiol. 2022
碳水化合物为所有生物提供了最丰富的生命支持能源,通常分为单糖、寡糖和多糖。
Han Q, et al., Front Microbiol. 2022
半乳糖:毒性作用
半乳糖是卵巢早衰和相关不孕疾病中报道的一种常见单糖,它对卵巢产生了毒性作用。
半乳糖还可能抑制卵泡向性腺区域的迁移,并导致卵巢储备和雌二醇合成减少。因此,糖-半乳糖代谢异常与卵巢早衰的发生和发展有关。

铁皮石斛多糖:保护作用
铁皮石斛多糖(DO)对自然老化啮齿动物的卵巢早衰过程产生保护作用。
口服给药剂量为70 mg/kg,有助于这些大鼠恢复正常体重,减轻卵巢的病理变化,如血管增殖减少和卵泡减少。
DO导向的多糖通过调节NF-κB和p53/Bcl-2信号通路,提高谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)活性,降低血清中丙二醛(MDA)浓度,从而发挥抗氧化作用,从而减少卵巢组织的炎症损伤。同时还操纵了线粒体功能,恢复了卵巢细胞的活力。
碳水化合物对卵巢早衰发病或进展的重要性应进一步评估。
脂肪和体重高可能与卵巢早衰严重程度的控制有关。


Han Q, et al., Front Microbiol. 2022
一些研究报告称,绝经早期与低体重指数相关。具体机制尚不清楚。
脂蛋白是可运输的脂肪形式,积极参与人体内的代谢活动。
研究人员对卵巢早衰患者进行了血脂分析,发现血清中较高的甘油三酯(TG)浓度和较低的高密度脂蛋白(HDL)水平与游离雄激素指数增加和性激素结合球蛋白丢失相关。这些发现表明,TG升高可能导致胰岛素敏感性降低。
在另一项回顾性临床研究中同样发现,与具有密切流行病学特征的正常女性相比,出现卵巢早衰综合征且既往无激素摄入史的年轻女性患者血清中总胆固醇(TC)和低密度脂蛋白(LDL)浓度更高。结果表明,女性卵巢早衰患者在雌激素缺乏的情况下会引发脂质改变。
然而,不同研究中HDL的浓度水平非常不一致,一些研究报告HDL水平升高,另一些研究报告更年期妇女HDL水平降低。
至于脂肪摄入对更年期的影响,不同种类的脂肪可能会造成差异,包括多不饱和脂肪、总脂肪和饱和脂肪。
有研究认为,多不饱和脂肪的高消费与绝经较早有关;同时,总脂肪和饱和脂肪摄入量几乎不影响绝经期和年龄。
然而,尚不清楚日常饮食中的不同脂肪类型是否会以某种方式影响卵巢早衰的发病机制。
“
高蛋白摄入有助于推迟更年期的提前到来


Han Q, et al., Front Microbiol. 2022
研究发现,海鲜(每周约3天)和新鲜鸡蛋(每周超过4天)的消费与绝经晚期发病呈正相关。其他几项研究也支持类似的结论。研究人员认为,高蛋白摄入有助于推迟绝经并延长生殖功能。欧洲癌症与营养前瞻性调查(EPIC)还进行了一项队列研究,其中早期绝经的发生与蛋白质摄入量呈负相关。
除了直接摄入蛋白质外,多肽对保护卵巢功能和延缓卵巢衰老也很重要。
通过酶解从牡蛎中纯化的牡蛎多肽,由于其DPPH(2,2-二苯基-1-苦酰肼基)自由基清除剂能力,能够保护其免受氧化应激和炎症,从而对卵巢早衰产生治疗作用。
牡蛎多肽可以纠正异常的发情周期,提高血清卵泡刺激素(FSH)和黄体生成素(LH)浓度。此外还增加了原始卵泡计数和分布,并通过模拟SOD清除显著减轻了卵巢细胞死亡。牡蛎多肽支持的卵巢细胞保护和存活在调节死亡受体BCL-2依赖性信号通路时被激活。因此,适当的蛋白质和肽摄入可能是影响卵巢早衰进展和严重程度的潜在途径。
维生素是一类仅来自食物的微量有机物质,在人体内维持一些重要的生理活动和功能。它们不提供能量,但调节代谢过程。许多维生素在支持女性健康方面发挥着关键作用,如维生素B、C、D、E和一些辅酶。


Han Q, et al., Front Microbiol. 2022
烟酸:改善卵泡发育,保护卵巢
烟酸属于维生素B家族,代谢细胞能量,并直接影响正常生理。除了许多神经和皮炎疾病外,烟酸还通过抑制氧化应激来改善卵泡发育,从而减少卵巢细胞死亡。
有趣的是,烟酸还能够改变卵巢早衰表型并恢复化疗或辐射刺激诱导的雌性卵巢早衰小鼠。作者进一步证实,添加10 Mmol烟酸可以降低卵泡阻滞标记FOXO3的表达水平,并增加卵母细胞标记DDX4的表达水平以发挥卵巢保护作用。
叶酸:妊娠率更高,提高卵母细胞的质量和成熟度
叶酸是一种水溶性维生素B,对蛋白质合成、红细胞分裂和生长很重要。
一项基于小样本的临床研究报告称,与安慰剂治疗相比,低生育率女性在接受400μg叶酸治疗12周后的妊娠率更高。叶酸的摄入缩短了健康女性的备孕时间,并提高了卵母细胞的质量和成熟度。
MTHFR可以强烈影响叶酸循环,并帮助同时患有非霍奇金淋巴瘤和重复妊娠损失的卵巢早衰患者成功分娩出健康的男婴。
维生素C:显著刺激卵巢标志物的表达
维生素C是一种天然抗氧化剂,并积极参与干细胞调节。
据报道,维生素C修饰人羊膜上皮细胞(hAECs)的生物学特性,并显著刺激移植POI小鼠卵巢组织中卵巢标志物的表达。
注:羊膜细胞通俗地说就是包裹羊水的那层透明薄膜上的细胞。
可能的影响机制是维生素C依赖的几种重要生长因子的旁分泌,如肝细胞生长因子和表皮生长因子。
维生素D:有争议
维生素D属于脂溶性维生素,通过调节钙和磷酸盐代谢对维持生命至关重要。其活性形式1,25-二羟基维生素D3定位于许多器官,如肾脏、肝脏、大脑和卵巢。在女性生殖系统中,维生素D可以调节颗粒细胞中的抗苗勒氏激素(AMH)分泌,从而影响FSH水平。
然而,它在卵巢早衰发病机制中的作用是有争议的,因为一些人声称它不影响卵巢早衰的病理生理过程。
而另一些人则报告维生素D缺乏与凝血相关,是由于卵泡发育不良和芳香化酶水平降低而导致卵巢早衰的主要因素。
先前的研究也没有报告任何关于补充维生素D治疗卵巢早衰的证实性发现。研究发现,在约2个月内,每周摄入50000 IU的维生素D与临床上的妊娠改善无关。提高卵子受体患者的血清维生素D水平也不能改善IVF结局。
因此,维生素D对卵巢早衰患者的意义的解释仍然模糊,仍需进一步调查。
维生素E:增加卵巢体积并刺激初级卵泡的增殖
维生素E主要由生育酚和生育三烯醇组成,它们在生理和病理条件下对清除自由基很重要。维生素E缺乏可能导致雌性啮齿动物模型中的卵巢细胞死亡和发育异常。
在一项临床研究中,在40名患者中,维生素E与卵巢早衰的发病有关。在月经正常的女性中,维生素E-α生育酚的活性形式浓度显著高于卵巢早衰患者。进一步分析表明,这可能与AMH表达水平降低有关,并表明卵巢储备能力在卵巢早衰发病机制中受到损害。
在另一项随机对照试验研究中,向卵巢早衰患者服用400IU的维生素E 3个月,除改善AMH水平外,还显著增加了窦卵泡数和平均卵巢体积。
补充维生素E可能有助于缓解卵巢早衰过程,几乎不会产生副作用。
植物雌激素确实不是雌激素的一部分,但通过提供高亲和力的雌激素受体β作为激素补充剂,其功能类似。


Han Q, et al., Front Microbiol. 2022
它们通常包括大豆异黄酮和芝麻木脂素,这两种都是我们日常饮食中重要和普通的食物类型。几项研究证实了植物雌激素消耗对绝经后女性TC、LDL和血脂的降低作用。
大豆异黄酮摄入也显著缓解了髂动脉动脉粥样硬化,绝经前后5年内食用大豆食物的女性减少了冠状动脉斑块的大小。对于绝经后开始以大豆食品作为日常饮食的人来说,这种有益效果并不明显。
研究人员指出,大豆异黄酮可以通过卵巢切除术减少更年期啮齿动物的潮热。该效应基于肠道微生物群和雌激素样机制产生的异丙戊酸雌马。
芝麻籽木脂素(芝麻籽油中的一种成分)在小鼠模型中增加了脂肪酸的β-氧化,并抑制了胆固醇的吸收。芝麻酚是一种强抗氧化剂,也是芝麻的主要成分。它可以改善记忆,减轻焦虑情绪,减少中枢神经系统中的氧化剂损伤。同时,与卵巢切除后的绝经大鼠相比,芝麻酚还通过降低血清中肿瘤坏死因子-α(TNF-α)浓度来调节血清中的脂质成分,并降低炎症效应。
益生菌、益生元和合生元


Han Q, et al., Front Microbiol. 2022
益生菌促进营养物质的消化和吸收,提高免疫功能,维持肠道菌群的结构平衡,并增强人体的抗氧化水平。许多益生菌应用于食品补充剂和医疗。对于女性健康,激素水平与肠道或阴道微生物群之间存在密切相关性。
在平滑肌瘤和乳腺癌患者中,肠道微生物群被视为雌激素的替代代谢供应商,主要富含大肠杆菌、梭状芽孢杆菌、乳酸杆菌和拟杆菌。
考虑到这些现象,益生菌的调节作用也可以通过改变几种具有雌激素或抗雌激素性质的蔬菜成分(称为植物雌激素,如大豆异黄酮、木脂素等)的代谢活性和效率以间接方式调节肠道微生物群来发挥。
益生菌参与调节经前综合征、泌尿生殖道感染和骨质疏松症。雌激素缺乏是与卵巢早衰后骨炎症和吸收相关的骨质疏松症的主要原因。
先前的研究表明,肠道微生物群对骨形成和代谢有潜在影响。在接受益生元治疗的小鼠、大鼠和鸟类中发现骨骼增加。
在体外和去卵巢的啮齿类动物研究中,益生菌罗伊氏乳杆菌抑制了骨髓CD4+T淋巴细胞的上调和随后的破骨细胞活化。研究人员假设罗伊氏乳杆菌可以直接使T细胞失活并抑制TNF-α的产生,并通过T细胞间接使基质细胞失活以减少破骨细胞因子的形成,从而增加骨代谢活性并减少骨损失。
在一项由60名40至60岁绝经后妇女组成的随机对照试验中,益生菌还增强了异黄酮的代谢活性,以缓解泌尿生殖系统问题,如阴道干燥和绝经后的不良性体验,连续治疗16周。该效果与低剂量阴道雌激素相当,后者是治疗更年期泌尿生殖系统综合征的金标准疗法。
研究人员在一项为期12周的随机临床试验中报告,1×1010菌落形成单位(CFU)浓度的多菌益生菌影响肠道通透性和心脏代谢参数,如脂多糖水平、胰岛素、葡萄糖、尿酸、脂肪质量、皮下脂肪和胰岛素抵抗指数。
研究人员在一项试点临床研究中发现,乳酸杆菌和蔓越莓提取物复合物可以防止女性患者在绝经前或绝经前后连续26周反复发生尿路感染。
益生元是发酵的膳食纤维,其在肠道微生物群的成分和/或生物活性方面都含有一定的修饰,对人体健康状况产生有益影响。目前,益生元主要包括双歧杆菌、不易消化的低聚糖(尤其是低聚半乳糖、菊粉及其水解产物低聚果糖)。
大量的营养益生元可能有助于钙的生物吸收,如酪蛋白磷酸肽(CPP),酪蛋白的蛋白水解产物,与钙一起构建可溶性复合物。此外,一些复杂的有机酸,如苹果酸或柠檬酸,可以增加肠道中生物可吸收钙的可溶性复合物的百分比。
益生元依赖性钙代谢的潜在机制包括来自结肠中细菌发酵碳水化合物的酸代谢产物,如乳酸、乙酸和丙酸,降低了pH值,以提高钙离子的管腔水平,并增加钙的被动生物吸收。此外,电荷可以通过Ca2+-H+复合物进行修饰。因此,益生元在女性绝经后骨质疏松症的预防和抑制中发挥了保护作用。
研究人员表明,壳聚糖和柑橘果胶这两种益生元增强了葡萄糖耐量,降低了血脂异常,并提高了血清精氨酸、丙酸、亮氨酸和丁酸水平。此外,壳聚糖更有助于调节肠道微生物群,从而影响绝经后症状。
还尝试将益生菌和益生素结合起来生产合生元。研究人员表明,副干酪乳杆菌和菊粉增强了异黄酮的生物活性可用性,有助于缓解更年期问题。
使用由发酵乳杆菌和花椰菜蘑菇中的β-葡聚糖组成的合生元作为益生菌和益生元,可以降低啮齿动物尾巴的皮肤温度,并保持血清和子宫指数中的17β-雌二醇水平。合生元依赖性机制进一步得到验证,因为它们激活了肝脏胰岛素信号,随后在雌激素缺乏大鼠中激活了AMPK磷酸化。
这些研究初步反映了益生菌、益生元和合生元在调节更年期综合征及其主要病理生理过程中的有益作用。这些发现对于研究卵巢早衰的发病机制和通过微生物营养策略治疗卵巢早衰至关重要。
营养对女性一生的健康至关重要,膳食营养素可以通过影响各个方面来延缓更年期,从直接提高卵巢活力和功能到抵消氧化应激、炎症、衰老和系统性内分泌失调。
越来越多的证据表明肠道菌群的改变与卵巢早衰相关,可能通过影响一些重要代谢物影响卵巢疾病进展,至于是否会导致血清代谢物失衡,进而导致更年期表现和相关健康问题,仍有待进一步验证。
从目前的研究来看,膳食和微生物营养素对于调节卵巢早衰等女性生殖障碍很重要且很有前途,因此,通过合理饮食、最佳生活方式对菌群进行干预是有希望的,值得更多研究人员的关注,希望为广大女性带来更健康的生活。
主要参考文献:
Han Q, Chen ZJ, Du Y. Dietary supplementation for female infertility: Recent advances in the nutritional therapy for premature ovarian insufficiency. Front Microbiol. 2022 Nov 17;13:1001209. doi: 10.3389/fmicb.2022.1001209. PMID: 36466679; PMCID: PMC9712792.
Chon SJ, Umair Z, Yoon MS. Premature Ovarian Insufficiency: Past, Present, and Future. Front Cell Dev Biol. 2021 May 10;9:672890. doi: 10.3389/fcell.2021.672890. PMID: 34041247; PMCID: PMC8141617.
Zhang X, Lu Y, Wu S, Zhao X, Li S, Zhang S, Tan J. Estimates of global research productivity in primary ovarian insufficiency from 2000 to 2021: Bibliometric analysis. Front Endocrinol (Lausanne). 2022 Oct 26;13:959905. doi: 10.3389/fendo.2022.959905. PMID: 36387882; PMCID: PMC9645456.
Wu J, Zhuo Y, Liu Y, Chen Y, Ning Y, Yao J. Association between premature ovarian insufficiency and gut microbiota. BMC Pregnancy Childbirth. 2021 Jun 5;21(1):418. doi: 10.1186/s12884-021-03855-w. PMID: 34090383; PMCID: PMC8180047.
Takahashi A, Yousif A, Hong L, Chefetz I. Premature ovarian insufficiency: pathogenesis and therapeutic potential of mesenchymal stem cell. J Mol Med (Berl). 2021 May;99(5):637-650. doi: 10.1007/s00109-021-02055-5. Epub 2021 Feb 27. PMID: 33641066.
Kim S, Lee SH, Min KJ, Lee S, Hong JH, Song JY, Lee JK, Lee NW, Lee E. Females with impaired ovarian function could be vulnerable to environmental pollutants: identification via next-generation sequencing of the vaginal microbiome. J Obstet Gynaecol. 2022 Jul;42(5):1482-1488. doi: 10.1080/01443615.2021.2006162. Epub 2022 Jan 7. PMID: 34996320.
Wu J, Ning Y, Tan L, Chen Y, Huang X, Zhuo Y. Characteristics of the vaginal microbiome in women with premature ovarian insufficiency. J Ovarian Res. 2021 Dec 8;14(1):172. doi: 10.1186/s13048-021-00923-9. PMID: 34879874; PMCID: PMC8655991.
Wen J, Feng Y, Yan W, Yuan S, Zhang J, Luo A, Wang S. Vaginal Microbiota Changes in Patients With Premature Ovarian Insufficiency and Its Correlation With Ovarian Function. Front Endocrinol (Lausanne). 2022 Feb 22;13:824282. doi: 10.3389/fendo.2022.824282. PMID: 35273569; PMCID: PMC8902819.

谷禾健康

疫苗是公共卫生领域最伟大的成就之一,每年可预防数百万儿童疾病和死亡病例。然而,许多疫苗的功效在地理和社会经济不同地区的婴儿之间可能存在很大差异。
有研究发现,肠道微生物组组成的差异已成为解释免疫结果差异的主要因素之一。
在本篇文章中,谷禾总结了各位学者的研究。关于肠道微生物群对生命早期免疫的影响,重点关注微生物群中具有促进健康和免疫调节特性的两个重要成员:双歧杆菌和拟杆菌。
此外还罗列了一些具有免疫刺激特性的微生物产物、与宿主的相互作用以及它们对婴儿疫苗反应和功效的影响。
通过本文,可以让大家更好地了解肠道微生物对免疫接种的影响,让人们更有针对性地选择免疫接种,更好地保护我们的健康。
本文出现的专业名词
疫苗是指用各类病原微生物制作的用于预防接种的生物制品。其中用细菌或螺旋体制作的疫苗亦称为菌苗。疫苗分为活疫苗和死疫苗两种。
常用的疫苗:常用的活疫苗有卡介苗,脊髓灰质炎疫苗、麻疹疫苗、鼠疫菌苗等;常用的死疫苗有百日咳菌苗、伤寒菌苗、流脑菌苗、霍乱菌苗等。
免疫球蛋白(Ig)——指具有抗体活性或化学结构,与抗体分子相似的球蛋白
辅助T细胞(Th细胞)在免疫反应中扮演中间过程的角色:它可以增生扩散来激活其它类型的产生直接免疫反应的免疫细胞
调节性T细胞(Tregs)是维持机体免疫耐受的重要因素之一,通过主动调节的方式抑制存在于正常机体内潜在的自身反应性T细胞的活化与增殖,从而调节机体的免疫力
G蛋白偶联受体(GPCRs)是一大类膜蛋白受体的统称
Toll样受体(TLR)是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,表达在巨噬细胞、树突状细胞和上皮细胞表面,可识别多种类型的病原体相关分子模式或损伤相关分子模式
人类胃肠道微生物群由细菌、病毒、古生菌和真菌组成的复杂群落,其组成沿胃肠道长度变化。
微生物定植在出生时开始,并在整个生命过程中不断变化,生命的前1000天是生态系统结构最脆弱和最不稳定的时期。
✦胃肠道微生物对健康至关重要
胃肠道微生物群有助于粘膜和全身免疫系统的成熟,抵抗病原体定植,消化膳食成分,并提供微量营养素。
胃肠道微生物群的结构和功能紊乱与各种疾病有关,包括代谢紊乱、神经退行性疾病,过敏,自身免疫性疾病,和癌症。
值得注意的是,影响微生物组的因素与影响疫苗免疫反应的因素相似,强调了免疫与胃肠道微生物群之间的相互关系。
在生命早期,影响胃肠道微生物群发育的其他因素是分娩方式,早产,营养(母乳与配方奶),早期使用抗生素或益生菌和卫生等。
✦ 分娩方式对早期微生物群的影响
在出生期间和出生后,婴儿会接触到促进免疫系统成熟的环境抗原和微生物,其性质取决于分娩方式。
●阴道分娩
阴道分娩的婴儿暴露于母体阴道和粪便微生物群中,导致微生物分布以埃希氏菌、乳酸杆菌、拟杆菌和双歧杆菌为主。
●剖宫产分娩
相比之下,剖宫产分娩的新生儿与母体皮肤和医院微生物的接触更多,并且经常被链球菌、葡萄球菌和肠球菌定植。
✦早期用抗生素对免疫系统发育有负面影响
早期使用抗生素治疗会对这种最初的定植和随后的免疫系统发育产生负面影响。这些早期生活障碍会在短期内导致感染风险增加。从长远来看,与免疫和代谢相关疾病(如特应性)的风险增加有关。
因此,在正确的时间由正确的微生物定殖对于有效建立免疫防御和稳态至关重要。
✦母乳喂养对肠道微生物群有益处
母乳喂养提供了抗菌肽、母体抗体和先天免疫因子,它们促进了对新生婴儿的被动保护,并提供了塑造婴儿微生物群的关键膳食成分。
人乳寡糖可增强双歧杆菌的定殖和持久性(占总微生物群落的80%),这在以配方奶喂养的婴儿中不太明显(5-30%)。
人乳寡糖(HMOs)是人类母乳中仅次于乳糖和脂肪的第三大固体成分,有助于预防人类细胞、组织和小鼠中的链球菌感染。
人乳寡糖的微生物代谢导致短链脂肪酸的产生,短链脂肪酸被与膜结合的特定G蛋白偶联受体识别,由免疫细胞在全身和胃肠道中表达,是关键用于发展免疫耐受性。母乳还直接通过母乳微生物组引入微生物,从而进一步播种婴儿肠道。
断奶和从母乳或以配方食品为基础的营养过渡到固体食物推动了胃肠道微生物群的重大变化,双歧杆菌种类减少,并引入了瘤胃球菌、阿克曼氏菌和普雷沃氏菌。
✦疫苗效果存在差异
许多许可疫苗的功效在人群之间存在差异,在某些情况下,转化为几乎没有效果。
许多内在因素导致疫苗反应的这种变异性,包括年龄、遗传(占受者之间变异的 20-40%)、贫血和性别。
此外,广泛的外部因素会极大地影响疫苗接种结果,包括疫苗成分和免疫方案,预先接触病原体和慢性炎症,暴露于母体抗体,营养状况和地理位置等。
✦肠道微生物有助于促进免疫
人们越来越认识到婴儿胃肠道微生物群在疫苗免疫中的作用。胃肠道微生物群已被证明可通过多种机制促进对疫苗的体液和细胞免疫反应的有效刺激。
肠道微生物群的免疫调节
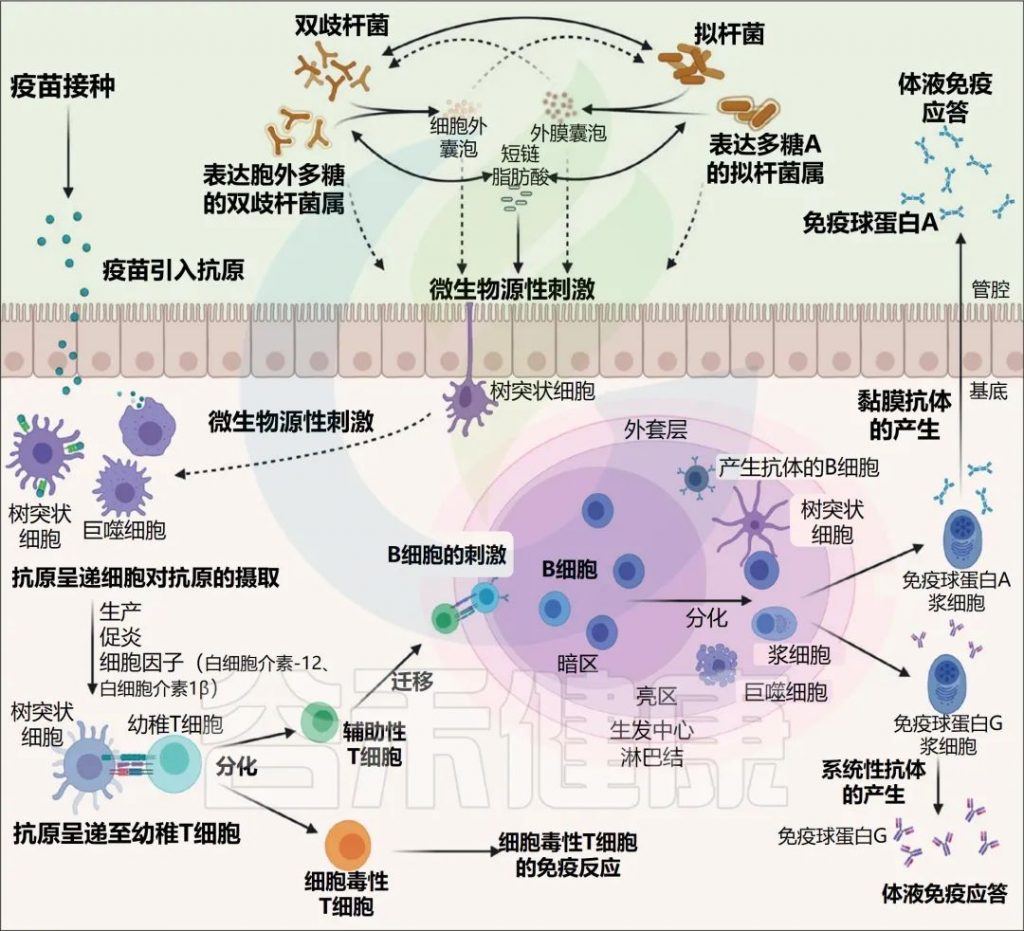

Jordan A,et al.Lancet Microbe.2022
微生物群刺激对于产生免疫球蛋白 (IgA) 的B细胞的发育和成熟、通过促进IgA类别转换的记忆浆细胞以及生发中心的发育至关重要。此外,通过介导浆细胞样树突状细胞产生I型干扰素,微生物群增强了抗原特异性T细胞反应。
肠道微生物群和免疫系统之间的共生关系,以及遗传和环境影响,可以解释个体对疫苗的免疫反应的可变性。
抗生素引起的新生小鼠微生物组紊乱,以及使用免疫缺陷的无菌幼崽,导致对不同佐剂和减毒活疫苗的体液反应受损,其特征是Th1和Th17反应降低,IgG和IgM生产。
注:辅助性T细胞1(Th1)主要为对抗细胞内细菌及原虫的免疫反应。
辅助性T细胞17(Th17)是一种新发现的能够分泌白介素17的T细胞亚群。
IgG是免疫球蛋白G,是免疫球蛋白中的一种,来源于浆细胞,具有抗病毒、抗菌和免疫调节的功能。
IgM是免疫球蛋白M,由于B淋巴细胞在抗原如病毒或细菌等病原微生物等的刺激下转化为浆细胞,产生能与相应抗原发生特异性结合的抗体,而形成免疫球蛋白。
值得注意的是,在通过施用特定的鞭毛大肠杆菌菌株或粪便微生物群转移来恢复微生物群后,这种损害是可逆的。
某些细菌科、属和物种的丰度与人类对疫苗的免疫反应差异有关,无论是正面的还是负面的。
// 不同地区间的研究
对来自加纳、巴基斯坦、孟加拉国和荷兰的接种轮状病毒疫苗的有反应和无反应儿童的微生物谱比较研究表明,与同一队列的无应答者相比,来自不同低收入和中等收入国家的应答者的微生物群组成与荷兰婴儿微生物群更为相似(即梭菌群XI和变形菌的丰度更高,拟杆菌门的数量更低)。
小结
由于胃肠道微生物组在激活和抑制免疫反应以及随后对疫苗免疫的影响方面具有多因素作用,因此研究不同的微生物群调节干预措施以最大限度地提高疫苗效力。
益生元、益生菌和抗生素
益生元——指一些不被宿主消化吸收却能够选择性地促进体内有益菌的代谢和增殖,从而改善宿主健康的有机物质。
益生菌——通过定殖在人体内,改变宿主某一部位菌群组成的一类对宿主有益的活性微生物。
✦益生元和益生菌对疫苗免疫有积极作用
对小鼠接种流感和霍乱疫苗的研究报告表明,不同的益生元与疫苗接种后的全身免疫反应之间存在正相关,与双歧杆菌和乳酸杆菌的丰度增加以及短链脂肪酸的产生有关。
已经研究了它们对疫苗接种反应的影响。系统评价总结了26项使用益生菌对人类进行干预研究的结果,以提高17种不同疫苗的功效,其中一半的研究显示出积极的结果。
婴幼儿使用益生菌效果更好
与成人相比,在新生儿和幼儿(0-16 周龄)中使用益生菌乳酸杆菌和双歧杆菌菌株的试验显示成功率更高,接种流感、白喉、轮状病毒和脊髓灰质炎疫苗后对体液免疫的影响最大。
然而,不同研究(包括使用的细菌菌株)的设计缺乏一致性,因此难以得出可靠的结论。
✦抗生素对疫苗的影响暂不明确
抗生素——指由微生物(包括细菌、真菌、放线菌属)或高等动植物在生活过程中所产生的具有抗病原体或其他活性的一类次级代谢产物,能干扰其他生活细胞发育功能的化学物质。
人体研究调查了抗生素介导的微生物耗竭对流感、脊髓灰质炎、轮状病毒、破伤风和卡介苗免疫反应的影响。没有观察到疫苗免疫原性改善或显著降低,这与抗生素使用、微生物群紊乱和免疫介导疾病的增加有关。
总之,某些细菌种类与婴儿疫苗应答者的体液或细胞免疫呈正相关或直接诱导增强。双歧杆菌是增强疫苗接种反应的良好候选者,也是健康早期肠道微生物群的关键成员。
其他可以刺激先天和适应性免疫反应的核心肠道微生物群成员,如拟杆菌属,也正在成为疫苗研究中的新型微生物群疗法。
扩展阅读:抗生素对微生物组及对人体健康的影响
双歧杆菌和拟杆菌的免疫调节
✦ 双歧杆菌减少炎症
在小鼠肥胖模型中,给予假链状双歧杆菌通过恢复调节性T细胞 (Treg) 和B淋巴细胞的平衡状态来减少全身炎症,并降低促炎细胞因子白细胞介素IL-17A和肿瘤坏死因子TNF的浓度。
白细胞介素——指在白细胞或免疫细胞间相互作用的淋巴因子,它和血细胞生长因子同属细胞因子。两者相互协调,相互作用,共同完成造血和免疫调节功能。
肿瘤坏死因子——血清中出现一种能使多种肿瘤发生出血性坏死的物质。
类似的免疫稳态特性已归因于双歧杆菌菌株,其通过体外刺激树突状细胞,诱导Th17谱并增强Treg细胞从幼稚淋巴细胞的分化。
双歧双歧杆菌DSM 20082裂解物刺激外周T细胞可增加CD8+ T细胞的细胞毒活性,而对CD4+ T细胞活性没有任何影响。
尽管支持这些免疫调节特性的机制尚不清楚,但已经提出了几个目标。
包括膳食发酵产物(例如,在人乳寡糖和其他复合碳水化合物代谢后),导致产生短链脂肪酸(即乙酸盐)和其他代谢副产物,这些副产物直接与宿主免疫细胞受体相互作用并促进其他共生体的交叉喂养细菌,如拟杆菌属和大肠杆菌。
长双歧杆菌亚种产生免疫调节化合物和蛋白质,如细胞外蛇毒蛋白,它不可逆地灭活促炎蛋白酶。
双歧杆菌MIMBb75之前已经证明其表面有肽聚糖水解酶TgaA,它通过启动白细胞介素-2生成和单核细胞衍生的树突状细胞激活,促进调节性T细胞扩增。
●双歧杆菌增强了免疫抗病毒反应
在新生仔猪中,长双歧杆菌AH1206菌株增强了肠道IL-10的产生,而动物双歧杆菌亚种乳酸Bb12、婴儿双歧杆菌MCC12和短双歧杆菌MCC1274促进了免疫成熟和免疫稳态。
更重要的是,MCC12和MCC1274 菌株在接种轮状病毒疫苗后增强了B细胞和抗病毒反应,表明双歧杆菌的免疫改变特征对某些菌株具有特异性。
●放线菌和双歧杆菌对人体免疫反应起促进作用
在人类中,几项研究强调了高丰度放线菌门和某些双歧杆菌菌株与对不同疫苗的免疫反应增加之间的正相关关系。
孟加拉婴儿胃肠道微生物组中高浓度的婴儿长双歧杆菌亚种与CD8+ T 细胞和CD4+ T 细胞反应增加以及接种卡介苗、破伤风和乙型肝炎疫苗后IgG滴度升高相关。
接种卡介苗、破伤风和乙型肝炎疫苗后,IgG滴度更高,在口服脊髓灰质炎疫苗接种后,双歧杆菌丰度高的中国婴儿表现出脊髓灰质特异性IgA应答增加。在疫苗补充研究中,B.longum BB536显示通过诱导干扰素-γ分泌来增强婴儿的Th1反应。
干扰素-γ——免疫干扰素,是由有丝分裂原刺激T淋巴细胞产生的。干扰素是一种高效的抗病毒生物活性物质,又是一种具有广泛免疫调节作用的淋巴因子。
扩展阅读:如何调节肠道菌群?常见天然物质、益生菌、益生元的介绍
✦拟杆菌影响疫苗免疫反应
拟杆菌属是婴儿期肠道定植的主要属,并且在整个成年生活中占主导地位。某些物种和菌株具有重要的互惠作用,从产生抗菌分子到通过分解不同聚糖提供营养。
关于拟杆菌和疫苗的反应性,存在相互矛盾的结果:
在加纳进行的轮状病毒试验发现,疫苗应答与拟杆菌门丰度呈负相关,而对巴基斯坦婴儿的一项类似研究显示,疫苗应答者中拟杆菌门的浓度增加。
观察到尼加拉瓜婴儿的疫苗反应者和无反应者中不同拟杆菌菌株的丰度存在差异。
注:由于样本量小,这些发现在多次调整后没有统计学意义,强调需要进行更大规模的研究来探索这些关联。
考虑到拟杆菌在诱导稳态免疫启动中的突出作用,可以预期拟杆菌和疫苗反应之间存在联系。
Bacteroides thetaiotaomicron中独特的寡糖结构具有佐剂特性,以依赖CD4+ T 细胞的方式诱导由乙型肝炎病毒疫苗引发的乙型肝炎病毒抗原特异性抗体浓度升高,这表明这种寡糖可作为大肠杆菌中毒性更大的脂多糖的替代佐剂。
短链脂肪酸是由肠道微生物群的不同成员通过发酵膳食复合碳水化合物(包括母乳或益生元中的碳水化合物)产生的。
短链脂肪酸在其一元羧酸碳链中含有少于六个碳原子,其中醋酸盐 (C2)、丙酸盐 (C3) 和丁酸盐 (C4) 最为普遍。它们是水溶性的,可以直接被不同的细胞吸收、转运或相互作用,包括肠上皮细胞、交感神经元和免疫细胞。
✦ 短链脂肪酸的多种益处
它们提供许多有益的健康影响,包括肠细胞的能量来源、加强上皮屏障、改变代谢过程、抑制肠道病原体生长、离子吸收的介质,以及作为肠道和全身免疫调节途径中的信号分子。
双歧杆菌和拟杆菌产生的乙酸,以及拟杆菌产生的丙酸盐,将在下面更详细地讲述。
●作为主要能源
乙酸盐可以酶促转化为乙酰辅酶A,并被许多不同的微生物群成员用来生产丁酸盐,并作为三羧酸循环中的主要能源。
●激活调节免疫细胞,增强疫苗反应
T细胞中细胞内乙酰辅酶A的增加会激活mTOR,从而驱动Th1和Th17 T细胞的分化。乙酸盐还可以激活B细胞、T细胞亚群、中性粒细胞、巨噬细胞、树突细胞和肠上皮细胞上表达的G蛋白偶联受体43(GPR43),导致固有层调节性T细胞增殖,和调节自身抗体的产生和边缘区B细胞。
mTOR是一种丝氨酸/苏氨酸蛋白激酶,对激素、生长因子、营养物质,能量和压力信号做出反应,是细胞代谢,生长和存货的中心调节因子。
GPR43的激活影响中性粒细胞趋化性和脱粒,以及脂肪组织中巨噬细胞产生肿瘤坏死因子。此外,缺乏GPR43的树突细胞无法诱导B细胞的类别转换。
没有产生短链脂肪酸的胃肠道细菌的小鼠的浆细胞分化减少,并且在稳态和病原体特异性抗体反应方面存在缺陷。乙酸盐可通过在体外增强针对霍乱毒素的抗原特异性IgA和IgG的产生以及刺激浆细胞分化所必需的树突状细胞中的信号分子来增强疫苗反应。
●改变巨噬细胞浓度
丙酸盐诱导小鼠调节性T细胞的分化和增殖以及白细胞介素10的表达。丙酸盐激活GPR15和GPR43还通过降低组蛋白去乙酰化酶6和9的表达以及抑制 NF-κB信号传导来增加结肠调节性T细胞的浓度。
丙酸盐激活GPR41会改变骨髓造血功能,导致巨噬细胞和树突状细胞前体浓度升高,并扭曲Th2分化。
✦短链脂肪酸是流感疫苗的潜在佐剂
一项调查短链脂肪酸对甲型流感病毒感染影响的研究揭示了短链脂肪酸(包括丙酸盐)通过激活GPR43来限制感染严重程度和伴随的肺炎球菌二重感染的重要作用。
GPR43被认为是甲型流感病毒进入的辅助受体
这意味着短链脂肪酸与该受体的结合抑制了病毒的进入和复制,这表明流感疫苗具有潜在的佐剂特性。
扩展阅读:你吃的膳食纤维对你有帮助吗?
胞外多糖是一些特殊微生物在生长代谢过程中分泌到细胞壁外、易与菌体分离、分泌到环境中的水溶性多糖,属于微生物的次级代谢产物。
胞外多糖是单糖或寡糖簇,包括形成同多糖或杂多糖的葡萄糖、果糖、半乳糖、岩藻糖和鼠李糖。
✦改变代谢物环境浓度,提供保护
这些可以分泌到肠道环境中或与亲本细菌的细胞壁有关。胞外多糖的表达增强了对宿主细胞的粘附,提供了对消化和环境压力的保护,并促进了生物膜的形成和胃肠道中的长期定植。
来自不同双歧杆菌菌株的胞外多糖可以被其他微生物发酵,从而改变代谢物环境和短链脂肪酸浓度。胞外多糖可以通过巨噬细胞和树突状细胞表面表达的特定模式识别受体(如TLR1、TLR2或TLR6)被识别为微生物相关的分子模式。
✦促进抗炎反应
受体的激活,取决于胞外多糖的化学物理特性(例如,分子量或电荷),导致产生不同的促炎和抗炎细胞因子谱,并以菌株特异性方式分别分化幼稚T细胞。
脆弱拟杆菌的表面多糖A可激活巨噬细胞上的Toll样受体2,并诱导调节性T细胞的扩增和抗炎白细胞介素10的产生,从而在病毒感染期间促进强烈的抗炎反应。
TLRs是一种模式识别受体家族,在先天免疫反应中起着重要作用。
✦增强对病毒的抵抗力
此外,多糖A激活结肠树突状细胞的Toll样受体2和肿瘤坏死因子分泌,增强了对病毒感染的天然抵抗力。
来自长双歧杆菌BCRC14634的胞外多糖被证明可增强巨噬细胞产生白细胞介素,与同基因的胞外多糖阴性突变体相比,来自B.longum亚种longum 35624的胞外多糖显示通过抑制促炎细胞因子产生来抑制促炎性Th17细胞的扩增。
在某些情况下,胞外多糖的存在与免疫沉默效应和逃避适应性B细胞反应有关,如在短双歧杆菌UCC2003中观察到的。
此外,这种双歧杆菌菌株和胞外多糖的存在也与较低丰度的促炎IFN-γ、肿瘤坏死因子和IL-12相关。
研究表明,青春双歧杆菌IF1-03通过增加巨噬细胞分泌IL-10来增加抗炎免疫反应,增加调节性T细胞浓度,这需要通过细胞外信号调节激酶或丝裂原活化蛋白激酶和NF-κB途径激活Toll样受体2和信号转导。
值得注意的是,在青春芽孢杆菌IF1-11产生的胞外多糖的情况下观察到相反的效果,它模拟巨噬细胞分泌高浓度的促炎性白细胞介素6、白细胞介素-17A 和转化生长因子-β,以及少量的白细胞介素10,随后将T细胞偏向Th17细胞。
转化生长因子-β(TGF-β)是属于一组新近发现的调节细胞生长和分化的TGF-β超家族
小结
这些研究展现了依赖于菌株的胞外多糖的免疫调节能力。以前使用乳酸杆菌的工作衍生的胞外多糖表明它们可以作为新型疫苗佐剂。因此,在特定疫苗接种后需要进一步测试关注拟杆菌和双歧杆菌相关胞外多糖的作用。
细菌细胞外囊泡是球形的膜衍生结构,大小从10纳米到 400 纳米不等,其中包含来自母细胞膜和周质的各种成分。
✦功能和分布
根据其膜组成和结构进行区分,其含量受环境因素(如培养条件或营养胁迫)的影响。这种影响可能导致DNA、RNA、脂多糖、酶、肽聚糖、毒素、信号分子、代谢物和毒力因子的数量和质量差异。
细菌细胞外囊泡并不局限于胃肠道,并且已在血液中检测到,它们可以从那里轻松进入不同的组织,包括大脑。
一项研究详细概述了不同的细菌膜外囊泡、它们的特性、功能和潜在应用。由共生细菌产生的细菌膜外囊泡有助于复杂微生物群落成员之间的合作和共养相互作用,并作为胃肠道微生物群成员与宿主之间跨界串扰的中介。
✦促进免疫反应
细菌细胞外囊泡可以激活免疫细胞并促进针对囊泡本身和亲代细胞的免疫反应。
膜脂、蛋白质(包括与微生物相关的分子模式)、危险信号和胞外多糖可以结合并激活模式识别受体和toll样受体,触发上皮细胞以外的不同免疫反应。
来自脆弱拟杆菌的囊泡携带荚膜多糖A,它激活黏膜下树突状细胞上的Toll样受体2,细胞外囊泡随后以肌动蛋白依赖性方式内化,导致白细胞介素10浓度增加和T细胞极化偏斜向调节性T细胞分化。
发现表明源于拟杆菌的胞外囊泡以物种特异性的方式在人类粘膜和血液树突状细胞中诱导白细胞介素10依赖性免疫调节反应。
✦为疫苗提供了多种可能性
细菌细胞外囊泡的非复制性及其内在的佐剂性、热稳定性以及对低pH值和酶降解的抵抗力,为疫苗设计和交付提供了多种可能性。
它们可以在不注射的情况下直接给药至粘膜部位(例如胃肠道和呼吸道),从而降低给药成本并降低与肠外分娩相关的潜在不良反应的风险。
此外,含有免疫原性成分的细菌细胞外囊泡可以促进强烈的先天性和适应性免疫反应,并提供大量针对传染病的保护。
✦呈递抗原,降低毒性
来自病原菌的细菌细胞外囊泡已成功用于疫苗制剂,一些针对霍乱弧菌和B Neisseria meningitidis的细胞外囊泡疫苗已获得许可,其中B Neisseria meningitidis疫苗显示出针对淋球菌的潜在跨物种保护作用。
其他研究表明,由微生物群成员产生的细菌细胞外囊泡,包括生物工程细菌细胞外囊泡,已被用于传递病原体的抗原。
源于拟杆菌的、表达不同鼠疫耶尔森菌抗原的细菌细胞外囊泡在体内诱导了特异性和强免疫反应,包括血清IgG和粘膜IgA,它们能够清除鼠疫感染。
来自突变的非致病性大肠杆菌的细菌细胞外囊泡对抗原特异性T细胞反应具有佐剂特性,并降低了毒性。
人类肠道微生物群正在成为疫苗反应性的重要决定因素,其中双歧杆菌和拟杆菌能够影响免疫和个体疫苗免疫反应。
这两个属是发育中的健康婴儿肠道微生物群的重要组成部分,但极易受到早期生活干扰的影响,例如剖腹产、配方奶与母乳以及抗生素的使用。
专注于这些促进健康的菌群,并利用它们的免疫调节特性,可能会导致更安全的方法来增强婴儿免疫力和疫苗效力。使用整个细菌或其产物和代谢物来调节免疫反应的新策略是可能的,例如在癌症中观察到对免疫检查点抑制剂的反应增强。
未来展望
对来自健康婴儿微生物组的关键菌株及其副产物和代谢物有更深入的了解和表征,可以催生新一代安全、无针和经济的疫苗促进疗法。关键特征,如剂量、疫苗设计和给药时间,将是重要的考虑因素。
主要参考文献:
Jordan A, Carding SR, Hall LJ. The early-life gut microbiome and vaccine efficacy. Lancet Microbe. 2022 Sep 8:S2666-5247(22)00185-9. doi:
10.1016/S2666-5247(22)00185-9. Epub ahead of print. PMID: 36088916.
Praharaj I, John SM, Bandyopadhyay R, Kang G.
Probiotics, antibiotics and the immune responses to vaccines.Philos Trans R Soc Lond B Biol Sci. 2015; 37020140144.
Ciabattini A, Olivieri R, Lazzeri E, Medaglini D.
Role of the microbiota in the modulation of vaccine immune responses.Front Microbiol. 2019; 101305.
Hill DL, Carr EJ, Rutishauser T, et al.Immune system development varies according to age, location, and anemia in African children.Sci Transl Med. 2020; 12eaaw9522.
Parker EPK, Bronowski C, Sindhu KNC, et al.Impact of maternal antibodies and microbiota development on the immunogenicity of oral rotavirus vaccine in African, Indian, and European infants.Nat Commun. 2021; 127288.

谷禾健康
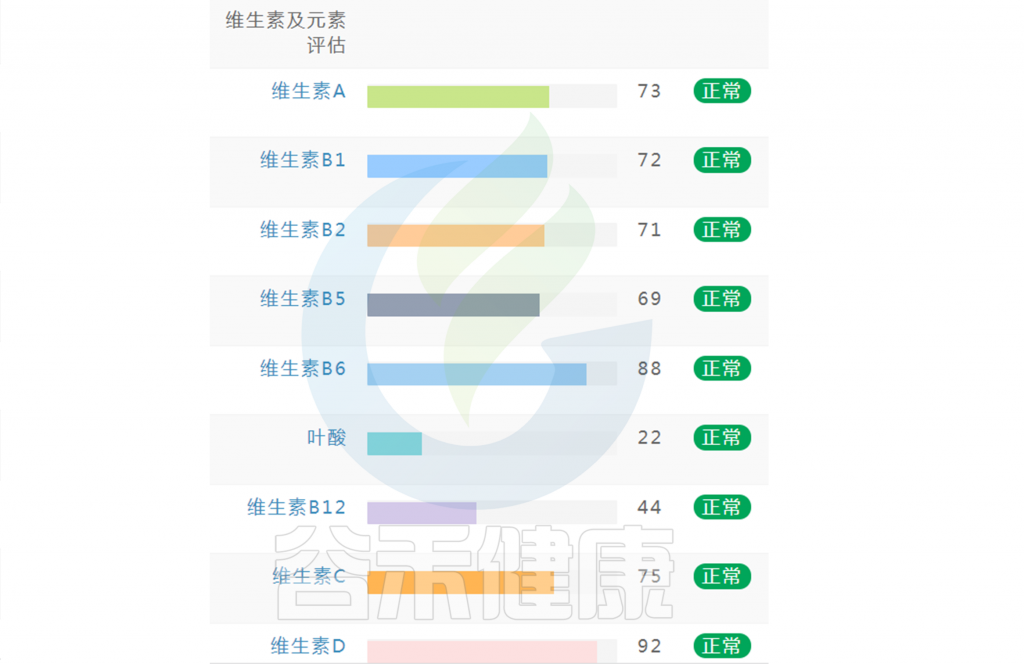
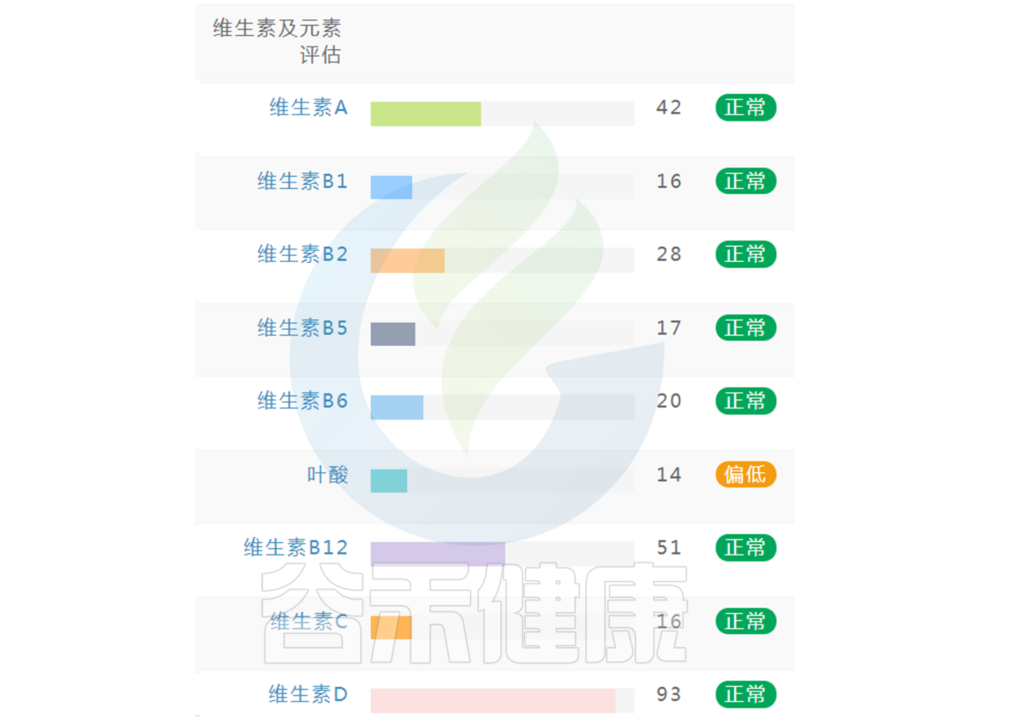
在谷禾肠道菌群健康检测中,我们会看到结果报告中关于维生素的评估如下:

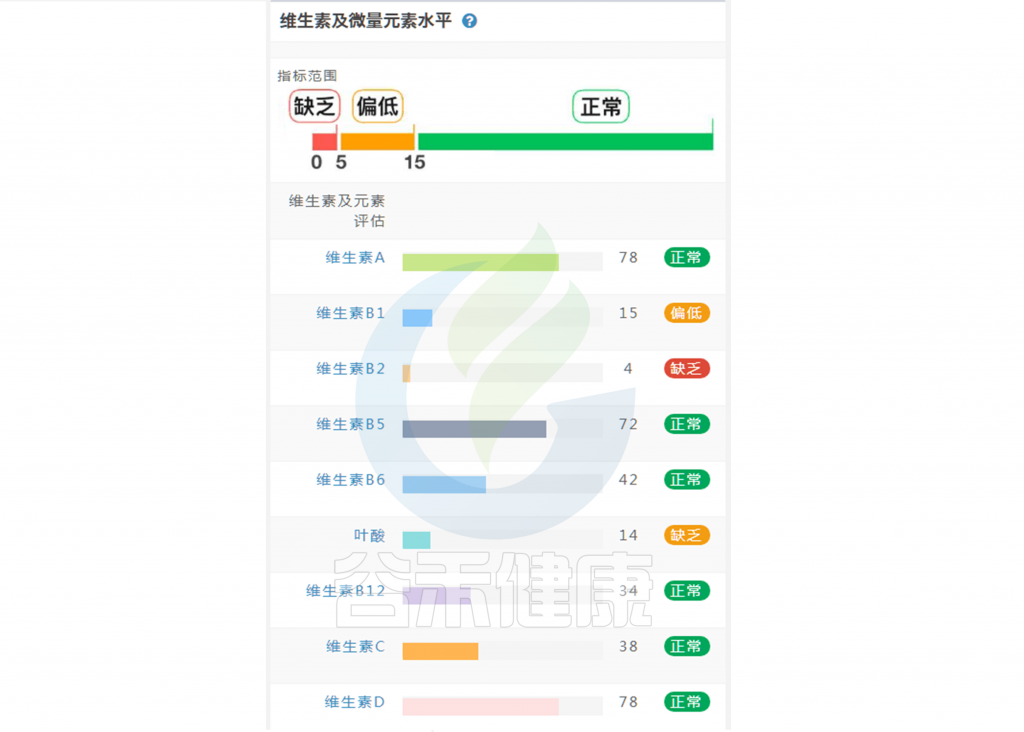
摄入水平建议保持在70-80分之间最佳,如果单项指标低于5表明摄入比例在人群中属于最低的5%,评估为缺乏,如上图中维生素B2;低于15评估为偏低,如上图中叶酸;达到或超过95则表明该项指标可能摄入比例偏高,可适当减少摄入;其余则为正常范围。
上图可以看到,像维生素C这项指标分值在38,虽然正常但相对于最佳来说是偏低的。
一些小伙伴可能会存在这样的疑惑:
为什么肠道菌群检测可以评估维生素?
这些维生素指标的分值代表着什么含义?
肠道菌群和维生素之间有什么样的关联?
它们如何影响人体健康/疾病?
如何判断维生素是否缺乏?
该如何补充?
…
本文就以上问题进行详细解答,同时也包括维生素-微生物群之间的相互作用,维生素维持肠道菌群稳态和减少肠道炎症以预防癌症的机制,产生维生素的益生菌,补充调节维生素的方式包括饮食、益生菌等。
在阅读本文之前,可以先了解一下各类常见的维生素功能,缺乏导致的症状。


每个维生素的详细介绍可以点开以下查看(请在谷禾健康微信公众号找到这篇文章查看)。
维生素B1(硫胺素)
维生素B2(核黄素)
维生素B3(烟酸)
维生素B5(泛酸)
维生素B6(吡哆醇)
维生素B7(生物素)
维生素B9(叶酸)
维生素B12(钴胺素)
以上每个都有关于该维生素的详细介绍,包括:
—正文—
维生素是一种微量营养素,在人体的生长、新陈代谢和发育中起着至关重要的作用。
在谷禾肠道菌群健康检测报告中,维生素分值即代表该维生素的膳食摄入水平和菌群代谢能力(报告中显示的分值是经过一系列计算得到的一个相对值)。
其中B族维生素很多需要通过肠道菌群对初始原料进行代谢之后才会产生,因此肠道菌群相应的基因和代谢途径的丰度水平也会直接反映这些维生素的摄入水平。
我们知道维生素的缺乏可能引起一些不良后果,导致维生素缺乏的原因有很多,摄入不足,吸收不良等都会导致维生素缺乏。
我们日常主要从饮食中获取维生素,肠道是主要吸收部位。例如,维生素 A 主要在近端空肠吸收,维生素 D 在远端空肠吸收最佳,维生素 E 和 K 主要在回肠吸收。因此,肠道功能受损可能会影响维生素的吸收。当然,影响维生素吸收的其他原因还包括年龄,某些疾病,药物等因素。
那么肠道菌群和维生素之间有什么关联?
肠道菌群是人体生理和健康的重要决定因素。肠道菌群帮助吸收营养,并参与维生素代谢。
肠道有益菌:乳酸菌和双歧杆菌,可以重新合成B族和K族维生素,为宿主提供约30%的每日摄入量。与从食物中获得的维生素不同,微生物产生的维生素主要在结肠中吸收。接下来了解一下具体哪些菌群,如何产生维生素。
前一章节我们知道,除了通过饮食提供维生素外,人体肠道中的细菌也可以产生一些维生素,如果吸收得当,可以部分满足人体的需要。
可以把这些细菌微生物想象成小小的维生素工厂。细菌确保为自己和与他们共生的微生物朋友提供维生素,同时也会为人体提供维生素。
合成的B族维生素的菌群较多
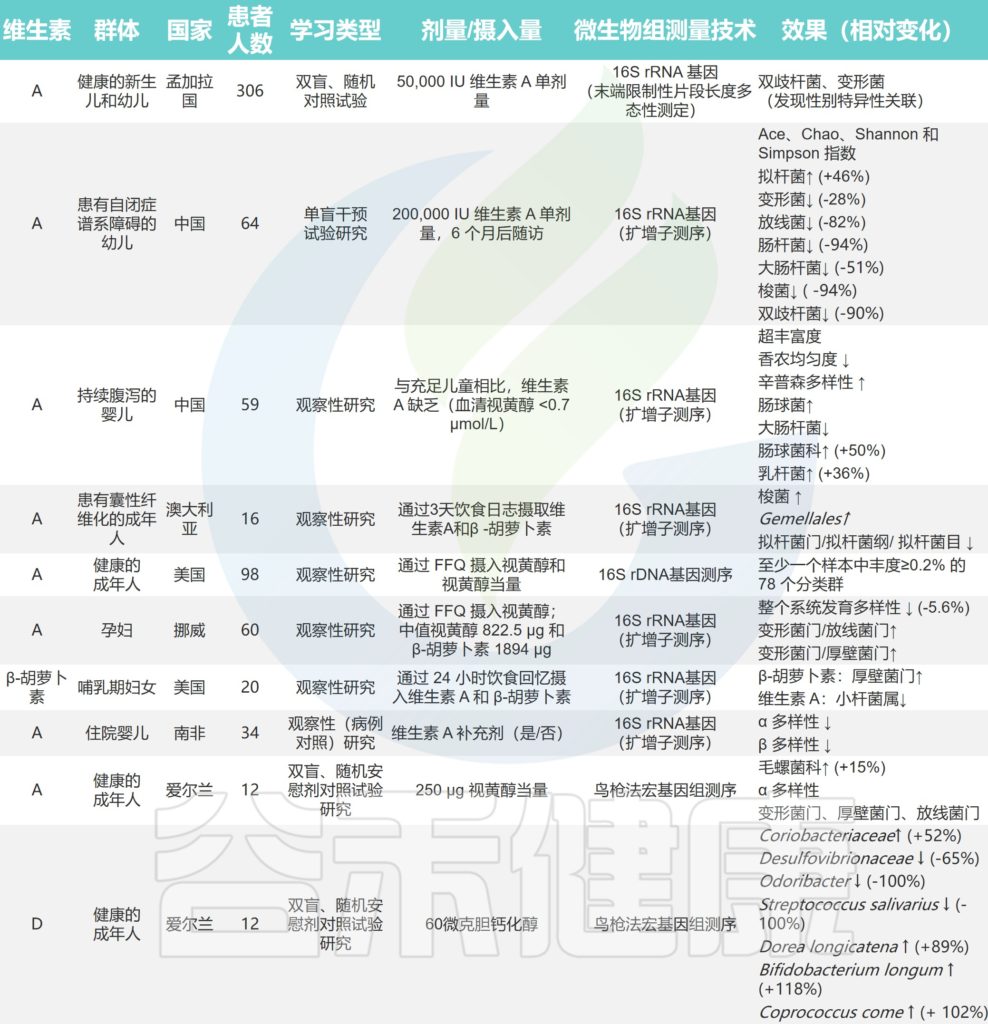
研究人员估计了人体肠道细菌可以提供维生素每日参考摄入量的百分比,得出的结论是可以提供:
40-65% 的人体肠道菌群具有合成 B 族维生素的能力。两种最常见的合成维生素是维生素B2和B3,预测分别有 166 和 162 个生产者。
可以合成 B 族维生素的细菌以及B 族维生素缺乏对肠道健康的影响
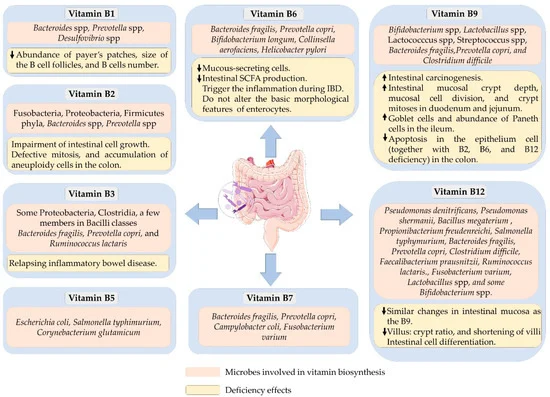
doi.org/10.3390/microorganisms10061168
大部分肠道菌群都参与维生素的合成
随着基因组注释方法的不断完善,研究人员可以预测维生素代谢途径并评估维生素生物合成潜力。通过检索 UniProt 数据库,研究人员发现:
厚壁菌门是维生素的主要代谢相关菌,其次是变形菌门,再然后是拟杆菌和放线菌。这四种菌群是人体肠道菌群的主要组成部分,占总菌群的60%-90%.
下表列出了参与合成B族维生素的肠道菌群,以及相应的代谢机制。


以上是肠道菌群对维生素产生的影响,而维生素和肠道菌群之间的作用是双向的,维生素也会影响肠道菌群,下一章节我们详细了解维生素对肠道菌群的影响。
维生素通过调节免疫力、细菌生长和新陈代谢来改变肠道微生物群的组成。
例如,膳食补充剂中的维生素 B、C、D 和 E 通过有利于双歧杆菌、乳酸杆菌和罗斯氏菌等有益菌属的肠道黏膜扩张和定植,在很大程度上有助于微生物组的组成。
肠道微生物组和宿主之间的微量营养素交换
doi: 10.1002/biof.1835
一项研究调查了 96 名健康志愿者,结果表明:
补充维生素 B2 后肠道微生物的种类数量显着增加;联合补充维生素 B2 和 C 导致Sutterella显着减少,但Coprococcus数量增加;
维生素C显着提高肠道微生物的α多样性;
服用维生素D后,促进放线菌的生长和抑制拟杆菌的生长。
补充维生素对人体肠道菌群的影响

doi.org/10.3390/nu14163383
/ 维生素A /
维生素 A 的充足状态可能与微生物多样性增加有关。在小鼠实验中,普通拟杆菌(Bacteroides vulgatus )在维生素 A 缺乏期显着增加。维生素 A 缺乏导致的粘膜反应受损,粘蛋白和防御素 6 表达减少,可能使病原菌更容易穿透肠道屏障。
维生素A缺乏使厚壁菌门中毛螺菌_NK4A136_群、厌氧菌、颤杆菌的数量减少,毛螺菌的含量也降低;然而,Parasutterella呈上升趋势。TLR4 可能参与了维生素 A 调节微生物群的过程。
/ B族维生素 /
研究人员在一个小的成年志愿者群体中进行了一项试点研究,该群体补充了过量核黄素(100mg),持续14天。他们发现,在补充期间,每克粪便中的Faecalibacterium prausnitzii数量增加。作者还注意到厌氧菌Roseburia 增加,大肠杆菌减少。
其他关于B族维生素对肠道菌群的影响详见:
/ 维生素C /
补充维生素 C 可减少肠杆菌科细菌的数量,增加乳酸杆菌的丰度,抑制有害菌的生长,促进有益菌的增加。
也有研究表明,维生素 C 服用4周导致 α 多样性增加,短链脂肪酸浓度增加。

/ 维生素D /
维生素 D 和肠道微生物群的相互作用对免疫稳态至关重要。补充高水平的维生素 D 增加了普氏菌,减少了韦荣氏菌和嗜血杆菌。
婴儿饮食中补充维生素 D 对早期微生物组成的变化有重要影响,而儿童缺乏维生素 D 会导致细菌多样性降低。
最近的一项研究表明,维生素D的活性代谢物1,25-二羟基胆钙化醇,维生素D受体的配体(VDR),影响美国不同地区老年人肠道菌群的α -和β -多样性。
研究人员报告了通过食物频率问卷评估的微量营养素摄入量与孕妇微生物群组成之间的相关性。他们观察到,高脂溶性维生素,特别是维生素D的膳食摄入量与微生物α多样性降低有关(P值<0.001),维生素D和视黄醇与变形菌相对增加有关,变形菌门是一个已知包含多种病原体并具有促炎特性的门。
/ 维生素E /
维生素E对变形菌有抑制作用,而维生素E(和纤维)的摄入量较低与Sutterella水平较高相关,据报道,自闭症和某些胃肠道疾病婴儿的Sutterella水平大量增加。
体外维生素E 可以防止几种人类病原体的生物膜形成,特别是金黄色葡萄球菌和表皮葡萄球菌。
/ 维生素K /
一项动物实验表明,缺乏维生素 K 的小鼠的肠道中,瘤胃球菌、毛螺菌科、Muribaculaceae的含量较多。
关于维生素对人体肠道微生物组直接影响的研究
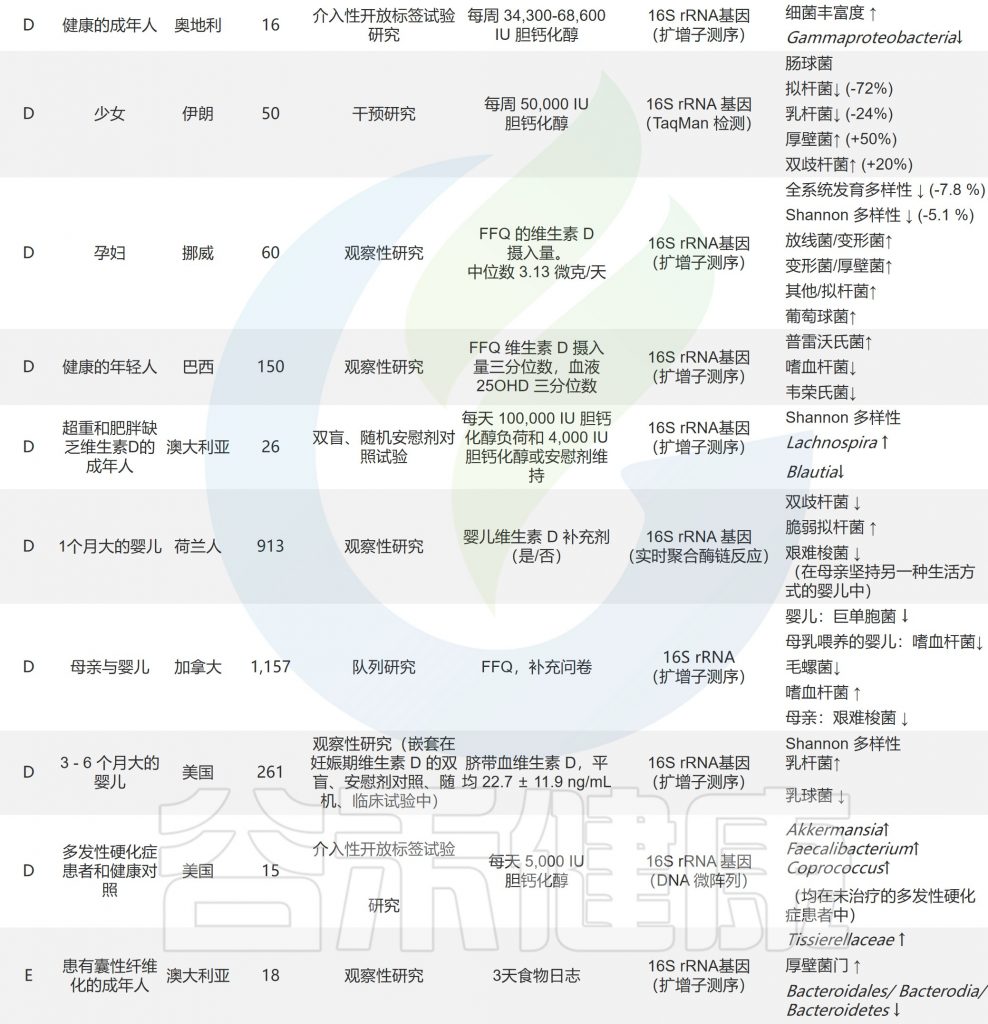
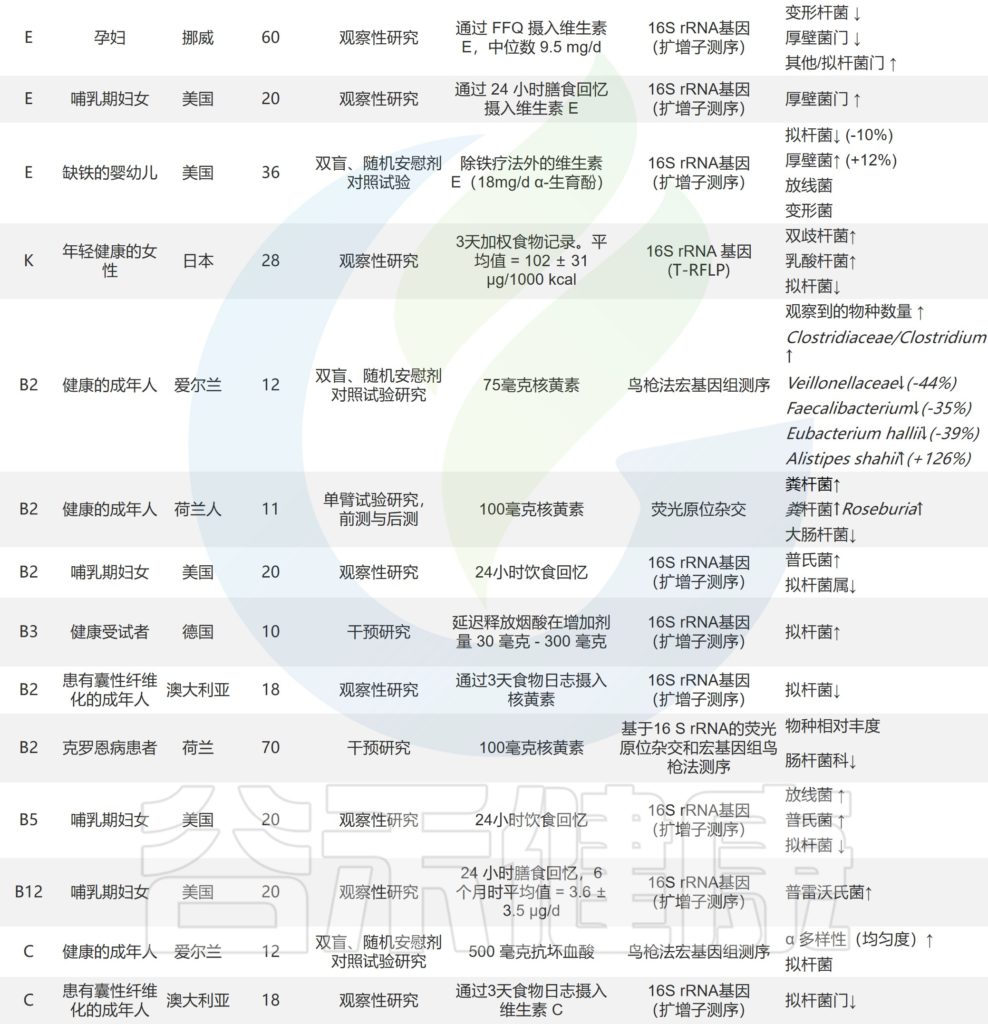
doi.org/10.1016/j.nutres.2021.09.001
饮食是维生素的主要来源,通过饮食补充维生素也会影响菌群。
注:由于测试饮食干预效果所需的随机试验的样本量和持续时间,相关发病率的研究具有挑战性。此外,由于特定的营养素不是孤立地消耗的,而是作为饮食模式的一部分,并且饮食成分之间相互作用,因此饮食带来的实际影响可能只有作为一个整体考虑时才会变得明显。
因此这里我们主要考虑饮食模式,例如地中海饮食等饮食方式。
地中海饮食是营养均衡饮食的典型代表,其特点是大量且频繁地摄入重要的纤维来源(谷物、蔬菜、豆类、水果和坚果)和具有抗氧化特性的化学成分(维生素、类黄酮、植物甾醇、矿物质、萜烯和酚类)。

同时地中海饮食还富含复杂和不溶性纤维含量。我们知道,大量摄入膳食纤维可促进肠道中有益菌群的生长,例如增加拟杆菌、普雷沃氏菌属、罗斯氏菌属、瘤胃球菌属、普拉梭菌等菌属的丰度,从而在肠道中产生高水平的短链脂肪酸,包括丁酸盐。
响应地中海饮食而增殖的细菌可以充当“基石”物种,也就是说它们对于稳定的“肠道生态系统”至关重要。这些变化主要是由于膳食纤维和相关维生素和矿物质的增加,特别是维生素C、B6、B9、铜、钾、铁、锰和镁。
总之,维生素似乎是微生物-宿主间代谢相互作用的重要媒介。
越来越多证据表明,维生素缺乏会导致肠道菌群紊乱,进而引发肠道疾病,甚至促进炎症和肿瘤的发展。下一章节详细讨论,维生素-微生物群相互作用对健康/疾病的影响。
最近的几项观察表明,微生物群失调和维生素缺乏是相互关联的。
维生素对宿主健康的影响

doi.org/10.1016/j.nutres.2021.09.001
这种关系可能直接影响宿主健康:例如,克罗恩病恶化与参与抗炎介质核黄素、硫胺和叶酸生物合成的微生物基因减少有关。
此外,2型糖尿病受试者在与微生物介导的维生素代谢相关的基因丰度谱中显示出显著变化。
营养不良儿童的微生物群显示,参与B族维生素代谢的多种途径(包括烟酸/NADP生物合成)显著减少。
在经历饮食振荡以诱导急性短期维生素A缺乏的灵长类小鼠模型中,Hibberd等人观察到细菌群落结构和宏转录组的调节,其中Bacteroides vulgatus是显著的应答者,在缺乏维生素A的情况下其丰度增加。有趣的是,B.vulgatus是在人类肠道微生物群的灵长类小鼠模型中鉴定的一种生长差异物种。
所有这些观察结果表明,维生素缺乏可能会改变肠道微生物群,从而影响人体健康。
下面我们以肠道疾病和精神类疾病两大类疾病为例,来具体了解维生素-微生物相互作用及其在疾病中的影响。
维生素 A 和 D 分别在近端和远端空肠吸收。维生素E和K主要在回肠吸收;微生物产生的维生素主要在结肠中吸收。维生素缺乏会加重肠道炎症,甚至通过多种机制促进癌症。
肠道菌群->维生素->肠道疾病中的作用
慢性 IBD 发生和发病机制中的关键作用是微生物(尤其是共生菌群)对宿主黏膜免疫功能的影响。同时,肠道微生物群和慢性炎症已被证明与肿瘤发生密切相关。
维生素具有调节肠道菌群和保护肠道的功能。因此,维生素和微生物群的相互作用可能在 IBD 和结直肠癌的治疗中具有巨大的潜力。
维生素A通过促进黏膜愈合、促进产生ASCFA的相关菌增加、降低UC相关菌的水平来达到治疗UC的效果。
费氏丙酸杆菌ET-3 产生维生素 K2 的前体,即 1,4-二羟基-2-萘甲酸 (DHNA),可激活芳烃受体 (AhR) 以改善结肠炎并调节肠道微生物群。
维生素 D 的缺乏会增加拟杆菌门、变形杆菌门和螺杆菌科的丰度,降低厚壁菌门和去铁细菌的丰度门,并且还影响 E-钙粘蛋白表达并减少耐受树突状细胞的数量。
然而,在治疗 IBD 时,维生素 D 与利福昔明的共同给药会影响肠道菌群和利福昔明的疗效。维生素 D 促进A. muciniphila的生长以保护肠粘膜屏障,这些作用对于对抗结直肠癌的发展尤为重要。
研究表明,维生素 E 及其代谢物在调节肠道菌群、减少炎症和抑制癌变方面具有巨大潜力。此外,维生素 Eδ-生育三烯酚 (δTE) 及其代谢物δTE-13′-羧基色原酚 (δTE-13′) 增加了肠道中的乳球菌和拟杆菌,并抑制炎症因子的产生。
维生素->肠道菌群->肠道疾病中的作用
▸维生素在IBD和结直肠癌中的作用不容忽视
大量临床研究表明,缺乏维生素 B 和维生素 D 的人群中结直肠癌的患病率较高。同时,IBD 的长期不愈合使患者面临更高的结直肠癌风险。维生素 D 水平低的 IBD 患者疾病严重程度和预后较差。
▸为什么肠道炎症容易导致癌症高风险?
在炎症背景下,敲除 IKKbetaβ(炎症与癌症之间的联系)可减少由于上皮细胞凋亡增加而导致的癌症发生。在一项关于结肠炎相关癌前癌 (CApC) 的研究中,IL-6 反式信号转导的存在增加了炎症性致癌的风险。如果不及时治疗,由肠道菌群紊乱和维生素缺乏引起的肠道炎症最终可能发展为癌症。
维生素 A 在肠道炎症和癌症中的作用
维生素 A 及其活性代谢物视黄酸 (RA) 在人体免疫系统中发挥着关键作用,并可能对辅助 T 细胞的分化产生影响。
炎症下:视黄酸从保护转变为破坏作用
在非炎症条件下,视黄酸能够抑制 IL-6 受体的表达和 Th1/Th17 的产生。
在炎症条件下,视黄酸从对粘膜的保护作用转变为破坏作用;这反映在活动期 IBD 患者黏膜中视黄酸水平显着升高,伴随着 CD4 和 CD8 分泌的 IL-17 和 IFN-γ 的上调。
维生素A及其代谢物:发挥抗炎作用
维生素 A 及其代谢物通过阻断 Th1 和 Th17 的激活,抑制 IL-17、INF-γ 和 TNF-α 的产生而显示出抗炎作用。同时,它们可以通过与TGF-β协同作用,提高Foxp3的水平,发挥免疫功能,从而促进抗炎因子的发挥。
一项数据显示,低水平的维生素 A 会激活核 NF-kB 并促进胶原蛋白的形成,从而加剧结肠炎的炎症。补充维生素后,肠道炎症明显缓解。
全反式维甲酸 (AtRA) 可降低 UC 和结直肠癌患者结肠黏膜分泌的 TNF-α 和一氧化氮合酶 2 (NOS2) 蛋白的表达。

维生素A保护肠黏膜屏障,其潜在机制是拮抗LPS的肠道破坏作用
在一项关于维生素 A 缺乏对结肠炎和结直肠癌发展的影响的检查中,研究人员使用葡聚糖硫酸钠 (DSS) 诱导小鼠结肠炎;此外,偶氮甲烷 (AOM) 预注射和 DSS 结肠炎的组合诱导了结直肠癌。缺乏维生素的小鼠肠道炎症水平较高,黏膜愈合较慢,免疫反应增强,更容易发生结直肠癌。
AtRA具有抗癌作用,结直肠癌中AtRA 水平降低
在结直肠癌小鼠模型中,肠道细菌引起的炎症影响 AtRA 代谢;这导致其水平下降。在 UC 及其相关结直肠癌的临床样本中发现 AtRA 代谢酶活性降低和 AtRA 水平降低。同时,AtRA通过激活CD8 + T细胞发挥抗癌作用;这为 CAC 的治疗提供了新的见解。
视黄醇和视黄醇结合蛋白(RBP)的结合激活致癌基因STRA6,促进结直肠癌的发生;Holo-RBP/STRA6 通路可通过促进成纤维细胞的致癌作用进一步发挥致癌作用。
在一项关于维生素 A 缺乏对结肠炎和结直肠癌发展影响的动物实验中,当维生素 A 处于低水平时,小鼠体内的维生素 A 脂滴会被降解,免疫反应会增强,结肠炎症会加重,癌变进程将加快。
维生素 B12 和叶酸在肠道炎症和癌症中的作用
IBD 患者缺乏维生素 B12 和叶酸的原因有很多,包括回肠和空肠微生物过度生长、维生素 B12 摄入不足或身体需求增加、维生素肠道破坏增加或吸收能力降低、某些药物(如甲氨蝶呤或柳氮磺胺吡啶)的不良反应、一些病理原因例如蛋白丢失性肠病、肝功能异常、回肠相关病变或手术切除、肠瘘等。
维生素 B12 缺乏不会影响健康的肠道微生物群组成;然而,它会导致实验性结肠炎中肠道菌群失调,并促进条件致病菌的生长。出乎意料的是,维生素 B12 缺乏减少了结肠组织的损伤;这可能与抗炎细胞因子 IL-10 的增加有关。

对甲基缺乏饮食 (MDD) 的潜在作用进行了一项研究,该饮食可降低维生素 B12 和叶酸的血浆浓度,并提高同型半胱氨酸水平,对 DSS 诱导的小鼠结肠炎的影响。喂食 MDD 的 DSS 治疗小鼠比其他治疗组患有更严重的结肠炎。
尽管超氧化物歧化酶和谷胱甘肽过氧化物酶活性保持稳定,但 caspase-3 和 Bax 的水平受到影响。除Bcl-2表达增加外,炎症相关标志物如胞质磷脂酶A2和环氧合酶2的表达也有明显增加趋势;这伴随着金属蛋白酶组织抑制剂(TIMP)3蛋白的表达降低。因此,维生素 B12 缺乏可能会加重实验性 IBD 的炎症程度。
高维生素 B12 水平可通过减少 DNA 甲基化来降低结直肠癌的风险
在结直肠癌患者中,与低血清维生素 B12 组相比,高维生素 B12 组的肿瘤区域和外周血单个核细胞 (PBMC) 中长散布的核元素 1 (LINE1) 甲基化被证明是降低的;肿瘤区域的LINE1甲基化水平也低于周围的非肿瘤区域。
氧化应激是结直肠癌发病机制之一;此外,叶酸和维生素 B12 的水平与体内抗氧化剂谷胱甘肽的水平呈正相关。提高 AOM 诱导的结直肠癌中的叶酸和维生素 B12 水平显示出显着的抗凋亡、抗氧化应激和抗 AOM 细胞毒性。
在对 4517 名 IBD 患者的系统评价和荟萃分析中,补充叶酸被证明可以降低 IBD 患者的结直肠癌风险并防止结直肠癌发展。
有趣的是,有证据表明缺乏甲基供体营养素叶酸、胆碱、蛋氨酸和维生素 B12 会抑制 Apc 突变小鼠的肿瘤发展。总而言之,维生素B12和叶酸在肠道疾病中的作用需要更深入的研究。
维生素 D 在肠道炎症和癌症中的作用
流行病学和动物实验表明,维生素 D 缺乏是 IBD 和 结直肠癌的高危因素。维生素 D 补充剂有助于降低疾病严重程度,可能通过多种机制,包括调节免疫细胞运输和分化,以及抗菌肽合成。
维生素D可以维持肠黏膜屏障的正常功能,提高机体的先天性和适应性免疫
1α,25-二羟基维生素 D3(骨化三醇)是维生素 D 的活性形式,可与 TGF-β 结合,提高 IL-2 水平,调节 T 细胞抑制炎性细胞因子的产生,增强 Foxp3 + Treg 细胞的存活和功能。

维生素D受体(VDR)是维生素D调节免疫和发挥抗炎作用的重要途径
相关资料显示,VDR对肠道有保护作用;它可以通过调节 JAK/STAT 通路来维持肠道稳态并预防癌症。
在 IBD 患者 中,结肠上皮中VDR的含量明显低于正常人。在实验性结肠炎模型中,与缺乏 VDR 的小鼠相比,表达 hVDR 的转基因小鼠的结肠炎症较少。用 hVDR 转基因恢复上皮 VDR 表达可减轻严重结肠炎并降低死亡率。内在机制是 VDR 通过抑制 NF-κB 活化发挥抗凋亡作用,以保护肠道屏障缓解结肠炎。
肠道菌群通过犬尿氨酸通路(合成维生素),在精神健康方面发挥作用
关于肠道细菌在心理健康方面的作用的关键方面,是它们通过犬尿氨酸通路参与调节色氨酸代谢。微生物群能够合成犬尿氨酸途径 (KP) 的酶促辅助因子,如维生素 B2 和 B6。

犬尿氨酸是主要的色氨酸代谢途径,其中 95% 的这种氨基酸被代谢为各种免疫和神经调节犬尿氨酸/色氨酸分解代谢物 (TRYCAT),在大脑中,犬尿氨酸途径主要在神经胶质细胞中分隔。
犬尿氨酸通路在精神、神经退行性和神经系统疾病中的作用是至关重要的,包括重度抑郁症,双相情感障碍,精神分裂症,阿尔茨海默病,亨廷顿病和帕金森病,与 HIV 感染相关的痴呆,手术后认知能力下降,肌萎缩侧索硬化(ALS) 等。
精神病理学和炎症中维生素缺乏与高同型半胱氨酸血症有关
精神病理学和炎症中维生素缺乏的另一个关键机制与高同型半胱氨酸血症(hHcy)有关,这可能是由叶酸、维生素 B6 和 B12 缺乏引起的。
高同型半胱氨酸血症和维生素 B 缺乏在重度抑郁症、精神分裂症、双相情感障碍、自闭症、焦虑症和痴呆症(包括阿尔茨海默病和帕金森病)中起关键作用。
同型半胱氨酸(Hcy)是在蛋白质消化过程中获得的另一种氨基酸蛋氨酸代谢过程中形成的氨基酸和中间体。该反应需要维生素 B12 作为酶促辅因子和叶酸衍生物(5-甲基四氢叶酸)作为甲基供体。
注:Hcy-同型半胱氨酸,是人体内含硫氨基酸的一个重要的代谢中间产物,可能是动脉粥样硬化等心血管疾病发病的一个独立危险因子。
此外,Hcy 可以在需要维生素 B6 作为酶辅因子参与的途径中转化为半胱氨酸。
因此,Hcy 被认为是叶酸和维生素 B12 缺乏的敏感标志物。
高同型半胱氨酸血症导致神经和精神病理学的机制包括:
促进免疫炎症反应、增加肠道和血脑屏障通透性、NMDA受体激动和神经毒性、诱导神经元凋亡、氧化应激、线粒体功能障碍和由于甲基化受损导致的单胺能神经递质合成失调。
目前对体内维生素水平的检测例如:
抽取血液检测其中维生素的含量水平,可以判断是否存在维生素的缺乏情况。
其他,例如通过肠道菌群健康检测,也可以查看近期体内维生素状况。
与通过血液进行维生素检测不同,肠道菌群的评估更加反映一段时间 ( 一般2周左右 ) 的长期状态,如部分B族维生素无法在体内留存,需要每日补充,血液检测波动较大。
注:菌群会受检测前一天饮食的影响,造成15~30%的菌群改变,同样也会反映在营养状况的评估上,因此建议检测前一天尽量保持近期正常饮食 ,这样能更好的反映真实的营养饮食状态。
在了解补充维生素的干预措施之前,我们先从肠道菌群的角度,来了解一下影响维生素合成吸收的因素。
人类基因的变异与肠道结构和微生物组组成有关。人类肠道微生物群中存在不同的维生素 B 生物合成途径支持人类遗传变异影响维生素 B 合成的观点。
维生素的合成吸收不仅需要靠饮食补充,还与吸收相关。而维生素的吸收涉及到相关基因,例如:
MTHFR 基因的突变会影响我们产生加工维生素 B9的酶——亚甲基四氢叶酸还原酶。
亚甲基四氢叶酸还原酶是叶酸代谢通路中的一种重要的辅酶,亚甲基四氢叶酸还原酶基因缺陷,容易造成叶酸在体内的代谢障碍,MTHFR基因最主要的两种突变为C677T、A1298C基因多态性。该两种位点同时突变可显著降低MTHFR活性进而降低叶酸水平。
VDR基因(维生素 D 受体):维生素 D(来自阳光、食物或补充剂)经过转化步骤后,活性形式骨化三醇 (1,25(OH)2D3 ) 可以通过VDR在细胞内发挥作用,是打开或关闭基因的转录因子。该基因突变可能导致维生素D缺乏引起的佝偻病。
维生素缺乏是一个严重的问题,尤其是在老年人中。随着年龄的增长,营养需求会随之变化。
由于食物中的维生素B12 需要胃酸及胃蛋白酶的作用才能释放出来被吸收,而老年人胃酸及胃蛋白酶分泌减少,就会影响维生素B12 的吸收。
患有维生素B12缺乏症的老年人可能出现神经精神或代谢缺陷。
一些药物会改变营养物质的吸收或代谢方式。例如,抗惊厥药也会减少叶酸的吸收。
肠道菌群通过各种代谢途径影响维生素的合成,例如拟杆菌属、肠球菌属和双歧杆菌属等人类肠道共生菌可以从头合成维生素 K 和大多数水溶性 B 族维生素,这在前面第二章节的表已经详细阐述。
在 B 族维生素合成中暴露于抗生素的反应因使用的抗生素类型而异。例如,在饮食中添加青霉素和金霉素会增加雄性大鼠的肝脏维生素 B2 浓度,以及 B2 和 B3 在尿液中的排泄。然而,链霉素和放线菌酮的施用降低了肝脏中维生素 B9 和 B12 的浓度。维生素合成对抗生素暴露的混合反应尚不清楚,但它们可能是由肠道微生物群的选择性改变引起的。
自由基是含有不成对电子的化学物质,可以诱导氧化应激。一个这样的例子是一氧化氮,它与金属离子形成复合物,包括钴,维生素 B12 的一种结构成分,因此使其无法用于细菌维生素 B12 的生物合成。此外,维生素生产者(如脆弱拟杆菌)暴露于过氧化氢等自由基会抑制其生长 ,从而降低维生素的生物合成能力。
维生素主要在小肠中吸收,其生物利用度取决于食物成分,相关相互作用等。
饮食和膳食的组成会通过影响肠道转运时间和/或混合胶束的肠道形成来影响某些维生素的吸收。
饮食中足量的水和膳食脂肪对于分别吸收水溶性和脂溶性维生素至关重要。
*水溶性维生素包括:B族维生素,维生素C;
脂溶性维生素包括:维生素 A、D、E 、K.
doi: 10.7717/peerj.11940
由于脂溶性维生素可以溶解在脂肪中,因此与膳食脂肪一起食用时最容易被吸收。例如,一种富含维生素 A 的小胡萝卜,如果单独食用,将在食物中获取维生素 A,但如果它是在含有一些膳食脂肪的食物成分中(比如说,橄榄油),将增加体内维生素 A 的吸收。
食物的性质(物理状态)也会影响维生素的吸收效率。例如,存在于可消化性较差的纤维植物材料中的类胡萝卜素已被证明相对于维生素A表现出较低的生物利用度。
当我们看到维生素缺乏的时候,可能希望通过饮食来补充相应缺乏的维生素,下表列出了常见的维生素的食物来源,可供参考。
此外,宿主饮食作为肠道中细菌的底物,其对肠道微生物分布的影响已被广泛研究。含有益生元和其他膳食营养素(如微量营养素和多酚)的饮食可以显着影响有益细菌的生长,包括维生素生产菌。
一些维生素,如核黄素,可作为氧化还原介质并刺激营养缺陷菌(如Faecaibacterium prauznitsii)的生长。
在即将形成共生关系的环境中,限制这些基质会增加微生物和微生物与宿主之间的竞争。
除了通过饮食直接补充之外,我们还可以通过补充益生菌来调节维生素水平,从而改善疾病。
双歧杆菌
在健康成人中补充益生菌菌株青春双歧杆菌DSM 18350、青春双歧杆菌DSM 18352 和假链双歧杆菌DSM 18353,导致粪便中叶酸浓度显着增加。
乳酸菌
乳酸菌通过不同的机制抑制炎症过程,包括调节IBD患者肠道菌群紊乱、保护肠道屏障和黏膜的正常功能、调节人体免疫反应等。乳酸菌通过产生核黄素(维生素 B2)和叶酸发挥抗炎和抗氧化作用。
产维生素的乳酸菌不仅对急性肠炎有抗炎作用,还能有效缓解复发性结肠炎。此外,在与美沙拉秦合用过程中,可有效降低不良反应,提高疗效。
研究人员发现注射产生叶酸的乳酸菌会缓解 5-FU 引起的肠炎小鼠的腹泻,改善结肠组织的结构和功能。这一发现降低了癌症化疗期间发生的肠黏膜炎症的严重程度,并提高了药物有效性;因此,这提高了患者的生活质量。
此外,乳酸菌 和 5-FU 的联合使用可减少 5-FU 引起的血细胞计数减少,并使患者获得完整的治疗周期。
产维生素的益生菌在肠道疾病中的作用

doi.org/10.3390/nu14163383
研究人员从 150 个收集的人类粪便样本中分离出三种产生核黄素和叶酸的益生菌;他们用它们来治疗乙酸引起的大鼠结肠炎。他们发现这些益生菌可以保护结肠黏膜,促进溃疡性病变的愈合;此外,它们具有抗炎和抗氧化应激作用。
一种新分离的具有产生叶酸能力的细菌——清酒乳杆菌LZ217,具有促进丁酸产生和改善肠道菌群组成的作用。
Akkermansia muciniphila 是肠道中的一种常见细菌,可调节 CLT 以保护肠道免受炎症和肿瘤侵袭;它还产生维生素 B12 以缓解 IBD 患者的维生素缺乏症。
研究发现,丙酸杆菌菌株 P. UF1 合成维生素 B12;这对肠道免疫和肠道健康有积极的调节作用。
大肠杆菌通过产生维生素来缓解 IBD. 使用大肠杆菌生产两种产生β-胡萝卜素的菌株来治疗维生素A缺乏症。这些结果显示出巨大的临床潜力。
维生素 A 及其代谢物与短乳杆菌KB290 的组合提高了 CD11c + MP/CD103-DC 比率;因此,这在结肠炎的治疗中起着积极的作用。
此外,肠道中的分段丝状细菌 (SFB) 可以产生 AtRA,以抵消感染对肠道的损害。
益生菌对维生素D及其受体活性有积极作用,如鼠李糖乳杆菌GG(LGG)和植物乳杆菌(LP);同样在沙门氏菌结肠炎模型中,使用 VDR (-/-) 小鼠验证 LGG 对 IBD 的缓解作用是通过 VDR 信号通路。
此外,胆汁盐水解酶 (BSH)活性罗伊氏乳杆菌NCIMB 30,242 可调节血浆中的活性维生素 D 水平。磷虾油 (KO)、益生菌罗伊氏乳杆菌和维生素 D 的混合物显着降低病理评分和炎症因子的释放,促进黏膜愈合并减少机会性感染的发生。
经益生菌 VSL#3 预处理后,VDR 水平显着提高,共同保护肠黏膜,防止损伤;这对预防CRC的发展起到一定的作用。
用从韩国泡菜中分离的乳酸菌条件培养基处理 HCT116 细胞或肠类器官后,其分泌的蛋白质 P40 和 P75 与 VDR 的表达增加有关;它们还增强自噬反应,共同具有抗炎作用。肠道微生物合成的石胆酸 (LCA) 充当连接 VDR 与微生物的桥梁,从而提高维生素 D 水平。
益生菌配方有助于抑郁症患者维生素水平的增加
一项随机对照试验中,重度抑郁症患者接受了多种益生菌配方,其中含有双歧杆菌W23、乳双歧杆菌W51、乳双歧杆菌W52、嗜酸乳杆菌W22、干酪乳杆菌W56、副干酪乳杆菌W20、植物乳杆菌W62、唾液乳杆菌W24、乳酸乳杆菌W19。
此外,益生菌组和安慰剂组的患者接受了相同剂量的维生素 B7。在两组中,抑郁症的临床参数都有所改善,然而,益生菌干预组与安慰剂组相比,仅在微生物 β 多样性方面存在差异,临床结果指标没有差异。有趣的是,尽管两组都接受了相同剂量的生物素,但接受益生菌的那组维生素 B6 和 B7 的合成上调。
多种益生菌相结合通过增加叶酸和维生素 B12血浆水平,改善精神疾病
八周的个性化饮食与含有多种益生菌的菌株相结合:婴儿双歧杆菌DSM 24737、长双歧杆菌DSM 24736、短双歧杆菌DSM 24732、嗜酸乳杆菌DSM 24735 、德氏乳杆菌、保加利亚乳杆菌DSM 24734、副干酪乳杆菌DSM 24733、植物乳杆菌DSM 24730 、嗜热链球菌DSM 24731 (VSL#3),在健康老年人中增加了叶酸和维生素 B12 血浆水平并降低了 Hcy 血浆水平。
此外,益生菌的添加导致粪便双歧杆菌浓度增加,这种变化与叶酸和维生素 B12 水平呈正相关。
在精神病患者中引入高同型半胱氨酸的评估和治疗可能非常有价值,益生菌可能成为治疗工具之一。
维生素是相互关联的、具有协同作用的微量营养素,当它们处于适当的平衡状态时,它们的全部潜力就会得到充分发挥。
因此,在食用益生菌和发酵食品时,应考虑维生素生产者与代谢者之间复杂的相互作用。
除了以上方式干预菌群之外,也可以通过良好的生活方式调理菌群,从而使维生素达到一个相对健康稳定的水平,减少各类疾病风险。
▸在服用维生素的同时可以服用益生菌吗?
可以。在大多数情况下,服用益生菌不会影响其他补充剂的效果。
一项 2021 年对临床试验的系统评价发现,益生菌可以改善健康人群的微量营养素水平,特别是维生素 B12、叶酸(维生素 B9)、钙、铁和锌。
2017 年的一项非随机临床试验发现,服用益生菌和铁补充剂的参与者比不服用益生菌的铁吸收明显更多。
有研究表明,维生素 D 和益生菌之间存在协同关系。
随机对照试验发现,维生素 D 补充剂与益生菌一起可以改善多囊卵巢综合征患者和同时患有冠心病的糖尿病患者的各种心理健康参数、一般健康状况、代谢和炎症标志物。
2019 年对随机对照试验的系统评价和荟萃分析发现,维生素 D 强化酸奶(富含益生菌嗜酸乳杆菌)有助于改善维生素 D 和胆固醇水平、代谢功能和身体测量值。
然而以上研究都没有单独研究维生素 D 和益生菌的作用,因此尚不清楚结果是否与两者的综合影响有关。
研究人员认为,无论有没有维生素,服用益生菌的时间很重要。作为一般规则,服用益生菌的最佳时间是空腹,大约在进食前 30 分钟。
研究人员担心胃酸的存在会影响益生菌的生存能力。在餐前或餐后几个小时服用时,当胃酸自然降低时,益生菌可以进入肠道,从而提高其生存几率。
何时服用维生素取决于维生素的种类。复合维生素通常最好在早上第一时间服用,非常适合搭配早餐前的益生菌。脂溶性维生素,如 A、D、E 和 K 以及一些矿物质,包括铁和镁,最好与食物一起服用。否则可能会导致胃部不适。
▸应该从食物中补充维生素还是通过维生素补充剂?
2020 年的一篇文献综述发现,与浓缩补充剂相比,许多微量营养素在其全食物形式中的生物利用度更高。因此提倡补充方式以食物为先。
一般认为,对于健康人来说,营养均衡的饮食可以提供身体需要的维生素,不需要额外补充,但对于可能存在免疫功能、肠道健康、吸收不良等问题的人群,可以考虑维生素补充剂进行补充,具体补充剂量请遵医嘱。
下表是维生素易缺乏的高风险人群:

▸可以长期服用维生素补充剂吗?补充过量会带来副作用吗?
一般健康人不需要长期服用维生素补充剂。
对于服用复合维生素片,多余的维生素会被排出体外,因此不用过于担心会带来危害。但是如果长期十倍以上的用量,对身体是有危害的。

doi: 10.7717/peerj.11940
在发现维生素缺乏的症状的时候,我们可能希望通过补充相应的维生素补充剂来改善健康。然而服用任何补充剂之前,我们应该寻找其根本原因而不是直接根据症状盲目补充。
通过肠道菌群健康检测可以了解维生素缺乏状况,且可以根据各类菌群丰度来推断维生素的菌群代谢状况。如果是由于菌群的代谢异常,可能直接补充并没有太大效果,这时候优先调节菌群或许是更好的选择。
如果维生素指标都显示正常没有缺乏(如下图),保持常规饮食不需要刻意补充。还想要更健康,指标更接近70的话,可以在数值略小的指标上,针对性地通过饮食进行补充调理。

如果维生素指标中出现个别指标缺乏或偏低(如下图),可以通过饮食针对性地进行改善调整,如果已经出现对应症状,例如缺乏维生素A,同时出现干眼症或者夜盲症等相应的症状,可以使用相应的维生素补充剂进行干预,或者根据菌群代谢通路判别,通过菌群调理进行相应干预。
如果维生素指标中出现缺乏或偏低的指标较多,则需要选用复合维生素,各类维生素之间可能存在协作关系,同时配合饮食、菌群进行干预。
选择补充剂,应优先考虑生产规范良好的产品,比如说可以查看是否有“OTC”标志。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Zhai Z, Dong W, Sun Y, Gu Y, Ma J, Wang B, Cao H. Vitamin-Microbiota Crosstalk in Intestinal Inflammation and Carcinogenesis. Nutrients. 2022 Aug 17;14(16):3383. doi: 10.3390/nu14163383. PMID: 36014889; PMCID: PMC9414212.Zhai Z, Dong W, Sun Y, Gu Y, Ma J, Wang B, Cao H. Vitamin-Microbiota Crosstalk in Intestinal Inflammation and Carcinogenesis. Nutrients. 2022 Aug 17;14(16):3383. doi: 10.3390/nu14163383. PMID: 36014889; PMCID: PMC9414212.
Bellerba F, Muzio V, Gnagnarella P, Facciotti F, Chiocca S, Bossi P, Cortinovis D, Chiaradonna F, Serrano D, Raimondi S, Zerbato B, Palorini R, Canova S, Gaeta A, Gandini S. The Association between Vitamin D and Gut Microbiota: A Systematic Review of Human Studies. Nutrients. 2021 Sep 26;13(10):3378. doi: 10.3390/nu13103378. PMID: 34684379; PMCID: PMC8540279.
Ofoedu CE, Iwouno JO, Ofoedu EO, Ogueke CC, Igwe VS, Agunwah IM, Ofoedum AF, Chacha JS, Muobike OP, Agunbiade AO, Njoku NE, Nwakaudu AA, Odimegwu NE, Ndukauba OE, Ogbonna CU, Naibaho J, Korus M, Okpala COR. Revisiting food-sourced vitamins for consumer diet and health needs: a perspective review, from vitamin classification, metabolic functions, absorption, utilization, to balancing nutritional requirements. PeerJ. 2021 Sep 1;9:e11940. doi: 10.7717/peerj.11940. PMID: 34557342; PMCID: PMC8418216.
Steinert RE, Lee YK, Sybesma W. Vitamins for the Gut Microbiome. Trends Mol Med. 2020 Feb;26(2):137-140. doi: 10.1016/j.molmed.2019.11.005. Epub 2019 Dec 17. PMID: 31862244.
Pham VT, Dold S, Rehman A, Bird JK, Steinert RE. Vitamins, the gut microbiome and gastrointestinal health in humans. Nutr Res. 2021 Nov;95:35-53. doi: 10.1016/j.nutres.2021.09.001. Epub 2021 Oct 21. PMID: 34798467.
Hossain KS, Amarasena S, Mayengbam S. B Vitamins and Their Roles in Gut Health. Microorganisms. 2022 Jun 7;10(6):1168. doi: 10.3390/microorganisms10061168. PMID: 35744686; PMCID: PMC9227236.
Rudzki L, Stone TW, Maes M, Misiak B, Samochowiec J, Szulc A. Gut microbiota-derived vitamins – underrated powers of a multipotent ally in psychiatric health and disease. Prog Neuropsychopharmacol Biol Psychiatry. 2021 Apr 20;107:110240. doi: 10.1016/j.pnpbp.2020.110240. Epub 2021 Jan 9. PMID: 33428888.
Barone M, D’Amico F, Brigidi P, Turroni S. Gut microbiome-micronutrient interaction: The key to controlling the bioavailability of minerals and vitamins? Biofactors. 2022 Mar;48(2):307-314. doi: 10.1002/biof.1835. Epub 2022 Mar 16. PMID: 35294077; PMCID: PMC9311823.
谷禾健康
你知道肠道和大脑之间的秘密吗?
大脑自闭了,为什么是肠道的锅?
肠道真的会影响大脑嘛,原理是啥?
……
已经有越来越多人开始好奇肠道和大脑之间的联系,关于这方面的前沿研究也在不断更新,人们开始逐渐深入了解相关机制。

中枢神经系统功能与肠道微生物之间存在关联,即大脑和肠道之间的串扰,与迷走神经、肠神经系统、免疫系统和循环相互作用。胃肠道微生物群可以影响神经系统,无论是通过迷走神经直接输入大脑,还是通过间接激活整个胃肠道的肠神经系统。
以下是我们整理过相对较全面的关于肠道和神经系统相关的文章:
深度解读 | 肠道菌群和中枢神经系统的关系
肠道微生物群在神经系统疾病中的作用
本文在这个基础上,结合最新研究进展,再次阐述人类肠道微生物组在神经系统疾病发病机制中的潜在作用,讨论了精神药物、益生菌、益生元、合生元、后生元、粪菌移植等方式治疗神经系统疾病的潜在作用。

大家越来越有这样的认知:胃肠道微生物群的不平衡会影响大脑的生理、认知和行为。
肠道微生物群通过神经、免疫、体液和内分泌联系参与肠-脑双向相互作用。我们先来了解一下以下它们之间几种“交流方式”:
肠道主要通过两条神经解剖学途径与大脑进行沟通。
首先,大脑和肠道直接通过迷走神经(VN)和脊髓中的自主神经系统(ANS)进行沟通。
其次,细菌通过迷走神经和肠神经系统传入神经元的刺激在大脑和胃肠道微生物群之间建立直接的神经联系。
此外,迷走神经激活表现出抗炎作用,迷走神经活动对肠道微生物群及有益菌的产生积极影响。
迷走神经可以将胃肠道中的内分泌、神经元和微生物改变转移到大脑。
几项临床前研究表明,肠道疾病的病理生理学和发病机制,包括炎症性肠病(IBD)和肠易激综合征(IBS),以及神经系统疾病和精神疾病,包括焦虑、抑郁、自闭症、阿尔茨海默、多发性硬化和帕金森病,与肠道微生物群失衡有关。
由于微生物群-肠-脑轴(MGBA)内存在多种相互作用机制,胃肠道微生物组主要通过免疫相关、神经、内分泌和代谢信号通路与中枢神经系统进行通信。
肠道微生物可通过在肠腔中产生大量代谢物与宿主交换感官信息,包括神经递质、GABA、血清素、多巴胺和去甲肾上腺素,激素(如下丘脑-垂体-肾上腺轴中促肾上腺皮质激素释放激素的分泌)、组胺、乙酰胆碱、儿茶酚胺,以及几种维生素和短链脂肪酸。其中一些分子可以通过血脑屏障进入大脑,并影响神经回路。在这些代谢物中,短链脂肪酸是结肠细菌发酵膳食纤维产生的主要代谢物,在调节神经免疫内分泌、代谢稳态、感染和炎症方面发挥着关键作用。
许多种类的乳酸杆菌和双歧杆菌产生γ-氨基丁酸(GABA),这是大脑中主要的抑制性神经递质。
念珠菌、大肠杆菌和肠球菌会产生神经递质5-羟色胺,而一些芽孢杆菌会产生多巴胺。
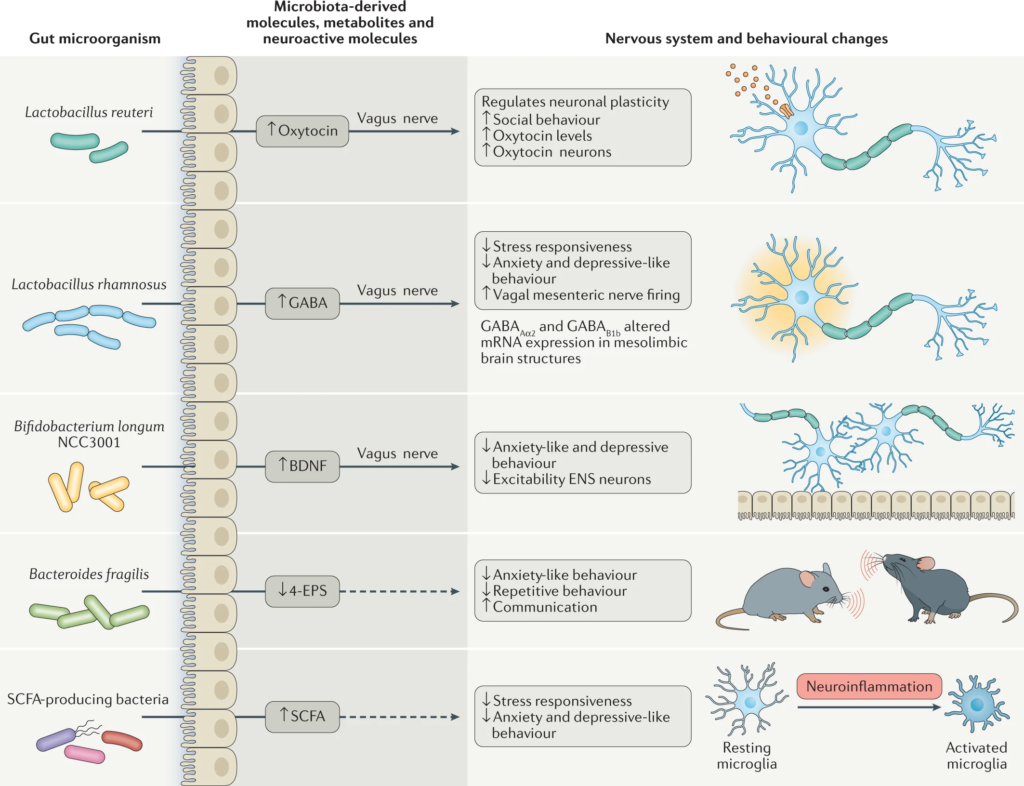
Morais LH, et al. Nat Rev Microbiol. 2021.
微生物群代谢产物,包括维生素、神经活性代谢物(如短链脂肪酸)和神经递质,介导双向微生物群-肠-脑轴相互作用以调节宿主神经生理学和免疫。
微生物代谢产物——短链脂肪酸,如乙酸、丙酸、丁酸,也可以通过进入体循环影响中枢神经系统。
短链脂肪酸能够刺激交感神经系统,粘膜血清素的释放,从而影响大脑的记忆或学习过程。
大约95%血清素(5-羟色胺)由肠粘膜嗜铬细胞产生。在外周,5-羟色胺参与Gl分泌、运动(平滑肌收缩和放松)和疼痛感知的调节,而在大脑中,5-羟色胺参与情绪和认知的调节。
肠道微生物群在色氨酸代谢中也起着重要作用,色氨酸代谢是产生5-羟色胺的前体。例如,婴儿双歧杆菌通过增加血浆色氨酸影响中枢5-羟色胺的传递。
我们知道了以上化学信使,那么它们通过什么途径去发挥作用?
细菌神经活性代谢物和饮食分子可以通过多种方式改变大脑和行为,例如影响上皮细胞以影响上皮屏障的功能,肠内分泌细胞释放激素,通过树突状细胞调节小胶质细胞和免疫细胞的功能。
代谢产物在通过血脑屏障运输后直接影响,或通过神经内分泌、免疫或迷走神经途径间接影响。
血脑屏障
细菌可以直接将因子释放到体循环中或可以转移到血液中。一旦进入血液,微生物组及其因子可以改变外周免疫细胞,促进与血脑屏障的相互作用,并最终与神经血管单元的其他元素相互作用。菌群代谢产物,例如短链脂肪酸,可穿过血脑屏障以影响脑功能。
肠道屏障
肠道微生物群还可以影响肠道屏障的完整性,控制信号分子从肠腔到固有层(包含免疫细胞和ENS神经元末端)或门静脉循环的通道。肠道屏障的完整性在某些神经精神疾病中会被破坏,如焦虑症、自闭症谱系障碍和抑郁症。
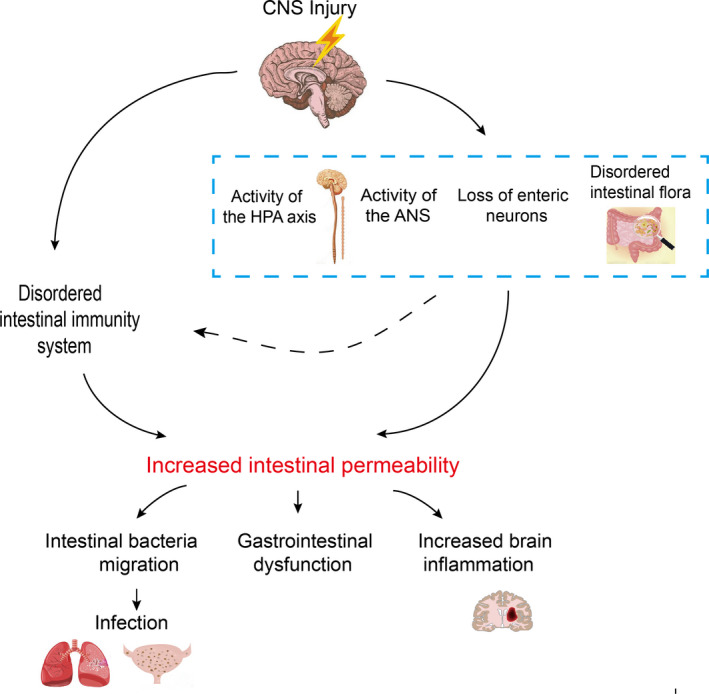
Li XJ,et al., CNS Neurosci Ther. 2020
肠道通透性
慢性应激可改变肠道通透性(肠漏综合征),这与低度炎症有关,在功能上与抑郁症等精神疾病有关。
在许多情况下,循环中细菌内毒素(脂多糖,LPS)的增加是导致疾病的基本危险因素。
肠道屏障和肠道通透性区别:
肠屏障
是将肠腔与内部宿主分开的功能实体,由机械元件(粘液、上皮层)、体液元件(防御素、IgA)、免疫元件(淋巴细胞、先天免疫细胞)、肌肉和神经元件组成
肠道通透性
指给定部位肠道屏障的功能特征,可通过分析整个肠壁或跨壁成分的定义分子的通量率进行测量
神经内分泌(HPA轴)
在神经系统内,应激是如何激活HPA轴反应?
该反应涉及下丘脑神经元,该神经元向大脑或门静脉循环分泌激素,如促肾上腺皮质激素受体激素(CRH),触发促肾上腺皮质激素(ACTH)的释放,然后启动皮质醇的合成和释放。
皮质醇调节神经免疫信号反应,进而影响肠屏障的完整性。
肠道渗漏导致促炎状态,循环中TNF-A、干扰素-y和IL-6水平升高。已知IL-6激活HPA轴。
随着时间的推移,它也下调糖皮质激素受体。这些受体是抑制HPA轴的反馈机制,然而,它们的下调导致HPA轴过度活跃和过度敏感。
有研究表明,这些变化导致海马5-羟色胺的减少以及BDNF表达的减少。BDNF表达降低是抑郁症发病的危险因素。
应激激素、免疫介质和CNS神经递质可激活肠神经系统的神经细胞和迷走神经的传入通路,从而改变肠道环境和微生物群组成。
目前,已经表明胃肠道微生物群在发展大脑免疫和神经发育中起着核心作用。
大脑并非免疫“特权”器官
免疫系统和中枢神经系统都是复杂而有组织的系统,在运作模式和发育过程中具有共同的特征。大脑中可以产生参与先天免疫的分子,如Toll样受体(TLR)、细胞因子、以及适应性免疫相关分子,如抗体受体和主要组织相容性复合体(MHC),这些分子在脑发育中起着关键的调节作用。
脑膜淋巴细胞和血脑屏障
尽管以前认为大脑是一个免疫特权器官,但它包含脑膜淋巴管。脑膜中淋巴管的存在使我们能够深入了解中枢神经外周免疫系统之间的可能联系,从而影响自身免疫。
此外,淋巴细胞和小胶质细胞可以调节认知,对神经元回路的正确连接也是必不可少的。小胶质细胞是巨噬细胞,占所有神经细胞的10%。它们负责中枢神经系统主动免疫防御的基本作用。而且大脑大部分区域的血管系统发展出选择性血脑屏障的组织特异性,允许所需分子进入大脑,并限制潜在有毒物质或细胞的渗透。
免疫影响大脑和神经
免疫细胞具有渗透大脑的能力。浸润性免疫细胞或小胶质细胞能够与中枢神经系统有效地相互作用,并影响大脑功能和病理学。
小胶质细胞从胚胎祖细胞中出现,并可在中枢神经系统中经历自我更新的过程。它们不仅参与典型的免疫功能,如吞噬和抗原递呈,还参与一些大脑生理活动。
免疫细胞如中性粒细胞、巨噬细胞、T细胞和自然杀伤(NK)细胞从大脑的外周循环血液进入。小胶质细胞对行为和某些神经系统疾病有着巨大的影响,如神经退行性疾病。
通常,成人大脑神经发生受宿主肠道微生物群的影响。成年小鼠的抗生素治疗影响肠道微生物群的多样性和海马的神经发生,而且益生菌具有重建肠道微生物群的能力并显示神经发生改善。
菌群与免疫
最近的许多研究表明肠道微生物组与大脑以及肠道微生物组与免疫系统调节之间存在联系。对无菌和对照啮齿动物的研究表明,肠道微生物组的缺失会加剧焦虑样行为。此外,如果肠道微生物群在生命早期恢复,这种行为完全可以治愈。微生物代谢产物可通过血液循环转移到大脑,并影响迷走神经或免疫系统和炎症反应,这表明由于生态失调引起的微生物代谢紊乱可对焦虑相关疾病产生巨大影响。
菌群招募免疫细胞
肠道微生物群落通过在各种免疫条件下招募不同的免疫细胞,直接或间接调节肠道内的免疫反应。胃肠道微生物的动态和异质性特征是宿主体内平衡的基础。据报道,与野生型小鼠相比,以胃肠道淋巴细胞水平降低为特征的免疫系统发育不平衡减少了无菌小鼠中免疫球蛋白a(IgA)、抗菌肽(AMP)和未成熟肠道相关淋巴组织(GALT)的数量,强调胃肠道微生物组在宿主免疫形成中的重要作用。
病原识别和抗体反应
此外,肠道免疫系统在区分共生动物和病原体以及确定导致免疫耐受的因素方面至关重要。因此,肠道菌群可以调节免疫系统的发育和功能,形成肠道微生物群落并调节肠道粘膜表面的病原体。例如,据报道,无菌小鼠中辅助性T细胞1(Th1)和Th17细胞数量的减少,以及IL-22和IL-17的减少,导致固有层数量减少。
影响T和B细胞发育和反应
肠道微生物组影响肠道T和B细胞反应的诱导和发展。肠道微生物群在肠道CD81 T淋巴细胞的激活中起着重要作用。
胃肠道微生物组影响固有层处肠道驻留B淋巴细胞的发育,因为无菌小鼠的固有层处B细胞计数较低。此外,这种类型的细胞也能够产生IgA,作为微生物成分的强调节因子。这表明在促进对共生微生物的免疫耐受以及在固有层中实现IgA的广泛多样化方面具有突出作用。
菌群代谢物参与免疫
对短链脂肪酸的研究表明,除了增强肠道系统中调节性T淋巴细胞的功能和数量外,它们还可以通过抑制转录因子NF-kB和HDAC活性来促进抗炎作用和肠道屏障功能。微生物肠道菌群与芳香烃受体(AhR)结合产生的色氨酸衍生物影响肠道免疫系统的功能。肠道菌群可产生精氨酸衍生物,包括二胺、精胺、亚精胺和多胺,通过增强常驻免疫细胞和肠粘膜的内环境平衡来调节免疫反应 。
微生物群与大脑之间通过肠脑轴的分子通讯途径
Sorboni SG, et al.,Clin Microbiol Rev. 2022
肠神经系统在人的一生中经历了一个巨大的发育变化,同时在病理生理功能方面保持了灵活性。因此,随着年龄的增长,肠神经系统开始衰弱,宿主微生物群、免疫系统和生理学也开始衰弱。
注:肠道神经系统是周围神经系统中最复杂、最重要的部分之一,由小神经节和神经元组成。这些神经元分布在整个胃肠道膜。
在了解菌群与神经衰退之前,首先看一下菌群与神经发育的关系。
大脑发育是一个复杂的过程,通常从妊娠第三周开始,一直持续到青春期晚期,生命的前3年被认为是胃肠道微生物群和脑突触形成的中心时期。
对无菌(GF)小鼠模型的研究表明,胃肠道微生物群、行为表现和大脑功能之间存在相关性。应激反应比无特定病原体(SPF)小鼠强烈得多。据报道,无菌小鼠模型中突触形成标记物水平的降低,包括分别负责突触成熟的突触素和PSD95,突出了共生细菌在大脑发育中的重要性。基于这些结果,肠道菌群似乎在大脑发育过程中对神经网络的形成起着核心作用。
部分自闭症患者表现出慢性便秘、肠道通透性增高、腹痛和肠道微生物群紊乱的症状,从而提供了生态失调和神经发育障碍之间的可能联系。微生物从母亲转移到胎儿、分娩方式、抗生素暴露和饮食习惯都会改变婴儿微生物群的定植和成熟。
怀孕期间补充抗生素会导致母体和新生儿肠道菌群的破坏,随后运动活动的减少,以及新生儿行为的改变。因此,临床证据支持抗生素诱导的失调与几种神经发育障碍的发展相关,包括精神分裂症、抑郁症和双相障碍。
尽管需要更多的研究来阐明上述因素与神经发育障碍之间的分子联系,但操纵早期生命微生物群可以被认为是预防自闭症和其他神经疾病的有益手段。
肠神经系统是否随年龄增长而变化?
一些研究认为随着年龄的增长,肌间神经元的数量和功能都会减少,而其他研究则没有报道这种后果。因此,肠神经系统是否会随着年龄的增长而发生变化仍在激烈争论中。
肠神经系统随年龄变化的研究表明,肠神经节的形态发生了变化,变性神经纤维的识别,α-突触核蛋白(α-syn)和脂褐素积累。这些报告表明老化和肠神经系统退化之间存在相关性。
肠神经系统在肠道细胞活动、营养吸收和肠道激素分泌中具有重要作用。针对肠神经系统的研究虽多,但机制不明确。根据以上研究证据,有理由假设肠神经系统发生了退化性变化,与宿主生理学、代谢、微生物群以及与衰老相关的免疫系统的变化相一致。
考虑到肠神经系统细胞不同的功能和形态特征,不同的细胞类型在年龄相关疾病的易感性中起主要作用。代谢活跃的神经细胞中氧化DNA损伤和活性氧(ROS)产生的负担可能是肠神经系统衰老的另一个潜在因素。
根据强调在老年动物模型中降低钙结合蛋白表达的重要性的研究,钙失调也可被认为与肠神经系统衰老有关。也有报道称,在衰老过程中,肠神经细胞中的钠通道基因表达显著改变。
对肠神经系统的年龄相关影响的额外研究是必要的,可能有助于对这些复杂的衰老和胃肠道关联的新理解,也可能带来新机会,发现治疗各种年龄相关神经疾病的新治疗方法,以及改善老年人的生活质量。
肠道微生物群与肠神经系统
考虑到胃肠道肠道神经元附近定植的微生物,肠神经系统似乎与肠道微生物群高度相关或可能受其影响。
几项研究表明,新生儿肠神经系统的发育是由早期暴露于肠道常驻微生物形成的。此外,肠道微生物群可以调节神经胶质细胞对固有层的初始定植以及稳态。
随着年龄的增长,拟杆菌和变形杆菌(尤其是Gammaproteobacteria)数量增加,厚壁菌和双歧杆菌数量显著减少。
与衰老过程中肠道微生物群的实质性变化类似,成人肠道神经元对年龄相关损伤的敏感性更高。肠道微生物群平衡的改变,包括条件致病菌的增加和有益菌或共生菌的减少,可导致胃肠道的不同微生物代谢产物谱。
因此,由肠道菌群的年龄相关改变引起的肠道炎症水平升高会影响肠神经系统,并导致肠道神经元不同生理和神经化学功能的损害或丧失,从而导致年龄相关疾病的发生。
肠神经系统还可以调节肠道微生物群落组成,维持和促进肠道健康。此外,肠道微生物群落的缺失可导致肠神经系统功能的异常和改变。
也有研究表明,肠道失调和肠道病理的发展与胃肠动力紊乱相关,表明肠神经系统在肠道微生物群维持和预防可导致宿主疾病的病原菌过度生长中的重要作用。
尽管确切的机制仍需澄清,但从肠-脑轴和老年人群神经病变的角度来看,肠道微生物群、粘膜免疫系统、肠道神经元和肠上皮细胞之间复杂的相互作用和相互作用强调了该领域研究的重要性,并强调了进一步研究的必要性。
胃肠道菌群和神经-肠内分泌系统中与年龄相关的变化可能通过肠-脑信号通路功能障碍影响大脑健康的分子通路图如下。
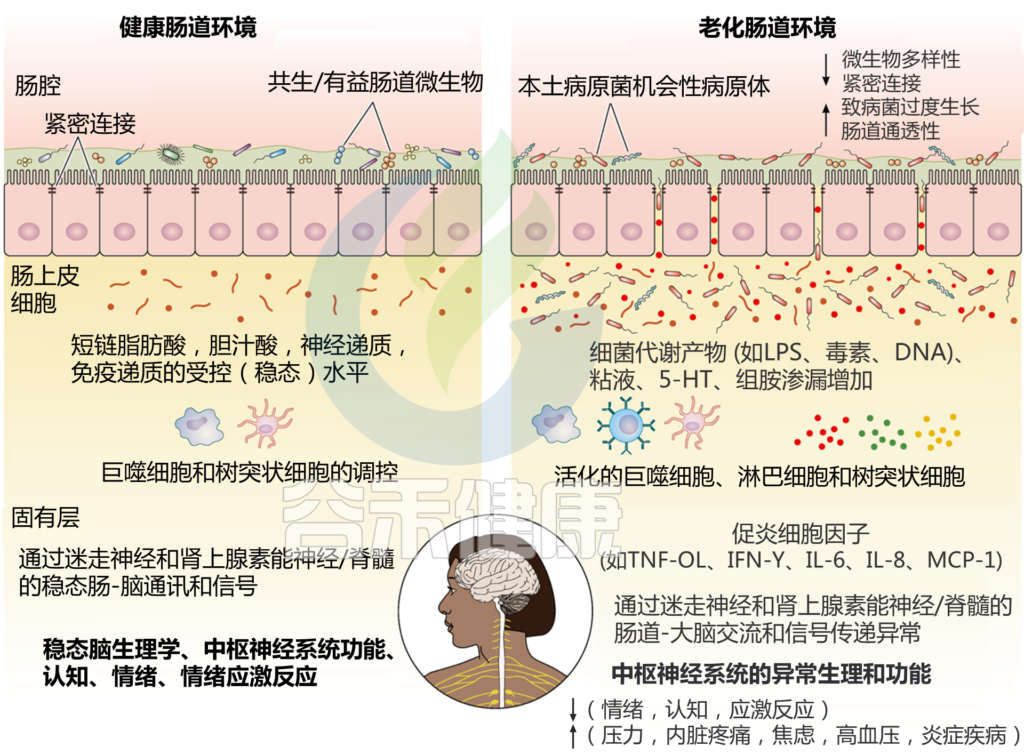
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在健康成人中,平衡的肠道菌群和肠道屏障完整性有助于维持平衡的微生物群落及其代谢产物,包括短链脂肪酸。胃肠道中神经递质的适当产生有助于通过巨噬细胞和树突状细胞的平衡增殖维持受控的肠道炎症和免疫系统,最终导致受控的肠脑通讯和中枢神经系统的适当功能。
然而,在衰老宿主中,胃肠道微生物群落多样性的改变和肠道屏障完整性的破坏,通过短链脂肪酸、LPS、5-羟色胺、组胺、葡萄糖和葡萄糖水平的不平衡,导致胃肠道上皮细胞衬里的生化和微生物微环境发生扰动,分泌性免疫球蛋白(sIgA)等。因此,在肠道环境中诱导过度激活的炎症环境导致健康肠道-大脑沟通中断。
老化的微生物组本身足以导致认知障碍
微生物群移植研究表明,老化的肠道微生物群可导致年轻受体发病。从老年供体小鼠到无菌受体小鼠的肠道微生物群移植有助于促进肠道炎症和增加通透性,这表明与较高水平的变形菌和TM7细菌相关。
最近的一项研究表明,来自老年供体小鼠的粪便微生物群移植导致年轻受体小鼠的空间学习和记忆障碍,产短链脂肪酸菌显著减少,包括Faecalibaculum、毛螺菌科和瘤胃菌科。
从老龄小鼠模型到无菌小鼠的粪菌移植导致粪便短链脂肪酸生成减少、促进抑郁样行为和短期记忆障碍,表明老龄肠道微生物组能够降低宿主的短链脂肪酸水平和随后的认知能力下降。
从老龄供体到年轻受体大鼠的粪菌移植导致受体小鼠的认知行为损伤、突触结构改变、糖基化终产物水平升高以及炎症和氧化应激增加。
自闭症谱系障碍
精神分裂症
抑郁症
自闭症谱系障碍(ASD) 包括一系列复杂的神经发育障碍症状,包括社交和交流障碍,以及限制性和重复性行为模式。
谷禾参与组织的一项多中心合作的自闭症谱系发育障碍与肠道菌群研究,该项目共包括 773 名自闭症受试者(16 个月至 19 岁)和 429 名神经典型 (NT) 发育受试者(11 个月至 15 岁)。该研究已发表的在《GUT》。【实际上这个研究仍在继续,目前我们已经构建了超过3000例的自闭症样本队列】
这项研究详细分析了不同年龄发育阶段自闭症儿童的菌群与正常儿童的差异和变化,并揭示了临床症状相关的自闭症儿童肠道微生物组发育动态特征。
研究显示多种菌、菌群代谢功能的改变与自闭症儿童的行为、睡眠和胃肠道症状的严重程度有关。
Lou M, et al., Gut. 2021
为了更好的应用于临床,我们尝试并给出了基于微生物群的疾病诊断模型,并在不同年龄和地区显示出很好的模型效果。
Lou M, et al., Gut. 2021
尤其是在早期,基于肠道菌群的模型对于临床鉴别和评估有更大价值。因为很难对低龄幼儿进行行为学评估,而错误的评估很容易错过早期干预的黄金时机,肠道菌群模型可以更加量化的评估,而不依赖问询或行为学,可以很好的对现有临床诊疗进行补充。
遗传和环境因素
自闭症的确切病因尚不确定。然而,有大量的临床证据表明,遗传和环境因素在该病的发病中起着至关重要的作用。已经确定了100多个影响中枢神经系统发育的基因和基因组区域,这些基因和基因组区域可能与自闭症的发展有关。
环境因素,如营养不良、病毒和婴儿期发育错误,特别是发育中大脑中七种蛋白质的母体自身抗体,也与自闭症有关。这些环境因素现在已经被证明对自闭症有着比以前认为的更重要的作用。
微生物群-大脑重要作用
大约40%的自闭症患者经历更多的胃肠功能障碍,包括肠功能改变和腹部痉挛(疼痛)、腹泻、反流和呕吐。
胃肠道症状与自闭症严重程度之间的相关性表明了肠道与大脑之间联系的重要性。
人们逐渐发现肠道中的微生物群和大脑相互作用在自闭症等神经精神疾病中起着关键作用。
肠道微生物群的组成与年龄有关。肠道微生物群正常组成的改变会增加致病菌的数量,从而导致感染。
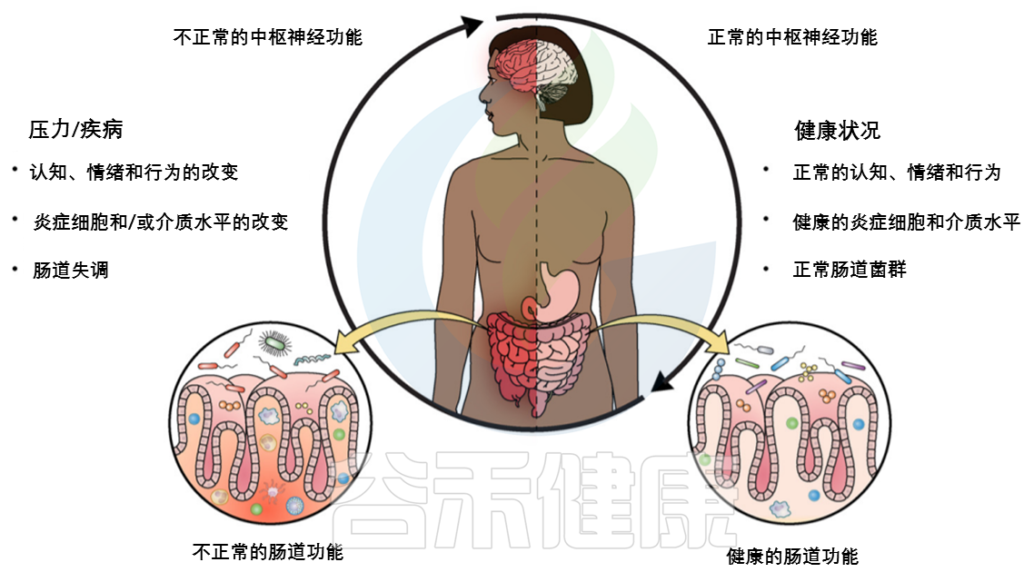
Sorboni SG, et al.,Clin Microbiol Rev. 2022
肠道失调 -> 炎症
自闭症患者的胃肠道紊乱和中枢神经系统症状可能与肠道失调引起的炎症状态有关。
根据最新研究,自闭症儿童的肠道微生物群组成发生了显著变化,胃肠道症状可能代表了炎症过程。炎症与肠粘膜屏障对细菌神经毒性肽(如脂多糖)的通透性增加和炎性细胞因子的产生有关。细菌代谢产物在肠-脑轴中起着至关重要的作用;因此,肠脑信号中断可能与自闭症和帕金森等神经精神疾病有关。
最近关于微生物干预预防和治疗自闭症的潜力的研究
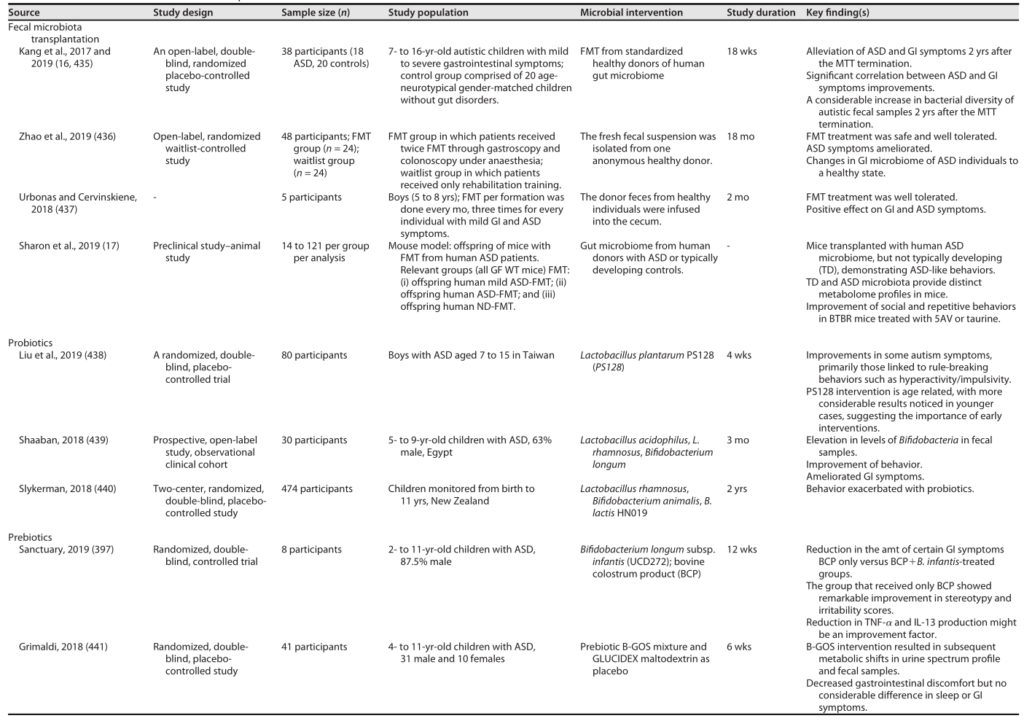
Sorboni SG, et al.,Clin Microbiol Rev. 2022
自闭症患者肠道菌群变化
自闭症儿童甚至成人的肠道微生物群与健康对照组完全不同。
对自闭症儿童粪便样本的调查表明,由于拟杆菌数量减少,拟杆菌/厚壁菌比例降低。
在患有自闭症的儿童中,乳酸杆菌、梭状芽孢杆菌、脱硫弧菌、Caloramator、Alistipes、Sarcina、Akkermansia、Sutterellaceae、肠杆菌科的水平升高。
许多研究人员已经评估了梭菌的丰度及其作为危险因素的作用。对自闭症儿童每周使用万古霉素治疗可显著改善神经行为和胃肠道症状。
发送信号 -> 控制肠通透性
除了肠道微生物群在免疫系统发育中的作用外,梭状芽孢杆菌通过肠上皮或迷走神经的传入纤维向大脑发送信号,并控制肠道通透性。
代谢
据报道,肠道微生物可通过产生酚类、短链脂肪酸和游离氨基酸等代谢物在肠道通透性中发挥重要作用。自闭症儿童丙酸和乙酸的比率较高,但丁酸的比率较低。非消化性碳水化合物的最终产物可能与自闭症发病机制有关。
详见:如何通过喂养菌群产生丁酸调节人体健康
自闭症儿童和正常发育儿童的粪便和血浆代谢组比较显示线粒体功能障碍;自闭症儿童中不同水平的酚类微生物代谢产物、脂质、氨基酸和外源性代谢可能被用作自闭症的分子生物标记物。
在另一项研究中对患有自闭症的儿童的血浆代谢物进行精确评估后,血浆代谢物的水平,包括烟酰胺核糖苷、IMP、亚氨基二乙酸、甲基琥珀酸、半乳酸、丙氨酸甘氨酸、肌氨酸和亮氨酸甘氨酸,明显较低。
然而,在微生物群转移疗法(MTT)后,这些代谢物发生了实质性变化,使其中一些与典型发育中儿童的代谢产物相似。
干预(饮食、微生物等)
已经证明,影响孕妇胎儿微生物群的高脂肪饮食也可能与自闭症有关。此外,母乳喂养6个月降低了自闭症表现的机会,而配方奶粉喂养与肠道艰难梭菌数量增加相关。
《cell》发表的关于自闭症的文章显示,与自闭症相关的行为与饮食多样性的减少有关。并提示在对精神疾病患者的微生物组分析时,应考虑饮食相关因素。
由于益生菌可以发挥抗炎作用并减轻IBD受试者的胃肠道症状,据报道微生物干预,如益生菌,可有助于减少自闭症患者的社会行为症状和炎症水平。
总的来说,自闭症患者肠道微生物群改变已得到证实。然而,考虑到参与患者的异质性和几个相互矛盾的结果,很难建立自闭症的独特特征。考虑到肠道功能障碍与自闭症患者社会行为障碍严重程度的不一致,这些数据提示我们应该考虑两种不同类型的自闭症,这些炎症类型与胃肠道并发症相关。
在各种治疗自闭症的方法中,益生菌治疗的结果很有潜力,同时也应考虑耐受性和安全性评估。鉴于微生物群分析方法的局限性,有必要进一步使用随机、安慰剂对照临床试验,以验证益生菌治疗自闭症的有效性。
精神分裂症(SCZ) 是一种严重的精神疾病,与幻听、妄想、思维和行为紊乱有关,损害日常功能和社会交往。
精神分裂症的生理病理学尚未得到解释,但最近的研究表明,环境因素增加了可能具有该疾病遗传易感性的个体发生精神分裂症的风险。
神经递质在多个系统中的功能障碍已被广泛研究,特别强调了信号异常的重要性,包括多巴胺、5-羟色胺、谷氨酸和GABA。
此外,炎症的重要性以及胃肠系统在精神分裂症病因中的可能作用正在考虑之中。
肠道菌群及其代谢物的影响
胃肠道微生物群在神经生成途径和肠道微生物组中起着至关重要的作用,微生物代谢物扰动已被证明会影响情绪和行为。
肠道微生物组的改变与几种神经发育和神经系统疾病相关。最近有研究表明,来自精神分裂症受试者的粪便移植到无菌受体小鼠,可诱发精神分裂症相关的行为症状。这与海马中GABA、谷氨酰胺和谷氨酸水平的改变有关。这表明精神分裂症患者的微生物群可能对神经化学产生影响,这可能与这些人类条件有关。
目前还没有报告可以促进受试小鼠模型行为改变的特定细菌功能。根据各种研究显示,放线菌、变形菌、拟杆菌和厚壁菌群在精神分裂症患者中的差异最大。
抗生素或许发挥作用
有趣的是,在一项体外研究中,补充抗生素减少了小胶质细胞对突触的吞噬。小胶质细胞降低了中枢神经系统突触的密度,这被认为是精神分裂症发育的一个重要步骤。
在对一组青少年的电子健康记录进行检查后,服用二甲胺四环素与精神分裂症的发病率略有降低有关,这意味着需要更多的研究来调查精神分裂症中微生物群的相关性。
益生菌缓解精神分裂症的消化障碍
根据SCZ的严重性和复杂性,尚未有研究证实精神分裂症患者通过补充益生菌来缓解任何行为症状。然而,一些研究认为,服用益生菌至少可以缓解与精神分裂症相关的消化障碍。
精神分裂症的微生物干预
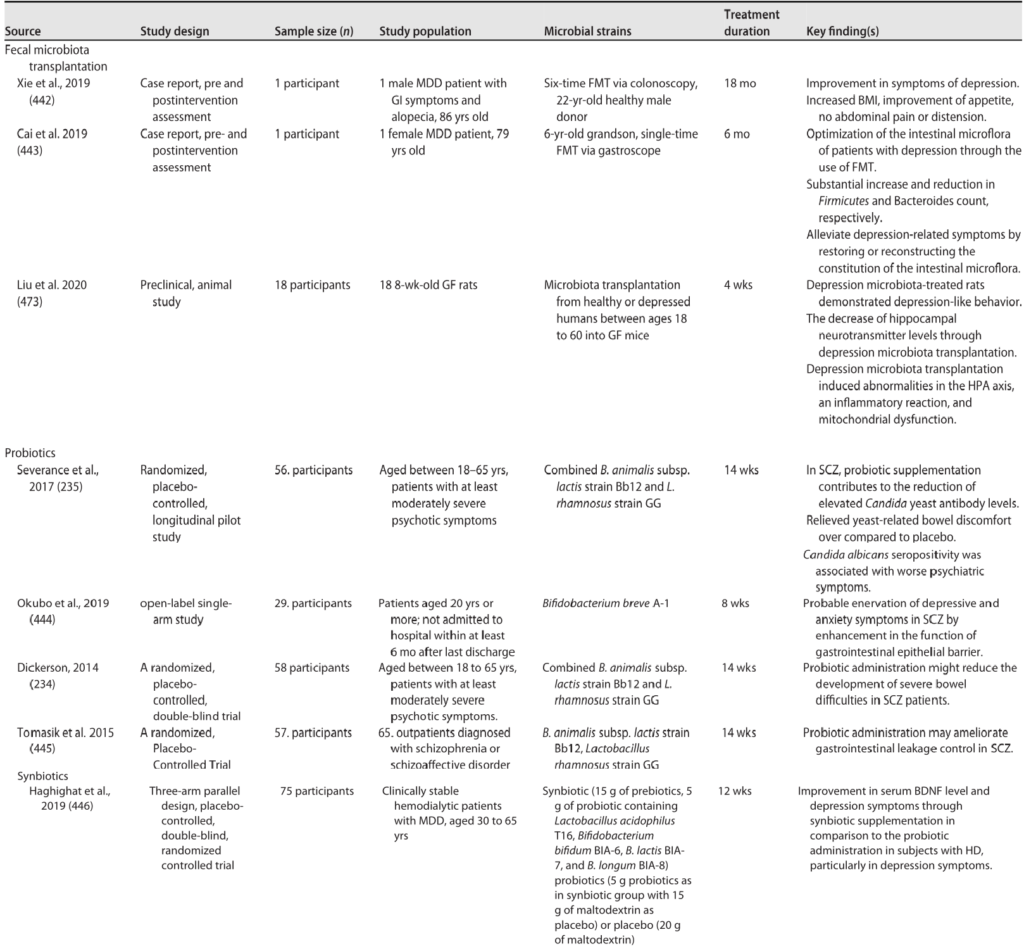
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在一项人类临床试验中,严重的胃肠道问题减少了,精神分裂症患者的精神症状没有任何改变。
另一项人体试验证明了白色念珠菌与胃肠道问题之间的相关性,在服用特定益生菌补充剂(包括鼠李糖乳杆菌GG和动物乳双歧杆菌Bb12)的男性患者中,精神症状有所改善,且白色念珠菌血清阴性。
已经发现了一整套针对严重精神病性疾病的新颖、可能的治疗干预措施,包括考虑肠道舒适性。需要进行更多的研究,通过纵向数据分析和更大的样本量来提高我们对胃肠道微生物群参与精神分裂症的理解。胃肠道微生物的功能和分类对于全面精神分裂症至关重要。
抑郁症是世界范围内导致严重残疾的一种常见的异质性疾病,其特征是情绪低落,经常伴随着对个人通常认为是愉快的活动失去兴趣。其严重形式为重度抑郁症,被归类为心境障碍。抑郁症对人们的健康有着更大的负面影响,并且它带来了与吸烟、血压和饮酒类似的死亡风险。它是癫痫和主要神经退行性疾病(下节内容)的相关共病,其病因包括代谢、神经内分泌和神经免疫因子。
抑郁症主要是一种脑部疾病,但大脑并不是孤立存在的,它存在于包括肠道在内的整个身体生理系统中。如果说成年健康个体的肠道菌群主要由拟杆菌和厚壁菌门组成(90%),那么重度抑郁症患者的肠道菌群在拟杆菌门、厚壁菌门、变形菌门和放线菌门的不同属的丰度上表现出显著变化。
在人类和动物模型中研究发现,临床抑郁症与肠道微生物群丰富度和多样性降低有关。来自抑郁症患者或对照组的粪便微生物群样本移植到微生物群缺陷大鼠模型中,诱发了抑郁症的行为和生理特征,包括快感丧失和焦虑样行为。
慢性炎症可能在重度抑郁症(MDD)的发病机制中发挥重要作用,肠道菌群的内环境平衡失调可能导致此类炎症,这表明胃肠道菌群在影响大脑发育、情绪和行为方面起着中心作用。
这些作者得出结论,生理和情绪压力会影响肠道微生物组的组成。
抑郁症通常与肠易激综合征共存,肠易激综合征的特征是肠道功能的改变,从动物研究中获得的数据表明,肠道微生物群可能影响抑郁症的神经生物学特征。
利用小鼠双侧嗅球切除术(已知会诱发抑郁样行为)来研究其是否会导致微生物群组成的变化:球切除术诱导的慢性抑郁导致肠道微生物谱改变,同时结肠运动、c-Fos活性和5-羟色胺水平增加。
由于抑郁症是肥胖患者的常见症状,研究人员从肥胖小鼠(表现出抑郁症样行为)移植到非肥胖对照小鼠体内的微生物组,观察发现在体重无显著差异的情况下,对照组非肥胖小鼠中肥胖衍生的微生物群重新定植导致探索、认知和定型行为的中断。
抑郁样行为也可以通过应激模型在小鼠中诱导,例如慢性社会挫败应激(CSDS)范式,在该范式中,小鼠反复遭受更大、更具攻击性的小鼠的社会挫败。应激小鼠表现出抑郁样行为,并表现出微生物多样性的变化,其中脱硫弧菌科、Rikenellaceae、毛螺菌科的数量增加,Allobaculum、Mucispirillum的数量减少。
现有证据表明,肠道微生物群可能在抑郁症的发展中起到因果作用,并且可能被认为是治疗/预防这种疾病的一个有价值的靶点。
神经退行性疾病是一类复杂疾病,脑和脊髓的神经元随时间发展而损害逐渐加剧,以特异性神经元的大量丢失为主要特征。这里介绍几种常见的神经退行性疾病及其与肠道微生物群的关系:
多发性硬化
帕金森病
阿尔茨海默
癫痫症
中风和脑损伤
多发性硬化
多发性硬化症(MS)是一种免疫介导的慢性中枢神经系统疾病,涉及受损轴突和脱髓鞘,影响全球约230万人,女性发病率较高。
多发性硬化的致病特征
在中枢神经系统中形成炎性局灶性脱髓鞘斑块,包括脊髓和大脑的灰质或白质,并触发神经炎症反应,导致包括少突胶质细胞在内的特殊细胞脱髓鞘,并导致神经退行性变。
脱髓鞘如何形成?
由于血脑屏障的异常通透性,免疫系统的各种细胞渗入中枢神经系统,导致脱髓鞘的发生。髓鞘抗原特异性T细胞(CD81和CD41 T细胞)穿过这一屏障,导致一系列事件导致脱髓鞘病变的形成。
多发性硬化发病的免疫机制
最近对多发性硬化小鼠模型(包括实验性自身免疫性脑脊髓炎模型)的研究表明,CD41 T淋巴细胞在多发性硬化发病机制中起主要作用。尤其是,CD41Th17和Th1淋巴细胞在多发性硬化发病中具有最突出的作用。
Th1有助于分泌δ干扰素(IFN-d),在活化后促进巨噬细胞酶的产生。此外,IFN-d刺激活性氮和活性氧的产生,分别导致细胞结构的亚硝化和氧化损伤。Th1细胞还能够产生IL-12,从而诱导肿瘤坏死因子(TNF-a)和IFN-d的分泌,导致慢性炎症反应和进一步的组织损伤。
由Th17细胞介导的特定细胞因子(包括IL-22、IL-21和IL-17)的产生导致慢性炎症进展。识别中枢神经系统自身抗原(如Th1和Th17)的CD41 T淋巴细胞参与多发性硬化的病理生理学。
除了CD81和CD41细胞外,其他免疫细胞也与多发性硬化发病有关,包括NK细胞、小胶质细胞和巨噬细胞。这些细胞与其细胞因子之间的分子相互作用维持了中枢神经系统内的炎症级联反应。
多发性硬化的几种临床变异
包括最常见的复发缓解型多发性硬化和进行性复发型多发性硬化,以及原发性进行性多发性硬化和继发性进行性多发性硬化(SPMS)。
遗传易感性和环境因素在多发性硬化症的病因中都起着重要作用。
肠道微生物群参与免疫调节
最近的研究表明,肠道共生微生物群落也与多种免疫介导的疾病(如多发性硬化)有关,可以认为是一种新的环境风险因素。换句话说,肠道微生物群负责免疫调节,改变血脑屏障的完整性和功能,刺激自身免疫脱髓鞘过程,并与中枢神经系统中存在的各种细胞类型直接相互作用。
与肠道微生物群α或β多样性的广泛差异不同,横断面调查主要揭示了多发性硬化儿童与健康个体相比在分类上的明显改变。
一些研究评估了多发性硬化患者微生物移植到两种不同的实验性自身免疫性脑脊髓炎(EAE)模型中的效果;这些研究强调了产生IL-10的CD1 T细胞在胃肠道微生物群介导的免疫调节中的重要性。
此外,胃肠道中SFB的存在,可能在Th17细胞活化中起作用 ,显著影响EAE小鼠的多发性硬化样症状。根据多发性硬化作为脱髓鞘疾病的定义,临床前抗菌研究表明,在汇集来自无菌小鼠模型的数据后,胃肠道微生物群可以调节小鼠模型前额叶皮质髓鞘的生成。
肠道菌群在血脑屏障调节中的基本作用
无菌小鼠研究表明,作为多发性硬化的一个主要标志,微生物组与血脑屏障完整性的丧失之间可能存在关联。
研究还表明,在膳食中补充短链脂肪酸或产短链脂肪酸的菌,可以逆转血脑屏障完整性的丧失。此外,饮食诱导的肠道微生物群落结构变化也参与了EAE的表现。
有证据表明,肠道微生物群可以调节大量的神经炎症途径。然而,补充研究对于理解多发性硬化病因的确切作用机制至关重要。动物和人类研究表明,肠道菌群可能与多发性硬化生理病理学的许多方面有关。
干预措施
关于如何有效地控制肠道微生物组作为一种干预措施,以最大程度地阻止复发和缓解症状,问题仍然悬而未决。
在一项试点实验中,补充一种特定的益生菌制剂(含有双歧杆菌、乳酸杆菌和链球菌)可以逆转微生物群的改变并调节炎症反应,这表明这种微生物群靶向治疗是有希望的(下表),尽管需要进一步调查以确认这些结果。
多发性硬化的微生物干预
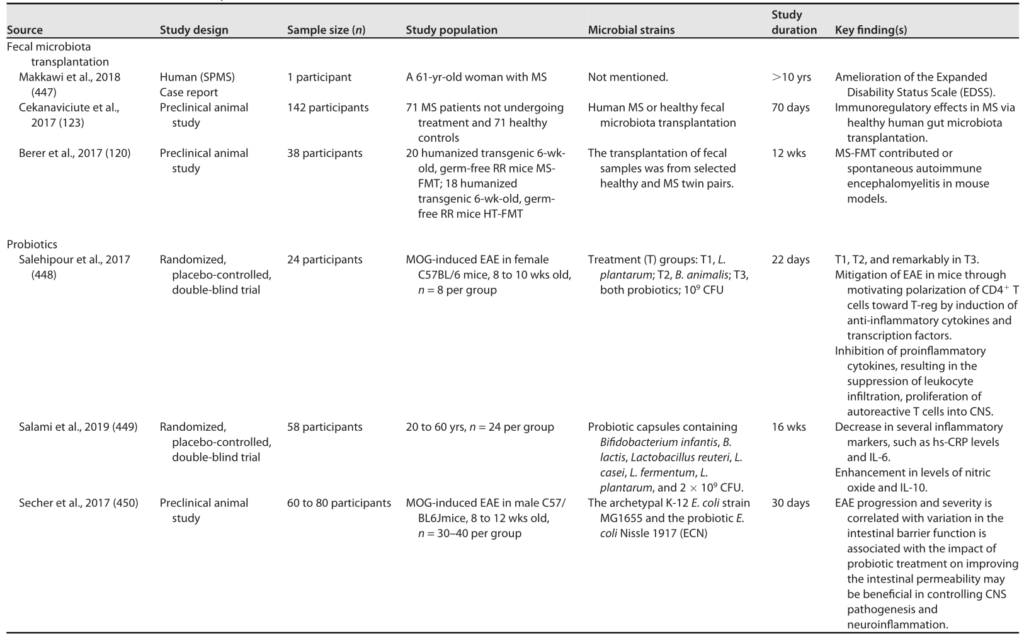
Sorboni SG, et al.,Clin Microbiol Rev. 2022
帕金森病
帕金森病(PD)是一种进行性多中心神经退行性疾病,由α-突触核蛋白(α-syn)沉积在部分大脑中心黑质的多巴胺能神经细胞中引起。这些过程促进了圆形片状嗜酸性细胞质内含物的逐渐聚集,称为Lewy小体。
然而,帕金森发病机制的确切机制仍不明确,它可能是一种多因素疾病,在这方面引入了各种理论。
衰老是帕金森发展和进展的重要风险因素
影响多种细胞途径,导致这些过程受损,并导致神经退行性变。可以想象,年轻神经元可以容忍的相同分子扰动在老年神经元中显示出一些灾难性后果。
帕金森病的临床症状主要表现为运动障碍症状,包括肌肉僵硬、静止性震颤、运动迟缓和姿势不稳 。帕金森病在50岁之前很少见,但随着年龄的增长,发病率会增加5到10倍。它主要发生在男性,每年每100000人中有5-35例新病例。
多巴胺能神经元逐渐退化,非运动和运动症状如抑郁症、痴呆症和胃肠道问题(包括便秘、唾液分泌异常、排便功能障碍、恶心和吞咽困难)之间存在着强相关。帕金森症状因个体而异。
几项研究表明,帕金森受试者的胃肠道异常与肠神经系统中的肠道失调和α-突触核蛋白沉积有关。
肠道菌群如何影响帕金森?
由于最初的胃肠道参与帕金森,并且宿主微生物组之间的生理相互作用潜力很大,因此有人认为胃肠道菌群可能影响帕金森。胃肠道功能异常,尤其是便秘,影响多达80%的帕金森病患者,并且可能在出现运动症状前几年发生。
特发性便秘是帕金森的主要相关因素,与肠神经系统的神经退行性改变有关。肠神经系统中的α-syn神经退行性变可能是帕金森的运动前临床症状之一。它与慢性便秘和胃肠道壁的生理改变有关。
肠道微生物群可能影响参与α-syn分泌的肠道神经元。这些变化在运动症状出现之前的帕金森开始时就已出现,可认为是运动前生物标记物。
——Prevotellaceae减少
对肠道微生物组与帕金森患者之间的相关性进行了不同的研究。一项研究观察到帕金森病患者粪便样本中Prevotellaceae种类显著减少。与对照组相比,Prevotellaceae的丰度显著降低(77.6%)。
Prevotellaceae通过膳食纤维发酵和肠道中的粘蛋白率先产生短链脂肪酸。Prevotellaceae减少引起的细菌内毒素全身暴露和肠道通透性的增强可触发α-syn结肠的不受控制的表达和错误折叠。
这种肠型负责硫胺素、叶酸和神经活性短链脂肪酸的生物合成。因此,补充这些维生素和短链脂肪酸可能有助于治疗帕金森。
最近的研究首次承认,帕金森病患者的机会性病原体数量显著增加。
——肠杆菌科丰度增加
步态困难姿势不稳的严重程度与肠道内肠杆菌科丰度呈正相关。肠杆菌科细菌在肠道中的过度生长导致作为血清中革兰氏阴性细菌细胞壁一部分的LPS滴定增强 。因此,研究表明,由于帕金森患者血液样本中LPS的吸收增加,LPS结合蛋白的全身浓度异常高。
——乳酸杆菌科的丰度增加
与Prevotellaceae一样,乳酸杆菌科与胃肠激素ghrelin有关。也有报道称帕金森患者的ghrelin分泌减少。
总的来说,研究结果揭示了胃肠道微生物群和帕金森作用之间的联系。进一步的微生物组学分析可能会提高准确性,澄清关系以及机制。
帕金森患者中菌群失衡可能会影响炎症,因为菌群失调会损害肠道屏障功能并触发免疫激活和全身炎症反应。
帕金森的持续存在会影响微生物群,肠道菌群可能在一些腹部症状中起作用,如便秘和炎症。
肠道屏障破坏
简而言之,LPS和其他细菌神经毒素在穿过肠壁后进入血液,导致肠上皮屏障的破坏。血液中细菌LPS的存在导致通过核因子kB(NF-kB)和TLR4产生炎症细胞因子,导致全身炎症。细菌LPS和炎性细胞因子(包括TNF-a、IL-1b和IL-6)诱导的血脑屏障破坏触发α-syn的积累。位于黑质的多巴胺能神经元丢失可能是血脑屏障分解的结果。由于帕金森的肠屏障破坏导致微生物易位升高和促炎症基因谱升高,结肠活检标本显示TLR4或细菌内毒素特异性配体、CD31 T 细胞和其他细胞因子的表达增强。
产短链脂肪酸的细菌减少
帕金森病患者在肠道失调期间产短链脂肪酸的细菌减少。TLR4介导的炎症在脑或肠道炎症中发挥重要作用,这可能是导致帕金森神经退行性变的重要因素之一。因此,增强肠道内肠杆菌科后LPS的相对增强与帕金森的发生相关。
闭塞和其他紧密连接蛋白对肠屏障结构至关重要。肠道生态失调,使闭塞素降解,导致肠道通透性增强。
促炎细胞因子升高
另一项针对帕金森病患者的研究调查了其粘膜中Ralstonia、肠球菌和变形菌浓度的增加,导致促炎细胞因子的升高。
帕金森受试者粪便样本中被认为具有抗炎作用的产丁酸菌(如布氏杆菌、粪球菌、粪杆菌和罗氏菌)数量显著减少。
此外,据报道,帕金森患者粪便样本的微生物群中LPS生物合成基因表达增加。有趣的是,幽门螺杆菌感染可被认为是帕金森发病机制中的一个重要触发因素。
小肠细菌过度生长(SIBO),与运动功能障碍有关,尤其是在帕金森患者中。
牙龈假单胞菌感染在帕金森的病因/危险因素中的重要作用
牙龈卟啉单胞菌的牙龈蛋白酶和LPS导致帕金森样本中出现异常血凝块。研究发现只有帕金森样本的凝块中观察到了牙龈蛋白酶抗体信号,这证实了这种细菌在帕金森病理学中的潜力。他们进一步指出,据报道,牙龈假单胞菌诱导的外周炎症导致肠道微生物群失衡,黑质多巴胺能神经元减少,肠道通透性增加,以及富含亮氨酸重复激酶2(LRRK2)相关帕金森病理生理学中小胶质细胞活化增强。
益生菌缓解症状
益生菌,包括乳酸杆菌和双歧杆菌,已被证明可以缓解帕金森样症状。
帕金森的微生物干预

Sorboni SG, et al.,Clin Microbiol Rev. 2022
芽孢杆菌作为一种益生菌,能够将L-酪氨酸转化为L-多巴,L-多巴是多巴胺的重要前体分子,其转化为多巴胺是通过多巴脱羧酶进行的。
据报道,定期服用含有干酪乳杆菌shirota的发酵乳饮料可通过减少帕金森患者粪便中葡萄球菌的数量促进排便。
肠道微生物群从二芳基黄烷醇中积极产生多酚,干扰α-突触核蛋白的错误折叠和毒性,是帕金森和其他α-突触核蛋白病的基本病理机制。
对口服富含拉法诺制剂(FRP)的异源性人源化侏儒小鼠的研究表明,FRP衍生代谢物的产生存在特殊差异,影响α-突触核蛋白的错误折叠或炎症。
对果蝇α-突触核蛋白病模型的研究表明,它对运动功能障碍有影响,从而导致其发病和进展的调节。
体外研究表明,在细菌发酵过程中,特定的细菌可以产生这些具有生物活性的酚酸。
总之,已经得出结论,个体间异质肠道微生物群诱导的二芳基黄烷醇的变化证明了益生菌、益生元和共生策略在调节帕金森和其他共核病变进展中的潜力。
目前,关于微生物组与帕金森病之间的相关性的不同研究结果并不一致。微生物组的结果产生了有价值的信息。帕金森患者使用的药物与肠道微生物之间存在联系,因为肠道微生物群在处方药物代谢中发挥作用,甚至药物对微生物组成产生影响。
对胃肠道微生物组和肠-脑轴的相互作用有一个完整的认识,可能阐明帕金森的病因和进展因素,以提供新的治疗视野和手段。例如,FMT和肠道微生物组作为帕金森临床诊断的新生物标记物的评估可能揭示传统治疗方法的替代治疗。
肠道不适可发生在帕金森的初始阶段;这有助于在出现震颤和强直等运动症状之前对该疾病进行早期诊断。微生物组学研究可以提供关于帕金森病的有用信息,但目前,我们不能依赖它们作为生物标志物。
阿尔茨海默病是一种慢性不可逆的大脑疾病,脑细胞的进行性退化导致记忆障碍、认知能力下降。它是老年人最常见的痴呆类型。阿尔茨海默患者表现出严重的学习、行为和记忆障碍,严重到足以影响日常活动。
阿尔茨海默的特征
阿尔茨海默患者的大脑中的神经元细胞死亡和进行性突触衰竭,伴随着神经元周围或外部的β淀粉样蛋白(amyloid-β,简称Aβ)沉积,伴随着皮质神经元树突和轴突中微管相关蛋白tau异常磷酸化的聚集。Aβ的积累和tau蛋白的聚集有助于微管稳定性的降低、突触失效和神经元钙稳态的紊乱,最终导致神经元凋亡。
尽管已经对阿尔茨海默的病因进行了大量研究,但阿尔茨海默的潜在机制尚不完全明确,目前的Aβ疗法对症状的缓解作用有限。据报道,淀粉样蛋白可能在大脑中充当AMP。
与中枢神经系统炎症有关
最近的研究发现阿尔茨海默的发病机制与周围感染引起的中枢神经系统炎症有关。在感染单纯疱疹病毒1型(HSV-1)的小鼠中,可以看到阿尔茨海默受试者中tau和Aβ沉积的共同特征。病毒感染诱导的高细胞内胆固醇25羟化酶(CH25H)水平对于调节Aβ产生和阿尔茨海默易感性至关重要。
阿尔茨海默 & 微生物群
此外,先前的研究已经证明阿尔茨海默与其他微生物感染(包括真菌、肺炎衣原体和螺旋体感染)之间存在潜在联系。阿尔茨海默患者脑脊液中肠道菌群微生物驱动代谢物的测定与阿尔茨海默生物标记物(如磷酸化tau和tau/Aβ42)相关,表明肠道微生物群在阿尔茨海默发病中的意义。
一项研究报告,根据Aβ前体蛋白转基因小鼠(APP)粪便样本的细菌16S rRNA序列分析,与野生型小鼠模型对照组相比,肠道微生物组成存在显著差异。研究还表明,具有阿尔茨海默表型的转基因小鼠模型具有多种肠道微生物。
对无菌小鼠的研究表明,在没有微生物的情况下,不会出现淀粉样斑块和神经炎症症状。
根据横断面研究结果,与健康对照组相比,阿尔茨海默患者粪便样本中参与炎症反应的两种细菌大肠杆菌和志贺菌的丰度显著增加。在患有认知障碍和脑淀粉样变性的患者中,可能与外周炎症状态有关的两种主要情况包括促炎性大肠杆菌和志贺菌的增加以及抗炎性直肠真杆菌的降低。
菌群失调 & 全身炎症
肠道微生物群失调和全身炎症之间存在联系,这可能是阿尔茨海默患者大脑中发生的神经退行性变的一个促成因素。
这些观察结果基于小规模研究,需要更多具有较大统计组的研究来评估肠道微生物群与阿尔茨海默进展的关系。一些科学家指出,在阿尔茨海默患者大脑中发现的感染因子可能与该疾病的发展有关,但在这方面,强有力的证据是必不可少的。
牙龈卟啉单胞菌在患者大脑中定植
在最近的一项阿尔茨海默治疗研究中,使用合成的神经毒性抑制剂是有益的。在这项研究中,牙龈卟啉单胞菌与慢性牙周炎有关,在阿尔茨海默患者的大脑中被发现。这些细菌在大脑中的定植导致Aβ1-42的产生增加。此外,神经毒性姜黄素对tau蛋白Aβ1-42有破坏性影响。
NLRP3炎症小体与阿尔茨海默
肠道微生物群失调与阿尔茨海默相关神经炎症之间的潜在关联。肠道NLRP3异常表达的增加与外周炎性体的激活呈正相关,后者随着阿尔茨海默的进展而增强神经炎症。因此,观察到,与年龄匹配的对照组小鼠相比,年轻和老年5xFAD小鼠模型的肠道微生物群组成发生了相当大的变化。
与非转基因小鼠相比,com 5xFAD小鼠由于粘附蛋白和紧密连接蛋白的丢失而表现出肠道屏障功能受损。此外,已经证明肠道微生物炎症体蛋白的高表达可能是激活下游细胞毒性和炎症介质的重要主导因素。因此,NLRP3炎症体介导的神经炎症可能通过胃肠道NLRP3促进。因此,肠道微生物群调节可能是治疗遗传易感个体阿尔茨海默相关神经系统疾病的一种可能策略。
将Tg2576小鼠阿尔茨海默模型(包括症状前和症状中转基因)与野生型进行比较,研究人员观察到肠上皮屏障(IEB)中血管A β肽的沉积破坏了IEB,并且吸收失调发生在其脑聚集之前。得出结论,肠-脑轴的改变与较高水平的炎症血浆细胞因子(如IL-9、IP-10和VEGF)相关。
考虑到阿尔茨海默患者的肠道功能障碍,阿尔茨海默治疗的未来治疗策略可能涉及肠道微生物群的早期调理。根据肠道微生物群参与阿尔茨海默Aβ病理学的发展,研究人员开发了一个新的框架,通过肠-脑轴确定阿尔茨海默的潜在机制,并将肠道微生物群的操作转化为临床实践。
抗生素疗法
用接受来自老年(16个月)APPSWE/PS1DE9小鼠的粪便供体移植的APPSWE/PS1DE9小鼠进行短期抗生素鸡尾酒疗法,收集粪便颗粒进行进一步分析。
抗生素治疗前小鼠的FMT重建主要归因于供者来源,如梭状芽孢杆菌和Coriobacteriae,有助于Aβ斑块的更高沉积。有趣的是,在微生物群植入后,Aβ斑块周围星形胶质细胞的激活受到抑制,而不是小胶质细胞。
在阿尔茨海默小鼠模型中,长期服用广谱抗生素也可以减少Aβ积累并调节影响Aβ淀粉样变的先天免疫反应。此外,在转基因小鼠中,通过定期使用抗生素鸡尾酒疗法,海马淀粉样斑块周围的小胶质细胞和星形胶质细胞聚集以及不溶性Aβ斑块减少 。
也有报道称,通过比较不同年龄的野生型和阿尔茨海默小鼠模型之间的粪便短链脂肪酸和微生物组成,观察到具有阿尔茨海默表型的小鼠中的丁酸球菌和瘤胃球菌数量显著减少,变形菌和疣状菌数量增加,提供改变的微生物组成和多样性。短链脂肪酸水平的下降表明至少有30条代谢途径受到干扰。
先前的一项研究也表明,小胶质细胞激活抑制Aβ清除和降解,Aβ的进一步积累导致阿尔茨海默的病理学。此外,Aβ沉积水平的升高有助于小胶质细胞内几种促炎介质的释放,如ROS、iNOS、NF-kB和COX2,从而促进阿尔茨海默患者的神经炎症。
阿尔茨海默的微生物干预
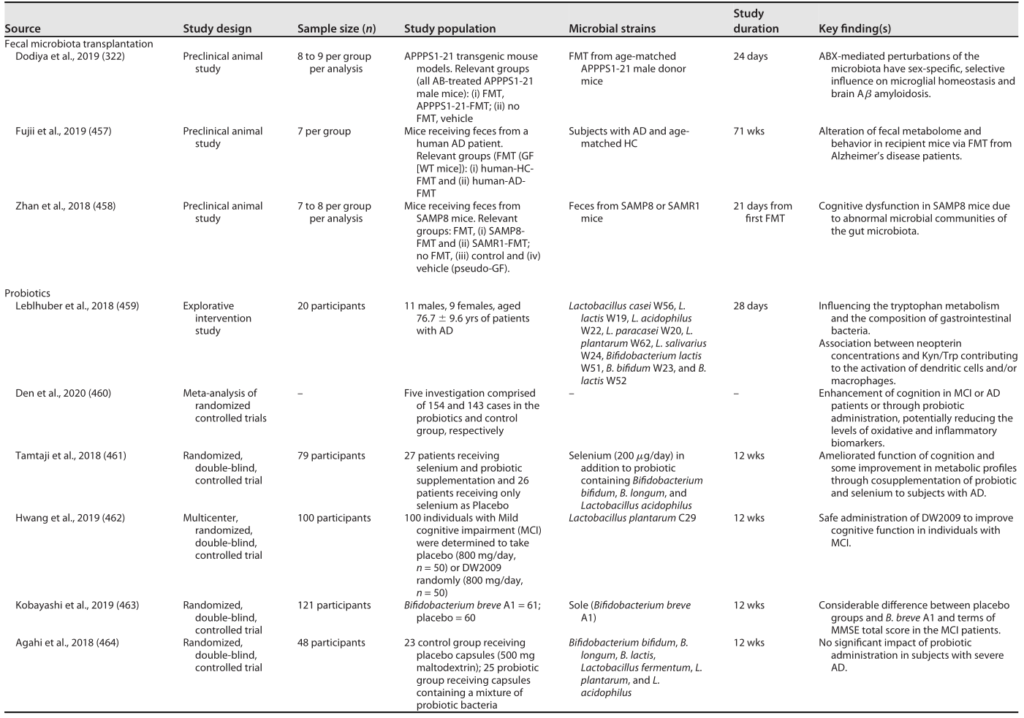
Sorboni SG, et al.,Clin Microbiol Rev. 2022
这些研究表明,某些种类的肠道微生物可激活Aβ信号通路,参与阿尔茨海默的发病机制,并在阿尔茨海默的分子调节中发挥关键作用。益生菌补充和营养干预可能成为阻碍阿尔茨海默进展的一种有希望的治疗方法。
癫痫是一种使人衰弱的神经系统疾病,影响全世界约6500万人。尽管医学上有许多新的进展,但确切的病因仍需完全阐明。大约一半的癫痫患者病因不明。据报道,癫痫患者的医疗费用是正常人的13倍。癫痫显著的社会经济影响是由于其死亡率和致残率高于正常人群。尽管正在使用抗癫痫药物(AEDs)进行药物治疗,但只有70%的癫痫患者能够完全控制癫痫发作。因此,大约三分之一的癫痫患者会出现难治性癫痫,影响他们的日常生活活动。
环境和遗传因素都决定癫痫的易感性。
此外,一些研究表明肠道细菌种类与癫痫的病理生理学之间存在关联。肠道微生物组失调与癫痫等神经精神疾病的发生有关。平衡的肠道微生物群与健康的大脑和免疫系统之间存在相关性。
最近的研究表明,慢性炎症在癫痫的发病和进展中起着重要作用。研究还表明,肠道菌群可以调节免疫和炎症反应。因此,操纵肠道微生物组作为癫痫的治疗策略具有潜力。
腹腔注射LPS诱导大鼠更易发生癫痫发作,同时增加血脑屏障的通透性和大脑中更高水平的促炎细胞因子。
未控制癫痫的替代治疗策略包括迷走神经刺激和生酮饮食。因此,控制肠道微生物群的多样性可以被认为是一种潜在的治疗方法。
癫痫患者肠道菌群变化
在几项研究中发现,与健康人群相比,采用各种治疗方法的癫痫患者的肠道微生物特征存在差异。
所有这些研究表明,在未控制的癫痫中,厚壁菌/拟杆菌比率增加。一些属于厚壁菌门的细菌能够调节神经递质水平。对肠道微生物群(包括α-多样性)的进一步分析表明,结果存在显著差异。在另一项研究中,与拟杆菌相比,厚壁菌的数量增加。
此外,与药物反应性患者相比,耐药患者的α-多样性测量结果与健康受试者相似。实质上,更高水平的α-多样性与罕见肠道细菌种类的异常增加有关。此外,在属水平上,报告了显著差异。根据这些结果,可以认为细菌在癫痫的有效治疗中起作用。
有趣的是,肠道微生物群可以调节唑尼沙胺代谢,唑尼沙胺是一种抗癫痫药物。此外,乳酸杆菌和双歧杆菌数量的增加与每年较少的癫痫发作相关。
在临床前和临床研究中,关于抗生素给药是否能诱导或预防癫痫发作,也有争议的发现。值得注意的是,潜在传染病在治疗过程中可能产生的促癫痫作用或抗生素直接引起的神经毒性副作用可能更为重要。
生酮饮食降低癫痫发作率
据报道,癫痫患者的生酮饮食可降低癫痫发作率,并与肠道菌群组成和功能的改变有关。
生酮饮食在颞叶癫痫的无菌小鼠模型中介导抗癫痫作用。事实上,这些研究人员发现,SPF小鼠在移植生酮饮食的微生物群或长期治疗细菌后癫痫发作阈值升高(长期治疗细菌包括Akkermansia muciniphila, Parabacteroides distasonis, Parabacteroides merdae)。
一些研究表明补充益生菌对癫痫有积极作用。
癫痫的微生物干预
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在全球范围内,中风和脑损伤是发病率和死亡率的重要原因。肠道菌群中的共生细菌可能通过调节多种脑血管疾病的危险因素(包括动脉粥样硬化、糖尿病、血脂异常和动脉高血压),与中风的发生有关。饮食也是一个重要的危险因素。
将动脉粥样硬化和失调联系起来会直接影响微生物组的组成和多样性。然而,越来越多的证据表明,肠道微生物群可能在脑血管疾病和中风中发挥更直接的作用。
三甲胺n-氧化物(TMAO)升高
三甲胺n-氧化物(TMAO)作为微生物群衍生的代谢物,可以从膳食胆碱中合成,可在体液和组织中检测到。最近的研究表明,TMAO与脑血管和心血管疾病的风险增加有关,这表明可能通过这种代谢物的治疗潜力调节肠道微生物群。
横断面调查表明,与健康对照组相比,中风患者的肠道微生物群组成不平衡。在一项对4000多例患者的纵向研究中,血浆样本中TMAO水平升高与卒中和心血管事件的高风险呈剂量依赖性相关。
抗生素补充引起的TMAO水平降低突出了肠道细菌在该化合物合成中的重要性。
同时,与无症状动脉粥样硬化患者相比,中风和短暂性脑缺血发作患者的TMAO水平相对较低。
磷脂酰胆碱代谢物
临床前研究表明,服用磷脂酰胆碱代谢物(如胆碱和TMAO)可上调参与动脉粥样硬化的巨噬细胞清除受体的表达,这可能是由于肠道中存在的细菌物种所致。
对无菌小鼠的研究表明,胆碱的服用与较高的动脉粥样硬化率无关,并且有助于减少主动脉斑块的体积。然而,关于饮食对TMAO和胆碱的影响以及肠道微生物群在动脉粥样硬化发病和进展中的有害和保护作用,重要的是不要过度解释临床前研究的结果。
健康的微生物组在动脉粥样硬化病变的恢复中起着重要作用。
大脑中动脉闭塞后补充广谱抗生素与小鼠存活率降低相关。抗生素诱导的胃肠道菌群改变也导致IL-17相关趋化因子表达下调和促炎性IL-17gd T细胞迁移减少。
因此,肠道细菌通过调节肠道T细胞向大脑的浸润来调节中风后的神经炎症。
卒中后含有短链脂肪酸产生菌的粪菌移植,包括发酵乳杆菌、长双歧杆菌、Faecalibacterium prausnitzii、Clostridium symbiosum,可缓解卒中后的认知障碍和炎症,还可增加血浆、肠道和大脑短链脂肪酸浓度,促进老年模型卒中后恢复。也有报道称,将中风患者粪菌移植到抗生素给药的小鼠,以及从中风模型转移到无菌小鼠,会增加缺血性脑损伤和相关功能损伤的大小。
中风和脑损伤的微生物干预
Sorboni SG, et al.,Clin Microbiol Rev. 2022
据报道,中风后拟杆菌的数量和多样性减少。另一项研究表明,短暂性脑缺血发作和中风患者的机会性病原体数量较多,包括脱硫弧菌、肠杆菌、巨球形杆菌和Osicillibacter,有益或共生菌属的数量较少,如拟杆菌、粪杆菌和Prevotella。此外,Prevotellaceae和Peptococcaceae的丰度增加与中风严重程度相关。
用一种特殊的细菌菌株,即丁酸梭菌进行治疗,可改善缺血/再灌注小鼠模型的认知功能,并减少神经元损伤。
根据这些解释,肠道微生物群在中风和脑损伤发病和进展中的作用尚不完全清楚。虽然临床前和临床研究提供了有趣的结果(表7),但还需要进一步的研究。有人建议在饮食中补充精神生物素,以减少创伤性脑损伤后的精神后果和共病。然而,需要更多的临床研究来阐明这种微生物治疗干预的潜力。
药物
益生元
益生菌
合生元
后生元
粪菌移植
其他
越来越多的证据表明,人们越来越认识到肠道微生物组在调节不同药物(如精神药物)的疗效和副作用方面的重要性。
抗生素
抗生素是影响胃肠道菌群的最有效和最直接的方法。
对1135名个体的肠道微生物组的深度测序表明,肠道微生物组与各种药物组之间存在关联。抗生素与胃肠道微生物组的改变密切相关。
值得注意的是,作者提供了其他几种治疗药物对胃肠道微生物群影响的证据,如二甲双胍、泻药、他汀类药物和质子泵抑制剂(PPI)。
多药疗法
同时使用多种药物治疗患者,也与肠道微生物群的改变有关。一项调查显示,服用药物的数量与微生物多样性之间存在显著的负相关。尤其是抗抑郁药、PPI和抗精神病药与分类单元丰度的相关性最大。
非抗生素药物
同时,新证据表明,除了药物药代动力学的调节外,非抗生素药物还可以改变肠道微生物组结构,对情绪和行为产生潜在影响。
另一方面,人们越来越重视肠道微生物组与药物之间的相互作用,这支持了肠道菌群可影响药物代谢和吸收的观点。在一项大规模队列研究发现,包括抗生素、抗抑郁剂、苯二氮卓类药物等在内的医疗干预可以改变肠道微生物组的组成。
精神药物
此外,研究了精神药物对40名焦虑症和/或重度抑郁症患者胃肠道菌群的影响。在其队列研究中,研究人员得出结论,抗精神病药物降低了胃肠道微生物组α多样性。这些研究人员确定抗精神病药物的剂量与这些患者的α-多样性呈负相关。
已经进行了多项体外研究,以评估非抗生素药物的抗菌活性,所有这些药物都具有抗菌活性,可能通过与特殊分子靶相互作用影响中枢神经系统功能。
其他报告显示抗抑郁药选择性5-羟色胺再摄取抑制剂(SSRIs)、氟西汀、舍曲林、西酞普兰和帕罗西汀对芽孢杆菌、梭状芽孢杆菌、肠球菌、假单胞菌和葡萄球菌菌株具有抗菌活性。
在最近的一项研究中,作者测试了不同类别的抗抑郁药对12种肠道菌群共生细菌菌株的抗菌活性。大多数被检查的抗抑郁药对被检查菌株的生长具有相当大的浓度依赖性抑制作用。此外,在对雄性BALB/c小鼠肠道微生物群的体内研究中,作者发现与对照组相比,地昔帕明可增加β-多样性并降低丰富度。
这些作者还发现,在补充了地昔帕明的小鼠模型中,Adlercreutzia、瘤胃球菌和未分类的α-变形杆菌的数量减少。三环类抗抑郁药,包括阿米替林,也被证明对致病细菌菌株,如芽孢杆菌属、葡萄球菌属和霍乱弧菌具有体外抗菌活性,而丙咪嗪分别对小肠结肠炎耶尔森菌和大肠杆菌具有生长抑制作用。
在一项老年住院患者队列研究中,研究了精神药物对肠道微生物群组成的影响。在受试药物中,与PPI和抗抑郁药相比,抗精神病药物与微生物群落α多样性的负相关性最高。
在另一项对双相情感疾病受试者的调查中,非典型抗精神病药物(APP)治疗与女性的微生物多样性降低相关,但与APP治疗的男性患者无关。在这一队列中,服用APPs的患者,其衣原体科和阿克曼氏菌的数量分别显著增加和减少。
在针对40种肠道共生菌代表的1000多种药物的大规模体外筛选研究中,据报道,24%的受试药物对至少一种细菌菌株表现出生长抑制。这些药物对相当相似的物种模式具有抗菌活性,表明直接抗菌活性可能是其药理作用的一部分,不应将其视为副作用。因此,迫切需要评估精神药物对胃肠道菌群的潜在影响。
阿片类药物
肠-脑轴的双向方面也反映在这样一个事实,即肠道神经胶质细胞的 GDNF 等分泌因子也通过粘膜免疫系统的成熟以及通过加强上皮紧密连接功能来调节微生物稳态。阿片类药物介导的 GDNF 表达降低也与肠道通透性增加和肠粘膜表面免疫监视改变有关。这些因素有助于维持阿片类药物治疗观察到的促炎环境,导致下游阿片类药物相关的合并症,如阿片类药物耐受、依赖和戒断。

Jalodia R, et al., J Neuroimmune Pharmacol. 2022
此外,来自肠神经元的神经元介质(例如,VIP、ACh、NO)的阿片类药物抑制释放会导致胃肠道分泌减少、水和电解质吸收增加、蠕动减少,从而导致阿片类药物诱导的便秘,进一步导致微生物群失调。总之,虽然 OUD 的药物治疗是可用的,但它们并非对所有患者都有效。
根据国际益生菌和益生元科学协会(ISAPP)的说法,“益生元是指宿主微生物群体专门利用的、对健康有益的非活性食品成分。”作为益生菌补充的替代品,益生元可用于调节肠道菌群。
这组化合物通过其影响胃肠道健康的能力进行鉴定,包括不可消化低聚糖(NDO)、母乳低聚糖(HMO)和可溶性可发酵纤维。尽管益生元疗法在增强有益细菌(如双歧杆菌和乳酸杆菌)方面具有潜力,但只有少数研究检测了这些化合物对人类和动物肠道菌群的有益影响。对低聚半乳糖和低聚果糖或其组合对雄性小鼠的作用的研究表明,这些化合物具有抗抑郁、抗焦虑作用,并逆转慢性应激的作用。
在一项安慰剂对照临床试验中,服用N-乙酰半胱氨酸8周后,自闭症婴儿的易怒性和重复行为有所下降。此外,补充商业益生元药物B GOS(Bimuno)和限制性饮食可改善自闭症儿童的行为,这可能是由于乳酸杆菌和双歧杆菌含量较高。
最近的一项研究还表明,益生元乳果糖可以通过自噬和抗炎途径改善阿尔茨海默小鼠模型的认知缺陷。因此,这些发现似乎表明益生菌和益生元是神经系统疾病的有效治疗选择。然而,考虑到仅仅是相关性并不一定表明因果关系,需要进行额外的调查以详细了解潜在的机制。
健康个体和患者肠道微生物群组成和功能的变化已被确定为各种神经系统疾病。人们已经认识到,饮食可以影响微生物组成,改变肠-脑轴的功能。多种治疗干预措施已用于治疗肠道微生物群落失调,恢复肠道微生物群落平衡,改善神经系统疾病的临床结果,包括使用益生菌。
益生菌在普通食品和药片中的应用越来越流行。益生菌主要由双歧杆菌和乳酸产生菌组成,例如乳酸杆菌。越来越多的证据表明,益生菌合成的代谢物是饮食诱导的宿主-微生物相互作用的基本介质。此外,一些肠道细菌种类,如拟杆菌、梭菌、双歧杆菌、消化链球菌、乳酸杆菌和瘤胃球菌,可产生多种色氨酸分解代谢产物,包括吲哚、3-甲基吲哚、吲哚乙酸(IAA)、色胺等。
新出现的数据表明,微生物组衍生的色氨酸分解代谢影响宿主健康。已经证明,这些代谢物可与AhR结合,从而激活免疫系统,改善肠道屏障功能,刺激胃运动活动(以及胃肠激素的分泌),发挥全身或局部抗氧化、抗炎作用,并可能调节肠道微生物组和代谢组。
据报道,由共生微生物群合成的色氨酸分解代谢物可诱导小胶质细胞AhR激活,抑制NF-kB信号、VEGF-B和TGF-α的激活。此外,AhR在树突状细胞中高度表达,控制分化和功能。树突状细胞中维甲酸、犬尿氨酸和AhR驱动的细胞因子的产生增强T-reg细胞的分化,抑制EAE作为多发性硬化动物模型的发展。
AhR信号在肠道和大脑中的作用
Gwak MG, et al., Immune Netw. 2021
星形胶质细胞在炎症介导的神经退行性变中发挥关键作用,发挥神经毒性作用,激活和招募与中枢神经系统发病机制有关的其他细胞。据报道,在EAE和多发性硬化动物模型中,星形胶质细胞的转录谱显示AhR表达上调。
最近的研究得到了几种神经系统疾病相关临床证据的支持,证明越来越重视使用益生菌和益生元来调节胃肠道微生物群。
使用小鼠模型进行的几项研究表明,益生菌的施用可有益于几种神经系统疾病(如自闭症、癫痫和阿尔茨海默),从而改善认知结果。然而,关于益生菌给药对人类神经功能障碍的有效性,临床证据仍然很少。
对几名患有焦虑和胃肠道症状的3-12岁自闭症儿童进行的调查发现,使用名为Visbome的特殊配方,包括八种不同的益生菌菌株,主要是乳酸杆菌,是安全的,并导致保留乳酸菌患者的自闭症和胃肠道症状的健康改善。
此外,当使用益生菌治疗人类神经退行性疾病(包括阿尔茨海默)时,已经发现了有希望的结果。首先,据报道,植物乳杆菌能够改善阿尔茨海默小鼠模型的认知能力并增加大脑中乙酰胆碱酯酶的水平。在患有阿尔茨海默的啮齿动物散发模型中,用嗜酸乳杆菌、发酵乳杆菌、乳酸双歧杆菌和长双歧杆菌进行Ab注射也发现类似结果。另一项随机临床研究表明,益生菌与鼠李糖乳杆菌GG(ATCC 53103)合用可能减少75名自闭症婴儿的多动症发展,并可能减少神经精神疾病的发展。
证据还表明益生菌对帕金森病患者的影响。最近的一项研究表明,长期服用由六种细菌组成的益生菌可减轻帕金森病遗传小鼠模型的运动损伤,并对多巴胺能神经元具有神经保护作用。
合生元是指益生元和益生菌的混合物,其中益生元有利于益生菌微生物的生长和代谢,提高其生存能力和效益,通过增加胃肠道中有益微生物的丰度来影响宿主。
合生元中使用的组合必须适当,以支持益生菌微生物在胃肠道中的存活。研究表明,使用合生元比单独使用益生菌或益生元更有效。结果表明,由GOS和包括瑞士乳杆菌和长双歧杆菌在内的多序列益生菌组成的合生元制剂可减少抑郁症症状,并改善重度抑郁症中的色氨酸信号。
随机对照试验中使用含合生元的多序列益生菌和益生元治疗的结果导致帕金森队列中功能性胃肠道症状的改善。婴儿双歧杆菌和低聚糖作为合生元被证明对缓解自闭症中的肠道相关疾病有效。然而,合生元对微生物群-肠-脑轴的影响还需要更多的研究 。
后生元,也称为代谢、生物原或CFSs(无细胞上清液),由细菌发酵代谢产物和从活细菌中获得或在细菌细胞裂解后释放的可溶性因子组成,如短链脂肪酸、酶、AMP、磷壁酸、胞内和胞外多糖、细胞表面蛋白、维生素、血浆素和有机酸。
非活性益生菌paraprobiotics被定义为不可存活或失活的微生物细胞,而一些研究人员将其作为后生物的一个亚组。非活性益生菌是一种结构成分,若给予适量,可能会触发宿主的生物活性。
灭活可通过各种方法实现,如物理(热灭活益生菌、紫外线照射或超声波)或化学方法。生物活性化合物,如肠道肽,是细菌与宿主相互作用的结果,被认为是益生元。热灭活副干酪乳杆菌PS23缓解了皮质酮诱导的焦虑样表型,改善了海马和前额叶皮质中的多巴胺水平。
关于大脑健康,对患有心理社会应激的小鼠进行短链脂肪酸组合(乙酸盐、丙酸盐和丁酸盐)治疗的研究显示了抗焦虑作用。
根据最近发现的微生物干预在调节肠道失调引起的神经系统疾病方面的潜力,粪便微生物群移植(FMT)似乎是一种有希望的治疗策略。
这种相对较新的治疗方法包括从健康粪便样本捐赠者及其微生物和代谢物转移到接受者。这种方法目前被用于治疗艰难梭菌感染,与抗生素治疗一起使用。
通过FMT,健康微生物群通过繁殖自我替换,并产生生物活性代谢物。口蹄疫是通过使用内窥镜、灌肠和冷冻干燥材料口服喂养来完成的。该方法的潜力已被用于治疗帕金森病、自闭症和多发性硬化症等神经系统疾病。这种方法的优点之一是没有明显的副作用报告,即使在高危患者中也被认为是安全的。
在最近一项关于自闭症小鼠的研究中,评估了体外培养的肠道微生物移植(GMT)的效果,该移植显著减轻了小鼠的焦虑样行为。在另一项研究中,对接受FMT的自闭症患者进行了结肠镜检查,结果证明自闭症相关症状显著改善,他们的肠道微生物群改变为健康状态。然而,需要更多的研究来进一步阐明FMT对自闭症患者的影响。
在动物模型中对阿尔茨海默进行了大量研究,但没有对人类患者进行具体研究。对阿尔茨海默小鼠模型的研究结果表明,认知功能障碍与肠道微生物群组成的变化有关;因此,通过FMT对该微生物群进行修饰被证明能有效缓解阿尔茨海默患者的认知功能障碍。许多关于FMT的神经系统疾病的研究已经完成,许多试验正在进行中。因此,很快就会有大量证据。
通过治疗性微生物干预调节肠道微生物群
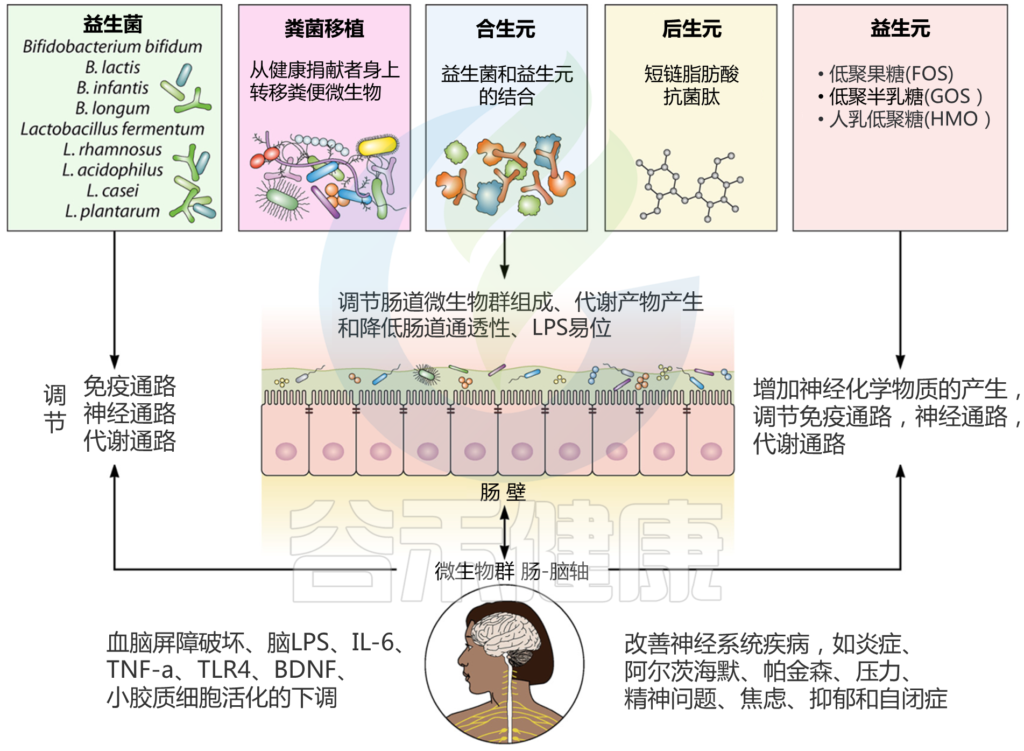
Sorboni SG, et al.,Clin Microbiol Rev. 2022
其他(食物及补充剂)
改善肠脑轴的食物
食物已被证明可以改善肠脑功能。其中许多含有精神生物化合物,包括:
Omega-3 脂肪
存在于油性鱼类和亚麻籽中,已被证明可以改善青春期和成年期的微生物群多样性。这可以降低患精神分裂症和抑郁症等脑部疾病的风险。
发酵乳制品
如酸奶和奶酪中发现的各种益生菌菌株。这些已被证明可以调节大脑活动。
富含纤维的食物
如水果和蔬菜、全谷物和坚果。这些含有益生元纤维,可降低皮质醇水平并改变情绪偏见。
富含多酚的食物
肠道菌群失调导致肠上皮黏膜屏障和血脑屏障通透性增高,并通过肠-脑轴的免疫、内分泌和肠神经途径影响阿尔茨海默的发生发展。多酚类化合物可能通过上述机制发挥防治阿尔茨海默的作用。
详见:肠道微生物群与膳食多酚互作对人体健康的影响
食用蘑菇类
香菇含有大量的维生素B6。因为维生素 B6 会影响血清素和神经递质的产生,所以健康的 B6 水平与积极的情绪和自然地减轻压力有关。
在动物研究中,它也被证明可以有效治疗抑郁症等情绪障碍。
坚果
如杏仁、腰果、核桃和巴西坚果。研究表明,食用这些会提高血清素的水平,血清素是一种让人感觉良好的化学物质,血清素降低,人会感到沮丧。
富含酪氨酸的食物
如杏仁、蛋鱼和鸡肉,富含酪氨酸,酪氨酸是一种能提高大脑多巴胺水平的氨基酸。
其他:
L-苏糖酸镁
镁对大脑至关重要,它是制造许多参与大脑功能的酶的必要辅助因子。它对于维持和发展突触之间的联系也至关重要,突触是学习和记忆的核心任务。大脑和脑脊液中高水平的镁与阿尔茨海默病和大脑衰老的发病率降低有关。补充剂 L-苏糖酸镁比其他镁形式更有效地通过血脑屏障,并且不会引起消化不良。
维生素 D3 和 维生素 K2
血清维生素 D 高水平对于维持大脑健康和降低阿尔茨海默病和其他神经退行性疾病导致的认知障碍风险极为重要。维生素 D 的抗炎和抗氧化特性也很重要。
相反,低维生素 D 会导致大脑中的钙含量增加,这与抑郁症有关,并且会导致表征痴呆的淀粉样蛋白斑块增加。
维生素 D 与维生素 K 协同作用以调节钙并防止其在软组织中积累,例如滋养大脑的血管。
补充剂应包括最易吸收的胆钙化醇(维生素 D3)形式的维生素 D,以及甲基萘醌(维生素 K2)形式的维生素 K,以帮助调理肠道。这种组合对预防血管钙化最有效。
姜黄素
姜黄根中的活性化合物姜黄素使咖喱粉呈现鲜艳的黄色。姜黄素激活 Nrf2 抗氧化信号通路,开启参与解毒和消除自由基的基因。
在大脑中,姜黄素补充剂具有强大的抗炎和抗氧化特性。姜黄素还通过抑制淀粉样蛋白的形成来帮助预防痴呆。姜黄素补充剂可以显著提高 BDNF(脑源性神经营养因子)的血清水平。BDNF 在保护现有神经元和刺激新神经元生长方面发挥着重要作用。
高水平可以帮助预防认知障碍,并有助于从脑震荡和脑损伤中恢复。
肠道微生物群不仅与消化吸收相关,还与大脑密切相关,从而影响各类神经系统疾病,如常见的自闭症、抑郁症、精神分裂症等。改善肠道健康后,通过肠脑轴的连接减少全身炎症,同时也改善心理健康。在现代社会普遍压力较大的情况下,注意减压的同时更不能忽视肠道健康。
主要参考文献:
Li XJ, You XY, Wang CY, et al. Bidirectional Brain-gut-microbiota Axis in increased intestinal permeability induced by central nervous system injury. CNS Neurosci Ther. 2020;26(8):783-790. doi:10.1111/cns.13401
Deidda G, Biazzo M. Gut and Brain: Investigating Physiological and Pathological Interactions Between Microbiota and Brain to Gain New Therapeutic Avenues for Brain Diseases. Front Neurosci. 2021;15:753915. Published 2021 Oct 12. doi:10.3389/fnins.2021.753915
Gwak MG, Chang SY. Gut-Brain Connection: Microbiome, Gut Barrier, and Environmental Sensors. Immune Netw. 2021;21(3):e20. Published 2021 Jun 16. doi:10.4110/in.2021.21.e20
Sorboni SG, Moghaddam HS, Jafarzadeh-Esfehani R, Soleimanpour S. A Comprehensive Review on the Role of the Gut Microbiome in Human Neurological Disorders. Clin Microbiol Rev. 2022 Jan 5;35(1):e0033820. doi: 10.1128/CMR.00338-20. Epub ahead of print. PMID: 34985325; PMCID: PMC8729913.
Suganya K, Koo BS. Gut-Brain Axis: Role of Gut Microbiota on Neurological Disorders and How Probiotics/Prebiotics Beneficially Modulate Microbial and Immune Pathways to Improve Brain Functions. Int J Mol Sci. 2020;21(20):7551. Published 2020 Oct 13. doi:10.3390/ijms21207551
Jalodia R, Abu YF, Oppenheimer MR, Herlihy B, Meng J, Chupikova I, Tao J, Ghosh N, Dutta RK, Kolli U, Yan Y, Valdes E, Sharma M, Sharma U, Moidunny S, Roy S. Opioid Use, Gut Dysbiosis, Inflammation, and the Nervous System. J Neuroimmune Pharmacol. 2022 Jan 7. doi: 10.1007/s11481-021-10046-z. Epub ahead of print. PMID: 34993905.
Morais LH, Schreiber HL 4th, Mazmanian SK. The gut microbiota-brain axis in behaviour and brain disorders. Nat Rev Microbiol. 2021 Apr;19(4):241-255. doi: 10.1038/s41579-020-00460-0. Epub 2020 Oct 22. PMID: 33093662.

谷禾健康

运动对心肺健康、肌肉力量、葡萄糖代谢、免疫系统和心理健康有影响。新的横断面研究证据表明,运动锻炼与肠道微生物群组成之间可能存在密切关联。

干预研究支持锻炼对肠道微生物群的有益影响。纵向研究表明,经常中等强度的耐力运动对肠道微生物产生最有益的影响,但是不同类型的运动训练方案(例如,阻力、间歇、伸展/柔韧性、耐力/有氧等)对肠道微生物群的影响存在差异。其他如饮食摄入,结肠运送时间,训练状态,共享训练环境,自愿性,健康或疾病状况,年龄,性别等因素也是评估运动和肠道菌群的混杂因素。

反过来,肠道微生物群对运动表现、恢复和疾病模式的各种指标都有间接影响,例如通过肌细胞因子,激素,神经肽和其他代谢物发出信号,调节下丘脑-垂体-肾上腺轴的激活,以及影响与表现相关的代谢途径。
了解肠道微生物群在运动表现中的各种作用,对于寻求改善锻炼结果以及减少训练恢复时间的普通人和运动员来说都非常重要。
本文就以下方面进行详细阐述:

最近的研究表明,运动对肠道微生物群有很多好处。它与有益微生物物种数量的增加和微生物多样性的丰富以及短链脂肪酸合成和碳水化合物代谢的增强有关。
适度运动的频率会导致厚壁菌门的多样性更大。包括Faecalibacterium prausnitzii(产生丁酸,抗炎共生菌),颤螺菌属(Oscillospira) ,有助于更健康肠道环境的Lachnospira和Coprococcus属的成员。
体脂百分比、肌肉质量和身体活动与几种细菌种群显著相关
研究发现,锻炼与女性中具有促进健康功能的细菌的比例更高有关。包括以产生丁酸盐的能力而闻名的F. prausnitzii(普拉梭菌)和Roseburia hominis,以及运动员体内丰富的Akkermansia muciniphila,低水平与肥胖和糖尿病等代谢状况有关。
一项研究调查了 40 名国际职业橄榄球联盟球员的微生物组,并将其与 BMI 高或低的相似年龄的对照组进行比较。结果表明,运动员肠道微生物多样性显著著增加。
与对照组相比,许多其他参数也显示出显著改善的结果。其中包括短链脂肪酸 (SCFA),该研究发现与对照组相比,运动员体内的乙酸盐、丙酸盐、丁酸盐和戊酸盐水平明显更高。”
简而言之,运动已被证明可以显著改善与身体表现和健康相关的几个指标,特别是在有益细菌类型及其功能方面。
然而,这些观察性研究的结果只能确认训练状态和微生物群之间的关联,而不能确定因果关系。
运动与肠道微生物群组成之间的关联似乎是双向的。来自动物研究的越来越多的证据也表明肠道微生物群在宿主的身体机能中起着重要作用。肠道微生物群的组成和代谢活动可能有助于消化膳食化合物并改善运动期间的能量收集,这可以为运动员在高强度运动和恢复期间提供代谢益处。
观察性研究表明,与久坐的受试者相比,运动员微生物组中与氨基酸和碳水化合物代谢相关的代谢活动和途径增加。
在肠道中,细菌将不易消化的碳水化合物发酵成短链脂肪酸乙酸盐、丙酸盐和丁酸盐。训练和定期锻炼与人类粪便短链脂肪酸含量增加有关,并且在动物研究中,特定短链脂肪酸与改善身体机能有关。
大多数短链脂肪酸从肠道吸收并有助于宿主的能量代谢。
丁酸盐主要被结肠中的上皮细胞用作能量来源。
乙酸盐在肌肉组织中代谢,但也可以穿过血脑屏障。
丙酸盐可用作肝脏中葡萄糖合成的前体。
此外,短链脂肪酸可改善肠道屏障完整性,降低局部和全身炎症风险。临床前研究强烈表明短链脂肪酸可能是身体机能的关键调节剂。
值得注意的是,宿主可能不是唯一受益于运动期间与微生物群的共生关系的一方。
目前关于肠道微生物群与身体机能之间相互作用如下:
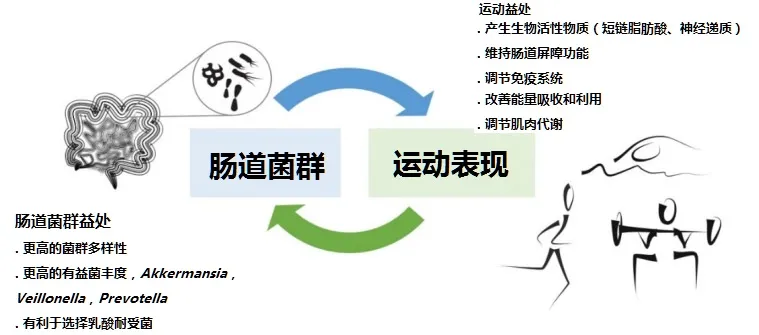
Maija Marttinen et al., Nutrients.2020

你可能想知道运动是否会改变微生物群,或者拥有健康的微生物群是否会让你更加活跃想运动。其实这用一句俗话讲就是“先有鸡还是先有蛋”的情景。
例如,肠道菌群失调会引起炎症,从而导致负面情绪,抑郁等症状,而抑郁不利于外出和积极运动锻炼。
多项研究表明,运动实际上可以改变你的肠道微生物群。
女性:运动与久坐女性菌群有差异
2017 年一项针对女性的研究表明,积极活动方式的女性和久坐女性之间肠道微生物群特征的差异。
积极参与者被选为在试验期间在 7 天内进行至少 10 小时运动的组。久坐组参加安静的活动,并从日常生活中不是经常运动的女性中挑选出来,每周进行 3 次不超过 30 分钟的适度运动。
11 个属(细菌的分类等级)在运动女性和久坐女性之间存在显著差异。重要的是,运动的女性群体拥有更丰富的促进健康的细菌,包括Faecalibacterium prausnitzii、Roseburia hominis和Akkermansia muciniphila.
他们还发现“体脂百分比、肌肉质量和身体活动与几种细菌种群显著相关。”
换句话说就是,过着积极的生活方式更能取悦某些细菌,这是一种正向反馈。
橄榄球运动员比久坐者具有更高的α多样性
一项对爱尔兰男性职业橄榄球运动员的研究表明,与久坐的对照组相比,运动员肠道微生物群的 α 多样性(细菌丰富度,例如在粪便样本中鉴定了多少细菌种类)更高。
肠道微生物群多样性与蛋白质消耗和血浆肌酸激酶水平呈正相关,血浆肌酸激酶水平是运动引起的肌肉损伤的生物标志物。
与高 BMI 对照组的比例相比,在橄榄球运动员和低体重指数 (BMI) 对照组中检测到的Akkermansia细菌比例更高。与低 BMI 的对照组相比,运动员中拟杆菌属的含量显著减少。
从大人群水平上看,Akkermansia和拟杆菌属与肥胖呈负相关。
在微生物代谢水平上也检测到橄榄球运动员和久坐对照组之间的差异,在运动员中检测到的氨基酸和碳水化合物代谢途径活性增加。此外,与久坐的对照组相比,橄榄球运动员的粪便 SCFA(乙酸盐、丙酸盐和丁酸盐)水平更高。
竞技自行车运动员中:经常训练者普氏菌高
在竞技自行车运动员中,每周训练超过 11 小时的自行车手比那些不经常训练的人的普氏菌相对丰度更高。
此外,元转录组学分析表明,普氏菌的转录与微生物组中的支链氨基酸 (BCAA) 代谢途径呈正相关。支链氨基酸,尤其是亮氨酸,是促进肌肉蛋白质合成的必需氨基酸,可以促进运动后的恢复。(详见本文09章节——蛋白质小节)
与业余自行车手相比,在职业自行车手中发现了更多的粪便Methanobrevibacter smithii。该菌与上调的甲烷代谢相关,这与肠道微生物组中短链脂肪酸代谢途径的上调呈正相关。
遗憾的是,该研究没有饮食控制和非运动员对照组。与在骑自行车的人中观察到的结果一致,在一小群精英竞走者中,粪便微生物群被分为普氏菌或拟杆菌为主的肠型。
马拉松运动员:韦荣球菌增加
马拉松运动员中的韦荣球菌丰度在马拉松后显著增加。此外,同一研究小组使用来自超级马拉松运动员和奥运会级别赛艇运动员的粪便样本进行宏基因组分析,结果显示与运动前样本相比,运动后与乳酸和丙酸代谢相关的基因富集。
在小鼠中进行的一项后续研究表明,研究人员从跑步者的粪便中分离培养出Veillonella atypica菌株,给小鼠灌注,结果发现,小鼠开始跑得更多,在跑步机上的跑步时间增加了 13% 。
中强度锻炼的人:促进健康和抗炎细菌增加
除了由专业或竞技运动员进行的高强度训练外,根据世界卫生组织 (WHO) 每周进行 150 分钟中等强度运动的指导方针,以推荐的最低水平进行运动 ,似乎足以改变肠道微生物群的组成。
与久坐不动的女性相比,以低强度进行连续运动的绝经前女性的嗜粘蛋白阿克曼菌、普拉梭菌等的丰度增加。这些都是与促进健康和抗炎作用相关的细菌种类。
此外,运动组和久坐组之间不同的饮食模式可能影响了肠道微生物群的组成,与久坐的女性相比,运动女性的膳食纤维摄入量明显更高,久坐组加工肉类的摄入量比例明显更高。
长期运动的人:菌群多样性更高
在迄今为止最长的运动干预中,研究了在 6 个月内,具有相似运动能耗的不同强度和方式的定期有氧训练对肠道微生物群的影响。
总共 88 名久坐的超重/肥胖受试者被随机分为四个组,包括习惯性生活(对照组)、非机动自行车积极通勤、休闲时间中等强度的运动或剧烈运动。
与对照组相比,所有运动组的 β多样性(样本间差异)都发生了变化,剧烈运动组的参与者组内菌群差异度变小,换句话说就是构成趋向一致。
此外,与对照组相比,剧烈运动组在3个月时的 α多样性增加更多。这表明可能需要更剧烈的运动来诱导久坐、超重/肥胖受试者的肠道微生物群发生变化。
在一项关于剧烈运动的研究中,拟杆菌门增加,厚壁菌门/拟杆菌门比率下降。这一结果与运动员有关,因为拟杆菌的增加在复杂糖聚合物的代谢转化和蛋白质降解中起着至关重要的作用。
梭菌属和Blautia属也减少了。梭菌在全身免疫反应中起着重要作用,而Blautia会增加促炎细胞因子的释放。有趣的是,结肠葡萄糖浓度与拟杆菌呈正相关,并与厚壁菌门、厚壁菌门/拟杆菌门比率和Blautia属相反。此外,Blautia属的丰度较低与更好的全身胰岛素敏感性相关。
这些结果强调了肠道底物摄取对全身的重要性,尤其是葡萄糖和蛋白质摄取,可能对肠道微生物群产生积极影响。
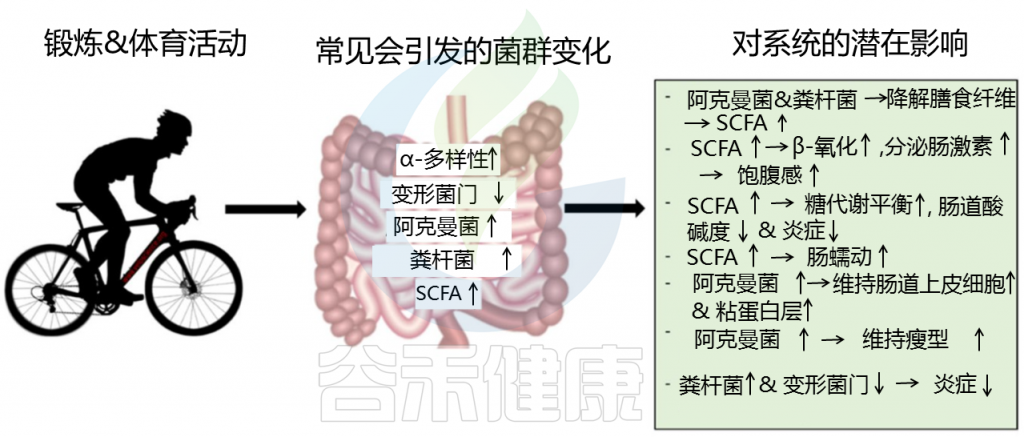

Lensu, S. et al., Metabolites, 2021
在儿童和老年人中也证明了身体活动水平与肠道微生物群组成之间的关联。
儿童:运动者菌群中梭菌目、毛螺菌科增加
来自美国肠道项目的 7-18 岁儿童研究队列中,在控制协变量(年龄、性别和使用抗生素和益生菌)。运动频率与富含厚壁菌门的肠道微生物群有关。此外,每天锻炼的儿童在梭菌目、毛螺菌科中的属增加了。
老年男性:与粪杆菌和Lachnospira菌有关
在老年男性中,根据步数和自我报告的活动测量的体力活动与微生物 α 多样性无关,但体力活动水平与粪杆菌属和Lachnospira属之间存在适度关联。
这些研究表明,运动员或经常运动人群与久坐人群之间的肠道微生物群组成存在差异。
运动者菌群特征可能与饮食有关
然而,运动员和身体活跃的人体内微生物群组成的一些特征可能是通过饮食来解释的,而不是运动的影响。
运动员经常遵循支持训练和表现的严格饮食,而极端运动通常与极端饮食有关。与正常人群相比,运动员的蛋白质摄入量可能要高得多。蛋白质补充剂通常用于满足训练者对蛋白质的更高需求,尽管蛋白质补充剂的流行也可能受到有关增加肌肉质量和改善性能和恢复的说法的影响。
摄入大量蛋白质后,未被吸收的蛋白质会进入结肠并促进特定细菌的生长和选择。
持续 10 周的蛋白质补充剂(乳清分离物和牛肉水解物)增加了跑步者拟杆菌的丰度,并减少了与健康相关的分类群,包括Roseburia spp、Blautia spp 和长双歧杆菌。然而,肠道微生物群组成的这种改变对宿主健康的长期影响仍不清楚。
动物研究:运动产生的变化与年龄、饮食、是否自愿、个体生理状态等因素都有关
很少有研究关注自愿运动对肠道微生物群的影响,迄今为止,除了七项实验研究外,所有研究都使用了小鼠模型。这些初步研究表明,运动会影响肠道微生物群的组成。
大鼠定期跑步运动与产丁酸菌的增加以及丁酸盐浓度的增加有关。其他动物研究表明,通过影响小鼠肠道微生物组成,每日轮式跑步运动可能会改善不健康状态的某些方面,例如饮食引起的肥胖、糖尿病和毒性。这些影响包括改变优势门厚壁菌门和拟杆菌门之间的比例。然而,这在研究之间并不总是相同。
在对动物进行的运动研究中,对于哪些种群受慢性运动的影响几乎没有达成一致。除了运动和乳酸杆菌之间的正相关关系之外,没有其他分类群在经常锻炼的小鼠或大鼠中相对丰度持续增加。
运动所产生的变化似乎取决于个人的生理状态。例如,无论是肥胖-高血压大鼠还是正常大鼠,有规律的强迫运动对微生物群的丰度都有不同的影响。高脂饮食的大鼠运动对微生物群的改变与正常饮食的大鼠不同,并且糖尿病小鼠产生的改变与其对照小鼠不同。
总的来说,这些发现表明,长期运动对微生物群的调节不仅取决于个体的生理状态,还取决于饮食。此外,动物强制运动与自愿运动之间的另一个显著差异是运动量。这在人类骑自行车的数据中得到了概括,需要在动物模型中进一步研究。
此外,年龄,性别也会呈现不同效果。据观察,与成年大鼠相比,运动对幼年大鼠的微生物群产生更有效的改变。在这些检查运动训练对肠道微生物群的影响的小鼠研究中,一个共同的发现是增加了α多样性。

在研究人类肠道微生物群时,很难分别研究运动和饮食。这种关系因饮食摄入变化而变得更加复杂(例如,抗阻力训练运动员的蛋白质摄入量增加或耐力运动员的碳水化合物摄入量增加,以及总体能量和营养摄入量的增加)。
为什么部分运动人群和久坐人群的菌群无显著差异?
高蛋白 + 膳食纤维少 = 运动改变菌群无效
韩国的一项研究表明,高蛋白/限制性膳食纤维与健康久坐人群之间的肠道微生物多样性或有益细菌没有显著差异。然而,当蛋白质或膳食纤维摄入量符合 KRDA(韩国推荐膳食允许量)时,肠道微生物多样性和有益细菌的相对丰度与健康久坐的受试者相比有显著差异。这些结果表明,运动对肠道微生物群的积极影响取决于蛋白质和膳食纤维的摄入量。结果还表明,在补充益生菌之前,应解决营养充足的问题。
研究人群之间膳食摄入量的差异,可能解释了不同研究结果之间观察到的一些不一致之处。
在韩国的一项临床研究中,总蛋白质摄入量与微生物多样性呈负相关 ,而爱尔兰职业橄榄球运动员的高蛋白质摄入量与微生物多样性增加有关。韩国运动员不符合膳食纤维摄入量的膳食建议(建议≥ 25 g/天;健美运动员的中位摄入量 19 g/天,耐力运动员 17 g/天),而爱尔兰橄榄球运动员的纤维摄入量处于推荐水平(中位摄入量 39 克/天)。
未消化的膳食纤维是肠道微生物群的重要能量和碳源,是短链脂肪酸合成的底物,是微生物多样性的关键贡献者。高蛋白饮食与低膳食纤维饮食相结合,可能对肠道微生物群组成有害,而不是单独摄入高蛋白。
营养补充剂介入运动和微生物关联
此外,主要来自动物研究的有限数据表明,流行的运动营养补充剂,如咖啡因、支链氨基酸、碳酸氢钠和肉碱,可以改变肠道微生物群的组成。大型研究队列的结果表明,运动与梭菌和毛螺菌科中的属增加有关。
其他小样本人群研究
尽管有几项研究调查了可能缺乏足够统计功效的小样本群,但有趣的是,通常诸如Akkermansia 和Prevotella等属在运动员和身体活跃的受试者中含量更高。然而,由于临床研究的数量仍然有限,参与者的人口统计学和膳食摄入量(特别是膳食纤维摄入量)差异很大,因此应谨慎得出结论。
运动前后营养变化不大,但是菌群有变化
运动对肠道菌群的影响需要考虑运动期间的饮食因素,那么运动前后对营养元素是否会显著变化?
一个研究小组表明,运动训练干预改变了久坐、未受过训练的芬兰女性的肠道微生物群组成,而饮食习惯、体重或身体成分没有改变。
作者证明,耐力运动改变了超重、久坐女性的肠道微生物群,这些女性参加了一项运动干预,包括每周 3 次、持续六周的自行车训练。研究表明,在训练干预后,总摄入量或常量营养素或膳食纤维的摄入量没有差异。
然而,耐力运动增加了Verrucomicrobia和Akkermansia相对丰度并减少肠道中与炎症相关的变形菌数量。此外,变形菌门和疣微菌门属对运动有反应,并且与年龄、体重、体脂百分比和食物摄入量无关。另一项研究为期 12 周的有氧运动训练计划显著增加了拟杆菌属的相对丰度,但是在年长、久坐的女性中,营养摄入没有变化。
下表总结了关于运动和/或运动饮食对肠道微生物群影响的研究



Mohr AE, et al., J Int Soc Sports Nutr. 2020

除了影响肠道微生物群,运动还会影响胃肠道生理机能。尽管运动通常是一种有益的或“刺激性”压力,但如果持续时间和强度的增加得不到足够的训练、休息、营养和抗氧化状态的支持,它就会变得有害。
运动后的生理效应
运动会激活自主神经系统,增加外周组织和胃肠道中皮质醇和儿茶酚胺、肾上腺素和去甲肾上腺素的循环浓度。这会导致流向胃肠道的血流量减少,导致缺氧、ATP 耗竭和氧化应激。这些作用会破坏肠道屏障,增加肠道通透性、内毒素血症、营养消耗和炎症。胃肠道通过释放与胃肠道紊乱相关的神经递质,如 γ-氨基丁酸 (GABA)、神经肽 Y 和多巴胺来应对压力激活。这些生理效应与运动的强度、持续时间和频率成正比。
长时间运动可能造成胃肠道紊乱
虽然低至中等强度的运动促进胃肠蠕动和转运时间,但剧烈的 [ >60%最大摄氧量(VO2max) ] 或长时间 (≥2 小时) 运动可能会产生相反的效果,并会造成急性胃肠道紊乱。定期运动可促进适应以维持肠道血流并减少炎症,当然恢复也必须足够。
为什么耐力运动员中常出现胃肠道问题?
胃肠道问题很常见,特别是在耐力运动员中,30-50% 的运动员出现胃肠道不适症状。这些症状可以通过生理,机械,心理,营养因子,包括血流量减少,增加的肠通透性引起的,产量增加应激激素和炎症细胞因子,胃排空不足。
然而,在耐力跑之外,很少评估胃肠道症状。例如,一项对参加 4 天严格越野滑雪行军的士兵的研究显示肠道通透性增加,但没有报告胃肠道症状,这使得对主观体验的影响和对运动表现的影响尚不清楚。
肠道上皮具有高周转率(3-5 天),需要大量的能量和营养。在没有足够燃料的情况下长时间高强度训练的运动员有可能出现肠道完整性和功能紊乱以及胃肠道症状。特别是,习惯性碳水化合物摄入量不足会增加对长时间、持续剧烈运动的促炎应激反应。

★
根据运动类型、强度、年龄和其他因素,20-50% 的运动员会出现胃肠道症状,并且随着运动强度的增加而增加。
高强度运动带来的负面影响
在对 29 名训练有素的男性铁人三项运动员的研究中,在比赛中,93% 的人报告消化功能紊乱,两名参与者因严重呕吐和腹泻而不得不放弃比赛。这些在运动员中很常见,因为在剧烈运动期间体温升高,血液从胃肠道流向周边肌肉和器官,如心脏和肺。远离肠道的血流重新分布以及对肠黏膜的热损伤可导致肠道屏障破坏,继而引发炎症反应。
在每周进行 4-10 小时耐力运动的健康年轻成年男性骑自行车者中,仅以 70% 的最大工作负荷进行 1 小时的运动就会产生内脏灌注不足,这会导致胃肠道循环减少、肠道通透性增加和小器官受损。
另一项研究表明,在 70% VO2max 下运动的人会导致内脏血流量减少 60-70%,当血流量减少 50% 时,运动引起的缺血会导致肠道通透性增加 。
加一句题外话,例如明星,网红为了美,限制碳水摄入,同时大量高强度锻炼来达到快速瘦身的效果,其实损害了肠道健康,可能会引起全身炎症反应,不要盲目效仿。
然而,研究主要集中在运动期间急性摄入(之前和期间)对胃肠道症状的影响,而不是习惯性饮食,尽管越来越多的运动员和研究人员关注避免食物的策略,例如低发酵低聚糖,二糖、单糖 、FODMAP 饮食或无麸质饮食。
剧烈运动 -> 胃肠道紊乱 -> 影响肠道微生物群
导致胃肠道症状的氧化应激增加和肠道屏障功能紊乱也会影响肠道微生物群。LPS(由肠道通透性增加引起的革兰氏阴性菌的成分)的易位会导致内毒素血症并触发促炎细胞因子分泌到胃肠道中,这可能会影响肠道微生物群并进一步加剧病情。
反过来:肠道微生物群失调 -> 胃肠道紊乱
相反,微生物代谢物丁酸盐和丙酸盐可作为结肠细胞的能量来源,减少粘膜降解、胃肠道通透性和炎性细胞因子。
肠道微生物群可作为生物标志物
由于微生物组成和多样性的改变与运动员胃肠道不适的流行有关,因此肠道微生物群组成可用作运动后代谢和全身压力的生物标志物。
例如,一项研究运动对血清和粪便代谢组以及肠道微生物群的急性影响的研究表明,一次运动上调骨骼肌底物利用和血清中碳水化合物代谢物的代谢途径,增加粪便氨和氨基酸代谢物,并增加梭菌的丰度。因此,微生物和代谢物谱的急剧变化可以提供有关运动对胃肠道和代谢影响的信息。
此外,考虑到运动对肠道微生物群的影响以及对以肠道为中心的饮食策略的需求,胃肠道症状评估可以补充有关肠道微生物群组成的信息。

一般运动员在运动训练中摄入大量单糖,以最大限度地储存糖原和维持血糖,同时尽量减少膳食纤维和抗性淀粉的摄入,以防止胃肠道紊乱。膳食纤维和抗性淀粉摄入不足可能会导致排便减少,从而导致肠道功能下降,也会降低肠道微生物群的多样性。
此外,运动员比非运动员消耗更多的动物蛋白来满足肌肉增生的需要。蛋白质摄入过多会导致肠道微生物中氮底物过量,产生腐败的发酵产物,如氨、硫化氢、胺、酚、硫醇和吲哚。随着食糜通过肠道,碳水化合物含量减少,腐烂的发酵变得更加有害。
实际上,蛋白质摄入过量,同时结肠中可发酵的膳食底物较低,会导致结肠黏膜DNA损伤。
高强度运动通过血液影响肠道微生物群
此外,高强度运动刺激血液从肠道器官重新分配到肌肉,同时它们积极进行细胞呼吸。血液的频繁重新分布可能会通过内脏低灌注和缺血以及随后的再灌注来扰乱肠道微生物群。因此,需要研究特定运动类型和运动员饮食对肠道微生物群的长期影响。
肠道微生物群在胃肠道功能、肠道免疫、内分泌以及调节氧化应激和水合水平等方面扮演多种角色,对肠道微生物群改善运动员肠道屏障功能的机制的研究也就越来越多。
微生物群产生的 SCFA 影响一系列宿主过程
在结肠和盲肠中,复杂的植物来源的多糖被消化,随后被肠道微生物(如乳杆菌、双歧杆菌、梭状芽孢杆菌、拟杆菌)发酵成短链脂肪酸和气体,这些气体也被专门的细菌(如还原性产乙酸菌)用作碳和能源、硫酸盐还原菌和产甲烷菌。肠道中乙酸盐、丙酸盐和丁酸盐在结肠和粪便中的摩尔比约为 60:20:20。肠道微生物群的组成,微生物群之间的代谢相互作用,及主要膳食宏量和微量营养素的数量和类型,决定了肠道微生物群产生的短链脂肪酸的类型和数量。
一个人吃的植物来源的多糖、寡糖、抗性淀粉和膳食纤维越多,这些细菌就越能将这些难以消化的食物来源发酵成有益的短链脂肪酸。微生物群产生的短链脂肪酸影响一系列宿主过程,包括控制结肠 pH 值,进而影响微生物群组成、肠道运动、肠道通透性和上皮细胞增殖。
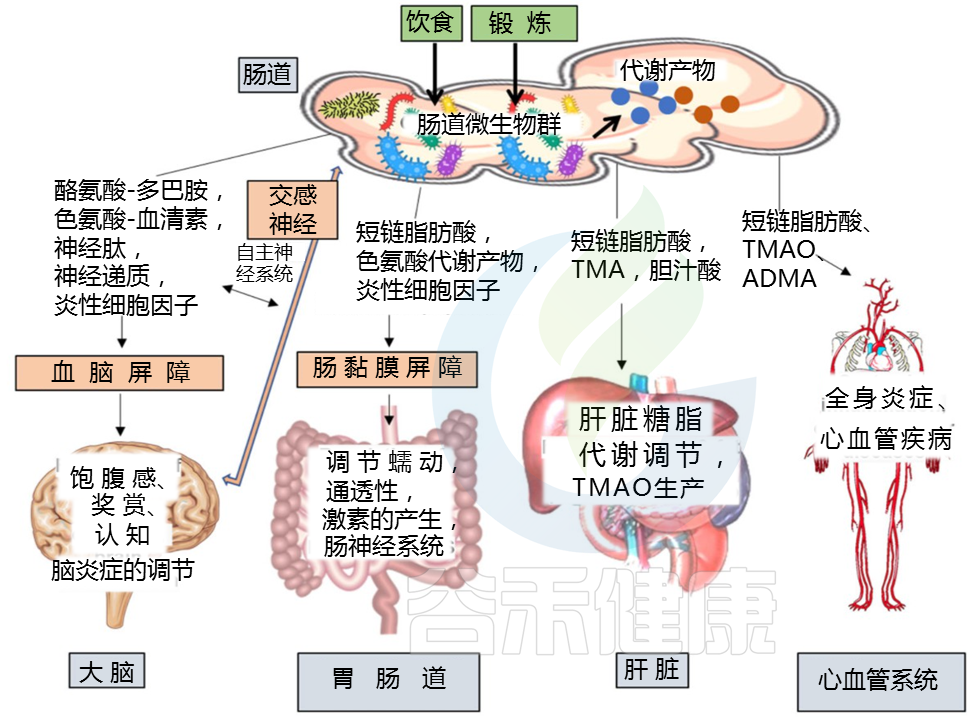
Lensu, S. et al., Metabolites, 2021

运动引起的压力会改变分解代谢激素、细胞因子和肠道微生物群,这可能会导致胃肠道紊乱、焦虑、抑郁和表现不佳。肠道微生物群在人类生物学的许多方面都具有基础性作用,包括新陈代谢、内分泌、神经元和免疫功能。
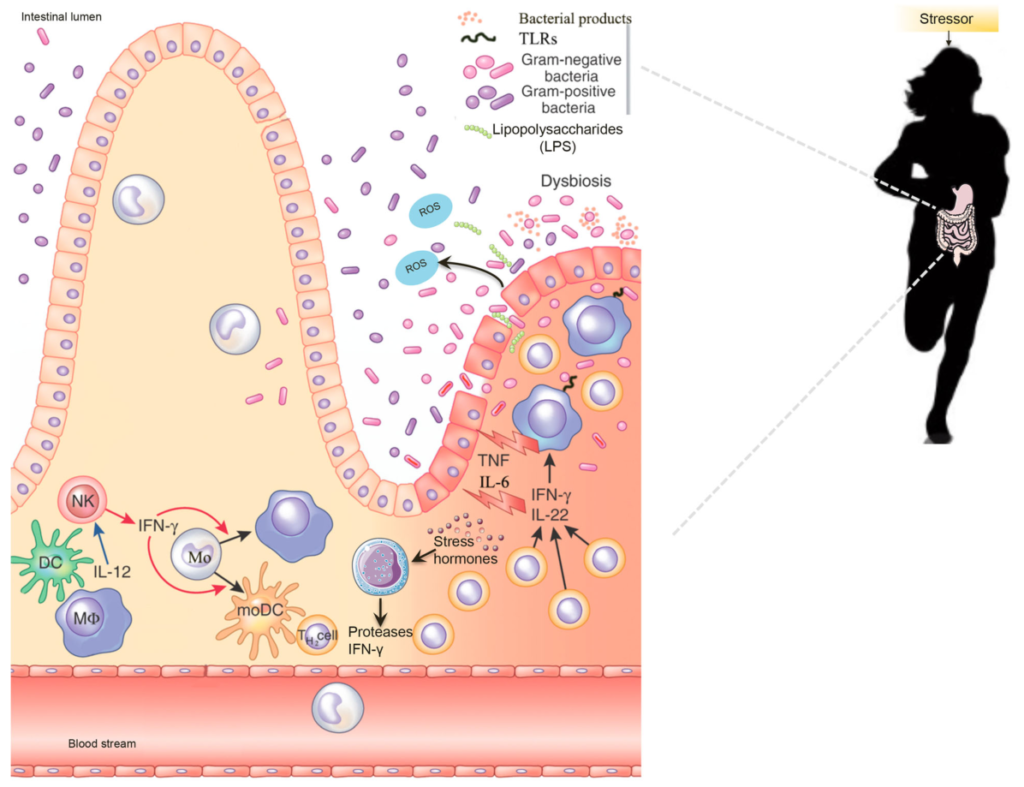
Allison Clark & Núria Mach,J Int Soc Sports Nutr. 2016
适当的肠道屏障功能对于维持健康和免疫力至关重要。但是训练和比赛数小时的精英运动员会经历身体和情绪压力,导致生理稳态发生变化,刺激SAM(交感神经-肾上腺髓质轴)和 HPA轴(下丘脑-垂体-肾上腺轴)高强度运动期间的胃肠道紊乱。
在剧烈运动期间,运动员的体温会升高,血液会在剧烈运动时从胃肠道流向周围肌肉和器官,例如心脏和肺。远离肠道的血流重新分布以及对肠黏膜的热损伤可导致肠道屏障破坏,继而引发炎症反应。长时间的剧烈运动会增加胃肠道中的应激激素和脂多糖 (LPS) 易位,从而引发免疫反应,这通常会导致促炎细胞因子和肠道通透性增加。
由于活性氧 (ROS) 的产生增加以及肠道微生物群组成和活性的改变(所谓的生态失调),肠道通透性可能会变得更糟。
胃肠道通过释放 GABA、神经肽 Y (NPY) 和多巴胺等激素来应对压力,这些激素会导致胃肠道紊乱、焦虑、抑郁、食物摄入减少和压力应对能力降低。相反,微生物群产生的丁酸盐和丙酸盐可以增加跨上皮抵抗,从而改善肠道屏障功能并减少炎症。
胃肠道通过释放 GABA、NPY和多巴胺等激素来应对压力
GABA,这是身体的主要抑制中枢神经系统的神经递质,调节血压和心率和在各种胃肠道功能中起着重要作用,如运动性,胃排空和瞬态下食道括约肌放松,以及焦虑、抑郁,疼痛感和免疫反应。
适度运动可以增加下丘脑中的 GABA 水平,从而降低静息血压、心率和交感神经张力。在 25 °C 水中强迫游泳时,发现大鼠海马 GABA 水平下降(基线的 70%)。
神经肽 Y(NPY)也会在胃肠道中响应各种压力刺激(例如剧烈运动)而释放,并在减弱 HPA 轴方面发挥作用。
注:神经肽Y是一种36个氨基酸的肽,位于整个肠脑轴,是大脑中最普遍的神经肽,在压力恢复和炎症过程中发挥作用。
检测了 12 名训练有素的赛艇运动员的神经肽 Y血清水平,发现运动后神经肽Y的浓度显著增加。虽然很少有研究研究了血清和海马 NPY 水平对运动的反应,但这些结果表明它在减少剧烈运动时的压力反应方面发挥作用。
多巴胺(去甲肾上腺素和肾上腺素的前体)也可以在胃肠道压力期间合成。
多巴胺的产生取决于几个因素:
整个肠道中有多种多巴胺受体,表明它在肠-脑轴中发挥作用。胃肠道、脾脏和胰腺会产生大量的多巴胺。在人胃上皮细胞中发现了多巴胺合成的限速酶酪氨酸羟化酶,表明其功能存在于大脑中的神经传递之外。每天大约 1-2 小时的习惯性运动已被证明会增加大脑中的多巴胺水平。
肠道微生物群如何与周围组织(如胃肠道粘膜层)的应激激素直接相互作用?
去甲肾上腺素(NE)已显示对肠道嗜水气单胞菌(Aeromonas hydrophila)、博德特氏菌属(Bordetella)、空肠弯曲杆菌(Campylobacter jejuni)、幽门螺杆菌(Helicobacter pylori)、李斯特菌(Listeria)和沙门氏菌(Salmonella enterica)有直接影响。
其中去甲肾上腺素促进致病细菌生长的一些方法是,通过增加其毒力因子 K99 菌毛粘附素的表达以及激活鼠伤寒沙门氏菌中毒力相关因子的表达来促进大肠杆菌粘附在肠壁上,然后使这些细菌更容易感染。
此外,去甲肾上腺素还会增加非致病性大肠杆菌和其他革兰氏阴性菌的水平。
微生物组如何调节运动引起的压力反应?
最近发表了一项研究,揭示了对胃肠道和全身健康很重要的,独特微生物群—宿主相互作用。
在结肠炎小鼠模型中,自愿跑步 6 周会减轻症状,而强制跑步机跑步会加剧肠道炎症和临床结果。粪便和盲肠水平与 6 周强制跑步机跑步组相比,与免疫功能和肠道疾病密切相关的在自愿跑步者中显著降低。
此外,与久坐组相比,强制组中的瘤胃球菌(Ruminococcus gnavus)在肠道粘液降解中具有明确的作用,以及增加了丁弧菌属、Oscillospira属和粪球菌属。
这项针对运动和压力动物的初步研究表明,运动可以改变微生物群的组成以及代谢功能,这可能根据运动强度和自愿性等对菌群产生积极或消极的影响。

由于营养、遗传和环境因素,在人类临床研究中剖析肠道微生物群对运动表现的确切作用可能很困难。无菌动物模型克服了其中的许多挑战,并已被用于证明肠道微生物群对身体表现结果所起的作用。
失去肠道微生物群的小鼠,运动表现下降
研究了无特定病原体 (SPF)、无菌 (GF) 和脆弱拟杆菌(Bacteroides fragilis)无菌小鼠的游泳能力。GF 小鼠从游泳到精疲力竭的时间最短,SPF小鼠最长,表明在没有肠道微生物群的情况下表现会下降。观察到与SPF小鼠相比,GF 小鼠表现降低的类似发现。
其他研究:失去肠道微生物群的小鼠运动表现无影响,但肌肉功能下降
与上述相反,另外的研究,GF 小鼠和 SPF 小鼠在运动至精疲力竭时的身体表现没有差异。然而,与 SPF 小鼠相比,GF 小鼠表现出肌肉质量减少、肌纤维减少和肌肉力量降低。GF 小鼠的肌肉萎缩与线粒体生物合成失调和氧化能力降低有关。SPF 小鼠肠道微生物群的移植恢复了 GF 小鼠的肌肉质量,与未治疗的 GF 小鼠相比,用短链脂肪酸混合治疗增加了 GF 小鼠的骨骼肌质量和肌肉力量。
抗生素治疗极大地改变了肠道微生物群的组成
研究证明肠道微生物群在光谱抗生素治疗后耗竭,同时减少了小鼠的耐力运行时间,通过重新接种微生物群恢复后,耐力能力恢复正常。耐力能力的变化与肌肉质量、肌纤维类型或线粒体功能的变化无关,但与肌糖原水平的变化有关,在重新接种后恢复。
多项研究报告了类似的发现,其中与未治疗的对照组相比,使用多种抗生素治疗的小鼠的跑步机运行时间更短。
SCFA 产生的影响及其对运动表现的作用
通过用具有不同底物可用性的纤维喂养小鼠,以在肠道中产生微生物 SCFA。与喂食高度可发酵纤维的小鼠相比,喂食可发酵纤维减少的小鼠的跑步时间显著缩短,这表明微生物群及其底物都与身体机能有关。
为了进一步探索 SCFAs 在表现能力中的假定作用,对抗生素治疗的小鼠进行皮下注射乙酸盐或丁酸盐。乙酸盐而非丁酸盐的输注改善了抗生素引起的剧烈运动带来的不良反应。
无菌动物当然是一种极端模型,可能无法解释在人类微生物群中观察到的更细微的差异。不过,无菌动物模型的研究已经建立了肠道微生物群与身体机能之间的因果关系。
总体而言,恢复肠道微生物群失调似乎可以有效恢复啮齿动物的运动能力和骨骼肌参数。
此外,肠道微生物群组成的差异或肠道微生物群的缺乏可以调节与肌肉结构、肌肉力量和/或能量利用相关的运动能力。
身体活动分为力量和耐力两大类,这取决于你的身体如何产生能量来维持你的运动表现。
无氧运动
力量运动通常高强度,如举重、短跑和拳击。这些运动通过锻炼细胞的无氧途径来增强肌肉质量。这就是说你的肌肉利用其有限的糖原储备来制造 ATP(肌肉的燃料),而无需使用氧气。
最近的一项研究表明,宿主骨骼肌在无氧运动期间产生的乳酸通过循环进入肠腔,为结肠中利用乳酸的物种提供了选择性优势。这项开创性工作的结果表明,在高强度运动期间,宿主以乳酸的形式为特定细菌提供燃料,这些细菌又会产生代谢物,例如丙酸盐,对运动宿主有益。
有氧运动
这与耐力运动不同,有氧运动允许身体以较低的强度进行运动,但运动时间要长得多,例如长跑、骑自行车和滑雪,此类运动肌肉使用氧气将脂肪和糖类转化为 ATP 作为燃料。
测量心血管健康最流行的方法是 V02最大值,它可以查看你的身体在剧烈运动期间可以使用的最大氧气量。用于评估耐力表现,并且可以通过高强度运动得到显著改善。
几项研究表明,微生物群组成与心肺健康之间的关系可以解释“分类丰富度”(微生物组中鉴定的细菌多样性)的 20% 以上的变化。注意到这些变化与其他因素无关,包括年龄、脂肪摄入量和碳水化合物摄入量。
有氧运动对微生物群及身体的益处
研究表明,有氧运动对你的微生物群有好处,包括有益菌和整体多样性丰度增加。
重复进行有氧运动可以增加健康个体和患有慢性便秘的中年患者的胃肠道转运时间。
有氧运动还会增加粪便 SCFA 浓度,从而降低结肠腔的 pH 值。
此外,作为运动副产物并在全身循环的代谢物(例如乳酸),可能会通过肠道过滤并作为某些细菌分类群(例如韦永氏菌)的能量来源。
有氧运动类型及建议
有氧运动是长期而稳定的,确保为你的肌肉提供氧气,以便它们可以产生燃料 (ATP)。这包括任何可以提高心率并长时间保持心率的运动。
比如:步行、慢跑、跳舞、慢骑自行车、椭圆机和健身房的划船机、登山、游泳等都是有氧运动。但是,锻炼的强度和持续时间还是根据身体的总体健康水平而异。
有氧运动是长期的。放轻松,坚持下去,你的身体会适应的。
NHS 已经发布了成人的运动建议:
至少150分钟中等的有氧运动,如骑自行车或快走
每周进行 2 天或更多天的力量锻炼,可以锻炼所有主要肌肉(腿部、臀部、背部、腹部、胸部、肩部和手臂)
或者
每周进行中等强度和剧烈有氧运动的组合——例如,两次 30 分钟的跑步加上 30 分钟的快走相当于 150 分钟的中等有氧运动
每周进行 2 天或更多天的力量锻炼,可以锻炼所有主要肌肉(腿部、臀部、背部、腹部、胸部、肩部和手臂)
适当的训练计划旨在平衡精英运动员所经历的全身压力因素以及个性化的饮食计划,以提高表现并减少运动引起的压力症状。
某种营养素对应激反应的调节程度取决于其持续时间、运动员的整体营养状况、运动的类型和强度、生理状况以及肠道微生物群的组成和功能。由于精英运动员的压力反应相当复杂(从肠漏到分解代谢和抑郁症),定义标准的饮食计划很困难。
一般来说,许多精英运动员被鼓励摄入大量的简单碳水化合物和蛋白质以及少量的脂肪和纤维,以提供快速的能量来源,同时避免潜在的消化问题,例如高纤维饮食有时会出现的胀气和腹胀。精英运动员的饮食计划也基于某些微量营养素的消耗,如铁、钙、氨基酸、必需脂肪酸和抗氧化剂。
饮食设计应考虑肠道微生物群
由于饮食强烈影响微生物群的组成和功能,通过营养治疗调节肠道微生物群可以改善运动员的压力反应并提高表现。可以假设,每个饮食计划可能都伴随着微生物群的同步调整。为运动员设计个性化饮食时的另一个重要考虑因素是了解微生物组如何随时间变化。
目前和未来运动员或经常的锻炼计划应根据其对肠道微生物群的潜在影响来考虑饮食策略,包括以运动为中心的饮食策略(例如,蛋白质补充剂、碳水化合物负荷)对肠道微生物群的影响以及以肠道为中心的饮食策略的影响。

对性能的饮食策略,除了摄入益生元、益生菌和合生元外,摄入足够的膳食纤维、多种蛋白质来源,并强调不饱和脂肪,尤其是 omega-3脂肪酸,在优化运动员的健康和表现。
蛋白质
蛋白质是骨骼肌的主要成分。然而,特定氨基酸在肝脏和骨骼肌的吸收和分解代谢以及它们调节肌肉蛋白质合成反应的能力方面有所不同。
必需氨基酸,尤其是支链氨基酸 (BCAA),对于肌肉蛋白质合成至关重要,并且比非必需氨基酸产生更大的肌肉蛋白质合成反应。因此,膳食蛋白质会影响蛋白质利用和骨骼肌对运动的合成代谢反应。
补充亮氨酸导致血浆亮氨酸和总支链氨基酸浓度显著增加,并改善耐力表现和上肢力量,影响血浆色氨酸:支链氨基酸比率。BCAA 的补充也被用于通过改变大脑神经递质的产生(如 5-HTP、多巴胺和去甲肾上腺素)来调节运动期间疲劳的影响。由于缺乏证据,无法对运动员应服用的 BCAA 类型或数量提出建议。
运动员可能需要的蛋白质是一般人群的两倍
用以维持蛋白质合成、能量产生、免疫功能和肠道完整性和运动引起的压力的结果。
这对于耐力和阻力训练的运动员来说比较重要。耐力运动员可能需要在运动后恢复期摄入更多的蛋白质,尤其是在禁食状态下进行耐力运动时,因为这可能会增加肌丝蛋白水解。
虽然根据饮食和生理因素而变化,例如消化率、氨基酸的数量和组成、食物基质以及其他营养素的存在,但约 10% 的蛋白质未被消化,可能会到达结肠被肠道细菌分泌的蛋白酶进行蛋白水解。
Hughes RL, et al., Adv Nutr. 2021
关于肠道微生物群代谢,氨基酸可以根据其发酵代谢产物进行分类:含硫氨基酸、芳香族氨基酸和色氨酸。
过量蛋白质摄入的不利影响
这些代谢物包括支链脂肪酸和短链脂肪酸、氨、硫化物、吲哚和酚类化合物。虽然其中一些代谢物(例如 SCFA 和吲哚)可能具有改善肠道完整性等有益效果,但其他代谢物(例如氨和对甲酚)会降低肠道上皮完整性。过量的蛋白质摄入可能会导致蛋白水解代谢物的产生水平超过宿主吸收、转化或解毒有害代谢物的能力,导致对肠道屏障功能、炎症和结肠健康的不利影响。
非蛋白质成分有助于运动后的蛋白质合成反应
另一个领域是全食物蛋白质与蛋白质补充剂的影响,因为全食物具有相同或更好的增效作用。例如,摄入全鸡蛋与蛋清相比,摄入全脂牛奶与脱脂牛奶相比,会导致更多的氨基酸摄入和运动后肌原蛋白合成,表明非蛋白质成分(例如,脂质、碳水化合物、微量营养素和其他生物活性化合物)有助于运动后的蛋白质合成反应。
过量蛋白质补充剂增加结直肠癌风险
蛋白质补充剂,包括添加到能量饮料中的支链氨基酸和牛磺酸,通常被运动员用来增强运动对骨骼肌的合成代谢和适应性作用,并促进恢复。过量的牛磺酸会导致牛磺胆酸(TCA)、脱氧胆酸(DCA) 和硫化氢 (H2S) 浓度升高,这与结直肠癌风险增加有关;然而,这些补充剂对运动肠道微生物群的影响尚不清楚。
谷氨酰胺
运动前几天食用高蛋白、低碳水化合物的饮食会导致运动后血浆谷氨酰胺浓度降低。然而,谷氨酰胺补充剂几乎没有得到对健康、营养良好的运动员的严格控制的科学研究的支持。此外,研究者指出谷氨酰胺补充剂应取决于症状(即血浆谷氨酰胺水平低、肠漏)。
酪氨酸
新的中央疲劳假说指出,当血清素水平升高而多巴胺水平降低时,疲劳就会开始,这可能是许多运动员服用酪氨酸补充剂以防止其消耗的原因,尽管尚未确定推荐的补充剂量。酪氨酸或 4-羟基苯丙氨酸可在体内由苯丙氨酸合成,存在于许多高蛋白食物中,如豆制品、鸡肉、火鸡、鱼、花生、杏仁、鳄梨、牛奶、奶酪、酸奶和芝麻。
肠道微生物群通过增加膳食蛋白质的生物利用度和吸收以及增加肌肉蛋白质合成影响肌肉功能
有证据表明,肠道微生物有助于蛋白质的吸收和利用。例如,益生菌补充剂(副干酪乳杆菌)增强了植物蛋白的生物利用度,将必需氨基酸和支链氨基酸的浓度提高到与动物蛋白相当的浓度。此外,当与蛋白质共同给药时,益生菌凝结芽孢杆菌(GBI-30,6086) 减少了上皮细胞炎症,改善了营养吸收,并产生了增加人类氨基酸吸收的蛋白酶。这些作用可以减少肌肉损伤并促进肌肉恢复,从而提高适应能力和表现。
需要注意的是,细菌虽发酵氨基酸,但它们代谢动物和植物蛋白的方式不同。每个饮食计划都伴随着微生物群组成和功能的同步调整。因此,纯素食者、素食者、杂食者和红肉摄入量高的饮食的微生物群组成差异很大。
多项研究表明在高蛋白饮食中添加抗性淀粉可以抵消高蛋白摄入的负面影响,进一步说明摄入足够的膳食纤维对肠道和整体健康的重要性。
碳水化合物
毫无疑问,充足的碳水化合物消耗对于繁重的训练计划和成功的运动表现至关重要。
碳水化合物怎么补充?
对于每天训练超过 2 小时的运动员,膳食碳水化合物的摄入量为每天 7 至 12 克/千克,脂肪摄入量通常小于每天体重的 1 克/千克(消耗总卡路里的 20%)。

碳水化合物在长时间的剧烈运动中恢复肌肉和肝脏糖原储存,减轻压力激素水平升高,如皮质醇,并可以限制与高强度运动相关的免疫抑制。高碳水化合物饮食(8.5 g/Kg/d;总能量摄入的 65%)和随意食用碳水化合物在高强度训练期间可以减少疲劳并改善身体机能和情绪。
运动前和运动中摄入大量简单碳水化合物
针对运动员的饮食建议在运动前摄入大量简单碳水化合物以维持葡萄糖稳态,并在运动前摄入低纤维以减少胃肠道不适,同时补充说,以植物为基础的高纤维饮食可能会降低能量供应。在运动前和运动期间摄入简单碳水化合物(例如,葡萄糖、果糖、蔗糖、右旋糖)可以减轻疲劳、提高运动表现、促进水重吸收和维持水分充足。
摄入等量的果糖和葡萄糖,优化果糖吸收减轻不适
然而,葡萄糖和果糖负荷以及果糖与葡萄糖的比例会影响肠道微生物发酵和胃肠道应激。葡萄糖和果糖的组合导致比摄入单一碳水化合物更高的碳水化合物氧化率,减少运动期间内源性能量储存的消耗。摄入等量的果糖和葡萄糖可优化果糖吸收,减少微生物发酵,从而减轻胃肠道不适症状。
乳糖提高运动表现和恢复能力
乳糖还可以作为运动前、运动中和运动后的良好燃料来源,以提高运动表现和恢复能力,同时还可能促进对肠道微生物群的有益影响,例如双歧杆菌和乳酸杆菌的增加。
注意:
高碳水化合物饮食不会改善免疫功能,也不会防止经过大量训练后血浆谷氨酰胺浓度降低。
富含简单和精制碳水化合物的饮食不会促进健康的肠道微生物群组成,也不会产生有益的短链脂肪酸。
需要更多的研究来了解微生物群从饮食中提取营养的能力,并包括宿主的代谢变化。
膳食纤维
一般每 1,000 卡路里摄入足够的纤维总量为 14 克,即成年女性为 25 克,成年男性为 38 克。
低膳食纤维供应与较低的微生物群多样性、较少的短链脂肪酸产生和较少的抗病原菌相关,所有这些都可能对宿主产生有害的长期后果。
运动员或运动锻炼期间可以通过增加植物性食物的摄入量(例如全谷类、豆类、蔬菜、水果和坚果),同时在恢复期和训练期减少来自高添加糖、精制碳水化合物和脂肪的加工食品的能量,从而获得足够的膳食纤维摄入量,因为在激烈的训练或比赛之前吃高纤维饮食可能会导致胃肠道不适,如腹胀、胀气。
腹胀详见:“肚子像气球?”“好像怀孕?”——可能是腹胀惹的祸
此外,膳食纤维和大量食用植物性食物似乎会抑制细菌从蛋白质中产生有害代谢物,这强调了摄入足够的复合碳水化合物以维持肠道微生物组碳水化合物发酵的重要性。
脂肪和多不饱和脂肪酸
运动员的脂肪消耗量往往很低,占膳食能量的 15-30% 。长时间运动期间脂肪代谢的增加(30-50% 的膳食能量)可能具有糖原节约作用,并可能改善耐力表现和健康。
高脂肠内营养可以减轻肠道灌注不足导致消化功能紊乱后的肠道炎症、细菌易位和肠道损伤。
高脂饮食的危害
另一方面,高脂饮食会导致类似焦虑的行为增加,选择性破坏探索性、认知性和刻板行为,神经炎症破坏肠道屏障功能的标志物,以及与高脂肪饮食的小鼠相比增加循环内毒素和淋巴细胞表达。
在人类中,与高碳水化合物饮食(65% 的饮食能量)相比,富含脂肪的饮食(62% 的饮食能量)可能对免疫功能有害。
这些作者比较了 10 名未经训练的年轻男性在每周 3-4 次持续 7 周的耐力训练期间食用富含碳水化合物的饮食,和10 名高脂饮食的受试者。高脂饮食的运动员的 NK 细胞活性较低。
注:NK 细胞溶解一定数量肿瘤靶细胞的能力
Omega-6 多不饱和脂肪酸
它可以改变细胞膜流动性并间接影响免疫功能,包括减少 IL-2 的产生和抑制有丝分裂原诱导的淋巴细胞增殖,从而在运动期间和运动后产生潜在的不良免疫功能。
omega-3 多不饱和脂肪酸
它的最佳剂量约为 1–2 g/d,二十碳五烯酸与二十二碳六烯酸的比例为 2:1,可能会减少运动过程中 ROS 的产生。

高脂饮食对运动的影响不明确
到目前为止,由于结果相互矛盾,很难就补充 omega-3 的数量和持续时间向运动员提出任何明确的建议。目前,高脂肪饮食对后续运动表现的影响是模棱两可的,并且缺乏关于压力个体的信息。
最重要的是,摄入高脂肪和卡路里的饮食与慢性“低度”全身炎症、肠道通透性和血浆LPS增加以及总细菌多样性降低以及拟杆菌和梭菌的相对比例增加有关。因此,似乎食用高脂肪饮食也可能导致肠道微生物群发生不利变化。
维生素和抗氧化剂
运动员通常不会补充维生素和其他抗氧化剂,但建议运动员应考虑增加抗氧化剂的摄入量,如维生素 C、E、β-胡萝卜素和多酚,以减少 ROS 的形成和脂质过氧化。

用蓝莓和绿茶提取物(作为布洛芬替代品)补充多酚并没有改变既定的炎症和氧化应激,但增加了肠道细菌多酚代谢特征的代谢物(例如马尿酸盐、4-羟基马尿酸、4-甲基儿茶酚硫酸盐)和跑步者在3天剧烈运动后恢复期间的生酮。
不推荐补充个别微量营养素或食用大剂量的简单抗氧化剂混合物
尽管没有任何负面影响的报道,但富含多酚提取物(蓝莓和绿茶)的运动员饮食并没有减轻剧烈运动带来的生理压力,也没有提高恢复速度。
摄入大剂量的个别维生素(在运动员中并不少见)可能弊大于利,因为大多数维生素在体内主要作为辅酶发挥作用。一旦这些酶系统饱和,游离形式的维生素就会产生毒性作用。因此,运动锻炼期间应该通过增加水果和蔬菜的摄入量来获得复杂的抗氧化化合物混合物。
益生菌
常规益生菌包括双歧杆菌属和乳酸杆菌,尽管在运动员中研究的其他细菌包括芽孢杆菌属、肠球菌属、链球菌属、韦永氏菌或酵母布拉氏酵母菌。
益生菌带来的健康益处及对运动效果的影响
益生菌可减少感染、炎症、肌肉酸痛和胃肠道通透性或不适。迄今为止,益生菌益处的最实质性证据是改善上呼吸道感染的发生率、持续时间和严重程度,这可能会间接提高运动成绩。
呼吸道症状改善的研究包括来自乳酸杆菌家族的有机体。L.salivarius也可能通过增加产生丁酸盐的类群Roseburia和Lachnospiraceae 来降低胃肠道通透性,并减少疣微菌。虽然有证据表明益生菌功能的共享机制,但益生菌的益处通常取决于益生菌的菌株和剂量。
益生菌可以通过改善肠道通透性和抗氧化状态以及减少炎症来减轻剧烈运动对运动员胃肠道不适和肌肉酸痛的影响。布拉氏酵母菌和嗜酸乳杆菌和双歧双歧杆菌的组合有助于预防旅行者腹泻。
益生菌还可以通过生物活性代谢物的产生(例如短链脂肪酸、神经递质)、肠道 pH 的调节和肠道的改变等机制改善营养吸收和利用、糖原储存、身体成分、能量收集、激素产生以及认知和情绪微生物群的活动。例如,植物乳杆菌增加了铁人三项运动员的耐力表现,同时增加了粪便短链脂肪酸。
一项对小鼠的研究表明,从一名奥林匹克举重运动员身上分离出的细菌菌株 [ L. salivarius亚种 salicinius (SA-03)] 通过增加肝脏和肌肉糖原并降低乳酸、血尿素氮、氨和肌酸激酶在运动后提高耐力表现和肌肉力量。
然而,更多的研究表明,多菌株益生菌比单菌株益生菌具有更强的增效作用,这表明多种菌株可能以互补的方式发挥作用以提供性能优势。
益生菌可能因此有利于通过直接和间接的机制,提高运动成绩,虽然增补效应的证据仍然稀少。
益生菌如何补充?
益生菌菌株和剂量的差异以及个人的基线饮食、免疫状态和微生物群组成可能会导致研究之间的结果存在差异,从而使比较和得出结论变得困难。
大多数针对运动员的益生菌补充研究并未评估肠道微生物群,因此很难确定疗效是否取决于基线或参与者肠道微生物群组成的变化。同时饮食摄入,尤其是纤维和益生元底物的摄入,也可能影响益生菌的作用,因此应在分析中加以考虑。因为消费者应该意识到,如果没有足够营养的饮食支持,单独补充益生菌可能不会产生预期的效果。
此外,针对运动的益生菌补充研究通常样本量较小(即 10 至 30 名参与者),并且通常仅包括或主要包括男性参与者,这是有问题的,因为存在可能是性别特定的影响。
发酵食品对运动的影响
人们越来越关注发酵食品中活培养物的影响 ,以及它们的影响或与肠道微生物群的关联。然而,很少有研究调查发酵食品(包括酸奶、开菲尔、酸菜)对运动的影响。
三项使用开菲尔或发酵乳的研究报告称,运动诱发的 CRP 或肌酸磷酸激酶和肌肉酸痛降低,表明这些发酵食品对减少炎症有积极作用。一项小鼠研究报告了开菲尔对力量和耐力的增效作用。因此,含有活微生物的发酵食品可能对炎症和运动表现有益。
合生元
合生元是“包含活微生物和宿主微生物选择性利用的底物的混合物,它赋予宿主健康益处”。合生元可能是益生菌和益生元的组合(互补合生元),尽管单个成分不一定需要满足益生菌和益生元的标准,只要它们在共同给药时协同作用(协同合生元)。因此,益生元成分可以增强益生菌(协同合生元)的功能,或者这两种成分在引入肠道及其常驻微生物(互补合生元)后可以提供独立的有益功能。
这种微生物和选择性利用底物的组合可能比单独补充益生元或益生菌具有不同的效果。然而,只有 1 项研究调查了这些成分对身体活跃的人类的协同和独立影响。合生元补充剂(副干酪乳杆菌431、动物双歧杆菌乳酸亚种BB-12、嗜酸乳杆菌LA-5、鼠李糖乳杆菌)与单独补充益生元(阿拉伯胶)相比,LGG、raftiline、raftilose、乳铁蛋白、免疫球蛋白、阿拉伯胶)与血清 IL-16 浓度的增加较小相关,但合生元补充剂和阿拉伯胶单独都不影响 SCFA 浓度、免疫或胃肠通透性。因此,与单独补充益生元或益生菌相比,合生元可能对运动员的健康和表现产生不同或额外的影响。
微量营养素
微量营养素有助于免疫功能、炎症、能量代谢和骨骼健康,影响运动表现。充足的铁、锌和维生素 A、E、C、B-6 和 B-12 的摄入量对于适当的免疫功能至关重要,在运动员的高强度训练和比赛条件下可能会受到影响。
此外,由于汗液和尿液的流失以及氧化应激的增加,运动员对某些微量营养素的饮食需求可能会增加。此外,女运动员或女性增加锻炼缺铁的风险更高,影响健康和表现。
微量营养素与肠道微生物群
缺乏抗氧化微量营养素(例如,维生素 C 和 E 以及硒)会减少共生肠道细菌的数量,同时促进大肠杆菌的增加。
在压力增加的动物中,维生素 C、维生素 E、多酚、硫辛酸和微生物抗氧化剂的抗氧化剂混合物可恢复肠道氧化还原状态,这与双歧杆菌和乳杆菌增加以及大肠杆菌减少有关。然而,过量摄入某些微量营养素也可能增加感染易感性。例如,婴儿过量补铁会增加病原微生物,包括大肠杆菌,并导致肠道炎症。
因此,在压力增加或微量营养素缺乏的情况下补充微量营养素可能对免疫和炎症具有微生物群介导的益处。
钙和维生素D
钙和维生素D支持骨骼健康。此外,维生素 D 可能通过调节钙依赖性收缩、蛋白质依赖性骨骼肌合成代谢、线粒体功能和胰岛素敏感性来影响骨骼肌质量和强度。纤维摄入后双歧杆菌、毛螺菌科和拟杆菌的增加与钙吸收的增加呈正相关。这可能是由于短链脂肪酸的产生,它通过降低结肠 pH 值或调节信号通路或基因表达来增加钙吸收。维生素 D 的摄入也会影响肠道微生物群,尽管结果的可变性排除了确定补充剂对特定分类群的影响的能力。摄入钙和维生素 D 与肠道微生物群之间的双向关系对所有年龄段运动员的骨骼健康都有重要意义,无论是生长还是维持骨密度,以降低骨折风险。
需避免的食物
胃肠道问题在运动员和长期运动锻炼人群中比较常见。为了缓解症状,运动员可能会避免或限制某些会引发症状的食物。运动员还可以采用营养策略来增加胃排空并改善水和营养物质的吸收,包括避免高 FODMAP食物和含麸质食物。
FODMAP 是不易消化的短链碳水化合物,可增加胃肠道内的渗透负荷。肠道微生物可以将这些膳食成分发酵形成气体,从而导致有些人出现腹胀和胃肠道不适。

最近一项调查耐力运动员 FODMAP 摄入量的研究报告称,高摄入量都会导致胃肠道症状。初步结果表明,低FODMAP饮食减轻了运动员胃肠道症状。然而,FODMAP也充当肠道微生物群的燃料,它们的限制可能会影响群落的组成和功能。
有一种推测,无麸质饮食之所以能改善胃肠道症状,并不是其本身,而是其中 FODMAP 食物的减少。
只有一项研究调查了无麸质饮食对非腹腔耐力运动员的影响,其中报告无麸质饮食对表现、胃肠道症状、健康、肠道损伤或炎症没有影响。

运动可能是改变肠道菌群组成和恢复肠道共生的重要干预措施
目前的研究支持运动作为一种重要的行为因素的作用,它可以影响肠道微生物组成和功能的定性和定量变化,并对宿主有益。运动可以丰富微生物群的多样性,刺激可以调节粘膜免疫、改善屏障功能的细菌的增殖,并刺激能够产生防止胃肠道疾病和提高性能的物质的细菌和功能通路。
尽管这些变化可能不会以类似的方式在个体间发生,也可能取决于微生物群和宿主的基线特征。
值得注意的是,某些菌群可能在运动员中富集,例如与瘦表型相关的A. muciniphila和产生丙酸盐的Veillonella(通过乳酸代谢)。精英运动员身上丰富多样的、有利于代谢的肠道微生物群,很可能是在整个青春期和成年期参加高水平运动期间,多年高营养摄入和高强度运动和训练的累积表现。
运动带来的益处涉及内在和外在因素的结合
常运动的人更有可能接触到他们的环境生物圈,并遵循整体健康的生活方式,因此拥有更健康的微生物群。
同时,耐力训练的内在适应性,例如血流量减少、组织缺氧以及转运和吸收能力增加,可导致胃肠道发生变化。胃肠道转运时间的变化又会影响结肠腔内的 pH 值,这可能导致肠道微生物群的组成发生变化。而较长的结肠转运时间与肠道微生物群多样性的减少有关,同时伴随着从近端结肠到远端结肠的转运过程中 pH 值的增加。
长时间过度运动对肠道功能产生不利影响
尽管运动通常有益健康,但如果持续时间和强度的增加,且得不到足够的休息、营养的支持,它就会变得有害。
剧烈运动将血液从内脏循环重新分配到活跃的呼吸组织。长时间的肠道低灌注会损害黏膜稳态并导致肠细胞损伤,可能会导致肠道缺血,特别是在脱水的情况下,表现为腹部绞痛、腹泻或偶尔血性腹泻,也会使肠道通透性增加,产生炎症。这种不利影响在耐力运动中尤其如此。
目前对人体肠道微生物群与运动之间相互作用的研究仍然缺乏
尤其是与控制饮食相结合的研究,这是一个重要的混杂因素。准确测量营养成分和饮食质量,将有助于把运动对肠道微生物群的影响与其他混杂因素区分开来。
研究还应记录液体摄入量或测量水合生物标志物(如和肽素),以确定水合状态是否影响肠道微生物群,反之亦然。
此外,饮食和运动对肠道微生物群的影响通常是短暂的,并且在干预完成后不会持续。这表明长期的生活习惯对于诱导肠道微生物群的稳定变化是必要的。在关键发育窗口期间的干预措施可能对肠道微生物群产生更持久的影响,当然这需要进一步研究。
未来与运动相关的肠道微生物群的研究领域

Mohr AE, et al., J Int Soc Sports Nutr. 2020
未来的研究应侧重于使用分层方法,使用人体临床试验来识别可能有益于运动表现的目标细菌,并使用动物和体外研究来确定因果关系和机制。
然后可以再次使用人体试验来确定是否补充已鉴定的细菌或实施饮食习惯(例如,益生元/不易消化的碳水化合物、ɷ-3 脂肪酸补充剂、蛋白质摄入量的类型/数量),以提高细菌丰度和/或功能有利于运动表现。
需要在控制饮食的情况下调查高蛋白饮食、全食物蛋白质来源和蛋白质补充剂的影响的临床研究,以确定这些饮食模式和成分对运动员肠道微生物群的影响。
此外,需要更多的研究来阐明膳食脂肪的数量和类型对肠道微生物群的影响以及随后微生物群介导的(例如,通过胆汁酸)对运动表现的影响。
总之,人们越来越意识到,微生物群的个体差异会导致运动反应和健康结果的差异性。
未来的研究还应该整合其他“组学”数据
整合其他“组学”数据,以确定可能导致、促成、介导或调节饮食和运动对肠道微生物群的影响的潜在代谢物、基因和表观遗传修饰。
“组学”数据的使用与机器学习方法相结合,有可能揭示肠道微生物群与其代谢物、饮食和运动表现之间的新关联,并预测对饮食策略的个性化反应。这些发现的影响包括提高运动员成绩和改善健康,尤其是胃肠道和呼吸系统健康的潜力。
此外,研究应对肠道微生物群、饮食和人类健康之间的相互作用有更深入的了解,这些相互作用可能具有超越运动人群的影响和应用,以造福所有人的健康。
声明:本账号发表的内容仅是用于信息的分享,仅供学习参考使用。在采取任何预防、治疗或治愈的措施之前,请先咨询临床医生。
主要参考文献:
Clark A, Mach N. Exercise-induced stress behavior, gut-microbiota-brain axis and diet: a systematic review for athletes. J Int Soc Sports Nutr. 2016;13:43. Published 2016 Nov 24. doi:10.1186/s12970-016-0155-6
Lensu, S.; Pekkala, S. Gut Microbiota, Microbial Metabolites and Human Physical Performance. Metabolites 2021, 11, 716.
Mohr AE, Jäger R, Carpenter KC, et al. The athletic gut microbiota. J Int Soc Sports Nutr. 2020;17(1):24. Published 2020 May 12. doi:10.1186/s12970-020-00353-w
Jang LG, Choi G, Kim SW, Kim BY, Lee S, Park H. The combination of sport and sport-specific diet is associated with characteristics of gut microbiota: an observational study. J Int Soc Sports Nutr. 2019;16(1):21. Published 2019 May 3. doi:10.1186/s12970-019-0290-yHughes RL,
Holscher HD. Fueling Gut Microbes: A Review of the Interaction between Diet, Exercise, and the Gut Microbiota in Athletes. Adv Nutr. 2021;12(6):2190-2215. doi:10.1093/advances/nmab077
Jollet M, Nay K, Chopard A, et al. Does Physical Inactivity Induce Significant Changes in Human Gut Microbiota? New Answers Using the Dry Immersion Hypoactivity Model. Nutrients. 2021;13(11):3865. Published 2021 Oct 29. doi:10.3390/nu13113865
Marttinen M, Ala-Jaakkola R, Laitila A, Lehtinen MJ. Gut Microbiota, Probiotics and Physical Performance in Athletes and Physically Active Individuals. Nutrients. 2020;12(10):2936. Published 2020 Sep 25. doi:10.3390/nu12102936
Sohail MU, Yassine HM, Sohail A, Thani AAA. Impact of Physical Exercise on Gut Microbiome, Inflammation, and the Pathobiology of Metabolic Disorders. Rev Diabet Stud. 2019;15:35-48. doi:10.1900/RDS.2019.15.35
Monda V, Villano I, Messina A, et al. Exercise Modifies the Gut Microbiota with Positive Health Effects. Oxid Med Cell Longev. 2017;2017:3831972. doi:10.1155/2017/3831972
Clauss M, Gérard P, Mosca A, Leclerc M. Interplay Between Exercise and Gut Microbiome in the Context of Human Health and Performance. Front Nutr. 2021;8:637010. Published 2021 Jun 10. doi:10.3389/fnut.2021.637010
Okamoto T, Morino K, Ugi S, Nakagawa F, Lemecha M, Ida S, Ohashi N, Sato D, Fujita Y, Maegawa H. Microbiome potentiates endurance exercise through intestinal acetate production. Am J Physiol Endocrinol Metab. 2019 May 1;316(5):E956-E966. doi: 10.1152/ajpendo.00510.2018. Epub 2019 Mar 12. PMID: 30860879.
Ticinesi A, Nouvenne A, Cerundolo N, et al. Gut Microbiota, Muscle Mass and Function in Aging: A Focus on Physical Frailty and Sarcopenia. Nutrients. 2019;11(7):1633. Published 2019 Jul 17. doi:10.3390/nu11071633
Hughes RL, Holscher HD. Fueling Gut Microbes: A Review of the Interaction between Diet, Exercise, and the Gut Microbiota in Athletes. Adv Nutr. 2021 Dec 1;12(6):2190-2215. doi: 10.1093/advances/nmab077. PMID: 34229348; PMCID: PMC8634498.
Zhao J, Zhang X, Liu H, Brown MA, Qiao S. Dietary Protein and Gut Microbiota Composition and Function. Curr Protein Pept Sci. 2019;20(2):145-154. doi: 10.2174/1389203719666180514145437. PMID: 29756574.
谷禾健康
自身免疫性疾病,包括炎症性肠病、多发性硬化和类风湿性关节炎,具有不同的临床表现,但肠道微生物群紊乱和肠道屏障功能障碍的潜在模式相同。但宿主因素的个体差异使得统一的方法不太可能。
我们往往会有这样的错觉:“自然”的东西一定是对健康有益的。我们是不是只要吃最原始的食物就能恢复健康?
事实上,优化人类健康的途径并不像照搬我们祖先的饮食或增加我们对微生物的接触那样简单。归根结底,过去和现在的环境是根本不同的,也许是不可逆转的。
因此,针对微生物群的饮食干预的目标不应是回到祖先的状态,而是操纵微生物群,优化宿主健康,直接适应日益工业化的世界。
本文介绍了关于饮食-局部炎症中的微生物群相互作用、肠道微生物群失衡和宿主免疫失调的知识。通过了解并结合个别饮食成分对微生物代谢输出和宿主生理的影响,研究了基于饮食的自身免疫性疾病预防和治疗的潜力。讨论了针对肠道微生物群的工具,如粪便微生物群移植、益生菌和正交小生境工程等。这些方法强调了在自身免疫性疾病不断增加的情况下,利用饮食精确操纵肠道微生物组的途径。
在肠道中,对微生物威胁作出适当反应的免疫平衡行为,对共生微生物和自身抗原的耐受,在生命早期尤其重要,这是定植微生物群和宿主免疫系统相互作用的窗口,引发促炎或抗炎倾向,可能对终身健康产生影响。
★ 婴儿期影响菌群的因素
看过我们文章的都知道,早期生活因素,如剖腹产、配方奶粉喂养和抗生素的使用,可能会干扰微生物群生长过程。
婴儿期母乳中的人乳低聚糖有助于双歧杆菌的定植,双歧杆菌在早期肠道微生物群中占主导地位,产生岩藻糖、乙酸盐、丙酮酸盐和1,2-丙二醇,通过交叉喂养支持微生物群的扩增,有助于对共生细菌的免疫耐受。
人类通常在6个月大时开始转变为固体食物饮食,自此菌群显著扩大,产生更多数量和种类的代谢物(例如,丁酸盐,它促进结肠粘液屏障的成熟,并阻止具有高致病潜力的细菌的生长)。
★ 抗性淀粉缓解系统性红斑狼疮
在一项涉及149名健康志愿者的研究中,脂多糖通过诱导TLR4耐受来抑制先天免疫过程。微生物抗原对TLR的不当刺激也可能影响自身免疫疾病的进展,并为其修复提供线索,如系统性红斑狼疮过度表达TLR7的小鼠模型中,通过添加抗性淀粉来改变微生物代谢产物和分类组成,狼疮进展得到缓解。
★ 微生物变化引起的免疫反应
在自身免疫性疾病患者中也发现了由微生物引起的适应性免疫反应失调。哺乳动物肠道中的共生微生物群,尤其是梭菌群IV和XIVa,它们将膳食纤维代谢成丁酸盐以诱导Treg细胞发育,与小鼠模型中的结肠炎严重程度呈负相关。
通常,自身免疫性疾病患者表现出产生耐受性IL-10的CD25 FOXP3 T细胞的丰度降低,自身反应性效应性T细胞亚群(如TH1细胞和TH17细胞)的丰度增加,从而使Treg细胞与效应性T细胞的比率偏离稳态水平。这些改变可能通过过度产生促炎细胞因子(如TNF和IL-17)进一步促进肠道通透性的增加,这些促炎细胞因子可调节紧密连接蛋白的表达。
自身免疫疾病共同的潜在驱动因素鼓励通过饮食干预或微生物群调节策略(下文讨论)来进行肠道微生物群工程,以将肠道微生物群转变为功能多样的“健康”状态。
饮食可直接影响肠道微生物群,调节其组成或代谢输出,从而可能促进疾病或形成稳态。

谷禾健康
在过去的 20 年中,膳食(多)酚类化合物作为具有预防慢性疾病的抗氧化剂受到了关注。而临床试验中证据很弱,主要因为个体间的差异很大。多酚的生物利用度低(5%–10% 被小肠吸收)。这些化合物的生物利用度严格取决于肠道微生物的酶促机制。
最近,鉴定参与肠道多酚转化的细菌越来越受到关注。已经表征了几种催化酚类物质代谢的菌群及其分解代谢途径。大多数描述的参与多酚转化的属是双歧杆菌、拟杆菌和厚壁菌。微生物会受到外部因素(例如饮食、药物和体育锻炼)、宿主的地理分布和个体差异的影响。肠道微生物群组成的年龄相关变化可能会影响某些营养素的生物利用度,包括其代谢活性介质。
特定的代谢型会产生对健康影响的生物活性代谢物。代谢型还可以反映肠道微生物群的组成和代谢状态,并且可能是通过肠道微生物群介导的潜在多酚健康影响的生物标志物。
基于最近的研究成果,本文将综合介绍膳食多酚以及其生物利用转化与肠道菌群的互作对人体健康的影响,为我们如何结合肠道微生物群选择和摄入膳食多酚提供一些视野。
膳食多酚是一组生物活性植物化学物质,主要存在于各种水果、蔬菜、种子、草药和饮料(啤酒、葡萄酒、果汁、咖啡、茶和巧克力)中,少量存在于干豆类和谷物中。食物中,这些化合物具有多种生态作用,从抵御生物和非生物压力因素到界内交流。
基于中心吡喃环的氧化态将黄铜类细分为几个亚类:
类黄酮类黄酮主要是黄烷醇、黄酮、花色素、黄烷酮、黄酮醇和异黄酮
非类黄酮
非黄酮类化合物主要类别是酚酸,可细分为苯甲酸衍生物,例如没食子酸和原儿茶酸,肉桂酸衍生物,包括香豆酸、咖啡酸、阿魏酸。
第二个主要组主要由芪类组成,白藜芦醇是主要代表,以顺式和反式异构形式存在。另一个重要的非黄酮类化合物是由两个苯丙烷单元氧化二聚产生的木脂素。
黄烷醇是食物中最常见的类黄酮形式,其最丰富的来源是洋葱、西兰花、茶、苹果、红酒、蓝莓、杏仁和开心果。
黄烷酮丰富的食物包括柑橘类水果,如柠檬、葡萄柚和橙子。
花青素是存在于红色水果和蔬菜(例如覆盆子、接骨木莓、草莓、石榴、卷心菜、红洋葱)中的水溶性黄酮类化合物。黄酮来源的有针叶樱桃、杏、橄榄油、蜂蜜、苹果、木瓜和芒果。
异黄酮是主要存在于豆科植物中的生物活性化合物,少量(浓度低于 0.1 毫克/千克)存在于杏、干枣、醋栗、芒果、李子、新鲜椰子和芝麻,而发现二苯乙烯存在于葡萄、红酒和浆果中。
红色、深色水果和蔬菜,如草莓和黑莓、黑萝卜、洋葱和茶,是也是酚酸的重要来源。
红葡萄酒中常含有芪,豆制品中常含有异黄酮。 亚麻籽和芸苔属蔬菜中含有大量木脂素; 其他,如松脂醇、落叶松脂醇通常也存在于许多食物中。
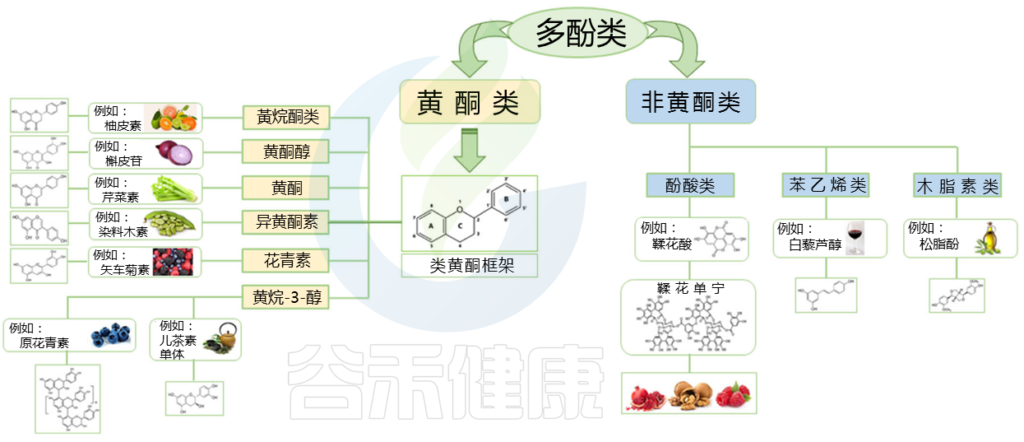
Davinelli S &Scapagnini G. Biofactors. 2021
谷禾健康
在开始本文之前,首先祝祖国母亲生日快乐!
是祖国的繁荣昌盛
成就我们无限可能
目光所致皆为华夏
五星闪耀皆为信仰


-正文-
我们知道肠道微生物群影响健康。然而肠道的内部工作机制较为复杂,不仅有各种微生物,也包括它们产生的气体,比如二氧化碳、氢、甲烷和硫化氢以及各种微量气体,都是由肠道内的化学相互作用和微生物群产生的。
分析这些肠道气体及其对饮食变化的反应可以揭示肠道微生物群的产物和功能及其对人类健康的影响。更好地理解肠道内产生气体的复杂相互作用将提高我们预防、诊断、治疗和监测许多胃肠道疾病的能力。
本文主要概述了肠道气体的生理学及其在胃肠道疾病中的作用,并讨论了目前对肠道主要气体成分、其产生来源及其与饮食摄入的关系的认识。
了解肠道气体的生理学,无论是由微生物发酵还是化学活动产生的,是了解其对人类健康影响的第一步。
气体和食物沿着肠道的运输
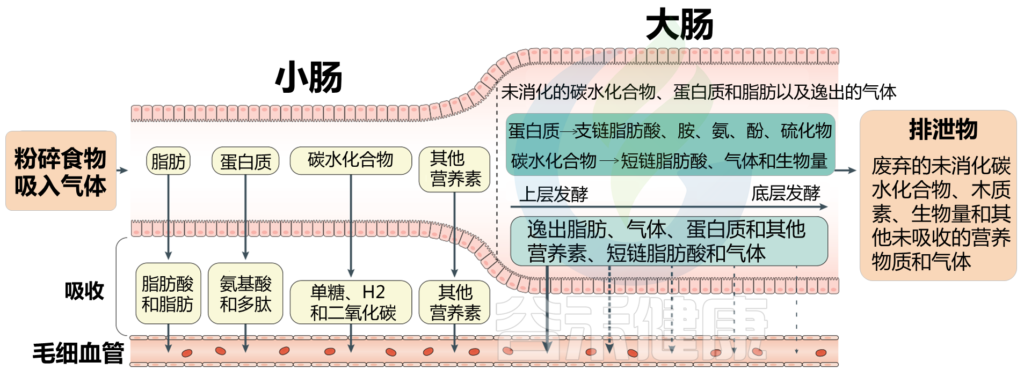
» 气体成分
主要的肠道气体:
氮气(N2)、氧气(O2)、二氧化碳(CO2)、氢气(H2)、甲烷(CH4)
其他气体(以微量浓度存在):
硫化氢(H2S)、一氧化氮(NO)和含硫化合物等
» 肠道气体产生与分布
肠道气体可溶解在肠道的液体成分中,或以气体形式保留在顶空气体中。气体可能通过吞食进入肠道,也可能通过内部化学反应或细菌发酵产生。
在肠道中,氧气(完全)和N2(大部分)来自吞食的空气(尽管少量N2是通过结肠中蛋白质的微生物反硝化作用产生的)。由于N2在通过肠道期间未被吸收或代谢,因此其水平在整个胃肠道内保持合理稳定。
相反,肠道在整个长度内变得越来越无氧,随着管腔微生物数量的增加,氧气浓度逐步降低;因此,结肠中的氧气浓度非常低。(见下图 ↓↓)
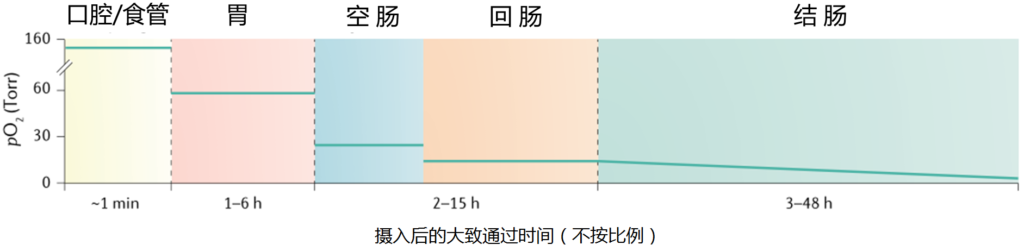
胃和小肠中的二氧化碳部分是通过化学反应产生的,虽然一些吞咽的呼吸性二氧化碳确实会与胃中的气体成分混合。
在近端小肠中,碳酸氢盐(HCO3−), 由胰腺分泌,与十二指肠胃食糜中的盐酸(HCl)发生化学反应,使管腔内pH值从酸性(~3)增加到接近中性(~7.4),并产生CO2.