-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
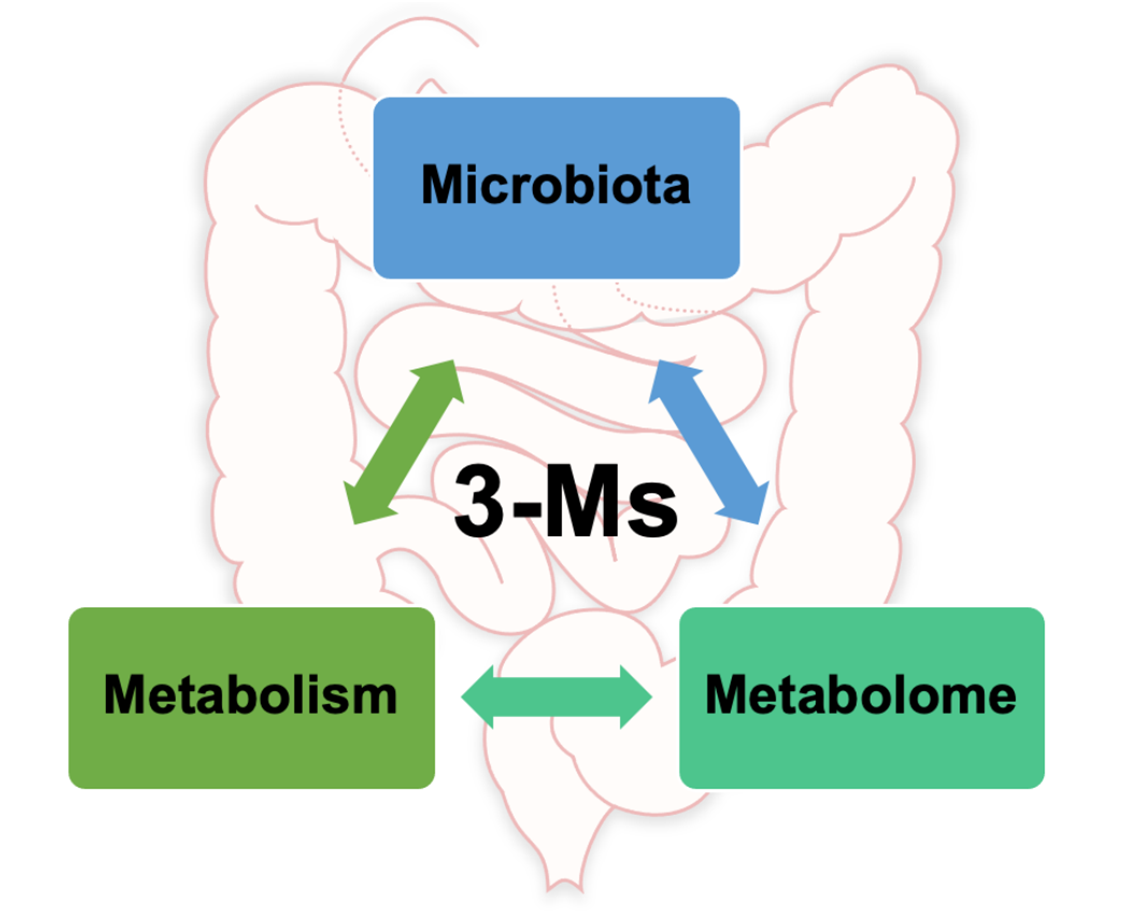
在过去的研究中,健康科学的突破表明人类肠道菌群可以受到环境因素的影响(饮食、生活方式等),而环境因素反过来又可以影响人类健康和疾病。
现在,更全新的概念肠道3M已经提出,即微生物组、代谢和代谢组(microbiota, metabolism, metabolome),对人类健康具有重要意义。
本文重点介绍3M相关的主要概念,提供了关于调节肠道健康的全面更新概述,有助于我们对肠道与人类健康和疾病之间的关系的基本理解。同时也定义了3M相互作用的挑战及讨论未来前景。
在阐述微生物群之前首先了解一下它的发展历史。
关于微生物群的历史
Dey P, et al., Free Radic Biol Med. 2021
人类微生物群
随着下一代高通量16S rRNA测序技术的出现,与人类健康和疾病相关的以微生物群为中心的研究有了巨大的增长。
数量
目前的估计表明,一个体重为70公斤的人平均含有39万亿细菌,而人体细胞则为30万亿。此外,在遗传水平上,在整个人类微生物群中基因数量超过1000万个基因,比人类基因(2万-2.5万)还要多很多,仅肠道微生物群基因就有330万。由于与生命各个方面相关的宿主-微生物相互作用的数量巨大,人类微生物群关联通常被称为“超有机体”。
分布
肠道细菌在肠道长度上的定植偏好是区域特异性的,可能是由缺氧肠腔内宿主的理化参数的变化(如pH值、营养有效性、pO2、胆汁酸、抗菌剂、粘蛋白)决定的。此外,在肠的特定区域内,管腔和绒毛隐窝之间的微生物种群多样性可能不同。比如说,厚壁菌和拟杆菌在盲肠中占优势,而隐窝主要由变形杆菌门和脱铁杆菌门定植。
“核心微生物群”
当然,由于与环境的不同相互作用,包括饮食模式的差异,文献中的微生物概况往往不一致。因此,人类微生物组项目的一个关键目标是确定一个“核心微生物组”,作为所有个体的普遍微生物分类学特征,该特征大部分保持不变。
谷禾健康
在开始本文之前,首先祝祖国母亲生日快乐!
是祖国的繁荣昌盛
成就我们无限可能
目光所致皆为华夏
五星闪耀皆为信仰


-正文-
我们知道肠道微生物群影响健康。然而肠道的内部工作机制较为复杂,不仅有各种微生物,也包括它们产生的气体,比如二氧化碳、氢、甲烷和硫化氢以及各种微量气体,都是由肠道内的化学相互作用和微生物群产生的。
分析这些肠道气体及其对饮食变化的反应可以揭示肠道微生物群的产物和功能及其对人类健康的影响。更好地理解肠道内产生气体的复杂相互作用将提高我们预防、诊断、治疗和监测许多胃肠道疾病的能力。
本文主要概述了肠道气体的生理学及其在胃肠道疾病中的作用,并讨论了目前对肠道主要气体成分、其产生来源及其与饮食摄入的关系的认识。
了解肠道气体的生理学,无论是由微生物发酵还是化学活动产生的,是了解其对人类健康影响的第一步。
气体和食物沿着肠道的运输
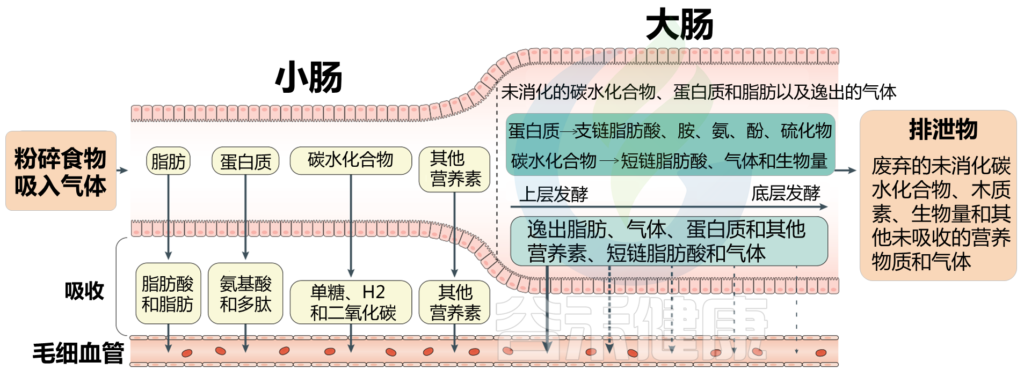
» 气体成分
主要的肠道气体:
氮气(N2)、氧气(O2)、二氧化碳(CO2)、氢气(H2)、甲烷(CH4)
其他气体(以微量浓度存在):
硫化氢(H2S)、一氧化氮(NO)和含硫化合物等
» 肠道气体产生与分布
肠道气体可溶解在肠道的液体成分中,或以气体形式保留在顶空气体中。气体可能通过吞食进入肠道,也可能通过内部化学反应或细菌发酵产生。
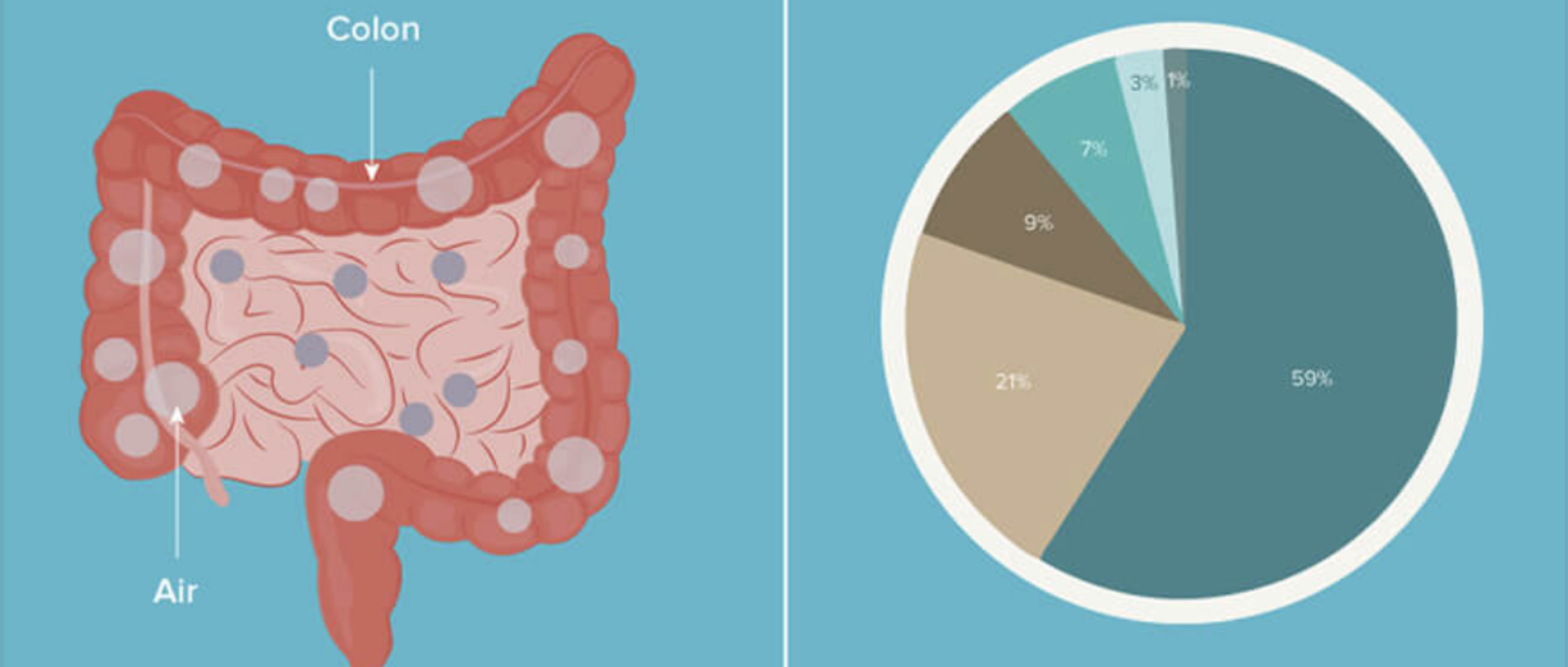
在肠道中,氧气(完全)和N2(大部分)来自吞食的空气(尽管少量N2是通过结肠中蛋白质的微生物反硝化作用产生的)。由于N2在通过肠道期间未被吸收或代谢,因此其水平在整个胃肠道内保持合理稳定。
相反,肠道在整个长度内变得越来越无氧,随着管腔微生物数量的增加,氧气浓度逐步降低;因此,结肠中的氧气浓度非常低。(见下图 ↓↓)
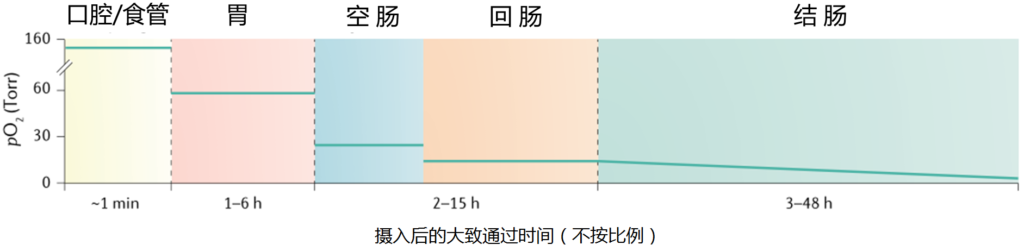
胃和小肠中的二氧化碳部分是通过化学反应产生的,虽然一些吞咽的呼吸性二氧化碳确实会与胃中的气体成分混合。
在近端小肠中,碳酸氢盐(HCO3−), 由胰腺分泌,与十二指肠胃食糜中的盐酸(HCl)发生化学反应,使管腔内pH值从酸性(~3)增加到接近中性(~7.4),并产生CO2.

谷禾健康
饮食失调即使在古罗马时期也是一个社会性问题。但直到如今,我们仍然对它知之甚少。
当前,这种疾病有多流行?现代有“瘦之审美”,畸形观念之泛滥,催生出大批饮食失调人群。
著名演员加布里·西迪贝患有饮食失调(因《 珍爱》 与 《美国恐怖故事:启示录》获得奥斯卡提名),在其回忆录《这就是我的脸:试着不凝视》中生动地描述了她如何用贪食症来应对抑郁。


她写道:
“我的情绪失控了,我只能哭好几个小时。”
“有一天,我哭了很久很辛苦,以至于我开始呕吐。吐完后,我不再哭了。我甚至都没有想过让我哭泣的原因。我感到空虚,这是一件很了不起的事–在此之前,我感觉太过情绪激动了。”
…
《柳叶刀·精神病学》发表的最新研究显示,2019年,全球范围内饮食失调患者总人数已达5550万左右。相比男性,女性患者的占比明显更高。正因如此,饮食失调的临床科研多以女性为主,对男性患病情况缺乏了解。我国饮食失调的发生率与西方国家相当,却未引起足够重视。
虽然有很多关于饮食失调的信息,但是大部分人把这些症状误认为是一种生活方式的选择。
饮食失调,学名“进食障碍”,是以不健康,不正常,强迫性的饮食习惯或异常紊乱的进食行为为主的精神心理障碍,属于轻性精神病。饮食失调通常伴随着情绪和身体症状。
如果你过多地关注饮食,时间和饮食量,以至于对生活造成负面影响,影响工作能力、社交等,则可能意味着你患有进食障碍。
节食、暴饮暴食等现代生活中很常见,媒体也常报道有明星为控制体重连续3天只喝水不吃饭,还有人几十年没碰过米。其实不吃、贪吃、猛吃都可能是饮食失调。
普通人只是偶尔节食,还算不上疾病。
临床上关于此诊断通常有三个维度:
1 频度,异常饮食行为是否持续3个月以上,或每周至少一次。
2 进食习惯表现,比如,是否过度限制饮食等;
3 影响,是否对生活、工作、学业等造成不良影响。
如果三项全部为“是”,且排除垂体肿瘤等神经系统器质性病变,即可认定为饮食失调。
其实饮食失调是导致不健康饮食习惯养成的一系列心理状况,更偏向轻性心理疾病,可能是从对食物、体重或体型的某类思想执迷开始的,比如说“非瘦不可”,“体重超过3位数没有未来”等言论,疯狂追求“A4腰”,“巴掌脸”……
然而,在严重的情况下,饮食失调对身体的破坏力超出你想象。如果不及时治疗,甚至可能导致死亡。
饮食失调包括以下六种:
神经性厌食症
神经性贪食症
暴饮暴食症
异食癖
反刍障碍
回避/限制性食物摄入障碍
神经性厌食症和贪食症是最常见的饮食失调,但暴饮暴食症有时也包括在内。尽管它们三个有相似的根本原因,但受害者行为却是不同的。
厌食症
厌食症:这种疾病的特征是对卡路里摄入量的极端控制,对体重增加的强烈恐惧以及对身体胖瘦和形态的不切实际的看法。
其实部分厌食症患者仍保持有正常的食欲,只是她们为了保持徧低的体重而过分地节制饮食。或因本身身体因素,对食物有排斥心理,导致身体对饮食搭配的失衡。
厌食症的特点是不断自我饥饿造成体重急剧减轻,而且大多数情况下还伴随剧烈运动。
神经性厌食症的常见症状包括:
与年龄和身高相近的人相比,体重明显偏低;
饮食习惯很受限制;
即使体重偏低,仍然强烈担心体重增加或持续某些行为以避免体重增加;
不懈追求瘦和不愿意保持健康体重;
自尊受到体重或感知的身体形态的严重影响;
扭曲身体形象,包括否认体重严重不足。
神经性厌食症主要出现在成年初期,追求苗条身材的心理达到了极致的状态,有一种心理障碍,总觉得自己臃肿,想要把自己饿到很瘦为止。这种病的症状就是把不合适的身材印象强加在自己身上,看周围肥胖的朋友不觉得他们胖,却对自己极为严格,总觉得自己很胖。

这类人群情绪不稳定,带有攻击性,又时常忧郁,试图把自己隔离在家人和朋友之外,最后会出现体重剧减、体温和脉搏下降、缺铁性贫血、白血球数减少、毛发损伤、便秘,以及月经中断等症状。
在模特和演员中也时常出现这种病症。如果无条件地认为瘦就是美,是一件很危险的事情。之所以要减肥,是因为我们需要更健康更有活力的生活,而不是放弃生活。
贪食症
贪食症: 贪食症的特征是频繁进食,暴饮暴食,随后进行清除以免体重增加。清除可能包括催吐,强迫运动以及滥用泻药和利尿剂。
这种疾病的特征是在短时间内频繁失控的进食,直到人们感到不适为止。暴食症通常是由于自我厌恶和尴尬而悄悄发生的。
这样的患者为了减肥只吃热量很低的食物(单一食谱法、丹麦式减肥法、800卡以内减肥法等),但实际上从早到晚都有想吃东西的欲望,结果名义上虽吃低热量食品,实际上却能一次吃光15000卡的食物,相当于正常人一周的食量。意识到之后又觉得很惭愧,身体也感到不适,于是又常常进行人为催吐或服用泻药等不健康手段。


这种节食又暴饮暴食的反复过程,彻底破坏了人体的平衡。反复的呕吐使食道和胃都受到损伤,牙齿表面也被破坏,心理上的负担不断加重,甚至由于极度绝望而导致自杀。
暴饮暴食症
暴饮暴食症:可定义为强迫进食至不适感。重要的是,与同类情况相比,它需要吃的食物要多得多,同时还伴有明显的困扰,缺乏补偿行为以及无法控制吃多少或什么东西。
暴饮暴食症有时被称为强迫进食障碍,与贪食症有很相似的症状,但一般没有催吐之类的行为。这些患者往往超重,因此会造成一些严重的健康问题。


普通人偶尔多吃点没有什么后果。但是暴饮暴食症有所不同,因为暴饮暴食发作变得频繁并开始干扰一个人的幸福感,人际关系和自我价值感。
有意思的是,贪食症患者的体重从低于标准体重,到正常或超重各种各样都有。
如果你发现自己或朋友或家人中有以下危险信号,则可能需要引起注意:
被食物,体重,脂肪或卡路里的思想所控制
避免吃自己喜欢的食物,不愿意享受食物
宁愿一个人吃饭,也不要和别人一起吃饭
过度运动,例如,计划锻炼的一天 ,设定不切实际的目标,或忽略受伤、疲劳等现象
更加关注别人的身体
定期催吐,或者使用食欲抑制剂,泻药,利尿剂,灌肠剂等。
异食癖
异食癖是指一个人总是吃不属于食物的东西。这些食物可能包括纸、肥皂、布、颜料片、蜡笔、灰尘或冰块,这些食物没有营养价值,可能不利于消化。
异食癖通常在两岁后才被诊断出来。
听起来有些不可思议。为什么有人会吃非食物?
一些异食癖者说他们喜欢异食癖的味道、质地或气味。其他人说,吃某些非食物可以缓解压力和焦虑。
医生并不总是能识别出病人在吃非食物,人们通常也不会告诉他们的医生,因为他们感到羞耻。然而异食癖会有可怕的后果,比如窒息、中毒和营养不良,所以寻求治疗是至关重要的。
反刍障碍
反刍症是一种进食障碍,其特征是食物吃进去以后又反流出来。反流可能是自发的。若患者报告称反复反流食物一个月或以上,医生将诊断为反刍症。
有些反刍症患者知道该行为是社会不可接受的,并试图掩盖或隐藏。
如果患者限制了他们的食物摄入量(避免其他人看到反流),他们可能会体重减轻或出现营养缺乏。
反刍经常发生在婴儿期和儿童期,但它也会影响到成年人。压力和焦虑是婴儿和儿童的风险因素,而焦虑和抑郁是成年人的风险因素。
这种情况是习惯性的或无法控制的,治疗的重点可能是打断和逆转这些习惯。
回避/限制性食物摄入障碍
回避/限制性食物摄入障碍(ARFID)发生在人们没有吃足够的食物来获得适当的能量或营养的时候。患有ARFID的人可能会因为食物的口感或气味等感官特征而避免进食,害怕进食的后果,或者根本对进食不感兴趣。结果可能导致体重减轻、营养不良和发育问题。
这种疾病通常出现在婴儿期和儿童期。当这种回避不能用食物匮乏或文化习俗来解释时,就会被诊断为这种行为。医疗问题、饮食失调和心理健康问题也必须排除。ARFID的危险因素包括焦虑、强迫症、自闭症以及胃肠道问题。


人们经常被挑食和ARFID之间的界限所混淆。当一个人不能满足他们的热量或营养需求时,挑食就会变成一种紊乱。他们可能无法增加体重,体重与身高不相称,或者依赖补充剂。如果它开始干扰他们的日常功能,他们可能患有疾病。
ARFID也不同于厌食症;ARFID的食物厌恶并不像厌食症那样,是由对身体形象或体重增加的恐惧驱动的。
虽然一些患有饮食失调症的人看起来很正常,但实际上他们的身体正处于危险之中。
饮食失调症状的一些常见后果,包括干扰发育,并可能导致健康问题如心率过低、月经周期缩短、脱发、菌群失调进而引发一系列疾病。
你可能不知道,饮食失调还会干扰人际关系,妨碍处理潜在的痛苦情绪,很难过上幸福的生活。

患有饮食失调的人经过干预治疗有些最终完全恢复,而有些则在恢复和复发期中循环,有的甚至会长期患病或死亡。
根据统计,饮食失调是所有精神疾病中死亡率最高的。估计有20%的饮食失调者最终会死于以下疾病:例如,不规则或非常低的心跳(心律不齐),突然的心脏骤停,严重的肝脏疾病或自杀等并发症。
即使是幸存者,也可能面临严重的健康问题,包括但不限于:
不可逆转的骨质流失、肌肉丢失和无力;
贫血、严重脱水;
可导致肾功能衰竭;
皮肤干燥、脱发;
消化慢(胃轻瘫),晕厥;
疲劳和整体虚弱;
月经不调或性欲减退,沮丧等。
饮食失调的原因很少人知道。
饮食失调可能源于遗传、人格特征和环境影响(例如童年经历、社会比较、压力或创伤事件以及文化、审美标准)之间的复杂关系。
抑郁,双相情感障碍和焦虑症的较早出现强烈地预示了青少年的饮食失调。饮食失调似乎是遗传的,可能与5-羟色胺受体的遗传差异有关。
当感到烦恼或烦闷时,进食能带来舒服的感觉,因此,很多暴食症患者在感到沮丧时,试图用进食带来舒服的感觉。但是,因吃得过多而感到腹胀和臃肿,患者又感到十分难受,于是借呕吐等方式来控制体重上升,紧接着,内疚、悲伤和可怜的感受亦随之产生。


此外,还有以下三个重要原因:
——个体因素
个体因素:包括生物学因素和个性因素。
生物学因素是指在进食障碍患者中存在一定的遗传倾向(家族中罹患进食障碍和其他精神类障碍的人多于正常人群)和部分脑区的功能异常。
对双胞胎、亲生家庭和收养家庭的研究表明,遗传会使人们患上疾病的风险更大。家庭成员患有饮食失调症的人,患饮食失调症的风险要大得多。
个性因素是指进食障碍患者中常见典型的人格特点——追求自我控制、追求完美和独特;爱幻想,不愿长大等。在青春期即容易表现出自主性和依赖性的强烈冲突,引发进食问题。
有时候我们会建立目标,然而目标越重要,朝着这个目标前进的动力与实现它所需的生活限制之间的等式就越不平衡,以食物作为达到目的的手段危险就越大。
——家庭因素
家庭因素:家庭因素在进食障碍的发生、发展、维持和康复中都可能起到重要作用。
常见的“进食障碍家庭”模式有:
(1)家庭成员的情感紧紧纠缠,无法分清彼此,没有空间;
(2)父母对孩子过度保护;
(3)父母冲突,孩子卷入其中,背负过重的负担;
(4)家庭模式僵化,无法适应孩子的发展——永远用对待婴儿的方式对待长大的孩子。
有学者提出患者以进食行为代表了对父母过度控制、过度保护的反抗;或以节食为手段达到对父母的反控制,以此作为解决家庭内冲突的一种方法。也有学者认为病人的依赖性强,多与母亲的关系过于密切、依赖,而以自我控制进食作为自己独立的象征。
——社会文化因素
社会文化因素:现代社会文化观念中,把女性的身材苗条作为自信、自律、成功的代表。所以青春期发育的女性在追求心理上的强大和独立时很容易将目标锁定在减肥上。而媒体大力宣传减肥的功效,鼓吹极致身材人人皆可拥有,也让追求完美、幻想极致的女孩更容易陷进去。
此外,看多了各式各样滤镜下的照片会导致自我比较——这个过程有时是无意识的。不断的比较会对自尊和身体满意度造成严重影响。
在过去一年的疫情中,日常生活变得不确定,特别是对于许多年轻人而言。因此,控制食物就像是在压力大,不确定的环境中进行控制的一种可行的选择。
然而,这并不能完全解释为什么只有某些人会患上饮食失调。
科学研究者在进行多学科饮食失调研究时遇到了一些挑战:
一个问题是,神经科学家和临床医生的处理方法不同
在临床研究中,重点是综合征(构成一种紊乱的症状的集合),而在神经科学中,重点是大脑与认知和行为之间的联系。
因此,临床医生可能会研究被诊断为饮食失调的人的焦虑,而神经科学家则会研究导致焦虑的大脑机制。
由于进食障碍分类是基于症状群的,因此每种分类内有很多差异。因此很难将临床研究与神经科学研究结合起来,过多的参与者差异阻碍了关于脑与行为关系的结论。
简而言之:两个具有相同饮食失调诊断的人可能出现不同的诊断或神经特征。


另一个问题是饮食失调类别之间以及饮食失调类别与其他心理疾病之间的重叠
为了缓解这种情况,美国国家心理健康研究所创建了一个面向神经科学的框架,用于研究心理障碍(RDoC)。
该框架使用不同层次的分析(即细胞;神经回路)来探索与行为相关的不同领域(即负面评价;奖励)。但很少有饮食失调研究人员使用过它。
研究饮食失调的神经科学的研究人员还遇到了大脑分析的局限性。由于大多数饮食失调并不是致命的,而且经历饮食失调的人群还相对年轻,因此缺乏用于饮食失调研究的人脑样本。这意味着神经科学家很少分析患有进食障碍的人的大脑。相反,他们依靠血液和其他体液来推断脑功能和饮食失调行为。

除生物样本外,还可以使用诸如fMRI(用于测量大脑区域中的氧化血流)和EEG(脑电图)(用于测量大脑中的电活动)之类的技术来“观察活着的人的黑匣子”。 然而,这些技术的准确性有限,它们只能告诉我们很多有关饮食失调行为的信息。
研究人员用于研究饮食失调的神经科学的另一种选择是使用动物模型。使用动物模型有点好处,它可以减少参与者的变异性,因为神经科学家可以控制动物的遗传学,早期生活经历,父母关怀和饮食。这放在人类是不可能的(也是不道德的)。
通过操纵某些条件,神经科学家可以研究特定因素(例如生命早期创伤)如何随着时间的推移影响动物的健康。这提供了关于大脑与饮食失调行为之间因果关系的更具结论性的论据。
哪些性格特征和态度与饮食失调相关?
饮食失调与完美主义、强迫倾向和对负面情绪的敏感性有关。低自尊和对身体的不满是风险因素,以及焦虑和抑郁等心理健康挑战。
研究表明,女孩饮食失调的最强预测指标之一是同龄人对体重和饮食的重视。这种趋势在大学中更加突出,大学是一个由同龄人组成的社小社会,很少有年长的人提供更广阔的视角。同伴感知的影响可能导致大学校园饮食失调的扩散。
许多年轻人在成年后仍会继续患有饮食失调症。他们将面临大量健康问题的高风险,例如蛀牙和频繁呕吐造成的染色、胆囊疾病、消化疾病等。
当我们研究饮食失调时,重要的是要区分可能导致问题开始的过程(饮食失调的原因)与导致问题持续的过程(饮食失调的维持因素)。
这需要区分所谓的发展阶段(即进食障碍发作之前)和维持阶段(即进食障碍发作之后)。
这种区别有两个重要的含义:
1)识别影响进食障碍发展的过程可能有助于设计有效的预防这些进食障碍的干预措施;
2)确定维持饮食失调的过程可能有助于制定成功的治疗干预措施。
饮食失调维持过程的关键角色
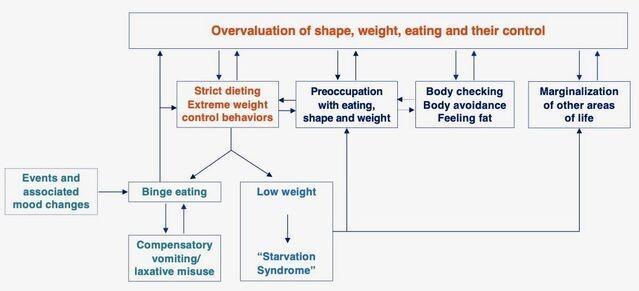
据认知行为理论,一种独特的自我评估方案(下图),即对身材,体重,饮食和饮食控制的过高评价(换句话说,就形态, 体重及其控制能力)在饮食失调中起重要作用。

暴饮暴食是不是高估形态,体重,饮食及其控制的一种行为 。这种行为存在于一大群饮食失调的人群中,它是通过以下机制从这种高估间接产生的:
1.严重饮食不足
太在乎或高估身材,体重,饮食及其控制能力可能导致个人饮食不足。这样做会产生神经内分泌信号的几种变化,这些变化控制着食物的摄入,传达了饱腹感/饥饿感。
2.极端和严格的饮食规则
饮食失调的人对这些极端和僵化的饮食规则会做出消极和极端的反应(通常是全有或全无),甚至小小的违规行为也往往被解释为自我控制力差的证据。对这种缺乏自我控制感的反应是暂时放弃限制饮食的努力,这导致暴饮暴食。 反过来,这加剧了人们对他们的身材,体重和饮食缺乏控制的担忧和信念,并鼓励进一步的饮食限制,从而增加了随后暴饮暴食的风险。
3.事件和相关的情绪变化
人们倾向于通过三种主要机制维持暴饮暴食的发作。
体重过轻,饮食不足,暴饮暴食和饮食失调的其他特征(即饮食限制和节制,自发性呕吐,泻药和利尿剂滥用,过度运动,身体检查和避免,发胖)通过多种机制得以维持在持续激活的状态下,人们对形态,体重和饮食控制的过度关注和过度重视,其结果是饮食失调的心态被锁定在患者的核心(下图)。

2012 年发表在《营养与饮食学会杂志》上的一项研究发现,患有饮食失调症的女性成为素食者的可能性是没有饮食失调症的女性的四倍。超过一半 (52%) 有饮食失调病史的女性曾在一生中的某个阶段吃过素。其他研究也发现了类似的关联。
那是否说明素食和饮食失调有直接关联?
不一定。同样是素食主义,有些是健康的,有些与饮食失调相关联。
这里需要明确一点:真正的素食主义不会导致饮食失调。它可以成为人生任何阶段的健康选择,前提是成为健康的素食者。
怎么样算健康的素食者?
健康的素食者会寻找替代品来补充他们所缺少的营养素,例如钙、蛋白质、omega-3脂肪酸、维生素 B12 和铁。当他们的饮食包含多种营养食品时,与非素食饮食相比,水果、蔬菜、纤维和复合碳水化合物的含量往往更高,饱和脂肪和胆固醇的含量更低。
但是如果是用加工过的垃圾食品代替肉类,那不仅不会促进身体健康,反而会更加疲劳和营养不良。
素食者需要注意的饮食失调风险
素食主义看起来是选择了一种积极的生活方式,但对某些人来说要警惕其潜在机制,如痴迷、控制和自卑,可能是精神疾病的征兆。怎么理解痴迷,控制等状态?
打个比方,如果是为了减肥而采取的一种过于自我苛刻的措施,那么有可能就走偏了。尤其是如果变得痴迷于把某些食物标签为“好”和“坏”,减少麻烦类别的饮食。这样下去,饮食方式逐渐变得极端,那么就有可能与饮食失调相关联。
总而言之,看起来同样是素食,但是驱动因素各不相同,有些人的素食与饮食失调挂钩,而有些人的素食是自然而然的健康选择。这是两种不一样的境界。
神经性厌食症在20世纪下半叶之前就已存在。西方世界对神经性厌食症的最早描述可以追溯到12世纪和13世纪,最著名的是锡耶纳的圣凯瑟琳,她拒绝进食是精神上对自我的拒绝。
1973年,希尔德·布鲁赫出版了一本书,书中有许多案例研究,名为《饮食失调:肥胖、神经性厌食症和内向的人》。这种混乱在20世纪70年代蔓延成为公众意识,病例增加。


贪食症(暴饮暴食,然后通过运动、呕吐或泻药进行清除)最早存在于中世纪的一些富人中,他们会在吃饭时催吐,这样就能吃得更多。
关于贪食症的第一篇临床论文发表于1979年。
厌食症和贪食症的病例在1970年代和1980年代呈上升趋势,有人会说他们在那个时期达到顶峰,但全国调查数据表明,贪食症仍在继续上升。
1970年代和80年代是美国肥胖率上升的时期。开始以空前的速度增长,低脂饮食开始流行。
存在第三种饮食失调,暴饮暴食失调,其中周期性的食物刺激不能通过限制或清除行为来补偿。 虽然许多肥胖的人正常饮食,但是暴饮暴食的人每天要消耗多达几万卡路里的热量,一整袋糖果或5-6份快餐的晚餐量。
再有,这种疾病已经虽然已经有几个世纪了,但似乎只是最近才升级了。暴食者约占寻求肥胖治疗的人的1/3。
随着肥胖患病率,遗传易感性的增长以及工业化食品消费的增加,人们不禁会怀疑饮食失调是否又是西方文明中的另一种疾病,最重要的原因是以不良的饮食习惯为依据。厌食症的大部分自然进程可以通过对身体形象的无序思考以及饥饿过程本身来解释。
随着时间的推移,饮食失调发病率依然在不断上升。一项大型审查研究发现,在2000-2006年间,有3.5% 的人患有饮食失调症,而在2013-2018 年间,有近8% 的人患有饮食失调症。
现在,加工,含糖和富含谷物的饮食会导致炎症,瘦素和胰岛素抵抗,肥胖,思维紊乱等,节食或催吐、催泻等行为可能是在标准饮食上保持“瘦”的唯一方法。这些方法代价很大,并且主要由年轻女性承担。
对饮食失调的关键维持过程的理解有助于开发有效的心理治疗方法。最重要的例子是增强的认知行为疗法(CBT-E):旨在针对上述主要维持过程而不是进食障碍诊断(即神经性厌食症,神经性贪食症,其他进食障碍)设计的一种灵活而个性化的心理治疗方法。
CBT-E的功效已在多项临床研究中进行了评估,目前被认为是饮食失调的成人和青少年最有效的治疗方法之一。
病情轻微者可在门诊部接受个人认知心理治疗、行为治疗和家庭治疗而改善其饮食及生活习惯,以帮助患者回复可接受的体重。
其实,对大部分患者来说,和她们讨论烦恼非常重要,例如:学业压力、校园霸凌现象、过分自觉、家庭问题、青春期恋爱问题等等,以更正不正确的观念和行为。

只有当这些基本的治疗步骤无效,或患者体重剧降至威胁生命时,才需入院接受治疗。住院治疗的方法和非住院治疗差不多,都是用饮食控制和心理治疗,所不同的是在一个更有规律的环境下进行。其中大多数可以得到令人鼓舞的康复效果。
治疗饮食失调有时候涉及团队合作,其中包括初级保健医生,心理健康医生和营养师等。
一个人需要的具体疗法将取决于疾病的类型和严重性。
心理治疗
心理疗法,也称为“谈话疗法”,可以帮助进食障碍的人学会用健康的思想或习惯代替有害的思想或习惯。
营养咨询
医学专家可以帮助您制定健康的饮食计划,以满足您的个人需求。
药物治疗
有时,药物可以帮助控制焦虑,敦促或不健康的想法。抗抑郁药和抗焦虑药可给予患有饮食失调症的人。
住院治疗
由于饮食失调而导致严重健康问题的人们可能需要住院治疗。此外,一些诊所还提供密集的住院治疗方案。
替代和补充疗法
某些替代药物可以帮助进食障碍的人放松身心并减轻压力。瑜伽,按摩,冥想和针灸是常见的疗法。
调节肠道菌群
肠道菌群和饮食互相调节互相反馈,饮食塑造影响肠道菌群构成和发育,肠道菌群参与食物消化,调节免疫炎症,影响神经和情绪进而影响进食
预防饮食失调
没有预防饮食失调的最优方法,但是根据研究,一个人可以通过以下方法降低其患病风险:了解体征,症状和风险;避免节食和不健康的减肥行为;避免负面的自我交谈并学会欣赏身体,行为出现问题及时寻求帮助。
如果是家人或亲近的人患上饮食失调,该如何帮助他们?
首先要做好心理准备,帮助患有饮食失调症的人做出治疗的决定可能是一个漫长的过程。你要做的可能是:
询问患者的想法和感受,帮助他们承认自己有问题(他们可能不相信自己有病)。
鼓励患者接受心理帮助和体检,帮助他们排解疾病带来的心理压力。
帮助他们确立未来的目标,这些目标会让他们觉得治疗是必要的、是非常重要的。
主要参考文献
Mason, T. B., & Lewis, R. J. (2015). Assessing the Roles of Impulsivity, Food-Related Cognitions, BMI, and Demographics in the Dual Pathway Model of Binge Eating Among Men and Women. Eating Behaviors 18: 151–55.
Miranda, J., Woo, S., Lagomasino, I., Hepner, K. A., Wiseman, S., & Munoz, R. (2006). Group Cognitive Behavioral Therapy for Depression: Thoughts and Your Mood. Cognitive Behavioral Depression Clinic, Division of Psychosocial Medicine San Francisco General Hospital, University of California, San Francisco.
Olsen, E. M., Koch, S. V., Skovgaard, A. M., & Strandberg‐Larsen, K. (2021). Self‐reported symptoms of binge‐eating disorder among adolescents in a community‐based Danish cohort—A study of prevalence, correlates, and impact. International Journal of Eating Disorders 54: 492– 505.
Schaeffer, J. (2016). Binge Eating Disorder Statistics: Know the Facts
Vocks, S., Tuschen-Caffier, B., Pietrowsky, R., Rustenbach, S. J., Kersting, A., & Herpertz, S. (2010). Meta-Analysis of the Effectiveness of Psychological and Pharmacological Treatments for Binge Eating Disorder. International Journal of Eating Disorders 43: 205–217.
Dalle Grave, R., & Calugi, S. (2020). Cognitive behavior therapy for adolescents with eating disorders. New York: Guilford Press.
Fairburn, C. G. (2008). Cognitive behavior therapy and eating disorders. New York: Guilford Press.
Fairburn, C. G. (2013). Overcoming binge eating, Second Edition. New York: Guilford Press.
National Guideline Alliance. (2017). Eating disorders: Recognition and treatment. London: National Institute for Health and Care Excellence (UK); 2017 May. (NICE Guideline, No. 69.) London.
1)Wildes, J., & Marcus, M. (2015). Application of the Research Domain Criteria (RDoC) framework to eating disorders: Emerging concepts and research. Current Psychiatry Reports, 17.
Wildes, J., & Marcus, M. (2013). Incorporating dimensions into the classificati
What Is Anorexia Nervosa? Symptoms, Causes, Diagnosis, Treatment, and Prevention By Julie MarksMedically Reviewed by Allison Young, MD Last Updated: March 18, 2021
What Is Bulimia? Symptoms, Causes, Diagnosis, Treatment, and Prevention. By Julie Marks Medically Reviewed by Allison Young, MD Last Updated: October 13, 2020
What Are Eating Disorders? Symptoms, Causes, Diagnosis, Treatment, and Prevention.By Nuna Alberts, LCSW Medically Reviewed by Allison Young, MD Last Updated: April 20, 2021

谷禾健康
饮食的改变会改变人体的微生物群,对健康造成潜在的影响。根据以往的研究,饮食驱动的微生物群变化不仅可以导致失调,还可以塑造生活史特征,推动人类进化。考虑到环境、健康和进化是相互关联的,那么饮食驱动的微生物群干扰是否会产生超出其对人类健康直接影响的后果?
最近德国科学家指出,饮食结构的变化会导致微生物组宿主基因配置不匹配,从而影响人类的寿命和繁殖成功。 这些失配也可引起可遗传的全功能体(holobiont)应激反应,这促使全生命周期在变化的营养环境中重新建立平衡。
该研究介绍一个前瞻性的模型,其中的微生物组在现代人类适应环境变化中发挥作用。假设饮食变化重新配置了整合人类微生物群中表观遗传控制的平衡健康状态。这种重新配置是一把双刃剑。一方面,它可能通过调节完整生物的生命史特征(如寿命和繁殖)的表达而增加疾病的风险和严重性。另一方面,它有助于重新调整全功能体(holobiont)系统与新的营养环境,利用宿主基因和微生物组之间的不匹配产生的压力。
简单笼统的说,就是该机制框架将两个迄今联系不充分的辩论联系起来:全球气候变化对饮食的影响,以及微生物组,表观基因组和宿主之间的复杂关系。
这些假设的动态不必只与正在进行的气候变化相耦合,也不必只适用于人类全息生物。相反,微生物群-表观基因组-免疫轴中的类似动力学可能是对过去非人为气候变化的反应,并对我们和其他物种的进化轨迹作出了贡献。
气候变化可以通过多种途径影响人类健康。到目前为止,关于气候变化对人类健康的影响的公众关注和科学研究主要集中在气候灾难(例如洪水,热浪和流行病)产生的CO2排放和健康风险上。尽管仍然相对罕见,但随着气候变化,这些灾难预计会变得更加频繁和严重。
在这些事件中暴露于危险条件的风险很高,幸存者可能会遭受长期的健康危机(例如,运动功能丧失)的困扰。随着时间的推移,这些风险会积累。饮食就是其中一种途径。
气候变化和经济发展压力会影响许多影响人类饮食的因素,包括作物产量,耕作方式和饮食习惯。农作物的生产耕作以及烹饪方式可能在正在改变以适应人类的饮食习惯。 气候变化,对饮食有明显影响。 例如,对玻利维亚八个Aymara社区的案例研究发现,农民在介绍他们认为更坚固的农作物的同时,种植了他们认为更易受气候影响的作物,例如块茎旱金莲(一种不一样的土豆)。
饮食变化对人类健康和进化有何后果? 虽然气候变化与饮食之间的联系在文献中可能已经很好地确立,但饮食变化转化为健康后果并帮助产生新的表型性状的机制仍需要阐明。
饮食摄入可能通过影响寄主的表观遗传学和寄主的微生物组而影响健康。 此外,宿主与微生物组之间存在复杂的表观遗传关系,表观遗传现象可能会影响进化。
在此基础上,德国科学家Francesco Catania和Jan Baedke提出了一个模型,该模型考虑了表观遗传机制与人类微生物组之间的相互作用以及它们与宿主遗传学的串扰。 并且认为,将人类概念化为灵活的生态系统或整体生物可能有助于揭示与饮食有关的变化对人类健康的某些后果,并提供对人类后代的预测历史特征和适应能力。
在该模型中,气候变化引起的饮食变化会通过营养不良增加健康风险。 同时,这些过程促使微生物组重新配置,从而触发跨代对环境变化的适应性反应。 作为实现这些短期和长期影响的关键途径,我们确定了微生物组-表观基因组-免疫轴。
饮食、人类健康和表观遗传学饮食对人类健康有重大影响。不同的饮食和饮食模式可以调节个体间的变异性(例如,增加心血管疾病的风险)。饮食有助于出生体重,这是婴儿和儿童健康以及成人疾病易感性的主要预测因素。饮食也会影响寿命和繁殖。例如‘饮食限制’,在不饥饿的情况下减少食物摄入量可以上调应激反应和先天免疫的相关途径,下调不同物种间生长和繁殖的相关途径。
饮食也可以有长期的影响,代际后果。由于营养不良(即营养过剩或营养不足)导致免疫状态受损的父母的后代本身也经常受到免疫系统的干扰。
此外,为了应对父母饮食能量的增加,后代表现出较高的促炎性和抑制的抗炎性。然而,在某些条件下,饮食的改变也可能对后代的健康产生相反的积极影响。在一个例子中,一组瑞典北部人的孙子孙女经历了几代人的作物短缺器,他们的死亡率和心血管疾病的风险较低,与前几代人相比,这些研究中的一些暗示了饮食对人类健康影响的表观遗传机制。
近年来,微生物组群已成为环境因素(如营养模式)与人类健康之间的一个新中介。人类微生物群包括定植于人类皮肤、胎盘、子宫、精液、肺、唾液、口腔粘膜、结膜,尤其是胃肠道的所有细菌、古细菌、真菌、原生生物和病毒。如果我们将人类视为一个完整的生态系统及其微生物群。那么,微生物群提供了大量的生态系统服务。通过生态系统服务,刺激免疫系统并塑造其发育,有助于神经系统的发育和功能,微量营养素的合成,营养素的消化和吸收,以及能量调节。
这些生态系统服务的可靠性取决于宿主与其微生物组之间的有效串扰,而这种串扰受饮食模式的影响。因此,根据最近的建议,气候变化引起的饮食或生活方式的改变也可能影响宿主的健康状况。
事实上,人类健康状况的变化肠道微生物群(例如,由于在食品生产中越来越多地使用抗生素)与各种疾病的发生和发展有关,如自身免疫疾病,癌症,代谢紊乱和精神障碍,如抑郁症,通过所谓的“肠-脑轴”。然而,这种关系的分子基础以及表型与微生物组的组成和丰度之间联系的范围和强度仍然不清楚。
已经提出了微生物群建立、稳定性和跨代传播的多种进化和生态模型。人类宿主与其驻留微生物群之间的广泛串扰表明它们已经共同进化或可能已经共同适应,即人类微生物群已经与宿主共同进化,适应人类生态系统并发展互利。与此观点一致,在人类生态系统中只有一小部分已知细菌菌群存在 。整体全息图关联也可能反映了一种单方面的适应过程(例如,宿主已适应其微生物,但微生物未适应其宿主)。
但是如何实现微生物组与人类宿主之间的共同进化或单方面的适应或共同适应?
这个问题对于理解饮食对人类健康和进化的影响至关重要。共进化意味着微生物组必须世代遗传和/或忠实获得。但是这是怎么做到的呢?
微生物群的构型在生命的早期就受到很大影响。在成年人中,微生物群保持一定程度的灵活性,这种灵活性可能在一定程度上受到环境条件和因素的调节,如宿主的遗传背景、行为和生活方式、性别和年龄。因此,微生物组分的跨代复发至少在一定程度上依赖于生命早期展开的生物过程。
在人类中,母体环境似乎有助于婴儿肠道的细菌定植。然而,这种母体贡献是部分的,因此不足以保证类似于遗传信息的可靠传播。稳定的(环境遗传的)文化和行为模式可以弥补宿主-微生物群关系的跨代稳定性不足。 例如,稳定的喂养方式,分娩方式和卫生习惯中的文化模式会导致婴儿期相似的微生物连续定居。 与其他动物一样,社会互动和网络可能会打开微生物传播的渠道。
最后,宿主遗传学也可能在微生物组(尤其是肠道)的获取,维持和稳定中发挥重要作用。 基因决定的免疫特性,连同微生物细胞之间的竞争,可能有助于调节和维持给定生态位空间中微生物种群的适当组成和水平。总之,垂直和水平传播以及宿主基因有助于微生物组的跨代稳定性。
宿主表观基因组对微生物定殖的贡献与将表观遗传变化(如DNA甲基化、组蛋白修饰、非编码RNA的调控)与微生物群定殖和功能性联系起来的研究一致。这也与研究改变微生物群表观遗传修饰的报告一致与疾病的发生有关。
宿主表观基因组既可以形成,也可以由获得的微生物群形成。获得的微生物群可以影响宿主的食欲、摄食行为和食物选择,进而影响基因调节和调节免疫反应。
因此,建议微生物群不仅可以通过各种模式和渠道稳定地传播和获取。 它也可以重塑宿主表观基因组。 这种表观遗传重塑会影响后代的发育,从而有效地将当前的环境变化(如饮食变化)与宿主的发育,代谢和免疫过程的未来变化联系起来。
表观和微生物组重塑的这种相互过程可能会在各个世代之间展开,直到整个全功能系统达到平衡状态(宿主-微生物组匹配)为止。

全功能生物的微生物群-表观基因组-免疫轴。(1) 气候变化改变了人类的饮食。(2) 与气候变化相关的饮食变化会影响微生物组(例如,影响微生物多样性、成分或代谢物)、宿主的表观基因组(例如,通过摄入改变基因表达的化合物)和宿主免疫系统(例如,营养不足可延迟对病原体的免疫反应)。(3) 在人体内,微生物群、宿主表观基因组和宿主免疫系统之间的相互作用是广泛而动态的。宿主DNA和环境会影响这种串扰(例如,表观遗传因素标志着微生物定殖的宿主生态位,这一过程也由免疫系统决定)。饮食介导的效应可以使微生物组、表观基因组和免疫系统之间的关系失去平衡,并在世代内和世代间对全息生物特性产生影响。(4) 同时,人类全息生物通过潜在的下游反馈积极地改变其环境(例如,通过文化生态位构建)
扩展上述命题,假设微生物物种的优势和复发及其在人类中的功能部分反映了可以跨代传递生态信息的保守的表观遗传调控过程。这些表观遗传过程可直接(例如,通过生态位特异性基因调控)和/或间接(例如,通过免疫系统的可塑性选择性)指导宿主的微生物定殖。
进一步假设“微生物组表观基因组免疫轴”对与气候变化相关的饮食、饮食习惯和压力相关的营养变化敏感。充分的饮食改变改变了宿主的表观基因组,进而改变了宿主的微生物组。同时,它们影响微生物的定殖过程,并通过这一过程影响宿主的表观基因组。这些动态变化在宿主的基因组成和非基因成分之间产生了不同程度的不匹配,从而产生了两个关键效应和权衡。
首先,全功能体内的生态系统服务可能被破坏,有害表型可能出现。这与通常提出的异常肠道菌群组成与肥胖症、炎症性肠病、和其他疾病之间的联系一致。然而,改变常驻或定植微生物群,如抗生素使用、饮食变化和人为影响也可能产生非疾病表型。
先前的研究表明,一方面,完整生物环境(即导致微生物组分和代谢能力失衡的环境)与生命早期先天免疫系统活性降低以及生命后期适应性免疫系统(AIS)的过度刺激有关。AIS过度刺激可能会增强免疫失火,从而促进自身免疫疾病的发生。
另一方面,AIS过度刺激可能会增强全功能体生物的防御机制,这种机制通常会随着年龄的增长而恶化,从而延长生物的寿命。AIS过度刺激导致的增强的免疫失火预计会降低妊娠至足月的几率。例如,自身免疫性疾病系统性红斑狼疮增加了妊娠丢失、临产前分娩和胎盘功能不全的风险。因此,在增加疾病的风险,饮食相关的改变也可能延长寿命,降低人类的生育成功率。
其次,宿主的基因组成与其微生物组之间的不匹配可能会产生生物内部的压力,这可能会对生物的组成部分施加不同程度的压力。这种压力类似于在宿主-病原体相互作用中或在本地物种和入侵物种之间的生物入侵过程中出现的压力。例如,宿主-微生物组错配可能会触发不期望的免疫反应,从而削弱宿主,同时在本地(即共同进化的)微生物组分受到破坏后,为定植创造生态位空间。因此,这种不匹配代表了获得适应性变化的第一步。
要理解这一进化过程,首先必须注意的是,寄主的基因组成和微生物群之间的不匹配可以由后代遗传。更具体地说,完整生物的表观基因组可能通过表观遗传修饰的直接传递或表观遗传标记的从头诱导从母亲传给胎儿。这些反复出现的表观遗传模式有利于后代完整生物中亲本微生物组群的重新配置。这意味着患有自身免疫性疾病的个体的后代可能通过非基因遗传表现出相同的特征。与此相一致的是,具有适度遗传力和共同环境风险因素的自身免疫性疾病通常会跨代复发。该模型的一个含义是,人类父母和后代寿命之间的正相关部分反映了跨代表观遗传,与先前的观察和其他物种的发现一致。
与上一代相比,根据宿主基因(其中一半遗传自母亲,另一半遗传自父亲)和环境(可能相对恒定或世代不同)之间的不匹配程度,后代完整生物反复出现的生理或免疫反应可能减弱或加剧。
在一个基本不变的环境中,表型性状的代际转换可能是有方向的,并趋向于局部最优。或者,当环境不断变化时,代际转换可能是波动和不规则的。最简单的情况是,代际环境基本不变,遗传变异性很小,全生命体内的压力有助于恢复生命史特征之间的失调前关系(即,生殖成功率的增加以寿命为代价)。
更一般地说,我们假设,人口的平均适合度有一种自然趋势,即在健康平衡中断时反弹(下图)。类似的动态也与“辅助基因流”有关,通过这种做法,合适的基因型被重新定位,以帮助当地人口跟上气候变化的步伐。这种非当地基因型的重新定位可能会导致繁殖抑制,从而降低人口相对于亲本人口的平均适应度。然而,这种健康状况的下降通常是暂时的。当地人口在几代之内恢复,可能获得比引进移民基因型之前更高的平均适应值。

整体人的健康和适应饮食变化的适应能力。 饮食变化会触发宿主微生物组失配,从而扰乱整个节肢动物(例如,在宿主体内触发不良的免疫反应),同时促进其适应性反应(例如,通过为新型微生物定殖创造适当的空间)。 箭头描绘了由于气候变化引起的饮食转变而引发的人类全生命周期的进化轨迹。 在第一阶段(红色箭头)描述了与饮食变化相关的整体全息内应力。 在这里,整体人面临着疾病的易感性,例如过敏性和自身免疫性疾病,这些疾病可能是表观遗传的。 在这种不稳定的健康状态下,整体类人承受着促进获得微生物,遗传和非遗传变异的压力,最终使整体类人达到了新的平衡(绿色箭头)
影响表型状态遗传的表观遗传机制有助于在新环境中建立最佳适应度。除此之外,还可能发生重新建立宿主-微生物和谐关系的基因变化。免疫、生殖和寿命相关的宿主基因是上述许多可塑性的基础。因此,这些基因的变化有助于重建生态失调前的宿主-微生物平衡。事实上,这些基因在人类适应中起着重要作用,是最常见的候选选择目标之一。
遗传变化也可能在全功能体生物的微生物成分中积累。应激诱导的突变提高了微生物的突变率,加速了有益基因变体的出现。此外,微生物组对应激(暴露于有毒物质)的快速适应和抗性细菌的选择可能使宿主的后代产生更高的毒性耐受性。这可能通过不同的微生物传播途径遗传。最后,微生物组对新饮食的适应可能解释了人类食用海藻的原因,]奶牛的草食进化,吸血蝙蝠的嗜血性。例如,有人认为,应对吸血蝙蝠新饮食所需的形态、免疫和生理适应的很大一部分并不是由于宿主的基因组适应,而是由普通蝙蝠功能核心微生物群中基因的正选择驱动的。因此,由于微生物组的适应性变化,全功能体生物可能进化出适应营养挑战的解决方案。宿主基因组的适应性变化可能伴随也可能不伴随微生物组的重组。
总而言之,与饮食相关的生物体内应激可能会促进宿主和微生物群的遗传和非遗传变化,这些变化可能会传染给下一代。虽然这些变化可能会增加疾病易感性,但也可能有助于重新调整宿主和微生物群的利益。宿主与其微生物群之间重新建立的和谐串扰(如果实现)表明了全息生物在新环境中的最佳综合性能。
除了对全基因组方法的扩展之外,该模型还提供了“健康”或“有利”微生物组的操作定义,即微生物联合体,不仅与宿主的生活方式、社会文化和环境环境相协调,而且在很大程度上,以及它的遗传背景。这些联盟不需要由固定物种组成。由于相当多的代谢冗余,具有相同功能的基因分布在许多细菌物种中。这使得一个“健康”的肠道微生物组群能够以多种不同的方式组合起来,并允许在宿主世代间丢失或重新发现微生物类群。这一定义有助于实施“精确”肠道微生物组群调节的最佳治疗策略。
微生物组通常被认为是许多慢性疾病(如自身免疫疾病)治疗干预的有效靶点,前提是改变的微生物组与某种疾病有因果联系,目前减轻与局部疾病相关的健康挑战的医疗干预形式有可能减轻或抑制生物体内的压力。
在该模型支持下,意味着医疗干预也延迟了潜在适应性变异的出现。基于医学干预放松了对疾病相关基因变异的自然选择这一观点,先前也得出了质量上类似的结论。最后,如果模型是正确的,目前未能解释表观遗传微生物背景和代际影响阻碍了我们对许多疾病的理解。通常与癌症等风险增加相关的特定基因变异,只有在与相关(微)环境因素相结合的情况下才可能是重要的。
到目前为止,很少有生物学家认为发育中有机体的微生物群是有偏见和快速适应性变异的潜在来源,尤其是在人类中。
该研究提出的大视野,跨时空观点需要理解全功能生物体既是一个免疫个体,也是一个进化个体。
为了研究这两者之间的复杂纠缠。首先需要掌握人类微生物变异的限度和范围,了解在环境变化面前(肠道)微生物群落的重组是如何广泛和迅速的。
第二个挑战是了解人类群体之间和内部肠道微生物变异性的差异是否会导致对气候变化相关营养挑战的不同健康和进化反应。
最后,为患者量身定制的医疗应用程序的开发不应将人类个体视为与气候变化相关的健康干预措施的唯一目标。相反,全功能生物体的集体应被视为潜在患者。它复杂的内部关系、串扰和权衡需要成为人们关注的焦点。
相关阅读:
参考文献:
Tomova, A., Bukovsky, I., Rembert, E., Yonas, W., Alwarith, J., Barnard, N. D., & Kahleova, H. (2019). The effects of vegetarian and vegan diets on gut microbiota. Frontiers Nutrition 6, 47
Meldrum, G., Mijatović, D., Rojas, W., Flores, J., Pinto, M., Mamani, G., Condori, E., Hilaquita, D., Gruberg, H., & Padulosi, S. (2018). Climate change and crop diversity: Farmers’ perceptions and adaptation on the Bolivian Altiplano. Environment, Development and Sustainability, 20(2), 703– 730.
Lynch, J. B., & Hsiao, E. Y. (2019). Microbiomes as sources of emergent host phenotypes. Science, 365(6460), 1405– 1409.
Catania Francesco,Baedke Jan,Fábregas-Tejeda Alejandro et al. Global climate change, diet, and the complex relationship between human host and microbiome: Towards an integrated picture.[J] .Bioessays, 2021.
Deutsch, C. A., Tewksbury, J. J., Tigchelaar, M., Battisti, D. S., Merrill, S. C., Huey, R. B., & Naylor, R. L. (2018). Increase in crop losses to insect pests in a warming climate. Science, 361(6405), 916– 919.

谷禾健康


看过往期文章的小伙伴都知道,人体微生物群维持体内的共生关系,促进新陈代谢功能,抵御病原体,训练和发展免疫系统,直接或间接影响我们的大部分生理功能。
每个人都拥有属于自己的独特的微生物组,人与人之间这种显著的个体差异性是疾病易感性差异的潜在来源。
基因是从出生开始确定了,很大程度上伴随着人的一生,微生物组是否也是遗传决定的呢?
2018年的研究显示,家庭中的遗传血统或单个多态性变体在肠道微生物组组成中的作用很小(<2%),而微生物组多样性中超过20%的变异可以从共享的环境因素中推断出来,例如与饮食和生活方式。可见环境是影响微生物组的重要因素。
那么:
影响微生物组环境因素包括哪些?
环境如何对人类微生物组产生影响?
环境如何通过微生物组影响人的健康?
环境对人类微生物组的影响研究会有哪些挑战?
这对理解非传染性疾病的微生物基础带来哪些启示?
本文我们来详细阐述以上问题。
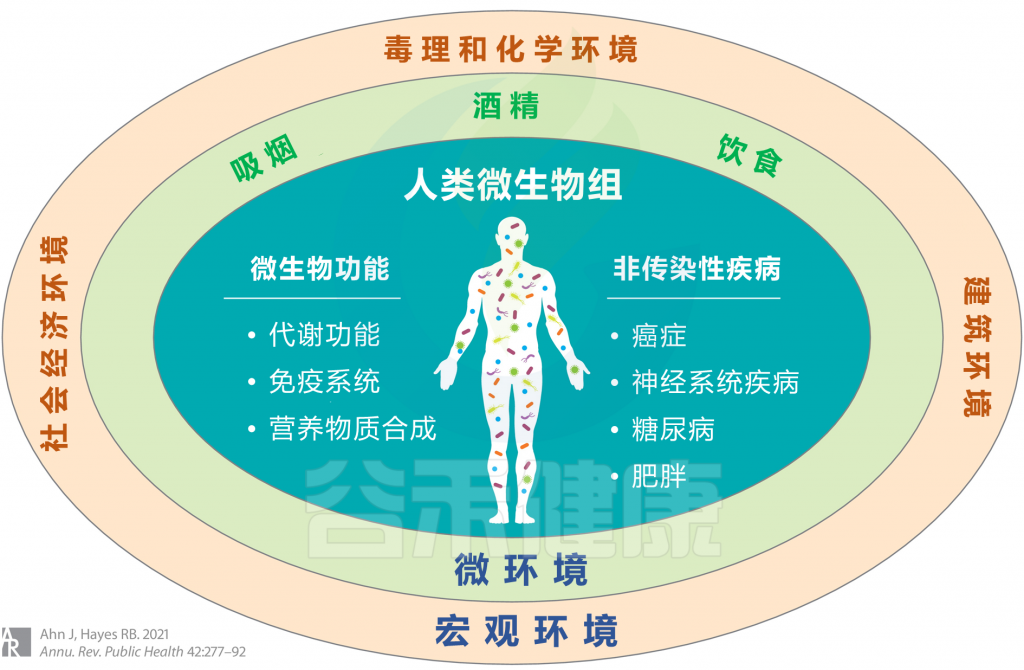
<从广义上考虑环境,涉及宏观环境和微环境,并考虑个人行为,包括吸烟,饮酒和饮食摄入等>

口腔消化道癌症
微生物诱发了至少60%的人类口腔消化道癌症,这表明控制微生物相关过程在预防和治疗口腔消化道癌症方面具有巨大的潜力。
流行病学研究一致报告口腔疾病与口腔消化道癌症(包括头颈部、食道癌、胃癌和胰腺癌)风险之间的联系。由于口腔疾病具有重要的微生物基础,这些观察导致了口腔微生物组与口消化癌的发生有关的假设。
基于大量人群的队列研究中的病例对照研究发现,用漱口水样本评估的诊断前口腔微生物组与随后发生的头颈部、食道和胰腺消化道癌症的相关。一些研究也明确指出了肠道微生物组梭菌属Fusobacterium和其他菌群与结肠癌之间的联系,以及肠道微生物组与炎症性肠病和结直肠腺瘤之间的联系。
微生物来源的信号通过不同的机制调节癌症的许多特征。一般来说,细菌不能直接诱发癌症;这一过程通常伴随着慢性炎症,并需要致癌信号通路的独立突变。
进一步的研究表明,微生物组与宿主之间的交互作用通过调节肿瘤微环境中的先天和适应性免疫功能,对口腔消化道肿瘤发生至关重要。
细菌-癌症模型提出,革兰氏阴性细菌促进致癌作用,因为脂多糖细菌外膜通过Toll样模式识别受体为先天免疫系统反应提供免疫原性刺激,导致由核转录因子NF-κB原瘤细胞因子释放、免疫细胞募集和活性氧释放引起的基因突变。
因此,微生物在形成肿瘤免疫微环境中的作用在癌症的发病机制中具有重要的潜在意义,特别是在口腔消化道。
神经系统疾病
肠道和中枢神经系统通过肠-脑轴相互作用,调节中枢神经系统功能,包括情感行为、认知表现、疲劳和睡眠。
研究表明,肠道微生物组通过影响肠-脑轴,可能在某些神经精神和神经发育障碍中发挥作用,改变行为,并可能影响神经系统障碍的发作和/或严重程度。
无菌小鼠和用抗生素治疗的小鼠表现出大量的神经免疫功能障碍和行为缺陷。主要在临床前模型中,肠道微生物组与大脑障碍有关,包括焦虑、抑郁、癫痫以及自闭症谱系障碍。
在人类中,胃肠道病理和神经精神疾病之间相互作用的证据已经在焦虑、抑郁和自闭症等情况中报告;然而,因果关系仍未得到证实。
揭示微生物组介导肠-脑连接的机制可能为靶向治疗肠道提供新的机会,以预防和治疗神经疾病。
糖尿病
大量的文献已经为肠道菌群在糖尿病前期和2型糖尿病病因学中的作用提供了证据。一份2020年的综述总结了40多项已发表的人类研究。
例如,在糖尿病前期研究中发现,基于肠道微生物群、炎症和免疫标志物的分子特征预测了2型糖尿病的发病。
两项开创性研究发现,2型糖尿病患者和非糖尿病对照组的肠道微生物组不同。
随后一项研究表明,2型糖尿病患者的肠道微生物群介导了用于控制糖尿病的二甲双胍的治疗效果。

还有研究人员开发了个性化饮食以优化2型糖尿病患者的血糖水平,同时考虑了个性化饮食习惯、体育活动和肠道微生物群。研究人员随后在一项盲法随机对照饮食干预试验中表明,应用这种算法可以改善餐后血糖反应。
目前面临的挑战是搞清楚,具体精确到哪些肠道微生物组组成部分,能驱动异质性、多因素、多器官疾病。
肥 胖
肥胖在全球范围内日益流行,导致过早死亡和许多慢性非传染性疾病。虽然肥胖的根本原因是能量摄入和输出之间的不平衡,但肠道微生物组成是导致体重增加的公认因素,当然还有其他机制,如遗传变异和表观遗传调节。


从野生型小鼠、肥胖小鼠或肥胖人类转移到无菌小鼠的肠道菌群实验表明,在该试验系统中,肠道菌群在体重增加和肥胖中起着关键作用,与肥胖表型的建立有关。这些实验结果引出了这样一个问题:
肠道的微生物组成是否会影响人类体重增加(无论是基因决定的还是饮食诱导的)?
一份早期的小规模人类样本报告与小鼠的研究结果一致,即肥胖状态与厚壁菌门(Firmicutes)的相对丰度增加和拟杆菌门(Bacteroidetes)的相对丰度减少有关。
然而,对人类的研究并没有证实这一特定模式:一些研究发现拟杆菌门(Bacteroidetes)的减少(但没有发现厚壁菌门(Firmicutes)的增加)与肥胖有关,而另一些研究则发现相反或未发现这两种门水平与体重指数(BMI)有关。
此外,研究已经确定了与BMI或肥胖相关的不同属和种水平的分类群。
点击此处查看 体重增长:目前为止我们所知道的一切
未来在动物模型和人类中的下游实验可以确定这些候选菌群是否在肥胖的病因学中起作用,如果是,建议干预肥胖的预防和治疗。
目前也有通过各种治疗方法(如益生菌、益生元、抗生素)改变菌群的潜力,微生物组是预防和治疗肥胖的一个不错的方式。


宏观环境
——毒理和化学环境
在人体中,消化道和呼吸系统是环境毒物进入和加工的主要途径。在这些器官系统中,人类微生物组丰富的代谢系统具有强大的转化外来生物化学物质的能力,有时与宿主的生物转化模式相反。
宿主代谢酶的典型特征是氧化和结合排泄,而微生物的酶反应主要是还原、水解和去甲基化,生成碳源进一步生长和分裂。
环境砷形态与心血管疾病和其他健康影响有关;证据表明,口腔消化道微生物组的甲基化能力可能会影响这些毒性。
肠道乳酸菌Lactobacillus对金属(如镉和铅)的固定化可能会影响金属毒性,降低重金属积累。
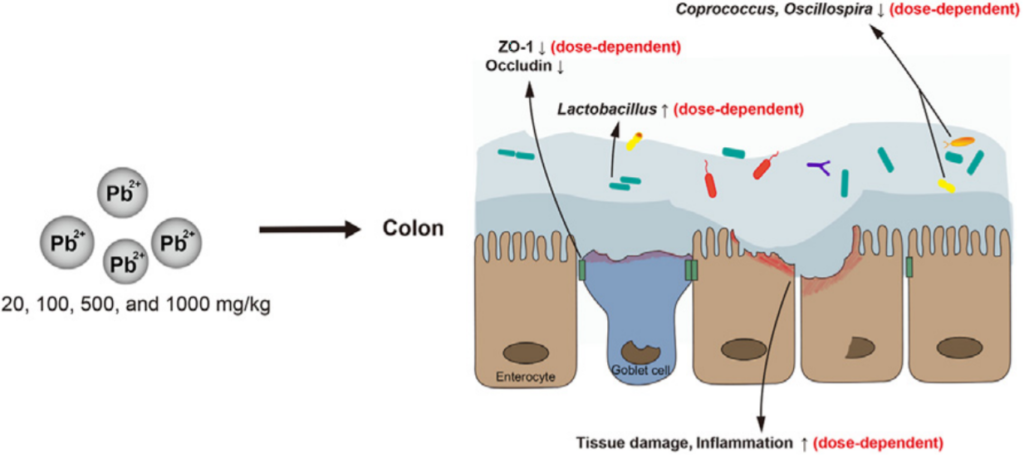
Yu.Let al., chemosphere2020
某些肠道细菌表达偶氮还原酶来代谢潜在致突变的偶氮化合物。个人护理产品中对环境具有持久性的化学物质,如三氯卡班(TCC)和三氯生(TCS)普遍存在,并与啮齿类动物微生物群的潜在变化有关。
肠道微生物群对化学物质(包括内分泌干扰物)的代谢会伴随微生物的失调:改变微生物群落结构,诱导特定细菌基因,改变微生物分子转化。此外,内分泌干扰物可以被吸收并运输到肝脏,然后被结合并通过胆汁分泌排泄回肠道,进一步进行微生物代谢。
酶如偶氮还原酶、酯酶、甲基酶、硫代还原酶、脂肪酶、硝基还原酶、β-葡萄糖醛酸苷酶、硫酸盐酶和β-裂解酶也参与环境化学物质的微生物代谢。
——建筑环境与新兴假说
建筑环境包括人类建造的所有建筑,包括家、工作场所、学校、车辆等。研究人员认识到许多微生物病原体可能存在于建筑环境中。
例如,细菌病原体,如结核分枝杆菌;真菌病原体,如烟曲霉菌Aspergillus fumigatus;致病性病毒,如鼻病毒和流感病毒,以及SARS-CoV-2冠状病毒等,均可通过在建筑环境中直接吸入传播。其他病原体,如艰难梭菌和粪肠球菌,以及诺如病毒和流感病毒,可通过皮肤或黏液接触传播给人,原因是病菌从表面传播。
除了直接的微生物传播,建筑环境中的微生物代谢产物也可能涉及人类健康,包括细菌和真菌毒素、细胞壁的致敏成分和微生物衍生的挥发性有机化合物。
室内空气和表面与灰尘和微生物化学产物有关。环境中相对湿度的增加导致灰尘和表面微生物代谢物的增加。室内潮湿和发霉条件(例如,可见的霉菌和霉菌气味)与许多不同的疾病状态有关,但建筑环境中微生物及其代谢产物的组成和浓度与疾病之间的联系仍然难以捉摸。

通过靶向细菌16S rRNA测序和宏基因组测序的应用,研究人员对建筑环境微生物生态的复杂性有了更全面的认识,包括可培养和非培养因子的多样性。认识到环境样品中微生物DNA序列的组成可能是由大量的不可活残留物组成的,环境微生物相关DNA表现出丰富的复杂性,反映了人类微生物来源,室内建造环境和人类来源的微生物来源之间的关系特别强。
卫生假说认为,卫生条件的改善可能与自身免疫性疾病的增多有关,这一概念也适用于有益菌暴露的概念。
研究人员研究了人类微生物组和建筑环境微生物组之间的相关关系,重点关注家庭环境,并绘制居住者和他们的家庭之间的细菌共享。这项调查表明,与表面有关的大多数细菌有很大的可能来自该住宅的居住者。暴露于室内灰尘中的复杂微生物群与患哮喘的可能性呈负相关。在另一项研究中,与没有接触到农业环境的儿童相比,接触到农场附近家庭灰尘并在农场积极参与工作的儿童患哮喘的风险有统计学上显著降低。

总之,越来越多的证据表明,建筑环境、微生物群和健康之间存在相互关系,但要了解建筑环境中微生物的生态和进化与人类健康之间的关系,还需要做大量的工作。
其他与建筑环境有关的著名假说也出现了。其中一个在文献中越来越流行的假说是野化假说,该假说认为,改变城市绿地使其恢复到更自然的状态,有可能改变环境中的微生物群,进而改变人类微生物群。对人和动物的研究表明,野化可能会影响微生物组和宿主的免疫反应。
除其他环境因素外,2018年的研究表明,吸入颗粒物空气污染会改变肠道微生物组的组成。
此外,日光暴露可以调节家庭灰尘细菌群落,这也可能表明阳光和紫外线辐射影响人体微生物群落组成,例如皮肤上的细菌群落。
微生物在皮肤老化中的作用模式
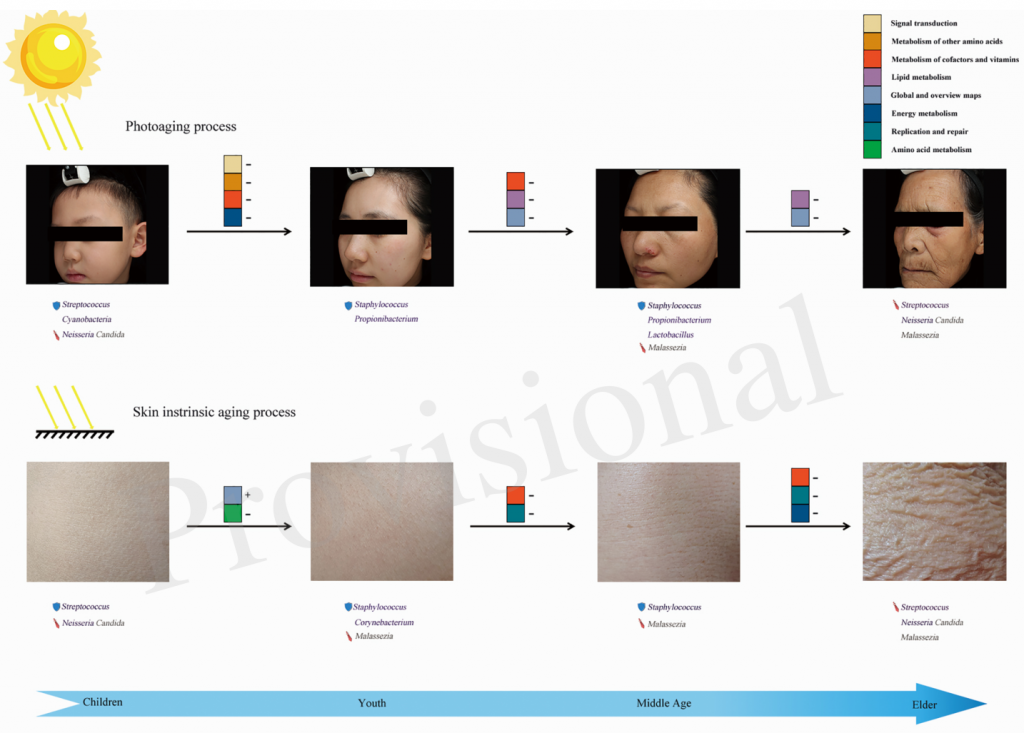

Li Zichao,et al., Front Microbiol, 2020
气候变化和极端高温也可能引发生理变化,可能有利于周围环境、食物或体内的某些微生物群。
此外,在应对将大量微生物菌群与无数已建立和新出现的暴露物结合起来的挑战时,将细菌宏基因组与环境暴露物结合起来的无针对性评估和发现可能是前瞻性研究议程的一部分。
——社会经济环境
较低的社会经济地位与多种与健康有关的行为有关,如获得医疗和牙科护理的机会减少,增加参与不健康行为(如吸烟和酒精依赖),减少对积极健康行为(如健康饮食和锻炼)的参与。低社会经济地位与较高的发病率和死亡率以及其他一些健康状况如肥胖、糖尿病和癌症的高发病率相关。
微生物群在调节社会经济地位和健康之间关系中的作用正在研究中。许多与低社会经济地位社区和生活方式相关的特征(例如,加工食品、久坐的生活方式、社会心理压力、暴露于污染物和内分泌干扰物)也与肠道微生物多样性减少有关。


研究已经检验了高社会经济地位和低社会经济地位群体之间微生物组成的差异。在美国,较高的社会经济地位与肠道微生物群中特定微生物的α多样性和种群丰度相关。
更好地理解微生物组在社会经济地位相关疾病易感性中的中介关系需要综合研究,包括调查社区和个人水平的暴露。建筑环境是考虑的一个部分。
微环境
——吸烟
香烟烟雾是大量有毒物质的来源,直接接触口腔和上呼吸道的细菌;这些毒物可以通过抗生素作用、缺氧或其他潜在机制扰乱微生物生态。由于吸烟而失去有益的口腔菌群可导致病原体定植并最终导致疾病;吸烟在微生物依赖性牙周炎的发病和发展过程中所起的既定作用有力地支持了这一论点。

实验室调查发现,与从不吸烟的人(变形菌门11.7%)相比,吸烟人群口腔微生物组的总体多样性降低,变形菌门的相对丰度降低(4.6%) (FDR q = 5.2×10−7)。
当前吸烟者体内三羧酸(TCA)循环和氧化磷酸化等微生物有氧代谢途径相关基因的丰度降低,糖酵解等非氧碳水化合物代谢途径的丰度增加。
当前吸烟者所消耗的其他途径包括与甲苯、一硝基甲苯、苯乙烯、氯环己烷和氯苯降解有关的某些外来生物降解途径以及细胞色素P450的外来生物代谢。相反,多环芳烃(PAH)和二甲苯降解在当前吸烟者中富集。这些化学物质是香烟烟雾的组成部分,因此口腔菌群降解这些物质的能力的改变可能会对宿主产生毒性后果。
除了创造一个厌氧、酸性和/或选择性有毒的环境,吸烟还被认为对人体免疫有显著的影响,这反过来可以影响宿主阻止病原体殖民的能力。
总之,越来越多的证据表明:
吸烟影响口腔微生物群的整体组成和许多种群丰度;吸烟可促进厌氧口腔环境和具有减少的异种生物降解能力的菌群。
观察性和介入性研究也提示吸烟者肠道微生物组的多样性降低,总的来说,变形菌门、拟杆菌门和梭菌属、拟杆菌属、普雷沃氏菌属呈上升趋势,放线菌门、厚壁菌门和双歧杆菌属、乳球菌属呈下降趋势。
可能解释吸烟对肠道微生物组影响的机制包括氧化应激增强、肠道紧密连接和肠道粘蛋白组成的改变以及酸碱平衡的改变。一些吸烟引起的肠道微生物组改变类似于炎症性肠病和肥胖等情况下的改变。应该进行进一步的研究来研究这种联系。吸烟会影响肠道微生物群,建议改变其组成。吸烟和肠道微生物组之间的相互作用可能有助于肠道和全身疾病的发展。
——酒精
酒精摄入可能通过几种方式影响人体口腔微生物群:
首先,口腔细菌和真菌将酒精和膳食糖代谢成致癌的乙醛,与香烟烟雾冷凝液相互作用,产生致癌的亚硝胺,并在实验上促进口腔癌变。无论是在体内还是体外,在吸烟者中,口腔微生物群有更强大的能力从乙醇中产生乙醛。
体外和动物实验也指出了口腔微生物群参与口腔癌变的可能机制,包括抑制细胞凋亡,激活细胞增殖,促进细胞侵袭,诱导慢性炎症,以及口腔多菌群中细菌和真菌的合作。
第二,酒精可能对细菌产生直接的细胞毒性作用。动物研究表明,摄入20%的酒精会增加变形链球菌Streptococcus mutans的定植,并显著减少大鼠口腔生物膜中可检测到的细菌种类。

在人类研究,饮用红酒与物种丰度降低以及龈下和龈上菌斑中某些厌氧菌的减少有关,而过量同时使用烟草和酒精与物种丰富度降低以及口腔粘膜生物膜中奈瑟菌Neisseria、Aggregatibacter和梭杆菌Fusobacteria丰度降低有关。
酒精除了直接作用外,还可能通过干扰宿主防御系统间接影响口腔微生物群,从而导致宿主介导的牙周炎。
大量以人群为基础的研究表明,每天至少喝一杯标准饮料会增加牙周炎15-27%的风险,并与糟糕的口腔健康有关。有证据表明,口腔微生物群与口腔健康状况密切相关。
酒精和肠道微生物组的研究主要是在大量饮酒的背景下进行的,酒精可能改变肠道屏障功能,导致肠道渗漏,产生促炎病原微生物产物,并扰乱肝脏代谢途径。
大量饮酒和肝硬化患者的研究表明,拟杆菌门细菌的相对丰度随着变形菌门的增加而降低,肝硬化患者中梭杆菌门的独特增加。
大量饮酒与肠道失调有关,而红酒作为膳食多酚的丰富来源,如果适量饮用,可能有利于改变胃肠道微生物群的组成。红酒多酚能显著增加变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的丰度,而杜松子酒则能显著减少这些细菌门。
——饮食
西方饮食的特点是高脂肪,高糖,大量食用红肉和加工肉类,大量食用精制谷物,而纤维摄入量较低。
许多研究表明,西方饮食与炎症、糖尿病、心血管疾病、肥胖、代谢综合征和癌症有关。而西方饮食有着广泛的生理影响,影响许多不同的细胞类型,如脂肪细胞,免疫细胞和内分泌细胞。
这个饮食习惯也与肠道菌群的变化密切相关,其特征是微生物多样性和物种丰富度降低,厚壁菌门增加,拟杆菌门减少。在属水平上,西方饮食显示双歧杆菌和乳酸菌减少,而肠杆菌增加。
纤维摄入量,是一个诱人的可改变的饮食因素,因为其假定有益的生物效应。一些研究表明,纤维可以预防2型糖尿病、心血管疾病、结肠癌和肥胖等疾病。纤维加速结肠运输,并可能减少结肠上皮细胞暴露于摄入的致癌物质。


此外,纤维经过微生物群发酵,产生短链脂肪酸如丁酸,对结肠能量代谢和上皮细胞增殖至关重要,在小鼠模型中,通过抑制组蛋白去乙酰化酶,显示出肿瘤抑制活性。因此,人们越来越关注膳食纤维对肠道微生物组成的影响,这可能最终影响一个人患癌症和其他疾病的风险。
高纤维饮食与更高的胃肠道微生物丰富度和多样性有关,特别是与普氏菌Prevotella和密螺旋体Treponema的丰富度有关,还与炎症信号的减少有关,对肥胖的保护,以及可能减少结肠直肠癌的存在。尽管短期饮食干预试验已经证明,不同数量的纤维摄入量可以在几周内显著改变肠道微生物群的组成,但很少有研究在人类中评估长期摄入纤维的饮食习惯对肠道微生物群的影响。
点此查看 你吃的膳食纤维对你有帮助吗
人类微生物组、健康、环境科学的这三个要素每一个都是复杂的,整合具有挑战。环境因素往往是复杂的;要考虑的环境因素众多,更不用说对微生物组的不断深入了解,难以全面把握外部环境如何在疾病发生率和死亡率中起因果作用。在现实生活中,这些因素通常相互影响,随着时间的推移是动态变化的。
化学毒物经常在混合物中出现,例如,与化妆品和内分泌干扰物的混合物。此外,在整个生命过程中暴露的风险可能随年龄而变化,即易感性窗口。由于这种复杂性,确定直接或间接影响人类健康和疾病的微生物特征仍然具有极大的挑战性。
需要新的方法来充分评价可能影响微生物组和人类健康的现有和尚未确定的因素。前瞻性队列研究是环境和人类健康研究的支柱,特别是因为这项研究设计在建立因果关系的自然时间序列方面很重要,而这在横断面或回顾性研究中往往很难理清。
对粪便样本和人体其他部位样本进行前瞻性收集,以及连续的纵向样本收集也只是在最近才达到一定规模。需要以大量人群为基础的队列,包括不同社会经济地位和地理群体等。

此外,环境和微生物组对健康状况的多维影响,加强了整合其他组学的需要,包括代谢组学、转录组学、基因组学和免疫组学。需要开发相关的数据集成工具和流程。
结语
以上强调了环境中通过影响人类微生物群与非传染性疾病相关的许多因素。必须考虑复杂的相互作用、上游因果因素和多种因果路径。以大数据驱动的技术正为微生物组研究和临床运用带来许多便捷。
随着深入研究,不久的将来我们会对环境,微生物组,健康三者之间的关系有进一步认识,结合公共政策领域,有效地从多方面去实现健康的改善。
相关阅读:
主要参考文献:
Li Zichao,Bai Xiaozhi,Peng Tingwei et al. New Insights Into the Skin Microbial Communities and Skin Aging [J]. Front Microbiol, 2020, 11: 565-549.
Ahn Jiyoung,Hayes Richard B,Environmental Influences on the Human Microbiome and Implications for Noncommunicable Disease [J] .Annu Rev Public Health, 2021, 42: 277-292.
Yu L, Yu Y, Yin R, Duan H, Qu D, Tian F, Narbad A, Chen W, Zhai Q. Dose-dependent effects of lead induced gut injuries: An in vitro and in vivo study. Chemosphere. 2021 Mar, 266: 129-130.
Hayes RB, Ahn J, Fan X, Peters BA, Ma Y, et al. 2018. Association of oral microbiome with risk for incident head and neck squamous cell cancer. JAMA Oncol. 4:358–65
Sampson TR, Mazmanian SK. 2015. Control of brain development, function, and behavior by the microbiome. Cell Host Microbe 17:565–76
Daisley BA, Monachese M, Trinder M, Bisanz JE, Chmiel JA, et al. 2019. Immobilization of cadmium and lead by Lactobacillus rhamnosus GR-1 mitigates apical-to-basolateral heavy metal translocation in a Caco-2 model of the intestinal epithelium. Gut Microbes 10:321–33
Gilbert JA, Stephens B. 2018. Microbiology of the built environment. Nat. Rev. Microbiol. 16:661–70
Rook GAW, Raison CL, Lowry CA. 2014. Microbial ‘old friends’, immunoregulation and socioeconomic status. Clin. Exp. Immunol. 177:1–12

谷禾健康

我们知道,肠道菌群在调节肠道生理中起着不可或缺的作用。最新研究发现,肠道真菌与宿主的健康和疾病有关。
细菌和真菌对免疫系统的作用非常相似,肠道细菌可以影响肠道真菌,如在某些情况下,大肠杆菌的超级感染会增强白色念珠菌的毒力。
肠道真菌不仅会影响肠道功能,还会影响其他重要肠外器官的生理功能,例如肝,肺和脑。
本文阐述了肠道真菌在肠道,肺,肝,肾,胰腺和脑功能调节中的重要性,并提出了将肠道真菌应用于减轻/治疗人类疾病的可能性。
最近,真菌在胎粪中被发现,表明肠道真菌的定植从出生时就开始了。(然而,由于缺乏直接证据和胎粪生物量低,很难忽视环境因素的影响。为了得到更有说服力的结论,迫切需要能够模拟整个妊娠过程的新模型和先进的检测技术。)
在新生儿肠道中,真菌的α多样性从出生到2岁一直持续增加,而β多样性在10天的婴儿中达到峰值。
在10日至3个月大的婴儿中,汉逊德巴利酵母Debaryomyces hansenii和胶红酵母Rhodotorula mucilaginosa是最丰富的真菌,而在1-2年后,肠道真菌群的组成发生了变化,其中酿酒酵母S. cerevisiae成为最丰富的真菌,而念珠菌属Candida spp.开始减少。
此外,在10天至3个月的婴儿中未检出青霉菌,但在1- 2岁的婴儿中可检出。
囊泡菌门Cystofilobasidium sp.子囊菌门Ascomycota sp.和单枝菌门Monographella sp. 仅在1- 2岁中检测到。之后,子囊菌门、接合菌门、担子菌门主导健康肠道真菌群。
念珠菌是人类和其他几种动物胃肠道和其他粘膜表面最普遍和丰富的真菌。
总的来说,肠道真菌的定殖和组成的研究还处于起步阶段。
肠道真菌在新生儿出生后立即在肠道内定居,其组成可能受到分娩方式、出生胎龄、婴儿喂养方式、母亲饮食、环境和宿主遗传等因素的影响。
影响肠道真菌群组成的因素

Wu X et al., Microbiome. 2021
分娩方式和孕妇的益生菌暴露
出生时健康的肠道菌群定植受分娩方式(自然分娩或剖宫产)的影响。自然分娩的婴儿更有可能从产妇生殖道获得真菌(例如白色念珠菌),而剖宫产后出生的婴儿更有可能从产妇的皮肤和周围环境获得真菌。
除了分娩方式外,胎龄和母亲的益生菌暴露量还决定了婴儿肠道菌群的组成。然而,在298对母亲-后代受试者中,婴儿抗生素或母体益生菌的递送和/或使用类型对肠道真菌的操作分类单位(OTUs)的丰度影响很小。这种差异可能源于所分析的样本,因为他们选择的都是参与同一项研究的母亲-子女对。
饮食营养
饮食是决定肠道真菌组成的决定因素之一。甚至有人提出,口腔和饮食中的真菌来源可以解释健康受试者粪便中存在的所有真菌,这表明饮食对肠道真菌组成有很大的影响。
有趣的是,由于西方饮食的脂肪和碳水化合物含量高,具有引发代谢综合症的高风险,并且已经显示出它可以诱导人肠道真菌结构的改变。例如,高脂肪饮食会降低小鼠肠道中S. cerevisiae的丰度。
猪体内梅奇酵母属Metschnikowia、革菌属Tomentella、Loreleia的丰度与短链脂肪酸相关;短链脂肪酸与人体内曲霉属真菌Aspergillus的肠道丰度呈负相关。
此外,富含碳水化合物的饮食与肠道念珠菌的丰度呈正相关。
同样,在健康志愿者中,高蛋白饮食与产甲烷短杆菌和念珠菌的丰度呈负相关。
有趣的是,酿酒酵母S. cerevisiae具有氨基酸转运蛋白,某些氨基酸如γ-氨基丁酸(GABA)和瓜氨酸,是酿酒酵母的重要氮源;因此,饮食中的氨基酸可能对肠道真菌的组成有深远的影响。
此外,亮氨酸代谢副产物2-羟基异己酸在72 mg/mL时具有较低的抑菌活性,可抑制假丝酵母菌丝的形成。
人类饮食中的特定化学物质,例如开心果和杏仁的植物化学物质,也与青霉菌和念珠菌属的含量呈负相关。
总之,检查饮食控制是否有可能减轻真菌感染是很重要的。如果该策略有效,那么对免疫抑制患者预防和控制继发感染可能特别有益。
其他因素
环境还能够触发肠道真菌的变化。
有趣的是,从杰克逊实验室的小鼠和服务部(JAX)获得的C57BL / 6J小鼠和在威尔·康奈尔医学(WCM-CE)处繁殖的小鼠的肠道真菌组成不同,分别以担子菌纲和子囊菌为主。而且,当SPF小鼠“野化”为野生状态时,它们的肠道真菌会显着增加。
季节是改变肠道真菌的另一个因素,尤其是真菌的α多样性。
性别和代谢紊乱(富营养,超重和肥胖)也会改变肠道真菌。例如,西藏猕猴的雌性与雄性有不同的菌群。
在肥胖的人类个体中观察到酵母数量增加,而富营养和超重的人类个体具有更多的丝状真菌。肠道念珠菌属仅在哺乳动物物种中发现。因此,肠道真菌可能在某种程度上因物种或基因型而异。
总体而言,肠道真菌受到内部和外部因素的影响。
这些因素不是独立的
也就是说,季节和环境与哺乳动物,特别是野生动物赖以生存的食物有关。环境也影响宿主接触潜在的致病或非致病微生物。
此外,不同物种有不同的遗传背景,更不用说它们的食物。
随着婴儿的进一步成长,他们将接受多种饮食,并暴露于复杂的环境和刺激下,例如yao物,性激素等。因此,必须系统地、相互关联地认识这些因素,不应过分强调每一个因素的单独作用。
与肠道细菌相似,肠道真菌高度多效性,调节宿主的各种生理功能。
目前对肠道真菌群对免疫反应途径和细胞网络的影响的认识:
肠道真菌对肠道免疫的影响
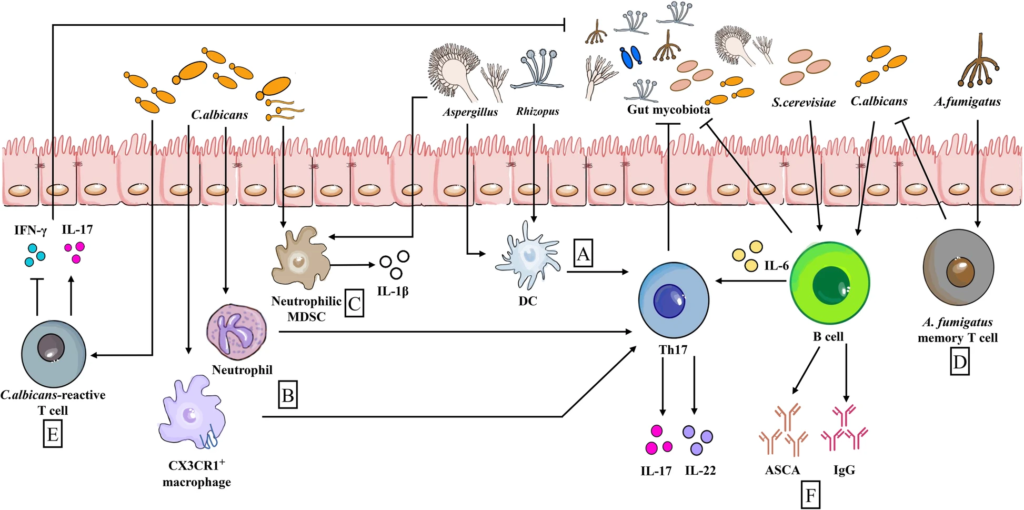
Wu X et al., Microbiome. 2021
(a) 当由曲霉属真菌Aspergillus和根霉属菌Rhizopus触发时,DCs促进Th17反应
(b) CX3CR1+巨噬细胞和中性粒细胞通过诱导Th17反应,产生高水平的IL-17和IL-22,有利于早期念珠菌控制。
(c) 同样,入侵的白色念珠菌和曲霉菌触发中性粒细胞MDSCs和IL-1β的产生。
(d)烟曲霉菌(A.fumigatus)记忆T细胞显示交叉反应白色念珠菌,因为他们有一个共享的TCR序列
(e) 同样,白色念珠菌活性T细胞通过产生IL-17与其他肠道真菌发生交叉反应
(f) 来自B细胞的抗酿酒酵母菌抗体ASCA和免疫球蛋白G(由白色念珠菌或酿酒酵母刺激)具有抗肠道真菌的作用。
除上述真菌成分和真菌代谢物,提取物和分泌物外,次生代谢物还负责影响宿主体内稳态。
表2 真菌衍生的化合物及其功能

Wu X et al., Microbiome. 2021
产生次级代谢物的各种基因簇表明,真菌通过复杂的途径产生次级代谢物,具有巨大的结构和功能多样性。
值得注意的是,真菌次生代谢产物在真菌疾病和合成生物学方面具有无限的潜力;它们也是抗生素和免疫抑制yao物的大量来源,因为它们具有靶向或干扰真菌和/或细菌的能力。
然而,真菌的一些次生代谢产物,包括黄曲霉毒素和柠檬酸,具有较强的肝毒性和/或肾毒性。
小鼠长期抗真菌治疗后肠道真菌的紊乱使结肠炎恶化,甚至使过敏性气道疾病恶化,肠道真菌组成失衡可能与肠道和肠外疾病有关。
肠内和肠外疾病与肠道真菌群的关系

Wu X et al., Microbiome. 2021
肠道真菌和肠道疾病
具体来说,健康的肠道真菌主要由几种丰富的共生真菌组成。肠道真菌可能是条件致病菌的贮存库。
炎症性肠病 IBD
炎症性肠病(IBD),包括溃疡性疾病(UC)和克罗恩氏病(CD),与肠道真菌失调有关。
与健康儿童相比,IBD儿童的粪便样本显示出较低的真菌多样性,而IBD样本(72.9%)的念珠菌属丰富度比健康对照组(32.9%)高两倍。
这些结果与溃疡性疾病和克罗恩氏病相关的人类白念珠菌肠道定植的报道一致。此外,白色念珠菌在IBD发作时比缓解时增加。
限制性马拉色菌是一种常见的皮肤常驻真菌,它与克罗恩病的发病机制有关,特别是在CARD9 (S12N)中携带IBD连锁多态性的患者中,限制性马拉色菌的定植加剧了DSS诱导的小鼠结肠炎的严重程度。
这项研究表明,除了白色念珠菌,其他鉴定出的真菌也可能参与IBD的发展,遗传因素,特别是CARD9多态性,在定义定植的炎症反应中很重要。
此外,克罗恩病样本中真菌与细菌多样性的比例增加,这表明克罗恩病患者的肠道环境可能更适合真菌的定植。
总的来说,IBD过程中肠道环境的改变与各种真菌和细菌的变化有关,并诱导真菌-细菌关系的改变。
然而,宿主IBD的最终命运不仅与影响肠道稳态的细菌和/或真菌群落有关,宿主免疫也起着决定性作用。
更重要的是,上述结果聚焦于克罗恩病和/或溃疡性疾病和克罗恩病混合患者或实验模型中的真菌群特征;溃疡性疾病患者肠道真菌群落的变化需要进一步的独立研究或实验模型。
有趣的是,酿酒酵母是有益菌,有能力改善肠胃炎,减轻CEACAM6(癌胚抗原相关细胞粘附分子6)表达小鼠的粘附性侵袭性大肠杆菌(AIEC)诱导的结肠炎,缓解人类受试者肠易激综合征(IBS)的腹痛。
因此,肠道真菌的调节可能是治疗IBD的一个潜在靶点。肠道共生真菌与IBD之间的因果关系有待进一步研究。此外,目前还不清楚肠道真菌是否通过与肠道细菌相互作用影响IBD的进展。
乳糜泻(CeD)
已发现乳糜泻(CeD)与肠道真菌群紊乱有关。乳糜泻的典型标志是可逆的小肠黏膜萎缩,临床症状不典型往往导致漏诊,疾病严重程度增加。
白色念珠菌可能是乳糜泻的潜在原因之一
念珠菌与乳糜泻的发病机制有关。具体来说,白念珠菌和乳糜泻之间的关联始于白色念珠菌毒力因子-菌丝壁蛋白1 (HWP1)的假设,它与T细胞抗原表位中乳糜泻相关的-α和γ醇溶蛋白相同或高度同源,并作为谷氨酰胺转胺酶(TG)底物,协助自身反应性抗体的产生。
随后,通过抗原抗体反应和微芯片分析,乳糜泻组和白色念珠菌感染(CI)组均表达高水平的抗HWP1、抗麦胶蛋白抗体和抗转谷氨酰胺酶(anti-TG) IgA抗体,乳糜泻组对HMP1的反应较高。然而,需要更多的证据来确定白色念珠菌参与乳糜泻。
其他
结肠癌与肠道真菌的失调有关,特别是在CARD9−/−小鼠中热带念珠菌的显著增加。
很少有研究证明肠易激综合征(IBS)和肠道真菌之间的联系。IBS的症状(如腹泻)与接受抗生素治疗或由念珠菌产物引发的念珠菌种类过度生长有关。然而,还需要更多的研究来揭示肠道真菌与这些肠道疾病之间的因果关系。
如上所述,黏膜免疫系统可能介导肠道真菌对肠道疾病发病机制的影响。特别是肠上皮细胞、其常驻免疫细胞、肠系膜淋巴系统、细胞因子、抗体以及上述真菌代谢产物,都可能在肠道疾病的发病机制中发挥重要作用。
肠脑轴和肠道真菌
肠道微生物-脑轴的证据主要包括以下几个方面:
(1) 肠道微生物通过迷走神经、细胞因子及其代谢产物如色氨酸、GABA和乙酰胆碱影响大脑
(2) 下丘脑-垂体-肾上腺(HPA)轴在肠道微生物群与大脑的交流中起核心作用
(3) 肠道-脑-微生物轴为抑郁症、自闭症和帕金森病提供了新的治疗靶点
肠道真菌在肠道-脑轴中的潜在机制

Wu X et al., Microbiome. 2021
(a) 肠道真菌以性别依赖的方式调节犬尿氨酸通路基因和海马区相关miRNAs的表达。
(b) 多发性硬化患者(MS)外周血和脑脊液中检测到念珠菌高。
(c) 精神分裂症患者(SC)的肠道真菌alpha多样性发生改变,毛壳菌属Chaetomium的丰度更高。
(d) 肠道补充乳酒假丝酵母 Candida kefyr有助于缓解实验性自身免疫性脑脊髓炎(EAE)。
念珠菌可能在介导肠道真菌-大脑相互作用中发挥重要作用。因此,肠道真菌可能在精神疾病中占有重要地位。
肠肺轴和肠道真菌
哮喘是一种典型的慢性过敏性气道疾病(AAD),被视为与Th2相关的疾病。
根据嗜酸性粒细胞和中性粒细胞的比例,哮喘已分为不同的炎症亚型。除Th2细胞外,Th1、Th9、Th17、NKT、CD8+ T、Treg细胞也参与了不同类型的哮喘。
众所周知,真菌细胞壁的许多成分是哮喘的过敏原,因此,真菌疾病与哮喘有关并不奇怪。
肠-肺轴上肠道真菌的潜在机制

Wu X et al., Microbiome. 2021
箭头表示激活,水平线表示抑制
(a) 氟康唑引起的肠道真菌失调足以恶化屋尘螨(HDM)所致的呼吸道变态反应(AAD),但对无肠道菌群的小鼠无影响。氟康唑诱导的肠道真菌失调刺激肠道CX3CR+巨噬细胞,导致Th2扩增,伴有巨噬细胞、中性粒细胞和嗜酸性粒细胞浸润肺。
(b) 肠道真菌诱导的前列腺素E2(PGE2)促进肺泡巨噬细胞M2极化,加重AAD。
(c) 肿瘤坏死因子(TNF)拮抗剂增强组织胞浆菌诱导的肺部感染的敏感性,在此过程中肠道特异性CD11b+CD103+DCs在肺内迁移和增强,从而增强肺部感染。
(d)白念珠菌C.albicans和酿酒酵母S. cerevisiae在肠道定植可触发肺中病毒特异性CD8T细胞(原因不明)和IFN-γ的产生,最终阻止流感病毒侵入呼吸道上皮细胞。
肠肝轴和肠道真菌
肝脏是一个重要的解毒器官并参与防御反应,参与肠道衍生的危险防御反应,被称为“肠-肝-轴”。
肠道微生物群的破坏是密切肝病如肝炎和肝硬化有关。例如,仔鸭口服赭曲霉毒素A (ochratoxin A,简称OTA)后,盲肠微生物多样性降低,产脂多糖拟杆菌门(LPS-producting Bacteroidetes)在盲肠和肝脏中的丰度增加,最终OTA通过TLR4-Myd88通路促进肝脏炎症。
肠道真菌可能通过肠肝轴参与肝脏疾病。也就是说,与健康对照相比,原发性硬化性胆管炎患者的真菌多样性增加了。
肝硬化患者的十二指肠真菌丰富,酒精滥用引起的肝硬化与念珠菌过度生长有关,血清酿酒酵母 S. cerevisiaeIgG抗体更高。
值得注意的是,开菲尔是一种针对肠道真菌群的抗酒精性脂肪肝的有效治疗方法。
注:开菲尔(Kefir)是以牛乳、羊乳或山羊乳为原料,添加含有乳酸菌和酵母菌的开菲尔粒发酵剂,经发酵酿制而成的一种传统酒精发酵乳饮料。
肠道真菌在肠-肝轴、胰腺疾病和肠-肾轴中的潜在机制
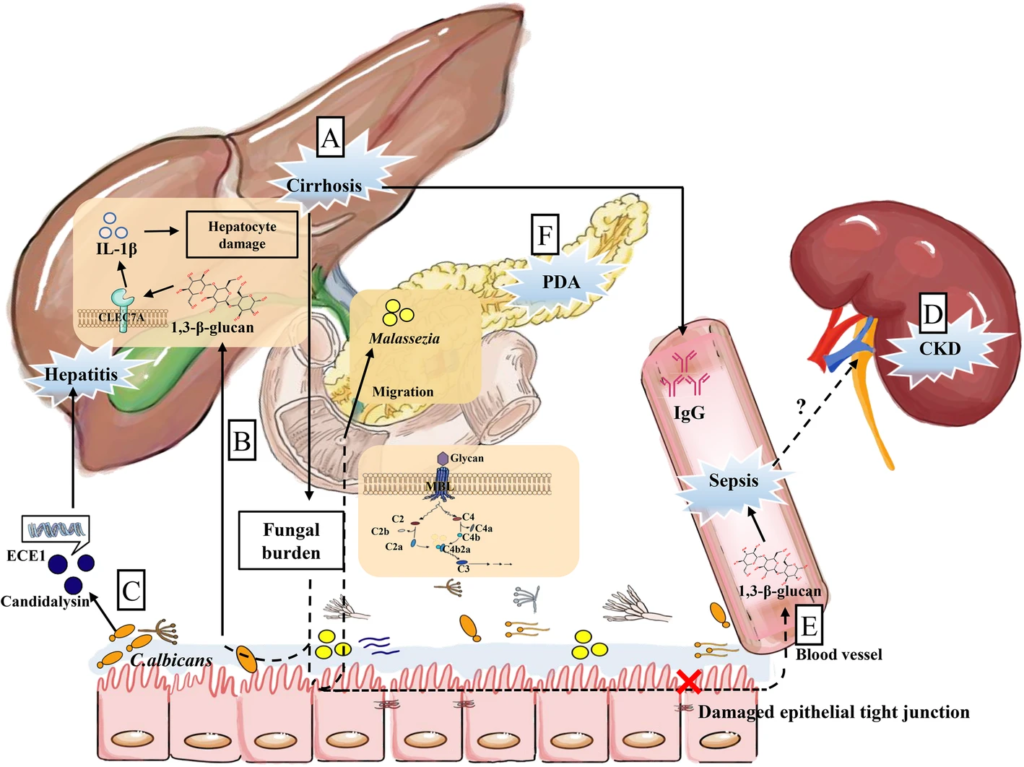
Wu X et al., Microbiome. 2021
(a)肝硬化患者肠道真菌负荷高,血清IgG水平高。
(b)随着1,3-β-D-葡聚糖(BG)的转运,肠道真菌负担增加。然后BG被C型凝集素样受体CLEC7A识别,诱导IL-1β的产生,加重肝细胞损伤。
(c)肠道定殖白色念珠菌分泌ECE1基因编码的念珠菌素,这与酒精性肝炎患者疾病加重有关。
(d)慢性肾病(CKD)小鼠肠道菌群发生改变,上皮紧密连接受损,导致细菌或真菌产物泄漏。
(e)肠漏可促进BG在血清中的迁移,加重脓毒症。
(f) PDA肿瘤在胰腺中高度富集马拉色菌,这是肠道真菌通过Oddi括约肌直接连接这两个器官而迁移的结果。此外,真菌细胞壁- MBL-补体级联途径的多糖在PDA中起重要作用。
肠肾轴和肠道真菌
肠-肾轴可能是肠道微生物的远端靶点。值得注意的是,慢性肾病(CKD)小鼠肠道微生物群的变化与上皮紧密连接受损有关,细菌产物可能通过肠道屏障泄漏,激活免疫反应。
同样,念珠菌在重症监护室患者肠道中的定植是念珠菌血症的一个易感因素。
两项研究均表明,白色念珠菌的肠道定植可能与败血症有关,肠道泄漏可能促进BG迁移,从而加重疾病进程。
在发生念珠菌播散感染的ICR小鼠中,肾脏的真菌负担最高,提示肾脏可能在循环真菌感染中发挥重要作用,但其机制仍有待研究。
然而,肾脏疾病中某些真菌的大量变化和假定的BG渗漏不能真正解释真菌肠肾轴的存在。同样,目前有关肠道真菌失衡直接影响肾脏疾病发病机制的研究还很有限,推测真菌肠道-肾脏轴是可行的。肠道真菌与肾脏之间是否还有其他联系值得探讨。
肠胰轴和肠道真菌
胰腺β细胞与1型糖尿病(T1DM)的发病机制相关。
与健康对照组相比,T1DM和2型糖尿病(T2DM)患者白色念珠菌定植率更高。T1DM患者甚至有更高的真菌种类多样性。这些发现表明,肠道真菌可能参与了糖尿病的发病机制。
然而,关于肠道真菌与胰腺细胞功能之间的直接关系的证据仍然有限。此外,肠道共生细菌衍生的Nod1配体(作为信号分子)是胰腺细胞中胰岛素转运所必需的。因此,探索肠道真菌来源的分子是否对胰腺细胞的功能有影响将很有意思。
此外,在胰腺导管腺癌(PDA)患者中,胰腺细菌和真菌明显增多。马拉色菌在人和小鼠的PDA中高度富集,肠道真菌可能通过Oddi括约肌迁移到胰腺。
然而,目前尚不清楚肠道真菌的失调是致癌进展的原因还是结果,揭示PDA的真菌特征是必要的;因此,我们仅提出Oddi和/或MBL补体级联可能作为肠-胰腺轴的连接。
总的来说,就像肠-肾轴一样,肠道真菌-胰腺相互作用的研究仍处于早期阶段。
虽然我们普遍关注肠道菌群,但值得注意的是,肠道真菌也具有许多潜在的功能。
肠道真菌参与肠道疾病或其他器官疾病可能为开发新的疾病治疗策略和提供新的诊断靶标提供新的窗口。然而,需要更多的研究来确定肠道真菌与肠道或肠道外疾病之间的因果关系。
除真菌本身外,肠道真菌化合物可能在疾病治疗中具有巨大潜力。一些真菌提取物具有抗病毒特性,因此利用真菌化合物可能为克服不可治愈的病毒性疾病提供新的突破。
相关阅读:
参考文献:
Kaźmierczak-Siedlecka K, Dvořák A, Folwarski M, Daca A, Przewłócka K,Makarewicz W. Fungal hut microbiota dysbiosis and its role in colorectal, oral, and pancreatic carcinogenesis. Cancers. 2020;12(5)
Sebaa S, Boucherit-Otmani Z, Courtois P. Effects of tyrosol and farnesol onCandida albicans biofilm. Mol Med Rep. 2019;19(4):3201–9.
Leonhardt I, Spielberg S, Weber M, Albrecht-Eckardt D, Bläss M, Claus R, BarzD, Scherlach K, Hertweck C, Löffler J, et al. The fungal quorum-sensing molecule farnesol activates innate immune cells but suppresses cellular adaptive immunity. mBio. 2015;6
Wu X, Xia Y, He F, Zhu C, Ren W. Intestinal mycobiota in health and diseases: from a disrupted equilibrium to clinical opportunities. Microbiome. 2021 Mar 14;9(1):60.
Leger T, Garcia C, Camadro JM. The Metacaspase (Mca1p) Restricts Oglycosylation during farnesol-induced apoptosis in Candida albicans. Mol Cell Proteomics. 2016;15(7):2308–23
Aaron L, Torsten M. Candida albicans in celiac disease: a wolf in sheep’sclothing. Autoimmun Rev. 2020;19(9):102621.
Enaud R, Prevel R, Ciarlo E, Beaufils F, Wieers G, Guery B, Delhaes L. The gut-lung axis in health and respiratory diseases: a place for inter-organ and inter-kingdom crosstalks. Front Cell Infect Microbiol. 2020;10:9.

谷禾健康
“ 在人类适应中整合宿主-微生物群的相互作用可以提供新的方法来提高我们对人类健康和进化的理解。”

面对快速的环境变化,生物如何适应新环境是进化生物学中的一个核心问题。
刚刚,来自德国马克斯·普朗克研究所研究人员在science发表了最新文章:

回顾了人类适应新环境的例子,这些例子表明宿主基因和微生物群之间的相互作用。提出宿主机制可以在本地适应过程中替代或补充有益的微生物群功能。寻找微生物群与人类遗传适应性有关的其他例子。
当人类在基因上适应新环境时,他们的微生物群也可能参与这个过程。微生物可以比宿主进化得更快,这使它们能够对环境变化做出快速反应。微生物群还过滤宿主的环境,从而改变宿主的选择性压力。
图1 人类及其微生物的局部适应

举例说明适应性宿主等位基因和适应性微生物群功能之间的相互作用。
选择压力的差异,包括饮食、气候和病原体暴露,导致了人类群体在性状上的差异,与消化、生理和免疫相关。这些差异是由跨多代发生的局部遗传适应造成的,与宿主一生中免疫系统的适应或生理适应是有区别的。
在许多情况下,主要的遗传变异体被确定为如下:
乳糖消化所需的乳糖酶:(由基因区域LCT编码)突变和截短
缺氧诱导因子2α:(由PAS1编码)在高原适应中产生作用
β-珠蛋白基因单倍型或镰状细胞性状:(由血红蛋白编码)在疟疾抗性中产生作用
此外,人类微生物群的组成和功能变化已被广泛描述。Amato等人最近回顾了可能影响人类本地适应性的微生物群的有益功能,例如微生物群增强营养和预防传染病。然而,在人类局部适应过程中,宿主适应性等位基因和适应性微生物群功能之间的特定相互作用仍有待研究。
接下来的两小节,作者详细研究了LCT–双歧杆菌和AMY1–瘤胃球菌之间的相互作用。在这些例子中,适应性宿主等位基因和适应性微生物功能是相联系的。
婴儿的主要能量来源于乳糖。在上消化道(GIT,下同),宿主酶乳糖酶将乳糖分解成葡萄糖和半乳糖。饮食中没有牛奶,乳糖酶的生产就会停止。乳糖酶非持续性LNP(乳糖不耐受)是祖先的条件。
注:由于乳糖酶活性的不同,人群中存在三种基因型,即纯合乳糖酶持续性(LP)、纯合乳糖酶非持续性(LNP)和杂合子(heterozygotes)。LNP是人群中最常见的表型。因乳糖酶的相对或绝对缺乏而导致的以腹泻为主的相关消化道症状的现象称之为乳糖不耐受。LNP是原发性乳糖不耐受的生理基础。
不同大陆的动物驯化(2500年到10000年前)和对非人类牛奶的反复消费导致了强烈的选择压力,使乳糖酶的生产持续到成年,即乳糖酶持久性LP(乳糖耐受)。LP是突变,在有长期放牧和挤奶历史的人群中常见。
宿主和微生物共争乳糖
许多肠道微生物群中常见的微生物可以使用β-半乳糖苷酶来裂解乳糖,然后发酵,乳糖可能被乳酸菌隔离。不管如何加工,微生物利用乳糖的副产物给宿主产生的能量更少。这意味着宿主和微生物在争夺乳糖,宿主有强烈的动机去战胜微生物。
乳糖耐受——宿主赢
乳糖耐受宿主胜过微生物,因为乳糖酶在微生物生物量较低的上层消化道中具有活性。
乳糖不耐受——微生物赢
相比之下,乳糖不耐受宿主主要在较低的消化道中获取微生物乳糖代谢的低能量密度产物。
因此,未消化的乳糖进入结肠可以被认为是一种需要微生物酶来处理的纤维形式。
就像结肠中的纤维降解一样,来自发酵的微生物,和它们的发酵产物[短链脂肪酸(SCFAs)]组成,虽然微生物群吸收了乳糖的一部分能量,但乳糖不耐受宿主的另一种选择是完全失去能量来源。
LCT位点的相同变异与肠道微生物群中双歧杆菌的相对丰度有关。
这种关联是迄今为止微生物组全基因组关联研究最一致的信号,该关联取决于牛奶消费量。
乳糖耐受基因型和双歧杆菌相对丰度之间的反比关系支持了哺乳动物乳糖酶和细菌β-半乳糖苷酶直接竞争乳糖的观点。
双歧杆菌是重要的乳糖降解菌,可能在产奶动物驯化后和选择乳糖耐受等位基因前帮助成年宿主从牛奶中提取能量。在畜牧业兴起后,乳糖代谢细菌可能在缺乏乳糖耐受等位基因的情况下对宿主的适应性产生积极影响。后来,有益的宿主等位基因出现并取代了微生物群的功能,在一些人群中变得几乎固定。
双歧杆菌(或功能过剩的微生物)产生的β-半乳糖苷酶也可能通过降低LCT基因型之间的适应度差异而减轻了对乳糖耐受等位基因的选择压力。
此外,如果微生物摄入乳糖能最大限度地减少与乳糖消化不良相关的疾病后果,并促进牛奶摄入,从而带来额外的益处,则微生物群可能会减轻能量权衡并维持人类群体中的乳糖酶多态性。
乳糖的例子表明,由微生物组和宿主基因组编码的活性可能特别容易受到宿主和微生物组之间竞争的影响。
与乳糖相反,人类饮食中的各种淀粉为宿主提供了一种机会,在较高的消化道中获得一种带有淀粉酶的淀粉,而在较低的消化道中为微生物群消化留下抗性淀粉。
事实上,淀粉有许多不同的形式,包括难以被宿主淀粉酶降解的结构,淀粉酶将淀粉分解成葡萄糖亚基。宿主和微生物群分配淀粉底物的程度可能取决于宿主基因型。
由AMY1基因编码的唾液淀粉酶在口腔中开始淀粉分解为葡萄糖的过程。唾液淀粉酶活性的个体差异与AMY1基因的拷贝数呈正相关,通常在2到15之间。
与AMY1 拷贝数含量低的个体相比,AMY1 拷贝数含量高的个体在食物到达较低的消化道及其微生物群之前,更彻底地消耗了给定饮食中对淀粉酶敏感的淀粉(图2,C和 D)。
图2 宿主基因型和微生物群之间联系的例子
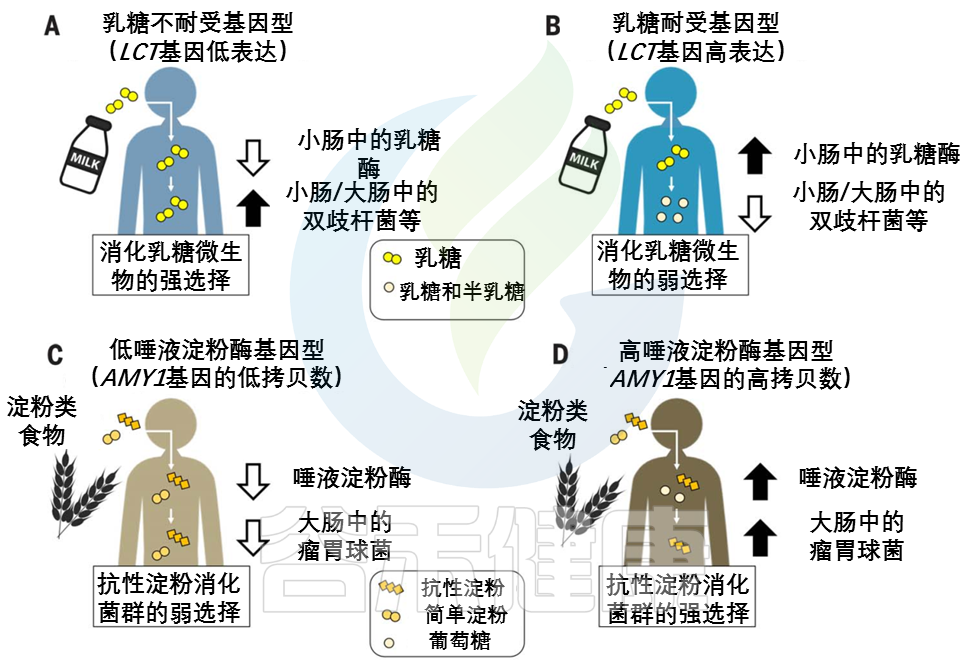
在(A) 乳糖不耐受宿主和(B) 乳糖耐受宿主中,乳糖酶基因型与双歧杆菌相对丰度呈负相关关系。
AMY1基因拷贝数(CN)和瘤胃球菌相对丰度之间的正相关性被描述为(C)低AMY1 拷贝数宿主和(D)高AMY1 拷贝数宿主。
不同类型的糖分以不同的形状和颜色显示。
AMY1 拷贝数为2是祖先的情况:AMY1 拷贝数在人类中的扩展可能是由从低淀粉饮食到高淀粉饮食的饮食转变所驱动的。
随着农业的发展,唾液淀粉酶水平的提高可能会促进高淀粉饮食人群的健康。与乳糖耐受的进化相似,宿主淀粉酶通过其比微生物发酵产物更大的能量产量而具有适应性优势。
具有AMY1高拷贝数的宿主还能从结肠微生物对抗性淀粉的强化降解中获益。
抗性淀粉发酵中的重要属——Ruminococcus
与AMY1低拷贝数个体的肠道微生物群相比,高AMY1拷贝数宿主的肠道微生物群富含瘤胃球菌属(Ruminococcus)。
在AMY1 低拷贝数宿主中,肠道细菌优先发酵淀粉酶敏感型淀粉,宿主不能使用这些淀粉,因为它们的唾液淀粉酶水平较低。
乳球菌,或功能冗余的微生物,可能通过放大AMY1高拷贝数和低拷贝数个体之间的相对适应度差异,增强了对AMY1 拷贝数扩增的选择压力,并可能增强了宿主基因-微生物的关联(图2,C和D)。因此,这种动态可能导致基于宿主基因型的微生物补充。
以上,作者提出宿主机制可以在本地适应过程中替代或补充有益的微生物群功能。接下来的章节,作者寻找微生物群与人类遗传适应性有关的其他例子,其中适应性的遗传基础得到了很好的描述。
有新的证据表明,微生物参与了其他几种人类遗传适应(图3),之前在这些适应中,微生物的作用没有得到充分认识。
图3 人类的局部适应性与微生物群有关
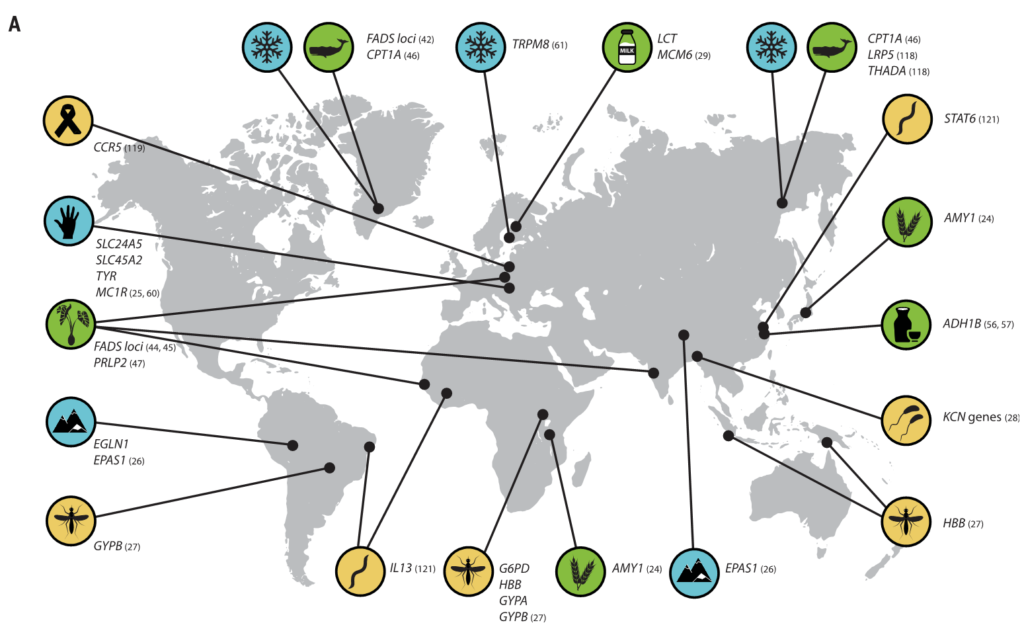
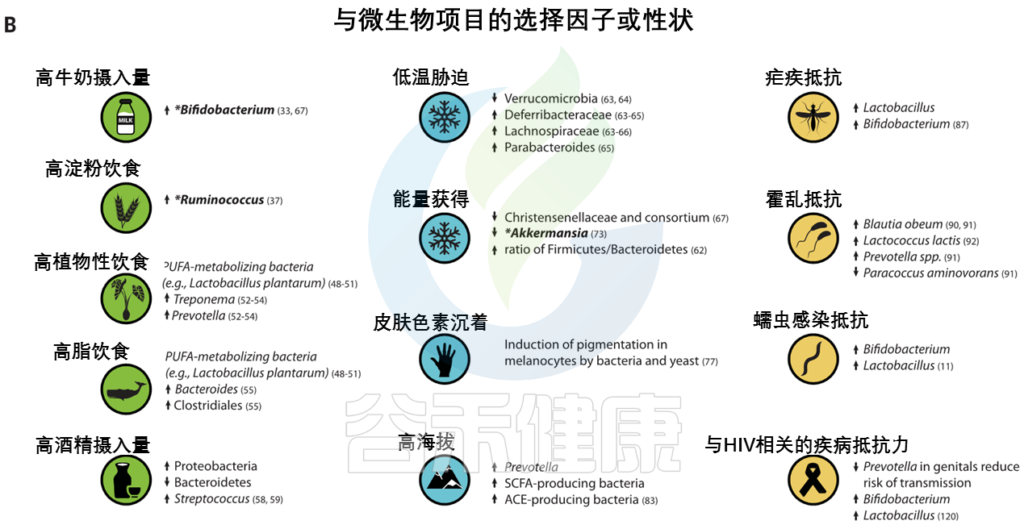
(A) 与适应性性状相关的人类基因位点的全球分布。这些符号对应于(B)中的选择因子和/或特征。
向上和向下的箭头分别表示微生物类群相对丰度与阳性或阴性相关的趋势。
微生物群的研究群体与宿主基因位点的研究群体不匹配.
星号和黑体字表示正向选择下与宿主基因位点相关的微生物类群: LCT和双歧杆菌,AMY1和Ruminococcus,PLD1和Akkermansia
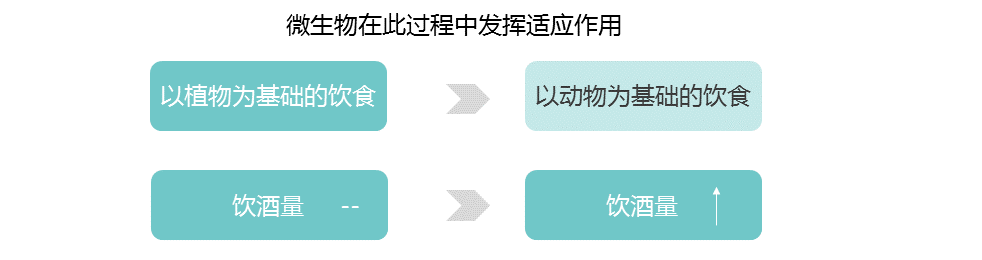
乳糖和淀粉消耗可能是第一个已知的与饮食相关的基因-微生物相互作用的例子,可以进一步研究其在人类适应中的作用,但其他例子可能会出现。例如,长链多不饱和脂肪酸(LC-PUFAs)是关键的营养物质,可以直接从动物性饮食中获得,或者使用宿主衍生的酶从植物衍生的前体中合成。
脂肪酸代谢相关基因【包括脂肪酸去饱和酶(FADS)、肉碱棕榈酰转移酶1A (CPT1A) 和胰脂肪酶相关蛋白2 (PLRP2)】的正向选择证据与多种人群的饮食适应有关。
FADS基因区域的祖先等位基因与食用植物性食物的人群相关,衍生等位基因与当前和历史上偏爱高脂肪食物的人群相关。属于至少10个门的细菌似乎能合成长链多不饱和脂肪酸。
在人类肠道微生物中,植物乳杆菌和其他细菌已被证明能代谢植物来源的前体,并影响多不饱和脂肪酸来源的代谢物在体外和体内的生物利用度。分别通过植物性饮食或动物性饮食富集的人类肠道微生物 。
类似地,酒精脱氢酶1B (ADH1B)位点在人类中显示出正向选择的证据,并与脱脂摄入有关,人们认为这是伴随着农业的发展而产生的。
人和细菌的酶可以将乙醇转化为乙醛;肠道微生物群的变异与饮酒和相关疾病有关。
这些观察表明:
我们已经适应了自己所在地的气候。生活在高纬度地区的人面临冷胁迫,与温度感应(TRPM8)和能量收获(如FADS和CPT1A)相关的基因与气候相关的适应有关。
气候是参与常见代谢紊乱基因的重要选择压力
人类微生物群也因纬度而异,并可能通过提高从饮食中提取能量和随后储存脂肪的效率来促进与气候相关的适应。微生物群中的一些变异与环境温度和宿主体型有关。对小鼠的实验研究表明,仅环境温度的变化就能引起肠道菌群的变化。
低温
低温暴露宿主的微生物表现出更高的吸收能力和能量收获能力,以及棕色脂肪组织产生的热量增加。然而,微生物介导的产热和TRPM8多态性在人类中是否相关仍有待确定。
· Christensenellaceae
人类肠道中最紧密和高度可遗传的分类单元,细菌家族christensenellaceae,它与较低的体重指数(BMI) 和代谢紊乱有关。甲烷菌科、脱水杆菌科 和Tenericutes在多个人类群体中也表现出遗传性,并与Christensenellaceae共存。
最近的证据表明,这些菌群之间的代谢相互作用可能会影响宿主对代谢物的利用。
GWASs没有发现显著的宿主遗传变异。这表明,一些明显可遗传的分类群可能具有多基因性质,其中许多基因的影响很小。
· Akkermansia
Akkermansia是一种微生物降解菌,也与体重指数有关,在多项研究中显示为一个可遗传的分类群。Akkermansia的相对丰度与PLD1 中的宿主遗传变异有关,PLD1是之前与BMI相关的基因。PLD1显示了非洲人群中正向选择的证据,但选择剂尚不清楚。
太阳辐射
生活在低纬度地区的人群面临高水平的太阳辐射,与皮肤色素沉着相关的基因是人类本地适应的典型例子(图3)。
皮肤中的黑色素保护皮肤免受紫外线辐射,其抗菌特性被认为是皮肤色素沉着纬度梯度的替代假设。因此,人类黑素细胞中皮肤色素沉着的增加可以通过暴露于微生物产物如脂多糖来诱导。
Guéniche等人报道了乳酸菌对皮肤的保护作用,紫外线照射后的全身免疫反应。鉴于肠道微生物群在调节皮肤内环境稳定中的新兴作用,进一步的研究可能有助于确定色素沉着基因与皮肤和肠道微生物之间的潜在相互作用。
高海拔环境
高海拔环境也带来了许多生理挑战,包括缺氧应激,这也可能被微生物群改变。在高海拔环境中,已经鉴定出与氧呼吸和血液循环相关的多种适应性特征和基因,这些特征和基因通常涉及血压的调节(图3)。
最近,肠道微生物群被证明通过产生短链脂肪酸来调节血压,短链脂肪酸有可能在高海拔环境中帮助调节血压。
包括丁酸盐在内的短链脂肪酸的产生影响小鼠缺氧诱导因子的活性,这也是多个人类群体中参与高海拔适应的关键途径。作用于肾素-血管紧张素系统的细菌血管紧张素转换酶(ACEs)的产生也可能改变高海拔环境中的血压。细菌ACEs已被证明能在体外转化哺乳动物血管紧张素。
病原体被认为是人类适应性进化的主要驱动力之一(图3),微生物群与病原体防御和免疫之间的界面已被广泛研究。
人类本地适应的一个典型例子是疟疾抗性的遗传基础,由疟原虫属的几种寄生原生动物引起。皮肤和肠道微生物可能影响疟疾的不同阶段。
相同细胞因子相关基因的遗传变异,包括IL10、IL12、肿瘤坏死因子、干扰素α和干扰素γ,与疟疾严重程度和微生物群组成的变异有关。
Ippolito等人总结了微生物群在疟疾抗性中可能扮演的多重角色的几种假说:
1 皮肤细菌产生可改变蚊子媒介吸引力的挥发性化合物
2 由肠道微生物诱导的抗原表达,该抗原表达诱导针对疟原虫传播的保护性抗体
3 影响血液阶段疟原虫感染严重性的微生物群的差异
其他可能受到微生物群和宿主遗传变异组合影响的感染包括霍乱、艾滋病毒和蠕虫感染。
霍 乱
霍乱毒素针对几个带有显示选择信号的基因的离子通道。已经在人群中鉴定出与霍乱易感性和从霍乱中恢复相关的肠道微生物分类群。实验研究已经确定了提供定殖抗性和抑制霍乱弧菌毒性的细菌分类群。
鉴于在胃肠疾病中离子通道的表达和功能经常被改变,探索微生物群和离子通道基因之间的联系对于治疗或预防腹泻疾病可能是有价值的。
艾滋病毒和蠕虫感染
阴道微生物群在艾滋病毒的获得和传播中起作用,
肠道微生物群与蠕虫相互作用并改变疾病结果。
对研究充分的宿主适应性等位基因和新兴有益微生物群功能之间的相互作用的进一步研究可能会揭示以前未知的抗病机制。
这里提到的所有宿主基因-微生物例子(图3)仍处于研究的早期阶段。但是在每一种情况下,微生物群都有可能通过改变适应性景观来影响宿主的进化。这些微生物可能改变了宿主的环境,导致宿主表型选择压力的改变。
在未来关于适应性宿主基因型和适应性微生物群功能之间关系的研究中,GWASs、候选基因方法或使用基因敲除模型的移植实验可以帮助确定维持有益微生物群功能的宿主遗传机制,并测试微生物群的替代和补充是否是适应性的一般特征。
基因研究已经将越来越多的群体纳入考虑范围,微生物群的特征研究也是如此。但到目前为止,包括宿主遗传学和微生物群的研究,除了少数例外,主要是在西方人群中进行的。
需要将人类基因研究的范围扩大到更广泛的人群和地点,其中包括微生物组成分。这些类型的研究结果将测试当前发现的普遍性,并描述更多微生物介导的适应情况。
还可以进一步研究特定分类群的遗传力,以更好地表征潜在的遗传多态性。遗传性既适用于分类群,也适用于微生物功能,因此通过宏基因组学将与人类遗传变异相关的性状从分类群扩展到功能群,将有助于进一步阐明微生物群在人类适应中的作用。
在这里关注的是宿主(主要是人类)的进化,但是微生物也在快速进化以适应它们的宿主环境。在适应性进化的背景下,对宿主基因组和微生物群之间相互作用的更好理解将阐明人类和其他动物及其微生物群是如何适应不断变化的世界的。
参考文献:
Suzuki Taichi A,Ley Ruth E,The role of the microbiota in human genetic adaptation.[J] .Science, 2020, 370
Bayless Theodore M,Brown Elizabeth,Paige David M,Lactase Non-persistence and Lactose Intolerance.[J] .Curr Gastroenterol Rep, 2017, 19: 23.
S. Fan, M. E. B. Hansen, Y. Lo, S. A. Tishkoff, Going global by adapting local: A review of recent human adaptation. Science 354, 5 4–59 (2016). doi: 10.1126/science.aaf5098; pmid: 27846491
M. Fumagalli et al., Greenlandic Inuit show genetic signatures of diet and climate adaptation. Science 349, 1343–1347 (2015). doi: 10.1126/science.aab2319; pmid: 26383953
T. A. Suzuki, F. M. Martins, M. W. Nachman, Altitudinal variation of the gut microbiota in wild house mice. Mol. Ecol. 28, 2378–2390 (2019). doi: 10.1111/mec.14905; pmid: 30346069

谷禾健康
功能性腹痛性疾病(FAPD)是儿童期最常见的疾病,全世界25%的儿童和婴儿受其影响。
功能性腹痛性疾病
小儿功能性腹痛性疾病,目前称为肠脑相互作用障碍,包括肠易激综合症,功能性消化不良,腹型偏头痛和功能性腹痛。
<罗马IV诊断标准见附录>
近日,英国和美国的研究科学家联合发表在《NATURE REVIEWS | DISEASE PRIMERS》上的一篇综述文章题为:“Paediatric functional abdominal pain disorders”(小儿功能性腹痛症)。


该文总结了FAPD患病率和致病性的最新进展,并特别关注了早期生命的影响和构建。对食源性发病机理和病理生理学有了更深入的了解,包括肠道器官(炎症,运动和微生物群),核心因素(心理方面,某些大脑区域的敏感性和/或连通性或活动性差异)以及外在因素(感染)。
此外,讨论了当前的诊断方法并着重介绍了这些疾病的治疗选择,特别是IBS和FAP-NOS。强调可用的药理干预措施仅限于儿童,因此,干预管理重点落在综合方法上,包括针对精神的干预措施(催眠疗法和认知行为疗法),饮食(益生菌)和经皮神经电刺激。这些方向将有助于理解病理生理学并更好地治疗这些疾病。
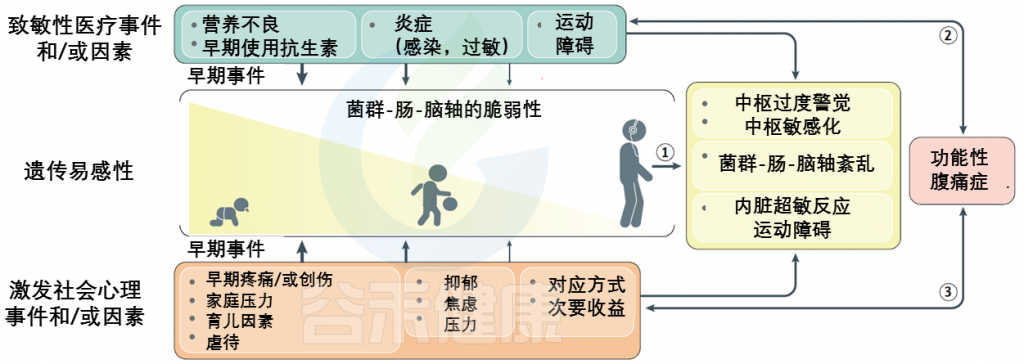
FAPDs的特征通常内脏痛觉过于敏感以及内脏刺激中枢感知增加而导致残疾,是遗传易感性和早期生活事件背景上叠加的社会心理因素和医学因素的最终结果。
功能性消化不良的症状特征主要来自胃肠道近端,涉及上腹部腹痛和/或餐后饱胀和/或早期饱腹感。
腹型偏头痛的特点是发作性长时间发作,剧烈,急性脐周,中线或弥漫性腹痛。这些痛苦的发作通常无能为力并干扰正常生活。
这些发作通常但不总是与其他症状(例如厌食,恶心,呕吐,头痛,畏光等)相关,这些症状可能在疼痛持续时间之前或与疼痛持续时间同时发生,并且这种症状性发作可能相隔数周至数月不等。
风险因素如下:


FAPDs是一种复杂的疾病,似乎是由于一个或多个元素的功能和/或更微妙的结构完整性的破坏造成的菌群-肠-脑轴。这些条件下相互作用的复杂性和多面性被整合到一个生物心理社会模型中。

该模型的关键组成部分是内脏超敏反应和中枢敏感化。
内 脏 超 敏 反 应
内脏超敏反应描述了对周围信号的知觉反应(即痛觉过敏),并且可能是内脏传入信号处理变化的结果或疼痛下调变化的结果(例如,中枢敏感化)。
表现:疼痛的感觉阈值降低,也就是稍微一点点刺激就会感到疼痛。
可能原因:在肠扩张期间或由于暴露于食糜的化学成分改变引起,部分解释了对诸如饮食调整和抑酸等治疗的反应。
潜在诱因:炎症,感染和压力
从本质上讲,这些触发因素可引起粘膜通透性变化并导致炎症,释放促生因子,包括5-羟色胺,组胺,NGF,蛋白酶和前列腺素,它们能够激活传入伤害感受器(痛觉神经)上的受体,引起急性疼痛以及持久的功能和结构改变,这是维持慢性疼痛的关键。
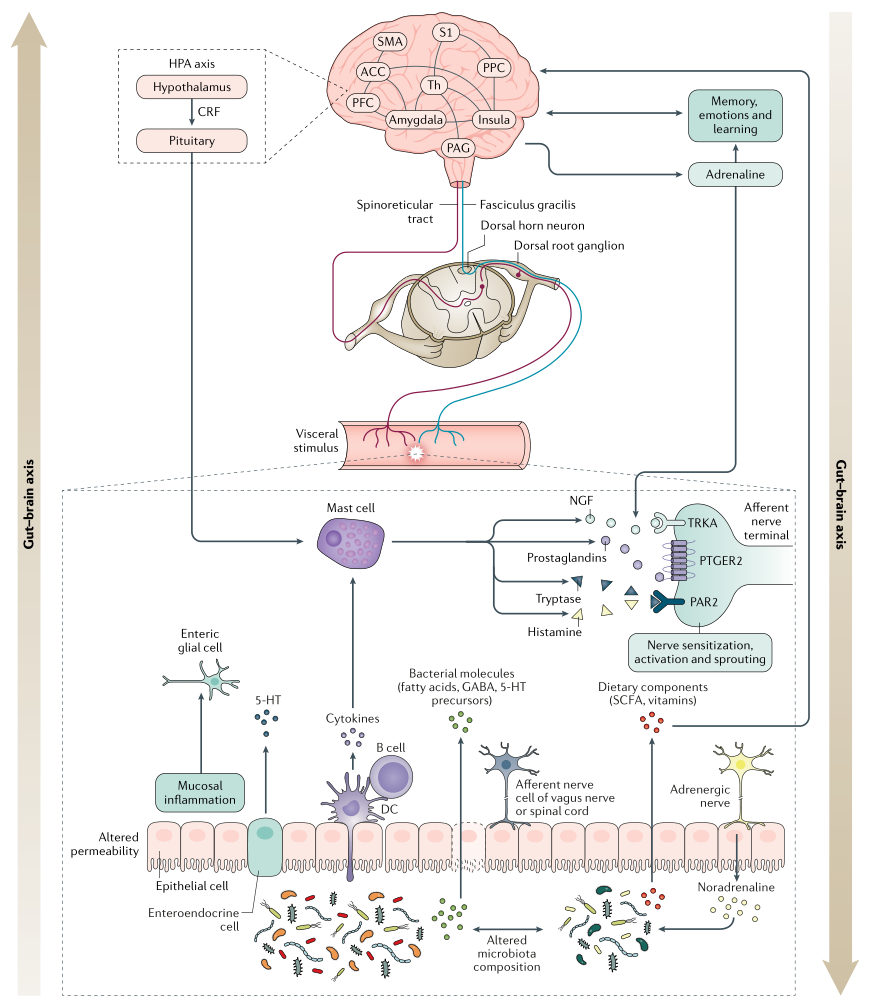

中 枢 敏 感 化
中枢敏化是指通过增强中枢神经系统内的神经元功能和神经信号来放大疼痛敏感性的现象,会引起疼痛超敏反应,并且是一种发展和维持慢性疼痛的机制。
除了疼痛超敏反应外,中枢敏化还会导致脑部活动的继发性变化,可以通过电生理或成像技术进行检测。患有FAPD的个体可能更倾向于发展来源不明的中央致敏。
2018年进行的一项系统性回顾涉及12项病例对照研究,发现功能性腹痛儿童的继发性痛觉过敏和皮质伤害感受改变。
生 命 早 期 事 件
在小儿FAPD中,损伤时机比导致微生物群-肠-脑轴成分破坏的多种因素或该轴本身的破坏更为关键。在生命的头二十年中,尤其是从围产期到儿童时期直至青春期,支撑其功能的肠脑轴所有元素的发育和成熟的关键过程至关重要。
包括手术(例如脐疝和幽门狭窄),细菌性胃肠道感染,炎性或免疫介导的疾病(例如乳糜泻,炎性肠病),以及在生命的最初几个月中发生无害的侮辱,例如婴儿期对牛奶过敏和早期使用抗生素等。
神 经 免 疫 相 互 作 用
在一些患有FAPD的儿童中,证据表明存在低度的肠道炎症,并在发病机理中发挥了神经免疫相互作用的作用。
一项研究发现,IBS患儿回结肠结肠粘膜中靠近神经的肥大细胞数量增加。神经纤维相关的肥大细胞计数与腹痛的强度和疼痛发作的频率相关。
胃 肠 蠕 动
胃肠动力异常促进FAPD的病理生理。具有上消化道症状的患者可能有胃排空延迟和/或胃适应性降低或两者都不存在。功能性下消化道症状的患者可能延迟,加速或正常结肠转移,和/或骨盆底运动障碍(肌肉协调障碍导致试图放松骨盆底肌肉时收缩)。
—功能性消化不良
—肠易激综合征
微 生 物 群
FAPD与肠道微生物群的多样性和菌群组成有关,尤其是IBS。2019年,一项系统评价86评估了健康个体和IBS患者(成人和儿童)的肠道菌群组成。发现双歧杆菌属的丰度下降。IBS患者中的抗炎作用与Faecalibacterium spp,尤其是Faecalibacterium prausnitzii一样,具有抗炎作用。
IBS患者的粪便微生物群的多样性降低或保持不变。粪便微生物群组成或代谢组组成可以预测患者可能从饮食中获益。
除细菌外,真菌或病毒也可能在FAPD病理生理中起作用。但是,有关真菌菌群失调或病毒菌群失调的可用数据有限,目前的研究主要集中于炎症性肠病,而不是IBS。
营 养
在患有FAPD的儿童中起着至关重要的作用。
饮食失调(例如神经性贪食症)可能导致IBS患儿肥胖的发生率增加。
碳水化合物的吸收不良可引起胃肠道症状。吸收不良可能与特定的酶缺乏症有关(例如乳糖酶缺乏症中的乳糖;蔗糖和异麦芽糖酶缺乏症中的蔗糖和淀粉)或与碳水化合物(如果糖,山梨糖醇或甘露醇)的吸收能力有限有关。
在糖较小的情况下,所引起的渗透负荷可导致肠腔膨胀小和快速转运。对于诸如果聚糖等较大的糖,人不具有消化的酶促能力,因此,吸收不良的糖会被结肠菌群发酵,从而导致气体形成和潜在的结肠扩张。
心 理 因 素
肠脑轴的生理很复杂,包括传入和传出成分。
下丘脑-垂体-肾上腺轴通过皮质醇和促肾上腺皮质激素释放因子的释放(在压力条件下均会增加),以及通过刺激肥大细胞和诱导脯氨酸释放的反馈回路,促进肠-脑相互作用。
研究表明,在成年人和有FAPDs的儿科患者中,压力都会增加肠道炎症标志物,如粪便钙卫蛋白和CRP。
肠道与大脑的相互作用涉及自上而下和自下而上的过程,因此,肠道菌群也可以影响脑功能。在压力条件下,肠道菌群可以增加上皮屏障的通透性,使抗原和/或病原体能够通过并引起炎症反应。由此产生的循环性促炎细胞因子可能会与中枢神经系统通讯,刺激大脑的免疫反应,从而可能导致或加重心理症状(例如焦虑和抑郁)。
几项研究表明,与健康儿童相比,患有家族性帕金森病的儿童的心理压力和行为问题有所增加。心理因素可能既是FAPD的起因,也是后果。

无论采用哪种治疗方法,患者与临床医生之间有效的沟通和病人教育,是成功进行FAPD管理的核心。必须花足够的时间向每位患者的照护者解释诊断,并讨论生物心理社会模型。
FAPD的管理受到几个因素的限制
1. 由于FAPD生物心理社会特性,每个孩子都有一套独特的病理生理因素,并且对疗法的反应也不同。
2. FAPD患儿的证据基础很小,许多治疗建议都是基于对成年人的研究。 儿童通常不会像成年人那样做出反应。
3. 一些有效的治疗方法是行为疗法(饮食疗法和心理疗法),由于缺乏专职医疗保健专业人员以及缺乏保险,这些方法并不容易。
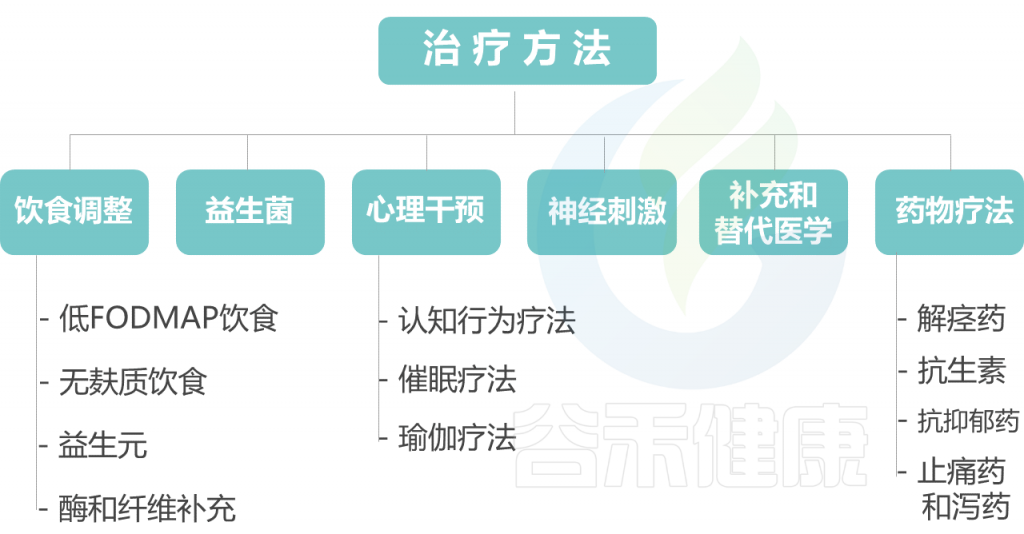

以下对每种治疗方法展开讨论。
饮 食 调 整


益 生 菌
多项研究检查了益生菌治疗FAPD的功效(大多成年IBS患者)。这些研究表明,益生菌或特定菌特定组合可能是有效的,但研究有局限性,如样品量,致盲性,所用益生菌的差异以及不同的剂量,其作用仍不清楚。
在患有IBS的儿童中,两项研究发现鼠李糖乳杆菌GG可有效减轻腹痛症状,而一项研究则报告腹痛没有改善,但感觉到的腹胀有所改善。在不同的研究中,疼痛程度再次有所不同。
在一个多中心,IBS儿童中进行的交叉RCT研究中,VSL#3(八种益生菌菌株的混合物)在改善症状和改善生活质量方面比安慰剂更安全,更有效。
心 理 干 预
心理干预迄今为止,诸如CBT和催眠治疗等心理干预已被证明是管理FAPD的最成功干预措施,并主张将其普遍纳入管理策略。
认知行为疗法(CBT)
CBT是治疗IBS的研究最多的心理疗法,其目的是改变认知,情绪和行为,这些不良情绪行为等都可能加剧或维持IBS症状。
在成人和儿童中的研究表明,与教育和其他控制干预措施相比,CBT在改善疼痛和参与社交生活的能力以及减轻焦虑或抑郁症状方面是有效的。
十二项随机对照试验涉及990名IBS儿童(7-18岁),显示出CBT对生活质量,学校表现和社会参与产生了长期的,持久的有益影响。CBT可以作为面对面的治疗提供,也可以通过互联网面向儿童或通过电话面向父母。
已报道,CBT在改善肠易激综合征儿童的疼痛和残疾方面具有有效性。患有家族性帕金森病的儿童的社区康复治疗主要集中在学习应对症状和减少残疾上,这些治疗应该是综合护理方法的理想组成部分。
催 眠 疗 法
在治疗师的指导下,患者会进入催眠状态,以响应改变主观体验,感知,情感,思想或行为的建议。
在成年人中,催眠疗法已被证明可导致结肠运动改变,改善内脏超敏性并减少长期持续存在的心理因素,例如躯体化和心理压力。
然而,在IBS患儿中,尽管接受了标准疗法的儿童的疼痛评分和躯体化评分均较低,但在催眠治疗后并未发现超敏反应降低(通过实验测试)。
IBS或FAP-NOS(n = 412;6-18岁)儿童的5个随机对照试验,无论是单独治疗还是在家中通过CD进行催眠治疗,均产生了长期有益影响。
在1年和5年的随访中,接受催眠治疗的患者中分别有85%和68%已没有症状,而对照组中分别只有25%和20%的患者缓解
瑜 珈 疗 法
瑜伽练习已被证明可以改善应激诱导的副交感神经系统活性不足。三个随机对照试验,包括127名IBS儿童(7-18岁),瑜伽疗法在减少腹痛方面具有积极作用。
但是,一项荷兰研究表明,在1年的随访中,瑜伽干预并没有比不包括CBT的标准治疗更有效。由于学习方法的重大缺陷,尚不能提出将瑜伽作为FAPD儿童的常规干预措施的建议。
神 经 刺 激
多项研究表明,脊髓和大脑的电刺激在调节疼痛途径中的功效,能够减少脊髓和中央杏仁核中50%以上的神经元放电,从而减轻内脏疼痛。
一项研究表明,经皮神经电刺激(PENFS)可以调节杏仁核和脊髓神经元的反应特性,并显着降低大鼠内脏超敏反应的发展。
随后,同一组受试者在115名FAPD的青少年(11至18岁)的随机对照试验中显示,具有主动装置的PENFS可以改善健康状况,并显着减轻疼痛和残疾 与假刺激组。
此外,PENFS的有益作用在2个月的随访期间得以维持。尽管有些耳部不适,但未报告严重的不良反应。
补 充 和 替 代 医 学
补充和替代医学包括不同的方法,从针灸和阿育吠陀医学到脊椎指压疗法、整骨疗法、顺势疗法、精神治疗、按摩和冥想等身心技术。大约40%的澳大利亚和荷兰诊断为糖尿病肾病的儿童使用其中某些替代疗法,其中草药治疗是最常见的(46%)。
许多补充疗法被公众认为是“自然的”,比现代医学的医疗设备更安全、更温和。FAPDs儿童对对抗疗法药物相关可能产生不良反应的恐惧,常规治疗没太大效果,让父母希望寻求补充和替代治疗。
然而,到目前为止,评估草药疗法、针灸、顺势疗法、身心疗法或肌肉骨骼操作(如整骨疗法和脊椎指压疗法)对患有家族性帕金森病的儿童的效果的随机对照试验尚不可用。
由于糖尿病周围神经病变的自发缓解率很高(30-70%),采取逐步的管理方法是明智的;必要时,教育、识别和改变压力因素和饮食干预可能是第一步。当症状持续或再次出现时,下一步可能是开始一种心理治疗,如认知行为疗法和催眠疗法,或PENFS。
药 物 疗 法




胃肠症状的严重程度和发生频率对不同患者的功能状态有不同的影响。患者报告的健康相关生活质量(HRQOL)测量应该有助于深入了解FAPDs对儿童和青少年功能状态的不同影响,包括身体、情感、行为、社会和认知方面。
评估症状和HRQOL影响的患者报告结果已成为成人临床状态和治疗结果的公认指标。但在儿童环境中,自我报告的HRQOL措施在仪器开发和临床应用中遇到了挑战,部分原因是担心儿童能否可靠地自我报告与健康相关的信息。
量化个体胃肠道症状对于开发以患者为中心和针对症状的干预措施很重要,这可以改善整体HRQOL。例如,一项针对259名患有功能性便秘,功能性腹痛或IBS的儿科患者的多中心研究发现,胃肠道症状最能预测整体受损。
FAPD在儿童时期很常见,FAPD患病率和/或复杂性可能会增加。因此,需要有来自所有地理区域以及世界各地精心设计的流行病学研究,才能真正了解问题的性质和规模。
特别重要的是,我们目前对导致儿童FAPD发病机理的潜在因素的了解,需要使用来自FAPD患儿的组织样本来解决免疫功能障碍和神经功能障碍的基础和转化科学研究。如上所述,早期的影响,即在复杂的肠脑轴各要素发展的关键阶段发生的事件,通常是辱骂或创伤(心理或医学方面的事件),使易感人群容易患上FAPD。
异常改变肠道菌群的因素可能会改变肠神经系统的结构或功能完整性,进而改变其与中枢神经系统的复杂且平衡的相互作用。结果可能是胃肠道重新调整为过敏状态,而大脑则重新编程为过度警觉状态。
当然,其他遗传因素,社会因素和生理变化,例如在青春期或青春期发生的那些,也可能促进症状发展。
现代工具越来越多地与焦虑和压力相关联,也可能会对FAPD产生重大影响。
总体而言,在过去十年中,儿童家庭保护方案取得了相当大的进展。对所有影响因素,及其与触发FAPD最终发展有关时机的更深入了解,可能带来更合适的预防或治疗策略。
【附录】
功能性腹痛疾病的罗马IV诊断标准
肠易激综合征
该标准必须满足至少2个月,并包括以下所有:
• 每月至少有4天腹痛伴有排便和/或排便次数的改变和/或大便外观的改变
• 腹痛不能随着便秘的解决而消失(疼痛消除的儿童患有功能性便秘,非肠易激综合征)
• 经过适当评估,症状不能完全由另一种疾病解释
功能性消化不良
诊断前必须至少满足2个月的标准,并且必须包括以下一种或多种症状,每月至少4天:
• 餐后饱腹感
• 早期饱腹感
• 与排便无关的上腹部疼痛或灼热感
• 经过适当评估,这种症状不能完全由另一种医学状况来解释
腹型偏头痛
必须在诊断前至少6个月内达到标准,并包括以下所有至少发生两次的情况:
• 持续1小时或更长时间的剧烈、急性脐周、中线或弥漫性腹痛的阵发性发作(应为最严重和最痛苦的症状)
• 发作间隔数周至数月;疼痛使人丧失能力并干扰正常活动;个体患者的定型模式和症状
• 疼痛与以下两种或两种以上症状相关:厌食、恶心、呕吐、头痛、畏光或苍白
• 经适当评估,症状不能完全由另一种医学状况解释,
功能性腹痛
未另行规定标准必须在诊断前至少2个月完成,每月至少四次,包括以下所有内容:
• 并非仅在生理事件(例如,饮食和月经)期间发生的偶发性或持续性腹痛;肠易激综合征、功能性消化不良或腹部偏头痛的标准不足
• 经过适当评估,腹痛不能由其他医疗状况完全解释
相关阅读:
主要参考文献:
Sjölund, J. et al. Prevalence and progression of recurrent abdominal pain, from early childhood to adolescence. Clin. Gastroenterol. Hepatol. 2020
Paediatric functional abdominal pain disorders.[J] .Nat Rev Dis Primers, 2020, 6: 88.
Rutten, J. M. T . M., Korterink, J. J., Venmans, L. M. A. J., Benninga, M. A. & T abbers, M. M. Nonpharmacologic treatment of functional abdominal pain disorders: a systematic review. Pediatrics 135, 522–535
Masuy, I., Van Oudenhove, L. & T ack, J. Review article: treatment options for functional dyspepsia. Aliment. Pharmacol. Ther. 49, 1 134–1 172 (2019)
Russell, A. C., Stone, A. L. & Walker, L. S. Nausea in children with functional abdominal pain predicts poor health outcomes in young adulthood. Clin. Gastroenterol. Hepatol. 15, 706–71 1 (2017)
Maragkoudaki, M. et al. Lactobacillus reuteri DSM 17938 and a placebo both significantly reduced symptoms in children with functional abdominal pain. Acta Paediatr. 106, 1857–1862 (2017).

谷禾健康
痤疮(俗称“痘痘”)是一种常见的皮肤病,会影响全球近10%的人口。导致痤疮发展的因素很多,包括皮脂和角蛋白的产生,引起痤疮的细菌,激素,毛孔阻塞和炎症。
饮食与痤疮之间的联系一直存在争议,但最近的研究表明饮食在痤疮的发生中可以发挥重要作用。
本文将列举以下7种可能引起痤疮的食物,并提供一些相应的饮食建议。


吃大量精制碳水化合物可能会增加血糖和胰岛素水平,并促进痤疮的发生。
与很少或没有痤疮的人相比,有痤疮的人往往消耗更多的精制碳水化合物。
富含精制碳水化合物的食物包括:
用白面粉制成的面包,饼干,谷类食品或甜点;
白面粉意面;
白米饭和米粉;
苏打水和其他含糖饮料;
甜味剂,如蔗糖,枫糖浆,蜂蜜;
…
一项研究发现,经常食用添加糖的人患痤疮的风险增加30%,而那些经常吃糕点和蛋糕的人患痤疮的风险则增加20%。
这可以通过精制碳水化合物对血糖和胰岛素水平的影响来解释。
精制的碳水化合物会迅速吸收到血液中,从而迅速提高血糖水平。当血糖升高时,胰岛素水平也会升高,以促进血糖从血液中传出并进入细胞。
但是,高水平的胰岛素对痤疮患者并不友好。胰岛素可使雄激素更加活跃,并增加胰岛素样生长因子1(IGF-1)。通过使皮肤细胞更快生长并促进皮脂生成,这有助于痤疮的发展。
另一方面,低升糖指数饮食法不会显著提高血糖或胰岛素水平,却可以减少痤疮的严重程度。
当然,仍需要进一步研究,来了解精制碳水化合物如何促进痤疮。


经常食用乳制品与痤疮严重程度的增加有关
许多研究发现,乳制品与青少年痤疮严重程度之间存在关联。
两项研究还发现,经常食用牛奶或冰淇淋的年轻人患粉刺的几率是不经常吃的人的 4 倍。
但是,迄今为止的研究主要集中在青少年和年轻人,并且仅显示了牛奶和痤疮之间的相关性,而不是因果关系。尚不清楚牛奶如何促进痤疮的形成,但是有几种理论:
已知牛奶会增加胰岛素水平,而不受其对血糖的影响,这可能会使痤疮严重程度恶化。
牛奶还含有刺激肝脏产生更多IGF-1的氨基酸,这与痤疮的发生有关。
需要进行更多的研究,以确定是否存在特定数量或类型的乳制品,可能加剧痤疮。
西式快餐

经常吃西式快餐与痤疮发生的风险增加有关
痤疮与进食富含卡路里,脂肪和精制碳水化合物的西式饮食密切相关。
西式快餐食品,例如汉堡,矿块,热狗,炸薯条,苏打水和奶昔,是典型西方饮食中常见的食物,可能增加痤疮的风险。
一项针对 5000 多名中国青少年的研究发现,高脂饮食会使痤疮发生风险增加43%。定期吃西式快餐会增加17%的风险。
另一项针对 2300 名土耳其男子的单独研究发现,经常吃汉堡或香肠与痤疮发生风险增加24%有关。
目前尚不清楚为什么吃西式快餐会增加患痤疮的风险,但一些研究人员提出,它可能以促进痤疮发展的方式影响基因表达并改变激素水平。
必须要说明的是,大多数有关西式快餐和痤疮的研究都使用了自我报告的数据。这种类型的研究仅显示饮食习惯和痤疮风险的关联,而不能证明西式快餐会直接导致痤疮。因此,需要更多的研究。
富含Omega-6脂肪的食物

富含omega-6脂肪酸和omega-3含量低的饮食具有促炎作用,并且可能使痤疮恶化。
跟典型的西方饮食一样,含有大量omega-6脂肪酸的饮食与炎症和痤疮的增加有关。
这可能是因为西方饮食中含有大量的玉米和豆油,它们富含omega-6脂肪,而很少包含omega-3脂肪的食物,例如鱼和核桃。
omega-6和omega-3脂肪酸的这种不平衡会促使人体进入炎症状态,这可能会加剧痤疮的严重性。相反,补充omega-3脂肪酸可降低炎症水平,并可减轻痤疮严重程度。
尽管Omega-6脂肪酸和痤疮之间有关联,但尚未对此主题进行随机对照研究,需要进行更多研究。
巧克力

研究支持食用巧克力和痤疮之间的联系
自上世纪二十年代以来,巧克力就一直被认为是痤疮的诱因,但到目前为止,尚未达成共识。
多项非正式调查已将食用巧克力与增加痤疮的风险联系起来,但这不足以证明巧克力会引起痤疮。
最近的一项研究发现,易长粉刺的男性每天食用25克99%黑巧克力,仅在两周后出现了更多的痤疮病变。
另一项研究发现,与服用安慰剂的男性相比,每天服用100%可可粉胶囊的男性,在一周后的痤疮病变明显更多。
至于巧克力为什么会增加痤疮的确切原因还不太清楚,有一项研究发现,吃巧克力会增加免疫系统对引起痤疮细菌的反应,这可能有助于解释上述发现。
乳清蛋白粉

少量数据表明,服用乳清蛋白粉与痤疮之间存在联系。
乳清蛋白粉是一种流行的膳食补充剂。
它是氨基酸、亮氨酸和谷氨酰胺的丰富来源。这些氨基酸可使皮肤细胞生长和分裂更快,这可能有助于痤疮的形成。
乳清蛋白中的氨基酸还可以刺激人体产生更高水平的胰岛素,这与痤疮的发生有关。
一些案例研究报告了男性运动员乳清蛋白消耗与粉刺之间的联系。另一项研究发现痤疮严重程度与乳清蛋白补充剂天数之间的直接相关性。
这些研究支持乳清蛋白和痤疮之间的联系,但需要更多的研究来确定乳清蛋白是否引起痤疮。
个人过敏食物
食物敏感性反应可增加体内的炎症程度,理论上可能会加剧痤疮。
有人提出,痤疮从根本上说是一种炎症性疾病。事实证明,抗炎药如皮质类固醇是治疗严重痤疮的有效方法,而且痤疮患者血液中的炎症分子水平升高。
食物导致炎症的一种方法是通过食物敏感性,也称为迟发型超敏反应。
当免疫系统错误地将食物识别为威胁并对其发起免疫攻击时,就会出现食物过敏。这会导致高水平的促炎分子在体内循环,从而加剧痤疮。
尽管炎症和痤疮之间似乎存在联系,但尚无研究直接调查食物敏感性在其发展中的特定作用。这是一个值得研究的领域,有助于更好地了解食物,免疫系统和炎症如何影响痤疮的发生。
知道自己对哪些食物过敏,就别吃了吧~
以上7种是可能引起痤疮的食物,那么到底该吃什么呢?
以下建议可供参考。
Omega-3脂肪酸
Omega-3具有抗发炎作用,经常食用富含Omega-3的食物可降低痤疮的发生风险。
益生菌
益生菌可促进健康的肠道和平衡的微生物组,这与减少炎症和降低痤疮发生的风险有关。
绿 茶
绿茶含有多酚,与减少发炎和降低皮脂产生有关。绿茶提取物被发现可以减少痤疮的严重程度。
姜 黄
姜黄含有抗炎多酚姜黄素,可帮助调节血糖,提高胰岛素敏感性并抑制引起痤疮细菌的生长,从而减少痤疮。
维生素A,D,E和锌
这些营养物质在皮肤和免疫健康中起着至关重要的作用,可能有助于预防痤疮。
旧石器时代饮食
旧石器时代饮食富含瘦肉,水果,蔬菜和坚果,而谷物,奶制品和豆类则少。与降低血糖和胰岛素水平有关。
地中海式饮食
地中海式饮食富含水果,蔬菜,全谷物,豆类,鱼和橄榄油,而乳制品和饱和脂肪则少。它也与降低痤疮严重程度有关。
结 语
你可以不必完全避免与痤疮有关的所有食物(一般也做不到
),但应与上述其他营养丰富的食物一起,保持均衡饮食。

小 妙 招
如果有时间,可以坚持把吃的东西记录下来,看看某些症状是否与特定食物有关联。
长此以往,你可以慢慢去寻找正在吃的食物和皮肤健康之间的某种关系,那也将会是属于你个人的饮食宝典。
主要参考文献:
向上滑动阅览
Burris J, Rietkerk W, Woolf K. Acne: the role of medical nutrition therapy. J Acad Nutr Diet. 2013 Mar;113(3):416-30. doi: 10.1016/j.jand.2012.11.016. PMID: 23438493.
Burris J, Rietkerk W, Shikany JM, Woolf K. Differences in Dietary Glycemic Load and Hormones in New York City Adults with No and Moderate/Severe Acne. J Acad Nutr Diet. 2017 Sep;117(9):1375-1383. doi: 10.1016/j.jand.2017.03.024. Epub 2017 Jun 9. PMID: 28606553.
Blasbalg TL, Hibbeln JR, Ramsden CE, Majchrzak SF, Rawlings RR. Changes in consumption of omega-3 and omega-6 fatty acids in the United States during the 20th century. Am J Clin Nutr. 2011 May;93(5):950-62. doi: 10.3945/ajcn.110.006643. Epub 2011 Mar 2. PMID: 21367944; PMCID: PMC3076650.
Khayef G, Young J, Burns-Whitmore B, Spalding T. Effects of fish oil supplementation on inflammatory acne. Lipids Health Dis. 2012 Dec 3;11:165. doi: 10.1186/1476-511X-11-165. PMID: 23206895; PMCID: PMC3543297.
Aksu AE, Metintas S, Saracoglu ZN, Gurel G, Sabuncu I, Arikan I, Kalyoncu C. Acne: prevalence and relationship with dietary habits in Eskisehir, Turkey. J Eur Acad Dermatol Venereol. 2012 Dec;26(12):1503-9. doi: 10.1111/j.1468-3083.2011.04329.x. Epub 2011 Nov 10. PMID: 22070422.
Adebamowo CA, Spiegelman D, Danby FW, Frazier AL, Willett WC, Holmes MD. High school dietary dairy intake and teenage acne. J Am Acad Dermatol. 2005 Feb;52(2):207-14. doi: 10.1016/j.jaad.2004.08.007. PMID: 15692464.
Melnik BC, John SM, Schmitz G. Milk is not just food but most likely a genetic transfection system activating mTORC1 signaling for postnatal growth. Nutr J. 2013 Jul 25;12:103. doi: 10.1186/1475-2891-12-103. PMID: 23883112; PMCID: PMC3725179.
Vongraviopap S, Asawanonda P. Dark chocolate exacerbates acne. Int J Dermatol. 2016 May;55(5):587-91. doi: 10.1111/ijd.13188. Epub 2015 Dec 29. PMID: 26711092.
Bar-Peled L, Sabatini DM. Regulation of mTORC1 by amino acids. Trends Cell Biol. 2014 Jul;24(7):400-6. doi: 10.1016/j.tcb.2014.03.003. Epub 2014 Mar 31. PMID: 24698685; PMCID: PMC4074565.
Silverberg NB. Whey protein precipitating moderate to severe acne flares in 5 teenaged athletes. Cutis. 2012 Aug;90(2):70-2. PMID: 22988649.
Pietschmann N. Food Intolerance: Immune Activation Through Diet-associated Stimuli in Chronic Disease. Altern Ther Health Med. 2015 Jul-Aug;21(4):42-52. PMID: 26030116.