-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
出于消化和吸收的目的,哺乳动物已经形成了一个非常复杂且高度专业化的胃肠系统,由粘膜屏障维持。
越来越多的数据强调了肠道屏障和肠道通透性对健康和疾病的重要作用。然而,这些术语定义不明确,其评估存在争议,临床意义也没有明确确定。
肠漏症正在成为一种流行病。虽然它尚未被医学界广泛认可,但全球数亿人可能患有与肠漏综合征相关的症状和疾病。
本文讨论的是关于粘膜屏障及其在疾病预防和治疗中的作用的知识。
首先,定义相关术语“肠到屏障”、 “肠道通透性”、“肠漏”。
其次,描述了影响肠道通透性的肠道屏障的关键要素。这个屏障代表了一个巨大的粘膜表面,数十亿细菌面对着身体最大的免疫系统。一方面,完整的肠道屏障保护人体免受微生物和毒素的侵袭,另一方面,这个屏障必须打开以吸收必需的液体和营养。这两个看起来矛盾的目标是通过肠道屏障组成的复杂解剖和功能结构来实现统一的,这正是我们常听说的“肠道通透性”。
第三,描述了饮食和细菌对肠道通透性的调节。特别是,必须考虑潜在的屏障破坏因素,例如肠道灌注不足、感染和毒素,还必须考虑选择过量的营养物质、药物和其他生活方式因素。
第四,讨论肠道菌群对肠道通透性的互相影响,以及与通透性增加相关的特定疾病,例如危重病、炎症性肠病、乳糜泻、食物过敏、肠易激综合征,以及肥胖和代谢疾病。所有这些疾病都以炎症为特征,炎症可能由管腔成分易位到宿主中引发。
最后,讨论了评估肠道通透性的方法。手段差异很大,可能评估屏障的不同功能组件。
“肠道屏障”和“肠道通透性”描述了同一解剖结构的两个不同方面。
“肠道通透性”是一个术语,主要由电生理学家使用动物或人类的组织外植体在 Ussing 室中研究上皮通透性而形成。
注:Ussing Chamber(尤斯室,也叫尤斯灌流室)是研究跨上皮转运的工具,可用于包括离子转运、营养物质转运及药物转运等的研究。通过跨上皮转运的研究,可以了解上皮的离子通道机制、营养成分及药物透过上皮的吸收、影响上皮屏障功能以及通透性的因素等等。来源:百度百科
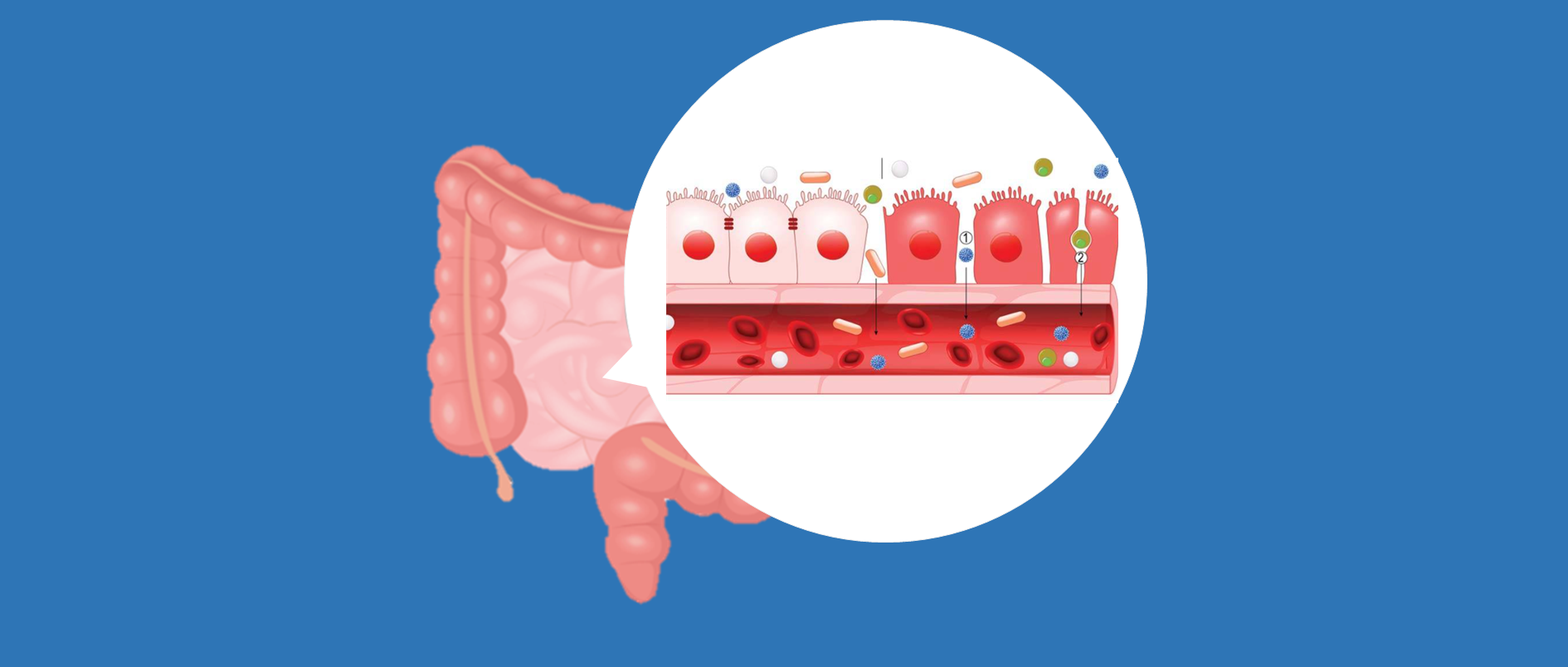
“肠道屏障”用来描述将内部环境与管腔环境分开的复杂结构。物理屏障包括由血管内皮、上皮细胞和粘液层组成。除了这个物理屏障之外,化学物质也参与了屏障功能。它们由消化分泌物、免疫分子、细胞产物如细胞因子、炎症介质和抗菌肽组成,主要由小肠隐窝中的潘氏细胞(Paneth cell)产生。
肠道屏障基本上将肠道内容物与身体分开。它由单层细胞(上皮细胞、传感细胞以及产生酶和神经递质的细胞)组成。这些细胞通过紧密连接(TJ)蛋白连接起来。
肠道屏障是一个动态实体,由多个元素组成,与各种刺激相互作用并做出反应。
首先,在管腔中,细菌和抗原被胆汁、胃酸和胰液降解,共生细菌通过产生抗微生物物质来抑制病原体的定植。
屏障的另一个要素是由未搅拌的水层、糖萼和粘液层组成的小环境,它们通过免疫球蛋白 A (IgA) 分泌以及糖萼和粘液提供的物理屏障防止细菌粘附。由顶端连接复合物连接的上皮细胞具有运输管腔内容物的能力,但它们也通过分泌氯化物和抗菌肽对有害刺激作出反应。
▃ 上皮层

谷禾健康
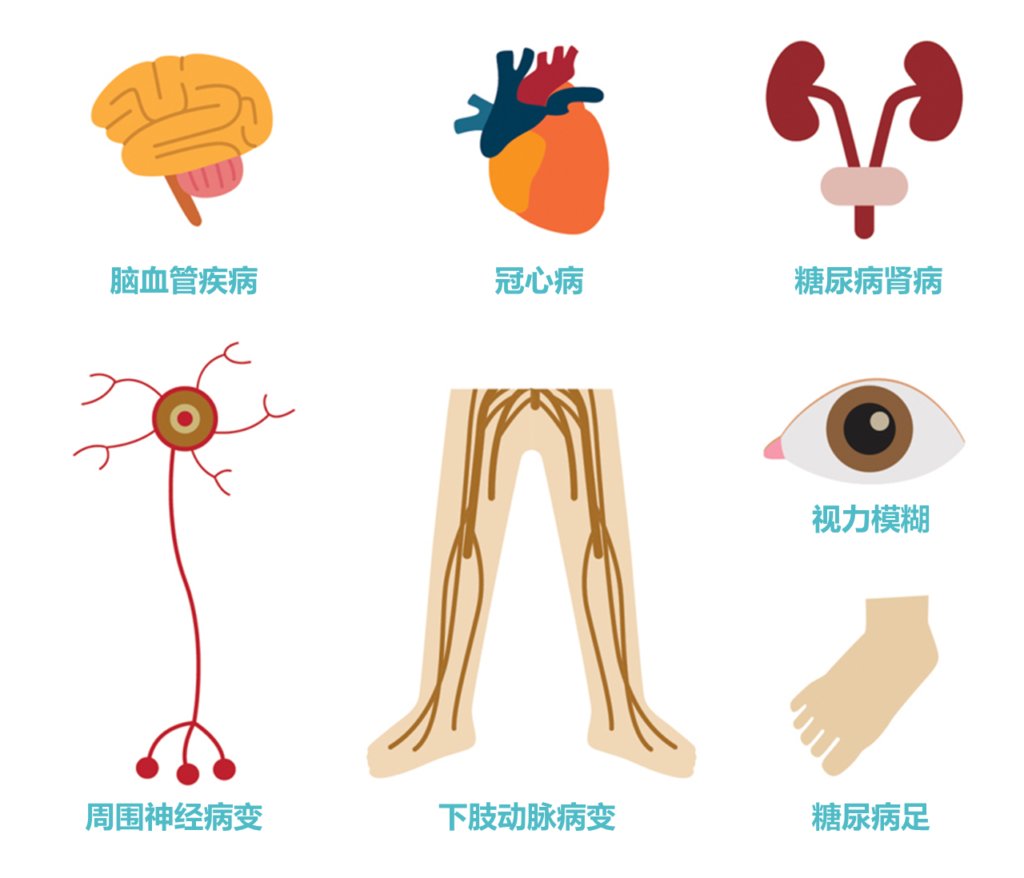
2型糖尿病是一种血糖水平升高(高血糖)的慢性代谢疾病,主要由胰岛素抵抗和胰岛素分泌不足引起。2型糖尿病全球患病率在不断上升。
截止到2020年,根据美国糖尿病学会评估标准,糖尿病患病率已达到12.8%。其实在我国成年人中,已经有将近一半的人存在血糖异常,未来极有可能发展为2型糖尿病。如果不加干预治疗,会引发许多不良后果。
很多研究表明,肠道菌群在宿主的代谢和疾病状态中起着重要的作用。特别是2型糖尿病,其病因复杂,包括肥胖、慢性低度炎症,受肠道微生物群和微生物代谢产物的调节。
本文将从肠道菌群的角度了解其与2型糖尿病的关系;肠道菌群及其代谢物对葡萄糖代谢、免疫系统的影响;
从影响肠道菌群变化的因素来了解各种干预措施,包括药物,饮食,益生菌/益生元,粪菌移植,间接性禁食等方式。
葡萄糖主要通过食用的食物和饮料进入人体。胰腺会产生一种叫做胰岛素的激素,以帮助血液中的葡萄糖进入肌肉、脂肪和肝脏,用作能量。
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像钥匙打开锁一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
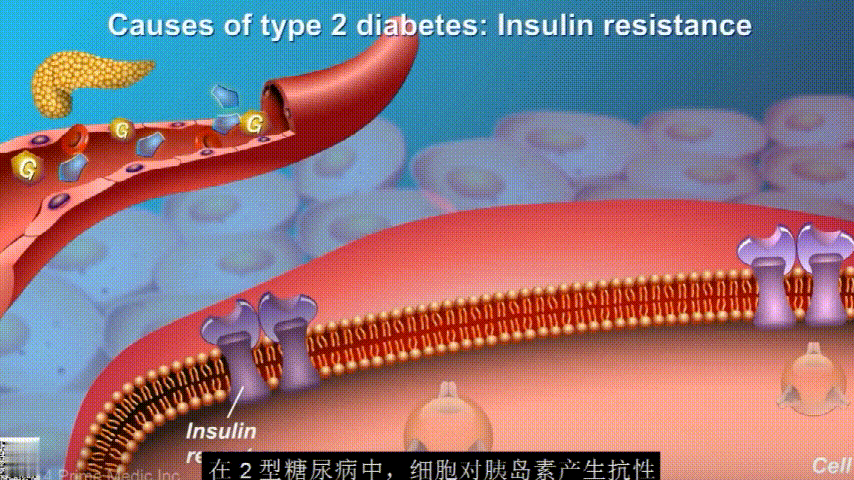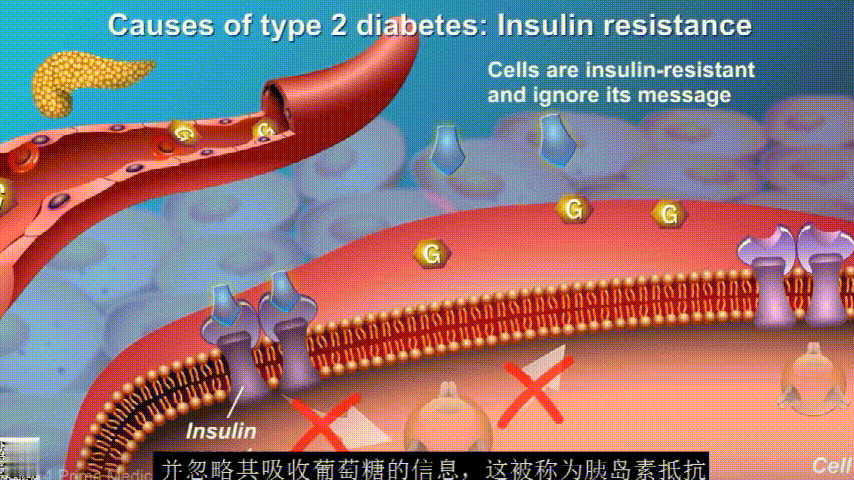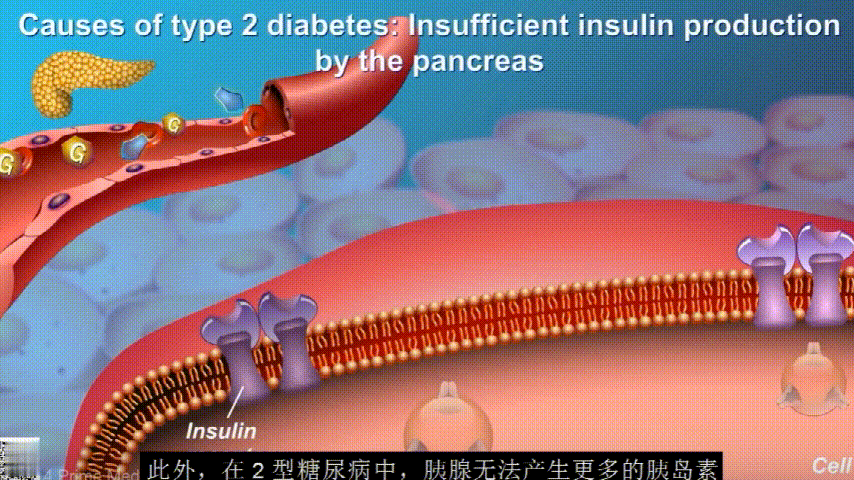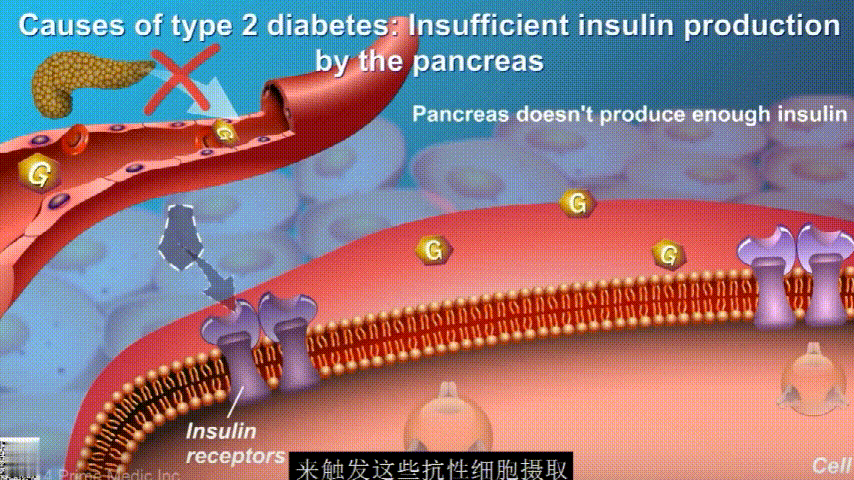
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
刚开始的时候,胰腺会觉得自己使不上力,于是不甘心开始拼命工作,产生更多的胰岛素来克服这种抵抗。
随着时间的推移,胰腺开始累了,力不从心,不能产生更多的胰岛素,这时候就是2型糖尿病开始了。
肠道微生物群可以直接或间接地影响人类健康,肠道微生物群失调可能会增加促炎疾病的患病率,如肥胖、炎症性肠病、2 型糖尿病、关节炎和癌症。
2型糖尿病人群中个体微生物群的差异
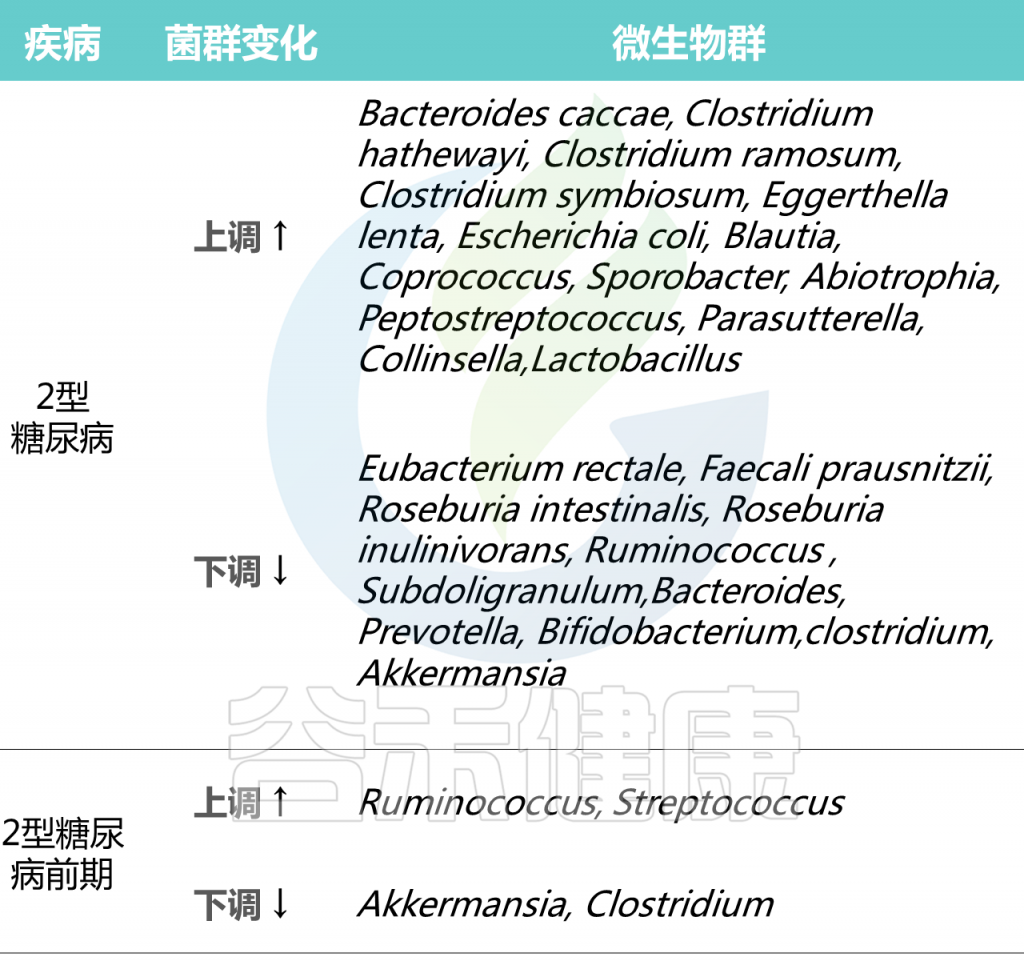

Cunningham A L et al., Gut Pathog, 2021
在2型糖尿病患者普遍具有相对高丰度的特定属:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
2型糖尿病患者中,产生丁酸菌特别缺乏,特别是梭菌目,包括:
Ruminococcus、Subdoligranulum,Eubacterium rectale、Faecali prausnitzii、Roseburia intestinalis 、
Roseburia inulinivorans
2型糖尿病患者中,其他明显较少的菌属有:
拟杆菌属、普雷沃氏菌属、双歧杆菌属
谷禾健康
2020年8月的一则消息让人深感痛惜,漫威系列电影《美国队长3》中饰演黑豹的演员查德维克·博斯曼因患结肠癌去世,享年43岁。

结直肠癌 (CRC) 是全球第三大常见癌症,每年有超过 100 万新病例和 600,000 例死亡。更糟糕的是,该病有越来越年轻化的趋势,有报告称,与1950 年出生的人相比,1990 年之后出生的人患结肠癌的可能性是其两倍,患直肠癌的可能性是其四倍。
科学家正在研究其原因,遗传因素在癌症发展中的作用相对较小(<10% 至 30%);而某些环境因素,例如食用大量加工食品、高脂饮食、纤维摄入不足、压力、炎症,甚至在儿童时期过度使用抗生素,这些可能是导致年轻一代结直肠癌风险显著增加的潜在原因。
以上所有因素都会改变肠道微生物群并诱导肠道微生态失调,从而导致宿主免疫系统低下进而发展为各种疾病。
肠道生态失调可分为三种类型:
有益菌的丧失
病原体或潜在有害物种的扩张
整体微生物多样性的丧失
在结直肠癌患者中这三种类型的失调都存在。
本文主要围绕肠道微生物群的改变与结直肠癌的关系展开讨论,也包含益生菌、益生元、合生元、后生元在结直肠癌中发挥的重要作用,以及结直肠癌的预防措施。
结直肠癌早期可能不容易被发现,很多情况直到晚期才引起症状。最常见的症状包括:
排便习惯的改变,例如腹泻、便秘或大便变窄,持续数天以上;
腹泻与便秘交替;
一种需要排便的感觉,但排便后也依然不能缓解这种感觉;
直肠出血,伴有鲜红色血液;
大便中带血,使粪便看起来发黑;
痉挛或腹痛;
虚弱或疲劳;
不明原因的体重减轻
结直肠癌患者具有独特的粘膜相关微生物群。例如,结直肠癌对微生物群的影响通常以微生物多样性的增加为特征,这似乎随着癌症的发展而进展——晚期结直肠癌样本(III 期和 IV 期)通常比早期结直肠癌样本(I 期)表现出更高的丰度。
黏 膜 菌 群
结直肠癌患者中,黏膜菌群变化如下:
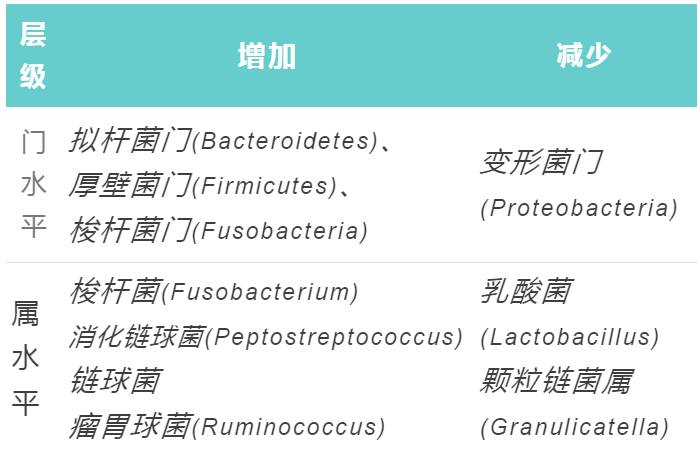

在癌变状态出现之前,也可以观察到黏膜相关微生物群的差异。来自息肉受试者和健康对照组的粘膜相关微生物群之间存在显着差异,这表明肠道微生物群从很早的阶段就参与了癌症的发展。
* 关于息肉和腺瘤:细胞的分化速度超过正常速度就会形成息肉,广义上来说,腺瘤就是息肉的恶变。
腺瘤组织的特征是变形杆菌和梭杆菌的丰度增加。
另一个大型队列多组学数据集表明,微生物组和代谢组的变化发生在结直肠癌发展的早期阶段,这可能具有病因学和诊断重要性。在成年早期至中期长期(≥2 个月)接触抗生素与60 岁时患结直肠腺瘤的风险增加有关。在结直肠癌患者中观察到的微生物群改变不仅限于肿瘤部位;也可以在周围的健康组织中看到。
正常和腺瘤患者体内微生物群主要细菌科的分布
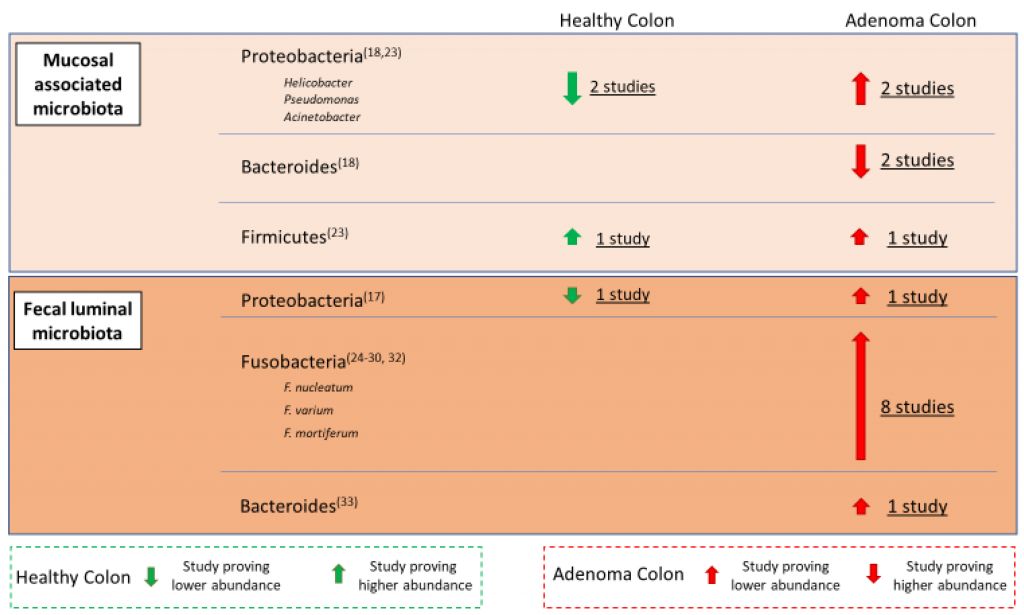

Aprile, F. et al., Cancers,2021

谷禾健康
虽然每个人都会老去,但是衰老的速度却不一定相同。生理年龄是每个人的遗传,环境和生活方式的影响。
人的一生,从出生到成年到老年,微生物组在免疫系统成熟,功能和调节中起着基本作用。免疫系统和微生物组形成一种互惠关系。
随着年龄的增长,免疫系统和肠道微生物组的组成和功能都会发生重大变化,这与对传染病的易感性增加有关。
导读
01)免疫衰老的一般标志
02)衰老和肠道微生物组
03)微生物老化的衡量指标
04)微生物老化加快免疫衰老和虚弱
05)肠道微生物组对疫苗反应的影响
06)对抗与年龄相关宿主免疫力下降的营养策略
07)恢复肠道微生物稳态、减少炎症和免疫衰老
08)健康长寿的普适方式
免疫衰老
“免疫衰老”是指在老年人中观察到的功能障碍,免疫反应有缺陷或异常。
与年龄相关的免疫反应的质量和数量的变化导致触发有效抗体和细胞反应抵御感染和疫苗的能力逐渐下降。
衰老的T淋巴细胞生物学研究十分突出,但所有造血源性细胞都显示出衰老的特征,包括功能失调的抗体产生B细胞、抗原呈递细胞、自然杀伤细胞和中性粒细胞。最早的造血祖细胞中也报告了表观遗传学改变,这可能解释了观察到的年龄相关的髓样细胞偏斜。
主要淋巴器官的老化(骨髓和胸腺磨损)、慢性抗原过载(如CMV)、肠道失调或炎症是免疫衰老的驱动因素,这些因素与遗传缺陷、细胞应激和/或细胞衰竭的累积一起,会导致免疫适应度随着年龄的增长而下降。
炎症
炎症是一种高度控制的生理过程,对对抗病原体、清除碎屑和愈合损伤至关重要。
随着年龄的增长,由于基因、环境和生活方式因素的复杂和不断变化的相互作用,促炎和抗炎之间的动态平衡下降。
慢性炎症状态是发病和死亡的一个重要危险因素。包括慢性感染、缺乏运动、内脏肥胖、饮食、心理压力、睡眠不足或肠道失调等多种因素都会引发和维持炎症。
长期暴露于应激源会加速细胞衰老和先天免疫失调,这是炎症的一个主要特征,反映在局部和全身炎症介质与白细胞介素-6(IL-6)、肿瘤坏死因子TNF-α 水平持续升高,IL-1β,C-反应蛋白(CRP)在老年人中普遍存在。
尽管先天性单核-巨噬细胞网络的失调可能是炎症的中心,但新的证据表明衰老细胞(包括T细胞和B细胞)通过其衰老相关的分泌表型参与慢性低度炎症的关键作用。
而慢性表达或暴露于炎症刺激可能使预先激活的免疫细胞对进一步的刺激难以耐受,从而导致观察到的老年人感染性疾病的频率和严重程度增加。
因此,先前存在的炎症已被证明是疫苗反应性的一个重要决定因素。
此外,炎症可能通过助长年龄相关疾病(包括代谢综合征、心血管疾病、肌细胞减少症、癌症和神经退行性疾病)而产生多种健康后果,因为大多数(如果不是所有)年龄相关疾病都具有炎症特征。
尽管衰老、炎症和慢性病之间存在着共同性,但生物医学研究继续巨额花费来单独解决这些疾病状态。这就提出了一个具有挑战性的问题,即:
针对慢性低度炎症或引起炎症的机制是否可能减缓衰老及其相关疾病?
虽然临床前研究表明炎症是导致年龄相关疾病和免疫反应性降低的一个因素,但证实这一假设的人类数据在很大程度上是缺失的。
而最近一项CANTOS的研究(Canakinumab Anti-inflammatory Thrombosis Outcomes Study)为老年人带来了巨大的希望。
对10000多名既往有心肌梗死史的稳定患者进行卡那单抗(Canakinumab,一种针对白细胞介素-1β的人单克隆抗体)治疗,可显著降低参与者的全身低度炎症。
重要的是,治疗方案可以预防复发性血管事件和肺癌的发生。虽然这些研究唤起了人们对有效抗衰老疗法的希望,但通过靶向阻断关键炎症介质来减少全身炎症需要在对传染病的易感性方面谨慎平衡。
这些免疫指标包括基于炎症年龄评分的iAGE、依赖于免疫球蛋白糖基化的聚糖生长或南丁格尔健康指数,其中糖蛋白乙酰化的全身炎症预测呼吸道感染、心血管疾病和全因死亡率的长期风险。
随着老龄化社会的健康管理成为一个日益增长的经济负担,这种免疫指标代表了有希望的工具,以确定风险个人的早期药物或营养干预。
为了应对不断变化的环境,肠道微生物通过菌种组成和代谢功能的变化动态响应。这个过程受到宿主免疫系统的严格调控,想象宿主免疫系统是一位建筑师,通过允许共生细菌生长和占据粘膜生态位,同时选择性地消除或中和有害微生物,从而塑造肠道微生物群。
随着年龄的增长,免疫适应度逐渐下降,宿主与微生物动态信号交换的监测受到损害,从而对宿主健康和免疫造成广泛的功能后果(图1)。
图1 模型:微生物老化及其对宿主免疫的相关影响
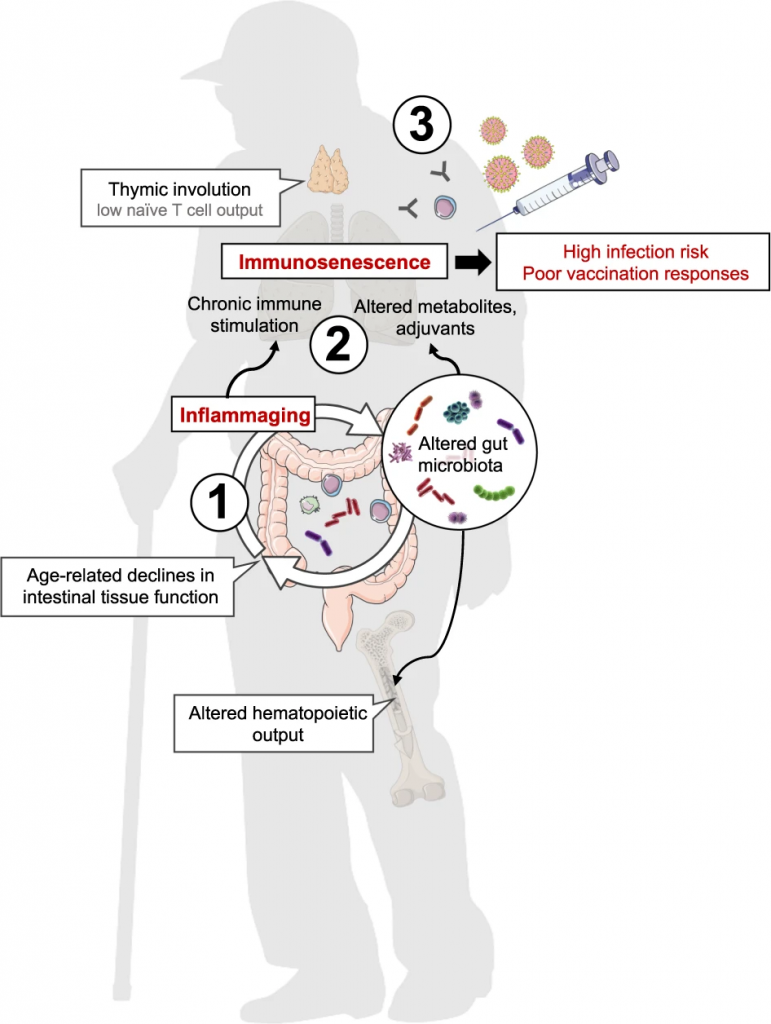

Nabil Bosco & Mario Noti,Genes & Immunity, 2021
(1) 年龄相关的肠道微生物群落变化和相关的肠道组织功能下降可能加剧炎症
(2) 由全身低度炎症引起的慢性免疫刺激、代谢组和微生物刺激的变化导致免疫衰老
(3) 免疫功能受损(如胸腺退化、造血功能改变),导致老年人感染风险增加,老年人接种疫苗反应差
在人类中,年龄相关的菌群失调(微生物老化)特征是梭状芽孢杆菌和双歧杆菌数量减少,变形菌门以及肠杆菌科等病原菌数量过多。
肠道微生物群落结构的组装也可能取决于宿主器官的功能。考虑到肠道的组织功能和完整性受到与年龄相关的显著变化,如再生能力、上皮屏障形成、黏液层组成和蠕动的改变,随着我们年龄的增长,粘膜生态位的变化很可能导致了失调状态。
这种肠道完整性的亚临床改变可能会促进微生物向全身部位渗出,全身性低度炎症,慢性炎症的发生和过早死亡。然而,确定人类的因果关系仍然具有挑战性,下文将进行讨论。
虽然,我们已经开始了解细菌的分类组成和多样性是如何随着年龄的变化而变化的,但我们对细菌进化和与宿主适应性相关的功能后果的了解仍然有限。有两种可能的情况:
1 肠道微生物群落结构中与年龄相关的变化是宿主衰老过程中发生的生理组织适应的简单结果
2 与年龄相关的失调是细菌进化的产物,通过使特定菌群逃避免疫监视,直接触发宿主衰老
因此,更好地了解老化的宿主微生物群,对于推进以微生物组为基础的治疗方法来对抗老化和与年龄相关的疾病至关重要。
我们需要先了解这样的概念。
生理年龄:指人达到某一时序年龄时生理和其功能所反映出来的水平,是从医学、生物学角度来衡量的。
肠道年龄:是基于健康人群每个年龄段样本的菌群构成使用深度神经网络模型提取特征菌属并构建的预测模型。
谷禾健康-肠道年龄预测模型图

注: 谷禾报告中的肠道年龄是基于超过6万人群队列的深度学习模型构建的,伴随年龄的变化肠道菌群也会相应的改变。对于0~2岁的儿童,肠道年龄通常偏差小于3个月,3~5岁偏差在6个月以内,6~15岁偏差在1岁左右,16~50岁人群正常肠道年龄的偏差在3岁以内,50岁以上正常偏差在5岁以内。在正常偏差内年龄差异可以理解为年轻或衰老,超出正常偏差的年龄无论是超过或低于都可能是菌群异常或健康状况不佳。
真实年龄与肠道预测年龄在范围内的差异可以反映其肠道菌群的发育和衰老状况。
以下情况可能会导致肠道预测年龄完全偏离真实年龄,包括:肠道菌群紊乱,菌群结构过于单一,近期服用包括抗生素等可能严重干扰肠道菌群的药物,病原菌感染或者处于疾病状态。
肠道菌群失调可以触发先天性免疫反应和慢性低度炎症,导致许多与年龄有关的退化性疾病和不健康的衰老。肠道菌群通过各种生物分子,营养素信号独立途径和表观遗传机制与宿主进行交流。与年龄有关的肠道菌群失调会干扰这些交流,从而影响宿主的健康和寿命。
与年龄相关的肠道微生物组成的改变不仅发生在人类身上,也发生在实验室模型生物身上。这些控制遗传、年龄、饮食和微生物组本身的模型系统提供了强有力的科学证据,表明宿主生理或微生物进化的内在改变足以促进一种失调状态。
这些模式生物已经证明肠道微生物群有潜力有益地调节衰老过程,以促进宿主的健康和寿命。
黑腹果蝇
对黑腹果蝇的研究(一个经常被用来研究微生物动力学、肠道生理中与年龄相关的变化和生物体健康之间相互作用的衰老模型)——已经完美地证明了肠道生态失调不仅是年龄相关肠道屏障功能障碍、系统免疫激活和机体死亡的前兆,而且还预测了这些疾病的发生。
结果表明,在整个生命过程中保持在无菌条件下的果蝇显示出较低的衰老率,这表明在这些模型设置中防止与年龄相关的菌群失调可以限制炎症,改善免疫稳态,促进健康。
非洲绿松石鳉鱼
利用自然短命的脊椎动物非洲绿松石鳉鱼(Nothobranchius furzeri)进一步证实了肠道微生物群在调节衰老过程中的影响。年轻的微生物群的慢性定植在中年鱼,诱导了长期有益的系统效应,导致脊椎动物的寿命延长。将年轻的供体微生物群定植在年老的鱼,与已知产生代谢产物的关键细菌属的存在有关,这些代谢产物既能维持免疫系统健康,又有抗炎作用。
小鼠
年轻小鼠菌群 → 早衰小鼠:特定菌发挥作用
将年轻供体的粪便微生物群移植到早衰小鼠中,可改善后者的健康状况和寿命,并将疣微菌门verrucomicrobia,Akkermansia muciniphila移植到早衰小鼠中,从而充分发挥有益作用。
此外,与年龄相关的Akkermansia muciniphila缺失与肠道完整性受损和胰岛素抵抗相关——这是一个通过微生物组-单核细胞-B细胞轴介导的过程。
除了对宿主代谢的影响,Akkermansia muciniphila还参与了调节抗原特异性T细胞反应和抗体产生来调节宿主免疫功能。
小鼠菌群 → 无菌小鼠:T细胞活化增加
用年轻或年老小鼠的肠道微生物群定植无菌(GF)小鼠。将老年供体微生物组移植给年轻小鼠足以促进肠道炎症、微生物产物向循环的渗漏和慢性低级别炎症的发生。作为全身低度炎症的结果,全身免疫区的T细胞活化增加。
年老菌群→年轻小鼠:巨噬细胞功能失调
另一项研究报告了类似的发现,在年轻的GF接受者中,移植一种老年微生物组可促进全身低度炎症。这些情况下的炎症进一步与巨噬细胞功能失调相关,巨噬细胞是炎症细胞因子的有力来源,其细菌杀灭活性较差。此外,基因或抗体介导的肿瘤坏死因子α(低度炎症的标志性细胞因子)的减少,可以预防年龄相关的肠道失调和相关的全身低度炎症。
年龄相关肠道免疫力下降:增加M细胞可恢复
最近的一项研究强调,年龄相关肠道免疫力下降可以通过操纵肠道微生物组增加M细胞数量来恢复。年老小鼠暴露于年轻的微生物群或鞭毛蛋白刺激都足以观察到这种效应:Peyer’s补丁中的M细胞成熟恢复,增强抗原摄取,年老小鼠肠道IgA反应增加。基于微生物组干预的M细胞修复确实依赖于肠道干细胞功能的改善,这表明修复老年肠道的再生能力可能对提高肠道免疫力有额外的好处。这些发现可能与改善口服疫苗应答或预防老年人胃肠道感染有关。
年龄相关肠道菌群改变影响造血
除了局部免疫调节外,年龄相关的肠道群落结构变化也可能对造血产生直接影响。对小鼠的研究表明,肠道微生物组的改变与造血系统的多谱系改变和多能祖细胞的抑制有关。
鉴于肠道微生物群通过促进造血功能密切参与了细菌感染的控制,与年龄相关的肠道微生物群平衡和多样性的变化可能导致老年人造血功能受损、更易感染和减少疫苗接种应答。然而,为了更好地理解年龄相关的生态失调对造血系统调节的影响,还需要更多的研究来支持这一假设。
总的来说,这些临床前模型系统的发现表明,校正与年龄相关的肠道菌群失调是有益的,为基于微生物组的治疗方法改善免疫系统功能、对抗衰老及相关疾病提供了理论依据。
虽然粪便微生物群移植(FMT)在动物模型中具有抗衰老特性(见上文),并且FMT已成功用于治疗男性复发性艰难梭菌感染,但在临床环境中提出FMT作为抗衰老策略仍存在一些障碍。更好地了解健康微生物组的特征(包括病毒组和真菌组)对于确保接受者的长期安全至关重要。
尽管我们对整个生命中肠道微生物群的理解取得了很大进步,但在疫苗学上的潜力尚未实现。鉴于微生物组严格调控免疫细胞的发育和功能,它可能最终影响疫苗的疗效。因此,由环境、社会经济、营养或卫生条件引起的肠道微生物群落结构的变化可以解释疫苗应答中的地理异质性。
对微生物群如何促进疫苗应答的机制更好地理解,可能有助于制定新的策略,以减少老年人感染性死亡。
直到最近,表明肠道微生物组影响疫苗接种反应的最佳证据来自使用无菌或缺乏微生物的小鼠的临床前模型系统。
研究人员探讨不同抗生素方案对抗原特异性体液免疫应答的影响,研究了克拉霉素、强力霉素和氨苄西林对小鼠破伤风类毒素(TT)、肺炎球菌多糖疫苗(PPV)、乙型肝炎病毒表面抗原(HBsAg)疫苗和减毒沙门氏菌活疫苗(Ty21a)的一级和二级抗体应答的影响。
有趣的是,抗原和抗生素的特异性反应都受到了影响。
克拉霉素和强力霉素抑制典型的T细胞依赖性和T细胞非依赖性抗体反应,而氨苄西林的效果较差或无效果。
此外,所有三种抗生素,特别是氨苄西林增强了对Ty21a-a减毒细菌粘膜疫苗模型的体液反应。在GF小鼠中进行疫苗接种实验的进一步工作证实了这些初步发现。
到目前为止,现有的研究主要集中在细菌,以及包括病毒、真菌、原生动物和古生菌在内的微生物群的其他组成部分。然而,仍然存在两个重要问题:
(一) 微生物群参与宿主免疫反应(特别是疫苗反应)的机制是什么?
(二) 这些发现对人类的影响是什么?
迄今为止,最令人信服的数据表明,肠道微生物群提供了佐剂的天然来源,能够调节宿主的系统和黏膜疫苗反应。
这一观点最初是在Nakaya等人的系统生物学报告中提出的,他们描述了在非佐剂流感疫苗接种三价灭活疫苗(TIV)后,人类toll样受体-5 (TLR5)的早期(第3天)和瞬时基因上调。TLR5的表达与TIV诱导的血凝抑制(HAI)滴度(滴度是稀释度的倒数)呈正相关。
随后,该研究小组证实TLR5对小鼠肠道微生物分泌的鞭毛蛋白的感应与TIV介导的应答有关。虽然直接给予鞭毛蛋白或有鞭毛的细菌移植可以提供天然佐剂来改善非佐剂流感疫苗的应答,但它不能与其他佐剂或活疫苗如破伤风-白喉-百日咳(Tdap)、黄热病(YF-17D)或重组乙型肝炎抗原(Recombivax HB)配合使用。
除TLR5外,另一种模式识别受体核苷酸结合寡聚结构域2 (NOD2)的特异性贡献,人血清白蛋白(HSA)抗原和霍乱毒素(CTX)佐剂鼻内刺激诱导的粘膜疫苗应答小鼠模型。在GF小鼠、抗生素处理小鼠或基因修饰缺乏NOD2信号的突变小鼠中,HSA特异性IgG反应持续下降。当这些动物接受一种被NOD2或表达MDP的细菌识别的肽聚糖MDP(muramyl dipeptide, MDP)时,HSA特异性IgG反应恢复。
虽然尚未使用人体相关疫苗,但这第二项工作表明,常驻微生物也可以增强用于粘膜疫苗接种方案的CTX的佐剂效果。需要进一步研究揭示肠道微生物群、其细胞壁成分或代谢物作为内源性疫苗佐剂的免疫能力,以放大对特定病原体的适应性免疫应答。
临床前和临床报告均观察到膳食纤维对功能免疫参数的积极影响,包括疫苗应答(表1),进一步支持基于其组成(细菌的性质)和或活性(分泌的代谢物的性质)的肠道微生物群的重要免疫调节潜力。
表1 益生元和/或益生菌临床干预试验探讨老年人免疫相关结果


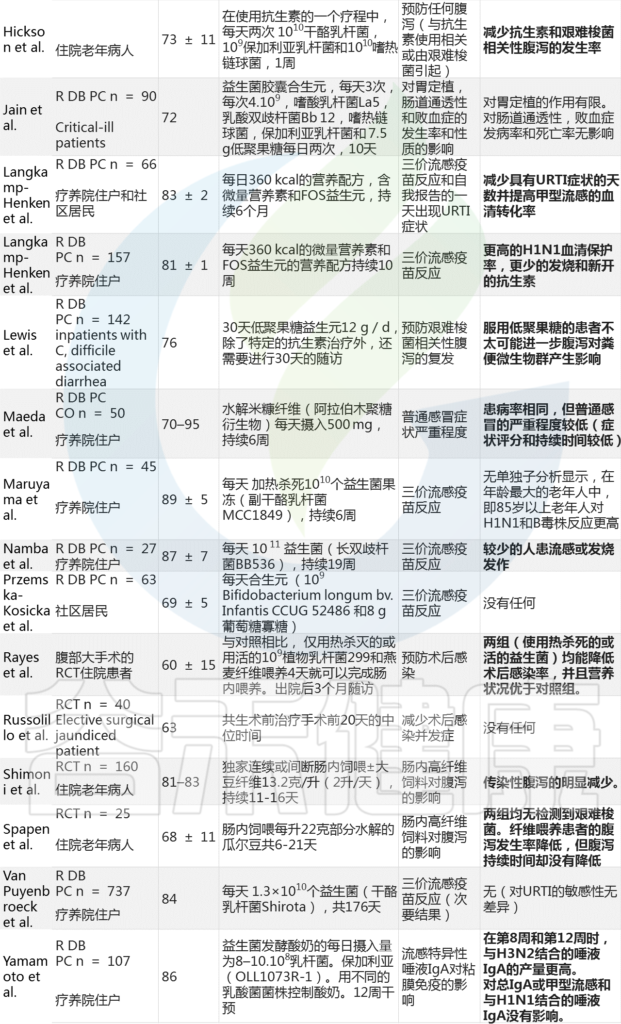
Nabil Bosco & Mario Noti,Genes & Immunity, 2021
关于纤维消化产生的短链脂肪酸(SCFAs)免疫调节活性的大量文献证明了这一点。这些代谢物在局部或全身释放,参与宿主的一般生理过程。
肠道微生物组组成和功能的动态变化也可以解释疫苗应答中观察到的地理异质性。研究人员还报道了成人和老年人接种流感疫苗后体液免疫反应的显著差异(超过100倍)。
宿主遗传、营养状况、母乳喂养习惯以及卫生条件和/或之前接触过病原体,被提出用来解释疫苗免疫原性的差异。然而,近年来研究宿主微生物群的技术进步为这一领域提供了新的思路。
粪便微生物群特征研究表明,肠道菌群组成可能影响口服脊髓灰质炎、卡介苗、破伤风类毒素和乙肝病毒的疫苗接种效果。
此外,在某些国家的儿童中,小肠细菌过度生长(SIBO)的流行率高。SIBO还可能限制疫苗的性能,因为相关的吸收不良、肠道微生物群和宿主免疫细胞之间争夺关键营养物质以及或通过渗漏的肠道系统释放微生物分子。从南非收集的样本中观察到反应迟钝的全血细胞(标准TLR刺激试验),并将来自北美和欧洲儿童的年龄匹配样本进行了比较。
上述人体研究仅存在相关性。
最近进行了三项研究,以确定婴儿和成人肠道微生物群失调和疫苗应答之间的因果关系。
在第一个大型(n = 754)和良好对照的研究中,广谱抗生素治疗(阿奇霉素)减少了致病性肠道细菌的流行,但没有改善印度婴儿的口服脊髓灰质炎疫苗接种。
接下来,Harris等人在开放标签试验中使用广谱抗生素(万古霉素)或广谱抗生素(万古霉素、环丙沙星和甲硝唑)治疗66名荷兰健康成人,并研究TT、口服轮状病毒(RV)和多糖肺炎球菌(Pneumo23)疫苗的应答。虽然RV疫苗观察到一些积极的效果,抗生素治疗没有改善TT或肺炎23价反应。
最后,Hagan和他的同事进行了一项研究,22名年轻的成年人接受广谱抗生素(万古霉素、新霉素和甲硝唑)治疗,然后接受TIV疫苗。虽然这种治疗对以前接种过流感疫苗的成年人影响有限,但在11名以前没有接触过流感(接种疫苗或自然感染)的健康个体中进行的第二次试验提供了突破性的发现。那些首次接受抗生素治疗的人的体液免疫反应,特别是对H1N1流感毒株的免疫反应大大减弱。
这些数据证实了早期的小鼠研究,并证明抗生素驱动的生态失调导致了非佐剂TIV引起的疫苗应答的显著改变。用系统生物学方法进行的更深层次的分子图谱也揭示了一种特定的炎症基因特征,即与抗生素治疗相关的更活化的髓系树突状细胞。
合理设计以微生物为内源性佐剂的疫苗在疫苗学领域具有广阔前景。这些方法可能需要个性化和工程可逆性来管理脆弱个体的疗效和潜在并发症。鉴于饮食是塑造肠道微生物群的最有力因素之一,营养干预与益生菌和益生元促进多样化的微生物群来维持健康受到了相当大的关注。
食品的发展是为了促进健康或减少疾病风险,1980年代中期,出现了“功能食品”一词:希望支持以营养为基础的预防性方法,以提高生活质量,减少与老龄化人口相关的医疗成本。
由于肠道微生物与宿主免疫系统的密切相互作用,临床试验研究的提高老年人免疫力的功能食品主要包括益生元(如纤维)、益生菌、两者的结合(即共生)或分泌可溶性代谢物(也称为后生元,如短链脂肪酸)。
随着年龄的增长,免疫适应能力下降,老年人无力抵抗感染,无力对抗原挑战作出反应,大多数这些试验探讨了感染流行程度、严重程度和持续时间或特定的疫苗接种结果。
在已确定的400项临床研究中,研究人员根据其相关性(免疫读数和目标人群为60岁的老年人)保留了31项研究,并将其总结在表1中。
这些研究是在社区居民、疗养院居民或住院患者中进行,这些患者可以服用口服补充剂或需要管饲。
大多数研究(20项研究)是随机双盲安慰剂对照组,考虑经典的混杂因素,如年龄、性别,有时还有医疗条件、营养状况、感染史或疫苗接种史。
预防感染性并发症,特别是危重症或选择性手术患者中艰难梭菌相关腹泻是第二个有意思的领域。
在对老年人进行的13项研究中,6项呈阳性。它们积极的性质也可能表明,疾病预防可以通过人体免疫系统的不同方面来实现。
疫苗挑战研究通常测试适应性免疫系统的功能,但没有解决某些细菌感染中与年龄相关的先天免疫下降的后果。然而,最近在英国23家养老院进行的规模最大的研究,即“益生菌减少养老院居民感染”试验,LGG和BB12胶囊每天服用长达1年,对预防感染没有效果。在感染症状、抗生素使用、住院或死亡率方面没有发现差异。
总的来说,可能有多种原因,研究之间缺乏一致性,如菌株特定差异或剂量,以及益生元性质和数量,或受试者的年龄和医疗条件。
这些研究中没有一项对干预前和干预后的患者微生物群进行了广泛的分析。虽然这些数据可能作为独立报告存在,以描述成分的特性,在未来,对干预前后的人体微生物群和免疫参数进行系统的平行评估是至关重要的,以揭示相关的相互作用或因果关系。
虽然实际年龄是不可逆转的,但随着年龄的增长,与肠道微生物群、炎症和免疫衰老相关的衰老变化是免疫介导的慢性疾病的共同帮凶,这可能是维持免疫和健康的目标。
当消炎药和衰老疗法选择性地消除衰老细胞(衰老抑制剂)或抑制衰老相关分泌表型(衰老表型)时,作为抗衰老疗法的临床试验正在迅速发展(图2),它们的长期使用需要谨慎地平衡对传染病的易感性和潜在的其他副作用。
为什么减少全身低度炎症可以促进疫苗应答,而疫苗学的主流观点是佐剂通过促进局部炎症来改善疫苗应答,这一悖论还需要进一步的研究来解释。
图2 恢复肠道微生物稳态、减少炎症和免疫衰老以支持老年人免疫功能的方法
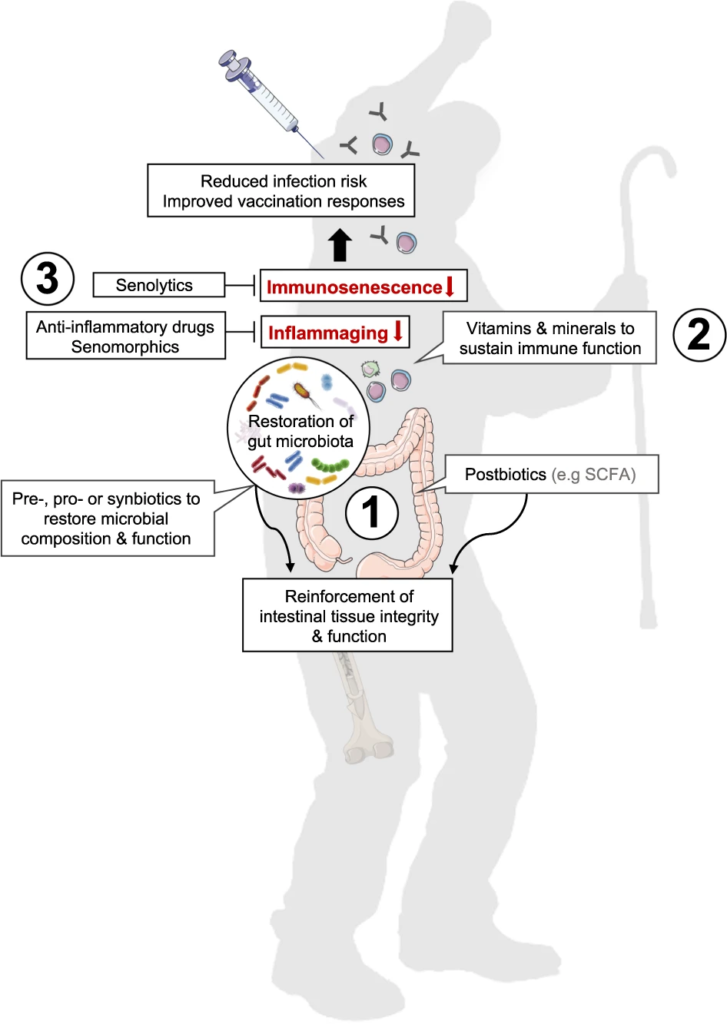
Nabil Bosco & Mario Noti,Genes & Immunity, 2021
(1)益生菌或益生元或合生元、后生元(如SCFAs)等进行干预可能有助于恢复与年龄相关的肠道微生物组成和功能下降
(2) 补充维生素和矿物质有助于正常的免疫细胞功能。
(3) 消炎药或老年药可能有助于减少炎症,而老年药直接消除老化细胞,燃料炎症。
单独或联合使用可能有助于增强宿主免疫,更好地控制感染,并随着我们年龄的增长产生适当的疫苗接种反应。
鉴于肠道微生物对宿主免疫系统的影响越来越大,可以合理推测,通过个性化营养或补充,恢复与年龄相关的肠道微生物丰富度和功能的下降,可能是一种对抗免疫适应性功能下降的预防措施。
在这种情况下,已在临床环境中测试了能够通过支持肠道屏障完整性或调节炎症过程来增强免疫力的益生菌、益生元、后生元或合生元(表1)。
然而,由于研究、菌株特异性差异或剂量、益生元的性质和数量或受试者的年龄和医疗条件之间缺乏一致性,因此很难验证这种方法在增强与年龄相关的宿主免疫适应性下降方面的有效性。
肠道微生物群是一个有待挖掘的宝藏,衰老学也不例外。正如许多临床前研究所证明的那样,恢复年轻的微生物群可以通过维持免疫和健康跨度来恢复老年宿主的活力。
因此,更好地了解肠道微生物群落结构和相关代谢组的动态变化,这些改变如何影响细胞免疫网络,以及这些通路如何被治疗靶向,将对未来加强甚至恢复老化免疫系统的策略产生广泛的影响。随着人口老龄化的加剧,迫切需要这样的解决方案来支持健康老龄化,减缓不断增长的医疗费用。
健康饮食
Omega-3脂肪酸
随着年龄的增长,神经细胞萎缩,向大脑提供的营养丰富的血液供应减少,Omega-3脂肪酸,尤其是二十二碳六烯酸(DHA)可以促进神经细胞之间的有效电信号传递,减少炎症,甚至可以改善精神集中度并与记忆力丧失作斗争。
较小的脑体积与阿尔茨海默氏症以及正常衰老有关。研究人员发现,血液中omega-3脂肪酸EPA和DHA水平较高的绝经后妇女的脑体积也更大。
富含Omega-3脂肪酸的食物:
鱼类:鲱鱼,沙丁鱼,鲭鱼,鲑鱼,大比目鱼,鳟鱼
绿叶蔬菜: 抱子甘蓝,菠菜,芝麻菜,薄荷,羽衣甘蓝和豆瓣菜
油: 亚麻籽油,正大籽油,鳕鱼肝油和磷虾油
其他:蛋、核桃等
黄酮类化合物
几乎所有的水果,蔬菜都含有类黄酮,具有许多健康益处,包括减少炎症,降低心脏病风险和湿疹症状,对衰老的大脑有益。有研究发现,食用大量浆果(类黄酮含量较高)的老年妇女将记忆力下降的时间推迟了两年以上。
类黄酮含量高的食物:
浆果: 蓝莓,草莓和黑莓
绿叶蔬菜: 菠菜,羽衣甘蓝和豆瓣菜
彩色农产品:胡桃南瓜,牛油果,李子,红葡萄
其他:咖啡,黑巧克力,红酒
维生素E
防止细胞损伤。已有几项研究发现,维生素E可以延缓轻度到中度阿尔茨海默病的进展
富含维生素E的食物:
坚果和种子:杏仁,山核桃,花生酱,花生,榛子,松子和葵花籽
油:小麦胚芽油,葵花籽油,红花油,玉米油,大豆油
绿叶蔬菜:菠菜,蒲公英嫩叶,唐莴苣,萝卜叶
运动
走楼梯:
瑞士一项研究发现,久坐不动的人把乘电梯换成走楼梯,过早死亡的风险可以降低15%。哈佛早期的研究显示,与每周爬楼梯少于10层的人相比,每周能爬35层或更多的楼梯能显著提高寿命。
骑车:
骑自行车上班是一种环保又健康的方式,在一天中挤出锻炼时间在户外,还能节省点油钱。
游泳:
一项数据发现,经常游泳的男性比久坐不动的男性死亡率低50%,游泳者的死亡率也比运动时走路或跑步的男性低。
每天锻炼15分钟:
2011年的一项研究发现,与久坐不动的人相比,每天15分钟锻炼可以平均延长3年的寿命。
保护牙齿
如果牙齿一直很敏感,那么随着年龄的增长,牙齿会越来越容易脱落,这会影响老年生活品质。请保持日常牙科护理的最佳状态,防止蛀牙。
保持良好的生活习惯
保证充足的睡眠:
NIH的数据显示,每晚持续睡眠少于7个小时的成年人患高血压,心脏病,肥胖,糖尿病和抑郁症的风险更高。另外,晚上睡不好会抑制重要激素的释放,这些激素可以修复细胞和组织,抵抗疾病和感染,睡不好会使身体无法自然康复。
尽可能避免吸烟:
戒烟可以减少许多疾病风险。
适当缓解压力:
压力容易让人变老。尝试放弃明显的压力源,适当安排休息时间,
经常锻炼记忆力
记忆就像肌肉一样可以训练;如果充分利用自己的记忆并定期使用它,记忆力可以磨练到老。比如每天尝试做一个填字游戏,以帮助建立和维护词汇量和记忆力。
《阿尔茨海默氏病杂志》上的一项研究显示,吃蓝莓可以增强记忆力和学习能力,喝苹果汁可以通过防止重要的神经递质的衰退来改善记忆力。
选择适宜的养老居住地
可以选择气候宜人的地方居住,良好的空气质量有助于保持健康,环境条件佳也有利于保持好心情。此外尽量选择拥有良好的经济和医疗体系的地方,帮助维持积极长寿的生活。
做好健康管理
定期进行肠道菌群健康检测或其他检查,及时了解自身健康状况,包括哪些风险,需要注意事项等,做好健康管理,享受健康幸福的晚年生活。
相关阅读:
主要参考文献:
Hägg S, Jylhävä J, Wang Y, Xu H, Metzner C, Annetorp M, et al. Age, frailty, and comorbidity as prognostic factors for short-term outcomes in patients with coronavirus disease 2019 in geriatric care. J Am Med Dir Assoc. 2020;21:1555–9.e2.
Khan SS, Singer BD, Vaughan DE. Molecular and physiological manifestations and measurement of aging in humans. Aging Cell. 2017;16:624–33.
Crooke SN, Ovsyannikova IG, Poland GA, Kennedy RB. Immunosenescence and human vaccine immune responses. Immun Ageing. 2019;16:25–16.
Butler CC, Lau M, Gillespie D, Owen-Jones E, Lown M, Wootton M, et al. Effect of probiotic use on antibiotic administration among care home residents: a randomized clinical trial. Jama. 2020;324:47–56.
Bosco Nabil,Noti Mario,The aging gut microbiome and its impact on host immunity.[J] .Genes Immun, 2021
Book: Mayo Clinic Family Health Book, 5th Edition
Wang J, Varghese M, Ono K, Yamada M, Levine S, Tzavaras N, Gong B, Hurst WJ, Blitzer RD, Pasinetti GM. Cocoa extracts reduce oligomerization of amyloid-β: implications for cognitive improvement in Alzheimer’s disease. J Alzheimers Dis. 2014;41(2):643-50.
James V. Pottala, Kristine Yaffe, Jennifer G. Robinson, Mark A. Espeland, Robert Wallace, William S. Harris Neurology Feb 2014, 82 (5) 435-442
Dysken MW, Sano M, Asthana S, et al. Effect of Vitamin E and Memantine on Functional Decline in Alzheimer Disease: The TEAM-AD VA Cooperative Randomized Trial. JAMA. 2014;311(1):33–44.
Berryman CE, West SG, Fleming JA, et al. Effects of Daily Almond Consumption on Cardiometabolic Risk and Abdominal Adiposity in Healthy Adults With Elevated LDL-Cholesterol: A Randomized Controlled Trial. Journal of the American Heart Association. January 2015.

谷禾健康

骨质疏松——“沉默的杀手”,是一种骨代谢异常的慢性病。别以为骨质疏松很遥远,骨质疏松正无声无息地向年轻人逼近。
肌肉骨骼系统是整个人类健康的重要决定因素。除了充当人体支架外,它还通过生化信号与体内其他器官不断沟通,具有基本的内分泌功能。
人的肠道内有一个复杂的微生物群落,会影响许多调节肌肉骨骼发育和体内平衡的过程。
肠道菌群及其代谢产物与肌肉减少症,骨质疏松症,骨关节炎和类风湿关节炎有关。该领域正在迅速发展,从描述简单的相关性到通过临床试验寻求因果关系。
肠道菌群及其微生物合成代谢产物鉴于其可延展性和对环境刺激的反应,有望为肌肉骨骼疾病的预防和治疗提供新的潜在替代品。
越来越多的证据表明,肠道菌群可以调节骨骼的通透性,激素分泌和免疫反应,并刺激钙和维生素D的吸收,从而在肌肉骨骼系统中发挥作用。
肠道微生物组对肌肉骨骼健康和疾病过程的影响可以是直接的或间接的。

骨代谢依赖于成骨细胞、骨细胞和破骨细胞作用下骨形成和骨吸收之间的平衡。骨质在出生后开始累积,并在成年后达到高峰,此后下降。最高的峰值骨量与降低以后的骨质疏松症风险有关,模拟研究表明,峰值骨量增加10%会使骨质疏松症的发作延迟13年,最大化峰值骨量和强度的措施非常重要。
注:骨质疏松特征是骨骼组织的微结构恶化加剧,骨骼质量低下,最终导致脆性骨折。
微生物组研究在骨骼健康方面的研究越来越热,在2013年至2019年期间,PubMed中出现了435多篇。
宿主的新陈代谢途径,免疫系统和激素环境是骨代谢的重要决定因素。因此,有理由认为肠道菌群在骨稳态中也起着重要的作用。骨质疏松症的风险与肠道微生物组的个体差异有关。
肠道微生物群有助于保持肠道屏障的完整性。肠道微生物群影响钙和维生素D的吸收,免疫系统的成熟,以及雌激素和雄激素等激素的产生和激活。
此外,肠道菌群失调可导致炎症细胞因子的产生,使肠道屏障易位,并对骨产生有害影响。益生菌和益生元已显示出缓解或恢复骨骼健康的潜力。

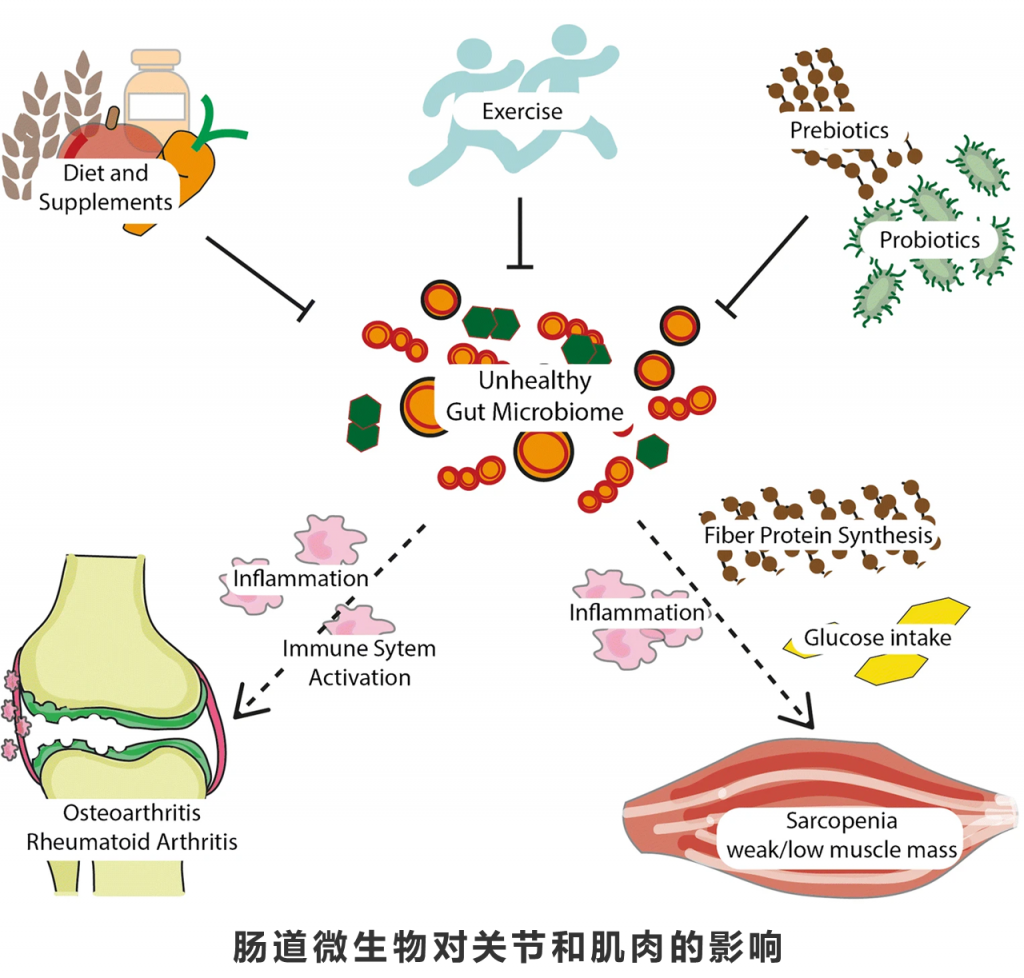
肠道微生物群可通过宿主免疫、炎症等机制影响关节健康。而对肌肉健康的影响还包括葡萄糖摄入、能量代谢和纤维蛋白合成。
营养与骨骼发育
钙和维生素D是骨骼健康的关键营养素,其消耗或缺乏会导致不利的骨骼并发症。
维生素D
对缺乏症儿童补充维生素D的随机对照试验表明,骨矿物质密度(BMD)有所改善。
维生素D除了直接影响钙吸收外,还通过维持上皮屏障的完整性以及微生物代谢物向宿主的转运来调节肠粘膜的稳态。这种调节也会影响免疫系统的成熟和炎症反应。
关于其与肠道菌群的关系,最近的一项小型干预研究表明,在青春期女孩中大量补充维生素D会导厚壁菌,双歧杆菌和肠球菌的增加,而拟杆菌和乳杆菌减少。
与这些发现一致,维生素D受体(VDR)敲除(KO)小鼠的微生物组中,拟杆菌和梭状芽孢杆菌富集,但乳酸杆菌耗尽。此外,这些小鼠的碳水化合物、蛋白质、脂质和胆汁酸代谢产生的代谢物也发生了变化。
这些研究支持维生素D调控肠道菌群的论点,也支持肠道菌群全基因组关联研究(GWAS)中VDR基因变异的鉴定。
相反,也有证据表明肠道菌群影响循环维生素D的水平。例如,127个个体的临床试验表明,在9周的干预后,补充罗伊氏乳杆菌NCIMB 30242增加了平均循环25-羟基维生素D 25.5%。
除此之外,像浅灰链霉菌Streptomyces griseolus这样的细菌可以像人类代谢酶一样,羟化维生素D3,这是激活维生素D3的必要步骤。
钙吸收
钙是人体内最常见的矿物质。为了达到高峰值骨量,钙的摄入需要充足,特别是在快速生长期间,吸收的钙被保留,而不是通过尿液排出。
一些研究表明,肠道菌群产生的短链脂肪酸(SCFAs)有助于改善人体对钙的吸收,并增加动物模型的骨密度和强度。
这些研究主要集中在食用膳食纤维的优势及其在增加短链脂肪酸以及副杆菌属、双歧杆菌属、拟杆菌属相对丰度方面的作用。
这些研究的重要性在于使用益生元(即诱导有益微生物生长或活动的化合物)或后生元(即活微生物分泌的因子)来纠正钙缺乏,而无需增加富含钙的食物或补充剂。
然而,有研究表明,肠道菌群和钙水平之间的关系不是单向的。补钙可以增加小鼠体内的微生物多样性和双歧杆菌、瘤胃球菌科Ruminococcaceae和阿克曼菌Akkermansia的数量。
此外,在健康男性中补钙和磷,持续8周,会增加粪便样本中梭状芽孢杆菌Clostridium XVIII的比例。
维生素K
研究表明,维生素K通过促进成骨细胞向骨细胞的转化、限制破骨细胞的生成和介导骨钙素羧化过程而与骨健康相关。
然而,最近的一项研究也表明这种维生素与有机或矿物物质的组成和结构的变化有关。通过对小鼠粪便微生物群的宏基因组分析以及对骨组织的纳米化学分析,作者能够确定骨强度受损的小鼠体内微生物产生的维生素K的浓度降低。

膳食纤维
两项大型流行病学研究显示,纤维摄入对骨预后有积极影响。假设纤维对健康的影响至少部分由肠道菌群发酵到SCFAs(乙酸、丙酸、丁酸)来解释。
除了SCFAs的积极作用外,丙酸(C3)或丁酸(C4)的使用还预防小鼠卵巢切除诱导的以及炎症依赖性骨丢失。
丁酸还可以抑制组蛋白脱乙酰化酶,并刺激成骨细胞分化,并随着骨唾液蛋白和骨保护素的增加而增加骨形成。丁酸通过调节细胞介导的WNT10B表达,可刺激骨形成。
从机制上讲,C3和C4诱导破骨细胞的代谢重编程,从而导致糖酵解增强,而不消耗氧化磷酸化,从而降低必需破骨细胞基因TRAF6和NFATc1。
最近,在小鼠牙槽骨中,也观察到破骨细胞分化的减少,以应对SCFAs的作用。与这些结果一致,以富含短链半乳寡糖和长链果糖(scGOS/lcFOS)为饲料的小鼠,肠道菌群作为生产SCFAs的底物,显示出一种改良的骨密度。
激素对骨骼代谢的作用
胰岛素样生长因子1(IGF-1)
IGF-1在调节骨骼发育和出生后生长中起着重要作用。Igf1 KO小鼠出生后生长速度降低,骨骼骨化延迟,而Igf1的过度表达显著增加了雄性和雌性小鼠的桡骨生长。
与无菌(GF)小鼠相比,肠道菌群完整的小鼠血清IGF-1水平更高。与预期一样,GF小鼠的线性生长、股骨长度、皮质厚度和骨小梁减少。给予短链脂肪酸足以增加循环IGF-1。
然而,一项在不同小鼠品系中进行的研究却显示了相反的结果。这些看似矛盾的发现可能由实验对象的特定遗传背景和/或年龄依赖性效应来解释。人类肠道病毒组中的Irdoviradae家族病毒可产生病毒胰岛素/IGF-1样肽(VILPs)。这些肽能够与小鼠和人IGF-1受体结合,并在体外刺激细胞生长。
性激素
在绝经后女性中观察到的雌激素缺乏对骨内稳态产生不利影响,循环雌激素的主要调节因子之一是肠道菌群。
肠道菌群通过分泌雌激素来调节雌激素β-葡萄糖醛酸酶(一种将雌激素解偶联成其活性形式的酶)。当这一过程因肠道菌群多样性降低而受损时,去结合的减少导致循环雌激素的减少。
破骨细胞的过度形成和吸收被认为是雌激素缺乏引起骨质疏松的主要病理改变。此外,雌激素缺乏会增加肠道通透性,使细菌易位,增加进入上皮粘膜的抗原数量,从而导致全身炎症。与正常小鼠相比,由于破骨细胞因子的减少,GF小鼠在雌激素缺乏后骨丢失较少。
此外,基于不同乳酸菌的益生菌降低破骨细胞因子的表达,增加骨组织中OPG的表达,保护小鼠免受卵巢切除(OVX)诱导的骨丢失。据报道,长双歧杆菌Bifidobacterium longum也能减轻OVX大鼠的骨丢失。
此外,通过去除肠道微生物群的抗生素或施用罗伊氏乳杆菌Lactobacillus reuteri来预防肠道渗漏的在糖皮质激素诱导的小鼠骨质疏松症中被证明是有效的。
雄激素,也是骨骼发育和维护所必需的。最近,有研究表明,肠道菌群可以调节远端肠道中的游离睾酮(DHT)水平,DHT是一种有效的雄激素。
但是,有必要进行进一步的研究以弄清肠道菌群是否具有调节肠道外部位雄激素代谢和作用的能力。
微生物群在免疫和炎症中的作用
肠道菌群在免疫系统的成熟中起着核心作用。它参与了循环细胞因子的产生和淋巴样细胞的发展,特别是T辅助淋巴细胞。
随着年龄的增长,特别是在雌激素缺乏的情况下,T细胞增加促炎和促破骨细胞因子的产生,如TNF-α和RANKL。肠道菌群增加这些细胞因子和减少小鼠皮质骨的能力实际上依赖于引起炎症反应的NOD1和NOD2信号。
研究还表明,toll样受体5 (TLR5)的激活,先天免疫系统使用的另一种模式识别受体,促进小鼠破骨细胞的形成和骨丢失。此外,TLR5-KO小鼠出现骨膜扩张,当肠道菌群被破坏时,骨膜扩张趋于正常,这与肠道菌群的中介作用一致。
运动是骨质疏松症管理的另一个重要组成部分,因为体育活动增加骨密度,减少炎症标志物。最近,有人提出,运动可能通过改变肠道菌群来防止骨流失。这是基于一项在小鼠中进行的活动研究的结果,双歧杆菌科成员已知可以减少肠道炎症,与骨密度正相关。
关联研究发现骨质疏松个体(N = 60)的放线菌、Eggerthella、Clostridium Cluster XlVa、乳酸杆菌属与骨密度正常个体(N = 60)相比,骨质疏松个体(N = 61)的大肠杆菌/志贺氏菌和韦荣球菌属Veillonella的丰度较低。各组间多样性指标无统计学差异。
相比之下,另一项研究发现患有骨质疏松症(N = 48)与个体与正常水平的BMD (N = 48)相比,具有更高的菌群多样性和丰富的Dialister和Faecalibacterium。
而两项中国研究,每个大约几百个人,分别报道了双歧杆菌Bifidobacterium、Roseburia、乳酸菌Lactobacillus和Allisonella、克雷伯菌Klebsiella、巨球菌Megasphaera和骨密度之间的相关性。
这些不一致的结果表明,在调查可能的新关联时,使用足够的样本量和控制多重测试的重要性。
基于微生物组的临床试验
在瑞典进行的两项不同的临床试验显示,绝经后妇女使用益生菌后骨质流失显著减少。
第一组,90名绝经后妇女,研究显示,在1年后每日补充乳杆菌reuteri 6475,出现胫骨体积骨密度损失减少(组间平均差异=1.02%;95%置信区间:0.02 – -2.03%)。
第二项研究的重点是腰椎(LS)的骨质流失。
323名绝经后早期妇女完成了试验,其中一半(116)接受了益生菌或安慰剂,12个月。
LS-DXA扫描分别在进食当天和一年后进行。与安慰剂相比,乳酸菌降低了LS-BMD损失(平均差异0.71%,95% CI 0.06至1.35)。在安慰剂组中,LS-BMD损失显著(-0.72%,−1.22至−0.22),而在乳酸菌处理组中没有观察到骨质损失(-0.01%,−0.50至0.48)。作者的结论是,乳酸菌菌株似乎针对小梁和皮质骨的不同作用机制。
相反,一项对76名健康绝经后的日本妇女进行的临床试验发现,在全髋部给予枯草芽孢杆菌C-3102 24周对髋部骨密度有积极影响(安慰剂= 0.83±0.63%,C-3102 = 2.53±0.52%,p =0.043)。与安慰剂组相比,益生菌的参与者的LS-BMD(腰椎)没有观察到显著的效果。基于微生物组谱,尿I型胶原交联N-末端肽和抗酒石酸酸性磷酸酶亚型5b的测量,作者推测C-3102通过抑制骨吸收和调节肠道菌群改善骨密度。
在一项包括50名健康绝经后伊朗妇女的研究中,与安慰剂组相比,干预组也检测到血清1型胶原交联c -末端肽(CTX)较低。干预组包括25名女性,连续6个月每天GeriLact。GeriLact含有干酪乳杆菌、长双歧杆菌、嗜酸乳杆菌、鼠李糖乳杆菌、保加利亚乳杆菌、短双歧杆菌和嗜热链球菌。干预组骨特异性碱性磷酸酶(BALP)水平降低也支持骨转换减少的存在。
肠道微生物组对骨骼肌质量和功能的影响
即使肠道-肌肉轴还没有被研究到肠道-骨骼轴的程度,这个领域研究仍在发展。
这一轴可能参与肌肉萎缩疾病的发病机制,通过从饮食营养素,炎症和胰岛素敏感性等调节前合成代谢刺激的转导(图1)。研究表明,无菌和施用抗生素的小鼠骨骼肌质量和物理功能降低。将肠道菌群从常规饲养的小鼠移植到无菌小鼠可导致骨骼肌质量的增加和肌肉萎缩标志物的减少。此外,仅仅使用短链脂肪酸就部分逆转了这些小鼠的骨骼肌损伤。
另一项研究表明,移植直肠真杆菌(Eubacterium rectale)、植物乳杆菌(Lactobacillus plantarum TWK10)和球囊梭菌(Clostridium coccoides)可以改善幼年无菌小鼠体质、运动性能和能量代谢下降的状况。
同样地,在使用抗生素的小鼠中发现了跑步耐力的降低和离体肌肉疲劳度的增加,这种疲劳度可以通过肠道菌群的自然重新播撒而完全恢复正常。
在人类中,一项小型研究表明,与功能低下的老年人相比,瘦体重更高、身体表现更好的老年人的粪便样本中普雷沃菌属和Barnesiella的含量更高(高功能,N = 18;低功能,N = 11)。高功能个体的人类微生物群定植无菌小鼠导致它们的握力更高。
然而,在高功能人类微生物群和低功能人类微生物群定植的小鼠中,没有观察到总瘦重量或耐力的差异。目前,爱尔兰正在进行一项临床试验,旨在评估凝结芽孢杆菌Bacillus coagulans作为益生菌对肌肉蛋白质合成率的影响。如果补充凝结芽孢杆菌可以在消耗植物蛋白后提高肌肉蛋白质的合成率,那么这可能是一种有效的、环境敏感的策略,可以减少老年人与年龄相关的肌肉质量和身体功能的不良损失。
肠道微生物组对关节的影响
骨关节炎(OA)是世界范围内最常见的慢性退行性关节疾病,也是导致关节残疾的主要原因。目前,OA没有治愈方法。公认的骨性关节炎的危险因素是肥胖和巨噬细胞介导的炎症,两者都与肠道菌群有关(图1)。
原则上,肠道菌群可以减少肥胖的不同机制将对改善OA风险有很大影响。因此,长期高脂肪饮食的小鼠易于发展肥胖介导的骨性关节炎。然而,通过对副干酪乳杆菌亚种paracase M5或益生元低聚果糖的干预可以降低这种风险。
此外,最近的一项小规模研究表明,在含有高细菌LPS(脂多糖)水平的血清和滑膜液中,膝关节囊和滑膜中激活巨噬细胞,导致OA病理恶化。
最近在一项针对老年人的大规模人群研究中发现,链球菌种类的丰富与膝关节疼痛和膝关节炎症增加有关。人体临床试验已经显示了干酪乳酸菌代田株Lactobacillus casei Shirota 和嗜热链球菌Streptococcus thermophilus在膝关节骨性关节炎进展中的积极作用。
肠道微生物组对免疫反应的影响
类风湿性关节炎(RA)是一种自身免疫性疾病,全身性慢性炎症导致关节破坏。在小鼠和人类的RA研究中都观察到口腔和肠道微生物群组成的改变。
在RA病例中发现了几种肠道菌群富集,包括普雷沃氏菌(Prevotella)和不同种类的乳酸杆菌(Lactobacillus)。
此外,口腔微生物群Cryptobacterium curtum已被发现在RA病例中富集。这种细菌能够产生大量瓜氨酸,瓜氨酸在RA中作为一种自身抗原而为人所知。在一项用大鼠进行的研究中,干酪乳杆菌Lactobacillus casei 也能抑制RA的诱导并保护骨骼免受破坏。
肠道菌群在肌肉骨骼研究中呈现了一个新前沿。在研究能够转化为临床之前,仍需克服几个障碍。
1. 16S技术在识别特定菌或评估功能潜力方面的分辨率有限,与宏基因组不同。
2. 大多数微生物组研究样本量太小。
3. 微生物组数据的收集、提取和分析的方法和程序需更多地标准化。
本文总结的有效临床试验很可能为进一步的研究肠道菌群和骨代谢关系,以及新疗法的开发提供动力。
目前对肌肉骨骼疾病的治疗仍有很大的改进空间,肠道菌群是一个转折点,代表着机会越来越多。在肌肉骨骼疾病方面,也可以将其定位为个性化医疗革命的潜在关键驱动力。
相关阅读:
肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?
参考文献:
Song W, Liu Y, Dong X, Song C, Bai Y, Hu P, et al. Lactobacillus M5 prevents osteoarthritis induced by a high-fat diet in mice. J Funct Foods. 2020;72:104039.
Li R,Boer C G,Oei L et al. The Gut Microbiome: a New Frontier in Musculoskeletal Research[J] .Curr Osteoporos Rep, 2021.
Lopez-Oliva I, Paropkari AD, Saraswat S, Serban S, Yonel Z, Sharma P, et al. Dysbiotic Subgingival Microbial Communities in Periodontally Healthy Patients With Rheumatoid Arthritis. Arthritis Rheumatol. 2018;70(7):1008–13
Huang WC, Chen YH, Chuang HL, Chiu CC, Huang CC. Investigation of the effects of microbiota on exercise physiological adaption, performance, and energy utilization using a gnotobiotic animal model. Front Microbiol. 2019;10:1906
Ticinesi A, Lauretani F, Tana C, Nouvenne A, Ridolo E, Meschi T. Exercise and immune system as modulators of intestinal microbiome: implications for the gut-muscle axis hypothesis. Exerc Immunol Rev. 2019;25:84–95

谷禾健康

肠道的内部环境作为外部环境和宿主之间的接口,不断受到宿主的消费习惯的挑战。在管腔一侧,微生物能够附着并定植于该空间,而在宿主一侧,胃肠道充当体内免疫细胞的最大隔室。
从解剖学上讲,肠道由不同的部分组成。十二指肠,空肠和回肠代表小肠(SI),它比由结肠和直肠组成的大肠(LI)占据更多的物理空间。与人类相比,啮齿动物的盲肠增大,盲肠囊是连接小肠和大肠的盲端囊。在小鼠中,盲肠充当了共生微生物的大贮藏库,这些微生物参与了无法通过其他方式裂解的纤维的发酵。 盲肠在小鼠中的作用很重要,因为它是短链脂肪酸(SCFA)产生的主要途径,去除盲肠会导致胃肠道远端部位炎症的增加 。在人类中,该部位微生物的体积远小于小鼠,但该隔室在兼性厌氧发酵中仍起着重要作用。
值得注意的是,共生微生物的组成和丰度在不同的胃肠道区域是不同的,例如,成年小肠中的微生物丰度低(<105个微生物/ mL),在结肠中则增加到1012。小肠和大肠具有独特的生理功能。 虽然十二指肠和空肠参与消化,营养吸收和运动过程,但大肠具有三个主要功能:吸收水和电解质,产生和吸收维生素以及形成和运输排泄的粪便。肠道不断暴露在食物颗粒和食物抗原,生理或机会性微生物群衍生的代谢产物以及其他免疫调节刺激。 胃肠道内的免疫细胞不仅对肠道内的抗原刺激作出反应,而且还显示出扩散到全身的远端器官,表明它们在全系统炎症稳态中的重要性。
微生物无处不在。 他们自我组织,在原本无法居住的生态环境中创建了复杂的生态系统,迅速适应了他们的环境。宿主依赖微生物组实现几种基本的共生功能,例如启动免疫系统和生产必需的维生素,以及从食物中获取能量。 肠道微生物群(定义为人类体内的微生物分类群)现在被认为是内分泌器官,可产生可在宿主中充当效应子的代谢产物,从而触发局部微环境或远端的靶器官系统(如心脏,肾脏,脉管系统)的反应和大脑。
肠腔内壁衬里是抵抗细菌感染的生理屏障,可以与毒素结合。此外,粘液是细菌的营养来源,因此会影响具有在粘液层中生存和扩展能力的微生物的定殖。Akkermansia muciniphila(AKK菌) 和Citrobacter rodentium (柠檬酸杆菌)能够降解粘蛋白,而后者在纤维缺乏期间会增殖。结肠粘液层完整性的丧失会增加宿主对病原体的敏感性。 在健康条件下,紧密的上皮层可防止病原微生物的入侵,而某些刺激物(如炎症性疾病或西餐)可导致肠道通透性和所谓的肠道渗漏综合征的发展。
随着高通量测序技术和代谢组学的建立以及高性能计算和人工智能的发展,人们逐渐破译生活方式,饮食,药物治疗和肠道微生物组之间的相互关系。每个人肠道微生物组随时间推移相对稳定,并与周围环境平衡共存。但是诸如抗生素,肠道感染以及饮食或生活方式变化等扰动都会引起短暂或持续的变化。
在过去的几十年中,实验和临床研究表明,先天性和适应性免疫系统的细胞在高血压,靶器官损害和心血管疾病(CVD)的发病机理中起着关键作用。促炎性效应记忆T细胞和 T辅助细胞亚型T辅助细胞17(Th17;产生IL-17)和1型辅助细胞(产生IFN-γ)促进高血压和心血管靶器官损伤,而调节性T细胞(Tregs)通常产生大量的抗炎性IL-10可以减轻血管,心脏和肾脏的损害。
此外,γδT细胞和髓样来源的抑制细胞在高血压的发病机理中也起着重要作用。 已经证明可以改变几种T细胞亚型激活状态的树突状细胞会增加盐反应性高血压,并提示其在菌群失调与血压(BP)之间的相互作用中发挥作用。
细菌可以直接或通过其产生的代谢产物与参与心血管的不同免疫细胞发生反应。例如,分段丝状细菌或Bifidobacterium adolescentis(青春双歧杆菌)可诱导Th17细胞,而Lactobacillus murinus(鼠乳杆菌)及其色氨酸代谢产物吲哚3乳酸则可抑制Th17细胞。 和SCFA丁酸盐是结肠中Treg的杰出诱导剂。
图 肠道微生物与宿主免疫相互作用

在宿主和微生物组方面均可发现肠道空间变异性。内腔和组织相关内容的相对水平在此处进行了说明,表明这两种功能的区域专业化。 已知肠道中的内腔含量在微生物负荷,微生物种群以及所产生的微生物产生的代谢产物方面有显着差异。尽管在整个胃肠道中的种群和区域规格都受到微生物的影响, 根据管腔内物质含量的变化,宿主免疫系统同样具有区域特异性。
这里显示的是免疫细胞,这些细胞在免疫稳态过程中表现出空间动态。
高血压的发病机制涉及多种因素,包括遗传、环境、激素、血液动力学和炎症等。越来越多的证据表明,肠道微生物群在高血压的发生和发病机制中起着重要作用。胃肠道是人体内最大的免疫细胞库,代表着环境和宿主的交汇点。因此,生活方式因素的形成和调节的微生物组,影响着高血压疾病形成和发生的风险。一个被广泛研究的例子是膳食纤维的消耗,能导致短链脂肪酸的产生,并有助于抗炎免疫细胞的扩张,从而防止高血压的进展。饮食干预如禁食也被证明通过微生物群影响高血压。
图 血压与肠道菌群的关系
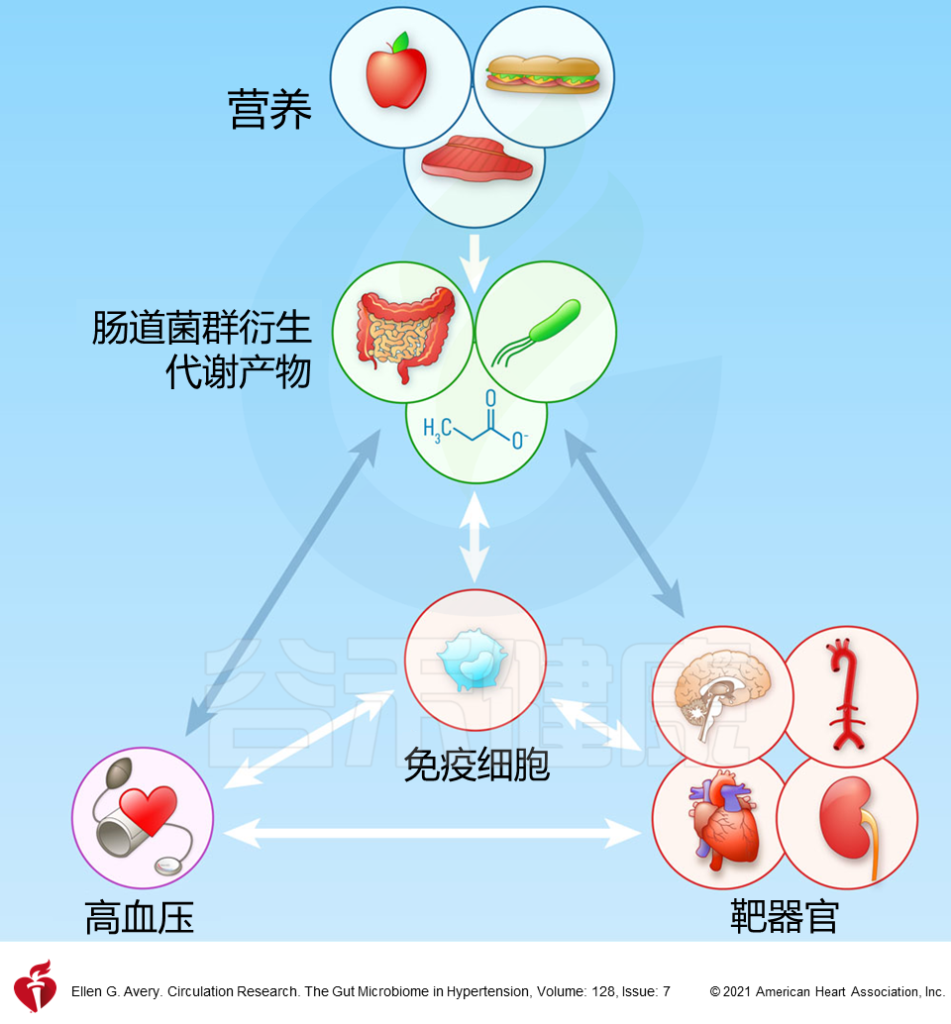
摄入的食物被肠道微生物群转化为小的代谢物。食物抗原、微生物产生的代谢物以及微生物本身都有助于免疫稳态。干扰宿主和微生物群之间的共生关系可通过免疫系统直接或间接导致血压变化和相关的心脏、血管或肾脏损害。
在过去的十年中,许多关于肠道微生物组和高血压的作用的证据已积累起来。多项针对人体的横断面研究表明,肠道微生物组与血压或高血压之间存在关联。高血压患者或血压较高的患者,α多样性降低,肥胖,高胰岛素血症和血脂异常也已观察到。 许多人类肠道微生物组研究报告了革兰氏阴性菌群较高的菌群之间的相关性,包括克雷伯菌,副细菌,脱硫弧菌和普氏菌,尽管并非所有研究都能确定这种模式。
来自HELIUS队列研究(城市环境中的健康生活)的研究表明,克雷伯菌属和链球菌属与血压呈正相关。此外,与高血压小鼠相比,从高血压人类供体接受粪菌移植的GF小鼠出现了与其供体相似的肠道菌群,以及8周后收缩压和舒张压升高。它从2个血压正常的供体那里接受了粪菌移植。
此外,还有几种有价值的啮齿动物高血压模型分析了肠道微生物组和血压的作用。自发性高血压大鼠存在失调,与正常血压WKY(Wistar-Kyoto)对照大鼠的微生物群存在显著差异。自发性高血压大鼠的肠道通透性和菌群失调也可能可通过使用降压药治疗大鼠来补救。
肠道微生物组与高血压之间的联系不是物种特异性的。 例如,在小鼠和人类中高盐处理都会减少乳酸杆菌属。 值得注意的是,未治疗的高血压患者中盐的适度降低能够降低血压并改善动脉顺应性。改善的临床结果伴随着8种循环SCFA的增加(包括2-甲基丁酸、丁酸、己酸、异戊酸和戊酸 )。此外,已证明益生菌乳酸菌处理可通过恢复吲哚3乳酸水平(抑制微生物色氨酸代谢)抑制Th17细胞并减轻盐敏感性高血压。
已显示,Lactobacillus coryniformis可以改善血管功能和胰岛素敏感性。Lactobacillus(乳杆菌)治疗不仅可以改善心血管疾病,还可以改善实验性自身免疫性疾病的结局。 对益生菌对高血压的作用进行调查的随机对照试验的系统评价表明,如果以足够高的剂量使用至少8周,含乳酸杆菌的益生菌是有效的。
在人类中,肠道中的核心微生物群落是稳定的,并且仅在响应诸如肠道感染,整体旅行或药物治疗等主要扰动时才发生变化,从而导致肠道微生物组发生短暂或持续的变化。 肠道菌群不仅对某些饮食刺激的比例具有反应性,而且还可能在时空环境中做出反应。
目前,我们对特定饮食变化影响炎症,自身免疫和心血管疾病易感性的确切机制的理解还很模糊。 使用经过微生物组组成和功能训练的机器学习算法可提供令人兴奋的机会,以促进更好地预测对营养刺激的反应。
新兴的研究表明,饮食因素(高盐或高纤维)和生活方式干预(盐分限制或热量限制)会影响微生物群落的结构和功能,这对免疫细胞活化和血压具有重要意义。西方人的生活方式通常涉及每天进食几顿主餐,并导致细菌多样性下降,某些食物喂养细菌的过度生长,以及随之而来的其他食物为底物的细菌的抑制。因此,菌群产生的代谢产物发生了转移,从而促进了炎症,最终可能导致肥胖症和动脉粥样硬化等疾病的发展。
从历史上看,餐食通常是新鲜烹制的,但如今,人们更经常食用通常含盐量更高的加工食品。这种生活方式通常会导致较高的盐摄入量 而不是医学指南或专家的建议。为减少心脏代谢疾病的风险,通常应节食健康的饮食和运动。 大多数建议的重点是将富含饱和脂肪,糖,盐和卡路里但纤维含量低的西方饮食改变为更健康的地中海式阻止高血压饮食方法,以实现最佳营养,平衡和降低盐摄入量,尽管合规性是一个重大挑战。
SCFA是最典型的微生物群代谢产物之一,它是在不易消化的纤维发酵过程中产生的。 乙酸,丙酸和丁酸是3种高丰度的SCFA。 膳食纤维是由≥3种单体组成的膳食碳水化合物的统称,如非淀粉多糖,抗性淀粉,菊粉,果胶,β-葡聚糖和低聚糖。 这些纤维状化合物中的大多数都被拟杆菌、厚壁菌和放线菌门微生物消化。Bifidobacterium adolescentis, Eubacterium rectale, Eubacterium hallii, Faecalibacterium prausnitzii ,Ruminococcus bromii 通常在大肠中定居,并具有消化纤维以生产SCFA的酶。
大肠的丙酸和丁酸水平比小肠高约4倍。SCFA在结肠中迅速吸收,而丁酸在很大程度上被用作向结肠上皮细胞提供能量的燃料。肠道SCFAs与门静脉血相比要高得多,而门静脉SCFAs较高,其次是肝脏血液,外周血最少,这表明SCFAs基本上被肝脏吸收。肝中丙酸的摄取是糖异生,脂肪生成的前体,以及蛋白质合成,而乙酸盐进入循环系统并被多个组织代谢,并且是胆固醇合成的底物。
SCFA可以与G蛋白偶联受体Gpr41(G蛋白偶联受体41),Gpr43( 小鼠中的G蛋白偶联受体43),Gpr109a(G蛋白偶联受体109 A),Olfr558(嗅觉受体558)和Olfr78(嗅觉受体78),也称为FFARs(游离脂肪酸受体)。FFARs存在于各种组织中,包括血管和肾脏,并参与调节丙酸、乙酸和丁酸的血管反应性。
Gpr41和Olfr78似乎都参与了血压的调节,尽管它们似乎促进了相反的作用。Olfr78激活后会诱导肾素分泌。与此相符的是,Gpr41敲除小鼠为高血压,有趣的是,醋酸盐以前曾用于血液透析缓冲液,但由于其降压作用而被大量废弃,这与SCFA在大多数情况下降低血压的观点一致。
纤维本身已被建议在一定程度上塑造微生物组成。
关于血压,纤维的刺激作用增加了SCFA生产者Faecalibacterium prausnitzii和Eubacterium rectale以及乳杆菌属的丰度。一项具有里程碑意义的研究表明,与传统上纤维含量高的未加工饮食的非洲儿童相比,食用西方饮食的欧洲儿童SCFA水平显着降低,Firmicutes与Bacteroidetes(F/B)比率高。自该研究以来,高F/B比率通常被用作肠道生态失调的替代指标,虽然也已知一些Firmicutes细菌产生有助于健康微生物组的微生物代谢物。
同样,实验工作通常依赖于F/B比作为疾病标志物。自发性高血压大鼠和易中风的自发性高血压大鼠显示F/B比率增加,这支持了这可以作为肠道生态失调的标志物的概念。
各种实验或临床研究已证明益生元高级纤维或后生SCFA治疗对血压的影响。研究报道丙酸在麻醉小鼠中诱导了急性的剂量依赖性降血压反应,这是由Gpr41介导的。益生元纤维不仅可以预防心血管疾病,而且这些营养素的缺乏可能是导致高血压和心血管疾病的危险因素。 还发现在低纤维饮食中添加益生元乙酸盐,丙酸盐或丁酸盐可改善血压并减少靶器官损害。
此外,GF小鼠的粪菌移植表明,与抗性淀粉相比,饮食中的肠道微生物组缺乏抗性淀粉。高纤维情况不仅在血管紧张素II攻击后导致较高的血压,而且还导致了心脏和肾脏损害的发病机制。
德国一项研究测试了在有和没有动脉粥样硬化的高血压小鼠中口服丙酸治疗的特性。在这两种模型中,丙酸治疗均能降低全身和局部炎症反应,血压以及心脏损害。丙酸的治疗作用是由Treg细胞介导的。但是该研究指出丙酸的降血压作用不是急性的,而是随着时间的推移而发生,提示SCFA的抗炎特性间接促进了血管表型的改善。Th17细胞和Th17与Treg的平衡介导SCFA在血压调节中的作用。
关于SCFA在血压中的作用的人类研究非常少见。对微生物群组成和高血压的一些研究表明,SCFA的生产者为Ruminococcaceae spp,Rothia或Roseburia spp. 与较低的血压相关。
在一项小型干预试验中,生物素丁酸酯(600 mg / d),益生素菊粉(10 g / d)以及这两者的组合均降低了代谢综合征患者的舒张压。在HELIUS队列中,将机器学习算法应用于微生物组数据可确定Roseburia spp解释对血压的最大绝对影响,甚至在调整混杂因素(包括使用药物)后,丰度也使收缩压降低4.1 mmHg。
相反,血压较高的患者的粪便SCFA水平较高。这种正相关与以前的研究一致,但似乎与血压与胃肠道内微生物SCFA生产者之间的负相关性相矛盾。 但是,粪便中的SCFA含量不一定反映肠道内的SCFA含量,而是反映肠道中产生的SCFA含量而宿主无法吸收的。
自发性高血压大鼠的实验工作支持了这一观点,表明实验性高血压会减少结肠丁酸对宿主的吸收。此外,AT1(血管紧张素II型1型)受体阻滞剂坎地沙坦(一种经常用于治疗高血压的药物) 已发现自发性高血压大鼠可以增加乳杆菌的丰度和粪便SCFA水平,改善肠道完整性并降低血压。
坎地沙坦治疗改善了重度肥胖受试者肠道中丁酸生成基因的缺失。总之,在HELIUS队列中,基于肠道微生物群组成的机器学习模型分别解释了收缩压和舒张压变异性的4.4%和4.3%。
纤维来源的SCFAs不仅影响血压,而且在其他心血管疾病和自身免疫中也起着关键作用。例如,用醋酸盐,丙酸盐或丁酸盐进行生物后处理可改善急性肾损伤。肾脏保护与局部和全身炎症反应减少,氧化性细胞应激和细胞凋亡。在多发性硬化症动物模型中,T细胞介导的中枢神经系统炎症性疾病丙酸盐增加了肠道和脾脏中抗炎Tregs的频率,这伴随着临床症状的改善。
高纤维摄入量和增加的SCFA浓度也被证明可以保护中枢神经系统。值得注意的是,多发性硬化症患者可以从丙酸盐治疗中获益。短期丙酸盐治疗导致显着和持续的富集功能正常的Tregs,同时1型辅助细胞和Th17细胞同时消耗。此外,补充SCFA或高纤维摄入对类风湿性关节炎(一种关节慢性炎症性疾病)的预后有积极影响。丙酸酯可增加骨量,并且发现SCFA通过增加Treg的数量刺激骨形成。
从机制上讲,SCFA可以影响不同的免疫细胞群。 例如,发现丙酸和丁酸处理后中性粒细胞产生的炎性细胞因子较少。丁酸还可以减少氧化应激和吞噬能力。
SCFA通过减少树突状细胞成熟并抑制CD4和CD8T细胞增殖来调节炎症过程。与乙酸盐相反,丁酸盐或丙酸盐通过HDAC(组蛋白脱乙酰基酶)抑制作用影响骨髓前体细胞的树突状细胞成熟。此外,丁酸可促使M1巨噬细胞分泌更少的炎性细胞因子,增加抗炎细胞因子IL-10的分泌。
SCFAs还引起人单核细胞和T细胞中抗炎标记的表达。 例如,丁酸抑制金黄色葡萄球菌刺激的人单核细胞中IL-12的产生并增强IL-10的分泌。
最近,研究证明了丙酸会降低Th17细胞分化的速率。还发现丁酸盐还通过Gpr43增加1型辅助细胞分化细胞中IL-10的分泌,由SCFA驱动的IL-10诱导激活STAT3(信号转导子和转录激活子3)和mTOR(雷帕霉素的机械靶标),从而上调转录因子B淋巴细胞诱导的表达成熟蛋白。
此外,SCFA最深入研究的特性之一是它们在诱导抗炎Treg中的作用。丁酸和丙酸可增加鼠和人Treg的分化并增强其抑制能力。除丁酸外,丙酸(而非乙酸)通过HDAC诱导外周新生Treg细胞形成。值得注意的是,Clostridia(梭菌)是共生微生物的主要类别,它介导了诱导性结肠Tregs,这与Clostridium butyricum(酪酸梭状芽胞杆菌)诱导Tregs并减少Th17细胞从而减轻实验性自身免疫的症状的发现是一致的。
越来越多的证据表明,禁食是控制代谢性疾病和炎性疾病的有效工具。热量限制会影响微生物组的基本原理令人兴奋。 然而,仍然缺乏关于人类的可靠数据。
一项研究关于10天定期禁食对15名健康男性的粪便微生物群的影响。禁食导致Lachnospiraceae和Ruminococcaceae菌减少。一项小型的人体试验研究表明,斋月禁食影响了健康受试者的微生物组,丰富了一些SCFA生产者。
在一项临床研究中,35名代谢综合征患者接受了5天的禁食,然后进行了3周的DASH饮食,也被译为「得舒饮食」,字面意思是防止高血压的饮食方法饮食。

对照组仅接受DASH饮食。禁食后接着DASH饮食降低血压,需要抗高血压药物和干预后3个月的体重,并改变影响SCFA生产者的肠道微生物群。队列对血压反应性的分层显示,空腹组中存在的免疫细胞变化在血压反应者中比在无反应者中更明显。
此外,禁食组的免疫移位与DASH组观察到的变化根本不同。观察到干预后禁食组中血压响应者特异性微生物组的变化(F.prausnitzii,拟杆菌和厚壁菌的富集;放线菌的消耗)。值得注意的是,丁酸盐生产者F.prausnitzii的富集甚至在禁食后3个月仍然存在。血压反应者和无反应者不仅对禁食反应不同,而且在基线时的丙酸合成能力不同。
将机器学习算法应用于基线免疫组或16S微生物组数据,预测模型通过重新分析调查禁食和血压影响队列(Mesnage数据集)证实,队列中显着的长期血压下降预计准确率约为70%,进一步支持这些发现可能是普遍化的想法。重要的是要强调,上述研究建立了微生物组和血压之间的关联,以应对禁食。禁食对许多患者来说是一项艰巨的挑战。能够操纵负责响应禁食的血压变化的机制将具有高临床效用。
禁食是热量限制的一种极端形式,在不同的文化和宗教习俗中起着重要的作用。 大量的热量限制不仅影响宿主的健康和生理,还降低了血压。生活方式和饮食引起的微生物群及其代谢产物的扰动可直接影响上皮细胞和免疫细胞的稳态。但是我们对营养,微生物群和微生物产物,免疫系统与宿主健康或疾病之间的联系仍处于‘婴儿期’。
宿主-微生物组相互作用对人类健康和疾病显然有影响。模型系统经常用于基础和临床前高血压研究,以研究疾病的发病机制和进展。小鼠和大鼠模型非常有用,可以提供人类队列研究无法获得的信息。然而,在模型系统中研究人-宿主-微生物组相互作用存在许多障碍。
差 异
01 胃肠生理学和形态学有许多方面,这在人类和啮齿动物物种之间是截然不同的。盲肠可能是人类和啮齿动物不同物种形成的最明显的例子,以及小鼠结肠粘液层的薄度。
02 小鼠和人类对炎症应激物的基因组反应是明显不同的,这可能与宿主特异性或微生物组特异性特征或两者的组合有关。
03 居住在胃肠道的微生物在小鼠和人类之间通常也是不同的。人和小鼠只有约15%的细菌谱系。虽然它们在属或门的水平上可能具有可比性,但物种特异性变化通常在高血压中具有临床重要性。
04 已知在每个微生物进化枝内,成员物种之间共享功能特性的程度例如,厚壁菌作为进化枝特别代谢不一致,当考虑到普遍使用F/B比率作为生态失调的标志物时,这再次提出了一个问题。
05 由于人类微生物组随时间的相对稳定性,实验室小鼠在这方面与人类不同。
06 小鼠和人体免疫组成和建立不同,人类免疫系统的强劲发展,需要接触各种真菌,病毒,微生物等,而GF小鼠与人或大鼠微生物的定殖不会诱导免疫成熟,只有小鼠特异性微生物能够诱导完全的免疫能力。
07 啮齿动物模型的嗜食性已被认为对微生物组具有独特的影响,这可以通过使用单一住房策略来避免,尽管这会诱发小鼠的应激反应,增加一个额外的混杂因素。
许多研究人员试图通过使用人类微生物定殖小鼠或野外捕获的小鼠来规避物种比较问题。这提出了两个重要的挑战,应该加以考虑。
一,存在宿主与其微生物之间相互作用的相互排斥的问题。事实上,这种相互作用的重要性在最近的一项研究中得到了证实,该研究表明GF小鼠与人或大鼠微生物的定殖不会诱导免疫成熟,只有小鼠特异性微生物能够诱导完全的免疫能力。有几点差异在小鼠和人体免疫组成之间注意到,这可能与免疫微生物组轴有关,例如,与小鼠(10%–25%)相比,外周血中性粒细胞的比例约为人类的两倍(50%–70%)。此外,CD8+T细胞在成年人非淋巴组织中的分布远高于无特定病原体的小鼠,这可能对细胞内感染或癌症的进展有影响。
二,尽管野外捕获的小鼠比实验室培养的无特定病原体的小鼠更准确地概括人体生理,可能与临床试验结果的一致性更高,对疾病的抵抗力更强。但是在科研研究和临床上应用大规模野外捕获老鼠的可能性会受到限制。
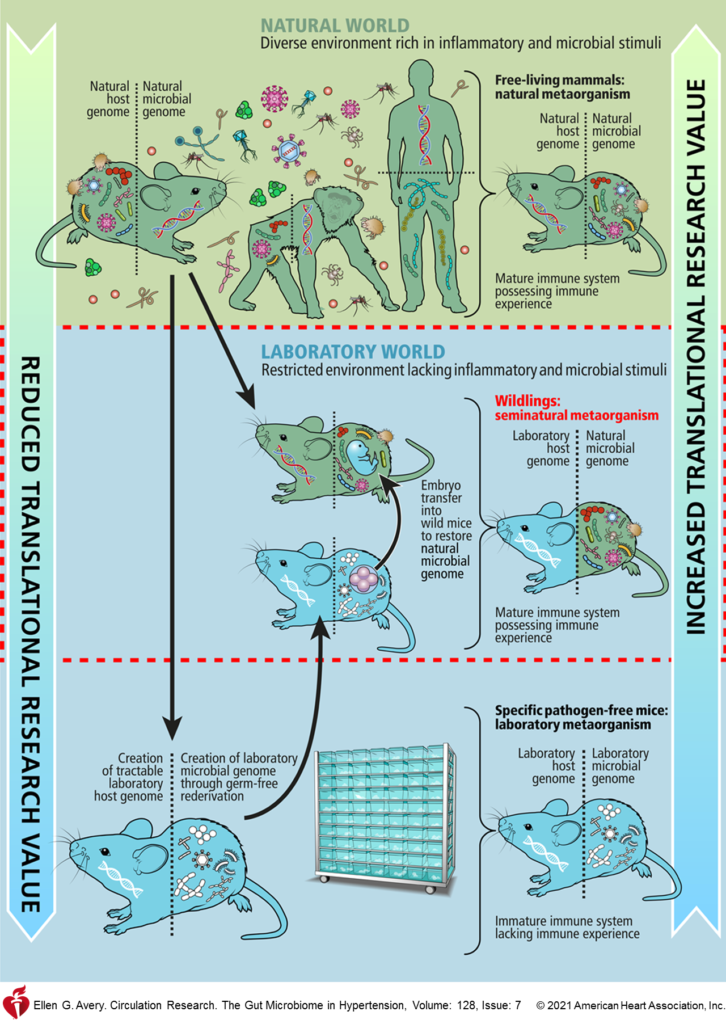
因此,在未来动物研究中,整个领域的程序标准化,例如使用同窝对照和可能影响微生物组的条件的稳健记录是必不可少的。要注意笼养,用品和饮食等因素可能会对结果产生重大影响。此外,采样时间,地点也尽量一致。
值得注意的是除了不同胃肠道区域的空间动态外,从粘膜和管腔空间取样的微生物组在小鼠和人类中是独特的。由于胃肠道是免疫细胞极化和微生物产生的代谢物吸收的作用部位,许多人质疑粪便取样是否正确研究宿主-微生物组界面的途径。粪便代表该系统的排泄产物。
然而,粪便取样是检查微生物组的最常见和实际适用的方法,特别是对于需要非侵入性方法的纵向研究。粪便的收集无疑有助于我们理解宿主-微生物组的相互作用。尽管怀疑局部产生的微生物副产物的相关性是重要的,特别是影响代谢物对循环的摄取并影响胃肠免疫细胞的活性,但是该隔室的测量是不发达的。在间质液中的作用部位鉴定微生物产生的化合物的能力可能提供对宿主-微生物组动力学的不同观点。
总之,尽管在解释微生物组数据时需要谨慎,但是,高血压中微生物组-宿主界面的研究是一个有前途且正在迅猛加速的研究领域。随着各种技术的进一步发展,针对微生物组领域的以药理学和辅助诊断方式为中心的方案可能会在不久的将来出现。
相关阅读:
参考文献:
Schluter J, Peled JU, Taylor BP, Markey KA, Smith M, Taur Y, Niehus R, Staffas A, Dai A, Fontana E, et al.. The gut microbiota is associated with immune cell dynamics in humans.Nature. 2020; 588:303–307.
Evangelou E, Warren HR, Mosen-Ansorena D, Mifsud B, Pazoki R, Gao H, Ntritsos G, Dimou N, Cabrera CP, Karaman I, et al.; Million Veteran Program. Genetic analysis of over 1 million people identifies 535 new loci associated with blood pressure traits.Nat Genet. 2018; 50:1412–1425.
Ellen G. Avery. CirculationResearch. The Gut Microbiome in Hypertension, Volume: 128, Issue: 7, Pages:934-950
Tierney BT, Yang Z, Luber JM, Beaudin M, Wibowo MC, Baek C, Mehlenbacher E, Patel CJ, Kostic AD. The landscape of genetic content in the gut and oral human microbiome.Cell Host Microbe. 2019; 26:283–295
Forslund K, Hildebrand F, Nielsen T, Falony G, Le Chatelier E, Sunagawa S, Prifti E, Vieira-Silva S, Gudmundsdottir V, Pedersen HK, et al.; MetaHIT Consortium. Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota.Nature. 2015; 528:262–266.
Verger EO, Armstrong P, Nielsen T, Chakaroun R, Aron-Wisnewsky J, Gøbel RJ, Schütz T, Delaere F, Gausseres N, Clément K, et al.; MetaCardis Consortium. Dietary assessment in the metacardis study: development and relative validity of an online food frequency questionnaire.J Acad Nutr Diet. 2017; 117:878–888.

谷禾健康
肥胖与许多疾病的风险增加有关,包括糖尿病、心血管疾病和癌症。越来越多的证据也表明肠道菌群失衡与疾病有关。通过调节肠道菌群或许能逆转或干预这些现象。
本期介绍两篇,分别以饮食控制和维生素给予为变量,同时都研究了基线时和干预后肠道菌群的变化。又是新的思路,新的挑战。
第一篇文章研究了基线肠道菌群在饮食控制的前提下是否能预测减肥轨迹?
答案是可以的,研究结论表示作为节食前个人体重减轻轨迹的预测指标,基线肠道微生物的作用超过了其他因素。
研究中对83名受试者(男47人,女36人,年龄20~45岁)进行了为期6个月的在营养师指导下的饮食干预计划。受试人群以以下标准排除:
(1)重大疾病;
(2)怀孕或哺乳;
(3)高血糖或低血糖;
(4)胃肠疾病;
(5)自身免疫性疾病;
(6)甲状腺疾病;
(7)在纳入前1个月内使用抗生素或激素;
(8)预计在研究过程中经常旅行。这也排除了服用上述条件下处方药物(如二甲双胍)的受试者。
按照中国人民解放军总医院营养科的医生设计的膳食计划,即碳水化合物含量为60%-65%,蛋白质含量为24%-26%,脂肪含量为12%-14%(能量百分比)。也包括400-500克蔬菜和100-200克低血糖指数水果,严格遵循饮食建议,卡路里控制在男性1200-1680千卡/天,女性1050-1470千卡/天。
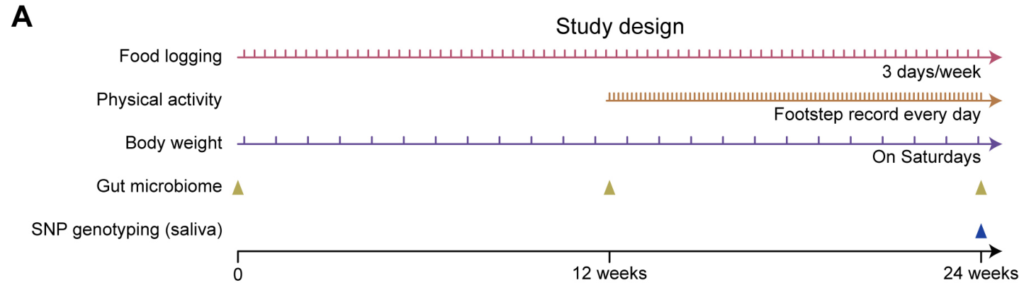
如图,结合电子秤与智能手机应用程序,纵向收集饮食、体力活动、体重和粪便微生物组数据以及SNP基因型,然后整合成高维数据用于后续分析。对采集的粪便样本进行宏基因组鸟枪法测序,得到的序列数据进行物种注释及KEGG功能注释。
1. 饮食因素与体重变化之间的联系因个体不同而不同。
首先确定有哪些饮食因素与所有个体的体重下降有关。使用GLMMLASSO模型,结果如图,当coef为非零时被认为是显著的。发现,在所有受试者中,体重下降与卡路里摄入量(系数=-0.153)、膳食中大量营养素组成(脂肪,系数=-0.161;碳水化合物,系数=-0.055;蛋白质,系数=0.084;纤维,系数=0.1)、膳食微量营养素含量和体力活动之间的具有弱相关。
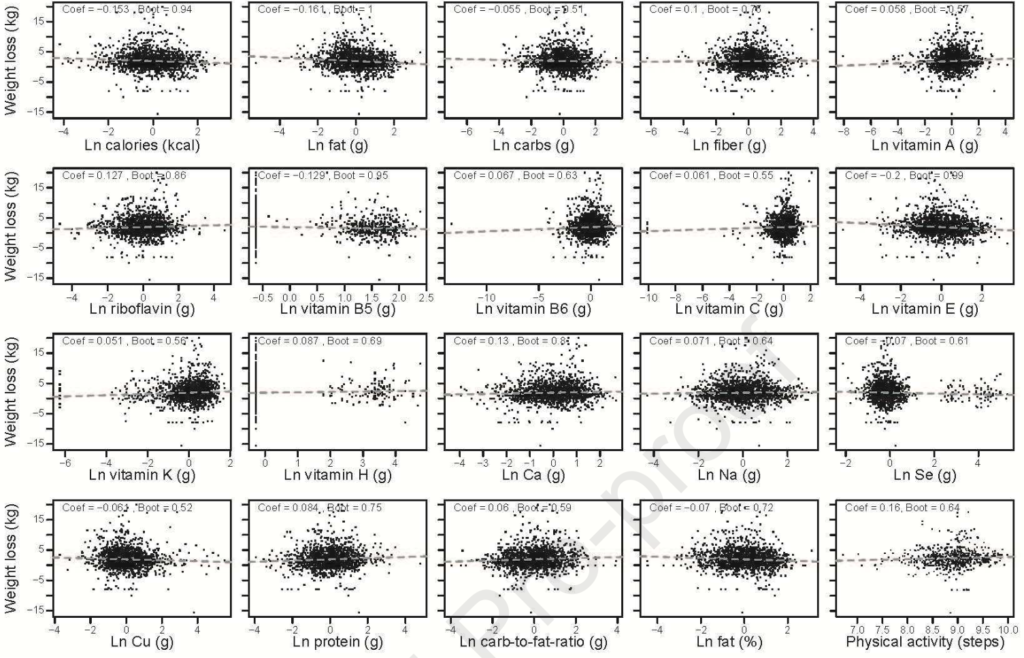
但是在个体间有很大差异。例如在受试者F00161中,纤维摄入量的增加与减肥之间存在正相关关系,而在F00147中,受试者的脂肪摄入量增加与体重减轻之间存在负相关关系。相反,尽管纤维或脂肪摄入量发生变化,F00203人仍然对体重变化不敏感(图G)。所以,即使是相似的膳食大量营养素,体重反应也是高度个性化的。蓝色,coef> 0;红色,coef< 0
2. 作为节食前减肥轨迹的预测指标,基线肠道菌群表现更好。
为了从饮食控制前的基线数据中建立预测体重下降的模型,开发了基于梯度增强回归的机器学习算法,并保留一个受试者进行交叉验证。为了识别除了饮食数据之外最相关的变量,这些模型分别在五组输入上进行了训练:
(1)膳食数据(包括卡路里摄入量、大量营养素组成、食物种类和饮食排序的前三个特征向量);
(2)膳食数据和肥胖相关SNPs;
(3)膳食数据和个人特征(年龄、性别和基线体重指数);
(4)膳食数据和基线肠道微生物群(包括细菌种类丰度和功能模块);
(5)膳食数据、个人特征、SNPs和基线肠道微生物群。

与不包含基线微生物群数据的模型相比,包含基线微生物群数据的模型的预测精度大大提高,而包括个人特征或肥胖相关的宿主基因组SNP对预测精度的贡献很小[(1)r=0.137;(2)r=0.073;(3)r=0.159;(4)r=0.523;(5)r=0.509]。因此,基线肠道菌群数据在预测6个月饮食控制计划期间体重变化方面优于其他因素(P <1e-14)。
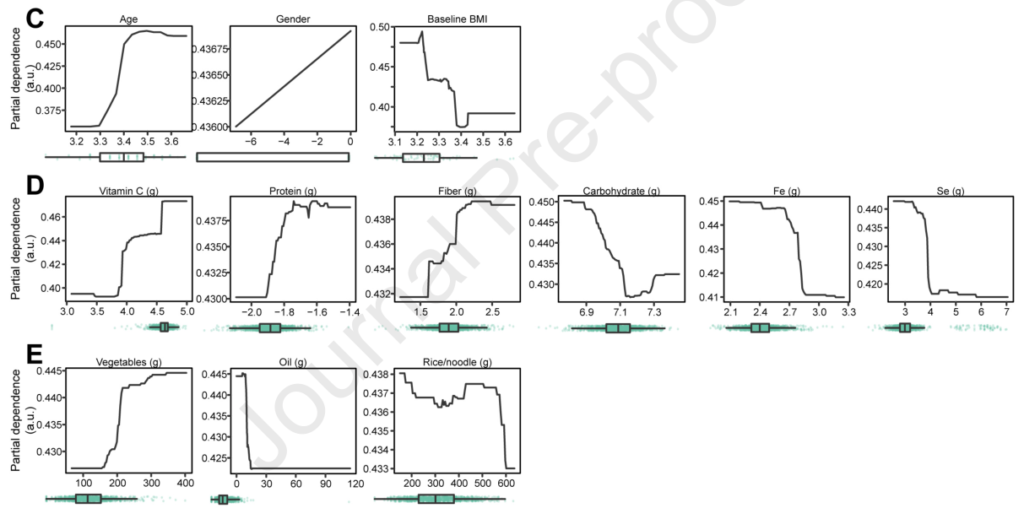
之后,研究人员进行了更细致的模型训练,发现了对体重下降模型影响最大的几个物种:

在功能分析中,发现涉及赖氨酸生物合成(M00030)和多糖运输系统(M00216)的模块对预测模型的影响最大

以及其他影响不那么显著的变量:年龄增加对模型产生积极影响,而基线BMI则相反;增加维生素C、蛋白质和纤维的摄入量对模型产生积极影响,而增加碳水化合物、铁和硒的摄入量则相反;剩下的几种维生素和矿物质、蔬菜、油、米和面条的摄入量以及与肥胖相关的6个SNP的基因型也对该模型产生了微弱的影响。以上这些变量都是重要的因素,可能有助于或阻止普通人群在长期节食期间的减肥轨迹。
3. 饮食控制期间肠道菌群的组成变化是否会影响减肥轨迹。
研究发现许多参与者的肠道菌群组成发生了实质性的变化,0-3个月的微生物群的变化幅度与体重下降的程度呈正相关,有15个个体肠型被改变了,体重变化范围从20公斤到+7公斤。这两个时间段都是一致的。这一发现表明,在饮食控制计划中,饮食和肠道菌群之间存在着持续的相互作用。如图:
同时使用随机森林算法,基于相对于基线的种水平物种变化来预测体重下降,预测精度R=0.271,发现R. gnavus (MGS0160), Bacteroides massiliensis (MGS1424)和Bacteroides finegoldii (MGS0729)这三个物种在模型中贡献度最大。

继续统计了一些在肥胖个体中丰富或减少的物种和功能以及那些与体重变化共同变化的细菌种类。其中,粪球菌属Coprococcus sp. (MGS0232)、Holdemanellabiformis (MGS1464)、Solobacterium moorei (MGS0945)、活泼瘤胃球菌R. gnavus (MGS0160)和Clostridium (MGS0558) 在肥胖个体中显著富集,且它们的减少与体重下降显著相关;Coprobacter (MGS1138)、Bacteroides intestinalis (MGS0117和MGS1302)、阿克曼菌Akkermansia muciniphila (MGS0120)、Alistipes obesi (MGS0342)和坦纳菌属Tannerella sp. (MGS0276)在瘦人个体中显著富集,且其在饮食控制过程中的增加与体重下降显著相关;在瘦人个体中,编码脂肪酸生物合成(M00085)的基因在基线时显著富集,且其增加与体重减轻相关。如下图:
这些结果表明可以基于基线肠道菌群组成和饮食数据建立个性化的体重预测模型。我们可以利用肠道菌群的分布做个性化的饮食推荐,以此调节体重,进而促进宿主健康。文章中发现的R. gnavus (MGS0160)、B. massiliensis(MGS1424)和B. finegoldii (MGS0729)这三种物种与体重下降显著相关,它们的减少有利于体重下降。这可以记一下,要是有机会做肠道菌群检测,可以参考参考。
第二篇文章,主要研究对结肠靶向给维生素对人体肠道菌群的组成和代谢活性的影响。通过人类临床研究和体外的批量发酵实验,结合评估屏障和免疫功能的细胞模型,研究了结肠输送的维生素A、B2、C、D和E对肠道菌群的影响。大家都比较熟知益生元或一些益生元成分如低聚果糖(FOS)、低聚半乳糖(GOS)和菊粉对肠道的影响。
最近一篇使用高剂量维生素或结肠靶向配方的干预研究表示,维生素会影响肠道菌群。补充100 mg核黄素14d可以增加健康受试者每克粪便中丁酸产生菌(Faecalibacterium prausnitzii和Roseburia)的数量,并减少炎症性肠病(IBD)患者的肠杆菌科细菌数量。
一共96名健康志愿者参与了这项研究,其中12人分成6组不同的维生素组(维生素A、维生素B2、维生素C、维生素B2+C、维生素D3和维生素E),安慰剂组有24人参与。
排除标准如下:严重急性或慢性疾病;吸烟;怀孕;在过去3个月内使用抗生素;药物和/或酒精滥用史(每天2份以上);过去3个月的主要饮食变化;饮食障碍;素食或纯素食;灌肠;膳食补充剂,包括基线访问前4周内和干预期间的益生元、益生菌或富含纤维的补充剂;高纤维饮食(即>30克);治疗活动性胃肠道疾病的慢性药物(除非该产品在筛查前服用至少2个月,并在整个研究期间保持相同的剂量);最近排便习惯的改变(<3个月);以及腹痛。
所有受试者在为期4周的时间里每天服用维生素补充剂或安慰剂,一共三次数据采集:筛查,基线(筛查后1周),基线后4周。每次都采集空腹静脉血样本,填写问卷,并在基线时和干预4周后,从每个受试者身上收集两份粪便样本。用于获知粪便微生物组成、粪便短链脂肪酸水平、粪便氨含量、血浆和粪便维生素B2浓度、粪便氧化还原和pH值、生活质量和胃肠道症状问卷等信息。
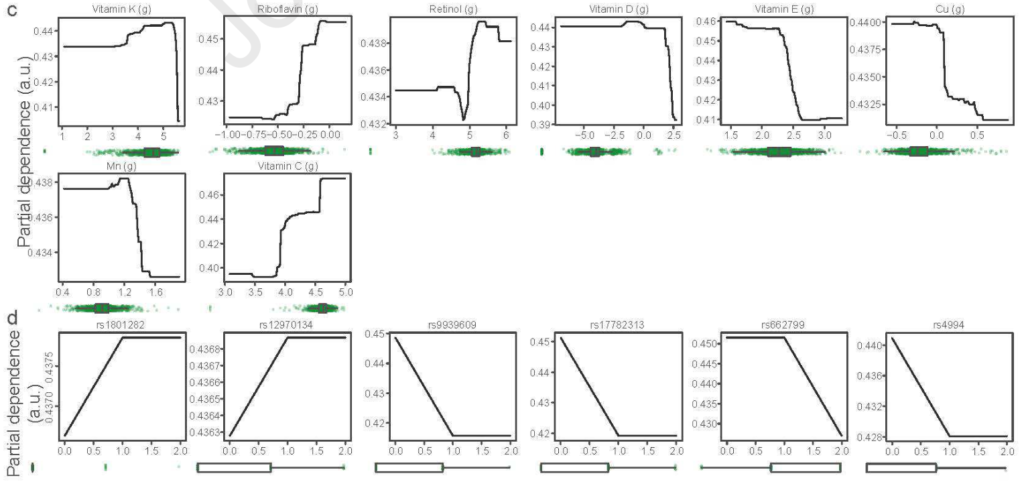
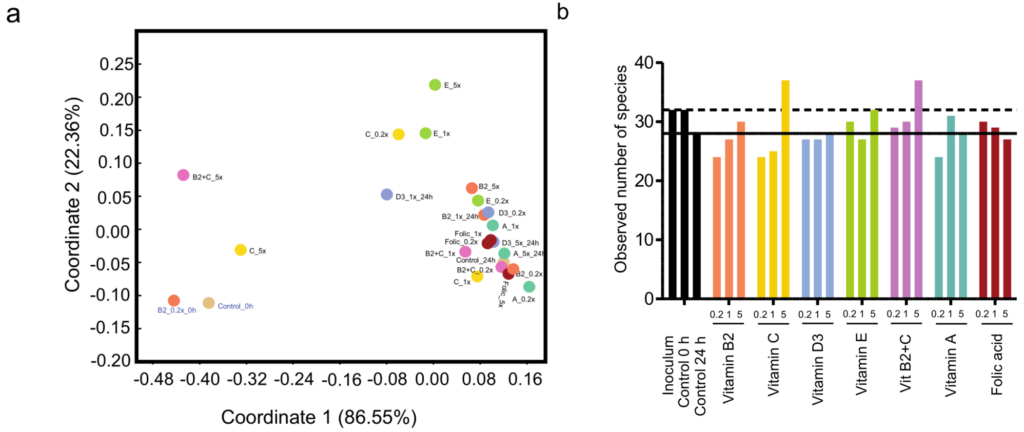
对肠道菌群组成分析,比较了结肠注射维生素干预前后的多样性指数。
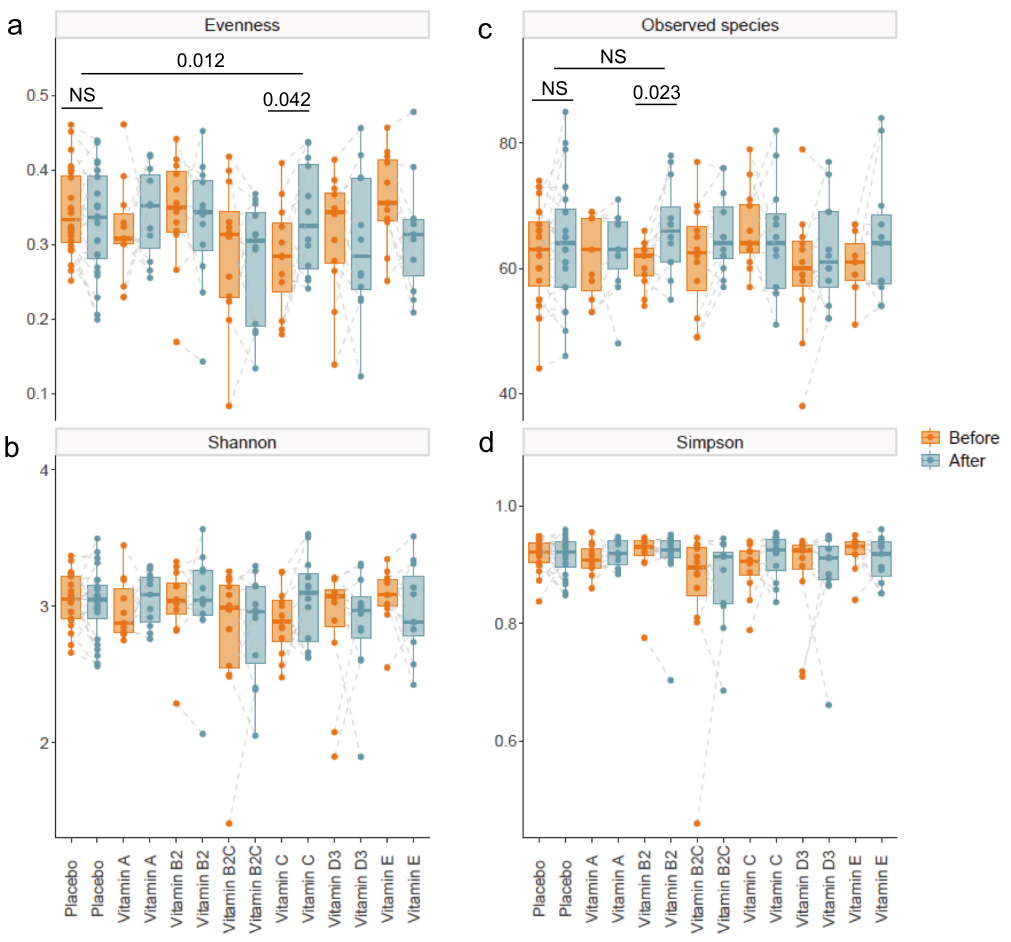
结果表明,与基线组(p=0.042)和安慰剂组(p=0.012)相比,维生素C在第四周显著提高了肠道微生物群落的均匀性。此外,与基线相比,维生素B2显著增加了观察到的物种数量(p=0.023)。
Bray-Curtis距离的置换多变量方差分析(PERMANOVA)表明,肠道微生物beta多样性的总体变化在组间或组内与基线相比没有显著差异。
不同的维生素引起组内以及治疗组和安慰剂组在门、科、属和种水平上肠道微生物组成的变化。

门水平:维生素B2+C导致变形杆菌显著减少(p=.021),与基线相比菌落数量增加和拟杆菌数量减少。此外,服用维生素D后,与基线相比,拟杆菌有减少的趋势(p=.052),与安慰剂相比有显著差异(p=.038)。最后,与安慰剂相比,维生素D和维生素A显著增加了放线杆菌的数量(p=.033和p=.041)。
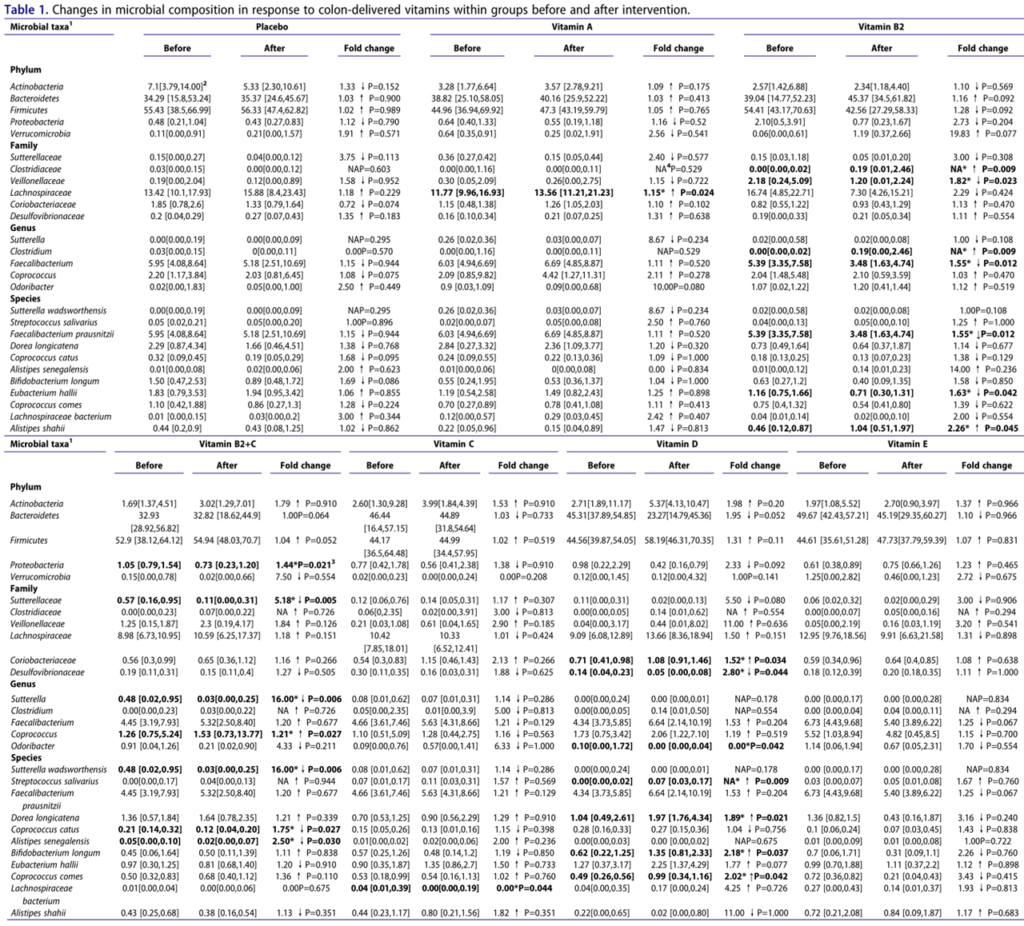
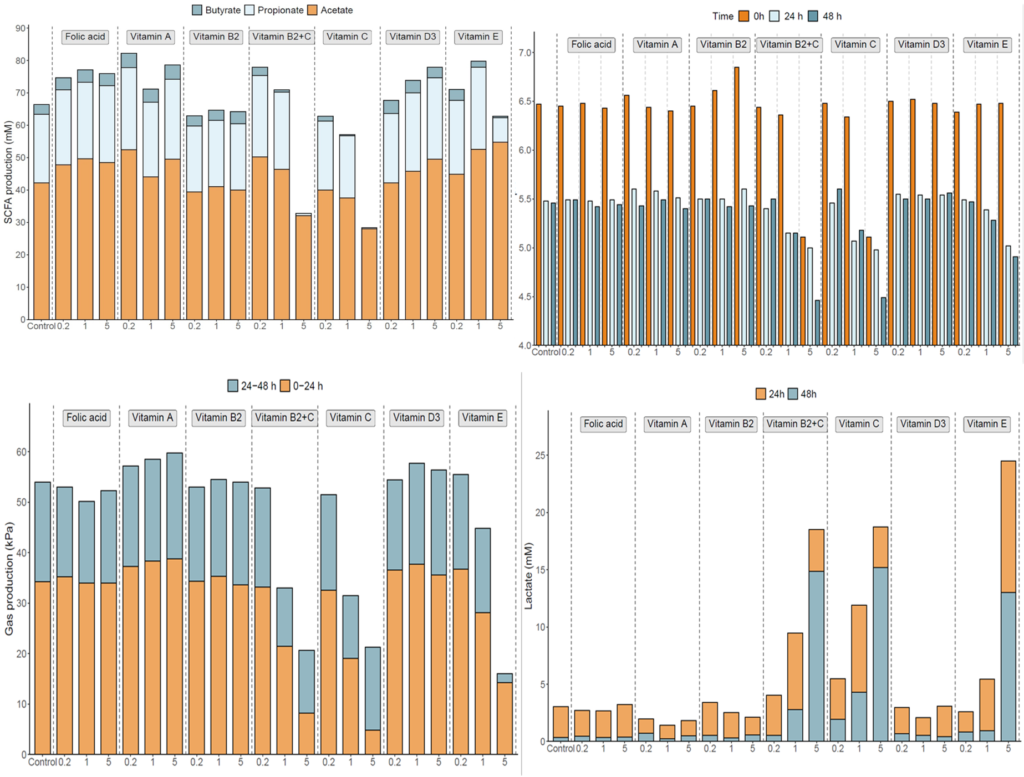
通过测量粪便中的SCFA浓度来评估肠道微生物群的代谢活性(下图)。
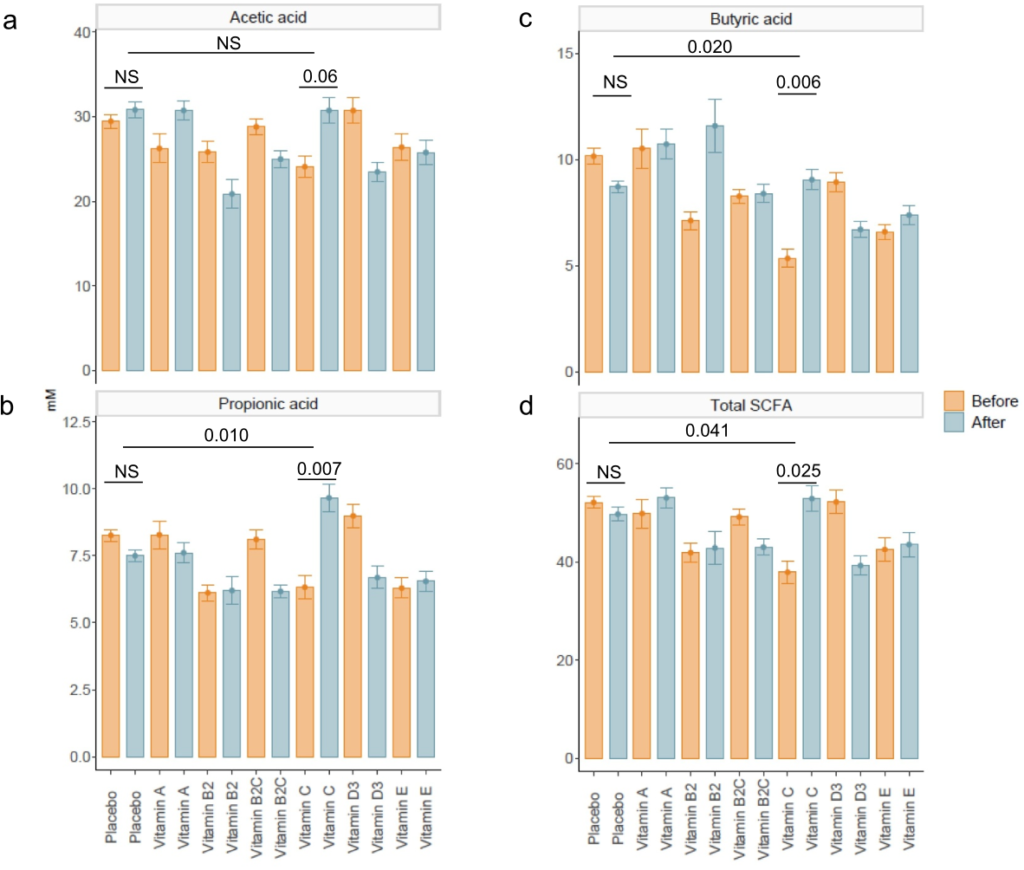
我们发现,与基线相比,维生素C显著增加了总SCFA(p=.025)、丙酸(p=.007)和丁酸(p=.006)浓度。与安慰剂相比,这些效果也很明显(分别为p=.041,p=.010和p=.020)。与安慰剂相比,服用维生素C对粪便pH值的降低更明显,但是,两组之间没有显著差异。
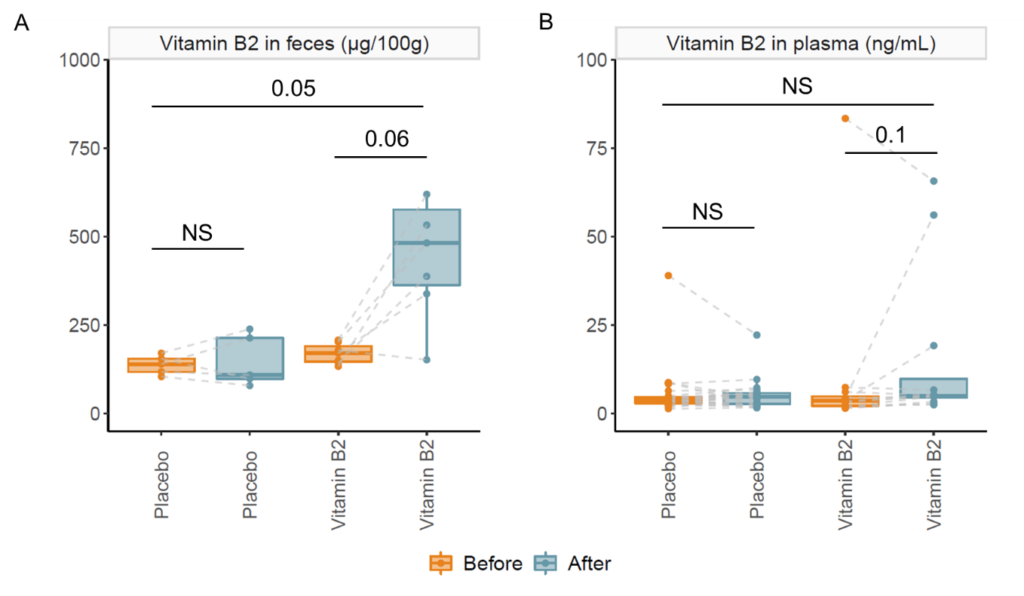
在服用维生素C后,粪便氧化还原电位降低,而服用安慰剂后,粪便氧化还原电位升高;然而,两组间也没有显著差异。最后为了确认维生素是否被输送到结肠,测量了干预前后粪便和血浆中维生素B2的浓度,并与安慰剂进行了比较。与基线(p=0.06)和安慰剂(p=0.05)相比,粪便中的维生素B2增加了。但是,这对血浆维生素B2浓度没有显著影响。
体外研究:
对3名粪便样本供体(男性,26岁;女性,35岁;女性,29岁)进行了短期结肠发酵实验,选出一名SCFA产量平衡的供体进入最终发酵实验。在发酵前(0h)和发酵后(48h)分别从每个发酵瓶采集出水样品,用0.22µm滤器过滤灭菌。样品用来分析粪便微生物组成、微生物体外代谢活性、Caco-2和HT29-MTX-E12细胞培养及屏障功能、HT29细胞培养和免疫功能。
加权UniFrac距离的主坐标分析(PCoA)显示发酵前(0h)和发酵后(24h)样品之间的分离,表明发酵随时间的影响(图a)。大多数维生素处理24 h的微生物群与24 h对照样品聚集在一起,表明维生素和对照样品之间的beta多样性没有变化。
然而,经维生素E(1x和5x)、维生素C(0.2x和5x)、维生素D(1x)和维生素B2+C(5x)处理24h的样品与对照样品明显分离,表明维生素处理对发酵过程中微生物群落的组成有一定的影响。此外,添加不同浓度的维生素C、E、B2+C、B2、A和叶酸,与24小时的对照相比,观察到的物种数量增加,表明对α多样性有影响。
同时,经维生素处理后,所有分类水平都有了些许变化,在门水平上变化最明显的是放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和Verrucomicrobia的增加以及拟杆菌门(Bacteroidetes)的减少,特别是维生素E、B2、B2 + C和C的添加。
在属水平上,除维生素B2以外,所有维生素都使Roseburia增加,而维生素C、B2、B2 + C、D和E增加了Akkermansia、Bifidobacterium和Faecalibacterium的相对丰度。
与对照相比,大多数维生素对SCFA的产生有明显的影响。维生素A处理的总SCFA浓度最高(0.2倍),而所有浓度的叶酸都持续增加总SCFA浓度。乳酸浓度、产气量和pH值为体外发酵系统的代谢活性提供了额外的衡量标准。在添加维生素C(1x和5x)和维生素E(5x)后,pH、产气量和乳酸积累量显著降低。
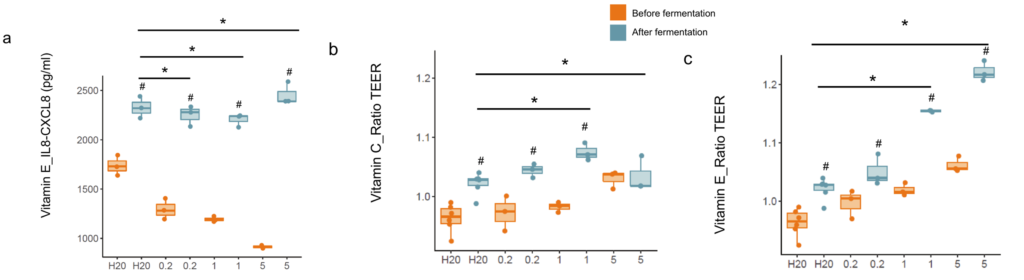
当HT29细胞与经维生素处理的微生物群的发酵样品孵育时,观察到IL8-CXCL8的分泌发生了变化。在所有浓度的维生素E中,IL8-CXCL8(956.67 pg/mL、1010.00 pg/mL、1544.00 pg/mL)与对照组(590.00 pg/mL)相比有轻微但一致的上调(p<0.05)。使用细胞肠道模型研究维生素C和维生素E对肠道屏障完整性的影响,发现在发酵之前,大多数维生素以剂量依赖的方式增加TEER。
此外,在发酵后用对照(水)上清液处理的细胞中,TEER显著增加,这一效果在所有实验中都是一致的(文章中只显示维生素C和E;其他维生素未显示)。橙色,发酵前;蓝色,发酵后。
这只是一项初步研究,文章中的研究人员也提到了有些许不足需要进一步验证的地方。但是这些图表数据也实打实的给出了一些结果。
经结肠传递的维生素对人体肠道菌群和相关代谢活动起了调节作用,根据在人体和体外观察到的效果,维生素C、B2和D似乎是被测试的维生素中影响最显著的。
在人类中,维生素C的效果最为明显,与安慰剂相比,维生素C显著增加了微生物α多样性和粪便SCFA。
在肠道菌群领域研究的科研人员从未停止脚步,如果肠道菌群是通往健康的其中一把钥匙,那么在大家的打磨之下,终将可以打开更加精准的个体化医疗技术大门。
参考文献:
Jie Zhuye,Yu Xinlei,Liu Yinghua et al.The Baseline Gut Microbiota Directs Dieting-Induced Weight LossTrajectories.[J] .Gastroenterology, 2021.
Pham Van T,Fehlbaum Sophie,SeifertNicole et al. Effects of colon-targeted vitamins on the composition and metabolicactivity of the human gut microbiome- a pilot study.[J] .Gut Microbes, 2021,13: 1-20.
相关阅读:

谷禾健康

感到疲惫?乏力?食欲不振?容易流血?皮肤发痒?腿肿?体重减轻?…这些有可能是慢性肝病的信号,慢性肝病是一个主要的健康问题,它可以发展为肝硬化和肝癌。
肝病按照病因划分,常见的有如下几大类:
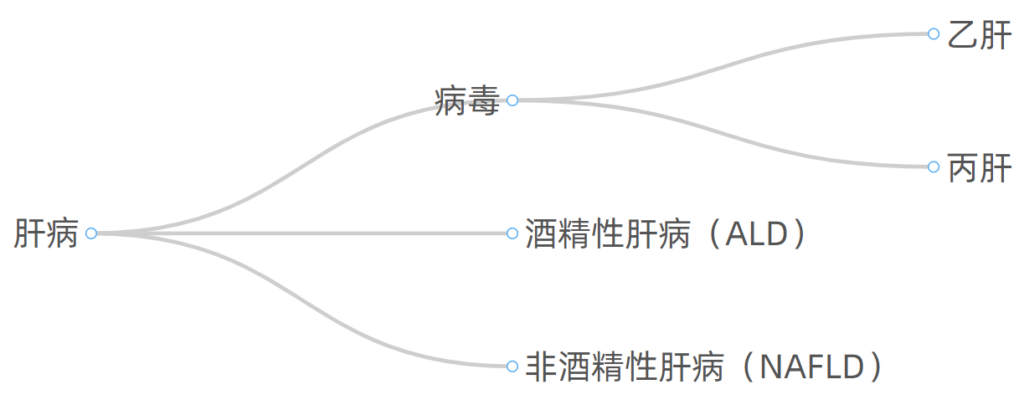
无论病因如何,肝病如果没有得到有效管理控制,进展的常见终末阶段是肝硬化。
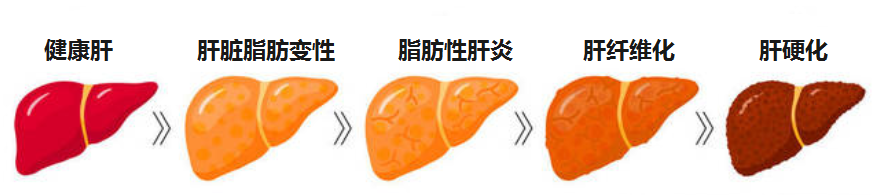

肝硬化可导致失代偿和肝细胞癌的发展。
发病率
目前由于疫苗接种计划和有效抗病毒治疗不断发展,乙肝和丙肝肝硬化的发病率正在下降,但由于以下两个原因导致另两种肝病发病率不断上升:
1、肥胖,导致非酒精性脂肪肝的发病率增加
2、饮酒,导致酒精性肝病的发病率增加。
本文带你详细了解肝病与肠道菌群:


肝脏也是胆汁产生的场所,在肠肝循环中具有重要作用。
肝脏,作为第一个接触微生物产物进入门静脉循环的器官,可能受到肠道微生物群及其变化的多种影响。肠道微生物群的成分或代谢物通过各种机制与肝脏相互作用。
肝脏中产生的胆汁酸(如胆酸和鹅去氧胆酸)与葡萄糖醛酸酶结合。一旦分泌到十二指肠肠腔,肠道菌群代谢和解共轭,产生尿胆原(排泄)和初级胆汁酸被吸收和循环。胆汁酸还通过内在的微生物调节活动来控制和影响菌群。
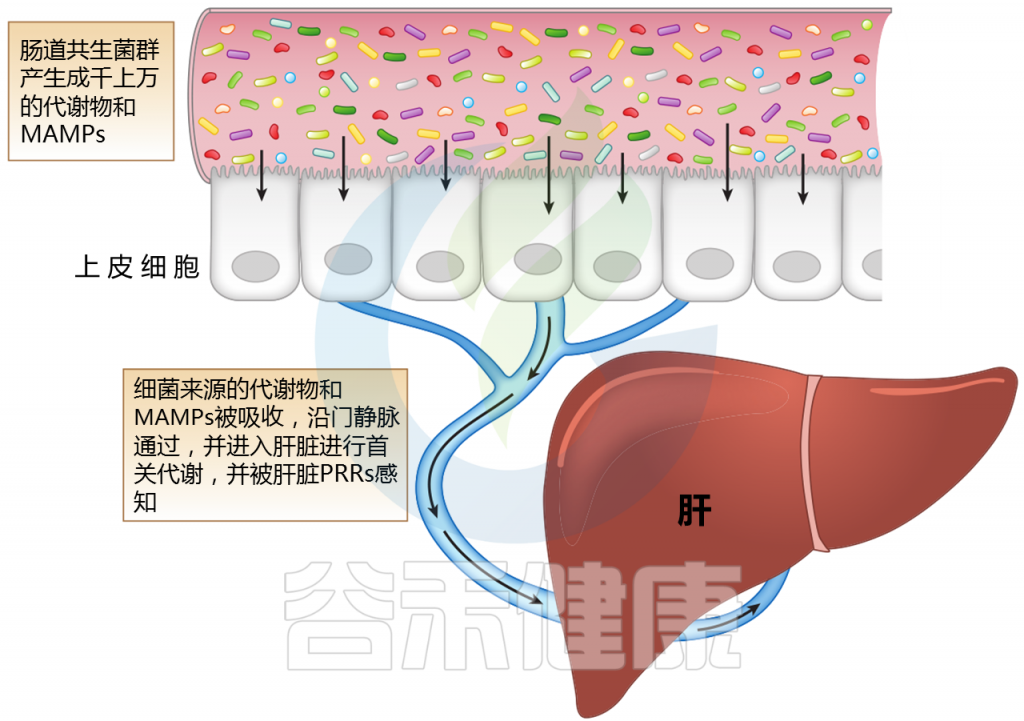

Jones R M,et al.,Annual Review,2020
注:MAMPs——微生物相关分子模式;PRR——模式识别受体
肝脏位于体循环和来自肠道吸收活动的大量外源性分子和微生物相关分子模式(MAMPs)之间的界面。
微生物产生的代谢物会随着微生物群的组成而变化;它们沿着门静脉分流并引发多种信号通路的激活。MAMP暴露过多会导致炎症。
肝硬化前期肠道菌群总体变化:
整体多样性减少,厚壁菌门减少,拟杆菌门和变形菌门增加。
在三种类型的肝炎中,肝硬化前期微生物参与非酒精性脂肪肝病和酒精相关性肝病的证据相对更为有力。
—— 非酒精性脂肪肝病
非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)是一种以肝细胞内脂质(主要是甘油三酯)的微泡或大泡状积聚为特征的肝病,并伴有不同程度的炎症浸润。
在非酒精性脂肪性肝病中,研究人员发现粪便、血液和肝活检中的致病菌(如肠杆菌科和大肠杆菌)的相对丰度增加。随着病原菌数量的增加和厚壁菌门数量的减少,菌群失调。
—— 酒精性肝病
长期摄入酒精可导致人类和动物模型中菌群结构的变化,肠道通透性增加,随着持续的酒精滥用,致病菌的多样性进一步减少,相对丰度增加,如肠杆菌科和肠球菌科。
在小鼠中,乙醇可以降低肠道屏障功能,并允许增加局部炎症。从机理上讲,乙醇也能抑制抗微生物凝集素的表达,在慢性乙醇消耗模型中,无Reg3β和Reg3γ的小鼠表现出增加的细菌移位和NASH的发生。这些发现表明乙醇可能介导了肝脏潜在的促炎性刺激,有多个长期后遗症。
尽管肝硬化的病因可能有所不同,但在肝病的末期,微生物群与肝脏的相互作用在很大程度上与病因无关。也就是说无论哪种都可能发展为肝硬化。
前面我们知道,肝炎如果不能得到有效控制,久而久之会对肝造成永久性损伤,也就是肝硬化。肝硬化又分为两种,一种是代偿性肝硬化,一种是失代偿肝硬化。
代偿性肝硬化虽然肝功能减退,但机体仍能正常运行。
失代偿性肝硬化指肝硬化发展到一定程度,出现肝功能衰竭,可能出现严重并发症,如肾功能衰竭、静脉曲张出血和肝性脑病等。
肝硬化患者最初没有症状,等到了肝硬化失代偿(定义为腹水、肝性脑病、黄疸和/或胃肠道出血),就是肝硬化过程中的转折点。
——肝硬化失代偿期会发生什么?
代偿性肝硬化患者可能会保持多年稳定,死亡率非常低,每年< 1%。然而,在第一次住院治疗后,35%的患者将在28天内出现后续的失代偿,需要频繁入院。肝硬化急性失代偿可导致慢加急性肝衰竭(ACLF)。
注:慢加急性肝衰竭是一种综合征,以一个或多个主要器官或系统(肝、肾、脑、凝血、循环或呼吸)衰竭为特征。
慢加急性肝衰竭是失代偿性肝硬化的主要死亡原因。他们的慢加急性肝衰竭(ACLF)的中位时间为2-3年,死亡率每年约为10%。


Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
每次失代偿后,慢加急性肝衰竭在28天内的发展约为30%,在此阶段死亡率在28天内攀升至40%。这些器官衰竭患者通常在重症监护室接受治疗,肝移植是唯一的治疗方法。
肠道菌群如何影响肝硬化失代偿?
肝硬化中微生物群-肠道-肝脏相互作用
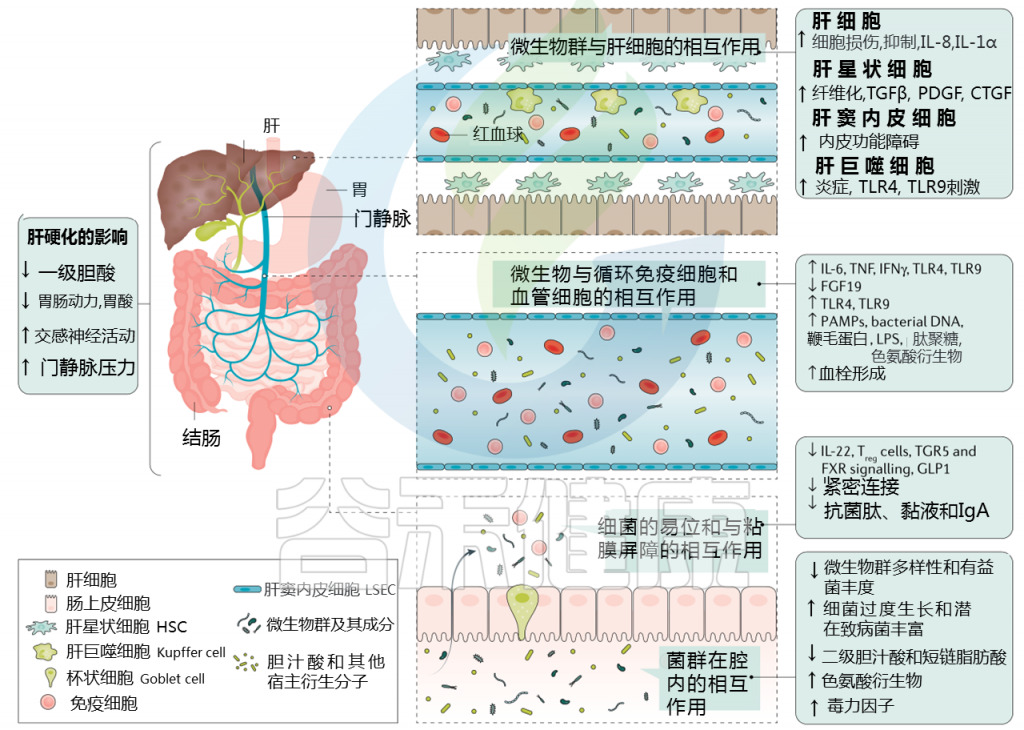

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
肝硬化发展过程中肠道微生物群的变化在很大程度上归因于肠道微生物群组成及其产物,产物可能具有致病作用。短链脂肪酸(SCFAs)、次级胆汁酸和色氨酸衍生物增加,而粘液蛋白的变化、功能失调的紧密连接和抗菌肽的减少促进了微生物组成分和/或其代谢物(病原体相关分子模式(PAMPs))跨肠屏障的移位。
接下来,就肠道菌群与肠道屏障,病变肝脏的相互作用,菌群代谢产物与转运,门静脉高压和酒精的作用这4个方面展开讨论。
1. 与肠道屏障相互作用
肠漏:
一个不正常的微生物群可以影响肠道上皮屏障,并导致内容物从肠道到肝脏和其他地方难以控制的转移。这种肠上皮屏障的损伤被称为漏肠。
在肝脏疾病期间,由于肝肠循环、肠道炎症和门脉高压的改变,宿主生理和肠道完整性发生重大变化。与此同时,肠道微生物组和肝脏之间的串扰也发生了重大变化:
肠道中的宿主粘膜蛋白和通路(例如FXR信号)被肠道微生物群代谢物(例如短链脂肪酸)改变,并可能导致肝脏损伤;
肝脏疾病进展引起的肠道内化变化可能会影响肠道屏障,促进肠道炎症,降低抑菌肽;
而肠道相关淋巴组织可能通过驱动肠道炎症,从而增加肠屏障的通透性参与肠屏障的功能障碍
由于穿过肠道上皮屏障的细菌成分会引发免疫反应,因此肠道渗漏被认为会增加慢性全身炎症。例如,在肝病患者,尤其是肝硬化患者中,细菌细胞壁脂多糖(LPS)水平升高,也被称为内毒素血症。
2018年的一项研究表明,从失代偿期肝硬化患者的循环血和其他“无菌”隔室中分离出的细菌是可行的,这表明即使是活的细菌也可以在失代偿期肝硬化期间通过肠屏障转位。
2. 与病变肝脏的相互作用
从失代偿到慢加急性肝衰竭的进展与全身炎症的广泛激活有关,影响许多细胞因子和炎症系统。
释放危险相关的分子模式来促进失代偿和炎症
慢加急性肝衰竭的发展,不同衰竭器官的死亡细胞和细胞外基质的重塑,特别是在肝脏,都通过释放危险相关的分子模式来促进失代偿和炎症,最终可能是慢加急性肝衰竭发展的先决条件。
这种联系在乙肝病毒引起的肝硬化和/或慢加急性肝衰竭患者中尤其常见。慢性乙肝病毒的再激活可能导致肝损伤,从而释放危险相关的分子模式,进而导致器官衰竭和慢加急性肝衰竭。
在慢性肝病和肝硬化患者中,甲肝病毒和戊肝病毒重叠感染也可能诱发慢加急性肝衰竭。
对病原体相关分子模式的免疫反应导致器官功能障碍
另一方面,这种炎症的爆发是由微生物或其成分的转移引起的,也称为病原体相关分子模式。对病原体相关分子模式的免疫反应可能在免疫病理学过程中导致器官功能障碍,在这种过程中,免疫反应会导致感染造成损害。
炎症标志物水平升高
血浆中全身性炎症标志物(如IL-8或IL-6)水平升高,无论是否有明显的细菌感染,都与肝硬化和慢加急性肝衰竭的急性失代偿有关。新的数据强化了改变后的肠道微生物群和慢加急性肝衰竭之间的联系。
血浆代谢物特征
除了肠道菌群衍生代谢物与慢加急性肝衰竭发展之间的关联之外,血浆代谢物特征(可能也来自肠道菌群)也与全身炎症和慢加急性肝衰竭密切相关。
这些发现可能解释了为什么肠道微生物群的改变和细菌易位的增加可能为不同器官的免疫病理发展为器官衰竭,加重全身炎症和诱导ACLF的环境。
酒精性肝病
2019年研究表明,乙肝病毒相关ACLF患者的循环细菌DNA显著增加,并与炎症标记物(如CXCL10,一种已知的趋化因子)相关,在非乙肝病毒病因中也与ACLF相关,尤其是酒精性肝硬化。
另外,在急性酒精性肝炎(ACLF的一个亚型)中,研究表明,与没有这种特殊菌株的患者相比,具有一种产生细胞溶血素的肠球菌菌株的患者具有极高的死亡率(180天内的死亡率分别为89%和3.8%)。
我们知道,急性酒精性肝炎与微生物变化密切相关,这可能决定患者的临床特征及其结果。在几乎一半的急性酒精性肝炎患者中,失代偿和慢加急性肝衰竭都会发生,但没有任何可识别的促发事件,这表明这与内源性机制有关(例如,门静脉高压症或细菌易位)。
3. 门静脉高压症和酒精的作用
即使肝硬化的门静脉高压症得到有效治疗,例如通过放置经颈静脉肝内门体分流术(TIPS)支架,许多患者仍出现进一步失代偿和ACLF(2年内约47%),尤其是由于全身炎症和随后的器官衰竭。
此外,与肝静脉、右心房和外周静脉血相比,腹水的存在决定了门静脉循环微生物群的组成(腹水:一种失代偿的指标),以及与炎症标记物和ACLF的发生相关的特定循环微生物群。
然而,应该指出的是,TIPS支架本身可能会加重高动力循环,从而导致内毒素水平的增加。从长远来看,TIPS支架降低了失代偿率,可能主要是由于这些肝硬化患者腹水的发生率降低。
失代偿性肝硬化和ACLF先于酒精性肝硬化发生。这一发现可能很重要,不仅因为酒精是失代偿期肝硬化最常见的病因,而且可能是由于酒精本身对肠道微生物群和肠屏障功能的直接影响。
在健康个体和动物模型中,已经证明急性酗酒会增加循环中的内毒素和细菌DNA水平。
酒精显著改变肠道微生物群的组成,降低拟杆菌的相对丰度,增加变形菌。
它的代谢物,特别是乙醛,可以破坏肠道上皮细胞的紧密连接,导致肠道渗漏,促进细菌和真菌的易位,这两者都可能与肝硬化的进展有关。
在不同病因的肝硬化(例如,非酒精性脂肪性肝炎或乙型肝炎引起的肝硬化)中也观察到微生物群组成的改变以及肠道的渗漏。
4. 微生物代谢产物和转运
肝硬化发展过程中肠道微生物群的变化在很大程度上不仅归因于肠道微生物群的组成,还归因于其产物,这些产物可能具有致病作用。
一项研究表明,在肝硬化向失代偿和ACLF发展的过程中,血液代谢物特征明显改变。
针对903人的大规模研究为某些强预测代谢物模式的微生物起源带来了重要的见解,但很难对这些发现作出有力的陈述。
另一项对602名患者进行的研究表明,微生物群衍生代谢物与ACLF的存在有关。其他微生物成分,如次级胆汁酸、短链脂肪酸和色氨酸代谢物也在肝硬化中发生较大变化,与疾病的进展有关。尤其是,胆汁酸通过下调FXR受体来改变肠道屏障功能,这为临床FXR激动剂已经可用提供了新的治疗机会。
间接证据表明肠道微生物群可能会影响肝硬化的预后。
首先,研究表明,使用非选择性β受体阻滞剂(一种预防肝硬化失代偿的常用方法)治疗可改善肠道屏障,减少肠道转运时间,从而降低肝硬化患者细菌转移的可能性。
第二,在静脉曲张破裂出血期间或作为失代偿期肝硬化的长期预防措施,抗生素治疗是一种推荐的治疗方法,因为它可以改善结果,其机制可能与减少细菌移位有关。
尽管这一观点尚未得到确凿的证实,但我们知道,一种特定的微生物组表型(所谓的肠型)会导致肝功能的病理改变,并且考虑到微生物群中存在着广泛的成员,如真菌或病毒,微生物组标志物可能是非常有用的临床工具,以确定有失代偿和ACLF风险的患者。
肠道微生物群可以作为疾病进展、严重程度和治疗反应的生物标志物。
不同肝病的菌群特征
肝硬化:
瘤胃菌科、毛螺菌科与其他菌(包括肠杆菌科和拟杆菌科)进行比较,菌群比率失调。随着ACLF的发展,肝硬化菌群失调比率恶化。
该研究表明,肝硬化患者的菌群比率失调
对129名患者的研究显示,毛螺菌科减少,巴斯德氏菌科(Pasteurellaceae)的丰度可以预测死亡率。
其他研究也提供了证据,表明特定的微生物组群特征可以区分肝硬化和健康对照组,并且微生物组的变化可能能够监测病情的严重程度和进展情况。
一组45例肝移植受者中,肝移植改变了肠道菌群,使微生物多样性增加,原生细菌增加(如毛螺菌科),潜在致病菌减少(如肠杆菌科)。
该研究强调了患病的肝脏会影响肠道菌群。
肝硬化和慢加急性肝衰竭:
慢加急性肝衰竭和肝硬化的肠道微生物群特征


Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
中国肝硬化患者宏基因组全关联研究(MWAS)显示,与健康个体相比,肝硬化肠道菌群组成有大于34个显著差异的菌群。肝硬化患者中韦荣球菌属和链球菌增多,而产丁酸共生菌包括Faecalibacterium prausnitzii 和Coprococcus comes减少。(下表)
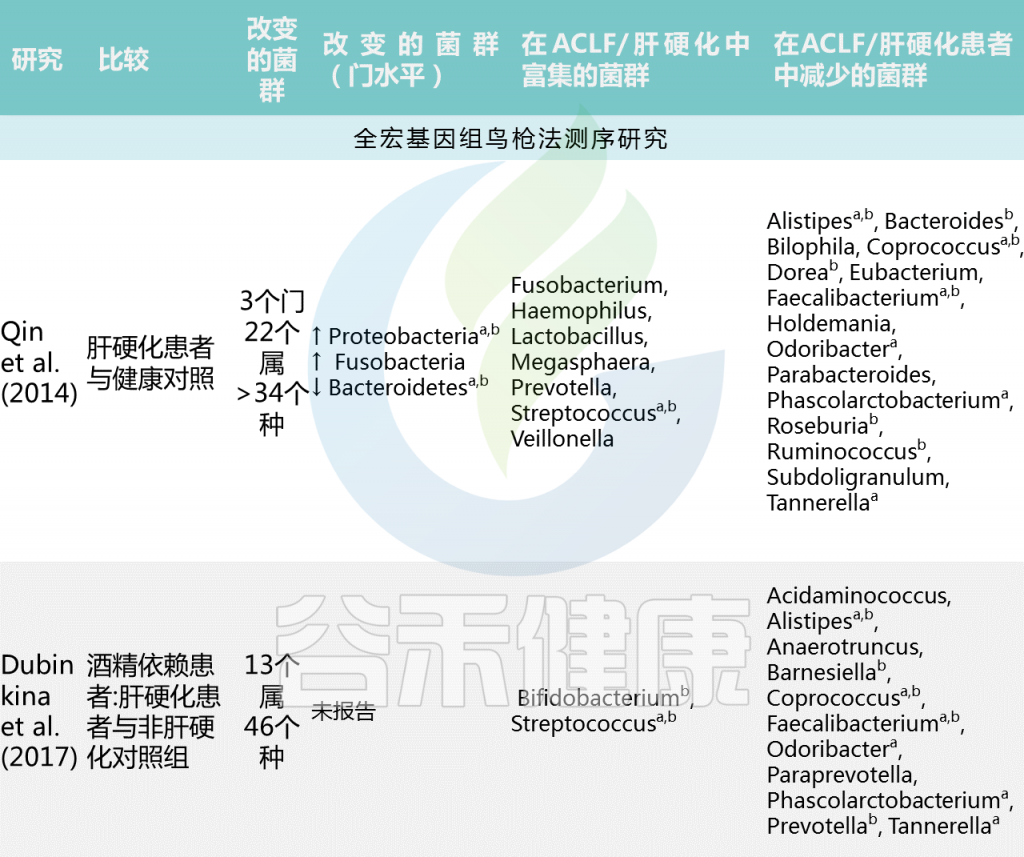

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
肝细胞癌(HCC)
持续的肝损伤和再生促进了肝细胞癌的发生,它是全球癌症死亡的第三大原因。
肝细胞癌HCC与肠道大肠杆菌过度生长有关,患者微生物群多样性增加,与产丁酸菌属(如Alistipes)减少有关,而致病性产脂多糖菌(如克雷伯氏菌)增加。
在与非酒精性脂肪性肝病相关的HCC,一项来自意大利的研究注意到拟杆菌和瘤胃球菌科增加,双歧杆菌减少。
不同部位菌群功能
肠道菌群:
从门诊病人的角度来看,肠道菌群可以证明是预测入院,MHE和晚期纤维化患者的有用工具。
一项针对NAFLD肝硬化的研究发现,粪便微生物分析中的27种细菌特征以及年龄,性别和体重指数(BMI)可预测NAFLD肝硬化。
晚期纤维化是NAFLD死亡率的重要预测指标,可以从粪便菌群中推断出纤维化,以帮助识别高危人群。
鉴于失代偿性肝硬化中存在预测的失调模式,因此将CDR(肝硬化失调率-毛螺菌科+瘤胃菌科+韦荣氏菌科/肠杆菌科+拟杆菌科)视为预测失代偿风险的工具(适用于所有常见的CLD病因)较低的分数预示结果较差,并且具有较强的预测价值。
粪便菌群也可以用来预测谁会在90天内再次入院和急性肝性脑病复发,因为急性肝性脑病和其他失代偿的粪便菌群有所不同。
唾液菌群:
唾液菌群失调比率是一种简单实用的临床工具(Lachnospiraceae + Ruminococcaceae + Veillonellaceae/ Streptococcaceae),可以预测有和无肝性脑病的失代谢性肝硬化患者90天的入院情况。
其他部位菌群:
一些研究表明,粪便微生物群和结肠黏膜相关微生物群是不同的。事实上,回肠、空肠和十二指肠粘膜样本或抽吸物的微生物群是不同的,它们可能对肝硬化具有重要的预后能力,主要表现为肝性脑病。然而,这些样本并不容易获得,而且很难将其作为生物标志物进行常规的护理点采集。
微生物工具的潜力
需要进一步的研究才能使人信服结论:患者在不同的条件和疾病下,它们的肠道微生物群既表现出疾病特异性的变化,也表现出非特异性的共同反应。因此,在其作为生物标志物的潜力得以实现之前,确定强有力的疾病特异性肠道菌群特征至关重要。
生物标志物和基于微生物的工具的潜力

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
要更准确地估计疾病对肠道微生物群的影响程度,就需要从世界各地获得强有力的大规模纵向数据,同时考虑各种混杂因素。理解和解释其他相关的混杂因素将使我们更接近以微生物组为基础的肝硬化生物标志物。
微生物组的整体观点,包括微生物基因表达和微生物衍生的代谢物或蛋白质,可能导致更准确和全面的生物标志物,类似于整合宿主遗传学与基因表达和表观遗传学时的强大疾病关联。这种包含宿主-微生物全生物的整体观点也可能支持诊断、分层和治疗的个体化,并可能开创全生物群关联研究的新时代,扩大宏基因组全关联研究领域。
我们知道,即使在没有肝病的情况下,微生物组也在调节情绪和潜在的认知中发挥作用。慢性肝病患者的脑功能改变是肠-肝-脑轴的结果,甚至在肝硬化之前就可以影响病程。
酒精使用障碍(AUD)
一项关于酒精使用障碍(AUD)患者肠-肝-脑轴的重要研究发现,抑郁、焦虑和酒精渴求与肠通透性增加相关,即使在戒酒后,肠通透性高的患者仍然存在抑郁、焦虑和酗酒。
最近发表的一篇关于AUD中这一轴的操纵的文章显示,对于AUD患者,在粪菌移植后,这些渴望、消费和长期的与AUD相关的住院治疗可能会降低。
肝性脑病
肝硬化中普遍存在的认知功能障碍是一种记忆障碍型,称为轻度或隐性肝性脑病。这可以发展为明显的肝性脑病,表现为嗜睡,迷失方向,晕眩和昏迷。
肝性脑病是肠肝轴中与微生物组相关的经典并发症,是全身性内毒素血症和炎症的结果,最终加重了神经炎症,而神经炎症是支撑肝性脑病发病机理的重要因素。
多年来,氨被认为是肝性脑病发病的关键,但后来发现全身炎症对于氨发挥其神经毒性作用是必不可少的。越来越多地描述了特定微生物群在肝性脑病和全身性炎症(包括性别影响)进程中的作用。在小鼠中,发现肠道微生物组是肝性脑病所特有的全身性炎症和神经炎症所必需的。
轻度肝性脑病和PTSD
在临床上,轻度肝性脑病需要专门的认知测试,例如心理计量学肝性脑病评分(PHES),抑制性对照测试,脑卒中诊断等。但这些测试最好在专门的环境中进行,并且需要专业知识。
轻度肝性脑病(MHE)和创伤后应激障碍(PTSD)肠道菌群之间也存在协同作用,与其他人相比,PTSD患者的菌群失调更为严重。PTSD,酒精滥用和肝硬化常常并存。微生物变化可能有助于将MHE与PTSD区别开来,并且可以帮助我们定义较新的疗法。
老年肠道-肝-脑轴改变
利用肠脑轴的主要挑战是老年人群(慢性肝病患者)。老年人患者的致病菌往往更具致病性,随着合并症,住院和抗生素暴露于更大的革兰氏阴性病原体中,病情恶化。
与类似的老年非肝硬化对照组相比,年龄较大(> 65岁)的肝硬化患者往往会改变肠道-肝-脑轴,从而增加炎症并损害记忆的认知能力。在相关网络分析的研究中,更重要的是,在老年肝硬化和非肝硬化组中也发现了类似的模式,这表明老年患者已经具有潜在的肠脑轴改变。
这对肝移植具有重要意义,因为尽管进行了肝移植,但与年龄相关的肠脑轴变化仍可能持续。人口老龄化往往会导致多种其他合并症和精神疾病,需要额外的照顾以确保最佳的移植后效果。
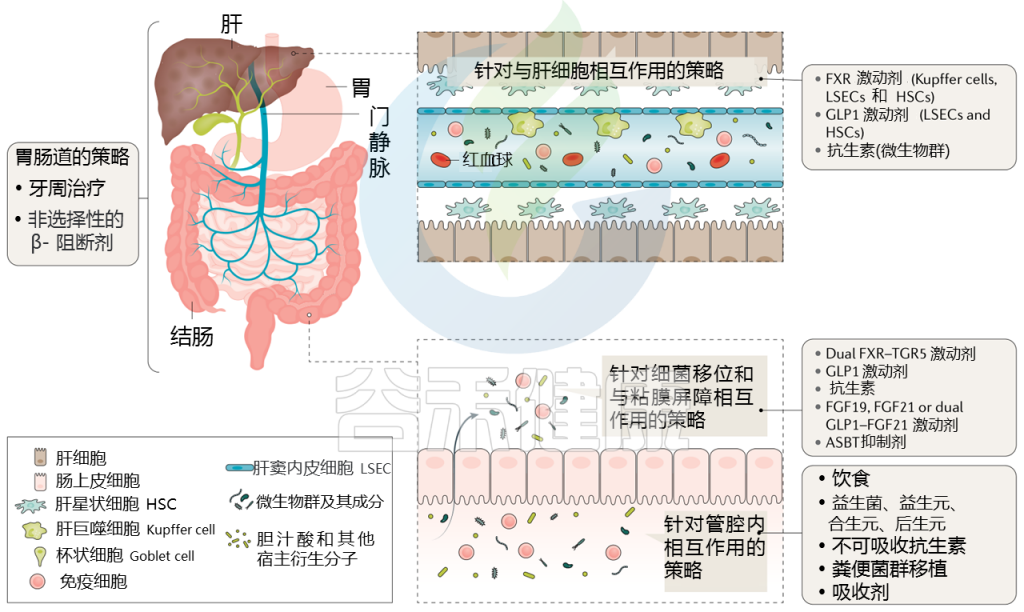
针对肝硬化肠道微生物群的策略

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
通过治疗(部分成立和部分试验)调节肠道微生物群可能改善肝硬化患者的预后,而微生物组生物标志物可能反映对这些治疗的反应。下表显示了不同的策略。
针对肠道微生物群的肝硬化干预措施

Trebicka Jonelet al, Nat Rev Gastroenterol Hepatol,2020
接下来主要介绍一些具体疗法:饮食、益生菌、抗生素、白蛋白、牙周、粪菌移植等,有些目前正在临床试验中。
饮 食
除其他因素外,饮食对肠道微生物群有重要影响,这一点已在各种疾病和条件下得到研究。一项针对国际肝硬化人群的研究报告称,咖啡、茶、蔬菜和酸奶的摄入都与微生物群落多样性的增加和住院率的降低有关,这为调节肠道微生物群落以促进肝脏健康提供了前景广阔的途径。(具体的饮食方面建议见文末附录部分)
益 生 菌
益生菌已经成为肝硬化临床研究的主题,特别是它们对脑功能的影响和肝性脑病的风险。
益生菌在肝硬化前可以改善NAFLD的组织学,在肝硬化中可以减少失调,对逆转OHE的二级预防有效,减少失代偿事件的住院率,但可能或不能改善认知能力(MHE)。
大多数制剂都含有乳酸菌,可产生短链脂肪酸,有利于结肠健康。一项短期(5天)口服两歧双歧杆菌和植物乳杆菌8PA3的小型试点研究表明,与单独标准治疗相比,口服两歧双歧杆菌和植物乳杆菌8PA3能恢复肠道菌群,并能更好地改善酒精性肝损伤。
以上是关于益生菌的前沿研究,如果想要尝试的话,最好是经过肠道菌群检测或者在医生的指导下服用更可靠。
抗 生 素
抗生素,也被用作失代偿期肝硬化的预防性治疗。
腹水患者发生自发性细菌性腹膜炎(SBP)的风险增加,接受抗生素预防来预防自发性细菌性腹膜炎的发展。这种SBP的一级预防已经被证明可以提高某些患者的生存率。
在一项多中心、随机对照试验中,对严重肝硬化患者使用抗生素,总体生存率没有任何益处,但是,同样,腹水中白蛋白浓度低的患者在接受抗生素治疗时,生存率得到了提高。
预防性抗生素治疗也同样有效建议用于其他临床情况,如静脉曲张破裂出血、既往SBP和复发性显性肝性脑病。然而,尽管对最脆弱的患者的短期效果可能是有益的,但在其他许多患者中,这些治疗不能阻止进一步的失代偿和ACLF。也许这种情况的部分原因是抗生素引起的微生物群落多样性减少。
因此,需要开发一种更具针对性的肠道微生物群来改善肝脏健康。
牙周卫生
也许你不知道,牙周卫生也会与肝硬化有关。已发表的人类MWAS表明,在肝硬化期间,肠道微生物组向口腔微生物组转变。
减少胃部充当天然屏障的酸性环境可能促成口腔微生物群转移到肠道,在肠道上皮屏障适应不同的微生物组分。如前所述,这些变化可能促进肠道微生物群通过肠道屏障的转移,进而导致并发症。因此,防止口腔微生物不必要的转移到肠道,可以成为未来肝硬化治疗的基础。
一项研究表明,与20名非肝硬化对照组相比,30名肝硬化患者的牙周卫生干预措施改变了肠道微生物群,改善了肝性脑病。
白蛋白作为潜在疗法
当肠道屏障被削弱时,它会双向泄漏,这也会导致重要的宿主分子从血液室泄漏到肠腔。例如,在酒精性肝病动物模型中,肠道通透性增加导致粪便白蛋白浓度升高。
随着肝硬化的进展,肝脏中的白蛋白合成受到损害:一方面,肝损伤导致肝细胞功能质量的丧失;
另一方面,肝脏僵硬程度的增加,白蛋白合成减少。不仅白蛋白减少,而且它能结合毒素和其他有害物质。这些观察结果将白蛋白水平定位为肝病严重程度的关键参数。
白蛋白还可通过前列腺素E2改善免疫B细胞功能,减少肝硬化患者的免疫反应,从而阻止与ACLF和死亡密切相关的全身炎症爆发。
长期白蛋白治疗肝损害和非自发性细菌性腹膜炎感染患者分别通过提高生存率和解决ACLF改善了临床结果。因此,白蛋白泄漏到肠腔可能会影响肠道微生物群并被其代谢,从而可能改变微生物组分,间接改变宿主。
粪菌移植(FMT)
失代偿期肝硬化中菌群移植的初步研究正在出现,其安全性也很高,为更大规模的研究铺平了道路。
菌群移植后变形菌减少,放线杆菌增多,肝脏疾病严重程度改善,严重酒精性肝炎患者3个月时的死亡率降低,1年生存率提高。
慢性乙型肝炎FMT组出现微生物改变,HBeAg降低。FMT减少了短期酒精渴求和消费,以及AUD相关的住院治疗。
一项包括20名复发性肝性脑病患者在内的开放性随机试验观察到,使用FMT灌肠剂减少了住院人数,改善了认知和菌群失调。
另一项研究也证明了这一点。使用口服胶囊制剂的FMT的新应用也显示出类似的安全性和对肝硬化和肝性脑病的治疗效果。然而,由于报告了一些由耐yao菌转移导致的FMT相关死亡病例,包括一些肝硬化患者,因此需要谨慎。因此,更好地理解和全面描述这些研究可能带来明确的微生物调节干预治疗失代偿期肝硬化。
加深菌群影响机制的理解
未来的研究应该探索和加深对肠道微生物组变化影响肝硬化进展和失代偿发展的动力学和机制的理解。
诊断、治疗
由于肝硬化表现为肠道微生物群与宿主的大量重要相互作用,微生物组诊断和治疗几乎是治疗疾病进展和失代偿发展的必经之路。需要进一步倡导基于微生物组检测和靶向疗法。
改善预后
针对不同水平微生物群与宿主相互作用的策略改善患者的预后。
产学研合作
使之更容易获得和更具成本效益,微生物检测需要更广泛地适应,因为它相对容易收集且信息量较大。可以帮助诊断,预测和潜在地个性化治疗。
多学科综合
多学科例如微生物学,宿主遗传学,基因组学,表观遗传学,代谢组学,营养学等相结合,更好地利用微生物帮助我们有效的进行慢病管理,预防为主,将指导落实到饮食、生活方式等具体应用上,用全新的视角帮助我们认识健康,保持健康。
饮 食 方 式
尽可能选择对肝脏友好的食物,帮你保护肝脏。以下是一些饮食技巧:
选择全麦谷物,面包和谷物。
多吃各种颜色的水果和蔬菜。
选择低脂乳制品。
选择瘦肉蛋白质。
选择植物油,例如橄榄油,而不是黄油。
零食坚果和种子食物。
减少钠摄入量。
每天喝8-10杯水。
避免含有反式脂肪的加工食品。
避免添加糖。
选择可以长期生活并遵循的饮食计划。
吃八分饱腹感
少吃多餐,每三到四个小时吃一顿小餐或吃零食,以补充精力。
限 制 饮 酒 量
肝脏是负责代谢营养物质和其他摄入物质的主要器官。如果体内酒精过多,肝酶可能没有足够的能力对其进行处理。过量的酒精会在身体的其余部分循环,产生负面影响。
定期减少饮酒量很重要。医生甚至可能建议你完全戒酒。
增 加 运 动 量
运动的好处不仅限于减肥和控制体重,还可以帮助减少肝脏周围的脂肪。定期运动也可以改善你的情绪,助你维持在最佳的健康状态。
开始时要循序渐进,比如可以每周进行150分钟运动开始,尽量选择你喜欢的运动,例如,跑步和步行的组合,多人参与的活动增加趣味性(如各种球类运动),健身房的器械训练等。
睡 觉
充足的睡眠对于保持健康状态非常重要(包括慢性肝病治疗期间睡眠很重要)。如果你觉得入睡困难,开始慢慢尝试练习良好的睡眠习惯,例如:
每天都在同一时间上床睡觉和起床,作息规律。
避免咖啡因,烟草和其他刺激物。
尽量保持卧室环境清爽舒适。
运动尽量安排在清晨或午后,不要在睡前剧烈运动。
相关阅读:
膳食胆固醇通过调节肠道微生物群和代谢产物驱动脂肪肝相关的肝癌
参考文献:
Grat M, Wronka KM, Krasnodebski M, et al. Profile of Gut Microbiota Associated With the Presence of Hepatocellular Cancer in Patients With Liver Cirrhosis. Transplant Proc 2016;48:1687-91.
Jones R M, Neish A S. Gut Microbiota in Intestinal and Liver Disease[J]. Annual Review of Pathology:Mechanisms of Disease, 2020, 16.
Acharya Chathur,Bajaj Jasmohan S,Chronic Liver Diseases and the Microbiome: Translating Our Knowledge of Gut Microbiota to Management of Chronic Liver Disease.[J] .Gastroenterology, 2020
Bajaj JS, Sharma A, Dudeja PK. Targeting Gut Microbiome Interactions in Service-related Gastrointestinal and Liver Diseases of Veterans: Meeting Summary.Gastroenterology 2019.
Liu R, Kang JD, Sartor RB, et al. Neuroinflammation in Murine Cirrhosis Is Dependent on the Gut Microbiome and Is Attenuated by Fecal Transplant. Hepatology 2020;71:611-626
Ren Z, Li A, Jiang J, et al. Gut microbiome analysis as a tool towards targeted non-invasive biomarkers for early hepatocellular carcinoma. Gut 2019;68:1014-1023.
Trebicka Jonel,Bork Peer,Krag Aleksander et al. Utilizing the gut microbiome in decompensated cirrhosis and acute-on-chronic liver failure.[J] .Nat Rev Gastroenterol Hepatol, 2020
Lang S, Fairfied B, Gao B, et al. Changes in the fecal bacterial microbiota associated with disease severity in alcoholic hepatitis patients. Gut Microbes 2020;12:1785251.
Ponziani FR, Bhoori S, Castelli C, et al. Hepatocellular Carcinoma Is Associated With Gut Microbiota Profile and Inflammation in Nonalcoholic Fatty Liver Disease. Hepatology 2019;69:107-120.
Gao B, Duan Y, Lang S, et al. Functional Microbiomics Reveals Alterations of the Gut Microbiome and Host Co-Metabolism in Patients With Alcoholic Hepatitis. Hepatol Commun 2020;4:1168-1182.
Duan, Y . et al. Bacteriophage targeting of gut bacterium attenuates alcoholic liver disease. Nature 575, 505–51 1 (2019)

谷禾健康
电离辐射可以引起造血系统,肠道系统以及心脑血管神经系统的多器官损伤。
放射治疗在临床上被广泛用于治疗多种肿瘤。但是由于放射射线不仅可以杀死癌细胞,还会对周围的正常细胞和组织造成损伤,因此放疗经常会引起各种副作用,比如疲劳,恶心,呕吐和腹泻等等。
肠道是辐射的主要目标,也是肠道菌群的最大生态位。虽然有小部分描述性研究表明,肠道微生物群与辐射损伤之间存在潜在的相关性,但这种关系的具体基础仍然不清楚。
近日,来自美国北卡罗拉纳大学教堂山分校的 Jenny P.Y. Ting 团队在 Science在线发表研究论文,题为“Multi-omics analyses of radiation survivors identify radioprotective microbes and metabolites”。

发现在致死剂量的全身性辐射模型中,肠道微生物群,特别是Lachnospiraceae和Enterococcaceae可以保护小鼠抵抗辐射引起的造血系统和肠道系统的损伤,从而在致死剂量的辐射后存活下来。并且这些有益的微生物在放疗副作用轻微的白血病病人的粪便中含量显著提高。
通过靶向性以及非靶向性代谢组学研究,该研究发现SCFAs和色氨酸代谢物能降低肿瘤坏死因子-α、白细胞介素-6、干扰素-γ等促炎细胞因子的生成,这些细胞因子都是辐射损伤的重要介质。
这些发现提出了肠道微生物群和代谢产物在辐射激发后疾病易感性调节中起关键作用的可能性。
研究人员发现,一小部分小鼠可以在高剂量的辐射下存活并正常生活。这些“精英幸存者”拥有一个独特的肠道微生物组,该微生物组是在辐射后形成的。
然后将这部分小鼠称为“精英存活小鼠”,并且收集了他们的粪便进行16srRNA的测序。与同年龄的对照小鼠相比,“精英存活小鼠”的肠道菌群有很明显的不同。
随后,研究人员通过多种不同的菌群干扰实验来直接验证肠道菌群是否可以影响机体对于辐射的反应。在“dirty cage sharing”(脏笼)实验中,作者将“精英存活小鼠”和同年龄常规饲养的的对照小鼠使用过的脏笼子收集起来,用来饲养SPF小鼠和接受者小鼠。
每一周他们都会将接受者小鼠转移到相对应的新鲜脏笼中。经过8周的 “dirty cage” 实验,对接受者小鼠进行致死剂量的辐射。
接受了 “精英存活小鼠” 脏笼子饲养后的接受者小鼠对致死剂量辐射具有了明显的抵抗效果,30天内生存率达到了70%。相反,接收对照组脏笼子饲养的接受者小鼠,30天存活率仅为20%左右。
另外,作者分别利用SPF小鼠和无菌小鼠进行了粪菌移植实验。
接下来他们直接收集了“精英存活小鼠”和对照小鼠的粪便,并将粪便处理物通过灌胃的方法转移到受体小鼠中。接收“精英存活小鼠”粪便移植的SPF小鼠和GF小鼠都表现出明显的抗辐射效果。
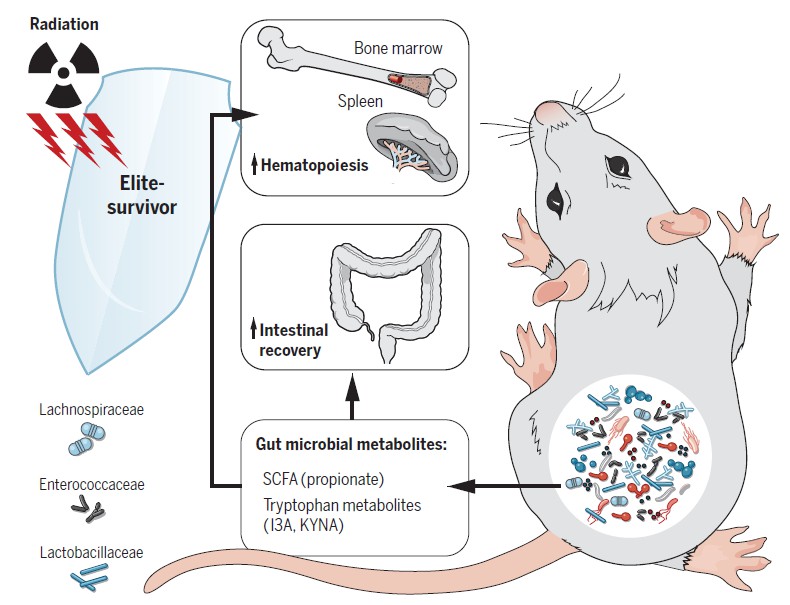
利用这一发现,结合粪便植入和‘dirty cage sharing’实验,证明来自精英幸存者的微生物群在无菌的和常规饲养的接受者中均提供了重要的放射防护,其特点是提高了存活率并改善了临床评分。
他们找出了8种在“精英存活小鼠”受体组显著升高的细菌以及5种显著下降的细菌。那么作者推测,这些在“精英存活小鼠”受体组显著升高的细菌就可能是使机体对辐射有抵抗效果的“有益菌”,相反在“精英存活小鼠”受体组显著下降的细菌则可能是“有害菌”。
那么,这些肠道菌群对辐射的影响在人体内是否也成立呢?
作者联合杜克大学以及纪念斯隆-凯特琳癌症中心的实验室,一起进行了一个小型临床研究。
他们收集了一些白血病病人的粪便并进行了16srRNA测序。由于腹泻是放疗之后常见的副作用,他们根据病人腹泻的持续时间,将病人样本分为轻度腹泻和重度腹泻两组。
肠道菌群分析
通过肠道菌群的分析发现,在轻度腹泻病人中,Lachnospiraceae,Enterococcaceae以及Lactobacillaceae这三种在小鼠中可能的“有益菌”数量明显高于重度腹泻的病人。Lachnospiraceae的数量与病人腹泻时间存在显著地负相关性。因此,作者推断在人体中,这些可能的“有益菌”也可以帮助病人降低放疗引起的副作用。
随后,作者挑选了三种可能的“有益菌”,三种可能的“有害菌”以及一种最著名的益生菌 Lactobacillus rhamnosus, 进行了单一菌株的体内实验。
组织学分析
作者发现,Lachnospiraceae对小鼠的保护作用极明显。并且,通过组织学分析,Lachnospiraceae极大地降低了辐射对于造血系统和肠道系统造成的损伤。骨髓和脾脏的组织结构和细胞死亡得到了极大地保护。大肠和小肠的损伤以及肠道渗透性也明显降低。
短链脂肪酸分析
由于Jenny Ting课题组和其他课题组已经报道过,Lachnospiraceae可以产生大量的短链脂肪酸,并且短链脂肪酸是调节机体免疫反应和炎症反应的重要物质,因此,作者检测了三种短链脂肪酸对辐射的影响。
他们发现,在接受了propionate丙酸处理后,小鼠可以有效地抵抗致死剂量辐射带来的造血系统和肠道系统的损伤,生存率也得到了极大的提高。
细胞分析
作者同时检测了骨髓中造血干细胞和祖细胞的比例,发现propionate处理小鼠要远高于对照小鼠。另外,辐射所导致的DNA损伤与活性氧的释放,在propionate处理后也明显降低。
非靶向性代谢组学分析
最后,作者通过非靶向性代谢组学研究发现了一系列的代谢产物在“精英存活小鼠”的粪便中含量显著提高。其中,升高最为明显的是色氨酸代谢通路的成员。作者选取了indole-3-carboxaldehyde (I3A)和kynurenic acid(KYNA)进行了体内验证。两个色氨酸途径代谢产物1H-吲哚-3-甲醛(I3A)和强尿酸(KYNA)在体内提供了长期放射防护。
该研究的发现强调肠道菌群作为宿主抵抗辐射的主要调节剂的关键作用,能够保护造血和胃肠系统。
“精英存活小鼠” 的肠道菌群组成和普通小鼠不同,他们的肠道中含有大量的Lachnospiraceae等“有益菌”。这些“有益菌”通过产生大量的短链脂肪酸和色氨酸代谢通路的代谢产物来促进造血发生以及肠道损伤修复,从而帮组机体抵抗辐射引起的损伤和死亡。
毛螺菌科和肠球菌科,以及以丙酸和色氨酸途径菌群为代表的下游代谢产物,对辐射防护起着重要作用。
这项研究揭示了微生物代谢物轴在产生广泛的抗辐射保护中所起的关键作用,并为治疗辐射暴露的不良副作用提供了有希望的治疗靶标。
Tips
该文做了很多生理,化学,生物代谢和病理等大小20多项实验,包括小鼠实验,辐射处理实验,“dirty-cage sharing”实验,FMT实验,细菌菌种管理实验,SCFA和色氨酸代谢处理实验,病理组织学,肿瘤接种和放射治疗实验,免疫染色和免疫印迹解折,肠通透性检测,骨髓干细胞,肠上皮细胞和肠上皮内淋巴细胞分离,ROS检测,流式细胞仪分析,粪便16S rRNA基因测序分析,气相色谱-质谱检测,非靶向代谢组实验。一篇高水平论文的研究思路和严谨的实验论证过程,值得我们借鉴和学习。
参考文献:
Guo Hao,Chou Wei-Chun,Lai Yunjia et al. Multi-omics analyses of radiation survivors identify radioprotective microbes and metabolites.[J] .Science, 2020, 370

谷禾健康
痘痘,粉刺,酒渣鼻等皮肤问题,困扰着一些爱美的朋友。这关乎到个人形象,甚至有些朋友还会因为这个感到焦虑,社交尴尬,严重影响自信。
为了祛痘,盲目往脸上涂抹太多祛痘护肤产品,正所谓“过犹不及”,涂抹太多,过量,不断刺激皮肤,雪上加霜。


改善皮肤和整体健康的关键,从你的肠道开始。
我们常常说,一个人由内而外散发着美。其实是有科学依据的。
你的肠道和皮肤有很多共同点:
· 都在保护你,不受外界影响。
· 各自都有微生物群,彼此直接交流。
· 都富含肥大细胞,是免疫系统抗病第一线。
· 它们在早期发育过程中来自同一类细胞。
为什么吃的东西会影响你的皮肤?
皮肤与周围的世界相互作用,而胃肠道则处理你吃的、呼吸的和吞咽的一切。你吃的食物经过新陈代谢,食物分解后的副产物会直接进入到你的皮肤。
把皮肤看成是肠道健康的窗口
以下是11种皮肤状况,实际上是从肠道开始的:


看过我们文章的小伙伴都知道,人体肠道中有大量的微生物群。那肠道微生物群是怎么和皮肤进行交流的呢?
这就涉及一个:肠道-皮肤轴。
肠道-皮肤轴是连接肠道及其微生物与皮肤的信号分子网络,跟脑-肠轴类似。
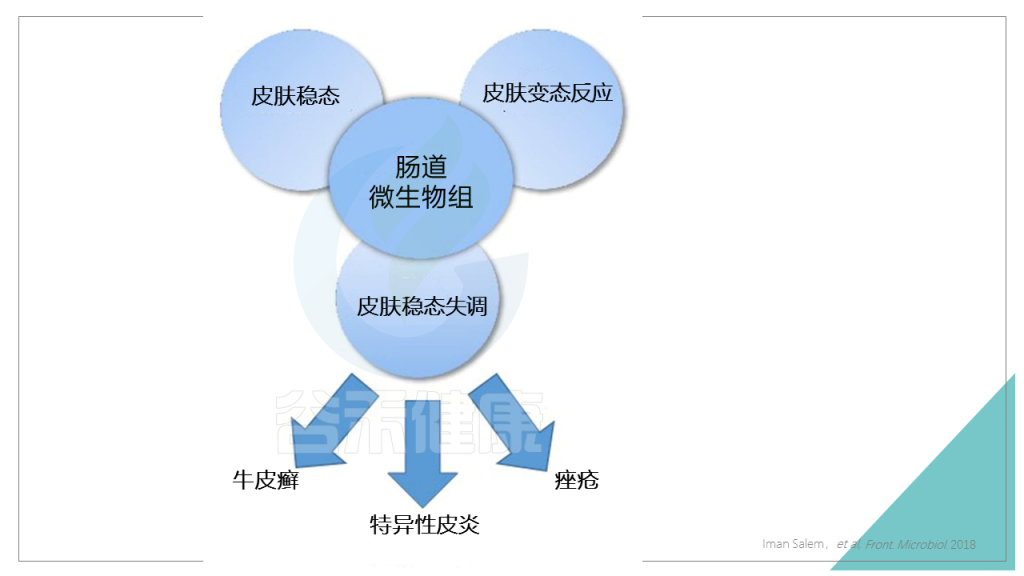

免疫系统、皮肤和大脑之间的沟通是通过微生物来调节的。
炎症—— 大多数疾病的根本原因。
氧化应激—— 炎症的主要原因。
组织脂质水平—— 健康新陈代谢的重要因素。
血糖—— 控制平衡血糖的能力。
神经肽水平—— 一个与你的情绪、疼痛耐受力和身体内环境平衡有关的因素。
致病菌—— 使你生病或引起疾病的坏细菌。
神经递质—— 调节情绪,例如,大约90%的血清素(你的快乐神经递质)是由肠道微生物群产生的。
肠道微生物组与以上协调皮肤稳态的各个途径都有关联,最终影响皮肤健康。
研究发现,痤疮与其说是皮肤的问题,不如说是肠道的问题。
脂多糖(LPS)内毒素是有害的革兰氏阴性菌的组成成分,已被证明对肠道和皮肤造成严重破坏。研究发现,当体内有高水平的脂多糖内毒素时,它们会干扰伤口愈合,使疤痕更严重。
LPS还与寻常痤疮(也就是粉刺)有关,使你更可能对大肠杆菌脂多糖内毒素(E.coli LPS)产生强烈反应。对E.coli LPS有很强的反应性意味着你更可能有纤维蛋白微凝块,这会导致小而疼痛的组织疤痕。
更可怕的是,高水平的脂多糖和大肠杆菌脂多糖会导致肠漏,使细菌进入血液,身体就会出现炎症,表现在皮肤上就是痤疮、粉刺等问题。它还会使你更容易患上肠易激综合征和焦虑症、抑郁症等。
另外,肠道菌群失衡,有害菌大量繁殖,促进炎性物质释放,从而也会引起痤疮等皮肤问题。
特应性皮炎是最常见的慢性瘙痒性炎症性皮肤病。
西方饮食的低纤维和高脂肪含量特征从根本上改变了肠道菌群,导致免疫调节代谢产物特别是短链脂肪酸的产生不足。短链脂肪酸对上皮屏障完整性起重要作用。
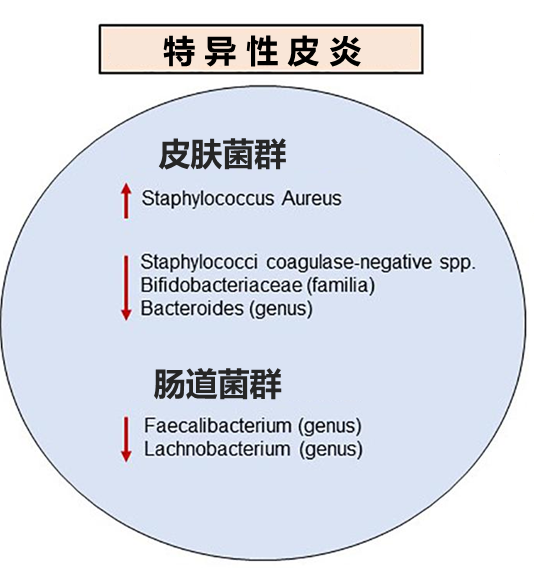
在两项韩国研究中,对特异性皮炎患者粪便样本的宏基因组分析显示,与对照组相比,普氏栖粪杆菌Faecalibacterium prausnitzii显著减少。
关于普氏栖粪杆菌的失调与上皮屏障破坏之间可能存在正反馈回路。肠屏障的破坏,允许消化不良的食物、微生物和毒素进入循环,到达目标组织包括皮肤,触发Th2免疫反应,导致进一步的组织损伤,从而促进该反馈回路。
关于特异性皮炎,更多详见:微生物群对三大过敏性疾病发展的影响
银屑病(俗称牛皮癣),是一种由免疫介导的慢性炎症性皮肤病,病程较长且易复发。
牛皮癣与胃肠道炎症的相关性特别强,7 – 11%的炎症性肠病(IBD)患者被诊断为牛皮癣。
某些共同的遗传和环境因素以及免疫途径在这两种疾病的发病机制中都有牵连。例如,Th17细胞及其细胞因子,已知在牛皮癣的发展中起主要作用,在IBD的病理生理学中也有牵连。
牛皮癣患者肠道菌群特征与IBD患者类似。与健康对照组相比,牛皮癣患者体内普氏栖粪杆菌Faecalibacterium prausnitzii的数量显著减少。
湿疹始于肠道。
当医生和皮肤科医生在寻找皮肤表面的解决方案时,他们忽略了湿疹是由免疫系统过度活跃引起的事实。这种过度活跃的免疫系统通常是肠道微生物群失调的结果。事实上,微生物多样性的下降会导致湿疹发作。
为了缓解湿疹症状,采取措施减少炎症和通过饮食增加微生物多样性是至关重要的。对抗湿疹的饮食需要针对你的微生物群和身体。
乳糜泻乳糜泻是一种常见的慢性疾病。它和皮肤状况密切相关。
患有乳糜泻的人更有可能有:
疱疹样皮炎、脱发、湿疹、
荨麻疹、白癜风、口腔黏膜病变
因为当患有乳糜泻的时候,免疫系统会释放出具有防御性质的抗体,也就是免疫球蛋白,它会在皮肤下面血管集中,导致皮疹的出现。
患有乳糜泻的人往往需要解决肠道的问题。他们有一个优势,就是他们会被引导去寻找与肠道有关的解决方案。
这就意味着,当他们进行无麸质或其他措施来减少乳糜泻的影响时,顺便在不经意间解决了皮肤状况。
至于其他的皮肤问题,往往需要比乳糜泻花更多的时间,才意识到原来肠道是问题的根源。
医生正在发现小肠细菌过度生长(SIBO)患者与酒渣鼻之间有着密切的联系。一些医生甚至报告说,当他们为患者治疗SIBO时,他们多年来的酒渣鼻会突然消失。
这对酒渣鼻患者来说绝对是个好消息。
SIBO是在2004年才被发现,许多人患有酒渣鼻,却不知道问题的根源可能是他们的肠道。现在可能许多人还不知道这一重要的联系。
每个人的肠道微生物组对他们来说都是独一无二的,因此每个人都有不同的适合自己的方法。
这里有些比较普适的建议。
减轻生活压力

持续的压力会对肠道菌群产生负面影响。减少压力时,进行规律饮食,保证良好睡眠,可以适当进行冥想、瑜伽、听音乐等方式,当然改善肠道健康也同样重要。
少吃糖

各种甜食虽然诱人,但还是尽量不要吃太多。糖分会刺激皮脂腺分泌,吃过多会导致皮肤爱出油、出油多自然容易长痘痘、粉刺等。另外,糖可以喂食许多有害菌,当你少吃糖时,提供给有害菌的能量少了,有害菌就会被饿死。
详见:深度解析 | 炎症,肠道菌群以及抗炎饮食 文中除了详细介绍机制外,还有相关的抗炎和促炎食物介绍。
均衡饮食
健康的饮食,最好由多种不同类型的食物组成,包含水果、蔬菜、谷物、肉类等。丰富的食物有利于肠道内不同类型细菌的生长,从而帮助肠道菌群多样性的增加。菌群多样性可能对恢复力起到积极作用,更能抵抗外界刺激引起的微生物群的扰动。
适量锻炼

适量锻炼,但不要太过 。锻炼对肠道微生物组有益,但如果锻炼过多,则无济于事。过度劳累又相当于形成了一种压力,并可能导致微生物失衡。
肠道菌群检测
每个人的肠道菌群都需要独特的饮食。对别人健康的食物可能对你来说并不理想。肠道菌群检测可以是一种工具,来帮你找到最适合你自己的健康食物。
其他方式,详见:
结 语
我们都知道分析问题要有整体观。面对疾病也一样,表面看是皮肤问题,实际可能是肠道的问题。
调理肠道健康,从根本上入手,一些皮肤问题也就迎刃而解了,而皮肤的改善提升颜值,带来的心情愉悦也可以进一步促进健康。
相关阅读:
参考文献:
Guo, Shuhong et al. “Lipopolysaccharide causes an increase in intestinal tight junction permeability in vitro and in vivo by inducing enterocyte membrane expression and localization of TLR-4 and CD14.” The American journal of pathology vol. 182,2 (2013): 375-87. doi:10.1016/j.ajpath.2012.10.014
O’Neill CA, Monteleone G, McLaughlin JT, Paus R. The gut-skin axis in health and disease: A paradigm with therapeutic implications. Bioessays. 2016 Nov;38(11):1167-1176.
Huang R, Wang K, Hu J. Effect of Probiotics on Depression: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients. 2016;8(8):483. Published 2016 Aug 6. doi:10.3390/nu8080483
Bowe WP, Logan AC. Acne vulgaris, probiotics and the gut-brain-skin axis – back to the future? Gut Pathog. 2011 Jan 31;3(1):1. doi: 10.1186/1757-4749-3-1. PMID: 21281494; PMCID: PMC3038963.
Caproni M, Bonciolini V, D’Errico A, Antiga E, Fabbri P. Celiac disease and dermatologic manifestations: many skin clue to unfold gluten-sensitive enteropathy. Gastroenterol Res Pract. 2012:952-753.
Parodi A, Paolino S, Greco A, Drago F, Mansi C, Rebora A, Parodi A, Savarino V. Small intestinal bacterial overgrowth in rosacea: clinical effectiveness of its eradication. Clin Gastroenterol Hepatol. 2008 Jul;6(7):759-64.
Wollina U. Microbiome in atopic dermatitis. Clin Cosmet Investig Dermatol. 2017;10:51-56.
Juhlin L, Michaëlsson G. Fibrin microclot formation in patients with acne. Acta Derm Venereol. 1983;63(6):538-40. PMID: 6198846
Yang H, Hu C, Li F, Liang L, Liu L. Effect of lipopolysaccharide on the biological characteristics of human skin fibroblasts and hypertrophic scar tissue formation. IUBMB Life. 2013 Jun;65(6):526-32. doi: 10.1002/iub.1159. Epub 2013 May 7. PMID: 23653386