-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
糖尿病是一种复杂的多系统代谢紊乱,其特征是高血糖,它还会导致并发症,降低生活质量并增加死亡率。糖尿病病理生理学包括β细胞、脂肪组织、骨骼肌和肝脏功能障碍。
1型糖尿病(T1D)是由免疫介导的β细胞破坏引起的。更常见的2型糖尿病(T2D)是一种异质性疾病,其特征是不同程度的β细胞功能障碍与胰岛素抵抗共同作用。
肥胖和2型糖尿病之间的密切关联涉及由中枢神经系统调节的通路,这些通路控制食物摄入和能量消耗,并整合来自外周器官和环境的输入。
患糖尿病或其并发症的风险代表了遗传易感性和环境因素之间的相互作用,包括营养食品的可用性和其他健康的社会决定因素。
糖尿病已经困扰人类数千年。从对这一疾病的“早期”描述到现代,目前人们对全球日益增多的糖尿病病人的流行病学、病理生理学、并发症和治疗选择的理解已经大大加深。
在过去的 50 年里,我们共同目睹了有关1型糖尿病和2型糖尿病病理生理学的知识爆炸式增长,而这种知识正在彻底改变糖尿病的治疗和预防方法。因此,任何关于糖尿病病理生理学和治疗进展的观点都不可能详尽无遗,或完全统一。
本文根据顶级期刊《Cell》近期发布的关于近50年有关糖尿病研究进展总结内容,与大家分享。
◮ 关于糖尿病的基础知识
糖尿病是由于胰岛素不足以刺激生理性葡萄糖处理,从而促进能量在脂肪组织、肌肉和肝脏中的储存而发展起来的。
糖尿病的表现范围从几乎完全的胰岛素缺乏症,如1型糖尿病(T1D)中出现的情况,到在胰岛素抵抗的情况下胰岛素相对缺乏的情况——2型糖尿病(T2D)的特征。
虽然糖尿病的诊断是基于测量血糖或糖化血红蛋白,但这种疾病应该被视为一个与多种合并症相关的多系统疾病。
◮ 糖尿病的大致分类
•1型糖尿病:由免疫介导的胰岛细胞破坏引起;
•2型糖尿病:与胰岛素抵抗和相对胰岛细胞功能不全相关;
•特定单基因疾病、药物毒性或胰腺功能不全引起的糖尿病综合征;
•妊娠期糖尿病
◮ 糖尿病的患病情况
2型糖尿病患者人数最多,1型糖尿病则不到所有病例的5%。2021年,全球糖尿病的患病率估计为6.1%,相当于5.29亿人,某些地区的患病率甚至高达12.3%。2型糖尿病占96%的病例,其中超过50%与肥胖有关。
糖尿病流行的趋势令人担忧,预计到2050年,将有13.1亿人患糖尿病。其他分析指出,2021年全球患病率已经超过10%。此外,2021年估计还有4.64亿人有糖耐量受损,2.98亿人有空腹血糖受损,总体上代表了糖尿病前期。
◮ 糖尿病大大增加了患其他病的风险
糖尿病大大增加了由心血管疾病和肾脏病造成的全因死亡率,且导致多种其他病症,包括失明、肢体丧失、慢性疼痛和残疾。
尽管升高的循环葡萄糖是任何原因引起的糖尿病的特征,但2型糖尿病是一种异质性疾病,不同人群亚群的结果存在差异。
鉴于肥胖与2型糖尿病之间的关联,有人认为,只要更加注重改善营养、增加身体活动和减少肥胖的政策,这种负担的大部分是可以预防的。然而,糖尿病的异质性表明,预防和治疗策略最好量身定制,以最大限度地发挥其在特定人群中的功效。
◮ 1型糖尿病概况
1型糖尿病(T1D)占所有糖尿病病例的5%–10%,由自身免疫介导的胰腺β细胞破坏导致。
胰岛素的发现使1型糖尿病从曾经的致命诊断变为可管理的慢性病。尽管取得了管理进步和新疗法的问世,只有约20%的患者能实现最佳血糖控制,且预期寿命较短。
◮ 遗传研究和疾病进展
全基因组关联研究(GWAS)鉴定了60多个与1型糖尿病相关的基因位点,显示出该病的高度遗传性。
对自然史的研究通过新生儿筛查和自身抗体筛查提供了对环境因素、疾病触发因素、胰岛自身免疫轨迹及代谢和免疫表型的见解。
重要观察之一是综合分析显示,有两种或更多胰岛自身抗体的人在15年内发展为临床1型糖尿病的风险超过80%。
◮ 疾病分期
1期T1D:存在两种或两种以上自身抗体
2期T1D:多种自身抗体阳性和血糖紊乱
3期T1D:明显的高血糖症
历史背景
在上世纪末,关于2型糖尿病的遗传学理解主要集中在少数几个基因座上,这些基因座与环境因素共同影响个体患病风险。
现代研究进展
随着全基因组关联研究(GWAS)的发展,现在已发现数百种与2型糖尿病相关的遗传变异。这些变异大多对患病风险的影响很小。
变异的作用机制
大多数与2型糖尿病相关的变异并不直接改变蛋白质功能,而是通过影响非编码基因组序列中的调控元件来改变基因表达的丰度。这些调控元件在特定的细胞类型和发育时间点发挥作用。
挑战与机遇
当前的挑战是将这些调控信号与具体的效应基因(转录本)关联起来,以了解其对糖尿病风险的影响。识别这些基因有助于理解糖尿病的机制,并可能发现新的治疗靶点。
单细胞多组学数据的应用
单细胞分辨率多组学数据集的出现为研究人员提供了工具,以更好地将遗传变异与其效应基因关联起来。这些数据结合高通量细胞表型分析,有助于评估变异相关的基因表达改变与疾病的关系。
临床应用的局限性
尽管这些研究提供了对糖尿病潜在病理生理学的生物学洞察,但目前尚无直接的精准诊断或治疗方法。
多样性研究的需求
大多数遗传学研究是在欧洲人群中进行的,因此需要在更广泛和多样化的人群中开展类似研究,以避免因缺乏多样性导致的健康差异,尤其是在糖尿病护理方面。
未来研究方向
研究人员对将心脏代谢和血糖特征的基因数据与2型糖尿病风险的基因数据结合起来很感兴趣。这些共享信号可能揭示潜在的组织和机制,通过这些机制,变异体会影响糖尿病或其并发症的风险。
聚类分析
通过不同聚类方法,研究人员正在识别2型糖尿病中常见的缺陷过程(如胰岛素作用、β细胞功能、血脂异常),并评估其临床效用。
20世纪90年代初,通过识别单基因糖尿病的突变,揭示了葡萄糖代谢与胰岛素分泌偶联机制的重要性。这些研究表明,关键的糖酵解酶如葡萄糖激酶的功能丧失突变影响胰岛素分泌。
转录因子HNF1A/HNF4A对内分泌胰腺的发育和维持至关重要,其发现为进一步研究胰腺和内分泌细胞发育的重要步骤奠定了基础。
基因变异的影响
罕见的完全渗透性突变在生命早期表现为糖尿病,而影响较小的等位基因也会增加2型糖尿病的风险。
胰腺功能的复杂性
研究发现外分泌和内分泌胰腺之间存在意想不到的联系。罕见的消化酶基因突变和与糖尿病相关的常见变异揭示了胰腺疾病(如胰腺炎和囊性纤维化)与内分泌细胞功能障碍之间的联系。
对β细胞功能受损的各种方式的机制理解得益于人类基因发现(下图)。
胰腺β细胞因环境和遗传因素受损的潜在方式示意图
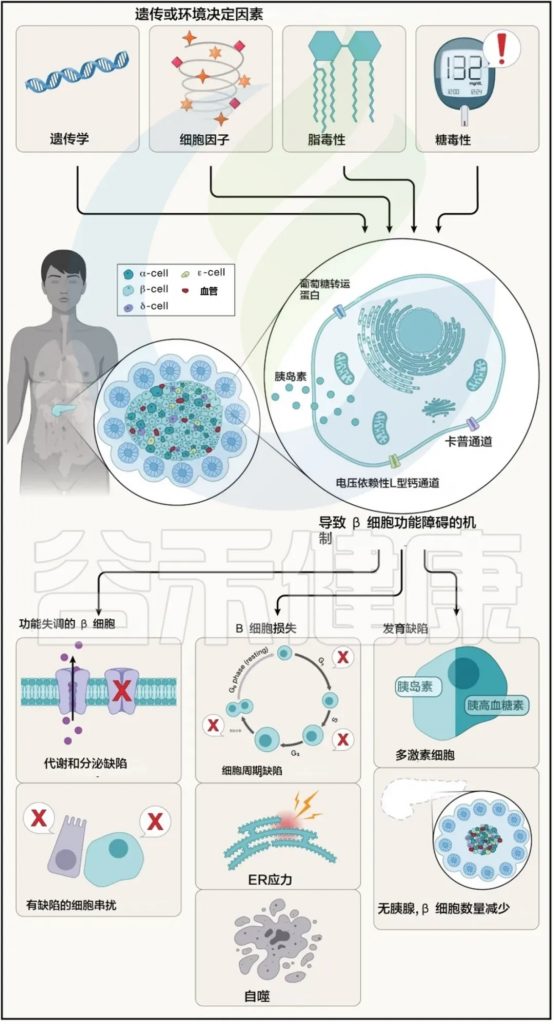
Abel ED,et al.Cell.2024
提升β细胞功能的兴趣
由于β细胞在维持正常葡萄糖耐受性中的关键作用,提高“功能性β细胞质量”被视为治疗1型和2型糖尿病的重要策略。
潜在治疗靶点
人类遗传学研究支持K-ATP通道和葡萄糖激酶为改善胰岛素分泌的潜在靶点。
SLC30A8基因中的特定蛋白质变体(ZnT8的锌转运蛋白)主要在胰腺β细胞中表达,并被证明可保护个体免受2型糖尿病的侵袭,因此相关药物的开发在进行中。
GLP-1受体(GLP-1R)
虽然在GWAS证实其作为治疗靶点的有效性之前人们就已经对它进行了广泛研究,但人类遗传学为其在降低血糖和改善心脏代谢健康方面的作用提供了有力证据。
GLP-1R激动剂不仅有效控制血糖,还具有减肥和降低心血管死亡率的积极作用。
开发新疗法的挑战
GLP-1类药物的多重成功显示了从多个角度治疗疾病生物学的巨大潜力,但也增加了专注于改善β细胞功能新疗法开发的难度。
社会健康决定因素(SDoH)指的是影响健康的社会条件,包括经济、教育、食品安全、医疗保健等因素。它们对包括2型糖尿病在内的多种疾病的发病和进展有深远影响。
SDoH通过复杂的途径影响2型糖尿病的发展,从生活方式行为到分子机制(例如HPA轴激活、微生物群失调)。粮食不安全和空气污染等具体因素已经被证明与糖尿病有关,表明需要多层次的干预策略。
粮食和营养不安全
粮食安全被定义为“所有人在任何时候都能获得足够的食物以过上积极和健康的生活”。
营养安全进一步扩展为“能够公平、稳定地获取、负担得起和利用促进健康、预防和治疗疾病的食品和饮料的状态”,包括饮食质量和社会健康决定因素(SDoH)。
粮食不安全的影响:粮食不安全导致水果和蔬菜摄入减少,精制碳水化合物、饱和脂肪和添加糖摄入增加,整体饮食质量下降。长期不良饮食习惯导致氧化应激、炎症和脂肪组织扩张。
粮食不安全与增加的炎症、生物荷负和肠道微生物多样性降低有关。社会经济压力则加剧了这种状态,影响补偿行为,并激活炎症途径。
空气污染
空气污染是重大环境健康风险,社会经济地位较低的人群受影响更大。关键污染物包括臭氧 (O₃)、二氧化氮 (NO₂) 和各种颗粒物 (PM),如PM2.5。
对糖尿病的影响:空气污染与胰岛素抵抗、血糖紊乱、高脂血症和2型糖尿病的发病率增加有关。观察性研究与孟德尔随机化研究支持其因果关系。
机制:初级启动途径:包括氧化应激、淋巴细胞活化、组织内DAMP产生及直接影响胰腺β细胞等。
次级效应途径:涉及全身炎症、神经内分泌失调、肝脂肪变性以及肠道微生物群失调等。
共同的病理生理影响:无论是营养不良还是空气污染,均通过氧化应激、炎症反应、HPA轴激活等机制影响糖尿病的发展。
粮食不安全和空气污染等因素可能在从胚胎到婴儿期影响后代未来的糖尿病风险。饥荒和空气污染对母体的营养和污染暴露都有证据表明会影响后代的代谢健康。
研究和政策发展:需跨学科团队的合作来深度研究SDoH的病理生理影响,指导新的干预策略和政策制定,以提高糖尿病预防和管理的公平性。
总之,粮食不安全和空气污染通过复杂的生物和环境机制显著影响2型糖尿病的进程。理解这些机制将有助于开发更有效的公共卫生政策和临床干预措施。
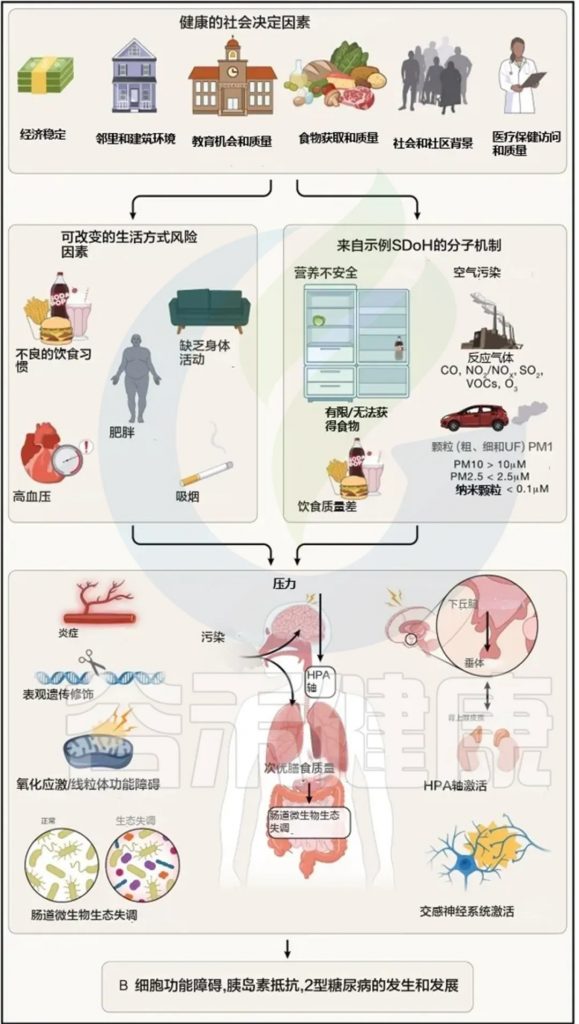
Abel ED,et al.Cell.2024
大量临床前数据强调了大脑在控制体重以及易感人群中胰岛素抵抗和肥胖发展中的重要作用。尤其中枢神经系统(CNS)在控制血糖和2型糖尿病病理生理学中的重要性。
◮ 重要性与作用
大量临床前数据显示,大脑在体重控制、胰岛素抵抗(IR)、肥胖及2型糖尿病发病机制中扮演关键角色。其中肥胖是2型糖尿病的重要风险因素。
食欲和能量消耗的调节对于肥胖的发生至关重要,受中枢系统全面调控。
肠道激素如生长素释放肽和瘦素,以及肠道微生物群的变化,在调节过程中起重要作用。
已在下丘脑和脑干中对这些调控神经回路的了解取得显著进展。
临床研究
人类研究重点关注中枢及自主神经系统如何整合体重调节及葡萄糖代谢,尤其在维持循环葡萄糖浓度中的作用。
动物模型研究
动物模型研究提供了许多见解,显示迷走神经及中枢神经系统回路对营养感知的重要性。
研究表明脂肪或糖摄入与多巴胺释放及暴饮暴食行为之间存在关联。
大脑与外周之间相互作用的示意图
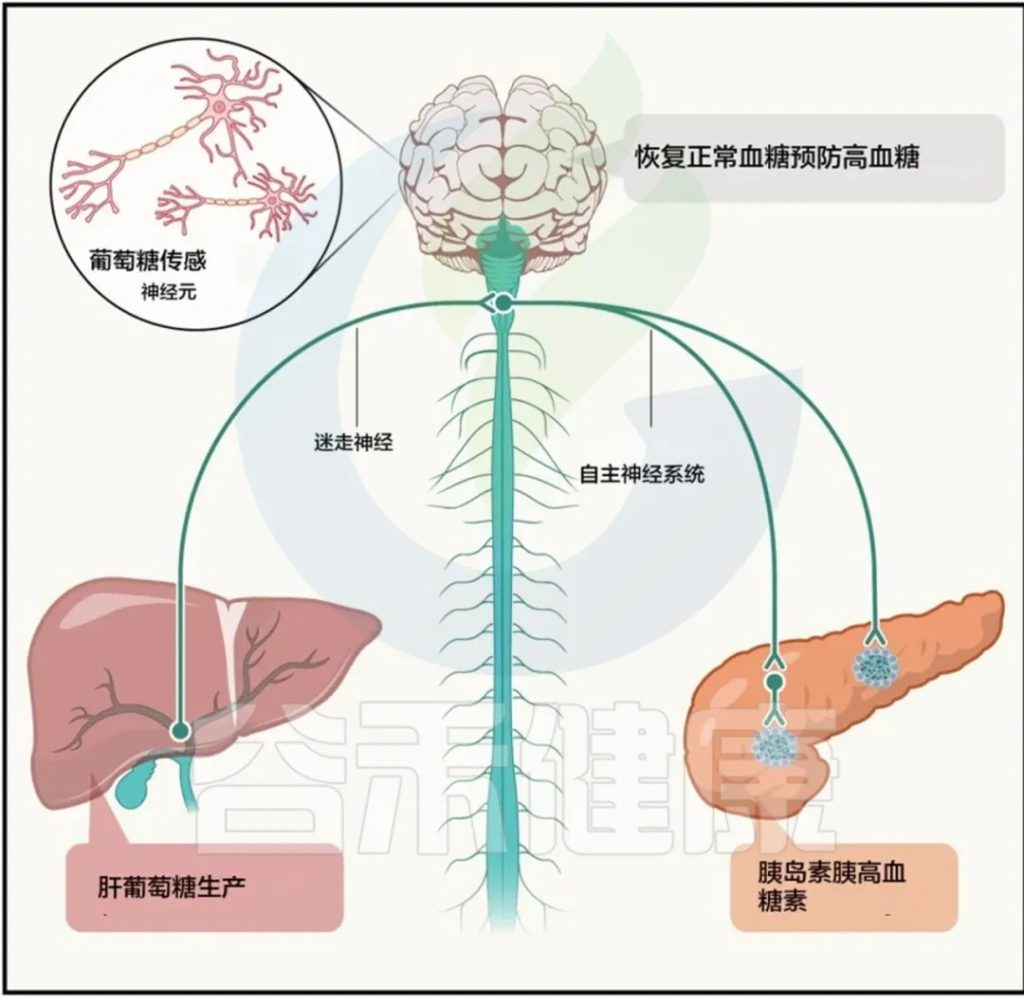
Abel ED,et al.Cell.2024
注:这些见解大多来自动物模型研究
为了更好地科普中枢神经系统(CNS)在糖尿病和代谢调节中的作用,可以从以下几个方面进一步理解:
基本概念
中枢神经系统(CNS)不仅仅是控制思维和行为的中心,它还在调节身体的代谢功能中发挥重要作用。特别是在血糖调节方面,CNS通过调控肝脏的葡萄糖生成和分解来维持血糖的稳定。
机制
下丘脑是CNS中一个关键区域,它通过神经信号影响胰腺的功能,调节胰岛素的分泌。胰岛素是降低血糖的主要激素,因此下丘脑的调控对于维持正常血糖水平至关重要。
胰岛素的作用
胰岛素不仅在外周组织中发挥作用,它在大脑中也有重要功能。研究表明,胰岛素可以通过鼻内给药直接作用于大脑,影响胰岛素的分泌和全身的胰岛素敏感性。
个体差异
不同个体对大脑胰岛素的反应存在差异,这种差异可能影响到胰岛素的分泌和代谢功能。这种差异也与肥胖和胰岛素抵抗(IR)有关。
FGF的潜力
成纤维细胞生长因子(FGF)在动物实验中显示出通过作用于大脑来缓解糖尿病的潜力。这种方法不依赖于体重减轻,而是直接改善葡萄糖代谢。
药物的CNS作用
一些用于治疗2型糖尿病的药物,如GLP-1受体激动剂,通过中枢神经系统发挥作用,影响食欲、体重和胰岛素分泌。
关联性
2型糖尿病与认知功能受损和神经退行性疾病(如阿尔茨海默病)之间存在关联。研究发现,糖尿病患者的大脑胰岛素反应性可能受损,这与认知功能下降有关。
潜在治疗
鼻内胰岛素和GLP-1受体激动剂在临床研究中显示出神经保护作用,可能降低痴呆症的发病率。
更具脑渗透性的药物
开发能够更好地穿透血脑屏障的药物,可能增强其神经保护作用,同时减少不良反应。
共同途径的探索
由于糖尿病和神经退行性疾病的发病率随着年龄增长而增加,研究共同的病理机制可能带来同时治疗这两种疾病的新方法。
胰岛素抵抗(IR)
当胰岛素无法有效地降低血糖时,称为胰岛素抵抗。这种情况不仅影响糖代谢,还导致脂肪组织释放更多的游离脂肪酸(FFA)进入血液。
脂解作用增加
在IR条件下,脂肪组织经历脂肪分解增加,产生更多的FFA。这些游离脂肪酸流入血液并扩散到其他组织,如肝脏和骨骼肌,进一步导致这些组织的发展胰岛素抵抗。
二酰甘油的作用
二酰甘油(DAG)是一种重要的信号分子。研究表明,在胰岛素抵抗的状态下,血浆中DAG水平升高。DAG可以与细胞膜上的蛋白激酶Cε (PKCε)结合,从而使胰岛素受体发生抑制性磷酸化。这一过程会限制胰岛素受体的激酶活性,削弱胰岛素的信号传导,导致细胞对胰岛素的反应降低。
特异性结合:DAG的不同立体异构体对作用靶点的结合亲和力不同,其中sn-1,2 DAG与PKCε结合最强,定位在质膜上,而其他异构体如sn-1,3 DAG和sn-2,3 DAG倾向于定位在脂滴和内质网(ER)。
神经酰胺的作用
神经酰胺是另一种导致胰岛素抵抗的脂质。高FFA水平促进长链神经酰胺(如C16和C18)的产生。神经酰胺通过激活特定的激酶,如蛋白激酶C ζ (PKCζ)和蛋白磷酸酶2A (PP2A),抑制关键信号分子Akt的磷酸化。这种抑制作用破坏了正常的胰岛素信号传导。
选择性影响:神经酰胺特异性地促进胰岛素抵抗,这是因为其他类似脂类(如二氢神经酰胺和鞘磷脂)未能在实验模型中表现出同样的效果。
异位脂质沉积
骨骼肌和肝脏中DAG和神经酰胺的积累会加剧胰岛素抵抗。这些组织的『选择性胰岛素抵抗』意味着通常应该增加葡萄糖吸收的组织变得不再敏感,反而可能继续将葡萄糖转化为脂质储存。
加速糖尿病的进展
当骨骼肌和肝脏对胰岛素的敏感性降低时,会加速糖尿病的进展。这些脂质代谢产物的积累不仅影响胰岛素信号传导,还可能引发脂质毒性,损伤细胞功能并加重代谢紊乱。
以上细节描述展示了脂质介质如何在分子水平上影响胰岛素信号通路,从而推动全身性胰岛素抵抗的发展。这些见解为开发针对性更强的干预措施和治疗策略提供了依据,以改善代谢健康并减缓或逆转糖尿病。
下面是肥胖和脂肪组织通过多种机制驱动胰岛素抵抗(IR)的详细总结:
1.脂肪酸羟基脂肪酸酯与胰岛素敏感性
脂肪酸羟基脂肪酸酯(FAHFA)的角色:FAHFA是一类由两个脂肪酸通过酯键结合形成的复合脂质。研究表明,FAHFA可以改善胰岛素敏感性,其水平在肥胖状态下和2型糖尿病中会降低。
机制:FAHFA通过与某些代谢重要组织中的G蛋白偶联受体结合,起到调节小鼠胰岛素敏感性、脂肪生成和能量消耗的作用。此作用途径表明FAHFA可能通过影响受体来调控广泛的代谢过程。
2.脂肪甘油三酯脂肪酶与FAHFA
脂肪甘油三酯脂肪酶(ATGL)的双重角色:ATGL是一种负责脂肪分解的酶,被认为可能在FAHFA代谢中也发挥作用。
ATGL可能充当FAHFA的合酶,通过改变ATGL功能,提供了FAHFA与2型糖尿病中的脂肪分解之间的潜在联系。调节ATGL功能的变化可能影响FAHFA的合成和分解。
3.前馈循环与全身性胰岛素抵抗
前馈循环:肥胖状态下,脂肪组织中多种信号分子的变化(包括FAHFA的减少)会驱动一种前馈的代谢循环。这种循环会进一步加剧全身胰岛素抵抗。
注释:代谢生理学中,”前馈循环” (feed-forward loop) 指的是一种生物学过程,其中某一信号或变化会增强或放大某一响应,而这种响应又会使初始信号或变化更加显著。上文中前馈循环是指肥胖状态下脂肪组织中多种信号分子的变化(例如 FAHFA 的减少)导致的一系列代谢事件。这些变化不仅直接影响机体的代谢状况,还通过促进某些过程或信号的放大,进一步加剧全身胰岛素抵抗。
具体来说,脂肪组织中信号分子的变化作为初始刺激,会引发代谢反应或变化,这些代谢反应可能通过各自的信号机制,反过来进一步促进初始信号或加大初始变化。如果这种循环不被打断,就可能导致长期的代谢失调,比如全身性的胰岛素抵抗,从而增加糖尿病等代谢疾病的风险。
4. 脂肪组织在全身性胰岛素抵抗中的作用
脂肪组织重塑:肥胖引起的脂肪组织重塑是全身性胰岛素抵抗、炎症以及葡萄糖和脂质代谢异常的关键驱动因素。
5. 高血糖与胰岛素抵抗的恶性循环
高血糖的影响:高血糖本身会通过增加己糖胺生物合成途径的通量,加剧胰岛素抵抗。这一途径生成尿苷二磷酸-N-乙酰葡萄糖胺 (UDP-GlcNAc),是N和O连接糖基化的前体。
O连接糖基化:包括Akt在内的胰岛素信号蛋白的O连接糖基化会进一步诱导胰岛素抵抗,形成恶性循环。
在胰岛素抵抗状态下,脂肪细胞的葡萄糖摄取功能受损。这种情况与脂肪细胞释放的胰岛素敏感因子和复合脂质的变化有关,这些变化会影响其他组织对胰岛素的响应。
肝脏和骨骼肌是胰岛素作用的主要目标组织,在胰岛素抵抗状态下,其糖代谢功能受损,尤其是肝脏的葡萄糖输出增加和骨骼肌的葡萄糖摄取减少。这些机制是糖尿病患者血糖水平升高的主要驱动因素。
糖原合成减少
在胰岛素抵抗的早期阶段,骨骼肌中胰岛素介导的糖原合成减少。这是因为胰岛素信号传导受损,影响了糖原合成酶的活性。
GLUT4易位受损
胰岛素通常促进葡萄糖转运蛋白4(GLUT4)从胞内储存池转移到质膜,以增加葡萄糖摄取。然而,在胰岛素抵抗状态下,这一过程受损,导致葡萄糖摄取减少。
葡萄糖氧化减少
由于胰岛素信号传导的缺陷,骨骼肌中葡萄糖的氧化能力降低,这进一步影响能量代谢。
长期影响
随着时间推移,骨骼肌胰岛素抵抗会导致肌肉萎缩、运动能力下降以及线粒体功能和质量的下降。
肝糖输出(HGP)增加
肝脏胰岛素抵抗的主要表现是肝糖输出增加。这是因为胰岛素对糖异生基因的抑制作用受损,导致肝脏中糖异生增加。
脂质积累
胰岛素抵抗还促进肝脏中脂质的积累,进一步影响肝脏功能。
组织间通讯的理解
未来的研究需要深入了解不同组织间的通讯机制,包括外泌体等新型介质在内的作用。
脂质动员机制
研究控制组织和细胞器之间脂质动员的机制,以及未表征脂质的功能,将有助于揭示2型糖尿病中的脂质失调。
复杂病理生理学的探索
进一步探索这些途径在持续胰岛素抵抗中的复杂病理生理学影响,将有助于开发新的治疗策略,改善代谢稳态。
综上所述,理解骨骼肌和肝脏的胰岛素抵抗机制及其与脂肪组织的相互作用,对于揭示2型糖尿病的发病机制和寻找新的治疗靶点至关重要。
近年来,越来越多的研究揭示了2型糖尿病与代谢功能障碍相关脂肪肝病(MASLD)之间的紧密联系,除了影响血糖稳态外,还对心血管并发症以及其他健康问题有显著的影响。
病理生理学背景
糖尿病患者常伴有肝脏代谢功能障碍,这是血糖稳态受损和糖尿病心血管并发症的主要因素之一。肥胖引发这些患者肝脏葡萄糖和脂质的异常增加。
MASLD的演变
MASLD从单纯脂肪变性(最初是可逆且普遍的状态)到代谢功能障碍相关脂肪性肝炎(MASH),可以进展至纤维化,这在严重情况下是主要的死亡原因。
下面是对2型糖尿病和MASLD相互作用的总结:
1.多重打击假说
这一理论解释不同患者发展严重并发症的原因,重点在于脂质蓄积后非实质细胞(NPC)的异常激活。对于早期疾病,GLP-1 基药物疗法可能有效,但对晚期纤维化无明显效果。
2.过量从头脂肪生成(DNL)
过量从头脂肪生成(DNL)在2型糖尿病患者中明显增加。健康人群中,胰岛素通过Akt信号通路抑制肝糖输出(HGP),同时激活脂肪生成的促进元素,如SREBP-1c。但在胰岛素抵抗状态下,FoxO1抑制失效增加葡萄糖生成,然而胰岛素仍然能推动DNL。
尽管胰岛素信号转导的某些功能失效,DNL却仍然活跃。这可能由于糖尿病患者CHREBP诱导Akt磷酸化调控机制存在异常,尤其是PHLPP2磷酸酶水平降低,导致了过量DNL。
3.胰岛素信号转导的动力学变化
在慢性高胰岛素血症背景下,正常的胰岛素信号分叉模型可能发生变化,影响胰岛素在早期和晚期阶段的作用。
早期阶段:胰岛素的快速作用通过抑制FoxO1来减少葡萄糖生成。
晚期阶段:延长的Akt活性则促进了DNL和脂质合成,潜在机制包括细胞自主信号、自主脂肪信号以及肠道介导的信号。
4.双向风险与相互促进
2型糖尿病和MASLD不仅拥有共同的风险因素,还可能通过如上机制双向增加各自的风险。研究显示,肝脏脂肪过多与2型糖尿病高度相关,即便在调整了BMI和其他潜在混杂因素后,二者之间的联系依然显著。
5.临床与研究启示
由于代谢功能障碍相关脂肪肝病(MASLD)在肥胖率较高的人群中表现为一种日益增长的健康挑战,当前的研究重点在于理清组织间通讯的复杂网络、揭示潜在的细胞机制、探索治疗新策略以及更好地管理代谢性肝病。
通过全面的机制研究和临床分析,我们可以更好地理解2型糖尿病与MASLD的复杂交互机制,为治疗和预防这些相关病理状态带来新的希望。
在2型糖尿病与代谢功能障碍相关脂肪肝病(MASLD)的研究中,理解肝脏脂质堆积及其进展至肝脏病变的过程尤为重要。以下是详细汇总和对当前研究状况的总结:
1.肝脂质过量与疾病进展
影像学发现:许多2型糖尿病患者在影像学检查中展示了肝脂质过量。然而,哪些患者将发展为有临床意义的肝脏疾病,以及进展的时间和诱导因素,仍不明确。
遗传因素:基因组广泛关联研究(GWAS)揭示了一些与体重和肝脏脂质积累相关的常见风险等位基因(如FTO、PNPLA3、TM6SF2和APOB)。然而,这些基因标记在预测疾病进展为代谢功能障碍相关脂肪性肝炎(MASH)方面的效能有限。
2.脂质管理障碍
2型糖尿病和MASLD患者的肝细胞可能有储存脂质的倾向,但难以在不损伤细胞的情况下管理过量的脂质。这导致了细胞的炎症反应和纤维化。
3.肝细胞的信号贡献
肝细胞在疾病中的作用:研究表明肝细胞不仅在血糖调节中起作用,还通过分泌促进NPC浸润和活化的趋化性和纤维化细胞因子,直接参与肝脏炎症和纤维化过程。
Notch信号的再激活:这是2型糖尿病和MASLD患者肝细胞炎症的一部分,影响HGP和DNL的增加。
4.临床研究和治疗前景
治疗性干预:使用如GalNAc修饰的反义寡核苷酸或siRNA,可以靶向性调制肝细胞信号通路,有可能改善病情。
5.当前研究的主要方向和挑战
高胰岛素血症的作用:2型糖尿病患者IR导致的高胰岛素血症,与肝脏DNL正相关,可能是MASLD病理机制之一。现有研究正在探讨抑制胰岛素分泌的策略,但其在糖尿病患者中的适用性仍需验证。
其他激素和营养因素:胰高血糖素、果糖和胆固醇也可能对肝脏脂质生成有影响。此外,肝交感神经系统的参与是否在脂质生成功能中有重要贡献,需要进一步探索。
通过这些研究,肝脏的代谢调节能力、遗传和环境因素的交互作用构成了2型糖尿病和MASLD在病理进程中的复杂图景。理解这些机制对于开发有效的治疗方案和风险评估方法至关重要。
尽管最近取得了进展,但许多问题依然存在,包括一下几点。
1.高胰岛素血症和非激素因素的作用
2型糖尿病的胰岛素抵抗(IR)显示出代偿性高胰岛素血症。人类数据表明血浆胰岛素水平与肝脏DNL正相关,动物研究证实胰岛素作用时机不当可能导致MASLD。有趣的是,奥曲肽通过阻断胰岛素分泌降低了大鼠的DNL标记物和肝脏甘油三酯。
目前,这一概念正在非糖尿病个体中使用二氮嗪(NCT05729282)进行测试,其结果是否适用于T2D患者尚不明确。其他激素如胰高血糖素也通过促进糖原分解和降低肝脏脂质起作用。
此外,果糖和胆固醇可能影响肝脏脂质生产。最后,非营养和非激素的肝糖输出(HGP)决定因素,如交感神经对肝脏的影响及其对脂质生产的共调节作用,仍不清楚。
2.脂肪性肝炎的空间决定因素
组织异质性:肝脏作为一种异质性组织,由于不同区域的氧张力和营养状态,产生了肝内糖异生和脂肪生成功能的分区。这种分区影响了MASH的区域特异性,表现为中枢周围或门管周围类型,后者尤为常见于儿童患者。
区域性亚型:代谢综合征和2型糖尿病患者倾向于发生门管周围类型的疾病。这种区域亚型与代谢和肝脏病理的发展程度相关,但其机制尚不清楚。针对肝脏区域特定通路(例如Notch、法呢醇X受体[FXR]、甲状腺激素受体[TR]和过氧化物酶体增殖激活受体[PPAR])的治疗可能提供新的干预策略。
3.纤维化消退的途径
尽管对肝脏促炎和纤维化途径的理解有所增加,但对纤维化清除及肝细胞途径影响纤维化消退的研究较少。我们推测,所有肝细胞决定的“纤维化开启”信号都有相应的“纤维化关闭”信号。
系统研究回归途径对肝纤维化的影响,类似于动脉粥样硬化病变的解决,可能带来重要的影响。对于部分对肠促胰岛素治疗抵抗的T2D患者,新的治疗靶点可能特别有价值。
4.双向肝细胞-非实质细胞串扰
虽然肝细胞在脂质过载中的作用被强调,但非实质细胞(NPC)对肝细胞功能也有显著影响。例如,肝星状细胞不仅是肝细胞再生的决定因素,还是一个潜在的调节因子。在2型糖尿病中,免疫细胞增加从而改变胰岛素敏感性。
6.对脂质超载的遗传适应
近来的研究揭示了MASLD/MASH患者肝细胞中FOX01的体细胞突变,这些突变可能是一种保护机制,减轻脂质超载的损伤。这种基因适应可能说明MASLD与2型糖尿病的关联。
7.与心血管疾病的关系
肝脏脂质过多增加了肝病相关死亡率的风险,但与2型糖尿病患者类似,MASLD/MASH患者的主要死因是心血管疾病(CVD)。鉴于直接加速CVD的常见并发症,需在临床前动物模型和人类中进行进一步机制研究以揭示其潜在机制。
糖尿病是一种影响全身的慢性疾病,会对多种系统造成广泛且复杂的影响,显著增加患病率和死亡率。以下是对糖尿病相关代谢异常和其主要并发症的详细分析。
增高的风险:糖尿病患者患动脉粥样硬化性心血管疾病(ASCVD)的风险增加2至5倍。
其他风险因素:包括高血压、血脂异常、肥胖和代谢综合征。
糖尿病性心肌病:糖尿病导致特有的心脏结构和功能异常,不完全依赖于冠状动脉疾病(CAD),而与异常代谢环境直接相关。
综合风险:没有单一机制可以解释CVD风险的增加,糖尿病引起的多种风险因素复杂相互作用导致CVD。
机制:与内皮细胞(EC)和血管平滑肌细胞(VSMC)功能障碍有关。
糖尿病影响:特征是内皮功能障碍,包括一氧化氮合酶功能下降和NO缺乏。
动脉粥样硬化驱动因素:糖尿病通过激活髓系细胞和炎症细胞(如单核细胞、巨噬细胞)的生成,直接加剧动脉粥样硬化。
风险因子和生物标志物:LDL胆固醇、血脂异常、HbA1c、肾功能和身体活动为疾病预测因子。新型生物标志物(如线粒体代谢物)可能用于风险分层。
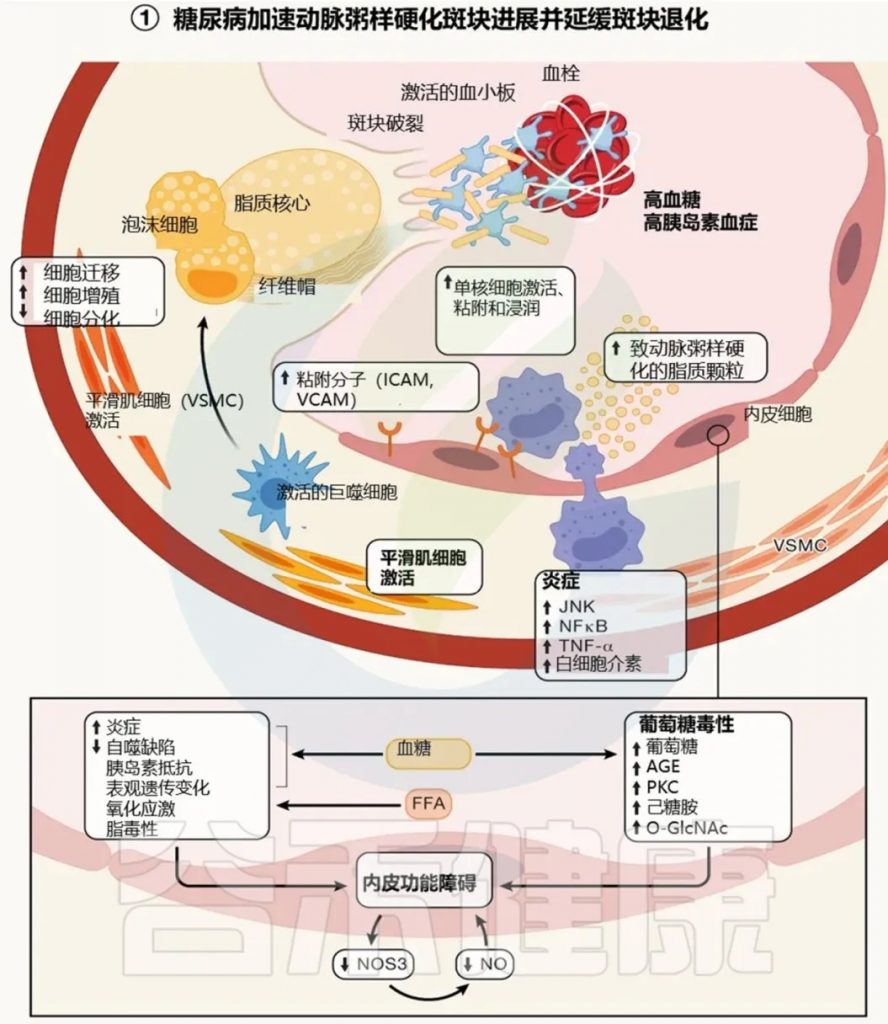
Abel ED,et al.Cell.2024
风险增加:糖尿病增加心力衰竭风险,这与冠状动脉疾病(CAD)风险增加无关。
机制:碳毒性(脂毒性和糖毒性)
氧化应激
线粒体生物能量学受损
线粒体解偶联
心肌兴奋-收缩偶联受损
促纤维化途径激活
选择性胰岛素抵抗引起的肥大性信号通路激活
人类研究证据:心脏移植研究显示,正常供体心脏在移植到糖尿病患者体内后数月内出现代谢异常。
观察到甘油三酯超载、神经酰胺等有毒脂质积聚、线粒体呼吸功能不全、氧化应激和炎症。
注:前驱糖尿病患者也观察到线粒体氧化缺陷,二甲双胍治疗可能减轻这些变化。
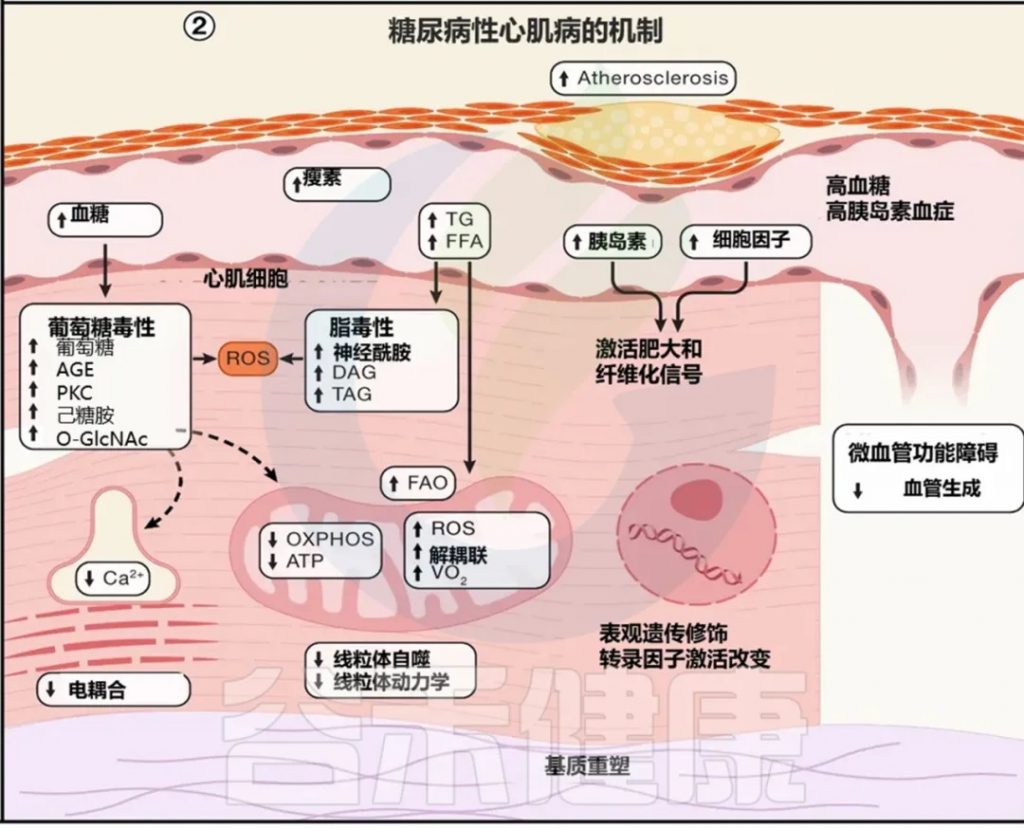
Abel ED,et al.Cell.2024
特征:糖尿病降低多种促血管生成因子的表达,导致血管生成信号通路紊乱。
影响:增加外周血管疾病和严重肢体缺血的风险。
机制:VEGF抵抗
一氧化氮信号受损
血管生成干细胞前体水平降低
周细胞丢失
微小RNA和长链非编码RNA的失调
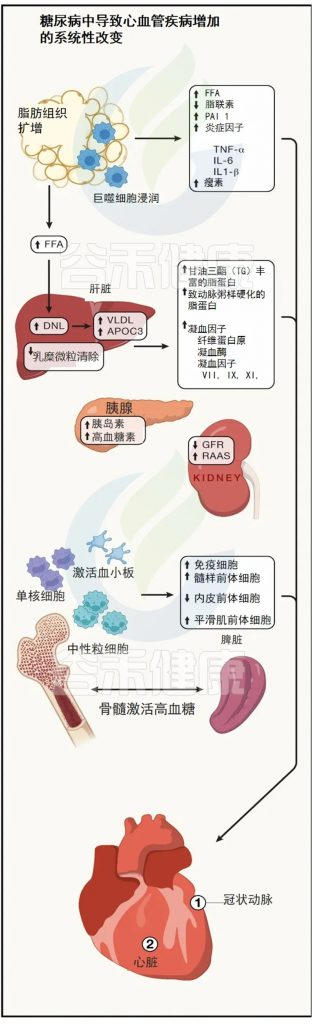
Abel ED,et al.Cell.2024
特征:白蛋白尿和估计肾小球滤过率(eGFR)降低。
患病率:约40%的糖尿病患者会发展为DKD。
肾血管功能障碍:肾小球高滤过是早期特征之一;
肾小管肾小球反馈机制导致肾小球传出动脉收缩。
肾小球和肾小管上皮细胞变化:
足细胞代谢改变,氧化应激增加。
RhoA/Rac1通路导致足突消失。
mTOR和生长因子信号改变导致足细胞增大。
足细胞丢失是疾病进展的关键步骤。
近端小管(PT)细胞:
高代谢活性,负责大量水和盐的重吸收。
初期细胞大小和数量增加,后期出现能量耗竭和细胞身份丧失。
线粒体损伤激活炎症途径。
小结
总的来说,糖尿病通过多种复杂的机制影响心血管系统和肾脏,涉及代谢异常、血管功能障碍、炎症反应和表观遗传变化等多个方面。
这些发现为理解糖尿病并发症的发生机制和开发新的治疗策略提供了重要的科学基础。
传统疗法的局限:早期治疗通常在T1D的3期开始,对于改变疾病进展的效果有限。
新进展:创新的分期系统为早期干预提供了框架,报告聚合抗CD3单克隆抗体teplizumab治疗延迟T1D进展的结果。这一研究促使FDA批准teplizumab作为首个T1D疾病改良疗法。
病毒传播与诊断挑战:目前缺乏统一的筛查指导方针,正测试多种自身抗体筛查策略。
胰岛素管理技术(如优化的药物动力学胰岛素、胰岛素泵和持续血糖监测设施)不断革新。
β细胞替代疗法:胰腺或供体胰岛移植显示出β细胞替代的可行性,但供体资源有限。
干细胞技术:通过多能干细胞分化得到的β细胞有望克服移植局限性,Vertex制药公司正在测试相关疗法(VX-880)。
异质性挑战:T2D患者的疾病表现由于遗传和环境因素而异,例如,非洲-加勒比和亚洲人群的T2D表现差异明显。
◮ 精准医疗的方法
临床分层工具:如BMI和eGFR用于HbA1c反应的预测,最新的研究表明此类因子可以指导选择更有效的治疗方法。
复杂数据整合:利用机器学习分类法如集群分析,识别糖尿病亚型,与特定并发症风险相关。
◮ 临床实施与研究挑战
标准化的必要性:研究需要一致的方法来评估精准治疗的优劣及其经济性。
证据差距:精准糖尿病治疗需要更多随机对照试验来证明其临床优势和成本效益。
精准医疗成功的例子:例如葡萄糖激酶突变的单基因糖尿病无需药物治疗,而HNF1A突变可用磺酰脲类药物有效管理。
综合来看,1型糖尿病的治疗正在向提前预防和细胞治疗方向发展,而2型糖尿病的精准医疗方法强调对不同人群亚型的特定管理。
随着研究的深入和技术的进步,这些策略有望显著改善糖尿病患者的治疗效果和生活质量。
在2型糖尿病的精准医疗和全球健康公平领域,取得了许多令人瞩目的成就,但仍面临资源可及性不均与种族多样性不足等挑战,并且新型疗法不断涌现,进一步推动病情管理和并发症预防。
◮ 资源限制与成本效益
2型糖尿病精准医疗是否能在不同资源环境中实施仍不明确,当前诊断和治疗的费用较高,尤其在中低收入国家。
如果精准医疗能提高治疗精度,减少资源浪费,则可能长期节约成本,但这些长期获益难以精准量化。
◮ 全球资源差异
许多中低收入国家患者难以获得基本药物,更复杂的精准医疗诊断尚难普及。简便的分层方法和决策支持工具可能在这些地区更具实用性。
糖尿病护理的差距往往影响社会经济地位低、少数民族群体。未经过周密计划和执行的精准医疗可能导致不平等加剧。
◮ 种群多样性的影响
研究多样性不足:大多数精准医疗研究在欧洲白人群体中进行,跨种族的应用性受限。需在不同种族背景下进行更多研究,以开发具有全球代表性的解决方案,适应不同遗传机制。
基因组研究局限:多样性缺乏的基因组研究可能导致偏见。例如,某些族群的2型糖尿病特征存在重大差异。开发跨祖先适用的基因风险评分,不同族群的参与和持续研究至关重要。
总体来看,精准医疗已经在2型糖尿病领域取得长足进步,但其广泛和公平实施受到资源、技术和种族多样性等多个因素的限制。未来的研究应致力于开发合适的工具和管理策略,以改善全球范围内的健康结果。
药物创新
GLP-1受体激动剂、DPP-4抑制剂和SGLT-2抑制剂在改善血糖及心血管、肾脏健康方面展现无与伦比的效果。
GLP-1RA的增强版本显示出非凡的减肥和心血管保护作用。SGLT-2抑制剂同样有助于不同心肾健康目标。
开发多激动剂如Tirzepatide(GIP受体-GLP-1R共激动剂),有效性超越单一疗法。此类疗法在减重和改善心血管风险方面效果显著,开创了治疗新方向。
基于GLP-1的治疗心脏代谢和神经退行性疾病
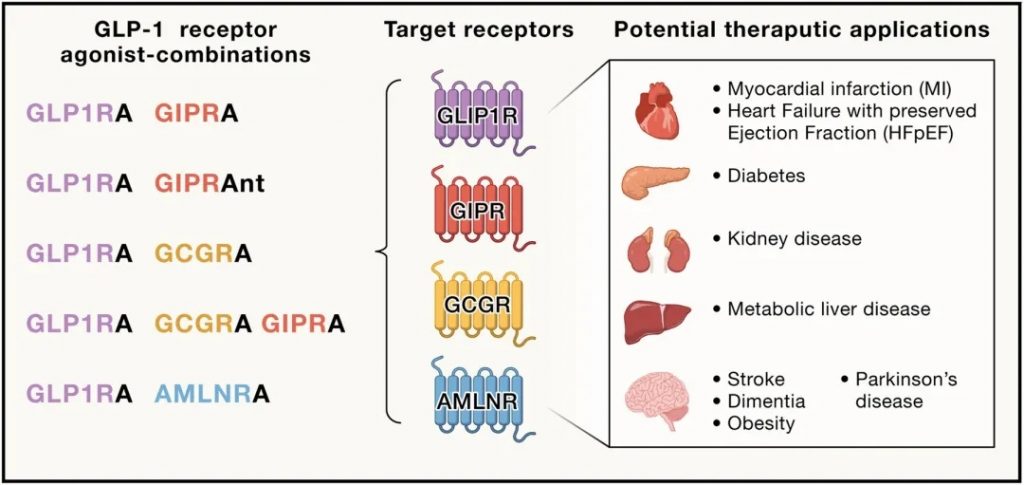
Abel ED,et al.Cell.2024
针对不同疾病机制的新疗法和联合疗法的临床试验持续进行,探索能够提供更高效、个性化处理方案的创新疗法。
多种基于GLP-1的联合疗法目前正处于临床后期开发阶段,期待它们在提高血糖控制和体重减轻效果的同时,继续展现心血管益处。这些治疗选项包括:
合成及联合应用疗法
-卡格列肽与索马鲁肽每周一次联合使用;
-胰高血糖素受体GLP-1R共激动剂如survodutide;
-GIP受体拮抗剂—GLP-1R激动剂抗体;
-三联胰高血糖素-GIP-GLP-1R多激动剂。
注:卡格列肽是一种肠促胰岛素激素,用于治疗2型糖尿病。
索马鲁肽,英文名称 “Semeglutide”,是一种新型的,长效的,每周皮下注射一次的 GLP-1 类似物,是基于利拉鲁肽基本结构而开发的长效剂型,其治疗2型糖尿病的效果更好。
新兴口服疗法
-包括danuglipron和orforglipron在内的小分子口服GLP-1R激动剂,以及ECC5004和GSBR-1290等其他小分子GLP-1RA。
-高剂量口服索马鲁肽(每天高达50毫克)与新配方吸收促进剂的应用。
这些创新药物不仅可能增强降糖和减重效果,还可能在外周动脉疾病、代谢性肝病、神经退行性疾病等领域拓展GLP-1药物的应用。
此外,对成瘾相关行为、遗传性肥胖、多囊卵巢综合征、1型糖尿病等多种适应症的研究也在进行之中。未来十年有望出现更为便捷和有效的GLP-1药物,这些药物的广泛适应症及安全性将通过更大规模临床试验的验证,为更多患者提供治疗选项。
随着糖尿病大流行的发展,我们对病理生理学以及治疗和预防方法的理解也呈指数级增长。目前的知识为提高识别增加β细胞功能障碍易感性标志物的特异性奠定了基础,特别是在肥胖环境中。
我们对大脑在体重调节中的作用以及脂肪组织分泌的新因子的理解可能有助于改进治疗或预防肥胖的方法。增加对肝功能障碍对胰岛素抵抗(IR)贡献的理解以及增加对代谢功能障碍相关肝病的理解代表了进一步研究的重要领域,以避免可能成为日益流行的肝功能衰竭。
心血管和肾脏疾病仍是糖尿病的主要死亡和发病因素,复杂的病理生理学涉及多器官系统和全身环境的交互作用。
糖尿病大流行由环境和社会因素推动,需综合管理。治疗进展为预防或治愈1型糖尿病和治疗2型糖尿病带来希望,不仅改善代谢稳态,还降低心肾疾病风险。
最后,随着我们了解和开发出识别导致糖尿病及其并发症的潜在异质性的工具,我们将为有针对性的治疗和预防策略奠定基础,以优化其在不同人群和医疗资源中的应用。
参考文献:
Abel ED, Gloyn AL, Evans-Molina C, Joseph JJ, Misra S, Pajvani UB, Simcox J, Susztak K, Drucker DJ. Diabetes mellitus-Progress and opportunities in the evolving epidemic. Cell. 2024 Jul 25;187(15):3789-3820.