-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
宝宝湿疹反复瘙痒总难根治,季节交替时喷嚏不断,擦不完的鼻涕,整晚咳嗽甚至发展为哮喘,到了学龄期孩子仍无法专注听讲…
如今约40%中国儿童在成长过程中会出现至少一种过敏症状(尤其是过敏性鼻炎),神经发育问题发生率也逐年上升。
多中心流行病学调查和系统综述显示:
神经发育障碍整体患病率呈上升趋势,已从 0.5 %‑1 % 逐步提升至约 5 %‑10 %,包括所有子类的累计比例。
中国儿童常见过敏性疾病的患病率总体呈上升趋势,哮喘约 3%–7%,过敏性鼻炎约 20%–25%,湿疹/特应性皮炎约 8%–20%,食物过敏约 3%–8%,且城市和经济发达地区患病率更高。
而这些看似独立的健康难题,都指向了肠道微生物群。
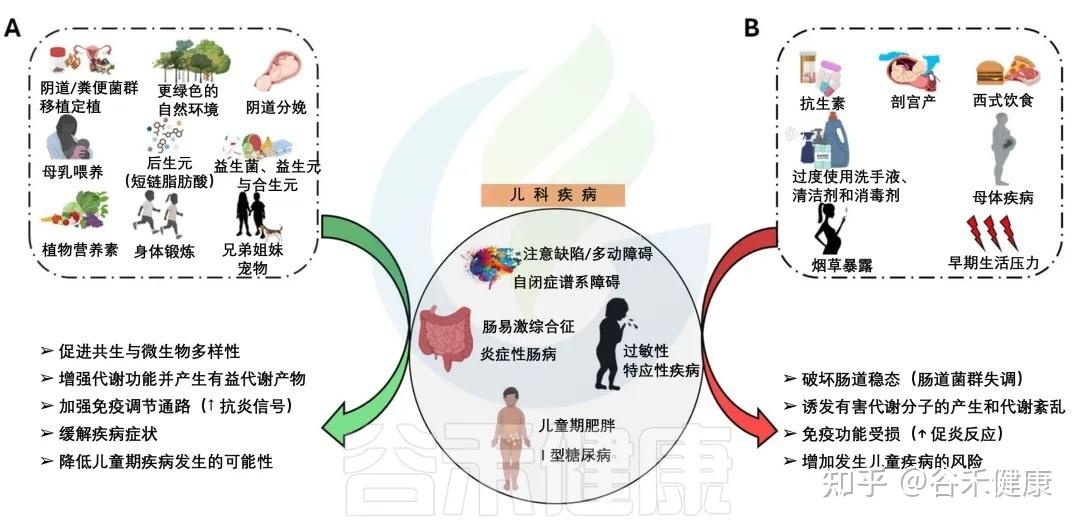
从出生开始,我们的肠道微生物群便陆续完成定植,在大约三年的时间里,从几乎一片空白,逐步演变为一个多样、稳定且高度复杂的微生态系统。这一阶段被认为是影响儿童健康的关键窗口期,而现代生活方式导致的环境污染、抗生素滥用、高加工食品摄入过多等问题,都在悄悄破坏着孩子娇嫩的肠道环境。
大量研究提示,生命早期一旦出现肠道菌群失衡,不仅会增加炎症性肠病、过敏性疾病(如哮喘、湿疹、过敏性鼻炎等)、自闭症、注意力缺陷多动障碍、儿童肥胖、糖尿病等多种儿科疾病的风险,其影响还可能延续至成年。相反,如果在这一时期通过合理的方式塑造一个平衡的肠道菌群,则有机会改善儿童免疫与代谢反应,甚至为一生的健康打下基础。
基于此,本文将围绕“早期肠道菌群与常见儿科疾病”这一主题,回顾当前研究进展,解析早期肠道菌群在疾病发生发展中的作用机制,并探讨可能的干预思路与临床应用前景。
我们知道肠道菌群不仅仅帮助我们消化食物,它还在免疫、营养吸收、抵御病菌、维护肠道屏障的完整性中扮演着关键角色。
尤其是在生命早期,肠道菌群会建立起连接大脑、肺、皮肤等远处器官的沟通轴线。这个关键发育窗口期建立的菌群平衡,就给未来打下了扎实的基础。如果这时候建立的菌群平衡被打破,就可能对儿童健康产生深远的不利影响,甚至引发多种疾病。
肠道与各大器官的交流
肠道菌群通过复杂的免疫、代谢和神经内分泌途径,与身体多个器官进行着持续的双向沟通。
这是最有名的这一条,大脑和肠道菌群,其实从宝宝还很小的时候就一起长大。
肠道菌群会产生影响情绪和行为的神经递质(如GABA),通过迷走神经和血液循环传递给大脑。
反过来,我们一紧张、焦虑,脑子里的压力信号会改变肠道里的环境,比如让酸碱度、激素水平发生变化,进而影响肠道菌群。这条轴线的失调与自闭症谱系障碍和注意力缺陷多动障碍有关。
再来看肠道和皮肤的关系。很多人都说“脸就是肠道的镜子”,其实还真有点道理。
肠道如果不太健康、菌群有点失衡,就很容易引发一些慢慢的、低度的炎症,还有一些代谢产物。这些东西会跟着血液到皮肤那儿去,影响皮肤表面的菌群平衡和局部免疫状态。
结果就是,像婴儿湿疹之类的问题,可能就会变得更严重或者更难治愈。
听起来好像肠道和肺离得挺远的,但它们之间也在悄悄互相影响。肠道菌群产生的代谢物,还有各种免疫信号,也可以通过血液到达肺部,帮忙调整呼吸道的免疫反应。肠道菌群失衡会增加儿童患哮喘和过敏的风险。
其他重要轴线: 研究还揭示了 肠-胰腺轴、肠-脂肪轴 等通路的存在。
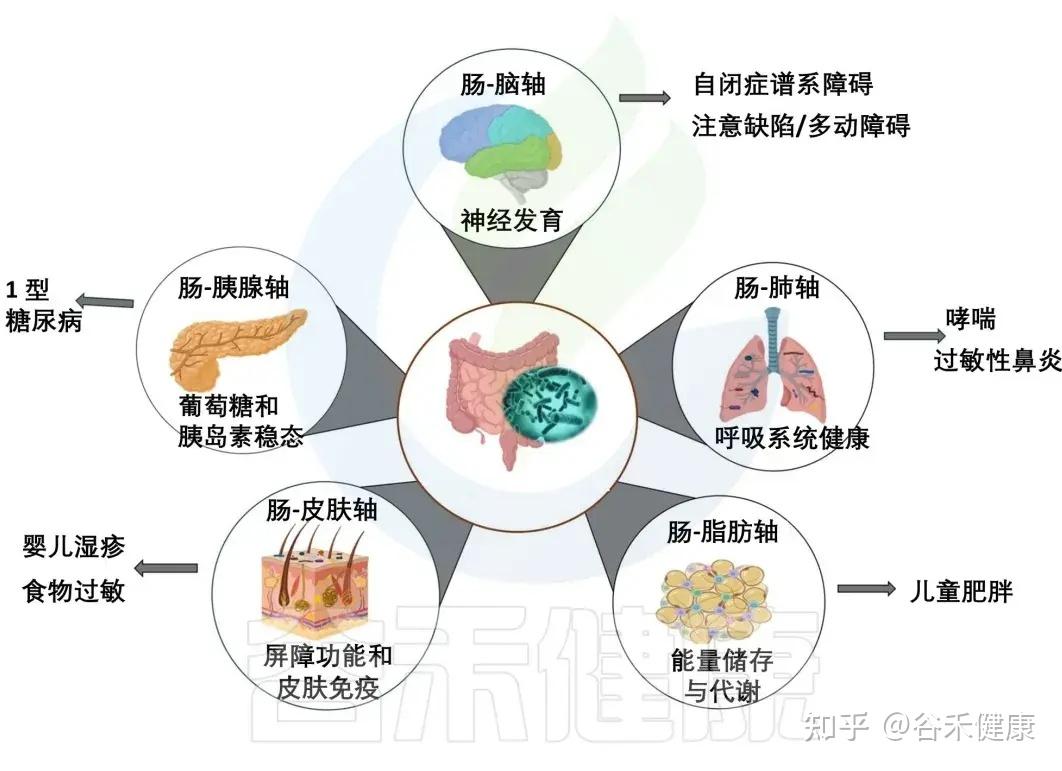
总之,肠道菌群通过这些复杂的代谢和信号通路,构建了一个覆盖全身的通讯网络,成为调节人体从免疫到神经系统等多个方面健康的核心枢纽。
母亲围产期营养状态
婴儿肠道菌群的初始状态,很大程度上继承自母亲。母亲在围产期保持均衡、健康的饮食,是为后代肠道菌群打下良好基础的第一步,也是至关重要的一步。
失衡的风险
如果母亲在孕期偏爱高热量、高脂肪的西式饮食,可能导致自身肠道菌群的失调。这种失调会通过胎盘、产道或母乳传递给婴儿,影响宝宝肠道健康。同样,营养不良也会导致菌群失调,可能增加如γ-变形菌门这类潜在致病菌群的出现。
▸细菌的入住,在出生前就开始了
与传统的“子宫无菌”理论不同,新的证据显示,细菌定植其实早在胎儿的宫内阶段便已开始。研究发现,非致病菌在妊娠期间能从母体肠道转移至胎儿,并存在于胎盘、羊水、脐带、胎儿组织及胎粪中。
而这个宫内微环境的菌群构成,又会受到母亲的健康状况、饮食习惯以及孕期菌群变化的影响,这为婴儿早期肠道菌群形成奠定了最初的基础。
分娩方式:顺产 or 剖腹产?
分娩方式,主要是顺产(即阴道分娩)与剖宫产,是显著影响新生儿肠道菌群组成和发育的关键因素。
▸出生方式决定了宝宝的第一批肠道居民
-顺产
顺产新生儿会接触到母体阴道与肠道来源的多样菌群,包括乳酸杆菌和双歧杆菌等优势菌株,这些菌群构成了初始肠道定植的核心。
顺产宝宝的菌群不仅更稳定、多样性也更高,而且他们的粪便菌群构成与母亲相似。
-剖宫产
与顺产儿相比,剖宫产儿的肠道菌群表现为双歧杆菌和乳酸杆菌的定植延迟、拟杆菌门的多样性较低,而主导菌群则通常是医院环境中常见的肠球菌属。
剖宫产宝宝的肠道里的菌群种类更少,而且这些菌群更像是来自妈妈皮肤和口腔里的。
注:
刚出生那段时间,两种分娩方式带来的菌群差别很大,这个差别会随着时间推移而慢慢变小。
有研究发现剖宫产宝宝的这种菌群特点,可能会让他们以后更容易得一些慢性病(比如哮喘、1型糖尿病、肥胖,但这个说法目前还有争议,不是所有研究结果都一样。
▸如何为剖腹产宝宝补回有益菌?
母体的阴道和粪便菌群是新生儿获得初始微生物的最主要、最丰富的来源。
——第一个办法:阴道菌群移植
为了弥补剖宫产宝宝在这方面的缺失,一些研究探索了“阴道菌群移植”的效果,就是说把母亲的阴道分泌物涂抹给新生儿。
部分研究显示,这种方法有助于部分恢复菌群定植;然而,另一些研究却得出相反结论,认为没什么影响。这种结果上的分歧,很可能是因为阴道菌群难以在婴儿肠道内实现长期定植。
——第二个办法:粪便菌群移植(仅科研探索阶段)
相对来说,母体消化道的菌群多样性要高得多,对宝宝肠道菌群定植的影响可能更深远。
基于这一理念,有些研究认为,母体粪便菌群移植是一种更有效的方法。它能近乎完全地恢复母婴间的微生物垂直传播,有效重塑新生儿的早期肠道菌群。
注:在我们看来,当前有关粪菌移植在儿童中的应用,仍主要停留在科研探索层面,且存在不少限制。成人与儿童的肠道菌群在组成和功能上存在显著差异,而目前临床检测和数据库中可用于精准匹配的儿童菌群数据仍相对有限。因此,现阶段粪便菌群移植更多作为研究工具和小范围、慎重的学术交流内容,并不适合作为常规干预手段。
喂养方式:母乳 or 配方奶?
▸母乳:不仅仅是食物
母乳 (HBM) 不仅为婴儿提供必需的营养,更在生命早期肠道菌群的成熟过程中扮演着至关重要的角色。
母乳富含多种生物活性成分,如免疫细胞、细胞因子、乳铁蛋白、抗菌蛋白和肽、抗体以及母乳低聚糖(HMOs)。这些成分能够对婴儿的肠道菌群进行正向调节,帮助宝宝抵抗感染。
与牛奶相比,母乳含有超过250种不同类型的母乳低聚糖。这些母乳低聚糖对于调节婴儿肠道微生物和影响免疫系统至关重要。
▸菌群差异:母乳 v.s. 配方奶
先前的研究已证实,母乳喂养和配方奶喂养的婴儿,其肠道菌群存在显著差异。
基于母乳喂养带来的整体健康益处,世界卫生组织推荐在婴儿出生后一小时内即开始母乳喂养,纯母乳喂养至六个月,并持续到至少一岁。
▸配方奶粉:添加母乳低聚糖
母乳喂养好处多多,但很多母亲会因乳腺炎、奶水不足或产后抑郁等原因而无法实现。为了弥补这一差距,现代高端婴幼儿配方奶粉开始添加在母乳中发现的关键成分——母乳低聚糖(HMOs),如2-岩藻糖基乳糖和乳糖-N-新四糖,这些有可能促进健康早期肠道微生物群的发展。
有研究发现,添加了HMOs的配方奶粉确实能带来积极效果:
▸生命早期,母婴间菌群如何传递?
母乳里的有益菌从何而来?研究人员认为,存在一个“肠道-乳腺通路”:
母亲肠道中的一些有益菌株可以被自身的免疫细胞(如树突状细胞)捕获。
这些免疫细胞随后通过淋巴系统,将这些细菌穿透肠上皮运送到乳腺。
最终,这些来自母亲肠道的有益菌就进入了母乳,并在喂养时传递给宝宝。
此外,母亲肠道细菌分泌的一些含有生物活性物质的小包裹(即细菌外囊泡,BEV),也可能通过同样的方式进入母乳,影响宝宝的肠道菌群建立。
总而言之,母亲自身的肠道健康状况,会直接影响母乳的微生物构成,进而深刻地影响着宝宝早期的肠道健康。
辅食添加:菌群发展的分水岭
当婴儿长到6个月左右开始添加辅食时,其肠道菌群会经历一次重大的转变。菌群会从以双歧杆菌为主的相对简单的状态,演变为一个相对更多样化的菌群。
-时机很关键
辅食添加太早或太晚,都会干扰菌群的正常成熟过程。因此,推荐在6个月左右开始添加营养丰富的辅食。
营养成分
不同的营养成分对肠道菌群有不同的影响。
▸宏量营养素(碳水、蛋白质等)
-碳水化合物
高纤维和低升糖指数的食物是肠道有益菌的“优质口粮”,有助于促进普雷沃氏菌属、双歧杆菌、毛螺菌属(Lachnoclostridium)和罗斯氏菌属(Roseburia)的生长。
一项研究表明,在婴儿的补充喂养阶段,食用来自各种全谷物、豆类、水果和蔬菜的膳食纤维会导致大量产丁细菌,如粪杆菌、粪球菌、Dorea、Oscillospira。
-蛋白质
相比动物蛋白,植物蛋白如扁豆,豆类,植物性饮食通常富含膳食纤维,含有足够量的多不饱和脂肪酸,通常更有利于结肠细菌的健康。
当然,为了维持肠道稳态,均衡摄入两种蛋白是最佳选择。
▸微量营养素(维生素与矿物质)
-维生素
多数维生素都能促进有益菌的生长,例如双歧杆菌和Akkermansia菌,同时抑制像艰难梭菌这样的致病菌。
例如,维生素A、B2、D、E、β-胡萝卜素可以增加有益共生菌的丰度。
维生素B2、E可以增加有益的SCFA产生菌。
-矿物质
它们的作用比较复杂。镁、钙、硒等有益于菌群。但需要特别注意的是,给婴儿补充铁剂可能是一把双刃剑,过量时可能会抑制双歧杆菌和乳杆菌科等有益菌,反而为一些有害菌的繁殖提供机会。
▸植物营养素(特别是多酚)
这是一类广泛存在于水果、蔬菜中的强大活性成分,能直接调节菌群。例如,生命早期服用葡萄多酚可以促进有益的Akkermansia和乳酸杆菌的生长。
更重要的是,母亲在孕期和哺乳期摄入的植物营养素可以传递益处。例如,母亲饮食中:
生命早期是一个塑造肠道菌群的黄金窗口期。在此期间,通过科学合理的营养干预来优化菌群构成,是预防多种儿童期乃至成年期疾病的有效策略。
运 动
除了我们吃什么,我们的“动与不动”也是影响肠道菌群的另一个关键因素。
▸运动如何优化肠道菌群?
规律的运动被证明可以从多个方面积极地重塑肠道微生态。
-增加有益菌和多样性
运动能显著增加肠道中有益菌的种类和数量,特别是那些能产生短链脂肪酸(SCFAs)的好菌。
宏基因组分析显示,运动量与罗斯氏菌属(Roseburia)和Akkermansia菌丰度呈正相关。
-久坐的危害
相反,久坐不动的生活方式则会破坏这种平衡。研究表明,久坐会导致肠道菌群多样性降低,并使得那些能更高效捕获食物能量的厚壁菌门增多,而放线菌门细菌减少。
▸生命早期的运动
在正确的时间运动,效果可能事半功倍,生命早期或许就是这样一个黄金窗口期。
-早期锻炼效果更佳
一项动物研究发现,如果在还很年幼的时候就开始运动,相比长大成年后才动起来,更能明显、积极地改变肠道菌群。
-具体的菌群变化
研究显示,幼年期的运动能显著增加拟杆菌门的比例,同时降低厚壁菌门的比例,这种菌群构成上的变化与增加瘦体重)直接相关。
基于这些益处,世界卫生组织建议,5岁以下的孩子,每天应累积进行至少180分钟的各类身体活动。
▸母亲的运动:给宝宝的第一份健康礼物
运动的影响力甚至可以追溯到生命开始之前。过去我们认为,父母传给孩子的是基因。现在我们知道母亲还可以传递一个健康的微生态系统。
-孕期运动的益处
母亲在孕前和孕期的规律运动,可以帮助宝宝的肠道减少有害菌,同时富集能产生短链脂肪酸的有益菌,从而改善宝宝整体的代谢健康。
-可能的机制
科学家推测,这其中的一个可能机制是,运动改变了母亲体内的代谢环境,如激素水平、血液循环和能量利用。这些生理变化信号传递到乳腺,影响了母乳的生产过程。
母乳中母乳低聚糖(HMOs)的种类和数量发生了改变。HMOs是母乳中仅次于乳糖和脂肪的第三大固体成分,但宝宝自己无法消化它。它不是给宝宝吃的,而是专门给宝宝肠道里的有益菌吃的。这样一来,宝宝的有益菌在菌群建立的早期就占据主导地位,抑制了有害菌的生长。
均衡的营养加上规律的身体活动,能最大程度地对早期肠道菌群的健康发展产生积极和深远的影响。
在生命早期操纵微生物发育的因素
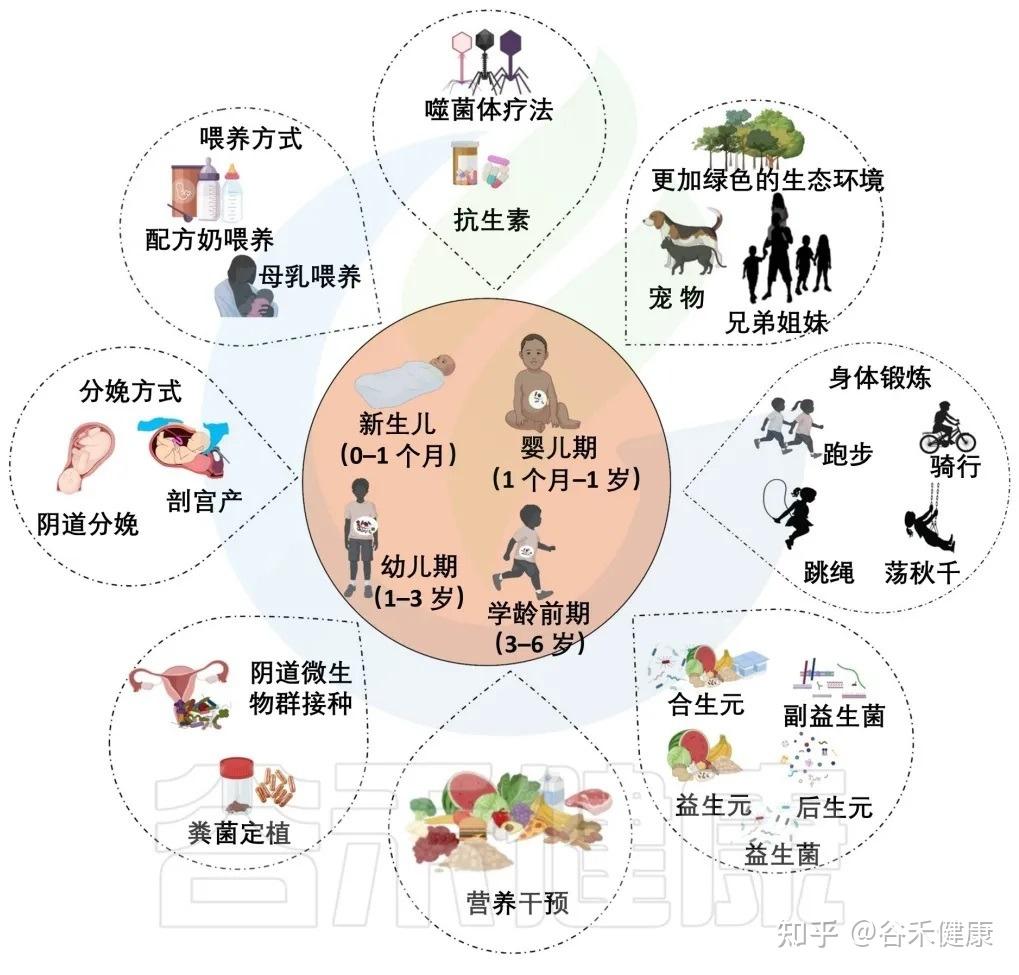
抗生素的使用:有利有弊
有些家长有过这种经历,带孩子看了一次病,用了抗生素,当时觉得病总算好了,松了口气,结果没过几天,新的问题又来了:孩子就开始拉肚子,或者突然吃一些东西开始食物不耐受了,甚至之前控制得好好的湿疹也加重了。这其实也跟肠道菌群有关。
关于抗生素,它确实对付细菌感染特别管用,不过呢,凡事都有两面,尤其是在生命早期,在宝宝身体各种系统都还在搭建的时候使用它,可能需要付出一些看不见的代价。
抗生素最大的问题在于其“不分敌我”的特性,它们不仅杀死了致病菌,也对肠道内大量的有益菌造成了连带伤害,导致肠道菌群失调。这种早期的菌群失调与日后的多种健康问题,如肥胖、哮喘以及抗生素耐药性等都有可能相关联。
婴儿接触到抗生素主要有两种途径:
▸母亲用药:穿越屏障的连锁反应
即使是母亲使用抗生素,其影响也能传递给宝宝。
-影响机制
在分娩期间,抗生素不仅会通过脐带传递给胎儿,还会改变母亲产道和粪便中的菌群,这些都是婴儿在出生时获得初始菌群的来源。
-对婴儿菌群的直接冲击
研究发现,经历过母亲产时抗生素暴露的婴儿,其粪便菌群表现出:
整体多样性降低;
放线菌门和拟杆菌门丰度显著减少;
变形菌门占据了主导地位。
-对母乳的影响
母亲使用的抗生素还会改变母乳中的微生物,这会直接阻碍双歧杆菌和乳酸杆菌等健康菌株在婴儿肠道的正常定植。
▸婴儿用药:艰难梭菌感染风险增高
当婴儿自己直接使用抗生素时,对肠道菌群的影响更为直接。
研究证实,这会导致婴儿肠道菌群构成发生剧变,主要表现为:有益的双歧杆菌数量锐减,而肠球菌属和克雷伯氏菌属等机会性致病菌的数量则会升高。
有些儿童在使用抗生素之后会发现,艰难梭菌(Clostridioides difficile)感染的风险会显著升高,艰难梭菌感染可能会引起严重的腹泻和结肠炎症。
除艰难梭菌外,抗生素使用还可能导致耐药菌株的选择性增长。例如,耐甲氧西林金黄色葡萄球菌(MRSA)和产超广谱β-内酰胺酶(ESBL)的肠杆菌科细菌,这些在抗生素治疗后更容易定植。
长远来看,可能会让宝宝更容易反复出现肠胃不适、拉肚子,或小病不断。因此,在抗生素用药之后,需要格外关注宝宝的饮食,排便,以及肠道菌群状态。
环 境
除了饮食和运动,我们生活于其中的物理和社会环境,也对生命早期的肠道菌群发展有着深刻而直接的影响。从家里的宠物到社区的公园,都在悄无声息地参与塑造这个微小的生态系统。
▸ “不干不净,吃了没病”
过度干净的环境,有时反而不利于建立一个强大的免疫系统和健康的肠道菌群。适度地接触来自外界的微生物,对婴儿来说是一种有益的早期训练。
-宠物带来的益处
宠物猫狗陪伴着孩子长大,像家人一般为孩子带来情感上的安慰与支持,也为孩子性格带来温暖的影响,让孩子感受更多无条件的爱与接纳。
从肠道菌群的角度来说,研究发现,与宠物(如猫狗)一起长大的婴儿,其肠道菌群的丰富度和多样性通常更高。具体来说,他们的肠道中比如双歧杆菌、颤螺菌属(Oscillospira)和瘤胃球菌属(Ruminococcus)这些有益菌的丰度会更丰富。

有趣的是,养猫的人肠道里的双歧杆菌水平也比不养猫的人要高。这就意味着,和猫咪一起生活,可能会通过菌群的交流,悄悄地帮我们补充有益菌,提升肠道健康水平。
注:然而也存在一些需要注意的潜在风险。研究指出,猫肠道里的抗生素耐药基因(ARG)丰度显著高于人类。这些耐药基因可能会通过猫咪在家里的活动(比如它走过地板、沙发),转移到环境中,进而有机会进入人体。简单说,就是猫可能会把它携带的耐药基因传递给主人,这增加了我们体内细菌变得耐药的可能性。
-兄弟姐妹的菌群共享
同样,有哥哥姐姐的孩子,其肠道菌群的多样性也更高。
道理其实很简单。宠物和哥哥姐姐会将更多来自室外(如土壤)或他们自身的微生物带入环境中,让婴儿有机会接触到更多样的细菌,这就像是给婴儿的肠道菌群进行了一次自然接种,有助于其发展得更加健全和有韧性。
▸新冠的意外发现:社交隔离对菌群的影响
新冠为我们提供了一个独特视角,观察环境剧变如何影响肠道菌群。
-菌群多样性下降
研究人员发现,在疫情期间出生的婴儿,其粪便样本中的微生物多样性显著低于疫情之前的同龄婴儿。
-可能的原因
这种变化被认为与疫情期间的特殊生活方式有关,包括:社交活动大幅减少,以及消毒剂、洗手液等清洁产品的使用频率急剧增加。这使得婴儿接触外界微生物的机会大大减少。
▸ 环境的力量:来自大自然的馈赠
我们与自然环境的接触,也能产生意想不到的健康关联。
-母亲接触绿色环境的益处
最近的一项研究指出,如果母亲在孕期更多地接触住宅区周围的公园、绿地等绿色环境,其母乳中母乳低聚糖(HMOs)的多样性和浓度都会更高。

我们已经知道,HMOs是婴儿肠道有益菌的超级食物。因此,通过提升母乳的质量,母亲接触绿色环境的益处最终能够传递给婴儿,积极地影响其肠道菌群的健康发育。
因此,生命早期丰富的环境暴露至关重要。一个不过分无菌、能适度接触来自他人、宠物和大自然的微生物的环境,是帮助孩子建立一个多样、稳定且有韧性的肠道菌群的关键因素之一。
生命从出生到3-6岁的这段时间,是肠道菌群发育的“关键窗口期”。这个阶段的任何干扰,都可能让菌群的健康发展偏离轨道,从而为日后儿童期的各种疾病埋下隐患。
儿童过敏
儿童过敏性疾病,包括湿疹、哮喘、过敏性鼻炎、食物过敏等,是一组以免疫系统对无害物质产生过度反应为特征的常见慢性病。它们的发病,往往与遗传和环境因素共同相关。
从临床分型上看,这些疾病都属于特应性疾病,其核心是身体产生了过度的IgE抗体来对抗那些本应无害的环境物质(如花粉、尘螨、某些食物等)。并且,患有其中一种过敏的孩子,往往更容易患上另一种,这被称为过敏进程。
▸肠道菌群:过敏病程中的关键调控者
这几年,无论是基础研究还是临床队列,都越来越一致地指向一个关键环节,肠道菌群在过敏的发生发展中扮演着关键的调控角色。
在我们对过敏儿童样本的菌群数据分析中,可以看到一种具有代表信的肠道菌群失调。
具体来说,过敏儿童的菌群通常具备几个共性:
更细分到食物过敏的时候会发现,不同食物过敏原(比如牛奶蛋白、鸡蛋蛋白、花生等)相关的菌群变化还可能各有其特异性的模式,不同分型这也是我们正在关注的方向。
▸失控的免疫反应:当前主流的菌群-免疫假说
那肠道菌群究竟是通过什么路径去影响免疫系统,进而推动过敏的呢?目前在学术界相对被广泛接受的,是围绕短链脂肪酸,尤其是丁酸盐的一条核心假说:
丁酸盐的缺失:菌群失调导致关键的代谢产物——丁酸盐浓度下降。
刹车失灵:丁酸盐是促进初始T细胞分化为调节性T细胞(Tregs)的关键信号。Tregs在免疫系统中可以理解为一个刹车装置,负责抑制过度的免疫反应,维持免疫平衡。
免疫过度激活:丁酸盐减少导致Tregs数量不足或功能受损,刹车失灵,免疫系统便会对无害物质反应过度。
典型免疫表型:在这种菌群失调的背景下,我们在过敏儿童身上通常可以看到这样一组特征性变化:
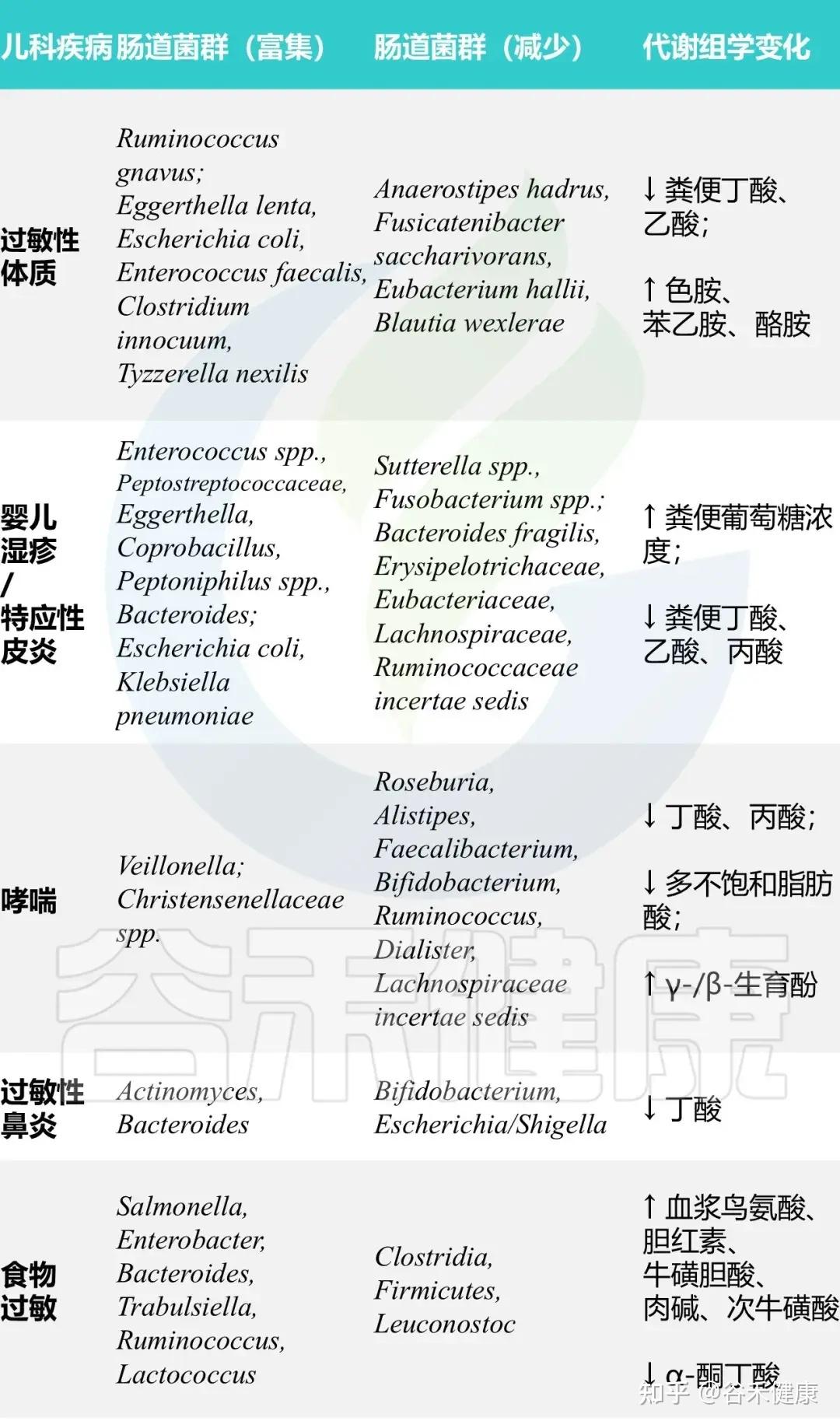
总而言之,生命早期的肠道菌群失调,通过影响免疫系统的正常教育过程,为日后一系列过敏性疾病的发生埋下了伏笔。而具体的菌群和代谢物变化,则在不同的过敏性疾病中呈现出各自的特征。
肠道菌群检测就是力求精准地捕捉到这些早期的菌群和代谢物特征,在实际应用中,我们并不会仅看哪个菌高了或者低了,而是会把菌群特征与已有的临床和免疫学指标放在一起综合判断。
例如,结合谷禾肠道菌群检测报告中的过敏相关菌群模块、肠道屏障评分,以及部分炎症相关因子和免疫调节指标(如 IL‑6 等),我们可以更准确地判断一个孩子的肠道生态,是不是已经处在一个更偏向炎症和过敏反应的状态,尽可能实现对高风险儿童的早期识别,从而为临床的早期预警和干预提供思路。
IBS 与 IBD
在儿童常见的胃肠道疾病中,炎症性肠病(IBD)和肠易激综合征(IBS)是两个重要的类别,它们都与肠道菌群的失衡密切相关。
虽然生命早期的肠道菌群构成与这两种疾病的确切因果关系仍在研究中,但科学家们已经在年龄较大的患病儿童中发现了明确的菌群改变。
▸失衡的菌群
IBS患儿的菌群特征:
IBD患儿的菌群特征:
▸代谢物的变化(化学信号的紊乱)
在IBD患儿体内,色氨酸、琥珀酸盐和3-羟基异丁酸等关键微生物代谢产物的水平较低。
在IBS患儿体内,则观察到葡萄糖、甾醇、乳酸水平升高,而有益的丁酸盐水平下降。
尽管如此,与生命早期相关的特定代谢组学特征,目前仍是一个有待深入探索的领域。
▸失控的免疫反应:炎症
在这两种疾病的背后,一个共同的核心病理机制是:由肠道屏障缺陷和微生物失调共同驱动的、失控的黏膜免疫反应。
IBD:
某些能够降解肠道黏液保护层的致病共生菌,例如黏附侵袭性大肠杆菌(adherent-invasive Escherichia coli),能够诱导巨噬细胞等免疫细胞分泌IL-1β,这会直接促进Th17细胞的分化,点燃肠道炎症。
从口腔跑到肠道的克雷伯氏菌属,也能促进树突状细胞和巨噬细胞产生促炎因子,从而推动初始T细胞分化为Th1和Th17细胞,加剧炎症。
此外,大量能产生IgG抗体的浆细胞被招募到肠道,也参与了IBD的疾病进展。
IBS:
虽然炎症程度不如IBD剧烈,但在IBS患儿的结肠黏膜和血液中,也观察到了先天免疫的过度活跃,特别是来自肥大细胞和单核细胞的活动增强。
适应性免疫同样参与其中,表现为肠道内T细胞数量增加、B细胞活性改变以及抗体的产生。
简而言之,IBD和IBS的发生,是肠道菌群失衡与免疫系统功能紊乱相互作用、相互放大的恶性循环。然而,上述这些复杂的免疫机制,在那些具有高患病风险的婴幼儿身上是如何运作的,仍需要更多未来的研究来进一步验证和阐明。
常见儿科疾病中的早期肠道生态失调
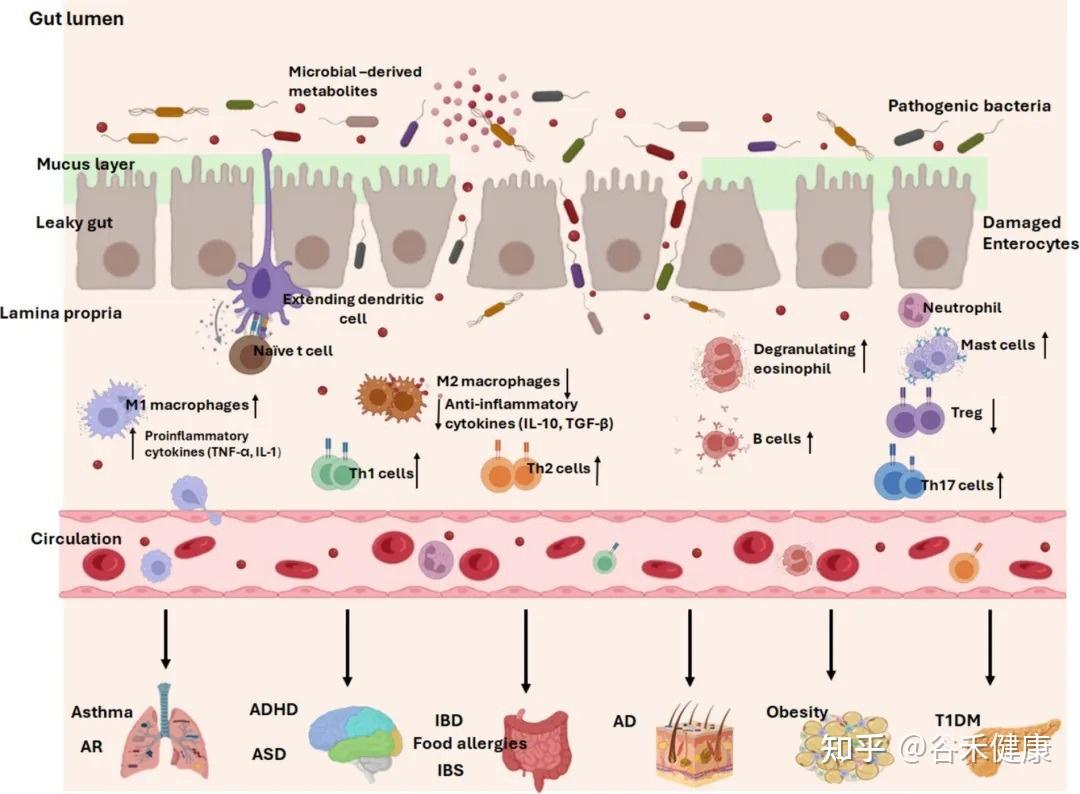
神 经 发 育
生命最初的几年,不仅是肠道菌群建立的关键窗口,也恰好与中枢神经系统发育的关键阶段,如神经突触的形成和髓鞘化高度重叠。这并非巧合。一条被称为肠-脑轴的复杂通讯网络,将肠道和大脑紧密地联系在一起,使得肠道菌群的状况能够深刻影响神经发育,甚至可能参与了自闭症谱系障碍(ASD)和注意力缺陷多动障碍(ADHD)等疾病的发生。
这两种情况有时会同时出现在一个孩子身上。
▸失衡的菌群,失调的化学信号
由于肠道微生物能通过其代谢产物和影响免疫通路来调控神经系统的发育和功能,科学家们将其视为自闭症和多动症发病的一个潜在贡献者。研究发现,与正常儿童相比,具有高患病风险的幼儿,其肠道菌群的构成和产生的生物活性代谢物均存在显著差异。
-菌群失衡
-关键神经递质的缺失
一个尤为引人注目的发现是,这些高风险儿童体内由细菌产生的、具有神经活性的分子——γ-氨基丁酸(GABA)的水平显著降低。
这些发现清晰地揭示了在生命早期,肠道菌群-代谢产物-神经系统之间存在的深刻联系。
▸从肠道炎症到大脑炎症
GABA的减少可能不仅仅是一个孤立的现象,它或许是连接肠道失衡与大脑功能异常的关键一环。GABA是大脑中主要的抑制性神经递质(负责让大脑冷静下来),它还在调节焦虑、改善睡眠、缓解疼痛以及帮助维持神经系统的整体平衡方面发挥着关键作用。
-连锁反应的启动
菌群失调导致GABA等代谢产物水平改变。
GABA水平的改变,加上菌群本身的失调,引发了不正常的免疫反应和全身性炎症(表现为血浆中细胞因子水平的异常)。
这种慢性的全身性炎症会逐渐破坏精密的血脑屏障的完整性。血脑屏障一旦受损,炎症细胞和炎症因子便更容易进入大脑,最终引发神经炎症,从而影响大脑的正常发育和功能。

简而言之,ASD和ADHD的发生,可能部分源于肠道开始,经由免疫系统,最终波及大脑。然而,这其中的具体机制非常复杂。尤其是在菌群发育的关键窗口期,究竟哪些早期的免疫学特征能够预示ASD和ADHD的发生,仍然是未来研究需要迫切解答的重要问题。
肥胖及1型糖尿病
在儿童期,最常见的代谢性疾病莫过于肥胖和1型糖尿病(T1DM),而这两者的发生,都与生命早期的肠道菌群失调有着千丝万缕的联系。
▸肠道菌群:调节新陈代谢
我们的肠道菌群在宿主的新陈代谢中扮演着至关重要的“总调度师”角色,其影响力涵盖了脂质与葡萄糖代谢、能量消耗与脂肪储存,乃至胰岛素信号的传导等多个方面。
更关键的是,T1DM的发病高峰期通常在生命最初的5-6年,这与肠道菌群发育的关键窗口期完全重合,这暗示了两者之间强烈的内在联系。
▸失衡的菌群
与健康儿童相比,患有或高风险患有这两种代谢病的儿童,其肠道菌群构成显示出特定的指纹。
-T1DM高风险儿童的预警信号
研究发现,在T1DM高风险儿童体内出现自身抗体(血清学转换)之前,他们的肠道中多形拟杆菌(Bacteroides dorei)和普通拟杆菌(B. vulgatus)的数量就已经显著增加。值得警惕的是,这两种拟杆菌属细菌均与肠道炎症有关。
-肥胖儿童的菌群
从婴儿早期开始,肥胖儿童的肠道中就表现出脆弱拟杆菌(Bacteroides fragilis)丰度更高,而有益的双歧杆菌属(Bifidobacteria)和柯林斯菌属(Collinsella)数量更少。这种菌群模式与日后过度的体重增加直接相关。
▸代谢紊乱:疾病发生前的信号
在疾病真正显现之前,身体的化学信号——代谢产物,可能已经发出了警报。
-肥胖儿童的代谢特征
他们的体内GABA(一种能调节食欲和体重的神经递质)水平显著较低。
同时,血液中对称性二甲基精氨酸和不对称性二甲基精氨酸的水平升高,这两种物质被认为与全身性炎症有关。
-代谢综合征儿童的发现
另一项研究观察到,在5岁的代谢综合征儿童体内,参与糖异生、氨基酸和脂肪酸代谢的循环代谢产物显著增加,这些代谢通路的变化与他们的BMI、腰围和空腹血糖水平密切相关。

▸免疫与炎症:连接菌群与疾病
早期肠道菌群与免疫系统之间的相互作用,是驱动这些代谢疾病的关键。
-肥胖与炎症
在3-5岁的重度肥胖儿童中,可以观察到C反应蛋白(一种全身性炎症标志物)的水平升高。
失调的肠道细菌及其代谢产物(分解代谢物)会损害脂肪组织的稳态,并诱发慢性低度炎症,从而助长儿童肥胖的发生。
-T1DM与炎症
儿童T1DM患者体内常常同时存在肠道菌群失调和全身性及组织特异性的炎症反应升高,这清晰地表明,肠道微生物在维持宿主代谢健康中扮演着不可或缺的角色。
因此,无论是儿童肥胖还是1型糖尿病,其背后都涉及生命早期的肠道菌群失调,通过扰乱宿主正常的新陈代谢通路和触发不当的免疫炎症反应,为这些慢性代谢疾病的发生和发展铺平了道路。
在生命早期干预和重塑肠道微生物群,是促进长期健康的有效方法。儿童的肠道菌群比成人更容易被环境因素改变,且该时期是免疫系统成熟的关键窗口,而免疫系统又受到肠道菌群的调节。
这里我们来了解一下在常见儿童疾病中,通过操纵早期肠道微生物组进行干预的前沿研究。
儿 童 过 敏
既然我们知道了肠道菌群失调是儿童过敏的关键推手,那么,我们是否能主动出击,通过调整菌群来拨乱反正,预防或缓解过敏呢?
答案是肯定的,现有研究已经为我们指明了几个有希望的方向。
▸抗生素的阴影与警示
在讨论干预之前,必须再次强调预防的重要性。大量证据表明,无论是母亲在孕期还是孩子在生命早期使用抗生素,都会增加儿童患过敏性疾病的风险。
剂量效应: 一项研究发现,母亲孕期使用抗生素的剂量越大,孩子日后患过敏病的风险就越高。
菌群变化: 生命早期使用大环内酯类抗生素,会导致肠道菌群发生剧烈变化,表现为放线菌门数量锐减,而拟杆菌门和变形菌门的数量则会增加。这种菌群的偏移,与哮喘风险和高BMI直接相关。
▸益生菌与益生元
直接补充益生菌及益生元,是最直接的干预手段之一,并且已经展现出不错的效果。
-针对湿疹
一项研究测试了一种含有两歧双歧杆菌(Bifidobacterium bifidum)和短双歧杆菌(B. breve)的特殊婴儿配方。结果显示,使用该配方的湿疹儿童肠道中,短双歧杆菌的丰度显著增加,同时 与乙酸盐合成相关的代谢通路被激活,这与湿疹症状的缓解显著相关。
-预防湿疹
另一项类似的研究也证明,补充益生菌和低聚半乳糖能够丰富肠道中的乳酸杆菌和双歧杆菌,从而有效预防了湿疹的发生。
-针对过敏性鼻炎
在一项芬兰的研究中,研究人员给孕晚期的母亲和她们出生后6个月内的婴儿补充四种益生菌菌株和低聚半乳糖(GOS)。在后来患上鼻炎的孩子组中,这种干预显著提升了双歧杆菌的数量,并减少了拟杆菌的数量。
▸母乳喂养与运动:有争议
-母乳喂养
理论上,母乳是建立婴儿免疫耐受的核心。但关于母乳喂养与预防过敏之间的关系,证据却并不完全一致。一些研究报告了其保护作用,而另一些则认为延长母乳喂养并没有预防效果。这说明其中的机制可能比我们想象的更为复杂。
-体育锻炼
在菌群可塑性最强的童年期,运动也可能扮演着重要角色。有研究显示,3-6岁时体育活动水平低的孩子,在儿童后期患哮喘的风险更高。然而,一个关键的不足是,这些研究并未分析运动究竟是如何影响肠道菌群的。
▸饮食:塑造菌群的日常选择
饮食是影响肠道菌群最基础、也最持久的因素。
PASTURE的一项研究发现,1岁时粪便中丁酸盐和丙酸盐水平高的婴儿,未来患上哮喘和发生过敏性致敏的风险更低。而这些短链脂肪酸的水平,又与婴儿饮食中摄入的酸奶、鱼、水果、蔬菜显著相关。
另一个代谢组学研究则指出,富含油炸和加工肉类的饮食习惯,与哮喘风险以及肠道中克里斯滕森菌科(Christensenellaceae)细菌的增多呈正相关。

「哮喘」最新研究已逐步渗透到更精细层面28 赞同 · 3 评论 文章
IBD 和 IBS
面对由菌群失调驱动的炎症性肠病(IBD)和肠易激综合征(IBS),研究人员正在积极探索一系列干预措施,试图通过调控肠道菌群,来调节肠道内的紊乱。
▸抗生素与噬菌体
越来越多的证据将矛头指向了抗生素。
一项涵盖22项研究的系统性回顾发现,生命最初两年内使用抗生素,与日后患上IBD的风险存在强烈关联。
另一项荟萃分析也指出,母亲在孕期接触抗生素和烟草烟雾,都会增加后代患IBD的风险。
噬菌体疗法:作为抗生素的潜在替代方案,噬菌体疗法(利用病毒去攻击特定的有害细菌)已在人体中显示出良好的安全性。它或许能成为治疗儿童胃肠道疾病的一种新方法,但要真正应用于临床,还需要大量深入的研究。
▸压力
早期生活压力的破坏力:肠道不仅感受生理刺激,也感受心理压力。一项动物研究利用母婴分离模型来模拟早期生活压力,结果发现,这种压力能够诱导小鼠从童年到成年持续出现类似IBS的症状,其肠道菌群也发生了改变,表现为乳酸杆菌、肠杆菌属等有益菌的减少。
▸饮食:塑造肠道的终极力量
在所有干预手段中,饮食调整可能是最基础、也最有效的方法之一。
-需要警惕的饮食
研究表明,高脂肪饮食以及富含可发酵寡糖、双糖、单糖和多元醇(FODMAPs)的饮食,会加剧IBD和IBS的症状。而在一项大型研究(斯堪的纳维亚出生队列的汇总研究数据)中,1岁时大量摄入含糖饮料也与日后更高的IBD风险相关。
-值得推荐的饮食
富含多酚、矿物质和高纤维的饮食则被证实有助于缓解症状。同一项研究发现,1岁时鱼类和蔬菜摄入量高的孩子,未来患IBD的风险更低。
-草本的力量
一些草本植物也显示出潜力。例如,在一项针对103名IBS患儿的随机双盲试验中,服用洋车前子(一种富含纤维的草本)长达6周的儿童,其腹痛发作的次数显著少于服用安慰剂的儿童。
但有趣的是,尽管症状得到了改善,两组儿童的肠道菌群构成却没有观察到显著差异,这提示其作用机制可能不仅仅是通过改变菌群。
肥胖和糖尿病
通过干预和调控生命早期的肠道菌群,我们或许能找到重置儿童新陈代谢的关键,从而预防这些疾病的发生。
▸抗生素
来自母亲的影响:现在的人群数据已经给了比较一致的信号。比如有研究发现,妈妈在备孕阶段频繁使用某些抗生素(像青霉素、喹诺酮类),和孩子日后T1DM 风险上升是相关的。
宫内暴露的后果:胎儿在子宫内接触到抗生素(如青霉素),与宝宝出生后的生长迟缓相关。这种暴露会导致婴儿肠道菌群多样性降低,并引发一系列菌群结构的改变:厚壁菌门和乳杆菌目减少,而变形菌门和拟杆菌门等则相对增多。
▸母乳喂养的黄金标准
在生命最初的几个月里,母乳是主要的营养来源,塑造早期肠道微生物群,促进双歧杆菌主导的肠道,这一点和我们日常检测到的健康婴幼儿菌群特征也是一致的。
明确的保护作用:来自两个基于人群的队列的数据显示,非母乳喂养的婴儿,其日后患T1DM的风险翻了一倍。同时,一项涵盖25项研究的荟萃分析也明确指出,母乳喂养是预防儿童肥胖的显著保护因素。
然而,大多数此类研究未能建立起从“母乳喂养”到“特定菌群改变”再到“代谢改善”之间的完整证据链。
▸益生菌
针对T1DM:研究显示,在生命最初的27天内进行益生菌干预,与T1DM高风险儿童的自身免疫风险降低相关。
针对肥胖:母亲在孕期及产后补充特定的益生菌(如鼠李糖乳杆菌HN001),能有效降低婴儿在2岁时过度肥胖的风险,这提示“母亲补充,婴儿受益”的策略或许能预防儿童肥胖。
▸运动的悖论:明确的效果与未解之谜
在肥胖儿童中的效果:研究证实,在肥胖儿童中,体育锻炼能够降低血糖和促炎通路,同时改善菌群(降低γ-变形杆菌,增加罗斯氏菌属Roseburia等),并提升有益的短链脂肪酸水平。
然而,这些研究几乎都是在年龄较大、菌群已趋于成熟的儿童或青少年中进行的。体育锻炼对于菌群可塑性最强的婴幼儿时期会产生怎样的影响,亟待未来的研究来解答。
▸营养:从母亲到孩子的饮食智慧
-母亲饮食的深远影响
母亲在孕期的饮食可以直接影响其自身的菌群,这种状态又能通过传递来重塑婴儿的早期菌群,从而为孩子未来的代谢健康打下基础。
-植物化学物质
多酚:如葡萄多酚,在动物实验中被证明能促进有益的Akkermansia菌和乳酸杆菌的定植,增加短链脂肪酸的产生。
实验室的研究也表明,无论是来自西兰花的萝卜硫苷,还是来自大豆的染料木黄酮,在生命早期摄入,都能有效减少后代的过度肥胖,改善其整体代谢健康。
这些发现揭示了巨大的潜力,但下一步需要通过转化研究来验证这些营养成分在人类儿童身上是否同样有效,以及它们是如何通过影响肠道菌群来发挥作用的。

膳食纤维对代谢健康和肥胖的影响8 赞同 · 1 评论 文章
儿 童 神 经 发 育
一切始于源头,生命最初的经历深刻地影响着大脑的发育轨迹。
-母乳喂养的保护
一项研究表明,更长时间的纯母乳喂养能够降低儿童患ASD和ADHD的风险。
-需要警惕的风险因素
相反,母亲吸烟、压力大、母乳喂养时间过短(< 4个月)则与更高的ADHD风险显著相关。而孕期感染和母亲患有自身免疫性疾病,也与ASD的发生呈正相关。
-补偿剖腹产的损失
对于剖腹产导致菌群未能正常传递的问题,一种名为阴道菌群移植(VMT)的新技术显示出潜力。研究发现,接受了VMT的新生儿,其肠道菌群和代谢物状况更优(如乳酸杆菌、双歧杆菌增多,克雷伯氏菌减少),并且在6个月大时,其神经发育评分也显著更高。
▸益生菌
直接补充特定的益生菌,为预防神经精神障碍提供了新的思路。
一项长达13年的里程碑式的研究中,科学家们给75名婴儿在生命最初的6个月里补充了鼠李糖乳杆菌GG。结果发现,这一干预引发了长期的、有益的菌群变化。更令人震撼的是,追踪到13岁时,这些接受了益生菌干预的孩子,其患上ADHD的风险显著降低了。
真实世界研究显示,植物乳杆菌PS128 服用者在注意力、沟通技能上有显著改善,且副作用小。
▸体育锻炼
体育锻炼不仅强健身体,更能健脑。
研究证实,让患有ASD的幼儿在进行课堂活动前进行体育锻炼(尤其是有氧运动),能够显著改善他们的学业反应能力。
▸母亲的饮食习惯
母亲通过塑造自身的肠道菌群,能将其影响传递给下一代,深刻影响孩子的行为和大脑功能。
母亲菌群多样性重要:一项大型队列研究发现,母亲孕期肠道菌群的α-多样性越高,其孩子在2岁时表现出的行为问题就越少。
有益菌的传承:在行为正常的孩子组中,他们的母亲肠道中富含能产生丁酸盐的菌科(如毛螺菌科Lachnospiraceae、瘤胃球菌科)。
健康的孕期饮食,与更高的母亲菌群多样性和更少的儿童内化行为问题直接相关,这清晰地表明,母亲的饮食是支持婴儿早期大脑发育的关键一环。
▸营养
研究报告称,ω-3脂肪酸、维生素、锌、镁、植物化学物质可能在管理与自闭症和多动症相关的生态失调方面发挥有益作用。
基于微生物的可改变因素对儿童疾病发展的影响

儿童神经发育异常的脑肠轴视角 – 自闭症早期风险判别和干预新路径6 赞同 · 0 评论 文章

探索大脑健康的宝藏:神经营养素、肠道菌群与我们的思维宇宙8 赞同 · 0 评论 文章
甲状腺功能障碍
甲状腺,这个位于颈部的蝴蝶状腺体,是身体新陈代谢的总开关。而它的功能状态与远在腹部的肠道菌群息息相关,形成了一条“肠道-甲状腺轴”。
肠道菌群失调和肠道屏障通透性增加(肠漏),与自身免疫性甲状腺疾病的风险增加有关,这是导致儿童甲状腺功能亢进或减退的主要原因。
▸肠道 ⇌ 甲状腺
肠道对甲状腺的影响:肠道细菌能影响甲状腺合成激素所必需的矿物质(如碘、硒、锌)的吸收和利用。同时,它们也参与甲状腺激素的代谢和激活。甲状腺免疫也受肠道微生物及其代谢产物的调节,从而导致自身免疫性甲状腺疾病的发病机制。
肠道对甲状腺的影响
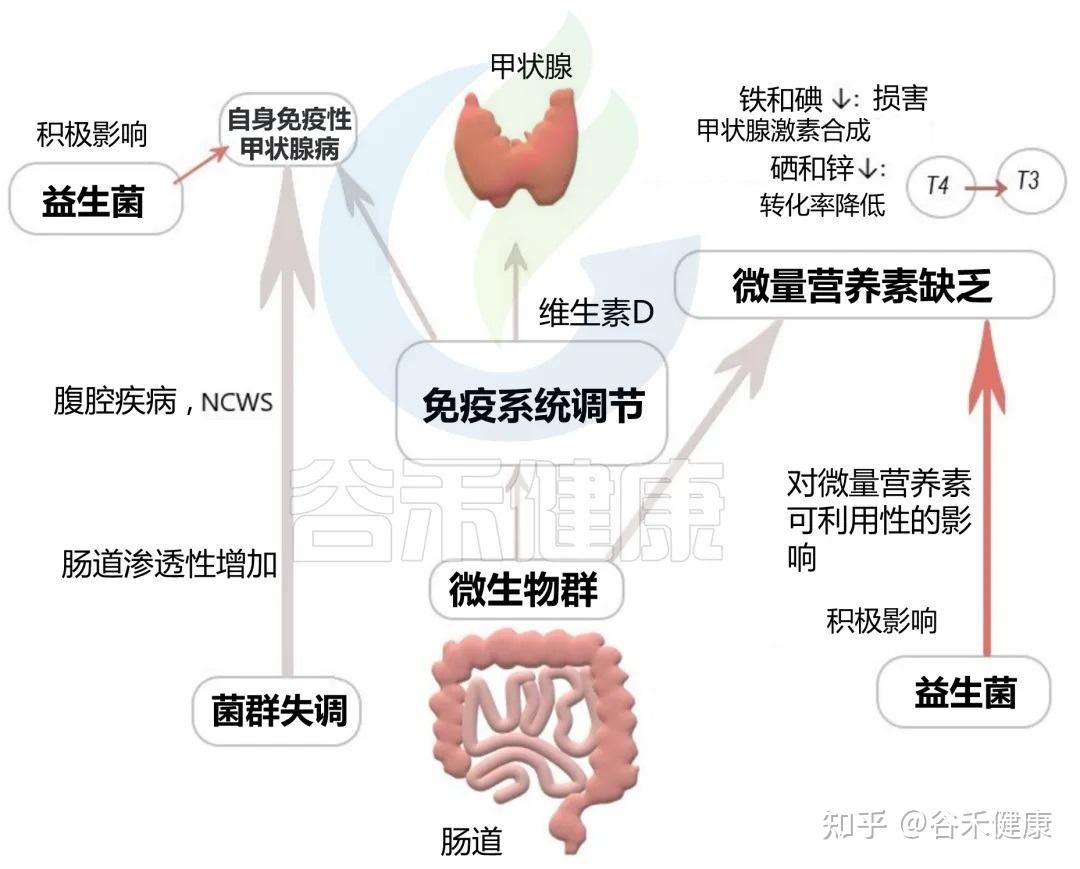
甲状腺对肠道的影响:甲状腺激素反过来也能影响胃肠道的蠕动,并可能直接调控肠道菌群的构成。
▸甲状腺相关疾病患者肠道菌群变化
在成人中:
甲亢患者的双歧杆菌和乳杆菌减少;
而桥本氏甲状腺炎患者则有Akkermansia菌和双歧杆菌的富集。
在儿童中,尤其是在菌群发育的关键窗口期,这方面的研究仍然非常稀少。
▸潜在的干预策略
研究提示,高纤维饮食、补充甲状腺相关的微量营养素、益生菌/益生元、体育锻炼甚至粪菌移植(FMT)都可能对保护甲状腺功能有益。相反,环境中的内分泌干扰物则是一个明确的风险因素。


慢性自身免疫性疾病——桥本甲状腺炎,改变认知和抓住关键16 赞同 · 1 评论 文章
性 早 熟
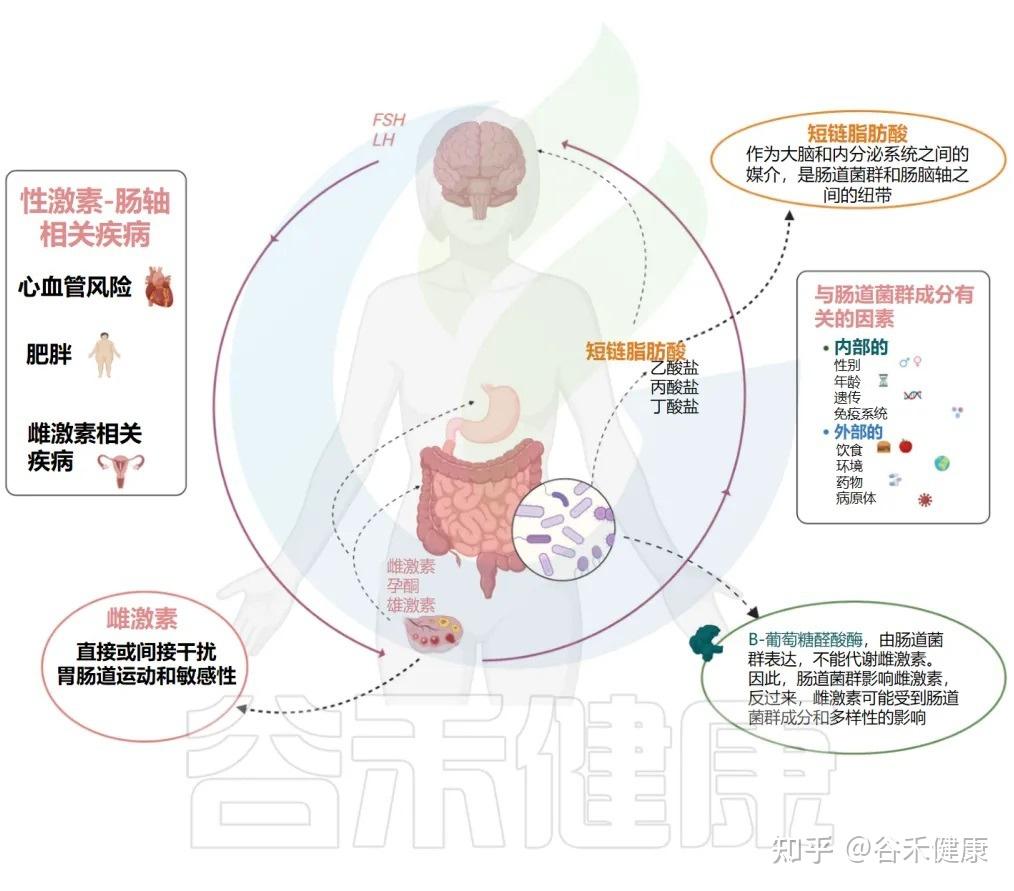
性早熟(PP),即第二性征过早出现,是儿童中一种日益普遍的内分泌紊乱,尤其在女孩中更为常见。最新的研究将目光投向了肠道菌群,认为它可能在“性激素-肠道菌群轴”上扮演了催化剂的角色。
▸菌群如何催熟?
影响雌激素代谢:某些肠道细菌,如瘤胃球菌属和拟杆菌属,能够通过产生β-葡萄糖醛酸酶来影响雌激素的代谢和循环,从而影响青春期的启动。
通过“肠-脑轴”通讯:菌群产生的短链脂肪酸(SCFAs)和神经递质,也能通过“肠-脑轴”向大脑发送信号,间接调控青春期的启动时机。
一项研究发现,与健康女孩相比,患有中枢性性早熟的女孩肠道中,多种特定细菌显著增加,如:
而这些细菌恰恰与肥胖、短链脂肪酸产生和雌激素代谢有关。
代谢组学分析进一步发现,这些女孩粪便中的代谢物发生了改变,与促进性腺激素分泌的通路(如类固醇生物合成)被激活有关。
性激素和肠道菌群之间的相互关系
▸干预与警示
有益的干预:动物实验表明,益生菌治疗可以逆转由早期压力或环境物质诱导的性早熟。在人类中,维生素D补充、复杂的碳水化合物和高蛋白饮食(如坚果、蔬菜、海鲜等)被认为可能对预防性早熟有益。
有害的暴露:生命早期接触内分泌干扰化学物质和环境污染物,会扰乱肠道菌群,从而增加性早熟的风险。
无论是甲状腺功能还是青春期的启动,这些看似与肠道无关的生命过程,都可能受到肠道菌群的深刻调控。这为我们理解和干预儿童内分泌疾病打开了一扇全新的大门。

性早熟和微生物群:性激素-肠道菌群轴的作用3 赞同 · 0 评论 文章
综上所述,我们看到许多儿童常见的健康问题,从反复过敏到体重管理,再到消化不适,似乎都与肠道这位“看不见的伙伴”——肠道菌群息息相关。生命早期是肠道菌群蓬勃发展并奠定基础的关键时期,它像一片微型森林,受到出生方式、母乳、饮食、环境等多种因素的影响。
案例一:
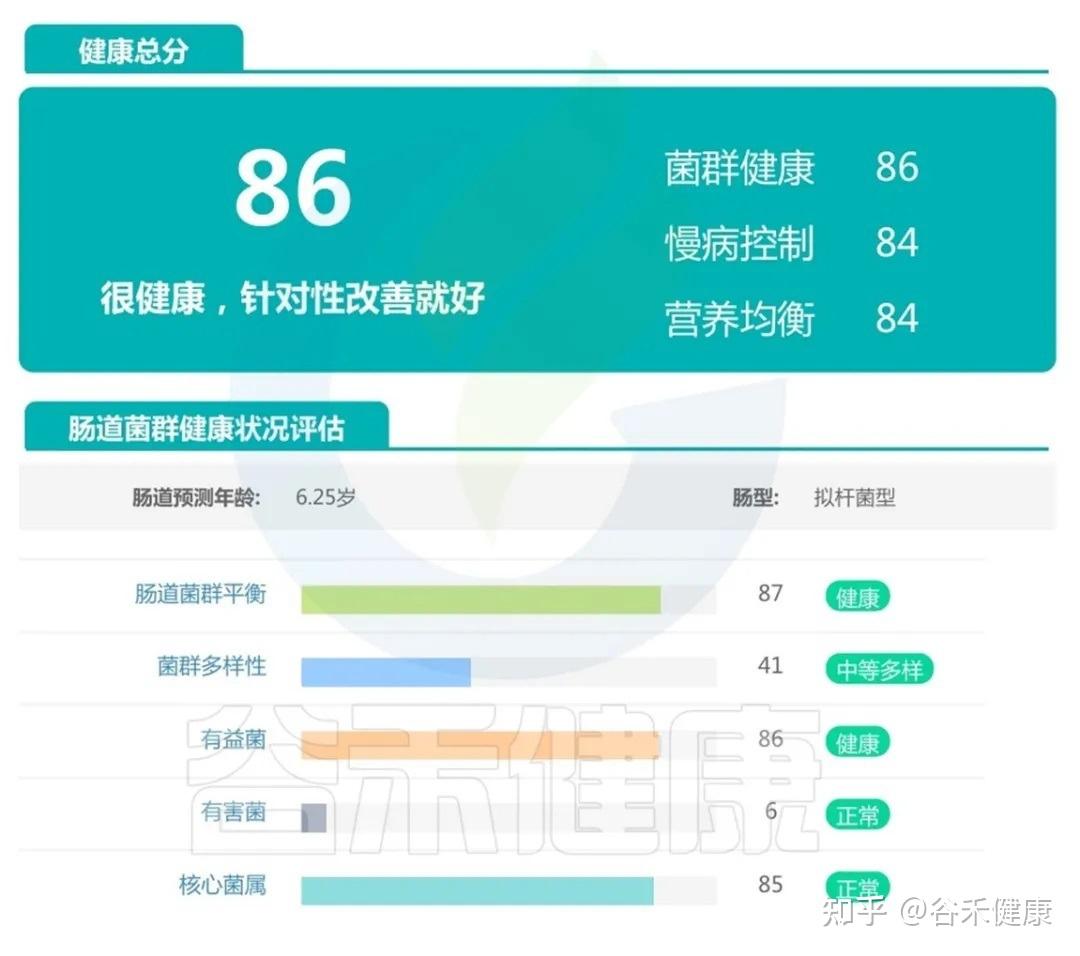
肠道整体健康的宝宝,可以看到他的菌群健康、慢病控制、营养均衡三个维度都处在良好水平,有益菌充足、有害菌处于正常低水平,核心菌属完善。
案例二:
这个宝宝处于中等平衡状态,菌群健康指标较前一位儿童有所减弱,核心菌属开始出现缺乏,提示他可能已经携带了某些代谢问题的风险信号。
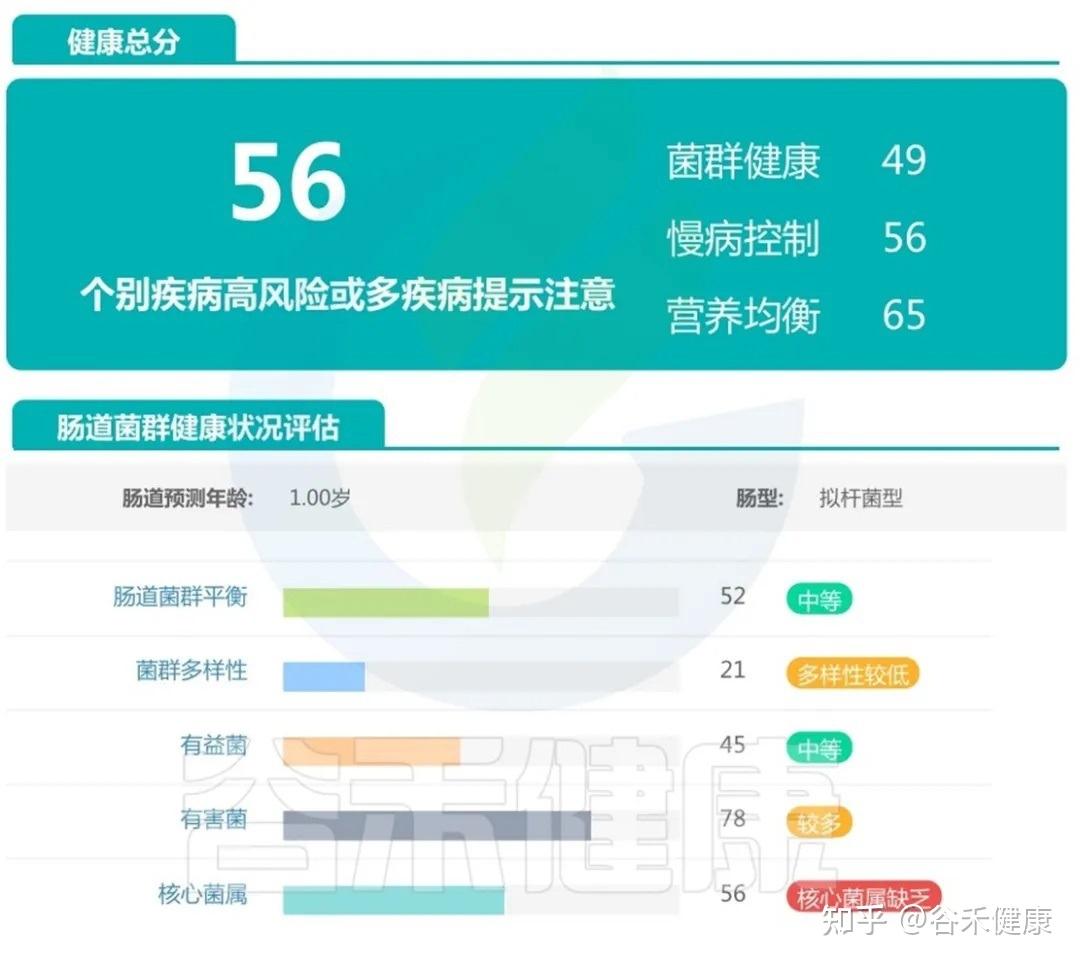
菌群多样性不足,有益菌占比下降,有害菌及产气相关菌群相对偏高。
这种菌群构成,容易让孩子陷入功能性消化不适的恶性循环:肠道动力紊乱、气体产生过多、肠腔内压波动增大,最终就表现为便秘与腹泻交替,夜间睡眠不安等问题。
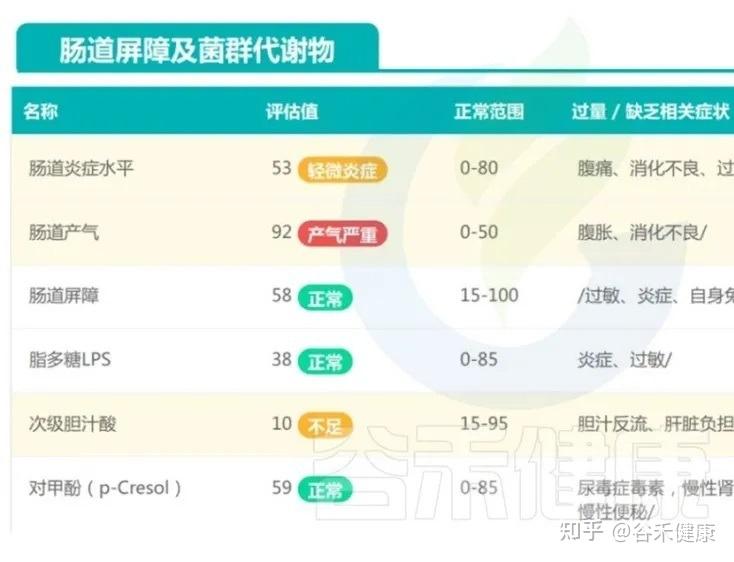
换句话说,这个孩子目前并不是存在明确器质性病变,更符合“肠道微生态已经出现早期失衡、但整体仍具有可逆性”的状态。
在这个阶段,如果能通过规范的饮食结构调整(例如逐步优化配方、增加优质膳食纤维、合理控制脂肪比例)、改善作息和生活方式,适当进行微生态干预(如针对性的益生菌/益生元支持),再配合后续的复查,就有较大机会把他的肠道环境拉回一个更平衡、更稳定的轨道。
案例三:
这个孩子目前看上去发育基本正常,仅社交能力稍不佳,从传统角度看,这样的孩子很容易被归为“现在没什么大问题”。但肠道菌群检测报告给出的信息却更加细腻:
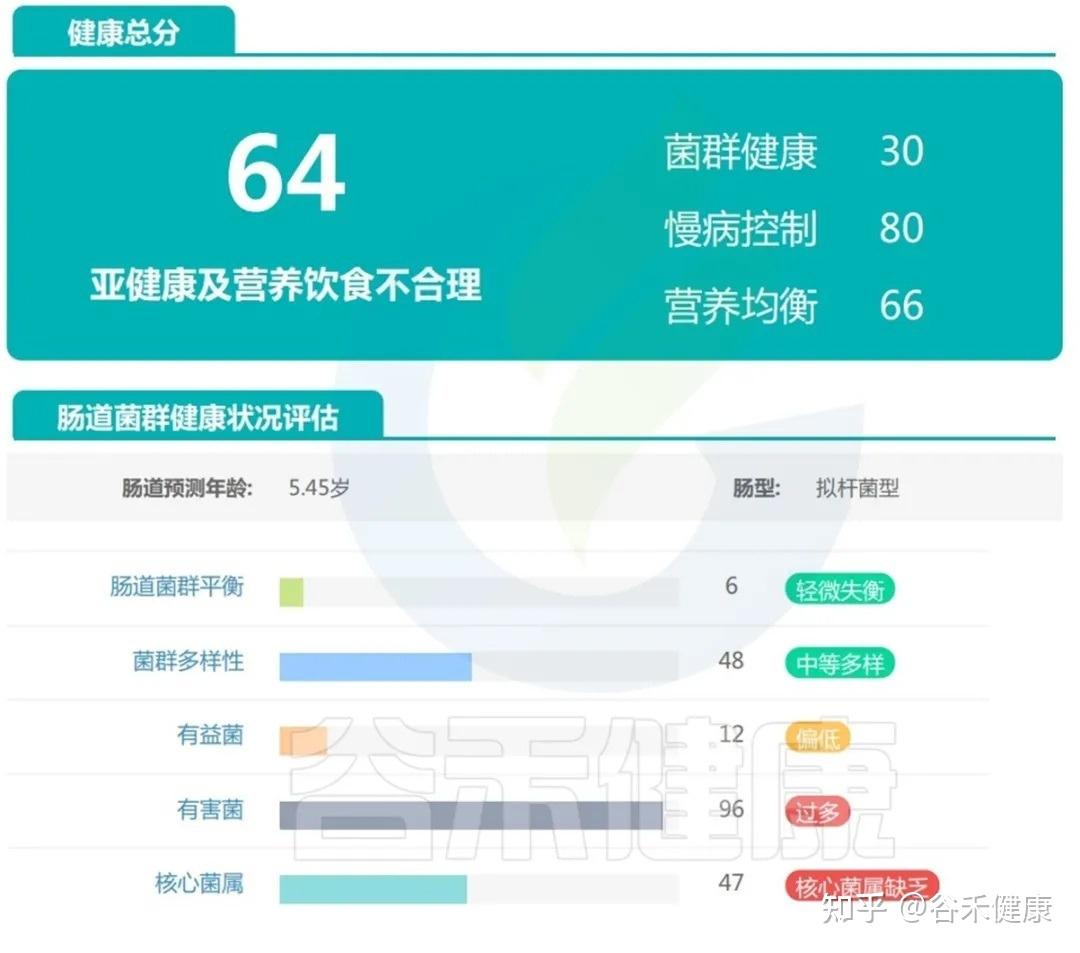
可以看到总体评分落在“轻微失衡”,已偏离理想健康状态。
有益菌丰度不足,有害菌比例偏高,核心菌属缺乏,这意味着肠道微生态的“稳定性”和“恢复力”都打了折扣。
结合该宝宝早期多次抗生素使用,很可能在肠道菌群发育的关键窗口期打断了原本的自然演化轨迹,走向一个“有益菌不足、有害菌偏多”的模式;这样的菌群背景,会让孩子在后续几年中更容易出现:反复上呼吸道感染、皮炎/湿疹、过敏性鼻炎等问题,这也与这与大量关于早期菌群失调和过敏性疾病风险上升的研究结果是吻合的。
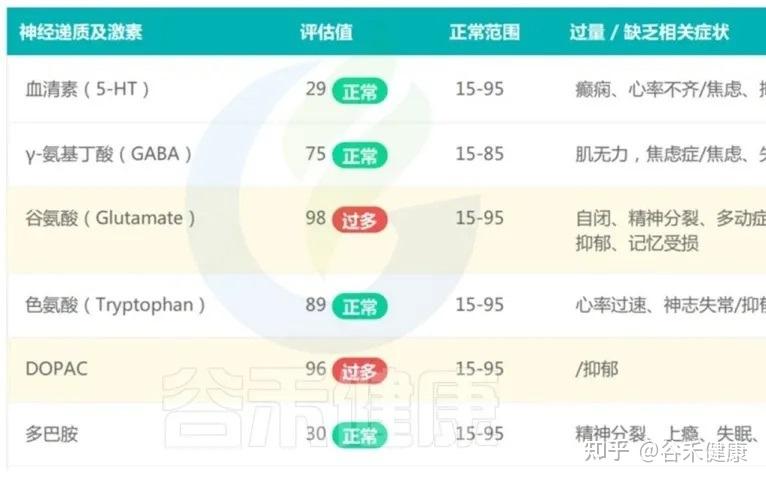
同时,在肠–脑轴的影响下,肠道微生态的轻度失衡,过度增殖有害菌及超标代谢物(如对甲酚、硫化氢)会通过“肠脑轴”影响神经递质稳定性(如DOPAC升高提示多巴胺代谢素乱),影响孩子的情绪调节和社交意愿。
对于这种情况,肠道菌群检测不在于发现一个明确的器质性疾病,而是帮助家长在孩子看起来挺正常的当下,就开始有意识地保护和重建他的肠道微生态——包括减少不必要的抗生素使用、优化饮食结构、增加天然膳食纤维摄入、合理安排户外活动和环境暴露。

通过定期菌群监测,观察肠道菌群、有无新的过敏发作、呼吸道感染频次以及情绪和社交状态的变化,形成一个“早识别—早管理—可追踪”的长期支持路径。
因此,持续关注理解并监测儿童肠道菌群的发育与动态变化,不仅能帮助我们更全面地认识这些健康挑战,还能为未来的干预提供新的思路。通过科学的探索,我们期待能更好地守护儿童肠道微生态的健康成长,为他们一生的健康打下坚实而有力的根基。
主要参考文献
Bankole T, Li Y. The early-life gut microbiome in common pediatric diseases: roles and therapeutic implications. Front Nutr. 2025 May 29;12:1597206.
Shulhai AM, Rotondo R, Petraroli M, Patianna V, Predieri B, Iughetti L, Esposito S, Street ME. The Role of Nutrition on Thyroid Function. Nutrients. 2024 Jul 31;16(15):2496.
Yue M, Zhang L. Exploring the Mechanistic Interplay between Gut Microbiota and Precocious Puberty: A Narrative Review. Microorganisms. 2024 Feb 4;12(2):323.
Stokholm J, Blaser MJ, Thorsen J, Rasmussen MA, Waage J, Vinding RK, Schoos AM, Kunøe A, Fink NR, Chawes BL, Bønnelykke K, Brejnrod AD, Mortensen MS, Al-Soud WA, Sørensen SJ, Bisgaard H. Maturation of the gut microbiome and risk of asthma in childhood. Nat Commun. 2018 Jan 10;9(1):141.
Knezevic J, Starchl C, Tmava Berisha A, Amrein K. Thyroid-Gut-Axis: How Does the Microbiota Influence Thyroid Function? Nutrients. 2020 Jun 12;12(6):1769.
Ma T, Wu Z, Lin J, Shan C, Abasijiang A, Zhao J. Characterization of the oral and gut microbiome in children with obesity aged 3 to 5 years. Front Cell Infect Microbiol. 2023 Mar 29;13:1102650.
Tian X, Liu X, Wang Y, Liu Y, Ma J, Sun H, Li J, Tang X, Guo Z, Sun W, Zhang J, Song W. Urinary Metabolomic Study in a Healthy Children Population and Metabolic Biomarker Discovery of Attention-Deficit/Hyperactivity Disorder (ADHD). Front Psychiatry. 2022 May 20;13:819498.
Agrawal M, Sabino J, Frias-Gomes C, Hillenbrand CM, Soudant C, Axelrad JE, Shah SC, Ribeiro-Mourão F, Lambin T, Peter I, Colombel JF, Narula N, Torres J. Early life exposures and the risk of inflammatory bowel disease: Systematic review and meta-analyses. EClinicalMedicine. 2021 May 15;36:100884.

谷禾健康

菌群.营养.炎症.免疫
营养在整个生命周期中对免疫和炎症以及最终的健康有深远影响。最新研究表明,饮食对肠道微生物组成和代谢产物具有显著影响,从而对宿主免疫和炎症产生重要影响。
研究发现,我们日常饮食中的特定食物成分和代谢产物在感染、慢性炎症和癌症过程中可能表现为促炎或抗炎,这突显了饮食与微生物代谢产物对免炎调节的重要影响。这将对精准营养和治疗干预方法产生重要影响。
小鼠研究表明,饮食-微生物轴对免疫介导性疾病(包括炎症性肠病和过敏)产生影响,同时在感染、疫苗接种和癌症免疫治疗等情况下优化免疫功能。例如,人类中,膳食纤维摄入量增加与黑色素瘤免疫检查点阻断治疗反应改善相关,而长期服用抗生素可能会损害微生物群,从而降低流感疫苗的效果。
这重新激发了科学界和公众的兴趣,健康饮食意味着什么,它到底如何通过微生物群影响健康免疫系统?
本文我们就来了解一下,饮食与微生物相互作用对免疫应答调节的影响,以及对感染、慢性炎症、代谢健康和抗肿瘤免疫背景下微生物代谢产物的机制作用的新见解。
膳食成分既有直接作用,又有依赖于微生物的影响,本文侧重于后者。这也为我们提供了一个“精准营养”的新视角,根据遗传、饮食习惯、社会经济地位、微生物群等多种因素为个体或人群提供营养建议,可作为传染性、炎症性、代谢性疾病和癌症整体治疗方法的一部分。
哺乳动物与驻留在屏障部位(包括肠道)的微生物群共同演化。宿主与微生物之间的相互作用塑造了多种生理过程,包括哺乳动物的免疫应答。屏障组织及其相关微生物群暴露于各种外部因素,包括膳食摄入、药物、感染和环境污染物,统称为“暴露组”。
人类饮食的历史变化
膳食是塑造我们进化、社会和文化的最具影响力的外部因素之一。值得注意的是,在过去一个世纪,人类饮食与历史上逐渐变化的膳食相比发生了急剧而显著的变化。
这些主要变化包括:
1)植物、蔬菜和复杂碳水化合物(包括未加工的全谷物)的减少;
2)精制碳水化合物、植物脂肪、简单糖、盐和加工食品摄入量的增加;
3)广泛使用人工甜味剂、乳化剂、增稠剂、胶凝剂、稳定剂以及色素和防腐剂等化学物质。
这些变化在工业化国家更为明显,并且在与全球化增长相关的较不工业化国家中迅速发展。
饮食与肠道菌群、炎症的关联
一系列比较了世界各地人群的饮食和微生物群的人口研究表明,我们的饮食模式深刻影响肠道微生物群。例如,西方饮食改变了细菌组成并降低了微生物群的多样性或丰富度。相反,微生物群也可以改变饮食对宿主生理的影响。
人类研究表明,膳食纤维干预可以降低血液中炎症标志物;然而,在微生物多样性降低的个体中,它却会增加炎症。值得注意的是,过去100年中,炎症性疾病,包括炎症性肠病、过敏和糖尿病也一直在增加,研究揭示了与饮食和炎症相关的多样免疫调节途径。
动物来源的食物是许多营养素的高效(有时是唯一的)来源,包括铁、钙、锌、牛磺酸、肌酸、肉碱、维生素A、维生素B12、维生素D3和包括 EPA 和 DHA 在内的omega-3 脂肪酸,农业的工业化提高了这些食物的全球可获得性。
不同饮食结构影响肠道微生物组成
然而,基于动物的西方饮食会促进一种与植物为基础的饮食所促进的微生物组成不同的肠道微生物群。在小鼠和人类中,拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)是两大微生物门,往往覆盖总微生物组的90%以上。
传统植物为基础饮食:普雷沃氏菌属主导
西方动物为基础的高脂饮食:拟杆菌属主导
通过饮食干预或由于迁徙至西方风格国家而从植物为基础的饮食转变为动物为基础的饮食,会导致拟杆菌属取代普雷沃氏菌属成为主导。因此,普雷沃氏菌属和拟杆菌属被认为是传统植物为基础饮食高纤维和西方动物为基础饮食高脂肪的生物标志物。高脂肪、高糖饮食及与之相关的肥胖在小鼠和人类中已被证明会降低拟杆菌属的总体相对丰度并增加Bacillota的丰度。
肠道菌群及其代谢产物如何影响宿主免疫反应和生理过程
饮食中的组分可以直接调节小鼠的免疫系统,然而最近的研究表明,饮食引起的微生物群变化也深刻影响宿主的免疫反应。在屏障表面的免疫系统可以检测微生物群及其结构成分,这种直接的相互作用建立了一种免疫反应的耐受状态。
然而,肠道微生物群产生成千上万种代谢产物,这些产物被吸收到我们的体内,并通过血液循环。许多这些代谢产物是由微生物群特异性产生的,而不是宿主产生的。它们属于不同的化学类别,包括短链脂肪酸(SCFAs)、非结合和结合的胆酸、酚类化合物、吲哚、胺类、黄酮类和气态化合物。
迄今为止已经确定的许多代谢产物是通过微生物群对饮食组分的直接转化而生成的,这些微生物群表达了能够消化特定膳食物质的专门酶。例如,短链脂肪酸是由膳食纤维的微生物发酵产生的。因此,微生物群从我们的饮食中提取和产生必需营养素,包括宿主无法产生的维生素。微生物群产生的代谢产物也是通过微生物将宿主代谢产物转化而生成的。
例如,初级结合胆酸被微生物群转化为初级非结合胆酸,进一步转化为次级胆酸或额外的结合胆酸。这些代谢产物可以在宿主的整个身体中循环,作为细胞表面或胞核受体的配体,并调节多种生物过程,包括新陈代谢、认知、组织稳态和免疫反应。
饮食可以迅速改变微生物群的组成
已经证明,饮食变化,例如从植物为基础的饮食转向动物为基础的饮食,可以在暴露于新饮食后的第一天就改变人类微生物群的组成。小鼠研究表明,饮食变化也会影响微生物群的代谢活动,因此可能会改变微生物群产生的代谢产物的浓度。
虽然某些饮食成分,包括特定类型的膳食纤维,可以促进有益菌的扩张,但其他成分可能导致菌群失调,即微生物群组成异常或微生物群产生的代谢产物失调的状态。
对于饮食对一些微生物群依赖的免疫调节效应,微生物群物种、微生物组分和宿主受体尚未完全表征。未来,揭示这些元素对于开发基于饮食和微生物群的精准营养和个性化医学将至关重要。
小鼠研究表明,在稳态条件下,黏膜免疫系统建立了对肠道微生物的耐受状态。参与这种耐受性反应的免疫细胞包括调节性T细胞(Treg细胞)和第3组固有淋巴细胞(ILC3s)等。然而,微生物群失调或异常免疫激活可能会破坏耐受性并引发慢性炎症病症。在这里以炎症性肠病为例来讨论。
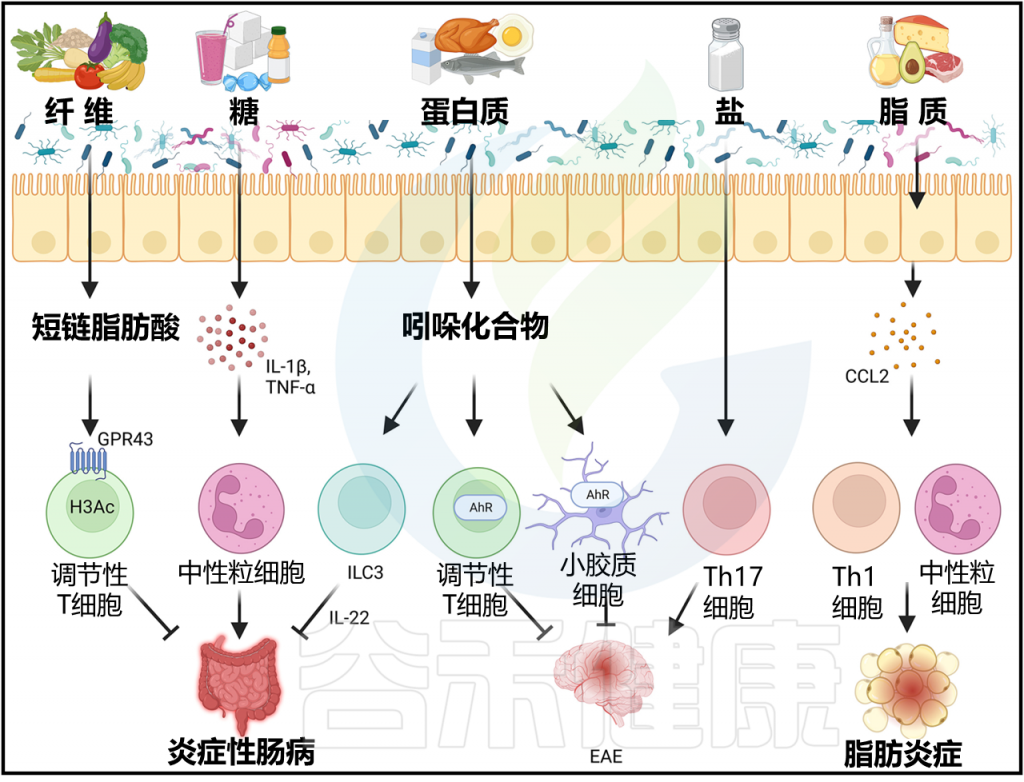
饮食和微生物群在膳食纤维和炎症性疾病的背景下的作用是最受关注的。
膳食纤维是一种复杂的碳水化合物,哺乳动物无法消化,而是被肠道微生物群发酵。微生物群利用膳食纤维作为营养源,并将其转化为包括乙酸、丙酸和丁酸在内的短链脂肪酸(SCFAs)。
短链脂肪酸激活几种G蛋白偶联受体,包括GPR41和GPR43,并抑制组蛋白去乙酰化酶(HDACs)。最近的研究表明,在各种炎症性疾病背景下,这些受体配体相互作用通过不同机制有助于抑制炎症。
短链脂肪酸对免疫细胞的影响
2009年一项开创性研究表明,乙酸能够通过GPR43依赖的方式促进小鼠肠道损伤和炎症模型中炎症的缓解。调节性T细胞在抑制炎症中起着关键作用,并且在维持免疫稳态和自身耐受性方面至关重要。Treg细胞对于控制自身免疫疾病和包括炎症性肠病在内的慢性炎症病症至关重要。
饮食对慢性炎症性疾病的影响
Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
2013年,微生物群研究取得了重要里程碑,发现短链脂肪酸通过激活GPR43和抑制HDACs促进小鼠Treg细胞的分化和扩张。此外,无菌小鼠或饲养低纤维饮食的特定无特定病原体(SPF)小鼠显示短链脂肪酸和结肠Treg细胞减少。
最后,研究表明短链脂肪酸对小鼠T细胞转移结肠炎模型具有保护作用。这些研究是早期揭示微生物代谢产物直接调节免疫细胞的一些报告之一。从那时起,已经证明短链脂肪酸在小鼠各种炎症性疾病模型中具有抗炎作用,包括哮喘、关节炎和实验性自身免疫性脑脊髓炎(EAE)。
值得注意的是,短链脂肪酸介导的抑制HDACs的作用不仅限于促进Treg细胞,因为乙酸和丙酸也可以在适当细胞因子的预处理下促进Th1或Th17细胞的产生。
短链脂肪酸调节肠道微生物群
罗伊氏乳杆菌(Lactobacillus reuteri)是一种与人体共生的细菌物种,在系统性红斑狼疮(SLE)小鼠模型中,可以通过促进外周树突状细胞的聚集和在肠道和脾脏中提高Ⅰ型干扰素基因表达,来加重疾病结果。
通过饮食中的抗性淀粉,可以逆转罗伊氏乳杆菌(Lactobacillus reuteri)加重SLE的效应。从机制上讲,抗性淀粉诱导的短链脂肪酸通过直接抑制罗伊氏乳杆菌的生长来改善疾病。
注:抗性淀粉,一种被认为是膳食纤维的淀粉形式,因为它逃避了消化并被微生物群发酵。
膳食纤维还发挥着独立于短链脂肪酸的重要抗炎作用
膳食纤维可以保护肠壁的粘液层。如果小鼠缺乏膳食纤维,肠道微生物群就会利用宿主上皮细胞分泌的粘液糖蛋白,导致粘液层降解。这种保护性结肠粘液屏障的侵蚀,会导致肠道病原体Citrobacter rodentium(啮齿类柠檬酸杆菌)进入上皮的机会增加,从而促进结肠炎。
总的来说,这些研究突出了膳食纤维和短链脂肪酸通过多样化的免疫调节途径发挥抗炎作用。
值得注意的是,除了膳食纤维外,发酵食品(包括泡菜、酸菜、乳酪、开菲尔等)也改变了肠道微生物组成和代谢产物,这与人体中炎症标志物的降低相关。这些食物可以作为益生菌,通过提供特定的微生物种群(例如乳杆菌属)以及作为益生元,促进其他微生物种群(例如梭菌和拟杆菌属),从而改善微生物多样性。然而,发酵食品和涉及的微生物种群和代谢产物的抗炎作用机制尚未完全理解,需要进一步研究。
膳食蛋白质,特别是富含色氨酸的食物,如鸡肉、牛奶,也可以影响具有抗炎特性的微生物代谢产物。色氨酸是一种必需氨基酸,存在于富含蛋白质的食物中,人体利用它来产生神经递质5-羟色胺,稳定情绪,褪黑素,调节睡眠的激素,以及维生素B3,作为辅酶。
然而,微生物群也将色氨酸代谢为色胺和吲哚衍生物,包括吲哚-3-醛、吲哚乙酸、吲哚-3-丙酸和吲哚磺酸酯。这些代谢产物可以作为芳香烃受体(AhR)的激动剂,AhR是一个转录因子,在许多哺乳动物细胞类型中调节关键基因表达。
微生物来源的色氨酸代谢产物吲哚、吲哚-3-磺酸盐、吲哚-3-丙酸和吲哚-3-醛在小胶质细胞中的AhR信号传导改变了星形胶质细胞的免疫信号,并减轻了实验性自身免疫性脑脊髓炎的疾病严重程度。
值得注意的是,AhR还可以被各种植物来源、外源化合物和内源配体激活。通过芥蓝科蔬菜(例如西兰花和抱子甘蓝的代谢物)产生的一种代谢产物吲哚-3-甲醇(indole-3-carbinol)激活AhR已被证明促进ILC3s的扩增及其产生组织保护性IL-22,有助于增强多种结肠炎实验模型中的组织保护作用。
通过外源配体2,3,7,8-四氯二苯并二恶英(TCDD)激活AhR可以促进T调节细胞的扩增并抑制实验性自身免疫性脑脊髓炎。相反,内源配体6-甲醛吲哚[3,2-b]咔唑(FICZ)抑制T调节细胞的发育并促进T辅助17细胞的分化,导致实验性自身免疫性脑脊髓炎加重。这些研究表明,AhR在免疫细胞中的功能通常是配体特异的。
关于芳香烃受体(AhR)和色氨酸的详细代谢可以关注下谷禾以前发表的文章:
西方饮食逐渐缺乏膳食纤维,脂肪含量增加,添加盐和糖的浓度也增加,包括蔗糖和高果糖玉米糖浆。尽管西方饮食常常与动物脂肪摄入增加有关,但增加的脂肪含量主要来自全球范围内变得更加普遍的植物油和脂肪。
高脂饮食导致微生物群失调与炎症关联
与高脂饮食或肥胖相关的微生物群组成变化已与小鼠和人类的炎症联系在一起论。高脂饮食会导致小鼠和人类肠道微生物群失调,降低微生物多样性或“丰富度”。在小鼠中,这种微生物群失调已与肠道通透性增加相关联。这导致小鼠在四周内出现低级别肠道炎症。这种初始的炎症反应最终发展成涉及脂肪组织和肝脏炎症的全身性炎症状态,导致胰岛素抵抗。
Ccl2介导的炎症反应在代谢紊乱中的作用
肠道中增加上皮趋化因子Ccl2的表达引发了炎症反应,导致结肠粘膜下层的促炎性巨噬细胞的招募。随后CCL2的全身性升高导致促炎性巨噬细胞渗入脂肪组织,随后是其他炎症免疫细胞类型的积累,包括Th1细胞、CD8+T细胞、自然杀伤细胞(NK细胞)和中性粒细胞。
敲除Ccl2或其受体(Ccr2)可以改善脂肪组织炎症、肝脂肪变性和葡萄糖耐量。在人类肥胖的情况下,胰岛素抵抗主要是由肌肉内炎症驱动的,其特征是肌肉和肌周脂肪组织内免疫细胞的大量浸润。在肥胖的人类中,炎症和胰岛素抵抗与微生物群丰富度降低有关。
此外,减重会降低各种炎症标志物的浓度,包括肿瘤坏死因子α(TNF-α)、IL-6和C-反应蛋白。综上所述,这些数据突出了微生物群在促进炎症和相关代谢紊乱方面在高脂饮食和肥胖背景下的影响。
膳食脂肪促进硫还原致病菌增殖,导致慢性肠道炎症
除了微生物群失调和相关的低级别肠道炎症外,已经显示膳食脂肪可以促进特定微生物物种的积累,这些微生物可以直接导致慢性肠道炎症。例如,高脂饮食会促进牛磺胆酸(TCA)的产生,TCA被释放到肠道中溶解脂肪。研究表明,TCA的高浓度增加了肠道中有机硫的可用性,导致硫还原致病菌(Bilophila wadsworthia)的大量增殖,从而促进Il10−/−小鼠的结肠炎。这些研究需要进一步调查,以更好地表征膳食脂肪相关微生物群与炎症性肠病之间的关联。
扩展阅读:
肠道重要菌属——嗜胆菌属 (Bilophila)喜欢脂肪、耐胆汁的促炎菌
除了膳食脂肪外,添加的糖和盐也以微生物群依赖的方式促进肠道和其他器官的炎症。
高浓度简单糖改变肠道菌群,加重炎症
高浓度的简单糖(如葡萄糖、蔗糖和果糖)改变小鼠的微生物群组成,并与粘蛋白降解致病菌的增加、粘液层侵蚀和肠道通透性增加相关。这导致结肠中IL-1β、IL-6和TNF-α的表达增加,中性粒细胞浸润,并在多种实验性结肠炎模型中以微生物群依赖的方式加重疾病严重程度。
高量的食用食盐(氯化钠)也以微生物群依赖的方式加重化学诱导的结肠炎
高量的食用食盐还通过改变微生物群促进致病性Th17细胞的产生,并加重EAE中的炎症和疾病结果。此外,高量的食用食盐会减少人类和小鼠中的几种乳酸菌菌株。值得注意的是,补充乳酸菌菌株可以预防食盐诱导的EAE加重,表明乳酸菌在神经炎症中具有保护作用。
膳食成分对感染免疫力的影响
Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
膳食纤维在结肠炎中的作用存在争议
尽管膳食纤维来源的短链脂肪酸(SCFAs)在多种结肠炎小鼠模型中减少肠道炎症,如前文所述,但使用各种高纤维饮食进行的类似研究报道了矛盾的结果。
例如,基于阿拉伯木聚糖的车前子、基于半乳糖的果胶和瓜尔胶具有抗炎或组织保护作用,而基于果糖的菊粉则加重炎症。已进行了多项临床试验来调节IBD患者的膳食纤维,尽管效果不一。此外,通常建议IBD患者避免富含纤维的饮食,因为膳食纤维可能加重疾病。然而,膳食纤维介导疾病恶化的机制尚不清楚。因此,在IBD背景下膳食纤维的作用仍存在争议。值得注意的是,最近的一项研究发现,低聚果糖,即菊粉纤维的结构单位,可以激活人类巨噬细胞产生与结肠炎相关的促炎细胞因子,包括IL-1β和IL-23。
此外,一项随机对照试验表明,给溃疡性结肠炎(UC)患者服用菊粉会增加结肠中的炎症细胞因子,包括IL-1β、IL-23和IL-5,并导致部分患者症状复发。在小鼠中,基于菊粉的高纤维饮食上调微生物群来源的胆酸代谢产物,促进IL-33的产生。这导致自然淋巴细胞群2(ILC2s)的激活和IL-5的产生,导致结肠中的嗜酸性粒细胞炎症。
菊粉纤维饮食还会触发肺部嗜酸性粒细胞增多,并加重小鼠过敏性气道炎症模型的疾病结果,而果胶纤维具有保护作用。
这些研究强调了假设膳食纤维的作用与SCFAs相同是误导性的。
但是以上数据表明饮食-微生物群轴对免疫细胞稳态和炎症性疾病具有深远影响。
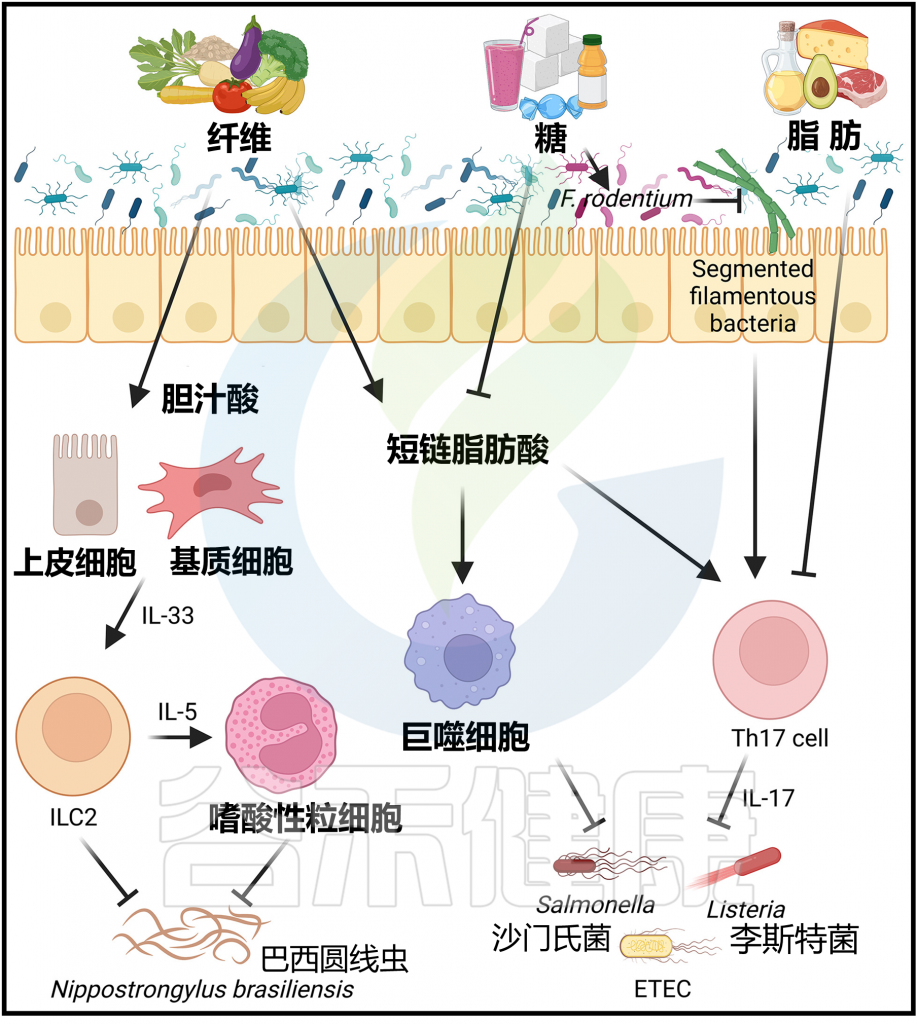
除了影响各种炎症性疾病外,饮食和微生物群也被证明能够塑造对抗各种感染的免疫反应。尽管膳食纤维大多能够保护免受感染,但膳食脂肪和糖分却可能促成病原体发病过程。
正如前面所讨论的,膳食纤维通过维持肠道屏障完整性来保护免受肠道感染的影响,因为膳食纤维不足会促使以粘蛋白为食的微生物群破坏小鼠肠道的保护性黏液层。
丁酸对肠道病原体的多种抗菌机制
来源于纤维的丁酸盐有助于体外维持结肠上皮细胞的紧密连接完整性。丁酸也可以通过HDAC3抑制促进单核细胞向巨噬细胞的分化。因此,丁酸增强了小鼠巨噬细胞对一系列肠道病原体(包括沙门氏菌伤寒沙门氏菌和粘附侵袭性肠毒素产生大肠埃希菌)的抗菌活性,这与增强的抗菌肽产生和吞噬能力有关。丁酸还降低了上皮细胞的氧化程度,从而限制了沙门氏菌的需氧生长。
丙酸,另一种SCFA,可以通过破坏细胞内pH稳态直接抑制伤寒沙门氏菌的生长。最后,对口服感染的小鼠进行丁酸补充可以促进细菌清除,并防止这些病原体的全身传播。
微生物群对抗病毒免疫的重要性
微生物群在天然和适应性抗病毒免疫中也发挥着至关重要的作用。涉及微生物群消耗或改变的小鼠研究表明,微生物群对包括诺如病毒、黄病毒和流感病毒在内的病毒感染的保护性免疫反应至关重要。
已经证明微生物群对于最佳激活不同抗病毒机制是必不可少的,包括干扰素反应、CD4+和CD8+ T细胞反应以及抗体产生。虽然膳食纤维和SCFA通过增强效应细胞CD8+ T细胞功能在抗病毒免疫中发挥着关键作用,但饮食和微生物群来源的代谢产物在许多微生物群调节的抗病毒免疫机制中的作用仍需要进一步研究。
膳食纤维在蠕虫感染免疫中的保护作用
膳食纤维还通过其他代谢产物在小鼠中提供对蠕虫感染的保护性免疫。富含菊粉的高纤维饮食促进了细菌去共轭胆酸,提高了体内各种未共轭胆酸的浓度,包括胆酸。这些微生物群来源的胆酸增加了肺上皮细胞和肠间质基质细胞产生IL-33,导致ILC2s的激活。
当小鼠感染蠕虫寄生虫巴西圆线虫(Nippostrongylus brasiliensis),这种寄生虫会感染肺部,然后迁移到肠道,与对照组饮食喂养的小鼠相比,富含菊粉的饮食会增加肺部的杯状细胞和肠系膜淋巴结中的嗜酸性粒细胞。
这些由菊粉纤维诱导的2型免疫反应导致了肠道中蠕虫的加速排出,表明了膳食纤维在抵御寄生性蠕虫方面的益处。这些研究可能有助于增加全球对食物和补品的了解,特别是在那些细菌性肠道感染和蠕虫感染仍然地方性流行的地区。
肠道微生物群对传染性疾病疫苗效果的调节
肠道微生物群及其相关代谢产物在小鼠对传染性疾病疫苗的有效性中也发挥着重要作用。例如,小鼠巨噬细胞通过检测肠道微生物群菌株产生的鞭毛蛋白,促进巨噬细胞内固有产生浆细胞生长因子,直接促进浆细胞产生抗体。
此外,B淋巴细胞可以利用来源于膳食纤维衍生的SCFA产生的乙酰辅酶A作为细胞代谢的燃料,从而支持抗体的产生。
在人类中,许多研究将微生物群与对各种传染性疾病的疫苗反应联系起来。例如,已经证明抗生素介导的微生物群失调会损害那些预先抗体滴度较低的受试者对季节性流感的抗体反应,并且与抗生素治疗导致次生胆酸系统浓度降低有关。然而,各种饮食在微生物调节疫苗反应中的作用仍未得到充分探讨。
高脂饮食快速影响微生物群组成和免疫反应
正如前面讨论的那样,高脂饮食会增加小鼠肠道微生物群中Bacillota的数量,并以微生物群依赖的方式促进肠道通透性和炎症。尽管高脂饮食诱导的小鼠肥胖需要数月的膳食干预,但微生物群组成的转变和相关的免疫反应变化是迅速的,可以在几天内检测到。相关研究表明,进行为期两周的高脂饮食干预足以加重小鼠对病原细菌感染的情况。例如,口服李斯特菌单胞菌感染的小鼠,高脂饮食组的盲肠、肠系膜淋巴结和脾脏中细菌负荷增加,比饲喂常规饮食组高。
在人类中,饮食引起的微生物群变化也会在饮食发生重大改变后立即开始。一个典型的饮食变化例子是从以植物为基础的饮食转变为以动物为基础的饮食,这在社交活动期间的宴会中经常发生,比如参加宴会。这些宴会饮食通常富含脂肪和糖分,而纤维含量较低。
饮食改变对抗肿瘤免疫和癌症免疫疗法的影响
Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
短期宴会饮食通过影响微生物群和Th17细胞抑制小鼠肠道免疫
一项研究使用了一种高脂肪、富含糖分(双糖和寡糖)、富含胆固醇、低纤维的饮食,因此模拟了“宴会饮食”。
研究发现,短暂接触这种宴会饮食会改变小鼠的微生物群组成,并抑制对细菌感染的黏膜免疫。在小鼠的回肠内容物中观察到了微生物群的快速和可逆性变化,宴会饮食3天后微生物群多样性减少,但在停止宴会饮食3天后迅速恢复到基线组成。
值得注意的是,这种为期3天的宴会饮食足以降低小肠Peyer氏板中Th17细胞的数量,降低回肠中Il17a、Il17f和Il22等3型细胞因 子的表达,这些细胞因子在维持肠道上皮屏障和抵御细菌病原体方面起着关键作用。
因此,这种饮食转变可能导致对沙门氏菌和李斯特菌感染的更高敏感性。与接受常规饮食小鼠回肠内容物的无菌小鼠相比,接受宴会饮食小鼠回肠内容物的无菌小鼠Il17a和Il17f的表达也减少,表明这种饮食介导的免疫抑制依赖于并可通过肠道微生物群传播。
高脂饮食(其中≥90%的热量来自脂肪)也会降低小鼠肠道中的Th17细胞,这与酮体介导的双歧杆菌耗竭有关。
值得注意的是,在不添加任何脂肪的低纤维、高糖饮食中,小鼠Th17细胞和细胞因子的减少情况也相似,这表明免疫表型的变化不取决于膳食脂肪,而是取决于饮食的能量密度和缺乏纤维。
宴会饮食降低SCFA,蔗糖促进Faecalibaculum rodentium 扩增,影响Th17细胞水平
宴会饮食会降低盲肠内容物中的乙酸和丁酸浓度,给予这两种短链脂肪酸(SCFA)的补充可以恢复Th17细胞数量并增强对沙门氏菌的保护。此外,另一项研究表明,向以普通饲料为基础的小鼠提供蔗糖饮水足以减少Th17细胞数量,这意味着小肠Th17细胞的减少也可能是由于高量的膳食糖引起的。
蔗糖会促使Faecalibaculum rodentium(该菌属于芽孢杆菌门下的Erysipelotrichaceae家族)的扩张。Faecalibaculum rodentium的扩增导致分段丝状细菌的替代,而后者已知能诱导和维持Th17细胞。
综合这些数据表明,虽然膳食纤维通过微生物群来源的短链脂肪酸和胆酸代谢产物对抗感染具有益处,但缺乏膳食纤维同时高量的脂肪和糖可能会削弱对各种肠道细菌病原体的肠道免疫力。
过去的十年里,许多临床前和临床研究报告指出,微生物群的组成在免疫系统对肿瘤的控制中起着重要作用,并可以促进对治疗的反应。
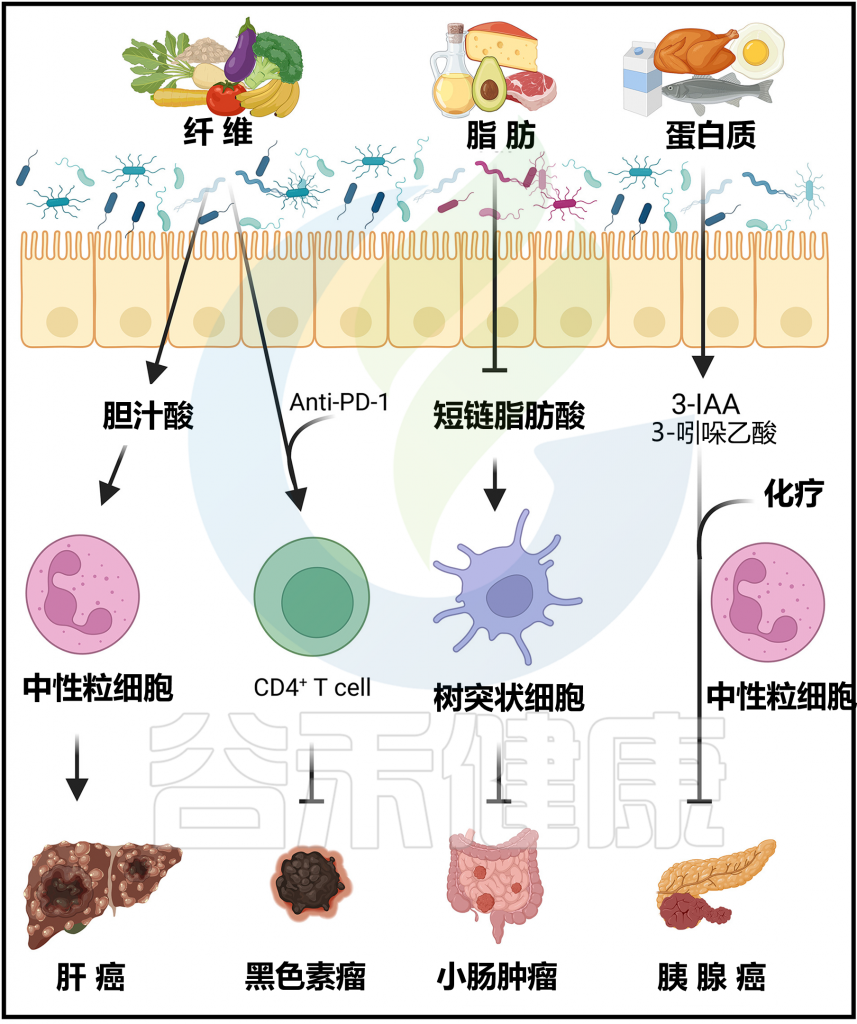
无菌小鼠或接受抗生素治疗的小鼠对化疗和免疫疗法表现出增强的抗药性。相比之下,口服具有益生菌Bacteroides fragilis有助于提高SPF小鼠对黑色素瘤的抗CTLA-4或抗PD-L1反应。
另外,缺乏膳食纤维的小鼠对黑色素瘤的抗PD1免疫检查点疗法没有反应,这与Ruminococcaceae的减少有关。这些小鼠中膳食纤维的抗肿瘤效果与CD4+T细胞增加有关。
在黑色素瘤和上皮癌患者中,对抗PD-1疗法的反应者和非反应者之间微生物组成存在显著差异。治疗反应与肿瘤中CD4+和CD8+T细胞的浸润增加有关,这与肠道微生物多样性高的几种菌,包括Akkermansia muciniphila、粪杆菌属(Faecalibacterium)、毛螺菌科(Lachnospiraceae) 等有关。这些菌谷禾专门科普过,详见:
肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
膳食纤维增强抗肿瘤效果,瘤胃球菌、粪杆菌属等与癌症免疫治疗反应有关
抗生素治疗可能降低上皮癌患者抗PD-1疗法的临床益处。黑色素瘤患者对免疫检查点抑制剂疗法的反应不佳与膳食纤维摄入不足(<20克/天)有关。
与无反应者相比,反应者的微生物群显示出瘤胃球菌科(Ruminococcaceae)和粪杆菌属(Faecalibacterium)的富集。值得注意的是,发挥抗肿瘤作用的有益微生物群是可传播的。
与无反应患者的粪便微生物群移植 (FMT) 相比,来自有反应患者的无菌或抗生素治疗小鼠,对抗 PD-1 和抗 PD-L1 治疗黑色素瘤和肉瘤的反应更好。
此外,来自应答患者的 FMT 可以促进免疫细胞(包括 CD8 + T 细胞)的数量和激活状态,并提高黑色素瘤患者抗 PD-1 治疗的临床获益。
这些发现表明,膳食纤维通过维持微生物群分类群(包括瘤胃球菌科和粪杆菌属)来促进癌症免疫治疗,从而改善治疗结果。然而,需要进一步的研究来确定微生物菌株和相关代谢物在这些疗法的有效性中的具体作用。
吲哚-3-乙酸增强胰腺癌化疗效果
微生物群来源的代谢产物已被证明可以调节多种癌症小鼠模型的临床结果。从膳食色氨酸的微生物代谢中产生的吲哚-3-乙酸可以以中性粒细胞依赖的方式增强小鼠对胰腺癌的化疗效果。从理论上讲,中性粒细胞来源的髓过氧化物酶氧化吲哚-3-乙酸,氧化产物可以阻止癌细胞的增殖。
除了上述关于饮食和微生物群在抗肿瘤疗法中的作用的研究外,还有几项研究强调了饮食和微生物群在肿瘤发生中的作用。
高脂饮食降低短链脂肪酸,促癌
高脂饮食会降低小鼠粪便中的短链脂肪酸浓度,并以微生物群依赖的方式促进易感基因小鼠肠道肿瘤的发展。通过丁酸的给药可以减轻高脂饮食介导的肿瘤进展,丁酸可以促进树突状细胞的招募。
菊粉纤维可能促癌
尽管膳食纤维通常被认为对抗肿瘤疗法有益,但特定类型的纤维可能会以依赖环境的方式发挥促肿瘤作用。例如,菊粉纤维通过改变与升高的胆酸代谢物和肝内中性粒细胞炎症相关的微生物群,促进小鼠肝细胞癌的发展。
综合这些研究表明,通过膳食调节微生物群来源的代谢产物影响肿瘤发生和治疗结果,这可以用于精准营养学以预防和治疗癌症。
肠道微生物群与免疫系统之间的相互作用形成了两者的组成和功能,从而在外周组织中维持稳态平衡。
关键是,饮食可以维持或扰乱这种平衡,导致有益或有害的影响。饮食可以调节微生物组成和菌群失调,取决于微生物群的状态和膳食暴露的类型。
挑战
剖析特定菌株与识别微生物来源代谢产物
虽然膳食纤维的抗炎作用以及膳食糖和脂肪的促炎后果已被充分确立,但我们对其他膳食成分如何影响免疫系统的了解仍然有限。此外,剖析调节这些过程的特定微生物菌株和代谢产物是具有挑战性的。基于代谢组学的最新进展已经允许在各种宿主组织部位检测和定量低丰度代谢产物。
最近可用的公共数据库和生物信息学工具有助于在质谱数据中识别微生物来源的代谢产物。此外,基于CRISPR的细菌遗传学正在使得难以培养或操作的微生物菌株的操纵成为可能。
新兴工具和技术
研究免疫介导性疾病中微生物群和代谢产物
通常,一个蛋白质的合成由一个基因介导,而一种代谢产物的合成涉及多个代谢酶(因此,多个基因),这增加了微生物群介导的宿主代谢产物生产的复杂性。据统计,在非靶向代谢组学分析中,只有不到2%的光谱被注释;即98%的光谱与现有数据库中的化合物不匹配。据推测,这些“暗物质”的相当一部分具有微生物起源。
额外的计算工具,如CSI:FingerID,将有助于通过质谱观察到的这些光谱的注释。
在微生物群的基因操纵中,可以确认微生物菌株及其代谢途径在微生物驱动的表型中的作用。然而,以往,由于许多非模式菌株的遗传可操作性存在限制,这种策略是难以实现的。
基于CRISPR-Cas9的技术的最新发展已经允许针对非模式微生物进行遗传研究。这些遗传工具还可以有助于因果关系或干预研究以及未来基于代谢产物的治疗。外部提供的代谢产物的剂量和数量可能无法准确模拟微生物来源的剂量和数量。因此,一种精确地探究微生物群衍生分子在其产生环境中的方法是通过删除负责基因,从而“切断”各种共生微生物来源的代谢产物的产生。这些额外的遗传和生物信息学工具将有助于推动机制研究,并确定特定微生物菌株和微生物来源的代谢产物在调节各种免疫途径中的不可替代作用。
潜力
微生物群与个性化治疗性饮食
我们目前对营养调节炎症的了解仅限于个别营养素或食物类别。饮食模式和摄食行为也可以影响肠道微生物群和人体健康。我们通过神经元和化学感受味觉受体感知饮食方式,可以影响与饮食相关疾病的病理生理学。
然而,对微生物群在这些过程中的作用的理解仍然不完整。通过个性化治疗性饮食和营养干预的精准营养的当前愿景需要更深入的机制理解饮食-微生物群相互作用和摄食行为,并将其与年龄、性别和疾病相关参数相结合。
对饮食-微生物群-代谢物三者之间关系的更好理解为在三个层面开发有针对性的治疗提供了潜力:
1)益生元,促进特定微生物群的饮食
2)益生菌,特定野生型或基因工程微生物群
3)后生元,特定微生物群衍生代谢产物或具有更好疗效的合成类似物。
结合我们对微生物代谢产物在基因、细胞、分子和化学生物学水平的了解,可以更好地理解它们在调节宿主炎症和免疫中的作用,并通过操纵饮食-微生物群轴促进健康。
主要参考文献:
Arifuzzaman M, Collins N, Guo CJ, Artis D. Nutritional regulation of microbiota-derived metabolites: Implications for immunity and inflammation. Immunity. 2024 Jan 9;57(1):14-27.
Akagbosu B, Tayyebi Z, Shibu G, et al. Novel antigen-presenting cell imparts Treg-dependent tolerance to gut microbiota[J]. Nature, 2022, 610(7933): 752-760.
Montrose D C, Nishiguchi R, Basu S, et al. Dietary fructose alters the composition, localization, and metabolism of gut microbiota in association with worsening colitis[J]. Cellular and molecular gastroenterology and hepatology, 2021, 11(2): 525-550.
Bisanz J E, Upadhyay V, Turnbaugh J A, et al. Meta-analysis reveals reproducible gut microbiome alterations in response to a high-fat diet[J]. Cell host & microbe, 2019, 26(2): 265-272. e4.
Alexander M, Turnbaugh P J. Deconstructing mechanisms of diet-microbiome-immune interactions[J]. Immunity, 2020, 53(2): 264-276.
谷禾健康
组胺是人体内的一种生物胺,最为人们所熟知的作用是作为过敏反应的介质,但也是神经系统、肠道、皮肤和免疫系统中重要的信号分子。
花粉之所以会引起人体过敏反应,并不是因为花粉本身,而是由于花粉颗粒携带了能引起过敏的抗原。接触过敏源后,体内的组织会释放组胺,作为一种神经递质,组胺会使毛细血管和微静脉的管壁通透性增加,导致局部组织水肿,造成皮肤发红、疹块;也会使气管平滑肌收缩,造成呼吸道狭窄,引起气喘、呼吸困难。
组胺主要由肥大细胞和嗜碱性粒细胞等免疫细胞产生和释放。一些细胞如树突状细胞或T细胞可以表达组氨酸脱羧酶,这是一种在刺激后合成组胺的酶。
尽管如此,一些食物中的微生物群和部分人体肠道微生物群也可以分泌组胺。表明组胺在肠道免疫调节中的潜在作用。事实上,最近的一项研究表明,组胺可以通过抑制肠道中白细胞介素18的产生来发挥抗炎作用。
组胺在免疫反应、神经传递和过敏反应中发挥着重要作用。在某些浓度范围内,组胺起着保护作用,对于维持健康状态至关重要。例如组胺可以刺激胃酸分泌,有助于消化;还会影响排便情况;组胺作为重要的神经递质,参与睡眠调节和体温调节。
然而,在较高浓度下,会导致包括组胺中毒和组胺不耐受或扩张血管,影响血压,导致免疫调节紊乱、胃肠道症状和神经系统疾病。组胺中毒是在食用被大量组胺污染的食物后发生的。如果个体由于基因突变而缺乏生物胺降解能力,或者正在服用单胺氧化酶抑制剂等抗抑郁药来减缓胺的降解,他们就会更容易出现组胺不耐受的症状。
组胺在体内与相应受体(H1、H2、H3、H4)结合而介导的各种症状。不同类型的组胺受体与该化合物之间的相互作用可能会引起多种影响,例如H1R主要介导过敏反应,而H2R具有抗炎作用,而H3R主要影响睡眠、认知障碍等精神健康。
肠道内的组胺对许多细胞过程的广泛影响会导致各种胃肠道疾病,包括食物过敏、肠易激综合征、炎症性肠病、结直肠癌等。谷禾将在本文带大家了解组胺在免疫及各种肠道疾病中的保护或致病作用。
组胺(C5H9N3)是一种重要的生物胺类神经递质,于20世纪初首次发现。从那时起,它的功能开始被逐渐发现并得到越来越详细的描述。
组胺存在于多种细胞类型中,是人体的关键信号分子,具有多种功能。例如作为神经递质或免疫反应调节剂。
拓展知识:组胺的发现
1903年,一位叫威廉·邓巴的医生证明了吸入花粉后的过敏反应并不是由花粉本身引起的,而是机体对花粉的反应引起的一种毒素的释放所造成的。
后来,亨利·戴尔于1910年在研究黑麦的毒性时,从麦角菌中提取出一种叫做组织胺的物质。他发现用组胺可以人工诱发荨麻疹。如果将组胺滴入气管,还会诱发哮喘发作。
★ 组胺的重要作用
介导过敏反应
组胺最被人熟知的是在过敏反应中的作用。例如在过敏性鼻炎、荨麻疹和血管神经性水肿等过敏性疾病中发挥重要的病理生理学作用。
当免疫系统对过敏原产生过度反应时,免疫细胞(如肥大细胞和嗜酸性粒细胞)会释放存储在细胞内的组胺。释放的组胺会结合到特定的受体上,引发一系列生理反应,例如瘙痒、肿胀、打喷嚏等。
扩张血管,影响血压
组胺对人心血管系统最突出的作用是扩张小血管。血管扩张使外周阻力降低,血压下降,并伴有潮红、头痛等症状。
组胺还增加毛细血管的通透性,使渗出增加,引起水肿,严重时甚至导致循环血量减少,可能引起休克。组胺对心脏的直接作用包括增强心肌收缩力、加快心率和减慢房室传导。
刺激胃酸分泌
首先,组胺可以刺激胃黏膜细胞中的H2受体,当组胺与H2受体结合时,会激活细胞内的信号转导通路,导致胃壁上的壁细胞释放胃酸。
其次,组胺还可以通过刺激嗜酸性细胞(胃窦细胞)来促进胃酸的分泌。嗜酸性细胞是胃黏膜中的一种细胞类型,它们包含大量的组胺。当胃黏膜受到刺激时,嗜酸性细胞会释放存储的组胺。释放的组胺通过与H2受体结合,刺激壁细胞分泌胃酸。
影响排便
一项研究中,发现细菌产生的组胺与小鼠结肠运动和粪便排出量增加有关,并且组胺受体拮抗剂治疗在很大程度上阻断了细菌组胺对结肠运动的影响。
收缩平滑肌
此外,组胺会诱导平滑肌细胞(包括支气管和肠道)收缩,哮喘患者对组胺比正常人敏感100~1000倍,组胺可引起支气管痉挛导致呼吸困难。组胺收缩胃肠平滑肌和子宫平滑肌还会引起痉挛性腹痛。
重要的神经递质
在中枢神经系统中,组胺作为一种神经递质,参与睡眠调节和体温调节等生理过程。组胺对感觉神经末梢有强烈的刺激作用,尤其对调节痛和痒的神经,该效应由H1受体所调节。
除此之外,有研究发现组胺还会影响伤口愈合、食欲和情绪等方面。
组氨酸是组胺的前体物质
组胺的主要细胞来源是肥大细胞和嗜碱性粒细胞。在细胞的高尔基体中,组胺是通过组氨酸脱羧酶将L-组氨酸氧化脱羧形成的,其辅助因子是吡哆醛(维生素B6)。
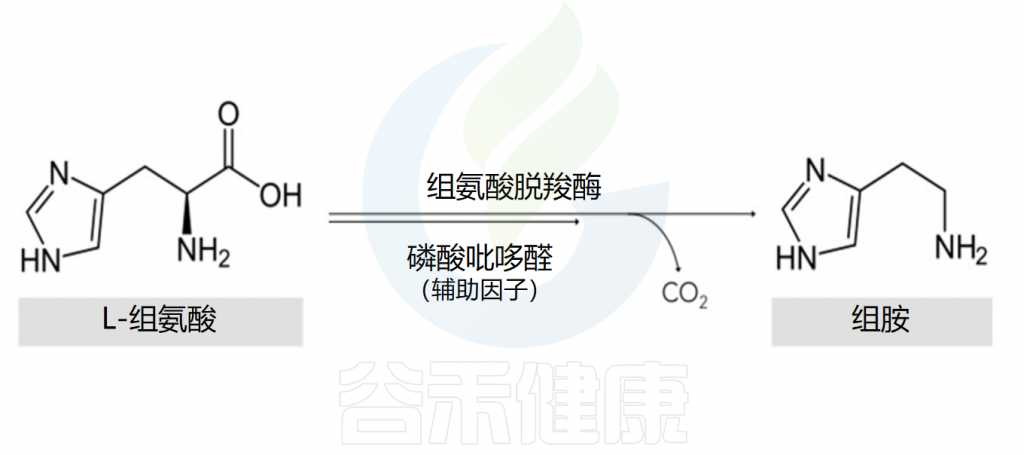
Comas-Basté O,et al.Biomolecules.2020
该反应的结果是组胺的形成,组胺随后与其他胺(如5-羟色胺)、蛋白酶、蛋白聚糖、细胞因子/趋化因子和血管生成因子一起储存在细胞质颗粒中,并在细胞致敏和脱颗粒后释放。
过敏时组胺会大量释放
肥大细胞的脱颗粒和组胺的释放主要是由于特异性抗原与FcRI受体结合以及对非免疫刺激(例如神经肽、补体系统的一部分、细胞因子、血小板活化因子)的反应。
IgE抗体是过敏性疾病期间肥大细胞脱颗粒的介质。IgE与其肥大细胞表面的高亲和力IgE受体的结合称为“致敏”。肥大细胞和嗜碱性粒细胞释放的组胺通过激活四种G蛋白偶联受体,即H1R、H2R、H3R(主要在大脑中表达)和H4R,发挥其生物活性。
细菌感染
某些细菌感染也可以引起组胺的释放。例如,胃幽门螺杆菌感染可以导致胃黏膜炎症,促使组胺释放,进而引发胃酸增多和溃疡等胃部疾病。
药物和化学物质
某些药物和化学物质也可以诱发组胺的释放。例如,非甾体抗炎药(如阿司匹林)和某些麻醉药物以及酒精可以引起组胺的释放,可能导致过敏样反应。
物理刺激
组胺释放也可由多种物理因素引起,如极端温度、创伤、摩擦等。这种情况下的组胺释放通常是局部性的,导致局部组织的充血和炎症反应。
运动和应激
剧烈运动、情绪激动和精神压力等也可以促使组胺的释放。这种情况下,组胺的释放通常是全身性的,可能导致血管扩张、心率增加和其他应激反应。
注:组胺也可以由其他细胞类型(例如胃肠嗜铬样细胞、组胺能神经元、树突状细胞、T淋巴细胞、血小板等)合成和释放。
食物和肠道微生物也是组胺的重要来源
一部分组胺通过食物进入人体或由肠道微生物产生。最受欢迎的富含组胺的食物是鱼和海鲜、发酵食品(如奶酪、葡萄酒、泡菜等)和一些蔬菜(如菠菜、茄子、番茄等)。
组氨酸主要在自溶或细菌过程中产生,因此高浓度的组胺主要存在于微生物发酵产物中。食品中生物胺形成的条件是游离氨基酸的可用性、脱羧酶阳性微生物的存在以及细菌生长和脱羧酶活性的条件。
影响细菌组氨酸脱羧酶活性的因素
细菌分泌脱羧酶受许多因素(例如,发酵碳水化合物、氧气或氯化物浓度的存在)调节。在酸性环境中,氨基酸脱羧酶活性的表达增加。
组氨酸脱羧酶活性较高的细菌种类有:
Morganella morganii,Eschericha coli, Hafnia alvei, Proteus vulgaris, Proteus milabilis, Enterobacter aerogenes, Raoultella planticola, Raoultella ornithinolytica, Citrobacter freundii, Pseudomonas fluorescens, Photobacterium damselae。其中一些细菌具有代谢组胺的能力。
我们将在下面的一个段落中展开讲述肠道中的组胺与微生物群。
在人体内,组胺降解主要有两种途径,涉及二胺氧化酶(DAO)或组胺-N-甲基转移酶(HNMT)。组胺降解酶缺失会导致组胺浓度过高甚至中毒,组胺不耐受患者就是组胺降解酶的酶活性降低或受到抑制,并且不足以灭活食物中的组胺并阻止其进入血液。
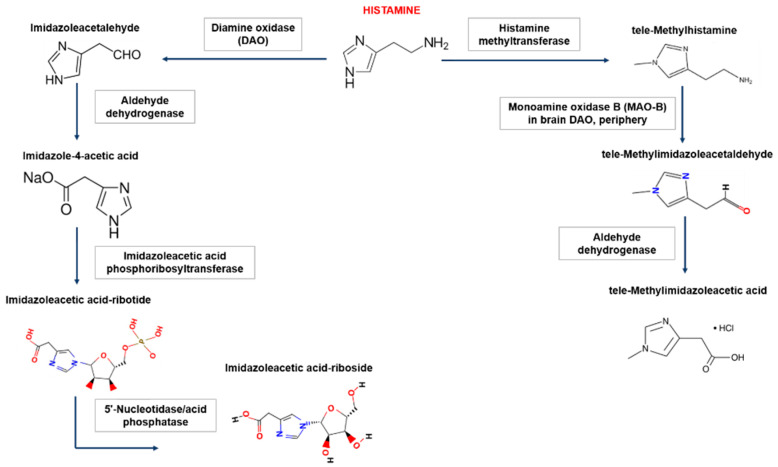
Shulpekova YO,et al.Nutrients.2021
组胺-N-甲基转移酶负责细胞内的组胺降解
组胺-N-甲基转移酶(HNMT)主要负责细胞内组胺的降解。HNMT在肾脏和肝脏以及脾脏、结肠、前列腺、卵巢、脊髓细胞、支气管和气管中的表达最高。一小部分组胺在HNMT的作用下转化为N-甲基组胺。
注:在原始形式中,约2%-3%的组胺被排泄。
二胺氧化酶负责细胞外的组胺降解
二胺氧化酶(DAO)是一种分泌蛋白,负责细胞外组胺的降解。DAO的最大活性记录在小肠、结肠、胎盘和肾脏中。DAO在细胞内囊泡中积累,然后进入细胞外空间,在那里降解组胺。绝大多数组胺通过DAO转化为咪唑乙酸。
保护身体免受组胺过高的侵害
二胺氧化酶执行“屏障功能”,从而限制组胺从肠道进入血液;组胺-N-甲基转移酶通过B族维生素和S-腺苷甲硫氨酸的参与使组胺甲基化,从而调节细胞内的组胺含量。
尽管二胺氧化酶和组胺-N-甲基转移酶这两种酶都存在于肠上皮中,但吸收组胺进入血流的主要障碍是 二胺氧化酶,组胺-N-甲基转移酶在此过程中仅发挥次要作用。在正常情况下,这种酶屏障足以防止组胺被吸收到血流中。
注:二胺氧化酶和组胺-N-甲基转移酶基因的多态性可能是组胺代谢个体差异的基础。在突触中,乙醛脱氢酶在组胺降解中发挥作用。
虽然健康人体内的组胺很快就会被二胺氧化酶降解,但即使在健康人体内,也可能会因摄入组胺含量高的食物(例如鲭鱼)导致血液中组胺浓度升高而出现严重症状——组胺中毒。
• 组胺中毒的症状
组胺中毒症状多种多样,可能包括口腔麻木、头痛、头晕、心悸、低血压、吞咽困难、脉搏微弱、荨麻疹、面部肿胀、潮红、呕吐、恶心和腹泻等。
组胺中毒的症状可能持续数小时或一天,但在极少数情况下,症状可能会持续数天。
• 组胺中毒的主要原因是食用鱼类和海鲜
不仅是鲭鱼,一些非鲭鱼(鲯鳅鱼、蓝鱼、沙丁鱼等)都含有大量组胺,此外发酵产品(奶酪、葡萄酒、罐头食品、腌制蔬菜和一些饮料)中组胺和血清素的含量也较高。
一项针对科学报告的分析显示,在98%的病例中,组胺中毒的原因是食用鱼类和海鲜,其余2%是由于食用奶酪等发酵食品。
鱼组织中的组胺是由多种细菌对游离组氨酸进行转化而产生的,这些细菌包括摩氏摩根菌(Morganellamorganii)、产气肠杆菌 (Enterobacter aerogenes), Raoultella planticola, Raoultella ornithinolytica和Photobacterium damselae。
鱼分解产生的其他物质会增强组胺的毒性并促进吸收
组胺中毒的发病机制不能仅用组胺的作用来解释。与口服等效剂量的纯组胺相比,鲭鱼毒性较高。还提出了其他机制,例如控制组胺的酶的抑制或增强、导致肥大细胞脱颗粒的物质的存在、其他组胺激动剂的存在。
鱼分解过程中产生的其他物质(尸胺和腐胺)会增强组胺的毒性,这些物质还会抑制肠道单胺氧化酶和二胺氧化酶,或从与粘膜粘蛋白的结合中释放组胺,促进其吸收。
组胺中毒后的干预及治疗
在生理值范围内。组胺中毒的病程通常是轻微的、自限性的、持续时间较短且不需要治疗。
对于严重的组胺中毒病例,需要进行治疗干预——支持性容量疗法和氧气疗法,并给予口服抗组胺药和支气管扩张剂。
组胺不耐受是由于组胺摄入量与机体清除能力不相称,导致组胺过度蓄积,并与相应的物质结合而出现症状的病理过程。
与组胺中毒不同,组胺中毒的严重程度与营养物质中组胺的含量成正比,组胺不耐受的发病机制与先天性或后天性缺乏中和组胺的酶有关。在健康患者中,肠上皮细胞具有由二胺氧化酶和组胺-N-甲基转移酶创建的酶屏障。该屏障可防止血液中外源性组胺的过度吸收。如果这些酶被抑制或减少,即使摄入少量的组胺也可能出现组胺不耐受的症状。
• 组胺不耐受的症状
组胺不耐受的神经系统症状包括头痛。除头痛外,其他重要症状包括弥漫性胃痛、绞痛、胀气和腹泻。
组胺不耐受的患者,在摄入组胺或酒精含量高的食物时或摄入后会出现流鼻涕、鼻塞等症状,极端情况下甚至会出现支气管哮喘发作、支气管收缩、咳嗽、喘息并伴有肺功能下降。
组胺不耐受患者还会出现皮肤瘙痒、发红、肿胀甚至荨麻疹。而患有组胺不耐受的女性会出现与月经周期相关的痛经和头痛。
• 影响组胺降解酶活性的因素
在胃肠道疾病(炎症性肠病、寄生虫感染、微生物菌群失调、代谢吸收不良)中,损伤的肠上皮细胞会减少二胺氧化酶的产生,或其他生物胺、酒精或药物也会抑制二胺氧化酶。
二胺氧化酶活性降低可见于慢性肾功能衰竭、病毒性肝炎、晚期肝硬化和慢性荨麻疹(一种典型的组胺相关疾病,对内源性组胺的耐受性降低)的患者。
二胺氧化酶降解能力下降还可能是由于缺乏其辅助因子、维生素B6、维生素C、铜和锌而导致的。
• 肠道微生物会影响组胺不耐受的发生
肠道微生物群也会影响组胺不耐受的发生。最近的研究表明,组胺不耐受可能是由肠道微生物群的改变引起的。肠道中大量的组胺分泌细菌可能会导致组胺不耐受。健康人体内双歧杆菌的数量较多。而在血清二胺氧化酶活性降低的人群中观察到变形菌属数量较多。
组胺不耐受人群存在肠道菌群失调
在组胺不耐受人群中观察到肠道菌群失调,与健康个体相比,与肠道健康相关的普氏菌科(Prevotellaceae)、瘤胃球菌(Ruminococcus)、粪杆菌(Faecalibacterium)和普拉梭菌(Faecablibacterium prausnitzii)的比例明显较低。组胺不耐受人群还具有显著更高丰度的组胺分泌细菌,包括葡萄球菌属和变形杆菌属、属于肠杆菌科的几个未识别属,以及产气荚膜梭菌和粪肠球菌。
需要注意的是,几项研究表明,即使在没有二胺氧化酶缺陷的个体中,大量的组胺产生细菌也会导致肠道内高水平组胺的积累、随后在血浆中的吸收以及不良反应的出现。
低组胺饮食
组胺不耐受疗法的基础是基于低组胺含量食物的消除饮食。一般来说,公认的饮食指南尚未制定;但是,建议避免食用富含组胺的食物如奶酪、油性鱼类和贝类,以及生发酵肉制品、腌菜、发酵豆制品、葡萄酒和啤酒、鸡蛋、巧克力和蘑菇。
避免食用易刺激组胺释放的蔬果
此外,应避免食用会刺激内源性组胺释放的蔬菜和水果(如菠菜、西红柿、柑橘类水果、草莓、茄子、鳄梨、木瓜、香蕉、猕猴桃、菠萝和李子)。


Kovacova-Hanuskova E,et al.Allergol Immunopathol.2015
补充二胺氧化酶
研究还发现补充二胺氧化酶可以改善组胺不耐受患者的生活质量。已开发出基于肠溶猪肾提取物的含二胺氧化酶食品添加剂。豆芽也被用作二胺氧化酶的来源,这种酶的活性是未发芽种子的250倍。
施用抗组胺药物
纠正组胺不耐受的药物方案基于使用组胺受体阻滞剂、肥大细胞膜稳定剂和其他具有抗组胺活性的药物。
在这方面,H1R拮抗剂是最有效的,特别是依巴斯汀。每天服用20毫克该药物,持续12周,46%的患者出现临床缓解。
一些生物活性物质有助于增强组胺降解
维生素C被用作纠正组胺不耐受的佐剂。每日剂量300-500毫克可增强组胺降解并抑制肥大细胞脱颗粒。
天然类黄酮(非瑟酮、山奈酚、槲皮素、芦丁和木犀草素)和活性生物碱小檗碱在体外抑制肥大细胞脱颗粒。这些都有助于减轻组胺不耐受。
虽然组胺含量过低的情况相对较少见,但也可能会对身体产生一些影响,包括:
• 伤口愈合减慢
组胺在人体中起着重要的调节作用,其能够帮助调节纤维细胞生长因子的生成,该成分可以加速局部肉芽的生长,帮助促进伤口的愈合。因此组胺含量较低时,伤口愈合能力也会减弱,速度会随之减慢。
• 消化不良
组胺可以通过刺激胃部,进而起到促进胃酸分泌的效果。若身体中没有组胺,则会导致胃酸减少,无法有效消化分解食物,进而引起消化不良的问题。
• 情绪不良
组胺还可以作为神经递质帮助调节中枢神经系统,而一旦没有组胺,则会影响中枢神经系统稳定性,引起睡眠异常、激素水平紊乱等情况,进而导致情绪不良。
• 血压升高
人体缺少组胺还会导致血压升高。因为组胺可以促进血管扩张,增加血管的通透性,所以具有降低血压的作用。若没有该成分,则血管会由于舒张能力减弱,因此出现血压升高的问题。
• 免疫力下降
组胺对免疫细胞,如吞噬细胞、T细胞、B细胞等,起到增强活性的功效,因此组胺还具有增强免疫功能的作用。若人体缺少该物质,则人体免疫力会下降,无法有效抵抗细菌、真菌等有害物质的侵入。
组胺对人体许多生理功能都可以起到积极作用,但是人体中的组胺也不能过量,否则容易导致过敏反应,出现头晕、皮肤瘙痒、胸闷等不适症状。
此种情况需及时就医,并且在医生的指导下服用抗组胺药物,例如盐酸西替利嗪片、氯雷他定片等药物,进行抗过敏治疗。
★ 组胺的免疫调节因受体的不同而存在区别
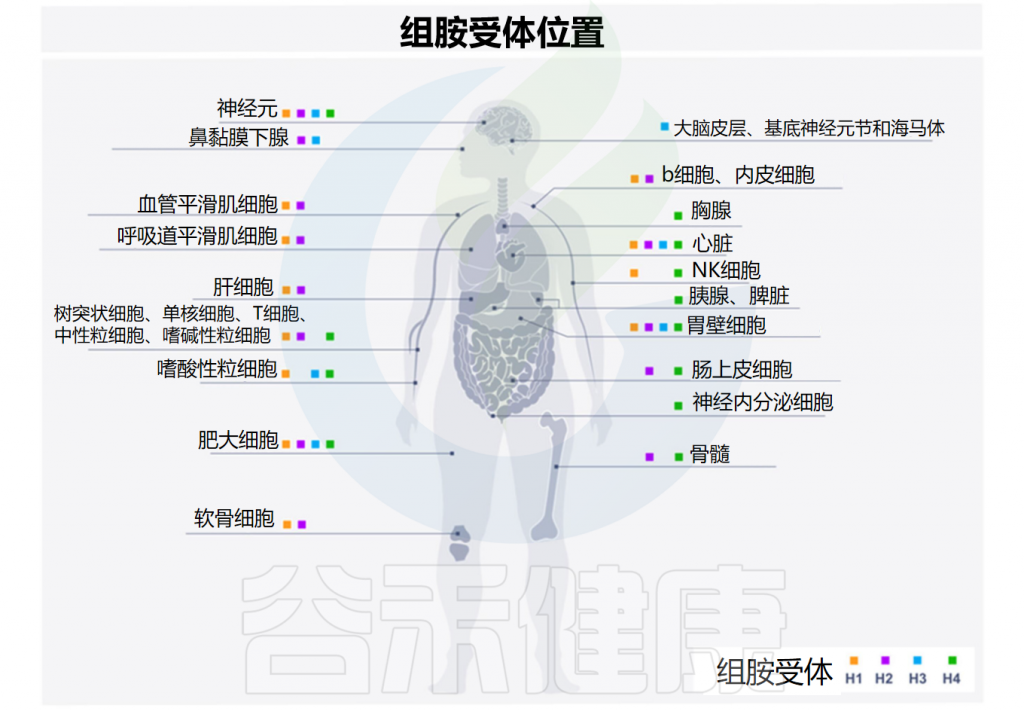
先天性和适应性免疫系统的细胞都可以被组胺调节。组胺的调节取决于它与组胺受体的四种亚型的结合,这些亚型按发现时间顺序命名——H1R-H4R,在多种细胞类型中差异表达,进而产生不同的作用。
Smolinska S,et al.Metabolites.2022
1
H1R
H1R受体存在于几乎所有组织的内皮细胞和血管平滑肌细胞中(它们的密度在胃肠道中特别高),以及下丘脑、肾上腺髓质和免疫活性细胞(单核细胞、中性粒细胞、T细胞和B细胞)中。
• H1R受体介导的主要作用
H1R刺激的主要作用是炎症、全身血管舒张、血管通透性增加、支气管收缩、回肠收缩和昼夜节律周期调节。
外周H1R介导的影响包括鼻漏、支气管收缩、过敏反应、结膜炎和荨麻疹,而中枢相关的H1R影响包括食物和水摄入的调节、抽搐、注意力和睡眠调节。
• H1R是过敏反应的主要受体
IL-3、IL-4和组胺可上调H1R基因表达,而H1R激活导致许多与过敏性即时型超敏反应相关的特征,例如发红、瘙痒和肿胀。
例如小鼠模型中H1R的激活会诱导IFN(干扰素)产生增加,这与1型辅助性T细胞的增殖有关,并诱导促炎作用。
研究表明,瘙痒因子(例如神经生长因子、信号素 3A)的表达受组胺H1R的调节。在小鼠模型和特应性皮炎患者中,使用H1R拮抗剂可降低IL-31(白细胞介素-31)水平,这与瘙痒的发作有关。
2
H2R
与H1R类似,H2R的表达存在于多种组织和细胞中,包括脑、胃壁细胞、平滑肌细胞、T和B细胞、树突状细胞和心脏组织。H2R受体位于突触后,主要通过环腺苷单正膦(cAMP)传递信号并与Gαs偶联。
不同组胺受体下游的信号通路
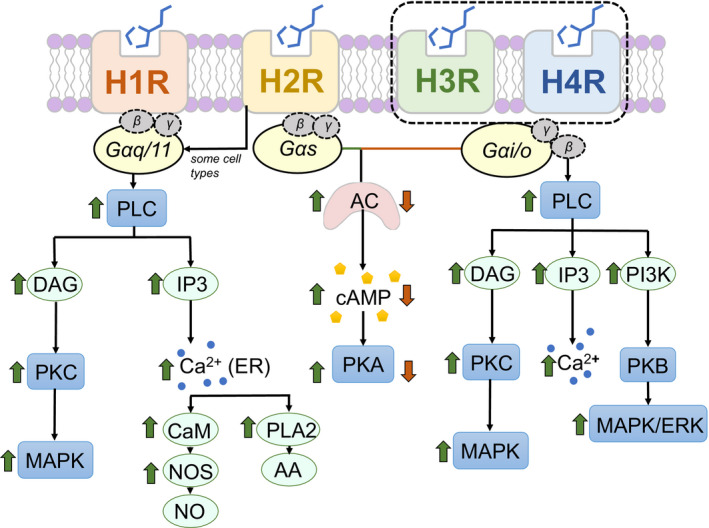
Sudarikova AV,et al.Physiol Rep.2021
H2R刺激的主要作用是外分泌(主要是盐酸)、心动过速、平滑肌细胞松弛、抗炎作用、抗体合成等免疫活动。
• H2R具有抗炎作用
在组胺与H2R结合期间,H2R刺激通过抑制单核细胞或巨噬细胞和肥大细胞产生IL-12、IFN-γ、TNF-α细胞因子,而IL-10分泌增加,从而引起抗炎作用。
• H2R影响对微生物的免疫反应
组胺(内源性和外源性)通过H2R显著改变对微生物的先天免疫反应。特别地,树突状细胞对微生物配体的反应被组胺以H2R依赖的方式显著改变。
H2R敲除的小鼠免疫系统紊乱以及胃缺陷(胃酸分泌减少),此外还观察到认知能力下降和伤害感受异常。
• 注意:不同组胺受体可能具有相反的作用!
H2R以与H1R不同的方式传输信号,H1R和H2R的激活对各种生物过程具有相反的影响。在T细胞介导的免疫反应中,H1R激活促进Th1极化,而H2R激活则抑制Th1极化。
在平滑肌收缩中也观察到H1R和H2R激活的相反作用。H1R和H2R拮抗剂分别抑制和加剧组胺引起的轻度哮喘患者的支气管痉挛。这些数据表明,组胺可能会产生相反的作用,具体取决于被激活的特定组胺受体。
3
H3R
• H3R主要存在于神经系统中
H3R受体在神经系统细胞中表达,特别是在大脑皮层,基底神经节神经元和海马体中。H3R位于含组胺神经元的突触前区域。它们的功能是调节组胺以及其他神经递质(如多巴胺、去甲肾上腺素、γ-氨基丁酸、乙酰胆碱和血清素)的合成和释放。
• H3R受体影响睡眠、认知障碍等精神健康
H3R受体表达和激活的变化在睡眠-觉醒周期障碍、注意力缺陷多动障碍、癫痫和认知障碍以及炎症的发展中发挥重要作用。
H3R缺陷小鼠表现出行为反应和运动的变化,以及伴有肥胖、食欲过盛以及瘦素和胰岛素水平升高的代谢综合征。
• H3R可能会促进炎症反应
H3R刺激可增加促炎活性以及免疫细胞呈递抗原的能力。H3R敲除也可导致神经炎症性疾病的严重程度和T细胞中IFN-诱导蛋白10的表达增加。
因此,组胺H3R拮抗剂的使用有可能用于预防或抑制炎症性疾病(例如呼吸系统疾病)的发展。
4
H4R
H4R受体是最近才发现的,它们的作用尚未完全了解。H4R主要存在于免疫细胞(嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞、自然杀伤细胞、树突状细胞、单核细胞和T细胞)中,也存在于脾脏、胸腺、骨髓、胆管、胰腺、肠上皮细胞和神经内分泌细胞中。
• H4R会增强过敏和炎症反应
与其他类型的组胺受体相比,H4受体在中枢和周围神经系统中表达并不显著。H4R通过与蛋白质Gα/io相互作用介导,参与炎症和超敏反应的发展。
H4R介导的肥大细胞活化,促炎细胞因子和趋化因子IL-6、TNF-α、TGF-β1、RANTES、IL-8、MIP-1α和MCP-1均被表达。研究发现H4R激活显著增强结肠炎、放射性结肠炎、肠道缺血/再灌注损伤和过敏反应的炎症反应。
因此,选择性H4R阻滞剂的开发可能代表了治疗炎症性肠病的一种有前途的方法。
• H4R的激活还会导致瘙痒
H4R的激活已被证明会导致瘙痒。而H1R和H4R拮抗剂的联合治疗可能通过协同抑制瘙痒和皮肤炎症对慢性皮炎产生显著的治疗效果。
此外,H4R通过激活Th2细胞并产生 IL-31,可能引发过敏性皮炎的发生。H4R和H3R的激活增加了乙酰胆碱对肠道蠕动的影响。H4R受体还参与消化性溃疡的形成和癌变。
//小结
如前所述,组胺特异性受体的组织定位、功能和对组胺的亲和力不同。组胺调节广泛的代谢过程,具有促炎和抗炎作用,具体取决于受体亚型和受刺激细胞的类型。
Barcik W,et al.Curr Opin Immunol.2017
组胺对免疫调节的各种作用似乎与其受体及其各自的细胞内信号的差异表达和调节有关。此外,这些受体对组胺的亲和力的差异在组胺和组胺受体药物配体的生物效应中发挥着关键作用。组胺受体在多种病理生理状况中发挥重要作用,是治疗过敏的有效靶点。
组胺因其在速发型超敏反应中的作用而广为人知。在胃肠道内,组胺以相对较高的浓度存在,特别是在炎症过程中。组胺水平的增加改变了宿主与微生物群的免疫相互作用,并导致体内平衡的破坏,导致许多难以应对的肠道疾病的发展。
★ 组胺的水平会影响肠道稳态
肠道中的组胺水平受到宿主过敏和炎症反应的影响,除了宿主微生物群的产生外,还会以某种方式改变降解或合成组胺的酶的活性及其饮食摄入量。
此外,在刺激产生组胺的免疫细胞时,可以增加内源性组胺的水平。所有这些都会影响肠道稳态,导致组胺积累,并影响特定疾病。组胺还可能对肠道寄生虫和细菌感染产生一定影响。
注:除H3R外,所有组胺受体都在人体肠道中表达。从量的角度来看,H4R表达的丰度明显低于H1R和H2R。
粘膜内的组胺
Smolinska S,et al.Allergy.2014
• 食物中的一些菌株会分泌组胺
除哺乳动物细胞外,还发现许多不同的细菌菌株能够在组氨酸通过组氨酸脱羧酶作用后分泌组胺。
最有力的证据就是那些能够在食品中分泌组胺的细菌。它们在奶酪、肉罐头、乳制品以及啤酒和葡萄酒发酵过程中产生组胺。鲭鱼中毒就是在储存或加工过程中处理不当,细菌代谢了鱼类中的组氨酸,导致组胺含量过高。
• 部分肠道微生物也会分泌组胺
迄今为止,对产生组胺细菌的研究主要集中在从食物样品中分离的菌株。肠道微生物群的组胺生成能力直到最近才被研究,数据仍然有限。
2021年发表的一项荟萃分析展示了人类肠道微生物组中具有假定组胺分泌能力的物种 ,其中许多属于广泛报道的组胺产生属,例如摩根菌属(Morganella),乳杆菌(Lactobacillus),葡萄球菌属(Staphylococcus), Photobacterium和巴氏梭菌(Clostridium)。
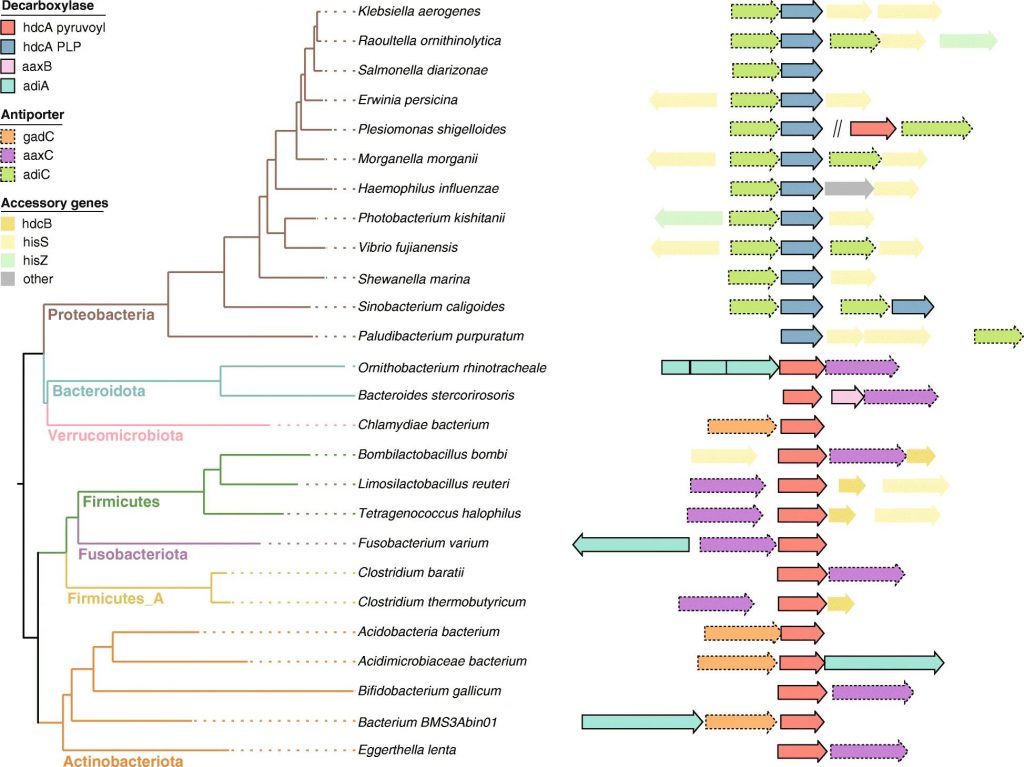
Mou Z,et al.BMC Genomics.2021
• 一些细菌具有组氨酸脱羧酶活性,也可能产生组胺
需要注意的是,一些具有组氨酸脱羧酶活性并与组胺中毒有关的细菌,可能也是潜在的组胺产生细菌。包括:Morganella morganii,
Eschericha coli,
Hafnia alvei,
Proteus vulgaris,
Proteus milabilis,
Enterobacter aerogenes,
Raoultella planticola,
Raoultella ornithinolytica,
Citrobacter freundii,
Pseudomonas fluorescens,
Photobacterium damselae。
证据表明细菌衍生的组胺具有多种影响,例如对宿主健康和食品安全。
• 抑制了促炎细胞因子的分泌
初步体外研究表明,组胺抑制人单核细胞衍生的树突状细胞中趋化因子和促炎细胞因子的分泌。
小鼠研究表明,给予分泌组胺的鼠李糖乳杆菌具有抗炎作用,各种白细胞介素和肿瘤坏死因子α的分泌减少。这种作用在缺乏组胺2受体的动物中消失,表明微生物群衍生的组胺可能具有免疫调节作用。
• 组胺的含量对于免疫效果至关重要
与鼠李糖乳杆菌相比,另一种乳杆菌能够分泌大约100倍多的组胺,服用这种乳杆菌会导致动物体重减轻和健康状况恶化。谷禾认为,微生物分泌的组胺量可能是决定其作用性质的关键。
最近的研究还表明,肠道中细菌释放的组胺不仅会引起宿主免疫系统的局部调节,而且还会在远处的粘膜部位(例如肺部)产生免疫学后果。例如成年哮喘患者肠道中分泌组胺的细菌丰度有所增加。
由于许多食物中含有组胺,一部分肠道微生物群也可以产生组胺,研究发现组胺在肠道疾病中可能发挥多种作用,下面讲述了一些与组胺相关的肠道疾病,组胺在其中发挥着有益或有害的作用。
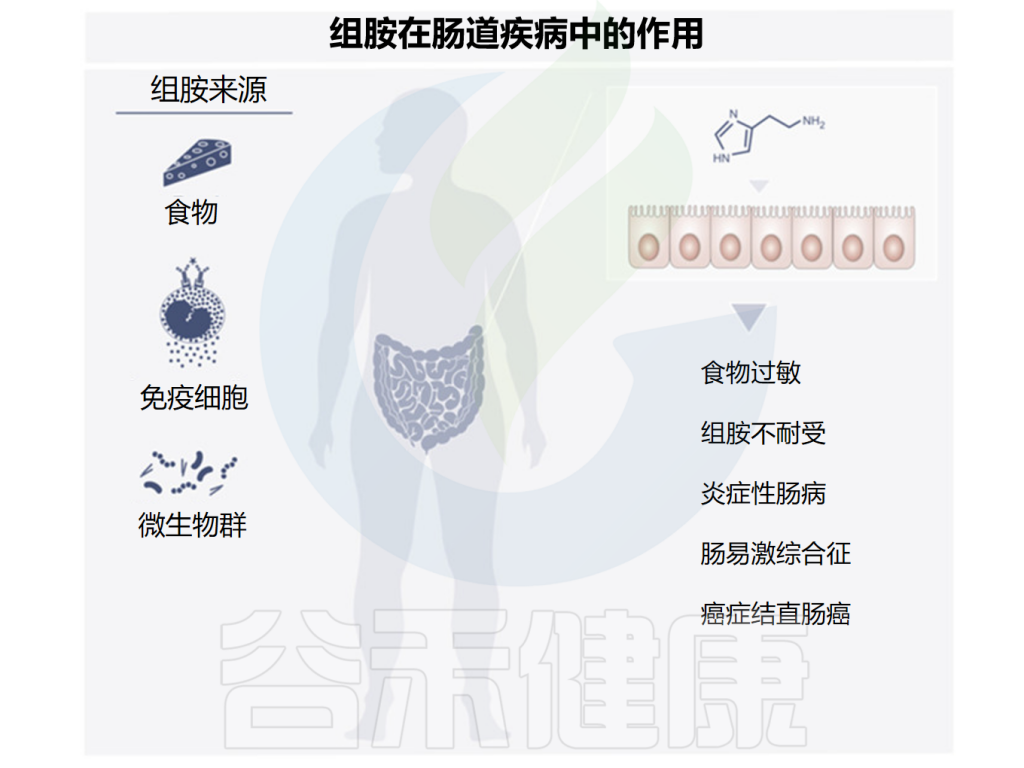
Smolinska S,et al.Metabolites.2022
消化道是接触大量不同分子的地方,这些分子中的一部分是潜在的过敏原,可能从而引起食物过敏。食物过敏可表现为轻度和重度症状,最严重的可能危及生命。
拓展:常见的食物过敏症状
食物过敏的症状表现在呼吸系统、消化系统、心血管系统和皮肤系统等。
皮肤反应:皮肤反应是最常见的食物过敏症状之一。它可以表现为皮疹、荨麻疹、瘙痒、红肿、水肿等。这些反应通常发生在口腔、面部、颈部和四肢等部位。
呼吸道症状:食物过敏还可以引起呼吸道症状,包括鼻塞、流涕、打喷嚏、喉咙痒、咳嗽、喉咙紧闭感和哮喘。严重的过敏反应可能导致呼吸困难和哮喘发作。
消化系统症状:食物过敏可以引起消化系统症状,包括腹痛、腹胀、恶心、呕吐和腹泻。这些症状还可能与肠道炎症反应、肠道收缩有关。
循环系统症状:在严重的食物过敏反应中,可能出现循环系统症状,如低血压、心悸、头晕和昏厥。这些症状是由于过敏反应导致血管扩张和血压下降。
全身症状:某些人可能出现全身性症状,如疲劳、焦虑、情绪波动和体重下降。这些症状可能与食物过敏引起的炎症反应和免疫系统的激活有关。
• 食物过敏时组胺分泌增加
IgE依赖性食物过敏是免疫系统紊乱的结果,使耐受性丧失。这导致将温和的食物抗原识别为病原体。组胺受体参与食物过敏的发展。研究表明,在人类中使用H2R拮抗剂会增加针对食物抗原的IgE的产生。在Th2细胞的刺激下,IgE与效应细胞(肥大细胞和嗜碱性粒细胞)上的Fcε受体结合。由于效应细胞的激活,组胺以及其他介质被释放。
在食物过敏受试者中,组胺分泌增加和肥大细胞数量增加已得到充分证明。嗜碱性粒细胞释放的组胺与皮肤点刺试验和食物激发呈正相关。与非过敏患者相比,食物过敏患者抗IgE介导的肥大细胞组胺释放增加。
此外,将食物过敏患者的活检与抗IgE(人类)抗体或过敏原一起孵育,会导致组胺释放增加9倍。
• 食物过敏的治疗
由于食物过敏的发生率不断增加,已经进行了大量研究以开发新的治疗和预防策略。严格避免食物过敏原是管理IgE介导的食物过敏的长期策略。
关于食物过敏发病机制的各个阶段也有许多研究,例如对Th2通路的影响、阻断IgE、抑制效应细胞和微生物治疗。长期免疫耐受应该是治疗食物过敏最理想的效果。
口服免疫疗法是食物过敏的发展治疗方法之一。它包括以每2-4周增加一次的剂量向患者施用过敏原,直到达到最大维持剂量。这个过程的结果是发展对食物的耐受性。该方法已用于对牛奶、鸡蛋、小麦、花生、坚果和贝类的食物过敏。
目前正在研究表皮和舌下免疫疗法。对牛奶和鸡蛋过敏的表皮免疫疗法也进行了临床试验。
炎症性肠病是特发性、慢性复发性肠道疾病。溃疡性结肠炎和克罗恩病是两种主要临床表现。
在克罗恩病中,炎症出现在弥漫性病变中,这些病变遍布消化道并深入穿透肠壁,可能影响所有层。相反,溃疡性结肠炎的炎性病变从直肠开始,向上但不超过结肠,并在黏膜浅表处保持。克罗恩病导致整个胃肠道的透壁性炎症,但其特征是模式不连续。与炎症为浅表的溃疡性结肠炎相比,溃疡主要局限于结肠粘膜。
• 炎症性肠病患者黏膜组胺水平升高
这两种疾病的发展都是遗传易感患者宿主免疫系统、肠道微生物群和环境因素之间复杂相互作用的结果。
炎症性肠病患者的黏膜组胺水平(而非血浆水平)升高。在患者尿液中发现与疾病活动度相关的N-甲基组胺水平升高。当受到抗原刺激时,源自活动性克罗恩病或溃疡性结肠炎切除结肠的肥大细胞能够释放比正常结肠更多的组胺。
• 炎症性肠病患者的组胺通路被破坏
克罗恩病和溃疡性结肠炎患者的组胺信号通路均被破坏,研究分析显示。炎症性肠病患者的组胺受体表达和功能活性发生改变。
在结肠炎模型中,H2R的阻断导致更严重的炎症性疾病。组胺主要抑制IFN-γ和TNF-α的分泌,这些细胞因子的基因表达与溃疡性结肠炎患者的H4R和H2R表达呈正相关。
发炎黏膜中组胺-N-甲基转移酶(HNMT)表达降低,二氨基氧化酶(DAO)多态性与炎症性肠病风险增加有关。使用H2R拮抗剂会增加克罗恩病患者的风险。
注:在小鼠结肠炎模型中,缺乏H2R或使用非莫替丁(H2R拮抗剂)抑制H2R的T细胞转移可加速体重减轻并增加疾病严重程度。
• 炎症性肠病的治疗
在许多情况下,获得缓解的唯一选择是根治性手术,切除发炎区域。潜在地,使用H1R和H4R拮抗剂同时使用H2R激动剂可能对炎症性肠病患者有益。
炎症性肠病患者还可接受抗炎药、类固醇、抗生素、氨基水杨酸盐治疗,或使用英夫利昔单抗(抗 TNF-α)进行生物疗法。
肠易激综合征是一种与腹部不适或疼痛有关的慢性疾病,其中吃的食物是更严重症状的触发因素。一些证据表明,肠易激综合征中肠道菌群发生了改变,这种改变会破坏黏膜的免疫应答。
• 内源性组胺与肠易激综合征的严重程度相关
研究显示,超过一半的患者因食用释放组胺的食物或富含生物胺的食物而出现胃肠道症状。内源性组胺的水平与肠易激综合征患者症状的严重程度绝对相关。活化的肥大细胞产生更多的组胺,这与肠易激综合征患者的腹痛相关。肠易激综合征患者的黏膜上清液的组胺含量高于健康受试者的上清液。
组胺水平更高,组胺受体表达也更高
肠易激综合征患者中组胺受体H1R和H2R的表达水平上调。我们推测:伴有组胺分泌或含组氨酸脱羧酶细菌的菌群失调可能与肠易激综合征的发生和加重有关。
给予特定微生物具有治疗作用,这也可能是微生物群变化导致疾病的原因。肠易激综合征没有特效治疗方法,减少炎症的药物正在使用中。
结直肠癌是第三常见癌症,也是癌症相关死亡的重要原因。与一般人群相比,炎症性肠病患者发生结直肠癌的终生风险会增加。
• 组胺可能具有潜在的抗肿瘤作用
肠道微生物群在结直肠癌中的作用已在谷禾之前的文章中详细描述过。而特定的肠道微生物代谢物可能与结直肠癌的病因有关。组氨酸脱羧酶缺乏已被证明通过CD11b+Gr-1+未成熟髓系细胞的积累促进炎症相关的结直肠癌,表明组胺具有潜在的抗肿瘤作用。
几种益生菌菌株,包括长双歧杆菌(Bifidobacterium longum)、嗜酸乳杆菌(Lactobacillus acidophilus NCFM)和鼠李糖乳杆菌GG,在结肠癌的小鼠模型中显示出有益作用。这些产生组胺的益生菌减少了结肠肿瘤的数量和大小。
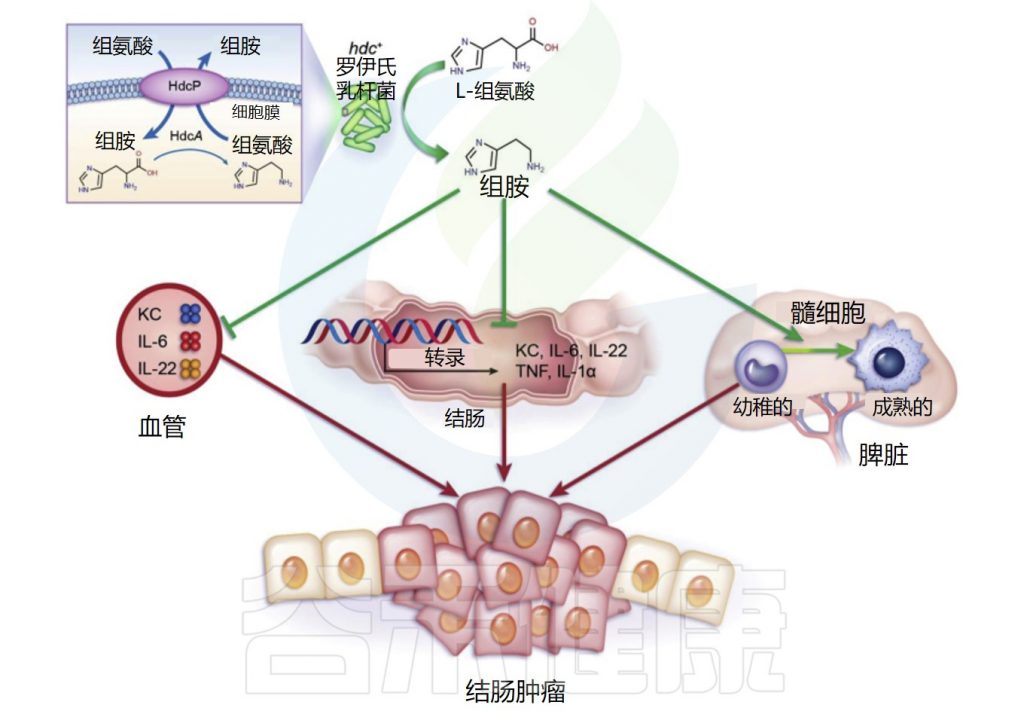
Gao C,et al.Am J Pathol.2017
罗伊氏乳杆菌(L. reuteri)抑制结肠粘膜中IL-22、IL-6、tnf-α和IL-1α 基因的表达,并减少血浆中促炎、癌症相关细胞因子、角质形成细胞趋化剂、IL-22和IL-6的数量。
此外,不能产生组胺的等基因组氨酸脱羧酶(HDC)缺陷罗伊氏乳杆菌突变体不能抑制致癌作用,这表明共代谢物组胺在抑制慢性肠道炎症和结直肠肿瘤发生中具有重要作用。
• 结直肠癌患者组胺含量和活性增加
在结直肠癌患者的结肠黏膜中,组氨酸脱羧酶活性和组胺含量均高于正常样本。在实验诱导的结直肠癌小鼠中,与野生型小鼠相比,组氨酸脱羧酶的缺失导致肿瘤发生增强,这也表明组胺具有抑制结直肠肿瘤发生的作用。
• 注意:过高的组胺含量可能对癌症不利!
需要注意的是,已发现肥大细胞在结肠癌中含量丰富,并促进小鼠化学诱导的结直肠癌的癌变,并且与人类结直肠癌患者的不良预后有关。与组胺通过H4R的促炎作用类似,H4R表达的缺失也导致小鼠化学诱导的致癌作用减少。
组胺作为一种重要信号分子,主要因其在诱导过敏症状中的作用而被识别,但它也参与非过敏性炎症反应。
组胺是肠道稳态的重要调节剂。通过增强分泌和蠕动,组胺促进潜在有毒物质的快速清除。这种生物胺对于肠道细菌的生存也至关重要。与健康个体相比,组胺不耐受患者的肠道菌群失衡或失调。
在某些浓度范围内,组胺起着保护作用,对于维持健康状态至关重要。然而,由于先天性或后天性缺乏组胺降解酶,以及肠道肥大细胞过度增生和过度活跃,使组胺浓度较高,会导致粘膜炎症性疾病,产生腹泻和腹痛。增强H2R表达或其细胞内信号,同时降低H1R和 H4R活性是提高粘膜免疫力的合理方法
组胺不耐受的现代治疗方法包括避免高组胺食物的摄入、影响组胺水平的药物(H1R阻滞剂、肥大细胞膜稳定剂和米氮平)和补充天然成分(维生素C、类黄酮、二氨基氧化酶强化补充剂和益生菌) 。
与此同时,使用具有释放组胺潜力的肠道微生物群提供了一种新的治疗视角。
主要参考文献
Smolinska S, Winiarska E, Globinska A, Jutel M. Histamine: A Mediator of Intestinal Disorders-A Review. Metabolites. 2022 Sep 23;12(10):895.
Sánchez-Pérez S, Comas-Basté O, Duelo A, Veciana-Nogués MT, Berlanga M, Latorre-Moratalla ML, Vidal-Carou MC. Intestinal Dysbiosis in Patients with Histamine Intolerance. Nutrients. 2022 Apr 23;14(9):1774.
Shulpekova YO, Nechaev VM, Popova IR, Deeva TA, Kopylov AT, Malsagova KA, Kaysheva AL, Ivashkin VT. Food Intolerance: The Role of Histamine. Nutrients. 2021 Sep 15;13(9):3207.
Krell T, Gavira JA, Velando F, Fernández M, Roca A, Monteagudo-Cascales E, Matilla MA. Histamine: A Bacterial Signal Molecule. Int J Mol Sci. 2021 Jun 12;22(12):6312.
Mou Z, Yang Y, Hall AB, Jiang X. The taxonomic distribution of histamine-secreting bacteria in the human gut microbiome. BMC Genomics. 2021 Sep 26;22(1):695.
Gao C, Ganesh BP, Shi Z, Shah RR, Fultz R, Major A, Venable S, Lugo M, Hoch K, Chen X, Haag A, Wang TC, Versalovic J. Gut Microbe-Mediated Suppression of Inflammation-Associated Colon Carcinogenesis by Luminal Histamine Production. Am J Pathol. 2017 Oct;187(10):2323-2336.
Kovacova-Hanuskova E, Buday T, Gavliakova S, Plevkova J. Histamine, histamine intoxication and intolerance. Allergol Immunopathol (Madr). 2015 Sep-Oct;43(5):498-506.
Barcik W, Wawrzyniak M, Akdis CA, O’Mahony L. Immune regulation by histamine and histamine-secreting bacteria. Curr Opin Immunol. 2017 Oct;48:108-113.
Smolinska S, Jutel M, Crameri R, O’Mahony L. Histamine and gut mucosal immune regulation. Allergy. 2014 Mar;69(3):273-81.