-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
随着中央国务院关于《健康中国2030指导意见》、《 “十四五”国民健康规划的通知》、《国民营养计划(2017—2030年)》等重要文件的发布,人们对日常膳食营养的关注度和认知也越来越高。自己吃的是否健康?怎么样吃的更健康?已经成为国民关注的重中之重。
在现代社会,随着物质生活的极大改善,传统意义上由饥饿导致的营养不良问题已大幅减少。然而,新的营养挑战正在浮现:即便在食物丰富的情况下,人们仍可能面临营养不良的风险。这种现象的根源在于人们往往忽视了营养均衡的重要性,特别是微量营养素的摄入。
近日,哈佛大学研究团队在世界著名期刊《柳叶刀·全球健康》上发表一项重磅研究成果。
该研究团队分析了185个国家超70亿人的15种微量营养素的摄入量。调查数据得出:
在同一国家和同一年龄人群组中不足量的有:
碘、维生素 B12、铁和硒:女性高于男性
镁、维生素B6、锌、维生素C、维生素A、维生素B1和维生素B3:男性高于女性。
因此,本文基于柳叶刀调查的结果,我们按照微量元素缺乏率由高代顺序,依次与大家介绍这些大人群容易缺乏的微量元素是什么?参与哪些生理生化活动?缺乏或过量对人体有哪些影响?风险因素是什么?有哪些检测方法?如果通过饮食改善或预防缺乏?
最重要的,我们需要清楚地了解自身是否缺乏这些微量营养素,以及缺乏了该如何补充改善,怎样才能更好地吸收利用?希望本文的内容对你们未来的合理膳食和健康有帮助。
碘是世界上最常见的营养素缺乏之一,超过50亿人存在碘缺乏。
碘是正常甲状腺功能的必要矿物质,是甲状腺素(T4)和三碘甲状腺原氨酸(T3)的重要组成部分。这两种激素对肝脏、肾脏、肌肉、大脑和中枢神经系统的功能至关重要。
碘对胎儿和儿童的神经发育、器官功能至关重要,并调节新陈代谢率,对心血管、免疫和生殖健康也有重要作用。
我国目前一般人群整体处于碘营养适宜的状态,但也存在碘缺乏和碘过量的问题。
特定人群如儿童、孕妇等可能存在碘营养缺乏的风险。
我国曾是世界上碘缺乏病流行严重的国家之一,自1995年实施普遍食盐加碘以来,碘缺乏病得到了有效控制,在2015年底实现了94.2%的县消除碘缺乏病的目标。
随着缺乏问题的缓解,碘过量的问题又凸显出来。
有研究指出,中国居民膳食碘摄入量较高的地区在内陆。
在水源性高碘地区,居民可能会受到高碘的危害,如甲状腺肿、亚临床甲状腺功能减退等。
根据《中国居民膳食营养素参考摄入量(2023版)》的建议:
0-0.5岁婴儿的适宜摄入量(AI)约为85微克/天。
0.5-1岁婴儿的AI约为115微克/天。
1-11岁儿童的推荐摄入量(RNI)为90微克/天。
12-14岁的RNI为110微克/天。
15岁(含)以上及成人的RNI为120微克/天。
孕妇的RNI为230微克/天。
乳母的RNI为240微克/天。
① 地理因素
某些地区的土壤和水中天然碘含量低,尤其是远离海洋的内陆地区和高山地区,这些地方的食物中碘含量普遍较低。
② 饮食因素
不食用或少食用富含碘的食物,如海产品(海鱼、海藻)和加碘盐。
素食者如果不注意摄入富含碘的植物性食物,可能会导致碘摄入不足。
③ 怀孕和哺乳期碘需求量增加
孕妇和哺乳期妇女对碘的需求增加,如果饮食中碘摄入不足,容易导致缺乏。
④ 环境污染
工业化进程中,大量的汞、氯和硫等元素的排放和使用,会干扰体内碘的吸收与代谢,使碘在体内的利用率降低。
⑤ 自身健康状况
某些健康状况或疾病(如甲状腺疾病)可能影响碘的吸收和代谢。
⑥ 药物因素
硫脲类抗甲状腺药物、四环素、磺胺类、咪唑类等药物会干扰碘的吸收和利用
碘缺乏症是最常见的营养素缺乏症之一,影响到世界上近三分之一的人口,而下列这些人群缺碘的风险更高。
高危人群:孕妇、胎儿、新生儿最容易出现碘缺乏症,因为碘在怀孕和生命早期的大脑发育和甲状腺功能中起着关键作用。
儿童也面临很高的风险,碘缺乏会损害生长、认知和运动功能。
生活在缺碘山区的人:一些内陆地区或高山地区的土壤和水中碘含量较低,导致当地居民容易缺碘。
素食者:如果饮食中缺乏富含碘的食物(如海产品),素食者可能面临缺碘的风险。
不使用碘盐的人群:如果饮食中不使用碘盐,可能会增加缺碘的风险。
有甲状腺疾病的人:某些甲状腺疾病可能影响碘的吸收和利用。
碘缺乏会出现下面的一些症状,快来自查一下你是否存在碘缺乏。
碘缺乏的最常见症状是甲状腺肿大,也称为甲状腺肿。它还可能导致心率加快、呼吸短促和体重增加。
生长和神经发育受损
严重的碘缺乏可能导致智力迟钝和发育异常。怀孕期间和婴儿期缺碘可能会损害生长和神经发育,导致儿童认知和运动功能障碍。
妊娠期间严重缺碘可导致呆小症,这是一种以严重智力和身体发育迟缓为特征的疾病。
甲状腺功能障碍
碘缺乏可导致甲状腺功能障碍,包括甲状腺肿大和甲状腺功能减退(甲状腺功能低下)。
慢性碘缺乏可导致毒性结节性甲状腺肿和甲状腺功能亢进,因为甲状腺受到长期刺激。
围产期和婴儿死亡率增加
怀孕期间碘缺乏可能导致流产、早产、死产和先天性畸形。并且可能生下甲状腺功能减退的新生儿,影响婴儿的生长和神经系统发育。
免疫功能下降
碘缺乏可能削弱免疫系统,使机体更易感染疾病。
心血管问题
长期碘缺乏可能影响心血管健康,导致心率减慢和血压异常。
◮ 大部分碘会进入甲状腺
膳食中的碘在小肠中被吸收,以碘化物(I−)的形式进入血液循环,然后通过Na+/I−同向转运体(NIS)清除,进入甲状腺,在甲状腺中,碘在滤泡细胞中浓缩为I2,用于甲状腺激素的生物合成。
它还被转运到乳腺等其他组织,为新生儿提供I−或由肾脏清除。在甲状腺功能正常的成年人中,甲状腺含有约70%–80%的身体I2 ,而I2的吸收量因营养状况的不同而有很大差异。
注:除了钠/碘同向转运体(NIS)之外,在肠道中,碘还可以通过钠多维生素转运体(SMVT)和囊性纤维化转运体(CFTR)吸收,不过,吸收程度很小。
◮ 垂体促甲状腺激素刺激碘代谢
垂体促甲状腺激素(促甲状腺激素(TSH))刺激甲状腺碘代谢的各个阶段,包括NIS介导的碘转运到甲状腺,以及甲状腺素(T4)和三碘甲状腺原氨酸(T3)的合成和分泌。大约90%的不必要的I−通过尿液排出,其余10%通过粪便和汗液排出。
◮ 影响碘吸收的因素
其他微量元素:日粮中的钙会妨碍碘的吸收,抑制甲状腺素的合成,加速碘的排出;磷与碘具有协同作用,但钙和镁会阻碍碘的吸收,当饮食中钙、氟、镁离子较多时,会妨碍碘的吸收。
硫氰酸盐:食物中的硫氰酸盐(如木薯、玉米等)在胃肠道逆转化为硫氰酸根,竞争性地抑制碘离子向甲状腺输送,使碘排出增多。
低蛋白、低能量:低蛋白、低能量可使血清中T3、T4、血浆蛋白结合碘(PBI)降低,血清促甲状腺素(TSH)升高,促使酷氨酸分泌减少,降低碘的有机化。
◮ 健康的肠道菌群支持正常的甲状腺功能
健康的肠道菌群可支持免疫系统并确保碘等必需微量营养素的供应,从而对甲状腺功能产生积极影响。
◮ 菌群失调会导致碘代谢异常
肠道菌群失调或不平衡常见于桥本甲状腺炎和格雷夫斯病等自身免疫性甲状腺疾病(AITD),并且可以通过改变营养吸收来影响碘代谢。
在炎症性肠病(IBD)中,已经观察到肠道菌群多样性降低,厚壁菌门和拟杆菌门丰度降低。碘吸收不良是IBD的常见后果,反之亦然,表明二者之间存在相互关系。
一篇论文展示了肠道菌群在调节大鼠碘吸收中的作用:与传统饲养的大鼠相比,用卡那霉素(一种可降低大鼠体内细菌总数的抗生素)治疗的动物在治疗3小时以及治疗42和72天后碘吸收量降低。
谷禾健康经过多年检测实践和与临床的合作,已经积累了超过2000例的甲状腺患者肠道菌群样本,从初步的研究结果看,甲状腺功能减退症和碘吸收异常患者有明显的肠道菌群特征。
碘缺乏症的全球性要求维持和加强碘营养监测计划。那么目前有哪些方法可以评估人体的碘含量呢?
① 测定尿液中的碘水平
世界卫生组织将碘缺乏症的指标从甲状腺肿患病率改为尿液中位碘排泄水平,即近期碘摄入量的主要指标,这一关键决定大大提高了患病率数据的准确性。然而,由于个人每天的碘摄入量都不同,对尿液碘值的解释需要谨慎。
② 尿碘/肌酐比
另一种方法是根据年龄和性别调整碘/肌酐比,这比基于每升浓度的随意报告更为准确,但可能导致在蛋白质摄入量低(尿肌酐低)的情况下估计过高,在肌酐排泄量高的情况下估计过低。
③ 血清TSH和血清甲状腺球蛋白
血清促甲状腺激素(TSH)和血清甲状腺球蛋白(Tg) 是碘状态的互补“功能性”生化指标,反映了对营养状态的中期反应。
然而,虽然TSH是新生儿碘状态的敏感指标,但它对年龄较大的儿童和成人相对不敏感,特别是在存在边缘碘缺乏的情况下。
•海产品,包括海带、海藻、深海鱼类(如三文鱼、金枪鱼、鳕鱼)、海虾、海蟹、蛤干、干贝、海参等,这些食物不仅含碘量高,而且易于吸收,是补充碘的良好选择。
•肉类:牛肉、猪肉、鸡肉等肉类食物,通常也含有一定的碘元素,适量食用可为身体补充一定的碘。
•乳制品和蛋类,牛奶、奶酪和酸奶等乳制品通常含有一定量的碘。鸡蛋,尤其是蛋黄,含有碘。
•碘盐,使用碘化食盐是许多国家预防碘缺乏的有效措施。
•水果和蔬菜,如柑橘类水果(橙子、柠檬)、葡萄、草莓、苹果、梨、香蕉以及菠菜、花椰菜、胡萝卜、芹菜、茄子、土豆、洋葱等,虽然碘含量相对较低,但适量食用仍能为身体补充一定的碘元素。
缺铁也是世界上常见的微量营养素缺乏症,超过40亿人的铁摄入不足,尤其是在婴儿、儿童、青少年和妇女中。
全球缺铁情况估计值
.png)
doi.org/10.1016/B978-0-12-802861-2.00002-X
(A)15-49岁孕妇;(B)6-59个月婴儿和儿童
铁是一种人体必需的矿物质。它是红细胞的一个重要组成部分,它与血红蛋白结合,将氧气输送到你的细胞。铁在新陈代谢和免疫防御中都起着重要作用。
缺铁会导致贫血、疲劳、免疫系统减弱和大脑功能受损、宿主发育迟缓等。
一般我们常见的缺铁,主要是以下几个原因:
① 铁摄入不足
这很好理解。我们的身体不能制造铁,需要从食物中获取。如果你每天摄入的铁量没有达到身体需要的量,就会出现缺铁。
② 铁需求增加
快速生长会增加铁需求,因此儿童、孕妇和哺乳期女性更可能缺铁。此外,进行耐力锻炼的人更容易患低铁症。
③ 铁流失过多
出血和失血会增加铁的流失,包括:月经出血、分娩、溃疡、痔疮、因受伤或手术而出血、献血等。长期使用消炎药(布洛芬、萘普生、双氯芬酸)会增加肠道出血的可能性。
需要注意的是,缺铁性贫血的一个常见且常被忽视的原因是月经过多。随着时间的推移,这种缓慢的血液流失通常会导致铁流失过多。
④ 铁隔离
在慢性炎症性疾病中也会出现缺铁,例如自身免疫性疾病、慢性感染、慢性肾病或癌症。因为铁对病原体和癌细胞的生长很重要,所以当发生感染或炎症时,身体会试图通过锁定铁来抑制病原体或恶性细胞的生长。
受感染或炎症影响的组织会释放降低铁血水平的细胞因子,从而导致贫血的发展。
⑤ 铁吸收不足
消化系统的疾病会降低铁的吸收,包括:乳糜泻、炎症性肠病、胃炎、幽门螺杆菌感染、小肠细菌生长过度等,此外,减肥手术也会减少营养吸收,包括铁。
铁吸收不足的其他原因包括大量摄入抑制铁吸收的食物或药物,包括:植酸盐(全谷物、豆类)、多酚(茶、咖啡、葡萄酒)、抗酸药、H2受体阻滞剂、四环素或消胆胺等药物等。
⑥ 肠道菌群紊乱,病原菌定植
还有一个很重要的我们可能会忽略的因素,就是菌群。大肠杆菌、铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌和结核分枝杆菌。这些病原菌的定植会与宿主进行铁的竞争吸收,同时诱发肠道炎症,改变肠腔环境,影响菌群构成,进一步导致缺铁加剧。
学龄前儿童:这个数字在学龄前儿童中上升到47%。除非给他们提供富含铁或强化铁的食物,否则他们非常可能缺乏铁。
月经期妇女:大约30%的月经期妇女由于每月失血过多也可能缺乏,高达42%的年轻孕妇也可能缺乏。
素食主义者:此外,素食者铁缺乏的风险增加,因为他们只摄入非血红素铁,而非血红素铁的吸收率不高。
贫血是缺铁最常见的危害
缺铁最常见的后果是贫血,据估计,女性贫血平均有50%是由于缺铁引起的,孕妇这一比例上升至60%,儿童约为42%。
由于贫血氧气输送能力下降,会出现呼吸困难(气短)和静息时心输出量增加、心血管压力增大等症状。
疲劳和身体虚弱
缺铁通常与疲劳、身体耐力下降和嗜睡有关,即使没有贫血。
认知和心理影响
注意力、专注力和记忆力下降等认知障碍与缺铁有关。此外,情绪低落、焦虑和烦躁等症状也很普遍。
异食癖
缺铁会导致异食癖,尤其是食冰癖(渴望和咀嚼冰块或其他冰冻食物),这与铁含量低密切相关。
不安腿综合症(RLS)
研究发现缺铁与不安腿综合征之间存在密切联系,补铁可改善症状。
免疫功能和感染风险
缺铁会损害免疫功能,特别是T细胞免疫,使人更容易受到感染。
头发和指甲的变化
缺铁患者还报告了脱发和指甲纹理变化等身体症状。
◮ 血红素铁吸收率更高
•血红素铁:这种铁的吸收率非常高。它只存在于动物性食物中,在红肉中含量特别高。
•非血红素铁:这种类型的铁在动物和植物食物中都有,比较常见。它不像血红素铁那样容易被吸收。
血红素铁和非血红素铁通过两种不同的途径吸收,血红素铁被十二指肠刷膜边缘的血红素载体蛋白1(HCP1) 吸收。
非血红素铁通常呈三价铁形式,不具有生物利用度,必须通过十二指肠细胞色素b(DCYTB)将其还原为二价铁形式,然后再由二价金属转运蛋白(DMT1)转运到十二指肠刷膜上。
肠上皮细胞对非血红素铁的吸收
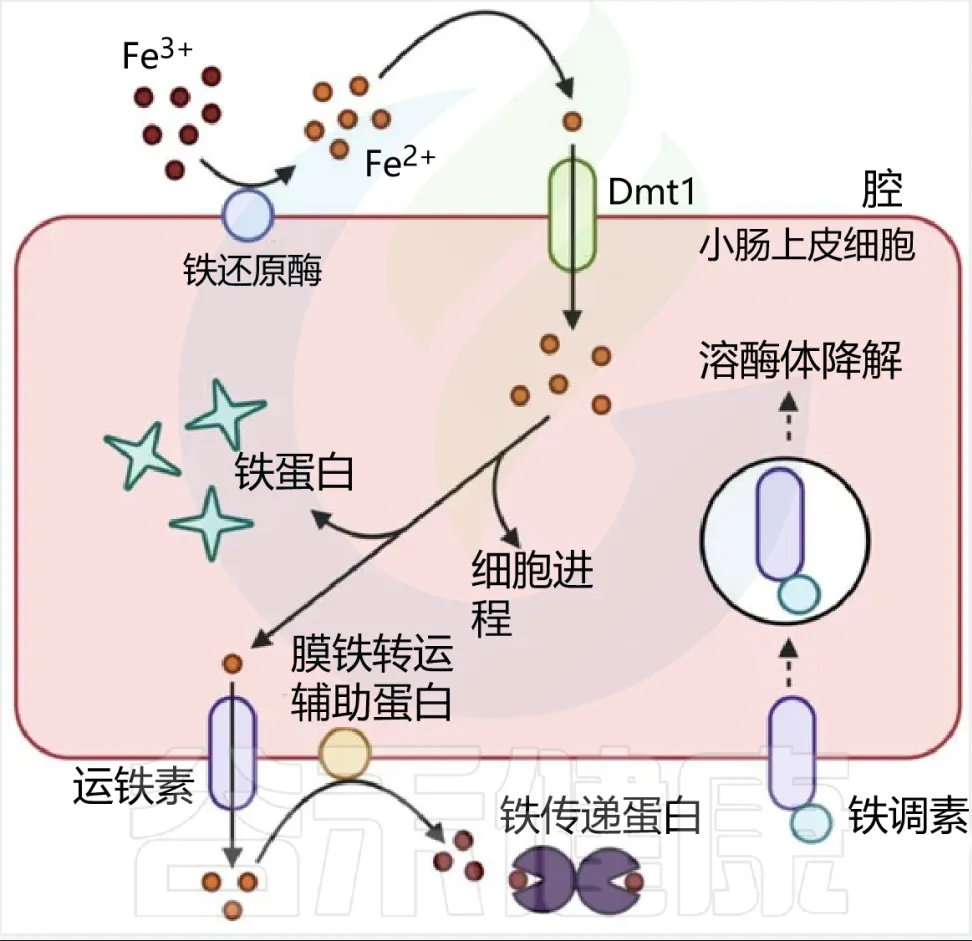
肠道内的微生物群可能与宿主竞争可用铁,也可能通过其他方式促进或抑制铁的吸收。
◮ 一些细菌可以直接利用铁
细菌可以通过分泌铁载体摄取Fe3+。铁载体是一种Fe3+特异性的螯合剂,对Fe3+具有超强的络合力。而大多数革兰氏阳性菌存在直接吸收血红素而获得铁元素的转运系统。
除此之外,细菌也可以产生分泌的或位于膜上的铁还原酶,将Fe3+还原成更容易溶解的Fe2+形式,并通过Feo、Yfe、Efe等转运系统来摄取Fe2+。
◮ 部分菌群调节肠道环境有助于更好地吸收铁
许多食物基质中的非血红素铁与抑制剂(例如多酚、纤维或植酸盐)相连,这些抑制剂可以被专用细菌酶降解,从而更好地吸收铁。
细菌还可以通过发酵饮食中的不可消化碳水化合物来产生短链脂肪酸,这会降低管腔pH值,从而将三价铁还原为二价铁,从而提高其被细菌和宿主的吸收。
其他一些有机酸(例如乳酸)是由许多细菌产生的,存在于整个消化道中。酸化的肠道环境还可以降解螯合微量营养素的复合物并促进铁的吸收。
特定的微生物代谢物,如羧酸,还可以通过防止肠道中的铁沉淀来增强铁的吸收。
◮ 一些肠道菌群代谢物会抑制铁的吸收

但是需要注意的是,还有研究发现肠道微生物群产生的代谢物会抑制缺氧诱导因子(HIF-2α)(肠道铁吸收的主要转录因子)并增加铁储存蛋白铁蛋白,从而导致宿主肠道铁吸收减少。
这可能是肠道微生物群通过抑制肠道HIF-2α活性和上调铁转运蛋白(FPN)表达来调节宿主全身铁稳态,有效防止全身铁过载。
评估缺铁的生化测试包括血清总铁、总铁结合能力(TIBC)、转铁蛋白、可溶性转铁蛋白受体(sTfR)、血清铁蛋白和红细胞锌原卟啉。
① 测定血红蛋白
血红蛋白是评估铁状态最常用的参数,因为它简单易用。然而,当单独使用时,它缺乏特异性,因为它受维生素B12和叶酸状态以及感染和血红蛋白病的影响。
② 测定血清铁蛋白
血清铁蛋白被认为是检测早期缺铁的较好生物标志物。然而,作为一种急性期反应物,其血清浓度受炎症状态影响,并可能因长期饮酒而升高,从而限制了其在缺铁性贫血(IDA)诊断中的实用性。
③ 测定血浆铁(PI)/总铁结合能力
血浆铁(PI)/总铁结合能力(TIBC)比值反映转铁蛋白饱和度,可通过在自动化平台上常规分光光度法分析的PI和TIBC轻松获得。
直接测量转铁蛋白已被提议作为一种更好的生物标志物,并且已经开发出自动化免疫化学方法,但在临床实验室中应用并不广泛。最近描述了一种使用合成转铁蛋白肽的LC-MS/MS方法用于测量血清转铁蛋白。它可以成为参考方法的基础,从而提高免疫学方法的准确性。
④ 测定可溶性转铁蛋白受体(sTfR)
可溶性转铁蛋白受体(sTfR)测量是最近描述的一种铁状态评估方法,通常可以区分缺铁性贫血(IDA)和慢性病性贫血(ACD) ,尤其适用于识别同时患有炎症性疾病(其中铁蛋白(一种急性期蛋白)增加)的患者的IDA。
⑤ 红细胞锌原卟啉
红细胞锌原卟啉是血红素合成异常的产物,在无并发症的铁缺乏症(缺铁性红细胞生成)的初步筛查中特别有价值,并且与sTfR一起用于在排除铅中毒(如今很少见)时监测补铁疗法。
低成本和能够用即时血荧光计直接测量一滴血中的红细胞锌原卟啉/血红素比率是该检测的主要优点。然而,自动化检测的困难限制了它在中心临床实验室中的使用。
⑥ 含铁血黄素
最后,可以检查骨髓以评估网状细胞中的含铁血黄素含量。然而,这种技术是侵入性的、半定量的、依赖观察者的,不能在临床病理实验室中常规使用。
考虑到缺铁对人体健康影响重大,因此实施适当的策略来解决这一问题至关重要。
最常见的策略是食物中的铁补充、益生菌、益生元、铁药物补充剂等方法。
◮ 富含铁的食物
前面我们知道,膳食铁有两种形式:血红素和非血红素。血红素铁具有较高的生物利用度,而非血红素铁的吸收要低得多。
血红素铁主要存在于以下食物中:
•红肉,尤其是牛肉,是血红素铁的重要来源,每 100克牛里脊肉含有约3毫克血红素铁;
•血液制品,例如猪血和鸭血,含有极其丰富的血红素铁,每100克含9.2至15.4毫克;
•内脏,尤其是肝脏,是血红素铁的极佳来源。例如,每100克猪肝含有约2.3毫克血红素铁;
•某些贝类,如青口贝、蛤蜊和牡蛎,也富含血红素铁,每100克含4.0至9.1毫克。
非血红素铁:
•豆类,如大豆、蚕豆。食用豆类是非血红素铁的重要来源;
•种子和坚果,芝麻和南瓜子是非血红素铁的良好来源;
•深色多叶蔬菜,西兰花、甘蓝和菠菜含有丰富的铁,此外韭菜、芹菜、黑木耳、豆芽等也含有一定的铁含量;
•全谷物,如燕麦、藜麦、糙米;
•鱼类,鳕鱼、鲤鱼、鲑鱼等鱼类中也有一定的非血红素铁。
◮ 维生素C:促进铁的吸收
特别注意的是,维生素C可以促进铁的吸收。与富含铁的食物一起吃富含维生素C的食物,像冬枣、柑橘、猕猴桃、草莓、西红柿等都含有丰富的维生素C,可以帮助你最大限度地吸收铁。
◮ 铁补充剂
不同形式的铁补充剂补充铁以亚铁和铁的形式存在。由于铁形态必须在体内转化为亚铁形态以供吸收,因此亚铁形态更具生物利用度。
常用的口服亚铁补充剂包括:
•柠檬酸亚铁
•硫酸亚铁
•葡萄糖酸亚铁
•铁琥珀酸亚铁
•氨基酸螯合物(如双甘氨酸铁、天冬氨酸铁)
•血红素铁
◮ 益生菌
一些益生菌可以产生乳酸,这可能会降低pH值,从而增加铁的溶解度,帮助其吸收。
例如,植物乳杆菌 299v 有助于预防缺铁性贫血。这种益生菌可以改善活跃的高加索欧洲人的膳食非血红素铁吸收。
发酵乳杆菌是人类微生物群中的一种主要益生菌,具有显著的铁还原活性。对羟基苯乳酸是该菌株产生的代谢物,通过DMT1转运体将Fe3+还原为Fe2+来增加肠细胞对铁的吸收。
◮ 益生元
益生元是功能性食品成分,可刺激肠道中有益细菌的生长和定植,最终改善身体健康。
几项研究将益生元或合生元的摄入与铁可用性的增加联系起来,主要是通过将Fe3+转化为Fe2+(由于它们的铁还原活性),并促进肠细胞对铁的吸收。
!
特别提醒
除非你真正需要,否则绝不应该补充铁,因为过多的铁可能非常有害。
钙对你身体的每个细胞都是必不可少的。它能使骨骼和牙齿矿化,特别是在快速生长的时期。除其结构功能外,钙还参与多种生命功能,包括受精、血液凝固、肌肉收缩、神经冲动传递、分泌活动、细胞死亡、免疫反应、细胞分化和酶活化。
获得和保持所需的钙量对于儿童骨骼的发育、强度和密度以及预防老年人的骨质流失和骨质疏松性骨折至关重要。充足的钙摄入量还有助于降低患高血压、高胆固醇血症、结肠癌、肾结石和腹部肥胖等各种慢性疾病的风险。
世界卫生组织(WHO)建议,年轻人的每日推荐钙摄入量(RDI)为1000毫克/天,65岁以上男性、绝经后女性和9至18岁的儿童的每日推荐钙摄入量为1300毫克/天。
然而之前的一项调查发现,只有不到15%的少女、不到10%的50岁以上的妇女、不到22%的少年和50岁以上的男子符合建议的钙摄入量。虽然目前这些数字略有增加,但大多数人仍然没有获得足够的钙。最新的研究表明,全球人口有超50亿存在钙不足(占66%)。
钙缺乏症是影响各类人群的全球健康问题,对骨骼健康和其他生理功能有重大影响。了解钙缺乏的原因对于制定有效的干预措施和政策以减轻其影响至关重要。
① 饮食摄入不足
世界上大约一半的人口无法获得足够的膳食钙,其中低收入和中等收入国家面临的风险最大,尽管高收入国家中的许多人也没有达到推荐摄入量。
对于儿童来说,钙摄入不足是缺钙的主要原因,而生长和骨骼发育对钙的需求较高,则加剧了缺钙现象。
② 生理和代谢因素
成人缺钙通常是由于钙通过肠道、肾脏和皮肤流失,而无法通过饮食摄入得到补偿。
在绝经后妇女中,尿钙流失增加和钙吸收不良导致钙缺乏和骨质疏松症。
③ 维生素D缺乏症
维生素D缺乏会导致钙吸收受损,从而导致钙缺乏症和佝偻病和骨软化症等相关疾病。
④ 荷尔蒙影响
激素变化,如绝经后女性的雌激素水平下降,会增加骨质吸收和钙质流失,加剧钙缺乏症。
此外,甲状旁腺激素(PTH)和骨化三醇水平因缺钙而升高,导致骨吸收以维持血钙水平。
⑤ 遗传和健康状况
影响矿物质代谢的遗传、先天或后天性疾病可能导致儿童继发性钙缺乏症。
⑥ 环境和生活方式因素
缺乏日光照射导致维生素D不足,以及含有钙结合剂(例如磷酸盐、草酸盐)的饮食习惯会损害钙的吸收。
老年人:老年人由于钙和维生素D摄入量低、日照时间短、肠道吸收能力下降、肾功能下降等因素,特别容易出现钙缺乏症。
绝经后的女性:由于雌激素水平下降,骨质流失加快,容易导致钙缺乏。
孕妇和哺乳期妇女:由于胎儿和婴儿对钙的需求增加,母体可能会出现钙不足。
素食者:如果饮食中缺乏富含钙的植物性食物,可能会导致钙摄入不足。
乳糖不耐受者:由于无法摄入乳制品,可能会导致钙摄入不足。
青春期青少年:由于快速生长发育,对钙的需求增加,如果饮食中钙摄入不足,容易缺钙。
长期服用某些药物的人:如长期服用类固醇药物,可能会影响钙的吸收和代谢。
患有某些疾病的人:如甲状旁腺功能亢进、肾病或胃肠道疾病,可能会影响钙的吸收和利用。
钙缺乏症的症状和健康危害主要包括以下几个方面:
骨折、骨质疏松症
当钙摄入量低或钙吸收不良时,就会发生骨吸收,骨骼中储存的钙用于维持正常的生物功能。长期钙缺乏会导致成年人骨质疏松,增加骨折的风险,尤其是绝经后女性和老年人。
佝偻病
更为严重的饮食性缺钙的症状包括儿童的软骨(佝偻病),钙缺乏会影响儿童骨骼生长和发育,表现为骨骼畸形、生长迟缓等。
某些疾病和特定饮食,如素食,可能会导致钙缺乏。炎症性肠病患者也需要补钙,尤其是使用皮质类固醇/糖皮质激素的患者。
妊娠期并发症
除了骨骼健康之外,孕妇钙缺乏可能增加患妊娠期高血压疾病、早产、低出生体重等妊娠并发症的风险。补钙最有据可查的好处之一是显著降低孕妇先兆子痫和产妇发病率以及早产的风险。
其他健康影响
钙缺乏还可能与其他健康问题有关,如牙齿问题、肌肉痉挛、心血管疾病、情绪不稳定等。
对于非妊娠成人,补钙可能对降低血压有轻微作用,尤其对于年轻人。补钙还与胆固醇代谢的有利变化有关,包括低密度脂蛋白的减少和高密度脂蛋白的增加。
钙以离子形式(即Ca2+)在胃肠道中吸收。肠道钙吸收是维持Ca2+稳态的重要过程,并通过两种不同的运输机制进行:跨细胞主动饱和转运和旁细胞被动不饱和转运。
◮ 钙的跨细胞主动转运
跨细胞运输发生在十二指肠和空肠上段,受维生素D刺激,包括三个基本步骤:
(1)钙进入细胞(通过正电化学梯度);
(2)扩散;
(3)从细胞中排泄。
一旦进入细胞,钙就会被转运到基底侧膜,与缓冲蛋白钙结合蛋白-D9K(CaBP-9K)结合,该蛋白对 Ca2+有很高的亲和力。另一种钙结合蛋白钙调蛋白可能有助于钙在细胞内的易位,但其作用程度不如钙结合蛋白-D9K。
钙通过位于基底侧膜的钙泵ATPase(PMCA1)和钠钙交换器(NCX1)的作用从上皮细胞挤出到间质空间。PMCA1对钙的吸收至关重要,在人体中,它存在于十二指肠、回肠和结肠中。PMCA1活性受钙调蛋白(CaM)、钙结合蛋白-D28K(CaBP-28K)和钙调节。
◮ 钙的旁细胞被动扩散
钙的旁细胞被动扩散主要发生在小肠中,该扩散不可饱和且不依赖于维生素D;随着钙摄入量的增加,通过旁细胞扩散的吸收增加,当钙摄入量高时,旁细胞吸收占主导地位。
旁细胞吸收通过整个小肠的紧密连接发生,紧密连接是存在于肠细胞顶端区域的细胞间结构,可调节离子和分子的旁细胞运输,而肠道微生物群对于紧密连接的构成至关重要。
◮ 当钙摄入不足时,骨骼会释放出钙进而引起骨质疏松
血液中的钙浓度受到严格的调节,任何多余的钙都会储存在骨骼中。如果你的摄入量不足,你的骨骼就会释放出钙。
这就是为什么缺钙最常见的症状是骨质疏松症,其特点是骨骼更软、更脆弱。
健康人的血钙维持在一个相对稳定的水平,主要依靠血液与细胞外液之间钙代谢的快速交换与平衡,而调控骨骼、肠道、肾脏等重要器官和核心环节的大型钙库则受钙调节因子的控制。例如经典的钙调节因子1,25-二羟基维生素D3。
维生素D3首先在肝脏中羟基化生成25-羟基维生素D3,然后在肾脏中经1α-羟化酶作用生成活性最强的1,25-二羟基维生素D3。活性维生素d3通过增加肠道钙吸收、减少肾脏钙排泄、调节骨代谢等作用而升高血钙。
◮ 肠道微生物可以影响钙调节因子水平
已有多项研究调查了不育小鼠血浆中25-羟基维生素d3和1,25-二羟基维生素d3水平非常低,而不育小鼠在植入肠道微生物群 2周后血清钙水平恢复至正常水平。

在一项临床试验中,参与者被给予NCIMB 30242罗伊氏乳杆菌胶囊后,服用益生菌胶囊的患者25-羟基维生素d3水平较服用安慰剂胶囊的对照组显著升高。
◮ 短链脂肪酸有助于增强钙的吸收
肠道微生物群还能产生短链脂肪酸(SCFAs)。实验证明,SCFAs的存在可以增加小鼠结肠腔内钙的转运,而单独用盐酸处理并不能增加钙的转运,SCFAs可能通过其他机制促进钙的吸收。
SCFAs是肠黏膜细胞的重要能量供应者,尤其是丁酸,是结肠和盲肠黏膜细胞所青睐的。所以SCFAs能促进肠道细胞生长,增加肠道吸收面积,从而增强钙的吸收。
此外,丁酸可以诱导骨调节T细胞的形成,进而达到甲状腺激素诱导的骨代谢,降低血钙的目的。
◮ 维生素D与肠道微生物群共同作用调节钙吸收
维生素D是人体唯一能合成的维生素,其来源主要是皮肤在太阳紫外线照射下合成的维生素D,其次是天然食物。维生素D与肠道微生物群相互作用,共同作用于机体对钙的吸收。
肠道菌群的组成可因维生素D状态或暴露而变化,维生素D摄入量与普氏菌的丰度相关,与拟杆菌呈正相关。另一方面,有数据支持菌群也影响维生素D代谢,一些细菌表达参与类固醇羟基化的酶,因此它们可以加工和激活维生素D。细菌CYP105a1(苍白链霉菌)可以通过两个独立的羟基化反应将维生素D3转化为1,25(OH) 2 D3,这表明细菌功能相当于维生素D代谢酶。
维生素D对机体钙平衡的调节作用是通过调节肠道、肾脏对钙的吸收,以及骨的成骨、破骨细胞生成过程来实现的,能促进小肠黏膜对钙的吸收。有研究表明,当维生素D由不足转为正常时,肠道对钙的主动吸收增加45~65%,而血清25-羟基维生素D低于30ng/ml时,肠道对钙的吸收明显降低。
① 饮食评估
膳食钙摄入量是广泛使用的钙状态测量指标,可用于得出人口状态指标(例如,摄入量充足或不足的个体比例;平均摄入量)。膳食评估方法可分为间接方法(如食物平衡表),利用二手数据估计国家和家庭层面可供消费的食物,以及直接方法(如24小时回忆),从个人收集原始膳食数据。
② 离子钙测量
直接测量离子钙(Ca2+)被认为是评估真实钙状态的黄金标准,因为它不受白蛋白等血清蛋白的影响。重症监护室通常使用血气分析仪进行离子钙测量,但其成本较高,且需要及时处理样品,因此受到限制。
③ 测量血清中的总钙
总钙通常用作一线检测,使用原子吸收光谱法的标准化参考方法可以准确测量血清中的总钙,但它们没有考虑离子钙。通常需要根据白蛋白或总蛋白进行调整才能估算离子钙。然而,这些调整通常与直接离子钙测量值不一致,可能无法准确反映真实的钙状态。
④ 骨量测量
虽然骨量测量结果与近期膳食钙摄入量没有很好的相关性,但它们反映了长期钙的充足性,并受整体钙状态的影响。
⑤ 空腹尿钙:肌酐比率
这种方法有望成为一种简单且廉价的指示近期钙状态的方法,尽管目前尚未广泛使用。
◮ 摄入高钙食物
摄入富含钙的食物是满足每日钙需求的最佳方式。
-高钙食物包括乳制品(牛奶、酸奶、奶酪);
-深海鱼类,深海鱼的含钙量比普通的鱼肉要高,虾皮含钙量高达991毫克/百克;
-蛋类,鸡蛋、鹌鹑蛋、甲鱼蛋等蛋类也含有丰富的钙元素;
-坚果,例如榛仁含钙达815毫克/百克;
-一些蔬菜,例如紫衣甘蓝、西兰花、香菇、木耳等食物也含有较多的钙。
◮ 使用钙补充剂
对于无法从饮食中摄取足够钙质的人,可能需要补充钙质。常见的钙质包括碳酸钙和柠檬酸钙,后者更容易被吸收。补充剂应根据个人需求量身定制,通常每天约500毫克,以补充饮食摄入量并达到推荐的每日摄入量。
钙与维生素D结合补充可增强钙的吸收,并具有其他健康益处,例如改善血脂状况并降低老年人的骨折风险。
注:建议每日摄入1000-1200毫克钙和800国际单位(IU)维生素D,尤其是对于老年人。
◮ 适当运动、晒晒太阳
运动不仅可以增强自身体质,还可以在户外增加晒太阳的时间,适当的阳光照射是皮肤合成维生素D的重要来源,对钙的吸收都有益处。
◮ 不吸烟、少喝酒
吸烟会增加肺癌的患病率,还有可能成为缺钙的重点人群。少喝酒,少摄入咖啡因。酒精和咖啡因会影响钙的吸收,也是造成骨质疏松的不可忽视的因素。
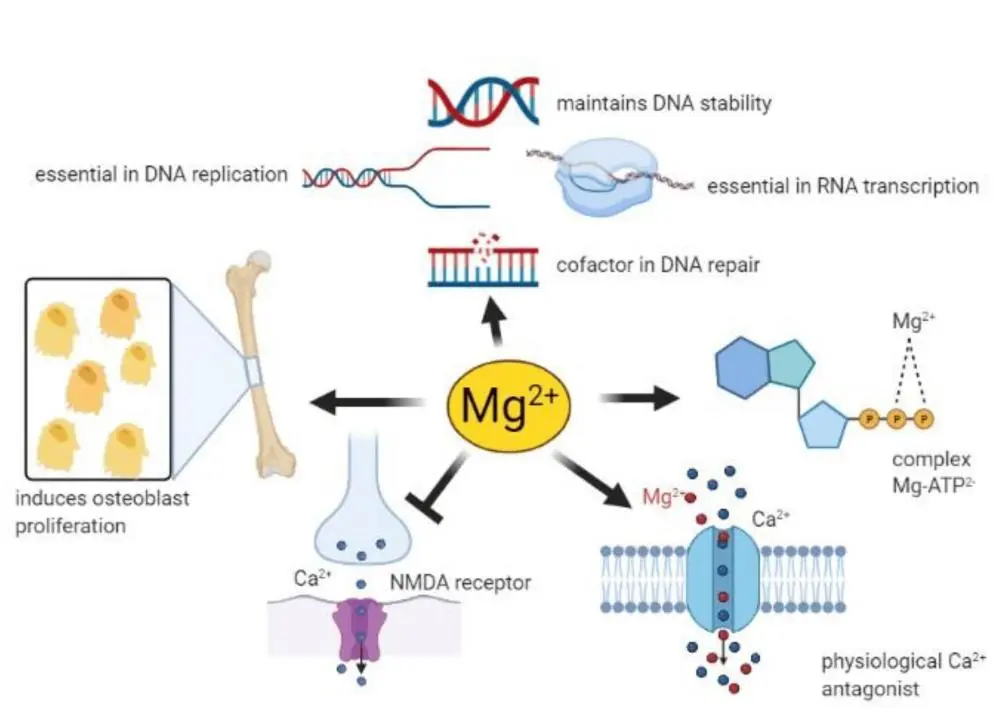
镁是人体内含量第四多的元素(Ca²+>K+>Na+>Mg²+),也是人体内细胞中含量第二多的阳离子,仅次于钾。
★ 镁在许多生理功能中发挥着重要作用
doi: 10.3390/nu13041136.
–MgATP复合物是许多酶活性所必需的。一般来说,Mg2+在所有涉及ATP利用和转移的反应中都起辅助因子的作用,包括细胞对生长因子的反应和细胞增殖,因此几乎参与了细胞中的每个过程。
–Mg2+是DNA和RNA聚合酶保持正确结构和活性所必需的,在DNA复制、RNA转录和蛋白质形成过程中必不可少,从而参与控制细胞增殖。此外,Mg2+对维持基因组和遗传稳定性至关重要,鉴于这些影响,Mg2+可用性低可能与癌症的发展有关。
-血清Mg2+浓度与骨代谢密切相关,骨表面Mg2+不断与血液中的Mg2+进行交换。此外,Mg2+会诱导成骨细胞增殖。
-Mg2+参与控制许多组织中某些离子通道的活性。这些能力与镁对心血管系统、肌肉和大脑的影响有关。
-神经元镁离子浓度会下调N-甲基-D-天冬氨酸(NMDA)受体的兴奋性,而这种受体对于学习和记忆中的兴奋性突触传递和神经元可塑性至关重要。出于这些原因,人们推测许多神经系统疾病都与Mg2+缺乏有关,例如偏头痛、癫痫、阿尔茨海默病、帕金森病和中风,以及焦虑和抑郁。
在普通人群中,镁缺乏症并不少见,并且男性的镁缺乏量要大于女性,因为雌激素会增强镁的利用率,有利于组织对镁的吸收。但由于不同原因和情况,习惯性摄入镁不足或过度流失会导致镁缺乏。
① 膳食摄入和不健康饮食
相当一部分人的镁摄入量未达到平均水平,这主要是由于现代西方饮食中镁含量低。此外,过去一个世纪里,蔬菜中的矿物质含量大幅下降,人们的蔬菜摄入量也减少,导致膳食中镁的摄入量降低。同时研究表明加工食品会阻碍镁的吸收。
② 胃肠道的pH值影响吸收
镁形式(无机盐、有机盐、螯合物等)的溶解度是一个重要因素,溶解度增加与吸收增加相关。胃肠道的pH值会影响镁形式的溶解度,pH值较低时镁的溶解度增加。而pH升高时,镁的吸收变得越来越困难。胃肠道中产生短链脂肪酸的细菌减少,可能会导致镁的吸收减少。
③ 药物的使用
某些药物,如利尿剂和质子泵抑制剂,可能导致镁缺乏。常用的质子泵抑制剂奥美拉唑影响体外被动运输。奥美拉唑通过使管腔酸度升高,抑制了镁的被动吸收。
④ 雌激素的水平
性别也会影响镁的状态,因为雌激素会增强镁的利用率,有利于软组织和硬组织对镁的吸收。年轻女性的镁保留能力比年轻男性更好,尤其是在排卵期或服用口服避孕药期间,此时雌激素水平最高。
⑤ 胃肠道和肾脏疾病
由于各种潜在的健康状况和治疗,住院患者,尤其是重症监护病房的患者,经常会缺乏镁。胃肠道和肾脏的流失是导致镁缺乏的重要因素。影响这些系统的疾病会导致镁排泄增加。
老年人:老年人从肠道吸收的镁较少,而由于肾脏排泄增加,镁流失较多,慢性镁缺乏症在老年人中确实很常见,通常是由于饮食摄入和肠道吸收减少所致,并且可能因雌激素缺乏而加剧,雌激素缺乏发生在老年女性和男性身上并导致高镁尿症。
患有胃肠道疾病的人:如克罗恩病、炎症性肠病和乳糜泻。特别是,除了乳糜泻导致的吸收效率低下之外,无麸质饮食还发现缺乏纤维和微量营养素,如镁。因此,患有乳糜泻的人是特别容易受到镁缺乏症的影响。
酗酒的人:酒精会影响肠道,并导致肠道吸收不良。乙醇还会导致近端肾小管功能障碍,增加尿镁流失。
使用一些药物的人:正在接受药物治疗(如利尿剂、质子泵抑制剂、他克莫司、免疫抑制剂、化疗药物和一些磷酸盐类药物)的人。
过去30年来,多项实验、临床和流行病学研究表明,慢性镁缺乏与多种疾病有关,或会加重这些疾病。
急性低镁血症
急性低镁血症具有明显的临床特征(严重痉挛、眼球震颤、心律失常等),并且易于检测。相反,亚临床或慢性镁缺乏症经常被低估,因为它反映的是细胞和骨骼内镁含量的降低,而不是细胞外镁含量的降低。
糖尿病
镁能诱导胰岛素受体的自身磷酸化,并调节这些受体上的酪氨酸激酶活性,从而起到胰岛素增敏剂的作用。多项研究报告称,细胞内镁水平降低会导致胰岛素抵抗增加。
骨质疏松症
镁缺乏可能是骨质疏松症的一个危险因素。研究发现,膳食镁、骨矿物质密度(BMD)和降低骨质疏松症风险之间存在正相关。

心血管疾病
越来越多的流行病学研究、随机对照试验和荟萃分析证据表明,镁摄入量与心血管疾病(CVD)呈反比关系。事实上,高镁摄入量与主要心血管风险因素(如高血压和糖尿病)、中风和总CVD的发生概率降低相关。此外,缺血性和冠心病风险降低与循环中镁含量较高有关。
癌症
多项流行病学研究表明,缺乏镁的饮食会增加患癌症的风险。镁是参与DNA修复机制的酶辅因子,在维持基因组稳定性和保真度、调节细胞周期进程、细胞增殖、分化和凋亡方面发挥着重要作用。镁缺乏会导致DNA突变,从而导致肿瘤发生以及癌症的风险和预后。此外,最近有报道称镁对化学致癌作用具有保护作用。
神经系统疾病
一篇文献非常详尽的总结了关于镁在预防和辅助治疗最常见的神经系统疾病方面所起的作用,镁缺乏可能导致偏头痛、中风、癫痫、阿尔茨海默病和帕金森病,以及常见的焦虑和抑郁并发疾病。
Mg2+主要通过小肠吸收,尽管有些也通过大肠吸收。Mg2+转运系统有两种,一种是被动的旁细胞机制,另一种是通过专门的Mg2+通道和转运蛋白进行的跨细胞转运。
Mg2+稳态由肠道、骨骼和肾脏在激素控制下维持。镁跨细胞膜的转运表现出组织差异,在人体组织中,心脏、肝脏、肾脏、骨骼肌、红细胞和脑的转运较高。
因此,镁的转运、镁稳态的生理学和细胞的代谢活动是紧密相关的。以下一些因素会影响膳食镁的吸收和利用:
◮ 饮食因素
膳食中钾含量过高会显著降低镁的吸收;钙和磷酸盐摄入量增加会损害镁的吸收。
某些膳食纤维(如半纤维素、纤维素、木质素)、植酸和草酸会抑制镁的吸收,而蛋白质和某些碳水化合物(如抗性淀粉、菊粉)则会促进镁的吸收。
◮ 维生素D
药理剂量的维生素D可增加镁的吸收,但相当一部分镁的吸收与维生素D无关。
◮ 激素水平
激素也会调节跨细胞Mg2+的吸收。最近的一项研究报告称,甲状旁腺激素(PTH)和成纤维细胞生长因子23(FGF-23)系统性地直接抑制十二指肠、空肠和回肠的跨细胞而非旁细胞Mg2+吸收。
◮ 肠道pH值
肠道内pH浓度会影响Mg2+溶解度和肠道Mg2+吸收,管腔pH升高导致可溶性Mg2+降低,从pH5.15时占管腔总Mg含量的79.61%下降到pH7.8时占管腔总Mg含量的8.71%。因此,腔内酸性可增强人体小肠和上皮样 Caco-2 单层细胞对Mg2+的吸收。
◮ 质子泵抑制剂的使用
自2006年以来,已有报道称质子泵抑制剂(PPI)诱发人类低镁血症(PPIH)和低镁尿。静脉补充Mg2+或停用PPI可使PPIH患者的血浆和尿液Mg2+水平迅速恢复正常,但口服补充Mg2+则不能。这些发现表明PPI可以抑制肠道Mg2+的吸收。
肠道菌群在结肠Mg2+吸收中可能发挥的作用已有人提出。
◮ 肠道菌群失调导致毒性物质产生增加
长期质子泵抑制剂(PPI)治疗可导致肠道菌群失调,例如负责维持粘膜屏障功能的放线菌和双歧杆菌属的减少。此外,长期使用PPIs治疗会导致小肠细菌过度生长,毒性物质的产生增加,如血清内毒素和刺激促炎细胞因子分泌的细菌化合物,这些有毒物质会干扰镁的吸收。
◮ 肠道微生物群会影响肠道吸收表面的变化
除了这些发现之外,我们之前的研究还显示低镁血症(PPIH)大鼠小肠存在潘氏细胞功能障碍和慢性炎症。肠道微生物代谢物的合成也可能导致肠道吸收表面的变化或刺激基因表达。
◮ 产短链脂肪酸的细菌有利于镁的吸收
在结肠中,双歧杆菌等细菌发酵会产生短链脂肪酸导致结肠酸化,有利于Mg2+的吸收。在人体小肠中,占主导地位的细菌门是链球菌属,它是一种厌氧菌,能够以较高的速率发酵相对简单的碳水化合物,而腔内酸性会显著诱导小肠对Mg2+的吸收。
自从认识到镁对人类健康的重要性以来,人们就提出了一个问题:如何才能清楚了解自身镁的状态?
① 原子吸收光谱法
原子吸收光谱法(AAS)可能是最古老、应用最广泛的评估生物样品中镁含量的技术。它的重要优点是可以应用于所有类型的生物样品,但其主要缺点是样品制备、仪器校准和分析耗时。
② 离子选择电极
Mg2+可用离子选择性电极进行电位测定,离子化的 Mg2+可以在全血、血清或血浆,或在红细胞等细胞中测量。该技术的主要缺点是电极缺乏特异性和反应时间较长。
③ 光学化学传感器
用于测定镁的光学化学传感器由于其良好的选择性、灵敏度和制备简单而成为重要且日益增长的应用领域。提出了几种荧光和比色测定方法,包括比色法和酶法测定和荧光化学传感器,前者的选择性和灵敏度更高。
④ 元素生物成像
化学成像是一个相当新的研究领域,它能够以高灵敏度和空间分辨率检测元素,另一个优势是它可以同时评估多种元素或分子。
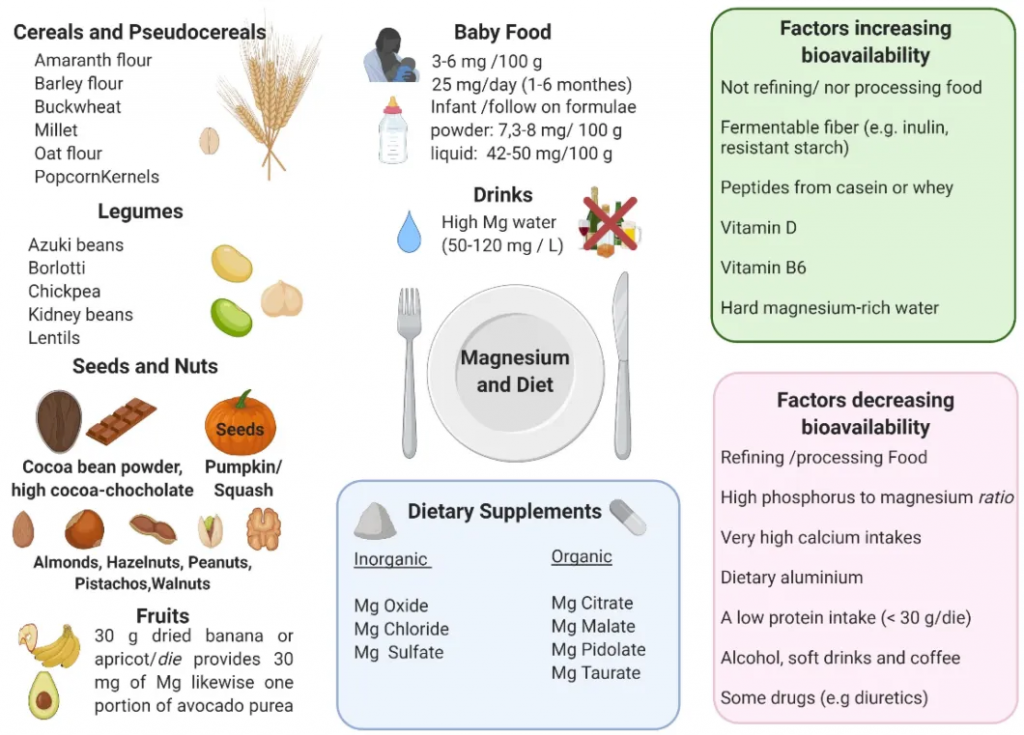
镁是生物体必需的营养物质,因此必须定期从饮食中补充,以达到推荐摄入量,防止缺镁。当食物中的镁摄入不足时,可能就需要使用镁补充剂。
◮ 饮食补充
镁广泛分布于食物中,尽管食物中的镁含量受多种因素影响,包括灌溉的土壤和水、肥料、保护以及精炼、加工和烹饪方法。一般来说,种子、豆类、坚果(杏仁、腰果、巴西坚果和花生)、全麦面包和谷物(糙米、小米)、一些水果(杏和香蕉)和可可被认为是镁的良好来源。
◮ 镁补充剂
镁补充剂有多种配方,包括无机盐(例如氧化镁、氯化镁、硫酸镁)和有机化合物(例如柠檬酸盐、苹果酸盐、吡多酸盐、牛磺酸盐)。
不同种类补充剂对镁的吸收并不相同。此外,吸收取决于受试者的镁状态。Mg2+的吸收量取决于摄入剂量。例如,当膳食中Mg2+摄入量较低时,相对吸收率可达80%,而在Mg2+丰度状态下,相对吸收率降至20%。通常,Mg2+以离子形式被吸收。可溶性镁比溶解性较低形式的镁更容易被肠道吸收。
◮ 菊粉、寡糖、抗性淀粉等有助于增强镁吸收
含有膳食非发酵纤维的食物确实含有高含量的镁,但其生物利用度较低,与铁类似。相比之下,可发酵的碳水化合物(如菊粉、寡糖、抗性淀粉、甘露醇和乳果糖)可增强 Mg2+的吸收。
◮ 生活方式调整
减少摄入过多的酒精和咖啡因,因为它们可能影响镁的吸收。
通过适当的运动和减压活动来改善整体健康,从而促进镁的吸收和利用。
下图展示了镁的主要来源、镁补充剂以及增加或减少镁生物利用度的因素:
doi: 10.3390/nu13041136.
硒是一种重要的微量营养素,主要通过硒蛋白(可作为结构蛋白或酶)来支持多种生理功能。它在抗氧化防御、甲状腺激素代谢、免疫功能、生殖健康以及潜在的癌症预防和慢性疾病管理中发挥着重要作用。
硒缺乏在人体中也不罕见,并且女性中硒缺乏量高于男性。硒缺乏的原因可以归结为多种因素,以下是详细的说明:
① 生活在低硒地区、饮食中缺硒
某些地区的土壤中硒含量低,如中国的克山病和大骨节病的重病区,这些地方的植物和动物产品中硒含量较低。
海产品和动物内脏是硒的良好食物来源,如鱼子酱,海参,牡蛎蛤蜊和猪肾等。饮食中缺乏硒的来源,导致营养性缺硒。
② 农药、化工产品阻碍硒的吸收
环境污染,农药、化肥、化工原料的残留物可拮抗硒元素的吸收,造成农作物缺硒,进而导致人体缺硒。
③ 体质和疾病状况
进入中老年后,人体的消化、吸收能力也会逐渐降低,影响硒元素的吸收。
疾病加剧缺硒、缺硒加剧疾病,例如,肿瘤、心血管病、克罗恩病、溃疡性结肠炎、糖尿病、肝病患者体内往往处于缺硒状态。
④ 特殊人群的硒需求量增加
长期酗酒、吸烟、情绪紧张的人体内的硒流失量远高于健康人,此外,包括孕妇和哺乳期妇女、儿童和青少年、老年人、癌症患者、运动员和体力劳动者的硒需求量增加。
人体缺硒的表现主要为脱发、脱甲;部分患者会出现皮肤症状;少数患者可出现神经症状及牙齿损害等问题;严重缺硒可导致溶血性贫血、克山病和大骨节病。
硒缺乏还被认为是几种慢性疾病的风险因素,这些疾病涉及胃肠道、肌肉和神经系统的氧化应激和炎症有关。
克山病
克山病亦称地方性心肌病,这种病是由硒缺乏和柯萨奇病毒突变株的存在相互作用而引起的,患者主要表现为急性和慢性心功能不全,心脏扩大,心律失常以及脑、肺和肾等脏器的栓塞。
大骨节病
缺硒还与大骨节病(一种地方性骨软骨病)有关,大骨节病被认为是硒缺乏和谷物中霉菌毒素以及饮用水中腐殖酸含量高共同引起的。
◮ 硒主要在十二指肠、盲肠、结肠中被吸收
膳食中摄入的有机或无机硒均在胃肠道中吸收,研究表明,有机硒的吸收率高于无机硒。硒的主要吸收部位是十二指肠、盲肠和结肠。
硒氨基酸通过各种膜转运机制在十二指肠、盲肠和结肠中主动转运,而硒酸盐则通过 SLC26 基因家族的阴离子交换剂转运。
从十二指肠吸收的硒首先进入血液,与血浆中的红细胞、白蛋白或α球蛋白结合,也可结合β球蛋白、血浆高密度脂蛋白或低密度脂蛋白,随后转运至肝脏,在肝脏中代谢并用于生成硒蛋白,然后分布至身体的其他组织。
硒的主要排泄形式是通过尿液,然而,在过量摄入的情况下,可能会发生呼吸道排泄。在适量摄入硒的情况下,通过肾脏排出的主要单甲基化合物是硒糖,即1β-甲基硒N-乙酰-D-半乳糖胺。食物中未被吸收的硒被吸收到胆汁、胰腺和肠道分泌物中,并在粪便中排出。
硒的吸收、代谢和分布
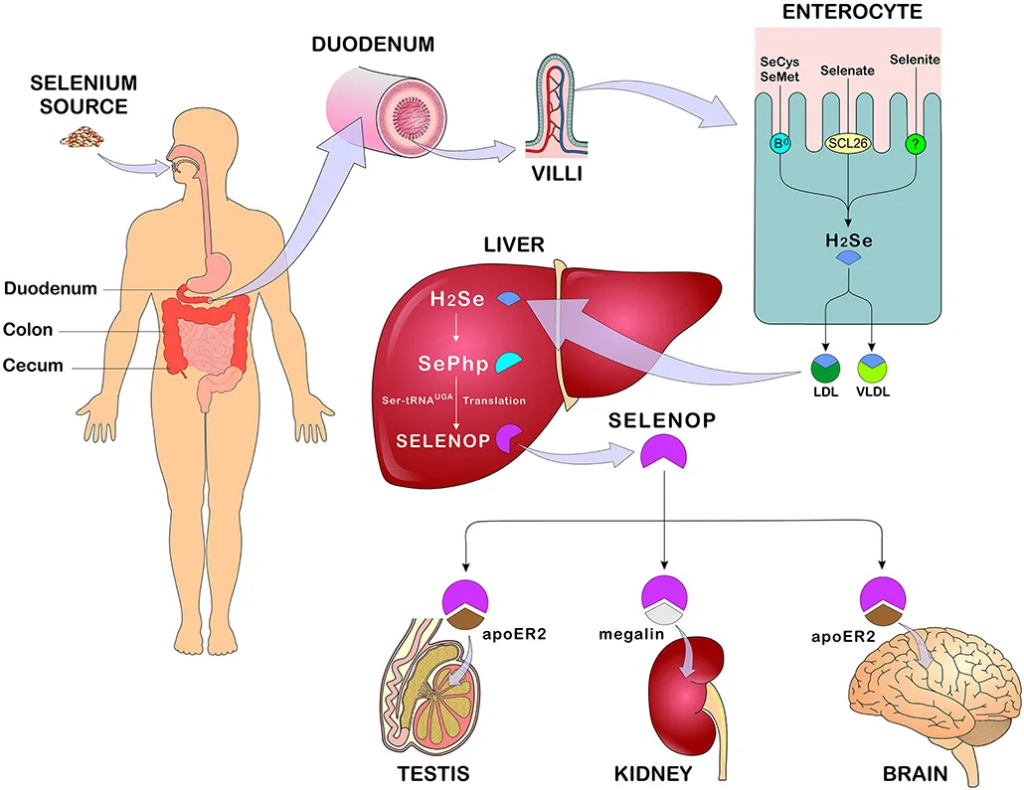
doi: 10.3389/fnut.2021.685317.
肠道微生物群的调节取决于硒的状态和硒衍生物的生物转化。
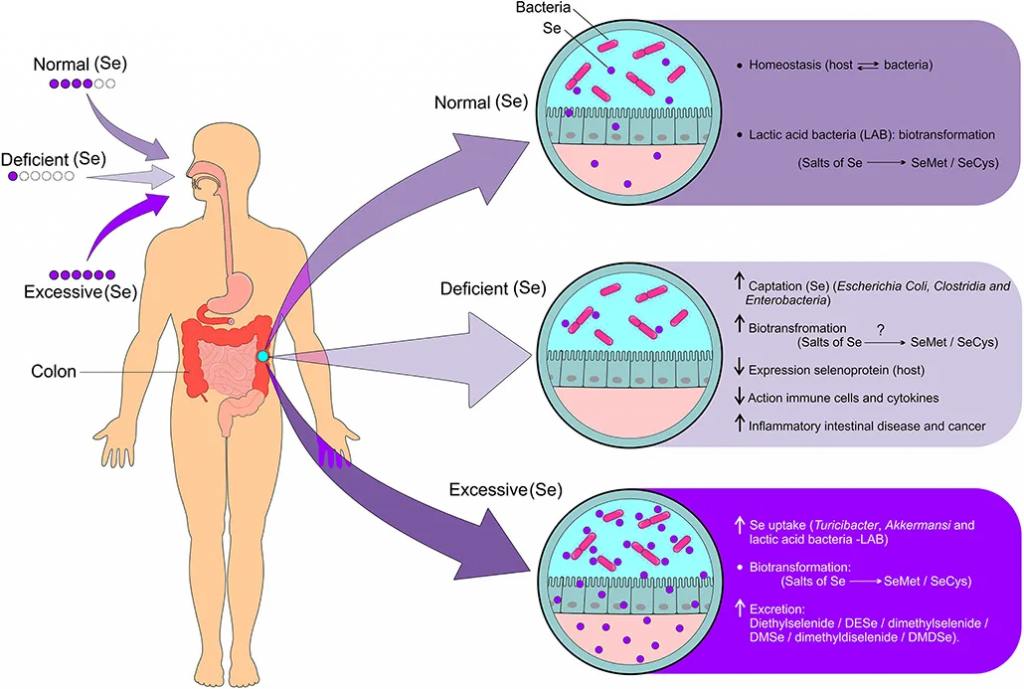
doi: 10.3389/fnut.2021.685317.
◮ 硒摄入充足时,肠道菌群有助于更好地转化和利用硒
如果硒摄入量充足,由于肠道和宿主细菌之间的有益关系,会导致硒化合物的生物转化(硒盐代谢为硒蛋氨酸和硒半胱氨酸),从而形成体内平衡。
一项研究表明,大鼠肠道菌群将几种无机和有机硒化合物代谢为硒蛋氨酸,并且硒蛋氨酸被整合到细菌蛋白质中。含有硒蛋氨酸的蛋白质可作为宿主动物的硒库,在肠道菌群中积累。尿液中的主要硒代谢物 SeSug1 被肠道菌群转化为营养上可利用的硒化合物。最后,在肠道菌群中观察到一些生物硒化合物(如SeCN、MeSeCys和SeSug1)对生物利用度有积极影响。
◮ 硒含量较低时,菌群会与宿主竞争导致更缺乏
尽管宿主和肠道菌群互利共生,但当微量营养素供应有限时,这两个环境就会变成竞争对手。肠道细菌对硒的吸收会对宿主体内硒蛋白的表达产生负面影响,导致硒蛋白在硒限制条件下的含量降低2到3倍。
硒缺乏会导致细菌(大肠杆菌、梭菌和肠杆菌)对硒的吸收增加,硒化合物的生物转化(硒盐代谢为硒蛋氨酸和硒半胱氨酸),宿主硒蛋白的表达减少,硒免疫细胞的活性降低,促炎细胞因子增加,炎症性肠病和癌症的风险增加。
◮ 一些菌群可以通过硒来增强毒力和致病性
一些细菌物种能够从硒中获益,从而触发致病机制。具有硒依赖性酶的细菌可以在哺乳动物肠道的厌氧条件下存活。因此,这些细菌通过使用硒来增加其毒力和致病性,从而对宿主产生一定危害。
硒状态可从三个层面进行评估,即摄入量、保留量/排泄量和组织浓度的生物标志物以及功能性生物标志物。
① 摄入量的评估
硒摄入量的评估可以使用评估食物消费的方法来执行,例如食物频率问卷。使用食物成分表可以估算食物中的硒含量。由于食物成分表中营养成分缺乏精确度,因此根据食物消费预测硒状态仍然是一个挑战,因为食物中硒浓度的变化与土壤中硒含量有关。
② 尿液硒浓度可以反应食物中的硒含量
测量尿液中的硒浓度被认为是硒状态的潜在可行生物标志物。此外,尿液中的硒浓度可用于识别硒状态的区域差异,并可能反映食物中硒含量随土壤类型的差异。
③ 指甲硒浓度可以反应硒的长期暴露情况
指甲中的硒浓度被认为是硒状态的优质生物标志物,因为它可以提供长期暴露(长达1年)的综合测量数据,而血液生物标志物则可指示短期暴露情况。注:脚趾甲被认为是非侵入性基质,并用于大型流行病学研究,因为它们生长缓慢、易于采集、受外部污染的影响较小。
④ 血浆硒浓度可以有效反应硒的摄入量情况
考虑到硒在血浆中的稳定性,血浆硒浓度是评估人体硒状态更有用的生物标志物。血浆中硒的测量已被证明可有效反映基线时硒浓度中等或较高的个体的摄入量 (补充) 变化。此外,强调了红细胞和全血中硒作为状态标志物的实用性,这两者都被报告为长期状态的标志物。
⑤ 硒功能的生物标志物
硒功能性的生物标志物包括SELENOP(占血浆硒的20-70%)、GPX3(占血浆硒的10-25%)和GPX1(可在红细胞、淋巴细胞、口腔细胞和组织活检标本中检测)。
血浆SELENOP被认为是硒摄入量相对较低的人群中硒状态的有用生物标志物,但不适用于硒摄入量高、在开始补充前硒水平就已经很高的人群。
GPX是细胞抗氧化防御系统的主要硒蛋白之一。由于硒蛋白的层次结构,推荐的硒摄入量是根据最佳血浆 GPX3 活性计算得出的。它还考虑了其他生物硒化合物正常浓度所需的硒量。
◮ 食物补充
巴西坚果、谷物、肉类、鱼类、海鲜、牛奶和坚果是硒的最佳来源。但鱼类和海鲜与汞相互作用会产生不溶性硒衍生物,从而降低硒的生物利用度。此外,饮食中的蛋白质、脂肪和重金属含量也会影响硒的生物利用度。
硒的生物利用度主要取决于其化学形态。一般而言,有机形态吸收更快。
◮ 药物补充
硒酵母胶囊:是一种常见的补硒药,主要成分为硒酵母,临床多用于治疗低硒的肿瘤、肝病、心脑血管疾病等。
亚硒酸钠片:属于一种常见的微量元素补充药,临床主要用于防治缺硒引起的疾病,如克山病、大骨节病等。
与矿物质相比,维生素在过去几年已经引起了广泛关注,市场上也涌现出众多维生素补充产品。因此,我们将维生素的讨论放在后面,但这并不意味着维生素的重要性被低估。顾名思义,维生素是“维持生命的重要元素”,它们在身体的正常运作、代谢过程以及免疫系统的健康中都扮演着不可或缺的角色。
维生素E又称生育酚,是一种脂溶性的维生素,是人体最主要的抗氧化剂之一。其对人体健康有多方面的作用,简单概况如下:
•抗氧化、抗自由基作用
•维持生育功能
•维持免疫功能
•减少细胞耗氧量
•改善脂质代谢
•抑制癌细胞分化
•促进红细胞膜稳定及红细胞的合成
•重要的血管扩张剂和抗凝血剂
•保护皮肤免受紫外线和污染的伤害
•对晶状体有一定保护作用
•促进蛋白质的更新合成
•治疗口腔溃疡
•治疗痔疮
最新的研究报告显示超过50亿人的维生素E摄入不足(占67%),这值得引起我们的重视。
根据最新的研究结果,探讨了维生素E缺乏的主要原因和促成因素。
① 营养缺乏
饮食中维生素E摄入不足,长期摄入低脂饮食或极低脂肪饮食可能导致维生素E摄入不足,因为维生素E是一种脂溶性维生素,主要存在于植物油、坚果和种子中。
缺乏富含维生素E的食物,如坚果、种子、植物油、绿叶蔬菜等。
② 吸收不良症
维生素E缺乏症通常是由脂肪吸收不良引起的,这种疾病会阻碍这种脂溶性维生素的正常吸收。脂蛋白代谢异常和α-生育酚转移蛋白缺陷等情况都可能导致维生素E缺乏。
③ 氧化应激和感染
发展中国家的人更容易出现维生素E缺乏症,因为他们更容易受到疟疾和艾滋病毒感染或其他氧化应激源的影响,而这些因素会增加人体对维生素E等抗氧化剂的需求。
④ 年龄和性别脆弱性
儿童和老年人更容易缺乏维生素E。此外,男性的风险可能高于女性,尽管这种性别差异的原因尚不完全清楚。
⑤ 减肥手术
接受减肥手术的患者,尤其是涉及吸收不良手术的患者,由于术后脂肪吸收受损,更容易出现维生素 E 缺乏症。
⑥ 遗传因素
家族性维生素E缺乏症是一种罕见的遗传综合症,会导致严重缺乏,并与氧化应激引起的多器官并发症有关。
⑦ 特殊人群需求量增加
饮用氯消毒自来水的人需要多摄入维生素E,心血管病患者、帕金森病患者、孕妇、中老年人和摄入酒精和激素的人维生素E的需求量也增大。
大多数人缺乏维生素E时,可能会导致贫血、免疫力下降、人体代谢紊乱、早衰、肌肉无力等症状。
•儿童
小儿缺乏维生素E时,可引发脊髓小脑病和轻度溶血性贫血。最为常见的是溶血性贫血,此外还可发生黄疸、全身性水肿、以及神经系统的症状,主要表现为小脑共济失调、色素性视网膜病、眼肌麻痹、眼球震颤和肌无力,反射减弱等。
•男性
男性严重缺乏维生素E会引起男性激素分泌不足、睾丸萎缩、精子生成障碍、精子减少或不成熟、精子活力不足等,甚至会导致不育。
•女性
女性缺乏维生素E容易导致黄体激素不足,易造成流产、不孕症、早产等,还容易造成皮肤干燥、易衰老。中年女性缺乏维生素E,很容易诱发更年期综合征、卵巢早衰。
•孕妇
孕妇若缺乏维生素E,所生婴儿会比较瘦小,发育较慢;孕妇严重缺乏维生素E会造成胚胎和胎盘萎缩,从而引起流产。
通过日常饮食调节维生素E是最便捷的方法,那么哪些食物中含有较高的维生素E呢?
种子植物的油,特别是小麦、黄豆、豌豆、棉籽和玉米胚芽油是含维生素E最丰富的来源(0.5-3mg/g)。
人造黄油也含有丰富的维生素E,而奶制品则含量较少,人和牛的初乳所含维生素E约比成熟乳含量高10倍。
其他植物如生菜,芹菜和甜薯也含有维生素E,但含量不高。蛋类、鸡(鸭)胗、绿叶蔬菜中也含有一定量的维生素E;肉,鱼类动物性食品,水果及其他蔬菜的维生素E含量较少。
维生素C,也称为抗坏血酸,是一种水溶性维生素,对人体健康非常重要。它在许多身体功能中起着关键作用,简单概况如下:
•抗氧化
•促进氨基酸中酪氨酸和色氨酸的代谢
•改善贫血
•增强免疫力
•促进胶原蛋白的形成
•防癌抗癌
•解毒排毒
•参与蛋白质合成
•改善脂肪和类脂特别是胆固醇的代谢
•提高钙的利用
① 饮食摄入不足
人体不能合成维生素C,必须从外界摄入。如果摄入不足,就有可能导致维生素C缺乏。
缺乏富含维生素C的食物:长期不摄入新鲜水果和蔬菜,如柑橘类水果、草莓、番茄、绿叶蔬菜等。
不均衡饮食:偏食或饮食单一,导致维生素C摄入不足。
② 吸收障碍
消化系统疾病:如克罗恩病、溃疡性结肠炎等,可能影响维生素C的吸收。
胃肠道手术:如胃切除术后,可能影响维生素C的吸收。
此外,维生素C遇热、碱或金属也极易被破坏,从而影响维生素C的利用。
③ 需求增加
生长发育期:儿童和青少年在快速生长阶段对维生素C的需求增加。
妊娠和哺乳期:孕妇和哺乳期妇女对维生素C的需求增加。
感染或疾病:在感染、手术或创伤后,身体对维生素C的需求可能增加。
④ 生活方式因素
吸烟:吸烟者体内维生素C的代谢加快,需求量增加。
酗酒:长期酗酒可能导致营养不良,包括维生素C缺乏。
维生素C缺乏症也称为坏血病,刚缺乏维生素C的时候症状不明显,大约一个月的时间才会出现症状。体内维生素C总含量低于300-400mg会出现明显症状。
•初期症状
缺乏维生素C初期常有一些非特异性表现,如易激、性情暴躁、倦怠、食欲减退、体重减轻和面色苍白等,也可出现易感染、伤口不易愈合或低热、呕吐、腹泻等消化功能紊乱症状。
•出血症状
随着病情的发展,可出现大小不等、程度不等的出血。常见长骨骨膜下出血;皮肤及黏膜出血多见于骨骼病变附近,膝部、踝部多见。
牙龈黏膜常肿胀、出血;也可出现鼻出血,眼结膜出血,眼眶骨膜下出血可引起眼球突出;偶见消化道出血、尿血甚至颅内出血。
•骨骼症状
维生素C缺乏症的较晚阶段患者下肢会由于骨膜下出血较多而肿胀、疼痛;部分患者肋骨与肋软骨的交接处会因骨干骺半脱位而隆起,形成坏血病串珠,内侧可扪及凹陷。
•长期症状
维生素C不足可影响铁的吸收和利用,加上长期出血会导致缺铁性贫血。当叶酸代谢障碍时,患者可能同时缺乏叶酸,从而出现巨幼红细胞贫血。
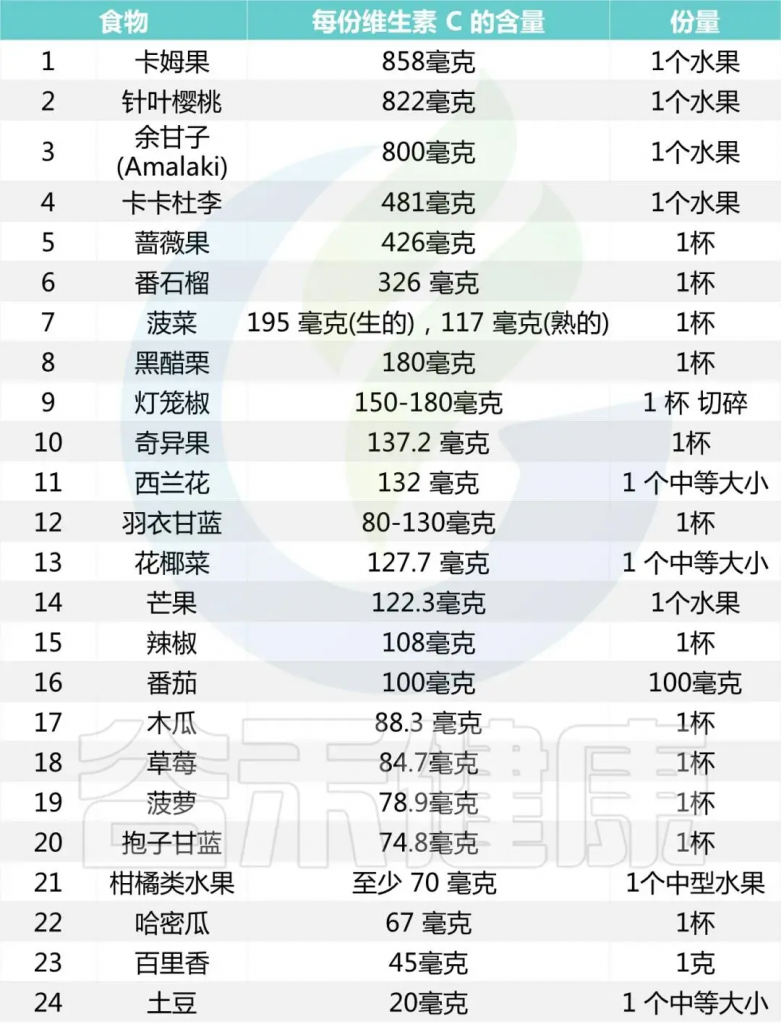
◮ 含维生素C的食物
维生素C广泛存在于新鲜蔬菜和水果中。番茄、花菜、柿子椒、深色叶菜、苦瓜、柑橘、柚子、苹果、葡萄、猕猴桃、冬枣中均富含维生素C。
一些维生素C含量较高的食物
◮ 维生素C补充剂
可以补充维生素C的药品多种多样,包括:
(1)维生素C片;
(2)维生素C泡腾片;
(3)抗坏血酸钙;
维生素A是一种重要的脂溶性维生素,又称抗眼干燥症因子。需要注意的是,维生素A并不是单一的化合物,而是一系列包括视黄醇、视黄醛、视黄酸、视黄醇乙酸酯和视黄醇棕榈酸酯等的视黄醇衍生物。
维生素A是最受关注的营养素之一,它对于维持正常的视力、基因表达、生殖、胚胎发育、生长和免疫功能都是极为重要的。维生素A在人体具有广泛而重要的功能:
•参与暗光视觉的物质循环,使机体可适应暗光环境
•保持皮肤和黏膜的完整
•细胞核激素样作用
•维持和促进免疫功能
•促进生长发育和维持生殖功能
•对骨骼代谢有影响
•抗氧化、防癌
•促进血红蛋白生成
自然界的维生素A包括维生素A1、维生素A2两种。维生素A1即视黄醇,多存在于哺乳动物及咸水鱼的肝脏中;维生素A2即3-脱氢视黄醇,常存在于淡水鱼的肝脏中,其生理活性为维生素A1的40%。
75%以上吃西方饮食的人获得的维生素A是足够的,不需要担心缺乏的问题。然而,在许多发展中国家,维生素A的缺乏是非常普遍的。在某些地区,大约44-50%的学龄前儿童有维生素A缺乏症。并且柳叶刀最新研究公布的数据显示,男性摄入的维生素 A不足量估计高于女性。
维生素A缺乏症的公共卫生数据
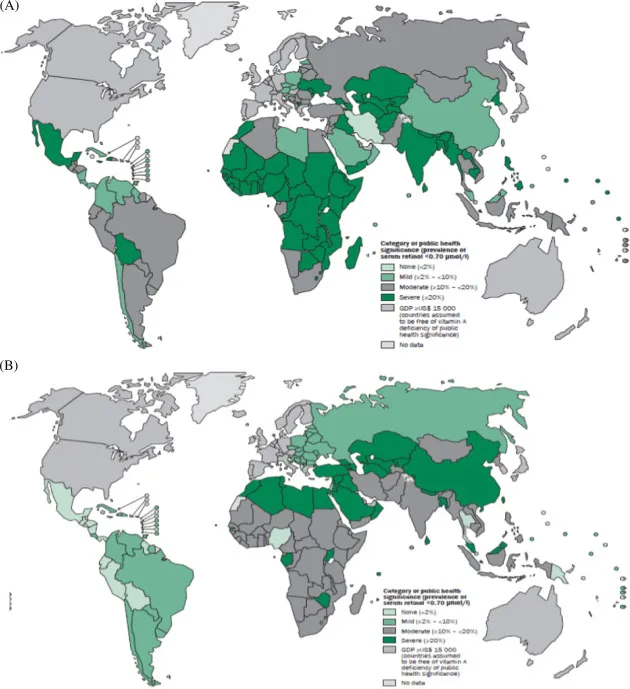
doi.org/10.1016/B978-0-12-802861-2.00002-X
上图反应了截止2018年的全球维生素A缺乏症情况:
(A)学龄前儿童;(B)孕妇
那么为什么一部分人会存在维生素A缺乏?主要是以下几点原因:
① 摄取不足
长期不摄入富含维生素A的食物,如动物肝脏、鱼肝油、乳制品、蛋黄,以及富含β-胡萝卜素的蔬菜和水果(如胡萝卜、甘薯、菠菜等)。
注:β-胡萝卜素,是一种原维生素A,你的身体能将其转化为维生素A。
② 排泄增加
肿瘤、泌尿系统疾病、急慢性感染性疾病等,可能会导致维生素A的消耗和流失增加,使得更易缺乏维生素A。
③ 吸收障碍
维生素A是脂溶性维生素,任何导致脂肪吸收不良的情况都会影响维生素A的吸收。这包括慢性胰腺炎、胆汁淤积、囊性纤维化等。
一些肠道疾病,如乳糜泻、克罗恩病等,这些疾病会影响肠道对维生素A的吸收。
④ 代谢异常
患有合成蛋白质和锌减少的疾病,如肝病、甲状腺功能低下、糖尿病等,导致胡萝卜素无法转变成维生素A。
维生素A的储存和代谢主要在肝脏进行,肝功能不全可能影响维生素A的代谢。
⑤ 需求增加
生长发育期:儿童和青少年在快速生长阶段对维生素A的需求增加。
妊娠和哺乳期:孕妇和哺乳期妇女对维生素A的需求增加。
无法通过正常饮食摄入足够的维生素A就可能导致这些人群缺乏。
•眼睛症状
维生素A的缺乏初期表现为眼睛干涩,随后可能出现夜盲;进一步发展会导致暂时和永久的眼睛损伤,甚至可能导致失明。这种缺乏是世界上主要的失明原因。
•皮肤症状
初期表现为皮肤干燥、脱屑;进一步发展可在大腿和手臂出现大量的丘疹,后期可蔓延至颈、腹、背等部位。
•生长发育障碍
长期缺乏维生素A,患儿可表现为骨骼粗短,牙齿发育不良、生长缓慢、智力轻度落后等。
•贫血
维生素A可以促进铁的吸收,当维生素A缺乏时,铁不能正常地被红细胞吸收,会造成贫血。
•免疫力下降
由于维生素A直接影响上皮细胞的体液免疫和细胞免疫,对机体的特异性免疫和非特异性免疫都具有一定作用,如果缺乏维生素A会导致机体的免疫力下降,容易继发感染性疾病。
•其他影响
缺乏维生素A还可能影响味觉、嗅觉的功能,导致食欲下降。
维生素A存在于动物体内,在鱼类特别是鱼肝油中含量很多。维生素A主要来源于各种动物肝脏和其他脏器类肉品,蛋黄、鱼油、奶油和奶制品。
植物中并不含有维生素A,但许多蔬菜和水果却含有维生素A原,维生素A原是指在人体内能转变为视黄醇,发挥维生素A生理功能的类胡萝卜素。富含维生素A原的食物包括各种红、黄、绿色蔬菜和水果,如胡萝卜、红心甜薯、菠菜、水芹、羽衣甘蓝、芥菜、南瓜、莴苣、西兰花等。
维生素B12,又称钴胺素,是一种水溶性维生素。维生素B12家族有四个成员,即氰钴胺、羟钴胺、腺苷钴胺和甲钴胺。
维生素B12对多种基本代谢功能至关重要,包括:
•促进红细胞发育
•促进人体神经细胞发育
•促进甲基转移
•提高叶酸利用率
•还参与脱氧核糖核酸(DNA)的合成,以及脂肪、糖类、蛋白质的代谢
•促进维生素A在肝脏的储存
维生素B12缺乏症非常常见,尤其是在素食者、孕妇和老年人中。同时数据表明女性摄入的维生素 B12不足量估计高于男性。
而导致维生素B12缺乏的原因可能是以下几种:
① 先天储备不足
孕妇多因长期素食、恶性贫血、胃肠道手术等引起体内维生素B12缺乏,从而导致新生儿维生素B12先天储备减少。
② 饮食结构不合理
长期素食或苯丙酮尿症患者长期拒绝动物蛋白摄入可引起体内维生素B12缺乏。
③ 吸收异常
包括以下几种情况:内因子的异常或缺失、维生素B12释放缓慢、回肠吸收面积减小、回肠维生素B12结合受体异常。
④ 先天性维生素B12代谢障碍
钴胺转运蛋白II是维生素B12的主要转运蛋白,先天性钴胺转运蛋白II缺乏可导致维生素B12转运障碍,从而出现维生素B12缺乏。
⑤ 其他因素
麻醉剂氧化亚氮可导致维生素B12失去生物活性,引起脊髓变性;大剂量维生素C可导致食物中维生素B12的利用率下降;不适当补给叶酸可诱导或加重维生素B12缺乏。
缺乏维生素B12导致的疾病有巨幼红细胞性贫血、神经系统损害、高同型半胱氨酸血症。
•血液系统
缺乏维生素B12可表现为贫血,乏力、肝脾大,重症患者可有皮肤瘀点、瘀斑等。严重者有发热,皮肤、巩膜轻度黄染。
•神经系统
症状出现较迟,有神经障碍、脊髓变性,脱髓鞘和严重的精神症状,患者有手指和脚对称性麻木及感觉异常、出汗障碍,指端和关节突处溃疡、行动困难、共济失调、健忘、易激、甚至痴呆。年幼患者有精神抑郁、智力减退,头、四肢和躯干震颤,亦可因昏迷而死亡。
•消化系统
消化道症状有呕吐,腹泻和舌炎,舌乳头萎缩,舌面有炎性小疱或浅溃疡,自觉疼痛。
•心脑血管
维生素B12缺乏会引起同型半胱氨酸过高,导致动脉粥样硬化、心脑血管疾病。
•小儿缺乏维生素B12
早期表现为精神情绪异常、表情呆滞。少哭少闹、反应迟钝、睡眠多等症状,最后可能出现贫血。
肠道菌群可以是维生素B12的消费者或生产者。
◮ 肠道细菌过度生长会导致维生素B12缺乏
胃肠道中大约80%的微生物群被认为是维生素B12的消费者。因此,细菌过度生长可能会与宿主竞争外源性维生素B12,从而降低生物利用度。在小肠细菌过度生长中,厌氧菌增加对维生素B12的消耗被认为是维生素B12缺乏症状的主要原因。
减少维生素B12消耗细菌的数量对维生素B12缺乏症有益。例如,每日使用益生菌治疗乳酸杆菌对细菌过度生长和维生素B12吸收均有益,这表明益生菌治疗可以改善维生素B12缺乏症。
◮ 一些肠道菌群可以产生维生素B12
据报道,有几种细菌是维生素B12的生产者,如罗伊氏乳杆菌和屎肠球菌。从发酵食品中分离出的植物乳杆菌和棒状乳杆菌产生维生素B12,而动物双歧杆菌在牛奶发酵过程中合成维生素B12。
此外,可能参与维生素B12合成和代谢的菌还有:
大约三分之一的嗜黏蛋白阿克曼菌(A.muciniphila)分离株能产生类似于A.glycaniphila的维生素B12。多种结肠微生物可以产生可供A.muciniphila利用的维生素B12。
据推测,补充产生维生素B12的细菌可以改善胃肠道对维生素B12的利用率。这种假设已在喂食缺乏维生素B12饮食的小鼠身上得到证实。补充产生维生素B12的菌株罗伊氏乳杆菌CRL1098可预防维生素B12缺乏的症状,表明肠道细菌对维生素B12缺乏症具有治疗作用。
◮ 肠道菌群改善了维生素B12的吸收利用
肠道菌群除了生产或消耗维生素B12外,还可能通过影响吸收相关的生理因素间接改变维生素B12的生物利用度。
与酸分泌或酶含量减少有关的胃肠道疾病可能会干扰食物中维生素B12的释放或维生素B12转化为内在因子。在以肠道通透性异常为特征的炎症性肠病中也观察到维生素B12吸收减少。
作为益生菌,Lacidofil治疗显著改善了H.pylori感染的胃酸分泌,从而有助于食物中维生素B12的释放。一些肠道细菌也表现出对炎症性肠病的缓解作用,这可能通过使肠道通透性正常化来改善维生素B12的吸收。
然而,肠道菌群与宿主之间的过度竞争可能会干扰维生素B12的生物利用度。例如,多形拟杆菌 (Bacteroides thetaiotaomicron)表达一种对维生素B12运输至关重要的表面暴露脂蛋白,名为BtuG。BtuG的结合亲和力较高,可能会将维生素B12从内在因子中移除,从而降低维生素B12的吸收。
饮食和微生物群的在维生素B吸收中的作用
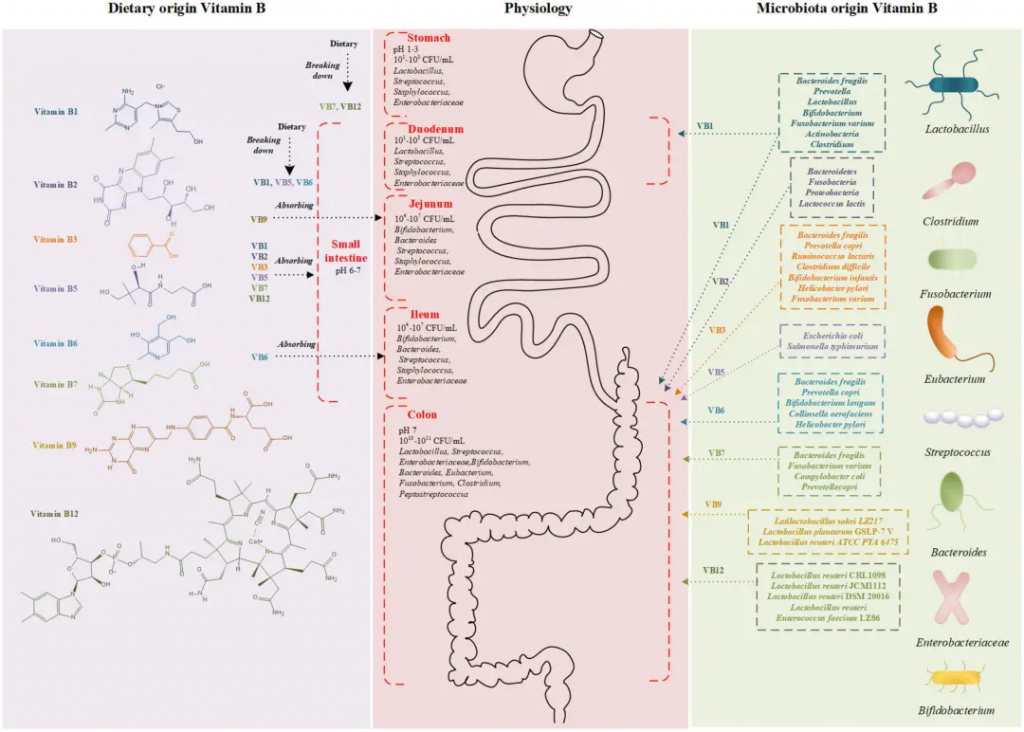
Wan Z,et al.Front Nutr.2022
维生素B12的膳食来源主要为动物性食品,含维生素B12较丰富的食物为动物内脏(肝、肾、心)、双壳贝(蛤、蚶和牡蛎)、脱脂奶粉、蟹、石鱼、鲑鱼、沙丁鱼和蛋黄,其他还有龙虾、鳕鱼、比目鱼、金枪鱼、发酵奶酪、鲜奶制品。
豆制品经发酵也会产生一部分维生素B12。
!
小贴士
有的人可能会担心维生素B12补充过量是否会存在一定风险,大量的维生素B12并不有害,因为它通常吸收不好,容易排出体外。
目前对体内维生素水平是否缺乏有以下几种方法:
1
临床症状观察
观察身体是否出现特定维生素缺乏的症状。例如,维生素C缺乏可能导致牙龈出血,维生素D缺乏可能导致骨骼疼痛或软化。
2
血液检测
血清维生素水平:通过血液检测直接测量特定维生素的浓度,如维生素D、B12、A等。
代谢产物检测:测量血液或尿液中某些代谢产物的水平,间接反映维生素状态。
3
饮食评估
饮食记录分析:记录几天的饮食,分析是否摄入足够的维生素。
食物频率问卷:通过问卷了解饮食习惯,评估维生素摄入情况。
4
肠道菌群健康检测
通过肠道菌群健康检测,也可以查看近期体内维生素状况。
与通过血液进行维生素检测不同,肠道菌群的评估更加反映一段时间(一般2周左右)的长期状态。
注意,菌群会受检测前一天饮食的影响,造成15~30%的菌群改变,同样也会反映在营养状况的评估上,因此建议检测前一天尽量保持近期正常饮食 ,这样能更好的反映真实的营养饮食状态。
5
功能性测试
红细胞溶血试验:用于评估维生素E的抗氧化能力。
骨密度测试:用于评估维生素D缺乏对骨骼的影响。
在了解维生素的重要性和缺乏带来的危害后,我们还需要了解一下影响维生素合成吸收的因素。
1
年龄变化
维生素缺乏是一个严重的问题,尤其是在老年人中。随着年龄的增长,营养需求会随之变化。
例如食物中的维生素B12需要胃酸及胃蛋白酶的作用才能释放出来被吸收,而老年人胃酸及胃蛋白酶分泌减少,就会影响维生素B12的吸收。
2
饮食摄入
不同的食物含有不同种类和数量的维生素。新鲜水果、蔬菜、全谷物、坚果、种子、肉类和乳制品是维生素的主要来源。饮食中缺乏这些食物会导致维生素摄入不足。
维生素主要在小肠中吸收,其生物利用度取决于食物成分,相关相互作用等。饮食和膳食的组成会通过影响肠道转运时间或混合胶束的肠道形成来影响某些维生素的吸收。
饮食中足量的水和膳食脂肪对于分别吸收水溶性和脂溶性维生素至关重要。
由于脂溶性维生素可以溶解在脂肪中,因此与膳食脂肪一起食用时最容易被吸收。例如,一种富含维生素A的小胡萝卜,如果单独食用,将在食物中获取维生素A,但如果它是在含有一些膳食脂肪的食物成分中(比如说,橄榄油),将增加体内维生素A的吸收。
doi: 10.7717/peerj.11940
食物的性质(物理状态)也会影响维生素的吸收效率。例如,存在于可消化性较差的纤维植物材料中的类胡萝卜素已被证明相对于维生素A表现出较低的生物利用度。
3
药物的使用
一些药物会改变营养物质的吸收或代谢方式。例如,抗惊厥药会减少叶酸的吸收。
抗生素的使用会影响众多维生素特别是B族维生素的吸收。例如,在饮食中添加青霉素和金霉素会增加雄性大鼠的肝脏维生素B2浓度,以及B2和B3在尿液中的排泄。然而,链霉素和放线菌酮的施用降低了肝脏中维生素B9和B12的浓度。
4
遗传因素
人类基因的变异与肠道结构和微生物组组成有关。人类肠道微生物群中存在不同的维生素B生物合成途径支持人类遗传变异影响维生素B合成的观点。
维生素的合成吸收不仅需要靠饮食补充,还与吸收相关。而维生素的吸收涉及到相关基因,例如:
MTHFR 基因的突变会影响我们产生加工维生素B9的酶——亚甲基四氢叶酸还原酶。
亚甲基四氢叶酸还原酶是叶酸代谢通路中的一种重要的辅酶,亚甲基四氢叶酸还原酶基因缺陷,容易造成叶酸在体内的代谢障碍,MTHFR基因最主要的两种突变为C677T、A1298C基因多态性。该两种位点同时突变可显著降低MTHFR活性进而降低叶酸水平。
VDR基因(维生素D受体):维生素D(来自阳光、食物或补充剂)经过转化步骤后,活性形式骨化三醇 (1,25(OH)2D3 ) 可以通过VDR在细胞内发挥作用,是打开或关闭基因的转录因子。该基因突变可能导致维生素D缺乏引起的佝偻病。
5
菌群影响维生素的合成吸收
肠道菌群通过各种代谢途径影响维生素的合成,例如拟杆菌属、肠球菌属和双歧杆菌属等人类肠道共生菌可以从头合成维生素K和大多数水溶性B族维生素。
6
暴露于自由基
自由基是含有不成对电子的化学物质,可以诱导氧化应激。一个这样的例子是一氧化氮,它与金属离子形成复合物,包括钴,维生素B12的一种结构成分,因此使其无法用于细菌维生素B12的生物合成。此外,维生素生产者(如脆弱拟杆菌)暴露于过氧化氢等自由基会抑制其生长 ,从而降低维生素的生物合成能力。
1
通过饮食直接补充
当我们知晓维生素缺乏的时候,可能希望通过饮食来补充相应缺乏的维生素,下表列出了常见的维生素的食物来源,可供参考。

此外,宿主饮食作为肠道中细菌的底物,含有益生元和其他膳食营养素(如微量营养素和多酚)的饮食可以显著影响有益细菌的生长,包括维生素生产菌,从而有利于产生更多的维生素。
一些维生素,如核黄素(维生素B2),可作为氧化还原介质并刺激营养缺陷菌(如Faecaibacterium prauznitsii)的生长。
2
通过产维生素的益生菌调节
除了通过饮食直接补充之外,我们还可以通过补充产维生素的益生菌来调节,从而改善疾病。
双歧杆菌—叶酸
在健康成人中补充益生菌菌株青春双歧杆菌DSM 18350、青春双歧杆菌DSM 18352和假链双歧杆菌DSM 18353,导致粪便中叶酸浓度显著增加。
乳酸菌—核黄素
乳酸菌通过产生核黄素(维生素B2)和叶酸发挥抗炎和抗氧化作用。乳酸菌通过不同的机制抑制炎症过程,包括调节炎症性肠病患者肠道菌群紊乱、保护肠道屏障和黏膜的正常功能、调节人体免疫反应等。
AKK菌—维生素B12
Akkermansia muciniphila是肠道中的一种常见细菌,可保护肠道免受炎症和肿瘤侵袭;它还产生维生素B12以缓解炎症性肠病患者的维生素缺乏症。
产维生素的益生菌及其作用

doi.org/10.3390/nu14163383
3
使用补充剂
在饮食无法满足需求时,可以考虑使用维生素补充剂,特别是对于特定人群(如孕妇、老年人、素食者等)。
个性化营养方案:在使用补充剂前,最好咨询医生或营养师,以制定个性化的饮食和补充方案,以满足特定的维生素需求。
4
调整生活方式
避免过度烹饪:过度烹饪会导致食物中的维生素流失,因此在烹饪食物时应尽量减少烹饪时间和温度。
避免吸烟和饮酒:吸烟和饮酒会影响身体对维生素的吸收和利用,因此应尽量避免吸烟和饮酒。
适量运动:适量运动有助于改善整体健康,促进营养吸收。
晒太阳:阳光中的紫外线可以促进合成维生素D,因此适当晒太阳可以帮助维持体内维生素D的水平。
5
定期健康检查
通过血液检测等方式监测维生素水平,及时发现缺乏或过量。在谷禾肠道菌群健康检测中,我们也能看到结果报告中关于维生素的评估。
治疗基础疾病,保持健康状态:某些疾病(如消化系统疾病)可能影响维生素的吸收,治疗这些疾病有助于改善维生素水平。
微量营养素(矿物质和维生素)缺乏是全球最常见的营养不良形式之一,尤其在中低收入国家的妇女、幼儿和青少年、老年人中更为严重。这种缺乏及其负面后果是许多地区的重要公共卫生问题,影响国民健康和经济。
世界卫生组织(WHO)和联合国粮食及农业组织(FAO)确定了改善微量营养素缺乏症的四大策略:营养教育,提高饮食多样性和质量;食品强化;补充;以及疾病控制措施。
当微量营养素缺乏较严重时,应采用补充剂。补充剂可以每日服用,也可以间歇性服用。补充剂作为一种策略,要求补充剂的提供切实可行,并有足够的计划来确保依从性。但补充剂并不能解决缺乏的根本原因,只是提供了一种相对经济有效的短期解决方案。人们越来越担心补充营养素可能表现出与食物中的营养素不同的生理反应和吸收:叶酸、锌和铁就是一个例子。
与补充剂相比,饮食改善是一种更长期的对抗微量营养素缺乏的策略。改善饮食与补充剂的不同之处在于,改善饮食意味着摄入丰富多样的食物,这些食物中含有多种微量营养素以及其他对健康有益的成分,同时食物中的微量营养素通常以天然的形式存在,与其他成分相互配合,使得它们更容易被人体吸收和利用。并且食物中的微量营养素其含量和比例相对较为安全,不至于补充过量。
一种新兴方法是生物方法,即可以通过改善肠道菌群来调节微量营养素水平,从而改善疾病。肠道菌群可以改善微量营养素的吸收利用,而肠道细菌过度生长会导致与宿主竞争,进而微量营养素缺乏。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
特别说明:本文中营养缺乏状况是基于柳叶刀-全球健康研究的185个国家的调查情况,中国居民的膳食营养缺乏可能与其存在一定差异,比如我国由于长期使用添加碘盐,碘缺乏的人群比例要远低于该研究。
主要参考文献
Singer P, Robinson E, Raphaeli O. The future of artificial intelligence in clinical nutrition. Curr Opin Clin Nutr Metab Care. 2024 Mar 1;27(2):200-206.
Barone M, D’Amico F, Brigidi P, Turroni S. Gut microbiome-micronutrient interaction: The key to controlling the bioavailability of minerals and vitamins? Biofactors. 2022 Mar;48(2):307-314.
Das NK, Schwartz AJ, Barthel G, Inohara N, Liu Q, Sankar A, Hill DR, Ma X, Lamberg O, Schnizlein MK, Arqués JL, Spence JR, Nunez G, Patterson AD, Sun D, Young VB, Shah YM. Microbial Metabolite Signaling Is Required for Systemic Iron Homeostasis. Cell Metab. 2020 Jan 7;31(1):115-130.e6.
Knezevic J, Starchl C, Tmava Berisha A, Amrein K. Thyroid-Gut-Axis: How Does the Microbiota Influence Thyroid Function? Nutrients. 2020 Jun 12;12(6):1769.
Wang J, Wu S, Zhang Y, Yang J, Hu Z. Gut microbiota and calcium balance. Front Microbiol. 2022 Dec 20;13:1033933.
Shkembi B, Huppertz T. Calcium Absorption from Food Products: Food Matrix Effects. Nutrients. 2021 Dec 30;14(1):180.
Shlisky J, Mandlik R, Askari S, Abrams S, Belizan JM, Bourassa MW, Cormick G, Driller-Colangelo A, Gomes F, Khadilkar A, Owino V, Pettifor JM, Rana ZH, Roth DE, Weaver C. Calcium deficiency worldwide: prevalence of inadequate intakes and associated health outcomes. Ann N Y Acad Sci. 2022 Jun;1512(1):10-28.
Fiorentini D, Cappadone C, Farruggia G, Prata C. Magnesium: Biochemistry, Nutrition, Detection, and Social Impact of Diseases Linked to Its Deficiency. Nutrients. 2021 Mar 30;13(4):1136.
Farsinejad-Marj M, Saneei P, Esmaillzadeh A. Dietary magnesium intake, bone mineral density and risk of fracture: a systematic review and meta-analysis. Osteoporos Int. 2016 Apr;27(4):1389-1399.
World J Gastroenterol. Jan 14, 2023; 29(2): 332-342Published online Jan 14, 2023.
Ferreira RLU, Sena-Evangelista KCM, de Azevedo EP, Pinheiro FI, Cobucci RN, Pedrosa LFC. Selenium in Human Health and Gut Microflora: Bioavailability of Selenocompounds and Relationship With Diseases. Front Nutr. 2021 Jun 4;8:685317.
Valdes AM, Louca P, Visconti A, Asnicar F, Bermingham K, Nogal A, Wong K, Michelotti GA, Wolf J, Segata N, Spector TD, Berry SE, Falchi M, Menni C. Vitamin A carotenoids, but not retinoids, mediate the impact of a healthy diet on gut microbial diversity. BMC Med. 2024 Aug 7;22(1):321.
Singer P, Robinson E, Raphaeli O. The future of artificial intelligence in clinical nutrition. Curr Opin Clin Nutr Metab Care. 2024 Mar 1;27(2):200-206.
Ian Darnton-Hill,Chapter 2 – Prevalence, Causes, and Consequences of Micronutrient Deficiencies. The Gap Between Need and Action,Editor(s): M.G. Venkatesh Mannar, Richard F. Hurrell,Food Fortification in a Globalized World,Academic Press,2018,Pages 13-28,
ISBN 9780128028612.
Wan Z, Zheng J, Zhu Z, Sang L, Zhu J, Luo S, Zhao Y, Wang R, Zhang Y, Hao K, Chen L, Du J, Kan J, He H. Intermediate role of gut microbiota in vitamin B nutrition and its influences on human health. Front Nutr. 2022 Dec 13;9:1031502.
谷禾健康
大脑健康,其实是我们每个人日常生活质量的关键所在。从决策到记忆,从情绪管理到社交互动,大脑在我们生活中扮演着不可或缺的角色。
近年来,科学研究逐渐揭示大脑健康、神经发生与神经营养素以及肠道菌群之间存在着密切的联系。
研究人员逐渐认识到,大脑在一生中不断通过形成新的神经连接来进行自我重组。大脑中新神经元的诞生被称为神经发生。现在科学认为,大脑在一生中不断自我重组并创造新的脑细胞。
神经生长因子 (NGF) 是一组称为神经营养因子的类蛋白质小分子之一,负责神经发生或新神经元的发育以及成熟神经元的健康和维持。
根据动物研究结果,研究人员认为神经生长因子可能促进神经元和轴突的生长、维持和存活。它还被认为有助于修复髓鞘,髓鞘是轴突周围的绝缘涂层。
动物实验发现,随着大脑中神经生长因子产生的减少,动物形成新连接以及保留和访问记忆的能力就会受到损害。神经生长因子可能会挽救退化的神经并帮助恢复其功能,但缺乏人体数据。
神经营养素有的像是ω-3脂肪酸这样分子,给大脑细胞补充能量,让其更加强健;有的则像是维生素E和C这样的抗氧化剂,为大脑提供了一层无形的护盾,对抗那些想要损害大脑的自由基;还有的,比如B族维生素,它们确保大脑的能量供应,让我们的思维更加敏捷。
肠道菌群是肠道中的居民,它们与大脑通过“肠-脑轴”的紧密相连。肠道菌群可以通过多种机制影响大脑功能,包括通过调节免疫系统、产生神经递质以及影响神经发生。不健康的肠道菌群组成可能会导致炎症的增加,从而影响大脑健康,增加患有情绪障碍和神经退行性疾病的风险。“肠-脑轴”让我们的大脑和肠道可以互相传递信息,这导致吃进肚子里的食物,能影响我们的情绪和思维。
科学家们通过不断的研究,揭示了这些微生物如何帮助我们的大脑保持年轻和活力。例如,补充ω-3脂肪酸可以改善记忆力,抗氧化剂的摄入与减缓认知衰退有关。
本文我们来了解一下神经发生、神经营养素、神经营养因子及其与肠道菌群的关联等,通过了解这些关键的生物学概念及其相互作用,可以采取措施维持肠道微生物群的平衡,可以为大脑提供必要的支持,提高认知能力,有效减缓认知衰退,从而保持其长期的活力和健康。

神经发生,或称神经元发生,是指在成年大脑中新的神经元(神经细胞)的形成过程。
成年大脑定型了吗?
长期以来,科学家们曾认为成年人的大脑不再能够产生新的神经元,也就是说大脑的结构和功能一旦在儿童时期和青少年时期形成之后便定型,不会有太大的变化。
然而,近年来的研究发现,成年大脑确实能够通过神经发生产生新的神经元,尤其是在海马区和嗅球区等特定区域。这一发现不仅挑战了以往的认知,也为理解大脑的可塑性、学习记忆机制以及大脑疾病的治疗提供了新的视角。

神经发生对大脑健康的影响和意义是多方面的
首先,它是大脑适应环境变化、学习新知识和技能的基础。新的神经元能够形成新的神经网络,增强大脑的处理能力和记忆存储能力。例如,在学习和记忆过程中,海马区的神经发生是非常重要的。
其次,神经发生对情绪调节和应对压力也有重要作用。研究表明,抑郁症和焦虑症患者的海马区神经发生水平较低,而适当的运动和抗抑郁治疗可以促进神经发生,改善情绪。
然而神经发生并非在所有情况下都是有益的
在某些脑部疾病,如癫痫,过度的神经发生可能导致异常的神经网络形成,引发病症的加剧。因此,如何在促进神经发生的同时,维持神经网络的稳定性和功能性,是当前研究的一个重要课题。
生活方式对神经发生也有显著影响
研究发现,规律的身体锻炼、充足的睡眠、健康的饮食习惯、积极的社交活动、一些草药和补充剂例如褪黑激素、尿苷等都能够促进成年大脑的神经发生。相反,长期的压力、抑郁、睡眠不足以及不健康的生活方式则可能抑制神经发生。
总之,神经发生是大脑适应环境变化、学习和记忆、以及情绪调节的一个重要机制。了解和促进神经发生的过程,不仅对于提高个体的认知功能和情绪健康有重要意义,也为治疗各种神经系统疾病提供了新的策略和方法。随着科学研究的深入,相信在未来,通过调控神经发生,人类将能更好地维护大脑健康,提高生活质量。
大脑可以看做是一座正在建设中的超级城市,而神经营养素就是那些建设这座城市所需的原材料和工人。这些营养素通过一系列精妙的机制,共同打造出一个健康、功能强大的大脑。
那这些机制是如何运作的呢?
“大脑城市”的基础工程:细胞外基质分子及受体
首先,有些像是建筑工地上的脚手架和信号旗,细胞外基质(ECM)分子及其受体(比如层粘连蛋白和纤连蛋白)为神经元提供结构支持和方向指示。它们确保神经元能够正确生长和相互连接,就像确保城市中的道路和桥梁精准对接一样。
“大脑成长”的营养奶粉:关键营养素
假如说这座城市还是个婴儿城市,那它在成长的早期阶段需要大量的“营养奶粉”,这里指的是蛋白质、能量、长链多不饱和脂肪酸、维生素和矿物质。这些营养素保证了城市(也就是我们的大脑)的健康发育,为神经细胞的生长、分化提供能量和原料。
而微量元素,比如铁、锌和碘,就像是城市中的微型工程队,它们在大脑发育中扮演着至关重要的角色。铁负责运输“氧气”,锌则负责“通信系统”的建设,保证城市运转顺畅。
“大脑城市”规划师与交通系统:神经营养因子与神经活动的调节
还有前面说到神经营养因子,如NGF和BDNF,它们就像是城市规划师和建筑师,指导神经元如何成长和相互连接,确保大脑城市的设计既清晰又实用。
神经活动的调节作用就像城市中的交通系统,根据需要调整道路和信号灯,以保证信息流动的顺畅和效率,从而促进大脑的可塑性和学习能力。
脂质在这个比喻中,可以看作是提供能量和材料的重要来源,帮助城市中的建筑物更加坚固,同时保证城市的能源供应。
生命早期的营养对这座城市的未来有着长远的影响。正确的营养摄入不仅能促进城市的健康成长,还能避免未来出现结构和功能的问题,确保城市居民(即我们的神经细胞)能够快乐、健康地生活。
这些神经营养素和它们的作用机制共同努力确保了我们的大脑能够健康成长,展现出最佳的功能。
试想一下,你的大脑始终处于工作的状态——调整呼吸和心跳、接收和处理信息、产生思想和调控运动等,即使你在睡觉时,它依然在24小时全天候工作。这就意味着你的大脑需要持续稳定的燃料供应,而这种“燃料”正是来源于你每天所吃的食物。
相比于其他身体部位,大脑消耗大量的能量。虽然人的大脑仅仅占人体重量的2%,但它所消耗的能量可占总能量的20-25%。因此,从食物到大脑神经元的能量转移所涉及的机制可能是调控脑功能的基础,能量代谢紊乱可直接影响大脑功能。
过去人们对食物的认知,还停留在为人体提供能量和提供构造身体的原料。现在越来越多的证据表明,某些营养素的摄入不足或过量都可直接影响神经健康,从而影响大脑的结构和功能,并最终影响认知和情绪。
如果把大脑想象成一个超级复杂的宇宙,神经营养素则是其中的超级英雄,守护着我们的认知功能——记忆、学习能力,乃至抵御神经退行性疾病的侵袭。但这并不简单,因为这些超级英雄的力量来源,也就是我们的饮食模式和营养素摄入量是可变的,有时候也可能成为我们的隐形敌人。
首先,看下反面角色。
高脂肪和高糖的饮食模式,就像是给大脑施加了一个沉重的负担,特别是在海马体这个与学习和记忆密切相关的区域,它们会导致突触功能障碍和神经可塑性的减退。
但也有积极的力量。膳食脂质,比如磷脂和鞘脂,是认知功能的守护者,通过影响我们肠道的微生物组成,它们以一种隐秘的方式保护着我们的认知健康。
优质脂肪
起初,大家认为脂肪对心血管系统功能有影响;但最近的研究显示,有益的膳食脂肪更对大脑有直接的作用,包括:
抗氧化维生素如β-胡萝卜素、α-生育酚以及叶酸,可以抵御认知功能的衰退。
植物营养素
类胡萝卜素是食物中的色素,让水果和蔬菜呈现色彩,如黄色、红色和橙色等。
植物营养素家族中一些较有影响力的成员,叶黄素和玉米黄质,相比有益大脑的功效,它们支持眼睛健康的效果更熟为人知。这些营养素与正常健康的认知功能有关。
大脑也需要其它营养素。它们是帮助保护大脑免受氧化压力损伤的抗氧化成分,可以尝试以下食物:
胡萝卜、南瓜、菠菜、红薯、红甜椒、番茄、羽衣甘藍等。
而当谈论营养状况对认知能力的影响时,B族维生素、维生素D、E和omega-3脂肪酸的摄入量成了关键角色。它们是大脑宇宙中的正能量,但过量摄入又可能适得其反,成为负面力量,引发高血压和血糖控制不佳等问题。
图源:askthescientists
Omega-3脂肪酸在促进大脑发育和维持大脑正常功能方面起着重要作用,其中DHA还是神经细胞膜的重要成分。人体无法自行合成Omega-3脂肪酸,因此这属于人体必需脂肪酸,这意味着这些重要脂肪酸的唯一来源是我们所摄入的食物。
Omega-3脂肪酸的主要来源是多脂鱼类,包括:
三文鱼、沙丁鱼、鲱鱼等。其中主要以DHA和 EPA的形式存在。
研究表明,多摄入DHA和EPA对认知功能具有保护作用;还可帮助改善患有轻度认知障碍人群的认知功能。
胆碱
胆碱在人体中具有多种重要功能。胆碱可与磷脂结合成磷脂酰胆碱,是大脑和神经元细胞膜的重要组成成分。同时,它也是神经递质——乙酰胆碱的前体分子,对神经信息传递起着重要作用,可控制人的运动、记忆和情绪等。
胆碱的缺乏还与某些肝脏疾病和神经系统疾病的发生有关。
可以选择一些食物如:
叶酸和维生素B12
叶酸(维生素B9)和维生素B12对于生命早期的神经发育至关重要,孕期如果缺乏这两种营养素,可能会导致胎儿神经管发育畸形。
血液中同型半胱氨酸水平过高可增加认知功能减退和患痴呆症的风险,而叶酸和维生素B12可降低血液中同型半胱氨酸的水平,从而降低认知功能减退和患痴呆症的风险。
缺乏叶酸可导致神经和认知问题
临床试验结果显示叶酸补充剂本身或与其它维生素(B6和B12)结合一起服用,可在衰老过程中有效维持健全的认知功能。
可以选择以下这些食物:

维生素C和维生素E
维生素C和维生素E 作为抗氧化营养素,可保护神经免受氧化损伤。此外,大脑神经元中需要保持一定水平的维生素C才能维持大脑的正常功能。因此,食用富含维生素C的食物可以帮助延缓因年龄增长而导致的认知功能退化。
一些维生素C含量较高的食物
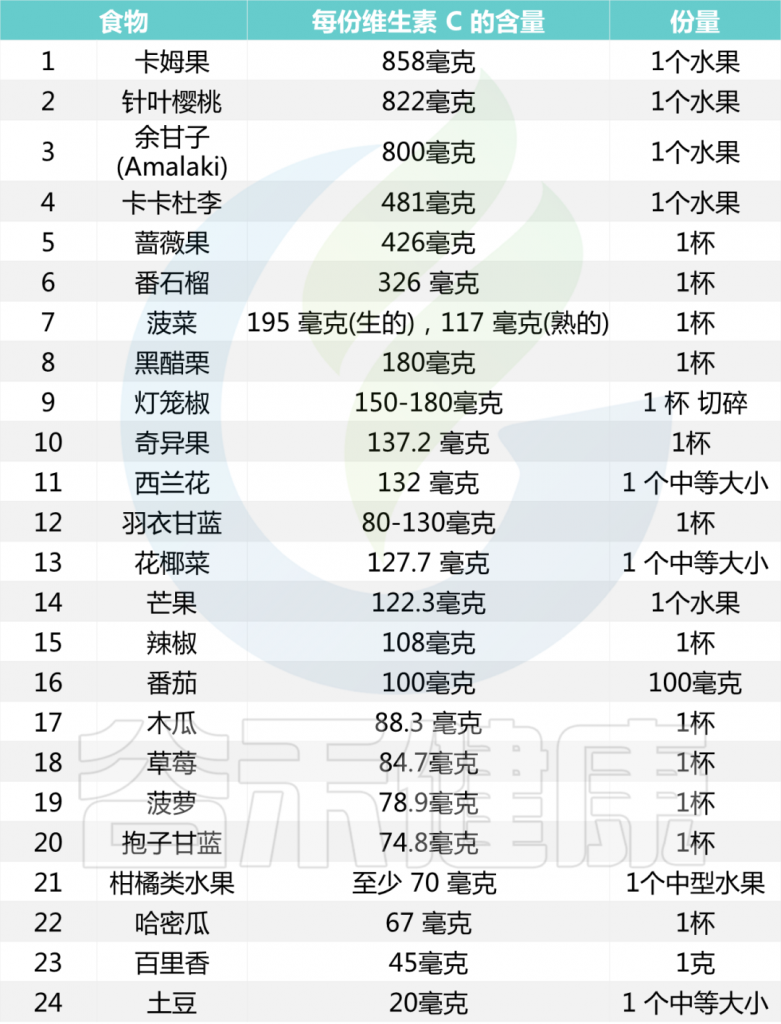
注:单位“杯”是一个常见的非正式计量单位,美规和英规略有区别,大约是237毫升-250毫升左右,涉及到果蔬的份量时,一杯通常是指将果蔬切碎后填满一杯容器的量。
维生素D
维生素D可影响神经元的生长、发育和存活的过程。研究表明,在老年人群体当中,体内维生素D水平低下,可能增加认知功能退化和患老年痴呆症的风险。
维生素D3是我们身体需要的维生素D形式。调节大脑中的钙水平,帮助保护脑细胞免受有害的氧化作用,并支持海马体(大脑记忆中心)的健康。
大多数研究发现,纯素食者的血液中维生素D3含量较低,并且在冬季,素食者更有可能出现维生素D3不足。
类黄酮
类黄酮可以提高血管功能,从而影响神经细胞间的物质传递和信息交流,进而影响神经健康和大脑功能。食用富含类黄酮的食物或饮料可以帮助提高人体健康水平,以及帮助提高患有轻度认知障碍老年人的认知功能。
类黄酮的抗氧化作用已在实验中获得证实,但这些植物化合物(如可可、银杏、葡萄籽提取物)在人体内具有更多的综合作用,目前仍在持续进行研究中。
一些类黄酮在保持健康的大脑功能方面表现出不错的结果。
槲皮素是一种类黄酮,是银杏萃取物中的主要成分,它已在一些研究中被证明能维持记忆力和学习能力。
类黄酮来自多种色彩丰富的植物食物。可以尝试以下这些食物:
钙和镁
大脑能如此天衣无缝地运作依靠的是神经元之间相互连结和交流的能力。钙和镁这两种矿物质对维持通讯顺畅进行发挥重要的作用。
钙质有助于维持神经细胞正常发挥功能,并有助于控制神经递质的流量。镁对脉冲传输发挥作用。它还透过催化B族维生素转化为活性形式,而帮助大脑释放B族维生素的所有益处。
富含钙质的食物如:
富含镁的食物如:
其它有益大脑的营养素
以下简要列举一些经研究对大脑健康有益的其它营养素:
α-硫辛酸
已获证实可维持记忆力和认知功能。它能够使其他抗氧化剂恢复到活性状态。富含的食物如:内脏(肾、心、肝)、土豆、菠菜、西兰花等。
咖啡因
不仅能帮助提神,摄入咖啡因还与大脑处理信息的能力之间存在联系有关。但注意适量,过多的咖啡因会让人过度兴奋或焦虑,一个健康的成年人每天的摄入量不应超过三到四百毫克。
锌
存在于大脑前部的一种必需矿物质。其运作机制仍需更多研究才能确定,但缺乏锌却与很多神经系统问题有关。当人的锌水平低时,可能会出现焦虑,抑郁,失眠和情绪失调等状况。
研究发现抑郁症和精神病患者的锌含量低。在患有帕金森氏病,阿尔茨海默氏病,唐氏综合症和多动症的患者中也发现了锌缺乏。
补锌有助于改善抑郁症状,是 “自然的抗抑郁药”。锌的饮食来源多种多样,尤其是在红肉,家禽和鱼类中。
姜黄素
一种强力抗氧化成分,可保护大脑免受脂质过氧化反应和一氧化氮类的影响。
新鲜姜黄可以适量切片或切碎后加入沙拉、汤或炒菜中。临床试验都表明姜黄素补充剂是安全且耐受性良好的。
几种胃肠激素或胜肽
如瘦素、饥饿肽、胰高血糖素样肽-1(GLP1)和胰岛素等, 可支持健康的情绪反应和认知过程。
不要忘了炎症——认知功能的隐形敌人,通过抗炎和促炎作用影响着大脑。而姜黄素、白藜芦醇、蓝莓多酚和多不饱和脂肪酸等超级食材,以及生活方式的选择,如热量限制和体育锻炼,都是强大的盟友,帮助保持认知功能。
地中海饮食、营养支持和热量控制饮食抵御了认知能力下降和神经退行性疾病的威胁。
如前所述大脑是一座忙碌的都市,神经营养素则是其中维持秩序的超级英雄,特别是在情绪调节这个复杂的领域。情绪调节就像城市交通系统,涉及多个区域,对我们的心理健康和行为至关重要。接下来我们再来探索一下大脑城市。
神经递质:大脑交通的信号灯
首先,神经递质犹如信号灯,这就像是在城市交通中错误地发出信号就会导致了交通堵塞甚至是严重的交通后果。所以神经递质和抑郁的严重程度之间的关系,就像是使用了不良情绪调节策略的结果。
前额皮质:情绪调节的指挥中心
然后,来到前额皮质区域,这个区域就像是大脑都市的交通指挥中心,它不仅参与情绪调节,还和身体的内分泌和免疫系统功能相关。这意味着,改善情绪调节就像是优化了城市交通,对整个都市的健康都有益处。
饮食与遗传:大脑都市的燃料与基础设施
我们的饮食,就像是为大脑都市提供燃料。特定的营养素能够影响神经元功能和突触可塑性,进而影响情绪。这就像是选择了高质量的燃料,让整个城市运转得更加顺畅。
遗传因素在情绪调节中也扮演了角色,就像是大脑都市中的基础建设。特定的遗传变异,比如血清素转运蛋白的变异,会影响情绪特征和神经系统,这就像是决定了城市交通系统的设计和效率。
神经影像学:交通管理
神经影像学研究揭示了参与情绪调节的特定大脑区域,就像是确定了城市中的关键交通节点。而实时功能磁共振成像神经反馈的研究,能够实时调节这些交通节点的流量,对精神障碍的治疗具有潜在的益处。
压力和性别:突发事件和不同司机
压力和性别在情绪调节中的作用,就像是突发事件和不同司机的驾驶习惯对城市交通的影响。急性压力可能会损害我们分散情绪刺激的能力,而性别差异则决定了我们减少负面情绪的能力。
总之,神经营养素通过对大脑功能和突触可塑性的影响,扮演着情绪调节中的超级英雄。无论是遗传因素还是饮食,都在这个复杂的城市交通系统中发挥着重要作用。而神经影像学的发现和实时神经反馈技术的进步,就像是为这座都市提供了新的管理工具。最后,不容忽视的是压力和性别差异,它们就像是影响交通流量的突发事件和不同司机的习惯。
在这个快节奏的世界里,大脑像是永不休息的工作狂,不断地处理信息、接收信息、做决策、回忆过去和规划未来。但是,就算是高效的机器,大脑也需要适当的燃料和维护来保持其最佳性能,特别是那些对脑健康至关重要的维生素B。
最新的研究发现让我们对维生素B和其他神经营养素在保持我们的思维敏捷和记忆力方面的作用有了更深的认识。比如说,一项研究发现,老年人补充omega-3脂肪酸可以让认知功能保持在较好的状态,甚至减缓认知衰退的脚步。另一项研究则揭示了维生素E补充剂与降低某些类型认知障碍风险的联系。
那么,具体来说,哪些人群最适合通过补充B族维生素来提升脑健康呢?
总的来说,补充维生素B似乎对记忆力有一定的益处,目前的证据还不足以推荐其用于改善认知功能、执行功能和注意力,或者用于稳定或减缓阿尔茨海默病患者的认知、功能、行为和整体变化的下降。还需要更多精心设计的、大样本量的随机对照试验来明确维生素B补充剂在这些亚组中的预防效果和最佳剂量。
接下来再聊聊那些让我们的大脑保持活力和健康的小帮手——神经营养因子。
神经营养因子:大脑城市的维护英雄
如果我们的大脑是一座充满活力的城市,那么神经营养因子就是那些维护城市基础设施、确保一切运转顺畅的英雄。
它们是一类特殊的蛋白质,对我们的神经系统来说,就像是超级食物一样,负责支持神经细胞的生存,促进受损神经细胞的修复,还有调节细胞之间的通信。简而言之,没有它们,我们的大脑就不能正常工作。
神经营养因子包括神经生长因子(NGF)和脑源性神经营养因子(BDNF)。
促进生长与修复
这些超级英雄通过与神经细胞表面的特定受体结合,激活一系列信号传导途径,从而促进神经细胞的生长、分化,增强我们大脑的可塑性和修复能力。
影响学习与记忆
神经营养因子在保护神经细胞、促进受损神经组织的修复,以及提高我们的学习和记忆能力方面发挥着显著作用。比如,BDNF的水平,就和我们的学习能力及记忆形成紧密相关。这也像是大脑的健身教练,帮助思维保持敏捷,记忆力强大。
与神经退行性和精神疾病相关
神经营养因子还参与了与神经退行性和精神疾病相关的病理生理学过程。它们的水平改变与阿尔茨海默病、亨廷顿舞蹈病、抑郁症和药物滥用等疾病有关。这些都表明,神经营养因子的平衡对我们的神经健康至关重要。
生活方式
运动
运动无疑是提高 BDNF 水平的最佳方法之一。
这些影响尚未在人类中进行研究。
睡觉
与睡眠健康的对照组相比,失眠患者的 BDNF 水平较低。根据一些未经证实的理论,压力是否会导致精神障碍取决于睡眠是否得到维持或受到干扰。在大鼠中,长期睡眠不足导致IL-1b和TNF增加,BDNF 减少。
在抗抑郁治疗中,BDNF 升高可能是抗抑郁药物是否有效的预测指标,尽管这一指标并不完全可靠。BDNF 实际上并不与抑郁症的减少同时发生,因此,人们认为大部分预测效果可能基于睡眠。这意味着 BDNF 可能是人们睡眠质量的一个标志,需要大规模研究来证实这一理论。
减轻压力
慢性或急性应激和皮质醇会降低大鼠海马和前额皮质中的 BDNF。
急性应激更显著降低 BDNF。
承受很大压力的人表现出较少的 BDNF。
晒太阳
对荷兰 2,851 人的分析发现,血液中的 BDNF 在春季和夏季增加,在秋季和冬季减少。BDNF 水平与一个人暴露在阳光下的小时数相关。
然而,维生素 D 补充剂可能无效。
人体试验中补充维生素D不会增加 BDNF。
绝经后女性补充维生素 D 实际上会降低 BDNF。
认知刺激
动物高度刺激的早期社会环境会增加 BDNF。
在小鼠中,探索行为的水平会诱发 BDNF,而在人类中,这相当于精神和身体刺激或新奇感。
当学习事物或挑战大脑时,大脑会增加 BDNF,因为它在学习和记忆中发挥着重要作用。
间歇性禁食
在小鼠中,隔日禁食(禁食日单餐摄入约 600 卡路里热量)可使 BDNF 的产生增加 50% 至 400%,具体取决于大脑区域。禁食对人类 BDNF 的影响还需进一步研究。
保持昼夜节律
一些科学家推测,昼夜节律失调与 BDNF 水平低有关。例如,昼夜节律失调的脑外伤患者的 BDNF 产生量也较低。
饮食/食物
科学家正在研究以下饮食因素是否会增加或降低 BDNF 水平:
西方饮食
所谓的“标准西方饮食”(“SAD”)——即高糖和饱和脂肪的饮食,可能会减少 BDNF 的产生。
鱼油 / DHA
抗性淀粉,例如抗性淀粉– 转化为丁酸盐,导致 BDNF 增加。
其他
下列物质均显着增加雌性大鼠额叶皮质中的 BDNF :
然而,没有临床证据支持上面列出的增加 BDNF 的方法。上述因素涉及动物和细胞研究,应进一步研究。
激素/神经递质
科学家发现动物体内以下激素与 BDNF 水平之间存在联系:
缺乏人类数据。
没有研究表明增加这些激素会增加人类的 BDNF。
在没有看医生的情况下不要服用任何激素。在没有医疗监督的情况下服用激素可能非常危险。
补充剂
膳食补充剂尚未获得批准用于医疗用途。补充剂通常缺乏扎实的临床研究。
一些研究表明,这些补充剂可能有助于增加 BDNF 并支持心理健康:
药物
尚未批准任何药物用于提高 BDNF 水平;以下研究是调查性的,不够有力,不足以被视为足够的使用证据。它仅供参考。
一些非法药物也会增加 BDNF,但会以整体有害的方式影响大脑并造成严重伤害。
其中许多药物可能劫持大脑的奖励系统,导致成瘾。它们的使用还可能导致危及生命的情况,应不惜一切代价避免使用。
注意:未经医生建议不要随意服用任何药物。
胃肠道(GI)对于营养物质的吸收,粘膜和全身免疫反应的诱导以及健康的肠道微生物群的维持是必不可少的。
你会发现肠道不只是消化的细胞,还有大量的神经元和免疫细胞,以及海量的肠道菌群。
想象一下,我们的肠道里住着数万亿的微生物,它们不仅帮助我们消化食物,还能影响我们的心情和大脑功能。
经研究发现,神经发育的主要过程与母体和新生儿肠道微生物的变化一致。
Sharon et al. Cell, 2016
微生物群对大脑结构的影响
关于微生物群在人类大脑结构发育中的作用的研究仍然很少。
在成年人中,聚类分析确定了与不同白质和灰质特征相关的不同微生物群组成,包括右海马、左伏隔核、右枕前沟和小脑的区域体积差异。微生物群中的α多样性也与肥胖成人的下丘脑、尾状核和海马的微观结构有关,而特定的放线菌门的相对丰度与下丘脑、丘脑和杏仁核的微观结构变量相关。
在儿童中,只有一项研究检测了大脑结构和肠道微生物群,报告了1岁时α多样性与2岁时左中央前回、左杏仁核和右角回体积之间的正相关。同样的研究还报告了基于微生物群聚类分析的特定区域脑容量差异。
微生物群对早产儿大脑发育的潜在影响
在新生儿重症监护病房早产儿粪便微生物群移植研究中采用了一种更具实验性的方法。与高生长菌群的受试者相比,在NICU中生长不良的婴儿微生物群定植的无菌小鼠在神经元分化、少突胶质细胞发育和大脑皮层髓鞘形成的标记方面表现出大脑发育延迟的迹象。来自低生长婴儿的微生物群也影响各种神经传递途径,增加神经炎症,同时降低生长激素的循环水平。
微生物群与大脑功能、神经发育的关联
去年两项研究都发表在儿童大脑功能或活动的微生物调节上。
相关动物研究
一项研究很好地拟合了动物早期应激模型中的观察结果。在母性分离后,一种已知会扰乱微生物群的早期应激啮齿动物模型,大鼠幼犬表现出条件性恐惧反应的加速成熟。在压力期间的益生菌补充足以逆转对这两种行为的影响前额叶皮层的激活。
在压力环境之外,在各种动物模型中,微生物调节大脑功能或活动的证据基础越来越强。例如,对无菌动物杏仁核的转录组分析揭示了差异基因表达、外显子使用和RNA编辑。
最近的一项关于在缺乏微生物群的小鼠中消除恐惧的研究发现,内侧前额叶皮层的基因表达、神经元活动和树突棘重塑发生了显著变化。此外,有许多关于通过操纵微生物群而改变各种神经递质系统的报告,特别是关于5-羟色胺和BDNF(脑源性神经营养因子)。这项工作与脑形态学的研究一起,强调了微生物群对大脑发育和健康的深远影响。
肠脑轴
我们的肠道和大脑之间有着一条看不见的纽带,这就是所谓的肠脑轴。这条线不仅仅是关于我们吃了什么,更是关于我们的情绪、认知能力乃至大脑的整体健康。
肠-脑轴综合示意图
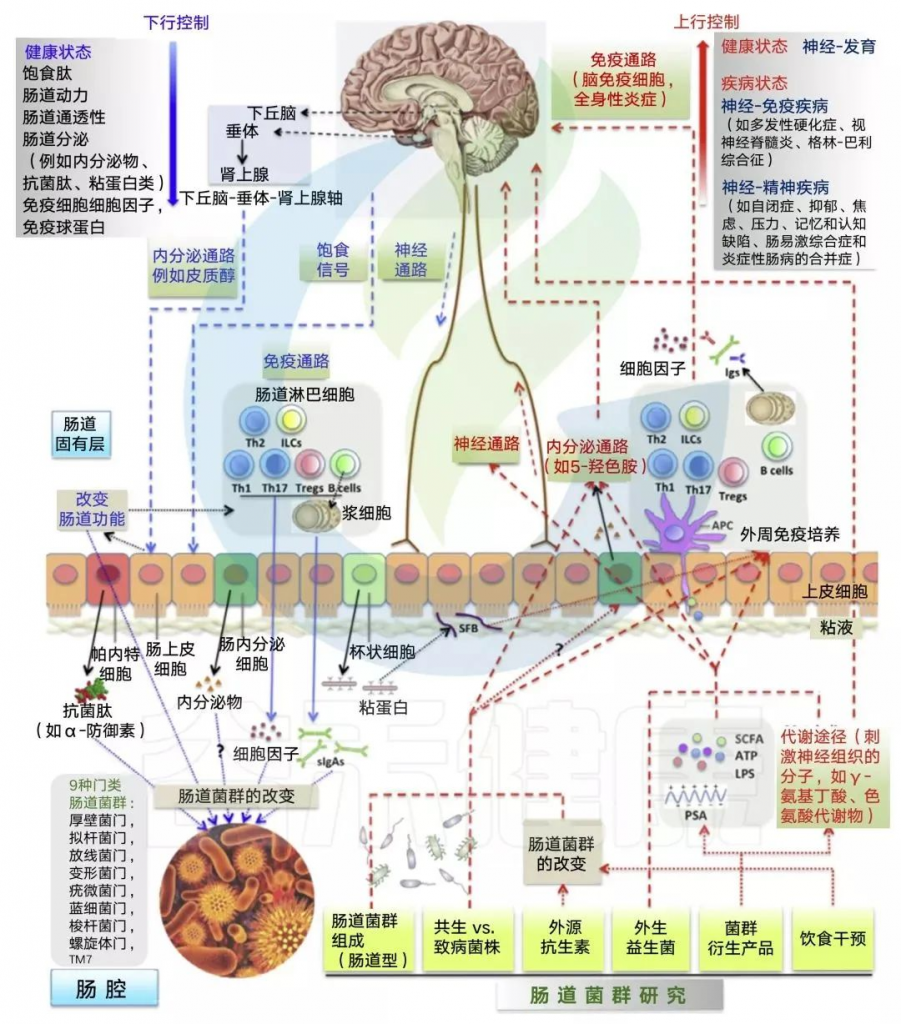
Wang and Kasper. Brain, behavior, and immunity, 2014
目前,微生物-肠道-脑轴内存在许多已知的通信途径,包括迷走神经、HPA轴、脊髓、免疫系统和代谢产物的外周传输等。这些已在其他地方详细阐述。在这里就提供一个简短的和简单的概述,其中一些路径与一个具体的发展重点(见下图)。
肠-脑轴参与婴儿早期神经发育与感受
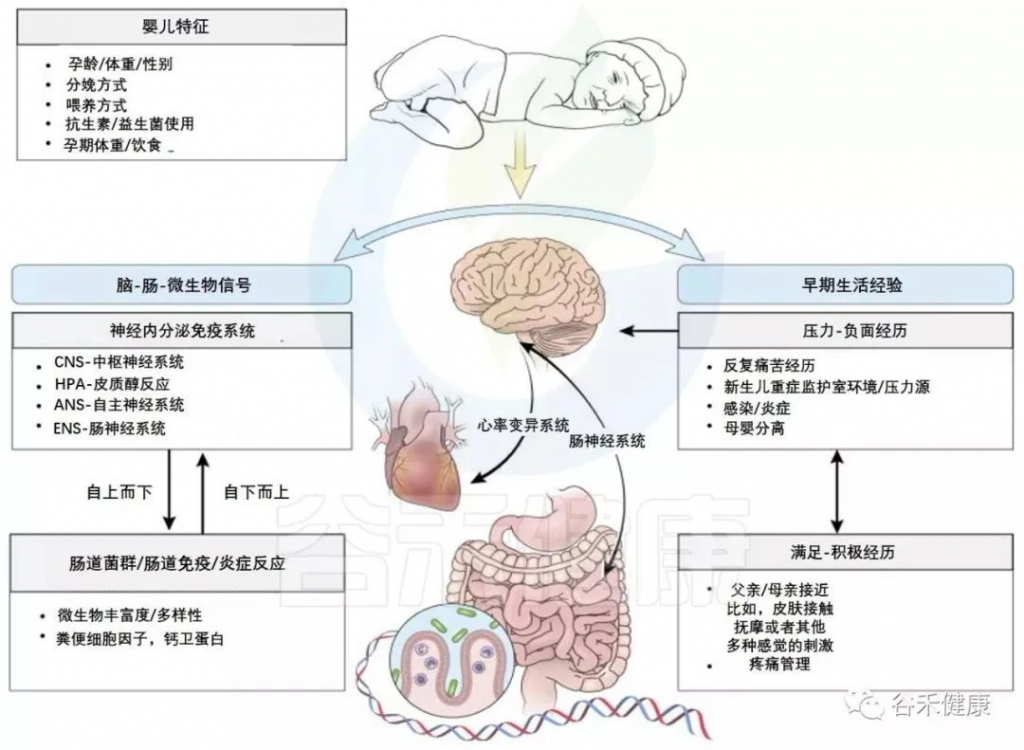
Cong et al., Advances in neonatal care: official journal of the National Association of Neonatal Nurses, 2015
此外,肠道菌群可以影响神经传递的产生和释放,比如血清素和多巴胺以及GABA,此外还有激素,谷氨酸,小分子肽等,这些都是影响我们情绪和认知的关键物质。
其次,通过调节免疫系统的反应,肠道菌群还能影响大脑中的炎症反应,这对于预防神经退行性疾病非常重要。
肠道菌群的代谢产物,比如短链脂肪酸,对大脑健康至关重要,它们不仅能为大脑提供能量,还能调节血脑屏障的完整性和功能。
由肠道微生物及其产物直接或间接驱动的基本发育过程
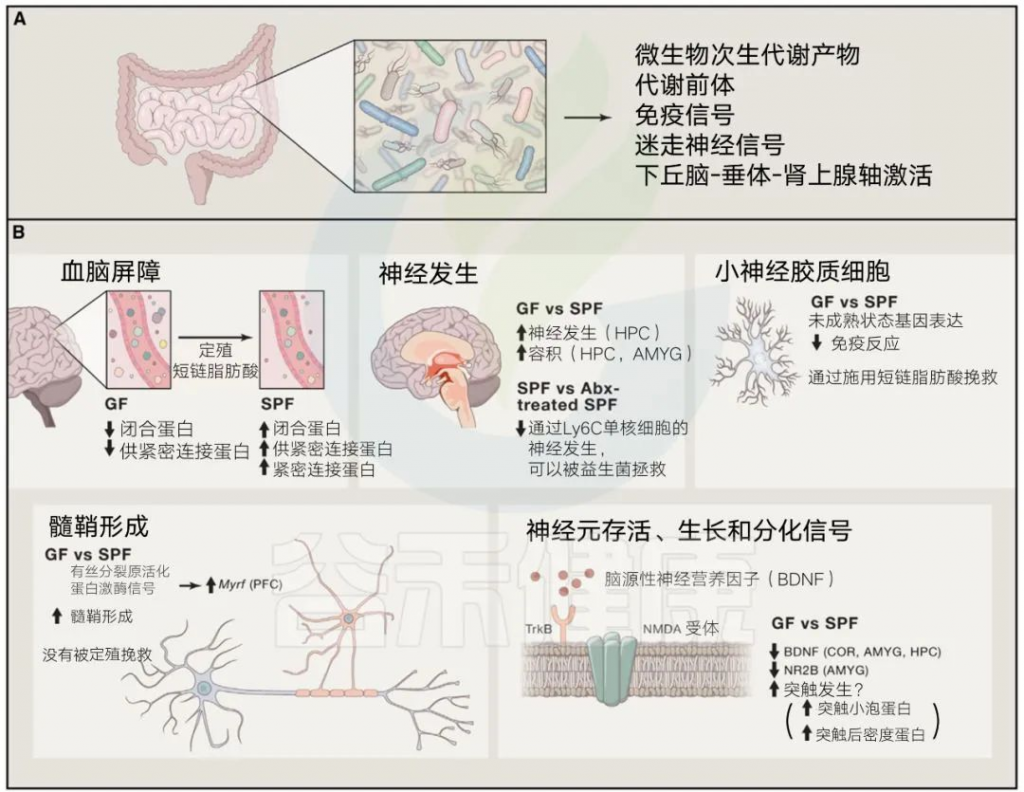
编辑
Sharon et al. Cell, 2016
深入一点来说,肠道微生物群通过涉及芳香氨基酸和色氨酸代谢的途径,影响诸如血清素、多巴胺和脑源性神经营养因子(BDNF)等神经递质水平。这就是为什么肠道菌群的失衡可能会导致神经递质途径紊乱,进而影响我们的大脑健康。
而且,特定的微生物酶能够直接产生神经递质,这说明了微生物群如何直接影响我们的生理和行为。肠道微生物群还能调节神经肽和神经递质受体的表达,影响体重调节和瘦素敏感性。
通过抗生素、益生菌或是粪菌移植等方式改变肠道微生物群组成,都会影响神经递质的调节,与一系列神经精神和神经系统疾病有关。
深入挖掘机制:微生物对神经发育的影响途径
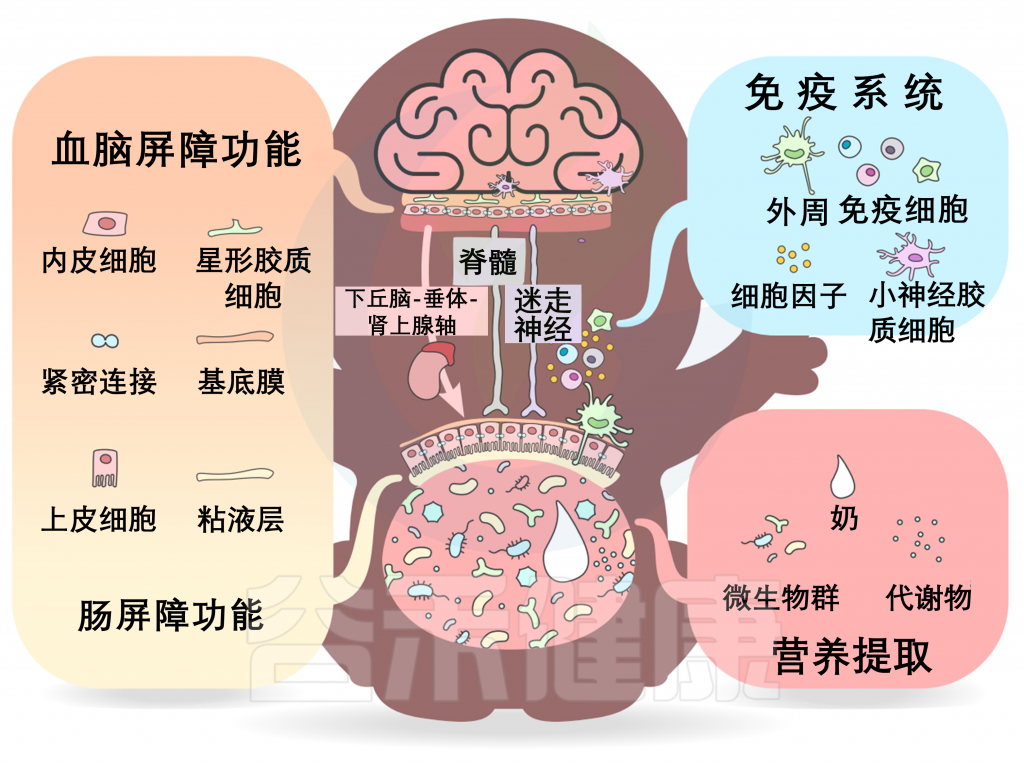
微生物群-内脏-大脑轴由多个通道组成,允许微生物群和大脑之间双向交流。在发育过程中,一些关键的通路包括营养提取、免疫信号和屏障功能,以及沿脊髓、迷走神经和下丘脑-垂体-肾上腺轴(HPA轴)的神经和激素信号。
之前的文章有详细介绍微生物群与大脑之间的通讯途径。
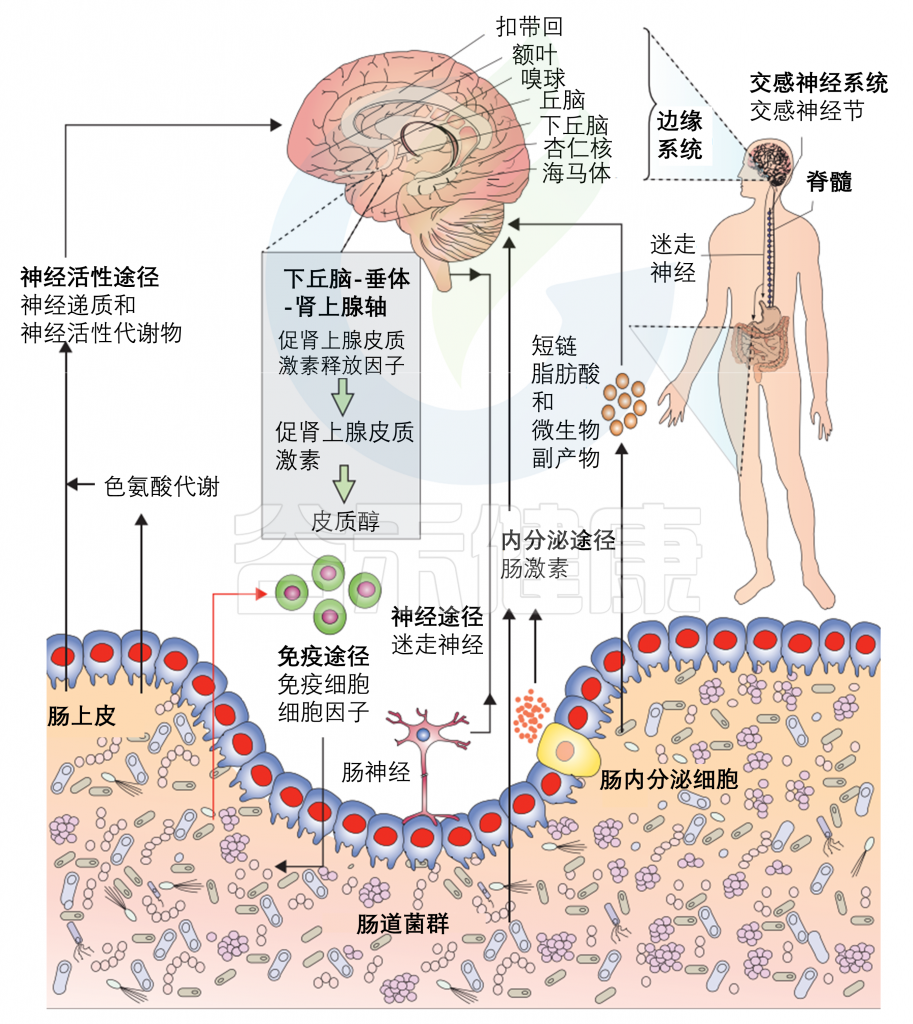
Cryan JF, et al., Lancet Neurol. 2020
多种直接(如迷走神经)和间接(如短链脂肪酸、细胞因子和关键的膳食氨基酸,如色氨酸、酪氨酸和组氨酸)途径,通过肠道微生物群可以调节肠-脑轴。
扩展阅读:
代谢和养分利用率
也许解释微生物群对神经发育的调节作用的最简洁的假设是,微生物群是生长中的大脑必需营养和能量的关键来源。微生物群将原本不易消化的食物成分,转化为具有营养或生物价值的产物,营养本身是一种公认的认知结果调节器。
母乳喂养是一种影响微生物群成熟的饮食因素,长期以来一直被认为可以改善认知结果,尽管最近的数据表明,这种影响是由诸如母亲智力或教育水平等混杂变量造成的。
另一方面,特定营养素缺乏和总体饮食质量低都与认知发展的长期负面影响有关,并且对易受伤害人群的营养干预可以改善儿童期的认知结果。有人认为,这些影响需要从发展中的微生物群的角度来考虑。
为了支持这一论点,最近对荷兰小学生进行的一项队列研究发现,学龄前饮食与代谢表型之间关系的强度取决于微生物群的组成。
儿童营养不良延缓了微生物的成熟,从营养不良的儿童身上移植到啮齿动物或猪身上的粪便菌群表明,这种改变的菌群在与营养不良相关的发育迟缓和代谢问题中起着因果作用。在这两种动物模型中,通过补充唾液酸化的母乳低聚糖来解决这些微生物依赖性问题。这些化合物通常存在于母乳中,作为微生物群的益生元,在营养不良儿童的母亲母乳中含量较低。
最近的另一项“微生物导向补充食品”试验发现,与传统食品治疗相比,在动物模型和营养不良儿童中都有很好的效果。
营养物的可利用性、微生物群和代谢发展之间似乎存在着重要的相互作用,通过喂养微生物群,微生物群可以喂养发育中的身体和大脑。
屏障功能
在微生物群和大脑之间,有两大屏障:胃肠道屏障和血脑屏障(BBB)。
这些屏障的通透性与微生物来源的代谢产物和神经递质在微生物-肠-脑轴之间的传递特别相关;渗透性越强,传递的信号就越多。
这两个障碍有惊人的相似之处:
饮食或益生菌干预有希望恢复?
饮食干预在减少压力或其他微生物群对整个生命周期学习和记忆结果的影响方面显示出了希望。
在成年啮齿动物中,益生菌补充被用于逆转压力、感染或抗生素治疗后的空间记忆缺陷,甚至在空间记忆、物体识别记忆和长期恐惧记忆方面为健康动物提供益处。
在青春期,饮食中添加ω-3多不饱和脂肪酸和维生素A可恢复慢性社会不稳定应激后盲肠微生物群的组成和新的物体识别障碍。
在发育早期,特定的益生菌菌株(鼠李糖乳杆菌和瑞士乳杆菌)拯救了暴露于早年母体分离应激的幼鼠条件恐惧行为的预期发育模式。压力大的婴儿表现出更持久的恐惧记忆,在恐惧消失后更容易复发,但这两种行为异常都可以通过益生菌治疗逆转。
饮食-微生物群相互作用在阿尔茨海默改善中的作用
鉴于阿尔茨海默患者与健康受试者之间微生物群差异的新数据,研究人员已经开始探索通过调节微生物群来改善阿尔茨海默。
我们知道肠道微生物群可以通过多种方法进行调控,包括使用益生菌、益生元、合生元和抗生素或改变饮食,但饮食是肠道微生物群的最重要调节方式。
以不饱和脂肪、水果和蔬菜以及全谷类为重点的饮食调节可以给阿尔茨海默相关的认知健康带来好处。例如,地中海饮食通过增加血浆类胡萝卜素和降低C-反应蛋白水平,与阿尔茨海默关键区域的脑萎缩减少相关,表明对阿尔茨海默病理学有积极影响。
此外,炎症也是阿尔茨海默的主要症状。食用富含二十二碳六烯酸(一种n-3多不饱和脂肪酸)的鱼制品与降低阿尔茨海默风险有关。富含维生素D3的鱼和富含维生素D的奶制品促进神经生长因子蛋白的分泌,这种蛋白可以防止大脑炎症和衰老。
由于地中海饮食对阿尔茨海默的这些改善作用,一项人体试验研究了MD-DASH饮食干预对神经退行性延迟(MIND)的影响,该饮食是地中海饮食与DASH饮食(阻止高血压的饮食方法)的结合,富含水果,蔬菜,全谷类,低脂乳制品和瘦肉蛋白,实验表明MIND饮食比单独使用地中海饮食或DASH更为有效。
除了某些饮食生活方式外,个别食物还可以带来抗阿尔茨海默病理学的益处。例如,在小鼠模型中:
几项研究探讨了直接针对阿尔茨海默肠道细菌的补充剂的使用:
益生菌和益生元的组合合生元也显示出对阿尔茨海默的益处。
综上所述,目前有关饮食和补充剂影响肠道微生物群和改善阿尔茨海默是有希望的,但更多的研究是也非常需要。
我们的肠道和大脑里都住着一些非常勤劳的免疫细胞。它们调节着炎症反应和免疫稳态。这种调节过程对于防止炎症相关疾病至关重要。
想象我们的肠道是一个繁忙的社交场所,各种微生物在这里聚会,它们通过免疫系统的路径与大脑沟通,影响着精神和神经发育。而饮食、压力和我们早期的生活经历则是这场社交活动的调味料,影响着微生物群的组成和它们的交流方式。
肠道微生物群和肠道屏障的微小变化,都能引起中枢神经系统内免疫调节的变化。这就像是在说,改变我们的饮食习惯有可能对治疗多发性硬化症等疾病有潜在的帮助。
而益生菌、益生元和健康饮食不仅能让我们的肠道微生物开心,还能通过一系列免疫、神经和代谢途径,帮助调节大脑的发育和行为。这就像是给大脑发送了一份特别的营养餐。
肠道微生物群的影响力非常强大,它们通过神经递质、神经肽、激素和细胞因子,成为大脑、肠道、免疫系统和自己之间沟通的信使。
肠-脑轴甚至能通过内分泌信号和免疫系统的激活,改变大脑的功能,有时候还会导致精神疾病。而迷走神经在这个双向通讯过程中,就像是一个忙碌的信息传递员。
有趣的是,微生物群还能通过抑制免疫系统和诱导炎症来影响脑肿瘤的发展和治疗结果。这让我们意识到,微生物群在精准肿瘤学中的作用可能远比我们想象的要大。
肠-脑轴内的相互作用,包括自主神经和中枢神经系统、应激系统和肠道免疫反应,都与炎症性肠病的发病机制有关。而大脑-肠道-微生物组通讯的干扰,可能会导致肠易激综合征、肥胖以及各种精神和神经系统疾病。
总之,肠-脑轴通过免疫系统调节大脑功能,免疫细胞、微生物代谢物和各种信号分子在肠道微生物群和大脑之间建立了一个复杂的通讯网络。饮食、压力和早期生活事件是塑造这种相互作用的关键因素,对于治疗精神、神经发育和神经退行性疾病,以及炎症和压力相关疾病的干预具有潜在的影响。
长双歧杆菌,能够通过阻止肠道菌群失调、降低内毒素水平和调节大脑炎症途径来保护我们的认知功能。简而言之,长双歧杆菌是我们大脑的守护神。
但是,就像任何城市一样,总有一些不那么受欢迎的居民。研究发现,Megamonas、Serratia、Leptotrichia和梭菌科的增加与阿尔茨海默病的早期阶段有关。同时,一些好家伙,比如CF231、Victivallis和肠球菌的数量减少,这也不是个好消息。
阿尔茨海默病患者的肠道小城市里,双歧杆菌、鞘氨醇单胞菌、乳酸菌和Blautia的数量丰富,但鞘氨醇单胞菌的增多似乎与认知功能的下降有关。同时,恶臭杆菌、厌氧杆菌的减少也值得我们关注。
认知障碍的情况下,放线菌和变形菌的丰度较高,而拟杆菌门和厚壁菌门的比例较低。这意味着,肠道小城市的居民组成与我们的认知健康紧密相关。
轻度认知障碍似乎与瘤胃球菌属、丁酸单胞菌属和草酸杆菌属的减少有关,而黄硝杆菌属的增加可能预示着问题。
主观认知能力下降的个体显示出抗炎的粪杆菌属显着减少,这提示我们,肠道中的抗炎英雄可能在保护我们的大脑健康方面发挥着关键作用。
科学研究已经锁定了一些特定的细菌属,它们似乎与重度抑郁症(MDD)有着密切联系。
研究人员发现,Gelria、Turicibacter、Anaerofilum、Paraprevotella、Holdemania、Eggerthella属在抑郁症患者中普遍存在,而普雷沃氏菌(Prevotella)和戴阿利斯特杆菌(Dialister)的存在减少。
抑郁症患者体内有益菌大量减少
后来的研究还发现,与对照组相比,抑郁症患者肠道微生物总体减少。肠道微生物群中的双歧杆菌和乳酸菌减少。
Dorea、瘤胃球菌属和阿克曼氏菌属的显著减少,副拟杆菌属(Parabacteroides)、普雷沃氏菌属和放线菌属(Actinobacteria)的增加与抑郁个体相关。
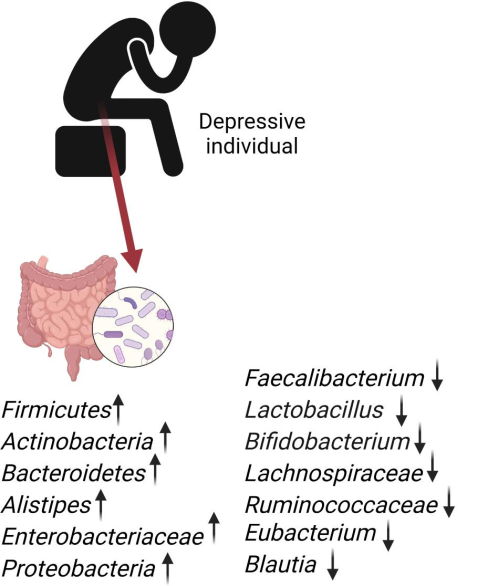
Basiji K, et al., Metab Brain Dis. 2023
通过饮食调整,增加那些能让有益菌群欣欣向荣的食物,比如高纤维的蔬菜和水果,以及富含益生菌的酸奶和其他发酵食品。同时,减少抗生素的使用和压力水平,也能帮助我们维持肠道菌群的平衡。
我们不仅能够保持消化系统的健康,还能通过肠脑轴的联系,促进大脑健康,提升生活质量。
首先,有一些细菌属如拟杆菌属和双歧杆菌属,它们就像是小小的神经发育助推器,特别是在认知和语言发育方面。这些微生物帮助大脑发育,让你变得更聪明。
Turicibacter和Parabacteroides在那些精细运动技能不太灵光的小朋友的肠道中更常见。相反,双歧杆菌和乳酸杆菌则在那些精细运动技能较好的孩子们中占据主导地位。就仿佛这些微生物在背后默默地支持着孩子们的每一个小动作。
Gordonibacter pamelae和Blautia wexlerae似乎与更高的认知功能有关,而瘤胃球菌则在认知得分较低的儿童中更常见。这就像是肠道中的智力竞赛,不同的细菌支持着大脑的不同功能。
毛螺菌科的出现与最佳的头围生长有关,而头围生长是神经发育的一个重要标志。
总的来说,特定的肠道细菌,如拟杆菌属、双歧杆菌属、乳杆菌属等,对早期神经发育有着不可忽视的影响。它们与认知和运动技能的发展,以及大脑的整体生长密切相关。这些发现让我们意识到,婴儿期肠道微生物组的组成可能对我们的神经和心理健康产生长期影响。
本文主要简述了大脑发育(神经发育),强调了神经营养素以及脑源性神经营养因子(BDNF)对神经发育以及功能和修复等的重要性。这些神经营养素或神经营养因子需要我们日常膳食足量足质的补充或摄入。此外,这些营养素吸收,转化以及代谢等都离不开肠道及其微生物群,而且肠道微生物还会通过其他多种途径影响大脑的发育,认知以及衰老和疾病发生。
如果将大脑和肠道都看着是两座超级大城市,那么神经营养素或因子和肠道菌群就是其中的参与者、建造者、使用者和维修者。例如优质的膳食脂质,比如磷脂和鞘脂,是认知功能的守护者,而双歧杆菌尤其长双歧杆菌就是肠道的领路者和超级英雄。
作为人体两大超级系统(大脑-肠道),它们之间的交流和互动密不可分,保持着信息和资源的畅通。我们在日常生活中的饮食习惯和生活方式不仅影响着肠道微生物的构成和功能,也直接关系到大脑的健康和发育。要想让这两座超级大城市运转良好,需要关注神经营养素的摄入和肠道菌群的平衡,尽可能让身体和大脑保持最佳状态。
主要参考文献
Borrego-Ruiz A, Borrego JJ. An updated overview on the relationship between human gut microbiome dysbiosis and psychiatric and psychological disorders. Prog Neuropsychopharmacol Biol Psychiatry. 2023 Sep 8:110861.
Cryan JF, O’Riordan KJ, Sandhu K, Peterson V, Dinan TG. The gut microbiome in neurological disorders. Lancet Neurol. 2020 Feb;19(2):179-194.
Bear T, Dalziel J, Coad J, Roy N, Butts C, Gopal P. The Microbiome-Gut-Brain Axis and Resilience to Developing Anxiety or Depression under Stress. Microorganisms. 2021 Mar 31;9(4):723.
Bryan B. Yoo et al. (2018) The Enteric Network: Interactions between the Immune and Nervous Systems of the Gut. Immunity. 46(6): 910–926.
Shivani Ghaisas et al. (2016) Gut microbiome in health and disease: linking the microbiome-gut-brain axis and environmental factors in the pathogenesis of systemic and neurodegenerative diseases. Pharmacol Ther. 158: 52–62.
Cerovic M, Forloni G, Balducci C. Neuroinflammation and the Gut Microbiota: Possible Alternative Therapeutic Targets to Counteract Alzheimer’s Disease? Front Aging Neurosci. 2019 Oct 18;11:284.
Cryan JF, O’Riordan KJ, Sandhu K, Peterson V, Dinan TG. The gut microbiome in neurological disorders. Lancet Neurol. 2020 Feb;19(2):179-194.

谷禾健康

微量营养素缺乏或称之为“隐性饥饿”,是目前一个严重的公共卫生问题,会对儿童发育及成人健康造成严重后果。
传统的治疗和预防方法,有些时候并是很有效,并且可能产生不良副作用(例如补铁引起的消化问题)。
★ 肠道细菌与微量营养素间存在重要的相互作用
许多研究发现肠道中的共生细菌可以增加特定微量营养素的生物利用度,特别是通过去除抗营养化合物(例如植酸盐和多酚),或通过合成维生素。
肠道黏膜是抵御病原体的第一道防线。肠黏膜微生物群有助于增强肠上皮的完整性并更好地吸收微量营养素。
细菌代谢还依赖于从肠道环境中获取的微量营养素,常驻细菌可能会竞争或协作以维持微量营养素稳态。因此,肠道微生物群的组成可以通过微量营养素的可用性来调节。

本文汇集了有关微量营养素和肠道微生物群之间双向关系的最新知识,重点关注铁、锌、维生素A和叶酸(维生素B9),因为这些缺乏症是全球范围内的比较严重的公共卫生问题。
目录
1.微量营养素缺乏
2.微量营养素与宿主健康
3.营养素与细菌的相互作用:以铁为例
4.细菌在锌生物利用中的作用
5.微生物群与宿主叶酸间的关联
6.微生物群与维生素A的相互作用
7.改善人体微量营养素的建议
8.结语
微量营养素,包括矿物质和维生素,是每天只需要少量的物质,但对人体代谢至关重要。
▼
微量营养素缺乏在全世界范围内非常普遍,最新估计表明,3.72亿学龄前儿童和1.20亿育龄非孕妇缺乏一种或多种微量营养素。
维生素和矿物质缺乏,也被称为“隐性饥饿”,是一个严重的公共卫生问题,世界各个国家都存在,特别是低收入和中等收入国家的弱势群体。
在全球范围内,三分之二的妇女和儿童(主要来自经济不发达家庭)的饮食中至少缺乏一种微量营养素。全球最普遍的微量营养素缺乏症包括铁、锌、维生素A和叶酸。
★ 微量营养素缺乏会导致不良健康结果
微量营养素缺乏与多种不良健康结果相关,例如儿童发病率和死亡率增加、贫血、发育迟缓和认知缺陷。
虽然存在多种改善个人或人群微量营养素状况的策略,其中主食强化被认为是改善人群微量营养素状况最具成本效益的干预措施。
然而,由于多种原因,应对微量营养素缺乏症的策略并不总是有效。包括可接受性差(例如,孕妇铁补充剂)、强化水平差和质量控制不足(例如,维生素A强化食用油),强化食品未能惠及最贫困人群。
★ 不同营养素的吸收具有差异
微量营养素的吸收主要发生在小肠中,根据微量营养素的不同,具有不同的机制。
例如,锌和铁主要通过特定的运输载体在十二指肠和空肠中吸收,这些运输载体针对每种矿物质及其形式而异,而叶酸不仅在小肠中被吸收,而且在结肠中也被吸收,因为在这两个部位都鉴定出了转运蛋白。
微量营养素的吸收差异很大,例如,铁充足的男性成年人吸收的铁摄入量不到5%,而正常条件下摄入的锌吸收量大于30%。
注:大部分摄入的微量营养素会到达结肠。
★ 微生物群与微量营养素之间存在相互作用
在消化道中,有一个复杂的微生物群落,其浓度和多样性从口腔到结肠不断增加。尽管含有其他微生物(病毒、真菌),但大多数研究都重点关注细菌,其中厚壁菌门、拟杆菌门、放线菌门、变形菌门和疣微菌门是最重要的。
粪便细菌组成在个体之间存在很大差异,并且不仅取决于宿主的遗传学,还取决于包括饮食在内的许多环境因素。
注:大多数关于食物对肠道微生物群影响的研究都集中在大量营养素(脂肪、碳水化合物、蛋白质)上。
然而,细菌需要微量营养素才能生存。例如,细菌需要外部来源的铁,其中一些甚至开发出特定的机制,例如转铁蛋白来竞争铁源。
相比之下,许多细菌可以直接合成维生素,例如叶酸(维生素B9),因此不一定需要外部来源。
细菌影响微量营养素的生物利用度
常驻细菌可能对微量营养素产生直接作用,影响其对宿主的生物利用度,或者产生间接作用,例如通过产生能够改善上皮健康的代谢物,从而导致更好的吸收。
微量营养素影响肠道细菌的组成和功能
微量营养素的消耗反过来会影响肠道细菌的组成和功能。事实上,事实证明,补充铁可以导致潜在致病性肠杆菌科细菌的增加,以及被认为对健康具有积极影响的双歧杆菌科细菌和乳杆菌科细菌的减少。
微量营养素在控制人类健康的新陈代谢和组织功能维持中发挥着核心作用。
然而,尽管人们努力通过补充食品和饮食多样化来增加微量营养素的摄入量,全球微量营养素缺乏症的患病率仍然非常高,包括工业化国家。
推荐营养素摄入量和摄入上限
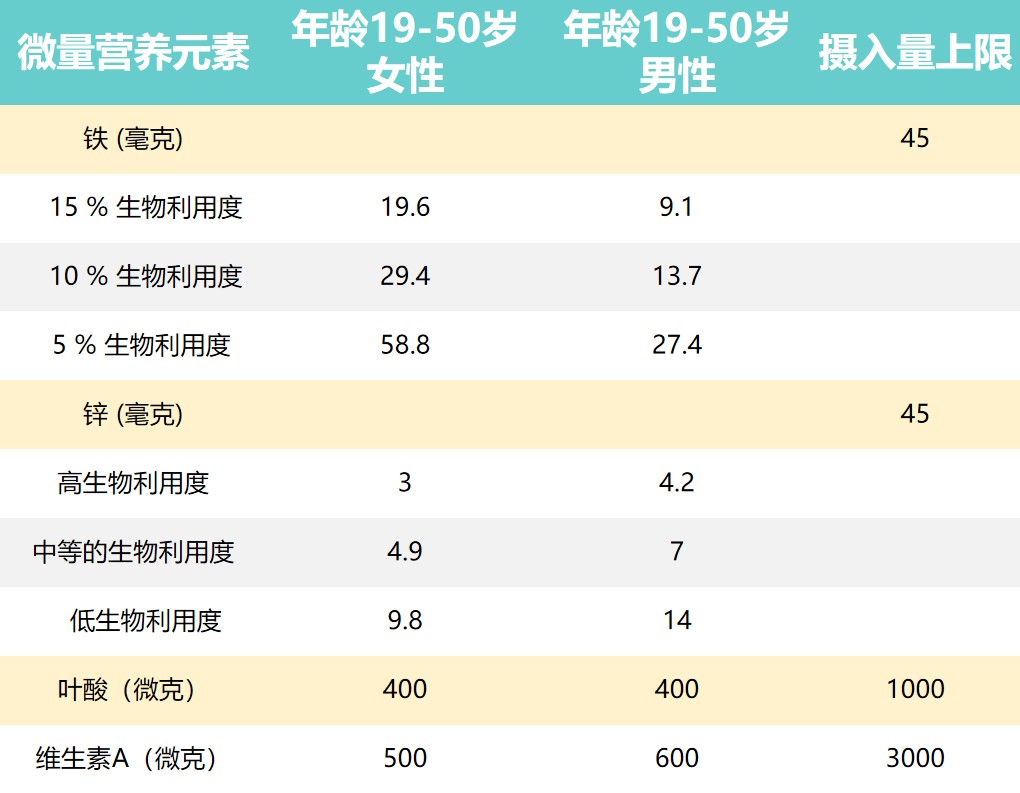
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
上表提出了男性和女性一些推荐营养素摄入量和可耐受的上限摄入水平。
由于维持生长和补偿损失(例如月经)的需求更高,儿童和妇女受到的影响更大。
★ 缺乏微量营养素的症状多样且大部分在晚期
单一微量营养素缺乏的临床症状多种多样,并且通常是具有微量营养素特异性的,但一般发生在缺乏的晚期阶段。例如缺铁性贫血是缺铁的最后阶段。
▼
缺铁被认为是最常见的微量营养素缺乏症,全世界估计有超过20亿人缺铁。它会导致贫血、免疫功能受损、工作能力下降以及内分泌功能受损。
导致铁缺乏的因素包括:
(1)血红素铁摄入量低,其生物利用度高于非血红素铁
(2)富含植酸酶或酚类化合物的饮食会降低生物利用度
(3)慢性炎症,导致铁调素水平升高,下调铁吸收
▼
据估计,全球有超过10亿人缺锌,它与儿童生长迟缓相关,但也会降低免疫能力,从而增加儿童对多种疾病的易感性,包括腹泻、肺炎,也许还有疟疾。
此外,锌缺乏似乎会导致其他微量营养素缺乏。
▼
据估计,低收入和中等收入国家超过20%的育龄妇女缺乏叶酸。
怀孕期间叶酸摄入不足与胚胎最初几周的神经发育缺陷有关。在普通人群中,叶酸缺乏还会导致巨幼红细胞性贫血和神经系统症状,这些症状与维生素B12缺乏症的症状部分重叠。
▼
维生素A缺乏不仅会导致干眼症和失明,还会影响免疫功能的许多方面,导致免疫能力下降以及皮肤和上皮完整性降低。
许多低收入和中等收入国家每半年向5岁以下儿童提供高剂量维生素A补充剂,以降低儿童死亡率,但这种干预措施的有效性受到质疑。
有关铁、细菌和宿主的相互作用,参考了最近的研究,下面总结了这种复杂关系的关键要素。
铁的吸收和稳态受到严格调节
由于人类无法主动排泄铁,因此铁的吸收在十二指肠中受到严格调节。
// 血红素铁
血红素铁和非血红素铁通过两种不同的途径吸收,血红素铁被十二指肠刷膜边缘的血红素载体蛋白1(HCP1) 吸收。
// 非血红素铁
非血红素铁通常呈三价铁形式,不具有生物利用度,必须通过十二指肠细胞色素b(DCYTB) 将其还原为二价铁形式,然后再由二价金属转运蛋白 (DMT1) 转运到十二指肠刷膜上 。
注:二价金属转运蛋白的存在已被描述,铁也在回肠和结肠中被吸收,但这些吸收位点对宿主铁状态的贡献仍不清楚。
铁进入肠上皮细胞后,储存在铁蛋白中,或通过基底外侧铁转运蛋白输出到循环系统中。
铁稳态由激素铁调素调节,铁调素通过不同机制抑制铁释放到血浆中。
铁调素是由肝脏合成并分泌的富含半胱氨酸的抗菌多肽,在免疫过程中能够大量表达参与免疫反应;在机体内铁平衡的调节中起到负性调节的作用。
肠道微生物群在铁吸收中的作用示意图
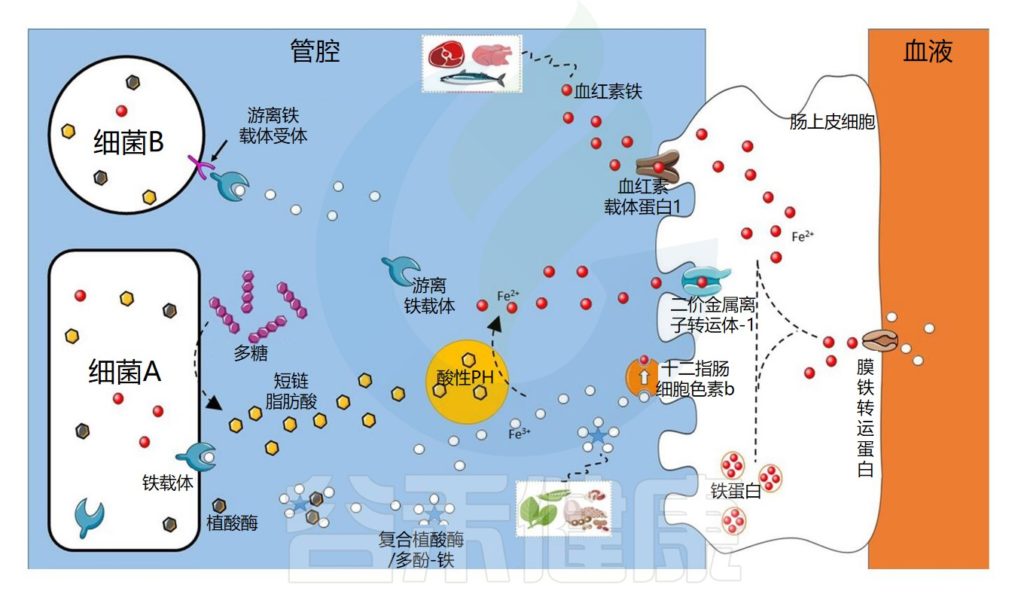
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
细菌可以通过不同的机制获取铁
细菌可以通过不同的机制获取铁,例如使用称为铁载体的铁特异性螯合剂,铁载体是化学性质多样的次级代谢产物,对铁具有高亲和力。
由此产生的铁-铁载体复合物通过特定的外膜蛋白(上图中的细菌A)内化。细菌还可以通过产生具有不同配体结合位点的外膜受体来利用其他细菌产生的铁载体(上图中的细菌B)。
铁载体在细菌缺铁的情况下表达
铁载体在细菌缺铁的情况下表达,因此不在铁充足的环境中表达。在厌氧条件和低pH值下,铁主要以二价铁的形式存在,可以被细菌直接转运,主要通过专用转运系统Feo,由不同的蛋白质。
细菌可以利用宿主铁化合物
细菌还可以利用宿主铁化合物,例如血红素或转铁蛋白,它们通过特定受体转运或直接吸收。此外,尽管牛奶中存在的乳铁蛋白具有抑菌功能,但它也可以被具有特定受体的细菌利用。
铁吸收的调节对于细菌非常重要,因为铁在较高浓度下有毒。在许多细菌物种中,当铁浓度过高时,铁吸收调节蛋白 (Fur) 会抑制与铁吸收相关的基因转录。
研究细菌有助于揭示新的铁吸收途径
值得注意的是,大部分关于细菌铁吸收的知识来自对病原菌的研究。长期以来,人们一直认为一些有益菌,例如乳杆菌科的成员,不需要铁来生长。然而已经在植物乳杆菌(Lactiplantibacillus plantarum)和清酒乳杆菌(Latilactobacillus sakei)中鉴定出了特定的系统。
研究这些细菌可能会揭示新的铁吸收途径。在铁吸收的主要部位十二指肠中,大约有103 个细菌/克,低于空肠(104 个细菌/克),并且远低于结肠,结肠中的细菌数量高达1012 个细菌/克。
此外,乳杆菌科属的成员在铁吸收最多的小肠中数量众多,因此这些细菌对宿主铁吸收的作用应受到更多关注,以确定它们是否在铁的生物利用度中发挥作用。
▼
铁对于许多细菌来说是必需的,它们的生长需要铁。
据计算,结肠中的铁浓度很高,并且远远超过细菌生长的最低要求。但细菌对铁的生物利用度还取决于一系列因素(铁的形式、铁形态、pH值、氧气水平等)。
不同形式的铁可用于补充或强化,例如硫酸亚铁、富马酸亚铁或乙二胺四乙酸铁钠。由于铁补充剂中含有的铁明显多于人体可以吸收的铁,因此大量未吸收的铁会留在消化道内腔中。
•铁补充剂会导致潜在致病菌水平升高
多项人类研究表明,铁补充剂或强化铁会导致潜在致病菌水平升高,并导致通常被认为是有益细菌种类减少,例如乳杆菌科成员。
最近一项针对大鼠的研究还表明,出生后补充铁会导致肠道微生物群发生改变,这种改变会持续到成年期。此外,研究表明,抗生素治疗后服用铁剂会导致肠道细菌的组成和功能发生改变。
铁对于致病细菌至关重要,哺乳动物的免疫系统已经具备了通过表达铁结合蛋白(如脂质运载蛋白-2 或乳铁蛋白)来控制细菌对铁的可用性的能力,这种现象称为“营养免疫”。
研究了补充铁对肠道微生物群的作用,总的来说,根据所使用的模型(体外、动物或人类),结果似乎有很大不同。
事实上,在补充铁期间,乳杆菌科总是减少,这在体外、小鼠和婴儿中均观察到。所用铁的化学形式似乎对细菌组成有不同的影响。此外,出乎意料的是,补充铁的效果与缺铁的效果并不直接相反。
▼
对于细菌和人体来说,非血红素铁的生物利用度低于血红素铁的生物利用度,因为它受到食物基质的成分和管腔的物理化学成分的影响。
•肠道细菌有助于更好地吸收铁
事实上,许多食物基质中的非血红素铁与抑制剂(例如多酚、纤维或植酸盐)相连,这些抑制剂可以被专用细菌酶降解,从而导致更好的铁吸收。
细菌还可以通过发酵饮食中的不可消化碳水化合物来产生短链脂肪酸,这会降低管腔pH值,从而将三价铁还原为二价铁,从而提高其被细菌和宿主的吸收。
其他一些有机酸(例如乳酸)是由许多细菌产生的,存在于整个消化道中。酸化的肠道环境还可以降解螯合微量营养素的复合物并促进铁的吸收。
扩展阅读:
▼
考虑到补铁的依从性低以及腹泻或便秘等副作用,很多研究已经测试和发现其他改善铁状态的策略。
它们包括使用益生菌、益生元和后生元等。
•使用益生菌改善铁状况
例如,将益生菌植物乳杆菌(Lactiplantibacillus plantarum 299v)与铁、抗坏血酸和叶酸一起食用,对健康、非贫血的瑞典孕妇的铁状况是安全的,可减少铁储备的损失并改善铁状况。
在另一项研究中,将果胶组装成铁纳米颗粒作为基质,用于植物乳杆菌(Lactiplantibacillus plantarum CIDCA 83114)的递送。益生菌没有毒性,生存能力没有减弱,这为用替代的铁输送策略对抗缺铁提供了新的视角。
•使用益生元帮助铁的吸收
在大鼠模型中,食用益生元寡糖通过调节肠道微生物群来增强铁吸收。摄入益生元后肠道pH值的降低可以帮助铁的吸收,此外还能以有益的方式改变肠道微生物组成。因此,益生元可以成为改善宿主铁状况的良好选择。
•食用乳铁蛋白增加铁的吸收
在肯尼亚婴儿中,研究表明,与单独服用硫酸亚铁相比,同时食用无铁乳铁蛋白(脱铁乳铁蛋白)和硫酸亚铁能够显著增加铁的吸收。
注:考虑到乳铁蛋白对肠道微生物群的影响,一些学者认为乳铁蛋白可能在婴儿铁配方中有用,因为它可以增加铁的吸收,同时可能减轻未吸收的铁对肠道微生物群的不利影响。
•使用富铁微生物
这些预防和治疗缺铁的新策略可能包括使用富铁微生物,除了从益生菌摄入中获益之外,它还可以为宿主提供大量矿物质。
在贫血小鼠中已显示,食用在铁存在下生长的酵母能够提高小鼠的血红蛋白浓度。在人类中只进行了一些尝试,其中含有富铁酵母的奶酪的吸收效率不如单独含有硫酸铁的奶酪。
注:还应该进行补充研究来评估富铁微生物在人类中的应用的全部潜力。
小结
从上面可以明显看出,肠道细菌在调节宿主铁的生物利用度方面发挥着重要作用。然而,宿主因素可以调节细菌对铁的吸收,例如,在炎症的情况下,脂质运载蛋白将与铁载体结合,从而对抗肠道细菌对铁的捕获。
最近,有人提出,共生细菌不仅使用不同的机制来释放和捕获铁,而且还在它们自己和它们的宿主之间共享铁。事实上,细菌扩散性铁载体生产的例子可以捕获铁,但不能保证这些铁将被生产细菌利用,这表明对可用铁的共同管理。
迄今为止,人类对锌、宿主和肠道微生物群之间相互作用的研究远少于铁。
★ 人体需要每日摄入锌
每日摄入锌补充剂,成人 40 毫克/天,通常被认为是安全的。
锌参与DNA合成、转录和翻译等重要过程。锌的吸收发生在十二指肠,涉及跨膜锌转运蛋白Zip4。然后,锌通过锌调节蛋白ZnT2-10转运至金属蛋白合成位点,或通过锌转运蛋白ZnT1输出至循环系统。
与铁相反,哺乳动物缺乏锌储存机制,每日摄入是必不可少的。如果过量,锌也可以主动排泄,锌通过基底外侧的 Zip5/Zip14 蛋白从循环分配到肠上皮细胞,并通过ZnT5从肠上皮细胞流出到管腔。
肠道微生物群在锌吸收中的作用示意图
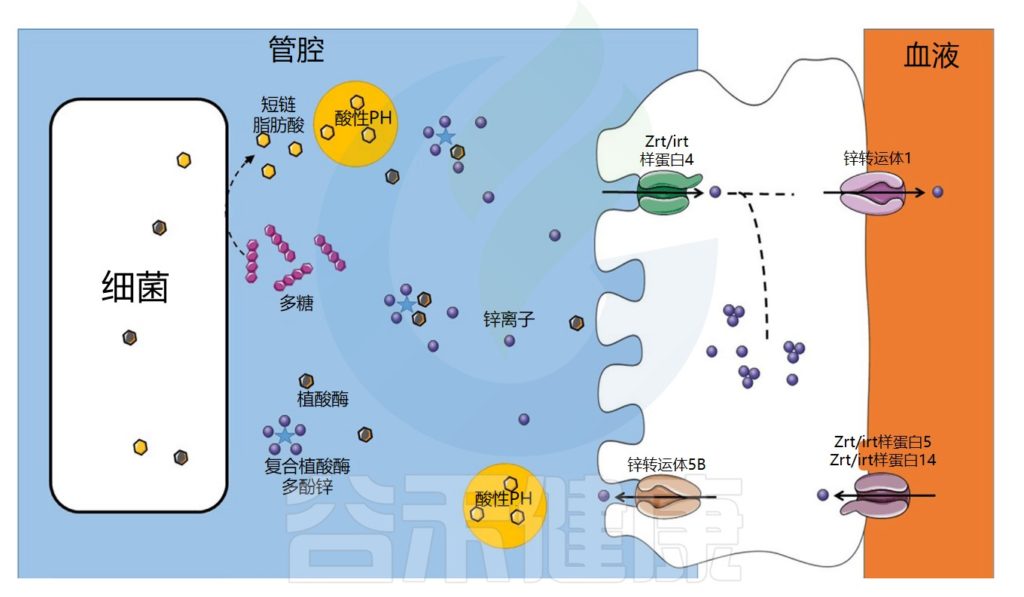
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
锌的转运与吸收过程
在食物中,锌可以与抗营养因子如植酸盐或多酚络合,从而减少其吸收。未被小肠吸收的锌会到达结肠,并可能被结肠细胞吸收,因为锌转运蛋白也在结肠中表达。
在细菌中,锌通过锌伴侣蛋白转运至金属蛋白合成位点。细菌对锌的吸收受锌吸收抑制因子Zur和锌流出抑制因子CzrA的调节。一些病原菌可以通过表达高亲和力转运蛋白(ZnuABC)来克服锌限制条件。
锌浓度过高可能对某些病原菌有毒。与铁的情况一样,宿主和病原微生物之间也存在竞争。事实上,宿主还利用营养免疫来通过产生钙卫蛋白来限制锌的生物利用度。
例如,钙卫蛋白在消化道中结合锌。
▼
锌缺乏与慢性腹泻相关。补锌对肠道微生物群的影响主要在动物模型中进行研究。它已在家禽和养猪业中以药物剂量用于减少胃肠道感染和腹泻。
√锌具有抗菌活性,能够减少腹泻
锌具有抗菌活性,不同的研究强调了高剂量的锌会引起肠道不同部位(从胃到结肠)细菌组成的变化。
在断奶仔猪中,使用低剂量的锌可以通过改善小肠形态和通透性、增强屏障功能,有效促进生长性能并减少腹泻。
此外,锌还能丰富肠道微生物群中的链球菌科(Streptococcaceae)和乳杆菌科(Lactobacillaceae),并减少芽孢杆菌和肠道疾病相关病原体,包括回肠腔中的梭状芽胞杆菌和克罗诺杆菌。
注:如果缺锌小鼠补充锌是有益的,那么过量的锌饮食摄入会改变肠道微生物群并降低对艰难梭菌感染的抵抗力。
√一些菌属可以预测锌的充足性
但研究结果并不一致。事实上,一项针对鸡的研究表明,瘤胃球菌属(Ruminococcus)可以预测宿主体内锌的充足性。但在一项针对小鼠的研究中,黑色素杆菌(Melainabacteria)和脱硫弧菌属(Desulfovibrio)被确定为锌状态的潜在标志物。
▼
尽管许多代谢过程都需要锌,但关于锌状态或补充剂对肠道微生物群影响的研究却很少。
√一些细菌可以作为锌缺乏的生物标志物
最近的研究表明,尽管缺锌和锌充足的学龄儿童之间的细菌多样性相似,但缺锌儿童的个体多样性更高。特别是,粪杆菌(Coprobacter)、醋酸弧菌(Acetivibrio)、副普雷沃氏菌(Paraprevotella)和梭状芽胞杆菌在缺锌组中更为丰富。它们可以用作进一步临床诊断锌缺乏的生物标志物,但需要更多的工作来推广这一结果。
锌的摄入量也会显著增加儿童粪便细菌。在同一项研究中还鉴定出了纳米颗粒抗性细菌的一些代表。
▼
由于补锌会改变肠道微生物群的组成和功能,因此许多研究已经研究了锌与益生菌一起服用的效果。
√锌与益生菌一起补充
例如,在大鼠中,施用在富锌培养基中生长的长双歧杆菌(Bifidobacterium longum CCFM1195)比单独补充锌更能有效地增加血浆锌浓度。
此外,一些细菌群(如乳杆菌科)的丰度随着富含锌的双歧杆菌的消耗而增加。使用富含硒和锌的植物乳杆菌对小鼠进行类似的设计,与对照组或补充硒锌的组相比,能够增加循环锌浓度。这种增加伴随着肠道细菌组成的改变,乳杆菌科(Lactobacillaceae)的比例增加。
√儿童单独补充锌可能更有效
最近总结了研究中获得的数据,对于24个月以下儿童的治疗,单独补充锌可能比益生菌更有效;在学龄前儿童中同时补充锌和植物乳杆菌并不比单独补充益生菌更有效。因此,锌和益生菌联合给药的有效性需要更多的人体研究。
使用益生元似乎效率较低,因为给猪施用锌和马铃薯纤维对大多数分析指标没有显示出任何交互作用。
注:锌源和纤维补充对微生物群生态的影响是独立的。
小结
与铁的情况一样,对锌状态和宿主微生物群的研究主要集中在致病条件上,而对细菌在正常情况下的作用知之甚少。
肠道细菌、锌和宿主之间的关系值得更深入地研究,尤其是在人类中。事实上,富锌益生菌等有前途的工具正在出现,它们代表了治疗锌缺乏症的替代方案。特别是大剂量、长期补锌可能会干扰铁和铜的吸收,导致铁和铜的缺乏。
叶酸,也可以称之为维生素B9,是一种水溶性维生素。叶酸在蛋白质合成及细胞分裂与生长过程中具有重要作用,对正常红细胞的形成有促进作用。
一些共生细菌已被证明可以合成某些维生素,细菌也可以成为宿主叶酸的来源,即使整体贡献的程度不清楚。同时,叶酸的摄入会影响肠道微生物群。
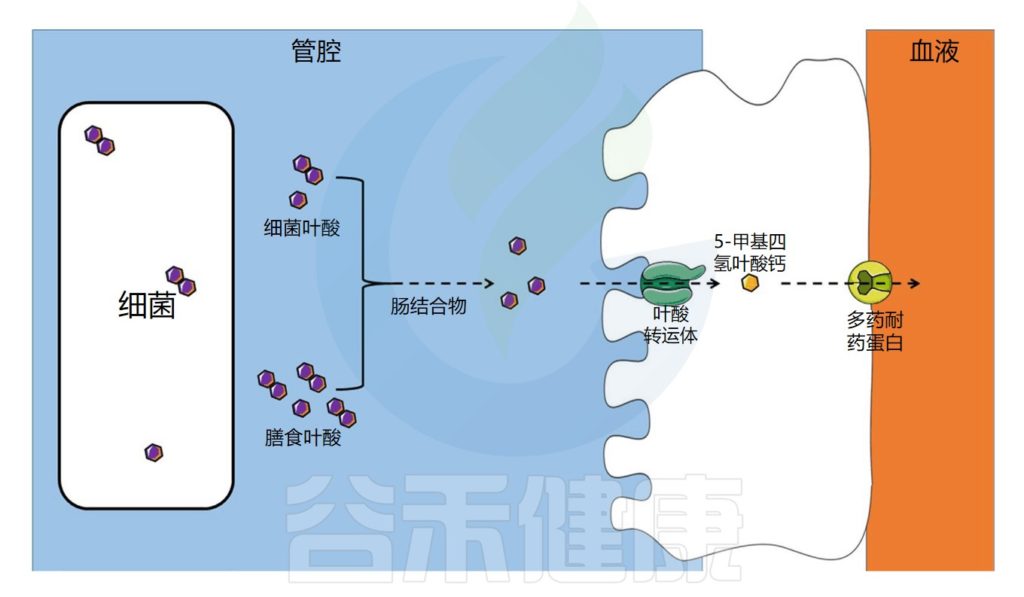
叶酸的转运与吸收过程
饮食中的叶酸以单谷氨酸盐和聚谷氨酸盐形式存在,它们被肠道结合物分解为单谷氨酸盐形式,然后通过特定的转运蛋白偶联叶酸转运蛋白(PCFT)在回肠中吸收。
在肠上皮细胞中,叶酸单谷氨酸转化为活性形式5-甲基四氢叶酸(5-MTHF),它可以被运输到循环系统。
注:细胞叶酸外排可能由多个耐药蛋白(MRPs)家族介导。在结肠中,已经发现了相同的一种受体。
肠道微生物群在叶酸吸收中的作用示意图
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
▼
细菌的生长需要叶酸,一些细菌是原养型细菌,可以从环境中存在的前体合成叶酸,而营养缺陷型细菌必须从环境中获取叶酸。
✦肠道细菌合成叶酸
大量文献支持细菌叶酸合成对宿主叶酸状态的重要贡献。早期研究报告称,人类粪便样本中的叶酸浓度为300-500µg/天,而饮食摄入量低于100µg/天,表明肠道细菌可以合成叶酸。
事实上,512个细菌基因组的叶酸生物合成能力预测表明,其中13%的细菌基因组包含所有叶酸生物合成相关基因,而39%的细菌基因组可以在外部来源提供额外的对氨基苯甲酸的情况下合成叶酸。
总而言之,这些数据表明肠道微生物群是叶酸的重要来源,并且饮食等不同因素导致的肠道微生物群组成的变化可能会影响叶酸的需求。
✦肠道细菌可以转化叶酸以便更好地利用
由于纤维消耗而改变肠道微生物群组成可能导致结肠内容物或循环中叶酸浓度增加。此外,尽管结肠中的叶酸吸收比小肠中的叶酸吸收慢100倍,但标记的叶酸被专门包裹在结肠中并在结肠中分解,并被纳入宿主组织。
肠道细菌不仅合成可供宿主使用的叶酸,还可以将叶酸转化为更好地被宿主吸收的维生素体,正如秀丽隐杆线虫(Caenorabditis Elegans)模型所证明的那样,其中细菌可以将叶酸转化为四氢叶酸。
✦微生物代谢叶酸的能力与宿主生理状况相关
肠道微生物群的代谢能力不仅取决于其组成,还取决于宿主的生理特征。例如,与成人相比,婴儿和幼儿肠道微生物群中更频繁地发现编码参与叶酸生物合成的酶的基因。
有趣的是,受营养不良影响的儿童的微生物组显示,参与B族维生素代谢的多个途径中的基因丰度显著降低。此外,在肥胖女性中观察到叶酸水平较低,同时产生B族维生素的细菌也减少。
▼
许多产生叶酸的细菌被鉴定并成功用于增加发酵食品的叶酸含量。其中一些细菌还能够改善缺乏叶酸饮食的啮齿动物的叶酸状况。
✦产生叶酸的益生菌改善叶酸状态并调节微生物组成
使用产生叶酸的益生菌可能是改善叶酸状态并调节肠道微生物群的一种方法。在体外发现了有希望的结果,其中产生叶酸的清酒乳杆菌(Latilactobacillus sakei)被证明可以增加短链脂肪酸并改变粪便细菌组成。
在大鼠中,食用使用产生叶酸的植物乳杆菌制备的发酵奶能够恢复正常的叶酸状态,同时广泛改变肠道细菌组成。
▼
叶酸摄入量对肠道细菌的影响并不一致。
✦叶酸缺乏可能影响部分动物的肠道细菌组成
在小鼠身上发现膳食叶酸缺乏不会影响肠道细菌组成,可能是一些细菌可以在缺乏时产生叶酸,叶酸摄入量的波动对肠道微生物群的影响较小。
然而,在其他动物模型中,叶酸摄入改变了肠道微生物群的组成,例如鸡和小猪。
✦叶酸缺乏影响微生物多样性
叶酸缺乏也会影响微生物多样性,因为在限生小鼠中发现,与微量营养素充足的饮食相比,叶酸缺乏的饮食在21天后增加了β多样性,但随后的14天全饮食治疗并没有改变这一趋势。
小结
宿主的叶酸状态、食物或肠道中的叶酸产生细菌之间存在多种关联。这种关联通常是矛盾的,但有利于宿主和细菌区室之间的密切相互作用,这表明需要进行大规模人类研究,以更好地了解与叶酸可用性和改善人群叶酸状态的策略相关的宿主-微生物群相互作用。
叶酸重要天然来源有:
花生(246微克/100克)、葵花籽(238微克/100克)、芦笋(149微克/100克)、生菜(136微克/100克)、一些绿叶蔬菜和柑橘类水果等。
扩展阅读:维生素B9(叶酸)
维生素A在免疫调节中发挥着至关重要的作用,包括调节细胞因子的产生和淋巴细胞归巢至粘膜表面。它通过调节肠上皮中免疫细胞的增殖和分化,直接有助于维持肠道屏障,并在抵抗肠道病原体入侵方面发挥着至关重要的作用。
膳食维生素A以视黄醇和类胡萝卜素的形式存在,分别存在于动物和蔬菜中。
肠道微生物群在维生素A吸收中的作用示意图
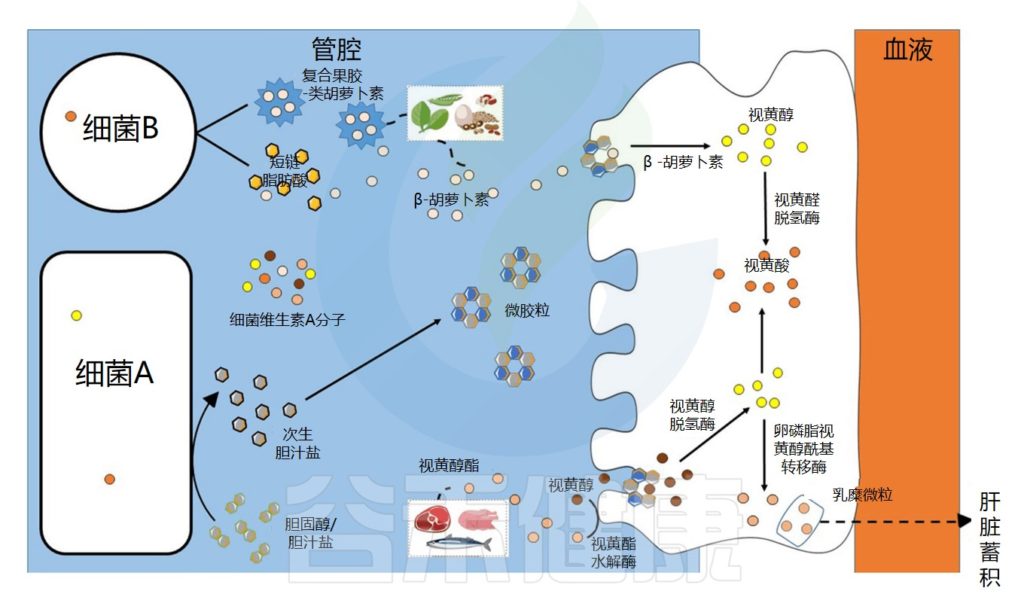
Dje Kouadio DK,et al.Crit Rev Food Sci Nutr.2023
维生素A的吸收过程
视黄醇和类胡萝卜素是膳食脂溶性成分,在被肠上皮细胞吸收之前需要通过胶束溶解 。在胃和十二指肠中发生乳化成液滴的阶段,类胡萝卜素和视黄醇的摄取发生在小肠的上半部。
在肠上皮细胞中,类胡萝卜素通过胡萝卜素-15,15′-双加氧酶直接转化为全反式视黄醛。视黄醛可被视黄醛脱氢酶不可逆地转化为具有生物活性的视黄酸分子,或被转化为视黄醇酯,储存在肝脏中。
▼
肠道微生物群在维生素A代谢中的作用可能依赖于特定酶、脂多糖的产生,脂多糖可能有助于胶束形成或直接吸收,以及胆汁稳态。
•微生物通过调节胆汁酸有利于维生素A的溶解和吸收
一项以绵羊为模型的研究表明,宿主微生物群通过调节胆汁酸分泌对维生素A吸收产生影响。在该模型中,胆汁酸水平降低与维生素A吸收减少相关,并与瘤胃球菌科丰度密切相关。
由乳杆菌(Lactobacillaceae)、双歧杆菌(Bifidobacterium)、拟杆菌(Bacteroides)或梭菌属等细菌产生的二级或三级胆汁盐的分泌可能有利于维生素A的溶解并改善其吸收,因为胆汁盐对于胶束化过程至关重要。
•肠道微生物可以直接和间接影响维生素A代谢
肠道细菌的基因组具有在动物和植物中发现的不同酶的类似物,这些酶允许乙酰辅酶A通过甲羟戊酸途径合成类胡萝卜素和类维生素A。
此外,来自拟杆菌(Bacteroides)、肠球菌(Enterococcus)和链球菌(Streptococcus)的细菌具有与宿主BCMO基因相似的brp/blh基因,可以将β-胡萝卜素转化为全反式视黄醇。
因此,肠道微生物组对维生素A代谢的影响既包括直接影响(如类胡萝卜素的合成),也包括间接影响(如调节其生物利用度)。
•肠道微生物合成相关蛋白有助于维生素A转运
类胡萝卜素的生物利用度会受到各种食物成分的影响,其中食物基质中蔬菜的细胞壁结构和组成形成物理屏障,从而限制消化酶的作用。
果胶和一些多酚(例如柚皮素)已被证明可以通过结合管腔中的胆固醇和胆汁盐来降低类胡萝卜素的体外生物利用度,从而抑制胶束的形成。
相反,果胶可以被许多共生细菌降解,并且肠道中的这种降解可能会增加类胡萝卜素的生物利用度。
此外,肠道微生物群合成酶或补体蛋白,例如细菌脂质运载蛋白,这可能有助于将类维生素A转运到肠上皮细胞中。
•肠道细菌调节宿主视黄醇的代谢
肠道微生物群可以消化膳食纤维,从而释放 β-胡萝卜素或其他结合态的微量营养素。
此外,肠道细菌群还可以调节宿主视黄醇的代谢,调节驱动免疫反应的视黄酸的产生。梭状芽胞杆菌类细菌可以通过抑制基因Rdh7的表达来调节肠道上皮中的视黄酸浓度,从而启动视黄醇向视黄酸的转化。
此外,这项研究表明,共生细菌群落降低了视黄酸的产生,视黄酸的产生通过肝脏储存形式的增加来平衡,并有利于视黄酯途径,而潜在致病菌则促进视黄酸的产生。
▼
肠道中维生素A的状态和类视黄醇的可用性可以调节肠道微生物的组成。
•维生素A调节免疫球蛋白的产生帮助保持细菌稳态
类胡萝卜素摄入、免疫功能和肠道细菌稳态之间相互作用的模型,表明维生素A可以通过调节IgA的产生来有助于保持细菌稳态。
在动物中,与未缺乏维生素A的小鼠相比,缺乏维生素A的小鼠的肠道微生物组成中,以下菌属的丰度较低:
另一项研究表明,拟杆菌在维生素A缺乏小鼠中的比例较低,维生素A缺乏组和维生素A充足组之间的几个细菌比例不同。在小鼠模型中,维生素A被证明可以调节分段丝状细菌(SFB)的丰度。
分段丝状细菌是一组能够诱导Th17细胞分化的细菌。
▼
•维生素A的摄入与微生物群多样性相关
类胡萝卜素的摄入量和状态与更大的微生物群多样性和有益细菌丰度的增加有关。
例如,在孕妇中,类胡萝卜素的摄入量和血浆浓度与肠道微生物群的α多样性呈正相关。
•维生素A影响免疫反应
维生素A对肠道微生物群组成的调节可能作为调节肠道免疫反应的间接途径。
例如,维生素A在体外和体内均被证明可以抑制诺如病毒(急性胃肠炎最常见的病毒因子)的复制,并且这种抑制似乎是通过微生物组变化直接或间接发生的,特别是肠道中的乳杆菌科。
•改善疾病患者的微生物组成
在溃疡性结肠炎患者中,摄入维生素A有益,可导致微生物群组成发生显著变化。
在自闭症儿童中,维生素A补充剂增加了拟杆菌目细菌的比例,并减少了双歧杆菌属的细菌比例。
有趣的是,一项针对306名孟加拉国新生儿的研究表明,与安慰剂相比,补充维生素A增加了男孩双歧杆菌的丰度,而这种差异在女孩中并未观察到。
对这些婴儿直至2岁的随访表明,女孩中放线菌相对丰度与血浆视黄醇呈浓度依赖性正相关,但男孩中则不然。
此外,阿克曼菌(一种与粘膜相关的细菌)的相对丰度也与女孩的血浆视黄醇呈正相关。
微生物群在肠道中参与了微量营养素的代谢和吸收,并且可以影响宿主的微量营养素状态。在这方面,给出以下一些建议:
➤ 1
摄入多样化的食物可以为肠道微生物提供更广泛的营养来源,从而促进微生物群的多样性和稳定性。
建议摄入富含膳食纤维的水果、发酵食物、蔬菜、全谷类食物以及富含微量营养素的食物,如坚果和海鲜等。
例如,香蕉钾含量高,还含有大量维生素 B6 和维生素 C。西兰花不仅富含维生素 C,还富含维生素 K、铁、钙和钾。
确保摄入足够的每种维生素和矿物质的一个简单方法就是“彩虹饮食”,彩虹饮食顾名思义就是色彩缤纷的蔬菜和水果,它们含有丰富的微量营养素,是一种健康趋势。每餐可以注意一下,是否有至少三到四种不同颜色的植物性食物,对于孩子,也可以鼓励他们去寻找不同的颜色。

下表列出了常见的维生素的食物来源,可供参考。

➤2
维生素D可以增加肠道对钙的吸收能力,并促进钙的转运到骨骼和其他组织中。
维生素 C 有助于改善植物中铁的吸收,这对于素食者来说尤其重要,可以在菠菜沙拉中添加柠檬汁。维生素C通过提高铁的溶解度或作为十二指肠细胞色素B将铁从铁还原为铁的辅助因子,有助于非血红素铁的生物利用度。
维生素B12和叶酸之间存在相互依赖的关系。维生素B12参与叶酸的代谢和激活,而叶酸则有助于维生素B12的合成和利用。
其他如,维生素E是一种脂溶性维生素,需要脂肪的存在来促进其吸收。摄入适量的脂肪可以提高维生素E的吸收率。
微量营养素之间的相互作用是复杂的,并且还受到其他因素的影响,最好的方式是通过均衡的饮食来获取各种微量营养素,因为食物中的微量营养素通常以复杂的组合形式存在,相互之间的相互作用更加协调和自然。
➤3
益生菌和益生元是一些有益的微生物和它们的营养物质,可以促进肠道的健康和微生物群的平衡。
建议摄入含有益生菌的酸奶、发酵食品、益生元的食物如洋葱、大蒜和麦麸等,以支持肠道微生物的生长和活动。
益生菌和益生元可能有助于微量营养素的最佳生物利用度,减少负面影响
例如,益生元低聚半乳糖减轻了补铁对婴儿肠道的不利影响,而罗伊氏乳杆菌与泻药氧化镁结合使用可以改善儿童的慢性便秘,而不会导致微生物组失衡。
益生元可以改变肠道微生物群,促进产短链脂肪酸的菌产生(如双歧杆菌、乳酸杆菌、真杆菌等),与钙吸收(在人类和动物模型中)、骨密度和强度(在动物模型中)增加相关。
扩展阅读:
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
➤4
一般来说,在小谷物食品的自然发酵中,B族维生素的利用率可能会增加,并且可能会产生一些氨基酸,虽然说谷物含有一些维生素,但在小谷物食品发酵过程中添加乳酸菌或酵母可能会提高维生素水平。
例如,添加乳酸乳球菌N8 和布拉酵母菌Saccharomyces boulardii SAA655可将 idli 面糊中核黄素和叶酸的浓度提高 40-90%。
注:Idli 是印度的一种传统发酵面包,是一种由大米和脱壳黑豆原料的混合物,经过湿磨和传统发酵制成的糕点。
尽管小米主要用于制造面粉,但其加工(发芽和发酵)会增加谷物的铁含量。
➤5
抗生素的滥用可能破坏肠道微生物群的平衡,影响微量营养素的代谢和吸收。
抗生素还可能导致肠道黏膜的炎症反应,进一步干扰微量营养素的吸收和利用。
在使用抗生素时,建议按照医生的指导使用,并且在必要时采取预防措施,如同时摄入益生菌和益生元,以减少对肠道微生物的不良影响。
扩展阅读:
➤6
过度摄入糖或长期的压力和焦虑会对肠道微生物和宿主营养吸收产生不良后果。
深加工食品通常经过多道工序,其中许多有益的营养物质可能被去除或破坏。这些食品通常富含添加剂、防腐剂和高糖分,而这些成分可能会对微量营养素的吸收和利用产生负面影响。
通过减少摄入加工食品、管理压力等干预措施,可以帮助改善营养吸收和维持良好的微量营养素水平。
扩展阅读:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
➤7
运动可以改善血液循环,增加血液流向肠道和其他组织,从而提高微量营养素的输送和吸收。
运动还可以提高新陈代谢,提高能量消耗和细胞代谢的速度。这可能会导致对微量营养素的需求增加,从而促进其吸收和利用。
➤8
定期体检可以帮助发现潜在的营养和健康问题,及早采取措施。
定期进行体检是监测体内微量营养素的一种方法,但它可能无法提供详细的微量营养素水平信息。常规体检通常包括血液检查,可以检测一些关键的营养素水平,如铁、维生素B12、维生素D等。对于有些微量营养素,可能需要进行特殊的检测。
➤9
由于每个人的肠道微生物群和微量营养素状态可能存在差异,个体化的营养咨询和评估可以帮助确定针对个体需求的饮食和营养。
肠道菌群和微量营养素之间存在着紧密的关系和相互作用。肠道菌群中的某些菌种可以帮助合成和吸收微量营养素。这些菌种通过代谢和转化,将食物中的原始形式的微量营养素转化为人体可以吸收和利用的活性形式,提供给宿主机体所需。
同时,适当的微量营养素摄取也对肠道菌群的平衡和健康至关重要。一些微量营养素,如锌、铁等,不仅是肠道菌群的生长和代谢所必需,还能影响菌群的结构和功能。缺乏这些微量营养素可能导致菌群紊乱,而菌群紊乱又可能影响微量营养素的吸收和利用。
肠道细菌对宿主微量营养素状态的影响是一个急需关注的研究领域。同时对微量营养素代谢的研究应该扩大到包括一般肠道微生物组成,而不仅仅是病原菌。
相关阅读:
主要参考文献
Dje Kouadio DK, Wieringa F, Greffeuille V, Humblot C. Bacteria from the gut influence the host micronutrient status. Crit Rev Food Sci Nutr. 2023 Jun 27:1-16.
Amimo, J., H. Michael, J. Chepngeno, S. Raev, L. Saif, and A. Vlasova. 2022. Immune impairment associated with vitamin A deficiency: Insights from clinical studies and animal model research. Nutrients 14 (23):5038.
Baldi, A. J., L. M. Larson, and S.-R. Pasricha. 2020. Balancing safety and potential for impact in universal iron interventions. Global Landscape of Nutrition Challenges in Infants and Children 93:51–62.
Cuisiniere, T., A. Calve, G. Fragoso, M. Oliero, R. Hajjar, E. Gonzalez, and M. Santos. 2021. Oral iron supplementation after antibiotic exposure induces a deleterious recovery of the gut microbiota. BMC Microbiology 21 (1):1–15.
Kang, S., R. Li, H. Jin, H. Y ou, and G. Ji. 2020. Effects of selenium and zinc-enriched Lactobacillus plantarum SeZi on antioxidant capacities and gut microbiome in an ICR mouse model. Antioxidants 9 (10):1028.
Kramer, J., Ö. Özkaya, and R. Kümmerli. 2020. Bacterial siderophores in community and host interactions. Nature Reviews. Microbiology 18 (3):152–63.
McMillen, S., S. Thomas, E. Liang, E. Nonnecke, C. Slupsky, and B. Lonnerdal. 2022. Gut microbiome alterations following postnatal iron supplementation depend on iron form and persist into adulthood. Nutrients 14 (3):412.
Qin H, Wu H, Shen K, Liu Y, Li M, Wang H, Qiao Z, Mu Z. Fermented Minor Grain Foods: Classification, Functional Components, and Probiotic Potential. Foods. 2022 Oct 11;11(20):3155. doi: 10.3390/foods11203155. PMID: 37430904; PMCID: PMC9601907.

谷禾健康

越来越多的证据表明,肠道菌群定植紊乱和微生物多样性减少与全球非传染性疾病 (NCD) 的增加有关。影响儿童和青少年的非传染性疾病包括肥胖及其相关合并症、自身免疫性疾病、过敏性疾病和哮喘。饮食变化也与非传染性疾病的发病机制有关,并且由于饮食是肠道微生物群组成和功能的主要驱动因素之一,因此人们开始关注通过饮食干预,来促进健康的肠道微生物群,最终促进健康。
一些生物活性营养素,如长链多不饱和脂肪酸 (LC-PUFA)、铁、维生素、蛋白质或碳水化合物,已被确定在婴儿出生后的前 1000 天对婴儿生长、神经发育发挥重要作用,以及肠道菌群的建立和成熟。LC-PUFA 是中枢神经系统 (CNS) 的结构成分,对视网膜发育或海马可塑性至关重要。最近,乳脂球膜 (MFG) 的成分被添加到婴儿配方奶粉中,因为它们在婴儿发育中起着关键作用。
大量摄入蛋白质会导致婴儿期体重增加更快,但这与后来的肥胖有关。可消化的碳水化合物提供葡萄糖,这对中枢神经系统的充分运作至关重要;不易消化的碳水化合物 [例如人乳低聚糖 (HMO)] 是肠道细菌的主要碳源。婴儿期缺铁性贫血与精神和精神运动发育的改变有关。与维生素 B6 和 B12 密切相关的叶酸代谢控制表观遗传变化。
从历史上看,重点一直放在早期营养对生长模式和儿童体脂成分的影响上。证据表明,生命早期摄入过多的能量和快速或缓慢的生长模式与不良的发育结果有关;事实上,婴儿期体重快速增加是晚年肥胖的重要预测指标。
肠道菌群与营养失调与多种儿科疾病有关,营养素的摄入和肠道微生物群的定植和成熟是相互关联的,因此通过饮食干预来促进健康的肠道微生物群是一种有前途的方法,可以改善儿童健康结果。

本文讨论和总结评估营养和肠道微生物群对儿童健康结果影响的临床研究的最新发现,并分享使用营养方法有利地改变肠道微生物群以改善儿童健康结果的研究成果。
脂肪酸是许多脂质的主要成分,必须通过婴儿饮食提供必需的脂肪酸,以实现健康成长、神经发育、免疫系统和胃肠功能。
婴儿的脂肪摄入量占比
在生命的头几个月,多不饱和脂肪酸 (PUFAs) 的需求增加,因为快速生长和神经发育。婴儿的脂肪摄入量在母乳喂养期间很高,从开始添加辅食后的第一年下半年逐渐减少。脂肪营养需求量占每日总能量摄入:
细分各类脂肪酸的摄入量
最近,不同的国家确定亚油酸的摄入量应占总能量的 4%,而 α 亚麻酸应占总能量的 0.5%。
长链多不饱和脂肪酸 (LC-PUFAs)、n-3 二十二碳六烯酸 (DHA, 22 : 6n-3) 和花生四烯酸 (ARA, 20 : 4n-6) 是中枢神经系统细胞膜的功能成分,在神经传递具有关键作用。
欧洲食品安全局 (EFSA) 委员会已确定:
0 ~ 24 个月的 DHA 摄入量为 100 毫克/天;
0 ~不到6个月的 ARA 摄入量为 140 毫克/天;
ARA 和 DHA 由母乳提供
婴儿的 DHA 状态是通过母乳提供的,它取决于母亲的 DHA 状态;尽管如此,母乳中的 ARA 浓度始终接近总脂肪酸的 0.5%,通常高于 DHA,与 DHA 相比更稳定。
与大脑发育相关的脂肪酸
大量的 n-3 和 n-6 LC-PUFA 在器官和组织的膜中迅速积累。在胎儿生命的最后三个月和生命的头两年,DHA 在脑组织中积累,特别是在与注意力、运动控制和感觉统合相关的灰质区域,而 ARA 负责海马可塑性。
已经表明,ARA 的延伸产物肾上腺酸 (ADA,22:4n-6) 是细胞膜中的重要成分。ADA构成了大脑中近一半的n-6 LC-PUFA,n-6 LC-PUFA的含量远远超过n-3 LC-PUFA。
均衡摄入DHA和ARA对大脑功能和发育至关重要
事实上,生命早期较高的 DHA/ARA 比率与更好的认知结果相关。已经表明,神经发育结果有利于 DHA 与 ARA 的比例为 1:1 或 1:2,而与1:1和1:2的比例相比,1.5∶1的比例会降低大脑发育过程中红细胞中ARA的浓度。
在脂肪酸摄入量和线性生长之间建立关系的研究得出了不同的结论。其中一些人认为必需脂肪酸对于婴儿期的最佳线性生长很重要,也有研究人员没有发现任何关联。
乳脂球膜蛋白的健康益处
另一方面,脂肪的研究工作表明,乳脂球膜 (MFGM) 蛋白代表母乳的生物活性部分,可提供一些健康益处。这种膜组分由不同的生物活性成分(磷脂酰胆碱、鞘磷脂、胆固醇和脑苷脂、神经节苷脂等)组成,它们对大脑发育和免疫功能有积极影响并保护新生儿胃肠道调节肠道菌群组成。
饮食中脂肪酸的分布与肠道菌群的关联
我们通常认为饮食中脂肪过多会造成肥胖,实际上,饮食中脂肪酸的分布也可能改变肠道微生物群的组成和肥胖状况。最近,表明人乳中的 sn-2 脂肪酸与婴儿肠道微生物群之间存在显着关联;ARA 和 DHA 与拟杆菌属(Bacteroides)、肠杆菌科(Enterobacteriaceae)、韦荣球菌属(Veillonella)、链球菌属(Streptococcus)和梭菌属(Clostridium)有关,参与短链脂肪酸(乙酸盐、丙酸盐和丁酸盐)生产的细菌,具有重要的免疫调节功能,在抵抗肠道病变的发展等方面发挥着关键作用,并且在母乳喂养后 13-15 天显着增加。
扩展阅读:脂肪毒性的新兴调节剂——肠道微生物组
蛋白质在生命的前 1000 天非常重要,因为它们在细胞结构中发挥着重要作用,并且是酶和神经递质的组成部分。
蛋白质推荐量
在出生后的头 6 个月内,每公斤体重/天的蛋白质推荐量为:
0 至 6 个月大时为 0.58 克;
6 至 36 个月大时为 0.66 克。
母乳中蛋白质种类多,有多种功能
母乳含有 400 多种蛋白质,多种功能如抗菌、免疫调节活性或刺激营养吸收等。蛋白质缺乏会导致生长发育不良以及运动和认知发育迟缓;然而,高蛋白质摄入会导致婴儿期体重增加更快,并与以后的肥胖相关。
使用婴儿配方奶粉喂养的婴儿在生命的前四个月内表现出正常的婴儿生长模式,婴儿的总蛋白质减少 1.0 g/dl(类似于母乳)。
辅食中蛋白质影响婴儿生长及肠道菌群组成
补充食品中的蛋白质来源和摄入量会显着影响婴儿生长并可能影响超重风险;以肉类和奶制品为基础的辅食会导致不同的生长模式,尤其是身高。
同时,补充喂养期间相关类型的富含蛋白质的食物,对配方奶喂养婴儿的肠道微生物组成和代谢物有影响;吃肉的儿童肠道群落富含厚壁菌门和粪杆菌属,同时变形杆菌门和双歧杆菌属减少。
扩展阅读:肠道菌群与蛋白质代谢
碳水化合物需求量
每日总能量摄入中的总碳水化合物需求量占比如下:
0 ~ 6 个月为 40-45%
6 至 12 个月以下为 45-55%
12 至 36 个月以下为 45-60%(接近成年人)
葡萄糖
葡萄糖对于中枢神经系统的充分运作起着关键作用,因为它是生长、神经冲动和突触的主要能量来源。葡萄糖由不同的碳水化合物提供给婴儿,例如乳糖,作为母乳中的主要糖分(范围为 6.7 至 7.8 g/dl),以及多种低聚糖,其含量约为 1 g/dl。
母乳低聚糖
母乳低聚糖 (HMO) 构成了婴儿无法消化的母乳碳水化合物的重要部分。母乳低聚糖具有益生元功能,可喂养胃肠道微生物群,并促进有益菌的生长;此外,它们还与多种生物学功能有关,例如对胃肠道发育和全身免疫的影响、双歧杆菌生成活性和抗感染、炎症调节、肠神经元激活和肠道运动,以及中枢神经系统功能的增强。
母乳低聚糖包括酸性低聚糖,主要是唾液酸化 [例如 6′-唾液酸乳糖 (6′-SL)、3′-唾液酸乳糖 (3′-SL)] 或中性低聚糖 [例如 2′-岩藻糖基乳糖 (2′-FL)]。
岩藻糖基聚糖是母乳中最丰富的母乳低聚糖形式 (80–90%) 。
聚糖
聚糖(glycans)是微生物的碳源,对宿主细胞和微生物之间的识别、信号传导和表观遗传调控至关重要,与广泛的免疫和代谢紊乱有关。双歧杆菌属和乳杆菌属与的生长之间存在显着相关性。在哺乳早期和晚期的婴儿肠道中。
几个临床前模型已经证明母乳低聚糖对认知功能的影响,但人类的临床数据尚未公布。
关于糖没有特定推荐量,2岁以下避免添加糖
关于糖,没有针对婴儿期糖的特定的每日参考摄入量。ESPGHAN 营养委员会建议,避免在 2 岁以下儿童的饮食中添加糖分。还建议避免饮用果汁或含糖饮料,因为过早摄入这些饮料会增加日后患 1 型糖尿病的风险。
为什么婴儿在 6 个月左右时需要添加辅食?与铁等营养素的需求有关
在婴儿出生前,胎儿会从母体中吸收铁元素,积累在肝脏中,以备出生后使用。然而,母乳中的铁含量相对较低,因此在婴儿 6 个月左右时,需要从饮食中摄取外源性铁以满足营养需求。
铁的需求量
0 ~ 6 个月为 0.3 毫克/天;
6 ~ 12 个月以下为 6-11 毫克/天;
12 ~ 36 个月以下的需求量为 3.9-9 毫克/天。
缺铁有哪些影响?
缺铁会影响大脑、神经和精神运动发育,因为铁是神经递质所需酶的组成部分。缺铁会导致携氧能力降低,从而导致生长发育所需的葡萄糖转化受限;这些限制可能导致生长迟缓、体重减轻和年龄增长,但与神经发育不同的是,它们可以通过补铁治疗来克服。
缺铁影响肠道菌群组成
母乳是短双歧杆菌的主要来源,它可以在二价金属通透酶和乳铁蛋白的帮助下获得管腔铁,促进这些有益细菌的生长,并从细菌病原体中隔离铁。缺铁导致肠道微生物群落失调,这反映在肠杆菌科(Enterobacteriaceae)和韦荣球菌科(Veillonellaceae)的相对丰度增加,以及与健康对照相比,红蝽菌科(Coriobacteriaceae)肠杆菌科和双歧杆菌科/肠杆菌科的丰度降低。
Coriobacteriaceae被确定为一个潜在的生物标志物,将运动与健康改善联系起来。
扩展阅读:人与菌对铁的竞争吸收 | 塑造并控制肠道潜在病原菌的生长
纯母乳喂养的婴儿摄入的维生素 D 低于最低推荐摄入量,远低于每日参考摄入量。
维生素D推荐摄入量
为避免因维生素D而可能出现的病症,例如骨矿化不足或软骨病,母亲每天补充 400 至 2000 IU 可以增加母乳中的维生素 D 水平;建议纯母乳喂养的婴儿接受阳光照射和补充维生素 D。
0 至 36 个月以下的婴儿维生素 D 营养需求为:
10 微克/天。
缺乏维生素D会引起什么?
维生素D诱导神经生长因子,促进神经突生长,抑制海马神经元凋亡。关键神经发育时期的缺陷会导致生命后期的行为、记忆和学习障碍。
低水平的维生素 D 会导致肠道通透性增加,产生慢性低度炎症状态。
维生素 D 与肠道菌群之间存在关联,在 3-6 个月大的不同种族婴儿的肠道微生物群组成中观察到一些差异,这些婴儿的母亲在怀孕期间补充了维生素 D 以预防其后代的哮喘和过敏症。
扩展阅读:维生素D与肠道菌群的互作
维生素 B12 的需求量
0 ~ 6 个月为 0.4 微克/天,
6 ~ 不到 12 个月为 0.5 至 0.8 微克/天,
12 ~ 36 个月以下为 0.6 至 1 微克/天。
叶酸的需求量
EFSA 推荐:
0 ~ 6 个月的叶酸营养需求为 65 微克/天,
6 ~ 12 个月婴儿的叶酸摄入量为 80 微克/天,
12 ~ 36 个月以下的需求量为100微克/天;
1-17 岁儿童的叶酸 (FA) 摄入量上限已确定为 200 – 800 微克/天。
叶酸和维生素B12的作用
叶酸和维生素 B12(钴胺素)作为参与广泛生物过程的辅助底物和辅助因子发挥着重要作用,例如核酸合成、糖酵解、糖异生和氨基酸代谢。
此外,叶酸和维生素 B12 以及单碳代谢循环所需的其他微量营养素辅助因子的状况可能会影响 DNA 甲基化,从而对健康产生长期影响。
叶酸——必须,但不要过量
众所周知,怀孕期间缺乏叶酸会导致后代出现神经管缺陷的风险更高。然而,高剂量的叶酸与更好的状态无关,与母亲或后代无关;事实上,怀孕期间摄入量高于 400 微克/天并没有明显的好处。母乳喂养期间补充叶酸可导致母乳总叶酸适度增加。
在儿童中,叶酸缺乏与认知发育受损以及腹泻和呼吸系统疾病增加相关;然而,补充叶酸对于减少这些病症并没有明显帮助。
过量摄入叶酸可能会产生潜在的不利影响,包括几种疾病(例如癌症、神经系统疾病、生长综合征、呼吸系统疾病和多发性硬化症)的发病率增加。
目前,由于食用补充剂或强化食品,很多欧洲儿童摄入大量叶酸;目前尚不清楚这些摄入量是否会造成伤害,尤其是在早期发育过程中,而许多组织中正在发生大量表观遗传变化。
缺乏维生素B12有什么影响?
当母亲的维生素B12状况不佳时,母乳中的含量会降低,会影响后代维生素B12的状态。维生素 B12 对中枢神经系统的代谢和维持至关重要,与叶酸一起在同型半胱氨酸代谢和髓磷脂的保护中起着关键作用。因此,维生素 B12 缺乏会导致覆盖颅神经、脊神经和周围神经的髓鞘受损,从而导致神经精神疾病的发展。
B族维生素缺乏影响肠道菌群
通过基因组重建和预测,针对几种B族维生素,预测整个微生物群落的代谢表型,发现微生物群落中有相当一部分是辅助营养物种(它们无法自己合成某些生命所需的化学物质,需要从外部环境中获取这些物质才能生存),它们的生存完全依赖于从饮食和/或原养型微生物中获取一种或多种B族维生素,通过特定的拯救途径(一种代谢途径,通过这种途径,微生物可以从外部环境或其他微生物的代谢产物中回收利用某些生命所需的化学物质,以满足自身生存所需)来实现。
膳食摄入影响:
母体甲基供体的摄入(胆碱、甜菜碱、叶酸、蛋氨酸)会改变其后代的DNA甲基化。观察到这种摄入量,特别是在围孕期,会影响婴儿口腔中与代谢、生长、食欲调节和维持 DNA 甲基化反应相关的基因的 DNA 甲基化。
细菌合成影响:
除了膳食摄入外,细菌叶酸生物合成也备受关注。细菌叶酸生物合成可以提供额外的叶酸来源,对健康结果和/或 DNA 甲基化具有重要意义。
在体外结肠模型中,研究发现补充甲钴胺和乳清可以提高厚壁菌门和拟杆菌属的比例,同时减少变形杆菌属的数量,其中包括一些病原体,如大肠杆菌(Escherichia)和志贺氏菌属(Shigella)等,以及假单胞菌属(Pseudomonas)。此外,研究还发现甲钴胺可以促进肠道细菌对脂质、萜类化合物和聚酮化合物的代谢,诱导外源性物质的降解,抑制转录因子和次级代谢产物(如维生素 B12)的合成。
扩展阅读:如何解读肠道菌群检测报告中的维生素指标?
新生儿肠道菌群的建立及发育
新生儿的肠道菌群既直接来自母亲,也来自分娩后的环境。微生物组在生命的头几个月经历动态演替和成熟,这一过程伴随着身体指标以及器官和神经认知发育的快速变化。
新研究结果强调母乳喂养和婴儿饮食会影响肠道微生物组成和功能。一项使用宏基因组鸟枪法测序的综合研究表明,停止母乳喂养(而不是引入固体食物),可以推动婴儿肠道微生物组的功能成熟,使其接近成人状态。
新生儿肠道菌群的影响因素
新生儿微生物组和免疫系统的不成熟似乎与肠道感染的易感性增加有关,特别是在 LMIC(中低收入国家) 环境中。虽然新生儿获得微生物群的时间各不相同,但多次接触,包括分娩方式、母婴饮食、药物、获得安全水和卫生设施以及多种宿主因素,是微生物群组成的主要决定因素。
母乳对婴儿的发育和成熟起着重要作用,微生物组在断奶时进入过渡阶段,此时微生物组会发生其他变化。
儿童营养不良和生长障碍是由膳食摄入不足和炎症之间复杂的相互作用驱动的,炎症通常是持续和/或反复感染和慢性疾病(包括镰状细胞病、艾滋病毒、先天性心脏病、心理障碍和内分泌或代谢疾病)的结果。
肠病是营养不良的一个重要驱动因素
肠病可能是肠病原体相关性腹泻病的结果,这在 LMIC 环境中的儿童中很常见,并且与死亡率、生长迟缓和认知发育不良的风险较高有关。
而这些环境中的许多儿童在存在或不存在已知肠病原体的情况下患有无症状肠病。这种肠病与非特异性持续粪口污染、反复肠道感染和小肠细菌过度生长 (SIBO) 有关。这种肠病与其他慢性肠道炎症有一些相似之处,包括克罗恩病和溃疡性结肠炎。它与发育迟缓密切相关,可能通过营养吸收不良和食欲抑制间接影响生长,并通过生长激素-胰岛素样生长因子 1 (IGF-1) 轴直接影响生长。
肠道通透性增加也会对发育产生负面影响
肠屏障功能障碍和肠道通透性增加可能导致微生物和/或微生物产物易位,从而激活先天免疫反应并促进全身炎症,从而对生长产生负面影响。
扩展阅读:什么是肠漏综合征,它如何影响健康?
肠道微生物群会影响多种宿主功能,包括代谢调节和信号传导,通过获取膳食营养素和微生物群衍生的代谢物、免疫耐受和对病原体的抵抗力、昼夜节律以及与儿童健康成长相关的其他途径。
肠道菌群失调可能影响儿童生长发育
由于疾病、环境或药物暴露或其他损害而破坏微生物组的正常多样性和组成,可能导致生态失调,这是一种以致病菌大量繁殖、共生体丧失和多样性丧失为特征的状态。在一些人群中,生态失调与肥胖、2 型糖尿病、肝脂肪变性和肠道疾病有关。在儿童和部分人群中,生态失调与生长和神经认知发育不良以及反复感染、免疫力改变和炎症增加有关。
与营养良好的儿童相比,营养不良的儿童拥有“不太成熟”的肠道菌群,其多样性较低。生态失调导致营养提取效率低下、吸收不良、易患肠杆菌科等侵袭性疾病和肠道炎症,从而影响生长。
肠道微生物群与发育迟缓之间存在密切关联,表明存在因果机制
谷禾健康与长沙妇幼儿童保健中心实验室合作发表的临床研究,揭示了肠道微生物群对患有严重急性营养不良 (SAM) 等严重儿科病理状况的儿童的重要性;临床诊断为生长发育迟缓 (FTT) 的受试者和正常生长正常的早产受试者 (NFTT-pre) 在不同年龄段表现出明显的肠道菌群发育轨迹中断,并且其α多样性的发展以及观察到的 OTU 和 Shannon 指数不足,尤其是在具有 FTT 的受试者中。
此外,与正常相比,FTT组中细菌如拟杆菌、双歧杆菌、链球菌和大多数年龄歧视性细菌分类群的顺序定殖和富集及其微生物功能紊乱。我们的研究结果表明,发育迟缓的婴儿肠道菌群发育不全,具有潜在的临床和实践意义。

肠道菌群失调还与共生微生物的易位和系统传播以及对病原体的易感性有关。此外,共生细菌抵抗肠道炎症的功能能力降低,如产生短链脂肪酸和色氨酸分解代谢配体(驱动芳烃受体激活),可导致肠道炎症。
恢复肠道菌群稳态,可促进儿童生长发育
共生菌还维持先天性淋巴样细胞,这是白细胞介素IL-22 的主要来源,IL-22 可刺激抗菌肽,帮助防止病原菌的微生物移位和入侵。恢复稳态微生物组和相关代谢物,有可能逆转与生态失调相关的表型,并促进儿童的生长发育。
确定肠道微生物群落结构和功能的变化(包括确定它们与疾病的因果关系)以制定有效的干预措施,对恢复肠道微生物群落结构并改善健康生长发育至关重要。
确定可以在怀孕、婴儿期和儿童期实施的干预措施,以预防或改善这些导致生长发育不良的驱动因素,对于改善短期和长期健康与发育至关重要。
扩展阅读:
怀孕期间母体肠道菌群的组成和功能似乎与出生结局密切相关,包括体重和胎龄。在健康的非妊娠成人中,肠道微生物群由相对稳定的种群组成,主要由拟杆菌门、厚壁菌门、放线菌门、变形菌门和疣微菌门组成。微生物组的组成和多样性在怀孕期间发生了变化。例如,在怀孕期间,肠道微生物群 α 多样性和产丁酸菌减少,而双歧杆菌、变形菌和产乳酸菌增加。
最近对来自刚果、印度、巴基斯坦和危地马拉的孕妇进行的一项纵向研究表明,怀孕期间肠道微生物群的个体属和 α 多样性(丰富度)有所减少。
妊娠期肠道菌群与新生儿生长关联
最近进行了一项研究,以了解津巴布韦农村地区妊娠期肠道微生物群分类群与代谢功能对胎龄、出生体重和新生儿生长的关联。
结果证明,抗性淀粉降解细菌,主要是瘤胃球菌科、毛螺菌科和真细菌科,是主要的肠道类群,并且是出生体重、新生儿生长和胎龄的重要预测因子。
此外,这项研究表明,与淀粉和能量代谢、信号和维生素 B 代谢相关的细菌功能,与出生体重增加有关。这些结果表明,非洲农村地区母亲食用富含淀粉的饮食的饮食模式,可能会推动选择影响婴儿健康和成长的物种。
扩展阅读:肠道核心菌属——毛螺菌属(Lachnospira)
肠道菌群变化分别与妊娠糖尿病和高脂血症有关
谷禾健康与江南大学食品科学与技术国家重点实验室合作的临床研究成果表明妊娠糖尿病 (GDM) 通常与高脂血症合并症有关。改变的人类肠道微生物群分别与妊娠糖尿病和高脂血症有关,但与合并症无关。发现链球菌(Streptococcus)、粪杆菌(Faecalibacterium)、韦荣球菌(Veillonella)、普雷沃氏菌(Prevotella)、嗜血杆菌(Haemophilus)和放线菌( Actinomyces )在糖尿病加高脂血症人群中显着更高。此外,几种细菌与患有妊娠糖尿病和高脂血症的参与者的空腹血糖和血脂水平相关。
扩展阅读:肠道重要基石菌属——普雷沃氏菌属 Prevotella
母体微生物群的干预:益生菌
针对母体微生物群的干预措施有可能显着影响婴儿健康,因为孕期生态失调和母体暴露会影响微生物群的建立、免疫发育和代谢健康。正在评估妊娠期膳食补充益生菌(对宿主健康有益的活微生物),以预防妊娠相关并发症和不良出生结果,包括早产和极低出生体重。
一些数据表明,益生菌对孕妇或哺乳期妇女在治疗妊娠糖尿病 (GDM)、B族链球菌定植和乳腺炎方面具有有益作用。
鉴于已知的安全性,益生菌作为妊娠干预措施特别有吸引力。然而,迄今为止的研究还没有定论。在新西兰、芬兰、丹麦、瑞典、澳大利亚、伊朗和我国的女性中,补充各种益生菌和混合物(包括乳酸杆菌、链球菌和双歧杆菌菌株)对出生人体测量没有影响。但有一些数据表明益生菌单独或联合使用可能与低收入国家早产儿死亡率、坏死性小肠结肠炎和/或新生儿败血症的降低有关。
新生儿和婴儿是考虑针对微生物组进行干预的关键人群,因为婴儿微生物组在出生后经历快速进化。此外,婴儿期是生长和神经认知发育的关键时期,也是发病率和死亡率最高的时期。
婴儿肠道菌群的定植
来自拟杆菌门和放线菌门的专性厌氧菌会迅速定植婴儿肠道,主要是双歧杆菌属、拟杆菌属和梭菌属,在生命的前 6 个月内,其特点是多样性低。
母体肠道微生物群似乎对婴儿肠道的定植有显着贡献,而阴道和皮肤来源的细菌似乎更短暂,并且不会在新生儿期后持续存在于婴儿肠道中。
婴儿肠道菌群->免疫系统->宿主
婴儿肠道微生物群为免疫系统的发育提供信息,而免疫系统又协调维持宿主-微生物共生的关键特征。因此,肠道微生物组成和代谢的异常可能会破坏正在发育的免疫系统。
母乳喂养->断奶,肠道菌群变化
婴儿期的母乳喂养还通过母乳中微生物种类的直接转移和其他主要成分的调节影响婴儿生长和塑造肠道微生物群,例如人乳低聚糖(HMO – 人类酶无法消化的复合糖),分泌IgA 和抗菌因子。
断奶,即逐渐将固体食物引入婴儿饮食,是婴儿发育的一个重要里程碑。断奶也是肠道菌群快速扩张的时期,包括双歧杆菌、乳杆菌、韦荣球菌(Veillonella)、柯林氏菌(Collinsella)、普雷沃氏菌、粪杆菌属和大肠杆菌属以及参与复杂多糖代谢的其他物种的多样化和扩张。
断奶期微生物群受干扰,可能导致肠道感染的易感性
断奶时微生物群的扩大还与强烈免疫反应的诱导有关,一种“断奶反应”,其特征是与生命后期的免疫成熟和耐受性相关的调节性 T 细胞的扩增。
在小鼠中,断奶期间限制微生物组的成熟会导致免疫发育受损并增加对肠道感染的易感性。此外,在母乳喂养率高且在长时间断奶期间也接受补充饮食的孟加拉国社区队列中,发现了一个独特的“过渡”长双歧杆菌进化枝,它携带利用母乳和食物底物的酶。这种过渡性长双歧杆菌在断奶期间引入固体食物后会扩大,并且在孟加拉国以外的婴儿队列中也得到证实,尽管患病率要低得多。 这些发现表明,底物和混合喂养的持续时间也会影响肠道微生物组的结构和功能。
断奶期过后,肠道菌群高度依赖于饮食习惯
农村地区的儿童表现出拟杆菌门的显着富集和厚壁菌门的枯竭,普雷沃氏菌属的细菌数量独特丰富,显示出利用富含多糖的营养素的能力。
然而,在工业化国家,这些普氏菌肠型不太常见,断奶后微生物组的特征是拟杆菌和瘤胃球菌肠型的存在。
在试图了解微生物群落是如何共同配置的,包括描述组成成员之间的相互作用以及这些群落随着年龄的增长而成熟时,需要较大的样本人群队列,这也是谷禾一直推进的事情。
微生物群是否有一个稳定的架构?
综合众多的研究结果确定了一个由几十个细菌分类群组成的核心“生态群”,这些分类群在孟加拉国、印度和秘鲁的出生队列的健康成员中,在 20 个月及以后表现出一致的协变。研究得出结论,生态群网络是微生物群组织的一个保守的一般特征,建议这样的生态群可以提供一个框架来描述营养不良儿童的生态失调。
我们建议这样的生态群可以用作定量指标,用于定义旨在重新配置肠道微生物群落的靶向干预措施的功效。
婴儿绞痛、反流和便秘常常引起父母的痛苦也是儿科就诊的主要原因。如前所述,母乳喂养婴儿的微生物群通常被认为富含双歧杆菌和乳杆菌等“有益”细菌,以及梭菌等产气细菌的生长减少。
益生菌:罗伊氏乳杆菌DSM 17938减少哭闹
在随机对照试验中,与安慰剂相比,使用罗伊氏乳杆菌(L. reuteri)DSM 17938 治疗绞痛婴儿可显着减少哭闹时间、反流和功能性便秘。
相比之下,报道了与L. reuteri DSM 17938 相比,安慰剂组在治疗 1 个月时的烦躁时间短暂减少和睡眠持续时间更长。这种烦躁增加仅发生在配方奶喂养的婴儿中,而不发生在母乳喂养的婴儿中。
另一项最近的研究评估了L. reuteri DSM 17938 在 1 个月和 3 个月大时通过显着减少哭闹时间来预防绞痛。一般来说,罗伊氏乳杆菌DSM 17938 似乎可以减少患有绞痛的母乳喂养婴儿的哭闹时间,但是,这种益生菌在绞痛配方奶喂养婴儿中的作用需要进一步研究。
同样对于绞痛的预防,使用L. reuteri DSM 17938 似乎是有效的,但这需要在其他研究环境中得到证实。
扩展阅读:认识罗伊氏乳杆菌(Lactobacillus reuteri)
为了促进“有益”细菌的生长,婴儿配方奶粉中添加了特定的益生元,并在临床试验中进行了评估。
益生元:低聚半乳糖降低绞痛和反流的风险
在最近的一项双盲随机对照试验中,摄入补充低聚半乳糖的配方奶显示出与母乳喂养参照组相似的双歧杆菌和乳杆菌发育趋势,并且与接受不含低聚半乳糖的配方奶粉的婴儿相比,降低了绞痛和反流的风险。
合生元:减少哭闹、减轻疾病发作
人们对合生元提供“有益”细菌及其底物的兴趣也越来越大。
与随机分配到安慰剂配方奶粉的对照组相比,给婴儿喂食七种益生菌菌株和低聚果糖的混合物后,婴儿在第 7 天和第 30 天的哭闹时间减少了 50% 以上。
在另一项前瞻性双盲随机对照试验中,评估了含有嗜热链球菌(Streptococcus thermophilus)、保加利亚乳杆菌(L. bulgaricus)和动物双歧杆菌( B. animalis ssp. lactis)的合生酸奶饮料的效果。
与安慰剂相比,乳糖和菊糖对疾病发作(腹泻、上呼吸道感染和发热性疾病)的影响减少了发烧天数。 干预组大便稀便的频率更高,需要照顾孩子的次数也更多,但差异无统计学意义。
注意:
作者强调益生菌的干预并不是适合所有有症状的婴儿,婴儿的肠道菌群变化较快,益生菌及其组合的干预需要充分评估肠道菌群及其功能,了解其肠道菌群网络结构下,选择对应症状的干预方式才能确保安全和发挥干预的效果。
总的来说,在得出任何确定的结论之前,需要更多的研究来评估益生元和合生元在这些在不同类型儿童及其整体肠道微生态条件下的作用。
扩展阅读:
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
人们还关注肠道菌群失调在过敏表型发生发展中的作用。
肠道菌群 & 过敏性疾病
肠杆菌科/拟杆菌比率↑ — 食物致敏的风险↑
据报道,在基于人群的加拿大健康婴儿纵向发育 (CHILD) 出生队列研究中,婴儿粪便中低肠道微生物群丰富度和升高的肠杆菌科/拟杆菌比率与随后食物致敏的风险增加有关。
瘤胃球菌科↓
–食物敏感 –特应性湿疹 –炎症性先天免疫反应过度
他们还发现食物敏感的婴儿在 1 岁时瘤胃球菌科的丰度下降。这可能与过敏性疾病高风险婴儿的病例对照研究结果一致,发现瘤胃球菌科的相对丰度较低与未出现任何过敏表现的婴儿相比,随后出现特应性湿疹的婴儿的粪便样本中。
值得注意的是,瘤胃球菌属的相对丰度较低也与炎症性先天免疫反应过度有关。
总的来说,这些发现进一步支持了这样一种假设,即缺乏潜在的免疫调节细菌可能会增加发生过敏表现的风险。由于瘤胃球菌能够降解纤维,并且是成人“核心”微生物组的一部分,未来的研究应该检验其重要性。
益生菌 & 肠道菌群
鼠李糖乳杆菌GG — 产丁酸菌↑
在最近的一项研究中,研究了益生菌对牛奶过敏婴儿肠道微生物组的影响。报道称,添加了鼠李糖乳杆菌GG (LGG) 的深度水解酪蛋白 (EHCF) 配方导致了与丁酸盐生产相关的特定细菌的富集。
丁酸盐是一种已知的结肠细胞底物,与增强肠道完整性有关。与单独使用 EHCF 相比,接受 EHCF + LGG 治疗的婴儿在治疗 6 个月后的丁酸产量呈双峰分布。
已知的丁酸盐生产者,Faecalibacterium,Blautia,Ruminococcus,Roseburia在高丁酸盐样本中富集,而拟杆菌显着减少。与牛奶不耐受的孩子相比,牛奶耐受的孩子Blautia和Roseburia富集。正如作者推测的那样,这些物种可能导致丁酸盐产量增加和肠道完整性增加。
扩展阅读:
肠道核心菌属——经黏液真杆菌属(Blautia),炎症肥胖相关的潜力菌
肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
母亲摄入益生菌降低孩子发病率
在该团队随后的2份研究中,其中在一项随机对照试验中,与无菌安慰剂牛奶相比,孕妇在围产期摄入含益生菌的低脂发酵牛奶可降低其孩子 2 岁和 6 岁时的湿疹发病率。然而,临床益处似乎与 3 个月或 2 岁时对肠道微生物多样性的影响无关。
由于益生菌仅给予母亲,另一种解释可能是通过影响母乳成分。在婴儿期益生菌随机对照试验的另一项后续研究中,对长期肠道微生物群的建立没有影响, 这与之前的报道一致。
注意:
虽然说荟萃分析报告,怀孕期间、母乳喂养期间和/或给婴儿服用益生菌可降低婴儿湿疹的风险,但证据仍然薄弱。因此,专家机构未能推出具体的指导方针。然而,在考虑所有关键结果时,世界过敏组织现在建议使用益生菌预防有过敏孩子高风险的孕妇和哺乳期母亲以及有高风险患过敏性疾病的婴儿(基于家族史)。
在他们的指南中,他们强调该建议是有条件的并且基于低质量的证据,并不能给出关于最有效的菌株、剂量或治疗的开始和持续时间的具体指导。因此,仍然需要更具体的指南和研究基础。
肠易激综合症
在一项评估肠易激综合征儿童低发酵底物饮食的初步研究中,该饮食与腹痛频率和严重程度的降低显著相关。与无反应者相比,对治疗有反应的儿童在基线和干预期间似乎具有不同的粪便微生物组。
在一项更大的、双盲、随机、交叉研究中,同一组使用 16S 测序研究了低发酵低聚糖、二糖、单糖和多元醇 (FODMAP) 饮食对肠易激综合症儿童的临床结果和肠道微生物组成的影响。
低 FODMAP 饮食减少了腹痛,并且对饮食有反应的儿童的微生物群具有更强的糖分解能力。作者建议,鉴定具有更强糖分解能力的微生物群可能作为预测对低 FODMAP 饮食反应的生物标志物。
克罗恩病
肠道微生物群环境的变化被认为是克罗恩病患者纯肠内营养治疗特性的中介。令人惊讶的是,与没有炎症性肠病家族史的健康对照相比,克罗恩病患儿在纯肠内营养过程中肠道微生物多样性、普拉梭菌和丁酸盐浓度有所降低。
当参与者恢复正常饮食时,这后来又恢复到治疗前的水平。伴随着这种假定的“不健康”微生物群,矛盾的是临床结果得到改善,结肠炎症标志物减少。然而,这些发现的相关性需要进一步阐明。
乳糜泻
在乳糜泻中,坚持严格的无麸质饮食 (GFD) 有时很困难,患者可能仍会出现临床症状和营养缺乏,随后持续发炎和肠道菌群失调。
由于特定的益生菌已被证明可以减轻炎症,因此在一项双盲探索性试验中,新诊断出患有乳糜泻的儿童被随机分配到摄入长双歧杆菌CECT 7347 或安慰剂组 3 个月。无论治疗如何,对 GFD 的依从性与生长参数呈正相关,与安慰剂组相比,益生菌组的身高有所增加。此外,益生菌处理减少了脆弱拟杆菌的数量组和分泌型 IgA。
在另一项评估两种益生菌短双歧杆菌菌株对 GFD 患儿影响的随机对照试验中,与安慰剂相比,干预减少了炎性细胞因子 TNFα 的产生。
总的来说,这些研究表明益生菌对患有乳糜泻的儿童可能有益,但需要在更大规模的试验中验证。
扩展阅读:双歧杆菌:长双歧杆菌
青年糖尿病环境决定因素 (TEDDY) 研究最近的一份报告中,该研究包括芬兰、瑞典、德国和美国患 1 型糖尿病的高风险儿童,肠道的组成和多样性都存在很大差异。即使在这个具有同源人类白细胞抗原 (HLA) II 类基因型并因此具有相似遗传风险的人群中,根据地理区域也存在显着差异。
这些差异的根本原因尚不清楚,因为即使在对早年生活和饮食变量进行调整后,差异仍然存在。
在同一项前瞻性队列研究中,还检查了早期接触益生菌和膳食可溶性纤维(可能影响肠道微生物群组成和形成免疫反应)与胰岛自身免疫的关系。与后期补充或无益生菌相比,益生菌暴露(≤27 天)与胰岛自身免疫风险降低相关。 相反,儿童早期膳食可溶性纤维的摄入与胰岛自身免疫或 I 型糖尿病无关。未来的研究需要检验这些发现的重要性。
人们一直对肠道菌群失调在影响儿科人群的大量疾病中的作用感兴趣。
儿童生长迟缓和认知发育不良的驱动因素是多方面的,包括饮食摄入量和多样性不足、暴露于反复感染、慢性疾病和肠道病理学,包括肠病和 SIBO。最近的研究表明,肠道菌群失调与发育迟缓之间存在密切关联,表明存在潜在的因果关系。这些研究强调需要确定肠道微生物群落的结构和功能改变,并恢复微生物组稳态和相关代谢物以促进低收入环境或国家儿童的生长发育。
儿童时期的肠道微生物组成高度依赖于饮食习惯。在营养不良的儿童中,与标准营养干预措施(如 RUSF)相比,含有当地可用成分的低热量密度 MDCF 可改善微生物组的成熟度和生长。未来我们需要努力探究不同地理环境和不同饮食习惯下中婴儿期微生物群的多样性,更深入地了解它们与免疫发育和生长的联系。
鉴定具有更高定植效率和临床有效性的适合当地的菌株可能提供巨大的潜力来优化可在怀孕、婴儿期和儿童期实施的干预措施,这可能会导致针对肠道微生物群的治疗和预防策略得到改进,并且也可能成为安全和具体指南的基础。
主要参考文献:
Njunge JM, Walson JL. Microbiota and growth among infants and children in low-income and middle-income settings. Curr Opin Clin Nutr Metab Care. 2023 Mar 6.
Videhult FK, West CE. Nutrition, gut microbiota and child health outcomes. Curr Opin Clin Nutr Metab Care. 2016 May;19(3):208-13.
Cerdó T, Diéguez E, Campoy C. Infant growth, neurodevelopment and gut microbiota during infancy: which nutrients are crucial? Curr Opin Clin Nutr Metab Care. 2019 Nov;22(6):434-441.
WHO. Levels and trends in child malnutrition: key findings of the 2021 edition of the joint child malnutrition estimates. United Nations Children’s Fund (UNICEF), World Health Organization, International Bank for Reconstruction and Development/The World Bank. 2021.
Gizaw Z, Yalew AW, Bitew BD, et al. Stunting among children aged 24-59 months and associations with sanitation, enteric infections, and environmental enteric dysfunction in rural northwest Ethiopia. Sci Rep 2022; 12:19293.
West CE, Renz H, Jenmalm MC, et al. The gut microbiota and inflammatory noncommunicable diseases: associations and potentials for gut microbiota therapies. J Allergy Clin Immunol 2015; 135:3–13.
Troesch B, Biesalski HK, Bos R, et al. Increased intake of foods with high nutrient density can help to break the intergenerational cycle of malnutrition and obesity. Nutrients 2015; 7:6016–6037.
Hiltunen H, Löyttyniemi E, Isolauri E, Rautava S. Early nutrition and growth until the corrected age of 2 years in extremely preterm infants. Neonatology 2018; 113:100–107.
Zheng M, Lamb KE, Grimes C, et al. Rapid weight gain during infancy and subsequent adiposity: a systematic review and meta-analysis of evidence. Obes Rev 2018; 19:321–332.
人体消化系统包含大约几百到几千种不同的细菌种类,其丰度构成因人而异。
其中少数益生菌乳杆菌属,即嗜酸乳杆菌、植物乳杆菌、短乳杆菌、乳酸乳杆菌、干酪乳杆菌、保加利亚乳杆菌、发酵乳杆菌、鼠李糖乳杆菌特异性产生细胞外蛋白、胞外多糖、细菌素和脂磷壁酸,通过与上皮细胞相互作用影响宿主的健康和生理,增强宿主免疫系统。
在乳杆菌菌种中,植物乳杆菌(L. plantarum)是革兰氏阳性、短杆状、微需氧、耐酸、不形成孢子、不呼吸、低 G + C 含量、异型发酵的乳杆菌群,具有一系列作为发酵剂和防腐剂在食品工业中的应用。
它是一种非孢子形成细菌,可产生有机酸,例如乙酸、琥珀酸和乳酸作为主要代谢物。植物乳杆菌在人类和其他哺乳动物的胃和其他复杂的胆汁盐分泌物中的低缓冲能力下生长。
除了在食品工业中的应用外,肠道微生物植物乳杆菌是一种很有前途的益生菌,可治疗腹泻、高胆固醇和特应性皮炎等。它是如何工作的,它还有哪些其他好处?本文带您了解更多。
植物乳杆菌是一种分布广泛、用途广泛的乳酸菌。它代表了许多食物和饲料的微生物群的一部分,包括乳制品、肉类、鱼类、蔬菜发酵产品(例如,葡萄汁、酸菜、泡菜、酸面团)和青贮饲料;它也是人和动物粘膜(口腔、胃肠道、阴道等)的天然居民。
植物乳杆菌是一种具有抗癌、抗炎、抗肥胖和抗糖尿病特性的抗氧化剂 [ 1 ] .
植物乳杆菌菌株的微观形态图像
DOI:10.1099/ijs.0.65319-0
植物乳杆菌耐受不同范围的盐,尤其是 NaCl 和胆汁盐,pH 值为 4.0-8.0,温度为 28-45°C,并且分别在 37°C 和 pH 7.0 的温度下具有最佳细胞生长。鉴定出的菌株在上消化道中经受了各种生物障碍,例如低 pH 值、裂解酶和胆汁盐。能够利用广泛的糖类,尤其单糖和双糖。此外,淀粉酶和蛋白酶等细胞外酶的产生对其有利。
B族维生素
从生牛奶中分离出的植物乳杆菌能够产生 B 族维生素核黄素( B2 ) 和叶酸(B9 ) [ 2 ].
铁吸收
植物乳杆菌可使健康女性从果汁饮料中吸收的铁增加约 50% [ 3 ].
植物乳杆菌可以使女性对燕麦中铁的吸收提高 100% 以上 [ 4 ].
钙吸收
含有植物乳杆菌的发酵乳表现出更高的钙保留摄取 [ 5 ].
植物乳杆菌是体内的短暂居民。它可以轻松抵御胃酸,并可以完成从补充品进入口腔,到肠道,到结肠,到粪便的完整旅程。植物乳杆菌生长的最佳温度非常接近体温。
植物乳杆菌也是一种强大益生菌,可猛烈攻击体内的致病性有害细菌。通过杀死坏菌,它帮助我们自己的本地细菌变得更强壮,并帮助我们人体更能抵抗外来病原体的入侵。
除了作为增强免疫系统的重要方式之外,人类在所有有记录的人类历史中都食用了大量的植物乳杆菌。
该菌株用于许多食品中,例如:
酵母面包;酸菜;泡菜;发酵食物
注意
植物乳杆菌益生菌补充剂尚未获得国家药监局和FDA的医疗用途批准,可能缺乏可靠的临床研究。为防止罕见的副作用,请在使用益生菌之前咨询权威的医疗建议。
可能有效
1) 腹泻
乳酸菌益生菌在改善与各种疾病相关的腹泻方面表现出很大的希望,包括旅行者腹泻和抗生素相关性腹泻 [ 6、7 ] .
在一项针对 438 名患有抗生素相关性腹泻的儿童的临床试验中,植物乳杆菌益生菌减少了稀便或水样便和腹痛的发生率,而且没有产生不良副作用 [ 7 ].
2) 皮肤健康
在临床试验中,植物乳杆菌显着增加了面部和手部的皮肤水分含量。益生菌组志愿者在第 12 周时皱纹深度明显减少,皮肤光泽度在第 12 周时也有显着改善。益生菌组的皮肤弹性在4 周后改善了 13.17%,在 12 周后改善了 21.73% [ 8 ] .
当作为益生菌服用时,植物乳杆菌改善皮肤水合作用,对人体皮肤具有抗光老化作用[ 9、10 ] .
植物乳杆菌抑制胶原蛋白的降解并促进其合成,减少活性氧 ( ROS ) 的产生 [ 11 ] .
在无毛小鼠中,植物乳杆菌降低了 UVB 诱导的表皮厚度,抑制了水分流失并增加了神经酰胺水平 [ 12 , 13 ] .
特应性皮炎
每天摄入含有热灭活植物乳杆菌的柑橘汁可减轻人类特应性皮炎的症状[ 14 ] .
从泡菜中分离出的植物乳杆菌改善小鼠特应性皮炎[ 15 ] .
3) 溃疡性结肠炎
在多项临床试验中,乳酸菌益生菌已显示出减轻溃疡性结肠炎症状的希望。含有植物乳杆菌的合生元混合物在8周后显着改善了 73 名患者的 UC 症状 [ 16、17 ] .
4) 胆固醇
在许多临床试验中,乳酸菌益生菌降低了胆固醇。在一项针对 60 名高胆固醇志愿者的研究中,含有植物乳杆菌的益生菌在 12 周后将总胆固醇降低了 13.6% [ 18 ] .
在患有糖尿病的大鼠中,植物乳杆菌降低血液甘油三酯和“坏”低密度脂蛋白胆固醇的比率,同时增加“好”高密度脂蛋白胆固醇的水平 [ 19 ] .
摄入植物乳杆菌后,胆固醇升高的小鼠的总血清胆固醇和甘油三酯显着降低 [ 20 ] .
双涂层植物乳杆菌可降低高脂肪饮食小鼠的胆固醇水平 [ 21 ] .
证据不足
研究人员目前正在调查植物乳杆菌是否具有其他健康益处。本节中的潜在益处至少在一项临床试验中产生了积极的结果,但这些研究规模小、相互矛盾或存在其他局限性。出于任何原因补充植物乳杆菌之前,请谨慎。
5) 肥胖
辅以含有植物乳杆菌的富含益生菌的奶酪的低热量饮食降低了患有肥胖症和高血压的俄罗斯成年人的 BMI 和血压[ 22 ].
植物乳杆菌还保护小鼠免受饮食引起的肥胖。这种细菌可降低肥胖小鼠的体重、脂肪量、空腹血糖、血清胰岛素、瘦素水平和促炎标志物 [ 23、24、25 ] .
植物乳杆菌发酵大麦逆转了高脂肪饮食大鼠的葡萄糖耐受不良,改善了升高的胰岛素,降低了甘油三酯和总胆固醇水平 [ 26 ].
植物乳杆菌通过诱导丙氨酸氨基转移酶( ALT )、γ-谷氨酰转移酶 ( GGT )、血浆甘油三酯、总胆固醇浓度、肌酐、尿素和体重的降低,来改善肥胖大鼠的肝功能和泌尿功能 [ 27 ].
6) 血糖
植物乳杆菌降低了绝经后妇女的血糖水平[ 22 ].
含有植物乳杆菌的豆浆具有抗氧化特性,可减少 2 型糖尿病患者的 DNA 损伤[ 22 ].
植物乳杆菌降低小鼠的食物摄入量、血糖水平、糖化血红蛋白水平和瘦素水平。这种细菌还有利于调节胰岛素水平并增加“好”(HDL) 胆固醇 [ 28 ].
植物乳杆菌导致高脂肪饮食小鼠对胰岛素的血糖水平显着降低 [ 29 ].
用植物乳杆菌治疗可有效调节糖尿病大鼠的血糖、激素和脂质代谢 [ 30 ].
植物乳杆菌显着改善糖尿病大鼠的免疫学参数并保护胰腺组织。此外,这种益生菌治疗显着降低了胰腺和血浆脂肪酶活性以及血清甘油三酯和低密度脂蛋白胆固醇率,并增加了高密度脂蛋白胆固醇水平。它还对肝肾功能发挥有效的保护作用 [ 19 ] .
7) 伤口愈合
在一项针对 34 名腿部溃疡患者的小型临床研究中,局部应用植物乳杆菌减少了糖尿病和非糖尿病患者的感染性慢性静脉溃疡伤口细菌负荷、中性粒细胞、凋亡和坏死细胞,并诱导伤口愈合[ 31 ].
8) 牙齿健康
热灭活的植物乳杆菌减少了接受牙周支持治疗的患者的牙周袋深度 [ 32 ].
9) 免疫力
在一项对 171 名成年人进行的临床研究中,植物乳杆菌提高了免疫活性并降低了应激标记物 [ 33 ].
即使是热灭活的植物乳杆菌也会激活人类的先天性和获得性免疫力 [ 32 ].
植物乳杆菌增强免疫抑制小鼠小肠的免疫力[ 34 ].
抗病毒
在感染单纯疱疹病毒 1 型 (HSV-1) 的小鼠中,口服植物乳杆菌显着延缓了感染早期皮肤损伤的发展,并减少了大脑中的病毒数量 [ 35 ].
同样在小鼠中,从发酵的韩国卷心菜中分离出的植物乳杆菌赋予了 100% 的保护作用,防止致命的甲型流感病毒感染,防止显着的体重减轻并降低肺部病毒载量 [ 36 ].
10) 过敏
在一项针对 42 名成年人的临床研究中,植物乳杆菌发酵的柑橘汁改善了日本柳杉花粉症的症状[ 37 ].
在一项细胞研究中,植物乳杆菌降低了大豆粉的过敏性 [ 38 ].
口服植物乳杆菌可减轻小鼠的气道高反应性和过敏反应 [ 39 ].
11) 念珠菌病
在外阴阴道念珠菌病 (VVC) 患者中,植物乳杆菌减少了常规治疗后的阴道不适,并改善了阴道细菌含量和阴道 pH 值 [ 40 ].
在一项临床试验中,使用植物乳杆菌可使外阴阴道念珠菌病复发风险降低三倍 [ 41 ].
植物乳杆菌还在实验室中杀死念珠菌 [ 42 ].
动物和细胞研究(缺乏证据)
没有临床证据支持将植物乳杆菌用于本节所列的任何病症。以下是对现有动物和细胞研究的总结,应指导进一步的研究工作。但是,不应将下列研究解释为支持任何健康益处。
12) 排毒
植物乳杆菌在实验室中减轻镉 (Cd) 在人类肠道细胞和小鼠中诱导的细胞毒性[ 43、44 ].
植物乳杆菌通过减少肠道铝吸收和组织积累,改善肝损伤、肾脏和大脑氧化应激,从而防止小鼠受到铝中毒[ 45 ].
用植物乳杆菌处理可通过增加铜排泄和减少铜在组织中的积累来减轻铜毒性。植物乳杆菌还逆转了铜暴露引起的氧化应激,恢复了 ALT 和AST血液水平并改善了小鼠的空间记忆 [ 46 ].
13) 血管性痴呆
植物乳杆菌发酵豆浆提取物可作为降血压剂和神经保护剂,改善血管性痴呆大鼠的学习和记忆 [ 47 ].
14) 焦虑
长期摄入植物乳杆菌可增加运动活性、多巴胺和血清素水平,同时减少小鼠的焦虑样行为。它还减少了抑郁样行为和炎性细胞因子水平,并增加了遭受早期生活压力的小鼠血清中的抗炎细胞因子水平[ 48、49 ].
15) 心血管健康
血压
植物乳杆菌发酵豆浆提取物可作为大鼠的降血压剂 [ 47 ].
同样在大鼠中,用植物乳杆菌发酵的蓝莓降低了血压并改善了可能指示心血管疾病风险的标志物 [ 50 ].
动脉粥样硬化
来自植物乳杆菌的脂磷壁酸 (LTA)可抑制小鼠促炎细胞因子的产生,并抑制动脉粥样硬化斑块炎症 [ 51 ].
16) 炎症
植物乳杆菌显着降低小鼠和大鼠促炎细胞因子的产生 [ 52 , 53 ]. 它还减轻了氧化应激和肾上腺素水平 [ 52 ].
17) 肝脏健康
用植物乳杆菌治疗大鼠阻塞性黄疸可恢复活跃的肝屏障功能 [ 54 ].
植物乳杆菌可保护小鼠免受氧化应激和肝脏炎症损伤 [ 55 ].
植物乳杆菌减轻了高脂血症小鼠的肝损伤[ 56 ].
补充植物乳杆菌 5 周可恢复患有非酒精性脂肪性肝病 (NAFLD) 大鼠的肝功能,并降低肝脏中的脂肪堆积水平。此外,该细菌显着减少了促炎细胞因子 [ 53 ].
18) 肠道健康
植物乳杆菌减少肠上皮细胞的炎症 [ 57 ].
摄入植物乳杆菌可以抵消肠道中不需要的细菌 [ 3 ].
植物乳杆菌增强了洛哌丁胺诱导的便秘小鼠的胃肠道转运[ 58 ].
溃疡
口服植物乳杆菌可通过抗炎和免疫调节活性改善小鼠的溃疡性结肠炎 [ 59 ].
肠易激综合症
植物乳杆菌可减少肠易激综合征患者的胀气问题和疼痛 [ 60 ].
幽门螺杆菌感染
植物乳杆菌可预防小鼠幽门螺杆菌感染引起的胃粘膜炎症和胃微生物群改变[ 61 ].
植物乳杆菌延缓幽门螺杆菌在大鼠胃中的定植,减轻胃炎症并改善胃组织病理学 [ 62 ].
19) 婴儿成长
植物乳杆菌菌株在慢性营养不良期间维持幼鼠的生长 [ 63 ].
20) 身体耐力
植物乳杆菌显着降低小鼠的体重并增加相对肌肉重量、握力和耐力游泳时间 [ 64 ].
21) 女性生育能力
植物乳杆菌改善了小鼠炎症诱导的不孕症 [ 65 ].
植物乳杆菌增强了自然微生物群落,并导致感染大肠杆菌的小鼠的生育能力恢复[ 66 ].
22) 组胺不耐受
植物乳杆菌可以在实验室环境中降解生物胺。在组胺不耐受的人群中可能值得研究 [ 67 ].
癌症研究
植物乳杆菌增强了肠腺癌小鼠的抗肿瘤免疫反应并延缓了肿瘤形成 [ 68 ].
长期服用植物乳杆菌可预防大鼠患乳腺癌 [ 69、70 ].
植物乳杆菌抑制大鼠结肠癌发生的发展 [ 71 ].
纳米尺寸的植物乳杆菌还在小鼠中表现出抗结直肠癌活性 [ 72 ].
植物乳杆菌显着抑制肝癌细胞、胃癌细胞和结直肠腺癌细胞的增殖[ 73 ].
这些影响尚未在人类受试者中进行过研究。
在大鼠身上没有观察到任何类型的不良反应,即使在大量食用后也是如此。然而,与其他益生菌一样,在器官衰竭、免疫功能低下和肠道屏障机制功能失调的患者中使用可能会导致感染 [ 74 ].
为了避免不良事件,请在使用益生菌之前咨询医生。
尽管这种情况可能很少见,但如果出现以下任何可能与非常严重的副作用相关的体征或症状,请立即寻求医疗帮助:
参考文献:
[1] Arasu MV, Al-Dhabi NA, Ilavenil S, Choi KC, Srigopalram S. In vitro importance of probiotic Lactobacillus plantarum related to medical field. Saudi J Biol Sci. 2016 Jan;23(1):S6-S10.
[2] Li P, Zhou Q, Gu Q. Complete genome sequence of Lactobacillus plantarum LZ227, a potential probiotic strain producing B-group vitamins. J Biotechnol. 2016 Sep 20;234:66-70.
[3] Hoppe M, Önning G, Berggren A, Hulthén L. Probiotic strain Lactobacillus plantarum 299v increases iron absorption from an iron-supplemented fruit drink: a double-isotope cross-over single-blind study in women of reproductive age. Br J Nutr. 2015 Oct 28;114(8):1195-202.
[4] Bering S, Suchdev S, Sjøltov L, Berggren A, Tetens I, Bukhave K. A lactic acid-fermented oat gruel increases non-haem iron absorption from a phytate-rich meal in healthy women of childbearing age. Br J Nutr. 2006 Jul;96(1):80-5.
[5] ergillos-Meca T, Cabrera-Vique C, Artacho R, Moreno-Montoro M, Navarro-Alarcón M, Olalla M, Giménez R, Seiquer I, Ruiz-López MD. Does Lactobacillus plantarum or ultrafiltration process improve Ca, Mg, Zn and P bioavailability from fermented goats’ milk? Food Chem. 2015 Nov 15;187:314-21.
[6] Olek A, Woynarowski M, Ahrén IL, Kierkuś J, Socha P, Larsson N, Önning G. Efficacy and Safety of Lactobacillus plantarum DSM 9843 (LP299V) in the Prevention of Antibiotic-Associated Gastrointestinal Symptoms in Children-Randomized, Double-Blind, Placebo-Controlled Study. J Pediatr. 2017 Jul;186:82-86.
[7] Hilton E, Kolakowski P, Singer C, Smith M. Efficacy of Lactobacillus GG as a Diarrheal Preventive in Travelers. J Travel Med. 1997 Mar 1;4(1):41-43.
[8] Lee DE, Huh CS, Ra J, Choi ID, Jeong JW, Kim SH, Ryu JH, Seo YK, Koh JS, Lee JH, Sim JH, Ahn YT. Clinical Evidence of Effects of Lactobacillus plantarum HY7714 on Skin Aging: A Randomized, Double Blind, Placebo-Controlled Study. J Microbiol Biotechnol. 2015 Dec 28;25(12):2160-8.
[9] Jeong JH, Lee CY, Chung DK. Probiotic Lactic Acid Bacteria and Skin Health. Crit Rev Food Sci Nutr. 2016 Oct 25;56(14):2331-7.
[10] Kim H, Kim HR, Jeong BJ, Lee SS, Kim TR, Jeong JH, Lee M, Lee S, Lee JS, Chung DK. Effects of oral intake of kimchi-derived Lactobacillus plantarum K8 lysates on skin moisturizing. J Microbiol Biotechnol. 2015 Jan;25(1):74-80.
[11] Hong YF, Lee Hy, Jung BJ, Jang S, Chung DK, Kim H. Lipoteichoic acid isolated from Lactobacillus plantarum down-regulates UV-induced MMP-1 expression and up-regulates type I procollagen through the inhibition of reactive oxygen species generation. Mol Immunol. 2015 Oct;67(2 Pt B):248-55.
[12] Ra J, Lee DE, Kim SH, Jeong JW, Ku HK, Kim TY, Choi ID, Jeung W, Sim JH, Ahn YT. Effect of oral administration of Lactobacillus plantarum HY7714 on epidermal hydration in ultraviolet B-irradiated hairless mice. J Microbiol Biotechnol. 2014 Dec 28;24(12):1736-43.
[13] Kim HM, Lee DE, Park SD, Kim YT, Kim YJ, Jeong JW, Jang SS, Ahn YT, Sim JH, Huh CS, Chung DK, Lee JH. Oral administration of Lactobacillus plantarum HY7714 protects hairless mouse against ultraviolet B-induced photoaging. J Microbiol Biotechnol. 2014 Nov 28;24(11):1583-91.
[14] Harima-Mizusawa N, Kamachi K, Kano M, Nozaki D, Uetake T, Yokomizo Y, Nagino T, Tanaka A, Miyazaki K, Nakamura S. Beneficial effects of citrus juice fermented with Lactobacillus plantarum YIT 0132 on atopic dermatitis: results of daily intake by adult patients in two open trials. Biosci Microbiota Food Health. 2016;35(1):29-39.
[15] Won TJ, Kim B, Lee Y, Bang JS, Oh ES, Yoo JS, Hyung KE, Yoon J, Hwang S, Park ES, Park SY, Hwang KW. Therapeutic potential of Lactobacillus plantarum CJLP133 for house-dust mite-induced dermatitis in NC/Nga mice. Cell Immunol. 2012 May-Jun;277(1-2):49-57.
[18] Fuentes MC, Lajo T, Carrión JM, Cuñé J. Cholesterol-lowering efficacy of Lactobacillus plantarum CECT 7527, 7528 and 7529 in hypercholesterolaemic adults. Br J Nutr. 2013 May 28;109(10):1866-72.
[19] Bejar W, Hamden K, Ben Salah R, Chouayekh H. Lactobacillus plantarum TN627 significantly reduces complications of alloxan-induced diabetes in rats. Anaerobe. 2013 Dec;24:4-11.
[20] Yoo JY, Kim SS. Probiotics and Prebiotics: Present Status and Future Perspectives on Metabolic Disorders. Nutrients. 2016 Mar 18;8(3):173.
[21] Jeun J, Kim S, Cho SY, Jun HJ, Park HJ, Seo JG, Chung MJ, Lee SJ. Hypocholesterolemic effects of Lactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice. Nutrition. 2010 Mar;26(3):321-30.
[22] Sáez-Lara MJ, Robles-Sanchez C, Ruiz-Ojeda FJ, Plaza-Diaz J, Gil A. Effects of Probiotics and Synbiotics on Obesity, Insulin Resistance Syndrome, Type 2 Diabetes and Non-Alcoholic Fatty Liver Disease: A Review of Human Clinical Trials. Int J Mol Sci. 2016 Jun 13;17(6):928.
[23] Pothuraju R, Sharma RK, Kavadi PK, Chagalamarri J, Jangra S, Bhakri G, De S. Anti-obesity effect of milk fermented by Lactobacillus plantarum NCDC 625 alone and in combination with herbs on high fat diet fed C57BL/6J mice. Benef Microbes. 2016 Jun;7(3):375-85.
[24] Park JE, Oh SH, Cha YS. Lactobacillus plantarum LG42 isolated from gajami sik-hae decreases body and fat pad weights in diet-induced obese mice. J Appl Microbiol. 2014 Jan;116(1):145-56.
[25] Wu CC, Weng WL, Lai WL, Tsai HP, Liu WH, Lee MH, Tsai YC. Effect of Lactobacillus plantarum Strain K21 on High-Fat Diet-Fed Obese Mice. Evid Based Complement Alternat Med. 2015;2015:391767.
[26] Zhang J, Xiao X, Dong Y, Xu T, Wu F. Dietary supplementation with Lactobacillus plantarum dy-1 fermented barley suppresses body weight gain in high-fat diet-induced obese rats. J Sci Food Agric. 2016 Dec;96(15):4907-4917.
[27] Ben Salah R, Trabelsi I, Hamden K, Chouayekh H, Bejar S. Lactobacillus plantarum TN8 exhibits protective effects on lipid, hepatic and renal profiles in obese rat. Anaerobe. 2013 Oct;23:55-61.
[28] Li X, Wang N, Yin B, Fang D, Jiang T, Fang S, Zhao J, Zhang H, Wang G, Chen W. Effects of Lactobacillus plantarum CCFM0236 on hyperglycaemia and insulin resistance in high-fat and streptozotocin-induced type 2 diabetic mice. J Appl Microbiol. 2016 Dec;121(6):1727-1736.
[29] Sakai T, Taki T, Nakamoto A, Shuto E, Tsutsumi R, Toshimitsu T, Makino S, Ikegami S. Lactobacillus plantarum OLL2712 regulates glucose metabolism in C57BL/6 mice fed a high-fat diet. J Nutr Sci Vitaminol (Tokyo). 2013;59(2):144-7.
[30] Li C, Ding Q, Nie SP, Zhang YS, Xiong T, Xie MY. Carrot juice fermented with Lactobacillus plantarum NCU116 ameliorates type 2 diabetes in rats. J Agric Food Chem. 2014 Dec 10;62(49):11884-91.
[31] Peral MC, Rachid MM, Gobbato NM, Huaman Martinez MA, Valdez JC. Interleukin-8 production by polymorphonuclear leukocytes from patients with chronic infected leg ulcers treated with Lactobacillus plantarum. Clin Microbiol Infect. 2010 Mar;16(3):281-6.
[32] Iwasaki K, Maeda K, Hidaka K, Nemoto K, Hirose Y, Deguchi S. Daily Intake of Heat-killed Lactobacillus plantarum L-137 Decreases the Probing Depth in Patients Undergoing Supportive Periodontal Therapy. Oral Health Prev Dent. 2016;14(3):207-14.
[33] Nishimura M, Ohkawara T, Tetsuka K, Kawasaki Y, Nakagawa R, Satoh H, Sato Y, Nishihira J. Effects of yogurt containing Lactobacillus plantarum HOKKAIDO on immune function and stress markers. J Tradit Complement Med. 2015 Aug 21;6(3):275-80.
[34] Xie J, Yu Q, Nie S, Fan S, Xiong T, Xie M. Effects of Lactobacillus plantarum NCU116 on Intestine Mucosal Immunity in Immunosuppressed Mice. J Agric Food Chem. 2015 Dec 30;63(51):10914-20.
[35] Matsusaki T, Takeda S, Takeshita M, Arima Y, Tsend-Ayush C, Oyunsuren T, Sugita C, Yoshida H, Watanabe W, Kurokawa M. Augmentation of T helper type 1 immune response through intestinal immunity in murine cutaneous herpes simplex virus type 1 infection by probiotic Lactobacillus plantarum strain 06CC2. Int Immunopharmacol. 2016 Oct;39:320-327.
[36] Park MK, Ngo V, Kwon YM, Lee YT, Yoo S, Cho YH, Hong SM, Hwang HS, Ko EJ, Jung YJ, Moon DW, Jeong EJ, Kim MC, Lee YN, Jang JH, Oh JS, Kim CH, Kang SM. Lactobacillus plantarum DK119 as a probiotic confers protection against influenza virus by modulating innate immunity. PLoS One. 2013 Oct 4;8(10):e75368.
[37] Harima-Mizusawa N, Iino T, Onodera-Masuoka N, Kato-Nagaoka N, Kiyoshima-Shibata J, Gomi A, Shibahara-Sone H, Kano M, Shida K, Sakai M, Miyazaki K, Ishikawa F. Beneficial Effects of Citrus Juice Fermented with Lactobacillus plantarum YIT 0132 on Japanese Cedar Pollinosis. Biosci Microbiota Food Health. 2014;33(4):147-55.
[38] Frias J, Song YS, Martínez-Villaluenga C, González de Mejia E, Vidal-Valverde C. Immunoreactivity and amino acid content of fermented soybean products. J Agric Food Chem. 2008 Jan 9;56(1):99-105.
[39] Liu YW, Liao TW, Chen YH, Chiang YC, Tsai YC. Oral administration of heat-inactivated Lactobacillus plantarum K37 modulated airway hyperresponsiveness in ovalbumin-sensitized BALB/c mice. PLoS One. 2014 Jun 17;9(6):e100105.
[40] De Seta F, Parazzini F, De Leo R, Banco R, Maso GP, De Santo D, Sartore A, Stabile G, Inglese S, Tonon M, Restaino S. Lactobacillus plantarum P17630 for preventing Candida vaginitis recurrence: a retrospective comparative study. Eur J Obstet Gynecol Reprod Biol. 2014 Nov;182:136-9.
[41] Palacios S, Espadaler J, Fernández-Moya JM, Prieto C, Salas N. Is it possible to prevent recurrent vulvovaginitis? The role of Lactobacillus plantarum I1001 (CECT7504). Eur J Clin Microbiol Infect Dis. 2016 Oct;35(10):1701-8.
[42] Sharma A, Srivastava S. Anti-Candida activity of spent culture filtrate of Lactobacillus plantarum strain LR/14. J Mycol Med. 2014 Jun;24(2):e25-34.
[43] Zhai Q, Tian F, Zhao J, Zhang H, Narbad A, Chen W. Oral Administration of Probiotics Inhibits Absorption of the Heavy Metal Cadmium by Protecting the Intestinal Barrier. Appl Environ Microbiol. 2016 Jun 30;82(14):4429-40.
[44] Zhai Q, Wang G, Zhao J, Liu X, Narbad A, Chen YQ, Zhang H, Tian F, Chen W. Protective effects of Lactobacillus plantarum CCFM8610 against chronic cadmium toxicity in mice indicate routes of protection besides intestinal sequestration. Appl Environ Microbiol. 2014 Jul;80(13):4063-71.
[45] Yu L, Zhai Q, Liu X, Wang G, Zhang Q, Zhao J, Narbad A, Zhang H, Tian F, Chen W. Lactobacillus plantarum CCFM639 alleviates aluminium toxicity. Appl Microbiol Biotechnol. 2016 Feb;100(4):1891-1900.
[46] Tian F, Xiao Y, Li X, Zhai Q, Wang G, Zhang Q, Zhang H, Chen W. Protective Effects of Lactobacillus plantarum CCFM8246 against Copper Toxicity in Mice. PLoS One. 2015 Nov 25;10(11):e0143318.
[47] Liu TH, Chiou J, Tsai TY. Effects of Lactobacillus plantarum TWK10-Fermented Soymilk on Deoxycorticosterone Acetate-Salt-Induced Hypertension and Associated Dementia in Rats. Nutrients. 2016 May 2;8(5):260.
[48] Liu YW, Liu WH, Wu CC, Juan YC, Wu YC, Tsai HP, Wang S, Tsai YC. Psychotropic effects of Lactobacillus plantarum PS128 in early life-stressed and naïve adult mice. Brain Res. 2016 Jan 15;1631:1-12.
[49] Liu WH, Chuang HL, Huang YT, Wu CC, Chou GT, Wang S, Tsai YC. Alteration of behavior and monoamine levels attributable to Lactobacillus plantarum PS128 in germ-free mice. Behav Brain Res. 2016 Feb 1;298(Pt B):202-9.
[50] Ahrén IL, Xu J, Önning G, Olsson C, Ahrné S, Molin G. Antihypertensive activity of blueberries fermented by Lactobacillus plantarum DSM 15313 and effects on the gut microbiota in healthy rats. Clin Nutr. 2015 Aug;34(4):719-26.
[51] Kim JY, Kim H, Jung BJ, Kim NR, Park JE, Chung DK. Lipoteichoic acid isolated from Lactobacillus plantarum suppresses LPS-mediated atherosclerotic plaque inflammation. Mol Cells. 2013 Feb;35(2):115-24.
[52] Toshimitsu T, Mochizuki J, Ikegami S, Itou H. Identification of a Lactobacillus plantarum strain that ameliorates chronic inflammation and metabolic disorders in obese and type 2 diabetic mice. J Dairy Sci. 2016 Feb;99(2):933-946.
[53] Li C, Nie SP, Zhu KX, Ding Q, Li C, Xiong T, Xie MY. Lactobacillus plantarum NCU116 improves liver function, oxidative stress and lipid metabolism in rats with high fat diet induced non-alcoholic fatty liver disease. Food Funct. 2014 Dec;5(12):3216-23.
[54] Zhang M, Wang XQ, Zhou YK, Ma YL, Shen TY, Chen HQ, Chu ZX, Qin HL. Effects of oral Lactobacillus plantarum on hepatocyte tight junction structure and function in rats with obstructive jaundice. Mol Biol Rep. 2010 Jul;37(6):2989-99.
[55] Peng X, Jiang Y. Protective effects of Lactobacillus plantarum NDC 75017 against lipopolysaccharide-induced liver injury in mice. Inflammation. 2014 Oct;37(5):1599-607.
[56] Wang LX, Liu K, Gao DW, Hao JK. Protective effects of two Lactobacillus plantarum strains in hyperlipidemic mice. World J Gastroenterol. 2013 May 28;19(20):3150-6.
[57] Murofushi Y, Villena J, Morie K, Kanmani P, Tohno M, Shimazu T, Aso H, Suda Y, Hashiguchi K, Saito T, Kitazawa H. The toll-like receptor family protein RP105/MD1 complex is involved in the immunoregulatory effect of exopolysaccharides from Lactobacillus plantarum N14. Mol Immunol. 2015 Mar;64(1):63-75.
[58] Li C, Nie SP, Zhu KX, Xiong T, Li C, Gong J, Xie MY. Effect of Lactobacillus plantarum NCU116 on loperamide-induced constipation in mice. Int J Food Sci Nutr. 2015;66(5):533-8.
[59] Liu YW, Su YW, Ong WK, Cheng TH, Tsai YC. Oral administration of Lactobacillus plantarum K68 ameliorates DSS-induced ulcerative colitis in BALB
/c mice via the anti-inflammatory and immunomodulatory activities. Int Immunopharmacol. 2011 Dec;11(12):2159-66.
[60] Ducrotté P, Sawant P, Jayanthi V. Clinical trial: Lactobacillus plantarum 299v (DSM 9843) improves symptoms of irritable bowel syndrome. World J Gastroenterol. 2012 Aug 14;18(30):4012-8.
[61] Pan M, Wan C, Xie Q, Huang R, Tao X, Shah NP, Wei H. Changes in gastric microbiota induced by Helicobacter pylori infection and preventive effects of Lactobacillus plantarum ZDY 2013 against such infection. J Dairy Sci. 2016 Feb;99(2):970-981.
[62] Thiraworawong T, Spinler JK, Werawatganon D, Klaikeaw N, Venable SF, Versalovic J, Tumwasorn S. Anti-inflammatory properties of gastric-derived Lactobacillus plantarum XB7 in the context of Helicobacter pylori infection. Helicobacter. 2014 Apr;19(2):144-55.
[63] ME, Balmand S, Hudcovic T, Heddi A, Rieusset J, Kozakova H, Vidal H, Leulier F. Lactobacillus plantarum strain maintains growth of infant mice during chronic undernutrition. Science. 2016 Feb 19;351(6275):854-7.
[64] Chen YM, Wei L, Chiu YS, Hsu YJ, Tsai TY, Wang MF, Huang CC. Lactobacillus plantarum TWK10 Supplementation Improves Exercise Performance and Increases Muscle Mass in Mice. Nutrients. 2016 Apr 7;8(4):205.
[65] Bhandari P, Rishi P, Prabha V. Positive effect of probiotic Lactobacillus plantarum in reversing LPS-induced infertility in a mouse model. J Med Microbiol. 2016 May;65(5):345-350.
[66] Bhandari P, Prabha V. Evaluation of profertility effect of probiotic Lactobacillus plantarum 2621 in a murine model. Indian J Med Res. 2015 Jul;142(1):79-84.
[67] Capozzi V, Russo P, Ladero V, Fernández M, Fiocco D, Alvarez MA, Grieco F, Spano G. Biogenic Amines Degradation by Lactobacillus plantarum: Toward a Potential Application in Wine. Front Microbiol. 2012 Apr 2;3:122.
[68] Hu J, Wang C, Ye L, Yang W, Huang H, Meng F, Shi S, Ding Z. Anti-tumour immune effect of oral administration of Lactobacillus plantarum to CT26 tumour-bearing mice. J Biosci. 2015 Jun;40(2):269-79.
[69] Kassayová M, Bobrov N, Strojný L, Kisková T, Mikeš J, Demečková V, Orendáš P, Bojková B, Péč M, Kubatka P, Bomba A. Preventive effects of probiotic bacteria Lactobacillus plantarum and dietary fiber in chemically-induced mammary carcinogenesis. Anticancer Res. 2014 Sep;34(9):4969-75.
[70] Kassayová M, Bobrov N, Strojný L, Orendáš P, Demečková V, Jendželovský R, Kubatka P, Kisková T, Kružliak P, Adamkov M, Bomba A, Fedoročko P. Anticancer and Immunomodulatory Effects of Lactobacillus plantarum LS/07, Inulin and Melatonin in NMU-induced Rat Model of Breast Cancer. Anticancer Res. 2016 Jun;36(6):2719-28.
[71] Kumar RS, Kanmani P, Yuvaraj N, Paari KA, Pattukumar V, Thirunavukkarasu C, Arul V. Lactobacillus plantarum AS1 isolated from south Indian fermented food Kallappam suppress 1,2-dimethyl hydrazine (DMH)-induced colorectal cancer in male Wistar rats. Appl Biochem Biotechnol. 2012 Feb;166(3):620-31.
[72] Lee HA, Kim H, Lee KW, Park KY. Dead Nano-Sized Lactobacillus plantarum Inhibits Azoxymethane/Dextran Sulfate Sodium-Induced Colon Cancer in Balb/c Mice. J Med Food. 2015 Dec;18(12):1400-5.
[73] Wang K, Li W, Rui X, Chen X, Jiang M, Dong M. Characterization of a novel exopolysaccharide with antitumor activity from Lactobacillus plantarum 70810. Int J Biol Macromol. 2014 Feb;63:133-9.
[74] Biljana Novkovic, 11+ Health Benefits of Lactobacillus plantarum (L. plantarum). September 20, 2021. selfhacked


人体内有宏量营养素(脂肪,蛋白质和碳水化合物),还有微量营养素。虽然称为“微量”,但它很强大,是维持正常生理活动的必需品。
微量营养素的发现:
1912年,波兰生物化学家卡西米尔·芬克发现了第一种微量营养素。他开始假设我们的食物中一定有其他“必需营养素”是维持健康所必需的。他把这些神秘的化合物称为“vital amines”,最终简称为“vitamins”(维生素)。
一百多年后,科学家们进行了大量的研究,列出了人体正常功能所需的近30种维生素和矿物质。饮食中哪怕只有一种微量营养素是缺乏的,其后果也可能是严重的。
对于每一种维生素或矿物质缺乏症,身体会迅速开始出现严重的功能失调。
例如,维生素A在维持机体正常的视力、基因表达、生殖、胚胎发育、生长和免疫功能等方面发挥着重要的作用。

维生素A缺乏可能会出现眼部疾病,儿童缺乏维生素A也会出现生长发育迟滞、血细胞生成障碍等问题。
<其他营养物质缺乏可详见本文末章节>
总之,每种微量营养素都在体内发挥作用。而每种缺陷都与疾病状况密切相关。
因此,在饮食中获取足够的必需微量营养素是维持健康的必要条件。
现代营养倡导“多样化”,食用各种类型的食物,以确保能够摄入身体所需的所有维生素和矿物质。
可能你吃到的大多数谷物,面包和其他加工谷物都已添加了各种B族维生素(和其他矿物质)。此外,很多人都会在饮食中加入水果,蔬菜,谷物和蛋白质等,尽可能地去满足大部分营养素所需的摄入量。
但问题来了,并不是你吃了什么就有什么,也得看身体的吸收能力。
有时候虽然吃的多,但并不代表消化系统已经为吸收做好了充分的准备。
为了更好地吸收营养,身体需要做好准备。这里涉及几个因素,例如健康的肠壁和肠道菌群,还取决于微量营养素的吸收方式和吸收位置。
消化过程:
消化系统的首要作用是摄取食物,并将其分解为更小,更有用的成分。
将食物放入嘴后立即开始第一步。当牙齿将食物粉碎成较小的碎片时,唾液腺开始分泌酶,其唯一目的是分解碳水化合物。
一旦被吞咽,食物就会进入食道并进入胃,暴露于强酸性胃液中,进一步降解碳水化合物,蛋白质和脂肪。
然后,消化后的食物被释放到小肠,接着,肝脏,胆囊和胰腺会分泌更多的消化酶,从而为营养吸收做好准备。
小 肠
小肠由三个不同的部分组成:十二指肠、空肠和回肠。大部分的营养吸收过程都在这里。
小肠吸收了食物中的成分,包括单糖、氨基酸、脂肪酸,微量营养素。大部分维生素和矿物质会在小肠中被吸收,但每种维生素和矿物质都需要独特的机制才能穿过肠道细胞壁。
当消化后的食物通过小肠并经历吸收营养过程后,最终进入大肠,然后被排出。
大 肠
大肠在消化中的作用相当直接。当食物的剩余成分进入大肠时,大部分营养物质已经被消化吸收了,它的主要功能是去除多余的水分和盐分,为排泄做好准备。残余物通常被分解成难以消化的残余物,如不易消化的纤维等。
现在我们知道这个领域有很多其他的关键功能。随着对肠道微生物群的更广泛了解,我们知道大多数肠道细菌在这一区域定居,吸收我们身体无法消化的东西,并将其分解,转化为对身体有益的许多必须营养素,从而给人体带来好处。
了解不同微量营养素的差异
了解不同类型的微量营养素之间的差异是改善吸收的一种方法。
例如有两类维生素:水溶性(各种维生素B和C)和脂溶性(如A、D、E和K)。
水溶性维生素需要水来运输。多喝水可以提高身体吸收和运输这些营养物质的能力。
脂溶性维生素需要脂肪来帮助吸收。改善脂肪转运的最好方法之一就是用脂溶性维生素丰富的食物来摄取健康的脂肪,确保身体能适当地吸收。
此外,水溶性维生素和矿物质都需要肠细胞内壁的特殊“转运体”来穿过细胞膜进入血液。功能越专业,保护性就越强。这种复杂而特殊的吸收过程确保只有正确的成分才能进入血液。
肠道菌群 ——营养吸收的低调英雄
微生物不仅有助于吸收营养,甚至可以提高必需营养素的水平。健康的肠道生态系统有助于维持肠道黏膜的完整。
为了真正优化吸收过程,身体需要健康的肠道细胞来吸收营养。
肠道菌群失衡可导致肠道细胞衰亡,破坏营养吸收。这大大降低了消化系统吸收修复和维持健康细胞所必需营养的能力。
肠道菌群被证明是许多必需营养素的来源。维生素K就是一个例子。
虽然我们的饮食中含有维生素K,但实际上,人体每天所需维生素K的一半以上是由肠道中的细菌产生的。
如果你的肠道生态系统不平衡,缺乏某些菌群,可能导致身体缺乏某些维生素。
因此,调理改善肠道菌群是一种可行的方式。
当然,每个人对营养物质的需求是独一无二的。归根结底,这取决于你的身体运作方式,基于生活方式、饮食、个人需求,以及肠道健康状况等多方面因素。
了解饮食中的差距可能是改善营养吸收的第一步。另外,肠道菌群检测有助于对身体健康状况的把握,知道补充哪些营养素,有助于什么类型的菌群生长,结合自身的症状,有针对性地改善菌群,从而真正改善健康状况。
随着对肠道菌群,营养饮食的研究深入,现在越来越倾向于个性化的干预方式,更加精准地选择适合自己的营养素,而不是盲目补充维生素。
1. 缺钙
麻木,手指发麻和心律异常
钙对于维持强壮的骨骼以及控制肌肉和神经功能非常重要 。严重低钙的迹象包括麻木,手指刺痛和心律异常等。
日需求量
大多数成年人每天需要1000毫克(mg)的钙,而50岁以上的女性和70岁以上的男性则需要1200毫克 。
补充钙
牛奶,酸奶,奶酪等乳制品是钙的良好来源,但如果不喜欢乳制品,可以在钙强化的橙汁或早餐麦片中获得。

2. 缺维生素D
疲劳,骨痛,情绪变化等
维生素D对骨骼健康至关重要,不过,维生素D缺乏的症状可能是模糊的,有可能出现疲劳、骨痛、情绪变化、肌肉疼痛、虚弱等。
维生素D长期缺乏会导致骨骼软化,还可能与癌症和自身免疫性疾病有关。
日需求量
大多数成年人每天需要15微克(mcg)的维生素D,而70岁以上的成年人则需要20 mcg。
补充维生素D
食物:牛奶或酸奶,金枪鱼等。
晒太阳:每周几次晒太阳,每次在10到30分钟内,对补充维生素D有帮助。

3. 缺 钾
肌肉无力,便秘,心律不齐等
钾可以帮助心脏、神经和肌肉正常工作,并在清除废物的同时向细胞输送营养物质。
此外,它还是一种有用的营养素,有助于抵消钠对血压的负面影响,对维持健康的血压很重要。
由于腹泻或呕吐;出汗过多;抗生素、泻药或利尿剂;过量饮酒;或肾脏疾病等慢性疾病,短期可能会出现低钾的情况。
缺乏的症状
包括肌肉无力、抽搐或痉挛;便秘;刺痛和麻木;以及心律异常或心悸。
天然钾的来源
香蕉、牛奶、南瓜、扁豆、芸豆和其他豆类。

4. 缺 铁
疲劳,呼吸急促,手脚冰冷,指甲脆等
铁是产生红细胞的必要物质,红细胞将氧气输送到全身。当铁含量过低时,可能会导致红细胞缺乏,从而导致贫血。
高风险的人群
包括经期妇女、成长中的人(如儿童和孕妇)和纯素食或半素食人群。
症状
包括虚弱和疲劳、呼吸短促、心跳加快、皮肤苍白、头痛、手脚冰冷、舌头肿痛、指甲脆裂以及对灰尘等奇怪事物的渴望。
刚开始的时候,这些症状可能很轻微,以至于你没有注意到有什么不对劲,但随着铁的储备越来越少,这些症状会变得更严重。
日需求量
50岁以上的成年男女每天需要8毫克
50岁以下的成年女性每天需要18毫克
富含铁的食物
牛肉、牡蛎、豆类(尤其是利马、海军和芸豆)、扁豆和菠菜等。

5. 缺维生素B12
麻木,疲劳,舌头肿胀等
维生素B12有助于红细胞和DNA的生成,还能改善神经递质功能。
半素食者和纯素食者可能特别容易缺乏维生素B12,因为植物不能产生维生素B12,而做过减肥手术的人也可能缺乏B12,因为手术后身体难以从食物中提取营养。
严重缺乏B12的症状
腿、手或脚麻木;行走和平衡方面的问题;贫血;疲劳;弱点;舌头肿胀发炎;记忆力差和思考困难,食欲不振。
这些症状可能会很快出现,也可能逐渐出现,而且由于症状的范围很广,有可能在一段时间内都没有注意到。
日需求量
成年人每天只需要:2.4微克(mcg)
怀孕或哺乳期需要更多:每天2.6至2.8 mcg
富含维生素B12食物
牛肉、猪肉、鸡肉、鱼类、内脏类、蛋类、蛤类、牛奶乳酪等。

6. 缺叶酸
疲劳,腹泻,舌苔光滑等
叶酸是一种B族维生素,对育龄女性尤其重要,叶酸支持健康的生长和功能,并能降低出生缺陷的风险,特别是那些涉及神经管(大脑和脊柱)的缺陷。
叶酸缺乏可能会使未出生婴儿的细胞总数和大红细胞数量减少,并导致神经管畸形。
叶酸缺乏的症状
包括疲劳、易怒、腹泻、生长缓慢和舌头光滑、触痛。
怀孕的女性应该确保她们每天摄入400微克的叶酸,此外还要食用含有叶酸的食物。
叶酸最好以补充剂的形式被人体吸收,其中85%是从补充剂中吸收的,50%是从食物中吸收的 。
从食物中获取叶酸
可以选择强化谷物,豆类,花生,葵花籽,全谷类,鸡蛋,深色绿叶蔬菜等。

7. 缺 镁
食欲不振,恶心,疲劳等
镁有助于骨骼健康,能量生成。
虽然缺乏镁在健康人群中并不常见,但某些药物(包括一些抗生素和利尿剂)或慢病(如2型糖尿病和克罗恩病)可能会限制镁的吸收,也可能加速镁在体内的流失。
日需求量
根据性别和年龄的不同,成年人需要310-420毫克镁。
镁缺乏症状
会导致食欲不振、恶心呕吐、疲劳,虚弱等。
在更严重的情况下,它也可能导致麻木和刺痛,肌肉痉挛或收缩,癫痫发作,心律失常,性格改变,或冠状动脉痉挛。
富含镁的食物
如杏仁、腰果、花生、菠菜、黑豆、毛豆等。

相关阅读:
参考文献:
Committee to Review Dietary Reference Intakes for Vitamin D and Calcium, Food and Nutrition Board, Institute of Medicine. Dietary Reference Intakes for Calcium and Vitamin D. Washington, DC: National Academy Press, 2010.
Burt LA, Billington EO, Rose MS, Raymond DA, Hanley DA, Boyd SK. Effect of High-Dose Vitamin D Supplementation on Volumetric Bone Density and Bone Strength: A Randomized Clinical Trial. JAMA. 2019;322(8):736–745.
Mason JB. Vitamins, trace minerals, and other micronutrients. In: Goldman L, Schafer AI, eds. Goldman-Cecil Medicine. 25th ed. Philadelphia, PA: Elsevier Saunders; 2016:chap 218.
Williams J, Mai CT, Mulinare J, et al. Updated estimates of neural tube defects prevented by mandatory folic acid fortification – United States, 1995–2011. MMWR Morb Mortal Wkly Rep. 2015;64(1):1–5.
Qin J, Pei X. Isolation of Human Gastric Epithelial Cells from Gastric Surgical Tissue and Gastric Biopsies for Primary Culture. Methods Mol Biol. 2018;1817:115-121.
Fieker A, Philpott J, Armand M. Enzyme replacement therapy for pancreatic insufficiency: present and future. Clin Exp Gastroenterol. 2011;4:55-73.
Koppel BS. Nutritional and alcohol-related neurologic disorders. In: Goldman L, Schafer AI, eds. Goldman-Cecil Medicine. 26th ed. Philadelphia, PA: Elsevier; 2020:chap 388.
Nutrient Recommendations: Dietary Reference Intakes (DRI) .National Institutes of Health.
Antony AC. Megaloblastic anemias. In: Hoffman R, Benz EJ, Silberstein LE, et al, eds. Hematology: Basic Principles and Practice. 7th ed. Philadelphia, PA: Elsevier; 2018:chap 39.
Veronese N, Stubbs B, Solmi M, et al. Dietary Magnesium Intake and Fracture Risk: Data From a Large Prospective Study. British Journal of Nutrition. June 2017.
Portincasa P, Di Ciaula A, Wang HH, Palasciano G, van Erpecum KJ, Moschetta A, Wang DQ. Coordinate regulation of gallbladder motor function in the gut-liver axis. Hepatology. 2008 Jun;47(6):2112-26.
Vegesna AK, Chuang KY, Besetty R, Phillips SJ, Braverman AS, Barbe MF, Ruggieri MR, Miller LS. Circular smooth muscle contributes to esophageal shortening during peristalsis. World J Gastroenterol. 2012 Aug 28;18(32):4317-22.