-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

饮食在塑造肠道微生物群的组成、功能和多样性方面起着关键作用,各种饮食对肠道内微生物群落的稳定性、功能性和多样性有着深远的影响。了解不同饮食对微生物群的深远影响至关重要,改善代谢和肠道健康,预防和减缓由饮食不当引起的特定饮食相关疾病的发生。
在生命早期,分娩方式、喂养、饮食和环境等因素会塑造肠道微生物群。在成年期,虽然微生物群趋于相对稳定,但外界因素,尤其是饮食,会大大影响其组成和功能。营养素、微生物群和免疫系统之间的这种复杂相互作用是维持体内平衡和防御外部病原体的重要调节机制。
精准营养承认每个人对饮食的代谢反应会有所不同,因此针对人群健康的广泛饮食指南在个人层面上并不理想。一些大规模研究已开始将微生物组概念纳入精准营养,发现纳入肠道微生物组组成的预测模型远远优于仅基于宿主、饮食和身体活动因素的预测模型。
比如从控制体重来说,我们常常关注卡路里的摄入与消耗,却可能忽略了肠道菌群层面的理解。不同人群可以选择不同的方式,高纤维饮食可以促进产生短链脂肪酸的肠道细菌的生长,这些短链脂肪酸不仅有助于维持肠道健康,还可能通过调节食欲和能量代谢等方式来帮助控制体重。
鉴于测序和机器学习等方面技术的最新进展,极大地提高了人们对饮食及其对微生物群影响的理解。在此基础上,本文讨论了常见整个饮食方式(如地中海饮食、高纤维饮食、植物性饮食、高蛋白饮食、生酮饮食、西方饮食、间歇性禁食、热量限制饮食等)影响肠道微生物群的机制,还包括生命早期和成年期肠道微生物群相关的饮食相关慢性疾病,临床实践中用于缓解或预防疾病进展的特定饮食等。
微生物组研究成果的迅速扩展使多种长期营养原则变得复杂,同时也为干预提供了新的机会。更深入地了解饮食、宿主和微生物之间的因果关系,可以为开发精准营养和基于微生物组的疗法提供新的视角。
饮食对肠道微生物群的组成和功能有相当大的有益或负面影响。
下图是常见饮食方式对肠道菌群的影响,这在后面我们会详细展开阐述。
全膳食的常量营养素组成及其对肠道菌群的影响

doi.org/10.1038/s41579-024-01068-4
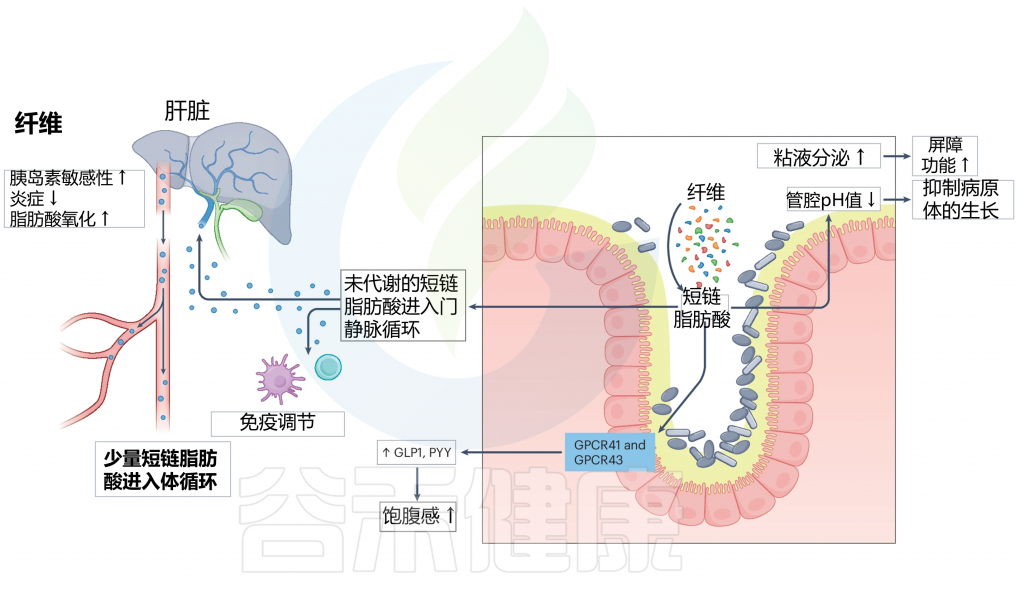
当膳食纤维到达肠道时,会经过肠道微生物群的发酵,产生如乙酸盐、丙酸盐和丁酸盐等短链脂肪酸(SCFA)。这些短链脂肪酸随后进入门脉循环,对宿主健康产生一系列积极影响。
激活GPCRs
短链脂肪酸激活G蛋白偶联受体GPCRs 41和43,这是它们发挥作用的初步机制。
触发肠道激素分泌
激活的受体进一步触发胰高血糖素样肽(GLP)和肽YY(PYY)等肠道激素的分泌。
注:GLP1和PYY在调节食欲、减缓胃排空和促进饱腹感方面起着关键作用。
增强肠道屏障功能
SCFAs通过增加粘液分泌和降低肠腔pH值来增强肠道屏障功能,保护肠道内壁,防止有害病原体进入血液。
抗炎与免疫调节作用
SCFAs具有抗炎和免疫调节作用,有助于维持整体肠道健康,并降低胃肠道疾病的风险。
肠道微生物群对纤维的分解及其对屏障功能和免疫力的影响
doi.org/10.1038/s41579-024-01068-4
在肠道中,膳食蛋白质经过肠道微生物群的代谢,这与拟杆菌属的增加有关。这导致产生各种代谢产物,包括短链脂肪酸、支链脂肪酸(BCFAs)和吲哚。
支链脂肪酸可以激活 GPCR41 和 GPCR43,从而触发 GLP1 和 PYY 等肠道激素的分泌。此外,BCFAs 可以增加粘液分泌并降低腔内 pH 值,从而增强肠道屏障功能并保护肠道内壁。
肠道微生物群对蛋白质的代谢以及SCFA和吲哚对人类健康的后续影响
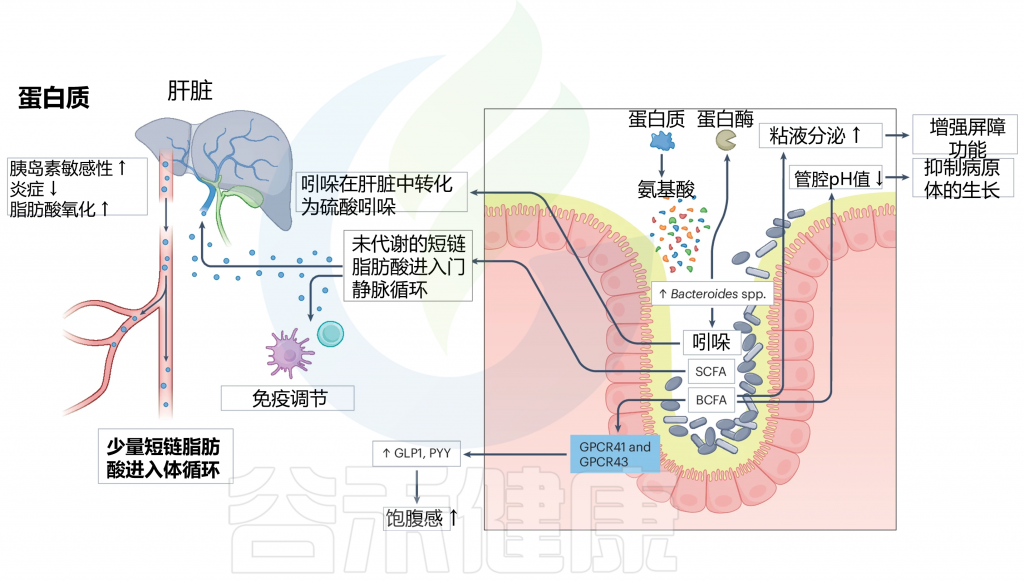
doi.org/10.1038/s41579-024-01068-4
SCFAs、BCFAs、GLP1 和 PYY 等肠道激素、粘液分泌和腔内 pH 对人体健康的影响,包括改善胃肠功能、调节食欲、减少炎症、改善胰岛素敏感性和脂肪酸氧化,从而促进整体肠道健康。
当膳食PUFAs到达肠道时,它们会被肠道微生物群代谢。这一过程增加了特定细菌的丰度,如双歧杆菌属和产丁酸菌。因此,产生了各种代谢产物,如短链脂肪酸,例如丁酸盐。
PUFAs可以减少促炎的肠杆菌属(Enterobacterium)的丰度,从而减少炎症并改善肠道屏障功能。这可能导致内毒素和IL-17的产生减少,进而减少炎症并改善对人类健康的影响。由PUFA代谢产生的未代谢SCFAs进入系统循环,在其中发挥免疫调节作用。它们可以通过改善胰岛素敏感性、减少炎症和改善肠道渗漏症内毒素血症来增强抵抗肥胖的能力。
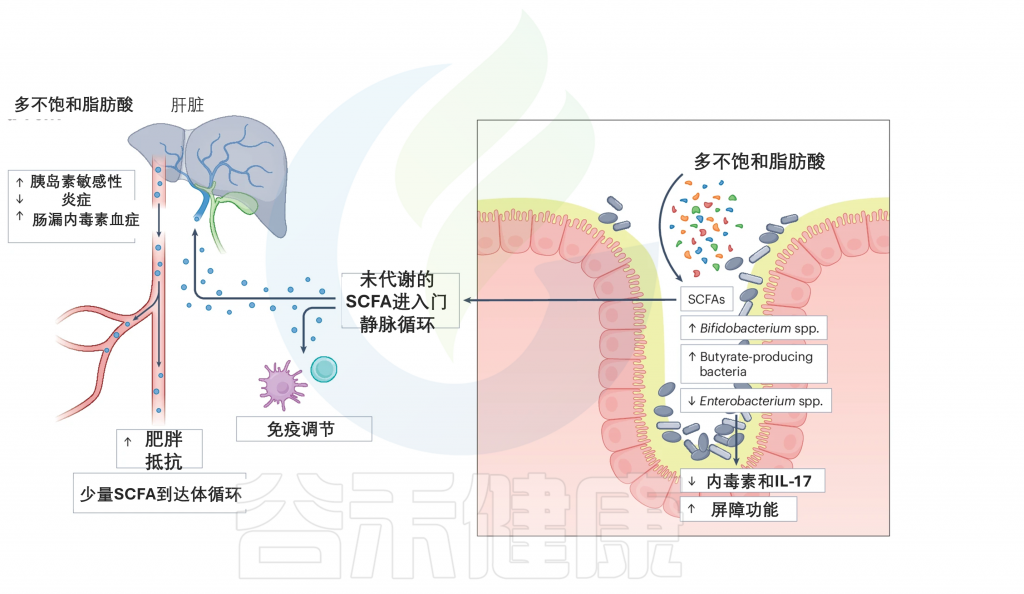
doi.org/10.1038/s41579-024-01068-4
多酚类物质被肠道细菌代谢,因此被分解成生物活性微生物代谢产物。多酚已被证明可以增加肠道腔中有益细菌的丰度,如双歧杆菌、Akkermansia、乳酸杆菌属。这些细菌在维持肠道屏障功能、调节免疫系统、促进肠道稳态和抑制病原菌生长方面起着至关重要的作用。
此外,多酚在肠道内表现出显著的抗炎和抗氧化作用。多酚代谢的副产物,缺乏酚类的代谢产物,在系统循环中被吸收,在那里它们发挥显著的免疫调节作用。例如,这些代谢产物已被证明可以通过减少炎症和氧化应激,以及改善内皮功能,从而改善肺部、大脑和心脏功能,增加周围血流。
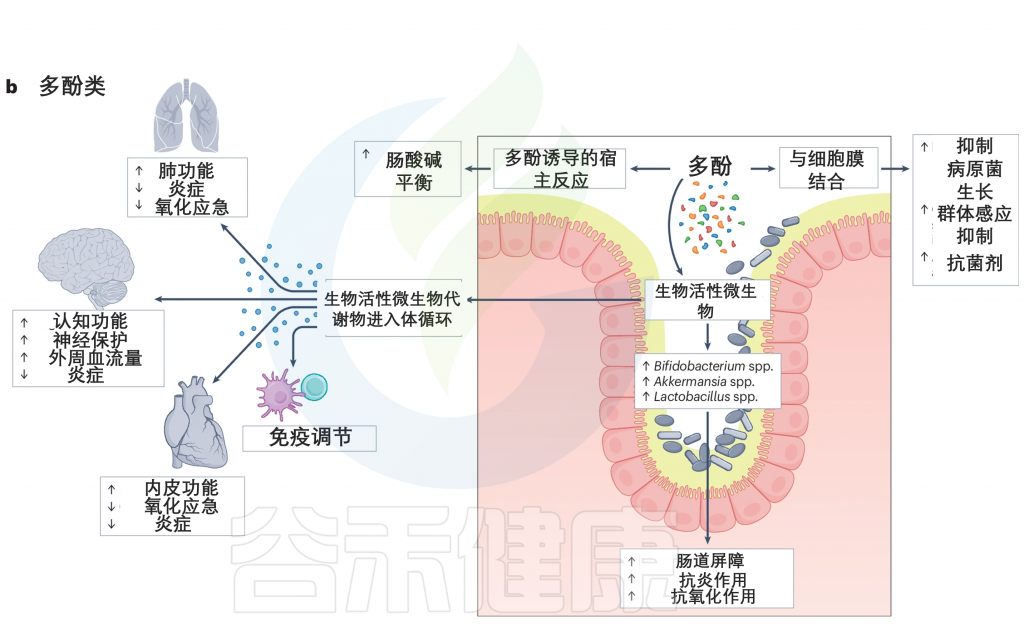
doi.org/10.1038/s41579-024-01068-4
肠道微生物组的差异性影响
不同肠道微生物群对宿主能量状态的贡献存在差异,与肥胖相关的肠道微生物组特征可能会加剧宿主的表型。
遗传性肥胖小鼠及其瘦弱的同窝小鼠在肠道微生物组成上存在差异,从ob/ob供体获得的肠道微生物群受体增加的体脂,比从遗传性瘦弱供体获得的微生物群受体多。
将适应高脂高糖(HFHS)饮食的小鼠肠道微生物群与适应低脂高植物多糖饮食的小鼠肠道微生物群进行移植,一致地增强了接受控制饲料的无菌受体小鼠的脂肪积累。
这些研究表明,无论是由遗传还是饮食驱动的肥胖表型,都可以通过肠道微生物群传播。
肠道微生物组与营养不良
患有夸希奥科病(kwashiorkor)的儿童的肠道微生物群表现出发育不良的特征,并通过在无菌小鼠中定植后与健康对照相比,损害了营养吸收,从而在因果上对营养不良有所贡献。
肠道微生物群的变化也已被证明有助于极低热量饮食(VLCDs)和Roux-en-Y胃旁路手术后的快速减重。
例如,对超重或肥胖的绝经后妇女进行每天800千卡的极低热量饮食,导致肠道微生物群的变化和改善的代谢表型,如体重减轻和减少的脂肪量,这些变化可以在接受了节食前后肠道微生物群的无菌小鼠受体中重现。
肠道微生物组的能量缓冲作用
与低消化性饮食相关的更高营养流入结肠可以以一种增强其对宿主能量状态贡献的方式改变肠道微生物群,表现为接受低消化性饮食条件的微生物群的无菌小鼠受体体重增加和脂肪量更多。
在这个宿主-微生物组生态共生的例子中,宿主的营养吸收较低被肠道微生物群衍生的代谢产物及其下游效应所部分缓冲,例如增加宿主的能量摄入。这样的能量缓冲在能量受限条件下可能有助于宿主的代谢健康,但在能量过剩条件下也可能妨碍体重管理。
肠道微生物组的环境和饮食依赖性
肠道微生物群对宿主能量平衡的贡献可能依赖于环境和饮食背景,即使不通过饮食操纵宿主能量平衡也是如此。
来自肥胖不一致的人类双胞胎的无菌小鼠受体通常模仿了它们供体的代谢表型,但是当差异性定植的受体动物共同饲养时,来自瘦弱供体的微生物群侵入了来自肥胖供体的微生物群,结果是两者都保持了瘦弱。
当共同饲养的受体动物被喂食高脂肪和低水果蔬菜的饮食时,与瘦弱相关的微生物群的传播性被破坏了。
这些复杂的相互作用强调了饮食对宿主-微生物组代谢相互作用的影响有时可能难以追踪。
肠道微生物通过其代谢产物影响健康
短链脂肪酸可以被各种宿主组织转化为ATP,其中:
SCFAs具有多样的信号功能,影响能量平衡。
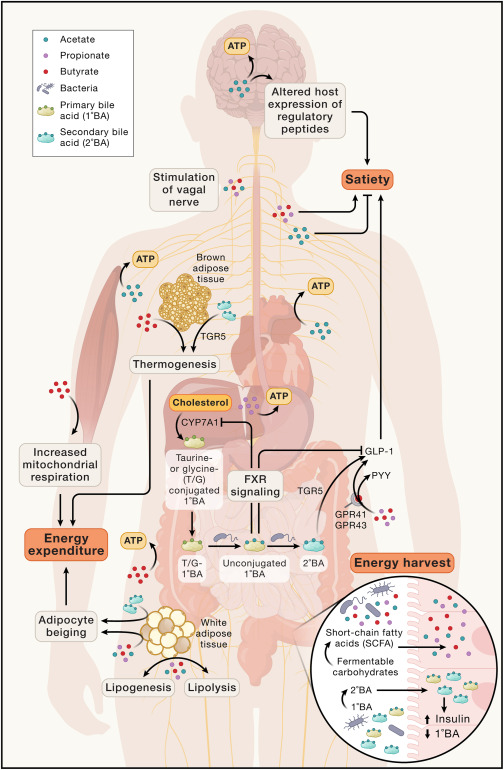
doi.org/10.1038/s41579-024-01068-4
SCFA通过各种方法影响能量摄入,包括乙酸盐穿过血脑屏障,介导调节性神经肽的表达,丙酸盐和丁酸盐结合肠内分泌L细胞中的GPR41和GPR43受体,刺激GLP-1和PYY的释放,以及通过迷走神经的肠脑信号传导,乙酸盐与SCFA混合物可能不同地介导这些信号传导。
SCFA通过促进棕色脂肪组织的产热、白色脂肪组织的米色和骨骼肌的线粒体呼吸来影响能量消耗。SCFA还可以影响脂肪生成和脂肪分解的动力学,据报道,丁酸盐促进脂肪分解,而乙酸盐和丙酸盐促进脂肪生成。
此外,肠道微生物组可以使宿主肝脏分泌的牛磺酸或甘氨酸结合的初级胆汁酸(T/G-1°BA)脱偶联和脱羟基,产生调节宿主能量代谢各个方面的非偶联初级胆汁酸和次级胆汁酸。未结合的初级胆汁酸通过法尼醇X受体(FXR)发出信号,抑制CYP7A1,CYP7A1是初级胆汁酸合成的限速步骤,对饮食脂肪吸收具有潜在的下游影响。次级胆汁酸激活TGR5,促进棕色脂肪组织的产热、白色脂肪组织的米色和胰腺β细胞的胰岛素产生。
肠道微生物胆汁酸代谢也可能通过对厌食素GLP-1的对比作用来影响能量摄入,2°BA激活的TGR5信号促进L细胞分泌GLP-1,1°BA活化的FXR信号在小鼠中显示出抑制GLP-1活性。这些多效性效应强调了对SCFA和胆汁酸的看法正在发生变化,从能量收获的载体转变为能够对宿主能量状态产生净积极和净消极影响的代谢调节因子.
地中海饮食(MD)强调摄入大量未加工的全植物性食品、橄榄油、乳制品、适量家禽和鱼类,以及少量红肉。
降低癌症死亡率及糖尿病风险
一项对美国25,315名女性的前瞻性研究显示,那些坚持地中海饮食模式的人在25年的随访期间全因死亡率降低了23%。这项研究还显示,较高的地中海饮食摄入量与20年随访期间未来2型糖尿病风险降低30%相关。地中海饮食模式可能还对癌症有保护作用。实际上,高度遵守这种饮食与普通人群中的癌症死亡率降低、癌症幸存者的全因死亡率降低,以及降低发展结直肠癌、头颈癌、呼吸、胃、肝和膀胱癌风险有关。
增加产丁酸菌
两项干预研究将地中海饮食与特定分类特征联系起来,增加Faecalibacterium prausnitzii、Roseburia丰度,减少Ruminococcus gnavus、Collinsella aerofaciens、Ruminococcus torques丰度。这些因饮食而导致的微生物组变化与短链脂肪酸产量的增加和代谢副产物(如乙醇、对甲酚和二氧化碳)产量的减少有关。
地中海饮食与特定功能途径有关
之前研究用宏基因组测序分析了307名男性长期饮食信息的微生物组数据。结果显示,地中海饮食与36条功能途径有关,这些途径大多类似于植物性饮食,具有丰富的微生物功能,用于SCFA发酵和膳食纤维降解。对地中海饮食的坚持显示出与特定功能途径的正相关,如用于果胶分解的d-果糖醛酸降解途径和用于半纤维素分解的甘露聚糖降解途径。地中海饮食的坚持和降低心血管疾病风险在P. copri水平较低的个体中更为明显。
地中海饮食plus版——更积极的变化相关
最近,DIRECT-PLUS研究包括294名肥胖或血脂异常的参与者,发现与地中海饮食相比,绿色地中海饮食与更显著的组成变化相关。绿色地中海饮食是地中海饮食的增强版,它增加了植物性食品的摄入量,减少了红肉的摄入,并且每天还摄入富含多酚的绿茶和Mankai水生植物。
这种饮食在微生物组成和多样性上产生了更大的变化,包括增加普雷沃特氏菌的丰度和支链氨基酸降解酶(异亮氨酸降解),减少双歧杆菌和支链氨基酸生物合成酶(缬氨酸和异亮氨酸生物合成)。这些变化与体重和心代谢指标的积极变化相关联。
膳食纤维对人类健康至关重要,它有助于降低长期体重增加,低纤维摄入量会增加患2型糖尿病和结肠癌的风险。
高纤维饮食会改变肠道微生物的组成,包括显著增加乳酸杆菌属和双歧杆菌属的丰度。
断奶后饮食变化,引起代谢复杂多糖的菌增加
不同的膳食纤维组分对肠道微生物的影响各不相同。例如,母乳喂养的婴儿表现出更高丰度的适应于利用人乳寡糖(HMOs——母乳中大量存在的不可消化的益生元糖类)的双歧杆菌。断奶后,肠道微生物组成会发生明显变化,这主要归因于饮食组成的改变。这导致能代谢更复杂多糖的拟杆菌门和厚壁菌门的扩张。
超重个体:改善菌群预防代谢疾病
在超重的个体中,阿拉伯木聚糖低聚糖的干预增加了普雷沃氏菌和直肠真杆菌(Eubacterium rectale)的丰度,伴随着代谢组学特征的有利变化,可能有助于预防代谢性疾病。
全谷物和小麦麸皮:双歧杆菌、乳杆菌↑↑
在31名志愿者中补充全谷物和小麦麸皮,导致双歧杆菌属和乳酸杆菌属的水平增加。全谷物消费者中的增加更为明显;两组都经历了总胆固醇的降低。
燕麦:厚壁菌门↑ 拟杆菌门↓ 心血管疾病风险↓
来自燕麦的高分子量β-葡聚糖减少了厚壁菌门,增加了拟杆菌门,并伴随着心血管疾病风险标志物的减少。
抗性淀粉:影响短链脂肪酸产生
以IV型抗性淀粉形式的膳食纤维对肠道微生物群的组成和功能以及丁酸盐或丙酸盐的产生了不同的影响。
简单碳水化合物在小肠中吸收,而复杂碳水化合物如膳食纤维则经历结肠微生物发酵,从而产生短链脂肪酸。人类只产生非常有限的用于碳水化合物降解的碳水化合物活性酶(CAZymes),因此依赖于肠道微生物群间接代谢几种膳食纤维。低纤维的饮食与肠道微生物群中减少的CAZyme储备相关。
短链脂肪酸的健康益处
包括前面文中提到过的,通过GPCRs传递信号,以及刺激肠道内分泌细胞分泌饱腹感激素(GLP-1和肽YY)。这影响了食欲调节,并调节了调节性T细胞的功能,以及脂质和葡萄糖代谢,在调节宿主能量代谢和结肠稳态中发挥关键作用。
丁酸盐作为结肠细胞的能量来源,通过肠细胞(巨噬细胞和树突状细胞)介导抗炎特性,并增强粘液产生,这突出了其在优化肠道吸收和肠道屏障功能中的作用。
短链脂肪酸与GPCRs及其他细胞的作用和互动不仅限于肠道,还扩展到外周组织、器官和免疫细胞。在小鼠模型中的报告表明,SCFAs和高纤维饮食可能在降低1型糖尿病、2型糖尿病、哮喘和压力的风险,减少脂肪酸合成和脂肪分解方面发挥作用,从而减轻体重并增强神经认知发展。SCFA的吸收导致肠腔pH值降低,这抑制了对pH敏感的病原体如梭菌纲和肠杆菌科的生长,并增加了营养素吸收。
全谷物中的不可溶纤维影响肠道传输速率和细菌发酵
两项随机对照交叉试验涉及50名超重或有代谢综合征风险的个体,表明全谷物饮食增加了粪便中的丁酸盐和己酸盐,改善了血脂水平,减少了炎症标志物,并与精制谷物饮食相比改善了体重减轻。产短链脂肪酸的菌与结肠传输时间显示出负相关关系。这进一步有助于调节肠道微生物组成和多样性,从而缓解各种肠道疾病,如肠易激综合症、炎症性肠病、结直肠癌和胃癌以及便秘。
微生物群与人类健康之间的相互作用强调了采取整体方法和更大规模的人类研究的必要性,以便深入认识饮食碳水化合物、肠道微生物群组成和疾病易感性之间复杂的关系。
植物性饮食富含多酚类、宿主可消化和不可消化的碳水化合物,并发挥益生元和后生元的双重效应。素食饮食导致形成独特的细菌环境,这一点从细菌功能能力的转变中得到证实。
素食者:拟杆菌↑ 普雷沃氏菌属↑
例如,素食者表现出低肉碱降解但增加氮同化。与杂食者饮食相比,这些饮食促进了拟杆菌门和普雷沃氏菌属的丰度,尽管由于微生物个体差异和研究方法的不一致性,研究结果有时会出现矛盾。
某些属或种的对比水平可以归因于饮食快速与逐渐转变对微生物造成的压力、健康与不健康饮食成分的存在,以及各种生物活性化合物的来源。例如:
植物性饮食的这些特性使其在预防和管理慢性疾病,如心血管疾病、2型糖尿病和某些癌症方面显示出潜力。然而,需要更多的研究来充分理解植物性饮食对肠道微生物组的具体影响,以及这些变化如何影响宿主的健康和疾病风险。
多酚类物质的吸收:少量在小肠,大量在结肠
多酚类物质,分为类黄酮和非类黄酮,是植物的次级代谢产物,存在于水果、蔬菜、谷物、葡萄酒、茶、咖啡等食物中。
少量的多酚类物质(5%~10%)在小肠中被吸收,主要是那些具有单体和二体结构的多酚。吸收后,苷元在肠细胞内经历生物转化,然后在肝细胞内继续转化。这些代谢产物通过循环系统运输到肾脏和肝脏等器官,并最终随尿液排出。
大部分多酚类物质(90%-95%)在回肠和结肠中与肠道微生物发生作用,它们促进双歧杆菌、Akkermansia、乳杆菌等物种的丰度,从而提供显著的抗炎和抗病原体特性,以及心血管保护作用。
最近一项涉及超过2万名成年人的随机对照试验表明,食用富含多酚的可可提取物减少了心血管疾病导致的死亡。然而,心血管疾病的发生并没有减少。
多酚类物质的抗菌和抗病原体特性
多酚类物质可以通过几种机制抑制细菌生长,包括结合并改变细胞膜的功能特性。它们还展现出对食源性病原体的抗菌活性,并以剂量依赖性方式作为群体感应抑制剂和抗菌剂。
肠道微生物群代谢多酚
肠道微生物群双向调节并代谢多酚类物质,将它们转化为更具生物活性的微生物代谢产物,并提高其相对于原始化合物的吸收。
代谢产物的健康益处
研究表明,食用生物活性微生物代谢产物对人类健康有益处。例如:
多酚类物质对肠道微生物群的调节
多酚类物质可以通过改变肠道微生物群的组成和影响各种微生物酶的功能,调节肠道微生物代谢产物,包括短链脂肪酸、TMAO、多巴胺、脂多糖、胆汁酸。
这最终可以通过多种方式引起多酚类物质诱导的宿主反应,例如,作为调节肠道酸碱平衡的调节器。多酚类物质对肠道微生物群的调节已被证明支持肺功能、中枢神经系统功能和肠道屏障完整性的稳态。
植物和动物源食物类型不同,对菌群影响有差异
植物和动物源性食物中蛋白质和脂肪类型的不同导致了肠道微生物组成和代谢组的差异。例如,基于动物的饮食导致耐胆汁细菌种类的丰度增加,如Alistipes、Bilophila,同时减少了厚壁菌门的丰度,降低了支链氨基酸(BCAAs)的水平,并增加了SCFAs和二甲基硫化物。
其他植物化合物,如纤维、萜类和类胡萝卜素,也已显示出健康益处。个体在从饮食多酚中产生酚类衍生代谢产物的量上的差异归因于每个人肠道微生物组的独特组成。
因此,分析多酚代谢产物可以作为一种有价值的方法,以更深入了解生物活性化合物效应,并为理解个体间的显著多样性提供全面的认识。
每日蛋白质摄入量超过1.5克/千克体重的饮食通常被认为是高蛋白饮食。这种饮食通常用于运动员或为超重人群减肥时所推荐。
蛋白质的消化和吸收
饮食中的蛋白质主要由宿主的蛋白酶分解,但每天有12-18克的蛋白质可到达大肠并被微生物群代谢。
不同类型的复杂蛋白质具有不同程度的可消化性,以及不同的氨基酸组成。
参与蛋白质分解的菌群
一些细菌物种参与蛋白质分解,并在高蛋白饮食者的肠道微生物群中富集,主要是拟杆菌属、芽孢杆菌属(Bacillus)、梭菌属(Clostridium)、Phocaeicola、丙酸杆菌属(Propionibacterium)、梭杆菌属(Fusobacterium)、乳杆菌属、链球菌属。
其他细菌可以直接利用氨基酸,并从蛋白质分解中受益,形成交叉喂养的相互作用。
蛋白质分解细菌使用多种酶
蛋白质分解细菌使用多种外肽酶、蛋白酶(包括金属、丝氨酸、半胱氨酸、天冬氨酸、苏氨酸、谷氨酸和天冬酰胺蛋白酶)和内肽酶来释放短肽和游离氨基酸。
氨基酸代谢产生短链脂肪酸
大多数氨基酸被发酵成短链脂肪酸:
部分发酵产物可能带来的健康危害
其他发酵产物包括可能的炎症化合物,如来自芳香族氨基酸(例如色氨酸)的吲哚和酚类化合物,以及氨、胺、有机酸和气体(即由含硫氨基酸半胱氨酸和甲硫氨酸产生的硫化氢,以及二氧化碳)。
值得注意的是,这些最终产物中的一些可能与疾病有关。吲哚和吲哚相关化合物可以到达肝脏并转化为硫酸吲哚酚,这是一种对肾脏有害的有毒代谢产物,并参与内皮功能障碍。此外,硫化氢可能具有致突变性,并可能在炎症中发挥作用,增加结肠癌的风险。
生酮饮食是一种极低碳水化合物、适量蛋白质和高脂肪的饮食模式,模拟了禁食期间的代谢反应,这种状态下循环酮体水平升高。
注:酮体是脂肪酸衍生的分子,当葡萄糖可用性受限时作为替代能量来源。这些酮体(KBs)包括β-羟基丁酸(βHB)、乙酰乙酸和丙酮,主要在肝脏中产生。
生酮饮食长期以来一直作为治疗癫痫的饮食疗法,并且越来越多的研究表明这种饮食在治疗阿尔茨海默症、肥胖症、癌症等各种疾病方面的益处。
注:传统的长链甘油三酯生酮饮食遵循脂肪(克)与蛋白质和碳水化合物总和的4:1比例。变体包括中链甘油三酯生酮饮食、改良阿特金斯饮食和低血糖指数治疗,每种方法都有稍微不同的宏观营养素比例。
在人类中,诱导生酮状态需要严格限制碳水化合物摄入(5%–10%千卡/天),适量蛋白质摄入(30%–35%),和高脂肪摄入(55%–60%)。
生酮饮食的潜在风险和副作用
生酮饮食(利于拟杆菌门) ≠ 高脂饮食(利于厚壁菌门)
典型的高脂饮食通常会增加厚壁菌门的丰度并减少拟杆菌门;然而,生酮饮食的效果不同。
——超重成年人
在涉及17名超重成年人的研究中,为期4周的生酮饮食显示在人肠道中放线菌门(Actinobacteria)和厚壁菌门的大量减少。具体来说,有益的双歧杆菌的19种物种减少了,而拟杆菌门丰度增加。这些变化部分是通过宿主产生酮体诱导的。
——癫痫儿童
在涉及12名严重癫痫儿童的为期3个月的研究中,遵循生酮饮食的儿童显示健康促进和消耗纤维的双歧杆菌属、直肠真杆菌(E. rectale)和Dialister属的丰度大幅减少。相反,儿童显示拟杆菌属和大肠杆菌属的丰度增加,后者部分归因于大肠杆菌(Escherichia coli)的增加。
生酮饮食对肠道微生物组的影响
临床前研究也表明,肠道微生物组的组成在响应生酮饮食时发生了显著变化,最明显的是:
酮体βHB↑ 双歧杆菌↓
一项分析生酮饮食对肠道微生物组组成的变化的潜在机制的研究报告了在人类和鼠类受试者中,双歧杆菌属和酮体β-羟基丁酸(βHB)之间的显著负相关,也就是说,随着βHB水平的增加,双歧杆菌属的水平会降低。
来自人类、啮齿动物和细胞培养的数据支持β-羟基丁酸抑制NLRP3炎症体的能力。高水平的酮体可以降低血压并增加血管功能。循环酮体水平的增加还可以减少心脏炎症和心力衰竭的可能性。酮体也可能通过刺激胰岛素受体,通过诱导AMP激活蛋白激酶(AMPK)和下调mTOR来改善胰岛素敏感性。高水平的酮体可能减少食欲,从而使体重减轻。
生酮饮食→双歧杆菌↓→减少诱导Th17→促炎降低
将生酮饮食者的粪便微生物群移植到无菌小鼠中,研究揭示了肠道TH17细胞的变化。
注:Th17细胞是一种辅助性T细胞亚群,其主要特征是能够产生多种促炎细胞因子,如IL-17、IL-21和IL-22等。
双歧杆菌属对肠道TH17细胞的有强烈诱导作用,而生酮饮食改变肠道菌群(双歧杆菌降低)也减少了诱导Th17的能力,可能导致这些细胞的促炎性降低,从而影响肠道和脂肪组织的炎症状态,
然而,由于有益的肠道微生物群的减少和促炎性及病原性肠道细菌的促进,需要进一步的研究来了解生酮饮食对宿主健康的长期影响。
西方饮食的特点是高热量含量,富含动物蛋白、饱和脂肪、简单糖和超加工食品,同时纤维、水果和蔬菜的摄入量不足。
西方饮食:多样性下降,拟杆菌为主
与其他饮食相比,西方饮食与肠道微生物组多样性的显著降低有关,其肠道特征转向以拟杆菌属为主的肠道特征。其他丰富的物种属于Ruminococcus、Faecalibacterium、双歧杆菌属、Alistipes、Blautia、Bilophila。
由于纤维摄入较少和不同的微生物组成,相关的微生物群产生的短链脂肪酸较少。
红肉中胆碱→TMAO→多种慢病相关
红肉中的特定化合物,如胆碱和肉碱,也可以被肠道微生物群转化为三甲胺,然后在肝脏中转化为与慢性疾病相关的三甲胺-N-氧化物(TMAO)。
加工食品和添加剂的影响
加工食品包含各种添加剂、防腐剂和乳化剂,能够直接或间接与肠道微生物群相互作用。
非营养性人造甜味剂,如低热量或饮食食品和饮料中的糖精、三氯蔗糖和阿斯巴甜,对微生物组多样性和组成的潜在长期影响尚不清楚。
其他添加剂,如卡拉胶(一种从红海藻中提取的增稠剂或凝胶剂,存在于许多加工食品中,如乳制品),已知会促进肠道炎症和破坏粘液层,导致肠道微生物组的变化。
人工食品色素,如糖果和烘焙产品中的Allura Red AC,赋予颜色并通过与肠道细菌的相互作用改变硫的稳态。
一些防腐剂,如加工肉类中的硝酸钠,也可以调节肠道微生物组的组成,而乳化剂,如羧甲基纤维素(一种存在于酱汁中的增稠剂)和聚山梨醇酯-80(一种存在于酱汁和烘焙食品中的乳化剂和稳定剂),直接冲击肠道微生物组的组成和功能。
详见我们之前的文章:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
糖,功能糖,代糖,如何从健康角度看这些肠道菌群的“甜蜜伙伴”
总体而言,西方饮食与慢性炎症的激增有关,导致与饮食相关的疾病,包括肥胖和其他非传染性疾病。
过去50年中,一种受到极大关注的饮食疗法是日常热量限制(CR),它被定义为在保持充足营养的同时,将饮食摄入量减少至低于维持体重所需的能量水平。观察性、临床前和临床试验的发现表明,CR可能将寿命延长1-5年,同时改善生活质量。
最严格的CR随机试验来自国家老龄化研究所资助的CALERIE(减少能量摄入长期效应综合评估)联盟。CALERIE研究包括CALERIE第一阶段(三项为期6至12个月的CR小规模试点研究)和CALERIE第二阶段(一项大型、多中心、为期2年的CR随机试验)。
注:这些研究招募了体重正常且健康状况良好的成年人。每项试验中实施的CR程度不同,但通常涉及日常能量摄入量减少10%至30%,同时确保其他关键营养素的充足摄入。
CR的健康益处
CALERIE研究的发现显示,短期和长期CR都可以减少体重、皮下脂肪、内脏脂肪和肝内脂肪含量。
CR减少了微生物表达的酶
这些酶能够使脂多糖A生物合成,从而限制了脂多糖(LPS)的产生,并以药理学上已知能刺激脂肪细胞褐化和减少内脏脂肪的方式抑制了LPS-TLR4途径。
将经过CR调节的与对照肠道微生物群移植到未经处理的无菌小鼠中,导致体重和体脂肪的增加减少,胰岛素敏感性提高,UCP1+(即褐/产热)脂肪细胞增加,这表明CR诱导的肠道微生物组变化在这些效应中起到了因果作用。
Dorea弱预测了CR诱导的体重减轻
人类的CR研究报道了肠道微生物组组成和功能的多种变化,但据所知,还没有研究表明这些变化是代谢益处的基础。
最近一项随机对照试验比较了147名超重或肥胖成年人中12周间歇性与持续性CR的效果,发现体重减轻与细菌相对丰度、群落α多样性或循环微生物代谢产物(例如短链脂肪酸)的变化之间没有关联。尽管如此,基线微生物组组成——特别是Dorea的相对丰度——弱预测了CR诱导的体重减轻。
超重人群日常热量限制后相关菌群变化
同样,一项涉及80名超重或肥胖成年人进行14周CR的前瞻性研究发现,体重减轻5%或以上与Collinsella和Christensenellaceae的丰度正相关,与大肠杆菌/志贺菌属、克雷伯菌属、巨球形菌属(Megasphaera)、Sellimonas、乳杆菌属的丰度负相关。
微生物组特征与特定代谢健康标志物之间的关联
如Akkermansia和Christensenellaceae与基于HOMA-IR的胰岛素敏感性之间的关系。需要额外的功能研究来测试这些微生物组特征与代谢反应之间的联系是因果关系还是其他生理状态的共线性结果。
解决开始和维持饮食模式重大转变挑战的一个潜在解决方案来自于一组数据,即间歇性禁食可以导致显著的体重减轻。
最常见的间歇性禁食形式是时间限制性进食(TRE),它涉及将进食窗口限制在4-10小时内,并在一天剩余的14-20小时内禁食。
TRE的做法
在进食窗口期间,个人不需要计算卡路里或以任何方式监测食物摄入,这种简单性可能解释了近期TRE受欢迎度的上升。在禁食窗口期间,个人被鼓励大量饮水,也可以消费无能量饮料,如不加添加剂的茶和咖啡。当肥胖成年人将进食窗口限制在每天4-10小时时,他们通常会将能量摄入减少200-550千卡/天,这种能量限制程度与日常CR(热量限制)相当。
TRE的减重效果
随机对照试验显示,TRE在降低体重和改善一些心血管健康标志物方面是有效的。体重通常在2-12个月的TRE后减少3%-5%,减少主要来自脂肪质量和内脏脂肪质量的减少,而不是瘦体重。
然而,并非所有关于人类TRE的研究都报告了体重减轻。有研究表明,3个月的8小时TRE(下午12点至晚上8点的进食窗口)对肥胖成年人的体重与无干预对照组相比没有影响。
注:然而,这项研究是在自由生活的参与者中进行的,他们在试验期间与研究团队的接触很少。
当进食窗口较早时,降血压效果才较为明显
即使实现了减重,也不是所有受试者都表现出代谢改善。血压通常在2-12个月的TRE后降低5-10毫米汞柱,但这些效果通常只有在进食窗口设在一天中较早的时候(即下午2点前)才会被注意到。早期进食窗口可能通过促进钠尿(通过肾脏在尿液中排泄钠)来降低血压,因为当盐分摄入转移到一天中较早的时候,由昼夜节律系统调节的钠排泄会增加。TRE似乎并不影响低密度脂蛋白胆固醇、高密度脂蛋白胆固醇或甘油三酯水平。循环炎症标志物,如C反应蛋白(CRP)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α),也不受TRE影响,尽管数据有限。
TRE改善血糖效果明显(早点吃,进食时间短)
临床试验发现,TRE在改善前驱糖尿病和肥胖个体的空腹胰岛素和胰岛素敏感性方面表现出相当一致的效果。TRE还改善了葡萄糖耐受性并减少了血清葡萄糖波动。这些改善更常见于早期进食窗口(即在下午3点前吃完所有食物)和较短的进食窗口(4-6小时)。
在2型糖尿病成人中,TRE改善了糖化血红蛋白水平,与每日CR相当,并且没有增加低血糖的风险。
TRE如何改善糖调节?
来自人类试验的数据显示,身体在TRE期间经历了代谢转换。
肠道微生物群发挥作用
在小鼠中,时间限制性喂养(TRF)通过恢复肠道细菌相对丰度的昼夜变化,减轻高脂高糖(HFHS)饮食的影响。
这些变化在远端小肠(回肠)最为明显,并与促胰高血糖素基因Gcg的表达增加和GLP-1的血浆水平升高相对应。
经抗生素处理和无菌小鼠的研究支持肠道微生物群在昼夜GLP-1释放中发挥因果作用,但具体的微生物效应因子仍不清楚。
一个概念验证来自于肠道共生菌Akkermansia muciniphila的研究,它分泌一种84kDa的蛋白质(P9),足以通过与细胞间粘附分子2(ICAM-2)相互作用诱导GLP-1的分泌。
需要更多的工作来理解参与TRE的糖调节和其他有益效应的微生物群的全范围,以及它们的临床相关性。
TREplus版:肠道菌群变化更显著
值得注意的是,最近的一项临床研究比较了CR与能量匹配的TRE加蛋白质plus(定义为每天四次均匀间隔的餐食;TRE-P)方案在超重或肥胖成年人中的效果,发现TRE-P与肠道微生物组组成的更显著变化相关,包括之前与减重和蛋白质消费有关的类群的丰富,如Christensenellaceae。此外,在TRE-P干预期间,体重减轻高与低的参与者之间观察到肠道微生物组组成和功能能力的差异,但这些微生物组变化是否对TRE-P诱导的代谢改善有因果贡献仍不清楚。
母乳是大量生物活性化合物的来源,包括人乳寡糖(HMOs)、免疫球蛋白G(IgGs)、免疫细胞和微小RNA(miRNA),其中一些可以影响婴儿的肠道微生物群。与配方奶相比,母乳喂养会导致粪便钙保护素和β-防御素2等炎症标志物水平更高,这反映了随着促炎血清细胞因子减少,免疫成熟的过程。
双歧杆菌和拟杆菌利用HMOs,因此占主导地位
HMOs被双歧杆菌属(包括Bifidobacterium breve、Bifidobacterium bifidum、B. longum、B. infantis、Bifidobacterium pseudocatenulatum)以及拟杆菌属物种利用,导致这些物种在母乳喂养的婴儿肠道中占主导地位。
这可能会改变宿主中微生物与代谢产物之间的关系,如降低的肌苷水平与长双歧杆菌丰度增加之间的相关性所证明的,这表明其可能在婴儿的免疫和神经发育中发挥作用。
HMOs作为益生元发挥作用
乳铁蛋白和溶菌酶具有抗菌特性,能够调节对感染的保护。
肠道中由HMO利用形成的SCFAs被宿主用作能量来源。
非母乳喂养的肠道菌群
非纯母乳喂养的配方奶喂养婴儿拥有更高丰度的链球菌属、肠球菌属、韦荣球菌、梭菌属,并表现出在更多碳水化合物代谢途径上的功能能力差异,这证明了饮食对肠道微生物组的重要性。
较短的母乳喂养时间,菌群多样化
较短的母乳喂养持续时间与早期生活中高度多样化且类似成人的微生物组成相关联。
母乳中的HMOs调节婴儿肠道微生物群,并提供若干健康益处,如长期保护免受过敏、特应性皮炎和肥胖的影响,以及增强肠道屏障功能。同样,引入辅食会导致肠道微生物群的变化,这些变化促进了碳水化合物的利用、维生素的合成和外源性物质的降解,结果是厚壁菌门和拟杆菌门中的微生物水平增加。
最近的研究报道,涉及脂肪和糖摄入的孕妇饮食干预改变了婴儿肠道微生物组的功能,而另一项研究则报告没有关联。
小鼠实验:母亲孕期低纤维饮食,幼鼠呼吸感染的严重程度增强
最近的研究显示,在怀孕期间接受低纤维饮食的小鼠在后代中经历了延迟的浆细胞样树突状细胞和调节性T细胞扩增的扰动,导致呼吸感染的严重程度增强。同样,在无纤维饮食的小鼠中,幼崽中的比例较低的Akkermansia muciniphila、固有淋巴细胞和TH17细胞,而缺乏AKK菌属且被喂食纤维的小鼠显示出减少的固有和适应性RORγt‐阳性免疫细胞亚群。
小鼠实验:富含发酵食品,减少新生儿结肠炎症
另一项在母猪和小鼠上进行的研究表明,富含发酵食品的母亲饮食影响了新生儿肠道微生物群的发展,并通过p38丝裂原激活蛋白激酶和c-Jun氨基末端激酶激活的caspase 3的磷酸化减少了结肠炎症。母亲饮食对婴儿长期健康影响的程度需要进一步研究。
肠道微生物群在调节宿主代谢方面发挥着关键作用,微生物组成的某些变化和多样性的减少与多种代谢性疾病发病率的上升有关。
肥胖与肠道菌群有关
利用无菌啮齿动物模型,研究人员已经建立了肠道微生物群与肥胖之间的联系。将肥胖小鼠的肠道微生物群定植到无菌小鼠体内,导致体重和胰岛素抵抗显著增加,而当无菌小鼠被喂食西式饮食时,肥胖的发展则不存在,这突显了肠道微生物群在肥胖中的作用。然而,其他几项同意微生物群在能量稳态中的作用的研究未能显示其在肥胖发展中的决定性作用,并指出需要更多的研究来探索这种复杂的关系。
2型糖尿病和肥胖的个体的肠道菌群特征
患有2型糖尿病和肥胖的个体通常表现出产丁酸菌减少,乙酸盐及促炎物种增加,这些与胰岛素抵抗性升高有关。在肥胖小鼠上进行的研究支持肠道微生物群在2型糖尿病中的作用。双歧杆菌属、拟杆菌属、Faecalibacterium、Akkermansia与2型糖尿病负相关,其中双歧杆菌增加了胰高血糖素样肽-2(GLP-2)的水平,从而改善肠道通透性并减少代谢性内毒素血症。
注:二甲双胍,一种常见的2型糖尿病药物,与肠道微生物群相互作用,可能通过调节葡萄糖稳态和短链脂肪酸的产生来介导其抗糖尿病效应。
饮食、肠道微生物组、代谢性疾病
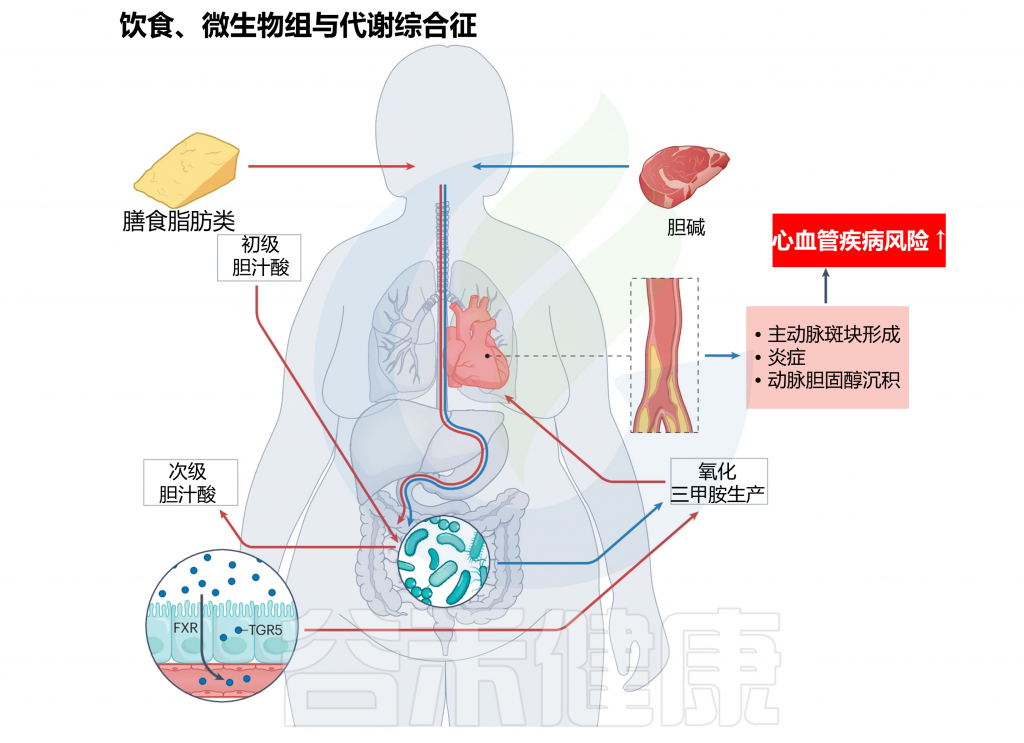
doi.org/10.1038/s41579-024-01068-4
注:红色箭头表示饮食脂肪可以通过何种作用机制对宿主健康产生下游影响,最终导致CVD风险。此外,蓝色箭头显示了主要存在于动物产品中的胆碱如何引起CVD风险。
心血管代谢疾病的个体的肠道菌群变化
特征是增加的肠杆菌科(Enterobacteriaceae)物种和减少的拟杆菌属以及抗炎的F. prausnitzii。肠道微生物群的这些变化与更具炎症性和较少发酵性的肠道环境有关。
TMAO
三甲胺-N-氧化物(TMAO),一种由肠道细菌从饮食化合物产生的代谢产物,与动脉硬化、血小板聚集和血栓形成有关。
在小鼠和人类的研究表明,饮食因素影响TMAO水平,某些情况下抗生素降低了TMAO,而杂食饮食增加了它。TMAO水平升高与心力衰竭患者的高死亡率相关。然而,结果并不一致,一些研究表明某些饮食成分如左旋肉碱和富含TMAO的食物可能有助于预防动脉粥样硬化,这引发了关于饮食、微生物组和宿主遗传学在动脉粥样硬化发展中复杂相互作用的问题。
增加的饮食脂肪可以影响FXR和TGR5等胆汁酸受体的激活,它们在脂质和葡萄糖代谢中发挥重要作用。这些途径的调节失常可能导致心血管疾病的发展。
由于微生物组改变导致的能量稳态的微小变化可能具有长期效应,在代谢性疾病中发挥作用,既是因果因素也是促成因素。此外,它们可以作为使用微生物组靶向治疗改善这些状况的目标。
饮食在肠道疾病的病理生理学中起着关键作用,特别是炎症性肠病、肠易激综合症和结肠癌。
肠易激综合征
过敏、食物不耐受、微生物群组成的转变、轻度粘膜炎症和肠道通透性的增加可能促成了肠易激综合症的表现。
研究发现,类似于病原性肠易激综合症的人类微生物组表现出拟杆菌门的丰度减少,以及厚壁菌门和与氨基酸及碳水化合物代谢相关的基因丰度增加。
饮食成分与炎症性肠病风险
饮食也可以改变炎症性肠病(包括克罗恩病和溃疡性结肠炎)的肠道微生物群落组成,影响短链脂肪酸和纤维等物质的代谢,这反过来又可能促成疾病的发生。
动物蛋白、乳制品、碳水化合物和多不饱和脂肪酸等食物成分与发生炎症性肠病的风险有关。
动物蛋白与炎症性肠病的机制
一个将炎症性肠病与动物蛋白联系起来的机制涉及小肠中的氨基酸和血红素吸收不良,导致产生酚类和氢气等有害副产物。这通过抑制丁酸盐的产生和减少肠道屏障中的二硫键,促成了炎症性肠病的发病机制。
高脂肪饮食也与炎症性肠病强烈相关
在实验模型中,高脂肪饮食可以破坏肠细胞间的结合蛋白功能,从而改变粘液层的组成和肠道微生物群。
持续且控制不当的炎症性肠病,以及由于不良饮食模式(如西方饮食)导致的慢性胃肠道炎症,是影响结肠炎相关结直肠癌风险的主要外部因素。这些因素影响免疫反应、肠道组织平衡和肠道微生物组。
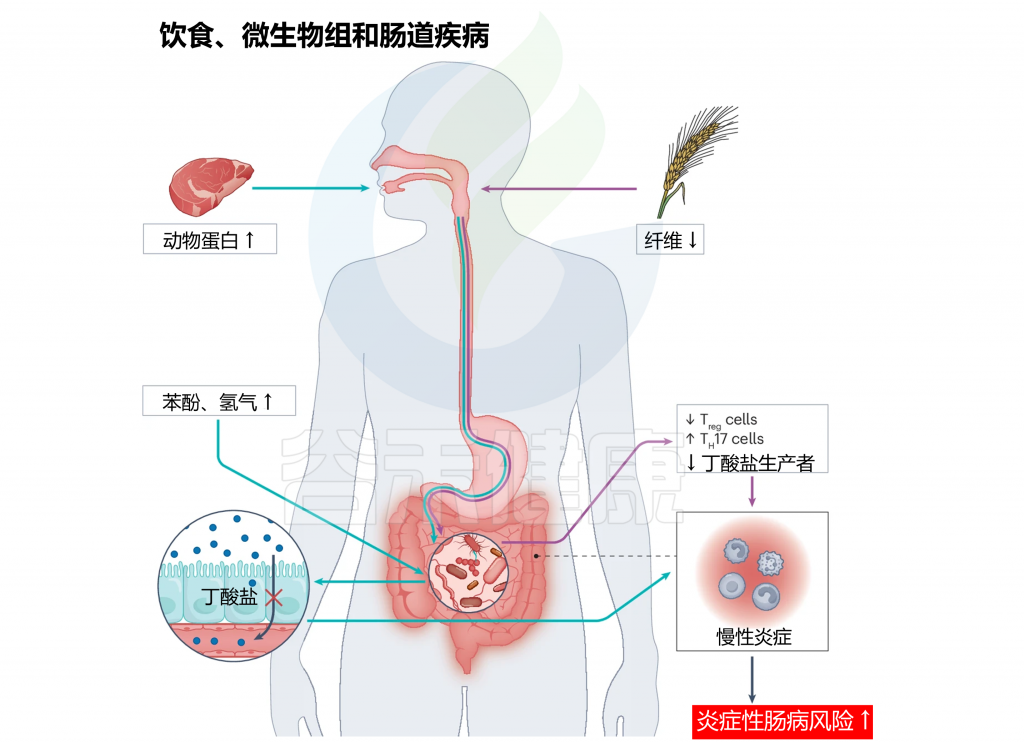
doi.org/10.1038/s41579-024-01068-4
注:增加的动物蛋白(绿色箭头)和低纤维(紫色箭头)饮食可能对生理功能和宿主健康产生下游影响。
增加红肉消费可导致胆碱水平升高,由于血红素吸收不良,在小肠中产生更多的氢气和苯酚。这反过来可以减少胃肠道中的丁酸盐生产,导致炎症增加。同样,饮食中纤维摄入减少可能通过增加TH17的产生,同时减少Treg和短链脂肪酸产生,对肠道健康产生负面影响。这种不平衡最终导致胃肠道内慢性炎症加剧。肠道内长期的慢性炎症可能大幅增加发展成炎症性肠病的风险。
饮食在散发性结直肠癌中的作用
研究发现,低纤维、高脂肪饮食与Fusobacterium nucleatum有关。拟杆菌属通过激活E-钙粘蛋白-β-链球蛋白信号、表观遗传变化和改变肿瘤微环境等机制与结直肠癌有关,从而促进恶性转变。同样,诸如产毒脆弱拟杆菌(Bacteroides fragilis)等致癌细菌被假设通过直接与结肠上皮细胞相互作用和改变局部微生物群组成来触发结直肠癌的发病。
人类肠道是真菌和病毒群的栖息地,分别称为肠道真菌组和病毒组。尽管这些群落只占肠道中总微生物的0.1%-1%,但它们都受到饮食的影响。
婴儿肠道真菌组中,酿酒酵母(Saccharomyces cerevisiae)是优势物种,断奶后被其他酵母属(丝孢酵母属Cystofilobasidium、曲霉属Ascomycota、单孢子酵母属Monographella)取代。
城市居民的肠道真菌组成包括酿酒酵母和较少的产短链脂肪酸菌,农村居民则有更多样化的真菌物种。
念珠菌属(Candida species)与富含碳水化合物的饮食相关,与富含蛋白质的饮食负相关。
母乳喂养和配方奶喂养婴儿的肠道病毒组组成差异由肠道微生物群变化和母乳垂直传递病毒引起。
高脂饮食与Siphoviridae病毒丰度减少和Microviridae噬菌体丰度增加有关。
无麸质饮食则与相反的变化有关,Siphoviridae在Microviridae之上,占主导地位。
肥胖和1型及2型糖尿病患者的病毒组成也发生变化,高脂饮食喂养小鼠的粪便病毒移植降低肥胖风险。
肠道耐药组,赋予微生物抗微生物药物耐药性的所有基因或遗传物质的集合,随着细菌微生物组和病毒组的变化而变化。
一些研究报告γ-变形菌纲(Gammaproteobacteria)属拥有丰富的抗生素抗性基因(ARG)储备。
配方奶喂养的婴儿ARG负荷更高,与细菌组成有关。
纯素和鱼素食饮食个体肠道中的微生物组成不同,但他们的耐药组档案并没有显著差异,表明耐药组主要由抗微生物药物暴露而非饮食塑造,可能的例外是含有特定防腐剂的食物。
需要进行详细的饮食干预研究,以了解饮食是否可以减少ARG的负担。
地中海饮食在缓解和管理多种疾病方面已被证明是有效的,包括心血管疾病、2型糖尿病、炎症性肠病、肠易激综合症、认知能力下降和抑郁症。此外,对这种饮食的调整,如MIND饮食,已成功降低阿尔茨海默病的风险并减缓认知能力下降。同样,DASH(阻止高血压的饮食方法)饮食已证明在治疗高血压方面有效。
特定的碳水化合物饮食在临床实践中用于治疗炎症性肠病的症状。特定的碳水化合物饮食在儿童和成人队列中已证明其有效性,并已与改善的临床参数和炎症标志物相关联。然而,使用这种饮食时必须保持营养控制,以避免营养不足和体重下降。
对于肠易激综合症的治疗,通常使用低发酵性低聚糖、二糖、单糖和多元醇(低FODMAP)饮食,有50%~80%的患者有积极的临床反应。
在41名患者中进行的为期四周的低FODMAP饮食研究显示,从类似病原性肠易激综合症的肠道微生物组向健康相关的肠道微生物组发生了组成和功能上的转变。
同样,研究表明,坚持低FODMAP饮食,双歧杆菌(Bifidobacterium adolescentis)方面表现出显著降低,这种细菌会破坏肠道屏障功能并改变紧密连接的完整性,从而支持低FODMAP饮食的积极效应是通过肠道微生物群介导的假设。
无麸质饮食目前是治疗乳糜泻的方法,研究已证实这种饮食在缓解胃肠道症状方面的有效性。采用这种饮食方案与肠道微生物组成和肠道微生物途径的改变有关。
最近一项研究分析了乳糜泻患者的小RNA和宏基因组测序数据,研究结果显示,采用无麸质饮食改变了miRNA和微生物群落的轮廓。该研究还揭示了乳糜泻患者中的miRNA-细菌关系和特定的分子模式,表明可能存在用于监测无麸质饮食依从性和评估肠道炎症状态的生物标志物。
对于慢性肾病的管理,推荐采用低蛋白饮食,目的是减缓进入终末期肾病的进展,并推迟对肾脏替代治疗的需求。
综述表明,极低蛋白饮食可能有效减少4期或5期肾病的发生。然而,仅采用低蛋白饮食并未影响终末期肾病的发展。
此外,五篇文章的系统综述和元分析发现,低蛋白饮食增加了拟杆菌科、乳酸菌科、咽峡链球菌Streptococcus anginosus的丰度,同时减少了Roseburia faecis和Bacteroides eggerthii的丰度。但是,在没有微生物多样性和丰富度的整体构成变化的情况下,这些主要在物种和科水平上的变化似乎不足以影响代谢或临床结果。
用于管理2型糖尿病的血糖指数饮食,因其对肠道微生物群的影响及其在影响疾病发展和严重程度方面的潜在作用而受到关注。
这种饮食包括消耗低血糖指数的碳水化合物(例如,豆类、燕麦和小麦),促进血糖水平逐渐且持续上升。尽管关于这种饮食对肠道微生物群影响的研究有限,但小鼠研究表明,它与因摄入大麦而增加的乳酸杆菌属、普雷沃特氏菌属和纤维降解S24-7细菌的丰度有关,或因摄入全谷物燕麦而增加的双歧杆菌属和乳酸杆菌-肠球菌属(Lactobacillus-Enterococcus)有关。
肠道微生物组在人体生理学中的中心作用彻底改变了我们对健康的看法,并日益渗透到营养研究和建议中。
目前,全球饮食指南普遍达成共识,但不幸的是,这种均质性也延伸到了微生物组,只有少数几个国家(例如美国和南非)明确考虑了饮食-微生物组相互作用。
很多文章已经讨论了肠道微生物组知识如何与当前的营养指南相结合,为包含微生物组的精准营养提供了机会,并广泛考虑了将微生物组科学纳入研究、教育、政策和公共卫生沟通的更广泛问题。
几乎所有方面的人类营养最终都需要根据饮食-微生物组相互作用对人类健康的直接和间接后果重新评估。
这里强调微生物组知识挑战营养科学的三个原则:
宿主卡路里≠宿主-微生物组卡路里
由美国化学家威尔伯·奥林·阿特沃特(Wilbur Olin Atwater)在19世纪末提出的阿特沃特系统,用于估算食物中各种营养成分的热量值,反映了食物中的平均化学能量减去粪便、尿液、分泌物和气体中排泄的平均分数。
阿特沃特系统估算热量含量的方法存在三个关键疏漏:
1、食物基质效应
没有捕捉到更广泛食物基质的效果,如植物性宏观营养素在细胞壁或亚细胞结构中的封装。
2、饮食诱导的热生成
没有捕捉到消化的代谢成本,这基于宏观营养素含量、餐食的可口性和食物加工而变化。
3、宿主与微生物组的卡路里区分
只在很小程度上区分了对人类可利用的卡路里和对肠道微生物组可利用的卡路里。
营养学领域长期以来一直合理地关注那些被吸收进入人体组织的饮食成分,因为这些成分有潜力直接影响健康。然而,大量证据表明肠道微生物组对饮食消化性很敏感,并且饮食引起的肠道微生物组的变化可以在不同情况下因果地塑造宿主的健康和疾病,这日益凸显了未吸收营养素的重要性。
未吸收营养素的重要性
与被吸收的营养素不同,未吸收的营养素可靠地到达结肠中最密集的微生物群落。此外,随着消化液在胃肠道内向下推进,未吸收的营养素会因为被吸收的营养素和水分的消失而浓缩。因此,可以预期,未吸收的营养素在塑造肠道微生物组及其对健康和疾病的下游影响方面,可能比被吸收的营养素具有更大的影响力。
饮食与肠道微生物组的相互作用
目前研究主要关注食物入口时的状态,而未充分考虑小肠末端的消化残余物。
虽然历史上对回肠消化性的描述依赖于体外模型或复杂的体内模型,例如插管动物、回肠造口术后的人类患者、健康人体中的侵入性鼻-回肠或结肠插管,以及在血浆中检测同位素标记的营养素,但受微生物组启发的新方法可能证明是有希望的。
深入理解饮食-微生物组相互作用的新视角
例如,基于DNA的饮食底物表征——一种称为DNA metabarcoding的技术,可能与基于DNA的微生物组分析相结合,研究特定排泄样本中直接的饮食-微生物组相互作用。可以在动物模型中或使用新的可吞咽装置在人体中执行对饮食和微生物组信号的双重表征,这些装置能够在由pH变化确定的胃肠道间隔处采样消化液。
许多食品物质已根据美国食品药品监督管理局(FDA)基于动物毒理学试验和/或过去在人类中广泛使用且未产生已知有害影响的基础上,被授予“通常认为安全”(GRAS)的认定。
潜在健康影响
然而,GRAS评估通常并未考虑这些物质对肠道微生物组的影响,或者通过微生物组介导的间接健康效应的潜力。
专注于宿主组织的危险通过发现乳化剂如卵磷脂和人造甜味剂如糖精等GRAS物质在饮食相关水平下可能通过影响肠道微生物组诱导肥胖和胰岛素抵抗的情况得到了说明。
牛磺胆酸可能通过菌群与肠道病理的关联
GRAS化合物牛磺胆酸及其化学成分,GRAS化合物牛磺酸和胆酸,可能与肠道微生物组相互作用,促进肠道病理。具体来说,由Bilophila wadsworthia细菌在牛磺胆酸的脱结合过程中释放的牛磺酸产生遗传毒性的硫化氢,同时释放的胆酸作为微生物产生促炎的次级胆汁酸脱氧胆酸的基质。因此,补充牛磺胆酸的饮食导致了B. wadsworthia的增长和易感基因型(IL-10−/−)小鼠中结肠炎的发展。
肠道微生物组可能转化为更有害的形式:杂环胺的肠肝循环
此外,肠道微生物组可能使用其广泛的酶库将饮食化合物或宿主代谢产物转化为更具有害的形式。例如,细菌β-葡萄糖醛酸酶有助于致癌的杂环胺(如IQ,2-氨基-3-甲基咪唑[4,5-F]喹啉)的肠肝循环,这些物质通过肝脏的葡萄糖醛酸化被解毒。
在暴露于IQ时,常规小鼠比无菌小鼠显示出更多的DNA加合物和DNA损伤。单核子大肠杆菌携带功能性与非功能性uidA基因(编码β-葡萄糖醛酸酶)的大鼠表现出增加的结肠遗传毒性,与这种化合物排泄的多个峰值相结合,这与肠肝循环一致。
三聚氰胺污染+肠道微生物组→肾脏病理
肠道微生物组还与由饮食污染物三聚氰胺引起的肾脏病理有关,三聚氰胺是一种用于许多食品制备工具的塑料添加剂。体外和体内实验表明,存在于一些婴儿肠道中的克雷伯菌可以将三聚氰胺转化为三聚氰酸,三聚氰酸现在已知与三聚氰胺形成不溶性的肾脏聚集体。
有益效应
另一方面,肠道微生物组对未吸收的饮食化合物的生物转化可能有助于有益效应,这些效应如果只关注饮食对宿主的直接影响则可能被忽视。
对抗乳腺癌的保护作用
例如,植物衍生的饮食木脂素(如全谷物、种子、豆类和坚果中发现的)的肠道微生物生物转化被认为是它们对抗乳腺癌的保护作用的基础。一组肠道细菌类群(例如,Eggerthella lenta、Blautia producta、Gordonibacter pamelaeae和Lactonifactor longoviformis)将饮食木脂素松香转化为具有抗癌作用的雌激素模拟物enterodiol和enterolactone。
因此,与无菌动物相比,在化学诱导乳腺癌时,能够从饮食木脂素前体产生enterodiol和enterolactone的细菌群落定植的无菌大鼠显示出较少的肿瘤数量和较小的肿瘤大小。
扩展阅读:
肠道菌群有助于饮食解毒改变疾病风险
例如,肠道细菌Oxalobacter formigenes参与草酸盐的分解,草酸盐是一种螯合饮食毒素,通过结合游离金属阳离子,有助于肾结石和肾衰竭。缺乏O. formigenes与高草酸尿症的风险增加有关,其在大鼠中的施用以剂量依赖性的方式减少了饮食诱导的高草酸尿症。
在探索肠道微生物群与饮食之间错综复杂的关系后,我们不难发现,这个微小的生态系统对我们的健康有着深远的影响。从调节能量平衡到影响免疫功能,从塑造情绪到预防疾病,肠道微生物群的作用远远超出了我们的想象。
当然,饮食也只是众多生活方式因素之一,例如身体活动、环境暴露和睡眠,这些因素都会影响宿主的能量平衡和肠道微生物群。此外,药物的广泛使用已经显著改变了饮食干预的背景。例如,GLP-1 激动剂延迟胃排空,这对消化有着深远的影响,包括肠道微生物代谢可用底物的变化。
即使仅考虑饮食,现在也非常清楚,肠道微生物影响宿主代谢的多种途径,加上关键的饮食和微生物组相关代谢物(如短链脂肪酸、次级胆汁酸等)的多效性作用,使预测特定饮食或微生物组特征的代谢影响变得复杂。
实现基于微生物组的精准营养方法需要对人类进行实验研究,以测量整个生物体水平的综合影响,涵盖地理、性别、种族和年龄等各种因素,以及更大规模的横断面研究,针对饮食成分、肠道微生物组结构和功能以及宿主健康之间的特定联系。
这些数据将受益于机器学习的快速发展并将人工智能与实施精准医疗方面的结合起来。随着技术的进步和数据的积累,肠道菌群检测有望成为精准营养和个性化医疗的重要组成部分,帮助我们更好地管理健康,预防疾病,并提升生活质量。
主要参考文献
Carmody RN, Varady K, Turnbaugh PJ. Digesting the complex metabolic effects of diet on the host and microbiome. Cell. 2024 Jul 25;187(15):3857-3876.
Ross FC, Patangia D, Grimaud G, Lavelle A, Dempsey EM, Ross RP, Stanton C. The interplay between diet and the gut microbiome: implications for health and disease. Nat Rev Microbiol. 2024 Jul 15.
Ahmad S, Moorthy MV, Lee IM, Ridker PM, Manson JE, Buring JE, Demler OV, Mora S. Mediterranean Diet Adherence and Risk of All-Cause Mortality in Women. JAMA Netw Open. 2024 May 1;7(5):e2414322.
McEvoy CT, Jennings A, Steves CJ, Macgregor A, Spector T, Cassidy A. Diet patterns and cognitive performance in a UK Female Twin Registry (TwinsUK). Alzheimers Res Ther. 2024 Jan 23;16(1):17.
Link VM, Subramanian P, Cheung F, Han KL, Stacy A, Chi L, Sellers BA, Koroleva G, Courville AB, Mistry S, Burns A, Apps R, Hall KD, Belkaid Y. Differential peripheral immune signatures elicited by vegan versus ketogenic diets in humans. Nat Med. 2024 Feb;30(2):560-572.
Staudacher HM, Mahoney S, Canale K, Opie RS, Loughman A, So D, Beswick L, Hair C, Jacka FN. Clinical trial: A Mediterranean diet is feasible and improves gastrointestinal and psychological symptoms in irritable bowel syndrome. Aliment Pharmacol Ther. 2024 Feb;59(4):492-503.
谷禾健康
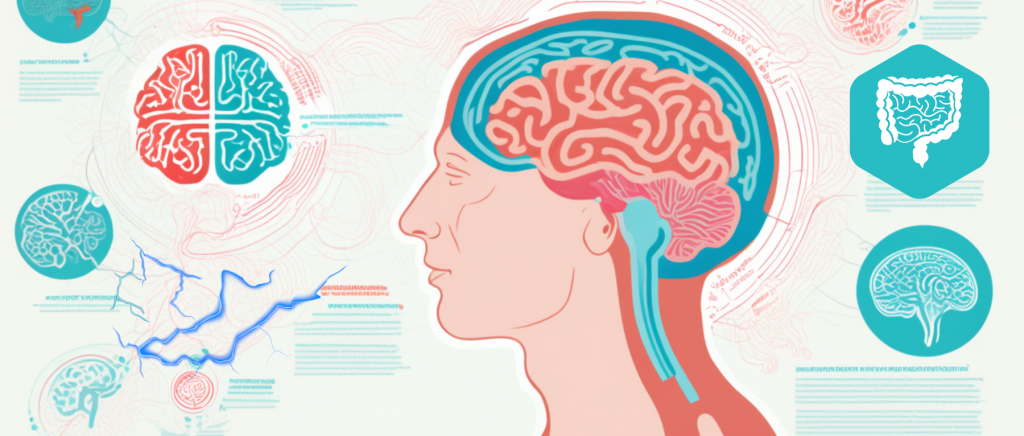
人的脑部大约有860亿个神经元和数万亿个突触连接,由250-300亿的神经胶质细胞支持,消耗基础氧气中约20%的比例来维持ATP驱动的活动。
与其他器官相比,大脑及其神经组织由于其高代谢率和能量活动而产生大量的 ROS(活性氧)。与此同时,与其他组织相比,大脑的抗氧化防御系统较弱,因此容易出现氧化还原稳态紊乱。
氧化应激是指由于 ROS 水平高于抗氧化剂水平而导致细胞内氧化还原信号通路中断。这种不平衡状态会产生有害影响,是许多神经系统疾病的主要原因。当大脑缺氧时,每分钟有大约190万个神经元和1400万个突触会开始丧失。
人们最初认为神经退行性疾病 (NDD) 是由神经系统缺陷引起的,而忽略了肠道和大脑之间的通讯涉及神经、代谢、内分泌和免疫途径。
大量研究观察到,肠道微生物组在通过其自身代谢产物或产生次生代谢产物减轻氧化应激、炎症和能量代谢方面发挥了不可忽视的作用,而通过使用具有抗氧化和抗炎活性的益生菌来调节肠道微生物组种群已显示出有希望的神经恢复能力。据报道从德氏乳杆菌(Lactobacillus delbrueckii)亚种Lactobacillus delbrueckii ssp. bulgaricus B3和 Lactobacillus plantarum GD2中分离出的胞外多糖可保护 SH-SY5Y 细胞免受 Aβ(1–42) 诱导的细胞凋亡,这表明它们有望成为药物治疗阿尔茨海默病 (AD)的有前途的天然化学成分。
doi: 10.1016/j.jare.2021.09.005
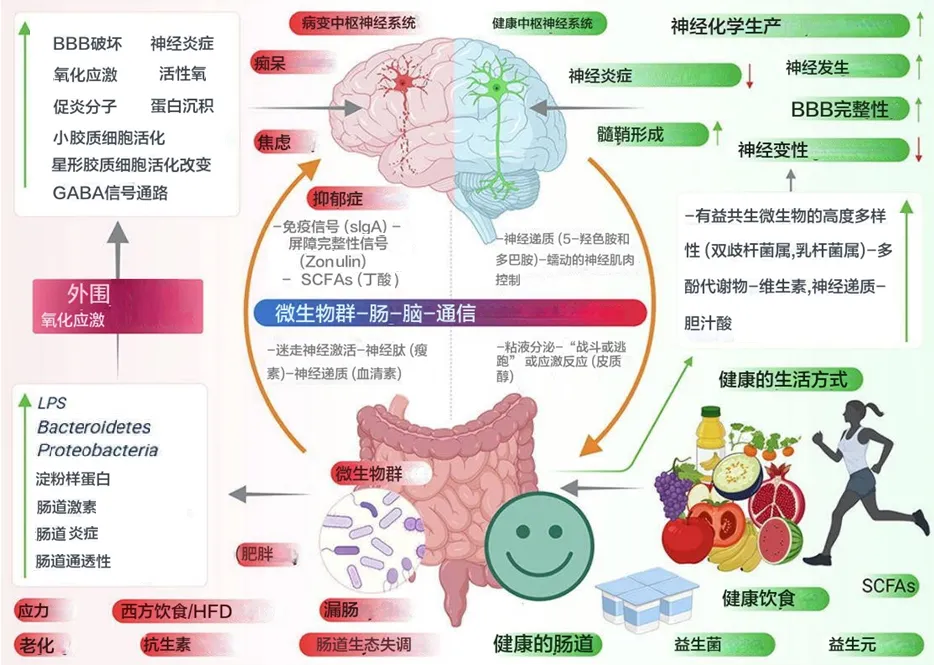
肠道微生物分子,如神经递质、氨基酸、短链脂肪酸 (SCFA)、淀粉样蛋白、脂多糖 (LPS) 和微生物相关分子模式 (MAMP),通过循环与宿主免疫系统相互作用,影响宿主的代谢和神经系统,并通过肠道神经系统直接激活迷走神经影响大脑。压力等情况会导致下丘脑神经元分泌促肾上腺皮质激素(CRH),触发肾上腺皮质激素释放激素(ACTH) 的释放,随后激活皮质醇的释放,影响肠道屏障完整性,进而影响肠道健康。
当肠道菌群失调时,抗炎分子(如SCFAs、H2)的含量减少,而促炎分子(LPS、淀粉样蛋白)的含量增加,同时有益菌种数目减少,致病菌增加。这导致肠道和血脑屏障通透性增加,随之增加外周免疫反应,进而在中枢神经系统(CNS)中增加氧化应激。在神经元的细胞器(如线粒体、内质网(ER)和过氧化物体)中观察到反应性氧化物种(ROS)的产生增加,同时伴随神经毒素的聚集,导致神经退行性变化。
近期的研究提出了肠道微生物群与大脑之间的两个最重要的联系:
所以本文想和大家一起深入了解相关方面研究成果和进展,重点关注涉及神经退化的肠道微生物群介导的氧化应激,以及显示肠道微生物群及其代谢物参与神经保护的研究。
神经退行性疾病(NDD)是一类涉及神经元退化和功能损害的疾病,通常会导致神经细胞的死亡或损伤,进而引起神经系统功能障碍。随着时间的推移逐渐恶化,影响患者的日常生活和活动能力,目前的发病人群越来越大。
阿尔茨海默病:一种进行性痴呆疾病,主要表现为记忆丧失、认知功能下降和行为变化。
帕金森病:一种影响运动控制的疾病,其中运动功能受损,如震颤、肌肉僵硬和运动迟缓。
亨廷顿病(Huntington’s Disease):一种遗传性疾病,表现为神经元的逐渐死亡,导致运动障碍、认知功能下降和精神障碍。
路易体痴呆症(Amyotrophic Lateral Sclerosis, ALS):一种肌萎缩性疾病,导致运动神经元受损,最终导致肌肉无力和萎缩。
多发性硬化:这是一种影响中枢神经系统的慢性疾病,导致神经纤维的髓鞘损伤,影响神经信号的传递。
中风与脑损伤:中风是一种急性神经退行性疾病,由于脑部血流中断导致脑组织损伤。脑损伤也可以是慢性的,随着时间的推移导致神经细胞的损伤。
肠道的“第二大脑”:肠神经系统 (ENS)
肠道不仅仅是消化食物的地方,它还有一个聪明的“大脑”——肠神经系统 (ENS)。它在胃肠道 (GI) 和中枢神经系统 (CNS) 之间架起了一座沟通的桥梁。
肠道神经元通过迷走神经、内分泌和免疫途径与中枢神经系统进行对话,确保我们的肠道健康有序。
肠道微生物群:调节通讯的关键
上面说的“肠神经系统”并不是独自工作的,它有一个重要的合作伙伴——肠道微生物群。这些微生物不仅数量庞大,其代谢能力甚至可以与我们的肝脏相媲美。它们是调节肠道与大脑之间通讯的幕后英雄。
肠道微生物群的多重角色
该领域的持续研究表明,肠道微生物群不仅参与免疫系统的建设和代谢调节,还在我们身体各种器官的发育中扮演着重要角色。
饮食、药物等各种环境因素以及年龄和遗传等宿主因素,不仅会改变肠道菌群的组成,还会造成它们的信号活性发生变化,进而影响我们的健康。
IgA:肠道菌群的守护者
免疫球蛋白A (IgA) 是粘膜表面分泌的最丰富的抗体,她不仅能够包裹病原体以防止其侵入,还能包裹肠道中的共生菌,从而共同抵抗病原菌,维持着肠道菌群的稳定。
连蛋白:肠道屏障的调控者
肠道菌群还会影响连蛋白(zonulin),而连蛋白是调节肠道和血管内皮 (血脑屏障) 紧密连接所必需的。肠道菌群的变化直接影响连蛋白通路,我们常听说的“肠漏”就与此相关。
肠道菌群与情绪
肠道菌群还能影响我们的肠道蠕动,甚至与我们的内分泌系统有关。例如,压力和抑郁可能与皮质醇水平的升高有关,而这种激素的变化又与肠道菌群的平衡有关。
简而言之,肠道菌群通过感知和调节大量化学信号,直接影响我们的身心健康。
肠道细菌与神经系统的联系:从被忽视到被认可
肠道细菌与神经系统疾病之间的关系首次在20世纪提出,现在已被众多研究人员认可。
最初,人们认为神经退行性疾病(NDDs)仅由神经系统内部的缺陷引起,但现代研究揭示了一个事实:肠道微生物能产生和改变各种免疫、代谢和神经化学因子,它们实际上在调控我们的大脑健康方面发挥着关键作用。
肠道菌群:参与神经退行性疾病的双重角色
——失调带来的破坏
神经退行性疾病主要由氧化损伤、活性氧 (ROS) 生成增加、神经炎症和能量代谢紊乱引起,这些病理过程不仅侵袭大脑,也影响肠道微生物群的平衡。
肠道微生物组成会随着身体新陈代谢从健康状态到患病状态的变化而改变。这表明肠道菌群与宿主和环境之间存在交集,且与各种神经和心理疾病存在关联。
肠道菌群失调和神经炎症是各种神经系统疾病病理生理学中一致的因素。在本文中,我们重点展示了肠道微生物群介导的氧化应激在神经退行性疾病中的作用,包括 ROS 产生机制的解释、大脑更容易受到氧化应激的原因以及肠道微生物代谢物如何影响氧化应激引起的大脑损伤,重点关注阿尔茨海默病、帕金森病、创伤性脑损伤。
——保护作用
虽然说肠道菌群在神经退行性疾病的病理学中发挥着作用,但肠道菌群也具有保护大脑免受损伤的潜力,一些细菌能够释放代谢物,这些代谢物转化自膳食纤维、多酚或宿主分子,如胆汁酸、类固醇激素等。此外,通过益生元调节肠道菌群的组成,可以增强神经恢复力。
益生菌的神经保护作用:实验室到临床的探索
肠道菌群的神经保护作用在最近的研究中已得到充分证实,从发酵食品中分离的 Lactobacillus buchneri KU200793菌株表现出较高的抗氧化活性,并且能够保护 SH-SY5Y 细胞免受有害物质 1-甲基-4-苯基吡啶 (MPP + ) 的侵害,表明其具有益生菌和神经保护作用。
同样,从德氏乳杆菌亚种Lactobacillus delbrueckii ssp. bulgaricusB3和 Lactobacillus plantarum GD2 中分离出的胞外多糖,展现出保护神经细胞免受阿尔茨海默相关毒性的能力。
热灭活的Rumnicoccus albus菌株在细胞和小鼠模型中显示出降低ROS水平和提高抗氧化酶(SOD和GSH)水平的能力。此外,植物乳杆菌MTCC1325在动物模型中显示出抗阿尔茨海默病的潜力,预防记忆缺陷。
总之,这些研究反映了肠道微生物群的良好作用、它们的抗氧化作用以及随后的神经保护作用。
氧化应激的微妙平衡
氧化应激是一种生物学现象,当细胞内的活性氧(ROS)水平超过抗氧化剂的防御能力时,就会发生。这种失衡可能会导致细胞内的氧化还原信号通路中断,进而引发一系列有害的生物效应,成为众多神经系统疾病的潜在推手。
ROS是怎么产生的?
有氧代谢中涉及的每个化学反应都会形成不稳定且短暂的反应性中间产物,即 ROS。
注:生物分子氧 (O2) 具有两个不成对电子,不能被完全还原,因此其不完全还原会形成高度亲电且短寿命的 ROS,如:H2O2、超氧化物阴离子、一氧化氮、过氧亚硝酸根阴离子、羟基、过氧化物自由基等。
ROS要么在正常细胞过程中通过ROS生成酶作为中间体产生,要么在药物、毒素和辐射等外源性因素存在下产生。
神经组织更容易产生ROS
与其他器官相比,神经组织因其高代谢率而更容易产生ROS。
线粒体,作为细胞的能量工厂,同时也是ROS生成的主要场所。在ATP生成的过程中,线粒体可能会产生超氧化物,这些超氧化物随后被转化为H2O2和O2。O2的量越多,超氧化物的形成越多,这进一步导致更多的 ROS,如 H2O2和羟基自由基等。
线粒体与神经元活动的紧密联系
线粒体 ROS 的产生与神经元活动密切相关。强烈的突触传递不仅能促进超氧化物的产生,而且这种产生还受到细胞内钙(Ca2+)水平的调节,线粒体 ROS 产生的增加也与线粒体膜电位的增加有关。
单胺氧化酶(MAO)与神经健康
线粒体外膜上有一种酶,叫单胺氧化酶(MAO),它在神经细胞的发育和功能中起着关键作用。MAO通过催化单胺的氧化脱氨,产生H2O2作为副产物,这在神经退行性疾病中可能起到重要作用。
注:MAO-A 主要存在于儿茶酚胺能神经元中,参与去甲肾上腺素和血清素的氧化,而 MAO-B 则特别表达于血清素能神经元和神经胶质细胞中,并氧化 β-苯乙胺。
一氧化氮合酶(NOS):神经信号与氧化应激的交汇点
一氧化氮合酶(NOS)是神经元中产生ROS的酶,也是脑内ROS的来源之一。它通过催化L-精氨酸的氧化,产生一氧化氮(NO),NO在调节突触传递和干扰氧化还原稳态中起着双重作用。
NADPH氧化酶(NOX):神经元活动的响应者
NADPH氧化酶(NOX)是另一种在神经组织中产生ROS的酶,也是脑内ROS的来源之一,在脑皮质和海马区域丰富。它在神经元活动中的作用表明,NOX可能参与了多种中枢神经系统疾病的进展,包括AD、PD、肌萎缩侧索硬化症 (ALS) 和亨廷顿氏病 (HD)等。
注:Ca2+是 NOX 的主要激活剂,导致酶复合物在神经元中定位于突触后,从而表明NOX 参与神经元活动。已报道 7 种 NOX 的同源物,即 NOX (1-5)、双氧化酶 DUOX (1 和 2),它们的大小和结构域不同,但主要参与 ROS 的生成。
先前的报道还揭示了线粒体 ROS 和 NOX-ROS 之间的协同关系,从而支持彼此的 ROS 生成。
因此,开发异构体选择性 NOX 抑制剂可能是治疗急性和慢性中枢神经系统疾病的一种有前途的治疗方法。
其他产ROS的酶
在细胞质中,非血红素铁酶(如脂氧合酶)在分子O2存在下催化花生四烯酸的过氧化,并产生超氧化物和羟基自由基。
细胞质中的许多其他酶,如黄嘌呤氧化酶、细胞色素 P450 单加氧酶、环氧酶、D-氨基氧化酶也是重要的ROS 产生者。
氧化应激通过介导脂质过氧化、蛋白质氧化和核酸损伤三种主要反应导致细胞损伤。
事实上,氧化应激是衰老过程中正常生理过程的一部分,但已知它与大脑慢性疾病有关,如阿尔茨海默病 (AD)、帕金森病 (PD)、HD、缺血性中风、抑郁症和硬化症。此外,它在生活方式相关的代谢紊乱中也起着重要作用,如 2 型糖尿病 (T2D)、非酒精性脂肪肝、非酒精性脂肪性肝炎、肥胖、心血管疾病和癌症。
Tips:生理状态下正常浓度ROS在脑中的作用
虽然高浓度的ROS是有害的,会导致生物分子损伤,从而引起多种细胞功能障碍,但在安全稳定的水平上,ROS其实是细胞生理功能中不可或缺的助手。
详情展开如下:
免疫反应的哨兵
在正常生理条件下,细胞外的ROS是先天免疫系统的得力助手,它们能够引发免疫反应,帮助身体抵御外来的感染。
细胞信号的激活者
细胞内产生的ROS也是信号通路的激活者,它们参与刺激细胞凋亡和增强细胞对氧化应激的防御能力。
NF-κB的触发器
ROS在激活核转录因子NF-κB方面扮演着重要角色,这一过程会引发炎症反应,进而可能引发氧化应激。
病原体的克星
次氯酸(HOCl)这样的自由基,由髓过氧化物酶在溶酶体中作用产生,是一种对抗病原体的强大氧化剂。
中枢神经系统的调控者
对于中枢神经系统,生理条件下许多反应产生的副产物ROS,不仅是细胞内信号转导途径的调节者,还参与调控细胞的增殖、分化和成熟。
促进神经发生
研究表明,ROS的产生和氧化还原平衡有助于前体神经元祖细胞向神经元的分化,以及轴突的形成,促进神经元在其微环境中的扩增。
影响信号级联
氧化还原信号,包括ROS,能够调节多种转录因子和信号分子的功能,影响神经发生的信号级联。
神经元兴奋性的调节者
ROS,如H2O2,能通过增强细胞内钙(Ca2+)信号来调节皮质神经元的兴奋性。
影响神经系统信号级联
氧化还原信号(ROS和氧化状态)还调节转录因子(如NF-κB)、活化T细胞的核因子和活化蛋白1(AP-1)以及酪氨酸磷酸化蛋白PKC的氧化还原状态的功能。
研究人员观察到 H2O2可增加皮质神经元和 PC12 细胞中 ERK 和 cAMP 反应元件结合蛋白 (CREB) 的磷酸化。
参与学习和记忆
ROS 在大脑的不同部位(如海马、大脑皮层、下丘脑、杏仁核和脊髓)充当第二信使,海马中的长期增强(LTP)被证实是必不可少的,而海马与哺乳动物的学习和记忆有关,因此表明 ROS 参与了突触增强。
参与疼痛调节
ROS还通过参与增加杏仁核中央核的兴奋性来影响疼痛相关行为,杏仁核是大脑中负责疼痛调节情绪方面的区域。同样,在脊髓中,与神经性疼痛和炎症疼痛相关的神经可塑性过程也受 ROS 作为信号分子的控制。
ROS在细胞生理中的作用是复杂而精细的。它们既是细胞健康的守护者,也是潜在的挑战者。了解ROS如何在不同生理条件下发挥作用,对于我们理解健康和疾病的机制至关重要。
(为何大脑更容易积累过量ROS,清除机制vs产生机制)
我们将从以下方面来阐述大脑易受氧化应激影响的因素:
Ca2+在神经细胞中的作用:在神经细胞中,动作电位引起的Ca2+瞬变对于维持神经元之间的连接强度(即双向突触可塑性)至关重要。
Ca2+稳态失调的影响:当细胞膜上的Ca2+通道功能受损,导致Ca2+流入过多时,细胞内的游离Ca2+浓度会异常增加。
激活有害酶类:这种高浓度的Ca2+会激活一些有害的酶,如神经一氧化氮合酶(NOS)、磷脂酶A2和钙蛋白,这些酶的活性增加可能导致细胞骨架的破坏。
NO的产生及其影响:NOS的激活会产生一氧化氮(NO),NO是一种信号分子,但高浓度时会对细胞产生负面影响。NO会与线粒体内的细胞色素C氧化酶结合,抑制线粒体的呼吸作用,影响能量产生。
形成有害物质:NO还可以与超氧阴离子(O2.– )反应生成过氧亚硝酸盐(ONOO–),这是一种强氧化剂,可以对细胞造成进一步的损害。
线粒体功能障碍:线粒体内的Ca2+超载会导致线粒体通透性转换孔(MPTP)开放,使得Ca2+和H2O2流出,这可能导致细胞坏死。
大脑易受氧化应激:由于上述过程,Ca2+的稳态失调会使大脑细胞更容易受到氧化应激的影响,氧化应激是指细胞内氧化剂和抗氧化剂之间的不平衡,可能导致细胞损伤。
谷氨酸的兴奋性作用:谷氨酸是一种主要的兴奋性神经递质,它在神经元之间的信号传递中起着关键作用。然而,当谷氨酸在细胞外环境中大量积累时,它可能导致神经细胞的损伤甚至死亡。
谷氨酸的毒性作用:谷氨酸的过量积累可以激活神经元上的谷氨酸受体,尤其是AMPA和NMDA受体。这些受体的激活会导致细胞内Ca2+和Na+的持续流入,引发所谓的“兴奋性毒性”。
注:AMPA和NMDA是两种类型的谷氨酸受体,它们在神经元之间的信号传递中起着关键作用。这些受体是离子通道受体,意味着它们不仅能够结合神经递质谷氨酸,还能够控制特定离子的流动,从而影响神经细胞的电活动。
AMPA受体:AMPA受体(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体)是快速兴奋性突触后电流的主要介质。当谷氨酸结合到AMPA受体时,受体通道打开,允许Na+和K+离子通过,导致突触后膜的去极化,这是神经信号传递的一个重要步骤。AMPA受体的激活通常与快速的、短暂的信号传递相关。
NMDA受体:NMDA受体(N-甲基-D-天冬氨酸受体)是另一种类型的谷氨酸受体,它们在学习和记忆中起着重要作用。NMDA受体通道的开放需要谷氨酸的结合以及突触后膜的去极化(通常由AMPA受体的激活引起)。NMDA受体通道开放时,允许Ca2+和Na+离子进入细胞,同时也允许K+离子流出。Ca2+的流入可以激活多种细胞内信号途径,包括那些涉及长期增强(LTP)和长期抑制(LTD)的途径,这些都是学习和记忆的关键机制。
这两种受体在神经传递中的协同作用对于正常的脑功能至关重要,包括感知、运动控制、学习和记忆。然而,当这些受体过度激活时,它们也可能参与神经退行性疾病和神经损伤的过程,如兴奋性毒性。
反应性物质的形成:细胞内Ca2+的增加可以激活NOS,产生一氧化氮(NO),NO与超氧阴离子(O2–)反应生成过氧亚硝酸盐(ONOO–)。ONOO–是一种强氧化剂,可以对细胞造成损害。
谷氨酸合成酶的抑制:ONOO–等反应性物质可以使谷氨酸合成酶失活,这种酶负责将谷氨酸转化为谷氨酰胺,从而抑制了谷氨酸的代谢。
谷氨酸与半胱氨酸的交换受阻:谷氨酸还可以通过Xc-载体抑制细胞内谷氨酸与半胱氨酸的交换。半胱氨酸是合成谷胱甘肽(GSH)的关键成分。
主编解读:在细胞内,氨基酸不仅是蛋白质的构建块,还参与多种生物化学反应。谷氨酸(Glutamate)和半胱氨酸(Cysteine)是两种重要的氨基酸,它们在细胞内的水平受到严格调控。
谷氨酸与半胱氨酸的交换通常通过特定的转运蛋白(载体)进行,这些转运蛋白位于细胞膜上,负责将氨基酸从细胞外环境转运到细胞内。这种交换是双向的,意味着谷氨酸可以从细胞内转运到细胞外,同时半胱氨酸可以从细胞外转运到细胞内。
半胱氨酸是合成谷胱甘肽(Glutathione, GSH)的关键前体。谷胱甘肽是一种重要的抗氧化剂,对于保护细胞免受氧化应激的损害至关重要。因此,半胱氨酸的供应对于维持细胞内GSH的水平和细胞的抗氧化能力非常重要。
当谷氨酸与半胱氨酸的交换受阻时,意味着这种双向转运过程受到了干扰。这可能是由于转运蛋白的功能障碍、细胞外谷氨酸水平的异常升高(如在兴奋性毒性情况下),或者其他因素导致的细胞膜通透性的改变。
这种交换受阻可能导致细胞内半胱氨酸的供应不足,进而影响GSH的合成。GSH的减少会使细胞更容易受到氧化应激的影响,可能导致细胞损伤或死亡。在某些情况下,这种交换受阻还可能与特定的疾病状态或病理过程相关。
谷胱甘肽的耗竭与铁死亡:由于谷氨酸与半胱氨酸的交换受阻,导致细胞内GSH的耗竭。GSH的减少会使细胞更容易受到氧化应激的影响,并可能导致一种称为“铁死亡”的细胞死亡形式,这是一种由铁依赖的脂质过氧化驱动的细胞死亡。
总结来说,谷氨酸的过量积累通过激活神经元上的受体,导致细胞内Ca2+和Na+的持续流入,进而引发一系列的生物化学反应,包括反应性物质的形成、谷氨酸代谢的抑制、GSH的耗竭,最终可能导致神经元的损伤和死亡。这些过程表明,谷氨酸的稳态对于维持神经细胞的健康至关重要。
扩展阅读:
过渡金属离子,如铁(Fe2+)和铜(Cu+),在大脑中扮演着多重角色。它们不仅是许多酶的辅因子,参与能量代谢、抗氧化防御和神经递质的合成等多种生物化学过程,而且还与神经退行性疾病和脑损伤有关。
酶的辅因子:Fe2+和Cu+等过渡金属离子是许多酶的必要组成部分,这些酶参与细胞内的各种代谢过程。例如,铁是细胞色素c氧化酶和铁硫蛋白的组成部分,而铜是细胞色素c氧化酶和超氧化物歧化酶的组成部分。
自由基反应的催化剂:在某些情况下,过渡金属离子可以催化自由基反应,这些反应可以产生有害的氧化剂,如羟自由基(·OH)。自由基是不稳定的分子,它们可以损害细胞结构,包括脂质、蛋白质和DNA。
铁的持久存在:大脑中的铁主要以Fe2+的形式存在,它在脑脊液中的结合能力较低,这意味着铁离子可以在脑脊液中相对自由地移动,并且可能积累在某些区域。铁的积累与氧化应激和神经退行性疾病(如阿尔茨海默病和帕金森病)有关。
脑损伤的应激因素:在脑损伤或疾病状态下,细胞可能会释放更多的过渡金属离子。这些离子在细胞外环境中可能催化自由基的产生,导致进一步的细胞损伤。
总结来说,过渡金属离子在大脑中的正常功能对于维持神经细胞的健康至关重要。然而,当这些离子在细胞外环境中过度积累或以不适当的形式存在时,它们可能成为氧化应激和细胞损伤的催化剂。因此,维持大脑中过渡金属离子的稳态对于预防神经退行性疾病和脑损伤具有重要意义。
神经递质的自动氧化:多巴胺、5-羟色胺和去甲肾上腺素等神经递质在有氧条件下可以发生自动氧化反应。这些反应涉及神经递质与氧气之间的化学反应,产生活性氧(ROS),如超氧阴离子(O2–)和羟自由基(·OH)。
多巴胺的自动氧化过程:多巴胺与氧气反应首先生成半醌(一种不稳定的中间产物)和超氧阴离子(O2–)。半醌可以进一步与氧气反应生成醌。醌是一种氧化产物,它可以被氧气重新氧化为醌醇和过氧化氢(H2O2)。
线粒体和溶酶体功能障碍:ROS的积累可以导致线粒体和溶酶体的功能障碍。线粒体是细胞的能量工厂,而溶酶体是细胞的“消化系统”,负责分解和回收细胞内的废物。这些细胞器的功能障碍可能导致细胞能量代谢的紊乱和细胞内废物的积累。
总结来说,神经递质的自动氧化是一个产生ROS的过程,这些ROS可以对细胞造成损害,特别是通过损害线粒体和溶酶体的功能。这种损害可能与多种神经退行性疾病有关,包括帕金森病和阿尔茨海默病。因此,控制神经递质的自动氧化和ROS的产生对于维持神经细胞的健康至关重要。
大脑对葡萄糖的依赖:大脑是身体中对葡萄糖依赖性最高的器官之一。葡萄糖不仅是大脑的主要能量来源,还参与多种代谢途径和信号传导过程。
糖醇磷酸途径:糖醇磷酸途径(Glycolysis)是葡萄糖分解代谢的第一步,产生能量和中间代谢产物。磷酸果糖激酶(Phosphofructokinase, PFK)是糖醇磷酸途径中的一个关键酶,它控制着糖酵解的速率。
神经元降解磷酸果糖激酶:在某些情况下,神经元可能会降解磷酸果糖激酶,这可能导致糖酵解速率的降低。糖酵解速率的降低意味着葡萄糖的利用效率下降。
蛋白质糖基化和AGE的形成:糖酵解速率的降低可能导致葡萄糖在细胞内的积累。过量的葡萄糖可以非酶促地与蛋白质发生反应,形成糖基化产物,最终生成高级糖基化终产物(Advanced Glycation End Products, AGE)。
AGE的损害作用:AGE可以与细胞内的AGE受体结合,引发炎症反应和氧化应激。这种氧化应激可以损害蛋白质和线粒体的功能。线粒体是细胞的能量工厂,其功能障碍可能导致细胞能量代谢的紊乱。
炎症性氧化应激:AGE诱导的炎症性氧化应激可能导致细胞内氧化剂和抗氧化剂之间的不平衡,进一步加剧细胞损伤。
Tips:以上总结就是葡萄糖诱导的氧化应激涉及糖酵解速率的降低、蛋白质糖基化和AGE的形成,以及由此引发的炎症性氧化应激。这些过程可能导致蛋白质和线粒体功能的损害,从而影响神经细胞的健康。因此,维持适当的糖酵解速率和控制AGE的形成对于预防神经退行性疾病和脑损伤具有重要意义。
大脑中的多不饱和脂肪酸:大脑富含多不饱和脂肪酸,特别是二十碳五烯酸(Docosahexaenoic Acid, DHA)。DHA是构成神经细胞膜的重要成分,对于维持神经细胞的结构和功能至关重要。
氧化应激的影响:多不饱和脂肪酸由于其化学结构中的多个双键,容易受到氧化应激的影响。氧化应激可以引发脂质过氧化反应,导致脂肪酸的氧化和损伤。
脂质过氧化和信号传导:脂质过氧化产物可以参与脑部的信号传导过程。然而,这些过氧化产物也可能对神经细胞产生负面影响,包括细胞膜的损伤和细胞功能的紊乱。
4-羟基壬酸醛的神经毒性:脂质过氧化产物之一,4-羟基壬酸醛(4-Hydroxynonenal, 4-HNE),可以通过提高细胞内Ca2+水平使谷氨酸转运体失活,从而具有神经毒性。谷氨酸转运体的失活可能导致谷氨酸的积累,引发兴奋性毒性。
α-酮戊二酸脱氢酶的失活:脂质过氧化物还可以使α-酮戊二酸脱氢酶(α-Ketoglutarate Dehydrogenase)失活,这是一种参与三羧酸循环(TCA循环)的酶。该酶的失活可能导致能量代谢的紊乱。
血管收缩作用和蛋白酶体的破坏:脂质过氧化物具有血管收缩作用,可能导致脑血流的减少。此外,它们还可以破坏蛋白酶体,这是一种负责蛋白质降解的细胞器,其功能障碍可能导致细胞内废物的积累。
脂质过氧化物在多种神经退行性疾病,如阿尔茨海默病中起着持续的作用。这些疾病的特点是神经细胞的进行性损伤和死亡。
大脑中多不饱和脂肪酸的易感性使得神经细胞更容易受到氧化应激的影响。脂质过氧化产物如4-HNE可以通过多种机制对神经细胞产生负面影响,包括神经毒性、能量代谢的紊乱、血管收缩和蛋白酶体的破坏。这些过程可能与神经退行性疾病的病理机制有关。
微胶质细胞的角色:微胶质细胞(Microglia)是大脑和脊髓中的常驻免疫细胞,它们在维持大脑的正常功能和发育中起着关键作用。微胶质细胞参与多种生理过程,包括神经保护、突触修剪、炎症反应和组织修复。
吞噬活动和反应性物质的产生:在正常的吞噬活动中,微胶质细胞可以清除死亡的细胞碎片和外来的病原体。在这个过程中,微胶质细胞产生超氧阴离子(O2–)和其他反应性物质,这些物质在清除病原体和受损细胞中起着重要作用。
NOX-2酶的作用:NOX-2(NADPH氧化酶2)是一种酶,它在微胶质细胞中产生O2–。NOX-2的激活可以增加O2–的产生,这是微胶质细胞应对损伤和感染的一种防御机制。
氧气生物可用性与微胶质细胞活性:微胶质细胞的活性取决于总的氧气生物可用性。在损伤或疾病状态下,微胶质细胞可能通过消耗更多的氧气来产生更多的O2–,这可能导致局部氧浓度的降低。
反应性物质与突触损伤:H2O2和NO等反应性物质在损伤部位吸引微胶质细胞,这些物质可以引发局部炎症反应。炎症反应可能导致突触的损伤,这是神经退行性疾病中的一个关键过程。
神经退行性的推动:微胶质细胞的过度激活和炎症反应可能推动神经退行性过程。在某些情况下,微胶质细胞的持续激活可能导致神经细胞的损伤和死亡,这是多种神经退行性疾病的共同特征。
一句话总结就是微胶质细胞在大脑中扮演着多重角色,包括免疫防御、吞噬活动和炎症反应。然而,微胶质细胞的过度激活和炎症反应可能导致神经细胞的损伤和神经退行性疾病的进展。因此,平衡微胶质细胞的活性对于维持大脑健康和预防神经退行性疾病至关重要。
大脑抗氧化防御系统的脆弱性:大脑是一个高代谢活跃的器官,对氧气的需求很高,因此容易受到氧化应激的影响。与其他组织相比,大脑的抗氧化防御系统相对较弱,这使得大脑更容易出现氧化还原稳态的紊乱。
过氧化氢酶的含量:过氧化氢酶(Catalase)是一种重要的抗氧化酶,它能够分解过氧化氢(H2O2)为水和氧气。神经元中的过氧化氢酶含量比肝细胞中的低得多,这可能是因为神经元对H2O2的处理能力较弱。
过氧化物酶体的限制:过氧化氢酶主要存在于过氧化物酶体中,这是一种细胞器,专门负责处理过氧化氢和其他有害物质。然而,过氧化物酶体的存在限制了过氧化氢酶的活性,使其无法作用于其他亚细胞区室(如线粒体和细胞质)产生的H2O2。
谷胱甘肽的含量:谷胱甘肽(Glutathione, GSH)是一种重要的细胞内抗氧化剂,它能够清除自由基并参与亲电子物质的代谢。神经元中的GSH含量非常低,这使得它们更容易受到氧化应激的影响,并且难以代谢亲电子物质。
铁死亡的风险:铁死亡是一种由铁依赖的脂质过氧化驱动的细胞死亡形式。神经元中GSH的低含量可能增加它们发生铁死亡的风险,这是一种与多种神经退行性疾病相关的细胞死亡机制。
总结来说,大脑的抗氧化防御系统相对脆弱,这使得神经元更容易受到氧化应激的影响。过氧化氢酶和谷胱甘肽的低含量限制了神经元处理氧化应激的能力,可能导致氧化还原稳态的紊乱和细胞损伤。
血红蛋白与H2O2的反应:血红蛋白(Hemoglobin)是红细胞中的一种蛋白质,负责携带氧气。当血红蛋白与过量的过氧化氢(H2O2)反应时,它可以释放出铁离子(Fe2+)和血红素(Heme)。这些产物可以参与进一步的化学反应,产生有害的过氧化物。
血红蛋白的氧化:在氧化应激条件下,血红蛋白可以被过氧化氢(H2O2)或其他氧化剂氧化。这种氧化过程可以破坏血红蛋白的结构,导致其携氧能力下降。
铁离子的释放:血红蛋白的氧化可以导致铁离子(Fe2+)从血红蛋白中释放出来。这些游离的铁离子可以参与Fenton反应,即铁离子与H2O2反应生成羟自由基(·OH)。羟自由基是一种强氧化剂,可以对细胞造成广泛损害。
血红素的释放:血红蛋白的氧化还可以导致血红素的释放。血红素是一种铁卟啉化合物,它是血红蛋白的活性部分。血红素可以催化脂质过氧化反应,导致细胞膜的损伤。
脂质过氧化:血红素可以催化不饱和脂肪酸的过氧化反应,生成脂质过氧化物。这些过氧化物可以进一步分解产生更多的自由基,加剧氧化应激。
血管收缩:血红素还可以与一氧化氮(NO)结合,形成复合物。这种复合物可能导致血管收缩,影响脑血流和氧气供应。
因此,控制血红蛋白与H2O2的反应对于预防神经毒性和维持大脑健康具有重要意义。
CYP2E1(Cytochrome P450 2E1)是一种属于细胞色素 P450 酶家族的酶。细胞色素 P450 酶是一组含有血红素(铁卟啉)的酶,它们在许多生物体内参与多种化合物的氧化代谢。CYP2E1 主要存在于肝脏中,但它也在其他组织中表达,包括大脑。
CYP2E1 的主要功能是催化小分子化合物的氧化反应,包括乙醇、某些药物、致癌物和其他外源性物质。这些反应通常涉及将分子中的氢原子移除,并添加一个氧原子,从而使化合物更容易被进一步代谢或排出体外。
CYP2E1 酶的角色:CYP2E1(Cytochrome P450 2E1)是一种存在于肝脏和其他组织中的酶,包括大脑。它参与多种代谢过程,包括小分子(如乙醇、某些药物和致癌物)的氧化代谢。
电子泄漏与氧化应激:CYP2E1 在催化反应时可能会发生电子泄漏,这意味着在代谢过程中,它可能会产生超氧阴离子(O2–)和其他活性氧(ROS)。这些 ROS 是高度反应性的分子,可以导致氧化应激,即细胞内氧化剂和抗氧化剂之间的不平衡。
大脑中的 CYP2E1:虽然大脑中含有低水平的细胞色素 P450 酶,但 CYP2E1 的存在使得大脑在代谢过程中容易受到氧化应激的影响。大脑中的 CYP2E1 活性可能导致神经细胞的损伤。
饮酒和吸烟的影响:研究表明,CYP2E1 的水平可能会因饮酒和吸烟而增加。这是因为乙醇和其他烟草中的化合物可以诱导 CYP2E1 的表达和活性。CYP2E1 的增加可能导致更多的 ROS 产生,从而加剧氧化应激。
总结来说,DNA 修复酶如 PARP-1 在修复 DNA 损伤中起着关键作用,但它们的过度激活可能导致 NAD+ 的消耗和能量产生的限制,以及可能通过 TRPM2 通道导致细胞内 Ca2+ 浓度的增加,从而导致神经元细胞死亡。
DNA 修复酶的角色:DNA 修复酶是一类酶,它们在细胞内负责修复 DNA 分子的损伤。这些损伤可能由多种因素引起,包括氧化应激、紫外线辐射、化学物质和复制错误。
PARP-1 的功能:聚 ADP 核糖聚合酶 (PARP-1) 是一种重要的 DNA 修复酶。当 DNA 发生单链断裂时,PARP-1 会被激活。它通过裂解烟酰胺腺嘌呤二核苷酸 (NAD+) 并将 ADP 核糖部分转移到核蛋白上,从而启动 DNA 修复过程。
PARP-1 的过度激活:在严重的 DNA 损伤或氧化应激条件下,PARP-1 可能会过度激活。这种过度激活会导致大量的 NAD+ 消耗,因为 NAD+ 是 PARP-1 活性所必需的底物。
因此,平衡 PARP-1 的活性对于维持细胞健康和预防神经退行性疾病具有重要意义。
RNA 的易感性:RNA 是单链分子,不像 DNA 那样有双螺旋结构和组蛋白的保护。因此,RNA 更容易受到氧化应激的影响。氧化应激可以导致 RNA 分子中的核糖和碱基发生氧化损伤。
氧化的 RNA 的影响:氧化的 RNA 可能会阻止核糖体合成蛋白质。核糖体是细胞内的蛋白质合成工厂,它们通过读取 RNA 分子上的遗传信息来合成蛋白质。如果 RNA 被氧化,其结构可能会改变,导致核糖体无法正确读取遗传信息,从而影响蛋白质的合成。
蛋白质合成异常:如果 RNA 的氧化损伤未得到修复,可能会导致合成的蛋白质未折叠或截短。未折叠或截短的蛋白质可能无法正常执行其功能,甚至可能形成有害的蛋白质聚集体,这在多种神经退行性疾病中是一个关键的病理特征。
氧化的 RNA 与氧化还原活性过渡金属(如铁和铜)一起可以催化 Fenton 反应。Fenton 反应是一种产生羟自由基(·OH)的化学反应,羟自由基是一种强氧化剂,可以对细胞造成广泛损害。
此外,超氧化物歧化酶(SOD)是一种重要的抗氧化酶,能够将超如果氧阴离子(O2–)转化为过氧化氢(H2O2)。铜锌超氧化物歧化酶(CuZn-SOD)的 mRNA 被氧化,可能是肌萎缩侧索硬化症(ALS)的临床前征兆。ALS 是一种神经退行性疾病,其特点是运动神经元的进行性退化和死亡。
注意,尽管神经退行性疾病中氧化的 RNA 在神经退行性疾病中的作用已经引起了关注,但其确切的作用机制和重要性仍需要进一步的研究。
胃肠道 (GI) 包含数万亿共生微生物和约 200-2000左右个物种,它们在维持膜屏障功能方面发挥着重要作用。这些微生物是肠道内的永久居民,参与宿主生物体内分子的不断流动,从而调节各种代谢功能。
人在出生后两年内,宿主胃肠道中的微生物群就会稳定下来,但它们的组成因个体而异,并且会根据年龄、健康、遗传和生活方式等外界因素而改变。胃肠道的腔侧暴露于饮食成分和肠道微生物群,此外,70% 的免疫细胞位于肠道组织,并由连接肠道和大脑的神经元支配,涉及肠道和大脑之间的持续沟通。
肠道微生物群与大脑之间的沟通主要涉及四条途径;
1、神经高速公路——迷走神经
第一种重要模式包括激活迷走神经,迷走神经连接胃肠道的肌肉层和粘膜层与脑干。最近研究显示,肠道病原体和益生菌通过激活迷走神经元改变大脑中的 γ-氨基丁酸 (GABA)、色氨酸、催产素和脑源性神经营养因子 (BDNF) 信号,从而调节宿主的焦虑、进食和抑郁等行为。
2、肠嗜铬细胞释放的血清素影响大脑
直接或间接影响大脑活动的通讯途径涉及通过肠道内壁的肠嗜铬细胞 (EC) 释放的血清素发出信号。一项研究表明,在用益生菌双歧杆菌治疗抑郁症小鼠模型时,其血清素和血清素前体水平会增加,从而改善其抑郁状态。同样,据报道,产芽孢细菌(梭菌属)的代谢物能够刺激 EC 产生血清素。
3、肠道菌群通过小胶质细胞介导对神经系统的调节
肠道菌群在小胶质细胞的发育、成熟和激活中起着至关重要的作用。在一项研究中,据报道,无菌 (GF) 小鼠携带的未成熟小胶质细胞数量比传统小鼠多,而且用双歧杆菌治疗时,可通过转录激活小胶质细胞。在行为和神经退行性疾病 (NDD) 中观察到小胶质细胞功能的变化,表明肠道微生物群通过小胶质细胞介导对 NDD 的影响。肠道微生物群还通过全身免疫系统(即细胞因子和趋化因子)影响神经系统。研究表明,与传统小鼠相比,GF 小鼠的血脑屏障 (BBB) 通透性更大,因此大脑更容易接触微生物产物,进而导致神经病理学状况。
4、肠道菌群传递化学信号
肠道微生物群通过直接向大脑传递化学信号进行交流。例如,肠道细菌发酵膳食纤维会产生短链脂肪酸 (SCFA),已被证明可以调节中枢神经系统的神经可塑性,还可以改善小鼠的抑郁行为。此外,肠道微生物群如拟杆菌、双歧杆菌、副拟杆菌、大肠杆菌属。能够产生神经递质 GABA,这表明肠道微生物群调节宿主生物体神经递质的浓度。
人体肠道内定植着四种主要的共生菌门,包括厚壁菌门、拟杆菌门、放线菌门、变形菌门。肠道中的共生菌和致病菌都能通过调节线粒体活性来改变细胞的 ROS。
共生菌产生甲酰化肽,这些肽与巨噬细胞和中性粒细胞上的 G 蛋白偶联受体 (GPCR) 结合,从而引发上皮细胞炎症。该过程导致 NOX-1 产生超氧化物,从而增加细胞的 ROS。
肠道乳酸杆菌和双歧杆菌具有将硝酸盐和亚硝酸盐转化为 NO 的能力,使肠道上皮成为 NO 的丰富来源。类似地,链球菌和杆菌利用 NOS 从 L-精氨酸产生 NO。
低浓度NO→保护;高浓度NO→有害
纳摩尔浓度的 NO 具有神经保护作用,是去甲肾上腺素能、非胆碱能肠道神经元的神经递质。而在较高浓度下,它会导致产生活性氧和氮物质 (RONS)(如超氧化物和 H2O2)而引起的有害影响,这进一步形成高活性羟基自由基,使其与神经炎症、轴突变性和神经退行性疾病相关。
肠道细菌产生的有益代谢物(如 SCFA)有助于通过影响线粒体活动来降低 ROS。这个后面章节详细讨论。
MAMPs维持微生物结构功能,影响大脑发育与炎症反应
膜相关分子模式 (MAMP) 维持着所有微生物类别的结构完整性和基本功能,甚至大脑也能检测到。这些是不同的化学基团,包括肽、核苷酸、碳水化合物和脂质。当宿主无法检测到此类分子模式时,它可能伴有急性到慢性炎症,并被发现会改变大脑的发育和功能。这些高度保守的结构基序与先天免疫系统细胞上的模式识别受体 (PRR) 结合,从而诱导线粒体 ROS 的产生和 NF-κB 通路的激活,导致炎症反应,引起神经元应激和细胞死亡。
在最近的一项研究中,据报道,细菌细胞壁成分肽聚糖易位到发育中的大脑,影响基因表达并导致社会行为的改变。同样,革兰氏阴性细菌细胞壁中的脂多糖被发现会损害小鼠的胎儿大脑发育、急性抑郁和认知障碍。此外,在 PD、自闭症谱系障碍 (ASD) 和突触核蛋白病模型中,急性和慢性暴露于 MAMP 是导致疾病症状的一个因素。
机会性病原体产生的细菌毒素,也对神经系统产生负面影响
发现梭菌属(Clostridium )产生的致命毒素,如毒素 B、肠毒素和ε 毒素,可降低神经元活力,并通过破坏的 BBB到达大脑,抑制神经递质的释放。
葡萄球菌属(Staphylococcus)和芽孢杆菌属(Bacillus)产生的肠毒素和麦芽孢杆菌素可通过刺激迷走神经引起呕吐和疾病行为。
沙门氏菌和大肠杆菌等致病菌能够降解含硫氨基酸,从而在肠道中产生硫化氢 (H2S) 。H2S水平的升高会引起各种代谢活动的变化,如乳酸增加和ATP生成减少、环氧合酶2 (COX-2)活性抑制、线粒体对O2的消耗减少、促炎细胞因子表达增加,并且已知会刺激高血压和神经炎症。
肠道菌群介导的氧化应激在神经退行性病变中的作用
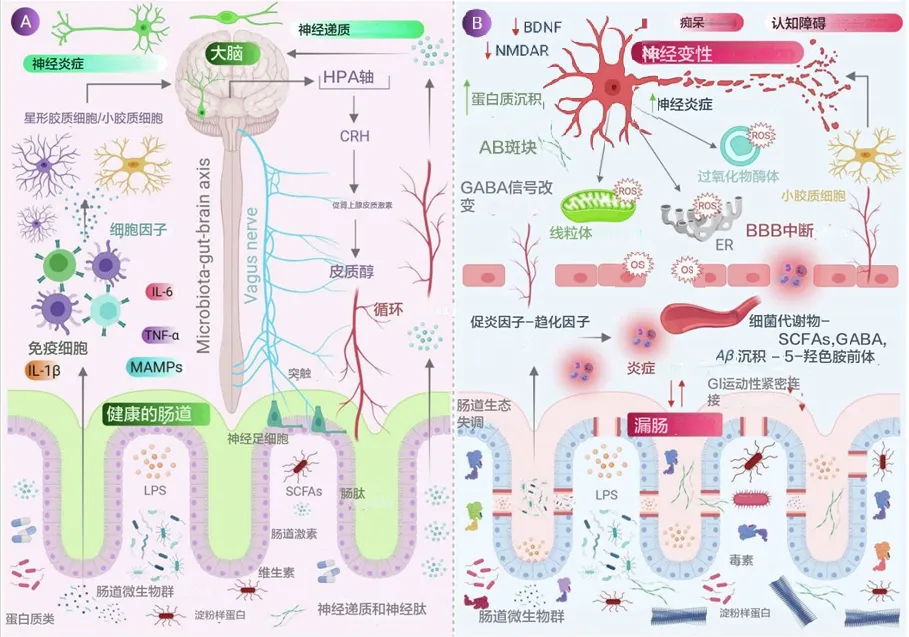
doi: 10.1016/j.jare.2021.09.005
神经退行性疾病(如阿尔茨海默病和帕金森病)的病因病理涉及神经细胞内蛋白质错误折叠及其聚集,氧化应激也被认为是其病理因素之一。发现帕金森患者的肠道中肌间神经丛(Auerbach丛)和粘膜下神经丛(Meissner丛)存在α-突触核蛋白的聚集,暗示了肠道菌群在启动肠道α-突触核蛋白聚集中的作用,然后通过跨突触途径向上影响中枢神经系统神经元导致神经退行性变化。
阿尔茨海默病:全球性的健康挑战
阿尔茨海默病 (AD) 是导致痴呆的主要原因,影响着全球超过 5000 万人口,其中老年人群的发病率更高,85 岁以上每 1000 人中约有 80 人患有该病。阿尔茨海默病的无症状病理学在记忆力减退和认知障碍等症状出现前约20年就开始了。
病理变化:蛋白质的异常积累
与阿尔茨海默相关的脑病理变化包括蛋白质淀粉样β蛋白 (Aβ-淀粉样斑块) 的细胞外积累和 tau 蛋白 (tau 缠结) 的细胞内积累。这种异常的蛋白质积累导致小胶质细胞被激活以清除 Aβ 和 tau 蛋白,但随着随后的衰老,会发生慢性炎症,引起神经元细胞死亡,从而导致萎缩。
氧化应激:阿尔茨海默的潜在危险因素
在可能的危险因素中,氧化应激和肠道微生物群的作用引起了科学界的关注,并被认为是神经退行性过程的直接可能后果。
许多研究表明,阿尔茨海默病患者大脑的抗氧化防御系统发生了变化,即超氧化物歧化酶和过氧化氢酶的活性和水平降低。同时,氧化应激生物标志物(如丙二醛、4-羟基壬烯醛和F2-异前列腺素、蛋白质羰基、3-硝基酪氨酸、8-羟基脱氧鸟苷)在血液和脑脊液中含量较高,这些物质的浓度与认知障碍和脑重量成正比。
阿尔茨海默症脑内ROS的产生还表现为细胞器功能障碍,如线粒体(细胞色素C氧化酶缺乏)、未折叠蛋白反应 (UPR) 引起的内质网、神经斑块中金属离子的积累以及小胶质细胞的过度活化和随后的NADPH氧化酶的过度表达。
Aβ沉积和氧化应激之间也存在相互关系
即Aβ聚集会诱导氧化应激(也存在于线粒体、内质网和高尔基体等细胞器中),而氧化应激会诱导Aβ积累。甚至,神经元中tau蛋白的聚集会导致NADH-泛醌还原酶活性降低,从而导致ROS生成增加和线粒体功能障碍。
肠道菌群失调→炎症→神经退行性病变
最近的事实和数据显示,阿尔茨海默不仅是局限性脑炎症的结果,也是外周炎症的结果。肠道菌群失调会导致炎症,而炎症会随着年龄的增长而增加,血脑屏障被破坏,免疫系统被激活,随后出现神经退行性病变,另一方面,健康均衡的肠道有助于减少 ROS 产生的有害影响。
共生菌减少,致病菌增加
已发现患有阿尔茨海默的个体体内共生菌如双歧杆菌和厚壁菌数量减少,大肠杆菌、志贺氏菌和拟杆菌数量增加,随后出现炎症和 Aβ 积累增加。
肠道菌群变化与阿尔茨海默病严重程度的关联
同样,在 APP/PS1 小鼠模型中,当用广谱抗生素联合治疗时,Aβ 斑块形成也减少。5xFAD 小鼠阿尔茨海默模型显示微生物群向促炎物种转变,同时氨基酸分解代谢也发生变化,相反,抗生素治疗可逆转这种影响,这表明疾病的严重程度和肠道菌群转化之间可能存在联系。
Toll样受体激活与肠道屏障紊乱
肠道中形成的微生物淀粉样蛋白激活 Toll 样受体 (TLR),分化簇 14 (CD14) 促进免疫反应,导致被忽视的错误折叠 Aβ 和 Aβ 清除受损,随后细胞因子产生增加,导致肠道和血脑屏障紊乱。此外,研究还表明,阿尔茨海默患者的肠道激素水平下降,相反,肠道微生物代谢物如 H2S 和三甲胺增加。
与年龄有关的肠道微生物多样性下降
研究表明,随着年龄的增长,双歧杆菌属减少,变形菌增加,痴呆症不是由于 SCFA 减少而是由于脂质代谢受到干扰。双歧杆菌在调节胆固醇水平方面发挥着重要作用,直接促进胆固醇通过粪便排出,间接通过增加血清瘦素水平,从而参与维持海马可塑性和记忆功能。
肠道菌群影响神经递质
肠道细菌如乳酸杆菌和双歧杆菌会代谢抑制性神经递质 GABA。一项研究发现,在 APPSwe/PSEN1DeltaE9 双基因 (人类早老素(DeltaE9)和人鼠淀粉样前蛋白(APPswe)融合体阿尔茨海默小鼠模型中,海马突触可塑性发生了改变,其中发现 GABA 生成减少,同时谷氨酸能神经传递增加。虽然有报道显示蓝藻门太高会产生导致认知障碍的神经毒素,但尚未观察到与阿尔茨海默的关系。
淀粉样蛋白的交叉播种机制
另一个可能的连接环节是脑淀粉样蛋白的积累和肠道微生物群,涉及微生物淀粉样蛋白的交叉播种机制,其方式类似于朊病毒的传播,因此形成的不同淀粉样蛋白构象体在其细胞靶标中诱导不同水平的毒性,推测存在阿尔茨海默表型。
口腔菌群与阿尔茨海默
除了肠道微生物群外,还研究了口腔共生菌与阿尔茨海默之间的联系。有趣的是,口腔卫生不良和牙齿脱落会增加阿尔茨海默早期发病的风险。
关于口腔菌群与神经系统疾病的关联,详见:
帕金森病 (PD) 的病理特征是多巴胺能神经元的进行性退化、磷酸化蛋白 α-突触核蛋白的聚集、过量 ROS 产生、线粒体功能障碍和小胶质细胞活化。其症状特征是患者无法控制自主运动(震颤、肌肉僵硬、行走困难和驼背姿势),这是由于大脑的黑质和纹状体区域受损所致。
它是第二常见的神经退行性疾病 (NDD),影响全球超过 1% 的老年人口。
关于肠道与帕金森病之间的关系的第一份报告出现在1817年詹姆斯·帕金森的一篇关于震颤麻痹的文章中。
注:詹姆斯·帕金森,我们所说的描述帕金森病的这位前辈,全名是“James William Keys Parkinson”。1817年,62岁的James Parkinson发表了论文“An Essay on the Shaking Palsy”,在文中,详细地描述了六例被其称为患有“震颤麻痹”的患者,在论文中他注意到了患者不适,像被无法逃脱的魔鬼所控制。他对这种疾病的描述,很多都被现在的医学观察所承认:不自主震颤的同时还有肌肉乏力,即使在被支撑时也不能缓解;身体前驱,不能刹车,越走越快甚至要小跑起来;感觉和智能几乎不受影响…..
肠道病理与帕金森病的联系
后来的研究支持了这一观点,表明了病理过程是从肠道开始,然后影响大脑。越来越多的证据显示,帕金森病患者常见的特征包括肠道炎症、磷酸化α-突触核的早期积累导致跨过迷走神经的腹背侧运动神经元、便秘问题和肠道通透性增加,这表明了肠道菌群与帕金森病发病机制之间的密切关系。
接受迷走神经切断手术的个体患帕金森病的风险降低,这进一步支持了肠道与PD之间的联系。
氧化应激与神经元损伤
较低水平的谷胱甘肽(GSH)和较高水平的铁和H2O2使黑质致密部 (SNc) 神经元易受氧化应激。而且,该区域的脂质过氧化和多巴胺氧化会导致神经元细胞死亡。研究还表明,线粒体呼吸链功能障碍会导致过量的 ROS 产生。
相关病理与细胞毒性
复合物 1 的抑制剂会对多巴胺神经元产生细胞毒性作用,这一事实也支持了这一观点,患有 α-突触核蛋白、磷酸酶和张力蛋白同源物 (PTEN) 诱导的假定激酶 1 (PINK1) 和 Parkin 病理的患者被检测到患有线粒体功能障碍和氧化应激增加。
异常蛋白聚集与肠道微生物群
与 AD 类似,异常蛋白质 α-突触核蛋白的聚集与氧化应激增加相关,反之亦然。谈到肠道微生物群的作用,一些致病菌会释放毒素,导致肠道和肠神经系统 (ENS)细胞的线粒体功能障碍,从而导致神经退行性。
肠道致病菌及其产物参与发病
帕金森病患者肠道中的致病菌增加及其微生物产物直接参与帕金森病的发病机制。为了支持这一事实,最近有报道称,大肠杆菌会产生一种名为 curli 的淀粉样蛋白,这种蛋白会促进 α-突触核蛋白在肠道和大脑中的聚集,会导致小鼠的运动障碍。
另一方面,当小鼠接受肠道限制性淀粉样蛋白抑制剂治疗时,小鼠的运动功能得到改善,便秘也得到改善,表明肠道与 PD 症状的病因有关。
克罗恩病与帕金森病共病风险高
肠道细菌引起的肠道炎症与 PD 中的进行性神经退行性病变直接相关。虽然 PD 患者的血清代谢谱和肠道成分发生了改变,但研究发现,在严重的 PD 情况下,肠道中的肠杆菌科细菌水平会增强,而抗炎细菌水平却非常低,这也表明它与克罗恩病的肠道炎症具有平行关联。这表明克罗恩病患者患 PD 的风险非常高。
同样,研究发现,在PINK1基因敲除小鼠模型中,柠檬酸杆菌(Citrobacter rodentium)感染会通过诱发肠道炎症加重 PD 症状。
肠道菌群代谢物影响PD药物疗效
除了诱发炎症之外,肠道菌群还会发挥代谢作用,例如,在 PD 患者中,其代谢物 β-葡萄糖醛酸、色氨酸和 SCFA 会发生改变。
肠道菌群的一个显著特性是,它能够通过降低抗 帕金森药物的生物利用度或增加药物失活来降低其疗效,就像在标准左旋多巴治疗中的那样。
H2饱和水对PD症状的改善
在这些研究中,还发现肠道细菌产生H2的减少是导致 PD 的因素之一。
当向患PD大鼠和 MPTP 小鼠模型提供 50% H2饱和水时,发现它能够成功减少黑质中的神经元丢失以及氧化应激标志物,当在人体中进行双盲随机试验时,PD患者的运动评分有所改善。
肠道菌群参与帕金森病的证据
此外,针对这一观点,最近对过表达人类 α-突触核蛋白基因的 GF 小鼠 PD 模型的研究表明,SCFA 水平降低,小胶质细胞活化减少,运动功能改善,这表明肠道菌群直接参与了增强 PD。
当将 PD 患者的肠道菌群移植到无菌α-突触核蛋白过表达的小鼠模型中时,运动症状恶化,表明肠道菌群功能失调在 PD 患者中起着作用。同样,用神经毒素治疗的小鼠模型显示肠道菌群组成发生改变,致病性肠杆菌科细菌水平升高。
一些特定的细菌物种,如奇异变形杆菌(Proteus mirabilis)发现能促进小鼠的神经退行性病变。综合起来,这些研究表明,肠道微生物群加剧了人类和动物帕金森病模型中的神经元功能障碍和神经炎症。
注:奇异变形杆菌(Proteus mirabilis, PM)是革兰阴性细菌,属于肠杆菌科。在自然界中广泛存在,具有特殊的群集运动能力,可促进结石形成,在导管、泌尿系上皮中形成结晶生物膜,是引起感染的重要病原。
创伤性脑损伤 (TBI) 是世界范围内最常见的损伤类型之一,是导致死亡和残疾的主要原因之一。
TBI的广泛影响
TBI 造成的残疾不仅包括脑的原发性机械损伤,还包括损伤后的继发性损伤,这种损伤发生在细胞和分子水平,可能导致代谢异常,如线粒体功能障碍、氧化应激、炎症、小胶质细胞活化、兴奋性毒性,从而造成暂时或终身的认知障碍。TBI 的严重程度不仅集中在大脑上,还可能造成多器官损伤,是一种异质性病理生物学状况。
TBI的治疗现状
由于脑损伤的异质性,针对 TBI 引起的神经病理学的治疗方法仍然缺乏,需要考虑新的治疗方案。针对这一问题,肠道益生疗法因其能够恢复肠道菌群失调和 TBI 之间的双面关系而受到广泛关注。
肠道微生物群与 TBI 损伤之间存在双向关系
TBI 的全身表现之一是肠道蠕动和通透性紊乱、粘膜损伤、肠绒毛组织病理学改变,这表明肠道微生物群组成受到干扰。
最近的报告显示,暴露于轻度反复性脑损伤 20 天的小鼠会逐渐出现白质损伤、认知能力下降和轻度、短暂性的肠道菌群失调。
肠道菌群失调也会影响创伤性中枢神经系统损伤的病理生理、血脑屏障通透性改变和小胶质细胞激活,导致严重后果。
研究发现,在脑损伤之前和之后,小鼠 TBI 模型中的肠道菌群耗尽会导致海马 CA1 区神经元密度增加、联想学习障碍减轻以及病变体积缩小。
TBI中肠道菌群的变化
最近的研究还表明,脊髓创伤后会出现肠道菌群失调,导致椎管内炎症和病变病理。
肠道菌群在TBI恢复中的作用
最近的一项研究指出,在 TBI 之前、期间和之后,广谱抗生素引起的肠道菌群失调会导致神经元丢失增加、神经发生受到抑制以及小胶质细胞和外周免疫反应发生改变,同时恐惧记忆反应也会发生调节。
因此,肠道菌群对 TBI 患者的影响具有至关重要的临床意义,因为 TBI 患者由于定期使用抗生素和长期住院,肠道菌群容易发生改变。此外,检测肠道菌群调节可能为识别 TBI 严重程度提供诊断工具,从而提供有针对性的治疗方法。
中枢神经系统与氧化应激
中枢神经系统极易受到氧化应激的影响,并导致神经系统疾病。由于高 O2需求和过氧化敏感脂质细胞的涌入,中枢神经系统运作期间会产生高水平的 ROS。这种氧化代谢产生活性物质,用于传递氧化还原信号以调节突触可塑性等关键功能。
抗氧化剂(无论是酶促还是非酶促、内源性还是外源性)通过阻止 ROS 的产生或清除自由基或使自由基产物失活来保护大脑免受氧化应激。
抗氧化防御机制
抗氧化酶的作用
抗氧化酶如:SOD通过催化超氧化物歧化为O2和H2O2来降低超氧化物阴离子的浓度;GPx还原H2O2和脂质过氧化物;硫醇特异性过氧化物酶如过氧化物酶减少羟基过氧化物的量,过氧化氢酶将H2O2转化为H2O和普通分子O2。
自由基激活参与抗氧化途径的基因转录,保护细胞免受不利影响。
谷胱甘肽不足可能会限制过氧化物酶的活性,从而使神经元更容易受到氧化应激的影响。
体内和体外研究表明:
重要途径与相关机制
Keap1-Nrf2-ARE 与神经退行性疾病相关的氧化应激防御机制有关,调节 SOD、硫氧还蛋白、过氧化物酶和 GPx 的活性。
NF-κB 是中枢神经系统 (CNS) 中的氧化还原传感器,可由 ROS 激活。
中枢神经系统抗氧化代谢的调节受到严格控制,而肠道微生物的作用是高度动态的。
肠道菌群之间、与宿主等相互作用产生代谢物
肠道菌与菌之间、菌与宿主之间的相互作用通过产生各种代谢物(如可吸收维生素、多酚、SCFA、BDNF、可扩散抗氧化剂和氧化剂气体等)来调节内源性和外源性 ROS 水平。
肠道菌群通过代谢物调节屏障、免疫系统、神经系统
肠道微生物还控制代谢物对血脑屏障的通透性、紧密连接完整性和肠道屏障,调节免疫系统,阻止病原体在肠道定植。副交感神经系统的迷走神经感知肠道代谢物,并将肠道信息传达给中枢神经系统,以产生特定的反应。
肠道菌群与神经系统疾病的关系
在应激条件下,迷走神经张力受到抑制,并由于菌群失调而表现出有害影响,如肠易激综合征 (IBS) 和炎症性肠病 (IBD)。参与 AD 发病机制的 Aβ 蛋白由肠道细菌(如ENS 中的大肠杆菌和肠道沙门氏菌)表达。
有益的肠道微生物还会产生多巴胺、血清素和 GABA。这些是调节 ENS 活性并可能相互关联的中枢神经递质。
肠道菌群管理小胶质细胞,失调引发神经炎症
一些研究表明,肠道微生物管理小胶质细胞的激活和成熟,而激活的小胶质细胞会释放大量诱导型一氧化氮合酶 (iNOS) 来调节 NO 的产生。菌群失调会引发炎症性 iNOS 并导致神经炎症。
我们已经看到肠道菌群的潜在作用以及氧化应激在介导神经元疾病中的重要作用,近年来,开发基于抗氧化剂的疗法来治疗氧化应激诱导的神经退行性疾病的需求日益增长,并且成为科学研究的重点。
抗氧化剂疗法与肠道微生物组的作用
抗氧化剂是能够抵消ROS/RNS诱导的氧化应激的化学或天然物质。尽管已经观察到抗氧化剂对糖尿病、关节炎、白内障和骨质疏松症等疾病的强大治疗作用,但用于中枢神经系统疾病的抗氧化疗法有限,仍然需要深入了解其机制。
肠道微生物组的双重作用
肠道微生物组的作用具有两面性,一方面它负责神经退行性(肠道菌群失调和神经炎症)的基本机制,另一方面,肠道微生物组及其代谢物调节许多相关通路,表明它们具有神经保护治疗作用。
蛋白质、维生素等微生物分子通过多步生物合成途径产生,可能对宿主系统产生有益或有害的影响。因此,通过包括益生元和益生菌在内的适当饮食来维持健康的肠道微生物群是维持神经元健康的先决条件。
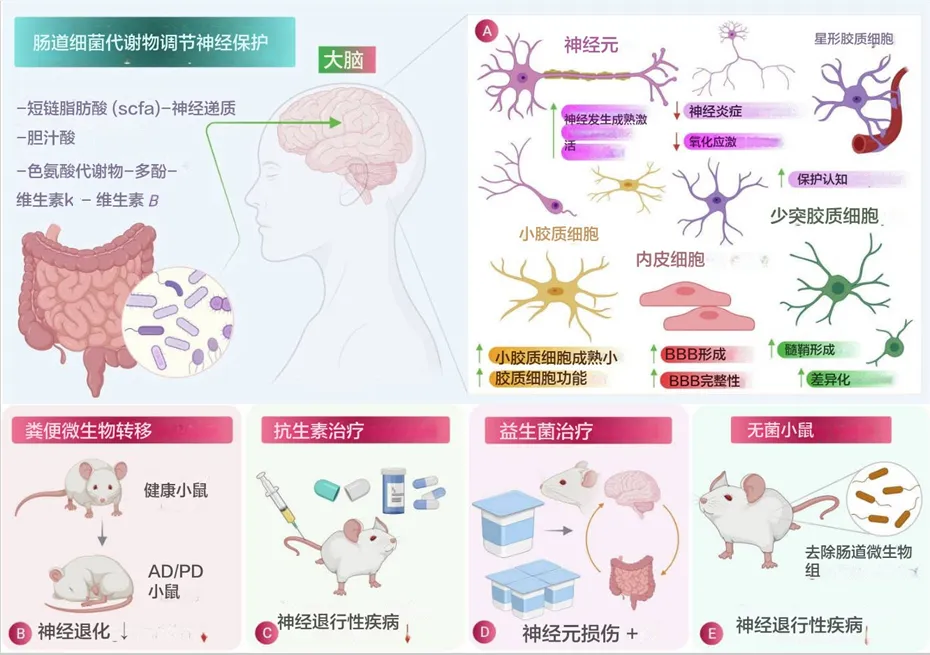
肠道菌群代谢物的作用及其对肠道菌群的调节过程在神经退行性疾病(NDDs)中的作用
doi: 10.1016/j.jare.2021.09.005
肠道菌群在神经保护中的作用:
(A)肠道菌群释放的有益代谢物在减少炎症和氧化应激方面对脑细胞的特定影响示意图。
(B)粪菌移植 (FMT) 涉及将粪便细菌从健康个体转移到有病理状况的个体,被发现是一种有效的程序,可减少阿尔茨海默病、帕金森病、亨廷顿病和多发性硬化症等神经退行性疾病的病理生理。
(C)和(D)分别使用抗生素治疗和益生菌治疗,它们在减少神经退行性疾病的发病机制方面显示出相当大的效果。
(E)无菌小鼠(没有肠道微生物的小鼠)显示神经退行性疾病的减少,也用于研究肠道微生物对大脑生理的影响,从而显示肠道微生物参与神经退行性疾病。
肠道微生物群在神经保护中的作用

doi: 10.1016/j.jare.2021.09.005
肠道菌群与宿主分子的相互作用
胆汁酸的生成与功能
胆汁酸在肝脏中产生并在肠腔中释放,主要参与脂质和脂溶性维生素的溶解、能量代谢信号传导,并且在脑的生理学和病理生理学中发挥重要作用。
胆汁酸对神经系统的影响
胆汁酸通过直接结合穿过血脑屏障的脑内受体或通过与肠道受体结合间接诱导成纤维细胞生长因子 (FGF) 和胰高血糖素样肽 1 的释放,影响脑不同区域的神经元活动以及迷走神经活动。
胆汁酸的神经保护特性
胆汁酸如熊去氧胆酸 (UDCA) 和牛磺熊去氧胆酸 (TUDCA) 具有神经保护特性且无细胞毒性,这分别在其 III 期临床试验和动物研究中得到证实。最近的数据显示,TUDCA 有助于减弱慢性 PD 小鼠模型中的自噬、α-突触核蛋白聚集和蛋白质氧化。
此外,它还有助于通过Takeda G 蛋白偶联受体 5/sirtuin-3 (TGR5/SIRT-3) 通路防止蛛网膜下腔出血大鼠的神经元凋亡。同样,UDCA 在带电多泡体蛋白 2B (CHMP2B) 内含子 5 额颞叶痴呆模型中表现出神经保护作用。
肠道微生物对胆汁酸的影响
肠腔内的肠道微生物群在脱水酶的作用下将初级胆汁酸(胆酸和鹅去氧胆酸)转化为次级胆汁酸,包括氨基酸与胆汁盐水解酶和其他酶促过程的解离,从而改变它们的核受体结合、溶解度和循环。在人类和小鼠的 AD、PD、ASD多发性硬化症模型中发现了次级胆汁酸水平的变化。
此外,细菌修饰的胆汁酸对 ALS 和中风有神经保护作用。肠道微生物群落的调节可导致胆汁酸水平和性质的变化,这可能是神经退行性或神经保护性的。
胆汁酸在神经保护和疾病治疗中的潜在应用
肠道微生物介导的脱氧胆酸增加会诱导小鼠 EC 中神经递质血清素的释放。胆汁酸代谢物被发现可改善脱髓鞘和减少氧化应激,通过分别作用于少突胶质细胞和小胶质细胞增强其神经保护作用。然而,微生物操纵的胆汁酸的潜在作用和影响尚不清楚,仍有待明确定义。
类固醇激素在大脑发育和功能中的作用
类固醇激素发出的信号对大脑的发育和功能(记忆、决策和性行为)至关重要。类固醇激素在整个身体中循环时,会遇到肠腔内的微生物群。
肠道微生物对类固醇激素的修饰作用
肠道细菌在 β-葡萄糖醛酸酶和 β-葡萄糖苷酶介导的去结合反应中修饰类固醇激素,从而重新激活激素并阻止其排泄。因此,肠道微生物群通过降解和活化途径影响活性和非活性类固醇激素的水平。
肠道微生物与性激素代谢
研究发现,雄激素和雌激素受到肠道微生物群的影响。研究发现,大量肠道细菌能代谢雌激素,雌激素在粪便样本中也会发生氧化还原反应,这表明肠道微生物群发挥了作用。
研究发现,肠道微生物群还具有将睾酮和胆固醇转化为雄激素的能力。受微生物影响的雌激素具有神经保护作用,对小胶质细胞具有抗炎作用。
此外,肠道微生物群落改变会导致雌激素水平降低,从而导致慢性炎症和认知障碍。雌激素分子还会影响少突胶质细胞的分化和髓鞘形成。最近的报告还显示,即使在 MPTP 帕金森病小鼠模型中使用黄体酮治疗也显示出神经保护、抗炎和免疫调节作用,但神经保护作用是始于肠道还是大脑仍不清楚。
肠道菌群与饮食分子的相互作用
膳食氨基酸与肠道微生物代谢
膳食氨基酸也可以被肠道微生物代谢,它们对大脑的影响取决于膳食摄入的类型和频率。虽然肠道微生物编码的氨基酸在宿主体内循环,但影响中枢神经系统的氨基酸是由肠道细菌代谢的膳食氨基酸。
芳香族氨基酸
酪氨酸、色氨酸和苯丙氨酸等芳香族氨基酸被肠道细菌代谢为短链脂肪酸、吲哚衍生物、神经递质、有机酸、胺和氨。
酪氨酸
酪氨酸代谢的最终产物是由酪胺中间体形成两种儿茶酚胺、多巴胺和去甲肾上腺素。体外研究表明,大量肠道细菌可以产生毫摩尔范围内的去甲肾上腺素。最近的报告显示,非肾上腺素通过刺激 B-3 肾上腺素能受体增加星形胶质细胞的谷胱甘肽供应,从而保护神经元免受 H2O2诱导的神经元死亡。
研究发现,酪氨酸也被肠道微生物代谢为苯酚,如 4-乙基苯酚,随后在宿主体内被硫酸化为 4-乙基苯酚硫酸盐,在 ASD 小鼠模型中发现该物质升高,也是 ASD 儿童尿液的生物标志物。
色氨酸代谢产生的神经活性分子
色胺和犬尿氨酸等吲哚衍生物是肠道细菌代谢色氨酸的产物,是一种神经活性分子。吲哚丙酸是一种吲哚衍生物,可作为抗氧化剂减少神经炎症,并被观察到在减少 AD 病理方面具有潜在作用。
发现犬尿氨酸代谢物会影响焦虑、记忆和应激样行为。还观察到犬尿氨酸代谢途径的紊乱会促进炎症、兴奋毒性谷氨酸的产生和自由基攻击,表明平衡的犬尿氨酸具有神经保护作用,并在 AD、PD 和 HD 中具有抗炎作用。
色氨酸代谢物通过调节其芳烃受体有助于降低星形胶质细胞的炎症反应,同时也影响它们与小胶质细胞的相互作用。同样,还观察到吲哚酚-3-硫酸盐控制小胶质细胞的活化,随后控制其与星形胶质细胞的相互作用。
谷氨酸和精氨酸的神经保护
氨基酸谷氨酸也被肠道细菌谷氨酸脱羧酶转化为 GABA,一种抑制性神经递质,在小鼠模型中观察到它可以减轻抑郁和焦虑症状。
就氨基酸精氨酸而言,它被代谢成四种多胺,即胍丁胺、腐胺、亚精胺和精胺,它们的作用机理是谷氨酸受体并参与维持突触可塑性和记忆形成。
胍丁胺在作为脑中 α-2 肾上腺素能受体和咪唑受体的配体时,对中枢神经系统疾病有治疗作用。亚精胺也在 3-硝基丙酸 3-NP HD 模型中显示出神经保护作用。
此外,胍丁胺能刺激 Nrf-2 信号通路,改善脂多糖 (LPS) 诱导的 ROS 产生。体外和体内研究还表明,胍丁胺可保护星形胶质细胞和小胶质细胞免受氧化应激引起的损伤。这些研究表明肠道微生物内分泌学在神经科学中的潜在作用。
肠道菌群可以将膳食纤维代谢成短链脂肪酸
未消化的膳食纤维(如复合碳水化合物多糖)在肠道微生物酶糖苷水解酶和多糖裂解酶的作用下,通过厌氧发酵转化为短链脂肪酸(SCFA)。
丁酸、乙酸和丙酸组成短链脂肪酸,是结肠上皮细胞的能量来源。除此之外,它还进入体循环,随后直接或间接影响许多器官的生理功能,包括神经发育和功能。
短链脂肪酸在神经退行性疾病中的作用
有报道显示,当通过使用益生菌混合物或使用抗炎短链脂肪酸来调节 AD 小鼠模型的肠道菌群时,有助于抵消疾病的进展。同样,短链脂肪酸被发现能有效加剧 GF 小鼠 PD 模型中的运动症状。
SCFA对神经系统的直接影响
短链脂肪酸和乙酸穿过血脑屏障,激活神经元,调节神经递质和神经营养因子的水平。一项研究表明,丙酸和丁酸会影响神经元细胞内的钾水平。
丁酸是调节表观遗传基因活化(组蛋白去乙酰化酶)的酶的强效抑制剂,并被发现在 AD、PD、HD、中风和记忆障碍的小鼠模型中起到强效抗炎剂的作用。
有趣的是,SCFA 会干扰 Aβ 肽之间的相互作用,形成神经毒性低聚物,从而预防 AD 病理。据报道,将野生型小鼠的粪便微生物群移植到 PD 动物模型中,同时给予丁酸,可显著改善运动症状和多巴胺缺乏症。
SCFA对神经系统保护的多重机制
当我们观察细胞特异性反应时,丁酸已被证明可以在体外减少星形胶质细胞中的神经炎症和氧化,而乙酸盐被这些细胞用作能量来源。
一项研究发现,SCFA 通过与内皮细胞上的 SCFA 受体结合来增加紧密连接蛋白的表达,从而有助于降低 血脑屏障的通透性并预防 LPS 诱发的癫痫和中风。
SCFA 通过减少小胶质细胞活化来减少大脑中的氧化应激,从而对抗 AD 和 PD 中的神经炎症。总之,从膳食纤维中获得的 SCFA 有助于改善大脑健康,具体取决于个人的肠道健康状况。
多酚的分类及抗氧化特性
多酚是植物中存在的生物活性分子,在植物的生长、保护和繁殖中起着根本性的作用。多酚分为黄酮类化合物、酚酸类化合物和单宁类化合物。
多酚的分子结构,即羟基的位置和芳香环取代的性质,使其具有清除自由基的能力,并被广泛研究作为治疗NDD的抗氧化疗法。
多酚的代谢及其神经保护机制
未吸收的多酚在宿主体内通过水解和酯化作用,在肠道微生物群的作用下转化为生物可利用和生物活性的代谢物,随后在到达外周组织之前进行甲基化、硫酸化、羟基化等修饰。
研究表明,从葡萄和葡萄酒中提取的白藜芦醇、从绿茶中提取的姜黄素和表没食子儿茶素-3-没食子酸酯等不同多酚通过激活蛋白激酶通路(如 Keap1/Nrf-2/ARE)发挥神经保护作用,而这些通路是缓解内源性和外源性 ROS 的主要通路。
多酚代谢物在神经退行性疾病中的潜在作用
据报道,细菌多酚代谢物如 3-羟基苯甲酸和 3-(3′-羟基苯基)丙酸可抑制淀粉样蛋白聚集,从而有助于抑制 AD 的进展。
同样,据观察,黄酮类槲皮素可作为 BACE-1 抑制剂。此外,天然黄酮类原花青素可在体外 减轻鱼藤酮诱导的多巴胺能神经元的氧化应激。此外,肠道菌群产生的多酚(如阿魏酸)可促进神经发生,并在 AD和脑缺血的小鼠模型中显示出神经保护作用。
多酚与肠道菌群的相互作用及其对神经保护的影响
雌马酚和肠内酯也是肠道细菌通过代谢植物雌激素(多酚之一)产生的衍生物,可能对雌激素受体介导的经典神经保护途径产生影响。有趣的是,多酚还可以调节肠道菌群的组成,进一步将其转化为抗炎和神经保护代谢物。
扩展阅读:
肠道微生物与维生素合成
肠道微生物也是维生素的重要来源,特别是维生素B和K,它们不仅对肠道微生物代谢至关重要,而且还对宿主的生理途径产生影响。
维生素的吸收与生理作用
虽然膳食维生素通过小肠吸收,但微生物衍生的维生素的吸收发生在结肠中。为了预防新生儿出血性疾病,在肠道菌群建立之前,需要补充维生素K,这是血栓形成过程中必不可少的物质。
此外,维生素B和K对大脑发育和功能也很重要。就神经退行性疾病 (NDD)而言,许多研究表明维生素B和K在改善神经元健康方面发挥着有效作用。
维生素K在神经退行性疾病中的作用
研究发现,维生素K缺乏与AD的发病机制有关,增加膳食中维生素K的摄入有助于改善老年患者的记忆功能。
最近的报告显示,维生素K2(甲基萘醌-4)具有强大的抗氧化特性,能显著抑制鱼藤酮诱导的p38活化、ROS产生和caspase-1活性,进而恢复线粒体膜电位,显示出其在治疗神经炎症诱导的帕金森方面的潜力。
类似地,维生素 K2 可有效调节 PC12 小鼠神经母细胞瘤细胞中的 bax 和 caspase-3 活化,保护其免受 6-OHDA 诱导的细胞凋亡。
维生素缺乏与神经系统疾病的关系
最近的一份报告显示,帕金森病患者体内维生素 K2 水平低与炎症反应失调和凝血信号级联有关。
维生素 B 缺乏还与脚气病和多发性神经病等神经系统疾病有关。同样,叶酸缺乏与老年女性的认知障碍和进行性痴呆有关。而且,大量摄入 B6、B9 和 B12 可降低与 AD 认知能力下降有关的大脑区域萎缩的速度。此外,还需要更多建设性的研究来证明肠道微生物群产生的维生素在神经保护中的潜在联系。
扩展阅读:
自由基可能带来的危害
ROS 形式的自由基是细胞正常代谢过程的副产物。自由基有可能破坏遗传物质、使酶失活、使复合碳水化合物解聚以及使脂质过氧化。
抗氧化剂的保护机制
细胞内分子的这种破坏会导致细胞死亡。为了平衡自由基,身体具有特定的抗氧化剂,如谷胱甘肽。
一些产品也开始流入医药市场以应对氧化应激,如阿魏酸 (FA),因为它具有抗氧化和抗炎特性。它通过增强 BDNF 和神经生长因子 (NGF) 以及一些具有抗炎特性的神经肽的产生来帮助神经干细胞增殖。
益生菌在抗氧化应激中的作用
2017 年的研究,益生菌如植物乳杆菌 NCIMB 8826、发酵乳杆菌 NCIMB 5221和动物双歧杆菌也能通过细菌 FA 酯酶大量产生 FA。
由于其治疗效果,它在 AD 治疗中的应用越来越受到关注,用 FA 进行预处理已被证明可以减少 Aβ 原纤维并治疗 AD 小鼠的神经炎症。产生 FA 的益生菌通过清除 ROS 来抑制 β-淀粉样蛋白原纤维的形成和聚集。
SIRT1蛋白脱乙酰酶的抗氧化特性
其他益生菌蛋白,sirtuin-1 (SIRT1) 蛋白脱乙酰酶已被证明具有抗氧化特性。这种蛋白质调节宿主抗氧化途径的基因,并具有神经保护作用。
在接受治疗的转基因 3xTg-AD 小鼠中,观察到大脑中 SIRT1 蛋白的表达和活性恢复,Aβ 肽的形成减少。然而,在未经治疗的 AD 小鼠中,发现 SIRT1 的表达显著下降。
此外,SIRT1 活性增强可降低 p53 蛋白乙酰化,并通过抑制凋亡途径提高应激细胞的存活率。其他研究也表明,益生菌补充剂可激活 SIRT1 途径并激发抗氧化作用。
SLAB51益生菌配方的神经保护作用
最近的研究探究了一种名为 SLAB51(嗜热链球菌、嗜酸乳杆菌、植物乳酸杆菌、副干酪乳酸杆菌、德氏乳酸杆菌保加利亚亚种、短乳酸杆菌、长双歧杆菌、短双歧杆菌、婴儿双歧杆菌)的益生菌配方缓解氧化应激的能力,并发现了其作用的分子机制。
SLAB51 还能增强 GPx 和过氧化氢酶抗氧化酶的活性,从而减轻氧化应激引起的损伤。在人类中也观察到了类似的发现,AD 患者大脑中的 SIRT1 浓度显著降低,这与 AD 患者大脑皮层中淀粉样蛋白 β 和 tau 的积累密切相关。一项补充益生菌菌株干酪乳杆菌 01 的人体研究报告称,SIRT1 水平有所提高。
肠道菌群与免疫反应
肠道菌群与宿主免疫细胞之间的关系非常脆弱。免疫细胞专门区分宿主友好细菌和致病细菌。如果这种关系受到损害,则会导致不必要的免疫反应,引发慢性炎症。这种分化是由肠上皮细胞启动的,肠上皮细胞负责根据细菌细胞表面抗原(如 LPS、肽聚糖和鞭毛蛋白)产生受过训练的巨噬细胞表型。当上皮细胞变得容易受到致病攻击时,抗原会转移到脉管系统中,并产生促炎细胞因子,如 IL(白细胞介素)-1、IL-6 和肿瘤坏死因子-α (TNF-α),从而导致感染性休克以及肠道和脑部炎症。
肠道微生物与神经系统炎症的关联
一些细菌毒素也可以穿过血脑屏障。为了探究微生物在淀粉样变性中的作用,研究人员通过评估认知障碍患者几种肠道微生物的促炎(CXCL2、CXCL10、IL-1β、IL-6、IL-18、IL-8、炎症小体复合物 NLRP3、TNF-α)和抗炎(IL-4、IL-10、IL-13)细胞因子活性进行了研究,结果发现:
大肠杆菌/志贺氏菌的数量增加和直肠真杆菌的数量减少与认知障碍和淀粉样蛋白阳性患者的促炎和抗炎细胞因子浓度变化显著相关。同时,在 AD 患者中观察到 IL-6、CXCL2、NLRP3 和 IL-1β 水平升高,而 IL-10 水平降低。这项研究表明,肠道微生物群可能引发、加重或减轻神经系统疾病的外周炎症。
扩展阅读:
随着技术的进步,有关大脑的知识正在成倍增加。神经科学家从分子生物学、分子遗传学、脑成像和其他新技术中生成了大量数据,并且对共享神经科学数据以进行各种分析有着浓厚的兴趣。
神经成像在预测和检测神经退行性疾病和精神障碍方面也非常有帮助。为了收集和分析神经科学数据,正在开发各种生物信息学工具,以进一步开发基于大脑功能的设备。到目前为止,研究人员对因各种压力条件而导致神经退化的分子通路有了初步了解。
集成数据库将有助于从公开来源收集与神经退行性疾病相关的不同类型的数据。
当前与神经数据相关的活跃数据库
编辑
doi: 10.1016/j.jare.2021.09.005
随着高通量技术的加强,人们对微生物组的全面了解及其在人类健康中的重要性正在快速增长。
近期已证明肠道细菌可以改变中枢神经系统生理,而菌群失调可能是神经炎症的一个潜在因素。
微生物群影响左旋多巴治疗PD效果,数据库助力解析神经退行性疾病
据报道,在临床试验中,左旋多巴治疗 PD 的结果在招募受试者之间有所不同。这种差异是由于他们的微生物群造成的。L-多巴由不同肠道细菌物种(即粪肠球菌和Eggerthella lenta A2)的酪氨酸脱羧酶 (TDC) 和多巴胺脱羟酶 (Dadh) 代谢。
为了灭活细菌 L-多巴脱羧酶,人们发现了一种药物,即 (S)-α-氟甲基酪氨酸 (AFMT)。L-多巴和 AFMT 的组合被用于治疗帕金森病。与健康个体相比,AD 患者的肠道微生物群在分类学水平上发生了改变,例如拟杆菌、放线菌、瘤胃球菌、毛螺菌科。
宏基因组数据/16S RNA 测序数据支持菌群失调与 AD 之间存在明确关联。细菌产物(如 LPS 和 SCFA)与淀粉样蛋白病理有关。开发这些数据库的主要目的是将数据组织成一组结构化记录,这些记录有助于分析师检索信息进行不同的分析,从而为与神经退行性疾病相关的各种未解之谜提供解决方案。
肠道微生物群与大脑的相互联系已导致神经科学研究取得变革性进展。迄今为止,发现的大多数研究都与肠道细菌神经科学研究有关,但肠道微生物群非常庞大,需要科学家的关注,以确定和描述肠道微生物及其群落对肠脑信号传导途径的影响。
★ 为什么大脑容易发生氧化应激?
目前我们了解到大脑含有丰富的神经元,突触以及神经胶质细胞,相比于其他器官有更高的能量代谢活动和要求,大脑的抗氧化防御系统较弱,因此容易出现氧化还原稳态紊乱。
大脑Ca2+的稳态失调,神经元的兴奋性氨基酸在大量摄入导致谷胱甘肽(SH)的耗竭,从而引发神经元的铁死亡。
神经递质如多巴胺、5-羟色胺和去甲肾上腺素自动氧化生成ROS。大脑对由葡萄糖诱导的氧化应激敏感。大脑富含多不饱和脂肪酸,尤其是二十碳五烯酸(DHA),这使得其更容易受到氧化应激的影响,因为脂质过氧化和脑部利用过氧脂质进行信号传导。
脑部的微胶质细胞是大脑的常驻免疫细胞,对于大脑发育和功能至关重要。微胶质细胞活性取决于总的氧气生物可用性,并借此展示对突触的损伤,通过消耗更多氧气来产生O2–。H2O2和NO等反应性物质在损伤部位吸引微胶质细胞,引发局部炎症并推动神经退行性。
因此综合以上因素表面大脑容易发生氧化应激,这是很多神经退行疾病比如阿尔茨海默病,帕金森以及痴呆等的主要原因。
而大量的研究观察到肠道微生物组在通过其自身代谢产物或产生次生代谢产物减轻氧化应激、炎症和能量代谢方面发挥了不可忽视的作用。
★ 肠道菌群如何影响神经系统?
肠道微生物还控制代谢物对血脑屏障的通透性、紧密连接完整性和肠道屏障,调节免疫系统,阻止病原体在肠道定植。副交感神经系统的迷走神经感知肠道代谢物,并将肠道信息传达给中枢神经系统,以产生特定的反应。
在应激条件下,迷走神经张力受到抑制,并由于菌群失调而表现出有害影响,如肠易激综合征 (IBS) 和炎症性肠病 (IBD)。参与 AD 发病机制的 Aβ 蛋白由肠道细菌(如ENS 中的大肠杆菌和肠道沙门氏菌)表达。有益的肠道微生物还会产生多巴胺、血清素和 GABA。这些是调节 ENS 活性并可能相互关联的中枢神经递质。
肠道微生物管理小胶质细胞的激活和成熟,而激活的小胶质细胞会释放大量诱导型一氧化氮合酶 (iNOS) 调节 NO产生。菌群失调会引发炎症性 iNOS 并导致神经炎症。
★ 肠道菌群代谢物的作用
胆汁酸通过直接结合穿过血脑屏障的脑内受体或通过与肠道受体结合间接诱导成纤维细胞生长因子 (FGF) 和胰高血糖素样肽 1 的释放,影响脑不同区域的神经元活动以及迷走神经活动。
色胺和犬尿氨酸等吲哚衍生物是肠道细菌代谢色氨酸的产物,是一种神经活性分子。吲哚丙酸是一种吲哚衍生物,可作为抗氧化剂减少神经炎症,并被观察到在减少 AD 病理方面具有潜在作用。
短链脂肪酸和乙酸穿过血脑屏障,激活神经元,调节神经递质和神经营养因子的水平。一项研究表明,丙酸和丁酸会影响神经元细胞内的钾水平。
雌马酚和肠内酯也是肠道细菌通过代谢植物雌激素(多酚之一)产生的衍生物,可能对雌激素受体介导的经典神经保护途径产生影响。
而通过使用具有抗氧化和抗炎活性的益生菌来调节肠道微生物组已显示出有希望的神经恢复能力。
★ 益生菌帮助恢复神经系统
益生菌如植物乳杆菌 NCIMB 8826、发酵乳杆菌 NCIMB 5221和动物双歧杆菌也能通过细菌 FA 酯酶大量产生 FA。由于其治疗效果,它在 AD 治疗中的应用越来越受到关注,
最近的研究探究了一种名为 SLAB51(嗜热链球菌、嗜酸乳杆菌、植物乳酸杆菌、副干酪乳酸杆菌、德氏乳酸杆菌保加利亚亚种、短乳酸杆菌、长双歧杆菌、短双歧杆菌、婴儿双歧杆菌)的益生菌配方缓解氧化应激的能力,并发现了其作用的分子机制。
从德氏乳杆菌(Lactobacillus delbrueckii)亚种Lactobacillus delbrueckii ssp. bulgaricus B3 和 Lactobacillus plantarum GD2 中分离出的胞外多糖可保护 SH-SY5Y 细胞免受 Aβ(1–42) 诱导的细胞凋亡,这表明它们有望成为药物治疗阿尔茨海默病 (AD)的有前途的天然化学成分。
★ 饮食塑造肠道菌群缓解氧化应激助力大脑健康
氨基酸谷氨酸也被肠道细菌谷氨酸脱羧酶转化为 GABA,一种抑制性神经递质,在小鼠模型中观察到它可以减轻抑郁和焦虑症状。
就氨基酸精氨酸而言,它被代谢成四种多胺,即胍丁胺、腐胺、亚精胺和精胺,它们的作用机理是谷氨酸受体并参与维持突触可塑性和记忆形成。
从葡萄和葡萄酒中提取的白藜芦醇、从绿茶中提取的姜黄素和表没食子儿茶素-3-没食子酸酯等不同多酚通过激活蛋白激酶通路(如 Keap1/Nrf-2/ARE)发挥神经保护作用,而这些通路是缓解内源性和外源性 ROS 的主要通路。
主要参考文献
2020 Alzheimer’s disease facts and figures. Alzheimer’s Dement 2020;16:391–460.
Akasaka Naoki, Fujiwara Shinsuke. The therapeutic and nutraceutical potential of agmatine, and its enhanced production using Aspergillus oryzae. Amino Acids. 2020;52(2):181–197.
Barua Sumit, Kim Jong Youl, Kim Jae Young, Kim Jae Hwan, Lee Jong Eun. Therapeutic Effect of Agmatine on Neurological Disease: Focus on Ion Channels and Receptors. Neurochem Res. 2019;44(4):735–750.

谷禾健康

日常感觉疲劳,精力不好,稍微不注意就容易腹泻便秘,一不小心就感冒,更可怕的是,无论使尽各种方法依然减不下去的体重……
有以上状况的小伙伴注意,可能是慢性炎症在体内作怪。炎症是我们免疫系统的自然反应,也就是说身体和病原体斗争,试图自愈的过程。
根据时间和病理特征,炎症可以是急性和慢性的。
急性炎症来势汹汹,通常持续时间很短(几分钟到几天),包括淋巴细胞/嗜中性粒细胞和巨噬细胞迁移到炎症部位,刺激促炎细胞因子的释放【如:肿瘤坏死因子-α(TNF-α)、白细胞介素6 (IL-6)、高运动性蛋白B1(HMGB-1)】,以及细胞聚集,酶分解等。
NOD样受体(NLRs)(如NLRP3、NLRP1和NLRC4)的激活导致高度调节的蛋白复合物(称为炎症小体)的募集,其激活启动下游炎症细胞因子的产生,主要是白细胞介素1β(IL-1β)和白细胞介素18 (IL-18)对细胞应激的反应。
其他中介包括趋化因子、脂质介质、急性期蛋白如C-反应蛋白(CRP)、转录因子包括核因子κB(NF-κB)和主要免疫细胞类型。
然而,急性炎症如果不受控制,则可能发展为永久性疾病,导致组织损伤、血流动力学改变和器官衰竭。
慢性炎症就像温水煮青蛙,带来的损害缓慢,但是持久。事实上,慢性炎症与肥胖等非传染性疾病和相关的共病的发生有关。在这方面,肥胖导致脂肪细胞中的异常脂肪积累、免疫细胞浸润和促炎环境,从而破坏胰岛素信号级联诱导胰岛素抵抗。
炎症和氧化应激相互作用对于理解肥胖症的生理病理学至关重要,包括内质网功能受损、脂肪组织缺氧、线粒体改变和活性氧过度产生。
肠道微生物群与肥胖相关的低度炎症的发展有关,包括脂多糖易位和toll样受体4(TLR-4)结合,从而引发血液内毒素血症。
由此产生的未解决的免疫激活不仅影响局部组织,还影响全身生理学,即所谓的代谢性炎症。
本文讨论了不同营养因素对炎症的影响和最终调节,包括特定营养素(碳水化合物类型、蛋白质来源、结构脂肪酸、矿物质、微量元素)和生物活性化合物(多酚);饮食模式(即西方、地中海和北欧饮食);治疗性饮食(DASH饮食);常见烹饪原料(调味品和草药)等。
与人类炎症结果相关的营养因素

了解日常饮食中的营养物质对炎症的影响和调节,可以帮助我们在日常饮食中有意识地进行相应调整,从而更好地改善健康状况。
纵向和观察性研究表明,膳食维生素摄入量与炎症特征之间存在一些关联。
例如,维生素C和E或胡萝卜素的摄入与血清CRP浓度的概率成反比 > 美国成年人服用3 mg/L。
在横断面KORA研究中,剂量-反应分析显示,经常摄入超过78毫克维生素E/天的参与者的血清CRP水平比未接触任何额外维生素E来源的受试者低22%。
摄入含有维生素E和C以及B族复合维生素(B1、B2、B3、B5、B6、B9和B12)的膳食补充剂与女性血CRP水平降低相关。
饮食维生素K1(叶喹酮)摄入量变化的上三分位受试者(随访1年后)的IL-6和TNF-α血浆浓度比最低三分位组的受试者下降更大。
健康韩国成年人的膳食维生素B5摄入量与血清CRP浓度呈负相关。
消费 > 健康成人每天摄入310毫克的膳食胆碱(通常归入复合维生素B组),血液中CRP、IL-6和TNF-α浓度较低。
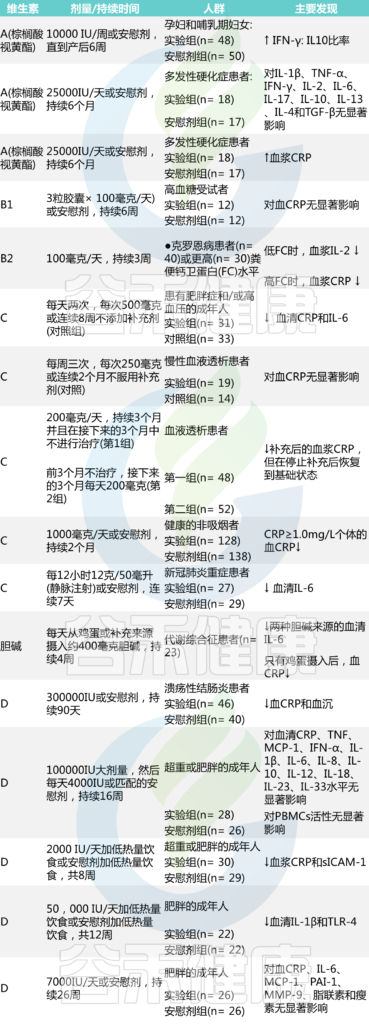
系统总结了探索维生素对炎症状态影响的临床试验结果(下表)。一些研究发现,补充维生素后有助于降低炎症。
表 临床试验:维生素和生物活性化合物抗炎作用

doi: 10.1007/s13679-022-00490-0
矿物质和微量元素对人体的结构、免疫和代谢功能至关重要。
高镁摄入与绝经后妇女体内潜在炎症标志物(CRP、sTNF-R2和IL-6)的血浆浓度降低有关。
在护士健康研究队列中,发现饮食来源的镁摄入量与血浆IL-6呈负相关。
一项嵌套病例对照研究报告,绝经后妇女的饮食锰与血清促炎细胞因子循环水平存在相反的关联。
据报道,淋巴细胞增殖和IL-2R表达的变化是健康男性轻度缺锌的早期标志。
膳食铜摄入量与成人血液CRP浓度直接相关。
反过来,肥胖相关炎症对肠道铁吸收的影响可能会加剧铁缺乏。
还显示了补充某些矿物质对人体抗炎作用的主要结果(下表)。
表 分析某些矿物质抗炎作用的临床试验



doi: 10.1007/s13679-022-00490-0
膳食碳水化合物对健康的影响取决于数量和质量特征。有趣的是,低碳水化合物饮食(总能量的20%)显著改善了糖尿病患者的亚临床炎症状态(血清IL-1Ra和IL-6水平较低)。
值得注意的是,坚持低碳水化合物饮食(占总能量的35%)可以降低肥胖女性的炎症标记物水平。
此外,低碳水化合物饮食的总体效果良好(≤ 30克/天)。此外,如其他地方报道的那样,与低脂饮食(总能量的24%)相比,极低碳水化合物饮食(占总能量的12%)可减少炎症反应。
血糖指数(GI)旨在根据对餐后血糖浓度的影响,从生理学上评估不同食物的碳水化合物质量。
有趣的是,高GI饮食(基于煮熟的意大利面,GI = 35)显著增加了瘦健康受试者单核细胞中NF-κB的激活率。
事实上,在糖尿病患者中,高GI饮食(GI > 70)诱导的负面代谢和炎症反应被低GI饮食(GI < 55)抵消。
此外,DIOGenes试验的结果表明,超重或肥胖受试者在减肥后,低GI碳水化合物(高GI碳水化合物的差异为15分)可以减少通过减肥饮食维持的低度炎症。
膳食纤维可能对健康有益,涉及一些免疫机制。因此,在糖尿病患者中,纤维摄入量等于或大于15 g/1000 kcal与血液CRP水平降低相关。
一项随机干预试验表明,从天然富含纤维的饮食或从补充剂中摄取纤维(30 g/天)可以显著降低瘦削正常血压参与者的循环CRP水平。
此外,中年成人膳食纤维摄入量(平均16.8克/天)和CRP血清浓度之间存在显著的负线性关系。
扩展阅读:肠道菌群与蛋白质代谢
膳食脂肪在生物体内引发许多基本功能;然而,过度消耗脂肪可能导致肥胖和相关的低度炎症过程。
事实上,临床证据表明,高脂饮食(即接近总能量的75%)会导致循环游离脂肪酸的过度生产和全身炎症。
一直以来,低脂饮食(占能量需求的25%)与糖尿病患者血浆IL-6水平降低相关。
越来越多的证据表明,膳食饱和脂肪酸(SFA)在肥胖和炎症之间起着重要的联系。
有趣的是,与摄入正常饱和脂肪的受试者相比,摄入超过10%能量作为饱和膳食脂肪的受试验者血清CRP水平升高(< 7%的热量摄入)。
同样,摄入膳食饱和脂肪酸(100毫升饱和脂肪含量为70%的乳脂)导致女性血浆CRP的脂质诱导升高,与肥胖状况无关。
单不饱和脂肪酸(MUFAs)被认为是一种健康的脂肪,油酸(OA)是日常营养中最常见的MUFA。
在这种情况下,一项针对日本人群的横断面流行病学研究报告,油酸摄入量(平均占总能量的6.94%)与血清CRP浓度之间存在显著的负相关。
对于不同剂量的MUFA治疗炎症特征的进一步对照试验是有保证的。
在过去的几年里,大量证据支持多不饱和脂肪酸(PUFAs)在预防心血管疾病和其他炎症性慢性疾病方面的有益作用。
在这种情况下,健康人n-3 PUFA二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)的摄入量与血浆中可溶性TNF受体1和2的水平呈负相关。
此外,总膳食n-3 PUFA与女性CRP和IL-6的血水平呈负相关。
此外,一些临床试验评估了高PUFA饮食处方或通过补充PUFA对炎症结果的影响。例如,鱼油补充(38.2克/天EPA + 90天内的DHA)降低了高血压患者血液中促炎症标记物的水平。
健康的年轻人服用n-3 PUFA(2.5 g/天,2085 mg EPA和348 mg DHA)12周后,血清IL-6水平下降了14%。
在超重成人中,低(1.25 g/天)或高(2.5 g/天)剂量的n-3 PUFA补充4个月可以减少炎症反应(特别是血清IL-6和TNF-α浓度)。
反式脂肪酸(TFA)主要由植物油氢化或反刍动物衍生食品(包括乳制品和肉类)在工业上形成。
反式脂肪酸摄入量与女性血浆炎症生物标志物(包括CRP、VCAM-1、E-selectin)呈正相关。
在同一人群中,反式脂肪酸的摄入与可溶性TNF受体1和2的血浆水平呈正相关,主要是在体重指数较高的女性中。
男性服用TFA(占总脂肪的8%)后血清CRP浓度升高。
胆固醇过高可能会对健康产生有害影响,包括一些影响炎症状态的过程。
例如,在伊朗成年人中,血清CRP浓度的最高四分位数(5.9 mg/L)与饮食胆固醇的摄入量较高(189 mg/天)有关。
在大量具有代表性的中东人群中,发现饮食胆固醇和血浆CRP水平之间存在正相关。
膳食蛋白质的数量和质量是营养价值和身体/内分泌稳态的主要决定因素。
在Framingham心脏研究后代队列的参与者中,膳食蛋白质摄入量(尤其是植物来源的蛋白质)与血清炎症标记物(如IL-6和CRP)呈负相关。
此外,摄入高(总能量的30%)或低(总能量10%)蛋白质饮食会导致病态肥胖个体的血液CRP浓度降低。
关于蛋白质来源,以较高动物蛋白质摄入量(高脂肪和加工肉类水平)为特征的饮食与某些血液促炎标记物(如CRP、IL-6、TNF-a、IL-8、血清淀粉样蛋白a和糖蛋白乙酰化)呈正相关。
此外,RESMENA膳食研究的结果(30%的能量来自蛋白质)表明,动物和肉类蛋白质摄入量与炎症之间存在正相关,而蔬菜或鱼类来源的蛋白质对炎症状态没有显著影响。
扩展阅读:肠道菌群与蛋白质代谢
多酚是一大类生物活性分子,广泛存在于植物性食品中,具有强大的抗氧化和抗炎特性。在这种情况下,据报道,美国成年人的总黄酮摄入量与血清CRP浓度呈负相关。
在多种族队列中,黄烷酮消耗量与血液IL-6浓度呈负相关。同样,异黄酮摄入量较高(最高四分位数 = 1.61–78.8 mg/天)与健康绝经前妇女血浆CRP降低有关。
此外,在黄酮、黄烷酮和总黄酮摄入量较高的女性中,发现血清IL-8水平较低(五分位数最高 = 分别为264 ng/L、273 ng/L和276 ng/L)。
此外,台湾人群总黄酮摄入量和茶叶摄入量的增加与CRP水平呈负相关。
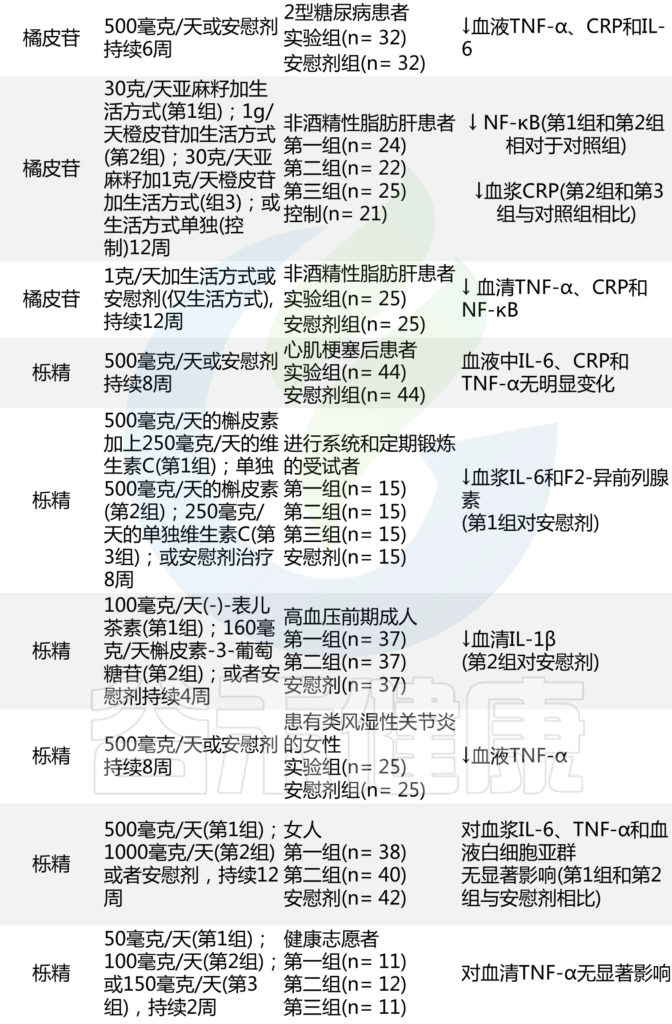
值得注意的是,许多随机临床试验已经测试了几种多酚的抗炎潜力,其结果总结如下:
表 分析某些多酚抗炎作用的临床试验


doi: 10.1007/s13679-022-00490-0
扩展阅读:
关于对炎症的影响,总摄入(中位数54 g/天)、未加工(中位数47 g/天)。
在多民族队列研究中,红肉和加工肉消费与血清CRP水平呈正相关。
在英国成年人中,食用加工肉与血清CRP水平增加有关(每天摄入50克以上,差异为38%)。
在调整后的模型中,在大量美国样本中,红肉消耗量与血液CRP显著相关。
在一项针对巴西人的横断面研究中,增加酸奶摄入量(中位数为10克/天)似乎会产生抗炎作用,而奶酪摄入量的增加(中位数10.7克/日)可能会加剧促炎状态。
在体重正常的青少年中,总乳制品和牛奶摄入量与血清IL-6浓度呈负相关。
ATTICA研究的结果显示,每周食用11-14份乳制品的人的CRP、IL-6和TNF-α血水平低于每周食用8份以下的人。
ATTICA研究结果显示,习惯性鱼类消费之间存在独立关联(> 每周食用300克鱼),并降低健康成年人的炎症标记物水平,包括CRP、IL-6、TNF-a、血清淀粉样蛋白a和白细胞计数降低。
在6年的随访中,食用鱼(约100克/周)可降低健康成人的内皮功能障碍和轻度炎症。
在表面上健康的日本人群中,高频率摄入鱼类与较低的外周血白细胞计数(慢性炎症标志物)相关。
事实上,随着每周摄入鱼的频率(0天、1-2天、3-4天或5-7天)的增加,全身炎症的标志显著降低(全身炎症的标志:中性粒细胞/淋巴细胞比率)。
近年来,食用昆虫被公认为具有抗炎和抗氧化特性的高价值食品。
例如,在健康成年人中,蟋蟀摄入量(25克/天)与通过微生物群调节减少全身炎症相关。
然而,需要对人类进行更多的研究来证实这些发现,以便推荐习惯性食用食用昆虫作为消炎疗法。
伊朗女性的水果和蔬菜摄入量与血清CRP水平呈负相关。
中国女性食用大量十字花科蔬菜(最高五分之一 > 140.6 g/天)显示循环中TNF-α、IL-1β和IL-6水平降低。
在一项随机交叉试验中,14天内食用十字花科蔬菜(14 g/kg体重)持续降低健康年轻人的循环IL-6.
在动脉粥样硬化的多种族研究中,经常食用坚果和种子(尤其是每周五次或五次以上)与较低水平的炎症标记物相关,包括IL-6和CRP。
在两个大的美国人队列中,与从未或几乎从未的频率类别的个体相比,每周坚果摄入五次或更多次的受试者的CRP和IL-6血浓度显著降低。
对随机对照试验的系统回顾和荟萃分析显示,摄入亚麻籽和相关营养衍生物系统地降低了肥胖受试者的循环CRP水平。使用同样的方法,急性高油酸花生摄入系统性地导致超重/肥胖男性餐后TNF-α浓度的下调。
研究表明,在健康饮食中添加杏仁(4周内每天56克)可以改善中国糖尿病患者的炎症和氧化应激。
一项随机试验还发现,在健康成年人中,食用杏仁(用杏仁替代对照饮食10–20%等量摄入4周)可以降低血清CRP水平。
事实上,在青少年和青年人中,杏仁喂养(每天56克,持续90天)后,血浆TNF-α和IL-6水平下降。
据报道,每天服用50毫升特级初榨橄榄油(EVOO),为期两周,可降低稳定型冠心病患者的血浆IL-6和CRP水平。
EVOO(50 mL)对正常血压的健康受试者具有急性餐后抗炎和抗氧化作用。
有趣的是,在糖尿病妇女中,谷类纤维的摄入与较低的CRP和TNF-R2血液水平呈负相关。
超重和肥胖受试者食用全麦小麦(8周内每天70克)后,血清TNF-α水平下降,血浆IL-10水平升高。
GRANDIOOS研究的结果表明,食用全麦小麦(每天98克,持续12周)可能会促进超重/肥胖和轻度高胆固醇血症患者的肝脏和炎症恢复力。
在中国中年女性中,食用大豆食品与炎症标志物(如IL-6、TNFα和可溶性TNF受体1和2)的循环水平呈负相关。
与习惯性饮食相比,一项为期6周的富含豆类的饮食营养试验(在所有干预阶段共摄入24包65克)显著降低了糖尿病患者的CRP浓度。
基于豆类的低热量饮食(每天160–235克,持续8周)持续降低超重/肥胖受试者的促炎状态并改善代谢特征。
在肥胖女性中,8周内补充绿茶提取物(450 mg/天)改善了氧化应激生物标记物,降低了IL-6循环水平。
3个月内饮用绿茶(379 mg/天)可降低肥胖、高血压患者的血清CRP和TNF-α浓度。
高咖啡消耗量(每天8杯)对习惯性咖啡饮用者的亚临床炎症产生了有益影响。
一直以来,在健康和糖尿病女性中,饮用咖啡与炎症标记物和内皮功能障碍呈负相关。
在年龄较大的非西班牙裔白人中,大量饮用咖啡(等于或超过2.5杯/天)的人全身炎症较低。
另一方面,来自ATTICA研究的分析报告称,中度至重度咖啡摄入后,炎症标记物(包括IL-6、TNF-α和CRP)增加(> 200毫升咖啡/天),强调剂量对结果的重要性。
补充蜂胶和限制热量饮食8周可以显著改善非酒精性脂肪性肝病患者的血糖稳态、肝纤维化评分和肝功能。
一项双盲安慰剂对照随机临床试验,44名非酒精性脂肪性肝病患者,用蜂胶和热量限制饮食(500千卡/天)干预,发现炎症因子降低,包括肿瘤坏死因子-α (TNF-α)、toll样受体-4 (TLR-4)和单核细胞趋化蛋白-1 (MCP-1)的血清水平以及肝酶和脂肪肝的严重程度显著降低。
现有证据表明,定期食用黑巧克力可能会减少炎症,尤其是对于每3天食用一份(20克)黑巧克力的消费者而言。
在一项随机平行临床试验中,与仅遵循一般生活方式指南的受试者相比,服用黑巧克力(8周内服用30克84%的黑巧克力)并保持健康生活方式的糖尿病患者的炎症标记物(CRP、TNF-α和IL-6)水平较低。
事实上,急性黑巧克力摄入(50克)通过增加IL-10的表达和减弱细胞内促炎性应激反应而引发抗炎症结果。
健康女性在摄入黑巧克力(一周内每天100克)后,CRP的血液水平较低,这在男性中没有发现。
在过去几十年里,几项调查已经确定了香料和草药在预防和治疗各种慢性病方面的有效作用。这些烹饪成分的多种健康特性归因于具有潜在抗炎特性的生物活性成分,如含硫分子、单宁、生物碱和酚类二萜。下表总结了探索香料对炎症状态影响的临床试验结果。
表 分析某些香料和烹饪成分抗炎作用的临床试验
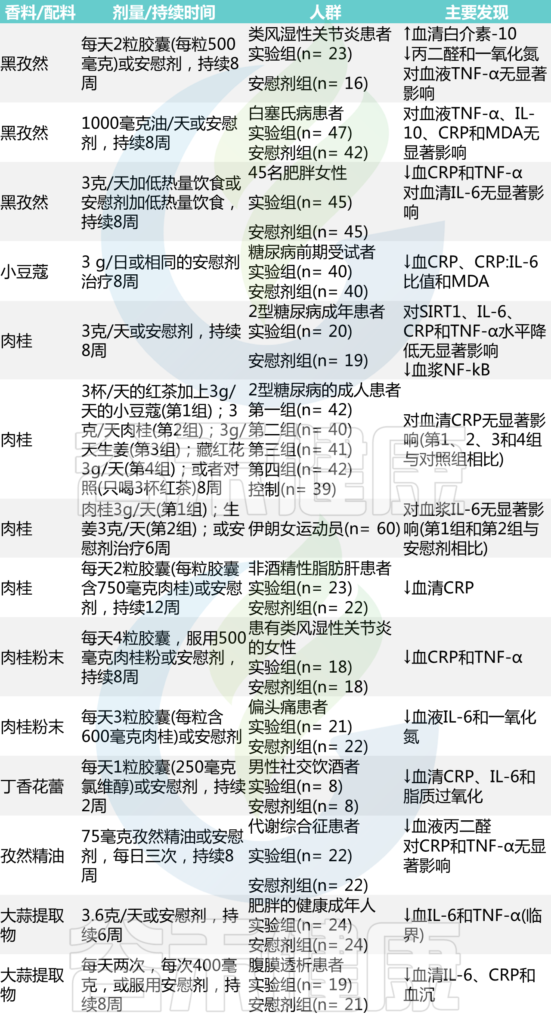

doi: 10.1007/s13679-022-00490-0
益生菌、益生元和合生元是有益的微生物、底物(多糖和寡糖)或最终也可能缓解炎症症状的组合。
对于糖尿病患者,建议补充益生菌和合生元,通过持续降低循环中CRP和TNF-α的水平来减少炎症表现。
关于肠道疾病,最近有报道称,使用益生菌(基于乳酸杆菌和双歧杆菌)和合生元可以促进抗炎反应并平衡肠道内稳态。
短链脂肪酸(称为后生元的非活性细菌产物)的抗炎作用是通过抑制肠上皮细胞中的NF-κB通路、Treg细胞分化和促炎细胞因子阻断来介导的。例如,干酪乳杆菌DG和衍生后生物抑制肠易激综合征患者结肠粘膜中IL-8、IL-1α、IL-6和TLR-4的表达水平。
关于益生菌,益生元在此就不详述了,在前面的文章已有介绍,详见:
总的来说,植物性饮食已经证明可以改善肥胖相关的炎症状态。
值得注意的是,在北美,素食对血液CRP和IL-6水平的有益影响是由BMI介导的。此外,一项系统回顾和荟萃分析显示,素食饮食模式也降低了免疫生物标志物,如纤维蛋白原和白细胞总浓度。
对观察性和干预性试验的系统审查表明,北欧饮食(以北欧国家的主食为基础)对低度炎症缓解有积极影响。潜在机制包括代谢综合征患者的促炎症基因下调,尤其是TNFRSF1A和RELA。
南欧大西洋饮食(SEAD)是葡萄牙北部和西班牙加利西亚的传统饮食,其特点是摄入更多的鱼、牛奶、土豆、水果、蔬菜和橄榄油以及红酒。总体而言,SEAD依从性与炎症标记物(主要是CRP)的血浆浓度降低和心脏代谢风险降低相关。
就亚洲地区而言,健康的日本饮食模式(富含蘑菇、海藻、大豆制品和土豆、蔬菜、鱼类/贝类和水果)似乎可以发挥抗炎作用,改善当地消费者的心理健康。
一些中药已经显示出抑制促炎途径和控制炎症相关疾病。
墨西哥传统饮食(TMexD)已证明可以降低墨西哥裔女性的全身炎症和胰岛素抵抗风险。TMexD的特定食物包括玉米、豆类、辣椒、南瓜、番茄、仙人掌和洋葱,它们富含纤维、维生素、矿物质和辣椒素,具有潜在的抗炎和抗氧化特性。
在一项综合横断面研究中,旧石器时代饮食(基于蔬菜和水果、瘦肉、鱼类、坚果和钙来源的多样性消费)与人类较低水平的全身炎症和氧化应激相关。
在6周内,DASH饮食模式(以水果和蔬菜、低脂乳制品和复合碳水化合物的大量摄入为特征)降低了代谢综合征青少年的CRP循环水平。在女性成年人中,DASH饮食与伊朗人血清CRP水平较低有关,但与IL-17A浓度无关。定量评估显示,随访4周后,DASH饮食使CRP降低了13%。
PREDIMED试验的结果表明,地中海饮食(富含蔬菜和水果、纤维和维生素C和E)具有抗炎作用,因为它下调了动脉粥样硬化形成过程中涉及的细胞和循环炎症生物标记物。
在这个队列中,地中海饮食降低了血清CRP和IL-6水平,以及内皮和单核细胞粘附分子和促炎性趋化因子。此外,在随访1年后,Med饮食(包括EVOO和蔬菜)降低了心血管高危患者的血浆TNFR60浓度。长期(3年),PREDIMED试验通过与对照低脂饮食相比降低IL-1β、IL-6、IL-8和TNF-α水平,证实了Med饮食的抗炎作用。
总的来说,西式饮食(WTD)含有大量不健康的脂肪、精制谷物、糖和盐,会引发慢性代谢性炎症。在这方面,在护士健康研究I队列中,西式饮食与炎症和内皮功能障碍标志物呈正相关。此外,伊朗女性的西式饮食评分与CRP和IL-6促炎标记物呈正相关。
有趣的是,巴西妇女食用含有大量游离糖、总脂肪、膳食饱和脂肪酸、反式脂肪酸和钠的超加工食品(UPF)与血清CRP水平之间存在正相关。同样,超加工食品中上三分之一的巴西青少年(≥ 总能量的30%)与第1三分位青少年相比,循环IL-8浓度增加(≤ 15.9%的总能量)。
此外,瑞典类风湿关节炎患者的不良饮食质量(考虑到习惯性随意饮食,如糖果、蛋糕、软饮料和油炸土豆)与炎症增加有关,如血浆CRP和红细胞沉降率。
生物节律和营养分析(称为“时间营养”)的最新进展表明,一天中进食的时间可能会影响代谢稳态和免疫功能。
在这种情况下,在饮食质量较差的成年人中,不吃早餐与血清CRP浓度升高之间存在显著关联。在一项随机对照交叉试验中,不吃早餐会导致人类外周血单核细胞和单核细胞中NLRP3炎性体的更高活化。
间歇性禁食(IF),即个体连续或隔天禁食,改善了肥胖男性的全身炎症。然而,在超重或肥胖的女性中发现了间歇性禁食后,脂肪组织中巨噬细胞浸润(CD40+)和骨骼肌(CD163 +)的生物标志物短暂升高。
现有证据表明,限时饮食(TRE)是一种基于一天活动期总热量摄入巩固的替代时间营养方法,可能会调节多种代谢疾病风险因素,包括炎症。事实上,已经假设TRE作为定期营养计划的一部分,可能有助于减少炎症,并对免疫系统的某些组成部分产生保护作用。
有趣的是,代谢综合征患者在隔日禁食(ADF)后,血液CRP水平显著下降,ADF包括“禁食日”,热量摄入有限,而“喂食日”则是随意进食。此外,隔日禁食降低了健康非肥胖受试者血浆中sICAM-1(年龄相关炎症标记物)的水平。
此外,据报道,晚吃是指推迟用餐时间(通常是一天的主食或晚餐),可能会增加患心脏代谢疾病的风险。事实上,晚吃与腹部肥胖、炎症生物标志物(如IL-6和CRP)以及儿童的昼夜节律紊乱有关。
对精确变量(年龄、性别、身体表型、习惯性饮食摄入、体力活动水平和生活方式)以及个性化问题(遗传背景、表观遗传特征、微生物群组成、基因表达谱和代谢指纹)的综合分析可能有助于制定更个性化的治疗方案,以改善炎症的营养和药物管理。
例如,有证据表明,遗传变异可能通过与环境因素(如饮食)的相互作用,调节个体对与炎症相关的慢性和急性疾病的易感性,从而易诱发炎症状态。
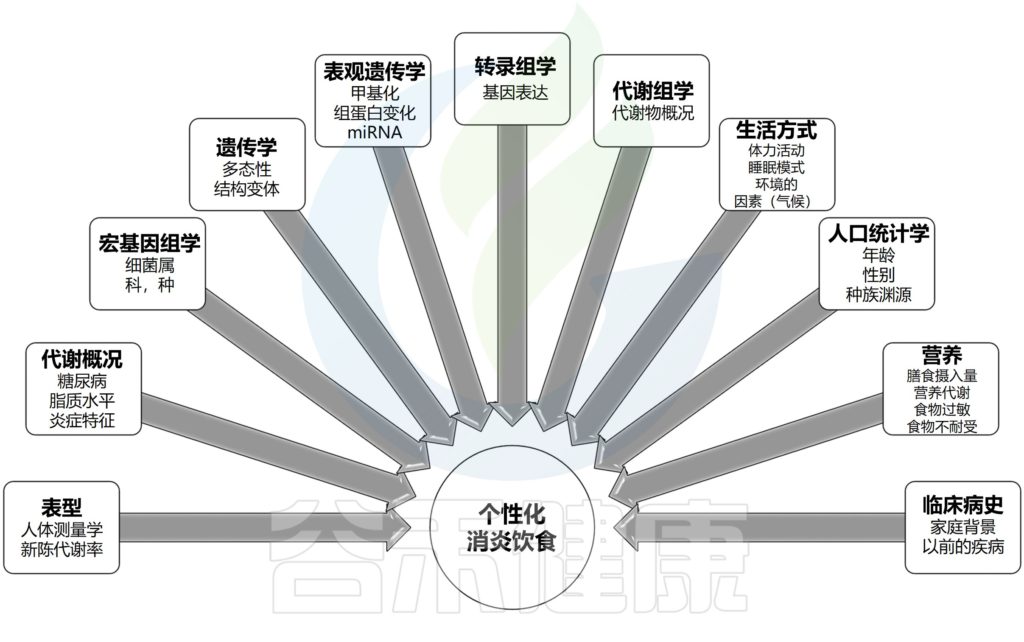
表观遗传标记(包括DNA甲基化、miRNA表达和组蛋白修饰)在炎症基因转录中起着基础作用。
值得注意的是,基于微生物群的回归模型已经能够预测人类肥胖相关炎症状态,这可能是精确管理炎症性的有用工具。
具有促炎和抗炎作用的基因表达最终决定炎症的结果。
代谢组学是一种综合方法,可用于剖析炎症的局部和全身代谢后果,为炎症疾病的调节提供新的见解。
这些应用有助于阐明独特和特异的炎症代谢类型,扩大了我们对人类代谢复杂性和多样性的理解。
总的来说,这些新颖的科学见解正带来精确药物/营养战略,以预防和控制具有炎症背景的流行性慢性病。
营养物质对生命和健康至关重要,不仅有助于疾病预防、健康维护和疾病管理,而且可以抵御内源性和外源性有害因素,包括炎症/氧化应激或免疫系统功能障碍。
促炎
促炎营养因素包括大量食用富含简单碳水化合物、膳食饱和脂肪酸、TFA、胆固醇和动物蛋白的食物,以及习惯性不吃早餐和晚吃暴食。
抗炎
潜在的抗炎化合物包括MUFA、PUFA、抗氧化维生素和矿物质、生物活性分子(多酚)、特定食品(乳制品、全谷物、鱼类、油籽、水果和蔬菜、食用昆虫、豆类、绿茶和咖啡),烹饪香料(肉桂、姜、小茴香、大蒜和姜黄)和一些饮食习惯,包括间歇性禁食和限时进食。
由于研究之间存在不一致和差异,考虑到异质性的关键方面,包括人群类型(祖先)、最低和最高水平以及不利影响、烹饪方法、生理病理状态和干预时间,仍需在该领域进行进一步研究。
目前的证据有助于理解营养与代谢性炎症之间的关系,为慢病的控制和管理提供了新的见解和潜在目标。
主要参考文献:
Ramos-Lopez O, Martinez-Urbistondo D, Vargas-Nuñez JA, Martinez JA. The Role of Nutrition on Meta-inflammation: Insights and Potential Targets in Communicable and Chronic Disease Management. Curr Obes Rep. 2022 Oct 18. doi: 10.1007/s13679-022-00490-0. Epub ahead of print. PMID: 36258149.
Li C, Xu MM, Wang K, Adler AJ, Vella AT, Zhou B. Macrophage polarization and meta-inflammation. Transl Res. 2018 Jan;191:29-44. doi: 10.1016/j.trsl.2017.10.004. Epub 2017 Nov 3. PMID: 29154757; PMCID: PMC5776711.
Nikbaf-Shandiz M, Tutunchi H, Khoshbaten M, Nazari Bonab H, Ebrahimi-Mameghani M. Propolis supplementation in obese patients with non-alcoholic fatty liver disease: effects on glucose homeostasis, lipid profile, liver function, anthropometric indices and meta-inflammation. Food Funct. 2022 Oct 20. doi: 10.1039/d2fo01280d. Epub ahead of print. PMID: 36263703.
Rossi JF, Lu ZY, Massart C, Levon K. Dynamic Immune/Inflammation Precision Medicine: The Good and the Bad Inflammation in Infection and Cancer. Front Immunol. 2021 Feb 23;12:595722. doi: 10.3389/fimmu.2021.595722. PMID: 33708198; PMCID: PMC7940508.