-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
微生物市场
当今全球生物医药投资领域,资本的嗅觉正在追逐下一个能够颠覆行业的风口。微生物组疗法正凭借其在慢病治疗领域的巨大潜力,迅速成为最受瞩目的焦点,它为无数传统药物难以解决的健康难题提供了全新的解决方案。
随之而来的,便是对其上下游的巨大需求,一个全新的、千亿级的市场正在悄然形成。
最新数据显示,2025年,全球微生物组制造市场规模预计将达到315.9亿美元,并有望在2034年飙升至约1303.7亿美元(约合人民币9200亿元),预测期内(2025-2034年)的复合年增长率高达17.06%。
这预示着一个新兴的生物技术赛道正在从潜力股转变为绩优股。如此强劲的增长势头并非偶然,其背后是由基础研究的资金支持、创新疗法的监管批准、市场需求的激增、生产能力的全球扩张等多重核心因素共同驱动的结果。
本文,我们基于Precedence Research机构最近出的2025年~2034年微生物制造市场规模及预测报告及其他最新资讯,来了解一下这个充满活力的市场。从占据主导地位的益生菌到潜力无限的活生物治疗产品到微生物检测应用,其产业链的各个环节,并探讨人工智能等前沿技术如何赋能这一变革,以及在迈向千亿市场的征途中,行业必须克服的复杂工艺和高昂成本等挑战。旨在为广大投资者、科研人员和相关产业从业者提供一个全面的微生物制造市场前景分析。
微生物组制造市场涵盖了用于人类健康、营养和诊断的活体微生物疗法、益生菌和微生物群落的开发与规模化生产。
其核心是利用先进的发酵技术和生产系统,在严格受控的环境中培养复杂的微生物群落,以确保产品的效力、稳定性和治疗精度。
该领域的成熟度在监管层面得到了印证。美国食品药品监督管理局(FDA)在2022年和2023年相继批准了Rebyota和Vowst这两款用于治疗复发性艰难梭菌感染的微生物组产品。这两项里程碑式的批准,不仅为活体微生物产品的商业化铺平了道路,也确立了其科学和监管路径。与此同时,欧洲药品管理局(EMA)和加拿大卫生部等机构也纷纷出台支持性框架,标志着全球正在协同推动微生物组产品的应用。
■ 驱动力:慢病高发与个性化需求催生巨大市场
慢病和生活方式相关疾病的日益流行,是推动微生物组制造市场增长的核心引擎。胃肠道疾病、代谢综合征、自身免疫性疾病和肥胖等问题,为基于微生物组的疗法创造了巨大的应用场景。医疗保健正从“对症下药”转向“调节失衡”,即通过靶向调节微生物群来从根源上解决问题。
根据世界卫生组织(WHO)2024年的报告,2022年全球有25亿成年人超重,其中8.9亿人患有肥胖症。此外,美国疾病控制与预防中心(CDC)2024年的数据显示,约有240万~310万美国成年人患有炎症性肠病。这些庞大的患者群体,为微生物组产品的治疗靶点提供了坚实的市场基础。
“微生物组产业有哪些新的市场细分或应用正在打开?
除了肠道健康之外,四个新兴应用领域代表了超越传统肠道健康应用的显著扩张机会,每个领域都针对未满足的临床需求,并拥有不同的监管途径。
“下一代测序和生物信息学成本快速下降
全基因组测序价格从2020年的每样本1万美元下降到2024年低于1000美元,同时计算成本降低了60%,实现了内部分析和患者分层的大众化。鸟枪法宏基因组学的普及使中型生物技术公司能够快速迭代细菌群落,指导个性化剂量,并为预测宿主-微生物药效的机器学习模型提供数据。这些进步降低了试验成本,提高了微生物组治疗市场临床成功的可能性。
“加速风险投资资金和大型制药公司合作
2024 年风险投资承诺额达到 5 亿美元,同比增长 40%,投资者优先考虑具有多适应症潜力的平台。雀巢健康科学的收购 VOWST™权利凸显了大型制药公司的兴趣,并预示着主流市场的广泛接受。战略联盟经常捆绑临床资产和独家生产名额,反映了稀缺发酵产能的需求。
合作伙伴关系现在强调人工智能驱动的发现和菌株级别的知识产权组合,为微生物组治疗市场在 2030 年之前继续保持交易活动奠定了基础。
同时,消费者对肠道健康的认知不断提升,对根据个人需求量身定制的个性化营养解决方案兴趣浓厚,这进一步推动了市场的扩张。
■ 制约:高昂的制造复杂性构成挑战
尽管前景广阔,但微生物组制造的道路并非一帆风顺。其最大的挑战在于高度的制造复杂性。活体生物治疗产品通常需要培养多种微生物菌株,每一种都需要高度受控的生长条件。发酵过程中的微小偏差都可能导致批次间的差异,增加成品不合格的风险,从而对规模化生产构成挑战。此外,高昂的生产和运营成本也可能对盈利能力产生负面影响,制约着市场的发展。
■ 机遇:研发投入激增,加速制造需求
幸运的是,全球对微生物组研发的投资正在以前所未有的力度增长。数十亿美元的资金正涌入微生物基因组学、合成生物学平台和人体临床试验等领域。科技巨头、制药公司和国际组织纷纷资助专注于新型微生物疗法的生物技术初创公司。
例如,美国国立卫生研究院(NIH)在2024年宣布,其超过25%的微生物组相关资金将用于支持活体生物治疗药物的规模化生产和制造准备。欧盟的“地平线欧洲2024”计划也包含了对微生物组项目的专项资助。这些投资不仅推动了生物加工技术的创新,也为满足严格的监管要求提供了保障。
人工智能(AI)正在为微生物制造领域带来一场革命,它使整个价值链的流程变得更智能、更快速、更可靠。
AI的融入,正在显著提升微生物组制造的效率和成功率,为市场的指数级增长注入了强大动力。
■ 按产品类型:益生菌主导,活体生物疗法潜力巨大
2024年,益生菌细分市场占据了主导地位,市场份额高达40%。这得益于其在胶囊、粉剂、饮料等多种剂型中的稳定配方,以及在消化和免疫支持方面得到证实的健康声明。
合生元和后生元绕过了冷链障碍,使它们能够在缺乏强大物流的地区渗透。微生物群衍生的代谢物虽然处于早期阶段,但由于小分子熟悉和可扩展的化学性质,吸引了制药行业的兴趣。
然而,增长最快的将是活体生物治疗药物(Live Biotherapeutics)领域。随着监管先例的建立,针对特定疾病的临床项目预计将大幅增加,其利用AI菌株筛选和厌氧发酵控制等先进技术,有望提高GMP批次的效力和一致性。
■ 按制造工艺:发酵为王,制剂与包装成新增长点
在制造工艺方面,发酵在2024年贡献了最大的收入份额(50%)。通过在受控的生物反应器中培养高密度菌株,制造商能够确保临床和商业批次的一致性。
展望未来,制剂与包装环节预计将以最快的复合年增长率增长。随着行业对活体产品稳定性、保质期和靶向递送的日益重视,对冻干、微胶囊化和控释基质等技术的投资正在增加。
■ 按终端用户:药企领跑,CDMO服务需求激增
制药与生物技术公司是2024年最大的终端用户,占据了55%的市场份额。这些公司已将微生物组发现纳入其药物管线,并拥有结合宏基因组学分析、菌株工程和转化药理学的专业团队。
与此同时,合同开发生产组织(CDMOs)预计将成为增长最快的细分市场。
注:合同开发生产组织(CDMO)是指那些为制药、生物技术和其他行业提供药物开发和生产服务的公司。它们为客户提供从药物研发到商业化生产的全过程外包服务。
由于微生物制造的复杂性,越来越多的公司选择外包服务。像Lonza这样的大型CDMO正在投资建设专用的微生物生产套件和一次性发酵罐,以满足日益增长的GMP级别外包需求。
■ 按技术平台:厌氧发酵是基石,微流控技术是未来
厌氧发酵平台在2024年占据了约45%的最大收入份额,是生产严格厌氧菌和肠道共生菌的核心技术。而基于微流控的培养技术(Microfluidics-based Culturing)则被视为未来增长最快的领域。该技术能够实现高通量分离、单细胞培养和受控的共培养,极大地加速了发现和早期生产过程,特别是在开发个性化和精准微生物疗法方面展现出巨大潜力。
■ 按应用领域:肿瘤学从概念验证转变为流程优先
复发性艰难梭菌感染在2024年占据38.45%的市场份额,成为微生物组治疗市场的商业立足点。真实世界数据显示,30天再入院率从24%下降到不到8%,增强了医疗系统需求。
肿瘤学代表增长最快的应用领域,以36.33%的复合年增长率发展,因为联合组织与检查点抑制剂协同作用并减轻免疫相关不良反应。
黑色素瘤和结直肠癌的II期临床试验结果已促成多中心试验,制药合作伙伴将微生物组调节视为伴随诊断机会。
除了这些基础应用外,炎症性肠病试验利用特定菌株恢复黏膜稳态,而代谢紊乱项目则通过胆酸信号调节胰岛素敏感性。神经系统应用从肠-脑轴数据中获得支持,帕金森病和自闭症研究正进入I期试验。
■ 北美:全球市场规模较大
2024年,北美市场以40%的份额主导了全球市场,其市场规模超过107.9亿美元。美国市场尤为突出,预计将从2024年的75.5亿美元增长到2034年的372.2亿美元。这一领先地位得益于哈佛医学院、斯坦福大学等顶级学术中心的转化研究,以及NIH的大量资金支持。
此外,大型CDMO和设备供应商对厌氧发酵套件、无菌灌装生产线等基础设施的投资,也极大地提升了该地区的生产能力。
■ 亚太地区:增长最快的新兴力量
亚太地区预计将成为预测期内增长最快的市场。2024年,该地区各国政府和机构加大了研发投入、提高了监管透明度并扩大了生产能力。
中国的庞大患者群体加速了试验招募,而海南省的博鳌乐城试验区加速了早期准入计划。
日本药品和医疗器械管理局在2024年采用了以美国食品药品监督管理局为中心的定义,促使他们大型企业获得西方平台许可。
跨国赞助商与区域人才发展的战略联盟,也正在加速技术转让和商业推广,使亚太市场成为不容忽视的新兴力量。
欧洲在绝对收入方面落后,但拥有一个复杂的研究基础。德国和英国是制造中心,利用生物工艺专长和研发税收抵免。监管滞后限制了近期的产品推出,但预计到2027年,欧洲药品管理局的协调将释放被压抑的需求。
2025年1月
Biohm Technologies 宣布将其长寿肠道报告作为其肠道微生物组检测平台的一部分推出。该功能利用人工智能和先进的生物信息学,评估个人肠道微生物组组成如何影响衰老过程。通过分析超过 1000 万个数据点,并识别出与长寿相关的近 100 种关键细菌和真菌类群,该公司开发了一个由机器学习和深度学习技术支持的可预测模型。
2025年2月
肠道微生物组研究领域的新兴公司MicrobioTx推出了一系列新的益生菌,以满足不同的健康需求。在印度微生物组科学家Palok Aich博士的指导下开发的配方旨在满足印度人群独特的微生物组需求。旗舰产品线包括DigesTx、MoodTx、GlucoTx和LeanTx,分别针对消化健康、心理健康、葡萄糖代谢和体重管理。
2025年2月
华大智造(MGI)推出了微生物组代谢编码测序包(MMSP),该包建立在该公司的DNBSEQ-G99和DNBSEQ-E25测序平台上。该新软件包专为全球微生物组研究人员设计,可使用16S/ITS rDNA测序进行全面的群落分析,为微生物分类和功能探索提供了一种高效且经济高效的方法。该技术使科学家能够研究包括人类健康、环境、工业和农业在内的各个领域的微生物多样性、丰度和相互作用。
2025年4月
全球代谢组学领导者Metabolon, Inc.推出了一种先进的微生物组研究解决方案,该解决方案将宏基因组测序与新型微生物组代谢物小组相结合。该集成工具包不仅可以识别微生物种类和遗传潜力,还可以揭示它们的代谢活动和生物活性化合物的产生,从而更深入地了解与诊断、治疗和精准医学相关的宿主-微生物相互作用。
2025年6月
达能北美公司,全球最大的B类认证公司之一,宣布了2024-2025年度肠道微生物组、酸奶和益生菌奖学金计划的获得者。今年,范德比尔特大学的Owen Hale和莱斯大学的Ella Ramamurthy获得了25000美元的研究资助,用于支持旨在深化对酸奶、益生菌和肠道微生物组科学理解的创新项目。
随着科学进步与临床应用的突破,微生物治疗市场的竞争格局正在被重塑。如今,行业领导力取决于跨学科的整合能力、高效的战略合作以及对市场的敏锐洞察——唯此方能驾驭挑战,抓住未来机遇。
全球微生物组制造市场正站在一个历史性的拐点。从不断增长的市场规模,到AI等颠覆性技术的应用,再到日益明朗的监管路径,所有迹象都预示着这个千亿级的蓝海市场正从概念加速走向现实。
与制造端并驾齐驱的是精准检测技术的飞跃。从判别菌群失衡,到评估微生物疗法效果,制造与检测的协同发展,将共同构筑起一个从诊断、生产到治疗的完整产业生态,驱动个性化健康管理的实现。
未来,随着科学研究的不断深入和制造技术的持续革新,我们有理由相信,基于微生物组的创新疗法和健康产品将深刻改变慢性病治疗和大众健康的未来图景。对于身处其中的企业、研究者和投资者而言,这无疑是一个充满挑战与无限机遇的黄金时代。
在微生物组产业的拐点上
告别营销炒作
回归科学实证
创新决定未来
主要参考资料
precedenceresearch. Microbiome Manufacturing Market Driving Innovation in Probiotics and Live Biotherapeutics,Sep 04, 2025
mordorintelligence. Microbiome Therapeutics Market Size & Share Analysis – Growth Trends & Forecasts (2025 – 2030)

谷禾健康

在自然界中,一些引人注目的共生现象出现在能够改变宿主行为的微生物与其宿主之间。
这些病原体的“精神控制”能力激发了许多末日小说作品,如HBO剧集《最后生还者》中令人毛骨悚然的真菌感染场景。
延展小知识
关于细菌沃尔巴克氏体、狂犬病毒、偏侧蛇虫草菌
Wolbachia pipientis 操控昆虫生殖及神经
Wolbachia pipientis 被喻为生物基因“木马”,可以操控昆虫生殖。常见于节肢动物门和部分线虫体内,影响所寄生动物的生殖和发育。除了影响生殖外,当它们转移到一个新的物种时,会使新寄主产生各种严重的神经系统并发症。2009年开始,科学家发现Wolbachia pipientis阻止登革热病毒在蚊子体内复制增殖,从而阻隔登革热的传播。
2019年,中山大学的研究人员利用利用Wolbachia pipientis感染的雄蚊使得雌蚊无法繁殖下一代几乎消灭了世界上最具侵入性的蚊子种类 – 亚洲虎蚊(白纹伊蚊,本地俗称花脚蚊)。
狂犬病病毒 (Rabies virus)
狂犬病病毒(Rabies virus,RABV) 感染宿主中枢神经系统的重要人兽共患病,一旦发病死亡率接近100%,每年造成全球几万人死亡。
Ophiocordyceps unilateralis,僵尸蚂蚁
Ophiocordyceps unilateralis ,也被称为偏侧蛇虫草菌,是一种拟寄真菌,偏侧蛇虫草菌在感染蚂蚁后,能够通过释放化学物质改变和控制蚂蚁的行为,让变成蚂蚁自己的傀儡,直到最终死亡。HBO新剧《最后生还者》(The Last of Us)第一季让大家领教了真菌的厉害。剧中的这种致命真菌就是偏侧蛇虫草(Ophiocordyceps unilateralis),它能够入侵昆虫的大脑,使其成为僵尸。
然而,改变行为的微生物并不仅限于这些极端的寄生生物。在自然界中,已有关于共栖和互利微生物驱动宿主行为操控的描述。这个观点在发现胃肠道内的细菌可以调节宿主中枢神经系统后,得到了广泛关注和逐步证实。
肠道微生物群——这一动态且多样化的微生物群落,被认为是肠-脑相互作用的关键调节器。与自然界中那些极端的”精神控制”案例不同,人体肠道微生物群以更加微妙和复杂的方式影响着我们的情绪、认知和行为。
各种证据表明,肠道细菌发出的信号可以循环到大脑,或影响肠-脑轴免疫和内分泌细胞的功能。一个庞大的神经网络——外周神经系统,不断且迅速地在肠道和大脑这两个远距离器官之间传递信息,使大脑能够协调胃肠功能,而肠道也能够影响情绪、认知和行为。
临床意义:当微生物失衡遇上疾病
肠道微生物结构的改变与这些生物系统的变化相关,并对人类代谢、神经精神和肠道健康产生重要影响。焦虑、抑郁、自闭症谱系障碍(ASD)和帕金森病等多种神经疾病都具有明确的胃肠疾病合并症。诸如肠易激综合征(IBS)和炎症性肠病等胃肠疾病常常表现为心理症状。关键是,这些临床相关性与失衡的微生物群和紊乱的肠—脑信号密切相关。
四条通路:微生物与大脑的对话方式
目前已经比较清晰的知道,连接肠道微生物群和大脑的四种主要通信方式。
肠道微生物群-脑轴
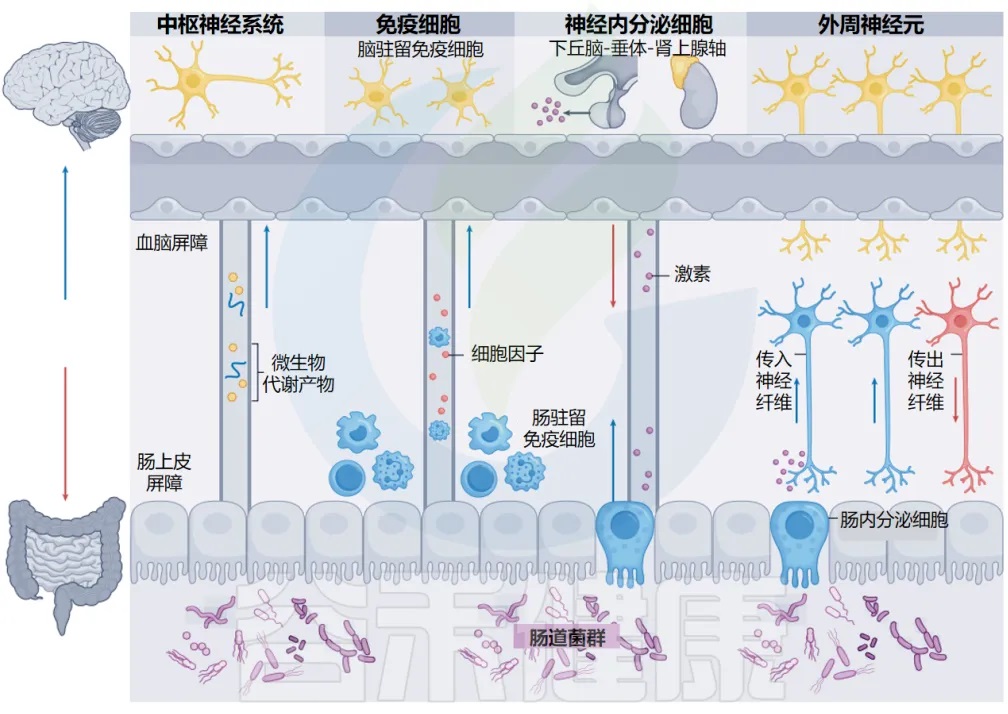
doi.org/10.1038/s41579-024-01136-9
聚焦核心:肠道神经上皮回路的精密机制
这些途径以多种方式相互交叉和影响。免疫细胞和周围神经元之间(神经-免疫轴)、神经内分泌细胞和免疫细胞之间(神经内分泌-免疫轴)、以及肠上皮细胞和周围神经元之间的双向串扰(肠神经上皮轴),为肠道和大脑之间的通信增加了额外的复杂性。
其中,肠上皮的化学感应细胞与支配肠道并延伸到中枢神经系统的周围神经元之间的关系尤为关键。这些肠道神经上皮回路代表了微生物-宿主相互作用的最前沿和最精密的机制。
本文我们将深入了解这些肠道神经上皮回路的分子机制、细胞间相互作用,以及它们如何导致疾病状态,揭示肠道微生物群如何通过这一精密的神经网络实现对宿主行为的影响。理解这些途径有助于促进基于微生物组的胃肠道和神经系统疾病新疗法的开发。
胃肠道免疫系统和神经系统
在哺乳动物中,胃肠道包含最大的免疫系统、微生物群生态系统和内源性神经系统,它们之间复杂的相互作用有助于维持正常的胃肠道生理功能。
特别是胃肠道的固有神经系统,即肠神经系统,调节着重要的胃肠道功能。肠神经系统回路的破坏会导致全身性的胃肠道症状,如腹泻、便秘、内脏疼痛等,这些症状影响着世界上高达40%的人口。
注:肠神经系统,enteric nervous system,简称 ENS,被誉为”第二大脑”。
神经免疫微环境的动态感知机制
胃肠道免疫系统和神经系统都进化出了感知和快速响应动态肠道环境的机制,能够实时监测并快速响应肠腔内的营养、微生物及病理性刺激信号。
许多神经将胃肠道粘膜中的局部免疫细胞连接起来,形成神经元免疫细胞单位,这些细胞单位可以通过肠道管腔营养来源和微生物来源的线索重塑。这些单元不仅能够独立启动局部免疫应答,还通过细胞间通讯网络进行信息整合,最终形成由肠道微生物群精密调控的”肠道神经-免疫轴”。这些协调一致的信号轴调节胃肠道屏障功能、免疫力和宿主保护。
病原感染中的神经免疫协同防御
肠道神经和免疫相互作用在感染期间尤为重要。感染应激可激活特定的胃肠道功能,可以通过腹泻反应快速清除病原体,腹泻反应可以通过增加局部水分泌到管腔中并促进推进性收缩模式来清除病原体,这两种反应都需要肠神经系统(ENS)的输入。
此外,感染或炎症引起的肠神经系统结构和/或活动紊乱可以促进或减少炎症,产生胃肠道症状,并限制组织病理学。
肠神经系统也可以再生,从而在损伤后恢复胃肠道功能。然而,在许多情况下,完全恢复往往受到限制,并且肠神经系统的损害可能产生长期后果,例如感染后胃肠道疾病。
肠道神经和免疫的相互作用的证据
尽管免疫系统与神经系统过去被分开单独研究,但现在越来越清楚,这两个复杂系统在功能上密切相关。这两个系统相互交流并不是一个新概念。两千年前,罗马医生Aulus Cornelius Celsus将炎症的四个主要症状归纳为:
疼痛、发红、肿胀、发热
其中疼痛由感觉神经系统引起,后三者则与血管和免疫功能相关。
神经对于宿主抵御病原体的调控也是进化上保守的特性,这一点从简单的多细胞动物(如线虫)到脊椎动物(如鱼和哺乳动物)的研究中都有明确证据。
过去几十年,科学家们发现神经—免疫交流在生理、抗感染、防御、修复和疾病中的多种作用。
肠道神经解剖——层层保护系统
肠道的神经解剖结构由居于器官内外的感觉神经元和自主神经元共同组成(感觉神经元负责感知信息,自主神经元负责自动控制),胃肠道在解剖学上由肠系膜、浆膜、肌肉、粘膜下层、固有层和上皮组成,由多个周围神经元群支配,这些神经元群与局部免疫细胞配合和协调反应。
肠系膜:是连接肠道与腹壁的重要结构,其主要功能是支撑、固定和保护肠道,同时为肠道提供血液供应和淋巴引流。
浆膜:保护器官,减少摩擦,参与免疫反应、维持器官位置。
肌肉:负责肠道蠕动的动力系统,推动食物通过消化道、进行机械性消化以及促进营养物质的吸收。
粘膜下层:提供营养和支持,还通过其神经和血管网络调节消化和分泌活动。
固有层:为上皮细胞提供结构支持,是免疫细胞聚集的防御前线,参与免疫防御、营养吸收和消化过程。
上皮:保护、分泌、吸收、免疫防御。
肠道支配神经元的命名法基于细胞体是位于胃肠道外部还是内部。肠道相关神经元通常归类为属于内源性肠道神经系统(ENS)。
相比之下,肠道外源性神经元包括体感神经元和自主神经神经元,其细胞体位于外周感觉或自主神经节、脊髓或脑干中。
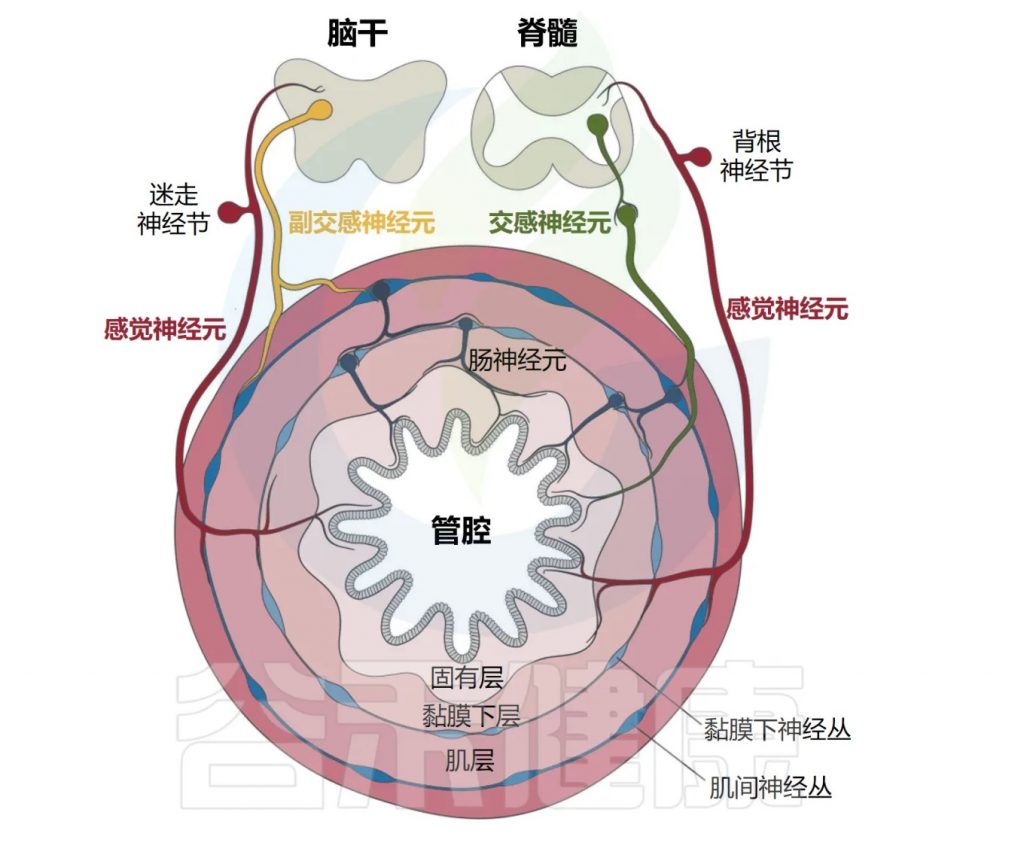
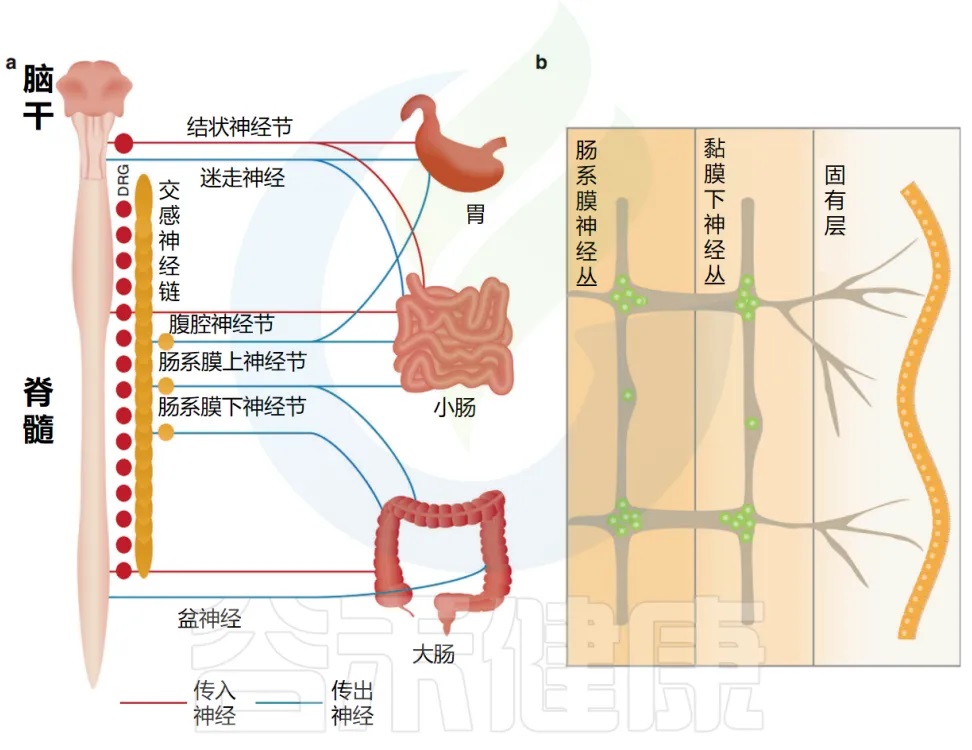
Yang et al. Cell Mol Immunol, 2023.
肠道外源性感觉神经元位于结节/颈静脉迷走神经节(VG)和背根神经节(DRG)中,分别将信号从肠道传递到脑干和脊髓。
自主神经神经元也支配肠道,包括迷走神经传出副交感神经运动神经元和位于自主神经节中的交感神经元。
肠道还拥有自己的内在和自主神经系统,由肠道神经元组成,它们的细胞体位于肌间神经丛和粘膜下神经丛中(如下图)。
doi.org/10.1038/s41385-020-00368-1
交感神经 vs 副交感神经:肠道的刹车和油门
交感神经元和副交感自主神经神经元分别起源于脊髓和脑干,并介导从大脑到肠道的信号转导。
神经支配的地理分布
迷走神经副交感神经元沿前尾方向支配胃肠道,胃的神经支配密度最高,小肠和结肠的神经支配密度降低。
这种分布差异与不同肠段的消化功能需求相关:胃的高密度神经支配支持其机械研磨与酸性环境调控,而结肠的低密度则反映其以水分吸收和粪便塑形为主的生理特性。
交感神经元和副交感神经元都与肌间神经丛中的 ENS 形成连接,形成错综复杂的局部神经回路。
神经元——两根触手
它们能感知什么?
这些感觉神经元群检测营养物质、机械拉伸、管腔威胁和免疫刺激,包括细胞因子。
除了感知,还会“说话”
这些神经元还通过从周围神经末梢释放神经肽在肠道内发出信号(神经肽就像”化学信号”,用来和周围的细胞交流。)。迷走神经节神经元主要支配近端小肠,而 DRG 神经元支配整个胃肠道。
肠道神经网络的双层架构
肠道神经元完全驻留在胃肠道内,并组织成环绕肠管的神经节网络,并在空间上分为两层:肌间神经丛,位于圆形和纵向肌肉层之间,以及粘膜下层的粘膜下神经丛。
这两个神经丛通过中间神经元、运动神经元和肠神经胶质细胞紧密相连。它们一起形成介导蠕动和分泌功能的反射回路。
此外,它们还整合来自外源性感觉、副交感神经和交感神经神经元的信号,以介导肠道生理学。
肠道神经和免疫的共同语言
神经系统和免疫系统已经进化出一种共同的语言,在它们对环境损伤的每一步反应中进行交流,从起始到解决。
神经系统和免疫系统:互相听懂语言
微生物:神经-免疫对话的调节员
神经系统与免疫系统之间的交流机制从进化角度来看是有道理的,因为这种机制减少了应对某些损伤的代价,并使两个系统能够协调复杂的宿主反应。微生物组在调节神经元激活和免疫发育中也起着关键作用。
鉴于免疫细胞和神经元都可以直接或间接感知微生物,微生物组的组成在神经元分化或成熟中起着关键作用,以调节内脏疼痛、肠道蠕动和肠道生理的其他方面。
中枢神经系统的调节
短链脂肪酸它如何发挥作用?
尽管生物屏障严重限制微生物进入 CNS,但是某些肠道微生物代谢物,如短链脂肪酸(SCFA),可以穿过血脑屏障并起神经调节剂的作用。例如,乙酸盐优先被下丘脑吸收,下丘脑是参与食欲控制的大脑中枢,直接抑制摄食行为 。
尽管 SCFA 受体在大脑中通常以低水平表达,但这些纤维发酵产物可以通过抑制组蛋白脱乙酰酶来调节神经元基因表达。
4-乙基苯基硫酸盐,参与情绪处理的大脑区域
除了 SCFAs,最近有报道称微生物代谢物 4-乙基苯基硫酸盐可以改变参与情绪处理的大脑区域,例如海马体和杏仁核,并诱导小鼠的焦虑样行为。由于无菌动物在基线时表现出异常的大脑化学和结构,这些改变发生的时间已成为一个关键的研究重点。目前越来越多的工作揭示了母婴肠道微生物组对早期神经发育结果的影响。
免疫细胞的调节
在皮肤、肺和肠道等屏障组织中,免疫细胞和神经纤维紧密相邻,它们经常互相聊天,交换神经免疫调节分子来保护身体健康。
为什么要这样合作?
这种神经免疫轴在面对感染、过敏原或毒素时尤为重要,因为这些情况需要快速的组织保护反应,然后进行行为适应以避免未来再次遭遇。
具体怎么合作?
– 食物过敏的例子:
通过食物过敏的动物模型,两项最近的研究发现,肠道里的肥大细胞发现过敏原,它们向大脑发送特定信息,大脑记住这种食物,下次就会产生回避行为。
– 皮肤过敏的例子:
皮肤中的γδ T细胞受到微生物调节,它们能调节感觉神经元的活动,控制过敏反应的强度。肠道黏膜γδ T细胞是否参与神经元信号传递仍有待确定。
免疫细胞的远程通讯:如何向大脑发送消息?
免疫细胞不只是在局部工作。它们还有两种方式向大脑汇报:
方式一:血液快递
免疫细胞把细胞因子释放到血液中,就像发快递一样,把信息送到大脑。
方式二:亲自出差
肠道中某些免疫细胞,例如IgA+浆细胞(专门产生抗体)和自然杀伤细胞(专门杀死异常细胞),也能搬家到大脑或脑膜,从而在中枢神经系统中发挥作用。
肠道细菌的重要作用
这些细胞的功能成熟很大程度上依赖于来自肠道的微生物信号。
– 实验证据:
无菌动物(没有肠道菌群的动物)大脑中的IgA+浆细胞和“激活”的自然杀伤细胞数量会减少。
大脑常驻免疫细胞也会受到肠道细菌的影响
例如小胶质细胞和T细胞,也会受到来自肠道菌群的信号影响。 在这方面,细胞因子IL-17,特别是来自脑膜γδ T细胞的IL-17,作为肠道菌群和行为之间潜在的联系受到了广泛关注。
神经内分泌细胞的调节
下丘脑:身体的应激总指挥
下丘脑也是通过下丘脑-垂体-肾上腺(HPA)轴调节身体应激反应的关键指挥者。这个主要的神经内分泌系统包含几个严格调控的激素级联反应(就像接力赛一样,一个传一个),促进器官间的稳态。
肠道细菌影响压力反应
无菌动物具有夸大的HPA反应,并伴有应激诱导的糖皮质激素水平升高。
早期接触共生微生物对HPA轴的正常调节非常重要。简单说,婴儿期的肠道细菌会影响我们一生应对压力的能力。
肠内分泌细胞:肠道里的激素工厂
肠道也包含其自身的神经内分泌细胞群,称为肠内分泌细胞 (EECs):
这些激素调节消化、葡萄糖稳态、食欲。虽然主要在营养感知的背景下进行研究,但 EECs 越来越被认为是肠道菌群的关键传感器和肠-脑信号传导的介质。
肠道激素:连接肠道与大脑的信使
肠道菌群会影响多种循环激素的分泌:
这些激素作用范围很广
这些激素中的大多数在胃肠道神经纤维、下丘脑和其他大脑区域都有靶点。
由于这些激素及其前体也由身体的各种神经元和非神经元细胞产生,因此了解 EEC 来源的信号对动物行为的具体贡献一直是一个重大挑战,近年来随着基因工具的进步,解决这一问题成为可能。
外周神经元的调节
第四条高速路:外周神经系统的闪电传输
肠道微生物与大脑之间的第四个联系是外周神经系统 (PNS),特别是自主神经系统 (ANS),它具有副交感神经和交感神经两个分支。
神经传输有什么特点?
与前面提到的激素传输或细胞迁移不同,神经系统传输信息超级快:
肠道的双重神经网络:外在 vs 内在
– 外在
作为一种内脏器官,胃肠道由“外在”传入和传出神经纤维支配,其细胞体位于大脑或脊髓区域,分别介导肠道到大脑和大脑到肠道的信号传递 。
– 内在
“内在”肠神经系统 (ENS) 的神经纤维也分布在胃肠道中,其细胞体位于肠壁外层。它们在很大程度上自主地执行基本的肠道功能,并接收来自微生物组和中枢神经系统的输入。
迷走神经:肠脑对话的专线电话
迷走神经作为副交感神经系统的主要分支,尤其与肠-脑通讯密切相关,具有传入和传出神经纤维。它在维持肠道稳态以及调节情绪、食欲和能量平衡方面发挥重要作用。
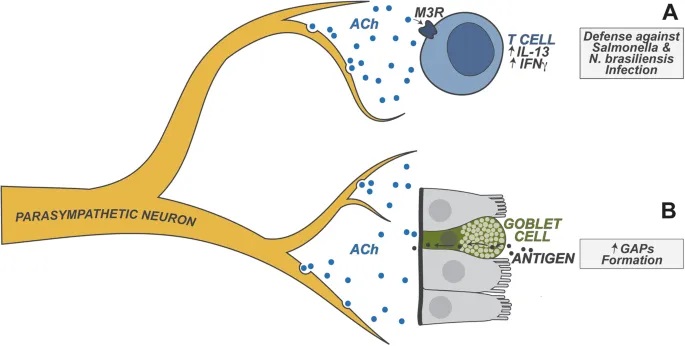
doi.org/10.1038/s41423-023-01054-5
实验证据
在迷走神经切断动物(即接受了迷走神经切断术的动物)中,肠道菌群的许多效应都会消失。然而,微生物信号是否能直接调节体内迷走神经的活动,目前证据仍然有限。
脊髓传入神经:疼痛信号的传递者
脊髓传入神经通过脊髓将感觉信息从肠道分别传递到大脑。我们对微生物组通过脊髓神经发出信号的许多了解都与内脏疼痛有关,因为许多这些纤维都是疼痛感应的。无菌动物表现出对结直肠扩张的超敏反应,而益生菌治疗可以缓解这种反应。共生微生物是否通过脊髓通路影响大脑生理或行为,目前仍不清楚。
交感神经系统:应激反应的调节者
交感神经系统调节多种胃肠道功能,尤其是在应对急性应激时。无菌小鼠的交感神经活动长期升高,这与这些动物体内HPA轴反应的增强相呼应。有趣的是,微生物群对交感神经活动的调节依赖于迷走神经传入纤维的信号,突显了周围神经系统相互关联的性质。
肠道神经元:免疫系统的调度员
肠道神经元是异质性的,能释放两大类物质来调节免疫功能:
– 细胞因子:
IL-18:调节抗菌肽的杯状细胞表达,抗菌肽介导宿主对肠道鼠伤寒沙门氏菌感染的保护
IL-6:抑制结肠中 RORγ+ 调节性T细胞的分化
– 神经肽:
NMU(神经调节素U)
CGRP(降钙素基因相关肽)
VIP(血管活性肠肽)
神经元与先天淋巴细胞的密切合作
肠道神经元还协调肠道先天淋巴细胞 (ILC) 的功能方面也起着重要作用。ILC 是协调下游适应性免疫的早期反应先天淋巴细胞。
– 空间优势
肠道神经元靠近 ILC,为这些神经元调节 ILC 功能奠定了细胞基础。
– ILC2的调节:过敏反应控制
ILC2 高度表达 NMUR1,NMUR1 是神经肽神经中介U(NMU)的受体。肠道感觉神经元的一个亚群表达 NMU,NMU 在过敏情况下释放。
– ILC3的调节:昼夜节律与宿主防御
肠道神经元在调节肠固有层 3 型 ILC (ILC3) 的功能中也起着关键作用。ILC3 表达高水平的 VIPR2,VIPR2 是神经肽 VIP 的受体。
肠道神经元的一个子集(以及迷走神经感觉神经元)表达高水平的 VIP,并且已发现它们在稳态和宿主防御期间调节 ILC3 功能。
– 具体调节过程
进食触发:食物消耗以昼夜节律方式触发VIP的神经元产生;
抑制作用:VIP抑制ILC3介导的IL-22产生,消除抗菌肽的肠道表达;
实验验证:VIP+神经元的化学激活导致IL-22+ ILC3比例降低,使宿主易受口腔啮齿柠檬酸杆菌感染。
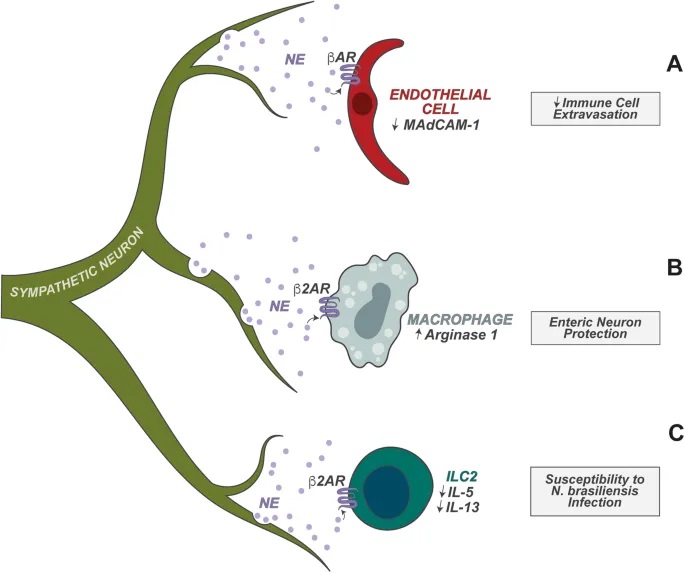
doi.org/10.1038/s41423-023-01054-5
肠道上皮每天都要面对来自食物和肠道菌群的各种化学物质。有时,有害刺激物和病原体会进入胃肠道,需要迅速采取损害控制措施。
为了理解管腔环境并区分“好”和“坏”,EEC(肠内分泌细胞) 和周围神经共同形成了一个广泛的肠道感觉网络。
信息处理:局部处理 vs 上报大脑
这些感觉信息有两种处理方式:
同时,大脑也会向肠道发送指令,引起特定的器官间反馈反应。
肠道神经上皮界面的肠道微生物群到大脑通路
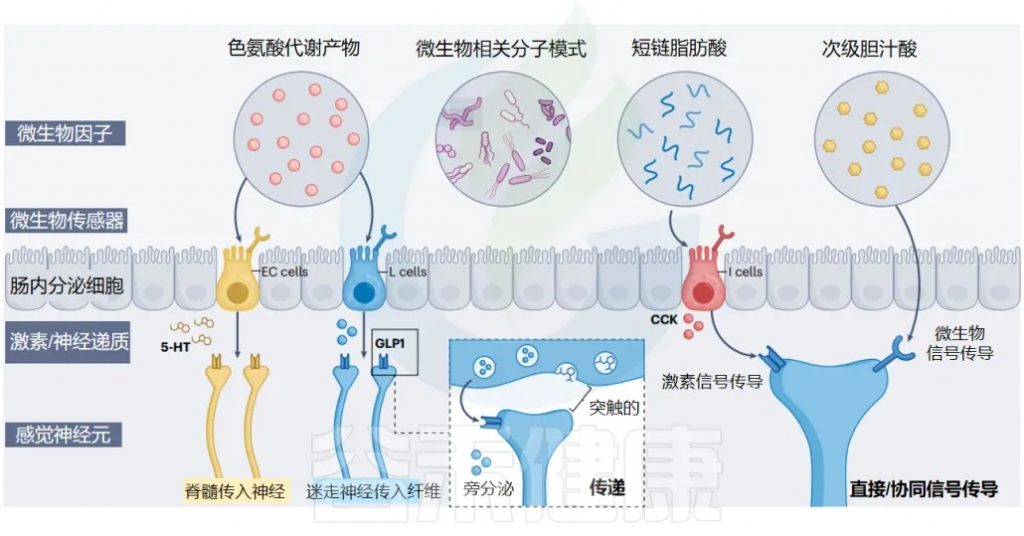
Ohara et al. 2025. Nat Rev Microbiol
肠内分泌细胞:肠道的化学传感器
肠内分泌细胞 (EECs) 是肠道的主要化学感应上皮细胞,通常根据其主要激素产物进行分类。产生 CCK、GLP1/PYY 和 5-HT 的 EEC 分别称为 I 细胞、L 细胞、肠嗜铬细胞(EC)。
在 EEC 家族中,这三个亚群最密切地参与肠-脑通讯:
EECs的灵活性
一些 EEC 在其生命周期中分泌多种不同的激素或经历激素转换,这表明 EEC 亚型并非完全固定。
重要的是,微生物组感应受体在远端肠道的 L 细胞和 EC 细胞中富集,这个区域正好是细菌载量最高的地方,并且主要被认为发生微生物-EEC 信号传导。
简单说,细菌最多的地方,正好是感应细菌信号的传感器最多的地方。
微生物相关分子模式 (MAMP)
MAMP
微生物相关分子模式(MAMP)就想是细菌身上的身份标识牌,是微生物上进化上保守的结构,就像每个细菌都带着固定的身份证。宿主细胞可以通过模式识别受体来读取这些身份信息,特别是先天免疫细胞,它们是识别细菌身份的专家。
Toll样受体
在模式识别受体中,Toll 样受体(TLR)在维持肠上皮细胞稳态中起着至关重要的作用。
肠内分泌细胞表达不同的TLR
体外和体内研究表明,肠内分泌细胞 (EECs) 表达几种不同的功能性 TLR,包括:
TLR信号如何影响激素分泌?
肠道中的 TLR 信号传导与 CCK(胆囊收缩素)、GLP1(胰高血糖素样肽1) 、5-HT(血清素)分泌的调节有关,但这仍有待进一步验证。
TLR4 也在感觉传入神经元中表达,但其与微生物组感应的相关性尚不清楚。
短链脂肪酸(SCFA)
短链脂肪酸(SCFA)是膳食纤维发酵的最终产物,由厌氧菌在结肠中大量产生。
特定的支链短链脂肪酸,如异戊酸盐和异丁酸盐,由肠道细菌通过支链氨基酸发酵制成。特征最明显的 SCFA 受体是游离脂肪酸受体2 (FFAR2)和 FFAR3,它们都在多个 EEC 亚群中表达,说明很多肠内分泌细胞都能听到SCFA的信号。
FFAR受体:如何传递SCFA信号?
FFAR 是一种 G 蛋白偶联受体,当被激活时,它与几个下游信号级联反应相连,就像按下按钮后,触发一连串的反应。
– 对L细胞的影响
SCFA 与 L 细胞上的 FFAR2 和 FFAR3 结合会触发细胞内钙动员(也就是钙离子在细胞内快速移动)以及 GLP1 和 PYY 的释放。
EC细胞:用嗅觉受体来感应SCFA
在结肠中,EC 细胞也通过 FFAR 以及嗅觉 G 蛋白偶联受体 OLFR78 和 OLFR558(refs)受到 SCFA 的调节。
不同种类的SCFA有不同的分工
尽管FFAR3在 I 细胞中广泛表达,但尚不清楚 SCFA 是否调节CCK的产生。FFAR2 和 FFAR3 在肠道支配感觉神经元中也有功能表达,表明传入神经纤维可能直接对SCFA做出反应。
次级胆汁酸
次级胆汁酸是肠道微生物群产生并被宿主识别的另一类重要代谢物。最初是肝脏产生的初级胆汁酸,这些初级胆汁酸到达远端肠道后,被肠道细菌进行”二次加工“,变成了次级胆汁酸。
简单说,这是肝脏和肠道细菌合作的产物。
主要的次级胆汁酸:两大明星分子
脱氧胆酸(DCA)和石胆酸是两种含量最丰富的次级胆汁酸,能够通过多种宿主受体发出信号,特别是 TGR5(也称为 G 蛋白偶联胆汁酸受体 1)和法尼醇 X 受体。两种受体都在 L 细胞中表达,并参与 GLP1 和 PYY 释放的调节,这就解释了为什么肠道细菌的变化会影响我们的血糖控制和食欲调节。
对EC细胞的影响:调节血清素产生
次级胆汁酸还向 EC 细胞发出信号,通过 TGR5 和可能通过 Tph1 的下游转录指导 5-HT 的产生,Tph1 编码 5-HT 生物合成的限速酶。
目前尚不清楚次级胆汁酸是否作用于 I 细胞,但这些胆汁酸的一部分可以通过肠肝循环到达近端肠道,并且表达 CCK A 型受体的迷走神经传入神经亚群以 TGR5 依赖性方式对 DCA 有反应。
色氨酸和吲哚衍生物
色氨酸是一种从膳食蛋白质中获得的必需氨基酸,人体无法自己制造,其分解产物代表了另一类有助于宿主健康的微生物代谢物。
吲哚途径:细菌的化学加工厂
在色氨酸降解的三个主要途径中,吲哚途径由肠道中的许多细菌物种进行,将色氨酸转化为吲哚及其衍生物,如吲哚-3-乙酸(IAA)和吲哚-3-醛。
吲哚类物质如何影响EECs?
吲哚是 L 细胞中 GLP1 分泌的已知诱导剂。也就是说,吲哚能够刺激L细胞释放GLP1。
在斑马鱼中,吲哚和吲哚-3-醛强烈激活 EEC 并通过瞬时受体电位锚蛋白 1 通道触发 5-HT 释放。
瞬时受体电位锚蛋白1:多功能的感应通道
瞬时受体电位锚蛋白 1 不仅能感应吲哚类物质,还有其他身份,它也是环境刺激物的传感器,比如能感应芥末油(这就解释了为什么吃芥末会有刺激感)。
瞬时受体电位锚蛋白 1 在哺乳动物EC细胞和感觉神经元中高度表达,可能是促进胃肠道蠕动和清除摄入毒素的机制。
在检测到微生物群衍生因子后,肠道感觉网络将此信息传递给CNS。这种传输究竟是如何发生的,特别是在脑-身体通信的背景下,是目前积极研究的一个领域。
新兴的经典肠道神经上皮通路涉及:
肠道感觉网络
肠内分泌细胞(EEC)和肠道支配感觉神经元在肠粘膜屏障处共同形成一个复杂的感觉网络,能够感知和响应各种微生物结构和代谢物。这些包括色氨酸代谢物、微生物相关分子模式、短链脂肪酸和次级胆汁酸。
结肠中的两大主力
在结肠中,有两类重要的EEC:
这两类细胞都表达这些微生物信号的受体,能够直接听到细菌的声音。
I细胞主要位于小肠中,生产胆囊收缩素(CCK),同样表达微生物传感器。
信号传递的两种方式
当EEC被激活时,它们会通过两种方式释放信号分子:
EEC会释放:
传递给:
不仅影响EEC,还直接影响神经
微生物输入还可以直接调节感觉神经纤维的敏感性,从而增强 EEC-神经荷尔蒙信号传导。
不同信号走不同高速路
根据所涉及的微生物传感器、EEC 亚群、神经肽和感觉神经元类型,不同的微生物线索可以通过不同的肠道神经上皮途径输送,最终对大脑功能和行为产生不同的影响。
感觉细胞多样性
肠道里的神经元是怎么工作的?
肠道中有两大类感觉传入神经负责不同的监测任务:
最近对迷走神经和脊髓神经元的分析发现了多种感觉神经元细胞类型,甚至在化学感受器和机械感受器中也是如此。
为什么需要这么多不同类型的神经元?
结合遗传的研究方法,得出一个研究的共识,即单个感觉神经元之间存在很大的分工。每种神经元都有自己的专业领域,就像专科医生一样。
这些神经元到底分工有多细?
一些具体的例子:
复杂分工的深层原因:系统的精密设计
这种刺激特异性神经元反应可能反映了肠道神经上皮水平信息感知和传递方式的复杂性,部分原因是 EEC 和感觉神经元群的异质性。这种精密的设计确保了肠道能够准确识别和传递各种不同的信号。
未来:寻找微生物组专属神经元
这些观察结果提出了一个有趣的问题,即是否有专门的“微生物组响应”感觉神经元来支配肠道,以及是否存在基于微生物刺激的亚型。
当然,GPR65 + 迷走神经神经元是不错的候选者,因为它们是在整个胃肠道中具有致密粘膜神经末梢的化学感受器。
然而,随着迷走神经支配沿结肠长度向远端减少,脊神经可能同样有助于将微生物线索传递给 CNS。
旁分泌传递与突触传递
传统方式:EEC的广播信号传递
当EEC受到刺激后,它们会采用最常见的信号传递方式:
这通常被认为以旁分泌方式发生——即最接近 EEC 范围,只要表达相关受体的纤维,就能接收信号并传播给大脑,也就是“近水楼台先得月”。
新发现:EEC的专线连接方式
科学家们发现了一种更直接的连接方式!研究发现了一种独特的 I 细胞和 L 细胞亚群,被称为”神经足”细胞。
– 什么是”神经足”细胞?
更多证据:EC细胞也有类似的专线
对于 EC 细胞和脊髓传入纤维提出了类似类型的连接。支持这种突触连接的证据:
然而,最近的高分辨率成像研究尚未发现令人信服的证据证明 EEC 和传入神经之间存在突触接触,这表明神经足细胞要么非常罕见,要么仅存在于某些 EEC 亚型中。另一种解释是,考虑到大多数 EEC 的寿命较短,EEC-神经突触是高度动态的。
了解 EEC 的特定子集是否可以直接进入大脑很有价值,因为它们将是影响与肠道微生物群相关的情绪和行为变化的候选者。
协作微生物-宿主信号传导
到目前为止,我们已经将肠道神经上皮回路描述为一条线性通路,信号在到达 CNS 之前从肠道微生物群传递到 EEC,再传递到内脏传入神经。
微生物群 → EEC → 内脏传入神经 → 中枢神经系统
新发现:微生物的捷径通道
一些微生物因子,包括 SCFA、次级胆汁酸、蛋白酶,可以绕过上皮层,并直接作用于感觉传入神经。
协同作用:1+1>2的效果
感觉神经纤维如何整合微生物和宿主来源线索的细节开始浮出水面。
– 例子1:DCA + CCK的强强联合
注:它是一种次级胆汁酸,由肠道菌群代谢初级胆汁酸而产生。
– 例子2:丙酸盐增强CCK效果
这些发现表明,微生物代谢物可以与肠道激素合作以影响感觉神经放电。
复杂的生物网络系统
鉴于最近对免疫细胞在协调脑-身体回路和肠胶质细胞在塑造肠道神经活动中的作用的见解,微生物群-神经上皮相互作用可能涉及多个细胞输入的影响,这个系统作为更大的互连生物系统网络的一部分,远比简单的线性通路复杂。
简单说,肠脑通讯不是一条高速公路,而是一个复杂的交通网络,有多条道路、多个路口,各种车辆(不同的信号分子和细胞)在其中协调运行。
肠道感觉网络收集的有关微生物组的信息,在组织本身、脑干和脊髓以及高级大脑区域内进行整合和处理。
大脑处理完信息后会做什么?
中枢神经系统的效应肢体会积极响应,主要包括:
它们的任务是对动态变化的肠道环境做出反应,调节胃肠道生理学的各个方面。
近年来,宿主通过局部和远程信号传导机制对肠道微生物群的定向作用受到了相当大的关注。
肠神经上皮界面的脑到肠道微生物群通路
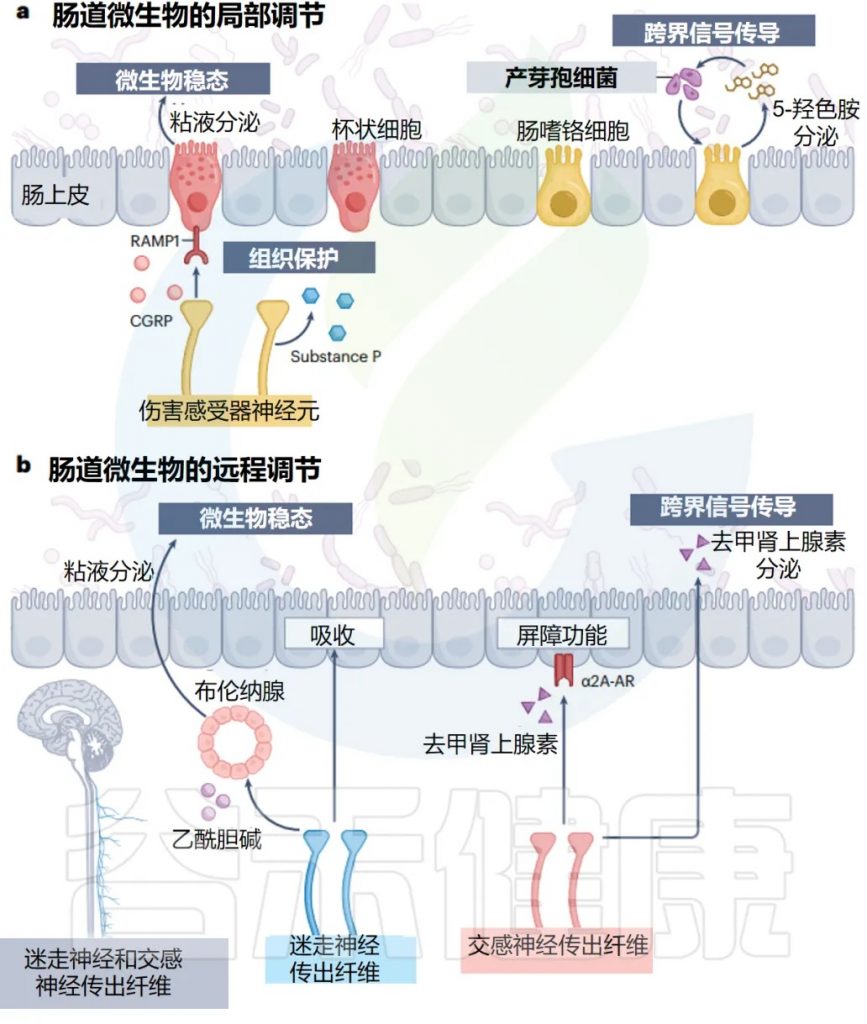
doi.org/10.1038/s41579-024-01136-9
局 部 调 控
传统认知:感觉神经只负责”上报”信息
传统上,感觉神经是将信息传递到 CNS 的传入纤维,就像信息传递员一样,只负责把肠道的情况报告给大脑。
新发现:感觉神经还有”管理”功能
现在人们普遍认识到,感觉神经元还通过在屏障组织局部释放各种神经肽和神经递质来执行传出功能。
– 管理方式:
通过作用于附近的免疫和非免疫细胞,感觉传入神经是维持组织健康不可或缺的一部分。
肠道中的疼痛神经:伤害感受器
在肠道中,许多具有局部效应功能的感觉神经元是伤害感受器,它们通常在皮肤中介导疼痛感。
– 伤害感受器:微生物管家
尽管它们的确切特征和功能正在阐明,但最近的两项互补研究发现,伤害感受器在调节肠道微生物稳态方面具有新作用。
– 实验证据:
在没有功能性伤害感受器的情况下,小鼠以微生物组依赖性方式更容易患结肠炎。
伤害感受器的保护机制:释放保护性分子
伤害感受器通过释放 P 物质和降钙素基因相关肽来促进组织保护,这些肽向邻近的肠道杯状细胞发出信号以驱动粘液分泌。
有趣的是,伤害感受器释放的 P 物质和降钙素基因相关肽受共生信号调节。因此,感觉神经元同时监测和调整肠道菌群的组成以支持肠道稳态。
EC细胞与5-HT的调节系统
一个显著的例子是 EC 细胞,它在压力、机械压力和迷走神经刺激下将 5-HT 释放到肠腔中。
– 微生物的影响:
微生物的策略:操控宿主为自己服务
因此,孢子形成细菌识别肠腔中的 5-HT,并通过结肠中的 EC 细胞进一步诱导宿主 5-HT 的产生,来促进自身在微生物组中的成员身份。
这种微生物群-EEC 串扰是孢子形成者独有的,还是其他细菌物种参与界间信号传导仍有待确定。
远 端 调 节
宿主调节微生物的双重策略:局部 vs 远程
宿主有两套不同的调节策略:
策略1:局部信号调节——就地解决问题
策略2:远程肠脑回路调节——统筹全局管理
ANS 的两个主要分支——迷走神经和交感神经,通过它们在胃肠道中的不同功能输出,来协调这种反馈反应。
迷走神经:身体休息和消化时的管家
虽然大多数迷走神经纤维将感觉信息传递到大脑,但有些也向肠道提供副交感神经流出,主要支配 ENS 并促进肠道蠕动和上皮分泌物,作为身体“休息和消化”反应的一部分。
最近的证据表明,迷走神经传出纤维在通过近端小肠 Brunner 腺调节肠道微生物群方面,具有惊人的作用。
– 对特定微生物的影响:
乳酸菌属对这种神经腺回路的扰动特别敏感,在迷走神经刺激时扩大,并在参与压力信号时丰度降低。
迷走神经传出神经元的活动,也极大地影响了肠上皮的吸收能力,可能会改变饮食-微生物群动力学和微生物代谢物对宿主的获取。
交感神经:压力状态下的应急管理员
– 交感神经的基本功能
交感神经为肠道提供肾上腺素能神经纤维,在那里它们支配 ENS 和肠粘膜,并释放去甲肾上腺素,尤其是在应对压力时。
– 对微生物群的具体影响
交感神经激活导致粘蛋白降解剂(如Akkermansia)增多,Turicibacter spp137 减少。
这些微生物组的变化伴随着粘液产生、抗菌基因表达和上皮周转率的变化,揭示了交感神经、上皮细胞和肠道细菌之间的密切关系。
交感神经的化学武器:去甲肾上腺素的直接作用
– 直接的化学信号传递
交感传出神经元影响微生物组的另一种机制是,通过将去甲肾上腺素释放到肠腔中。
– 跨界信号传导的例子
QseC 组氨酸激酶对宿主来源的儿茶酚胺(如肾上腺素和去甲肾上腺素)的细菌感应,是王国间信号传导的另一个例子。
– 对病原菌的影响
在某些大肠杆菌菌株中,儿茶酚胺可以改变毒力基因表达和致病性。有趣的是,肠腔中游离儿茶酚胺的水平部分受肠道微生物群的调节。
这可能具有临床意义,因为 GLP1 受体激动剂利拉鲁肽是一种常见的抗糖尿病药物,被发现可以激活交感神经传出纤维,触发去甲肾上腺素释放到肠腔中,并诱导大肠杆菌的扩增 。
总的来说,这些研究表明,交感神经可以直接影响肠道细菌定植。
神经免疫学是一个快速发展的领域。最近在不同的神经元亚群如何调节肠道免疫反应方面的突破,加深了我们对生理和病理条件下肠道免疫的理解。
除了被动接受和应对有害的威胁外,免疫系统还向神经系统发出信号以启动防御性反应。同时,神经系统在对潜在威胁的预期和感知下,积极调节肠道中的免疫反应。神经系统和免疫系统之间的协调使宿主能够正确处理复杂的刺激和不断变化的环境。
肠道微生物群也是调节肠脑轴中神经元和免疫激活的关键臂。结合微生物组、转录组、蛋白质组的多组学研究,配合光遗传学和化学遗传学等新兴技术,将深化我们对神经元如何塑造肠道生态系统的理解。
肠道菌群检测技术的应用将成为连接基础研究与临床实践的重要桥梁。基于微生物组构成和神经反应模式的个体化治疗将成为现实,通过功能性微生物组分析,结合肠道菌群检测报告中的神经递质等相关指标,实现疾病风险预测和治疗效果的个性化评估。自迷走神经电刺激在减轻炎症方面的发现以来,生物电子医学在临床应用中展现出广阔前景,无创迷走神经刺激已在克罗恩病临床试验中显示疗效。
神经递质和神经肽受体信号传导的治疗靶向为药物创新提供了新思路。β-肾上腺素能受体拮抗剂和CGRP受体拮抗剂等现有药物,凭借其调节肠道免疫的能力,可重新用于胃肠道功能障碍治疗,同时基于微生物代谢物的新药开发和靶向EEC的小分子化合物研究正在兴起。
这些突破将更大地改变焦虑、抑郁、自闭症、帕金森病等神经疾病以及肠易激综合征、炎症性肠病等消化系统疾病的治疗策略。通过微生物疗法、肠道靶向神经调节和神经-免疫平衡调节的联合治疗,未来,临床医生可能会根据患者的肠道菌群特征、免疫状态和神经系统表型制定个性化治疗方案。
医学正从标准化治疗转向个体化精准医疗,肠道-菌群-免疫-神经将成为未来疾病治疗的重要方向。短链脂肪酸、色氨酸代谢物以及其他菌群代谢产物正被开发为新型神经调节剂,它们能通过血脑屏障或迷走神经途径影响中枢神经系统功能。
早期干预肠道菌群失调可能成为预防神经精神疾病的关键途径,特别是对具有遗传风险的人群。肠道健康将成为整体健康管理的重要组成部分。
主要参考文献
Jacobson, A., Yang, D., Vella, M. et al. The intestinal neuro-immune axis: crosstalk between neurons, immune cells, and microbes. Mucosal Immunol 14, 555–565 (2021).
Ohara, T.E., Hsiao, E.Y. Microbiota–neuroepithelial signalling across the gut–brain axis. Nat Rev Microbiol 23, 371–384 (2025).
Yang, D., Almanzar, N. & Chiu, I.M. The role of cellular and molecular neuroimmune crosstalk in gut immunity. Cell Mol Immunol 20, 1259–1269 (2023).
谷禾健康
播种肠道,喂养心灵
在新冠疫情的影响下,我们的生活方式和社交模式都发生了很大的改变。随着社交距离的要求和封锁措施的实施,我们不得不放弃了很多与朋友和家人的互动,这给我们的身心健康带来了很大的影响。
然而,随着疫情的好转和社交限制的逐渐放松,我们有了更多的机会去重新建立社交联系和友谊。
社会关系对于群居动物(例如我们人类和其他灵长类动物)的健康和福祉至关重要。越来越多的证据表明,肠道微生物组通过所谓的“肠-脑轴”,在我们的身心健康中发挥着关键作用,而且细菌可以通过接触等方式在社交中传播。
本文来了解一下,社会关系与肠道菌群之间的一些有趣的关联。

从动物到人类都有一个微生物组,或者更确切地说,有几个微生物组。消化系统、皮肤和身体的其他部位承载着微生物群落,也就是肠道微生物群、皮肤微生物群等。
在过去的10-15年中,随着DNA测序技术的不断进步,人们有了更清晰的视野来观察微生物组的多样性和复杂性。
一般关于微生物组与社会性之间联系的研究都集中在病原体和感染上。
任何场所,不管是曾经在医院就医,或生过孩子,还是与咳嗽和打喷嚏的人一起乘坐公共交通工具等,微生物都可以通过身体接触或共享环境将疾病从一个人传播到另一个人。
一些研究人员认为,对感染的恐惧可能是人类对陌生人根深蒂固的戒心的一种解释。
越来越多的迹象表明,社会伙伴之间的微生物共享也正在影响其他事情。例如,大黄蜂可能会被一种有害的剧毒寄生虫感染。2011 年,研究人员发现大黄蜂携带一种微生物,这种微生物通过蜂巢进行社会传播,保护蜜蜂免受这种寄生虫的侵害,这是有益社会传播的明显案例。
在一些啮齿动物研究中,特定细菌的存在与否可以决定小鼠是否表现出社交缺陷,避免与同伴互动。肠道细菌在吸引果蝇为其配偶方面发挥了作用。微生物可以影响身体产生催产素等荷尔蒙,后者在亲密关系中起着强大的作用。
扩展阅读:微生物和你的爱情生活有什么关系?
对于人类,我们知道合住一所房子的人也有共同的微生物群。2014年,芝加哥大学和阿贡国家实验室的微生物学家 Jack Gilbert 和他的同事对七个家庭及其住宅进行了六周多的研究,他们发现每个家庭中的微生物群很容易相互区分,每个人都可以被家人识别。研究期间搬家的三个家庭都带着他们的微生物特征。
在婴儿出生后的第一年,肠道中一半的微生物菌株与母亲共享。母亲的影响力随着时间的推移而减弱—— 大约从 3 岁时的 27% 下滑到 30 岁时的 14%,但并没有消失。
其他家庭成员也是肠道微生物的重要来源。4 岁以后,孩子与父亲和母亲共享的微生物菌株数量相似。
分开生活的时间越长,彼此远离的双胞胎共享的肠道微生物就越少。一起长大的双胞胎有大约30%的共享菌株,在分开生活30年后下降到大约10%.
共享甚至发生在几个农村生活组的家庭之间:与来自不同村庄的人相比,来自同一个村庄不同家庭的人往往在肠道微生物方面有更多的重叠。
住在一起的人,往往有相同的口腔微生物菌株,而且住在一起的时间越长,他们共享的越多。

人类有体味,许多动物都有气味标记腺体。几十年前,研究人员提出,产生气味的不是动物本身,而是微生物,微生物产生挥发性有机化合物,这些化合物通过空气传播,从而产生真正的气味。如果我们用气味来相互交流,微生物很可能是产生交流的中间人。
牛津大学实验心理学系教授 Robin Dunbar 博士说:我们不仅在社会世界中进化,也在微生物世界中进化。
社会关系对人类健康和死亡率产生持续影响,高度社会融合和良好的人际关系的影响,远远超过戒烟或保持正常体重等个人行为对死亡率的保护作用。
研究表明,身心健康以及长寿的主要预测指标是我们亲密关系的质量和数量。事实上,饮食、体重、酒精摄入和环境污染物(包括空气质量差)等其他生活方式方面对健康和幸福的影响,要比良好的社交和心情影响要小。

对微生物群数据整合研究已有 60 年历史的威斯康星纵向研究中,发现与家人和朋友的社交与人类粪便微生物群的差异有关。
对配偶 (N = 94) 和兄弟姐妹对 (N = 83) 的分析进一步表明,与兄弟姐妹相比,配偶拥有更相似的微生物群和更多共同的细菌类群。与独居者相比,已婚者拥有更多样化和更丰富的微生物群落。这些结果表明,人与人之间的互动,尤其是持续的亲密婚姻关系,会影响肠道菌群。
研究人员还发现,拥有更强大社交网络的人通常具有更多样化的肠道微生物组,而更孤立、微生物多样性更少的人面临更大压力和焦虑的风险更高。健康的肠道微生物组及其多样性甚至与新生儿时期更高水平的社交能力相关。
而且这种现象不仅限于人类。灵长类动物研究实际上表明,黑猩猩社会中,通过社会互动共享微生物(水平传播)比母婴微生物共享(垂直传播)导致更高的肠道微生物组多样性。

来自佛罗里达州立大学和其他机构的研究人员比较了疫情前和疫情后的数据,发现人类社会中个体的四个特征有所下降:外向性,开放性,宜人性和尽责性。但是第五个特征,神经质,在人群中,尤其年轻人中增加了。最近对 COVID 流行期间近 5000 人进行的一项横断面研究发现,神经质与焦虑和抑郁呈正相关。
研究人员评估了 672 名成年人(23 ~ 69 岁),发现当按上面提到的五大人格特质进行分层时,微生物组的多样性和组成显示出显著差异。
LEfSe分析人格特征肠道微生物丰度的两组差异
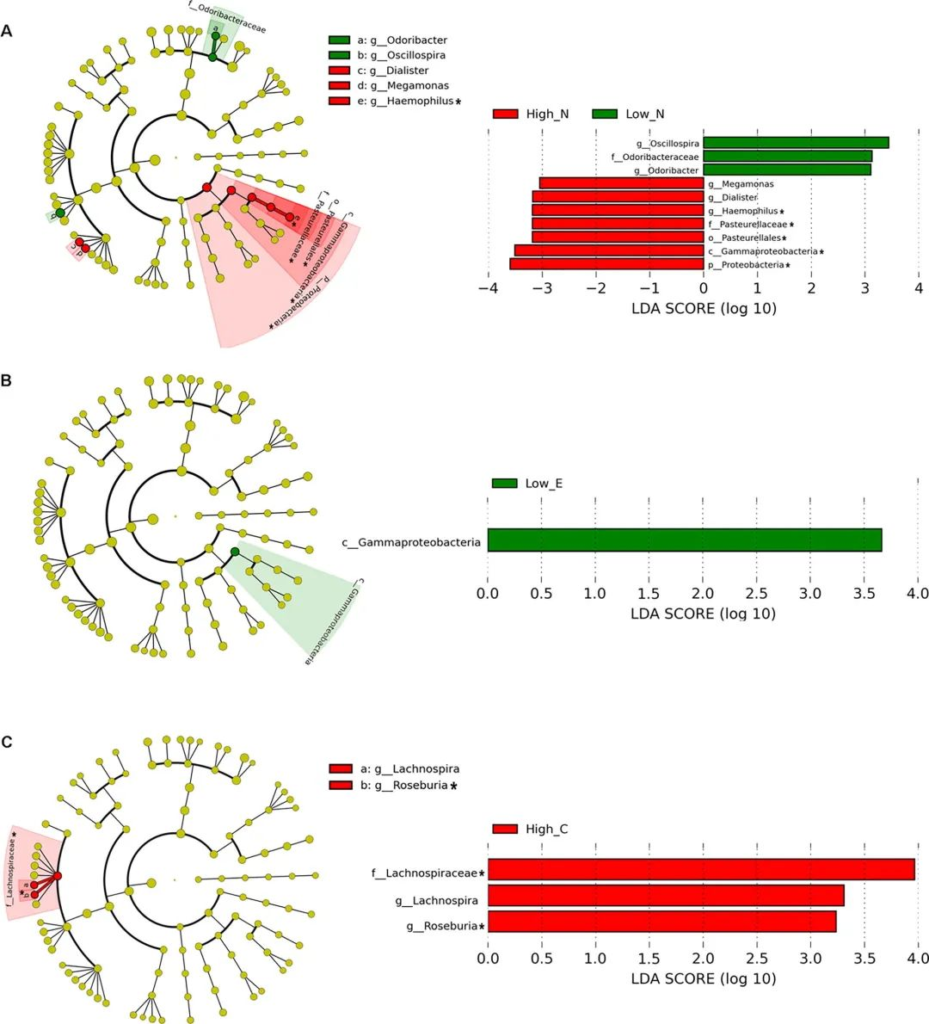
doi.org/10.1016/j.bbi.2017.12.012
对于神经质特征得分较高的个体,研究人员发现γ-变形杆菌(Gammaproteobacteria )的水平升高,其中包括多种属,包括潜在的病原体,如肠杆菌(Enterobacter)、埃希氏菌(Escherichia)、嗜血杆菌、克雷伯氏菌(Haemophilus)、假单胞菌(Pseudomonas)、志贺氏菌(Shigella)和弧菌(Vibrio)。这些菌群水平升高也见于责任心得分较低的个体,这与较低的动机和自律水平有关。
作者还在这些高度神经质-责任心较低的个体中发现了 HPA 轴激活和炎症标志物升高。
此外,值得注意的是,肠道屏障通透性增加允许细菌移位到肠腔外,以及循环中革兰氏阴性细菌脂多糖 (LPS) 毒素的存在可能在神经质的生理学中发挥作用。
人类微生物组杂志的一项研究描述了肠道微生物通过神经、免疫、内分泌和神经递质途径对人格特征的影响。该研究包括 655 名平均年龄为 42 岁的成年人(83% 为北美人)。
作者发现,焦虑和压力的增加以及睡眠质量的下降与微生物组组成的改变和多样性的降低显着相关,特定的细菌属与特定的行为特征相关。例如,特定的拟杆菌属菌株与抑制性神经递质 (GABA) 的产生有关,这种神经递质对于抵御压力和抑郁症很重要。

扩展阅读:
近日,来自爱尔兰科克大学的研究人员发现,社交焦虑症中的肠道微生物群发生变化。对 49 个粪便样本(31 个病例和 18 个性别和年龄匹配的对照)分析,通过 β 多样性衡量的总体微生物群组成,发现社交焦虑症组和对照组之间存在差异,并且在属和种水平上发现了一些分类学差异。
在属水平上发现,Anaeromassillibacillus和Gordonibacter在社交焦虑症组中升高,而Parasuterella在健康对照中富集。
在物种水平上,发现Anaeromassilibacillus sp An250在社交焦虑症患者中更丰富,而Parasutterella excrementihominis在对照组中含量更高。肠道代谢模块“天冬氨酸降解I”在社交焦虑症患者中升高。

邓巴数字表明,人类无法在认知上管理大于 150 人的有意义的社会群体。尽管这个数字本身一直存在争议,但很明显,个人的社交需求因人格类型和内在特征而异:
注释:邓巴数字——人类社交网络的节点不会超过150个,即和你保持友好关系的人在150人以内。这个著名的论断是由英国牛津大学人类学家罗宾·邓巴在20世纪90年代提出。
对于我们所有人来说,无论性别、年龄或现有社交网络规模,如果长期处于相对隔离状态,有时甚至是绝对隔离,对我们的社交都显著影响。尽管网络是一种帮助我们保持高效和虚拟连接的工具,但它并没有显著减轻与封锁相关的孤独感和抑郁感,尤其是对于那些可能很少接触和/或不太习惯使用网络的老年人。
尽管很少有关于 COVID 感染对大脑本身影响的纵向研究,但英国的一项此类调查评估了近 400 名在感染 SARS-CoV-2 之前和康复后接受过脑部扫描的人。研究人员发现,与匹配的对照组相比,COVID 感染者的全脑体积和灰质总量减少,默认网络(default network)发生显着变化,这表明社交技能和网络规模的丧失。
注释:默认网络(Default Mode Network)的概念被提出,并引起了很多神经科学家的关注。默认网络是由在脑处于静息状态时相互联系、维持健康代谢活动的若干脑区组成的网络,在个体从事如监控外界环境、记忆提取和控制自身心理状态等多种事务中发挥着重要作用。
默认模式网络会随着年龄的增长而发生变化,反映的是大脑神经细胞自发活动的组织模式,可能会与大脑的学习、记忆及认知等功能相关。(参考自百度百科)。
在急性感染 SARS-CoV-2 病毒后,许多人的健康状况发生了长期变化。事实上,据估计,全世界有超过6500 万人患有所谓的“长新冠”(Long COVID)。与长新冠相关的问题包括大脑特定问题,如心理健康状况、疲劳、睡眠问题和认知障碍。
与长新冠相关的各种各样的大脑相关问题以及数百万人遭受这些问题的困扰,促使研究人员和普通公众研究新冠病毒感染如何以及为什么会影响大脑。
一些可能导致大脑损伤的因素包括:病毒传播到大脑、与感染相关的炎症、代谢问题、微生物组变化和血管损伤。然而,同样重要的是要强调,许多人在疫情期间可能经历过与感染无关的类似大脑问题,这反映了在大规模封锁措施的背景下发生的压力、不健康饮食和生活方式的改变。
扩展阅读:
阳康后是否会二次感染,长新冠与肠道菌群的关联,多种潜在的相关干预措施
在 2023 年 3 月发表在《大脑、行为和免疫》杂志上的一项研究中,研究人员在动物模型中研究了 SARS-CoV-2 病毒,发现该病毒激活了大脑中的免疫细胞,加剧了大脑炎症。重要的是,我们现在知道大脑中的免疫细胞(称为小胶质细胞)可能在情绪、认知等方面发挥作用,而肠道菌群积极参与了这一过程。
肠道微生物影响大脑的方式有很多。例如,有些可能会分泌通过血液传播到大脑的信使分子。其他细菌可能会刺激从大脑底部延伸到腹部器官的迷走神经。细菌分子可能通过最近发现的位于肠道内壁的“神经足”细胞将信号传递给迷走神经,这些细胞感知其生化环境,包括微生物化合物。每个细胞都有一个长长的“脚”,向外延伸,与附近的神经细胞(包括迷走神经细胞)形成突触状连接。
扩展阅读:
间接影响也包括像炎症和免疫。越来越多的研究人员将炎症视为抑郁症和自闭症等疾病的关键因素。肠道细菌是免疫系统正常发育和维持的关键,研究表明,微生物的失调会破坏该过程,并促进炎症。
肠道微生物产物可能会影响肠内分泌细胞,这些细胞位于肠道内壁并释放激素和其他肽。其中一些细胞有助于调节消化和控制胰岛素的产生,但它们也会释放神经递质血清素,它会从肠道中逸出并传播到全身。
神经精神疾病的药物开发已经滞后了几十年,而且许多现有药物并不对所有患者都有效,甚至会引起不必要的副作用。越来越多的研究人员在基于微生物的治疗或“精神益生菌”中看到了一种有前途的替代方法。
事实上,临床研究表明,补充精神益生菌,不仅可以改善情绪和行为,还可以将大脑活动朝积极的方向转变,功能性磁共振成像证明了这一点。常见的精神益生菌例如:
• 干酪乳杆菌 W56(Lactobacillus casei W56)
• 乳酸乳球菌 W19(Lactococcus lactis W19)
• 嗜酸乳杆菌 W22(Lactobacillus acidophilus W22)
• 乳双歧杆菌 W52(Bifidobacterium lactis W52)
• 副干酪乳杆菌 W20(Lactobacillus paracasei W20)
• 植物乳杆菌 W62(Lactobacillus plantarum W62)
• 乳双歧杆菌 W51( Bifidobacterium lactis W51)
• 双歧双歧杆菌 W23(Bifidobacterium bifidum W23)
• 唾液乳杆菌 W24 (Lactobacillus salivarius W24)
精神益生菌的潜在作用模式
Singh S,et al.Microorganisms.2022
详见:环境污染物通过肠脑轴影响心理健康,精神益生菌或将发挥重要作用
当我们都在适应新常态时,逆转隔离对身体的影响与重新参与社交一样重要。一个重要的步骤是积极地重新调整平衡肠道微生物群,并重振肠脑轴。
健康的微生物有助于预防疾病。所以,平衡我们身体内部微生物种群与身体外部的消毒防护之间的关系很重要。继续坚持洗手,但要多吃纤维、发酵食品和益生菌,减少糖、重加工和红肉的过量摄入。
同时,加强锻炼、减少压力,野外能多走走就多走走。环境中的微生物也可以被摄入,并成为我们肠道菌群的一部分,在肠道内一些微生物种群可以帮助促进健康的肠道细胞。
扩展阅读:
“玩泥巴”也有利于健康?接触环境微生物群可能调节肠道菌群和免疫系统
结语
总的来说,肠道菌群与社会关系之间存在复杂的相互关联。
社会关系对肠道菌群的组成和多样性有着直接的影响。一个人的家庭环境、工作环境、与其他人的接触等因素都可能对肠道菌群产生影响。
此外,肠道菌群也可以反过来影响社会行为和认知能力。肠道菌群可以通过与中枢神经系统交流,来影响人体的认知和行为。肠道中特定种类的菌群可以影响情绪,从而表现出焦虑、抑郁等症状。
共享微生物带来的好处,可能会促使我们人与人之间彼此互动,同时我们也可以积极地去寻找和维护社交和友谊,以保持身心健康和肠道微生物群的健康。
主要参考文献
Holt-Lunstad, J., Smith, T. B., Baker, M., Harris, T. & Stephenson, D. Loneliness and social isolation as risk factors for mortality: a meta-analytic review. Perspect. Psychol. Sci. 10, 227–237 (2015)
Yang, Y. C. et al. Social relationships and physiological determinants of longevity across the human life span. Proc. Natl Acad. Sci. USA 113, 578–583 (2016)
Johnson KV. Gut microbiome composition and diversity are related to human personality traits. Hum Microb J. 2020 Mar;15:None.
Christian L.M. Gut microbiome composition is associated with temperament during early childhood. Brain Behav Immun. 2015;45:118–127.
Moeller A. Social behavior shapes the chimpanzee pan-microbiome. Sci Adv. 2016;2
Kim HN, Yun Y, Ryu S, Chang Y, Kwon MJ, Cho J, Shin H, Kim HL. Correlation between gut microbiota and personality in adults: A cross-sectional study. Brain Behav Immun. 2018 Mar;69:374-385.
Johnson KV. Gut microbiome composition and diversity are related to human personality traits. Hum Microb J. 2020 Mar;15:
Valles-Colomer M, Blanco-Míguez A, et al., The person-to-person transmission landscape of the gut and oral microbiomes. Nature. 2023 Feb;614(7946):125-135.
Barrett E., Ross R.P., O’Toole P.W., Fitzgerald G.F., Stanton C. γ-Aminobutyric acid production by culturable bacteria from the human intestine. J Appl Microbiol. 2012;113:411–417
Bruce-Keller A., Salbaum J.M., Berthoud H.-R. Harnessing gut microbes for mental health: getting from here to there. Biol Psychiatry. 2018;83:214–223
Lindenfors P, Wartel A, Lind J. ‘Dunbar’s number’ deconstructed. Biol Lett. 2021 May;17(5):20210158.
Dunbar, R. I. M. The anatomy of friendship. Trends Cogn. Sci. 22, 32–51 (2018)
Butler MI, Bastiaanssen TFS, Long-Smith C, Morkl S, Berding K, Ritz NL, Strain C, Patangia D, Patel S, Stanton C, O’Mahony SM, Cryan JF, Clarke G, Dinan TG. The gut microbiome in social anxiety disorder: evidence of altered composition and function. Transl Psychiatry. 2023 Mar 20;13(1):95.
Pollet, T. V., Roberts, S. G. & Dunbar, R. I. Extraverts have larger social network layers. J. Individ. Differ. 32, 161–169 (2011)
Roberts, S. G., Dunbar, R. I., Pollet, T. V. & Kuppens, T. Exploring variation in active network size: constraints and ego characteristics. Soc. Netw. 31, 138–146 (2009)
Savignac H.M., Kiely B., Dinan T.G., Cryan J.F. Bifidobacteria exert strain-specific effects on stress-related behavior and physiology in BALB/c mice. Neurogastroenterol Motil. 2014;26:1615–1627
Robb, C. E. et al. Associations of social isolation with anxiety and depression during the early COVID-19 pandemic: a survey of older adults in London, UK. Front. Psychiatry 11, 591120 (2020).
Douaud, G. et al. SARS-CoV-2 is associated with changes in brain structure in UK Biobank. Nature 604, 697–707 (2022)
Bzdok, D., Dunbar, R.I.M. Social isolation and the brain in the pandemic era. Nat Hum Behav 6, 1333–1343 (2022).
Bagga D, Reichert JL, Koschutnig K, Aigner CS, Holzer P, Koskinen K, Moissl-Eichinger C, Schöpf V. Probiotics drive gut microbiome triggering emotional brain signatures. Gut Microbes. 2018 Nov 2;9(6):486-496.

谷禾健康

写在前面
本文是谷禾健康微生物团队参考自英国大不列颠国家图书馆,美国微生物学会于 2003 年 在南卡罗来纳州查尔斯顿举办的一次微生物学座谈会,以及哈佛医学院微生物学系教授罗伯托·科尔特(Roberto Kolter)给Annual Review 期刊成立75 周撰写的微生物特刊等综合整理的,我们不是历史学家,更称不上微生物学专家,整理本文仅仅是向大家分享微生物学诞生和发展历程,以及全世界微生物学如何蓬勃发展、微生物相关技术给人类生命健康和生产生活等带来哪些影响和改变,我们相信未来微生物学的历史进程将会发生巨大的变化,因为从未见过像现在这样普遍的对微生物感兴趣。
我们应该思考随着技术的进步和人类对世界资源的压力越来越大,微生物科学正在发生怎样的变化?哪些主题值得探索,探索这些领域的障碍在哪里。
当我们站在基因组学、公众对生物恐怖主义、全球传染病爆发、前所未有的计算能力以及大规模生态灾难的可能性的交汇处,微生物学的最大机遇在哪里,什么是真正需要的,必须克服哪些障碍实现的机会?21世纪微生物学应该有哪些新方向?
总之,我们应该将此视为一个特殊的机会,致力于共同改善人们的生活和我们共同星球的健康。
前言
从当今科学飞速发展的角度来看,微生物学经历了漫长的发展。从安东尼·范·列文虎克(Antonie van Leeuwenhoek)对小动物的描述,到法国化学键路易斯·巴斯德(Louis Pasteur)创造的“微生物”一词已经过去了200多年。但是关于微生物学的累积知识和技术发展,大部分是在19世纪下半叶获得的,得益于多学科方法来研究地球上的各种微生物活动。
此时此刻,对于微生物学来说,是一个承上启下空前发展的阶段,尤其是2019 年冠状病毒病 (COVID-19) 大流后,我们越来越意识到微生物是生物圈的基础。它们是所有生物的祖先,也是所有其他生命形式的支持系统。
矛盾的是,某些微生物对人类健康以及植物和动物的健康构成威胁。作为生物圈的基础和人类健康的主要决定因素,微生物在地球上的生命中扮演着主要的、根本的角色。因此,研究微生物对于研究所有生物至关重要,而微生物学对于研究和理解这个星球上的所有生命至关重要。
微生物学研究正在迅速变化。该领域受到影响公众对微生物认知的事件的影响,例如全球大流行的新冠病毒出现和持续变异、生物恐怖主义的威胁、以前有效的抗生素和治疗微生物疾病的疗法越来越失败,以及大规模污染食物的事件。微生物研究正在利用开辟新研究领域的技术进步,特别是在基因组学方面。
微生物有着迷人的生活方式,许多生活在自然环境中的微生物会根据它们所处的环境发挥有益或有害的功能。微生物学从未像今天这样令人很多人感兴趣。强大的新技术,包括新颖的成像技术、基因组学、蛋白质组学、纳米技术、快速 DNA 测序和海量计算能力,已经融合在一起,使科学家能够深入研究以往认为无法或难以实现的研究。因此,几乎每一天都会有一项关于微生物的研究发表表明微生物具有核心重要性。
1
什么是微生物和微生物学?
微生物是在自然栖息地中共同生活的微生物群落,这些生物只能用显微镜才能看到,这些生命形式被称为微生物或微生物组。微生物包括细菌、古生菌、病毒、真菌、原生动物、朊病毒和酵母菌以及微观藻类。
微生物学是对肉眼无法看到的所有生物体的研究。微生物学研究涵盖了这些微生物的所有方面,例如它们的行为、进化、生态学、生物化学和生理学,以及它们引起的疾病的病理学。正如接下来的章节中所讨论的,微生物学在不同的流中扮演着非常重要的角色。
为什么微生物很重要?
在人类的发展史上,每个人都着延长寿命,1850年出生的婴儿只能指望活35年,然而目前的人类普遍的平均寿命都可以超过75年了。
那么人类是如何推翻掌握我们生命计算尺的预言,很大程度依赖过去,现在,未来在实验室战斗的无畏科学家们,尤其是微生物学家,比如,安东尼·飞利浦·范·列文虎克(发明显微镜,并观察到 “动物”(小动物)的微生物(细菌和原生动物)的人)、路易斯·巴斯德(他创造了“发酵”一词,是“现代微生物学之父/细菌学之父”)、罗伯特·科赫(提出科赫法则,验证了疾病的细菌理论,现代微生物的奠基人)、亚历山大·弗莱明安东(青霉素的发现者)、中国科学家伍连德(中国科学防疫第一人,世界鼠疫专家)、汤飞凡(著名微生物学家、沙眼衣原体发现人)等,他们抢救孕妇,拯救婴儿,对抗瘟疫,研制疫苗,发现抗生素等,大大扩展了人类对生命和微生物的认知,对延长人类寿命做出重要的贡献。
2
微生物和微生物学的核心作用
微生物影响着所有生命以及我们星球的物理和化学组成。从生命的起源开始,没有所有其他生物的生命是可能的,但没有微生物的生命是不可能的。
因此,科学家认为如果不考虑微生物的活动,就无法对生物学或地质学的任何分支进行深入研究。微生物是生物圈的主人,而我们存在的星球确实是微生物的星球。
微生物也是人类健康的决定因素,也是医疗和工业用途的关键材料的来源。因此,微生物学与生物化学、遗传学、进化或分子生物学一样,是生命研究的核心。
// 生命之树的根源
天体生物学中最大的问题之一是生命如何起源于地球。生命的基石和对生命至关重要的有机分子从原始地球开始就存在于地球上,在那里形成了生命的基本单位——细胞。这个过程是如何完成的,是天体生物学的主要研究领域之一。
微生物是现在地球上所有复杂多样的生物形式的祖先。植物和动物出现在微生物世界中,并与微生物保持着密切的联系和依赖。
作为生命之树的根,微生物是所有生命形成的原始模板,所有生命都与之密切相关。为了了解我们今天在生命之树的树枝顶端看到的生物的进化过程,有必要研究它们与祖先的关系以及这些祖先是什么样的。
通过研究当今生活的与第一批生命形式的特性相呼应的微生物,微生物学家试图了解创造我们全球生态系统的力量和过程。
此外,微生物是用于实验进化的卓越系统,因为它们为研究人员提供了快速的世代时间、遗传灵活性、无与伦比的实验规模和易于管理的研究系统。使用微生物的研究对所有物种的进化产生了开创性的见解。例如,对微生物相互关联性的研究首先揭示了地球上所有生命进化关联性的当前模型,即生命之树。
1970 年代发现了“生命的第三领域”。古生菌因其独特的生物学特性和大分子而被认为是非凡的研究对象。这一发现引发了许多关于生命起源和了解生物系统如何运作的潜力的问题,因为古细菌为研究提供了独特的资源,以揭示免疫系统的多样性和复杂性。
微生物学家开始拼凑生物系统如何从其组成部分工作,从而使科学家能够设计出执行定制功能的生物体。随着合成生物学领域的发展,现实世界的应用正在从思想领域和实验室范围内的研究转向产业化实践和产业。
最初,许多科学家的印象是深海通风口是生命起源的关键。在这里发现的化合物,可以在我们的海洋底部合成,尽管它是黑暗的,但有许多有机分子和微生物在那里发现了生命。这导致科学家们将他们的研究超越了我们的世界,对包括火星在内的行星进行了任务。鉴于我们知道微生物有能力在水中生存,他们一直在寻找确定“红色星球”过去是否有海洋。
// 维持地球上的生命
生命不仅始于微生物,地球上生命的持续存在完全依赖于不起眼的微生物。据估计,大约有5×10 31( 重达 50 万亿公吨)微生物细胞存在于这个星球上,它们对生物圈的重要性再怎么强调都不为过。
微生物负责循环生命中的关键元素,包括碳、氮、硫、氢和氧。通过在土壤中循环这些元素,微生物可以调节植物养分的可用性,从而控制土壤肥力并实现维持人类和动物生命的有效植物生长。
微生物在循环大气气体中也发挥着重要作用,包括造成“温室效应”的化合物,自相矛盾的是,它维持着我们星球上的生命,但通过全球变暖,对所有生物构成威胁。与绿色植物相比,微生物进行更多的光合作用。
事实证明,由于微生物可以吸收大型生物通常无法利用的营养物质和其他元素,因此微生物位于许多食物链的底部,在那里它们将以前惰性的无机材料转化到生物圈中。
微生物也是回收专家,它们降解生物废物并释放关键元素供其他生物使用。
目前,科学家才刚刚开始了解微生物如何适应环境,它们如何应对变化,以及它们如何与微生物群落的其他成员交流以执行维持生物圈的功能。了解这些现象将有助于我们更全面地了解我们的全球生态系统,并可能使科学家能够纠正人类对大大小小的生态系统的破坏。
// 对人类健康至关重要但危险
人类与微生物有着密切的关系。尽管它们对环境产生了很大的有益影响,但一小部分臭名昭著的细菌、真菌、寄生虫和病毒可能会导致疾病。
我们体内90%以上的细胞都是微生物;细菌和真菌遍布我们的皮肤、口腔、肠道和其他区域。微生物能够在我们的肠道中有效消化,合成必需的营养物质,并与身体器官保持良性甚至有益的关系。这些生物的存在会影响我们的身心健康。
微生物是如何引起疾病的?病原微生物和病毒具有各自的生态策略,该策略决定了它们攻击的位置以及它们对宿主的影响。
问题的根源之一是病原体在我们的免疫系统认为是“特权”的人体区域定殖。在进入这些地点或维持其菌落的过程中,微生物和病毒可能会对人体组织造成损害,产生疾病的迹象和症状。当免疫系统检测到微生物细胞或病毒时,疾病也可能开始。身体的免疫系统会对可能对身体本身造成伤害的外来生物进行攻击。在某些情况下,病原体在人体组织中造成的损害或对它们的免疫反应可以促进病原体向新宿主的传播。
因此,疾病的出现是一种新的致病微生物或病毒被识别或一种旧的微生物或病毒导致一种新的疾病——是当今的热门话题。从大肠杆菌O157 菌株到 SARS到COVID-19,每年都会发现新的疾病和新的病原体,这让公众感到恐惧。许多情况可能在疾病出现率的增加中起作用,包括各种宿主、环境和社会因素。
// 对工业和医学有用
工业和医学越来越依赖微生物来生产化学品、抗生素和酶,从而改善我们的世界并拯救生命。微生物正在被分子生物学工具驯化,以生产可生物降解的塑料和各种类型的新材料。
生物技术很快将成为各国工业基础的支柱,它以多种方式利用微生物和病毒,包括作物基因工程和基因治疗等不同应用。微生物学研究使这些成功的技术成为可能,而在工业和医学中使用微生物的未来进步依赖于今天进行有效的研究。
3
为什么微生物学研究很重要?
如上所述,微生物在我们的生活中起着至关重要的作用。事实上,我们不能没有他们,但他们可以没有我们。它们涉及许多过程,并且存在于多种环境中,其中一些是极端的。
由于它们的多功能性,微生物可以在许多方面发挥作用:疾病的原因和控制、制造救命药物、制造生物燃料、清理污染以及生产/加工食品和饮料,影响气候和生态环境。
// 医学微生物学的重要性
医学微生物学主要研究对人类和动物都有益和有害的微生物。医学微生物学的分支包括病毒学、细菌学、寄生虫学和真菌学等。
医学微生物学具有的一些重要特征,这些重要性在于它有助于病原微生物的鉴定、分离、诊断和治疗,还可以产生有益的生物体,如酵母菌和一些抗生素。
微生物学家研究微生物,而支撑现代社会的一些最重要的发现来自著名微生物学家的研究,例如詹纳和他的天花疫苗、弗莱明和青霉素的发现、马歇尔以及确定幽门螺杆菌之间的联系幽门螺杆菌感染和胃溃疡,以及 zur Hausen,他确定了乳头状瘤病毒与宫颈癌之间的联系。
生物医学研究源自生命和物理科学的许多领域,包括生物学。生物学家使用微生物学来开发预防疾病的新方法。微生物学提供的信息可进一步用于制造针对不同疾病的疫苗和治疗方法。
随着新细菌和感染的识别和分类,医学微生物学家的工作也在不断发展。生物学家在研究免疫系统时会使用从微生物学中获得的知识。
科学家在确定维生素补充剂对人类的影响时研究维生素效率。如果没有微生物学,科学家将无法看到细胞的内部结构并了解细菌、病毒和原生生物如何发育、生长和感染其他细胞。
微生物学在医疗设备中发挥着重要作用,例如荧光融合,用于快速准确地检测组织样本中的病原体。它是一种进行免疫荧光研究的技术,可用于在复杂的生物系统中寻找特定细胞。
医学微生物学的最大例子是给糖尿病患者注射从动物身上获得的胰岛素。但是由于大量需求以及由于它不是人类衍生的兼容性问题,因此需要一些其他来源的人胰岛素。然后采用涉及大肠杆菌的rDNA(Recombinant DNA)技术生产大量甚至安全的人胰岛素。
外科、医疗技术和药理学领域的发展促进了以前无法治愈的各种恶性和非恶性疾病的治疗。这些进步导致预期寿命和生活质量的提高。然而,也有不利的一面,包括因手术和其他侵入性手术、免疫抑制药物治疗或免疫系统老化而特别容易感染的患者数量激增。这些患者可能会感染多种微生物,包括那些通常不具致病性的微生物。
人们也越来越认识到感染的异常临床表现和病原体在它们通常不相关的身体区域中的存在。分子技术能够检测不可培养或难以培养的微生物,有望快速检测新的和不寻常的微生物。并非所有分子系统都是针对所有病原体设计的,但未来可检测微生物的范围可能会增加。
实验室检查是临床医生处理侵袭性感染患者的重要工具。脓毒症的发病率在世界某些地区有所增加,迫切需要快速识别致病微生物。与传统的培养和鉴定技术相比,多项研究已经确定现代分子方法的总体敏感性和特异性更高。检测时间也令人印象深刻,快速分子方法为 0.2-6 小时,而传统方法为 24-48 小时。
// 人体微生物学的重要性
人类胃肠道是极其密集的微生物群落的家园。这些微生物采用独特的策略在这种主要厌氧的环境中捕获能量。在分解源自饮食和宿主的底物的过程中,肠道微生物群会产生范围广泛的代谢产物,这些产物会在肠道中积累到高水平。越来越多的研究表明,这些化学物质通过作用于胃肠道内的细胞或进入循环并在体内远端部位发挥作用,从而影响宿主生物学。
鉴于肠道微生物群的高度功能多样性和多样化饮食,人体内微生物群衍生分子的组成部分因个体而异。因此,肠道中的微生物和它们产生的代谢终产物代表了一个表型杠杆,我们可以控制它来开发个性化医疗的新疗法。
越来越多的微生物组功能研究揭示了代谢物对人类健康和疾病的具体影响。随着对这些分子知识的扩展和生物学机制的阐明,将会出现一组新的治疗靶点。我们设想精确的健康策略将需要测量一个人的微生物组并将这些数据与代谢组以及蛋白组等分析相结合。然后,这些数据将指导利用微生物组的相对可塑性来调节微生物代谢物和促进健康的策略。
研究人员正在研发和推进控制微生物的个性化的策略,包括:
(a)改变微生物代谢的底物可用性
(b)通过饮食调节物种组成
(c)靶向微生物或代谢物的药物
(d)开发设计益生菌
(e)组装微生物群落
(f)进行粪便微生物群移植
….
这些策略存在于分子特异性的连续统一体上,从针对单个微生物中的单个酶的药物治疗方法到替代微生物组大部分代谢活动的粪便移植。
找到有效的策略将取决于对微生物和宿主新陈代谢的精确了解,同时需要足够大的人群数据库。这些与宿主修饰的化合物特别相关,在动物模型中控制代谢物通量的化合物可能不会在人体中这样做,因为 I 期和 II 期代谢不同。
// 环境微生物学的重要性
环境微生物学是对环境中微生物群落的组成和生理学的研究。在这种情况下,环境是指覆盖地球的土壤、水、空气和沉积物,还可以包括居住在这些区域上的动植物。
环境微生物学还包括对存在于人工环境(如生物反应器)中的微生物的研究。在这一领域工作的科学家通常强调微生物与植物生命和动物生命的相互作用,以及污染和季节变化等所有环境因素。
以下是微生物学的一些环境用途。它用于油的降解。
众所周知,石油是有毒的,石油造成的污染是一个重大的生态问题。沿海地区和公海的石油泄漏难以控制且难以缓解,但大部分石油可以通过微生物群落的碳氢化合物降解活动消除,特别是碳氢化合物细菌 (HCB)。这些生物可以帮助修复海洋栖息地石油污染造成的生态破坏。HCB 在生物塑料和生物催化领域也具有潜在的生物技术应用。
其次,它用于芳香族化合物的降解。从环境中分离出来的不动杆菌菌株能够降解多种芳香族化合物,也用于废物生物处理的分析。
分子生物学和基因组学在环境微生物学中的应用导致在自然微生物群落中发现了巨大的复杂性。在一系列分子和生物信息学技术的支持下,对自然种群的多样性调查、社区指纹识别和功能询问已经变得很普遍。
// 微生物学在食品工业中的重要性
微生物学也有助于保证我们的食品安全。微生物学帮助我们识别食物中存在的微生物。更好地了解这些微生物,帮助生物学家找出防止食物腐败变质和确保食物安全的方法。科学家使用好细菌对抗病原菌来防止食物污染。以下是微生物学在食品和农业工业中的优点。
专门研究食品细菌的微生物学家可以与食品和药物管理局合作,帮助识别可能对人类健康构成风险的食品。他们还调查食物中毒的爆发,旨在找出其原因,以防止再次发生。
微生物学也为我们提供了干净的水。这些活细菌有助于通过污水处理保持水的清洁。细菌分解污水中的有机物,在水释放回环境之前帮助净化水。
微生物学家研究微生物在土壤中的重要作用。一些专注于植物病虫害,开发控制它们的方法,甚至使用微生物来控制害虫和杂草。其他人则研究导致农场动物疾病的微生物。此外,微生物学帮助农民优化硝酸盐水平并最大限度地提高产量。
它有助于找出天然农药。很少有像细菌和病毒这样的微生物被用来对抗攻击农作物的害虫。因此,它们被称为天然农药。它们对害虫或昆虫如此特殊,不会对植物或动物和人类造成任何伤害。
帮助使用天然肥料。很少有像藻类和细菌这样的微生物通过固氮和保持土壤容量的水分来提高土壤肥力。因此,它们还保持适合植物生长的土壤微生物学。轮作是农民采用的一种技术,通过利用豆科植物根部的微生物来提高土壤肥力。
农业微生物学有助于分解废物。微生物分解农业土壤中的合成农药残留和其他有毒物质,从而保护农场免受毒素积累。
食品工业中微生物学应用的一个例子是乳酸链球菌素。它是一种抗菌剂,用于奶酪、肉类和饮料,通过抑制有害细菌的生长来延长保质期。
// 微生物学在日常生活中的重要性
微生物学在我们的日常生活中使用并在其中发挥着重要作用。这里讨论了我们日常生活中使用的微生物学的一些主要特征。日常生活中应用的微生物学,在食品生产、生物降解、商业产品生产、生物技术和基因工程方面。
有各种各样的菜肴需要微生物。例如,为了制作凝乳和奶酪,就需要微生物。一种叫做乳酸杆菌的细菌将牛奶中的乳糖转化为乳酸,从而将牛奶转化为凝乳。此外,酵母可以用来制作面包,在制作酸奶的过程中,细菌很重要。
此外,维生素K只能由人体内的微生物合成。除此之外,细菌用于合成具有商业价值的产品,例如用于制造一次性尿布和塑料的羟基丁酸。也在乙醇中,这是一种生物燃料,它们还合成氨基酸,这是非常常见的膳食补充剂。
因此,微生物学旨在通过研究微生物的形态、新陈代谢、生理学、繁殖和遗传学来获得和扩展我们对微生物的基本理解。这就是微生物学在不同领域发挥重要作用的方式。
在接下来的几年里,我们将看到微生物学的各种其他用途,这对我们在各个方面都非常有益。
1
诞生时代
▸微生物学一词是由法国化学家路易斯巴斯德 (Louis Pasteur, 1822-95) 提出的。
▸据说微生物学起源于 1850 年后生物科学的巨大扩展和发展。
▸Sedillot (1878) 首次使用微生物一词。
2
发展时代
▸17 世纪的英国科学家罗伯特·胡克是第一个使用镜头观察他称之为“细胞”的最小组织单位的人。不久之后,荷兰业余生物学家安东·范·列文虎克用他自制的显微镜观察了他所谓的“动物”。
▸荷兰代尔夫特的安东尼·范·列文虎克 (1632-1723)是第一个在 1676 年观察并准确描述称为“动物”(小动物)的微生物(细菌和原生动物)的人。他建造了 250 多台小型强大的显微镜,可以放大大约 50-300 倍。
▸列文虎克是第一个使用他自己制造的显微镜对细菌和原生动物进行精确和正确描述的人。由于对微生物学的这一非凡贡献,安东尼·范·列文虎克被认为是“微生物学之父”。
3
过渡时代
▸当已知微生物存在时,大多数科学家认为这种简单的生命形式肯定可以通过自发产生。也就是说,生命被认为是从泥泞、湖泊或任何营养充足的地方自发产生的。这个概念是如此引人注目,以至于它一直持续到 19 世纪后期。
▸Francesco Redi (1626-1697):自发产生的古老信念首先受到意大利医生 Redi 的挑战,他对腐肉及其自发产生蛆的能力进行了一系列实验。
▸John Needham (1713-1781):他可能是自发产生理论的最大支持者。他提出这种微生物是在他的羊肉汁中自发产生的。他像 Redi 那样用软木塞盖住烧瓶,甚至加热了一些烧瓶。微生物仍然出现在羊肉汤上。
▸拉扎罗·斯帕兰扎尼(Lazzaro Spallanzani,1729-1799):他是一位试图反驳李约瑟实验的意大利博物学家。他将牛肉汤煮了更长的时间,从烧瓶中抽出空气,然后密封容器。在温育之后,他在这些烧瓶中没有观察到生长。他表明,只要在脖子上开一个小裂缝,加热的营养物质在暴露在空气中时仍然可以生长出微生物。因此,斯帕兰扎尼反驳了自发产生的学说。
▸Nicolas Appert遵循了 Spallanzani 的工作理念。他是一位法国酿酒师,他证明了汤和液体可以通过在厚厚的香槟瓶中广泛加热来保存。
▸Ignaz Semmelweis和John Snow是对疾病传播方式的认识日益增强的两个人。
▸两位德国学者Schulze (1815-1873)和Theodor Schwan (1810-1882)认为空气是微生物的来源,并试图通过将空气通过热玻璃管或强化学物质进入烧瓶中煮沸的输液来证明这一点。两种情况下的输液都没有微生物。
▸George Schroeder和Theodor Von Dusch (1854)率先提出使用棉塞塞住微生物培养管的想法。
▸达尔文(1859 年)在他的著作《物种起源》中表明,人体可以被视为易受自然法则影响的生物。他认为疾病可能是一种生物学现象,而不是任何魔法。
4
黄金时代
▸微生物学的黄金时代始于路易斯巴斯德和罗伯特科赫的工作,他们拥有自己的研究所。更重要的是,全世界的科学界都接受了他们的工作,并愿意继续和扩展这项工作。在此期间,我们看到了微生物学作为生物学学科的真正开端。
▸法国化学家路易斯·巴斯德( Louis Pasteur)在一组涉及鹅颈烧瓶的启发性实验中最终搁置了自发产生的概念。当他在直颈烧瓶中煮肉汤并将其暴露在空气中时,有机体就会生长。当他用他的鹅颈烧瓶做这个时,什么都没有。第二个烧瓶的 S 形截留空气中的灰尘颗粒,防止它们到达肉汤。通过证明他可以让空气进入烧瓶而不是空气中的颗粒,巴斯德证明了在肉汤中生长的是灰尘中的有机体。
▸因此,巴斯德在 1858 年终于解决了自发产生与生物发生的争论,并证明微生物不是从无生命的物质自发产生的,而是从其他微生物产生的。
▸他还发现水果和谷物发酵产生酒精是由微生物引起的,并确定细菌是发酵过程中葡萄酒变质的原因。巴斯德在 1862 年提出,在 62.8°C (145°F) 温度下温和加热 30 分钟而不是煮沸足以在不破坏产品味道的情况下破坏有害生物,该过程称为巴氏杀菌。巴氏杀菌法于 1892 年在商业基础上引入美国。他的工作导致了疾病细菌理论的发展。
▸路易斯巴斯德被誉为“现代微生物学之父/细菌学之父”。
▸John Tyndall (1820 – 1893):一位英国物理学家,在 1877 年对自发产生进行了最后一击。他在一个无菌设计的盒子中进行了实验,以证明灰尘确实携带了细菌。他证明,如果不存在灰尘,无菌肉汤即使直接暴露在空气中,也可以无限期地保持没有微生物生长。他在干草的输液中发现了高度抗性的细菌结构,后来被称为内生孢子。需要长时间煮沸或间歇加热来杀死这些孢子,使输液完全灭菌,这一过程称为丁达尔化。
▸大约在巴斯德进行实验的同时,一位名叫罗伯特·科赫的医生正在努力寻找一些非常讨厌的动物疾病(首先是炭疽,然后是肺结核)的原因。他首次直接证明了细菌在引起疾病中的作用。他是一位德国医生,1876年首先分离出炭疽杆菌(Bacillus anthracis,引起炭疽病)。他完善了纯培养分离细菌的技术。他还在 1881 年通过使用明胶作为固化剂介绍了固体培养基的使用。1882年发现结核分枝杆菌. 他提出了科赫假设,该假设发表于 1884 年,是疾病细菌理论的基石,至今仍在用于证明传染病的病因(具体原因)。
科赫的四个假设是:
许多科学家的共同努力,最重要的是路易斯巴斯德和罗伯特科赫建立了疾病的细菌理论。看不见的微生物是疾病的原因的想法被称为细菌理论。
5
医学和外科的发展
▸一旦科学家们知道微生物会导致疾病,医疗实践的显着改善只是时间问题。手术曾经和不做任何事情一样危险,但一旦引入无菌(无菌)技术,康复率就会显着提高。洗手和对感染患者进行隔离减少了疾病的传播,并使医院成为接受治疗的地方,而不是死亡的地方。
▸约瑟夫·李斯特勋爵 (1827-1912):一位著名的英国外科医生,因其对预防和治疗伤口感染的抗菌治疗的显着贡献而闻名。Lister 得出结论,伤口感染也是由微生物引起的。
1867 年,他开发了一种消毒手术系统,旨在通过在手术敷料上使用苯酚来防止微生物进入伤口,有时还会喷洒在手术区域。
他还设计了一种方法,通过向空气中喷洒细小的石炭酸雾来破坏手术室中的微生物,从而产生消毒环境。因此,约瑟夫李斯特是第一个引入无菌技术,通过使用今天仍在使用的物理和化学试剂来控制微生物。由于这一显着的贡献,Joseph Lister 被称为防腐手术之父。
▸微生物的致病机理在很大程度上是环境微生物学的一部分。罗伯特·科赫的工作是世界观即将发生变化的主要驱动力。科赫证明细菌是重要传染病的病原体,这一观点的强大吸引力使微生物学的医学方面处于中心地位。知道细菌是传染病的病原体,长期以来一直是人类死亡的主要原因,意味着如果你能杀死负责的细菌,你就能治愈疾病。
▸到了20世纪初,微生物学主要集中在努力识别人类传染病背后的微生物。1918年流感大流行造成的可怕死亡人数只是加速了这些努力。由于直到20世纪30年代才发现流感病毒,在此之前,人们认为罪魁祸首是一种细菌,因此在大流行之后的几年里,许多致病细菌都得到了鉴定和深入研究。在这种情况下,关于微生物有益方面的研究基本上被搁置一旁。
▸在鉴定致病微生物的同时,许多微生物学家将注意力转向发现能够专门杀死这些微生物的化合物,这导致了20世纪人类医学史上最戏剧性的革命。
萨哈希罗·哈塔(Sahachiro Hata)和保罗·埃利希(Paul Ehrlich)的早期努力产生了第一种有机抗菌剂,即毒性较大的砷胂胺(Salvarsan),早在1910年就用于治疗梅毒。将染料用作抗菌灵丹妙药的长期努力导致了磺胺类药物的偶然发现,首先是磺胺嘧啶核苷(Prontosil),它在20世纪30年代进入临床使用。但毫无疑问,最有影响力的早期抗菌药物是青霉素。
从1928年亚历山大·弗莱明意外发现青霉素,到1942年霍华德·弗洛里、恩斯特·查恩、玛格丽特·詹宁斯等人在牛津大学的开创性工作,青霉素的纯化和有效注射使用,这种抗生素的开发仍然是人类最伟大的成就之一。
▸一种临床上有用的杀死其他微生物的微生物产品的发现对微生物学、医学和整个制药业的历史产生了持久的影响。为了发现更多的抗生素,出现了一场巨大而非常成功的热潮。
抗生素的临床成功导致其产量增加。这最初得益于20世纪40年代初的世界大战思维。由于青霉素被视为战争中的神奇药物,它的产量在很短的时间内急剧增加。1941年,全球的库存量只有几毫克,到1945年,每月生产近4000公斤。
由于与环境微生物学的分歧,医学微生物学很少关注生产和使用如此大量抗菌剂的生态后果。那些对根除病原菌的方法感兴趣的人和那些对微生物生态学感兴趣的人之间几乎没有什么合作和深入的交流对话。
6
疫苗开发
▸疫苗接种是在细菌理论之前发现的,但直到巴斯德时代才被完全理解。在 18 世纪后期,挤奶女工从他们挤奶的奶牛身上感染了非致命的牛痘病,而这些女工在周期性地肆虐英格兰的致命天花爆发中幸免于难。医生爱德华·詹纳(Edward Jenner)使用牛痘痂脓液为人们接种天花疫苗。
▸爱德华·詹纳(Edward Jenner,1749-1823)是第一个预防天花的英国医生。观察到农村挤奶女工在挤奶时接触了牛痘(牛痘是一种与天花密切相关的病毒引起的较轻的疾病),随后对天花产生了免疫力,这让他印象深刻。1796年 5 月 14日,他证明给人们接种牛痘病灶的脓液可以预防天花。
▸Jenner 于 1798 年发表了他对 23 名成功接种者的研究结果。最终这个过程被称为疫苗接种,基于拉丁词“Vacca”,意思是奶牛。
▸Jenner 的实验意义是由巴斯德实现的,他接下来将这一原理应用于预防炭疽病,并且奏效了。他将减毒培养疫苗(Vacca = 牛)和该过程称为疫苗接种。
受到通过疫苗接种成功预防炭疽热的鼓舞,巴斯德通过研制一种针对恐水症或狂犬病(一种通过狗和其他动物叮咬传播给人类的疾病)的疫苗,朝着为人类服务的方向前进。
与詹纳的天花疫苗接种一样,狂犬病的预防治疗原则也充分发挥了作用,为现代免疫计划奠定了针对白喉、破伤风、百日咳、脊髓灰质炎和麻疹等许多可怕疾病的免疫计划的基础。
▸Elie Metchnikoff (1845-1916)于 1883 年提出了免疫吞噬理论。他发现一些血液中的白细胞、白细胞 (WBC) 通过吞噬引起疾病的细菌来预防疾病。这些细胞被称为吞噬细胞和吞噬过程。因此,人体血细胞也具有免疫力,称为细胞免疫。
7
化疗药物、抗毒素和抗生素的开发
▸两位著名的法国细菌学家Emile Roux (1853-1933)和Alexandre Yersin证明了在白喉生物肉汤培养物的滤液中产生了毒素。
Emil von Behring (1854 -1917) 和 Shibasaburo Kitasato (1852-1931) 都是 Robert Koch 的同事,在 1890 年发现了破伤风(锁颚)抗毒素。在宣布发现破伤风抗毒素仅大约一周后,1890 年,冯·贝林 (Von Behring) 就用白喉抗毒素对白喉进行免疫治疗提出了反驳。毒素-抗毒素关系的发现对免疫学的发展具有重要意义。
▸Paul Ehrlich (1854-1915)在 1904 年发现染料台盼红对导致非洲昏睡病的锥虫具有活性,可用于治疗。这种具有抗菌活性的染料被称为“魔术子弹”。随后在 1910 年,埃利希与日本医生畑坂弘合作,推出了药物 Salvarsan(砷苯)作为治疗由梅毒螺旋体引起的梅毒。Ehrlich 的工作为未来的许多发展奠定了重要基础,Salvarsen 的使用标志着化学疗法的开端,以及选择性抑制或杀死病原体而不对患者造成伤害的化学物质的使用。
▸1935 年,德国的Gerhard Domagk用多种合成染料进行了实验,并报告说 Prontosil 是一种用于给皮革染色的红色染料,它对小鼠体内的病原体、链球菌和葡萄球菌具有活性,尽管它在试管中对相同的传染原没有作用。同年,两位法国科学家 Jacques 和 Therese Trefonel 表明,化合物 Prontosil 在动物体内被分解为真正的活性因子磺胺(磺胺药物)。Domagk 因发现第一种磺胺类药物而于 1939 年获得诺贝尔奖。
▸抗生素是在 1920 年代完全偶然发现的,当时在培养皿(称为盘子)中放置的固体培养物比平时更长。就像任何食物来源一样,它会发霉,长出一块毛茸茸的真菌。与平板其余部分的细菌相比,真菌菌落周围区域的菌落尺寸较小,并且似乎生长不良。被发现负责这种抗菌作用的化合物被命名为青霉素。第一种抗生素青霉素后来被用于治疗患有各种细菌感染的人,并预防烧伤患者的细菌感染,以及许多其他应用。就这样,亚历山大·弗莱明爵士在 1929 年发现了第一个抗生素青霉素。
▸美国罗格斯大学的瓦克斯曼在 1944年发现了另一种抗生素链霉素,它是由两种放线菌(灰色链霉菌)产生的。瓦克斯曼于 1952 年因发现用于治疗结核病的链霉素获得了诺贝尔奖,这是一种由结核分枝杆菌引起的细菌性疾病由 Robert Koch 于 1882 年发现。
▸到 1950 年,又鉴定出其他三种产生抗生素的微生物,例如Paul R. Burkholder 博士于 1947 年从委内瑞拉链霉菌中提取的氯霉素(氯霉素),以及BM 博士从金黄色葡萄球菌中提取的金霉素1948 年的挖掘机;Finlay、Hobby 和合作者于 1950 年从S. rimosus中提取土霉素。
▸1910 年罗伯特·科赫 (Robert Koch) 去世和第一次世界大战的到来标志着微生物学研究发生了巨大转变。巴斯德研究所关闭,德国实验室转而生产用于治疗战争感染的血液成分。许多人称之为微生物学的黄金时代就此结束。
8
20世纪:分子生物学时代
▸到 1900 年底,微生物学发展到青春期,并已成为更具包容性的生物学领域的一个分支。
晚年,微生物被作为研究各种生命过程的理想工具而被广泛采用,由此诞生了一个独立的微生物学学科——分子生物学。
微生物的相对简单性、它们的短寿命和遗传同质性为了解活生物体的生理、生化和遗传复杂性提供了一个真实的模拟模型。
分子生物学领域在理解遗传密码、如何调节 DNA 以及如何将 RNA 翻译成蛋白质方面取得了长足的进步。在此之前,研究主要集中在植物和动物细胞上,它们比细菌细胞复杂得多。当研究人员转而研究细菌中的这些过程时,基因和酶的许多秘密开始显露出来。
▸快速浏览一下从 1947 年到 1976 年分子生物学取得的进展,绝对会让人惊叹不已。科学从对基因性质的不确定状态转变为对复制、转录、翻译的分子基础以及如何调节这些过程的基础知识的相当完整的理解。大多数进展是细菌遗传学(Delbrück 和噬菌体小组的遗产)和生物化学(以 Avery 的纯化和表征方法为例)结合在一起的结果,生物物理学也做出了重要贡献。这一切的中心是大肠杆菌及其噬菌体。
很容易想象单看 DNA 结构就能揭示 DNA 复制和蛋白质合成的机制。但这种结构无疑提供了使用所有可用工具解决这些问题所需的所有动力。在不到十年的时间里,复制和蛋白质合成的一般机制被研究出来。
▸在提出 DNA 结构后不久,了解 DNA 中包含的信息如何被处理以产生蛋白质成为一个关键问题。1954 年,宇宙学家 George Gamow 提出了一种过程,即蛋白质合成通过钥匙锁机制在 DNA 表面发生,其中每个氨基酸都将作为一把钥匙,专门插入可能的 20 个孔或锁中的一个。
▸大部分关于 DNA 如何通过 RNA 聚合酶转录成 mRNA 以及 mRNA 如何在核糖体中翻译成蛋白质以及破译遗传密码的基础知识都发表于 1961 年,这是分子生物学非凡的一年。
▸核糖体于 1955 年被发现并被描述为真核细胞中蛋白质合成的场所。1958年报道了tRNA的存在。但到 1960 年底,几乎没有更多细节被公布。然后,在短暂的推进中,所有的拼图都慢慢凑齐了。基于对噬菌体突变体的遗传分析,Crick 与 Leslie Barnett、Sydney Brenner 和 Richard Watts-Tobin (23) 表明遗传密码是三联密码,三联密码不重叠,密码不包含逗号,每个基因序列都是从特定的起点读取的。
▸ 在基因活动调控这一主题上取得的进展使 1961 年发表的所有其他成就加冕。虽然研究了许多系统,但毫无疑问,在该主题上最有影响力的工作来自弗朗索瓦·雅各布和雅克·莫诺。通过应用遗传分析来研究大肠杆菌中β-半乳糖苷酶活性的诱导,他们开辟了一个关于基因如何关闭和开启的全新世界。
特别是,到 1961 年,他们发表了具有里程碑意义的论文,展示了他们积累的关于乳糖利用基因如何在大肠杆菌中受到调节的遗传证据。其中,他们提出了他们的操纵子模型,其中多个编码酶的基因由作用于操纵基因的阻遏基因调节。事实证明,他们的想法对分子生物学家如何进行基因调控研究产生了持久而极强的影响。
9
归为统一,21世纪微生物学
在 20 世纪的最后 20 年里,毫无疑问,研究宿主-病原体与模型系统和纯培养物相互作用的非常成功的方法使他们中的许多人专注于他们正在进行的研究。1999 年发表了使用非培养方法描述人类肠道微生物群高度多样性的最早报告之一。也许是因为它的资深作者 Joel Doré 曾接受过环境微生物学家的培训,这项开创性的工作几年来相对不为人所知。
在 Torsvik 描述土壤中的高细菌多样性 15 年后,Paul Eckburg、David Relman 及其同事在 2005 年发表了一篇广泛阅读的论文,描述了人类肠道中的高微生物多样性。这项工作让许多人大开眼界,它引发了人类微生物群研究的爆炸式增长。很快,几个实验室要么在纯培养中研究模型微生物,要么在动物模型中使用它们,转而使用独立于培养的方法研究人类微生物群的不同方面。这种转变恰逢测序方法的显着改进和计算能力的提高。
这个话题引起了科学家和公众的极大兴趣,因此美国国立卫生研究院于 2007 年启动了耗资 1.7 亿美元、为期 10 年的人类微生物组计划。尽管对因果关系有大量的夸张和广泛的不恰当解释,但将特定的微生物群落组成与功能联系起来有很多精彩的工作,这项新工作还包含生态学。
人类希望发展能够减轻与人类疾病相关的痛苦的医学实践,推动了继续进行基因研究的努力。世界各地的研究人员越来越多地以联盟和其他协作小组的形式聚集在一起,以完成生物学的重大成就。这些努力的第一个重大成功是人类基因组的测序,这是通过人类基因组计划(HGP) 完成的。
这种对理解人类与其相关微生物群落之间相互作用的兴趣的增加对整个微生物学产生了深远的,当然也是非常积极的影响。生态学家、进化生物学家、化学家、物理学家、计算生物学家和其他人已经进入该领域,因为他们的专业知识变得至关重要。现在,人们对微生物及其代谢途径的广泛多样性的研究重新引起了人们的关注,因为人们认识到所有生态系统都在其最基本的水平上存在微生物。生态和进化原理现在指导着微生物的研究。无论是研究人类肠道还是南极洲的冰冻湖泊,都是环境微生物学。
10
过去十年,微生物学发生了怎样的变化
在过去的 15 年里,这一统一的新微生物学出现了许多令人兴奋的新进展,因此不可能在此一一介绍。最近的历史仍在形成中,而且是最难评估的。
公众现在比历史上任何时候都更加了解微生物和病毒。不幸的是,这种公众意识通常伴随着焦虑和恐惧。过去十年的事件和媒体报道这些事件的基调助长了公众的恐惧,并产生了微生物世界风险增加的看法。这种“微生物恐惧症”导致消毒剂、抗菌肥皂和其他声称可以阻止疾病的产品的普及。
与传染病相关的话题对微生物学家来说当然不是什么新鲜事,但过去十年的发现和进步揭示了该领域的新视野,为提高人类生活质量提供了令人兴奋的机会。预测疾病出现的能力是一个特别关键的话题。对引发病原体出现的环境因素、驱动疾病迁移的因素以及疾病频率的季节性模式的研究可能会揭示影响新旧疾病如何在人群中出现和持续存在的因素。这些观察结果将使我们能够为新的和现有的病原体设计更好的治疗策略。
最近发现将人类疾病越来越多的与细菌或病毒原因联系起来,突出了其他具有神秘病因的慢性疾病也可能由微生物介导的可能性。候选药物包括炎症性肠病、糖尿病、类风湿性关节炎、结节病、系统性红斑狼疮和冠状动脉疾病。对这些疾病和其他疾病原因的研究将更加了解这些疾病及其诊断、预防和治疗。
生物恐怖主义以及炭疽或其他传染性微生物可能被用作对付无辜平民、农作物或牲畜的武器的明显可能性已经吓坏了全球人民。COVID-19、SARS、西尼罗河病等新型传染病的出现明显增加,也将微生物带入了公众视野。
最近,用于对抗某些传染病(包括艾滋病和肺结核)的常规健康疗法由于这些病原体的不断进化而失败,这加剧了公众对科学家和医生保护公众免受熟悉疾病侵害的能力的怀疑。一些曾经被认为是由遗传易感性或偶然性等因素引起的慢性疾病已被证明是由细菌或病毒引起的。而在很多国家,大规模食品污染事件呈上升趋势。
由于公众对生物战、传染病和食源性疾病的担忧,过去十年微生物学的进步经常被忽视。然而,过去十年的进步是不可否认的。药物研究现在严重依赖微生物和微生物学来进行药物发现和生产。2019年,美国科学家团队捕捉到细菌“间谍”:研究人员发现了一种有助于耐药细菌感知抗生素的蛋白质。肠道微生物作为隐藏的骑士:肠道微生物群被证明可以保护宿主免受轮状病毒感染。
使用微生物进行工业过程的绿色化学是解决化学相关行业安全性和可持续性问题的一种日益有效的策略。生物技术也依赖微生物技术和微生物基因来进行改良,以改善作物、牲畜品种和合成原料。
在农业中,微生物和微生物产品现在用于益生菌疗法、抗生素和害虫防治措施。
食品微生物学的进步提高了我们在超市和餐馆购买的食品的安全性,无疑每天都在挽救生命。
在危险废物处理场,微生物已经开始消化有毒化学物质——将它们代谢成无害物质,从而防止进一步污染土壤和水。
生物恐怖主义和疾病令人恐惧,但应牢记微生物学的进步和应用微生物正在解决看似棘手的人类问题。
在过去十年中,不仅公众对微生物学的看法发生了变化,微生物学研究的实践也发生了变化。过去十年的微生物学是充满活力和令人兴奋的,新的发现建立在过去非凡的工作之上。
1
更多的综合,更少的简化
微生物学曾经几乎只关注在人工条件下孤立生长的单个微生物,试图从实验室记录的微小观察中推断出对疾病或环境的理解。然而,今天,许多科学正在从还原论方法转向综合领域——将微生物、其环境以及其他生物体在许多尺度上的影响的测量和观察编织在一起,以创建一个综合图景的微生物活动。曾经不熟悉的细胞由相互作用的蛋白质网络组成的概念现在已经渗透到科学界。现在更加重视系统级研究,其中微生物在其栖息地被视为一系列相互关联的隔间、过程、和反馈。
将合成或系统镜头放在微生物学上可能具有很高的指导意义,并且与严格的还原论相比具有几个优点。希望在未来,综合方法将使微生物学家能够预测微生物结果,使他们能够查明人类健康或给定生态系统扰动的后果。
2
更加重视进化和生态
在过去的十年里,微生物学家越来越认识到生态和进化的重要性。实验生态学和进化论的研究提供了不仅适用于微生物的原理的证据,也可能适用于更大的生物体。生态思维已占主导地位,微生物学不再是过去的试管科学。一个例子是认识到微生物引起疾病的方式实际上是一个生态问题,需要了解微生物及其环境——疾病的宿主。
微生物学研究的调查方式也发生了变化。以前,由于技术限制或缺乏与微生物学相关的领域(如土壤科学、地质学或医学)的专业知识,许多调查潜力领域都被关闭了。在这些情况下,研究中的问题经常被重新定义以适应手头的技术和主要研究者的学术经验。今天,这些探究路线通常通过应用过去十年的技术进步进行正面探索,更重要的是,通常通过合作从其他学科招募专业知识和资源。
3
技术进步
技术进步改变了微生物学研究的格局,使长期存在的关于微生物的问题终于可以研究。在过去十年的重大进步中,最主要的是使基因组学成为可能的技术的发展,包括增强的计算能力、更快速的 DNA 测序和其他实验室技术。
基因组学利用基因组的全部或部分,即细胞的完整遗传体,来回答有关生物体的问题。尽管基因组学已经影响了大部分生命科学,并让人们对所有生命形式的功能和过程有了新的认识,但其最重要的影响还是对微生物学的影响,这一发展为微生物的生态学和进化开辟了新的认识。其他大规模研究,例如蛋白质组学或转录组学(基因表达的模式),也对微生物学研究的实践产生了很大影响。
信息技术的进步增加了所有领域研究人员之间的互动,使微生物学与其他学科之间的共同点得以持续对话。纳米技术和相关方法应该允许研究人员用单细胞进行实验,回答关于微生物生理学的长期问题。
最后,核磁共振成像 (NMR)、ESR 等高端成像技术允许对微生物细胞结构和微生物群落结构进行详细分析。信息技术的进步增加了所有领域研究人员之间的互动,使微生物学与其他学科之间的共同点得以持续对话。
纳米技术和相关方法应该允许研究人员用单细胞进行实验,回答关于微生物生理学的长期问题。最后,核磁共振成像 (NMR)、ESR 等高端成像技术允许对微生物细胞结构和微生物群落结构进行详细分析。
随着分子微生物学的出现,用于定义疾病微生物病因的传统方法(如科赫假设)已被发现不足,因为它们经常导致“假阴性”结论。研究人员一直在努力制定强有力的标准来识别超出科赫假设的微生物因果关系,并利用技术进步来识别因果关系,即使是无法在实验室培养的微生物也是如此。
本科阶段的培训
在本科阶段,微生物学教育有两个不同的方面:培养未来的微生物学家和培养其他领域的生物学家。关于培养未来的微生物学家,需要努力修改教科书,以反映关于微生物全球重要性的新知识,并克服可能仍然困扰一些微生物学课程的对记忆的强调。
很明显,所有生命科学家都应该接受微生物学培训,作为其核心课程的一部分。微生物生理学、进化、生物化学和遗传学等主题都应纳入生命科学本科生的课程。
幸运的是,有很多机会将适当的微生物学课程引入其他学科的课程。例如,几乎所有生物学学生都需要的有机化学课程将从微生物学和绿色化学的例子中受益,以证明从简单的前体合成复杂的化合物。即使是生命科学以外领域的学生也会从微生物学课程中受益,可能会在非专业的生物学探索课程中作为“微生物和你”部分进行介绍。
在许多大学中,微生物学被严格视为专业领域,而不是核心学科。鉴于微生物科学的根本意义,应该认识到拥有大量微生物科学教师的重要性。这样的教师不一定要设在微生物学系。地质学、化学、临床医学、工程学甚至历史学系都非常需要微生物学家的任命。这些教师可以跨越传统的部门障碍,在许多领域进行互动,有效地教育和培训下一代科学家。
提高微生物素养
回顾事实:微生物是最早的生命形式,它们是人类健康的重要决定因素,它们执行确保清洁饮用水和肥沃土壤的过程。它们是基因和生化最多样化的生命形式,也是地球上进化最快的生物。
微生物控制着世界营养物质和生命必需物质的环境循环。在每一个裂缝和每一个表面,从地壳深处,再到地球上每一种昆虫的肠道,微生物都在那里。
它们是所有生物系统的关键组成部分。鉴于这些事实,很明显微生物学家必须努力教育公众和政策制定者。然而,公共素养从事微生物学工作的人所经历的兴奋与公众的意识水平之间存在着严重的鸿沟。
然而,有证据表明,在艾滋病毒-艾滋病、西尼罗河病和 SARS 等重大公共卫生问题上对公共扫盲的支持水平提高会影响大学生对专业和研究项目的选择。换句话说,提高公共素养可能有助于引导学生进入最需要他们精力的领域。
此外,公众舆论可以通过提高对微生物学中未解决问题的认识来引导,从而影响领导者将资源投入到需要的领域。因此,旨在解决微生物学重大问题的培训计划应包括培养公众和政府意识的外展计划。
对公众进行微生物学教育的最佳方式是什么?迫切需要向公众宣传微生物学成功和紧迫的公共卫生问题的机制。
沟通问题
在向公众传达有关微生物学的信息时,首先要确定目标受众和适合传达给每个受众的信息类型是至关重要的。微生物外展的潜在目标受众包括一长串,包括商界领袖、各级学生和教师、公职人员、卫生专业人员(可能对微生物学不够熟悉)、农民、餐馆工作人员、联邦决策者机构等。
为了实现最有效的外展计划,教育公众的过程应该有明确的目标。具体的外展计划应该考虑到可以在指定时间段内实施的具体教育目标。这种方法将允许进行有针对性的评估,以确定外展计划在向公众传播微生物学方面是否有效。例如,一个项目的目标可能是在五到十年内对公众进行特定微生物学主题的教育,并且可以使用调查或其他指标来衡量目标受众的知识水平。
沟通的途径
向非科学家传达科学信息的最佳方式是什么?有许多途径可供外展。
例如,可以发起一项运动,向使用公共交通工具的人展示科学信息:公共汽车、火车、出租车或机场。
基于微生物主题的流行书籍的出版也将吸引大量读者。科学博物馆是教育年轻人的有力渠道,互动微生物展品可以以一种引人入胜的方式激发许多未来科学家的思想。也可以使用大众媒体。
以系统的方式研究目前用于向公众传播的与微生物学相关的材料的质量可能是有益的。目前缺乏公共知识可能是由于可用信息质量差,而不是可用性低。
改善向公众提供的知识需要让传播专业人士参与并通知他们。微生物组织应优先接触传播专业人士,并应帮助培训科学作家。
与决策者沟通
关于推进本报告中概述的目标,“决策者”一词包括联邦机构,例如国家科学基金会、卫生研究院、环境保护署、能源部、疾病控制和预防中心、农业部。其他包括地方教育委员会、国土安全部、食品和药物管理局、私人基金会等。
荧光显微镜、热循环仪、qPCR 机器、杂交炉、自动化专家系统、专用试剂——这些是现代微生物实验室更昂贵的要求。
在一些地区,新技术的吸收速度一直很慢。对于资源匮乏的地区,这些障碍似乎无法克服,因为必须为升级实验室基础设施和员工培训以及购买主要设备分配大量资金。同时,采购所需的设备、试剂供应和售后服务也很困难。
用于确认临床诊断、进行传染病监测和指导公共卫生保健政策的实验室拨款相对较少。获得良好实验室检测的机会有限导致对临床算法的依赖,但如果没有实验室确认,误诊可能很常见,导致治疗不充分、死亡率增加和缺乏对传染病真实流行率的了解。
受微生物科学进步影响但本身不是微生物学家的知情人士可能是微生物学的最佳倡导者之一。例子包括生物技术公司及其客户的代表、依赖训练有素的微生物学家技能的商业创始人、使用微生物修复财产的社区成员以及微生物疗法的受益者,包括细菌衍生的抗生素和其他药物。
建议
由于微生物对生命至关重要,并且在生物学研究中必须考虑到它们的活动,所有生物学家都必须具有扎实的微生物科学背景。微生物学课程应纳入生命和地球科学所有学生的核心课程。
在年轻学生中建立对微生物的了解,最终将提高公众对微生物对个人和地球日常健康重要性的认识。修改小学、初中和高中的学校科学课程,以包括微生物学课程和实验室练习。
通过与疾病相关的问题、生物技术、生物恐怖主义和食品安全,微生物和微生物学对公众产生了深远的影响。为了提高个人管理健康和对微生物科学做出明智判断的能力,与微生物学相关的专业协会应支持培养公共微生物素养的项目。
主要参考文献:
Microbiology in 20th Century. 2011. Link (accessed July 21, 2016).
Introduction to Microbiology. 2016. Link (accessed July 21, 2016).
Microbiology, American Society For. Significant Events in Microbiology 1861-1999. 2006. Link (accessed july 21, 2016).
Rhoads, Dan. History of Cell Biology. 2007. Link (accessed July 22, 2016).genbacteriology.
Bacterial Growth. 2015. Link (accessed July 22, 2016).
Utah.edu. PCR. 2016. Link (accessed July 22, 2016).
Innes, Centre John. Microscopy. 2016.
Mikell, Meredith. Understanding Cell Biology: History & Theories. 2003.
Pasteur, L. “”Animalcules infusoires vivant sans gaz oxygene libre et determinant des fermentations.”.” Compt. Rend. Acad. Sci., 1861: 344-347.
Pray, L. “Discovery of DNA Structure and Function: Watson and Crick.” Nature Education, 2009: 100-101
Microbiology in the 21st Century: Where Are We and Where Are We Going? This report is based on a colloquium sponsored by the American Academy of Microbiology held September 5–7, 2003, in Charleston, South Carolina. Washington (DC): American Society for Microbiology; 2004. PMID: 32809308.
Microbiology in the 21st Century: Where Are We and Where Are We Going?
American Academy of Microbiology held September 5–7, 2003, in Charleston, South Carolina.
Washington (DC): American Society for Microbiology; 2004.
Engelkirk, P. G., Duben-Engelkirk, J. L., & Burton, G. R. W. (2011). Burton’s microbiology for the health sciences. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins.
Levinson, W. (2014). Review of medical microbiology and immunology (Thirteenth edition.). New York: McGraw-Hill. Chicago
Cowan, M. Kelly.Herzog, Jennifer. (2013) Microbiology fundamentals :a clinical approach New York, NY : McGraw-Hill
Trivedi P.C., Pandey S, and Bhadauria S. (2010). Textbook of Microbiology. Pointer Publishers; First edition
Tortora, Gerard J., Funke, Berdell R.Case, Christine L.. (2013) Microbiology :an introduction Boston : Pearson.
Apurba Sankar Sastry and Sandhya Bhat K. 2018. Review of Microbiology and Immunology. 6th Edition. Jaypee Brothers Medical Publishers (P) Ltd.

谷禾健康

从生命早期到成年,微生物群对婴儿的健康起着至关重要的作用。生命早期的微生物群不仅是婴儿健康的关键调节剂,而且与长期健康有关。怀孕到生命早期是婴儿微生物群建立的黄金时期,受环境和遗传因素的影响。
最近,关于微生物群在人类疾病中作用的 研究呈爆炸式增长,但在疾病或健康方面的应用相对有限,因为人类微生物群的许多方面仍然存在争议,尤其是婴儿微生物群。
在怀孕期间,母体微生物群会影响胎儿的发育,尤其是大脑发育,如子宫微生物群、阴道微生物群、胃肠道微生物群、胎盘微生物群(有争议的)和口腔微生物群。值得注意的是,母体微生物群的紊乱会导致不良妊娠结局,严重威胁后代的健康。出生后,受环境和遗传因素影响的婴儿微生物群迅速建立,以确保健康成长。
孕期母体微生物群
以前,胎儿宫内感染的罪魁祸首被认为是来自阴道的微生物,如细菌、病毒和真菌。然而,随着科学技术的发展,人们发现口腔和肠道微生物群也与胎儿的健康有关,因为这些部位的微生物群可以通过血液传播。
在怀孕期间,母亲的肠道、口腔和阴道微生物群都会发生变化。这些变化相关的各种因素,包括饮食,抗生素的使用,感染,应激和宿主基因(下图)。
影响母婴微生物群的因素以及微生物群调节的机会窗口

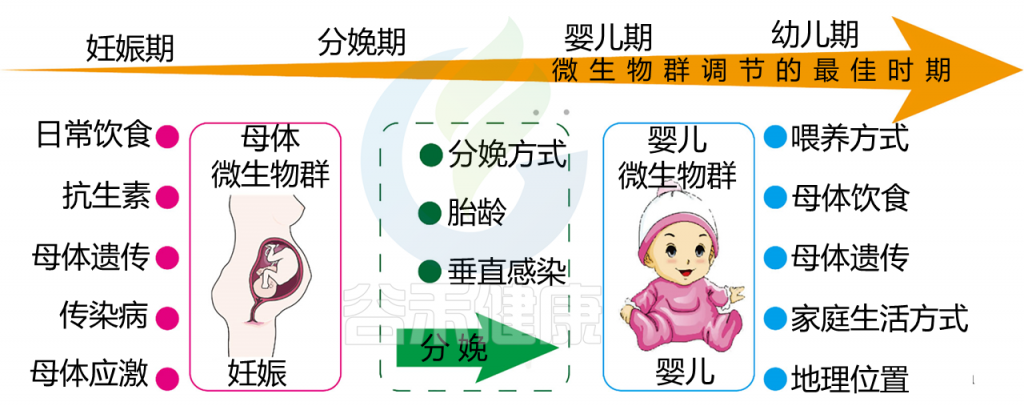
Yao Y, et al. Front Immunol. 2021
研究已经揭示健康孕妇阴道微生物群的稳定性高于健康非孕妇,乳酸菌是健康孕妇阴道微生物群的主要成分。传统上,子宫被认为是无菌的,但这个概念直到最近几年才被打破。子宫内膜有自己的微生物群,尽管这些微生物群的生物量比较低。遗憾的是,目前对子宫内膜微生物群的了解有限,其在胎儿发育和妊娠结局中的作用仍有待充分阐明。
新出现的证据表明,孕妇肠道菌群的丰富度和均一性与正常女性没有显着差异,但分布和组成发生了明显变化。此外,患有妊娠并发症的孕妇肠道微生物群的多样性降低,这对母亲和胎儿的健康都是不利的。例如,妊娠期慢性高血压大鼠的肠道微生物重塑受损。先兆子痫孕妇肠道微生物群中产生短链脂肪酸的粪球菌的丰度降低。

谷禾健康
疾病表现、进展和治疗反应的可变性一直是医学的核心挑战。尽管宿主因素和遗传学的变异性很重要,但很明显,在迈向个性化治疗的过程中,必须考虑肠道微生物组具有巨大的遗传和代谢多样性。
疾病表现、治疗反应和治疗不良反应的个体差异是有效管理疾病和患者安全的主要挑战。这种认知是精准医学的基础,其最简单的形式可以这么说,用个性化方法为合适的患者确定合适的治疗方法,无需反复试验。
将肠道微生物组与人类遗传学区分开来的一个方面是它代表了我们健康的动态组成部分,通过复杂的网络不断与宿主和环境因素相互作用。虽然存在潜在挑战,肠道微生物组的可塑性也提供了一个独特的机会,使其成为精准医学的一个有吸引力的目标。
本文支持使用肠道微生物组作为精准医学工具的当前证据,并建议未来需要将微生物组作为个体化治疗或干预工具的工作。
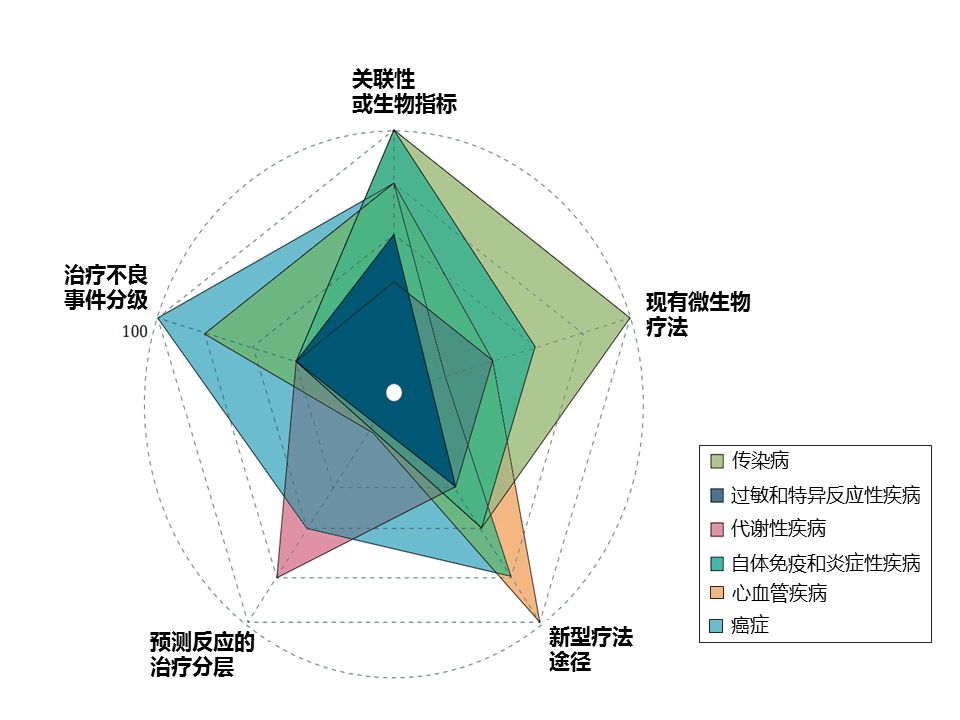
该研究团队选择了六个广泛的疾病组,这些组具有相对较强的证据表明肠道微生物组的作用。 尽管每个疾病组都有不错的发展,但在考虑临床影响时,不同疾病组的前景和成熟度各不相同(下图)。
抗生素诱导的肠道微生物组破坏会促进机会性和医院感染的机制。最常见的院内腹泻感染艰难梭菌为例,强调可能解释临床结果的个体差异的微生物组和病原体特异性特征。
复发性艰难梭菌感染 (CDI) 一直是微生物组研究的中心焦点。CDI 出现最常见的原因是使用抗生素,但矛盾的是,CDI 的一线治疗也包括抗生素。
抗生素对一般人相当有效,但为什么部分患者出现治疗失败,或是成功治疗后复发?
这可能与宿主特征(例如高龄)或药物的使用(例如质子泵抑制剂)有关, 以及肠道微生物组中特定病原体的特征有关。
除了宿主因素外,肠道微生物群的破坏也是 CDI 的关键因素。
· 与健康对照个体相比,CDI患者的肠球菌、韦永氏菌、乳杆菌、γ-变形菌属的相对丰度较高,而拟杆菌属、毛螺菌科、瘤胃球菌科的含量较低。
谷禾健康
胰腺癌是致命的癌症之一,其特点是:
难发现(发现多为晚期),病程短,发展恶化速度快,中位生存期为3-6个月,正所谓 “无声杀手”。
胰腺癌为什么难发现?这要从胰腺癌的位置说起。
胰腺位于人体后腹部深处,被胃、肝等层层围绕,且体积小,胰腺癌早期几乎没有不适。普通检查手段较难发现。
随着胰腺肿瘤的生长,出现的许多症状看起来与其他疾病的症状很像,比如:发冷和出汗、发热、腹胀、腹泻、恶心、疲劳、食欲不振、不明原因体重减轻、上背部或上腹部疼痛、手臂或腿部肿胀、黄疸迹象等。这就容易导致误诊。


胰腺癌的发病率近年来呈快速上升的趋势,死亡率排在首位,因此也被称为“癌中之王”。
胰腺癌的诊断难,治愈也难,应对胰腺癌治疗这样的难题,科学界在不断努力中。
胰腺癌独特的免疫抑制微环境是免疫治疗面临的最大障碍,而微生物群的改变也被认为是塑造肿瘤局部微环境并影响免疫治疗的重要因素。
科学家发现微生物群在调节代谢和免疫反应中起着关键作用。通过维持相对健康的微生物群类型,提高胰腺癌化疗药物和免疫治疗的有效性,为胰腺癌患者带来新的希望。
接下来,本文详细列举口腔、肠道和胰腺微生物群在胰腺癌发展中的作用的关键信息,讨论不同类型的微生物群,它们在调节药物代谢、耐药性、免疫反应和胰腺癌治疗潜力中的潜在作用,以及相关预防措施。
图源:知易社
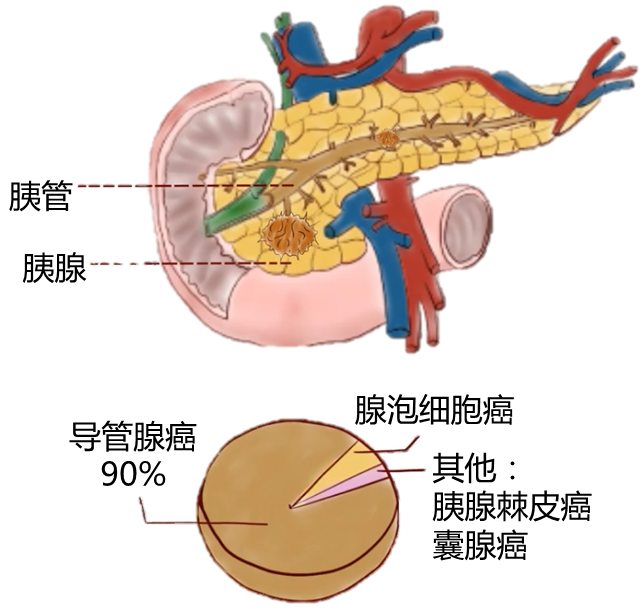
一般说的胰腺癌主要是指胰腺导管腺癌,简称PDAC,下同:
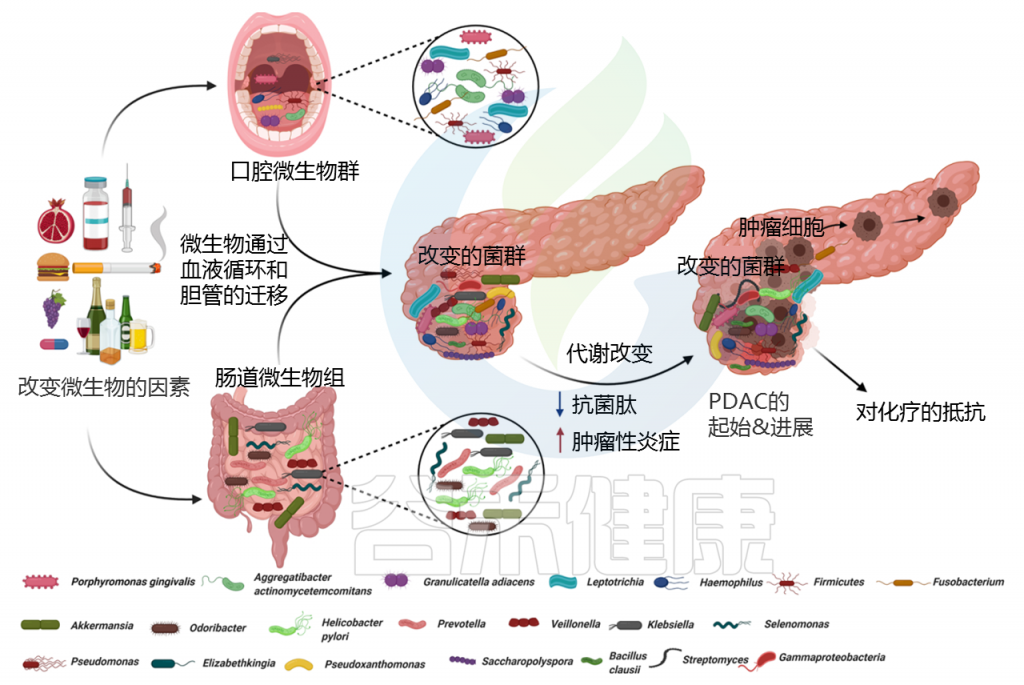
从临床和解剖学的角度来看,胰腺与肠道微生物群没有直接的物理联系,因此胰腺被认为是无菌组织。但微生物可以通过消化道中的胆管迁移到胰腺。

Pandya Gouri,et al., Semin Cancer Biol, 2021
许多研究表明,口腔、胃肠道、粪便和器官特异性(胰腺)微生物群的组成与PDAC高度相关。

PDAC的口腔、唾液、舌苔微生物群
口腔和唾液微生物群组成的改变与PDAC的风险相关。最近的研究表明,口腔中参与PDAC肿瘤发生的主要致病菌有:
牙龈卟啉单胞菌(Porphyromonas gingivalis)、梭杆菌(Fusobacterium)、缓症链球菌(Streptococcus mitis )、长奈瑟氏球菌(Neisseria elongata ).
牙龈卟啉单胞菌和Aggregatibacter actinomycetemcomitans 与胰腺癌高风险之间的相关性,表明口腔微生物群可能是导致PDAC肿瘤发生的危险因素。据推测,牙龈卟啉单胞菌可能分泌肽基精氨酸脱亚胺酶,通过引起KRAS和TP53基因突变来降解精氨酸代谢。
唾液微生物群
在胰腺癌患者的唾液样本中,与健康对照组相比,PDAC患者的长奈瑟氏球菌和缓症链球菌的水平明显降低,而Granulicatella adiacens的水平明显升高。
——作为预测胰腺癌的非侵入性生物标志物
在区分PDAC病患者和健康个体时,长奈瑟氏球菌和缓症链球菌的组合显示出96.4%的敏感性和82.1%的特异性。这项研究的结果表明,唾液微生物群可以作为预测胰腺癌的非侵入性生物标志物。
有研究对胰腺癌患者的唾液样本进行了微生物鉴定,发现纤毛菌Leptotrichia的丰度较高,而卟啉单胞菌和奈瑟氏球菌的比例相对较低。因此,唾液中纤毛菌Leptotrichia与卟啉单胞菌的显著高比率(L/P比率)可用作PDAC的预测标记。
口腔微生物组
PDAC和对照组在相关类群的平均相对比例上观察到差异。
PDAC患者 :高水平的厚壁菌门和相关类群,包括:乳杆菌科(Lactobacillales)、嗜热链球菌(Bacillli Streptococcus thermophilus)、链球菌科(Streptococcaceae)
对照组:具有相对较高水平的变形菌和相关分类群,包括:γ变形菌(Gammaproteobacteria)、巴氏杆菌科(Pasteurellaceae)、副流感嗜血杆菌(Haemophilus parainfluenzae);β变形菌(Betaproteobacteria),奈瑟氏球菌(Neisseria),黄奈瑟氏球菌(Neisseria flaviscen)
舌苔微生物群
胰头癌患者优势菌群如下:梭杆菌属Fusobacterium, 纤毛菌属Leptotrichia, 放线菌属Actinomyces, 罗氏杆菌属Rothia, 奇异菌属Atopobium, 棒状杆菌Corynebacterium, 莫拉氏菌属Moraxella, 消化链球菌属Peptostreptococcus, 产线菌属Filifactor, Oribacterium,坦纳菌属Tannerella
对照组优势菌群如下:嗜血杆菌Haemophilus, 卟啉单胞菌属Porphyromonas,Paraprevotella
在健康对照组和胰头癌患者中分别观察到嗜血杆菌、卟啉单胞菌和纤毛杆菌、梭杆菌的富集量有显著差异。
类似地,在胰头癌患者中观察到链球菌和罗氏菌属相对较高的富集,而在肝癌患者中SR1的相对丰度较高。因此,SR1和链球菌可用于区分肝癌和胰头癌。
*SR1:SR1 genera incertae sedis
对PDAC与微生物群的变化在多样性和组成方面的关联研究非常有限。需要在一个大队列中进一步的调查证实这些发现,从而得出确切的结论。

PDAC的胃肠道微生物群
——肠道微生物群可以直接影响胰腺微环境
给WT小鼠口服荧光标记的粪肠球菌Enterococcus faecalis,有趣的是,在这些小鼠的胰腺中观察到荧光,这表明细菌从肠道向胰腺迁移。
在另一项研究中,将抗生素混合物口服给药于PDAC、结肠癌和黑色素瘤的小鼠模型,观察到在所有受试模型中肠道微生物群的减少显著减弱了肿瘤的生长。
几个小组观察到,吸烟是胰腺癌的一个关键风险因素,可导致微生物群的显著变化,特别是在人类的肠道中。吸烟者肠道中厚壁菌门和放线菌门的减少,梭菌门、拟杆菌门、变形菌门的数量显著增加。
——胰腺癌患者和健康对照者粪便样本显著差异
微生物谱分析 (胰腺癌患者粪便样本,基于属水平的线性鉴别分析)
显著富集普雷沃菌属(Prevotella)、韦荣球菌属(Veillonella)、肠杆菌属(Enterobacter)、克雷伯氏菌属(Klebsiella)、哈氏菌属(Hallella)、月形单胞菌属(Selenomonas)、Cronobacter spp.
显著减少双歧杆菌属(Bifidobacterium)、芽孢杆菌属(Gemmiger)、梭状芽孢杆菌属(Clostridium IV)、Coprococcus、经黏液真杆菌属(Blautia)、Flavonifractor、丁酸球菌属(Butyricicoccus)、厌氧菌属(Anaerostipes)、Dorea spp.
这种粪便微生物群组成的显著差异表明,胰腺癌的胃肠道微生物是独一无二的。此外,本研究的数据表明,与脂多糖(LPS)生产、类异戊二烯和亮氨酸的生物合成相关的微生物有显著的富集/定殖,而已观察到产丁酸菌和益生菌的减少。
16S rRNA测序分析
分析PDAC患者和对照的粪便标本微生物群,观察到不同的优势菌:
PDAC患者:变形菌门(Proteobacteria),互养菌门(Synergistetes),广古菌门(Euryarchaeota),Akkermansia,韦荣氏菌科Veillonellaceae,Odoribacter
健康肠道:Clostridiacea,瘤胃球菌科,Ruminococcaceae,毛螺科Lachnospiraceae
除此之外,幽门螺杆菌感染和胰腺癌之间也呈正相关。在胃癌(69%)和胰腺癌(65%)患者的血液样本中,幽门螺杆菌感染率异常高。Meta分析和前瞻性队列研究表明,幽门螺杆菌感染的患者患胰腺癌的风险明显较高。然而,为了明确解决幽门螺杆菌在PDAC的影响,需要进行更多的人群和动物研究。
PDAC的胰腺微生物群
过去几十年科学家一直认为,在胰腺中存在蛋白酶,且胰腺环境是高碱性的,那么微生物无法生存。
胰腺中存在细菌,PDAC患者细菌更多
用16S rRNA基因特异性PCR对胰腺囊肿液体标本进行分析,发现优势菌:氨基酸球菌属Acidaminococcus, 埃希氏杆菌属Escherichia, 拟杆菌属Bacteroides, 志贺氏杆菌Shigella。这表明胰腺囊液可能是微生物群分析的良好来源。
最近,对PDAC样本进行的16S rRNA荧光探针和qPCR实验都证实,与正常人相比,PDAC患者的胰腺组织中存在细菌(约为正常人的1000倍)。
PDAC的标本中的主要菌
对人类PDAC肿瘤标本进行16S rRNA测序,发现了13个不同的门。
PDAC患者:变形菌门 (45 %);拟杆菌门(31 %);厚壁菌门 (22 %);放线菌门 (1%);假长双歧杆菌Bifidobacterium;
·pseudolongum【Kras(G12D)介导的胰腺癌小鼠模型】;假单胞菌属 Pseudomonas;Elizabethkingia;梭杆菌 Fusobacterium
对照组:乳酸菌 Lactobacillus
梭杆菌——预后生物标志物
PDAC肿瘤内梭杆菌Fusobacterium的定殖与PDAC患者的预后更差相关。这项研究的结果表明,梭杆菌属可以作为PDAC的预后生物标志物。
耐药患者的组织标本中 γ -变形菌定植
从耐受”吉西他滨”的PDAC中获得的组织标本中,γ-变形菌门Gammaproteobacteria定植,表明γ -变形菌可能干扰吉西他滨的代谢,并产生耐药性。
男女患者菌群差异
男性和女性患者之间微生物群组成的差异,各自的主导菌群如下:
男性患者:A. ebreus,Acinetobacter baumannii
女性患者:Geobacillus kaustophilus HTA426 ,Escherichia coli 55989
吸烟与非吸烟差距
此外,吸烟PDAC患者与非吸烟PDAC患者的对比,鲍曼不动杆菌A. baumannii 和M. hyopneumoniae高度富集,且与不良临床结果相关。这些微生物显示出富集的致癌信号和抑制肿瘤和免疫信号。
胰腺癌转移相关菌群
胰腺组织中微生物群的丰度与患者的转移和总生存率相关。M. hyopneumoniae、Sitophilus zeamais、宋内志贺菌Shigella sonnei、肠道沙门氏菌Salmonella enteric的高丰度与转移呈正相关。
更具体地说,Acidovorax ebreus与PDAC患者的转移和高肿瘤分级相关。
长期、短期生存的菌群不同
对长期和短期生存的PDAC患者的肿瘤标本进行了16S rRNA测序,肿瘤内微生物群:
PDAC长期生存者:多样性高;以下菌丰富:Pseudoxanthomonas, Saccharopolyspora, Bacillus clausii, Streptomyces
PDAC短期生存者:拟杆菌,梭状芽孢杆菌
上述数据表明,确定微生物群进入胰腺的机制以及这些微生物与胰腺癌的进展和转移之间的关系还有很大的研究空间。
宿主和微生物群形成共生关系。宿主可以通过其遗传、饮食摄入和生活方式影响微生物群的组成和生物量,而微生物群可以通过分泌微生物代谢物、代谢营养物、合成维生素和消化酶来影响宿主。
细菌成分及其代谢物可以渗透到宿主的体循环中,并被运输到发挥激素样作用的部位。这些生物活性代谢物调节宿主中的信号转导,以调节基因表达调节中涉及的各种途径。
代谢物对肿瘤的发生有促进和抑制作用
丁酸盐、乙酸盐和丙酸盐是主要的短链脂肪酸(SCFAs),由结肠中的粪肠球菌、双歧杆菌和梭状芽孢杆菌 等细菌产生,可发挥抗癌作用。
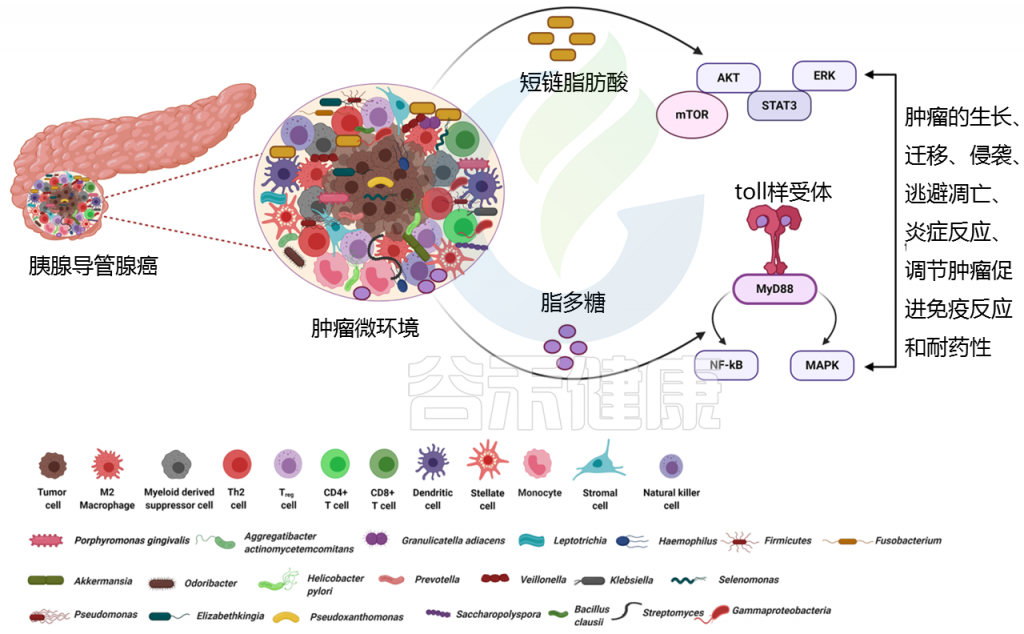
短链脂肪酸通过与游离脂肪酸受体(FFAR2/FFAR3)结合发挥作用,游离脂肪酸受体通常在癌细胞、基质细胞和肠细胞上表达,刺激G蛋白偶联受体,通过激活致癌途径(包括PDAC的AKT、ERK、mTOR和STAT3)促进肿瘤生长和转移。
对微生物代谢物在PDAC和胰腺中刺激FFAR2/3的作用的理解需要进一步详细研究。
改变的微生物群在PDAC免疫反应调节中的作用

Pandya Gouri,et al., Semin Cancer Biol, 2021
体外研究表明,丁酸盐可以减少PDAC细胞的增殖,同时诱导它们向分泌表型分化。
此外,透明质酸与丁酸盐的共轭物显示出在PDAC细胞中诱导细胞抑制作用。据报道,丙戊酸(一种合成SCFA)结合5-FU对PDAC细胞有抑制细胞生长的作用。
PDAC患者多胺代谢失调
在PDAC患者中,益生菌和产丁酸的细菌被大量抑制。细菌可以合成多种多胺,如腐胺、精胺、亚精胺和尸胺。据报道,在PDAC患者中,多胺代谢严重失调。在小鼠模型和患者血清样本中,多胺均上调,并随着肿瘤的进展而进一步增多。
微生物代谢物可作为非侵入性生物标志物
罗伊乳酸杆菌Lactobacillus reuteri 在4个月大的KPC(K-rasLSL.G12D; p53R172 H/+; Pdx1-Cre)小鼠肿瘤标本(K-rasLSL)中定殖。罗伊乳酸杆菌参与多胺代谢。与2个月大的KPC鼠血清标本相比,4个月大的KPC鼠血清标本中多胺的浓度显著高。这些结果表明,微生物代谢物可被开发并用作潜在的非侵入性生物标志物,用于PDAC病的诊断,尤其是在肿瘤变得可见和明显之前的早期阶段。
脂多糖是与炎症、代谢性疾病和胰腺癌相关的关键因素
在PDAC患者中,脂多糖存在于高度富集的革兰氏阴性菌的细胞壁上。
脂多糖与线粒体的代谢重编程有关,从而有助于糖酵解、活性氧和炎症导致肿瘤发生。
脂多糖如何导致免疫抑制?
脂多糖可以有效地与免疫细胞上的toll样受体相互作用,并募集MyD88/TRIF分子来刺激NF-κB和MAPK信号产生炎性细胞因子,从而导致免疫抑制。
代谢产物——脱氧胆酸(DCA)
一些肠道相关细菌代谢原始胆汁并形成脱氧胆酸(DCA)。DCA通过与TGR5 (G蛋白偶联的细胞表面BA受体)结合发挥作用,TGR5反过来刺激PDAC细胞中的EGFR、MAPK和STAT3信号,并进一步导致细胞周期的进展。
代谢产物——熊去氧胆酸
与此相反,熊去氧胆酸通过抑制PDAC细胞系上皮细胞向间充质细胞的转化而显示出抗癌作用。
γ -变形菌科合成酶将化疗药代谢成不活跃形式
肿瘤内细菌属γ -变形菌科,能够合成胞苷脱氨酶(CDD),该酶能有效地将化疗药物吉西他滨代谢成2′,2′-difluorodeoxyuridine(不活跃的形式)。
说到化疗药物,为什么同样的药物治疗,有些人有效,有些人无效?这与微生物会有什么样的联系?
我们将在接下来的章节详细阐述。
肠道微生物群在改变癌症治疗中药物治疗的疗效方面发挥着既定的关键作用。当然,化疗药物也会使肠道微生物群失调。
二十多年来,吉西他滨单独和/或与化疗剂/药物联合用于治疗PDAC病患者。
引起化疗耐药性——猪支原体
人皮肤成纤维细胞中猪支原体(Mycoplasma hyorhinis)的存在,在体外和小鼠模型中导致了对吉西他滨的抗性,其中它被代谢为其非活性和脱氨代谢物,名为2’,2’-二氟脱氧尿苷。
引起化疗耐药性——γ – 变形菌
除此之外,γ – 变形菌能够通过表达胞苷脱氨酶(CDD)的长形式灭活吉西他滨。分析113个PDAC患者组织样本时,86个样本(76%)显示了γ – 变形菌的存在。
在结肠癌小鼠模型中,γ – 变形菌诱导的吉西他滨耐药可通过联合应用环丙沙星抗生素逆转。表明这种耐药是可逆的。
引起化疗耐药性——大肠杆菌
大肠杆菌可导致几种药物如克拉屈滨、吉西他滨、CB1954、氟达拉滨的原始化学结构发生改变。
在体外和体内小鼠模型中,非致病性大肠杆菌菌株引起了对吉西他滨治疗的化学抗性。
改变微生物群——更好的抗癌效果
最近,FOLFRNOX已被用于针对PDAC患者的多中心试验。结果报告了比吉西他滨更好的长期生存率。在这些试验中,患者腹泻和恶心的发生率很高。表明药物可以改变微生物群以产生更好的抗癌效果。
其他代谢疾病与胰腺癌的相关性
另一方面,肥胖、2型糖尿病和胰腺癌病例增加之间有很强的联系。
在KC小鼠中,高脂肪热量饮食(HFCD)显示完整腺泡的丧失和胰腺上皮内瘤形成的发展。此外,在小鼠模型中,高脂肪热量饮食显示出明显的微生物群组成变化,特别是梭状芽胞杆菌。
二甲双胍对这些小鼠的治疗与KC小鼠中PDAC的抑制相关,Akkermansia的定植显著增加,梭状芽胞杆菌的丰度显著减少。二甲双胍通过降低循环中脂多糖的水平来促使HFCD-KC小鼠模型的肠道菌群失调。这可以进一步抑制胰腺中M1巨噬细胞的脂多糖依赖性极化,从而抑制上皮内瘤的形成。
药物联合益生菌抗癌
吉西他滨与益生菌联合给药后,随着波形蛋白和Ki-67表达的抑制,上皮内瘤PanIN的形成明显减少。
鼠伤寒沙门氏菌与吉西他滨和贝伐单抗的组合在PDAC异种移植模型中产生了协同抗肿瘤作用。
肠道微生物群在调节化疗反应、将药物代谢成非活性形式,甚至对某些药物产生化学抗性方面起着不可避免的作用,越来越多的临床研究证明了微生物群对化疗的影响。这为癌症患者的治疗目的操控肠道菌群提供了基础。
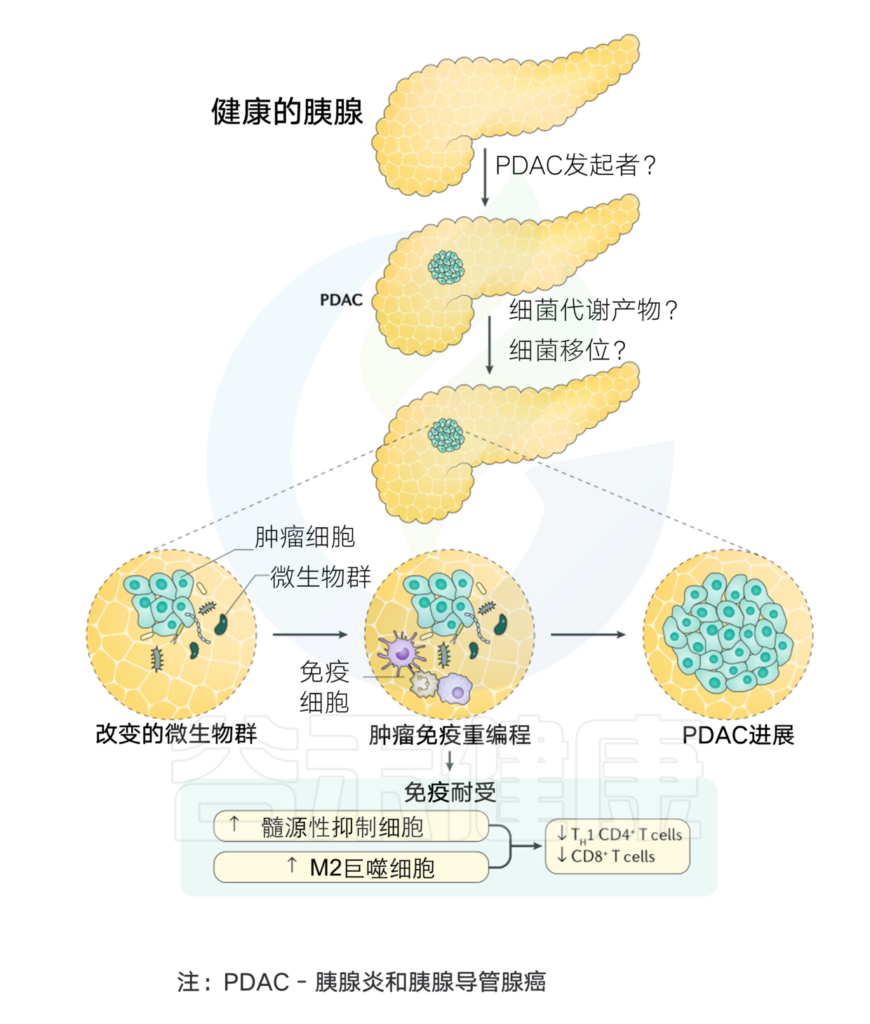
免疫系统和微生物群之间的健康互动对于健康的生活方式和身体稳态至关重要。微生物群的失调会导致全身炎症和细菌代谢物介导的免疫反应,这可能进一步促进免疫调节,从而促使癌症发生和发展。
在胰腺癌的发展过程中,已经观察到胰腺组织内的微生物群和免疫细胞之间存在复杂的关系。癌症免疫可以通过微生物群的存在来改变。
菌群与胰腺癌发生的关系
Thomas R M, et al.,Nature Reviews Gastroenterology & Hepatology, 2019
详见: 微生物,或许是下一个癌中之王(胰腺癌)诊断和干预治疗的新出路
微生物群对免疫系统的影响
当粘膜内层受到任何损伤时,微生物往往会进入肠道固有层,然后迁移到远处的淋巴器官,激活宿主免疫系统。PDAC肿瘤微环境基本上与免疫细胞交织在一起,其中免疫细胞与某些炎症因子一起负责促进肿瘤发生、免疫细胞浸润和疾病进展。
微生物衍生产物或代谢物,如脂蛋白、脂多糖、脂肽、单链或双链DNA,甚至CpG DNA可以有效地结合PPRs以激活TLRs,TLRs通过抑制胰腺癌的免疫反应在炎症和肿瘤发生过程中起关键作用。这与NF-κB和MAPK信号通路的激活有关,导致产生促进肿瘤的细胞因子和其他促炎分子,从而导致癌症的发展。
假长双歧杆菌促进肿瘤发生(TLRs)
假长双歧杆菌Bifidobacterium pseudolongum在肠道和肿瘤区域高度占优势,通过TLR介导的信号传导促进侵袭性肿瘤发生,TLR4和TLR7在PDAC的肿瘤微环境中特别强有力地表达。有研究显示,刺激TLRs会导致胰腺炎,并与K-ras协同促进胰腺癌在动物模型中的发展。
TLR7在人和鼠胰腺癌标本中有强有力的表达,并显示出刺激MAPK、NF-κB、STAT3和Notch信号以增强致癌作用。TLR7阻断可以通过阻止以上通路刺激,从而抑制胰腺癌。
肠道微生物群影响抗癌免疫治疗反应
肠道微生物群(脆弱双歧杆菌、双歧杆菌)的组成通过阻断CTLA-4和PD-1影响抗癌免疫治疗反应。
PDAC肿瘤微环境的产生在小鼠模型中具有免疫抑制作用,这归因于特定的肠道和胰腺内微生物。这也证明了随着免疫治疗抗性的增强,癌症进展的增强。
此外,微小核糖核酸与PDAC患者的生长、血管生成、化疗耐药性和转移增加有关。已知某些微生物如幽门螺杆菌和鼠伤寒沙门氏菌也能调节上述微小核糖核酸的表达,而这些微小核糖核酸又能调节宿主的免疫反应。
这表明肠道微生物群控制宿主免疫反应,从而提高免疫疗法的有效性,并在与PDAC相关的癌症领域具有巨大的意义。
微生物具有巨大的潜力,可用于设计不同的治疗方法,以对抗疾病的发展和进展。更具体地说,新出现的证据表明,微生物可能导致人类对恶性肿瘤的易感性,也可能影响对治疗的反应,还可能影响治疗相关的毒性。
用有益菌如拟杆菌和伯克霍尔德氏菌Burkholderiales恢复肠道提高了CTLA-4封闭的治疗效果。
双歧杆菌的存在增强了PDL-1阻断的抗癌潜力。
因此,微生物群的保护和恢复对改善治疗效果至关重要。
粪便微生物群移植(FMT)是一种直接有效的方法。肿瘤小鼠接受了来自短期生存期PDAC患者、长期生存期无疾病证据(LTS-NED)和健康对照组的粪便微生物群,发现肿瘤生长明显减少。这表明,在PDAC鼠模型中,来自长期存活者的FMT比来自短期存活者或没有PDAC的那些接受FMT的人对肿瘤有更好的保护作用。
此外,FMT在应对化疗的副作用方面显示出潜力,化疗会导致其他恶性肿瘤如转移性肾细胞癌的腹泻。这表明,用益生菌恢复肠道是一种可行的方法,可以与其他治疗方案一起使用,并且在治疗癌症方面可能非常有效。
目前这些研究探索了微生物群的多样性和组成,以及患者的菌群失调,与健康人的差异等,尽管还需要做深入研究,但这个方向的探索对于癌症治疗无疑是很有希望的。
虽然说没有完全避免胰腺癌的特定方法,但以下方法可以降低风险:
■ 戒烟
可避免的最重要的风险因素,戒烟有助于降低患胰腺癌风险
■ 维持正常体重
如果你现在正处于超重或肥胖阶段,减肥有助于降低胰腺癌风险;适当进行锻炼
■ 健康饮食
加工过的红肉和含糖饮料也可能增加患胰腺癌的风险。美国癌症协会建议遵循包括大量水果、蔬菜和全谷物在内的健康饮食模式,并限制或避免红肉和加工肉类、含糖饮料和高度加工食品
■ 不酗酒
大量饮酒与胰腺癌有关,也可能患上慢性胰腺炎,后期有发展成为胰腺癌的风险
■ 避免使用工作场所化学品
工作场所中的某些化学品会增加患胰腺癌和其他癌症的风险
■ 进行肠道菌群检测
维持一个相对健康的肠道菌群,监测健康状态,降低胰腺癌的风险
微生物组是一个新兴的前沿领域,它为胰腺癌的诊断、预后和转移的新生物标志物等提供了新的方向。
微生物治疗的个性化在于每个个体微生物群具有独特性,微生物群又与日常饮食,生活习惯,慢性病等息息相关,通过这些方式的改变使菌群维持或恢复到相对健康的状态,这对于胰腺癌及其他癌症的预防、治疗具有重大意义。
主要参考文献:
G.A. Vitiello, D.J. Cohen, G. Miller, Harnessing the microbiome for pancreatic cancer immunotherapy, Trends Cancer 5 (11) (2019) 670–676.
R. Mendez, K. Kesh, N. Arora, L. Di Martino, F. McAllister, N. Merchant, S. Banerjee, S. Banerjee, Microbial dysbiosis and polyamine metabolism as predictive markers for early detection of pancreatic cancer, Carcinogenesis 41 (5) (2020) 561–570.
R.M. Thomas, R.Z. Gharaibeh, J. Gauthier, M. Beveridge, J.L. Pope, M.V. Guijarro, Q. Yu, Z. He, C. Ohland, R. Newsome, J. Trevino, S.J. Hughes, M. Reinhard, K. Winglee, A.A. Fodor, M. Zajac-Kaye, C. Jobin, Intestinal microbiota enhances pancreatic carcinogenesis in preclinical models, Carcinogenesis 39 (8) (2018) 1068–1078.
Pandya Gouri,Kirtonia Anuradha,Singh Aishwarya et al. A comprehensive review of the multifaceted role of the microbiota in human pancreatic carcinoma.[J] .Semin Cancer Biol, 2021
B. Gupta, D. Sadaria, V.U. Warrier, A. Kirtonia, R. Kant, A. Awasthi, P. Baligar, J.K. Pal, E. Yuba, G.Sethi, M. Garg, R.K. Gupta, Plant lectins and their usage in preparing targeted nanovaccines for cancer immunotherapy, Semin. Cancer Biol.(2020).
J. Chakladar, S.Z. Kuo, G. Castaneda, W.T. Li, A. Gnanasekar, M.A. Yu, E.Y. Chang, X.Q. Wang, W.M. Ongkeko, The pancreatic microbiome is associated with carcinogenesis and worse prognosis in males and smokers, Cancers 12 (9) (2020).
J.S. Chang, C.R. Tsai, L.T. Chen, Y.S. Shan, Investigating the association between periodontal disease and risk of pancreatic Cancer, Pancreas 45 (1) (2016) 134–141.
H. Tilg, T.E. Adolph, Beyond digestion: the pancreas shapes intestinal microbiota and immunity, Cell Metab. 25 (3) (2017) 495–496.
Can Pancreatic Cancer Be Prevented? American Cancer Society. May 31, 2016.

谷禾健康


看过往期文章的小伙伴都知道,人体微生物群维持体内的共生关系,促进新陈代谢功能,抵御病原体,训练和发展免疫系统,直接或间接影响我们的大部分生理功能。
每个人都拥有属于自己的独特的微生物组,人与人之间这种显著的个体差异性是疾病易感性差异的潜在来源。
基因是从出生开始确定了,很大程度上伴随着人的一生,微生物组是否也是遗传决定的呢?
2018年的研究显示,家庭中的遗传血统或单个多态性变体在肠道微生物组组成中的作用很小(<2%),而微生物组多样性中超过20%的变异可以从共享的环境因素中推断出来,例如与饮食和生活方式。可见环境是影响微生物组的重要因素。
那么:
影响微生物组环境因素包括哪些?
环境如何对人类微生物组产生影响?
环境如何通过微生物组影响人的健康?
环境对人类微生物组的影响研究会有哪些挑战?
这对理解非传染性疾病的微生物基础带来哪些启示?
本文我们来详细阐述以上问题。
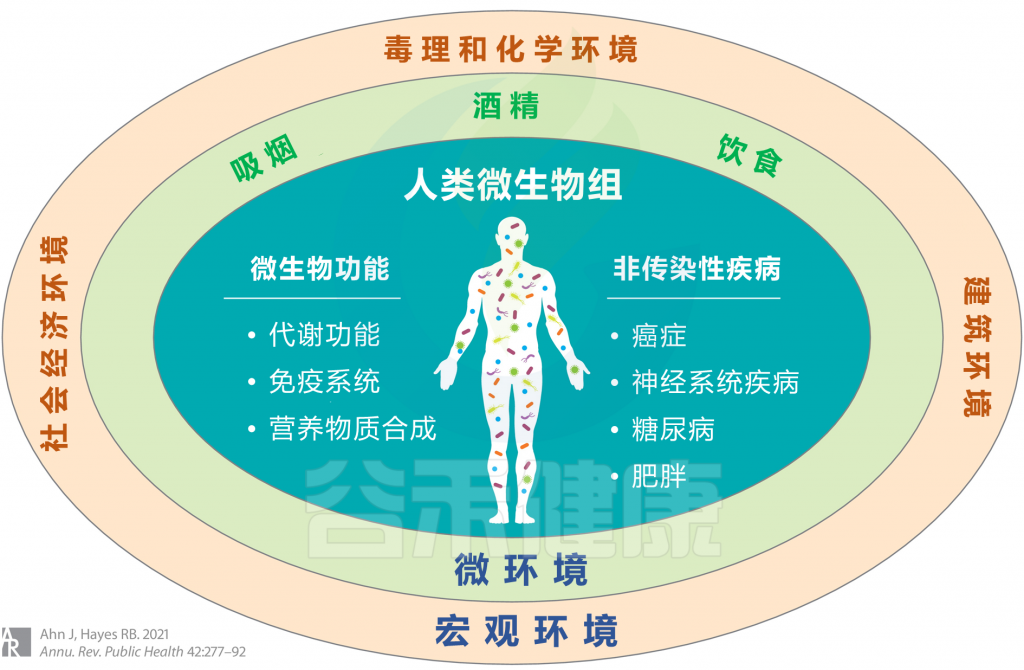
<从广义上考虑环境,涉及宏观环境和微环境,并考虑个人行为,包括吸烟,饮酒和饮食摄入等>

口腔消化道癌症
微生物诱发了至少60%的人类口腔消化道癌症,这表明控制微生物相关过程在预防和治疗口腔消化道癌症方面具有巨大的潜力。
流行病学研究一致报告口腔疾病与口腔消化道癌症(包括头颈部、食道癌、胃癌和胰腺癌)风险之间的联系。由于口腔疾病具有重要的微生物基础,这些观察导致了口腔微生物组与口消化癌的发生有关的假设。
基于大量人群的队列研究中的病例对照研究发现,用漱口水样本评估的诊断前口腔微生物组与随后发生的头颈部、食道和胰腺消化道癌症的相关。一些研究也明确指出了肠道微生物组梭菌属Fusobacterium和其他菌群与结肠癌之间的联系,以及肠道微生物组与炎症性肠病和结直肠腺瘤之间的联系。
微生物来源的信号通过不同的机制调节癌症的许多特征。一般来说,细菌不能直接诱发癌症;这一过程通常伴随着慢性炎症,并需要致癌信号通路的独立突变。
进一步的研究表明,微生物组与宿主之间的交互作用通过调节肿瘤微环境中的先天和适应性免疫功能,对口腔消化道肿瘤发生至关重要。
细菌-癌症模型提出,革兰氏阴性细菌促进致癌作用,因为脂多糖细菌外膜通过Toll样模式识别受体为先天免疫系统反应提供免疫原性刺激,导致由核转录因子NF-κB原瘤细胞因子释放、免疫细胞募集和活性氧释放引起的基因突变。
因此,微生物在形成肿瘤免疫微环境中的作用在癌症的发病机制中具有重要的潜在意义,特别是在口腔消化道。
神经系统疾病
肠道和中枢神经系统通过肠-脑轴相互作用,调节中枢神经系统功能,包括情感行为、认知表现、疲劳和睡眠。
研究表明,肠道微生物组通过影响肠-脑轴,可能在某些神经精神和神经发育障碍中发挥作用,改变行为,并可能影响神经系统障碍的发作和/或严重程度。
无菌小鼠和用抗生素治疗的小鼠表现出大量的神经免疫功能障碍和行为缺陷。主要在临床前模型中,肠道微生物组与大脑障碍有关,包括焦虑、抑郁、癫痫以及自闭症谱系障碍。
在人类中,胃肠道病理和神经精神疾病之间相互作用的证据已经在焦虑、抑郁和自闭症等情况中报告;然而,因果关系仍未得到证实。
揭示微生物组介导肠-脑连接的机制可能为靶向治疗肠道提供新的机会,以预防和治疗神经疾病。
糖尿病
大量的文献已经为肠道菌群在糖尿病前期和2型糖尿病病因学中的作用提供了证据。一份2020年的综述总结了40多项已发表的人类研究。
例如,在糖尿病前期研究中发现,基于肠道微生物群、炎症和免疫标志物的分子特征预测了2型糖尿病的发病。
两项开创性研究发现,2型糖尿病患者和非糖尿病对照组的肠道微生物组不同。
随后一项研究表明,2型糖尿病患者的肠道微生物群介导了用于控制糖尿病的二甲双胍的治疗效果。

还有研究人员开发了个性化饮食以优化2型糖尿病患者的血糖水平,同时考虑了个性化饮食习惯、体育活动和肠道微生物群。研究人员随后在一项盲法随机对照饮食干预试验中表明,应用这种算法可以改善餐后血糖反应。
目前面临的挑战是搞清楚,具体精确到哪些肠道微生物组组成部分,能驱动异质性、多因素、多器官疾病。
肥 胖
肥胖在全球范围内日益流行,导致过早死亡和许多慢性非传染性疾病。虽然肥胖的根本原因是能量摄入和输出之间的不平衡,但肠道微生物组成是导致体重增加的公认因素,当然还有其他机制,如遗传变异和表观遗传调节。


从野生型小鼠、肥胖小鼠或肥胖人类转移到无菌小鼠的肠道菌群实验表明,在该试验系统中,肠道菌群在体重增加和肥胖中起着关键作用,与肥胖表型的建立有关。这些实验结果引出了这样一个问题:
肠道的微生物组成是否会影响人类体重增加(无论是基因决定的还是饮食诱导的)?
一份早期的小规模人类样本报告与小鼠的研究结果一致,即肥胖状态与厚壁菌门(Firmicutes)的相对丰度增加和拟杆菌门(Bacteroidetes)的相对丰度减少有关。
然而,对人类的研究并没有证实这一特定模式:一些研究发现拟杆菌门(Bacteroidetes)的减少(但没有发现厚壁菌门(Firmicutes)的增加)与肥胖有关,而另一些研究则发现相反或未发现这两种门水平与体重指数(BMI)有关。
此外,研究已经确定了与BMI或肥胖相关的不同属和种水平的分类群。
点击此处查看 体重增长:目前为止我们所知道的一切
未来在动物模型和人类中的下游实验可以确定这些候选菌群是否在肥胖的病因学中起作用,如果是,建议干预肥胖的预防和治疗。
目前也有通过各种治疗方法(如益生菌、益生元、抗生素)改变菌群的潜力,微生物组是预防和治疗肥胖的一个不错的方式。


宏观环境
——毒理和化学环境
在人体中,消化道和呼吸系统是环境毒物进入和加工的主要途径。在这些器官系统中,人类微生物组丰富的代谢系统具有强大的转化外来生物化学物质的能力,有时与宿主的生物转化模式相反。
宿主代谢酶的典型特征是氧化和结合排泄,而微生物的酶反应主要是还原、水解和去甲基化,生成碳源进一步生长和分裂。
环境砷形态与心血管疾病和其他健康影响有关;证据表明,口腔消化道微生物组的甲基化能力可能会影响这些毒性。
肠道乳酸菌Lactobacillus对金属(如镉和铅)的固定化可能会影响金属毒性,降低重金属积累。
Yu.Let al., chemosphere2020
某些肠道细菌表达偶氮还原酶来代谢潜在致突变的偶氮化合物。个人护理产品中对环境具有持久性的化学物质,如三氯卡班(TCC)和三氯生(TCS)普遍存在,并与啮齿类动物微生物群的潜在变化有关。
肠道微生物群对化学物质(包括内分泌干扰物)的代谢会伴随微生物的失调:改变微生物群落结构,诱导特定细菌基因,改变微生物分子转化。此外,内分泌干扰物可以被吸收并运输到肝脏,然后被结合并通过胆汁分泌排泄回肠道,进一步进行微生物代谢。
酶如偶氮还原酶、酯酶、甲基酶、硫代还原酶、脂肪酶、硝基还原酶、β-葡萄糖醛酸苷酶、硫酸盐酶和β-裂解酶也参与环境化学物质的微生物代谢。
——建筑环境与新兴假说
建筑环境包括人类建造的所有建筑,包括家、工作场所、学校、车辆等。研究人员认识到许多微生物病原体可能存在于建筑环境中。
例如,细菌病原体,如结核分枝杆菌;真菌病原体,如烟曲霉菌Aspergillus fumigatus;致病性病毒,如鼻病毒和流感病毒,以及SARS-CoV-2冠状病毒等,均可通过在建筑环境中直接吸入传播。其他病原体,如艰难梭菌和粪肠球菌,以及诺如病毒和流感病毒,可通过皮肤或黏液接触传播给人,原因是病菌从表面传播。
除了直接的微生物传播,建筑环境中的微生物代谢产物也可能涉及人类健康,包括细菌和真菌毒素、细胞壁的致敏成分和微生物衍生的挥发性有机化合物。
室内空气和表面与灰尘和微生物化学产物有关。环境中相对湿度的增加导致灰尘和表面微生物代谢物的增加。室内潮湿和发霉条件(例如,可见的霉菌和霉菌气味)与许多不同的疾病状态有关,但建筑环境中微生物及其代谢产物的组成和浓度与疾病之间的联系仍然难以捉摸。

通过靶向细菌16S rRNA测序和宏基因组测序的应用,研究人员对建筑环境微生物生态的复杂性有了更全面的认识,包括可培养和非培养因子的多样性。认识到环境样品中微生物DNA序列的组成可能是由大量的不可活残留物组成的,环境微生物相关DNA表现出丰富的复杂性,反映了人类微生物来源,室内建造环境和人类来源的微生物来源之间的关系特别强。
卫生假说认为,卫生条件的改善可能与自身免疫性疾病的增多有关,这一概念也适用于有益菌暴露的概念。
研究人员研究了人类微生物组和建筑环境微生物组之间的相关关系,重点关注家庭环境,并绘制居住者和他们的家庭之间的细菌共享。这项调查表明,与表面有关的大多数细菌有很大的可能来自该住宅的居住者。暴露于室内灰尘中的复杂微生物群与患哮喘的可能性呈负相关。在另一项研究中,与没有接触到农业环境的儿童相比,接触到农场附近家庭灰尘并在农场积极参与工作的儿童患哮喘的风险有统计学上显著降低。

总之,越来越多的证据表明,建筑环境、微生物群和健康之间存在相互关系,但要了解建筑环境中微生物的生态和进化与人类健康之间的关系,还需要做大量的工作。
其他与建筑环境有关的著名假说也出现了。其中一个在文献中越来越流行的假说是野化假说,该假说认为,改变城市绿地使其恢复到更自然的状态,有可能改变环境中的微生物群,进而改变人类微生物群。对人和动物的研究表明,野化可能会影响微生物组和宿主的免疫反应。
除其他环境因素外,2018年的研究表明,吸入颗粒物空气污染会改变肠道微生物组的组成。
此外,日光暴露可以调节家庭灰尘细菌群落,这也可能表明阳光和紫外线辐射影响人体微生物群落组成,例如皮肤上的细菌群落。
微生物在皮肤老化中的作用模式
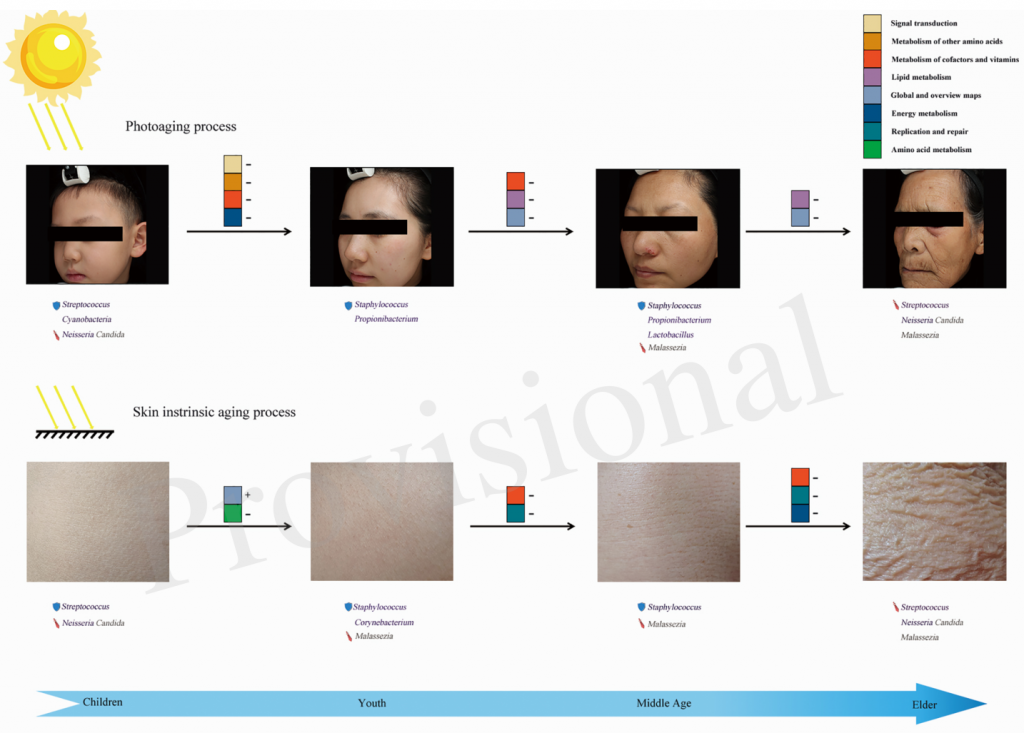

Li Zichao,et al., Front Microbiol, 2020
气候变化和极端高温也可能引发生理变化,可能有利于周围环境、食物或体内的某些微生物群。
此外,在应对将大量微生物菌群与无数已建立和新出现的暴露物结合起来的挑战时,将细菌宏基因组与环境暴露物结合起来的无针对性评估和发现可能是前瞻性研究议程的一部分。
——社会经济环境
较低的社会经济地位与多种与健康有关的行为有关,如获得医疗和牙科护理的机会减少,增加参与不健康行为(如吸烟和酒精依赖),减少对积极健康行为(如健康饮食和锻炼)的参与。低社会经济地位与较高的发病率和死亡率以及其他一些健康状况如肥胖、糖尿病和癌症的高发病率相关。
微生物群在调节社会经济地位和健康之间关系中的作用正在研究中。许多与低社会经济地位社区和生活方式相关的特征(例如,加工食品、久坐的生活方式、社会心理压力、暴露于污染物和内分泌干扰物)也与肠道微生物多样性减少有关。


研究已经检验了高社会经济地位和低社会经济地位群体之间微生物组成的差异。在美国,较高的社会经济地位与肠道微生物群中特定微生物的α多样性和种群丰度相关。
更好地理解微生物组在社会经济地位相关疾病易感性中的中介关系需要综合研究,包括调查社区和个人水平的暴露。建筑环境是考虑的一个部分。
微环境
——吸烟
香烟烟雾是大量有毒物质的来源,直接接触口腔和上呼吸道的细菌;这些毒物可以通过抗生素作用、缺氧或其他潜在机制扰乱微生物生态。由于吸烟而失去有益的口腔菌群可导致病原体定植并最终导致疾病;吸烟在微生物依赖性牙周炎的发病和发展过程中所起的既定作用有力地支持了这一论点。

实验室调查发现,与从不吸烟的人(变形菌门11.7%)相比,吸烟人群口腔微生物组的总体多样性降低,变形菌门的相对丰度降低(4.6%) (FDR q = 5.2×10−7)。
当前吸烟者体内三羧酸(TCA)循环和氧化磷酸化等微生物有氧代谢途径相关基因的丰度降低,糖酵解等非氧碳水化合物代谢途径的丰度增加。
当前吸烟者所消耗的其他途径包括与甲苯、一硝基甲苯、苯乙烯、氯环己烷和氯苯降解有关的某些外来生物降解途径以及细胞色素P450的外来生物代谢。相反,多环芳烃(PAH)和二甲苯降解在当前吸烟者中富集。这些化学物质是香烟烟雾的组成部分,因此口腔菌群降解这些物质的能力的改变可能会对宿主产生毒性后果。
除了创造一个厌氧、酸性和/或选择性有毒的环境,吸烟还被认为对人体免疫有显著的影响,这反过来可以影响宿主阻止病原体殖民的能力。
总之,越来越多的证据表明:
吸烟影响口腔微生物群的整体组成和许多种群丰度;吸烟可促进厌氧口腔环境和具有减少的异种生物降解能力的菌群。
观察性和介入性研究也提示吸烟者肠道微生物组的多样性降低,总的来说,变形菌门、拟杆菌门和梭菌属、拟杆菌属、普雷沃氏菌属呈上升趋势,放线菌门、厚壁菌门和双歧杆菌属、乳球菌属呈下降趋势。
可能解释吸烟对肠道微生物组影响的机制包括氧化应激增强、肠道紧密连接和肠道粘蛋白组成的改变以及酸碱平衡的改变。一些吸烟引起的肠道微生物组改变类似于炎症性肠病和肥胖等情况下的改变。应该进行进一步的研究来研究这种联系。吸烟会影响肠道微生物群,建议改变其组成。吸烟和肠道微生物组之间的相互作用可能有助于肠道和全身疾病的发展。
——酒精
酒精摄入可能通过几种方式影响人体口腔微生物群:
首先,口腔细菌和真菌将酒精和膳食糖代谢成致癌的乙醛,与香烟烟雾冷凝液相互作用,产生致癌的亚硝胺,并在实验上促进口腔癌变。无论是在体内还是体外,在吸烟者中,口腔微生物群有更强大的能力从乙醇中产生乙醛。
体外和动物实验也指出了口腔微生物群参与口腔癌变的可能机制,包括抑制细胞凋亡,激活细胞增殖,促进细胞侵袭,诱导慢性炎症,以及口腔多菌群中细菌和真菌的合作。
第二,酒精可能对细菌产生直接的细胞毒性作用。动物研究表明,摄入20%的酒精会增加变形链球菌Streptococcus mutans的定植,并显著减少大鼠口腔生物膜中可检测到的细菌种类。

在人类研究,饮用红酒与物种丰度降低以及龈下和龈上菌斑中某些厌氧菌的减少有关,而过量同时使用烟草和酒精与物种丰富度降低以及口腔粘膜生物膜中奈瑟菌Neisseria、Aggregatibacter和梭杆菌Fusobacteria丰度降低有关。
酒精除了直接作用外,还可能通过干扰宿主防御系统间接影响口腔微生物群,从而导致宿主介导的牙周炎。
大量以人群为基础的研究表明,每天至少喝一杯标准饮料会增加牙周炎15-27%的风险,并与糟糕的口腔健康有关。有证据表明,口腔微生物群与口腔健康状况密切相关。
酒精和肠道微生物组的研究主要是在大量饮酒的背景下进行的,酒精可能改变肠道屏障功能,导致肠道渗漏,产生促炎病原微生物产物,并扰乱肝脏代谢途径。
大量饮酒和肝硬化患者的研究表明,拟杆菌门细菌的相对丰度随着变形菌门的增加而降低,肝硬化患者中梭杆菌门的独特增加。
大量饮酒与肠道失调有关,而红酒作为膳食多酚的丰富来源,如果适量饮用,可能有利于改变胃肠道微生物群的组成。红酒多酚能显著增加变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的丰度,而杜松子酒则能显著减少这些细菌门。
——饮食
西方饮食的特点是高脂肪,高糖,大量食用红肉和加工肉类,大量食用精制谷物,而纤维摄入量较低。
许多研究表明,西方饮食与炎症、糖尿病、心血管疾病、肥胖、代谢综合征和癌症有关。而西方饮食有着广泛的生理影响,影响许多不同的细胞类型,如脂肪细胞,免疫细胞和内分泌细胞。
这个饮食习惯也与肠道菌群的变化密切相关,其特征是微生物多样性和物种丰富度降低,厚壁菌门增加,拟杆菌门减少。在属水平上,西方饮食显示双歧杆菌和乳酸菌减少,而肠杆菌增加。
纤维摄入量,是一个诱人的可改变的饮食因素,因为其假定有益的生物效应。一些研究表明,纤维可以预防2型糖尿病、心血管疾病、结肠癌和肥胖等疾病。纤维加速结肠运输,并可能减少结肠上皮细胞暴露于摄入的致癌物质。


此外,纤维经过微生物群发酵,产生短链脂肪酸如丁酸,对结肠能量代谢和上皮细胞增殖至关重要,在小鼠模型中,通过抑制组蛋白去乙酰化酶,显示出肿瘤抑制活性。因此,人们越来越关注膳食纤维对肠道微生物组成的影响,这可能最终影响一个人患癌症和其他疾病的风险。
高纤维饮食与更高的胃肠道微生物丰富度和多样性有关,特别是与普氏菌Prevotella和密螺旋体Treponema的丰富度有关,还与炎症信号的减少有关,对肥胖的保护,以及可能减少结肠直肠癌的存在。尽管短期饮食干预试验已经证明,不同数量的纤维摄入量可以在几周内显著改变肠道微生物群的组成,但很少有研究在人类中评估长期摄入纤维的饮食习惯对肠道微生物群的影响。
点此查看 你吃的膳食纤维对你有帮助吗
人类微生物组、健康、环境科学的这三个要素每一个都是复杂的,整合具有挑战。环境因素往往是复杂的;要考虑的环境因素众多,更不用说对微生物组的不断深入了解,难以全面把握外部环境如何在疾病发生率和死亡率中起因果作用。在现实生活中,这些因素通常相互影响,随着时间的推移是动态变化的。
化学毒物经常在混合物中出现,例如,与化妆品和内分泌干扰物的混合物。此外,在整个生命过程中暴露的风险可能随年龄而变化,即易感性窗口。由于这种复杂性,确定直接或间接影响人类健康和疾病的微生物特征仍然具有极大的挑战性。
需要新的方法来充分评价可能影响微生物组和人类健康的现有和尚未确定的因素。前瞻性队列研究是环境和人类健康研究的支柱,特别是因为这项研究设计在建立因果关系的自然时间序列方面很重要,而这在横断面或回顾性研究中往往很难理清。
对粪便样本和人体其他部位样本进行前瞻性收集,以及连续的纵向样本收集也只是在最近才达到一定规模。需要以大量人群为基础的队列,包括不同社会经济地位和地理群体等。

此外,环境和微生物组对健康状况的多维影响,加强了整合其他组学的需要,包括代谢组学、转录组学、基因组学和免疫组学。需要开发相关的数据集成工具和流程。
结语
以上强调了环境中通过影响人类微生物群与非传染性疾病相关的许多因素。必须考虑复杂的相互作用、上游因果因素和多种因果路径。以大数据驱动的技术正为微生物组研究和临床运用带来许多便捷。
随着深入研究,不久的将来我们会对环境,微生物组,健康三者之间的关系有进一步认识,结合公共政策领域,有效地从多方面去实现健康的改善。
相关阅读:
主要参考文献:
Li Zichao,Bai Xiaozhi,Peng Tingwei et al. New Insights Into the Skin Microbial Communities and Skin Aging [J]. Front Microbiol, 2020, 11: 565-549.
Ahn Jiyoung,Hayes Richard B,Environmental Influences on the Human Microbiome and Implications for Noncommunicable Disease [J] .Annu Rev Public Health, 2021, 42: 277-292.
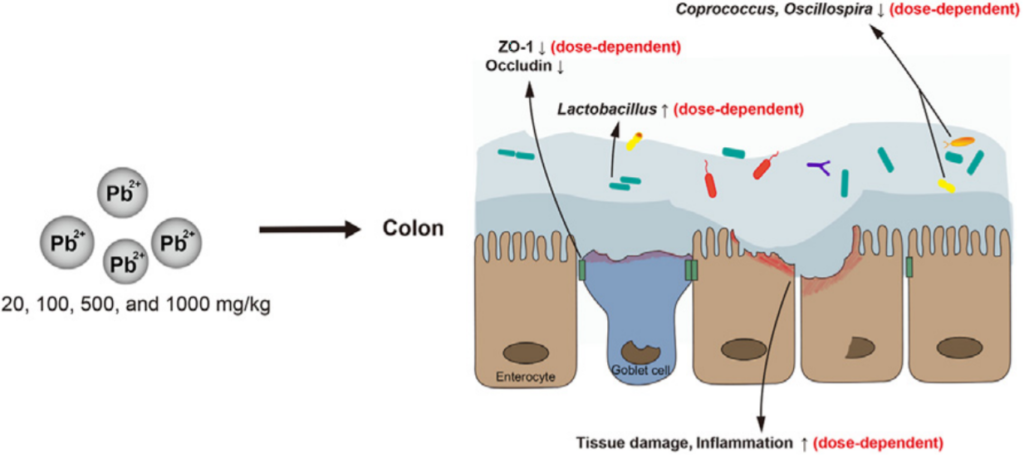
Yu L, Yu Y, Yin R, Duan H, Qu D, Tian F, Narbad A, Chen W, Zhai Q. Dose-dependent effects of lead induced gut injuries: An in vitro and in vivo study. Chemosphere. 2021 Mar, 266: 129-130.
Hayes RB, Ahn J, Fan X, Peters BA, Ma Y, et al. 2018. Association of oral microbiome with risk for incident head and neck squamous cell cancer. JAMA Oncol. 4:358–65
Sampson TR, Mazmanian SK. 2015. Control of brain development, function, and behavior by the microbiome. Cell Host Microbe 17:565–76
Daisley BA, Monachese M, Trinder M, Bisanz JE, Chmiel JA, et al. 2019. Immobilization of cadmium and lead by Lactobacillus rhamnosus GR-1 mitigates apical-to-basolateral heavy metal translocation in a Caco-2 model of the intestinal epithelium. Gut Microbes 10:321–33
Gilbert JA, Stephens B. 2018. Microbiology of the built environment. Nat. Rev. Microbiol. 16:661–70
Rook GAW, Raison CL, Lowry CA. 2014. Microbial ‘old friends’, immunoregulation and socioeconomic status. Clin. Exp. Immunol. 177:1–12

谷禾健康
有证据表明,从地球生命的开始,细菌就能够形成固着群落。尽管如此,科斯特顿(Costerton)等人创造了“生物膜”这个术语(Bill Costerton教授是世界著名生物膜专家,他首先在世界上提出了生物膜概念及理论),作为描述表面上各种各样微生物聚集体的一个简单表达,至今还不到50年。此后,环境微生物学家报告了几乎所有自然和工业生态系统中都存在生物膜。
就像在自然界中一样,微生物在人类栖息地中可以定居各种生态位。 称为生物膜的多细胞群落的主要定居形式是在人类组织表面。胃肠道是大量微生物的家园,它们的生活方式相互交织,但并不完全相同。
定义
生物膜
微生物在生长过程中为适应生存环境而形成了生物膜。微生物生物膜是由微生物群体及其包被的细胞外多聚物和基质网组成,它们彼此黏附或者黏附到组织或物体的表面。微生物生物膜与微生物的耐药性形成,基因的转移以及疾病发生的持续性感染等都密切相关。
长期以来,与粘膜组织接触的异常有害生物膜与人类疾病有关,包括外科植入物感染、牙龈疾病、导管引起的尿路和肺部感染以及一些肠道疾病。
然而,生物膜表型也有助于肠道内稳态、组织定植抗性、群落稳定性和恢复力、宿主防御成熟、食物消化和化学药物修饰。生物膜的这些有益作用尚未完全纳入我们目前对肠道微生物群的认识。
近年来有几项研究已经在成分、遗传和行为方面明确区分了粪便和粘膜附着的微生物群落。因此,粘膜多微生物群落对于寻找新的疾病生物标志物(例如,结直肠癌CRC和炎症性肠病IBD)尤其重要。
从相关性到这些疾病的潜在病因,将需要对粘膜群落进行进一步的研究,重点放在宿主与其自然生物膜表型下的微生物群之间的相互作用。
分类
目前对粘膜和粪便微生物群在微生物结果表明粘膜和粪便微生物群在微生物组成是不同的。粘膜生物膜的需要从粘膜取样推断,而不是粪便样本。
不同生态位的菌群构成也不一样。
在人类结肠中,健康人的结肠活检样本被薄薄的生物膜所覆盖,这些生物膜主要由拟杆菌科、乳酸菌科和肠杆菌科组成,位于右升结肠,拟杆菌科和乳酸菌科位于左降结肠。
健康成人的口咽组织通常定植有厌氧共生菌属,如:
韦荣球菌属Veillonella, 普氏菌属Prevotella, Leptotrichia 和 梭菌属Fusobacterium 潜在致病菌如 链球菌Streptococcus, 嗜血杆菌Haemophilus 和 奈瑟氏菌属Neisseria。
而在在小鼠小肠中,多糖和氨基酸的代谢有利于兼性厌氧菌,如变形杆菌和乳酸杆菌。小鼠结肠主要是富含梭状芽胞杆菌簇XIVa成员的粘膜群落(如羊肠球菌科和瘤胃科的物种),以及在较小程度上富集于拟杆菌科、肠球菌科和乳酸杆菌科的粘膜群落。
稳定性和弹性
除了分类学方面的考虑,微生物群的稳定性和微生物群的恢复力也是至关重要的。
从生态学的角度来看,生物膜内的这种持久竞争导致了整个群落的稳定,部分原因是可用生态位的划分。在多物种生物膜环境中,细菌之间的相互作用对群落的最终结果功能起着关键作用,因为一些生物体依赖于其他生物体的代谢活性生长。
实际上,从人类粪便样本中回收的拟杆菌、梭状芽胞杆菌、梭杆菌、金黄色葡萄球菌、普雷沃氏菌和韦荣氏球菌属的厌氧菌分离物在体外不同地粘附并形成单种生物膜。有趣的是,这项利用肠道相关分类群的研究表明,不会单独形成生物膜的细菌物种可以从与其他形成生物膜的强物种共存的混合生物膜群落中获益。
在抗生素治疗、粪便微生物群移植和益生菌定植后,粘膜相关群落可能在促进微生物群复原力方面发挥关键作用。我们可以期待关于生物膜生活方式在与肠道内稳态相关的微生物群的稳定性和恢复力特性方面的重要发现。
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
定植抗力
生物膜是一种具有化学成分和特定代谢的物理结构,起着保护屏障的作用,可以抵御环境分子、免疫细胞、捕食性原生生物和细菌。
共栖物种确实拥有许多竞争策略,例如快速生长以获得营养,直接攻击以将其他竞争物种排除在环境之外,从其他竞争物种中获益或剥削其他竞争物种。
这种生物膜诱导的对入侵者的保护作用可以通过肠道微生物群对肠道病原菌的定殖抗性来证明。这种抗性在小鼠体内通过直接机制(如细菌素的产生、短链脂肪酸(SCFA)的产生、胆汁酸的转化和VI型分泌系统的表达)和间接机制(宿主生理和免疫的调节)介导。
共生体也在体内与病原体竞争营养物质、获取金属和封存残余氧。最后,共生菌株(特别是大肠杆菌)的生物膜表型驱动了对占据类似生态位的相关分类群如:为肠聚集性大肠杆菌和肺炎克雷伯菌的定植抗性。
多微生物和跨生态位相互作用
与胃肠道表面相关的微生物群包含所有4个生命域(古细菌、原核生物和真核生物)和病毒。肠道生物膜内的细菌相互作用,并与人体细胞相互作用。这些跨“区域”的相互作用可能在维持消化系统健康方面起着重要作用,当这些体内平衡相互作用被破坏时,也可能在疾病中起着重要作用(称为失调)。
发生这种情况的机制在很大程度上虽然还不清楚,但是越来越清楚的是,这些微生物群与宿主的相互作用高度依赖于细菌群落作为生物膜结构的性质和空间组织。
随着测序技术的进步,微生物组成的变异在每个个体之间都可以观察到,在单个人体器官(如消化道)的景观中也可以观察到。利用显微镜和测序方法对小鼠和非人灵长类动物进行的研究表明,在不同的空间尺度和轴上,共生微生物群落确实在整个胃肠道的地理上是分层的。
最高的微生物密度通常出现在富含粘液的区域,靠近胃肠上皮和食物颗粒周围,在管腔中形成斑片状聚集体(下图)。因此,肠道生物膜利用形成凝胶的粘液层作为基质在活体中附着。
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
在微米尺度上,每个微生境都被混合类群的群落所占据,这些类群在物理上相互粘合。这个组织不太可能是随机的,尽管它的生物学重要性还不清楚。
总的来说,小鼠的生物地理学被认为受动态因素的控制,包括运动、粘液流量、胃肠道上皮细胞分泌、对宿主和食物颗粒的亲和力,以及微生物之间的生态相互作用。
粘膜相关微生物群的生物地理、组成和代谢活动也受到每日振荡的影响,这有助于使肠道生理在昼夜节律上同步。
现在,重要的工作仍然是精确描述整个胃肠道的微生物微生境,确定每个分类群在粘膜生物膜中的确切位置,以及更好地理解微生物生物地理学对肠道健康的生理贡献(下图)。
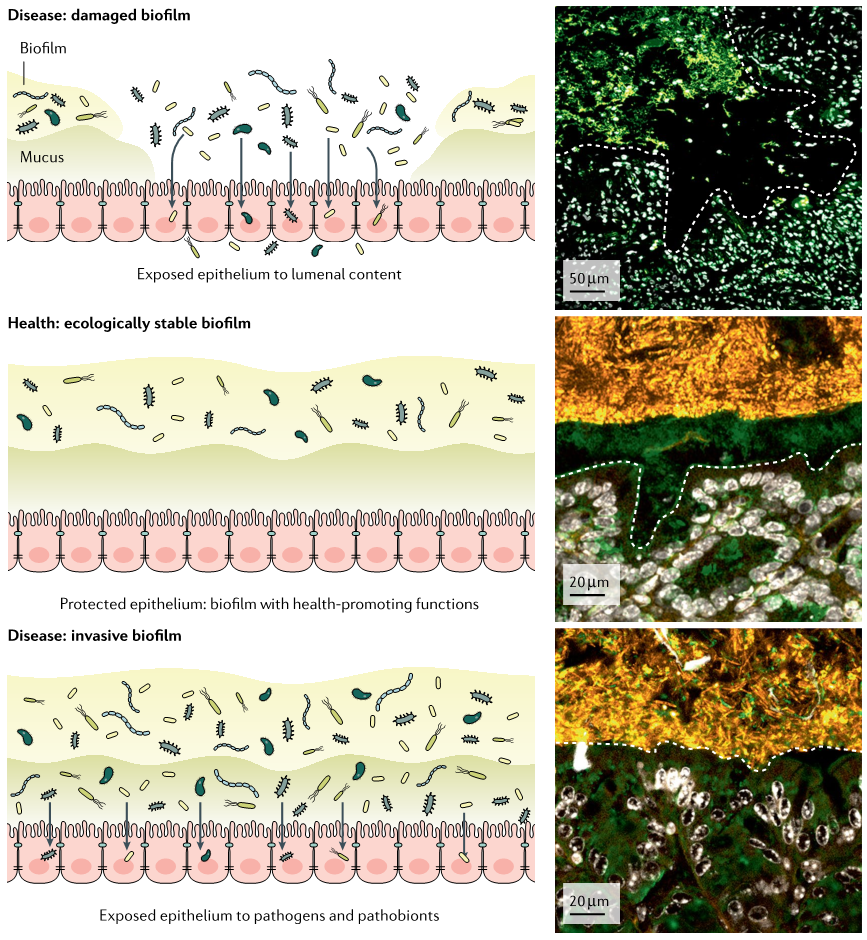
Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
生物膜组分诱导宿主反应
肠道生物膜刺激独特的粘膜反应。宿主粘膜防御系统对肠道生物膜的每一个组成部分都有不同的识别和反应,即使这些分子可以隐藏在生物膜基质中。
在体内平衡的背景下,这些相互作用可能在培养宿主防御和塑造肠道生理学方面发挥重要作用。
多糖
生物膜基质可由参与多种结构和代谢功能的多糖家族组成。体外实验证明鼠伤寒生物膜以及其作为一个屏障,以防止非生产者的基质成分从进入已建立的生物膜。
植物乳杆菌Lactobacillus plantarum, ,伯克霍尔德菌Burkholderia cepacia和肠炎沙门氏菌亚种Salmonella enterica subsp分泌的多糖(也称为胞外多糖)。伤寒降低人和猪免疫细胞在体外的细胞因子产生并抑制趋化性和氧爆发反应和人类结肠组织外植体。 鉴定肠道生物膜在体内自然产生的多糖,并了解宿主对此类成分的反应,可能有助于开发新的疗法,以防止病原性生物膜在粘膜表面生长。
蛋白质
基质相关蛋白是体外生物膜基质的重要组成部分,其总生物量与多糖相当。它们具有结构功能,促进细菌扩散,保护宿主介质并参与细胞间的通讯。
作为生物膜生长的特定细菌的基质相关蛋白质组不同于同等浮游生物培养物的分泌体。例如,在生物膜中,毒力蛋白的表达上调,其表达谱在作为单一菌种生长的生物膜和带有白色念珠菌的多菌种生长的生物膜之间不同。
宿主对体内生物膜蛋白质组分的反应可分为先天性和适应性机制。天然反应和抗菌防御蛋白可通过激活甲酰肽受体介导,该受体可识别含有N-甲酰蛋氨酸衍生物的生物膜相关寡肽。
与同一病原体的浮游培养物相比,在生物膜的刺激下,对金黄色葡萄球菌的先天性和适应性免疫反应被证明是不同的,这在小鼠白细胞和兔子中得到了证实。这些研究表明,20种金黄色葡萄球菌生物膜特异性蛋白具有免疫原性,可引起特定的宿主反应。
有趣的是,一组微生物胞内蛋白(特别是核糖体蛋白、RNA聚合酶和精氨酸脱氨酶)包裹在体外生长的人肠道多微生物生物膜的生物膜基质中,也可以被肠上皮蛋白酶凝血酶切割。这一发现可能表明生物膜相关细菌利用宿主蛋白酶来切割包裹在生物膜基质中的微生物蛋白。
这种裂解的目的是激活还是降解微生物蛋白质还有待研究。然而,这一观察结果提供了一个潜在的基于蛋白质的生物膜——宿主信号传递的额外例子。
膜泡和疏水化合物
膜泡(也称为外膜泡)由细菌和古细菌释放,是其生物膜基质的重要组成部分。基质相关蛋白主要来源于膜囊泡,如铜绿假单胞菌生物膜。
膜泡的产生依赖于细菌的应激反应。膜泡在体内的假定生物学作用可能是保护分泌的细菌分子不被降解或充当抗菌剂的诱饵。与可溶性分子相比,铜绿假单胞菌膜泡在体外增强了人巨噬细胞的活化。
虽然在肠道生理学的背景下说明的不充分,但生物膜囊泡的研究有望增强我们对肠道生物膜成分对肠道内稳态的贡献的理解。生物膜基质中存在的其他疏水性化合物是糖脂和肽脂。
鼠李糖脂是一类糖脂表面活性剂(如粘蛋白和表面蛋白),存在于变形杆菌生物膜中。它们介导群菌(一种集体运动行为)并增加中的生物膜分散。葡萄球菌在体外产生的肽脂参与其生物膜表面的疏水性。这一过程有助于确定生物膜对环境分子的不可渗透性。
核酸
细胞外核酸在一些肠道相关菌属如大肠杆菌、柠檬酸杆菌、李斯特菌、肠球菌、链球菌、假单胞菌和奈瑟菌作为生物膜基质的结构支架发挥作用。它们促进水平基因转移,并有助于细菌粘附和聚集到表面。
铜绿假单胞菌生物膜基质细胞外DNA中的非甲基化胞嘧啶-磷酸鸟嘌呤(CpG)基序可触发人中性粒细胞TLR9的激活。体外实验证明,铜绿假单胞菌的胞外DNA与多糖结合形成阳离子受限的环境,以保护生物膜不被抗菌肽(AMPs)溶解。
致病性变形杆菌(P.aeruginosa和E.coli)分泌的RNA可通过膜泡到达宿主粘膜,抑制小鼠膀胱(尤其是尿路致病性E.coli)、人气道上皮细胞系和小鼠肺(尤其是P.aeruginosa)的免疫应答。
当一个细菌群落达到一个临界值时,细菌可以同步它们的新陈代谢,并参与类似群落的行为,形成生物膜。这种机制被称为群体感应。
群体感应由革兰氏阴性细菌中的两亲性小分子和革兰氏阳性细菌中的小肽介导。铜绿假单胞菌衍生的群体感应分子(例如,3-氧代-C12-HSL)可以改变免疫细胞和肺上皮及内皮细胞凋亡的体外细胞因子产生和趋化性。铜绿假单胞菌群体感应分子在肠道中的类似作用有待证实。相反,大肠杆菌通过群体感应途径识别肾上腺素和去甲肾上腺素等肠道激素。
阿片类物质(例如内啡肽和强啡肽)也能被小鼠体内的铜绿假单胞菌识别,并作为群体感应分子。有趣的是,去甲肾上腺素增强了短螺旋体粘附和附着于人类肠上皮细胞系的能力,这一特性可以解释人类体内肠螺旋体病期间结肠上皮上生物膜的形成。
其他几种肠道相关分类群,如:伤寒沙门菌Salmonella typhi,单核细胞增生李斯特菌Listeria monocytogenes,弗氏柠檬酸菌 Citrobacter freundii,阪崎肠杆菌Cronobacter sakazakii,粪肠球菌Enterococcus faecalis,幽门螺杆菌Helicobacter pylori,空肠弯曲杆菌Campylobacter jejuni,梭杆菌属Fusobacterium spp对人体肠道激素(如去甲肾上腺素)有反应,多巴胺和肾上腺素),直接影响动物模型的感染结果。
总之,宿主和肠道微生物生物膜之间通过群体感应途径存在着明显的跨生态位对话。未来对体内多微生物生物膜的研究将成为“微生物内分泌学”这一朝阳领域。
控制生物膜的宿主因素不仅取决于宿主的遗传和免疫状况,而且还取决于生物膜及其亚基因组的分类组成。宿主和/或微生物方面这种微妙平衡的改变可能是肠道疾病的主要驱动因素,并可能解释与许多肠道疾病相关的失调。
宿主-生物膜相互作用的相关因素:对肠道健康和疾病的贡献和意义

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
为了开发旨在恢复肠道内稳态的改良疗法,确定宿主组织控制粘膜表面肠道生物膜生长的因素和途径非常重要(下图)。

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
粘蛋白
粘蛋白是上皮杯状细胞分泌的一类高度糖基化的蛋白质。它们是覆盖在肠上皮上的粘液屏障的主要蛋白质成分。这种粘液层的组成和屏障特性在胃肠道的不同部分有所不同(图2)。
共生细菌和病原细菌已经进化出几种机制,使它们能够粘附在粘液上,并相互竞争,利用粘液作为有益的栖息地。空肠弯曲菌和霍乱弧菌等病原体利用粘蛋白作为信号,促进毒力因子的表达,并诱导形成生物膜。
在健康的远端结肠中,粘液层由内层组成,内层致密,无细菌,牢固地附着在上皮上。松散粘附的外层容纳了大多数细菌群落。粘液层可能更紧密地附着于生物膜群落而不是肠上皮本身。因此,体内肠道生物膜可定义为粘液包埋、粘液粘附的微生物聚集体。
胃肠道自然含有非溶粘液细菌的分类群。由于粘蛋白的消耗需要大量酶活性的组合,非溶粘液性肠道细菌将共同受益于多微生物生物膜生活方式的代谢特性。最后,人们普遍认为胃肠道中的粘蛋白层阻止病原体以及共生体到达和接触肠上皮细胞。
然而,粘液层的组成,厚度和粘弹性沿胃肠道变化很大。微生物聚集体和上皮之间的接触在上肠道和近端结肠中很常见。体外研究表明,胃源性粘蛋白通过诱导鞭毛运动引起铜绿假单胞菌生物膜的扩散。
下消化道粘蛋白(如MUC2)在肠道生物膜上的确切作用仍有待澄清。虽然粘蛋白在防止生物膜与粘膜表面接触方面的作用在结肠中已被明确确立,但这种粘蛋白也可能对生物膜内的细菌种类有特定(但尚未发现)的作用。
抗菌肽
AMPs是一类广泛分布于自然界的宿主防御肽。它们由真菌、昆虫、两栖动物、哺乳动物和原核生物产生。大多数AMP是阳离子的,这种性质有助于通过破坏膜、形成孔隙、渗透和抑制细菌细胞内分子和酶以及抑制细胞壁合成来杀死浮游细菌。
AMPs在体外对多种药耐药和临床分离的细菌群具有很强的抗生物膜活性。它们通过减少生物膜对表面的粘附力、杀死嵌入的细菌或直接干扰生物膜形成的代谢途径,在体外分散生物膜。
体内实验的研究表明,防御素(例如,人α-防御素6)可以形成称为“纳米网”的自聚合结构,然后可以捕获细菌并防止其与肠上皮细胞物理接触。
有趣的是,这种聚合可以通过不同于肠隐窝和绒毛顶部的氧化还原条件进行微调。总的来说,AMPs可以被认为是对抗有害生物膜的传统抗生素的良好替代品。
硫化氢
硫化氢(H2S)是胃肠道炎症、稳态和修复的介质。肠道共生菌群是H2S的主要来源,其中一些作为能量来源。
此外,一些报告表明,微生物产生的H2S(由硫酸盐还原细菌以及其他肠道菌株,如大肠杆菌、梭状芽孢杆菌和肠杆菌)具有遗传毒性,可能在大肠癌和溃疡性结肠炎的病理生理学中起作用。另外,H2S的局部作用也会对肠道组织产生一些有益的影响。例如,H2S抑制NF-κB的活化,具有抗氧化活性,并抑制caspase-3的裂解,从而限制凋亡。研究还表明,H2S可保护健康的远端结肠生物膜组织。
根据一项体外研究,表明大肠炎患者炎症发作中存在微生物群衍生的H2S 可能与结直肠癌的发生有关。结肠上皮本身也通过胱硫醚-β-合酶、胱硫醚-γ-裂解酶(CSE)和3-巯基丙酮酸硫转移酶产生H2S。
结肠内源性H2S生成已被证明有助于促进健康结肠微生物群生物膜的形成和粘液屏障功能。在结肠炎期间将释放H2S的化合物直接注入小鼠结肠可促进粘液的正常产生并恢复健康的微生物群生物膜。
有趣的是,大蒜中富含H2S的膳食化合物在体外对各种病原体(如伤寒杆菌、金黄色葡萄球菌、恶性疟原虫、布氏锥虫和白色念珠菌)具有抗菌、抗真菌和抗寄生虫的特性。
此外,一种释放H2S的抗炎药(Antibe therapeuticals)可降低IBD患者体内生物膜的毒性。然而,如果要在人类身上实现基于H2S的疗法的转化应用,还需要进一步研究H2S在生理肠道生物膜上的确切作用。
免疫球蛋白
肠腔分泌免疫球蛋白(特别是IgA)和微生物毒素并包裹细菌,防止其粘附在上皮细胞上。高亲和力IgA涂层表明炎症细菌的一个亚群,其侵入粘液层的能力增强,激活炎症小体途径,从而导致肠道疾病,如IBD。由于许多其他肠道相关细菌在其生物膜基质(例如,大肠杆菌和铜绿假单胞菌)中产生卷曲或卷曲样淀粉样蛋白,这种新的生物膜特异性免疫疗法有可能应用于多种致病性生物膜。
虽然细菌的生长通常受到IgA涂层的损害,但在体外,共生微生物可以被IgA涂层,而不会对其生长产生实质性的改变。事实上,IgA可以促进肠道内的微生物定植,因为肠道细菌(大肠杆菌和幽门螺杆菌)表达识别IgA糖蛋白基因的受体。IgA与这些表面受体的结合确实可以促进细菌与宿主表面的初始粘附,例如在牙菌斑生物膜中。
肠道上皮细胞表面的肠道生物膜形成(如人类细胞系单层所示)也通过向环境中添加分泌性IgA(但不是通过添加IgG)来帮助。相反,体外生物膜的形成是由IgA特异性蛋白酶阻止的。
因此,免疫球蛋白可以对肠道生物膜发挥免疫排斥和免疫包容功能。它们可以促进肠腔中的生物膜表型,同时防止浮游元素或最终生物膜分散元素侵入粘液层,接触并穿过上皮屏障。
蛋白酶体
存在于肠腔中的真核蛋白酶,例如从丝光绿蝇蛆中提取的糜蛋白酶,对细菌生物膜的形成具有负面影响。有趣的是,宿主胰蛋白酶样蛋白酶在小鼠泌尿道传播粪肠球菌生物膜的形成。
通过体内方法(小鼠模型)和体外人体肠道微生物群生物膜培养,上皮凝血酶被确定为结肠粘膜表面内稳态生物膜抑制的关键因子。以生物膜的基质相关蛋白骨架为靶点,例如通过蛋白酶引起的酶解,似乎是一种很有希望的方法来控制或根除医学和宿主表面的生物膜。
有趣的是,肠杆菌科如铜绿假单胞菌和大肠杆菌可以释放其生物膜基质中的蛋白酶抑制剂ecotin,以保护其免受中性粒细胞弹性蛋白酶的溶解。胃肠道含有多种来源的蛋白酶,其中许多蛋白酶的产生和活性在疾病条件下发生改变。
肠道生物膜有什么临床意义?
生物膜相关感染的临床相关性很重要,因为人体内绝大多数持续性感染源于生物膜。生物膜特征的改变与IBD、癌症和传染病有关,并与分类组成的改变、生物地理分布、抗生素耐受性或耐药性以及生物膜分散的病理生物出现有关。
生物膜是肠道微生物的一种自然生活方式,不一定是疾病的标志物,因此未来的治疗方向可能侧重于恢复宿主生物膜稳态,而不一定消除粘膜表面的生物膜。由于整个胃肠道的生物膜组织可能会有所不同,因此这些方法也需要区域特异性。
微生物生物膜群落有助于维持整个胃肠道内各个方面的稳态。然而,在某些临床情况下,这些生物膜需要保存或修复时破坏,而在其他上皮附着生物膜可能需要根除。因此,在尝试开发治疗性生物膜特异性控制策略方面花费了巨大的研究努力
胃肠道管腔化合物、生物膜和宿主之间的相互作用是复杂的,需要在健康和疾病方面加以考虑。
生物膜可以以多种不同的方式管理胃肠道管腔化合物。管腔化合物,无论是微生物、饮食分子、污染物还是外源性物质,都可以自由扩散穿过生物膜并到达宿主上皮细胞,或者被生物膜阻断,生物膜起着严密的屏障作用。这些管腔化合物也可以通过生物膜过滤,生物膜只允许某些分子通过,从而起到选择性过滤的作用。
消化过程中产生的一些饮食分子、外源物质或污染物也可以通过生物膜工厂进行化学转化(下图),然后产生新的化合物,释放到宿主细胞附近。这些转化生物膜的化合物对宿主是有益还是有害,当然取决于生物膜的组成及其代谢。
最后,宿主和生物膜可能相互竞争的管腔化合物。因为生物膜与管腔的内容物接触更紧密,它可能比宿主有优势。然而,在上消化道,上皮的某些区域似乎与管腔化合物密切接触。

Jean-Paul Motta et al., 2021, Nat Rev Gastroenterol Hepatol
综上所述,可以合理地认为,根据生物膜的组成,更重要的是根据生物膜的代谢,宿主识别的管腔化合物可能具有不同的性质和不同的浓度。当这些分子来源于健康的生态稳定的生物膜时,它们可能是有益的;当它们来源于不健康的不稳定的生物膜时,它们可能是有害的。因此,综合了解生物膜的组成、代谢活性及其空间分布具有重要意义。
结肠可被视为一个中央发酵器官,参与消化残渣的发生和加工。肠道微生物群可以改变几乎所有种类的膳食化合物,包括复杂的多糖、脂类、蛋白质和植物化学物质(图5)。早期观察表明,在粪便中心、粘液-粪便界面和食物颗粒附着的微生物群落上,细菌的生长存在差异。这些研究为生物膜表型对微生物结肠发酵的贡献提供了有用的信息。
肠道生物膜对未消化碳水化合物复合物(如饮食中的碳水化合物复合物以及与粘蛋白相关的碳水化合物复合物)的代谢可导致SCFA的产生,主要是乙酸盐、丙酸盐和丁酸盐。SCFAs的其他来源是氨基酸,如缬氨酸、亮氨酸和异亮氨酸,它们是由蛋白质分解产生的。
SCFAs在肠道中的生物学作用是多方面的:它们可以作为肠上皮的能量来源,有助于降低肠腔pH值,直接抑制病原菌的生长,促进T调节细胞的分化,改善上皮紧密连接的完整性。有趣的是,在喂食不同纤维来源的模型猪的肠腔中,SCFA的浓度从结肠的近端到远端减少。这一观察结果有些令人惊讶,因为远端结肠的细菌密度高于近端结肠。
生物膜表型为细胞在其环境中代谢氨基酸提供了有利条件,这一特性已在工业生物技术过程中得到利用。蛋白质的微生物代谢可导致最终产物的形成,如多胺(来自精氨酸、赖氨酸、酪氨酸或组氨酸)、H2S(来自蛋氨酸和半胱氨酸)、酚类和吲哚类化合物(来自色氨酸),以及N-亚硝基化合物(亚硝胺和亚硝胺)的产生,它们是动物模型中肠道肿瘤的有效诱导物。
维生素B12(一种用于DNA合成、脂肪酸和氨基酸代谢的关键维生素)和维生素K(一种用于合成凝血级联蛋白酶的关键维生素)是由肠道微生物群落中一小部分分类群合成的。假单胞菌属合成维生素B12的所有维生素体(也称为钴胺素),包括氰钴胺、羟基钴胺素、腺苷钴胺素和甲基钴胺素。
假单胞菌还利用维生素B12在生物膜形成过程中通过氧依赖途径合成蛋氨酸和核糖核苷酸。因此,在人类IBD中观察到的维生素B12的可利用性降低可以部分解释为在炎症过程中蛋白细菌的粘膜丰度增加和氧张力的改变。
维生素K缺乏症在接受大剂量抗生素治疗的人中发生得很快,这种缺乏症与严重的胃肠道损伤(出血和溃疡)有关。枯草芽孢杆菌的生物膜表型有利于体外特定的发酵途径,显著提高维生素k的产量。尽管生物膜对止血和粘膜组织本身的生理学至关重要,但生物膜表型对维生素K产生的贡献仍有待阐明。
治疗药物可改变动物模型和人类肠道微生物群的组成,但肠道微生物群本身也参与药物加工。尽管宿主的新陈代谢通常会将外源物质从体内清除,但肠道微生物可以将这些化合物用作营养和能源。
肠道微生物群确实可以直接代谢外源性物质(例如,胺碘酮、他克莫司、地高辛等),从而改变其化学性质、稳定性、生物利用度和潜在的生物效应。因此,由微生物群驱动的外源性物质加工可能会导致不必要的不良反应,导致分子失效,或相反地导致更具活性和效率的分子。这一观察结果对人类使用药物的建议和剂量提出了严重的问题,特别是考虑到其中一些药物由于毒性而必须仔细监测。
越来越清楚的是,肠道微生物群的代谢谱比人类细胞的代谢谱要大。不幸的是,在绝大多数情况下,具体的微生物或微生物群落,以及介导这些反应的酶,都是未知的。此外,胃肠道内的不同生境可导致不同的分类组成以及不同的代谢过程。这一观察结果增加了试图解决微生物群对外源或药物加工的影响的复杂性。
生物膜生活方式在地球上的每一个自然栖息地中都占主导地位,包括胃肠道表面。然而,生物膜在医学上的概念只有50年的历史,不仅应被视为一种病理性慢性感染,而且应被视为一种生活在粘膜表面的微生物的普通生活方式。
微生物生物膜是许多肠道疾病病理生理学的核心,但它们也是肠道稳态发育的关键因素。肠道生物膜的调节可能是新疗法的关键。
我们需要将微生物生态学的重要概念转化为我们目前对肠道生理和宿主-微生物群相互作用的看法。这些概念包括微生物群稳定性、复原力和微生物生物地理学,并要求我们确定它们如何影响胃肠健康。有机会使用生物膜的代谢能力超过浮游生物培养中所描述的,以帮助代谢外来的优势。
未来的研究将有助于更好地了解肠道粘膜生境中多微生物的多样性和复杂性。这一认识构成了开发更好的肠道疾病生物标志物和治疗方法的必要步骤。
为了迎接这一挑战,我们将受益于跨学科的合作,不仅是微生物学家、生理学家和临床医生之间的合作,而且还将受益于与生物物理学家开发临床相关的生物膜模型,生物信息学家分析大数据集,以及微生物生态学家的理论框架来理解这样一个异常复杂的栖息地。
相关阅读:
参考文献:
Motta Jean-Paul,Wallace John L,Buret André G et al. Gastrointestinal biofilms in health and disease.[J] .Nat Rev Gastroenterol Hepatol, 2021
Tomkovich, S. et al. Human colon mucosal biofilms and murine host communicate via altered mRNA and microRNA expression during cancer. mSystems 5, e00451-19 (2020).
Raffatellu, M. Learning from bacterial competition in the host to develop antimicrobials. Nat. Med. 24, 1097–1103 (2018)
Zmora, N. et al. Personalized gut mucosal colonization resistance to empiric probiotics is associated with unique host and microbiome features. Cell 174, 1388–1405. (2018)
Rumbaugh, K. P. & Sauer, K. Biofilm dispersion. Nat. Rev. Microbiol. 10, 571–586 (2020)
Guilhen, C. et al. Colonization and immune modulation properties of Klebsiella pneumoniae biofilm-dispersed cells. NPJ Biofilms Microbiomes 5, 25 (2019).
Jalili-Firoozinezhad, S. et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nat. Biomed. Eng. 3, 520–531 (2019).