-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

俗话说:“病从口入”。饮食是决定个人健康状况的重要因素,饮食与疾病的发展有关,特别是胃肠道(GI)疾病。
与膳食相关的症状发生率很高,例如在吸收不良(如乳糖不耐症)情况下出现的腹痛和腹泻;乳糜泻、食物过敏人群在食用麸质类后出现的腹胀、腹痛、水肿;肠易激综合征患者在摄入一些刺激性食物后(酸、辣)的腹痛、排便异常等。饮食作为胃肠道症状的驱动因素已经逐渐被人们所认识。
然而对出现食物相关症状的机制仍不太清楚。随着对肠道微生物研究的深入,肠道微生物群也被认为是胃肠道疾病的重要影响因素,这促使人们研究微生物作为饮食和宿主生理之间的关键联系。
同样的饮食摄入效果会因人体的健康状况以及肠道个性化的微生物群落而产生的不同的效果。例如低聚果糖(FOS)会加重炎症性肠病(IBD)患者的炎症,但在健康个体中却具有抗炎作用。麸质、小麦、牛奶和大豆等物质直接注射到粘膜下层可以通过激活IBS患者的肥大细胞来引发免疫反应,但在健康受试者中则不然。还有纵向研究报告称,饮食蛋白质摄入量相似,但IBS-D患者的色氨酸和色胺水平(而非吲哚衍生物)高于健康人。另一方面,结肠内乙酸盐可增强对结肠直肠扩张的敏感性。具体影响可能取决于宿主健康和肠道中的整体代谢环境。
近年来,人们越来越认识到个性化的饮食干预在预防和治疗胃肠道疾病中的潜力。个性化饮食不仅考虑到个体的遗传背景、健康状况和生活习惯,还特别关注其独特的微生物群组成。通过分析和调整个体的饮食,可以优化肠道微生物群的平衡,增强其对疾病的抵抗能力。
在本文中,主要关注两种胃肠道疾病:肠易激综合征和炎症性肠病。宿主和肠道微生物群对膳食营养素的利用决定肠道中最终的生物活性代谢物特征以及这些代谢物对胃肠道生理学的生物效应。此外强调了单个代谢物的不同作用如何影响不同的胃肠道疾病,类似的饮食干预对多种疾病状态可能具有不同的影响。
食物在肠道内会被肠道菌群代谢、转化。食物成分本身的性质,加上肠道菌群作用后的代谢产物,共同决定了食物对人体健康的作用。因此,仅考虑食物成分是不够的,还要考虑个人肠道菌群状况,两者结合才能判断食物的健康效应。
例如,传统观点认为,大部分可消化的食物成分会通过小肠表面吸收。剩余的不可消化成分传递到远端,作为肠道微生物群的能量来源,产生如短链脂肪酸(SCFA)等发酵最终产物。
然而,这种观点简化了过程。肠道微生物群不仅依赖于难以消化的膳食成分,还可以从宿主上皮表面粘液层中的糖蛋白和多糖获取营养,尤其是在碳水化合物缺乏的情况下,如低纤维摄入时。
★ 不同的肠道微生物结构造就了独特的代谢
肠道微生物群与营养物质的利用:肠道微生物群如何利用营养物质取决于具体的营养成分和每种微生物的代谢能力。不同微生物有不同的代谢途径,使得营养利用变得复杂,而不是简单的化学计量问题。
微生物群落结构的影响:肠道中的微生物群落结构可以影响宿主和微生物之间的营养合作动态。比如,在体内平衡期间,宿主在小肠中有效吸收氨基酸,从而使得一些微生物无法获得这些氨基酸。
营养物质的竞争:某些细菌(如梭状芽孢杆菌)如果过度生长,就可能在一些情况下(如膳食蛋白质有限时)与宿主竞争氨基酸的吸收。
营养层次与利用率:更高级的营养物质(如单糖和双糖)的增加会降低某些细菌对氨基酸的利用率。这意味着营养物质的可用性对微生物代谢有影响。
调节信号的作用:肠道中的特定信号分子(如短链脂肪酸或肽YY)也能影响宿主对营养物质的利用方式。
在下面小节中,我们重点介绍两个例子(色氨酸和膳食纤维),以说明宿主和肠道微生物群在营养利用上的差异如何影响宿主的生理学。
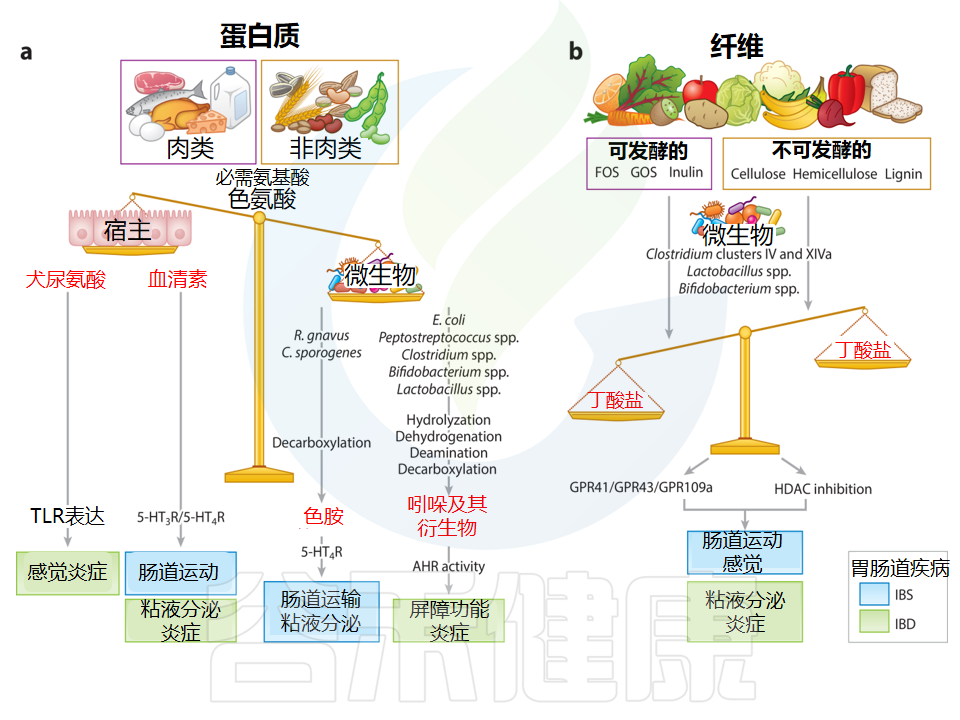
色氨酸是一种必需氨基酸,是宿主神经递质血清素 (5-HT;胃肠道生理的重要调节剂) 的前体,也是微生物代谢物(如色胺和吲哚衍生物)的前体。色氨酸库很大程度上取决于饮食。
色氨酸被整合到蛋白质中并被宿主利用,通过不同的途径产生5-HT(1-2%)和犬尿氨酸(∼95%)。肠道微生物成员如Ruminococcus gnavus和Clostridium sporogenes含有色氨酸脱羧酶,可将色氨酸转化为色胺,而色胺则是血清素受体4(5-HT 4R)的激动剂。
同时,脆弱拟杆菌(Bacteroides fragilis)和大肠杆菌(Escherichia coli)等细菌含有色氨酸酶,这种酶有助于从色氨酸产生吲哚和吲哚衍生物。如吲哚乙酸和吲哚丙酸,可以通过激活芳烃受体(AHR)对宿主的免疫途径发挥生物学效应。
这些细菌产生的色氨酸衍生生物活性代谢物的水平取决于肠道菌群的组成、肠道细菌利用色氨酸的程度和位置,以及宿主色氨酸利用相关基因的活性。
Jadhav A,et al.Annu Rev Nutr.2023
饮食衍生的代谢物可改变多种生物途径,而这些途径是多种胃肠道(GI)疾病的基础。
a)饮食蛋白质,包括肉类和非肉类(例如谷物、种子和坚果),都含有不同水平的氨基酸,例如色氨酸。可被宿主代谢产生犬尿氨酸和血清素(5-HT)。肠道微生物群还可以通过不同的代谢途径将色氨酸转化为色胺或吲哚和吲哚衍生物。色胺通过激活血清素受体4来增加肠道分泌和杯状细胞的粘液释放,而吲哚和吲哚衍生物是芳烃受体(AHR)的配体,在调节屏障功能和免疫反应中发挥重要作用。
b)膳食纤维包括可发酵[例如低聚果糖、低聚半乳糖和菊粉]和不可发酵(例如纤维素、半纤维素和木质素)纤维。根据肠道细菌的类型和纤维的类型,它们会发酵成不同的短链脂肪酸,例如丁酸盐和乙酸盐。丁酸盐可以增加血清素合成,增强结肠收缩力,缓解内脏过敏,增强屏障。
色氨酸衍生的生物活性代谢物取决于肠道菌群,那么纤维的发酵产物与微生物组成有关吗?
富含膳食纤维的饮食被认为是有益的,因为肠道微生物群会发酵纤维产生丁酸、乙酸和丙酸等短链脂肪酸,这些短链脂肪酸会影响宿主生理学的重要方面,包括代谢、细胞周转和免疫系统。
然而,人类研究表明,个体对纤维摄入量的反应存在显著差异,并且基于纤维类型的差异也很大。这并不奇怪,因为纤维是一个总称,包括具有不同连接和分子结构的不同碳水化合物群体。不同细菌携带的基因使它们能够利用具有特定连接和结构的碳水化合物。
膳食纤维的生物学效应取决于纤维的成分、个体肠道微生物群代谢特定纤维的潜力以及不同发酵最终产物的相对量。
▸ 低聚果糖在健康人体和炎症性肠病患者中作用大为不同
编辑
最近的一项研究发现,低聚果糖(FOS)会加重炎症性肠病(IBD)患者的炎症,而肠道细菌代谢它会减轻其在活动性炎症的IBD患者的炎症作用。
有趣的是,低聚果糖在健康个体中具有抗炎作用。因此,低聚果糖的炎症潜力取决于肠道微生物组成以及宿主疾病状态。
产生的短链脂肪酸的水平和类型可能因纤维组成和肠道微生物群而异。在饮食中添加菊粉会增加丁酸盐,但会降低乙酸盐的产生。相反,在消耗相同纤维量的患者亚组中,粪便丁酸水平较低,这归因于产生丁酸的细菌水平较低。这些结果有助于解释对纤维反应的个体间差异。
鉴于微生物代谢产物对宿主发挥多效性作用,因此,相同的代谢物可以影响多种宿主功能,每种功能都可能与不同的疾病状态相关。
色氨酸代谢物如色胺和5-HT会影响胃肠道转运,这与肠脑轴(DGBA)相关,而色胺和吲哚衍生物可以改变粘液和免疫反应,这对炎症性肠病具有影响。
同样,丁酸等发酵终产物会影响胃肠道运动以及上皮屏障功能,这分别与DGBA和IBD相关。
肠道微生物组的一个重要决定因素是饮食,它会对肠道微生物组产生长期和短期影响,它们会随着个体饮食的变化而变化。
与农业社会相比,工业化社会个体饮食的成分显著改变和肠道微生物多样性减少能证明习惯饮食的长期影响。
▸ 低纤维饮食会导致肠道微生物多样性逐渐减少
研究证明,低纤维饮食会导致人肠道微生物多样性逐渐丧失,这在早期阶段是可逆的,但可能会导致后代特定分类群的灭绝,而仅靠饮食干预是无法恢复的。
这一观察结果为西方人群中观察到的肠道微生物多样性较低提供了一种解释,并强调了微小的变化是如何在几代人的过程中积累起来的。因此,个体的微生物群落结构可能反映了人群的长期饮食模式。
▸ 短期饮食改变也会影响肠道微生物群,但可逆
短期的饮食改变也会改变肠道微生物组。虽然这些变化在不同程度上是可逆的,这取决于人体的基本恢复力和适应性,但短期变化可能在一定程度上解释慢性病患者症状的频率和严重程度不同。
这些短期影响也强调了微生物群导向的饮食干预作为治疗策略的潜力。
肠易激综合征(IBS)是一种常见的疾病,全球患病率约为11.2%。根据过去3个月内每周至少出现一次腹痛、伴有排便或大便频率或形式的变化并在过去6个月内出现症状进行诊断。
IBS一般可分为腹泻型(IBS-D)、便秘型(IBS-C)、混合型和未分类亚型。
胃肠道运输、分泌、感觉、免疫激活、肠道通透性和肠脑轴的改变等生理变化是IBS症状的基础。与IBS相关的危险因素包括宿主遗传、压力、抗生素使用和幼儿期经历,但饮食最常被认为是肠易激综合征的潜在罪魁祸首。基于人群的研究表明,近70%的IBS患者认为自己存在食物不耐受。
饮食引起症状的机制仍在研究中,但最近的研究已经开始阐明IBS中由饮食驱动的症状背后的微生物群独立机制和微生物群依赖机制。
研究发现将食物抗原(例如麸质、小麦、牛奶和大豆)直接注射到粘膜下层可以通过激活IBS患者的肥大细胞来引发免疫反应,但在健康受试者中则不然。
他们进一步表明,肥大细胞激活会引起内脏疼痛,并通过组胺刺激内脏神经元的敏化增加肠道通透性。虽然这项研究证明了一种独立于微生物群的机制,但其他研究发现,富含可发酵寡糖、二糖、单糖和多元醇(FODMAP)的饮食也可以通过Toll样受体4(TLR4)途径激活肥大细胞,这表明肠道微生物群的参与。
据报道,IBS-D患者中受饮食影响的微生物产物(如脂多糖和鞭毛蛋白)的血清水平显著升高。
脂多糖(LPS)是肠道细菌的一组异质细胞壁成分,充当TLR4的配体,在食用高脂肪饮食或高FODMAP饮食的个体中也会增加。除了在肥大细胞激活中的作用外,不同形式的LPS还能促进肠神经元的存活并增强平滑肌收缩力,这表明LPS浓度或结构的差异可能会驱动不同的宿主反应。
除微生物细胞壁成分外,宿主微生物代谢膳食成分产生的代谢终产物也可影响胃肠道生理,从而引发胃肠道症状。乙酸盐、丙酸盐和丁酸盐等短链脂肪酸由特定肠道微生物成员产生,其水平取决于微生物组成和膳食纤维摄入量。
丁酸盐是一种多效性代谢物,可通过G蛋白偶联受体(GPCR)直接发出信号,并通过表观遗传调控改变转录反应。丁酸盐可以浓度依赖性方式改变肠嗜铬细胞中的5-HT合成,通过直接影响肠道神经肌肉装置增加结肠收缩力,增强肠道上皮屏障,并通过与肠道神经胶质细胞相互作用调节内脏高敏感性。
另一方面,结肠内乙酸盐可增强对结肠直肠扩张的敏感性。具体影响可能取决于宿主健康和肠道中的整体代谢环境。
饮食、宿主粘液和微生物代谢都是肠道中氨基酸的主要来源。一项纵向研究报告称,尽管饮食蛋白质摄入量相似,但IBS-D患者的色氨酸和色胺水平(而非吲哚衍生物)高于健康人。
这种差异可能是由于肠道微生物群增加了色氨酸的产生和转化,或由于宿主对其利用率降低。胰蛋白酶激活肠细胞上的5-HT4R,进而增加肠液分泌。
另一项研究发现,IBS患者和健康受试者在结肠组织对色胺的5-HT4R表达或反应方面没有差异,这表明较高的色胺水平可能是腹泻的重要驱动因素。
在腹泻型(IBS-D)患者中,其他饮食和微生物驱动的途径也被描述了。无乳糜泻的IBS-D患者中经常报道麸质不耐症,这似乎部分依赖于宿主基因型和肠道微生物群组成。据报道,与阴性患者相比,HLA-DQ2/HLA-DQ8 阴性的IBS-D患者在无麸质饮食后腹胀显著减轻。
HLA-DQ2和HLA-DQ8基因是导致乳糜泻的主要基因。
其他研究表明,肠道微生物群可以对麸质的消化和免疫原性产生不同的影响。麸质对IBS-D影响的具体机制仍需进一步研究确定。
胆汁酸(BA)在肝脏中合成,储存在胆囊中,用于脂质乳化。膳食脂肪和姜黄是刺激初级胆汁酸释放到小肠中的重要因素。
近95%的初级胆汁酸在远端小肠中被重新吸收,剩余的初级胆汁酸在进入结肠后被肠道微生物去偶联、脱羟基和差向异构化为次级胆汁酸。
初级胆汁酸如鹅去氧胆酸通过氯化物通道增加结肠分泌,并降低健康个体的直肠感觉阈值。在啮齿类动物模型中,鹅去氧胆酸通过激活核受体法尼素X受体、释放神经生长因子和在背根神经节中下游表达瞬时受体电位香草素1(TRPV1),影响内脏敏感性。
▸ IBS-D患者的胆汁酸水平较高
IBS-D患者的粪便胆汁酸水平可能更高,这归因于胆汁酸吸收不良或肠道微生物群减少导致的继发性胆汁酸转化减少。因此,高脂肪饮食可以通过调节胆汁酸的释放,直接或通过胆汁酸的微生物代谢间接改变胃肠道生理学。
除此之外,最近的一项研究发现,感染后IBS-D患者的细菌编码的β-葡萄糖醛酸酶水平较低,这种酶可以解除胆红素的结合。
这些患者的结合胆红素水平较高,导致对宿主蛋白酶的抑制作用降低,肠道通透性增加,从而引发内脏超敏反应。
炎症性肠病(IBD)是一种特发性、慢性、使人衰弱的炎症性胃肠道疾病,包括两种疾病——克罗恩病(CD)和溃疡性结肠炎(UC)。克罗恩病表现为遍布整个胃肠道的斑片状透壁炎症,而溃疡性结肠炎则是结肠的持续性粘膜炎症。
这两种疾病都是由于环境、遗传和免疫因素共同作用下,对肠道微生物信号产生的不受控制的炎症反应引起的。从流行病学角度来看,IBD曾被认为是西方国家的疾病,欧洲和北美的发病率最高。但自20世纪90年代以来,IBD的高发区已大幅向东方扩展,在非洲、亚洲(如印度每10万人9.3例,中国每10万人3.3例)和南美洲的新兴工业化国家中,发病率迅速上升。
▸ 炎症性肠病的风险升高与饮食改变紧密相关
这些流行病的转变与全球饮食模式的转变相吻合,包括引入包装和加工食品;广泛接受和使用食品添加剂、防腐剂和抗生素;推广快餐连锁店,同时减少针对特定地区的当地饮食。
流行病学研究表明,饮食是形成炎症性肠病(IBD)的关键环境因素之一,从低发病地区迁移到高发病地区的人群中,IBD的患病率有所上升。此外,法国和西班牙的南北流行率差异也很微妙。在这些国家的北部地区观察到较高的IBD负荷,那里的个人食用更多的黄油、土豆、火腿、奶酪、香肠和啤酒,而南部地区的个人则遵循地中海饮食,主要由橄榄、新鲜水果和蔬菜、葡萄酒和海鲜组成。
饮食成分不仅可以直接影响炎症性肠病的病理生理学,而且还可以通过其在肠道微生物群中的转化间接影响疾病进程。让我们一起来了解下其中的具体机制。
饮食在炎症性肠病发病机制和预防中的作用
Jadhav A,et al.Annu Rev Nutr.2023
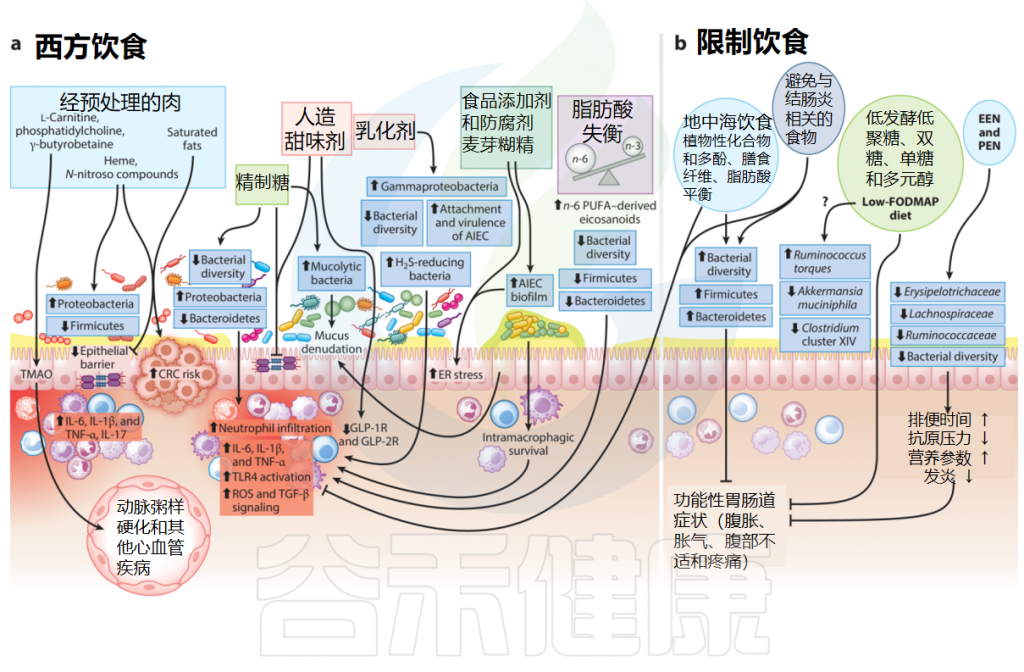
膳食中的大量营养素、微量营养素、添加剂和热量含量之间相互作用复杂;宿主免疫、遗传学和肠道微生物组可能是炎症性肠病(IBD)风险和临床病程的重要决定因素。
▸ 红肉饮食可能加剧炎症性肠病风险

最近一项由125445名参与者组成的大型前瞻性队列研究发现,西方饮食(包括红肉、家禽和加工肉类等动物蛋白)与溃疡性结肠炎发展可能性增加之间存在关联。
此外,红肉加剧炎症性肠病的影响在其他研究中也得到了证实。欧洲癌症和营养前瞻性调查队列表明,红肉摄入增加了亚油酸摄入量,从而使溃疡性结肠炎风险增加超过一倍。
同时,一项法国大型前瞻性问卷研究也支持这一观点。值得注意的是,加工红肉的摄入,与克罗恩病患者死亡率的显著增加有关。
▸ 红肉中的左旋肉碱等物质经微生物转化为氧化三甲胺与炎症呈正相关
红肉主要由蛋白质、脂肪和血红素组成,这些成分水平的增加会改变肠道微生物群的组成,进而对上皮细胞更新和肠道屏障完整性产生负面影响,并加剧肠道炎症。
值得注意的是,红肉中富含左旋肉碱、磷脂酰胆碱和γ-丁甜菜碱,这些物质通过肠道微生物代谢转化为三甲胺。三甲胺在宿主肝脏中通过含黄素单加氧酶形成氧化三甲胺(TMAO)。动物研究和人类流行病学研究表明,TMAO与炎症、心血管疾病、结直肠癌和死亡率之间有很强的正相关关系。
与传统的饮食习惯不同,西方饮食富含简单的精制碳水化合物、饱和脂肪以及超加工食品,而新鲜水果和蔬菜、豆类、全谷物和膳食纤维的含量较低。
超加工食品是在已经加工过的食品基础上再加工的食品,这类食品通常是高糖、高脂、高热量的食品。可涵盖多种食物,包括肉类、淀粉类零食、乳制品、豆类、水果和蔬菜。
研究报告了西方饮食对人类健康的不利影响,并将其与肥胖、糖尿病、炎症性肠病、慢性肾病和其他与生活方式相关的疾病联系起来。食品的(超)加工旨在提高其保质期、适口性以及储存和分销的便利性,其中涉及掺入许多非天然成分和添加剂,例如人造香料、稳定剂、防腐剂和乳化剂。
▸ 超加工食品的摄入量较高与炎症性肠病风险增加相关

最近一项针对来自7个地理区域 21个低收入、中等收入和高收入国家的大型前瞻性队列(116,087名成年人)的研究发现,超加工食品的摄入量较高与炎症性肠病风险呈正相关;然而,未加工的白肉、红肉、乳制品、淀粉、水果和蔬菜的摄入与炎症性肠病的发病率无关。
研究发现,炎症性肠病(IBD)风险与非酒精含糖饮料的消费存在正相关关系。
▸ 含糖饮料摄入过多增加炎症性肠病风险

最近的两项荟萃分析整合了关于饮料摄入量与IBD风险的观察性研究,表明高摄入量的含糖饮料与IBD风险增加相关。实验显示,高膳食糖摄入与炎症诱导和肠道微生态失调有关。一项基于问卷的研究比较了IBD患者与健康人群的饮食模式,发现IBD患者的含糖饮料消费量更高。
阿斯巴甜、糖精、安赛蜜和三氯蔗糖等人造甜味剂因其在不增加额外热量的情况下赋予食物甜味而广泛流行。然而,动物研究和健康人类试验报告称,这些非营养性甜味剂降低了肠道微生物多样性,使肠道炎症永久化,通过增加变形菌门(Proteobacteria)成员和减少有益微生物(如瘤胃菌科、毛螺菌科和梭状芽孢杆菌群XIVa)的比例来改变肠道微生物群,并损害肠道屏障的完整性。
▸ 麦芽糊精会加剧肠道炎症
麦芽糊精(E1400)是一种重要的食品添加剂,可用作加工食品的增稠剂,在小鼠结肠炎模型中,它通过诱导内质网应激和改变粘液层,以剂量依赖性方式加剧肠道炎症。小鼠模型中的报告还表明,麦芽糊精通过调节细菌基因表达,促进克罗恩病相关的粘附侵袭性大肠杆菌形成生物膜。
▸ 防腐剂会降低肠道微生物多样性
加工食品中的防腐剂会加剧有害影响。苯甲酸钠(E211)、亚硝酸钠(E250)和山梨酸钾(E202)这三种最常用的防腐剂会降低肠道微生物多样性,在人类肠道微生物群相关的小鼠模型中,变形菌门增加,梭状芽胞杆菌的减少。
注:尽管人类和动物研究已经提供了关于这些非营养性膳食添加剂对肠道菌群失调和肠道健康的负面影响的机制见解,但仍缺乏评估这些甜味剂对炎症性肠病人群影响的人体随机对照试验。
▸ 乳化剂过量食用会导致肠道微生物失调并促进慢性炎症
类似地,合成乳化剂,如聚山梨酯80和羧甲基纤维素,被用作增强质地和延长保质期的添加剂。在动物研究中,这些乳化剂被广泛认为会导致肠道微生态失调并促进慢性炎症。

▸ 摄入过多的脂肪增加炎症性肠病风险
进行的一项大型前瞻性流行病学研究,基于超过200,000名参与者的食物频率调查问卷,显示ω-6多不饱和脂肪酸的摄入量与溃疡性结肠炎(UC)风险增加之间存在显著关联。
高摄入总脂肪、ω-6多不饱和脂肪酸和肉类会增加患溃疡性结肠炎的风险;高摄入饱和脂肪、ω-6多不饱和脂肪酸和肉类也会增加患克罗恩病的风险。
▸ ω-6脂肪酸在炎症性肠病中具有促炎性
虽然主要的膳食ω-3不饱和脂肪酸,即二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),及其下游类二十烷酸具有抗炎特性,但ω-6多不饱和脂肪酸,如花生四烯酸(AA)及白三烯、羟基二十碳四烯酸、脂氧素和环氧二十碳三烯酸等在炎症性肠病中表现出强烈的促炎活性。
这些介质增强中性粒细胞的趋化性;增强血管通透性;以及炎症细胞因子的产生,例如肿瘤坏死因子(TNF-α)、白细胞介素(IL)-1β、IL-6和IL-8。有趣的是,这些脂肪酸介质的代谢在炎症粘膜中发生了改变,ω-6 花生四烯酸水平较高,ω-3 EPA水平较低,这表明脂肪酸代谢与炎症性肠病之间存在关联。
▸ ω-6促进肠道炎症与肠道微生物失调相关
最近的动物研究和人体试验已经将饮食中的ω-6多不饱和脂肪酸与肠道微生物微生态失调联系起来。γ-亚麻酸水平越高,2型糖尿病的发病率越高;肠道微生物多样性降低;有益微生物如普雷沃菌属(Prevotella)、Odoribacter、粪杆菌属、Paraprevotella、经黏液真杆菌属(Blautia)和丁酸弧菌属,以及梭菌目、Rikenellaceae和Coriobacteriaceae的成员减少。
在断奶阶段补充ω-6高脂肪饮食的小鼠显示,成年期结肠炎症和增生性病变的数量增加,厚壁菌门、梭状芽孢杆菌和毛螺菌属成员显著减少。在衰老小鼠模型中,补充ω-6也有类似效果,高ω-6脂肪饮食减少了厚壁菌门和拟杆菌门的有益成员,并导致肠道炎症。而补充鱼油可以逆转观察到的肠道微生态失调。
饮食成分在肠易激综合征和炎症性肠病等胃肠道疾病的病理生理学中发挥作用,使得通过饮食调节成为一种无创、更日常便利的治疗方法。
然而,目前的饮食策略缺乏特异性,在具有不同病理生理学的胃肠道疾病(如肠易激综合征和炎症性肠病)中也采用类似的方法。最常见的策略是限制、改变或补充营养。
▸ 可发酵碳水化合物不利于肠易激综合征患者的健康
治疗肠易激综合征(IBS)最常见的饮食干预之一是减少FODMAP食物(通常是吸收不良的“可发酵”碳水化合物,包括果糖、乳糖、多元醇、果聚糖和低聚半乳糖)摄入12周,然后缓慢恢复上述食物组。
这类营养素被认为是疾病病理生理学的重要驱动因素。基于这样的观点:FODMAP会增加渗透负荷并产生更高水平的氢,从而导致管腔扩张。这些碳水化合物还会会被结肠中的细菌发酵,并引起肠易激综合征特有的腹胀、胀气和腹痛等症状。
▸ 低FODMAP饮食改善肠易激综合征患者症状

对澳大利亚肠易激综合征患者进行的一项关键研究显示,与西方饮食相比,低FODMAP饮食可显著改善症状。最近的一项荟萃分析纳入了397名患者的七项随机对照研究,结果显示,与对照干预相比,低FODMAP饮食可减轻整体症状。
然而,这项荟萃分析中的三项随机对照试验比较了低FODMAP饮食和严格的对照饮食,这些试验之间的异质性较小,且效应量有限。因此,虽然低FODMAP饮食能够使肠易激综合征患者受益,但数据的整体质量较低。
这一发现表明,几种不同的饮食干预措施都可以改善IBS症状,找到它们之间的共同点将会很有帮助。
▸ 低FODMAP饮食的效果会因肠道微生物组成不同而存在差异
有趣的是,一项针对健康受试者的研究发现,低FODMAP饮食并没有减少结肠体积,这表明症状改善背后可能存在其他机制。低FODMAP饮食的效应是与肠道菌群存在重要联系。
荟萃分析还发现无麸质饮食对肠易激综合征患者无显著益处。如上所述,这种影响可能取决于宿主基因型或其他宿主/环境因素。麸质主要存在于小麦、大麦和黑麦中,它们是高FODMAP饮食的一部分;因此,在部分患者中观察到的改善也可能是限制FODMAP的结果,而不仅仅是麸质的结果。
最近的一项综述显示,炎症性肠病患者中非腹腔麸质敏感性患病率很高;但几乎没有证据支持这些患者采用无麸质饮食。临床前研究发现无麸质饮食可以改善炎症和通透性,但缺乏针对人类受试者的高质量前瞻性研究。关于麸质微生物降解对炎症性肠病和乳糜泻都具有重要意义,是未来研究的重要领域。
地中海饮食(MD)富含水果、蔬菜、面包、谷物、豆类、坚果和初榨橄榄油,以及适量的乳制品、鱼和肉。地中海饮食被认为是一种平衡且健康的长期饮食选择。
地中海饮食和低FODMAP饮食的效果


Jadhav A,et al.Annu Rev Nutr.2023
▸ 地中海饮食的炎症性肠病患者症状减轻
最近的一项前瞻性、随机研究纳入了100名患有轻度至中度疾病的青少年炎症性肠病患者,比较了地中海饮食与常规饮食的疗效,结果显示,小儿克罗恩病活动指数和小儿溃疡性结肠炎活动指数的临床评分显著下降。以及较低水平的炎症标志物,例如血清C反应蛋白、钙卫蛋白、TNF-α、IL-17、IL-12和IL-13。
临床试验,也观察到地中海饮食对炎症性肠病的有益作用。这项研究涉及142名炎症性肠病患者(84名 溃疡性结肠炎和58名克罗恩病)。接受地中海饮食治疗6个月,显著改善了体重指数和腰围,并导致肝脏脂肪变性和营养不良相关参数显著减少。其中40%的轻度至中度克罗恩病患者在接受6-12周的地中海饮食治疗后病情得到缓解。
▸ 地中海饮食与健康有益的微生物特征相关
地中海饮食与有益的肠道微生物特征相关,特别是与膳食纤维代谢物的富集有关,例如普拉梭菌、解纤维素拟杆菌和普雷沃氏菌,以及参与植物多糖降解和短链脂肪酸和次级胆汁酸生产的其他微生物。
地中海饮食富含ω-3不饱和脂肪酸,使得ω-3和ω-6脂肪酸达到平衡。在前瞻性溃疡性结肠炎队列中证明了EPA和其他不饱和脂肪酸的积极作用,其中肠道炎症细胞因子水平与PUFA、EPA和二十二碳五烯酸呈负相关。
▸ ω-3 不饱和脂肪酸有助于对抗肠道相关炎症
涉及ω-3脂肪酸代谢的三个关键基因(CYP4F3、FADS1和FADS2)的单核苷酸多态性与克罗恩病风险增加相关,这显示了炎症性肠病饮食相关调节的额外遗传因素。
ω-3 不饱和脂肪酸可能通过下游脂质介质(例如消解素、保护素和噬消素(maresins))发挥抗炎作用,这些介质可以对抗IBD相关炎症。从机制上讲,ω-3 不饱和脂肪酸已被发现:
(a)降低中性粒细胞和单核细胞对各种化学引诱剂的趋化性;
(b)通过阻断丝裂原激活蛋白激酶释放核因子κB来抑制TLR4表达和NOD2信号传导;
(c)抑制NLRP3炎性体激活并随后阻碍促炎细胞因子的释放;
(d)增加产生丁酸盐的细菌属如双歧杆菌属、罗氏菌属和乳杆菌属以及毛螺菌科成员的丰度。
▸ 地中海饮食通过微生物产生的短链脂肪酸也有助于减轻肠道炎症
由于可发酵碳水化合物含量较高,地中海饮食可导致肠道微生物群产生更多的短链脂肪酸。此外还发现,地中海饮食可改善坚持饮食的肠易激综合征患者的腹胀和腹痛。
膳食纤维、益生元和合生元等营养物质具有促进细菌群落生长的作用,对健康有益,并被证明可以改善宿主肠道炎症。
益生元和合生元在IBS和IBD中的作用




Jadhav A,et al.Annu Rev Nutr.2023
▸ 可溶性膳食纤维有助于改善肠道炎症
对14项随机对照研究(包括906名肠易激综合征患者)进行的荟萃分析发现,可溶性膳食纤维可显著改善症状,但麸皮则不然。
注:但这些研究大多数都使用纤维补充剂;他们中很少有人改变饮食以增加纤维摄入量。尽管有几项研究调查了益生元和合生元,但没有足够的数据来提出建议。
炎症性肠病的临床前模型发现,高纤维(主要是车前草)、低蛋白饮食可增强肠道屏障功能并减少炎症。因此,可溶性纤维似乎对肠易激综合征患者和炎症性肠病患者都有益。
最近的一项荟萃分析还发现,膳食纤维摄入量与克罗恩病风险之间存在线性剂量依赖性关系,每天每增加10克纤维摄入量,克罗恩病风险就会降低 13%。
▸ 补充益生元可以降低疾病活动性
一项针对肠易激综合征患者的随机、平行、双盲研究比较了地中海饮食和益生元补充剂(β-低聚半乳糖)与低FODMAP饮食和安慰剂木糖补充剂的效果,发现肠易激综合征患者的症状有所改善,但补充益生元后肠道微生物群分布更有利。这一发现突显了饮食调整和补充作为胃肠道疾病管理中限制性饮食习惯的替代方案的潜力。
基于食物和补充剂的纤维和益生元干预研究报告指出,富含纤维的半素食、车前子种子、燕麦麸和发芽大麦食品在缓解和显著改善胃肠道症状(如腹痛和反流)方面取得了令人振奋的成果。
在接受低聚果糖(每天15克,持续3-4周)、富含低聚果糖的菊粉(每天两次,每次10克,持续4周)、全麦麸(每天0.5杯,持续4周)、菊粉型果聚糖(每天7.5克,持续9周)和发芽大麦食品补充的活动性疾病队列中也报告了类似的结果,特别是显著降低了疾病活性并提高了生活质量。
▸ 纤维和益生元的益处会因个体健康状况和肠道菌群组成而不同
一项评估纤维摄入量对肠道微生物组组成影响分析表明,与安慰剂/低纤维饮食相比,高膳食纤维摄入与双歧杆菌属和乳杆菌属的丰度显著增加以及粪便丁酸盐含量增加相关。
不过这些研究主要针对成年炎症性肠病患者进行,对儿童的益处尚不清楚。膳食纤维被广泛用于包括一系列复合碳水化合物(包括益生元)。但如上所述,膳食纤维的效果可能会因碳水化合物结构、健康状况和肠道微生物群组成而异。
一些研究表明合生元对成年溃疡性结肠炎患者有益。与安慰剂组相比,补充长双歧杆菌和富含低聚果糖的菊粉4周可改善症状,并降低炎性细胞因子(TNF-α和IL-1β)的表达。
在一项随机对照试验中报告了类似的结果,该试验涉及补充8周由屎肠球菌、植物乳杆菌、嗜酸乳杆菌、嗜热链球菌、乳双歧杆菌、长双歧杆菌和低聚果糖组成的合生元混合物。
纯肠内营养(EEN)已被接受为儿科克罗恩病患者的一线饮食干预措施。特指经消化道途径(包括口服和管饲)提供营养物质的一种营养支持治疗方式,包含所有必需的常量营养素和微量营养素。
▸ 纯肠内营养有助于减轻克罗恩病患者症状
许多研究表明,纯肠内营养(EEN)在诱导轻度至中度克罗恩病儿科患者缓解方面的效果与皮质类固醇相当。例如,在澳大利亚和西班牙的独立试验中,补充EEN8周分别使84%和80%的受试者达到临床缓解。
EEN对患有克罗恩病的围手术期成年患者也有效。两项前瞻性队列研究的荟萃分析显示,术前接受EEN的患者(22%)与未接受EEN的患者相比,术后并发症显著减少。尽管有限,但其他研究已经描述了EEN在治疗穿透性克罗恩病、狭窄性克罗恩病和肠外克罗恩病方面的益处。
▸ 纯肠内营养增强肠道微生物群的抗炎作用
从机制上讲,EEN可能通过改变肠道菌群的组成和功能发挥作用。尽管它反而降低了肠道微生物多样性和通常被认为有益的菌群的丰富度(粪杆菌属、瘤胃球菌属和双歧杆菌属以及丹毒丝科、毛螺菌科的其他成员),但它根据代谢物的变化增强了肠道菌群的功能。
由于EEN的组成简单,降低抗原压力和肠道休息也可能是其重要的作用机制。此外,EEN配方中的活性成分可以改善营养参数,并可能对肠上皮产生抗炎作用。
在成人中,EEN作为二线或三线治疗使用,而皮质类固醇则是主要的诱导治疗,因为这些药物比EEN更有效地诱导临床缓解。
▸ 排除饮食减少肠道微生物的有害变化有助于病情缓解
部分肠内营养(PEN),即补充患者一半的热量需求作为肠内营养和全食物饮食,有助于克罗恩病患者维持病情缓解。
一项儿科克罗恩病队列研究中,无限制的PEN与元素配方结合效果有限;因此,研究人员认为需要一种针对克罗恩病和溃疡性结肠炎的排除饮食,排除某些有害食物。
克罗恩病排除饮食(CDED)与PEN相结合,是一种全食物饮食制度,旨在减少与肠道微生物群有害变化(如变形杆菌的扩张)、屏障完整性受损和胃肠道炎症相关的饮食成分和食物的暴露。
CDED不包含加工食品,并含有有益的纤维,再加上液体配方奶粉,以满足患者的能量需求。一项前瞻性研究报告称,与EEN相比,CDED加PEN在CD队列中具有更好的耐受性和更有效的效果,并且75%的CDED加PEN患者获得了无类固醇的临床缓解。
饮食衍生的代谢物因宿主健康状况和肠道微生物群中不同代谢途径而异,这反过来影响了饮食的生物学效应。因此,同一种食物可能对不同人群的生理功能具有不同的作用,可以影响多种疾病的病理生理,这也解释了相同饮食干预对不同疾病有益。
我们仍处于研究饮食-宿主-肠道菌群相互作用产生的生物活性分子如何影响慢性胃肠道疾病的病理生理和治疗反应的早期阶段。一个重要的考虑因素是,在评估饮食干预的反应时观察到的显著个体间差异。这种差异可能源于饮食中生物可利用营养素的差异(由于成分和加工方式(如烹饪)的差异)、影响宿主代谢途径或免疫状态的基因多态性,以及肠道菌群代谢能力的差异。此外,其他环境和宿主因素也可能影响反应。我们需要考虑所有这些因素,以便能够为患者提供个性化的饮食建议。
编辑
Jadhav A,et al.Annu Rev Nutr.2023
总而言之,饮食与个性化微生物群在胃肠道疾病中的相互作用是一个复杂且充满潜力的研究领域。理解这种相互作用不仅有助于揭示疾病的发病机制,还为个性化医疗和精准营养提供了新的视角和方法。随着科学技术的不断进步,我们有理由相信,通过优化饮食和微生物群的相互作用,可以实现对胃肠道疾病更加有效的预防和治疗。
在应用方面,谷禾专注于高通量检测技术和人工智能的结合,通过精确、便捷、无创的检测方式,以肠道菌群为核心,结合蛋白质及代谢物检测的多组学检测,开发多模态表征和大模型框架。肠菌检测作为一种基于实证的工具,它不仅可以评估个人肠道菌群及营养状况,还可以从整个个性化营养生态的视角出发,多场景、全方位地为疾病预防和健康管理解决方案提供帮助。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Jadhav A, Bajaj A, Xiao Y, Markandey M, Ahuja V, Kashyap PC. Role of Diet-Microbiome Interaction in Gastrointestinal Disorders and Strategies to Modulate Them with Microbiome-Targeted Therapies. Annu Rev Nutr. 2023 Aug 21;43:355-383.
Armstrong HK, Bording-Jorgensen M, Santer DM, Zhang Z, Valcheva R, Rieger AM, Sung-Ho Kim J, Dijk SI, Mahmood R, Ogungbola O, Jovel J, Moreau F, Gorman H, Dickner R, Jerasi J, Mander IK, Lafleur D, Cheng C, Petrova A, Jeanson TL, Mason A, Sergi CM, Levine A, Chadee K, Armstrong D, Rauscher S, Bernstein CN, Carroll MW, Huynh HQ, Walter J, Madsen KL, Dieleman LA, Wine E. Unfermented β-fructan Fibers Fuel Inflammation in Select Inflammatory Bowel Disease Patients. Gastroenterology. 2023 Feb;164(2):228-240.
Dong C, Chan SSM, Jantchou P, Racine A, Oldenburg B, Weiderpass E, Heath AK, Tong TYN, Tjønneland A, Kyrø C, Bueno de Mesquita B, Kaaks R, Katzke VA, Bergman MM, Boeing H, Palli D, Masala G, Tumino R, Sacerdote C, Colorado-Yohar SM, Sánchez MJ, Grip O, Lindgren S, Luben R, Huybrechts I, Gunter MJ, Mahamat-Saleh Y, Boutron-Ruault MC, Carbonnel F. Meat Intake Is Associated with a Higher Risk of Ulcerative Colitis in a Large European Prospective Cohort Studyø. J Crohns Colitis. 2022 Aug 30;16(8):1187-1196.
Narula N, Wong ECL, Dehghan M, Mente A, Rangarajan S, Lanas F, Lopez-Jaramillo P, Rohatgi P, Lakshmi PVM, Varma RP, Orlandini A, Avezum A, Wielgosz A, Poirier P, Almadi MA, Altuntas Y, Ng KK, Chifamba J, Yeates K, Puoane T, Khatib R, Yusuf R, Boström KB, Zatonska K, Iqbal R, Weida L, Yibing Z, Sidong L, Dans A, Yusufali A, Mohammadifard N, Marshall JK, Moayyedi P, Reinisch W, Yusuf S. Association of ultra-processed food intake with risk of inflammatory bowel disease: prospective cohort study. BMJ. 2021 Jul 14;374:n1554.
Khademi Z, Milajerdi A, Larijani B, Esmaillzadeh A. Dietary Intake of Total Carbohydrates, Sugar and Sugar-Sweetened Beverages, and Risk of Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis of Prospective Cohort Studies. Front Nutr. 2021 Oct 1;8:707795.
IBD in EPIC Study Investigators; Tjonneland A, Overvad K, Bergmann MM, Nagel G, Linseisen J, Hallmans G, Palmqvist R, Sjodin H, Hagglund G, Berglund G, Lindgren S, Grip O, Palli D, Day NE, Khaw KT, Bingham S, Riboli E, Kennedy H, Hart A. Linoleic acid, a dietary n-6 polyunsaturated fatty acid, and the aetiology of ulcerative colitis: a nested case-control study within a European prospective cohort study. Gut. 2009 Dec;58(12):1606-11.
Dionne J, Ford AC, Yuan Y, Chey WD, Lacy BE, Saito YA, Quigley EMM, Moayyedi P. A Systematic Review and Meta-Analysis Evaluating the Efficacy of a Gluten-Free Diet and a Low FODMAPs Diet in Treating Symptoms of Irritable Bowel Syndrome. Am J Gastroenterol. 2018 Sep;113(9):1290-1300.

谷禾健康

氨基酸(Amino Acid, 简称AA ) 是蛋白质合成的基石。它们是正常细胞生长、分化和功能所必需的细胞结构元素和能量来源。
蛋白质是长链氨基酸。人的身体有数千种不同的蛋白质,每种蛋白质都有重要的作用。每种蛋白质都有自己的氨基酸序列。该序列使蛋白质呈现不同的形状并在体内具有不同的功能。
可以将氨基酸视为字母表中的字母。当你以不同的方式组合字母时,会组成不同的单词。氨基酸也是如此——当以不同的方式组合它们时,就会产生不同的蛋白质。
氨基酸代谢紊乱与许多病理状况有关,包括代谢疾病、心血管疾病、免疫疾病和癌症。就肿瘤而言,氨基酸代谢的改变不仅可以用作癌症进展的临床指标,还可以用作治疗策略。
由于肿瘤的生长发育依赖于外来氨基酸的摄入,因此越来越多的研究针对肿瘤相关氨基酸的代谢来选择性杀伤肿瘤细胞。此外,免疫相关研究证实,氨基酸代谢调节效应T细胞和调节性T细胞的功能,影响免疫细胞的功能。因此,确定氨基酸代谢途径中的靶点可能有助于疾病的治疗。
近日,浙江大学医学院附属第一医院,国家卫健委多器官联合移植重点实验室,中国医学科学院器官移植诊治重点实验室,以及器官移植重点实验室联合发表在《Signal Transduct Target Ther》综述成果详细阐述和讨论氨基酸代谢相关的代谢性疾病、心血管疾病和免疫相关疾病的研究及临床研究进展。
本文就该篇文章为主要参考,分享围绕肿瘤相关疾病中的氨基酸代谢研究,结合讨论肠道微生物群在蛋白质和氨基酸代谢中的作用,以期为靶向氨基酸代谢管理治疗提供理论依据。
官方氨基酸定义包括任何同时含有羧基和氨基的有机化合物(如下图)。它们都具有共同的结构特征氨基 (-NH3+)、羧酸根 (-COO–) 基团和与同一碳原子键合的氢键。
氨基酸有多少种?
氨基酸一共有20种,每种氨基酸在体内都发挥着非常特殊的作用,并通过其各自的氨基酸侧链来区分。从细菌到人类,都是由同一组 20 种氨基酸构成。
每个氨基酸都有 4 个不同的基团连接到 α-碳。它们的不同之处在于称为 R 基团的侧链。如下氨基酸的R基团不同:
来源:byjus
氨基酸还可以根据其结构和侧链分为其他组,
包括:
根据每种氨基酸中“R”基团的性质,氨基酸可以分为四个大类。
氨基酸可以是极性的、非极性的、带正电的或带负电的。
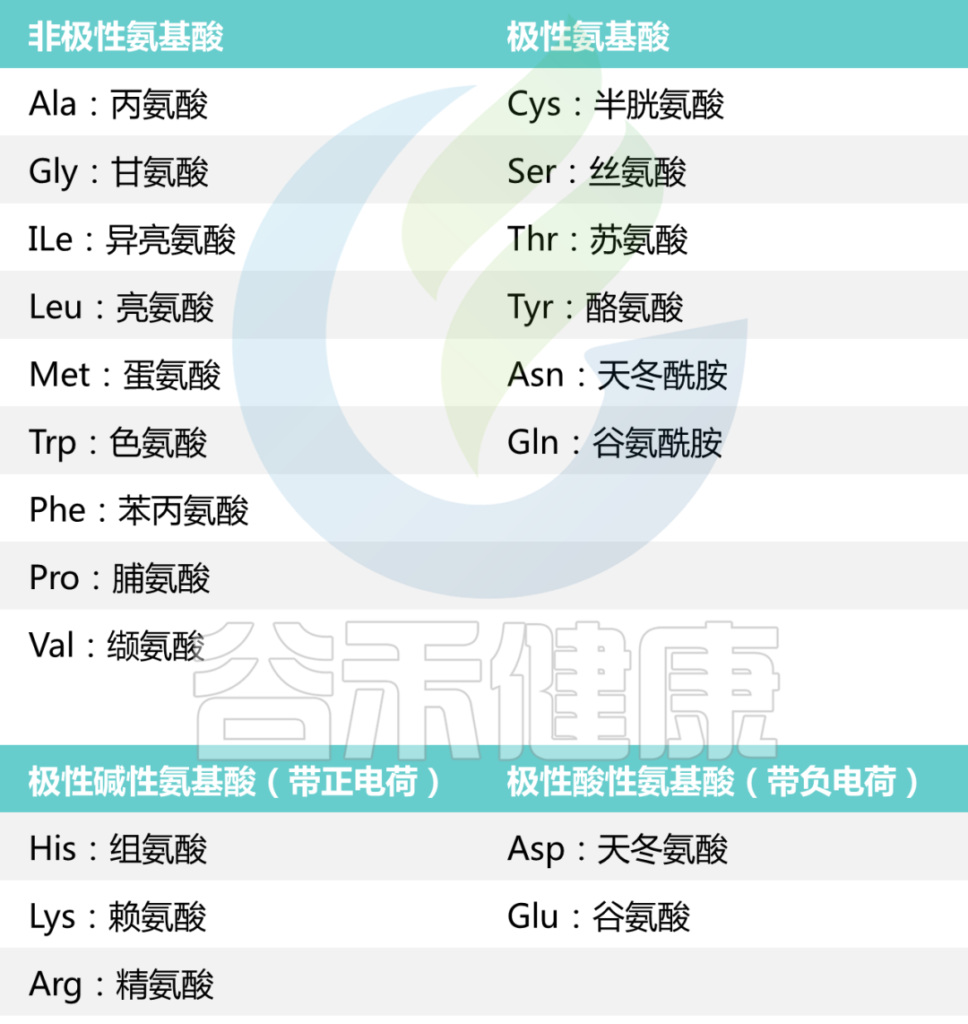
氨基酸是作为蛋白质构建块的基本分子。蛋白质由一条或多条氨基酸链(称为多肽)组成,其序列由基因编码。
图源:National Human Genome Research Institute
这些氨基酸参与几乎所有生物过程并有助于:
伤口愈合、激素产生、免疫功能、肌肉生长、能源生产等。
身体需要所有氨基酸才能发挥作用并茁壮成长。有些可以在体内产生,而另一些则需要从食物中获取。
氨基酸有着有趣而悠久的历史。天冬酰胺是第一个被发现的氨基酸,由法国化学家 Louis Nicolas Vauquelin 和 Pierre Jean Robiquet 于 1806 年从芦笋营养中分离出来。
身体所需的 20 种氨基酸可进一步分为两个不同的类别:必需氨基酸和非必需氨基酸。
人体无法合成必需氨基酸,这意味着必须从食物中获取它们才能满足需求。
必需氨基酸有多少种?
必须通过饮食获得九种必需氨基酸,包括:
赖 氨 酸
赖氨酸是生长和组织修复以及多种激素、蛋白质和酶的产生所必需的。赖氨酸对于促进抗体、激素和酶的形成以及骨骼中钙的形成和固定是必需的。
亮 氨 酸
这种必需氨基酸参与蛋白质合成、伤口愈合、血糖控制、生长激素和新陈代谢。
异 亮 氨 酸
研究表明异亮氨酸有助于解毒、免疫功能和激素排泄。此外,在血红蛋白的形成、刺激胰腺合成胰岛素以及将氧气从肺部输送到各个部位方面起着至关重要的作用。
色 氨 酸
色氨酸是最著名的氨基酸之一,也是功能性氨基酸,参与维生素 B3 和血清素激素的产生。血清素是调节情绪、疼痛、食欲和睡眠的神经递质。
苯 丙 氨 酸
这种氨基酸有助于产生其他氨基酸以及多巴胺和去甲肾上腺素等神经递质,有助于维持健康的神经系统和增强记忆力。
苏 氨 酸
研究表明苏氨酸是胶原蛋白和弹性蛋白等结缔组织的基础,这些蛋白质为皮肤和结缔组织提供结构。它们还有助于形成血凝块,从而有助于防止出血。苏氨酸在脂肪代谢和免疫功能中也发挥着重要作用。
缬 氨 酸
缬氨酸支持大脑功能、肌肉协调和平静。缬氨酸参与肌肉生长、组织再生和产生能量。
组 氨 酸
这种氨基酸维持人体内髓鞘的健康,保护神经细胞免受损伤。参与许多酶促过程以及红细胞和白细胞的合成。组氨酸有助于制造一种称为组胺的大脑化学物质(神经递质)。组胺在身体的免疫功能、消化、睡眠和性功能中发挥着重要作用。
蛋 氨 酸
研究表明蛋氨酸可以保持皮肤弹性,并有助于强化头发和指甲。还用于治疗肾结石、保持皮肤健康,还用于控制病原菌的入侵。蛋氨酸有助于身体的组织生长、新陈代谢和解毒。蛋氨酸还有助于吸收必需矿物质,包括锌和硒。
在饮食中摄入多种氨基酸对于维持整体健康至关重要。任何这些关键必需氨基酸的缺乏都会导致严重的副作用,影响健康的几乎各个方面,包括免疫功能、肌肉质量、食欲等。
相比之下,非必需氨基酸可以由身体产生,这意味着通过吃的食物获取它们并不那么重要。
非必需氨基酸列表中共有 11 种氨基酸,包括:
精 氨 酸
精氨酸可刺激免疫功能、抗疲劳并优化心脏健康。一水肌酸在肝脏、胰腺和肾脏中形成,主要是在精氨酸、甘氨酸和蛋氨酸的帮助下形成的。有助于促进蛋白质和激素的合成、肾脏解毒、愈合伤口和维持健康的免疫系统。
丙 氨 酸
研究表明丙氨酸有助于新陈代谢,为肌肉、大脑和中枢神经系统提供能量。此外可以帮助清除体内毒素并参与葡萄糖和其他氨基酸的生产。
半 胱 氨 酸
半胱氨酸是头发、皮肤和指甲中发现的主要蛋白质类型,作为一种抗氧化剂,对于胶原蛋白的产生和皮肤健康至关重要。
谷 氨 酸
这种非必需氨基酸在中枢神经系统中充当神经递质,主要参与人脑的发育和功能。
天 冬 氨 酸
天冬氨酸有助于产生其他几种氨基酸,包括天冬酰胺、精氨酸和赖氨酸。主要参与将氮输送到身体细胞中、形成嘌呤和嘧啶以合成DNA、神经系统的发育和提高我们的身体耐力。
甘 氨 酸
甘氨酸有助于维持适当的细胞生长及其功能,并且在愈合伤口方面也起着至关重要的作用。此外,甘氨酸作为神经递质支持大脑健康。
脯 氨 酸
脯氨酸存在于胶原蛋白中,有助于促进关节健康、新陈代谢和皮肤弹性。主要参与胶原蛋白形成过程中的组织修复,防止动脉壁增厚和硬化(动脉硬化)以及新皮肤的再生。
丝 氨 酸
丝氨酸是脂肪代谢、免疫功能和肌肉生长所必需的。
酪 氨 酸
甲状腺激素-T3 和 T4 的产生以及合成一类神经递质和黑色素(我们的眼睛、头发和皮肤中发现的天然色素)方面发挥着至关重要的作用。
谷 氨 酰 胺
研究表明,谷氨酰胺支持许多代谢过程并为体内细胞提供能量。促进健康的大脑功能,是合成核酸(DNA 和 RNA)所必需的。
天 冬 酰 胺
天冬酰胺起到利尿剂的作用,可以优化大脑和神经细胞的功能。
氨基酸列表中的一些化合物也被认为是“有条件必需的”。这意味着它们通常不是身体所需要的,但在某些情况下可能变得必不可少,例如极端疾病或压力。
氨基酸缺乏的一些主要症状可能包括:
蛋白质缺乏症会影响任何饮食中氨基酸摄入不足的人。老年人和患有癌症等慢性病的人缺乏蛋白质的风险特别高,因为他们通常对蛋白质的需求增加而食物摄入量减少。
那些遵循纯素或素食饮食的人还应该仔细计划他们的饮食,以确保通过食用各种植物性蛋白质食物来满足他们的蛋白质需求。
富含氨基酸的食物包括植物性产品,如西兰花、豆类、甜菜根、南瓜、卷心菜、坚果、干果、奇亚籽、燕麦、豌豆、胡萝卜、黄瓜、绿叶蔬菜、洋葱、大豆、全谷物、花生豆类、扁豆等。
富含氨基酸的水果有苹果、香蕉、浆果、无花果、葡萄、甜瓜、橙子、木瓜、菠萝、石榴等。
其他动物产品包括乳制品、鸡蛋、海鲜、鸡肉、肉类、猪肉等。
从富含蛋白质的食物中摄入大量蛋白质不太可能引起任何负面影响。然而,有可能过量摄入蛋白质,尤其是蛋白质补充剂。
摄入过多蛋白质可能产生的一些副作用包括体重增加、肾脏问题、便秘和口臭,炎症以及肠道菌群的失调。
氨基酸是含有氨基和羧基的有机化合物,根据核心结构官能团的位置可分为α-、β-、γ-、δ-氨基酸,其中大部分参与蛋白质合成的是 α-氨基酸。
氨基酸参与生物合成、神经传递和其他生命过程。肽键连接氨基酸形成多肽链,多肽链经过翻译后修饰,有时与其他多肽链结合形成蛋白质。
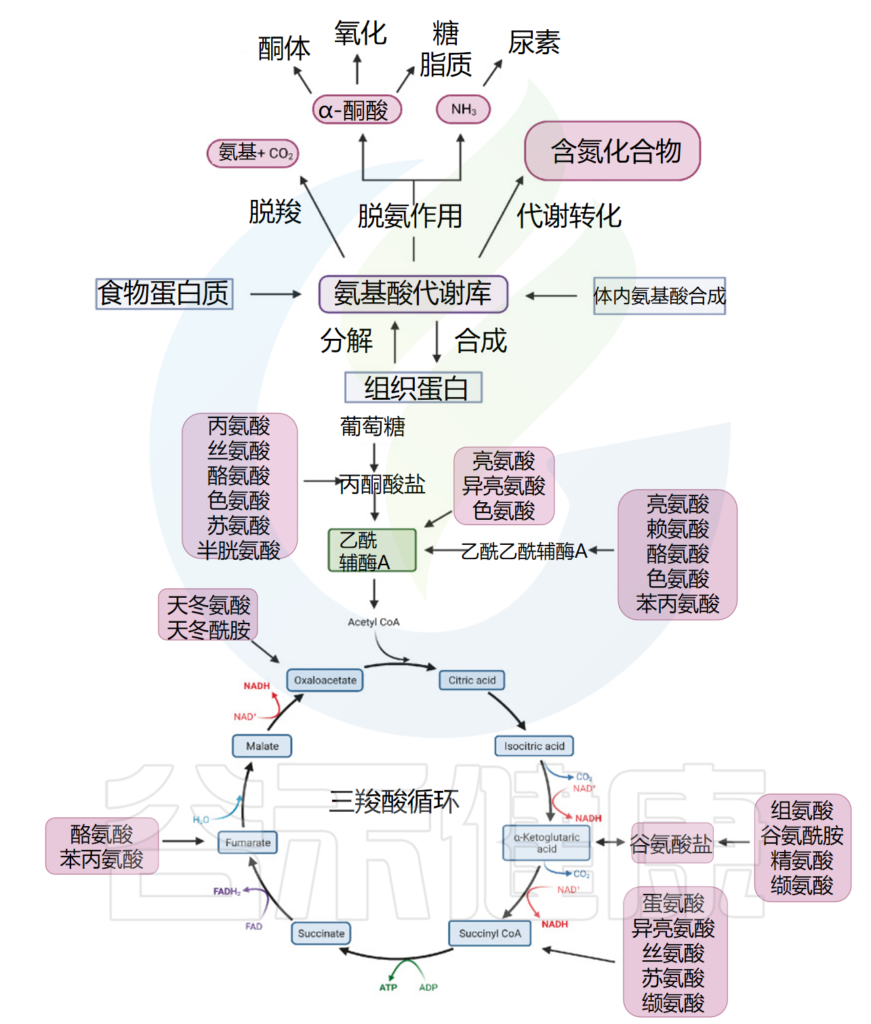
九种氨基酸不能由其他化合物合成,必须从食物中获取,这些氨基酸从食物中被人体摄入后,除了用于蛋白质等生物分子的合成外,还可以通过氧化途径氧化为尿素和二氧化碳作为能量来源。
氧化途径以转氨酶介导的脱氨作用开始,将氨基转移至α-酮戊二酸,形成谷氨酸进入尿素循环。另一种产物酮酸进入柠檬酸循环,为生命活动提供能量(下图)。该循环提供某些氨基酸的前体,以及还原剂NADH,用于许多其他反应。
doi: 10.1038/s41392-023-01569-3
人体可以通过食物消化吸收、组织分解、内部合成三种途径获得氨基酸。
氨基酸代谢库中的氨基酸可脱酸,产生氨基酸和二氧化碳,或在代谢产物的转化中参与嘌呤、嘧啶等含氮化合物的合成;或者脱氨基产生α-酮酸和NH3。
根据不同的酶和途径,α-酮酸可以产生酮体,或参与氧化供能或糖和脂质的合成;NH3进入尿素循环。
细胞或细胞器对氨基酸的摄取需要氨基酸转运蛋白(AAT)的参与。不同的氨基酸依赖于特定的AAT,但氨基酸和转运蛋白并不是一一匹配的。多个AAT可以转运一个氨基酸,同一个转运蛋白也可以转运多个底物。AAT 除了充当氨基酸进出细胞的通道外,还充当感测氨基酸水平的探针和营养信号的引发剂。
根据结构和功能的多样性,AAT可分为不同的家族,其中溶质载体(SLC)超家族约占人类基因组编码的所有膜蛋白的20%,是最大的膜转运蛋白超家族。
根据底物特异性,AAT可分为中性、碱性和酸性类别,以及进一步的子类别,包括钠依赖性和钠非依赖性类型。从机制上讲,由于哺乳动物细胞(包括人类)细胞内液中的氨基酸浓度通常高于细胞外液中的氨基酸浓度,因此 AAT 通过离子共轭或氨基酸交换转运氨基酸以产生钠离子。
氨基酸除了是肽和蛋白质的组成部分外,还参与维持细胞生长、代谢和免疫的关键途径。
例如,哺乳动物雷帕霉素靶蛋白 (mTOR) 信号通路是调节蛋白质合成的主要机制。mTOR 系统包含雷帕霉素敏感复合物 1 (mTORC1) 和雷帕霉素不敏感复合物 2 (mTORC2)。mTORC1 被谷氨酰胺 (Gln)、精氨酸 (Arg) 和亮氨酸 (Leu) 激活,并通过 eIF4E 结合蛋白 1 (4E-BP1) 和核糖体蛋白 S6 激酶 1 (S6K1) 的磷酸化激活蛋白质合成。
此外,丙氨酸(Ala)可以通过抑制丙氨酸激酶来调节糖异生和糖酵解,从而维持饥饿肝脏产生的葡萄糖量。
TIPs:
糖异生是指非糖物质(如某些氨基酸、乳酸、丙酮酸和甘油等)在人体的肝脏和肾脏等器官中某些酶的催化下转变成糖原或葡萄糖的过程。简单说来,就是非糖物质转化为糖的过程。
糖分解是生物体取得能量的主要方式。生物体中糖的氧化分解主要有3条途径:糖的无氧氧化、糖的有氧氧化和磷酸戊糖途径。其中,糖的无氧氧化又称糖酵解(glycolysis)。生物在无氧条件下,从糖的降解代谢中获得能量的途径,也是大多数生物进行葡萄糖有氧氧化的一个准备途径。
糖酵解/糖原异生的差异比较
在某种程度上,糖异生可能被认为是糖酵解的逆过程,因为糖酵解将葡萄糖分解成两个丙酮酸分子以获得能量并供给三羧酸循环,而糖异生将两个丙酮酸分子构建成一个葡萄糖分子。然而,仅仅把糖异生看作糖酵解是不太正确的,因为这两者之间有一些重要的区别。
糖酵解是一种古老的代谢途径,为所有形式的细胞生命所共有,并且可以由所有细胞进行以获得能量(每个葡萄糖净2个三磷酸腺苷)。
相比之下,糖异生更具特异性:在人类中,它主要在肝细胞中进行,在某种程度上也在肾上腺皮质中进行。它还有一个更具体的目标:当血糖水平较低时,产生葡萄糖分泌到血液中。
在免疫方面,氨基酸参与免疫细胞增殖、分化和功能激活。例如,T细胞激活会上调多种氨基酸转运蛋白,包括SLC7A5,而SLC7A5的缺失会导致mTOR信号通路的激活和转录因子MYC的上调,从而抑制T细胞增殖。
当T细胞缺乏色氨酸(Trp)和 精氨酸 (Arg)时,活化的T细胞无法进入S期,这证明Trp和Arg是T细胞进入细胞周期的关键物质。此外,亮氨酸(Leu) 和异亮氨酸 (ILe) 的消耗会诱导 T 细胞进入 S-G1 期,然后停止分裂并死亡。
综上所述,氨基酸是维持生命所必需的有机化合物,是生物合成的原料,也是生命活动的能量来源。
接下来,我们针对支链氨基酸、天冬氨酸、谷氨酰胺、精氨酸、蛋氨酸五种氨基酸的代谢展开详细讨论,包括它们在癌症或其他疾病中的作用,希望给大家呈现一个更全面的视角,为疾病的发生发展和临床治疗方向带来更多的启示。
★
支链氨基酸(BCAA)是一类具有一个分支的脂肪侧链氨基酸,包括亮氨酸、异亮氨酸和缬氨酸。三种支链氨基酸占人体必需氨基酸肌肉中必需氨基酸的35%。
所有物种中支链氨基酸的分解过程都是相似的,最初通过支链氨基酸转移酶(BCAT)形成支链α-酮酸(BCKA),并将氮转移到氮受体(最常见的氮受体是α-酮戊二酸) (α-KG) 形成谷氨酸)。
第二步是支链α-酮酸脱氢酶(BCKDH)催化的不可逆限速反应,该反应被特定激酶BCKDH激酶(BCKDK)磷酸化并失活,并被蛋白磷酸酶1K(PPM1K)去磷酸化和激活。然后产物通过进一步氧化参与不同的生理活动。
促进肝脏和其他组织中的蛋白质合成
支链氨基酸参与多种生理过程。在代谢和信号通路研究方面,支链氨基酸尤其是亮氨酸,是mTOR信号通路的有效激活剂。亮氨酸可以与 Sestrin2(mTORC1 活性的负调节因子)结合,促进 mTORC1 激活,从而促进肝脏和其他组织中的蛋白质合成。
促进肝脏和骨骼肌对糖原的吸收,淋巴细胞增殖
支链氨基酸还可以促进肝脏和骨骼肌对糖原的吸收,并增强糖原的合成。
支链氨基酸对于免疫系统中免疫细胞的正常功能至关重要,通过氧化分解免疫细胞表达的脱氢酶和脱羧酶,促进淋巴细胞增殖和细胞毒性 T 细胞活化。
癌症患者的支链氨基酸循环水平发生了变化。
胰腺导管腺癌
最近的代谢组学回顾性研究表明,血浆支链氨基酸水平升高与胰腺癌风险增加相关,这一点在胰腺导管腺癌 (PDAC) 基因工程小鼠模型中得到了验证。可能是由于系统性蛋白质分解以满足致瘤期生长所需的支链氨基酸所致。
非小细胞肺癌 v.s. 胰腺导管腺癌
一项研究表明KRAS突变可以促进支链氨基酸代谢。尽管非小细胞肺癌 (NSCLC) 和 胰腺导管腺癌 (PDAC) 中存在 KRAS 激活和 P53 缺失,这两种肿瘤尽管初始事件相同,但对支链氨基酸的利用却不同。胰腺导管腺癌细胞倾向于分解并利用细胞外蛋白质获取氨基酸,而非小细胞肺癌细胞则通过分解循环支链氨基酸来提取氮。
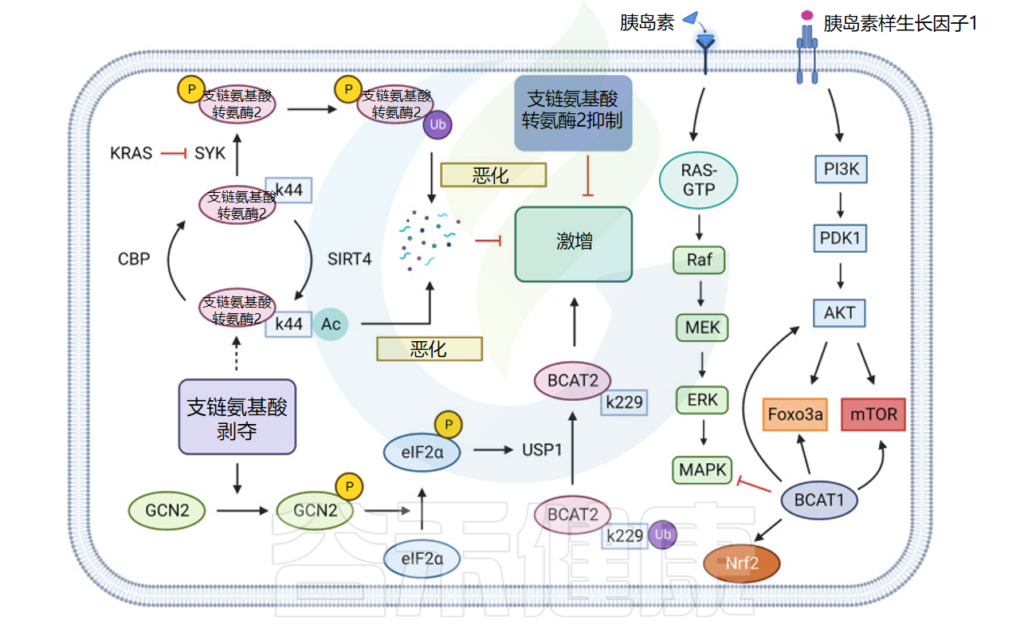
为什么胰腺导管腺癌的支链氨基酸代谢低于周围正常组织?
胰腺导管腺癌细胞中的CBP和SIRT4结合BCAT2的K44位点,使该位点乙酰化,从而进一步促进BCAT2通过泛素蛋白途径降解,降低代谢胰腺导管腺癌中支链氨基酸的比例,进而抑制肿瘤细胞的生长。
注:CBP——cAMP反应元件结合(CREB)结合蛋白
KRAS和USP1也可以通过泛素-蛋白酶途径调控PDAC中BCAT2的表达:KRAS通过抑制脾酪氨酸激酶(SYK)和E3泛素化连接酶TRIM21对BCAT2的泛素化来稳定PDAC中BCAT2的表达;而USP1则通过去泛素化BCAT2的K229位点,并通过GCN2-eIF2a途径促进USP1蛋白的翻译水平,促进支链氨基酸表达。
另一项研究发现,USP1 和 BCAT2 的表达水平在基因编辑小鼠和临床样本中一致呈正相关,阐明了为什么胰腺导管腺癌的支链氨基酸代谢低于周围正常组织,进而转向其他途径获取氮。
癌症中的支链氨基酸代谢
doi: 10.1038/s41392-023-01569-3
血浆支链氨基酸升高是胰腺癌的危险因素
在胰腺癌进展的早期阶段,在人类和小鼠胰腺癌模型中观察到循环支链氨基酸升高,并且由于胰腺癌周围组织中蛋白质过度分解,血液中支链氨基酸水平升高。
肿瘤微环境中的支链氨基酸代谢
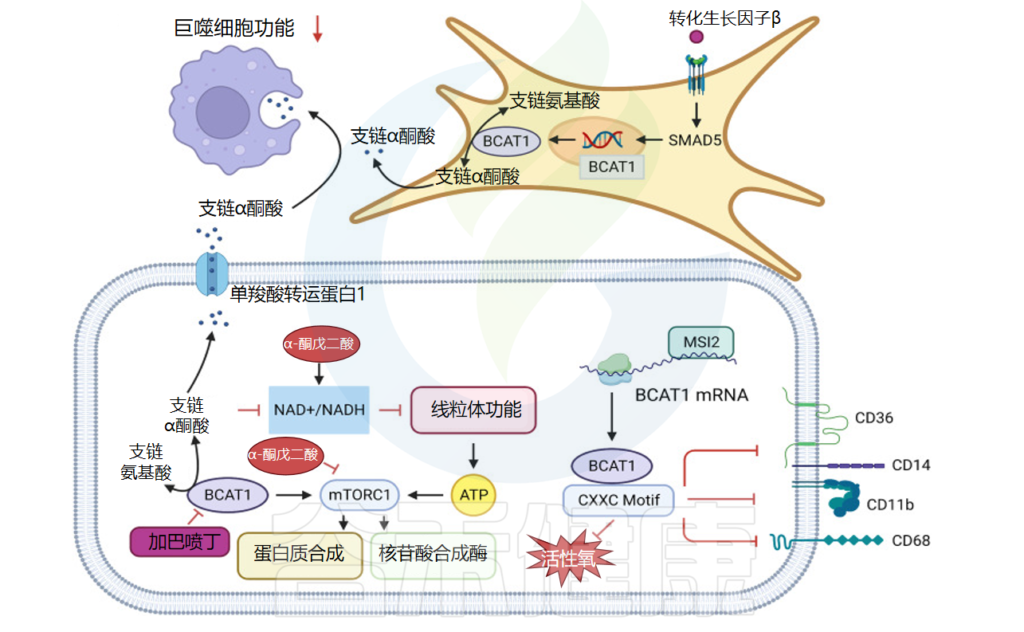
doi: 10.1038/s41392-023-01569-3
肺部肿瘤支链氨基酸摄取量高于胰腺导管腺癌
对标记的支链氨基酸代谢物的分析显示,非小细胞肺癌细胞中标记的 α-酮异己酸 (α-KIC) 和亮氨酸衍生的支链α-酮酸(BCKA)较多。同时BCKDK在非小细胞肺癌中高表达并调节细胞内ROS的产生,影响细胞存活。
代谢性疾病
支链氨基酸及其代谢物是肥胖、胰岛素抵抗和 2 型糖尿病等代谢性疾病的最强生物标志物。支链氨基酸及其代谢物升高是2型糖尿病等代谢性疾病早期进展的关键。
每种支链氨基酸都有独特的代谢作用
低异亮氨酸饮食→快速恢复肥胖小鼠代谢健康
异亮氨酸可以作为代谢健康的调节剂,低异亮氨酸饮食可以改善肥胖对代谢的不利影响。
肥胖可通过增加肝细胞中BCKDK(BCKDH激酶)/ PPM1K(BCKDH去磷酸化酶)的比例,抑制肝脏对支链氨基酸的利用,导致BCKDH失活。在肥胖和胰岛素抵抗的小鼠模型中,通过限制支链氨基酸饮食或调节 BCKDK/PPM1K 比率可以逆转这种现象。
肝脏和肾脏疾病
肝硬化:循环支链氨基酸降低 ↓↓
非酒精性脂肪肝:循环支链氨基酸升高↑↑
肝硬化患者中,高氨血症环境中支链氨基酸分解代谢增强、谷氨酸合成增加以及循环支链氨基酸水平降低被认为是该疾病的标志,并与肝性脑病风险增加相关。
在非酒精性脂肪肝 (NAFLD) 中检测到循环支链氨基酸升高。
此外,这种支链氨基酸代谢紊乱与 2 型糖尿病的发展具有协同作用。其他研究表明,补充支链氨基酸有助于恢复慢性肝病患者的葡萄糖稳态并增强免疫系统功能。
慢性肾病:循环支链氨基酸降低 ↓↓
在肾脏疾病中,慢性肾功能衰竭患者的循环支链氨基酸水平显著降低。这种现象在慢性肾脏病 (CKD) 患者中已观察到,一项 II 期慢性肾病队列研究发现,与正常对照相比,慢性肾病患者血浆亮氨酸 和缬氨酸显著降低。
这可能是由于慢性肾病患者长期营养不良和血液透析导致支链氨基酸水平下降。代谢性酸中毒还会增强支链氨基酸脱氢酶 (BCKD) 活性并加速蛋白质分解。然而,给慢性肾功能衰竭患者补充支链氨基酸和其他必需氨基酸,有助于维持蛋白质平衡,减少尿毒症毒性。
★
天冬氨酸(Asp)是一种用于蛋白质合成的 α-氨基酸,具有 α-氨基、α-羧酸基和侧链甲酰胺。它是一种非必需氨基酸,因为人体可以合成它。
草酰乙酸——天冬氨酸的前体
转氨酶将氨基从谷氨酸转移到草酰乙酸,产生 α-酮戊二酸和天冬氨酸。在天冬酰胺合成酶介导的酶反应中,谷氨酰胺提供氨基,与 β-天冬氨酸-AMP 结合形成天冬酰胺 (Asn) 和 AMP。
天冬酰胺——大脑发育必需的氨基酸
由于血液中的天冬氨酸不能直接通过血脑屏障,神经细胞的发育依赖于其在大脑中的合成。
当脑内天冬氨酸合成酶水平不足时,脑细胞的增殖就会受到限制,甚至导致细胞死亡。
反过来,在分解代谢过程中,天冬酰胺被天冬氨酸酶水解为天冬氨酸,然后用 α-酮戊二酸胺化,形成谷氨酸和草酰乙酸。然后草酰乙酸进入柠檬酸循环(下图)。
天冬氨酸、精氨酸和蛋氨酸代谢
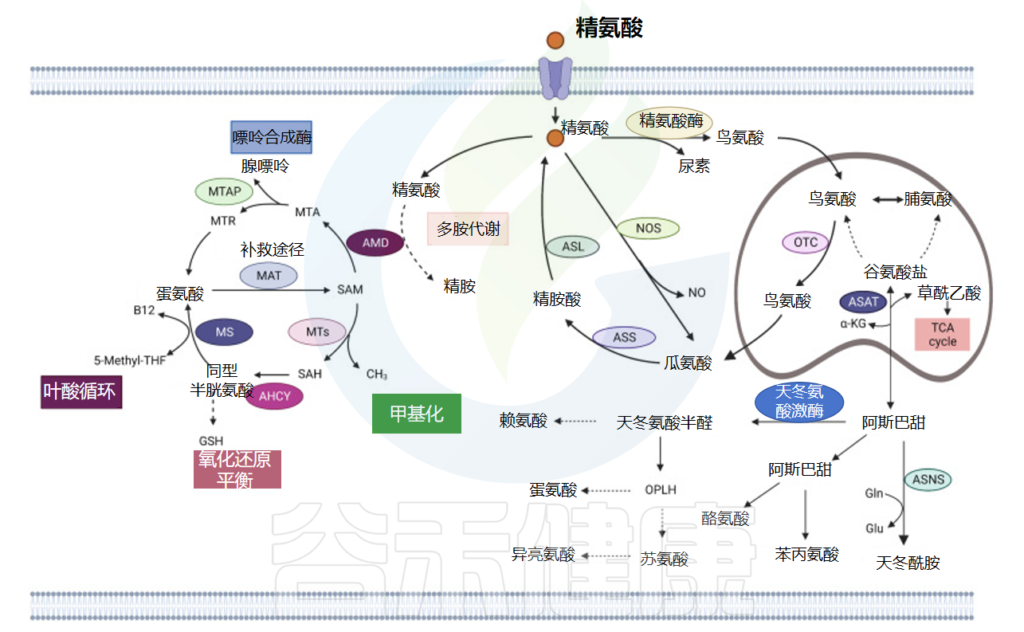
doi: 10.1038/s41392-023-01569-3
天冬氨酸也是尿素循环的代谢物
在苹果酸-天冬氨酸穿梭中携带还原当量,在肌苷合成中提供氮原子,并在 ATP 合成中充当氢受体。
天冬氨酸也是四种必需氨基酸(蛋氨酸、苏氨酸、赖氨酸和异亮氨酸)的前体。天冬氨酸还可以作为氨基酸交换因子,成为氨基酸进出细胞的介质,特别是组氨酸、精氨酸和丝氨酸。天冬氨酸通过氨基酸交换因子功能调节丝氨酸代谢、核苷酸合成和 mTORC1 活性。
TP53是人类癌症中突变频率最高的基因。该基因编码的蛋白p53通过调节细胞周期、细胞凋亡、基因组稳定性等途径抑制肿瘤的发展。
结肠癌
结肠癌细胞系中的天冬氨酸(Asp)和 天冬酰胺 (Asn) 可通过与 LKB1(编码丝、苏氨酸激酶,并直接磷酸化蛋白质产物以激活 AMPK)来抑制其活性,从而抑制 AMPK 介导的 p53 激活。
淋巴瘤和结直肠肿瘤
在淋巴瘤和结直肠肿瘤模型中,p53 的激活会破坏 天冬氨酸-天冬酰胺 稳态,并促使细胞衰老和周期停滞。缺氧条件下,天冬氨酸是肿瘤生长的限制因素。
缺氧会抑制电子传递链 (ETC),影响能量和天冬氨酸的合成。研究了肿瘤细胞对线粒体 ETC 抑制剂的敏感性,发现对 ETC 抑制不敏感的肿瘤细胞通过 Asp/谷氨酸转运蛋白 SLC1A3 维持细胞内的Asp 浓度,这使肿瘤细胞具有生存优势。
膀胱癌
在另一项关于肿瘤代谢的研究中,发现当环境中缺乏氧气时,天冬氨酸合成是膀胱癌生长的限制因素。在膀胱癌细胞中,天冬氨酸细胞的渗透性差,阻碍了肿瘤细胞从环境中摄取天冬氨酸。虽然细胞对天冬酰胺的通透性高于天冬氨酸,但膀胱癌细胞中天冬酰胺酶的活性不足,无法将天冬酰胺转化为天冬氨酸。
使用豚鼠天冬酰胺酶 1 (gpASNase1) 促进肿瘤细胞中天冬酰胺转化为 Asp 后,肿瘤细胞的生长速度显著增加,表明 Asp 获取是 Asp 获取困难的肿瘤的内源性代谢限制。有人提出,Asp是体内某些肿瘤生长的内在限制,突破这一限制将促进肿瘤生长。
天冬氨酸-谷氨酸转运蛋白 SLC1A3 与 ETC 抑制剂的作用密切相关,并且 SLC1A3 位点在非神经胶质上皮肿瘤亚簇中扩增,从而对抗天冬氨酸限制。
乳腺癌
发现SLC1A3促进乳腺癌细胞对L-天冬酰胺酶(ASNase)的抵抗。而且,SLC1A3可以补充ASNase对天冬氨酸和谷氨酸的消耗,从而消除ASNase的抑制作用,促进肿瘤的发展。
此外,另一种氨基酸转运蛋白SLC25A22可以促进KRAS突变结直肠癌(CRC)细胞中天冬氨酸的合成,激活AMPK通路并减少氧化应激。
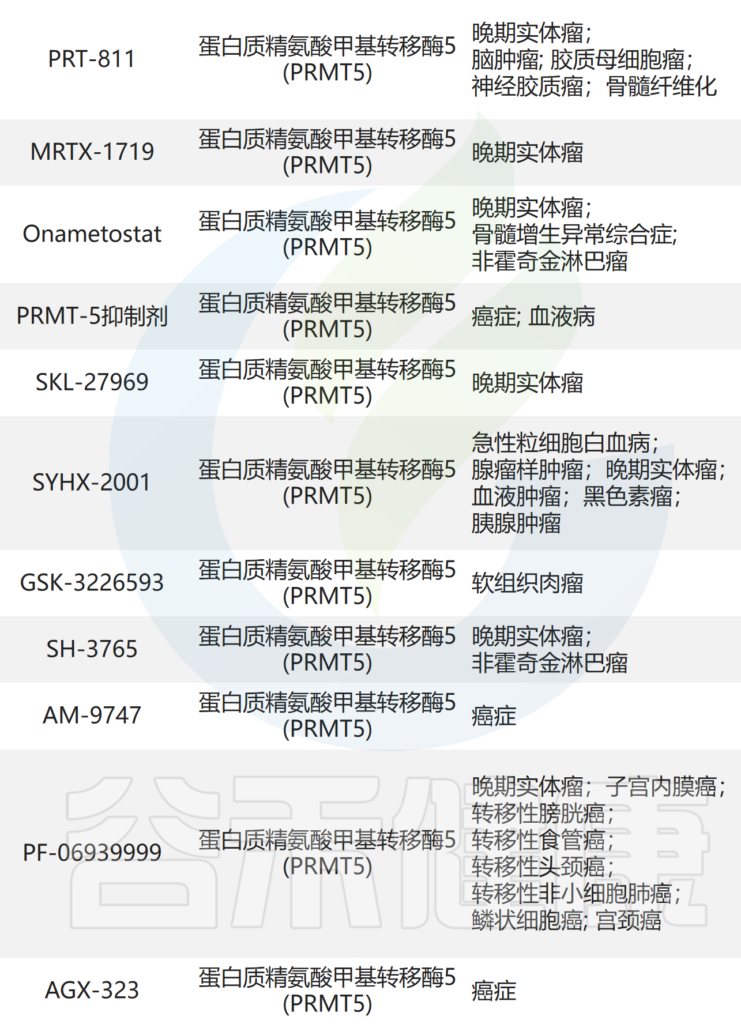
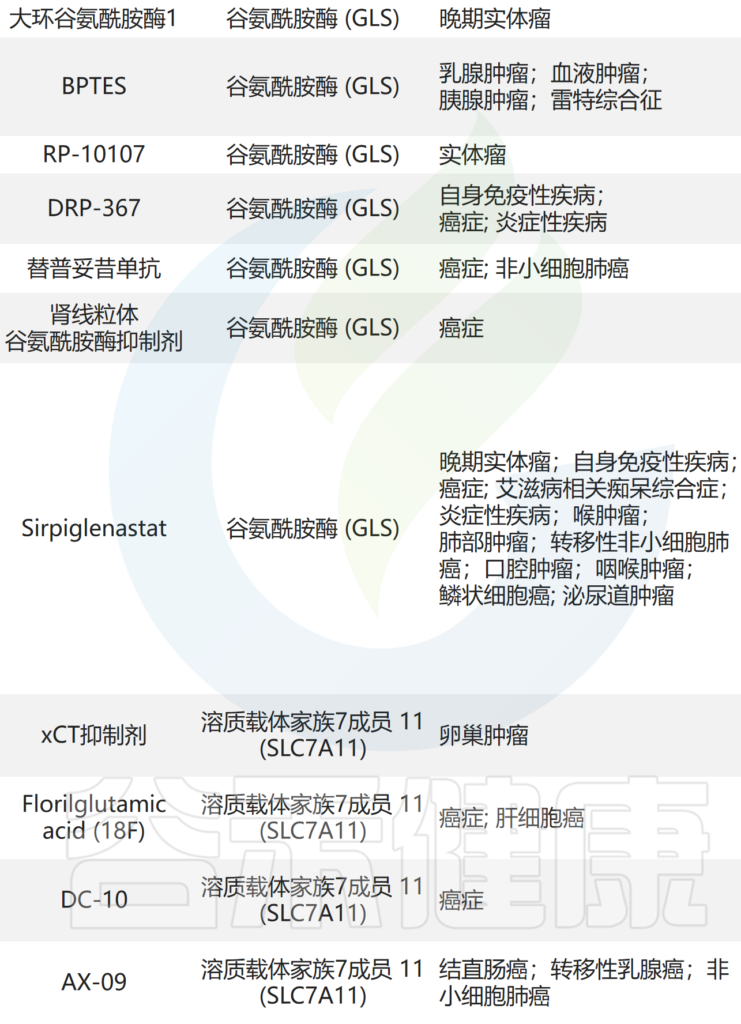
这些研究表明,AAT 是肿瘤代谢重编程的潜在靶标。目前正在测试的针对 AAT 的药物见(见后面的表格)。
实体瘤中的天冬氨酸代谢
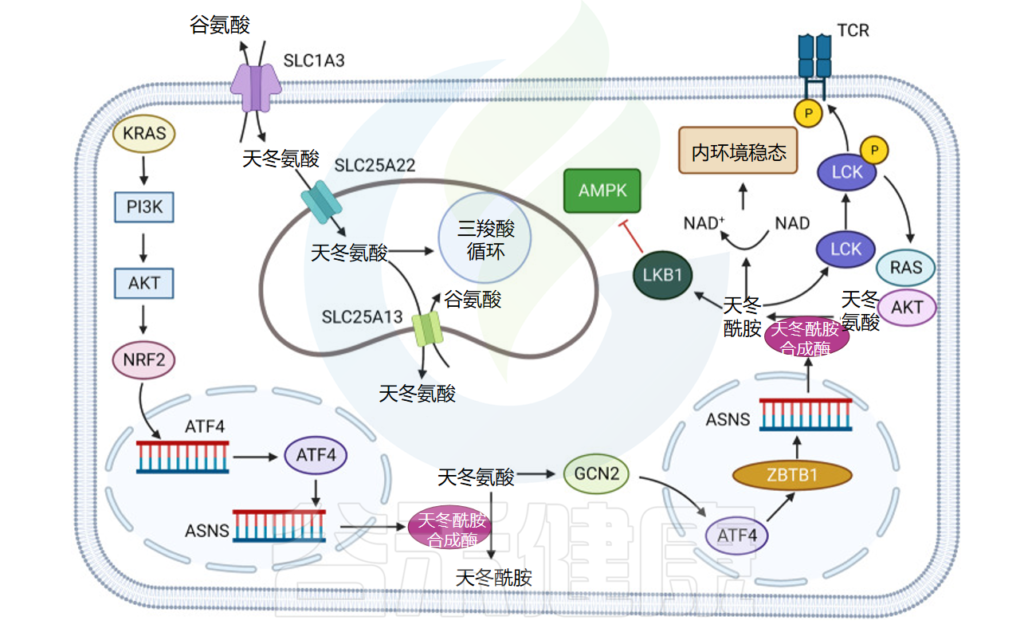
doi: 10.1038/s41392-023-01569-3
天冬酰胺作为癌症治疗的新靶点受到广泛关注
报道指出乳腺癌中天冬酰胺合成酶(ASNS)的表达水平与转移复发密切相关,抑制ASNS或限制饮食天冬酰胺可以减少肿瘤转移。
非小细胞肺癌
在非小细胞肺癌中,激活转录因子 4 (ATF4) 可以通过 KRAS 下游的 AKT 和 NRF2 改变氨基酸摄取并增加天冬酰胺合成。此外,将AKT抑制剂与细胞外天冬酰胺(ASN)消耗结合使用可以显著抑制肿瘤生长。
天冬酰胺在免疫细胞的生长和功能中发挥关键作用
发现CD8 + T细胞在CD8 + T细胞激活的早期阶段几乎不表达天冬酰胺合酶(ASNS),并且CD8 + T细胞的生长、激活和代谢重编程在天冬酰胺剥夺的情况下被破坏。
还证明,活化的 CD8 + T 细胞中的天冬酰胺水平增加,并与 SRC 家族酪氨酸激酶 LCK 结合,协助 LCK 在 Tyr394 和 505 处磷酸化,增强 LCK 活性和 T 细胞受体信号传导。
血液恶性肿瘤
天冬酰胺在血液恶性肿瘤中也发挥着关键作用。目前,细菌源性 L-天冬酰胺酶 (ASNase) 在儿童急性淋巴细胞白血病 (ALL) 中的应用已显著提高了治愈率。然而,在实体瘤中,多项临床试验表明会出现药物相关的毒副作用,如胰腺炎、中性粒细胞减少和低蛋白血症。
这些毒副作用至少部分是由L-天冬酰胺酶中谷氨酰胺酶的协同活性引起的。基于提高L-天冬酰胺酶在血液恶性肿瘤中的疗效、扩大L-天冬酰胺酶的用途、减少副作用的目的,新一代L-天冬酰胺酶正在开发中。
临床试验中靶向氨基酸代谢的药物

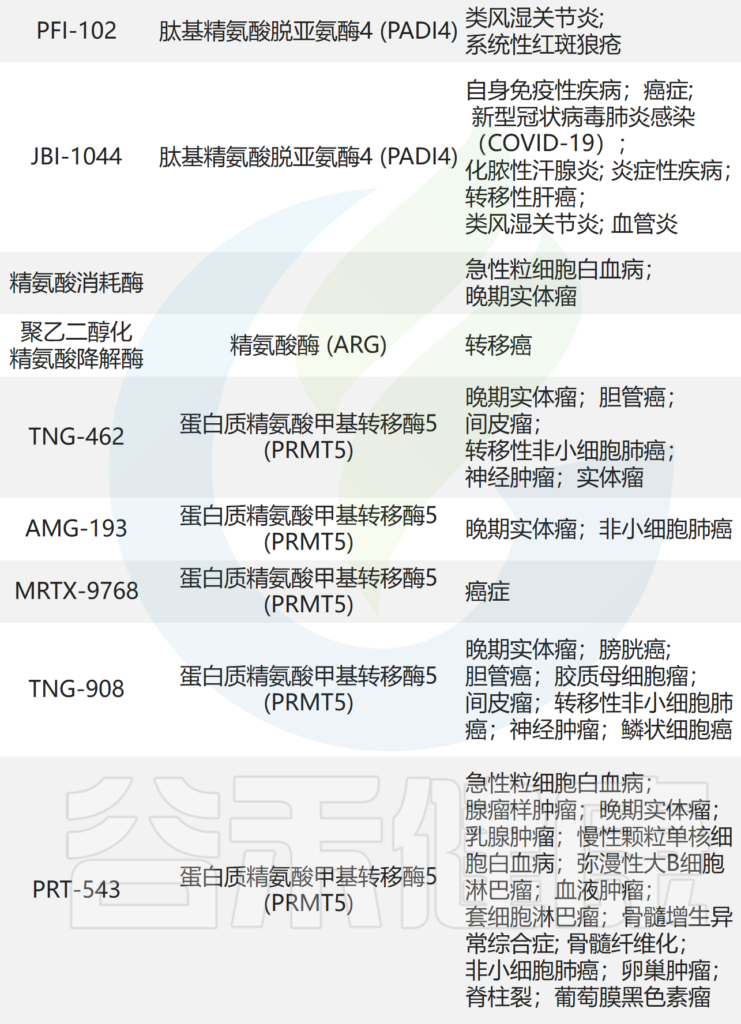


doi: 10.1038/s41392-023-01569-3
免疫疾病
自身免疫性疾病中免疫细胞代谢异常可促进炎症细胞的趋化性和炎症因子的产生。
类风湿性关节炎:T细胞天冬氨酸的丰度降低↓↓
在类风湿性关节炎 (RA) 中,细胞因子肿瘤坏死因子 (TNF) 的过量产生是发病机制中的一个核心事件,而富含内质网 (ER) 的 T 细胞是发炎关节中 TNF 的主要释放者。
发现类风湿性关节炎(RA)T细胞中线粒体天冬氨酸(Asp)的丰度降低,从而抑制NAD +周转,导致NAD +/NADH 比值降低以及NAD+蛋白质的ADP核糖基化减少依赖。
类风湿性关节炎和其他自身免疫性疾病的治疗策略是使用抗体来阻断细胞因子或其受体。最新的小分子抑制剂是靶向 Janus 激酶 (JAK) 抑制剂。这些治疗策略旨在阻断炎症途径的下游实践。然而,这些下游信号通路广泛分布在免疫细胞以外的细胞类型中,这会导致血栓形成等不良事件。因此,对自身免疫性疾病上游炎症的研究有助于从源头上预防疾病的发展。
神经系统疾病
天冬酰胺合成障碍是一种新发现的神经系统疾病,与染色体 7q2 上的 ASNS 基因突变有关。
自闭症:血清和脑脊液中天冬酰胺降低↓↓
自闭症谱系障碍(ASD)严重影响早期神经发育,导致智力障碍、发育迟缓、顽固性癫痫发作、进行性脑萎缩和呼吸系统缺陷。目前,该疾病中有一小部分人的血清和脑脊液中天冬酰胺水平可检测到降低,这阻碍了该测试用于初步筛查。由于血脑屏障的存在,天冬酰胺不会在大脑中积极积聚,因此大脑中 ASNS 活性的降低被认为是导致这种疾病的原因。
迄今为止,已报道了15种与ASD相关的突变,其中一些突变破坏了蛋白质结构,降低了ASNS的底物结合能力和催化效率。
例如,R49Q是位于N端结构域的谷氨酰胺 (Gln)结合袋中的突变,该突变不仅导致第二个β-折叠的氢键丢失,而且导致Gln的氢键丢失。此外,G289A和T337I突变位于C端结构域的ATP结合袋附近,G289A会引起与Ser293的空间冲突,而T337I会在蛋白质表面引起疏水斑并降低蛋白质溶解度。
补充天冬氨酸部分有效,需进一步研究
在治疗方面,膳食补充天冬氨酸并没有想象中那么有效,人为升高血液天冬氨酸可能会因竞争共转运蛋白而影响其他氨基酸的吸收。目前的治疗方法仅部分有效,需要进一步了解该疾病的机制来开发有效的药物。
★
谷氨酰胺(Gln)是一种用于蛋白质合成的 α-氨基酸。它的结构与谷氨酸类似,但侧链的羧酸基团被酰胺取代。谷氨酰胺是从食物中获取的非必需氨基酸,也是消耗最多的氨基酸,参与合成所有非必需氨基酸 (NEAA) 和蛋白质。
哪里产生谷氨酰胺?
肌肉组织在人体内产生最多的谷氨酰胺,约占全部合成谷氨酰胺的90%。
大脑和肺部也能释放少量的谷氨酰胺。肝脏虽然也能合成谷氨酰胺,但其主要功能是调节从肠道吸收的大量谷氨酰胺。
哪里消耗谷氨酰胺?
肠道细胞、肾细胞、激活的免疫细胞和各种肿瘤细胞是谷氨酰胺最迫切的消耗者。
具体通路
谷氨酰胺通过氨基酸转运蛋白 ASCT2/SLC1A5 进入细胞,并通过涉及谷氨酰胺酶 (GLS) 的脱氨反应在线粒体中转化为谷氨酸。然后谷氨酸在谷氨酸脱氢酶(GDH)或谷氨酸转氨酶或天冬氨酸转氨酶(TAs)的催化下产生α-酮戊二酸(α-KG)。α-KG是TCA循环的中间产物。
在缺氧或线粒体功能障碍下,α-KG可通过异柠檬酸脱氢酶(IDH2)催化的羧化反应转化为柠檬酸,用于氨基酸和脂肪酸的合成以及还原剂NADPH的生产。
肿瘤细胞是谷氨酰胺的紧急消耗者。信号分子Akt、Ras和AMPK可以通过激活糖酵解引起Warburg效应来诱导乳酸产生,促使肿瘤细胞通过谷氨酰胺代谢来满足能量需求。
在各种肿瘤中,谷氨酰胺代谢受癌基因/抑癌基因(例如 c-Myc 和 p53)的调节。癌基因 c-Myc 通过 GLS 和 SLC1A5 基因的转录激活上调谷氨酰胺代谢。
GLS 驱动的谷氨酰胺代谢是前列腺癌 (PCa) 放疗耐受性的调节因子,并且 GLS 1 和 c-MYC(谷氨酰胺的关键调节因子)的高表达与接受治疗的前列腺癌患者的无进展生存期缩短显著相关与放射治疗。
谷氨酰胺代谢可以通过α-KG依赖性染色质双加氧酶维持前列腺癌干细胞(CSC)。抑制谷氨酰胺代谢可降低体内 CSC 群体的频率以及小鼠模型中肿瘤生长的速率。
结肠癌
在结肠癌中,谷氨酰胺剥夺刺激p53激活,促进天冬氨酸/谷氨酸转运蛋白SLC1A3的表达,从而促进谷氨酸、谷氨酰胺和核苷酸合成,维持电子传递链和三羧酸循环活性。
SLC1A3 的缺失会降低肿瘤细胞对谷氨酰胺饥饿的抵抗力并抑制肿瘤细胞的生长。此外,研究表明,高表达胱氨酸/谷氨酸抗转运蛋白SLC7A11/xCT的肿瘤细胞高度依赖谷氨酰胺代谢。
在缺乏胱氨酸等氨基酸的情况下,细胞通过通用控制非阻遏物 2 (GCN2) -真核起始因子 (eIF2a) 信号通路促进 ATF4 的翻译,从而促进参与氨基酸代谢和应激反应的基因转录,包括 SLC7A11,使细胞能够应对氨基酸饥饿。
肿瘤中的谷氨酰胺代谢
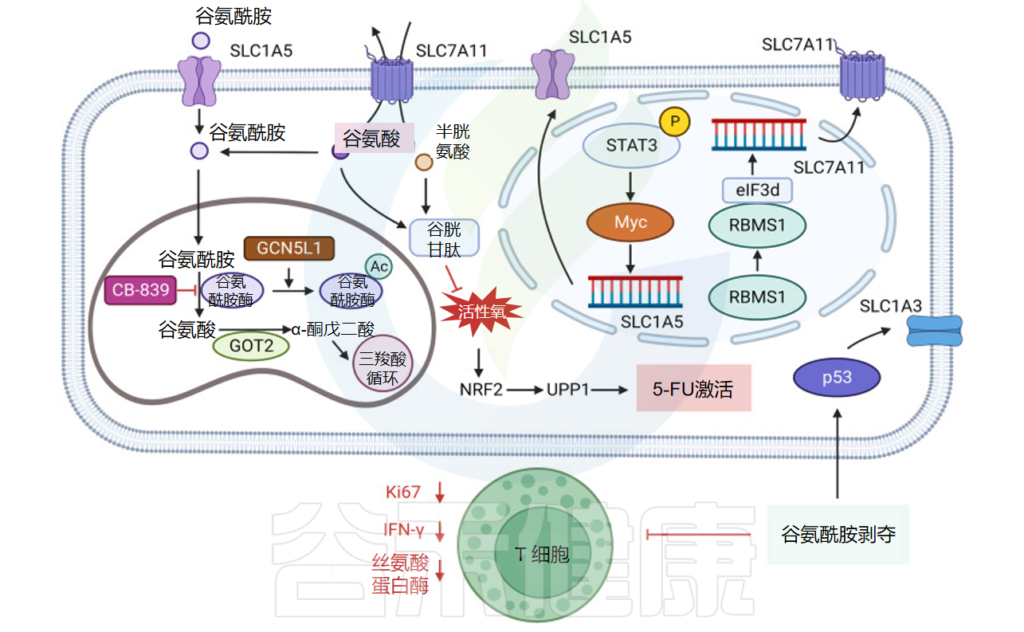
doi: 10.1038/s41392-023-01569-3
由于肿瘤细胞通过 SLC7A11 将细胞内的谷氨酸交换为细胞外的胱氨酸,细胞内的谷氨酸被消耗,导致细胞吸收更多的谷氨酰胺,并激活谷氨酰胺酶来补充细胞内的谷氨酸,使得 SLC7A11 高表达的细胞成为谷氨酰胺依赖型。
SLC7A11在三阴性乳腺癌、肺癌、胰腺导管腺癌、肾癌和肝癌中高表达
在三阴性乳腺癌 (TNBC) 中,与其他乳腺癌细胞相比,SLC7A11 高表达的细胞消耗更多的谷氨酰胺,并且对谷氨酰胺饥饿更敏感。
研究发现,SLC7A11 的缺失对小鼠正常胰腺组织的发育没有影响,但会严重损害 KRAS 驱动的胰腺导管腺癌生长。
生理条件下 SLC7A11 的非必需性以及 SLC7A11 在肿瘤中的高表达使 SLC7A11 成为癌症治疗的有希望的靶标。
谷氨酰胺酶可将谷氨酰胺水解为谷氨酸,是谷氨酰胺代谢中的关键酶。
谷氨酰胺酶的表达具有组织特异性。谷氨酰胺酶在汇管周围肝细胞、肾上皮细胞和中枢神经系统中活跃表达,用于合成尿素和神经递质。
人类谷氨酰胺酶的四种异构体分为两种由 GLS1 编码的高活性肾谷氨酰胺酶类型和两种由 GLS2 编码的低活性肝谷氨酰胺酶类型。
不同肿瘤中GLS1和GLS2表达的异质性表明恶性肿瘤细胞对谷氨酰胺代谢的需求不同。发现肝癌细胞线粒体中氨基酸合成5样1(GCN5L1)的通用控制可以促进GLS1和GLS2异构体的乙酰化和失活,从而抑制mTORC1激活和细胞增殖。
卵巢透明细胞癌
在卵巢透明细胞癌 (OCCC) 中,谷氨酰胺酶抑制剂 CB-839 抑制 ARID1A(富含 AT 的相互作用结构域蛋白 1A)突变的 PDX 肿瘤生长。
肾细胞癌
一项针对晚期肾细胞癌 (RCC) 的随机、双盲、对照 II 期试验证明,谷氨酰胺酶抑制剂 telaglenastat (CB-839) 和 mTOR 抑制剂依维莫司 (TelaE) 联合使用具有协同抗癌作用,且患者耐受性良好既往接受过 TKI 治疗的患者。此外,与安慰剂加依维莫司 (PboE) 相比,TelaE 可以改善无进展生存期 (PFS)。
另一项 Ib 期临床试验也显示 TelaE 或 telaglenastat 联合卡博替尼 (TelaC) 治疗 RCC 具有良好的耐受性和临床活性。
胰腺炎
补充谷氨酰胺降低重症死亡率,改善IBS,利于伤口愈合
谷氨酰胺可作为多种疾病的营养补充剂。多项荟萃分析发现,补充谷氨酰胺可以降低重症胰腺炎患者的死亡率、并发症发生率和总住院时间。
一项随机、双盲、安慰剂对照临床研究表明,在低发酵低聚单糖和多元醇 (FODMAP) 饮食中补充谷氨酰胺可改善肠易激综合征 (IBS) 症状。
在促进伤口愈合方面,研究发现,补充精氨酸和谷氨酰胺对伤口愈合有积极影响,补充谷氨酰胺显著影响患者的氮平衡,减少住院时间和死亡率。
补充谷氨酰胺并没有显著影响烧伤患者的预后
在一项招募 1200 名患者的双盲、随机、安慰剂对照试验中,谷氨酰胺补充剂组的出院生存期为 40 天,而安慰剂组为 38 天。谷氨酰胺组的死亡率为 17.2%,与安慰剂组的 16.2% 没有显著差异,并且补充谷氨酰胺并没有减少住院时间。
在他们的研究中,表明了补充谷氨酰胺的益处和风险,而烧伤和其他疾病的临床试验却显示出相互矛盾的结果。
补充谷氨酰胺对各种疾病的益处和风险仍需要更多临床试验数据。
心血管疾病
在心血管疾病中,Myc 和 Myc 相关因子 X (Max) 上调肺动脉高压中的谷氨酰胺转运蛋白 SLC1A5 和 SLC7A5 以及线粒体苹果酸,从而促进谷氨酰胺分解诱导的右心室肥厚。
氧化应激下,谷氨酰胺显著下降
在氧化应激下,心肌细胞中的谷胱甘肽(GSH)水平下降 60-70%,谷氨酰胺、谷氨酸和 α-酮戊二酸(α-KG)水平也显著下降,同时将谷胱甘肽转化为谷胱甘肽的 GLS 酶活性显著降低。
调节葡萄糖稳定性的关键氨基酸
2 型糖尿病是心血管疾病发生的主要危险因素。糖尿病患者骨骼肌代谢失调会影响胰岛素敏感性和葡萄糖稳态。研究发现,谷氨酰胺是调节葡萄糖稳定性和胰岛素敏感性的关键氨基酸,谷氨酰胺水平影响骨骼肌的炎症反应并调节胰岛素信号抑制剂适应性蛋白GRB10的表达。此外,谷氨酰胺的全身升高可改善肥胖小鼠模型中的胰岛素敏感性并恢复葡萄糖稳态。
补充谷氨酰胺——心脏保护的新希望
蒽环类抗生素阿霉素(DOX)是一种广泛应用于实体恶性肿瘤的抗肿瘤药物;然而,这种疗法可能因自由基和氧化应激而导致严重的心脏毒性。补充谷氨酰胺显著降低心脏脂质过氧化物水平,增加过氧化物酶和谷胱甘肽水平,保护 DOX 治疗的大鼠模型的心脏功能。
针对心脏谷氨酰胺代谢的药物正在开发中。冬凌农 (Ori) 是一种从植物冬凌草 (Hemsl.) 中提取的天然萜类化合物,在大鼠心肌损伤模型中,可提高心脏谷氨酰胺水平并抑制 ATP/ADP 比值下降,保护心肌细胞并减少梗塞面积。
严重急性呼吸道综合症
严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 是 2019 年冠状病毒病 (COVID-19) 的病因。该疾病通过人与人之间的密切接触或感染者的呼吸道分泌物传播。
COVID-19:谷氨酰胺降低↓↓
COVID-19的危险因素包括心血管疾病和糖尿病,此类高危人群表现出谷氨酰胺、NAD +水平低和透明质酸(HA)过量产生的共同代谢特征。
谷氨酰胺和 NAD +水平会导致 SIRT1 失调
SIRT1 是透明质酸合酶 2 (HAS2) 基因的关键负调节因子。这些代谢改变最终导致 HA 和纤溶酶原激活剂抑制剂 1 (PAI-1) 的过量产生以及 Tregs 和骨髓源性抑制细胞 (MDSC) 群体的扩张。因此,谷氨酰胺缺乏导致了 COVID-19 高危人群的免疫功能障碍和 HA 过量产生。
HA可以通过PAI-1激活STAT3。由于 SIRT1、STAT3 和 O-GlcNacylation 失调,通过激活 HAS2 诱发透明质酸风暴。
谷氨酰胺消耗加剧
此外,尽管SARS-CoV-2疫苗显著减少了COVID-19病例,但SARS-CoV-2感染后细胞处于强烈的氧化应激条件下,从而促进谷氨酰胺的消耗以合成谷胱甘肽。这一过程加剧了高危人群的谷氨酰胺缺乏,并可能诱发代谢功能障碍。同时,它还能引起STAT3通路失活和PAI-1激活,导致部分人出现严重的COVID-19并发症。
补充谷氨酰胺降低患者严重程度
小型临床试验表明,补充谷氨酰胺可以降低 COVID-19 患者感染后的严重程度。然而,这部分研究需要扩大,以更准确地评估谷氨酰胺在治疗 COVID-19 中的价值。
★
精氨酸,又称L-精氨酸,是蛋白质合成的原料,也是尿素和一氧化氮循环的中间产物。精氨酸被归类为条件必需氨基酸,其需求量取决于发育阶段和健康状况。
在人类中,小肠上皮细胞将谷氨酰胺和谷氨酸转化为瓜氨酸,然后通过循环系统转运至肾近端肾小管细胞,其中精氨酸由尿素循环中的精氨酸-琥珀酸合成酶和精氨酸-琥珀酸裂合酶合成。
当小肠和肾功能受损时,精氨酸合成就会受损,从而产生对精氨酸的饮食需求。在其他细胞类型中,瓜氨酸合成的精氨酸非常低,但当诱导型一氧化氮合酶 (NOS) 增加时,精氨酸合成会急剧增加。
在这些条件下,一氧化氮合成的副产物瓜氨酸可以通过精氨酸-瓜氨酸途径回收精氨酸。精氨酸对于细胞分裂、伤口愈合和免疫功能很重要。
蛋白质中的精氨酸可被 PAD 酶催化为瓜氨酸,这一过程称为瓜氨酸化,是正常免疫过程的一部分。另一种类型的翻译后修饰是精氨酸甲基转移酶 (PRMT) 的甲基化,其中精氨酸可以甲基化为单甲基化精氨酸或二甲基化精氨酸。
精氨酸甲基转移酶可分为以下三类:
精氨酸甲基化通常发生在富含甘氨酸和精氨酸的“GAR基序”中。许多精氨酸甲基化蛋白质已被证明可以与 DNA 或 RNA 相互作用,并且精氨酸残基充当磷酸主链的重要氢供体。
此外,精氨酸甲基化还会影响各种细胞过程中涉及的蛋白质-蛋白质相互作用,例如蛋白质运输、信号转导和转录调节。
正常细胞中的瓜氨酸和天冬氨酸可通过尿素循环中的精氨酸-琥珀酸合成酶 1 (ASS1) 和精氨酸-琥珀酸裂解酶 (ASL) 转化为精氨酸。
精氨酸琥珀酸合成酶 1 (ASS1) 转录抑制发生在各种肿瘤中,产生对外部精氨酸的依赖,并实现精氨酸剥夺疗法。
在GBM中使用精氨酸消耗剂聚乙二醇化精氨酸脱亚胺酶ADI-PEG20可以增加一氧化氮(NO)合成并产生细胞毒性过亚硝酸盐,增加肿瘤细胞对电离辐射的敏感性,显著增强放疗对GBM的效果。
精氨酸剥夺促进HCC细胞中GCN2依赖性周期停滞,而精氨酸剥夺HCC细胞中GCN2的抑制促进细胞衰老并增加衰老化合物的功效。
Ass 缺陷的前列腺癌和胰腺癌也被证明对 ADI-PEG20 敏感,而 ADI-PEG20 通过诱导自噬和细胞凋亡来促进细胞死亡。
肿瘤细胞中的精氨酸代谢
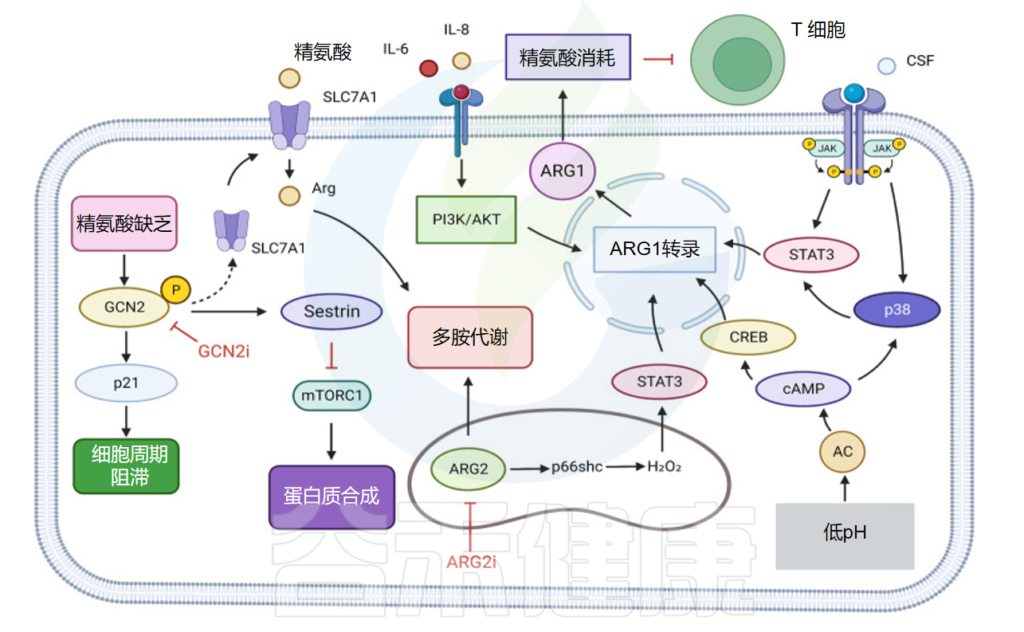
doi: 10.1038/s41392-023-01569-3
精氨酸耗竭可以增加肝细胞癌细胞中GCN2的磷酸化水平,激活GCN,增加SLC7A11的表达水平,增加精氨酸的摄取。
伤口愈合
在伤口愈合过程中,精氨酸通过精氨酸-NO途径参与炎症因子的反应。此外,精氨酸酶降解精氨酸产生的鸟氨酸和尿素在此过程中是必需的,并且在胶原蛋白和多胺的合成中具有关键作用。
精氨酸可以通过 GPRC6A-ERK1/2 和 PI3K/Akt 信号通路促进成纤维细胞增殖。
精氨酸调节免疫
精氨酸可以在炎症早期阶段增加单核细胞迁移和外周血中促炎因子的产生;在炎症后期,精氨酸还可以抑制免疫细胞的活性,调节免疫状态。总之,精氨酸及其代谢物对于伤口愈合至关重要,并参与伤口愈合的多个阶段,包括胶原蛋白形成、细胞增殖和免疫调节。
补充精氨酸有助于各种伤口愈合
膳食补充精氨酸是最方便的方法,对伤口愈合有多种好处。补充精氨酸可以增强人体 DNA 的合成。在结肠炎模型中,精氨酸补充剂可抑制炎症因子和趋化因子的表达,抑制炎症反应,促进受损组织的修复。
遭受创伤/失血性休克的患者由于胶原蛋白合成减少而难以实现伤口愈合。相反,补充精氨酸可以显著缓解上述问题并增加伤口强度。
糖尿病伤口愈合过程中,补充精氨酸可以逆转NO合成不足的情况,恢复受损组织中NO的浓度,促进伤口愈合。精氨酸也被用来降低压疮的风险,在压疮(褥疮)高风险患者中补充精氨酸可以显著加速压疮愈合。
阿尔茨海默病(AD)
阿尔茨海默病 (AD) 的特征是由淀粉样蛋白-β 和磷酸化 tau 沉积引起的老年斑和神经原纤维缠结 (NFT)。
精氨酸治疗改善阿尔茨海默病
晚期糖基化终末产物 (AGE) 会修饰蛋白质,导致其功能障碍。AMPK-γ 亚基的糖基化会抑制 AMPK 功能,精氨酸治疗可保护 AMPK-γ 免受糖基化并增加阿尔茨海默病小鼠模型中的 AMPK 磷酸化,从而改善阿尔茨海默病。
与其他药物联合使用,改善认知
在轻度阿尔茨海默病 /认知障碍 (MCI) 患者中,联合使用 L-精氨酸、HMG-CoA 抑制剂辛伐他汀和四氢生物蝶呤可增强内皮一氧化氮合酶 (eNOS) 通路,从而适度增加脑血流量并改善认知。
此外,据报道PRMT4催化的不对称二甲基精氨酸(ADMA)作为配体与NOS结合,导致NOS功能障碍,导致脑血流量减少,加重阿尔茨海默病,通过抑制PRMT4可以逆转这种情况。
肺部疾病
哮喘是一种多变的、反复发作的、长期的呼吸道炎症性疾病。精氨酸和一氧化氮代谢失衡与哮喘的病理生理学有关。
哮喘:精氨酸水平显著降低↓↓
对哮喘儿童血浆代谢质谱分析显示,与非哮喘易感组相比,哮喘易感组的精氨酸(Arg)、赖氨酸(Lys)和蛋氨酸(Met)水平显著降低。
还显示,哮喘和阻塞性睡眠患者的血清不对称二甲基精氨酸 (ADMA) 浓度显著增加,一氧化氮合酶 (NOS) 抑制增强,精氨酸分解代谢增强,鸟氨酸 (Orn) 和脯氨酸 (Pro) 水平增加,以及精氨酸/鸟氨酸比值降低呼吸暂停(OSA)。
在标记的哮喘药物中添加 L-精氨酸并不能显著减少哮喘发作
这可能是由于 IL-4 和 IL-13 诱导的精氨酸酶活性显著增加,以及过敏原刺激的肺部下游产物腐胺显著增加。
在肥胖哮喘患者的药物中添加 L-瓜氨酸(L-精氨酸循环和 NO 合成的前体),可能有助于控制哮喘并改善 NO 排泄分数 (FeNO) 水平。
心血管疾病
不对称二甲基精氨酸 (ADMA) 升高↑↑
患有高胆固醇血症和血管疾病的患者通常会出现不对称二甲基精氨酸 (ADMA) 升高,这与 NO 合成受损和内皮功能障碍的早期标志物有关。
ADMA 是一种内源性一氧化氮合酶 (NOS) 抑制剂,可显著减少血管舒张剂 NO 的合成,导致心血管疾病的发生。
PRMT1是催化ADMA的主要酶。它通过调节心肌肌动蛋白启动子区域的组蛋白甲基化修饰来调节基因激活。PRMT1的消融可以下调心肌素等收缩基因的表达,并显著降低主动脉的收缩力和血管平滑肌细胞(VSMC)的牵引力。
PRMTs的异常活性导致ADMA和MMA增加,从而增加心血管疾病的风险。
针对 PRMT 的抑制剂正在开发和实验测试中。精氨酸(Arg)甲基化酶抑制剂 (AMI) 是对称磺化尿素,可特异性抑制 PRMT 活性,并在大鼠模型中抑制环氧合酶 2 (COX-2) 表达并抑制炎症。
★
蛋氨酸(Met)是一种必需氨基酸,也是其他氨基酸的前体,例如半胱氨酸 (Cys) 和牛磺酸,以及 S-腺苷-L-甲硫氨酸 (SAM) 和谷胱甘肽 (GSH)。蛋氨酸生物合成的骨架主要来自天冬氨酸。
在分解代谢中,蛋氨酸被蛋氨酸腺苷转移酶 (MAT) 催化为 SAM。作为甲基供体,SAM 参与各种甲基转移反应,并在反应中转化为 S-腺苷高半胱氨酸 (SAH)。蛋氨酸可以增加细胞内谷胱甘肽的浓度,促进细胞氧化还原调节,并通过与氧化代谢物结合来保护细胞。
蛋氨酸作为一种必需氨基酸,在肿瘤的生长和代谢中具有重要作用。除外源供应外,蛋氨酸补救途径是唯一的蛋氨酸来源。该途径需要甲基腺苷磷酸化酶 (MTAP) 和 蛋氨酸合酶 (MS) 的活性。
MTAP 位于肿瘤抑制因子细胞周期蛋白依赖性激酶抑制剂 2 A (CDNK2A) 的外围,这两个基因的共同缺失发生在约 15% 的癌症中,导致高度侵袭性肿瘤且预后不良。这些酶在恶性肿瘤中常常下调,导致细胞对外部环境中蛋氨酸摄入的强烈依赖。
肿瘤细胞中的蛋氨酸代谢
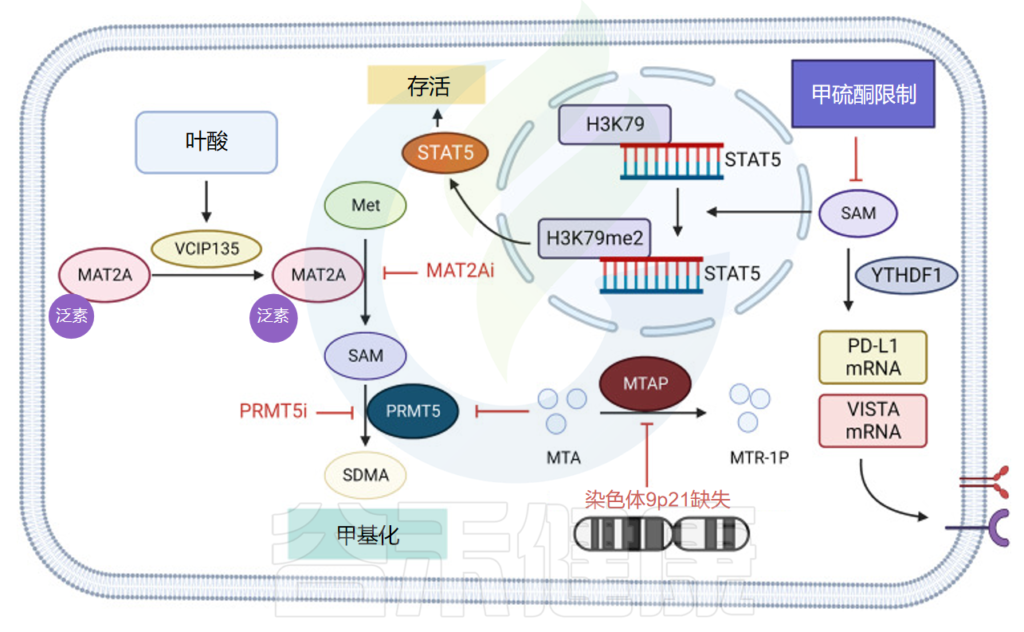
doi: 10.1038/s41392-023-01569-3
肿瘤细胞竞争消耗蛋氨酸→T细胞蛋氨酸缺乏
肿瘤细胞可以通过SLC43A2的高表达来增加蛋氨酸的摄入,竞争性消耗环境中的蛋氨酸,导致T细胞蛋氨酸缺乏。T细胞蛋氨酸限制可抑制细胞内正常甲基化,导致STAT5基因转录受阻,影响T细胞存活和功能。另一方面,蛋氨酸代谢抑制 PD-L1 和 T 细胞激活的 V 结构域 Ig 抑制因子 (VISTA) 免疫检查点翻译。
由于其在甲基化中的核心作用,蛋氨酸被认为是由 10-11 易位 (TET)、异柠檬酸脱氢酶 (IDH) 蛋白、甲基转移酶和其他表型修饰剂驱动的肿瘤治疗的候选靶点。
无蛋氨酸饮食的抗肿瘤作用,抑制肿瘤免疫逃逸
无蛋氨酸饮食的抗肿瘤作用首次在患有 Walker-256 肉瘤的 Sprague-Dawley 大鼠中被报道。
Met限制饮食可以减少肿瘤细胞中的N6-甲基腺苷(m6A)甲基化和免疫检查点翻译,例如PD-L1和T细胞激活的V域Ig抑制因子(VISTA)。
此外,它还能增加肿瘤浸润CD8 + T细胞的数量,从而抑制肿瘤免疫逃逸。补充蛋氨酸或抑制肿瘤细胞中SLC43A2的表达可以逆转上述T细胞功能抑制,激活肿瘤免疫。
这些研究表明,蛋氨酸限制不仅抑制肿瘤细胞代谢,还涉及免疫细胞,并且肿瘤细胞本身具有复杂的优先途径来调节蛋氨酸代谢。因此,应针对肿瘤细胞蛋氨酸代谢开发更精准、更有针对性的治疗方法。
脂肪肝疾病
非酒精性脂肪性肝病(NAFLD)是一种由于代谢途径异常导致甘油三酯(TG)在肝脏积聚而引起的疾病。肥胖和2 型糖尿病是 NAFLD 的重要危险因素。
高脂饮食、蛋氨酸和胆碱缺乏饮食(MCD)可以模拟人类疾病的组织学和代谢异常,通常用于建立NAFLD小鼠模型。
非酒精性脂肪性肝病早期,蛋氨酸水平降低↓↓
在评估两种方法构建NALFD/NASH模型的差异时发现,MCD饮食可在2-4周内自发导致肝纤维化,并显著影响肝纤维化途径相关基因的表达。高脂饮食的这种作用直到胰岛素抵抗后 24 周才观察到,从而减少了肝纤维化。
临床数据显示,NAFLD 早期阶段蛋氨酸水平降低,且较高的蛋氨酸摄入量与纤维化风险呈负相关。甲基供体补充通过激活 AMPK 信号通路增加脂肪酸消耗来减少肝脏脂肪积累。
肾脏疾病
常染色体显性多囊肾病:蛋氨酸水平升高↑↑
常染色体显性多囊肾病(ADPKD)是一种常见的单基因疾病,其特征是肾囊肿增大。在ADPKD模型中,蛋氨酸(Met)和SAM的水平升高,从而诱导Mettl3的表达。
Mettl3 可以增加 c-Myc 和 Avpr2 mRNA 修饰,激活 c-Myc 和 cAMP 通路,并加速囊肿生长。限制蛋氨酸饮食可能会减缓常染色体显性多囊肾病的进展。
在蛋氨酸限制 (MR) 小鼠损伤模型中,肾损伤标志物簇蛋白和胱抑素 c 显著下降。与正常喂养模型相比,MR模型中Emr1、Nos2、Tnfa等肾脏炎症基因下调,嗜碱性粒细胞聚集程度较低。
糖尿病
2 型糖尿病:循环蛋氨酸水平升高 ↑↑
糖尿病肾病:循环蛋氨酸水平升高 ↑↑
在2 型糖尿病和糖尿病肾病 (DKD) 中可以检测到循环蛋氨酸、乙酰天冬氨酸和天冬酰胺水平升高。此外,循环蛋氨酸(Met)水平升高可用于预测患糖尿病的风险。
蛋氨酸代谢调节 Cys 和内源性硫化氢 (H2S) 水平。H2S 抑制胰腺 β 细胞中葡萄糖诱导的胰岛素释放和脂肪组织中胰岛素刺激的葡萄糖摄取。
胱硫醚γ-裂解酶(CSE)是H2S合成中的关键酶,CSE抑制剂的使用会增加脂肪细胞对葡萄糖的摄取。
总之,蛋氨酸限制 (MR) 可以通过干扰葡萄糖稳态、增加胰岛素敏感性和炎症反应来缓解糖尿病。
氨基酸水平和代谢影响多个层面的细胞代谢和许多细胞过程,从蛋白质合成到表观遗传调控。这些生理过程与维持细胞稳态和正常功能密切相关。因此,氨基酸代谢异常可能导致疾病的发展。
综上,一些肿瘤病人比如,肝硬化、肺癌、乳腺癌、食管癌、肾癌、胃癌、甲状腺癌、头颈部肿瘤等病人血浆中氨基酸浓度与健康人血浆中氨基酸浓度相比表现出异常,对氨基酸代谢变化的分析可以用来辅助诊断疾病。氨基酸代谢的改变对肿瘤细胞及肿瘤免疫微环境有着显著影响。肿瘤细胞通常依赖于外源氨基酸的供应,相对于肿瘤细胞,正常细胞对氨基酸的需求较低,干扰氨基酸的可获得性,通过氨基酸消耗疗法来诱导癌细胞凋亡也是近年来备受瞩目的研究热点之一。
支链氨基酸在肿瘤和代谢疾病中起重要作用,但不同肿瘤之间对支链氨基酸的需求存在差异。支链氨基酸代谢对促炎CD4+和CD8+T细胞以及免疫抑制调节性Treg细胞的功能同样重要,Treg细胞在代谢性疾病、肝脏和肾脏疾病中发挥着关键作用。
天冬氨酸在某些肿瘤生长中是一个内在的限制因素,其转化依赖于天冬酰胺酶的活性。转氨产物天冬酰胺比天冬氨酸更具渗透性。然而,膀胱癌细胞缺乏天冬酰胺酶,导致转化为天冬氨酸的功能障碍。SLC1A3在某些实体瘤中高表达,可能为解决天冬氨酸酶耐药提供解决方案。
谷氨酰胺在肠、肾、免疫和肿瘤细胞中广泛消耗,与癌基因c-Myc和STAT3有关。SLC7A11在多种癌症中显著高表达,可作为有前景的靶标。GLS是肾小管氨基酰胺代谢的关键酶,CB-839是其抑制剂,显示出良好的抗肿瘤活性。
精氨酸调节免疫,缺乏ASS1的细胞对精氨酸具有依赖性。精氨酸甲基转移酶(PRMT)在肿瘤发生发展中的调节作用也受到广泛关注,多种 PRMT 抑制剂表现出良好的抗肿瘤活性。
蛋氨酸作为必需氨基酸的地位及其在转甲基化过程中的作用注定了细胞对蛋氨酸代谢的依赖。甲硫腺苷磷酸化酶 (MTAP) 基因缺失在一些实体瘤中发生,针对缺乏MTAP的肿瘤细胞的治疗策略是抑制蛋氨酸代谢途径中的关键酶MAT2A。蛋氨酸限制饮食可以抑制肿瘤免疫逃逸。
但是,氨基酸代谢靶向治疗面临挑战,血液氨基酸代谢是一个复杂的生物过程,涉及多个代谢途径和相互作用。因此,准确评估血清氨基酸水平对于疾病筛查和治疗有主要的意义。同时,目前血清各类氨基酸测定方法,一般是空腹抽取这增加了检测的复杂性。而且检查前一周熬夜、饮酒、劳累、服药、情绪抑郁以及进食油腻食物等都会影响氨基酸的评估。
肠道菌群在蛋白质和氨基酸代谢中扮演着重要的角色。通过评估肠道菌群的组成和功能,可以更从另外一个维度了解氨基酸代谢的状态。
一些研究发现,通过调节肠道菌群可以影响氨基酸代谢和相关疾病的进展。通过了解个体的肠道菌群状态,可以针对性地选择合适的综合治疗方法,如益生菌、益生元和饮食干预,以优化氨基酸代谢和减少治疗的不良副作用,比如抗体来阻断细胞因子或其受体导致的血栓形成等不良事件。
除本文常见的20种蛋白质氨基酸外,还包括在各个代谢途径中较为重要的氨基酸及短肽,比如牛磺酸、γ-氨基丁酸(GABA)、肌酸、肌肽等。它们在某些方面对人体的重要作用一样不比蛋白质氨基酸逊色,后续我们再和大家分享。
主要参考文献:
Ling ZN, Jiang YF, Ru JN, Lu JH, Ding B, Wu J. Amino acid metabolism in health and disease. Signal Transduct Target Ther. 2023 Sep 13;8(1):345.

谷禾健康
2型糖尿病是一种血糖水平升高(高血糖)的慢性代谢疾病,主要由胰岛素抵抗和胰岛素分泌不足引起。2型糖尿病全球患病率在不断上升。
截止到2020年,根据美国糖尿病学会评估标准,糖尿病患病率已达到12.8%。其实在我国成年人中,已经有将近一半的人存在血糖异常,未来极有可能发展为2型糖尿病。如果不加干预治疗,会引发许多不良后果。
很多研究表明,肠道菌群在宿主的代谢和疾病状态中起着重要的作用。特别是2型糖尿病,其病因复杂,包括肥胖、慢性低度炎症,受肠道微生物群和微生物代谢产物的调节。
本文将从肠道菌群的角度了解其与2型糖尿病的关系;肠道菌群及其代谢物对葡萄糖代谢、免疫系统的影响;
从影响肠道菌群变化的因素来了解各种干预措施,包括药物,饮食,益生菌/益生元,粪菌移植,间接性禁食等方式。
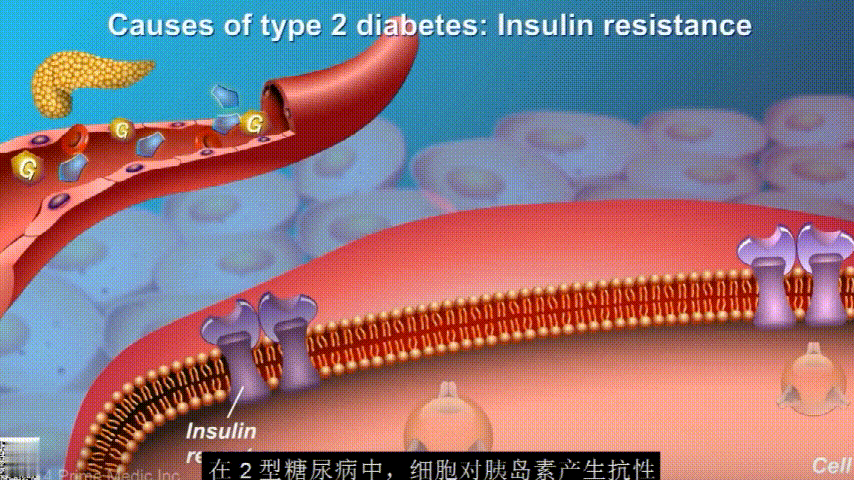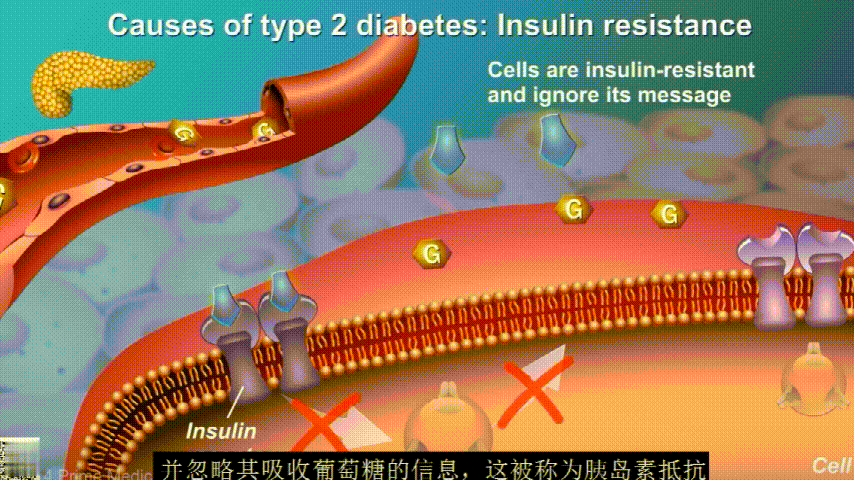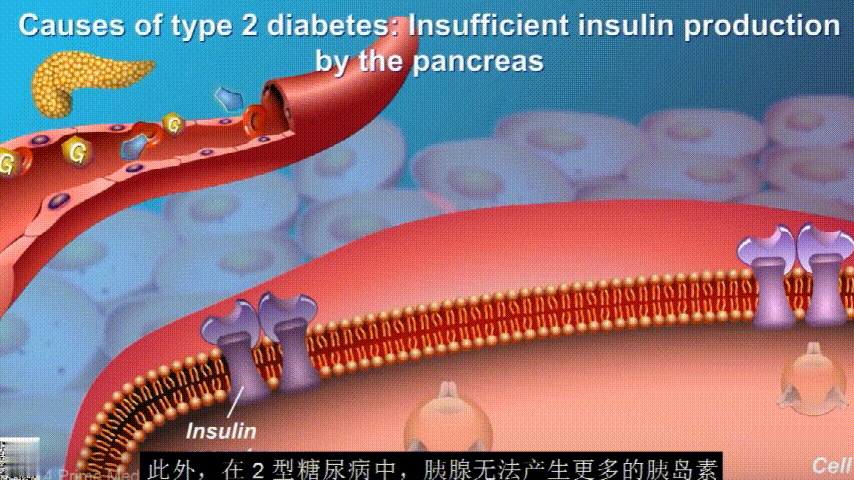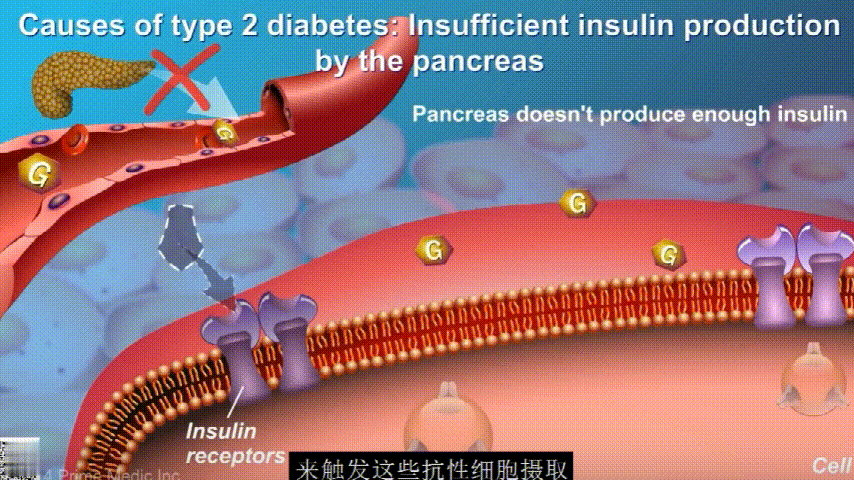
葡萄糖主要通过食用的食物和饮料进入人体。胰腺会产生一种叫做胰岛素的激素,以帮助血液中的葡萄糖进入肌肉、脂肪和肝脏,用作能量。
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像钥匙打开锁一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
刚开始的时候,胰腺会觉得自己使不上力,于是不甘心开始拼命工作,产生更多的胰岛素来克服这种抵抗。
随着时间的推移,胰腺开始累了,力不从心,不能产生更多的胰岛素,这时候就是2型糖尿病开始了。
肠道微生物群可以直接或间接地影响人类健康,肠道微生物群失调可能会增加促炎疾病的患病率,如肥胖、炎症性肠病、2 型糖尿病、关节炎和癌症。
2型糖尿病人群中个体微生物群的差异
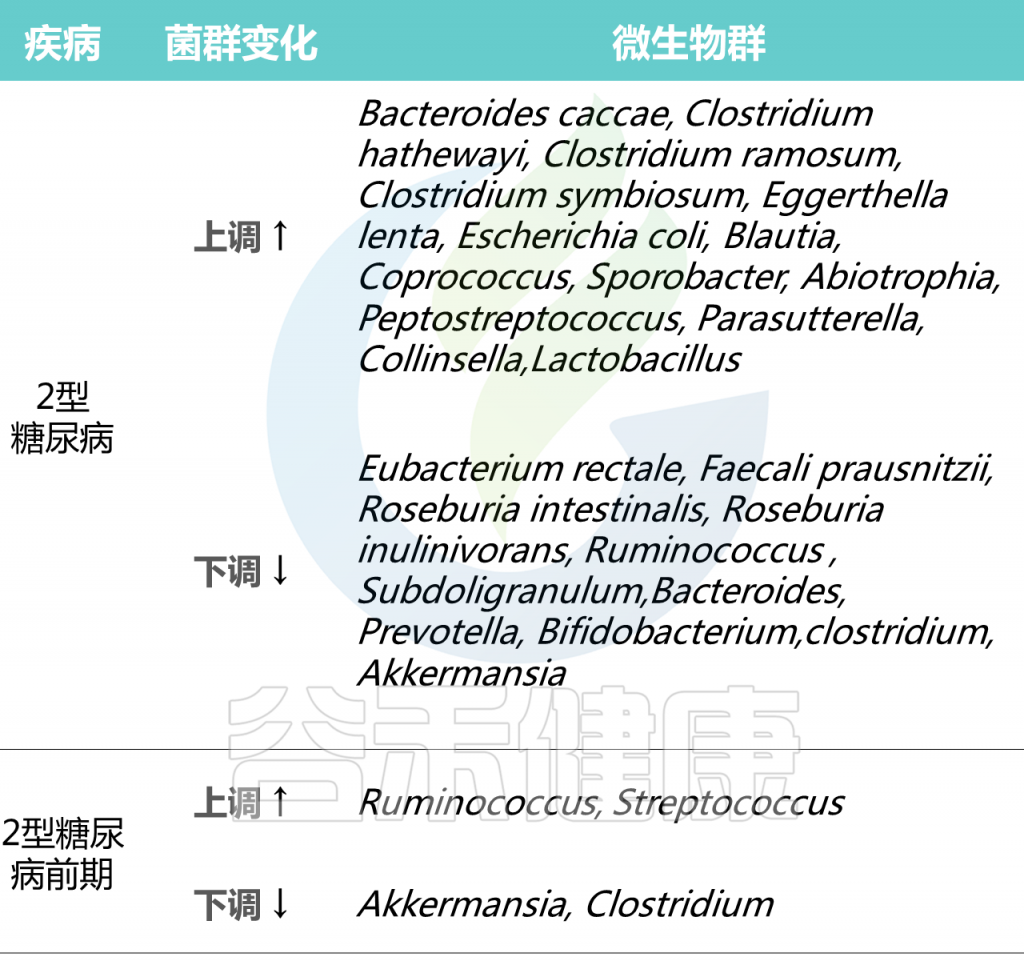

Cunningham A L et al., Gut Pathog, 2021
在2型糖尿病患者普遍具有相对高丰度的特定属:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
2型糖尿病患者中,产生丁酸菌特别缺乏,特别是梭菌目,包括:
Ruminococcus、Subdoligranulum,Eubacterium rectale、Faecali prausnitzii、Roseburia intestinalis 、
Roseburia inulinivorans
2型糖尿病患者中,其他明显较少的菌属有:
拟杆菌属、普雷沃氏菌属、双歧杆菌属