-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
肠道微生物群是居住在人类胃肠道中的复杂生态系统,由数万亿微生物(包括细菌、病毒、真菌和其他微生物)组成。通过代谢活动和与宿主相互作用,肠道微生物群在影响正常生理过程、代谢稳态和疾病易感性方面发挥重要作用,并影响健康的各个方面。
研究表明,肠道菌群失调或改变可通过影响葡萄糖代谢、胰岛素敏感性和炎症来促进2型糖尿病发展。此外,肠道菌群通过葡萄糖耐量受损和胰岛素抵抗增加等机制与2型糖尿病、肥胖、代谢综合征等疾病发作相关。
2型糖尿病患者通常表现出产丁酸盐的有益细菌(如罗氏菌属和普拉梭菌)减少,而有害细菌(如埃希菌属和扭链瘤胃球菌属)增加。
而平衡的肠道微生物群与葡萄糖代谢和胰岛素敏感性改善相关,有可能降低糖尿病相关并发症风险。最近的荟萃分析表明,微生物群衍生的干预措施可显著改善血清空腹胰岛素和糖化血红蛋白水平,这两者都是2型糖尿病患者疾病进展的关键标志物。调节肠道微生物群的策略包括使用益生菌、益生元和合生元。益生菌是摄入后对健康有益的活微生物,益生元是刺激有益肠道细菌生长的不可消化化合物,合生元是益生菌和益生元的组合,协同作用以增强肠道健康。
尽管关于益生菌在2型糖尿病中作用的研究正在迅速扩大,强调它们对血糖控制和代谢参数的积极影响,然而益生元作为细菌营养基质的重要作用经常被忽视。不同类型的益生元可直接影响血糖水平,并通过支持有益细菌生长间接影响糖尿病。菊粉、低聚果糖、低聚半乳糖、抗性淀粉、果胶低聚糖、多酚、β-葡聚糖和铁皮石斛等益生元已被证明可改善肠道微生物组成并支持2型糖尿病患者血糖控制。
本文将详细描述不同的益生元、它们建议的每日剂量、含有它们的食物、它们对2型糖尿病的直接影响,以及由此产生的肠道微生物群的变化。益生元还通过不同机制改善血糖指数,包括对短链脂肪酸的影响、抗炎作用、肠促胰岛素分泌优化、血脂水平改善和抗氧化特性。深入地了解如何利用益生元以及个性化饮食干预有望作为优化糖尿病管理和改善整体健康的治疗策略。
2型糖尿病(T2DM)是一种由胰岛素抵抗或分泌不足等导致血糖水平升高的慢性代谢性疾病,典型症状被称为”三多一少”:即多饮、多尿、多食和体重减轻。
2型糖尿病已成为21世纪最严重的全球性健康危机之一。据国际糖尿病联盟数据,全球糖尿病患者从2000年的1.51亿激增至2021年的5.37亿,预计2045年将达7.83亿,其中90-95%为2型糖尿病。并且在全球20-79岁成年患者中,中国占1.41亿人,超过总数的四分之一。
2型糖尿病的危害
这一”现代流行病”不仅以惊人的速度蔓延,更以其广泛而深远的健康危害威胁着人类生存质量:它是导致失明、肾衰竭、糖尿病截肢的主要原因,还会使心血管疾病风险增加2-4倍,每年夺走超过400万人的生命。
2型糖尿病的危害包括以下几方面:
▸ 急性并发症
①糖尿病酮症酸中毒 (DKA)
发生率:2型糖尿病患者中约5-25%;
病理机制:胰岛素严重不足,脂肪分解增加,酮体生成过多;
临床表现:恶心、呕吐、腹痛、意识障碍;
死亡率:未治疗情况下可达5-10%。
②高血糖高渗状态 (HHS)
血糖通常>33.3 mmol/L,血浆渗透压>320 mOsm/kg;
脱水严重,可达体重的20-25%;
死亡率:10-50%。
③严重低血糖
血糖<2.8 mmol/L且伴有症状;
可导致认知功能损害、昏迷、死亡;
老年患者风险更高。
▸ 慢性微血管并发症
①糖尿病肾病
病理改变:肾小球基底膜增厚、系膜扩张、结节性硬化;
分子机制:高血糖激活蛋白激酶C,促进细胞外基质合成;
糖基化终末产物 (AGEs) 激活炎症反应;
肾素-血管紧张素系统激活;
患病率:30-40%的糖尿病患者发生肾病,是导致终末期肾病的主要原因。
②糖尿病视网膜病变
病理机制:视网膜毛细血管基底膜增厚;
周细胞丢失,血管通透性增加;
视网膜缺血,血管内皮生长因子 (VEGF) 释放;
新生血管形成,纤维增殖;
患病率:病程20年后约60%患者发生;
致盲率:糖尿病是工作年龄人群致盲的主要原因。
③糖尿病神经病变
远端对称性多发神经病变:
病理:轴突变性、脱髓鞘、神经纤维丢失;
症状:疼痛、麻木、感觉异常;
患病率:50-90%。
自主神经病变:
心血管自主神经病变:心率变异性降低,体位性低血压;
胃肠道自主神经病变:胃轻瘫,腹泻或便秘;
泌尿生殖系统病变:膀胱功能障碍,勃起功能障碍。
▸ 慢性大血管并发症
①冠心病
发病机制:动脉粥样硬化加速形成;
内皮功能障碍,一氧化氮生成减少;
血小板聚集性增加,凝血功能异常;
炎症反应激活,C反应蛋白升高;
发病风险:比非糖尿病患者高2-4倍;
预后:糖尿病患者心肌梗死后死亡率更高。
②脑血管病
缺血性脑卒中风险:增加2-3倍;
病理机制:大动脉粥样硬化、小血管病变、心源性栓塞;
认知障碍:血管性痴呆风险显著增加。
③外周动脉疾病
下肢动脉疾病:患病率15-20%。
糖尿病足:
发病机制:神经病变+血管病变+感染;
溃疡年发生率:2-10%;
截肢率:比非糖尿病患者高10-20倍。
▸ 代谢和内分泌影响
①脂代谢紊乱
糖尿病性血脂异常:甘油三酯升高(>1.7 mmol/L);
高密度脂蛋白胆固醇降低(<1.0 mmol/L男性,<1.3 mmol/L女性);
小而密的低密度脂蛋白增加。
非酒精性脂肪肝:患病率60-70%。
②电解质和酸碱平衡紊乱
高钾血症:肾功能不全时常见;
低钠血症:高血糖导致的稀释性低钠;
代谢性酸中毒:晚期肾病或酮症时。
▸ 免疫功能损害
①感染易感性增加
机制:中性粒细胞趋化性和吞噬功能下降;
细胞免疫功能减退;
组织愈合能力降低。
常见感染:
泌尿系统感染
皮肤软组织感染
肺部感染
真菌感染(如念珠菌病)
②疫苗应答减弱
流感疫苗、肺炎疫苗效果降低;
需要加强免疫策略。
▸ 心理和认知影响
①认知功能损害
2型糖尿病引起的脑血管病变、慢性炎症、胰岛素信号异常、高血糖毒性可能损害认知功能;
表现:执行功能、记忆力、注意力下降;
痴呆风险:增加1.5-2倍。
②心理健康问题
抑郁症:患病率25-30%,是一般人群的2倍;
焦虑障碍:患病率15-20%;
糖尿病痛苦:疾病管理负担导致的心理压力。
2型糖尿病是如何形成的?
葡萄糖通过食物和饮料进入人体,此时胰腺会分泌胰岛素激素帮助血液中的葡萄糖进入肌肉、脂肪和肝脏以提供能量。
▸ 胰岛素有助于控制正常血糖水平
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像“钥匙打开锁”一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
初期,胰腺会代偿性地分泌更多胰岛素来克服胰岛素抵抗。随着时间推移,胰腺功能逐渐衰竭,无法产生足够的胰岛素,2型糖尿病由此发生。
▸ 胰岛素抵抗的发生机制
细胞水平机制
胰岛素受体缺陷:受体数量减少或亲和力下降;
胰岛素受体底物-1 (IRS-1) 功能障碍:磷酸化异常,信号传导受阻;
PI3K-Akt通路受损:葡萄糖转运蛋白4 (GLUT4) 转位障碍;
线粒体功能异常:氧化磷酸化效率降低,ATP生成受限。
分子机制
蛋白激酶C (PKC) 激活:由二酰甘油 (DAG) 激活,抑制胰岛素信号;
c-Jun氨基末端激酶 (JNK) 激活:促进IRS-1丝氨酸磷酸化;
核因子κB (NF-κB) 激活:促进炎症因子释放;
过氧化物酶体增殖物激活受体γ (PPARγ) 功能减退。
▸ β细胞功能衰竭
早期阶段
β细胞代偿性增生:胰岛β细胞质量增加20-50%;
胰岛素分泌相位改变:第一相分泌减少,第二相延迟;
淀粉样蛋白沉积:胰岛淀粉样多肽 (IAPP) 在胰岛内沉积。
进展阶段
β细胞凋亡:氧化应激、内质网应激诱导细胞死亡;
β细胞去分化:失去成熟β细胞特征,分泌功能丧失;
胰岛纤维化:细胞外基质沉积,胰岛结构破坏。
▸ 遗传易感性
主要易感基因
TCF7L2:最强的2型糖尿病易感基因,影响胰岛素分泌;
PPARG:调节脂肪细胞分化和胰岛素敏感性;
KCNJ11和ABCC8:编码胰岛β细胞ATP敏感性钾通道;
IGF2BP2、CDKN2A/B、CDKAL1:影响β细胞功能。
遗传风险
一级亲属患病风险增加2-6倍;
同卵双胞胎一致性达90%;
不同种族遗传易感性存在差异。
▸ 环境和生活方式等因素
肥胖会增加患2型糖尿病的风险
内脏脂肪堆积:释放游离脂肪酸,诱发胰岛素抵抗;
脂肪因子异常:脂联素减少,瘦素抵抗,抵抗素增加;
慢性低度炎症:TNF-α、IL-6等促炎因子升高;
异位脂质沉积:肝脏、肌肉、胰腺脂肪浸润。
其他环境因素
久坐行为:肌肉胰岛素敏感性下降;
睡眠障碍:皮质醇分泌异常,葡萄糖稳态破坏;
慢性应激:下丘脑-垂体-肾上腺轴激活;
肠道菌群失调:短链脂肪酸减少,肠道屏障功能受损。(肠道菌群与2型糖尿病的关系将在后续章节详细描述,通过益生元和改善肠道微生物群可能成为治疗2型糖尿病的一种新方法)
研究表明,肠道菌群失调可通过影响葡萄糖代谢、胰岛素敏感性和炎症反应促进2型糖尿病(T2DM)的发生发展。
此外,肠道菌群还通过葡萄糖耐量受损和胰岛素抵抗等机制与肥胖、代谢综合征和2型糖尿病相关。最新荟萃分析显示,微生物群干预可显著改善空腹胰岛素和糖化血红蛋白水平,这两项均为2型糖尿病进展的关键指标。
2型糖尿病患者的肠道微生物群组成显示出明显的改变,提供了微生物分类群和相关代谢物之间的重要相关性,这些代谢物要么增加了对2型糖尿病发展的敏感性,要么防止了2型糖尿病的发展。
1
产丁酸盐细菌减少
具体而言,2型糖尿病(T2DM)患者表现出有益的产丁酸盐细菌减少,微生物多样性降低,包括普拉梭菌(Faecalibacterium prausnitzii)、罗氏菌属(Roseburia)和直肠真杆菌(Eubacterium rectale)。
丁酸盐是一种短链脂肪酸(SCFA),在调节食欲、体重和胰岛素抵抗方面起着关键作用。此外,在糖尿病患者中,另一种丁酸盐生产梭菌的减少已有记录。
• 与葡萄糖代谢相关的青春双歧杆菌等有益菌群减少
此外,2型糖尿病患者中另一种有益细菌Anaerostipes hadrus含量降低,这种减少与葡萄糖代谢受损和胰岛素抵抗增加有关。研究还显示,直肠真杆菌水平下降与加重胰岛素抵抗的菌群失调有关。
瘤胃球菌(Ruminococcus bromii)对葡萄糖代谢至关重要,但在糖尿病患者(尤其是慢性胰腺炎患者)中含量较低。2型糖尿病患者的青春双歧杆菌(Bifidobacterium adolescentis)和克里斯滕斯菌科(Christensenellaceae)水平均降低,后者与糖化血红蛋白水平呈负相关。糖尿病前期个体的梭菌显著减少,其降低与血糖水平、胰岛素抵抗和炎症反应改善相关。
2
对血糖有积极影响的菌群减少
放线菌门中的双歧杆菌与较低的2型糖尿病风险相关,厌氧菌门对空腹血糖有积极影响。其他研究表明,2型糖尿病患者的肠道拟杆菌(Bacteroides intestinalis)、拟杆菌(Bacteroides)和普通拟杆菌(Bacteroides vulgatus)水平降低。
早期研究显示,2型糖尿病患者的梭状芽胞杆菌和厚壁菌门水平显著下降,新诊断患者中球囊梭菌(Clostridium coccoides)和柔嫩梭菌属(Clostridium leptum)水平尤其降低。
青春双歧杆菌(Bifidobacterium adolescentis)和Bifidobacterium angulatum有助于改善血糖控制,Oscillospiraceae水平升高与胰岛素抵抗改善相关。巨单胞菌高水平与正常葡萄糖耐量相关。
• 双歧杆菌减少
双歧杆菌属具有显著的健康益处,包括改善肠道通透性,从而降低内毒素的循环水平并减少全身炎症。这与改善宿主的糖耐量和葡萄糖诱导的胰岛素分泌,并减少炎症有关。
• Akkermansia菌减少
Akkermansia muciniphila和Faecali prausnitzii这两种菌为2型糖尿病的发展提供了保护。
Akkermansia菌在维持粘蛋白层完整性和减少炎症方面发挥关键作用。粘蛋白作为高度糖基化的大分子蛋白质参与胃肠道保护,减少细菌移位,改善脂肪储存、脂肪组织代谢和葡萄糖稳态。
• Faecali prausnitzii 减少
2型糖尿病的Faecali prausnitzii丰度降低,而糖尿病治疗可导致了Faecali prausnitzii丰度的增加、全身炎症的二次减少和胰岛素抵抗的改善。
3
与糖尿病风险增加相关的有害菌丰度升高
临床前和临床试验的系统评价显示,双歧杆菌、拟杆菌、粪杆菌、阿克曼氏菌和罗氏菌属与2型糖尿病发展呈负相关,有助于改善代谢和肠道健康。相反,瘤胃球菌属、梭杆菌属和经黏液真杆菌属(Blautia)与糖尿病风险增加相关。
• 扭链瘤胃球菌与胰岛素抵抗和高血糖相关
并且2型糖尿病患者中潜在有害细菌显著增加,例如埃希氏菌和普雷沃氏菌。还观察到糖尿病患者变形菌门的显著增加。在T2DM 患者中经常观察到更高水平的 Collinsella,尤其是 Collinsella aerofaciens。此外,扭链瘤胃球菌(Ruminococcus torques)与胰岛素抵抗和高血糖有关,在减重手术和糖尿病缓解后水平下降。
2型糖尿病患者中高丰度的特定菌属还包括:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
4
平衡的肠道菌群对改善2型糖尿病有益
• 双歧杆菌可能有助于改善2型糖尿病
多种双歧杆菌,包括青春双歧杆菌、两歧双歧杆菌、假链双歧杆菌、长双歧杆菌和齿双歧杆菌,与2型糖尿病呈负相关,尤其是在接受二甲双胍治疗的患者中。
产丁酸细菌如柔嫩梭菌属(Clostridium leptum)与糖化血红蛋白和空腹血糖呈负相关。2型糖尿病患者厚壁菌门水平普遍升高,但在糖尿病模型中与空腹血糖呈负相关。
• 阴沟肠杆菌与葡萄糖耐量受损相关
在2型糖尿病中观察到Desulfovibrio和Odoribacter水平升高。肥胖和糖尿病患者丹毒丝菌科(Erysipelotrichaceae)丰度较高,阴沟肠杆菌与葡萄糖耐量受损相关。
同时糖尿病患者免疫功能受损增加肺炎克雷伯菌感染风险。代谢综合征患者Odoribacter水平升高,产气荚膜梭菌可致糖尿病患者肝脓肿,体现其机会致病特性。
• 平衡的肠道菌群益于葡萄糖代谢和降低并发症
另一方面,平衡的肠道微生物群(共生状态)与2型糖尿病患者葡萄糖代谢改善和胰岛素敏感性增加相关。此外,共生状态有助于预防与2型糖尿病(T2DM)相关的并发症,因为健康的肠道微生物群可以降低糖尿病并发症的风险,如视网膜病变、肾病和其他相关疾病。
益生元选择性地刺激有益细菌的生长,增强微生物多样性。它们不会促进有害细菌,但可以影响某些细菌种类的生长,有时可能与在糖尿病等疾病中观察到的微生物变化重叠。
如上所述,某些细菌类型在糖尿病患者中可能更丰富。而服用益生元为2型糖尿病提供了双重好处,促进共生,同时改善血糖指数。
要被归类为益生元,食品成分必须满足特定标准:它必须抵抗胃酸,避免被消化酶水解,并能被胃肠道菌群发酵代谢,并增加促进健康的肠道细菌的丰度。
益生元本质上是不可消化的食物基质,绕过人体消化,最终到达肠道,为肠道微生物群提供能量来源。这种关系是共生的,因为益生元促进有益肠道微生物群的生长,如乳酸杆菌、阿克曼菌、双歧杆菌、粪杆菌和罗氏菌属,这有助于缓解与2型糖尿病相关的代谢过程。
碳水化合物被认为是最有效的益生元,可按分子大小或聚合程度分类。不可消化碳水化合物、特定蛋白质肽段及某些脂质也被确定为潜在益生元成分。菊粉、低聚果糖、低聚半乳糖、抗性淀粉、果胶低聚糖、β-葡聚糖、多酚和石斛属等益生元已被证实可通过优化肠道微生物组成对2型糖尿病患者血糖控制产生治疗作用。下面将讲述这些益生元的功能特性及其对肠道微生物组成和血糖指数的影响。
1
菊粉
菊粉是一种水溶性储存多糖,存在于36000多种植物中,属于果聚糖类不可消化碳水化合物。作为分类益生元,菊粉天然存在于多种食物中,建议每日摄入量为2-12克。
建议每天摄入菊粉量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
菊粉表现出显著的益生元特性,长链菊粉型果聚糖对发酵活性和细菌群落组成的影响更强。菊粉的药理特性使其成为各种食品类别的多功能成分。它作为一种低热量甜味剂和不易消化的纤维,有助于提高食品的粘度、形成凝胶并改善食品的感官特性。菊粉能开发出具有理想质地和感官品质的低脂肉类和家禽产品,其脂肪替代和质地改性特性适用于各种食品。
注:菊粉广泛用于肉制品、乳制品、酱汁和糖果的脂肪替代品,还作为食品添加剂应用于面包、烘焙产品、乳制品、糖果和婴儿食品中,在食品工业中发挥重要作用。
• 菊粉对治疗2型糖尿病具有益处
多项研究表明菊粉对2型糖尿病的潜在益处。一项涉及49名BMI为25-35 kg/m²的2型糖尿病女性研究显示,每日服用10g菊粉2个月可降低空腹血糖和糖化血红蛋白水平,同时增加总抗氧化能力。
另一项52名2型糖尿病女性患者研究表明,补充10g富含低聚果糖的菊粉8周同样可降低空腹血糖和糖化血红蛋白水平。
• 菊粉改善了糖尿病患者的胰岛素敏感性
双盲交叉研究发现,糖尿病前期患者每日服用30g菊粉2周可改善胰岛素敏感性。每日补充15g菊粉6个月可降低糖尿病前期患者空腹胰岛素水平并改善胰岛素抵抗。
然而,一项随机双盲试验报告每日摄入10g菊粉12周对2型糖尿病患者胆固醇、血糖或糖化血红蛋白无显著影响。尽管如此,大量证据支持菊粉作为2型糖尿病治疗选择的潜力。
• 菊粉增加抗炎细菌丰度,改善厚壁菌门/拟杆菌门比率
关于肠道微生物群影响,糖尿病前期患者每日服用15g菊粉6个月可增加放线菌、双歧杆菌、乳酸菌等相对丰度,同时降低另枝菌属(Alistipes)丰度。
健康成人每日服用5-7.5g龙舌兰菊粉21天后,放线菌门和双歧杆菌丰度增加,脱硫弧菌丰度降低。双歧杆菌作用与较高粪便短链脂肪酸浓度相关,可能对2型糖尿病产生有益影响。
小鼠模型显示菊粉补充剂通过调节肠道神经胶质细胞产生显著抗炎作用,改善厚壁菌门/拟杆菌门比率。丁酸盐水平升高可抑制NF-κB通路,降低促炎因子表达。人体研究证实菊粉的抗炎益处,60例糖尿病患者补充菊粉后TLR4、NF-κB和IL-1表达降低。
• 菊粉可改善胰岛素抵抗
菊粉还被证明可以改善胰岛素抵抗的标志物,包括特定基因和胰岛素受体底物的表达。在一项针对67例2型糖尿病患者的纵向研究中,每日补充10g菊粉2个月可降低INS基因甲基化。有趣的是,据报道,胰岛细胞的胰岛素启动子中含有 INS 基因甲基化,这进一步揭示了菊粉干预人类后表观遗传修饰的作用。
此外,在小鼠模型中,菊苣菊粉补充8周后,IRS-1和MAPK信号通路受到影响。该研究表明,IRS活性上调并抑制丝裂原活化蛋白激酶(MAPK)通路,该通路对T2DM发病机制和糖尿病肾病等并发症有重大影响。
最后,在一项针对60名2型糖尿病患者的研究中,补充菊粉与丁酸盐联合使用,改善了血糖标志物、血脂谱和GLP-1分泌。
总体而言,有大量证据支持菊粉在改善血糖指数、减轻2型糖尿病发病机制相关分子过程和增强肠道微生物组成方面具有作用。
2
抗性淀粉
抗性淀粉在碳水化合物中具有独特特性,能抵抗小肠内源性淀粉酶消化,到达大肠作为肠道细菌营养。这一特性使抗性淀粉被归类为膳食纤维,具有多种潜在健康益处。抗性淀粉分为五种类型,天然存在于全谷物、豆类、煮熟冷却的马铃薯、大米和未成熟香蕉等食物中。
抗性淀粉包括物理难接近淀粉(RS1)、酶抗性淀粉(RS2)、逆降解淀粉(RS3)和化学改性淀粉(RS4),对人体葡萄糖反应影响不同。
抗性淀粉可通过发酵、挤压和化学处理等加工技术生产和改性,增强其结构、发酵特性和抗消化性。建议每日摄入量为10-15克。由于热量低,抗性淀粉适合添加到纤维和膨化谷物、零食、意大利面和烘焙食品中,不会显著增加卡路里。此外,它还能改善食品质地、稠度和稳定性。
建议每天摄入抗性淀粉量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 补充抗性淀粉有助于血糖水平下降
2023年荟萃分析显示,2型糖尿病或糖尿病前期患者补充1型和2型抗性淀粉后餐后血糖降低,RS2的餐后胰岛素反应减少。另一荟萃分析发现,健康个体和糖尿病患者补充抗性淀粉后空腹胰岛素、HOMA-B、糖化血红蛋白降低,HOMA-S增加,糖尿病患者空腹血糖水平下降。
2020年的荟萃分析也表明,补充抗性淀粉可降低空腹血糖,摄入量超过28g/d或干预超过8周时改善更显著。
• 抗性淀粉具有抗炎抗氧化特性从而改善血糖
抗性淀粉改善血糖控制的机制涉及其抗氧化和抗炎特性。一项meta分析纳入了16项试验和706例2型糖尿病患者,结果显示,总抗氧化能力增加,炎症标志物(如CRP、IL-6和TNF浓度)降低。
这些发现一致强调了抗性淀粉在控制T2DM患者血糖水平和减少炎症方面的好处。除了这些荟萃分析外,个别临床试验还提供了强有力的证据,支持将抗性淀粉纳入2型糖尿病患者的饮食中,从而更详细地了解与食用相关的代谢改善。
例如,在60例T2DM女性患者中,补充10g/天的RS2持续8周,导致HgbA1c降低,甘油三酯降低,促炎性TNF-α减少,同时血清HDL水平升高。在另一项针对T2DM患者的研究中,补充RS2显示出对餐后GLP-1的有益影响,从而改善餐后胰岛素反应。
• 抗性淀粉饮食增加了罗氏菌属、阿克曼菌等
关于肠道菌群影响,富含抗性淀粉的饮食增加厚壁菌门与拟杆菌门比例,胰岛素敏感性低的个体中普拉梭菌、普雷沃氏菌科、瘤胃球菌、直肠真杆菌、罗氏菌属和嗜粘蛋白阿克曼菌增加。
不同类型抗性淀粉会引起不同反应:RS4可能促进拟杆菌门,RS2有利于厚壁菌门。研究显示,食用含RS4饼干的参与者放线菌门和拟杆菌门增加,厚壁菌门减少;食用含RS2饼干的个体瘤胃球菌和直肠真杆菌增加。但两种类型的抗性淀粉都与梭菌状芽胞杆菌比例的增加有关。
3
低聚果糖
低聚果糖(FOS)广泛用于生产功能性和低热量食品,作为甜味剂和生物防腐剂,以益生元作用著称。建议每日摄入量为12.5-20g,天然存在于洋葱、菊苣、大蒜、香蕉和朝鲜蓟等植物中。
建议每天摄入低聚果糖量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 补充低聚果糖增加了双歧杆菌丰度,但会因年龄而异
与其他益生元结合使用时,低聚果糖显示出更好的代谢控制。与多酚类配对时,联合益生元效应可改善胰腺β细胞功能,降低肝脏胰岛素抵抗和低密度脂蛋白胆固醇水平,肠道菌群也发生显著变化,双歧杆菌属增加4倍,真杆菌属增加2倍。
2022年荟萃分析显示,低聚果糖给药后双歧杆菌浓度增加(每日7.5-15g,持续4周以上),乳杆菌属或肠杆菌科无显著变化。低聚果糖对肠道菌群的影响因年龄而异,成人和老年人Odoribacter显著减少,所有年龄组嗜胆菌属和毛螺菌属减少,年轻人和成人颤螺菌属(Oscillospira)减少。
• 低聚果糖对GLP-1分泌的影响还未确定
分子水平上,低聚果糖在小鼠模型中对肠促胰岛素激素(如GLP-1)分泌有积极影响。在2型糖尿病模型中,低聚果糖减轻肠道L细胞凋亡,增强GLP-1分泌。含低聚果糖饼干可在体外增加GLP-1浓度并降低血糖。
然而,人类急性摄入低聚果糖未产生类似结果,肠道激素水平或饱腹感无显著变化。富含低聚果糖的糖浆也不会显著改变餐后生长素释放肽或GLP-1水平。
4
低聚半乳糖
低聚半乳糖是天然功能性低聚糖,也是牛奶中的关键活性成分和广泛使用的益生元。它存在于α-低聚半乳糖和β-低聚半乳糖两种亚型,通过特定半乳糖键区分。
低聚半乳糖因双重功能在食品生产中受到关注:既能改善加工食品的感官品质(如味道、质地和稳定性),又能通过选择性刺激双歧杆菌和乳酸杆菌生长促进肠道健康。建议每日摄入量为2-20克。
建议每天摄入低聚半乳糖量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 低聚半乳糖可能影响空腹胰岛素和血糖水平
关于低聚半乳糖对空腹胰岛素和血糖水平的影响,研究结果不一致,类似于低聚果糖。一项超重个体研究显示,每日补充5.5g低聚半乳糖84天后空腹胰岛素显著降低,同时总胆固醇、甘油三酯和炎症标志物(如CRP)也降低。
相反,另一项针对2型糖尿病患者的相同剂量和持续时间研究未观察到空腹血糖、糖化血红蛋白或空腹胰岛素水平的显著变化。荷兰一项针对超重或肥胖个体每日摄入15g低聚半乳糖84天的研究也未报告空腹血糖、胰岛素、肠道激素或炎症标志物的显著变化。
• 补充低聚半乳糖后双歧杆菌等有益菌丰度增加
虽然空腹胰岛素和血糖结果不一致,但低聚半乳糖对肠道微生物群的影响显示出更一致的结果。小鼠研究表明补充低聚半乳糖后双歧杆菌水平增加。人类研究同样显示低聚半乳糖增加双歧杆菌科,12周研究发现粪便双歧杆菌增加5倍。最近一项涉及53名糖尿病前期个体的研究显示,补充低聚半乳糖和短双歧杆菌12周后,糖化血红蛋白和空腹血糖显著降低。
除了增加双歧杆菌外,低聚半乳糖补充剂还与肠道微生物组成的其他有益变化有关。例如,在一项针对溃疡性结肠炎患者的研究中,每天服用2.8g低聚半乳糖,双歧杆菌属和克里斯滕森氏菌的丰度增加。还报道了几种有益细菌种类的增加,包括长双歧杆菌、青春双歧杆菌、乳酸菌科和瘤胃球菌属,以及补充低聚半乳糖后梭状芽胞杆菌、丹毒丝菌科、Odoribacteraceae和颤螺菌科(Oscillospiraceae)的减少。
总体而言,虽然低聚半乳糖在改善2型糖尿病血糖指数方面的功效仍无定论,但其对肠道微生物群的积极影响已得到充分证明。数据表明,与益生菌或其他有益剂结合使用时,低聚半乳糖可能增强疗效,尽管单独补充可能不会显著改变血糖结果。
5
果胶低聚糖
果胶是高等植物细胞壁中的必需多糖,对维持植物组织刚性和结构至关重要。水果和蔬菜中果胶含量为0.1%-2.5%,建议每日摄入30克可减少餐后血糖反应、维持正常胆固醇水平和增加饱腹感,从而减少热量摄入。
注:果胶含量因来源而异:橄榄渣34.4%,柑橘废料30%,洋葱皮27-34%,苹果浆20.9%,甜菜浆16.2%。果胶也是果胶低聚糖(POS)的来源,建议每日摄入10-20克,提供益生元益处并支持肠道健康。
• 果胶通过提高胰岛素敏感性等机制抗糖尿病
多项研究证实果胶的抗糖尿病特性。红辣椒果实提取的果胶可显著提高胰岛素敏感性并降低血糖水平。在含106g碳水化合物的膳食中添加16g瓜尔豆和10g果胶可显著降低胰岛素依赖型和非胰岛素依赖型糖尿病患者的餐后血糖和胰岛素水平。
健康成年人在含碳水化合物膳食中摄入10g果胶也可降低餐后血糖。一项涉及43名2型糖尿病志愿者的研究显示,补充果胶后空腹血糖和糖化血红蛋白水平显著降低,HOMA-IR指数降低表明胰岛素抵抗改善。
果胶还可以在胃肠道形成凝胶,减缓胃排空并减少葡萄糖吸收,调节血糖水平并增加饱腹感;对脂质代谢有积极影响,降低胆固醇水平;具有抗炎作用,可能通过减少炎症标志物改善整体代谢健康。
• 果胶促进有益菌生长并产生短链脂肪酸
果胶调节肠道菌群的能力是另一个关键因素,因为它促进有益细菌的生长,从而改善代谢健康和胰岛素敏感性。果胶经过缓慢发酵,并通过产生短链脂肪酸(SCFA)表现出益生元作用。
果胶低聚糖(POS)已显示出促进双歧杆菌的潜力,并提供各种健康益处,包括抗肥胖、抗癌和抗氧化特性。POS代表了一类新的益生元,它通过肠道微生物群的发酵产生SCFA。一项研究表明,甜菜中的POS具有最高的双歧杆菌生成促进作用和最高的SCFA浓度,而柑橘皮中的 POS 增加了乳酸菌种群。
2型糖尿病中响应益生元的肠道微生物组成变化
Iatcu OC,et al.Nutrients.2024
6
多酚类
酚类化合物是源自植物的具有生物活性的次生代谢产物,在蔬菜、水果、全谷物和其他植物来源中含量丰富。这些化合物因其抗炎、抗氧化和代谢调节特性而受到关注。每日定期摄入约1-2克多酚与预防慢性疾病相关,每日摄入超过650毫克可显著降低死亡风险。
• 酚类化合物具有控制糖尿病的潜力
膳食酚类化合物(如类黄酮、香豆素、醌、二苯乙烯和姜黄素类化合物)控制糖尿病的潜力受到关注。酚类已被证明能增强胰岛素分泌,调节血糖水平,并可能通过影响复杂分子过程帮助预防糖尿病相关并发症。
杨梅提取物通过增强肝细胞葡萄糖摄取和提高谷胱甘肽水平显示降糖活性。苹果多酚可刺激葡萄糖吸收,改善线粒体功能,减少氧化应激。牛至、黑莓提取物、白桑葚和发芽藜麦酸奶也显示出降血糖、抗氧化和抗炎作用。
• 2型糖尿病患者服用多酚后餐后血糖降低
临床试验进一步证实多酚的抗糖尿病潜力。一项涉及25名糖尿病风险男性的研究发现,早餐时食用250毫升芙蓉提取物可降低血糖、胰岛素、甘油三酯和C反应蛋白。
2型糖尿病患者每日两次补充160毫克纯化花青素24周后,低密度脂蛋白胆固醇、甘油三酯、空腹血糖和胰岛素抵抗降低,高密度脂蛋白胆固醇和抗氧化能力增加。对口服降糖药无反应的2型糖尿病患者每8小时补充350毫克越橘提取物2个月后,空腹血糖、餐后血糖和糖化血红蛋白显著降低,对肝肾功能无不良影响。
• 多酚可增加乳酸杆菌和双歧杆菌
生物活性酚类化合物,包括类黄酮和非类黄酮,在胃和小肠中部分吸收,其余部分到达大肠。在那里,它们要么被肠道微生物群利用以发挥益生元作用,要么转化为活性代谢物。大约90-95%的食用酚不会立即被吸收,而是到达大肠,在那里它们对人类健康起着保护作用。
各种研究表明,多酚可增加有益肠道细菌(如乳酸杆菌和双歧杆菌)的丰度,同时调节其他微生物群,包括拟杆菌、梭状芽胞杆菌和普拉梭菌。肠道微生物群的这些变化可能有助于酚类化合物的抗糖尿病、抗氧化和抗炎作用,进一步支持它们在代谢健康中的作用。
7
β-葡聚糖
β-葡聚糖是主要存在于燕麦和大麦中的可溶性膳食纤维,因其在糖尿病控制方面的健康益处而受到认可。这些化合物天然存在于植物细胞壁、谷物种子以及某些真菌、酵母、藻类和细菌中,高度集中在燕麦和大麦胚乳细胞壁中,占其含量的75%,在麸皮中占10.4%。
注:燕麦和大麦在谷物中β-葡聚糖浓度最高,燕麦每100克干重含3-8克(溶解度82%),大麦含2-20克(溶解度65%)。
• β-葡聚糖改善血糖控制,增加胰岛素敏感性
研究表明,β-葡聚糖可显著改善血糖控制,增加胰岛素敏感性,降低胆固醇水平。其主要作用机制是增加肠道粘度,减慢碳水化合物吸收,调节餐后血糖水平,防止血糖急剧飙升。
β-葡聚糖能在低浓度(1%)下形成高粘度溶液,在各种pH值下都具有稳定性,优于其他可溶性纤维。每日摄入约3克β-葡聚糖可显著改善2型糖尿病患者血糖控制,降低胰岛素抵抗,并与较低的糖化血红蛋白水平相关。
除改善血糖控制外,β-葡聚糖还对脂质代谢产生积极影响,有助于降低糖尿病患者心血管风险。它们通过与胆汁酸结合、促进胆汁排泄和减少肠道胆固醇吸收来降低总胆固醇和低密度脂蛋白胆固醇水平。这种降脂作用与其增加肠道粘度的能力相关,结合葡萄糖、胆汁酸和胆固醇,增强粪便排泄。β-葡聚糖通过肠道菌群发酵刺激短链脂肪酸产生,调节GLP-1和PYY等激素,增加胰岛素分泌并增强饱腹感。
• β-葡聚糖可增加肠道中阿克曼菌等产丁酸菌
β-葡聚糖发酵促进肠道菌群健康变化。糖尿病动物模型研究显示,酵母β-葡聚糖和面包酵母β-葡聚糖给药后阿克曼氏菌增加。燕麦β-葡聚糖增加梭菌和丁酸球菌,减少拟杆菌属、乳酸菌属、颤螺菌属和瘤胃球菌属。肥胖动物研究报道,大麦β-葡聚糖给药后双歧杆菌、拟杆菌属、乳酸菌属和Atopobium增加。
谷物β-葡聚糖对调节肠道微生物群的影响已得到广泛研究。有代谢综合征风险的患者食用富含β-葡聚糖的大麦粉面包后,双歧杆菌属和阿克曼菌属数量增加。动物研究表明,低分子量β-葡聚糖增加双歧杆菌和拟杆菌数量,促进短链脂肪酸(特别是乙酸盐和丁酸盐)产生。食用全麦大麦意大利面后,人罗氏菌属和瘤胃球菌属增加,梭菌门和厚壁菌门减少。
8
铁皮石斛
近年来,石斛属因其显著的益生元特性而受到关注,特别是在2型糖尿病动物模型中。它具有减少慢性炎症、防止胰腺β细胞功能障碍、刺激GLP-1分泌以及通过增强微生物多样性上调短链脂肪酸浓度等显著益处。这些作用改善多种代谢参数,包括葡萄糖耐量、胰岛素抵抗和血脂水平。
• 上调短链脂肪酸产生并改善胰岛素分泌
在糖尿病前期小鼠模型中,铁皮石斛通过调节炎症、修复胰岛损伤、增加肠促胰岛素释放和改善胰岛素分泌发挥作用,特别是通过减少脂多糖介导的TLR4激活。
补充铁皮石斛增加了Roseburia、Alloprevotella、拟杆菌、双歧杆菌和乳酸杆菌的相对丰度,同时上调短链脂肪酸产生和肠道GPR43表达。另一项研究发现类似的抗炎作用,铁皮石斛通过增加Allobaculum、双歧杆菌和乳酸杆菌丰度来增强代谢参数,通过下调LPS/TLR-4通路减少炎症,并加强肠道屏障。
• 铁皮石斛调节信号通路促进血糖控制
铁皮石斛多糖通过减少肝脏糖异生酶和调节AMP-PKA和Akt等信号通路促进血糖控制。在评估2型糖尿病小鼠模型脂质代谢的研究中,石斛补充剂通过激活PPAR信号通路改善肝功能,导致血脂水平降低和胰岛素敏感性提高。类似研究报道,石斛治疗4周后PPARγ激活导致炎症减轻。
尽管尚未在2型糖尿病患者中进行随机临床试验,但动物模型的有希望证据表明,石斛属的益生元作用可能需要进一步研究作为血糖控制的辅助治疗。
益生元和肠道菌群可以通过多种机制改善血糖参数,包括将食品发酵成生物活性短链脂肪酸 (SCFA)、减少炎症、增加降血糖激素水平、增强脂质代谢和提高抗氧化酶活性。
这些分子因素和途径的相互作用有助于2型糖尿病患者通过食用益生元改善健康状况。这些机制将在以下小节中具体讲述。
益生元对2型糖尿病患者血糖指数的影响
Iatcu OC,et al.Nutrients.2024
1
通过产生短链脂肪酸改善血糖指数
益生元主要由可溶性纤维组成,由肠道微生物群通过一系列反应发酵,产生短链脂肪酸(SCFA),即乙酸盐、丙酸盐和丁酸盐。
• 短链脂肪酸增强葡萄糖摄取,提高胰岛素敏感性
短链脂肪酸(特别是丁酸盐)作为结肠细胞关键能量来源,具有多种益处。研究表明,定期摄入纤维与人类短链脂肪酸浓度增加约4倍相关。各种益生元在微生物群组成和短链脂肪酸产生方面表现出相似反应。短链脂肪酸通过激活G蛋白偶联受体(GPR41/GPR43)和启动细胞能量稳态信号通路增强外周组织葡萄糖摄取,对提高胰岛素敏感性至关重要。
例如,小鼠模型中益生元纤维缺乏与GPR41和GPR43信号传导减少相关,导致心脏代谢健康状况下降。益生元补充剂通过增加产生短链脂肪酸的肠道微生物群,增强肝脏AMP活化蛋白激酶信号传导,从而降低胰岛素抵抗。AMPK激活通过促进葡萄糖和脂肪酸氧化、增强摄取、抑制脂肪合成和减少糖异生等能量消耗过程来提高胰岛素敏感性。丙酸盐通过GPR43/AMPK通路抑制肝脏糖异生,GPR43激活导致肝细胞钙依赖性AMPK激活,减少糖异生。
• 增加短链脂肪酸产生菌丰度并释放肠促胰素
此外,益生元通过增加短链脂肪酸产生和促进产生短链脂肪酸的细菌来增强抗炎作用、抗氧化特性、脂质代谢和肠促胰岛素激素释放。膳食纤维摄入通过增加短链脂肪酸产生改善2型糖尿病相关的各种参数,包括炎症、血脂水平和早期饱腹感。
2
抗炎作用改善血糖控制
2型糖尿病的特征是低度炎症,由脂肪组织释放促炎细胞因子、巨噬细胞浸润和有害肠道微生物及其代谢物驱动。这种炎症在临床上通常与C反应蛋白水平升高相关。
益生元干预措施的荟萃分析表明,2型糖尿病患者使用益生元后C反应蛋白水平显著降低,循环肿瘤坏死因子-α减少,抗氧化酶活性改善。另一项纳入27项研究的荟萃分析显示,抗性淀粉、抗性糊精和低聚果糖等益生元具有显著的降糖和抗炎益处。其中19项研究报告血糖指标改善,包括糖化血红蛋白、HOMA-IR评分和血糖,许多研究还显示抗炎作用增强。
• 益生元与肠道菌群通过抗炎作用改善2型糖尿病
脂多糖是革兰氏阴性菌外膜组成部分,通过与Toll样受体4结合,触发全身性促炎细胞因子释放,起到有效的炎症刺激作用。这些细胞因子(特别在脂肪组织和肝脏中)通过干扰胰岛素信号通路导致胰岛素抵抗。
白细胞介素-6和肿瘤坏死因子-α等细胞因子激活磷酸化胰岛素受体底物1的激酶,损害胰岛素信号传导。白细胞介素-6诱导细胞因子信号传导抑制因子3表达,降解胰岛素受体底物1,进一步恶化胰岛素抵抗。此外,白细胞介素激活核因子κβ,刺激细胞因子释放并产生反馈回路,加剧血糖失调。
肠道菌群和益生元通过发挥抗炎作用抵消这些炎症过程。多糖补充已被证明可减少2型糖尿病中脂多糖泄漏和代谢炎症。从机制上讲,益生元上调紧密连接蛋白,改善肠道屏障完整性,减轻脂多糖和核因子κβ介导的炎症损伤和氧化应激。
同时,有益的产生短链脂肪酸的双歧杆菌和乳酸杆菌种群增加两倍,有害的幽门螺杆菌种类受到抑制。研究表明,在脂多糖刺激的炎症细胞中进行短链脂肪酸治疗可降低血糖正常和控制不佳的2型糖尿病个体的肿瘤坏死因子-α和干扰素-γ。
注:异麦芽糖糊精是另一种潜在益生元,可抑制肿瘤坏死因子-α和白细胞介素-6,通过抑制脂肪组织中巨噬细胞浸润和恢复胰岛素受体底物1表达来调节免疫反应。它还提高拟杆菌-普雷沃氏菌浓度,改善微生物多样性,提高胰岛素敏感性。
总体而言,炎症是导致血糖控制不佳的重要因素,益生元和肠道菌群在减轻与2型糖尿病发作相关的炎症信号通路方面起着至关重要的作用。
3
影响激素水平从而调节血糖
肠促胰岛素激素(如胰高血糖素样肽1和胃抑制多肽)是众所周知的餐后胰岛素分泌增强剂,是目前流行的改善代谢健康的药物。
益生元摄入可通过改变肠道菌群组成及其代谢物自然刺激胰高血糖素样肽1、肽YY和胃抑制多肽的释放。例如,服用益生元2周与标准化膳食后血浆胰高血糖素样肽1和肽YY浓度升高及餐后血糖水平降低显著相关。
• 胰高血糖素样肽1和肽YY分泌增加
通过益生元增强胰高血糖素样肽1释放可部分归因于短链脂肪酸浓度增加。短链脂肪酸与分泌胰高血糖素样肽1的L细胞上的GPR41和GPR43受体结合,通过Gq信号传导促进胞质钙释放,刺激胰高血糖素样肽1分泌。低聚果糖和菊粉等益生元通过上调GPR43受体表达和增加结肠中分泌胰高血糖素样肽1的L细胞数量来促进这些作用。
例如康普茶作为富含多酚和益生元的茶,通过增加产生短链脂肪酸的细菌(如丁酸球菌、乳酸菌和毛螺菌科)水平来促进胰高血糖素样肽1和肽YY释放,对胰岛β细胞功能显示出有益作用。干预4周后,还观察到血糖控制的其他标志物改善,包括脂多糖水平降低、肠道屏障完整性改善,以及有害细菌属(如脱硫弧菌、大肠杆菌和志贺氏菌)减少。
总体而言,有强有力的证据支持益生元介导的肠促胰岛素激素释放增加,有助于改善血糖控制。
4
改善血脂水平进而增强血糖控制
益生元补充剂的另一个重要结果是改善血脂水平,从而直接或间接增强血糖控制。与其他有益机制类似,益生元通过促进产生短链脂肪酸的有益肠道微生物群生长来实现更好的脂质调节。
• 抑制肝脏胆固醇合成、减少异位脂肪沉积
丙酸盐通过下调参与胆固醇产生的关键酶(如乙酰辅酶A羧化酶和脂肪酸合酶)来抑制肝脏胆固醇合成,减少甘油三酯形成,降低极低密度脂蛋白分泌。
丁酸盐促进脂肪酸氧化,减少肝脏、肌肉和脂肪组织中的脂质积累。血糖控制改善主要由于异位脂肪沉积减少,因为无法抑制脂肪分解是导致2型糖尿病患者胰岛素抵抗的重要因素。
这些代谢益处通常同时发生,补充β-葡聚糖的益生元已被证明可减少胰岛素抵抗(AMPK信号传导)和脂肪酸储存(过氧化物酶体增殖物激活受体γ)的标志物。临床上,研究表明抵抗性糊精补充剂8周导致空腹血糖、糖化血红蛋白和低密度脂蛋白胆固醇水平降低,同时高密度脂蛋白浓度增加。
因此,益生元在控制脂质参数中的作用至关重要,因为脂质代谢与2型糖尿病的发生和发展有着密切关系。
5
益生元、抗氧化剂和血糖指数
氧化应激部分由有害微生物物种过度生长驱动,通过破坏胰岛素信号通路和促进胰腺β细胞功能障碍,在2型糖尿病发病机制和进展中起重要作用。
活性氧介导的通路触发胰岛细胞凋亡信号,导致细胞损伤和功能能力下降。在氧化应激状态下,胰岛素受体底物1磷酸化进一步损害胰岛素敏感性。
此外,促氧化剂损害内皮细胞,减少一氧化氮产生,而一氧化氮通过血管舒张作用将葡萄糖输送到细胞中是必不可少的。埃希菌属、梭状芽胞杆菌属和肠球菌属等细菌属,以及变形菌门和厚壁菌门与拟杆菌门比例增加,与2型糖尿病患者氧化应激增加相关。
• 减轻氧化应激、保护胰腺β细胞并改善葡萄糖稳态
益生元(特别是多酚)通过增加具有固有抗氧化能力的有益细菌相对丰度来减轻氧化应激,这些有益细菌可有效清除活性氧。多酚被肠道微生物群代谢产生酚酸,这是一种有效的抗氧化剂,已知可增强胰岛素信号传导、保护胰腺β细胞并改善葡萄糖稳态。
从机制上讲,酚酸通过下调NADPH氧化酶和上调核因子红细胞2相关因子2,后者是抗氧化酶的有效刺激剂。该研究还表明下游胰岛素信号传导增强,显著增加Akt磷酸化,表明胰岛素敏感性提高。
例如姜黄素是一种多酚,通过上调谷胱甘肽过氧化物酶和超氧化物歧化酶等抗氧化酶来促进胰岛细胞存活和功能,同时减少细胞凋亡。多酚已被证明可降低2型糖尿病患者脂质过氧化,通过降低低密度脂蛋白和增加高密度脂蛋白水平来优化血脂谱。这些改善与抗氧化防御机制增加相关,包括总谷胱甘肽水平升高,有助于防止糖尿病并发症进展。
因此,益生元的抗氧化特性在控制2型糖尿病氧化应激和控制血糖指数方面起着关键的治疗作用。
基于肠道微生物群的精准营养干预正成为功能食品和营养保健品行业的重要发展方向。随着个性化医疗的兴起,针对不同肠道菌群特征和代谢表型的定制化益生元产品将具有巨大的市场潜力。
肠道微生物群失调是2型糖尿病发生发展的重要机制,患者普遍存在产丁酸盐有益细菌(如双歧杆菌、罗氏菌属、普拉梭菌)减少,而有害细菌增加的现象。
研究表明,益生元在肠道菌群在2型糖尿病管理中的重要作用,本文深入分析菊粉、抗性淀粉、低聚果糖、低聚半乳糖、果胶低聚糖、多酚、β-葡聚糖和铁皮石斛等八种主要益生元,揭示了它们通过多重机制改善2型糖尿病的分子基础:促进短链脂肪酸产生、发挥抗炎作用、优化肠促胰岛素激素分泌、改善血脂代谢以及增强抗氧化特性。这些机制协同作用,显著改善血糖控制、胰岛素敏感性和代谢健康状况。
未来,应关注益生元与现有药物的协同作用,发展“药物+营养”的综合治疗模式。根据个体肠道微生物群特征和代谢特征定制益生元干预措施是一种策略。同时,这种“检测-分析-干预-监测”的精准营养循环,不仅能够实现血糖控制的显著改善,更能从根本上修复代谢紊乱的生物学基础。有望实现更好的血糖控制和整体健康改善。
主要参考文献
Iatcu OC, Hamamah S, Covasa M. Harnessing Prebiotics to Improve Type 2 Diabetes Outcomes. Nutrients. 2024 Oct 11;16(20):3447.
Zhou M., Zhao J. A Review on the Health Effects of Pesticides Based on Host Gut Microbiome and Metabolomics. Front. Mol. Biosci. 2021;8:632955.
Keivanlou M.H., Amini-Salehi E., Sattari N., Hashemi M., Saberian P., Prabhu S.V., Javid M., Mirdamadi A., Heidarzad F., Bakhshi A., et al. Gut microbiota interventions in type 2 diabetes mellitus: An umbrella review of glycemic indices. Diabetes Metab. Syndr. 2024;18:103110.
Quigley E.M.M. Prebiotics and Probiotics in Digestive Health. Clin. Gastroenterol. Hepatol. 2019;17:333–344.
Hamamah S., Iatcu O.C., Covasa M. Nutrition at the Intersection between Gut Microbiota Eubiosis and Effective Management of Type 2 Diabetes. Nutrients. 2024;16:269.
Megur A., Daliri E.B., Baltriukiene D., Burokas A. Prebiotics as a Tool for the Prevention and Treatment of Obesity and Diabetes: Classification and Ability to Modulate the Gut Microbiota. Int. J. Mol. Sci. 2022;23:6097.
Wu J., Yang K., Fan H., Wei M., Xiong Q. Targeting the gut microbiota and its metabolites for type 2 diabetes mellitus. Front. Endocrinol. 2023;14:1114424.
Gargari B.P., Dehghan P., Aliasgharzadeh A., Jafar-Abadi M.A. Effects of high performance inulin supplementation on glycemic control and antioxidant status in women with type 2 diabetes. Diabetes Metab. J. 2013;37:140–148.

谷禾健康

在谷禾的检测实践中发现很多自闭症和情绪障碍人群的对甲酚含量很高,并且结合现有文献,有充分的证据认为对甲酚与自闭症存在相关性。

<来源:谷禾健康自闭症儿童检测示例>
什么是对甲酚?对甲酚是人体中特定细菌(例如艰难梭菌、部分梭杆菌、肠杆菌)降解蛋白质中的l-酪氨酸产生的一种酚类化合物。
目前在自闭症谱系障碍(ASD)患者的血液、尿液和粪便中均已发现对甲酚及其人体代谢物对甲酚硫酸盐的水平明显升高,并发现ASD患者的重复刻板行为、交流与认知障碍症状的加重与尿液中对甲酚和对甲酚硫酸盐水平升高密切相关。
分析还发现,尿液中的对甲酚和对甲酚硫酸盐水平能够很好地区分开ASD儿童与健康儿童,有望作为自闭症谱系障碍的生物标志物和客观定量指标。
作为经过肠道代谢和吸收的物质,过量的对甲酚对肠道健康也存在一定的危害。高浓度对甲酚对结肠细胞具有毒性,会抑制细胞的增殖并增加线粒体耗氧量;还与肠道菌群失衡相互促进,促使耐受和产生对甲酚的细菌进一步增长,并损害肠道上皮细胞,导致屏障功能受损。
除了在自闭症中展现出的相关性及对肠道的危害外,过量的对甲酚还可作为一种尿毒症毒素。在慢性肾脏疾病(CKD)中,血浆中对甲酚和对甲酚硫酸盐的显著升高被检测到,在肾小管细胞中,对甲酚和对甲酚硫酸盐增加氧化应激,影响线粒体功能,并导致细胞死亡,加重慢性肾脏疾病进展。并且对甲酚硫酸盐被发现与肾纤维化有关。
对甲酚和对甲酚硫酸盐也被怀疑在CKD相关的不良心血管事件中发挥作用,因为它们影响内皮细胞的增殖和迁移,降低内皮伤口修复的能力,增加内皮细胞的衰老,并与心肌细胞功能障碍相关。
在这种背景下,本文详细讲述了对甲酚及其代谢产物对自闭症、肠道细胞及菌群和外周组织细胞(即肾小管细胞和血管内皮细胞)的影响。此外,我们将回顾最近的证据,探讨肠道微生物群和对甲酚的产生与自闭症之间的关联,以及该化合物在自闭症中可能发挥的机制。
如何检测自身对甲酚水平,并通过饮食或药理手段降低对甲酚或对甲酚循环浓度也是人们所关心的。在本文的最后一个部分,我们列举了当前主要的一些降低体内对甲酚水平或减轻其危害的措施,包括使用克里美净等药物;多食用富含原花青素的水果,减少红肉的摄入;保持平衡的肠道菌群状态;以及一些合生元疗法。降低对甲酚水平还可能有助于改善自闭症、慢性肾脏疾病和相关的心血管障碍。
对甲酚过高的危害
我们发现,当人体中对甲酚浓度过高时,会存在以下的危害:
•可能是介导自闭症的关键因子
•导致肠道菌群失衡
•对结肠细胞具有毒性
•诱导肠道屏障功能的改变
•会加重肾脏疾病
•与心血管功能障碍相关
作为栖息在我们肠道中的微生物群落,其就像一个个小型的加工厂,可以产生许多代谢产物。
▸肠道菌群代谢酪氨酸产生对甲酚
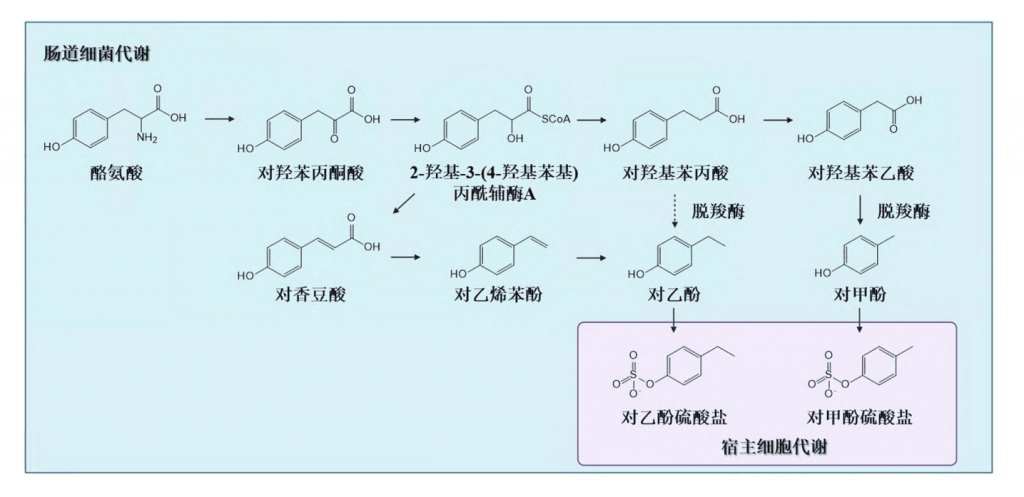
人体内的对甲酚主要来源于肠道菌群的代谢。在微生物代谢可用的底物中,肠道微生物群降解未消化(或未完全消化的蛋白质)释放的芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸),产生酚类和吲哚类产物。在这些化合物中,酚类化合物对甲酚(4-甲基苯酚)由l-酪氨酸产生。
如下图所示,以梭菌属为代表的细菌可表达脱羧酶,该酶可将酪氨酸的中间代谢产物对羟基苯乙酸和对羟基苯丙酸脱去羧基形成对甲酚和对乙酚。
肠道细菌似乎使用几种酪氨酸衍生的代谢产物,如4-羟基苯丙酮酸、4-羟基苯乳酸、3-(对羟基苯基)丙酸和4-羟基苯乙酸作为对甲酚合成的中间体。
DOI︰10.20059/j.cnki.pps.2023.08.1011
▸艰难梭菌、乳杆菌科等可以产生对甲酚
分析表明,在人类肠道中存在的细菌中,特定的细菌家族,如梭杆菌科、肠杆菌科、梭菌科、拟杆菌科、乳杆菌科和红椿菌科(Coriobacteriaceae),是强对甲酚生产者,部分双歧杆菌科也可代谢产生对甲酚。
其中以艰难梭菌的对甲酚产量最高,可达其他细菌的10~1000倍。因此,感染艰难梭菌的患者体内可能会出现对甲酚含量升高的情况。

在另一项研究中,通过使用补充有酪氨酸及其代谢物的培养基鉴定产生对甲酚的肠道细菌。发现B.longumsubsp.infantis YIT 4018亚种、艰难梭菌 YIT 10084T、Cl. paraputrificum YIT 10074T和F.necrogenes YIT 10362T具有产生对甲酚的能力。
▸乳酸可以减少对甲酚的产生
艰难梭菌产生对甲酚的能力与其相对于其他肠道细菌的竞争优势有关,从艰难梭菌感染的小鼠模型中可以看出,过量生产对甲酚会影响肠道微生物群的生物多样性。
乳酸是另一种细菌代谢产物,已被证明可以在体外减少细菌对甲酚的产生。利用这一特点,我们推测提升产乳酸细菌的丰度有助于减少对甲酚的产生。
▸高蛋白摄入量会增加对甲酚浓度
在哺乳动物中,饮食中蛋白质摄入量的增加会提高粪便和尿液中的对甲酚浓度,这可能是由于来源于未消化蛋白质的底物l-酪氨酸在细菌代谢活动中的可用性增加。
相反,含有抗性淀粉和麦麸提取物的饮食会减少对甲酚的粪便含量。
人体细胞由于缺乏相关的酶,自身并不会产生对甲酚。
对甲酚除了可经肠道细菌代谢产生以外,石油、颜料、香水、化妆品等日用品中含有对甲酚,对甲酚也是部分食品用防腐剂的原料,因此人体内的对甲酚也可能来源于饮食直接摄入或气体挥发吸入。
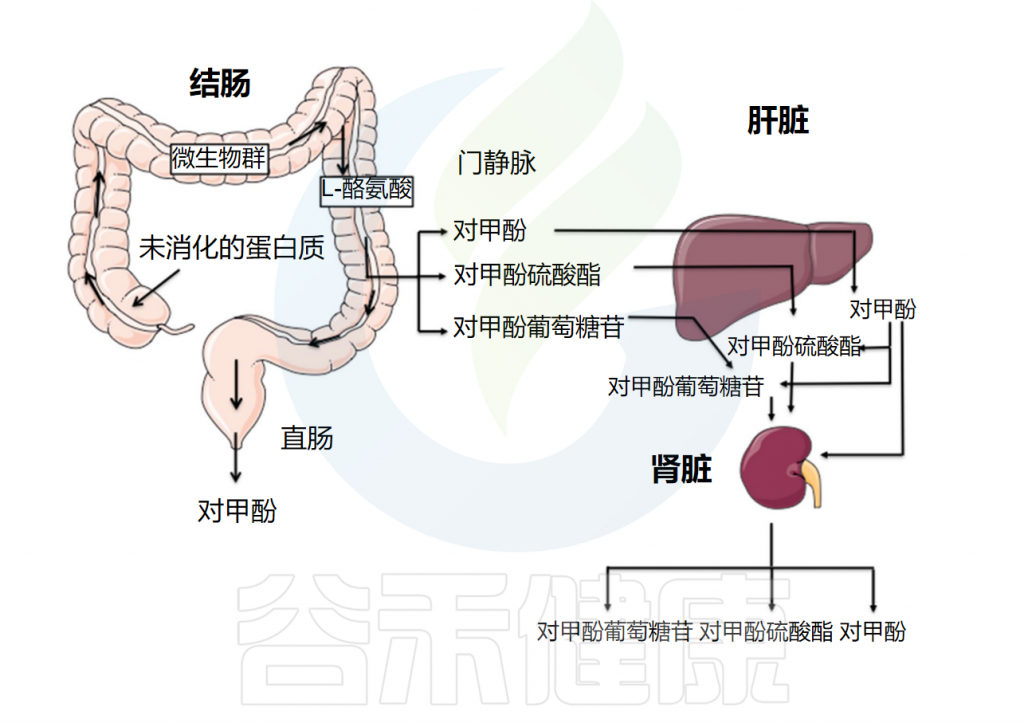
对甲酚虽然不是宿主合成的,但在吸收过程中及吸收后可在宿主组织中被修饰。肠上皮细胞吸收对甲酚,产生几种共代谢产物,最终这些产物会在尿液中排出。
▸结肠黏膜结合生成对甲酚硫酸盐
结肠黏膜与硫酸盐和葡萄糖苷酸结合酚类物质的能力已得到证实,分别允许产生对甲酚硫酸盐(p-CS)和对甲酚葡糖苷酸(p-CG)。
在一项研究中,比较了有结肠和没有结肠的血液透析患者血浆中的p-CS水平,表明结肠在p-CS的产生中起着重要作用。从肠道门静脉释放的未代谢的对甲酚由肝脏代谢,主要产生对甲酚硫酸盐,在较小程度上产生对甲酚葡糖苷酸以及其他次要代谢物。
肠道菌群和宿主组织对甲酚代谢的示意图
doi: 10.1007/s00726-021-03064-x.
▸与白蛋白结合保持血液中的含量平衡
对甲酚、p-CS和p-CG以可逆的方式与血浆白蛋白结合,导致血液中结合和游离部分之间的平衡。健康受试者血液中对甲酚的总浓度为9-13µM,而总p-CS的循环浓度为13-15µM。在血液中,游离形式的p-CS浓度平均仅为0.31µM,约占总量的2%。
最后,未与白蛋白结合的对甲酚、p-CS和p-CG会通过尿液排出。志愿者尿液中对甲酚的平均浓度为340µM,个体值之间存在显著差异。这些研究中未报告志愿者的饮食状况,加上个体肠道微生物群组成的差异,可能解释了这种差异。
▸素食者的对甲酚浓度会较低
值得注意的是,一项针对少数食用素食或无限制饮食的健康志愿者的研究表明,素食者的p-CS尿排泄量明显低于无限制饮食者,这可能是因为素食者的膳食纤维含量较高,蛋白质摄入量较低。
在一项针对志愿者的随机、平行、双盲试验中,研究表明,与等热量对照组(不补充蛋白质,摄入相似量的膳食纤维)观察到的微生物群组成相比,补充膳食蛋白质会导致细菌代谢向氨基酸降解转变。
与对照组相比,服用酪蛋白补充剂的组尿p-CS较高,而服用大豆蛋白补充剂的组则没有,这表明膳食蛋白质的来源可能对肠道微生物群对对甲酚的产生或宿主对这种细菌代谢物的代谢产生不同的影响。
▸对甲酚硫酸盐具有神经毒性,与自闭症相关
有临床研究表明对甲酚硫酸盐可能具有神经毒性,是部分神经系统疾病的潜在病因。
目前在自闭症谱系障碍(ASD)患者的血液、尿液和粪便中均已发现对甲酚和对甲酚硫酸盐的水平明显升高,并发现ASD患者的重复刻板行为、交流与认知障碍症状的加重与尿液中对甲酚和对甲酚硫酸盐水平升高密切相关。
我们将在后面的章节中详细讨论对甲酚在自闭症中的作用及其机制。
▸高浓度对甲酚对结肠细胞具有毒性
在体外实验中,浓度为1000µM及以上的对甲酚对人结肠细胞表现出剂量依赖性的遗传毒性。在不同底物的情况下,结合对人类结肠细胞发酵上清液的遗传毒性测试,发现对甲酚是这些上清液中对结肠细胞遗传毒性的最大预测因子。
▸过量的对甲酚减少增殖和线粒体耗氧量
浓度为800µM的对甲酚减缓了人结肠细胞HT-29 Glc−/+的增殖,伴随S期细胞的积聚和细胞分离的轻微增加。在这项研究中,800µM对甲酚的急性处理减少了集落细胞中的线粒体耗氧量。
此外,预处理细胞1天后,基础和最大耗氧量增加,可能抵消了对甲酚对细胞呼吸的不利影响。预处理的细胞中测量到阴离子超氧化物产量增加。在较高浓度(1600和3200µM)下,对甲酚预处理也显示出类似效果,但处理1天后,质子通过线粒体内膜的泄漏增加,降低了线粒体的生物能量代谢效率。
用浓度在800至3200µM之间的对甲酚预处理结肠细胞3天后,细胞内ATP浓度呈剂量依赖性降低。因此,在这个体外模型中,过量的对甲酚被确定为能量代谢的干扰物和对结肠细胞的遗传毒性物质。
对甲酚对结肠上皮的主要作用
doi: 10.1007/s00726-021-03064-x.
▸抑制革兰氏阴性细菌的生长繁殖,同时对对甲酚不敏感的菌群具有生存优势
进一步研究发现肠道中的对甲酚水平和肠道菌群失衡存在相互促进的关系。对甲酚可抑制脆弱拟杆菌等革兰氏阴性肠道细菌的生长繁殖,造成艰难梭菌等对对甲酚不敏感的革兰氏阳性肠道细菌具备生存优势,进而导致肠道菌群组成及多样性的改变;而艰难梭菌正是肠道中产生对甲酚最多的细菌,其相对丰度升高又会进一步造成肠道中对甲酚水平升高。
▸过量的对甲酚促使菌群失衡,失衡的菌群进一步升高对甲酚水平
即肠道中过量的对甲酚促使肠道菌群失衡,失衡的肠道菌群又可进一步升高肠道中的对甲酚水平并加剧菌群的失衡。
关于对甲酚及其代谢物对炎症性肠病病因的影响数据很少。一项研究发现,克罗恩病患者尿液中p-CS的含量低于健康对照组,这提出了炎症性肠病患者结肠细胞中对甲酚代谢/解毒可能受影响的假设。
▸损害肠道上皮细胞,屏障功能受损
研究发现,对甲酚可通过抑制结肠上皮细胞线粒体呼吸链造成ATP产量减少,并促使结肠上皮细胞产生超氧阴离子引发DNA损伤,导致结肠上皮细胞活性及增殖能力受损,造成结肠上皮细胞层完整性受损、细胞间透过性增加,说明对甲酚可通过损害肠道上皮细胞造成肠道屏障功能受损。
使用人Caco-2结肠细胞单层,1600-6000µM的对甲酚剂量依赖性地增加了细胞之间的旁运输,表明高浓度对甲酚可诱导肠屏障功能的改变。在后续研究中,水果提取物中的多酚混合物阻止了对甲酚诱导的旁运输变化,但植物提取物中化合物发挥作用的机制仍需进一步确定。
★ 对甲酚是肠道菌群参与自闭症发生的重要介质
过量的对甲酚被怀疑会对中枢神经系统产生有害影响,这种影响可能与自闭症谱系障碍(ASD)的病因有关。对甲酚、对甲酚硫酸盐在自闭症谱系障碍(ASD)患者体内水平升高且与异常行为的程度呈明显的正相关关联,说明对甲酚可能是肠道菌群参与ASD发生发展的重要中介物质。
有什么证据支持尿液和粪便中对甲酚含量升高可能作为ASD早期有价值的生物标志物,并可能在自闭症病因中发挥作用?接下来将介绍对甲酚在自闭症谱系障碍(ASD)中的潜在致病机制及其与ASD病因和生理变化的关系。
▸自闭症儿童粪便和尿液中对甲酚含量高于正常儿童
首先,与年龄和性别匹配的对照儿童相比,自闭症儿童晨尿中对甲酚浓度较高。这些浓度差异在7岁前都能明显检测到。在另一项研究中,8岁以下的自闭症幼儿尿中对甲酚及其共代谢物对甲酚硫酸盐(p-CS)和对甲酚葡糖苷酸(p-CG)含量高于同年龄、同性别的对照儿童,但在大一点的儿童中则没有。
尿中对甲酚和对甲酚硫酸盐的水平与刻板印象和强迫/重复行为有关。另外两项研究也对自闭症儿童和对照组儿童粪便中的对甲酚进行了测量,结果表明自闭症儿童粪便中对甲酚含量高于对照组儿童。
▸额外注射对甲酚会导致焦虑行为及大脑结构发生改变
在小鼠模型中,单次静脉注射1mg/kg的对甲酚可诱导焦虑和运动活动增加。在10mg/kg的较高剂量下,对甲酚加剧了小鼠自闭症的核心症状,并显著减少了小鼠之间的社会互动偏好。此外,研究中进行了脑区特异性神经化学分析,结果表明这些行为变化与大脑某些区域(如杏仁核、伏隔核和背尾状壳核)多巴胺周转量的剂量依赖性增加相关。
值得指出的是,自闭症不应该仅仅被视为一种“脑部疾病”,因为免疫系统和消化道的异常也存在于自闭症。
大鼠腹腔注射对甲酚(30mg/kg)可改变伏隔核和海马体中N-甲基-D-天冬氨酸谷氨酸受体(NMDARs)亚基的表达,表明对甲酚可能损害这些结构中NMDAR依赖的活性。NMDARs在学习、记忆和突触发育中发挥核心作用。
此外,对甲酚在体外抑制少突胶质细胞的分化,这些细胞是中枢神经系统的髓磷脂形成细胞,源自胶质祖细胞。
中脑边缘多巴胺奖赏环路的正常激活是形成社会动机和产生奖励行为的基础。奖赏环路的激活可产生愉悦感并促进相关奖赏行为的重复,同时促进社交意向等社会动机的形成;而其激活失常则可能导致重复刻板行为和社会交往障碍等ASD核心症状。
该环路由中脑腹侧被盖区(VTA)的多巴胺神经元通过释放多巴胺,向伏隔核、杏仁核和前额叶皮质等脑区的多巴胺敏感神经元发出投射,从而调节行为动机与奖赏反馈。
目前,临床神经影像学技术已观察到ASD患者中脑腹侧被盖区(VTA)与伏隔核之间的结构性和功能性损伤,并在多种ASD模型小鼠中检测到奖赏环路下游神经元兴奋性降低,提示多巴胺奖赏环路受损可能是ASD的重要潜在发病机制。
▸补充对甲酚后社交缺陷加重、多巴胺及其代谢产物水平升高
研究表明对甲酚可能是诱发自闭症谱系障碍(ASD)的重要机理。ASD模型小鼠在服用对甲酚后,其社交缺陷、刻板行为和焦虑样行为明显加重,且在伏隔核等脑区内多巴胺及多巴胺代谢终产物高香草酸的水平显著升高,提示对甲酚可提高多巴胺在奖赏环路中的蓄积与代谢水平;而健康小鼠在服用对甲酚后不仅既可呈现出社交缺陷和重复刻板行为等AS样表现,其VTA多巴胺神经元的兴奋性和兴奋传导能力也显著降低,表现为神经元动作电位的产生数量减少、自发性兴奋性突触后电流的频率和振幅降低,这一现象符合由血清皮质酮升高所引发的神经生理改变。
DOI︰10.20059/j.cnki.pps.2023.08.1011
▸奖赏环路功能受损、神经元兴奋性受抑制
此外,研究还发现升高血清对甲酚硫酸盐水平可显著提升小鼠的血清皮质酮水平,皮质酮是一种受下丘脑和垂体调控、由肾上腺皮质分泌的激素,通常在机体应激时分泌增加从而升高血糖并使精神紧张。提高血清皮质酮水平会提高应激反应,从而造成社交活动减少等ASD样症状。给予其口服式活性炭AST-120则可同时降低其血清对甲酚硫酸盐水平和血清皮质酮水平。
注释:AST-120是一种口服式活性炭,服用后可通过物理作用非特异性地吸附肠道中的酚类物质及其他芳香族化合物并随着肠道的蠕动排出体外,目前已在临床上应用于肾功能衰竭患者的治疗康复。
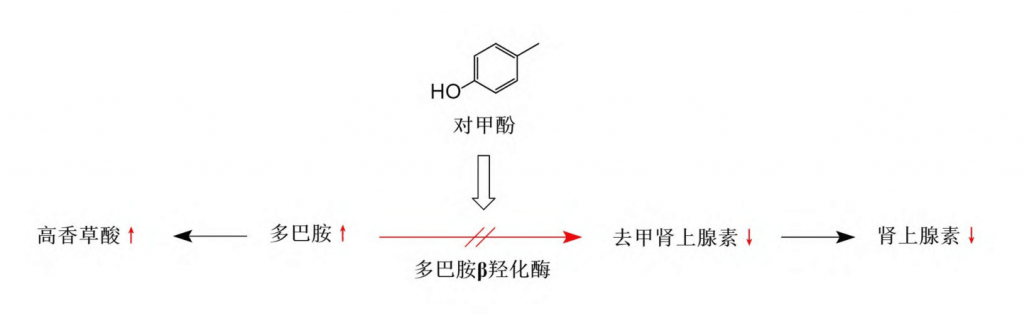
以上结果说明,对甲酚在体内被代谢为对甲酚硫酸盐后,可引发肾上腺糖皮质激素分泌增加,进而引发奖赏环路中多巴胺水平异常升高和多巴胺D2受体过度激活,造成奖赏环路功能受损、神经元兴奋性和兴奋传导受抑制,进而导致自闭症相关行为异常。
▸抑制多巴胺β羟化酶活性
此外,体外实验还发现对甲酚可使多巴胺β羟化酶不可逆地失去活性,而该酶是催化多巴胺向去甲肾上腺素转化的关键酶。
这一结果说明对甲酚除了可以通过升高血清肾上腺糖皮质激素提高VTA中的多巴胺水平以外,还可能通过抑制多巴胺向去甲肾上腺素的转化从而进一步导致神经系统及奖赏环路中多巴胺的蓄积以及多巴胺代谢水平升高,继而参与ASD的发病机制。
综上所述,对甲酚可能通过提高肾上腺糖皮质激素的分泌和抑制多巴胺β羟化酶的活性,导致多巴胺蓄积并引发中脑边缘多巴胺奖赏环路损伤,进而参与社交障碍等ASD症状的发生发展。
大脑前额叶皮质负责调控情绪、认知、决策等高级功能,参与威胁性刺激的解析评估、恐惧记忆的储存与消退并调节应激反应。临床研究显示ASD患者前额叶皮质的功能以及与其他脑区的连接性明显降低,小鼠实验表明社交障碍等ASD症状与前额叶皮质中多种神经元兴奋性异常有关,提示该脑区功能异常可能是诱发ASD的重要病因。
▸对甲酚硫酸盐诱发氧化应激和神经炎症
有研究发现对甲酚硫酸盐可在小鼠前额叶皮质中蓄积并诱发氧化应激与神经炎症,造成前额叶皮质神经元和神经干细胞受损凋亡。在服用AST-120后,该小鼠前额叶皮质中对甲酚硫酸盐的水平显著下降,同时前额叶皮质的氧化应激与神经炎症水平明显降低,神经元与神经干细胞的活性损伤得以修复,小鼠行为异常与ASD样症状随之得到改善,说明对甲酚硫酸盐可能通过影响前额叶皮质功能从而参与ASD的发病机制。
▸对甲酚硫酸盐可增加CD68的表达
研究还发现,对甲酚硫酸盐显著增加小鼠前额叶皮质中CD68分子的表达,而前额叶皮质中对甲酚硫酸盐水平的降低伴随CD68表达水平的下降。CD68可激活小胶质细胞,参与脑内免疫应答并介导炎症反应。
多项临床研究表明,ASD患者脑内小胶质细胞密度增加且过度激活,导致的神经系统炎症可能是引发ASD症状的重要因素。这提示对甲酚硫酸盐可能通过间接激活小胶质细胞,导致前额叶皮质的神经炎症与功能损伤,从而引发ASD症状。
▸自闭症患者存在线粒体功能障碍
线粒体是细胞中直接能源物质腺苷三磷酸(ATP)的产生场所,同时也参与细胞的应激反应与自噬凋亡。ASD患者常伴随线粒体功能障碍,临床上已借助脑磁共振波谱成像在ASD患者的多个脑区观察到线粒体功能障碍。
线粒体中的谷胱甘肽能起到解毒和抗氧化的作用,有助于维持线粒体内氧化还原反应平衡,保障线粒体产能功能的正常行使。肠道宏基因组测序显示,在ASD患者的肠道菌群中,谷胱甘肽合成酶及相关通路出现明显缺陷,说明肠道菌群的潜在线粒体保护功能受损;血液学检测显示ASD患者血浆中还原型谷胱甘肽与氧化型谷胱甘肽的比例明显降低,ASD患者有可能存在较为广泛的线粒体功能障碍。
▸耗竭细胞中的还原型谷胱甘肽
体外实验发现,对甲酚和对甲酚硫酸盐可耗竭细胞中的还原型谷胱甘肽,并显著提升胞内氧化型谷胱甘肽的水平。体内实验也发现对甲酚硫酸盐可显著降低小鼠前额叶皮质中的还原型谷胱甘肽水平,而通过服用AST-120降低小鼠体内的对甲酚硫酸盐能有效恢复前额叶皮质中的还原型谷胱甘肽水平。
谷胱甘肽的合成减少与解毒功能减弱是可能造成线粒体功能障碍并引发ASD症状的重要机制。
研究发现,对甲酚硫酸盐可增强细胞对葡萄糖和氧的摄取,提高线粒体的有氧呼吸,但显著降低ATP产量。这是因为对甲酚硫酸盐降低了与氮代谢和酸碱平衡相关的酶(如谷氨酰胺酶和谷氨酸脱氢酶)及抗氧化防御相关酶(如烟酰胺核苷酸转氢酶)的表达,同时激活NADPH氧化酶,导致线粒体能量消耗和氧化应激水平升高,从而引发线粒体ATP产量下降、分裂和凋亡。
上述证据反映了,对甲酚可能通过消耗细胞中的还原型谷胱甘肽、提高线粒体的氧化应激水平,造成线粒体功能障碍和能量代谢失衡,进而参与ASD的发病机制。
▸自闭症患者的肠道症状与菌群和行为异常有关
自闭症谱系障碍(ASD)患者常出现腹痛、胀气等肠道不适症状,严重者可长期伴随呕吐、便秘、腹泻等肠道功能紊乱表现,且患者的肠道症状与其行为异常之间存在程度上的显著关联。临床研究发现ASD患者肠道菌群组成失衡,提示肠道菌群失调可能是引发ASD相关行为异常的重要潜在诱因。
研究发现,将ASD患者的肠道菌群移植给无菌小鼠可导致小鼠脑中出现ASD相关基因的可变剪接,并表现出ASD样行为。特定的肠道细菌及其代谢产物能够调节小鼠行为并诱发ASD样表现,而移植健康人肠道菌群则不会引发这些变化。
▸过量的对甲酚导致肠道菌群紊乱及ASD症状
进一步研究发现,长期服用对甲酚的小鼠出现肠道菌群紊乱和社交障碍等ASD样症状。将这些小鼠的肠道菌群移植给健康小鼠后,后者也表现出ASD样症状和肠道中对甲酚水平上升。而将另一健康小鼠的肠道菌群移植给长期服用对甲酚的小鼠,则可降低其肠道中对甲酚水平,缓解VTA神经元兴奋性异常,并改善ASD样行为。
肠道中的对甲酚水平和肠道菌群失衡存在相互促进的关系。即肠道中过量的对甲酚促使肠道菌群失衡,失衡的肠道菌群又可进一步升高肠道中的对甲酚水平并加剧菌群的失衡,这可能是对甲酚参与 ASD发病机制的重要途径。
▸过量对甲酚损害肠道屏障功能
除了肠道菌群失调,肠道屏障功能受损也是ASD患者常见肠道症状的可能原因和潜在诱因。活检结果显示,75%的ASD患者小肠上皮细胞中维持肠道屏障完整性的紧密连接组分表达量减少,说明ASD患者普遍存在肠道通透性增加。这导致肠道中细菌、毒素及外源性蛋白质(包括细菌和食物来源)进入血液,成为引发ASD的潜在病因。
研究发现,对甲酚通过抑制结肠上皮细胞的线粒体呼吸链减少ATP产量,并促使细胞产生超氧阴离子引发DNA损伤,导致结肠上皮细胞活性和增殖能力受损,进而影响细胞层的完整性和增加细胞间透过性。这说明,对甲酚可能通过损害肠道上皮细胞来影响肠道屏障功能,这可能是其参与ASD发病的另一潜在机制。
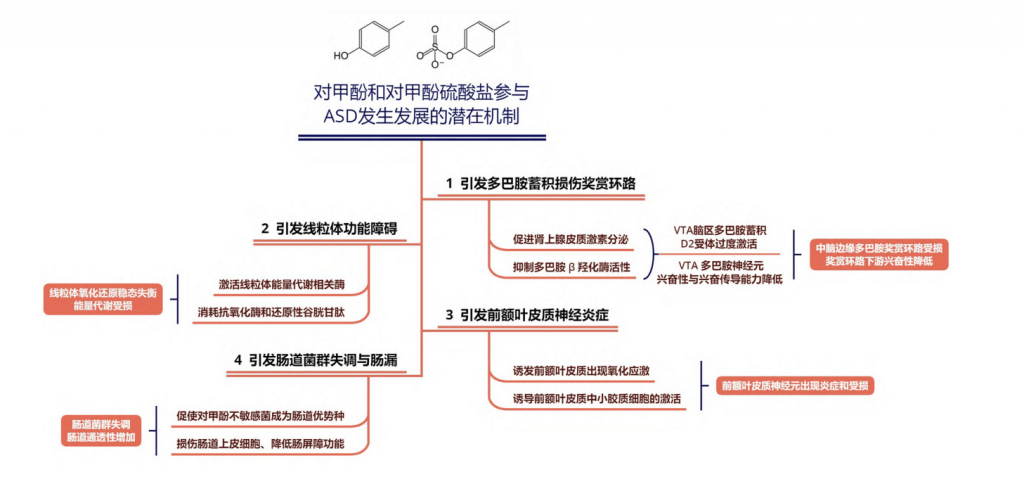
编者小结
综上所述,对甲酚及其代谢产物对甲酚硫酸盐可能通过四种潜在途径参与ASD的发生发展:
①引发多巴胺蓄积和中脑边缘多巴胺奖赏环路受损;
②导致线粒体功能障碍;
③前额叶皮质神经炎症;
④以及肠道菌群失调和肠屏障功能受损。
DOI︰10.20059/j.cnki.pps.2023.08.1011
在慢性肾病(CKD)患者中,肾功能障碍的进展与血浆中蛋白结合和水溶性尿毒症溶质的积累有关。在这些尿毒症溶质中,对甲酚及其代谢物对甲酚硫酸盐(p-CS)在很大程度上被怀疑会加重CKD。因为它们与血清蛋白结合的能力很强,容易在血液中积累。
相比之下,血清中另一种对甲酚共代谢物对甲酚葡糖苷酸(p-CG)的蛋白结合程度远低于p-CS。
▸慢性肾病和透析患者血液中对甲酚浓度更高
慢性肾病和血液透析患者血液中的对甲酚和p-CS浓度远高于健康人。在血液透析患者中,总对甲酚的5-7%以游离形式存在,其余为共轭形式。CKD患者的p-CS血药浓度为50-120µM,血液透析患者为110-220µM,其中约7%以游离形式存在。相比健康人,CKD/血液透析患者的对甲酚和p-CS浓度分别高出4-19倍和4-16倍。
并且血液透析患者肾小管分泌对甲酚硫酸盐的清除率显著低于健康人,表明CKD患者的p-CS分泌受损。
对甲酚和p-CS作为尿毒症毒素参与CKD进程。一项针对CKD患者的研究显示,p-CS基线水平可预测CKD进展,而血液透析患者血清中对甲酚的游离浓度与死亡率相关。
▸对甲酚硫酸盐与肾纤维化有关
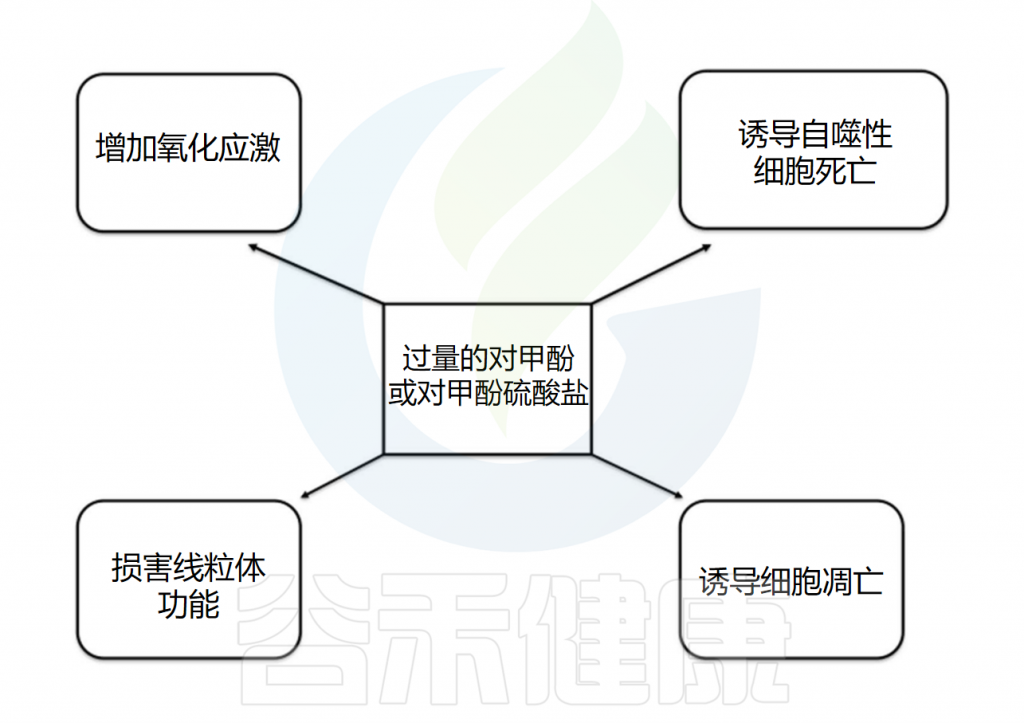
体外研究和部分肾切除小鼠经对甲酚硫酸盐(p-CS)治疗4周的体内数据表明,p-CS可能与肾纤维化相关。由于肾小管分泌是肾处理p-CS的主要途径,p-CS可能通过诱导氧化应激导致肾小管细胞损伤。
在体外,p-CS浓度为5-26µM时,会以与炎症反应相关的方式改变近端肾小管细胞的基因表达;浓度为5-260µM时,会损害线粒体功能和生物发生。此外,对甲酚在12-52µM时对肾小管细胞具有凋亡作用,而在144-577µM时可诱导细胞自噬死亡。
有趣的是,在接受维持性血液透析的终末期肾病患者中,摄入含有抗性淀粉的饮食8周能够降低血清中对甲酚浓度。此外,在透析患者中,在饮食中补充不可消化的碳水化合物可降低血浆中p-CS的浓度,从而表明这种饮食干预在减少结肠源性对甲酚的产生方面是有效的。
▸不可消化的碳水化合物有助于减轻对甲酚过量引起的症状
未消化的碳水化合物可能通过减少对甲酚在结肠的吸收间接降低其循环浓度。在慢性肾病中,尿素流入结肠后被脲酶活性细菌转化为铵,过量的铵会损伤结肠黏膜,增加通透性,并引起结肠黏液层和吸收性结肠细胞的形态学改变,同时减少短链脂肪酸氧化。
下图总结了对甲酚及其代谢物在过量时对肾细胞的有害影响。低蛋白饮食(0.6-0.8g/kg/天)通常被推荐用于延缓CKD进展和推迟透析治疗,这与高蛋白饮食显著增加肠道微生物群合成对甲酚所需l-酪氨酸正好相反。
doi: 10.1007/s00726-021-03064-x.
对甲酚及其次生代谢物作为尿毒症毒素受到广泛关注,其对心血管系统的有害影响主要来自肾病患者的观察性研究和内皮细胞的体外实验。
▸对甲酚浓度与心血管疾病风险相关
观察研究发现,血清游离对甲酚浓度是慢性肾病(CKD)患者心血管疾病的风险预测因子,而在血液透析患者中,血清游离和总对甲酚浓度与心血管事件相关。
尿中对甲酚硫酸盐(p-CS)的高排泄与CKD患者的心血管事件直接相关。血清游离对甲酚浓度与首次心血管事件的发生和心血管疾病相关,并可能预测老年人心血管疾病的死亡率。
▸不同浓度对甲酚对内皮细胞的影响
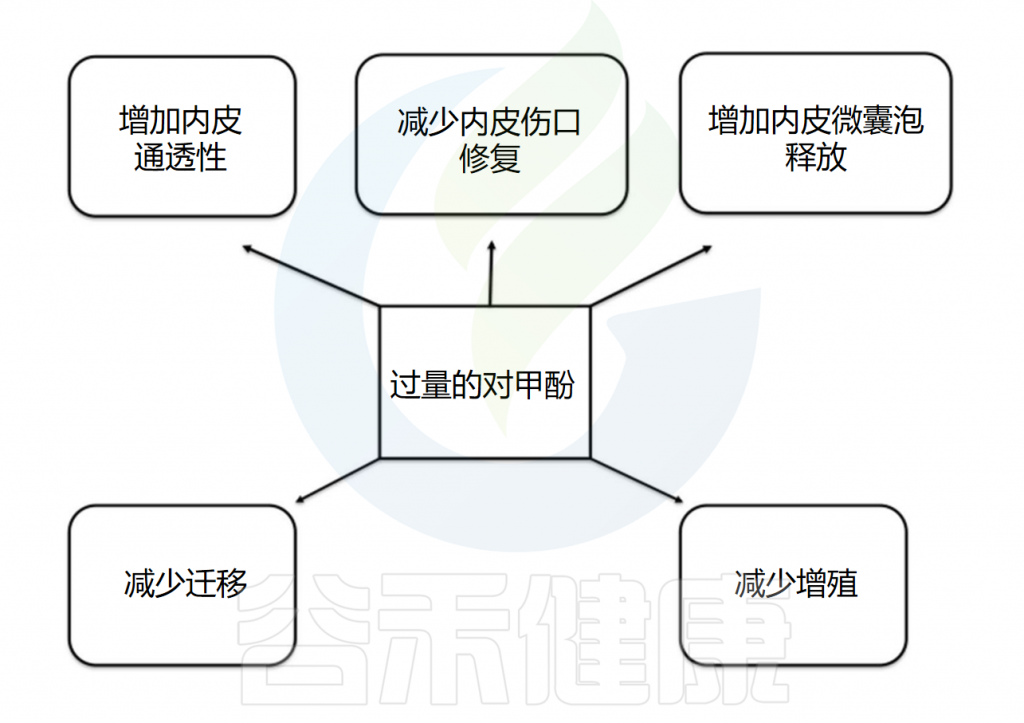
内皮功能障碍在心血管疾病发展中起重要作用,几项实验研究测试了对甲酚对内皮细胞生理的影响。
在白蛋白存在下,对甲酚浓度为100-500µM时,剂量依赖性地抑制内皮细胞增殖和伤口修复。浓度为185-739µM时,抑制作用部分源于细胞周期G0/G1期细胞的积累,伴随细胞周期抑制剂p21/WAF1/Cip1表达增强和cyclin D1表达抑制。此外,对甲酚显著增加内皮通透性,并在90-3000µM范围内导致细胞周期G2/M期积累,损害内皮祖细胞增殖和迁移。浓度为92-740µM时,其对内皮祖细胞增殖的抑制与p38和Erk1/2磷酸化的激活有关。
370µM浓度的对甲酚(自由形式或与白蛋白结合)会增加内皮细胞释放内皮微泡。内皮微泡是从活化或凋亡的内皮细胞和血细胞中释放的膜泡,大小为0.1-1.0µm,反映内皮细胞损伤程度。这些由细胞质膜起泡脱落形成的微泡被认为是调节血管生理的活跃细胞信使。内皮微泡释放的增加会降低内皮细胞迁移能力,促进成熟内皮细胞衰老,从而影响内皮修复。
▸影响内皮细胞的生物学和修复
在血液透析患者中,游离血清对甲酚浓度与循环内皮微泡的数量相关。最近有研究表明,对甲酚在230µM浓度下时,可增强内皮细胞中微囊泡的释放;当在92-920µM范围内时,可以激活内皮细胞中的整合素连接激酶。该激酶是整合素信号复合体的关键组成部分,参与血管完整性和血管生成。在体外获得的大量实验证据清楚地表明,对甲酚可能影响内皮细胞的生物学和修复。
下图概述了对甲酚对内皮细胞的影响:
doi: 10.1007/s00726-021-03064-x.
▸对甲酚过量与心肌细胞功能障碍相关
对甲酚在心肌细胞中的作用研究表明,在230-920µM范围内,对甲酚可逆地降低新生儿心肌细胞的自发收缩率,并引发间隙连接分解,说明其过量与心肌功能障碍的关联。
间隙连接在心肌细胞间的电偶联和脉冲传播中起关键作用。此外,相同浓度下,对甲酚还会破坏心肌细胞的粘附连接,可能进一步影响心肌细胞功能。
1
克里美净等药物降低对甲酚水平
▸克里美净降低对甲酚水平并改善自闭症症状
临床研究表明,给12-17岁的自闭症谱系障碍(ASD)儿童服用克里美净(AST-120),可明显降低受试儿童尿液中对甲酚硫酸盐的水平,同时显著改善了受治儿童的重复刻板行为和社会动机异常等ASD症状,并且未发现明显的不良副作用。
对于具有严重情绪障碍的ASD儿 童 还 可 显 著 降 低 其 焦 虑 和 易 怒 程度。克里美净(又名AB-2004、AST-120)是一种可食用的活性碳颗粒,可非选择性地吸附肠道内的酚类物质及其他芳香族化合物。由于AST-120本 身 并 不 参 与 体 内 生 化 反应,仅起到物理吸附作用,不会被人体所吸收,因此具有良好的安全性。这也从侧面表明临床上降低肠道中对甲酚水平具有改善孤独症症状的能力。
▸阿卡波糖减少对甲酚的生成和浓度
其他研究还发现,小肠α-葡萄糖苷酶抑制剂,如阿卡波糖(Glucobay®)可增加到达结肠的未消化碳水化合物的数量,并可降低蛋白质结合的尿毒症溶质对甲酚的生成和血清浓度。
注:本文不作为医疗建议,药物需在医生建议下服用
2
高纤维,低蛋白饮食调整
▸富含原花青素和多酚提取物的果蔬可预防对甲酚的有害作用

一项研究在暴露于对甲酚的结肠上皮细胞中评估了来自苹果、牛油果、蔓越莓、葡萄或其他含有原花青素和多酚提取物水果的保护作用。
对甲酚会显著增加乳酸脱氢酶(LDH)渗漏并降低 ATP 含量,而在Caco-2细胞中,它显著降低跨上皮电阻并增加葡聚糖的细胞旁转运。蔓越莓和牛油果中提取的原花青素类物质阻止了对甲酚诱导的细胞的改变。
原花青素细菌代谢物减少了LDH泄漏,改善了细胞活力,但未改善细胞内ATP。所有多酚提取物和原花青素细菌代谢物都阻止了对甲酚诱导的屏障功能改变。这些结果表明,含原花青素的多酚提取物和原花青素代谢物可能有助于保护结肠粘膜免受对甲酚的有害影响。
▸增加膳食纤维和抗性淀粉摄入,降低对甲酚水平
已经研究了补充纤维在降低透析前慢性肾脏病 (CKD)患者对甲酚的影响。在血液透析(HD)患者中,纤维补充已被证明可显著降低血浆对甲酚浓度。提供豌豆壳纤维和菊粉可使血清对甲酚减少24%,与低聚果糖和菊粉在HD患者中的效果相似,表明补充纤维对疾病早期患者有潜在益处。
3期和4期CKD患者在补充益生菌和6.6克/天菊粉后,15天和30天内对甲酚减少40%,需要注意的是,益生菌可能也在降低对甲酚方面发挥作用。
该研究支持这样一个结论,即提供高度可发酵的纤维,如菊粉,可能通过抑制蛋白水解和增强糖发酵来减少对甲酚的产生。豌豆壳纤维也可能通过缩短肠道运输时间来帮助减少蛋白水解发酵从而减少对甲酚的产生。
还有研究比较了食用抗性淀粉或表没食子儿茶素没食子酸酯(EGCG)对体内对甲酚含量的影响。研究表明,抗性淀粉可以在大鼠模型中有效降低结肠和尿液中的对甲酚水平。
表没食子儿茶素没食子酸酯(EGCG):这种茶多酚中最有效的活性成分,通过调节肠道微生物群,减少对甲酚生成细菌的含量,从而降低其血浆和尿液浓度。
▸高蛋白和酪氨酸摄入会增加体内对甲酚水平
我们知道,蛋白质中的酪氨酸是对甲酚产生的原料,因此饮食中蛋白质摄入量的增加会提高粪便和尿液中的对甲酚浓度,这可能是由于蛋白质的底物l-酪氨酸在细菌代谢活动中的可用性增加。
3
通过调整肠道菌群,减少对甲酚的产生
▸减少艰难梭菌等产对甲酚的细菌
在人类肠道中存在的细菌中,梭杆菌科、肠杆菌科、梭菌科、拟杆菌科、乳杆菌科和红椿菌科,是对甲酚生产者,部分双歧杆菌科也可产生对甲酚。
其中艰难梭菌的对甲酚产量最高,可达其他细菌的10~1000倍。因此,感染艰难梭菌的患者体内可能会出现对甲酚含量升高的情况。
并且肠道中的对甲酚水平和肠道菌群失衡存在相互促进的关系。对甲酚会抑制一些革兰氏阴性肠道细菌的生长繁殖,并造成艰难梭菌等对对甲酚不敏感的革兰氏阳性肠道细菌具备生存优势,导致肠道菌群组成及多样性的改变;而艰难梭菌正是肠道中产生对甲酚最多的细菌,其相对丰度升高又会进一步造成肠道中对甲酚水平升高。
因此,减少艰难梭菌等产对甲酚的细菌,相当于对“生产机器”进行了阻断,减少了体内对甲酚的产生。
▸产乳酸细菌有助于抑制对甲酚
乳酸是另一种细菌代谢产物,已被证明可以在体外减少细菌对甲酚的产生。利用这一特点,我们推测提升产乳酸细菌的丰度有助于减少对甲酚的产生。
嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei)、长双歧杆菌(Bifidobacterium longum)、婴儿双歧杆菌(Bifidobacterium infantis)和乳链球菌(Streptococcus lactis)是常见的产乳酸细菌,一些发酵乳制品及益生菌产品中常有其存在,通过提高其肠道占比可能有助于减少对甲酚的产生。
▸一些粪肠球菌菌株有助于对甲酚的解毒

还有研究发现,粪肠球菌(Enterococcus faecalis)的三个菌株(UTD-1、UTD-2和UTD-3),能够以很高的速率降低细胞外对甲酚浓度(30μg/ml),说明肠道分离株粪肠球菌可能是减轻对甲酚危害的潜在候选方法。
▸粪菌移植使肠道菌群正常化也降低了自闭症患者的对甲酚水平
此外,临床研究发现粪菌移植治疗可持续降低自闭症儿童肠道中过高的对甲酚水平,并且可以改善患者的肠道不适以及情绪和行为异常。
同时也进一步提示,菌群失调造成菌群代谢物紊乱继而引发肠道功能失调和菌肠脑轴失衡可能是自闭症的重要潜在病因,对甲酚等菌群代谢物具有作为 自闭症诊断和治疗靶标的潜力。
4
短期合生元治疗有助于降低对甲酚水平

一项初步研究调查了Probinul-neutro®(一种使肠道菌群正常化的合生元)是否可以降低血浆对甲酚浓度并减轻未透析慢性肾脏病(CKD)患者的胃肠道症状。
每包含有冻干细菌(5×109植物乳杆菌、2×109干酪乳杆菌亚种和2×109加氏乳杆菌、1×109婴儿双歧杆菌和1×109长双歧杆菌、1×109嗜酸乳杆菌、1×109唾液乳杆菌和1×109产孢乳杆菌和5×109嗜热链球菌)、益生元菊粉(2.2克;VB Beneo Synergy 1) 和1.3克木薯淀粉。
在两组中观察到对甲酚的相反变化:在接受安慰剂治疗的患者中,观察到但不显著的增加趋势,而在合生元组中显著降低。治疗开始后15天,血浆总对甲酚浓度比基线低约40%,然后一直保持在该水平直到研究结束。
这种影响可能源于共生诱导下肠道中产生对甲酚的细菌减少。益生菌和益生元成分均可调节肠道微生物组,合生元干预可显著降低3-4期慢性肾脏病患者的血浆总对甲酚浓度。
自闭症谱系障碍(ASD)患者的肠道菌群及体内对甲酚水平与健康人群相比呈现出显著差异,菌群多样性较低,产对甲酚细菌显著增多,并且对甲酚水平明显偏高。
对甲酚过量可能通过:①引发多巴胺蓄积和中脑边缘多巴胺奖赏环路受损;②导致线粒体功能障碍;③前额叶皮质神经炎症;④以及肠道菌群失调和肠屏障功能受损这几个方式促进自闭症的发展。
对甲酚水平过高还会导致肠道菌群失调和肠道屏障功能受损,菌群失调造成菌群代谢物紊乱继而引发肠道功能失调和肠脑轴失衡及一些代谢物通过“肠漏”进入血液可能是自闭症的重要潜在病因,对甲酚、对甲酚硫酸盐等菌群代谢物具有作为自闭症诊断和治疗靶标的潜力。
此外,对甲酚作为一种“尿毒症毒素”对肾脏和心血管的危害也不容小觑,在肾小管细胞中,对甲酚和对甲酚硫酸盐增加氧化应激,影响线粒体功能,并导致细胞死亡,加重慢性肾脏疾病进展。它还影响内皮细胞的增殖和迁移,降低内皮伤口修复的能力,增加内皮细胞的衰老,并与心肌细胞功能障碍相关。
《黄帝内经》中曾提到,“上医医未病,中医医欲病,下医医已病”。自闭症和慢性肾病一旦确诊,想要完全治愈极为困难,及时并准确地获取体内对甲酚水平和肠道菌群组成,可能是提前预测并预防自闭症和慢性肾脏疾病的一个方法。
谷禾的肠道菌群检测,能够以较为快速且精准的方式,获取人体肠道菌群的组成情况、菌群的多样性和占比以及包括对甲酚、吲哚等重要的菌群代谢物等关键信息。根据这些检测结果和数据,可以更有针对性地制定个性化的治疗方案或预防措施,做到对症下药。这不仅大大提高了治疗的效果,还能减少不必要的治疗手段和药物使用,为人们的健康提供更精准、有效的保障。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Blachier F, Andriamihaja M. Effects of the L-tyrosine-derived bacterial metabolite p-cresol on colonic and peripheral cells. Amino Acids. 2022 Mar;54(3):325-338.
Toft PB, Vanslette AM, Trošt K, Moritz T, Gillum MP, Bäckhed F, Arora T. Microbial metabolite p-cresol inhibits gut hormone expression and regulates small intestinal transit in mice. Front Endocrinol (Lausanne). 2023 Jul 18;14:1200391.
Stewart Campbell A, Needham BD, Meyer CR, Tan J, Conrad M, Preston GM, Bolognani F, Rao SG, Heussler H, Griffith R, Guastella AJ, Janes AC, Frederick B, Donabedian DH, Mazmanian SK. Safety and target engagement of an oral small-molecule sequestrant in adolescents with autism spectrum disorder: an open-label phase 1b/2a trial. (2022) Nature Medicine, Advance online publication.
Chen B, Morioka S, Nakagawa T, Hayakawa T. Resistant starch reduces colonic and urinary p-cresol in rats fed a tyrosine-supplemented diet, whereas konjac mannan does not. Biosci Biotechnol Biochem. 2016 Oct;80(10):1995-2000.
Meijers BK, Claes K, Bammens B, de Loor H, Viaene L, Verbeke K, Kuypers D, Vanrenterghem Y, Evenepoel P. p-Cresol and cardiovascular risk in mild-to-moderate kidney disease. Clin J Am Soc Nephrol. 2010 Jul;5(7):1182-9.
Salmean YA, Segal MS, Palii SP, Dahl WJ. Fiber supplementation lowers plasma p-cresol in chronic kidney disease patients. J Ren Nutr. 2015 May;25(3):316-20.
Vijayasarathy M, Kiran GK, Balaji S, Jabastin J, Bruntha Devi P, Brindha Priyadarisini V. In Vitro Detoxification Studies of p-Cresol by Intestinal Bacteria Isolated from Human Feces. Curr Microbiol. 2020 Oct;77(10):3000-3012.
Chang MC, Chang HH, Chan CP, Yeung SY, Hsien HC, Lin BR, Yeh CY, Tseng WY, Tseng SK, Jeng JH. p-Cresol affects reactive oxygen species generation, cell cycle arrest, cytotoxicity and inflammation/atherosclerosis-related modulators production in endothelial cells and mononuclear cells. PLoS One. 2014 Dec 17;9(12):e114446.
Wong X, Carrasco-Pozo C, Escobar E, Navarrete P, Blachier F, Andriamihaja M, Lan A, Tomé D, Cires MJ, Pastene E, Gotteland M. Deleterious Effect of p-Cresol on Human Colonic Epithelial Cells Prevented by Proanthocyanidin-Containing Polyphenol Extracts from Fruits and Proanthocyanidin Bacterial Metabolites. J Agric Food Chem. 2016 May 11;64(18):3574-83.

谷禾健康

目前越来越多营养概念诸如”低碳水化合物饮食”正在流行,然而,所有的碳水化合物都是不好的吗? 其实并非如此。
其中,抗性淀粉就是一种特殊的碳水化合物,它与我们通常所熟知的淀粉有区别。抗性淀粉之所以得名,是因为它能够抵抗人体消化酶的作用,逃离被吸收的命运,直接进入肠道。这种特性使得抗性淀粉拥有许多健康功效,它不仅能调节血糖,还能促进有益菌的生长,改善肠道功能,甚至还能增强饱腹感,帮助控制体重。
抗性淀粉天然存在于豆类(如扁豆、鹰嘴豆)、某些谷物(如大麦、燕麦)、块茎(如土豆、山药)等食物中。此外,各种食品加工和烹饪方法可以提高食品中的抗性淀粉含量,进一步使这种淀粉的潜在膳食来源多样化。
作为一种膳食纤维,抗性淀粉可以作为微生物发酵的底物,例如拟杆菌属,瘤胃球菌,双歧杆菌等可以发酵抗性淀粉。
一些肠道细菌促进抗性淀粉发酵产生短链脂肪酸。短链脂肪酸的主要功能是改善肠上皮屏障的完整性,缓解局部和全身炎症,产生全身效应,影响代谢健康、免疫功能,甚至可能影响大脑健康。
目前代谢性疾病负担正在增加,一些膳食可以通过调节肠道菌群干预疾病,其中抗性淀粉也很重要,它结合了传统和科学,促使研究人员和消费者重新审视传统饮食习惯并认识到其潜在的健康影响。
本文探讨了抗性淀粉和肠道微生物组之间复杂的相互作用,包括抗性淀粉影响微生物群落的机制、这些相互作用对健康的影响。此外,还讨论了富含抗性淀粉的饮食对肠道健康的影响。随着对肠道菌群在健康和疾病中的作用了解越来越多,强调从天然来源获取抗性淀粉的饮食将会不断增长,为营养干预提供新途径。
▼
什么是抗性淀粉?
抗性淀粉(RS)是一种不被人体消化酶分解的淀粉,被认为是膳食纤维。
淀粉作为葡萄糖的储存形式天然存在于植物中。食品中的淀粉可分为慢消化淀粉(SDS)、快速消化淀粉(RDS)或抗性淀粉(RS)。
一般淀粉在小肠中迅速分解并转化为葡萄糖,并迅速吸收到血液中,而抗性淀粉则抵抗正常消化,因此得名。它不会分解成葡萄糖,而是不受干扰地通过消化道,直到到达结肠。
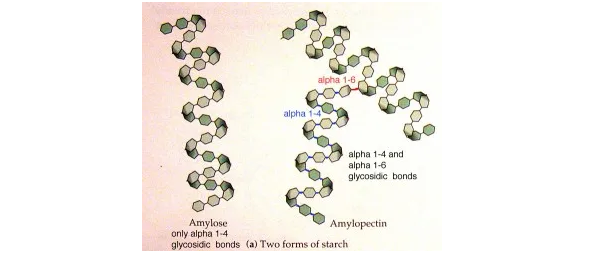
首先,淀粉的基本结构基于两种不同的葡萄糖聚合物——直链淀粉和支链淀粉。
直链淀粉主要是由α-1,4-葡萄糖单元组成的线性分子,与支链淀粉的分支结构形成对比,支链淀粉还包含α-1,6键连接。
这两种组分的比例及它们在淀粉颗粒内的排列方式显著影响淀粉的可消化性。这些分子越密集、排列越紧密,消化酶就越难接近它们。
抗性淀粉(RS)是一种独特的膳食纤维,不是在小肠中消化,而是在大肠中发酵。不同食物类别(包括谷物、豆类、块茎和某些加工食品)中抗性淀粉的含量差异很大。
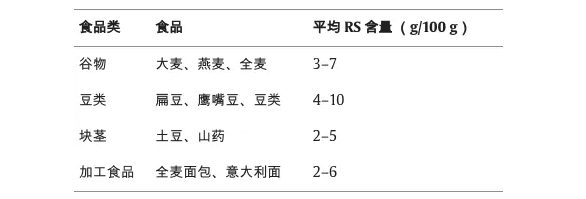
doi.org/10.1016/j.fochx.2024.101118
谷物,特别是大麦、燕麦和全麦等全谷类食物,是抗性淀粉的重要来源,尤其是在它们经过最低限度加工的情况下。比如,煮熟并冷却大米会增加其抗性淀粉含量,这是由于直链淀粉的逆淀粉化作用。
扁豆、鹰嘴豆等豆类也富含抗性淀粉。它们的抗性淀粉含量归因于它们的高直链淀粉和支链淀粉比率,这有助于它们缓慢的消化率。烹饪和冷却过程进一步增加了其抗性淀粉含量。
块茎,包括马铃薯和山药,含有抗性淀粉,尤其是在煮熟和冷却时,这是一个诱导淀粉回生的过程。这使得冷土豆沙拉等菜肴成为良好的抗性淀粉来源。
某些加工食品,特别是那些由全谷物制成或含有 抗性淀粉作为成分的食品,可能是重要的抗性淀粉来源。经过挤压烹饪等过程的全麦面包和意大利面保留了大量的抗性淀粉。
了解这些来源及其抗性淀粉含量对于饮食计划和营养优化至关重要。
在此基础上,抗性淀粉可以根据其起源和特性大致分为四种主要类型:
RS1型(RS1):由于食物基质和蛋白质外壳形成的保护屏障,这种形式的 RS 在物理上无法被酶接近。常见的来源包括全谷物和种子。
RS2型(RS2):RS2 的特点是其天然颗粒形式,主要存在于某些生食中。例子包括生土豆、青香蕉、高直链淀粉玉米。这些来源的高直链淀粉含量导致紧密堆积的颗粒结构,限制了酶的获取。
RS3型(RS3):也称为逆行淀粉,当某些食物煮熟然后冷却时会形成 RS3。这种冷却过程导致淀粉分子的重新排列和重结晶,进一步使它们对酶分解具有抵抗力。煮熟和冷却的土豆、意大利面和米饭等食物是 RS3 的主要来源。
RS4型(RS4):这种类型包括食品中天然不存在的化学改性淀粉,例如一些商业生产的面包和糕点。各种工业过程在淀粉分子中引入交联或取代,以增强其对消化的抵抗力。
部分分类有:
RS5型(RS5): 这是一个较新的类别。它需要通过加热和冷却含有特定脂质(例如脂肪或蜡)的淀粉类食品的过程产生的抗性淀粉。例如含有脂肪成分的面包或含有人工制造的淀粉-脂质复合物的食物。

虽然这些类别有助于讨论和研究,但许多现实世界的食物都含有抗性淀粉类型的混合物。此外,食品加工方法,储存条件和其他食品成分的存在等因素可以显着调节这些食品中的抗性淀粉含量。
抗性淀粉的潜在健康益处和生理影响主要来自其在大肠中的发酵。然而,这些益处的程度和特异性可能因抗性淀粉类型而异。例如,不同的抗性淀粉类型可能优先促进特定微生物物种的生长或导致挥发性脂肪酸的产生速率不同。
总之,抗性淀粉的生化结构和分类对于确定其与肠道微生物组的相互作用以及随后的健康结果至关重要。全面了解这些基础方面对于旨在利用抗性淀粉潜在益处的饮食干预的研究和应用至关重要。
保持血糖稳定
由于抗性淀粉消化缓慢,因此可以保持血糖水平稳定。这可以帮助减少餐后血糖峰值,这对糖尿病患者特别有益。
抗性淀粉具有第二餐的效果:根据一项小型研究的结果,早餐吃抗性淀粉可以降低午餐时的血糖。
2022年1月发表在《Frontiers in Nutrition》 的一篇评论指出,在饮食中添加抗性淀粉是一种简单的生活方式调整,可以帮助糖尿病管理。
促进心脏健康
2018年6月《Nutrition Research》发表的荟萃分析结果,抗性淀粉可以通过降低胆固醇水平有益于心脏健康。它还可以改善血糖控制,正如2017年《Nutrition Journal》上发表的一项针对超重成年人的小型研究所证明的那样,它通过促进肠道中健康细菌的生长来实现这一点,这些细菌产生具有有益作用的短链脂肪酸。
根据2022年3月发表在《国际分子科学杂志》上的一篇评论,短链脂肪酸有助于调节交感神经系统。抗性淀粉可能有助于治疗因神经系统过度活跃而加剧的心脏病,例如慢性心力衰竭、高血压和冠状动脉疾病。
减肥效果
抗性淀粉非常有饱腹感,可能会降低食欲。与其他碳水化合物相比,它的热量也较低,通过这些方式,抗性淀粉可能有助于减肥。
虽然早期研究表明抗性淀粉可能在减肥中发挥作用,但还需要进一步的研究来证实任何此类益处。2017 年《营养杂志》上发表的研究表明,每天吃 30 克抗性淀粉,持续六周,18 名超重成年人减少饥饿激素和无意识地吃零食,但不会改变身体成分。
支持肠道健康
抗性淀粉的作用类似于纤维,而纤维会被肠道中的健康细菌发酵。“这些有益的肠道细菌可以产生短链脂肪酸,这对肠道健康有帮助。
例如,短链脂肪酸可以帮助保持肠道内壁坚固,并有助于粘液产生和炎症,还可能有助于降低结直肠癌的风险。这在后面章节我们会详细阐述。
成人每天应摄入约15克抗性淀粉。然而,据估计大多数人每天的摄入可能不到这个量。
抗性淀粉食品含量表
(每100克食品的平均含量)
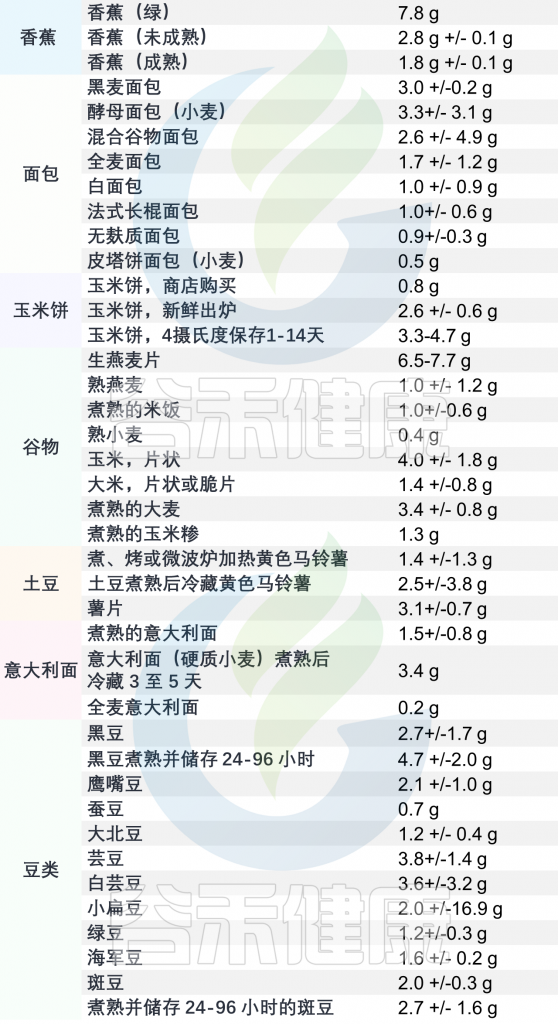
注:如果要增加摄入量时,请逐步增加,一下子吃太多可能会腹胀和胀气。
挤压烹饪,广泛用于生产即食谷类食品和零食,可以增加最终产品的抗性淀粉含量,取决于应用的条件,诸如含水量、螺杆速度和温度等参数可以进行调整以优化抗性淀粉的形成。
退火过程涉及水化淀粉颗粒而不使其明胶化,已发现这一过程可以增加一些谷物中的抗性淀粉含量。
发酵,是各种文化中历史悠久的烹饪和保鲜方法,具有提高抗性淀粉水平的固有能力。这一过程通常涉及有益细菌或酵母分解和发酵糖类,可以改变淀粉结构,使更多的淀粉对消化具有抗性。例如,将谷物发酵制成酸面包或某些传统非洲菜肴不仅赋予了独特的风味,还增加了它们的抗性淀粉含量。
虽然探索和应用这些方法可以显著增加抗性淀粉含量,但必须考虑更广泛的营养后果。并非所有增加抗性淀粉的方法都是普遍有益的。有些加工方法可能会剥夺食物的重要营养素,或引入不良化合物。
在增强抗性淀粉获得肠道健康益处,和确保食物整体营养价值保持完整之间取得平衡至关重要。
抗性淀粉(RS)与肠道微生物组之间错综复杂的相互作用主要发生在结肠,结肠是大多数未消化碳水化合物达到代谢目的的地方。
肠道微生物群发酵抗性淀粉
人类结肠内有着丰富多样、复杂的微生物群,对发酵未消化膳食成分,尤其是抗性淀粉,起着至关重要的作用。
抵达结肠后,抗性淀粉将被居住在肠道的微生物群体进行厌氧发酵。这一发酵过程导致了短链脂肪酸的产生,主要是乙酸、丙酸和丁酸,以及氢气、甲烷和二氧化碳等气体。
在短链脂肪酸中,丁酸在结肠健康中发挥着关键作用。作为结肠细胞的主要能源来源,丁酸还具有抗炎性能,加强结肠防御屏障,并潜在降低结肠癌的风险。此外,短链脂肪酸通过调节肠道pH值,有利于有益菌的生长,同时抑制致病菌株的增殖。
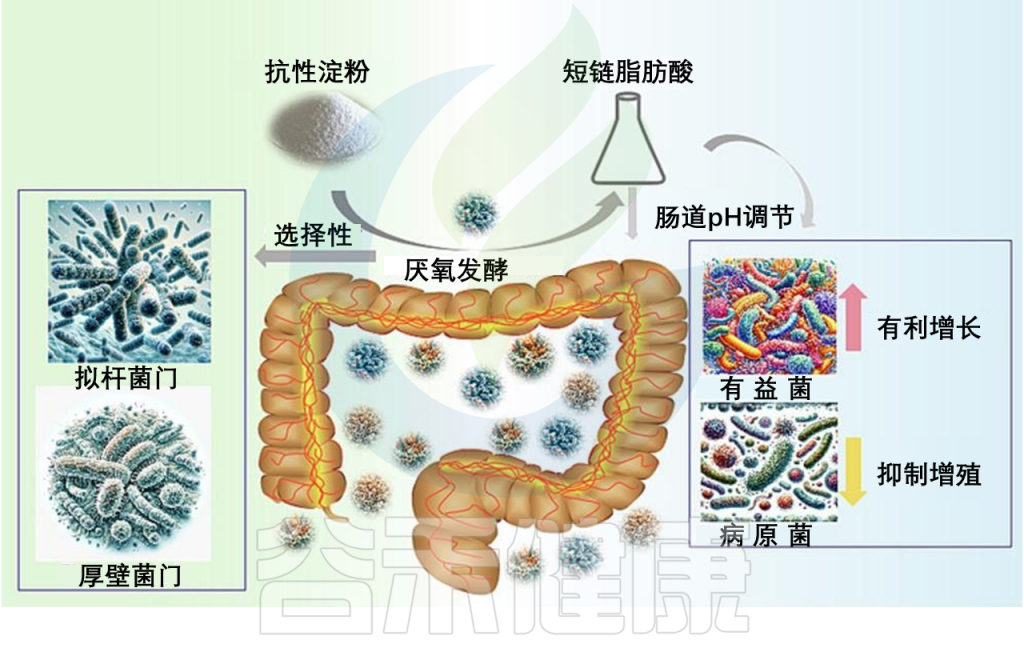
doi.org/10.1016/j.fochx.2024.101118
选择性发酵:抗性淀粉增多→有益菌随之增加
抗性淀粉发酵的另一个有趣的方面是其选择性。并非所有肠道微生物都能够有效发酵抗性淀粉;特定菌群,特别是来自拟杆菌门和厚壁菌门的细菌群,是主要的抗性淀粉发酵者。
这种选择性发酵会导致肠道微生物组成的变化。持续的抗性淀粉摄入可以促进这些抗性淀粉发酵细菌的增殖,使肠道富含有益微生物,进一步提高发酵效率和短链脂肪酸的产生。因此,抗性淀粉和肠道微生物群之间的动态相互作用有望进行有针对性的干预,有可能通过饮食策略调节肠道微生物组成和活性。
抗性淀粉为微生物发酵提供了底物,作为回报,肠道微生物会产生有益于宿主健康的代谢物。
前面我们了解了结肠中抗性淀粉发酵的机制,这里了解这一过程中的关键微生物参与者也很重要。
拟杆菌门
积极参与抗性淀粉发酵的主要群体属于拟杆菌门,尤其是拟杆菌属,拟杆菌的代谢能力使它们能够在各种复杂的碳水化合物中茁壮成长,包括抗性淀粉。它们的酶库有助于将抗性淀粉分解成更简单的单元,然后发酵以产生短链脂肪酸。
厚壁菌门
抗性淀粉发酵的另一个重要贡献者是厚壁菌门,尤其是瘤胃球菌属,瘤胃球菌是这一领域的关键物种,因其在启动抗性淀粉降解方面的无与伦比的效率。瘤胃球菌(R. bromii)进行的初步降解使抗性淀粉更易于其他微生物群进一步发酵。考虑到在摄入富含抗性淀粉饮食的个体中的统治地位,其重要性变得明显。此外,瘤胃球菌的丰度较高与改善的肠道健康状况相关,表明其潜在的保护作用。
放线菌门
虽然拟杆菌门和厚壁菌门脱颖而出,但另一个门放线菌门通过双歧杆菌属促进抗性淀粉发酵。双歧杆菌是备受推崇的益生菌,已知具有无数的健康益处。在抗性淀粉的背景下,双歧杆菌发酵它以产生短链脂肪酸,从而降低肠道 pH 值,从而创造不利于病原菌的环境。此外,抗性淀粉的双歧杆菌效应,即补充抗性淀粉导致双歧杆菌增加,已在各种研究中得到充分证明。
产甲烷古细菌
古菌,特别是产甲烷的Methanobrevibacter smithii,在抗性淀粉发酵领域也发挥作用。
M. smithii消耗其他微生物在抗性淀粉发酵过程中产生的氢气,将其转化为甲烷。这种氢气的去除至关重要,因为它防止了结肠中氢气的积累,否则可能会阻碍发酵过程。因此,M. smithii通过维持其他发酵者的适宜环境,间接支持抗性淀粉发酵过。
总而言之,结肠中的抗性淀粉发酵并不是归因于单个微生物分类群的孤立过程。这是一项涉及多个微生物群体的协同合作,每个微生物群体都为该过程及其健康益处做出了独特的贡献。
只有少数菌群如瘤胃球菌和青春双歧杆菌能够利用淀粉,这些细菌本身并不直接产生丁酸盐,而是依靠与其他肠道细菌的交叉喂养相互作用来产生丁酸盐。
他们的集体行动强调了肠道是一个代谢“器官”的概念,其中饮食成分,主要是抗性淀粉,以协调的方式代谢。
丁酸梭菌(Clostridium butyricum)是一种降解抗性淀粉的菌,能够在多种类型和来源的抗性淀粉上生长,在这个过程中产生大量的丁酸盐。它通过使用一种酶系统来实现这一点,该酶系统虽然是迄今为止在能够降解抗性淀粉的细菌中发现的最简单的酶系统,但在抗性淀粉的消化过程中表现出高度的协同作用和功能多样性。在一个生物体中,消化抗性淀粉和丁酸生产的结合有可能绕过交叉喂养网络的复杂性,而交叉喂养网络通常是抗性淀粉消耗过程中生产丁酸所必需的。
这种独特的性状组合表明,它可能作为一种与抗性淀粉协同使用的菌株,促进更广泛的丁酸反应,从而为更多人群解锁这种益生元的健康益处。
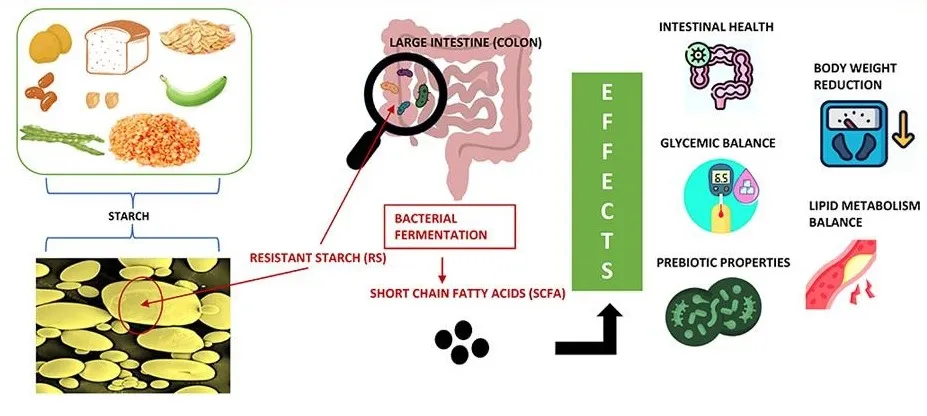
doi.org/10.1016/j.jff.2022.105094
我们了解到肠道微生物群领域及其与抗性淀粉的错综复杂互动是广阔而多层次的。抗性淀粉可以影响肠道微生物群的组成和功能,但同样明显的是,这些影响的程度和性质受到各种因素的调节。揭示这些因素可以增进我们对肠道健康复杂性的理解,并帮助更有效地定制膳食和治疗干预措施。
个体肠道微生物群的基线组成
一个主要决定因素是个体肠道微生物群的基线组成。每个人的肠道微生物群具有独特的特征,受到遗传、早期生活暴露、抗生素和饮食模式等因素的影响。引入膳食时,抗性淀粉可能会因个体肠道微生物的起始点而在个体之间产生不同效应。例如,基线拟杆菌水平较低的个体,在摄入抗性淀粉后,可能会比那些已经拥有更高丰度的个体出现这些细菌增加更显著。
不同类型的抗性淀粉会被特定菌群优先代谢
消费的抗性淀粉类型是另一个重要因素。根据其物理化学性质和来源,抗性淀粉有多种类型:RS1、RS2、RS3、RS4。每种类型可能会被特定微生物类群优先代谢。例如,瘤胃球菌对高直链淀粉玉米中的RS2表现出明显的偏好,而某些拟杆菌物种可能更青睐来自逆行淀粉的RS3。因此,膳食中包含的抗性淀粉类型可以引导微生物群变化的轨迹。
其他营养素的影响
抗性淀粉消费的膳食背景也不容忽视。其他膳食纤维、蛋白质、脂肪和微量营养素的存在可以影响抗性淀粉的可获得性和发酵性。例如,富含可溶性纤维的饮食可能通过促进有益菌(如乳杆菌)的生长来放大抗性淀粉的益生效应。相反,富含蛋白质的饮食可能会使一些结肠细菌转向蛋白质发酵,产生像氨之类的潜在有害化合物。
抗性淀粉摄入的持续时间
抗性淀粉摄入的持续时间也起着关键作用。初始引入抗性淀粉可能会导致微生物群组成的快速变化。然而,随着摄入时间的延长,微生物群可能会稳定下来,表明适应性。长期摄入抗性淀粉可以导致更具弹性和多样化的微生物群,这些微生物群更能抵抗干扰和潜在的菌群失调。
其他宿主相关因素
最后,宿主相关因素,如年龄、健康状况和遗传,调节着抗性淀粉与微生物群的相互作用。与微生物群的年龄相关变化、肠道传输时间的差异和酶活性可能会影响抗性淀粉在肠道中的发酵。同样,患有肠道紊乱症状如肠易激综合征(IBS)或炎症性肠病(IBD)的个体可能对抗性淀粉有不同反应,鉴于这些情况下肠道环境和微生物群的组成发生了改变。
总之,抗性淀粉与肠道微生物群之间的互动是一个受多种因素影响的动态过程。认识和理解这些因素对于个性化营养策略旨在利用抗性淀粉的肠道健康益处是至关重要的。这些见解呼唤着在营养和肠道健康领域采取更个性化的方法,更胜于一刀切的建议。
抗性淀粉已成为膳食的关键成分,其影响远远超出了其营养价值。抗性淀粉最重要的作用之一在于它能够维持肠道的屏障功能。这种错综复杂的粘膜细胞和细胞间连接是我们全身健康的关键,可防止病原体入侵并维持代谢平衡。鉴于肠道相关疾病的负担不断加重,了解抗性淀粉如何影响这一屏障可以为疾病预防和治疗干预提供关键的见解。
肠道屏障是一个动态和反应灵敏的系统,而不是一个静态的实体。在其核心,上皮细胞形成前线,作为对管腔环境的主要防御。
抗性淀粉促进粘蛋白分泌
抗性淀粉通过支持细胞更新和促进粘蛋白的分泌来增强上皮屏障,粘蛋白是一种糖蛋白,可润滑和保护上皮表面免受潜在病原体和研磨性食物颗粒的侵害。粘蛋白层不仅形成保护毯,还为共生细菌提供栖息地,有助于宿主和微生物群之间的双向关系。
抗性淀粉正向调节紧密连接蛋白
紧密连接蛋白,结合上皮细胞的微观结构,对于维持屏障完整性至关重要。这些蛋白质决定了屏障的渗透性,决定了哪些物质被允许通过,哪些物质仍然被排除在外。在“肠漏”的情况下,这些蛋白质会受到损害,导致肠道通透性增加。这种情况会允许不需要的物质(包括病原体和毒素)进入血液,引发全身炎症。研究表明,抗性淀粉正向调节这些蛋白质。抗性淀粉发酵产生短链脂肪酸,特别是丁酸盐,在上调紧密连接蛋白的表达、强化肠道屏障方面发挥作用。
抗性淀粉间接影响局部免疫反应
驻留在肠道粘膜内的免疫细胞为屏障的防御机制增加了另一层。在这里,抗性淀粉展示了其免疫调节能力。通过改变肠道微生物群组成,抗性淀粉间接影响局部免疫反应。它促进有益细菌的生长,进而与免疫细胞相互作用,指导它们的功能。这种串扰确保了潜在病原体的迅速消除,同时保持了对膳食抗原和共生微生物的耐受性。
抗性淀粉通过神经,免疫,血管等相互作用,间接提供保护
除了这些直接影响外,抗性淀粉诱导的肠道微生物群变化也会影响肠脑轴。肠道和中枢神经系统之间的这种双向沟通渠道对整体健康至关重要。肠道屏障功能的破坏与神经系统疾病有关,强调了抗性淀粉等膳食成分在神经保护中的重要性。
此外,肠道内的血管结构,包括血液和淋巴管,在屏障功能中发挥作用。它们确保营养吸收和免疫细胞运输。抗性淀粉通过其代谢物调节血管内皮屏障,优化营养吸收并确保有效的免疫监测。
总之,抗性淀粉与肠道屏障的细胞、免疫和血管成分错综复杂的相互作用,为应对环境挑战提供了强大的防御能力。拥抱抗性淀粉的治疗潜力可以重新定义面向胃肠道健康及其他方面的策略。
炎症是免疫系统对病原体、伤害或有害刺激发起的保护性反应,当放松管制时,可能会成为一把双刃剑。特别是在肠道内,持续的炎症会加剧从炎症性肠病发展到结直肠癌等多种疾病。人们的注意力已经转向可以调节炎症的饮食成分,其中抗性淀粉已成为一个至关重要的参与者。
抗性淀粉促进抗炎短链脂肪酸 (丁酸盐) 产生
与其他淀粉不同,抗性淀粉在小肠中抵抗消化,基本完好无损地到达结肠。一旦进入结肠,抗性淀粉就会充当某些有益肠道细菌的底物,导致短链脂肪酸的产生,主要是乙酸盐、丙酸盐和丁酸盐。值得注意的是,丁酸盐因其显着的抗炎作用而得到认可。丁酸盐通过抑制促炎细胞因子的产生来发挥作用,例如TNF-α和IL-6,它们在炎症传播中起着核心作用。
抗性淀粉影响免疫细胞分化
抗性淀粉发酵和随后的短链脂肪酸产生已被证明会影响免疫细胞分化,尤其是调节性 T 细胞(Tregs)。这些细胞在维持肠道免疫稳态方面起着不可或缺的作用。Tregs数量的增加与炎症减少有关,这证明了它们抑制异常免疫反应的能力。短链脂肪酸,特别是丙酸盐,影响幼稚T细胞分化为Tregs,确保肠道内平衡的免疫反应。
抗性淀粉影响肠道神经系统
肠道神经系统功能微妙,确保肠道蠕动和分泌,同时与免疫系统密切相互作用。肠道神经系统的破坏会导致肠道运动障碍,从而为细菌过度生长和炎症创造有利的环境。抗性淀粉通过其代谢物,尤其是丁酸盐,影响肠道神经系统功能。它有助于维持肠道神经元的健康和功能,随后促进肠道的定期肌肉收缩,最大限度地减少细菌停滞和炎症的机会。
抗性淀粉维持平衡的肠道pH值
此外,抗性淀粉可以通过调节肠道的 pH 值来影响肠道炎症。抗性淀粉发酵产生的短链脂肪酸导致结肠中的微酸性环境。这种酸度阻止了病原菌的生长,同时促进了有益共生细菌的增殖。这两个细菌群之间的平衡对于维持肠道健康至关重要,任何向致病性优势的转变,称为生态失调,都可能引发炎症。通过维持酸性 pH 值,抗性淀粉间接阻止炎症的发生和发展。
总之,抗性淀粉在调节肠道炎症中的复杂作用揭示了其潜在的治疗应用。它能够改变微生物组成,促进抗炎短链脂肪酸的产生,影响免疫细胞分化,并维持平衡的肠道pH值,这表明其在确保肠道稳态方面的多方面方法。随着肠道相关炎症的患病率不断上升,利用抗性淀粉的益处可以为提供预防和治疗潜力的新型饮食干预铺平道路。
肠道和免疫系统之间的界面是人体内最具活力的相互作用之一。我们整个免疫系统的近70%都存在于肠道内,随时准备对来自食物和病原体的各种抗原做出反应。正是在这种背景下,抗性淀粉等膳食成分占据了中心位置。抗性淀粉不仅仅是消化过程中的旁观者,它还以多种方式塑造和影响肠道的免疫反应。
抗性淀粉发酵产物,减少促炎细胞因子
抗性淀粉天然抵抗上消化道的消化,到达结肠基本保持不变。在结肠中,抗性淀粉由特定菌群发酵,导致短链脂肪酸的产生增加,主要是乙酸盐、丙酸盐和丁酸盐。除了作为结肠细胞的能量底物外,这些短链脂肪酸还调节各种免疫细胞功能。例如,短链脂肪酸可以降低炎性细胞因子的表达并增加抗炎介质,从而有效地抑制过度的免疫反应。特别是丁酸盐对中性粒细胞功能具有深远的影响,并减少炎症介质如TNF-α和IL-6的产生。
肠道相关淋巴组织 (GALT) 是免疫系统不可或缺的一部分,在维持肠道稳态方面起着至关重要的作用。在 GALT 内,树突状细胞不断对肠道的管腔内容物进行采样。这些细胞在遇到细菌代谢物(如抗性淀粉发酵产生的短链脂肪酸)时,其活性受到调节,导致调节性T细胞的产生增加,这些T细胞在控制炎症和自身免疫方面起着关键作用。此外,已经注意到短链脂肪酸对巨噬细胞的直接影响,观察到抗炎细胞因子产生增加和促炎细胞因子产生减少。
抗性淀粉增强屏障功能,减少LPS易位
抗性淀粉发酵产物会影响肠道屏障的完整性。维持肠上皮层连续性的紧密连接蛋白被短链脂肪酸上调,从而增强屏障功能,并减少细菌内毒素如脂多糖(LPS)进入体循环的易位。LPS易位减少导致内毒素血症相关免疫激活减少,有益于整体健康。
抗性淀粉促进有益菌生长,IgA升高
抗性淀粉作为一种益生元,选择性地滋养有益菌,进而积极调节免疫反应。例如,双歧杆菌和乳酸杆菌等有益细菌的富集通常与抗性淀粉消耗有关,与免疫球蛋白 A(IgA)的产生增强有关,IgA是粘膜防御中的一抗。升高的IgA水平在中和病原体和维持粘膜稳态方面起着关键作用。
从本质上讲,抗性淀粉与免疫系统之间的相互作用强调了饮食、微生物群和免疫力之间复杂的相互作用。通过其发酵产物和肠道微生物群的调节,抗性淀粉有可能成为调节免疫反应和维持肠道健康的重要膳食成分。它带来了全身益处,并为免疫调节的饮食策略开辟了途径。
抗性淀粉越来越被认为是一种重要的膳食成分,不仅因为它对肠道健康的直接影响,还因为它更广泛的代谢影响,特别是与代谢综合征有关。代谢综合征是一组疾病,包括血压升高、高血糖、腰部脂肪过多以及胆固醇或甘油三酯水平异常,会增加患心脏病、中风和糖尿病的风险。抗性淀粉减轻代谢综合征方面的潜力主要归因于其肠道微生物群发酵产物,如乙酸盐、丙酸盐和丁酸盐。
尤其是丁酸盐,在维持肠道屏障完整性方面发挥着重要作用,并具有抗炎特性,这对于对抗与代谢综合征相关的炎症过程至关重要。丁酸盐还通过增强结肠中的能量消耗和脂肪氧化,与改善胰岛素敏感性有关,胰岛素敏感性是代谢综合征的关键因素。此外,丙酸盐具有糖异生作用,有可能调节血糖水平,这对患有或有2型糖尿病风险的人至关重要。
此外,抗性淀粉在食欲调节中的作用也值得一提。随着短链脂肪酸的产生,它们会刺激厌食激素的释放,如肽YY(PYY)和胰高血糖素样肽-1(GLP-1),从而增加饱腹感并减少卡路里摄入量。这种食欲调节作用,加上对血脂和血压的潜在益处,使抗性淀粉消费成为预防或管理代谢综合征的有前途的策略。
体重管理和肥胖的全球挑战与饮食成分及其代谢结果有着内在的联系。肥胖的增加伴随着 2 型糖尿病、心血管疾病和几种癌症风险的增加,使其成为最重要的健康问题。从这个角度来看,抗性淀粉不仅作为一种膳食纤维脱颖而出,而且作为对抗肥胖症的潜在变革性膳食成分脱颖而出。
一些研究表明,抗性淀粉可能对体重管理有直接影响。一个主要机制是食物的热效应,这是消化和加工食物时消耗的能量的量度。抗性淀粉对立即消化具有抵抗力,往往会增加这种热效应,导致在大肠发酵过程中消耗更高的能量。这不仅有助于负能量平衡,还会影响脂肪储存并增强脂肪氧化,这对体重管理至关重要。此外,如前几节所述,抗性淀粉发酵导致短链脂肪酸的产生,短链脂肪酸通过释放 PYY 和 GLP-1 等激素在控制食欲方面发挥积极作用。调节食欲等同于减少热量摄入,这是体重管理的一个重要方面。
此外,抗性淀粉与改善肠道健康有关,这对肥胖有间接影响。健康的肠道生物群与更瘦的表型有关。当肠道微生物群发酵抗性淀粉时,它会导致微生物组成的变化,有利于与肥胖呈负相关的有益菌。
近日,一项针对 37 名超重或肥胖参与者的随机安慰剂对照交叉设计试验(ChiCTR-TTRCC-13003333) 中,研究人员测试了抗性淀粉作为膳食补充剂是否会影响肥胖相关的结果。
研究表明补充抗性淀粉 8 周有助于实现体重减轻(平均 -2.8 公斤)并改善体重超重个体的胰岛素抵抗。
补充青春双歧杆菌(一种与减轻研究参与者肥胖显著相关的物种)可以保护雄性小鼠免受饮食引起的肥胖。从机制上讲,抗性淀粉诱导的肠道微生物群变化会改变胆汁酸分布,通过恢复肠道屏障来减少炎症,并通过调节ANGPTL4抑制脂质吸收,提高脂肪组织对FGF21的敏感性。
次级胆汁酸,例如甘氨脱氧胆酸、脱氧胆酸、甘氨胆酸和牛磺脱氧胆酸,对于提高胰岛素敏感性和改善肝脂肪变性具有重要作用。胆盐水解酶负责次级胆汁酸的去偶联。补充抗性淀粉降低了胆盐水解酶的产生,增加了次级胆汁酸的水平。
抗性淀粉至少可以部分通过青春双歧杆菌促进体重减轻,并且肠道微生物群对于抗性淀粉的作用至关重要。
因此,持续食用富含抗性淀粉的食物可能会导致肠道环境不太容易使体重增加和肥胖。
糖尿病是一种以慢性高血糖为特征的代谢紊乱,是一个不断升级的全球健康问题,具有从个人健康恶化到国家经济负担的多方面影响。鉴于发病率不断上升,迫切需要饮食干预来缓解或可能逆转这种疾病的进展。抗性淀粉是一种引人注目的膳食成分,其多种代谢影响与糖尿病管理和血糖控制有关。
糖尿病管理的核心是调节餐后血糖和胰岛素反应。摄入抗性淀粉似乎有利地调节这些反应。与快速消化的淀粉不同,抗性淀粉不会直接导致餐后血糖峰值,因为它绕过了小肠的消化,它在大肠中的发酵会产生短链脂肪酸。特别是,丙酸盐可促进肝脏葡萄糖产生调节,降低餐后葡萄糖偏移的风险。此外,丁酸盐在促进胰高血糖素样肽-1(GLP-1)分泌中的作用。
注:GLP-1是一种增强胰岛素分泌和减少胰高血糖素释放的激素,协调血糖水平。
此外,长期服用抗性淀粉与提高胰岛素敏感性有关,这是 2 型糖尿病发病机制的关键因素。研究表明,食用富含抗性淀粉的饮食的胰岛素抵抗个体表现出胰岛素敏感性的显著改善。这种改善被认为与短链脂肪酸的抗炎特性有关,尤其是丁酸盐,以及它在减少氧化应激中的作用,氧化应激有助于胰岛素抵抗。此外,抗性淀粉培养有益肠道微生物群组成的能力对代谢健康有间接影响,进一步强调了其在糖尿病管理中的潜在作用。
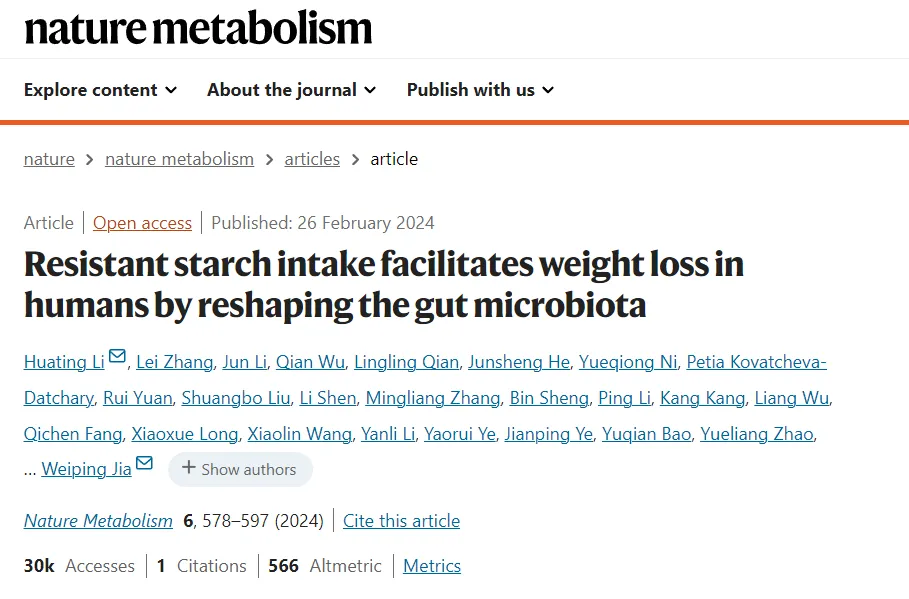
莲子抗性淀粉抑制高脂血症大鼠中下列菌群的生长:
莲子抗性淀粉促进初级胆汁酸(CA、CDCA 、β-MCA)和次级胆汁酸(LCA、UDCA)的产生,降低高脂血症中TCA、DeHydro-LCA、isoLCA、LCA-3-S、THDCA的含量。
Blautia、norank_f__Muribaculaceae、norank_f__Eubacteria_coprostanoligenes_group与 DeHydro-LCA、isoLCA、TCA、LCA-3-S、 TCHO、TG和 LDL-C呈正相关。
莲子抗性淀粉通过调节肠道菌群并加速肝脏中胆固醇分解为胆汁酸来改善血脂水平。
doi.org/10.1016/j.foodchem.2022.134599
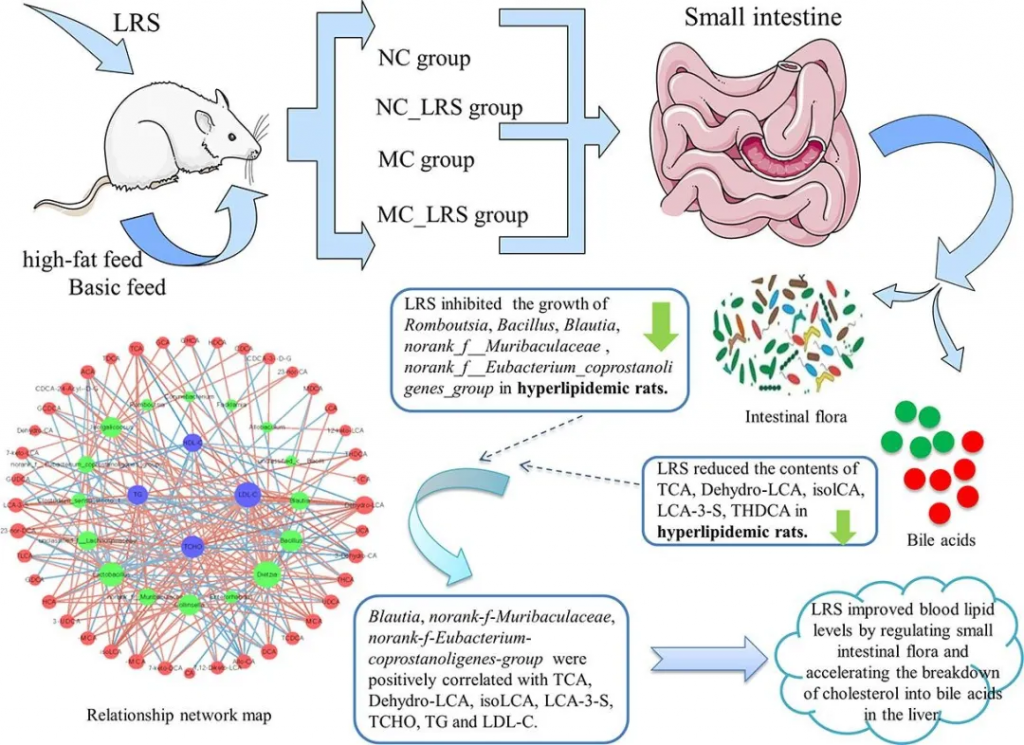
认知能力下降是衰老的常见后果。缺乏纤维和高饱和脂肪的饮食模式会引发促炎症途径和代谢功能障碍,从而加剧认知障碍。新的证据强调了富含纤维的饮食对神经认知的益处以及肠道-微生物-大脑信号传导的关键作用。
经过为期20周的饮食方案,包括含有5%重量比来自芸豆(PTB)、黑眼豆(BEP)、扁豆(LEN)、鹰嘴豆(CKP)或菊糖纤维(INU)的抗性淀粉的西式饮食(实验组),与不含抗性淀粉的西式饮食(对照组),发现抗性淀粉特别是来自扁豆的抗性淀粉,可以改善西式饮食引起的认知障碍。
从机理上看,抗性淀粉通过改善肠道菌群-代谢组,包括增加短链脂肪酸和降低支链氨基酸水平,从而改善神经认知功能评估。这种肠道菌群-代谢物-大脑信号级联抑制了神经炎症、细胞衰老和血清瘦素/胰岛素水平,同时通过改善肝功能增强脂质代谢。总的来说,数据证明了抗性淀粉的益生菌效应可通过调节肠-脑轴改善神经认知功能。
doi.org/10.3389/fnut.2024.1322201
溃疡性结肠炎是一种复杂的炎症性疾病,发病率不断上升。一项研究通过酶法分离方法从紫甘薯中获得抗性淀粉(PSPRS)。然后,研究了PSPRS的结构特性及其对葡聚糖硫酸钠诱导的结肠炎的保护功能。
结构表征结果表明,PSPRS的结晶度从CA型转变为A型,并且在酶水解过程中层状结构被完全破坏。与结肠炎小鼠相比,PSPRS给药以剂量依赖性方式显著改善病理表型和结肠炎症。
ELISA 结果表明,给予PSPRS的结肠炎小鼠表现出较高的 IL-10 和 IgA 水平,但较低的 TNF-α、IL-1β 和 IL-6 水平。同时,高剂量(300 mg/kg)的PSPRS显著增加了乙酸盐、丙酸盐和丁酸盐的产生。
16S rDNA高通量测序结果显示,PSPRS治疗组中厚壁菌门与拟杆菌门的比例以及潜在益生菌水平显著增加,如乳杆菌、Alloprevotella, 毛螺菌科_NK4A136_组、双歧杆菌。同时,高剂量 PSPRS 显著抑制了拟杆菌属、葡萄球菌属和阿克曼氏菌等有害细菌 (p < 0.05)。因此,PSPRS有潜力成为促进肠道健康、缓解溃疡性结肠炎的功能食品。
慢性肾病是与心血管疾病、发病率和死亡率风险增加相关的主要健康问题。最近的研究表明,慢性肾病的进展可能与肠道菌群的变化有关。抗性淀粉是一种膳食纤维,可以作为微生物发酵的底物。一些研究发现补充抗性淀粉可以改善慢性肾病患者的肠道菌群紊乱。
在 2022 年随机对照试验的荟萃分析中,发现补充抗性淀粉可以降低患有透析患者血液中硫酸吲哚酚、磷、IL-6和尿酸的水平。
抗性淀粉还对肠道环境产生有益影响,包括增加Ruminococcus bromide。
Ruminococcus brucei是厚壁菌门的主要成员之一,是一种主要的抗性淀粉发酵菌株。通过其针对抗性淀粉的特殊活性,Ruminococcus brucei从淀粉中释放能量以逃避宿主酶的消化。此外,摄入富含抗性淀粉的食物可以增加肠道短链脂肪酸水平,调节微生物代谢物,并改善葡萄糖稳态和胰岛素敏感性。
通过摄入抗性淀粉,胆固醇和甘油三酯降低,胰岛素敏感性提高,可以大大降低代谢综合征的发生率。慢性肾病患者也可能受益于更好的葡萄糖代谢、血脂水平和更好的体重管理。
近年来,富含抗性淀粉(RS)的食物因其多方面的健康益处而受到越来越多的关注,从肠道健康到调节全身新陈代谢。
益处
作为一种必需的膳食成分,抗性淀粉与典型的淀粉不同,主要是由于其对小肠消化的抵抗力,它基本上完好无损地到达大肠,在那里它作为微生物发酵的底物,产生有益的代谢物,如短链脂肪酸。
抗性淀粉中天然丰富的食物包括青香蕉、豆类、全谷物和某些类型的煮熟然后冷却的食物,如土豆和米饭。食用此类食物的好处之一是它们有可能增强血糖控制。富含抗性淀粉的食物具有较低的升糖指数,转化为较慢的餐后血糖升高。这一特性对患有糖尿病等代谢紊乱的人特别有益。此外,抗性淀粉发酵产生的短链脂肪酸,特别是丁酸盐,丁酸盐是结肠细胞的主要能量来源,并具有抗炎特性,使其对结肠健康不可或缺。
注意事项
抗性淀粉摄入量的快速和大量增加会导致胃肠道不适,包括腹胀、胀气和排便习惯改变。通常建议逐渐将富含抗性淀粉的食物引入饮食中,以使肠道微生物群有时间适应。此外,患有某些健康状况的人,例如患有肠易激综合征(IBS)或特定碳水化合物不耐受的人,应谨慎对待富含抗性淀粉的食物,并在专业指导下。抗性淀粉的发酵有时会加剧这些人的症状。
总之,虽然富含抗性淀粉的食物具有许多健康益处,尤其是在肠道健康和代谢调节方面,但个人应注意摄入饮食中的抗性淀粉的来源和数量。
最好取得平衡:优化健康益处,同时最大限度地减少潜在的不利影响。
抗性淀粉的作用超越了其个人益处,使其成为各种饮食模式和制度的关键成分。
地中海饮食
例如,当考虑因其保护心脏的益处而广受赞誉的地中海饮食时,我们发现豆类,抗性淀粉的天然来源,是其成分的基石。经常食用豆类,其丰富的抗性淀粉含量不仅有助于增强肠道健康,还有助于与这种饮食模式相关的心脏保护作用,因为抗性淀粉具有调节餐后血糖反应的潜力。
旧石器饮食
旧石器时代的饮食,俗称旧石器饮食,是另一个有趣的领域,其中抗性淀粉找到了相关性。对旧石器饮食的当代解释集中在块茎和某些根的消费上,当通过特定方法制备时,例如烹饪后冷却,这些根会富含抗性淀粉。这证实了我们的祖先可能已经消耗了大量的抗性淀粉,为他们的肠道微生物群提供了可发酵的底物。从理论上讲,肠道微生物与其宿主之间的共生关系已经共同进化了数千年,而抗性淀粉可能是推动这一进化过程的关键饮食元素。
低碳和生酮饮食
低碳水化合物和生酮饮食,在减肥和代谢健康方面很受欢迎,通常会限制淀粉的摄入。然而,将抗性淀粉整合到这些饮食中可以提供明显的优势。由于抗性淀粉不表现出与普通淀粉相同的消化率,因此它的加入不会显著提高血糖水平。这意味着这种饮食的人可以获得抗性淀粉的好处,例如增强肠道健康和饱腹感,而不会影响酮症或低碳水化合物方案的状态。从根本上说,抗性淀粉允许当代饮食方法之间的共生关系,重点是减肥或代谢益处,以及滋养肠道微生物群的古老进化重要性。
将抗性淀粉纳入饮食中不仅要承认其生理益处,还要了解其最佳摄入量并融入各种饮食中,以最大限度地发挥其潜力。随着越来越多的证据描绘抗性淀粉的多方面优势,从调节肠道微生物群到调节血糖水平,向更广泛的公众提供可操作的指南变得至关重要。
循序渐进
首先,身体可能需要一些时间来适应饮食中添加抗性淀粉。因此,需要循序渐进逐步添加。
添加少量抗性淀粉。例如,早餐中加入一根绿色香蕉,午餐中加入四分之一杯扁豆。
食物中获取
最好从食物中获取抗性淀粉,常见的食物补充包括:青香蕉、豆类(豌豆、扁豆)、全谷物(燕麦和大麦)、煮熟并冷却的米饭。
注:增加纤维摄入量时,要慢慢喝大量的水,以减少胃肠道副作用。

补充剂
补充性抗性淀粉通常以粉末形式服用,可混合到食品或饮料。如绿色香蕉粉、木薯粉等。
烹饪,可进一步提高抗性淀粉的含量
必须认识到并非所有抗性淀粉来源都是一样的。虽然豆类、全谷物和某些块茎天然富含抗性淀粉,但烹饪方法可以进一步调节其抗性淀粉含量。例如,烹饪然后冷却土豆或米饭等淀粉类食物可以增加其抗性淀粉含量,提供了一种直接的策略来提高饮食中的抗性淀粉水平,而无需任何剧烈变化。
抗性淀粉的推荐每日摄入量通常在 15-30 克之间。这可以通过多样化的饮食来实现,包括冷意大利面沙拉、隔夜燕麦或豆类菜肴等食物。
考虑个人的消化耐受性的重要性
抗性淀粉摄入量的突然激增会导致一些人的胃肠道不适。因此,谨慎的做法是在几周内逐渐增加抗性淀粉的摄入量,让肠道进行调整。此外,将富含抗性淀粉的食物与益生菌食物(如酸奶或开菲尔)相结合,可以产生协同效应,为有益的肠道细菌茁壮成长营造一个好的环境。与任何饮食改变一样,应根据个人口味、健康状况和饮食习惯定制抗性淀粉,确保方法既平衡又可持续。
抗性淀粉作为益生元可以调节肠道微生物群,对于肠道菌群失调相关的许多疾病包括炎症性肠病、肠易激综合征、结直肠癌等具有重要意义,为这些疾病辅助治疗的潜在用途奠定了基础。
抗性淀粉的另一个治疗意义在于其抗炎特性。慢性炎症在心血管疾病、2型糖尿病和某些癌症等多种疾病的发病和进展中发挥着关键作用。肠道微生物群发酵抗性淀粉会产生短链脂肪酸,尤其是具有抗炎作用的丁酸,可以抑制促炎细胞因子,使抗性淀粉成为减轻炎症引起的疾病的潜在候选者。
抗性淀粉也有望成为对抗肥胖和相关并发症的饮食策略。鉴于其调节饱腹感、提高胰岛素敏感性和调节脂质代谢的能力,抗性淀粉可以作为代谢综合征和相关病症的辅助或预防措施。例如,将抗性淀粉纳入饮食中可以改善糖耐量受损个体的餐后葡萄糖反应,强调其潜在的治疗相关性。
抗性淀粉在个性化营养方面的潜力也不容忽视,但仍需谨慎对待。剂量、持续时间和个体差异在决定抗性淀粉在任何治疗应用中的功效方面发挥着关键作用。
个体对抗性淀粉的反应可能存在很大差异。年龄、遗传、肠道微生物群组成和整体健康状况等因素会影响人们处理抗性淀粉摄入及益处。例如,摄入相同量抗性淀粉的两个人可能会表现出不同的餐后葡萄糖反应或结肠中不同的短链脂肪酸产生情况。此外,肠道微生物群将抗性淀粉发酵成有益代谢物的能力在个体之间可能有所不同,特别是在微生物群多样性高的人和微生物群较少的人之间差异较大。
这种个体差异突出了个性化营养方法的必要性。与其采取一刀切的抗性淀粉摄入建议,不如根据个人独特的代谢和菌群特征来定制饮食建议。随着深入探索个性化医疗时代,整合肠道菌群数据或许能为优化个人抗性淀粉摄入、获得健康效益提供更精准的建议。
主要参考文献:
Chen Z, Liang N, Zhang H, Li H, Guo J, Zhang Y, Chen Y, Wang Y, Shi N. Resistant starch and the gut microbiome: Exploring beneficial interactions and dietary impacts. Food Chem X. 2024 Jan 3;21:101118.
Li H, Zhang L, Li J, et al., Resistant starch intake facilitates weight loss in humans by reshaping the gut microbiota. Nat Metab. 2024 Mar;6(3):578-597.
Junejo SA, Flanagan BM, Zhang B, Dhital S. Starch structure and nutritional functionality – Past revelations and future prospects. Carbohydr Polym. 2022 Feb 1;277:118837.
Arp CG, Correa MJ, Ferrero C. Modified celluloses improve the proofing performance and quality of bread made with a high content of resistant starch. J Sci Food Agric. 2023 Apr;103(6):3041-3049.
Du X, Wu J, Gao C, Tan Q, Xu Y. Effects of Resistant Starch on Patients with Chronic Kidney Disease: A Systematic Review and Meta-Analysis. J Diabetes Res. 2022 Jul 18;2022:1861009.
Tekin T, Dincer E. Effect of resistant starch types as a prebiotic. Appl Microbiol Biotechnol. 2023 Feb;107(2-3):491-515.
Wang, Z.; Gao, M.; Kan, J.; Cheng, Q.; Chen, X.; Tang, C.; Chen, D.; Zong, S.; Jin, C. Resistant Starch from Purple Sweet Potatoes Alleviates Dextran Sulfate Sodium-Induced Colitis through Modulating the Homeostasis of the Gut Microbiota. Foods 2024, 13, 1028
Chen R, Zhang C, Xu F, Yu L, Tian F, Chen W, Zhai Q. Meta-analysis reveals gut microbiome and functional pathway alterations in response to resistant starch. Food Funct. 2023 Jun 6;14(11):5251-5263.
Kadyan S, Park G, Hochuli N, Miller K, Wang B, Nagpal R. Resistant starches from dietary pulses improve neurocognitive health via gut-microbiome-brain axis in aged mice. Front Nutr. 2024 Jan 24;11:1322201.
Pickens TL, Cockburn DW. Clostridium butyricum Prazmowski can degrade and utilize resistant starch via a set of synergistically acting enzymes. mSphere. 2024 Jan 30;9(1):e0056623.

谷禾健康

我们知道肠道菌群代谢产生短链脂肪酸,丁酸是短链脂肪酸之一,它支持消化系统健康和疾病预防,地位不容小觑。
丁酸作为一种有效的调节因子,是宿主-微生物串扰的关键介体。本文整理了丁酸盐的特性,探讨其健康益处及改善健康的潜力。
肠道菌群消化膳食纤维,并将它们转化为多种有机化合物,这些化合物对人体健康有益,包括氨基酸、短链脂肪酸等。内源性丁酸主要是肠道内产丁酸细菌利用糖类发酵产生一类短链脂肪酸。
丁酸在体内可以通过脂肪酸氧化为机体供应能量,是肠道上皮细胞的主要供能物质。丁酸与机体健康密切相关,对调节肠道健康、抑制炎症及癌症等病症意义重大。在养殖业中常添加丁酸盐保护动物健康生长,如预防断奶仔猪腹泻、调节鸡肠道菌群并增强其免疫力等。
1、 为肠道细胞提供燃料
丁酸盐是结肠细胞的主要能量来源,结肠细胞是构成肠道内壁的细胞。
与身体中使用糖(葡萄糖)作为主要能量来源的大多数其他细胞不同,肠道内壁细胞(结肠细胞)主要使用丁酸盐。如果没有丁酸盐,这些细胞就无法正确执行其功能。
厚壁菌属的成员以产生丁酸盐而闻名,像Roseburia,Faecalibacterium prausnitzii,直肠真杆菌 E.rectale 等。
这种关系是相互的。丁酸盐为结肠细胞提供燃料,作为回报,这些细胞有助于提供一个无氧环境,有益的肠道微生物在其中茁壮成长。这可以控制炎症,保持肠道细胞健康,并使肠道细菌保持健康。
2、 促进肠道运动
丁酸盐还可以穿过上皮屏障,通过连接胃肠道、脾脏和肝脏的肝门静脉进入循环。肝脏似乎是内脏产生的SCFA的主要库,它们可能通过β-氧化代谢,用于合成酮体或转化为AcCoA。
最近的研究发现,外周血短链脂肪酸水平与膳食中溴的摄入量相关,这表明丁酸盐是通过循环运输的,其他器官可能会受到丁酸盐浓度变化的影响。
短链脂肪酸转运体的表达受到短链脂肪酸存在的调控,未在结肠中代谢的短链脂肪酸通过门静脉进入肝脏,作为肝细胞的能量底物,因此在体循环中只留下极少的丁酸。
实验室研究表明,丁酸盐通过作为SCFA受体的配体和激活剂,诱导肠道激素肽YY24或介导肠嗜铬细胞释放5-羟色胺来促进肠道运动。
★ 增强电解质吸收
丁酸盐通过上调Na+-H+交换器和诱导ATPase离子交换器基因来增强水和电解质的吸收。并且可能有益于预防某些类型的腹泻。
3、 激活AMPK
丁酸盐激活AMPK (AMP-activated protein kinase, AMPK)。AMPK的作用是促进细胞内的平衡。它在我们的新陈代谢功能中也扮演着重要的角色。一些科学家把减肥归功于AMPK的激活。
在有和没有NAFLD的小鼠中,当AMPK被激活时,肝脏中的脂肪水平下降,也就是说,新的脂肪产生减慢,现有的脂肪被代谢。此外,在喂食高脂肪食物的小鼠中当AMPK被激活时,小鼠的体重增加和肥胖缓解,肝脏炎症的迹象也更少。
AMPK对食欲调节至关重要。它在减肥方面也有重要作用。
刺激AMPK促进自噬。这个自然过程是细胞破坏和消耗老细胞。最后,肠道内的细胞变得更强壮。由于激活AMPK,丁酸盐帮助结肠细胞维持其4 – 5天的生命周期。有了健康细胞的存在,小肠的紧密连接变得更加强健。
反过来,来自器官的颗粒和毒素不会渗透导致肠漏的问题。因此,丁酸盐可以帮助修复肠道内壁。
4、 抗氧化能力
丁酸盐保护细胞免受有害物质的侵害,以维持肠道健康。
说起抗氧化,我们先了解一下自由基。它基本上是体内化学反应产生的废物。另一方面,抗氧化剂是身体抵御它们的防御措施。大量自由基会造成损害并压倒身体的修复系统。我们称之为氧化应激。氧化应激被认为是导致衰老和疾病的一个重要因素。
丁酸增加谷胱甘肽,可以中和自由基
结肠或大肠是身体产生的废物的储存容器。较高的丁酸盐水平已被证明会增加谷胱甘肽的水平,谷胱甘肽是一种在人体细胞中产生的抗氧化剂,可以中和肠道中的自由基(自由基与炎症和许多疾病有关)。
5、 防止肠漏
肠道内壁需要丁酸盐来保持健康和正常运作。
肠道内壁是肠道屏障。它促进绒毛的生长,微小的手指状挤压物排列在肠道内,并增加粘蛋白的产生,粘蛋白是一种覆盖肠道内部的凝胶状物质。它选择性地让维生素和矿物质等物质离开肠道,进入血液,并到达需要它们的地方。同样,它可以阻止毒素、病原体和食物化合物进入血液。
当屏障健康时,称为紧密连接的小孔会放松,让水和营养物质通过。
一些习惯,比如频繁吃零食,会阻止这些紧密连接在两餐之间的关闭,因此细菌和不需要的物质会进入血液,于是肠漏就发生了。
肠道微生物从膳食纤维中产生的丁酸盐提供了肠道内壁细胞所需的燃料。通过这样做,它可以保持肠道内壁的完整性,防止发生肠漏。
6、 抗炎、抗癌特性
丁酸盐对肠道具有抗炎和抗癌功能。
肠道内壁会保持低水平的炎症,以防与微生物群接触的粘膜表面发生任何变化。低水平的炎症受到严格控制,但如果它被破坏,会导致氧化损伤,并在很长一段时间内导致癌症。
丁酸盐会阻止体内的一些促炎物质发挥作用。丁酸盐的抗炎作用可减少氧化应激并控制自由基造成的损害。
丁酸盐的抗炎特性,部分原因是其抑制转录因子核因子-κB (NF-κB)的激活,通过下调NF-κB信号通路,丁酸盐可以调节促炎细胞因子的产生。
丁酸盐对免疫功能的调节作用
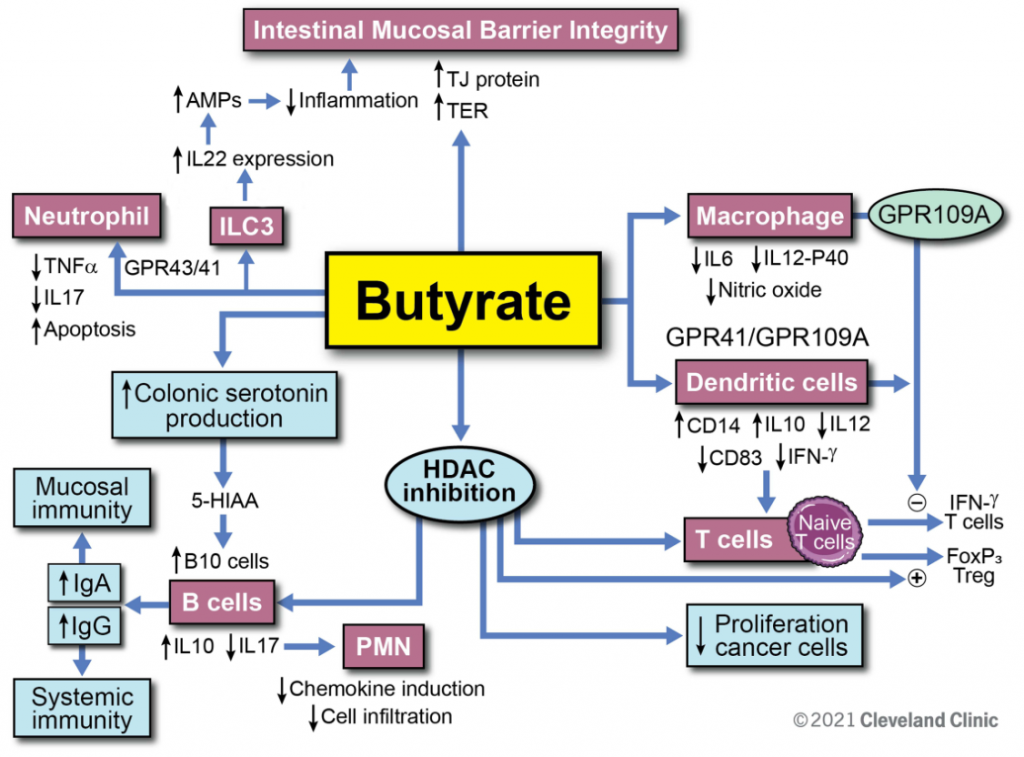

前面我们知道,丁酸盐通过直接诱导上皮中的紧密连接蛋白来增强肠粘膜屏障。此外,丁酸盐诱导ILC3细胞分泌IL-22进一步增强了这种作用。通过与GPCR 43和41的相互作用,丁酸抑制中性粒细胞的促炎细胞因子分泌。丁酸通过GPCR直接作用于巨噬细胞和树突状细胞,并通过增加Foxp3 T细胞调节T细胞功能,同时抑制产生IFN-ɣ的T细胞。丁酸增加5-羟色胺的产生,也是HDAC的抑制剂。它通过这些途径调节B细胞功能,增加抗炎细胞因子IL-10,同时降低IL-17。丁酸盐通过增加B细胞的IgA和IgG抗体反应,增强特异性免疫和抑制自身免疫。
抗炎 -> 抗癌
丁酸盐也是一种组蛋白脱乙酰酶(HDAC)抑制剂。组蛋白脱乙酰酶是大多数癌症中产生的酶。因为丁酸盐是一种抑制剂,它实际上会改变基因表达,抑制细胞增殖,诱导细胞分化或凋亡。因此,它可以阻止癌细胞的发展。
炎症性肠病
炎症性肠病(IBD)是一种慢性肠道炎症性疾病,有两种主要亚型:克罗恩病和溃疡性结肠炎。
虽然IBD的确切发病机制尚不完全清楚,但IBD涉及遗传、肠道微生物群和粘膜免疫等多种影响因素之间的复杂相互作用,包括先天性和适应性免疫反应。
据报道,在这两种IBD亚型中,产生丁酸的肠道微生物减少。丁酸对肠道防御机制具有多阶段调节作用,包括通过促进肠上皮中的紧密连接蛋白保护肠粘膜屏障,支持先天性和适应性免疫反应,以及通过降低环氧合酶-2(COX-2)水平抑制氧化应激,并通过诱导过氧化氢酶,改善过氧化氢(H2O2)的解毒作用。
肠粘膜溃疡是IBD的主要表现之一,丁酸对肠上皮细胞生长和细胞死亡过程的影响已被充分证明。
根据整体稳态条件,丁酸酯已被证明对人类结肠上皮细胞具有生长刺激或凋亡特性。此外,在人和大鼠来源的结肠细胞培养物中,丁酸已被证明能减少氧化应激引起的DNA损伤。
母乳通过丁酸保护宝宝的抗炎环境
据报道,母乳喂养等早期接触对IBD的发展和发病机制具有保护作用。母乳通过其代谢物丁酸诱导紧密连接蛋白和粘液产生基因的表达,从而诱导新生儿胃肠道的抗炎环境。
前面章节我们了解到,当肠道屏障完整时,炎性体具有保护作用,但一旦屏障被肠道失调破坏,炎性体的激活和免疫细胞的募集与粘膜炎症相关——这是IBD持续炎症的另一个主要病理生理机制。
在肠炎症的体外共培养模型中,丁酸已被证明可调节促炎症信号并抑制几种核苷酸结合寡聚化结构域样受体-3(NLRP3)炎症体标记物。
丁酸盐结合其他疗法
一项研究报告称,当IL-1β被其他IBD疗法(如5-ASA)抑制时,丁酸盐显著降低IL-8分泌,从而降低IL-8介导的趋化性,突出了单独丁酸盐不一致临床反应背后的机制,以及丁酸盐与IBD其他治疗方式相结合的可能性。
通过添加产丁酸菌改善屏障完整性
通过添加产丁酸菌(prausnitzii杆菌、白痢丁酸球菌和六种丁酸产生菌的混合物)来增加克罗恩病患者的微生物群中的产丁酸菌,从而改善体外上皮屏障完整性。
丁酸治疗潜力
由于丁酸治疗的反应不一致,可能在某种程度上由于剂量、持续时间和配方标准化的变化,目前丁酸在IBD中的适用性最多被视为补充治疗。
丁酸盐显示出更一致有效性的一个领域是转移性结肠炎,这是一种术后表现,当结肠的一部分失去连续性时,丁酸盐消耗被认为是导致炎症的主要因素。虽然手术治疗或结肠再连接或切除转移是一种更确切的治疗方法,但在考虑医疗管理时,丁酸灌肠已被证明具有治疗价值。
癌症
丁酸盐使肠道环境保持稳定,并且是膳食纤维对某些癌症的保护作用的一部分。
肠癌,是西方世界的主要健康负担,主要归咎于饮食。膳食纤维含量低的饮食会影响肠道中的细菌。结肠细胞需要丁酸盐作为能量,如果它们没有能量,就无法工作。
低膳食纤维 -> 丁酸盐↓ -> 肠癌
丁酸盐是由肠道细菌从植物性食物中的益生元纤维中产生的。如果肠道内的细胞无法工作,与肿瘤进展相关的细胞就会茁壮成长,接着会发出炎症信号并导致肿瘤发展。因此,低膳食纤维会使丁酸盐的产生减少,是肠癌的危险因素。
结直肠癌
据报道,结直肠癌患者包括丁酸盐在内的短链脂肪酸水平较低。
丁酸盐对肠上皮细胞的增殖具有双面作用,一方面支持健康细胞处于稳态,但另一方面抑制癌症诱导的过度增殖。丁酸钠已被证明以p-53非依赖性途径诱导人结肠癌细胞系凋亡。丁酸盐还可以防止氧化应激和DNA损伤。
据报道,丁酸盐还通过多种途径具有癌症保护作用,包括抑制神经纤毛蛋白-1(NRP-1)、抑制丝裂原活化蛋白激酶(MAPK)信号通路、差异调节Wnt-β-连环蛋白信号通路、上调microRNA miR-203和促进细胞凋亡,和促增殖miR-92a的抑制。
由于饮食模式在结直肠癌发病中的作用已得到充分证实,大多数人体试验研究了通过改变膳食纤维摄入量进行干预的方法,并报告了结直肠癌复发风险的降低。
代谢相关疾病
越来越多的证据表明饮食、肠道微生物群和代谢紊乱之间存在复杂的相互作用。
★ 肥胖
对人类的研究表明,肥胖和瘦人群的肠道细菌存在差异,微生物多样性的减少与胰岛素抵抗和血脂异常有关。
包括丁酸盐在内的SCFA可通过激活肠细胞内的FFAR来降低食欲和体重。这促进胰高血糖素样肽1(GLP-1)和肽YY(PYY)的释放,前者促进胰岛素分泌并抑制胰高血糖素分泌,后者降低食欲并减缓胃排空。
SCFA还能减少所谓的“饥饿激素”——ghrelin的分泌;FFAR2存在于ghrelin分泌细胞上,包括乙酸盐和丙酸盐在内的FFAR2激动剂可减少ghrelin分泌。
也有证据表明短链脂肪酸作用于交感神经系统,交感神经节中FFAR3的激活导致能量消耗增加。
然而,关于丁酸盐对食物摄入的影响,有相互矛盾的结果报道。
食物摄入量减少 -> 抗肥胖
有研究发现,丁酸盐在9天内使喂食HFD的小鼠的食物摄入量减少了22%。这与直接服用丁酸后GLP-1和PYY分泌增加有关。FFAR3基因敲除小鼠减少了丁酸刺激的GLP-1分泌,尽管丁酸减少了体重增加和食物摄入的程度与野生型小鼠相似,这表明FFAR3和GLP-1对于丁酸的抗肥胖作用不是必需的。
另一研究发现类似的结果,在HFD喂养的小鼠中,急性口服(而非静脉注射)丁酸盐在24小时内减少了21%的食物摄入量,而丁酸盐的慢性补充在9周内减少了相似量的摄入量。
在迷走神经切断术后,丁酸盐并没有改变小鼠的食物摄入量,因此作者认为丁酸盐通过肠-脑神经回路诱导饱腹感。这可能与GLP-1有关,因为GLP-1作用于迷走神经。
食物摄入量增加,体重不变 -> 抗肥胖
相反,有研究表明,在1-10周的四个测量时间点,补充丁酸盐可增加HFD喂养小鼠的食物摄入量。尽管增加了食物摄入量,但补充丁酸盐的小鼠体重并未显著增加,而对照组小鼠的平均体重增加了17克。相反,补充丁酸盐的小鼠在暴露于低温时,其能量消耗增加,产热增加,这一点可以从较高的体温中看出。
在小鼠中,丁酸增加棕色脂肪组织(UCP1)和骨骼肌(UCP2和UCP3)中解偶联蛋白、促进热量生成的线粒体蛋白的表达。在丁酸盐处理的小鼠骨骼肌中Ucp2和Ucp3基因的启动子处发现组蛋白乙酰化增加,这表明丁酸盐可能通过HDAC抑制增加解偶联蛋白表达来增加产热,从而增加能量消耗。
★ 糖尿病
研究发现,糖尿病患者和糖尿病前期受试者中丁酸盐水平降低。
丁酸盐通过多种途径影响糖代谢的调节
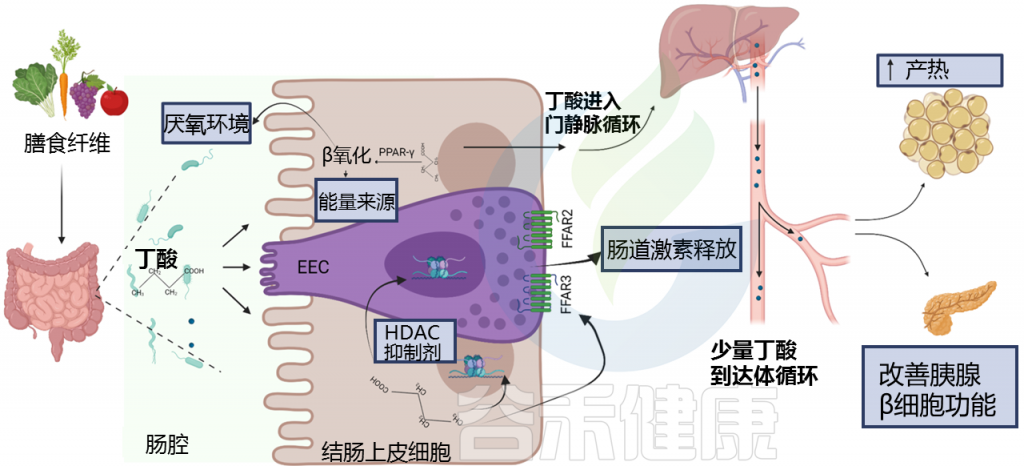

Arora T,et al., Front Endocrinol (Lausanne). 2021
膳食纤维经肠道菌群发酵产生短链脂肪酸,包括丁酸盐。丁酸盐介导的PPAR-γ的激活,诱导β-氧化和氧的消耗,从而促进厌氧条件的建立,这是几种厌氧肠道共生体生长和功能所需的条件。
丁酸在肠内分泌细胞(EEC)中与游离脂肪酸受体(FFAR) FFAR2和FFAR3结合,调节肠道激素释放,如胰高血糖素样肽 1 (GLP-1) 和肽 YY (PYY)。
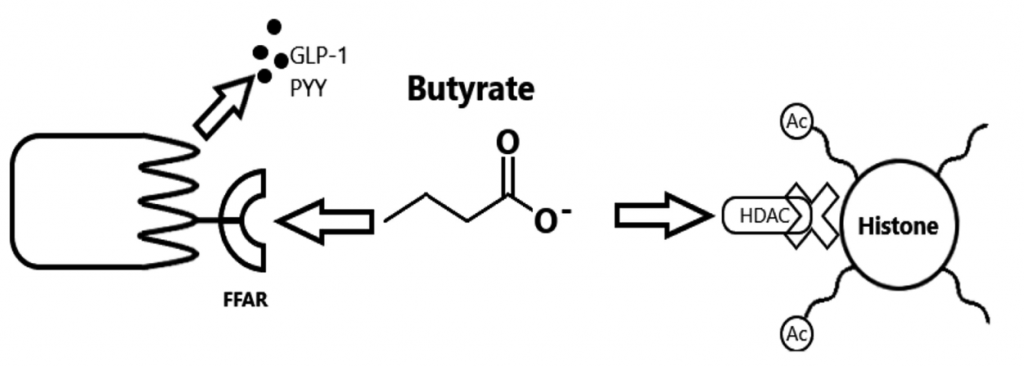

S.C. Bridgeman et al. Pharmacological Research,2020
GLP-1 增加胰岛素的产生并减少胰腺中胰高血糖素的产生。
PYY 会增加肌肉和脂肪组织对葡萄糖的吸收。
这些激素共同作用以保持血糖水平稳定。当血糖过高时,胰岛素会告诉身体的肌肉和脂肪细胞吸收多余的葡萄糖,所以说这些激素对肥胖和糖尿病很重要。丁酸盐增加这些肠道激素的释放,表明对控制血糖水平和防止体重增加有潜在的好处。
丁酸还可作为组蛋白去乙酰酶(HDAC)抑制剂,调节EEC和肠上皮细胞的基因表达。残余丁酸被结肠细胞吸收利用后,先排入门静脉循环,再排入外周体循环。在体循环中,丁酸可能调节棕色脂肪组织的产热和胰腺β细胞的功能。
增加丁酸水平的临床研究
一项随机临床研究中,对T2D患者补充混合膳食纤维可改善血糖参数,同时增加产生乙酸和丁酸的细菌丰度,并增加粪便中乙酸和丁酸水平。
在另一项研究中,将产丁酸菌(E.hallii,Clostridium beijerinckii,C.butyricum)与其他肠道细菌(A.muciniphila,婴儿双歧杆菌)和菊粉作为可发酵纤维混合,适度增加了T2D患者的丁酸水平,改善了口服葡萄糖耐量和糖化血红蛋白水平。
最后,添加菊粉和丁酸钠胶囊45天可改善T2D个体的空腹血糖和腰臀比。
这些研究清楚地表明,膳食纤维本身或与ngp或丁酸盐联合可以改善T2D的葡萄糖控制。
然而,维持患者依从性的策略和对这些补充剂的长期影响的调查仍然是值得的。此外,显然基线肠道菌群是饮食干预、益生菌注射和微生物移植成功的一个强有力的预测因素,基于微生物群对个体进行T2D分层可能有助于实现更好的代谢结果。
神经系统疾病
除了在肠道中的作用外,丁酸盐还具有支持大脑健康的巨大潜力。
由结肠中的细菌产生的丁酸盐具有一系列生物学功能。这些功能还与神经保护作用有关(有益于大脑和中枢神经系统)。
丁酸盐也是一种大脑助推器,因为它对大脑和中枢神经系统有保护作用。例如,它与许多与帕金森氏症、阿尔茨海默氏症甚至中风等疾病相关的通路有关。
丁酸盐对宿主生理和脑功能影响的示意图
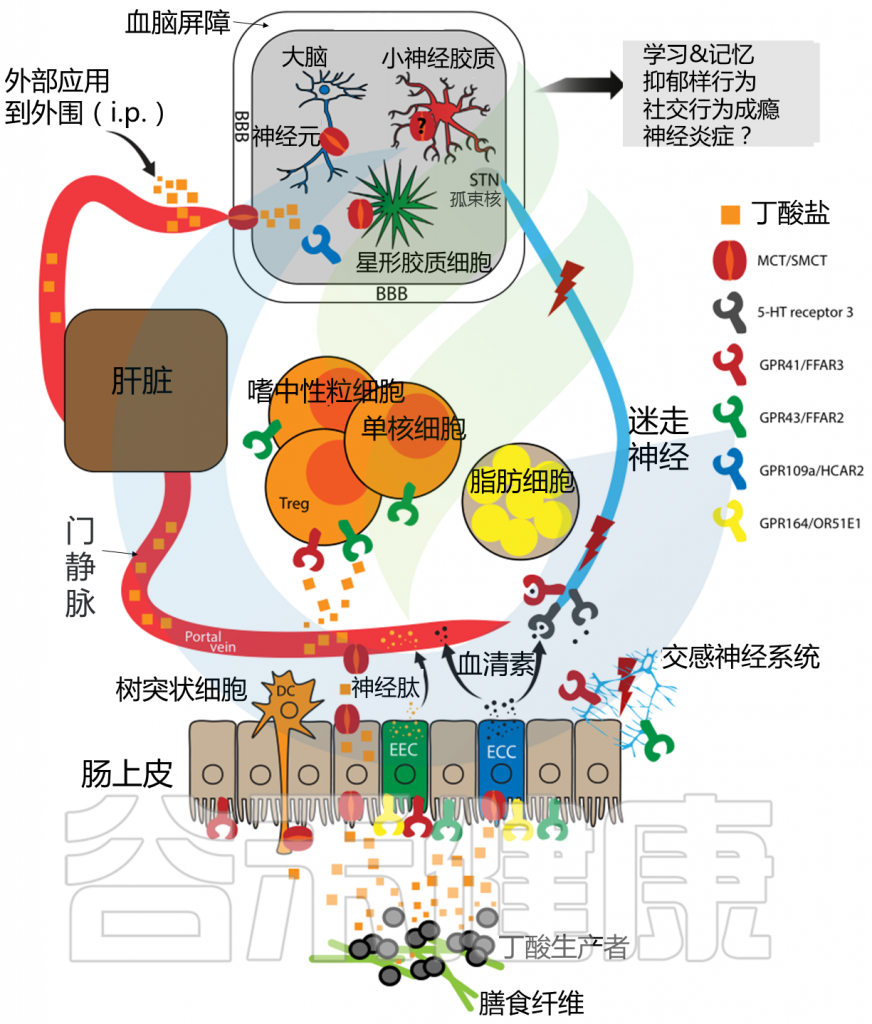

R.M. Stilling et al. / Neurochemistry International, 2016
由于抑郁症和其他神经精神疾病具有促炎症表型,反之亦然,丁酸盐在这些情况下也可能活跃。重要的是,丁酸盐的抗炎特性也对宿主(大脑)衰老具有根本意义,特别是考虑到许多组织(包括大脑)都会发生炎症衰老的慢性炎症状态。具体而言,丁酸盐通过减少NF-kB信号传导和诱导凋亡,从而促进神经保护,在脑内巨噬细胞(小胶质细胞)中显示出抗炎作用。
因此,丁酸盐会影响大脑健康,而饮食可能是改善疾病结果的一种简单方法。
压力、焦虑、抑郁等情绪都涉及肠道微生物群。
通过饮食提高丁酸盐的产量既简单又风险低。研究发现在加速老化的SAMP8小鼠模型中,长期喂养益生元纤维可改善认知能力下降,并具有抗炎、延缓衰老的作用。
未来有一天,它甚至可能成为脑部疾病的潜在治疗选择。


睡眠
新证据表明,肠道微生物群是促进睡眠信号的来源。细菌代谢产物和细菌细胞壁的成分可能在肠道共生菌群和大脑中的睡眠生成机制之间提供重要联系。
丁酸是一种短链脂肪酸,由肠道细菌通过不易消化的多糖发酵产生。研究人员验证了丁酸可能作为细菌源性促睡眠信号的假设。经口灌胃给予丁酸酯前药三丁酸甘油酯,在治疗后4小时内使小鼠非快速眼动睡眠(NREMS)增加近50%。
类似地,门脉内注射丁酸盐导致大鼠NREMS迅速而强劲地增加。在丁酸盐注射后6小时内,NREMS增加了70%。口服和门静脉注射丁酸盐都会导致体温显著下降。全身皮下或腹腔注射丁酸对睡眠或体温没有任何显著影响。
结果表明,丁酸盐的睡眠诱导作用是由位于肝脏和/或门静脉壁的感觉机制介导的。肝门丁酸盐敏感机制可能在肠道微生物群的睡眠调节中发挥作用。
扩展阅读:睡眠与肠道菌群
社交行为
微生物群可能会影响你的社交行为,虽然听起来可能有点夸张。
简而言之,丁酸盐很臭。
“butyrate”这个词实际上源自拉丁语butyrum,意思是黄油。你可能熟悉牛奶变质或变质黄油的气味,丁酸盐就是那个味儿。丁酸是哺乳动物最强烈的气味之一,人类可以通过嗅觉受体OR51E1检测到它的浓度约为亿分之240。


哺乳动物鼻子对丁酸酯气味敏感的一个合理原因是,丁酸酯是一种仅在厌氧条件下发生的细菌产物,如生物分解、腐败或发酵,也可能产生有害毒素。对丁酸盐高度敏感的另一种非互斥解释可能是其存在于体味中。
因此,它可以作为一种社会线索,携带有关微生物群组成和活动的信息,从而间接承载宿主免疫系统特征,类似于主要组织相容性复合体(MHC)中遗传变异性的公认社会信号功能。
存在于尿液和汗液中的MHC分子的肽配体被认为是携带遗传相关性和个体性信息的社会识别信号,并且可以被嗅觉上皮或犁鼻器官中的专门嗅觉受体神经元感知。
“气味相投”——可能是ta的气味在“撩”你
对包括人类在内的许多脊椎动物的研究表明,MHC基因座的变异影响社会行为,最显著的是配偶选择,但也影响社会群体的合作行为。也有人认为MHC依赖的嗅觉信号并不是携带个体和遗传变异信息的唯一线索,“嗅觉指纹”更为复杂。
化学通讯的发酵假说
一些科学家认为,它也是体味的一个组成部分。我们会使用丁酸盐等有气味的短链脂肪酸来(无意识地)相互交流。
事实上,这些微生物群是由产生挥发性脂肪酸、酯类、醇类和醛类的发酵厚壁菌门细菌主导的,这一事实促使作者提出了“化学通讯的发酵假说”,即共生细菌的变异驱动了物种、性别和个体特定气味的变化,从而促进了社会交流。
在雄性叉角羚(Antilocapra americana)的耳下气味中也发现了异戊酸和丁酸酯,用于标记其领地。此外,戊酸的潜意识气味已被证明能够引导社会偏好,例如降低人类受试者的面部受欢迎程度。
因此,丁酸盐和其他微生物发酵挥发性产物等短链脂肪酸似乎有可能不仅存在于专门的气味腺中,而且也存在于其他栖息地,如人类的腋窝,可能有助于化学交流,并传递有关微生物群组成的信息,从而也将遗传信息传递给感兴趣的接受者。
除食源性丁酸,动物体内丁酸主要是由盲肠和结肠的厌氧型细菌发酵产生,而由胃和小肠产生的丁酸含量极低。大肠产丁酸的菌种主要是梭菌属XIVa和IV族,以及真杆菌属和梭杆菌属。盲肠和结肠中丁酸的产生速度和数量主要取决于肠道微生物组成、日常膳食中可利用发酵成分组成等。
其中厚壁菌门的成员以其产生丁酸盐的能力而闻名。
在结肠中特别流行的产丁酸的细菌包括:
粪杆菌、直肠真杆菌E.rectale、Roseburia
双歧杆菌等常见益生菌配方中的微生物与丁酸盐生产者之间的交叉喂养相互作用已被证明是可以产丁酸盐的。
在消化道中发现的已知丁酸盐生产者中,大多数似乎属于毛螺菌科和瘤胃球菌科。
Faecalibacterium prausnitzii (FP) 是瘤胃球菌科的一部分,值得特别一提,因为它是消化道中最丰富的微生物之一,也是主要的丁酸盐生产者之一。FP 的特征包括通过丁酸盐产生和其他复杂途径的抗微生物活性和抗炎/免疫调节活性。
关于FP菌,详见:肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
Anerostipes、Roseburia和 Coprococcus都是属于毛螺菌科,它们也是人类肠道中的主要丁酸盐生产者。
产生丁酸盐的细菌被认为在生命的第一年内定植于宿主,并且在成年时占总细菌群落的 20% 以上。
然而各种疾病状态都表明产生丁酸盐的肠道细菌相对缺乏。
有趣的是,现如今益生菌补充剂中常用的细菌菌株很多都不是丁酸盐生产者,因为丁酸盐生产者很多是高度厌氧的,这意味着它们在氧气存在的情况下会很快死亡,所以要补充产丁酸菌就比较具有挑战性。
或许我们可以转换个思路来考虑,既然不能直接补充菌,那是不是可以补充产菌的食物呢?
所以哪些食物可以喂养产丁酸菌?
饮食对人体微生物组有显著影响,通过饮食干预可显著改变细菌数量并增加微生物多样性。
富含纤维的饮食对丁酸盐的产生特别有益,因为它可以滋养产生丁酸盐的细菌。
网上还有很多关于如何增加肠道丁酸盐的建议,比如多吃黄油或服用丁酸盐补充剂。然而,补充丁酸盐不一定对肠道有益,因为如果摄入丁酸盐,它会被胃吸收,也就是说它不会到达肠道为其细胞提供燃料。
记住,丁酸盐是微生物群产生的代谢物。
益生元是直接滋养微生物群的食物,包括蔬菜、水果、豆类和全谷物。它们含有膳食纤维,可被肠道细菌发酵成丁酸盐等有机化合物。通过食物增强微生物群是促进消化系统健康和丁酸盐生成的有效且安全的方法。
肠道细菌以膳食纤维为食,而不是动物蛋白。因此,优化丁酸盐产量的最佳方法是通过高纤维饮食。
高蛋白、高脂肪、低碳水化合物的饮食已被证明会破坏微生物组中丁酸盐的产生。在一项研究中,研究人员分析了短期饮食限制碳水化合物摄入量的肥胖参与者的微生物组,从而限制了他们对植物性膳食纤维的消耗。
在低碳水化合物饮食(每天 24 克)和中等碳水化合物饮食(每天 164 克)4 周后,短链脂肪酸的浓度低于高碳水化合物饮食(每天 399 克)。具体来说,当碳水化合物摄入量减少时,丁酸盐浓度会降低。同一项研究还发现,厚壁菌门细菌种类 Roseburia 和 E. Rectale 的密度与丁酸盐浓度之间存在联系,两者都随着碳水化合物摄入量的减少而降低。
然而,以上所谓的“膳食纤维”并不能完全解决这个问题,为什么呢?
理解以下几点很重要:
1、即使是来自同一物种的细菌菌株,对不同底物的反应也非常不同,甚至是属于同一类碳水化合物的底物。
2、某些细菌能够消化果聚糖,有些则不能。而那些可以消化的里面又有不一样的情况,其中一些能够消化短链的果聚糖,但不能消化更长链菊糖的果聚糖。
3、以上只是细菌消化不同底物能力的一个例子。由于这种变化的存在,不能一概而论。
而我们最需要的,更应该是寻找特定类型的纤维。
一项研究表明,不同类型碳水化合物的SCFA产量(单位:kJ)如下所示:
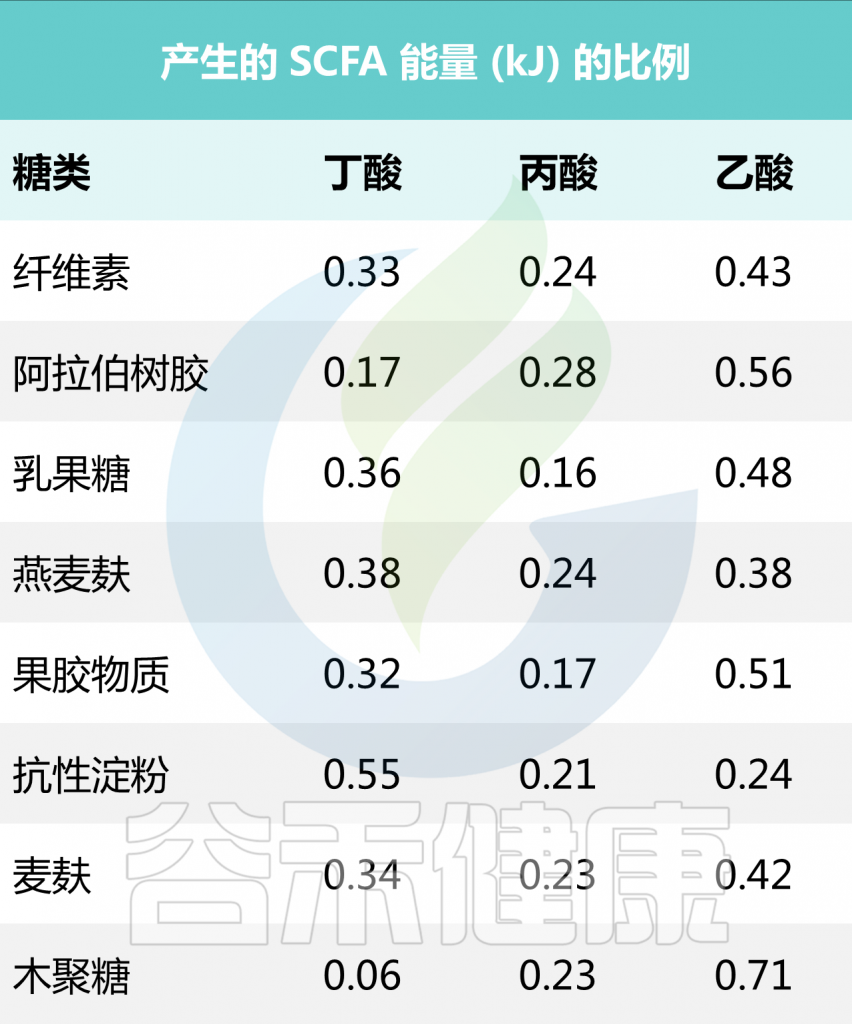

Bourassa MW, et al., Neurosci Lett. 2016
在该研究中,低聚果糖(FOS)的类型是洋葱、芦笋和香蕉等食物,而抗性淀粉(RS)则是全谷物和豆类。
另一项研究表明,补充特定猕猴桃中发现的低聚果糖可在4周内使F.prausnitzii菌增加100%。这是一项重大发现,因为目前有大量研究报告,F.prausnitzii 的相对缺乏与几种主要肠道疾病有关——最显著的是炎症性肠病、溃疡性结肠炎和克罗恩病。
抗性淀粉2型和3型,哪种更好?
这项研究表明,从生马铃薯和高直链淀粉玉米淀粉以及全谷物中发现的阿拉伯木聚糖中提取的2型抗性淀粉含量高的日粮中丁酸产量显著增加。
在174名健康年轻人的饮食中添加马铃薯抗性淀粉后,丁酸盐产量增加。玉米、菊苣和玉米中的抗性淀粉也进行了测试,但只有当食用土豆中的抗性淀粉时,粪便中的丁酸总量才会显著增加。
在该研究中,使用的是Bob’s Red Mill(品牌)未改性马铃薯淀粉。对于这种类型的抗性淀粉(RS2)是否对人类“有益”存在不同的观点,有多个来源表明RS3是一种更好的来源,因为RS2似乎可以喂养有害细菌,而RS3可以喂养有益细菌。
此外,鳄梨增加了能够产生短链脂肪酸的微生物数量,以及产生的总短链脂肪酸。
果聚糖(菊粉)
许多研究表明,菊粉可以增加短链脂肪酸的产量,包括丁酸盐。这可能解释了香蕉在溃疡性结肠炎和克罗恩病患者的饮食中如此有效的原因之一。然而,链长较短的果聚糖通常比链长的果聚糖(如菊粉)更容易喂养产丁酸菌。
补充菊粉虽然能够改变宿主的微生物群,但不会增加粪便丁酸水平。尽管这一结果似乎与谷物相反,但许多研究证明了补充菊粉在增加肠道短链脂肪酸生成方面的功效。


也就说,抗性淀粉和果聚糖(短链低聚果糖 和长链菊粉)在肠道中发酵时会产生丁酸盐。
对于抗性淀粉,似乎大多数研究都集中在 RS2 上。然而,在许多情况下,据报道 RS3 会产生更高水平的丁酸盐,对人类更健康。
抗性淀粉:
煮熟后冷却:土豆、红薯、米饭、意大利面、燕麦、豆类、豆类、全谷物。
原料:青香蕉、马铃薯、马铃薯淀粉、青香蕉粉。
果聚糖:
洋葱、菊苣、香蕉、朝鲜蓟、芦笋、大蒜、韭菜、西兰花、开心果和各种提取物。
由于人与人之间的常驻微生物存在显著差异,并且它们消化某些底物的能力不同,因此比较明智的选择是食用包含多种抗性淀粉和果聚糖的饮食。例如以马铃薯抗性淀粉、燕麦麸皮纤维或车前草种子或短链低聚半乳糖、长链低聚果糖和谷氨酰胺的混合物的形式短期补充,增加丁酸盐水平。
丁酸是不是越多越好?
丁酸并不总是越多越好,低浓度丁酸促进细胞增殖和生长,高浓度丁酸反而抑制细胞增殖和生长,增加肠道的通透性。
胃肠道不同部位对丁酸的耐受阈值也存在一定差异,胃和小肠对丁酸的耐受阈值低,结肠和盲肠耐受阈值高。
添加普通丁酸钠制剂(主要在肠道前端被吸收利用),反而造成肠道炎症、菌群失调。
更有意思的是,轻微炎症或者轻度溃疡部位添加丁酸盐可以促进肠道损伤的修复,在严重溃疡肠道部位添加,不利于溃疡的恢复,甚至加剧整个溃疡。
有学者发现溃疡部位的粘膜组织对丁酸的代谢降低,甚至只有正常粘膜组织的一半,主要是由于其转运载体和氧化相关的酶活降低。
p.s. 进行干预之前需要了解现有肠道丁酸盐的水平状况,可以更好地进行干预治疗前后对比
Tips
如果你正在被一些肠道疾病困扰,需要注意其中几种食物的凝集素含量:土豆、燕麦、豆类、豆类和全谷物。如果你打算吃这些食物,建议先浸泡和加压烹饪,然后从很少量开始。也可以排除生食。
如果你患有自身免疫性疾病,不推荐豆类和大多数全谷物。
此外,许多患有肠道疾病和/或自身免疫性疾病的人难以食用果糖,这可能是果糖不耐受的迹象。症状包括胀气、腹胀等。
相关阅读:
肠道菌群健康检测报告——常见问题解析
主要参考文献:
Arora T, Tremaroli V. Therapeutic Potential of Butyrate for Treatment of Type 2 Diabetes. Front Endocrinol (Lausanne). 2021;12:761834. Published 2021 Oct 19. doi:10.3389/fendo.2021.761834
Siddiqui MT, Cresci GAM. The Immunomodulatory Functions of Butyrate. J Inflamm Res. 2021 Nov 18;14:6025-6041. doi: 10.2147/JIR.S300989. PMID: 34819742; PMCID: PMC8608412.
Bourassa MW, Alim I, Bultman SJ, Ratan RR. Butyrate, neuroepigenetics and the gut microbiome: Can a high fiber diet improve brain health?. Neurosci Lett. 2016;625:56-63. doi:10.1016/j.neulet.2016.02.009
Hu Liu, Ji Wang, Ting He, Sage Becker, Guolong Zhang, Defa Li, Xi Ma, Butyrate: A Double-Edged Sword for Health?, Advances in Nutrition, Volume 9, Issue 1, January 2018
Bridgeman SC, Northrop W, Melton PE, Ellison GC, Newsholme P, Mamotte CDS. Butyrate generated by gut microbiota and its therapeutic role in metabolic syndrome. Pharmacol Res. 2020 Oct;160:105174. doi: 10.1016/j.phrs.2020.105174. Epub 2020 Aug 27. PMID: 32860943.
Rivière, A., Selak, M., Lantin, D., Leroy, F., & De Vuyst, L. (2016). Bifidobacteria and Butyrate-Producing Colon Bacteria: Importance and Strategies for Their Stimulation in the Human Gut. Frontiers in microbiology, 7, 979.
LeBlanc JG, Chain F, Martín R, Bermúdez-Humarán LG, Courau S, Langella P. Beneficial effects on host energy metabolism of short-chain fatty acids and vitamins produced by commensal and probiotic bacteria. Microb Cell Fact. 2017 May 8;16(1):79. doi: 10.1186/s12934-017-0691-z. PMID: 28482838; PMCID: PMC5423028.
Stilling RM, van de Wouw M, Clarke G, Stanton C, Dinan TG, Cryan JF. The neuropharmacology of butyrate: The bread and butter of the microbiota-gut-brain axis? Neurochem Int. 2016 Oct;99:110-132. doi: 10.1016/j.neuint.2016.06.011. Epub 2016 Jun 23. PMID: 27346602.
Szentirmai É, Millican NS, Massie AR, Kapás L. Butyrate, a metabolite of intestinal bacteria, enhances sleep. Sci Rep. 2019 May 7;9(1):7035. doi: 10.1038/s41598-019-43502-1. PMID: 31065013; PMCID: PMC6504874.