-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

随着生活方式的变化和环境压力的增加,慢性疾病的发病率正在全球范围内急剧上升。这些慢性疾病,包括心血管疾病、糖尿病、抑郁症和多种自身免疫性疾病,不仅对个人的健康和生活质量构成了严重威胁,也给全球卫生系统带来了前所未有的挑战。
我们知道抗生素对肠道菌群会产生很大影响,事实上,其他这些药物也被报告具有类似的改变肠道微生物群的效果。这引发了人们对药物通过影响肠道微生物群从而影响健康和疾病的关注。特别是,肠道微生物群与大脑之间的相互作用,也就是所谓的“肠-脑轴”,成为一个热点领域,这可能为一些神经系统疾病的新治疗方法提供线索。
另一方面,神经系统疾病的治疗面临着许多难点,其中包括疾病机制的复杂性、治疗效果的个体差异、长期药物治疗的副作用,缺乏针对疾病根本原因的治疗方法。这些难点突显了寻找新的治疗目标和策略的重要性。
本文我们来了解一下药物引起的生态失调,以及日常处方药包括二甲双胍、他汀类药物、质子泵抑制剂和非甾体抗炎药为什么以及如何可能通过微生物群改变肠脑轴,以抑郁症、多发性硬化症、帕金森病和阿尔茨海默病等神经系统疾病为例来说明。
关于药物和肠道菌群及其与神经系统疾病之间的关联研究,提供了一个全新的视角,对于开发新的神经系统疾病相关治疗方法具有重要意义。
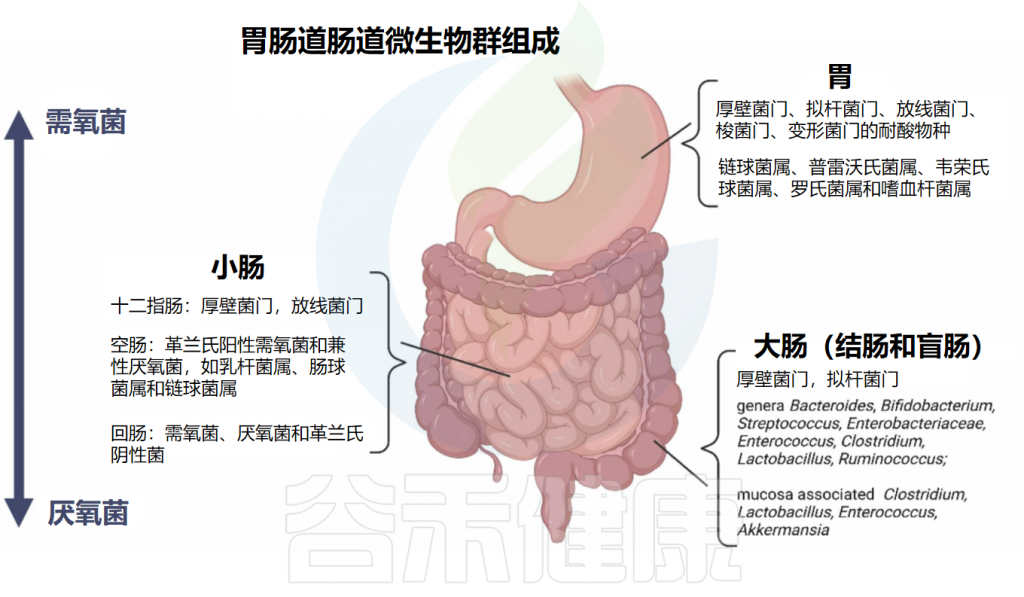
不同的细菌种群在消化道的不同部位繁殖,这是由于不同的微环境所致。关于居住在胃和肠道中的肠道细菌组成的总结见下图:
doi.org/10.1016/j.brainresbull.2024.110883
从上消化道到下消化道,细菌种类从需氧菌过渡到厌氧菌。
肠脑轴定义了肠神经系统(ENS)和中枢神经系统(CNS)之间的连接。随着研究的深入,微生物群在这一轴线中扮演着至关重要的角色。现已将肠脑轴扩展到了微生物群-肠-脑轴(MGBA)。
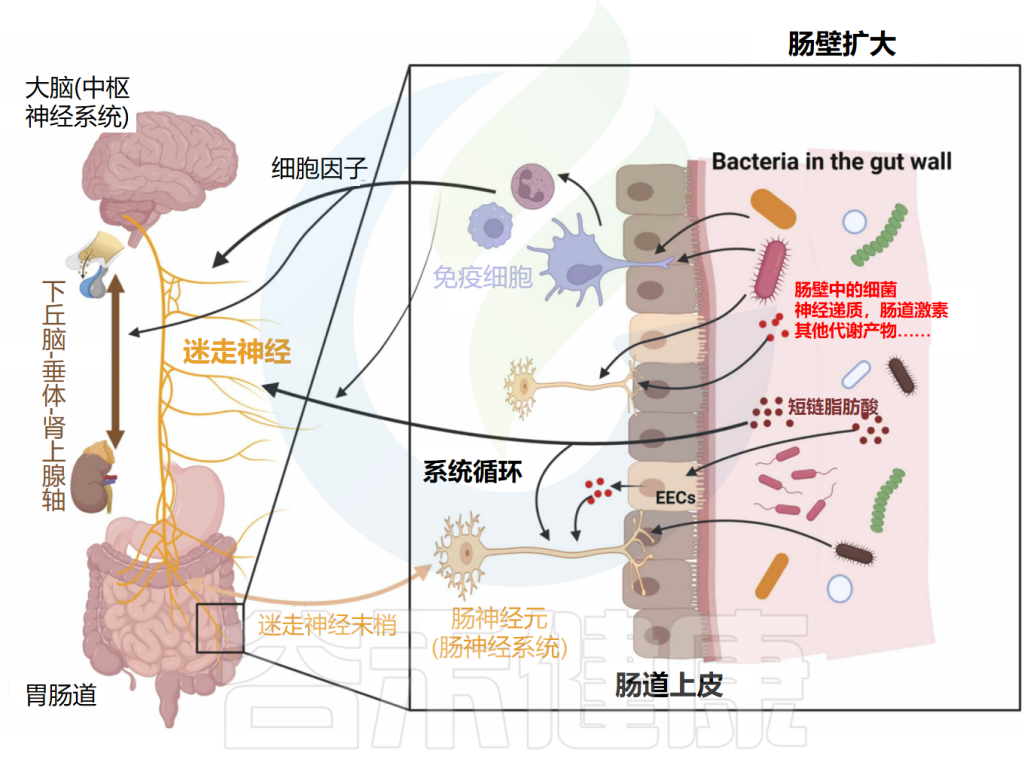
微生物群-肠-脑轴是肠道菌群和CNS之间的双向通信路径,肠道菌群可能通过细菌产生的神经递质和代谢物(所谓的化学信号)、迷走神经、免疫系统或包括下丘脑-垂体-肾上腺轴(HPAA)在内的神经内分泌系统影响大脑。
微生物群-肠-脑轴通信图
doi.org/10.1016/j.brainresbull.2024.110883
神经、免疫和内分泌介质,如神经递质、细胞因子和肠激素,是微生物群-肠-脑轴双向路径中的通信者。释放的细胞因子在免疫细胞识别细菌后可直接影响大脑。细胞因子和迷走神经也可以影响下丘脑-垂体-肾上腺轴(HPA轴)。细菌还可以通过其脂多糖(LPS)直接与肠神经元通信,触发肠神经元上的TLR4。
间接路径包括由肠道细菌产生的代谢物,如神经递质和短链脂肪酸(SCFAs)。这些代谢物可以进入全身血液循环,从而影响大脑。此外,这些代谢物可以刺激肠道中的肠内分泌细胞(EECs),然后它们在血液中释放肠激素。细菌代谢物和肠激素也可以通过属于迷走神经的肠神经元发送传入信号。
另一方面,大脑通过传出迷走神经纤维和其他肠神经系统(ENS)细胞进行通信。它因此在诸如粘液分泌和肠蠕动等重要方面影响肠生理。
关于微生物群-肠-脑轴在我们前面的文章已经详细阐述,详见:
最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用
抗糖尿病药物二甲双胍是 2 型糖尿病的一线治疗药物,已用于2 型糖尿病患者 60 多年。
口服后,二甲双胍在小肠吸收后的生物利用度约为40-60%。它在人肠道中的浓度比血浆中高 30-300 倍。
二甲双胍发挥什么作用?
二甲双胍通过改善胰岛素的作用、抑制肝脏糖异生、抑制肝脏中的胰高血糖素信号传导、增加骨骼肌中的葡萄糖摄取和降低体重来调节血糖水平,从而发挥其作用。新的研究表明,它通过抑制不同肿瘤类型的发作或进一步生长,具有抗癌作用。此外,二甲双胍已被证明通过与肠道菌群的相互作用降低葡萄糖水平。
二甲双胍对肠道微生物的影响
二甲双胍的肠道改变作用可能是由于对肠道微生物组的直接作用和/或通过其他代谢物的间接作用。高胰岛素血症也会改变肠道微生物群。因此,通过二甲双胍降低胰岛素会引起肠道微生物群的间接变化。
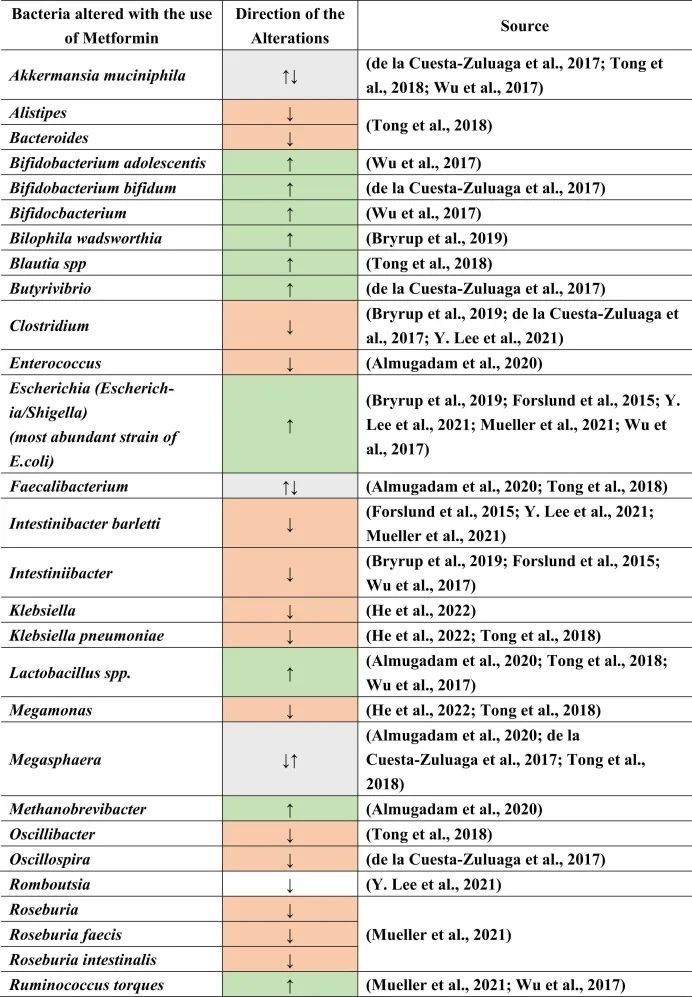
在接受二甲双胍治疗的患者中肠道菌群变化
doi.org/10.1016/j.brainresbull.2024.110883
由于二甲双胍诱导的肠道菌群改变,该药物也正在研究用于治疗IBD、自身免疫病等,和/或用于恢复其他肠道改变药物的作用。
研究人员讨论了二甲双胍改善抗精神病药物引起的代谢功能障碍的可能性,代谢功能障碍主要通过各种途径引起体重增加,如胰岛素抵抗和高血糖,并影响神经活性物质(如神经递质和神经肽)。
二甲双胍→肠道菌群→改善抗精神病药物副作用
用抗精神病药物治疗的小鼠比微生物组耗尽的小鼠体重增加更大,这表明肠道菌群在体重管理中的作用。在抗精神病药物治疗的小鼠中,发现许多菌群减少,如乳酸杆菌和阿克曼菌。另一方面,大肠杆菌和双歧杆菌增加。特别是二甲双胍可以减少体重增加,A.muciniphila也显示了这一点。后者已被提议作为缓解全身炎症的益生菌治疗。因此,二甲双胍可以通过肠道微生物组改善抗精神病药物使用的副作用。
人体研究是在较小的队列规模(5-25名受试者)中进行的,还没有足够的数量。然而,对小鼠模型的研究充分证实了二甲双胍和肠道菌群之间的相互作用。
他汀类药物是预防心脏病和动脉粥样硬化最常用的心血管药物之一。超过2亿人单独或联合服用各种类型的他汀类药物。他汀类药物通过抑制HGM-CoA还原酶产生胆固醇的酶来降低低密度脂蛋白(LDL)。
在人类中进行的研究很少,以确定他汀类药物对肠道微生物群的影响,数据不一致。例如,瑞舒伐他汀在动力不足的人体试验中没有显示出显著变化。另一方面,它引起了肠道菌群功能潜力的显著改变,即细菌代谢物的水平。
他汀类药物治疗促炎菌降低
一项荟萃分析研究表明,他汀类药物通过降低Bact2肠型(Bacteroides 2)的发生率,而具有抗炎作用。
注:有研究人员根据在肠道占有优势地位的细菌种类将人的肠道微生物组成划分为4种“肠型”:拟杆菌1型(Bact1)、拟杆菌2型(Bact2)、瘤胃球菌型(Rum)和普氏菌型(Prev),其中拟杆菌2型可以被归类为“不健康肠型”,它与肥胖和系统性炎症水平高有关。
观察到接受他汀类药物治疗的患者Bact2较低,拟杆菌水平降低。这一结果可以进一步解释,在他汀类药物治疗下,粪杆菌属(Faecalibacterium)也可能增加,或者拟杆菌与粪杆菌属的比例较低,导致Bact2发生率降低。
他汀类药物治疗与产丁酸菌的增加有关
具体而言,与未治疗的高胆固醇血症患者相比,阿托伐他汀治疗的高胆固醇血症患者的下列菌群丰度增加:
促炎菌群减少,如:
与未经治疗的高胆固醇血症患者相比,在减少的共生菌中也测量到了Oscillospira(抗炎菌),Firmicutes,Proteobacteria,Desulfovibrio属和条件致病菌,包括克雷伯氏菌,链球菌和柯林斯菌属。
此外,在相同的比较中观察到Bilophila wadsworthia和双歧双歧杆菌(胆汁酸相关物种)的相对减少。他汀类药物治疗后,也观察到不同种类的拟杆菌如B.dorei和B.uniformis的丰度增加,同时B.vulgatus和B.ovatus的生长降低。这些结果表明他汀类药物引起的肠道菌群变化,可能通过肠道菌群进一步影响GBA。
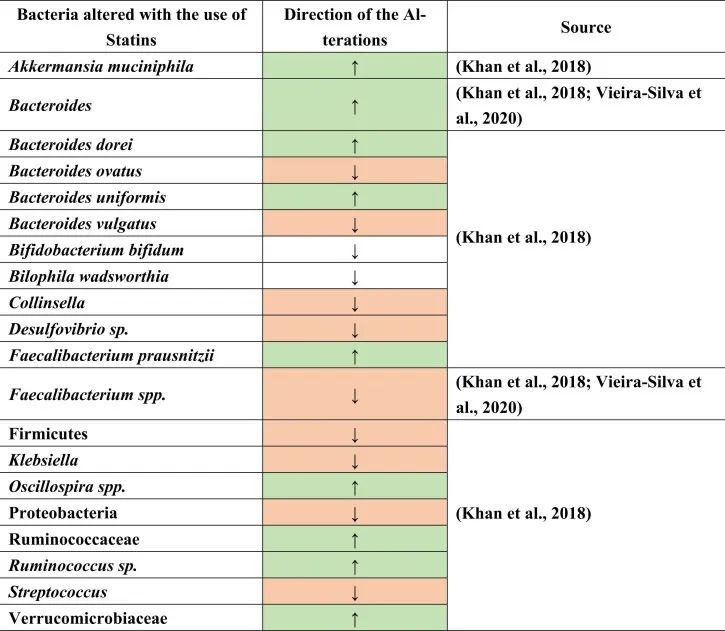
doi.org/10.1016/j.brainresbull.2024.110883
质子泵抑制剂(PPIs)用于预防胃病。很多患者尤其是老年人,会同时服用质子泵抑制剂和其他药物,如止痛药或抗抑郁药,以抵消后者对胃的副作用。
PPI对人体健康的影响
虽然说PPI的作用主要针对胃,但许多研究表明肠道微生物群发生了改变。PPI对微生物组诱导的人体代谢的影响还包括口腔,胃和小肠细菌过度生长(SIBO),肠道艰难梭菌的增加和沙门氏菌感染,肝性脑病,自发性细菌性腹膜炎,社区获得性肺炎,炎症性肠病的不良后果以及功能途径的变化。
PPI对肠道菌群的影响
许多这些疾病和改变是PPI使用后继发的生态失调的后果。一般来说,拟杆菌门丰度较低,厚壁菌门丰度较高。胃肠道中特定的菌群失调:
Naito等人总结了下列菌群丰度的相对增加:
而下列菌群减少:
功能性消化不良患者使用PPI的菌群变化
另一项研究得出结论,功能性消化不良与对照组相比,与粘液相关的细菌,如奈瑟氏菌(Neisseria)、卟啉单胞菌(Porphyromonas)、硒单胞菌(Selenomonas)、梭杆菌、嗜血杆菌(Haemophilus)的丰度较低。
使用PPI后对照组和功能性消化不良的普雷沃氏菌减少。停用PPI后,奈瑟氏菌仍然增加,表明药物使用后微生物变化持续存在。此外,其他细菌群如Holdemania和Blautia,Granulicatella,Rothia和Dorea,以及梭状芽孢杆菌簇XIVa和XIVb在PPI使用者中也有所增加。
在物种水平上:
反流性食管炎使用PPI治疗的菌群变化
由于PPI是给有胃病或反流问题的人服用的,因此一项研究仅检查了PPI治疗前后反流性食管炎患者的粪便微生物群组成。其中,在治疗的不同时间间隔中,乳杆菌(兼性厌氧菌)如加氏乳杆菌,罗伊氏乳杆菌和瘤胃乳杆菌,发酵乳杆菌,短乳杆菌的亚群在治疗后显著增加。
同样,对于链球菌属、肠杆菌科下的兼性厌氧菌计数以及葡萄球菌(也是兼性厌氧菌)也是如此。
有关于口服空肠弯曲菌或罗伊氏乳杆菌等研究显示,迷走神经传入信号发生变化,并在切除迷走神经的小鼠中恢复正常。
使用PPI后,细菌向下消化道区域的转移
在口腔,喉咙和鼻腔中发现了许多上述菌群,这表明由于使用PPI导致胃酸降低,细菌向下消化道区域的转移。通过PPI使用粪便样品显示远端肠道部分与上部胃肠道部分的定植,增加下列菌群:
减少下列菌群:
在一项健康双胞胎的研究中也观察到了同样的情况,结论是生态失调主要是由于咽部和口腔微生物群定殖到下肠道引起的,导致与上述文献相同的细菌改变。
PPI使用与肠道菌群多样性及SIBO相关影响
PPI的使用会导致细菌种群的进一步变化。例如,在PPI治疗后,远端肠道由上肠道的微生物群定殖。总体而言,微生物多样性较低,细菌种类减少,而上消化道中肠道共生菌的丰度较高。
小肠细菌过度生长(SIBO)是后一种情况的一个例子,导致链球菌,埃希氏菌,克雷伯菌,拟杆菌,乳酸杆菌,肠球菌,韦荣氏菌的丰度增加;双歧杆菌和放线菌科的减少。
与细菌转移相关联的是肠道的副交感神经刺激减少,如小肠细菌过度生长。下表总结了菌群的变化。
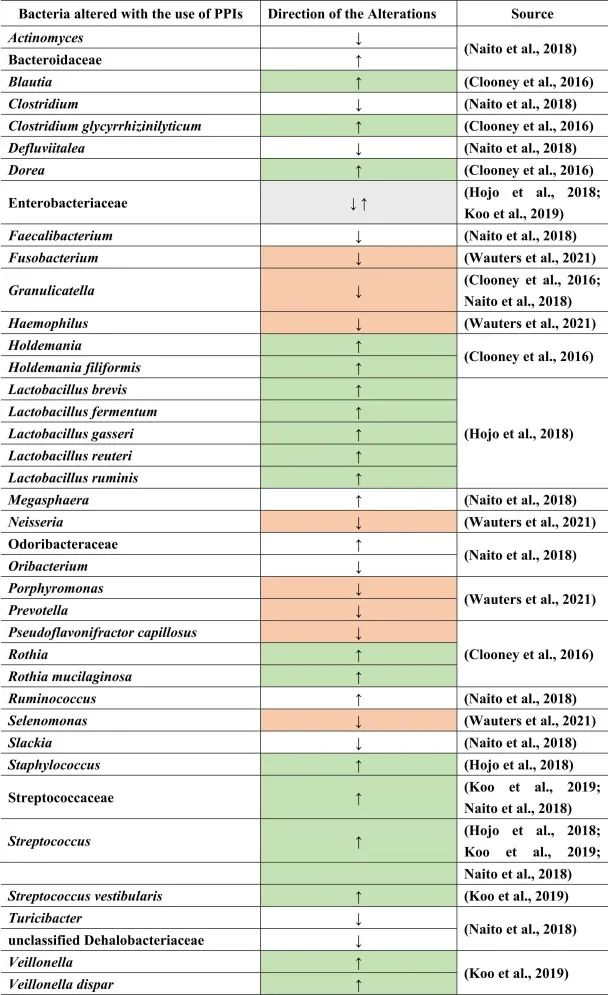
doi.org/10.1016/j.brainresbull.2024.110883
PPI使用增加链球菌,导致功能性消化不良等疾病患者消化不良症状持续
此外,在功能性消化不良,肝硬化,血液透析,类风湿性关节炎和癌症患者中观察到生态失调,这些患者表现出链球菌属的特异性增加。质子泵抑制剂用于缓解消化不良,尤其是幽门螺杆菌感染。然而,随着它增加链球菌的丰度,消化不良症状可能持续存在。来自胃窦胃炎患者的活检显示链球菌数量过多,证实了链球菌与消化不良的关系。
PPI引起肠道微生物失衡,增加肠道感染机会
总之,PPI用于预防其他药物(如NSAIDs)引起的消化不良,其作用是通过减少酸的产生。然而,它改变了肠道环境,使近端肠道细菌转移到肠道的远端。同时,它会导致一些菌群的丰度增加或减少。因此,这种生态失调导致更多的机会的肠道感染,涉及有害细菌,如艰难梭菌或沙门氏菌。
PPI治疗消化不良,影响肠道菌群,改变细菌丰度和细菌移位。主要影响链球菌丰度和艰难梭菌感染的高发病率。
与上述其他药物组一样,非甾体抗炎药(NSAIDs)用于疼痛和抗炎,或低剂量阿司匹林作为心血管健康的血小板聚集抑制剂。NSAIDs也可能导致菌群失调及后果,如小肠细菌过度生长。大量使用NSAID诱导肠道病变。这是由于肠细胞死亡和免疫系统破坏导致肠道屏障受损的结果,从而导致革兰氏阴性细菌的增殖和革兰氏阳性细菌的减少。
PPIs和NSAIDs共同作用于肠道病变与微生物群失衡
PPIs和NSAIDs在由于生态失调引起的肠道肠病中发挥联合作用。NSAIDs可导致胃病,PPIs可减少其发生。NSAIDs和PPIs的联合摄入导致肠病,因为PPIs将微生物群从上胃肠道转移到远端肠道。
例如,用阿司匹林治疗会导致肠道微生物群组成的变化,增加普雷沃氏菌,拟杆菌,Ruminococcaceae,Barnesiella。
塞来昔布和布洛芬增加了酸性氨基球菌科(Acidaminococcaceae)和肠杆菌科的丰度。
与非使用者或萘普生使用者相比,布洛芬会导致丙酸杆菌科(Propionibacteriaceae),假单胞菌科,Puniciecoccaceae,Rikenellaceae的富集。
吲哚美辛诱导拟杆菌,普氏菌科的增加;变形菌门,α变形菌纲,根瘤目(Rhizobiales),假单胞菌科的减少。
同一项研究显示了性别特异性效应,因为女性肠道中的厚壁菌门较低,而男性肠道中的厚壁菌门较高。
一项比较研究表明,各种非甾体抗炎药诱导的生态失调增加了分类群,如肠杆菌科,酸性氨基球菌科,丙酸杆菌科,假单胞菌科,Punicecoccaceae,Rikenellaceae。
总结上述结果,在导致生态失调和NSAID肠病的不同细菌类群和物种中发现了明显的变化。
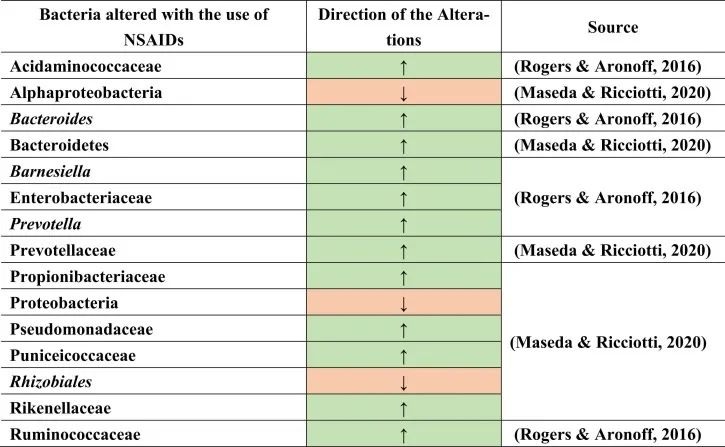
doi.org/10.1016/j.brainresbull.2024.110883
抗抑郁药(例如选择性5-羟色胺再摄取抑制剂SSRIs)是抑郁症的一线治疗方法。5-羟色胺是选择性5-羟色胺再摄取抑制剂(SSRIs)的靶标,增加了其在大脑中的可用性水平。
肠脑轴与抑郁症之间存在联系,但只有少数人体研究抗抑郁药对肠道菌群的影响。
抗抑郁药对肠道菌群的影响
艾司西酞普兰改变了肠道菌群,Christensenellaceae,Eubacterium ruminantium group,Fusobacterium显著增加,同时乳酸杆菌丰度相应降低,拟杆菌发生了显著变化。
注:艾司西酞普兰是一种用于治疗抑郁症和广泛性焦虑症的药物,通过增加大脑中神经递质5-羟色胺的水平来改善情绪。
Le Bastard等人的文章研究了非典型抗精神病药物治疗对双相情感障碍患者的影响,结果显示Lachnospiraceae的相对丰度增加(p=0.029),Akkermansia和Sutterella的相对丰度降低(p=0.0006)。
在荷兰队列的另一项研究中,B.dorei(p=0.051)和Coprococcus eutactus(p=0.041)与抗抑郁药呈正相关,而Eubacterium hallii与抗抑郁药呈负相关(p=0.055)。
在小鼠模型中存在许多关于SSRIs诱导的肠道改变的研究。常见的选择性5-羟色胺再摄取抑制剂(SSRI)舍曲林,氟西汀和帕罗西汀显示出对革兰氏阳性细菌如葡萄球菌和肠球菌的活性。
产毒肠杆菌随着SSRIs的使用而减少
其他潜在的产毒肠杆菌,如铜绿假单胞菌,肺炎克雷伯菌,柠檬酸杆菌属和摩根氏菌(M. morganii),产气荚膜梭菌和艰难梭菌也在一定程度上随着SSRIs的使用而减少。这些结果是在体外研究的基础上发现的。
服用某些抗抑郁药(如氟西汀)的抑郁成年人更容易发生艰难梭菌感染(CDI)。据报道,在小鼠中,艾司西酞普兰和锂在相似程度上增加了血清素水平。然而,这项研究没有讨论生态失调是根本原因。虽然SSRI对抑郁症的作用机制与这些药物的任何抗菌作用无关,但仍然可以看到微生物群落的潜在变化,并可能影响与情绪相关的其他炎症或生理参数。
抑郁症或重度抑郁症是最常见的神经精神疾病。它是导致残疾、发病率和死亡率的主要原因之一,导致生活质量低下。大约每五个人一生中就被诊断出一次。
抑郁症的基本症状
抑郁症是一种复杂的疾病,具有不同的症状和病理生理学。根据DSM-5,它被诊断出患有持续2周以上的一系列以下症状:持续的抑郁情绪,快感缺失,孤独感,动机降低,食欲和睡眠障碍,精神运动激动,注意力不集中,疲劳,内疚感或无价值感以及自杀念头。
抑郁症的病因
病因或病理生理学通过许多机制来解释,但整体上仍不清楚,可能有以下情况:
1) 血清素,去甲肾上腺素和多巴胺水平低,谷氨酸水平高;
2) HPA轴的改变;
3) 由于免疫介质的不平衡导致错误的免疫细胞通信,特别是微胶质细胞,引起系统性炎症;
4) 最后但同样重要的是与肠道微生物组-脑-肠轴有关的微生物群。
抑郁症的肠道菌群变化
迄今为止,研究发现,在门水平上,拟杆菌,变形杆菌,放线菌,放线菌增加,而抑郁症患者粪便中的厚壁菌减少。
在科的水平上,下列菌群有所增加:
下列菌群有所减少:
在属的层面上,提到了下列菌属减少:
下列菌属增加:
在少数细菌群体中,如Prevotellaceae,Prevotella,Bacteroides enterotype 2,双歧杆菌,Parasutterella,在不同的研究中发现了差异。
抑郁症患者菌群改变与二甲双胍,他汀类药物,
PPIs和NSAIDs使用者菌群改变有关
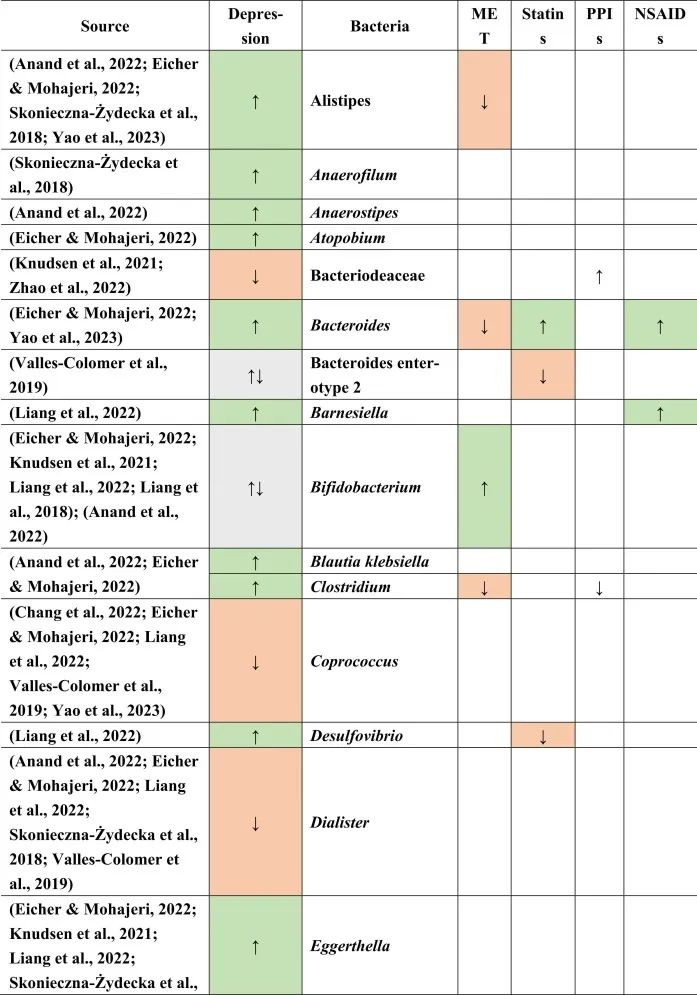
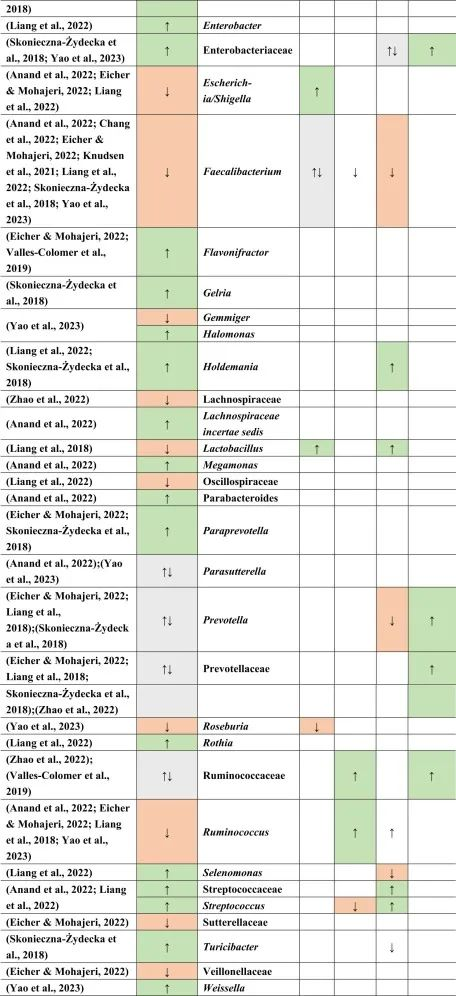
doi.org/10.1016/j.brainresbull.2024.110883
在比较抑郁症患者的肠道菌群与上述药物引起的生态失调时,可以观察到不同细菌分类群水平与一种或多种药物的相似性。
拟杆菌的增加可能对抑郁症有潜在益处
拟杆菌在使用他汀类药物和非甾体抗炎药(NSAIDs)以及抑郁症患者的肠道中都有所增加。拟杆菌是一种产生γ-氨基丁酸(GABA)的革兰氏阴性菌,具有免疫触发LPS和抗炎SCFAs,从而引发免疫反应。
抑郁症与血清素减少相关的系统性和神经炎症都有关联。然而,原本拟杆菌产生的短链脂肪酸和GABA在抑郁症患者体内的含量较低,那么拟杆菌的增加,也增加了GABA和短链脂肪酸,有助于缓解抑郁行为。
他汀类药物和PPIs → 瘤胃球菌↑
瘤胃球菌(Ruminococcus)是一种产短链脂肪酸菌,在他汀类药物和PPI的使用者中增加,再次抵消了短链脂肪酸的低含量。后者也可能是抑郁症患者在口服他汀类药物或PPIs后,粪杆菌属数量低下的原因,粪杆菌是已知的丁酸盐生产者,对肠道屏障稳态和抗炎作用很重要。
他汀类药物 → Bact2↓
特别是他汀类药物可以降低拟杆菌2型(Bact2),这反过来可能导致抑郁症状。
抑郁症可能与他汀类药物和PPI的使用呈负相关,因为抑郁症患者的瘤胃球菌较低,而他汀类药物和PPI使用者的瘤胃球菌较高。
二甲双胍和PPI → 梭菌↓
二甲双胍和PPI中可以降低梭菌丰度,但在抑郁症中没有,因此,二甲双胍和PPI可能有助于减少梭菌。
梭菌的过度生长可能带来的不利结果大于有利结果,例如,艰难梭菌具有毒性和传染性,而梭菌簇XIVa产生短链脂肪酸带来益处。
二甲双胍 → 大肠杆菌↑
血清素可能通过迷走神经影响体液肠-脑通路。大肠杆菌和链球菌与肠杆菌科物种参与血清素合成。在抑郁症患者中,大肠杆菌低丰度,链球菌高丰度,二甲双胍可以缓解低水平的大肠杆菌,因为在使用二甲双胍后大肠杆菌的丰度增加。
他汀类药物抵消PPIs
NSAIDs和PPIs可能分别对肠杆菌科和链球菌产生相同的作用,而他汀类药物可能抵消PPIs的作用,与链球菌数量减少呈正相关。
药物影响与谷氨酸途径的菌群
拟杆菌,乳酸杆菌,双歧杆菌,链球菌也可能参与谷氨酸途径。因此,它们的药物诱导影响可能在单独或通过彼此的相互作用提高谷氨酸能神经传递中发挥作用。
关于谷氨酸详见:兴奋神经递质——谷氨酸与大脑健康
因此,二甲双胍,他汀类药物,PPIs和NSAIDs药物诱导的菌群失调可能各自影响抑郁症的发展和进展,并且它们的作用可能相互抵消或加剧。
扩展阅读:
多发性硬化症是中枢神经系统中最丰富的自身免疫性疾病。全世界有250多万人受到影响,其中大多数是年轻人。它是一种慢性炎症性疾病,其特征是神经纤维脱髓鞘和轴突继发性破坏,表现为白质组织病变。
多发性硬化的症状
症状因受影响的组织区域而异。第一个最常见的症状是视神经炎引起的视觉障碍以及感觉障碍和疲劳。间歇性症状是运动障碍,疼痛,认知,心理和植物障碍,使疾病具有进行性或复发性。
多发性硬化的病因
炎症过程通过自身反应性外周T淋巴细胞侵入中枢神经系统来解释。然而,这种自身免疫反应的出现尚不清楚。脂肪因子和细胞因子水平之间的遗传不平衡,爱泼斯坦-巴尔病毒(EB病毒)感染引起的自身反应性,维生素D缺乏,吸烟以及改变微生物-肠-脑轴的细菌和病毒肠道生态失调,都与多发性硬化的病理生理学有关。
多发性硬化患者与健康对照组微生物群不同
移植了多发性硬化患者粪便物质的GF小鼠复制了自身免疫性脑脊髓炎(一种在动物中发现的脱髓鞘疾病)的表型。这些结果与具有健康对照粪便物质的GF小鼠形成对比。甚至疾病的严重程度和/或活动性似乎也与不同的微生物组成有关。一般来说,抗炎菌群丰度较低。
多发性硬化的微生物群特征
临床活跃的病例(即复发性发作)与临床非活跃的治疗前患者相比,具有更丰富的微生物组。
在比较细菌种类时,临床上不活跃的多发性硬化患者的普拉梭菌(Faecalibacterium prausnitzii)和Gordonibacter urolithinfaciens的丰度显著高于临床活跃的多发性硬化患者。
同一研究发现61种在微生物组成上有差异的物种。多发性硬化中富集的物种如下:
减少的菌群包括:
总体而言,多发性硬化患者的微生物组成丰富度低于健康对照组。这也与多发性硬化相关细菌物种相关的特定炎症生物标志物的丰度更高有关。
其他研究产生了类似的结果,下列菌群增加:
下列菌群减少:
总体而言,拟杆菌门减少,相应的物种也有所减少,例如B.coprocola,B.coprophilus,B.stercoris。
在Faecalibacterium,Slackia,Clostridium,Methanobrevibacter和Butyricimonas中观察到不一致的结果。
在所有引用的有关多发性硬化的文献中,阿克曼菌的增加和普雷沃氏菌的减少一直是菌群持续改变的原因之一。
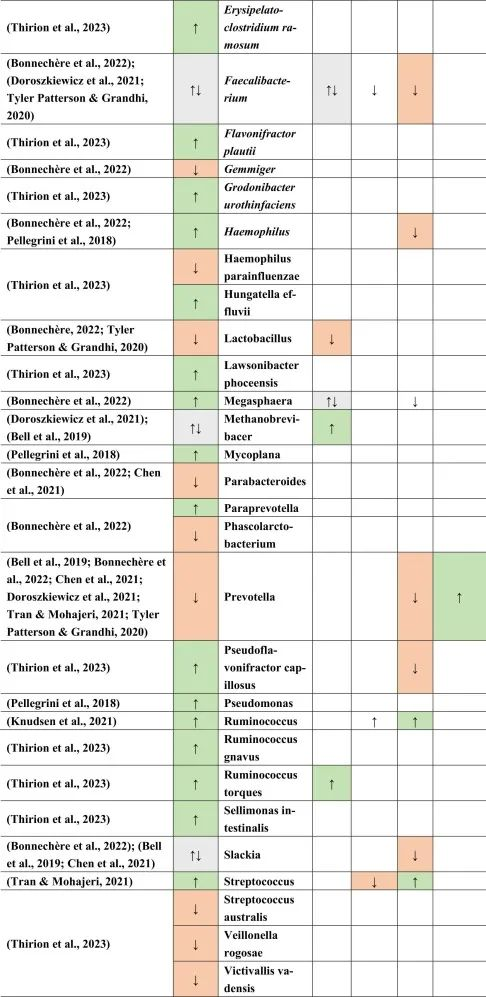
doi.org/10.1016/j.brainresbull.2024.110883
他汀类药物,NSAID → 拟杆菌↑
与多发性硬化患者相比,他汀类药物和非甾体抗炎药使用者的拟杆菌(一种革兰氏阴性细菌属和SCFA和GABA生产者)增加。
多发性硬化、二甲双胍→Bilophila wadsworthia↑
另一种革兰氏阴性物种Bilophila wadsworthia 在多发性硬化和二甲双胍中增加,但在他汀类药物中减少,这表明二甲双胍可能对多发性硬化患者不利,而他汀类药物对多发性硬化患者有利。革兰氏阴性细菌由于其细胞壁中存在LPS而诱导宿主免疫应答。
多发性硬化、PPI→链球菌↑ 他汀类→ 链球菌↓
链球菌属也是如此,在多发性硬化患者和PPI使用者中发现链球菌数量增加,而在他汀类药物使用者中发现链球菌数量减少。链球菌是一种条件致病菌,可产生神经毒素,乙酸盐和5-羟色胺(5-HT)。
多发性硬化、二甲双胍、PPI → Blautia↑
另一方面,Blautia 在多发性硬化,二甲双胍和PPI中增加。Blautia是丁酸盐生产者,这对于肠道屏障和血脑屏障等完整性以及小胶质细胞成熟和活化很重要。
二甲双胍和PPIs → 梭菌↓
然而,在多发性硬化症患者中,二甲双胍和PPIs使用者的梭状芽孢杆菌数量减少。梭菌产生SCFA,这可能影响Treg细胞,影响多发性硬化患者的自身免疫。
产短链脂肪酸菌Ruminococcus在多发性硬化和他汀类药物和PPI使用后增加。
Prevotella是LPS携带者和GABA生产者和丙酸生产者,NSAIDs增加,多发性硬化和PPIs减少。
双歧杆菌和乳酸杆菌,GABA和乙酸盐生产者在多发性硬化和摄入MET后分别增加和减少,表明这两个属可能影响多发性硬化疾病和进展。
从结果来看,多发性硬化与药物引起的生态失调之间可能存在许多关联。然而,需要更明确的研究结果来证明这些假设的关联。
扩展阅读:
帕金森病(PD)主要症状是运动症状,伴有运动障碍,僵硬,静息性震颤和姿势不稳,由多巴胺缺乏引起,多发生在黑质。路易体聚集体由错误折叠的蛋白质聚集体组成,即淀粉样蛋白,主要是α-突触核蛋白淀粉样蛋白,是多巴胺能神经元破坏的主要原因。
帕金森病的非运动前驱症状及其对疾病进展的影响
帕金森患者在很大程度上受到非运动症状的影响,其中许多症状在运动功能缺失发生前数十年就已出现。胃肠功能障碍,抑郁情绪,睡眠障碍,肌肉和关节疼痛是这些前驱症状中的一些。前者最常见的是便秘或胃排空延迟,流涎,吞咽困难,胃轻瘫和SIBO。患有这些前驱胃肠道疾病的患者帕金森进展更为严重。在ENS神经元中也观察到淀粉样蛋白的形成,特别是在小鼠和帕金森患者的早期。最近的研究表明,大脑中路易体的形成是由小鼠胃肠道中的淀粉样蛋白纤维诱导的,并且通过迷走神经干切断术大大降低了路易体形成的风险。
淀粉样蛋白的交叉形成与肠道微生物的潜在关联
淀粉样蛋白的形成不一定仅限于一种蛋白质。产生淀粉样蛋白的蛋白质可以相互交叉形成淀粉样蛋白。分子过程仍然未知,但可能发生在人类之间以及人类和非人类淀粉样蛋白之间。肠道微生物群中的多个物种能产生包含淀粉样蛋白的生物膜。有人提出,肠道淀粉样蛋白理论上可以通过迷走神经路径传输到大脑,并与α-突触核蛋白交叉促使形成淀粉样蛋白。
大肠杆菌、假单胞菌、链球菌、葡萄球菌、沙门氏菌、分枝杆菌、克雷伯菌、柠檬酸杆菌和芽孢杆菌是肠道中产生这种胞外淀粉样蛋白的候选细菌。Nuzum等人还指出产短链脂肪酸菌的总体丰度较低。因此,肠道微生物群可能既能启动也能调节帕金森病的发起。
帕金森患者的肠道菌群特征
当比较帕金森患者与健康对照组的微生物组成时,在帕金森患者中主要是下列菌群增多:
下列菌群减少:
乳杆菌科不一致,显示出较高和较低的丰度。
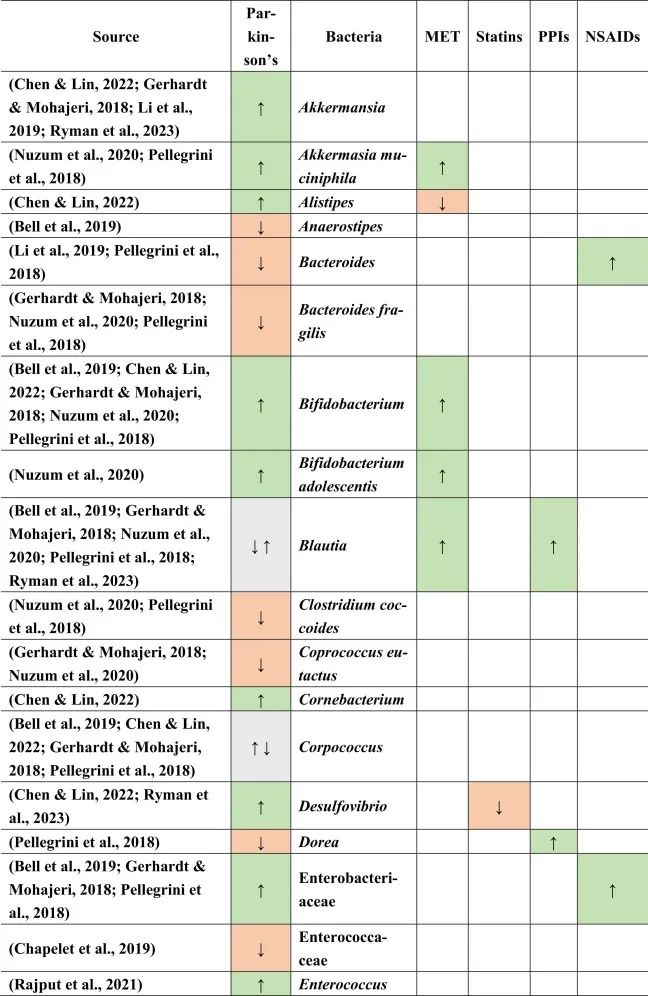
doi.org/10.1016/j.brainresbull.2024.110883
在比较帕金森的生态失调和药物引起的生态失调时,假设如下:PPI诱导小肠细菌过度生长,并增加沙门氏菌感染的风险。两者都可能影响帕金森,因为小肠细菌过度生长也在帕金森病患者中发现,沙门氏菌是细胞外淀粉样蛋白的产生者。然而,在PPI和帕金森中没有观察到沙门氏菌作为一个共同因素。
与多发性硬化类似,瘤胃球菌科在帕金森,他汀类药物和NSAIDs中增加。然而,已知短链脂肪酸可以增强BBB的完整性,因此可以降低炎症因子通过大脑从而形成细胞外淀粉样蛋白的风险。
帕金森,他汀类药物,PPI → 粪杆菌↓
另一方面,粪杆菌(Faecalibacterium)是一种已知的丁酸盐生产者,对肠道和BBB完整性以及抗炎菌群具有重要意义,在帕金森,他汀类药物和PPI中减少,这表明粪便杆菌可能是帕金森病患者屏障减弱和炎症过程加剧的原因之一。
二甲双胍和PPIs可能有助于逆转粪杆菌的不利影响
因为二甲双胍和PPIs增加了Blautia的存在,而帕金森患者则减少了Blautia。同样,由于他汀类药物和非甾体抗炎药,瘤胃球菌科的丰度增加,也可以补偿粪杆菌和其他不利菌的影响。这也表明,没有一种药物会产生所有负面或正面影响,例如,PPI会增加Blautia(一种有利的短链脂肪酸生产菌)并同时增加小肠细菌过度生长,这是人体的负面过程。
菌群之间的相互作用力量不可忽视
总体而言,与本文提到的其他药物相比,二甲双胍对微生物组产生的影响与帕金森病中所见的影响最相似。在帕金森患者和二甲双胍使用者中均观察到Akk菌(短链脂肪酸生产者和LPS携带者),青春双歧杆菌(GABA生产者)和大肠埃希氏菌(LPS携带者,5-HT-metabolsier)的丰度增加,其中第一种和后一种细菌是革兰氏阴性,其细胞壁中存在LPS,但也分别产生短链脂肪酸和5-HT。
同样,它们都传达了有利和不利的影响,这表明没有一种细菌是某种疾病发病机制的主要决定因素。菌群之间的相互作用和相对丰度似乎对疾病发作和进展的总体影响很重要。
阿尔茨海默病(AD)是老年痴呆症最常见的形式,约占全球痴呆症病例的50-70%。由于其患病率随着年龄的增长而增加,并且世界人口正在老龄化,阿尔茨海默的发病率在未来几年将更高。在大多数情况下,它始于新形成的记忆的丧失,神经认知和执行功能(如语言和视觉空间取向)进一步下降。
阿尔茨海默病的病理生理学
病理生理学是多方面的,导致不可逆的神经元细胞和突触丢失。除年龄外,阿尔茨海默的其他标志是不溶性淀粉样β斑块的积累,其次是Tau蛋白的神经原纤维缠结,神经递质的失衡和神经炎症。随着年龄的增长,肠道微生物组会发生实质性变化,因此,有人认为与年龄相关的肠道菌群失调也可能导致阿尔茨海默的发病。
扩展阅读:
老年人肠道菌群失衡与阿尔茨海默病发病
在老年人中,随着促炎细菌与抗炎细菌比例的增加以及产短链脂肪酸菌的减少,导致肠漏,BBB紊乱和小胶质细胞活化。后者在清除Aβ斑块方面很重要,当其清除能力因Abeta的过度产生或由于炎症性结构变化导致的能力丧失而受阻时,淀粉样斑块可能会在阿尔茨海默病患者的大脑中积累。
淀粉样蛋白的细菌来源与神经炎症加剧
据推测,淀粉样蛋白也被推测可能来自细菌源,类似于帕金森,要么在大脑中与其他淀粉样结构交叉播种,要么由于肠漏引起的系统性炎症而加剧神经炎症。此外,据报道,通过显著阳性的SIBO呼吸试验(p=0.025)报告细菌移位。阿尔茨海默患者的细菌移位和LPS水平升高都会加剧神经炎症。
主要发现表明促炎细菌埃希氏菌/志贺氏菌水平升高,抗炎直肠真杆菌水平降低。它们失衡可能是认知障碍和淀粉样蛋白合成的主要原因之一,因为在促炎细胞因子和抗炎细胞因子之间发现了各自的相关性,而且大肠杆菌也属于产生淀粉样蛋白的细菌。
阿尔茨海默患者的肠道菌群特征
据报道,阿尔茨海默患者中下列菌群增加:
下列菌群减少:
在厚壁菌门,乳酸杆菌,Lachnospiraceaea和拟杆菌科中发现了不一致的结果。
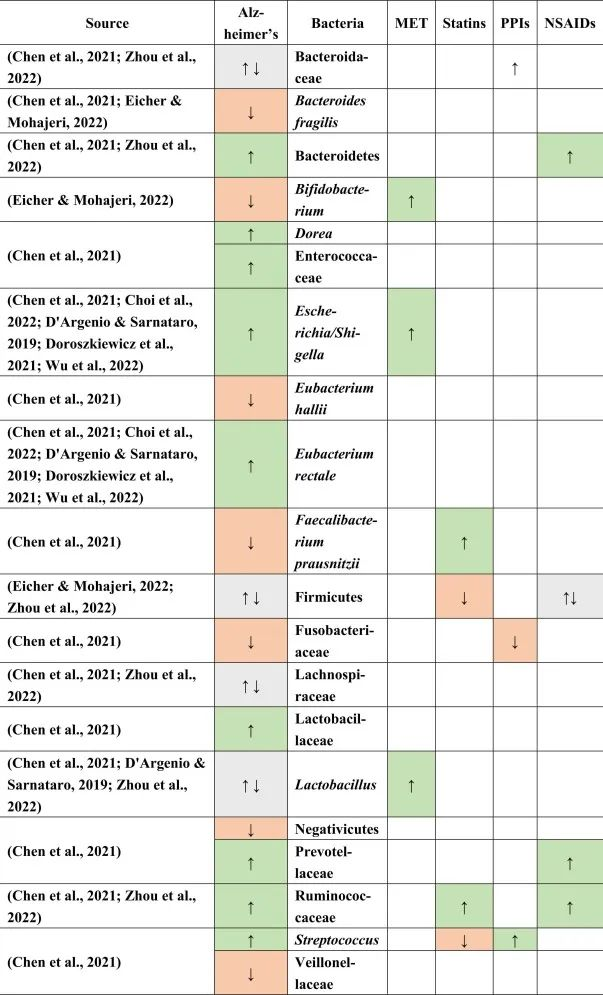
doi.org/10.1016/j.brainresbull.2024.110883
他汀类药物 → 普拉梭菌↑ → 抗炎
在上述药物和阿尔茨海默病患者中,他汀类药物的使用与改变的微生物群的关联最强。特别是,产丁酸菌普拉梭菌在他汀类药物使用者中增加,这可能有助于维持血脑屏障,因为丁酸盐在抗炎过程和小胶质细胞活化和成熟中起主要作用。
他汀类药物联合PPI → 抵消链球菌富集
他汀类药物与PPI一起使用,可能有助于抵消由于PPI使用而导致的链球菌富集,因为链球菌被认为会产生细胞外淀粉样蛋白。
瘤胃菌科是一种短链脂肪酸生产者,在他汀类药物以及NSAID使用者和阿尔茨海默患者中升高,可能具有与帕金森病相同的补偿作用,因为在阿尔茨海默患者中观察到短链脂肪酸丰度较低。
与帕金森一样,在阿尔茨海默患者中观察到阳性小肠细菌过度生长结果,PPI可能是其主要贡献者,无论是否口服NSAIDs。
扩展阅读:
有力的证据表明药物使用与肠脑轴之间、肠脑轴与神经系统疾病之间分别存在联系。由于药物和神经系统疾病,菌群失调环境中存在共同的细菌菌株。少数药物可以在特定疾病情况下缓解菌群失调,但也可能引起菌群失调。菌群彼此之间及其相互作用将影响肠脑轴,药物在共病患者中通经常联合使用。因此,它们的效果可能相互抵消或加剧细菌种群的相应变化,并与神经系统疾病中的菌群失调呈正面或负面关联。
由于肠道微生物群会因食物、环境、生活方式等各种因素而发生变化,因此在这类研究中也应考虑伴有共病的老年人。当老年人同时服用多种药物且因食欲不振而饮食不佳时,可能会预期其肠道微生物群发生不同的变化。然而,药物引起菌群失调及其通过肠脑轴对神经系统疾病影响的相关性仍是一个新领域。
本文中有些数据也是有限的,没有考虑原发病情况、其他药物的合并使用、药物剂量、药物暴露和服药时间、年龄、性别、患者饮食、共病等混杂因素,缺乏大队列数据支持,目前还没有足够的数据来得出建议性的结论。因此,还需要更多的工作来克服现有的局限性并提供更加坚实的证据基础,包括设计大型的、多中心的、随机对照试验,以收集高质量的数据来验证这些初步发现。
主要参考文献
Garg K, Mohajeri MH. Potential effects of the most prescribed drugs on the microbiota-gut-brain-axis: A review. Brain Res Bull. 2024 Jan 18;207:110883.
Garg K, Mohajeri MH. Potential effects of the most prescribed drugs on the microbiota-gut-brain-axis: A review. Brain Res Bull. 2024 Jan 18;207:110883.
Deng X, Zhang C, Wang P, et al., Cardiovascular Benefits of Empagliflozin Are Associated With Gut Microbiota and Plasma Metabolites in Type 2 Diabetes. J Clin Endocrinol Metab. 2022 Jun 16;107(7):1888-1896.
Epishina IV, Budanova EV. Rol’ mikrobioty cheloveka v razvitii neirodegenerativnykh zabolevanii [A role of human microbiota in the development of neurodegenerative diseases]. Zh Nevrol Psikhiatr Im S S Korsakova. 2022;122(10):57-65.
He D, Han H, Fu X, Liu A, Zhan Y, Qiu H, Ma L, Zhang X, Wang X. Metformin Reduces Blood Glucose in Treatment-Naive Type 2 Diabetes by Altering the Gut Microbiome. Can J Diabetes. 2022 Mar;46(2):150-156.
Knudsen JK, Bundgaard-Nielsen C, Hjerrild S, Nielsen RE, Leutscher P, Sørensen S. Gut microbiota variations in patients diagnosed with major depressive disorder-A systematic review. Brain Behav. 2021 Jul;11(7):e02177.
谷禾健康
迄今为止最全面的全球抗菌素耐药性 (AMR) 研究发现,由耐药菌引起的感染是所有年龄段人群死亡的主要原因之一。
22年发表在《柳叶刀》杂志上的分析估计,2019 年有 495 万人死于细菌性 AMR 发挥作用的疾病。其中,127 万人死亡是 AMR 的直接结果——这意味着耐药性感染导致的死亡人数超过了艾滋病毒/艾滋病(864,000 人死亡)或疟疾(643,000 人死亡)。
细菌性 AMR 感染最常见的三个部位是胸部、血液和腹部——身体这些部位的感染占直接归因于 AMR 死亡的 78.8%。六种最致命的细菌病原体导致了将近四分之三的所有因耐药性导致的死亡。2019 年,仅耐抗生素大肠杆菌就导致约 20 万人死亡。
“AMR 确实是一个全球性问题,需要决策者和全球卫生界采取紧急行动,以避免可预防的死亡,”
对抗生素有耐药性的细菌比例正在上升。在一个抗生素使用变得如此普遍的世界里,耐药细菌比那些被药物杀死的细菌更胜一筹。
伤口敷料的微观纤维上的金黄色葡萄球菌
图片来源: Science Photo Library
预计到 2050 年,每年可能有多达 1000 万人死于抗菌素耐药性。如果任其发展,以前可以用几天抗生素治愈的感染可能变得无法治愈。
如果细菌感染无法控制会导致严重的健康问题,比如梅毒会引起失明和神经损伤。女性感染衣原体会导致不孕。梅毒可以传染给未出生的孩子,导致出生时患有这种疾病的婴儿流产、死产或大脑和器官受损。
淋病细菌(如图)对某些抗生素产生了耐药性
图片来源: SPL
数据显示,低收入国家的 AMR 相关死亡率最高。在 21 个 GBD 地理区域中,西撒哈拉以南非洲直接归因于 AMR 的死亡率最高,每 10 万人中有 27.3 人死亡。大洋洲最低,每 10 万人中有 6.5 人死亡。
低收入地区的耐药率和耐药菌感染数量均高于富裕国家。造成这种情况的原因包括环境卫生和卫生条件差、用于治疗的检测设施不足以及无法获得最新的抗生素和疫苗。
但是注意,许多低收入和中等收入国家的抗微生物药物耐药性数据很少,这表示实际的AMR比调查的数据更严重,这凸显了在这些地区大幅扩大实验室能力的必要性。
抗生素药物旨在消灭细菌,但它们不一定会杀死所有的细菌,它们只是将细菌减少到安全水平。但是不幸的是,这个过程选择留下了最强壮的细菌个体,然后可以通过基因传递产生耐药性。几十年后,就会有这么多种细菌进化出对一系列抗生素的抗性。
对抗生素产生耐药性的致病细菌的出现,往往归因于人类和牲畜过度和不合理使用抗生素。虽然这是问题背后的主要机制,但这不是唯一的因素。昆士兰大学的研究人员希望测试其他药物,即使是那些没有抗生素特性的药物,是否可以在超级细菌的出现中发挥作用。
最近昆士兰大学的研究人员已经将注意力集中在另一个潜在的抵抗力驱动因素上:抗抑郁药。通过研究在实验室中生长的细菌,已追踪到抗抑郁药如何引发耐药性。
“即使接触几天后,细菌也会产生耐药性,不仅针对一种抗生素,还针对多种抗生素”,布里斯班昆士兰大学澳大利亚水与环境生物技术中心的资深作者郭建华(英译)说。
早期线索
2014 年,郭开始对非抗生素药物对抗生素耐药性的可能贡献产生兴趣,因为他的实验室发现生活废水样本中循环的抗生素耐药基因比抗生素使用率更高的医院废水样本中循环的抗生素耐药基因更多。
郭的团队和其他团队还观察到,抗抑郁药——世界上使用最广泛的药物之一——可以杀死或阻碍某些细菌的生长。郭解释说,它们会引发“SOS 反应”,从而触发细胞防御机制,使细菌能够更好地在随后的抗生素治疗中存活下来。
在 2018 年的一篇论文中,该小组报告说,大肠杆菌在接触氟西汀后就对多种抗生素产生了耐药性,氟西汀通常以百忧解的形式出售。最新研究检查了6种此类药物中的5种其他抗抑郁药和13种抗生素,并调查了大肠杆菌的耐药性是如何产生的。
备注:百优解(盐酸氟西汀胶囊)是一种选择性血清素(5-羟色胺,5-HT)再吸收抑制剂(SSRI)型的抗忧郁药,其药物形态为盐酸氟西汀(Fluoxetinehydrochloride),商品名为“百优解”或“百忧解”(Prozac)。在临床上用于成人忧郁症、强迫症等。
在氧气充足的实验室条件下生长的细菌中,抗抑郁药会导致细胞产生活性氧:一种激活微生物防御机制的有毒分子。最重要的是,这激活了细菌的外排泵系统,这是许多细菌用来消除各种分子(包括抗生素)的通用排出系统。这可能解释了细菌如何在没有特定抗性基因的情况下抵抗抗生素。
在抗抑郁药存在的情况下,革兰氏阴性细菌大肠杆菌可以抵御抗生素
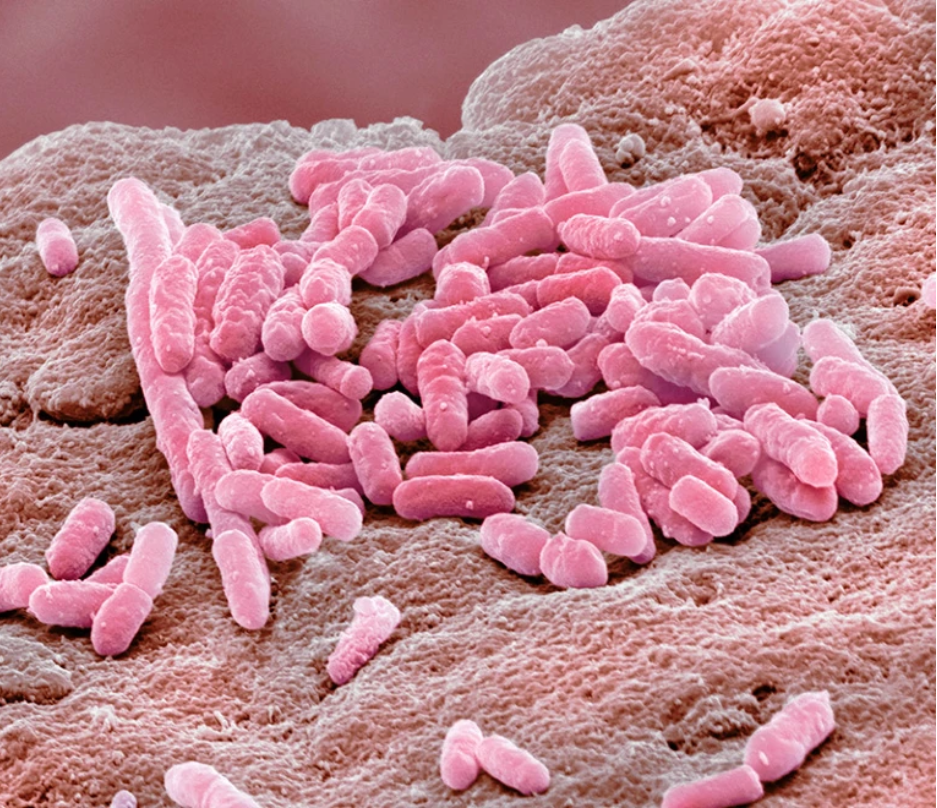
图片来源:Steve Gschmeissner/Science Photo Library
但是大肠杆菌暴露于抗抑郁药也导致微生物突变率增加,以及随后选择各种抗性基因。然而,在厌氧条件下生长的细菌中,活性氧水平要低得多,抗生素耐药性的发展要慢得多。
此外,至少一种抗抑郁药舍曲林(舍曲林是5-羟色氨再摄取抑制剂,是一种新型的抗抑郁剂,具有较强抗抑郁,抗焦虑作用,既可用于抑郁症,焦虑症、双相障碍的抑郁相,强迫障碍的治疗)促进了细菌细胞之间的基因转移,这一过程可以加速耐药性在人群中的传播。这种转移可以发生在不同类型的细菌之间,从而使耐药性在物种之间转移——包括从无害细菌到致病细菌。
越来越多的认可
英国剑桥大学研究微生物组-化学相互作用的 Kiran Patil 说,在过去五年中,人们越来越认识到许多针对人体细胞的非抗生素药物也会影响细菌并导致抗生素耐药性。
德国图宾根大学的 Lisa Maier 指出,研究药物与微生物组之间的相互作用,要了解抗抑郁药如何驱动抗生素耐药性,研究人员需要确定药物针对细菌中的哪些分子并评估药物对更广泛的临床相关细菌种类的影响。
2018 年,Maier 和她的同事调查了 835 种不针对微生物的药物,发现 24% 的药物抑制了至少一种人类肠道细菌菌株的生长。
Patil 和 Maier 表示,重要的是要收集证据来评估抗抑郁药在现实世界中对耐药性的影响,例如抗抑郁药是否正在推动抗生素耐药细菌的积累,尤其是致病细菌在人、动物或环境中的积累。
尽管在废水中发现了大量的抗抑郁药,但报告的水平往往低于郭的小组在大肠杆菌中看到显着效果的浓度。不过,预计在服用这些药物的人的大肠中会达到在这项研究中具有强烈作用的一些抗抑郁药的浓度。
后续研究
Maier 说,现在有几项研究将抗抑郁药和其他非抗生素药物与细菌的变化联系起来,并且初步研究已经给出了关于这些药物如何影响服用它们的人的微生物组的“初步提示”。
但在健康人类中,大肠杆菌主要存在于大肠中,那里的条件是厌氧的,这意味着论文中描述的过程可能不会以相同的速度发生在人身上,Maier 说,未来的研究应该使用细菌生长条件来模拟抗抑郁药可能起作用的部位。
郭说他的实验室现在正在研究给予抗抑郁药的小鼠的微生物组。早期未发表的数据表明,这些药物可以改变动物的肠道微生物群并促进基因转移。
但是郭和相关研究人员告诫人们不要根据这项研究停止服用抗抑郁药。“如果您患有抑郁症,则需要以最好的方式进行治疗,其次是关注肠道细菌”。
但是研究人员和制药公司需要量化非抗生素药物对抗生素耐药性的贡献。非抗生素药物是我们不应忽视的一个大问题。
寻找新抗生素的需求迫在眉睫,但许多科学家和政策制定者正在从其他角度解决抗菌素耐药性问题。《Nature》期刊详细地介绍了三种方法。
➤ 等离子清洗
富含化学不稳定形式的氧和氮(也称为自由基和活性物质)的等离子活化水被认为是潜在的新型消毒剂。“如果细菌被自由基淹没,它们最终就会死亡,” 澳大利亚阿德莱德大学的生物医学研究员 Katharina Richter 说。
Richter 和她的同事正在研究与未经治疗的伤口相比,血浆活化水清除感染耐甲氧西林金黄色葡萄球菌(MRSA) 的伤口的速度有多快。他们还将这项技术与通过静脉滴注施用抗生素进行比较。
她说,尚未公布的初步结果还不错。“治疗改善了伤口并比没有治疗更快地清除了感染,” 她说,“它不如抗生素治疗有效,但 Richter 说实验设计可能是罪魁祸首。将其与局部给予的抗生素进行比较会更公平。我们的下一项研究将有更好的控制。”
➤ 金属奇迹
细菌虽然在自然界中是单细胞,但确实聚集在一起并互相帮助以逃避药物和防腐剂。他们这样做的一种方法是形成生物膜——生活在它们自己制造的粘液环境中的细菌群。
生物膜保护居住在其中的单个细胞;据认为,大约 80% 的慢性人类感染是由生物膜引起的。金属元素镓会干扰细菌对铁的吸收,最终导致微生物缺乏营养。
正因为如此,含镓药物是一种正在探索的破坏生物膜的途径。英国曼彻斯特大学的科学家发现,镓化合物可以减少多达 87% 的细菌生长(JM Baker et al. Life Sci . 305 , 120794; 2022)。
这项工作建立在中国上海交通大学研究人员的研究结果之上,该研究表明镓可以有效溶解 MRSA 生物膜的结构,使细菌可以用常用抗生素剂量的十分之一杀死(W. Xia et al., ACS Infect. 2021, 2565–2582)。现在的研究重点是如何最好地输送镓以及输送多少剂量。
➤ 分子签证
抗生素应具有三个关键特性:溶解性,易于与细菌结合的能力,以及穿透细胞膜的能力。这使得设计一种新的抗生素成为一项艰巨的任务。
因此,一些研究人员并没有创造全新的抗生素,而是通过“大型数字图书馆”进行筛选,以预测哪些现有化合物可能已经具备所需的条件。
新加坡生物技术初创公司 BIOptimize 的计算化学家 Javad Deylami 说:“已经有既定的方法可以在几分钟内评估前两个特性,但渗透是这个难题中缺失的一块。”
Deylami 说,这意味着科学家们经常评估理论上可以很好地杀死细菌的化合物,但在进入细菌内部的第一个障碍上却达不到要求。“这就像他们到达边境但没有签证可以通过。”
Deylami 构建了一个细菌外细胞膜的计算机化版本,在上面进行模拟,测试分子穿透细胞膜的能力。他的模型确定了影响潜在药物通过或失败的力,从而使 Deylami 能够计算化合物的渗透性。
通过该程序运行已知的分子结构,Deylami 的团队能够在人工智能的帮助下了解化合物需要哪些“品质”来提高其渗透性。这些知识应该可以帮助他们在“庞大的图书馆”中寻找具有这些特性的现有药物。
主要参考文献
Wang, Y. et al. Proc. Natl Acad. Sci. USA 120, e2208344120 (2023).
Drew L. How antidepressants help bacteria resist antibiotics. Nature. 2023 Jan 24. doi: 10.1038/d41586-023-00186-y. Epub ahead of print. PMID: 36693968.
Antimicrobial Resistance Collaborators Lancet 399, 629–655 (2022).
Jin, M. et al. Environ. Int. 120, 421–430 (2018).
Maier, L. et al. Nature 555, 623–628 (2018).