-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
肠道微生物群是居住在人类胃肠道中的复杂生态系统,由数万亿微生物(包括细菌、病毒、真菌和其他微生物)组成。通过代谢活动和与宿主相互作用,肠道微生物群在影响正常生理过程、代谢稳态和疾病易感性方面发挥重要作用,并影响健康的各个方面。
研究表明,肠道菌群失调或改变可通过影响葡萄糖代谢、胰岛素敏感性和炎症来促进2型糖尿病发展。此外,肠道菌群通过葡萄糖耐量受损和胰岛素抵抗增加等机制与2型糖尿病、肥胖、代谢综合征等疾病发作相关。
2型糖尿病患者通常表现出产丁酸盐的有益细菌(如罗氏菌属和普拉梭菌)减少,而有害细菌(如埃希菌属和扭链瘤胃球菌属)增加。
而平衡的肠道微生物群与葡萄糖代谢和胰岛素敏感性改善相关,有可能降低糖尿病相关并发症风险。最近的荟萃分析表明,微生物群衍生的干预措施可显著改善血清空腹胰岛素和糖化血红蛋白水平,这两者都是2型糖尿病患者疾病进展的关键标志物。调节肠道微生物群的策略包括使用益生菌、益生元和合生元。益生菌是摄入后对健康有益的活微生物,益生元是刺激有益肠道细菌生长的不可消化化合物,合生元是益生菌和益生元的组合,协同作用以增强肠道健康。
尽管关于益生菌在2型糖尿病中作用的研究正在迅速扩大,强调它们对血糖控制和代谢参数的积极影响,然而益生元作为细菌营养基质的重要作用经常被忽视。不同类型的益生元可直接影响血糖水平,并通过支持有益细菌生长间接影响糖尿病。菊粉、低聚果糖、低聚半乳糖、抗性淀粉、果胶低聚糖、多酚、β-葡聚糖和铁皮石斛等益生元已被证明可改善肠道微生物组成并支持2型糖尿病患者血糖控制。
本文将详细描述不同的益生元、它们建议的每日剂量、含有它们的食物、它们对2型糖尿病的直接影响,以及由此产生的肠道微生物群的变化。益生元还通过不同机制改善血糖指数,包括对短链脂肪酸的影响、抗炎作用、肠促胰岛素分泌优化、血脂水平改善和抗氧化特性。深入地了解如何利用益生元以及个性化饮食干预有望作为优化糖尿病管理和改善整体健康的治疗策略。
2型糖尿病(T2DM)是一种由胰岛素抵抗或分泌不足等导致血糖水平升高的慢性代谢性疾病,典型症状被称为”三多一少”:即多饮、多尿、多食和体重减轻。
2型糖尿病已成为21世纪最严重的全球性健康危机之一。据国际糖尿病联盟数据,全球糖尿病患者从2000年的1.51亿激增至2021年的5.37亿,预计2045年将达7.83亿,其中90-95%为2型糖尿病。并且在全球20-79岁成年患者中,中国占1.41亿人,超过总数的四分之一。
2型糖尿病的危害
这一”现代流行病”不仅以惊人的速度蔓延,更以其广泛而深远的健康危害威胁着人类生存质量:它是导致失明、肾衰竭、糖尿病截肢的主要原因,还会使心血管疾病风险增加2-4倍,每年夺走超过400万人的生命。
2型糖尿病的危害包括以下几方面:
▸ 急性并发症
①糖尿病酮症酸中毒 (DKA)
发生率:2型糖尿病患者中约5-25%;
病理机制:胰岛素严重不足,脂肪分解增加,酮体生成过多;
临床表现:恶心、呕吐、腹痛、意识障碍;
死亡率:未治疗情况下可达5-10%。
②高血糖高渗状态 (HHS)
血糖通常>33.3 mmol/L,血浆渗透压>320 mOsm/kg;
脱水严重,可达体重的20-25%;
死亡率:10-50%。
③严重低血糖
血糖<2.8 mmol/L且伴有症状;
可导致认知功能损害、昏迷、死亡;
老年患者风险更高。
▸ 慢性微血管并发症
①糖尿病肾病
病理改变:肾小球基底膜增厚、系膜扩张、结节性硬化;
分子机制:高血糖激活蛋白激酶C,促进细胞外基质合成;
糖基化终末产物 (AGEs) 激活炎症反应;
肾素-血管紧张素系统激活;
患病率:30-40%的糖尿病患者发生肾病,是导致终末期肾病的主要原因。
②糖尿病视网膜病变
病理机制:视网膜毛细血管基底膜增厚;
周细胞丢失,血管通透性增加;
视网膜缺血,血管内皮生长因子 (VEGF) 释放;
新生血管形成,纤维增殖;
患病率:病程20年后约60%患者发生;
致盲率:糖尿病是工作年龄人群致盲的主要原因。
③糖尿病神经病变
远端对称性多发神经病变:
病理:轴突变性、脱髓鞘、神经纤维丢失;
症状:疼痛、麻木、感觉异常;
患病率:50-90%。
自主神经病变:
心血管自主神经病变:心率变异性降低,体位性低血压;
胃肠道自主神经病变:胃轻瘫,腹泻或便秘;
泌尿生殖系统病变:膀胱功能障碍,勃起功能障碍。
▸ 慢性大血管并发症
①冠心病
发病机制:动脉粥样硬化加速形成;
内皮功能障碍,一氧化氮生成减少;
血小板聚集性增加,凝血功能异常;
炎症反应激活,C反应蛋白升高;
发病风险:比非糖尿病患者高2-4倍;
预后:糖尿病患者心肌梗死后死亡率更高。
②脑血管病
缺血性脑卒中风险:增加2-3倍;
病理机制:大动脉粥样硬化、小血管病变、心源性栓塞;
认知障碍:血管性痴呆风险显著增加。
③外周动脉疾病
下肢动脉疾病:患病率15-20%。
糖尿病足:
发病机制:神经病变+血管病变+感染;
溃疡年发生率:2-10%;
截肢率:比非糖尿病患者高10-20倍。
▸ 代谢和内分泌影响
①脂代谢紊乱
糖尿病性血脂异常:甘油三酯升高(>1.7 mmol/L);
高密度脂蛋白胆固醇降低(<1.0 mmol/L男性,<1.3 mmol/L女性);
小而密的低密度脂蛋白增加。
非酒精性脂肪肝:患病率60-70%。
②电解质和酸碱平衡紊乱
高钾血症:肾功能不全时常见;
低钠血症:高血糖导致的稀释性低钠;
代谢性酸中毒:晚期肾病或酮症时。
▸ 免疫功能损害
①感染易感性增加
机制:中性粒细胞趋化性和吞噬功能下降;
细胞免疫功能减退;
组织愈合能力降低。
常见感染:
泌尿系统感染
皮肤软组织感染
肺部感染
真菌感染(如念珠菌病)
②疫苗应答减弱
流感疫苗、肺炎疫苗效果降低;
需要加强免疫策略。
▸ 心理和认知影响
①认知功能损害
2型糖尿病引起的脑血管病变、慢性炎症、胰岛素信号异常、高血糖毒性可能损害认知功能;
表现:执行功能、记忆力、注意力下降;
痴呆风险:增加1.5-2倍。
②心理健康问题
抑郁症:患病率25-30%,是一般人群的2倍;
焦虑障碍:患病率15-20%;
糖尿病痛苦:疾病管理负担导致的心理压力。
2型糖尿病是如何形成的?
葡萄糖通过食物和饮料进入人体,此时胰腺会分泌胰岛素激素帮助血液中的葡萄糖进入肌肉、脂肪和肝脏以提供能量。
▸ 胰岛素有助于控制正常血糖水平
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像“钥匙打开锁”一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
初期,胰腺会代偿性地分泌更多胰岛素来克服胰岛素抵抗。随着时间推移,胰腺功能逐渐衰竭,无法产生足够的胰岛素,2型糖尿病由此发生。
▸ 胰岛素抵抗的发生机制
细胞水平机制
胰岛素受体缺陷:受体数量减少或亲和力下降;
胰岛素受体底物-1 (IRS-1) 功能障碍:磷酸化异常,信号传导受阻;
PI3K-Akt通路受损:葡萄糖转运蛋白4 (GLUT4) 转位障碍;
线粒体功能异常:氧化磷酸化效率降低,ATP生成受限。
分子机制
蛋白激酶C (PKC) 激活:由二酰甘油 (DAG) 激活,抑制胰岛素信号;
c-Jun氨基末端激酶 (JNK) 激活:促进IRS-1丝氨酸磷酸化;
核因子κB (NF-κB) 激活:促进炎症因子释放;
过氧化物酶体增殖物激活受体γ (PPARγ) 功能减退。
▸ β细胞功能衰竭
早期阶段
β细胞代偿性增生:胰岛β细胞质量增加20-50%;
胰岛素分泌相位改变:第一相分泌减少,第二相延迟;
淀粉样蛋白沉积:胰岛淀粉样多肽 (IAPP) 在胰岛内沉积。
进展阶段
β细胞凋亡:氧化应激、内质网应激诱导细胞死亡;
β细胞去分化:失去成熟β细胞特征,分泌功能丧失;
胰岛纤维化:细胞外基质沉积,胰岛结构破坏。
▸ 遗传易感性
主要易感基因
TCF7L2:最强的2型糖尿病易感基因,影响胰岛素分泌;
PPARG:调节脂肪细胞分化和胰岛素敏感性;
KCNJ11和ABCC8:编码胰岛β细胞ATP敏感性钾通道;
IGF2BP2、CDKN2A/B、CDKAL1:影响β细胞功能。
遗传风险
一级亲属患病风险增加2-6倍;
同卵双胞胎一致性达90%;
不同种族遗传易感性存在差异。
▸ 环境和生活方式等因素
肥胖会增加患2型糖尿病的风险
内脏脂肪堆积:释放游离脂肪酸,诱发胰岛素抵抗;
脂肪因子异常:脂联素减少,瘦素抵抗,抵抗素增加;
慢性低度炎症:TNF-α、IL-6等促炎因子升高;
异位脂质沉积:肝脏、肌肉、胰腺脂肪浸润。
其他环境因素
久坐行为:肌肉胰岛素敏感性下降;
睡眠障碍:皮质醇分泌异常,葡萄糖稳态破坏;
慢性应激:下丘脑-垂体-肾上腺轴激活;
肠道菌群失调:短链脂肪酸减少,肠道屏障功能受损。(肠道菌群与2型糖尿病的关系将在后续章节详细描述,通过益生元和改善肠道微生物群可能成为治疗2型糖尿病的一种新方法)
研究表明,肠道菌群失调可通过影响葡萄糖代谢、胰岛素敏感性和炎症反应促进2型糖尿病(T2DM)的发生发展。
此外,肠道菌群还通过葡萄糖耐量受损和胰岛素抵抗等机制与肥胖、代谢综合征和2型糖尿病相关。最新荟萃分析显示,微生物群干预可显著改善空腹胰岛素和糖化血红蛋白水平,这两项均为2型糖尿病进展的关键指标。
2型糖尿病患者的肠道微生物群组成显示出明显的改变,提供了微生物分类群和相关代谢物之间的重要相关性,这些代谢物要么增加了对2型糖尿病发展的敏感性,要么防止了2型糖尿病的发展。
1
产丁酸盐细菌减少
具体而言,2型糖尿病(T2DM)患者表现出有益的产丁酸盐细菌减少,微生物多样性降低,包括普拉梭菌(Faecalibacterium prausnitzii)、罗氏菌属(Roseburia)和直肠真杆菌(Eubacterium rectale)。
丁酸盐是一种短链脂肪酸(SCFA),在调节食欲、体重和胰岛素抵抗方面起着关键作用。此外,在糖尿病患者中,另一种丁酸盐生产梭菌的减少已有记录。
• 与葡萄糖代谢相关的青春双歧杆菌等有益菌群减少
此外,2型糖尿病患者中另一种有益细菌Anaerostipes hadrus含量降低,这种减少与葡萄糖代谢受损和胰岛素抵抗增加有关。研究还显示,直肠真杆菌水平下降与加重胰岛素抵抗的菌群失调有关。
瘤胃球菌(Ruminococcus bromii)对葡萄糖代谢至关重要,但在糖尿病患者(尤其是慢性胰腺炎患者)中含量较低。2型糖尿病患者的青春双歧杆菌(Bifidobacterium adolescentis)和克里斯滕斯菌科(Christensenellaceae)水平均降低,后者与糖化血红蛋白水平呈负相关。糖尿病前期个体的梭菌显著减少,其降低与血糖水平、胰岛素抵抗和炎症反应改善相关。
2
对血糖有积极影响的菌群减少
放线菌门中的双歧杆菌与较低的2型糖尿病风险相关,厌氧菌门对空腹血糖有积极影响。其他研究表明,2型糖尿病患者的肠道拟杆菌(Bacteroides intestinalis)、拟杆菌(Bacteroides)和普通拟杆菌(Bacteroides vulgatus)水平降低。
早期研究显示,2型糖尿病患者的梭状芽胞杆菌和厚壁菌门水平显著下降,新诊断患者中球囊梭菌(Clostridium coccoides)和柔嫩梭菌属(Clostridium leptum)水平尤其降低。
青春双歧杆菌(Bifidobacterium adolescentis)和Bifidobacterium angulatum有助于改善血糖控制,Oscillospiraceae水平升高与胰岛素抵抗改善相关。巨单胞菌高水平与正常葡萄糖耐量相关。
• 双歧杆菌减少
双歧杆菌属具有显著的健康益处,包括改善肠道通透性,从而降低内毒素的循环水平并减少全身炎症。这与改善宿主的糖耐量和葡萄糖诱导的胰岛素分泌,并减少炎症有关。
• Akkermansia菌减少
Akkermansia muciniphila和Faecali prausnitzii这两种菌为2型糖尿病的发展提供了保护。
Akkermansia菌在维持粘蛋白层完整性和减少炎症方面发挥关键作用。粘蛋白作为高度糖基化的大分子蛋白质参与胃肠道保护,减少细菌移位,改善脂肪储存、脂肪组织代谢和葡萄糖稳态。
• Faecali prausnitzii 减少
2型糖尿病的Faecali prausnitzii丰度降低,而糖尿病治疗可导致了Faecali prausnitzii丰度的增加、全身炎症的二次减少和胰岛素抵抗的改善。
3
与糖尿病风险增加相关的有害菌丰度升高
临床前和临床试验的系统评价显示,双歧杆菌、拟杆菌、粪杆菌、阿克曼氏菌和罗氏菌属与2型糖尿病发展呈负相关,有助于改善代谢和肠道健康。相反,瘤胃球菌属、梭杆菌属和经黏液真杆菌属(Blautia)与糖尿病风险增加相关。
• 扭链瘤胃球菌与胰岛素抵抗和高血糖相关
并且2型糖尿病患者中潜在有害细菌显著增加,例如埃希氏菌和普雷沃氏菌。还观察到糖尿病患者变形菌门的显著增加。在T2DM 患者中经常观察到更高水平的 Collinsella,尤其是 Collinsella aerofaciens。此外,扭链瘤胃球菌(Ruminococcus torques)与胰岛素抵抗和高血糖有关,在减重手术和糖尿病缓解后水平下降。
2型糖尿病患者中高丰度的特定菌属还包括:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
4
平衡的肠道菌群对改善2型糖尿病有益
• 双歧杆菌可能有助于改善2型糖尿病
多种双歧杆菌,包括青春双歧杆菌、两歧双歧杆菌、假链双歧杆菌、长双歧杆菌和齿双歧杆菌,与2型糖尿病呈负相关,尤其是在接受二甲双胍治疗的患者中。
产丁酸细菌如柔嫩梭菌属(Clostridium leptum)与糖化血红蛋白和空腹血糖呈负相关。2型糖尿病患者厚壁菌门水平普遍升高,但在糖尿病模型中与空腹血糖呈负相关。
• 阴沟肠杆菌与葡萄糖耐量受损相关
在2型糖尿病中观察到Desulfovibrio和Odoribacter水平升高。肥胖和糖尿病患者丹毒丝菌科(Erysipelotrichaceae)丰度较高,阴沟肠杆菌与葡萄糖耐量受损相关。
同时糖尿病患者免疫功能受损增加肺炎克雷伯菌感染风险。代谢综合征患者Odoribacter水平升高,产气荚膜梭菌可致糖尿病患者肝脓肿,体现其机会致病特性。
• 平衡的肠道菌群益于葡萄糖代谢和降低并发症
另一方面,平衡的肠道微生物群(共生状态)与2型糖尿病患者葡萄糖代谢改善和胰岛素敏感性增加相关。此外,共生状态有助于预防与2型糖尿病(T2DM)相关的并发症,因为健康的肠道微生物群可以降低糖尿病并发症的风险,如视网膜病变、肾病和其他相关疾病。
益生元选择性地刺激有益细菌的生长,增强微生物多样性。它们不会促进有害细菌,但可以影响某些细菌种类的生长,有时可能与在糖尿病等疾病中观察到的微生物变化重叠。
如上所述,某些细菌类型在糖尿病患者中可能更丰富。而服用益生元为2型糖尿病提供了双重好处,促进共生,同时改善血糖指数。
要被归类为益生元,食品成分必须满足特定标准:它必须抵抗胃酸,避免被消化酶水解,并能被胃肠道菌群发酵代谢,并增加促进健康的肠道细菌的丰度。
益生元本质上是不可消化的食物基质,绕过人体消化,最终到达肠道,为肠道微生物群提供能量来源。这种关系是共生的,因为益生元促进有益肠道微生物群的生长,如乳酸杆菌、阿克曼菌、双歧杆菌、粪杆菌和罗氏菌属,这有助于缓解与2型糖尿病相关的代谢过程。
碳水化合物被认为是最有效的益生元,可按分子大小或聚合程度分类。不可消化碳水化合物、特定蛋白质肽段及某些脂质也被确定为潜在益生元成分。菊粉、低聚果糖、低聚半乳糖、抗性淀粉、果胶低聚糖、β-葡聚糖、多酚和石斛属等益生元已被证实可通过优化肠道微生物组成对2型糖尿病患者血糖控制产生治疗作用。下面将讲述这些益生元的功能特性及其对肠道微生物组成和血糖指数的影响。
1
菊粉
菊粉是一种水溶性储存多糖,存在于36000多种植物中,属于果聚糖类不可消化碳水化合物。作为分类益生元,菊粉天然存在于多种食物中,建议每日摄入量为2-12克。
建议每天摄入菊粉量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
菊粉表现出显著的益生元特性,长链菊粉型果聚糖对发酵活性和细菌群落组成的影响更强。菊粉的药理特性使其成为各种食品类别的多功能成分。它作为一种低热量甜味剂和不易消化的纤维,有助于提高食品的粘度、形成凝胶并改善食品的感官特性。菊粉能开发出具有理想质地和感官品质的低脂肉类和家禽产品,其脂肪替代和质地改性特性适用于各种食品。
注:菊粉广泛用于肉制品、乳制品、酱汁和糖果的脂肪替代品,还作为食品添加剂应用于面包、烘焙产品、乳制品、糖果和婴儿食品中,在食品工业中发挥重要作用。
• 菊粉对治疗2型糖尿病具有益处
多项研究表明菊粉对2型糖尿病的潜在益处。一项涉及49名BMI为25-35 kg/m²的2型糖尿病女性研究显示,每日服用10g菊粉2个月可降低空腹血糖和糖化血红蛋白水平,同时增加总抗氧化能力。
另一项52名2型糖尿病女性患者研究表明,补充10g富含低聚果糖的菊粉8周同样可降低空腹血糖和糖化血红蛋白水平。
• 菊粉改善了糖尿病患者的胰岛素敏感性
双盲交叉研究发现,糖尿病前期患者每日服用30g菊粉2周可改善胰岛素敏感性。每日补充15g菊粉6个月可降低糖尿病前期患者空腹胰岛素水平并改善胰岛素抵抗。
然而,一项随机双盲试验报告每日摄入10g菊粉12周对2型糖尿病患者胆固醇、血糖或糖化血红蛋白无显著影响。尽管如此,大量证据支持菊粉作为2型糖尿病治疗选择的潜力。
• 菊粉增加抗炎细菌丰度,改善厚壁菌门/拟杆菌门比率
关于肠道微生物群影响,糖尿病前期患者每日服用15g菊粉6个月可增加放线菌、双歧杆菌、乳酸菌等相对丰度,同时降低另枝菌属(Alistipes)丰度。
健康成人每日服用5-7.5g龙舌兰菊粉21天后,放线菌门和双歧杆菌丰度增加,脱硫弧菌丰度降低。双歧杆菌作用与较高粪便短链脂肪酸浓度相关,可能对2型糖尿病产生有益影响。
小鼠模型显示菊粉补充剂通过调节肠道神经胶质细胞产生显著抗炎作用,改善厚壁菌门/拟杆菌门比率。丁酸盐水平升高可抑制NF-κB通路,降低促炎因子表达。人体研究证实菊粉的抗炎益处,60例糖尿病患者补充菊粉后TLR4、NF-κB和IL-1表达降低。
• 菊粉可改善胰岛素抵抗
菊粉还被证明可以改善胰岛素抵抗的标志物,包括特定基因和胰岛素受体底物的表达。在一项针对67例2型糖尿病患者的纵向研究中,每日补充10g菊粉2个月可降低INS基因甲基化。有趣的是,据报道,胰岛细胞的胰岛素启动子中含有 INS 基因甲基化,这进一步揭示了菊粉干预人类后表观遗传修饰的作用。
此外,在小鼠模型中,菊苣菊粉补充8周后,IRS-1和MAPK信号通路受到影响。该研究表明,IRS活性上调并抑制丝裂原活化蛋白激酶(MAPK)通路,该通路对T2DM发病机制和糖尿病肾病等并发症有重大影响。
最后,在一项针对60名2型糖尿病患者的研究中,补充菊粉与丁酸盐联合使用,改善了血糖标志物、血脂谱和GLP-1分泌。
总体而言,有大量证据支持菊粉在改善血糖指数、减轻2型糖尿病发病机制相关分子过程和增强肠道微生物组成方面具有作用。
2
抗性淀粉
抗性淀粉在碳水化合物中具有独特特性,能抵抗小肠内源性淀粉酶消化,到达大肠作为肠道细菌营养。这一特性使抗性淀粉被归类为膳食纤维,具有多种潜在健康益处。抗性淀粉分为五种类型,天然存在于全谷物、豆类、煮熟冷却的马铃薯、大米和未成熟香蕉等食物中。
抗性淀粉包括物理难接近淀粉(RS1)、酶抗性淀粉(RS2)、逆降解淀粉(RS3)和化学改性淀粉(RS4),对人体葡萄糖反应影响不同。
抗性淀粉可通过发酵、挤压和化学处理等加工技术生产和改性,增强其结构、发酵特性和抗消化性。建议每日摄入量为10-15克。由于热量低,抗性淀粉适合添加到纤维和膨化谷物、零食、意大利面和烘焙食品中,不会显著增加卡路里。此外,它还能改善食品质地、稠度和稳定性。
建议每天摄入抗性淀粉量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 补充抗性淀粉有助于血糖水平下降
2023年荟萃分析显示,2型糖尿病或糖尿病前期患者补充1型和2型抗性淀粉后餐后血糖降低,RS2的餐后胰岛素反应减少。另一荟萃分析发现,健康个体和糖尿病患者补充抗性淀粉后空腹胰岛素、HOMA-B、糖化血红蛋白降低,HOMA-S增加,糖尿病患者空腹血糖水平下降。
2020年的荟萃分析也表明,补充抗性淀粉可降低空腹血糖,摄入量超过28g/d或干预超过8周时改善更显著。
• 抗性淀粉具有抗炎抗氧化特性从而改善血糖
抗性淀粉改善血糖控制的机制涉及其抗氧化和抗炎特性。一项meta分析纳入了16项试验和706例2型糖尿病患者,结果显示,总抗氧化能力增加,炎症标志物(如CRP、IL-6和TNF浓度)降低。
这些发现一致强调了抗性淀粉在控制T2DM患者血糖水平和减少炎症方面的好处。除了这些荟萃分析外,个别临床试验还提供了强有力的证据,支持将抗性淀粉纳入2型糖尿病患者的饮食中,从而更详细地了解与食用相关的代谢改善。
例如,在60例T2DM女性患者中,补充10g/天的RS2持续8周,导致HgbA1c降低,甘油三酯降低,促炎性TNF-α减少,同时血清HDL水平升高。在另一项针对T2DM患者的研究中,补充RS2显示出对餐后GLP-1的有益影响,从而改善餐后胰岛素反应。
• 抗性淀粉饮食增加了罗氏菌属、阿克曼菌等
关于肠道菌群影响,富含抗性淀粉的饮食增加厚壁菌门与拟杆菌门比例,胰岛素敏感性低的个体中普拉梭菌、普雷沃氏菌科、瘤胃球菌、直肠真杆菌、罗氏菌属和嗜粘蛋白阿克曼菌增加。
不同类型抗性淀粉会引起不同反应:RS4可能促进拟杆菌门,RS2有利于厚壁菌门。研究显示,食用含RS4饼干的参与者放线菌门和拟杆菌门增加,厚壁菌门减少;食用含RS2饼干的个体瘤胃球菌和直肠真杆菌增加。但两种类型的抗性淀粉都与梭菌状芽胞杆菌比例的增加有关。
3
低聚果糖
低聚果糖(FOS)广泛用于生产功能性和低热量食品,作为甜味剂和生物防腐剂,以益生元作用著称。建议每日摄入量为12.5-20g,天然存在于洋葱、菊苣、大蒜、香蕉和朝鲜蓟等植物中。
建议每天摄入低聚果糖量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 补充低聚果糖增加了双歧杆菌丰度,但会因年龄而异
与其他益生元结合使用时,低聚果糖显示出更好的代谢控制。与多酚类配对时,联合益生元效应可改善胰腺β细胞功能,降低肝脏胰岛素抵抗和低密度脂蛋白胆固醇水平,肠道菌群也发生显著变化,双歧杆菌属增加4倍,真杆菌属增加2倍。
2022年荟萃分析显示,低聚果糖给药后双歧杆菌浓度增加(每日7.5-15g,持续4周以上),乳杆菌属或肠杆菌科无显著变化。低聚果糖对肠道菌群的影响因年龄而异,成人和老年人Odoribacter显著减少,所有年龄组嗜胆菌属和毛螺菌属减少,年轻人和成人颤螺菌属(Oscillospira)减少。
• 低聚果糖对GLP-1分泌的影响还未确定
分子水平上,低聚果糖在小鼠模型中对肠促胰岛素激素(如GLP-1)分泌有积极影响。在2型糖尿病模型中,低聚果糖减轻肠道L细胞凋亡,增强GLP-1分泌。含低聚果糖饼干可在体外增加GLP-1浓度并降低血糖。
然而,人类急性摄入低聚果糖未产生类似结果,肠道激素水平或饱腹感无显著变化。富含低聚果糖的糖浆也不会显著改变餐后生长素释放肽或GLP-1水平。
4
低聚半乳糖
低聚半乳糖是天然功能性低聚糖,也是牛奶中的关键活性成分和广泛使用的益生元。它存在于α-低聚半乳糖和β-低聚半乳糖两种亚型,通过特定半乳糖键区分。
低聚半乳糖因双重功能在食品生产中受到关注:既能改善加工食品的感官品质(如味道、质地和稳定性),又能通过选择性刺激双歧杆菌和乳酸杆菌生长促进肠道健康。建议每日摄入量为2-20克。
建议每天摄入低聚半乳糖量和最丰富的食物来源
Iatcu OC,et al.Nutrients.2024
• 低聚半乳糖可能影响空腹胰岛素和血糖水平
关于低聚半乳糖对空腹胰岛素和血糖水平的影响,研究结果不一致,类似于低聚果糖。一项超重个体研究显示,每日补充5.5g低聚半乳糖84天后空腹胰岛素显著降低,同时总胆固醇、甘油三酯和炎症标志物(如CRP)也降低。
相反,另一项针对2型糖尿病患者的相同剂量和持续时间研究未观察到空腹血糖、糖化血红蛋白或空腹胰岛素水平的显著变化。荷兰一项针对超重或肥胖个体每日摄入15g低聚半乳糖84天的研究也未报告空腹血糖、胰岛素、肠道激素或炎症标志物的显著变化。
• 补充低聚半乳糖后双歧杆菌等有益菌丰度增加
虽然空腹胰岛素和血糖结果不一致,但低聚半乳糖对肠道微生物群的影响显示出更一致的结果。小鼠研究表明补充低聚半乳糖后双歧杆菌水平增加。人类研究同样显示低聚半乳糖增加双歧杆菌科,12周研究发现粪便双歧杆菌增加5倍。最近一项涉及53名糖尿病前期个体的研究显示,补充低聚半乳糖和短双歧杆菌12周后,糖化血红蛋白和空腹血糖显著降低。
除了增加双歧杆菌外,低聚半乳糖补充剂还与肠道微生物组成的其他有益变化有关。例如,在一项针对溃疡性结肠炎患者的研究中,每天服用2.8g低聚半乳糖,双歧杆菌属和克里斯滕森氏菌的丰度增加。还报道了几种有益细菌种类的增加,包括长双歧杆菌、青春双歧杆菌、乳酸菌科和瘤胃球菌属,以及补充低聚半乳糖后梭状芽胞杆菌、丹毒丝菌科、Odoribacteraceae和颤螺菌科(Oscillospiraceae)的减少。
总体而言,虽然低聚半乳糖在改善2型糖尿病血糖指数方面的功效仍无定论,但其对肠道微生物群的积极影响已得到充分证明。数据表明,与益生菌或其他有益剂结合使用时,低聚半乳糖可能增强疗效,尽管单独补充可能不会显著改变血糖结果。
5
果胶低聚糖
果胶是高等植物细胞壁中的必需多糖,对维持植物组织刚性和结构至关重要。水果和蔬菜中果胶含量为0.1%-2.5%,建议每日摄入30克可减少餐后血糖反应、维持正常胆固醇水平和增加饱腹感,从而减少热量摄入。
注:果胶含量因来源而异:橄榄渣34.4%,柑橘废料30%,洋葱皮27-34%,苹果浆20.9%,甜菜浆16.2%。果胶也是果胶低聚糖(POS)的来源,建议每日摄入10-20克,提供益生元益处并支持肠道健康。
• 果胶通过提高胰岛素敏感性等机制抗糖尿病
多项研究证实果胶的抗糖尿病特性。红辣椒果实提取的果胶可显著提高胰岛素敏感性并降低血糖水平。在含106g碳水化合物的膳食中添加16g瓜尔豆和10g果胶可显著降低胰岛素依赖型和非胰岛素依赖型糖尿病患者的餐后血糖和胰岛素水平。
健康成年人在含碳水化合物膳食中摄入10g果胶也可降低餐后血糖。一项涉及43名2型糖尿病志愿者的研究显示,补充果胶后空腹血糖和糖化血红蛋白水平显著降低,HOMA-IR指数降低表明胰岛素抵抗改善。
果胶还可以在胃肠道形成凝胶,减缓胃排空并减少葡萄糖吸收,调节血糖水平并增加饱腹感;对脂质代谢有积极影响,降低胆固醇水平;具有抗炎作用,可能通过减少炎症标志物改善整体代谢健康。
• 果胶促进有益菌生长并产生短链脂肪酸
果胶调节肠道菌群的能力是另一个关键因素,因为它促进有益细菌的生长,从而改善代谢健康和胰岛素敏感性。果胶经过缓慢发酵,并通过产生短链脂肪酸(SCFA)表现出益生元作用。
果胶低聚糖(POS)已显示出促进双歧杆菌的潜力,并提供各种健康益处,包括抗肥胖、抗癌和抗氧化特性。POS代表了一类新的益生元,它通过肠道微生物群的发酵产生SCFA。一项研究表明,甜菜中的POS具有最高的双歧杆菌生成促进作用和最高的SCFA浓度,而柑橘皮中的 POS 增加了乳酸菌种群。
2型糖尿病中响应益生元的肠道微生物组成变化
Iatcu OC,et al.Nutrients.2024
6
多酚类
酚类化合物是源自植物的具有生物活性的次生代谢产物,在蔬菜、水果、全谷物和其他植物来源中含量丰富。这些化合物因其抗炎、抗氧化和代谢调节特性而受到关注。每日定期摄入约1-2克多酚与预防慢性疾病相关,每日摄入超过650毫克可显著降低死亡风险。
• 酚类化合物具有控制糖尿病的潜力
膳食酚类化合物(如类黄酮、香豆素、醌、二苯乙烯和姜黄素类化合物)控制糖尿病的潜力受到关注。酚类已被证明能增强胰岛素分泌,调节血糖水平,并可能通过影响复杂分子过程帮助预防糖尿病相关并发症。
杨梅提取物通过增强肝细胞葡萄糖摄取和提高谷胱甘肽水平显示降糖活性。苹果多酚可刺激葡萄糖吸收,改善线粒体功能,减少氧化应激。牛至、黑莓提取物、白桑葚和发芽藜麦酸奶也显示出降血糖、抗氧化和抗炎作用。
• 2型糖尿病患者服用多酚后餐后血糖降低
临床试验进一步证实多酚的抗糖尿病潜力。一项涉及25名糖尿病风险男性的研究发现,早餐时食用250毫升芙蓉提取物可降低血糖、胰岛素、甘油三酯和C反应蛋白。
2型糖尿病患者每日两次补充160毫克纯化花青素24周后,低密度脂蛋白胆固醇、甘油三酯、空腹血糖和胰岛素抵抗降低,高密度脂蛋白胆固醇和抗氧化能力增加。对口服降糖药无反应的2型糖尿病患者每8小时补充350毫克越橘提取物2个月后,空腹血糖、餐后血糖和糖化血红蛋白显著降低,对肝肾功能无不良影响。
• 多酚可增加乳酸杆菌和双歧杆菌
生物活性酚类化合物,包括类黄酮和非类黄酮,在胃和小肠中部分吸收,其余部分到达大肠。在那里,它们要么被肠道微生物群利用以发挥益生元作用,要么转化为活性代谢物。大约90-95%的食用酚不会立即被吸收,而是到达大肠,在那里它们对人类健康起着保护作用。
各种研究表明,多酚可增加有益肠道细菌(如乳酸杆菌和双歧杆菌)的丰度,同时调节其他微生物群,包括拟杆菌、梭状芽胞杆菌和普拉梭菌。肠道微生物群的这些变化可能有助于酚类化合物的抗糖尿病、抗氧化和抗炎作用,进一步支持它们在代谢健康中的作用。
7
β-葡聚糖
β-葡聚糖是主要存在于燕麦和大麦中的可溶性膳食纤维,因其在糖尿病控制方面的健康益处而受到认可。这些化合物天然存在于植物细胞壁、谷物种子以及某些真菌、酵母、藻类和细菌中,高度集中在燕麦和大麦胚乳细胞壁中,占其含量的75%,在麸皮中占10.4%。
注:燕麦和大麦在谷物中β-葡聚糖浓度最高,燕麦每100克干重含3-8克(溶解度82%),大麦含2-20克(溶解度65%)。
• β-葡聚糖改善血糖控制,增加胰岛素敏感性
研究表明,β-葡聚糖可显著改善血糖控制,增加胰岛素敏感性,降低胆固醇水平。其主要作用机制是增加肠道粘度,减慢碳水化合物吸收,调节餐后血糖水平,防止血糖急剧飙升。
β-葡聚糖能在低浓度(1%)下形成高粘度溶液,在各种pH值下都具有稳定性,优于其他可溶性纤维。每日摄入约3克β-葡聚糖可显著改善2型糖尿病患者血糖控制,降低胰岛素抵抗,并与较低的糖化血红蛋白水平相关。
除改善血糖控制外,β-葡聚糖还对脂质代谢产生积极影响,有助于降低糖尿病患者心血管风险。它们通过与胆汁酸结合、促进胆汁排泄和减少肠道胆固醇吸收来降低总胆固醇和低密度脂蛋白胆固醇水平。这种降脂作用与其增加肠道粘度的能力相关,结合葡萄糖、胆汁酸和胆固醇,增强粪便排泄。β-葡聚糖通过肠道菌群发酵刺激短链脂肪酸产生,调节GLP-1和PYY等激素,增加胰岛素分泌并增强饱腹感。
• β-葡聚糖可增加肠道中阿克曼菌等产丁酸菌
β-葡聚糖发酵促进肠道菌群健康变化。糖尿病动物模型研究显示,酵母β-葡聚糖和面包酵母β-葡聚糖给药后阿克曼氏菌增加。燕麦β-葡聚糖增加梭菌和丁酸球菌,减少拟杆菌属、乳酸菌属、颤螺菌属和瘤胃球菌属。肥胖动物研究报道,大麦β-葡聚糖给药后双歧杆菌、拟杆菌属、乳酸菌属和Atopobium增加。
谷物β-葡聚糖对调节肠道微生物群的影响已得到广泛研究。有代谢综合征风险的患者食用富含β-葡聚糖的大麦粉面包后,双歧杆菌属和阿克曼菌属数量增加。动物研究表明,低分子量β-葡聚糖增加双歧杆菌和拟杆菌数量,促进短链脂肪酸(特别是乙酸盐和丁酸盐)产生。食用全麦大麦意大利面后,人罗氏菌属和瘤胃球菌属增加,梭菌门和厚壁菌门减少。
8
铁皮石斛
近年来,石斛属因其显著的益生元特性而受到关注,特别是在2型糖尿病动物模型中。它具有减少慢性炎症、防止胰腺β细胞功能障碍、刺激GLP-1分泌以及通过增强微生物多样性上调短链脂肪酸浓度等显著益处。这些作用改善多种代谢参数,包括葡萄糖耐量、胰岛素抵抗和血脂水平。
• 上调短链脂肪酸产生并改善胰岛素分泌
在糖尿病前期小鼠模型中,铁皮石斛通过调节炎症、修复胰岛损伤、增加肠促胰岛素释放和改善胰岛素分泌发挥作用,特别是通过减少脂多糖介导的TLR4激活。
补充铁皮石斛增加了Roseburia、Alloprevotella、拟杆菌、双歧杆菌和乳酸杆菌的相对丰度,同时上调短链脂肪酸产生和肠道GPR43表达。另一项研究发现类似的抗炎作用,铁皮石斛通过增加Allobaculum、双歧杆菌和乳酸杆菌丰度来增强代谢参数,通过下调LPS/TLR-4通路减少炎症,并加强肠道屏障。
• 铁皮石斛调节信号通路促进血糖控制
铁皮石斛多糖通过减少肝脏糖异生酶和调节AMP-PKA和Akt等信号通路促进血糖控制。在评估2型糖尿病小鼠模型脂质代谢的研究中,石斛补充剂通过激活PPAR信号通路改善肝功能,导致血脂水平降低和胰岛素敏感性提高。类似研究报道,石斛治疗4周后PPARγ激活导致炎症减轻。
尽管尚未在2型糖尿病患者中进行随机临床试验,但动物模型的有希望证据表明,石斛属的益生元作用可能需要进一步研究作为血糖控制的辅助治疗。
益生元和肠道菌群可以通过多种机制改善血糖参数,包括将食品发酵成生物活性短链脂肪酸 (SCFA)、减少炎症、增加降血糖激素水平、增强脂质代谢和提高抗氧化酶活性。
这些分子因素和途径的相互作用有助于2型糖尿病患者通过食用益生元改善健康状况。这些机制将在以下小节中具体讲述。
益生元对2型糖尿病患者血糖指数的影响
Iatcu OC,et al.Nutrients.2024
1
通过产生短链脂肪酸改善血糖指数
益生元主要由可溶性纤维组成,由肠道微生物群通过一系列反应发酵,产生短链脂肪酸(SCFA),即乙酸盐、丙酸盐和丁酸盐。
• 短链脂肪酸增强葡萄糖摄取,提高胰岛素敏感性
短链脂肪酸(特别是丁酸盐)作为结肠细胞关键能量来源,具有多种益处。研究表明,定期摄入纤维与人类短链脂肪酸浓度增加约4倍相关。各种益生元在微生物群组成和短链脂肪酸产生方面表现出相似反应。短链脂肪酸通过激活G蛋白偶联受体(GPR41/GPR43)和启动细胞能量稳态信号通路增强外周组织葡萄糖摄取,对提高胰岛素敏感性至关重要。
例如,小鼠模型中益生元纤维缺乏与GPR41和GPR43信号传导减少相关,导致心脏代谢健康状况下降。益生元补充剂通过增加产生短链脂肪酸的肠道微生物群,增强肝脏AMP活化蛋白激酶信号传导,从而降低胰岛素抵抗。AMPK激活通过促进葡萄糖和脂肪酸氧化、增强摄取、抑制脂肪合成和减少糖异生等能量消耗过程来提高胰岛素敏感性。丙酸盐通过GPR43/AMPK通路抑制肝脏糖异生,GPR43激活导致肝细胞钙依赖性AMPK激活,减少糖异生。
• 增加短链脂肪酸产生菌丰度并释放肠促胰素
此外,益生元通过增加短链脂肪酸产生和促进产生短链脂肪酸的细菌来增强抗炎作用、抗氧化特性、脂质代谢和肠促胰岛素激素释放。膳食纤维摄入通过增加短链脂肪酸产生改善2型糖尿病相关的各种参数,包括炎症、血脂水平和早期饱腹感。
2
抗炎作用改善血糖控制
2型糖尿病的特征是低度炎症,由脂肪组织释放促炎细胞因子、巨噬细胞浸润和有害肠道微生物及其代谢物驱动。这种炎症在临床上通常与C反应蛋白水平升高相关。
益生元干预措施的荟萃分析表明,2型糖尿病患者使用益生元后C反应蛋白水平显著降低,循环肿瘤坏死因子-α减少,抗氧化酶活性改善。另一项纳入27项研究的荟萃分析显示,抗性淀粉、抗性糊精和低聚果糖等益生元具有显著的降糖和抗炎益处。其中19项研究报告血糖指标改善,包括糖化血红蛋白、HOMA-IR评分和血糖,许多研究还显示抗炎作用增强。
• 益生元与肠道菌群通过抗炎作用改善2型糖尿病
脂多糖是革兰氏阴性菌外膜组成部分,通过与Toll样受体4结合,触发全身性促炎细胞因子释放,起到有效的炎症刺激作用。这些细胞因子(特别在脂肪组织和肝脏中)通过干扰胰岛素信号通路导致胰岛素抵抗。
白细胞介素-6和肿瘤坏死因子-α等细胞因子激活磷酸化胰岛素受体底物1的激酶,损害胰岛素信号传导。白细胞介素-6诱导细胞因子信号传导抑制因子3表达,降解胰岛素受体底物1,进一步恶化胰岛素抵抗。此外,白细胞介素激活核因子κβ,刺激细胞因子释放并产生反馈回路,加剧血糖失调。
肠道菌群和益生元通过发挥抗炎作用抵消这些炎症过程。多糖补充已被证明可减少2型糖尿病中脂多糖泄漏和代谢炎症。从机制上讲,益生元上调紧密连接蛋白,改善肠道屏障完整性,减轻脂多糖和核因子κβ介导的炎症损伤和氧化应激。
同时,有益的产生短链脂肪酸的双歧杆菌和乳酸杆菌种群增加两倍,有害的幽门螺杆菌种类受到抑制。研究表明,在脂多糖刺激的炎症细胞中进行短链脂肪酸治疗可降低血糖正常和控制不佳的2型糖尿病个体的肿瘤坏死因子-α和干扰素-γ。
注:异麦芽糖糊精是另一种潜在益生元,可抑制肿瘤坏死因子-α和白细胞介素-6,通过抑制脂肪组织中巨噬细胞浸润和恢复胰岛素受体底物1表达来调节免疫反应。它还提高拟杆菌-普雷沃氏菌浓度,改善微生物多样性,提高胰岛素敏感性。
总体而言,炎症是导致血糖控制不佳的重要因素,益生元和肠道菌群在减轻与2型糖尿病发作相关的炎症信号通路方面起着至关重要的作用。
3
影响激素水平从而调节血糖
肠促胰岛素激素(如胰高血糖素样肽1和胃抑制多肽)是众所周知的餐后胰岛素分泌增强剂,是目前流行的改善代谢健康的药物。
益生元摄入可通过改变肠道菌群组成及其代谢物自然刺激胰高血糖素样肽1、肽YY和胃抑制多肽的释放。例如,服用益生元2周与标准化膳食后血浆胰高血糖素样肽1和肽YY浓度升高及餐后血糖水平降低显著相关。
• 胰高血糖素样肽1和肽YY分泌增加
通过益生元增强胰高血糖素样肽1释放可部分归因于短链脂肪酸浓度增加。短链脂肪酸与分泌胰高血糖素样肽1的L细胞上的GPR41和GPR43受体结合,通过Gq信号传导促进胞质钙释放,刺激胰高血糖素样肽1分泌。低聚果糖和菊粉等益生元通过上调GPR43受体表达和增加结肠中分泌胰高血糖素样肽1的L细胞数量来促进这些作用。
例如康普茶作为富含多酚和益生元的茶,通过增加产生短链脂肪酸的细菌(如丁酸球菌、乳酸菌和毛螺菌科)水平来促进胰高血糖素样肽1和肽YY释放,对胰岛β细胞功能显示出有益作用。干预4周后,还观察到血糖控制的其他标志物改善,包括脂多糖水平降低、肠道屏障完整性改善,以及有害细菌属(如脱硫弧菌、大肠杆菌和志贺氏菌)减少。
总体而言,有强有力的证据支持益生元介导的肠促胰岛素激素释放增加,有助于改善血糖控制。
4
改善血脂水平进而增强血糖控制
益生元补充剂的另一个重要结果是改善血脂水平,从而直接或间接增强血糖控制。与其他有益机制类似,益生元通过促进产生短链脂肪酸的有益肠道微生物群生长来实现更好的脂质调节。
• 抑制肝脏胆固醇合成、减少异位脂肪沉积
丙酸盐通过下调参与胆固醇产生的关键酶(如乙酰辅酶A羧化酶和脂肪酸合酶)来抑制肝脏胆固醇合成,减少甘油三酯形成,降低极低密度脂蛋白分泌。
丁酸盐促进脂肪酸氧化,减少肝脏、肌肉和脂肪组织中的脂质积累。血糖控制改善主要由于异位脂肪沉积减少,因为无法抑制脂肪分解是导致2型糖尿病患者胰岛素抵抗的重要因素。
这些代谢益处通常同时发生,补充β-葡聚糖的益生元已被证明可减少胰岛素抵抗(AMPK信号传导)和脂肪酸储存(过氧化物酶体增殖物激活受体γ)的标志物。临床上,研究表明抵抗性糊精补充剂8周导致空腹血糖、糖化血红蛋白和低密度脂蛋白胆固醇水平降低,同时高密度脂蛋白浓度增加。
因此,益生元在控制脂质参数中的作用至关重要,因为脂质代谢与2型糖尿病的发生和发展有着密切关系。
5
益生元、抗氧化剂和血糖指数
氧化应激部分由有害微生物物种过度生长驱动,通过破坏胰岛素信号通路和促进胰腺β细胞功能障碍,在2型糖尿病发病机制和进展中起重要作用。
活性氧介导的通路触发胰岛细胞凋亡信号,导致细胞损伤和功能能力下降。在氧化应激状态下,胰岛素受体底物1磷酸化进一步损害胰岛素敏感性。
此外,促氧化剂损害内皮细胞,减少一氧化氮产生,而一氧化氮通过血管舒张作用将葡萄糖输送到细胞中是必不可少的。埃希菌属、梭状芽胞杆菌属和肠球菌属等细菌属,以及变形菌门和厚壁菌门与拟杆菌门比例增加,与2型糖尿病患者氧化应激增加相关。
• 减轻氧化应激、保护胰腺β细胞并改善葡萄糖稳态
益生元(特别是多酚)通过增加具有固有抗氧化能力的有益细菌相对丰度来减轻氧化应激,这些有益细菌可有效清除活性氧。多酚被肠道微生物群代谢产生酚酸,这是一种有效的抗氧化剂,已知可增强胰岛素信号传导、保护胰腺β细胞并改善葡萄糖稳态。
从机制上讲,酚酸通过下调NADPH氧化酶和上调核因子红细胞2相关因子2,后者是抗氧化酶的有效刺激剂。该研究还表明下游胰岛素信号传导增强,显著增加Akt磷酸化,表明胰岛素敏感性提高。
例如姜黄素是一种多酚,通过上调谷胱甘肽过氧化物酶和超氧化物歧化酶等抗氧化酶来促进胰岛细胞存活和功能,同时减少细胞凋亡。多酚已被证明可降低2型糖尿病患者脂质过氧化,通过降低低密度脂蛋白和增加高密度脂蛋白水平来优化血脂谱。这些改善与抗氧化防御机制增加相关,包括总谷胱甘肽水平升高,有助于防止糖尿病并发症进展。
因此,益生元的抗氧化特性在控制2型糖尿病氧化应激和控制血糖指数方面起着关键的治疗作用。
基于肠道微生物群的精准营养干预正成为功能食品和营养保健品行业的重要发展方向。随着个性化医疗的兴起,针对不同肠道菌群特征和代谢表型的定制化益生元产品将具有巨大的市场潜力。
肠道微生物群失调是2型糖尿病发生发展的重要机制,患者普遍存在产丁酸盐有益细菌(如双歧杆菌、罗氏菌属、普拉梭菌)减少,而有害细菌增加的现象。
研究表明,益生元在肠道菌群在2型糖尿病管理中的重要作用,本文深入分析菊粉、抗性淀粉、低聚果糖、低聚半乳糖、果胶低聚糖、多酚、β-葡聚糖和铁皮石斛等八种主要益生元,揭示了它们通过多重机制改善2型糖尿病的分子基础:促进短链脂肪酸产生、发挥抗炎作用、优化肠促胰岛素激素分泌、改善血脂代谢以及增强抗氧化特性。这些机制协同作用,显著改善血糖控制、胰岛素敏感性和代谢健康状况。
未来,应关注益生元与现有药物的协同作用,发展“药物+营养”的综合治疗模式。根据个体肠道微生物群特征和代谢特征定制益生元干预措施是一种策略。同时,这种“检测-分析-干预-监测”的精准营养循环,不仅能够实现血糖控制的显著改善,更能从根本上修复代谢紊乱的生物学基础。有望实现更好的血糖控制和整体健康改善。
主要参考文献
Iatcu OC, Hamamah S, Covasa M. Harnessing Prebiotics to Improve Type 2 Diabetes Outcomes. Nutrients. 2024 Oct 11;16(20):3447.
Zhou M., Zhao J. A Review on the Health Effects of Pesticides Based on Host Gut Microbiome and Metabolomics. Front. Mol. Biosci. 2021;8:632955.
Keivanlou M.H., Amini-Salehi E., Sattari N., Hashemi M., Saberian P., Prabhu S.V., Javid M., Mirdamadi A., Heidarzad F., Bakhshi A., et al. Gut microbiota interventions in type 2 diabetes mellitus: An umbrella review of glycemic indices. Diabetes Metab. Syndr. 2024;18:103110.
Quigley E.M.M. Prebiotics and Probiotics in Digestive Health. Clin. Gastroenterol. Hepatol. 2019;17:333–344.
Hamamah S., Iatcu O.C., Covasa M. Nutrition at the Intersection between Gut Microbiota Eubiosis and Effective Management of Type 2 Diabetes. Nutrients. 2024;16:269.
Megur A., Daliri E.B., Baltriukiene D., Burokas A. Prebiotics as a Tool for the Prevention and Treatment of Obesity and Diabetes: Classification and Ability to Modulate the Gut Microbiota. Int. J. Mol. Sci. 2022;23:6097.
Wu J., Yang K., Fan H., Wei M., Xiong Q. Targeting the gut microbiota and its metabolites for type 2 diabetes mellitus. Front. Endocrinol. 2023;14:1114424.
Gargari B.P., Dehghan P., Aliasgharzadeh A., Jafar-Abadi M.A. Effects of high performance inulin supplementation on glycemic control and antioxidant status in women with type 2 diabetes. Diabetes Metab. J. 2013;37:140–148.

谷禾健康

在这个快节奏的现代社会中,”疲劳”似乎已经成为了我们生活中挥之不去的常客,尤其是在后疫情时代,它更是频繁地困扰着我们的日常生活。
你是否有过这样的经历:
疲劳是一种正常的生理反应,就像手机电量不足需要充电一样。一般疲劳的发生,主要有两方面:
身体方面:就比如说跑步后肌肉酸痛,主要是因为能量消耗过多,乳酸等代谢物累积,以及肌肉微损伤等原因造成的。
大脑方面:就像电脑运行太多程序会变卡一样,主要是因为大脑神经递质失衡,比如5-羟色胺增多,多巴胺减少等。
但是,当疲劳持续很长时间,并且休息后也无法缓解时,这可能预示着更深层次的健康问题。
慢性疲劳综合征很复杂,就像一台精密仪器出了故障,涉及多个系统:免疫系统失调、神经系统异常、能量代谢紊乱、内分泌系统紊乱、肠道微生物失衡等。疲劳也是癌症、甲状腺功能减退等疾病的常见症状,此外,疲劳还会导致焦虑和抑郁,神经系统疾病的发作。
最新研究发现,肠道微生物群在疲劳和慢性疲劳综合征中扮演着重要角色,肠道微生物群可以帮助产生重要的神经递质,维持肠道屏障完整性,防止炎症物质进入血液。在慢性疲劳综合征患者中,研究发现产丁酸盐菌明显减少,这可能与症状严重程度相关。
本文我们主要探讨各种常见疾病相关疲劳的症状、发病机制及干预措施,包括营养干预、心理支持、饮食及生活方式调整等。长新冠和慢性疲劳综合征的疲劳症状管理是一个复杂的过程,需要多方面的干预策略。虽然目前尚无特效治疗,但综合管理策略可以显著改善患者的症状和生活质量。对症下药的同时,重视整体健康的提升,才能在这复杂的症状中找到一丝突破。
目录
01 关于疲劳
02 慢性疲劳的发病机制
03 各种不同的疲劳
04 针对疲劳的菌群干预措施
疲劳是一种压倒性的疲倦感和精力耗尽感,在各种生理、病理和心理失衡的情况下出现。这种感觉通常无法通过休息或睡眠得到充分缓解,会严重影响个人的日常活动和生活质量。
意大利生理学家安杰洛·莫索(Angelo Mosso) 在一个多世纪前表示,“疲劳”一词至少指的是两种现象,“首先是肌肉力量的减少。第二个是疲劳作为一种感觉”。换句话说,有一个是可以测量的物理事实,而一个是心理事实。
注:肌肉力量的减少通常可以通过一系列客观测试来量化,例如运动后肌肉的力量测试和乳酸水平的检测。
“感觉衰减假说”认为疲劳发生在个体感知到完成任务所需的努力超过预期时。这种感觉输入主要来自收缩肌肉的本体感觉信号,正常情况下这些信号会被减弱,使得日常活动感觉轻松。然而,在疲劳状态下,这种减弱失效,导致日常活动感觉费力。这种假说解释了为什么疲劳患者在进行相同强度的活动时,会感到比正常人更费力。
在现代生理学中,疲劳的定义已经趋于复杂化,涵盖了生理、心理及情绪多个层面。
简单可以分以下几大类:
生理性疲劳 (如运动疲劳)
生理性疲劳是由正常的生理活动引起的,如运动后的肌肉疲劳。这种疲劳通常是可预期的,并且可以通过适当的休息和恢复来缓解。例如,运动疲劳是一种典型的生理性疲劳,表现为运动后肌肉力量或功率输出的暂时性下降。
病理性疲劳 (如癌症相关疲劳、慢性疲劳综合征)
病理性疲劳与各种疾病或病理状态有关,如癌症相关疲劳、慢性疲劳综合征(ME/CFS)等。这种疲劳通常更为严重和持久,可能需要医疗干预。
心理性疲劳
心理性疲劳主要与心理因素有关,如长期压力、焦虑或抑郁等。这种疲劳可能表现为情绪低落、注意力不集中等症状,需要通过心理干预来缓解。
疲劳的症状表现可以涉及身体、认知和情绪等多个方面:
身体症状:
认知症状:
情绪症状:
睡眠障碍:
睡眠障碍是疲劳的一个重要症状,同时也可能是疲劳的原因之一。主要表现包括:
虽然疲劳是一种常见的症状,但当疲劳变得持续且严重,并伴随着其他症状时,可能就不仅仅是简单的疲劳了,可能是一种复杂的长期疾病,与正常疲劳在定义、持续时间、症状和机制上有显著差异。
正常疲劳:
病理性疲劳:
在讨论了正常疲劳和病理性疲劳的区别之后,我们需要特别关注一种具代表性的病理性疲劳类型——慢性疲劳综合征(ME/CFS)。这种疾病不仅完整体现了病理性疲劳的各项特征,更因其独特的临床表现和严重的致残性,成为近年来医学界研究的重点。
慢性疲劳综合症
慢性疲劳综合征,也叫肌痛性脑脊髓炎,是一种严重的、多系统失能性疾病。它会导致至少持续六个月的极度疲劳。症状在身体或精神活动时加重,但休息后不会完全改善。
注:慢性疲劳综合征(CFS)和肌痛性脑脊髓炎(ME)是同种疾病,慢性疲劳综合征(CFS)强调了最主要的症状特征;肌痛性脑脊髓炎(ME)则更多地体现了疾病的神经系统病理特征,医学界现在倾向于使用合并的说法(ME/CFS),这样可以更全面地描述这种疾病的特点。
慢性疲劳综合征发病前,大多数患者都是能正常工作和成功的。许多患者初发为类似病毒感染性疾病,伴淋巴结肿大、极度疲劳、发热和上呼吸道症状。最初的综合征会消退,但似乎会引发长期的严重疲劳,这会干扰日常活动。
症状因人而异,症状的严重程度每天都会波动。除了疲劳,症状可能包括:
体格检查是正常的,没有肌无力、关节炎、神经系统受累或者脏器肿大等表现。但是一些患者存在低度发热、非渗出性咽炎和/或可触及而柔软的(非肿大)淋巴结。
慢性疲劳综合征并发症
慢性疲劳综合征的复杂和非特异性症状可能导致许多误诊,并伴有其他严重疾病,包括纤维肌痛、原发性睡眠障碍(睡眠呼吸暂停)、营养障碍(缺铁、肥胖)、肌肉骨骼疾病、焦虑/抑郁和胃肠道疾病(乳糜泻、肠易激综合征、炎症性肠病)。
在新冠开始后不久的研究表明,慢性疲劳综合征的症状与约87%的急性SARS-CoV-2感染恢复患者报告的症状相似,具体来说,长新冠患者出现了慢性疲劳综合征已知的29种症状中的25种。
其中最主要的症状包括:

doi.org/10.3390/nu16111545
慢性疲劳综合征发病率
美国疾病预防控制中心(CDC)的流行病学数据估计,美国有 0.84-250 万慢性疲劳综合征患者,其中约 25% 无法出门或卧床不起。慢性疲劳综合征的全球患病率在 0.4%~2.5% 之间。
慢性疲劳综合征的发病通常在20~40岁之间的成年人中。
女性患者比男性更为常见,比例大约为 3:1。有些研究显示比例可高达 6:1。
大多数慢性疲劳综合征病例被归类为长期病程,表现超过 3 年。
■ 生理因素
内分泌系统问题
营养代谢问题
免疫系统问题
■ 生活方式因素
睡眠问题
运动相关
饮食习惯
■ 心理因素
压力相关
情绪问题
■ 环境因素
工作环境
生活环境
■ 病理因素
常见疾病
感染
其他疾病
疲劳往往是多种因素共同作用的结果,这些因素往往相互关联、相互影响,无论是生理、心理还是环境因素,都可能通过不同的途径和机制影响我们的身体,最终导致疲劳的产生。
要深入理解慢性、持久的疲劳这个复杂的生理现象,我们需要进一步探讨疲劳产生的具体机制,了解它是如何在分子、细胞和器官系统层面上发展的。
以上我们已经知道疲劳有很多不同种类型,如运动性疲劳、慢性疲劳综合征、癌症相关性疲劳、肾上腺疲劳、长新冠疲劳、更年期疲劳、骨质疏松疲劳、周一疲劳综合征等,虽然各个类型有特异性表现,它们往往共享一些基础的发病机制。
疲劳是一种复杂的生理病理现象,涉及多个系统的功能紊乱,以下我们从能量代谢、神经内分泌系统、免疫系统、氧化应激反应、炎症因子变化、肠道菌群失调等角度来探讨疲劳的机制,为防治疲劳提供新的思路和方法。
能量代谢失衡是疲劳发生的重要基础。
ATP产生和利用的功能障碍
研究表明,疲劳状态下存在ATP产生和利用的功能障碍。在剧烈运动过程中,ATP-酶泵功能受损会导致能量产生效率下降,能量产生效率降低进一步加重疲劳感。
当ATP水平降低时,疲劳程度会增加,例如,枸杞多糖 (LBP) 和 滑子菇多糖 (PNP) 可以通过增加ATP水平来缓解疲劳。
山药多糖可通过调节炎症途径和氧化应激来对抗疲劳,从而降低 IL-lβ、MDA、BUN 和 LDH 的水平,并增加 ATP 和 SOD 的活性。
代谢产物的积累效应
在强度运动期间产生的过量代谢物,会在骨骼肌和血液中积累,打破体内稳态,影响血乳酸(BLA)、丙二醛(MDA)、乳酸脱氢酶(LDH)等指标水平。这种能量代谢紊乱不仅影响肌肉收缩能力,还会引发一系列级联反应,导致疲劳症状加重,形成恶性循环。
富含多糖的芦苇根茎(PEP)提取物可显著延长小鼠的游泳耐力,提高血糖水平,降低 LDH 和 CK 活性。
玉米丝、翘鳞肉齿菌、党参和山药还通过调节相关代谢物的积累而具有抗疲劳作用。
线粒体功能的影响
线粒体是细胞能量产生的主要场所,慢性疲劳综合征患者存在外周线粒体功能异常,正常化静息代谢率(nRMR)发生改变,这些改变会影响细胞能量的正常供应,加重疲劳症状。
印加萝卜水提取物可以通过防止线粒体介导的肌肉损伤和氧化应激来发挥抗疲劳功能。
红参提取物可以通过挽救骨骼肌线粒体的密度和形态以及增加线粒体生物发生来改善线粒体功能障碍,从而发挥抗疲劳作用。
神经内分泌系统的改变在疲劳发生中起着核心作用。
神经递质系统改变
5-羟色胺(5-HT)水平升高:高浓度5-HT会影响运动神经元和肌肉收缩,通过影响运动神经元输出导致疲劳。
螺旋藻多糖可以抑制运动诱导的 5-HT 和色氨酸羟化酶-2(TPH2)的增加,并上调 5-羟色胺能 1B 型(5-HT1B)的表达以增强运动能力。
多巴胺(DA)系统功能异常:多巴胺合成和转化率下降会加重疲劳,多巴胺参与大脑网络的连接和结构整合,影响疲劳的发展和体温调节。
牛樟芝多糖干预可以抑制6-羟基多巴胺(6-OHDA)诱导的ROS-NLRP3的表达,保护多巴胺能神经元,提高小鼠的运动能力。
去甲肾上腺素(NA)系统改变:NA系统加速中枢疲劳的发生,影响认知和情绪调节。
淫羊藿多糖通过增加去甲肾上腺素和肌酸激酶水平来治疗疲劳,从而对代谢紊乱产生改善作用。
γ-氨基丁酸(GABA)和乙酰胆碱的代谢改变:参与中枢/精神疲劳的调节,影响认知和情绪功能。
下丘脑-垂体-肾上腺轴(HPA轴)功能紊乱
研究发现,疲劳患者普遍存在下丘脑-垂体-肾上腺轴(HPA轴)功能紊乱,尤其是肾上腺疲劳患者,HPA轴过度激活,影响皮质醇和应激激素的分泌,这种紊乱会通过多种信号通路放大疲劳和应激反应。例如:
芦根多糖提取物通过抑制 HPA 轴的过度激活以及降低 TC 和皮质醇的含量来发挥抗应激和抗疲劳作用。
在慢性疲劳综合征、癌症相关疲劳、长新冠疲劳中都会存在免疫系统异常的情况。
免疫系统改变是疲劳发生的重要机制之一。研究表明,疲劳初期是机体的一种适应性免疫介导反应,目的是提高抗炎细胞因子的产生,增强抗病能力。然而,持续的疲劳状态会导致免疫功能受损,表现为:
铁皮石斛多糖提取物,可以调节其潜在的免疫功能改善疲劳,大大增加 T 和 B 淋巴细胞的细胞变异性,并缓解由负重游泳引起的疲劳综合征。
人参多糖可以提高运动耐力,延长疲惫的游泳时间;它还可以通过改善受训练小鼠的生化指标和增强脾细胞增殖(T 或 B 淋巴细胞)来延缓运动引起的疲劳和运动相关损伤。
壳寡糖(COS)与跑步相结合,促进脾肺发育、淋巴细胞水平、T 细胞/CD8+ T 细胞比例,并通过 TNF、IL-2、IL-10等细胞因子改善大鼠免疫状态,从而减轻疲劳。
黄精多糖不仅显著降低了 IL-1β、IL-6 和 TNF-α 的上调,而且还通过调节 miR-340-3p/IRAK3 和 GLUT-4 改善了 L6 肌管中的炎症和葡萄糖摄取。
黄芪多糖通过激活 AMPK 通路、限制 ROS 的产生以及降低 IL-1β、TNF-α 和 NF-κB 的水平,对SD大鼠过度运动诱导的心肌损伤具有保护作用。
氧化应激在疲劳发生中扮演着重要角色。虽然低水平的活性氧(ROS)对于产生正常的肌肉力量是必要的,但高浓度的ROS会导致肌肉收缩能力受损。
研究表明,持续的耐力运动会产生大量ROS,影响肌肉的运动能力,慢性疲劳综合征ROS水平也是异常,过量的ROS会导致机体氧化还原系统失衡,ROS可能触发线粒体膜的脂质过氧化,破坏线粒体功能,影响能量供应。
高水平的氧化应激可能导致炎症标志物恶化,过量的ROS与癌症相关疲劳的发生发展密切相关。
远志多糖可以降低疲惫运动小鼠的 BLA 和 BUN 浓度,并增加 LG 、肌糖原(MG)、LDH 的水平;它在体外对羟基自由基和 DPPH 自由基表现出高清除率,并表现出良好的抗氧化特性。
人参多糖可以减少BLA、LDH、BUN、MDA的积累,增加 SOD、CAT 和 CK 的活性,从而延长小鼠的疲劳耐受性。
枸杞多糖能够通过提高抗氧化酶水平和调节代谢机制来缓解疲劳。
冬虫夏草酸性多糖可以通过刺激海马中磷脂酰肌醇 3-激酶(PI3K)、蛋白激酶 B(AKT)、Nrf2 和 HO-1 蛋白的表达水平来缓解小鼠的运动疲劳并改善小鼠的学习和记忆。
近年来的研究发现,肠道菌群失调与疲劳的发生密切相关。在慢性疲劳综合征(ME/CFS)患者中观察到:
具体的每种疲劳相关的肠道菌群变化在下一章节详细阐述。
以上这些机制之间并非独立存在,而是相互影响、相互作用。例如,肠道菌群失调可通过肠-脑轴影响神经内分泌功能,同时也会引起免疫失调和炎症反应;氧化应激则可能加重炎症反应,影响能量代谢。因此,在研究和治疗疲劳时,需要采取整体观念,综合考虑这些机制的相互作用。
理解这些基础机制对于解释不同类型疲劳的发生发展具有重要意义。例如,慢性疲劳综合征可能同时存在能量代谢紊乱、神经内分泌功能失调和免疫系统异常;而癌症相关性疲劳则可能主要通过炎症反应和氧化应激来影响机体功能。
接下来,我们将具体分析几种常见类型疲劳的特点及其与这些基础机制的关系。
慢性疲劳综合征(简称ME/CFS)是一种无法解释的衰弱性慢性疾病,核心症状在于:

慢性疲劳综合征患者可能看起来没有生病,但无法进行正常活动,前面我们也已经知道了慢性疲劳综合征最常见于中年人群,但也影响儿童、青少年和老年人。在成人中,女性比男性更容易受到影响。在儿童中,青少年比年幼的孩子更容易受到影响。
慢性疲劳综合征的病因尚不清楚,可能涉及多种因素的组合,包括:
除了上述原因及上一章节提到的发病机制之外,慢性疲劳综合征还与肠道菌群的变化密切相关。
慢性疲劳综合征的肠道菌群组成
长期COVID 和慢性疲劳综合征患者肠道菌群组成的改变,以及报告的恶心、腹泻和腹痛等胃肠道症状可能表明肠道菌群失调在这两种疾病的发展中可能起作用。
多项研究表明,疲劳患者的肠道菌群组成与健康人群存在显著差异。主要特点包括:
多样性减少
慢性疲劳综合征患者肠道细菌的多样性明显下降,比健康人少了大约34%(P < 0.00001)。
ME/CFS 患者肠道微生物组 α 和 β 多样性的变化
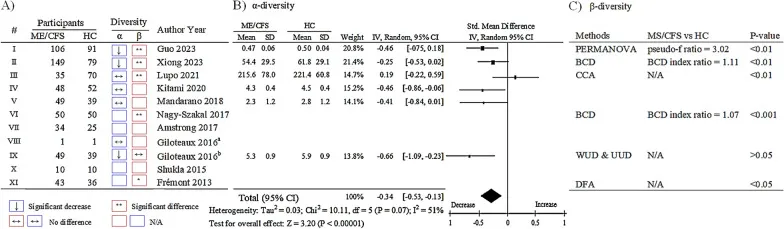
A、从 11 项选定研究中概述的肠道微生物组 α 和 β 多样性变化,用罗马数字 I 至 XI 表示。
B、使用随机效应荟萃分析模型总结肠道微生物组的 α 多样性的森林图。
C、ME/CFS 患者与健康对照组肠道微生物组的肠道微生物组 β 多样性列表。
促炎菌增多
与健康对照组相比,慢性疲劳综合征患者体内促炎性革兰氏阴性细菌(如 Alistipes、拟杆菌、肠杆菌科)的水平更高,这可能会加重病程,导致疲劳、疼痛和精神错乱的严重程度增加。
产丁酸菌减少
慢性疲劳综合征与厚壁菌门某些菌群的减少有关,包括粪杆菌属、罗斯氏菌属、梭菌属,其中产丁酸菌粪杆菌的减少被认为是对慢性疲劳综合征有诊断价值的潜在生物标志物。
注:在 IBD、癌症和自身免疫患者(如多发性硬化和1型糖尿病)中发现粪杆菌丰度减少与疲劳感增加之间存在关联,从而表明全身性炎症和肠道菌群失调可能会影响与其他重要器官的双向联系,并导致神经精神和胃肠道症状的发展。
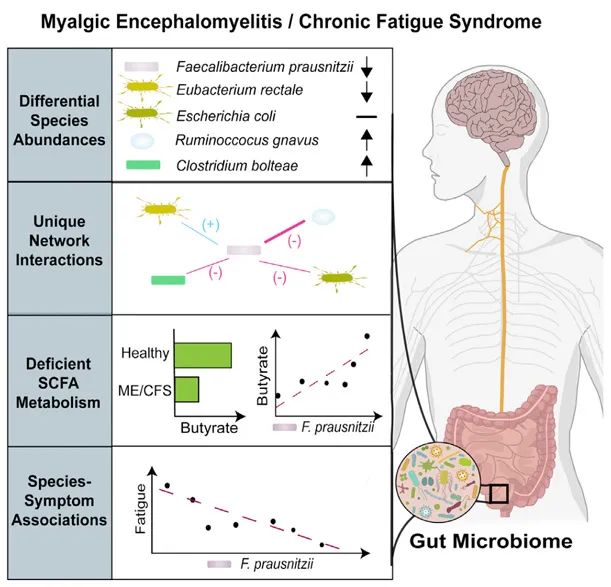
doi:10.1016/j.chom.2023.01.004
条件致病菌增加
4 项研究表明,慢性疲劳综合征患者中一些机会性致病细菌物种显著增加,包括Erysipelatoclostridium ramosum、Enterocloster citroniae、Hungatella hathewayi、Eggerthella lenta等。
慢性疲劳综合征患者的一些乳酸菌和其他有益物种明显减少,如Faecalibacterium prausnitzii、Bifidobacterium angulatum、Lactobacillus ruminis、Roseburia intestinalis等。
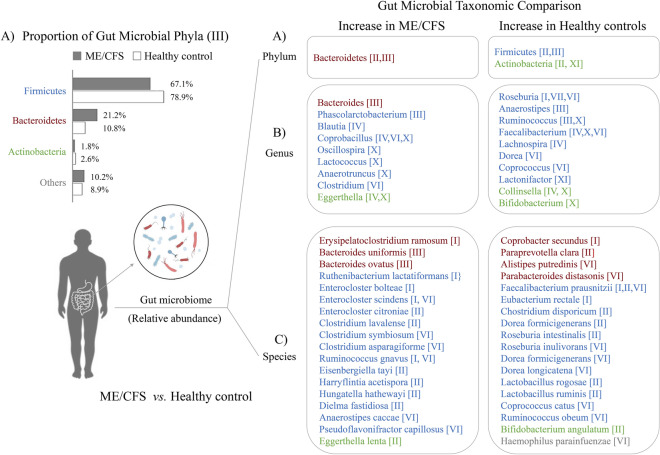
编辑
doi: 10.1186/s40001-024-01747-1
肠道菌群如何通过代谢产物影响疲劳?
短链脂肪酸
有 5 项研究报告了慢性疲劳综合征患者和健康对照者之间代谢物的潜在差异,特别是,慢性疲劳综合征患者的粪便、血液或尿液中的短链脂肪酸 (SCFA,如丁酸盐、乙酸盐) 和支链SCFA(如异丁酸盐)均显著减少。
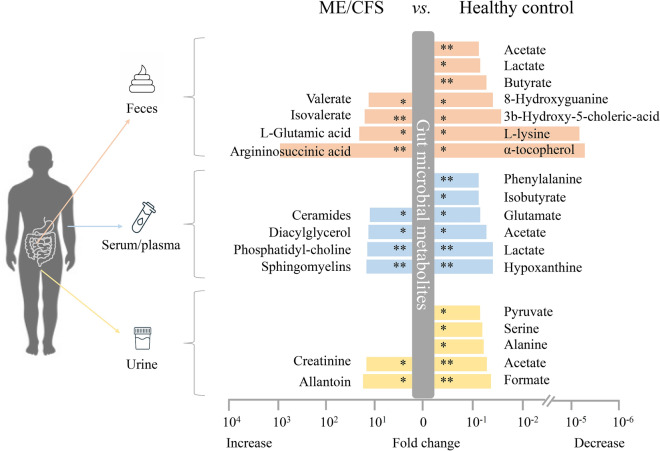
doi: 10.1186/s40001-024-01747-1
在慢性疲劳综合征患者中也有其他细菌产生的代谢物(如乙酸盐和异戊酸盐)的显著减少,这些代谢物作为能量来源,并表现出抗菌特性(如乳酸盐和苯甲酸盐)。这些变化与 Clostridium 呈正相关,与 Bacteroides 呈负相关。
维生素E
维生素E(α-生育酚)作为一种重要的抗氧化维生素,在维持认知功能和心理健康方面发挥着关键作用。然而,在慢性疲劳综合征患者中观察到一个显著现象:
与健康对照组相比,慢性疲劳综合征患者血清 α-生育酚 (维生素 E)大幅降低(P<0.05)。这种降低可能与肠道菌群的改变密切相关。具体来说:
因此,慢性疲劳综合征患者出现的认知障碍很可能是由这种肠道微生物组的特定改变引起的维生素E水平显著降低所致。
鞘脂
肠道微生物组衍生的鞘脂可以改变宿主脂质代谢。具体来说,具有丝氨酸棕榈酰转移酶 (SPT)基因的拟杆菌属具有产生鞘脂的能力。因此,这可以部分阐明长期慢性疲劳综合征患者血清脂质水平升高和高拟杆菌素同时出现。
色氨酸
色氨酸是一种必需氨基酸,也是神经递质5-羟色胺(血清素)的关键前体物质。在正常生理状态下,色氨酸的代谢主要有两条重要通路:
血清素合成通路:
色氨酸 → 5-羟色胺(5-HT,血清素) → 褪黑素
这条通路对维持情绪、睡眠-觉醒周期和能量代谢至关重要。
犬尿氨酸通路:
色氨酸 → 犬尿氨酸 → 其他代谢物
这条通路与免疫调节和神经炎症有关。
在这个过程中,如果某些肠道细菌通过各种途径将色氨酸分解,那么用于制造血清素的“原料”就减少了。血清素不足会引起一系列问题:如睡眠质量下降、情绪容易低落、疲劳感增加、精力不足等,这些睡眠、情绪问题都会带来更加疲惫的恶性循环。
肠道菌群如何通过“肠漏”影响疲劳?
前面我们知道,在慢性疲劳综合征中,肠道菌群中产丁酸菌明显减少,丁酸盐是肠道上皮细胞的主要能量来源,丁酸盐产生菌减少导致丁酸盐不足,影响肠道屏障完整性维持。
促炎细菌增加导致炎症因子升高,炎症也同时损害肠道屏障功能,肠道通透性增加,细菌及其代谢物进入血液,激活系统性免疫反应,通过迷走神经影响大脑功能,导致神经炎症和认知功能障碍,血清素和GABA等神经递质产生受影响,影响情绪和睡眠调节,加重疲劳感知。
疲劳导致活动减少,活动减少进一步降低丁酸盐产生,丁酸盐减少加重肠漏,肠漏加重全身炎症和疲劳,循环往复,症状持续…
具体针对菌群的对慢性疲劳综合征的干预措施我们将在下一章节详细展开。
长新冠的首个大规模研究,调查来自56个国家的近3800人,该研究显示,最常见的症状为疲劳、劳累后不适。近86%的受访者表示劳累会引起症状复发 ;87%的受访者表示疲劳是主要症状。
不同人群的发病率差异:
COVID 引起的疲劳通常会感觉如下:
克利夫兰诊所的一项新研究可能有助于解释原因。它发现 67% 的长期 COVID 参与者经历了中度至重度睡眠障碍。
COVID可以杀死大脑中的神经细胞,影响睡眠
COVID进入大脑的一种方式是通过鼻子中的神经纤维进入下丘脑和额叶皮层,这可能是COVID攻击的两个“初始站点”,然后传播到大脑的其他部分。下丘脑负责调节呼吸、我们如何应对压力、体温、新陈代谢、心血管功能,也包括睡眠。
科罗拉多大学丹佛-安舒茨医学校区神经外科教授Granholm-Bentley在2023 年 7 月的《临床医学杂志》上对 SARS-CoV-2 对大脑影响的研究进行了进一步的评论,引用了检查重症COVID患者大脑的研究,这些研究显示 COVID 病毒颗粒在大脑中徘徊。她说,这很重要,因为“下丘脑中有含有食欲素的神经细胞,这些神经肽特别参与睡眠/觉醒周期。这些神经细胞在下丘脑对感染很敏感,因此它们在像 COVID 这样的病毒攻击中很容易死亡,永远不会再生。
当这种情况发生时,你可能会发现自己在夜间经常醒来,难以定期入睡,或两者兼而有之,所有这些都会让人长期疲惫不堪,甚至可能在未来患上其他神经退行性疾病。
斯坦福大学发作性睡病中心发表的一篇论文,有朝一日可能会通过增加大脑中的食欲素水平来治疗慢性睡眠障碍,该中心正在研究下丘脑周围睡眠障碍的潜在疗法。
病毒攻击“细胞的发电厂”——线粒体
长新冠持续攻击线粒体,线粒体是我们体内每个细胞的能量来源,你也可以理解为细胞的发电厂。病毒实际上能够改变线粒体功能,因此它能够复制,同时还可以减少进入细胞的能量,通常,线粒体只会关闭能量产生几天或几周,直到病毒颗粒消失。但对于某些感染,线粒体很难自行恢复。线粒体功能障碍造成的能量下降也是触发下丘脑睡眠中心离线的原因。
来自长期 COVID 患者的组织样本还显示严重的肌肉损伤、免疫反应紊乱和微凝块积聚。
微凝块积聚
对肌肉组织的深入研究还发现了长新冠病理学中另一个越来越熟悉的特征——微凝块。
南非的研究人员已经将注意力集中在这些携带“被困炎症分子”的微凝块上,这些微凝块表明患者的脉管系统受损。这意味着微凝块实际上可能已经通过受损的脉管系统进入肌肉,这也可能发生在其他组织中。
在这种情况下,微凝块可能反映了血管内壁的损伤程度,这也会损害氧气向肌肉组织的输送。有研究人员在肌肉组织中发现了来自 SARS-CoV-2 的病毒蛋白的证据。但这也可能是病毒残留物,是否直接导致劳累后不适仍存在争议。
免疫系统异常
与肠道微生物有关
一些研究表明,长期 COVID 患者可能会获得新的食物过敏和敏感性(尤其是对小麦和麸质),胃肠道症状的发生率为 3% ~ 79% 。同样,高达 92% 的合并诊断为肠易激综合征(IBS)的慢性疲劳综合征患者也认为胃肠道症状是常见的合并症。
而胃肠道不适,包括腹痛和腹胀,以及疲劳、头痛和认知障碍等肠外症状,可能是由于慢性肠道炎症和肠道上皮屏障受损而出现的,其次是粘膜相关不变T(MAIT)细胞的比例显著增加,这与 MHC I 类相关分子中微生物抗原的识别和微生物感染期间对细胞因子诱导刺激的反应有关。
持续感染或无活力的病原体残留会刺激慢性炎症,因为肠道病毒和细菌感染都会影响微生物组。
肠道菌群具体如何影响长新冠疲劳?
目前越来越多的研究报告了从急性感染中恢复的长新冠患者的肠道成分和多样性的变化。这些个体的肠道组成已发生显著变化,其特征是共生菌种类减少长达 30 天,包括直肠真杆菌、普拉梭菌、双歧杆菌属,而即使在恢复期 6 个月后,微生物群落的丰富度似乎也没有恢复。
抗炎微生物群Alistipes onderdonkii 、Faecalibacterium prausnitzii的减少,表现为促炎细胞因子(包括 IL-2、IL-7、IL-10 和 TNF-α)水平升高,这与疾病严重程度和症状严重程度增加密切相关,包括呼吸、神经精神、胃肠道和疲劳问题。
对初次诊断后 6 个月出现长期 COVID 症状的患者(占 106 名患者初始样本的 76%)进行的一项观察性研究显示,瘤胃球菌和普通拟杆菌(Bacteroides vulgatus)水平明显较高,而普拉梭菌水平较低,这与持续的呼吸道症状和神经精神疾病和疲劳相关,包括Clostridium innocuum、Actinomyces naeslundii.
有趣的是,产丁酸菌,包括假小链双歧杆菌(Bifidobacterium pseudocatenulatum)和普拉梭菌(Faecalibacterium prausnitzii),在 6 个月时与长期 COVID 症状呈最大的负相关 。
一项针对新冠肺炎康复的有症状患者的前瞻性随访研究报告称,出院一年后,存在某些肠道微生物群失调,包括细菌多样性显著降低和产短链脂肪酸菌的相对丰度较低,如Eubacterium hallii, Subdoligranulum、Ruminococcus、Dorea、Coprococcus、Eubacterium ventriosum。
有趣的是,在肠道微生物群改变的个体中,持续12个月出现身体功能受损、精神疾病(主要是焦虑或抑郁)、肺功能下降和影像学异常等长期症状的个体与恢复阶段的临床指标显著相关,从而表明肠道微生物群可能在长新冠中发挥重要作用。
总的来说,肠道菌群失调与通过微生物群-肠道-免疫-大脑轴调节慢性疲劳综合征和长新冠的大脑活动和认知功能有关。然而,迄今为止尚不清楚肠道微生物组和神经胶质细胞如何相互作用,以及这些相互作用如何触发慢性疲劳综合征和长新冠的神经认知症状(也称为“脑雾”)和劳累后疲劳的发作。研究人员认为可能的触发因素之一可能是神经递质及其特异性受体的产生、运输和功能失调(初级M1运动皮层内GABA能和谷氨酸能活性的兴奋性降低)。
目前尚无治愈或批准的慢性疲劳综合征及长新冠疲劳的治疗方法,但有些措施及注意事项可以缓解。
营养补充
补充B族维生素、C、D、E,微量元素如锌、硒等。
改变生活方式以提高能量水平
日常生活习惯、饮食和锻炼习惯的简单改变会显着影响整体活力。避免过量饮酒。避免久坐不动。
采取健康的适合自己的饮食方式
在日常饮食中,尽量选择新鲜、天然的食材。水果、蔬菜、全谷物和优质蛋白质应成为饮食的主角。每个人的身体都是独特的,饮食方式的选择应当结合个人的生活方式和文化习惯。合理规划饮食时间与频率也是必要的,必要时可以采取间歇性禁食,它的战略性进食暂停旨在让你的身体有时间专注于修复而不是消化。
探索重金属排毒
有些人认为重金属积累可能会导致持续疲劳,探索重金属排毒成为一种潜在的缓解途径。需在医疗专业人员指导下进行重金属排毒,确保针对慢性疲劳综合症患者的独特需求量身定制安全和个性化的策略。
调整生活节奏
由于慢性疲劳综合征可能会波动,你可能会一次感到几天甚至几周的疲惫,然后有一天醒来感觉好多了。发生这种情况时,不要做太多事情来弥补其他日子,换句话说,你感觉更好的日子里不要把自己逼得太紧,结果让自己再次变得更糟。享受这一天,不要强迫完成所有堆积如山的事情,慢慢来,调整自己的节奏。
认知行为疗法(CBT)
在慢性疲劳综合征的治疗中具有一定的应用和效果。一项长期跟踪研究显示,接受CBT的患者中有68%在5年后自我评价为“显著改善”或“非常显著改善”,接受CBT的患者在治疗结束后仍能维持较高的工作时间。CBT不仅改善了患者的疲劳症状,还对积极心理维度如希望和乐观产生了积极影响。
分级运动疗法(GET)
对慢性疲劳综合征患者的长期影响有多个研究支持,2021年的研究调查了分级运动疗法在常规专科诊所中的有效性,结果显示疲劳评分在第4次会话时显著降低,并在随访时保持显著改善。
注:分级运动疗法与认知行为疗法(CBT)一样,是慢性疲劳综合征的有效治疗方法。两者在总体效应大小上相当,但在初级保健设置中和接触时间较少的治疗中,CBT的效果较小。
具体针对菌群的对长新冠疲劳的干预措施我们将在下一章节详细展开。
癌症相关疲劳是癌症常见症状,也是癌症治疗最常见的副作用。
癌症相关疲劳(CRF)被定义为“与癌症或癌症治疗相关的令人痛苦的、持续的、主观的身体、情感和/或认知疲倦或疲惫感,与最近的活动不成比例,并干扰正常功能。与健康个体所经历的疲劳相比,癌症相关疲劳更严重、更痛苦,并且不太可能通过休息来缓解”。
它主要表现为持续疲劳和情绪和认知功能下降,无法通过休息和睡眠缓解,导致身体功能和生活质量下降。
一项荟萃分析指出,近一半的癌症患者都会感到疲劳。也有研究发现,在接受治疗后5-10年内,大约有20~30%的癌症患者报告持续的疲劳。
横断面和纵向研究证明,功能状态下降和合并症水平较高的年轻女性肿瘤患者报告的癌症疲劳水平较高。癌症疲劳程度较高的肿瘤患者报告更高水平的整体、疾病特异性和累积生活压力,以及睡眠障碍、抑郁、认知功能障碍和疼痛的并发情况。
研究表明,炎症生物标志物,如C反应蛋白和促炎细胞因子与各种癌症人群中的疲劳有关;下丘脑-垂体-肾上腺轴的失调也与疲劳有关。但人们对疲劳原因了解的不够深入,科学现状仍存在局限性。
在理解肠道-大脑轴及其与疲劳关系的研究进展,促使许多研究者关注肠道微生物变化对癌症患者疲劳潜在影响。
一些研究发现了特定肠道微生物属的相对丰度与癌症患者的疲劳水平有关,具体而言,高疲劳水平与促炎菌群相关,而低疲劳水平与抗炎菌群或产短链脂肪酸菌相关。例如,瘤胃球菌的相对丰度与低疲劳水平相关,而大肠埃希氏菌Escherichia和肠杆菌科Enterobacteriaceae的相对丰度与高疲劳水平相关。
瘤胃球菌科属于产丁酸菌,由于丁酸盐是一种具有抗炎特性的短链脂肪酸,因此疲劳与产生丁酸盐的瘤胃球菌科之间的关系是合乎逻辑的。在慢性疲劳综合征里面也有类似研究结果。
Enterobacteriaceae是变形菌门下的一个革兰氏阴性菌,这些微生物表面的分子成分,称为微生物相关分子模式,通过与免疫细胞受体的相互作用直接增加炎症。由于炎症水平升高与疲劳增加有关,因此与高相对丰度Enterobacteriaceae相关的更高疲劳是合理的。
晚期癌症
一项横断面观察研究,识别晚期癌症患者中微生物组组成与疲劳之间的关联。具体来说,
患者选择:患者来自MD安德森癌症中心的调查癌症治疗部门,共88名晚期、转移性、不可切除的癌症患者。最常见的诊断包括结肠癌、卵巢癌、宫颈癌和非小细胞肺癌。
注:纳入标准为至少18岁,能够说英语,病理诊断为晚期、转移性、不可切除的癌症,且在入组前至少30天未使用抗生素。
疲劳测量:使用MD安德森症状清单(MDASI)免疫疗法模块(MDASI-Immunotherapy)评估疲劳。
注:该模块已验证用于评估20种症状,包括7种免疫疗法特定项目和6种干扰项目。
疲劳评分:
88名患者中,58名(66%)归为低疲劳,30名(34%)归为高疲劳。
肠道菌群:
Eubacterium hallii与疲劳严重程度评分呈负相关(r=-0.31, p=0.0026),而Cosenzaea与疲劳严重程度评分呈正相关(r=0.26, p=0.014)。
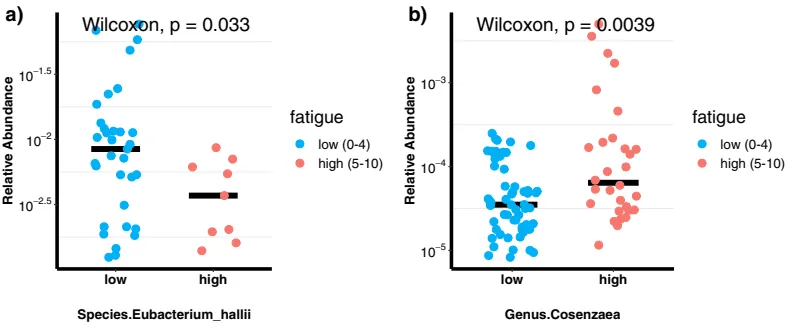
doi.org/10.1038/s41598-021-84783-9
作为营养相互作用中的关键物种,Eubacterium hallii可以高度影响代谢平衡,最终影响肠道微生物群落、宿主稳态以及宿主健康。此外,Eubacterium hallii已被用于治疗与胰岛素抵抗相关的疾病,包括血脂异常、1型糖尿病和库欣综合征以及其他内分泌疾病。综合这些数据表明,Eubacterium hallii在肠道代谢和免疫稳态中扮演着可能影响肠道-脑轴和疲劳的角色。
Cosenzaea(以前称为Proteus myxofaciens),有利条件下,生活在环境中的细菌,存在于人类的肠道中,可引起尿路感染、伤口感染和脑膜炎(新生儿和婴儿)。高疲劳癌症患者中Cosenzaea的丰度增加表明细菌在诱导炎症中的潜在作用。
癌症治疗
局部晚期直肠癌(RC)的治疗通常采用放化疗(CRT),尽管CRT提高了局部控制和生存率,但它常常导致如疲劳等严重的副作用,影响患者的生活质量。癌症治疗引起的肠道微生物组扰动/失调可能与炎症有关,进而导致系统性炎症反应和行为症状如疲劳。
在接受放化疗的直肠癌患者中,约67%会出现严重疲劳,85%的患者在放化疗后仍会持续出现疲劳症状,疲劳程度与肿瘤分期呈正相关。
一个概念验证研究,用于解决CRT引起的肠道微生物群扰动与疲劳之间的关系问题。在CRT开始前、中期(12-16次治疗后)和末期(24-28次治疗后)收集粪便样本和疲劳评分。
疲劳程度的变化
CRT结束时,疲劳评分显著高于CRT前(中位数从17.0提高到23.0,p≤0.05)。
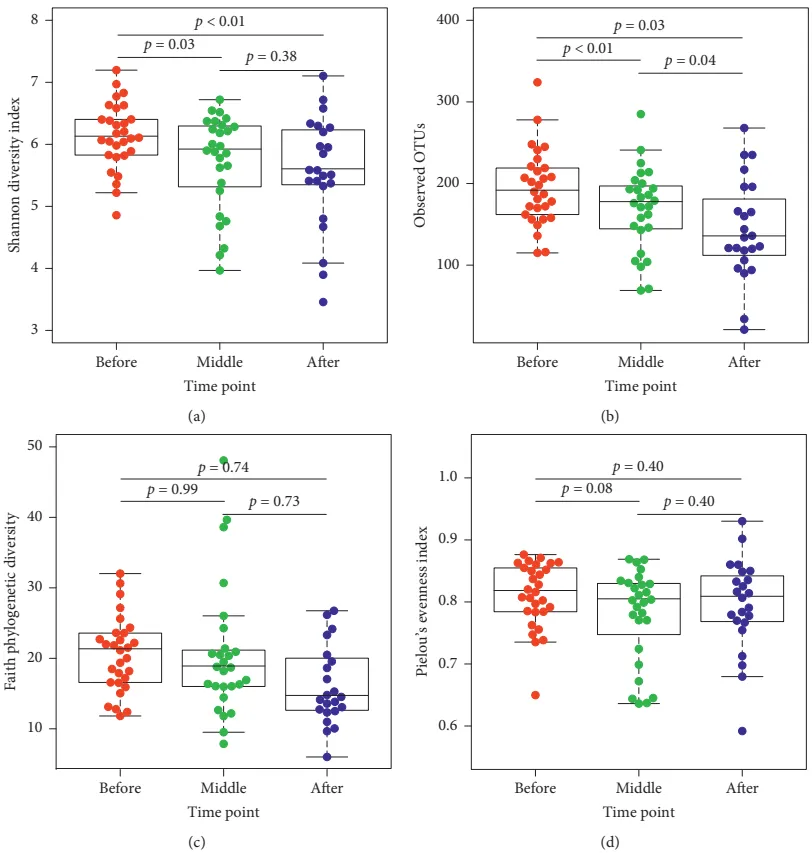
doi: 10.1155/2020/6375876
肠道微生物群多样性变化
在整个CRT过程中,Shannon多样性指数、观察到的操作分类单元(OTUs)数量和Pielou均匀度指数均显著降低。
多样性变化与肠道微生物群失衡有关,可能影响营养物质的吸收和利用,导致患者营养不良,进一步加重疲劳症状。同时也可能引发免疫系统的异常反应,导致炎症反应加剧。
疲劳与非疲劳患者的差异
在CRT中期,疲劳患者的OTUs数量显著低于非疲劳患者(149.30±53.1 vs. 189.15±44.18,t(23)=2.08,p≤0.05)。
主要菌群的相对丰度
在CRT中期,疲劳患者的拟杆菌门相对丰度显著低于非疲劳患者(U=124,p≤0.04)。
在CRT末期,疲劳患者的拟杆菌门相对丰度显著高于非疲劳患者(U=16,p≤0.01)。
在门水平上,据报道,肠易激综合征和非酒精性脂肪肝等肠道炎症疾病中拟杆菌门增加。有趣的是,拟杆菌属可能包括一种潜在的病原体,例如脆弱拟杆菌B. fragilis。
最近的一篇文献表明,脆弱拟杆菌的产肠毒素菌株不仅与结直肠癌有关,还与菌血症、结肠炎、腹泻、脓毒症、全身感染、全身炎症和神经系统疾病(如阿尔茨海默病)有关。后一篇综述还强调,脆弱拟杆菌与全身炎症和神经退行性变相关的机制之一可能与脆弱拟杆菌分泌促炎脂多糖 BF-LPS 等神经毒素的能力有关。
主要菌属的差异
在CRT中期,疲劳患者的Escherichia属显著增加(p≤0.05)。
在CRT末期,疲劳患者的Bacteroides、Faecalibacterium、Oscillospira属显著增加(p≤0.05)。
一些大肠埃希菌菌株,特别是在免疫功能低下的癌症患者中,与可能严重和危及生命的感染有关,如UTI、急性和慢性腹泻(如肠致病性和肠出血性大肠埃希菌腹泻,或血流感染)。此外,一些大肠杆菌菌株与结直肠癌肿瘤大小呈正相关。这也支持疲劳组促炎环境的假设,与 CRT 结束时非疲劳参与者相比,拟杆菌门和拟杆菌属的相对丰度显著更高证明了这一点。
鉴于肿瘤分期与疲劳的高关联,临床医生需要意识到那些表现出更高肿瘤分期的患者疲劳可能恶化的风险。因此,建议在癌症治疗过程中定期评估患者的疲劳状况,特别是对晚期患者进行更频繁的随访和监测。同时,应当重视肠道微生物组在癌症相关疲劳中的潜在作用,考虑将微生物组分析纳入疲劳评估体系。
这可能是肾上腺疲劳或甲状腺功能低下或……两者都有。这两种情况都主要影响女性,女性患甲状腺功能减退的可能性是男性的 5~8 倍。
肾上腺疲劳与甲状腺功能低下如何区分?
它们在某些关键方面有所不同。简单说,肾上腺疲劳主要是压力大,而甲状腺功能低下主要是因为自身免疫的问题。
肾上腺疲劳是当产生皮质醇等压力荷尔蒙的肾上腺收到停止产生尽可能多的皮质醇的信号或身体产生蛋白质来结合皮质醇时发生的一种情况(稍后会详细介绍)。
而甲状腺功能低下是指甲状腺不产生甲状腺激素,和肾上腺疲劳原因不同。
下面我们分别看一下肾上腺疲劳和甲状腺疲劳的发病机制。
肾上腺疲劳又名 HPA 轴失调
肾上腺疲劳不是一个实际的诊断,但它是人们通常对下丘脑-垂体-肾上腺轴(HPA 轴)失调出现的一系列症状的命名。
注:HPA 轴是下丘脑、垂体、肾上腺和肾上腺激素之间的复杂通讯系统。它控制我们体内的压力反应。
当我们感到压力时,下丘脑会向垂体发出信号,以释放促肾上腺皮质激素(ACTH)。然后 ACTH 向肾上腺发出信号以释放皮质醇。皮质醇有时被称为“压力荷尔蒙”,因为它可以帮助我们应对身体、情绪或精神压力。皮质醇通过调节血糖和新陈代谢在体内发挥作用,它激活中枢神经系统,维持血压,并具有抗炎作用。
在身体或情绪压力期间,皮质醇水平会上升。它加速了新陈代谢,因此我们能够度过那段紧张的时期。
皮质醇在短期内是有帮助的,但当我们经历慢性压力时,肾上腺分泌压力荷尔蒙的时间会比它们的设计时间更长。HPA 失调时,大脑和肾上腺通讯就会被甩开,这可能导致感觉“疲惫不堪”或精疲力尽。
起初,皮质醇升高的人会感到颤抖,心跳加速,并且可能有失眠问题。最终,肾上腺将无法产生足够的皮质醇来满足需求,并且水平会下降并保持在较低水平。这称为肾上腺疲劳。
即使是皮质醇水平的微小变化也会导致明显的症状,尤其是疲劳和脑雾。
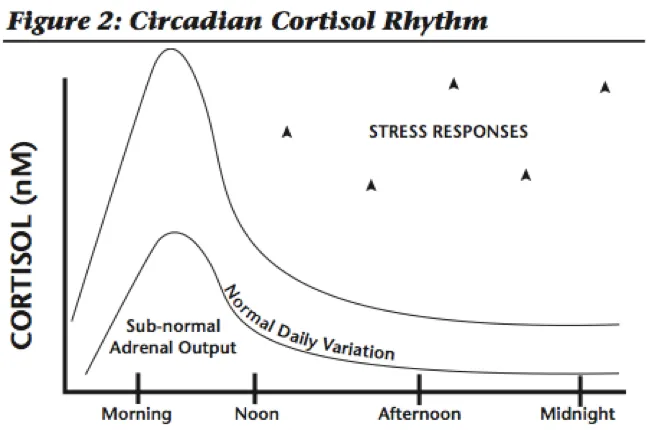
编辑
此外,为了保护身体免受皮质醇的促衰老作用,身体会产生一种称为皮质醇结合球蛋白(CBG) 的结合蛋白。CBG 抓住皮质醇,使其无法刺激体内细胞。
肾上腺疲劳主要还是因为压力大,因此,压力管理对于正常的肾上腺功能至关重要。
这可以包括瑜伽、冥想、定期锻炼以及为爱好腾出时间。

按摩能增加人体内催产素水平,减少让人紧张、亢奋的肾上腺皮质激素。还能降低肌肉组织内炎症因子水平,促进肌纤维再生,修复肌肉损伤。按摩还能调动副交感神经,使大脑平静放松,改善睡眠。
避免咖啡因等兴奋剂甚至 ADHD 药物也很重要。咖啡因通过对肾上腺施加压力以产生更多的皮质醇并增加肾上腺素的产生来帮助产生能量。当肾上腺系统已经虚弱时,这不是一件好事。因此,如果有咖啡因依赖,请尝试戒掉咖啡因依赖。
甲状腺功能低下又名甲状腺功能减退
甲状腺功能低下或甲状腺功能减退也表现为疲劳,但这是因为甲状腺功能没有发挥最佳功能。你的甲状腺就像身体的代谢恒温器,它控制着新陈代谢、体重、体温和心率。它还在生育能力和月经周期中起着重要作用。
甲状腺疲劳什么感觉?
会一直感到疲劳、即使在睡了一夜好觉之后也是如此。它还可能包括脑雾、注意力不集中、一直感到寒冷、月经不调、体重增加等。
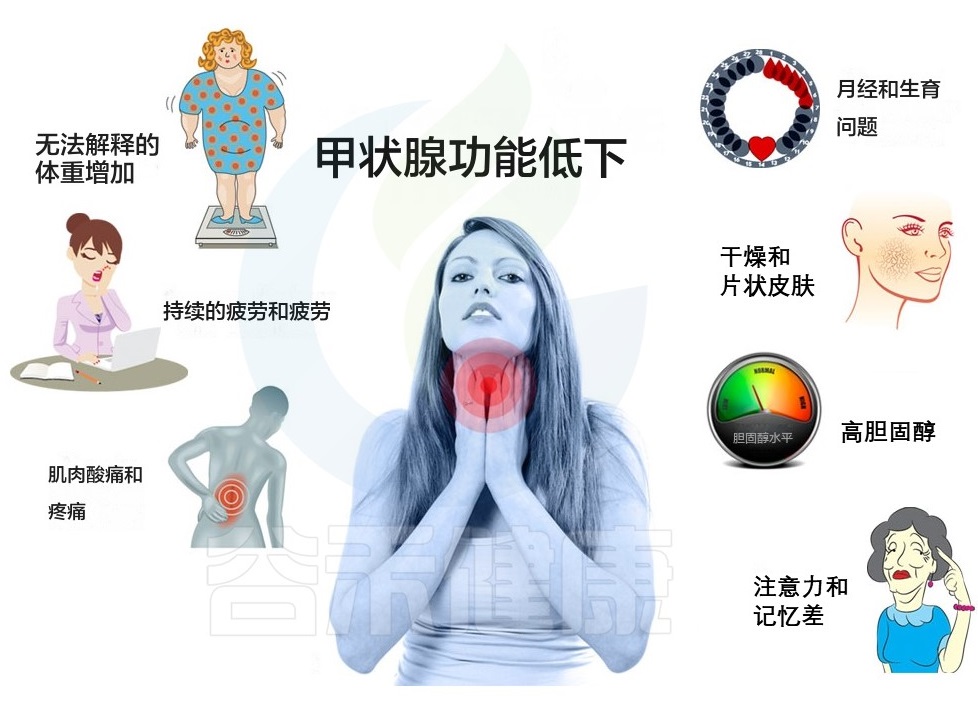
甲状腺疲劳是怎么发生的?
患有甲状腺功能减退症时,要么无法产生足够的甲状腺激素来满足身体的需要(原发性甲状腺功能减退症),要么无法将可用的甲状腺激素转化为活性形式。
甲状腺功能减退症也可能让人更容易患上肾上腺疲劳,因为根本原因是自身免疫。
自身免疫引起的炎症
大多数女性甲状腺功能减退症的主要原因是桥本氏症。高达 90% 的甲状腺功能减退症是由桥本氏甲状腺炎引起的。人群中多达 10% 患有桥本氏病。
桥本氏病是一种自身免疫性疾病。这意味着某些事情导致免疫系统失控并攻击自己的一部分,攻击导致身体该部位的炎症细胞增加。炎症会让人感到“疲惫不堪”,类似于感染病毒时的感觉。
吃有机、天然的食物并避免加工食品和糖也很重要。关于桥本甲状腺炎及相关干预措施我们也有写过相关文章,详见:
除了桥本氏病之外,甲状腺功能减退的原因包括:甲状腺切除术、放射暴露治疗甲状腺功能亢进、暴露于环境中的辐射、某些药物、环境毒素、感染、碘过多或过少、先天性疾病等。
食物敏感
甲状腺疾病通常与食物敏感性有关。其中最常见的是麸质。麸质是一种存在于谷物产品中的蛋白质,尤其是小麦。据估计,多达 1/3 的人对麸质有一定程度的敏感性。这些食物敏感性会导致消化道发炎,从而损害其吸收营养的能力。当缺乏营养时,疲劳通常是一个主要症状。
关于麸质不耐受可以详见我们之前的文章:
低铁蛋白/铁
铁蛋白是铁的储存形式。体内有适量的铁水平对于正常的能量产生至关重要。它也是正常甲状腺激素产生所必需的。缺铁会导致疲劳和其他症状,例如脱发、运动耐力下降、频繁感染以及胃肠道问题,例如胀气和腹胀。甲状腺功能减退症也会影响正常吸收铁的能力。这会产生一个恶性循环,导致严重的疲劳。
即使没有贫血的证据(低血红蛋白),补充铁也被证明可以提高能量和减轻疲劳。
维生素B12 缺乏
甲状腺疾病通常与胃酸水平低有关。如果没有足够的胃酸,就无法完全消化食物并从中提取营养。自身免疫(如桥本甲状腺炎)引起的炎症只会使营养物质的吸收变得更糟。甲状腺激素缺乏会导致某些维生素(如 B12)的营养缺乏。事实上,高达 40% 的甲状腺功能减退患者的维生素 B12 水平不佳。由于 B12 对细胞中线粒体的影响,它直接参与能量产生。缺乏 B12 会降低线粒体能量产生的效率,从而导致疲劳。如果缺乏严重,还会导致恶性贫血。
MTHFR(甲基四氢叶酸诱导酶)是一种向某些营养物质中添加甲基的酶,使我们的身体能够代谢它们。当这种酶缺乏时,我们就无法有效地代谢营养物质,从而导致该营养物质的缺乏。B12 和叶酸等 B 族维生素以这种方式代谢。在 MTHFR 突变的患者中,它们的水平可能不理想。它还可能导致同型半胱氨酸水平升高,从而增加患心血管疾病的风险。
因此可以考虑补充维生素 B12。注射剂优于口服剂型,因为它们直接进入组织并绕过胃肠道吸收。许多甲状腺患者存在便秘、SIBO 和其他胃肠道相关问题,这些问题会损害营养物质的吸收。绕过胃肠道有助于确保 B12 被尽可能多地吸收。
血糖失衡
糖和简单碳水化合物可以快速提升能量,因为它们被迅速吸收和代谢,但从长远来看它们是有害的。当你吃糖或简单的碳水化合物时,血糖水平会飙升。这会触发胰腺释放胰岛素,胰岛素将葡萄糖输送到细胞中。然后胰岛素会降低糖分。有时身体会过度纠正,血糖水平就会下降得太低。从而导致疲劳、颤抖、脑雾以及想吃更多甜食或碳水化合物等症状。
这个循环又重新开始。
较高水平的胰岛素也会导致长期体重增加和/或难以减肥。如果你发现自己在上午晚些时候和下午中午感到疲倦,那么血糖可能在过山车上。
尽可能从饮食中减少糖和简单的碳水化合物。需要 “训练”身体优先使用脂肪而不是糖。最初几天不适应可能会感到有点昏昏沉沉和疲倦,但这些症状会逐渐消失。然后你会注意到精力增加和食欲下降。一些饮食模式例如:原始人饮食法,生酮饮食可参考。
睡眠不良,睡不醒
低(或高)甲状腺激素可能会直接降低睡眠质量。已经表明,甲状腺激素参与 REM 和非 REM 睡眠。如果睡眠质量差,无论睡多久多会觉得累。
如果是因为甲状腺功能减退症导致睡眠质量下降,那么需要甲状腺激素替代疗法来解决这个问题。
另一个重要因素是考虑何时入睡。人们在晚上睡觉时往往有更好的昼夜节律功能,而不是白天。
床是用来睡觉的。避免在床上看电视、阅读、工作电脑或玩智能手机。
尽量每晚在同一时间上床睡觉,每天早上在同一时间起床。身体会对一致的例程做出更好的反应。
晚上避免服用任何兴奋剂,睡前避免剧烈运动,这些会影响睡眠模式。
更多关于睡眠的内容详见我们之前的文章:
疲劳是甲状腺疾病非常常见的症状,可能表明存在更深层次的问题,从荷尔蒙失衡到营养缺乏。仅仅替代甲状腺激素可能不足以让身体完全充满活力并减轻疲劳。重要的是要采取全面的方法来解决问题并调查所有潜在的促成因素。

如果你患有疲劳和骨质疏松症,疲劳可能与药物的副作用、潜在的健康状况或缺乏维生素D有关,而不是骨骼疾病本身。
睡眠不足
目前尚不清楚为什么骨质疏松症患者经常感到疲劳,但根据最近的研究,睡眠不足可能会增加骨折的风险,反之亦然。
2019 年发表在《骨与矿物质研究杂志》上的一项研究得出结论,睡眠不足与绝经后女性的骨密度(BMD)较低和骨质疏松症风险较高有关。
2018 年对女性健康倡议中 157,000 名女性的分析进一步表明,每晚睡眠少于 5 小时的人复发跌倒的几率增加了 27%。
药物副作用
当身体失去过多的骨量,或没有足够快地构建新骨时,就会发生骨质疏松症,从而增加骨折的风险。一些为促进骨骼健康和骨密度而开具的药物可能会引起副作用,这些副作用可能会干扰睡眠并促进疲劳。
其他慢病
类风湿性关节炎、多发性硬化症、糖尿病、多发性骨髓瘤和白血病是导致骨密度低和疲劳的继发性疾病。2018 年的一项研究发现,长期承受精神、情绪或身体压力会给肾上腺带来负担,对骨量有直接的不利影响。
营养失衡
例如维生素 B12 缺乏症,会进一步导致与骨质疏松症作斗争的人感到疲惫。维生素 D 缺乏症在骨质疏松症患者中普遍存在,可导致疲劳、肌肉无力和骨痛。
因此,解决骨骼健康问题、确保摄入维生素 D 等必需营养素以及监测药物副作用是管理与骨质疏松症相关的疲劳的关键步骤。
保证充足的睡眠时间,避免过度劳累。学会压力管理,保持积极心态。
避免久坐不动,选择低冲击性运动,循序渐进避免过度。根据身体状况调整活动强度。
遵医嘱用药,定期进行骨密度检查。
更多关于骨质疏松的改善详见我们之前的文章:
酮症疲劳是过渡到生酮饮食的常见症状,通常在进行生酮饮食后的最初几周内会减轻。在开始低碳水化合物、高脂肪饮食后出现酮症疲劳是对新陈代谢强大变化的正常反应。
在酮症的早期阶段,你的身体会转向燃烧脂肪而不是糖来获取能量。大脑、肌肉和器官必须适应利用脂肪,而疲劳、缺乏精力和疲倦是这种转变的标志。其他症状可能包括头晕、恶心、心律不齐等。
生酮饮食可能会导致矿物质和电解质的损失,如钠、钾和镁,这些电解质对于肌肉功能和能量代谢至关重要。它还会增加对 B 族维生素的需求,这些都可能会导致肌肉疲劳和无力。
由于生酮饮食中碳水化合物的减少,身体可能会失去水分,导致脱水,这也可能是导致疲劳的一个因素。
确保摄入足够的钠、钾和镁,可以帮助缓解由于电解质失衡引起的疲劳。
即使不感到口渴,也要确保充足的水分摄入,以防止脱水。
适量的体育活动可以帮助身体适应酮症状态,并可能提高能量水平。
如果疲劳持续存在,可能需要调整生酮饮食的比例,或者咨询医生或营养师的建议。
每个人对生酮饮食的反应都是不同的,有些人会经历酮症疲劳,而有些人可能就没有这个问题。通常,随着时间的推移,身体会逐渐适应这种新的代谢状态,疲劳感也会减轻。一旦你的身体适应了,酮症疲劳通常会在一两周后消失。
更年期生殖激素水平的变化与身体和精神疲劳有关。它们会对其他激素产生连锁反应,并可能导致睡眠质量变差、血糖控制下降以及维生素或矿物质缺乏,所有这些都会让人感到疲倦。女性的更年期疲劳经历差异很大,从一般的精力不足到突然的“崩溃疲劳”或脑雾。崩溃性疲劳是指突然的剧烈疲惫,可能包括肌肉无力。
一项研究发现,虽然近 20% 的绝经前妇女报告了身心疲惫,但在围绝经期上升到 46%以上,绝经后上升到 85%以上。
荷尔蒙失衡
在围绝经期和更年期,身体的天然激素平衡,尤其是雌激素、黄体酮和睾丸激素开始减弱。由此产生的不平衡会引发不舒服的症状,如潮热、极度疲劳、情绪波动、体重增加、低下、脑雾等。
压力增加
更年期荷尔蒙失衡通常与其他中年压力源达到顶峰同时出现——工作压力、照顾孩子和年迈的父母以及睡眠不足。当我们经历慢性压力时,每个腺体和器官都会专门用于泵出称为肾上腺素和皮质醇的压力荷尔蒙。在“皮质醇窃取”中,这种对皮质醇的需求为其他激素提供了基础。这意味着身体剩下最少的资源来滋养甲状腺和性激素,尤其是雌激素、黄体酮和 DHEA。长期升高的压力和高皮质醇会对荷尔蒙平衡和能量水平产生毁灭性影响。
血糖控制不佳
雌激素还可以帮助身体对胰岛素做出反应,胰岛素是保持血糖水平稳定的激素。随着雌激素水平下降,血糖控制会恶化,从而增加吃某些类型食物后“崩溃”的风险。
失眠
在潮热、盗汗、思绪奔腾和体重增加之间,更年期症状会使安宁的睡眠几乎是不可能的。荷尔蒙波动还会触发皮质醇的释放,从而进一步破坏正常昼夜节律睡眠周期。
低雌激素和黄体酮水平的变化与失眠风险增加有关。其他更年期症状,如盗汗、焦虑和肌肉疼痛或关节痛,也会打断您的睡眠。
脑雾
如果你的疲劳感觉更多的是精神上的而不是身体上的,那么雌激素也可能与这里有关。它对健康的大脑功能和认知能力很重要,这就是为什么许多女性经历更年期“脑雾”的原因,在思考、记忆和注意力方面苦苦挣扎。
如果在围绝经期感到疲劳,当荷尔蒙波动时,症状可能会随着接近更年期并且情况开始稳定而改善。围绝经期通常持续约 4~8 年。
如果雌激素水平降低是主要问题,那疲劳可能会持续到更年期,此时荷尔蒙会永久处于低位。
激素替代疗法(HRT)
可替代更年期过渡期间流失的生殖激素,如雌激素和黄体酮,可以帮助缓解一系列围绝经期和更年期症状。可以以药丸和片剂的形式服用,也可以通过凝胶和贴剂通过皮肤服用。
改变饮食改善
精制碳水化合物或糖含量高的食物会迅速将葡萄糖释放到血液中。这可能导致血糖飙升,随后能量消耗崩溃。雌激素水平低降低了对胰岛素的敏感性,使控制这些波动变得更加困难。
早餐:将加工过的早餐麦片或白吐司换成蛋白质、健康脂肪和纤维含量更高的选择,如鸡蛋和牛油果,或带有坚果和浆果的酸奶。
午餐和晚餐:将面包、米饭或意大利面换成高纤维全麦、蔬菜和豆类,以及一些健康蛋白质,如豆腐、鱼或鸡肉。
小吃和饮料:吃水果、坚果,而不是蛋糕和饼干。尽量避免含糖饮料和果汁。
维生素B12
随着年龄的增长,维生素 B12 缺乏症更为常见,可导致贫血、精力下降、疲劳和呼吸急促,使身体活动更加困难。研究表明,服用 B12 补充剂可以显著改善这些症状。也可以吃一些鱼类,肉类,鸡蛋等食物。
南非醉茄
南非醉茄根是一种传统的草药,最近许多科学研究都以此为基础,包括一些研究表明它可以提高围绝经期的雌激素水平。
镁
矿物质镁对广泛的生理过程至关重要,包括调节生物钟。摄入更多镁的人往往睡得更久、更好,这可能有助于减轻白天的疲劳。
铁
如果在围绝经期月经过多,可能会导致缺铁,从而导致疲倦、精力不足和呼吸急促。一项涉及缺铁绝经前妇女的研究回顾发现,服用铁补充剂使她们的疲劳感减少了 60% 以上。
铁的食物来源包括:红肉和内脏、鱼、家禽、豆类、坚果和种子、深绿色蔬菜,如菠菜、羽衣甘蓝、西兰花等。
多喝水
雌激素有助于调节液体水平,保持细胞水分。随着更年期雌激素的下降,身体会发现更难保持液体,可能会脱水。这会导致疲劳,头晕,潮热或盗汗导致的出汗过多会使情况变得更糟。
随着年龄的增长,对身体的口渴信号变得不那么敏感,因此有意识地努力摄入足够的液体很重要。
定期锻炼
一项大型观察性研究发现,只进行少量体育活动的女性明显更容易出现一系列更年期症状,包括疲劳。
定期锻炼有助于提高能量水平和情绪,并改善睡眠。
如果目前不怎么运动,可以慢慢开始并逐渐增加。目标是每周至少进行 150 分钟的适度身体活动或 75 分钟的剧烈运动,分几天进行。
尝试进行一系列不同的运动,包括有氧运动(如快走、游泳或有氧运动)、力量训练(重量训练、自重锻炼或使用阻力带)以及涉及伸展和平衡的活动,如瑜伽和普拉提。
许多患者认为,因为他们已经在麻醉下睡着了,相当于休息了,所以在手术结束后应该有更多的精力。然而,手术后的疲劳感是大多数患者的常见情况。有以下一些原因:
· 抑郁或焦虑
手术前的焦虑导致睡眠不足,加重疲劳感,需要术后弥补
· 贫血
手术过程中的失血可能导致贫血,引起疲劳、虚弱和头晕
· 禁食
手术前的禁食会导致电解质和矿物质流失,影响身体机能
· 恢复
年龄增长和整体健康状况会影响术后恢复能力和疲劳程度;手术创伤使身体进入修复模式,需要更多能量进行愈合。
· 药物
麻醉药物和术后用药可能加重疲劳感。
美托洛尔或利尿剂(例如氢氯噻嗪)等降压药来降低血压,这些药物的副作用包括疲劳;
手术后,苯二氮卓类药物(例如劳拉西泮)等药物可用于镇静和/或肌肉痉挛。苯二氮卓类药物也用于治疗失眠,并可能导致嗜睡;
抗生素是在手术期间或手术后立即开始的。一些抗生素,如头孢氨苄、甲氧苄啶和磺胺甲噁唑,会引起疲劳。
1、保证充足的睡眠时间,避免过多访客打扰,循序渐进地恢复活动。
2、监测血红蛋白水平,补充铁剂等营养素。
3、维持电解质平衡,补充必要的矿物质,注意营养均衡。
4、缓解手术相关焦虑,保持积极心态,必要时寻求心理支持。
5、合理用药,遵医嘱服用药物,注意药物相互作用,尽可能避免使用导致疲劳的药物,必要时调整用药方案。
更多关于术后康复内容详见:
“周末赛神仙,周一丧整天”。
对很多人来说,周一早上可能真的很艰难,周一早上醒来时出现疲劳、焦虑、头晕、胸闷、注意力不集中、感觉压力大、沮丧、烦躁、喜怒无常、渴望撤退、食欲不振等症状。

周一具有挑战性,这通常涉及调整睡眠时间表、从休闲活动切换到工作任务以及为一周的责任做好心理准备。
为什么有人会出现这样的症状?
好消息是这通常是暂时的,可以通过特定的策略来解决,让周一更愉快。星期一也可以代表一个新的开始,这一天带来了设定新目标和做出积极改变的机会。与其将星期一视为周末的结束,不如尝试将它们视为一个新的开始。每个星期一都是重新开始、应对新挑战并为成功和令人满意的一周定下基调的机会。
如何调整?
1、“圆桌派”有这样一个观点:焦虑的反面是“具体”。可以妥善安排工作或项目并制定工作时间表。严格执行,不要将周五的工作留到下周一。
2、锻炼是一种很好的方式,你会专注于身体和感觉,这可以让你在周一工作时暂时把所有的烦恼放在一边。冥想可以帮助您平静心情,减轻压力。快走、瑜伽课并将其作为你周一早上仪式的一部分。
3、自我反思,重新评估您的工作目标和满意度。经常与朋友和同事沟通,以提高工作效率,改善工作态度。
4、星期天的时候可以出去散步,尤其是大自然,在清新安静的环境中度过周末。接触自然环境可以帮助我们减轻心理压力,观察大自然的过程能唤起我们内心的敬畏感,我们会感知到更小的自我,自我的需求和欲望不那么重要,进而产生深深的被治愈的感觉。
5、和宠物互动可以增强人们的心理健康和幸福感,甚至与植物交谈也有改善情绪、减轻压力的作用。动物和植物都是优秀的倾听者,它们允许一个人充分表达自己的感受和情绪,不会打断和评判。

6、周日晚上好好洗个热水澡,睡觉时听一些轻柔的音乐,轻松阅读,让身体真正放松。尽可能地在周日晚上11点之前睡觉。
7、周一早上建立积极的星期一仪式,例如特别的早餐、最喜欢的播客等,周一早上早点到公司,提前安排一周的工作。尽量保持周一的议程轻松且易于管理。
8、列出一些会让自己期待的一周中的好事情或者计划。比如,下班后晚上和朋友吃饭、喝咖啡、约会、看电影、健身或者其他你喜欢的活动。
9、选择热量较少的食物,有助于减轻身体新陈代谢的负担。不要试图通过喝大量的咖啡和牛磺酸饮料来抵抗星期一综合症。
10、完美的妆容和清新的衣服可以帮你在五分钟内振作起来。
以上只是建议,或许可以帮到你,当然你也可以有适合自己的调整方式。
在慢性疲劳综合征和长新冠患者中,益生菌可能通过以下机制发挥作用:
慢性疲劳综合征
对慢性疲劳综合征患者进行的干预主要集中在使用双歧杆菌和乳酸菌菌株上,这些菌株在减少炎症和氧化应激方面始终表现出良好的效果,并且伴随着疲劳感的降低。例如,在8周内使用干酪乳杆菌菌株Shirota的益生菌治疗可显著降低慢性疲劳综合征(ME/CFS)患者的炎症标志物。
使用多菌株益生菌制剂,这些制剂可以对抗抗生素耐药性病原体,增强粘膜屏障并调节免疫反应,包括制剂鼠李糖乳杆菌联合干酪乳杆菌(Ramnoselle) 和干酪乳杆菌联合乳酸双歧杆菌(Cytogenex) 在 8 周后有效改善疲劳(Chadler 评分),这归因于炎症减少,与基线相比,CRP 水平降低了近 30%,免疫力增强,其特征是 IgM 显着增加(是基线值的三倍)和 CD4/CD8 比率降低。
注:CRP一般是指C-反应蛋白的缩写,是血检中常见的炎症指标,当发生细菌感染或组织损伤时,其浓度显著升高。
IgM(免疫球蛋白M)是一种重要抗体,IgM在急性感染早期出现,是感染初期的重要标志物,在人体免疫系统中发挥重要作用。
长新冠
用嗜热链球菌 BT01、短链球菌 BB02、动物芽孢杆菌乳酸亚种 BL03、动物芽孢杆菌亚种 BI04、嗜酸乳杆菌 BA05、植物乳杆菌 BP06、副干酪乳杆菌 BP07 和瑞士乳杆菌 BD08 的八种活菌株和冻干菌株组成的益生菌联盟进行处理 (VSL#3®),与安慰剂相比,4 周后长期COVID患者的Chalder疲劳量表 (CFS)疲劳评分显著降低,安慰剂在干预后维持 4 周。
使用合生元将植物乳杆菌、鼠李糖乳杆菌、保加利亚乳杆菌、乳球菌和副干酪乳杆菌的益生菌菌株与益生元菊粉纤维相结合,以及柑橘果实、洋甘菊、姜黄、石榴以及从虎杖根中提取的白藜芦醇,与安慰剂相比,4 周后,平均疲劳评分降低了近 2 倍,主观幸福感评分的整体幸福感评分提高了一倍。
这些植物作为天然衍生的益生元纤维、抗氧化剂和微量营养素的来源,可能提供促进肠道健康和微生物活性的协同效益,与微生物代谢物的产生有关,其系统作用可以改善整体健康状况并促进疲劳恢复。
多组分制剂的对疲劳的改善
一项初步研究调查了多组分制剂“OMNi-BiOTiC®STRESS Repair 9”的有效性,该制剂由益生菌,例如干酪乳杆菌 W56、嗜酸乳杆菌 W22、副干酪乳杆菌 W20、乳双歧杆菌 W51、唾液乳杆菌 W24、乳酸乳球菌 W19、乳双歧杆菌 W52、 植物乳杆菌 W62 和双歧双歧杆菌 W23;益生元低聚果糖(FOS),如菊粉、酶(淀粉酶)和选定的微量营养素,包括氯化钾、维生素 B2(核黄素 5′-磷酸钠)、维生素 B6(盐酸吡哆醇)、硫酸锰和维生素 B12(氰钴胺素)组成,已被证明可有效改善益生菌和安慰剂组的疲劳、情绪和生活质量,但益生菌组在治疗 6 个月后有更大的改善。
由发酵乳杆菌LF16、鼠李糖乳杆菌LR06、植物乳杆菌LP01和长双歧杆菌BL04;嗜酸乳杆菌、干酪乳杆菌和双歧杆菌;瑞士乳杆菌R0052、长双歧杆菌R0175和植物乳杆菌299组成的精神生物制剂已被证明可以通过减少抑郁和愤怒情绪来显著改善情绪,并减少对HPA轴压力的反应,唾液皮质醇水平降低,所有这些都能改善睡眠。特别是,与基线相比,12周后在疲劳的参与者中补充副干酪乳杆菌HII01已被证明可以显著降低唾液皮质醇水平,这表明对病毒感染后综合征患者的疲劳减轻也有潜在益处。


doi.org/10.3390/nu16111545
总之,迄今为止的研究表明,益生菌,尤其是乳酸菌,可能有助于减轻慢性疲劳综合征和长期 COVID 患者的胃肠道症状。益生菌的免疫调节特性可能有助于恢复肠道微生物群的受干扰组成和菌群失调,从而减轻症状的严重程度(与丁酸菌丰度减少有关)。
因此,通过提高短链脂肪酸(如丁酸盐)水平(由于其强大的免疫调节和抗炎特性),使用活的F.prausnitzii和B.pullicaecorum菌株作为强效的丁酸盐生产者,可能必须在过度炎症后恢复肠道稳态,并且通过加强肠道屏障,可以预防与IBS样症状相关的肠漏综合征。此外,某些精神益生菌菌株和抗炎特性可能有助于减轻由压力诱导的肠道生态失调和HPA轴激活引起的心理困扰引起的胃肠道症状。
补充丁酸盐可能比较有利,因为它具有经过验证的免疫调节作用,例如,通过诱导干扰素-γ 和颗粒酶 B 的表达来增加粘蛋白和防御素的分泌并促进抗病毒防御,并减少全身炎症,从而可能减轻精神和疲劳症状。
后生元作为不可存活或无活性的益生菌及其代谢副产物,可能提供提供所有益处的显著优势,从而为患有慢性炎症和/或免疫力低下的个体提供一种可能更安全、更合适的方法。
此外,探索益生菌/合生元与其他具有免疫调节和抗氧化特性的生物活性物质(如辅酶 Q10 和硒或辅酶 Q10 和类脂酸)联合使用的潜在协同作用,值得进一步研究。
一项研究验证了针灸在乳腺癌化疗相关疲劳中的抗疲劳效果,其机制可能通过调节肠道菌群-肠-脑轴来实现。
根据针灸理论,选择足三里(ST36)、三阴角(SP6)、关元(CV4)、气海(CV6)、百会 (GV20)的穴位进行针灸治疗。
针灸治疗可有效缓解CRF小鼠的疲劳样行为,包括减少强迫游泳不动时间和增加总活动距离。针灸治疗可以显著提高肠道菌群的多样性和丰度,增加有益菌如乳杆菌,Candidatus arthromitus、Clostridia_UCG-014_unclassified,减少有害菌如大肠杆菌-志贺氏菌、链球菌的含量。
针灸治疗可以显著提高肠道紧密连接蛋白(ZO-1、occludin、claudin-5)的表达水平,减少肠道和海马体中的炎症因子(IL-1b、IL-6和TNF-a)的表达水平。
针灸治疗可以显著提高血清中CRH和CORT的水平,降低ACTH的水平,改善HPA轴功能。
针灸治疗可以调节血清中的代谢物,如N-甲基烟酰胺、β-甘油磷酸、香叶基乙酰乙酸、血清素和色氨酸等,影响相关的代谢途径。
总的来说,针灸能够改善肠道屏障功能、减少肠道和神经炎症反应、改善HPA轴功能,并调节血清代谢物,从而缓解疲劳症状。
疲劳可能发生在我们任何人身上,但通常不是一个长期的问题。如果它变成长期的,则表明可能存在更严重的健康问题,需要引起重视。
近年来的研究表明,肠道菌群方面的研究为慢性疲劳的诊断和治疗提供了新的视角。通过检测肠道菌群的组成变化,如产丁酸菌的减少、促炎菌的增加以及菌群多样性的降低,评估肠道屏障完整性等,可以帮助我们更好地理解个人疲劳情况是否与其肠道菌群有关,如果相关,则可以根据菌群失调的具体情况制定治疗方案。
例如,针对检测发现的具体菌群失调,可以采用相应的益生菌、后生元补充,或调整饮食结构来改善肠道微生态环境。同时,通过定期检测还能监测治疗效果,及时调整干预策略。
免责声明:本文所含信息仅供参考,不应视为医疗建议。如有任何健康问题,以及在进行任何医疗或生活方式改变之前,请咨询您的医生。
主要参考文献
Lv Z, Liu R, Su K, Gu Y, Fang L, Fan Y, Gao J, Ruan X, Feng X. Acupuncture ameliorates breast cancer-related fatigue by regulating the gut microbiota-gut-brain axis. Front Endocrinol (Lausanne). 2022 Aug 24;13:921119.
Wang, JH., Choi, Y., Lee, JS. et al. Clinical evidence of the link between gut microbiome and myalgic encephalomyelitis/chronic fatigue syndrome: a retrospective review. Eur J Med Res 29, 148 (2024).
Jurek JM, Castro-Marrero J. A Narrative Review on Gut Microbiome Disturbances and Microbial Preparations in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome: Implications for Long COVID. Nutrients. 2024 May 21;16(11):1545.
Zhou Y, Chu Z, Luo Y, Yang F, Cao F, Luo F, Lin Q. Dietary Polysaccharides Exert Anti-Fatigue Functions via the Gut-Muscle Axis: Advances and Prospectives. Foods. 2023 Aug 17;12(16):3083.
Tornero-Aguilera JF, Jimenez-Morcillo J, Rubio-Zarapuz A, Clemente-Suárez VJ. Central and Peripheral Fatigue in Physical Exercise Explained: A Narrative Review. Int J Environ Res Public Health. 2022 Mar 25;19(7):3909.
Guo C, Che X, Briese T, Ranjan A, Allicock O, Yates RA, Cheng A, March D, Hornig M, Komaroff AL, Levine S, Bateman L, Vernon SD, Klimas NG, Montoya JG, Peterson DL, Lipkin WI, Williams BL. Deficient butyrate-producing capacity in the gut microbiome is associated with bacterial network disturbances and fatigue symptoms in ME/CFS. Cell Host Microbe. 2023 Feb 8;31(2):288-304.e8.
Raizen DM, Mullington J, Anaclet C, Clarke G, Critchley H, Dantzer R, Davis R, Drew KL, Fessel J, Fuller PM, et al., Beyond the symptom: the biology of fatigue. Sleep. 2023 Sep 8;46(9):zsad069.
Du Preez S, Corbitt M, Cabanas H, Eaton N, Staines D, Marshall-Gradisnik S. A systematic review of enteric dysbiosis in chronic fatigue syndrome/myalgic encephalomyelitis. Syst Rev. 2018 Dec 20;7(1):241.
Boolani A, Gallivan KM, Ondrak KS, Christopher CJ, Castro HF, Campagna SR, Taylor CM, Luo M, Dowd SE, Smith ML, Byerley LO. Trait Energy and Fatigue May Be Connected to Gut Bacteria among Young Physically Active Adults: An Exploratory Study. Nutrients. 2022 Jan 21;14(3):466.
González-Mercado VJ, Pérez-Santiago J, Lyon D, Dilán-Pantojas I, Henderson W, McMillan S, Groer M, Kane B, Marrero S, Pedro E, Saligan LN. The Role of Gut Microbiome Perturbation in Fatigue Induced by Repeated Stress from Chemoradiotherapy: A Proof of Concept Study. Adv Med. 2020 Feb 7;2020:6375876.
Bourgonje, A.R., Hörstke, N.V., Fehringer, M. et al. Systemic antibody responses against gut microbiota flagellins implicate shared and divergent immune reactivity in Crohn’s disease and chronic fatigue syndrome. Microbiome 12, 141 (2024).
Ceban F, Ling S, Lui LMW, Lee Y, Gill H, Teopiz KM, Rodrigues NB, Subramaniapillai M, Di Vincenzo JD, Cao B, Lin K, Mansur RB, Ho RC, Rosenblat JD, Miskowiak KW, Vinberg M, Maletic V, McIntyre RS. Fatigue and cognitive impairment in Post-COVID-19 Syndrome: A systematic review and meta-analysis. Brain Behav Immun. 2022 Mar;101:93-135.
Hajjar J, Mendoza T, Zhang L, Fu S, Piha-Paul SA, Hong DS, Janku F, Karp DD, Ballhausen A, Gong J, Zarifa A, Peterson CB, Meric-Bernstam F, Jenq R, Naing A. Associations between the gut microbiome and fatigue in cancer patients. Sci Rep. 2021 Mar 12;11(1):5847.
谷禾健康
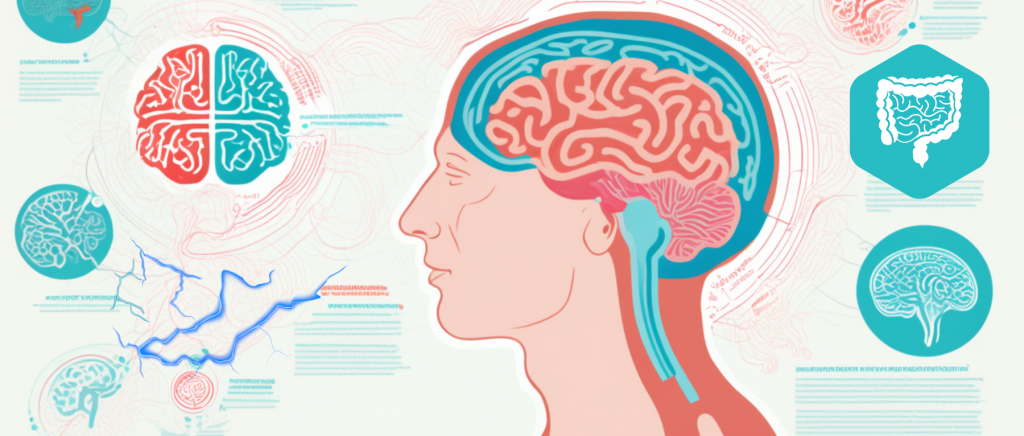
人的脑部大约有860亿个神经元和数万亿个突触连接,由250-300亿的神经胶质细胞支持,消耗基础氧气中约20%的比例来维持ATP驱动的活动。
与其他器官相比,大脑及其神经组织由于其高代谢率和能量活动而产生大量的 ROS(活性氧)。与此同时,与其他组织相比,大脑的抗氧化防御系统较弱,因此容易出现氧化还原稳态紊乱。
氧化应激是指由于 ROS 水平高于抗氧化剂水平而导致细胞内氧化还原信号通路中断。这种不平衡状态会产生有害影响,是许多神经系统疾病的主要原因。当大脑缺氧时,每分钟有大约190万个神经元和1400万个突触会开始丧失。
人们最初认为神经退行性疾病 (NDD) 是由神经系统缺陷引起的,而忽略了肠道和大脑之间的通讯涉及神经、代谢、内分泌和免疫途径。
大量研究观察到,肠道微生物组在通过其自身代谢产物或产生次生代谢产物减轻氧化应激、炎症和能量代谢方面发挥了不可忽视的作用,而通过使用具有抗氧化和抗炎活性的益生菌来调节肠道微生物组种群已显示出有希望的神经恢复能力。据报道从德氏乳杆菌(Lactobacillus delbrueckii)亚种Lactobacillus delbrueckii ssp. bulgaricus B3和 Lactobacillus plantarum GD2中分离出的胞外多糖可保护 SH-SY5Y 细胞免受 Aβ(1–42) 诱导的细胞凋亡,这表明它们有望成为药物治疗阿尔茨海默病 (AD)的有前途的天然化学成分。
doi: 10.1016/j.jare.2021.09.005
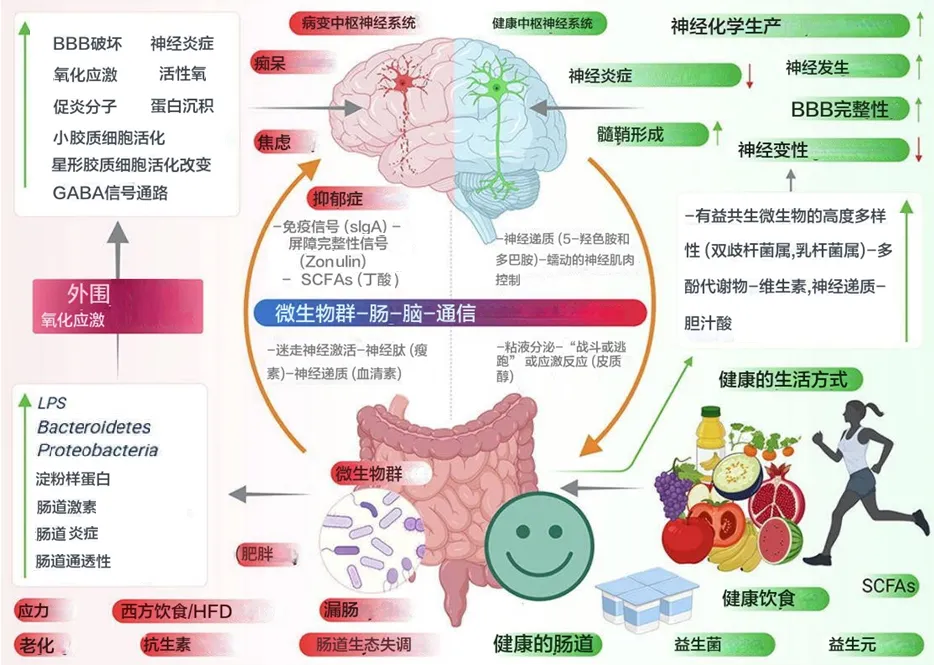
肠道微生物分子,如神经递质、氨基酸、短链脂肪酸 (SCFA)、淀粉样蛋白、脂多糖 (LPS) 和微生物相关分子模式 (MAMP),通过循环与宿主免疫系统相互作用,影响宿主的代谢和神经系统,并通过肠道神经系统直接激活迷走神经影响大脑。压力等情况会导致下丘脑神经元分泌促肾上腺皮质激素(CRH),触发肾上腺皮质激素释放激素(ACTH) 的释放,随后激活皮质醇的释放,影响肠道屏障完整性,进而影响肠道健康。
当肠道菌群失调时,抗炎分子(如SCFAs、H2)的含量减少,而促炎分子(LPS、淀粉样蛋白)的含量增加,同时有益菌种数目减少,致病菌增加。这导致肠道和血脑屏障通透性增加,随之增加外周免疫反应,进而在中枢神经系统(CNS)中增加氧化应激。在神经元的细胞器(如线粒体、内质网(ER)和过氧化物体)中观察到反应性氧化物种(ROS)的产生增加,同时伴随神经毒素的聚集,导致神经退行性变化。
近期的研究提出了肠道微生物群与大脑之间的两个最重要的联系:
所以本文想和大家一起深入了解相关方面研究成果和进展,重点关注涉及神经退化的肠道微生物群介导的氧化应激,以及显示肠道微生物群及其代谢物参与神经保护的研究。
神经退行性疾病(NDD)是一类涉及神经元退化和功能损害的疾病,通常会导致神经细胞的死亡或损伤,进而引起神经系统功能障碍。随着时间的推移逐渐恶化,影响患者的日常生活和活动能力,目前的发病人群越来越大。
阿尔茨海默病:一种进行性痴呆疾病,主要表现为记忆丧失、认知功能下降和行为变化。
帕金森病:一种影响运动控制的疾病,其中运动功能受损,如震颤、肌肉僵硬和运动迟缓。
亨廷顿病(Huntington’s Disease):一种遗传性疾病,表现为神经元的逐渐死亡,导致运动障碍、认知功能下降和精神障碍。
路易体痴呆症(Amyotrophic Lateral Sclerosis, ALS):一种肌萎缩性疾病,导致运动神经元受损,最终导致肌肉无力和萎缩。
多发性硬化:这是一种影响中枢神经系统的慢性疾病,导致神经纤维的髓鞘损伤,影响神经信号的传递。
中风与脑损伤:中风是一种急性神经退行性疾病,由于脑部血流中断导致脑组织损伤。脑损伤也可以是慢性的,随着时间的推移导致神经细胞的损伤。
肠道的“第二大脑”:肠神经系统 (ENS)
肠道不仅仅是消化食物的地方,它还有一个聪明的“大脑”——肠神经系统 (ENS)。它在胃肠道 (GI) 和中枢神经系统 (CNS) 之间架起了一座沟通的桥梁。
肠道神经元通过迷走神经、内分泌和免疫途径与中枢神经系统进行对话,确保我们的肠道健康有序。
肠道微生物群:调节通讯的关键
上面说的“肠神经系统”并不是独自工作的,它有一个重要的合作伙伴——肠道微生物群。这些微生物不仅数量庞大,其代谢能力甚至可以与我们的肝脏相媲美。它们是调节肠道与大脑之间通讯的幕后英雄。
肠道微生物群的多重角色
该领域的持续研究表明,肠道微生物群不仅参与免疫系统的建设和代谢调节,还在我们身体各种器官的发育中扮演着重要角色。
饮食、药物等各种环境因素以及年龄和遗传等宿主因素,不仅会改变肠道菌群的组成,还会造成它们的信号活性发生变化,进而影响我们的健康。
IgA:肠道菌群的守护者
免疫球蛋白A (IgA) 是粘膜表面分泌的最丰富的抗体,她不仅能够包裹病原体以防止其侵入,还能包裹肠道中的共生菌,从而共同抵抗病原菌,维持着肠道菌群的稳定。
连蛋白:肠道屏障的调控者
肠道菌群还会影响连蛋白(zonulin),而连蛋白是调节肠道和血管内皮 (血脑屏障) 紧密连接所必需的。肠道菌群的变化直接影响连蛋白通路,我们常听说的“肠漏”就与此相关。
肠道菌群与情绪
肠道菌群还能影响我们的肠道蠕动,甚至与我们的内分泌系统有关。例如,压力和抑郁可能与皮质醇水平的升高有关,而这种激素的变化又与肠道菌群的平衡有关。
简而言之,肠道菌群通过感知和调节大量化学信号,直接影响我们的身心健康。
肠道细菌与神经系统的联系:从被忽视到被认可
肠道细菌与神经系统疾病之间的关系首次在20世纪提出,现在已被众多研究人员认可。
最初,人们认为神经退行性疾病(NDDs)仅由神经系统内部的缺陷引起,但现代研究揭示了一个事实:肠道微生物能产生和改变各种免疫、代谢和神经化学因子,它们实际上在调控我们的大脑健康方面发挥着关键作用。
肠道菌群:参与神经退行性疾病的双重角色
——失调带来的破坏
神经退行性疾病主要由氧化损伤、活性氧 (ROS) 生成增加、神经炎症和能量代谢紊乱引起,这些病理过程不仅侵袭大脑,也影响肠道微生物群的平衡。
肠道微生物组成会随着身体新陈代谢从健康状态到患病状态的变化而改变。这表明肠道菌群与宿主和环境之间存在交集,且与各种神经和心理疾病存在关联。
肠道菌群失调和神经炎症是各种神经系统疾病病理生理学中一致的因素。在本文中,我们重点展示了肠道微生物群介导的氧化应激在神经退行性疾病中的作用,包括 ROS 产生机制的解释、大脑更容易受到氧化应激的原因以及肠道微生物代谢物如何影响氧化应激引起的大脑损伤,重点关注阿尔茨海默病、帕金森病、创伤性脑损伤。
——保护作用
虽然说肠道菌群在神经退行性疾病的病理学中发挥着作用,但肠道菌群也具有保护大脑免受损伤的潜力,一些细菌能够释放代谢物,这些代谢物转化自膳食纤维、多酚或宿主分子,如胆汁酸、类固醇激素等。此外,通过益生元调节肠道菌群的组成,可以增强神经恢复力。
益生菌的神经保护作用:实验室到临床的探索
肠道菌群的神经保护作用在最近的研究中已得到充分证实,从发酵食品中分离的 Lactobacillus buchneri KU200793菌株表现出较高的抗氧化活性,并且能够保护 SH-SY5Y 细胞免受有害物质 1-甲基-4-苯基吡啶 (MPP + ) 的侵害,表明其具有益生菌和神经保护作用。
同样,从德氏乳杆菌亚种Lactobacillus delbrueckii ssp. bulgaricusB3和 Lactobacillus plantarum GD2 中分离出的胞外多糖,展现出保护神经细胞免受阿尔茨海默相关毒性的能力。
热灭活的Rumnicoccus albus菌株在细胞和小鼠模型中显示出降低ROS水平和提高抗氧化酶(SOD和GSH)水平的能力。此外,植物乳杆菌MTCC1325在动物模型中显示出抗阿尔茨海默病的潜力,预防记忆缺陷。
总之,这些研究反映了肠道微生物群的良好作用、它们的抗氧化作用以及随后的神经保护作用。
氧化应激的微妙平衡
氧化应激是一种生物学现象,当细胞内的活性氧(ROS)水平超过抗氧化剂的防御能力时,就会发生。这种失衡可能会导致细胞内的氧化还原信号通路中断,进而引发一系列有害的生物效应,成为众多神经系统疾病的潜在推手。
ROS是怎么产生的?
有氧代谢中涉及的每个化学反应都会形成不稳定且短暂的反应性中间产物,即 ROS。
注:生物分子氧 (O2) 具有两个不成对电子,不能被完全还原,因此其不完全还原会形成高度亲电且短寿命的 ROS,如:H2O2、超氧化物阴离子、一氧化氮、过氧亚硝酸根阴离子、羟基、过氧化物自由基等。
ROS要么在正常细胞过程中通过ROS生成酶作为中间体产生,要么在药物、毒素和辐射等外源性因素存在下产生。
神经组织更容易产生ROS
与其他器官相比,神经组织因其高代谢率而更容易产生ROS。
线粒体,作为细胞的能量工厂,同时也是ROS生成的主要场所。在ATP生成的过程中,线粒体可能会产生超氧化物,这些超氧化物随后被转化为H2O2和O2。O2的量越多,超氧化物的形成越多,这进一步导致更多的 ROS,如 H2O2和羟基自由基等。
线粒体与神经元活动的紧密联系
线粒体 ROS 的产生与神经元活动密切相关。强烈的突触传递不仅能促进超氧化物的产生,而且这种产生还受到细胞内钙(Ca2+)水平的调节,线粒体 ROS 产生的增加也与线粒体膜电位的增加有关。
单胺氧化酶(MAO)与神经健康
线粒体外膜上有一种酶,叫单胺氧化酶(MAO),它在神经细胞的发育和功能中起着关键作用。MAO通过催化单胺的氧化脱氨,产生H2O2作为副产物,这在神经退行性疾病中可能起到重要作用。
注:MAO-A 主要存在于儿茶酚胺能神经元中,参与去甲肾上腺素和血清素的氧化,而 MAO-B 则特别表达于血清素能神经元和神经胶质细胞中,并氧化 β-苯乙胺。
一氧化氮合酶(NOS):神经信号与氧化应激的交汇点
一氧化氮合酶(NOS)是神经元中产生ROS的酶,也是脑内ROS的来源之一。它通过催化L-精氨酸的氧化,产生一氧化氮(NO),NO在调节突触传递和干扰氧化还原稳态中起着双重作用。
NADPH氧化酶(NOX):神经元活动的响应者
NADPH氧化酶(NOX)是另一种在神经组织中产生ROS的酶,也是脑内ROS的来源之一,在脑皮质和海马区域丰富。它在神经元活动中的作用表明,NOX可能参与了多种中枢神经系统疾病的进展,包括AD、PD、肌萎缩侧索硬化症 (ALS) 和亨廷顿氏病 (HD)等。
注:Ca2+是 NOX 的主要激活剂,导致酶复合物在神经元中定位于突触后,从而表明NOX 参与神经元活动。已报道 7 种 NOX 的同源物,即 NOX (1-5)、双氧化酶 DUOX (1 和 2),它们的大小和结构域不同,但主要参与 ROS 的生成。
先前的报道还揭示了线粒体 ROS 和 NOX-ROS 之间的协同关系,从而支持彼此的 ROS 生成。
因此,开发异构体选择性 NOX 抑制剂可能是治疗急性和慢性中枢神经系统疾病的一种有前途的治疗方法。
其他产ROS的酶
在细胞质中,非血红素铁酶(如脂氧合酶)在分子O2存在下催化花生四烯酸的过氧化,并产生超氧化物和羟基自由基。
细胞质中的许多其他酶,如黄嘌呤氧化酶、细胞色素 P450 单加氧酶、环氧酶、D-氨基氧化酶也是重要的ROS 产生者。
氧化应激通过介导脂质过氧化、蛋白质氧化和核酸损伤三种主要反应导致细胞损伤。
事实上,氧化应激是衰老过程中正常生理过程的一部分,但已知它与大脑慢性疾病有关,如阿尔茨海默病 (AD)、帕金森病 (PD)、HD、缺血性中风、抑郁症和硬化症。此外,它在生活方式相关的代谢紊乱中也起着重要作用,如 2 型糖尿病 (T2D)、非酒精性脂肪肝、非酒精性脂肪性肝炎、肥胖、心血管疾病和癌症。
Tips:生理状态下正常浓度ROS在脑中的作用
虽然高浓度的ROS是有害的,会导致生物分子损伤,从而引起多种细胞功能障碍,但在安全稳定的水平上,ROS其实是细胞生理功能中不可或缺的助手。
详情展开如下:
免疫反应的哨兵
在正常生理条件下,细胞外的ROS是先天免疫系统的得力助手,它们能够引发免疫反应,帮助身体抵御外来的感染。
细胞信号的激活者
细胞内产生的ROS也是信号通路的激活者,它们参与刺激细胞凋亡和增强细胞对氧化应激的防御能力。
NF-κB的触发器
ROS在激活核转录因子NF-κB方面扮演着重要角色,这一过程会引发炎症反应,进而可能引发氧化应激。
病原体的克星
次氯酸(HOCl)这样的自由基,由髓过氧化物酶在溶酶体中作用产生,是一种对抗病原体的强大氧化剂。
中枢神经系统的调控者
对于中枢神经系统,生理条件下许多反应产生的副产物ROS,不仅是细胞内信号转导途径的调节者,还参与调控细胞的增殖、分化和成熟。
促进神经发生
研究表明,ROS的产生和氧化还原平衡有助于前体神经元祖细胞向神经元的分化,以及轴突的形成,促进神经元在其微环境中的扩增。
影响信号级联
氧化还原信号,包括ROS,能够调节多种转录因子和信号分子的功能,影响神经发生的信号级联。
神经元兴奋性的调节者
ROS,如H2O2,能通过增强细胞内钙(Ca2+)信号来调节皮质神经元的兴奋性。
影响神经系统信号级联
氧化还原信号(ROS和氧化状态)还调节转录因子(如NF-κB)、活化T细胞的核因子和活化蛋白1(AP-1)以及酪氨酸磷酸化蛋白PKC的氧化还原状态的功能。
研究人员观察到 H2O2可增加皮质神经元和 PC12 细胞中 ERK 和 cAMP 反应元件结合蛋白 (CREB) 的磷酸化。
参与学习和记忆
ROS 在大脑的不同部位(如海马、大脑皮层、下丘脑、杏仁核和脊髓)充当第二信使,海马中的长期增强(LTP)被证实是必不可少的,而海马与哺乳动物的学习和记忆有关,因此表明 ROS 参与了突触增强。
参与疼痛调节
ROS还通过参与增加杏仁核中央核的兴奋性来影响疼痛相关行为,杏仁核是大脑中负责疼痛调节情绪方面的区域。同样,在脊髓中,与神经性疼痛和炎症疼痛相关的神经可塑性过程也受 ROS 作为信号分子的控制。
ROS在细胞生理中的作用是复杂而精细的。它们既是细胞健康的守护者,也是潜在的挑战者。了解ROS如何在不同生理条件下发挥作用,对于我们理解健康和疾病的机制至关重要。
(为何大脑更容易积累过量ROS,清除机制vs产生机制)
我们将从以下方面来阐述大脑易受氧化应激影响的因素:
Ca2+在神经细胞中的作用:在神经细胞中,动作电位引起的Ca2+瞬变对于维持神经元之间的连接强度(即双向突触可塑性)至关重要。
Ca2+稳态失调的影响:当细胞膜上的Ca2+通道功能受损,导致Ca2+流入过多时,细胞内的游离Ca2+浓度会异常增加。
激活有害酶类:这种高浓度的Ca2+会激活一些有害的酶,如神经一氧化氮合酶(NOS)、磷脂酶A2和钙蛋白,这些酶的活性增加可能导致细胞骨架的破坏。
NO的产生及其影响:NOS的激活会产生一氧化氮(NO),NO是一种信号分子,但高浓度时会对细胞产生负面影响。NO会与线粒体内的细胞色素C氧化酶结合,抑制线粒体的呼吸作用,影响能量产生。
形成有害物质:NO还可以与超氧阴离子(O2.– )反应生成过氧亚硝酸盐(ONOO–),这是一种强氧化剂,可以对细胞造成进一步的损害。
线粒体功能障碍:线粒体内的Ca2+超载会导致线粒体通透性转换孔(MPTP)开放,使得Ca2+和H2O2流出,这可能导致细胞坏死。
大脑易受氧化应激:由于上述过程,Ca2+的稳态失调会使大脑细胞更容易受到氧化应激的影响,氧化应激是指细胞内氧化剂和抗氧化剂之间的不平衡,可能导致细胞损伤。
谷氨酸的兴奋性作用:谷氨酸是一种主要的兴奋性神经递质,它在神经元之间的信号传递中起着关键作用。然而,当谷氨酸在细胞外环境中大量积累时,它可能导致神经细胞的损伤甚至死亡。
谷氨酸的毒性作用:谷氨酸的过量积累可以激活神经元上的谷氨酸受体,尤其是AMPA和NMDA受体。这些受体的激活会导致细胞内Ca2+和Na+的持续流入,引发所谓的“兴奋性毒性”。
注:AMPA和NMDA是两种类型的谷氨酸受体,它们在神经元之间的信号传递中起着关键作用。这些受体是离子通道受体,意味着它们不仅能够结合神经递质谷氨酸,还能够控制特定离子的流动,从而影响神经细胞的电活动。
AMPA受体:AMPA受体(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体)是快速兴奋性突触后电流的主要介质。当谷氨酸结合到AMPA受体时,受体通道打开,允许Na+和K+离子通过,导致突触后膜的去极化,这是神经信号传递的一个重要步骤。AMPA受体的激活通常与快速的、短暂的信号传递相关。
NMDA受体:NMDA受体(N-甲基-D-天冬氨酸受体)是另一种类型的谷氨酸受体,它们在学习和记忆中起着重要作用。NMDA受体通道的开放需要谷氨酸的结合以及突触后膜的去极化(通常由AMPA受体的激活引起)。NMDA受体通道开放时,允许Ca2+和Na+离子进入细胞,同时也允许K+离子流出。Ca2+的流入可以激活多种细胞内信号途径,包括那些涉及长期增强(LTP)和长期抑制(LTD)的途径,这些都是学习和记忆的关键机制。
这两种受体在神经传递中的协同作用对于正常的脑功能至关重要,包括感知、运动控制、学习和记忆。然而,当这些受体过度激活时,它们也可能参与神经退行性疾病和神经损伤的过程,如兴奋性毒性。
反应性物质的形成:细胞内Ca2+的增加可以激活NOS,产生一氧化氮(NO),NO与超氧阴离子(O2–)反应生成过氧亚硝酸盐(ONOO–)。ONOO–是一种强氧化剂,可以对细胞造成损害。
谷氨酸合成酶的抑制:ONOO–等反应性物质可以使谷氨酸合成酶失活,这种酶负责将谷氨酸转化为谷氨酰胺,从而抑制了谷氨酸的代谢。
谷氨酸与半胱氨酸的交换受阻:谷氨酸还可以通过Xc-载体抑制细胞内谷氨酸与半胱氨酸的交换。半胱氨酸是合成谷胱甘肽(GSH)的关键成分。
主编解读:在细胞内,氨基酸不仅是蛋白质的构建块,还参与多种生物化学反应。谷氨酸(Glutamate)和半胱氨酸(Cysteine)是两种重要的氨基酸,它们在细胞内的水平受到严格调控。
谷氨酸与半胱氨酸的交换通常通过特定的转运蛋白(载体)进行,这些转运蛋白位于细胞膜上,负责将氨基酸从细胞外环境转运到细胞内。这种交换是双向的,意味着谷氨酸可以从细胞内转运到细胞外,同时半胱氨酸可以从细胞外转运到细胞内。
半胱氨酸是合成谷胱甘肽(Glutathione, GSH)的关键前体。谷胱甘肽是一种重要的抗氧化剂,对于保护细胞免受氧化应激的损害至关重要。因此,半胱氨酸的供应对于维持细胞内GSH的水平和细胞的抗氧化能力非常重要。
当谷氨酸与半胱氨酸的交换受阻时,意味着这种双向转运过程受到了干扰。这可能是由于转运蛋白的功能障碍、细胞外谷氨酸水平的异常升高(如在兴奋性毒性情况下),或者其他因素导致的细胞膜通透性的改变。
这种交换受阻可能导致细胞内半胱氨酸的供应不足,进而影响GSH的合成。GSH的减少会使细胞更容易受到氧化应激的影响,可能导致细胞损伤或死亡。在某些情况下,这种交换受阻还可能与特定的疾病状态或病理过程相关。
谷胱甘肽的耗竭与铁死亡:由于谷氨酸与半胱氨酸的交换受阻,导致细胞内GSH的耗竭。GSH的减少会使细胞更容易受到氧化应激的影响,并可能导致一种称为“铁死亡”的细胞死亡形式,这是一种由铁依赖的脂质过氧化驱动的细胞死亡。
总结来说,谷氨酸的过量积累通过激活神经元上的受体,导致细胞内Ca2+和Na+的持续流入,进而引发一系列的生物化学反应,包括反应性物质的形成、谷氨酸代谢的抑制、GSH的耗竭,最终可能导致神经元的损伤和死亡。这些过程表明,谷氨酸的稳态对于维持神经细胞的健康至关重要。
扩展阅读:
过渡金属离子,如铁(Fe2+)和铜(Cu+),在大脑中扮演着多重角色。它们不仅是许多酶的辅因子,参与能量代谢、抗氧化防御和神经递质的合成等多种生物化学过程,而且还与神经退行性疾病和脑损伤有关。
酶的辅因子:Fe2+和Cu+等过渡金属离子是许多酶的必要组成部分,这些酶参与细胞内的各种代谢过程。例如,铁是细胞色素c氧化酶和铁硫蛋白的组成部分,而铜是细胞色素c氧化酶和超氧化物歧化酶的组成部分。
自由基反应的催化剂:在某些情况下,过渡金属离子可以催化自由基反应,这些反应可以产生有害的氧化剂,如羟自由基(·OH)。自由基是不稳定的分子,它们可以损害细胞结构,包括脂质、蛋白质和DNA。
铁的持久存在:大脑中的铁主要以Fe2+的形式存在,它在脑脊液中的结合能力较低,这意味着铁离子可以在脑脊液中相对自由地移动,并且可能积累在某些区域。铁的积累与氧化应激和神经退行性疾病(如阿尔茨海默病和帕金森病)有关。
脑损伤的应激因素:在脑损伤或疾病状态下,细胞可能会释放更多的过渡金属离子。这些离子在细胞外环境中可能催化自由基的产生,导致进一步的细胞损伤。
总结来说,过渡金属离子在大脑中的正常功能对于维持神经细胞的健康至关重要。然而,当这些离子在细胞外环境中过度积累或以不适当的形式存在时,它们可能成为氧化应激和细胞损伤的催化剂。因此,维持大脑中过渡金属离子的稳态对于预防神经退行性疾病和脑损伤具有重要意义。
神经递质的自动氧化:多巴胺、5-羟色胺和去甲肾上腺素等神经递质在有氧条件下可以发生自动氧化反应。这些反应涉及神经递质与氧气之间的化学反应,产生活性氧(ROS),如超氧阴离子(O2–)和羟自由基(·OH)。
多巴胺的自动氧化过程:多巴胺与氧气反应首先生成半醌(一种不稳定的中间产物)和超氧阴离子(O2–)。半醌可以进一步与氧气反应生成醌。醌是一种氧化产物,它可以被氧气重新氧化为醌醇和过氧化氢(H2O2)。
线粒体和溶酶体功能障碍:ROS的积累可以导致线粒体和溶酶体的功能障碍。线粒体是细胞的能量工厂,而溶酶体是细胞的“消化系统”,负责分解和回收细胞内的废物。这些细胞器的功能障碍可能导致细胞能量代谢的紊乱和细胞内废物的积累。
总结来说,神经递质的自动氧化是一个产生ROS的过程,这些ROS可以对细胞造成损害,特别是通过损害线粒体和溶酶体的功能。这种损害可能与多种神经退行性疾病有关,包括帕金森病和阿尔茨海默病。因此,控制神经递质的自动氧化和ROS的产生对于维持神经细胞的健康至关重要。
大脑对葡萄糖的依赖:大脑是身体中对葡萄糖依赖性最高的器官之一。葡萄糖不仅是大脑的主要能量来源,还参与多种代谢途径和信号传导过程。
糖醇磷酸途径:糖醇磷酸途径(Glycolysis)是葡萄糖分解代谢的第一步,产生能量和中间代谢产物。磷酸果糖激酶(Phosphofructokinase, PFK)是糖醇磷酸途径中的一个关键酶,它控制着糖酵解的速率。
神经元降解磷酸果糖激酶:在某些情况下,神经元可能会降解磷酸果糖激酶,这可能导致糖酵解速率的降低。糖酵解速率的降低意味着葡萄糖的利用效率下降。
蛋白质糖基化和AGE的形成:糖酵解速率的降低可能导致葡萄糖在细胞内的积累。过量的葡萄糖可以非酶促地与蛋白质发生反应,形成糖基化产物,最终生成高级糖基化终产物(Advanced Glycation End Products, AGE)。
AGE的损害作用:AGE可以与细胞内的AGE受体结合,引发炎症反应和氧化应激。这种氧化应激可以损害蛋白质和线粒体的功能。线粒体是细胞的能量工厂,其功能障碍可能导致细胞能量代谢的紊乱。
炎症性氧化应激:AGE诱导的炎症性氧化应激可能导致细胞内氧化剂和抗氧化剂之间的不平衡,进一步加剧细胞损伤。
Tips:以上总结就是葡萄糖诱导的氧化应激涉及糖酵解速率的降低、蛋白质糖基化和AGE的形成,以及由此引发的炎症性氧化应激。这些过程可能导致蛋白质和线粒体功能的损害,从而影响神经细胞的健康。因此,维持适当的糖酵解速率和控制AGE的形成对于预防神经退行性疾病和脑损伤具有重要意义。
大脑中的多不饱和脂肪酸:大脑富含多不饱和脂肪酸,特别是二十碳五烯酸(Docosahexaenoic Acid, DHA)。DHA是构成神经细胞膜的重要成分,对于维持神经细胞的结构和功能至关重要。
氧化应激的影响:多不饱和脂肪酸由于其化学结构中的多个双键,容易受到氧化应激的影响。氧化应激可以引发脂质过氧化反应,导致脂肪酸的氧化和损伤。
脂质过氧化和信号传导:脂质过氧化产物可以参与脑部的信号传导过程。然而,这些过氧化产物也可能对神经细胞产生负面影响,包括细胞膜的损伤和细胞功能的紊乱。
4-羟基壬酸醛的神经毒性:脂质过氧化产物之一,4-羟基壬酸醛(4-Hydroxynonenal, 4-HNE),可以通过提高细胞内Ca2+水平使谷氨酸转运体失活,从而具有神经毒性。谷氨酸转运体的失活可能导致谷氨酸的积累,引发兴奋性毒性。
α-酮戊二酸脱氢酶的失活:脂质过氧化物还可以使α-酮戊二酸脱氢酶(α-Ketoglutarate Dehydrogenase)失活,这是一种参与三羧酸循环(TCA循环)的酶。该酶的失活可能导致能量代谢的紊乱。
血管收缩作用和蛋白酶体的破坏:脂质过氧化物具有血管收缩作用,可能导致脑血流的减少。此外,它们还可以破坏蛋白酶体,这是一种负责蛋白质降解的细胞器,其功能障碍可能导致细胞内废物的积累。
脂质过氧化物在多种神经退行性疾病,如阿尔茨海默病中起着持续的作用。这些疾病的特点是神经细胞的进行性损伤和死亡。
大脑中多不饱和脂肪酸的易感性使得神经细胞更容易受到氧化应激的影响。脂质过氧化产物如4-HNE可以通过多种机制对神经细胞产生负面影响,包括神经毒性、能量代谢的紊乱、血管收缩和蛋白酶体的破坏。这些过程可能与神经退行性疾病的病理机制有关。
微胶质细胞的角色:微胶质细胞(Microglia)是大脑和脊髓中的常驻免疫细胞,它们在维持大脑的正常功能和发育中起着关键作用。微胶质细胞参与多种生理过程,包括神经保护、突触修剪、炎症反应和组织修复。
吞噬活动和反应性物质的产生:在正常的吞噬活动中,微胶质细胞可以清除死亡的细胞碎片和外来的病原体。在这个过程中,微胶质细胞产生超氧阴离子(O2–)和其他反应性物质,这些物质在清除病原体和受损细胞中起着重要作用。
NOX-2酶的作用:NOX-2(NADPH氧化酶2)是一种酶,它在微胶质细胞中产生O2–。NOX-2的激活可以增加O2–的产生,这是微胶质细胞应对损伤和感染的一种防御机制。
氧气生物可用性与微胶质细胞活性:微胶质细胞的活性取决于总的氧气生物可用性。在损伤或疾病状态下,微胶质细胞可能通过消耗更多的氧气来产生更多的O2–,这可能导致局部氧浓度的降低。
反应性物质与突触损伤:H2O2和NO等反应性物质在损伤部位吸引微胶质细胞,这些物质可以引发局部炎症反应。炎症反应可能导致突触的损伤,这是神经退行性疾病中的一个关键过程。
神经退行性的推动:微胶质细胞的过度激活和炎症反应可能推动神经退行性过程。在某些情况下,微胶质细胞的持续激活可能导致神经细胞的损伤和死亡,这是多种神经退行性疾病的共同特征。
一句话总结就是微胶质细胞在大脑中扮演着多重角色,包括免疫防御、吞噬活动和炎症反应。然而,微胶质细胞的过度激活和炎症反应可能导致神经细胞的损伤和神经退行性疾病的进展。因此,平衡微胶质细胞的活性对于维持大脑健康和预防神经退行性疾病至关重要。
大脑抗氧化防御系统的脆弱性:大脑是一个高代谢活跃的器官,对氧气的需求很高,因此容易受到氧化应激的影响。与其他组织相比,大脑的抗氧化防御系统相对较弱,这使得大脑更容易出现氧化还原稳态的紊乱。
过氧化氢酶的含量:过氧化氢酶(Catalase)是一种重要的抗氧化酶,它能够分解过氧化氢(H2O2)为水和氧气。神经元中的过氧化氢酶含量比肝细胞中的低得多,这可能是因为神经元对H2O2的处理能力较弱。
过氧化物酶体的限制:过氧化氢酶主要存在于过氧化物酶体中,这是一种细胞器,专门负责处理过氧化氢和其他有害物质。然而,过氧化物酶体的存在限制了过氧化氢酶的活性,使其无法作用于其他亚细胞区室(如线粒体和细胞质)产生的H2O2。
谷胱甘肽的含量:谷胱甘肽(Glutathione, GSH)是一种重要的细胞内抗氧化剂,它能够清除自由基并参与亲电子物质的代谢。神经元中的GSH含量非常低,这使得它们更容易受到氧化应激的影响,并且难以代谢亲电子物质。
铁死亡的风险:铁死亡是一种由铁依赖的脂质过氧化驱动的细胞死亡形式。神经元中GSH的低含量可能增加它们发生铁死亡的风险,这是一种与多种神经退行性疾病相关的细胞死亡机制。
总结来说,大脑的抗氧化防御系统相对脆弱,这使得神经元更容易受到氧化应激的影响。过氧化氢酶和谷胱甘肽的低含量限制了神经元处理氧化应激的能力,可能导致氧化还原稳态的紊乱和细胞损伤。
血红蛋白与H2O2的反应:血红蛋白(Hemoglobin)是红细胞中的一种蛋白质,负责携带氧气。当血红蛋白与过量的过氧化氢(H2O2)反应时,它可以释放出铁离子(Fe2+)和血红素(Heme)。这些产物可以参与进一步的化学反应,产生有害的过氧化物。
血红蛋白的氧化:在氧化应激条件下,血红蛋白可以被过氧化氢(H2O2)或其他氧化剂氧化。这种氧化过程可以破坏血红蛋白的结构,导致其携氧能力下降。
铁离子的释放:血红蛋白的氧化可以导致铁离子(Fe2+)从血红蛋白中释放出来。这些游离的铁离子可以参与Fenton反应,即铁离子与H2O2反应生成羟自由基(·OH)。羟自由基是一种强氧化剂,可以对细胞造成广泛损害。
血红素的释放:血红蛋白的氧化还可以导致血红素的释放。血红素是一种铁卟啉化合物,它是血红蛋白的活性部分。血红素可以催化脂质过氧化反应,导致细胞膜的损伤。
脂质过氧化:血红素可以催化不饱和脂肪酸的过氧化反应,生成脂质过氧化物。这些过氧化物可以进一步分解产生更多的自由基,加剧氧化应激。
血管收缩:血红素还可以与一氧化氮(NO)结合,形成复合物。这种复合物可能导致血管收缩,影响脑血流和氧气供应。
因此,控制血红蛋白与H2O2的反应对于预防神经毒性和维持大脑健康具有重要意义。
CYP2E1(Cytochrome P450 2E1)是一种属于细胞色素 P450 酶家族的酶。细胞色素 P450 酶是一组含有血红素(铁卟啉)的酶,它们在许多生物体内参与多种化合物的氧化代谢。CYP2E1 主要存在于肝脏中,但它也在其他组织中表达,包括大脑。
CYP2E1 的主要功能是催化小分子化合物的氧化反应,包括乙醇、某些药物、致癌物和其他外源性物质。这些反应通常涉及将分子中的氢原子移除,并添加一个氧原子,从而使化合物更容易被进一步代谢或排出体外。
CYP2E1 酶的角色:CYP2E1(Cytochrome P450 2E1)是一种存在于肝脏和其他组织中的酶,包括大脑。它参与多种代谢过程,包括小分子(如乙醇、某些药物和致癌物)的氧化代谢。
电子泄漏与氧化应激:CYP2E1 在催化反应时可能会发生电子泄漏,这意味着在代谢过程中,它可能会产生超氧阴离子(O2–)和其他活性氧(ROS)。这些 ROS 是高度反应性的分子,可以导致氧化应激,即细胞内氧化剂和抗氧化剂之间的不平衡。
大脑中的 CYP2E1:虽然大脑中含有低水平的细胞色素 P450 酶,但 CYP2E1 的存在使得大脑在代谢过程中容易受到氧化应激的影响。大脑中的 CYP2E1 活性可能导致神经细胞的损伤。
饮酒和吸烟的影响:研究表明,CYP2E1 的水平可能会因饮酒和吸烟而增加。这是因为乙醇和其他烟草中的化合物可以诱导 CYP2E1 的表达和活性。CYP2E1 的增加可能导致更多的 ROS 产生,从而加剧氧化应激。
总结来说,DNA 修复酶如 PARP-1 在修复 DNA 损伤中起着关键作用,但它们的过度激活可能导致 NAD+ 的消耗和能量产生的限制,以及可能通过 TRPM2 通道导致细胞内 Ca2+ 浓度的增加,从而导致神经元细胞死亡。
DNA 修复酶的角色:DNA 修复酶是一类酶,它们在细胞内负责修复 DNA 分子的损伤。这些损伤可能由多种因素引起,包括氧化应激、紫外线辐射、化学物质和复制错误。
PARP-1 的功能:聚 ADP 核糖聚合酶 (PARP-1) 是一种重要的 DNA 修复酶。当 DNA 发生单链断裂时,PARP-1 会被激活。它通过裂解烟酰胺腺嘌呤二核苷酸 (NAD+) 并将 ADP 核糖部分转移到核蛋白上,从而启动 DNA 修复过程。
PARP-1 的过度激活:在严重的 DNA 损伤或氧化应激条件下,PARP-1 可能会过度激活。这种过度激活会导致大量的 NAD+ 消耗,因为 NAD+ 是 PARP-1 活性所必需的底物。
因此,平衡 PARP-1 的活性对于维持细胞健康和预防神经退行性疾病具有重要意义。
RNA 的易感性:RNA 是单链分子,不像 DNA 那样有双螺旋结构和组蛋白的保护。因此,RNA 更容易受到氧化应激的影响。氧化应激可以导致 RNA 分子中的核糖和碱基发生氧化损伤。
氧化的 RNA 的影响:氧化的 RNA 可能会阻止核糖体合成蛋白质。核糖体是细胞内的蛋白质合成工厂,它们通过读取 RNA 分子上的遗传信息来合成蛋白质。如果 RNA 被氧化,其结构可能会改变,导致核糖体无法正确读取遗传信息,从而影响蛋白质的合成。
蛋白质合成异常:如果 RNA 的氧化损伤未得到修复,可能会导致合成的蛋白质未折叠或截短。未折叠或截短的蛋白质可能无法正常执行其功能,甚至可能形成有害的蛋白质聚集体,这在多种神经退行性疾病中是一个关键的病理特征。
氧化的 RNA 与氧化还原活性过渡金属(如铁和铜)一起可以催化 Fenton 反应。Fenton 反应是一种产生羟自由基(·OH)的化学反应,羟自由基是一种强氧化剂,可以对细胞造成广泛损害。
此外,超氧化物歧化酶(SOD)是一种重要的抗氧化酶,能够将超如果氧阴离子(O2–)转化为过氧化氢(H2O2)。铜锌超氧化物歧化酶(CuZn-SOD)的 mRNA 被氧化,可能是肌萎缩侧索硬化症(ALS)的临床前征兆。ALS 是一种神经退行性疾病,其特点是运动神经元的进行性退化和死亡。
注意,尽管神经退行性疾病中氧化的 RNA 在神经退行性疾病中的作用已经引起了关注,但其确切的作用机制和重要性仍需要进一步的研究。
胃肠道 (GI) 包含数万亿共生微生物和约 200-2000左右个物种,它们在维持膜屏障功能方面发挥着重要作用。这些微生物是肠道内的永久居民,参与宿主生物体内分子的不断流动,从而调节各种代谢功能。
人在出生后两年内,宿主胃肠道中的微生物群就会稳定下来,但它们的组成因个体而异,并且会根据年龄、健康、遗传和生活方式等外界因素而改变。胃肠道的腔侧暴露于饮食成分和肠道微生物群,此外,70% 的免疫细胞位于肠道组织,并由连接肠道和大脑的神经元支配,涉及肠道和大脑之间的持续沟通。
肠道微生物群与大脑之间的沟通主要涉及四条途径;
1、神经高速公路——迷走神经
第一种重要模式包括激活迷走神经,迷走神经连接胃肠道的肌肉层和粘膜层与脑干。最近研究显示,肠道病原体和益生菌通过激活迷走神经元改变大脑中的 γ-氨基丁酸 (GABA)、色氨酸、催产素和脑源性神经营养因子 (BDNF) 信号,从而调节宿主的焦虑、进食和抑郁等行为。
2、肠嗜铬细胞释放的血清素影响大脑
直接或间接影响大脑活动的通讯途径涉及通过肠道内壁的肠嗜铬细胞 (EC) 释放的血清素发出信号。一项研究表明,在用益生菌双歧杆菌治疗抑郁症小鼠模型时,其血清素和血清素前体水平会增加,从而改善其抑郁状态。同样,据报道,产芽孢细菌(梭菌属)的代谢物能够刺激 EC 产生血清素。
3、肠道菌群通过小胶质细胞介导对神经系统的调节
肠道菌群在小胶质细胞的发育、成熟和激活中起着至关重要的作用。在一项研究中,据报道,无菌 (GF) 小鼠携带的未成熟小胶质细胞数量比传统小鼠多,而且用双歧杆菌治疗时,可通过转录激活小胶质细胞。在行为和神经退行性疾病 (NDD) 中观察到小胶质细胞功能的变化,表明肠道微生物群通过小胶质细胞介导对 NDD 的影响。肠道微生物群还通过全身免疫系统(即细胞因子和趋化因子)影响神经系统。研究表明,与传统小鼠相比,GF 小鼠的血脑屏障 (BBB) 通透性更大,因此大脑更容易接触微生物产物,进而导致神经病理学状况。
4、肠道菌群传递化学信号
肠道微生物群通过直接向大脑传递化学信号进行交流。例如,肠道细菌发酵膳食纤维会产生短链脂肪酸 (SCFA),已被证明可以调节中枢神经系统的神经可塑性,还可以改善小鼠的抑郁行为。此外,肠道微生物群如拟杆菌、双歧杆菌、副拟杆菌、大肠杆菌属。能够产生神经递质 GABA,这表明肠道微生物群调节宿主生物体神经递质的浓度。
人体肠道内定植着四种主要的共生菌门,包括厚壁菌门、拟杆菌门、放线菌门、变形菌门。肠道中的共生菌和致病菌都能通过调节线粒体活性来改变细胞的 ROS。
共生菌产生甲酰化肽,这些肽与巨噬细胞和中性粒细胞上的 G 蛋白偶联受体 (GPCR) 结合,从而引发上皮细胞炎症。该过程导致 NOX-1 产生超氧化物,从而增加细胞的 ROS。
肠道乳酸杆菌和双歧杆菌具有将硝酸盐和亚硝酸盐转化为 NO 的能力,使肠道上皮成为 NO 的丰富来源。类似地,链球菌和杆菌利用 NOS 从 L-精氨酸产生 NO。
低浓度NO→保护;高浓度NO→有害
纳摩尔浓度的 NO 具有神经保护作用,是去甲肾上腺素能、非胆碱能肠道神经元的神经递质。而在较高浓度下,它会导致产生活性氧和氮物质 (RONS)(如超氧化物和 H2O2)而引起的有害影响,这进一步形成高活性羟基自由基,使其与神经炎症、轴突变性和神经退行性疾病相关。
肠道细菌产生的有益代谢物(如 SCFA)有助于通过影响线粒体活动来降低 ROS。这个后面章节详细讨论。
MAMPs维持微生物结构功能,影响大脑发育与炎症反应
膜相关分子模式 (MAMP) 维持着所有微生物类别的结构完整性和基本功能,甚至大脑也能检测到。这些是不同的化学基团,包括肽、核苷酸、碳水化合物和脂质。当宿主无法检测到此类分子模式时,它可能伴有急性到慢性炎症,并被发现会改变大脑的发育和功能。这些高度保守的结构基序与先天免疫系统细胞上的模式识别受体 (PRR) 结合,从而诱导线粒体 ROS 的产生和 NF-κB 通路的激活,导致炎症反应,引起神经元应激和细胞死亡。
在最近的一项研究中,据报道,细菌细胞壁成分肽聚糖易位到发育中的大脑,影响基因表达并导致社会行为的改变。同样,革兰氏阴性细菌细胞壁中的脂多糖被发现会损害小鼠的胎儿大脑发育、急性抑郁和认知障碍。此外,在 PD、自闭症谱系障碍 (ASD) 和突触核蛋白病模型中,急性和慢性暴露于 MAMP 是导致疾病症状的一个因素。
机会性病原体产生的细菌毒素,也对神经系统产生负面影响
发现梭菌属(Clostridium )产生的致命毒素,如毒素 B、肠毒素和ε 毒素,可降低神经元活力,并通过破坏的 BBB到达大脑,抑制神经递质的释放。
葡萄球菌属(Staphylococcus)和芽孢杆菌属(Bacillus)产生的肠毒素和麦芽孢杆菌素可通过刺激迷走神经引起呕吐和疾病行为。
沙门氏菌和大肠杆菌等致病菌能够降解含硫氨基酸,从而在肠道中产生硫化氢 (H2S) 。H2S水平的升高会引起各种代谢活动的变化,如乳酸增加和ATP生成减少、环氧合酶2 (COX-2)活性抑制、线粒体对O2的消耗减少、促炎细胞因子表达增加,并且已知会刺激高血压和神经炎症。
肠道菌群介导的氧化应激在神经退行性病变中的作用
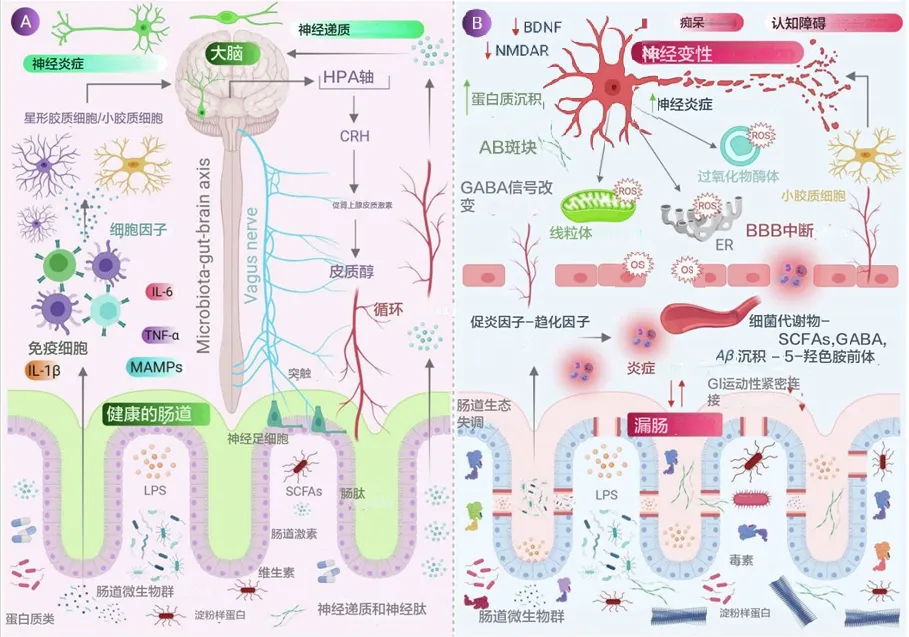
doi: 10.1016/j.jare.2021.09.005
神经退行性疾病(如阿尔茨海默病和帕金森病)的病因病理涉及神经细胞内蛋白质错误折叠及其聚集,氧化应激也被认为是其病理因素之一。发现帕金森患者的肠道中肌间神经丛(Auerbach丛)和粘膜下神经丛(Meissner丛)存在α-突触核蛋白的聚集,暗示了肠道菌群在启动肠道α-突触核蛋白聚集中的作用,然后通过跨突触途径向上影响中枢神经系统神经元导致神经退行性变化。
阿尔茨海默病:全球性的健康挑战
阿尔茨海默病 (AD) 是导致痴呆的主要原因,影响着全球超过 5000 万人口,其中老年人群的发病率更高,85 岁以上每 1000 人中约有 80 人患有该病。阿尔茨海默病的无症状病理学在记忆力减退和认知障碍等症状出现前约20年就开始了。
病理变化:蛋白质的异常积累
与阿尔茨海默相关的脑病理变化包括蛋白质淀粉样β蛋白 (Aβ-淀粉样斑块) 的细胞外积累和 tau 蛋白 (tau 缠结) 的细胞内积累。这种异常的蛋白质积累导致小胶质细胞被激活以清除 Aβ 和 tau 蛋白,但随着随后的衰老,会发生慢性炎症,引起神经元细胞死亡,从而导致萎缩。
氧化应激:阿尔茨海默的潜在危险因素
在可能的危险因素中,氧化应激和肠道微生物群的作用引起了科学界的关注,并被认为是神经退行性过程的直接可能后果。
许多研究表明,阿尔茨海默病患者大脑的抗氧化防御系统发生了变化,即超氧化物歧化酶和过氧化氢酶的活性和水平降低。同时,氧化应激生物标志物(如丙二醛、4-羟基壬烯醛和F2-异前列腺素、蛋白质羰基、3-硝基酪氨酸、8-羟基脱氧鸟苷)在血液和脑脊液中含量较高,这些物质的浓度与认知障碍和脑重量成正比。
阿尔茨海默症脑内ROS的产生还表现为细胞器功能障碍,如线粒体(细胞色素C氧化酶缺乏)、未折叠蛋白反应 (UPR) 引起的内质网、神经斑块中金属离子的积累以及小胶质细胞的过度活化和随后的NADPH氧化酶的过度表达。
Aβ沉积和氧化应激之间也存在相互关系
即Aβ聚集会诱导氧化应激(也存在于线粒体、内质网和高尔基体等细胞器中),而氧化应激会诱导Aβ积累。甚至,神经元中tau蛋白的聚集会导致NADH-泛醌还原酶活性降低,从而导致ROS生成增加和线粒体功能障碍。
肠道菌群失调→炎症→神经退行性病变
最近的事实和数据显示,阿尔茨海默不仅是局限性脑炎症的结果,也是外周炎症的结果。肠道菌群失调会导致炎症,而炎症会随着年龄的增长而增加,血脑屏障被破坏,免疫系统被激活,随后出现神经退行性病变,另一方面,健康均衡的肠道有助于减少 ROS 产生的有害影响。
共生菌减少,致病菌增加
已发现患有阿尔茨海默的个体体内共生菌如双歧杆菌和厚壁菌数量减少,大肠杆菌、志贺氏菌和拟杆菌数量增加,随后出现炎症和 Aβ 积累增加。
肠道菌群变化与阿尔茨海默病严重程度的关联
同样,在 APP/PS1 小鼠模型中,当用广谱抗生素联合治疗时,Aβ 斑块形成也减少。5xFAD 小鼠阿尔茨海默模型显示微生物群向促炎物种转变,同时氨基酸分解代谢也发生变化,相反,抗生素治疗可逆转这种影响,这表明疾病的严重程度和肠道菌群转化之间可能存在联系。
Toll样受体激活与肠道屏障紊乱
肠道中形成的微生物淀粉样蛋白激活 Toll 样受体 (TLR),分化簇 14 (CD14) 促进免疫反应,导致被忽视的错误折叠 Aβ 和 Aβ 清除受损,随后细胞因子产生增加,导致肠道和血脑屏障紊乱。此外,研究还表明,阿尔茨海默患者的肠道激素水平下降,相反,肠道微生物代谢物如 H2S 和三甲胺增加。
与年龄有关的肠道微生物多样性下降
研究表明,随着年龄的增长,双歧杆菌属减少,变形菌增加,痴呆症不是由于 SCFA 减少而是由于脂质代谢受到干扰。双歧杆菌在调节胆固醇水平方面发挥着重要作用,直接促进胆固醇通过粪便排出,间接通过增加血清瘦素水平,从而参与维持海马可塑性和记忆功能。
肠道菌群影响神经递质
肠道细菌如乳酸杆菌和双歧杆菌会代谢抑制性神经递质 GABA。一项研究发现,在 APPSwe/PSEN1DeltaE9 双基因 (人类早老素(DeltaE9)和人鼠淀粉样前蛋白(APPswe)融合体阿尔茨海默小鼠模型中,海马突触可塑性发生了改变,其中发现 GABA 生成减少,同时谷氨酸能神经传递增加。虽然有报道显示蓝藻门太高会产生导致认知障碍的神经毒素,但尚未观察到与阿尔茨海默的关系。
淀粉样蛋白的交叉播种机制
另一个可能的连接环节是脑淀粉样蛋白的积累和肠道微生物群,涉及微生物淀粉样蛋白的交叉播种机制,其方式类似于朊病毒的传播,因此形成的不同淀粉样蛋白构象体在其细胞靶标中诱导不同水平的毒性,推测存在阿尔茨海默表型。
口腔菌群与阿尔茨海默
除了肠道微生物群外,还研究了口腔共生菌与阿尔茨海默之间的联系。有趣的是,口腔卫生不良和牙齿脱落会增加阿尔茨海默早期发病的风险。
关于口腔菌群与神经系统疾病的关联,详见:
帕金森病 (PD) 的病理特征是多巴胺能神经元的进行性退化、磷酸化蛋白 α-突触核蛋白的聚集、过量 ROS 产生、线粒体功能障碍和小胶质细胞活化。其症状特征是患者无法控制自主运动(震颤、肌肉僵硬、行走困难和驼背姿势),这是由于大脑的黑质和纹状体区域受损所致。
它是第二常见的神经退行性疾病 (NDD),影响全球超过 1% 的老年人口。
关于肠道与帕金森病之间的关系的第一份报告出现在1817年詹姆斯·帕金森的一篇关于震颤麻痹的文章中。
注:詹姆斯·帕金森,我们所说的描述帕金森病的这位前辈,全名是“James William Keys Parkinson”。1817年,62岁的James Parkinson发表了论文“An Essay on the Shaking Palsy”,在文中,详细地描述了六例被其称为患有“震颤麻痹”的患者,在论文中他注意到了患者不适,像被无法逃脱的魔鬼所控制。他对这种疾病的描述,很多都被现在的医学观察所承认:不自主震颤的同时还有肌肉乏力,即使在被支撑时也不能缓解;身体前驱,不能刹车,越走越快甚至要小跑起来;感觉和智能几乎不受影响…..
肠道病理与帕金森病的联系
后来的研究支持了这一观点,表明了病理过程是从肠道开始,然后影响大脑。越来越多的证据显示,帕金森病患者常见的特征包括肠道炎症、磷酸化α-突触核的早期积累导致跨过迷走神经的腹背侧运动神经元、便秘问题和肠道通透性增加,这表明了肠道菌群与帕金森病发病机制之间的密切关系。
接受迷走神经切断手术的个体患帕金森病的风险降低,这进一步支持了肠道与PD之间的联系。
氧化应激与神经元损伤
较低水平的谷胱甘肽(GSH)和较高水平的铁和H2O2使黑质致密部 (SNc) 神经元易受氧化应激。而且,该区域的脂质过氧化和多巴胺氧化会导致神经元细胞死亡。研究还表明,线粒体呼吸链功能障碍会导致过量的 ROS 产生。
相关病理与细胞毒性
复合物 1 的抑制剂会对多巴胺神经元产生细胞毒性作用,这一事实也支持了这一观点,患有 α-突触核蛋白、磷酸酶和张力蛋白同源物 (PTEN) 诱导的假定激酶 1 (PINK1) 和 Parkin 病理的患者被检测到患有线粒体功能障碍和氧化应激增加。
异常蛋白聚集与肠道微生物群
与 AD 类似,异常蛋白质 α-突触核蛋白的聚集与氧化应激增加相关,反之亦然。谈到肠道微生物群的作用,一些致病菌会释放毒素,导致肠道和肠神经系统 (ENS)细胞的线粒体功能障碍,从而导致神经退行性。
肠道致病菌及其产物参与发病
帕金森病患者肠道中的致病菌增加及其微生物产物直接参与帕金森病的发病机制。为了支持这一事实,最近有报道称,大肠杆菌会产生一种名为 curli 的淀粉样蛋白,这种蛋白会促进 α-突触核蛋白在肠道和大脑中的聚集,会导致小鼠的运动障碍。
另一方面,当小鼠接受肠道限制性淀粉样蛋白抑制剂治疗时,小鼠的运动功能得到改善,便秘也得到改善,表明肠道与 PD 症状的病因有关。
克罗恩病与帕金森病共病风险高
肠道细菌引起的肠道炎症与 PD 中的进行性神经退行性病变直接相关。虽然 PD 患者的血清代谢谱和肠道成分发生了改变,但研究发现,在严重的 PD 情况下,肠道中的肠杆菌科细菌水平会增强,而抗炎细菌水平却非常低,这也表明它与克罗恩病的肠道炎症具有平行关联。这表明克罗恩病患者患 PD 的风险非常高。
同样,研究发现,在PINK1基因敲除小鼠模型中,柠檬酸杆菌(Citrobacter rodentium)感染会通过诱发肠道炎症加重 PD 症状。
肠道菌群代谢物影响PD药物疗效
除了诱发炎症之外,肠道菌群还会发挥代谢作用,例如,在 PD 患者中,其代谢物 β-葡萄糖醛酸、色氨酸和 SCFA 会发生改变。
肠道菌群的一个显著特性是,它能够通过降低抗 帕金森药物的生物利用度或增加药物失活来降低其疗效,就像在标准左旋多巴治疗中的那样。
H2饱和水对PD症状的改善
在这些研究中,还发现肠道细菌产生H2的减少是导致 PD 的因素之一。
当向患PD大鼠和 MPTP 小鼠模型提供 50% H2饱和水时,发现它能够成功减少黑质中的神经元丢失以及氧化应激标志物,当在人体中进行双盲随机试验时,PD患者的运动评分有所改善。
肠道菌群参与帕金森病的证据
此外,针对这一观点,最近对过表达人类 α-突触核蛋白基因的 GF 小鼠 PD 模型的研究表明,SCFA 水平降低,小胶质细胞活化减少,运动功能改善,这表明肠道菌群直接参与了增强 PD。
当将 PD 患者的肠道菌群移植到无菌α-突触核蛋白过表达的小鼠模型中时,运动症状恶化,表明肠道菌群功能失调在 PD 患者中起着作用。同样,用神经毒素治疗的小鼠模型显示肠道菌群组成发生改变,致病性肠杆菌科细菌水平升高。
一些特定的细菌物种,如奇异变形杆菌(Proteus mirabilis)发现能促进小鼠的神经退行性病变。综合起来,这些研究表明,肠道微生物群加剧了人类和动物帕金森病模型中的神经元功能障碍和神经炎症。
注:奇异变形杆菌(Proteus mirabilis, PM)是革兰阴性细菌,属于肠杆菌科。在自然界中广泛存在,具有特殊的群集运动能力,可促进结石形成,在导管、泌尿系上皮中形成结晶生物膜,是引起感染的重要病原。
创伤性脑损伤 (TBI) 是世界范围内最常见的损伤类型之一,是导致死亡和残疾的主要原因之一。
TBI的广泛影响
TBI 造成的残疾不仅包括脑的原发性机械损伤,还包括损伤后的继发性损伤,这种损伤发生在细胞和分子水平,可能导致代谢异常,如线粒体功能障碍、氧化应激、炎症、小胶质细胞活化、兴奋性毒性,从而造成暂时或终身的认知障碍。TBI 的严重程度不仅集中在大脑上,还可能造成多器官损伤,是一种异质性病理生物学状况。
TBI的治疗现状
由于脑损伤的异质性,针对 TBI 引起的神经病理学的治疗方法仍然缺乏,需要考虑新的治疗方案。针对这一问题,肠道益生疗法因其能够恢复肠道菌群失调和 TBI 之间的双面关系而受到广泛关注。
肠道微生物群与 TBI 损伤之间存在双向关系
TBI 的全身表现之一是肠道蠕动和通透性紊乱、粘膜损伤、肠绒毛组织病理学改变,这表明肠道微生物群组成受到干扰。
最近的报告显示,暴露于轻度反复性脑损伤 20 天的小鼠会逐渐出现白质损伤、认知能力下降和轻度、短暂性的肠道菌群失调。
肠道菌群失调也会影响创伤性中枢神经系统损伤的病理生理、血脑屏障通透性改变和小胶质细胞激活,导致严重后果。
研究发现,在脑损伤之前和之后,小鼠 TBI 模型中的肠道菌群耗尽会导致海马 CA1 区神经元密度增加、联想学习障碍减轻以及病变体积缩小。
TBI中肠道菌群的变化
最近的研究还表明,脊髓创伤后会出现肠道菌群失调,导致椎管内炎症和病变病理。
肠道菌群在TBI恢复中的作用
最近的一项研究指出,在 TBI 之前、期间和之后,广谱抗生素引起的肠道菌群失调会导致神经元丢失增加、神经发生受到抑制以及小胶质细胞和外周免疫反应发生改变,同时恐惧记忆反应也会发生调节。
因此,肠道菌群对 TBI 患者的影响具有至关重要的临床意义,因为 TBI 患者由于定期使用抗生素和长期住院,肠道菌群容易发生改变。此外,检测肠道菌群调节可能为识别 TBI 严重程度提供诊断工具,从而提供有针对性的治疗方法。
中枢神经系统与氧化应激
中枢神经系统极易受到氧化应激的影响,并导致神经系统疾病。由于高 O2需求和过氧化敏感脂质细胞的涌入,中枢神经系统运作期间会产生高水平的 ROS。这种氧化代谢产生活性物质,用于传递氧化还原信号以调节突触可塑性等关键功能。
抗氧化剂(无论是酶促还是非酶促、内源性还是外源性)通过阻止 ROS 的产生或清除自由基或使自由基产物失活来保护大脑免受氧化应激。
抗氧化防御机制
抗氧化酶的作用
抗氧化酶如:SOD通过催化超氧化物歧化为O2和H2O2来降低超氧化物阴离子的浓度;GPx还原H2O2和脂质过氧化物;硫醇特异性过氧化物酶如过氧化物酶减少羟基过氧化物的量,过氧化氢酶将H2O2转化为H2O和普通分子O2。
自由基激活参与抗氧化途径的基因转录,保护细胞免受不利影响。
谷胱甘肽不足可能会限制过氧化物酶的活性,从而使神经元更容易受到氧化应激的影响。
体内和体外研究表明:
重要途径与相关机制
Keap1-Nrf2-ARE 与神经退行性疾病相关的氧化应激防御机制有关,调节 SOD、硫氧还蛋白、过氧化物酶和 GPx 的活性。
NF-κB 是中枢神经系统 (CNS) 中的氧化还原传感器,可由 ROS 激活。
中枢神经系统抗氧化代谢的调节受到严格控制,而肠道微生物的作用是高度动态的。
肠道菌群之间、与宿主等相互作用产生代谢物
肠道菌与菌之间、菌与宿主之间的相互作用通过产生各种代谢物(如可吸收维生素、多酚、SCFA、BDNF、可扩散抗氧化剂和氧化剂气体等)来调节内源性和外源性 ROS 水平。
肠道菌群通过代谢物调节屏障、免疫系统、神经系统
肠道微生物还控制代谢物对血脑屏障的通透性、紧密连接完整性和肠道屏障,调节免疫系统,阻止病原体在肠道定植。副交感神经系统的迷走神经感知肠道代谢物,并将肠道信息传达给中枢神经系统,以产生特定的反应。
肠道菌群与神经系统疾病的关系
在应激条件下,迷走神经张力受到抑制,并由于菌群失调而表现出有害影响,如肠易激综合征 (IBS) 和炎症性肠病 (IBD)。参与 AD 发病机制的 Aβ 蛋白由肠道细菌(如ENS 中的大肠杆菌和肠道沙门氏菌)表达。
有益的肠道微生物还会产生多巴胺、血清素和 GABA。这些是调节 ENS 活性并可能相互关联的中枢神经递质。
肠道菌群管理小胶质细胞,失调引发神经炎症
一些研究表明,肠道微生物管理小胶质细胞的激活和成熟,而激活的小胶质细胞会释放大量诱导型一氧化氮合酶 (iNOS) 来调节 NO 的产生。菌群失调会引发炎症性 iNOS 并导致神经炎症。
我们已经看到肠道菌群的潜在作用以及氧化应激在介导神经元疾病中的重要作用,近年来,开发基于抗氧化剂的疗法来治疗氧化应激诱导的神经退行性疾病的需求日益增长,并且成为科学研究的重点。
抗氧化剂疗法与肠道微生物组的作用
抗氧化剂是能够抵消ROS/RNS诱导的氧化应激的化学或天然物质。尽管已经观察到抗氧化剂对糖尿病、关节炎、白内障和骨质疏松症等疾病的强大治疗作用,但用于中枢神经系统疾病的抗氧化疗法有限,仍然需要深入了解其机制。
肠道微生物组的双重作用
肠道微生物组的作用具有两面性,一方面它负责神经退行性(肠道菌群失调和神经炎症)的基本机制,另一方面,肠道微生物组及其代谢物调节许多相关通路,表明它们具有神经保护治疗作用。
蛋白质、维生素等微生物分子通过多步生物合成途径产生,可能对宿主系统产生有益或有害的影响。因此,通过包括益生元和益生菌在内的适当饮食来维持健康的肠道微生物群是维持神经元健康的先决条件。
肠道菌群代谢物的作用及其对肠道菌群的调节过程在神经退行性疾病(NDDs)中的作用
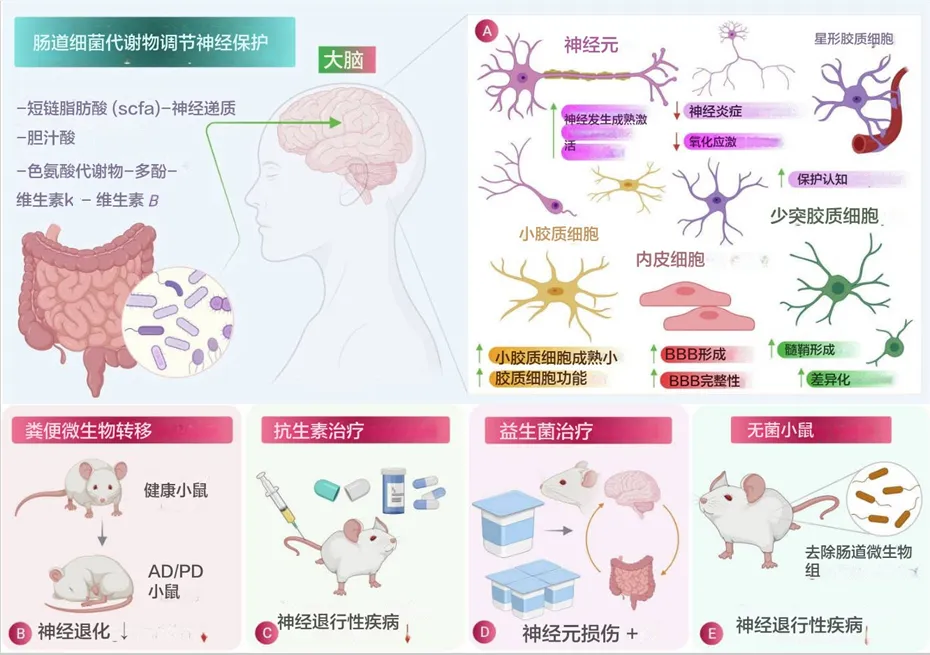
doi: 10.1016/j.jare.2021.09.005
肠道菌群在神经保护中的作用:
(A)肠道菌群释放的有益代谢物在减少炎症和氧化应激方面对脑细胞的特定影响示意图。
(B)粪菌移植 (FMT) 涉及将粪便细菌从健康个体转移到有病理状况的个体,被发现是一种有效的程序,可减少阿尔茨海默病、帕金森病、亨廷顿病和多发性硬化症等神经退行性疾病的病理生理。
(C)和(D)分别使用抗生素治疗和益生菌治疗,它们在减少神经退行性疾病的发病机制方面显示出相当大的效果。
(E)无菌小鼠(没有肠道微生物的小鼠)显示神经退行性疾病的减少,也用于研究肠道微生物对大脑生理的影响,从而显示肠道微生物参与神经退行性疾病。
肠道微生物群在神经保护中的作用

doi: 10.1016/j.jare.2021.09.005
肠道菌群与宿主分子的相互作用
胆汁酸的生成与功能
胆汁酸在肝脏中产生并在肠腔中释放,主要参与脂质和脂溶性维生素的溶解、能量代谢信号传导,并且在脑的生理学和病理生理学中发挥重要作用。
胆汁酸对神经系统的影响
胆汁酸通过直接结合穿过血脑屏障的脑内受体或通过与肠道受体结合间接诱导成纤维细胞生长因子 (FGF) 和胰高血糖素样肽 1 的释放,影响脑不同区域的神经元活动以及迷走神经活动。
胆汁酸的神经保护特性
胆汁酸如熊去氧胆酸 (UDCA) 和牛磺熊去氧胆酸 (TUDCA) 具有神经保护特性且无细胞毒性,这分别在其 III 期临床试验和动物研究中得到证实。最近的数据显示,TUDCA 有助于减弱慢性 PD 小鼠模型中的自噬、α-突触核蛋白聚集和蛋白质氧化。
此外,它还有助于通过Takeda G 蛋白偶联受体 5/sirtuin-3 (TGR5/SIRT-3) 通路防止蛛网膜下腔出血大鼠的神经元凋亡。同样,UDCA 在带电多泡体蛋白 2B (CHMP2B) 内含子 5 额颞叶痴呆模型中表现出神经保护作用。
肠道微生物对胆汁酸的影响
肠腔内的肠道微生物群在脱水酶的作用下将初级胆汁酸(胆酸和鹅去氧胆酸)转化为次级胆汁酸,包括氨基酸与胆汁盐水解酶和其他酶促过程的解离,从而改变它们的核受体结合、溶解度和循环。在人类和小鼠的 AD、PD、ASD多发性硬化症模型中发现了次级胆汁酸水平的变化。
此外,细菌修饰的胆汁酸对 ALS 和中风有神经保护作用。肠道微生物群落的调节可导致胆汁酸水平和性质的变化,这可能是神经退行性或神经保护性的。
胆汁酸在神经保护和疾病治疗中的潜在应用
肠道微生物介导的脱氧胆酸增加会诱导小鼠 EC 中神经递质血清素的释放。胆汁酸代谢物被发现可改善脱髓鞘和减少氧化应激,通过分别作用于少突胶质细胞和小胶质细胞增强其神经保护作用。然而,微生物操纵的胆汁酸的潜在作用和影响尚不清楚,仍有待明确定义。
类固醇激素在大脑发育和功能中的作用
类固醇激素发出的信号对大脑的发育和功能(记忆、决策和性行为)至关重要。类固醇激素在整个身体中循环时,会遇到肠腔内的微生物群。
肠道微生物对类固醇激素的修饰作用
肠道细菌在 β-葡萄糖醛酸酶和 β-葡萄糖苷酶介导的去结合反应中修饰类固醇激素,从而重新激活激素并阻止其排泄。因此,肠道微生物群通过降解和活化途径影响活性和非活性类固醇激素的水平。
肠道微生物与性激素代谢
研究发现,雄激素和雌激素受到肠道微生物群的影响。研究发现,大量肠道细菌能代谢雌激素,雌激素在粪便样本中也会发生氧化还原反应,这表明肠道微生物群发挥了作用。
研究发现,肠道微生物群还具有将睾酮和胆固醇转化为雄激素的能力。受微生物影响的雌激素具有神经保护作用,对小胶质细胞具有抗炎作用。
此外,肠道微生物群落改变会导致雌激素水平降低,从而导致慢性炎症和认知障碍。雌激素分子还会影响少突胶质细胞的分化和髓鞘形成。最近的报告还显示,即使在 MPTP 帕金森病小鼠模型中使用黄体酮治疗也显示出神经保护、抗炎和免疫调节作用,但神经保护作用是始于肠道还是大脑仍不清楚。
肠道菌群与饮食分子的相互作用
膳食氨基酸与肠道微生物代谢
膳食氨基酸也可以被肠道微生物代谢,它们对大脑的影响取决于膳食摄入的类型和频率。虽然肠道微生物编码的氨基酸在宿主体内循环,但影响中枢神经系统的氨基酸是由肠道细菌代谢的膳食氨基酸。
芳香族氨基酸
酪氨酸、色氨酸和苯丙氨酸等芳香族氨基酸被肠道细菌代谢为短链脂肪酸、吲哚衍生物、神经递质、有机酸、胺和氨。
酪氨酸
酪氨酸代谢的最终产物是由酪胺中间体形成两种儿茶酚胺、多巴胺和去甲肾上腺素。体外研究表明,大量肠道细菌可以产生毫摩尔范围内的去甲肾上腺素。最近的报告显示,非肾上腺素通过刺激 B-3 肾上腺素能受体增加星形胶质细胞的谷胱甘肽供应,从而保护神经元免受 H2O2诱导的神经元死亡。
研究发现,酪氨酸也被肠道微生物代谢为苯酚,如 4-乙基苯酚,随后在宿主体内被硫酸化为 4-乙基苯酚硫酸盐,在 ASD 小鼠模型中发现该物质升高,也是 ASD 儿童尿液的生物标志物。
色氨酸代谢产生的神经活性分子
色胺和犬尿氨酸等吲哚衍生物是肠道细菌代谢色氨酸的产物,是一种神经活性分子。吲哚丙酸是一种吲哚衍生物,可作为抗氧化剂减少神经炎症,并被观察到在减少 AD 病理方面具有潜在作用。
发现犬尿氨酸代谢物会影响焦虑、记忆和应激样行为。还观察到犬尿氨酸代谢途径的紊乱会促进炎症、兴奋毒性谷氨酸的产生和自由基攻击,表明平衡的犬尿氨酸具有神经保护作用,并在 AD、PD 和 HD 中具有抗炎作用。
色氨酸代谢物通过调节其芳烃受体有助于降低星形胶质细胞的炎症反应,同时也影响它们与小胶质细胞的相互作用。同样,还观察到吲哚酚-3-硫酸盐控制小胶质细胞的活化,随后控制其与星形胶质细胞的相互作用。
谷氨酸和精氨酸的神经保护
氨基酸谷氨酸也被肠道细菌谷氨酸脱羧酶转化为 GABA,一种抑制性神经递质,在小鼠模型中观察到它可以减轻抑郁和焦虑症状。
就氨基酸精氨酸而言,它被代谢成四种多胺,即胍丁胺、腐胺、亚精胺和精胺,它们的作用机理是谷氨酸受体并参与维持突触可塑性和记忆形成。
胍丁胺在作为脑中 α-2 肾上腺素能受体和咪唑受体的配体时,对中枢神经系统疾病有治疗作用。亚精胺也在 3-硝基丙酸 3-NP HD 模型中显示出神经保护作用。
此外,胍丁胺能刺激 Nrf-2 信号通路,改善脂多糖 (LPS) 诱导的 ROS 产生。体外和体内研究还表明,胍丁胺可保护星形胶质细胞和小胶质细胞免受氧化应激引起的损伤。这些研究表明肠道微生物内分泌学在神经科学中的潜在作用。
肠道菌群可以将膳食纤维代谢成短链脂肪酸
未消化的膳食纤维(如复合碳水化合物多糖)在肠道微生物酶糖苷水解酶和多糖裂解酶的作用下,通过厌氧发酵转化为短链脂肪酸(SCFA)。
丁酸、乙酸和丙酸组成短链脂肪酸,是结肠上皮细胞的能量来源。除此之外,它还进入体循环,随后直接或间接影响许多器官的生理功能,包括神经发育和功能。
短链脂肪酸在神经退行性疾病中的作用
有报道显示,当通过使用益生菌混合物或使用抗炎短链脂肪酸来调节 AD 小鼠模型的肠道菌群时,有助于抵消疾病的进展。同样,短链脂肪酸被发现能有效加剧 GF 小鼠 PD 模型中的运动症状。
SCFA对神经系统的直接影响
短链脂肪酸和乙酸穿过血脑屏障,激活神经元,调节神经递质和神经营养因子的水平。一项研究表明,丙酸和丁酸会影响神经元细胞内的钾水平。
丁酸是调节表观遗传基因活化(组蛋白去乙酰化酶)的酶的强效抑制剂,并被发现在 AD、PD、HD、中风和记忆障碍的小鼠模型中起到强效抗炎剂的作用。
有趣的是,SCFA 会干扰 Aβ 肽之间的相互作用,形成神经毒性低聚物,从而预防 AD 病理。据报道,将野生型小鼠的粪便微生物群移植到 PD 动物模型中,同时给予丁酸,可显著改善运动症状和多巴胺缺乏症。
SCFA对神经系统保护的多重机制
当我们观察细胞特异性反应时,丁酸已被证明可以在体外减少星形胶质细胞中的神经炎症和氧化,而乙酸盐被这些细胞用作能量来源。
一项研究发现,SCFA 通过与内皮细胞上的 SCFA 受体结合来增加紧密连接蛋白的表达,从而有助于降低 血脑屏障的通透性并预防 LPS 诱发的癫痫和中风。
SCFA 通过减少小胶质细胞活化来减少大脑中的氧化应激,从而对抗 AD 和 PD 中的神经炎症。总之,从膳食纤维中获得的 SCFA 有助于改善大脑健康,具体取决于个人的肠道健康状况。
多酚的分类及抗氧化特性
多酚是植物中存在的生物活性分子,在植物的生长、保护和繁殖中起着根本性的作用。多酚分为黄酮类化合物、酚酸类化合物和单宁类化合物。
多酚的分子结构,即羟基的位置和芳香环取代的性质,使其具有清除自由基的能力,并被广泛研究作为治疗NDD的抗氧化疗法。
多酚的代谢及其神经保护机制
未吸收的多酚在宿主体内通过水解和酯化作用,在肠道微生物群的作用下转化为生物可利用和生物活性的代谢物,随后在到达外周组织之前进行甲基化、硫酸化、羟基化等修饰。
研究表明,从葡萄和葡萄酒中提取的白藜芦醇、从绿茶中提取的姜黄素和表没食子儿茶素-3-没食子酸酯等不同多酚通过激活蛋白激酶通路(如 Keap1/Nrf-2/ARE)发挥神经保护作用,而这些通路是缓解内源性和外源性 ROS 的主要通路。
多酚代谢物在神经退行性疾病中的潜在作用
据报道,细菌多酚代谢物如 3-羟基苯甲酸和 3-(3′-羟基苯基)丙酸可抑制淀粉样蛋白聚集,从而有助于抑制 AD 的进展。
同样,据观察,黄酮类槲皮素可作为 BACE-1 抑制剂。此外,天然黄酮类原花青素可在体外 减轻鱼藤酮诱导的多巴胺能神经元的氧化应激。此外,肠道菌群产生的多酚(如阿魏酸)可促进神经发生,并在 AD和脑缺血的小鼠模型中显示出神经保护作用。
多酚与肠道菌群的相互作用及其对神经保护的影响
雌马酚和肠内酯也是肠道细菌通过代谢植物雌激素(多酚之一)产生的衍生物,可能对雌激素受体介导的经典神经保护途径产生影响。有趣的是,多酚还可以调节肠道菌群的组成,进一步将其转化为抗炎和神经保护代谢物。
扩展阅读:
肠道微生物与维生素合成
肠道微生物也是维生素的重要来源,特别是维生素B和K,它们不仅对肠道微生物代谢至关重要,而且还对宿主的生理途径产生影响。
维生素的吸收与生理作用
虽然膳食维生素通过小肠吸收,但微生物衍生的维生素的吸收发生在结肠中。为了预防新生儿出血性疾病,在肠道菌群建立之前,需要补充维生素K,这是血栓形成过程中必不可少的物质。
此外,维生素B和K对大脑发育和功能也很重要。就神经退行性疾病 (NDD)而言,许多研究表明维生素B和K在改善神经元健康方面发挥着有效作用。
维生素K在神经退行性疾病中的作用
研究发现,维生素K缺乏与AD的发病机制有关,增加膳食中维生素K的摄入有助于改善老年患者的记忆功能。
最近的报告显示,维生素K2(甲基萘醌-4)具有强大的抗氧化特性,能显著抑制鱼藤酮诱导的p38活化、ROS产生和caspase-1活性,进而恢复线粒体膜电位,显示出其在治疗神经炎症诱导的帕金森方面的潜力。
类似地,维生素 K2 可有效调节 PC12 小鼠神经母细胞瘤细胞中的 bax 和 caspase-3 活化,保护其免受 6-OHDA 诱导的细胞凋亡。
维生素缺乏与神经系统疾病的关系
最近的一份报告显示,帕金森病患者体内维生素 K2 水平低与炎症反应失调和凝血信号级联有关。
维生素 B 缺乏还与脚气病和多发性神经病等神经系统疾病有关。同样,叶酸缺乏与老年女性的认知障碍和进行性痴呆有关。而且,大量摄入 B6、B9 和 B12 可降低与 AD 认知能力下降有关的大脑区域萎缩的速度。此外,还需要更多建设性的研究来证明肠道微生物群产生的维生素在神经保护中的潜在联系。
扩展阅读:
自由基可能带来的危害
ROS 形式的自由基是细胞正常代谢过程的副产物。自由基有可能破坏遗传物质、使酶失活、使复合碳水化合物解聚以及使脂质过氧化。
抗氧化剂的保护机制
细胞内分子的这种破坏会导致细胞死亡。为了平衡自由基,身体具有特定的抗氧化剂,如谷胱甘肽。
一些产品也开始流入医药市场以应对氧化应激,如阿魏酸 (FA),因为它具有抗氧化和抗炎特性。它通过增强 BDNF 和神经生长因子 (NGF) 以及一些具有抗炎特性的神经肽的产生来帮助神经干细胞增殖。
益生菌在抗氧化应激中的作用
2017 年的研究,益生菌如植物乳杆菌 NCIMB 8826、发酵乳杆菌 NCIMB 5221和动物双歧杆菌也能通过细菌 FA 酯酶大量产生 FA。
由于其治疗效果,它在 AD 治疗中的应用越来越受到关注,用 FA 进行预处理已被证明可以减少 Aβ 原纤维并治疗 AD 小鼠的神经炎症。产生 FA 的益生菌通过清除 ROS 来抑制 β-淀粉样蛋白原纤维的形成和聚集。
SIRT1蛋白脱乙酰酶的抗氧化特性
其他益生菌蛋白,sirtuin-1 (SIRT1) 蛋白脱乙酰酶已被证明具有抗氧化特性。这种蛋白质调节宿主抗氧化途径的基因,并具有神经保护作用。
在接受治疗的转基因 3xTg-AD 小鼠中,观察到大脑中 SIRT1 蛋白的表达和活性恢复,Aβ 肽的形成减少。然而,在未经治疗的 AD 小鼠中,发现 SIRT1 的表达显著下降。
此外,SIRT1 活性增强可降低 p53 蛋白乙酰化,并通过抑制凋亡途径提高应激细胞的存活率。其他研究也表明,益生菌补充剂可激活 SIRT1 途径并激发抗氧化作用。
SLAB51益生菌配方的神经保护作用
最近的研究探究了一种名为 SLAB51(嗜热链球菌、嗜酸乳杆菌、植物乳酸杆菌、副干酪乳酸杆菌、德氏乳酸杆菌保加利亚亚种、短乳酸杆菌、长双歧杆菌、短双歧杆菌、婴儿双歧杆菌)的益生菌配方缓解氧化应激的能力,并发现了其作用的分子机制。
SLAB51 还能增强 GPx 和过氧化氢酶抗氧化酶的活性,从而减轻氧化应激引起的损伤。在人类中也观察到了类似的发现,AD 患者大脑中的 SIRT1 浓度显著降低,这与 AD 患者大脑皮层中淀粉样蛋白 β 和 tau 的积累密切相关。一项补充益生菌菌株干酪乳杆菌 01 的人体研究报告称,SIRT1 水平有所提高。
肠道菌群与免疫反应
肠道菌群与宿主免疫细胞之间的关系非常脆弱。免疫细胞专门区分宿主友好细菌和致病细菌。如果这种关系受到损害,则会导致不必要的免疫反应,引发慢性炎症。这种分化是由肠上皮细胞启动的,肠上皮细胞负责根据细菌细胞表面抗原(如 LPS、肽聚糖和鞭毛蛋白)产生受过训练的巨噬细胞表型。当上皮细胞变得容易受到致病攻击时,抗原会转移到脉管系统中,并产生促炎细胞因子,如 IL(白细胞介素)-1、IL-6 和肿瘤坏死因子-α (TNF-α),从而导致感染性休克以及肠道和脑部炎症。
肠道微生物与神经系统炎症的关联
一些细菌毒素也可以穿过血脑屏障。为了探究微生物在淀粉样变性中的作用,研究人员通过评估认知障碍患者几种肠道微生物的促炎(CXCL2、CXCL10、IL-1β、IL-6、IL-18、IL-8、炎症小体复合物 NLRP3、TNF-α)和抗炎(IL-4、IL-10、IL-13)细胞因子活性进行了研究,结果发现:
大肠杆菌/志贺氏菌的数量增加和直肠真杆菌的数量减少与认知障碍和淀粉样蛋白阳性患者的促炎和抗炎细胞因子浓度变化显著相关。同时,在 AD 患者中观察到 IL-6、CXCL2、NLRP3 和 IL-1β 水平升高,而 IL-10 水平降低。这项研究表明,肠道微生物群可能引发、加重或减轻神经系统疾病的外周炎症。
扩展阅读:
随着技术的进步,有关大脑的知识正在成倍增加。神经科学家从分子生物学、分子遗传学、脑成像和其他新技术中生成了大量数据,并且对共享神经科学数据以进行各种分析有着浓厚的兴趣。
神经成像在预测和检测神经退行性疾病和精神障碍方面也非常有帮助。为了收集和分析神经科学数据,正在开发各种生物信息学工具,以进一步开发基于大脑功能的设备。到目前为止,研究人员对因各种压力条件而导致神经退化的分子通路有了初步了解。
集成数据库将有助于从公开来源收集与神经退行性疾病相关的不同类型的数据。
当前与神经数据相关的活跃数据库
编辑
doi: 10.1016/j.jare.2021.09.005
随着高通量技术的加强,人们对微生物组的全面了解及其在人类健康中的重要性正在快速增长。
近期已证明肠道细菌可以改变中枢神经系统生理,而菌群失调可能是神经炎症的一个潜在因素。
微生物群影响左旋多巴治疗PD效果,数据库助力解析神经退行性疾病
据报道,在临床试验中,左旋多巴治疗 PD 的结果在招募受试者之间有所不同。这种差异是由于他们的微生物群造成的。L-多巴由不同肠道细菌物种(即粪肠球菌和Eggerthella lenta A2)的酪氨酸脱羧酶 (TDC) 和多巴胺脱羟酶 (Dadh) 代谢。
为了灭活细菌 L-多巴脱羧酶,人们发现了一种药物,即 (S)-α-氟甲基酪氨酸 (AFMT)。L-多巴和 AFMT 的组合被用于治疗帕金森病。与健康个体相比,AD 患者的肠道微生物群在分类学水平上发生了改变,例如拟杆菌、放线菌、瘤胃球菌、毛螺菌科。
宏基因组数据/16S RNA 测序数据支持菌群失调与 AD 之间存在明确关联。细菌产物(如 LPS 和 SCFA)与淀粉样蛋白病理有关。开发这些数据库的主要目的是将数据组织成一组结构化记录,这些记录有助于分析师检索信息进行不同的分析,从而为与神经退行性疾病相关的各种未解之谜提供解决方案。
肠道微生物群与大脑的相互联系已导致神经科学研究取得变革性进展。迄今为止,发现的大多数研究都与肠道细菌神经科学研究有关,但肠道微生物群非常庞大,需要科学家的关注,以确定和描述肠道微生物及其群落对肠脑信号传导途径的影响。
★ 为什么大脑容易发生氧化应激?
目前我们了解到大脑含有丰富的神经元,突触以及神经胶质细胞,相比于其他器官有更高的能量代谢活动和要求,大脑的抗氧化防御系统较弱,因此容易出现氧化还原稳态紊乱。
大脑Ca2+的稳态失调,神经元的兴奋性氨基酸在大量摄入导致谷胱甘肽(SH)的耗竭,从而引发神经元的铁死亡。
神经递质如多巴胺、5-羟色胺和去甲肾上腺素自动氧化生成ROS。大脑对由葡萄糖诱导的氧化应激敏感。大脑富含多不饱和脂肪酸,尤其是二十碳五烯酸(DHA),这使得其更容易受到氧化应激的影响,因为脂质过氧化和脑部利用过氧脂质进行信号传导。
脑部的微胶质细胞是大脑的常驻免疫细胞,对于大脑发育和功能至关重要。微胶质细胞活性取决于总的氧气生物可用性,并借此展示对突触的损伤,通过消耗更多氧气来产生O2–。H2O2和NO等反应性物质在损伤部位吸引微胶质细胞,引发局部炎症并推动神经退行性。
因此综合以上因素表面大脑容易发生氧化应激,这是很多神经退行疾病比如阿尔茨海默病,帕金森以及痴呆等的主要原因。
而大量的研究观察到肠道微生物组在通过其自身代谢产物或产生次生代谢产物减轻氧化应激、炎症和能量代谢方面发挥了不可忽视的作用。
★ 肠道菌群如何影响神经系统?
肠道微生物还控制代谢物对血脑屏障的通透性、紧密连接完整性和肠道屏障,调节免疫系统,阻止病原体在肠道定植。副交感神经系统的迷走神经感知肠道代谢物,并将肠道信息传达给中枢神经系统,以产生特定的反应。
在应激条件下,迷走神经张力受到抑制,并由于菌群失调而表现出有害影响,如肠易激综合征 (IBS) 和炎症性肠病 (IBD)。参与 AD 发病机制的 Aβ 蛋白由肠道细菌(如ENS 中的大肠杆菌和肠道沙门氏菌)表达。有益的肠道微生物还会产生多巴胺、血清素和 GABA。这些是调节 ENS 活性并可能相互关联的中枢神经递质。
肠道微生物管理小胶质细胞的激活和成熟,而激活的小胶质细胞会释放大量诱导型一氧化氮合酶 (iNOS) 调节 NO产生。菌群失调会引发炎症性 iNOS 并导致神经炎症。
★ 肠道菌群代谢物的作用
胆汁酸通过直接结合穿过血脑屏障的脑内受体或通过与肠道受体结合间接诱导成纤维细胞生长因子 (FGF) 和胰高血糖素样肽 1 的释放,影响脑不同区域的神经元活动以及迷走神经活动。
色胺和犬尿氨酸等吲哚衍生物是肠道细菌代谢色氨酸的产物,是一种神经活性分子。吲哚丙酸是一种吲哚衍生物,可作为抗氧化剂减少神经炎症,并被观察到在减少 AD 病理方面具有潜在作用。
短链脂肪酸和乙酸穿过血脑屏障,激活神经元,调节神经递质和神经营养因子的水平。一项研究表明,丙酸和丁酸会影响神经元细胞内的钾水平。
雌马酚和肠内酯也是肠道细菌通过代谢植物雌激素(多酚之一)产生的衍生物,可能对雌激素受体介导的经典神经保护途径产生影响。
而通过使用具有抗氧化和抗炎活性的益生菌来调节肠道微生物组已显示出有希望的神经恢复能力。
★ 益生菌帮助恢复神经系统
益生菌如植物乳杆菌 NCIMB 8826、发酵乳杆菌 NCIMB 5221和动物双歧杆菌也能通过细菌 FA 酯酶大量产生 FA。由于其治疗效果,它在 AD 治疗中的应用越来越受到关注,
最近的研究探究了一种名为 SLAB51(嗜热链球菌、嗜酸乳杆菌、植物乳酸杆菌、副干酪乳酸杆菌、德氏乳酸杆菌保加利亚亚种、短乳酸杆菌、长双歧杆菌、短双歧杆菌、婴儿双歧杆菌)的益生菌配方缓解氧化应激的能力,并发现了其作用的分子机制。
从德氏乳杆菌(Lactobacillus delbrueckii)亚种Lactobacillus delbrueckii ssp. bulgaricus B3 和 Lactobacillus plantarum GD2 中分离出的胞外多糖可保护 SH-SY5Y 细胞免受 Aβ(1–42) 诱导的细胞凋亡,这表明它们有望成为药物治疗阿尔茨海默病 (AD)的有前途的天然化学成分。
★ 饮食塑造肠道菌群缓解氧化应激助力大脑健康
氨基酸谷氨酸也被肠道细菌谷氨酸脱羧酶转化为 GABA,一种抑制性神经递质,在小鼠模型中观察到它可以减轻抑郁和焦虑症状。
就氨基酸精氨酸而言,它被代谢成四种多胺,即胍丁胺、腐胺、亚精胺和精胺,它们的作用机理是谷氨酸受体并参与维持突触可塑性和记忆形成。
从葡萄和葡萄酒中提取的白藜芦醇、从绿茶中提取的姜黄素和表没食子儿茶素-3-没食子酸酯等不同多酚通过激活蛋白激酶通路(如 Keap1/Nrf-2/ARE)发挥神经保护作用,而这些通路是缓解内源性和外源性 ROS 的主要通路。
主要参考文献
2020 Alzheimer’s disease facts and figures. Alzheimer’s Dement 2020;16:391–460.
Akasaka Naoki, Fujiwara Shinsuke. The therapeutic and nutraceutical potential of agmatine, and its enhanced production using Aspergillus oryzae. Amino Acids. 2020;52(2):181–197.
Barua Sumit, Kim Jong Youl, Kim Jae Young, Kim Jae Hwan, Lee Jong Eun. Therapeutic Effect of Agmatine on Neurological Disease: Focus on Ion Channels and Receptors. Neurochem Res. 2019;44(4):735–750.
谷禾健康
随着人口老龄化的不断加重,骨质疏松症(OP)已成为三大慢性疾病之一。骨质疏松症会导致骨折风险增加,骨骼变性,身体功能受限等。因此,骨质疏松症的防治逐渐成为中老年人健康关注的焦点,减少和治疗骨质疏松症对于减轻医疗负担、缓解社会压力具有重要意义。
数据显示,全球大约每3秒就有一例骨质疏松性骨折发生,大约50%的女性和20%的男性在50岁后患有原发性骨质疏松性骨折。
骨质疏松症是一种慢性疾病,其特征是骨组织微结构恶化和骨量减少。研究表明,体内激素失衡和氧化炎症可影响破骨细胞和成骨细胞的动态平衡,主要表现为骨微结构退化、骨量减少、骨强度下降。骨髓间充质干细胞的成骨分化和骨内血管生成的下降同时发生,导致骨脆性增加和骨折易感性增加。
我们日常的饮食中多酚类物质含量极其丰富,并且可以在自然界的多种植物中找到。多酚在化学上被鉴定为具有酚类结构特征的化合物。多酚的丰富来源包括水果、蔬菜和全谷物,以及其他类型的食物和饮料,如茶、巧克力和葡萄酒。
多酚可以通过影响骨形成和骨吸收而在骨重建中发挥作用。多酚作用于破骨细胞、成骨细胞和骨髓间充质干细胞,调节多个重要信号通路,在骨重塑中发挥重要作用。此外,多酚还通过抗炎、促进骨形成等机制抑制骨质疏松症。
此外,越来越多的研究表明,骨质疏松症患者及相关动物模型的肠道菌群与健康个体的肠道菌群有些不同,骨质流失的严重程度也与肠道菌群的改变有关。这也表明肠道微生物群可能成为预防和治疗骨质疏松症的潜在目标。
通过产生代谢物,肠道微生物影响和调节肠道屏障功能。正常的肠道屏障对于隔离有害物质、促进营养吸收和提供免疫保护非常重要。肠道屏障功能受损被认为是导致骨质疏松症的致病因素之一。
肠道微生物紊乱削弱了肠道屏障功能,导致有害物质进入体内,从而促进激活破骨细胞并导致骨吸收因子的产生,影响骨形成和骨吸收,最终导致骨质疏松。
而多酚等膳食成分还与肠道微生物群存在相互作用。肠道微生物群可以将多酚降解为更容易吸收的代谢物,从而提高其生物利用度。多酚可以塑造肠道微生物群并增加其丰度和活性,增强肠道屏障功能。在两者的协同作用下,可能对骨质疏松症的治疗效果最大化。
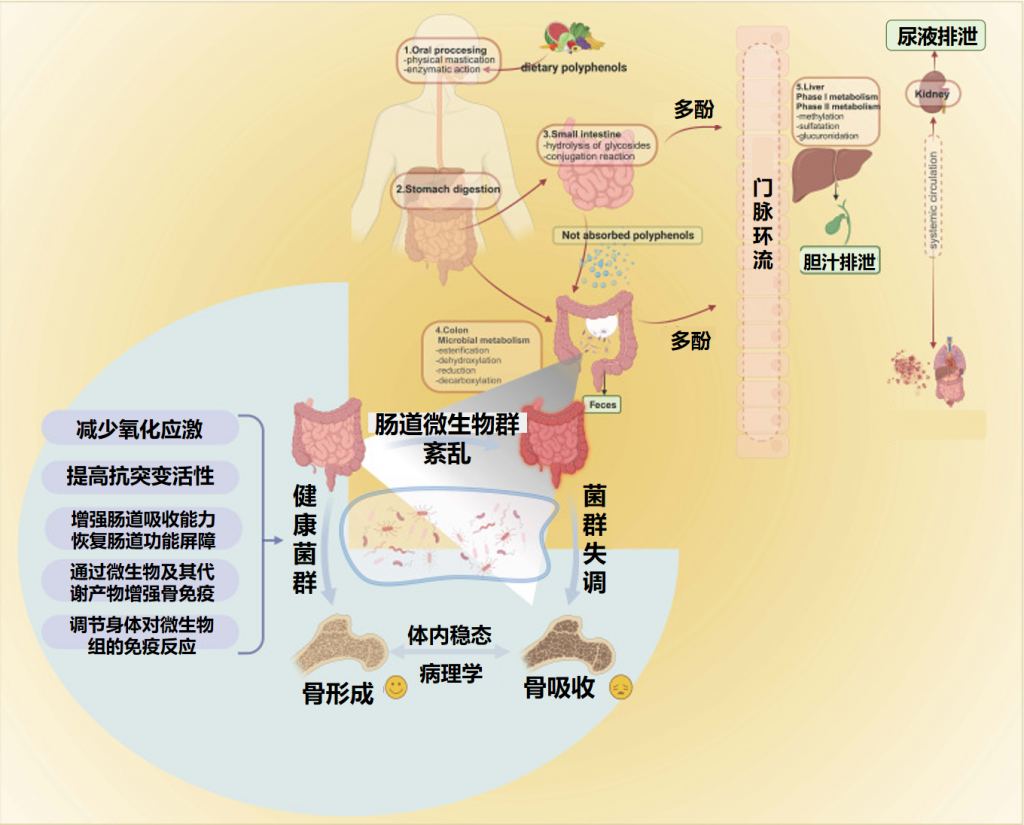
Wang K,et al.Front Immunol.2023
随着人口老龄化的不断加重,骨质疏松症(OP)已成为三大慢性疾病之一。这种全身性骨骼疾病的特点是骨矿物质密度(BMD)低,骨组织微结构恶化和骨量减少。
世界卫生组织将骨质疏松症定义为骨密度T值低于相应年龄和种族的健康年轻人平均密度2.5或更多标准差。
骨质疏松症的特点是破骨细胞功能增加,随后骨吸收增加,骨形成相应减少。成骨细胞和破骨细胞失衡是骨密度低和骨愈合不良的标志。成骨细胞是骨骼生长和维持的重要细胞,它们形成骨组织。
★ 年龄增加和女性绝经是骨质疏松的最常见原因
骨质疏松症最常见的原因是绝经和年龄,因为骨重塑过程受到雌激素、甲状旁腺激素、炎症细胞因子和维生素D的调节。
因此,老年女性的患病率(30%)高于老年男性(16%)
研究表明,体内激素失衡和局部氧化炎症也可影响破骨细胞和成骨细胞的动态平衡,主要表现为骨微结构退化、骨量减少、骨强度下降。骨髓间充质干细胞的成骨分化和骨内血管生成的下降同时发生,导致骨脆性增加和骨折易感性增加。
每年估计有890万起骨折是由于骨质疏松症而造成的。
由于骨骼是一种可塑性物质,它会根据生理和体外因素不断进行重塑,因此骨吸收增加以及随之而来的骨质流失,呈现出一种复杂的病理生理学,可能受到年龄、激素水平、遗传倾向,以及药物(如糖皮质激素)、生活方式和饮食的影响。
骨质疏松症分为原发性和继发性二大类。
✦ 原发性骨质疏松症
原发性骨质疏松症是指没有明显的诱因或疾病导致的骨质疏松症。它包括与年龄相关的骨质疏松症和绝经后骨质疏松症以及特发性骨质疏松(包括青少年型)。
老年性骨质疏松症:老年性骨质疏松症是一种与年龄相关的骨质疏松症,通常发生在50岁以上的男性和女性。它是由于骨骼的自然老化和骨形成减少而引起的。
老年性骨质疏松症患者的全身性骨质减少,尤其是脊椎、髋部和前臂骨。因此一些老人在不慎摔倒后特别容易出现髋部骨折。
绝经后骨质疏松症:绝经后骨质疏松症是绝经后女性最常见的骨质疏松症类型。在绝经后,女性体内雌激素水平下降,导致骨质流失加速。
绝经后骨质疏松症主要影响脊椎骨和髋部骨,增加骨折的风险。
特发性骨质疏松症:特发性骨质疏松症是指非目前所知的任何原因引起的骨质疏松。它包括特发性青少年骨质疏松和特发性成年骨质疏松,它们的病因和发病机制有很大不同。特发性青少年骨质疏松是一种比较罕见的病症,而特发性成年骨质疏松较常见。
特发性骨质疏松原因尚未明确,可能的原因是骨量的峰值下降造成骨量与同龄人比相对减少。骨量减少可能在早年就已经开始,并持续至成年。
✦ 继发性骨质疏松症
继发性骨质疏松症是由其他疾病、药物或疗法引起的骨质疏松症。它可以是由以下原因引起的:
激素失衡:某些激素失衡,如甲状腺功能亢进、垂体功能减退、库欣综合征(皮质醇增多症)等,都可能导致骨质疏松症。
药物:长期使用某些药物,如糖皮质激素、抗癫痫药物、抗抑郁药物等,也可能导致骨质疏松症。
慢性疾病:一些慢性疾病,如类风湿性关节炎、炎症性肠病、慢性肾病等,会增加骨质疏松的风险。
营养不良:缺乏足够的钙、维生素D和其他营养素,也可能导致骨质疏松症。
其他原因:骨质疏松症还可能与酗酒、吸烟、久坐不动、低体重指数等因素有关。
骨质疏松症是一种骨骼疾病,其主要特征是骨组织的密度和质量下降,导致骨骼变得脆弱和易碎。但骨质疏松症还可能带来以下其他危害:
✦ 骨折风险增加
骨质疏松症使骨骼变得脆弱,易于发生骨折。常见的骨折部位包括腕部、脊椎、髋部和股骨颈。即使是日常活动中的轻微压力或摔倒,也可能导致骨折,严重影响生活质量。
✦ 身体功能受限
骨质疏松症引起的骨折可能导致疼痛、残疾和功能受限。脊椎骨折可能导致身高减少、姿势异常和背部疼痛,严重影响日常活动和生活质量。
✦ 骨骼变形
骨质疏松症使骨骼弱化,容易发生骨骼变形,如驼背(脊柱前屈)和骨质疏松相关的骨折,这可能导致身体外观的改变和功能障碍。
✦ 慢性疼痛
骨质疏松症可能导致慢性骨痛,尤其是脊椎骨折引起的背部疼痛。这种疼痛可能会影响日常活动、睡眠和心理健康。
✦ 增加死亡风险
骨质疏松症相关的骨折,特别是髋部骨折,与较高的死亡风险相关。骨折还可能导致并发症,如感染、血栓形成和肺栓塞等,严重影响患者的生存率。
✦ 经济负担
骨质疏松症和相关骨折对个人、家庭和社会都带来了巨大的经济负担。治疗骨质疏松症和骨折的医疗费用、康复费用和长期护理费用都很高。
骨质疏松症有多种合适的治疗方法,目前的治疗建议包括锻炼、补充钙和维生素D,以及最终的双磷酸盐治疗。
正确的临床管理需要采取分阶段的方法,并仔细考虑具体干预措施的时机。
许多女性在绝经后会出现骨质减少,但尚未达到骨质疏松症的诊断标准;这可能是开始更保守治疗的理想时机,以防止骨质减少发展为骨质疏松症,并可能获得更好的长期疗效。
临床治疗可分为四个主要领域,其侵入性各不相同,分别为改变生活方式、补充营养、药物干预和手术治疗。
对于有骨质疏松症风险的患者,一致建议改变生活方式以防止骨质流失。充足的钙和维生素D、锻炼、戒烟、预防跌倒咨询和避免大量饮酒都是应注意的生活方式,特别是对于有骨质疏松症家族史的人来说。
高纤维饮食有助于预防骨质疏松症
饮食调整和运动是两种最有益和保守的治疗方法之一。对啮齿动物的研究表明,高纤维饮食以及由此增加肠道微生物群中短链脂肪酸的产量,特别是丁酸。
短链脂肪酸似乎可以防止小鼠绝经后和炎症性骨质流失、修复肠道屏障并预防骨质疏松症的发展。这些结果适用于人群,其中膳食纤维消耗增加与骨矿物质密度之间的关联已被证明。
避免使用促进骨质流失的药物
此外,处于骨质疏松症初始阶段或经历骨质减少的个体应避免使用促进骨质流失的药物,例如糖皮质激素。
在糖皮质激素引起骨质流失的情况下,发现饮食中添加山奈酚(一种在水果和蔬菜中发现的黄酮类化合物)可诱导成骨标志物的更高表达,并且在功能上似乎可以改善愈伤组织骨损伤部位形成并减少骨质流失,有效对抗糖皮质激素对骨骼健康的不利影响。
适度运动可以减少骨质疏松的发生
运动已显示出多种有益的健康效应,包括改善肌肉组织以预防跌倒和改善骨矿物质密度。
关于骨骼健康的运动训练,还发表了一篇有价值的文献,他们采用更多的细胞方法来考虑运动有益效果的机制。无论具体的获益机制如何,生活方式改变的证据表明,运动应该成为一线临床建议,以防止患者从骨质减少进展为骨质疏松症。
营养干预措施比较容易实现,而且相对便宜,应考虑将其作为骨质减少和骨质疏松症临床管理的措施。
增加钙与维生素D的摄入
增加钙摄入量并补充维生素D已被证明可以降低骨矿物质流失率,且不会损害肠道微生物群。膳食钙摄入不足的患者应在膳食中分次补充钙(通常为500至 1000毫克/天),将总钙摄入量提高到约1200毫克/天。
需要注意的是,钙的总摄入量(饮食加补充剂)通常不应超过2000毫克/天,因为钙摄入过高可能会出现不良反应,包括肾结石、心血管疾病、消化不良、铁和甲状腺激素失调以及便秘等。
关于维生素D的剂量存在争议。众所周知,维生素 D3(胆钙化醇)可促进小肠中钙的吸收;因此,确保足够的水平是必要的。
益生菌与益生元有助于钙代谢和骨骼健康
益生元和益生菌已被发现有助于治疗各种慢性炎症性疾病,并且越来越多的证据表明它们还有助于钙代谢和骨骼健康。
此外,向长期接受糖皮质激素治疗的小鼠添加益生菌、抗生素或粘液补充剂可预防糖皮质激素诱导的骨质疏松症的发生。

de Sire A,et al.Cells.2022
除了生活方式和其他保守的干预措施之外,骨折风险高或经历过脆性骨折的患者最有可能受益于药物辅助治疗。
双膦酸盐是一类抗骨吸收药物,自20世纪60年代首次用于治疗骨疾病以来,已被广泛使用。不过,渐进式新一线治疗方法越来越受欢迎,例如狄诺塞麦和合成代谢药物,包括甲状旁腺激素相关肽类似物和抗硬化素抗体。
具体药物需要根据患者的情况进行评估
值得注意的是,尽管有许多药物可以支持骨骼平衡和重塑,但它们的成功通常取决于患者对药物治疗的依从性。因此,最好根据患者的骨折风险设计治疗策略,并结合骨矿物质密度和临床风险因素进行评估。
此外,在开始药物治疗之前,所有患者的血钙和25-羟基维生素D水平应在范围内,如果食物摄入不足,应给予营养干预。骨质疏松症的药物治疗可分为抗吸收剂、合成代谢剂或激素调节剂。
重点来了
然而,还有其他方法可以治疗或预防骨质疏松症,这些方法可能更有效且副作用更少。本文接下来讲述的多酚等膳食成分与肠道菌群的协同作用可能就属于一种新型疗法。
多酚是存在蔬菜、谷物、水果、咖啡、茶等植物性食物中的次生代谢产物,具有潜在促进健康作用。
多酚按结构可分为黄酮类、酚酸类、木脂素类、芪类等。
流行病学研究表明,长期食用植物多酚可以预防心血管疾病、癌症、骨质疏松症、糖尿病和神经退行性疾病。
研究人员广泛研究了多酚类物质的有益作用,已知多酚可以增强骨形成并抑制骨吸收。
✦ 淫羊藿苷促进成骨细胞分化、抑制破骨细胞形成
淫羊藿苷(ICA)是8-异戊烯基黄酮苷。研究发现淫羊藿苷可以促进成骨细胞的分化,增加骨密度。骨形成主要通过成骨细胞的增殖和分化促进骨基质的合成和矿化,成骨细胞在骨形成和骨质疏松中发挥重要作用。
淫羊藿苷具有类似雌激素的药理活性,可以刺激成骨细胞的分化和矿化,调节破骨细胞的分化,并增加成骨细胞分化为成熟成骨细胞的数量。
淫羊藿苷抑制破骨细胞的形成,ICA抑制前破骨细胞向破骨细胞的分化。它还抑制参与破骨细胞形成和骨吸收的各种基因的表达。
研究表明,淫羊藿苷可以通过抑制NF-κB的激活,阻断MCF 7和MDA-MB-231诱导的破骨细胞形成。
✦ 芒柄花素增加骨量、减少骨吸收
芒柄花素(FO)是从黄芪中提取的主要异黄酮之一。研究表明,它可以刺激成骨细胞的形成,从而增加骨量,改善骨的微观结构。
芒柄花素还可以抑制破骨细胞的活化。研究表明,芒柄花素可抑制原代骨髓单核巨噬细胞向破骨细胞的增殖和分化,下调破骨细胞骨吸收功能相关蛋白和基因的表达。
✦ 葛根素对骨吸收也有调节作用
葛根原产于中国,历史悠久,是亚洲最常用的中药之一。由于异黄酮含量高,它已被广泛用作绝经后激素疗法的天然替代品。
研究表明,葛根素(PUE)对骨吸收也有调节作用。葛根素能够下调破骨细胞标志基因CTR、CATH-K、NFATc1和c-fos的mRNA水平,表明PUE抑制破骨细胞功能。
在体外,葛根素减弱骨吸收而不损害破骨细胞活力,并通过抑制骨吸收而不改变骨形成来显著防止骨丢失。此外,随着葛根素浓度的增加,葛根素会在体外抑制RANKL诱导的破骨细胞活化、骨吸收能力和F-肌动蛋白环形成。
白藜芦醇和淫羊藿苷控制成骨分化的分子机制
Wang K,et al.Front Immunol.2023
✦ 抗氧化应激
当活性氧的产生和消除不平衡时,就会发生氧化应激。过多的活性氧会导致细胞损伤和凋亡,影响细胞功能,引发疾病。
氧化应激可以影响骨髓间充质干细胞的功能,从而影响间充质干细胞的骨生长和成骨分化。因此,这可能导致成骨细胞功能受损并加速成骨细胞的形成和分化。
多酚化合物含有大量酚羟基,可作为抗氧化剂,防止活性氧引起的损伤。将单线态氧还原为活性较低的三线态氧,从而降低氧自由基产生的概率,终止自由基引发的链式反应。
有研究证据表明,摄入富含食源性多酚化合物的天然浆果,如蔓越莓和蓝莓,可以通过清除自由基来对抗氧化应激,预防和治疗骨质疏松症。
✦ 抗炎作用
多酚类化合物通过负调节炎症途径,特别是对关键的NF-κB转录因子的调节,发挥抗炎作用。雌激素受体能够参与与NF-κB的蛋白质相互作用,导致复合物的形成以及随后NF-κB与特定反应元件的结合。这些特异性反应元件以细胞类型特异性的方式调节NF-κB依赖性基因的转录,在调节炎症过程中至关重要。
例如,可以通过调节转录因子NF-κB并在HMC-1细胞中作为雌激素受体ERK来抑制脂质过氧化和对抗氧化应激。诱导型一氧化氮合酶表达受损会减少炎症因子TNF-1、IL-6、IL-8和NO的产生和释放。这一过程会产生抗炎作用,并有助于减轻骨丢失。
此外,多酚化合物已被证明通过下调受体激活的NF-κB配体(RANKL)来抑制骨吸收,并通过下调NFATc1和炎症介质来直接抑制成骨细胞的产生,从而降低成骨活性。
✦ 激活Wnt/β-Catenin信号通路
Wnt信号通路在骨骼发育和代谢稳态的维持中发挥着关键作用。Wnt相关蛋白或因子可以与卷曲基因受体(Fzd)结合并启动下游细胞内级联反应,从而调节β-Catenin、过氧化物酶体增殖物激活受体γ(PPARγ)和RUNX2等靶基因的转录或表达。然后调节成骨细胞形成、分化和成熟的生理过程。
Runx2是成骨细胞特异的转录因子,与成骨细胞的增殖和分化密切相关。
β-Catenin是通路中的关键因子,是Wnt/β-Catenin信号通路的中心调节因子。β-Catenin可以增强碱性磷酸酶(ALP)的活性,同时促进骨骼生长。
在一项研究中,发现淫羊藿苷对大鼠骨髓基质细胞的干预通过刺激β-连环蛋白的激活来增加总β-连环素和核转位。此外,Wnt信号传导成员(β-catenin、Lef1、TCF7、c-jun、c-myc和细胞周期蛋白D)的表达显著上调。
雌激素受体(ERα)的激活可增强成骨基因的表达,从而促进BMSCs的增殖和成骨分化。白藜芦醇是一种非黄酮类多酚有机化合物,具有雌激素样作用。一些研究人员通过白藜芦醇介导的Wnt/β-catenin途径得出结论。白藜芦醇通过刺激Runx2的表达,下调GSK38的表达水平,阻止β-连环蛋白降解复合物的有效形成,确保β-连环素在细胞质中的稳定积累和向细胞核的移位,从而激活Wnt/B-连环蛋白通路,促进成骨分化,提高骨密度,在预防和治疗骨质疏松症中发挥作用。
多酚调节骨形成或骨吸收的多种信号通路
Li Y,et al.Front Pharmacol.2022
✦ 抑制NF-κB通路
NF-κB信号通路在骨代谢中也具有重要作用,并且还可以与其他信号通路相互作用,影响骨质疏松症的进展。
应用芍药苷干预RAW 264.7细胞系分化的破骨细胞模型,观察芍药苷对破骨细胞信号通路的影响。结果表明,芍药苷减弱了p65 NF-κB的磷酸化水平,即抑制了NF-κB信号通路的激活。NF-κB途径是破骨细胞分化的主要生物学途径之一。已经证实,芍药苷通过抑制p65 NF-κB的激活,降低NF-κB信号通路的活性,降低破骨细胞的活性,减少骨吸收,并进一步维持骨稳态。
芍药和蛇籽都是中药,都含有多酚类物质。通过抑制NF-κB信号通路,抑制破骨细胞的产生,来达到骨质疏松的治疗效果。
Wang K,et al.Front Immunol.2023
许多研究还揭示了肠道微生物群与骨质疏松症之间的显著联系。肠道微生物群调节骨稳态,并可以通过多种机制影响骨质疏松症。
这些包括调节其代谢物、影响宿主代谢、改变药物代谢以及调节肠道屏障功能的完整性。一些研究还强调了肠道微生物对胶原蛋白特性的改变,这与骨骼脆弱性密切相关。
肠道微生物群组成的变化会导致肠道炎症并破坏免疫调节网络的平衡,许多研究表明这与骨质疏松症有关。
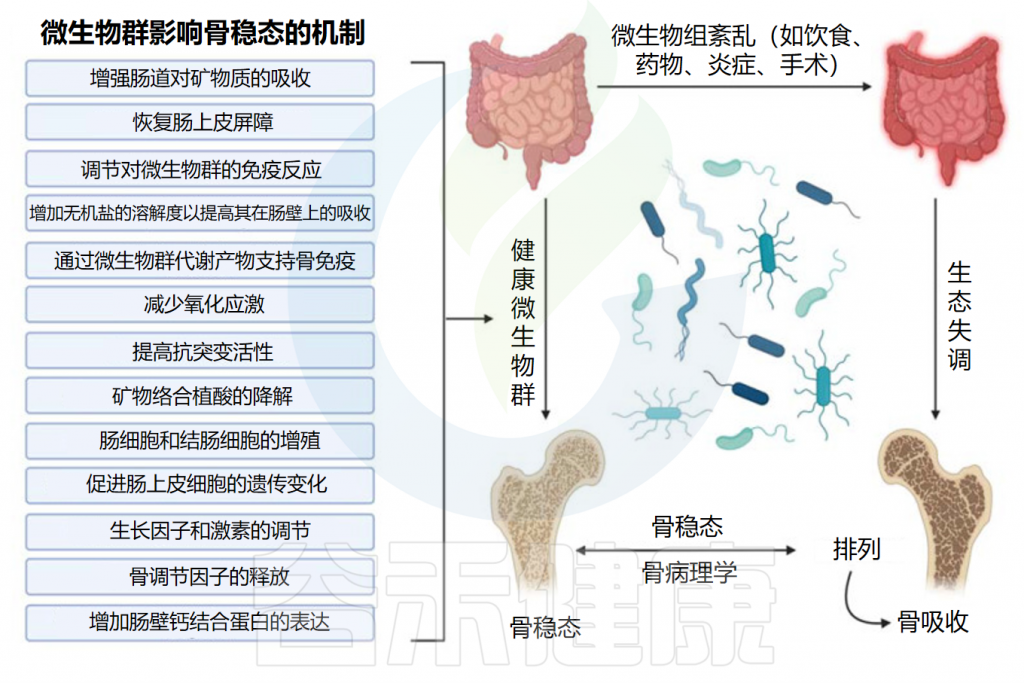
Seely KD,et al.Int J Mol Sci.2021
1.增加无机盐的溶解度,以改善其在肠壁的吸收
磷酸盐等无机盐的可用性对于成骨细胞的骨矿物质沉积和骨稳态至关重要。这种效应可能部分归因于微生物合成植酸酶将矿物质复合植酸代谢为无机磷酸盐和磷酸肌醇衍生物。
2.增强肠道矿物质吸收表面
通过促进肠上皮细胞和结肠细胞的增殖,介导肠道微生物群稳态,并支持肠道矿物质吸收。结肠细胞代谢的增加已被证明可以促进专性厌氧菌的产生,专性厌氧菌可以代谢纤维,从而增加短链脂肪酸,这对于骨稳态以及其他生理功能都至关重要。
3.恢复和维持肠道上皮屏障
肠道微生物群稳态有助于构建肠道上皮屏障,而健康的肠道上皮屏障可以防止因紧密连接受损而导致的通透性过高。通透性过高或“肠漏”会渗出异常高水平的炎症细胞因子,产生全身炎症并导致破骨细胞过度活跃和骨质退化。
4.通过微生物群代谢物增加骨密度
肠道微生物群产生的短链脂肪酸通过抑制活化B细胞的核因子kappa轻链增强子的活化来提供抗炎作用,从而减少自身免疫炎症。此外,短链脂肪酸,特别是丙酸和丁酸,通过下调TRAF6和NFATc1来抑制破骨细胞生成和骨吸收,从而有效增加骨密度,而不直接改变成骨细胞。
5.减少氧化应激
氧化应激被证明会导致过度的骨细胞凋亡,从而导致破骨细胞生成的失衡,导致骨重塑、周转和损失增加。特异性益生菌可以通过产生几种抗氧化分子(如谷胱甘肽、叶酸和胞外多糖)来缓解氧化应激。此外,几种肠道微生物群产生的短链脂肪酸还可以通过促进抗氧化分子的产生来帮助缓解氧化应激。
6.调节免疫反应
肠道微生物群通过影响与骨细胞密切相关的免疫系统,在维持骨骼健康方面发挥着至关重要的作用。在异常状态下,免疫系统对微生物群刺激的反应会通过T细胞的作用导致循环破骨细胞因子增加。它通过利用宿主完全发育的免疫系统来调节整个身体的反应来实现这一点,从而控制骨转换和密度。
7.增加抗诱变活性
尽管这种能力已在癌症领域得到广泛探索,但某些产乳酸微生物群可以有效的结合诱变剂,例如热解产物和杂环胺在肠道中降低这些化合物的诱变活性。减少DNA损伤可以减少炎症、保护肠壁、增加矿物质吸收并抑制骨质疏松症。
8.增加肠壁钙结合蛋白的表达
增加肠壁钙结合蛋白D9k基因的表达可以增加吸收钙的能力,通过抑制甲状旁腺激素的作用,有效抑制骨降解和促进骨沉积。此外,增强钙吸收以及抑制甲状旁腺激素活性和胰岛素样生长因子1的产生也可以改变破骨细胞和成骨细胞的发育。
9.调节生长因子和激素的分泌
肠道微生物群可以被视为基于大量分泌分子的内分泌器官。具体来说,肠道微生物群通过短链脂肪酸介导的途径促进胰岛素样生长因子1(IGF-1)的产生。已知IGF-1可刺激成骨细胞、破骨细胞和软骨细胞的分化。
肠道微生物群也可能通过皮质醇介导的相互作用增强骨降解。肠道微生物群还调节肠道血清素的产生,这是一种与骨细胞相互作用的分子,被认为可以充当骨量调节剂。
人类肠道微生物群和宿主相互作用,影响骨量的动态平衡,以及骨骼生长、骨骼老化和病理性骨质流失的过程,这催生了骨微生物学领域的兴起。
骨微生物学的最新研究将骨表型的变化与肠道菌群的变化联系起来。平衡、健康的微生物组似乎对于防止骨质流失是必要的,这一假设有证据支持,在小鼠的饮食中补充益生菌可逆转骨质疏松症的致病过程。
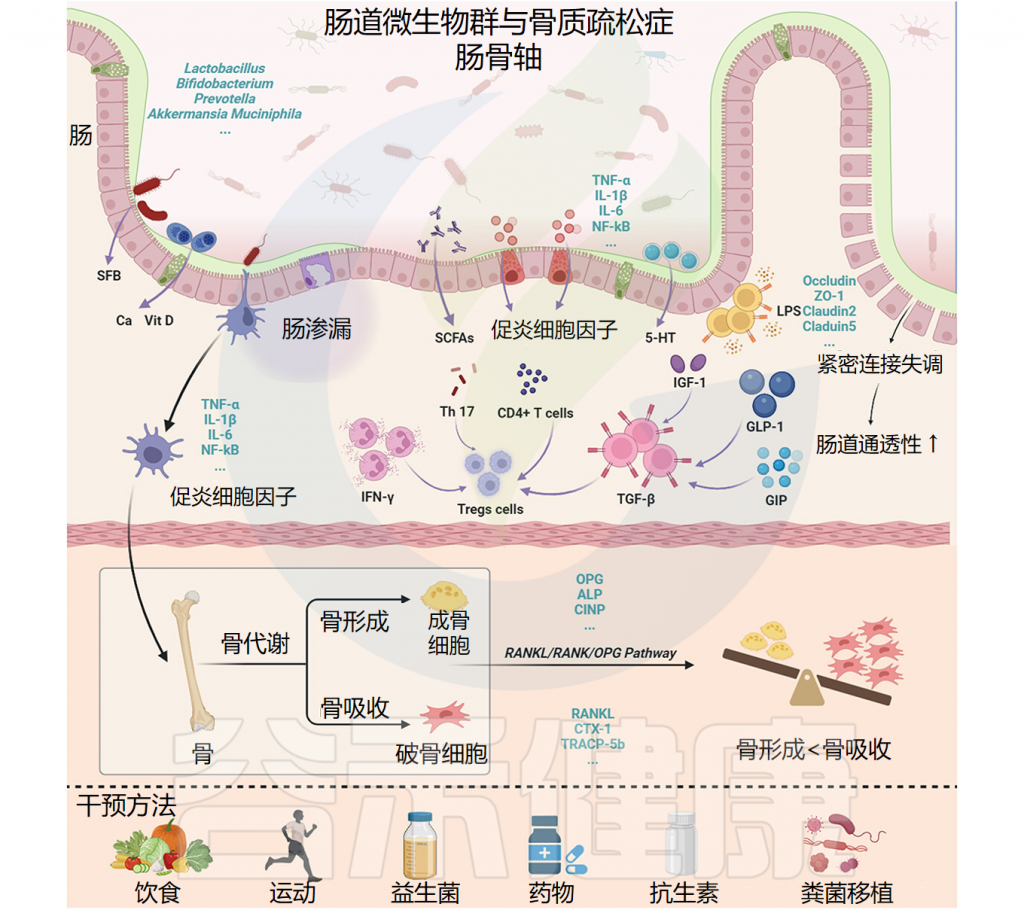
Zhang YW, et al.Gut Microbes.2024
✦ 骨质疏松症患者肠道菌群的多样性减少
评估骨质疏松症患者肠道内细菌种群数量和多样性的几项研究检查表明,骨质疏松症成年人的生物多样性似乎有所减少,某些物种如梭菌属(Fusobacterium),戴阿利斯特杆菌属 (Dialister),Faecalibacterium,甲苯单胞菌属(Tolumonas)以及拟杆菌属(Bacteroides)和罗氏菌属(Roseburia)减少。
注:上述这些基本都是肠道核心菌甚至是对人体健康非常重要的益生菌。
✦ 肠道菌群影响免疫细胞进而影响骨稳态
事实上,肠道微生物群与骨骼愈合和重塑之间的部分关联是由免疫细胞调节的。
免疫细胞成熟和功能所必需的许多细胞信号级联在一定程度上取决于肠道微生物群在整个生命过程中持续的最佳功能和体内平衡。尽管非常复杂,但近期文献中关于整体骨骼健康与肠道微生物组之间联系的主要假设以T细胞和Th17免疫细胞为中心 。在T细胞依赖性机制中,免疫系统对微生物群刺激的反应会增加循环的破骨细胞因子。
此外,虽然其作用尚不完全清楚,但Th17免疫细胞似乎是破骨细胞群的一个组成部分。因此,可以假设肠道微生物群的任何不平衡可能反过来影响骨稳态所需的关键免疫机制。
除了所提出的T细胞介导的相互作用之外,更广泛的免疫系统对微生物组的反应导致产生许多循环细胞因子和基于细胞的免疫效应物,这些效应物对骨细胞具有显著影响,这表明考虑肠道微生物群的健康可能会有益于骨愈合障碍。
✦ 肠道微生物影响微小RNA进而影响骨骼健康
尽管肠道微生物群对宿主免疫系统的影响有着相对较长的记录历史,但这并不是肠道微生物群影响骨骼健康的唯一潜在机制。类固醇激素、甲状旁腺激素和维生素D代谢物都可能受到微生物群的影响。
此外,细菌衍生的化合物(例如维生素)可能会进入血液并直接影响骨细胞活性。或者,肠道微生物群可能通过对宿主微小RNA (miRNA) 的影响来影响骨质疏松症的发展,宿主微小 RNA 是参与基因表达调节的非编码 RNA 分子。
一些 miRNA 可以影响与骨质疏松症中成骨细胞分化相关的转录物,例如 miRNA-33-5p、miRNA-194和miRNA-433-3p。尽管尚未完全了解,但在支持肠道微生物失调的反馈机制中,微生物群可能会影响宿主 miRNA,进而抑制成骨细胞发育,对骨质疏松修复构成障碍。
总的来说,肠道微生物群通过破骨细胞生成影响骨愈合和重塑有多种潜在途径。
益生菌是一类对宿主有益的活性微生物,定植于人体肠道和生殖系统等部位,能够产生精准的健康益处,改善微生态平衡,发挥有益作用。随着生命结构的不断改变,越来越多的益生菌被开发和利用,这与维持机体功能的稳定密不可分。
除了食品之外,益生菌的应用范围也越来越广,牙膏、啤酒等都在添加益生菌。益生菌对骨质疏松症的调节是一个新兴领域,研究益生菌如何改善骨代谢、预防或治疗骨质疏松症已成为研究热点,并已取得一定进展。
✦ 益生菌恢复肠道微生物平衡利于骨骼健康
目前的研究证据表明,补充益生菌以恢复肠道微生物群及其代谢产物的平衡对骨骼健康有益。
具体来说,被诊断患有炎症性肠病或相关疾病的个体由于肠道微环境的变化和随之而来的菌群失调而经常患有骨质疏松症,并研究了乳双歧杆菌BL-99可以作为有益的益生菌制剂来预防骨质疏松症。
最近的研究还表明,益生菌治疗可以通过抑制IL-6的分泌和肠道炎症反应来抑制卵巢切除术(OVX)诱导的小鼠破骨细胞的活性,从而增强骨量。
例如补充Bacteroides vulgatus ATCC 8482可以缓解骨质疏松小鼠肠道微生物群的失衡,下调脂多糖/TLR-4/p-NF-κB通路,改善腰椎的骨丢失和骨微结构破坏,这表明Bacteroides vulgatus ATCC 8482可能是一种具有改善绝经后骨丢失潜力的益生菌。
✦ 同时补充益生菌对改善绝经后女性的骨质疏松比单一常规药物更有效
目前益生菌防治骨质疏松的研究多集中于动物实验,临床试验报道较少。但一项基于人群的试验表明,在治疗绝经后骨质疏松症方面,施用Bifidobacterium animalis subsp. lactis Probio-M8与常规药物/补充剂的组合比单独使用常规药物/补充剂更有效。
在一项双盲、安慰剂对照研究中,75至80岁且骨矿物质密度较低的女性被随机分配每天口服10^10菌落形成单位的罗伊氏乳杆菌 ATCC PTA 6475或安慰剂,并且结果表明,补充罗伊氏乳杆菌 ATCC PTA 6475可能是预防骨质疏松症的新方法。
此外,在一项随机对照试验中,补充罗伊氏乳杆菌 ATCC PTA 6475有可能预防骨密度低的老年女性肠道微生物群恶化和炎症状态,这可能对骨代谢产生有益影响。
由此可见,越来越多的学者开始从补充益生菌的角度探讨调节肠道菌群及其代谢物的深层机制,益生菌也成为预防和治疗骨质疏松症的潜在候选者。
不同食物中营养素的组成和含量显著影响肠道微生物群的组成和丰度,进而影响骨代谢,调节骨质疏松。
因为一些微生物直接利用某些营养物质作为生长物质的来源,而大量摄入此类营养物质可能会导致细菌丰度增加并作用于骨代谢。例如,链球菌(Streptococcus), 芽孢杆菌(Bacillus),丙酸杆菌(Propionibacterium), 拟杆菌(Bacteroides)和梭菌属(Clostridium)等微生物可以利用蛋白质作为氮源,较高的膳食蛋白质摄入量也可以增加其丰度和多样性。
此外,人们还认识到,日常饮食摄入引起的生理环境的变化会影响微生物群落的选择。以膳食脂肪摄入为例,富含脂肪的膳食可能会促进胆汁分泌,以利于脂质的消化,而胆汁酸对细菌的细胞膜有不利影响,这使得胆汁酸对微生物产生强大的选择压力并导致这些肠道微生物群相关代谢物在骨质疏松症的代谢调节中发挥负面作用。
由于多酚抑制炎症因子并参与各种其他机制的能力,多酚已被确定为治疗骨质疏松症和慢性炎症的潜在药物,并且与肠道屏障的功能密切相关。
同时,多酚还可以充当肠道屏障-骨-免疫系统的调节介质和诱导剂。多酚可以通过两种方式影响肠道微生物群,即促进有益细菌的增殖和增加其丰度。
✦ 多酚可作为益生元增加有益菌的丰度
多酚具有益生元的属性并改变人类肠道微生物群组成。富含多酚的食物已被一致证明可以有效改变肠道微生物群。
大多数研究一致证明多酚可以引起肠道微生物群组成的有利改变。具体来说,当个体食用富含多酚的饮食时,人体肠道菌群会发生显著变化,乳杆菌、双歧杆菌、阿克曼氏菌、肠球菌和拟杆菌的数量增加,而梭菌和厚壁菌与拟杆菌的比例显著下降。
富含多酚的食物改变肠道微生物组成的证据
例如,富含多酚的红酒被发现可以刺激肠道微生物群中某些细菌的生长,例如拟杆菌和罗氏菌属。
发酵木瓜汁中发现的某些类型的多酚,例如没食子酸和咖啡酸,可以影响肠道微生物的组成。研究表明,这些多酚可以减少肠球菌、产气荚膜梭菌和艰难梭菌等有害细菌的数量,同时促进双歧杆菌等有益细菌的生长。
此外,某些多酚还可以促进肠道微生物群中真菌的生长。食用富含原花青素的葡萄籽可以增加肠道中乳酸杆菌、梭菌和瘤胃球菌的数量。
蔬菜与水果类似,富含多酚和益生元纤维。摄入胡萝卜中的膳食多酚可以增加拟杆菌和乳杆菌的数量,并减少产气荚膜梭菌、科氏梭菌、球状拟杆菌和肠杆菌。
利用16S rRNA和宏基因组测序分析研究了白藜芦醇对肠道生物屏障的影响。研究结果表明,白藜芦醇对肠道微生物群的多样性和结构具有积极影响。具体来说,它增加了益生菌的丰度并调节肠道微生物群的功能以对抗免疫抑制。


Wang K,et al.Front Immunol.2023
✦ 多酚衍生代谢物具有抗炎作用增强肠道健康
除了上述益生菌作用外,多酚衍生的代谢物可以增强肠道健康和表现出抗炎特性。例如,可可多酚的生物活性代谢物可以增强肠道健康,具有抗炎作用,对免疫系统有积极作用,并降低各种疾病的风险。
摄入多酚可以通过促进短链脂肪酸的产生、增强肠道免疫功能和其他生理过程来改善肠道微生物群的健康效应。
✦ 多酚减少有害细菌的水平
据观察,在含有人类粪便细菌的培养基中加入茶多酚,特别是儿茶素,可以减少有害细菌的水平,包括大肠杆菌、产气荚膜梭菌。
这一发现表明,在肠道环境中引入茶多酚可能对抗这些特定病原菌的增殖。强调了茶多酚对肠道微生物群平衡的积极影响。
还研究了茶多酚对肠道氧化还原状态的影响及其与肠道微生物群的相关性。研究发现螺旋体和拟杆菌属被确定为肠道氧化还原状态的生物标志物,并揭示了茶多酚的益处。
因此,多酚和肠道微生物群之间的协同作用成为治疗骨质疏松症的关键因素。
营养因素也对骨质疏松症有着至关重要的影响,低钙摄入、维生素D缺乏、高磷和钠饮食、过量饮酒以及碳酸饮料的摄入被普遍认为是骨质疏松症的危险因素,而充足的蛋白质摄入有利于骨骼健康。
膳食营养素通过作用于肠道微生物群及其代谢物对骨质疏松症产生影响:
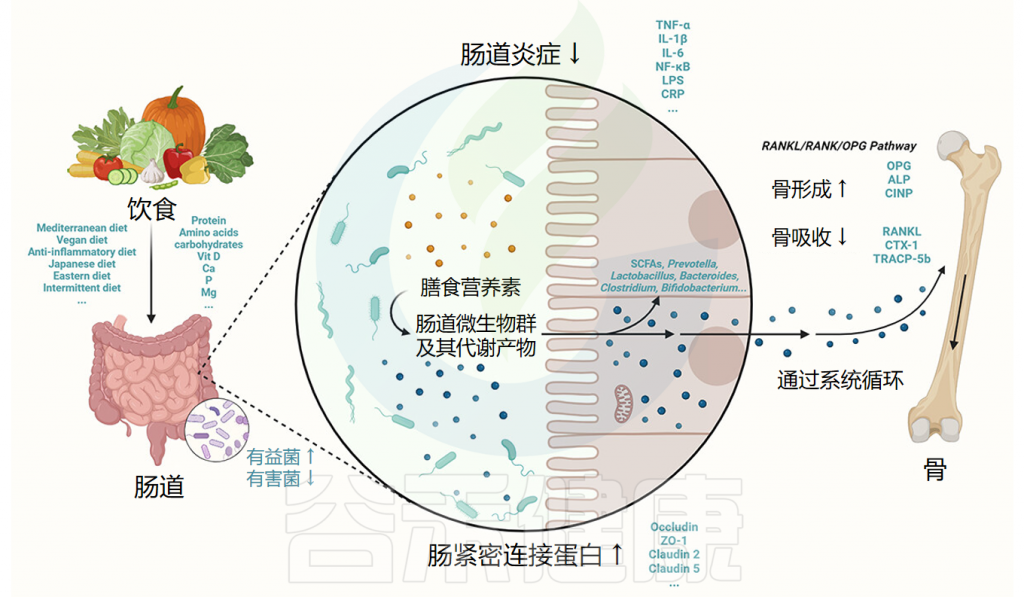
Zhang YW, et al.Gut Microbes.2024
人体的膳食蛋白质摄入可以通过细菌发酵、甲烷化、脱羧反应和硫还原来改变呼吸链中的电子受体,从而对转化为对健康具有不同影响的物质。
✦ 改变细菌生长环境,调整肠道菌群的组成
例如,含硫氨基酸如蛋氨酸和半胱氨酸可以在硫还原作用下生成硫化氢,而氨基酸和肽可以在厌氧菌的作用下通过脱羧反应产生胺类。这些代谢产物改变了细菌的生长微环境,并使细菌获得了一定的生长优势,从而改变了肠道菌群的组成和丰度。
同时,研究表明,高蛋白饮食者的肠道菌群中Bacteroides, Prevotella, Treponema, Fusobacterium, Clostridium perfringens和Bacillus的数量相对于传统饮食者增加,而厚壁菌门的数量减少。这种改变也已被证实与骨质疏松症的逆转一致。
✦ 蛋白质的代谢产物影响骨吸收和骨形成
研究人员揭示,肠道菌群发酵的蛋白质、氨基酸和肽的主要代谢产物是短链脂肪酸,如乙酸、丙酸和丁酸,而短链脂肪酸参与了骨形成和骨吸收的调节。
学者们还发现,肠道厌氧菌能够从甘氨酸、苏氨酸、谷氨酸、赖氨酸、鸟氨酸和天冬氨酸中合成乙酸,从苏氨酸、谷氨酸和赖氨酸中主要合成丙酸。
更重要的是,包括乙酸、丙酸和丁酸在内的短链脂肪酸的调节与骨质疏松症的发生和发展密切相关。与此同时,梭菌属可以利用支链氨基酸(缬氨酸、亮氨酸和异亮氨酸)合成支链脂肪酸,而支链氨基酸和短链脂肪酸也是代谢性疾病如骨质疏松症、肥胖症、2型糖尿病等的潜在调节因素。
膳食脂肪是身体的有效能量来源。先前的研究已表明,膳食脂肪摄入的质量和数量可能会影响肠道微生物群的组成和丰度。
✦ 适量的不饱和脂肪酸可助肠道菌群有益改变
不饱和脂肪酸通过提高拟杆菌门与厚壁菌门的比例来改变肠道微生物群的组成和丰度。Omega-3脂肪酸可导致肠道微生物群的有益改变,包括增加双歧杆菌、乳酸杆菌、链球菌、脱硫弧菌和阿克曼菌。
✦ 高脂饮食会导致骨代谢紊乱和骨质疏松
但大量摄入饱和脂肪酸和反式脂肪酸会增加心血管和骨代谢相关疾病的风险,减少拟杆菌、普雷沃氏菌、乳杆菌和双歧杆菌的丰度,从而可能导致全身炎症、骨代谢紊乱和骨质疏松。
研究发现,长期高脂饮食会导致骨量下降、微生物群失调、肠漏和全身炎症,而低聚果糖或低聚半乳糖的施用可以显著增强肠道微生物群的生物多样性和短链脂肪酸浓度,逆转高肠道通透性和炎症细胞因子,最终预防高脂饮食诱导的骨质疏松症。
研究结果还表明,高脂饮食引起的骨质流失伴随着骨髓脂肪组织的扩张和骨形成的抑制。
高脂饮食对骨骼结构和健康具有至关重要的影响,肠道菌群失衡、肠道屏障恶化、炎症反应、氧化应激、脂肪因子改变和骨髓脂肪组织堆积被认为是潜在的机制。
研究还发现,运动可以预防高脂饮食对男性骨骼健康的多种负面影响,运动引起的肠道微生物群变化(降低厚壁菌门与拟杆菌门的比例)可能表现出一种新的机制,有助于运动诱导的骨骼健康益处。
可消化和不可消化的碳水化合物都可能影响肠道微生物群的组成和丰度,这两者都已被证实可以增加双歧杆菌的数量。各种水果中的可消化碳水化合物(例如葡萄糖、蔗糖和果糖)已被证明会降低拟杆菌和梭菌的丰度。
✦ 高膳食纤维的摄入有助于骨骼健康
难消化的碳水化合物也称为膳食纤维。近年来,随着肠骨轴研究的快速发展,膳食纤维发酵的短链脂肪酸已成为一种重要的介质,重点关注肠道微生物群与骨质疏松症之间的联系。
膳食纤维通过调节拟杆菌门与厚壁菌门的比例来改变肠道微生物群,并改变多种功能途径(包括氨基酸和脂质相关代谢),从而参与骨代谢的调节。研究人员分析了膳食纤维摄入不足的后果,观察到低纤维饮食显著降低了长达三代的微生物多样性,并且补充膳食纤维后微生物多样性无法恢复。
更重要的是,研究人员总结,摄入更多富含纤维的食物(包括粗粮、新鲜水果和蔬菜),再加上充足的运动、适当的饮水和规律的排便,可能有助于维持人体肠道和骨骼的健康,尤其是中老年人,以预防骨质疏松症。因此,食用多种食物中的膳食纤维对维持肠道健康和防止骨质流失至关重要。
肠道菌群在调节宿主健康中发挥着至关重要的作用,不同个体肠道菌群的组成存在显著差异,并受到饮食、环境等多种因素的影响,其中饮食是不可忽视的重要因素。
★ 饮食模式和膳食成分都会影响健康
不同的饮食模式对肠道微生物群的结构、代谢和功能有不同的影响,并参与各种生理活动,如食物消化、营养代谢吸收、能量供应、免疫调节和胃肠道稳态的维持,与骨质疏松症的发生发展密切相关。
此外,饮食不仅会影响肠道微生物群的结构和组成,还会影响其基因和功能。即使是同一属的细菌,在不同饮食模式的影响下,其功能和核心基因也存在显著差异。
纯素食和地中海饮食可以增强肠道微生物群的多样性,促进有益细菌的生长,如双歧杆菌、乳酸杆菌和普雷沃氏菌,而西方饮食可以减少肠道微生物群多样性,增加厚壁菌门与拟杆菌门的比例。
!
不同饮食对骨骼健康的影响
通过阅读相关文献,谷禾在这里为大家整理了不同饮食模式对肠道微生物群、代谢物和骨骼健康的影响,如下图:

Zhang YW, et al.Gut Microbes.2024
多元化的饮食更利于骨骼健康
不同的膳食成分可能以时间依赖性的方式塑造肠道细菌群落,并且不同的膳食成分对肠道微生物群的影响显著不同。
因此,合理的膳食结构、正确的膳食习惯和方法、适当的营养配比是保证人体健康的基础,而不合理的膳食结构则是高血压、糖尿病、骨质疏松等多种慢性病的罪魁祸首。在此基础上,还必须根据肠道菌群及其代谢产物对骨质疏松症的调节影响提出合理的饮食建议。
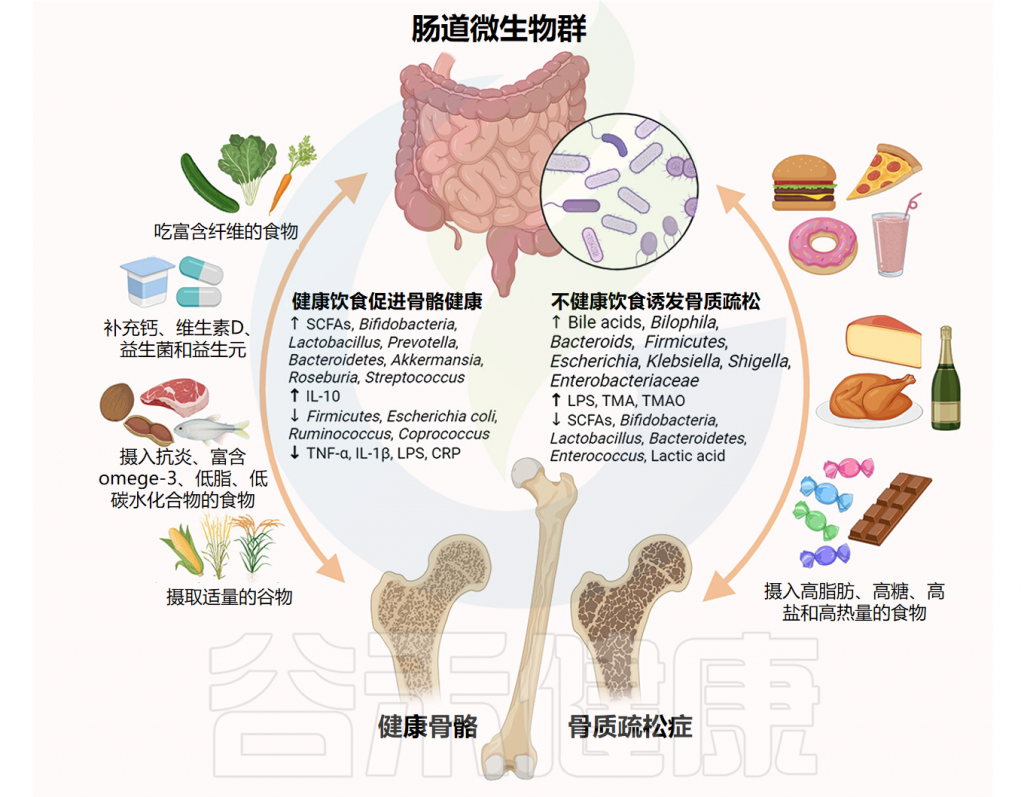
Zhang YW, et al.Gut Microbes.2024
合理的饮食模式融合了地中海饮食、抗炎饮食等健康饮食模式的特点,主要包括食物多样化、高纤维摄入、低糖摄入、低脂肪摄入、高谷物摄入。
合理的膳食结构主要以食物多样化为原则,建议多食用蔬菜、水果、豆类及其制品、鱼类、海鲜,同时少吃红肉和饱和脂肪酸,保证充足的摄入以植物性食物为主,适量动物性食物为主,从而获得种类齐全、数量充足、比例适当的膳食营养素,满足中老年人群维持骨骼健康、预防骨质疏松的生理需要。
合理的饮食模式也为塑造肠道稳态、有益菌繁殖、消除有害菌、维持肠道菌群多样性奠定了坚实的基础。
骨质疏松症作为一种中老年人常见的慢性疾病,在日常生活中如何更好地预防和改善非常重要。
除了常规的日常护理外,肠道微生物群与饮食也起着至关重要的作用。肠道微生物群可以将多酚等膳食成分分解为更容易吸收的有益代谢物,如短链脂肪酸,而多酚可以增加肠道中有益菌的丰度和活性,增强肠道屏障,从而促进骨健康。
两者协同作用下,更大程度地发挥各自的功能和作用,可能作为预防和治疗骨质疏松症的新方法。
主要参考文献:
Zhang YW, Song PR, Wang SC, Liu H, Shi ZM, Su JC. Diets intervene osteoporosis via gut-bone axis. Gut Microbes. 2024 Jan-Dec;16(1):2295432.
Wang K, Hu S. The synergistic effects of polyphenols and intestinal microbiota on osteoporosis. Front Immunol. 2023 Oct 23;14:1285621.
Seely KD, Kotelko CA, Douglas H, Bealer B, Brooks AE. The Human Gut Microbiota: A Key Mediator of Osteoporosis and Osteogenesis. Int J Mol Sci. 2021 Aug 31;22(17):9452.
Zhou RX, Zhang YW, Cao MM, Liu CH, Rui YF, Li YJ. Linking the relation between gut microbiota and glucocorticoid-induced osteoporosis. J Bone Miner Metab. 2023 Mar;41(2):145-162.
Cheung KCP, Jiao M, Xingxuan C, Wei J. Extracellular vesicles derived from host and gut microbiota as promising nanocarriers for targeted therapy in osteoporosis and osteoarthritis. Front Pharmacol. 2023 Jan 6;13:1051134.
de Sire A, de Sire R, Curci C, Castiglione F, Wahli W. Role of Dietary Supplements and Probiotics in Modulating Microbiota and Bone Health: The Gut-Bone Axis. Cells. 2022 Feb 21;11(4):743.
Martiniakova M, Babikova M, Mondockova V, Blahova J, Kovacova V, Omelka R. The Role of Macronutrients, Micronutrients and Flavonoid Polyphenols in the Prevention and Treatment of Osteoporosis. Nutrients. 2022 Jan 25;14(3):523.
Inchingolo AD, Inchingolo AM, Malcangi G, Avantario P, Azzollini D, Buongiorno S, Viapiano F, Campanelli M, Ciocia AM, De Leonardis N, de Ruvo E, Ferrara I, Garofoli G, Montenegro V, Netti A, Palmieri G, Mancini A, Patano A, Piras F, Marinelli G, Di Pede C, Laudadio C, Rapone B, Hazballa D, Corriero A, Fatone MC, Palermo A, Lorusso F, Scarano A, Bordea IR, Di Venere D, Inchingolo F, Dipalma G. Effects of Resveratrol, Curcumin and Quercetin Supplementation on Bone Metabolism-A Systematic Review. Nutrients. 2022 Aug 26;14(17):3519.
Li Y, Li L, Li X, Luo B, Ye Q, Wang H, Yang L, Zhu X, Han L, Zhang R, Tian H, Wang P. A mechanistic review of chinese medicine polyphenols on bone formation and resorption. Front Pharmacol. 2022 Oct 12;13:1017538.
谷禾健康

无论是什么社会阶层
无论以前的职业是什么
任何人都有可能患上阿尔兹海默症
这种疾病如同橡皮擦一般
逐渐抹掉一个人的记忆
…
在详细了解阿尔兹海默症之前,我们先来看一个动画短片(2020年奥斯卡最佳动画短片提名),该片讲述的是一位患有阿尔茨海默病的艺术家慢慢失去自己记忆的故事。
2020奥斯卡最佳动画短片提名——勿忘我(Mémorable)_腾讯视频
“ 他们彼此搂着对方在旋转中化作了记忆的露珠 ”
“你是我空白世界里最后一处的风景”
…
阿尔兹海默症正在呈指数级蔓延,目前却没有治愈的方法。
本文,我们在了解阿尔兹海默症的同时,也带来了关于阿尔兹海默症研究的新方向——结合肠道微生物群(“肠-脑轴”的阐述)来更深入了解该疾病。
阿尔茨海默氏病(AD)是一种神经退行性疾病,影响全世界超过5000万人,是最常见的痴呆症,临床表现为进行性认知功能减退和功能障碍。AD主要影响老年人(> 65岁),表明衰老是主要的危险因素之一,其中与衰老相关的AD进展被称为散发性AD
AD及其相关痴呆症的发病率在世界范围内呈上升趋势,以前,在高收入国家(西欧和北美),AD患病率最高。 然而,中低收入国家的痴呆症发病率开始增加,预计到2030年,所有病例中的63%发生在中低收入国家中,到2050年,占所有病例的71%。但其病因仍未解决,目前尚无有效的预防或改善治疗方法。
缩略词:

新的证据表明AD患者的肠道微生物群与认知正常的患者不同。肠道内的细菌强烈影响肠-脑轴,肠道微生物代谢物包括短链脂肪酸、促炎因子和神经递质也可能影响AD的发病机制和相关的认知能力下降。
饮食是肠道微生物群最强的调节剂之一,也强烈影响着大脑健康和AD病理学。例如,肥胖和2型糖尿病是AD的潜在危险因素,并且研究已将高脂饮食和高碳水化合物饮食与AD发生的风险联系在一起。 相反,地中海(MD)和生酮饮食与更健康的大脑衰老和较低的AD风险相关。 进一步证实了这一证据,在发展中国家,随着肥胖和糖尿病患者比例的增加,流行病学转变导致AD患病率增加。
因此,通过健康饮食来逆转肠道菌群异常可能有益于大脑并降低AD风险。
· 遗传
尽管尚不清楚AD的病理和影响因素,但仍存在一些遗传突变,例如淀粉样前体蛋白(APP)基因的额外拷贝和21号染色体三体等基因突变,这些突变增强了神经退行性β淀粉样蛋白(Aβ)的表达与家族性AD相关的蛋白质沉积。
· 病理
病理上,细胞外神经原纤维斑块和细胞内高磷酸化tau(pTau)缠结遍布AD大脑皮质实质,尤其是颞叶。深部脑萎缩也可能支持AD的诊断,这些明显的特征长期以来被认为是AD病理的主要因素。
新皮层中pTau的Aβ斑块和神经原纤维缠结的堆积会引起炎症,氧化应激和最终的神经退行性变。 这些症状也可以通过活性氧来介导,活性氧通常通过酶促抗氧化剂来控制。 然而,当抗氧化剂水平降低时,活性氧会引起氧化应激并导致神经退行性变。
大脑中的炎症也与AD患者常见的肠道渗漏有关,免疫系统因子如多形核中性粒细胞能够从肠壁漏出。来自肠道的持续炎症可开始降解血脑屏障,使这些炎症因子进入大脑并引起进一步的炎症。
用于AD诊断的生物标志物包括低Aβ-42和脑内高tau水平,PET上氟脱氧葡萄糖摄取减少,MRI上出现结构性脑萎缩。
AD的临床诊断因患者而异,很难用一系列规定的症状来描述。
需要关注的这10个方面
记忆退化/困难; 问题解决; 熟悉的任务完成; 时间/地点识别; 图像或空间关系的理解; 沟通; 追溯步骤; 判断/人际互动; 工作/社交活动; 情绪/认知
早期症状
记忆:丢钥匙,忘记朋友的名字或最近的一次谈话,在熟悉的地方迷路。
讲话:重复自己的话或努力跟上对话。
视觉:很难看到三维的东西和判断距离。
决策:难以做出决定、解决问题或完成多步骤任务,比如做饭。
方向:对自己的位置、时间和日期感到困惑。
情绪:感到焦虑、沮丧或易怒的。
晚期症状
错觉:
例如,毫无理由地相信有人在偷他们的东西
不寻常的行为:
表现出攻击性或躁动、喊叫或扰乱睡眠模式
行走和说话困难:
卧床不起或坐轮椅,需要24小时护理来帮助进食、饮水和上厕所
由于淀粉样蛋白级联假说的不可理解性,研究正在调查Aβ斑块和pTau作为一个系统的标志物,这个系统从许多末端被破坏。
研究假设β-淀粉样蛋白是一种抗菌肽,由于非有益微生物的大量携带,可能来自炎症导致的血脑屏障降解,因此可能会在AD大脑中积聚。这些淀粉样蛋白是由APP的裂解和toll样受体2激活的髓样分化主要反应途径形成的。
脑淀粉样变性外,肠道中还存在细菌淀粉样蛋白,其三级结构类似于中枢神经系统淀粉样蛋白,并可能在刺激大脑中的免疫系统中发挥作用,因为免疫系统学会了识别肠道中的淀粉样蛋白,然后 大脑中淀粉样蛋白的增强攻击,导致炎症。
饮食(例如高脂饮食)可进一步介导导致AD炎症和神经退行性变的肠道渗漏综合征。 因此,AD的可测量症状具有与肠道菌群相关的复杂原因。
Aβ 斑块和tau缠结假说是AD病理生理学的理想模型。然而,新的研究已经证实AD是系统性功能障碍的一个组成部分,至少部分由慢性、全身性和神经元炎症以及肠道微生物群介导。在这一点上,神经炎症假说建立在肠-脑轴上,它将肠道微生物群活动与神经元健康和功能障碍联系起来(下图)。
AD中肠道微生物群的作用是由微生物代谢物介导的,这些代谢物作用于肠道和周围组织中的局部神经元并向大脑发送信号,和/或从肠道吸收并通过循环到达大脑。例如:单胺类、短链脂肪酸(SCFA)、γ-氨基丁酸(GABA)、β-甲胺基-L-丙氨酸、脑源性神经营养因子、血清素和多巴胺。
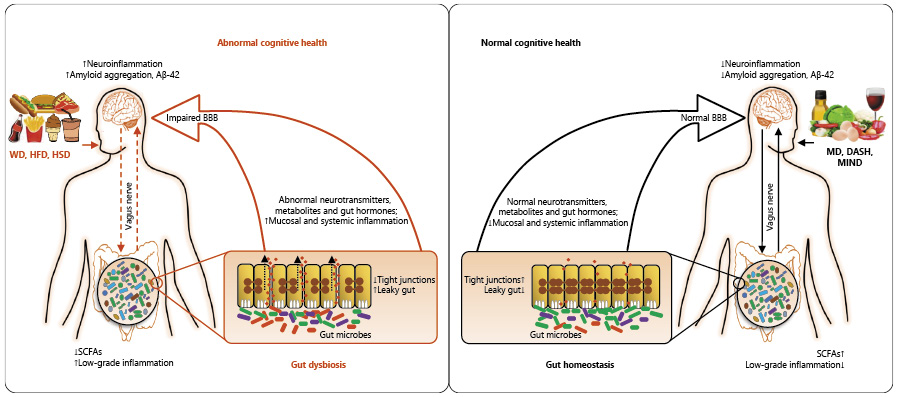
Kincaid HJ, et al., Ann Nutr Metab,2021
MCI和AD患者中饮食与微生物组相互作用与大脑和认知健康之间的假定联系的示意图。
AD患者和/或患有轻度认知障碍(MCI)的受试者存在明显的微生物群模式。
随着自然衰老相关的肠道营养不良开始发展并削弱肠道上皮,已经存在的微生物群营养不良会进一步影响大脑的衰老,从而导致肠道渗漏和炎症。
全身性炎症的加剧促使免疫功能受损,使大脑中的β-淀粉样蛋白堆积。这表明,患者通常要到老年时发展为AD,即使在生命早期就存在存在危险因素,如基因突变。
患有MCI和AD的患者在脑脊液中还显示出较高水平的肠道微生物来源的三甲胺N-氧化物(TMAO),这与AD生物标志物(包括pTau,总Tau和Aβ42)相关。
TMAO治疗可通过改善神经元衰老和线粒体功能障碍来降低小鼠的认知功能和衰老迹象。尽管TMAO在AD中的作用机制尚不清楚,但TMAO及其前体是炎症生物标志物,可能与AD相关的肠道渗漏有关。
西方饮食由低纤维、高脂肪和高蛋白食物组成,通常吃富含TMA和胆碱的高脂肪红肉和鸡蛋,从而增加TMAO的产生。这可能部分解释了西方国家AD发病率较高的原因。
此外,TMAO相关的脑损伤和认知缺陷可能由氧化应激增加介导。因为大脑消耗大量的氧气,而且神经元的新陈代谢率很高,所以一般人大脑中的神经元面临更高的氧化应激风险。然而,氧化应激可能是AD病理的原因和后果。
炎症引发氧化应激,从而导致β pTau的积累;然而,在一个破坏性的循环中,反之亦然也是可能的。
此外,氧化应激可导致线粒体功能障碍,肠道微生物源性代谢产物影响线粒体功能。饮食可以调节氧化应激,如高果蔬饮食可以提高认知能力,这与老年人氧化应激的降低有关;而西方饮食不富含水果和蔬菜,这也可能解释了在西方国家AD患病率较高的原因。
肠道微生物群对我们的新陈代谢、免疫和大脑健康至关重要。在健康的稳态条件下,肠道微生物群与宿主保持共生关系,对宿主营养和代谢、对病原体的定植抗性、肠道屏障完整性和免疫调节发挥重要作用。
肠道微生物群对脑部疾病有影响,包括抑郁症、焦虑症、高血压和帕金森病。最近的研究也将肠道微生物群与AD联系起来;然而,值得注意的是,这些研究大多是横断面调查,因此,需要更多的纵向干预研究来确定微生物群和AD病理学之间的偶然联系。
美国北卡罗来纳州科学团队最近报道了MCI患者拟杆菌丰度较低,厚壁菌和变形杆菌(肠杆菌科)丰度较高,此外在属水平上也存在一些差异。其他研究也报道了AD受试者的多样性较低,厚壁菌与拟杆菌比率较低,痴呆患者的拟杆菌比率较低,而与MCI患者和正常受试者相比,AD患者的多样性较低,厚壁菌和变形杆菌比率较高。
一项研究表明,丁酸盐产生菌参与认知功能。有趣的是,该团队还发现MD生酮饮食改善了AD生物标志物,即。MCI患者脑脊液中的淀粉样蛋白和tau蛋白,其中这些变化与肠丁酸盐增加有关。
已经研究了Aβ积累与微生物群的关系。 例如,APP-PS1小鼠是使用最广泛的AD模型,它以年龄依赖的方式展示了Aβ在大脑中的蓄积; 然而,它的微生物群不同于野生型小鼠。 此外,移植有AD微生物群的小鼠倾向于具有更高的Aβ积累。 此外,Aβ聚集可以被微生物群衍生的戊酸酯和丁酸酯抑制。
此外,细菌内毒素也可能与AD-淀粉样变性相关的炎症有关。 例如,脂多糖(LPS)是革兰氏阴性细菌的外细胞壁成分,具有高度促炎性,可以增强大脑中Aβ的积累并引起认知功能障碍。
AD患者的血浆LPS水平较高,新皮质和海马较高。 LPS还可能导致慢性神经发炎,内嗅皮质神经细胞死亡以及海马神经元的突触可塑性受损。 特定的细菌,例如大肠杆菌(Escherichia coli),枯草芽孢杆菌(Bacillus subtilis),鼠伤寒沙门氏菌(Salmonella typhimurium)和肠沙门氏菌 (Salmonella enterica)也可以产生淀粉样蛋白。 然而,这些并不是人类肠道微生物的典型且一致的’居民’。
此外,AD相关淀粉样变性与细菌淀粉样变性之间的关系仍不清楚。 尽管如此,细菌淀粉样蛋白可能会激活与AD发病机制有关的特定信号通路,这提示肠道菌群可能会加剧与淀粉样变性病相关的炎症。 这些研究通过微生物细胞外成分,促炎因子,毒素,SCFA,淀粉样蛋白和神经递质将微生物群与淀粉样蛋白的积累联系起来。 考虑到迅速兴起的研究,可以预见的是,AD预防和治疗将绕不开针对微生物群的影响。
鉴于AD患者与健康受试者之间微生物群差异的新数据,研究人员已经开始探索调节微生物群的方法,希望能够改善AD病理学。
尽管肠道微生物群可以通过多种方法进行调控,包括使用益生菌、益生元、合生元和抗生素或改变饮食,但饮食是肠道微生物群的最高级调节剂。
以不饱和脂肪、水果和蔬菜以及全谷类为重点的饮食调节可以给AD相关的认知健康带来好处(上图)。例如,MD通过增加血浆类胡萝卜素和降低C-反应蛋白水平,与AD关键区域的脑萎缩减少相关(表明对AD病理学有积极影响)。
此外,炎症减少也是AD的主要症状。食用富含二十二碳六烯酸(一种n-3多不饱和脂肪酸)的鱼制品与降低AD风险有关。富含维生素D3的鱼和富含维生素D的奶制品促进神经生长因子蛋白的分泌,这种蛋白可以防止大脑发炎和衰老。
由于MD对AD的这些改善作用,一项人体试验研究了MD-DASH干预对神经退行性延迟(MIND)饮食的影响,该饮食是MD与DASH饮食(阻止高血压的饮食方法)的结合,富含 水果,蔬菜,全谷类,低脂乳制品和瘦肉蛋白证明,MIND饮食比单独使用MD或DASH更为有效,尽管所有3种饮食均显示出降低AD病理学的益处。
除了某些饮食生活方式外,个别食物还可以带来抗AD病理学的益处。 例如,在小鼠模型中,饮用红酒可防止Aβ肽生成并降低AD风险。具体而言,据报道,适度饮酒可减少轴突末端的GABA能发芽,这可能是AD中神经退行性变的部分原因。 富含类黄酮的食物,例如黑加仑子,葡萄,柑橘和绿茶,已显示出抑制Aβ沉积并防止tau蛋白过度磷酸化的作用,同时改善了AD的其他生物标志物。
具体而言,据报道,适量饮酒可减少轴突终末的GABA能发芽,这可能是AD中发现的神经退行性变的部分原因。富含类黄酮的食物,如黑加仑、葡萄、柑橘和绿茶,已被证明能抑制β 沉积和阻止tau蛋白的过度磷酸化,同时改善AD的其他生物标志物。
虽然大多数研究都在研究健康饮食对改善AD病理的影响,几项研究探讨了直接针对AD肠道细菌的补充剂的使用。
一项随机双盲对照人体试验,研究了12周食用嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei)、双歧杆菌 (Bifidobacterium bifidum)和发酵乳杆菌(Lactobacillus fermentum),的益生菌组合的效果,据报道,对认知功能有显著的积极影响,但对氧化应激或炎症没有影响。
一项小鼠实验研究了生物素丁酸钠对早期AD小鼠Aβ水平和行为症状的影响,发现补充丁酸钠12周后Aβ水平显着降低,行为反应增加。
益生菌和益生元的组合合生元也显示出对AD的益处。一项人类研究观察到,AD患者食用开菲尔谷物发酵的牛奶(形成共生物质)90天后,精神能力得到改善,炎症和氧化应激减少。
综上所述,目前有关饮食和补充剂影响肠道微生物群和改善AD是有希望的,但更多的研究是也非常需要。
此外,研究已经通过测试Tramiprosate(一种GABA的类似物)来靶向GABA,并发现它有望增加AD模型和临床试验中Aβ抑制的长期增强作用。5-羟色胺激动剂和再摄取抑制剂曲唑酮(trazodone)也表明,与延缓AD患者认知障碍的相关性是非曲唑酮使用者的2.6倍。
AD在世界范围内迅速增长,但是迄今为止尚无治愈方法,这强调了需要有效的策略,例如饮食因素来调节AD相关的神经炎症并预防或减慢AD的进展。
目前的证据表明,饮食成分的促炎和抗炎能力都可能在AD管理中发挥作用。
富含单糖,饱和/反式脂肪,高级糖基化终产物和加工肉的饮食可能对AD患者的大脑产生促炎性影响,同时可能加速肥胖症,高血压,血脂异常,动脉粥样硬化和2型糖尿病。
相反,富含蔬菜,水果,沙拉,坚果,豆类,浆果,多不饱和脂肪酸,维生素,类黄酮,多酚,益生菌/益生元和全谷物的复杂饮食模式(例如,MD,DASH和MIND)可能有助于预防或减缓认知能力下降和AD进展。
研究表明,肠道菌群通过肠脑轴参与了AD病理。饮食会强烈调节和塑造肠道菌群,这可能是这些饮食模式改善肠道脑轴与AD相关的摄动的潜在机制之一。 对生活方式因素与AD相互作用的机械理解可以阐明生活方式模式的改变与AD患病率增加之间的联系,同时包括微生物群等对于宿主生活方式与健康之间的相互作用至关重要的因素。
对饮食,微生物群,生活方式和痴呆症之间的联系进行解码,将有助于揭示AD病理的潜在机制,同时有助于发现预防/治疗AD和相关痴呆及认知能力下降的新策略。
虽然该疾病目前无法得到根治,也无法逆转,但如果在早期就介入治疗,是可以有效延缓疾病的进程。
音乐
有观察表明,音乐疗法可以极大地帮助许多患有阿尔茨海默氏病的人,2019年3月发表在《神经科学前沿》上的一篇评论发现,音乐疗法可以改善行为,认知和社交功能-帮助缓解焦虑症和抑郁症。
对于许多患有阿尔茨海默氏症的人来说,正确的音乐疗法可以在恐惧和孤独的时候提供安慰、快乐。
“以某种方式、形式对音乐做出反应,无论是身体反应、情感反应、社会反应,还是认知反应”,来自伯克利音乐学院音乐治疗系主任乔伊认为,“我们知道痴呆患者的大脑受损,但对音乐作出反应的那部分似乎是最后消失的部分。”
音乐的镇静作用可以减少日常生活中产生焦虑的事件中的躁动,并使阿尔茨海默症患者及其护理者的过渡不那么令人焦虑。
精油
梅奥诊所称,当吸入精油时,它会刺激嗅觉感受器,嗅觉感受器通过中枢神经系统向边缘系统传递正(或负)信息。边缘系统是大脑控制情绪的部分。
梅奥诊所的从业者不会将精油涂抹在患者身上,而是用于供阿尔茨海默患者吸入。
当然吸入太多也不好。如果周围有太多的气味,就像用扩散器一样,使嗅觉系统饱和,甚至再也认不出这种气味了。所以不能过量使用。
几项小型研究表明,薰衣草精油可帮助改善痴呆症患者的行为并改善睡眠。柠檬香脂可以按摩到皮肤或吸入,在减轻压力和焦虑方面显示出优势。生姜精油缓解恶心症状。
但不推荐使用薄荷精油,较刺激,许多人会对它产生不良反应。
瑜伽
关于瑜伽及其对阿尔茨海默氏病的影响的研究在某种程度上是有限的,还远没有定论,但在阿尔茨海默氏症的护理中加入诸如瑜伽之类的补充方法,可能会有助于缓解该疾病的某些症状。
2018年2月发表在《神经生物学的压力》杂志上的一项研究综述指出,越来越多的证据表明,压力可能会对像阿尔茨海默氏症这样的神经退行性疾病的发展产生有害影响。
瑜伽具有潜在的好处,可以帮助减轻压力,平息躁动并改善整体情绪。
大多数针对阿兹海默症患者的瑜伽都是以缓慢,轻松的方式进行轻柔运动。上课时间通常比一般的瑜伽课短,一般持续10至30分钟。根据个人体能定制,老师从不强迫运动,并鼓励参与者做自己想做的事情。
一篇文章发表在2019年的《大脑可塑性》杂志上,发现瑜伽似乎对负责记忆和信息处理以及情绪调节的大脑关键区域具有积极作用。
游戏
大多数专家似乎都同意游戏本身并不能真正改变疾病的生物学或阻止阿尔茨海默氏症对大脑的破坏性作用。
但有研究人员认为,这使他们增加了进行更多社交互动的机会,这比游戏本身更重要,可以提高生活质量,并可能减少认知能力下降。
发表在2019年8月6日《神经病学》上的一项研究发现,精神刺激活动(例如使用计算机,玩游戏,制作手工艺品和参加社交活动)与年龄相关的记忆力丧失的风险较低或延迟有关。
研究发现,在中老年人参加社交活动,例如去看电影或与朋友外出,或玩填字游戏或纸牌游戏等游戏,发展轻度认知障碍的风险降低了20%。
当然也可能是因为有轻度认知障碍的人没有能力经常降低参加这些活动的机会,因此,需要进一步的研究来调查这些发现。
不同人喜欢玩不同游戏,同一款游戏多次重复也会无聊,以下多款游戏可供参考:
填字、拼图、数独、西蒙、Risk、Azul、Lumosity等。
肠道菌群检测
定期进行肠道菌群健康检测,可以了解该疾病风险,如果能在非常早期的时候及时发现,结合肠道菌群进行多种方式针对性干预(如饮食,益生菌,生活方式的调整等),可能会大大延缓病程。
主要参考文献
Kincaid HJ, Nagpal R, Yadav H. Diet-Microbiota-Brain Axis in Alzheimer’s Disease. Ann Nutr Metab. 2021 Apr 27:1-7. doi: 10.1159/000515700. Epub ahead of print. PMID: 33906194.
Prince M, Bryce R, Albanese E, Wimo A, Ribeiro W, Ferri CP. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers Dement. 2013 Jan;9(1):63–e2.
Alonso R, Pisa D, Fernández-Fernández AM, Carrasco L. Infection of fungi and bacteria in brain tissue from elderly persons and patients with Alzheimer’s disease. Front Aging Neurosci. 2018;10:159.
Szczechowiak K, Diniz BS, Leszek J. Diet and Alzheimer’s dementia: nutritional approach to modulate inflammation. Pharmacol Biochem Behav. 2019 Sep;184:172743.
Blum S, Aviram M, Ben-Amotz A, Levy Y. Effect of a mediterranean meal on postprandial carotenoids, paraoxonase activity and C-reactive protein levels. Ann Nutr Metab. 2006;50(1):20–4.
Mosconi L, Murray J, Tsui WH, Li Y, Davies M, Williams S, et al. Mediterranean diet and magnetic resonance imaging-assessed brain atrophy in cognitively normal individuals at risk for Alzheimer’s disease. J Prev Alzheimers Dis. 2014 Jun;1(1):23–32.
Morris MC, Tangney CC, Wang Y, Sacks FM, Bennett DA, Aggarwal NT. MIND diet associated with reduced incidence of Alzheimer’s disease. Alzheimers Dement. 2015 Sep;11(9):1007–14.
Nagpal R, Neth BJ, Wang S, Craft S, Yadav H. Modified mediterranean-ketogenic diet modulates gut microbiome and short-chain fatty acids in association with Alzheimer’s disease markers in subjects with mild cognitive impairment. EBioMedicine. 2019 Sep;47:529–42.
Bhattacharjee S, Lukiw WJ. Alzheimer’s disease and the microbiome. Front Cell Neurosci. 2013;7:153.

谷禾健康
焦虑,抑郁,双相情感障碍,这类词越来越多出现在我们的生活。
你也许不知道,饮食可以通过多种途径影响心理健康
即便知道了饮食干预可以改善抑郁,那么如何进行饮食干预呢?
饮食干预措施有好几大类,包括:营养干预措施(例如锌,omega-3脂肪酸);食品干预措施(例如绿茶,橄榄油);全饮食干预措施(例如地中海饮食)
什么样的饮食干预措施有效?
对哪些人有效?
在什么情况下有效?
……
要探索这些问题的答案
就需要了解支持这种关系的关键生物学机制。
将饮食与健康结果相关联的作用机制是复杂的,多方面的,相互作用的,并不局限于任何一种生物途径。
饮食可能影响心理和脑部健康的基本作用机制
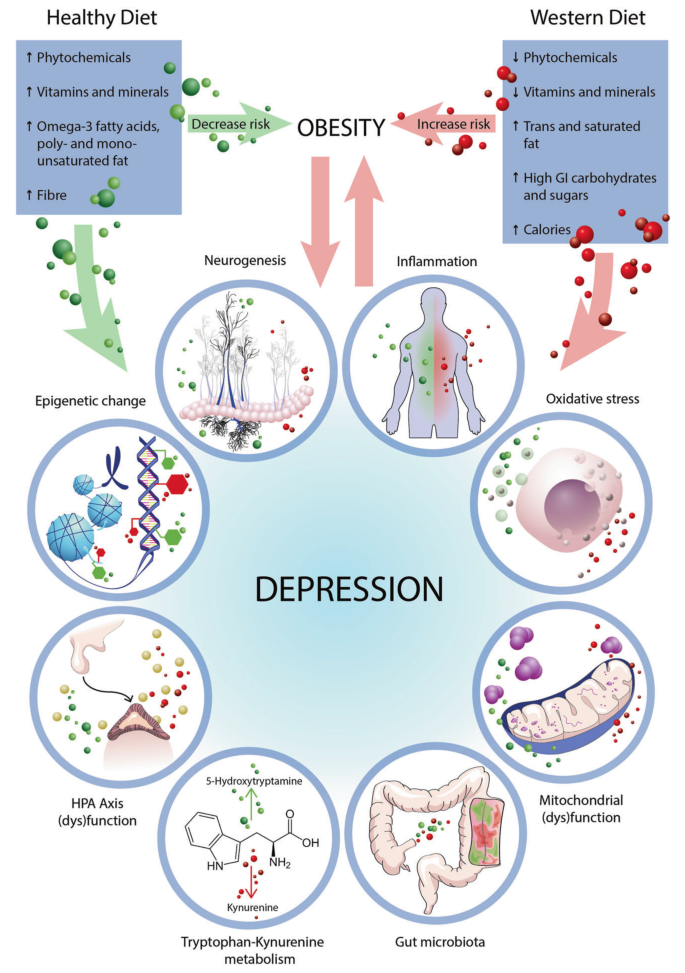
Wolfgang Marx,et al, Mol Psychiatry, 2020
有人说,抑郁和发炎有什么关系?
——大约25%的精神疾病患者(包括情绪障碍和精神分裂症)表现出较高的炎症水平。
炎症反应如何引起的?
免疫系统的这种过度激活是由多种因素引起的。生活中的困境,来自社会的压力,不良生活习惯(吸烟,缺少锻炼)等,都会引起炎症反应增加,从而促进抑郁症状。
典型的炎症反应包括三个主要成分:
炎症诱导剂(例如病原体或与受损相关的分子模式);
检测诱导物的传感器(例如免疫细胞表达的受体);
传感器诱导的炎症介质,包括细胞因子,趋化因子和前列腺素。
一旦被激活,这些炎症分子就可以影响与情绪障碍相关的生理领域,包括神经递质代谢,神经内分泌功能和大脑活动功能等。
抗炎剂可能辅助治疗抑郁症
用于医疗目的的细胞因子给药(如干扰素α注射)可引起情绪和行为的改变,例如情绪低落,疲劳,焦虑,睡眠障碍,快感缺乏和认知功能障碍,所有这些都与抑郁症的症状非常相似。Meta分析得出结论:抗炎剂,如细胞因子抑制剂、非甾体抗炎药和抗生素,包括米诺环素,可能是抑郁症的有效辅助治疗法。
健康饮食的抗炎特性
健康的饮食习惯(和单独的饮食成分)已显示出可能与精神疾病有关的抗炎特性。在慢性代谢疾病人群中进行的纵向观察研究和临床试验均表明,采用健康的饮食方式(例如地中海饮食)可以减少全身性炎症。
最近的研究还证实,患有严重精神疾病的个体比一般人群具有高得多的“饮食炎症”,即,促炎食物(如精制碳水化合物和反式脂肪)的摄入量较高,而抗炎食物的摄入量(主要来源于天然食品和植物)较低。
对纵向研究的Meta分析表明,具有炎性饮食模式的个体随着时间的推移发展为抑郁症的风险更大。
因此,促炎饮食改变为地中海或其他抗炎饮食模式,可能提供一种对抗与精神障碍的发作和严重程度相关的炎症状态的新策略。


抗炎食物
健康的饮食习惯会帮助摄入许多营养成分,可以减轻炎症。其中,蓝莓,可可和姜黄素等存在的植物化学物质(例如多酚)具有很强的抗炎特性,可能有助于治疗多种精神疾病。
Omega-3脂肪酸二十碳五烯酸和二十二碳六烯酸,多不饱和脂肪酸在鲑鱼等海洋食品中含量很高,具有抗炎特性,可以改善并延缓细胞因子诱发的抑郁症的发作。
氧化应激(氧化和抗氧化过程的不平衡)可能导致细胞对脂质,蛋白质和DNA的损伤。
持续的氧化应激是抑郁症和其他精神疾病的一种潜在的作用机制。
抑郁症氧化应激指标升高
对115项研究的Meta分析报告显示,与健康对照组相比,抑郁症患者的氧化应激指标(如丙二醛和8-F2-异前列腺素)升高,而抗氧化剂指标(如总抗氧化剂含量)较低。
此外,据报道抗抑郁药治疗后氧化应激标志物降低,证实了因果关系。一项验尸研究也显示,与健康对照相比,抑郁症、躁郁症和精神分裂症患者大脑中的氧化应激标志物升高。
除了氧化应激对细胞损伤的直接影响外,活性氧和氮的增加会导致线粒体功能障碍、炎症和色氨酸代谢改变,这些都与精神健康障碍有关。
西式饮食增加氧化应激的标志
饮食可以通过剥夺或增加具有抗氧化特性的饮食化合物的供应来加剧和改善氧化应激。动物研究表明,高脂肪西式饮食可以增加氧化应激的标志,如大脑和外周的蛋白质氧化和脂质过氧化反应。
提高膳食质量是可行的干预措施
营养丰富的饮食富含一系列具有直接和间接抗氧化特性的化合物,与氧化应激标志物(如f2 -异前列腺素和血浆氧化低密度脂蛋白)的降低有关。
维生素,例如抗坏血酸(维生素C)和α-生育酚(维生素E)具有直接清除自由基的特性。
营养素(例如硒,锌和半胱氨酸)是抗氧化剂系统(例如谷胱甘肽过氧化物酶和超氧化物歧化酶)的辅助因子。初步证据表明,补充抗氧化剂如n-乙酰半胱氨酸可以改善抑郁症状。
临床前研究表明,多酚还可以通过上调抗氧化防御系统来降低氧化应激,包括诱导核因子红细胞相关因子(Nrf)-2和调节炎症途径核因子κB(NFkB)和有丝分裂激活蛋白激酶(MAPK)。
肠道微生物群是饮食和大脑健康之间潜在的关键中介途径。
大量研究表明,肠道微生物群通过微生物群-肠-脑轴来调节生理过程,包括认知功能,神经精神疾病和行为。动物模型表明饮食、微生物群和与抑郁症相关的机制之间存在直接联系。
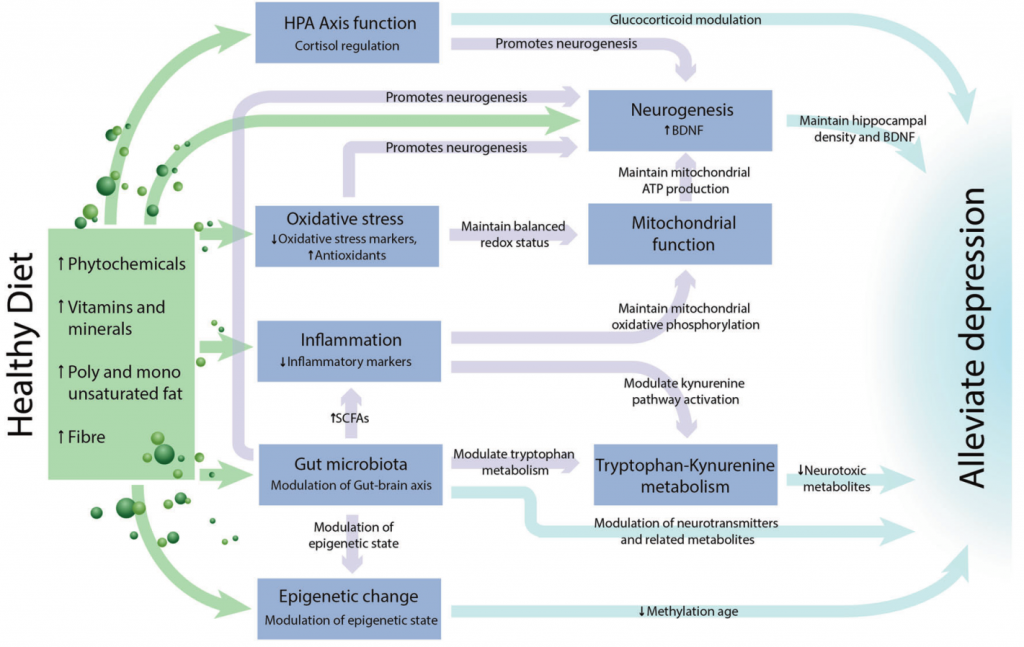

Wolfgang Marx,et al, Mol Psychiatry, 2020
高脂饮食导致焦虑样行为增加,记忆力下降
饮食引起的肠道微生物群的改变会导致行为改变,焦虑和抑郁。例如,在啮齿动物模型中,高脂肪西式饮食导致厚壁菌门/拟杆菌门比例增加,探索行为减少,焦虑样行为增加,记忆力下降。
其他临床前研究表明,高热量饮食会增加梭状芽孢杆菌 Clostridiales,疣微菌科 Ruminococcaceae 和拟杆菌目 Bacteroidales 的丰度,并导致认知灵活性较差,社会和物体识别能力受损。
益生元逆转慢性应激引起的肠道菌群变化
益生元补充剂(低聚果糖和低聚半乳糖)通过防止有益微生物(如双歧杆菌或乳杆菌)的减少,抑制正常的慢性应激诱导的促炎性细胞因子和小鼠的抑郁样行为的出现。
已经提出:肠道微生物群的多种直接和间接途径可以调节大脑功能和行为,包括微生物代谢产物(例如纤维细菌发酵产生的短链脂肪酸),神经元途径(例如迷走神经),神经活性途径(如5-羟色胺等神经递质和神经活性代谢物),下丘脑-垂体-肾上腺(HPA)轴,免疫和内分泌途径以及微生物群的直接神经活性代谢潜能。
饮食模式影响肠道菌群,影响情绪改变行为
短期营养摄入和长期饮食模式都是影响肠道菌群多样性,组成和代谢功能的因素。
迄今为止,只有一项不受控制的饮食干预研究的人类数据表明,富含菊粉的蔬菜饮食增加了双歧杆菌,导致饱腹感和个人能力水平的改善(但在情绪或感知压力方面没有差异)。

类似地,最近的一项研究表明,在老年参与者中,通过1年的地中海饮食干预,菌群变化与认知功能的改善和炎症标志物C反应蛋白和白细胞介素-17的减少有关。
营养素通过直接影响菌群调节大脑健康
例如,由肠道微生物群发酵膳食纤维产生的短链脂肪酸具有重要的免疫调节功能。这种关系也可能是双向的,肠道微生物群参与了这些化合物的生物利用度。
由此,我们可以想到,通过膳食补充剂(益生菌和益生元)和食物(例如发酵食品:泡菜,酸奶和酸菜等)来调节肠道菌群,以此作为调节菌群-肠-脑轴的一种手段。
益生菌和益生元
益生菌和益生元对精神健康影响的证据有限且变化很大。
研究表明,单独乳酸菌或与双歧杆菌联合使用——可能会改善抑郁和焦虑。
但也有Meta分析表明,与对照组相比,补充益生元后的抑郁或焦虑症状没有显著差异。然而,这是在大部分非临床参与者的有限样本(n = 4-5个)中进行的,一般来说,生物干预可能在临床参与者中显示疗效,而不是在非临床参与者中。
发酵食品是另一种具有操纵肠-脑交流的食品
研究表明,食用发酵食品后,有望改善情绪。由于益生菌的生存能力和可变定居能力,这可能解释了物种/菌株及其组合之间的效力不一致;包括各种植物食物来源的饮食模式,可能更有利于促进各种益生元底物和益生菌菌株消耗。

菌群通过食物过敏来介导饮食与大脑健康的联系
自我报告食物过敏在抑郁症患者中更为常见:
抑郁症vs.健康对照(13% vs. 9%)
真正的食物过敏,则饮食中的过敏原会触发胃肠道粘膜中肥大细胞的IgE致敏,导致一系列炎症介质,从而削弱肠道通透性。肠道通透性的提高与革兰氏阴性肠杆菌的易位性增强和免疫激活有关,可能导致全身性炎症,包括神经炎症,这是抑郁症的特征。
需要进一步对真正的食物过敏者进行大规模研究,以阐明其促进抑郁症的发展。对非IgE介导的食物超敏感(即食物不耐受)的研究(如麸质和酪蛋白),也可能揭示饮食诱导的肠道微环境变化如何影响情绪。
HPA轴由大脑(下丘脑),垂体和肾上腺组成,调节糖皮质激素的产生,并与精神疾病的病理生理有关。
超过60%的抑郁症患者表现出过多的皮质醇产生或对HPA系统产生其他干扰,例如对地塞米松抑制试验的反应改变和促肾上腺皮质激素水平降低。在临床恢复后,观察到HPA轴活性改变的一些指标的正常化,表明其在疾病病理生理学中发挥作用。
此外,儿童早期创伤可能会导致HPA轴永久失调,从而导致整个生命周期内出现精神疾病的风险增加。例如,与母亲分离的动物改变了HPA轴,从而表现出对成年期压力和记忆力障碍的反应。
营养素(例如维生素C)的临床干预试验报告显示,皮质醇对急性反应性降低健康成年人的生理压力。
Omega-3脂肪酸干预研究还表明,健康成年人和抑郁症患者的皮质醇水平都有改善。
同样,使用富含多酚的食物(如石榴汁和黑巧克力)进行的干预研究也报告了健康个体皮质醇水平的降低。


这种影响可能是通过心理应激后对下丘脑激活的促炎反应的调节而介导的。由于肠脑轴在心理健康中的新角色,益生菌也已被研究为针对HPA轴的潜在干预措施。
在健康成年人中进行的初步临床干预研究证实了这些结果。例如,在一项双盲,随机,对照试验中,与安慰剂相比,在健康个体中,多菌株益生菌干预24小时无尿皮质醇和自我报告的应激改善的结果。但在一项针对60名抑郁症患者的类似益生菌临床试验中,两组之间的血液皮质醇水平无显著差异。
成年海马体的神经发生水平与认知和情绪直接相关。
抑郁症患者的血清BDNF水平降低。
海马体是边缘系统的关键组成部分,在学习,记忆形成和情绪中起着核心作用。
啮齿类动物功能研究表明,成年海马体的神经发生水平与认知和情绪直接相关。例如,在小鼠中,海马神经发生水平增加与学习和记忆能力的改善有关,而海马神经元的减少通常与抑郁症某些方面行为有关。
BDNF(脑源性神经营养因子)是一种神经营养蛋白,在海马体中高度表达,并参与关键的细胞功能
确实,BDNF是典型的分子,可以解释饮食,运动和抗抑郁疗法对抑郁症和焦虑症行为的作用。重型抑郁症患者的血清BDNF水平降低,而BDNF对抑郁症发病机制的保护作用已获得了一些实验性支持。
证据表明,可以通过饮食调节BDNF和成人海马神经发生的调控。动物模型表明,高脂肪和高糖的西式饮食会损害神经发生并降低海马体内的BDNF水平,并对认知能力产生不利影响。
在动物模型中的大量研究表明,饮食成分(例如omega-3脂肪酸,益生菌和维生素)的有益作用。在精神病理,衰老和疾病的情况下,诸如白藜芦醇,蓝莓,绿茶,姜黄素和可可等多种多酚化合物,也已被证明可以逆转不良变化并保持成年海马神经发生的完整性。

此外,动物模型表明,其他饮食指标(包括卡路里摄入,进餐频率和进餐质地)可能会调节海马神经发生水平。
观察性研究提供了进一步的证据,表明健康的饮食习惯与较大的海马体积之间存在直接的联系,而不受多种解释因素(例如年龄,性别,教育程度)的影响。其他饮食范例,例如通过持续减少每日总食物摄入量或间歇性禁食(例如,每隔一天进食)来限制热量,也可能影响BDNF的表达。
最近的人类干预研究表明,西式饮食会损害海马依赖性学习和记忆能力。
当然,也可以通过本文中提到的其他途径,例如通过肠道菌群和炎症途径来调节神经发生。
色氨酸的主要生理途径是沿着犬尿氨酸途径,它会产生神经毒性的喹诺林酸和神经保护性的神经氨酸。
色氨酸是饮食中必须提供的一种必需氨基酸,是许多关键神经活性分子的重要组成部分。
在精神病学中,对色氨酸的可用性和代谢的关注主要集中在其转化为血清素,血清素是绝大多数抗抑郁药和一线抗焦虑药的治疗目标。
然而,色氨酸的主要生理途径是犬尿氨酸途径,它会产生神经毒性的喹诺林酸和神经保护性的神经氨酸。人们越来越多认识到导致犬尿氨酸产生增加的外周机制的重要性,并且认识到沿该途径产生的代谢物是一系列神经和精神疾病的重要神经生物学介质,包括但不限于抑郁症和精神分裂症。
此外,这种代谢级联反应的启动可能是由于压力或免疫系统和炎症途径的激活。这使得色氨酸在这一途径上的代谢可用性成为心理健康管理中的一个重要考虑因素。
我们日常生活中很多食物都含有色氨酸,包括鸡肉,金枪鱼,燕麦,花生,香蕉,牛奶,奶酪和巧克力。


尽管大部分来自摄入蛋白质的色氨酸都在小肠中吸收,但也还有大量可能到达结肠,肠道菌群在其命运和活动中起着关键作用。
在使用饮食干预措施进行心理健康预防和治疗的背景下,了解色氨酸的可用性和新陈代谢可能很重要。例如,增加的蛋白质摄入量可导致色氨酸的利用率增加,碳水化合物摄入量的变化会影响游离色氨酸的水平,非酯化脂肪酸可从生理上置换白蛋白中的色氨酸。
与色氨酸竞争通过血脑屏障运输的其他氨基酸的可用性波动也会影响中枢神经系统的代谢库。已经尝试了直接补充色氨酸作为抑郁症患者的一种干预措施,以改善血清素能信号传导。
还有一个研究调查了饮食干预通过其他方式调节尿氨酸代谢的作用,包括调节吲哚胺2,3双加氧酶(IDO)活性。体外和动物模型已经报道了个别的饮食成分,如姜黄素和绿茶,以及饮食方案,包括生酮饮食和禁食来调节尿氨酸途径的活性。
初步干预研究还表明,饮食方案,如热量限制和个人饮食成分,包括益生菌干预、白藜芦醇和红茶可能会调节尿氨酸代谢。例如,在最近一项针对60名抑郁症患者的试验中,与安慰剂相比,益生菌干预显著降低了尿氨酸水平,增加了3-羟基尿氨酸水平。
抑郁症的许多核心症状,如疲劳和认知障碍,都与中枢和外周线粒体功能障碍和生物发生减少相一致。
抑郁症和其他原发性精神疾病,包括双相情感障碍和精神分裂症一样,与线粒体功能障碍有关。
氧化磷酸化的破坏和线粒体ATP生成的受损可能导致神经可塑性失调和神经发生的减少,这两者都是抑郁症神经生物学的核心要素。
最近的一项研究显示,小鼠的线粒体移植恢复了海马体的ATP生成,逆转了脂多糖诱导的抑郁症模型,这一新证据支持了抑郁症的病理生理学因素。
大量临床前证据表明,不良饮食可能导致线粒体功能障碍。高脂饮食与线粒体生物发生异常有关,也与自由基生成增加、炎症和胰岛素抵抗有关。
高热量高碳水化合物饮食和高盐饮食有相似的作用,这些都是劣质西式饮食的核心成分。也有可能是由不良饮食引起的线粒体功能障碍的跨代遗传。在人类中,关于热量限制对线粒体功能的潜在有益影响,有不同的数据。
一些人类研究表明,限制热量的线粒体生物发生的标记物增加。
另一项研究显示,柠檬酸合成酶(一种线粒体含量的标志物)水平的提高和其他动物研究表明线粒体解偶联蛋白活性增强。到目前为止,还没有关于抑郁症患者热量限制的研究来测量线粒体功能障碍。


生酮饮食
有人提出了一种饮食模式来逆转线粒体功能障碍,特别是抑郁症患者从有氧到糖酵解能量的转变,就是生酮饮食。尽管在人类身上评估这一假设的临床试验仍在等待。生酮饮食增加线粒体解偶联蛋白的活性和水平。
注:生酮饮食(ketogenic-diet,简称KD)是一个超低碳,高脂肪饮食法。主要原理是用脂肪来替换碳水化合物,身体消耗完葡萄糖后,慢慢开始燃烧脂肪,给自己身体供能,身体慢慢进入生酮状态,最终,让身体进入一个高速燃脂的状态。
线粒体生物发生的改变在多大程度上介导了健康地中海饮食对抑郁症的有益影响尚不清楚。一些食物衍生物也有增加线粒体生物发生的假定作用,槲皮素,n -乙酰半胱氨酸和白藜芦醇都有一些支持的证据。
表观遗传过程可以影响DNA甲基化年龄,这与成年人的抑郁症有关以及许多其他神经发育结局和合并症,包括认知功能,酒精依赖,躁郁症和减少的海马体积,但不减少精神分裂症。
表观遗传学描述了在不改变基础DNA序列的情况下控制基因活性并使发育发生的分子机制。
极少有研究评估营养干预对甲基化年龄的影响,但已有研究发现其降低的证据。表观遗传状态受遗传序列,内部和外部环境以及发育过程中发生的随机过程的影响。产前发育,配子形成和青春期敏感时期的环境影响与患有与抑郁症有共同途径的慢性疾病风险有关,包括心脏代谢和神经发育障碍。这种现象被称为“健康与疾病的发展起源”(DOHaD)。
在DOHaD环境中,营养是对表观遗传学研究最多的环境影响因素。检验荷兰饥荒影响的研究表明,由于早期发育期间的营养不良,表观遗传失调与成人疾病风险有关。
很少有观察性的人类研究评估过表观遗传变化在介导早期营养对神经发育结局的影响中的作用,并且大多数是横断面的。最近的一项综述得出的结论是,有证据表明,某些早期营养摄入(例如母乳喂养和母亲肥胖)会影响表观遗传状态,进而可能介导儿童和青少年的心理病理学,例如内在化和外在化行为。
另外一项研究发现由于蛋白质和能量不足而在婴儿期住院的成年人在神经精神病风险基因中表现出DNA甲基化变化。体外细胞培养实验和啮齿动物研究表明,大量营养素的限制或过量存在对许多不同基因的多种表观遗传机制具有可再现的作用,包括与代谢和行为有关的基因。代谢扰动已成为基因组和表观基因组改变的驱动力,通过饮食,饮食中的影响得以保存在基因中。


营养丰富的饮食成分,包括叶酸,生物素,B6和B12等维生素;多酚,如姜黄素,白藜芦醇和染料木黄酮;脂肪酸和ω-3脂肪酸已通过多种机制影响表观遗传状态。此外,丁酸通常被认为是膳食纤维发酵过程中产生的有益微生物代谢产物,也可以影响宿主细胞的表观遗传状态。
饮食、情绪障碍和肥胖之间的多因素关系是双向和复杂的。Meta分析数据显示,肥胖症的男性和女性患抑郁症的风险增加55%,而抑郁症的个体患肥胖症的风险增加58%。
最近的一篇综述报道了饮食,情绪障碍和肥胖之间关系的几种相互关联的途径。途径包括HPA轴,其异常调节,过度活化以及糖皮质激素的过度合成和分泌与情绪障碍和肥胖症有关。
此外,研究表明接触高脂饮食(包括5-羟色胺和多巴胺)后,参与调节神经系统奖励回路,情绪和饮食摄入的各种神经递质水平降低。
为了减轻与压力有关的焦虑(由于被称为情感饮食和舒适食物的现象),长期压力和HPA轴过度活化可能导致过多食用西式食物和随后的肥胖。
在情绪障碍和肥胖症中都显示较高水平的炎症和相关细胞因子,提示其潜在病因之间存在另一个共同的联系。
在一项横断面研究中,肥胖在抑郁症与炎症标志物(即白介素6和C反应蛋白)之间的介导作用中,推测关系的因果关系是由抑郁症导致肥胖,炎症标志物升高。肥胖的这种发炎作用反过来推动体重增加和高复发率之间的关系。
不过这也说明了,限制热量和减肥饮食可能是减轻炎症状态和抑郁症状的可靠方法。同时,SMILES临床试验的结果表明,为期12周的地中海饮食干预对在没有体重变化的情况下降低临床抑郁症的症状。同样,前瞻性观察性研究反复报道了饮食质量与常见精神障碍之间的关联性证据,这些关联性与体重的测量无关。
性别差异也不能忽视
最近的一项Meta分析表明,饮食干预可能男性比女性受益。进一步的Meta分析显示,肥胖降低了男性患抑郁症的风险,而女性则增加了风险。可能有许多生物行为机制负责这种潜在的性别特异性效应,需要进一步研究。
首先,女性可能具有更大的改变脂肪或葡萄糖代谢的能力,以应对饮食干预。
其次, 男性在食物选择上更加以快乐为导向(这可能是由于多巴胺受体的差异所致),使得坚持健康饮食变得更加困难。
第三,男人更倾向于与男性气质相关的食物(例如红肉),而不是被认为更“女性化”的水果和蔬菜。
越来越多的证据支持饮食干预作为精神障碍的辅助治疗方法的潜在用途。本文主要讨论了饮食,肥胖和抑郁之间的相互作用(9种途径),当然饮食也可能通过其他慢性疾病影响抑郁,这些疾病通常与抑郁并存,包括糖尿病,代谢综合征和心血管疾病。
营养精神病学领域还处于萌芽状态。现有文献主要是临床前动物研究。还需要进一步的研究来确定可能影响饮食干预措施和饮食习惯的个体因素(例如年龄,BMI,共病),行为(例如改变的动机)和生物学(例如氧化应激,炎症)因素,可能影响治疗反应的因素等。
营养精神病学研究领域的扩展,使人们了解在什么情况下,哪类干预,适合什么人,为精神疾病患者制定新的针对性策略和临床指南,更加个性化地解决每个人的需求。
如果你深陷抑郁,请寻求专业治疗;
如果你朋友抑郁,那么请记得尊重。
相关阅读:
最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用
参考文献:
Lassale C, Batty GD, Baghdadli A, Jacka F, Sanchez-Villegas A,Kivimaki M, et al. Healthy dietary indices and risk of depressiveoutcomes: a systematic review and meta-analysis of observational studies. Mol Psychiatry. 2019;24:965–86.
Khalid S, Williams CM, Reynolds SA. Is there an associationbetween diet and depression in children and adolescents? Asystematic review. Br J Nutr. 2016;116:2097–108.
Borge TC, Aase H, Brantsæter AL, Biele G. The importance ofmaternal diet quality during pregnancy on cognitive and behavioural outcomes in children: a systematic review and metaanalysis. BMJ Open. 2017;7:e016777.
Hepgul N, Pariante CM, Baraldi S, Borsini A, Bufalino C,Russell A, et al. Depression and anxiety in patients receivinginterferon-alpha: the role of illness perceptions. J Health Psychol.2018;23:1405–14.
Köhler‐Forsberg O, Lydholm CN, Hjorthøj C, Nordentoft M,Mors O, Benros ME. Efficacy of anti‐inflammatory treatment onmajor depressive disorder or depressive symptoms: meta‐analysis of clinical trials. Acta Psychiatr Scand. 2019;139:404–19.
Rapaport MH, Nierenberg AA, Schettler PJ, Kinkead B, CardoosA, Walker R, et al. Inflammation as a predictive biomarker forresponse to omega-3 fatty acids in major depressive disorder: aproof of concept study. Mol Psychiatry. 2016;21:71–9.
Borsini A, Alboni S, Horowitz MA, Tojo LM, Cannazza G, SuKP, et al. Rescue of IL-1beta-induced reduction of human neurogenesis by omega-3 fatty acids and antidepressants. BrainBehav Immun. 2017;65:230–8.
Reichelt AC, Loughman A, Bernard A, Raipuria M, Abbott KN,Dachtler J, Van TT, Moore RJ. An intermittent hypercaloricdiet alters gut microbiota, prefrontal cortical gene expression andsocial behaviours in rats. Nutritional neuroscience.2020;23:613–27.
Long-Smith C, O’Riordan KJ, Clarke G, Stanton C, Dinan TG,Cryan JF. Microbiota-gut-brain axis: new therapeutic opportunities. Annual review of pharmacology and toxicology. 2020;60(Jan):477–502.
Marx Wolfgang,Lane Melissa,Hockey Meghan et al. Diet and depression: exploring the biological mechanisms of action.[J] .Mol Psychiatry, 2020
Liu RT, Walsh RF, Sheehan AE. Prebiotics and probiotics fordepression and anxiety: a systematic review and meta-analysis ofcontrolled clinical trials. Neuroscience & BiobehavioralReviews. 2019;102(Jul):13–23.71. Aslam H, Green J, Jacka FN, Collier F, Berk M, Pasco J,Dawson SL. Fermented foods, the gut and mental health: amechanistic overview with implications for depression andanxiety. Nutritional neuroscience. 2020;23(Sep):659–71.
Lerner BA, Green PH, Lebwohl B. Going against the grains:gluten-free diets in patients without celiac disease—worthwhileor not? Dig Dis Sci. 2019;64:1740–7.