-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
真菌感染
真菌病原体正迅速崛起为全球公共卫生体系中最具挑战性的威胁之一,其引发的抗真菌耐药性问题日益严峻。每年,真菌感染影响数亿人,并导致约160万例死亡,其致病范围从浅表皮肤感染到危及生命的侵袭性疾病,尤以免疫功能低下患者为重。其中白色念珠菌(Candida albicans)、新型隐球菌(Cryptococcus neoformans)和烟曲霉(Aspergillus fumigatus)已被世界卫生组织列入重点优先监测病原体名单。
目前临床上可用的抗真菌药物主要局限于唑类、多烯类和棘白菌素类这三大类别,这一有限的药物谱系难以满足日益复杂的临床需求。并且耐药株的持续出现和积累,使传统药物的疗效显著下降,部分病例甚至对联合治疗方案也产生抵抗。
此外,真菌生物膜的形成进一步加剧了治疗难度。真菌生物膜是一种由真菌细胞附着在宿主组织或医疗器械表面形成的结构,外包裹复杂的细胞外基质(ECM),为真菌提供了物理与化学双重屏障。研究显示,生物膜中的真菌对抗真菌药物的耐受性可提高多达一千倍,导致感染顽固复发,并显著增加了住院时间和医疗成本。
面对这一挑战,科研界正积极探索创新治疗策略,包括靶向生物膜结构的药物、旧药新用及天然产物疗法。这些新兴方法展示出克服耐药性、破坏生物膜完整性与提升抗真菌疗效的潜力。深入理解真菌病原体的耐药机制,并结合多样化的干预手段,有望为未来开发更为高效、低毒的抗真菌疗法奠定基础,从而开辟对抗真菌生物膜相关感染的新局面。
真菌感染已成为全球重要的公共卫生问题,其中白色念珠菌(C.albicans)、新型隐球菌(C.neoformans)和烟曲霉(A.fumigatus)是最主要的病原体。
白色念珠菌普遍存在于人体黏膜,当宿主免疫功能下降时可引起侵袭性感染,其毒力源于形态转换和生物膜形成;新型隐球菌则以多药耐药性和持久生物膜为特征,已导致多起医院暴发;烟曲霉是免疫受损患者中侵袭性曲霉病的主要致病菌,能够形成致密菌丝生物膜并产生耐药突变。
生物与非生物上的真菌感染
Elgammal Y,et al.Crit Rev Microbiol.2025
生物膜可以在生物或非生物表面形成。生物感染发生在人体组织和器官上(例如脑,引起隐球菌性脑膜炎;口腔,引起口腔念珠菌病;肺部,引起肺曲霉菌病;皮肤,导致持续性皮肤感染;血液,引起侵袭性念珠菌病;非生物感染发生在植入式医疗器械(例如起搏器、导管等)上。 心脏装置)、假肢(例如人工关节或植入物)和气管插管。
白色念珠菌及治疗方法
白色念珠菌是一种常见于人体粘膜表面的真菌。但在免疫功能低下者中可过度生长并转变为致命的机会性病原体,导致侵袭性念珠菌病。
它是医院感染的主要原因,造成约15%的败血症病例和40%的血流感染。其毒力与酵母形态和菌丝形态之间的可逆转换密切相关,菌丝形式中更高含量的几丁质可提供额外的结构强度与环境保护。
• 生物膜促进真菌黏附并提高其抗性
生物膜的形成由细胞壁黏附素介导,使真菌黏附于宿主组织和医疗器械表面。发育成熟的生物膜以丝状菌为主,形成坚固的三维结构并大量产生胞外基质(ECM)。β‑1,3‑葡聚糖是其中的关键成分,可隔绝抗真菌药物并抑制中性粒细胞活化,从而增强真菌对先天免疫的抵抗力。随着生物膜相关感染和非白念珠菌种在医院中的增加,评估和改进现有治疗策略至关重要。尤其是耳念珠菌(C.auris),已成为全球多药耐药院内感染的重要来源。
真菌生物膜形成阶段
Elgammal Y,et al.Crit Rev Microbiol.2025
上图说明了三种医学上重要的真菌:白色念珠菌、新型隐球菌和烟曲霉的生物膜形成过程,经历了四个不同的阶段:
(1) 酵母/丝状细胞粘附到表面;
(2) 真菌细胞生长成薄层细胞并发育成微菌落,烟曲霉细胞发芽形成菌丝网络;
(3) 通过发育成熟具有细胞外基质的生物膜结构;
(4) 真菌细胞从生物膜中分散,促进其他位点的定植。
• 部分念珠菌已具有耐药性,急需开发新疗法
目前的主要抗真菌药物包括唑类、多烯类和棘白菌素类。
多烯类(如两性霉素B)通过与麦角甾醇结合并形成细胞膜孔道发挥广谱杀真菌作用,但在生物膜条件下效力显著下降,且其肾毒性限制了临床使用。
唑类药物以阻断麦角甾醇生物合成为作用机制,毒性较低,但白念珠菌近年来对其耐药性逐渐增强。
棘白菌素通过抑制细胞壁β‑葡聚糖合成,对生物膜更具靶向性,其良好的疗效和安全性使其成为念珠菌感染治疗的一线药物。然而,FKS基因突变已导致部分菌株对棘白菌素耐药。
部分临床分离的念珠菌已表现出泛耐药性,对目前三大类抗真菌药物均无效,并能形成持久的生物膜,进一步强化其耐药性。这凸显出研发新型抗真菌药物和改进现有疗法的迫切需求。
注:尽管移除受感染植入物仍是治疗生物膜感染的常用手段,但该方法风险高、成本大,进一步强调了开发更安全有效疗法以应对白色念珠菌生物膜感染的紧迫性。
生物膜相关真菌病原体的关键耐药机制
Elgammal Y,et al.Crit Rev Microbiol.2025
这些机制主要包括:
(1) 细胞外基质充当物理屏障,阻碍抗真菌药物渗透至生物膜内部;
(2) 外排泵转运蛋白在生物膜形成早期上调,主动排出药物,降低细胞内浓度并促进耐药性;
(3) 持久细胞处于代谢休眠状态,对药物高度耐受,使生物膜在治疗中存活并可在压力解除后再生;
(4) 其他机制如应激反应、细胞密度、化学环境和靶点蛋白过度表达等,也进一步增强了生物膜的耐药性。
新型隐球菌及治疗方法
新型隐球菌(C.neoformans)又名溶组织酵母菌,是土壤,鸽类,牛乳、水果等的腐生菌,也可侵犯人体。新型隐球菌是导致免疫功能低下个体脑膜脑炎的主要原因之一。
• 新型隐球菌可形成脑部生物膜样结构
其毒力主要源于由葡糖醛酸甘露聚糖(GXM)组成的多糖荚膜。GXM不仅调节宿主免疫反应,也是生物膜形成的关键成分,对生物膜结构的建立起重要作用。新型隐球菌可形成脑部生物膜样结构,使感染更具持续性和治疗难度。耐药机制的出现进一步削弱了现有疗法的效果,凸显出开发新型抗真菌策略以针对其生物膜的必要性。
• 当前治疗方法对生物膜感染效果有限
当前推荐的治疗方案为脂质体两性霉素B联合5-氟胞嘧啶诱导治疗,之后以氟康唑维持,用于肺隐球菌病及隐球菌性脑膜炎。该方案对浮游状态的新型隐球菌有效,但对生物膜内菌株疗效显著下降。
此外,氟康唑相关耐药病例中发现ERG11基因突变,该基因编码唑类药物靶标酶14α-脱甲基酶,导致药物敏感性降低。这些问题凸显了迫切需要新型疗法以有效靶向并控制新型隐球菌生物膜感染。
烟曲霉及治疗方法
烟曲霉是一种机会致病真菌,是侵袭性曲霉病的主要致病因子,尤其危害免疫功能低下者。其致病机制与形成致密交织的菌丝型生物膜能力密切相关,该生物膜经历多阶段发育过程。
烟曲霉广泛分布于环境中,因其强适应性、高效空气传播及能抵达远端气道而成为重要病原体。此外,它可形成由菌丝团构成的局部感染——曲霉瘤,进一步促进生物膜相关感染,可通过曲霉病患者的支气管肺泡灌洗液检测到。
• 目前主要以三唑类药物治疗,但也出现耐药性
目前,烟曲霉感染的主要治疗药物为三唑类(如伏立康唑、伊曲康唑、泊沙康唑和艾沙康唑)及两性霉素B。虽然这些药物对敏感菌株疗效良好,但多地已报告三唑类耐药菌株的出现,严重影响疗效并带来公共卫生风险。
耐药机制主要包括cyp51A基因突变(改变唑类靶点)及外排泵过度表达(降低药物浓度)。当出现唑类耐药时,两性霉素B常作为一线替代药物使用,其脂质体制剂因毒性较低正日益应用于临床。
针对耐药菌株的联合治疗显示出潜在疗效,例如棘白菌素与泊沙康唑或艾沙康唑联合使用可能产生协同作用,但相关临床证据仍有限。与唑类和多烯类不同,棘白菌素作用于真菌细胞壁,特异性高,且有助于减少交叉耐药性。然而,日益增加的耐药性与治疗选择受限依然是临床难题。应通过加强抗真菌药物管理、常规监测耐药性,并开发新型或改良制剂以提升治疗安全性和有效性。
新型抗真菌药物的研发对于应对系统性和生物膜相关真菌感染具有关键意义,因为现有治疗手段在面对耐药性和生物膜屏障时往往效果有限。通过开发能够有效穿透或破坏真菌生物膜的新型药物,可以显著增强抗真菌治疗的渗透性和杀菌效率,从而改善患者预后并降低感染复发风险。
这些新兴疗法的研究重点在于结合药理活性与生物膜干预机制,以突破传统药物难以到达感染核心区域的限制。在此背景下,我们系统评估这些潜在药物在临床重要真菌所致生物膜感染及系统性疾病治疗中的应用前景,深入探索其作用机制、疗效表现及潜在的临床转化价值,为未来抗真菌治疗策略的优化提供科学依据。
白色念珠菌的新型疗法
由于白色念珠菌在医院感染中的高发病率,针对其生物膜的抗真菌药物成为重点研究方向。
• Rezafungin(雷扎芬净)药效时间长
Rezafungin是FDA批准的第二代棘白菌素,具有改良的药代动力学特性。其半衰期高达130小时,可实现每周一次给药而非每日给药。Rezafungin能破坏白色念珠菌生物膜形成,降低成熟生物膜的代谢活性和厚度,并抑制菌丝生成,活性优于氟康唑。
• Ibrexafungerp药效更明显,且可减少耐药
Ibrexafungerp是一种源自恩夫曼芬的半合成三萜类药物,是首个具有高组织分布和优良口服生物利用度的葡聚糖合酶抑制剂。它对包括白色念珠菌在内的多种致病真菌具有广谱活性,已获FDA批准用于治疗外阴阴道念珠菌病。尽管其作用机制与棘白菌素相似,但因结合位点部分不同,可避免交叉耐药。体外研究表明,Ibrexafungerp在0.25 µg/mL即可使生物膜代谢活性降低50%,而氟康唑需超过256 µg/mL才能达到相同效果。
• Fosmanogepix削弱白色念珠菌的毒力因子
Fosmanogepix是一种由前体药物转化而来的新型抗真菌剂,经碱性磷酸酶激活为Manogepix。目前其治疗念珠菌血症和侵袭性念珠菌病的III期临床试验正在进行中。该药通过抑制肌醇乙酰转移酶Gwt1干扰真菌细胞壁合成,从而削弱白色念珠菌的黏附、菌丝化和生物膜形成等毒力因子。其>90%的口服生物利用度和广谱抗真菌活性显示出作为新型系统感染治疗药物的潜力。
• Turbinmicin降低生物膜代谢活性
从海鞘微生物组中发现的Turbinmicin能靶向Sec14蛋白,对白色念珠菌生物膜表现出优异活性。Sec14在生物膜基质的囊泡递送中起关键作用。Turbinmicin通过抑制囊泡输出破坏基质形成,并在极低浓度下显著降低生物膜代谢活性。
动物实验显示,其在2.5 µg/mL时即可减少生物膜衍生菌落约2 log₁₀,在10 µg/mL时可完全清除感染导管,展现出在医疗器械相关感染中的高应用潜力。
针对不同细胞途径的新型抗真菌药物的作用机制
Elgammal Y,et al.Crit Rev Microbiol.2025
• 四唑类新药有更高的选择性并降低对宿主毒性
此外,四唑类新药如VT‑1161(奥替瑟唑)和VT‑1598代表第四代唑类抗真菌药,具有对真菌CYP51酶更高的选择性(约2000倍)并显著降低宿主毒性。
VT‑1161已获FDA批准用于治疗复发性外阴阴道念珠菌病,VT‑1598则在白色念珠菌、耳念珠菌及隐球菌感染模型中均表现出良好疗效。
多重耐药白色念珠菌,尤其是形成生物膜的菌株,给临床治疗带来严峻挑战。新型抗真菌药物的出现为现有疗法提供了有效替代方案,不仅展现出更强的抗真菌活性,还能靶向生物膜特异性机制,克服传统治疗的局限。
未来需继续通过系统研究和临床试验验证其有效性与安全性,以期改善侵袭性念珠菌感染的治疗效果。
隐球菌的的新型疗法
虽然新型隐球菌整体耐药率较低,但近年对氟康唑的耐药性日益引起关注,约有10–30%的临床分离株表现出敏感性下降。同时,其对氟胞嘧啶的耐药性也不断增加,这正是临床常将其与两性霉素B联合使用的主要原因之一。
氟胞嘧啶耐药主要源于fcy1、fcy2和fur1基因突变,这些基因分别编码胞嘧啶脱氨酶、胞嘧啶通透酶和尿嘧啶磷酸核糖基转移酶。突变会阻碍药物的摄取与代谢,阻断5‑氟胞嘧啶向其活性形式5‑氟尿嘧啶的转化,从而削弱抗真菌效果。相比之下,对两性霉素B的耐药性较低。
值得注意的是,这些耐药性评估多基于浮游状态的菌体,未充分考虑隐球菌生物膜对药物的天然抗性。此外,真菌对唑类药物的固有耐药性进一步强调了开发新型靶向疗法的必要性,以减少对传统两性霉素B与氟胞嘧啶方案的依赖。
• Fosmanogepix也对新型隐球菌表现出显著抗菌作用
除对白色念珠菌的活性外,Fosmanogepix也通过抑制真菌细胞壁合成对隐球菌表现出显著抗真菌作用。其Gwt1抑制剂衍生物的MIC低至0.004 µg/mL。在隐球菌性脑膜炎小鼠模型中,Fosmanogepix显著降低了肺部和脑部真菌负荷,尤其在与氟康唑联合应用时效果更佳,显示出增强疗效和克服耐药的潜力。
新型隐球菌耐药性的上升表明开发新一代抗真菌药物迫在眉睫,尤其针对生物膜相关感染。隐球菌自身致密且富含多糖的基质,加之血脑屏障的限制,使脑部感染极难清除,需要长疗程治疗,而复发仍更为常见。Fosmanogepix等新兴疗法为此类顽固感染提供了新的希望。
未来,需通过系统的体内实验与严格的临床试验,全面评估并优化这些新型药物的疗效,以期为隐球菌性脑膜炎带来更有效的治疗方案。
烟曲霉的新型疗法
尽管抗真菌治疗取得显著进展,但烟曲霉仍是重要且难治的致病真菌,尤其危及免疫功能低下患者。其对现有抗真菌药物的耐药性及复杂的生物膜结构,凸显了对新型治疗手段的迫切需求。目前,多种新型抗曲霉药物正处于不同临床开发阶段,具有多样的作用机制和制剂形式,为临床治疗提供了新的可能。
• Olorofim抑制早期生物膜形成
Olorofim(F901318)是一种处于III期临床试验的抗真菌药,对包括烟曲霉在内的多种难治真菌感染有效。它抑制早期生物膜形成(4小时内减少约66.4%),虽对成熟生物膜作用有限,但强调了早期干预的重要性。
Olorofim通过抑制真菌二氢乳清酸脱氢酶(DHODH)阻断嘧啶合成,具有极低脱靶风险。其对唑类和两性霉素B耐药菌仍具活性,在大量临床分离株中未发现固有耐药。药物口服吸收良好,半衰期20–30小时,可穿越血脑屏障并分布于肺、肝、肾组织,每日一次服用耐受性佳,仅有轻度胃肠不适。
但需注意其与唑类药物可能存在拮抗作用。此外,对具有相似作用机制的农业杀真菌剂异氟醚喹的耐药性,可能促进其临床耐药风险。
• Opelconazole专门针对肺部烟曲霉感染
Opelconazole(PC945)是一种吸入型三唑类抗真菌药,专为肺部烟曲霉感染设计。其强亲脂性使药物可在肺内蓄积,即使停药后仍保持活性,表现出持久局部效应与低系统暴露。
该特性为高风险人群(如肺移植受者)提供了潜在的预防性治疗选择,但其对烟曲霉生物膜活性的研究仍不充分,尚需进一步验证。
• Ibrexafungerp对曲霉也有广谱抗性
Ibrexafungerp除对白色念珠菌有效外,对曲霉也具广谱活性。在侵袭性肺曲霉病实验模型中,与艾沙康唑联用表现出协同作用,提高生存率并降低肺组织损伤。在一项针对难治性或不耐受真菌感染(包括侵袭性肺曲霉病)的III期研究中,其成功率为46.2%,并涵盖生物膜相关病例,显示出临床应用潜力。
在这里总结了这些新兴药物的药代动力学、剂量与安全特征。
Elgammal Y,et al.Crit Rev Microbiol.2025
新型药物也存在一些限制
尽管这些化合物极大拓宽了抗真菌药物储备,但从实验室到临床的转化仍面临挑战。由于真菌与人体在主要代谢通路上的高度保守性,一些有效抑制真菌生长的药物也可能对宿主细胞产生毒性,加之药物相互作用风险,使得复杂用药患者群体(如免疫低下者)更易受不良反应影响。
此外,许多新药受限于药代动力学和药效学特征,如口服吸收差、组织渗透性不足或中枢神经系统分布有限,削弱了其在系统性或侵袭性真菌感染中的应用潜力。高昂的研发成本与严格的审批流程亦增加了临床转化难度,尤其对结构复杂的天然产物而言更为显著。因此,在药物开发早期整合药理学、临床与经济学考量,并采用创新研究设计,将是推动抗真菌新药成功转化的关键。
• 根据生物膜阶段选择合适的药物
为进一步理解这些药物对生物膜的作用机制,可根据其干预生物膜生命周期的阶段(如粘附、萌发或成熟)进行分类。
阻断早期粘附或代谢活动的药物可防止生物膜形成,如唑类和四唑类(氟康唑、奥替康唑、VT‑1598)通过抑制麦角固醇合成削弱膜功能、减少表面定植。
而针对已形成的生物膜,则需药物具备穿透或破坏胞外基质(ECM)的能力。两性霉素B与棘白菌素在此阶段仍具一定效力,但作用有限。新型葡聚糖合酶抑制剂及Turbinmicin等则能直接靶向基质运输与ECM结构,对成熟真菌生物膜展现出更强活性。
药物再利用,是指将原本用于治疗其他疾病、已获批准或正在研发的药物,重新用于治疗真菌感染的一种策略。它的核心理念是:“旧药新用”——基于已有的药物安全性、药代动力学以及临床数据,探索其潜在的抗真菌活性,从而发现新的治疗方案。
药物再利用为发现新的抗真菌疗法提供了有前景的途径,尤其针对由白色念珠菌、新型隐球菌和烟曲霉等引起的生物膜相关感染。该策略具有高性价比优势,且大多数已用于人体的药物其毒性特征明确,安全性可控。通过高通量筛选及现有药物协同效应的研究,科研人员能够加速抗真菌治疗的创新与开发。
再利用的药物治疗白色念珠菌
白色念珠菌的生物膜相关感染常与导管使用有关,对传统抗真菌治疗具有显著耐受性。药物再利用被视为克服这一挑战的有前景策略。
• 依布硒啉有效抑制白色念珠菌生物膜形成
依布硒啉(Ebselen)是一种合成有机硒化合物,原用于治疗听力损失、美尼尔病及SARS‑CoV‑2感染,具有显著的抗真菌潜力。其通过模拟谷胱甘肽过氧化物酶活性,保护细胞免受活性氧伤害,并以中和自由基发挥神经保护作用。在8.96 µg/mL浓度下,依布硒啉即可有效抑制白色念珠菌生物膜形成,对多重耐药的耳念珠菌亦有类似活性。
• 环孢菌素A、匹伐他汀等也表现出对念珠菌生物膜的抑制作用
环孢菌素A作为抑制IL‑2合成的免疫抑制剂,能恢复氟康唑的疗效并增强对白色念珠菌生物膜的抑制。降胆固醇药物匹伐他汀通过抑制HMG‑CoA还原酶,与氟康唑联合表现出明显的抗生物膜协同作用,提示其主要影响生物膜形成过程。
此外,5‑羟色胺再摄取抑制剂如舍曲林和氟西汀也表现出抗生物膜活性,无论单用或与氟康唑联用均能增强抗真菌效果。这些研究强调了药物再利用作为一种实用、经济的策略,可拓展对白色念珠菌及其生物膜相关感染的治疗手段。
• 动物研究已验证部分再利用药物的疗效
部分再利用药物已在动物模型中验证疗效。例如,用于治疗类风湿性关节炎的含金抗炎药金诺芬在小鼠导管感染模型中,于3 µg/mL和10 µg/mL时均显著减少白色念珠菌生物膜。与抗原生动物药喷他脒联合使用时,金诺芬对成熟生物膜表现出协同效应。
高通量筛选还发现多种具有抗生物膜活性的药物,包括阿维菌素、苯溴马隆、盐酸育亨宾、佐替平和双羟萘酸吡咯烷铵,均对白色念珠菌具有抑制作用。
此外,真菌线粒体复合物I组分NDU1被确定为新的抗真菌靶点。FDA批准的抗蠕虫药氯硝柳胺在2 µg/mL时即可抑制NDU1并破坏成熟生物膜。将其制成纳米颗粒后,在小鼠口咽和外阴阴道念珠菌感染模型中显著降低了舌部与阴道的真菌负荷。这类NDU1抑制剂突出显示了通过靶向线粒体功能和破坏生物膜保护性基质来突破真菌防御的潜力。
再利用的药物治疗新型隐球菌
新型隐球菌生物膜因对标准抗真菌治疗的高度耐药性,仍是治疗中的主要难题。药物再利用揭示了多种非抗真菌药物对其具有显著活性,为治疗提供了新的方向。
• 联合使用时可能具有更强的抗生物膜作用
其中,抗结核药物如异烟肼和乙硫异烟胺可使隐球菌生物膜代谢活性降低约50%。当二者与氟康唑或伊曲康唑联合使用时,产生明显协同效应,对成熟生物膜的作用优于单独使用唑类药物。
甲苯咪唑是一种抗寄生虫药,也表现出强效的抗隐球菌活性,在0.0156µM浓度下可显著减少隐球菌生物膜形成并根除成熟生物膜。此外,甲苯咪唑与阿替霉素B联合使用时,两种化合物在较低MIC下均表现出抗隐球菌活性。
• 精神药物氟哌啶醇也减少隐球菌生物膜形成
抗精神病药物对新型隐球菌具有抗真菌活性。特别是氟哌啶醇,主要用于治疗精神分裂症和图雷特综合征,具有抗真菌活性。特别是氟哌啶醇衍生物化合物B10在2µg/mL时可有效减少隐球菌生物膜形成≥80%,并与氟康唑协同作用,显著降低小鼠脑真菌负荷。
这些发现凸显了药物再利用作为对抗新型隐球菌生物膜的有效策略的潜力,为以更短的研发时间和更低的成本扩大现有抗真菌药物库提供了一条有前景的途径。
再利用的药物治疗烟曲霉
三唑类耐药烟曲霉株的流行率持续上升,尤其是能形成坚固生物膜的菌株,凸显出开发替代疗法的紧迫性。
• 新鱼腥草素钠可减少生物膜并使其变薄
源自鱼腥草素的新鱼腥草素钠(SNH)传统上因抗菌特性在亚洲广泛使用。SNH通过干扰烟曲霉类固醇合成途径,抑制麦角固醇生成。XTT还原实验显示,SNH在1×MIC时可使成熟生物膜减少约20%,在4×MIC时减少约80%。显微镜观察发现,其显著缩短菌丝并使生物膜变薄。此外,经SNH治疗的曲霉感染小鼠其真菌负荷、组织损伤及促炎因子水平均显著下降。
• 双胍类化合物等也能够抑制真菌增殖
双胍类化合物Alexidine dihydrochloride(AXD)对白色念珠菌、新型隐球菌及烟曲霉均具抗真菌活性。在1.5–6 μg/mL浓度范围内,AXD能通过抑制真菌的丝状化与增殖,完全破坏成熟烟曲霉生物膜。
同时,抗利什曼病药物米替福新(Miltefosine)也表现出抑菌作用,其通过干扰鞘脂生物合成并对唑类耐药株依然有效。转录组学结果表明,米替福新通过SmiA转录因子调控鞘脂途径相关基因,而鞘脂分析进一步证实处理突变株的鞘脂水平显著降低。
另有研究发现螺吖啶衍生物,原以抗利什曼病与抗肿瘤作用闻名,可作为几丁质酶抑制剂,显示其作为生物膜靶向抗真菌候选物的潜力。
小结
药物再利用为开发更高效、低毒且经济的抗生物膜策略提供了新思路。这些化合物与现有抗真菌药联合应用可能产生协同效应。对其抗真菌活性及联合疗法的持续研究,加之优化给药方式,有望改善生物膜相关感染的治疗并有效应对日益严峻的耐药挑战。
除了药物治疗外,天然产物在应对真菌生物膜方面同样扮演着重要角色。长期以来,天然产物一直是抗真菌药物发现的重要宝库,凭借其天然来源的丰富化学结构和独特活性,提供了与合成化合物截然不同的多样性和创新性。相比人工合成的药物,天然化合物往往具有更复杂的分子骨架和多重作用机制,这使其在破坏真菌生物膜结构、抑制其形成及干扰信号传导等方面展现出独特优势。
随着真菌对现有抗真菌药物耐药性的持续上升,传统治疗手段的有效性逐渐下降,促使科学界重新关注天然产物这一重要资源。近年来,来自植物、微生物乃至海洋生物等多种天然来源的化合物被系统研究,显示出显著的抗真菌和抗生物膜活性。一些研究揭示,这些天然化合物不仅能够影响真菌细胞壁组成和代谢通路,还可能作为潜在的药物先导物,为新型抗真菌治疗策略的开发提供了坚实基础。
具有抗真菌生物膜活性的天然产物
Elgammal Y,et al.Crit Rev Microbiol.2025
1
维生素可减少白色念珠菌生物膜
维生素已成为易于获取的抗生物膜剂。维生素D3在60微克/毫升的浓度下可将白色念珠菌生物膜的形成减少高达88%,其半抑制浓度(IC50)为7.5微克/毫升,通过干扰核糖体生物发生和代谢途径来发挥作用。
它不仅在0.4至0.8毫克/毫升的浓度下降低新型隐球菌生物膜的代谢活性,还能防止粘附,从而限制生物膜的形成。此外,维生素C或抗坏血酸也表现出抗生物膜作用,但其机制与维生素D不同。
2
精油具有抗真菌生物膜的作用
精油对白色念珠菌和新型隐球菌的生物膜具有显著的抗真菌作用。百里香和牛至油中的主要成分百里香酚与香芹酚可有效降低生物膜的粘附性与代谢活性。将精油与抗真菌药物联合使用能增强后者的疗效。
例如,桉树油成分桉树醇可与两性霉素B、制霉菌素及伊曲康唑产生协同作用,通过降低这些药物对白色念珠菌生物膜的MIC提升抗真菌效能。其他精油,如椰子油、茶树油和菜籽油,也表现出抑制白色念珠菌生物膜的潜力。
3
中草药活性成分同样具有抗真菌作用
中草药也被广泛应用于对白色念珠菌和新型隐球菌生物膜的治疗。其中,青蒿素作为FDA批准的抗疟药,可通过调控白色念珠菌生物膜相关基因,抑制菌丝形成。
丹皮酚源自牡丹根皮,具有抗炎及多靶点抗真菌活性。在4和8 mg/mL浓度下,丹皮酚能抑制白色念珠菌菌丝生长,破坏新型隐球菌成熟生物膜,并削弱其荚膜和黑色素的生成,显示出多重抗毒性机制。
此外,多种植物来源化合物如姜黄素、胡椒碱和生姜也表现出对白色念珠菌生物膜的抑制作用。然而,由于其药代动力学性质较差,体内血浆浓度低且半衰期短,难以达到有效水平。其他天然产物如大蒜、肉桂、石榴和蔓越莓提取物同样展现出一定的抗真菌活性,为开发新的抗生物膜策略提供了潜在方向。
4
抗真菌肽和靶向热休克蛋白抑制剂
抗真菌肽已成为治疗真菌感染(包括新型隐球菌)的有效药物。源自酿酒酵母的SP1抗真菌肽在16 µM浓度下可使新型隐球菌生物膜生物量减少86.4%,代谢活性降低96.9%,并在64 µM时使成熟生物膜代谢活性下降73.6%。同样,来源于家蝇的AMP-17肽在64 µg/mL下可分别降低生物膜生物量和代谢活性78%与86%。这些结果显示出新型抗隐球菌生物膜肽的巨大潜力。
根霉酚是一种从镰刀菌属(Fusarium)中提取的天然Hsp90抑制剂,对新型隐球菌的MIC为1–2 µg/mL。尽管单独使用时对生物膜活性有限,但与氟康唑或伊曲康唑联合后表现出协同作用,可显著抑制成熟生物膜的形成。这表明Hsp90抑制剂作为佐剂,具备增强现有抗隐球菌疗法效果的潜在价值。
注:靶向热休克蛋白(Hsp),尤其是Hsp90作为毒力因子,能增强新型隐球菌的抗药性与致病性,并参与多糖荚膜的分泌,对生物膜形成至关重要。
5
其他具有抑制烟曲霉能力的物质
Plakortide F酸(PFA)是一种来源于海洋的聚酮内过氧化物,可通过破坏细胞钙稳态诱导细胞死亡,对烟曲霉具有显著抑制作用。研究还发现,PFA能激活钙调神经磷酸酶依赖的反应元件,表明其干扰了酵母关键的钙信号传导通路。
顺式-9-十六烯醛是一种具备抗烟曲霉生物膜活性的植物来源化合物,在0.078 mg/mL时可抑制真菌生长,在0.156 mg/mL时表现出显著的抗生物膜效应。扫描电子显微镜观察显示,其可导致烟曲霉生物膜大面积破坏,表现为胞外基质缺失及菌丝受损,效果优于烟曲霉素B。细胞毒性实验表明,该化合物对白色肺上皮细胞(L‑132)毒性较低,安全性良好。
天然产物作为自然界中丰富且复杂的化学资源,依然是一片尚未被充分开发的潜力领域,在抗真菌感染的研究与治疗中展现出广阔前景。这些来源于植物、微生物或海洋生物的化合物往往具有多样的生物活性和独特的作用机制,能够干扰真菌的生长、粘附及生物膜形成。
通过与现有药物协同作用,提高药物的生物利用度或降低真菌的耐药性,从而显著增强整体治疗效果。同时,其免疫调节特性有助于激发或强化宿主自身的防御机制,为机体提供额外的保护屏障。正因如此,天然产物不仅为抗真菌研究提供了新的思路,也为防治真菌生物膜相关感染开辟了更具前景的治疗途径。
针对真菌生物膜的治疗手段并不仅仅局限于传统的抗真菌药物或天然产物,还探索了多种具有潜力的替代疗法。这些新兴策略旨在弥补现有治疗的局限性,为真菌生物膜相关感染提供更多元化和更有效的干预途径,从而拓展抗真菌治疗的整体思路与应用前景。
1
光动力疗法
光动力疗法使用一种光敏剂,其被特定波长的光激活,目的是产生活性氧(ROS),这导致微生物细胞损伤和死亡。(维生素B2)和金丝桃素,它们是在贯叶连翘中发现的蒽醌衍生物。核黄素和金丝桃素被蓝色和黄橙色光激活,并且已经证明了在降低真菌生物膜形成的活力方面的显著功效。然而,由于ROS具有潜在毒性,该技术仍需进一步研究与优化。
2
防止医疗器械表明真菌定植
改变医疗器械的表面是防止真菌定植的关键。例如,在不锈钢医疗器械上进行银亚胺处理可抑制白色念珠菌生物膜的定植约82%,无哺乳动物毒性。钛植入物上的石墨烯涂层也被证明可以显著减少真菌粘附。
其他防止医疗器械上真菌生物膜形成的涂层包括之前提到的聚氨酯静脉导管上的壳聚糖和咪唑鎓盐共轭聚(L-丙交酯)。
3
使用疫苗防止真菌感染
疫苗为防治真菌生物膜提供了一种替代策略,可靶向生物膜形成相关抗原或诱导针对真菌细胞壁的广泛免疫应答。新型疫苗NDV‑3A(处于Ⅱ期临床试验阶段)能够诱导产生抗rAls3p抗体,从而抑制白色念珠菌与内皮细胞的粘附和侵入,并在导管小鼠模型中有效防止中心静脉生物膜形成。
此外,真菌细胞壁碳水化合物也是极具潜力的免疫治疗靶点。糖缀合疫苗和针对β‑葡聚糖及甘露聚糖的单克隆抗体在临床前研究中均展现出保护效果,并筛选出多种有望开发的候选抗体。尽管目前尚无疫苗获批用于预防真菌感染或生物膜形成,但研究仍在积极推进中,目标是开发出能够有效防控真菌感染的新型疫苗。
4
结合疗法效果更好
真菌生物膜的预防可通过将抗真菌药物、新型小分子或肽与材料表面修饰相结合来实现。例如,与单独的钛相比,卡泊芬净涂层钛片可完全抑制真菌附着;β‑环糊精与咪康唑联合应用于医疗器械后,白色念珠菌生物膜减少约90%。
鉴于真菌对常规抗真菌剂的高耐药性,小分子和肽类物质被广泛用于防止生物膜形成。其中,白色念珠菌在生物活性玻璃(耳蜗植入体)、牙科树脂(义齿)和硅胶(导管)上的粘附分别减少99%、77%和60%。
真菌生物膜感染依然是临床医学中最复杂且最具挑战性的问题之一。现有抗真菌药物虽然仍是治疗的核心手段,但其疗效受到多重限制——包括毒性高、药物渗透性不足以及抗药性风险增加。尤其在生物膜相关感染中,由于细胞外基质的屏障作用与多重耐药机制的存在,传统药物的效果大幅削弱。这不仅凸显了研发新型抗真菌药物的迫切性,也强调了探索能够有效干预生物膜形成与维持机制的创新策略的重要意义。
近年来,新一代抗真菌药物的研发、旧药再利用及天然产物的研究展现出显著潜力。药物再利用提供了一种低成本、低风险且可直接进入临床应用的途径,而天然化合物作为药物或辅助剂,能在防止生物膜形成和抑制其生长方面发挥重要作用。这些新策略的出现,为应对真菌系统性感染与生物膜相关感染提供了新的可能性。
除传统药理学方法外,多种跨学科创新技术正加速推进抗真菌治疗的革新。例如,光动力疗法、表面功能化与抗黏附涂层、以及基于纳米技术的药物递送系统,为从病灶源头预防和根除真菌生物膜提供了全新思路。这些手段不仅能增强药物靶向性与局部浓度,同时降低宿主毒性。值得注意的是,这些新兴疗法在白色念珠菌、新型隐球菌及烟曲霉等医学关键病原体中均展现出广谱抗真菌活性。
未来,抗真菌领域正迎来转变。通过整合分子靶向药物、天然产物、智能材料与纳米技术,有望实现对真菌生物膜的精准破坏与再感染预防。同时,应以患者安全与疗效为核心导向,构建兼顾个体化与精准治疗的综合策略,以延缓甚至防止真菌耐药性的进一步扩散。随着多学科融合与临床应用的推进,这些新一代疗法有潜力显著改善抗真菌治疗的临床结局,并最终在保障患者安全的同时,重塑真菌感染防治的新格局。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Elgammal Y, Garcia Martinez RI, Requejo A, Martinez LR. Current and emerging therapies for fungal biofilms and systemic infections. Crit Rev Microbiol. 2025 Oct 10:1-20.
Agbadamashi DJ, Price CL. Novel Strategies for Preventing Fungal Infections-Outline. Pathogens. 2025 Feb 1;14(2):126.
Buil JB, Oliver JD, Law D, Baltussen T, Zoll J, Hokken MWJ, Tehupeiory-Kooreman M, Melchers WJG, Birch M, Verweij PE. Resistance profiling of Aspergillus fumigatus to olorofim indicates absence of intrinsic resistance and unveils the molecular mechanisms of acquired olorofim resistance. Emerg Microbes Infect. 2022 Dec;11(1):703-714.
Kirchhoff L, Dittmer S, Furnica DT, Buer J, Steinmann E, Rath PM, Steinmann J. Inhibition of azole-resistant Aspergillus fumigatus biofilm at various formation stages by antifungal drugs, including olorofim. J Antimicrob Chemother. 2022 May 29;77(6):1645-1654.
Sutar Y, Nabeela S, Singh S, Alqarihi A, Solis N, Ghebremariam T, Filler S, Ibrahim AS, Date A, Uppuluri P. Niclosamide-loaded nanoparticles disrupt Candida biofilms and protect mice from mucosal candidiasis. PLoS Biol. 2022 Aug 17;20(8):e3001762.
Vassiliou E, Awoleye O, Davis A, Mishra S. Anti-Inflammatory and Antimicrobial Properties of Thyme Oil and Its Main Constituents. Int J Mol Sci. 2023 Apr 8;24(8):6936.
Yang L, Tian Z, Zhou L, Zhu L, Sun C, Huang M, Peng J, Guo G. In vitro Antifungal Activity of a Novel Antimicrobial Peptide AMP-17 Against Planktonic Cells and Biofilms of Cryptococcus neoformans. Infect Drug Resist. 2022 Jan 25;15:233-248.
Liu Y, Zhang Y, Zhao X, Lu W, Zhong Y, Fu YV. Antifungal Peptide SP1 Damages Polysaccharide Capsule of Cryptococcus neoformans and Enhances Phagocytosis of Macrophages. Microbiol Spectr. 2023 Mar 14;11(2):e0456222.

谷禾健康

自古以来,中医就有“药食同源”的理念,强调食物与药物之间的内在联系,认为许多食物既可作为日常饮食,又具有调治疾病的作用。随着现代科学的发展,这一古老的智慧得到了新的诠释和应用,逐渐发展成为今天的营养大健康行业的重要组成部分。
药食同源的理念,源于对自然界植物、动物等观察和长期实践。在古代,人们发现某些食物在特定情况下能够缓解或治疗某些症状,这些食物因而被赋予了药用价值。例如,生姜被用来缓解感冒症状,大枣用来滋补身体,这些实践在现代医学中也得到了相应的科学解释和验证。
然而,药食同源的意义远不止于此,它还涉及到食物与人体之间复杂的相互作用,以及食物如何通过影响人体内部环境,特别是肠道菌群,来发挥其健康效益。
近年来,随着研究的深入,人们逐渐认识到肠道菌群对人体健康的重要性。它不仅参与食物的消化和营养吸收,还与免疫系统、神经系统以及许多代谢过程密切相关。因此,肠道菌群的健康状态直接影响到个体的健康状况,而饮食则是影响肠道菌群组成的主要因素之一,这一发现为个性化营养提供了新的视角。
个性化营养的兴起,标志着营养学从“一刀切”的群体指导向“量身定制”的个体化服务转变。在这一过程中,药食同源的概念被赋予了新的生命。通过结合现代营养学、微生物学、分子生物学、数据科学等多学科知识,个性化营养能够更精准地满足个体在不同生理阶段、不同健康状况下的营养需求。这种基于个体差异的精准营养干预,有望提高营养建议的依从性和有效性,从而更好地促进健康和预防疾病。
本文从药食同源的基本概念出发,探讨其在现代营养学中的应用,分析肠道菌群与健康的关系,特别是在肠道菌群检测技术日益成熟的背景下,如何将传统理念与现代科技相结合,为人们提供更科学、更有效的健康解决方案。这里展示药食同源在大健康行业中的潜力和前景,同时指出面临的挑战和未来的发展方向。
在这个营养大健康行业的新时代,我们可以更深入挖掘药食同源的科学意义,利用现代科技手段,为人们提供更加精准、个性化的营养服务。这不仅是对传统智慧的传承和创新,更是对未来健康生活方式的探索和引领。期待能够为营养学界、健康产业等带来相关启示。
本文目录
01 药食同源
药食同源的定义、特点、物质
传统中医中的药食同源理论
现代科学中的药食同源
02 营养基因组学与药食同源:个性化健康新纪元
03 什么原因导致不同个体之间的效果差异?
04 如何实现个性化干预?
肠道菌群参与活性成分的生物转化
药食同源成分调节肠道菌群(多糖、多酚等)
药食同源物质通过肠道菌群影响疾病
消化系统疾病、肝病、内分泌疾病、
神经精神疾病、心血管疾病、其他
05 药食同源干预和开发的注意事项
药食同源-循证依据
如何监测其效用?
药食同源技术创新
展望
药食同源,这一概念最早源于中国古代的医学典籍,其核心思想是某些物质既可以作为日常食物,也可以作为药材使用,即“药食同源”。
在中医理论中,这一理念体现了食物与药物之间的内在联系和相互转化的可能性。
在现代,药食同源的定义得到了进一步的扩展和科学化。它不仅包括了传统意义上的食疗,还涵盖了食物中活性成分的研究、功能性食品的开发以及营养与健康的密切关系。药食同源的物质通常指的是那些在自然界中既可以食用,又具有一定的药理作用,能够在不造成副作用的前提下,通过日常饮食来维护或改善健康的植物、动物或矿物。
▼
药食同源物质的特点
安全性:这些物质应当是长期被人类食用,且对人体没有明显毒性或副作用的。
功能性:含有能够对人体健康产生积极影响的生物活性成分,如多糖、黄酮、皂苷、挥发油等。
营养性:提供必要的营养素,如维生素、矿物质、蛋白质、膳食纤维等。
可食性:这些物质应当能够以食物的形式被人体消化吸收,且在口感、风味上能够被接受。
药食同源的物质在中医中有着广泛的应用,如黄芪、当归、枸杞、山药等,它们既可作为食材加入日常饮食,也可作为药材用于疾病的治疗和调理。
在现代,随着科学研究的深入,越来越多的药食同源物质被发掘和验证,如大蒜、生姜、绿茶、蓝莓等,其健康益处得到了科学界广泛认可。
药食同源的物质 例如:
传统“药食同源”理念的智慧和现代营养学、食品技术的进步,使得药食同源材料,如益智仁、川贝母、苦茶、桂皮、灵芝、生姜、银杏、鱼腥草、甘草、百合、枸杞、黑胡椒、紫苏、茯苓、马齿苋、薏仁、枸杞、大枣等在医药、普通膳食、功能食品和保健品中的应用日益广泛,即从2002年的 86 种增加到2021年的 110 种。

doi: 10.1016/j.jare.2023.05.011
在传统中医中,药食同源理论是一种深植于中国几千年文化和医学实践中的核心理念。中医认为,人体是一个整体,与自然环境息息相关,疾病的产生与人体内外环境的失衡有关。因此,中医治疗的目标是恢复和维持身体的平衡状态,即“阴阳平衡”。在这一理论体系中,食物不仅仅是满足基本营养需求的物质,更是调节身体、预防和治疗疾病的天然药物。
食物的性味归经
中医认为食物具有“四气”(寒、凉、温、热)和“五味”(酸、苦、甘、辛、咸),这些特性决定了食物对人体的作用和影响。
– 寒凉性食物通常具有清热、泻火的作用,适合于热性体质或热性疾病的患者;
– 温热性食物则有温中、补阳的功效,适用于寒性体质或寒性疾病的患者。
此外,食物还根据其对人体脏腑经络的作用被归入不同的“经”,如心经、肝经、脾经等,通过食物的归经特性,可以针对性地调节相应脏腑的功能。
传统中医强调“辨证施食”
根据个体的体质、疾病状态和环境因素来定制饮食方案。这种方法体现了中医个体化治疗的特点,认为没有一种食物或药膳适合所有人。因此,中医会根据患者的具体情况,调整饮食结构,推荐适合的食物和药膳,以达到最佳的治疗效果。例如,某些温热性的食物可能对寒性体质的人有益,但对热性体质的人则可能造成不适。
传统“药食同源”思想的主要特征是:
药食相隐、辨证施食、阴阳平衡、五脏滋养调理、防治结合、顺应自然、适可而止、适度食用。
这些思想体现了一种深度融合医学理论、兼顾个体差异、强调食物与药物功能相辅相成、追求整体平衡与自然和谐的饮食观念。这一理念在当今社会仍然具有重要的指导意义,对提高民众健康意识、倡导健康生活方式有着积极的影响。
现代“药食同源”饮食理念,是在继承和发扬传统“药食同源”思想的基础上,逐步融入了现代遗传学、代谢和营养学理论、生物医学和临床研究成果、先进的工具和技术,以及实际的社会生活经验等。
在中药材理念的基础上,一条集食品、保健品和药品于一体的紧密产业链已经形成。这条产业链不仅包括中药的生产和分销,还包括药食同源食品和营养补充剂的发展。桑葚和枸杞的兴起表明传统和现代健康领域的成功融合。
2022 年,桑葚被创新地用于保健茶,成为药食同源市场中增长最快的成分,价值超过 300 亿元人民币。
枸杞已从中老年人的传统保健选择转变为年轻人中流行的保健元素,预计到 2023 年消费量将达到 138 万吨,市场规模将达到 653 亿元人民币。
由于基因、环境、生活方式等因素的差异,同一种药食同源物质在不同人群中可能产生不同的效果。
例如,大枣这种药食两用的果实,在传统医学中被用于补气养血、安神益智。然而,现代研究发现,大枣的这些效果可能因个体差异而有所不同:
随着人们对健康的追求日益个性化,“药食同源”理念也在不断演变。现代的药食同源不仅包括传统的食疗,还涵盖了功能性食品的开发以及营养与健康的密切关系研究。
然而,这种演变也带来了新的挑战:如何在保持药食同源物质整体效用的同时,实现真正的个性化应用?
融合东西方饮食文化、借助最新技术
融合东西方饮食文化和医疗实践甚至调和/推进两者的现代“药食同源”饮食在当今世界越来越受欢迎。借助人工智能、大数据等新兴技术,基于“药食同源”的个性化营养建议、健康饮食/保健建议、智能饮食生活计划、定制食谱提示、定制膳食建议等远程营养咨询服务应运而生,这将使“药食同源”的体验更具吸引力。

科技赋能传统智慧
全基因组关联研究的进展,包括表观基因组学、代谢组学、转录组学、蛋白质组学和微生物组分析技术(如 DNA 下一代测序)在内的先进“组学”技术等技术突破,使个体营养需求、遗传状况和肠道菌群分布得到全面分析,可以快速识别涉及基因-饮食相互作用的遗传变异及其与各种疾病的潜在联系,从而使“药食同源”饮食更加个性化和精准,从而提高饮食和生活方式建议的有效性。
总的来说,现代“药食同源”的主要特征包括:
科学性、循证性、精准性、标准化、功能性、多样性、生态化、可持续化、智能化、数字化、教育普及化、跨学科协作化、跨文化、国际化。
换言之,现代“药食同源”是一套将传统“药食同源”智慧与现代智能技术、先进的食物、人类和地球知识深度融合的饮食原则,旨在满足当代社会对健康、营养、精神健康、便利性和环境可持续性以及地球健康的多方面饮食需求。
正是在这样的背景下,营养基因组学应运而生。这一领域的出现,为我们理解和应对药食同源效果的个体差异提供了全新的视角和工具。下一章节,我们来探讨营养基因组学如何推动药食同源理论的发展,开启个性化健康的新纪元。
随着人们对饮食及其影响健康的潜力的认识和了解不断增长,导致了营养基因组学出现。
营养基因组学
营养基因组学作为一门新兴的学科,它研究了基因与饮食之间的相互作用,以及如何通过个性化的饮食干预来优化健康。
营养基因组学于 2001 年首次提出,旨在研究食物与遗传基因之间的关系,已应用于开发支持健康和降低饮食相关疾病风险的食品或饮食。
来自世界各地的 1,072 条与营养基因组学相关的研究文献显示,营养基因组学使个性化饮食方法能够恢复体内平衡并消除与饮食相关的疾病,提供了一系列工具来深入了解可能影响基因、蛋白质组或代谢组水平的主要途径以及肠道微生物群和相关代谢物对人类健康的潜在贡献,并提供了重要见解。
通过营养基因组学的研究,可以发现不同人群对药食同源物质的代谢和反应差异,从而为个性化营养提供依据。例如,某些人群可能对某种药食同源物质的代谢能力较弱,需要适当调整摄入量;而另一些人群可能对某种药食同源物质的反应较为敏感,需要谨慎使用。
个性化营养理念与现代人的健康需求不谋而合
现代人更加意识到通过健康的生活方式来预防疾病。人们需要安全、营养充足、身体、精神和情感健康、环境可持续、经济公平和负担得起、文化可接受的食品和饮食。
近年来出现的“个性化食品/饮食”、“个性化营养”、“主动健康”和“天然功能性食品”等术语都反映了人类对基于个人基因、微生物群和生活方式的特定饮食/食品的需求日益增加。
因此,具有特定健康促进特性和定制产品形式的超级成分和功能性食品产品的普及预计将在全球范围内进一步增加。
药食同源物质的机会
自 2023 年以来,人们寻求从方便食品/餐食中获得有意识的享受,这进一步模糊了正餐和零食之间的界限。这为药食两用材料/物质提供了巨大的机会,它们可以作为额外的“补充”加入/强化各种零食类消费食品/餐食,提供维持/促进健康、预防/治疗疾病和延长寿命的效果。
科学知识、现代加工技术和生物技术、组学技术和创新的生物信息学工具的进步,为实现”为人类生命和健康量身定制食品/饮食”提供了可能。这与中医”药食同源”理念的智慧不谋而合,后者强调了”预防”高于”治疗”的首要地位,强调了人与自然的相互影响,以及每个人健康的独特性。
这些理念的现代体现就是”主动护理“或”主动健康”的趋势。
“主动护理”的趋势,重塑可持续健康管理
主动护理(也称为主动健康)是 2019 年疫情以来的主导趋势,在 2020-2021 年成为更为重要的服务模式。在新冠疫情期间和之后,“食物作为药物提供天然的功能”再次得到强调,并得到了显著加强。
人们希望在早期阶段增强对生活压力和不可预测疾病和状况的抵抗力,改善全身健康状况,提高生活质量,延迟和减少进一步医疗和住院治疗的需求,并建立更可持续、更高效的卫生和社会护理体系,从而推动主动护理的转变。
“更安全、温和”的趋势
同时,越来越多的人开始追求更安全、更温和的治疗。预防保健应运而生,以促进生活质量和更健康的生活方式,提倡及早发现健康问题。
当然它也有缺陷,包括不同社会经济群体之间资源可及性的差异、个人的依从性以及不可预见的健康风险和疾病的风险。
根据世界卫生组织(WHO)的数据,草药为全球一半以上的人口提供了初级卫生保健的基础。食物和传统药物的综合使用(例如“人体阴阳平衡和气调”的思想),而不是单独使用药物/药物,已成为古代和现代正常人和亚健康人群预防保健的趋势。

药食两用的水果举例:龙眼
龙眼就是一个很好的例子,它是一种药食两用的水果。龙眼在中国和日本传统医学中用于补心健脾、养血安神,以及治疗健忘、失眠、气血不足等症状。
现代研究表明,龙眼通过抑制NF-κB 和 AP-1 信号通路来抑制脂多糖刺激的巨噬细胞一氧化氮的产生,其多糖能提供免疫调节作用。
在小鼠实验中龙眼能够增强学习和记忆能力(部分由脑源性神经营养因子表达和未成熟神经元存活介导),并改善认知能力、减轻病理损伤 [部分通过抑制RAS/丝裂原活化蛋白激酶(MEK)/细胞外信号调节激酶(ERK)信号通路介导]。
药食同源理论和个性化营养的发展为我们提供了全新的健康管理视角。然而,在实际应用中,有些人可能对龙眼的免疫调节作用特别敏感,而另一些人则可能在认知功能改善方面受益更多。
这不仅关系到药食同源理论的实际应用效果,也是个性化营养和精准医疗领域的核心挑战。要回答这个问题,我们需要深入探讨导致个体差异的多种因素,包括遗传背景、生活环境、饮食习惯、肠道菌群等。
要回答这个问题之前,我们先了解一下有哪些食物或者说药材及其成分。
2020年,国家卫健委、国家市场监督管理总局联合发布的《关于开展党参等9种按传统既是食品又是中药材的物质管理试点工作的通知》指出:
众多药食同源的中药材中含有当归、八角、豆蔻、丁香、小茴香、白芷、地茯苓、火麻仁、人参、人参果、人参叶、山楂、马苋菜、刀豆、甘草、人参、木瓜、梅干、白果、山药、木薯等84种成分。
这些药食同源物只要使用得当,几乎没有任何危险的副作用,且含有生物碱、长链脂肪酸、多酚、多糖、蛋白质、三萜类化合物、有机酸和维生素等生物活性物质,具有抗氧化、抗炎、抗菌、抗癌、抗高血压、增强免疫力和保护肾脏等多种生理功能。
例如,枸杞含有丰富的维生素C、维生素E、矿物质和多糖,具有增强免疫力和抗氧化能力,促进患者康复的功效。
现代科学研究:药食同源物质中的活性成分
现代科学研究揭示了许多传统药食同源物质中的活性成分,如多酚类、黄酮类、皂苷类、生物碱等,这些成分具有抗氧化、抗炎、抗菌、抗病毒等多种生物活性。例如:
正如我们所了解的,药食同源物质含有多种生物活性成分,这些成分对健康有着广泛的影响。然而,这些成分在不同个体中的作用效果会有差异。这种差异性主要是由以下因素造成的:
遗传差异
药食同源物质含有多种成分,个体基因的不同会影响这些成分的代谢途径。例如,某些人可能有更高效的酶来代谢这些成分,从而影响其效果。有些人可能对某些药食同源物质更敏感,即使是很小的剂量也可能产生显著效果。例如,某些人对大蒜中的蒜素特别敏感,可能会有更强烈的生理反应。
健康状况
个体的健康状况,特别是肝脏和肾脏功能,对药食同源物质的代谢和排泄至关重要。例如,肝脏功能不佳可能会影响甘草中甘草酸的代谢,进而影响其抗炎效果。
年龄和性别
不同年龄和性别的人可能对药食同源物质有不同的反应。随着年龄的增长,新陈代谢减慢可能会影响某些成分的效果。
生活习惯
饮食、运动、睡眠和压力管理等生活习惯也会影响药食同源物质的效果。例如,高脂肪饮食可能会影响绿茶中儿茶素的吸收,而规律运动可能增强黄芪的抗疲劳效果。
剂量
药食同源物质的剂量也会影响其效果,不同个体可能需要不同的剂量以达到最佳效果。例如,不同个体对人参的敏感性不同,所需的最佳剂量也会有所不同。
药食同源成分——相互协同作用
中医认为这些同源植物具有“四气”(寒、热、温、凉)和“五味”(酸、苦、甘、辣、咸),有助于调节人体各方面的机能和阴阳平衡,相互促进和制约,促进脏腑功能和气血协调,从而预防或治疗疾病。例如:
张锡纯在《中西医结合》一书中指出:“食疗既治病又充饥,既充饥又可口,对症下药,病自然会慢慢好,即使不对症下药,也不会有其他问题。”
这些思想强调食疗与药疗的协同作用,在现代依然适用,比如说:
药食同源物质/成分中的营养成分和生物活性物质是可靠的,在人类治疗某些健康状况或疾病方面有着悠久的安全历史,副作用较小,尤其适用于慢性病的长期治疗。这些药食同源物质/成分的组合应经过量身定制,以最大限度地发挥其对人体阴阳平衡和免疫力的调节作用,以达到治疗某些疾病或在药物治疗过程中起到辅助作用。
基于这些药食同源物种的特点,对食物和药物进行个性化选择,可以使两者共同发挥作用,提高药物的疗效和生物利用度,同时抵消部分药物引起的不良反应。
肠道菌群不仅参与消化过程,帮助我们分解食物中的营养素,还参与了药物和食物成分的代谢,影响其生物利用度和效果。
因此,当我们考虑药食同源物质对每个人效果的差异时,必须将肠道菌群作为一个关键因素纳入考量。
个性化的营养和健康管理策略应当考虑到个体的肠道菌群组成,以及它们如何与药食同源物质相互作用,从而优化这些天然资源的健康效益。
不同的厨师用同样的食材,可以做出不同口味的菜肴,那么同样,不同人的身体体质,基础条件,代谢能力等都不一样,药食同源物质活性成分发挥的效果就不一样。这些差异不仅体现在生理和遗传层面,还涉及到很重要的——肠道微生物群。不同的肠道菌群可能通过不同的代谢途径处理相同的活性成分,产生不同的代谢产物。
肠道菌群会分泌出一些酶,这些酶能够改变这些天然材料的结构。一旦结构被改变了,这些天然材料的物理化学性质和生物活性也会跟着变化,这样的变化能让它们在身体里发挥更好的治疗效果。
肠道微生物群转化,比化学合成有什么优势?
与化学合成对这些天然产物的修饰相比,肠道菌群的生物转化具有独特的优势:
1) 能干
肠道菌群分泌的催化酶驱动的大多数反应,难以通过化学合成完成;
2) 精准
酶促反应选择性强,也就是特别挑,只对特定部位下手,不用担心误伤到不用改变的部分;
3) 温和
生物转化反应条件相对温和,不会像高温、高压那样粗暴,这样能更好地保护那些珍贵的活性成分不受损。
下面具体来看,一些药食同源的成分经过肠道菌群代谢后,如何产生更容易吸收的或者更有益于人体的物质。
呋喃香豆素—经黏液真杆菌属—更容易吸收代谢
白芷里就含有多种呋喃香豆素,比如花椒毒素、佛手柑内酯、欧前胡素和异欧前胡素等等。
呋喃香豆素是一种在食物和草药里常见的活性成分,抗炎、抗癌、保护神经。但是,如果我们吃了含有呋喃香豆素的东西再去晒太阳,可能会有光毒性,就是皮肤对光特别敏感,容易发炎。
呋喃香豆素还会影响肝脏里的一种叫做CYP3A的酶,这种酶负责代谢药物,一旦被抑制了,药物在身体里待的时间就会变长。
肠道菌群是怎么发挥作用的?
肠道菌群中的经黏液真杆菌属(Blautia),能产生一种叫做 Co O-甲基转移酶MRG-PMF1,裂解甲基芳基醚,这种酶能把花椒毒素和香柠檬烯这些成分变成花椒毒醇和香柠檬醇,重要的是,异戊二烯基芳醚基团以相同的方式裂解。
去甲基化和去异戊烯化
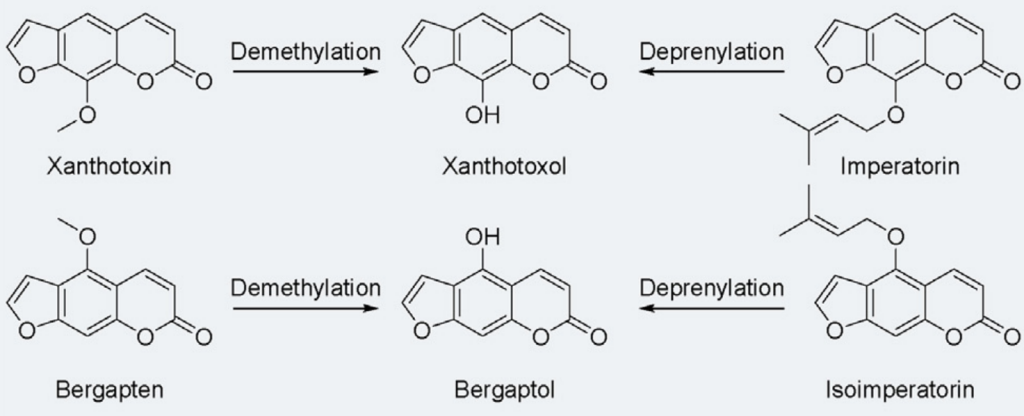
doi: 10.1016/j.jare.2023.05.011
欧前胡素和异欧前胡素经肠道微生物转化脱异戊烯基化也产生了上述产物。
这些溶解性更好的脱甲基和脱异戊烯基酚代谢物可以迅速随尿液排出。
也就是说,肠道内经黏液真杆菌高的人,可能更有效地代谢和排出体内的某些毒素,减少因体内毒素积累引起的炎症反应,从而降低慢性炎症性疾病的风险。
人参皂苷—双歧杆菌——抗癌、抗疲劳效果↑
人参皂苷的生物利用度通常约为给药量的 0.1% ~ 0.5%。某些肠道菌群如拟杆菌、双歧杆菌、真杆菌、普氏菌、梭杆菌,可以代谢人参皂苷并产生具有促进健康作用和显著提高生物利用度的新化合物。
比如,人参皂苷Rb1在双歧杆菌的作用下,先变成Rd,继续去糖基化,再变成抗癌和抗糖尿病效果更强的Compound K。而且,Rg1去糖基化变成的20(S)-protopanaxatriol(PPT),抗疲劳效果就更强。
那么,有些肠道内双歧杆菌含量较高的人,对他们来说,吃人参的效果可能更显著。
黄芪中毛蕊异黄酮—拟杆菌属13—抗病毒效果↑
黄芪中的主要异黄酮类化合物有毛蕊异黄酮-7-O-β-D-葡萄糖苷 (CG) 。
来自人类肠道细菌的拟杆菌属 13对 CG 进行去糖基化,获得了糖苷配基毛蕊异黄酮,它比相应的糖苷具有更强的抗病毒能力,可以保护 PC12 细胞免受损伤。
去糖基化
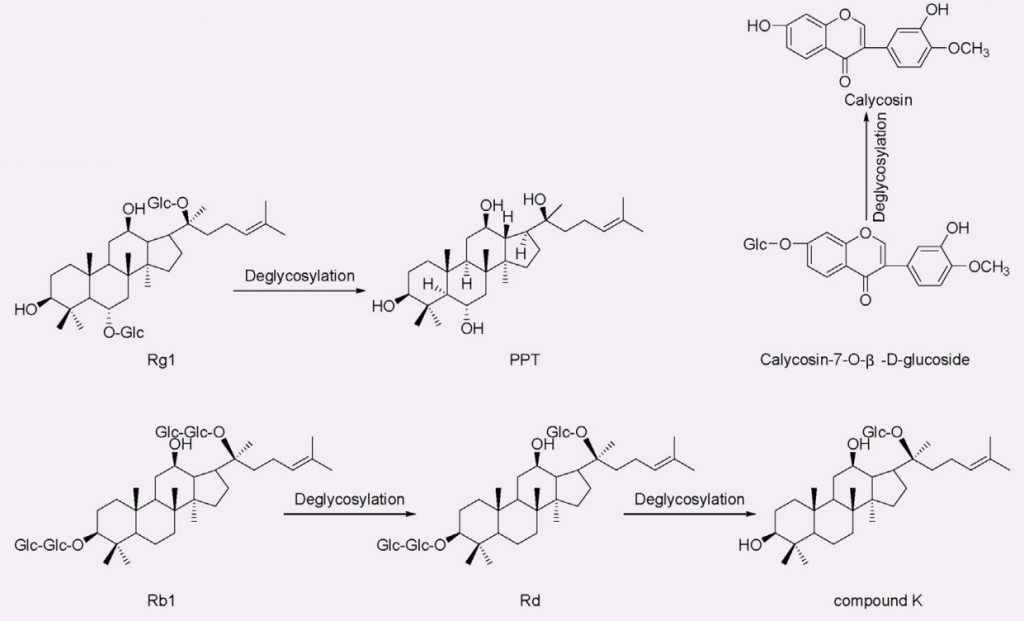
doi: 10.1016/j.jare.2023.05.011
毛蕊异黄酮—拟杆菌58—芒柄花素预防癌症
芒柄花素是一种植物雌激素,用于预防和治疗乳腺癌、前列腺癌、结肠癌和骨质疏松症。
来自人类肠道细菌的拟杆菌属58能够使毛蕊异黄酮脱水并将其转化为芒柄花素。
此外,毛蕊异黄酮的乙酰化是由菌株梭菌属21-2完成的。
脱水和乙酰化
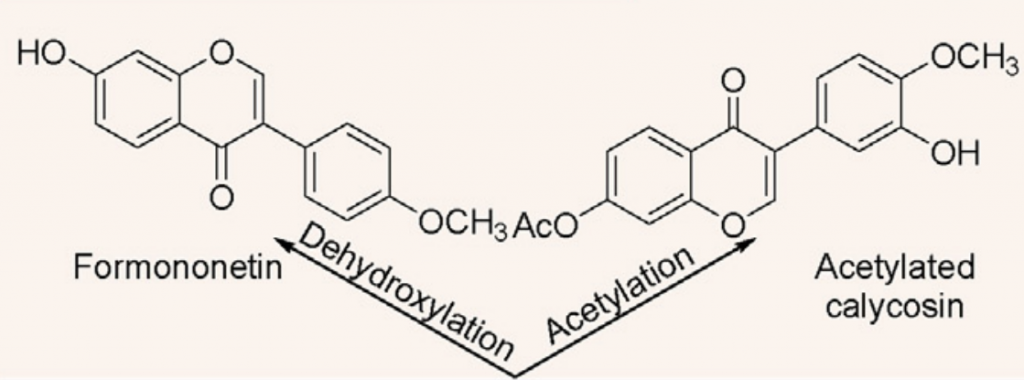
doi: 10.1016/j.jare.2023.05.011
药食同源物质对肠道菌群的调节作用是现代营养学和传统医学交汇点上的一个研究热点。
药食同源物质,如中药材、功能性食品和富含生物活性成分的天然食品,已被证明能够对肠道菌群产生积极影响。这些物质中含有的多糖、多酚、挥发油、皂苷等生物活性成分,都可以调节肠道菌群。
这些生物活性成分不仅为肠道菌群提供营养,还能选择性地促进某些有益菌的生长,同时抑制有害菌的繁殖,从而帮助维持肠道微生态的平衡。
多糖
促进有益菌,减少有害菌,比如说,麦冬多糖可以通过调节肠-肝轴显著保护非酒精性脂肪性肝病。
麦冬多糖显著降低了一些有害细菌的相对丰度,包括乳球菌、肠杆菌、Turicibacter、Tyzzerella、Oscillibacter等,并增加一些有益菌,如Alistipes、Ruminiclostridium、Rikenella。这种多糖还显著增加了两种产短链脂肪酸菌( Butyricimonas、Roseburia )丰度以及乙酸和戊酸的水平,从而改善了炎症反应和肝脏脂质代谢。
促进短链脂肪酸(SCFAs)的产生
枸杞多糖补充剂可降低厚壁菌门与拟杆菌门的比例,增加产短链脂肪酸菌,如Lacticigenium、Butyricicoccus、Lachnospiraceae等,从而改善肥胖小鼠的肠道菌群失调。
改善代谢,缓解疾病
银耳多糖通过多途径调节肠道菌群及其代谢物,改善了DSS诱导的溃疡性结肠炎。银耳多糖可以增加Lactobacillus的丰度,从而改善色氨酸的分解代谢。这导致黄嘌呤酸、KA和吲哚衍生物(如5-羟吲哚、5-羟吲哚-3-乙酸、5-羟吲哚乙酰酸)的增加。
天然多糖因其在缓解运动性疲劳中的潜在效果和较少的副作用而受到关注。研究表明,肌肉功能与肠道菌群的多样性和组成密切相关,而天然多糖如决明子、灵芝、枸杞、冬虫夏草等可通过不同机制发挥抗疲劳作用。
doi.org/10.3390/foods12163083
多酚
多酚是药食同源食物中含量丰富的活性化合物,膳食多酚类化合物具有预防慢性疾病的抗氧化剂,而临床试验中证据很弱,主要因为个体间的差异很大。多酚的生物利用度低(5%–10% 被小肠吸收)。这些化合物的生物利用度严格取决于肠道微生物的酶促机制。
肠道微生物群通过改变糖苷配基、糖苷和结合物的结构来影响多酚的生物利用度。
一般来说,口服多酚在上消化道的吸收相对较低;很大一部分多酚积聚在结肠中,影响和改变肠道微生物群的组成。摄入多酚可能通过促进有益细菌的生长,抑制有害细菌的生长,从而使宿主受益。
随机,双盲,安慰剂对照的人类试验表明,经口摄入没食子儿茶素-3-没食子酸酯和白藜芦醇,持续12周超重男性显著降低拟杆菌的粪便丰度和趋向于降低Faecalibacterium prausnitzii 的丰度。
在高脂饮食中补充膳食葡萄多酚导致肠道微生物群落结构发生显著变化,包括厚壁菌门与拟杆菌门的比例降低以及AKK菌的大量繁殖。膳食多酚促进肠道细菌Akkermansia muciniphila 的生长并减轻高脂饮食诱导的代谢综合征。
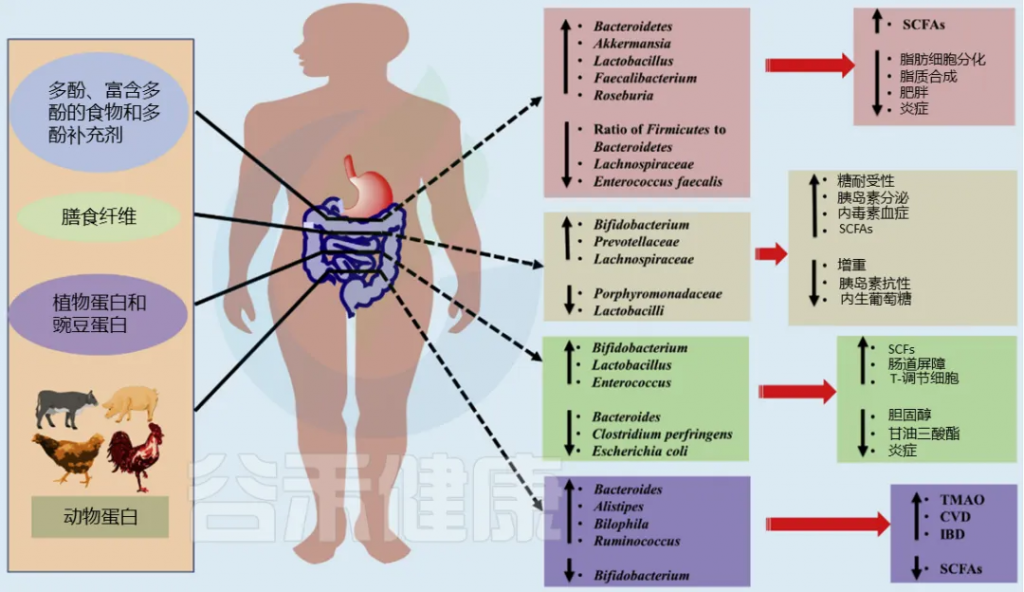
Vemana Gowd, et al.,Trends in Food Science & Technology, 2019
下面按照疾病类型分类分为消化系统疾病、肝病、内分泌疾病、神经精神疾病、心血管疾病等,逐一了解药食同源如何通过肠道菌群影响健康。
■ 消化系统疾病
炎症性肠病(IBD)
炎症性肠病(IBD)是一种肠道的慢性病,它会反复发生,造成肠道发炎和损伤。肠道屏障是保护肠道不受病菌侵害的关键。肠道菌群失衡可能会引起IBD。特别是,如果肠道里的革兰氏阴性细菌多了,它们细胞壁上的脂多糖(LPS)也会增加,这可能会引发过度的免疫反应,导致IBD。
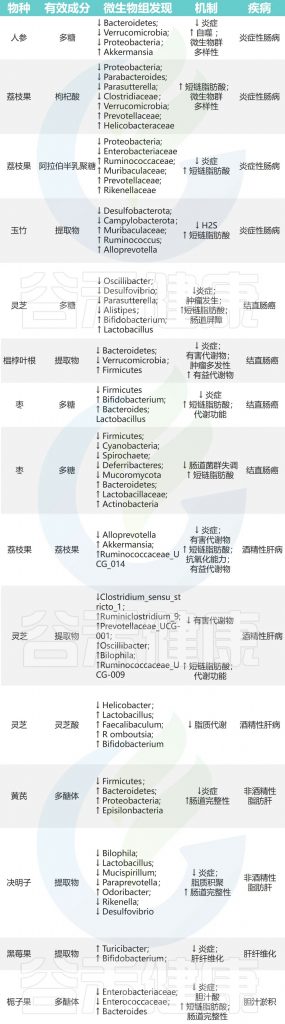
人参→拟杆菌、疣微菌、变形菌↓→LPS↓→抗炎
枸杞→副拟杆菌属,Parasutterella,梭菌属↓ 螺杆菌科↑
玉竹提取物→脱硫弧菌科↓
除了上面提到的,还有很多药食同源的植物也能调节肠道菌群,帮助治疗IBD,比如山楂、蜂蜜、山药、菊花、酸枣仁、姜黄、黄芪和灵芝。这些植物可能成为治疗IBD的新药物。
多糖治疗IBD的机制
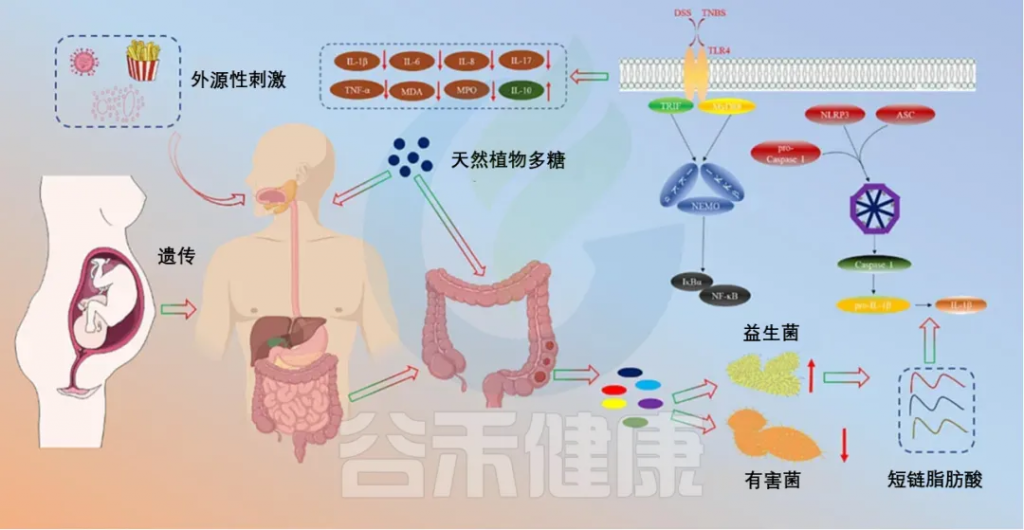
doi.org/10.1016/j.ijbiomac.2023.126799
结直肠癌(CRC)
结直肠癌(CRC)是全球常见的癌症之一,占全球每年所有癌症诊断和所有癌症相关死亡的 10%。长期患有 IBD 和不健康的生活方式导致肠道菌群紊乱的患者患结直肠癌的风险更高。因此,发基于药食同源物种的新型、有效但低毒的产品用于预防和治疗结直肠癌变得越来越重要。
灵芝→厚壁菌门、双歧杆菌、乳酸杆菌↑ 拟杆菌门、脱硫弧菌、颤杆菌↓ →预防结直肠癌
西洋参→疣微菌↓→抗炎、抗肿瘤
大枣→双歧杆菌、拟杆菌、乳酸杆菌↑→预防肿瘤
■ 肝 病
酒精性肝病(ALD)
酒精性肝病(ALD)与长期喝酒太多有关,它包括脂肪肝、酒精性肝炎和酒精性肝硬化等不同的肝脏问题。喝酒太多不仅会伤害肝脏,还会让肠道菌群不平衡,破坏肠道屏障,这会影响肠道和肝脏之间的正常联系,导致肝病。
枸杞→阿克曼氏菌、瘤胃球菌↑→保护肝脏
灵芝→瘤胃球菌、普雷沃氏菌、颤杆菌克属↑→改善脂肪代谢、抑制炎症
对沙棘、葛根、黄芪及其相关加工产品的药食同源物种的研究表明,它们通过肠道菌群在预防和减轻ALD方面发挥越来越多作用。
非酒精性脂肪性肝病
非酒精性脂肪性肝病(NAFLD)肝脏中脂肪积累过多,这与胰岛素抵抗和氧化应激有关,可能导致肝细胞损伤和炎症。虽然NAFLD的肝脏变化与酒精性肝病(ALD)相似,但NAFLD患者并不饮酒过量。目前,除了运动和饮食调整外,还没有特定的药物被批准用于治疗NAFLD。
黄芪多糖→厚壁菌门/拟杆菌门比例↓→抗炎
决明子中的蒽醌+益生菌 DM9054 和 86066→预防 NAFLD
其他药食同源的物质,如砂仁、茯苓、山楂、葛根,也显示出通过调节肠道菌群来预防和治疗NAFLD的潜力,可能通过激活相关的信号通路来发挥作用。
其他肝病
其他肝病还包括其他亚型,比如肝纤维化和肝硬化,它们可能由炎症或外界因素引起。
覆盆子→双歧杆菌、Turicibacter↑→肝功能改善
马齿苋→阿克曼氏菌和粪杆菌↑→减轻肝肾损伤
这些草药通过调节肠道菌群,显示出在肝病治疗中的潜力。
doi: 10.1016/j.jare.2023.05.011
■ 神经和精神疾病
阿尔茨海默病(AD)
阿尔茨海默病(AD)的大脑中淀粉样斑块和神经纤维缠结的形成,会导致大脑损伤和认知能力下降,目前还没有治愈的方法。近年来,研究表明肠道菌群,也就是我们体内的“第二大脑”,可能通过肠-脑轴影响阿尔茨海默病的发展。
茯苓→乳酸杆菌↑产内毒素菌↓→产GABA
黄芪→Roseburia、Lactobacillus↑→延缓淀粉样蛋白的沉积
天麻→约翰逊乳杆菌、鼠乳杆菌、罗伊氏乳杆菌↑→改善认知障碍
西洋参和黄芪→异杆菌属、嗜粘蛋白阿克曼氏菌、乳酸杆菌↑→有助于治疗AD
茯苓在阿尔茨海默治疗中作用
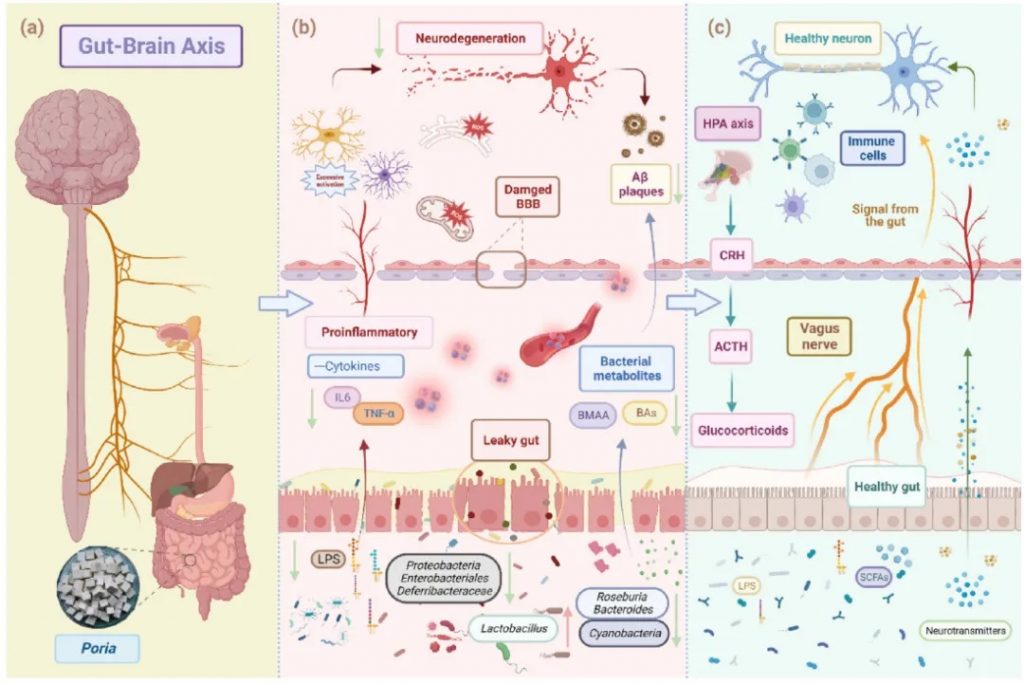
doi: 10.1016/j.jare.2023.05.011
抑郁症
抑郁症是一种常见的精神障碍,影响很多人的生活。科学家认为,大脑中某些化学物质,比如GABA、去甲肾上腺素(NE)和血清素(5-HT)水平降低,可能会导致抑郁症。还有一种叫做脑源性神经营养因子(BDNF)的物质,它在调节抑郁症状中也很重要。
豆豉→瘤胃球菌↑ 拟杆菌↓→抗抑郁
肉苁蓉→瘤胃球菌↓ 拟杆菌↑→缓解抑郁症
茯苓→普雷沃氏菌、异杆菌、苍白杆菌↓→抗抑郁
焦虑症
焦虑症是一种常见的精神障碍,主要症状是过度紧张、担忧、失眠等,严重影响患者生活质量。
茯苓→Blautia↓瘤胃球菌、普雷沃氏菌↑→抗焦虑
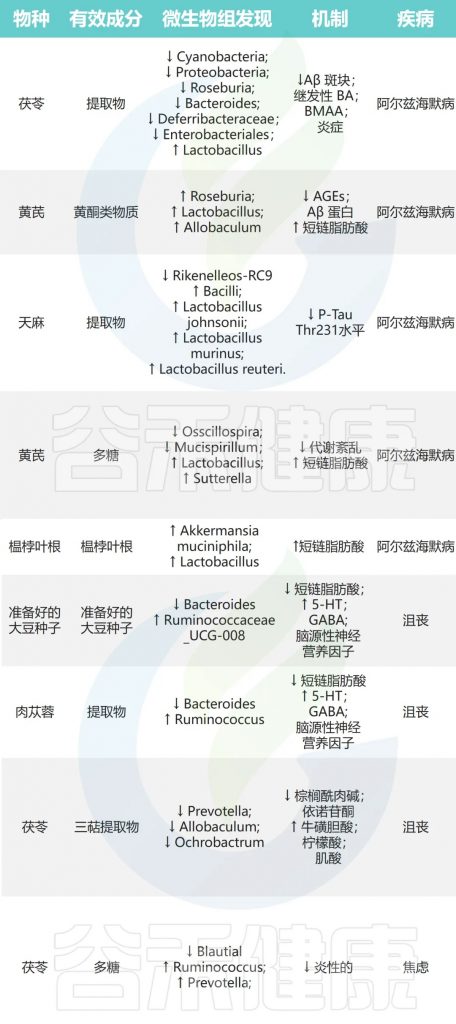
doi: 10.1016/j.jare.2023.05.011
■ 心血管疾病
动脉粥样硬化(AS)
动脉粥样硬化(AS)是一种心血管疾病,可能因为血脂异常等问题引起,是全球主要的死亡原因之一。研究发现,一些天然物质可以通过调节肠道菌群来帮助缓解动脉粥样硬化。
人参皂苷→Muribaculaceae、乳杆菌、双歧杆菌↑
氧化三甲胺 (TMAO) 可以预测动脉粥样硬化早期阶段,它与胆固醇代谢和氧化应激有关。
银杏内酯B→拟杆菌↑、幽门螺杆菌↓→TMAO↓
草果→异杆菌、脱硫弧菌↓ Ruminococcus_2↑→降低胆固醇
灵芝→普氏菌、产短链脂肪酸菌↑→改善血脂异常
这些研究表明,通过调节肠道菌群,天然物质可能在预防和治疗动脉粥样硬化方面发挥作用。
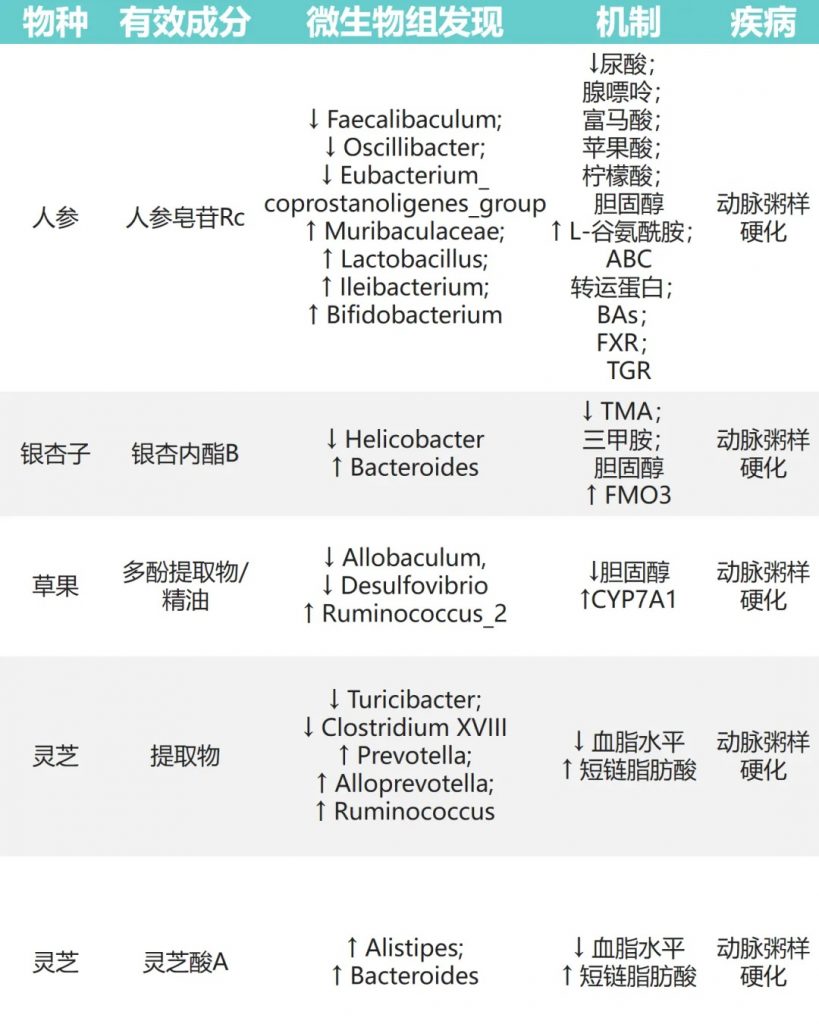
doi: 10.1016/j.jare.2023.05.011
■ 内分泌疾病
糖 尿 病
糖尿病是一种代谢紊乱,高血糖是由于胰岛素分泌不足和/或作用不足造成的。根据国际糖尿病联合会2021年的数据,全球有 5.37 亿人患有糖尿病。研究表明,肠道菌群在控制宿主的生理和代谢方面至关重要,其失调与糖尿病的进展有关。
枸杞→瘤胃球菌科、Intestinimonas↑→GLP-1、PYY↑→促进胰岛素的分泌
罗汉果→Elasimicrobium↑、脱硫弧菌、大肠埃氏菌属-志贺氏菌属↓
桑叶→ Romboutsia、Oscillatoriales cyanobacterium↓ Alloprevotella、副拟杆菌、Muribaculaceae↑→缓解糖尿病
马齿苋→ 支链氨基酸↓→ 减缓糖尿病
肥 胖
肥胖已成为全球严重的健康问题,药食同源物种通过调节肠道菌群和相关信号发挥其抗肥胖活性。
这些研究表明,通过调节肠道菌群,药食同源物种可能成为管理肥胖的有效策略。

doi: 10.1016/j.jare.2023.05.011
■ 其他疾病
慢性非细菌性前列腺炎 <茯苓多糖>
茯苓多糖(PPs)可以通过调节肠道菌群来缓解慢性非细菌性前列腺炎。茯苓多糖显著增加副拟杆菌属、梭杆菌属、Parasutterella等有益菌,同时改变结肠上皮中关键基因表达,调节激素水平,抑制前列腺炎症。
恶性黑色素瘤 <黄芪多糖>
黄芪多糖(AP)能够通过调节肠道菌群来降低髓系抑制细胞(MDSC)的数量和相关分子的表达,增加CD8 T细胞的数量,削弱MDSC抑制CD8 T细胞杀死肿瘤细胞的能力。黄芪多糖干预下,与假长双歧杆菌呈负相关、与约氏乳杆菌呈正相关的L-谷氨酸和肌酸显著上调,揭示了黄芪多糖抑制肿瘤生长的治疗能力。
乳腺癌 <茯苓>
茯苓能够通过增加有益细菌如乳酸杆菌和双歧杆菌,减少有害细菌如硫酸盐还原菌脱硫弧菌和Mucispirillum等,来改善乳腺癌小鼠的菌群失调。
骨质疏松症 <杜仲叶提取物>
杜仲叶提取物补充剂能够促进保加利亚乳杆菌的生长,增加粪便和血清中的短链脂肪酸浓度,表现出抗骨质疏松症活性。
慢性肾脏疾病 <茯苓补充剂>
茯苓补充剂可以通过调节肠道菌群及其代谢产物来延缓慢性肾脏疾病的发展。
药食同源领域的研究正处于快速发展阶段,它融合了传统智慧与现代科学,为我们提供了一个全面的健康新视角。随着研究的深入,我们对药食同源物质的安全性、独立性效益以及它们如何影响肠道菌群有了更深入的理解。
药食同源物质的安全性是其研究的首要关注点。历史上,许多药食同源物质已被人类长期安全食用。这块还可以探索这些物质在不同剂量、不同人群中的使用效果,以及可能的长期影响。
如何通过科学的方法来证明药食同源物质的疗效和安全性?
它涉及到的是研究设计、实验方法、数据分析等,目的是建立药食同源物质功效的科学证据基础。这通常包括以下几个方面:
文献回顾:查找和分析现有的研究,了解药食同源物质的历史和当前的知识状态。
实验室研究:在细胞和动物模型中测试药食同源物质的生物活性。
临床试验:通过随机对照试验等方法,在人体中测试药食同源物质的效果。
横断面研究:在某一时间点对大量人群进行调查,了解药食同源物质的使用情况及其与健康状况的关联。
系统评价和荟萃分析:综合多项研究的结果,以评估药食同源物质的整体效果。
长期跟踪和安全性评估:对药食同源物质进行长期跟踪,评估其长期使用的效果和潜在的副作用。通过毒理学研究和临床监测,确保药食同源物质的安全性。
法规和标准化:遵循相关法规和指南,同时应确保药食同源物质的质量,包括纯度、稳定性和成分标准化。
利用微生物组数据进行疾病筛查和个性化预防
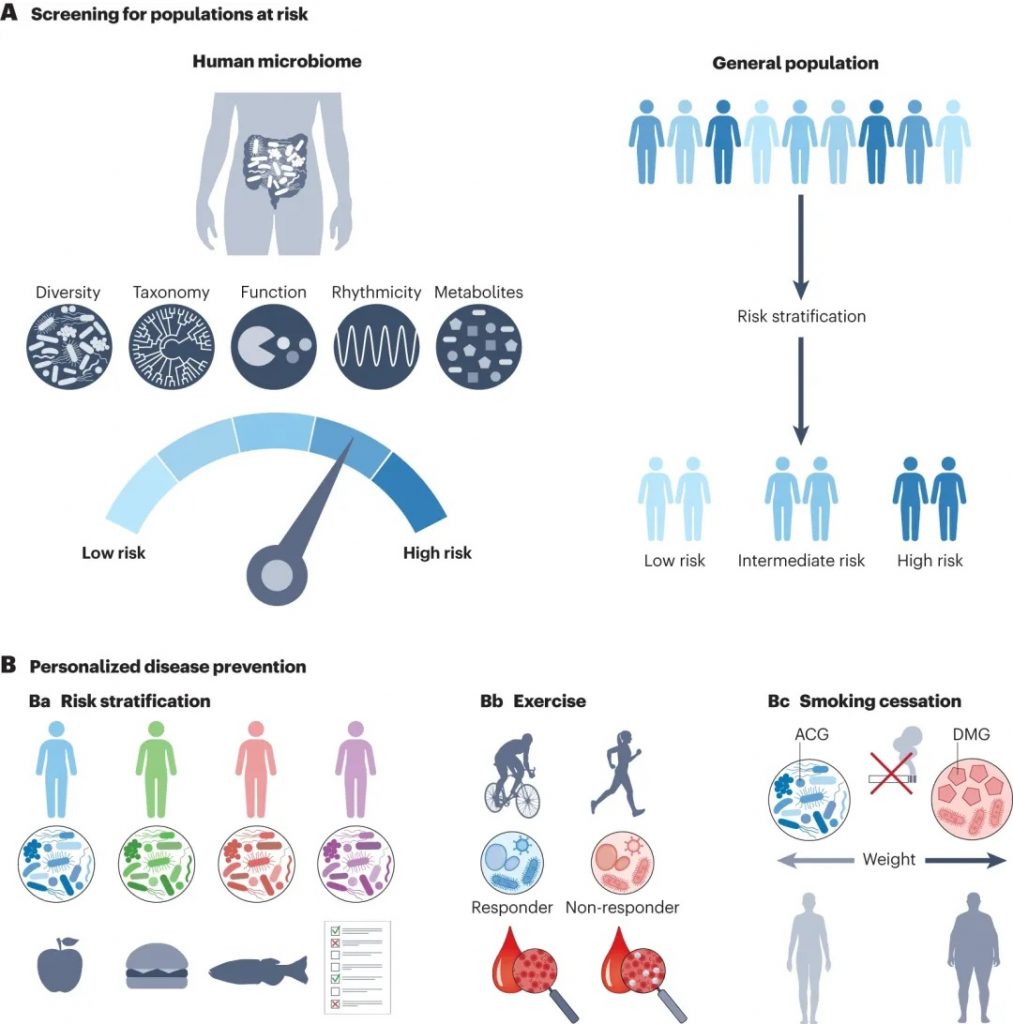
doi.org/10.1038/s41579-023-00998-9
目前常用的监测手段包括生理指标监测(心率、血压、血糖等)、生物标志物检测(血液、尿液等)、肠道菌群检测、自我报告和问卷调查等。
症状记录:记录使用药食同源物质前后的症状变化,如疲劳感、消化问题、睡眠模式等。
免疫功能检测:例如,灵芝多糖可以通过增加NK细胞活性和T细胞增殖来增强宿主的抗肿瘤免疫反应。可以检测外周血中NK细胞活性和T细胞亚群比例来评估灵芝多糖的效用。
肠道通透性检测:例如,枸杞多糖可以通过上调紧密连接蛋白(如Occludin和ZO-1)的表达来增强肠道屏障功能。可以通过检测血清中细菌内毒素(LPS)的水平来间接评估肠道通透性,从而评估枸杞多糖的效用。谷禾肠道菌群检测报告中也有相关详细的菌群代谢产物水平提示。
肠道菌群检测:可以用来评估特定药食同源物质(如中药材、功能性食品)对肠道菌群组成的影响。通过比较干预前后的菌群变化,可以了解这些物质如何改变肠道微生物的多样性、丰度等,这有助于监测治疗效果和疾病进展。同时,结合大数据分析与生物信息学技术,能够识别出一些特定菌群的变化,疾病风险评估,根据肠道菌群评估营养状况,找到一些个性化的健康管理方案。
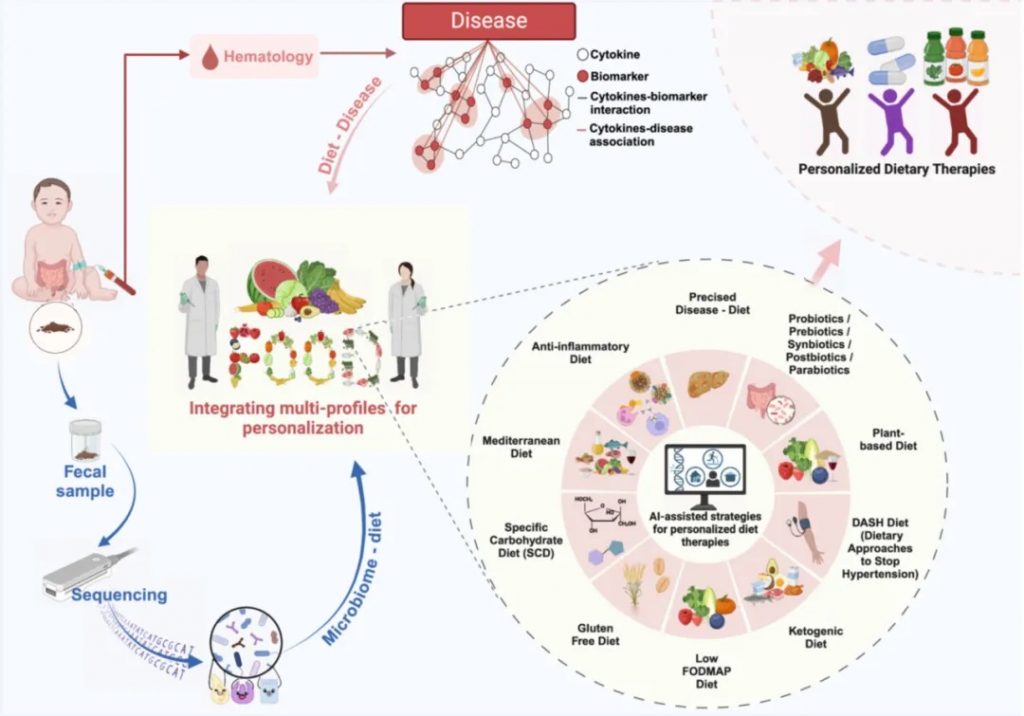
doi.org/10.1002/imt2.230
提高生物利用度
例如,基于纳米技术的人参皂苷Rb1递送系统,可以显著提高其在肠道中的稳定性和吸收率。这种新型递送系统不仅可以提高药食同源物质的效果,还可能降低所需剂量,减少潜在的副作用。
新的药食同源物开发
利用大数据分析技术,可以从大量的药食同源物质中筛选出具有潜在药用价值的候选物质。通过分析这些物质的化学成分、生物活性和用途,结合肠道菌群检测技术和药食同源的研究,为药食同源物质的深入研究提供科学依据,推动理论创新和技术进步,发现新的生物活性物质和药物靶点,同时可以推动新药食同源物质和/或功能性食品的开发。
药食同源物质与现代药物的协作
药食同源物质与现代药物协同作用的研究,例如,灵芝多糖可以增强某些化疗药物的抗肿瘤效果,同时减轻其副作用。这种协同作用的研究不仅可以提高现有治疗方案的效果,还可能为开发新的联合治疗策略提供依据。
污染问题监测的新型解决方案
药食同源产品的生产和加工过程中可能会遇到食品安全和污染的问题,如农药残留、重金属污染等。确保产品的安全性是药食同源产品开发的重要挑战。
肠道菌群检测可以作为评估和解决这一问题的有效工具。
每个人的基因、代谢类型、生活方式、健康状况都不同,对营养的需求也各异。随着科技的发展,药食同源可以与肠道菌群检测、人工智能、大数据分析、基因编辑等前沿科技相结合,为实现精准、高效、可持续的个性化营养提供更多创新的可能。比如,根据个人的肠道菌群特点选择合适的药食同源物质,满足个性化的营养需求,从而提高营养干预的有效性和依从性。
药食同源的研究涉及营养学、医学、微生物学、遗传学等多个学科,推动了跨学科研究的发展。这种跨学科合作有助于深入理解食物、营养和健康之间的复杂关系,有助于制定促进全民健康的膳食指南。
主要参考文献
Xia X, Xiao J. Natural Ingredients from Medicine Food Homology as Chemopreventive Reagents against Type 2 Diabetes Mellitus by Modulating Gut Microbiota Homoeostasis. Molecules. 2021 Nov 17;26(22):6934.
Yang, Minmin, et al. “Advances in understanding of health‐promoting benefits of medicine and food homology using analysis of gut microbiota and metabolomics.” Food frontiers 1.4 (2020): 398-419.
Zhong, Huan, et al. “The evolution and significance of medicine and food homology.” Acupuncture and Herbal Medicine 4.1 (2024): 19-35.
Zuo WF, Pang Q, Yao LP, Zhang Y, Peng C, Huang W, Han B. Gut microbiota: A magical multifunctional target regulated by medicine food homology species. J Adv Res. 2023 Oct;52:151-170.
Neu, J. The evolution of personalized nutrition. Nat Med 30, 1826–1827 (2024).
Sun-Waterhouse, et al. “Transformation from traditional medicine-food homology to modern food-medicine homology.” Food & Medicine Homology 1.1 (2024).
Doris Vandeputte, Personalized Nutrition Through The Gut Microbiota: Current Insights And Future Perspectives, Nutrition Reviews, Volume 78, Issue Supplement_3, December 2020, Pages 66–74
Chen, Jiali, et al. “Dietary therapies interlinking with gut microbes toward human health: Past, present, and future.” iMeta: e230.
Singar S, Nagpal R, Arjmandi BH, Akhavan NS. Personalized Nutrition: Tailoring Dietary Recommendations through Genetic Insights. Nutrients. 2024 Aug 13;16(16):2673.
Guess, N. Big data and personalized nutrition: the key evidence gaps. Nat Metab 6, 1420–1422 (2024).
Simon, Marie‐Christine, et al. “Gut microbiome analysis for personalized nutrition: the state of science.” Molecular Nutrition & Food Research 67.1 (2023): 2200476.