-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
炎症,慢病
炎症,作为一种保护机制,其本身是有益的。因受伤或感染而产生的急性炎症具有适应性,能够成功支持先天和适应性免疫反应的精心协调。然而,无论是由心理因素还是器质性因素(如抗原或损伤)引起的,持续或反复激活免疫系统都会导致长期的炎症反应,从而引发低度慢性炎症。
失调的炎症作为影响最常见慢性病的驱动因素,它不分青红皂白地影响着整个人体。
人体,作为一个综合系统,一个变量的紊乱会通过多种途径对其他关键因素“造成”连锁反应,并且过程还与反馈相关。人体需要一种通用的方式在其不同的解剖部分之间进行交流,即一种共同的生理机制。炎症可能是了解疾病在体内如何发展和进展的关键,炎症不仅是身体系统的“表达语言”,也是解决多种慢性疾病的指标或目标。
因此,普遍存在的疾病彼此独立、需要通过离散的特定干预措施进行管理的孤立观点已不再站得住脚。疾病的“表型”特征只是整个系统紊乱的一种表现,即一个人身上“多种不同疾病”的个例,实际上是由炎症这一共同线索串联起来的。
因此,识别具体的炎症来源、标志物,并综合这些指标来判别定位这些影响的靶器官或组织,是预防和管理慢性病的重要思路。
未来的预防医学需要无创、便捷且准确的方法来判别炎症源和炎症反应影响的靶器官或组织。例如,识别促炎细胞因子如IL-1、IL-6、IL-12、IL-18、TNF-α、IFN-α,组织代谢物如尿酸盐晶体和肝素结合蛋白的变化以及是否高负荷状态,是未来医学的重要一环。
随着大数据和多组学技术的发展,目前还可以通过分析体温、血压、心率等生理指标的变化,同时结合微生物组学、基因组学、蛋白组学数据,识别出与炎症水平相关的身体标志物,将有助于为个体综合治疗管理提供更加全面的依据。
本文将回顾了促炎和抗炎调节的局部免疫级联以及与神经和心理通路相互关联的反馈回路。
共同探讨和尝试了解身体这个精细调节的系统,如果遭受持续不断的“超负荷”将导致全身性炎症,从而导致慢性疾病的出现。描述了几种常见疾病的途径,以及这些详细理解对临床医学、预防和卫生系统等的启思。

■ 免疫系统的主要目标:
清除体内外来或非自身细胞物质,如细菌、病毒、真菌、寄生虫和受损细胞。
■ 免疫系统由两个分支组成:
先天免疫系统是基本的首道防线,负责启动炎症反应。
适应性免疫系统进化得更高级,能够在生物体一生中接触抗原时“学习”并形成“记忆”。

免疫系统的两个分支虽然功能各异,但都致力于保护身体的健康。它们的主要任务是协同工作,并有效清除体内的有害物质(非自身细胞物质)。这两个分支都负责监测整个身体的抗原存在情况;但每个分支的启动方式却不同。
简而言之,这两个分支就像是身体的两支特种部队,各有所长,但通力合作,共同守护健康。
■ 初级淋巴器官
包括骨髓和胸腺,淋巴细胞在此生成和/或分化。例如,T 细胞在胸腺中分化并经历正向和负向选择,使 T 细胞进入血液,只有当识别具有主要组织相容性复合体 (MHC) 标记的细胞并呈递抗原时,T 细胞才会被激活。
■ 次级淋巴器官
包括淋巴结和脾脏,它们是幼稚免疫细胞的储存器。淋巴结过滤淋巴系统并提供抗原激活白细胞与 B 细胞和 T 细胞之间的相互作用。
幼稚白细胞监测血液和组织中的外来抗原和/或被免疫信使(如细胞因子)招募到炎症部位并被激活。一旦被激活,白细胞就会清除受影响区域的外来抗原、受感染、受伤或死亡的细胞,并协助修复。
免疫细胞利用细胞因子作为自分泌、旁分泌或内分泌信使,在彼此之间以及与其他生物系统之间进行交流,从而产生协同、拮抗或多重效应。
注:自分泌(Autocrine)信使:
自分泌信使是指细胞释放的化学物质作用于同一细胞自身。这种信号传递方式使细胞可以调节自身的功能和活动。例如,一种细胞产生某种激素或生长因子后,会通过自分泌方式使自身的生理活动发生变化。
旁分泌(Paracrine)信使:
旁分泌信使是指细胞释放的化学物质作用于邻近的细胞。这种类型的信号传递对于局部细胞间的通讯至关重要。例如,在伤口愈合过程中,某些细胞释放的生长因子可以影响周围细胞的增殖和修复能力。
内分泌(Endocrine)信使:
内分泌信使是指细胞或腺体释放的激素通过血液循环到达远离其来源的靶细胞,通常这种信号传递作用于身体内的多个系统。例如,胰腺分泌的胰岛素通过血液传播,调节各个组织的糖代谢。
细胞因子环境可以调节适应性免疫反应。例如, IL-2(白细胞介素 2) 和 IFN-γ(干扰素-γ) 的产生支持细胞毒性 T 淋巴细胞的激活,是抵抗细菌和病毒所必需的。然而,高水平的IL-4和IL-6支持B淋巴细胞的激活和增殖,有利于抗体的产生。
先天免疫系统不仅涉及细胞防御,还涉及物理和化学屏障。
物理屏障包括皮肤和呼吸系统及胃肠道系统的粘膜。化学屏障是胃的酸性 pH 值。
尽管先天免疫系统比较简单,但它是造成即时非特异性炎症的原因,例如皮肤割伤引起的发热、发红、疼痛、肿胀。
利用识别细菌常见膜配体的模式识别受体 (PRR),先天免疫系统可以检测多种微生物抗原并引发炎症反应。
注:模式识别受体(Pattern Recognition Receptors,PRR)是存在于宿主细胞表面或细胞内的一类受体,主要负责识别和应对病原体(如细菌、病毒、真菌和寄生虫)以及其他有害物质(如损伤相关分子模式,DAMPs)。这些受体在先天免疫系统中发挥关键作用,帮助机体快速识别并响应感染和损伤。
此外,血液中还存在可溶性模式识别受体,包括补体系统。补体是一系列蛋白质,可导致微生物膜上“穿孔”,并有助于招募炎症细胞。
积极参与先天免疫反应的免疫细胞包括巨噬细胞(活化单核细胞)、中性粒细胞、自然杀伤 (NK) 细胞和树突状细胞 (DC)。
利用吞噬作用清除抗原或微生物,并产生活性氧来杀死微生物。
裂解病毒感染的细胞。一旦被激活,NK 细胞就会继续通过细胞因子招募新的免疫细胞。
也称为抗原呈递细胞 (APC),会迁移到淋巴结以引发适应性免疫系统的激活。
对先天免疫系统有效性至关重要的细胞因子包括 IL-1、IL-6、TNF-α、IFN-α。这些免疫信使会引发发烧、疼痛和疲劳(临床上称为疾病行为),并激活下丘脑-垂体-肾上腺轴 (HPA轴)。
■ IL-1(白细胞介素-1):
IL-1是一种主要的促炎细胞因子,由巨噬细胞、单核细胞和其他免疫细胞产生。
它有两种主要形式:IL-1α 和 IL-1β。
主要功能包括促进炎症反应、刺激T细胞和B细胞的增殖、诱导发热,并参与机体对感染和损伤的反应。IL-1还可以促进其他细胞因子的产生,增强免疫反应。
■ IL-6(白细胞介素-6):
IL-6是一种多功能细胞因子,由多种细胞产生,包括巨噬细胞、内皮细胞和肌肉细胞。
它在急性炎症、免疫反应和细胞增殖中发挥重要作用。IL-6可以刺激B细胞分化为抗体产生细胞,促进T细胞增殖,并参与急性期反应,增加急性期蛋白的产生。
■ TNF-α(肿瘤坏死因子-α):
TNF-α是一种主要的促炎细胞因子,由巨噬细胞、T细胞和其他细胞产生。
它在免疫反应和炎症中发挥关键作用,能够诱导细胞凋亡、促进炎症反应、增强免疫细胞的活性,并参与各种疾病的病理过程,如自身免疫病和感染。
■ IFN-α(干扰素-α):
IFN-α是干扰素家族中的一种,主要由病毒感染的细胞、T细胞和树突状细胞产生。
它在抗病毒免疫中发挥重要作用,能够增强细胞的抗病毒能力,抑制病毒复制,并刺激邻近细胞产生其他抗病毒蛋白。IFN-α还可以增强白细胞的活性,促进适应性免疫反应。
这些细胞因子在免疫反应、炎症以及与多种疾病(如感染、癌症和自身免疫疾病)的发展中扮演着重要的角色,它们的相互作用和调控对于维持机体的免疫平衡和健康至关重要。
更进化的适应性免疫系统仅存在于脊椎动物中,负责增加抗原清除的强度和特异性,以及发展记忆,以便在二次接触时更快地清除抗原。

在人类中,适应性反应需要10-14 天才能产生原发性抗原特异性反应。
T 细胞有两种主要类型:辅助性T (TH) 细胞 (CD4+) 和细胞毒性T (TC) 细胞 (CD8+),它们在血液和淋巴系统中循环,并驻留在次级淋巴器官中。
一旦 T 细胞通过 APC 呈现抗原,它们就会分化为记忆细胞和效应细胞。TC效应细胞是细胞毒性 T 淋巴细胞 (CTL),可裂解携带抗原的细胞。
APC(抗原呈递细胞,Antigen-Presenting Cell)
是免疫系统中的一种特殊细胞,负责捕获、处理和呈递抗原(如病原体、毒素和其他外源性物质)以激活T细胞,从而启动适应性免疫反应。APC在免疫反应中的作用至关重要。
■ 常见的APC包括:
树突状细胞:最有效的抗原呈递细胞,负责捕获外来物质并在淋巴结中激活T细胞。
巨噬细胞:具有吞噬和消化病原体的能力,也能呈递抗原。
B细胞:虽然主要功能是产生抗体,但也能作为APC呈递抗原。
■ 抗原呈递的过程
抗原呈递涉及以下步骤:
捕获抗原:APC通过吞噬或内吞作用捕获外源性抗原,通常是在感染的部位或周围组织。
处理抗原:APC内的酶会将捕获的抗原分解成小肽片段。
呈递抗原:这些小肽片段与主要组织相容性复合体(MHC)分子结合,然后被转运到APC的细胞表面。

编辑
■ MHC分子分为两类:
MHC I类:呈递内源性抗原,通常由所有有核细胞表达,主要激活CD8+细胞毒性T细胞。
MHC II类:呈递外源性抗原,通常由APC(如树突状细胞和巨噬细胞)表达,主要激活CD4+辅助T细胞。
■ T细胞激活与免疫应答
T细胞激活:当T细胞的T细胞受体(TCR)识别并结合APC表面的抗原-MHC复合物时,它们被激活。激活后的T细胞会增殖,分化为效应T细胞,参与免疫应答。
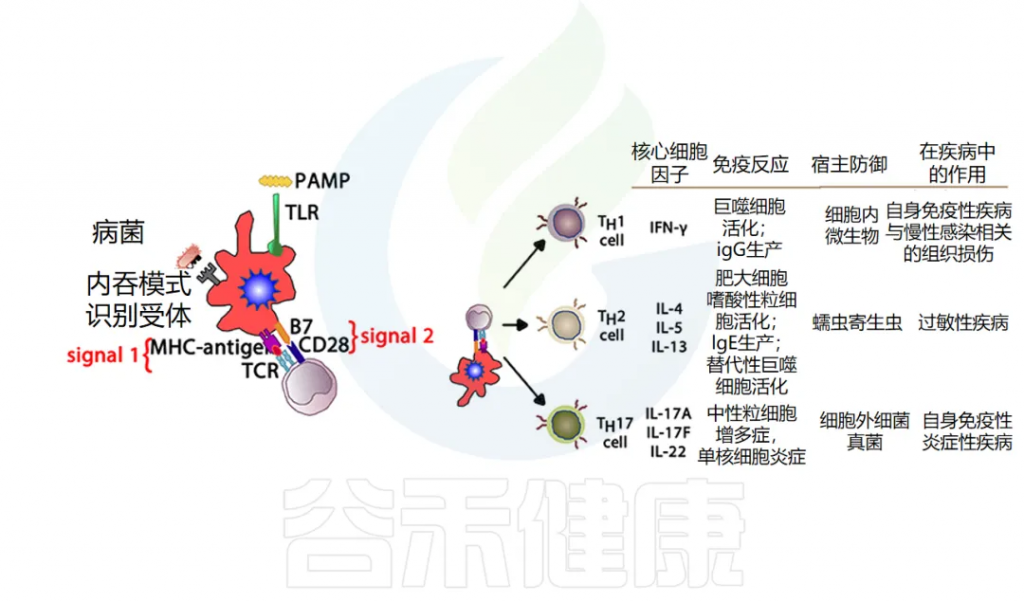
TH效应细胞功能:负责产生细胞因子并指导 B 细胞发育或动员。先天免疫细胞产生的当前细胞因子环境会影响 TH细胞的发育,进而影响免疫反应的进程,使其倾向于两个主要方向之一。
TH1 细胞产生细胞因子 IL-2、IFN-γ 和 TNF-α,这些细胞因子可驱动 CTL 活化并支持细胞免疫。这种细胞介导的免疫反应对于针对细胞内细菌和病毒产生有效反应至关重要。
注:CTL是适应性免疫系统中的主要效应细胞,负责识别和消灭被病毒感染的细胞以及肿瘤细胞。其主要功能是通过释放细胞毒性因子来诱导靶细胞凋亡,从而发挥抗感染和抗肿瘤的作用。
另一方面,TH2 细胞产生IL-4和IL-5,进而支持B细胞活化和分化,也称为体液免疫。
TH和TC记忆细胞通过血液和淋巴系统监测身体是否反复接触抗原。这两种细胞类型对于快速、有效地对抗原产生二次反应都至关重要。
其他T细胞亚群的作用
其他T细胞亚群也被定义为在宿主防御中发挥关键作用,并且更多 T 细胞亚群的重要性日益得到认可:T 调节细胞(Treg)和 TH17 细胞。
Treg细胞在调节其他免疫反应中起着核心作用,它们释放 TGF-β 和 IL-10 来下调 TH1 和 TH2 细胞的过度活化,如果不加以控制,这些细胞分别可能导致自身免疫或过敏性疾病。
TH17 会释放 IL-17,在涉及中性粒细胞募集(尤其是对粘膜)的抗菌防御中起重要作用,在防御某些特定病原体(如念珠菌)方面发挥着特别重要的作用。
■ 体液免疫的重要性
体液免疫反应,在对抗细胞外微生物和在对抗原的原发性和继发性反应期间产生抗体反应方面非常重要。
未成熟 B 细胞遍布全身,在淋巴结中浓度较高。活化的 B 细胞成为效应浆细胞,并制造抗原特异性抗体,以中和游离抗原或标记受感染细胞以进行破坏。
记忆 B 细胞是长效细胞,通过为吞噬或溶解免疫细胞创造更大的攻击目标(如在原发性反应中)来支持在第二次接触期间更快地清除。
例如,NK 细胞和巨噬细胞检测抗体复合物,从而导致抗体中和抗原或受感染细胞的吞噬。此外,抗体可以激活或延续补体级联。
当身体感受到感染、创伤、缺血、物理、化学或其他形式的“危险”时,就会引发炎症。
暴露于病原体相关分子模式 (PAMP) 和损伤相关分子模式 (DAMP) 会导致单核细胞-巨噬细胞谱系细胞激活,从而表达促炎基因并抑制抗炎基因。
■ 病原体相关分子模式 (PAMP)
定义:PAMP是指广泛存在于病原体(如细菌、病毒、真菌和寄生虫)中的特征分子,相较于宿主细胞而言,这些分子是特异性地存在于病原体中。
常见的PAMP示例包括:
特点:
PAMP通常是高度保守的分子结构,使得宿主的免疫系统能够快速识别和应对多种病原体。
功能:
PAMP通过与宿主细胞的模式识别受体(PRR,如Toll样受体等)结合,激活免疫反应,包括炎症反应、白细胞的招募和抗体的产生。它们在启动先天免疫反应中起到关键作用。
■ 损伤相关分子模式 (DAMP)
定义:DAMP是指宿主细胞在受到损伤、死亡或应激时释放的内源性分子。这些分子可以被免疫系统识别,从而触发免疫反应。
常见的DAMP示例包括:
特点:DAMP并不是特定于病原体的,而是在细胞受到损伤或应激时由宿主自身细胞释放的。
功能:DAMP通过与模式识别受体相互作用,促进免疫细胞的活化,诱导炎症反应,帮助机体清理损伤细胞并启动修复过程。
细胞因子和趋化因子在炎症中的作用
细胞因子、趋化因子和其他化学物质的产生会介导非特异性细胞募集和体液介导的血管变化。这些细胞过程由各种细胞内信号传导和核转录途径介导。
促炎反应:NF-κB 和 AP-1
NF-κB 和 AP-1 这两种转录因子在促炎反应中扮演关键角色,它们能够驱动促炎细胞因子(如TNF-α 和 IL-1)、趋化因子(如 CCL2 和 CXCL8)以及内皮粘附分子的表达,从而影响炎症反应的进程。
干扰素反应因子 IRF3 和 IRF7
另一方面,干扰素反应因子 IRF3 和 IRF7 则主要负责促进 I 型干扰素(如 IFN-α 和 β)的产生,这些干扰素在对抗病毒防御中具有重要作用。
然而,炎症反应并不仅仅由这些分子机制所限定。实际上,除了病原体引起的免疫激活外,非抗原性刺激也能触发炎症过程。
非抗原刺激引发的炎症反应
非抗原刺激可能被视为“危险”并引发炎症反应;这些影响包括创伤,如辐射、缺血、毒素暴露,甚至心理压力。
这些因素可能通过各种机制诱发炎症,包括激活神经内分泌通路(如情绪压力所见,见抑郁症部分),或通过上调刺激炎症信号传导的“应激”通路,如缺血性中风中的小胶质细胞激活。
环境毒素和化学物质的影响
如农药残留、添加剂、防腐剂等,也可能通过激活细胞色素 P450 通路、诱导活性氧或代谢为具有免疫毒性作用的反应中间体和新抗原,来诱发炎症活动。也就是说,我们日常接触的化学物质可能正悄悄影响着我们的免疫系统。
芳烃受体 AhR 在炎症中的角色
在探讨了化学物质如何诱发炎症之后,我们进一步了解到芳烃受体AhR在其中扮演的角色。芳烃受体AhR激活可以介导对一系列内源性和外源性配体的炎症反应,在粘膜免疫和正常屏障功能中发挥关键作用,同时也是各种致癌因素途径,如二恶英的致病。强调了环境因素与炎症性疾病之间的复杂联系。
临床上,炎症的典型表现是疼痛、发热、发红、肿胀和功能丧失。组织损伤会导致组胺释放,刺激毛细血管扩张,导致血管淤滞,使吞噬细胞迁移和血浆渗漏(发红、发热和肿胀)。
缓激肽的释放会增加含有神经末梢的组织的疼痛敏感性。功能丧失被认为是对疼痛的神经反射。
吞噬活性可清除病原体,炎症级联的下调可导致愈合。
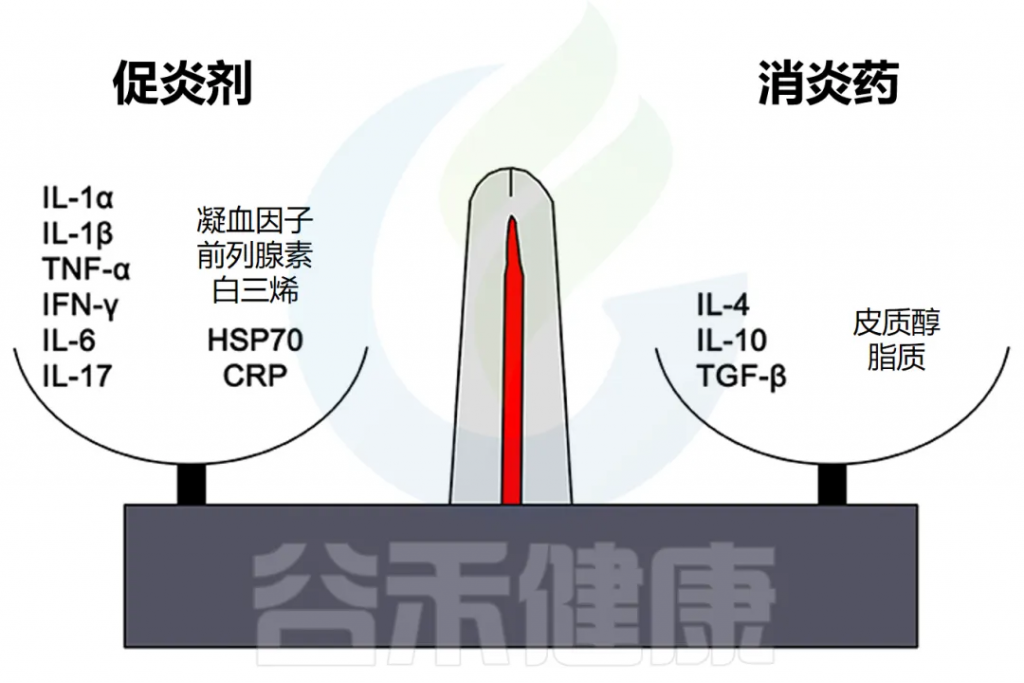
细胞因子在炎症中的双重作用
IL-1、IL-6 和 TNF-α 等因子有利于炎症,而 IL-10 和 TGF-β 等细胞因子可抑制炎症。
然而,这些区别并不是绝对的,有些因素起着双重作用。例如,IL-4 会干扰某些肿瘤的炎症,但有利于过敏症中的抗体产生。
慢性炎症中IL-6的作用
在慢性炎症的背景下,IL-6 通常被认为是促炎的,然而,也有 IL-6 具有抗炎作用的例子,也可能表明其他自然的持续过程,如组织修复。因此,在检查炎症水平时,结合背景至关重要,才得出正确的结论。
doi.org/10.3389/fmed.2018.00316
此外,炎症平衡的非细胞因子介质包括促炎化学物质,如 CXCL8 趋化因子和某些金属蛋白酶,以及抗炎剂,包括抗菌肽、TIMP(金属蛋白酶组织抑制剂)和趋化因子 CCL2 。
这些“宏观”炎症变化受免疫调节途径控制。然而,免疫反应释放的免疫介质和细胞因子会触发神经元反应,从而放大局部炎症反应,并触发全身神经内分泌和神经反应,最终导致炎症过程消退并恢复正常的稳态。
这些正常的反馈回路可能会因中枢神经系统长时间或不适当的激活而中断,从而导致激素抑制不足导致过度炎症,或因过度或长时间的抗炎反应导致不受控制的感染。
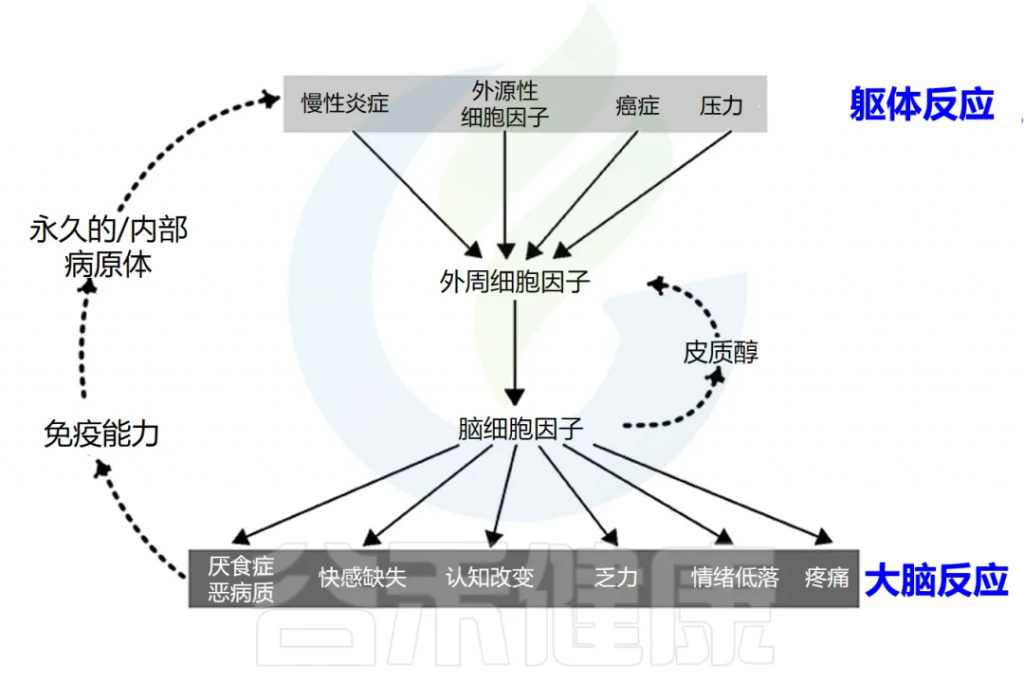
炎症会导致全身不适反应
可能会出现发烧、恶心、食欲不振、疲倦,睡眠质量差、易怒、情绪低落、注意力不集中、健忘、社交退缩等。
这些症状是由促炎细胞因子引发的,包括 IL-1α、IL-1β、TNF-α、IFN-γ、 IL-6等。虽然它们是对感染的局部反应,但它们会刺激大脑细胞因子系统,导致出现疾病症状,促使人们减少活动,多休息更好地应对感染。
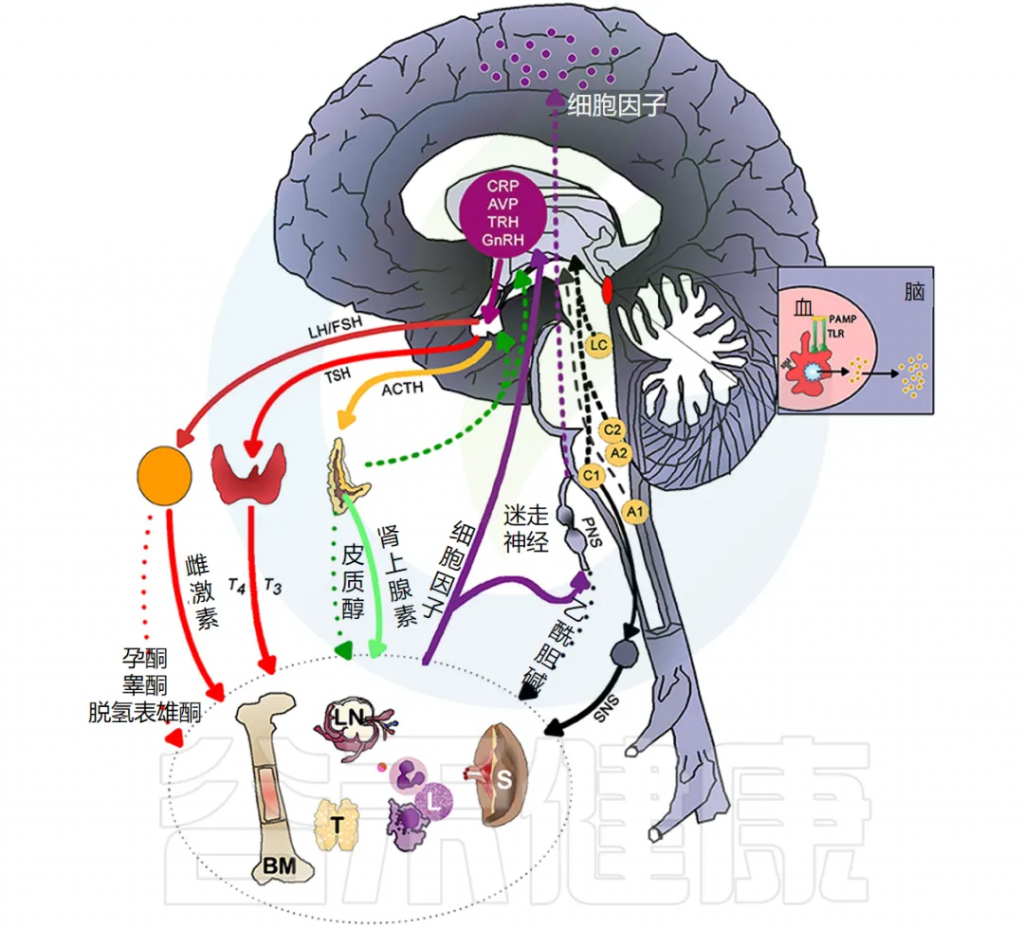
炎症通过激活许多不同的反馈回路触发全身反应。中枢神经系统 (CNS) 对环境刺激反应迅速,导致神经递质和神经肽与免疫介质刺激的相同信号通路结合。
炎症部位释放的免疫调节剂与疼痛通路的神经递质受体相互作用,反过来,局部神经肽可以释放组胺等促炎介质来增强局部炎症反应。
神经对炎症的反应很快,但会随时间而变化,并且可能对炎症过程产生放大或抑制作用,因此临床上观察到的疾病行为会随时间而变化。
总体而言,这些神经反应模式旨在维持正常的生理稳态,以响应免疫系统刺激和正常组织功能的恢复。
下图说明大脑免疫系统的主要通路和反馈回路。
doi.org/10.3389/fmed.2018.00316
交感神经系统 (SNS) 激活促进免疫细胞活动和全身免疫反应,而副交感神经系统 (PNS) 和下丘脑-垂体-肾上腺 (HPA) 轴通常会抑制炎症反应。然而,慢性应激反应系统的激活会导致免疫细胞过度活跃并促进全身炎症(详情将在下一节讨论)。
大脑中有小胶质细胞、巨噬细胞和树突状细胞等免疫细胞,它们在受到炎症刺激时会产生细胞因子和前列腺素,刺激神经和非神经脑细胞受体,从而影响大脑功能。
小胶质细胞和神经元可以对外周细胞因子的产生作出反应。此外,小胶质细胞是免疫系统中的常驻神经细胞,对细菌脂多糖 (LPS) 敏感,由于 Toll 样受体 (TLR) 的表达,它可直接引发中枢神经系统炎症,而无需外周细胞因子的参与。
无论是与实际年龄还是慢性疾病状态相关的衰老大脑,都有更多反应性小胶质细胞,它们对刺激有过度的细胞因子反应,并破坏神经可塑性以及行为和认知功能。
doi.org/10.3389/fmed.2018.00316
大脑对外周免疫反应的监测
大脑还通过传入神经刺激、体液途径、跨血脑屏障的细胞因子交换以及血管周围巨噬细胞和脑小静脉内皮细胞上的 IL-1 受体激活来监测外周免疫反应。
抗炎细胞因子的调节作用
大脑中的抗炎细胞因子 IL-10 和 TGF-rβ 可改善疾病体验。在健康状态下,大脑中的促炎和抗炎细胞因子保持平衡。由于衰老与先天免疫系统活动增加有关,因此大脑会产生大量的促炎细胞因子,但抗炎细胞因子的产生会减少,从而导致更明显的疾病行为。
皮质醇的基本功能
皮质醇是一种糖皮质激素,影响身体的日常功能,如能量利用/储存、记忆形成、呼吸、心率、胃肠功能和情绪。它有稳定的昼夜节律,但也会因内部(如过度免疫活动)和外部(如感知到的威胁)压力源而释放。皮质醇是下丘脑-垂体-肾上腺 (HPA) 轴的终产物。
HPA轴与皮质醇的调控
下丘脑的促肾上腺皮质激素释放激素 (CRH) 会启动垂体前叶释放促肾上腺皮质激素 (ACTH)。ACTH 通过血流传播并刺激肾上腺皮质产生皮质醇。
通过对海马中的糖皮质激素受体进行负反馈,皮质醇会阻止 CRH 和 ACTH 的进一步释放。其他各种激素,包括雄激素、雌激素、垂体后叶激素、加压素和催产素,都可以调节HPA轴。
皮质醇与免疫系统的相互作用
在调节良好的系统中,免疫细胞会表达糖皮质激素受体,从而使皮质醇抑制免疫细胞活化和促炎细胞因子释放。
然而,慢性压力可能会长时间升高皮质醇水平,导致糖皮质激素受体表达下调。因此,不受调节的免疫细胞会产生过量的促炎细胞因子。
“
皮质醇作为HPA轴的终产物,在调节身体对压力的响应、维持生理平衡以及抑制免疫反应中发挥着关键作用。理解皮质醇的生理作用及其调控机制,对于我们认识压力如何影响健康具有重要意义。同时,慢性压力下皮质醇水平的变化及其对免疫系统的潜在影响,也提示我们在面对长期压力时需要采取适当的应对策略,维护身心健康。
自主神经系统直接连接大脑和周围器官和组织。其两个独立分支发出相反的信息,即交感神经兴奋和副交感神经放松。
■ 交 感 神 经 系 统
交感神经支配将大脑直接与肾上腺髓质联系起来,让身体做好“战斗或逃跑”的准备。
交感神经激活后,肾上腺髓质会释放儿茶酚胺、肾上腺素和去甲肾上腺素,这些物质会导致心率、血压和呼吸频率增加,并将血液从非重要器官转移到主要肌肉群和大脑。
尽管儿茶酚胺的半衰期较短且在血液中代谢迅速,但交感神经系统 (SNS) 也直接支配作为免疫细胞储存器的次级淋巴结构。因此,慢性交感神经激活和去甲肾上腺素释放可导致免疫失调。例如,去甲肾上腺素促进核因子 κB (NF-κB) 活化,这会增加几种促炎介质的基因表达,进而增强炎症。
此外,肾上腺素在应激期间会增加 IL-6 和 TNF-α 的产生。因此,肾上腺素和去甲肾上腺素可以诱导促炎细胞因子的产生并增强全身炎症。
■ 副 交 感 神 经 系 统
副交感神经与交感神经的平衡
副交感神经系统 (PNS) 通过多种方式对抗交感神经系统,例如减慢心率、降低呼吸频率、促进消化和平静情绪。迷走神经具有传入和传出神经纤维,用于大脑和周围神经之间的双向通讯。
副交感神经的免疫调节作用
副交感神经激活会导致乙酰胆碱释放。乙酰胆碱可以与免疫细胞表面的 α7 烟碱型乙酰胆碱受体 (nAChR) 结合。α7 nAChR 刺激可抑制 NF-κB 改变炎症表达,从而导致细胞因子产生减少和抗炎作用。
PNS在压力管理中的角色
在静息期间,PNS控制着器官和身体功能。长期压力下,如果交感神经占主导地位,PNS对免疫功能的调节作用可能会受到抑制。
维持平衡的自主神经系统
即休息时迷走神经占主导地位,以及 PNS 的动态、可变激活,与情绪反应和压力脆弱性有关。Porges 的多重迷走神经理论利用进化和发展的方法,将 PNS 活动和社会沟通与支持对宁静、潜在危险和危及生命的环境做出适应性反应的电路层次联系起来。
神经内脏整合模型,以描述压力源(无论来源如何)如何从外周感觉汇聚到大脑,这些信息如何整合,以及 PNS 反应的灵活性,对于理解个体生理如何受到调节至关重要。
心率变异性的评估与意义
无论使用哪种视角,心率变异性 (HRV) 都可以评估 PNS 对 SNS 的影响,PNS 激活的变异性越大(即身体越平衡、越灵活),HRV 就越高。
因此,与 HRV 较低的人相比,HRV 较高的人功能更好,幸福感更强(例如,社交、情感、心理、生理),包括炎症更低。对于初级保健临床医生和为弱势群体服务的医疗工作者来说,HRV 可以作为个人功能状况的良好估计,包括免疫功能的间接替代指标。
炎症消退的其他途径
虽然本文主要关注神经内分泌系统和免疫系统之间的交集,但我们认识到还有其他途径可以消退炎症。例如,脂质介质(如消退素、保护素和马来素)在关闭和清除急性炎症反应方面起着关键作用。此外,这些生物活性脂质似乎可以阻断 NF-κB 活化,这与皮质醇和乙酰胆碱的作用相似。
Tips
因受伤或感染而产生的急性炎症具有适应性,能够成功支持先天和适应性免疫反应的精心协调。然而,无论是心理上还是器质性(即抗原、损伤)相关的,持续或重复激活免疫系统都会导致长期暴露,从而导致低度炎症。
这种慢性炎症会破坏多个系统,因为它会影响神经系统,并通过细胞因子受体在多个身体组织中表达而局部破坏多个系统。
作为一个综合系统,人体需要一种通用的方式在其不同的解剖部分之间进行交流,即一种共同的生理机制。炎症可能是了解疾病在体内如何发展和进展的关键,炎症受促炎和抗炎细胞因子的产生所调节。
因此,普遍存在的疾病彼此独立、需要通过离散的特定干预措施进行管理的孤立观点已不再站得住脚。疾病的“表型”特征只是整个系统紊乱的一种表现。在综合系统中,一个变量的紊乱会通过多种途径对其他关键因素“造成”连锁反应,并且总是与反馈相关,以调节“致病变量”的行为。
例如,外部因素和内部因素可导致相同的表型结果;社会经济地位低和脂肪组织过多都与慢性炎症有关。这种炎症加剧会导致大脑细胞因子信号增加,损害学习和记忆,并导致抑郁症状或病态行为;
这种反馈导致负面或不健康的系统性循环进一步传播。因此,不受控制或失调的炎症将慢性身心疾病的表现结合在一起,这些疾病通常普遍存在于高压力、脆弱的人群中(例如少数民族、社会经济地位较低等)。
目前,大多数疾病的病因都是由外部致病因素和/或内部生物医学变化导致疾病的宏观和/或微观表现所致。然而,一个显而易见但很少被提出的问题是:这些疾病是如何促成的?
大多数疾病(无论是急性还是慢性)都是由炎症引起的。
神经内分泌—免疫平衡失调,无论是受到“压力”和侵入性病原体等外部因素刺激,还是受到糖尿病或肾衰竭等代谢紊乱等内部因素刺激,都会导致免疫细胞活动失控。抗炎机制的同步丧失导致细胞因子负荷升高,进而激活 NF-κB和基因转录调控。
此外,许多疾病都是触发了“相关”疾病共病,如心脏病和糖尿病。疾病分类只提供了表型分类或命名,而不考虑潜在的病因和生理网络相互作用。
这些见解挑战了当前对“多重患病”的方法,一个人的表型疾病集合是精细调节的相互关联的生理网络反应的出现结果。
这里我们看到了,体内促炎与抗炎活动的微妙平衡,为我们提供了一种有效且高效的机制,以应对所有可能威胁生物体生存的内外干扰。这种平衡确保了我们能够迅速而恰当地响应各种挑战。
接下来我们将详细(但也不全面)地概述许多常见慢性疾病背后的一些重要炎症机制。特别是强调了,通过刺激下丘脑-垂体-肾上腺 (HPA) 轴而激活的炎症与慢性交感神经激活对疾病的促进之间的关联。
过去 30 年来,过敏性呼吸道疾病(过敏性气道疾病、哮喘和过敏性鼻炎)的患病率不断上升;哮喘影响约 8% 的人口,过敏性鼻炎影响 15% 至 20% 的人口。
过敏原的类型
过敏是指对环境中普遍存在且本质上相对无害的病原体产生的不适当的破坏性反应。
常年诱因包括:
屋尘螨、动物皮屑、霉菌、蟑螂蛋白。
季节性诱因包括:草、树、杂草的花粉。
更多过敏原及过敏的预防措施详见:
过敏的机制
过敏症,即在TH2 型 T 细胞的驱动下,对普遍存在的抗原产生过量 IgE 抗体。过敏症是由过敏原特异性 IgE 反应引起的,可通过表皮皮肤测试(下图)或血液过敏原特异性 IgE 测量来证实。
此类测试可揭示致敏的存在,但只有一小部分人会发展出临床上明显的过敏性疾病:过敏性皮炎(湿疹)、过敏性鼻炎、哮喘、食物过敏和其他过敏反应等。
特应性具有很强的遗传决定性
如果父母一方患有特应性,则患过敏性疾病的可能性约为 50%,而如果父母双方都患有特应性,则患过敏性疾病的可能性为 70%。
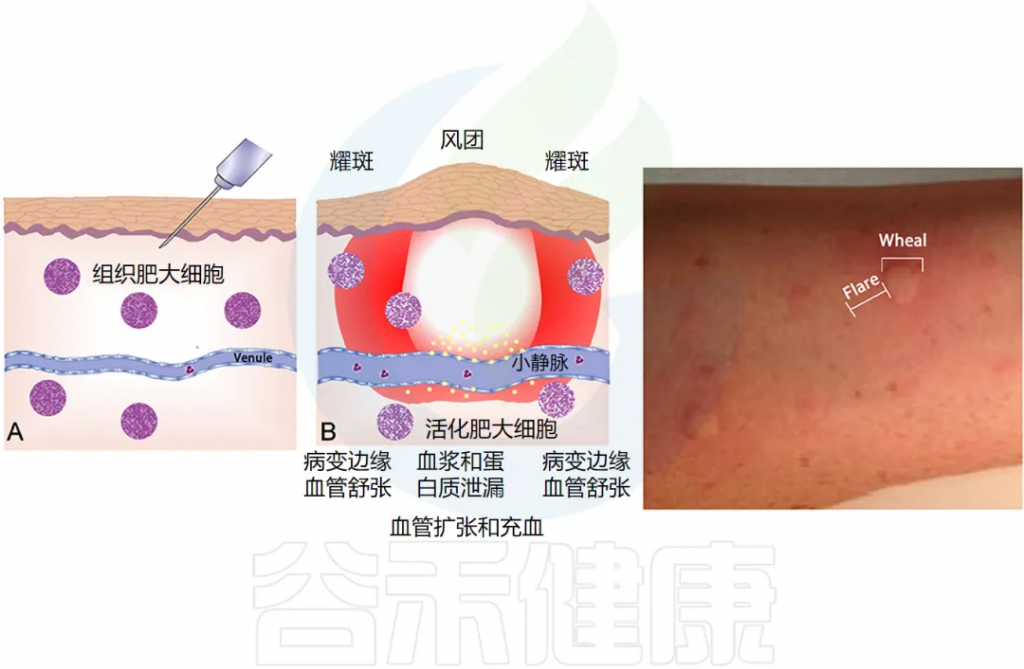
doi.org/10.3389/fmed.2018.00316
哮喘
哮喘是一种疾病,表现为反复发作的呼吸道受阻。特征包括时好时坏的气道堵塞、慢性的支气管炎症和对刺激表现出极强的敏感性。
过敏性哮喘的成因
这些问题主要是由于气道对某些过敏物质的强烈反应引起的,尤其是由一些特定化学物质(如白三烯)引发的过敏反应。
不过,对于约30%没有明确过敏原的哮喘患者,这种病可能是因为对多种刺激(如感染、药物、寒冷、胃酸倒流和运动)过度反应引起的。
非过敏性哮喘的成因
在所谓的“非过敏性”哮喘患者中,包含许多不同的亚群。其中一些亚群表现与典型过敏反应相似,但不产生过敏抗体,而另一些亚群则表现出不同的免疫特征。
过敏性呼吸道疾病的免疫机制
对于过敏性呼吸道疾病,免疫系统的某些细胞会将入侵体内的外来物(称作抗原)处理和呈递给免疫细胞,导致过敏反应的发生。这一过程需要多种信号进行协调,类似打响并引导免疫反应。
如果在抗原呈递过程中,有些特定信号分子(如IL-4)成为主导,会导致免疫细胞趋向于“过敏反应”,这时体内如哮喘的表现就可能加重。
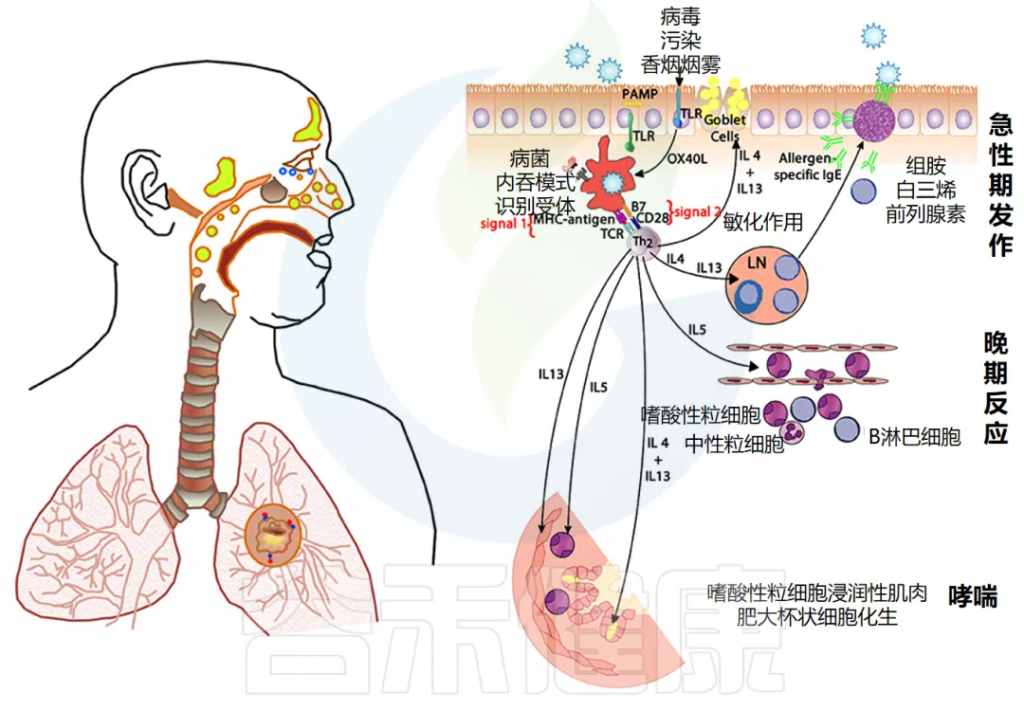
doi.org/10.3389/fmed.2018.00316
自身免疫性疾病影响大约 5% 的人口 ,并表现为一系列全身性疾病(如狼疮、硬皮病)和器官特异性性疾病(如慢性荨麻疹、甲状腺炎)。
自身免疫性疾病的成因
自身免疫性疾病是当身体的免疫系统错误地攻击自身组织时发生的。这种情况通常是因为身体的“中枢”和“外周”耐受机制失效了。
有些人可能携带自身抗体或免疫细胞,但这并不意味着他们一定会得自身免疫性疾病。这些抗体和细胞在某些情况下可能有助于清除体内的损伤产物。
自身免疫性疾病的诊断
在怀疑患有自身免疫性疾病的个体血清中检测抗体,在许多情况下都具有很大的诊断帮助作用。
例如,在系统性红斑狼疮 (SLE) 中检测 ANA,在类风湿性关节炎中检测抗环瓜氨酸肽 (anti-CCP),在乳糜泻中检测组织转谷氨酰胺酶 (tTG) 抗体。
然而,重要的是不要根据这些抗体的存在推断它们具有致病性。事实上,大多数可以识别抗体的自身免疫性疾病实际上主要由 T 细胞介导的病理学介导,抗体只不过是诊断上有用的附带现象。这些细胞介导的疾病的例子通常由相对较新定义的 TH17(IL-17 分泌)途径的过度活动主导,并涉及淋巴细胞和/或中性粒细胞浸润和炎症组织破坏,包括 1 型糖尿病、牛皮癣、桥本甲状腺炎、多发性硬化症、类风湿关节炎、克罗恩病。
自身免疫性疾病的风险因素
这些疾病的发生受遗传和环境多方面因素的影响,比如遗传缺陷、自身抗原的异常暴露或环境因素(如感染)都会增加风险。基因尤其在6号染色体上的影响较大,这与免疫系统在识别和耐受自体组织时发挥的作用有关。
doi.org/10.3389/fmed.2018.00316
心血管疾病是世界范围内慢性发病和死亡的最大原因,主要涉及冠状动脉和脑动脉。其基础是动脉粥样硬化,这是一种血管慢性炎症性疾病。
动脉粥样硬化的病理过程
动脉粥样硬化斑块的关键部位是其肩部区域,该区域被活化的 T 细胞、巨噬细胞和肥大细胞浸润,这些细胞会产生促炎介质和酶。斑块破裂会引发血小板聚集和血栓形成,导致急性缺血、临床症状和潜在的远端细胞死亡。
巨噬细胞在动脉粥样硬化中的作用
巨噬细胞是动脉粥样硬化病变的标志。
泡沫细胞的形成:它们通过清道夫和 Toll 样受体 (TLR) 摄入氧化低密度脂蛋白 (oxLDL)。胆固醇在细胞质中酯化,将巨噬细胞转化为泡沫细胞。
泡沫细胞的炎症作用:氧化脂蛋白向斑块周围的细胞发出信号,尤其是向内皮细胞和泡沫细胞发出信号,增加粘附分子的表达,进而吸引更多的单核细胞和淋巴细胞进入局部活化的内皮细胞。
泡沫细胞和活化的内皮细胞产生促炎细胞因子——IL-1、IL-6、IL-12、IL-18、IFN-γ、TNF-α,这会加剧炎症反应。
动脉粥样硬化病变的组成与免疫反应
动脉粥样硬化病变包含巨噬细胞、T细胞、树突状细胞、蛋白聚糖和平滑肌细胞以及从血液中渗出的胆固醇。氧化胆固醇会触发先天性和适应性免疫反应,导致 T 细胞活化和抗体产生。
TH2 细胞产生 IFN-γ,具有促炎作用,并通过激活巨噬细胞进一步驱动炎症活动,而 TH2 细胞产生 IL-4 和 IL-5。
TH1 和 TH2 活性是自我调节的:
在斑块内,TH1活性占主导地位,但被巨噬细胞和 TH2 细胞产生的 IL-10 所平衡(下图)。
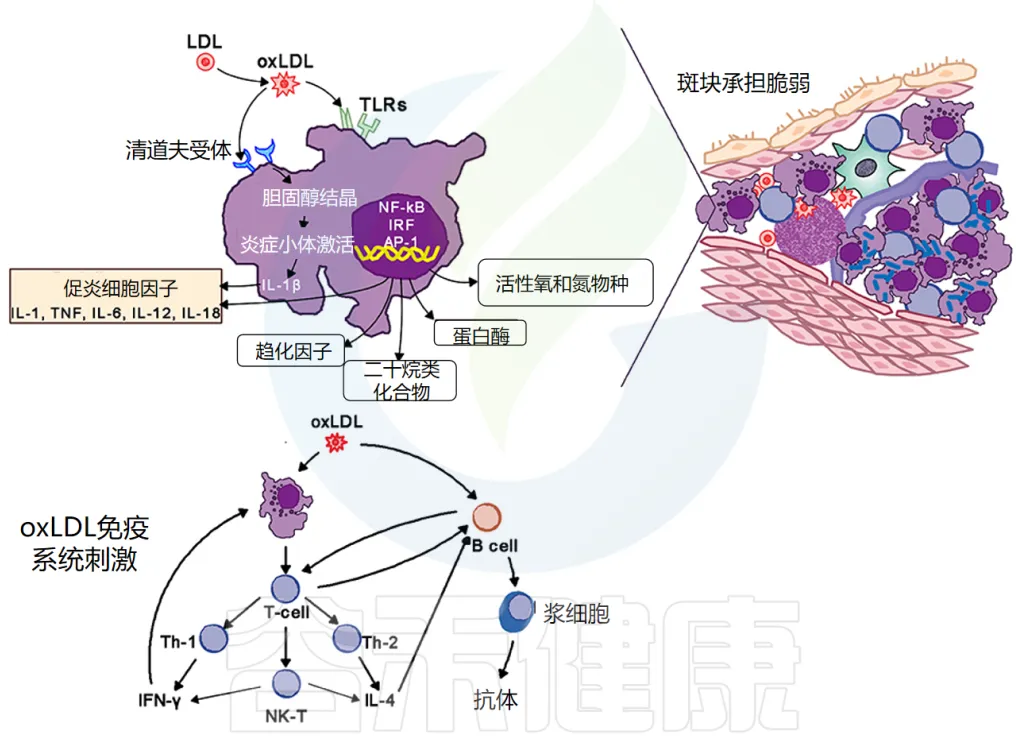
doi.org/10.3389/fmed.2018.00316
动脉粥样硬化的免疫调节和治疗策略
不同免疫细胞之间的相互作用有可能显著影响斑块炎症的结果。
实验研究表明,输注 IFN-γ、IL-12 或 IL-18 均会增加动脉粥样硬化,而输注 CD50L 和 oxLDL 抗体则会减少动脉粥样硬化。
抗炎治疗的潜力
TGF-β 被发现具有抗炎作用,一方面限制白细胞的募集,另一方面促进胶原蛋白的合成,从而稳定斑块。
此外,衣原体等生物体可能会激活 TLR 并促进动脉粥样硬化的炎症过程 。
他汀类药物的治疗作用
在治疗上,他汀类药物可抑制 Rho/ROCK 通路并阻断 IL-1β 的促炎作用。
扩展阅读:
心脏自主神经调节异常(心脏自主神经重塑,交感神经活动增加而副交感神经活动减少)会增加恶性心律失常和心源性猝死的风险,尤其是在患有心血管疾病的患者中。
如前提到的,交感神经激活具有促炎作用,而副交感神经调节具有抗炎作用,炎症可能在心律失常的发生中起着核心作用。
炎症生物标志物与猝死风险
事实上,炎症生物标志物水平升高与心源性猝死风险增加有关。在一项 17 年的随访期内,无论老年人是否患有心脏病(心力衰竭或心肌梗死),IL-6 或 C反应蛋白 (CRP) 水平升高都与心脏猝死风险增加有关。即使在调整基线风险因素后,IL-6 仍存在心脏猝死风险,但 CRP 则不存在。
炎症与心房颤动的关联
促炎途径也可能在心房颤动 (AF) 中发挥重要作用。研究证实,炎症过程会损害心房并促进电紊乱,最终导致 AF。具体来说,他们在孤立性心房颤动患者的心房活检中发现淋巴单核细胞浸润,但在对照受试者(Wolf-Parkinson’s-White 综合征患者)中从未发现过。
随后,许多临床研究证实了炎症生物标志物(CRP、IL-2、IL-6、IL-8、TNF-α;单核细胞趋化蛋白-1)与持续性和阵发性心房颤动之间存在密切关联。
抗炎治疗在心律失常治疗中的潜力
炎症与心房颤动(心律不齐的一种)和心源性猝死(心脏突然停止导致的死亡)有密切关系。因此,针对炎症的治疗可能成为治疗心律失常的新方法。
抗炎药物,如非甾体抗炎药(NSAID)和皮质类固醇,已经被证明可以降低手术期间心房颤动的风险。然而,在其他患者中,这些药物反而可能增加心房颤动的发生率。此外,这些药物对室性心律失常(心室的心律不齐)和猝死的影响还不清楚,需要进一步研究。
炎症正在成为衰老的最重要机制(称为炎症衰老),并在大多数解释模型中发挥着不可或缺的作用。
衰老是细胞损伤不断积累的结果,而这种损伤与无法清除损伤相关分子模式 (DAMP) 有关——坏死细胞的分解产物、细胞外 ATP、尿酸、淀粉样蛋白原纤维、游离胆固醇晶体。
注:关于损伤相关分子模式 (DAMP),我们在文章前面介绍过。
组织先天免疫细胞对DAMP的响应
组织先天免疫细胞包括巨噬细胞、脑中的小胶质细胞、肝脏中的库普弗细胞、骨中的破骨细胞和肾脏中的系膜细胞可以检测 DAMP。
慢性炎症与衰老
DAMP 负荷的增加导致炎症小体复合物的持续激活,从而释放促炎细胞因子(IL-6 和 IL-18),引起持续的低度慢性炎症。
慢性炎症的特征是血清或受影响器官组织内和周围促炎标志物持续低水平升高,临床上与神经退行性疾病、代谢紊乱、癌症、肌肉骨骼疾病、心血管疾病和虚弱有关。
衰老过程中炎症标志物的变化
与年轻人相比,50 岁以上的人群中促炎标志物(如 IL-6、IL-18、TNF-α 和 CRP)和血清淀粉样蛋白 A 升高 2-4 倍。值得注意的是,即使在没有特定疾病的情况下,多个器官的慢性低度炎症也会导致功能衰竭。
IL-6与衰老相关性
特别是,IL-6 水平较高与虚弱和残疾程度增加有关,临床上与步行速度慢、肌肉力量弱、小腿功能差和贫血有关。在老年患者中,体质虚弱的患者促炎标志物水平较高,而抗炎标志物水平较低,如皮质醇、IL-10。
扩展阅读:
免疫衰老
免疫衰老是指随着年龄增长,适应性免疫系统功能衰退,先天免疫系统过度活跃。
虽然绝对淋巴细胞计数保持不变,但 B 细胞、T 辅助细胞 (CD4+) 和 T 细胞毒性细胞 (CD8+) 的绝对数量减少,而 NK 细胞数量增加。
幼稚 T 细胞也会减少,导致对新抗原的反应减弱,T 细胞和 B 细胞克隆扩增,尤其是针对 CMV、EBV 和 VZV 等疱疹病毒的细胞。
因此,衰老的身体对新抗原呈递的反应能力下降,对已知抗原的记忆反应下降,使老年人更容易患上传染病 。此外,终生接触抗原会导致先天免疫细胞逐渐激活,进一步增加促炎细胞因子释放和慢性低度炎症 (下图)。

doi.org/10.3389/fmed.2018.00316
已经提出了两种炎症衰老机制:
脂肪在免疫功能中起着重要作用,因为白细胞浸润水平高——网膜脂肪占基础循环 IL-6 的 10-35%。
因此,随着年龄相关体重的增加,低度炎症会持续存在,这尤其会增加动脉粥样硬化中患糖尿病的风险。促炎细胞因子通过血脑屏障的被动扩散最初会由于 HPA 轴激活而引发主动的抗炎反应,从而导致肾上腺排出皮质醇。然而,过度的促炎负荷可激活 CRP 释放细胞,从而进一步激活 HPA 轴,最终导致皮质醇水平长期升高,进而导致糖皮质激素不敏感,进一步加剧促炎状态。
较高的外周炎性细胞因子负荷会影响衰老的小胶质细胞,从而触发脑内细胞因子的加速产生。高脑细胞因子负荷会影响神经元功能,导致与年龄相关的心理功能特征。
炎症与虚弱症
虚弱症本来就是由于高促炎负荷导致的炎症所致,而尿路感染或肺炎等感染导致的促炎负荷过度增加则极易导致虚弱症。
IL-1β对大脑功能的影响
IL-1β 的增加会触发影响大脑不同部位的适应不良疾病行为;谵妄会导致工作记忆受损和冷漠(海马体)、焦虑加剧和长期严重的活动减退(杏仁核)、HPA 轴激活(室旁核)以及无热感染和过度低体温(内侧视前核)。
如今,肥胖已成为最可预防的发病和过早死亡原因。肥胖可以通过体重指数 (BMI) 来评估,BMI在30-39 表示肥胖;40 或更高则被认为是病态肥胖。
脂肪组织的功能与影响
脂肪组织,特别是位于中心的脂肪组织,其行为方式很像内分泌腺,可以调节其他组织的活动,并受同位神经系统和免疫系统的影响。
巨噬细胞位于脂肪组织中。无论是肥胖发病机制中的一个关键因素,还是由于携带过量脂肪组织的身体压力所致,肥胖都与循环中促炎细胞因子的增加有关。
因此,肥胖个体会经历一种似乎与剂量相关的慢性炎症状态,并且无论不良健康行为和疾病状况如何都会存在。
压力会加剧肥胖个体的促炎状态
例如,肥胖女性对急性应激源表现出比非肥胖女性更强烈的炎症应激反应。脂肪组织产生的促炎细胞因子(如 IL-1、IL-6 和 TNF-α )或应激反应可激活下丘脑-垂体-肾上腺 (HPA) 轴;因此,肥胖、全身炎症和应激反应之间的关系本质上是周期性的。在中断此周期之前,临床医生和其他健康倡导者必须首先意识到它的存在。
减肥可降低炎症
包括 CRP、TNF-α、IL-6 和 IL-18,单独控制饮食或结合身体活动干预后,这种效果可持续维持长达 2 年。通常,联合干预(饮食和身体活动)最有效,因为可以减少脂肪质量组成;然而,由于脂肪减少和身体活动增加之间的内在联系,很难确定哪个因素推动了炎症的减少。
例如,与身体活动较少相比,身体活动较多可降低慢性炎症,但当考虑 BMI 和瘦素水平时,这种关系不再存在。
在一项纵向研究中,低度炎症的增加与肥胖有关,但与身体健康无关。
总之,尽管身体活动和锻炼与降低炎症有关,但由于个人脂肪量的管理与全身炎症升高密切相关,因此似乎是整体健康的更关键因素。
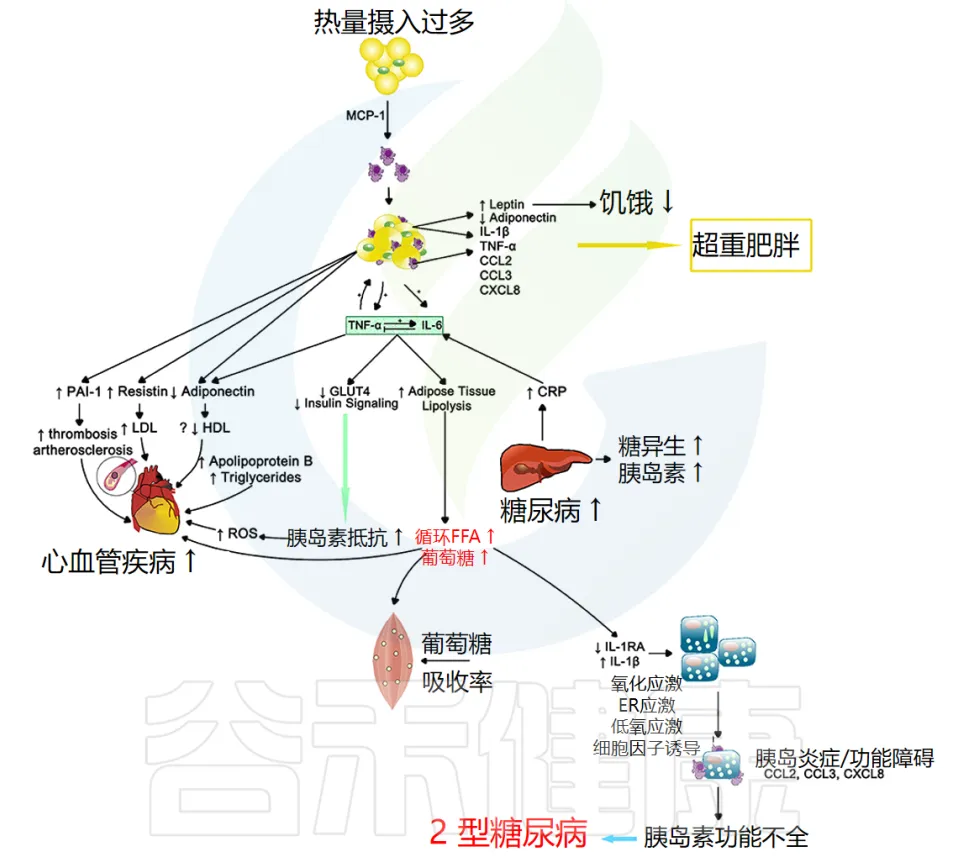
当个体细胞对胰岛素吸收血液中葡萄糖的信息不敏感时,就会发生胰岛素抵抗。
这种不敏感性导致胰腺产生更多的胰岛素;从而引发一个永无止境的负面循环,这通常会导致 β 细胞疲劳或凋亡,并引发 2 型糖尿病等代谢疾病。全身性炎症似乎在这两种代谢异常中都起着关键作用(下图)。
doi.org/10.3389/fmed.2018.00316
注:CRP指的是C反应蛋白(C-reactive protein)。C反应蛋白是一种由肝脏产生的蛋白质,其水平在体内炎症或感染时会升高。CRP常被用作炎症的生物标志物。
炎症与胰岛素抵抗的关系
较高的 CRP 水平与胰岛素抵抗有关,这表明炎症加剧可能导致 2 型糖尿病进展。事实上,在控制了 BMI 和 2 型糖尿病家族史后,女性健康研究中的 CRP 和 IL-6 升高 在 4 年期间独立预测了 2 型糖尿病的发展。因此,全身性炎症本身就可以促进胰岛素抵抗,但肥胖似乎会使情况更加复杂。
肥胖与炎症的相互作用
如肥胖部分所述,BMI 增加或肥胖与全身炎症(例如 CRP、IL-6 和 TNF-α 水平)增加有关。肥胖引起的炎症也与胰岛素抵抗的形成有关,即使控制 BMI 也是如此,这表明胰岛素抵抗带来的额外身体压力除了脂肪量外,还会增加慢性炎症。
此外,胰岛素抵抗会加剧炎症相关疾病,如丙型肝炎感染 ,而类风湿性关节炎患者服用 TNF-α 抑制剂会增加他们的胰岛素敏感性。
扩展阅读:
胎球蛋白 A 在胰岛素抵抗中的作用
有充分证据表明炎症与胰岛素抵抗和/或 2 型糖尿病之间存在关联。胎球蛋白 A 是一种肝脏急性期蛋白,可能提供关键机制。胎球蛋白 A 水平升高与胰岛素抵抗和/或 2 型糖尿病的横断面发生和纵向发展相关 。
胎球蛋白 A 有两种内源性效应支持这些数据:
治疗 2 型糖尿病的行为和药物干预可减轻炎症
与通过生活方式管理降低 BMI 可减轻炎症类似,减肥干预可降低血浆 IL-18 并增加胰岛素敏感性;这表明降低 BMI 和/或脂肪组织的努力可以改善对胰岛素的敏感性。二甲双胍和罗格列酮等血糖控制药物可同时减轻炎症并增加胰岛素敏感性;然而,炎症改善的确切机制仍不清楚。
IL-18(白细胞介素-18):
IL-18(白细胞介素-18)是一种由免疫系统细胞产生的细胞因子,属于白细胞介素家族。它在免疫反应中发挥重要作用,特别是在促进炎症和调节免疫细胞活性方面。
IL-18的主要功能和作用包括:
精神和身体疲劳是抑郁症的主要症状,包括注意力不集中、动力不足或没有动力、对以前喜欢的活动缺乏兴趣、睡眠和食欲紊乱、易怒、无望和社会孤立。
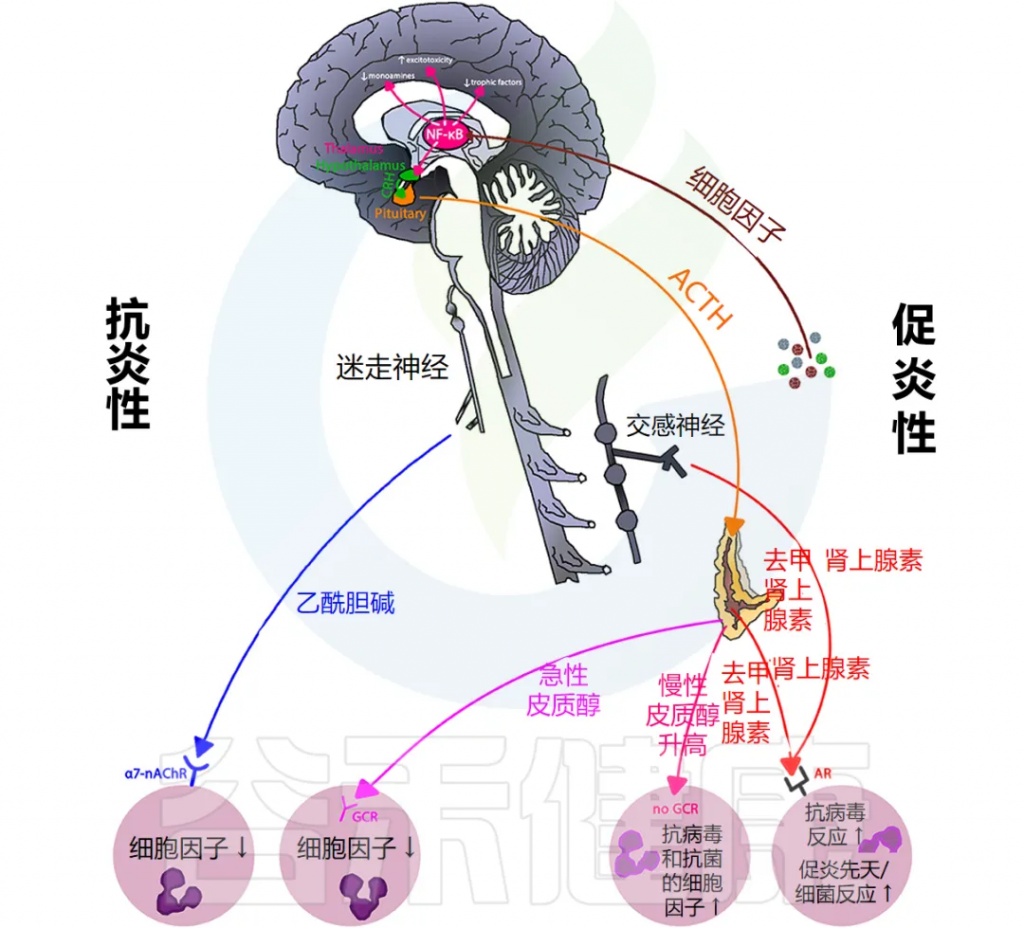
几十年来, HPA 轴失调一直与抑郁症有关;然而,抑郁症与炎症之间的关系最近才有所发展。
抑郁症与炎症的新认识
抑郁症常常与炎症相关疾病如心血管疾病和癌症并发 ;这表明慢性炎症可能与抑郁症有关。事实上,社区成年人的重度抑郁症和抑郁症状与慢性炎症有关,其严重程度呈现剂量依赖性模式。
由于长期和过度的应激激活导致免疫细胞不受控制或失调,可能会导致这种观察到的关系(下图)。
doi.org/10.3389/fmed.2018.00316
与非抑郁个体的免疫细胞相比,抑郁症患者的免疫细胞由于皮质醇敏感性降低而具有更高的 NF-κB 活性,从而创造了一种有利于持续产生促炎细胞因子的细胞内环境。
抑郁和炎症之间的关系是双向的
例如,在健康志愿者中,接触促炎细胞因子可产生病态行为或抑郁样症状,包括消极情绪、疲劳和精神运动迟缓。
细胞因子会影响血清素和多巴胺等神经递质的产生和代谢,而这些神经递质在情绪中起着至关重要的作用。
抗炎药物在抑郁症治疗中的作用
与同时服用抗抑郁药和安慰剂的患者相比,在临床抑郁症患者中,当同时服用非甾体抗炎药(如 COX-2 抑制剂或阿司匹林)时,血清素和去甲肾上腺素再摄取抑制剂的抗抑郁作用会增强。
抑郁症的周期性与炎症
抑郁症,尤其是重度抑郁症,具有周期性,因此增加确定其起源的困难:全身炎症增加还是抑郁症状增加。炎症对心理健康有影响吗?鉴于抑郁症与炎症之间存在显著联系,答案是肯定的。
炎症与其他精神疾病的关联
精神分裂症、躁郁症和创伤后应激障碍等其他精神疾病也与炎症加剧有关。因此,临床医生在治疗患有慢性炎症性疾病或抑郁症和其他潜在神经精神疾病的患者时,需要敏锐地意识到这种心理-生理关系。慢性炎症,无论是精神障碍的驱动因素还是结果,都开始模糊我们对身体和心理健康状况的理解,提示我们需要将它们视为相互关联的整体体验。
扩展阅读:
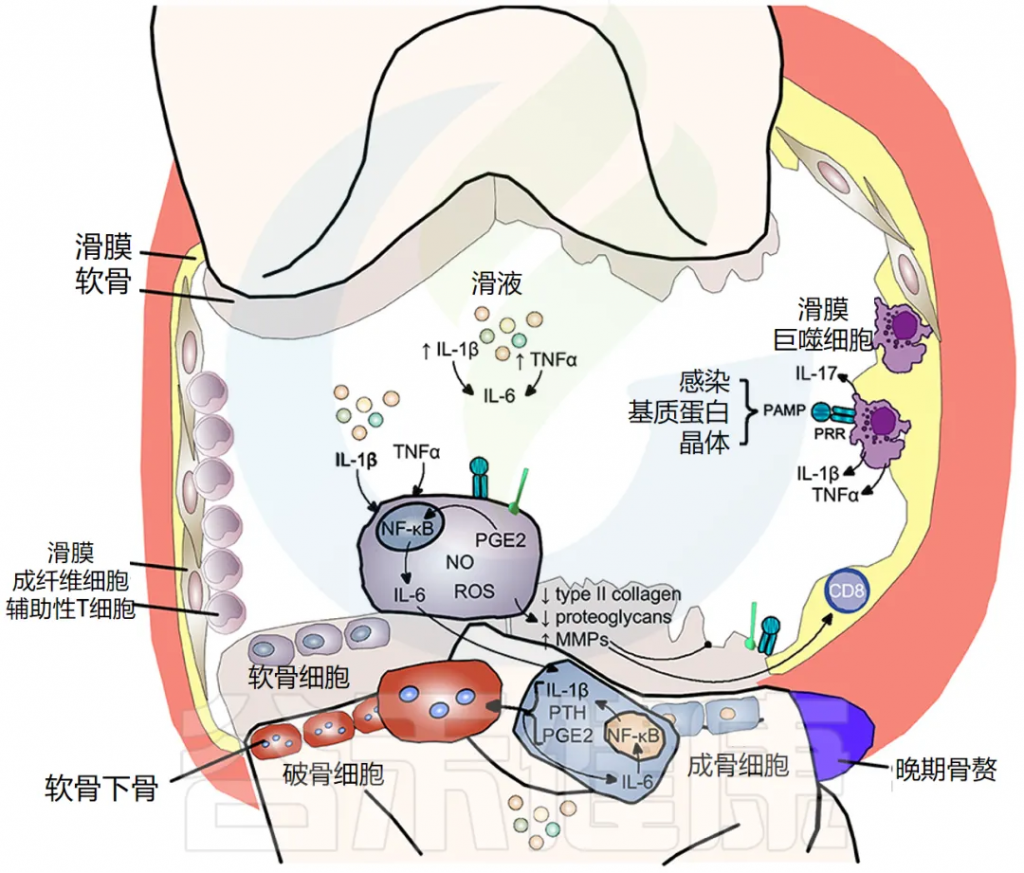
软骨破坏、软骨下骨重塑和滑膜炎症是骨关节炎的典型特征。最初,骨关节炎被认为是一种导致软骨损失的“磨损”疾病,这是临床上的主要特征;然而,现在显然滑膜炎是该疾病的主要驱动因素。流行病学研究表明,骨关节炎的进展与滑液中促炎细胞因子的数量相关,特别是 IL-1β、TNF-α 和 IL-6。
滑膜炎症是骨关节炎的一个重要的早期特征
其特征是滑膜内膜增生、巨噬细胞和淋巴细胞浸润、新血管生成和纤维化。滑膜炎导致滑液、滑膜、软骨下骨和软骨中的促炎细胞因子 IL-1β 和 TNF-α 增加。滑膜炎的程度在临床上与疼痛和功能丧失、骨赘形成和软骨损失的进展相关。
炎症的引发因素与机制
炎症可由感染性和非感染性刺激物引发,如透明质酸、滑液中的蛋白质和晶体,导致模式识别受体 (PRR) 和 Toll 样受体 (TLR) 激活,从而增加滑液中炎性细胞因子,如 IL-1β 和 IL-17。
炎症——软骨破坏
IL-1β 和 TNF-α 以及 PRR 和 TLR 的刺激,使软骨细胞内原本严格控制的合成/分解软骨稳态转向分解代谢程度更高的状态。一氧化二氮、自由基氧和前列腺素 E2 的产生增加,增加了基质金属蛋白酶 (MMP) 的释放,并抑制了软骨细胞中 II 型胶原蛋白和蛋白聚糖的表达,导致软骨破坏。
骨关节炎中的骨重塑
IL-1β 和 TNF-α 也显著上调软骨细胞释放 IL-6,激活成骨细胞释放 IL-1β、PTH 和 PGE2,进而激活破骨细胞活性,导致软骨下骨吸收。同时,这些介质刺激细胞间 IL-6 产生,维持破骨细胞活性。骨赘反映新骨形成,仅在疾病晚期出现(下图)。
doi.org/10.3389/fmed.2018.00316
现在人们认识到骨关节炎是一种由低度炎症驱动的全身性疾病和衰老,与智力衰退、脑血管病和心血管疾病等常见衰老情况有关。肥胖,特别是内脏脂肪,会导致促炎细胞因子产生显著增加,而脂肪因子、血糖水平升高和ox-LDL都会加剧低度炎症活动。特别是脂肪因子与直接扰乱软骨稳态有关;减肥的好处更可能来自于炎症负荷的减少,而不是关节机械负荷的减少。
随着对健康和疾病理解的深入,我们认识到19世纪的生物医学模型已不足以应对21世纪的慢性疾病挑战。现代研究显示,疾病是一个相互关联的复杂网络构成,而非孤立事件。炎症作为连接宏观疾病与个体体验的桥梁,强调了疾病发生的多因素性质。
面对这一现实,临床医学需要超越传统的生物医学方法,采用更全面的生物心理社会模型,关注患者的生活环境和心理状态。
监测炎症标志物如CRP、IL-6等,对于评估和控制疾病至关重要,尽管这些指标的解读需要考虑多种影响因素。
成功控制炎症疾病状态需要三个简单的步骤:
预防等于减少促炎活性
鉴于炎症在疾病发病机制和/或预后中的作用,我们需要改变疾病和疾病预防的方法。由于炎症活动会导致患病并产生可定义的疾病,因此成功的预防计划需要针对个人及其社会环境中促进促炎刺激的那些领域。
个体层面的抗炎预防
个人层面的预防策略应该从孕期就开始着手,目的是增强并维持母亲的适应能力,这一过程应该持续终身。
为了提高身体的适应力,我们应该采取以下措施:
“你吃什么,你就是什么”,这句老话在近年来得到了新的科学支持。随着理论和技术的发展,我们的饮食与健康之间的联系变得更加清晰。一个低饱和脂肪和精制糖、高复合碳水化合物、高纤维、富含鱼类蛋白质、坚果中的健康多不饱和脂肪酸(PUFA)、新鲜水果和蔬菜的饮食模式,一直被认为是健康的黄金标准。
肠道微生物研究为我们提供了更深入的理解
肠道微生物不仅帮助我们消化食物,还影响我们的免疫系统、肠壁的完整性,甚至影响大脑功能和行为。脑-肠轴理论认为,这些细菌及其消化副产物能够调节炎症、神经递质、神经递质前体的产生,以及肠神经系统的功能。
现在,我们已经能够测肠道微生物组的组成,并且可以实时观察食物变化对肠道微生物组的影响。复合碳水化合物和不饱和脂肪有助于支持抗炎细菌的生长,而简单碳水化合物(如精制糖)和不健康的脂肪(如过多的omega-6脂肪酸)则支持促炎细菌。肠道炎症的加剧与身心健康的损害密切相关。因此,关注肠道健康,选择加工程度较低的食物,或采取慢食的生活方式,是预防和干预炎症的关键步骤。
➣
总的来说,对疾病的理解应转向综合征概念,这有助于我们更好地识别和治疗如纤维肌痛等复杂疾病(例如,多达50%的纤维肌痛患者有抑郁症史)。未来的医学实践需要整合跨学科的知识,以更全面地理解炎症的作用,更有效地管理慢性疾病,并推动医学向更精准的方向发展。
主要参考文献:
Wang Y, Ma H, Zhang X, Xiao X, Yang Z. The Increasing Diagnostic Role of Exosomes in Inflammatory Diseases to Leverage the Therapeutic Biomarkers. J Inflamm Res. 2024 Jul 25;17:5005-5024.
Bennett JM, Reeves G, Billman GE, Sturmberg JP. Inflammation-Nature’s Way to Efficiently Respond to All Types of Challenges: Implications for Understanding and Managing “the Epidemic” of Chronic Diseases. Front Med (Lausanne). 2018 Nov 27;5:316.
Giacca M. SARS-CoV-2 infection boosts inflammation in atherosclerotic plaques. Nat Cardiovasc Res. 2023 Nov;2(11):966-967.
Matter MA, Tschaikowsky T, Stähli BE, Matter CM. Acute-on-chronic inflammation in acute myocardial infarction. Curr Opin Cardiol. 2024 Aug 20.
谷禾健康
人体的肠道粘膜内层形成物理屏障和免疫防御系统,以防止微生物入侵。当身体受到感染或细胞遭受损伤时,免疫系统会启动炎症反应来应对这些情况。炎症是对感染和组织损伤的一种急性反应,以限制对身体的伤害,这种反应是身体自然的防御机制,旨在清除病原体并修复受损细胞或组织。
先天免疫系统包含多种种系编码的模式识别受体(PRRs),这些受体可以检测由细胞损伤或组织损伤产生的微生物抗原,称为病原体相关分子模式(PAMPs)或损伤关联分子模式(DAMPs)。
这些PRRs包括位于细胞膜上的Toll样受体(TLRs)和C型凝集素受体(CLRs),以及细胞内PRRs如RIG样受体。NOD样受体(NLRs)是其他可以识别来源于病原体和受损细胞的分子模式的PRRs。
炎性小体的概念在2002年首次被提出,它是细胞内多种蛋白质组成的复合体,处在免疫防御和代谢控制十字路口,是细胞完整性的守护者并调控各种关键细胞功能。主要介导宿主对微生物感染和细胞损伤的免疫反应,在骨髓细胞中产生,是免疫系统的重要组成部分。
在感知外界病原体或损伤后,传递信号给免疫系统,启动炎症。它们形成大型多蛋白信号传导平台来裂解和激活caspase-1,这是一种主要的炎症途径。活性caspase-1可以将非活性形式的促炎细胞因子白细胞介素1β(IL-1β)和IL-18裂解为活性形式来调节炎症和宿主防御反应,这些相关细胞因子介导针对感染的多种局部和全身免疫反应,包括诱导发热、白细胞迁移至损伤或感染部位,以及Th1、Th2和Th17反应的激活和极化。
此外,炎性小体激活与细胞焦亡有关,细胞焦亡又称细胞炎性坏死,是一种程序性细胞死亡。在对抗感染中发挥重要作用。研究发现其参与宿主防御鼠伤寒沙门菌(Salmonella typhimurium)、土拉热弗郎西丝菌(Francisella tularensis)和炭疽芽孢杆菌(Bacillus anthracis)。
各种内源性和外源性刺激已被证明可以激活炎性小体。由于大量微生物寄居在粘膜表面,维持人体和微生物群之间的稳定需要与炎性小体的共生相互作用。

炎性小体主要充当复杂的传感器,使宿主能够区分有益细菌和有害细菌,但它们也充当宿主与其肠道微生物群之间沟通的介质。肠腔的环境状态持续影响宿主反应,导致通过产生IL-1β或IL-18产生特定信号,进而调节肠道微生物群。
随后,调节的微生物群可以通过短链脂肪酸和胆汁酸衍生物等微生物副产物增强宿主反应。但是炎性小体的激活需要受到严格调节,以限制异常激活和对宿主细胞的损害。如果失调,可能会导致不同的疾病。包括自身免疫疾病、癌症、胃肠道(GI)疾病和炎症性疾病。
因此,炎性小体对于协调体内精确的相互作用是不可或缺的。通过针对与炎症小体信号传导相关的结构来研究炎症小体活性的适当调节和治疗干预,可能是一个有前途的研究领域。
本文旨在使人们更清晰地认识炎性小体,讨论了不同炎性小体在人体内的功能、外来细菌、病毒等病原体入侵时,炎性小体在抵抗感染的作用。此外,炎性小体的失调或异常激活可能与人体一些疾病相关。炎性小体和微生物群的相互作用影响着人类健康。
✦
炎性小体(inflammasome)是由多种蛋白质组成的复合体,也称炎症小体,是免疫系统的重要组成部分,此概念由于2002年首次提出。
炎性小体可识别多种炎症诱导的刺激,包括病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs),并控制重要的促炎细胞因子如白细胞介素-1β(IL-1β)和IL-18的产生。
▼
炎性小体的功能
炎症小体是细胞内多聚蛋白复合物,是细胞完整性的守护者并控制各种关键细胞功能的完整性。具体来说,炎症小体的功能包括以下几个方面:
▸ 参与免疫反应,加工IL-1β和IL-18
在体内,炎性小体已被证明参与抗微生物先天免疫反应。在这方面研究最广泛的炎症小体是NLRP3炎性小体,它参与了抗菌、病毒、真菌和寄生虫的免疫反应。
caspase-1的激活受炎症小体调节,caspase-1的激活会导致IL-1β和IL-18的加工。
在非经典途径中,小鼠体内caspase-11(人类直系同源物包括caspase4和5)的裂解会激活NLRP3炎症小体,该炎症小体在维持肠道免疫稳态中发挥着关键作用。
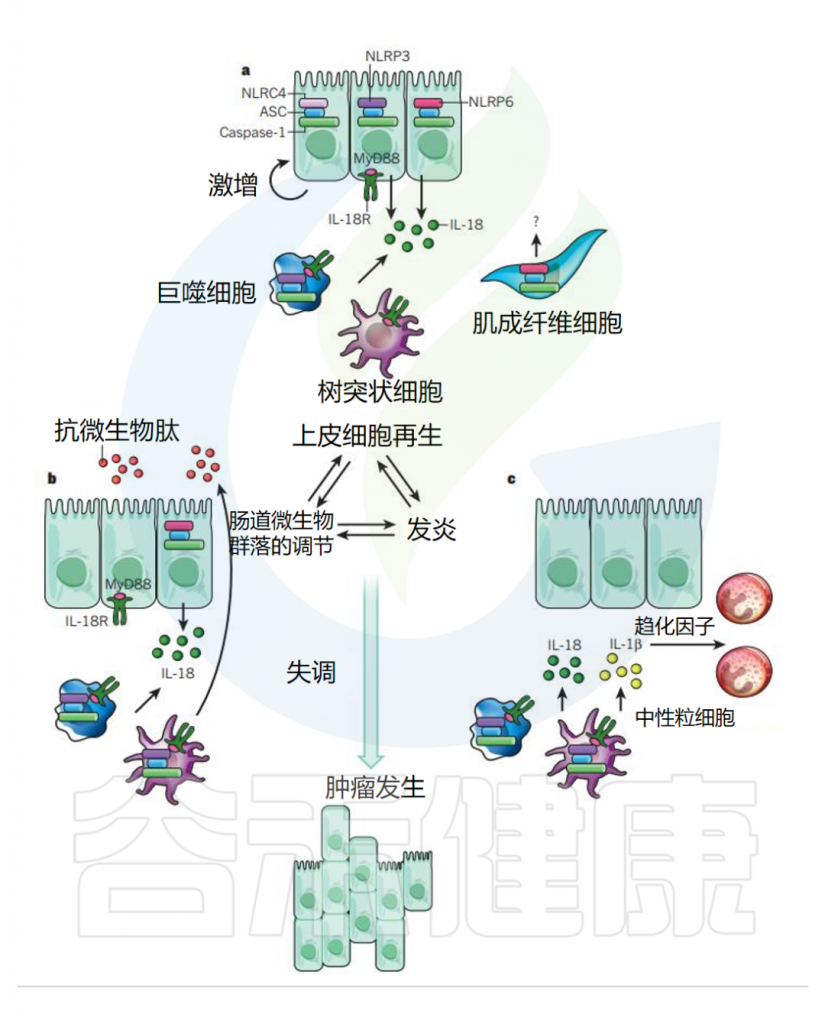
doi: 10.1038/nature10759.
需要注意的是,在急性炎症中,炎症小体的激活有助于去除死细胞并启动组织修复。然而,在慢性炎症中,炎症小体的持续激活是有害的,因为它会损伤组织。
▸ 促进细胞焦亡
此外,炎症小体激活与细胞焦亡有关。细胞焦亡是一种程序性细胞死亡,表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物的释放进而激活强烈的炎症反应,是机体一种重要的天然免疫反应,在抗感染中发挥重要作用。
细胞焦亡最常发生在细胞内病原体感染时,并且可能形成抗菌反应的一部分。焦亡是caspase-1依赖性的,并且独立于促凋亡caspase发生。
注:尽管细胞焦亡被认为是程序性细胞死亡的一种形式,但它与细胞凋亡所呈现的免疫沉默细胞死亡不同。焦亡伴随着质膜破裂、水流入、细胞肿胀、渗透溶解和促炎细胞内容物的释放。焦亡还伴随着DNA裂解和核浓缩,这与细胞凋亡的DNA阶梯特征不同,因为核完整性并未受到损害。
细胞焦亡的调控尚不明确;然而,细胞焦亡的程度似乎随着炎症体刺激的增加而增加。细胞焦亡是否在产生更活跃的炎症小体途径(下文讨论)的遗传性自身炎症疾病中发挥病理作用尚待确定。
▸ 与炎症性疾病相关,调节肠道稳态
炎性小体激活需要严格调节,以限制异常激活和对宿主细胞的损害。炎症小体活性失调与多种炎症性疾病有关,包括自身免疫、癌症和胃肠道疾病。
尽管炎症小体主要充当复杂的传感器,使宿主能够区分有益细菌和有害细菌,但它们也充当宿主与其肠道微生物群之间沟通的介质。
肠腔的环境状态持续影响宿主反应,导致通过产生IL-1β或IL-18产生特定信号,进而调节肠道微生物群。
随后,调节的微生物群可以通过短链脂肪酸和胆汁酸衍生物等微生物副产物增强宿主反应。因此,炎症小体对于协调体内精确的相互作用是不可或缺的。在这方面,通过针对与炎症小体信号传导相关的结构来研究炎症小体活性的适当调节和治疗干预,可能是一个有前途的研究领域。
炎症小体调节微生物感染和自身炎症性疾病期间的炎症
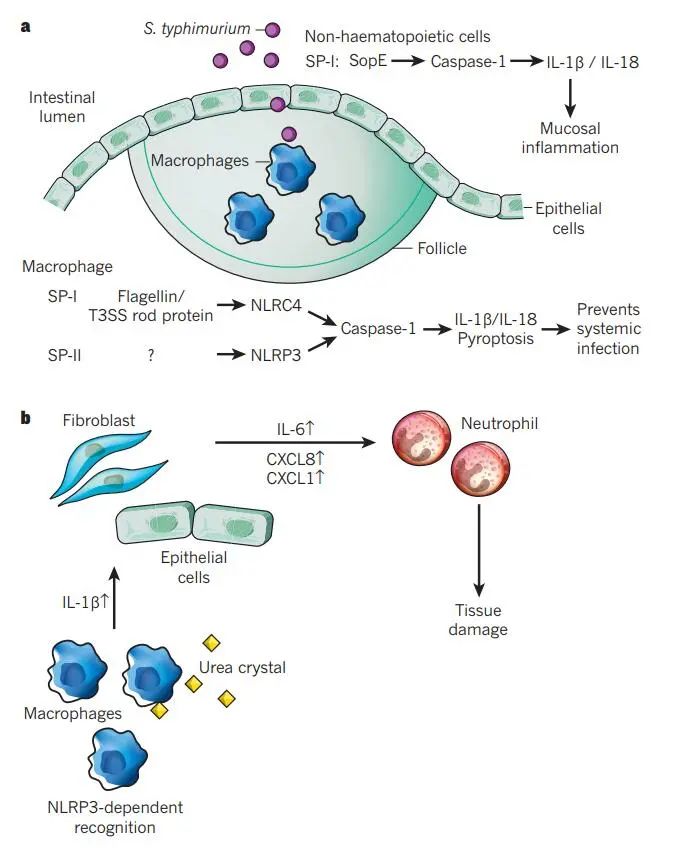
doi: 10.1038/nature10759.
a.鼠伤寒沙门氏菌通过肠上皮屏障进入宿主。M细胞是一种特殊的上皮细胞类型,分布在Peyer’s斑块上,特别参与沙门氏菌的胞吞作用和Peyer’s斑块中巨噬细胞的感染。炎症小体和caspase-1参与了几种细胞类型和感染的几个步骤。将细菌效应蛋白SopE注射到上皮细胞中,通过涉及GTPase Rac1的过程诱导caspase-1独立于NLRP3和NLRC4的激活。由此产生的粘膜炎症依赖于非造血细胞产生的IL-1β和IL-18。在巨噬细胞感染时,细菌蛋白鞭毛蛋白和PrgJ (T3SS的一部分)通过NLRC4被感知。这导致caspase-1的激活,导致IL-1β/IL-18加工和焦亡,从而限制全身感染。NLRP3通过识别未知信号参与这些过程。
b.巨噬细胞吞噬尿酸钠(MSU)晶体诱导nlrp3依赖性caspase-1激活和IL-1β释放,刺激非造血细胞产生IL-6和趋化因子(CXCL1和CXCL8),吸引中性粒细胞。然后,活化的中性粒细胞引起组织损伤。治疗性阻断人IL-1β可改善痛风的炎症发作。
▸ 和自噬途径的相互调节
自噬是一种细胞保护过程,细胞通过该过程将受损的蛋白质、细胞器或病原体隔离在双膜室(自噬体)中,靶向这种细胞材料在溶酶体中降解,并回收组成分子。
自噬发生在正常生理条件下,但可以通过细胞应激(如饥饿、促炎信号传导(例如 IFNγ)或细菌感染)上调。
最近的报告揭示了炎症小体和自噬途径之间复杂的相互作用。在没有污染配体的情况下,用TLR4激动剂脂多糖处理不会诱导野生型巨噬细胞中的炎症小体活化。然而,通过自噬调节因子Atg16L1或 Atg7 的基因消融来阻断自噬,可以实现LPS依赖性炎症小体激活,这表明自噬通常会对抗LPS引起的炎症小体激活。
另一项研究发现,炎症小体对自噬有负向调节作用,这使炎症小体和自噬之间的联系更加复杂。
!
炎性小体是好是坏
“抛开剂量谈毒性都是耍流氓”——炎症小体过少或过于活跃对健康都是不利的。炎症小体的活动是需要严格控制的,不能随意抑制和刺激,以避免产生过多的炎性细胞因子导致细胞死亡,伤及自身。
所以正常情况下,炎症小体,特别是NLRP3的表达在许多细胞中相对较低,需要诱导去引发信号。
先天免疫系统包含多种编码的模式识别受体(PRR),可检测微生物抗原,称为病原体相关分子模式(PAMP)或损伤相关分子模式(DAMP),由细胞或组织损伤产生。
炎症小体如何被激活尚不清楚。由于激活炎症小体的PAMP、DAMP和病原体具有不同的性质,因此可能存在多种途径。
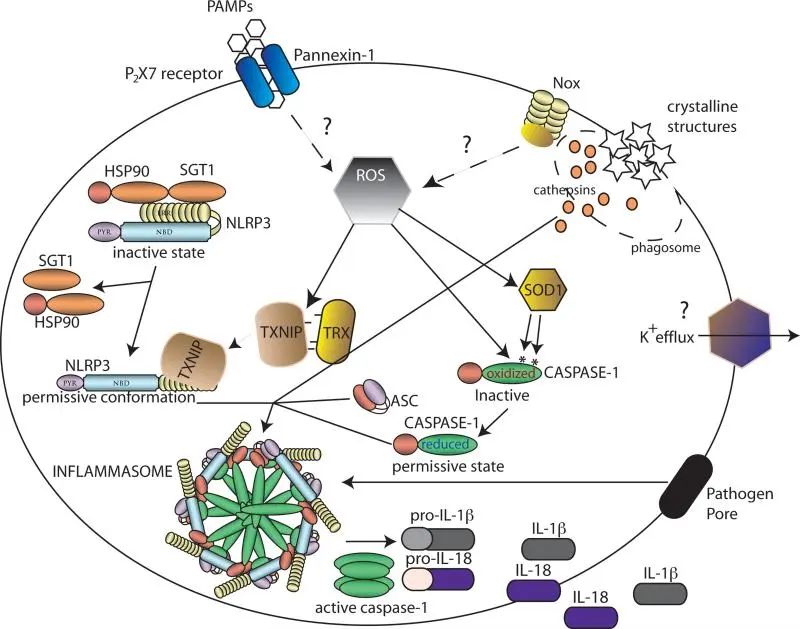
炎性小体在感知到PAMPs和DAMPs的结构多样性后进行组装。已经提出了几个模型来解释这些信号是如何被感知的,包括基于一般细胞应激识别的模型(图a和b)或基于激活信号的直接和间接识别的模型(图c-e)。
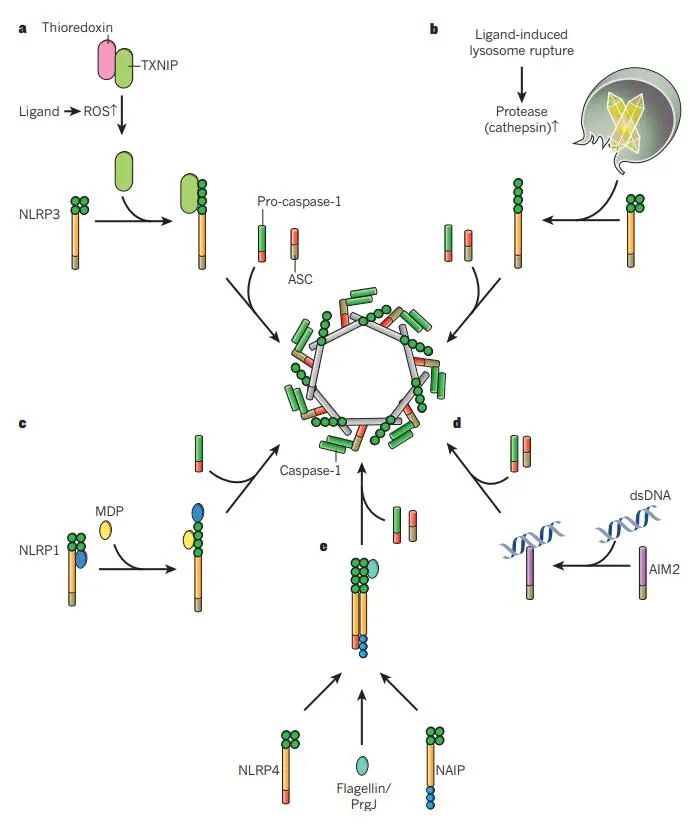
doi: 10.1038/nature10759.
(a) NLRP3感知细胞内(可能由线粒体)直接或间接由NLRP3炎症小体激活剂产生的活性氧(ROS)。硫氧还蛋白和硫氧还蛋白相互作用蛋白(TXNIP)的复合物可以感知ROS的增加,从而导致该复合物的解离。
随后,TXNIP与NLRP3结合导致NLRP3的激活,ASC和前caspase-1的募集,以及活性炎性体复合物的形成。
(b) 溶酶体失稳后,NLRP3被激活。特定晶体和颗粒结构的吞噬可导致溶酶体不稳定和溶酶体内容物(包括蛋白酶)的释放。这些蛋白酶可导致负调节因子的蛋白水解失活或NLRP3正调节因子的蛋白水解激活,导致炎性小体组装。
(c, d) NLRP1和AIM2直接感知配体。特异性配体(muramyl二肽(MDP)和双链DNA (dsDNA))的直接结合可导致NLRP1和AIM2的构象改变,导致炎性小体活化。
(e) NLRP1炎症小体的形成不依赖于ASC。NAIP蛋白感知细菌蛋白,导致NLRC4的募集和NLRC4炎症小体的组装。
此外,构成信号的限制因子如pro-IL1β和-IL18的转录上调是炎症小体激活的先决条件。除了编码原细胞因子的基因的诱导转录之外,NLRP3转录的激活也由NF-κB 激活剂(例如TLR配体)诱导。
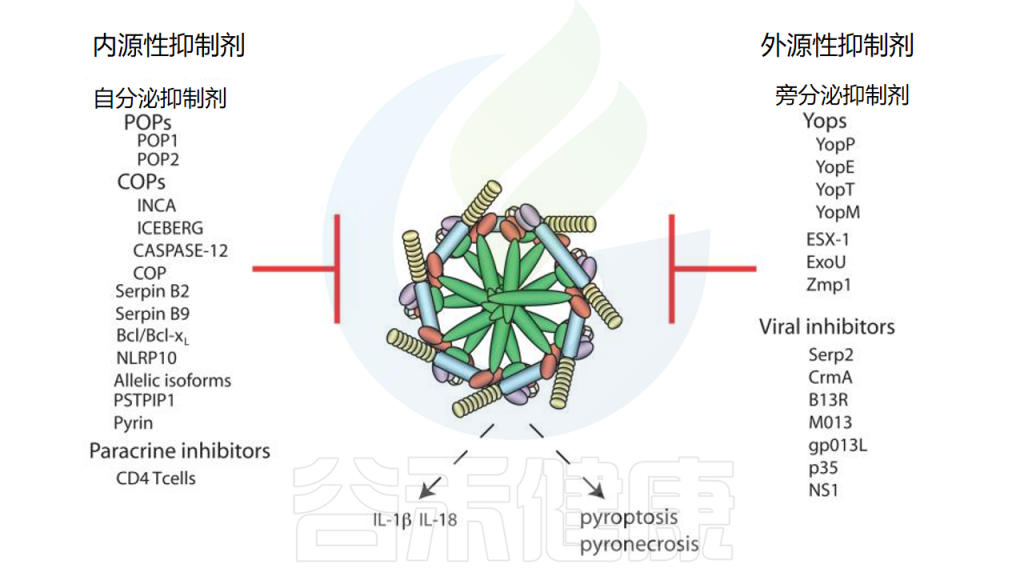
doi: 10.1146/annurev-immunol-031210-101405.
大部分炎性小体主要由受体蛋白(NLR或ALR家族的成员),衔接蛋白ASC和效应蛋白caspase组成。
炎性小体作为一种重要的细胞结构,它在炎症和免疫反应中发挥着关键作用。不同类型的炎性小体在形态和功能上都有所不同,对于了解炎症过程和治疗炎症性疾病具有重要意义。下面将探讨不同类型的炎性小体的特点和对肠道微生物群的作用机制。
Manshouri S,et al.Cell Commun Signal.2024
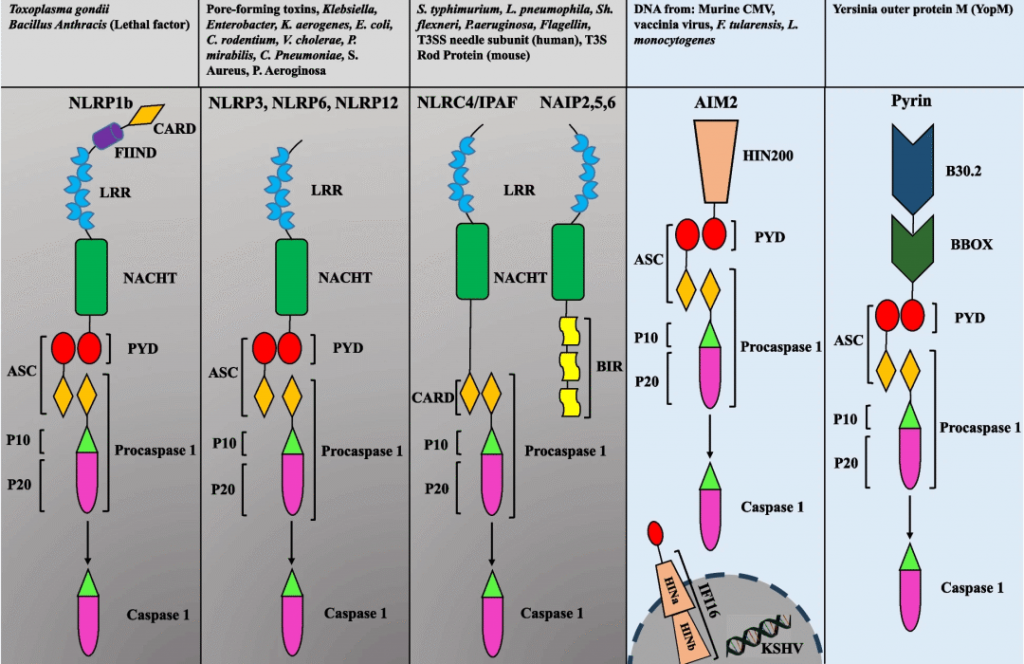
NLRP1炎症小体
NLRP1是第一个报道的形成炎症小体的分子,对caspase-1、caspase-5和ASC的需求最低。
NLRP1在结构上与其他NLR的不同之处在于其额外的C端延伸,由具有未知功能的结构域和CARD结构域组成。
NLRP1炎症小体在小鼠和人类中是不同的。小鼠NLRP1炎症小体由Nlrp1a、b和c的三个旁系同源物组成,其中包含NR100结构域,而不是人类中看到的PYD。
▸ NLRP1会影响产生丁酸盐的菌群
研究发现NLRP1炎症小体可以影响肠道微生物群。Nlrp1缺陷的小鼠表现出产生丁酸盐的细菌数量增加。丁酸盐已被证明通过促进肠道屏障的功能(例如粘液产生和紧密连接)对炎症性肠病(IBD)具有有益作用。
NLRP1炎症小体可能通过减少肠道微生物群的丁酸盐产生而对IBD产生负面影响。IBD有两种主要的临床形式,包括克罗恩病和溃疡性结肠炎。短链脂肪酸(SCFA)是由有益肠道细菌通过高纤维饮食发酵产生的。这些SCFA在减少炎症、调节免疫功能和防止过度活跃的免疫反应方面发挥着至关重要的作用,从而减缓IBD的临床进展。
NLRP3炎症小体
NOD样受体蛋白3(NLRP3)炎性小体包括N末端的热蛋白结构域(PYD)、中央NACHT结构域(包括带有核苷酸三磷酸腺苷/三磷酸鸟苷 (ATP/GTPase) P 环的七个基序和Walker A 和 B 结合位点),以及C端的9个富含亮氨酸的重复序列 (LRR)。
▸ 与其他炎症小体相比,NLRP3炎症小体需要两个信号
信号1(启动)由微生物分子或内源性细胞因子或 PRR(例如 TLR)的激活提供,导致经典和非经典 NLRP3 炎性体成分的转录上调。
它由NLRP3和pro-IL-1β的转录上调以及非转录机制组成,例如N端 PYD 内残基的去磷酸化、PYD 和 NACHT 结构域之间关键丝氨酸残基的磷酸化和 NLRP3 去泛素化。
Caspase-8和FAS相关死亡结构域蛋白(FADD)通过调节NF-kB通路介导此步骤。Lys-63 特异性去泛素酶 BRCC36 (BRCC3) 和 IL-1 受体相关激酶 1 (IRAK1) 调节 NLRP3 的激活。
信号2(激活)由PAMP或DAMP、成孔毒素、K +外流、溶酶体破坏、线粒体活性氧产生、心磷脂重新定位到线粒体外膜以及氧化线粒体DNA的释放提供,然后Cl -流出。
NLRP3炎症小体的经典和非经典激活机制
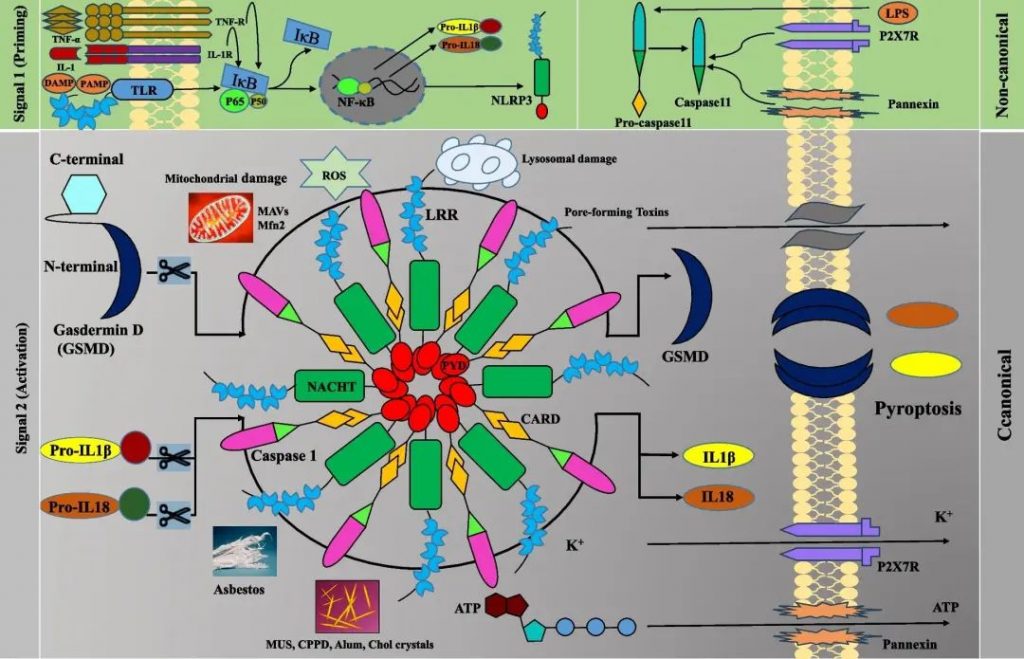
Manshouri S,et al.Cell Commun Signal.2024
经典途径涉及TLR信号传导,通过NF-κB途径诱导IL-1β、IL-18和NLRP3的转录。非规范途径涉及脂多糖等刺激,需要caspase-11来激活caspase-1。
▸ 微生物与NLRP3炎症小体的相互作用
一些共生肠道微生物可能会激活肠粘膜巨噬细胞中的NLRP3炎性小体。据报道,奇异变形杆菌(Proteus mirabilis)可能通过产生溶血素成为 NLRP3 激活剂。肠杆菌(Enterobacter)和克雷伯菌属(Klebsiella spp)在口腔定植可能会触发NLRP3炎症小体。存在于小鼠口腔中的产气克雷伯菌(K.aerogenes)通过巨噬细胞分泌IL-1β导致牙周炎。
研究还报道了肠道微生物群异常积累对年龄相关性心房颤动的因果影响,表明微生物群-肠道屏障-心房NLRP3炎性体相互作用可能作为治疗年龄相关性心律失常的潜在靶点。
在临床前研究中,研究人员发现金黄色葡萄球菌将线粒体与吞噬体隔离开,以逃避杀菌活性氧。这种巨噬细胞死亡的逃避依赖于NLRP3炎性体。使用小干扰RNA(siRNA)靶向NLRP3可以改善感染金黄色葡萄球菌的小鼠的细菌清除率。研究人员还发现,NLRP3 抑制和电子传递链复合物 II 抑制相结合,可以提高对人类单核细胞中金黄色葡萄球菌的杀伤力。
最近,证明了NLRP3炎性体在接触香烟烟雾后被激活,从而为肺部造成铜绿假单胞菌引起的急性损伤做好准备。这项研究表明,靶向NLRP3炎性体可能是治疗香烟烟雾引起的肺损伤的潜在治疗方法。
NLRP6炎症小体
NLRP6,也称为 PYPAF5,被描述为大多数免疫细胞中NF-κB和caspase-1表达的调节剂。这种蛋白质存在于肠上皮细胞中。研究表明,NLRP6对于调节肠道微生物组的组成和功能至关重要。
▸ 调节肠道微生物的组成和功能
NLRP6通过炎症小体依赖性和炎症小体独立途径、结肠炎相关肿瘤发生和杯状细胞中的粘液分泌来协调宿主与肠道病毒和细菌感染的相互作用。肠上皮细胞中的NLRP6缺陷与IL-18产生和caspase-1激活中断有关。NLRP6缺陷小鼠表现出普氏菌科和 TM7 的生长,以及乳杆菌和厚壁菌门的减少。
这些不平衡会引发结肠炎和肠道自发炎症。微生物群相关代谢物,例如牛磺酸和肠道共生细菌,可以激活NLRP6炎性体产生抗菌肽。杯状细胞可以通过 TLR-Myd88 信号传导激活 NLRP6 炎症小体,从而产生muc2。革兰氏阳性病原体产生脂磷壁酸,通过ASC募集激活NLRP6炎症小体,导致全身感染。应激诱导的促肾上腺皮质激素释放激素(CRH)抑制NLRP6炎症小体的激活,后者会导致肠道炎症和肠道微生物组的改变。
▸ NLRP6缺陷会导致胃肠道生态失调
NLRP6 缺陷的小鼠容易发生炎症。NLRP6 炎症小体在正常条件下是自我抑制的。脂磷壁酸和双链 RNA (dsRNA) 可以直接与 NLRP6 结合,从而产生可能的构象变化,以帮助液-液相分离(LLPS),这是炎症小体组装所必需的早期步骤。
此外,脂多糖可以直接与NLRP6结合,这可能导致LLPS的形成。然后,它与ASC相互作用激活 caspase-1或 caspase-11,从而激活 GSDMD 并导致质膜中孔的形成以及促炎细胞因子和细胞内内容物的释放。如果与ASC的相互作用不形成 NLRP6 炎症小体,则 LLPS 中的 NLRP6 通过诱导干扰素 (IFN) 和 IFN 刺激基因,诱导替代的炎症小体独立途径。
总而言之,在强烈的炎症反应具有破坏性的情况下,NLRP6可能通过 TLR 轴发挥保护作用,而其作用对于维持肠道稳态是必要的。NLRP6炎症小体与胃肠道的稳态有关。先前的研究表明NLRP6失调可能导致胃肠道生态失调。
此外,NLRP6炎症小体刺激抗菌肽(AMP)的表达,包括血管生成素-4(Ang4)。一些微生物代谢物,包括牛磺酸、精胺和组胺,似乎可以诱导NLRP6依赖性IL-18和AMP的产生。
NLRP12炎症小体
NLRP12,也称为Nalp12和Pypaf-7,与ASC和胱天蛋白酶1形成炎症小体,使IL-1β成熟。它是最早与衔接蛋白ASC共定位并相互作用形成炎症小体的NLR之一。人类基因组中NLRP12编码序列的突变与IL-1介导的炎症性疾病有关。
▸ 识别鼠疫耶尔森氏菌等病原菌
尽管我们对NLRP12在健康和疾病中的作用的了解有限,但最近的数据表明,NLRP12对于识别鼠疫耶尔森氏菌(鼠疫病原体)至关重要。
NLRP12在巨噬细胞感染鼠疫杆菌后控制caspase-1裂解以及IL-1β和IL-18分泌。然而,NLRP12可以抑制骨髓源性巨噬细胞产生IL-12,并负向调节宿主对流产布鲁氏菌的防御。
NLRP12的确切配体目前未知;然而,它的激活需要一个功能正常的T3S系统。这表明细菌毒力因子进入宿主细胞质可能是直接激活NLRP12或改变宿主信号通路所必需的。无论激活机制如何,NLRP12驱动的IL-18分泌和相关的IFN-γ产生在小鼠抵抗鼠疫耶尔森氏菌感染方面发挥着关键作用。NLRP12缺陷小鼠在感染后表现出更高的死亡率和细菌载量。
▸ 抑制肠道炎症和肿瘤
除了形成炎症小体之外,NLRP12还通过负向调节NF-kB信号传导来抑制肠道炎症和肿瘤发生。几项独立研究表明,NLRP12 在生化检测、结肠癌和结肠炎模型中对经典和非经典NF-κB信号传导有负向调节作用。
NLRP12被认为在鼠伤寒沙门氏菌感染期间独立于炎症小体抑制宿主防御,因为Nlrp12缺陷小鼠比WT对照对鼠伤寒沙门氏菌感染具有更强的抵抗力,并且炎症细胞因子水平较低。
NLRP12在造血细胞中发挥抑制肿瘤发生的作用,但它不是造血细胞,而是非造血细胞,这对于限制肿瘤数量至关重要。尽管如此,两项研究都表明NLRP12在控制结肠炎症反应中发挥着重要作用。
NLRC4炎症小体
NLRC4(以前称为IPAF,Card12)在感染各种革兰氏阴性菌后可形成炎症小体,如鼠伤寒沙门菌(S.typhimurium)、嗜肺军团菌、福氏志贺菌和铜绿假单胞菌。NLRC4在髓系中表达,其基本作用是防止细菌入侵。
与其他炎症小体不同,NLRC4与另一种NLR蛋白NAIP结合被激活,NAIP作为NLRC4激活剂的受体。
▸ 有效抵御铜绿假单胞菌和伤寒沙门氏菌
几项研究表明,NLRC4在宿主防御有鞭毛的铜绿假单胞菌方面是有效的。在缺乏NLRC4或胱天蛋白酶-1激活的情况下,含有军团菌的吞噬体不能与溶酶体融合。相反,鞭毛蛋白突变的军团菌不能激活巨噬细胞中的胱天蛋白酶1。
鼠伤寒杆菌可以激活NLRC4和NLRP3,这导致ASC的形成和胱天蛋白酶向炎症小体的募集。NLRC4炎症小体感知PrgJ,一种III型分泌系统(T3SS)的成分,并通过CARD-CARD与胱天蛋白酶-1的相互作用启动炎症小体组装。
▸ 与婴儿期肠炎伴自体炎症相关
研究人员证明, NLRC4的功能获得性突变与一种极其罕见的疾病有关,这种疾病称为婴儿期肠炎伴自体炎症(AIFEC)。这种疾病的特点是巨噬细胞激活和胃肠道严重炎症。常驻肠道单核吞噬细胞(iMP),例如树突状细胞和巨噬细胞,可以对抗肠道病原微生物,同时保持对共生微生物的耐受性。
由于胃肠道的免疫细胞主要与许多共生微生物发生反应,它们应用多种机制来限制针对胃肠道共生微生物的不受控制的免疫反应。iMP中的NLRC-4激活后,分泌IL-1β诱导内皮细胞中粘附分子的表达。这些粘附分子促进中性粒细胞募集到肠粘膜和外来微生物的摄入。
PYHIN炎症小体
另一类与NLR不同的炎症小体已被鉴定为PYHIN家族。PYHIN是由四个人类基因(AIM2、IFI16、MNDA和IFIX)和13个小鼠基因组成的家族,并包含一个PYD和一个或两个HIN-200DNA 结合域。
AIM2和IFI16已被证明可形成caspase-1激活炎症小体。与NLR不同,AIM2和IFI16在这两种情况下都直接与其配体dsDNA结合。ASC是招募pro-caspase-1所必需的,因为AIM2和IFI16缺乏 CARD。
▸ AIM2对于肠道微生物群稳态非常重要
在感染过程中,AIM2感知来自鼠巨细胞病毒、牛痘病毒、土拉弗朗西斯菌和单核细胞增生李斯特菌的 DNA 。
AIM2炎症小体的一个功能是调节肠道微生物群。研究表明,AIM2炎症小体的激活导致肠道中IL-18和AMP的产生。Aim2缺陷小鼠的IL-18和AMP(例如REG3c和REG3b)减少。AIM2 的缺乏会导致肠道菌群失调,从而增加对结肠炎的易感性。
同时研究发现, Aim2缺陷小鼠粪便中肠杆菌科成员(例如大肠杆菌)的数量比普通小鼠高数百倍。当新杀弗朗西丝菌(F.novicida)(一种胞质病原体)从液泡逃逸到细胞质时,AIM2炎性小体就会受到刺激。缺乏逃离液泡的关键基因的F. novicida突变体无法触发AIM2炎症小体。
与NLRP6类似,AIM2炎性小体对于维持肠道微生物稳态至关重要。在胃肠道中,未经治疗的Aim2缺陷小鼠显示,Akkermansia muciniphila和 Anaeroplasma的数量较高,而双歧杆菌、普雷沃菌、Anaerostipes和Paraprevotella的数量较低。
Pyrin炎症小体
Pyrin是一种高分子量(86kDa)蛋白质,主要存在于免疫细胞中,包括中性粒细胞、单核细胞和树突状细胞。
与其他免疫传感器不同,pyrin通过细胞骨架重塑而不是微生物化合物来检测细菌毒力。
Pyrin在识别病原体对RhoA GTPase的失活修饰后,以ASC依赖性方式介导caspase-1炎症小体组装。小鼠pyrin有两个功能性磷酸化位点:Ser-205 和Ser-241,它们通过与14-3-3蛋白结合而使pyrin 失活。当毒素刺激或细菌感染时,导致Rho修饰,Ser-205和Ser-241去磷酸化,导致14-3-3解离。该级联导致吡啶激活并形成寡聚吡啶-ASC炎性体复合物。
▸ 在维持肠道稳态中发挥作用
尽管关于肠道微生物群产生的特定pyrin炎症小体激活剂的知识很少,但最近的研究揭示了它们在维持肠道稳态中的作用。在一项使用小鼠结肠炎的研究中,pyrin炎症小体信号可防止生物失调,促进肠道屏障完整性,并改善结肠炎症和肿瘤发生。
最近一项使用全基因组合并CRISPR筛选技术的研究中,两种胆汁酸类似物(BAA485和BAA473)被鉴定为在髓系和IEC系中诱导pyrin炎症小体信号传导的特异性配体。由于肠道细菌是胆汁酸代谢的丰富来源,类似的微生物组衍生的pyrin炎症小体激活配体可能有助于调节肠道稳态。
总体而言,pyrin炎症小体为与细胞骨架结合的先天免疫成分提供了新的范例,为细胞免疫的结构调节提供了新的机制。
✦
炎症小体正在成为宿主针对微生物病原体反应的关键调节因子。当微生物侵入组织或引起细胞损伤时,这些胞质多蛋白复合物会招募并激活半胱氨酸蛋白酶caspase-1。
炎症小体激活的caspase-1通过将促炎细胞因子IL-1β和IL-18裂解为其生物活性形式并将高迁移率族蛋白B1(HMGB1)释放到细胞外环境中来诱导炎症。此外,炎症小体通过称为细胞焦亡的炎症细胞死亡程序来对抗细菌复制并清除受感染的免疫细胞。
跟着谷禾一起来深入了解炎症小体在宿主与微生物相互作用中所扮演的重要角色,探讨其对免疫调节和疾病防御的影响,以及在维持体内微生物稳态和免疫平衡方面的关键功能。
炎症小体的组装和caspase-1的激活在病原体特异性方式下发生,尽管不同的炎症小体在感染过程中可能具有相似的作用。
▸ Nlrp1b炎症小体
Nlrp1b炎症小体识别细胞质中存在的炭疽芽孢杆菌致死毒素,Nlrp1b基因突变被确定为炭疽致死毒素诱导巨噬细胞死亡的关键易感位点。值得注意的是,Nlrp1b炎性体诱导的细胞焦亡赋予体内对炭疽芽孢杆菌孢子感染的抵抗力,突显了细胞焦亡对于宿主防御病原体的重要性。
▸ Nlrp3炎症小体
NLR家族成员Nlrp3的激活包括一个两步过程,需要用TLR和NLR配体启动以增强NF-κB驱动的Nlrp3转录,然后将巨噬细胞暴露于微生物毒素和离子载体(例如尼日利亚菌素和蓖麻毒素)或内源性毒素。
在巨噬细胞分别感染细菌、病毒和真菌病原体如金黄色葡萄球菌、肺炎链球菌、流感病毒和白色念珠菌的过程中,可以结合Nlrp3启动和激活步骤。类似于Nlrp1b炎症小体在炭疽杆菌感染中的作用,Nlrp3炎症小体激活缺陷使小鼠对念珠菌病高度敏感。
▸ Nlrc4炎症小体
Nlrc4炎性体可检测沙门氏菌(Salmonella)、假单胞菌(Pseudomonas)、军团菌(Legionella)和志贺氏菌(Shigella spp.)的III型和IV型细菌分泌系统的细菌鞭毛蛋白和基体杆成分。
除了分泌IL-1β和IL-18之外,最近还确定诱导焦亡细胞死亡是一种关键的体内机制,Nlrc4炎性体通过该机制清除表达鞭毛蛋白的细菌,例如嗜肺军团菌和伯克霍尔德菌。
人们认为细胞焦亡使细胞内细菌暴露于细胞外免疫监视,从而使它们被抗菌肽、免疫球蛋白和补体系统破坏,并被中性粒细胞和其他免疫细胞摄取。
▸ AIM2炎症小体
最后,AIM2响应土拉热弗朗西斯菌(F.tularensis)、单核细胞增多性李斯特菌和某些DNA病毒(例如CMV和痘苗病毒)以诱导caspase-1激活。caspase-1缺陷型小鼠对土拉菌病(土拉菌病的病原体)感染的敏感性增加,说明AIM2炎性小体在宿主对微生物病原体的防御反应中发挥着关键作用。
细菌和病毒效应物对炎症小体途径的调节
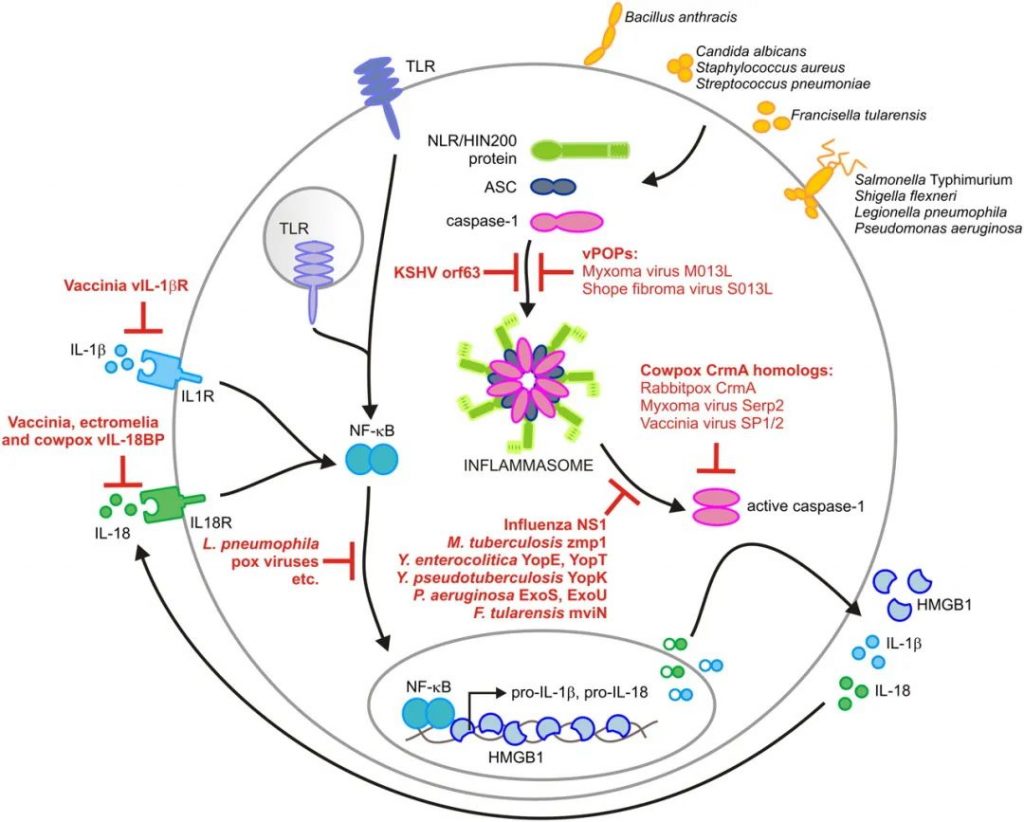
doi: 10.4049/jimmunol.1100229.
细菌、病毒和真菌病原体感染巨噬细胞和树突状细胞会诱导炎性体复合物的组装。这些多蛋白复合物驱动诱导caspase-1的激活,从而使IL-1β、IL-18和高迁移率族蛋白B1(HMGB1)释放到细胞外。
鉴于炎症小体在控制微生物病原体复制和传播中的重要性,细菌进化出一套机制来对抗炎症小体组装并干扰caspase-1效应机制的诱导也就不足为奇了。
▸ Yop蛋白等毒力因子抑制IL-1β分泌
例如,肠道病原性小肠结肠炎耶尔森氏菌通过专用的III型分泌系统将称为Yop蛋白的毒力因子注入宿主细胞胞浆中。在这些效应蛋白中,YopE和YopT抑制caspase-1激活以及随后成熟IL-1β的分泌。
这些Yop蛋白是Rho GTP酶和Rho介导的过程(例如细胞骨架重组和吞噬作用)的负调节因子。
尽管目前尚不清楚Yop效应蛋白和细胞骨架过程如何干扰炎症小体信号传导,但显性失活蛋白和化学抑制剂导致Rho GTPase Rac1失活表明该Rho GTPase在caspase-1激活和IL-1β分泌中发挥着关键作用。
假结核耶尔森氏菌使用名为YopK的第三种效应蛋白来掩盖细菌III型分泌系统并阻止其被Nlrp3和Nlrc4炎性体识别。这导致宿主巨噬细胞中的细菌存活率增加,说明炎症小体在控制侵入性耶尔森氏菌细胞内增殖中的重要性。
▸ 毒力因子外酶抑制caspase-1激活
表达毒力因子外酶(Exo)U的铜绿假单胞菌分离株使用不同的策略来抑制人类吞噬细胞中caspase-1的激活。这种革兰氏阴性病原体编码一种名为ExoU的具有磷脂酶A2活性的酶,可抑制Nlrc4炎性体驱动的受感染巨噬细胞分泌IL-1β和IL-18。
ExoS是另一种假单胞菌毒力因子,可干扰炎症小体诱导的IL-1β产生。该效应蛋白通过涉及其ADP-核糖基转移酶活性的不完全表征过程抑制caspase-1激活。
▸ 干扰炎性小体的信号传导
嗜肺军团杆菌(L.pneumophila)代表了革兰氏阴性病原体如何干扰炎症小体信号传导的另一个例子。Nlrc4炎性小体限制体外培养的巨噬细胞和受感染小鼠肺部的军团菌生长。该病原体干扰炎性小体接头ASC的转录上调,以保护其在人单核细胞中的增殖。
F.tularensis利用假定的脂质II翻转酶mviN来抑制AIM2炎症小体的激活。mviN突变株感染小鼠,由于AIM2炎性体介导的IL-1β分泌增强和巨噬细胞焦亡,导致体内毒力受损。
革兰氏阳性病原体(例如结核分枝杆菌)也已进化出干扰炎性体功能的机制。被称为Zmp1的推定Zn2+金属蛋白酶对Nlrc4炎性体激活和IL-1β分泌的抑制使这种人类结核病病原体在骨髓细胞中增殖。
炎症小体信号传导的调节并不局限于细菌病原体。事实上,病毒提供了一些最具特征的机制,通过这些机制影响炎症小体。
▸ 牛痘病毒编码的丝氨酸蛋白酶抑制剂抑制 Caspase-1
牛痘病毒细胞因子反应修饰物A(CrmA)及其在牛痘病毒中的同源物直接靶向影响Caspase-1的酶活性。
CrmA和其他丝氨酸蛋白酶抑制剂在增强痘病毒毒力方面的重要性通过以下观察得到证实:CrmA的缺失会减弱BALB/c和C57BL/6小鼠鼻内和颅内感染的毒力。同样,感染缺乏CrmA同源Serp2的粘液瘤病毒突变体的兔子的病毒滴度显著降低。
此外,正痘病毒、痘苗病毒和副痘病毒产生可溶性IL-18结合蛋白,可防止细胞因子诱导的IL-18受体激活。因此,正痘病毒通过丝氨酸蛋白酶抑制剂和清道夫受体分别对caspase-1活性和下游炎症体效应子的联合抑制作用来增加毒力。
注:清道夫受体是吞噬细胞表面的一组异质性分子
▸ 病毒诱饵蛋白对炎症小体组装的抑制作用
除了直接靶向caspase-1的酶活性并干扰IL-1和IL-18受体的连接外,病毒还部署了阻止炎症小体组装的分子。
卡波西肉瘤相关疱疹病毒(KSHV)Orf63的作用很好地说明了这一点,Orf63是一种病毒Nlrp1同源物。KSHV Orf63与人Nlrp1和Nlrp3相互作用,以阻止其各自炎症小体的组装以及随后的caspase-1依赖性先天免疫反应。
KSHV Orf63表达的转录下调降低了病毒复制率,这是由于Nlrp1和Nlrp3介导的IL-1β分泌增强以及KSHV感染的人单核细胞和293T细胞中焦亡诱导的结果。
吡啶结构域蛋白(POP),例如粘液瘤病毒M013L和纤维瘤病毒S013L,代表了病毒诱饵蛋白抑制炎性体的另一个例子。由于宿主炎症反应增加和病毒复制减弱,缺乏编码M013L基因的粘液瘤病毒突变体的病毒血症显著减少,从而强调了粘液瘤病期间病毒POP的重要性。
此外,人类CARD蛋白ICEBERG、COP、INCA和CASP12 S被认为通过与caspase-1前结构域中的CARD基序的同型CARD相互作用来清除caspase-1,从而干扰炎症小体组装。然而,与病毒POP不同,人类CARD-only蛋白的病毒对应物仍有待鉴定。
炎症小体的抑制
doi: 10.1146/annurev-immunol-031210-101405.
▸ 流感病毒抑制炎症小体信号传导
有趣的是,流感病毒使用与上述正痘病毒无关的机制来阻止caspase-1的激活并干扰炎症小体信号传导。人类流感A/PR/8/34(H1N1)的突变病毒,其中流感NS1基因被删除,触发受感染宿主细胞分泌显著增加的IL-1β和IL-18水平,并未能阻止巨噬细胞中caspase-1的成熟。
这些突变病毒在体外被减毒,但caspase-1依赖性和非依赖性机制在多大程度上促成了这种表型尚不清楚。流感NS1驱动的caspase-1激活抑制似乎仅依赖于NS1的N-末端RNA结合/二聚化结构域,而羧基末端效应结构域对于抑制IL-1β和IL-18分泌是可有可无的。对流感病毒NS1抑制胱天蛋白酶-1激活的分子机制的进一步分析可能揭示病毒靶向炎症小体的有趣的新机制。
我们的观点
总体而言,宿主-病原体相互作用本质上是动态的。病毒利用了人体的基因,并利用它们来规避免疫系统。细菌也进化出了复杂的机制。病原体对炎症小体的特异性靶向强调了其在先天免疫中的重要性。
✦
炎症小体是一种在人体免疫系统中起关键作用的多蛋白复合物,其异常活化或抑制与多种炎症性疾病的发生和发展密切相关。炎症小体在调节炎症反应、细胞焦亡和免疫调节中发挥重要作用。
但由于炎症小体成分的遗传突变以及调节缺陷而导致的不适当的炎症小体反应与多种人类疾病有关。研究表明,炎症小体的功能异常与自身免疫疾病、感染性疾病和肿瘤等的发生有关。
1
在肠道炎症和肿瘤发生中的作用
结直肠癌是一种常见的恶性肿瘤,发病率和死亡率在全球范围内居高不下。据统计,结直肠癌是全球第三常见的癌症,也是溃疡性结肠炎和克罗恩病等炎症性肠病的主要并发症。炎症性肠病和结直肠癌通常与炎症细胞因子的过度产生有关。
IL-1α/β、IL-6和TNF-α等炎症细胞因子在炎症促进的肿瘤发生中发挥重要作用。基于炎症小体在IL-1β加工中的关键作用,研究了NLRP3炎症小体在结肠炎和结肠炎相关癌症(CAC)中的作用。
▸ 炎症小体在控制肠道稳态和预防肿瘤中起作用
多个研究小组意外地发现炎症小体的成分在控制肠道稳态和预防肿瘤发生方面发挥着保护作用。
NLRP3、ASC或caspase-1缺陷的小鼠更容易患结肠炎和CAC。这种表型与局部和全身IL-1β和IL-18分泌减少有关。数据表明,NLRP3负责防止肠道炎症和肿瘤发生增加。
此外,观察到caspase-1对DSS诱导的结肠炎具有类似的保护作用。Casp1−/−小鼠在DSS治疗后表现出肠道炎症和NF-κB激活增强以及组织修复受损。
▸ IL-18可能介导了炎症小体对肠道的保护作用
IL-18是肠道稳态和炎症所必需的。研究发现,IL-18信号传导可防止DSS诱导的结肠炎和DSS+氧化偶氮甲烷诱导的CAC动物模型中的组织损伤。此外,外源性IL-18使Casp1−/−小鼠免受结肠炎诱发的体重减轻影响。因此,IL-18似乎负责NLRP3炎性体介导的针对肠道炎症、组织损伤和肿瘤发生的保护作用。
▸ NLRP3炎症小体在化疗抗肿瘤反应中起作用
还研究了NLRP3炎症小体在肿瘤发生中的作用。研究指出,NLRP3炎症小体对化疗诱导的抗肿瘤反应是必不可少的。从机制上看,化疗诱导的垂死肿瘤细胞释放的ATP激活了NLRP3炎症小体,进而通过IL-1β的分泌进一步激活产生IFN-γ的CTL。
考虑到用于激活NLRP3炎症小体的外源性ATP浓度远高于化疗诱导的垂死肿瘤细胞释放的ATP浓度(mM与μM),其他内源性NLRP3激活剂,如尿酸,可能在化疗期间释放,从而激活体内的NLRP3炎性小体。
2
NLRP3炎症小体和代谢紊乱
近几十年来,肥胖、2型糖尿病、动脉粥样硬化等代谢性疾病的发病率急剧上升,严重威胁人类健康。
▸ 肥胖患者的促炎细胞因子上调
在过去的十年中,人们已经清楚地认识到慢性炎症是代谢紊乱的一个关键预测因素。例如,肥胖与细胞因子产生的上调和炎症信号通路的激活有关。
肥胖状态下,脂肪组织中的炎症小体活化会导致促炎细胞因子的过度分泌,如IL-1β和IL-18等。这些促炎细胞因子的释放会引发炎症反应,进而影响胰岛素信号传导、葡萄糖代谢和脂质代谢,加剧肥胖相关的代谢紊乱。
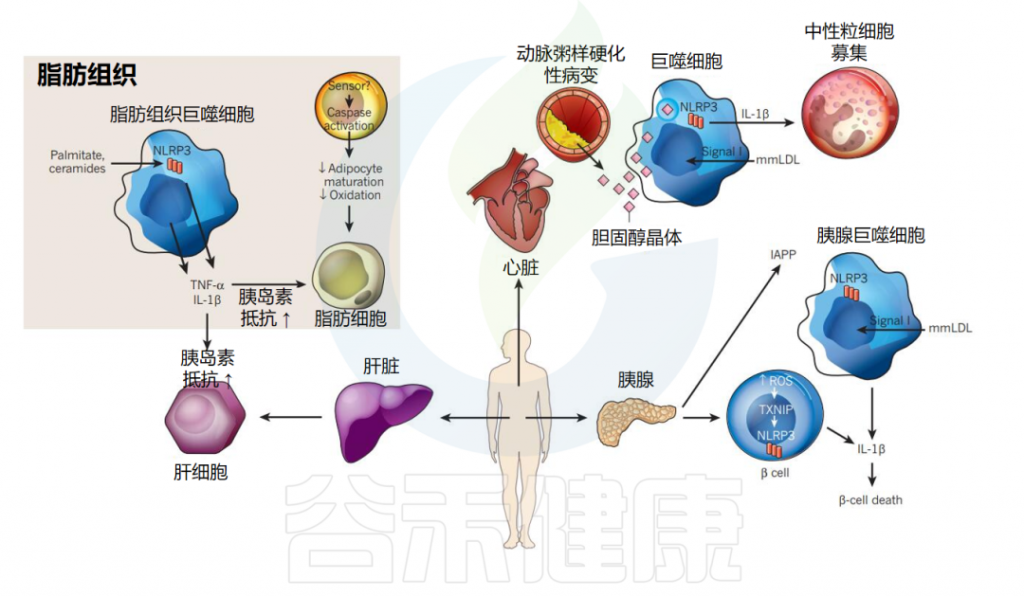
▸ 炎症小体分泌IL-1β破坏胰岛素调节
NLRP3炎症小体在2型糖尿病(T2D)中扮演着重要角色。它作为代谢应激传感器,在治疗T2D的临床试验中加强了IL-1β受体拮抗作用。
IL-1β升高是发生T2D的危险因素,并通过拮抗胰岛素信号传导导致胰岛素抵抗。IL-1β还介导胰岛中长期高血糖(糖毒性)的毒性作用,导致β细胞破坏并调节葡萄糖诱导的胰岛素分泌。
最近的一项研究描述了慢性高血糖期间小鼠胰岛中IL-1β的分泌情况:高细胞外葡萄糖通过NLRP3炎症小体触发IL-1β分泌。
此外,NLRP3结合蛋白TXNIP作为胰腺β细胞死亡和外周葡萄糖摄取失败的介质,与T2D密切相关。
炎性小体在代谢综合征中的作用
doi: 10.1038/nature10759.
▸ NLRP3炎症小体在动脉粥样硬化中起重要作用
最近的研究还表明NLRP3炎症小体在动脉粥样硬化中发挥着核心作用。动脉粥样硬化是一种慢性炎症性疾病,其特征是动脉粥样硬化病变中炎性成分的积累和免疫细胞的募集。
观察到在早期饮食引起的动脉粥样硬化病变中存在微小胆固醇晶体的沉积,这与巨噬细胞的募集有关。体外生成的胆固醇晶体在脂多糖引发的人外周血单核细胞和小鼠巨噬细胞中诱导NLRP3/ASC炎性体激活和caspase-1/IL-1β/IL-18裂解。
此外,使用骨髓嵌合体的体内实验表明,骨髓细胞来源的NLRP3、ASC和IL-1β/β在动脉粥样硬化病变的发展中发挥着关键作用。由于活性氧(ROS)还促进动脉粥样硬化的发展,因此测试ROS在胆固醇晶体诱导的NLRP3炎性体激活中的参与将很有意义。
3
炎症小体和适应性免疫
NLRP3炎性小体除了在先天免疫反应中的促炎作用外,最近的研究强烈表明NLRP3炎性体介导的细胞因子(IL-1β和IL-18)在形成适应性免疫反应中发挥着重要作用。
▸ IL-1β调节早期TH17细胞分化
据报道,IL-1β信号传导可调节早期Th(辅助性T)17细胞分化,并在实验性变态反应性脑脊髓炎(EAE)诱导中发挥重要作用。
从机制上讲,IL-1β信号传导诱导IRF4和RORγt的表达,这是参与Th17分化的两个重要转录因子。IL-1β 还被证明可以与IL-23协同作用,诱导产生IL-17的 γδ T 细胞的发育,从而促进EAE的发展。因此,人类Th17细胞的分化需要IL-1β的存在。
▸ IL-18协同其他细胞因子影响T细胞的反应
与IL-1β相反,IL-18信号在Th细胞分化中的作用取决于其他协同细胞因子。例如,IL-18与IL-12的协同作用诱导产生IFN-γ的Th1细胞,而IL-18与IL-2的组合增强了IL-13(一种Th2细胞因子)的产生。
通过与IL-23协同作用,IL-18扩增极化Th17细胞产生的IL-17。因此,与IL-1β相比,IL-18在形成适应性T细胞反应方面表现出更灵活的功能,这可以解释IL-1β和IL-18在某些疾病模型(如肠道炎症和2型糖尿病)中的不同功能。
基于IL-1β和IL-18在T细胞分化和自身免疫性疾病中的作用,几个研究了炎症小体在T细胞介导的疾病中的作用。数据表明NLRP3在加剧EAE发展中发挥着重要作用。这是由于抗原呈递巨噬细胞和DC需要NLRP3才能最佳地激活初始T细胞形成Th1和Th17效应细胞。
总之,NLRP3炎症小体介导IL-1β和IL-18的产生,IL-1β和IL-18与其他炎症细胞因子配合调节T效应细胞的产生并影响疾病进展。这些研究将炎症小体的作用扩展到适应性免疫的调节。
4
炎症小体和痛风
痛风是一种自身炎症性疾病,其特征是严重的关节炎症,导致关节病和相当大的疼痛。痛风与代谢紊乱密切相关,导致血尿酸水平升高(高尿酸血症)和 尿酸盐(MSU)晶体在关节中沉积。
▸ 尿酸盐是NLRP3炎症小体的有效激活剂
最近的研究阐明了尿酸盐(MSU)依赖性关节炎症的潜在机制。MSU在体外是NLRP3炎症小体的有效激活剂,并且MSU依赖性中性粒细胞募集在体内依赖于ASC衔接子、caspase-1和IL-1R。
IL-1β拮抗剂在临床试验中的成功支持了炎症小体调节的IL-1β在人类痛风和密切相关的假痛风中的致病作用。
5
炎症小体和肝损伤
尽管NLRP3炎性体在DSS诱导的结肠炎期间的组织损伤中发挥保护作用,但对乙酰氨基酚(APAP)诱导的肝损伤动物模型的研究表明,NLRP3炎性体会放大免疫反应并加剧肝损伤。
▸ NLRP3可能是造成肝损伤的关键介质
APAP治疗通过有毒代谢中间产物诱导肝毒性,导致肝细胞死亡。最近的一项研究发现TLR9和NLRP3炎症小体是APAP诱导的肝损伤和炎症的关键介质。TLR9检测APAP诱导的肝细胞死亡后释放的内源DNA,并上调pro-IL-1β和pro-IL-18的产生,这些物质进一步被NLRP3炎性小体裂解。
因此,TLR9和NLRP3炎症小体在APAP诱导的肝损伤和炎症过程中发挥着作用。然而,NLRP3炎症小体的刺激尚未得到充分研究。基于APAP治疗诱导的急性和强烈的细胞死亡,从死亡细胞释放的尿酸、ATP、线粒体或透明质酸可能会激活TLR9或激活巨噬细胞中的NLRP3炎症小体。
此外,AIM2最近被鉴定为介导caspase-1激活和IL-1β/IL-18加工的胞质DNA传感器。需要进一步的研究来测试AIM2在肝损伤和其他涉及广泛细胞死亡的疾病模型(如脓毒症)中的作用。
▸ 拓展:其他炎症小体可能影响的疾病
NLRP3以外的NLRP突变与人类疾病相关。NLRP12突变与一种名为FACS2的类似FCAS的发热综合征有关。
研究人员认为,这些患者的NLRP12突变可能破坏了该蛋白的NF-κB抑制活性。然而,考虑到NLRP12和NLRP3之间的高度同源性以及FCAS和FCAS2患者症状的相似性,这些患者的炎症小体活性可能存在失调。
NLRP1的突变与白癜风等多种自身免疫性疾病有关。最近,NLRP2突变被发现与一例家族性Beckwith-Wiedmann综合征有关,这是一种导致胎儿过度生长和印记障碍的疾病。
此外,NLRP7突变与家族性和复发性葡萄胎有关,这是一种异常妊娠状态,胎盘绒毛退化,受精卵无法存活。这些基因突变参与的疾病机制以及炎症小体途径的潜在参与仍有待进一步阐明。
检测炎症小体激活的方法
激活炎症小体具有多个重要特征,包括ASC斑点的形成、促炎性细胞死亡、具有生物活性IL-1β/IL-18细胞因子的分泌以及HMGB1的表达。一般可以通过以下几种方法检测:
1.使用RT-qPCR检测NF-κB诱导的pro-IL-1β和NLRP3是否上调;
2.使用荧光显微镜或流式细胞术监测细胞系中ASC斑点的形成;
3.使用Western blot检测caspase-1的裂解或pro-IL-1β/IL-18的成熟;
4.使用ELISA测定IL-1β、IL-18或HMGB1的释放;
5.使用乳酸脱氢酶(LDH)测定或碘化丙啶(PI)染色法检测细胞焦亡;
6.使用检测IL-1β、IL-18分泌的报告基因功能细胞系。
以上方法各有利弊,可以适当的结合这些方法来检测炎症小体的激活。
✦
越来越清楚的是,炎症小体激活caspase-1以多种方式有助于保护宿主免受入侵微生物的反应。例如通过分泌IL-1β和IL-18诱导炎症,介导HMGB1等“警报素”的释放,并触发受感染宿主细胞的焦亡以消除微生物病原体。
炎症小体与肠道微生物群之间的相互作用在维持肠道稳态和调节免疫反应中也发挥着至关重要的作用。然而炎症小体的功能具有两面性(有害与有益)。这种相互作用的失调可能导致各种胃肠道疾病的发生。因此,必须对其进行严格监管,以限制异常激活和对宿主细胞的损害。
NLRP6炎性小体缺乏被证明与促进自身炎症的微生物群的扩张有关,如普氏菌科(Prevotellaceae)。炎症小体可以感知微生物群成员或群落,调节组织修复和再生,以及在稳态和炎症状态下协调粘膜免疫反应。
在之前的研究中发现,炎症小体缺乏和肠道菌群的改变都与人类代谢综合征(如肥胖和动脉粥样硬化)的发展倾向有关。炎症小体对肠道菌群的调节是否会影响体重、代谢和炎症,预计将成为该领域的主要研究方向。
主要参考文献
Manshouri S, Seif F, Kamali M, Bahar MA, Mashayekh A, Molatefi R. The interaction of inflammasomes and gut microbiota: novel therapeutic insights. Cell Commun Signal. 2024 Apr 2;22(1):209.
Liang Z, Damianou A, Di Daniel E, Kessler BM. Inflammasome activation controlled by the interplay between post-translational modifications: emerging drug target opportunities. Cell Commun Signal. 2021;19:1–12.
Sim J, Park J, Moon J-S, Lim J. Dysregulation of inflammasome activation in glioma. Cell Commun Signal. 2023;21(1):239.
Pellegrini C, Antonioli L, Lopez-Castejon G, Blandizzi C, Fornai M. Canonical and non-canonical activation of NLRP3 inflammasome at the crossroad between immune tolerance and intestinal inflammation. Front Immunol. 2017;8:36.
Davis BK, Wen H, Ting JP. The inflammasome NLRs in immunity, inflammation, and associated diseases. Annu Rev Immunol. 2011;29:707-35.
Carriere J, Dorfleutner A, Stehlik C. NLRP7: From inflammasome regulation to human disease. Immunology. 2021 Aug;163(4):363-376.
Lamkanfi M, Dixit VM. Modulation of inflammasome pathways by bacterial and viral pathogens. J Immunol. 2011 Jul 15;187(2):597-602.
Strowig T, Henao-Mejia J, Elinav E, Flavell R. Inflammasomes in health and disease. Nature. 2012 Jan 18;481(7381):278-86.
Próchnicki T, Latz E. Inflammasomes on the Crossroads of Innate Immune Recognition and Metabolic Control. Cell Metab. 2017 Jul 5;26(1):71-93. doi: 10.1016/j.cmet.2017.06.018. PMID: 28683296.