-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
粪菌移植(FMT)这几年很热,表面看,它的逻辑很直白:将健康人的肠道菌群移植到患病者体内,期望借此改善肠道微生态,帮助缓解疾病症状。但是,同样是 FMT,为什么有些人效果明显,甚至症状得到了长期缓解,而有些人却反应并没有达到预期?
其关键在于供体菌群能否在受体肠道定植并长期维持。
定植并不只是看移植后肠道菌群更像供体,而是看供体菌株是否能在受体体内站稳脚跟、稳定下来,并在长期的群落动态中维持。这个过程背后,涉及到很多因素——包括供体和受体肠道环境的相似度、供体菌群的多样性、移植方式等等。
目前,越来越多的研究开始聚焦于供体菌株的定植效率。换句话说,供体菌群是否真的能够在受体肠道环境中稳定生长,功能性地替代或补充原有群落。这是 FMT 成功的一个关键因素。
而定植的成败又受到多方面因素的共同影响,包括微生物物种之间的兼容性、菌株之间的互补性,以及肠道环境本身的特性。在不同的疾病状态下,影响定植效率的因素可能截然不同。
近期的两项大型随机对照试验(FOCUS Trial 和 Gut Bugs Trial)对这两种疾病背景下 FMT 的效果进行了深入分析,其研究结果发表在《Gut Microbes》期刊上。

研究表明,在溃疡性结肠炎的队列中,供体和受体菌群的相似性越高,定植效果越好;而在肥胖的队列中,更大的相似性反而可能降低定植效率,反而更互补的供体-受体匹配可能更有利。
本文我们将通过这两项试验的数据,探讨影响 FMT 定植效率的关键因素,并分析其如何在不同的疾病背景下产生不同的效果。随着对 FMT 机制的深入了解,未来我们也许能在个性化医疗的框架下,根据患者的疾病背景和微生物特点,更精确地选择供体和设计治疗方案,从而提高 FMT 的疗效。
许多FMT 研究会先用群落层面的指标(如 PCoA、α 多样性)说明受体菌群是否更像供体。但这类指标回答的仍是整体相似性问题。尤其在单供体 FMT 中,供体来源相对明确。
在多供体 FMT 设计的实际应用中,还有更棘手更具体的问题:
后面所有“哪些因素影响定植”的统计分析,都是围绕这个问题展开的。本章先把作者怎么定义与计算定植效率讲清楚。
多供体FMT第一道坎:究竟谁给了谁?
单供体 FMT 比较直观:受体出现一个新菌株,大概率来自那位供体。
但在溃疡性结肠炎(UC) 的 FOCUS 试验里,每次用的是 4–7 位供体混合。于是会出现两个麻烦:
所以作者先做了一个基础动作(逻辑很简单):
把受体治疗后样本里的菌株,拿去和每位供体的菌株做DNA 相似度比对,足够像就可以算供体匹配菌株(donor-matching strain)。
再统计一个受体样本里,能匹配上的供体菌株有多少——这就是后面要用到的定植相关指标的基础。
怎么“用菌株匹配”拼出每个受体的供体来源
这一步相当于在反向破案。
先定一条线——多像才算同一菌株
作者用 StrainPhlAn3 估计每个样本在每个物种里的“主导菌株”,再算菌株间 DNA 距离,并做了归一化(不同物种的菌株差异天生不一样,不能直接比)。
下图对比了两类距离:
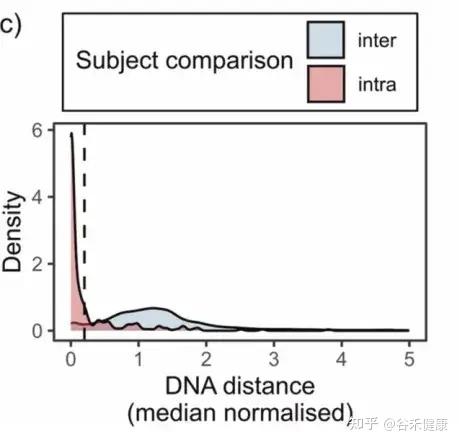
然后画了一条阈值线:0.2。
作者把距离 ≤0.2 当成是“同一菌株/高度匹配”的层级。
注:这条线很重要,因为后续所有“某受体匹配到某供体菌株”的判断,都建立在这个阈值上。
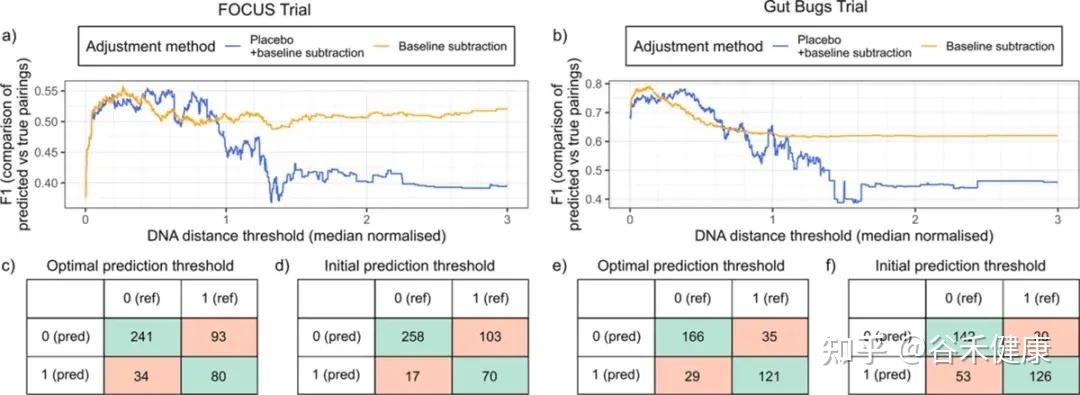
不同队列/测序条件下最优阈值不同,且优化阈值能显著提升配对预测的整体表现
你可以把它理解成:作者先用数据告诉你,同一个人的前后样本(或者同来源)通常会落在怎样的距离范围,再在这个分布上划一个相对保守的界限,用它来决定是不是同一株。
安慰剂组里也会出现看似匹配的噪音,所以要剔除模糊供体菌株
你会注意到一个事实:安慰剂组里也可能出现一些供体匹配菌株 ——这显然不能被解释为真的做了 FMT。这类匹配可能来自背景噪音、算法阈值的误差、或某些菌株本来就在群体里很常见导致碰巧接近。

所以作者在 Figure 1b 做了关键一步:
把安慰剂组里出现的这些模糊供体菌株(ambiguous donor strains)当作噪音来源,从 FMT 组数据里移除,再重新画热图。这样就尽量避免把“背景共有菌株”误判成“FMT 导致的定植”。
这也是多供体、菌株匹配分析里比较严谨的一点:不是匹配上了就算,而是还要问一句,在没有 FMT 的情况下,这种匹配会不会也出现?
反推每个受体可能接到了哪些供体
剔噪后,下图统计每个受体匹配到的菌株分别来自哪些供体,用不同颜色表示不同供体贡献。
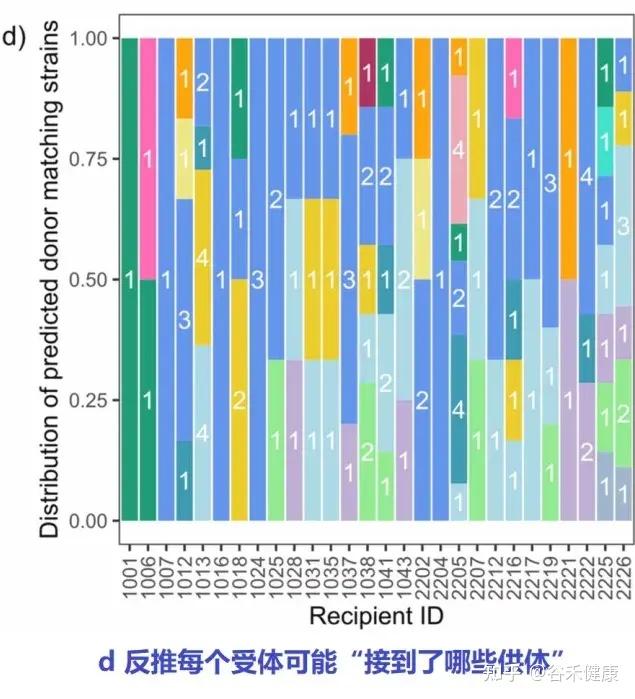
FOCUS 的 FMT 组里,28/32 名受体在 8 周能检测到“只在 FMT 组出现且基线不存在”的供体匹配菌株。
也就是说:大多数人确实能看到来自供体的新菌株信号。
在结果里把定植拆成了两类:新增与替换
同样叫“定植”,机制可能不同。
对每个发生定植的物种—菌株事件,看受体基线有没有这个物种:
注: 这两类在生态学上差别很大:
替换意味着同物种内的菌株竞争、基因型差异、以及原有菌株的生态位被重新占据;
新增更像是受体原来缺失的成员被补齐,或者说受体生态系统里存在可被填补的空位。
这一步很必要,因为它会影响你怎么理解后面供受体相似/不相似:
这也解释了为什么后面在不同疾病队列里,相似性指标的方向可能不一样。
那么,“定植效率”在本文里到底是什么
把“能住下来多少菌”变成一个数字。
当研究人员能数清,受体里到底出现了多少个“可追踪的供体匹配菌株事件”后,就能把它汇总成一个可建模的因变量:
供体的定植效率(engraftment efficiency)。
注:可以粗略地理解为供体带来的、能被追踪到的菌株,在受体体内“留下来”的程度。
后面所有模型(相关性、线性模型、线性混合模型)基本都是:用 定植效率 当结果,看看它和哪些因素有关。
到这里,作者先解决了“没配对表也能继续分析”的卡点。接下来进入论文真正想回答的核心:
哪些因素决定菌株能不能定植?
这种规律在不同疾病人群里是不是完全不同?
两个队列:UC vs 肥胖
作者选了两项双盲、随机、安慰剂对照的多供体 FMT 临床试验:
为什么要用两项试验来说?
这里研究人员认为,如果“哪些因素决定定植”是一条普遍规律,那么换一个疾病队列也应该差不多;如果规律会变,那说明定植机制是队列/疾病特异的。
FOCUS:强干预、长疗程、但测序相对浅
FOCUS试验对象:患有溃疡性结肠炎(UC)的成年人。
FOCUS(UC)试验采用多供体粪菌制备的灌肠剂及胶囊,给UC患者的治疗方案很猛:
采样与数据方面,作者为了让前后对比简单且可比,主要选了:
受体:基线 + 8 周(FMT 组与安慰剂组)
供体:个人供体样本 + 混合供体批次样本
对菌株来说,这是一个供体数量可变、竞争更复杂的输入环境。
Gut Bugs:供体数固定、胶囊给药、测序深
Gut Bugs Trial是另一种更标准化的多供体:
采样时间点:基线与6周(尽量对齐“即时干预后”)。
这些结构差异会怎么影响定植效率?
两项试验虽然都叫多供体,但 FOCUS 的结构更像供体数量可变的混合生态输入,Gut Bugs 更像供体数量固定的标准化输入。
在 FOCUS 里,受体面对的是 4–7 个供体生态位的竞争,而且批次大小(batch size,即每位受体的供体数量)在模型里被作者作为固定效应单独纳入(因为它会影响每个供体成分能否留下来)。
在 Gut Bugs 里,供体数恒定为 4,所以作者明确说明:不把 batch size 当作固定效应。
这会让后面的相关性(比如β多样性与定植效率的方向)更可能呈现队列差异。
再看分析结构:为什么FOCUS能盲法预测配对,而Gut Bugs更多是验证
Methods 里还特别强调了一个分析流程上的差异:
FOCUS 试验:作者在一开始不知道真实供体—受体配对的前提下,先用供体菌株匹配去反推每个受体可能用了哪些供体(盲分析)。之后才从原试验作者处拿到真实配对,用于验证与后续分析。
Gut Bugs 试验:真实配对关系在此前已发表,因此无法再做同样的盲法预测;它在该文章中的角色更像是验证集,验证这套菌株匹配框架在另一种疾病队列里是否还能工作、结论是否一致。
FOCUS更偏向从0推断供体贡献,Gut Bugs更偏在已知答案下验证规律是否可迁移。
FMT的定植不是供体越强越好,也不是受体越空越好,而是供体携带的菌株库、受体基线生态位,以及两者的匹配关系共同决定。
同样是健康供体,有的人就是更容易送进去
很多人会以为:多供体混在一起,最后效果应该差不多“平均掉”。但原文首先用数据把这个想法打破:供体之间的平均定植效率差异显著(p<0.001)。
更直观的是 FOCUS(UC)队列里两个常见供体的对比:
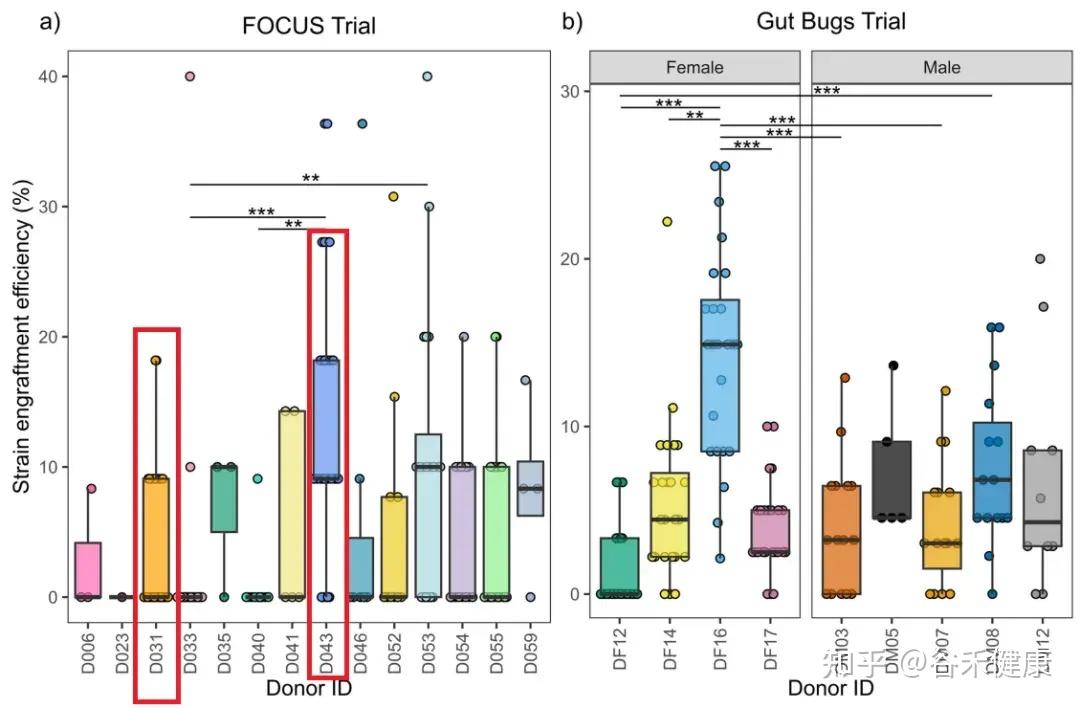
可以看到供体之间差异显著,比如说FOCUS里面:D043、D053 高,D033、D040 低;Gut Bugs里面:DF16 高、DF12 低。
而且这两位供体都被大量使用(分别对应 n=29、n=26 个受体)。这意味着:不是谁用得多谁就看起来强,而是供体本身确实存在可重复的可定植性差异 。
反转:用“匹配度”量化后,两队列规律不同
这个供体适不适合这个受体,它不靠主观印象,在这里研究人员用β 多样性把匹配变成可计算、可检验的量,并发现两队列的关键信号落在不同层面。
在 FOCUS(UC)队列中,供受体的功能谱越接近,供体菌株越容易留下来:
研究人员还进一步做了“按单个 COG 类别差异”去解释的线性模型,但没有找到某一个功能单独驱动的证据,因此提出更合理的解释:这更可能反映的是整体功能的互补性/匹配,而不是某一个功能类别单打独斗。
在 Gut Bugs(肥胖)队列中,功能 β 多样性并没有显著影响定植效率(下图显示相关性不显著)。也就是说,至少在这个队列与这套数据里,“功能越像越好”并不是主导信号。
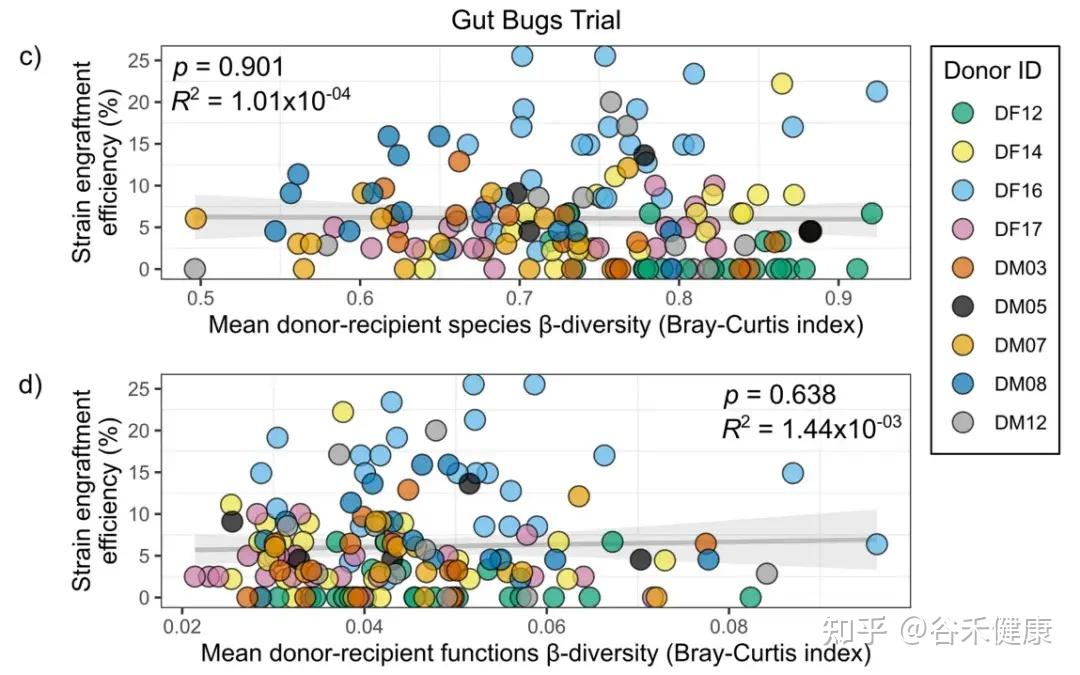
但 Gut Bugs 的匹配信号并不是不存在,而是体现在更接近缺口的指标上:
Jaccard更像在问:受体缺不缺这个物种席位。缺得越多,供体带来的成员越容易补进去。
简单来说,就是UC 队列更像功能上别差太远更容易留下(兼容性/匹配);肥胖队列更像物种上更不一样反而更容易留下(互补性/空位)。
这不是一句话能简化的供体筛选公式
到这里你已经知道为什么会被概括成相反规律:FOCUS(UC)更强调兼容性/匹配(尤其功能层面),Gut Bugs(肥胖)更像互补性/空位(物种有无层面的缺口)。
但这不等于能把它简化成一个选供体公式。下一章节的P/B模型会提示:供体强弱不仅是供体自身属性,还会受受体本身的影响(存在交互项)。换句话说,匹配本身就是关键变量。
原文还提到 D043 有一个很醒目的特征:
它是所有供体里面唯一的一个,平均 Prevotella/Bacteroides(P/B)比 > 1(也就是 Prevotella 更占优势)的供体,这个特征在一些研究里被联系到所谓“超级供体”现象。作者在这里比较谨慎:他们并不武断地说D043 就是超级供体,而是提醒你,它被用得多,也可能本身更容易定植。
α多样性不是越高越好,更像一个最低门槛
很多 FMT 文章都喜欢讲多样性,但这篇文章的结论更接近真实世界:多样性有用,但不是线性万能解释。
在 UC 的 FOCUS 队列里,作者观察到一个挺像门槛的现象:当供体 α 多样性(Shannon)比较低(大约 < 2.5)时,供体—受体配对更容易出现 0% 定植效率。
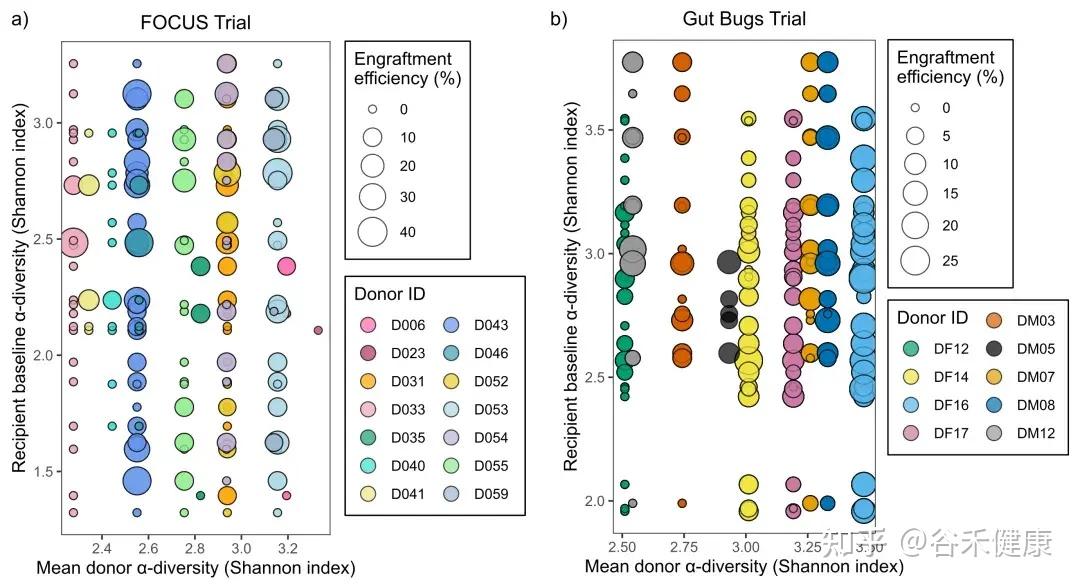
图中比例差异很明显:低于 2.5 时 86.5% 配对为 0%,高于 2.5 时下降到 44.9%.
也可以这样理解,供体群落太单薄,可输出的菌株本来就少,想在受体里留下来更难。
关键是:当供体多样性在常见范围内时,供体多样性与定植效率并没有稳定线性相关(FOCUS:p = 0.955;Gut Bugs 也未显著)。研究人员还强调,两项试验里都出现过“受体 α 多样性反而高于供体”的情况。于是,简单用“供体更丰富→就更能定植”来解释就站不住了。
P/B 比:一个很能用的群落标签(供体端与受体端)
作者用了一个相对好理解、也常用于描述群落结构的指标:Prevotella/Bacteroides 比例(P/B 比) 。有的人肠道菌群里 Prevotella 占优势,有的人 Bacteroides 占优势。
在两项试验的线性混合模型(Figure 6)里,P/B 比给出了比较稳定的信号:
供体 P/B 比越高,定植效率越高 FOCUS(b = 6.28, p = 0.023),Gut Bugs(b = 3.83, p = 0.036)。
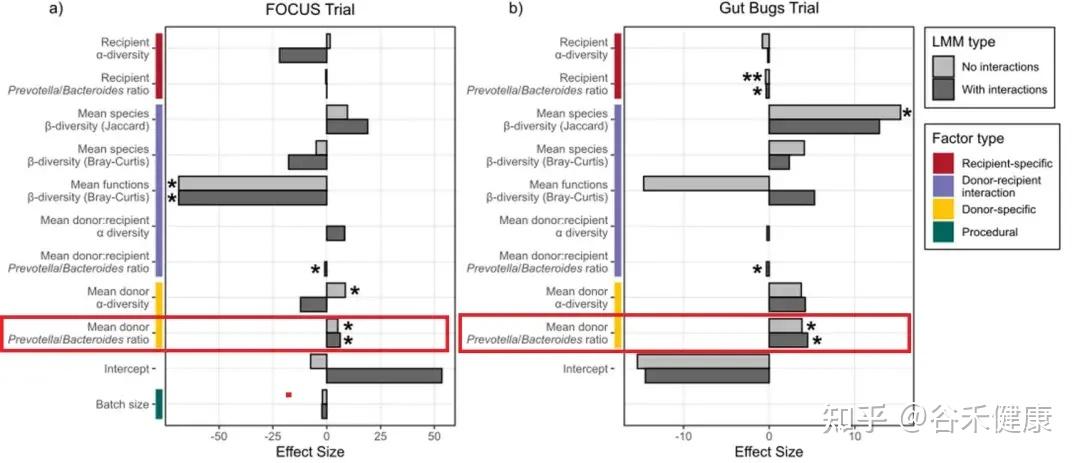
但 P/B 比并不是说,供体越偏 Prevotella 越好这么简单。
受体端与交互:同一供体,在不同受体身上不一定一样
模型同时显示:受体端的 P/B 比、以及供受体之间的组合关系,会显著改变这种供体优势的作用方式。
首先看 Gut Bugs(肥胖)队列:受体 P/B 比对定植效率是显著负向的(b = -0.424, p = 3.77×10^-3)。这意味着在这个队列里,受体本身越偏 Prevotella(P/B 越高),总体上越不利于供体菌株定植。可以理解为:当受体群落已经更偏向某一类“Prevotella 型结构”时,可被外来菌株占据的生态位更少(或同类竞争更强),因此总体定植更难发生。
再看 FOCUS(UC)队列:作者不仅看到供体 P/B 的正向主效应,还看到了一个显著的供体×受体 P/B 交互项(b = -0.899, p = 0.017)。
交互项为负的意思是:偏 Prevotella 的供体并非对所有受体都同样有效;当受体本身也偏Prevotella 时,供体的这种优势更可能被抵消,甚至变成同生态位的竞争。
可以这样理解:供体端的某些群落结构会加分,但受体端也会把关,而且不同疾病背景下,把关方式不一样。
总体思路:对的人 + 对的生态位规则
肠道菌群检测报告可以作为个性化 FMT 的入门级决策与随访工具:一方面用于治疗前分层与配对,另一方面用于治疗后量化是否定植、改了什么,并将结果回收为下一轮配对的证据。
该研究作者甚至强调应建立针对每种疾病的特异方法学,并提出 FMT 的真正潜力应以个体化医学实现:根据疾病/亚型,把受体与一个或多个最可能带来有益菌定植的供体进行配对。
这意味着:
同一份菌群报告,在不同疾病里“怎么解读、怎么用来配对”,规则不应相同。
个性化 FMT 的核心是两件事:
这里的落地流程(四步闭环):
筛受体 → 筛供体 → 做匹配 → 评估与复盘
治疗前——患者分层(用哪套匹配方案)
一份肠道菌群检测用于分病种策略选择,同时缩小供体候选池:
把菌群平衡指标作为受体“微生态脆弱程度”的一个粗筛维度,用于确定是否需要更强的干预(如多次给药、路线选择、随访更密集等),以及作为后续是否改善的评估指标之一。
把多样性作为“受体可被改造程度/生态位可用性”的基础变量。前面的研究也讨论到,跨疾病的 Meta分析中受体 α 多样性与定植常存在关系,但在不同队列呈现不同交互与权重,所以不能只用一个阈值做所有病种的决策,更合理的是在某病种人群里建立自己的判读边界。
哪些常见核心菌群、产丁酸相关菌、黏液层相关菌、有益菌等缺位,决定了后续更偏向新增还是替换。
简单来说,先别急着挑供体,用检测回答:这个受体的底盘是缺位型还是紊乱型,以及属于哪种疾病队列的生态规则。
供体筛选:从安全合格走向微生态特征可量化
传统供体筛选主要是安全(病原体/寄生虫等),而该研究认为,供体的物种组成、功能结构,以及与受体的互补/相似关系,会影响定植效率。
因此供体筛选至少要增加两层可量化标准:
基础质量指标:供体的 α 多样性、关键结构特征(例如 P/B 比在研究里被作为指标之一,也可以同时用其他的相关指标)。
报告列出多种有益菌(如 Lactobacillus、Bifidobacterium等)的丰度与检出情况,可作为供体是否具备可提供的功能模块的证据(例如 产丁酸相关菌群)。
有害菌总体是否过高、以及抗生素耐药风险评估等,可作为长期可用供体库管理的一部分。
供体稳定性:如果供体多次采样,观察其菌群波动(稳定供体更利于可复现)。
供体受体匹配:建立按疾病分轨的匹配规则
该研究给出的最重要启示,是同样的供受体差异度指标,在不同疾病队列里方向可能相反:
炎症性肠病类疾病(更强调功能兼容)
匹配优先级:供受体在功能维度不要差太远(避免来者水土不服),同时供体能补足受体缺失的关键菌群。
可以用谷禾检测报告里的菌群平衡、多样性等指标先做受体分层。炎症类可考虑供体中抗炎/屏障模块相关指标更好的(例如肠道屏障、LPS等指标),并避免在受体本已存在风险提示的方向上进一步加重。
屏障不足者在方案上更强调先稳环境再引入,并把屏障改善作为疗效评估的一部分,而不只追求菌的变化。
如果条件允许,可以用宏基因组做供受体功能匹配。
代谢类疾病(更强调生态位空缺)
匹配优先级:在安全与稳定的前提下,供体应能提供受体缺失的菌群模块;供受体在物种组成上适度拉开差异,可能更利于新菌株进入。
对多供体方案,可进一步用供体间互补减少内耗,避免多个供体在同一生态位高度重叠、彼此竞争导致有效输出下降。
匹配不是一个公式,而是一个分病种的规则库。
当疾病队列的生态位规则复杂、且个体差异大时,多供体更像提高覆盖率的工程策略;但最终仍需靠检测把贡献拆开、把有效组合沉淀下来。
治疗后评估——用同一套指标呈现是否定植
随访时不只看整体更像谁,还可以拓展一些:
这一步形成反馈:把这位患者用什么供体组合更容易定植沉淀为可复用规则,推动下一次配对更精确。
注:做前后评估要尽量保持同一检测平台与标准化流程。
这项研究真正的价值,不只是告诉我们某个供体更强,而是把FMT推进到更精细的层面: 从看群落像不像推进到追踪菌株能不能留下来,并提示不同疾病人群的肠道微生态规则不同。
当我们开始用整个肠道微生态的思路去理解FMT, 就不仅是找一个最强供体,未来更可行的路径是:分病种建立可验证的匹配策略,把治疗做成一套可测量、可比较、可迭代的闭环:治疗前的受体分层,治疗中的供受体匹配,治疗后的定植追踪与反馈,从而让 FMT 更接近可计算的精准干预。
主要参考文献
Behling, Anna H., et al. “Cohort-specific determinants of donor strain engraftment following multi-donor faecal microbiota transplantation in two randomised clinical trials.” Gut Microbes 17.1 (2025): 2597628.

谷禾健康
《血糖,微生物,胰岛素》
2型糖尿病(T2D)是一种全球性慢性代谢性疾病,目前已影响超过 4.6亿人,其社会经济负担巨大,迫切需要寻求有效的治疗方法。
根据中华医学会糖尿病学分会发布的《中国2型糖尿病防治指南》,我国2型糖尿病的管理路径清晰而规范:以生活方式干预为基石,以二甲双胍为一线首选,后续根据情况采取阶梯式的强化治疗。
然而,尽管指南明确,临床上仍然面临治疗反应个体差异大这一核心难题,这导致我国仍有近半数患者血糖控制不达标。为何同样的“金标准”方案,效果却天差地别?
多项研究发现,2型糖尿病的肠道菌群组成与健康人存在明显差异,菌群失衡可能通过影响短链脂肪酸合成、胆汁酸代谢及胰岛素敏感性等途径促进代谢紊乱。
甚至连二甲双胍这些药物的降糖效应,竟有相当一部分是依赖其对患者肠道微生物群的重塑和调节。
本文将介绍当前有关肠道微生物群调控葡萄糖稳态的潜在机制,并重点探讨近年来通过靶向肠道菌群改善糖代谢的研究进展。其中包括粪菌移植、益生元、益生菌、合生元与外源性代谢调节物质等多种策略在动物模型中的应用及其转化潜力。这些非侵入性干预手段有望为2型糖尿病带来新的、有效的治疗或至少是辅助选择。
要揭示肠道菌群与个体糖尿病的关系,需要谨慎和长期的队列研究
肠道菌群:一个多因素互动的复杂网络
然而,事情并非绝对“好细菌”与“坏细菌”的简单对抗。肠道菌群是一个复杂的生态系统,这个复杂的网络包括:
所有这些因素交织在一起,共同决定了我们的代谢健康状况。
因此,要真正揭示肠道菌群在糖代谢中的作用机制,就需要做到:
这类研究不仅能为糖尿病的早期预测和个体化干预提供坚实证据,也将为利用肠道菌群进行精准营养调控和代谢重塑奠定科学基础。
谷禾已经通过14,846例2型糖尿病患者(包括妊娠糖尿病)构建了早期糖尿病预测模型,但该模型仍面临若干挑战。
未来谷禾会继续推进研究结合代谢组,药理学等多组学数据,并通过多中心、纵向的设计来控制药物等潜在混杂因素,以实现更高精度、更具普适性的肠道菌群早期糖尿病预测模型。
通过深入探索这些微生物是通过哪些机制影响血糖平衡和代谢功能的,也许会为糖尿病治疗带来新的突破。
肠道屏障受损:免疫与糖代谢的微妙联系
肠道屏障是先天性免疫系统的重要组成部分,它的主要工作就是筑起一道坚固的墙,将肠道内的细菌、病原体及其代谢产物牢牢地限制在肠道内,防止进入血液循环。
▸当肠道屏障出现漏洞
然而,高脂饮食(HFD)会破坏肠道微生物群平调,诱发肠漏,这使得细菌内毒素,特别是革兰阴性菌产生的脂多糖(LPS),更容易进入血液循环,形成“代谢性内毒素血症”。
▸炎症的触发机制
—警报响起
泄漏到血液中的LPS会激活免疫细胞表面的Toll样受体4 (TLR4)。
—信号传导
TLR4被激活后,会启动一个信号级联反应,导致细胞核内的 NF-κB激活。NF-κB是调控炎症反应的总开关。
—促炎因子
被激活的NF-κB会命令细胞大量生产和释放促炎细胞因子,如肿瘤坏死因子-α (TNF-α)、白介素-6(IL-6)等。在全身造成低度慢性炎症。
值得注意的是,近期研究发现,不同菌种来源的LPS在影响葡萄糖代谢、炎症反应及肠屏障完整性方面存在差异,说明仅以LPS总量评价肠漏程度可能并不准确。
▸ 慢性炎症:导致胰岛素抵抗的元凶
这种炎症状态是导致代谢紊乱的关键因素之一,例如,TNF-α会直接干扰肌肉细胞对胰岛素的响应,阻碍血糖的正常利用,最终引发胰岛素抵抗、高血糖及高胰岛素血症。
▸免疫系统与菌群的双向互动
免疫系统和肠道菌群的关系并非单向的,而是一个复杂的双向互动。
关键免疫细胞:Th17细胞
这是一种特殊的T细胞,它在正常情况下分泌IL-17和IL-22等因子,对于维持肠道屏障的完整性和抵御病原体至关重要。可以看作是城墙的守护者。
➦ 菌群 → 免疫系统
证据1(生酮饮食):生酮饮食会减少肠道中Th17细胞的数量。但如果给无菌小鼠移植了采用生酮饮食的人的粪菌,小鼠的Th17细胞也会减少。而补充双歧杆菌则可以恢复Th17细胞的水平。
证据2(高糖高脂饮食):高糖高脂饮食会减少那些能够诱导Th17细胞发育的特定细菌。如果给高糖高脂饮食喂养的小鼠补充这些特定的细菌,它们的Th17细胞水平得以恢复,血糖也得到改善。
➦ 免疫系统 → 菌群
证据(过继转移):将Th17细胞直接移植到肥胖小鼠体内,这些小鼠的肠道菌群结构发生了有益的改变,葡萄糖耐量也得到了改善。
doi.org/10.1146/annurev-physiol-051524-094728
►▷
不良饮食 → 菌群失调 → 肠漏 → LPS进入血液 → 激活免疫系统(TLR4)→ 慢性炎症(TNF-α)→ 胰岛素抵抗。
菌群的改变会影响关键免疫细胞(如Th17)的数量,而免疫系统的状态反过来又能重塑肠道菌群的构成。
这种菌群与肠道免疫之间错综复杂的相互作用,是理解代谢性疾病病理生理的核心,也为未来的治疗提供了新的靶点。
短链脂肪酸:菌群送给你的控糖礼物
短链脂肪酸(SCFAs)包括丁酸、丙酸、乙酸,它们是由肠道细菌通过碳水化合物发酵产生。
它们不仅仅是代谢产物,更是重要的信号分子,是肠道菌群与我们身体对话的语言。
▸ 短链脂肪酸如何调控血糖?
▸ 动物研究,直接补充SCFA改善血糖
多项动物实验表明,外源性补充SCFAs可改善能量代谢与血糖稳态,表现为体重下降、葡萄糖耐受性提升及胰岛素抵抗减轻。
▸ 人体研究,效果不一致
例如,口服丁酸仅在健康受试者中改善血糖控制,而对代谢综合征患者无显著效应,提示代谢紊乱本身,可能就损害了人体对SCFA信号的响应能力。
▸ 口服补充为何会失效?
口服补充SCFA是不符合生理规律的。
在自然状态下,绝大多数SCFA是在远端肠道(结肠)中由细菌产生的。
口服的缺陷:口服的SCFAs在到达结肠之前,可能早已在胃或小肠中被吸收或代谢掉,无法到达它们应该发挥主要作用的地方。
有力的证据: 一项巧妙的研究解决了这个问题。科学家设计了一种“菊粉-丙酸酯”,这种特殊结构可以保护丙酸不被提前吸收,精准地将其运送到结肠释放。结果发现,这种精准投放的丙酸,确实能够有效改善超重和肥胖人群的能量代谢和胰岛素敏感性。
这说明,SCFA在哪里释放,比释放了多少,可能更为重要。
▸ 为何病人的粪便里SCFA反而更高?
库存 ≠ 产量
一些研究发现,代谢疾病患者粪便中的SCFA含量反而更高。这似乎与“SCFA是有益的”这一观点相矛盾?
合理解释:粪便中的SCFA含量,仅仅是未被肠道吸收和利用的“剩余物资”。
▸ 肠道菌群-短链脂肪酸-肠道激素轴
短链脂肪酸通过与肠内分泌细胞(EECs)上的受体结合,刺激激素的释放,比如说,GLP-1(胰高糖素样肽-1)、PYY(肽YY)、GIP(胃抑制肽)、CCK(胆囊收缩素)等。GLP-1与GIP为主要的“促胰素”,能够在摄食后迅速加强胰岛素分泌反应,是控制餐后血糖的关键。
doi.org/10.1146/annurev-physiol-051524-094728
近年来的新发现进一步揭示,微生物群可通过调控宿主营养感知机制影响肝脏糖异生,形成由GLP-1介导的“肠–脑–肝”信号轴。
►▷
由于肠道菌群与上皮层密切接触,它可能通过改变肠内分泌细胞的营养感知机制,并利用短链脂肪酸及其他微生物代谢物作为信号分子,调控肠激素分泌和葡萄糖平衡。这种微生物与宿主的相互作用网络为解析肠源信号调控代谢疾病提供了新的理论框架。
菌群把胆汁酸变成影响血糖的信号
肠道是一个高度复杂的生态系统,如同一个动态的生物反应器,在这个反应器里,无数的微生物与我们吃进去的食物、以及我们身体自己分泌的物质(如胆汁)发生反应,生成了大量独特的代谢产物。
关于肠源性代谢产物我们前面已经讨论过短链脂肪酸,现在焦点转向另一位主角:胆汁酸。
★ 胆 汁 酸
▸ 初级胆汁酸
出生地: 肝脏。 原料: 胆固醇。
初始形态:在肝脏合成后,它们会与牛磺酸(主要在小鼠中)或甘氨酸(主要在人类中)结合,形成结合型初级胆汁酸。
主要工作:进入肠道,帮助我们消化和吸收脂肪。
▸ 次级胆汁酸
一旦初级胆汁酸完成了消化任务并进入肠道后段,肠道菌群就接管了,对胆汁酸进行两步关键的改造:
这种从初级到次级的转变至关重要,因为不同形态的胆汁酸,会像不同的钥匙一样,激活不同的细胞受体“锁”,从而触发完全不同的生理效应。
doi.org/10.1146/annurev-physiol-051524-094728
▸ 两大关键受体:TGR5 与 FXR
次级胆汁酸主要通过激活两个著名的受体来发挥信号作用:
—— TGR5受体 (明确益处)
激活机制:菌群将初级胆汁酸(如鹅去氧胆酸)转化为次级胆汁酸(如石胆酸),后者是TGR5受体的强效激动剂。
明确的益处:激活肠道细胞上的TGR5受体,能够促进GLP-1的分泌,从而改善高脂饮食动物的血糖稳态。
—— FXR受体 (更具争议)
FXR受体则要复杂得多,它的作用似乎取决于它在哪个器官被激活。
在肝脏中(作用清晰):
激活肝脏的FXR受体,可以改善健康和糖尿病小鼠的胰岛素敏感性。
在肠道中(作用矛盾):
一些研究报告称,使用激动剂激活肠道FXR能改善胰岛素抵抗和葡萄糖耐量。
而另一些研究(包括我们之前讨论的产乳酸菌的研究)则发现,使用拮抗剂抑制肠道FXR,或者直接把肠道FXR基因敲除掉,反而能改善血糖稳态。
这说明,FXR在肠道中的作用远非简单的“开”或“关”,而是受到多种因素调控的复杂网络。
★ 其他代谢产物
这些肠源性代谢产物通过影响能量代谢、免疫反应以及宿主信号通路,构成肠道微生物–代谢–宿主疾病之间的重要生物学纽带。
既然我们已经明确,肠道菌群是糖尿病发生发展的关键一环,那么一个问题随之而来:我们目前广泛使用的那些经典降糖疗法,比如二甲双胍等,它们的疗效背后,是否也隐藏着菌群的秘密?下面我们就来看看,常见的治疗方式是如何通过影响肠道菌群来帮助我们控制血糖的。
二甲双胍
二甲双胍是最常见的降糖药之一。它降低血糖的传统机制是减少肝脏制造葡萄糖的能力。但近些年,人们发现——它在肠道里也发挥着巨大作用。
研究发现,口服二甲双胍比注射更能有效降糖,提示它在消化道内可能有额外的作用通路。科学家进一步发现,二甲双胍能改变肠道菌群结构:
更有趣的是,如果把“吃过二甲双胍的小鼠”的小肠菌群移植到其他糖尿病老鼠体内,这些受体小鼠体内的营养感知通路得以恢复,进而抑制了肝脏的葡萄糖生成——也就是说,药效可以通过菌群“传递”出来。
这说明,二甲双胍不仅是“肝药”,更是“肠药”。它同时通过肠道菌群、胆汁酸,以及“肠–脑–肝”信号网络,共同调控血糖代谢。
GLP-1受体激动剂
GLP-1受体激动剂(胰高糖素样肽-1受体激动剂,GLP-1RAs)是一类降糖药物,GLP-1受体激动剂通过多靶点机制发挥作用:
▸肠道菌群对GLP-1的双重影响
促进分泌:肠道菌群能够促进肠道内GLP-1激素的分泌,这是一种有益的代谢效应。
限制作用:分泌的GLP-1在体内极易被二肽基肽酶-IV(DPP-IV)快速降解,导致其对血糖和食欲的系统性调节作用受限,仅产生局部、短暂的代谢效应。
注:DPP-IV 是 Dipeptidyl Peptidase-IV 的缩写,中文名称为 二肽基肽酶-4。它是一种丝氨酸蛋白酶(serine protease),广泛存在于人体的多种组织中,包括肠道上皮、肝脏、肾脏、免疫细胞以及血浆中。
因此,肠道菌群在介导GLP-1药物系统性效应中的具体角色仍不明确。
▸动物与人体研究中的差异
关于GLP-1RAs对肠道菌群的影响,现有研究结果存在不一致。
动物研究:在高脂饮食或糖尿病动物模型中,GLP-1RAs治疗能够增加肠道菌群的多样性,并提升有益菌(如Akkermansia muciniphila、乳酸杆菌)的丰度。
🧍♀️人类研究:也有观察到双歧杆菌数量增加。但大多数人类临床研究报告称,在接受GLP-1RAs治疗后,患者的肠道菌群组成并无显著变化。
▸给药途径:可能是造成差异的关键因素之一
大部分GLP-1RAs均经皮下注射给药,因此菌群改变或许是药物通过影响肠道生理功能(如延缓胃排空、降低肠蠕动等)所致的间接效应,而非药物直接作用于菌群。
目前,虽然口服剂型司美格鲁肽已获批准,但其对肠道菌群的直接影响尚缺乏系统性评估。
▸新视角:来自肠道菌群的DPP-IV
近期的一项关键研究为理解这一复杂关系提供了重要的新视角:
部分肠道微生物自身能够产生并分泌DPP-IV酶。这种细菌源性的DPP-IV同样会降解宿主的GLP-1,从而削弱其生理活性。
临床关联: 研究发现,在对DPP-IV抑制剂药物西他列汀反应不佳的个体中,其肠道微生物的DPP-IV活性显著更高。
干预潜力: 基于此,研究人员已鉴定出一种能特异性抑制微生物DPP-IV的抑制剂,并在动物模型中证实其能改善葡萄糖耐受性,并降低粪便DPP-IV活性。
►▷
这一发现为2型糖尿病(T2D)的治疗开辟了新思路。未来可能开发出一种联合干预策略,即同时靶向宿主和菌群来源的DPP-IV。这种策略有望更有效地保护内源性GLP-1,从而实现更优的血糖控制效果。
减重手术
两种常见的减重手术——Roux-en-Y胃旁路术(RYGB)和 袖状胃切除术(VSG),在胃肠道生理结构上的改变机制不同,但它们在治疗肥胖和糖尿病方面的效果及益处相当。
起初,人们认为手术后的机械性限制,也就说胃容量变小减少食物摄入,是体重下降与代谢改善的主要原因。然而,后续研究发现,减重手术会引发一系列深远的胃肠道生理适应,包括肠道激素分泌、胆汁酸代谢及 肠道微生物群的显著变化,这些因素彼此关联,共同促进体重下降与血糖耐受性改善。
▸ 肠道菌群的核心作用与证据
——菌群持久且独立的变化
研究表明,减肥手术后,肠道菌群会发生显著且持久的变化(至少维持十年)。这种改变似乎是独立于体重减轻或热量限制本身。
证据:与仅节食减肥个体相比,RYGB手术患者的菌群多样性增加;并且,RYGB手术的肥胖大鼠菌群,与体重相当的假手术组大鼠(未真正手术但体重通过节食控制)的菌群显著不同。
——因果关系的探索 (动物、人类)
动物实验:将接受了RYGB手术小鼠的肠道菌群移植到无菌小鼠体内,能够复制体重下降的效果,这强烈暗示了由手术介导的菌群改变在驱动体重减轻中可能具有部分因果作用。
人类研究:然而,在人类研究中结果更为复杂。将术后一年且体重下降30%的供体的菌群移植给代谢综合征患者,并未能改善其葡萄糖稳态。但值得注意的是,这种移植确实阻止了受体胰岛素敏感性的进一步恶化(相比之下,接受其他代谢综合征患者菌群移植的对照组则出现了恶化)。
这说明,肠道微生物群在RYGB的代谢改善中虽起到一定作用,但更可能是与其他机制协同发挥效应,而非单一决定因素。
▸ 菌群发挥作用的关键途径
近期的证据揭示了菌群影响代谢的具体机制,主要涉及以下两个方面:
——胆汁酸信号通路
垂直袖状胃切除术的降糖效果依赖于肠道菌群,并且需要功能正常的FXR和TGR5受体(两者均为胆汁酸受体)。
手术后的菌群改变会增加肠道中胆汁酸转运体的表达,从而促进石胆酸 (lithocholic acid) 的吸收并将其运输至肝脏。
在肝脏,石胆酸被转化为CA7S,这种物质可以直接激活TGR5受体,从而增加GLP-1的分泌,最终改善血糖控制。
——短链脂肪酸信号通路
减肥手术后,肥胖个体循环系统中的丁酸和丙酸水平显著增加,而乙酸水平则降低。
这些短链脂肪酸的变化,同样被认为有助于改善体重和葡萄糖稳态。
减肥手术带来的全面健康益处(体重减轻和葡萄糖稳态改善)不能归因于任何单一机制。它很可能是多种因素,包括肠道菌群的深远影响、胆汁酸信号的改变和短链脂肪酸的产生等共同作用的结果。
总结来说,不同的减重手术(如胃旁路术和袖状胃切除术)虽然操作方式差别很大,但减重与控糖效果相近。关键并非只是吃得少、吸收少,而是对肠道—代谢轴的系统性重启。
肠道菌群、胆汁酸、激素信号和神经代谢网络共同协作,把机体从易胖、胰岛素抵抗的状态,切换回更健康、更稳定的能量代谢模式。
以上这些发现让我们意识到,我们可能一直在间接利用菌群的力量。这自然而然地将我们引向了糖尿病治疗的下一个前沿:与其依赖药物对菌群的附带效应,不如直接将肠道菌群作为干预的核心。接下来,我们将探索那些专门为此设计的创新途径。
FMT 是目前临床上应用最广泛且成功率最高的治疗方法之一,特别是在治疗艰难梭菌感染以及其他多种胃肠道疾病中表现突出。近年来,FMT 也被探索作为一种新型的神经系统、免疫系统及代谢性疾病(包括肥胖与2型糖尿病)替代疗法。
▸ 动物研究中,FMT显著成效
糖尿病小鼠实验:持续为糖尿病模型小鼠(db/db小鼠)移植健康人类的粪便菌群,能够改善它们的葡萄糖耐量和新陈代谢。
运动与饮食实验:从健康饮食并坚持运动的小鼠身上获取菌群,并将其移植给久坐不动的高脂饮食小鼠,可以改善后者的葡萄糖耐量并减少其脂肪堆积。
肠道内容物移植:将健康大鼠的小肠内容物移植到高脂饮食的大鼠体内,可以迅速改善其对葡萄糖的耐受能力,并减少葡萄糖的生成。
动物研究普遍表明,移植健康的肠道菌群能够有效改善代谢问题。
▸ 🧍♀️人体临床研究的:效果有限且短暂
关键研究案例: 在两项人类研究中,患有代谢综合征的男性受试者,接受了来自瘦型的健康捐赠者的FMT。
短期效果(6周后): 受试者的胰岛素介导的葡萄糖摄取能力得到改善,糖化血红蛋白(HbA1c)水平也下降了。这是一个积极的信号。
长期效果(18周后):然而,之前观察到的有益效果不再显著。
▸ 为什么在人类身上效果不佳?
▸ 未来的改进方向
为了让FMT成为治疗代谢疾病的可行方案,需要更精细化的策略:
优化方案:需要调整FMT的时间、重复和剂量。
联合疗法:将FMT与生活方式干预(如改变饮食、补充膳食纤维)相结合。
近期的两项临床试验证明,当FMT与饮食改变或膳食纤维补充相结合时,这种联合策略确实能改善肥胖或2型糖尿病患者的代谢结果。
个性化FMT:类似于个性化医疗,未来可能需要发展“个性化粪菌移植”。即根据每个患者的具体情况,精心挑选或设计最适合他们的菌群来进行移植。
谷禾也会根据肠道菌群检测报告为合作方提供相关指标,便于更好地筛选与匹配。
多项研究表明,在代谢性疾病(包括肥胖与2型糖尿病)的动物和人类模型中,补充益生菌可在急性及长期阶段均显著改善多项代谢指标。
在这里,介绍用产乳酸菌、产丁酸菌和特定物种Akkermansia muciniphila治疗2型糖尿病和其他代谢疾病状态的效果。
AKK菌|Akkermansia muciniphila
Akkermansia muciniphila(简称AKK菌)是一种革兰氏阴性菌,具有降解黏蛋白的能力,主要定植于肠道黏液层,并可在粪便样本中检测到。
肠道粘液层的主要成分是粘蛋白(Mucins),粘蛋白是一种富含糖基的结构蛋白,是肠道黏液层的重要组成部分,这也是Akk菌的“主食”。
AKK菌与健康的关系:绝大多数证据指向有益
大量研究发现,在啮齿动物与人类中,肥胖或2型糖尿病患者体内的Akk菌丰度都显著偏低;当其丰度减少时,常伴随炎症水平上升、肝脏脂肪变性以及胰岛素抗性增强。
有一项宏基因组学研究报告指出,AKK菌的增加与2型糖尿病相关,理由是它降解粘蛋白会破坏肠道粘液层的完整性。
更多的研究表明,AKK菌的丰度与更厚的粘液层和更低的肠道通透性(即更少的“肠漏”)正相关。它似乎能通过一种尚不完全明确的机制,刺激肠道中负责生产粘蛋白的杯状细胞数量增加,从而实现“越吃越有”的良性循环。
Akk菌如何发挥作用?
Akk菌的益处主要通过其菌体上的特定成分和它分泌的蛋白质来实现。
Akk菌外膜上的一种叫 Amuc_1100 的蛋白质。
作用过程: 这种蛋白质可以激活肠道细胞上的TLR2受体,进而调节一系列负责细胞连接的紧密连接蛋白(如Claudin 3,Occludin等)的表达。
最终效果: 这大大增强了肠道细胞间的连接,加固了肠道屏障。屏障加固后,肠道中的有害物质(如内毒素LPS)就难以泄漏到血液中,从而减轻了全身的低度炎症,最终改善胰岛素抵抗和血糖控制。
最近,科学家发现Akk菌还能分泌一种名为 P9 的新型蛋白质。
作用效果: 在小鼠实验中,P9被证实能够促进GLP-1(一种重要的降糖激素)的分泌,从而改善葡萄糖耐量。
研究发现,活的Akk菌和巴氏杀菌的Akk菌都有效,但高温彻底灭活(Heat-killed/Autoclaved)的Akk菌则无效。
原因在于:巴氏杀菌的温度(约70°C)足以杀死细菌,但不会破坏关键蛋白Amuc_1100的结构和活性。而更高的灭菌温度则会使其变性失效。这为开发安全的菌剂产品提供了重要依据。
🧍♀️人体临床证据
Akk菌的益处已经在人体上得到初步验证。
安全性:早期的临床研究证实,无论是活菌还是巴氏杀菌的Akk菌,对人体都是安全且耐受性良好的。
有效性: 在一项针对代谢综合征患者的研究中,与安慰剂组相比,服用巴氏杀菌Akk菌的患者出现了显著的积极变化:
►▷
综合来看,上述动物与早期临床研究一致显示:
AKK菌的干预可重建肠道屏障完整性、降低代谢炎症并改善血糖稳态,提示该菌株具有成为治疗肥胖与2型糖尿病的潜在候选益生菌的巨大应用前景。
产丁酸菌
产丁酸菌并非单一菌种,而是一个庞大的功能性菌群。产丁酸菌是一类能够在厌氧环境下、通过发酵多种底物产生丁酸的肠道共生菌群。
★ Faecalibacterium prausnitzii
F. prausnitzii 是一种严格厌氧、产丁酸的共生菌,在小鼠与人类结肠中含量丰富。
为什么它如此重要?(关联性证据)
研究发现,2型糖尿病患者体内 F. prausnitzii 的丰度显著降低,而在接受减重手术后,该菌丰度显著增加,且与炎症标志物水平呈显著负相关。
这一系列发现表明,F. prausnitzii 可能通过减少肠道炎症、增强肠屏障完整性、改善代谢性内毒症,从而发挥潜在益生作用。
它如何发挥作用?
在结肠炎小鼠模型中,给予 F. prausnitzii 或其上清液,可显著增加肠上皮紧密连接蛋白表达,并降低炎症性细胞因子水平。
一个关键的发现是:单独使用丁酸,其抗炎效果远不如用F. prausnitzii的培养上清液。这说明,F. prausnitzii的益处并不仅仅来自于丁酸,它还分泌其他抗炎的有益物质。
研究人员后来确实鉴定出了一种由F. prausnitzii产生的“微生物抗炎分子”(microbial anti-inflammatory molecule, MAM),这种分子能够修复糖尿病小鼠的肠道屏障功能,并上调紧密连接蛋白表达。
给予F.prausnitzii可以改善啮齿动物的葡萄糖稳态,并且对2型糖尿病患者进行GLP-1RA治疗可以增加粪便中F.prausnilzii的丰度,这与空腹血糖呈负相关。
虽然目前尚无直接临床试验验证F. prausnitzii 在血糖调节中的疗效,但近期一项研究已证实,其长期补充在人体中是安全且可耐受的,并已启动相关的临床试验以进一步评估其作为下一代益生菌的潜力。
★ Anaerobutyricum soehngenii
这个菌它最初是在一项粪菌移植临床试验中引起关注的。研究者观察到,Anaerobutyricum属增加与受试者胰岛素敏感性改善密切相关。
动物实验:给糖尿病小鼠补充 A. soehngenii 可显著提高粪便中丁酸及次级胆汁酸水平,增强胰岛素敏感性,提升能量消耗。
🧍♀️人体临床试验:两项针对代谢综合征人群的临床试验表明,A. soehngenii 的口服或十二指肠输注均安全且耐受良好;单次十二指肠灌注实验显著提升GLP-1水平,并改善胰岛素分泌与敏感性。
►▷
无论是F. prausnitzii还是A. soehngenii,它们的益处是多方面的,不仅仅是生产丁酸,还包括分泌其他抗炎分子和调节宿主激素(如GLP-1)。这些产丁酸菌的研究都凸显了它们作为治疗代谢疾病的新型疗法的巨大潜力。
产乳酸菌
产乳酸菌是一类耐酸的革兰氏阳性菌,通常不具运动性,主要通过发酵碳水化合物产生乳酸作为主要代谢产物。乳酸是厌氧呼吸中的重要代谢物,既是宿主能量代谢中关键的中间产物,也可作为底物被其他肠道菌群利用以产短链脂肪酸。
明星成员: 其中最著名、研究最广泛、应用最普遍的就是乳杆菌属和双歧杆菌属的成员。
动物研究,效果显著
在啮齿类动物模型中,补充多种乳酸生成菌可显著带来以下代谢益处:
在多项研究中,使用以下菌株治疗,显著改善小鼠的血糖控制:
乳杆菌属
双歧杆菌属
核心作用机制:巧妙抑制FXR信号,促进GLP-1分泌
产乳酸菌改善血糖的机制相当精妙,其中一个核心通路与胆汁酸受体FXR有关:
1
分泌“胆盐水解酶” (BSH)
许多乳杆菌能产生一种叫做“胆盐水解酶”的工具。
2
分解胆汁酸
胆盐水解酶这个工具可以将“结合型胆汁酸”分解为“游离型胆汁酸”。
3
抑制肠道FXR活性
“游离型胆汁酸”激活肠道FXR受体的能力较弱,因此,这一过程的最终结果是降低了肠道FXR信号的整体活性。
4
解放GLP-1
关键点来了,肠道中的FXR受体被激活时,会抑制GLP-1(一种重要的降糖激素)的分泌。因此,当产乳酸菌抑制了FXR后,就相当于解除了对GLP-1的束缚,从而促进了GLP-1的释放,改善了血糖控制。
双重协同作用:抑制FXR还能增强短链脂肪酸诱导GLP-1分泌的效果。同时,某些产乳酸菌自身也能促进丁酸等短链脂肪酸的产生。这种 抑制FXR + 增加短链脂肪酸的协同作用,可能共同放大了GLP-1的分泌。
🧍♀️ 人体临床研究,好坏参半
与动物实验的普遍成功形成鲜明对比,产乳酸菌在人体临床试验中的表现,结果好坏参半:
☺一项研究显示,包含多种产乳酸菌的复合益生菌产品,相比安慰剂,能够降低2型糖尿病患者的糖化血红蛋白(HbA1c)和空腹血糖。
☺另一项研究发现,单独使用植物乳杆菌也能降低餐后血糖和HbA1c。
☹ 然而,与安慰剂对照组相比,补充罗伊氏乳杆菌、嗜酸乳杆菌或乳双歧杆菌并没有显著改善健康或糖尿病患者的血糖控制或胰岛素敏感性。
☺一个值得注意的细节是,在一项研究中,乳双歧杆菌(B. lactis)虽然没有改善代谢综合征患者的指标,但成功维持了他们的胰岛素敏感性,阻止了其进一步恶化。
鉴于在糖尿病患者体内,许多产乳酸菌(尤其是双歧杆菌)的数量有所减少,那么通过“缺啥补啥”的思路来恢复它们的水平,理论上应是一种有前景的治疗方法。
然而,现有的人体临床证据有限,乳酸菌对改善代谢性疾病的作用不足,因为每个人的饮食、基线肠道菌群和疾病表现都千差万别(即高度异质性),想用标准化的益生菌对所有人都产生效果,是不容易的。因此,益生元等可以增加整体微生物群的多样性和丰富性,而不是单一细菌,这可能会为更广泛的人群提供更有效的治疗选择。
2型糖尿病的治疗策略
doi.org/10.1146/annurev-physiol-051524-094728
益生元被定义为:“能够被选择性发酵,并导致胃肠道微生物群组成和/或活性产生特定变化,从而对宿主健康带来益处的成分。”
简单来说,一种物质要被称为“益生元”,必须满足苛刻的条件:
基于这些标准,许多食物或成分都可以被归入益生元的范畴。在众多候选物质中,当前研究最为集中、并在糖尿病治疗中表现出潜在疗效的包括几类新型功能性益生元。
菊粉型果聚糖(ITFs)
菊粉型果聚糖(ITFs)——主要包括菊粉(inulin)、低聚果糖(OFS)和果寡糖(FOS),它们本质上是一类由果糖分子链组成的不可消化性碳水化合物。能够被肠道细菌发酵利用,从而促进宿主健康。
它们如何发挥作用?—— 多途径、多靶点的系统工程
核心作用:精准“施肥”,优化菌群
机制一:放大GLP-1信号,控制血糖
这是菊粉型果聚糖改善血糖的核心途径。
证据: 益生菌(特别是双歧杆菌)利用菊粉型果聚糖作为底物,发酵产生短链脂肪酸,如乙酸和丁酸。而短链脂肪酸是已知的肠道L细胞分泌GLP-1的强效刺激剂。
铁证: 在GLP-1受体被基因敲除的小鼠中,或者在使用了GLP-1受体拮抗剂的小鼠中,菊粉型果聚糖带来的所有降糖益处都完全消失了。这证明了GLP-1通路在其中的决定性作用。
菊粉型果聚糖也能显著提高人和动物的餐后GLP-1水平。
机制二:激活GLP-2信号,修复肠道屏障
GLP-2可以看作是GLP-1的兄弟,它主要负责维持和修复肠道屏障的完整性。
研究发现,补充菊粉型果聚糖能够增加内源性GLP-2的分泌。如果在小鼠中阻断GLP-2受体,那么菊粉型果聚糖带来的修复肠道屏障、抗炎等益处也大部分会消失。
机制三:调节内源性大麻素系统
这是一个更深层的机制。菊粉型果聚糖诱导的菌群变化(或AKK菌的增加)能够调节肠道的内源性大麻素信号系统(endocannabinoid),增加2-棕榈酰甘油(2-palmitoylglycerol)、2-油酰甘油(2-oleoylglycerol)和2-花生四烯酰甘油(2-arachidonoylglycerol);降低花生酰胺(anandamide)水平;进而增强肠道屏障功能,减少LPS泄漏。
🧍♀️ 人体临床证据
虽然不是所有研究都报告了积极结果,但大量的临床试验已经证实了菊粉型果聚糖在人体中的益处:
►▷
菊粉类果聚糖代表了一种非常有前景的、非侵入性的2型糖尿病治疗方案。它不像直接补充益生菌那样面临能否存活和定植的问题,而是通过为体内已有的有益菌(如Akk菌和双歧杆菌)提供精准的养料,激发一连串有益的生理反应——核心是驱动GLP-1和GLP-2的分泌,最终达到控制血糖和修复肠道屏障的双重目的。
其他膳食纤维
首先,一个基本共识是:增加膳食纤维的摄入量,能显著降低患上肥胖和2型糖尿病的风险。
膳食纤维主要分为两大类:
🧬 植物来源的主要可溶性纤维包括:
然而,研究发现,不同可溶性纤维的效果差异很大,这取决于纤维的用量、食物来源、补充方式(是直接吃食物还是吃提纯的纤维补充剂)等因素。
几种可溶性纤维的表现:
🧪 β-葡聚糖—— 全能选手
来源: 主要存在于燕麦和大麦中。
一项对比研究发现,在高脂饮食中添加富含β-葡聚糖的大麦粉,能增加肠道丁酸、改善血糖。但如果直接添加提纯的β-葡聚糖纤维,同样能改善代谢。这表明β-葡聚糖本身就是强效的功能成分。
⁎ 作用机制
无论是动物还是人体研究,都强有力地支持β-葡聚糖作为一种益生元,在改善血糖和治疗代谢疾病方面具有巨大潜力。
🌽 抗性淀粉—— 瞒过小肠的特工
抗性淀粉它本质上是淀粉,但由于其特殊的结构,能抵抗小肠的消化,完整地到达结肠,成为微生物的食物。
来源:冷却的米饭、土豆、未完全成熟的香蕉等。
⁎ 作用机制(与β-葡聚糖类似):
🧍♀️ 人体证据
在患有代谢综合征和2型糖尿病的人群中,补充抗性淀粉(特别是2型抗性淀粉,如高直链玉米淀粉)能够改善胰岛素敏感性并降低空腹血糖,同时也能观察到短链脂肪酸产量的增加。
一个有趣的发现:补充高直链玉米淀粉会特异性地增加双歧杆菌的丰度,而双歧杆菌正是一种擅长发酵抗性淀粉的细菌。
🍎 果胶 —— 机制独特
来源: 广泛存在于水果中,如苹果、柑橘等。
⁎ 作用机制(与其他不同):
►▷
简而言之,膳食纤维是“好菌的食物,也是代谢的调节器”:当你吃更多含纤维的天然食物(燕麦、豆类、全谷、蔬果),肠道菌群就会发酵产出丁酸等代谢产物,能修复肠道、提升GLP-1分泌、降低炎症、帮助降糖。β-葡聚糖与抗性淀粉尤其被视为下一代代谢健康促进纤维,未来可能成为糖尿病膳食疗法的核心成分。
合生元是一种同时包含益生菌和益生元的产品。
这个设计的初衷是,通过提供益生菌最喜欢吃的益生元,来帮助它在复杂的肠道环境中更好地存活、定植并发挥作用。
鉴于益生菌能产生短链脂肪酸,而益生元是产生短链脂肪酸的代谢前体物质(原料),那么将两者结合,应能够协同增加短链脂肪酸的产生,从而对代谢健康产生比单独使用任何一种都更强大的益处。
🧬 合生元的常见组合
双歧杆菌/乳杆菌 + 低聚糖/膳食纤维
这种组合的设计理念是:由益生元提供底物,使益生菌能够在肠道定植并活跃代谢,从而增强肠道生态修复与宿主代谢调节效应。
并未实现“1+1 > 2”的突破
动物与人体研究均表明,补充益生元或益生菌本身即可带来代谢性益处,合生元干预能够改善肠道菌群生态与增加粪便SCFA含量。然而,在大多数研究中,联合应用(合生元)并未显示出明显优于单独使用益生元或益生菌的效果。
为什么这个看似完美的策略效果不理想?
研究人员认为是由于缺乏精准匹配,也就是说大多数研究在设计合生元产品时,只是想当然地将一种常见的益生菌和一种常见的益生元组合在一起,但未能首先验证,这个益生菌是否真的喜欢吃、并且能高效利用配给它的那个益生元。
这并不意味着合生元的理念是错误的,而是说明我们的执行方式需要更加科学和严谨。
改进:在进行昂贵且复杂的人体临床试验之前,必须增加一个关键的验证步骤:
►▷
合生元的概念本身极具潜力,但需确保益生菌和益生元是真正的天作之合,这种“1+1>2”的协同效应才会在临床上有更好的效果。这要求我们对菌株和底物的特性有更深入的了解和更严格的前期验证。
外源化合物(Xenobiotics)被定义为:“在机体内非天然存在的外来化学物质。”这个范畴非常广泛,从化妆品、药物到膳食补充剂中的成分都可能属于外源物。
前文已提到二甲双胍(metformin)与GLP-1受体激动剂(GLP-1RA)的降糖作用同样被认为与肠道微生物介导机制相关,而这些药物本质上也属于外源化合物的范畴。
虽然很多外源物对健康有害,但我们这里聚焦的是那些有益的外源物,重点分析两种备受关注的有益外源物:多酚和小檗碱。
多 酚 类 化 合 物 (Polyphenols)
多酚是一大类存在于植物中的化合物,如白藜芦醇、类黄酮等。
多酚类化合物是植物来源的次级代谢物,主要包括:
这些分子既能调节肠道微生物群结构,也能改善2型糖尿病的多种代谢指标。
💊白藜芦醇(Resveratrol)
白藜芦醇是多酚中研究最为深入的代表性化合物之一。
来源: 葡萄皮、红酒、花生等。
它可显著改善胰岛素敏感性、葡萄糖稳态、血脂水平、高血压等。但它的生物利用度很低,口服后能进入血液循环的量很少,而且大部分还和蛋白质绑定,无法发挥活性。
那它是如何起作用的?
答案指向了肠道。
口服有效。 多项研究发现,口服白藜芦醇可以改善小鼠的血糖,但腹腔注射(绕过了肠道)则无效。这有力地证明了它的作用点在肠道内。
口服补充剂也有益地改变了啮齿动物的肠道微生物组,降低了厚壁菌门/拟杆菌的比例,增加了Akk菌、双歧杆菌和乳杆菌的丰度,这与改善葡萄糖稳态和炎症标志物有关。
最终证据——粪菌移植: 将服用过白藜芦醇的小鼠的粪菌移植给普通高脂饮食的小鼠,后者也出现了血糖改善的效果。
🧍♀️ 人体临床研究
尽管研究尚少,但已有临床试验发现,补充白藜芦醇可以增加代谢综合征男性体内的AKK菌,并轻微改善血糖。
💊 黄酮类化合物(Flavonoids)
除白藜芦醇外,黄酮类化合物也能增加肠道有益菌数量,并改善葡萄糖耐受性、抑制炎症反应、增强肠屏障功能。
来源: 广泛存在于各种水果、蔬菜、茶中。
动物实验研究
在高脂饮食诱导的肥胖或糖尿病小鼠模型中:
蔓越莓提取物可提高胰岛素敏感性、降低HOMA-IR与循环内毒素(LPS)水平;同时伴随AKK菌丰度显著上升与肠屏障完整性增强。
蓝莓原花青素含有丰富的花青素与原花青素,同样可改善葡萄糖耐受;增加AKK菌含量;并增厚胃肠道黏液层。
苹果原花青素处理高脂饮食小鼠时,也观察到一致的结果:肠道屏障功能及AKK菌丰度同步提升。
这些研究揭示不同植物来源的黄酮类多酚均通过促进有益菌的富集和黏液层重塑,实现改善肠屏障与系统代谢功能的作用。
🧍♀️ 人体及体外研究证据
尽管人群中关于单独考察黄酮类化合物作用的临床研究仍然有限,但已有体外模拟与部分干预研究提供了支持性证据:
红酒葡萄提取物或红茶多酚在人体肠道模拟模型中均能增加AKK菌的丰度。
可可黄烷醇则在健康人群中可显著增加双歧杆菌和乳杆菌的数量,表明其对肠道菌群结构也具有积极调节作用。
综上,黄酮类化合物以其独特的双重功能而受到关注:
这些作用共同促进了葡萄糖代谢与胰岛素敏感性的改善,为其作为代谢性疾病营养干预的潜在候选物提供了有力依据。
小 檗 碱
来源: 黄连、黄柏等中草药的主要活性成分。
小檗碱可以直接作用于肝细胞,激活AMPK(一个关键的能量代谢开关),从而改善血糖(增强胰岛素敏感性与葡萄糖稳态控制)。但它的口服生物利用度同样很低。
小檗碱是否进入循环系统,依赖肠道菌群
小檗碱只有在被肠道菌群代谢为更易吸收的衍生物后,其药效才能被充分发挥。
——肠道菌群:加工
肠道菌群能将小檗碱转化为更容易被人体吸收的形式,帮助它进入血液循环。
例如,某些肠道细菌可将小檗碱还原为二氢小檗碱,这种形式在肠上皮中的吸收效率更高,随后可重新氧化为小檗碱并在全身循环中发挥作用。
——肠道菌群:效应放大器
动物实验表明,口服(而非注射)小檗碱能增加肠道产丁酸菌的数量和丁酸产量,并改善空腹血糖。这说明小檗碱的另一部分功效是通过调节菌群-丁酸实现的。
临床研究与争议
动物研究:在动物模型中,小檗碱改善血糖的机制似乎与增加GLP-1/GLP-2、增加次级胆汁酸(DCA)从而激活TGR5受体、增加SCFA产量等有关。这是一个非常清晰、正面的通路。
人体研究的反转:迄今为止唯一一项相关的糖尿病人体研究却得出了矛盾的结果:小檗碱使血液中次级胆汁酸和有益的产短链脂肪酸菌的显著下降了,但同时它确实又显著降低了患者的糖化血红蛋白。
这凸显了小檗碱作用机制的复杂性。小檗碱确实是一种有效的降糖物质,但它究竟是如何通过菌群在人体内发挥作用的,远比我们想象的要复杂,目前仍是一个充满争议和未解之谜,其肠道依赖机制亟需更多临床研究验证来阐明。
►▷
小檗碱就像一个“需要肠道助手的药”:它自己难以被吸收,但一旦被肠道菌群“加工”成可利用的形式,便能帮助调节血糖、减少炎症、修复肠屏障。不过,因为每个人肠道菌群不同,它在不同人身上可能表现出截然不同的效果。
尽管大量动物研究已明确证实,肠道菌群在血糖稳态调控中扮演着核心角色,但将这些发现直接转化为对人类有效的通用疗法却挑战重重。其根本原因在于人类肠道菌群的复杂性与高度个体化。
这种个体差异正是许多干预措施(如益生元或益生菌)效果因人而异的关键。
益生元:当人们吃下富含β-葡聚糖的特制大麦面包后,只有一部分人的代谢状况得到了改善。科学家检查后发现,这些“有效者”在干预开始时,体内就存在着“无效者”所缺乏的特定肠道细菌。是这些细菌帮助他们更好地利用了膳食纤维。
益生菌:吃下益生菌,不代表它们就能在你的肠道里安家落户,一项研究发现,11种常见益生菌能否成功在肠道定植,取决于每个人已有的菌群构成。
既然每个人都是不同的,那么治疗方案也必须因人而异,兼顾菌群个体差异与动态变化。这个“个性化”会是什么样子呢?
比如,个性化饮食算法,这个算法不仅分析一个人吃了什么,更整合了这个人肠道菌群数据、血液指标等多种参数。这样不仅可以预测这个人吃下特定食物后的血糖反应,更能反过来为他量身定制一套可以最大程度平稳餐后血糖的个性化饮食方案。
在糖尿病前期人群中,通过整合基线菌群特征,机器学习模型,也能预测哪些患者能通过什么样的运动有效改善血糖,而哪些患者则收效甚微。
简而言之,要让基于微生物群的疗法真正在人体中奏效,我们需要摆脱“一刀切”的思路,而是把每个人的肠道菌群当作独特的生态系统。未来的糖尿病干预,可能需要“定制化的微生物处方”:先读取你的菌群模式,再精准投喂适合的菌与食物,让微生物群自己帮你稳糖、抗炎、调代谢。
深入理解并善用
每个人的独有菌群信息
将是我们开启
代谢疾病精准治疗
新时代大门的钥匙
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Weninger, Savanna N., Andrew Manley, and Frank A. Duca. “Managing Glucose Homeostasis Through the Gut Microbiome.” Annual Review of Physiology 88 (2025).
Howard, Elizabeth J., Tony KT Lam, and Frank A. Duca. “The gut microbiome: connecting diet, glucose homeostasis, and disease.” Annual review of medicine 73 (2022): 469-481.
Cho, Hyoung-Soo, et al. “Structure of gut microbial glycolipid modulates host inflammatory response.” Cell 188.19 (2025): 5295-5312.
Sun, Hanxiao, et al. “GLP‐1 receptor agonists alleviate colonic inflammation by modulating intestinal microbiota and the function of group 3 innate lymphoid cells.” Immunology 172.3 (2024): 451-468.
Su, Lili, et al. “Health improvements of type 2 diabetic patients through diet and diet plus fecal microbiota transplantation.” Scientific reports 12.1 (2022): 1152.
Anhê, Fernando F., et al. “Metabolic endotoxemia is dictated by the type of lipopolysaccharide.” Cell reports 36.11 (2021).
Baroni, Irene, et al. “Probiotics and synbiotics for glycemic control in diabetes: A systematic review and meta-analysis of randomized controlled trials.” Clinical Nutrition 43.4 (2024): 1041-1061.

谷禾健康
失眠是一种常见的睡眠障碍,近 40%的成年人表现出失眠症状,10.8%的成年人患有慢性失眠症。
失眠主要表现为睡眠质量差、入睡困难、睡眠时间不足等,并与认知能力下降、焦虑、慢性疲劳、注意力不集中和记忆力减退等身心后果相关。睡眠不足也会增加慢病风险(如心血管疾病、糖尿病和肥胖),形成恶性循环,进一步威胁患者的整体健康状况。
目前的失眠疗法主要包括药物治疗和心理治疗。然而,像苯二氮䓬类药物有不良影响,如过度的神经毒性、成瘾性和耐受性。心理疗法,如认知行为疗法,已显示出长期的有效性。然而,由于缺乏训练有素的理疗师和高昂的成本,其可用性有限。
近年来,随着微生物群-肠-脑轴理论的深入发展,研究人员发现了肠道微生物不仅参与消化代谢过程,还能通过多种途径影响脑功能和行为,为失眠的发病机制研究提供了全新的视角。
在这一背景下,中草药及其活性成分作为独特的益生元,展现出巨大的治疗潜力。它们不仅为肠道菌群的活动提供能量,还通过调节肠道菌群改善肠道微环境,从而影响身体的多种生理功能,特别是睡眠调节功能。例如:
本文阐述了肠道菌群如何通过肠道-脑轴的复杂通信网络调节睡眠质量,也介绍了利用中药及其活性成分调节肠道微生物群来改善睡眠质量的潜力,同时探讨了基于肠道菌群的其他针对失眠的干预措施,为失眠治疗开辟了一条融合传统智慧与现代科学的创新路径。
失眠意味着晚上难以入睡、难以保持睡眠,或两者都有,它是最常见的睡眠障碍之一。
仅数天的失眠发作称为短期(急性)失眠。当持续存在睡眠问题时,通常会被诊断为长期(慢性)失眠。
注:慢性失眠有许多不同的定义。一个普遍接受的定义是:每周超过3晚,持续至少3个月,或持续一个月或更长时间的失眠。
急性和慢性失眠都非常普遍。大约每3个成年人中有1个有可能出现失眠症状。
症 状
失眠症状可能包括:
哪些人群更容易失眠?
几乎每个人偶尔都会有失眠的夜晚。但下列人群更可能出现失眠的情况:
月经周期和更年期期间激素变化可能起作用。更年期时,夜间盗汗和潮热常常会扰乱睡眠。失眠在怀孕期间也很常见。
由于睡眠模式和健康状况的变化,随着年龄的增长,更有可能患有失眠。
可能是什么原因?
慢性失眠通常是由压力、生活事件或破坏睡眠的习惯引起的。慢性失眠的常见原因包括:
对工作、学校、健康、金钱或家庭的担忧会使思绪在夜间保持活跃,难以入睡。压力性生活事件,如亲人的去世或疾病、离婚或失业或搬家,也可能导致失眠。
身体的“内部时钟”,即昼夜节律,指导着诸如睡眠-觉醒周期、新陈代谢和体温等。破坏这些节律可能导致失眠。比如跨越多个时区的旅行导致的时差反应、上晚班或早班、频繁轮班或三班倒等都可能引发失眠。
包括每天上床睡觉和起床的时间不同、午睡、睡前过于活跃以及睡眠区域不舒服。
其他不良的睡眠习惯包括在床上工作、吃饭或看电视。在睡前使用电脑或智能手机、玩电子游戏或看电视可能会破坏睡眠周期。
睡前吃点清淡的小零食是可以的。但如果吃太多,可能会在躺下时感到不舒服。很多人还会出现胃灼热的情况。这是指胃酸反流到从口腔到胃的食物管道中。胃灼热可能会让人无法入睡。
焦虑症,如创伤后应激障碍,可能会扰乱你的睡眠。过早醒来可能是抑郁的迹象。失眠常常与其他心理健康问题同时发生。
许多处方药会影响睡眠,例如某些抗抑郁药和用于治疗哮喘或高血压的药物。许多非处方药,如一些止痛药、过敏和感冒药以及减肥产品,含有咖啡因和其他兴奋剂,这些物质会干扰睡眠。
与失眠相关的状况包括慢性疼痛、癌症、糖尿病、心脏病、哮喘、胃食管反流病(GERD)、甲状腺功能亢进、帕金森病和阿尔茨海默病。
睡眠呼吸暂停症会导致在夜间有时停止呼吸,从而扰乱睡眠。不安腿综合征会在你试图入睡时引起强烈的、不适的移动双腿的欲望,这可能无法入睡难以再次入睡。
咖啡、茶、可乐和其他含有咖啡因的饮料让人兴奋。在下午或晚上饮用会难以入睡。烟草产品中的尼古丁是另一种会破坏睡眠的兴奋剂。酒精可能会让你入睡,但它会阻止更深睡眠阶段,在半夜醒来。
肠道菌群可以通过肠-脑轴直接或间接地参与调节大脑的睡眠功能。肠道菌群的失调,通过减少肠道屏障完整性和短链脂肪酸含量以及增加触发炎症反应的炎症介质等机制,影响宿主的睡眠行为。详见下一章节。
失眠会影响肠道菌群的丰富度和多样性
与正常组相比,睡眠缺乏小鼠的Akkermansia muciniphila、拟杆菌和粪杆菌(Faecalibacterium)丰度显著降低,气单胞菌(Aeromonas)丰度显著增加。
临床研究中的失眠或其他睡眠障碍菌群特征
与对照组相比,失眠患者的Collinsella、Adlercreutzia、Clostridiales、Pediococcus、Erysipeltrichaceae、拟杆菌属、葡萄球菌属、Carnobacterium、Odoribacter、假单胞菌属、长双歧杆菌属、Phascolarctobacterium的丰度存在显著差异。
同样,阻塞性睡眠呼吸暂停患者在下列菌群丰度存在显著差异:乳杆菌属、瘤胃球菌科、 变形杆菌科、梭菌科(Clostridiaceae)、 颤螺菌科(Oscillospiraceae)、 克雷伯氏菌(Klebsiella)、脱硫弧菌科(Desulfovibrionaceae)、脆弱拟杆菌(Bacteroides fragilis)、普拉梭菌(Faecalibacterium prausnitzii)。
无论是与炎症相关的菌株的改变,如变形杆菌科、梭菌科、Oscillospiraceae、克雷伯氏菌,还是与肠道屏障完整性相关的菌株,如脱硫弧菌科、脆弱拟杆菌、F. prausnitzii,这些变化都与睡眠质量相关的参数显著相关。
失眠不仅会降低肠道的抗氧化能力、抗炎细胞因子水平、粘蛋白2(MUC2)和紧密连接蛋白表达,还会增加促炎细胞因子的水平,导致肠道黏膜损伤和屏障通透性增加。
实验证据:睡眠剥夺通过肠道菌群影响大脑功能
当睡眠剥夺动物的肠道微生物群移植到正常小鼠体内时,供体动物的肠道菌群发生了变化,导致脂多糖(LPS)和气单胞菌水平升高,丁酸盐和Lachnospiraceae_NK4A136水平降低,海马小胶质细胞活化和神经元死亡增加。
然而,用植物乳杆菌124或A.muciniphila预处理可以恢复被破坏的肠道微生物群,减少肠道中的氧化应激、炎症和屏障损伤,增加乙酸和丁酸水平,并防止LPS刺激的小胶质细胞-神经元共培养中的突触损失。
因此,肠道微生物群的破坏通过降低肠道屏障完整性和短链脂肪酸含量,增加引发炎症反应的炎症介质等机制,影响宿主的睡眠行为。
下面章节我们就来详细看一下肠道菌群参与失眠症调节的相关机制。
下丘脑-垂体-肾上腺轴
失眠激活并导致HPA轴功能障碍。微生物可能通过神经信号传导、短链脂肪酸、表观遗传学、肠道屏障完整性或血脑屏障(BBB)通透性影响HPA轴活性。因此,失眠引起的肠道微生物群失调可能与HPA轴的激活有关。
HPA轴的破坏与致病菌(包括肠杆菌科、链球菌科、韦荣球菌科)的增加和有益细菌(包括双歧杆菌和毛螺菌科)的减少有关。
某些特定的肠道微生物群可以抑制HPA轴的激活,并介导相关的脑功能。大肠杆菌(Escherichia coli)和粪肠球菌(Enterococcus faecalis)可以降低小鼠血清中的皮质醇水平,从而缓解压力和抑郁焦虑行为。
分析表明,粪便中的羟甲睾酮(Oxymesterone)可以介导皮质醇对副拟杆菌属(Parabacteroides)的负面影响,而3-(2,4-环戊二烯-1-基)-5α-雄甾烷-17β-醇可以介导皮质类固醇对气球菌(Aerococcus)的负面影响;洛伐他汀酸(Mevinolinic acid)还可以介导气球菌对皮质醇的负面影响。这表明肠道微生物群和HPA轴之间的信号传导是双向的。
doi: 10.3389/fphar.2025.1572007
微生物内分泌产物和代谢物
★ 褪 黑 素
什么是褪黑素?
褪黑素(Melatonin,MT)又称为”暗激素”,因为它主要在黑暗环境中分泌,是我们身体内重要的睡眠调节激素。夜幕降临,褪黑素水平开始上升,告诉我们的身体该睡觉了;当太阳升起时,它的分泌减少,帮助我们保持清醒。可以说,褪黑素就像是身体内部的生物钟管家,维持着我们正常的睡眠-觉醒周期。
色氨酸的”三岔路口”
要理解肠道微生物与褪黑素的关系,我们首先需要了解一个关键的氨基酸——色氨酸(Trp)。色氨酸是合成褪黑素的重要原料,但在正常情况下,人体内仅有不到5%的色氨酸用于合成血清素(5-HT)和褪黑素,而高达95%都通过肝脏中的犬尿氨酸(Kyn)途径进行代谢。
这就像是一个”三岔路口”:
压力→肠道菌群失调→褪黑素下降
长期压力会破坏肠道菌群平衡,导致失调,失调的微生物刺激犬尿氨酸通路过度活跃,本应用于合成褪黑素的色氨酸被大量转移到犬尿氨酸途径,最终导致循环中的褪黑素水平下降,影响睡眠质量。
有益菌的助眠作用
令人惊喜的是,肠道中的某些微生物也能够主动促进其合成。研究发现,罗伊氏乳杆菌和大肠杆菌这两种微生物激活TLR2/4/MyD88/NF-κB信号通路,促进关键酶AANAT(芳烷基胺N-乙酰基转移酶)的表达,推动褪黑素的合成。
微生物代谢产物的协同效应
除了直接合成,肠道微生物的代谢产物——短链脂肪酸(SCFA)也发挥着重要作用:
外源性褪黑素补充
不仅能直接改善睡眠,还能帮助生物钟恢复正常运转,改善肠道菌群的组成和功能,增加短链脂肪酸水平,改善肠脑交流,优化肠道与大脑之间的信息传递。
研究表明,褪黑素补充能够通过多个途径改善睡眠剥夺引起的认知障碍:
最后,这些在肠道中产生的褪黑素分子会通过血液循环系统到大脑,与大脑中的MT1或MT2受体结合,最终调节我们的睡眠行为。这就形成了一个完整的”肠道-血液-大脑“调节环路。
★ γ- 氨 基 丁 酸
什么是GABA?为什么它能帮助睡眠?
γ-氨基丁酸(GABA)是一种众所周知的促进睡眠的氨基酸,是一种天然的抑制性神经递质。当我们感到焦虑、紧张或难以入睡时,GABA帮助我们的神经系统冷静下来,促进放松和睡眠。
简单来说,GABA的作用就像给过度活跃的神经系统踩了一脚”刹车“,让我们从兴奋状态转向平静状态,为优质睡眠创造条件。
肠道:GABA的”第二生产基地”
许多人以为GABA只能在大脑中产生,但实际上,我们的肠道也是一个重要的GABA生产基地。在肠黏膜中,存在着一系列特殊的细胞——肠神经内分泌细胞(如STC-1和STC-2),它们就像是内置的”GABA工厂“,它们可以表达GABAA受体及其受体亚型(α1、α3、α5、β1、β3、δ)的mRNA。
除了胃肠神经内分泌细胞合成、储存和分泌GABA的能力外,肠道微生物群的某些成员也可以产生GABA。
乳酸菌和双歧杆菌是GABA产生的关键成员
– Limosilactobacillus fermentum L18:
高效分泌GABA的专业户,通过增加连接蛋白的浓度和有益肠道细菌的丰度来增强肠道屏障
– 鼠李糖乳杆菌GG:
除了保护肠道屏障外,还可以通过调节肠脑轴来提高海马和杏仁核中的脑源性神经营养因子(BDNF)和GABA受体水平。
– 短乳杆菌:
通过发酵产生高剂量GABA,可以提高肠道中有益细菌的相对丰度和SCFA的水平,进而可以上调GABA能和5-羟色胺能神经递质的mRNA和蛋白质表达水平。这将导致θ和δ波以及非快速眼动(NREM)睡眠的显著增加。
GABA如何在肠道中发挥多重功效?
– 维护肠道屏障:构建健康防线
刺激Ca²⁺信号传导;增加MUC2释放,强化肠道黏膜屏障;促进肠道干细胞增殖,维持肠道健康。
– 调节肠脑轴:远程遥控大脑
增加海马和杏仁核中的BDNF水平,促进神经元健康;上调大脑中GABA受体水平,增强镇静效果;拟杆菌丰度与GABA受体蛋白表达呈正相关。
GABA很难穿过血脑屏障直接作用于中枢神经系统,那么肠道产生的GABA是如何影响大脑和睡眠的呢?
肠神经系统:另辟蹊径的”高速公路”
有研究人员认为,肠道内分泌细胞中存在大量GABA受体,通过肠神经系统这个”第二大脑”发挥作用,不需要直接穿过血脑屏障,而是通过肠-脑轴的复杂网络影响大脑功能。
★ 血 清 素
什么是血清素?
血清素(5-羟色胺,5-HT),有时候被称为”快乐激素”,因为它不仅能让我们感到愉悦和放松,还是调节睡眠-觉醒周期的重要神经递质。当血清素水平充足时,我们更容易感到心情平静、思维清晰,也更容易获得优质的睡眠。
作为肠脑轴中的关键神经递质,血清素(5-HT,血清素)是肠道微生物群和大脑之间进行交流的重要介质,将肠道的信息准确传递给大脑,告诉大脑什么时候工作,什么时候该休息了。
肠道:血清素的主要生产基地
体内约95%的血清素来源于肠道,而大脑反而只是小作坊。
一般生产路径:
非经典调控途径:
肠道菌群如何助力血清素的生产?
肠道菌群代谢产生短链脂肪酸,短链脂肪酸通过调节血清素转运体(SERT);调节5-HT受体的敏感性;抑制色氨酸转化为犬尿氨酸,确保更多原料用于血清素合成来促进合成。
肠道菌群多样性影响血清素
肠道微生物群的多样性会影响5-HT水平,进而影响人体的睡眠模式。补充色氨酸和血清素已被证明可以改善肠道微生物群的多样性,增加肠道中短链脂肪酸的量,提高血清素的血液水平,所有这些都可以改善老年人和新生儿的睡眠质量。
血清素代谢失衡与睡眠障碍的病理关联
在用抗生素耗尽微生物群后,5-HT的表达水平降低,导致REM睡眠的发作频率增加,NREM和REM睡眠之间的频繁转换,最终对睡眠产生负面影响。
如何通过调节血清素改善睡眠?
例如,灵芝可以调节肠道微生物群和5-羟色胺相关途径,增加5-羟色胺和GABA的血清水平,同时降低HPA轴激素水平,有效缓解焦虑小鼠的失眠行为。显然,微生物群可以通过影响肠道中5-羟色胺的合成和释放来调节大脑中的睡眠行为。
影响睡眠的微生物群-肠道-大脑轴交流模式
Sen P, et al.,Trends Mol Med. 2021
★ 短 链 脂 肪 酸
短链脂肪酸(SCFA)是肠道细菌通过发酵我们吃下去的膳食纤维产生的主要代谢产物,被认为是神经调节物质,对肠道微生物群控制睡眠至关重要。通过免疫、神经、内分泌途径,微生物群与大脑睡眠过程形成密切联系;“肠-脑轴”是两者之间的纽带,SCFA起着信使的作用。
失眠会减少产短链脂肪酸的菌的数量
产短链脂肪的菌如粪杆菌(Faecalibacterium)、Roseburia、Ruminococacaceae,这反过来又降低了肠道中SCFA的数量,而SCFA的缺乏又会进一步影响睡眠质量,形成一个难以打破的恶性循环。
肠道短链脂肪酸水平升高可提高睡眠质量
相关研究表明,短链脂肪酸水平的升高可以通过穿越血脑屏障和调节大脑中血清素和多巴胺(DA)的产生来影响大脑发育。
短链脂肪酸不仅能直达大脑,在肠道局部也发挥着重要的睡眠调节作用。
增强睡眠相关物质:
调节压力系统:
调节免疫功能
SCFA调节HPA轴:缓解压力促进睡眠
通过显著增加SCFA含量,可以带来一系列积极变化:
短双歧杆菌207-1可以通过显著增加SCFA和GABA水平,整体抑制HPA轴相关激素来改善睡眠质量。
不同SCFA的作用
乙酸盐、丁酸盐、戊酸盐与HPA轴相关激素水平呈负相关;丙酸盐显示出相反的模式。
因此,微生物群产生的SCFA可以通过改善肠道屏障和肠道免疫环境来影响神经系统。它们通过增加肠道中SCFA的多样性和水平、刺激睡眠相关细胞因子的分泌和抑制炎症反应等机制,改善失眠。
★ 多 巴 胺
多巴胺(DA)被称为大脑中的”奖励分子”和”动力激素”,但在睡眠调节中,它是”人间清醒”。作为一种促进警觉性的强效神经递质,多巴胺对于控制我们的睡眠-觉醒周期至关重要。
当多巴胺水平充足时,我们会感到精神饱满、注意力集中、反应敏捷;而当多巴胺不足时,我们可能会感到昏昏欲睡、缺乏动力、思维迟钝。
多巴胺:肠道保护功能
多巴胺在肠道中并不仅仅是一个”过客”,它还承担着重要的肠道保护功能:
通过D5受体的作用:
通过D2受体的作用:
肠道菌群失调:多巴胺代谢的破坏者
肠道菌群可以影响多巴胺的水平,相关研究表明,肠道菌群失调导致多巴胺代谢紊乱(以高香草酸减少为特征),从而影响大脑的清醒和认知功能。
注:高香草酸是多巴胺代谢的重要产物,它的减少就像是”多巴胺工厂”生产效率下降的信号。
补充益生菌可以有效逆转这些紊乱
补充益生菌已被证明可以恢复Blautia、Dialister、F.prausnitzii、Ruminococcus、拟杆菌属,这些菌群与高香草酸水平呈显著正相关。这意味着它们能够有效修复多巴胺代谢通路,恢复正常的觉醒调节功能。
两种特别的”多巴胺生产专家”
粪肠球菌(Enterococcus faecalis)和屎肠球菌(Enterococcus faecium) 具有酪氨酸羟化酶和多巴脱羧酶活性,使其能够将酪氨酸转化为L-dopa(多巴胺的前体)。进一步的研究表明,粪肠球菌和屎肠球菌的移植增加了PGF小鼠肠道内多巴/多巴胺的合成,促进了多巴/多巴胺从肠道进入血液,从而提高了大脑中的多巴胺水平。
这表明,调节肠道微生物群中苯丙氨酸酪氨酸多巴多巴胺的生物合成途径可能会改善脑功能。
短链脂肪酸的协同作用
研究表明,肠道微生物群代谢产生的短链脂肪酸可以直接穿透血脑屏障,控制5-羟色胺和多巴胺的合成,进而影响大脑发育。因此,肠道细菌可以通过多种途径调节大脑的多巴胺能系统,从而影响大脑的唤醒能力和功能。
微生物群-迷走神经通路
迷走神经就像是连接肠道和大脑之间的一条专线电话,肠壁中富含迷走神经纤维,这些神经纤维就像是密布在肠道中的信号接收器,能够从肠道接收各种信号并将其精确地传递到大脑。可以说,迷走神经是肠道微生物群影响大脑功能、调节睡眠的重要通路之一。
肠道微生物如何启动迷走神经?
通过这条”迷走神经专线”,肠道细菌能够:
粪菌移植和罗伊氏乳杆菌
粪菌移植可以触发肠道的迷走神经系统,从而导致脑干和海马体的5-HT和DA神经传递途径的长期改变。
通过迷走神经依赖机制,罗伊氏乳杆菌还可以改变催产素和多巴胺能信号在腹侧被盖区(VTA)的传递方式。值得注意的是,海马体和VTA中的多巴胺能回路在维持睡眠-觉醒相关行为方面都起着至关重要的作用。
证据:迷走神经切断实验
为了证实迷走神经参与肠道和大脑之间的信息传递,研究人员进行了一个实验:膈下迷走神经切断术。就像是切断电话线,看看肠道和大脑之间的通讯是否会中断。
治疗效果消失:
注:选择性5-HT再摄取抑制剂是一类通过抑制突触前膜5-HT再摄取、增强突触间隙5-HT浓度的抗抑郁药物。
信号传递的机制
当肠道内的5-HT与迷走神经纤维上密集分布的5-HT受体结合时,迷走神经被激活。然后,神经元通过特定的投射对5-HT信号做出反应并进行分类,然后将其传递到大脑。
迷走神经刺激:治疗睡眠障碍的新策略
研究表明,迷走神经刺激可通过降低外周血和海马中IL-1β和IL-6的水平,以及防止星形胶质细胞和小胶质细胞激活,从而改善由睡眠剥夺引起的抑郁样行为。
微生物-免疫炎症通路
免疫炎症通路就像是身体内部的警报系统,当有危险信号出现时,它会迅速启动防御机制。在肠道微生物调节睡眠的过程中,它也扮演着至关重要的角色。这套系统运行正常时,我们能享受优质睡眠;而当系统失调时,就可能出现失眠、睡眠质量下降等问题。
微生物通过免疫炎症途径与大脑的睡眠调节功能建立复杂的相互作用。简单来说,肠道微生物可以通过调节免疫系统的炎症反应,间接影响大脑的睡眠中枢,就像是通过免疫语言与大脑进行对话。
睡眠剥夺:引发免疫炎症风暴的导火索
睡眠剥夺破坏肠道屏障和血脑屏障通透性,增加NLRP3水平,并激活肠道中的TLR4/NF-κB信号通路,导致炎症信号传递到大脑,从而加剧大脑中的神经炎症和小胶质细胞激活。
恢复被破坏的肠道微生物群可以缓解肠道氧化应激、炎症反应和屏障损伤,从而改善睡眠质量。
肠道微生物代谢物:TMAO的双面性
某些肠道微生物可以通过其代谢产物介导宿主的炎症反应来调节大脑的睡眠功能。例如,三甲胺N-氧化物(TMAO)是肠道微生物群的代谢产物,可以通过调节膜联蛋白A1信号传导来增强血脑屏障的完整性,保护大脑免受炎症损伤,还可以通过NF-κB信号通路促进NLRP3激活来影响睡眠。
特定菌群与炎症因子
睡眠剥夺会引发肠道微生物群失调,导致炎症因子如IL-1β、IL-6、TNF-α的表达失衡。
相关分析表明,IL-1β和TNF-α与肠道中的Ruminococcus_1和Ruminococcoccus e_UCG-005呈正相关。
– NLRP3炎症体:睡眠调节的关键开关
NLRP3是参与IL-1β调控睡眠的关键介质之一。NLRP3的组装可以激活caspase-1,激活的caspase-1随后将pro-IL-1β切割成成熟的IL-1β,然后调节中枢神经系统对生理睡眠的控制。
TNF-α和IL-1β受体通过配体激活介导NF-κB转录,触发参与睡眠调节和影响睡眠的炎症相关分子的转录。
这个指挥系统一旦启动,就会产生级联放大效应,小小的炎症信号最终可能对睡眠产生显著影响。
尽管睡眠剥夺对血脑屏障的影响在某种程度上是可逆的,但修复过程并不简单,即使在恢复正常睡眠模式后,恢复正常的血脑屏障功能仍然是一个漫长的过程。
这些发现为失眠的免疫治疗提供了新的思路,通过调节肠道微生物群来优化免疫炎症反应,进而改善睡眠质量。
源自中草药的药用食品及其生物活性化合物是独特的“益生元”,具有以下优点:副作用小、安全性高、提高患者依从性、适合长期食用。这些特性突显了这些草药在营养和治疗应用中的双重价值。此外,它们具有调节肠道微生物群稳定性的潜力,为通过调节肠道微生物组预防和治疗失眠提供了新的视角。
酸 枣 仁
酸枣仁(Ziziphi spinosae semen,SZR)是指鼠李科植物枣属种类中,中国枣(Ziziphus jujuba Mill. var. spinosa (Bunge) Hu ex H. F. Chou)的干燥成熟种子。
酸枣仁以其酸甜口味和中性特性为特征,靶向肝、胆囊、心经。它以“滋阴养心、补血养肝、安神安神”的功效而闻名,对治疗虚证和慢性失眠特别有效。正是因为其卓越的安神助眠功效,酸枣仁被誉为”东方睡眠果实“,在临床上广泛用于治疗失眠。
注:从历史角度看,酸枣仁在中医中一直受到高度重视,无论是作为单一草药还是复方制剂,都展现出了令人瞩目的疗效。
酸枣仁的”睡眠密码”:三大活性成分
皂苷、黄酮、生物碱是酸枣仁镇静和催眠作用的主要活性成分。先前的研究表明,酸枣仁可以调节氨基酸代谢、神经递质释放、炎症因子平衡和HPA轴稳态等生理过程,从而调节神经活动,实现神经系统的平衡,改善睡眠。
最近的研究表明,酸枣仁可以恢复失眠引起的肠道菌群失衡,增加大鼠体内有益菌的相对丰度,如乳杆菌、双歧杆菌、乳球菌、真杆菌,同时减少普雷沃氏菌的相对丰度。
菌群代谢产物——短链脂肪酸(SCFA)
梭菌和乳杆菌丰度的增加导致其代谢产物丁酸盐含量的增加,这进一步影响了体内的氨基酸代谢途径,从而显著恢复了患有睡眠-觉醒节律紊乱的小鼠的睡眠-觉醒节奏。
SCFA可以间接调节肠道和大脑中的5-HT水平。
研究表明,通过酸枣仁的微生物代谢增加的SCFA,可以调节结肠中TLR4/NF-κB/NLRP3相关信号通路中代表性因子的表达,从而调节微生物群-肠-脑轴,改善小鼠的失眠和抑郁行为。
注: TLR4:控制肠道免疫系统的”警报器”;NF-κB:调节炎症反应的”总开关”;NLRP3:影响炎症体的活化程度。
酸枣仁调节肠道菌群,而不是直接作用于大脑
显然,酸枣仁可以通过微生物群神经通路和微生物群免疫通路调节微生物群肠脑轴,从而实现对生物体睡眠行为的控制。这可能解释了酸枣仁的活性成分不能穿过血脑屏障,但仍然能改善睡眠质量。
卷 丹 百 合
在中医传统中,百合类植物一直被认为具有”润肺止咳、清心安神“的功效,而现代科学研究正在揭示其改善睡眠的深层机制。
卷丹百合(LB)可以通过降低血清中HPA轴激素的水平、增加5-HT和MT的水平、降低下丘脑中去甲肾上腺素(NE)的水平以及上调GABAA受体和5-HT1A受体的表达,来改善大鼠的下丘脑病理并缓解失眠行为。
肠道菌群调节:失眠改善的核心机制
卷丹百合调节肠道菌群的方式可能直接关系到它缓解失眠的效果。除了逆转失眠对肠道微生物群的多样性、丰度和粪便代谢表型的不利影响外,卷丹百合还控制花生四烯酸和色氨酸的代谢,从而降低与心理健康问题相关的化学物质犬尿氨酸的表达水平。
卷丹百合显著调节肠道内乳杆菌、埃希氏菌、Porphyromonadaceae的相对丰度,并积极调节下丘脑中的5-羟基-L-色氨酸,后者参与5-HT的代谢。通过卷丹百合干预,最重要和最基本的途径被认为是5-羟色胺能系统和花生四烯酸代谢途径。
复方协同:卷丹百合与地黄汤的联合
卷丹百合和地黄汤(LBRD)可以通过纠正肠道微生物群失调和避免肠道屏障受损或血脑屏障泄漏引起的炎症,来减轻与抑郁行为相关的神经元损伤。根据粪便微生物群移植和肠道微生物群组成研究,通过肠道-脑轴,乳杆菌、双歧杆菌、乳球菌(Lactococcus)被证明是地黄汤抗抑郁作用的重要因素。
灵 芝
灵芝的镇静作用与肠道菌群密切相关
当灵芝与罗伊氏乳杆菌发酵时,它可以增加血清中5-HT和GABA的水平,降低HPA轴激素的水平,有效缓解焦虑小鼠的失眠症状。
灵芝的乙醇提取物也对微生物组的结构产生了显著影响。
下丘脑的5-HT浓度与双歧杆菌和动物双歧杆菌呈正相关,这不仅提高了那里的5-HT水平,还增加了包括Tph2、Iptr3、Gng13在内的重要转录因子的产生。在用抗生素耗尽肠道微生物群后,灵芝乙醇提取物的促进睡眠作用以及与睡眠行为相关的粪便代谢物的变化完全消失。这表明肠道微生物群在灵芝的促睡眠作用中起着不可或缺的作用。
多糖成分的免疫调节与神经保护作用
来自灵芝的多糖已被证明可以提高小鼠大脑中的GABA和5-HT水平,并通过延长NREMS期间的δ波来提高其睡眠质量。
此外,灵芝多糖及其水解产物,即灵芝肽,通过各种途径表现出免疫调节活性。具体而言,灵芝多糖不仅降低了肠道中的F/B比值,而且显著上调了回肠中NF-κBp65、IL-2、IL-4的表达水平;它们还显著增强BDNF的表达,抑制促炎细胞因子的表达,并抑制小胶质细胞和星形胶质细胞的激活,从而发挥抗抑郁作用。
灵芝肽参与关键途径,如叶酸循环、脂肪酸的生物合成和代谢以及cAMP代谢。灵芝多糖在调节肠道微生物群稳态和提供神经保护方面具有巨大潜力。
茯 苓
茯苓(P.cocos)自古以来就被誉为”四时神药”,茯苓性平味甘,具有健脾利湿、宁心安神的功效,是古代人治疗失眠的首选核心药物之一,
传统核心药物的现代机制:多糖和三萜
茯苓含有多糖和三萜类化合物,是其镇静和诱导宁静的主要活性成分。研究表明,茯苓中的酸性多糖可以通过干预肠道微生物群和调节相关途径发挥镇静作用。
这些多糖不仅增加了肠道微生物群的丰度,如厚壁菌门、杆菌门、乳杆菌门、Fusicatenibacter、Prevotellaceae_UCG-001;它们还上调下丘脑中关键神经递质5-HT、DA、NE、GABA的水平,增加神经元细胞的数量,同时降低炎症因子的表达水平。
此外,来自茯苓的水提取物和水溶性多糖可以通过改善肠道微生物群失衡、缓解代谢紊乱、调节肠道神经肽和神经递质水平以及抑制TNF-α/NF-κB信号通路来有效预防焦虑的发作。
增加短链脂肪酸、促进色氨酸代谢
茯苓多糖可以通过增加肠道中的短链脂肪酸水平和促进色氨酸代谢来增强肠道屏障。它们不仅通过增加吲哚乳酸盐和吲哚-3-醛的水平来促进色氨酸代谢;还通过增加肠道中短链脂肪酸的水平、调节IL-2、IL-4、IL-6、IL-10、TGF-β、IFN-γ等关键免疫因子的表达,激活Wnt/β-Catenin信号通路来维持肠道屏障的完整性和功能。
色氨酸和短链脂肪酸的水平以及肠道屏障的健康稳态与肠道微生物群密切相关,对改善睡眠质量有重大影响。
人 参
人参被誉为”百草之王”,是中药中最珍贵的滋补品之一。作为五加科植物,人参含有丰富的活性成分,具有补元气、复脉固脱、补脾益肺、生津养血、安神益智等功效。现代研究发现,人参不仅能直接作用于大脑,还能通过调节肠道微生物群来改善睡眠质量。
多重活性成分的协同作用:跨越血脑屏障
人参中发现的肽、多糖、皂苷具有穿过血脑屏障并调节神经内分泌平衡和大脑代谢环境的能力。人参多糖通过增强肠道吸收和影响肠道微生物代谢来增强人参皂苷Rb1和微生物代谢产物的暴露。Rb1通过调节瑞士乳杆菌丰度和GABAA受体表达发挥神经保护作用。
人参皂苷Rg1(Rg1)对神经系统具有潜在的健康促进作用。Rg1可以改善吗啡诱导的肠道微生物群失调(特别是拟杆菌),抑制肠道微生物群衍生的色氨酸代谢,调节异常升高的血清素、5-羟色胺受体1B和5-羟色胺受体2A水平,使其回归正常范围。
人参皂苷的多途径神经保护机制
人参皂苷Rg可能影响肠道微生物群,并通过多种不同途径提供神经保护。
Rg1可以通过调节5-HT神经递质系统、阻止肠道微生物群产生的色氨酸代谢和改善肠道微生物群失调(特别是拟杆菌)来防止小鼠产生吗啡依赖。
Rg5不仅可以纠正不平衡的肠道微生物群,恢复肠道屏障的功能,还可以通过控制脂肪和葡萄糖的代谢,提高GABA/Glu比值,上调GABAA、GABAB和5-HT受体1A的表达,改变时钟相关蛋白质的节律特征,改善睡眠质量,进而影响GABA和5-HT神经递质系统。
复方协同与代谢循环优化
人参和酸枣仁的联合使用,可以改善肠道微生物群的结构,促进Glu/GBA-Gln代谢循环的正常运作,增加海马中GABA的合成和释放,从而显著改善失眠大鼠的睡眠状态。这表明人参可以通过多种途径干预肠道微生物群并调节大脑睡眠功能。
doi: 10.3389/fphar.2025.1572007
天 麻
天麻(G.Blume)是兰科植物天麻的干燥块茎,素有”定风草”之称,是著名的息风止痉、平抑肝阳的中药材。
天麻素的多重神经保护机制:从炎症调控到信号通路调节
从天麻中提取和分离天麻素(GAS)已被证明对中枢神经系统疾病有显著影响,包括但不限于失眠、焦虑、抑郁、认知障碍、缺血性中风。
天麻素通过控制IL-6、IL-1β等炎性因子的表达、B细胞淋巴瘤-2(Bcl-2)蛋白的活性以及p-ERK与ERK的比值,不仅改善了失眠小鼠的睡眠质量,而且通过调节TLR4/NF-κB和Wnt/β-catenin信号通路,改善了快速眼动睡眠剥夺引起的睡眠障碍。因此,天麻素在提高睡眠质量方面具有很大的潜力。
肠道微生物群调节
已经进行的研究表明,天麻素可以通过调节微生物群-肠-脑轴来抑制神经元凋亡,从而改善阿尔茨海默病小鼠的认知障碍和神经变性。
在抑郁的小鼠中,天麻的水提取物可以通过促进潜在有益菌(Alloprevotella、双歧杆菌、Defluviitaleaceae UCG-011、Akkermansia、Parabifidobacter)和粪便SCFA水平的增加和平衡,使结肠中5-羟吲哚乙酸与5-HT的比例正常化,并降低犬尿氨酸与色氨酸的比例来重塑肠道微生物组结构。抗生素混合物的给药部分消除了天麻素对阿尔茨海默小鼠的神经保护作用。
天麻及其活性成分对大脑功能的影响是显而易见的,因为它们部分针对微生物群-肠道-大脑轴。然而,支持天麻素可以通过这种微生物群-肠-脑轴调节大脑睡眠功能这一观点的确凿实验证据仍有待观察。需进一步研究来确定天麻素通过改变肠道微生物群来改善睡眠质量的确切过程,以便更谨慎地开发和使用天麻。
蒙 古 黄 芪
蒙古黄芪是豆科植物蒙古黄芪的干燥根,被誉为”补气圣药”,在中医药学中具有重要地位。黄芪性温味甘,具有补气固表、托毒排脓、利水消肿的功效,是临床上最常用的补气药之一。
现代研究发现,蒙古黄芪富含黄酮类化合物、多糖、皂苷,通过控制肠道微生物群的组成、代谢和活性,有助于保持肠道微环境的稳定。
黄芪多糖的免疫调节机制:特异性菌群调控的双向作用
研究发现,不同浓度的黄芪多糖(APS)对睡眠剥夺小鼠的脾脏和身体损伤具有缓解和保护作用。
进一步的研究表明,黄芪多糖可以通过调节与炎症和免疫反应、短链脂肪酸合成和TLR4/NF-κB通路有关的某些微生物来改善免疫功能障碍。
例如,黄芪多糖可以改善免疫功能低下的小鼠和大鼠的免疫功能,这是由于减少了Pseudoflavonifractor、Oscillibacter、Tyzzerealla、Paraprevotella、Lachnoclostridium的丰度,并增加了乳杆菌、双歧杆菌、Roseburia、脱硫原体、Paracoccus、副拟杆菌、Clostridium XIVb、Butyricicoccus的丰度。
然而,在肠道微生物群减少的免疫功能低下小鼠中,黄芪多糖并没有改善免疫功能。
肠脑轴的积极调控:从代谢产物到神经递质的全面优化
为了积极控制肠-脑轴,黄芪多糖不仅增加了肠道中乳杆菌和芽孢杆菌的相对丰度,还增加了粪便中短链脂肪酸和GABA的含量,提高了虾的免疫力。
此外,黄芪多糖可以显著减轻与年龄相关的肠道屏障破坏、胃肠酸碱平衡丧失、肠道长度缩短、肠道干细胞过度增殖以及衰老后的睡眠障碍。
因此,肠道微生物群不仅积极帮助身体吸收黄芪多糖,而且通过提高肠道SCFA水平来改善免疫功能障碍,并通过促进神经递质的释放来积极调节肠道脑轴。
龙 眼
龙眼肉,又称桂圆肉,自古以来就被誉为”智慧果”。在中医理论中,龙眼肉性温味甘,具有补益心脾、养血安神的功效,《神农本草经》将其列为上品药材。龙眼肉是中国传统医学中常用的治疗失眠的草药之一,但关于其改善睡眠质量的潜力的药理活性研究很少。
龙眼含有GABA,可以用作天然膳食补充剂。龙眼中富含多种氨基酸,如GABA和Glu,并且随着果实年龄的增长,其浓度也会增加。成熟后在冷藏温度下储存可以增加水果中的GABA含量。
此外,通过增加胃中Lactobacilli、Pediococci、 Bifidobacteria的数量,肠道微生物群对龙眼多糖的代谢可以提高琥珀酸和SCFA(乙酸、丙酸和丁酸)的水平,增强肠道免疫力。
无论是作为富含GABA的膳食补充剂还是通过调节肠道内的微生物代谢产物,龙眼肉都有可能通过影响肠道中GABA、MT、5-HT等睡眠相关神经递质的合成和释放来调节肠道微生物群-肠脑轴。这可以直接或间接地调节身体的睡眠-觉醒周期,从而发挥强大的睡眠促进作用。
其他中草药及其成分
中医药宝库中蕴藏着众多具有安神功效的珍贵药材,这些草药在千百年的临床实践中积累了丰富的应用经验。
除了前述的经典药材外,栀子、三七、莲子等传统药材同样具有改善睡眠的潜力,但它们通过肠道微生物群调节睡眠机制的研究相对较少。这里讨论了其他一些草药及其活性成分如何影响肠道菌群,从而提高睡眠质量的能力。
栀子、三七
研究表明,栀子可以通过调节肠道微生物群和降低TNF-α和IL-7β水平来改善睡眠质量和缓解焦虑症状。
由肠道微生物群代谢的三七总皂苷转化为人参皂苷Rg,其保护海马神经元并调节大脑中的神经递质水平,从而改善失眠、抑郁和认知障碍。
莲子、荷叶
莲子和荷叶都可以通过调节肠道微生物群的丰度和结构来调节GABA能系统,从而促进睡眠。然而,它们调节肠道微生物群的方式存在显著差异。具体而言:
枣、谷芽
枣具有改善睡眠质量和通过调节GABA能系统提供神经保护的潜力。具体而言,它可以上调Lachnoclosdium、Marvinbryantia的丰度,同时下调Alistipes、Akkermansia的丰度。
谷芽[Setaria italica(L.)Beauv]可能会增加肠道中普雷沃氏菌、乳酸菌、Ruminococcus的丰度,从而通过调节神经递质和炎症因子水平来提高SCFA水平并改善睡眠质量。
山茶、枸杞
山茶[(L.)Kuntze]可能通过改善肠道微生物群来影响神经内分泌途径和免疫系统,从而调节睡眠-觉醒周期。
枸杞可能通过改善肠道屏障和抑制TLR4信号通路来保护神经系统。
交泰丸
由黄连根茎和肉桂皮组成的交泰丸可以改善睡眠,并减轻慢性睡眠剥夺引起的炎症和胰岛素抵抗。组学结果表明,交泰丸治疗显著增加了小鼠中毛螺菌科、拟杆菌属、AKK菌属的相对丰度。
黄连温胆汤对失眠的机制可能与它抑制 5-羟色胺含量的降低和γ-氨基丁酸水平的升高有关。同样,研究发现甘麦大枣汤可以增加 NE 和 5-羟色胺的含量,改善睡眠,在一定程度上缓解抑郁,柴胡加龙骨牡蛎汤主要通过调节下丘脑-垂体-肾上腺轴(ACTH、CORT等)和脑单胺神经递质(NE、DA、5-羟色胺等)的水平来治疗失眠。
草药及其活性成分在改变肠道微生物群和提高睡眠质量方面的巨大潜力已经得到证实,尽管这一研究领域仍处于早期阶段。更多的研究不仅可以为治疗失眠提供坚实的支持,还可以通过阐明这些草药与微生物群-肠道-大脑轴相互作用的机制来调节与睡眠相关的大脑功能,从而帮助我们更明智地开发和使用这些草药。
针 灸
针灸治疗注重根据辨证选择穴位,基于辨证的针灸疗法可以取得良好效果并改善胃肠功能,针灸结合腹部环形按摩可以改善下丘脑和海马旁回的功能,从而达到改善失眠症状的效果。
此外,研究发现针灸可以抑制 HPA 轴的活性,从而改善失眠症状。
有研究在微生物-肠-脑轴理论指导下总结了针灸的原则:
可以直观地发现,这些针灸穴位与微生物-肠-脑轴的解剖部位有许多重叠。从健脾和胃治疗失眠的角度来看,主要穴位有中脘、关元、天枢、气海等。
这些针灸疗法可以通过调节神经递质和某些激素的分泌,以及下调 HPA 轴来抑制交感神经并改善内分泌,从而改善失眠症状,这些症状是微生物-肠-脑轴相同调节机制的一部分。
doi: 10.12998/wjcc.v12.i18.3314
饮 食 调 整
不良饮食模式的负面影响
长期高糖摄入会刺激免疫系统,诱发过度炎症反应,导致睡眠片段化。
肥胖人群中Faecalibacterium丰度显著下降,这在慢性失眠患者中同样存在。
健康饮食模式的积极作用
富含植物性食物、抗氧化剂和不饱和脂肪酸;促进产丁酸菌丰度增加,显著改变肠道微生物代谢活性,与更好的睡眠质量和更长的睡眠时间相关。
适用人群:肥胖青少年、结合增加体力活动
增加肠道中乳杆菌的丰度,乳杆菌以其促进睡眠的有益作用而闻名。
其他,如习惯性饮茶,可能通过肠道菌群-胆汁酸轴减轻慢性失眠引起的肠道菌群失衡和胆汁酸代谢紊乱。
益 生 菌
接受发酵益生菌 Lactobacillus brevis DL1-11 牛奶的小鼠表现出更短的睡眠潜伏期和更长的睡眠时间。因为 DL1-11 可以产生大量的 GABA,GABA 可以促进放松并增强睡眠。
Lactobacillus fermentum PS150TM通过增加下丘脑腺苷 A1 受体的表达,有效地促进了正常小鼠的睡眠,并缓解了咖啡因诱导失眠小鼠的失眠症状。PS150TM 能够恢复因首夜效应导致睡眠障碍的小鼠的非快速眼动睡眠,这可能是由于其重塑肠道菌群组成的能力,改变血清素能通路,减少慢性轻度压力大鼠的抑郁和焦虑。
Bifidobacterium breve CCFM1025 通过抑制 HPA 轴活性,改善了睡眠并缓解了压力水平。
Bifidobacterium adolescentis SBT2786 可以通过增加快速眼动睡眠时间来延长总睡眠时间,白天疲劳减少。
Lactobacillus plantarum PS128 显著增强了深度睡眠,并减少了疲劳和抑郁症状。
Lactobacillus gasseri CP2305 也已可以改善肠道微生物群组成,并降低唾液皮质醇浓度,从而减轻压力并增强睡眠 。
Lactobacillus casei Shirota 牛奶通过延长睡眠时间和减少觉醒时的嗜睡感,帮助面临考试压力的个体 。
Lactococcus lactis subsp. cremoris YRC3780 也显示出改善睡眠和缓解压力的潜力,这一点由日本进行的一项双盲、安慰剂对照的临床试验所证实,接受 YRC3780 干预的参与者主观睡眠质量和心理健康均有显著改善。
doi: 10.3390/ijms252313208
益 生 元
益生元饮食(由半乳寡糖、聚葡萄糖、乳铁蛋白和乳清蛋白浓缩牛奶脂肪球膜蛋白-10 组成)通过在正常情况下增强非快速眼动睡眠,并在压力情况下延长快速眼动睡眠,对小鼠的睡眠模式产生了积极影响。
接受益生元饮食(由半乳寡糖和聚葡萄糖组成)的大鼠在睡眠紊乱情况下表现出更长的非快速眼动睡眠和快速眼动睡眠。菌群分析发现,在益生组中,Parabacteroides distasonis 的相对丰度增加,这与促进睡眠和恢复昼夜节律有关。
在一项人体研究中,45 名参与者被随机分为三组,分别接受低聚果糖(FOS)、低聚半乳糖(GOS)或安慰剂。结果表明,低聚半乳糖组的参与者睡眠质量得到改善,唾液皮质醇觉醒反应显著降低。这种皮质醇的减少与肠道菌群中 Bifidobacteria 的相对丰度增加有关,这些菌具有代谢低聚半乳糖的能力,并对心理健康有积极作用。
抗性淀粉是另一种已被证明能通过减少炎症和 HPA 轴活性来改善 2 型糖尿病患者睡眠质量的益生元。
一项随机、双盲、安慰剂对照的研究也报道了益生元酵母甘露聚糖的改善睡眠效果。酵母甘露聚糖组的非快速眼动睡眠第 3 阶段睡眠时间和总睡眠时间均显著长于安慰剂组。
粪菌移植 (FMT)
目前,越来越多的研究将粪菌移植作为精神健康疾病的一种潜在治疗方法,因为肠道微生物群可以通过微生物群-大脑轴影响中枢神经系统。
临床研究表明,洗涤微生物群移植增加了有益细菌(如 Bifidobacterium、Ruminococcus gnavus 、Prevotella 7、Faecalibacterium)的相对丰度,并减少了有害细菌(如 Escherichia-Shigella 、 Streptococcus)的相对丰度,显著改善了患有各种潜在疾病的患者睡眠障碍。睡眠质量得到改善的患者在抑郁程度和 IBS 症状严重程度上也表现出更大的减少。
另一项开放标签的观察性研究发现,在患有胃肠道疾病且出现睡眠障碍的患者中,结果相似,作者认为整体改善归因于FMT治疗后菌群多样性的增加。
一项真实世界研究发现,粪菌移植显著改善了失眠患者的睡眠质量,缩短了睡眠潜伏期,并提高了睡眠效率。通过比较肠道菌群组成,研究人员发现,粪菌移植显著增加了产短链脂肪酸菌的相对丰度,包括 Lactobacillus、Bifidobacterium 、 Turicibacter。
注:所有这些研究都将失眠视为与其他疾病相关的共病,这表明睡眠的改善也可能归因于疾病症状的缓解,粪菌移植对睡眠障碍的有效性需要进一步研究。
随着现代医学对肠-脑轴研究的深入,传统中医药”治未病“的理念与现代微生态学理论完美融合,为失眠治疗开辟了全新视角。
未来研究应重点关注个体化精准治疗策略的制定。肠道菌群检测技术的应用将为临床实践提供重要指导,通过分析患者特异性的菌群结构,识别关键的失调菌群如拟杆菌、双歧杆菌、乳杆菌等,可为选择最适宜的中药配方提供科学依据。
同时,肠道菌群代谢产物如短链脂肪酸、GABA、血清素等关键代谢产物水平,这些在谷禾肠道菌群检测报告中也都有相应指标,结合肠道菌群检测报告有助于辅助评估治疗效果并优化用药方案。
<来源:谷禾肠道菌群检测数据库>
在中医药现代化进程中,应深入挖掘经典方剂如甘麦大枣汤、安神定志丸等复方的菌群调节机制,探索经典方剂与菌群协同效应的内在规律。同时,结合中医体质辨识与肠道菌群分型,建立”体质-菌群-证候“三位一体的诊疗模式。
通过构建中药-菌群相互作用数据库,为临床医师提供相对精准的用药指导,最终实现传统中医智慧与现代精准医学的深度融合,为失眠患者带来更加安全、有效的个性化治疗方案。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Wu C, Dou J, Song X, Yang F, Liu X, Song W, Zhang X. Gut microbiota: a new target for the prevention and treatment of insomnia using Chinese herbal medicines and their active components. Front Pharmacol. 2025 May 6;16:1572007.
Li C, Chen S, Wang Y, Su Q. Microbiome-Based Therapeutics for Insomnia. Int J Mol Sci. 2024 Dec 9;25(23):13208.
Ito H, Tomura Y, Kitagawa Y, Nakashima T, Kobanawa S, Uki K, Oshida J, Kodama T, Fukui S, Kobayashi D. Effects of probiotics on sleep parameters: A systematic review and meta-analysis. Clin Nutr ESPEN. 2024 Oct;63:623-630.
Patterson E, Tan HTT, Groeger D, Andrews M, Buckley M, Murphy EF, Groeger JA. Bifidobacterium longum 1714 improves sleep quality and aspects of well-being in healthy adults: a randomized, double-blind, placebo-controlled clinical trial. Sci Rep. 2024 Feb 14;14(1):3725.
Liwinski T, Lang UE, Brühl AB, Schneider E. Exploring the Therapeutic Potential of Gamma-Aminobutyric Acid in Stress and Depressive Disorders through the Gut-Brain Axis. Biomedicines. 2023 Nov 24;11(12):3128.
Li L, Wu L, Jiang T, Liang T, Yang L, Li Y, Gao H, Zhang J, Xie X, Wu Q. Lactiplantibacillus plantarum 124 Modulates Sleep Deprivation-Associated Markers of Intestinal Barrier Dysfunction in Mice in Conjunction with the Regulation of Gut Microbiota. Nutrients. 2023 Sep 15;15(18):4002.
Pan LM, Hong ZB, Guan RQ. Research progress on insomnia treated by traditional Chinese medicine and acupuncture based on microbial-gut-brain axis theory. World J Clin Cases. 2024 Jun 26;12(18):3314-3320.
谷禾健康
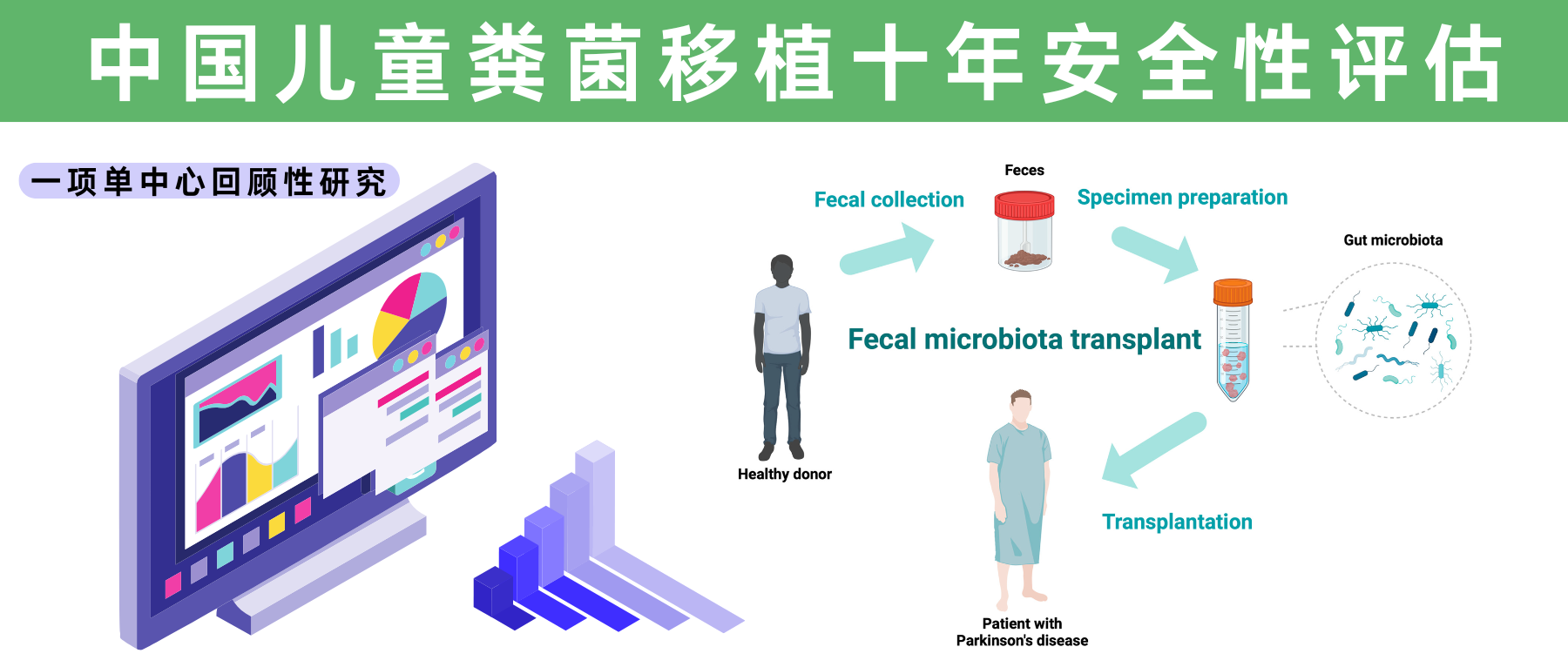
随着现代医学的不断进步,人类对于肠道微生态的研究正逐渐深入,粪菌移植(FMT)作为一种新兴的、生物学意义深远的治疗手段,在临床实践中展现出了革命性潜力。FMT广泛用于治疗艰难梭菌感染等复杂疾病,并逐渐延伸至免疫功能调节、代谢紊乱等领域,尤其是在儿童人群中的应用引发了广泛关注。
然而,在这项技术日益普及的同时,其在特殊人群中的安全性问题始终是临床医生和产业从业者关注的焦点。大多数关于FMT安全性的研究主要集中在成人人群中,而对儿科人群的了解较少,目前所有儿科FMT数据均来自小型病例系列和病例报告。
近日,一项来自上海儿童医院的大规模单中心回顾性研究,揭示了FMT在儿童人群中的长期安全性数据。这项跨越十年(2013-2023年)、涵盖813名儿童患者的研究,不仅是目前样本量最大的儿科FMT安全性评估,更是首次系统性地呈现了中国儿童接受FMT后的长期随访结果。

研究发现,FMT在儿科人群中总体表现安全,短期不良事件(AE)发生率仅为5.8%,且大多为轻微自限性症状;在长达122个月的随访期内未观察到长期不良事件。
这些珍贵的临床数据将为技术优化、产品研发和临床应用提供重要参考,并为拓展儿科FMT市场提供有力支撑。
本文我们来详细了解一下这项研究。

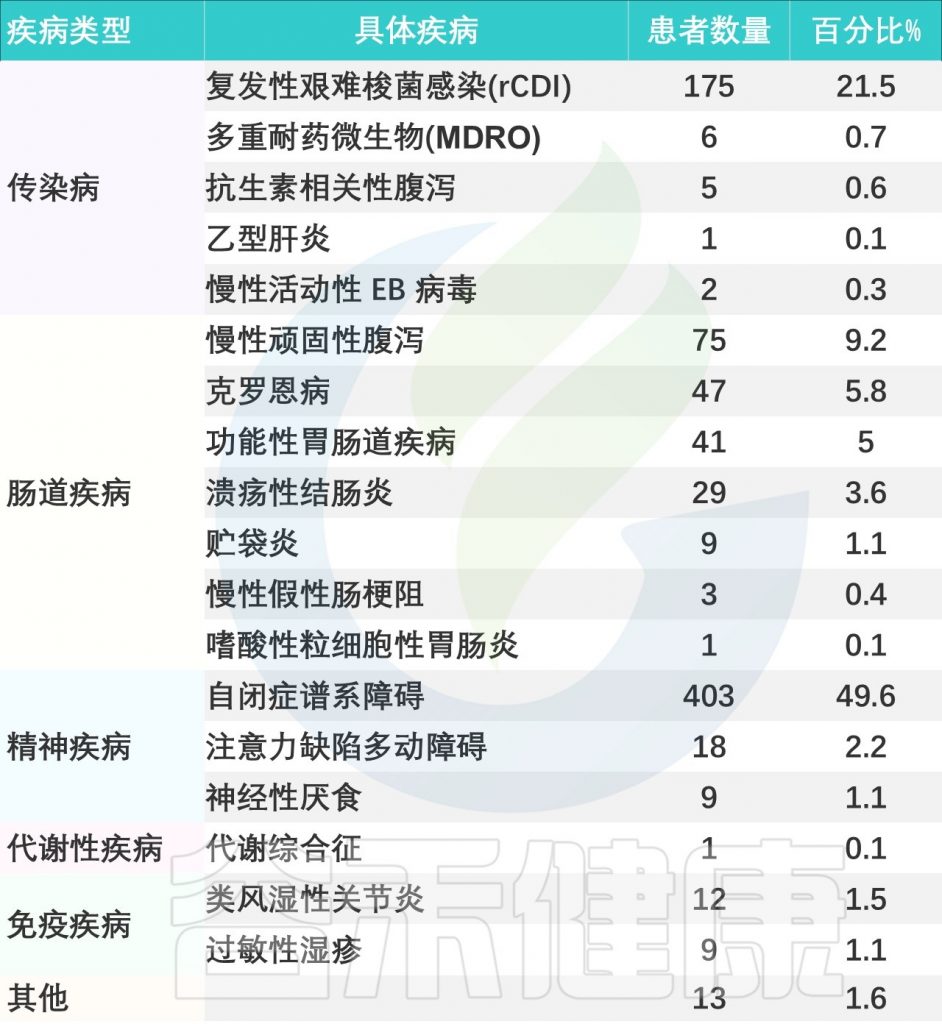
该研究回顾性分析了2013年12月~2023年12月在上海儿童医院接受 FMT 治疗的儿科患者,例如复发性艰难梭菌感染、抗生素腹泻、乙肝、慢性顽固性腹泻、炎症性、慢性肠假性梗阻、自闭症、多动症、神经性厌食症等,详见下表。
doi.org/10.1186/s12866-025-03858-z
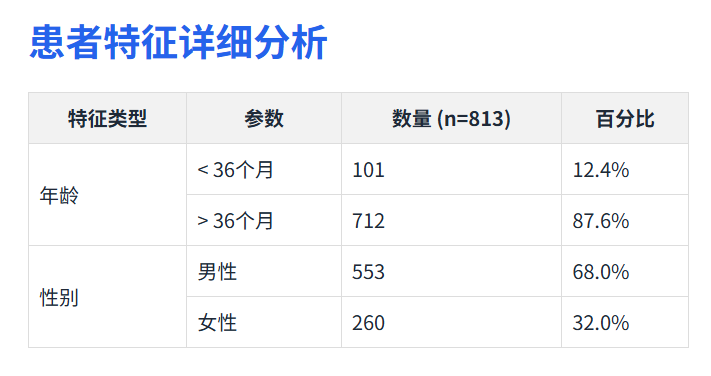
患者特征详细分析

1. FMT相关不良事件
短期不良事件总发生率为5.8%(47/813例)
最常见的短期不良反应包括:
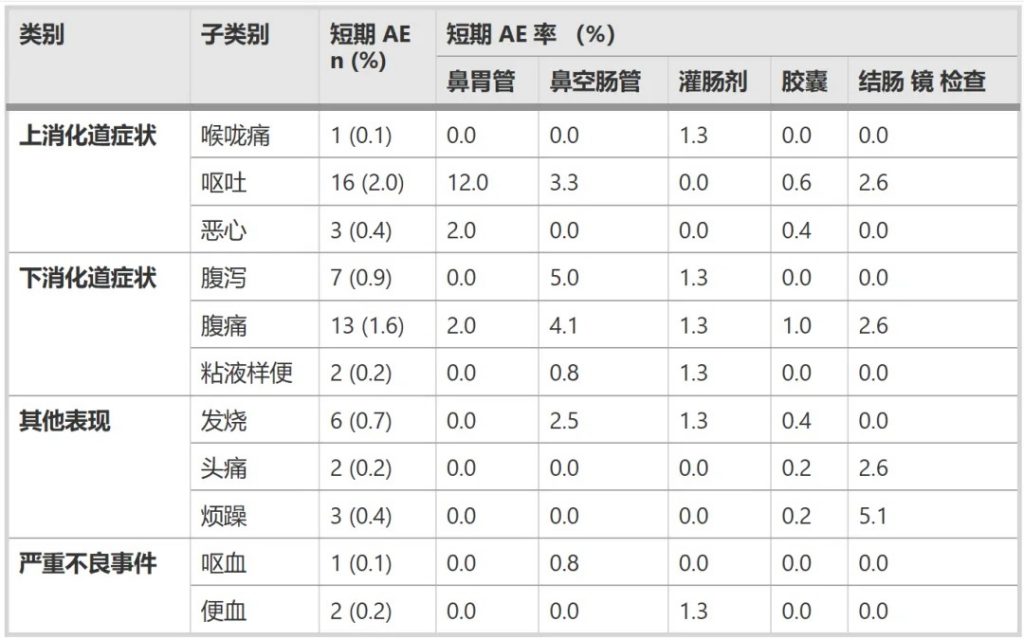
doi.org/10.1186/s12866-025-03858-z
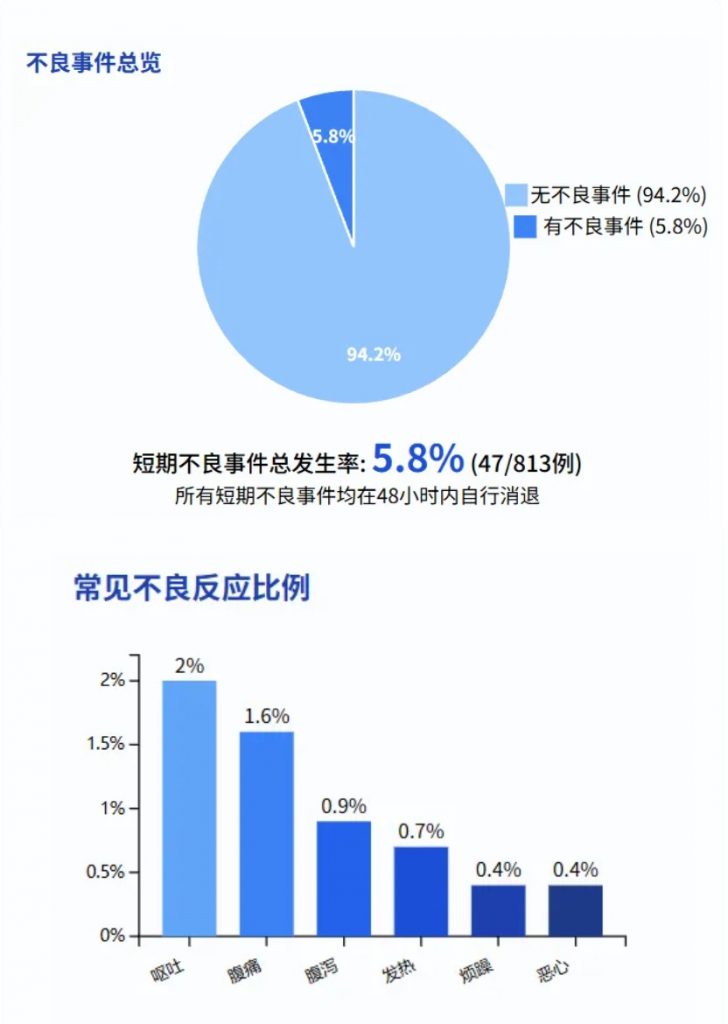
2. 给药途径与不良事件关联
FMT 的给药途径在短期不良事件的发生中起着重要作用。
给药选择包括上消化道(UGI),例如使用鼻胃管或鼻空肠管、内窥镜检查、胶囊,以及下消化道途径(LGI),如保留灌肠、乙状结肠镜检查或结肠镜检查。
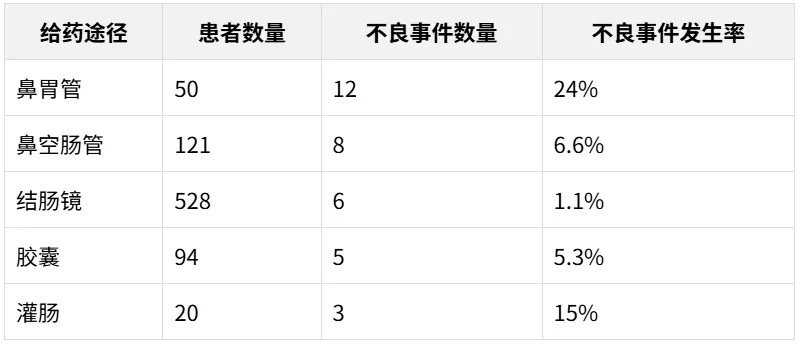
与其他途径相比,胶囊的短期不良事件发生率较低;鼻胃管(16.0%,8/50) 和鼻空肠管(14.0%,17/121) 的短期不良事件发生率更高。
FMT不同给药方式下的短期不良事件发生率(%)
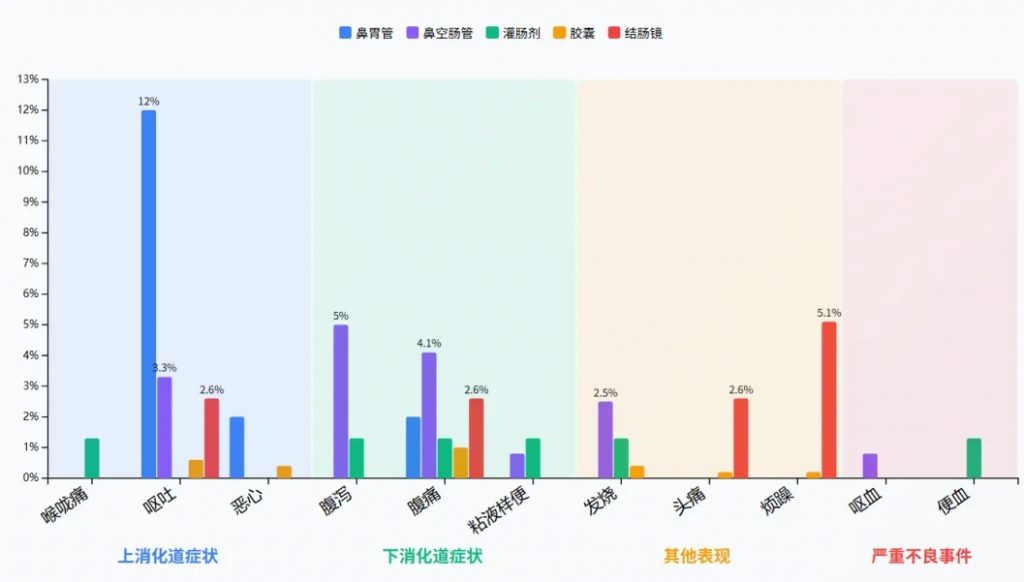
鼻胃管给药方式下,呕吐的发生率最高(12.0%),是所有给药方式中单一不良事件最高的发生率。
鼻空肠管给药方式下,腹痛(4.1%)和腹泻(5.0%)的发生率较高。
严重不良事件(呕血、便血)总体发生率极低(0.1%-0.2%)。

胶囊形式安全也更易于标准化生产、储存和运输,有利于FMT治疗的普及和推广。
3. 疾病类型与不良事件关联
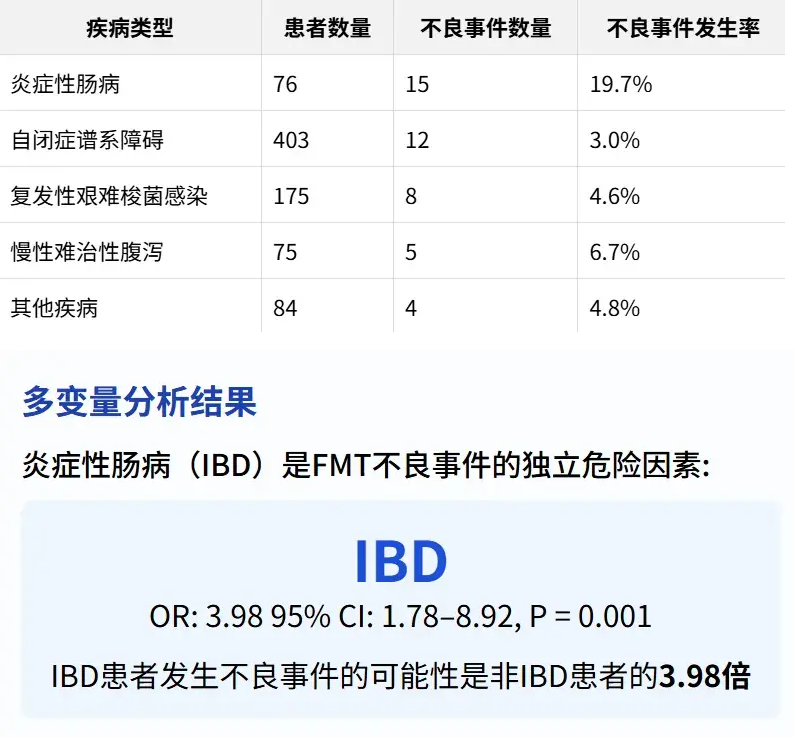
提示在产品开发中需针对IBD患者群体设计更安全的给药方案。
4. 长期随访结果
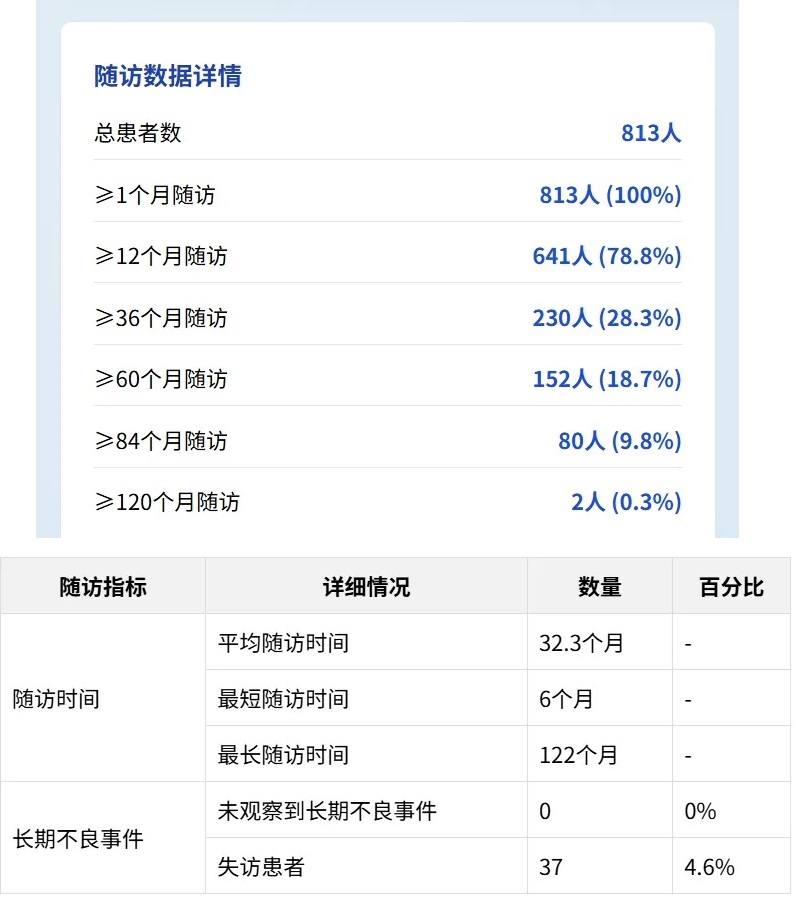
研究纳入813名患者,平均随访时间达32.3个月,最长随访期达122个月,形成了一个极具代表性的儿科FMT安全性数据库。
该研究作为迄今为止中国儿科领域样本量最大、随访时间最长的粪菌移植(FMT)安全性评估,具有较大的科学价值和临床指导意义。
这种大样本、长随访的队列设计克服了以往研究样本量小、随访时间短的局限性,为FMT安全性评估提供了更为可靠的证据。
且该研究覆盖了多种疾病类型和给药途径,包括感染性疾病、肠道疾病、精神疾病、代谢性疾病等多种适应症,以及鼻胃管、鼻空肠管、灌肠剂、胶囊和结肠镜等多种给药方式,能够指导不同疾病和不同情况下FMT的应用策略。
该研究提供的长期安全性数据将增强医患对FMT的接受度,促进其临床应用的规范化,也为微生物组治疗领域的产业化发展奠定了基础。未来,FMT产业有望通过以下方向发展:
未来需要加强微生物组移植后的菌群定植与功能研究,深入探索宿主-菌群互作机制,开发更加精准的微生物组干预策略。
随着高通量测序技术和人工智能技术的发展,FMT治疗前后的连续性菌群数据采集成为可能。这种基于海量微生物组动态变化数据的安全性评估,将远超传统的症状观察方法,能够在潜在安全问题出现前就发出预警,大幅提升FMT的安全性保障水平

谷禾健康

春节假期期间,亲朋好友欢聚一堂,美食佳肴各种狂炫,然而当传统节日遭遇现代饮食文化,频繁的高脂高蛋白摄入、不规律的进食节奏,正不断冲击着肠道屏障的免疫调控网络,部分人群可能正被食物过敏困扰。
食物过敏(FA)是一个当今面临公共卫生问题。一个人可以在任何时候对任何食物过敏,但有引起过敏反应最普遍的食物包括:牛奶、鸡蛋、花生、坚果、大豆、小麦、鱼类和贝类。这些过敏反应范围从肿胀和荨麻疹到危及生命的过敏性休克。
更不乐观的是,食物过敏在当今全球工业化社会中的流行率呈现显著代际增长(一代比一代增强)。与此同时食物过敏率的上升与很多疾病的增加相呼应,包括肥胖、糖尿病、哮喘、自闭症和炎症性肠病(以及其他疾病)。我们如何解释这种代际变化?
食物过敏是过敏性疾病的一部分,被称为I型超敏反应,是由食物蛋白(抗原)通过肥大细胞和/或嗜碱性细胞表面上的免疫球蛋白同种型E(IgE)交联引起的,这与由食物成分引起的食物敏感性不同(例如,乳糖不耐症)。
与此同时,我们的肠道相关淋巴组织(GALT)每天都面临着相当大的挑战。它遇到的抗原估计来自1014微生物和每年超过约30公斤的食物蛋白质。这要求它必须将这些无害的抗原与潜在的病原体区分开来,并能同时引起适当的宿主免疫应答。
目前越来越明确的是,与先天免疫细胞和常驻微生物群密切相互作用的功能性上皮屏障对于建立和食物过敏以及口服耐受性至关重要。而口服耐受性的形成取决于年龄、遗传学、粘膜屏障状态、抗原的物理性质、暴露剂量和频率以及肠道微生物群。
是什么驱动了对食物抗原的过敏反应,近年来有关微生物群在调节抗原摄取和抗原呈递中的作用开始被解开。在4至6个月大的婴儿中早期引入致敏性食物已被证明有希望降低部分但并非所有儿童的IgE-食物过敏(IgE-FA)发病率。
IgE-FA尚无明确的治愈方法,金标准治疗是在发生过敏反应时避免使用对症治疗。幸运的是,疾病修饰疗法,包括免疫疗法,生物制剂等有希望。
本文汇总和依托这些文献结果,讨论了IgE-食物过敏在其自然史的背景下,发展的风险因素,免疫生物学,诊断和治疗,包括新兴疗法。同时,我们也将探讨肠道微生物群在食物过敏中的作用,以及如何通过调节肠道微生物群来预防和管理食物过敏。
食物过敏是一种由免疫球蛋白E(简称IgE)引起的过敏反应。这种病近几十年来越来越常见,可能会威胁生命。特别是对于那些难以完全避开的食物(比如牛奶或鸡蛋)过敏的人来说,生活质量会受到很大影响。
对牛奶、鸡蛋、小麦和大豆的过敏,随着年龄增长可能会慢慢好转。
对花生、坚果和海鲜的过敏,通常会伴随终身。
食物过敏常常和其他过敏性疾病一起出现,比如:
虽然理论上任何食物蛋白质都可能引起过敏,但最常见的是:
小麦过敏和乳糜泻是两种不同的病:
小麦过敏是对小麦蛋白的过敏反应;
但在乳糜泻中,部分水解的麦醇溶蛋白被小肠粘膜中的组织转氨酶脱酰胺。这种特异性和有序的脱酰胺作用增强了小肠固有层中CD4+T细胞对麦胶蛋白的识别,导致免疫应答。细胞因子的后续释放导致肠粘膜的组织学变化。
◆ 过敏疾病是如何发展的?
医生们发现,很多孩子的过敏疾病会按照一定规律逐步发展,这个过程被称为“过敏进行曲”。大约有30-50%的过敏儿童会经历这个过程。不过每个孩子的发展过程可能不太一样。
◆ 过敏疾病通常会按这个顺序出现:
湿疹(特应性皮炎):通常在出生后6个月内最先出现
食物过敏:在1岁前就可能出现
过敏性鼻炎和哮喘:在有湿疹的孩子中,差不多三分之二会在3岁前出现这些症状。
特别提醒:如果湿疹控制得不好,更容易得其他过敏病。
◆ 为什么会得食物过敏?
食物过敏的形成和很多因素有关:
个人因素:
严重的早期湿疹
父母有过敏病史
环境因素:
接触过敏物的时间
肠道中的菌群平衡情况
环境因素如何影响过敏?
新出现的数据表明,在免疫系统发育过程中暴露于非微生物环境因素,包括空气过敏原、清洁剂、污染物和微塑料,可能会导致屏障功能障碍。霉菌、蟑螂和尘螨等空气过敏原含有促进上皮蛋白分解的蛋白酶,导致上皮渗透性增加,例如,清洁剂破坏角质层内的紧密连接和脂质依赖性相互作用,从而增加细胞旁渗透性。
◆ 食物过敏的风险因素:
对过敏原蛋白的反应会受到多种因素的影响,包括:
个人的敏感程度:有些人对过敏原特别敏感,而有些人反应较轻。
过敏原的特性:不同食物中的过敏原性质不同,反应也会有所差异。
食物加工方式:加工过程可能会改变过敏原的性质,比如加热可能降低或增强过敏性。
有的加工对某些过敏原有帮助,比如鸡蛋中的卵清蛋白和卵粘蛋白在加热后过敏原性下降。
但对某些过敏原(如花生蛋白)可能起反作用,加热会使其形成更稳定的抗性结构,增加过敏原性。
◆ 胃肠道屏障与过敏风险
婴幼儿风险更高: 由于他们的胃肠道屏障和免疫系统尚未成熟,食物过敏更容易发生。
胃酸不足: 服用抗酸剂可能降低胃酸浓度,使更多未被分解的蛋白质进入肠道,增加过敏风险。
肠道通透性增加: 肠道屏障功能受损可能导致更多过敏原进入免疫系统,增加致敏和过敏反应的可能性。
食物成分的相互作用:食物中的其他成分可能会影响过敏原的作用。
◆ 过敏反应的严重程度
敏感人群的过敏反应可能从轻微到严重不等,严重时甚至可能危及生命(如过敏性休克)。因此,避免接触过敏原是目前最有效的预防方法。
◆ 为什么食物过敏难以治疗?
目前还没有针对食物过敏的有效治疗方法,因为科学家对引发过敏的分子机制还没有完全弄清楚。因此,过敏患者最好的办法就是避免食用含有过敏原的食物。但问题是,只有在明确知道食物中含有过敏原时,才能做到有效避免。
◆ 食品标签的重要性
食品标签是帮助消费者了解食物中是否含有过敏原的重要手段。然而,确保全球食品标签的准确性并不容易,主要有以下几个挑战:
◆ 哪些食物最容易引发问题?
牛奶是最常见的未标注过敏原,其次是小麦和大豆。这些食物经常出现在食品召回事件中,很大程度因为它们被意外添加或未正确标注。
对于过敏患者来说,了解食品标签和避免过敏原是保护自己的关键。但由于标签错误、交叉污染等问题,完全避免过敏原仍然具有挑战性。
食物过敏原主要是一类特殊的蛋白质(糖蛋白),它们通常能溶于水,而且比较”顽固”-不容易被热、酸和消化酶破坏。
不过,不同的过敏原特性会有很大差异。有的需要糖分子的修饰才能发挥作用,有的则不需要。
过敏原的结构特点:
大小不一:从小分子到大分子都有。
结构多样:有的是单个分子,有的会几个分子组合在一起。
稳定性强:通常含有特殊的化学键(二硫键),使它们不容易被破坏。
结合能力:能与金属、脂肪等物质结合,这种结合会让过敏原更稳定。
不同食物的过敏原如果结构相似,可能会导致交叉过敏。
常见的交叉过敏组合:
过敏原的识别位点(表位):
直线型表位:像一串珠子一样排列的氨基酸片段
立体型表位:蛋白质折叠形成的特殊立体结构
一般认为直线型表位更重要,因为它们更稳定,不容易被破坏。
但在某些情况下,立体型表位也能在食物中保持稳定,发挥作用。
了解这些特性有助于预测哪些食物可能会引起交叉过敏;改进食物加工方法,降低过敏风险;开发更好的过敏预防和治疗方案。
致敏是指免疫系统首次接触到某种过敏原后,开始产生针对它的特异性抗体(IgE),但此时不会引发过敏症状。
致敏的主要途径:
小麦过敏是一种IgE介导的I型过敏反应,部分人群对小麦中的某些蛋白质成分较为敏感,即使在护肤品中接触也可能出现过敏症状。
如果你已知对小麦过敏,或者属于敏感肌肤,建议谨慎使用含有水解小麦蛋白的护肤品。
花生过敏者可能因皮肤接触花生而致敏,尤其是皮肤屏障受损的人。
胃肠道致敏(1类食物过敏): 最常见的方式,食物过敏原通过消化道进入身体,导致过敏反应,尤其常见于婴幼儿,因为他们的肠道屏障和免疫系统尚未完全发育。常见过敏原包括牛奶、鸡蛋和豆类。
吸入性致敏(2类食物过敏): 通过呼吸道接触到空气中的过敏原(如花粉、动物毛发等),随后对相关食物产生过敏。
皮肤接触致敏: 通过皮肤接触到过敏原而致敏。例如:
蜱叮咬致敏: 蜱叮咬可能导致对红肉的过敏反应,这是一种特殊的皮内致敏途径。
子宫内暴露: 胎儿可能通过胎盘接触到母体食物中的过敏原(如牛奶、鸡蛋和花生),但目前没有确凿证据表明母亲的饮食会直接影响婴儿的食物过敏风险。
B细胞的双重角色 | 引起过敏/预防过敏
什么是B细胞?
B细胞是我们身体里的一种免疫细胞,它最重要的工作就是产生抗体(免疫球蛋白)。在食物过敏中,B细胞主要产生一种叫IgE的抗体。
食物过敏发生的过程:
第一步: 识别“入侵者”
B细胞会产生IgE抗体,这些IgE能够识别食物中的特定蛋白质(过敏原)。
第二步: 设置“警报器”
IgE会附着在特殊的免疫细胞(肥大细胞和嗜碱性粒细胞)表面,这些细胞就像身体的“警报器”。
第三步: 过敏反应的触发
当吃到过敏食物时,IgE认出并抓住过敏原
“警报器”被触发,免疫细胞释放出化学物质,这些化学物质引起过敏症状(如皮疹、呼吸困难等)。
关于IgE的特点:
IgE在所有抗体中数量最少,但它在过敏反应中起着关键作用。
B细胞的变化过程:
B细胞可以通过特殊方式转变,开始产生IgE,这个转变需要其他免疫细胞(T细胞)的帮助,还需要特定的信号分子(IL-4和IL-13)的参与。
对花生过敏的研究发现,科学家从花生过敏患者的血液中找到了产生IgE的B细胞。这些B细胞寿命较短。
不同过敏患者的IgE抗体可能会以相似的方式识别花生中的过敏原,这些发现帮助我们更好地理解食物过敏的发生机制,为开发新的治疗方法提供线索,从而可能帮助预防或减轻过敏反应。
图 控制对过敏原反应的免疫过程
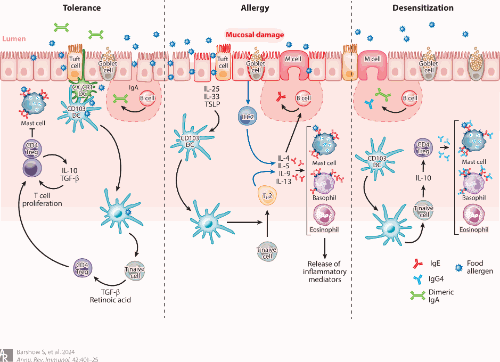
(左)耐受性:耐受性是一种主动免疫过程,在此过程中暴露于过敏原不会引发过敏性炎症。耐受性可涉及特异性抗原呈递细胞、TcB的诱导和活化以及B细胞同种型转换为伊加。
(中)过敏症:在过敏症中,上皮细胞功能障碍使抗原进入并触发alarmins IL-25、IL-33和TSLP的释放。幼稚T细胞分化成TH2细胞,其分泌促炎性TH2细胞因子IL-4、IL-5、IL-9和IL-13,其导致B细胞同种型类别转换为IgE。IgE通过高亲和力IgE受体(FcεR1)与肥大细胞和嗜碱性粒细胞结合,导致急性过敏性炎症。
(右)脱敏:过敏原免疫疗法的脱敏与IL-10的Treg产生相关。B细胞类别从IgE转变为IgG 4和伊加产生。IgG 4和伊加可通过分别与IgE竞争变应原结合位点和直接结合食物变应原而充当阻断抗体来抑制TH2适应性免疫应答。缩略语:DC,树突状细胞;TH2,2型辅助性T细胞; Treg,调节性T细胞; TSLP,胸腺基质淋巴细胞生成素。
不是所有抗体都会引起过敏;B细胞除了能产生引起过敏的IgE抗体,还能产生其他种类的保护性抗体,这些保护性抗体可以帮助预防食物过敏。
保护性抗体是如何工作的?
科学家通过小鼠实验发现粘膜中的IgA抗体能阻止过敏原被肠道吸收。
IgG抗体有两种保护作用:
直接捕获并中和过敏原;
通过FcγRIIb受体的作用抑制过敏反应。
此外,治疗食物过敏的新发现在口服免疫治疗(OIT)中观察到,保护性抗体IgG4会明显增加,IgG4与致敏抗体IgE的比值升高。这些变化与患者对食物的耐受性直接相关。
调节性B细胞的重要性
研究发现牛奶过敏患者与健康人对比,过敏患者的调节性B细胞明显减少,这些细胞产生的IL-10也较少。
IL-10的重要作用可以减少致敏抗体IgE的产生,促进保护性抗体IgG4的产生。
B细胞的信使功能:
B细胞也可通过IgE促进的抗原呈递作用作为T细胞的抗原呈递细胞(APC),其中IgE-过敏原复合物被低亲和力IgE受体CD 23(FcεRII)内化,后者在B细胞上表达。
值得注意的是,最近的一项研究表明,B细胞上CD 23的表面密度通过IgE促进的抗原呈递决定了过敏原特异性T细胞的活性,并与总血清IgE水平呈正相关。抗CD 23单克隆抗体鲁昔单抗通过靶向CD 23-IgE相互作用抑制IgE合成。
B细胞治疗方面潜力:
预防方面:
T细胞在食物过敏中的角色
1. TH2细胞:过敏反应的”指挥官”
研究发现,TH2细胞是引发食物过敏的核心细胞,它通过三种方式发挥作用:
2. 治疗的新发现
口服免疫治疗(OIT)的研究显示:能够抑制TH2细胞的活动,减少过敏相关物质的产生,帮助建立对食物的耐受性。
3. 新发现的重要T细胞类型
最新研究发现Tfh13细胞在食物过敏中的重要作用,动物实验证明,这种细胞对产生高效过敏抗体必不可少,能直接影响过敏反应的强度。
注:Tfh13(滤泡辅助性T细胞13)是一种特殊的免疫细胞亚型,属于CD4+ T细胞家族。它在免疫反应中起着重要作用,尤其是在过敏反应和IgE抗体的产生过程中。
此外,还有TH2A细胞,这是一种特殊的记忆性T细胞,该细胞只在过敏人群中发现,其表面有特定标记物(CD161、CRTH2、CD49d)。发现该细胞不仅与食物过敏有关,还与其他过敏病相关,例如,湿疹、过敏性鼻炎、哮喘和食管炎。
4. T细胞的共同识别标记
研究人员通过CD154标记发现:花生过敏患者的T细胞有特殊特征,17%的特定序列在不同花生过敏患者中相同。这说明花生过敏可能有共同的免疫机制。
5. 调节性T细胞(Treg):过敏的“刹车系统”
Treg细胞是免疫系统的调节者,有两种来源:
动物实验显示,牛奶过敏小鼠经过治疗后:Treg细胞数量增加,产生更多保护性物质(IL-10和TGF-β)。
人类研究发现,鸡蛋过敏儿童成功治疗后:特定类型Treg细胞增加。与此同时,花生过敏治疗后:Treg相关基因活性增加。
T细胞在诊断和治疗方面应用潜力:
肥大细胞:驻扎在“人体边防”的过敏触发器
主要在身体的”边界”位置:皮肤、呼吸道、消化道。
研究发现:对胃肠道过敏患儿的活检发现,他们的胃部和结肠中,肥大细胞数量比健康孩子多(通过CD117和类胰蛋白酶标记检测)。
临床观察:在食物过敏患者的肠道检查中发现,过敏相关物质明显增加:
特定条件下可能缓解过敏
小鼠实验发现,肥大细胞表面有个“刹车开关”(FcγRIIb),能接收IgG抗体的“停战指令”,抑制过敏反应,这可能是未来治疗的关键靶点。
嗜碱性粒细胞:血液中的哨兵
基本特征:在血液中数量很少(仅占白细胞的0.5-1%),但在过敏反应中作用重要。
临床应用:可以通过流式细胞术(BAT)检测,使用CD63和CD203c作为标记,帮助诊断食物过敏,监测治疗效果。
治疗相关发现:口服免疫治疗(OIT)研究显示,成功治疗后:
小鼠实验发现:在 IgE-FA 的小鼠模型中,嗜碱性粒细胞耗竭减轻了腹泻的发生率,临床过敏反应减弱。同一项研究表明,嗜碱性粒细胞来源的 IL-4 对于肥大细胞募集和/或增殖至关重要。
临床意义:可以通过检测这两种细胞,判断过敏严重程度,评估治疗效果。
治疗方向:可以破坏 IgE-FA 中肥大细胞和嗜碱性粒细胞反应性的新型干预措施,可能代表未来研究的有吸引力的治疗靶点。
抗原呈递细胞(APCs):免疫系统的“情报分析员”
主要包括三类细胞:
抗原呈递细胞是如何工作的?
➤ 发现并捕获食物过敏原 → 分解成小片段(肽段) → 用MHC II分子“举牌”展示
➤ 指挥CD4+ T细胞分化成不同细胞(TH1/TH2/Treg等)
不同派系的树突状细胞:过敏派 vs 和平派
◈ 过敏派(CD209+树突状细胞)
锁定目标:锁定致敏蛋白,如花生、坚果等。
煽风点火:释放信号诱导T细胞变身TH2(分泌IL-4/IL-5/IL-13)
研究证据:
◈ 和平派(CD103+树突状细胞)
维稳专家:在小鼠肠道训练T细胞成为Foxp3+ Treg(分泌IL-10),有助于预防过敏。
制衡机制:表达诱导性T细胞共刺激配体(ICOS-L),促进“调解员细胞”生成。
树突状细胞功能的其他重要考虑因素包括共刺激分子如 CD80 和 CD86 等表达,它们是 CD28 的天然配体;这些分子与 T 细胞表达的 CD28 的相互作用受损可能导致激活减少或缺失,并最终导致 T 细胞无反应。
花生口服免疫治疗降低了APC上CD86的表达,尽管这些变化可能是暂时的。
诊断方面:通过分析树突状细胞的亚型特征和活化状态,可评估个体过敏风险等级,并预测潜在的过敏反应发生概率。
治疗突破:为过敏治疗开辟了新路径。
1)精准调控不同功能亚型DC的比例平衡;
2)靶向干预DC表面关键分子(如共刺激分子)的表达;
3)特异性增强具有免疫调节功能的DC活性。
总之,免疫系统的多个部分协同作用。
正常耐受状态是B细胞生产保护性抗体(IgA),调节性T细胞(Treg)担任”指挥”角色,共同抑制过度反应,防止肥大细胞引发过敏症状。
过敏状态TH2细胞过度活跃,产生大量致敏物质,指导B细胞产生过敏抗体(IgE)。多种免疫细胞被激活,包括肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞等。受损的肠道细胞会释放:IL-25、IL-33、TSLP,这些物质进一步加重过敏反应。
成功的脱敏治疗会带来以下变化:
T细胞方面,抑制致敏T细胞(TH2)、增加调节性T细胞;
B细胞方面,增加保护性抗体(IgA和IgG4)、减少致敏抗体(IgE)。
来自人类和动物研究的越来越多的证据支持肠道微生态失调在食物过敏发展中的关键作用。
基于16S rRNA测序的研究发现,与没有食物过敏的儿童相比,患有食物过敏的儿童具有独特的肠道微生物组结构。
表. 在有和没有FA的小儿患者之间主要的肠道微生物组差异(基于16S-rRNA测序的研究)
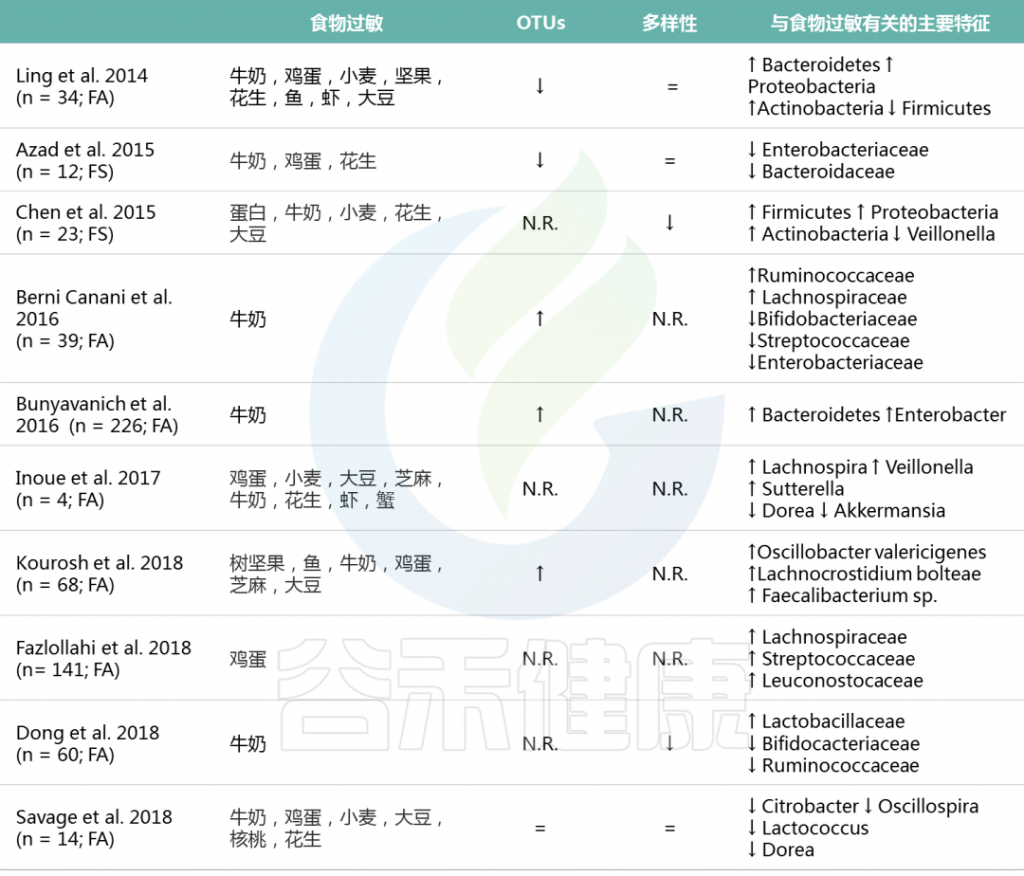
M.D.Costanzo et al, Int.J.Mol.Sci. 2020
FA:食物过敏; FS: 食物过敏; OTUs:操作分类单元; N.R.: 未报道过的; ↑ : 增加;↓: 减少; =: 不变.
表1中所有研究均调查了IgE介导的食物过敏。有趣的是,关于46例受非IgE介导的牛乳过敏(CMA)影响的患者的数据显示,与健康对照组相比,失调的菌群中拟杆菌Bacteroides (Bac 12) 和Alistipes丰富,IgE介导的CMA儿童的特征重叠,是从健康到IgE介导的CMA患者的拟杆菌逐渐增加。
在同一项研究中,患有非IgE介导的CMA的儿童的粪便中丁酸浓度明显低于健康人。
菌群失调先于食物过敏发作
来自人体研究的可用数据表明,菌群失调先于食物过敏发作。
Azad 等人研究发现,在婴儿早期肠道微生物组含量较低的情况下,肠杆菌科(Enterobacteriaceae) / 拟杆菌科(Bacteroidaceae)的比率增加和Ruminococcaceae的丰度较低与随后的食物敏感性相关,这表明早期肠道菌群失调对食物过敏的后续发展有促进作用。
此外,人类研究的可用数据表明,生命早期,尤其是生命的头6个月,微生物组构成与食物过敏的发展更为相关;
在出生后的前 6 个月内,在食物过敏儿童的肠道菌群中占比过高的菌如下:
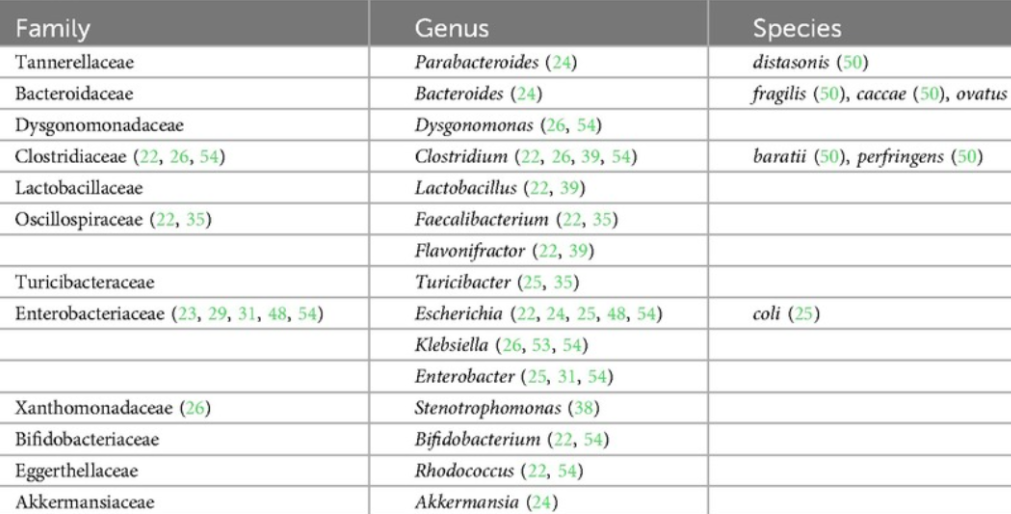
doi.org/10.3389/falgy.2024.1438252
在出生后的前 6 个月内,在食物过敏儿童的肠道菌群中缺乏的菌如下:
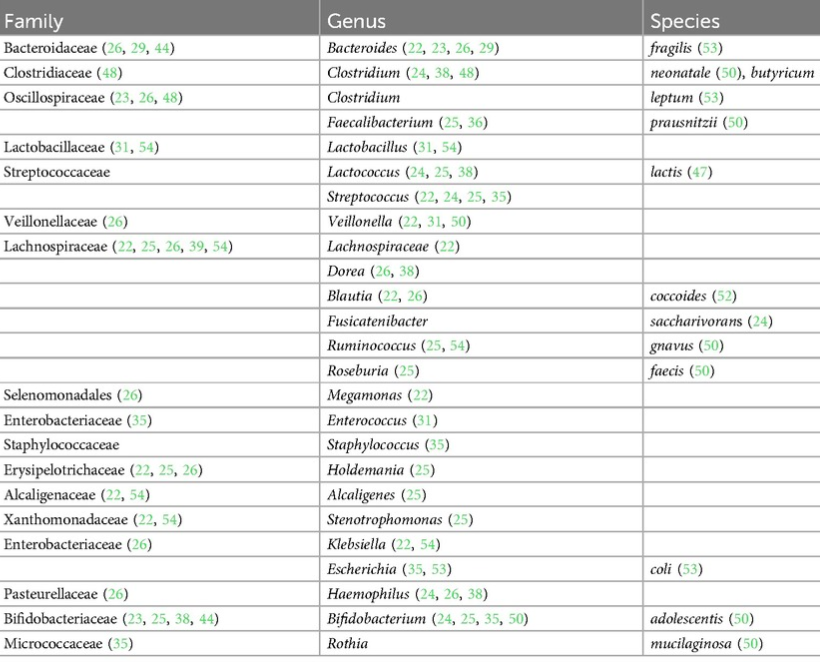
doi.org/10.3389/falgy.2024.1438252
▲ 有害菌增加:
肠杆菌等有害菌释放脂多糖(LPS)等毒素:
▼ 有益菌减少:
双歧杆菌、乳杆菌等能分解食物纤维,产生短链脂肪酸(如丁酸),这类物质:
调节免疫耐受
肠道菌群通过调节Tregs细胞的分化和功能,增强对食物抗原的耐受性。例如,梭菌和双歧杆菌能够通过其代谢产物(如SCFAs)和信号分子(如IL-10、TGF-β)促进Tregs的分化和增殖,从而抑制过敏反应。
肠道菌群还通过调节树突状细胞(DCs)的功能,影响免疫反应。例如,健康的肠道菌群能够使DCs产生TGF-β和视黄酸(RA),从而诱导Tregs的分化。
共生菌介导免疫耐受
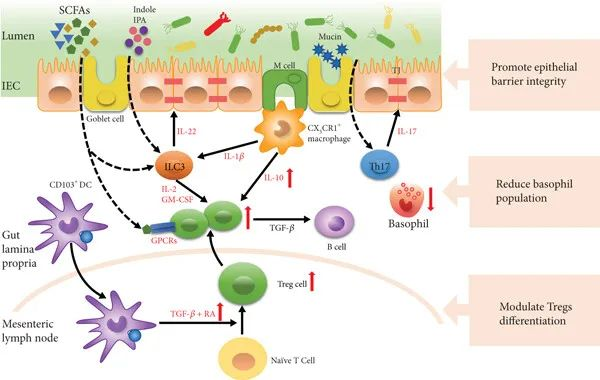
doi.org/10.1155/2023/9575410
增强肠道屏障功能
肠道菌群通过产生短链脂肪酸(如丁酸)和色氨酸代谢产物(如吲哚)来增强肠道上皮屏障的完整性。这些代谢产物能够促进黏液分泌和紧密连接蛋白的表达,从而防止食物抗原进入血液循环,减少过敏反应的发生。
例如,丁酸能够通过诱导IL-22的产生,增强肠道上皮细胞的屏障功能,减少过敏原的渗透。
调节过敏效应细胞
肠道菌群能够调节过敏效应细胞(如嗜碱性粒细胞)的数量和功能。例如,抗生素处理或无菌小鼠的嗜碱性粒细胞数量增加,而补充益生菌可以减少这些过敏效应细胞的数量,从而减轻过敏症状。
关于肠道菌群的干预措施,我们将在06章节详细阐述。
IgE-食物过敏的诊断依赖于临床病史和过敏试验的结合,如食物特异性IgE的存在。诊断指南和标准临床实践在国际上各不相同。这些差异主要是由于多种方法可用于评估IgE-FA;这些方法在灵敏度、特异性、成本、时间和可及性方面各不相同。准确的诊断对于防止不必要的食物避免和提供及时和适当的治疗建议至关重要。
金标准
双盲安慰剂对照食物激发试验(DBPCFC)是最可靠的确诊方法。由于12.9%的试验可能出现安慰剂反应,其准确性优于非盲法试验。
确定IgE对给定食物致敏的两种主要方法是:
体内皮肤点刺试验(SPT)
操作:将微量食物(新鲜的或更常见的作为提取物)刺入皮肤表层
判读标准:15-20分钟后,检查皮肤刺痛部位,若出现比阴性对照大3mm以上的红肿包块(因肥大细胞释放组胺所致)即为阳性。
编辑
血清特异性IgE(sIgE)
sIgE测定定量外周血中存在的过敏原特异性IgE的量。
传统标准:≥0.35 kU/L为阳性
新型检测:临界值可低至0.1 kU/L
注意:两项检测结果必须谨慎解释,均需结合症状分析,因可能出现”致敏但无过敏反应”的假阳性。
检测结果优化策略:
使用较大的SPT包块直径或较高的sIgE临界值可增加临床反应性的可能性,但这是以牺牲敏感性为代价的。
组合检测优势:
对1247例食物激发试验数据分析显示:
SPT+sIgE联合检测或sIgE/总IgE比值(sIgEr)
的阳性预测值显著优于单项检测。
应用价值:在临床试验等场景中可替代部分激发试验,但仍需更多验证。
现存挑战:许多具有临床相关IgE-FA的患者的SPT和/或sIgE值可能低于已发表的临界值,强调需要更稳健的诊断方法来取代口服食物激发试验。
食物过敏检测升级版:成分检测与表位检测有什么用?
除了常规的皮肤点刺、抽血验IgE,医生手里还有两把更精细的“放大镜”——成分检测和表位检测。它们能帮你区分“假警报”和“真危险”,甚至预测过敏反应有多严重。
成分检测:锁定过敏食物里的“关键蛋白质”
原理:
食物过敏其实是对其中某些蛋白质过敏。比如花生含有Ara h1、Ara h2等多种蛋白质,成分检测(CRD)可以单独测出你对哪一种蛋白质过敏。
实际用途:
区分“花粉过敏连带反应”和“真过敏”。
比如有人吃花生过敏,但检测发现只对Ara h8蛋白敏感,这通常是因为它和桦树花粉蛋白相似,属于“交叉反应”(可能症状轻微,比如口腔发痒)。
但如果对Ara h1/2/3敏感,则是真正的花生过敏,严重时可能引发全身反应。
预判过敏风险高低
研究证实:对花生中的Ara h2蛋白过敏的人,严重过敏风险更高;而另一种Ara h6蛋白(与Ara h2结构相似)阳性,也可能指向真实过敏。

表位检测: 看清IgE攻击的“精确靶点”
原理:如果把过敏蛋白比作一根长绳,表位就是绳子上被IgE抗体“咬住”的具体位置(分线性和构象两种结构)。表位检测能识别这些关键攻击点,帮助判断过敏是否会长期存在或容易引发严重反应。
在花生过敏的儿童和成人中,针对花生过敏的BBEA表位检测法(检测Ara h2蛋白的两个线性表位):灵敏度92%,特异性94%,准确度碾压常规检测:比皮肤点刺、普通IgE检测更准。
另一个相关的体液测试是 过敏原特异性IgG4
IgG4抗体通过充当阻断抗体而在IgE-FA中具有保护作用。一项研究发现,花生致敏但临床耐受或花生过敏并接受OIT治疗的儿童的血浆能够抑制花生诱导的肥大细胞活化。重要的是,当血浆中的IgG4耗尽时,肥大细胞的活化不能完全恢复。
但是目前需要进一步的研究来更全面地了解IgG4单独或与其他生物标志物结合在食物过敏诊断和/或预后中的作用。
编辑
诊断方法仍然主要限于研究环境,包括嗜碱性粒细胞活化试验(BAT)和肥大细胞活化试验(MAT)。
BAT与MAT的优劣对比:
BAT和MAT都是基于体外流式细胞术的实验室检测,用于测量过敏原刺激后活化标志物的表达。
BAT检测(嗜碱性粒细胞活化试验)
需要采集新鲜血液立即检测。
BAT在诊断IgE-食物过敏时的特异性高于SPT和sIgE水平,在花生过敏中的特异性为98%,灵敏度为75%。
但存在15%人群天生对检测无反应。
MAT检测(肥大细胞活化试验)
可用冷冻血清来激活培养的原代人血源性肥大细胞。
在花生过敏诊断中比BAT更准确。
重复检测结果高度一致(组内相关性:MAT 0.96 VS BAT0.43)。
新的诊断方法包括:
评估食物过敏原特异性B和T细胞
外周血中的过敏原特异性B和T细胞由于其稀缺性而历来难以分离。由于技术的进步,这些罕见的细胞现在可以通过几种方法来识别。
关于T细胞,这些方法包括:
a)用所选抗原或肽体外刺激PBMC,然后通过表达特异性活化标志物经由流式细胞术鉴定活化的T细胞;
b)用重组肽-MHC(pMHC)复合物离体染色T细胞。pMHC四聚体或多聚体技术也可用于鉴定变应原特异性B细胞。
多组学研究
包括基因组学、表观基因组学、转录组学、蛋白质组学、代谢组学、微生物组学和免疫组学在内的组学科学有望成为研究过敏性疾病(包括IgE-FA)的高通量方法。需要多组学方法来全面识别生物标志物,如基因,蛋白质和/或代谢产物,可以提高IgE-食物过敏诊断和预后的准确性。
此外,非常需要鉴定可预测IgE-食物过敏反应严重程度的生物标志物。特别令人感兴趣的是血小板活化因子乙酰水解酶(PAF-AH)。之前的研究已经证实,PAF-AH可以通过灭活PAF来预防过敏级联反应的进展。
肠道菌群检测
通过高通量测序技术获得菌群组成和功能数据,结合机器学习模型(如随机森林、神经网络)识别过敏相关特征。肠道菌群检测报告菌群失衡程度、关键菌群丰度及代谢物水平,提示过敏风险。
干预后复查菌群,观察过敏症状是否缓解,验证菌群与过敏的因果关系。
该方法是非侵入性的,且可以早期预警,因为很多时候菌群失衡可能早于过敏症状出现。通过个性化干预,指导益生菌、膳食调整等精准治疗。
肠道菌群检测可作为食物过敏的辅助诊断工具,为个性化治疗提供依据。可以结合临床传统方法(如食物激发试验)综合判断,通过连续检测评估过敏风险和干预效果,整合IgE检测、皮肤点刺试验和菌群数据,提高准确性。
1. 当前的食物过敏治疗方式
目前,食物过敏没有治愈方法,治疗的核心是避免接触过敏原。如果意外接触导致过敏反应,通常使用肾上腺素和抗组胺药进行处理。
由于食物过敏带来的严重健康和经济负担,科学界投入了大量资源研究新的治疗方法。
2. 预防的转变:从回避到早期接触
过去建议高过敏风险的婴儿(如父母有过敏史)避免接触过敏性食物,比如花生。
但后来研究发现,在婴儿早期引入过敏性食物(如花生)反而可以降低过敏风险。这项发现改变了过敏预防的建议,也激发了对免疫疗法的研究热情。
3. 免疫疗法的探索
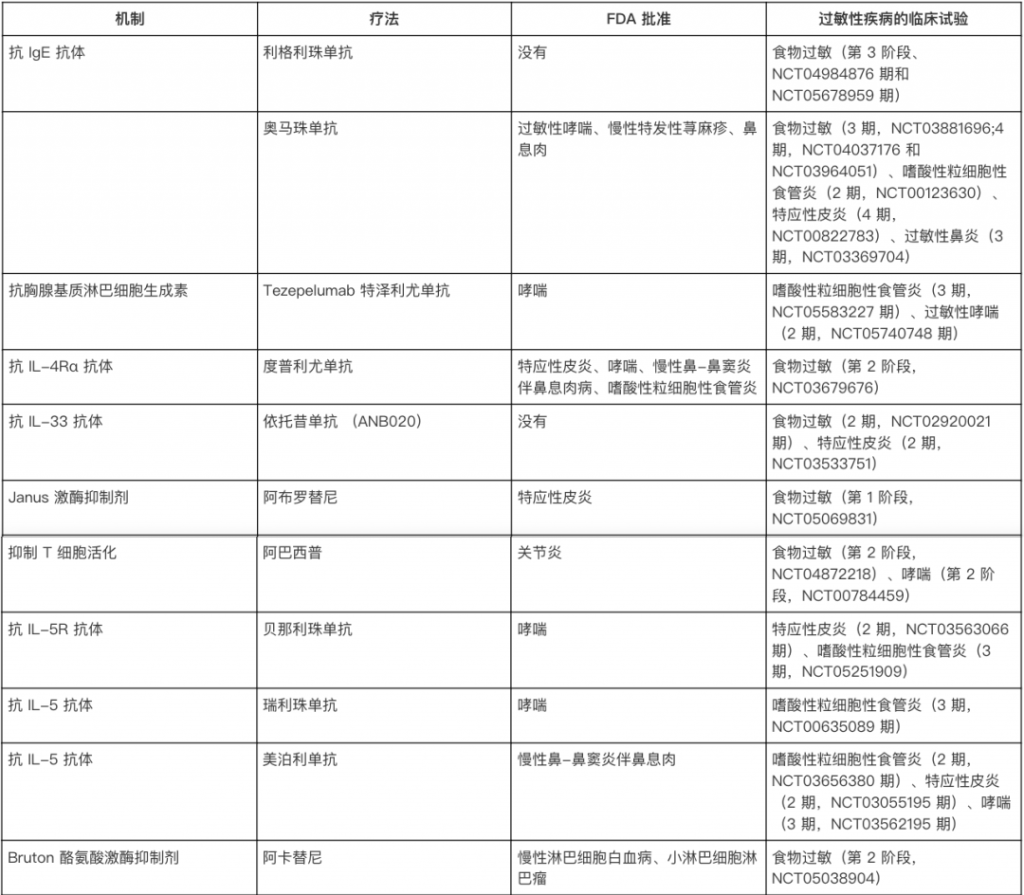
免疫疗法的目标是通过逐步改变免疫系统的反应,让身体对过敏原“习惯”并耐受。方法包括:
其中,口服免疫疗法(OIT)效果最好,但也存在风险。比如,患者可能会出现轻微不适(如口痒、肚子痛),甚至更严重的过敏反应(如全身性过敏或嗜酸性食管炎)。
doi.org/10.1146/annurev-immunol-090122-043501
4. 辅助治疗:提高疗效,减少副作用
为了让免疫疗法更安全有效,科学家正在研究辅助治疗:
此外,新的治疗IgE-FA包括疫苗、纳米颗粒、Janus激酶(JAK)和布鲁顿的酪氨酸激酶抑制剂。
5. 基于微生物群的干预
研究发现,肠道中的某些细菌和它们的代谢产物(如丁酸盐)可以调节免疫系统,帮助身体更好地耐受过敏原。下列措施可以在调节肠道菌群的基础上干预食物过敏。
饮 食
增加膳食纤维
高纤维饮食(如全谷物、蔬菜、水果)可促进双歧杆菌、乳酸菌等有益菌增殖,增加短链脂肪酸的生成,抑制促过敏的Th2免疫反应。
举例:
菊粉(如洋葱、大蒜):增加双歧杆菌。
果胶(如苹果、柑橘):改变厚壁菌门与拟杆菌门的比例,增加血清和粪便中SCFA的含量,并通过损害树突状细胞功能来预防炎症的发展。
高纤维摄入通过重塑肠道微生物群和增加SCFA水平,特别是乙酸盐和丁酸盐水平,保护小鼠免受花生过敏。此外,这种保护作用取决于SCFA的受体GPR43和GRP109A,因为缺乏其中一种的小鼠表现出更严重的食物过敏。
减少高脂高蛋白饮食
过多动物蛋白和脂肪可能促进拟杆菌属等菌群占优,增加炎症风险,间接诱发过敏。建议适量摄入,平衡植物蛋白(如豆类)。
高脂饮食诱导的肠道菌群变化也被证实可以诱导食物过敏。
一项研究显示,高脂饮食通过增加Ruminococcaceae(梭菌目)、Desulfovibrionaceae(δ-变形菌纲)和Rikenellaceae(拟杆菌纲)的相对丰度,同时减少Muribaculaceae和Prevotellaceae的丰度来诱导食物过敏。
增加优质脂肪
ω-3脂肪酸,ω-3主要来自海洋来源(如鱼油、藻类)和某些植物(如亚麻籽):通过抑制树突状细胞(DCs)的激活、抑制CD4 T细胞的增殖和活化、减少促炎因子、降低IgE水平以及抑制肥大细胞脱颗粒,从而减轻食物过敏。
增加膳食多酚
多酚是次生植物代谢产物,富含水果、蔬菜、谷物、咖啡和茶。非结合多酚通过肠道菌群调节、紧密连接蛋白表达和 β-防御素分泌来缓解食物过敏。
可可多酚:
研究表明,富含可可多酚的饮食可以减少厚壁菌门和变形菌门,增加Tenericutes和蓝藻门(Cyanobacteria),从而抑制特定抗体和肠道IgA的合成,有助于减少过敏反应。
矢车菊素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside):
通过增加有益菌(如乳酸杆菌和Odoribacter)和减少有害菌(如幽门螺杆菌和Turicibacter)来上调紧密连接蛋白的表达,促进分泌型IgA和β-防御素的分泌,并平衡Th1/Th2水平,有助于增强肠道屏障功能,减少过敏原的渗透,从而减轻食物过敏症状。
槲皮素(Quercetin):
槲皮素具有抗氧化、抗炎和抗癌活性。它可以通过与卵清蛋白(OVA)结合,减少OVA的致敏性,并降低特异性免疫球蛋白水平,从而减轻过敏反应。
咖啡酸和表儿茶素没食子酸酯(Epigallocatechin-3-gallate, EGCG):
与乳清蛋白结合后,可以减轻乳清蛋白引起的口服致敏反应,降低小鼠血清中特异性抗体和mMCP-1水平,并减少体外CD4 T细胞的增殖,有助于减少乳清蛋白引起的过敏反应。
益生菌
双歧杆菌(Bifidobacterium)
乳杆菌(Lactobacillus)
丁酸梭菌(Clostridium butyricum)
混合益生菌
注意:
益生元
通过特定益生元干预食物过敏的机制主要是调节肠道菌群,促进短链脂肪酸生成,抑制过敏相关炎症反应。以下为具体益生元及研究证据:
临床试验显示,补充该组合可显著降低高风险婴儿食物过敏发生率,可能与促进双歧杆菌生长有关。
2’-岩藻糖基乳糖(2’-FL)和乳糖-N-新四糖(LNnT):添加到配方奶粉中可缓解牛奶蛋白过敏(CMA),降低IgE水平和炎症因子(如IL-4、IL-6)。
乳-N-岩藻五糖III(LNFP III):摄入量高的婴儿CMA风险更低。
动物实验表明,母体补充可诱导免疫耐受,降低后代小麦过敏风险。
多不饱和脂肪酸(PUFA)等可能减少儿童食物致敏风险。
合生元
合生元是一种包含活菌(益生菌)和宿主微生物选择性利用的底物(益生元)的混合物,能够为宿主带来健康益处。
在一项多中心随机对照试验(RCT)中,研究了含有短双歧杆菌M-16V和低聚果糖(scGOS/lcFOS)的氨基酸配方(AAF-S)对IgE介导的牛奶过敏(CMA)婴儿的安全性。
结果显示,与普通氨基酸配方(AAF)相比,AAF-S在控制过敏症状和促进正常生长方面同样有效,但在减少感染、用药次数和住院率方面效果更好。具体数据如下:AAF-S组婴儿的感染发生率显著降低、使用的药物更少、住院率显著降低(8.8% vs. 20.2%,p = 0.036)。
粪便微生物组分析显示,AAF-S组婴儿的双歧杆菌丰度显著增加,而Eubacterium rectale和C. coccoides的丰度显著降低。
代谢产物变化:AAF-S组婴儿的粪便中乙酸和L-乳酸水平显著升高,粪便pH值显著降低。
粪菌移植
最近,一项小鼠模型研究表明,FMT抑制了特应性皮炎小鼠中OVA诱导的过敏反应。
除了恢复肠道微生物群外,FMT还降低了IgE水平;受监管的Tregs;肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞减少;提高了SCFA的含量;恢复Th1/Th2平衡。
与其他方法相比,FMT是一种相对简单的治疗策略,可以改变人体肠道微生物群;然而,迄今为止,这项研究还不够充分,需要开展大量工作来提高我们对用FMT治疗食物过敏的理解。
中草药
中药因其低成本、高安全性以及高生物活性,近年来在食物过敏治疗中受到越来越多的关注。虽然传统中医中没有“食物过敏”的具体术语,但一些中药方剂在现代研究中显示出对食物过敏的潜在治疗效果。
食物过敏草药配方-2(FAHF-2):
来源:FAHF-2是从传统的“乌梅丸”(Wu Mei Wan)中开发而来的。
临床研究:在一项多中心、双盲、随机、二期临床试验中,68名12-45岁的食物过敏患者每天三次服用FAHF-2或安慰剂,持续六个月。结果显示,FAHF-2安全且耐受性良好。
免疫调节作用:FAHF-2能够显著抑制外周血单个核细胞(PBMCs)产生的IL-5,并增加IL-10和调节性T细胞(Tregs)的生成,显示出良好的免疫调节效果。
改进形式:由于FAHF-2的剂量较大,研究者开发了两种改进形式:丁醇纯化的FAHF-2(BF2)和乙酸乙酯及丁醇纯化的FAHF-2(EBF2)。在花生过敏的小鼠模型中,EBF2显示出很强的抑制IgE产生的能力,被认为是对花生过敏最有潜力的治疗药物。
尽管中药在治疗过敏性疾病中被广泛应用,但关于食物过敏的临床研究样本量小,且研究受限,需要进一步验证中药在食物过敏治疗中的效果。
从概念上讲,人类食物供应中的任何蛋白质都可能是潜在的过敏原,因此建立“无过敏原食品”体系不现实。由于不同个体的免疫系统对相同的过敏原可能会有不同的反应,因此很难对食物过敏做出普遍适用的定义。
现有诊断工具(如特异性IgE检测)可靠性有限,过敏原结构、加工方式及食物基质相互作用均影响致敏性。
引起个体过敏反应所需的最小量(阈值)也取决于个体的敏感性。大多数过敏性食物的阈值尚未确定,导致警示标签(如“可能含”)难以精准保护敏感人群。 需开发特异性强、灵敏度高的检测方法,并基于主要过敏食物(如牛奶)建立分级阈值标准——从鉴定关键过敏原及其表位入手,明确检测目标。
肠道菌群可能通过调节免疫耐受影响过敏风险。未来可探索菌群检测(如特定菌群丰度与过敏表型关联)作为辅助诊断工具,或通过益生菌等多种干预手段重塑菌群平衡,降低致敏性。
协同策略:
整合免疫学、微生物组学与食品加工技术,推动从“一刀切”警示转向动态风险评估,实现过敏防控的精准化与人性化。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Iweala OI, Nagler CR. The Microbiome and Food Allergy. Annu Rev Immunol. 2019 Apr 26;37:377-403.
Januszkiewicz, Emilia, et al. “The importance of the gut microbiome in the development of allergic diseases.” Alergologia Polska-Polish Journal of Allergology 10.3 (2023): 202-209.
Venter, Carina. “Immunonutrition: Diet diversity, gut microbiome and prevention of allergic diseases.” Allergy, Asthma & Immunology Research 15.5 (2023): 545.
Jiachen Liang, Baodong Zheng, Yi Zhang, Hongliang Zeng, Food allergy and gut microbiota, Trends in Food Science & Technology, Volume 140, 2023, 104141, ISSN 0924-2244
Farnetano M, Carucci L, Coppola S, Oglio F, Masino A, Cozzolino M, Nocerino R, Berni Canani R. Gut microbiome features in pediatric food allergy: a scoping review. Front Allergy. 2024 Sep 25;5:1438252.

谷禾健康
认识免疫疗法
免疫疗法是一种利用人体自身的免疫系统来对抗疾病的方法,尤其是在癌症治疗中,它通过激活或增强免疫系统来识别和攻击癌细胞。这一疗法的核心在于激发免疫系统对肿瘤细胞的特异性反应,从而达到治疗目的。
免疫疗法具有高度的选择性和靶向性,能够减少对正常细胞的伤害,降低传统化疗和放疗的副作用。免疫疗法的种类多样,包括单克隆抗体、免疫检查点抑制剂、肿瘤疫苗、过继细胞疗法等。
肠道微生物群与癌症治疗之间的关联已经成为癌症研究领域的热点。多项研究表明,肠道微生物群的组成和功能与癌症患者的免疫疗法反应性密切相关。肠道微生物群不仅在维持肠道健康中起着关键作用,而且在调节全身免疫反应、影响药物代谢和毒性反应中也扮演着重要角色。例如,某些特定的肠道细菌在调节免疫检查点抑制剂的疗效中起到关键作用,而抗生素的使用可能会干扰这一过程,影响治疗效果。
本文我们来了解肠道微生物组对 ICI (免疫检查点抑制剂) 疗效的影响,讨论了微生物组与先天和适应性免疫细胞相互作用以改善 ICI 反应的机制,微生物组衍生的代谢物和分子介导的抗肿瘤免疫反应对 ICI 的机制,同时也包括操纵肠道微生物组以提高 ICI 疗效的治疗策略和正在进行的临床试验。
•
首先了解下关于免疫疗法相关的一些关键知识和问题:
免疫疗法利用人体自身免疫系统对抗疾病主要通过以下几种方式:
免疫检查点抑制剂(ICI):
免疫检查点抑制剂通过阻断 PD-1 或 CTLA-4 等蛋白质,解除对免疫细胞的抑制,使免疫系统能够更有效地识别和攻击肿瘤细胞。
过继性细胞免疫治疗:
从患者体内提取免疫细胞(如 T 细胞),在体外进行基因修饰或培养扩增,使其具有更强的识别和攻击肿瘤细胞的能力,然后再回输到患者体内,发挥抗癌作用。
例如,CAR-T 细胞疗法就是通过对T细胞进行基因改造,使其表面表达能够特异性识别肿瘤抗原的嵌合抗原受体(CAR),从而增强对肿瘤细胞的杀伤能力。
肿瘤疫苗:
包括预防性疫苗(如预防某些病毒感染引起的癌症,如 HPV 疫苗预防宫颈癌)和治疗性疫苗。治疗性疫苗通过向患者体内引入肿瘤相关抗原,刺激免疫系统产生针对肿瘤细胞的特异性免疫反应。
单克隆抗体治疗:
利用人工制备的单克隆抗体特异性地结合肿瘤细胞表面的靶点,直接杀伤肿瘤细胞或通过标记引导免疫系统攻击肿瘤细胞。
总之,免疫疗法旨在激发、增强或调节人体自身的免疫系统,使其能够更有效地识别和消除异常细胞,从而达到治疗疾病的目的。
✦✧✦
免疫功能是一把双刃剑,过强或过弱都会危害人体健康,因此,需要对患者进行免疫功能的监测和评估。
人体免疫可以从三个层面进行探讨:
在免疫细胞中,淋巴细胞谱系与髓样细胞谱系,各占半壁江山,共同抵抗外界对人体的侵袭。
淋巴细胞是构成免疫系统的主要细胞类别,占外周血白细胞总数的 20%-45%,成年人体内约有 1012 个淋巴细胞。
淋巴细胞可分为许多表型与功能均不同的群体,如 T细胞、B细胞、NK细胞等,T 细胞和 B 细胞还可进一步分为若干亚群。淋巴细胞不同亚群的比例、数量以及功能会直接影响机体的免疫状态。
一,T淋巴细胞(简称T细胞)
起源于骨髓造血干细胞,在胸腺素及胸腺微环境影响下分化成熟为T细胞,故T细胞又称胸腺依赖性淋巴细胞。
T 细胞主要参与细胞免疫,表达CD3抗原,其中,T 细胞又包括辅助T细胞(Th)和细胞毒性T细胞(Tc),它们分别表达 CD4 和 CD8。
T淋巴细胞亚群的临床意义
它能反映机体当前的免疫功能、状态和平衡水平,并可以辅助诊断某些疾病,对分析发病机制,观察疗效及检测预后都有重要意义。
例如:CD4+/CD8+ 比值是指在血液中,CD4+ T细胞的数量与CD8+ T细胞数量的比率。这个比值对于评估免疫系统的健康状况非常重要。

CD4+/CD8+的其他临床应用场景
——器官移植
跟移植前相比,器官移植后CD4+/CD8+明显增加,则可能发生排斥反应。
——肿瘤病人
在肿瘤病人外周血中T淋巴细胞亚群数值都有异常,其特征是患者体内 CD3+细胞、CD4+细胞明显减少,而 CD8+细胞明显增加;CD4+/CD8+比值显著降低,说明肿瘤患者的细胞免疫功能处于免疫抑制状态,患者对识别和杀伤突变细胞的能力下降,形成了肿瘤的生长转移。
——再生障碍性贫血与粒细胞减少症
患者的外周血 CD4+细胞数减少,CD8+细胞数增多,CD4+/CD8+比值明显下降。
二、B/NK 淋巴细胞的临床意义
B 细胞主要参与体液免疫,表达 CD19 抗原;NK 细胞表达 CD16 和/或 CD56,在机体中不依赖抗原刺激自发地发挥细胞毒效应。淋巴细胞在免疫应答中起核心作用。
NK 细胞(CD3-CD16+和/或CD56+)能够介导对某些肿瘤细胞和病毒感染细胞的细胞毒性作用。
注:以上内容参考自 赛欧细胞
2007~2013 年
小鼠研究表明肠道菌群可以刺激抗肿瘤免疫反应。
2015年
两项临床前小鼠研究首次将肠道菌群与 ICI 反应联系起来。
2018 年
小鼠和人类研究表明,肠道菌群的组成和多样性可以预测对 ICI 免疫疗法的反应。将对 ICI 有反应的患者的粪菌移植到无菌或抗生素治疗的小鼠中,可以改善肿瘤控制并改善对 ICI 的反应。
2019~2020 年
前瞻性研究证实,非小细胞肺癌(NSCLC)、肝细胞癌 (HCC)、黑色素瘤、肾细胞癌 (RCC) 患者的肠道菌群与 ICI 结果之间存在显著相关性。
在非小细胞肺癌 (NSCLC) 和肾细胞癌 (RCC) 中,细菌多样性较高的患者对抗 PD-1 疗法更敏感。对ICI 无反应者进行 FMT 后口服补充Akkermansia muciniphila 可恢复抗 PD-1 治疗反应 。
在黑色素瘤患者中,肠道菌群的多样性和组成与抗 PD-1 治疗反应呈正相关。大多数情况下,对 ICI 有反应的患者肠道中粪杆菌和瘤胃球菌科的丰度较高,其外周CD4 + T 细胞和 CD8 + T 细胞数量增加。另一项针对转移性黑色素瘤患者研究表明,长双歧杆菌、产气柯林斯菌(Collinsella aerofaciens)、屎肠球菌(Enterococcus faecium)在有反应患者的基线粪便中更为丰富。
回顾性研究表明,抗生素与生存率下降和对 ICI 的反应减弱有关,支持抗生素引起的菌群失调与 ICI 疗效不佳之间存在因果关系。
2021 年
两项临床试验发现,ICI反应者的FMT联合抗PD-1疗法克服了黑色素瘤患者对 PD-1 阻断的耐药性。
肠道菌群和 ICI 疗效的时间表
doi:10.1186/s13045-022-01273-9
以上是肠道菌群对调节免疫检查点抑制剂(ICI)免疫治疗外,肠道菌群还可以影响细胞免疫转移(ACT)免疫治疗、CpG寡核苷酸(CpG-ODN)免疫疗法和基于细胞的免疫疗法。
ACT疗法
抗生素暴露降低了小鼠的ACT疗法疗效,而通过给予细菌脂多糖(LPS)来影响治疗效果,通过toll样受体4信号(TLR)传导恢复了治疗效果。另一项研究表明,肠道菌群通过增加CD8α+ DC的丰度和上调IL-1来维持ACT疗法的治疗效果。
注:过继性细胞转移(Adoptive Cell Transfer, ACT)疗法,是一种利用患者自身的免疫细胞进行癌症治疗的方法。它涉及从患者体内分离出T细胞,然后在体外进行改造,使其能够识别并攻击肿瘤细胞,最后再输回患者体内。包括TIL、TCR-T以及CAR-T等几种治疗方法。
CpG-ODN免疫疗法
在CpG-ODN免疫疗法中,肠道菌群激活TLR4,直接或间接启动肿瘤相关骨髓细胞对CpG-ODNs的TLR9依赖反应。CpG-ODN的有效性在无菌和暴露抗生素的小鼠中被削弱,影响了肿瘤坏死因子(TNF)和IL-12的产生。
注:CpG-ODN免疫疗法是一种利用CpG寡脱氧核苷酸(CpG ODN)来激活和调节免疫系统的治疗方法。它通过激活多种免疫细胞如自然杀伤细胞(NK细胞)、单核/巨噬细胞、树突状细胞(DC)、B细胞和T细胞等,来增强机体的免疫反应。
基于细胞的免疫疗法
肠道菌群介导的胆汁酸代谢增加了肝脏中CXCR6+自然杀伤T(NKT)细胞的丰度,并在肝细胞癌中发挥抗肿瘤作用。
总之,肠道菌群在调节免疫治疗方面发挥着重要作用,影响细胞免疫转移和各种免疫疗法效果,并通过不同机制影响治疗效果。这些研究揭示了肠道菌群对免疫疗法的关键影响,包括调节免疫细胞活性和相关信号通路,进而影响肿瘤治疗的效果。
★ 毛螺菌科(Lachnospiraceae)
不可切除肝细胞癌(HCC)患者在接受抗PD-1药物治疗后,有客观临床反应的患者的粪便样本中Lachnoclostridium富集,且与胆汁酸等特定细菌代谢物的高浓度相关。类似的现象也在对抗PD-1治疗有反应的黑色素瘤患者中观察到。Lachnospiraceae的某些菌株与改善无进展生存期(PFS)相关。
★ 瘤胃球菌科(Ruminococcaceae)
Ruminococcaceae家族的共生菌通过降低肠道通透性促进宿主健康,并在产生短链脂肪酸如乙酸和丙酸中起重要作用。
临床研究表明,瘤胃球菌属在多种癌症类型中与ICI治疗反应性正相关,但其对ICI毒性的潜在影响及通过SCFA直接影响ICI效果的证据有限。不同瘤胃球菌属对ICI治疗反应的影响各异,表明需要进一步研究以开发基于肠道菌群组成的治疗反应预测生物标志物。
★ 颤螺旋菌科(Oscillospiraceae)
Faecalibacterium与ICI反应性:观察研究表明,Oscillospiraceae特别是F. prausnitzii的丰度与黑色素瘤患者对ICI的反应正相关,并减少不良事件。
Faecalibacterium刺激Tregs增殖并释放抗炎细胞因子如IL-10和IL-33,有助于维持肠道内抗炎因子平衡。
Faecalibacterium可能通过诱导CTLA-4+ Tregs的扩增增强抗CTLA-4治疗的效果,并作为增强疗效的辅助剂。
Faecalibacterium衍生的效果与免疫细胞频率增加相关,可能增强抗PD-1治疗的疗效,但研究结果存在差异。
★ 乳酸杆菌科(Lactobacillaceae)
乳酸菌作为共生菌具有免疫调节特性,常用作益生菌,临床前研究表明其能增强小鼠对anti-CTLA-4的反应,可能作为ICI治疗成功与否的生物标志物。
乳酸菌增强免疫应答:乳酸菌与小鼠树突细胞共培养可促进细胞成熟,增强免疫反应,提高IFN-γ和Granzyme B的产生,增加肿瘤中的CD8+ T细胞浸润,减缓肿瘤生长。
乳酸菌与PD-1抑制剂的协同效应:乳酸菌ZW18和L. reuteri的补充可优化肠道菌群组成,增强抗PD-1治疗的效果,通过不同机制提高CD8+ T细胞的活性和肿瘤组织中的IFN-γ表达。
★ 拟杆菌门
系统性抗生素治疗可能破坏其与厚壁菌门的比例,拟杆菌门增多,引起肠道菌群失衡和抗肿瘤免疫的负面影响。
负面影响:研究发现,拟杆菌门的丰度与黑色素瘤患者对免疫治疗的反应率呈负相关,高水平拟杆菌属与较差的ICI治疗反应有关。
拟杆菌门的增多可能抑制外周细胞因子反应,并促进免疫抑制细胞如Tregs和骨髓源抑制细胞的频率,从而影响ICI治疗的效果。
正面影响:尽管拟杆菌门的整体丰度与不良的ICI治疗反应相关,但某些物种如B. caccae、B. fragilis、B. thetaiotaomicron在转移性黑色素瘤患者中可能具有免疫刺激效应。
尽管拟杆菌门的某些物种对宿主免疫系统有益,但整体丰度与ICI治疗效果呈负相关。特定拟杆菌属的加入可能通过促进效应免疫反应来增强ICI治疗的效果,但需要更多研究来验证这一点。
★ 疣微菌科(Akkermansiaceae)
积极作用:Akkermansia muciniphila是一种在人体和动物消化系统中丰富的菌种,能分解黏蛋白,其丰度在对anti-PD-1/PD-L1治疗有反应的多种癌症患者中较高,有助于增强免疫反应和提高治疗效果。
增强免疫应答:A. muciniphila通过刺激树突细胞释放IL-12,减少免疫抑制Tregs的招募,增强Th-1相关免疫反应,与无进展生存期(PFS)相关。
注:该菌能通过其细胞膜中的脂质二酰基磷脂酰乙醇胺调节TLR1-TLR2分子途径,并在宿主代谢调节中发挥关键作用。
尽管A. muciniphila通常与正面的临床结果相关,但一些研究显示其在肠道微生物群中的主导地位可能预示着对anti-PD-1阻断的反应较差。
作为预测生物标志物和治疗策略:A. muciniphila的积极效果使其成为预测ICI治疗反应的潜在生物标志物,其口服给药在临床前模型中能将无反应者转变为有反应者,但剂量是关键因素。
★ 红蝽菌科(Coriobacteriaceae)
研究发现,对anti-PD-1治疗有反应的黑色素瘤患者中C. aerofaciens的丰度更高,且带有响应者菌群(包括C. aerofaciens)的无菌小鼠显示出更强的T细胞激活,导致增强的anti-PD-1效果和减缓的肿瘤生长。
C. aerofaciens的增加不仅促进T细胞激活,还通过提高IL-17A和CXCL1及CXCL5趋化因子的产生来促进炎症环境,同时减少紧密连接蛋白的表达,增加肠道通透性,这些免疫调节效应提示C. aerofaciens对ICI活性的重要性需要进一步探索。
★ 双歧杆菌科(Bifidobacteriaceae)
多项研究表明,双歧杆菌科的存在与增强的免疫介导的肿瘤抑制和ICI治疗的疗效相关。双歧杆菌与多种癌症(包括肾细胞癌、结直肠癌、黑色素瘤、非小细胞肺癌和三阴性乳腺癌)中ICI治疗的有效性增强有关。
双歧杆菌通过改变树突细胞的功能、促进CD8+ T细胞浸润、增加干扰素-γ的产生等机制,提高抗肿瘤反应。
双歧杆菌产生的肌苷通过T细胞特异性腺苷2A受体A2AR信号传导增强抗肿瘤能力,双歧杆菌通过抗原交叉反应,使表达特定新抗原的肿瘤对T细胞介导的破坏更加敏感。
双歧杆菌的这些特性使其成为潜在的预测ICI治疗反应的生物标志物,并且其作为单一治疗或与ICI治疗结合的策略在临床前模型中显示出前景。
临床前和临床研究中不同细菌对 ICI 治疗效果的积极和消极影响
doi.org/10.1016/j.xcrm.2024.101487
细菌种群与ICI治疗结果之间的关联
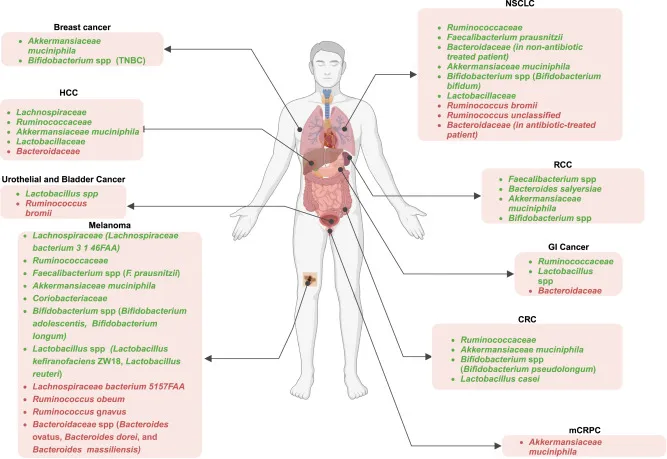
doi.org/10.1016/j.xcrm.2024.101487
注:癌症患者中绿色高亮细菌的存在或高丰度与不同癌症类型对ICI治疗的积极反应相关,而非应答患者中红色高亮细菌的流行率更高。
TNBC,三阴性乳腺癌;HCC,肝细胞癌;NSCLC,非小细胞肺癌;RCC,肾细胞癌;GI,胃肠道;CRC,结直肠癌;mCRPC,转移性去势抵抗性前列腺癌。
研究表明,肠道菌群调节 ICI 反应,有必要详细探索特定细菌种类和微生物代谢物对 ICI 的作用机制。
肠道菌群可调节先天性和适应性免疫,并影响 TME 中的抗肿瘤免疫反应。如下表,特定细菌种类在免疫背景下影响TME 以提高 ICI 疗效的复杂机制。

肠道菌群调节先天免疫、适应性免疫和肿瘤抗原,以改善 ICI 反应。
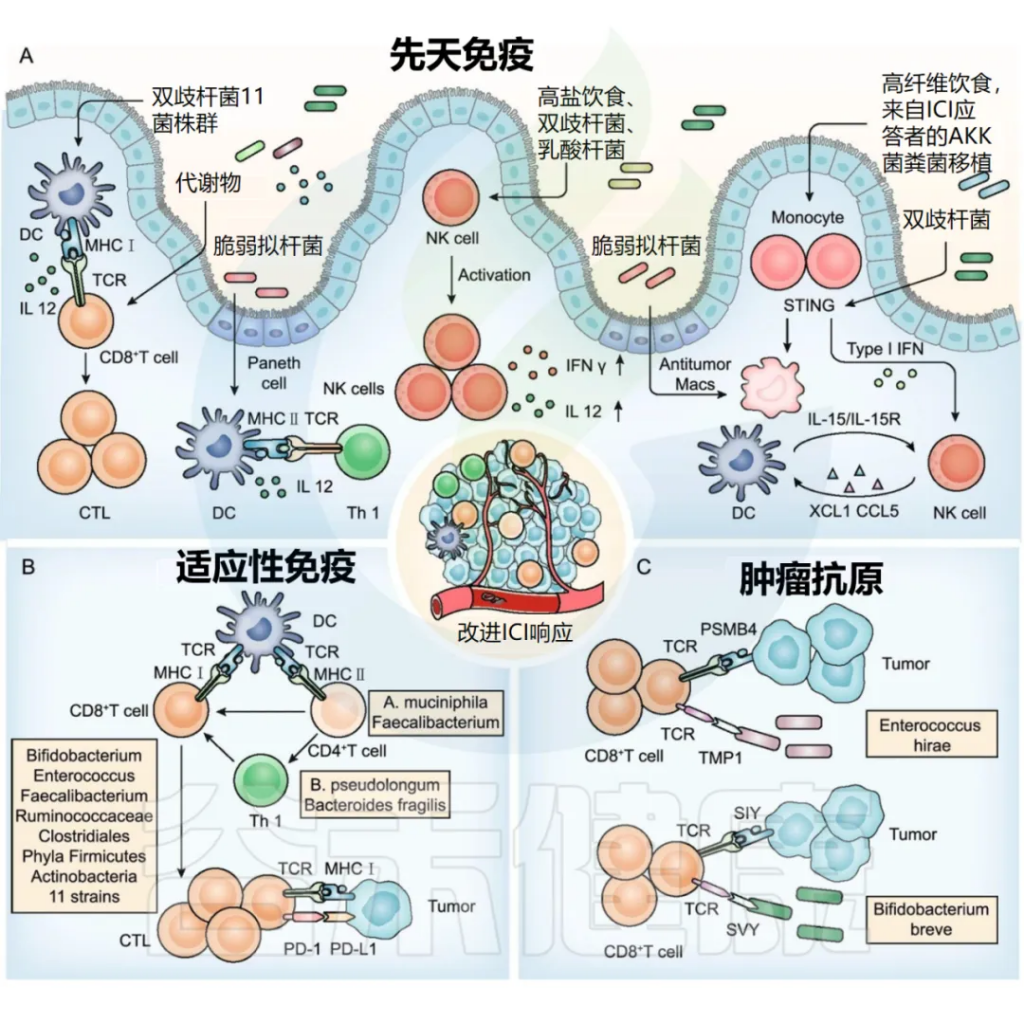
doi:10.1186/s13045-022-01273-9
■ 树突状细胞
双歧杆菌、十一种菌株及其代谢物和脆弱拟杆菌促进树突状细胞成熟或活化,随后活化 CD8 + T 细胞和 Th1 细胞。
树突状细胞 (DC) 是一组特殊的抗原呈递细胞,在 T 细胞活化和抗肿瘤免疫中起着至关重要的作用。肠道菌群抗原或含有免疫调节剂的代谢物可用于动员和激活树突状细胞 ,逆转未成熟树突状细胞诱导的免疫耐受。
例如,口服双歧杆菌可增加树突状细胞 (DC) 活化,进而支持改善肿瘤特异性CD8 + T细胞应答,并恢复抗 PD-L1 疗法在肠道菌群“不利”的小鼠中的治疗效果。
11 种菌株与 ICI 相结合,可强力诱导干扰素 (IFN) γ + CD8 + T 细胞,以依赖于固有层 cDC1 和主要组织相容性复合体 (MHC) I 类的方式抑制肿瘤生长。
脆弱拟杆菌通过触发树突状细胞成熟和刺激 IL-12 依赖性 Th1 细胞免疫反应,增强了 CTLA-4 阻断的抗肿瘤作用。
此外,万古霉素介导的肠道微生物组成调节通过增加 cDC1 和上调 IL-12,提高了抗肿瘤特异性效应 T 细胞的活性。
■ NK细胞
植物乳杆菌增加 NK 细胞活化;
高盐饮食增加肠道通透性和肿瘤内双歧杆菌的定位,并增强 NK 细胞活化以诱导抗肿瘤免疫。
NK 细胞可以调节TME 中的DC 和 CD8 + T 细胞丰度并影响对 ICI 的反应。越来越多的研究发现 NK 细胞和肠道菌群之间的相互作用。
注:NK 细胞也被称为自然杀伤细胞,是一类重要的淋巴细胞,主要起着免疫监视和细胞毒灭活的作用。这些细胞在体内寻找并摧毁受感染或变异的细胞,帮助维持身体的免疫功能。NK 细胞是免疫系统中的重要组成部分,对抗病毒感染和肿瘤细胞具有重要作用。
具有高微生物多样性的 NSCLC 患者在 PD – 1 阻断反应中具有更高丰度的独特记忆 CD8 + T 细胞和外周 NK 细胞亚群。
植物乳杆菌有效增加天然细胞毒受体(NCR)蛋白的表达并促进 NK 细胞活化以触发先天免疫。
次优剂量的 PD-1 阻断联合高盐饮食显著抑制了小鼠的肿瘤生长。
高盐饮食的双重作用
研究发现,高盐饮食会导致肠道通透性增加,以及双歧杆菌在肿瘤内部的定殖(即定居和繁殖)。这些变化会促进自然杀伤细胞(NK细胞)的活化,进而增强身体对肿瘤的免疫反应,从而发挥抗肿瘤作用。
由于高盐饮食与慢性炎症、心血管疾病和自身免疫性疾病有关,因此食用高盐饮食被认为是一种不健康的生活方式。免疫系统会转向促炎作用,然而,这种不良副作用被发现对肿瘤免疫有益。
高盐饮食增加了肠道的通透性,有利于双歧杆菌进入肿瘤部位,刺激自然杀伤细胞(NK细胞)并激活T细胞,导致肿瘤细胞的破坏并增加苯甲酸盐水平。肿瘤细胞通过程序性细胞死亡受体蛋白L1逃避破坏,L1与PD受体结合并使T细胞失活。
尽管抗PD-1疗法可以恢复T细胞功能,但由于某些肿瘤的PD-1分泌功能,它并非对所有肿瘤都有效。通过测量苯甲酸盐水平可以指导抗PD-1疗法的效果。高盐环境提供了一种避免肿瘤细胞检查点抑制的途径,通过干扰免疫介导的炎症,这可以通过调节盐水平被用作治疗方式。
总之,高盐饮食是一把双刃剑,但通过影响肠道微生物组和其他细菌产物,在肿瘤免疫中有希望的作用,需要进一步研究以揭示其潜在的好处。
■ 单核细胞/巨噬细胞
喂食高纤维饮食、用产生 cdAMP 的A. muciniphila单定植或从 ICI 反应者转移粪便菌群可触发单核细胞-IFN-I-NK 细胞-DC 级联;
双歧杆菌以 STING 信号和 IFN-I 依赖的方式促进基于 CD47 的免疫治疗;
脆弱拟杆菌诱导巨噬细胞表型极化为M1。
IFN-I (I型干扰素)和单核吞噬细胞水平的偏差导致免疫失调和免疫抑制性 TME。微生物诱导的 IFN-I 信号传导介导从先天免疫到适应性免疫的转变(上图)。
注:I型干扰素是一类干扰素,包括多种干扰素如IFN-α和IFN-β等,在免疫系统中起着重要的调节和抗病毒作用。
微生物衍生的干扰素基因刺激物 (STING) 激动剂(如 c-di-AMP)诱导肿瘤内单核细胞发出 IFN-I 信号传导,从而使单核吞噬细胞转向抗肿瘤巨噬细胞 (Macs) 并引发单核细胞-IFN-I-自然杀伤 (NK) 细胞-DC 串扰。
喂食高纤维饮食、用产生 cdAMP 的A. muciniphila进行单定植或从 ICI 应答者转移粪便微生物群可改善抗肿瘤反应和 ICI 疗效。
类似地,研究显示双歧杆菌优先定植于肿瘤部位,以 STING 信号和 IFN-I 依赖的方式促进基于 CD47 的免疫治疗。
脆弱拟杆菌诱导巨噬细胞表型极化为M1,并上调细胞中 CD80 和 CD86 的表达,促进先天免疫。
■ CD8 + T 细胞
双歧杆菌、肠球菌、粪杆菌、瘤胃球菌和梭菌目促进 CD8 + T 细胞浸润至肿瘤组织;
厚壁菌门和放线菌门可提高ICI 应答者外周血CD56 + CD8 + T 细胞的活化;
11 种菌株可增加体循环中效应 IFNγ + CD8 + T 细胞的比例。
多项研究已证实,特定肠道菌群可在体循环或 TME 中 诱导 CD8 + T 细胞(上图)。例如,具有相对丰富的有益菌群(包括梭菌目、瘤胃球菌科或粪杆菌)的黑色素瘤患者,其抗原呈递增加,外周血和 TME 中的效应 CD4 + T 细胞和 CD8 + T 细胞功能改善,从而改善了 ICI 的抗肿瘤功效。
临床试验的证据表明,厚壁菌门和放线菌门在 FMT 与 PD-1 阻断反应者联合治疗中富集。FMT 和 PD-1 阻断联合治疗可刺激外周血单核细胞 (PBMCs) 中的粘膜相关不变 T (MAIT) 细胞和 CD56 + CD8 + T 细胞,并上调肿瘤部位 CD8 + T 细胞上人类白细胞抗原 (HLA) II 类基因 CD74 和 GZMK 的表达。
同时,FMT 联合 PD-1 阻断治疗后,难治性转移性黑色素瘤中的肠球菌相对丰度增加,导致肿瘤内 CD8 + T 细胞浸润增加和肿瘤细胞坏死。
此外,双歧杆菌和 11 种菌株也可以增加依赖树突状细胞 (DC) 的 CD8 + T 细胞的丰度,以提高 ICI 治疗效果。
■ CD4 + T 细胞
B. pseudolongum和脆弱拟杆菌刺激 Th1 免疫反应;
A . muciniphila触发CCR9+CXCR3+CD4+T 淋巴细胞募集到瘤床;
粪杆菌可增加 CD4 + T 细胞比例。
在小鼠模型中,B. pseudolongum主要通过肠道微生物代谢物肌苷促进 Th1 转录分化和抗肿瘤免疫反应,从而提高 ICI 疗效。
脆弱拟杆菌通过促进固有层树突状细胞的动员来刺激 IL-12 依赖的 Th1 免疫反应,从而恢复对 ICI 的免疫反应。
FMT无反应小鼠口服补充A. muciniphila可通过触发 CCR9 + CXCR3 + CD4 + T 淋巴细胞募集到瘤床来恢复抗 PD-1 反应。
注:瘤床(Tumor Bed)是指在肿瘤手术切除后,原有肿瘤所在的部位,包括切除肿瘤组织后的创面以及周围组织。瘤床的特征和变化对于肿瘤的预后和治疗效果起着重要作用。
在人类患者中,粪杆菌增加了外周血中的 CD4 + T 细胞比例和血清 CD25 的产生,并降低了外周血中的 Treg 细胞比例,从而诱导了伊匹单抗的长期临床益处。
注:伊匹单抗(yervoy)是首个免疫检查点抑制剂,于2013月由FDA批准上市,用于治疗转移性黑色素瘤或无法手术切除的黑色素瘤。伊匹单抗是一种抗CTLA-4抗体。
CTLA-4表达于T细胞表面,是第一个用于临床研究的Chemicalbook抑制性受体靶点。CTLA-4在T细胞活化阶段发挥抑制功能:T细胞活化后,CTLA-4在T细胞表面上调表达,一方面与CD28竞争性结合共刺激分子B7,另一方面传导抑制性信号来终止细胞活化,CTLA-4在维持免疫系统内稳态中起至关重要的作用。
肠道菌群通过提供肿瘤交叉抗原来增强肿瘤细胞的免疫原性,从而改善 ICI 的疗效,包括抗原表位 TMP1 和抗原表位 SVY。
肿瘤免疫原性降低是肿瘤细胞抵抗T细胞杀伤的重要机制。
一方面,肠道菌群可以通过作用于肿瘤细胞表面的UBA6,直接增强肿瘤细胞的先天免疫原性,从而增强ICI反应。
另一方面,肠道菌群可以通过提供肿瘤交叉抗原来间接增加肿瘤细胞的免疫原性,从而促进ICI的疗效。已鉴定出肠道微生物表达的抗原与肿瘤细胞之间存在一些交叉反应性(上图C ) 。
Enterococcus hirae 基因组中的抗原表位尾长卷尺蛋白1(TMP1)与蛋白酶体亚基β4型(PSMB4)肿瘤抗原具有高度相似性。它们同时激活CD8 + T细胞,提高PD-1阻断疗法的疗效。
已证明共生菌短双歧杆菌表达的抗原表位SVYRYYGL(SVY)与肿瘤表达的抗原表位SIYRYYGL(SIY)相似,导致SVY特异性T细胞识别SIY并抑制肿瘤生长。
肠道微生物群及其代谢物对免疫疗法影响的机制
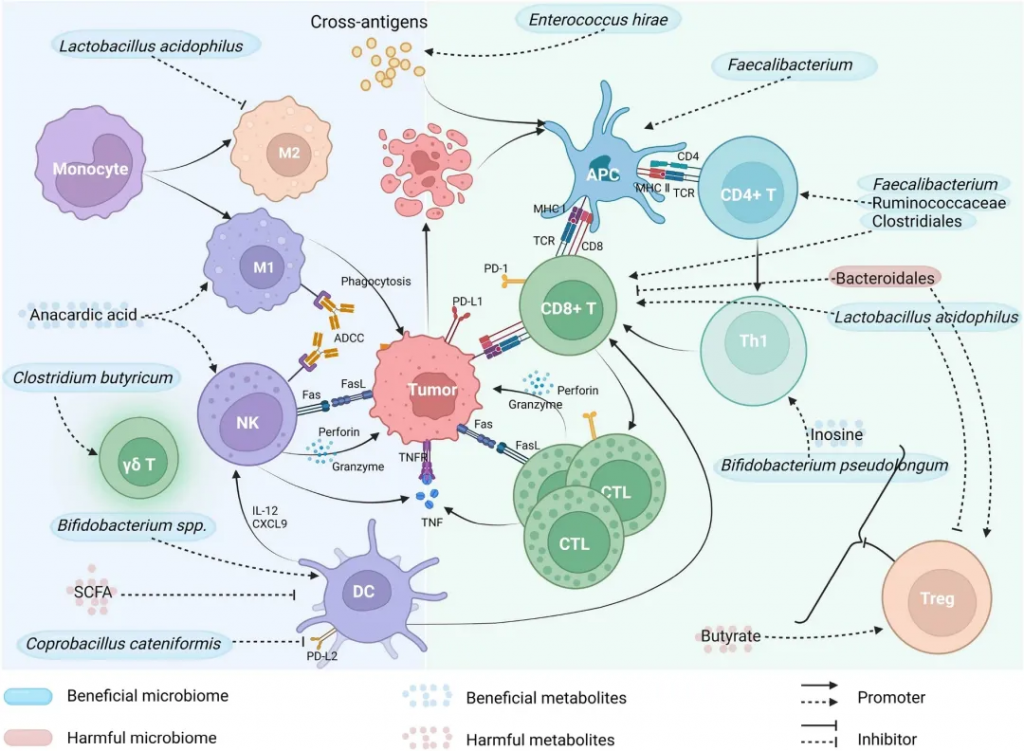
doi.org/10.1186/s40164-023-00442-x
肠道微生物群调节抗肿瘤免疫的主要方式之一是通过代谢物。肠道微生物群合成或转化大量代谢物,这些代谢物是可以从肠道中的原始位置扩散的小分子,影响局部和全身抗肿瘤免疫反应,从而促进 ICI 疗效。
这里进一步讨论不同肠道菌群代谢物的机制以及肠道菌群特征的其他特征介导抗肿瘤免疫反应。
肌苷是人体正常代谢产物,生理状态下参与核酸代谢、能量代谢和蛋白质合成,能激活免疫细胞、刺激新陈代谢。以往研究表明肌苷具有免疫抑制作用。而近年来更多研究发现肌苷可以重编程肿瘤微环境 (TME),改善ICI治疗的反应性。目前的研究表明,肌苷主要通过以下机制影响ICI疗效。
肠道微生物代谢物肌苷促进ICI疗效的潜在机制
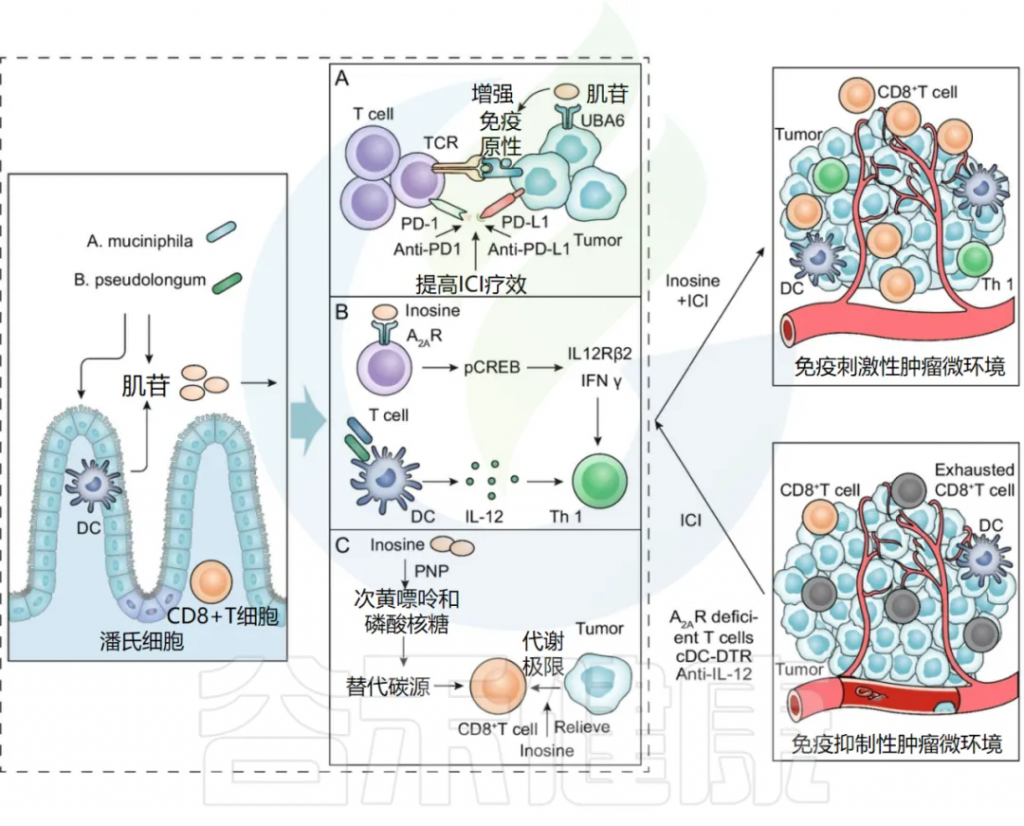
doi:10.1186/s13045-022-01273-9
肠道菌群A. muciniphila和B. pseudolongum的嘌呤代谢物肌苷,与ICI联合治疗可发挥协同抗肿瘤作用。
A) 肌苷增加肿瘤细胞的免疫原性
肌苷通过增强肿瘤抗原呈递和激活IFNγ及TNFα信号通路,提升肿瘤细胞的免疫原性,使免疫细胞更易识别并杀死肿瘤细胞。此外,肌苷还能通过抑制UBA6酶,增强T细胞介导的细胞毒作用,从而提高免疫检查点抑制剂(ICI)的疗效。
B) 肌苷促进免疫细胞活化
肌苷可能通过作用于肠癌、膀胱癌和黑色素瘤小鼠模型中T淋巴细胞上的A2AR,增强ICI疗效。它通过肌苷-A2AR-cAMP-PKA信号通路刺激cAMP反应元件结合蛋白(pCREB)的磷酸化,从而上调IL12Rβ2和IFNγ转录,促进Th1细胞分化和在TME中的聚集。
ICI 与肌苷联合使用的体内抗肿瘤作用需要共刺激物,例如 CpG 和 IL-12。肌苷还可以增强植物血凝素 (PHA) 介导的免疫反应,提高肿瘤抗原水平,并增强 T 淋巴细胞分化和增殖。此外,肌苷通过激活巨噬细胞刺激B淋巴细胞分化和抗体产生,发挥抗病毒和抗肿瘤作用。
C) 肌苷为CD8 + T细胞提供了替代碳源
肌苷可以在葡萄糖受限时作为CD8 + T细胞的替代碳源,缓解肿瘤细胞对CD8 + T细胞能量代谢的限制。
注:T 细胞通过嘌呤核苷磷酸化酶(PNP)将肌苷代谢为次黄嘌呤和磷酸化核糖。肌苷的核糖体亚基进入中央代谢途径,为糖酵解途径和戊糖磷酸途径(PPP)提供 ATP 和生物合成前体。
结肠厌氧菌从未消化和吸收的碳水化合物或肠道上皮细胞分泌的糖蛋白中产生短链脂肪酸 (SCFA)。
肠道微生物衍生的短链脂肪酸与实体瘤的纳武单抗或派姆单抗治疗之间的关联已得到证实。
注:纳武单抗OPDIVO(nivolumab)具有免疫检查点抑制活性和抗肿瘤活性,用于先前有过治疗的晚期鳞状NSCLC患者。
派姆单抗(Pembrolizumab),是一种人源化单克隆抗体,主要用于治疗多种实体瘤和淋巴瘤。
研究发现,短链脂肪酸是重要的物理和化学屏障,可刺激潘氏细胞和杯状细胞产生 AMP 和粘液,从而维持肠粘膜屏障的完整性。
短链脂肪酸在复杂的肠道微生物免疫和代谢网络中发挥关键作用,影响免疫细胞和肿瘤细胞的活性(下图)。
肠道菌群代谢物SCFAs增强ICI疗效的潜在机制
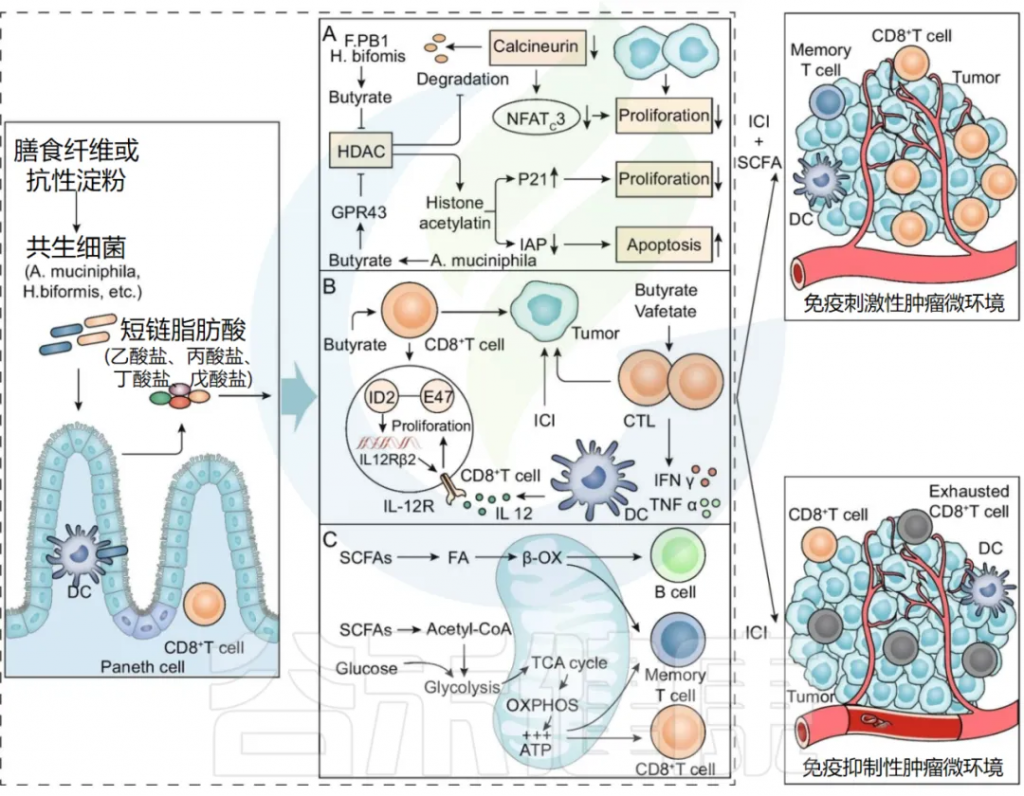
doi:10.1186/s13045-022-01273-9
A) SCFAs抑制癌细胞增殖并诱导癌细胞凋亡
Faecalibaculum rodentiumPB1和H. biformis的代谢产物SCFAs中的丁酸,可抑制HDAC的活性和钙调神经磷酸酶介导的NFATc3转录因子的激活,从而阻断肿瘤细胞的增殖。
A . muciniphila产生的丙酸通过GPR43激活细胞周期抑制剂p21并下调IAP抑制剂,从而抑制癌细胞增殖,诱导细胞凋亡,提高ICI的抗肿瘤作用。
B) SCFAs改善抗肿瘤免疫反应
丁酸可以通过IL-12信号诱导CD8+T细胞中ID2的表达,直接增强CD8 + T细胞的抗肿瘤细胞毒作用。
SCFA 中的戊酸和丁酸促进 IFNγ 和 TNFα 等效应分子的表达,增强 CTL 的抗肿瘤作用。
C) SCFA为免疫细胞提供能量
SCFA 通过调节糖酵解、TCA 循环和 β-氧化等代谢途径,为 B 细胞、记忆 T 细胞和效应 T 细胞提供能量,从而增强 ICI 疗效。
漆树酸能调节抗肿瘤免疫反应
在前瞻性研究中,对接受 ICI 治疗的黑色素瘤患者粪便细菌的代谢组学分析显示,Bacteroides caccae显著富集,ICI 反应组的漆树酸水平大幅升高(62 倍,P < 0.01)。
注:漆树酸是一类具有生物活性的有机化合物,主要存在于腰果壳液中(Cashew Nut Shell Liquid, CNSL),也可以在其他漆树科植物中找到。这类化合物以酚类结构为特征,并具有多种生物学和药理学活性,包括抗菌、抗病毒、抗氧化和抗炎作用。
漆树酸激活先天免疫
漆树酸通过磷酸化丝裂原活化蛋白激酶 (MAPK) 触发巨噬细胞中的经典活化途径,从而激活先天免疫。
漆树酸促进适应性免疫反应
漆树酸还能诱导中性粒细胞胞外陷阱( NET) 的产生,从而促进巨噬细胞、NK 细胞和 T 淋巴细胞产生肿瘤浸润免疫细胞,从而调节适应性免疫和抗肿瘤免疫。
临床前模型中,漆树酸的抗肿瘤作用
在乳腺癌模型中,漆树酸增加了肿瘤浸润的NK细胞和CTL的水平,并诱导了肿瘤细胞的凋亡(下图)。
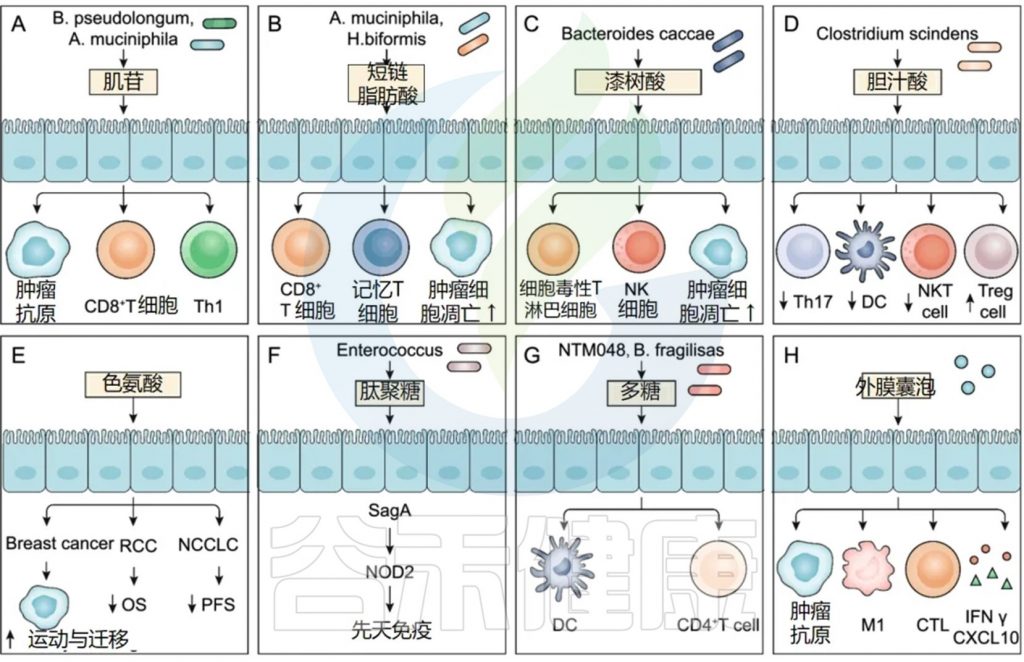
doi:10.1186/s13045-022-01273-9
一些研究显示,肠道菌群代谢物,如次级胆汁酸或色氨酸,具有免疫抑制作用(上图5D、E)。
例如,胆汁酸代谢物3-氧化石胆酸和丰富的肠道代谢物异石胆酸可以抑制Th17细胞的分化。
此外,次级胆汁酸3β-羟基脱氧胆酸在DCs中表现出较弱的免疫刺激特性,从而诱导Foxp3的表达,增加Tregs的数量,促进免疫逃逸。
喂食次级胆汁酸或胆汁酸代谢细菌Clostridium scindens能减弱NKT细胞介导的肝脏选择性肿瘤抑制。
IL-2通过激活STAT5-5-羟色氨酸(5-HTP)-AhR轴,诱导CD8+ T细胞的耗竭,并强烈表达色氨酸羟化酶1。
色氨酸代谢物有效促进乳腺癌肿瘤细胞的运动和迁移。
在接受纳武单抗治疗的黑色素瘤和肾细胞癌患者中,血清中犬尿氨酸/色氨酸比值的增加与总体生存率的降低有关。
非小细胞肺癌患者中,低血浆色氨酸代谢物-3-羟苯甲酸水平与延长的无进展生存期(PFS)显著相关。
肽聚糖(PG)和多糖(PSA)
肠球菌(Enterococcus)表达和分泌同源NlpC/p60 PG水解酶SagA,可以促进先天免疫传感蛋白NOD2的表达,并增强ICI抗肿瘤效力。此外,以NOD1依赖的方式识别源自微生物的PG可以促进系统性先天免疫。
Leuconostoc mesenteroides NTM048或脆弱拟杆菌产生的PSA作为免疫刺激剂,能够增强粘膜屏障并影响系统性免疫反应。PSA可被小肠中的DCs识别,并激活CD4+ T细胞分泌细胞因子,促进T细胞增殖,改善Th1/Th2细胞失衡,并促进淋巴组织形成功能。
TLRs(如TLR9及其激动剂CpG-ODN)在病原体识别和免疫反应启动中起着重要作用。艰难梭菌毒素A结合的DNA激活了TLR9信号和先天免疫反应。
外膜囊泡(OMV)
由细菌自然分泌的微生物来源外膜囊泡(OMVs)可以重新编程肿瘤微环境,并已被开发用于肿瘤免疫治疗剂、细菌疫苗、佐剂和药物递送载体。
OMVs表达肿瘤抗原,诱导先天免疫反应和抗原特异性T细胞介导的抗肿瘤免疫;生物工程改造的OMVs可表达多种肿瘤抗原,触发协同抗肿瘤免疫反应。
带有磷酸钙(CaP)外壳的OMVs能促进细胞毒性T细胞渗透和M2型巨噬细胞向M1型极化,有效改善免疫抑制性TME。此外,全身给药的细菌OMVs能特异性靶向并积聚在肿瘤床中,随后诱导产生抗肿瘤细胞因子CXCL10和IFN-γ,有效增强抗肿瘤免疫反应。
免疫检查点抑制剂(ICI)治疗在杀死肿瘤细胞的同时可能扰乱宿主的免疫平衡,导致免疫相关性结肠炎、肺炎,甚至危及生命的心肌炎。
多项研究表明,肠道微生物群在免疫相关不良事件(irAEs)中的作用是一把双刃剑。
一些肠道细菌的保护作用
小鼠模型验证了双歧杆菌、脆弱拟杆菌和伯克氏菌可在抗CTLA-4治疗的背景下改善肠道免疫病理学。
一项前瞻性研究显示,拟杆菌门的增加和参与多胺运输及维生素B生物合成的微生物基因途径与治疗转移性黑色素瘤患者ipilimumab造成的结肠炎的抵抗性有关。
注:Ipilimumab是一种单克隆抗体,主要用于治疗某些类型的癌症,如黑色素瘤、肾癌等。其作用机制是通过阻断细胞毒性T淋巴细胞抗原-4(CTLA-4),从而增强免疫系统对癌细胞的攻击能力。
另一些肠道菌群与ICI引起的高风险毒性有关
在接受抗PD-1治疗的黑色素瘤患者中,Lachnospiraceae 和Streptococcus 的富集与irAEs的增加有关。
肠道菌群的双重作用
有趣的是,不同的肠道微生物基线可能同时与良好的抗癌反应和ICI引起的毒性有关。在26名接受ipilimumab治疗的转移性黑色素瘤患者中,基线时富含Faecalibacterium和Firmicutes的患者易同时发生免疫治疗引起的结肠炎和增强的ICI敏感性,称为ICI背景下的疗效-毒性耦合效应。
肠道菌群作为预测生物标志物
肠道微生物如拟杆菌,也可用作预测接受联合CTLA-4和PD-1阻断治疗的晚期黑色素瘤患者ICI治疗毒性的生物标志物。
肠道菌群的重构与治疗毒性
通过重构肠道微生物组和增加结肠黏膜中Tregs比例,FMT这种治疗方式已在两例患者中显示出对免疫治疗引起毒性的有益效果。
这些研究表明,肠道微生物组对ICI引起的毒性具有复杂的正负作用。在充分筛选和操控肠道微生物组以增强ICI反应和减少irAEs之前,还需要更多证据。
了解肠道微生物群及其代谢物对抗肿瘤免疫和免疫治疗反应的生物机制,对于合理调控微生物活动以提高免疫检查点抑制剂(ICI)的疗效至关重要。下面介绍了结合肠道微生物群与ICI的治疗策略。
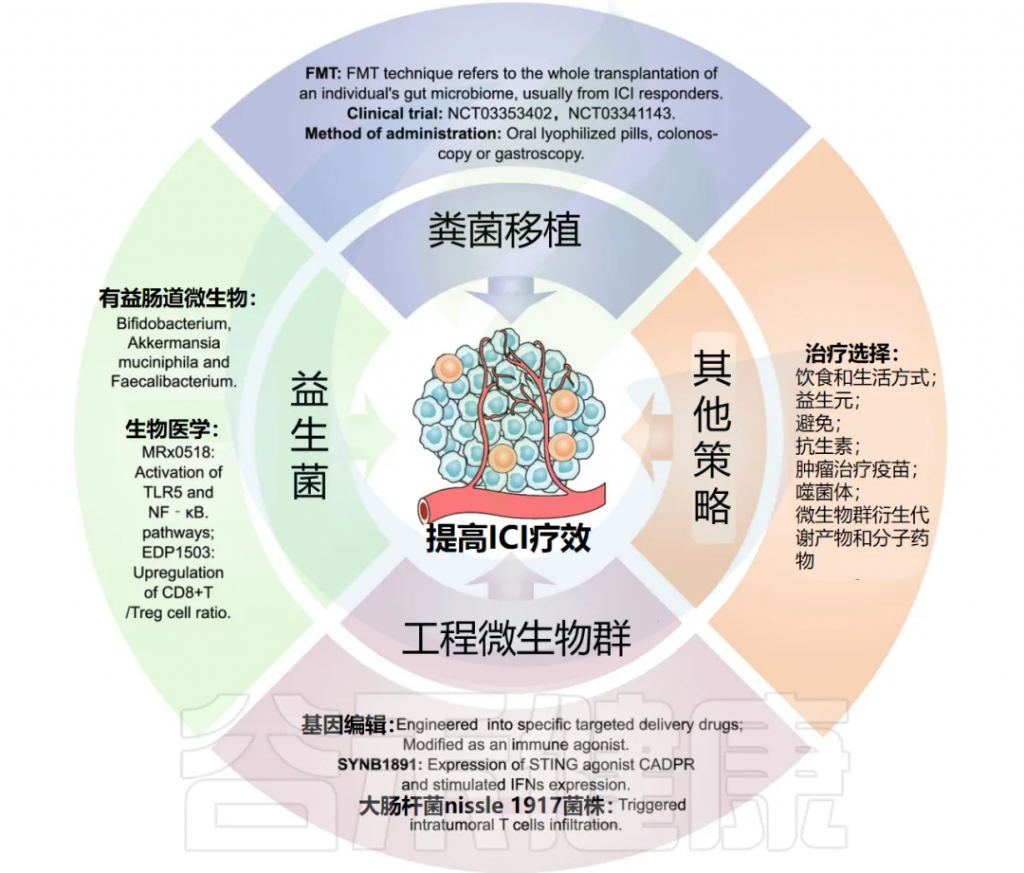
doi:10.1186/s13045-022-01273-9
粪菌移植(FMT)治疗指的是将个体的全部肠道微生物群进行移植,通常从ICI响应者中获取。
FMT制剂可以通过口服冻干胶囊或通过结肠镜或胃镜直接给药。FMT最初用于治疗对传统疗法耐药的艰难梭菌感染。
FMT增强抗肿瘤效果
近年来,多项研究表明,FMT可以增强ICI的抗肿瘤效果并克服对免疫治疗的耐药性。
FMT的应用是逆转ICI免疫治疗耐药性和减少irAEs的一种新方法。
FMT与ICI治疗结合的临床试验
目前,一些评估FMT与ICI治疗结合的安全性和有效性的临床试验正在进行中。
武汉大学人民医院肿瘤中心陈永顺教授团队与善泰健康合作的题为”Fecal microbiota transplantation plus tislelizumab and fruquintinib in refractory microsatellite stable metastatic colorectal cancer: an open-label, single-arm, phase II trial (RENMIN-215) “前瞻性临床研究结果在线发表于《eClinicalMedicine》上。
注:《eClinicalMedicine》是LANCET(柳叶刀)的高端金色子刊,医学类一区TOP期刊,影响因子15.1。

该研究对至少二线系统治疗失败的微卫星稳定型(MSS)晚期结直肠癌患者进行了创新性治疗。
从2021年5月10日至2022年1月17日,共纳入20名患者。中位随访时间为13.7个月。该方案耐受性良好,无因不良反应导致死亡。通过“三联疗法”(肠道菌群移植 + PD-1单抗 + 靶向药)有效延长难治型结直肠癌患者的生存期,粪便中双歧杆菌丰度较低、毛螺菌科丰度高和外周血中扩增的 TCR 可能是预后预测和风险分层的宝贵分类因素。
这一突破性的临床研究成果具有重要的科研价值和临床应用前景,同时也充分证明了善泰健康坚持采集山区儿童供体制备优质肠道菌群的价值。
一些评估FMT联合ICI治疗安全性和有效性的临床试验正在进行中(下表)。

doi:10.1186/s13045-022-01273-9
FMT治疗的安全性考量
尽管FMT治疗在接受ICI治疗的患者中显示出有前景的结果,但其长期安全性仍存在担忧。
2019年报道的两项独立临床试验中,两名患者在接受来自同一供体的FMT后,感染了产超广谱β-内酰胺酶(ESBL)的大肠杆菌,其中一名患者死亡。这一研究促使美国食品药品监督管理局发布安全公告,警告FMT治疗的感染风险。
一项对供体粪便中多药耐药生物进行检测的回顾性队列研究显示,在66名受试者中,有6人(9%)在任何时间点检测出多药耐药生物。
因此,应定期筛查供体粪便,以严格限制可能导致不良感染事件的生物的传播,这对于免疫缺陷患者尤为重要。进一步的临床研究,对于更好地理解供体FMT的来源、移植程序和受体表型,对于成功的ICI-FMT联合治疗至关重要。
益生菌是指“当以适当剂量给予时,对宿主健康有益的活微生物群”。早期针对癌症患者的临床试验主要评估益生菌如何改变微生物群组成或调节抗肿瘤免疫。
一项针对乳腺癌患者的临床试验评估了益生菌(13种有益菌株)对TME中CD8+ T细胞浸润的影响(NCT03358511)。
接受益生菌(乳双歧杆菌和嗜酸乳杆菌)治疗的CRC患者在肿瘤、黏膜和粪便中有更多的丁酸盐生成细菌(NCT03072641)。
另一项试验表明,接受益生菌治疗的患者结肠黏膜中的IL-1b、IL-10、IL-23A mRNA水平较低(NCT01895530)。
益生菌作为免疫佐剂的作用
特定肠道微生物,如双歧杆菌、Akkermansia、肠球菌、粪杆菌、Ruminococcaceae,在ICI免疫治疗中起着免疫佐剂的作用。
多项临床试验正在评估益生菌与ICI联合使用的安全性和有效性。例如,MRx0518(粪肠球菌胶囊)主要依靠自由鞭毛蛋白激活TLR5和NF-κB信号通路,发挥抗肿瘤作用。
EDP1503是一种基于双歧杆菌的癌症免疫治疗新佐剂。临床试验(NCT03775850)显示,EDP1503与帕姆单抗联合使用是安全且耐受良好的,生物标志物研究发现,EDP1503通过上调CD8+ T细胞/Treg细胞的比例发挥作用。
doi:10.1186/s13045-022-01273-9
随着细菌基因工程技术的发展,通过改造肠道微生物群或其代谢物来改善免疫检查点抑制剂(ICI)的抗肿瘤反应变得可行。与FMT相比,基因工程药物具有特异性。
基因工程细菌的临床前模型应用
目前,经过基因改造的营养缺陷型和可诱导性大肠杆菌、双歧杆菌、李斯特菌和沙门氏菌已被用于静脉内、肿瘤内和口服给药途径的临床前模型中,显示出抗肿瘤效果。
利用工程菌作为药物载体
利用多种菌株(包括沙门氏菌和梭菌)在固体肿瘤中的靶向特性,使它们成为递送和诱导免疫刺激剂、延缓肿瘤生长和转移的理想载体。
工程化细菌的临床试验进展
SYNB1891是一种基于大肠杆菌生物学设计的双重固有免疫激动剂,被改造后表达STING激动剂CADPR,可刺激IFNs表达并实现抗肿瘤效果。正在进行临床试验以探索SYNB1891联合阿替利珠单抗在晚期实体瘤中的安全性和有效性。
工程化益生菌增强T细胞活性
L-精氨酸通过调节T细胞代谢来增强T细胞存活和抗肿瘤活性。
工程化益生菌大肠杆菌Nissle 1917菌株在肿瘤部位定植,并持续将代谢产物氨转化为L-精氨酸。在小鼠中,该菌株的肿瘤内注射增加了细胞内L-精氨酸浓度,触发肿瘤内CD4+ T细胞和CD8+ T细胞浸润,并在与抗PD-L1联合使用时产生协同抗肿瘤效果。
这些结果表明,工程化微生物治疗能够通过代谢调控肿瘤微环境,以增强免疫治疗的疗效。
通过调控肠道微生物群来增强免疫检查点抑制剂(ICI)疗效的治疗策略还包括调整饮食和生活方式、摄取益生元和避免使用抗生素。
肿瘤治疗疫苗的开发
利用肿瘤交叉抗原和肠道微生物来源的免疫激活剂,开发新的肿瘤治疗疫苗,如Ty21a、JNJ-64041809、VXM01。这些疫苗的开发为增强ICI疗效提供了新的途径。
微生物衍生药物的应用
EO2401是一种结构上与肿瘤相关抗原相同的微生物衍生多肽药物,EO2401联合纳武利尤单抗的临床试验正在胶质母细胞瘤和肾上腺皮质癌患者中进行。
口服微生物群衍生化合物(如噬菌体和微生物代谢物)可能比完整或特定活菌移植更加实际和精确。噬菌体作为一种治疗策略,可以调节肠道微生物群、免疫系统和肿瘤微环境。
短链脂肪酸戊酸(VPA)是一种微生物来源的代谢物。评估VPA与ICI联合使用在实体瘤患者中安全性和有效性的临床试验已经在进行中。
菌群影响ICI疗效的准确性
肠道菌群对肿瘤ICI治疗的影响是多方面的,甚至是双向的。未来研究需要准确分类针对免疫细胞或通路的有利和不利的菌群特征,并充分了解它们在不同肿瘤微环境中的作用。
提高治疗策略的精准度
了解菌群-代谢物-免疫轴有助于直接操纵来自肠道菌群的特定免疫刺激代谢物或化合物,而不是整个或独特的活菌移植,以改善ICI反应。其他促进抗肿瘤免疫反应的菌群衍生分子的作用可能成为未来ICI临床前或临床研究的方向。
肠道菌群作为预测有效性的生物标志物
患者的菌群数据可以与其他已知的相关预测标志物(如PD-L1表达和肿瘤突变负荷)相结合,以预测免疫治疗的潜在疗效或不良事件。
提高临床试验的有效性
在人体临床试验中,需要全面监测影响肠道菌群的因素,如饮食、益生菌、抗生素、药物、心理健康、宿主免疫系统、宿主遗传学、地理因素、肿瘤类型和分期等。
整合微生物学、遗传学、免疫学、代谢组学、分子病理学和流行病学的多层次多维度研究设计将成为未来个性化癌症治疗的一部分。
通过这些策略和研究方向,我们可以更深入地理解肠道微生物群在抗肿瘤免疫治疗中的作用,并开发出更有效的治疗方案。
肠道微生物组与免疫调节
肠道微生物组与先天性和适应性免疫细胞发生相互作用,增强先天性免疫细胞的中间效应,增强适应性免疫细胞的抗肿瘤作用,增加肿瘤细胞的免疫原性,从而重新编程TME的免疫力并改善ICI反应。
微生物代谢物与ICI效率
微生物衍生的循环代谢物调节多种人体生理,并从其在肠道中的原始位置扩散,介导局部和全身抗肿瘤免疫反应,从而促进ICI效率。
肠道微生物组与ICI相结合的治疗策略
例如适当的抗生素选择、益生菌摄入、FMT和细菌基因工程,可能为肠道微生物组及其代谢物成为ICI的优良佐剂提供新的可能性。进一步了解ICI与肠道微生物组协同作用的机制并准确识别免疫刺激和免疫抑制菌株或途径,有望开发更有效的ICI联合治疗策略并推进精准医疗策略。
肠道微生物群在癌症治疗中的应用前景广阔
首先,肠道微生物群的特性有望用于早期检测和预后评估。通过分析患者的粪便样本,可以评估其肠道微生物群的组成,预测对特定免疫疗法的反应性,从而为临床医生提供个性化的治疗方案。
其次,肠道微生物群的调节可能成为提高治疗效果的策略。例如,通过益生菌/益生元的补充、饮食调整或粪便微生物群移植,可以优化肠道微生物群的组成,增强免疫系统的抗癌能力。
肠道微生物群在癌症治疗中的作用日益受到重视,其在预测治疗反应、优化治疗策略和开发新型抗癌药物方面具有巨大潜力。
未来的研究需要进一步深入探索肠道微生物群与癌症治疗之间的具体作用机制,以及如何在临床实践中有效利用这些发现,为癌症患者带来更好的治疗效果和生活质量。
附录:
免疫疗法的治疗效果如何评估?
免疫疗法的治疗效果可以通过以下多种方式进行评估:
肿瘤大小和数量的变化
通过影像学检查,如 CT、MRI 等,观察肿瘤的大小、数量以及是否有新的病灶出现。这是评估治疗效果的常见指标之一。如果肿瘤缩小或消失,通常表明治疗有效。
肿瘤标志物水平
某些肿瘤会产生特定的蛋白质或生物标志物,检测血液中这些标志物的水平变化可以辅助评估治疗效果。
症状改善
患者的症状,如疼痛、呼吸困难、乏力等的减轻或消失,也可以反映治疗的效果。
生存时间
包括无进展生存期(PFS),即从治疗开始到肿瘤出现进展或患者死亡的时间;总生存期(OS),即从治疗开始到患者死亡的时间。较长的 PFS 和 OS 通常表示治疗效果较好。
免疫细胞的活性和数量
通过检测血液中免疫细胞(如T细胞、NK细胞等)数量、活性和表型,了解免疫系统的状态,评估免疫疗法对免疫系统的激活和调节作用。
免疫相关指标
如细胞因子水平、免疫检查点分子的表达等,也可以作为评估免疫治疗效果的参考。
患者的生活质量
通过问卷调查等方式评估患者在身体功能、心理状态、社会功能等方面的生活质量改善情况。
需要注意的是,免疫疗法的效果评估可能较为复杂,有时可能会出现假性进展或延迟反应等特殊情况,需要综合多种评估指标和患者的具体情况进行判断。
免疫疗法可以用于哪些癌症的治疗?
免疫疗法目前已被广泛应用于多种癌症的治疗,以下是一些常见的例子:
随着研究的不断深入,免疫疗法的应用范围还在不断扩大,有望为更多癌症患者带来希望。
免疫疗法的治疗周期一般是多久?
免疫疗法的治疗周期并没有一个固定的标准,会因癌症类型、患者个体情况、治疗方案以及治疗反应等多种因素而有所不同。
一般来说,免疫治疗可能需要持续几个月到几年不等。
对于某些癌症,如黑色素瘤,可能需要进行几个月的初始治疗,然后根据治疗效果和患者的耐受性,决定是否继续维持治疗。维持治疗的周期可能会持续数月甚至数年。
在肺癌的治疗中,免疫治疗的周期也会因病情和治疗方案而异。有的患者可能需要持续治疗 2 年左右,而有些情况下可能会更长。
对于一些治疗效果显著且耐受性良好的患者,医生可能会建议长期使用免疫治疗药物以防止癌症复发。
需要注意的是,医生还会定期评估患者的病情、治疗效果和不良反应,从而调整治疗方案和治疗周期。
免疫疗法治疗效果和患者耐受性有哪些关系?
免疫疗法的治疗效果和患者的耐受性密切相关。
首先,患者对免疫治疗的耐受性好,能够按计划完成治疗疗程,这有助于药物充分发挥作用,从而提高治疗效果。如果患者因耐受性差而频繁中断治疗或减少药物剂量,可能无法达到理想的治疗浓度和作用时间,影响对肿瘤细胞的抑制和杀灭效果。
其次,耐受性不佳可能导致严重的不良反应,如严重的免疫相关炎症等。这些不良反应不仅会影响患者的生活质量,还可能需要使用大量的药物来控制,这些药物之间的相互作用有时会干扰免疫治疗药物的疗效。
另外,耐受性差可能使患者心理负担加重,产生焦虑、恐惧等不良情绪,影响患者的治疗依从性和信心,进而间接影响治疗效果。
相反,良好的耐受性能够让患者保持积极的心态,更好地配合治疗,有助于增强免疫系统的功能,提高免疫治疗的效果。
总之,患者对免疫疗法的耐受性在很大程度上影响着治疗效果,而治疗效果的好坏也会反过来影响患者的耐受性和治疗依从性。
免疫疗法的优势和劣势
免疫疗法与其他传统疗法(如手术、放疗、化疗)相比,具有以下优势和劣势:
优 势
长期效果:免疫疗法有可能产生持久的免疫记忆,一旦有效,其疗效可能持续较长时间,甚至实现长期的肿瘤控制或治愈。
全身性治疗:能够激发全身性的免疫反应,不仅可以作用于局部肿瘤病灶,还可以对转移灶发挥作用,减少肿瘤复发和转移的风险。
低毒性:相比化疗等方法,免疫治疗的全身性副作用通常较轻,对正常细胞的损伤相对较小,患者的生活质量相对较高。
适用范围广:对于一些晚期或转移性肿瘤,以及传统治疗方法无效的患者,免疫疗法仍可能有一定的效果。
当然,免疫疗法也可以与其他治疗方法(如化疗、放疗或靶向疗法)结合使用,从而增强治疗效果。
劣 势
起效较慢:免疫治疗发挥作用通常需要一定的时间,不像手术能迅速切除肿瘤,也不像化疗有时能较快地缩小肿瘤体积。
个体差异大:不同患者对免疫治疗的反应差异较大,部分患者可能疗效不佳。
价格昂贵:免疫治疗药物的研发和生产成本较高,导致治疗费用昂贵,给患者带来较大的经济负担。
潜在的免疫相关不良反应:虽然相对较轻,但仍可能出现免疫相关的炎症反应,如免疫性肺炎、免疫性肝炎、免疫性肠炎等,需要密切监测和及时处理。
预测疗效困难:目前还缺乏准确可靠的方法来预测哪些患者能够从免疫治疗中获益,导致治疗的选择存在一定的盲目性。
随着研究的不断深入和技术的进步,免疫疗法的优势有望进一步扩大,劣势也有望逐渐得到改善。在实际治疗中,医生会根据患者的具体情况,综合考虑各种疗法的特点,制定最适合的个体化治疗方案。
免疫疗法的适用人群有哪些?
免疫疗法的适用人群主要包括以下几类:
晚期癌症患者
对于一些晚期癌症,如晚期黑色素瘤、非小细胞肺癌、肾癌、膀胱癌等,在传统治疗方法效果不佳时,免疫疗法可能成为一种有效的治疗选择。
具有特定基因突变的患者
例如携带微卫星高度不稳定(MSI-H)或错配修复缺陷(dMMR)的实体瘤患者,往往对免疫治疗有较好的反应。
肿瘤突变负荷(TMB)高的患者
TMB 高通常意味着肿瘤产生了更多的新抗原,更容易被免疫系统识别,免疫治疗效果可能更好。
部分血液系统恶性肿瘤患者
如某些类型的淋巴瘤等。
一线治疗后复发或进展的患者
在其他治疗方案失败后,免疫疗法可能为他们提供新的治疗机会。
然而,并非所有癌症患者都适合免疫疗法。医生会综合考虑患者的身体状况、肿瘤类型、基因突变情况等多种因素,来判断患者是否适合接受免疫治疗。同时,在治疗过程中也会密切监测患者的反应和副作用,以便及时调整治疗方案。
哪些人群不适合免疫疗法?
以下人群可能不适合免疫疗法:
自身免疫性疾病控制不佳的患者
如患有严重的类风湿关节炎、系统性红斑狼疮等,免疫治疗可能会加重自身免疫反应,导致病情恶化。
器官功能严重障碍的患者
例如存在严重的心肺功能不全、肝肾功能衰竭等,可能无法耐受免疫治疗带来的潜在副作用。
处于急性感染期的患者
身体正在对抗严重的感染,此时进行免疫治疗可能会进一步影响免疫系统的平衡,加重感染或影响治疗效果。
怀孕或哺乳期妇女
免疫治疗可能对胎儿或婴儿产生潜在的不良影响。
对免疫治疗药物成分过敏的患者
这会引发严重的过敏反应,危及生命。
患有精神疾病或无法配合治疗和随访的患者
免疫治疗需要患者密切配合治疗和定期随访,以监测疗效和不良反应。
对于每个患者是否适合免疫疗法,需要医生根据患者的具体情况进行综合评估和判断。
免疫疗法有哪些不良反应?
免疫疗法的副作用是一个重要的问题,因为它们可能会影响患者的生活质量和治疗效果。
免疫疗法的副作用包括疲劳、发热、恶心、呕吐、腹泻、皮疹、瘙痒、呼吸困难、头痛、肌肉疼痛、关节疼痛等。需要对这些副作用进行评估和管理。
免疫疗法可能会引起多种不良反应,免疫疗法的副作用可以分为两类:
与免疫疗法直接相关的副作用包括免疫相关不良事件(irAE)和免疫检查点抑制剂相关不良事件(ICI-AE)。
皮肤反应:如皮疹、瘙痒、白癜风等。
胃肠道反应:如腹泻、结肠炎、恶心、呕吐等。
内分泌系统紊乱:可能导致甲状腺功能异常(甲状腺功能减退或亢进)、垂体炎、肾上腺功能不全等。
肝脏毒性:表现为转氨酶升高、肝炎等。
肺部问题:如肺炎、咳嗽、呼吸困难等。
心血管系统不良反应:如心肌炎、心包炎、心律失常等,严重情况下可能危及生命。
关节和肌肉疼痛:可能出现关节炎、肌痛等症状。
神经系统症状:头痛、头晕、外周神经病变等。
这些不良反应的发生机制主要与免疫系统被过度激活,攻击自身正常组织和器官有关。不过,并非每个接受免疫治疗的患者都会出现不良反应,且不良反应的严重程度因人而异。在治疗过程中,医生会密切监测患者的身体状况,以便及时发现和处理这些问题。
免疫疗法在治疗周期内需要注意什么?
在免疫疗法的治疗周期内,需要注意以下几个方面:
饮食方面:保持均衡的饮食,摄入富含蛋白质、维生素和矿物质的食物,以增强身体的抵抗力。避免食用过多油腻、辛辣和刺激性食物。
作息规律:保证充足的睡眠,规律作息,避免过度劳累,有助于维持免疫系统的正常功能。
按时复查:按照医生的要求定期进行血常规、肝肾功能、肿瘤标志物等检查,以及影像学检查(如 CT、MRI 等),以便及时监测治疗效果和发现可能出现的不良反应。
关注身体变化:留意自身的身体状况,如是否出现发热、咳嗽、皮疹、腹泻、关节疼痛等异常症状。若有不适,及时告知医生。
用药管理:严格按照医嘱用药,不可自行增减药量或停药。
心理调节:保持积极乐观的心态,避免过度焦虑和紧张,可以通过适当的运动、与家人朋友交流等方式缓解心理压力。
避免感染:注意个人卫生,勤洗手,避免去人员密集、容易感染的场所。
运动适度:根据自身身体状况,进行适量的运动,如散步、瑜伽等,但避免剧烈运动和过度劳累。
告知医生其他用药:如果在治疗期间需要使用其他药物,包括保健品、中草药等,应提前告知医生,以防药物相互作用影响免疫治疗效果或增加不良反应风险。
主要参考文献
Zhao W, Lei J, Ke S, Chen Y, Xiao J, Tang Z, Wang L, Ren Y, Alnaggar M, Qiu H, Shi W, Yin L, Chen Y. Fecal microbiota transplantation plus tislelizumab and fruquintinib in refractory microsatellite stable metastatic colorectal cancer: an open-label, single-arm, phase II trial (RENMIN-215). EClinicalMedicine. 2023 Nov 14;66:102315.
Yousefi Y, Baines KJ, Maleki Vareki S. Microbiome bacterial influencers of host immunity and response to immunotherapy. Cell Rep Med. 2024 Apr 16;5(4):101487.
Lu Y, Yuan X, Wang M, He Z, Li H, Wang J, Li Q. Gut microbiota influence immunotherapy responses: mechanisms and therapeutic strategies. J Hematol Oncol. 2022 Apr 29;15(1):47.
Balan Y, Sundaramurthy R, Gaur A, Varatharajan S, Raj GM. Impact of high-salt diet in health and diseases and its role in pursuit of cancer immunotherapy by modulating gut microbiome. J Family Med Prim Care. 2024 May;13(5):1628-1635.
Kang X, Lau HC, Yu J. Modulating gut microbiome in cancer immunotherapy: Harnessing microbes to enhance treatment efficacy. Cell Rep Med. 2024 Apr 16;5(4):101478.
Zhang, M., Liu, J. & Xia, Q. Role of gut microbiome in cancer immunotherapy: from predictive biomarker to therapeutic target. Exp Hematol Oncol 12, 84 (2023).
谷禾健康
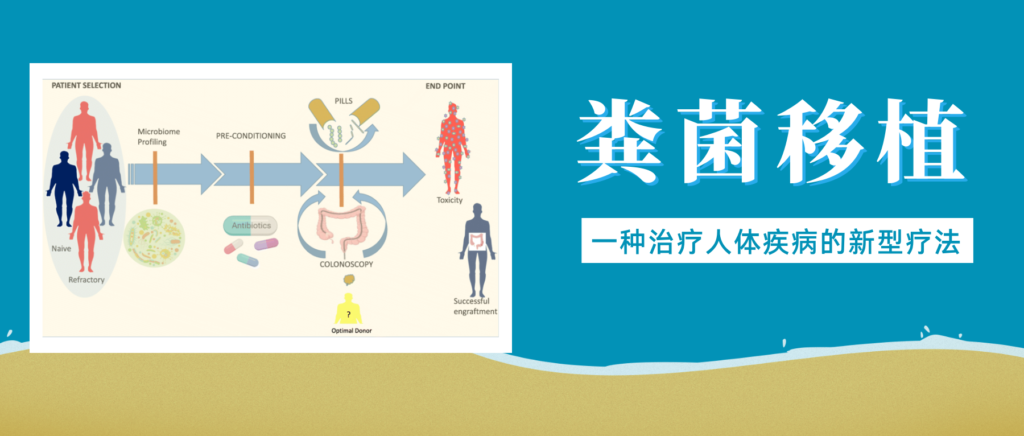
粪菌移植是一项近年来备受关注的医疗技术,它涉及将健康捐赠者的粪便物质转移至患有疾病或障碍患者的胃肠道。

简单来说就是选择健康合适的人粪便,通过科学方法提取出有用的微生物,去除有害与无用的部分,然后制成制剂,给病人口服或者直接注入肠道,目的是恢复健康的肠道微生物群并改善整体健康状况。
粪菌移植的历史悠久
粪菌移植在传统中医中已有数百年的应用,粪菌移植的第一个记录可以追溯到四世纪的中国,当时人类粪便被称为黄汤,用于治疗严重腹泻的患者。
15到16世纪的中国明朝,有关于将新鲜或发酵的粪便悬浮液用于治疗腹泻、便秘和腹痛等胃肠道疾病的记载。
但直到20世纪50年代晚期,它才首次用于现代医学,以治疗由抗生素耐药菌引起的严重腹泻。
在20世纪80年代和90年代,粪菌移植主要用于治疗反复发作的艰难梭菌感染。然而,随着肠道微生物群的发现及其在健康和疾病中的作用,粪菌移植开始被探索作为治疗其他疾病的潜在方法,包括炎症性肠病、肠易激综合征甚至神经系统疾病等。

粪菌移植在未来拥有巨大前景
近年来,粪菌移植受到医学界和公众越来越多的关注,许多临床试验和研究正在进行,以评估其疗效和安全性。
粪菌移植的疗效已经在多种肠道疾病中得到证实,如艰难梭菌感染、肠炎、炎症性肠病等。粪菌移植的出现,为肠道微生物失调带来了新的治疗思路和方法,也为人类健康提供了新的希望。
随着我们对肠道微生物群研究的不断发展,粪菌移植很可能成为治疗其他疾病越来越重要的工具。谷禾在本文中将为大家介绍粪菌移植。
粪便微生物群移植 (粪菌移植) 是一种医疗程序,涉及将粪便从健康供体转移到受体的胃肠道中。已发现粪菌移植可有效治疗各种胃肠道疾病,包括艰难梭菌感染、炎症性肠病和肠易激综合征。
来自大量临床试验的数据表明,粪菌移植也可能对许多其他疾病具有治疗潜力,从胃肠道到肝脏疾病,神经系统疾病、自身免疫性疾病、皮肤疾病、心血管疾病、脑部疾病、肥胖和代谢综合征。
根据这些相关研究,谷禾带大家了解粪菌移植在治疗人体疾病中的作用。
人类疾病中的粪菌移植
Biazzo M,et al.J Clin Med.2022
▼
粪菌移植主要用于治疗反复发作的艰难梭菌感染(CDI),这是一种细菌感染,会引起严重的腹泻和结肠炎症。
√粪菌移植对治疗艰难梭菌感染特别有效
研究表明,粪菌移植在治疗复发性艰难梭菌感染方面特别有效,已发现粪菌移植在治疗艰难梭菌感染方面的成功率超过90%,而且几乎没有副作用。
▼
粪菌移植已被证明是治疗多种胃肠道疾病的有效方法,包括炎症性肠病(IBD)、肠易激综合征(IBS)。
炎症性肠病是一种复杂的炎症和慢性疾病,其特征是免疫失调,最终导致消化道免疫介导的损伤,包括溃疡性结肠炎(UC)和克罗恩病(CD)。肠道微生物群失调被认为是炎症性肠病发展中的关键调节事件,因此粪菌移植代表了一种可能的治疗策略。
√缓解溃疡性结肠炎患者症状
最近一项随机对照试验的荟萃分析发现,粪菌移植可有效诱导溃疡性结肠炎患者症状缓解,缓解率为36%,而对照组仅为9%。对核糖体 16S RNA 的分析表明,粪菌移植后微生物多样性增加并持续存在。
对活动期溃疡性结肠炎的儿科患者(4至17岁)进行了随机临床试验。粪菌移植组中92%的患者在第6周实现了小儿溃疡性结肠炎活动指数的改善(与安慰剂组的50%相比)。
√短期内改善了克罗恩病患者症状
评估了25名患有腹腔内炎症性肿块的克罗恩病患者使用多种新鲜粪菌移植(初始粪菌移植随后每三个月重复粪菌移植)的疗效和安全性。
超过一半的患者在第一次粪菌移植后三个月表现出临床反应的缓解,这一比例在12个月和18个月时有所下降。
注:这表明尽管粪菌移植在短期内缓解了临床症状,但未能产生持久的临床效果。
√对肠易激综合征有积极影响
六项不同的临床试验发现粪菌移植对肠易激综合征症状有积极影响:
(1) 在一项只有10名患者入组的小型临床试验中,在粪菌移植后4周,6 名患者有所改善;有趣的是,作者发现报告改善的患者接受了来自双歧杆菌含量高于无效供体的粪菌移植,这表明富含双歧杆菌的粪便供体可能是粪菌移植成功的预测因素。
(2)观察到65%的患者在通过结肠镜检查接受粪菌移植治疗三个月后症状缓解以及粪菌移植之后微生物特征向供体特征的转变,包括增加的α和β多样性。
(3)报告了腹泻型肠易激综合征患者的症状和生活质量的改善,这些患者通过胃镜接受新鲜粪便,并且(在连续分析中)增加了短链脂肪酸。
(4)报告显示,在接受来自健康供体(同种异体移植)或来自他们自己(自体移植)的粪便材料的患者中,肠易激综合征症状出现短暂改善;接受同种异体移植的患者抑郁评分有所下降。
(5)使用仅从一名健康、特征良好的供体获得的粪便样本通过胃镜粪菌移植治疗肠易激综合征患者,发现了疲劳和生活质量的改善以及细菌微生物群概况的变化、粪便短链脂肪酸的变化。
(6)在最近的一项临床试验中,招募了难治性肠易激综合征患者,主要是腹胀,并通过鼻空肠给药接受一次粪菌移植治疗;粪菌移植一年后,56%的患者报告肠易激综合征症状和生活质量有所改善。
▼
复发性肝性脑病是肝硬化的并发症(与饮酒无关),由肝功能衰竭和肠-肝-脑轴受损引起,可导致意识障碍和昏迷 。
√粪菌移植改善肝性脑病患者认知和微生态失调
粪菌移植最近被研究为一种可能的新治疗工具。第一项试验描述,通过灌肠递送的单一粪菌移植在短期内减少了肝性脑病患者的住院时间,改善了他们的认知和微生态失调。
粪菌移植治疗后一年内,与对照组相比,降低了住院率并改善了认知功能。
√粪菌移植展现出肝病的治疗潜力
广泛的研究支持粪菌移植作为一种控制肝病的疗法。粪菌移植改善了高脂肪饮食引起的肝损伤和脂质代谢,同时增加了小鼠肠道微生物群的多样性。来自对酒精性肝病有抵抗力的供体小鼠的粪菌移植可以预防酒精性肝损伤。
此外,粪菌移植已经用于慢性肝病患者。最近一项针对严重酒精性肝炎患者的初步研究表明,粪菌移植与存活率提高和腹水消退有关。
▼
多项研究探索了粪菌移植在治疗神经系统疾病方面的潜在益处,例如帕金森病、多发性硬化症和自闭症谱系障碍。
√改善帕金森病患者症状
发表在《神经病学》杂志上的一项研究发现,粪菌移植改善了帕金森病患者的症状,如便秘和睡眠障碍。
在帕金森病小鼠模型中,来自正常小鼠的粪菌移植可以减少黑质的病理特征并减轻身体损伤。
√改善多发性硬化症患者症状
发表在《神经炎症杂志》上的另一项研究发现,粪菌移植改善了多发性硬化症患者的症状,例如疲劳和抑郁。
√影响抑郁症、阿尔兹海默症状态
此外,来自重度抑郁症患者的粪菌移植在正常小鼠中诱导了抑郁症的行为/生理特征。
最后,在阿尔茨海默病小鼠模型中,源自正常对照小鼠的粪菌移植改善了认知功能。
▼
除神经系统疾病外,粪菌移植在治疗其他非胃肠道疾病(如肥胖、糖尿病和代谢综合征)方面也显示出前景。
√改善代谢综合征患者胰岛素敏感性
几项临床试验研究了粪菌移植对代谢综合征患者的的影响,显示出改善:报告说,患有代谢综合征的男性参与者接受了来自健康人群的肠道微生物群输注六周后胰岛素敏感性增加。
研究人员概括了关于胰岛素抵抗增加的发现,并补充说它取决于粪菌移植后肠道微生物群的变化。
最后,与移植正常供体粪便的受试者相比,使用代谢综合征供体粪便移植肥胖和胰岛素抵抗的男性受试者时,胰岛素敏感性降低,从而显示代谢综合征中胰岛素敏感性和微生物群之间的因果关系。
发表在《胃肠病学》杂志上的一项研究也发现,粪菌移植改善了代谢综合征患者的胰岛素敏感性。
注:代谢综合征是糖尿病的前兆。
除了这些已经确定的应用,粪菌移植还有一些新兴的用途。例如,粪菌移植被探索作为治疗肥胖和2型糖尿病的潜在方法。
▼
在过去的几年中,肠道微生物群在致癌过程中的作用已得到越来越多的认可。肠道微生物失调和个别细菌可以通过激活致瘤途径、诱发炎症和破坏宿主DNA来诱发癌症或影响癌症进程。
细菌影响癌症的具体机制
几种细菌拥有或产生促进β-连环蛋白与E-钙粘蛋白分离的蛋白质,激活参与癌发生的β-连环蛋白信号通路。
肠道生态失调导致细菌衍生的短链脂肪酸的产生减少。肠道生态失调通过Toll 样受体 (TLR) 的微生物相关分子模式发挥促炎作用,增加细胞产生促炎因子,从而增加致癌作用。
除了诱发炎症外,许多细菌还能够通过释放特定代谢物来破坏DNA,从而促进癌症进展。
β-连环蛋白(β-catenin)是一种细胞骨架蛋白,主要位于细胞膜,在乳腺上皮中,β-catenin游离量较少,通过介导与E-cadherin的相互作用,将细胞外黏附因子与细胞质内细胞骨架相互连接,以保持质膜的完整性,并参与细胞的黏附、迁徙与转移等过程。
β-catenin异常表达时脱离细胞间连接进入细胞质或细胞核,将失去介导细胞间链接、黏附的功能,并引起某些癌基因的表达,导致细胞癌变、转移。
β-catenin还是介导Wnt信号传导的关键分子,其在细胞核中决定着Wnt信号通路的开放或关闭,通过调节基因表达过程,在乳腺发育以及肿瘤发生的调控中起到了重要的作用。
细胞膜中β-catenin的丢失以及细胞质、细胞核中β-catenin的高表达都可以经过不同的调节途径独立发生,诱导乳腺癌的发生,并影响乳腺癌的预后。
E-钙粘蛋白(E-cadherin)是钙黏蛋白家族成员,在上皮细胞中连接细胞骨架与细胞外环境,参与细胞信号传导。在正常乳腺组织中,E-cadherin在肌上皮中呈颗粒状膜阳性,在腺上皮细胞中呈细胞膜强阳性,是区分DCIS和小叶原位癌的标志物;E-cadherin几乎在所有的DCIS细胞上呈线状膜染色,而小叶原位癌的细胞膜大多不表达E-cadherin。
令人惊讶的是,特定的微生物群物种具有调节癌症治疗的功效,显著影响癌症患者的临床预后。
√粪菌移植有助于治疗黑色素瘤
黑色素瘤是一种皮肤癌,涉及产生黑色素的黑色素细胞。最近,新工具利用免疫检查点抑制剂来增强患者对肿瘤的免疫反应(这种治疗方法称为“癌症免疫疗法”),并且有趣地发现肠道微生物组调节这种反应。
注:谷禾前面的文章中也有讲过癌症免疫疗法。
在两个具有不同肠道微生物组成的小鼠中,黑色素瘤的生长及其对抗程序性死亡配体1(PD-L1)免疫疗法的反应显著不同。
如果将来自对抗PD-1治疗有积极反应的黑色素瘤患者的粪便样本移植到无菌小鼠体内,则PD-1阻断的抗肿瘤作用会得到改善。
粪菌移植似乎有望通过转移有利的肠道微生物群来增强黑色素瘤患者的抗肿瘤免疫力。
通过粪便微生物群移植治疗癌症
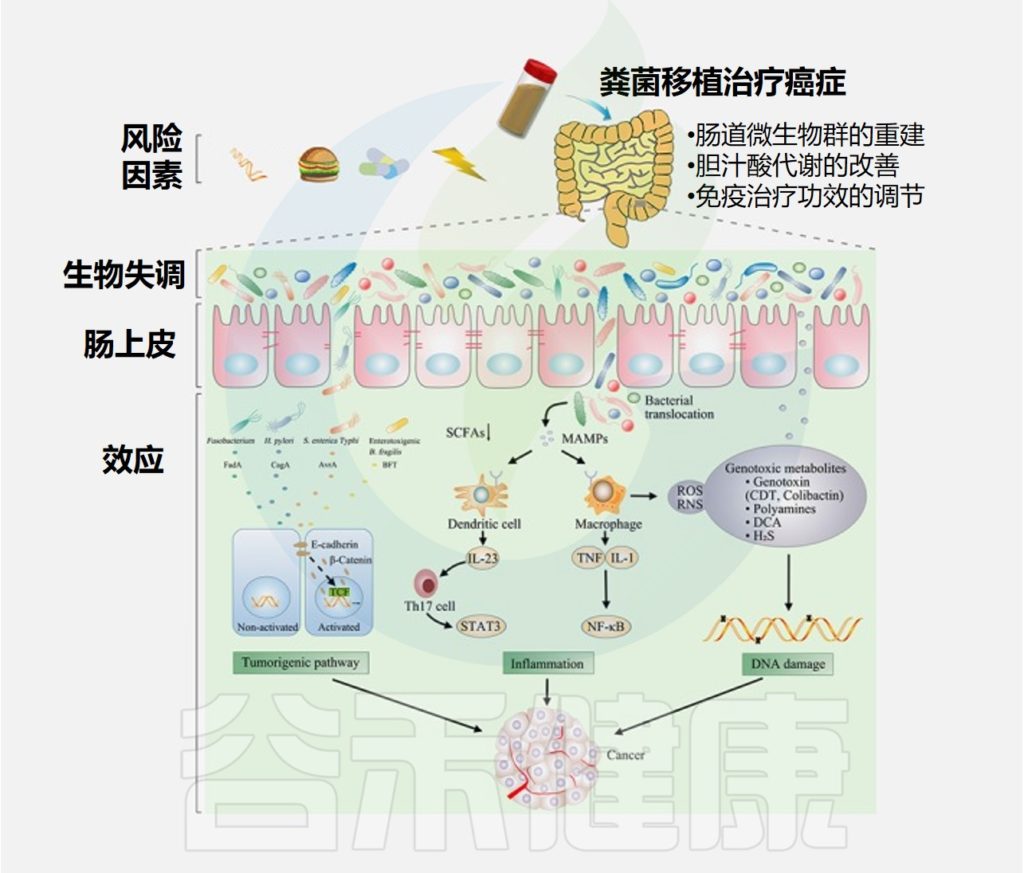
Chen D,et al.Int J Cancer.2019
▼
根据最近的研究,粪菌移植可能是治疗各种皮肤病症(包括湿疹和牛皮癣)的潜在治疗选择。人体肠道微生物群在免疫调节中起着至关重要的作用,肠道微生物群的改变与各种皮肤病有关。
一些案例报告了湿疹和牛皮癣患者经粪菌移植后成功治疗。
√改善了牛皮癣患者的严重程度
在研究皮肤病学杂志上发表的一项研究中,研究人员发现粪菌移植改善了四分之三的牛皮癣患者的严重程度。
√湿疹症状有了显著改善
此外,发表在美国皮肤病学会杂志上的一项研究报告说,粪菌移植使三分之二的患者的湿疹症状有了显著改善。
总之,粪菌移植显示出作为治疗湿疹等皮肤病的巨大潜力。同样重要的是要注意粪菌移植具有潜在的风险,包括感染和不良反应。
需要更多的研究来确定粪菌移植治疗皮肤病的最佳频率和剂量。因此,在考虑将其作为皮肤病的治疗选择之前,必须彻底评估粪菌移植的潜在益处和风险。
▼
关于微生物群和粪菌移植干预在心血管疾病中的作用,只有有限的证据可用,而且大多是在动物模型中获得的。
√菌群影响房颤的易感性
最近提出了老年人肠道菌群失调在房颤发病机制中的因果作用。研究表明,将患有心房颤动的老年大鼠粪菌移植移植到年轻大鼠体内会导致更高水平的脂多糖和更高的疾病易感性。
√菌群移植改善了心肌损伤
仍然在动物模型中,实验性自身免疫性心肌炎(EAM)小鼠模型中对照小鼠的粪菌移植增加了微生物的丰富度,包括厚壁菌门/拟杆菌门的比例增加,并且由于炎症减轻而改善了心肌损伤。
尽管科学文献中很少有证据表明粪菌移植策略在心血管疾病中有治疗价值,但在动物模型和人类中获得的这些数据肯定会为进一步研究提供坚实的基础。
本章小结
未来,粪菌移植也可能用于治疗自身免疫性疾病,如类风湿性关节炎和红斑狼疮,以及精神健康状况,如抑郁症和焦虑症。
值得注意的是,这些新兴应用仍处于研究的早期阶段,需要进一步的研究来确定它们的疗效和安全性。
总的来说,目前粪菌移植主要用于治疗反复发作的艰难梭菌感染和一部分胃肠道疾病,但它在治疗其他疾病和障碍方面具有巨大的潜力,正在进行研究探索其在各个医学领域的潜在应用。
▼
移植所需的粪菌来自经过严格筛查的供体,供体捐赠样本后,用一套全自动化的机器进行分离,经过注水、搅拌、过滤、离心、沉淀等步骤,得到纯化的细菌。
粪便菌群移植过程示意图
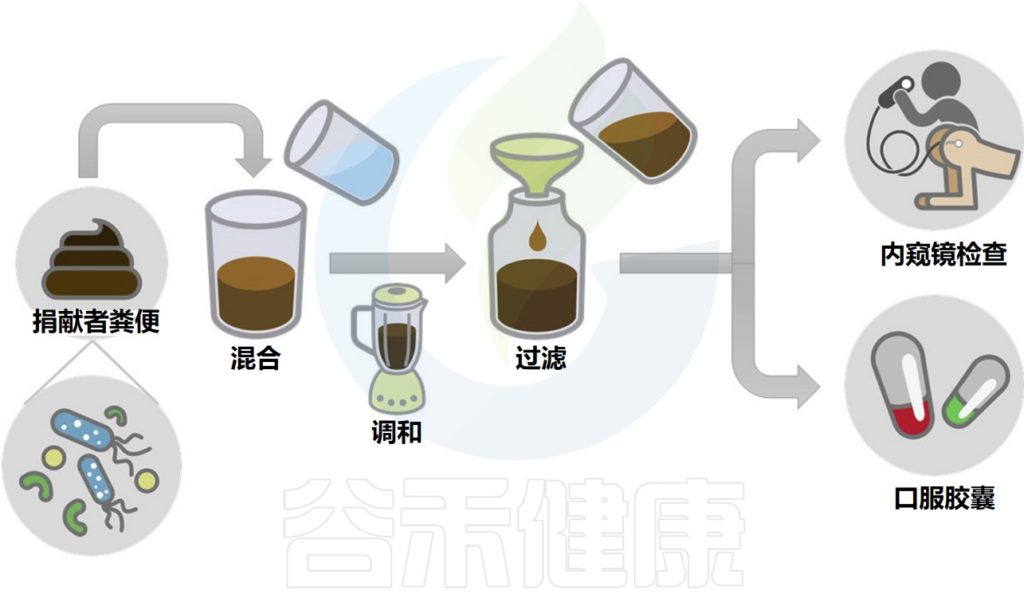
Wang JW,et al.J Formos Med Assoc.2019
其中单单过滤的步骤就要重复数次,每一道过滤用的滤网孔径都比前一道滤网的孔径更小,最后一道滤网的孔径只有0.07毫米,基本上可以把所有的杂质去除,只剩下细菌这些微生物。
分离出来的粪菌再用生理盐水制成混悬液供移植使用。
▼
“移植”过程不是简单粗暴的将一个人的粪便直接注入患者的肠道,主要是将健康供体的粪便离心纯化,获得功能菌,然后通过上消化道、中消化道和下消化道转移至受体肠道。从而重建稳定的肠道微生态环境,缓解相关症状,治疗疾病。
★ 粪菌移植的途径与治疗目的有相关性
例如,想要治疗溃疡性结肠炎可以采取经结肠镜灌肠。要治疗慢性乙型肝炎,则是经上消化道,可以采取:经麻醉胃镜、普通胃镜、经鼻饲管,或者用粪菌胶囊,经典方式是通过麻醉胃镜。
粪便微生物群移植的方法
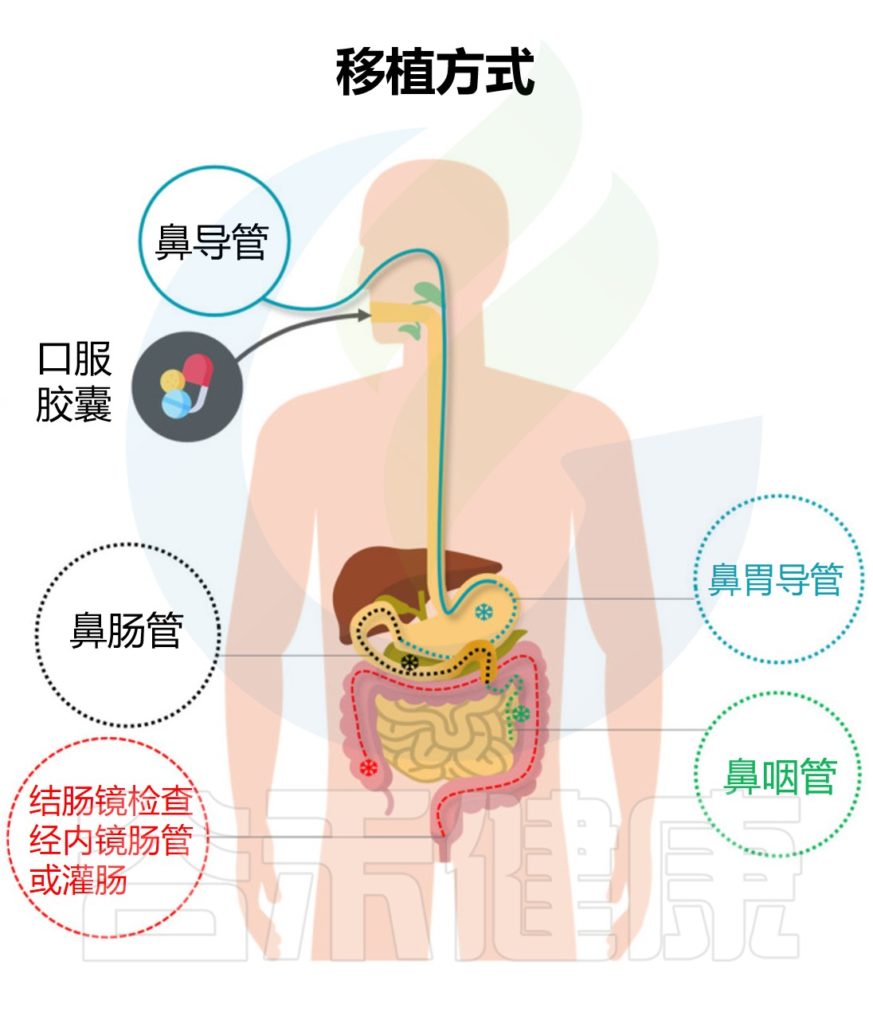
Biazzo M,et al.J Clin Med.2022
不同的粪菌移植方式具有各自的优缺点,下面谷禾具体来讲述经不同部位消化道进行粪菌移植的特点。
▸ 上消化道
操作简单,总体风险较低
上消化道途径中,口服给药和鼻胃管应用广泛,操作简单,总体风险较低。但在此过程中,可能会因菌液反流或吸出而导致窒息,如果机体本身存在梗阻,则移植的菌液可能无法准确到达肠道。
其中,口服途径主要指包封粪菌材料,通过将提取的粪菌与冷冻保护剂(主要是甘油)混合制备,然后进行多重包装以保护粪菌移植材料免受胃肠道环境的影响。同时,操作人员可以根据预期的释放位置进一步选择胶囊壳的材料。目前,市售的胶囊壳通常针对胃或结肠的释放,并被配制以确保细菌的存活率和定植。
降低潜在疾病传播的概率
此外,在制作胶囊的过程中,也可以去除无症状供体中可能存在的真菌、寄生虫、病毒和部分炎症介质,以降低潜在的疾病传播概率。
总的来说,通过上消化道途径的粪菌移植具有无需昂贵器械、重复使用对患者损伤小、患者耐受性好等优点。该途径适用于不能耐受鼻肠管和胃镜移植的患者,以及需要口服定制菌的患者。
▸ 中消化道
减少移植时的细菌位移
中消化道途径主要是指鼻肠移植和经内镜肠道植管术,能够实现全肠道给药。其中鼻肠管通过导丝拉伸拉直,在胃肠蠕动正常的情况下自动通过幽门,进一步减少粪菌移植时的细菌移位。
在一项随机对照试验中报道,通过鼻肠管的粪菌移植优于单独使用万古霉素治疗艰难梭菌感染,但粪菌移植组患者也出现了腹泻、痉挛和便秘等不良事件。
什么是经内镜肠道植管术?
经内镜肠道植管术(TET)具体指的是在内镜下辅助植入固定管并固定在肠道深处,同时外端沿肠道与外部相通。TET主要包括结肠途径介导的TET和中胃肠道途径介导TET。
结肠通路介导的TET需要应用结肠镜检查,并且使用这种途径进行重复粪菌移植是昂贵的。相比之下,中胃肠道途径介导的TET更方便,更容易维持。
由于中胃肠道介导的TET不需要在内镜手术后通过X射线或其他医疗仪器进一步确认肠道位置,对于无法进行结肠镜检查肠道准备的患者,或需要重复粪菌移植的患者,中胃肠道中介导的经内镜肠道植管术也是主要选择。
▸下消化道
下消化道通路主要指灌肠、结肠镜检查、结肠通路介导的经内镜肠道植管术等操作。
灌肠侵入性较小且相对简单
其中,灌肠是一种侵入性较小且相对简单的操作。灌肠法患者耐受性好,不需要昂贵的器械,有效降低了手术风险。但这种方法需要将输注的粪悬液保留较长时间,患者保持仰卧位以减少粪便排泄,同时反复灌肠易于被患者接受。
注意:粪菌移植的细菌是否可以通过灌肠的方式保留在肠段的命题尚不明确,而且这种方式也伴随着无法到达结肠和脾曲的风险,需要多次灌注才能获得疗效和更长的手术时间,以弥补肠道菌群保留率低的缺陷。同时,由于细菌液的滞留,这种方法可能不适用于肛门括约肌松弛或尿失禁的患者。
此外,在结肠镜检查和结肠通路介导的经内镜肠道植管术方面,它具有多种优势,主要包括:
(1)能够完整显示结肠和活检可疑组织的情况,有利于疾病的诊断、识别和分期;
(2) 允许操作人员直接评估肠道炎症,并在适当的部位注入足量的供体粪便细菌;
(3) 可将肠道菌群准确移植到受影响的肠段,并进一步将细菌保留在目标肠段;
(4)可以准确地输入足量的供体粪便菌,可以在一定程度上提高治疗效率。
然而,这些手术也伴随着部分不良事件,包括加重肠道反应。
粪菌移植的主要操作方式及优缺点


Zhang YW,et al.J Bone Miner Metab.2022
▼
粪菌移植的安全性主要与两方面因素有关,即供体的生物安全性、移植的操作安全性。
•供体的生物安全性
供体不仅要筛查排除乙肝、丙肝、梅毒、艾滋病、这些已知传染病,还要排除寄生虫、条件致病菌感染,甚至连饮食习惯、排便习惯、情绪状态、肿瘤家族史都要进行调查,不符合要求的都要排除。
供体的筛查可以说是“百里挑一”,要成为一个合格的供体是非常困难的。所有这些筛查工作都是为了保证供体的生物安全性。
•移植的操作安全性
移植的操作安全性主要与移植的方式有关。经胃镜、结肠镜的移植操作风险与常规胃镜、结肠镜检查的风险基本一致。
注:在后面的章节我们会详细讲述粪菌移植操作的具体要求。

为了评估粪菌移植的安全性,上海同济粪菌移植工作组主任等研究人员对8547名采用过粪菌移植的患者进行跟踪研究,得出以下结论:
1、回顾性分析数据表明,粪菌移植的短期和长期(从2周到5年)安全性都是比较好的,患者不要担心;
2、短期不良事件与粪菌移植给药方法有关,多为轻中度、较短暂,包括恶心、呕吐、腹泻等,只有42名(0.5%左右,很低比例)患者发生胃肠症状恶化;
3、长期随访期间的新发疾病主要是胃肠道和呼吸道疾病,发病率与一般人群无异;
4、 随访期间无粪菌移植相关感染传播事件,11例死亡与粪菌移植无关;
5、通过规范适应症和给药时机后,短期安全性和患者满意度升高。
所以,粪菌移植还是比较安全的。
粪菌移植已被证明是治疗多种胃肠道疾病的有效方法,然而,粪菌移植的潜在长期影响以及粪菌移植的最佳频率和剂量仍未得到很好的了解。
本章节旨在回顾有关粪菌移植潜在长期影响的现有文献,并为未来的研究和临床实践提供建议。
▼
虽然粪菌移植已被证明在短期内有效,但对粪菌移植长期影响的研究有限,粪菌移植对肠道微生物组和整体健康的长期影响仍不清楚。
✦可能导致抗生素抗性基因的转移
粪菌移植是一种医疗程序,它将健康捐赠者粪便中的微生物移植到受体的肠道中,以恢复或改善肠道微生物平衡。虽然粪菌移植已被证明在治疗某些疾病方面非常有效,但它的使用也存在一定争议。
一些研究表明,粪菌移植可能会产生意想不到的后果,例如抗生素抗性基因的转移或致病菌的引入。
✦病毒或其他感染因子可能通过粪菌移植传播
此外,人们还担心病毒或其他感染因子可能通过粪菌移植传播。需要更多的研究来充分了解粪菌移植的长期影响,并制定安全有效地使用该程序的指南。
▼
✦粪菌移植的监管
粪菌移植的监管因国家而异,一些国家如美国对其使用采取更为严格的方法。在美国,粪菌移植被美国食品药品监督管理局作为生物制品进行监管,只批准用于治疗未对其他治疗方法产生反应的复发性艰难梭菌感染。
在欧洲,粪菌移植通常被视为医疗程序,并由国家卫生部门进行监管。
✦粪菌移植的伦理问题
粪菌移植的伦理考虑包括知情同意、捐赠者选择以及对捐赠者和受体的潜在风险。捐赠者必须接受广泛的筛查,以确保他们健康且没有传染病,并且必须同意他们的粪便用于粪菌移植。
受体也必须提供知情同意,并且必须完全了解该程序的潜在风险和好处。粪菌移植的主要争议之一是该程序缺乏标准化。目前没有粪菌移植的标准化方案,粪便成分在捐赠者之间可能会有很大的差异。
▼
✦粪菌移植的剂量会影响其疗效
目前,粪菌移植的最佳频率和剂量仍不确定。一些研究表明,粪菌移植的剂量可能会影响其疗效,但目前还没有确定最佳剂量的标准。
✦一般需要多次粪菌移植
关于粪菌移植的频次,目前尚无明确的建议。一些研究表明,单次粪菌移植可能无法完全恢复肠道微生物群的平衡,需要多次粪菌移植才能达到最佳疗效。
单次粪菌移植可以有效治疗某些疾病,如复发性艰难梭菌感染。然而,对于其他疾病,可能需要多次粪菌移植才能获得最佳效果。
但是,多次粪菌移植也可能增加感染和其他不良反应的风险。因此,粪菌移植的频次应根据患者的具体情况和病情进行个体化的决策。
总之,粪菌移植的最佳频次和剂量应根据患者的具体情况和病情进行个体化的决策,同时应注意监测和预防不良反应的发生。
需要更多的研究来确定粪菌移植的最佳频率和剂量,以便在临床实践中更好地使用该程序。
根据《上海市菌群移植技术管理规范(2021年版)》,以下是部分粪菌移植操作要求:
▼
(一)严格遵守粪菌移植治疗操作规范和诊疗指南,严格掌握粪菌移植治疗适应证和禁忌证。
▷粪菌移植适用于治疗以下消化系统疾病
(1)艰难梭状芽胞杆菌感染:复发性/难治性艰难梭状芽胞杆菌感染。
(2)其他消化系统疾病:溃疡性结肠炎、克罗恩病、功能性便秘、肠易激综合征、菌群紊乱相关腹泻等。
▷粪菌移植治疗的其他疾病
(1)神经系统疾病:帕金森病、阿尔兹海默症、癫痫等。
(2)精神疾病:自闭症、情绪障碍、多动症、抽动症等。
(3)代谢相关疾病:代谢综合征、糖尿病等。
(4)肿瘤相关疾病:免疫治疗及放化疗所致肠炎等。
(二)除复发性/难治性艰难梭状芽胞杆菌感染外,出于其他治疗目的使用粪菌移植治疗均须以临床研究形式开展,并通过本机构伦理审查与备案。
(三)实施粪菌移植治疗前应当向患者及其家属告知治疗目的、风险、注意事项及可能发生的并发症等,并签署知情同意书。
(四)医疗机构应当建立完整的电子化临床数据库及严格的术后随访制度,在完成每例粪菌移植治疗后应当按照有关规定将治疗相关信息上报卫生健康行政部门。
▼
(1)有明确与肠道菌群紊乱有关的肠道内疾病,如肠功能障碍性疾病、肠道感染性疾病(复发性艰难梭菌感染)、肠道炎症性疾病及假性和麻痹性肠梗阻等;
(2)有明确与肠道疾病或者肠道菌群紊乱有关的肠道外疾病,如便秘合并帕金森病、便秘或腹泻合并自闭症、便秘或腹泻合并过敏性皮炎;
(3)患者需充分理解粪菌移植治疗过程及机制,并签署知情同意书。
!
出现以下情况之一不宜进行粪菌移植:
(1)肠道大面积溃疡、出血;
(2)移植通道梗阻;
(3)移植操作本身(内镜、置管、灌肠、经口饮食)的禁忌证;
(4)未通过伦理审核的临床试验或患者拒绝接受粪菌移植。
(5)生命体征(体温、心率、血压、呼吸)不稳定;
(6)严重免疫系统紊乱;
(7)孕妇或哺乳期妇女;
(8)代偿或者失代偿肝功能障碍。
▼
(1)个人情况:作息规律,饮食健康,家庭和睦,无不良性交,无吸烟、饮酒、吸毒等嗜好,无药物成瘾,近6个月未接种过疫苗或参加药物试验,近6个月未接受纹身或出现皮肤破损,近6个月无热带地区旅居史;无胃肠道病变家族史,无恶性肿瘤家族史,无传染病家族史;非孕期,非经期。
(2)开展病史和身体检查,评估供体的健康状况和是否符合粪菌移植的供体资格;选择无传染病史、无抗生素使用史、无消化系统疾病等方面的供体。
身体状态:年龄18-30周岁,体重指数(BMI)18.5-23.9 kg/m2,儿童医院开展粪菌移植,供体要求可放宽至15-30周岁。
心理状态:心理科医师或心理咨询师访谈认定心理状态良好;抑郁自评量表(SDS)、焦虑自评量表(SAS)、匹兹堡睡眠质量指数(PSQI)等评分正常。
(3)进行多项检测,如血液化验、粪便检测、病原菌检测、URTI检测等,确保找到适合的健康供体;以确保其不携带有害微生物和多重耐药菌。同时,需要考虑供体的肠道微生物组成和短链脂肪酸水平,以选择最适合的供体。
血液学检测:包括血常规、肝肾功能、电解质、C反应蛋白正常,肝炎病毒、HIV、梅毒、EB病毒、巨细胞病毒、COVID-19抗体、线虫、阿米巴等病原检测阴性;
粪便检测:粪便常规检查正常,隐血实验阴性,艰难梭菌、弯曲菌、沙门菌、志贺菌、产志贺毒素大肠杆菌及虫卵、小肠结肠耶尔森菌、致病性弧菌(副溶血弧菌、霍乱弧菌)、气单胞菌、阿米巴、孢子、诺如病毒、轮状病毒和新型冠状病毒(COVID-19)等病原学检测阴性。
(4)评估供体的肠道微生物组成,多样性和稳定性,包括菌群、真菌群和病毒群,并建立数据库;在选择供体时,除了肠道微生物群的总体多样性外,还应考虑到益生菌的丰富度,如乳酸菌、双歧杆菌等,选择粪便丁酸浓度高的供体微生物组。
(5)根据评估结果选择合适的供体,注意进行家族成员偏向,判别成熟度和完整性,同时避免与患者组群共同优势菌种重合等;一些研究表明,供体微生物组成与受体的微生物组成相似,可以提高移植成功率。
(6)移植前需对受体进行评估和准备,包括清洁肠道和停用抗生素等;为了提高移植效果,一些研究还使用抗生素预处理和肠道灌洗等方法来增强供体菌株的移植。
限食耐受性:通过限食实验完成。部分受体存在食物过敏及食物不耐受(如鸡蛋、牛奶等),根据受体要求,供体需在捐赠粪便前5天限制食物种类,如该供体不可耐受,则不可作为本次移植的捐赠者。
(7)进行移植后,对受体的微生物组成进行多次采样和分析,以评估移植效果和持续时间;
①每2个月复查以上条目,仍然符合上述要求;
②每次捐赠的粪便均留样行宏基因或者16s rDNA测序(根据各自单位检测能力),保证菌群组成及多样性稳定;
③每次捐献粪便应留样行代谢组学检测。
(8)监测受体的生理状况和不良反应,及时采取措施进行处理。
▼
(1)粪便采集:应采用无菌容器采集,粪便重量不少于100g,性状为Bristol评分标准中3-5分方为合格,立即进入菌液制作流程,或立即密封后2-8℃保存。
(2)制作流程:每次需取不少于50g粪便与无菌生理盐水以1∶3比例混合,充分搅拌混匀后过滤,从粪便排出体外至菌液制作完成应保证在2小时以内,整个处理过程应在无菌环境下操作。
注:为了避免感染窗口期的问题,菌液或胶囊制备后应待21 天后经过病毒细菌等检验合格后出库,每批产品留样至少6个月以供追溯。
(3)冻存与复融:菌液制备完成后置于-80℃保存,6个月之内使用不影响疗效;如置于-20℃保存,应在1-4周内使用。使用前置于室温复融,6小时内输注;如使用水浴锅复融,则水温不得超过37℃。
(4)质控标准:每次制作完成的菌液应随机抽样,进行致病菌监测、细胞计数及宏基因或16s rDNA菌群测序。
每50mL菌液中活细胞数应不小于2.5×10^12个,同供体同批次样本应达到菌群组成一致,6个月内同供体不同批次样本应达到菌群组成差异无统计学意义。
制作完成的菌液应有独立包装与标签。如制作胶囊,还应取胶囊内容物进行细菌活性监测与活细胞计数,其中细菌活性应不低于85%,每克内容物包含活菌数不小于10^9CFU。
▼
(1)菌液输注前需结合患者自身情况及疾病种类行肠道准备。
(2)应根据指南及操作规范选择上消化道或下消化道进行菌液输注。
(3)操作时应观察患者耐受情况,并及时处理不良反应。
▼
(1)管理原则:医疗安全(不良)事件的管理,遵循预防为主、紧急处理、合理控制、防微杜渐、持续改进的原则。
(2)上报要求:凡科室职工均有权上报医疗安全(不良)事件,可通过网络、书面、电话上报,上报时限要求在不良事件发生后24小时之内。
(3)审核、处置要求:科室负责人24小时内审核、处置科室发生的不良事件,并呈报至相关职能部门。
注意:主管职能部门自接报之日起,24小时内审核、处置不良事件;对于接报的Ⅱ级及以上不良事件,应呈报至主管院领导。
主管院领导对于接报的Ⅱ级及以上不良事件,必要时组织委员会进行讨论分析,并提交院务会。
▼
(1)每次菌液输注后密切观察患者耐受情况24小时,如有不良反应立刻处理并及时上报。
(2)1个疗程治疗结束后4周内应对患者症状学和肠道菌群改善情况进行评估,粪菌移植治疗疾病的随访及疗效判断指标主要遵循原发疾病的治疗指南。移植前后重复检测粪便及血液中传染病相关指标,有条件者可行免疫相关检测。
注意:如第1个疗程结束3周后病情无改善,可尝试更换供体,重新给予1个疗程粪菌移植,若有效可继续治疗,若仍无效则应视为粪菌移植无反应性,此时不应继续给予粪菌移植,以免耽误病情;如患者接受粪菌移植治疗后症状明显改善,可重复3-5次粪菌移植后结束治疗。
随访至末次粪菌移植结束后至少8周,有条件者应进行大于1年甚至5年以上的长期随访。
随着对微生物与宿主相互作用的了解不断加深,肠道微生物群的参与已成为一种新颖、巧妙且不可忽视的调节宿主健康的方式。
粪菌移植是一种治疗胃肠道疾病的有效方法,还有望治疗其他更多疾病。未来的研究应该重点关注粪菌移植对肠道微生物组和整体健康的长期影响,并制定安全有效地使用该程序的指南。
此外,需要进一步研究如何提高粪菌移植的改善效果,供体和受体的配型以及移植肠道菌群的定植和效果的长期性,以便在临床实践中更好地使用。
主要参考文献:
Zhang YW, Cao MM, Li YJ, Zhang RL, Wu MT, Yu Q, Rui YF. Fecal microbiota transplantation as a promising treatment option for osteoporosis. J Bone Miner Metab. 2022 Nov;40(6):874-889.
Biazzo M, Deidda G. Fecal Microbiota Transplantation as New Therapeutic Avenue for Human Diseases. J Clin Med. 2022 Jul 15;11(14):4119.
Quaranta G, Guarnaccia A, Fancello G, Agrillo C, Iannarelli F, Sanguinetti M, Masucci L. Fecal Microbiota Transplantation and Other Gut Microbiota Manipulation Strategies. Microorganisms. 2022 Dec 7;10(12):2424.
Vendrik KEW, Ooijevaar RE, de Jong PRC, Laman JD, van Oosten BW, van Hilten JJ, Ducarmon QR, Keller JJ, Kuijper EJ, Contarino MF. Fecal Microbiota Transplantation in Neurological Disorders. Front Cell Infect Microbiol. 2020 Mar 24;10:98.
Wang JW, Kuo CH, Kuo FC, Wang YK, Hsu WH, Yu FJ, Hu HM, Hsu PI, Wang JY, Wu DC. Fecal microbiota transplantation: Review and update. J Formos Med Assoc. 2019 Mar;118 Suppl 1:S23-S31.
Chen D, Wu J, Jin D, Wang B, Cao H. Fecal microbiota transplantation in cancer management: Current status and perspectives. Int J Cancer. 2019 Oct 15;145(8):2021-2031.
Stallmach A, Steube A, Stallhofer J, Grunert PC, Merkel U, Hartmann M. Fäkaler Mikrobiomtransfer – Indikationen, Risiken und Chancen [Fecal microbiota transplantation: indications, risks and opportunities]. Inn Med (Heidelb). 2022 Oct;63(10):1036-1042. German.

谷禾健康

我们知道,肠道微生物群对人类健康和福祉很重要,调节宿主代谢,塑造免疫系统并防止病原体定植。
通过粪便微生物群移植(FMT)恢复平衡多样的微生物群,已成为研究疾病发病机制中微生物群因果关系的潜在治疗策略和有前途的工具。
然而,FMT 带来了后勤方面的挑战和潜在的安全风险,如病原微生物的转移、不期望的表型(如肥胖)的潜在转移,或在生命后期发展疾病的风险增加。
因此,一种更可控、更个性化的培养有益微生物混合物可能是更好的选择。
这些有益微生物中的大多数将是宿主的内源性共生体,没有长期安全有益的使用历史,因此通常被称为下一代益生菌(NGP)或活生物治疗产品(LBP)。
植物乳杆菌菌株,其益生菌和功能特性及其促进健康的作用脱颖而出,可以很好地调节肠道菌群组成。
一项FMT研究发现共生产丁酸菌Anaerobutyricum spp.(以前称为Eubacterium hallii)与代谢综合征受试者胰岛素敏感性的提高有关。因此,着手进一步研究和开发这种潜在的有益微生物,并将重点放在Anaerobutyricum soehngenii L2-7等,因为它的特征最好。
在小鼠模型中使用Anaerobutyricum soehngenii 完成临床前试验后,在受控条件下生产菌株,并进行了几项临床研究,以评估其在人体中的安全性和有效性。
本文将以植物乳杆菌为例,介绍其益生菌特性;以A.soehingeii为例,介绍用于临床的的开发,为下一代益生菌的开发和测试提供了实践指导。
传统的益生菌被定义为“活的微生物,当给予足够的量时,会给宿主带来健康益处”。这些微生物使用历史悠久,被认为是安全的。
注:在美国具有公认安全(GRAS)状态,在欧盟具有合格安全推定(QPS)状态。
益生菌的使用可能代表一种调节肠道微生物群和改善人类疾病的治疗策略。
doi.org/10.1016/j.micres.2022.127289
相比之下,下一代益生菌(NGP)是一种没有长期安全有益使用历史的微生物,与传统益生菌一样,当以足够的量给药时,下一代益生菌对宿主健康有益。
2012年,美国食品和药物管理局引入了活生物治疗产品(LBP)一词,定义为“一种生物产品”,其:
(1)含有活生物体,如细菌;
(2)适用于预防、治疗或治愈人类疾病或病症;
(3)不是疫苗。
LBP在《欧洲药典》(Ph.Eur.)中被定义为“含有活微生物(细菌或酵母)的供人类使用的医药产品”。然而,由于LBP除了微生物外还包括最终产品的配方,并且被定义为药物产品,因此不应系统地使用该术语来替代NGP。
NGP一词更为广泛,包括LBP中存在的微生物和目前正在研究的、尚未在最终产品中配制的微生物。此外,NGPs既可以用作传统益生菌等食品补充剂,也可以用作预防、治疗或治愈疾病的医药产品。最后,转基因微生物也可以被视为NGP,尽管最有可能作为LBP上市。
下图示意性地描述了各种定义。
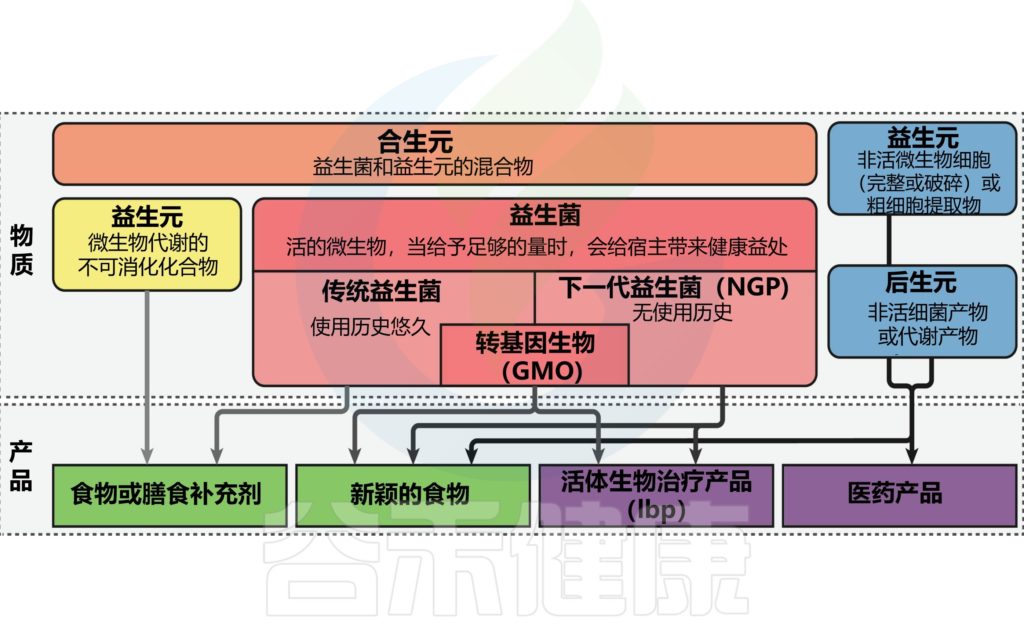
doi.org/10.3389/fmed.2022.1077275
植物乳杆菌是乳杆菌中最重要的成员之一,由于其出色的益生菌特性(良好的 GI 耐受性、粘附性、抗氧化性和抗菌性),它通常被用作益生菌。
✔ 抵抗胃肠道疾病
将微生物视为益生菌的一个基本特征是能够在人类胃肠道的恶劣条件下存活。
植物乳杆菌MA2菌株和B23菌株表现出良好的耐受性,可以在低pH值(2.5-3)下存活。植物乳杆菌KU15149 具有胃和胆汁盐耐受性。
✔ 对肠粘膜和/或细胞外基质成分的粘附能力
粘附到上皮细胞的粘膜或粘附到肠道细胞外基质的成分是益生菌微生物的理想特征,因为它们将有利于益生菌在宿主中的定植和持久存在。
两种植物乳杆菌菌株DKL3 和 JGR2 分别显示出 82.8% 和 79.6% 的粘附程度。
植物乳杆菌菌株 KACC11451 和 Wikim0112 的肠上皮粘附率约为 60–62%.
✔ 抗氧化活性
一些益生菌已被证明具有抗氧化活性,可减少氧化反应造成的损害。
✔ 细菌素生产
细菌素可以在食物和宿主中发挥各种益处,因为它们可以分别延长保质期和防止不必要的定植。许多植物乳杆菌菌株已被证明能够产生细菌素,赋予这种微生物益生菌特性。
植物乳杆菌产生通常称为 plantaricin 的细菌素。
KLDS1.0391、ZJ5、TN635、B23 和 AA135 菌株分别是细菌素 Plantaricin MG、Plantaricin ZJ5、细菌素 ST28MS 和 ST26MS、细菌素 BacTN635、细菌素 Lac-B23 和 Plantaricin AA135 的生产者,它们具有对几种革兰氏阴性菌的抗菌作用。
✔ 抗菌活性
益生菌的特点是抑制病原微生物的生长、发育和定植。
在植物乳杆菌的发酵代谢过程中,它会产生多种抗菌化合物(除细菌素外),其中可能包括有机酸,例如乳酸、柠檬酸、异丁酸和乙酸、乙醇、双乙酰和 H2O2. 植物乳杆菌还可以产生具有天然抗真菌活性的胞外多糖。
✔ 本土肠道调节
构成肠道微生物组的不同物种的生态平衡,对于预防传染性和非传染性疾病以及阻止微生物群平衡的紊乱至关重要。益生菌具有调整肠道菌群组成和纠正免疫系统异常反应的能力,从而对宿主产生不同的有益作用。
植物乳杆菌ZJ316 在体外肠道模型中发挥了微生物群的调节作用,增加了Veillonella的生长,这可以提高人体呼吸系统和消化系统的免疫力。同时减少了 Blautia 的存在。
注:Blautia与肥胖儿童的肠道炎症有关。
此外,ZJ316 菌株减少了肠杆菌科,包括共生生物和原发性和机会性病原体。
注:这些病原体很容易在发炎的肠道中繁殖,从而导致微生物群失衡。
不同植物乳杆菌菌株对肠道菌群的影响
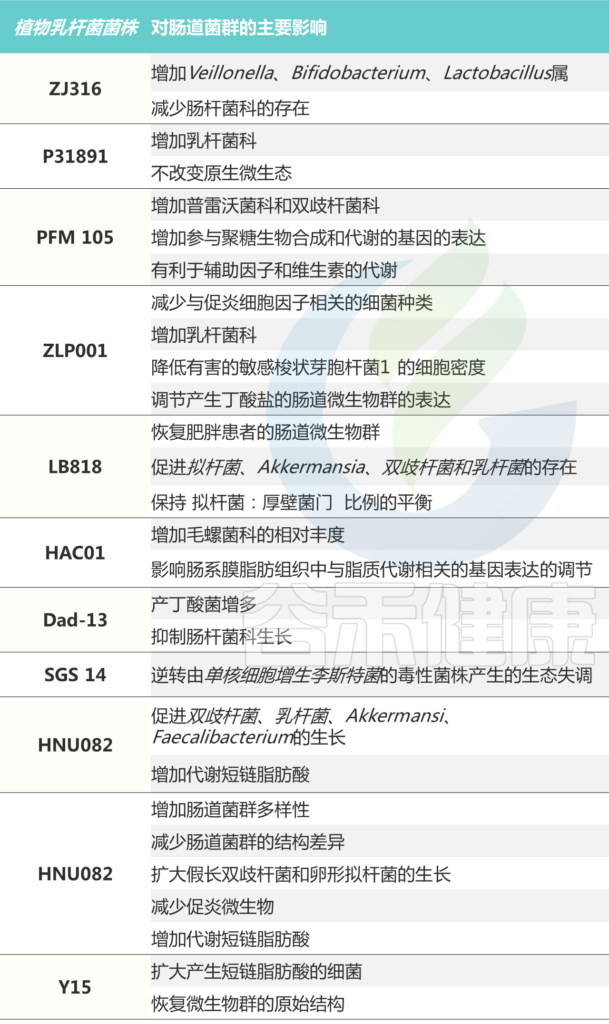
doi.org/10.1016/j.micres.2022.127289
更多关于植物乳杆菌的介绍详见:客观认识植物乳杆菌 (L. plantarum) 及其健康益处
随着全球肥胖流行病的恶化,代谢综合征的发病率急剧增加,比较容易患上心血管疾病和2型糖尿病。肠道微生物群的动态变化与代谢综合征的出现相关。
进一步研究肠道微生物群在代谢综合征中的因果作用 ↓↓↓
研究人员先前向患有代谢综合征的男性受试者输注了来自瘦健康供体的粪便微生物群。输注供体微生物群6周后,与自体FMT组相比,外周胰岛素敏感性随着丁酸产生菌的水平而增加。
在这些产生丁酸的细菌中,厌氧产丁酸菌在小肠中更为丰富,这表明其在通过丁酸产生调节胰岛素敏感性方面具有潜在作用。
由于胰岛素抵抗代谢综合征受试者的特点是产短链脂肪酸菌水平降低,口服丁酸盐可改善饮食诱导的肥胖小鼠的胰岛素抵抗和血脂异常。
因此研究人员得出结论,A.soehingenii可能是一种有前途的下一代益生菌,可改善胰岛素抵抗。
//
1996年,从婴儿粪便中分离出的A.soehngenii菌株L2-7,以前被命名为E.hallii,是一种严格厌氧、革兰氏阳性、过氧化氢酶阴性的Lachnospiracae科细菌。A.soehngenii菌是人类胃肠道核心菌群的一部分。与其他已知的丁酸盐生产物种(如Roseburia和Faecalibacterium spp.)不同,A.soehingenii有能力在乙酸盐存在下利用D-和L-乳酸盐。此外,基因组中含有胆汁酸钠共转运蛋白和胆碱水解酶基因,表明A.soehngenii 可以影响宿主胆汁酸代谢。
学习要点和方向
下一代益生菌的开发通常采用两种策略。
第一种方法是将特定菌株的存在与健康表型相关联,并探讨该菌株是否对疾病表型有因果影响。
迄今为止,已经使用测序技术确定了许多NGP候选株,以选择患病受试者中丰度耗尽的菌株或与FMT治疗成功相关的菌株。
第二种策略是采用具有良好特征的益生菌菌株,并对该菌株进行基因修饰,例如通过生物活性分子的生产和递送,从而赋予健康益处。
后一种方法将导致转基因生物(GMO)在世界各地受到特定法规的约束,如欧盟。
无论用于识别或生成NGP的策略如何,在体内研究任何健康益处之前,需要在体外充分表征候选菌株。
下图总结了除了菌株的基因分型和表型外,必须评估的最重要特征。
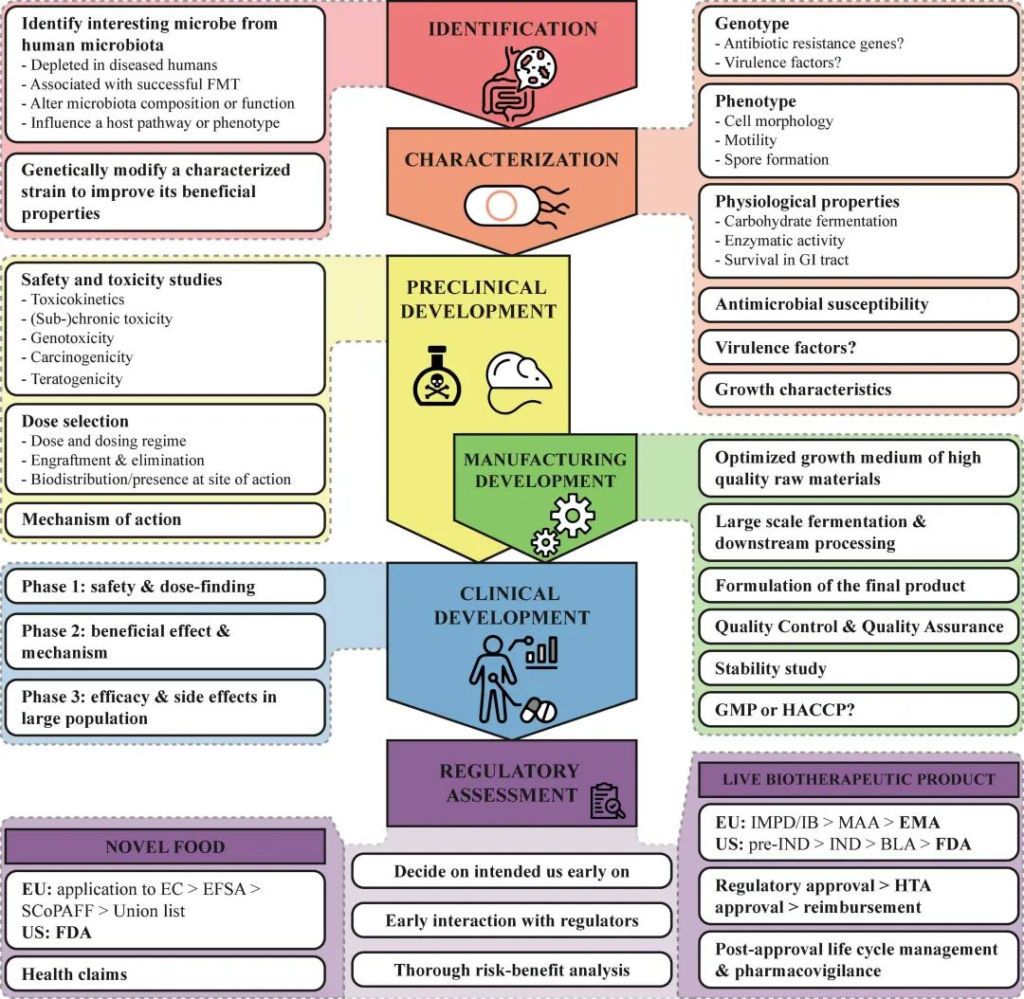
doi.org/10.3389/fmed.2022.1077275
此外,必须记录菌株的起源和随后的操纵或基因修饰。如果存在任何抗微生物耐药基因或毒力基因,则应评估人体微生物群向其他微生物传播的可能性,并采取措施减轻这种风险。
当下一代益生菌用于患有免疫抑制的上皮屏障损伤的患者时,应确定细菌易位的风险。彻底的菌株特征评估对于在健康或患病人群中使用NGP的潜在安全问题至关重要。
在对A.soehngenii进行体外测试后,研究人员转向动物模型,以评估该菌株对胰岛素敏感性的安全性和有效性。
首先,在厌氧条件下生产了一批临床前的A.soehngenii。
简而言之,培养物在厌氧条件下生长至指数阶段结束,通过厌氧离心浓缩,用磷酸盐缓冲盐水(PBS)洗涤,最后用10%甘油稀释至100μl的106、108和1010菌落形成单位(CFU)浓度。
通过16S rRNA测序和细胞形态学的显微评估来评估纯度。
通过最可能数(MPN)分析评估生存能力,并通过显微分析确认。样品直接储存在−80°C下,并在生产6个月内使用,在此期间生存能力稳定。
此外,其中一些样品在2年内进行了稳定性测试,以支持临床试验的产品开发。
接下来,研究人员在雄性糖尿病(db/db)小鼠中进行了一项剂量发现研究,以测试口服A.soehingeii对胰岛素敏感性和脂质代谢的安全性和有效性。
每天用A.soehingeii或安慰剂(10%甘油)治疗小鼠达4周,期间未观察到不良事件(正常生命体征)。在胰岛素耐受试验期间观察到胰岛素敏感性的显著改善,这在108CFU剂量下最强。这伴随着肝脏脂肪的减少和Fasn和Acc1基因的表达减少,两者都参与脂肪生成。
为了证实这些发现并进一步剖析A.soehingeii的治疗机制,Bäckhed教授的实验室对db/db小鼠进行了第二项研究。
用108 CFU的A.soehingeii或热灭活A.soehingeii处理小鼠4周。当体重保持不变时,在活跃的A.soehingeii治疗后观察到静息能量消耗增加。此外,与热灭活的A.soehingeii相比,活性A.Soehingeii增加了粪便丁酸水平,并改变了胆汁酸代谢。
这两项小鼠研究表明,用 A.soehingeii 进行治疗是安全的,并对代谢产生有益影响,这可能由丁酸盐的产生和胆汁酸代谢的变化介导。这些数据用于获得我们在人类中进行的临床研究的伦理批准。
最近,对A.soehingeii CH106(一种来自A.soehingeii 菌株L2-7T的四环素敏感衍生物)进行了毒理学安全性评估,表明以推荐剂量摄入是安全的。
根据欧洲食品安全局(EFSA)和美国食品和药物管理局(FDA)对新的不可吸收食品成分进行安全评估的要求,对A.soehingeii进行了遗传毒性和亚慢性毒性评估。细菌反向突变和体外哺乳动物细胞微核试验均未显示出遗传毒性作用。
此外,大鼠的90天亚慢性毒性没有发现与A.soehingeii 喂养相关的任何不良事件,即使在最高剂量(5×1011 CFU/kg体重/天)下,也没有发现超过人类建议每日摄入量100倍以上的不良事件。
这些研究结果支持口服A.soehingeii 作为食物补充剂是安全的。
学习要点和方向
在临床前开发期间,应提供足够的药理学和毒理学信息,以支持拟议的临床试验。
NGP的安全性和毒性研究具有挑战性↓↓
由于该产品通常不会到达全身循环,但其代谢产物或其活性可能直接或间接影响身体的生理功能,因此疗效和毒性不一定与剂量有关。
人体生理学和微生物群组成等其他因素可能会影响安全性和疗效。
由于大多数NGP与人类宿主(全生物概念)共同进化,很难将动物研究的结果转化为人类环境。
因此,强烈建议将体外、离体和体内模型结合起来,以建立适应预期人群风险的全球安全性概况。
通常根据经济合作与发展组织(OECD)的良好实验室规范(GLP)原则进行安全性和毒性研究。然而,由于需要创新的方法和模型(例如,人类胃肠道的人工模型),而这些方法和模型可能既无法验证,也无法在GLP水平上验证,因此这可能很困难。
对于食品成分和膳食补充剂,EFSA建议采用毒理学研究的分级方法。
该分级方法评估NGP的毒代动力学、遗传毒性、亚慢性和慢性毒性、致癌性和致畸性,平衡数据要求和风险。该方法也用于A.soehingeii CH106的毒理学安全性评估。如果NGP打算用作患病人群中的药物产品,则必须证明目标人群的安全性。
前面的图总结了必须解决的最重要的问题,例如治疗剂量和持续时间对毒性反应的影响,以及致畸、致癌和遗传毒性的可能性。
在能够口服 A. soehngenii 给人类之前,必须制造出适合临床试验的产品。
在独立伦理委员会批准时(2014年),A.soehngenii被视为益生菌,必须遵守荷兰“Warenwet”,这符合欧盟膳食补充剂法规。这意味着必须根据危害分析和关键控制点(HACCP)标准进行生产。可根据HACCP标准进行临床干预研究。
首先,为了大规模生产食品级产品,进一步优化了生长培养基。该组合物基于先前的经验:
(1)实验室化学物质转化为食品级来源
(2)仅使用无动物成分(无血红素或肉蛋白胨)
(3)复杂性降低(微量矿物质、维生素、碳源和有机酸的去除/减少)
(4)生物量产量进一步提高。原材料来源于经过审计的可靠供应商,以确保高质量。发酵前,在大型发酵罐系统中制备并消毒生长培养基,通过氮气(N2)冲洗使其完全厌氧。
发酵分四个连续步骤进行,如下图所示:
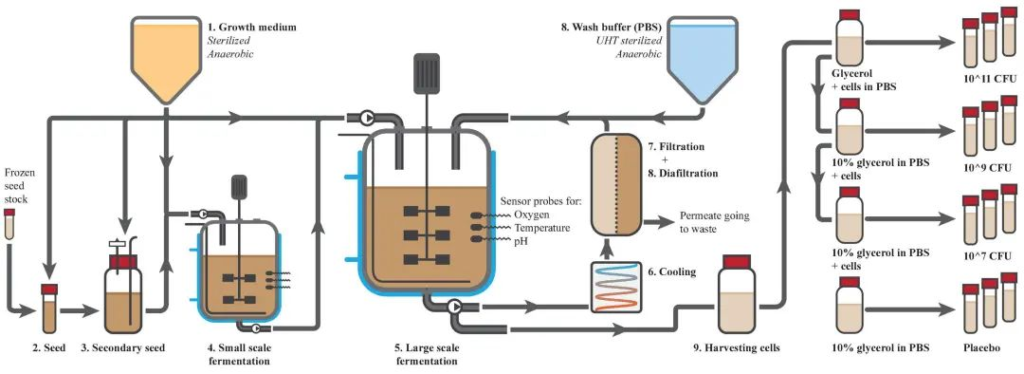
doi.org/10.3389/fmed.2022.1077275
首先,用精心准备的A.soehngenii 冷冻种子储备接种少量食品级培养基。动物研究中使用了相同的菌株,因此,该菌株具有良好的特性,是可行的、纯净的,没有任何细菌或病毒污染物。在37°C下发酵24小时后,使用培养物接种1 L培养基,再次发酵18小时。
然后,使用该二级种子培养物在小型发酵罐中接种30 L培养基。该发酵罐发酵17小时,作为大规模发酵的试车。
最后,用10L小发酵罐的接种物接种大发酵罐中的290L培养基。控制小型和大型发酵罐的温度、pH和氧气水平,并使用培养物的光密度(OD)确定发酵时间(14至18小时)。在大型发酵罐中发酵16小时后,A.soehngenii生长至OD约为10.
使用中空纤维膜(Koch膜系统;HF3043-25-43-PM500;HF3043-16-106-PM500)和PBS渗滤,浓缩并洗涤细胞。将发酵液冷却至10°C,泵送通过厌氧膜装置,并在3小时内浓缩至40–50 L。
在第二阶段进行渗滤以降低培养基成分和发酵产物的水平。使用超高温对洗涤缓冲液进行灭菌、脱气并直接添加到返回的细胞流中进入发酵罐。6小时后,将细胞浓缩约20倍至15升,99.8%的培养基化合物被丢弃成废物,最终浓缩物中只剩下2.9%的培养基组分。
最后,可将9L产品从系统中收获到10L的无菌N2冲洗容器中。
为临床研究生产了四个不同的批次,包括600个试管和一个安慰剂批次,其中PBS中含有浓度为106、108和1010 CFU/mL的10mL A.soehngenii,PBS+10%甘油,PBS中只有10%甘油。
对于每一批,用甘油和PBS制备7L瓶用于进一步稀释,将其高压灭菌、冷却并用N2冲洗。从9L收获的浓缩液中,向这些瓶中加入必要的体积以获得正确的浓度。在连续搅拌和N2冲洗下,将瓶子置于冰上。
首先用N2填充10mL管,然后用定量管泵填充10mL产品。立即关闭试管,贴上标签,并在灌装后10分钟内将其置于−30°C的冰箱中。所有填充均在消毒层流柜内进行。
在制造过程中,持续监测温度、pH值和氧气水平。此外,在过程中的每一步都测定了细胞计数和OD,以及是否存在任何污染物。由于厌氧菌很难在琼脂平板上定量计数,因此在厌氧条件下进行MPN分析以获得活细胞的数量,并用显微镜评估细胞形态。所有上述质量控制均针对符合人类消费标准的包装小瓶进行。
Anaerobutyricum soehingeii 中间体和最终产品规范

doi.org/10.3389/fmed.2022.1077275
随后,每6个月测试生产的小瓶的稳定性。生产完成后,这些小瓶的“保质期”为6个月,这是荷兰法律要求的食品。如果满足生存能力和纯度标准,有机会延长小瓶的有效期。
下表显示了在3年时间段内具有最高剂量 A. soehngenii 的小瓶的效力和纯度。
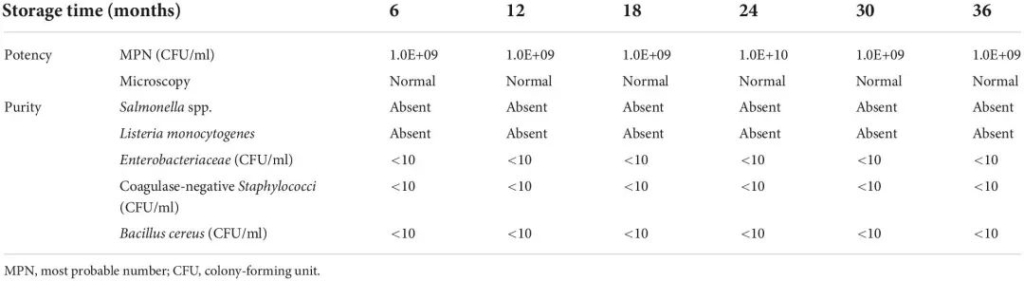
doi.org/10.3389/fmed.2022.1077275
学习要点和方向
▸ 工业规模生产是技术挑战
与实验室规模培养相比,以工业规模生产菌株对菌株和培养基的要求不同。因此,当一种菌株符合潜在NGP的条件时,应采取措施,看看该菌株是否可以在工业规模上培养。
培养NGPs所需的严格条件是技术挑战之一,例如需要特定的营养、缺氧、稳定的温度和合适的pH。此外,更长的保持时间、泵送的绝对压力、下游净化过程和储存可能会对细菌细胞的生存能力产生负面影响。
▸ 将菌株加入产品后需要有效策略,将其输送到作用部位
接下来,必须将菌株加入产品中,如胶囊、粉末或液体悬浮液。由于大多数NGP是严格的厌氧菌或兼性厌氧菌,因此应尽量减少接触氧气。为此,应降低容器中的氧气渗透性,并可添加抗氧化剂以降低氧化还原电位。
摄入产品后,NGP必须在胃肠道的恶劣环境中生存。肠溶胶囊和微胶囊是保护细菌并将其运送至其作用部位的有效策略。
▸ 有效期之前,足够量的递送剂量
最终,制造需要产生一种强健、稳定的产品,该产品将允许在有效期之前以足够数量的NGP递送有效剂量。
▸ 质量控制和质量保证计划需要到位
对于医药产品或LBP,需要按照良好生产规范(GMP)进行生产。对于食品和膳食补充剂,HACCP认证工厂的生产是标准。无论如何,质量控制和质量保证计划需要到位,以确保成分和最终产品的一致质量,并确保可靠的生产过程。
应从所用原材料、细胞库系统、细胞生长和收获、纯化和下游加工到过程中测试,应清楚记录菌株的制造过程。
▸ 彻底描述最终产品的制造
同样,必须彻底描述最终产品的制造,包括生产记录和配方、填充、标签和包装说明。对于菌株和产品制造,必须评估与同一房间或同一接触设备生产的其他产品交叉污染的风险。
▸ 必须描述菌株和产品的规格
包括采样程序和验证测试方法的说明。这些规范应描述身份、效力、纯度、污染、外观,如果适用,还应描述活细胞百分比、颗粒物、热原、pH和残留水分的附加测试。
▸ 必须生成稳定性数据
证明产品在计划的使用期限内,在效力和污染方面是稳定的。
对于冷冻产品,应评估多次冻融循环的影响,而对于冻干产品,应探讨重构后的保质期。
▸ 需要评估该产品对环境的影响
特别是当该菌株经过基因修饰、致病、生态上比野生型更适合或难以根除时。
为了验证人类环境中的小鼠数据,研究人员建立了一项单盲、I期/II期剂量递增试验,以确定Anaerobutyricum soehingeii 在肥胖、胰岛素抵抗受试者中的安全性和有效性。
在这项研究中,27名患有代谢综合征的肥胖高加索男性被纳入并分配接受soehngenii,剂量为107、109或1011个细胞/天,持续28天。
当受试者对其各自的治疗剂量进行盲测时,前9名受试者必须在剂量增加到更高浓度之前成功完成最低剂量的研究方案。
受试者在家中的−20°C温度下储存冷冻瓶,每天解冻一个10mL瓶,与100mL牛奶混合并口服。添加牛奶以增加胃中的pH值,从而在胃肠道通过期间保护活细胞。主要结果是安全性,此外,治疗4周后评估了对胰岛素敏感性和脂解的影响。
使用高达1011个细胞/天的A.soehngenii治疗耐受性良好,无任何严重不良事件。
当所有治疗组合并时,A.soehngenii 的粪便丰度与改善的外周胰岛素敏感性相关,并伴有胆汁酸分布的有益变化。
出乎意料的是,没有观察到粪便丁酸盐水平的增加,这可以通过短链脂肪酸的挥发性和化验的检测限来解释,这使得丁酸盐难以测量。
A.soehngenii 丰度的增加是短暂的,大多数在停止后2周消失。给药菌株的生存能力受到胃酸和氧气的负面影响。
然而,如接受最高剂量的受试者粪便中的最高复制信号所示,A.soehngenii部分能够在胃肠道中存活。通过包封和/或冷冻干燥更好地保护菌株免受酸性和含氧环境的影响,可以进一步提高生存能力(和治疗效果)。
为了进一步阐明A.soehngenii在人体中的作用模式,进行了一项随机安慰剂对照交叉试验,在该试验中,直接在十二指肠中施用该菌株,从而避免胃酸并减少氧气暴露。
由于小肠在葡萄糖增敏、调节胰岛素敏感性/分泌和葡萄糖稳态中起着核心作用,因此假设十二指肠直接输注A.soehngenii 可以进一步提高治疗效果。
同样,患有代谢综合征(N=12)的肥胖受试者被纳入并随机接受单次鼻十二指肠输注,输注最高剂量的A.soehngenii(1011个细胞)或安慰剂(PBS中的10%甘油)。6小时后,进行十二指肠活检和混合膳食试验。
此外,受试者监测了24小时血糖,并收集了一些粪便样本。经过4周的冲洗期后,受试者转为另一个治疗组,在第一次试验中,该治疗组被确定为足够长的时间来减轻压力。
再次,这项研究表明,A.soehngenii 的给药安全且耐受性良好。该菌株的治疗增加了促胰岛素激素胰高血糖素样肽1(GLP-1)的餐后漂移,伴随着葡萄糖变异性的降低。
鉴于A.soehngenii 具有产生丁酸盐的能力,并且在A.soehngenii处理后,粪便中的丁酸盐水平趋于较高,GLP-1分泌增加可能是丁酸盐激活肠L细胞上的G蛋白偶联受体43(GPR43)的结果。
由于A.soehngenii表达胆汁酸钠共转运蛋白和胆汁酸水解酶,并且二级胆汁酸的血浆水平升高,GLP-1表达增加也可能是TGR5被二级胆汁酸类激活的结果。
注:TGR5是G蛋白偶联受体超家族成员,TGR5不仅是胆汁酸受体,也是多种选择性合成激动剂的受体,调节不同信号通路的衍生物。参与能量稳态、胆汁酸平衡及葡萄糖代谢。
此外,用A.soehingeii治疗导致十二指肠核法尼素X受体(FXR)及其靶基因OSTa的表达降低,这也可能是GLP-1可用性增加的原因。
最后,葡萄糖变异性的改善可以通过GLP-1和丁酸盐的胰岛素增敏作用来解释。
此外,A.soehingeii改变了73个基因的十二指肠转录,最显著的是诱导REG1B和REG1A的表达,后者编码生成胰岛衍生蛋白1A/B。
注:Reg1A和Reg1B在肠隐窝底部的Paneth细胞中强烈表达,在管腔中分泌,可能通过诱导祖细胞或L细胞增生局部发挥作用。
此外,发现REG1B的诱导与施用A.soehngenii后24小时GLP-1分泌增加和葡萄糖变异性降低相关。单剂量A.soehingeii 的治疗不会影响微生物群的组成或多样性,正如之前的研究中所见。
此外,粪便A.soehngenii的丰度没有随时间变化,排除了交叉时微生物群介导的遗留效应。
学习要点和方向
第一次临床研究的主要目的是确定安全性,并根据产品的耐受性确定适当的剂量范围和方案。这包括确定最小有效剂量或最佳有效剂量范围,如果可能,还包括最大安全剂量。
除给药外,重点应是获取安全数据,以识别常见的产品相关不良事件。这些早期临床研究通常在健康志愿者中进行,但纳入患者可能更合适,例如当NGP应纠正生物失调时。应考虑确保研究参与者安全的风险缓解措施,如连续入组、剂量递增和独立数据监测委员会的监测。
此外,监测易位、炎症和感染以及确定NGP的持久性及其在最终给药后的作用是有利的。
重要的是考虑影响微生物群功能或组成的其他混杂因素,如年龄、饮食、生活方式和环境因素。在这方面,采用安慰剂对照交叉设计的研究非常有用,因为它们可以限制这种外在和内在混杂因素的影响,从而允许更小的样本量。不用说,盲板非常重要,应仔细考虑冲洗期。
越来越多地,基线微生物群组成也被纳入筛选标准,例如寻找特定肠道类型中特定细菌群的存在或集群。这将导致更具可比性的研究组,并且当特定的菌群参与作用机制时,可以优化干预的效果。
根据粮农组织和世界卫生组织对益生菌的定义,益生菌可分为膳食补充剂和药物,但两者在监管上存在着巨大的差异。同样,含下一代益生菌的产品可以作为食品、膳食补充剂或药物进入市场,具体取决于预期用途。
在欧盟,食品由欧洲食品安全局监管,药品由欧洲药品管理局监管,而在美国,食品和药物管理局负责这两类产品。当预期用途与预防、缓解或治疗疾病有关时,该产品将被视为医疗产品或医疗器械。
与增强生理功能或降低疾病风险因素有关的口服摄入产品可被归类为功能性食品或食品补充剂。此外,具有纯美容功能的局部应用产品可被评定为化妆品。为了确保法规遵从性,在临床前研究和制造之前,必须决定缩进的用途和随后的法规分类。
在欧盟,“食品” 被定义为“任何物质或产品,无论是加工的、部分加工的还是未加工的,旨在或合理预期被人类摄入”。根据标签、展示和广告的一般要求和规定,对每一类进行了相应的管理。
当NGP被用作食品或膳食补充剂时,它们很可能被认为是一种新型食品。然而,如果NGP经过了基因改造,它将作为转基因食品受到监管。为了使NGP作为一种新型食品进入市场,它需要获得授权并列入欧盟名单。
最重要的条件之一是NGP不会对人类健康造成风险,这必须得到科学证据的支持。这包括一项综合风险评估,结合预期人类接触的生物和毒理学研究,评估对人类健康的潜在风险。此外,申请应包含NGP、制造工艺、产品成分、使用的分析方法、标签和预期用途条件的详细说明。
除安全性外,该产品不得促进食品链或环境中抗微生物耐药性的传播,需要对抗微生物耐药性进行表型和基因型评估。
即使“含有益生菌/益生元”的声明在欧盟也被视为健康声明。为了接受健康声明,需要对NGP进行适当的描述,并通过高质量的研究证明其对健康有益的影响和因果关系。
自2012年和2019年以来,FDA和EDQM明确了LBP的质量要求,其中LBP被描述为含有供人类使用的活微生物的医药产品。除这些质量要求外,目前没有具体的LBP法规。
然而,由于LBP含有活微生物,它们被视为生物医药产品,因此必须遵守立法和监管框架。如果没有特定的LBP子类别,开发商将不得不依赖其他子类别生物医药产品的监管概念。
其中一个概念是基于从临床前和临床研究中获得的质量、安全性和疗效数据进行彻底的风险效益分析。
临床前和临床研究设计的其他相关指南包括:
迄今为止,没有LBP进入欧盟市场,这部分是由于缺乏明确的监管框架。在缺乏明确指导方针的情况下,尽早与主管当局进行互动,以讨论不确定性和减少风险的重要性。
随着对我们肠道微生物群的了解越来越多,将发现和开发越来越多的潜在下一代益生菌。本文以A.soehingeii为例,介绍了将其开发为下一代益生菌的经验。
重要的是,这些新菌株具有良好的特性、高质量和安全性。对NGPs进行彻底的安全评估非常重要(虽然很复杂),特别是因为疗效和毒性不一定与剂量有关。
由于这个领域相对稚嫩,目前还没有具体的LBP监管,因此在开发的早期阶段与监管机构进行沟通有助于降低风险并澄清任何不确定性。这需要在开发初期对市场(食品或药品)的路线有明确的看法。
在FMT干预后,A.soehingeii 这种微生物被确定为潜在的有益微生物,在临床前的体外和体内研究以及人类研究中都显示出很有前景的结果。它在改善胰岛素敏感性、增加GLP-1分泌和降低葡萄糖变异性方面显示出良好的效果。
这些效应可能通过丁酸和次生胆汁酸的产生介导。通过更好地保护菌株免受酸性和含氧环境的影响,例如通过冷冻干燥和封装,可以潜在地提高生存能力,从而提高治疗效果。
主要参考文献:Wortelboer K, Koopen AM, Herrema H, de Vos WM, Nieuwdorp M, Kemper EM. From fecal microbiota transplantation toward next-generation beneficial microbes: The case of Anaerobutyricum soehngenii. Front Med (Lausanne). 2022 Dec 5;9:1077275.
Kumari M, Singh P, Nataraj BH, Kokkiligadda A, Naithani H, Azmal Ali S, Behare PV, Nagpal R. Fostering next-generation probiotics in human gut by targeted dietary modulation: An emerging perspective. Food Res Int. 2021 Dec;150(Pt A):110716.
Echegaray N, Yilmaz B, Sharma H, Kumar M, Pateiro M, Ozogul F, Lorenzo JM. A novel approach to Lactiplantibacillus plantarum: From probiotic properties to the omics insights. Microbiol Res. 2022 Dec 22;268:127289.
Garcia-Gonzalez N, Battista N, Prete R, Corsetti A. Health-Promoting Role of Lactiplantibacillus plantarum Isolated from Fermented Foods. Microorganisms. 2021 Feb 10;9(2):349.
Seegers JFML, Gül IS, Hofkens S, Brosel S, Schreib G, Brenke J, Donath C, de Vos WM. Toxicological safety evaluation of live Anaerobutyricum soehngenii strain CH106. J Appl Toxicol. 2022 Feb;42(2):244-257.
谷禾健康
你知道肠道和大脑之间的秘密吗?
大脑自闭了,为什么是肠道的锅?
肠道真的会影响大脑嘛,原理是啥?
……
已经有越来越多人开始好奇肠道和大脑之间的联系,关于这方面的前沿研究也在不断更新,人们开始逐渐深入了解相关机制。

中枢神经系统功能与肠道微生物之间存在关联,即大脑和肠道之间的串扰,与迷走神经、肠神经系统、免疫系统和循环相互作用。胃肠道微生物群可以影响神经系统,无论是通过迷走神经直接输入大脑,还是通过间接激活整个胃肠道的肠神经系统。
以下是我们整理过相对较全面的关于肠道和神经系统相关的文章:
深度解读 | 肠道菌群和中枢神经系统的关系
肠道微生物群在神经系统疾病中的作用
本文在这个基础上,结合最新研究进展,再次阐述人类肠道微生物组在神经系统疾病发病机制中的潜在作用,讨论了精神药物、益生菌、益生元、合生元、后生元、粪菌移植等方式治疗神经系统疾病的潜在作用。

大家越来越有这样的认知:胃肠道微生物群的不平衡会影响大脑的生理、认知和行为。
肠道微生物群通过神经、免疫、体液和内分泌联系参与肠-脑双向相互作用。我们先来了解一下以下它们之间几种“交流方式”:
肠道主要通过两条神经解剖学途径与大脑进行沟通。
首先,大脑和肠道直接通过迷走神经(VN)和脊髓中的自主神经系统(ANS)进行沟通。
其次,细菌通过迷走神经和肠神经系统传入神经元的刺激在大脑和胃肠道微生物群之间建立直接的神经联系。
此外,迷走神经激活表现出抗炎作用,迷走神经活动对肠道微生物群及有益菌的产生积极影响。
迷走神经可以将胃肠道中的内分泌、神经元和微生物改变转移到大脑。
几项临床前研究表明,肠道疾病的病理生理学和发病机制,包括炎症性肠病(IBD)和肠易激综合征(IBS),以及神经系统疾病和精神疾病,包括焦虑、抑郁、自闭症、阿尔茨海默、多发性硬化和帕金森病,与肠道微生物群失衡有关。
由于微生物群-肠-脑轴(MGBA)内存在多种相互作用机制,胃肠道微生物组主要通过免疫相关、神经、内分泌和代谢信号通路与中枢神经系统进行通信。
肠道微生物可通过在肠腔中产生大量代谢物与宿主交换感官信息,包括神经递质、GABA、血清素、多巴胺和去甲肾上腺素,激素(如下丘脑-垂体-肾上腺轴中促肾上腺皮质激素释放激素的分泌)、组胺、乙酰胆碱、儿茶酚胺,以及几种维生素和短链脂肪酸。其中一些分子可以通过血脑屏障进入大脑,并影响神经回路。在这些代谢物中,短链脂肪酸是结肠细菌发酵膳食纤维产生的主要代谢物,在调节神经免疫内分泌、代谢稳态、感染和炎症方面发挥着关键作用。
许多种类的乳酸杆菌和双歧杆菌产生γ-氨基丁酸(GABA),这是大脑中主要的抑制性神经递质。
念珠菌、大肠杆菌和肠球菌会产生神经递质5-羟色胺,而一些芽孢杆菌会产生多巴胺。
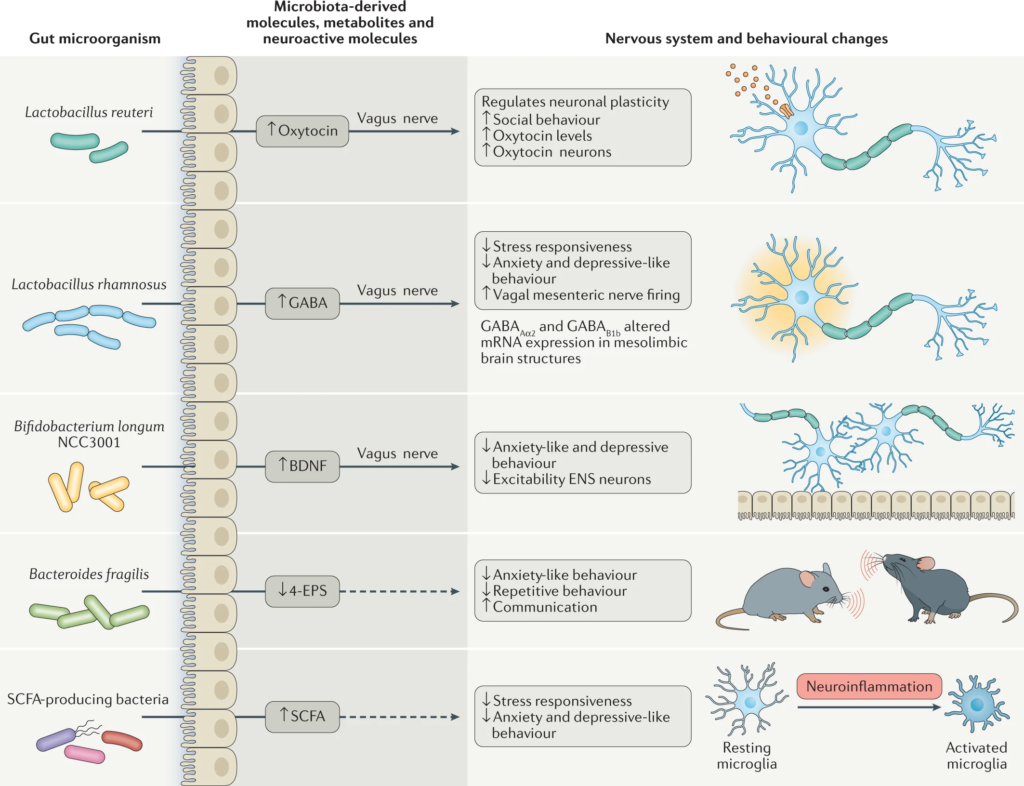
Morais LH, et al. Nat Rev Microbiol. 2021.
微生物群代谢产物,包括维生素、神经活性代谢物(如短链脂肪酸)和神经递质,介导双向微生物群-肠-脑轴相互作用以调节宿主神经生理学和免疫。
微生物代谢产物——短链脂肪酸,如乙酸、丙酸、丁酸,也可以通过进入体循环影响中枢神经系统。
短链脂肪酸能够刺激交感神经系统,粘膜血清素的释放,从而影响大脑的记忆或学习过程。
大约95%血清素(5-羟色胺)由肠粘膜嗜铬细胞产生。在外周,5-羟色胺参与Gl分泌、运动(平滑肌收缩和放松)和疼痛感知的调节,而在大脑中,5-羟色胺参与情绪和认知的调节。
肠道微生物群在色氨酸代谢中也起着重要作用,色氨酸代谢是产生5-羟色胺的前体。例如,婴儿双歧杆菌通过增加血浆色氨酸影响中枢5-羟色胺的传递。
我们知道了以上化学信使,那么它们通过什么途径去发挥作用?
细菌神经活性代谢物和饮食分子可以通过多种方式改变大脑和行为,例如影响上皮细胞以影响上皮屏障的功能,肠内分泌细胞释放激素,通过树突状细胞调节小胶质细胞和免疫细胞的功能。
代谢产物在通过血脑屏障运输后直接影响,或通过神经内分泌、免疫或迷走神经途径间接影响。
血脑屏障
细菌可以直接将因子释放到体循环中或可以转移到血液中。一旦进入血液,微生物组及其因子可以改变外周免疫细胞,促进与血脑屏障的相互作用,并最终与神经血管单元的其他元素相互作用。菌群代谢产物,例如短链脂肪酸,可穿过血脑屏障以影响脑功能。
肠道屏障
肠道微生物群还可以影响肠道屏障的完整性,控制信号分子从肠腔到固有层(包含免疫细胞和ENS神经元末端)或门静脉循环的通道。肠道屏障的完整性在某些神经精神疾病中会被破坏,如焦虑症、自闭症谱系障碍和抑郁症。
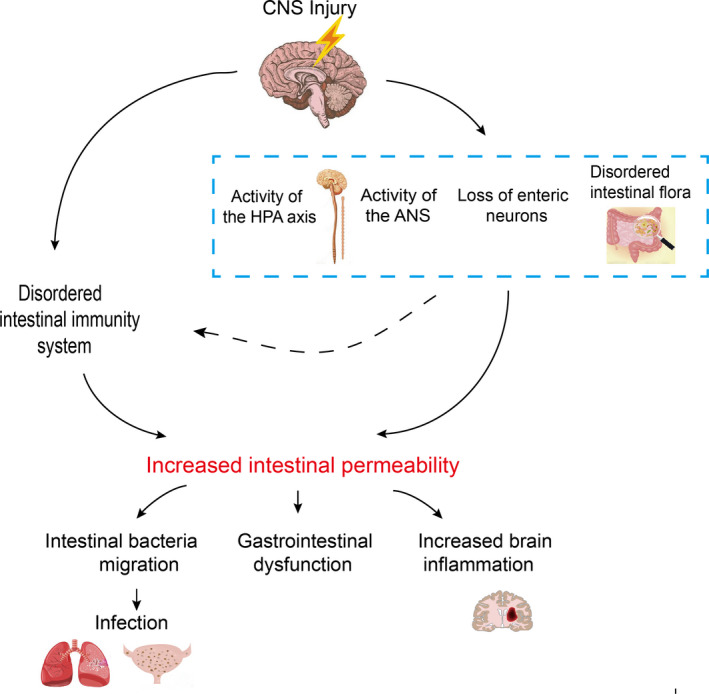
Li XJ,et al., CNS Neurosci Ther. 2020
肠道通透性
慢性应激可改变肠道通透性(肠漏综合征),这与低度炎症有关,在功能上与抑郁症等精神疾病有关。
在许多情况下,循环中细菌内毒素(脂多糖,LPS)的增加是导致疾病的基本危险因素。
肠道屏障和肠道通透性区别:
肠屏障
是将肠腔与内部宿主分开的功能实体,由机械元件(粘液、上皮层)、体液元件(防御素、IgA)、免疫元件(淋巴细胞、先天免疫细胞)、肌肉和神经元件组成
肠道通透性
指给定部位肠道屏障的功能特征,可通过分析整个肠壁或跨壁成分的定义分子的通量率进行测量
神经内分泌(HPA轴)
在神经系统内,应激是如何激活HPA轴反应?
该反应涉及下丘脑神经元,该神经元向大脑或门静脉循环分泌激素,如促肾上腺皮质激素受体激素(CRH),触发促肾上腺皮质激素(ACTH)的释放,然后启动皮质醇的合成和释放。
皮质醇调节神经免疫信号反应,进而影响肠屏障的完整性。
肠道渗漏导致促炎状态,循环中TNF-A、干扰素-y和IL-6水平升高。已知IL-6激活HPA轴。
随着时间的推移,它也下调糖皮质激素受体。这些受体是抑制HPA轴的反馈机制,然而,它们的下调导致HPA轴过度活跃和过度敏感。
有研究表明,这些变化导致海马5-羟色胺的减少以及BDNF表达的减少。BDNF表达降低是抑郁症发病的危险因素。
应激激素、免疫介质和CNS神经递质可激活肠神经系统的神经细胞和迷走神经的传入通路,从而改变肠道环境和微生物群组成。
目前,已经表明胃肠道微生物群在发展大脑免疫和神经发育中起着核心作用。
大脑并非免疫“特权”器官
免疫系统和中枢神经系统都是复杂而有组织的系统,在运作模式和发育过程中具有共同的特征。大脑中可以产生参与先天免疫的分子,如Toll样受体(TLR)、细胞因子、以及适应性免疫相关分子,如抗体受体和主要组织相容性复合体(MHC),这些分子在脑发育中起着关键的调节作用。
脑膜淋巴细胞和血脑屏障
尽管以前认为大脑是一个免疫特权器官,但它包含脑膜淋巴管。脑膜中淋巴管的存在使我们能够深入了解中枢神经外周免疫系统之间的可能联系,从而影响自身免疫。
此外,淋巴细胞和小胶质细胞可以调节认知,对神经元回路的正确连接也是必不可少的。小胶质细胞是巨噬细胞,占所有神经细胞的10%。它们负责中枢神经系统主动免疫防御的基本作用。而且大脑大部分区域的血管系统发展出选择性血脑屏障的组织特异性,允许所需分子进入大脑,并限制潜在有毒物质或细胞的渗透。
免疫影响大脑和神经
免疫细胞具有渗透大脑的能力。浸润性免疫细胞或小胶质细胞能够与中枢神经系统有效地相互作用,并影响大脑功能和病理学。
小胶质细胞从胚胎祖细胞中出现,并可在中枢神经系统中经历自我更新的过程。它们不仅参与典型的免疫功能,如吞噬和抗原递呈,还参与一些大脑生理活动。
免疫细胞如中性粒细胞、巨噬细胞、T细胞和自然杀伤(NK)细胞从大脑的外周循环血液进入。小胶质细胞对行为和某些神经系统疾病有着巨大的影响,如神经退行性疾病。
通常,成人大脑神经发生受宿主肠道微生物群的影响。成年小鼠的抗生素治疗影响肠道微生物群的多样性和海马的神经发生,而且益生菌具有重建肠道微生物群的能力并显示神经发生改善。
菌群与免疫
最近的许多研究表明肠道微生物组与大脑以及肠道微生物组与免疫系统调节之间存在联系。对无菌和对照啮齿动物的研究表明,肠道微生物组的缺失会加剧焦虑样行为。此外,如果肠道微生物群在生命早期恢复,这种行为完全可以治愈。微生物代谢产物可通过血液循环转移到大脑,并影响迷走神经或免疫系统和炎症反应,这表明由于生态失调引起的微生物代谢紊乱可对焦虑相关疾病产生巨大影响。
菌群招募免疫细胞
肠道微生物群落通过在各种免疫条件下招募不同的免疫细胞,直接或间接调节肠道内的免疫反应。胃肠道微生物的动态和异质性特征是宿主体内平衡的基础。据报道,与野生型小鼠相比,以胃肠道淋巴细胞水平降低为特征的免疫系统发育不平衡减少了无菌小鼠中免疫球蛋白a(IgA)、抗菌肽(AMP)和未成熟肠道相关淋巴组织(GALT)的数量,强调胃肠道微生物组在宿主免疫形成中的重要作用。
病原识别和抗体反应
此外,肠道免疫系统在区分共生动物和病原体以及确定导致免疫耐受的因素方面至关重要。因此,肠道菌群可以调节免疫系统的发育和功能,形成肠道微生物群落并调节肠道粘膜表面的病原体。例如,据报道,无菌小鼠中辅助性T细胞1(Th1)和Th17细胞数量的减少,以及IL-22和IL-17的减少,导致固有层数量减少。
影响T和B细胞发育和反应
肠道微生物组影响肠道T和B细胞反应的诱导和发展。肠道微生物群在肠道CD81 T淋巴细胞的激活中起着重要作用。
胃肠道微生物组影响固有层处肠道驻留B淋巴细胞的发育,因为无菌小鼠的固有层处B细胞计数较低。此外,这种类型的细胞也能够产生IgA,作为微生物成分的强调节因子。这表明在促进对共生微生物的免疫耐受以及在固有层中实现IgA的广泛多样化方面具有突出作用。
菌群代谢物参与免疫
对短链脂肪酸的研究表明,除了增强肠道系统中调节性T淋巴细胞的功能和数量外,它们还可以通过抑制转录因子NF-kB和HDAC活性来促进抗炎作用和肠道屏障功能。微生物肠道菌群与芳香烃受体(AhR)结合产生的色氨酸衍生物影响肠道免疫系统的功能。肠道菌群可产生精氨酸衍生物,包括二胺、精胺、亚精胺和多胺,通过增强常驻免疫细胞和肠粘膜的内环境平衡来调节免疫反应 。
微生物群与大脑之间通过肠脑轴的分子通讯途径
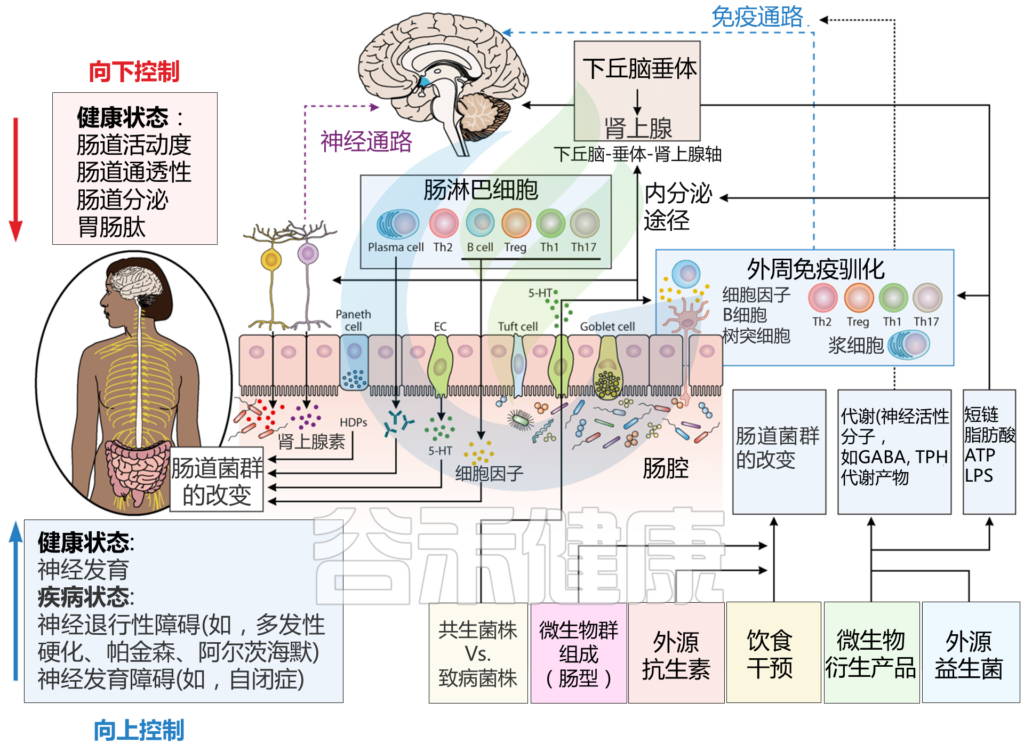
Sorboni SG, et al.,Clin Microbiol Rev. 2022
肠神经系统在人的一生中经历了一个巨大的发育变化,同时在病理生理功能方面保持了灵活性。因此,随着年龄的增长,肠神经系统开始衰弱,宿主微生物群、免疫系统和生理学也开始衰弱。
注:肠道神经系统是周围神经系统中最复杂、最重要的部分之一,由小神经节和神经元组成。这些神经元分布在整个胃肠道膜。
在了解菌群与神经衰退之前,首先看一下菌群与神经发育的关系。
大脑发育是一个复杂的过程,通常从妊娠第三周开始,一直持续到青春期晚期,生命的前3年被认为是胃肠道微生物群和脑突触形成的中心时期。
对无菌(GF)小鼠模型的研究表明,胃肠道微生物群、行为表现和大脑功能之间存在相关性。应激反应比无特定病原体(SPF)小鼠强烈得多。据报道,无菌小鼠模型中突触形成标记物水平的降低,包括分别负责突触成熟的突触素和PSD95,突出了共生细菌在大脑发育中的重要性。基于这些结果,肠道菌群似乎在大脑发育过程中对神经网络的形成起着核心作用。
部分自闭症患者表现出慢性便秘、肠道通透性增高、腹痛和肠道微生物群紊乱的症状,从而提供了生态失调和神经发育障碍之间的可能联系。微生物从母亲转移到胎儿、分娩方式、抗生素暴露和饮食习惯都会改变婴儿微生物群的定植和成熟。
怀孕期间补充抗生素会导致母体和新生儿肠道菌群的破坏,随后运动活动的减少,以及新生儿行为的改变。因此,临床证据支持抗生素诱导的失调与几种神经发育障碍的发展相关,包括精神分裂症、抑郁症和双相障碍。
尽管需要更多的研究来阐明上述因素与神经发育障碍之间的分子联系,但操纵早期生命微生物群可以被认为是预防自闭症和其他神经疾病的有益手段。
肠神经系统是否随年龄增长而变化?
一些研究认为随着年龄的增长,肌间神经元的数量和功能都会减少,而其他研究则没有报道这种后果。因此,肠神经系统是否会随着年龄的增长而发生变化仍在激烈争论中。
肠神经系统随年龄变化的研究表明,肠神经节的形态发生了变化,变性神经纤维的识别,α-突触核蛋白(α-syn)和脂褐素积累。这些报告表明老化和肠神经系统退化之间存在相关性。
肠神经系统在肠道细胞活动、营养吸收和肠道激素分泌中具有重要作用。针对肠神经系统的研究虽多,但机制不明确。根据以上研究证据,有理由假设肠神经系统发生了退化性变化,与宿主生理学、代谢、微生物群以及与衰老相关的免疫系统的变化相一致。
考虑到肠神经系统细胞不同的功能和形态特征,不同的细胞类型在年龄相关疾病的易感性中起主要作用。代谢活跃的神经细胞中氧化DNA损伤和活性氧(ROS)产生的负担可能是肠神经系统衰老的另一个潜在因素。
根据强调在老年动物模型中降低钙结合蛋白表达的重要性的研究,钙失调也可被认为与肠神经系统衰老有关。也有报道称,在衰老过程中,肠神经细胞中的钠通道基因表达显著改变。
对肠神经系统的年龄相关影响的额外研究是必要的,可能有助于对这些复杂的衰老和胃肠道关联的新理解,也可能带来新机会,发现治疗各种年龄相关神经疾病的新治疗方法,以及改善老年人的生活质量。
肠道微生物群与肠神经系统
考虑到胃肠道肠道神经元附近定植的微生物,肠神经系统似乎与肠道微生物群高度相关或可能受其影响。
几项研究表明,新生儿肠神经系统的发育是由早期暴露于肠道常驻微生物形成的。此外,肠道微生物群可以调节神经胶质细胞对固有层的初始定植以及稳态。
随着年龄的增长,拟杆菌和变形杆菌(尤其是Gammaproteobacteria)数量增加,厚壁菌和双歧杆菌数量显著减少。
与衰老过程中肠道微生物群的实质性变化类似,成人肠道神经元对年龄相关损伤的敏感性更高。肠道微生物群平衡的改变,包括条件致病菌的增加和有益菌或共生菌的减少,可导致胃肠道的不同微生物代谢产物谱。
因此,由肠道菌群的年龄相关改变引起的肠道炎症水平升高会影响肠神经系统,并导致肠道神经元不同生理和神经化学功能的损害或丧失,从而导致年龄相关疾病的发生。
肠神经系统还可以调节肠道微生物群落组成,维持和促进肠道健康。此外,肠道微生物群落的缺失可导致肠神经系统功能的异常和改变。
也有研究表明,肠道失调和肠道病理的发展与胃肠动力紊乱相关,表明肠神经系统在肠道微生物群维持和预防可导致宿主疾病的病原菌过度生长中的重要作用。
尽管确切的机制仍需澄清,但从肠-脑轴和老年人群神经病变的角度来看,肠道微生物群、粘膜免疫系统、肠道神经元和肠上皮细胞之间复杂的相互作用和相互作用强调了该领域研究的重要性,并强调了进一步研究的必要性。
胃肠道菌群和神经-肠内分泌系统中与年龄相关的变化可能通过肠-脑信号通路功能障碍影响大脑健康的分子通路图如下。
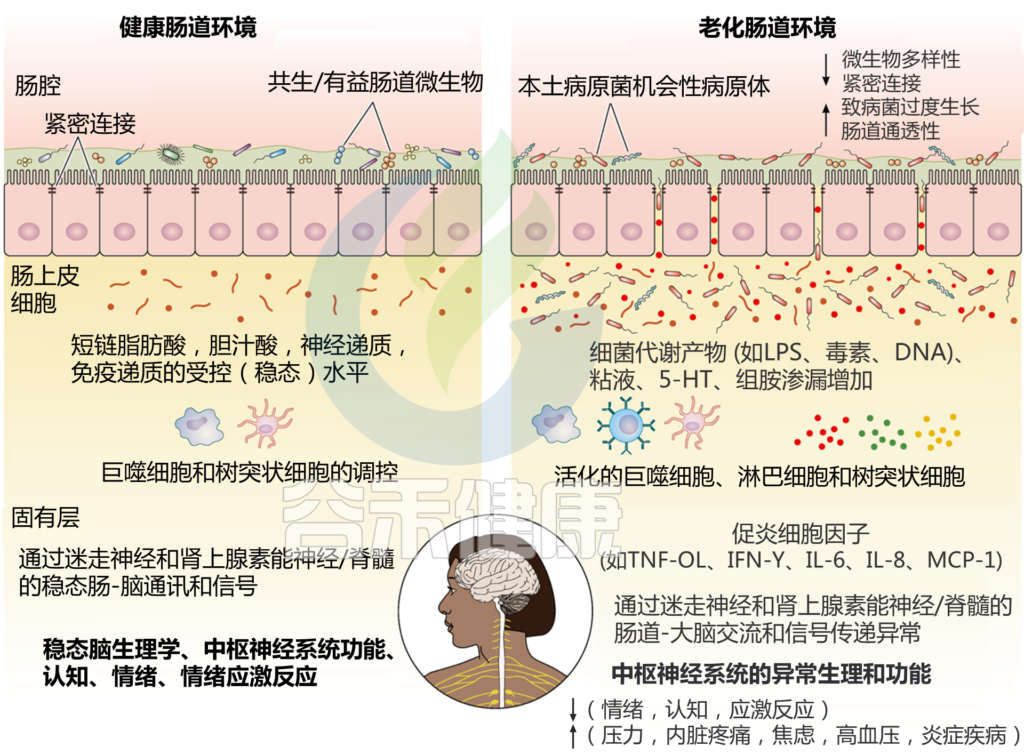
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在健康成人中,平衡的肠道菌群和肠道屏障完整性有助于维持平衡的微生物群落及其代谢产物,包括短链脂肪酸。胃肠道中神经递质的适当产生有助于通过巨噬细胞和树突状细胞的平衡增殖维持受控的肠道炎症和免疫系统,最终导致受控的肠脑通讯和中枢神经系统的适当功能。
然而,在衰老宿主中,胃肠道微生物群落多样性的改变和肠道屏障完整性的破坏,通过短链脂肪酸、LPS、5-羟色胺、组胺、葡萄糖和葡萄糖水平的不平衡,导致胃肠道上皮细胞衬里的生化和微生物微环境发生扰动,分泌性免疫球蛋白(sIgA)等。因此,在肠道环境中诱导过度激活的炎症环境导致健康肠道-大脑沟通中断。
老化的微生物组本身足以导致认知障碍
微生物群移植研究表明,老化的肠道微生物群可导致年轻受体发病。从老年供体小鼠到无菌受体小鼠的肠道微生物群移植有助于促进肠道炎症和增加通透性,这表明与较高水平的变形菌和TM7细菌相关。
最近的一项研究表明,来自老年供体小鼠的粪便微生物群移植导致年轻受体小鼠的空间学习和记忆障碍,产短链脂肪酸菌显著减少,包括Faecalibaculum、毛螺菌科和瘤胃菌科。
从老龄小鼠模型到无菌小鼠的粪菌移植导致粪便短链脂肪酸生成减少、促进抑郁样行为和短期记忆障碍,表明老龄肠道微生物组能够降低宿主的短链脂肪酸水平和随后的认知能力下降。
从老龄供体到年轻受体大鼠的粪菌移植导致受体小鼠的认知行为损伤、突触结构改变、糖基化终产物水平升高以及炎症和氧化应激增加。
自闭症谱系障碍
精神分裂症
抑郁症
自闭症谱系障碍(ASD) 包括一系列复杂的神经发育障碍症状,包括社交和交流障碍,以及限制性和重复性行为模式。
谷禾参与组织的一项多中心合作的自闭症谱系发育障碍与肠道菌群研究,该项目共包括 773 名自闭症受试者(16 个月至 19 岁)和 429 名神经典型 (NT) 发育受试者(11 个月至 15 岁)。该研究已发表的在《GUT》。【实际上这个研究仍在继续,目前我们已经构建了超过3000例的自闭症样本队列】
这项研究详细分析了不同年龄发育阶段自闭症儿童的菌群与正常儿童的差异和变化,并揭示了临床症状相关的自闭症儿童肠道微生物组发育动态特征。
研究显示多种菌、菌群代谢功能的改变与自闭症儿童的行为、睡眠和胃肠道症状的严重程度有关。
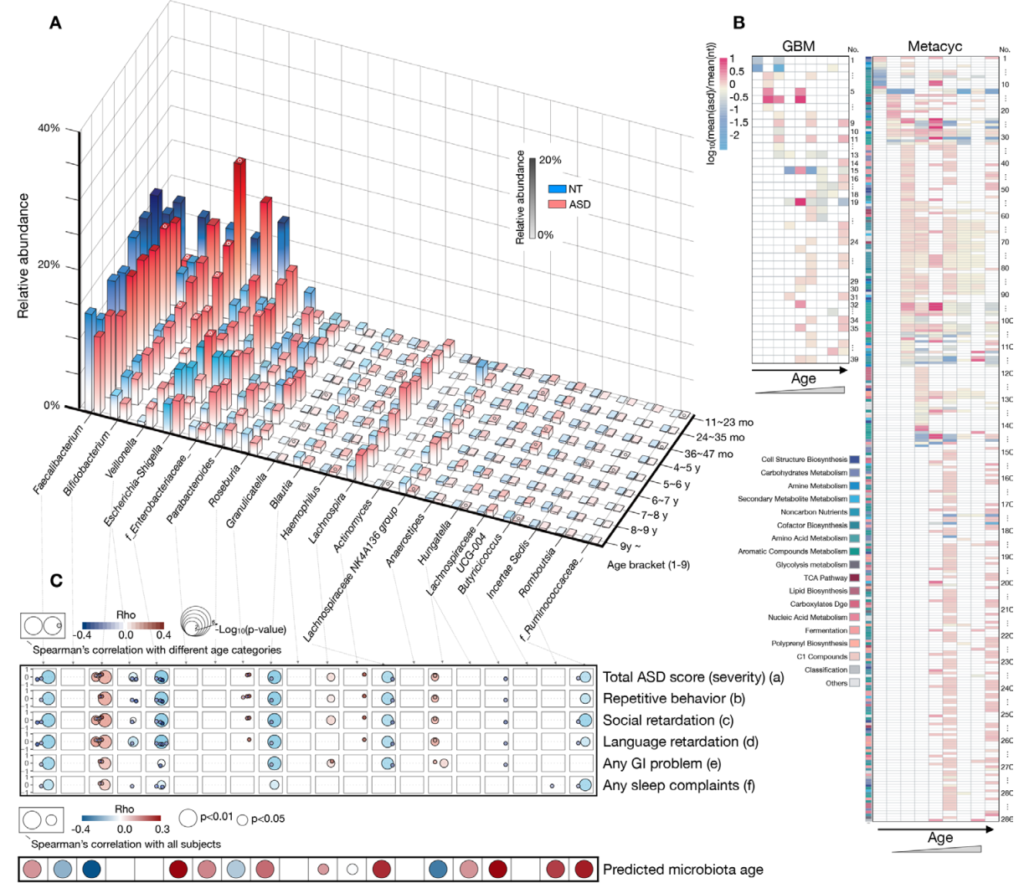
Lou M, et al., Gut. 2021
为了更好的应用于临床,我们尝试并给出了基于微生物群的疾病诊断模型,并在不同年龄和地区显示出很好的模型效果。
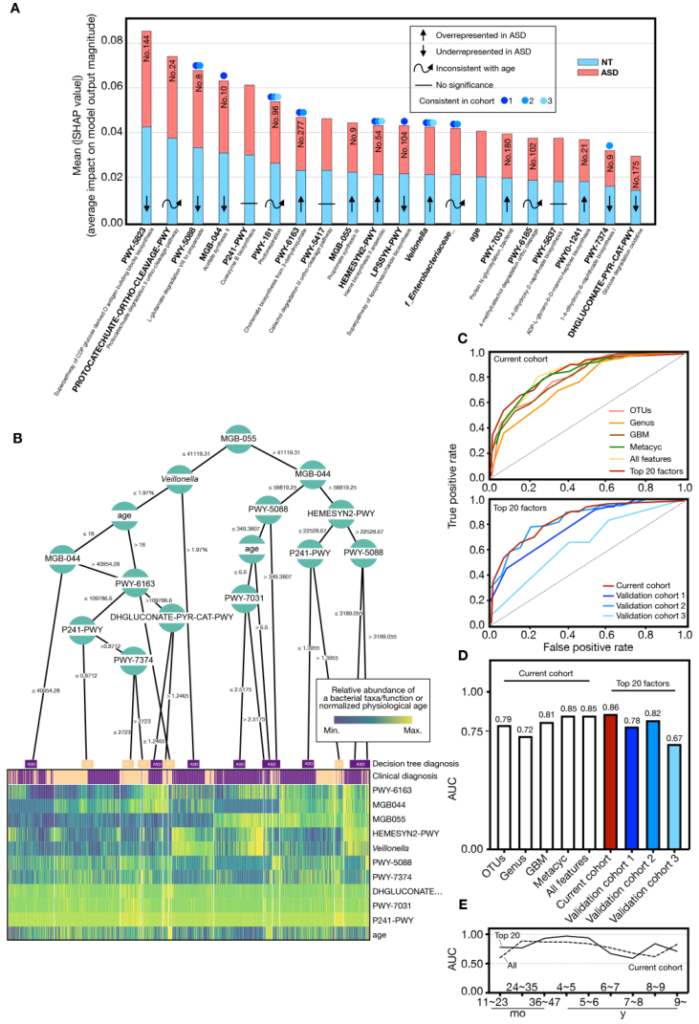
Lou M, et al., Gut. 2021
尤其是在早期,基于肠道菌群的模型对于临床鉴别和评估有更大价值。因为很难对低龄幼儿进行行为学评估,而错误的评估很容易错过早期干预的黄金时机,肠道菌群模型可以更加量化的评估,而不依赖问询或行为学,可以很好的对现有临床诊疗进行补充。
遗传和环境因素
自闭症的确切病因尚不确定。然而,有大量的临床证据表明,遗传和环境因素在该病的发病中起着至关重要的作用。已经确定了100多个影响中枢神经系统发育的基因和基因组区域,这些基因和基因组区域可能与自闭症的发展有关。
环境因素,如营养不良、病毒和婴儿期发育错误,特别是发育中大脑中七种蛋白质的母体自身抗体,也与自闭症有关。这些环境因素现在已经被证明对自闭症有着比以前认为的更重要的作用。
微生物群-大脑重要作用
大约40%的自闭症患者经历更多的胃肠功能障碍,包括肠功能改变和腹部痉挛(疼痛)、腹泻、反流和呕吐。
胃肠道症状与自闭症严重程度之间的相关性表明了肠道与大脑之间联系的重要性。
人们逐渐发现肠道中的微生物群和大脑相互作用在自闭症等神经精神疾病中起着关键作用。
肠道微生物群的组成与年龄有关。肠道微生物群正常组成的改变会增加致病菌的数量,从而导致感染。
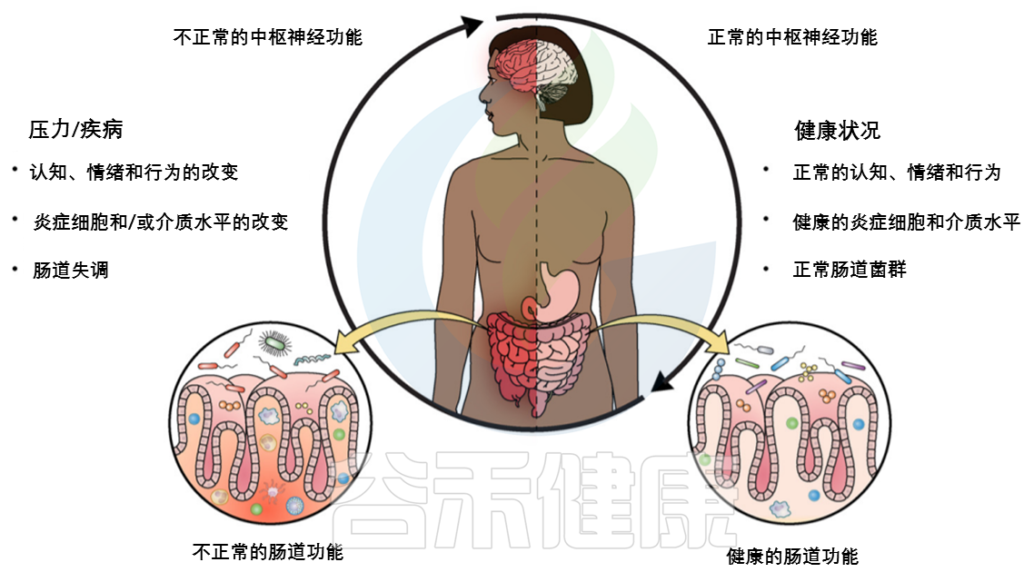
Sorboni SG, et al.,Clin Microbiol Rev. 2022
肠道失调 -> 炎症
自闭症患者的胃肠道紊乱和中枢神经系统症状可能与肠道失调引起的炎症状态有关。
根据最新研究,自闭症儿童的肠道微生物群组成发生了显著变化,胃肠道症状可能代表了炎症过程。炎症与肠粘膜屏障对细菌神经毒性肽(如脂多糖)的通透性增加和炎性细胞因子的产生有关。细菌代谢产物在肠-脑轴中起着至关重要的作用;因此,肠脑信号中断可能与自闭症和帕金森等神经精神疾病有关。
最近关于微生物干预预防和治疗自闭症的潜力的研究
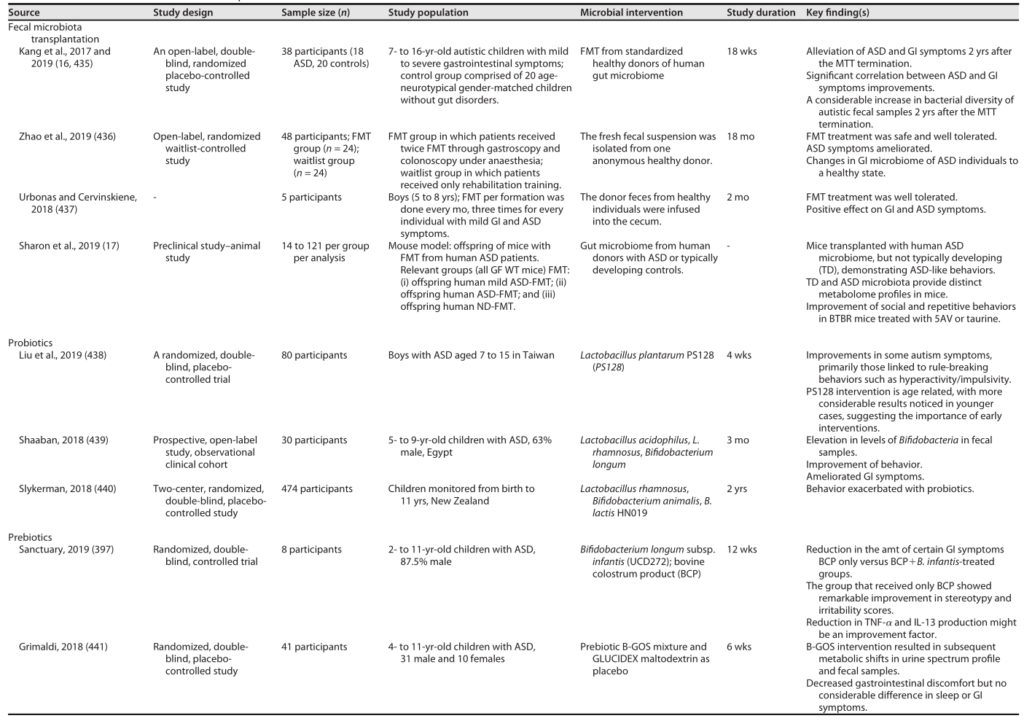
Sorboni SG, et al.,Clin Microbiol Rev. 2022
自闭症患者肠道菌群变化
自闭症儿童甚至成人的肠道微生物群与健康对照组完全不同。
对自闭症儿童粪便样本的调查表明,由于拟杆菌数量减少,拟杆菌/厚壁菌比例降低。
在患有自闭症的儿童中,乳酸杆菌、梭状芽孢杆菌、脱硫弧菌、Caloramator、Alistipes、Sarcina、Akkermansia、Sutterellaceae、肠杆菌科的水平升高。
许多研究人员已经评估了梭菌的丰度及其作为危险因素的作用。对自闭症儿童每周使用万古霉素治疗可显著改善神经行为和胃肠道症状。
发送信号 -> 控制肠通透性
除了肠道微生物群在免疫系统发育中的作用外,梭状芽孢杆菌通过肠上皮或迷走神经的传入纤维向大脑发送信号,并控制肠道通透性。
代谢
据报道,肠道微生物可通过产生酚类、短链脂肪酸和游离氨基酸等代谢物在肠道通透性中发挥重要作用。自闭症儿童丙酸和乙酸的比率较高,但丁酸的比率较低。非消化性碳水化合物的最终产物可能与自闭症发病机制有关。
详见:如何通过喂养菌群产生丁酸调节人体健康
自闭症儿童和正常发育儿童的粪便和血浆代谢组比较显示线粒体功能障碍;自闭症儿童中不同水平的酚类微生物代谢产物、脂质、氨基酸和外源性代谢可能被用作自闭症的分子生物标记物。
在另一项研究中对患有自闭症的儿童的血浆代谢物进行精确评估后,血浆代谢物的水平,包括烟酰胺核糖苷、IMP、亚氨基二乙酸、甲基琥珀酸、半乳酸、丙氨酸甘氨酸、肌氨酸和亮氨酸甘氨酸,明显较低。
然而,在微生物群转移疗法(MTT)后,这些代谢物发生了实质性变化,使其中一些与典型发育中儿童的代谢产物相似。
干预(饮食、微生物等)
已经证明,影响孕妇胎儿微生物群的高脂肪饮食也可能与自闭症有关。此外,母乳喂养6个月降低了自闭症表现的机会,而配方奶粉喂养与肠道艰难梭菌数量增加相关。
《cell》发表的关于自闭症的文章显示,与自闭症相关的行为与饮食多样性的减少有关。并提示在对精神疾病患者的微生物组分析时,应考虑饮食相关因素。
由于益生菌可以发挥抗炎作用并减轻IBD受试者的胃肠道症状,据报道微生物干预,如益生菌,可有助于减少自闭症患者的社会行为症状和炎症水平。
总的来说,自闭症患者肠道微生物群改变已得到证实。然而,考虑到参与患者的异质性和几个相互矛盾的结果,很难建立自闭症的独特特征。考虑到肠道功能障碍与自闭症患者社会行为障碍严重程度的不一致,这些数据提示我们应该考虑两种不同类型的自闭症,这些炎症类型与胃肠道并发症相关。
在各种治疗自闭症的方法中,益生菌治疗的结果很有潜力,同时也应考虑耐受性和安全性评估。鉴于微生物群分析方法的局限性,有必要进一步使用随机、安慰剂对照临床试验,以验证益生菌治疗自闭症的有效性。
精神分裂症(SCZ) 是一种严重的精神疾病,与幻听、妄想、思维和行为紊乱有关,损害日常功能和社会交往。
精神分裂症的生理病理学尚未得到解释,但最近的研究表明,环境因素增加了可能具有该疾病遗传易感性的个体发生精神分裂症的风险。
神经递质在多个系统中的功能障碍已被广泛研究,特别强调了信号异常的重要性,包括多巴胺、5-羟色胺、谷氨酸和GABA。
此外,炎症的重要性以及胃肠系统在精神分裂症病因中的可能作用正在考虑之中。
肠道菌群及其代谢物的影响
胃肠道微生物群在神经生成途径和肠道微生物组中起着至关重要的作用,微生物代谢物扰动已被证明会影响情绪和行为。
肠道微生物组的改变与几种神经发育和神经系统疾病相关。最近有研究表明,来自精神分裂症受试者的粪便移植到无菌受体小鼠,可诱发精神分裂症相关的行为症状。这与海马中GABA、谷氨酰胺和谷氨酸水平的改变有关。这表明精神分裂症患者的微生物群可能对神经化学产生影响,这可能与这些人类条件有关。
目前还没有报告可以促进受试小鼠模型行为改变的特定细菌功能。根据各种研究显示,放线菌、变形菌、拟杆菌和厚壁菌群在精神分裂症患者中的差异最大。
抗生素或许发挥作用
有趣的是,在一项体外研究中,补充抗生素减少了小胶质细胞对突触的吞噬。小胶质细胞降低了中枢神经系统突触的密度,这被认为是精神分裂症发育的一个重要步骤。
在对一组青少年的电子健康记录进行检查后,服用二甲胺四环素与精神分裂症的发病率略有降低有关,这意味着需要更多的研究来调查精神分裂症中微生物群的相关性。
益生菌缓解精神分裂症的消化障碍
根据SCZ的严重性和复杂性,尚未有研究证实精神分裂症患者通过补充益生菌来缓解任何行为症状。然而,一些研究认为,服用益生菌至少可以缓解与精神分裂症相关的消化障碍。
精神分裂症的微生物干预
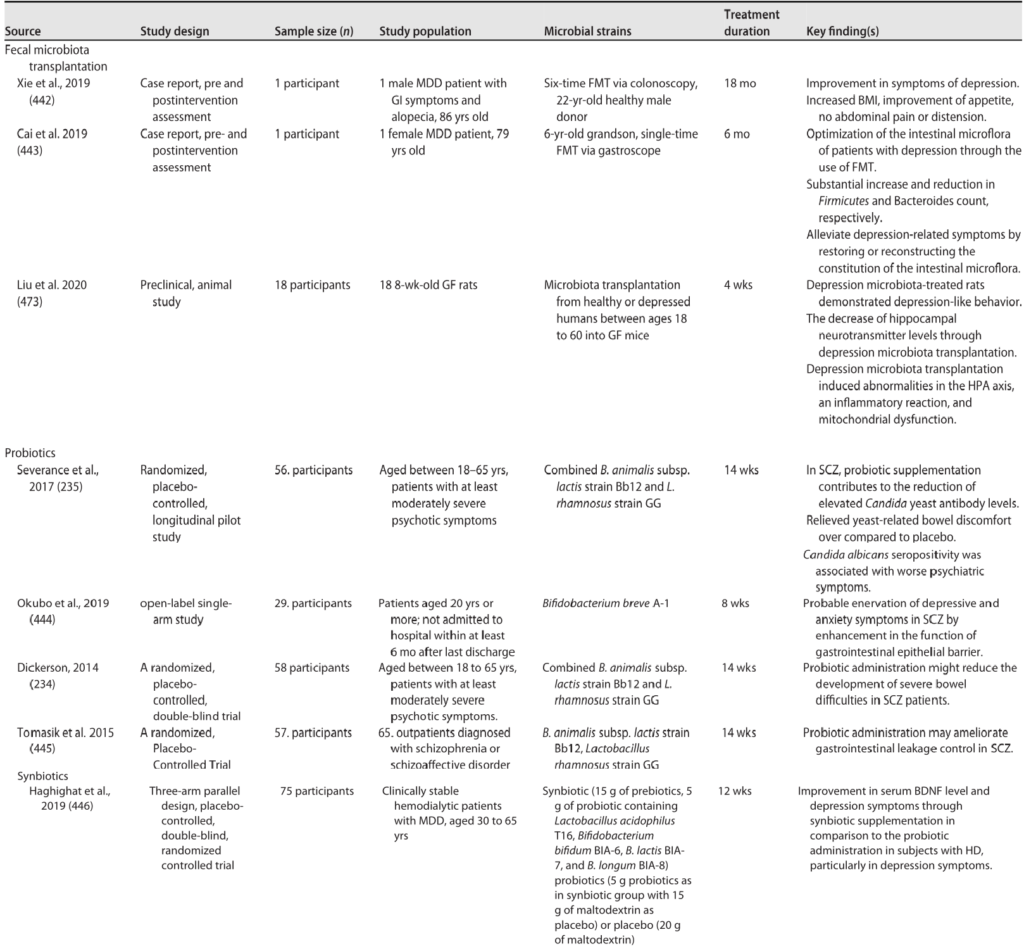
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在一项人类临床试验中,严重的胃肠道问题减少了,精神分裂症患者的精神症状没有任何改变。
另一项人体试验证明了白色念珠菌与胃肠道问题之间的相关性,在服用特定益生菌补充剂(包括鼠李糖乳杆菌GG和动物乳双歧杆菌Bb12)的男性患者中,精神症状有所改善,且白色念珠菌血清阴性。
已经发现了一整套针对严重精神病性疾病的新颖、可能的治疗干预措施,包括考虑肠道舒适性。需要进行更多的研究,通过纵向数据分析和更大的样本量来提高我们对胃肠道微生物群参与精神分裂症的理解。胃肠道微生物的功能和分类对于全面精神分裂症至关重要。
抑郁症是世界范围内导致严重残疾的一种常见的异质性疾病,其特征是情绪低落,经常伴随着对个人通常认为是愉快的活动失去兴趣。其严重形式为重度抑郁症,被归类为心境障碍。抑郁症对人们的健康有着更大的负面影响,并且它带来了与吸烟、血压和饮酒类似的死亡风险。它是癫痫和主要神经退行性疾病(下节内容)的相关共病,其病因包括代谢、神经内分泌和神经免疫因子。
抑郁症主要是一种脑部疾病,但大脑并不是孤立存在的,它存在于包括肠道在内的整个身体生理系统中。如果说成年健康个体的肠道菌群主要由拟杆菌和厚壁菌门组成(90%),那么重度抑郁症患者的肠道菌群在拟杆菌门、厚壁菌门、变形菌门和放线菌门的不同属的丰度上表现出显著变化。
在人类和动物模型中研究发现,临床抑郁症与肠道微生物群丰富度和多样性降低有关。来自抑郁症患者或对照组的粪便微生物群样本移植到微生物群缺陷大鼠模型中,诱发了抑郁症的行为和生理特征,包括快感丧失和焦虑样行为。
慢性炎症可能在重度抑郁症(MDD)的发病机制中发挥重要作用,肠道菌群的内环境平衡失调可能导致此类炎症,这表明胃肠道菌群在影响大脑发育、情绪和行为方面起着中心作用。
这些作者得出结论,生理和情绪压力会影响肠道微生物组的组成。
抑郁症通常与肠易激综合征共存,肠易激综合征的特征是肠道功能的改变,从动物研究中获得的数据表明,肠道微生物群可能影响抑郁症的神经生物学特征。
利用小鼠双侧嗅球切除术(已知会诱发抑郁样行为)来研究其是否会导致微生物群组成的变化:球切除术诱导的慢性抑郁导致肠道微生物谱改变,同时结肠运动、c-Fos活性和5-羟色胺水平增加。
由于抑郁症是肥胖患者的常见症状,研究人员从肥胖小鼠(表现出抑郁症样行为)移植到非肥胖对照小鼠体内的微生物组,观察发现在体重无显著差异的情况下,对照组非肥胖小鼠中肥胖衍生的微生物群重新定植导致探索、认知和定型行为的中断。
抑郁样行为也可以通过应激模型在小鼠中诱导,例如慢性社会挫败应激(CSDS)范式,在该范式中,小鼠反复遭受更大、更具攻击性的小鼠的社会挫败。应激小鼠表现出抑郁样行为,并表现出微生物多样性的变化,其中脱硫弧菌科、Rikenellaceae、毛螺菌科的数量增加,Allobaculum、Mucispirillum的数量减少。
现有证据表明,肠道微生物群可能在抑郁症的发展中起到因果作用,并且可能被认为是治疗/预防这种疾病的一个有价值的靶点。
神经退行性疾病是一类复杂疾病,脑和脊髓的神经元随时间发展而损害逐渐加剧,以特异性神经元的大量丢失为主要特征。这里介绍几种常见的神经退行性疾病及其与肠道微生物群的关系:
多发性硬化
帕金森病
阿尔茨海默
癫痫症
中风和脑损伤
多发性硬化
多发性硬化症(MS)是一种免疫介导的慢性中枢神经系统疾病,涉及受损轴突和脱髓鞘,影响全球约230万人,女性发病率较高。
多发性硬化的致病特征
在中枢神经系统中形成炎性局灶性脱髓鞘斑块,包括脊髓和大脑的灰质或白质,并触发神经炎症反应,导致包括少突胶质细胞在内的特殊细胞脱髓鞘,并导致神经退行性变。
脱髓鞘如何形成?
由于血脑屏障的异常通透性,免疫系统的各种细胞渗入中枢神经系统,导致脱髓鞘的发生。髓鞘抗原特异性T细胞(CD81和CD41 T细胞)穿过这一屏障,导致一系列事件导致脱髓鞘病变的形成。
多发性硬化发病的免疫机制
最近对多发性硬化小鼠模型(包括实验性自身免疫性脑脊髓炎模型)的研究表明,CD41 T淋巴细胞在多发性硬化发病机制中起主要作用。尤其是,CD41Th17和Th1淋巴细胞在多发性硬化发病中具有最突出的作用。
Th1有助于分泌δ干扰素(IFN-d),在活化后促进巨噬细胞酶的产生。此外,IFN-d刺激活性氮和活性氧的产生,分别导致细胞结构的亚硝化和氧化损伤。Th1细胞还能够产生IL-12,从而诱导肿瘤坏死因子(TNF-a)和IFN-d的分泌,导致慢性炎症反应和进一步的组织损伤。
由Th17细胞介导的特定细胞因子(包括IL-22、IL-21和IL-17)的产生导致慢性炎症进展。识别中枢神经系统自身抗原(如Th1和Th17)的CD41 T淋巴细胞参与多发性硬化的病理生理学。
除了CD81和CD41细胞外,其他免疫细胞也与多发性硬化发病有关,包括NK细胞、小胶质细胞和巨噬细胞。这些细胞与其细胞因子之间的分子相互作用维持了中枢神经系统内的炎症级联反应。
多发性硬化的几种临床变异
包括最常见的复发缓解型多发性硬化和进行性复发型多发性硬化,以及原发性进行性多发性硬化和继发性进行性多发性硬化(SPMS)。
遗传易感性和环境因素在多发性硬化症的病因中都起着重要作用。
肠道微生物群参与免疫调节
最近的研究表明,肠道共生微生物群落也与多种免疫介导的疾病(如多发性硬化)有关,可以认为是一种新的环境风险因素。换句话说,肠道微生物群负责免疫调节,改变血脑屏障的完整性和功能,刺激自身免疫脱髓鞘过程,并与中枢神经系统中存在的各种细胞类型直接相互作用。
与肠道微生物群α或β多样性的广泛差异不同,横断面调查主要揭示了多发性硬化儿童与健康个体相比在分类上的明显改变。
一些研究评估了多发性硬化患者微生物移植到两种不同的实验性自身免疫性脑脊髓炎(EAE)模型中的效果;这些研究强调了产生IL-10的CD1 T细胞在胃肠道微生物群介导的免疫调节中的重要性。
此外,胃肠道中SFB的存在,可能在Th17细胞活化中起作用 ,显著影响EAE小鼠的多发性硬化样症状。根据多发性硬化作为脱髓鞘疾病的定义,临床前抗菌研究表明,在汇集来自无菌小鼠模型的数据后,胃肠道微生物群可以调节小鼠模型前额叶皮质髓鞘的生成。
肠道菌群在血脑屏障调节中的基本作用
无菌小鼠研究表明,作为多发性硬化的一个主要标志,微生物组与血脑屏障完整性的丧失之间可能存在关联。
研究还表明,在膳食中补充短链脂肪酸或产短链脂肪酸的菌,可以逆转血脑屏障完整性的丧失。此外,饮食诱导的肠道微生物群落结构变化也参与了EAE的表现。
有证据表明,肠道微生物群可以调节大量的神经炎症途径。然而,补充研究对于理解多发性硬化病因的确切作用机制至关重要。动物和人类研究表明,肠道菌群可能与多发性硬化生理病理学的许多方面有关。
干预措施
关于如何有效地控制肠道微生物组作为一种干预措施,以最大程度地阻止复发和缓解症状,问题仍然悬而未决。
在一项试点实验中,补充一种特定的益生菌制剂(含有双歧杆菌、乳酸杆菌和链球菌)可以逆转微生物群的改变并调节炎症反应,这表明这种微生物群靶向治疗是有希望的(下表),尽管需要进一步调查以确认这些结果。
多发性硬化的微生物干预
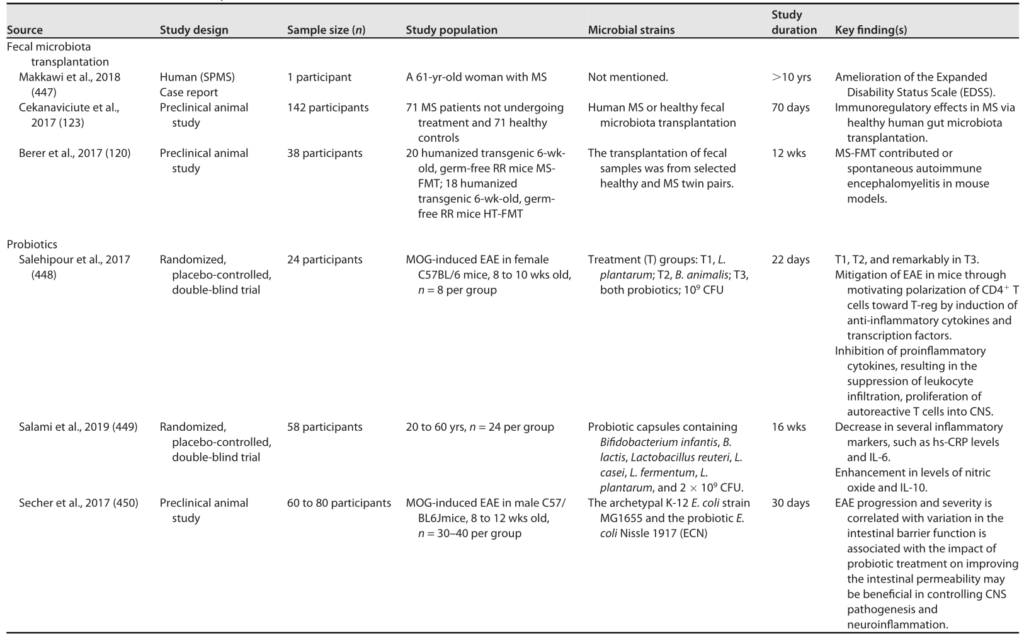
Sorboni SG, et al.,Clin Microbiol Rev. 2022
帕金森病
帕金森病(PD)是一种进行性多中心神经退行性疾病,由α-突触核蛋白(α-syn)沉积在部分大脑中心黑质的多巴胺能神经细胞中引起。这些过程促进了圆形片状嗜酸性细胞质内含物的逐渐聚集,称为Lewy小体。
然而,帕金森发病机制的确切机制仍不明确,它可能是一种多因素疾病,在这方面引入了各种理论。
衰老是帕金森发展和进展的重要风险因素
影响多种细胞途径,导致这些过程受损,并导致神经退行性变。可以想象,年轻神经元可以容忍的相同分子扰动在老年神经元中显示出一些灾难性后果。
帕金森病的临床症状主要表现为运动障碍症状,包括肌肉僵硬、静止性震颤、运动迟缓和姿势不稳 。帕金森病在50岁之前很少见,但随着年龄的增长,发病率会增加5到10倍。它主要发生在男性,每年每100000人中有5-35例新病例。
多巴胺能神经元逐渐退化,非运动和运动症状如抑郁症、痴呆症和胃肠道问题(包括便秘、唾液分泌异常、排便功能障碍、恶心和吞咽困难)之间存在着强相关。帕金森症状因个体而异。
几项研究表明,帕金森受试者的胃肠道异常与肠神经系统中的肠道失调和α-突触核蛋白沉积有关。
肠道菌群如何影响帕金森?
由于最初的胃肠道参与帕金森,并且宿主微生物组之间的生理相互作用潜力很大,因此有人认为胃肠道菌群可能影响帕金森。胃肠道功能异常,尤其是便秘,影响多达80%的帕金森病患者,并且可能在出现运动症状前几年发生。
特发性便秘是帕金森的主要相关因素,与肠神经系统的神经退行性改变有关。肠神经系统中的α-syn神经退行性变可能是帕金森的运动前临床症状之一。它与慢性便秘和胃肠道壁的生理改变有关。
肠道微生物群可能影响参与α-syn分泌的肠道神经元。这些变化在运动症状出现之前的帕金森开始时就已出现,可认为是运动前生物标记物。
——Prevotellaceae减少
对肠道微生物组与帕金森患者之间的相关性进行了不同的研究。一项研究观察到帕金森病患者粪便样本中Prevotellaceae种类显著减少。与对照组相比,Prevotellaceae的丰度显著降低(77.6%)。
Prevotellaceae通过膳食纤维发酵和肠道中的粘蛋白率先产生短链脂肪酸。Prevotellaceae减少引起的细菌内毒素全身暴露和肠道通透性的增强可触发α-syn结肠的不受控制的表达和错误折叠。
这种肠型负责硫胺素、叶酸和神经活性短链脂肪酸的生物合成。因此,补充这些维生素和短链脂肪酸可能有助于治疗帕金森。
最近的研究首次承认,帕金森病患者的机会性病原体数量显著增加。
——肠杆菌科丰度增加
步态困难姿势不稳的严重程度与肠道内肠杆菌科丰度呈正相关。肠杆菌科细菌在肠道中的过度生长导致作为血清中革兰氏阴性细菌细胞壁一部分的LPS滴定增强 。因此,研究表明,由于帕金森患者血液样本中LPS的吸收增加,LPS结合蛋白的全身浓度异常高。
——乳酸杆菌科的丰度增加
与Prevotellaceae一样,乳酸杆菌科与胃肠激素ghrelin有关。也有报道称帕金森患者的ghrelin分泌减少。
总的来说,研究结果揭示了胃肠道微生物群和帕金森作用之间的联系。进一步的微生物组学分析可能会提高准确性,澄清关系以及机制。
帕金森患者中菌群失衡可能会影响炎症,因为菌群失调会损害肠道屏障功能并触发免疫激活和全身炎症反应。
帕金森的持续存在会影响微生物群,肠道菌群可能在一些腹部症状中起作用,如便秘和炎症。
肠道屏障破坏
简而言之,LPS和其他细菌神经毒素在穿过肠壁后进入血液,导致肠上皮屏障的破坏。血液中细菌LPS的存在导致通过核因子kB(NF-kB)和TLR4产生炎症细胞因子,导致全身炎症。细菌LPS和炎性细胞因子(包括TNF-a、IL-1b和IL-6)诱导的血脑屏障破坏触发α-syn的积累。位于黑质的多巴胺能神经元丢失可能是血脑屏障分解的结果。由于帕金森的肠屏障破坏导致微生物易位升高和促炎症基因谱升高,结肠活检标本显示TLR4或细菌内毒素特异性配体、CD31 T 细胞和其他细胞因子的表达增强。
产短链脂肪酸的细菌减少
帕金森病患者在肠道失调期间产短链脂肪酸的细菌减少。TLR4介导的炎症在脑或肠道炎症中发挥重要作用,这可能是导致帕金森神经退行性变的重要因素之一。因此,增强肠道内肠杆菌科后LPS的相对增强与帕金森的发生相关。
闭塞和其他紧密连接蛋白对肠屏障结构至关重要。肠道生态失调,使闭塞素降解,导致肠道通透性增强。
促炎细胞因子升高
另一项针对帕金森病患者的研究调查了其粘膜中Ralstonia、肠球菌和变形菌浓度的增加,导致促炎细胞因子的升高。
帕金森受试者粪便样本中被认为具有抗炎作用的产丁酸菌(如布氏杆菌、粪球菌、粪杆菌和罗氏菌)数量显著减少。
此外,据报道,帕金森患者粪便样本的微生物群中LPS生物合成基因表达增加。有趣的是,幽门螺杆菌感染可被认为是帕金森发病机制中的一个重要触发因素。
小肠细菌过度生长(SIBO),与运动功能障碍有关,尤其是在帕金森患者中。
牙龈假单胞菌感染在帕金森的病因/危险因素中的重要作用
牙龈卟啉单胞菌的牙龈蛋白酶和LPS导致帕金森样本中出现异常血凝块。研究发现只有帕金森样本的凝块中观察到了牙龈蛋白酶抗体信号,这证实了这种细菌在帕金森病理学中的潜力。他们进一步指出,据报道,牙龈假单胞菌诱导的外周炎症导致肠道微生物群失衡,黑质多巴胺能神经元减少,肠道通透性增加,以及富含亮氨酸重复激酶2(LRRK2)相关帕金森病理生理学中小胶质细胞活化增强。
益生菌缓解症状
益生菌,包括乳酸杆菌和双歧杆菌,已被证明可以缓解帕金森样症状。
帕金森的微生物干预

Sorboni SG, et al.,Clin Microbiol Rev. 2022
芽孢杆菌作为一种益生菌,能够将L-酪氨酸转化为L-多巴,L-多巴是多巴胺的重要前体分子,其转化为多巴胺是通过多巴脱羧酶进行的。
据报道,定期服用含有干酪乳杆菌shirota的发酵乳饮料可通过减少帕金森患者粪便中葡萄球菌的数量促进排便。
肠道微生物群从二芳基黄烷醇中积极产生多酚,干扰α-突触核蛋白的错误折叠和毒性,是帕金森和其他α-突触核蛋白病的基本病理机制。
对口服富含拉法诺制剂(FRP)的异源性人源化侏儒小鼠的研究表明,FRP衍生代谢物的产生存在特殊差异,影响α-突触核蛋白的错误折叠或炎症。
对果蝇α-突触核蛋白病模型的研究表明,它对运动功能障碍有影响,从而导致其发病和进展的调节。
体外研究表明,在细菌发酵过程中,特定的细菌可以产生这些具有生物活性的酚酸。
总之,已经得出结论,个体间异质肠道微生物群诱导的二芳基黄烷醇的变化证明了益生菌、益生元和共生策略在调节帕金森和其他共核病变进展中的潜力。
目前,关于微生物组与帕金森病之间的相关性的不同研究结果并不一致。微生物组的结果产生了有价值的信息。帕金森患者使用的药物与肠道微生物之间存在联系,因为肠道微生物群在处方药物代谢中发挥作用,甚至药物对微生物组成产生影响。
对胃肠道微生物组和肠-脑轴的相互作用有一个完整的认识,可能阐明帕金森的病因和进展因素,以提供新的治疗视野和手段。例如,FMT和肠道微生物组作为帕金森临床诊断的新生物标记物的评估可能揭示传统治疗方法的替代治疗。
肠道不适可发生在帕金森的初始阶段;这有助于在出现震颤和强直等运动症状之前对该疾病进行早期诊断。微生物组学研究可以提供关于帕金森病的有用信息,但目前,我们不能依赖它们作为生物标志物。
阿尔茨海默病是一种慢性不可逆的大脑疾病,脑细胞的进行性退化导致记忆障碍、认知能力下降。它是老年人最常见的痴呆类型。阿尔茨海默患者表现出严重的学习、行为和记忆障碍,严重到足以影响日常活动。
阿尔茨海默的特征
阿尔茨海默患者的大脑中的神经元细胞死亡和进行性突触衰竭,伴随着神经元周围或外部的β淀粉样蛋白(amyloid-β,简称Aβ)沉积,伴随着皮质神经元树突和轴突中微管相关蛋白tau异常磷酸化的聚集。Aβ的积累和tau蛋白的聚集有助于微管稳定性的降低、突触失效和神经元钙稳态的紊乱,最终导致神经元凋亡。
尽管已经对阿尔茨海默的病因进行了大量研究,但阿尔茨海默的潜在机制尚不完全明确,目前的Aβ疗法对症状的缓解作用有限。据报道,淀粉样蛋白可能在大脑中充当AMP。
与中枢神经系统炎症有关
最近的研究发现阿尔茨海默的发病机制与周围感染引起的中枢神经系统炎症有关。在感染单纯疱疹病毒1型(HSV-1)的小鼠中,可以看到阿尔茨海默受试者中tau和Aβ沉积的共同特征。病毒感染诱导的高细胞内胆固醇25羟化酶(CH25H)水平对于调节Aβ产生和阿尔茨海默易感性至关重要。
阿尔茨海默 & 微生物群
此外,先前的研究已经证明阿尔茨海默与其他微生物感染(包括真菌、肺炎衣原体和螺旋体感染)之间存在潜在联系。阿尔茨海默患者脑脊液中肠道菌群微生物驱动代谢物的测定与阿尔茨海默生物标记物(如磷酸化tau和tau/Aβ42)相关,表明肠道微生物群在阿尔茨海默发病中的意义。
一项研究报告,根据Aβ前体蛋白转基因小鼠(APP)粪便样本的细菌16S rRNA序列分析,与野生型小鼠模型对照组相比,肠道微生物组成存在显著差异。研究还表明,具有阿尔茨海默表型的转基因小鼠模型具有多种肠道微生物。
对无菌小鼠的研究表明,在没有微生物的情况下,不会出现淀粉样斑块和神经炎症症状。
根据横断面研究结果,与健康对照组相比,阿尔茨海默患者粪便样本中参与炎症反应的两种细菌大肠杆菌和志贺菌的丰度显著增加。在患有认知障碍和脑淀粉样变性的患者中,可能与外周炎症状态有关的两种主要情况包括促炎性大肠杆菌和志贺菌的增加以及抗炎性直肠真杆菌的降低。
菌群失调 & 全身炎症
肠道微生物群失调和全身炎症之间存在联系,这可能是阿尔茨海默患者大脑中发生的神经退行性变的一个促成因素。
这些观察结果基于小规模研究,需要更多具有较大统计组的研究来评估肠道微生物群与阿尔茨海默进展的关系。一些科学家指出,在阿尔茨海默患者大脑中发现的感染因子可能与该疾病的发展有关,但在这方面,强有力的证据是必不可少的。
牙龈卟啉单胞菌在患者大脑中定植
在最近的一项阿尔茨海默治疗研究中,使用合成的神经毒性抑制剂是有益的。在这项研究中,牙龈卟啉单胞菌与慢性牙周炎有关,在阿尔茨海默患者的大脑中被发现。这些细菌在大脑中的定植导致Aβ1-42的产生增加。此外,神经毒性姜黄素对tau蛋白Aβ1-42有破坏性影响。
NLRP3炎症小体与阿尔茨海默
肠道微生物群失调与阿尔茨海默相关神经炎症之间的潜在关联。肠道NLRP3异常表达的增加与外周炎性体的激活呈正相关,后者随着阿尔茨海默的进展而增强神经炎症。因此,观察到,与年龄匹配的对照组小鼠相比,年轻和老年5xFAD小鼠模型的肠道微生物群组成发生了相当大的变化。
与非转基因小鼠相比,com 5xFAD小鼠由于粘附蛋白和紧密连接蛋白的丢失而表现出肠道屏障功能受损。此外,已经证明肠道微生物炎症体蛋白的高表达可能是激活下游细胞毒性和炎症介质的重要主导因素。因此,NLRP3炎症体介导的神经炎症可能通过胃肠道NLRP3促进。因此,肠道微生物群调节可能是治疗遗传易感个体阿尔茨海默相关神经系统疾病的一种可能策略。
将Tg2576小鼠阿尔茨海默模型(包括症状前和症状中转基因)与野生型进行比较,研究人员观察到肠上皮屏障(IEB)中血管A β肽的沉积破坏了IEB,并且吸收失调发生在其脑聚集之前。得出结论,肠-脑轴的改变与较高水平的炎症血浆细胞因子(如IL-9、IP-10和VEGF)相关。
考虑到阿尔茨海默患者的肠道功能障碍,阿尔茨海默治疗的未来治疗策略可能涉及肠道微生物群的早期调理。根据肠道微生物群参与阿尔茨海默Aβ病理学的发展,研究人员开发了一个新的框架,通过肠-脑轴确定阿尔茨海默的潜在机制,并将肠道微生物群的操作转化为临床实践。
抗生素疗法
用接受来自老年(16个月)APPSWE/PS1DE9小鼠的粪便供体移植的APPSWE/PS1DE9小鼠进行短期抗生素鸡尾酒疗法,收集粪便颗粒进行进一步分析。
抗生素治疗前小鼠的FMT重建主要归因于供者来源,如梭状芽孢杆菌和Coriobacteriae,有助于Aβ斑块的更高沉积。有趣的是,在微生物群植入后,Aβ斑块周围星形胶质细胞的激活受到抑制,而不是小胶质细胞。
在阿尔茨海默小鼠模型中,长期服用广谱抗生素也可以减少Aβ积累并调节影响Aβ淀粉样变的先天免疫反应。此外,在转基因小鼠中,通过定期使用抗生素鸡尾酒疗法,海马淀粉样斑块周围的小胶质细胞和星形胶质细胞聚集以及不溶性Aβ斑块减少 。
也有报道称,通过比较不同年龄的野生型和阿尔茨海默小鼠模型之间的粪便短链脂肪酸和微生物组成,观察到具有阿尔茨海默表型的小鼠中的丁酸球菌和瘤胃球菌数量显著减少,变形菌和疣状菌数量增加,提供改变的微生物组成和多样性。短链脂肪酸水平的下降表明至少有30条代谢途径受到干扰。
先前的一项研究也表明,小胶质细胞激活抑制Aβ清除和降解,Aβ的进一步积累导致阿尔茨海默的病理学。此外,Aβ沉积水平的升高有助于小胶质细胞内几种促炎介质的释放,如ROS、iNOS、NF-kB和COX2,从而促进阿尔茨海默患者的神经炎症。
阿尔茨海默的微生物干预
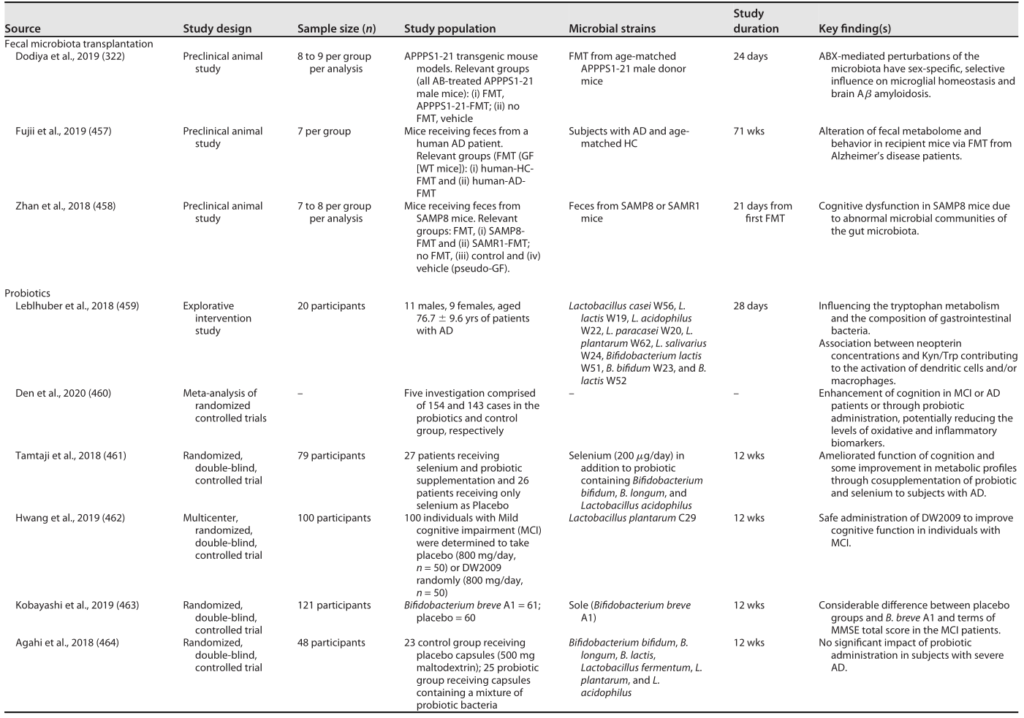
Sorboni SG, et al.,Clin Microbiol Rev. 2022
这些研究表明,某些种类的肠道微生物可激活Aβ信号通路,参与阿尔茨海默的发病机制,并在阿尔茨海默的分子调节中发挥关键作用。益生菌补充和营养干预可能成为阻碍阿尔茨海默进展的一种有希望的治疗方法。
癫痫是一种使人衰弱的神经系统疾病,影响全世界约6500万人。尽管医学上有许多新的进展,但确切的病因仍需完全阐明。大约一半的癫痫患者病因不明。据报道,癫痫患者的医疗费用是正常人的13倍。癫痫显著的社会经济影响是由于其死亡率和致残率高于正常人群。尽管正在使用抗癫痫药物(AEDs)进行药物治疗,但只有70%的癫痫患者能够完全控制癫痫发作。因此,大约三分之一的癫痫患者会出现难治性癫痫,影响他们的日常生活活动。
环境和遗传因素都决定癫痫的易感性。
此外,一些研究表明肠道细菌种类与癫痫的病理生理学之间存在关联。肠道微生物组失调与癫痫等神经精神疾病的发生有关。平衡的肠道微生物群与健康的大脑和免疫系统之间存在相关性。
最近的研究表明,慢性炎症在癫痫的发病和进展中起着重要作用。研究还表明,肠道菌群可以调节免疫和炎症反应。因此,操纵肠道微生物组作为癫痫的治疗策略具有潜力。
腹腔注射LPS诱导大鼠更易发生癫痫发作,同时增加血脑屏障的通透性和大脑中更高水平的促炎细胞因子。
未控制癫痫的替代治疗策略包括迷走神经刺激和生酮饮食。因此,控制肠道微生物群的多样性可以被认为是一种潜在的治疗方法。
癫痫患者肠道菌群变化
在几项研究中发现,与健康人群相比,采用各种治疗方法的癫痫患者的肠道微生物特征存在差异。
所有这些研究表明,在未控制的癫痫中,厚壁菌/拟杆菌比率增加。一些属于厚壁菌门的细菌能够调节神经递质水平。对肠道微生物群(包括α-多样性)的进一步分析表明,结果存在显著差异。在另一项研究中,与拟杆菌相比,厚壁菌的数量增加。
此外,与药物反应性患者相比,耐药患者的α-多样性测量结果与健康受试者相似。实质上,更高水平的α-多样性与罕见肠道细菌种类的异常增加有关。此外,在属水平上,报告了显著差异。根据这些结果,可以认为细菌在癫痫的有效治疗中起作用。
有趣的是,肠道微生物群可以调节唑尼沙胺代谢,唑尼沙胺是一种抗癫痫药物。此外,乳酸杆菌和双歧杆菌数量的增加与每年较少的癫痫发作相关。
在临床前和临床研究中,关于抗生素给药是否能诱导或预防癫痫发作,也有争议的发现。值得注意的是,潜在传染病在治疗过程中可能产生的促癫痫作用或抗生素直接引起的神经毒性副作用可能更为重要。
生酮饮食降低癫痫发作率
据报道,癫痫患者的生酮饮食可降低癫痫发作率,并与肠道菌群组成和功能的改变有关。
生酮饮食在颞叶癫痫的无菌小鼠模型中介导抗癫痫作用。事实上,这些研究人员发现,SPF小鼠在移植生酮饮食的微生物群或长期治疗细菌后癫痫发作阈值升高(长期治疗细菌包括Akkermansia muciniphila, Parabacteroides distasonis, Parabacteroides merdae)。
一些研究表明补充益生菌对癫痫有积极作用。
癫痫的微生物干预
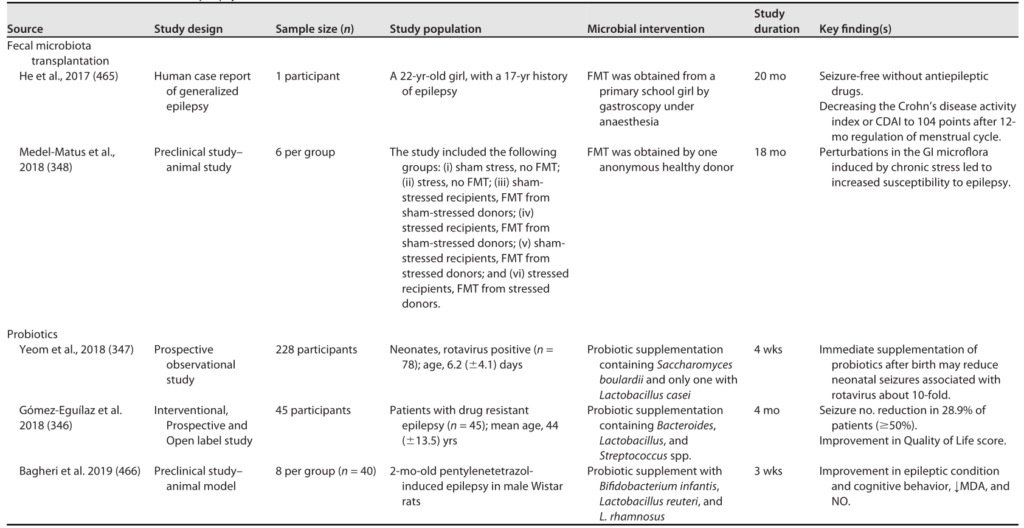
Sorboni SG, et al.,Clin Microbiol Rev. 2022
在全球范围内,中风和脑损伤是发病率和死亡率的重要原因。肠道菌群中的共生细菌可能通过调节多种脑血管疾病的危险因素(包括动脉粥样硬化、糖尿病、血脂异常和动脉高血压),与中风的发生有关。饮食也是一个重要的危险因素。
将动脉粥样硬化和失调联系起来会直接影响微生物组的组成和多样性。然而,越来越多的证据表明,肠道微生物群可能在脑血管疾病和中风中发挥更直接的作用。
三甲胺n-氧化物(TMAO)升高
三甲胺n-氧化物(TMAO)作为微生物群衍生的代谢物,可以从膳食胆碱中合成,可在体液和组织中检测到。最近的研究表明,TMAO与脑血管和心血管疾病的风险增加有关,这表明可能通过这种代谢物的治疗潜力调节肠道微生物群。
横断面调查表明,与健康对照组相比,中风患者的肠道微生物群组成不平衡。在一项对4000多例患者的纵向研究中,血浆样本中TMAO水平升高与卒中和心血管事件的高风险呈剂量依赖性相关。
抗生素补充引起的TMAO水平降低突出了肠道细菌在该化合物合成中的重要性。
同时,与无症状动脉粥样硬化患者相比,中风和短暂性脑缺血发作患者的TMAO水平相对较低。
磷脂酰胆碱代谢物
临床前研究表明,服用磷脂酰胆碱代谢物(如胆碱和TMAO)可上调参与动脉粥样硬化的巨噬细胞清除受体的表达,这可能是由于肠道中存在的细菌物种所致。
对无菌小鼠的研究表明,胆碱的服用与较高的动脉粥样硬化率无关,并且有助于减少主动脉斑块的体积。然而,关于饮食对TMAO和胆碱的影响以及肠道微生物群在动脉粥样硬化发病和进展中的有害和保护作用,重要的是不要过度解释临床前研究的结果。
健康的微生物组在动脉粥样硬化病变的恢复中起着重要作用。
大脑中动脉闭塞后补充广谱抗生素与小鼠存活率降低相关。抗生素诱导的胃肠道菌群改变也导致IL-17相关趋化因子表达下调和促炎性IL-17gd T细胞迁移减少。
因此,肠道细菌通过调节肠道T细胞向大脑的浸润来调节中风后的神经炎症。
卒中后含有短链脂肪酸产生菌的粪菌移植,包括发酵乳杆菌、长双歧杆菌、Faecalibacterium prausnitzii、Clostridium symbiosum,可缓解卒中后的认知障碍和炎症,还可增加血浆、肠道和大脑短链脂肪酸浓度,促进老年模型卒中后恢复。也有报道称,将中风患者粪菌移植到抗生素给药的小鼠,以及从中风模型转移到无菌小鼠,会增加缺血性脑损伤和相关功能损伤的大小。
中风和脑损伤的微生物干预
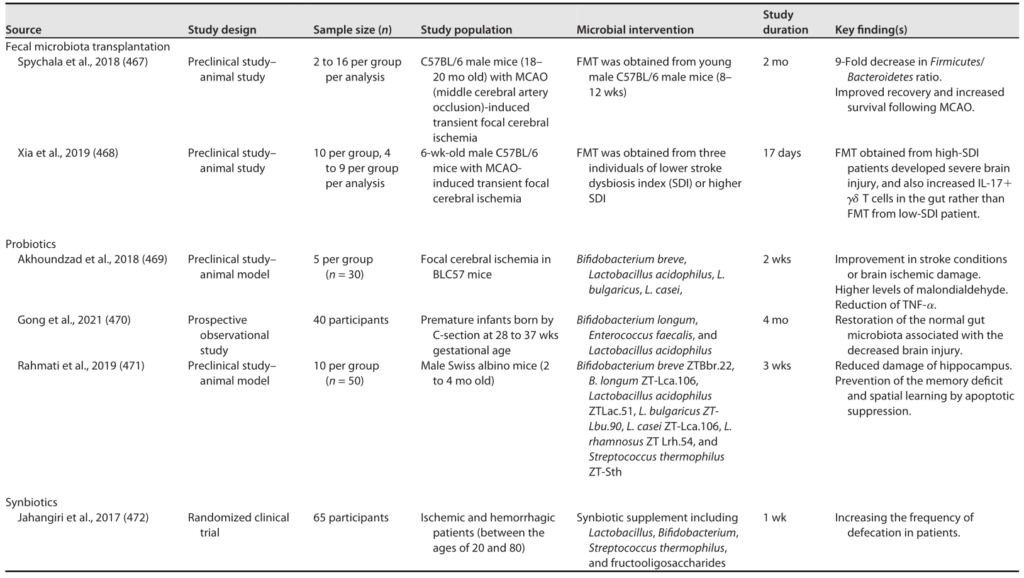
Sorboni SG, et al.,Clin Microbiol Rev. 2022
据报道,中风后拟杆菌的数量和多样性减少。另一项研究表明,短暂性脑缺血发作和中风患者的机会性病原体数量较多,包括脱硫弧菌、肠杆菌、巨球形杆菌和Osicillibacter,有益或共生菌属的数量较少,如拟杆菌、粪杆菌和Prevotella。此外,Prevotellaceae和Peptococcaceae的丰度增加与中风严重程度相关。
用一种特殊的细菌菌株,即丁酸梭菌进行治疗,可改善缺血/再灌注小鼠模型的认知功能,并减少神经元损伤。
根据这些解释,肠道微生物群在中风和脑损伤发病和进展中的作用尚不完全清楚。虽然临床前和临床研究提供了有趣的结果(表7),但还需要进一步的研究。有人建议在饮食中补充精神生物素,以减少创伤性脑损伤后的精神后果和共病。然而,需要更多的临床研究来阐明这种微生物治疗干预的潜力。
药物
益生元
益生菌
合生元
后生元
粪菌移植
其他
越来越多的证据表明,人们越来越认识到肠道微生物组在调节不同药物(如精神药物)的疗效和副作用方面的重要性。
抗生素
抗生素是影响胃肠道菌群的最有效和最直接的方法。
对1135名个体的肠道微生物组的深度测序表明,肠道微生物组与各种药物组之间存在关联。抗生素与胃肠道微生物组的改变密切相关。
值得注意的是,作者提供了其他几种治疗药物对胃肠道微生物群影响的证据,如二甲双胍、泻药、他汀类药物和质子泵抑制剂(PPI)。
多药疗法
同时使用多种药物治疗患者,也与肠道微生物群的改变有关。一项调查显示,服用药物的数量与微生物多样性之间存在显著的负相关。尤其是抗抑郁药、PPI和抗精神病药与分类单元丰度的相关性最大。
非抗生素药物
同时,新证据表明,除了药物药代动力学的调节外,非抗生素药物还可以改变肠道微生物组结构,对情绪和行为产生潜在影响。
另一方面,人们越来越重视肠道微生物组与药物之间的相互作用,这支持了肠道菌群可影响药物代谢和吸收的观点。在一项大规模队列研究发现,包括抗生素、抗抑郁剂、苯二氮卓类药物等在内的医疗干预可以改变肠道微生物组的组成。
精神药物
此外,研究了精神药物对40名焦虑症和/或重度抑郁症患者胃肠道菌群的影响。在其队列研究中,研究人员得出结论,抗精神病药物降低了胃肠道微生物组α多样性。这些研究人员确定抗精神病药物的剂量与这些患者的α-多样性呈负相关。
已经进行了多项体外研究,以评估非抗生素药物的抗菌活性,所有这些药物都具有抗菌活性,可能通过与特殊分子靶相互作用影响中枢神经系统功能。
其他报告显示抗抑郁药选择性5-羟色胺再摄取抑制剂(SSRIs)、氟西汀、舍曲林、西酞普兰和帕罗西汀对芽孢杆菌、梭状芽孢杆菌、肠球菌、假单胞菌和葡萄球菌菌株具有抗菌活性。
在最近的一项研究中,作者测试了不同类别的抗抑郁药对12种肠道菌群共生细菌菌株的抗菌活性。大多数被检查的抗抑郁药对被检查菌株的生长具有相当大的浓度依赖性抑制作用。此外,在对雄性BALB/c小鼠肠道微生物群的体内研究中,作者发现与对照组相比,地昔帕明可增加β-多样性并降低丰富度。
这些作者还发现,在补充了地昔帕明的小鼠模型中,Adlercreutzia、瘤胃球菌和未分类的α-变形杆菌的数量减少。三环类抗抑郁药,包括阿米替林,也被证明对致病细菌菌株,如芽孢杆菌属、葡萄球菌属和霍乱弧菌具有体外抗菌活性,而丙咪嗪分别对小肠结肠炎耶尔森菌和大肠杆菌具有生长抑制作用。
在一项老年住院患者队列研究中,研究了精神药物对肠道微生物群组成的影响。在受试药物中,与PPI和抗抑郁药相比,抗精神病药物与微生物群落α多样性的负相关性最高。
在另一项对双相情感疾病受试者的调查中,非典型抗精神病药物(APP)治疗与女性的微生物多样性降低相关,但与APP治疗的男性患者无关。在这一队列中,服用APPs的患者,其衣原体科和阿克曼氏菌的数量分别显著增加和减少。
在针对40种肠道共生菌代表的1000多种药物的大规模体外筛选研究中,据报道,24%的受试药物对至少一种细菌菌株表现出生长抑制。这些药物对相当相似的物种模式具有抗菌活性,表明直接抗菌活性可能是其药理作用的一部分,不应将其视为副作用。因此,迫切需要评估精神药物对胃肠道菌群的潜在影响。
阿片类药物
肠-脑轴的双向方面也反映在这样一个事实,即肠道神经胶质细胞的 GDNF 等分泌因子也通过粘膜免疫系统的成熟以及通过加强上皮紧密连接功能来调节微生物稳态。阿片类药物介导的 GDNF 表达降低也与肠道通透性增加和肠粘膜表面免疫监视改变有关。这些因素有助于维持阿片类药物治疗观察到的促炎环境,导致下游阿片类药物相关的合并症,如阿片类药物耐受、依赖和戒断。

Jalodia R, et al., J Neuroimmune Pharmacol. 2022
此外,来自肠神经元的神经元介质(例如,VIP、ACh、NO)的阿片类药物抑制释放会导致胃肠道分泌减少、水和电解质吸收增加、蠕动减少,从而导致阿片类药物诱导的便秘,进一步导致微生物群失调。总之,虽然 OUD 的药物治疗是可用的,但它们并非对所有患者都有效。
根据国际益生菌和益生元科学协会(ISAPP)的说法,“益生元是指宿主微生物群体专门利用的、对健康有益的非活性食品成分。”作为益生菌补充的替代品,益生元可用于调节肠道菌群。
这组化合物通过其影响胃肠道健康的能力进行鉴定,包括不可消化低聚糖(NDO)、母乳低聚糖(HMO)和可溶性可发酵纤维。尽管益生元疗法在增强有益细菌(如双歧杆菌和乳酸杆菌)方面具有潜力,但只有少数研究检测了这些化合物对人类和动物肠道菌群的有益影响。对低聚半乳糖和低聚果糖或其组合对雄性小鼠的作用的研究表明,这些化合物具有抗抑郁、抗焦虑作用,并逆转慢性应激的作用。
在一项安慰剂对照临床试验中,服用N-乙酰半胱氨酸8周后,自闭症婴儿的易怒性和重复行为有所下降。此外,补充商业益生元药物B GOS(Bimuno)和限制性饮食可改善自闭症儿童的行为,这可能是由于乳酸杆菌和双歧杆菌含量较高。
最近的一项研究还表明,益生元乳果糖可以通过自噬和抗炎途径改善阿尔茨海默小鼠模型的认知缺陷。因此,这些发现似乎表明益生菌和益生元是神经系统疾病的有效治疗选择。然而,考虑到仅仅是相关性并不一定表明因果关系,需要进行额外的调查以详细了解潜在的机制。
健康个体和患者肠道微生物群组成和功能的变化已被确定为各种神经系统疾病。人们已经认识到,饮食可以影响微生物组成,改变肠-脑轴的功能。多种治疗干预措施已用于治疗肠道微生物群落失调,恢复肠道微生物群落平衡,改善神经系统疾病的临床结果,包括使用益生菌。
益生菌在普通食品和药片中的应用越来越流行。益生菌主要由双歧杆菌和乳酸产生菌组成,例如乳酸杆菌。越来越多的证据表明,益生菌合成的代谢物是饮食诱导的宿主-微生物相互作用的基本介质。此外,一些肠道细菌种类,如拟杆菌、梭菌、双歧杆菌、消化链球菌、乳酸杆菌和瘤胃球菌,可产生多种色氨酸分解代谢产物,包括吲哚、3-甲基吲哚、吲哚乙酸(IAA)、色胺等。
新出现的数据表明,微生物组衍生的色氨酸分解代谢影响宿主健康。已经证明,这些代谢物可与AhR结合,从而激活免疫系统,改善肠道屏障功能,刺激胃运动活动(以及胃肠激素的分泌),发挥全身或局部抗氧化、抗炎作用,并可能调节肠道微生物组和代谢组。
据报道,由共生微生物群合成的色氨酸分解代谢物可诱导小胶质细胞AhR激活,抑制NF-kB信号、VEGF-B和TGF-α的激活。此外,AhR在树突状细胞中高度表达,控制分化和功能。树突状细胞中维甲酸、犬尿氨酸和AhR驱动的细胞因子的产生增强T-reg细胞的分化,抑制EAE作为多发性硬化动物模型的发展。
AhR信号在肠道和大脑中的作用
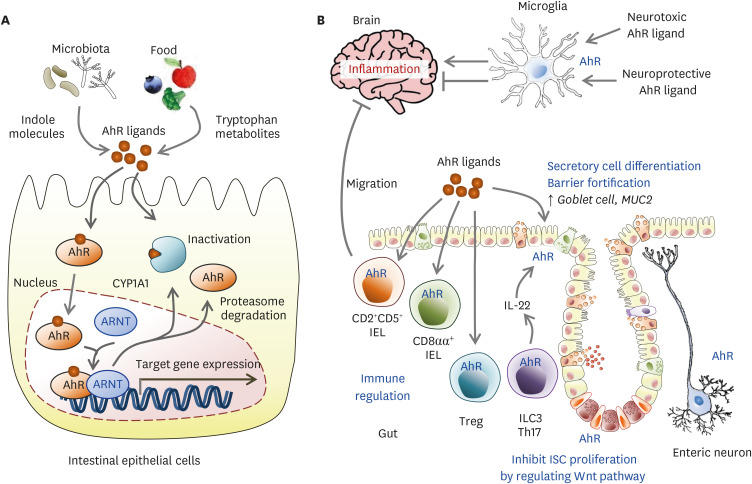
Gwak MG, et al., Immune Netw. 2021
星形胶质细胞在炎症介导的神经退行性变中发挥关键作用,发挥神经毒性作用,激活和招募与中枢神经系统发病机制有关的其他细胞。据报道,在EAE和多发性硬化动物模型中,星形胶质细胞的转录谱显示AhR表达上调。
最近的研究得到了几种神经系统疾病相关临床证据的支持,证明越来越重视使用益生菌和益生元来调节胃肠道微生物群。
使用小鼠模型进行的几项研究表明,益生菌的施用可有益于几种神经系统疾病(如自闭症、癫痫和阿尔茨海默),从而改善认知结果。然而,关于益生菌给药对人类神经功能障碍的有效性,临床证据仍然很少。
对几名患有焦虑和胃肠道症状的3-12岁自闭症儿童进行的调查发现,使用名为Visbome的特殊配方,包括八种不同的益生菌菌株,主要是乳酸杆菌,是安全的,并导致保留乳酸菌患者的自闭症和胃肠道症状的健康改善。
此外,当使用益生菌治疗人类神经退行性疾病(包括阿尔茨海默)时,已经发现了有希望的结果。首先,据报道,植物乳杆菌能够改善阿尔茨海默小鼠模型的认知能力并增加大脑中乙酰胆碱酯酶的水平。在患有阿尔茨海默的啮齿动物散发模型中,用嗜酸乳杆菌、发酵乳杆菌、乳酸双歧杆菌和长双歧杆菌进行Ab注射也发现类似结果。另一项随机临床研究表明,益生菌与鼠李糖乳杆菌GG(ATCC 53103)合用可能减少75名自闭症婴儿的多动症发展,并可能减少神经精神疾病的发展。
证据还表明益生菌对帕金森病患者的影响。最近的一项研究表明,长期服用由六种细菌组成的益生菌可减轻帕金森病遗传小鼠模型的运动损伤,并对多巴胺能神经元具有神经保护作用。
合生元是指益生元和益生菌的混合物,其中益生元有利于益生菌微生物的生长和代谢,提高其生存能力和效益,通过增加胃肠道中有益微生物的丰度来影响宿主。
合生元中使用的组合必须适当,以支持益生菌微生物在胃肠道中的存活。研究表明,使用合生元比单独使用益生菌或益生元更有效。结果表明,由GOS和包括瑞士乳杆菌和长双歧杆菌在内的多序列益生菌组成的合生元制剂可减少抑郁症症状,并改善重度抑郁症中的色氨酸信号。
随机对照试验中使用含合生元的多序列益生菌和益生元治疗的结果导致帕金森队列中功能性胃肠道症状的改善。婴儿双歧杆菌和低聚糖作为合生元被证明对缓解自闭症中的肠道相关疾病有效。然而,合生元对微生物群-肠-脑轴的影响还需要更多的研究 。
后生元,也称为代谢、生物原或CFSs(无细胞上清液),由细菌发酵代谢产物和从活细菌中获得或在细菌细胞裂解后释放的可溶性因子组成,如短链脂肪酸、酶、AMP、磷壁酸、胞内和胞外多糖、细胞表面蛋白、维生素、血浆素和有机酸。
非活性益生菌paraprobiotics被定义为不可存活或失活的微生物细胞,而一些研究人员将其作为后生物的一个亚组。非活性益生菌是一种结构成分,若给予适量,可能会触发宿主的生物活性。
灭活可通过各种方法实现,如物理(热灭活益生菌、紫外线照射或超声波)或化学方法。生物活性化合物,如肠道肽,是细菌与宿主相互作用的结果,被认为是益生元。热灭活副干酪乳杆菌PS23缓解了皮质酮诱导的焦虑样表型,改善了海马和前额叶皮质中的多巴胺水平。
关于大脑健康,对患有心理社会应激的小鼠进行短链脂肪酸组合(乙酸盐、丙酸盐和丁酸盐)治疗的研究显示了抗焦虑作用。
根据最近发现的微生物干预在调节肠道失调引起的神经系统疾病方面的潜力,粪便微生物群移植(FMT)似乎是一种有希望的治疗策略。
这种相对较新的治疗方法包括从健康粪便样本捐赠者及其微生物和代谢物转移到接受者。这种方法目前被用于治疗艰难梭菌感染,与抗生素治疗一起使用。
通过FMT,健康微生物群通过繁殖自我替换,并产生生物活性代谢物。口蹄疫是通过使用内窥镜、灌肠和冷冻干燥材料口服喂养来完成的。该方法的潜力已被用于治疗帕金森病、自闭症和多发性硬化症等神经系统疾病。这种方法的优点之一是没有明显的副作用报告,即使在高危患者中也被认为是安全的。
在最近一项关于自闭症小鼠的研究中,评估了体外培养的肠道微生物移植(GMT)的效果,该移植显著减轻了小鼠的焦虑样行为。在另一项研究中,对接受FMT的自闭症患者进行了结肠镜检查,结果证明自闭症相关症状显著改善,他们的肠道微生物群改变为健康状态。然而,需要更多的研究来进一步阐明FMT对自闭症患者的影响。
在动物模型中对阿尔茨海默进行了大量研究,但没有对人类患者进行具体研究。对阿尔茨海默小鼠模型的研究结果表明,认知功能障碍与肠道微生物群组成的变化有关;因此,通过FMT对该微生物群进行修饰被证明能有效缓解阿尔茨海默患者的认知功能障碍。许多关于FMT的神经系统疾病的研究已经完成,许多试验正在进行中。因此,很快就会有大量证据。
通过治疗性微生物干预调节肠道微生物群
Sorboni SG, et al.,Clin Microbiol Rev. 2022
其他(食物及补充剂)
改善肠脑轴的食物
食物已被证明可以改善肠脑功能。其中许多含有精神生物化合物,包括:
Omega-3 脂肪
存在于油性鱼类和亚麻籽中,已被证明可以改善青春期和成年期的微生物群多样性。这可以降低患精神分裂症和抑郁症等脑部疾病的风险。
发酵乳制品
如酸奶和奶酪中发现的各种益生菌菌株。这些已被证明可以调节大脑活动。
富含纤维的食物
如水果和蔬菜、全谷物和坚果。这些含有益生元纤维,可降低皮质醇水平并改变情绪偏见。
富含多酚的食物
肠道菌群失调导致肠上皮黏膜屏障和血脑屏障通透性增高,并通过肠-脑轴的免疫、内分泌和肠神经途径影响阿尔茨海默的发生发展。多酚类化合物可能通过上述机制发挥防治阿尔茨海默的作用。
详见:肠道微生物群与膳食多酚互作对人体健康的影响
食用蘑菇类
香菇含有大量的维生素B6。因为维生素 B6 会影响血清素和神经递质的产生,所以健康的 B6 水平与积极的情绪和自然地减轻压力有关。
在动物研究中,它也被证明可以有效治疗抑郁症等情绪障碍。
坚果
如杏仁、腰果、核桃和巴西坚果。研究表明,食用这些会提高血清素的水平,血清素是一种让人感觉良好的化学物质,血清素降低,人会感到沮丧。
富含酪氨酸的食物
如杏仁、蛋鱼和鸡肉,富含酪氨酸,酪氨酸是一种能提高大脑多巴胺水平的氨基酸。
其他:
L-苏糖酸镁
镁对大脑至关重要,它是制造许多参与大脑功能的酶的必要辅助因子。它对于维持和发展突触之间的联系也至关重要,突触是学习和记忆的核心任务。大脑和脑脊液中高水平的镁与阿尔茨海默病和大脑衰老的发病率降低有关。补充剂 L-苏糖酸镁比其他镁形式更有效地通过血脑屏障,并且不会引起消化不良。
维生素 D3 和 维生素 K2
血清维生素 D 高水平对于维持大脑健康和降低阿尔茨海默病和其他神经退行性疾病导致的认知障碍风险极为重要。维生素 D 的抗炎和抗氧化特性也很重要。
相反,低维生素 D 会导致大脑中的钙含量增加,这与抑郁症有关,并且会导致表征痴呆的淀粉样蛋白斑块增加。
维生素 D 与维生素 K 协同作用以调节钙并防止其在软组织中积累,例如滋养大脑的血管。
补充剂应包括最易吸收的胆钙化醇(维生素 D3)形式的维生素 D,以及甲基萘醌(维生素 K2)形式的维生素 K,以帮助调理肠道。这种组合对预防血管钙化最有效。
姜黄素
姜黄根中的活性化合物姜黄素使咖喱粉呈现鲜艳的黄色。姜黄素激活 Nrf2 抗氧化信号通路,开启参与解毒和消除自由基的基因。
在大脑中,姜黄素补充剂具有强大的抗炎和抗氧化特性。姜黄素还通过抑制淀粉样蛋白的形成来帮助预防痴呆。姜黄素补充剂可以显著提高 BDNF(脑源性神经营养因子)的血清水平。BDNF 在保护现有神经元和刺激新神经元生长方面发挥着重要作用。
高水平可以帮助预防认知障碍,并有助于从脑震荡和脑损伤中恢复。
肠道微生物群不仅与消化吸收相关,还与大脑密切相关,从而影响各类神经系统疾病,如常见的自闭症、抑郁症、精神分裂症等。改善肠道健康后,通过肠脑轴的连接减少全身炎症,同时也改善心理健康。在现代社会普遍压力较大的情况下,注意减压的同时更不能忽视肠道健康。
主要参考文献:
Li XJ, You XY, Wang CY, et al. Bidirectional Brain-gut-microbiota Axis in increased intestinal permeability induced by central nervous system injury. CNS Neurosci Ther. 2020;26(8):783-790. doi:10.1111/cns.13401
Deidda G, Biazzo M. Gut and Brain: Investigating Physiological and Pathological Interactions Between Microbiota and Brain to Gain New Therapeutic Avenues for Brain Diseases. Front Neurosci. 2021;15:753915. Published 2021 Oct 12. doi:10.3389/fnins.2021.753915
Gwak MG, Chang SY. Gut-Brain Connection: Microbiome, Gut Barrier, and Environmental Sensors. Immune Netw. 2021;21(3):e20. Published 2021 Jun 16. doi:10.4110/in.2021.21.e20
Sorboni SG, Moghaddam HS, Jafarzadeh-Esfehani R, Soleimanpour S. A Comprehensive Review on the Role of the Gut Microbiome in Human Neurological Disorders. Clin Microbiol Rev. 2022 Jan 5;35(1):e0033820. doi: 10.1128/CMR.00338-20. Epub ahead of print. PMID: 34985325; PMCID: PMC8729913.
Suganya K, Koo BS. Gut-Brain Axis: Role of Gut Microbiota on Neurological Disorders and How Probiotics/Prebiotics Beneficially Modulate Microbial and Immune Pathways to Improve Brain Functions. Int J Mol Sci. 2020;21(20):7551. Published 2020 Oct 13. doi:10.3390/ijms21207551
Jalodia R, Abu YF, Oppenheimer MR, Herlihy B, Meng J, Chupikova I, Tao J, Ghosh N, Dutta RK, Kolli U, Yan Y, Valdes E, Sharma M, Sharma U, Moidunny S, Roy S. Opioid Use, Gut Dysbiosis, Inflammation, and the Nervous System. J Neuroimmune Pharmacol. 2022 Jan 7. doi: 10.1007/s11481-021-10046-z. Epub ahead of print. PMID: 34993905.
Morais LH, Schreiber HL 4th, Mazmanian SK. The gut microbiota-brain axis in behaviour and brain disorders. Nat Rev Microbiol. 2021 Apr;19(4):241-255. doi: 10.1038/s41579-020-00460-0. Epub 2020 Oct 22. PMID: 33093662.

谷禾健康
Sutterella——萨特氏菌
Sutterella是一种革兰氏阴性杆细菌,主要从肠道和胃肠道感染中分离出来的。其属的成员已从横膈膜下方的人类感染中分离出来。
来源:spectrumnews
Sutterella(萨特氏菌)是变形菌门最丰富的菌之一,是一种厌氧或微需氧的、耐胆汁、解糖 、非运动性且不形成孢子和球杆菌形的短杆状革兰氏阴性球杆菌。
Sutterella菌的体型极小,约0.4 到 2 微米,只能在培养基上形成小型菌落。当收集的细菌聚集成一团时,呈现为红色的特征。
肠道Sutterella中主要分为两大类,分别为华德萨特菌(Sutterella wadsworthensis)和粪链球菌(Sutterella stercoricanis)。
其中Sutterella wadsworthensis 菌是一种不溶性、硝酸盐阳性、脲酶阴性的有机体,需要甲酸盐、富马酸盐或氢作为生长添加剂,并可在琼脂培养基中培养。
扫描电子显微镜图像(S. wadsworthensis)
Mukhopadhya I, et al., PLoS One. 2011
Sutterella通常与人类疾病有关,例如自闭症、唐氏综合症和炎症性肠病 (IBD),但这些细菌对健康的影响仍不清楚。
Sutterella 属的成员是肠道重要的共生菌,在健康成人的十二指肠中含量丰富,朝向结肠的梯度逐渐减小。在人类胃肠道中具有轻度促炎能力,并且对与微生物群失调和变形菌增加相关的上皮稳态破坏没有显著贡献。
母体传播,IgA缺乏
——Sutterella可以将肠道疾病从母亲传给后代
一项发表在《自然》杂志上报告说,该研究发现,母鼠可以通过一种名为 Sutterella的肠道细菌,将肠道疾病的易感性传递给她的后代,例如炎症性肠病。
长期以来,科学家们一直推测,母亲可以通过分娩过程,然后通过母乳喂养和接吻将有益细菌传递给她的后代。这些无数的细菌迅速传播并覆盖婴儿的皮肤、口腔和消化道。
到目前为止,大多数医生都认为 IgA 缺乏症(见于慢性腹泻、克罗恩病和溃疡性结肠炎等疾病)主要是遗传性的,这意味着这种缺乏症是通过基因遗传的。这一新发现是首次鉴定出后代可以遗传的特定特征——是一种称为免疫球蛋白 A 或 IgA 的血液蛋白缺乏,它是肠道疾病的根源——由特定的可以从母亲传给后代的细菌基因引起。
研究发现成年小鼠通过粪便将 Sutterella 细菌传播给彼此,而母鼠在出生后不久将 Sutterella 细菌直接传播给它们的后代,从而传递了这种低 IgA 的特征。Sutterella 抑制 IgA 的分泌。但是注意Sutterella 可能只是改变人类疾病易感性的众多细菌之一。
炎症
——Sutterella具有抑制降解IgA的能力
Sutterella会过分泌IgA蛋白酶,降解IgA,从而降低肠粘膜中IgA的浓度,损害肠道抗菌免疫反应功能。但有实验指出Sutterella并不会引起大量的炎症反应,但是因为这项研究并没有确切以及多项的实验进行证明,所以并不能得出决定性的结论。
粪菌移植研究中发现,Sutterella的丰度和UC(溃疡性结肠炎)缓解程度呈负相关;并且,在临床队列的研究中发现,Sutterella丰度和炎症细胞因子(IL-12, IL-13,IFN-γ)水平呈负相关。
同样的,在一组体外实验中Sutterella能黏附于肠上皮细胞,促进IL-8的分泌,有轻微促炎作用,但不破坏单层上皮细胞完整性。
炎症性肠病 (IBD) 发生在遗传易感个体中,这是由于未知的环境触发因素所致,可能是迄今为止未知的细菌病原体。
儿科炎症性肠病或乳糜泻患者与健康对照组之间 Sutterella 丰度未检测到显著差异。
另一项研究中表明,炎症性肠病成人结肠活检中 Sutterella wadsworthensis 的丰度与对照组没有差异, Sutterella parvirubra 比其他两种 Sutterella 粘附性更好。
S. wadsworthensis 最初更频繁地从 IBD 受试者中分离出来,因此进行了这项综合研究以阐明其在 IBD 中的作用。利用这些样本,开发了一种新设计的 PCR,以研究这种细菌在成人溃疡性结肠炎患者中的流行情况。
发现83.8% 的成年溃疡性结肠炎患者检测到Sutterella wadsworthensis,对照组为86.1% (p= 0.64). Sutterella 16S rRNA 基因序列也在克罗恩病和溃疡性结肠炎患者的肠活检和粪便样本中得到鉴定。但因缺乏相关流行病学以及致病潜力的证明,所以对其是否存在人类感染以及炎症部位的物种代表原因还有待研究。
腹泻
——Sutterella对于腹泻具有正相关影响
在一项对健康仔猪进行的实验中,采用16srRNA基因测序和宏基因组等技术测序粪便菌群得到其在属水平中,断奶前腹泻仔猪粪便菌群Prevotella、Sutterella和Anaerovibrio相对丰度都具有显著的增加。
在对关于抗生素性腹泻(Antibiotic-associated diarrhea,AAD)的相关实验中,30只七周龄SPF级雄性大鼠的粪便样本进行高通量测序发现,中药制剂在缓解抗生素性腹泻的同时,也显著改变了肠道菌群结构组成。其中,Sutterella属的相对丰度与SLBZS的给药呈负相关,与AAD病情的发展呈正相关,表明Sutterella属对于AAD的发生发展可能有重要作用。
而在属水平上,Sutterella属和Bacteroides属可能与AAD的发生发展关系密切。
粪菌移植FMT治疗效果
研究发现Sutterella可能在FMT治疗反应中起重要作用。在FMT治疗前后收集的患者粪便和结肠样本中,与未获得缓解的患者相比,FMT后未达到缓解患者体内的Fusobacterium gonidiaformans、Sutterella wadsworthensis和大肠杆菌种类增多,血红素和脂多糖生物合成水平增加。
一系列微生物类群与缓解不足有关,包括梭杆菌属(Fusobacterium)、萨特氏菌(Sutterella)、嗜血杆菌、大肠杆菌、嗜双歧杆菌等。
Sutterella、Eshcerichia和血红素生物合成可能允许为溃疡性结肠炎的FMT治疗精心选择合适的供体和患者,并告知如何修改FMT治疗或更明确的(如窄谱)治疗微生物操作,以提高其治疗效果。
自闭症
研究人员发现,被诊断患有自闭症和胃肠道紊乱的儿童中,超过一半的肠道活检组织中存在 Sutterella菌,而通常发育中的胃肠道紊乱儿童的活检组织中没有 Sutterella。
胃肠道症状,如便秘、腹泻、腹痛和腹胀,在自闭症儿童中很常见。但目前尚不清楚胃肠道不适是自闭症的核心特征还是挑食或其他疾病症状的结果。
研究人员已从阑尾炎等感染和克罗恩病(一种导致胃肠道炎症的自身免疫性疾病)患者中分离出Sutterella。然而,目前尚不清楚这些细菌是感染的原因还是后果,也不知道它们是否总是存在于健康个体中。
目前尚不清楚儿童的胃肠道症状是否是由Sutterella引起的,但这种细菌可能会取代有益的共生细菌,从而导致症状。
11名孤独症儿童和1名对照儿童也携带与Sutterella交叉反应的抗体,Sutterella是感染和炎症的迹象。根据PCR分析,其中三名儿童对Sutterella不呈阳性,这表明总共有15名儿童可能携带该细菌。
肥胖
Sutterella是 LPS 的重要来源之一,可影响肠道通透性,导致血浆中 LPS 浓度增加(内毒素血症),与肥胖受试者典型的慢性低度炎症有关。大部分研究表示体重和脂肪量的增加以及空腹胰岛素与拟杆菌、梭状芽孢杆菌、Sutterella 和肠杆菌科呈负相关。
运动健身锻炼可以有助于减肥,一项研究证实高效有氧健身锻炼与Sutterella丰度增加和物种多样性呈正相关。
其他
● 由21号染色体三体所引发的神经发育遗传病——唐氏综合症,其患者的异常行为评分与大量的Sutterella显著相关。
● 通过对Roux-en-Y胃转流术(RYGB)和SG后二型糖尿病(T2D)的特定肠道微生物群的研究发现,其Sutterella可能对RYGB后T2D患者的糖代谢产生有益的影响。
Sutterella对于人体健康的影响并不仅限于以上病症,大多可归类为胃肠道类紊乱以及神经系统性疾病。
岩藻多糖
岩藻多糖具有降低Sutterella丰度的作用。
岩藻多糖是一种从褐藻中获取的复杂硫酸多糖,被认为是一种蛋白益生元。它可以改变肠道菌群,减缓环磷酰胺诱导的肠道粘膜损伤,减少宿主中的抗原负载和炎症反应。并且,岩藻多糖对减少Sutterella 的丰度,以及提高Prevotella的丰度具有显著的效果。
一项健康成年人多酚干预研究显示Sutterella增加。
低聚半乳糖
低聚半乳糖和低聚果糖的组合可以改善抑郁的症状。
补充低聚半乳糖(GOS)以及低聚果糖(FOS)的混合补充物,可以改善啮齿动物的焦虑以及抑郁的行为。
一项研究指出给狗服用益生元后检测出更多的Sutterella。
由于现今对Sutterella 相关的临床性实验以及具有说服力的研究数据不足,无法支持证明其作用完全性。Sutterella 决定性作用以及对人体的确定性影响还有待研究。
维生素D
与所有营养素一样,维生素适量会帮助身体健康。但是高剂量的维生素会导致小鼠发生严重的结肠炎,Sutterella 的增加,表明高剂量维生素D导致向促炎症微生物群的转变。此外,高剂量维生素D小鼠的血清维生素D水平显著下降,并伴有结肠炎,这可能是由于维生素D代谢产物因摄入过量维生素D引起的肠道炎症所致。
提高维生素D还应该多晒太阳和补充维生素D的丰富的食物,如鱼油等。
此外,Sutterella显示对甲硝唑的耐药性。
主要参考文献:
Targeting Gut Microbiota Dysbiosis: Potential Intervention Strategies for Neurological Disorders[J].Engineering,2020, 6(4):415-423.
Williams BL, Hornig M, Parekh T, Lipkin WI. Application of novel PCR-based methods for detection, quantitation, and phylogenetic characterization of Sutterella species in intestinal biopsy samples from children with autism and gastrointestinal disturbances. mBio. 2012 Jan 10;3(1):e00261-11
Xue M, Ji X, Liang H, et al. The effect of fucoidan on intestinal flora and intestinal barrier function in rats with breast cancer[J]. Food & Function, 2018, 9(2).
Sutterella Species, IgA-degrading Bacteria in Ulcerative Colitis,
10.1016/j.tim.2020.02.018,2020-03-23.
Hiippala K, Kainulainen V, Kalliomäki M, Arkkila P, Satokari R. Mucosal Prevalence and Interactions with the Epithelium Indicate Commensalism of Sutterella spp. Front Microbiol. 2016 Oct 26;7:1706.
Williams BL, Hornig M, Parekh T, Lipkin WI. Application of novel PCR-based methods for detection, quantitation, and phylogenetic characterization of Sutterella species in intestinal biopsy samples from children with autism and gastrointestinal disturbances. mBio. 2012 Jan 10;3(1):e00261-11.
Lv W, Liu C, Ye C, et al. Structural modulation of gut microbiota during alleviation of antibiotic-associated diarrhea with herbal formula[J]. International Journal of Biological Macromolecules, 2017.
Adams JB, Johansen LJ, Powell LD, Quig D, and Rubin RA. 2011. Gastrointestinal flora and gastrointestinal status in children with autism—comparisons to typical children and correlation with autism severity. BMC Gastroenterol. 11:22.
Greetham HL et al. 2004. Sutterella stercoricanis sp. nov., isolated from canine faeces. Int. J. Syst. Evol. Microbiol. 54:1581–1584.