-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

目前可获得的有关人类不同人群微生物组成的大量数据显示,总体而言,人类肠道中最丰富的细菌属于两个门,即厚壁菌门和拟杆菌门。而在拟杆菌门的成员中,有两个属占主导地位——拟杆菌属(Bacteroides)和普雷沃氏菌属(Prevotella)。
在任何生态系统中,某些生物体往往扮演着更为重要的角色。类似于在人类社会中,科学家和发明家对人类发展做出了重大贡献,肠道菌群社区中也存在一些关键物种,它们在菌群的定植、聚集、生存和保护方面发挥着重要作用。这些关键物种包括拟杆菌属的某些物种、普雷沃氏菌属的某些物种,以及其他一些共生菌。它们在维持肠道生态平衡和促进健康方面具有重要贡献。
普雷沃氏菌和拟杆菌是两类重要的肠道细菌,它们来自同一个祖先,但在进化过程中选择了不同的生存环境:
◆ 拟杆菌
拟杆菌是肠道中的“先驱开拓者”,从婴儿时期就开始在肠道定居。它们能够很好地适应肠道环境,主要有两个原因:
一是因为婴儿的饮食相对简单,主要是一些简单的糖类,而拟杆菌恰好擅长分解这些糖类,把它们转化为更简单的糖分,不仅自己获得营养,还能为其他细菌提供食物来源。
二是它们能够很好地利用肠道粘液层中的粘蛋白。这些粘蛋白就像”停靠站”,帮助细菌在肠道中定居。
此外,细菌居民获取营养物质可能需要:
1)细胞外多糖水解酶
2)细菌细胞表面的受体蛋白
3)适当的糖转运系统
4)细胞质碳水化合物降解酶
拟杆菌属成员的多糖利用位点(PUL)刚好包括:
分泌的糖苷酶
细胞表面聚糖结合蛋白的补体
TonB依赖性外膜寡糖受体/转运蛋白
细胞质膜中的摄取转运蛋白
细胞质碳水化合物代谢酶
然后它们通过多糖利用位点来获取和利用营养,这使其能在竞争激烈的肠道环境中占据优势的同时,还能影响其他菌的生存。
例如Bacteroides thetaiotaomicron VPI-5482菌株具有88个多糖利用位点,可用于降解各种聚糖,包括饮食衍生和宿主聚糖。还具有灵活的聚糖捕食能力,当膳食多糖变得稀缺时,它可以轻松切换到宿主多糖。在营养缺乏期间,这为肠道细菌组的生态系统提供了整体稳定性。
◆ 普雷沃氏菌
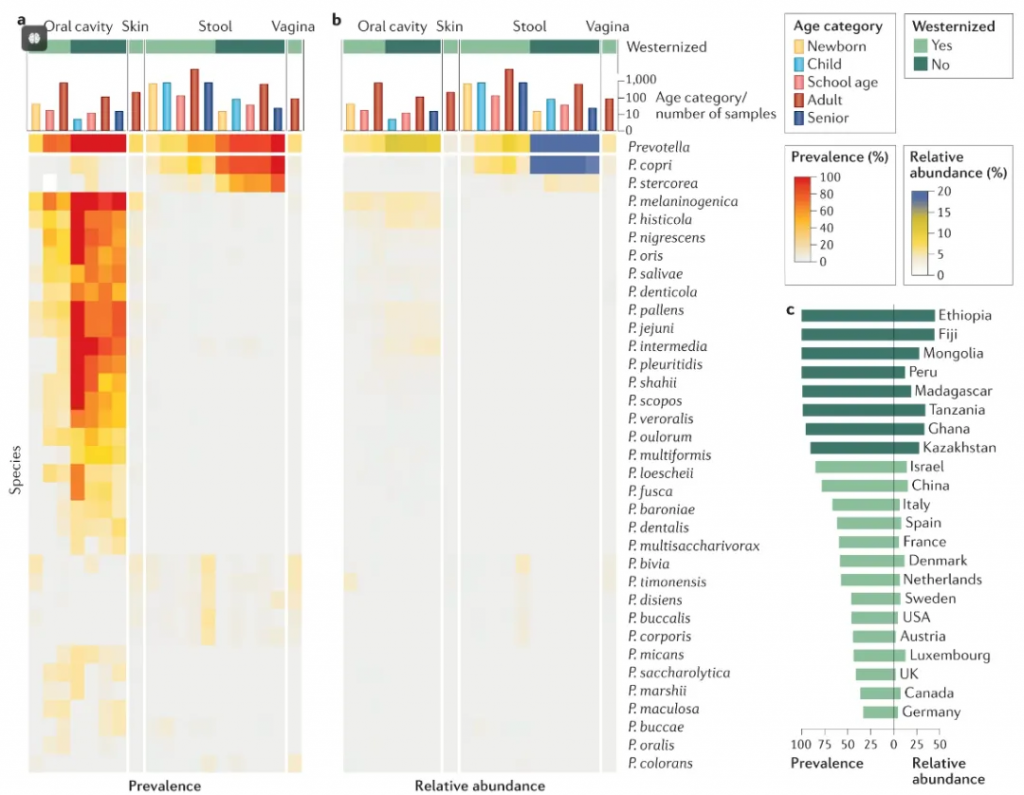
普雷沃氏菌属以微生物学家AR Prevot的先驱之名命名。普氏菌属包含50多个已鉴定的物种,除了存在于肠道,在人体的口腔和阴道丰度也较高。
虽然都是拟杆菌门下的革兰氏阴性厌氧菌,但普雷沃氏菌属的糖利用和分解能力弱于拟杆菌,并且缺乏参与戊糖磷酸途径的酶,如葡萄糖6磷酸脱氢酶、6磷酸葡萄糖酸脱氢酶,这使它们与拟杆菌属不同。
普雷沃氏菌属是肠道中的膳食纤维发酵剂,与地中海饮食呈正相关,特别是与高碳水化合物以及水果和蔬菜摄入量有关。
一项研究利用小鼠研究了拟杆菌和普雷沃氏菌在无菌小鼠体内的相互作用。实验结果显示,当两种细菌同时定植时,拟杆菌的数量超过普雷沃氏菌,但两者的数量都低于它们单独定植时的水平。这表明两种细菌之间可能存在拮抗作用。
通过进行 PubMed、Web of Science 核心合集和 Google Scholar 电子搜索确定了研究。我们发现85篇出版物报告了饮食模式对肠道微生物群落的影响,特别是普雷沃氏菌与拟杆菌(P/B)比率。但单一饮食成分对普雷沃氏菌的影响并不容易预测。
在一项随机对照试验,80名超重参与者被随机分配到不同的干预组或对照组,以比较不同干预措施的效果。发现在普雷沃氏菌与拟杆菌比率(P/B)高的个体比P/B比率低的个体多减重和减脂3.8kg。
高纤维摄入(>30g/10MJ)时:
P/B比率高组减重8.3kg
P/B比率低组减重3.2kg
两组差异达5.1kg
相关性分析:
P/B比率高组:纤维摄入与体重变化强相关(r=0.90)
P/B比率低组:相关性较弱(r=0.25)
这项研究表明,肠道菌群中P/B比率可能是预测减重效果的重要指标,特别是在高纤维饮食干预中。
图片来源:Laura Marshall/NPG
2011年,科学家首次提出了“肠型”的概念,试图将人类肠道中的微生物群落分类。这就像是给我们的肠道细菌”划分阵营”,帮助我们更好地理解肠道微生物的分布特点。
最初科学家认为有三种主要的肠型,但随着研究深入,实际上主要确定了两种显著的类型:
以拟杆菌属(Bacteroides)为主导的类型
以普雷沃氏菌属(Prevotella)为主导的类型
第三个与瘤胃球菌有关,但不够明显,因为瘤胃球菌分布在其他两类中。
■ 饮食习惯与肠型的关系
研究发现,不同地区、不同饮食习惯的人群往往具有不同的肠型特征:
西方饮食人群(如欧美人群)
特点:高蛋白、高脂肪、低纤维
主导菌:拟杆菌较多
传统饮食人群(如非洲农村):
特点:高纤维、低蛋白、多植物性食物
主导菌:普雷沃氏菌较多
■ 有趣的研究发现
儿童研究
意大利儿童(西式饮食,低纤维,更多的动物蛋白、脂肪和糖,母乳喂养1年):拟杆菌占优势
非洲儿童(传统饮食,富含蔬菜和纤维,母乳喂养到两岁):普雷沃氏菌占优势
母乳喂养的婴儿:双歧杆菌较多
跨文化比较
美国人vs非洲人:饮食习惯不同导致肠道菌群差异明显
城市vs农村:生活方式的差异也会影响肠道菌群构成
总体而言,采用西方饮食的美国人和欧洲人的肠道微生物群往往以拟杆菌属和梭菌目为主,而高纤维、低蛋白饮食的农村人口往往以普雷沃氏菌为主。
■ “肠型”概念的局限性
想象一下,我们在试图给不同人的肠道细菌”画像”。科学家们发现,虽然”肠型”这个词很常用,但可能过于简化了实际情况。这就像把人分类成”高个子”和”矮个子”,忽略了身高其实是连续的,中等身高的人可能更多。
两种主要细菌的重要性
拟杆菌和普雷沃氏菌是最常见的两种主要细菌
它们通常占据肠道细菌总量的40%以上
有趣的是,当一种细菌数量多时,另一种就会很少
常规研究方法的特点
科学家们通常用特殊的方法(PCoA和NMDS)来分析样本。这些方法就像在地图上标注位置:相似的样本会被画在一起,不同的样本会被画得远一些。因为这两种主要细菌的变化最大,所以它们在分析中的影响最明显。
研究的挑战
当研究的细菌种类太多,而样本数量较少时,可能会得出不准确的结论。目前的证据表明,把人的肠道细菌简单地分成几种固定的”肠型”可能不够准确。
从谷禾的角度以及部分科学家的建议还是不要简单地用”肠型”来给人分类,改用”具体的菌群结构以及指标或生物标注物”这个概念。这些标志物可以更好地反映一个人的生活环境和健康状况。
因为肠道菌群比我们想象的要复杂得多,不同的生活方式和饮食习惯会影响肠道菌群,需要更细致的方法来研究和理解肠道健康。
这就像是从”给人贴标签”转变为”理解每个人的独特性”,这种方式更科学,也更有助于我们理解如何维护肠道健康。
① 拟杆菌:肠道中的”适应高手”
拟杆菌就像是肠道中的“生存专家”,它们有着令人惊叹的适应能力。让我们来看看它们是如何在肠道中生存和繁荣的:
•超强的环境适应能力:氧气适应
虽然拟杆菌通常不喜欢氧气,但它们能在极少量氧气存在的环境中生存,这种能力帮助它们在人体组织中更好地定居。例如,脆弱拟杆菌可以在低O2条件下生长,这可能有利于它在含氧宿主组织中建立初始感染。
•灵活的饮食习惯
婴儿时期:能利用母乳中的营养物质
断奶后:可以转而消化植物纤维
它就像一个”美食家”,几乎能消化各种碳水化合物,例如B.thetaiotaomicron会根据宿主的情况调整其食物来源,在哺乳期优先使用宿主衍生的多糖以及来自母乳的单糖和寡糖,然后在断奶后扩大其新陈代谢以使用植物多糖。
•竞争策略
拥有类似”微型武器系统”的机制,能够抑制其他细菌的生长,确保自己的生存空间。拟杆菌进一步在胃肠道中立足,利用类似于 VI 型分泌系统的系统将物质转移到胃肠道中的受体微生物,输出抗菌效应物并拮抗其他胃肠道细菌。
•基因的”魔法”
拟杆菌最神奇的地方在于它的基因特性:
基因的灵活性
能够根据需要“开启”或”关闭”特定基因
就像随身携带的”百宝箱”,需要什么就拿出什么
在对174个脆弱拟杆菌组临床分离株的研究中,至少有10个编码孔蛋白的不同基因序列和8个青霉素结合蛋白的不同序列,这可能影响生物体的抗菌敏感性。
•基因的学习能力
能从其他细菌那里”学习”新的基因(称为水平基因转移),这种能力让它们能获得新的特性,比如抗药性。
多样的基因版本:同一个功能的基因可能有多个不同版本,能根据环境选择最合适的版本使用。
肠道微生物群中拟杆菌门的数量较多,水平基因转移率较高,这对拟杆菌门与其他细菌之间的微生物组基因转移产生了重大影响,导致整个细菌群落发生重要的遗传变化。
由于拟杆菌的这些特性,它们可能帮助传播抗生素耐药性,这提醒我们要谨慎使用抗生素。
② 拟杆菌:肠道中的多面手
拟杆菌是肠道中最稳定和重要的细菌之一,它们具有非常丰富的代谢能力,能够影响人体的多个生理功能。
•智能适应系统
拟杆菌有一个特殊的”感应系统”,能够检测环境中的营养物质,根据需要,它可以快速开启或关闭相应的基因,产生不同的消化酶。这种能力让它能够适应各种不同的食物来源。
拟杆菌属凭借其多功能的多糖利用机制可以降解复杂的植物多糖,如淀粉、纤维素、木聚糖和果胶,使它们成为微生物群中最稳定的成员,并能够作为关键物种影响微生物组。
•强大的消化能力
能分解复杂的植物纤维,如淀粉、纤维素等,当简单糖类已经被人体吸收后,它仍能利用其他复杂的营养物质,这种能力使它成为肠道中的“常驻居民”。
•产生多种有益代谢物
能产生有益物质,如短链脂肪酸(SCFA),包括:琥珀酸、乙酸、丙酸、丁酸。
丁酸盐被用作结肠上皮细胞的主要能量来源,而丙酸盐和乙酸盐是肝脏中脂肪生成和糖异生所必需的。
除此之外,拟杆菌属还能产生神经递质类化合物,如GABA。在一项对人类肠道拟杆菌分离株的研究中,几乎所有分离株都产生 GABA,浓度范围很宽(取决于前体可用性和浓度)。有强有力的临床前和临床证据表明微生物群影响神经系统的发育和功能,并可能影响大脑功能和心理健康。
③ 拟杆菌:肠道的守护者
拟杆菌不仅参与消化,还能保护我们的肠道健康,特别是在抵抗有害细菌入侵方面发挥重要作用。
•对抗感染
几种拟杆菌属会产生胆汁盐水解酶,这些酶可解离逃逸肠肝再循环的胆汁酸,这是将初级胆汁酸转变为次级胆汁酸的两步过程的第一步。这种转化过程能够抑制艰难梭菌(一种导致严重腹泻的细菌)的生长。在粪便菌群移植治疗中,这种机制帮助患者预防艰难梭菌感染的复发。研究发现拟杆菌含量越高,艰难梭菌感染的风险越低。
•维持肠道屏障,调节微生物平衡
拟杆菌帮助维持肠道壁的完整性,减少炎症反应,保护肠道健康。同时促进有益菌群的生长,增加肠道微生物的多样性。
•其他健康影响
拟杆菌还可以帮助调节血糖水平,参与脂肪代谢可能与预防肥胖和糖尿病有关。研究表明拟杆菌数量减少可能与肥胖有关;一些研究发现它与2型糖尿病呈负相关;某些拟杆菌种类可能有助于改善胰岛素敏感性。
④ 拟杆菌:平衡中的潜在病原体
虽然大多数研究表明拟杆菌对健康有益,但也存在一些复杂性。它们通常是共生生物,但一些拟杆菌属。可能是机会致病菌。
一些情况,包括胃肠道疾病、创伤、癌症和胃肠道手术,可能会使拟杆菌逃离胃肠道中的生态位,侵入其他解剖位置并引起感染。
促进这种入侵的脆弱拟杆菌的毒力因素包括其产生的脆弱拟杆菌毒素(增加通透性并诱导活性氧形成)、裂解粘蛋白多糖的神经氨酸酶和促进脓肿形成的荚膜多糖。
拟杆菌最常与腹内感染相关,通常是因为肠壁完整性受到损害而发生。如果不及时治疗,这些感染可能会发展为菌血症。
触发条件:
-肠道疾病
-外伤
-癌症
-手术创伤
这些情况可能导致拟杆菌”越界”,从肠道进入身体其他部位。
致病机制:
-产生特殊毒素(BFT),可能损害组织
-分泌能分解粘液的酶
-形成保护性外壳,有助于细菌存活
-可能引发的健康问题
常见感染:
-腹腔感染(最常见)
-血液感染
-皮肤和软组织感染
-肺部感染
-脑部感染
危险信号:
-当肠道屏障受损时,感染风险最高
-如果不及时治疗,可能会扩散到血液中
治疗方法:
甲硝唑是首选药物,其次还有一些抗生素包括:哌拉西林-他唑巴坦、亚胺培南、美罗培南。
治疗注意事项:
-通常需要联合用药,因为感染往往涉及多种细菌
-医院感染可能需要额外的抗生素覆盖
未来随着拟杆菌对抗生素的耐药性增加,需要开发新的治疗策略,预防感染变得越来越重要。
因此,保持肠道健康,避免不必要的抗生素使用,手术时注意预防感染,及时治疗肠道疾病。
⑤ 拟杆菌:在抗癌中的双重角色
拟杆菌是一类在肠道中常见的细菌,它在癌症发展和抑制中的作用是一个颇具研究价值的话题。
•保护与免疫调节
拟杆菌产生代谢副产物,如丁酸盐,对肠道健康具有保护作用。
在一项动物研究中,使用携带肠癌的小鼠模型,发现移植脆弱拟杆菌有助于减少体重减轻并抑制肿瘤生长。
•与免疫疗法的协同作用
在接受抗癌药物ipilimumab治疗的小鼠中,脆弱拟杆菌似乎增强了药物效果,并减轻了药物引发的肠道不良反应。
•拟杆菌的促癌潜力
携带特定毒素的脆弱拟杆菌可能在特定情况下增加结肠癌风险。有研究指出,结肠癌患者肠道中脆弱拟杆菌毒素基因的数量较多。
一些动物研究也表明,当拟杆菌定殖在肠道时,可以促进肿瘤发生。
未来识别哪些具体的拟杆菌种类最有利于预防癌症,了解哪些种类可能促进癌症发展是重要的研究方向。
⑥ 拟杆菌:抗炎作用
普通拟杆菌(FTJS7K1)在脂多糖诱导的急性肠道损伤小鼠模型中显示出对急性炎症的显著保护作用,包括恢复因急性损伤而受到干扰的肠道微生物群。
移植物抗宿主病(GVHD)是一种促炎性疾病,由同种异体造血细胞移植后供体T细胞发展而来。在一项临床前小鼠GVHD模型研究中,给予脆弱拟杆菌增强了小鼠肠道的多样性,减少了急性GVHD的发生,并预防了慢性GVHD。
金氏副拟杆菌(P. goldsteinii)已被证明有助于免疫系统的成熟和发展。具体而言,P.goldsteinii促进了 CD4+效应T细胞亚型的发育,调节肠粘膜的适应性免疫,从而在肠粘膜的稳态和炎症中发挥重要作用。
β-己糖胺酶是拟杆菌门中的一种保守酶,有助于预防小鼠结肠炎模型中的炎症。
普雷沃氏菌属(Prevotella)是人类体内、特别是在肠道和口腔中常见的细菌群之一,具有多种重要的菌群特性。
① 生态位与环境适应
普雷沃氏菌主要存在于人类的口腔和肠道中。在健康的口腔微生物群中,普雷沃氏菌是一种普遍存在的菌种,且在肠道微生物群中占据重要位置。它们通常作为共生菌存在,但在特定条件下可能转变为机会性病原体。
•主要栖息地
口腔环境:在牙菌斑、牙周袋等部位常见
消化道:主要分布在结肠和直肠
女性生殖道:在阴道微生物群中也有发现
•环境适应特征
普雷沃氏菌是一类严格厌氧的细菌,能够在缺氧环境中生存,这是它们适应宿主微环境的关键特性。它们对宿主的免疫环境具有一定的适应能力,能够调节宿主免疫反应,促进其自身的生存和繁殖。
氧气耐受性:严格厌氧,需要低氧或无氧环境生存
pH适应性:最适pH在6.5-7.0之间
温度要求:37℃为最适生长温度
营养需求:需要特定生长因子,如维生素K和血红素
② 代谢特征与营养方式
普雷沃氏菌在代谢方面表现出高度的灵活性,能够利用各种碳源,包括植物性纤维和淀粉。它们能够生成短链脂肪酸,如丙酸和丁酸,这些代谢产物对于宿主的肠道健康具有重要意义。
此外,普雷沃氏菌还与宿主的营养状态和代谢健康密切相关,可能在一些代谢疾病中扮演角色。
•碳水化合物代谢
主要底物:
-复杂多糖(如木聚糖、果胶)
-植物性纤维
-粘蛋白
代谢产物:
-短链脂肪酸(如丙酸、丁酸)
-琥珀酸
-乳酸
•特殊代谢能力
多糖降解酶系统:
-β-木糖苷酶
-α-葡萄糖苷酶
-纤维素酶
蛋白质降解能力:
-产生蛋白酶
-肽酶系统完整
③ 基因组特征
普雷沃氏菌拥有丰富的基因组多样性,其中某些种类如P.copri表现出显著的遗传多样性。研究表明,这些细菌的不同亚种可能对维持宿主健康或诱发疾病具有不同的功能特性。
它们的基因组常包含与代谢能力、毒力因子及抵抗药物相关的基因,这使得普雷沃氏菌在健康与疾病之间的界限变得模糊。
•基因组结构
基因组大小:2.5-3.5 Mb
GC含量:约40-48%
基因密度:每kb约0.9个基因
•功能基因特征
碳水化合物代谢相关基因:
-多糖降解酶基因簇
-糖转运体基因
耐药基因:
-β-内酰胺酶基因
-外排泵基因
毒力因子基因:
-粘附素
-溶血素
④ 肠道分布特点与生态学意义
•群落分布特征
-某些人群中可达20%以上
地理分布差异:
-东亚人群中部分人含量较高
-非洲农村人群中含量较高
-西方发达国家人群中含量较低
•菌株代谢能力差异
研究表明,西方人群中的普雷沃氏菌(特别是P.copri)往往缺乏有效代谢碳水化合物的能力。这一现象与西方饮食结构有关,通常富含高脂肪和低纤维,这使得某些普雷沃氏菌在这样的环境中生存和增殖的能力受到限制。
而东亚人群的普雷沃氏菌则表现出较强的代谢碳水化合物的能力,尤其在以碳水化合物为主的饮食中,普雷沃氏菌能显著占据主要菌群的组成。
•生态适应性
东亚地区人群中的普雷沃氏菌群体在饮食多样性与微生物生态位的适应性上表现出更高的灵活性,这可能与他们的饮食模式(例如更多的全谷物和蔬菜)密切相关。相对地,西方人群由于饮食结构的变化,导致普雷沃氏菌的生态位和多样性出现了很大的变化,从而影响了肠道微生物组的平衡。
⑤ 健康相关性
•有益作用
-维持肠道屏障功能
-产生有益代谢物:短链脂肪酸、维生素B族
-调节免疫系统:促进Th17细胞分化、调节炎症反应
•潜在风险
-与某些疾病相关:牙周炎、类风湿性关节炎、炎症性肠病
-机会性感染:在免疫力低下时可能致病、可能参与混合感染
⑥ 致病机制和触发因素
1.环境因素
普雷沃氏菌的致病性与特定的环境因素密切相关,包括:
-pH值改变:口腔或肠道的pH值显著变化,会促进普雷沃氏菌的生长,特别是在细菌性阴道病或口腔感染中。
-氧化还原电位改变:微环境中的氧气水平异常,过度的厌氧环境可能会促使厌氧细菌大量繁殖。
-营养物质改变:特定营养物质的过度丰富(例如糖类)可能会导致普雷沃氏菌的快速增殖。
2.宿主因素
宿主的状态也是普雷沃氏菌引发感染的重要因素,包括:
-免疫功能低下:免疫抑制治疗、HIV感染或器官移植后的免疫抑制可能使宿主更易受到普雷沃氏菌的感染。
-局部屏障受损:例如粘膜损伤、手术创伤或放化疗后的局部损伤,会使普雷沃氏菌更容易入侵。
3.微生态失衡
-优势菌群改变:抗生素的使用可能导致菌群失调,抑制保护性菌群的生长,使得普雷沃氏菌过度增殖。
-菌群多样性下降:多样性的减少往往会导致生物膜的形成和感染风险的增加。
普雷沃氏菌的致病机制包括以下几种:
1.直接致病作用
普雷沃氏菌通过产生毒素直接致病:包括内毒素和外毒素,这些毒素能够导致组织损伤和炎症。
普雷沃氏菌产生的毒力因子

组织侵袭:普雷沃氏菌还可能释放组织降解酶,破坏周围组织和细胞间连接。
2.免疫介导损伤
-炎症反应激活:普雷沃氏菌的感染可刺激宿主免疫系统,促进炎症因子的释放和趋化因子的产生,导致局部或全身的免疫反应。
免疫失调:T细胞应答的异常可能导致自身免疫反应,使得宿主的免疫反应对自身组织造成损伤。
3.代谢紊乱
普雷沃氏菌在代谢方面的失调可能导致:
-营养物质竞争:普雷沃氏菌可能与宿主或其他细菌竞争营养物质,从而影响宿主的营养吸收。
-有害代谢产物积累:某些代谢产物可能对宿主造成毒性,进一步加重疾病。
⑦ 感染的信号和治疗
•临床表现
普雷沃氏菌感染的临床表现通常包括:
-口腔症状:如牙龈出血、口臭加重和牙周疼痛。
-消化道症状:如腹痛、腹泻和消化不良。
-全身症状:可表现为发热、乏力和体重下降。
•实验室指标
-炎症标志物的升高:例如C反应蛋白(CRP)和红细胞沉降率(ESR)。
-微生物学检查:可以通过检测普雷沃氏菌的丰度来判断感染情况。
•治疗方案
1.抗生素治疗
对于普雷沃氏菌感染,通常采用以下抗生素:
首选药物:包括β-内酰胺类、克林霉素和甲硝唑。
用药原则:根据药敏结果选择合适药物,确保足量和足疗程,多考虑联合用药。
2.微生态调节
益生菌补充:可以使用乳酸杆菌和双歧杆菌,有助于帮助恢复健康的肠道微生物群。
益生元应用:如低聚糖和膳食纤维可促进益生菌的生长。
3.免疫调节
免疫功能评估和支持:可使用免疫调节剂和提供必要的营养支持。
•治疗注意事项
1.用药监测
定期评估疗效和不良反应,关注药物耐药性的发展。
2.预防措施
维持良好的口腔卫生和调整饮食结构以避免菌群失调。
3.长期管理
定期复查和生活方式指导用以防止复发。
⑧ 肠道普雷沃氏菌—饮食与健康
普雷沃氏菌属,尤其是P.copri复合群,通常与非西方饮食模式以及富含碳水化合物、抗性淀粉和纤维的饮食习惯相关。
在西方饮食中,梭状芽孢杆菌属(包括瘤胃球菌科和毛螺菌科)通常负责降解膳食纤维。尽管如此,通过增加富含纤维的食物来进行营养干预时,往往会导致普雷沃氏菌数量的增加。
•膳食纤维与普雷沃氏菌和拟杆菌丰度密切相关
膳食纤维不仅能改善糖代谢,还与普雷沃氏菌和拟杆菌的相对比例关联密切。研究显示,普雷沃氏菌对葡萄糖稳态和整体代谢有潜在的益处。然而,也有研究指出,P. copri与胰岛素抵抗相关,而其在基线时的较低水平则与超重个体在地中海饮食干预后改善胰岛素抵抗的效果相关。
普雷沃氏菌能有效分解膳食中的复杂多糖。这一点与人类的代谢密切相关,因为人类基因组中编码的酶只能降解有限类型的碳水化合物,比如蔗糖、乳糖和淀粉。因此,肠道微生物能够发酵多糖,促进人类营养吸收是至关重要的。
此外,普雷沃氏菌能够分解植物来源的多糖和某些宿主来源的粘蛋白,但不具备分解动物来源多糖的能力。这就解释了为何工业化西方人群的普雷沃氏菌多样性下降,因为他们很少摄入多种类的植物性食物。
研究也表明,普雷沃氏菌的多样性越高,其在消化多糖和维持肠道稳态方面的能力就越强。在这些发现基础上,研究人员正在努力揭示普雷沃氏菌对于饮食变化和健康状况的具体影响机制,尽管目前对其角色的理解仍存在一定的争议。
共存关系的形成
1.进化适应
普雷沃氏菌和拟杆菌都经过长期进化,形成了与人类肠道共生的关系。它们在进化过程中获得了特殊的代谢能力:
-可以分解复杂的膳食纤维
-与人体免疫系统相适应的表面分子结构
-能够在肠道厌氧环境中生存的代谢系统
2.生态位分配
这两类菌群在肠道中形成了独特的生态位分配:
拟杆菌主要分布在结肠前端,更适应中性偏酸性环境;
而普雷沃氏菌则在结肠后段较为丰富,能够适应更广范围的pH值。
3.不用降解能力
此外它们对不同类型的膳食纤维具有互补性的降解能力。
拟杆菌主导型:
-适应高蛋白、高脂肪的西式饮食
-产生更多支链氨基酸和饱和脂肪酸
-倾向于形成较高的胆汁酸代谢活性
普雷沃氏菌主导型:
-适应高纤维、植物性为主的饮食
-产生更多短链脂肪酸
-有利于维持肠道屏障功能
拟杆菌代谢特点:
-善于降解动物性蛋白质
-产生较多的乙酸盐和丙酸盐
-影响胆固醇代谢
普雷沃氏菌代谢特点:
-擅长发酵复杂碳水化合物
-产生琥珀酸等代谢物
-影响葡萄糖代谢
相互制约机制
1.营养物质竞争
两类菌群之间存在竞争关系
对碳源的竞争:不同种类的膳食纤维
对氮源的竞争:蛋白质和氨基酸
对微量元素的竞争:铁、锌等
2.代谢产物影响
拟杆菌主要通过产生短链脂肪酸(SCFAs)来抑制普雷沃氏菌的生长。乙酸盐是拟杆菌产生的主要SCFAs之一,在酸性环境下可抑制普雷沃氏菌的生长,研究表明高浓度乙酸盐会降低普雷沃氏菌的增殖速率。
拟杆菌还通过琥珀酸途径产生丙酸盐,可降低环境pH值,不利于普雷沃氏菌生长,对普雷沃氏菌的生物膜形成有抑制作用。
普雷沃氏菌发酵碳水化合物产生琥珀酸,高浓度琥珀酸可抑制拟杆菌的生长,影响拟杆菌的代谢通路。
占比此消彼长的原因
1.饮食因素
拟杆菌属通常被认为是能够有效降解多种膳食纤维的细菌,尤其是在高纤维饮食环境中表现良好。这种菌群能够利用复杂的碳水化合物(如植物多糖)作为其主要能量来源,同时能促进短链脂肪酸的生成。
而普雷沃氏菌特别是P. copri复合群,通常与丰富的碳水化合物、抗性淀粉和膳食纤维的饮食模式相关。这类菌群能较好地利用膳食纤维,尤其是对于那些以植物性为主的饮食表现出强大的代谢能力。特定的普雷沃氏菌在研究中显示出较强的能力来降解阿拉伯木聚糖和低聚果糖,这些物质常见于富含纤维的饮食中。
2.环境因素
pH值变化会影响两种菌群的相对丰度
肠道氧化还原电位的改变会影响菌群平衡
肠道蠕动速度会影响营养物质的可及性
普雷沃氏菌的健康影响机制
普雷沃氏菌(Prevotella)在不同健康状况下的影响机制涉及多个领域,特别是在与炎症、代谢和免疫反应相关的疾病中。
炎症反应
普雷沃氏菌与类风湿性关节炎(RA)等免疫介导疾病的发病机制相关。
一些研究指出,普雷沃氏菌可引发促炎性T细胞(如Th17细胞)的反应。这些细胞分泌多种细胞因子(如IL-17),加剧局部和全身性炎症,从而可能导致关节和组织的损伤。
研究发现,普雷沃氏菌的数量增加与粪便样本中的炎症因子水平升高相关。此外,普雷沃氏菌在类风湿性关节炎患者的滑液中也存在,表明其可能通过免疫激活机制参与疾病的发生。
代谢影响
普雷沃氏菌与葡萄糖代谢的关系相对复杂。
一些研究显示,P. copri 可能与胰岛素抵抗相关,但其作用依赖于饮食和个体差异。在高纤维饮食下,普雷沃氏菌的富集通常有助于改善葡萄糖稳态。
其主要机制可能与普雷沃氏菌对抗性淀粉和其他膳食纤维的高效发酵能力相关,这使得它们能够生成短链脂肪酸,为宿主提供代谢能量,有助于改善代谢综合症。
微生物群失调
普雷沃氏菌的丰度在不同人的微生物组中表现出差异。在细菌性阴道病(BV)或HIV感染相关的肠道菌群失调情况下,普雷沃氏菌的增加与炎症因子的释放、局部免疫反应的增强有关,可能导致更易患其他感染。
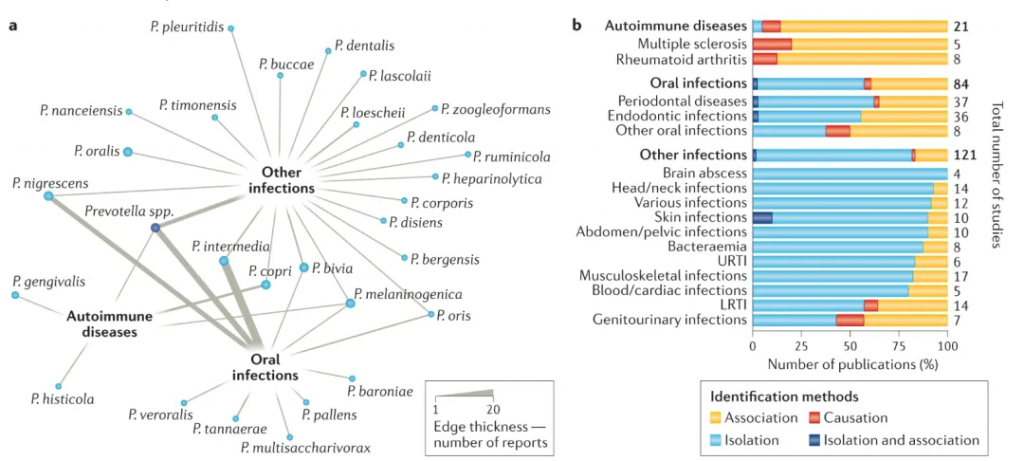
doi.org/10.1038/s41579-021-00559-y
网络分析显示每种普雷沃氏菌与一种或多种疾病(分为三大类:自身免疫性疾病、口腔感染或其他感染)的关联,基于总共226项研究。边的厚度与报告普雷沃氏菌与疾病关系的文章数量成正比。
❤ 编者总结
这两个菌属是中国人群肠道菌群最主要的两个属,两个菌属代表了不同的饮食习惯,展现了肠道菌群令人惊叹的适应能力和复杂的相互作用。它们不仅在进化过程中形成了独特的生态位分配,还通过各自的代谢特长参与营养物质的消化和吸收,还能通过产生多种代谢物来调节人体免疫系统,影响我们的整体健康状况。
主要参考文献
Hjorth MF, Blædel T, Bendtsen LQ, Lorenzen JK, Holm JB, Kiilerich P, Roager HM, Kristiansen K, Larsen LH, Astrup A. Prevotella-to-Bacteroides ratio predicts body weight and fat loss success on 24-week diets varying in macronutrient composition and dietary fiber: results from a post-hoc analysis. Int J Obes (Lond). 2019 Jan;43(1):149-157.
Rinninella E, Raoul P, Cintoni M, Franceschi F, Miggiano GAD, Gasbarrini A, Mele MC. What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases. Microorganisms. 2019 Jan 10;7(1):14.
Hitch TCA, Bisdorf K, Afrizal A, Riedel T, Overmann J, Strowig T, Clavel T. A taxonomic note on the genus Prevotella: Description of four novel genera and emended description of the genera Hallella and Xylanibacter. Syst Appl Microbiol. 2022 Nov;45(6):126354.
Shah HN, Collins DM. Prevotella, a new genus to include Bacteroides melaninogenicus and related species formerly classified in the genus Bacteroides. Int J Syst Bacteriol. 1990 Apr;40(2):205-8.
De Filippis F, Pasolli E, Tett A, Tarallo S, Naccarati A, De Angelis M, Neviani E, Cocolin L, Gobbetti M, Segata N, Ercolini D. Distinct Genetic and Functional Traits of Human Intestinal Prevotella copri Strains Are Associated with Different Habitual Diets. Cell Host Microbe. 2019 Mar 13;25(3):444-453.e3.
De Filippis F, Pellegrini N, Laghi L, Gobbetti M, Ercolini D. Unusual sub-genus associations of faecal Prevotella and Bacteroides with specific dietary patterns. Microbiome. 2016 Oct 21;4(1):57.
Larsen JM. The immune response to Prevotella bacteria in chronic inflammatory disease. Immunology. 2017 Aug;151(4):363-374.
Tett A, Huang KD, Asnicar F, Fehlner-Peach H, Pasolli E, Karcher N, Armanini F, Manghi P, Bonham K, Zolfo M, De Filippis F, Magnabosco C, Bonneau R, Lusingu J, Amuasi J, Reinhard K, Rattei T, Boulund F, Engstrand L, Zink A, Collado MC, Littman DR, Eibach D, Ercolini D, Rota-Stabelli O, Huttenhower C, Maixner F, Segata N. The Prevotella copri Complex Comprises Four Distinct Clades Underrepresented in Westernized Populations. Cell Host Microbe. 2019 Nov 13;26(5):666-679.e7.
Hjorth MF, Blædel T, Bendtsen LQ, Lorenzen JK, Holm JB, Kiilerich P, Roager HM, Kristiansen K, Larsen LH, Astrup A. Prevotella-to-Bacteroides ratio predicts body weight and fat loss success on 24-week diets varying in macronutrient composition and dietary fiber: results from a post-hoc analysis. Int J Obes (Lond). 2019 Jan;43(1):149-157.
Gellman RH, Olm MR, Terrapon N, Enam F, Higginbottom SK, Sonnenburg JL, Sonnenburg ED. Hadza Prevotella Require Diet-derived Microbiota Accessible Carbohydrates to Persist in Mice. bioRxiv [Preprint]. 2023 Mar 9:2023.03.08.531063.
Yeoh YK, Sun Y, Ip LYT, Wang L, Chan FKL, Miao Y, Ng SC. Prevotella species in the human gut is primarily comprised of Prevotella copri, Prevotella stercorea and related lineages. Sci Rep. 2022 May 31;12(1):9055.
Iljazovic A, Roy U, Gálvez EJC, Lesker TR, Zhao B, Gronow A, Amend L, Will SE, Hofmann JD, Pils MC, Schmidt-Hohagen K, Neumann-Schaal M, Strowig T. Perturbation of the gut microbiome by Prevotella spp. enhances host susceptibility to mucosal inflammation. Mucosal Immunol. 2021 Jan;14(1):113-124.
Tett, A., Pasolli, E., Masetti, G. et al. Prevotella diversity, niches and interactions with the human host. Nat Rev Microbiol 19, 585–599 (2021).

谷禾健康

每个人的一生都会经历很多,从出生到长大,健康到衰老疾病。你的出生、遗传、家庭环境、很大程度上决定的人生起点,日常的饮食、行为习惯决定你的身体成长,一些不同的选择或意外的事件又会让人生有很多起伏和不同。
每个人的菌群和我们的人生一样也是独一无二的,我们菌群的特点反映着不同人各自生活的烙印。从母亲的腹中开始影响和决定了我们最初的菌群,出生方式、喂养的食物、用药等都决定了我们的菌群基数。当我们开始从喝奶到开始摄入辅食,我们的菌群也同样迎来巨大的演变。当我们生病、感染、运动、饮食、社交、虚弱、衰老这些同样反映在我们菌群的变化和演替上。
相对的,当我们更多的了解我们的菌群,善待和改善它们,同样的变化也会出现在我们的身体和生活中。
越来越多的证据表明,年龄与人类微生物群之间的关联很大,肠道微生物群是许多年龄相关变化的核心,包括免疫系统失调和疾病易感性。几个身体部位的微生物组成可以相对准确地预测人类的年龄。
谷禾健康肠道菌群检测数据库中,也有关于肠道年龄预测:
谷禾健康-肠道年龄预测模型图
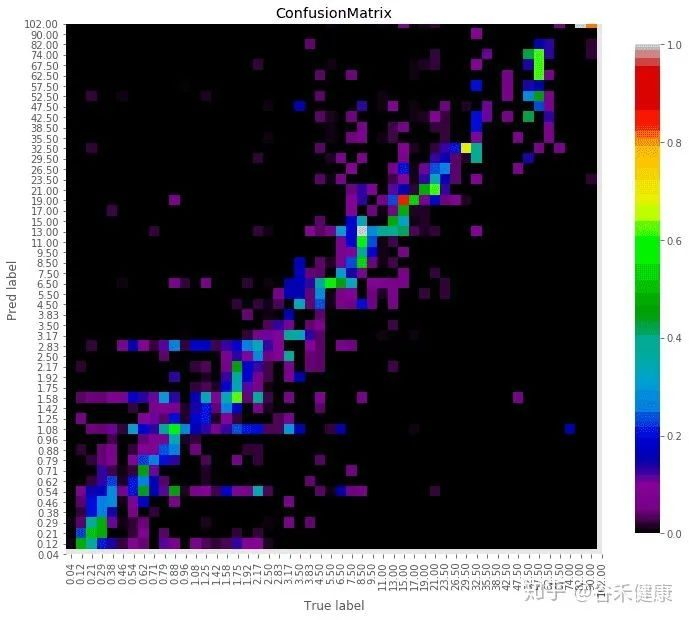
<来源:谷禾健康肠道菌群数据库>
可以看到,肠道年龄和生理年龄基本是符合的。健康人的肠道菌群年龄恰恰是最符合真实年龄的,与真实年龄差异大意味着肠道菌群出现偏离。
健康的人存在更多样化且平衡的肠道菌群。微生物群中与年龄相关的变化归因于生理,生活方式和健康状况。这些因素中的每一个都与某些菌群的相对丰度变化有关。
例如,饮食、卫生、兄弟姐妹、宠物、过敏、儿童疾病和抗生素是影响儿童微生物组的一些突出因素。到了成年期微生物群相对稳定,而到了老年期,一些有益菌开始逐渐下降,菌群又向另一个阶段过渡。
在从出生到死亡和分解的每个生命阶段,微生物群落都是身体的动态组成部分。研究微生物群的自然和诱导变化有可能彻底改变我们对人类生物学的理解。
本文介绍了健康人的微生物群在一生中的变化,讨论了从出生时菌群构成,到疾病或抗生素使用时的变化,再到死亡时的微生物扩展的各个阶段,以及这些阶段在身体部位和组成(细菌、真菌或病毒)上的差异。了解微生物群与年龄关系的未来研究方向,以此对人体微生物群及基于此的干预有更好的了解。
微生物群落存在于人体的每个粘膜表面,人的每个身体部位都有一个独特的生态学。每个人的微生物群像指纹一样,都是独特的。
在个体内,特定的身体部位、地理位置和个体的年龄与健康微生物群具有极强的关系。年龄驱动人类微生物群的α多样性和β多样性。
在了解各个阶段的微生物群变化之前,我们先了解一个概念:微生物演替。
微生物演替是指微生物群落中一种或多种生物的存在、相对丰度或绝对丰度的变化。
在正常或健康衰老期间,微生物演替的三个主要阶段自然发生在人类生活中。
✦初级演替(出生时先锋菌群定植,快速变化直到童年晚期)
第一阶段,初级演替,从先锋物种首次建立群落时开始,随后微生物群落发生快速变化。从出生到童年,变化率降低,许多中间物种存在于出生到童年晚期之间。
初级演替结束于顶级群落的形成,在青春期实现,并在很大程度上持续到成年;该群落的特征是其相对稳定。
虽然成年期的微生物群比儿童期更稳定,但仍然存在变异,这引发了关于人类微生物群中是否存在顶级群落的争论。成年微生物群的自然变异存在于小时(昼夜节律)到年(老化)的时间尺度上,但微生物群相对稳定,除非存在干扰,如饮食或药物的改变。
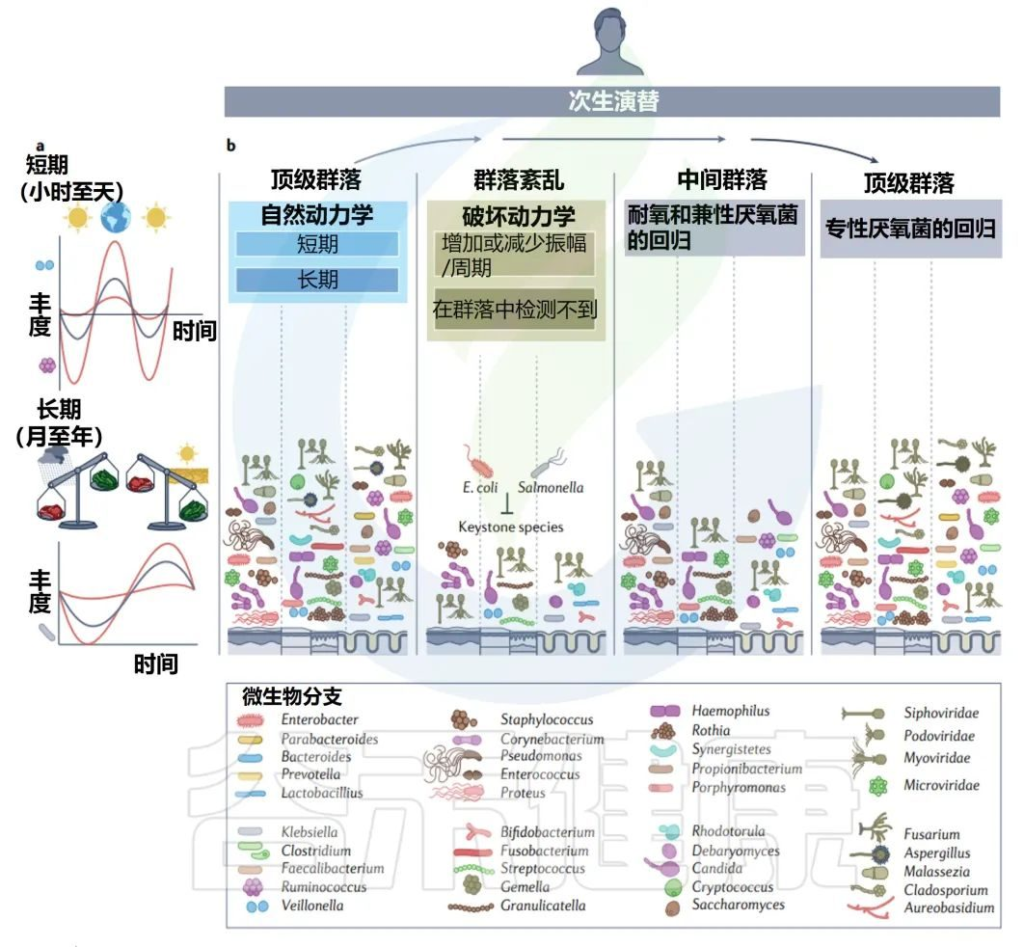
✦次生演替(菌群的改变,重建)
下一个阶段,即次生演替,发生在一个先前存在的稳定群落一部分被改变或移除之后,然后群落再生到相同的状态或不同的状态。这可以通过抗生素等医疗手段人为实现,也可以通过霍乱弧菌感染等疾病自发实现。
人类的次生演替的特征是至少有一段时间的随机过程占主导地位。在诱导条件下,如单疗程抗生素,群落遵循类似于初级演替的过程,其中现有微生物群落的一部分充当“微生物记忆”,帮助重建一个类似于以前存在的群落。
这一过程被认为是由核心微生物群驱动的,而不是驱动初级演替的先锋微生物。
✦末期演替(自然衰老和死亡阶段)
最终的末期演替是宿主自然衰老和死亡的一部分。在老年期间,微生物群落再次以更高的变化率,成功产生了一个由更少成员组成的群落,通常变形菌门(也称为假单胞菌)的相对丰度增加,有时占总优势。
研究演替的每个阶段使研究人员能够解决与人类相关的微生物群落是如何形成和维持的。通过了解这些过程,我们可以更好地了解微生物群随着年龄的增长的变化及其与人类健康的关系,了解如何管理微生物群。
人类相关微生物群从受孕到死亡的变化
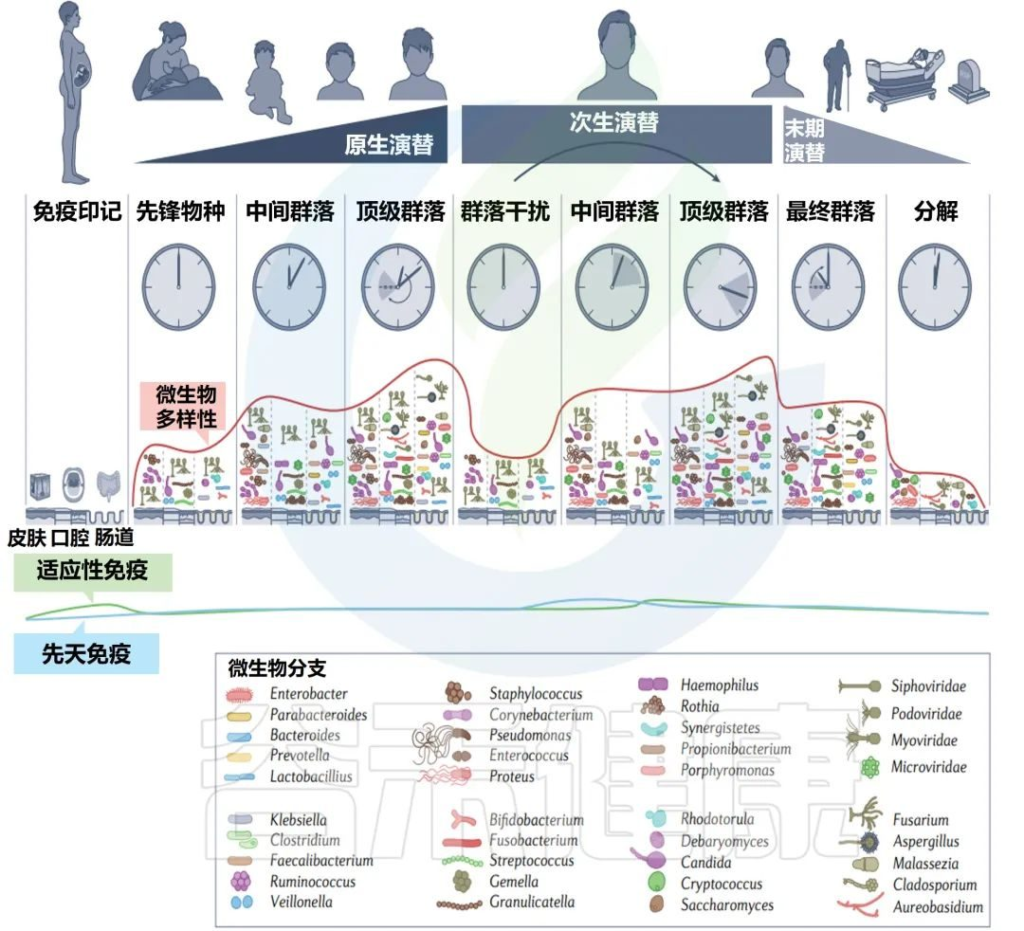
Martino C,et al.Nat Rev Microbiol.2022
常驻细菌、真菌和病毒的多样性在人类生命的各个阶段都会发生变化。模拟时钟代表每个微生物群落阶段发育的宿主年龄的相对时间。
免疫印记在出生前通过母亲的微生物群及其代谢物开始(第一栏)。先锋物种的初始定殖始于出生,身体部位特定的微生物群落出现(第二栏)。这些群落的复杂性不断增加,直到它们达到相对稳定的群落结构(第三列和第四列)。
这些微生物群落的次生演替可能来自内部和外部扰动(第五栏)。中间微生物重新建立初始群落,并再次达到稳定状态(第六列和第七列)。
在晚年,随着寄主接近自然死亡,群落经历了最后的演替和变化(第八栏)。微生物演替的最后阶段发生在腐败和分解阶段。在此阶段,多样性进一步下降,在最初的24-48小时内,许多人类微生物群结构保持不变,但随后很快开始侵蚀分解(第九栏)。
绿线和蓝线分别显示了微生物演替不同阶段的适应性免疫和先天免疫的相对强度。
不同年龄段的细菌多样性测量
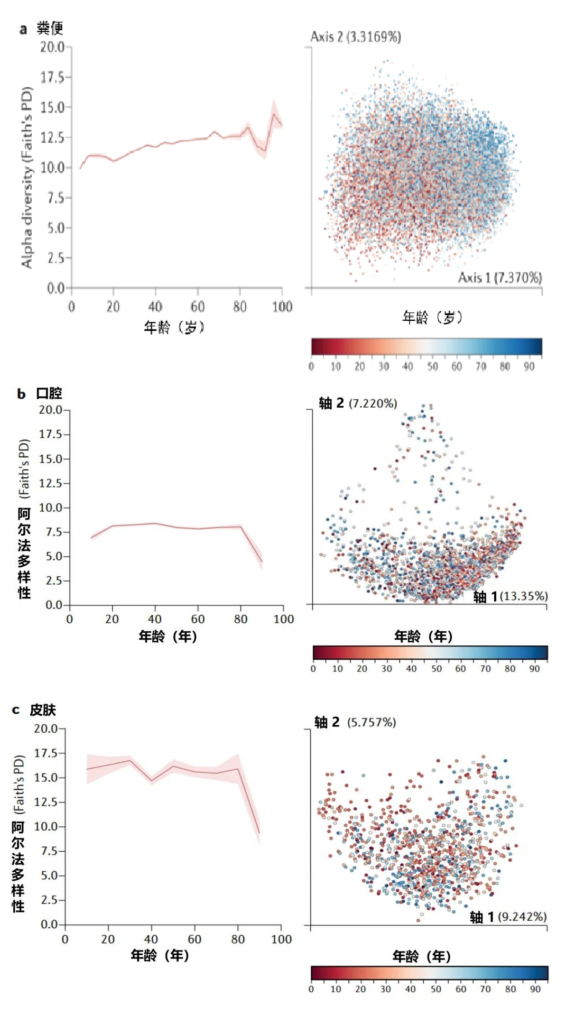
Martino C,et al.Nat Rev Microbiol.2022
美国一个肠道项目集中测量了从儿童到老年的人类粪便(a部分)、口腔(b部分)和皮肤(c部分)微生物群的细菌多样性和系统发育史,该项目包含21919个粪便、1920个口腔和998个皮肤微生物群样本,带有16S核糖体RNA基因扩增子序列。
α多样性,一种对样本中不同类型微生物数量的定量测量,通过Faith的系统发育多样性(PD)α多样性度量跨年龄测量。
UniFrac β多样性主坐标分析,一种用于比较微生物群落相似性的方法,其中空间上接近的点表示相似的样本,空间上远离的点表示不同的样本,按年龄着色。
✦胎儿时期——菌群及代谢物影响免疫发育
塑造人类微生物群的第一个因素来自胎儿发育过程中的母亲。
胎儿通过胎盘接触到母亲微生物群落产生的代谢物,这些代谢物会影响其免疫系统,并会影响正常微生物群和后期病理学的各个方面。代谢物,如短链脂肪酸(乙酸盐)和其他微生物化合物,可以通过胎盘转移到胎儿体内,并影响免疫发育。母亲的饮食和健康也会影响这些代谢物。
胎儿组织中的乙酸盐影响与成人调节性T细胞生成相关的表观遗传印记,其与防止生命后期哮喘的发展相关。
✦出生后——菌群受出生模式,饮食,环境等影响
出生后,微生物群落根据身体部位迅速分化。
在最初的时候,先锋物种和未来4年的群落发展可能会受到出生模式和妊娠时间的影响。中间群落由饮食影响,如母乳或配方奶粉的消费,以及环境。
最后,饮食和环境再次塑造了稳定的顶级群落。主要由真菌、细菌和病毒组成。
子宫内和生命早期的主要演替
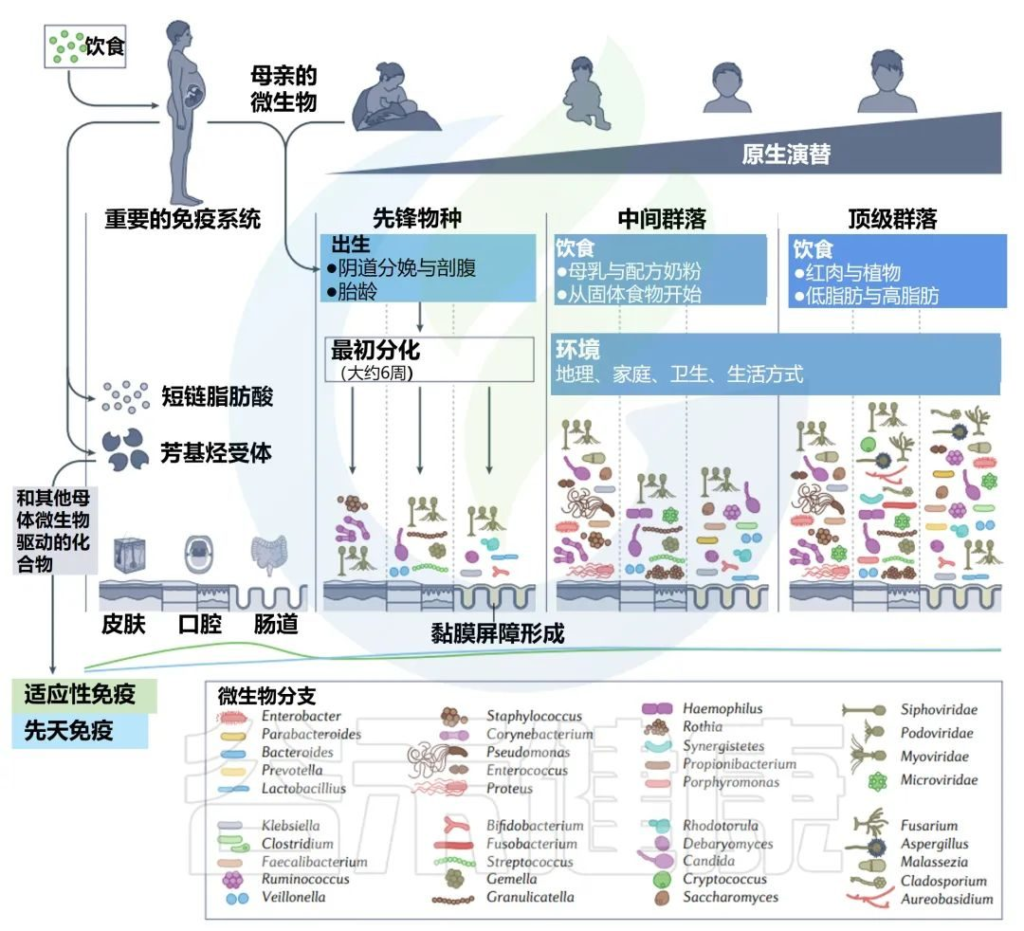
微生物代谢物和配体调节宿主芳基烃受体,这有助于塑造新生儿微生物和免疫发育。母亲使用抗生素和胃肠道相关疾病,如炎症性肠病,也被认为会通过胎儿免疫系统的印记增加后代的病理风险。
然而,这些联系仅在非人类实验中研究过。在一个案例中,由患有炎症性肠病的孕妇或其新生儿的微生物群所定殖的无菌小鼠继续发展出异常微生物群和指示炎症性肠病的免疫发育。
✦怀孕期间母体的微生物群与免疫系统的变化
在怀孕期间,母亲的微生物群和免疫系统也发生了改变。母亲的阴道微生物群变得更加多样化,通常由在其他身体部位发现的许多微生物群组成。
孕期母体免疫系统与胎儿形成协同作用,包括通过胎盘转移IgG抗体。
关于出生时获得的微生物群是否通过混合来源于阴道和粪便,或者阴道微生物群本身在出生时是否具有多能性,是否是微生物先驱的主要来源,存在一些争议。
无论确切的母体来源如何,这一阶段的特征是先锋细菌种类。包括下列菌群:
然后这些细菌定居在常规身体部位:肠道、口腔和皮肤。
许多先锋细菌是兼性厌氧菌,它们会消耗氧气,从而使专性厌氧菌能够在以后的每个环境中定居。起初,新生儿的每个身体部位都相对未分化,但先锋微生物很快开始启动身体部位依赖性微生物多样性的级联,至少在生命的第4到第6周,每个部位的细菌都可以很容易地区分。
先锋细菌进驻后,生命早期的微生物群逐渐开始形成。接下来的章节我们来了解生命早期的肠道,口腔,皮肤等各部位的微生物群(包括细菌、真菌、病毒等)。
✦肠道细菌群——双歧杆菌主导
人类肠道细菌群落的发展已经得到了很好的研究。
双歧杆菌属一直占主导地位,直到在生命的第一年结束时,它们被双歧杆菌、梭状芽孢杆菌和拟杆菌属的组合所取代。拟杆菌属的丰度增加,而双歧杆菌属等物种的丰度相对减少。
双歧杆菌分解母乳低聚糖,开始终生影响免疫系统
最近,一项研究发现,双歧杆菌等细菌含有母乳低聚糖分解代谢所需的基因,与婴儿免疫发育之间存在功能联系。特别是,接受Bifidobacterium infantis EVC001极化初始T细胞的婴儿的粪便水与来自对照组的粪便水平不同,其方式与减少肠道炎症有关。
其他菌属也可降解母乳低聚糖(如拟杆菌、阿克曼菌)
到3-6岁时,肠道细菌群落汇聚到整个成年期持续的顶级群落。这一微生物群是已知的密度最大、多样性最强的生态群落之一。通常,在这段时间内,普通健康人中只有两个细菌门占优势:厚壁菌门和拟杆菌门。
✦肠道其他微生物群——真菌、古细菌、病毒
在人类肠道发育过程中,对病毒组、真菌组和古菌组的研究远远少于细菌组。在整个生命周期中,真菌群落所占的总数远远少于细菌组或病毒组。
//真菌群落
真菌群落在生命的最初几天含有大量的Rhodotorula和Debaryomyces,接下来的一个月则是CandidaCryptococcus和Saccharomyces spp.。
到成年时,主要的真菌属是Aspergillus, Candida和Saccharomyces。
//古细菌群落
发育期间肠道的古细菌群落尚不清楚,但古细菌是一些最早的移生菌落,但丰度较低。
早期定植的古细菌包括Methanosphaera和Methanobrevibacter。
// 病毒群落:噬菌体家族在出生后就开始流行
主要由噬菌体组成的病毒群落在出生后的第一周数量众多。噬菌体家族Siphoviridae、Podoviridae和Myoviridae在出生后立即流行,主要以溶原形式整合到细菌基因组中。
到生命的第四个月,有尾噬菌体目大量生长,成员更常为裂解型(传染性噬菌体颗粒或主动复制的噬菌体)。
在成人中,Caudovirales和Microviridae在肠道噬菌体群落中占主导地位,但噬菌体肠道病毒组对个体具有高度特异性,其演替仍有许多未知之处。
与噬菌体不同,感染真核病毒的肠道病毒组主要与儿童和成人的病理相关。最近,在健康儿童和健康成人中也观察到一些感染真核细胞的病毒丰度较低,但其发生时间和流行率尚不清楚。
✦口腔细菌群:出生后几个月逐渐趋于稳定,牙齿形成后再次转变
在出生时,口腔细菌群在以下菌属中的流行率很高:
在接下来的几个月里,Lactobacillus和Fusobacterium也开始流行。Staphylococcus的丰度在出生后3个月左右达到峰值,然后稳步下降,让位与更高丰度的GemellaGranulicatella, Haemophilus和Rothia spp.
牙齿形成后,口腔微生物群再次转变,在成年期具有更高丰度的梭杆菌门, Synergistetes, Tenericutes, Saccharibacteria (TM7), SR1 。
✦口腔其他微生物:成年口腔含产甲烷菌,最常见的噬菌体群是尾状病毒
口腔真菌群落被认为比皮肤和内脏的真菌多样性少。Candida spp.是口腔的第一批真菌定植菌。对中级口腔真菌群落知之甚少,但成年人CandidaCladosporiumAureobasidium
AspergillusFusarium和Cryptococcus spp.的丰度较高。
发育过程中的口腔古菌体尚不清楚,但成年口腔中含有许多古菌产甲烷菌,包括甲烷杆菌属。
目前对人类婴儿口腔中病毒的知之甚少。在成年人中,与肠道类似,最常见的噬菌体群是尾状病毒。
口腔病毒群在本质上通常被视为病理性的(例如柯萨奇A病毒、麻疹病毒、红疹病毒和人乳头瘤病毒),并且没有对病毒群落组成进行纵向研究。然而,在无症状和健康成人中也观察到许多真核病毒分类群。
✦皮肤细菌群落:出生时母亲阴道乳杆菌属占据较多,4-5周与成人相似
皮肤细菌群落在出生时含有大量的母亲阴道乳杆菌属。到第4-5周,婴儿皮肤微生物群与成人皮肤微生物群相似,但在青春期继续变得更具位点特异性。
Staphylococcus和Corynebacterium在不同位点PseudomonasEnterobacterEnterococcus,
Proteus和Klebsiella在特定位点(如腋窝与前臂)。
✦皮肤其他微生物:马拉色菌占比较高,古细菌占4%左右
在皮肤真菌群落中,MalasseziaCandida和 Saccharomyces在生命的前30天最为普遍。对于中间群落的确切组成知之甚少,但成年真菌群落中Malassezia的丰度通常很高,估计约占真菌群落总组成的75%至90%。
关于皮肤古细菌群落的发育情况了解较少,但古细菌约占成年人菌群的4%。大体上,成年人皮肤古细菌群由Thaumarchaeota门和Euryarchaeota门代表。在成人皮肤上也发现了Halobacteriaceae和 Methanobrevibacter。
与肠道和口腔不同,健康的皮肤微生物群拥有相对较少的已知病毒多样性,很少有对其进行研究,可能是由于与低生物量样本相关的技术限制。不过,皮肤上有一些自然存在的病毒群。
以上了解关于生命早期肠道、口腔、皮肤的微生物群,那么哪些因素会给生命早期的微生物群发展带来影响?
在生命的最初几年中,有几个因素塑造并区分了微生物群落的发展。
✦出生方式和母体抗生素的使用
出生方式和母体抗生素的使用是影响人类微生物群落的研究最好、最清楚的因素之一。然而,微生物的发育可能会导致独特的结果,即使是在同居的同卵双胞胎中,这可能是由于许多未知或随机的过程。
通过剖腹产和围产期和新生儿抗生素暴露,自然微生物群落的建立过程可能会在所有身体部位受到干扰。这一发现突出了阴道微生物群落的重要性,阴道微生物群落自然含有大量Lactobacillus spp.,但在青春期发生改变,对女性健康至关重要。
一些最佳样本的婴儿发育研究,通常缩写为DIABIMMUNE ECAM和TEDDY,在婴儿出生后的前2年和3年进行了随访,重点关注抗生素使用或出生方式的影响。
在上述所有研究中,阴道分娩的婴儿的拟杆菌属相对丰度高于剖腹产婴儿。
由于缺乏建立微生物群落的天然先锋微生物群,导致可变的群落组成被认为是由随机过程而不是确定性过程驱动的,出生模式对微生物群落组成的影响直到生命的第四年仍然可见。
出生模式影响的一个例外是早产,可能是由于在出生后的头几天大量使用抗生素,其特点是无论出生模式如何,微生物发育都不稳定。婴儿微生物群自然发育的这种改变与感染、免疫疾病、肥胖和神经内分泌异常的风险增加相关。
✦母乳喂养:母乳低聚糖给菌群带来稳定性
其次,与其他因素相比,母乳喂养对微生物群的发育有很大影响。与母乳喂养相比,配方奶粉的使用导致了更高的多样性和更不确定的微生物群落。
例如,考虑到出生时肠道中双歧杆菌科的自然优势,缺乏某些母乳低聚糖作为主要营养源可能会导致初始定植的不稳定性。然而,微生物群、牛奶代谢组和免疫系统发育的多组学整合是一个活跃且快速发展的研究领域。
除了母乳低聚糖,母乳还含有其他免疫调节化合物,例如革兰氏阴性细菌的脂多糖、分泌性IgA、先天免疫因子、抗菌肽和益生元因子。
最后,所有这些因素都会影响人类免疫发育。微生物相关分子模式识别受体与微生物群衍生分子相互作用,代谢物如短链脂肪酸(与GPR43、GPR41和GPR109相互作用)和次级胆汁酸(与FXR相互作用)直接影响免疫发育。
//
这些因素加在一起,有助于形成一个独特的、相对稳定的细菌、真菌和病毒微生物群落,这种微生物群落在人类生命的大部分时间都持续存在。
前面章节了解了婴儿期初级演替期间发生的巨大变化,与之相比,成年期微生物群基本上是稳定的(15-65岁),但该群落可能会受到干扰,因此本章节从以下三方面展开讨论:
健康成年人中某些细菌的基因组随着时间的推移而进化,表明在次生演替中,功能和组成进化以稳定状态发生。
• 昼夜节律影响菌群变化
成人微生物群也会发生自然的短期变化,时间尺度为一天到数月或数年。
短期变化的一个典型例子是微生物群落组成的昼夜节律。与昼夜节律相关的人类基因表达和免疫激活,以及肠道微生物群中细菌的丰度和组成也遵循这种模式。
在小鼠中表现出昼夜循环的细菌家族包括瘤胃球菌科、毛螺菌科、Muribaculaceae和疣微菌科,但对人体的等效周期知之甚少。
青春期和成年生活中的二次演替
Martino C,et al.Nat Rev Microbiol.2022
• 口腔和皮肤的微生物群随清洗而变化
在口腔中,整组真菌和细菌的每日振幅与刷牙频率一致。在皮肤上,真菌和细菌每天的变化也与洗涤频率一致,并依赖于个人护理产品。
• 饮食会影响肠道微生物群
一个经过充分研究的发生在几周到几年范围内的变化的例子是饮食驱动的肠道微生物群的改变。饮食对微生物群落有很大影响,可以包括群落中的自然和可逆变化。
例如,坦桑尼亚哈扎部落在旱季食用富含肉类和块茎的饮食,但在雨季食用富含蜂蜜和浆果的饮食,在拟杆菌等属中表现出较大的季节波动。
饮食对微生物群形成的巨大影响也可能在人类健康中发挥作用,许多工作致力于了解特定的饮食成分和总体饮食模式如何影响微生物群及其对健康的影响。
肠道细菌喜欢大量的水果、蔬菜、全谷物、橄榄油等健康食物。研究表明,饮食主要由富含纤维的食物(如地中海饮食)组成的人具有更大的微生物组多样性,并且通常更健康。
此外例如,西方饮食中红肉含量高,这与全因死亡率有关。肠道微生物群可能以有害的方式将红肉中富含的左旋肉碱转化为三甲胺,而肝脏则将三甲胺转化为三甲胺氮氧化物,据推测这会促进动脉粥样硬化。
肠道微生物群也可以起到保护作用,例如,在红肉被肠道吸收之前将其分解,以防止炎症。除了饮食,还有许多其他因素有助于形成成年微生物群,包括遗传学、地理、宿主因素,如代谢病和药物。
扩展阅读:深度解析 | 炎症,肠道菌群以及抗炎饮食
• 抗生素对微生物群的影响巨大
由于微生物群的破坏而发生的次生演替已被广泛研究和审查。在破坏微生物群的众多因素中,抗生素是最强的,治疗后的恢复率往往各不相同。
抗生素治疗后肠道微生物群反弹的能力被认为取决于特定的群落成员,如拟杆菌和青春双歧杆菌。
扩展阅读:抗生素对微生物组及对人体健康的影响
细菌的天敌抗生素,如何用好这把救命的双刃剑?
疾病本身也会破坏微生物群,无论这种变化是由微生物群落内部、宿主还是多种因素共同引起的。
• 疾病破坏菌群
——肠道:炎症破坏菌群
肠道中的许多其他疾病,如炎症性肠病,破坏了微生物群落,但没有达到新的稳定群落组成,而是在没有干预的情况下继续长期不稳定。
——皮肤:炎症引起金黄色葡萄球菌大量增殖
在皮肤上,特应性皮炎的特征是免疫介导的炎症引起的金黄色葡萄球菌大量繁殖和细菌多样性减少。在金黄色葡萄球菌大量繁殖期间观察到马拉色菌属的数量减少,反之亦然,真菌数量增加导致金黄色葡萄菌数量减少,这部分可能是由于真菌产生蛋白酶的能力,蛋白酶消化金黄色葡萄球菌生物膜并降低细菌逃避免疫系统的能力。
——口腔:细菌和真菌间的竞争和协同
口腔中也存在类似的跨界相互作用;例如,真菌白色念珠菌的定殖依赖于细菌生物膜,但同时,Pseudomonas和Staphylococcus等细菌属分别形成竞争和协同关系。
这些例子强调了微生物群落的相互作用和演替是如何跨域和与宿主作用的,但由于其高阶相互作用的复杂性质,仍然没有完全理解。
干扰后微生物群落恢复的障碍导致许多研究人员探索有针对性地恢复微生物群落的干预措施的可能性。微生物群落恢复包括定向重新播种或某些物种的富集或耗竭,旨在促使微生物群落恢复到接近扰动前的水平。
这可以通过益生菌、益生元、抗生素或其他药物、从健康个体移植完整的微生物联合体或这些的组合来尝试。
尽管这些疗法在某些特征明确的环境中可以非常有效地恢复健康的微生物群落,但它们往往因缺乏与现有群落相互作用的机理知识,或因其仅短暂移植的能力而受到限制。
为了解决这些,研究集中在两个领域:
第一个领域涉及更好地了解群落是如何组合的。例如,对人类发育的研究有助于确定微生物群落在发育过程中如何聚集,以及这种聚集在生命后期的影响。
其次,正在开发新方法,通过探索微生物群落相互作用来确定机制,包括计算和实验,包括高通量共培养和微生物群落的基因组编辑。
为了解决瞬时性问题,采用了两种主要方法:
首先,微生物群疗法的短暂和个性化影响是由每个人的微生物群的个体性质决定的。因此,精准医学将群落改变的目标定位于每个人独特的微生物群,前景广阔。例如,基于微生物群落组成的个性化营养在盲法随机对照干预中有效地改善了餐后血糖。
另外,超越细菌组,探索病毒组和真菌群落及其之间的相互作用,具有巨大的前景。例如,噬菌体疗法已经用于严重的耐药细菌感染,并且对目标细菌菌株具有高度特异性。但大多数此类干预措施仍处于初步研究阶段,且规模成本高昂。
前面章节我们了解了成年微生物群的变化,以及变化后的恢复情况等,成年稳定微生物群在老年时转变为最终群落,本章节来详细了解老年微生物群。
“老年”的确切时间尺度取决于其他几个与宿主相关的因素,如疾病,但迄今为止大多数文献将“老年人”定义为65岁及以上的人。
接近寿命终点的晚期演替
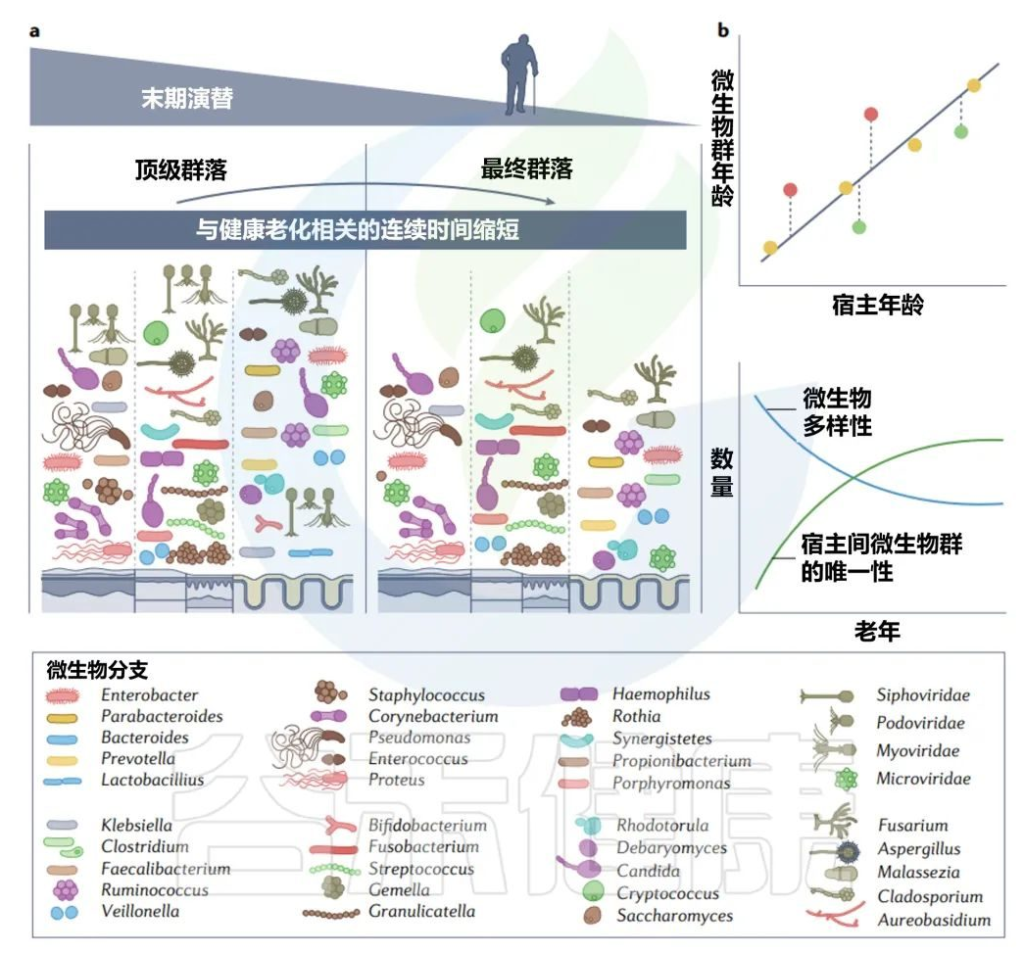
由于生物编程和生命中损伤的累积而导致的衰老影响细胞功能的各个方面,微生物群也不例外。随着年龄的增长,肠道微生物群α多样性减少,β多样性增加。
关于老年微生物群,仍有许多未知之处,而文献也有些矛盾(一项报告称65岁及以上成年人拟杆菌数量增加,与其他研究相矛盾),大多数研究都集中在肠道细菌上。
老年微生物群:年轻优势菌丰度减少
一般而言,肠道中观察到的群落演替是年轻成年人中占优势和普遍的细菌属丰度减少,如Bifidobacteria, Bacteroides, Lactobacillus, 抵御机会细菌爆发的能力降低。
• 皮肤
在65岁及以上的人群中,genera Cutibacterium和Staphylococcus的皮肤细菌数量减少,同时观察到的Corynebacterium。
• 口腔
在口腔部位,Rothia和Streptococcus spp.是核心口腔细菌群落,PorphyromonasTreponema和Faecalibacterium spp.的数量持续减少。
• 肠道
老年期肠道真菌群落的特征是Penicillium, CandidaAspergillus和Saccharomyces spp.的优势度增加。
在皮肤和口腔部位的研究很少,但老年期皮肤上的Malasseziaspp.和口腔内的Candidaspp.丰度减少。
在肠道噬菌体中,成年期的Siphoviridae占主导地位,而老年期的Microviridae和Podoviridae则占主导地位。与肠道细菌、真菌和噬菌体群体相比,真核病毒的多样性在童年后和整个余生中保持不变。
研究重点
由于个体之间的高度变异性,老年微生物演替的研究重点主要是比较健康和不健康的衰老。
目前尚不清楚微生物群是否在健康衰老中起着机械作用,还是仅仅是其他变量的一个有力指标,如饮食、运动和药物。然而,在那些长寿健康的人中,可以观察到在健康成年人中高度流行的菌群的持续保留方面的共同点。
然而,百岁老人表现出更独特的微生物群,α多样性增加,群落组成的个体间差异更大,使“健康”和“不健康”年龄之间的比较复杂化。次生胆汁酸在百岁老人中含量丰富,也可能在健康老龄化中发挥作用。尽管前景看好,但这一研究领域仍处于起步阶段。
扩展阅读:肠道菌群与健康长寿
• 微生物的演替不会随着个体的死亡而结束
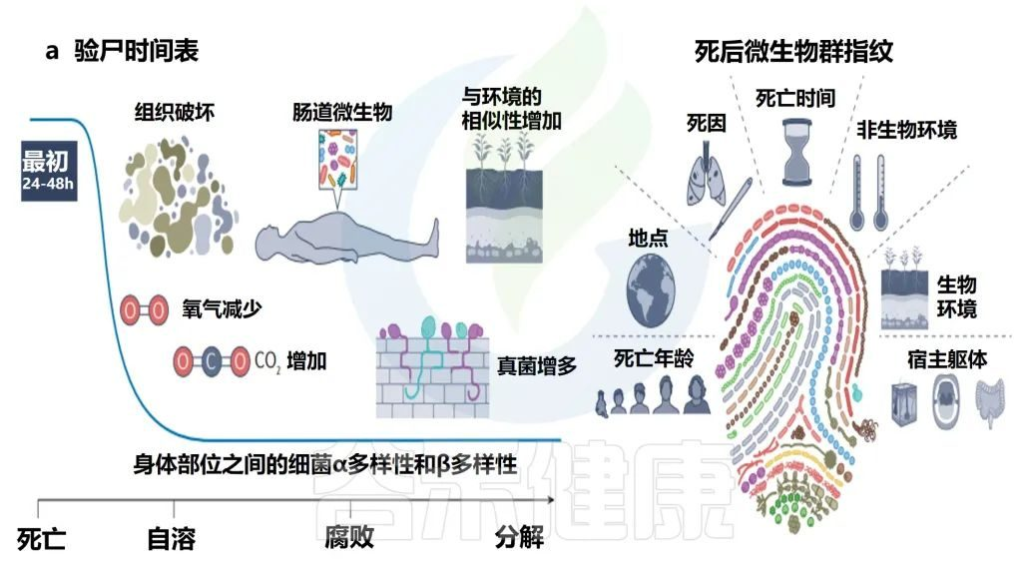
宿主的死亡可以视为微生物群的生态干扰。心脏停止后,组织立即因缺氧而开始分解。细胞功能持续,直到所有剩余的氧气耗尽,二氧化碳不再能够从组织中运输为止。细胞内二氧化碳的积累创造了一个缺氧的酸性环境,导致细胞破裂。
细胞成分,例如酶会泄漏到周围环境中,在被称为“自溶”的过程中进一步促进组织分解。自溶通过消除免疫系统、松开细胞连接并为微生物群提供营养,触发了一系列负责组织分解的微生物过程。
死亡后的微生物群
Martino C,et al.Nat Rev Microbiol.2022
• 死亡后微生物群分解
人类微生物群在死亡后的前24-48小时内相对稳定,具有不同的身体部位微生物生态、年龄的α多样性模式和可识别的个性化皮肤微生物群特征。
在分解的最初几天到几周内,腐败主要由细菌进行,但随着分解的进行,真菌的作用增加。然而,在这个过程中,对病毒组的演替和功能作用了解甚少。
随后,环境变化促进了微生物的演替,改变了人体和微生物群,不再像活着的个体(除非身体被冷冻)。
由于缺乏宿主生活中先前遇到的环境限制,使得微生物的相对丰度发生了快速变化以及在身体各部位的移动。迁移的细菌群成为从肠道转移到肠外部位的先锋物种,根据身体部位参与初级演替或次级演替。
• 死亡微生物群——生物指示器
死亡微生物群因其对法医调查的影响而引起了越来越多的关注。与多个个体和身体部位相关的一致的时间序列模式证明,死后微生物群可以作为死后间隔的生物指示器。
每个尸体的死后微生物群都是独一无二的,并且根据死亡时间、死因、环境、死亡地点和年龄以及开始时身体部位之间的差异,尸体之间的微生物群是不同的。
当微生物演替包括群落成员的快速更替时,在分解的早期阶段(即死亡后的前2-3周),死后时间间隔估计更为准确,但在分解的后期阶段(例如骨骼)仍然有用,因为几乎没有证据可以估计死后时间间期。
• 死亡原因与微生物群存在联系
还证明了与死亡原因和微生物群存在的联系。例如,在死于心脏病的个人的口腔微生物群中发现了的Rothia spp.。
此外,皮肤微生物群脱落可能通过将个人与他们接触过的物品联系起来,从而有助于追踪证据;然而,这一独特特征能够准确匹配到个体的时间取决于对象的材料和用途。
人类微生物群是动态的。考虑到这一点,设计一种能够捕捉微生物群的时间和空间变异性的采样策略非常重要,特别是当这些波动与所提出的科学问题相关时。
✦测量时间不同:多个时间点的样本采集
横断面研究从每个个体收集一个样本,而重复测量研究在多个时间点或身体部位收集样本。随着时间的推移,采样频率应该调整到研究人员试图观察的现象。
例如,小鼠昼夜节律研究通常每2-4小时收集一次粪便样本;而在炎症性肠病中,在一周内对患者进行三到五次采样可以改善疾病分类。
在其他应用中,例如研究特定治疗对个体微生物群的影响,这可能与进行“一对一”研究有关,在该研究中,同一参与者被反复检测其微生物群的结果变化;治疗前采集的样本被视为个体水平的对照。
✦测量空间不同:城市化/农村环境不同
同样重要的是要考虑到人口的微生物群高度依赖于地理和种族。
例如,在一个大型中国群体中,一种与年龄高度相关的微生物在一个美国大型群体中根本没有检测到。
另一个具体的例子涉及城市化社会的“建筑环境”;城市化人群通常较少接触环境微生物,更多地使用家用抗菌剂,与来自农村社会的人类微生物群相比,这导致了重大变化。
这些考虑因素与微生物群领域尤其相关,因为大多数公共微生物群数据来自城市化的北美和欧洲人。因此,现有数据集的结论可能无法很好地推广到全球人口。
从人类微生物群和微生物群研究中生成的测序数据的主要类别是扩增子测序数据和鸟枪测序数据。
✦扩增子测序
在扩增子测序中,对已建立的高变区的PCR产物(扩增子)进行深度测序,从而能够通过与个体“条形码”匹配来识别和测量群体成员。
这里有两种选择:要扩增的基因和该基因的哪一部分要扩增。微生物基因组的常见扩增区域包括:细菌的16S核糖体RNA基因、真核微生物的18S核糖体DNA基因和真菌的内部转录间隔区。
每个特定基因中高变区的选择取决于要捕获的特定微生物,但广泛使用的高变区包括来自地球微生物组项目的V4区。
✦肠道微生物群参与人体的调节
在鸟枪测序中,所有微生物DNA都被测序,而不仅仅是PCR产物,从而能够对微生物进行更具体的分类。由于鸟枪测序不依赖于任何标记基因,因此与扩增子测序相比,它对某些微生物的偏向性较小。
然而,鸟枪测序的成本要高得多,并且需要更大的计算能力,这使得在不需要提高鸟枪序列分辨率的情况下,扩增子测序具有吸引力。
结合其他技术进行扩增子或宏基因组测序可以丰富对微生物群和宿主的理解。定量PCR和荧光激活细胞分选等技术通过将相对丰度锚定到可靠的绝对丰度测量值,为相对丰度提供了更多的背景。
酶联免疫吸附试验和单细胞测序可以通过提供宿主细胞类型或宿主免疫信息与宏基因组测序很好地配对。
培养组学使研究人员能够通过实验验证功能或活性的基因组预测,并将微生物转化为益生菌。微生物产生的代谢物或蛋白质,即微生物群的下游效应物,可以分别通过代谢组学和蛋白质组学进行探测。
最后,宿主基因组学和转录组学越来越多地与扩增子或宏基因组学数据配对,以深入了解宿主基因表达和微生物群之间的联系。
最后,从被调查的参与者那里收集数据至关重要。一般微生物群研究的一些重要元数据类别包括人口统计、临床信息和饮食信息;然而,使用的确切元数据因研究而异。应采用产生标准化元数据的实践,以便结果可重复使用和再现。
本文描述了目前对不同年龄和不同身体部位的人类常驻微生物群落组成的研究现状。
人类健康与微生物群组成之间存在许多联系,对肠道菌群的干预可能改善健康。侧重于整个微生物群而不是单一物种的富集或消除的干预措施,需要了解这些群落是如何形成和维持的。
不同人群年龄,不同部位的微生物群需要依托于大样本数据库的构建,这为微生物群研究的准确性提供了保障。
通过研究人类整个生命周期中的微生物群,我们可以更好地了解这些微生物群复杂的相互作用,以及如何有效地将微生物群推向宿主所需的组成。此外也正应用于除人类健康外的其他领域,如法医学。随着微生物群的相关研究不断突破,将给人类生命健康和生产生活带来巨大的影响。
主要参考文献:
Martino C, Dilmore AH, Burcham ZM, Metcalf JL, Jeste D, Knight R. Microbiota succession throughout life from the cradle to the grave. Nat Rev Microbiol. 2022 Jul 29. doi: 10.1038/s41579-022-00768-z. Epub ahead of print. PMID: 35906422.
Lim, A. I. et al. Prenatal maternal infection promotes tissue-specific immunity and inflammation in offspring. Science 373, eabf3002.
Al Nabhani, Z. & Eberl, G. Imprinting of the immune system by the microbiota early in life. Mucosal Immunol. 13, 183–189.
Helve, O. et al. 2843. Maternal fecal transplantation to infants born by cesarean section: safety and feasibility. Open. Forum Infect. Dis. 6, S68.
Seppo, A. E. et al. Infant gut microbiome is enriched with Bifidobacterium longum ssp. infantis in old order mennonites with traditional farming lifestyle. Allergy 76, 3489–3503.