-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

慢性疼痛已成为困扰全球五分之一成年人的重大公共卫生挑战,表现为一种复杂的、多维度失调的病理状态,深刻影响患者的生理、心理乃至社交。
这一持续3个月或更长时间的疼痛现象,呈现出锐痛、刺痛、灼烧感、酸痛等多样化特征,可能局限于特定部位或广泛分布全身,因其易于复发的特性,给个人、家庭及整个社会带来了沉重的经济与医疗负担。
尽管现代医学在疼痛管理方面已取得一定进展,但现有的治疗策略——如阿片类药物、非甾体抗炎药(NSAIDs)、抗惊厥药及抗抑郁药等,往往伴随着疗效有限、副作用显著(如成瘾、胃肠道损伤、中枢神经系统抑制等)以及个体差异巨大等问题。
更重要的是,这些疗法多以对症处理为主,难以触及慢性疼痛复杂病理生理机制的核心——包括外周敏化、中枢敏化、神经炎症、神经-免疫失衡等关键病理过程,导致许多患者的临床需求远未得到满足。因此,探索慢性疼痛发生发展的深层机制,并据此开发更为精准、高效且安全的创新性治疗策略,已成为疼痛研究领域亟待突破的关键瓶颈。
近年来飞速发展的肠道菌群研究为我们理解和干预慢性疼痛提供了一个新视角。肠道菌群通过”微生物群-肠-脑轴”这一复杂的双向通讯网络,影响着中枢神经系统的功能,包括情绪、认知乃至疼痛感知。越来越多的证据表明,肠道菌群失调与多种慢性疾病的发生发展密切相关,特别是在神经病理性疼痛、炎症性疼痛、内脏痛等多种慢性疼痛模型中,菌群结构与功能的特征性改变及其与疼痛表型的密切联系正以前所未有的速度向纵深拓展。
本文旨在系统阐述慢性疼痛的核心病理特征,并概述肠道菌群失调对宿主生理的广泛影响;深入剖析微生物群-肠-脑轴在疼痛感知与调节中的多通路作用,包括神经、免疫、内分泌及关键代谢产物(如短链脂肪酸、次级胆汁酸、色氨酸代谢物)的介导机制;同时整合最新的临床前与临床研究证据,展示在不同慢性疼痛模型中肠道菌群的特征性改变;评估了当前基于肠道菌群调控的慢性疼痛干预策略,为慢性疼痛的基础研究与临床转化提供参考。
慢性疼痛持续3个月或更长时间,可能持续性的,也可能时好时坏地反复发作。它可能影响人们到无法工作、正常进食、参与体育活动或享受生活的程度。
慢性疼痛有哪些症状?
慢性疼痛有:锐痛、刺痛、灼烧感、搏动性疼痛、酸痛、僵硬感等。
慢性疼痛可能局限于特定部位(背部、颈部、关节)或广泛分布全身。
患有慢性疼痛的人常常也会感到疲倦,睡眠问题,食欲不振和/或对食物失去兴趣,以及体重减轻。
经典闭环:疼痛、抑郁、失眠
疼痛可能会让人专注于疼痛,出现抑郁和易怒,抑郁和易怒通常会导致失眠和疲劳,进而导致更多的易怒、抑郁和疼痛。
慢性疼痛的原因?
一些已知的慢性疼痛原因包括:
这包括关节、肌肉和骨骼的广泛疼痛,通常表现为隐痛或酸痛。
关节炎引起的疼痛也发生在关节中,通常表现为隐痛。这是关节炎对关节造成的损伤所导致的。
腹痛和痉挛可能由于 IBS 发生,这是由于肠道和大脑之间的联系。肠易激综合征引起的慢性疼痛通常包括腹部痉挛和剧烈疼痛,甚至背痛。
持续的下体疼痛可能来自多种原因,包括先前的损伤或特定状况,如坐骨神经痛或椎间盘突出。
虽然头痛和偏头痛不同,但你可能会因为其中任何一种而出现慢性疼痛。如果头痛或偏头痛每月出现 15 天或更多天,则被视为慢性。
这种状况会影响盆腔和腹部区域,并在月经周期期间、之前或之后引起慢性盆腔疼痛。它还可能导致消化问题和一般的胃痛。
患有慢性疲劳综合征的人可能会经历身体疼痛、头痛和喉咙痛,伴随极度疲劳、疲劳和睡眠障碍等症状。
还有很多其他例如癌症等疾病,总的来说,包括神经性的(神经损伤或刺激)、伤害性的(组织损伤、受伤、手术等)、肌肉骨骼性的(韧带、肌腱、肌肉、关节、骨骼等)、炎症性的(免疫系统对感染或受伤的反应)、心因性的(心理状况引起的疼痛)、机械性的(受到物理压力)等。
为什么传统的对症治疗往往收效甚微,甚至可能带来新的问题?要回答这些问题,我们需要深入探讨慢性疼痛的病理生理学基础。
慢性疼痛的本质远非简单的伤害性感受信号的持续传递,而是一个涉及外周及中枢神经系统发生复杂可塑性改变的病理过程。
慢性疼痛的核心特征在于,神经系统对伤害性及非伤害性刺激的反应模式发生了持久性的、异常的增强和放大,使得疼痛感知与初始损伤或刺激的程度和范围不再匹配,甚至在原始致伤因素消失后依然存在。
理解这些核心机制,是后续探讨肠道菌群如何影响疼痛的关键。
外周敏化与中枢敏化:疼痛信号的恶性循环
☆ 外周敏化
外周敏化(Peripheral Sensitization)是指在外周组织损伤或炎症部位,伤害性感受器(痛觉感受器)的兴奋性异常增高的现象。
组织损伤后释放的多种炎症介质,如缓激肽、前列腺素(PGE₂)、TNF-α、IL-1β、神经生长因子(NGF)等,可以直接或间接地作用于感觉神经末梢上的特异性受体和离子通道(如瞬时受体电位香草酸受体1亚型 TRPV1、酸敏感离子通道 ASIC等)。
这些介质通过激活下游信号通路(如PKA、PKC、MAPK等),导致离子通道磷酸化、表达上调或膜转运增加,从而降低伤害性感受器的激活阈值,并增强其对刺激的反应强度。
其结果是,即使是轻微的刺激也会引发强烈的疼痛感(痛觉过敏,hyperalgesia),甚至非伤害性刺激(如轻触)也能诱发疼痛(异常疼痛,allodynia)。
☆ 中枢敏化——慢性疼痛持续化和扩散的关键机制
中枢敏化(Central Sensitization)指脊髓背角和更高级中枢(如丘脑、杏仁核、前扣带皮层等)神经元对伤害性信号的反应性增强和持久性增高。其形成涉及复杂的神经元可塑性改变:
长期或强烈的伤害性输入,导致初级传入神经元末梢释放过量的兴奋性神经递质,如谷氨酸和P物质。谷氨酸激活突触后膜上的AMPA受体和NMDA受体(N-甲基-D-天冬氨酸受体)。特别是NMDA受体的激活,允许Ca²⁺内流,触发一系列下游信号级联反应,导致突触后神经元兴奋性增强,出现wind-up效应和长时程增强(LTP)。
中枢敏化过程中,脊髓背角的抑制性神经元(如释放GABA或甘氨酸的神经元)功能减弱或凋亡,导致对兴奋性信号的抑制不足,进一步加剧了疼痛信号的放大。
来自脑干(如中缝大核、蓝斑核)的下行抑制通路,通过释放5-羟色胺(5-HT)和去甲肾上腺素(NE)等神经递质,对脊髓水平的疼痛传递发挥重要的抑制作用。在慢性疼痛状态下,这些下行抑制通路的功能往往受损,导致疼痛信号的“闸门”失控。
长期的中枢敏化可导致神经元内基因表达发生持久性改变,合成更多促进疼痛的受体、离子通道和神经递质,从而巩固和维持疼痛状态。
神经炎症:疼痛的“催化剂”与“放大器”
神经炎症是指在中枢神经系统(CNS)内发生的炎症反应,以神经胶质细胞(主要是小胶质细胞和星形胶质细胞)的激活为核心特征。在慢性疼痛状态下,神经炎症不仅参与疼痛的启动,更在疼痛的维持和慢性化中扮演关键角色。
作为中枢神经系统中的主要免疫细胞,小胶质细胞(Microglia)在接收到外周损伤信号或神经元异常活动信号后被迅速激活。激活的小胶质细胞形态改变,并大量释放促炎细胞因子(如TNF-α, IL-1β, IL-6)、趋化因子(如CCL2, CXCL1)以及活性氧(ROS)等。这些物质直接增强神经元的兴奋性,促进中枢敏化的形成。
星形胶质细胞(Astrocytes)的激活通常稍晚于小胶质细胞,但在疼痛的慢性化维持中作用更为持久。激活的星形胶质细胞同样释放多种促炎介质,并且可以通过减少对谷氨酸等兴奋性神经递质的清除、下调GABA能抑制以及形成胶质瘢痕等方式,进一步加剧神经元兴奋性的异常和疼痛的持续。
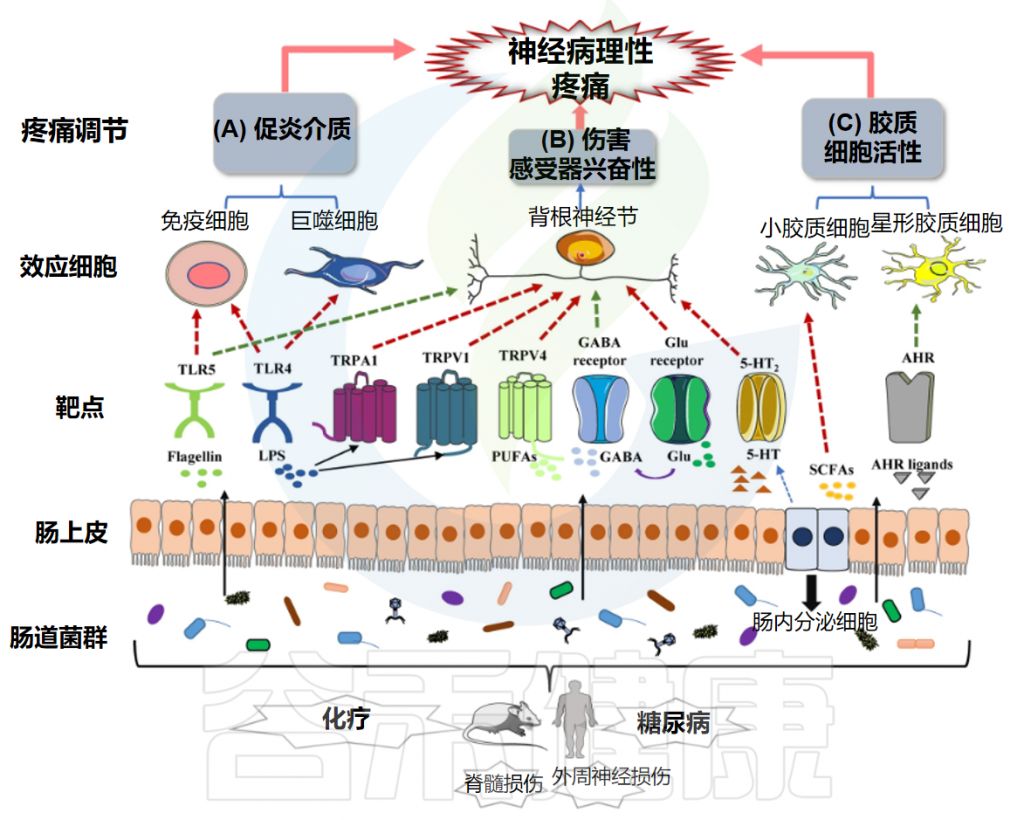
神经免疫交互作用:复杂的对话网络
慢性疼痛的持续化并非单纯的神经系统事件,而是神经系统与免疫系统之间复杂交互作用的结果。
外周免疫细胞(如巨噬细胞、T淋巴细胞)可以释放细胞因子和趋化因子,这些因子不仅作用于外周神经元,还可以通过血脑屏障(在某些病理状态下其通透性会增加)或迷走神经等途径影响中枢神经胶质细胞和神经元的活性。
神经系统也可以通过释放神经递质和神经肽来调节免疫细胞的功能。这种双向的神经免疫对话失衡,是导致炎症反应迁延不愈、疼痛信号持续放大的重要原因。例如,某些T细胞亚群(如Th1, Th17)及其分泌的细胞因子被认为促进疼痛,而调节性T细胞(Treg)则可能发挥疼痛缓解作用。
关键分子与信号通路:疼痛机制的核心节点
上述病理生理过程的实现,依赖于一系列关键分子和信号通路的参与。简要了解这些节点,有助于后续理解肠道菌群如何通过影响这些靶点来调控疼痛:
– TRP通道家族(TRPV1, TRPA1, TRPM8等)参与温度、化学和机械刺激的感受;
– 电压门控钠离子通道(Nav1.7, Nav1.8, Nav1.9等)负责动作电位的产生和传导;
– P2X受体(特别是P2X3, P2X4, P2X7)是ATP的受体,参与神经元和胶质细胞的激活。
NMDA受体是中枢敏化的核心;AMPA受体介导快速兴奋性突触传递;GABA受体和甘氨酸受体介导抑制性传递。
TNF-α、IL-1β、IL-6等促炎细胞因子及其相应的受体在神经炎症和神经元敏化中起关键作用。
如MAPK通路(ERK, JNK, p38)、NF-κB通路、PI3K-Akt通路等,这些通路被上游受体激活后,调控基因表达,影响神经元功能和炎症反应。
慢性疼痛的病理生理机制是一个多层面、多环节、动态演变的复杂过程,涉及外周与中枢神经系统的敏化、神经炎症的驱动以及神经-免疫的失衡互动。正是这些核心机制的异常,构成了慢性疼痛难以治愈的根源。
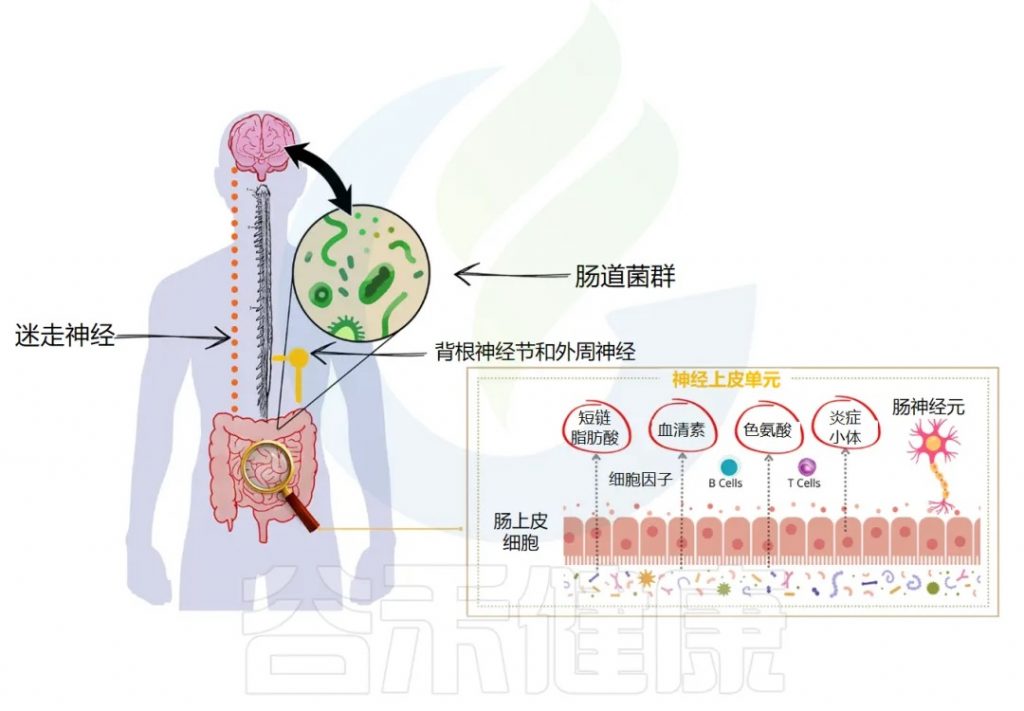
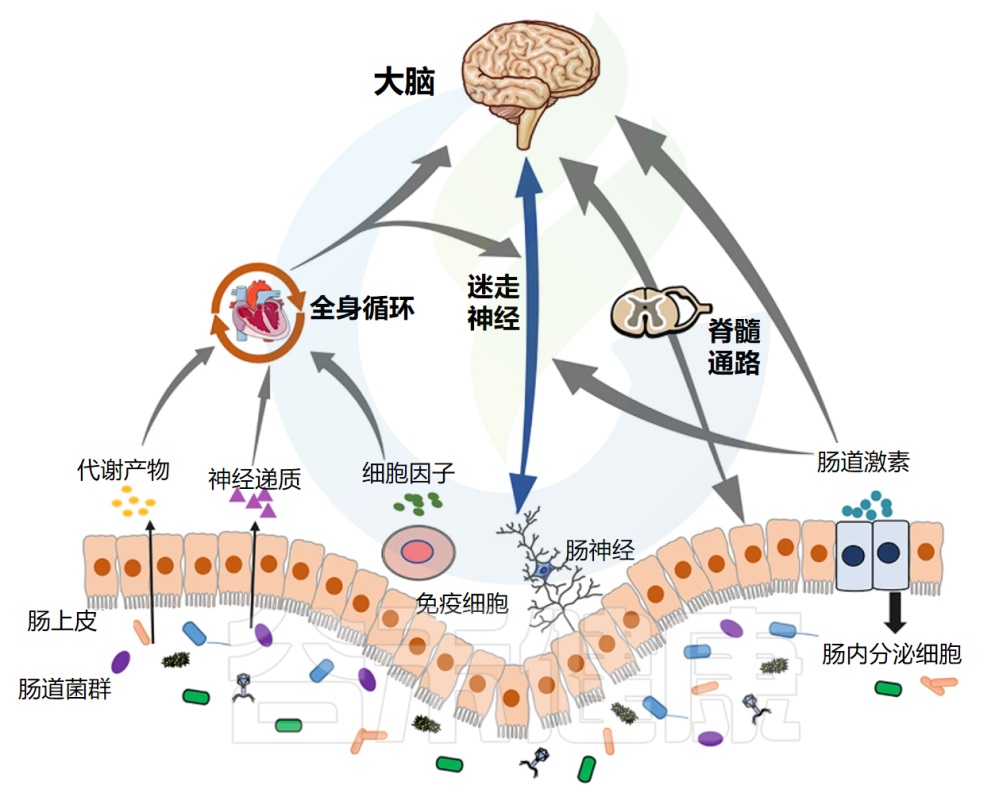
肠道菌群在健康与疾病中的作用日益受到重视,其与中枢神经系统功能及相关疾病的复杂联系,包括慢性疼痛,正通过“微生物群-脑-肠轴”(Microbiota-Gut-Brain Axis, MGBA)这一概念得到系统性的阐释。
微生物群-脑-肠轴是一个复杂的、双向的通讯网络,整合了神经、免疫、内分泌、代谢等多个信号通路,允许肠道微生物与大脑之间进行持续的对话。肠道菌群的稳态或失调,能够深刻影响这一轴的功能,从而在慢性疼痛的发生、发展和维持中扮演关键角色。
微生物群-脑-肠轴:疼痛调控的关键枢纽
脑-肠-菌轴构成了肠道微生物影响宿主疼痛感知和调控的主要生理基础。其主要通讯途径包括:
▼
神经通路:迷走神经的桥梁作用
迷走神经(Vagus Nerve),作为第十对脑神经,是连接脑干与胸腹腔脏器之间最长、分布最广的神经通路,构成了微生物群-脑-肠轴中最为直接和关键的神经通讯链路。其在拉丁语中意为“流浪者”,形象地描述了它在体内广泛的行程。
迷走神经具有双向传导功能,但其传入纤维(afferent fibers)占据了绝大多数(约80-90%),这意味着它主要负责将来自内脏(包括胃肠道)的各种生理和病理信号传递给中枢神经系统。
这些信号包括机械牵张(如肠道扩张)、化学刺激(如营养物质、pH变化、毒素),以及至关重要的来自肠道菌群及其代谢产物的信号。
1、迷走神经传入信号的感知与传递
肠道菌群并不直接与大脑进行物理接触,但它们产生的海量代谢物以及对肠道内环境的塑造,能够被迷走神经末梢灵敏地感知。这一感知过程可以是直接的,也更多是通过间接途径实现:
——间接激活:肠道内分泌细胞的关键中介作用
肠道内分泌细胞(Enteroendocrine Cells, EECs)是散在于肠道上皮细胞间的特化感觉细胞,它们能够直接感受肠腔内的化学环境变化,包括菌群代谢产物的刺激。当菌群代谢产物,特别是短链脂肪酸(SCFAs),如乙酸、丙酸和丁酸,作用于EECs表面的特异性G蛋白偶联受体(如GPR41/FFAR3, GPR43/FFAR2)时,会触发EECs释放多种神经活性物质。
——直接激活(可能性较低但存在)
这些由菌群活动引发的、经由迷走神经传入的信号,首先汇聚于脑干的孤束核(Nucleus of the Solitary Tract, NTS)。NTS是内脏感觉信息传入中枢的第一个整合处理站。从NTS开始,这些信号进一步投射到更高级的脑区,包括:
通过这一系列复杂的神经投射,肠道菌群的状态能够深刻影响宿主对疼痛的感知强度、情感反应以及认知评价。
2、 迷走神经在菌群介导的镇痛及行为调节中的关键作用——来自迷走神经切断术的证据
迷走神经的完整性对于许多肠道菌群介导的生理效应至关重要,尤其是在情绪和疼痛调节方面。迷走神经切断术(Vagotomy),特别是保留肝支和胃支的膈下迷走神经切断术(Surgical Subdiaphragmatic Vagotomy, SDG),已成为研究迷走神经在菌群-脑轴中作用的关键实验手段。
益生菌的镇痛与抗焦虑/抑郁效应依赖于迷走神经
研究表明,迷走神经的完整性对于某些菌群介导的镇痛效应至关重要;迷走神经切断术可以阻断特定益生菌的抗焦虑和抗抑郁作用,并可能影响其对内脏痛的调节。
例如,经典研究表明,益生菌鼠李糖乳杆菌(Lactobacillus rhamnosus JB-1)能够通过迷走神经依赖的机制减轻小鼠的焦虑和抑郁样行为,并改变中枢GABA受体的表达。当迷走神经被切断后,这些有益效应便消失了。
类似地,一些益生菌在动物模型中能够缓解内脏疼痛。但是,当研究者切断迷走神经后,这种镇痛效果会消失或明显减弱。这有力证明了迷走神经的重要作用,它是有益菌株信号传递到大脑的必要通路,也是产生镇痛效应的关键环节。
3. 迷走神经传出信号对肠道和菌群的反向调控
微生物群-肠-脑轴的通讯是双向的。大脑不仅接收来自肠道和菌群的信号,也通过迷走神经的传出纤维(efferent fibers)主动调节肠道功能,进而间接影响肠道菌群的生态位和组成。
– 调节肠道蠕动和分泌
迷走神经传出信号是胃肠道运动(如胃排空、小肠蠕动)和消化液分泌(如胃酸、胰酶)的主要神经调节器。这些生理活动直接影响食糜在肠道内的停留时间、营养物质的消化吸收效率以及肠道内的物理化学环境(如pH值),从而为不同类型的微生物创造或改变其生存和繁殖的生态位。
– 维持肠道屏障完整性
迷走神经的传出信号,特别是通过胆碱能抗炎通路(Cholinergic Anti-inflammatory Pathway, CAP),在维持肠道屏障功能和控制局部炎症中发挥重要作用。该通路涉及迷走神经释放乙酰胆碱(ACh),ACh作用于肠道黏膜免疫细胞(如巨噬细胞)表面的α7烟碱型乙酰胆碱受体(α7nAChR),从而抑制促炎细胞因子的产生,减轻炎症反应,保护肠道屏障。一个健康的肠道屏障对于限制有害菌及其产物(如LPS)的易位至关重要。
– 影响黏液层
迷走神经可能参与调节肠道黏液层厚度和成分,黏液层是肠道上皮的第一道物理和化学屏障,也是特定菌群(如Akkermansia muciniphila)的栖息地和营养来源。
通过这些传出途径,中枢神经系统的状态(如应激、情绪)可以通过迷走神经影响肠道生理和菌群稳态,形成一个完整的反馈回路。
▼
免疫通路:菌群塑造的全身性免疫网络与疼痛
肠道不仅是消化吸收的主要场所,更是人体最大、最复杂的免疫器官,其广阔的黏膜表面(约200-300平方米)直接暴露于数以万亿计的共生微生物及其代谢产物之中。
这种持续的、动态的相互作用,使得肠道菌群在宿主免疫系统的发育、成熟、校准和功能调节中扮演着无可替代的核心角色。它们如同免疫系统的“陪练员”和“调校师”,通过与肠道相关淋巴组织——包括派尔集合淋巴结(Peyer’s patches)、肠系膜淋巴结(mesenteric lymph nodes)以及弥散在肠黏膜固有层和上皮内的免疫细胞的持续对话,塑造着宿主的先天性和适应性免疫反应,其影响深远,不仅限于肠道局部,更能波及全身,包括对疼痛感知和慢性化的调控。
1、菌群介导的免疫细胞分化与平衡:塑造敌我识别与炎症刹车
肠道菌群通过其组成成分和代谢产物,能够精准地诱导和调控不同免疫细胞亚群的分化与功能平衡,这对维持免疫稳态、防止过度炎症反应以及有效清除病原体至关重要。当这种平衡被打破时,往往与慢性炎症和疼痛的发生发展相关。
分节丝状菌(Segmented Filamentous Bacteria, SFB)是一种特殊的、能紧密附着于小肠上皮细胞的共生菌。分节丝状菌能有效诱导辅助性T细胞17(Th17)的分化。
Th17细胞以其分泌的标志性细胞因子IL-17以及IL-21、IL-22等而闻名。
IL-17家族(特别是IL-17A和IL-17F)是强效的促炎细胞因子,能够招募中性粒细胞,诱导其他促炎细胞因子(如TNF-α, IL-1β, IL-6)和趋化因子的产生,参与组织炎症和自身免疫性疾病的病理过程。因此,在多种自身免疫性疾病(如类风湿关节炎、多发性硬化)和炎症性疼痛模型中,Th17细胞及其相关通路被认为是驱动炎症和疼痛的关键因素。
SFB的定植虽然在抵抗某些病原体感染中具有保护作用,但其过度激活或在特定遗传背景下,可能导致Th17反应失控,加剧炎症和疼痛。
与Th17细胞的促炎作用相对的是调节性T细胞(Treg),它们是维持免疫耐受和抑制过度免疫反应的关键刹车细胞,主要通过分泌IL-10和TGF-β等抑制性细胞因子,以及细胞接触依赖性机制来发挥作用。
某些梭菌属细菌(如 Clostridium clusters IV和 XIVa,这些是主要的产丁酸菌群)和脆弱拟杆菌(Bacteroides fragilis)及其荚膜多糖A(Polysaccharide A, PSA)则能有效诱导Treg细胞的产生和IL-10的分泌。
这种由特定菌群驱动的Th17/Treg平衡,对于决定机体对炎症刺激的反应强度和持续时间至关重要。菌群失调若导致Th17细胞过度活化而Treg细胞功能不足,则易于引发或加剧慢性炎症性疼痛。
2. 细胞因子网络的调控:菌群失调与慢性低度炎症的“导火索”
肠道菌群稳态的维持对于局部和全身细胞因子网络的平衡至关重要。菌群失调,有益菌减少、潜在致病菌增多、菌群多样性下降,往往伴随着免疫失衡和慢性低度炎症状态的形成。
– 促炎细胞因子的过度产生
菌群失调常常导致TNF-α、IL-1β、IL-6等关键促炎细胞因子的过量产生。这些细胞因子不仅在肠道局部加剧炎症反应、破坏肠道屏障,更关键的是,它们可以释放入血液循环,形成一种全身性的慢性低度炎症背景。这种状态是多种慢性疾病(包括心血管疾病、糖尿病、神经退行性疾病以及慢性疼痛)的共同病理生理基础。
– 抗炎细胞因子的相对不足
菌群失调也可能导致IL-10和TGF-β等关键抗炎细胞因子的产生减少,使得炎症反应难以被有效控制和终止。
– 对疼痛的直接和间接影响
这些循环中的促炎细胞因子能够直接作用于外周伤害性感受器,降低其激活阈值,导致外周敏化。例如,TNF-α和IL-1β能直接激活或敏化TRPV1等痛觉相关离子通道。
同时,它们也能穿过在某些病理状态下通透性增加的血脑屏障(BBB)和血脊髓屏障(BSCB),或通过激活脑血管内皮细胞产生次级信使,作用于中枢神经系统,激活小胶质细胞和星形胶质细胞,诱导神经炎症,促进中枢敏化。
因此,菌群失调介导的细胞因子网络紊乱,是连接肠道与远端疼痛感知的关键免疫学桥梁。
3、微生物相关分子模式与模式识别受体:免疫系统的警报系统
肠道菌群的结构成分,如细菌细胞壁的组分,被称为微生物相关分子模式(MAMPs)。
宿主的先天免疫细胞(如巨噬细胞、树突状细胞)以及一些非免疫细胞(包括肠上皮细胞、神经元和胶质细胞)表面表达着一系列模式识别受体(PRRs),用于识别这些MAMPs并发起适当的免疫应答。
– 关键MAMPs及其识别
– PRR激活与炎症信号通路
当MAMPs与相应的PRRs结合后,会迅速激活下游的信号转导通路,其中最经典的是NF-κB(核因子κB)通路和MAPK(丝裂原活化蛋白激酶)通路。这些通路的激活导致多种促炎基因的转录上调,大量释放炎症介质,包括前述的促炎细胞因子(TNF-α、IL-1β、IL-6)、趋化因子(吸引更多免疫细胞至炎症部位)、黏附分子以及一氧化氮(NO)和前列腺素等。
– 肠道屏障受损与MAMPs易位(肠漏)
在健康的肠道中,完整的肠道屏障(包括物理屏障、化学屏障、免疫屏障)能够有效地将大部分肠道菌群及其MAMPs限制在肠腔内,仅允许少量、受控的MAMPs与免疫系统相互作用以维持免疫张力。
然而,当肠道菌群失调、饮食因素、应激、药物(如NSAIDs)等因素导致肠道屏障功能受损,即出现“肠漏”时,大量的MAMPs(特别是LPS)会从肠腔跨过受损的屏障易位进入血液循环,导致所谓的“代谢性内毒素血症”。
循环中的LPS能够激活全身各处的TLR4,引发持续的、低度的全身性炎症反应,这与胰岛素抵抗、肥胖、非酒精性脂肪肝以及多种慢性疼痛状态(特别是神经病理性疼痛和纤维肌痛)的发生发展密切相关。LPS也可以直接作用于背根神经节(DRG)的感觉神经元和中枢的胶质细胞,增强其对伤害性刺激的反应,促进疼痛的产生和维持。
综上所述,肠道菌群通过塑造免疫细胞的分化平衡(如Th17/Treg平衡)、调控全身细胞因子网络以及通过MAMPs-PRRs相互作用激活先天免疫,构成了影响宿主疼痛感知和慢性化的关键免疫通路。菌群失调导致的免疫失衡和慢性炎症状态,是连接肠道微生态与疼痛病理生理过程的重要桥梁。因此,靶向调节肠道菌群以恢复免疫稳态,已成为开发新型疼痛干预策略的重要方向。
doi: 10.1186/s10194-020-01170-x
▼
内分泌通路:HPA轴的菌群调节与应激疼痛
下丘脑-垂体-肾上腺(HPA)轴是机体最主要的应激反应系统。慢性应激是慢性疼痛发生和恶化的重要风险因素。肠道菌群能够双向调节HPA轴的活性。
无菌动物模型研究显示,缺乏正常菌群的动物对应激表现出异常的HPA轴反应(通常是过度反应),表现为促肾上腺皮质激素释放激素(CRH)和皮质酮水平的升高。早期定植特定菌群可以部分逆转这种异常。
– 菌群代谢产物的影响
SCFAs等菌群代谢产物可以通过影响迷走神经或直接作用于肾上腺等方式,调节HPA轴。
– 肠道屏障与LPS
菌群失调导致的肠漏和LPS易位,可以激活免疫系统,间接刺激HPA轴。
HPA轴的失调,特别是皮质醇节律的紊乱和长期高水平,不仅与抑郁、焦虑等情绪障碍相关,也直接促进疼痛的慢性化。例如,糖皮质激素可以影响神经元的兴奋性和胶质细胞的活性。因此,菌群通过调节HPA轴的稳态,间接影响宿主对疼痛的易感性和疼痛程度。
▼
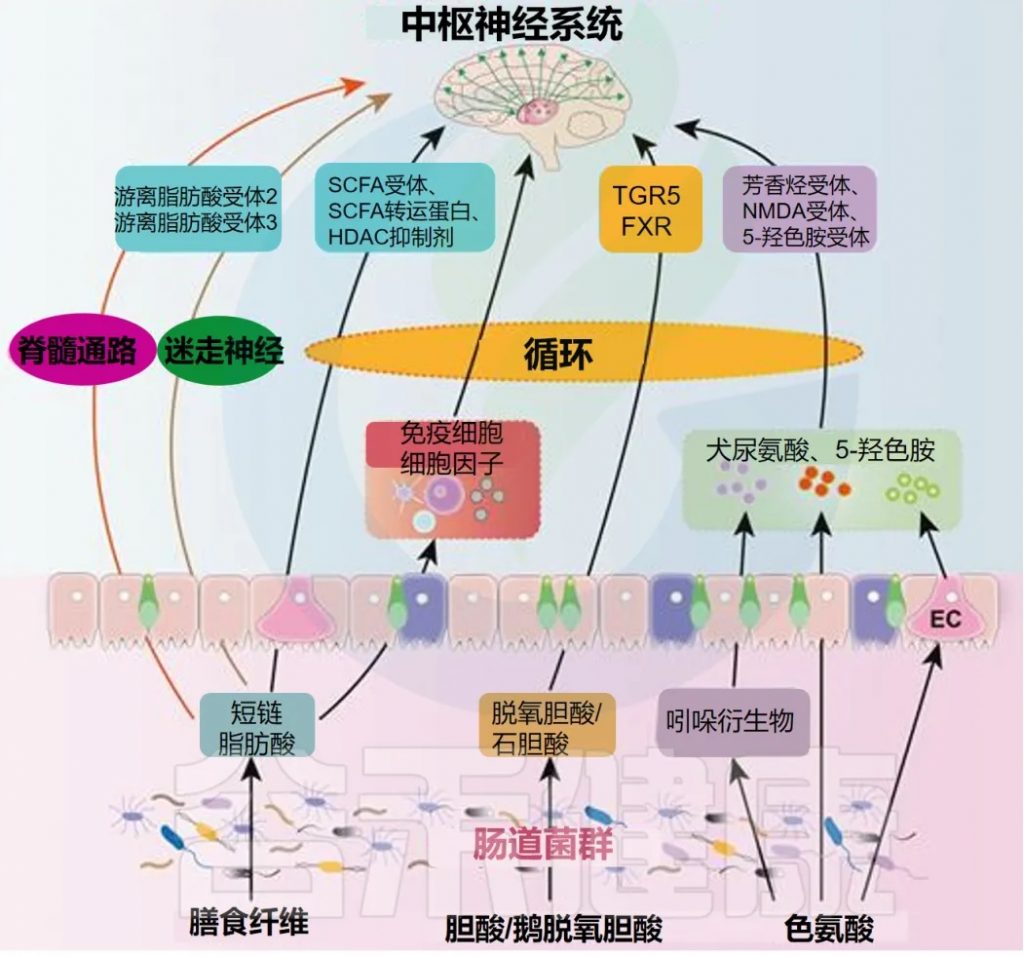
代谢通路:菌群工厂的杰作与疼痛调控
肠道菌群拥有庞大的酶系统,能够代谢宿主不能消化的膳食成分(如膳食纤维)以及宿主自身产生的物质(如胆汁酸),产生大量具有生物活性的小分子代谢物,这些代谢物是菌群影响宿主生理(包括疼痛)的关键介质。
– 短链脂肪酸(SCFAs)
主要包括乙酸、丙酸、丁酸,是膳食纤维经厌氧菌发酵的主要产物。SCFAs不仅是结肠上皮细胞的主要能源物质,维持肠道屏障的完整性(例如丁酸能促进紧密连接蛋白如occludin和ZO-1的表达),还具有广泛的全身性调节作用:
– 次级胆汁酸
初级胆汁酸(如胆酸CA,鹅去氧胆酸CDCA)在肝脏合成后排入肠道,在肠道菌群(主要是梭菌属)的酶(如7α-脱羟酶)作用下转化为次级胆汁酸,如脱氧胆酸(DCA)和石胆酸(LCA)。这些次级胆汁酸是重要的信号分子,主要通过激活法尼醇X受体(FXR)和G蛋白偶联胆汁酸受体1(TGR5,又称GPBAR1)发挥作用。
– 色氨酸代谢产物
膳食中的必需氨基酸色氨酸在宿主和肠道菌群的共同作用下,可以通过多条途径代谢,产生一系列具有神经活性的分子。
– 脂多糖等微生物相关分子模式(MAMPs)
如前所述,LPS是革兰氏阴性菌外膜的主要成分。在肠道屏障功能受损(“肠漏”)的情况下,LPS会从肠腔易位进入血液循环,形成“代谢性内毒素血症”。
特定慢性疼痛模型中肠道菌群改变的证据
大量临床前和部分临床研究已经揭示了肠道菌群失调与多种慢性疼痛状态之间的密切关联。
神经病理性疼痛
神经病理性疼痛由躯体感觉神经系统的损伤或疾病直接引起。
化疗是治疗癌症的重要手段,但许多化疗药物,如紫杉醇、奥沙利铂、长春新碱、硼替佐米等,常导致严重的剂量限制性副作用——CIPN。
患者表现为肢体远端的麻木、刺痛、烧灼感和痛觉过敏/异常疼痛,严重影响生活质量并可能导致化疗方案的调整甚至中断。
多种化疗药物(如紫杉醇、奥沙利铂)可引起严重的CIPN,其患者和动物模型中均观察到肠道菌群的显著改变,如多样性下降,厚壁菌门/拟杆菌门(F/B)比值改变,特定菌属如Akkermansia muciniphila(常被认为是益生菌)和产丁酸菌(如Faecalibacterium prausnitzii)的丰度下降,而一些潜在致病菌(如某些变形菌门细菌)丰度增加。补充A. muciniphila或其活性成分被证明可以缓解CIPN。
这些经典的神经病理性疼痛动物模型中,也观察到肠道菌群失调,伴随肠道屏障功能受损、LPS水平升高和神经炎症,粪便移植自CCI大鼠可诱导幼稚大鼠产生痛觉过敏。FMT或特定益生菌干预能够改善疼痛行为,并逆转部分菌群和炎症指标。
糖尿病患者常伴有肠道菌群失调,这被认为是糖尿病神经病变发生的风险因素之一。糖尿病患者的菌群失调通常表现为产丁酸菌(如Faecalibacterium prausnitzii, Roseburia)的减少,某些机会致病菌(如肠杆菌科细菌)的增加,以及整体多样性的下降。菌群失调可能通过加剧代谢紊乱、促进全身性炎症和氧化应激来促进糖尿病神经病变的发生。
炎症性疼痛
内脏痛
肠易激综合征(IBS),是最常见的内脏痛相关功能性胃肠病,其患者肠道菌群失调的证据最为充分。表现为菌群多样性降低,F/B比值改变,特定菌属如乳杆菌属和双歧杆菌属的减少,而某些潜在致病菌(如肠杆菌科细菌)的增加。
菌群失调通过多种机制导致IBS的核心症状——腹痛和内脏高敏感性,包括:肠道屏障功能受损、低度免疫激活、5-HT信号通路异常、SCFAs谱改变等。针对IBS的菌群干预(如低FODMAP饮食、特定益生菌、FMT)已成为研究和治疗的热点。
中枢性疼痛综合征
这类疼痛综合征(如纤维肌痛、偏头痛)的病理机制被认为主要涉及中枢神经系统的功能失调,但外周因素也可能参与其中。
宿主遗传背景、性别差异与肠道菌群在疼痛中的交互作用
– 宿主遗传背景
宿主基因可以直接影响肠道菌群的组成(例如通过影响免疫系统、肠道黏液层构成等),反过来,肠道菌群也可以通过表观遗传修饰(如DNA甲基化、组蛋白修饰,SCFAs是重要的HDAC抑制剂)等方式影响宿主的基因表达。这种基因-菌群的交互作用共同塑造了个体对疼痛的易感性和慢性化风险。
– 性别差异
慢性疼痛在女性中更为普遍,其严重程度和对治疗的反应也存在性别差异。肠道菌群的组成和功能同样存在显著的性别差异,这可能受到性激素的影响。
研究表明,性别、性激素、肠道菌群和免疫反应之间存在复杂的交互作用,共同影响疼痛的性别二态性。例如,雌激素水平的变化可以影响肠道菌群和肠道屏障功能,进而可能影响疼痛敏感性。
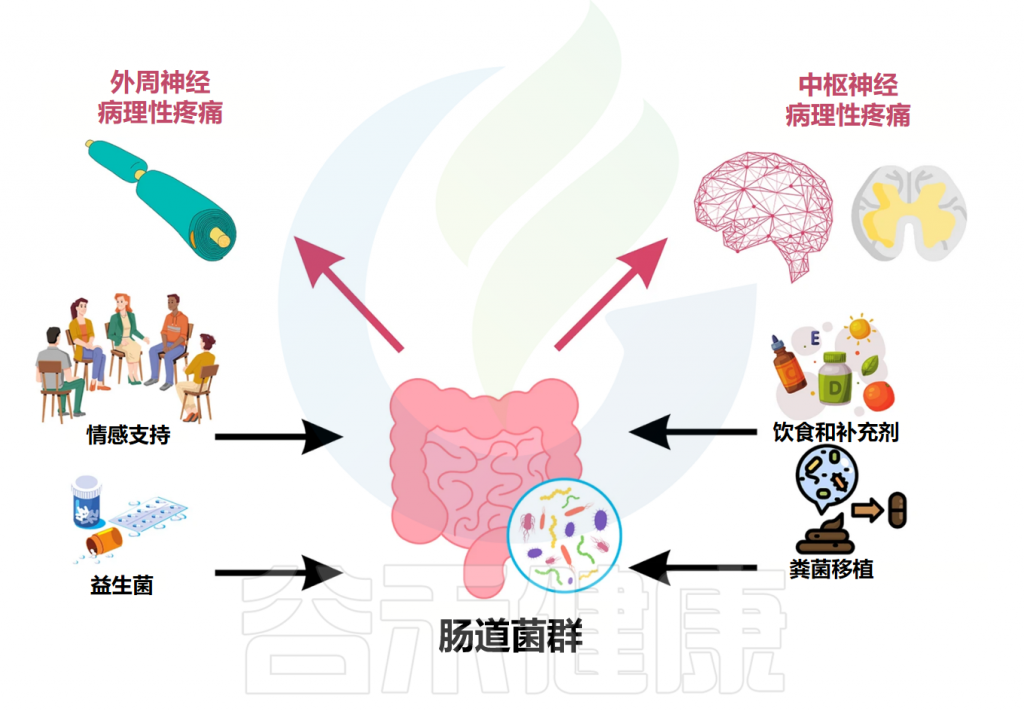
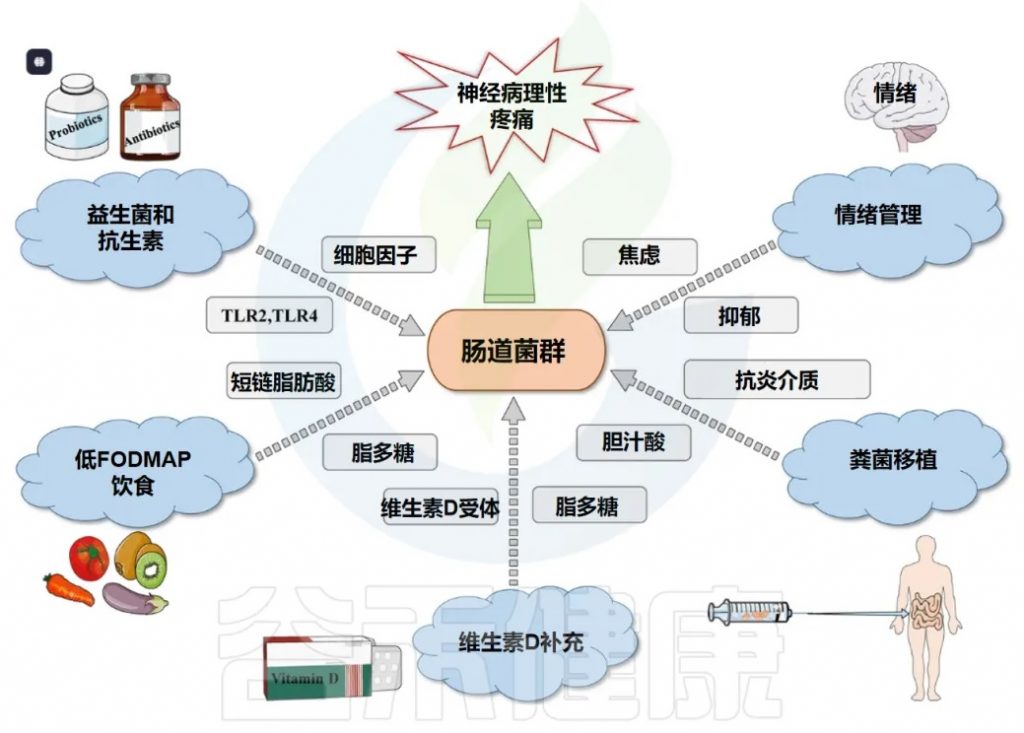
鉴于肠道菌群在慢性疼痛病理生理机制中的核心作用日益明确,针对肠道菌群的调控策略已成为开发新型疼痛干预措施的重要方向。这些策略旨在通过恢复肠道微生态平衡、调节菌群代谢、改善肠道屏障功能及抑制神经炎症等途径,达到缓解疼痛的目的。
饮食干预与益生元
饮食是塑造肠道菌群组成和功能最直接、最持久的因素之一。通过合理的膳食结构调整和特定益生元的补充,可以有效地引导肠道菌群向有益于宿主健康(包括疼痛缓解)的方向发展。
机制
代表性饮食模式
特定益生元
益生元是选择性地被宿主微生物利用并从而赋予健康益处的底物。它们通常是不可消化的碳水化合物。
抗生素和益生元/益生菌/合生元通过改变肠道微生物群来治疗疼痛有一定的希望。
适用人群与注意事项
饮食干预和益生元补充通常被认为是相对安全的。然而,个体对不同膳食成分和益生元的反应存在差异。例如,突然大量增加膳食纤维或某些益生元可能导致部分人群出现腹胀、产气等不适。对于特定疾病(如IBS),某些益生元(如高FODMAPs的菊粉)可能反而加剧症状。因此,饮食调整和益生元的使用最好在医生或营养师指导下进行,循序渐进,并关注个体耐受性。
doi: 10.1186/s10194-020-01170-x
益生菌与合生元(Synbiotics)
益生菌是指当摄入足够数量时能对宿主健康产生有益作用的活性微生物。合生元则是益生菌和益生元的组合。
菌株特异性原理
益生菌的作用具有高度的菌株特异性,这意味着并非所有益生菌都具有相同的功能,其效果取决于具体的菌株。不同菌株通过不同机制发挥作用,例如:
益生菌通过调节宿主肠道植物群或肠道免疫系统的平衡来支持宿主健康,并指出广泛使用的益生菌如双歧杆菌和乳杆菌在治疗慢性疼痛疾病方面具有潜力。例如,干酪乳杆菌改善了关节炎大鼠的症状,并抑制了体内促炎因子的表达。
临床研究证据
然而,许多现有研究仅在动物中进行,其结果可能在临床阶段有所不同,且由于疼痛的不同亚型和个体差异,限制了益生菌在临床治疗慢性疼痛中的应用。更多高质量的人类数据是无价的。
合生元的优势
合生元将益生菌和为其提供选择性生长底物的益生元结合起来,理论上可以产生协同增效作用,即“1+1>2”的效果。益生元有助于益生菌在肠道内的定植、存活和发挥功能。
适用人群与选择标准
选择益生菌时,应考虑疼痛的类型、可能的菌群失调特征以及具体菌株的循证依据。由于菌株特异性的存在,不能一概而论。患者应在医生指导下选择经过临床验证、安全性较高的产品。目前,益生菌主要作为辅助干预手段,不应替代标准治疗。
粪菌移植(FMT)
FMT是指将健康个体粪便中的功能菌群,通过灌肠、口服胶囊或经内镜等途径,移植到患者肠道内,以重建健康的肠道微生态。
作用机制
FMT的核心机制在于通过引入一个完整、多样且功能健全的微生物群,来纠正受体肠道内的菌群失调,恢复肠道屏障功能,调节免疫反应,并改变菌群代谢谱,从而达到治疗疾病的目的。
在难治性慢性疼痛中的探索性应用
粪便微生物群移植已经成为慢性内脏疼痛病症(例如炎症性肠病和肠易激综合征)的有益疗法,通过恢复肠道细菌的健康平衡。
一项研究显示,FMT在剂量依赖性的情况下,对IBS相关症状的管理非常有效。目前,FMT在治疗复发性艰难梭菌感染方面已获得广泛认可,其在IBS、IBD等其他菌群失调相关疾病(包括其伴随的疼痛)中的应用也正积极探索中,并已有一些案例报道和小型临床试验显示出一定的潜力。
挑战与风险
关于FMT在疼痛治疗中的使用存在一些争议,深入阐明肠道菌群在慢性疼痛中的调节机制,增加临床数据,将有助于未来在临床实践中应用FMT。
适用人群的严格筛选
目前,FMT主要用于标准治疗无效或复发性艰难梭菌感染。对于其他疾病(包括慢性疼痛),FMT仍主要处于临床研究阶段,应在严格的伦理审查和知情同意下,由经验丰富的医疗团队在特定情况下审慎考虑。
▼
新兴与未来疗法
随着对肠道菌群及其与宿主互作机制认识的深入,更多精准靶向的菌群干预策略正在涌现。
后生元(Postbiotics)
指对宿主健康有益的无生命微生物和/或其成分,包括菌体成分(如细胞壁片段、胞外多糖)或菌群代谢产物(如SCFAs、特定酶、有机酸)。直接应用这些已明确功能的分子,可能比直接移植活菌更安全、更可控,且易于标准化。
工程益生菌(Engineered Probiotics)
通过基因工程技术改造益生菌菌株,使其能够:
噬菌体疗法(Phage Therapy)
噬菌体是特异性裂解细菌的病毒。通过筛选能够靶向清除特定有害菌(如在某些疼痛状态下过度增殖的条件致病菌)的噬菌体,可以实现对肠道菌群的精准“编辑”,而不破坏有益菌群。
针对菌群的药物开发
开发能够选择性调节肠道菌群特定功能的小分子药物。例如:
尽管靶向肠道菌群为慢性疼痛的治疗带来了希望,但仍面临诸多挑战。肠道菌群的组成和功能具有高度的个体特异性,且受饮食、生活方式、遗传、药物等多种因素影响。因此,“一刀切”的菌群干预方案可能效果有限,未来的发展方向在于个体化菌群干。
通过宏基因组学、代谢组学等多组学技术,分析个体患者的肠道菌群特征(如关键菌种的缺失/富集、特定代谢通路的异常),结合临床表型,识别与疼痛相关的菌群失调模式。
基于精准诊断结果,为患者量身定制干预方案,如选择最合适的益生菌菌株、益生元种类,甚至进行个性化的FMT供体筛选或开发定制化的后生元/工程菌。在干预过程中,持续监测患者菌群和临床症状的变化,及时调整干预策略。
肠道微生物组的调节可能很快成为慢性疼痛管理的重要工具,靶向肠道菌群为慢性疼痛的治疗开辟了充满潜力的新途径。随着研究的深入和技术的进步,有望从“经验性”干预走向“精准化”菌群调控,为饱受慢性疼痛困扰的患者带来更有效、更安全的个体化治疗方案。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Cai W, Haddad M, Haddad R, et al., The gut microbiota promotes pain in fibromyalgia. Neuron. 2025 Apr 18:S0896-6273(25)00252-1.
Minerbi A, Fitzcharles MA. Gut microbiome: pertinence in fibromyalgia. Clin Exp Rheumatol. 2020 Jan-Feb;38 Suppl 123(1):99-104. Epub 2020 Feb 12. PMID: 32116215.
Niu M, Li J, Zhuang X, Yangyang C, Chen Y, Zhang Y, Maes M. Unraveling the role of gut microbiota and plasma metabolites in fibromyalgia: Insights from Mendelian randomization and dietary interventions. Mol Pain. 2025 Jan-Dec;21:17448069251332140.
Erdrich S, Hawrelak JA, Myers SP, Harnett JE. Determining the association between fibromyalgia, the gut microbiome and its biomarkers: A systematic review. BMC Musculoskelet Disord. 2020 Mar 20;21(1):181.
Minerbi A, Fitzcharles MA. Gut microbiome: pertinence in fibromyalgia. Clin Exp Rheumatol. 2020 Jan-Feb;38 Suppl 123(1):99-104. Epub 2020 Feb 12. PMID: 32116215.
Häuser, Winfrieda,b,*; Fitzcharles, Mary-Annc,d; Henningsen, Peterb. Fibromyalgia syndrome—a bodily distress disorder/somatic symptom disorder?. PAIN Reports 10(1):p e1223, February 2025.
Liu L, Wu Q, Chen Y, Ren H, Zhang Q, Yang H, Zhang W, Ding T, Wang S, Zhang Y, Liu Y, Sun J. Gut microbiota in chronic pain: Novel insights into mechanisms and promising therapeutic strategies. Int Immunopharmacol. 2023 Feb;115:109685.
谷禾健康
前几日,南方医科大学深圳医院院长周宏伟教授团队在国际顶尖医学期刊《Nature Medicine》上发表了一项重要研究。首次揭示一种名为活泼瘤胃球菌(Ruminococcus gnavus)的细菌产生的物质——苯乙胺,在肝性脑病发生中的关键作用。

同时谷禾的人群检测数据及相关研究也发现,活泼瘤胃球菌(R.gnavus)广泛存在于人体中,超过90%的人可以检测到。并且在例如肥胖、抑郁症、炎症性肠病、2型糖尿病等疾病患者中丰度偏高。
想必很多人对这个名字比较陌生,可能只知道瘤胃球菌属。虽然其名为活泼瘤胃球菌,但关于其的具体归属还有争议(有一段时间它被归类为Blautia属,但最近又被重新归为Mediterraneibacter属)。
活泼瘤胃球菌(Ruminococcus gnavus)是一种革兰氏阳性、严格厌氧的细菌,属于毛螺菌科,普遍存在于人类和动物的肠道中,是婴儿肠道的早期定植者,并在成年后也持续存在,占健康个体肠道微生物群丰度的0.1%至2%。
拉丁语gnavus的意思是忙碌,R.gnavus具有积极的碳水化合物发酵能力,可以将复杂的淀粉降解成更简单的分子。在淀粉、麦芽糖和岩藻糖基化聚糖等食物消化中具有重要功能。并产生乙酸盐、丙酸盐、甲酸盐和乙醇,但不产生丁酸盐。
虽然R.gnavus能有效利用植物性食物中的糖,但肠道中的糖并非全来自食物,人体自身也会生成糖类,如构成肠道内壁的粘蛋白聚糖。一些菌株依赖这些糖,并进化出策略以持续获取,可能破坏肠道屏障。
活泼瘤胃球菌(R.gnavus)生活在我们的肠道内壁,因此可以很好地感知肠道环境的变化并将其与身体的其他部分进行沟通。这在我们的免疫系统中发挥作用,也会对体内其他器官的功能产生影响。
研究发现R.gnavus能够产生一种炎性多糖,该分子诱导树突状细胞产生炎性细胞因子,如TNFα(肿瘤坏死因子),可能导致人体的炎症反应。并且越来越多的证据表明,R.gnavus的过度生长可能与某些肠道疾病有关,包括炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌。
此外,研究还发现,患有影响身体其他部位的健康问题(包括感染、过敏、肥胖、代谢综合征、2型糖尿病、肝脏疾病和神经系统疾病)的人肠道中活泼瘤胃球菌(R.gnavus)的水平较高,说明R.gnavus与这些疾病之间存在相关性。
注:这种关联并不一定意味着R.gnavus是这些疾病的原因。相反,它可能只是表明这些疾病为R gnavus在肠道中的生长创造了有利条件。
活泼瘤胃球菌(Ruminococcus gnavus)到底是多种疾病的风险标志物还是正常的肠道共生菌?让我们来一探究竟。
活泼瘤胃球菌(Ruminococcus gnavus)是一种革兰氏阳性厌氧菌,属于厚壁菌门。R.gnavus于1974年首次从人类胃肠道的粪便和内容物中分离出来。当时它被描述为专性厌氧、非孢子形成、非运动或运动球菌,具有1-3个鞭毛,以链状或成对出现。
R.gnavus ATCC 35913 的扫描电子显微镜图像

拉丁语gnavus的意思是忙碌,指的是该物种的积极发酵能力。这种细菌具有特殊的酶,可以将复杂的淀粉降解成更简单的分子。在淀粉、麦芽糖和岩藻糖基化聚糖等食物消化中具有重要功能。可以产生乙酸盐和甲酸盐,但不产生丁酸盐。
R.gnavus的细胞壁由一种复杂的葡配甘露聚糖组成,它具有高度的免疫原性,可以在宿主中诱导特异性抗体。
R.gnavus的脂聚糖是一种附着在脂质上的聚糖,也是免疫原性的,可以调节宿主免疫系统。不同品系的R.gnavus具有不同的结构。
R.gnavus的基因组由一条约2.5Mb的圆形染色体和几个不同大小的质粒组成。它编码许多参与碳水化合物代谢的基因。其基因组DNA的G+C含量为43mol%。
虽然R.gnavus ATCC 29149无法在氧气存在下生长,但它确实表现出对大气氧气的一定耐受性,10%-15%的细胞在暴露于氧气1小时后仍保持活力,3小时后下降到0.05%-0.1%左右
该菌株对阿莫西林、替卡西林、头孢噻肟、亚胺培南、普那霉素、万古霉素、利奈唑胺、甲硝唑、利福平、甲氧苄啶/磺胺甲噁唑敏感,对林可霉素、红霉素、左氧氟沙星耐药。
▸ 在生命早期就定植于肠道
活泼瘤胃球菌(R.gnavus)是“正常”人类肠道微生物群的常见成员,多项证据表明其在生命早期就普遍存在。
生命第一年,分娩方式、饮食和遗传等因素都会影响微生物定植。一项针对25名1至24个月大婴儿样本的研究中,确定R.gnavus普遍存在;具体来说,在25个样本中的22个(88%)都检测到了活泼瘤胃球菌(R.gnavus)。
▸ 可能在婴儿消化与代谢中发挥作用
活泼瘤胃球菌(R.gnavus)可能是婴儿肠道的主要物种,其水平与双歧杆菌属相当。通过16S rRNA基因测序分析的研究强调了R.gnavus与母乳喂养或不同配方奶粉之间的饮食关联。
例如,在一项针对90名2个月大婴儿(每组30名)的比较研究中,与喂食牛奶的婴儿中更多样化的微生物特征相比,母乳或山羊奶喂养的婴儿中,毛螺菌科(Lachnospiraceae)的存在仅限于一种物种,即R.gnavus。
在另一项随机对照试验比较了喂食乳糖牛奶配方奶粉(CMF)与广泛水解蛋白配方奶粉(EHF,适用于牛奶蛋白不耐受婴儿)的婴儿粪便微生物群。结果显示,随着时间推移,EHF组中R.gnavus丰度增幅最大,成为区分不同食物喂养微生物组的显著特征。
这些数据表明,R.gnavus可能在肠道微生物群构建中发挥作用,并与婴儿正常体重增长和状态相关。
▸ 淀粉等固体食物会增加R.gnavus丰度
R.gnavus的相对丰度变化可能体现了婴幼儿微生物群的正常“成熟”。一些证据表明,R.gnavus在断奶后相对丰度增加,而其他物种,如双歧杆菌,已知相对丰度降低。
注:最近一项针对怀孕和分娩时婴儿肠道微生物群(脐带血)的研究显示,R.gnavus与产前血浆25-羟基维生素D(25[OH]D)呈正相关,但与脐带25[OH]D呈负相关。
一项研究调查了断奶对605名婴儿微生物群的影响,结果显示首次引入固体食物后,R.gnavus所属的比例显著增加。短链脂肪酸(SCFA)分析也反映了肠道微生物群的变化,数据显示断奶期间丁酸盐的产生发生变化。
对28名尼日利亚婴儿出生后第一年内粪便微生物群的分析显示,母乳喂养婴儿以R.gnavus、Collinsella和Sutterella为主。丁酸盐在断奶开始时(4-6个月大)首次检测到,引入固体食物后乙酸盐和乳酸仍然较高,12月龄时丁酸盐水平较低,与R.gnavus的已知发酵能力一致。
综上所述,这些研究支持R.gnavus在肠道早期定植中的作用。一些R.gnavus菌株能够代谢人乳低聚糖(HMO)和粘蛋白,其结构聚糖相似性进一步支持该物种在其他细菌定植过程中发挥重要作用的假设。
▸ R.gnavus在成年后也持续存在于肠道
R.gnavus在成年后也持续存在;根据对来自北美和欧洲的健康成年人的粪便样本的宏基因组测序,发现它是存在于≥90%的个体中的物种。
最近,在来自中国、埃塞俄比亚、西班牙、美国和瑞典的健康成年人的公开肠道微生物群宏基因组中发现了R.gnavus平均丰度为0.3%。
谷禾多年的检测数据显示,国人活泼瘤胃球菌(R.gnavus)检出率超过95%,表明其在人群中普遍存在,是肠道微生物群的基本组成部分。
▸ R.gnavus有助于消化复杂的碳水化合物
瘤胃球菌是分解碳水化合物最有效的细菌属之一。我们知道瘤胃球菌是“降解抗性淀粉的关键菌”。瘤胃球菌能有效地分解坚硬的植物物质,如细胞壁,这有助于人体消化水果蔬菜,不太可能引起胃痛。
注:抗性淀粉是在小扁豆、豆类和未加工的全谷物等高纤维食物中发现的复杂碳水化合物。
这种细菌具有特殊的酶,可以将这些复杂的淀粉降解成更简单的分子。这也与它利用一些母乳低聚糖和在粘蛋白聚糖表位上觅食的能力有关。值得注意的是,R.gnavus ATCC 29149具有一种独特的唾液酸代谢途径,专门用于2,7-脱水Neu5Ac。
R.gnavus碳水化合物的最终发酵产物包括乙酸盐、甲酸盐和乙醇,以及丙醇和丙酸盐,但不包括丁酸盐。
尽管活泼瘤胃球菌(R.gnavus)是人类肠道微生物群的组成部分,正常情况下在健康个体的肠道中普遍存在,但许多研究表明,当其丰度过高时,可能与多种疾病的发生发展存在密切关联。这些疾病不仅包括与肠道相关的疾病,如炎症性肠病(IBD)、肠易激综合征、结直肠癌,还涉及一些非肠道相关的疾病,如代谢性疾病和免疫系统紊乱等。
R.gnavus与疾病和潜在分子介质的关联
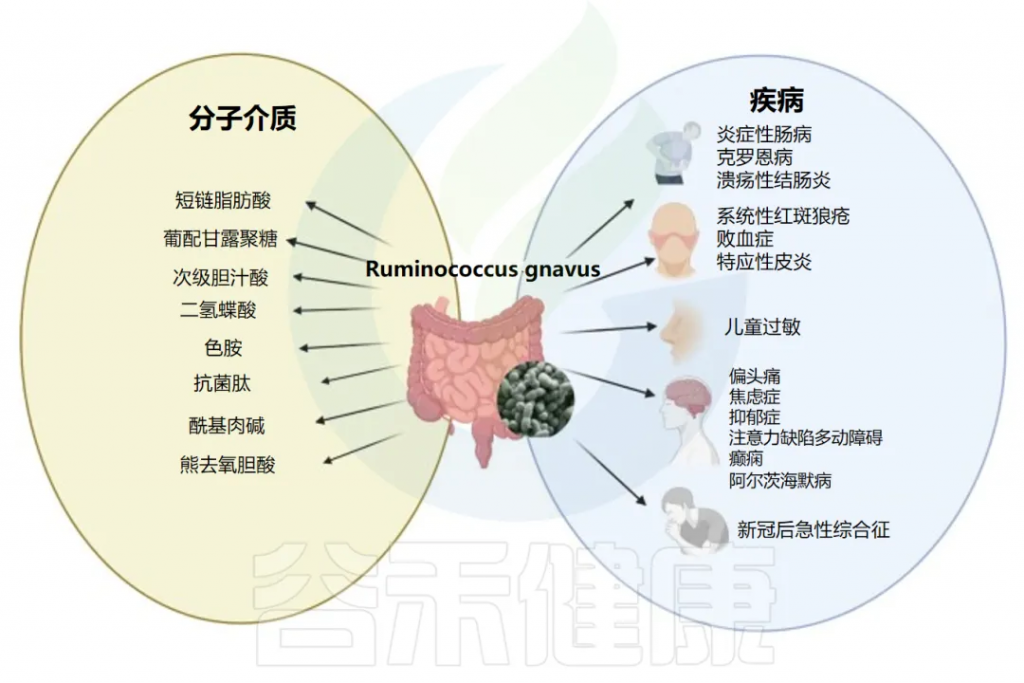
Crost EH,et al.FEMS Microbiol Rev.2023
1
炎症性肠病
克罗恩病(CD)和溃疡性结肠炎(UC)是多因素慢性炎症性肠病,一直与肠道微生物失调有关。越来越多的研究表明R.gnavus与炎症性肠病(IBD)之间存在正相关,尽管因果关系仍有待证明。
▸ R.gnavus在IBD患者中含量增加
分析了炎症性肠病(IBD)患者肠粘膜组织的早期研究表明,粘膜相关细菌的丰度增加。例如,与健康粘膜相比,R.gnavus和R.torques在CD和UC粘膜中含量更高,而主要的粘液降解细菌A.muciniphila在CD和UC粘膜中的含量明显较低。
在一项后续研究中,分析了68名CD患者、84名未受影响的亲属和55名匹配的对照者粪便样本,并使用实时PCR进行定量。结果显示,R.gnavus是五种与菌群失调相关的细菌中唯一在克罗恩病(CD)中丰度增加的物种。
通过内窥镜采集IBD患者粘膜表面样本(43名UC患者、26名CD患者和14名非IBD对照),利用16S rRNA 基因测序分析粘膜相关微生物群落。结果显示,与非IBD对照相比,CD患者变形菌门丰度显著增加,而厚壁菌门和拟杆菌门丰度显著降低。其中,埃希氏菌属、瘤胃球菌属(R.gnavus)、放线杆菌属和肠球菌属显著增加,而粪杆菌属、粪球菌属、普雷沃氏菌属和罗氏菌属显著减少。
▸ R.gnavus能够诱导产生炎性细胞因子

一项研究发现,肠道细菌R.gnavus产生了炎性多糖,其种群在克罗恩病患者的症状发作期间丰度增加。R.gnavus可以合成并分泌具有鼠李糖骨架和葡萄糖侧链的复杂多糖glucorhamnan,它有效诱导树突细胞分泌炎性细胞因子(TNFα),并可能导致R.gnavus与克罗恩病之间的关联。
另一项基于对40对双胞胎的肠道微生物群分析的研究显示,在回肠CD患者中,肠杆菌科和R.gnavus的丰度增加,而粪杆菌属(Faecalibacterium)和罗氏菌属(Roseburia)等核心细菌的消失。
▸ R.gnavus丰度与IBD疾病结果相关
R.gnavus是与克罗恩病相关的菌群,已被确定为导致克罗恩病症状的原因之一。在克罗恩病患者中活泼瘤胃球菌(R.gnavus)的相对丰度升高与症状严重相关。
通过Illumina MiSeq对IBD患者(70名UC,39名CD)及100名健康对照的粪便微生物群分析显示,它们在 IBD中表现出差异丰度。结合20名IBD患者和12名对照的宏基因组分析与R.gnavus分离株的全基因组测序,强调了R.gnavus菌株水平的重要性。
研究还揭示了IBD特异性、菌株特异性的基因,这些基因参与氧化应激反应、粘附、铁获取和粘蛋白利用,可能赋予R.gnavus在IBD患者肠道中的适应性优势。在小鼠模型中,提出了多种支持R.gnavus与 IBD关联的机制。
此外,分析了化疗后接受造血细胞移植和干细胞植入的癌症患者的>10000个纵向微生物群样本,发现R.gnavus的绝对丰度与淋巴细胞率负相关,与其生长速率正相关,表明R.gnavus可能驱动高中性粒细胞与淋巴细胞比率,这一特征与IBD不良预后密切相关。
注:R.gnavus的富集还与CD患者的心理评分呈正相关,与次级胆汁酸TDCA和TLCA呈负相关,进一步表明其与患者心理状态和疾病进展的关联。
综上所述,一些研究人员认为R.gnavus可以作为 炎症性肠病(IBD)的生物标志物,但因果关系仍有待证明。
2
肠易激综合征
肠易激综合征(IBS)是一种慢性异质性疾病,影响约6%的人口。IBS的病理生理学是多因素的,其中包括肠道微生物群的改变。
对IBS患者、健康个体粪便和结肠活检样本,以及小鼠模型样本的细菌测序分析表明,症状和炎症的严重程度可能与粘液相关细菌(如R.gnavus)的变化密切相关。
编辑
▸ 在腹泻型IBS患者中明显更丰富
对80名IBS患者(16-70岁)和65名无IBS对照的粪便进行鸟枪法和16S rRNA 测序显示,R.gnavus和毛螺菌科其他物种在 IBS 中显著更丰富,尤其在腹泻型IBS(IBS-D)患者中,与外周5-羟色胺(5-HT)水平和严重症状相关。
这一现象也在R.gnavus单定植小鼠中得到验证。代谢组学和宏基因组学研究表明,R.gnavus的富集与二氢蝶酸水平降低密切相关,二氢蝶酸是叶酸合成的重要中间体,其失调可能导致IBS病理变化。
此外,在新诊断的初治IBD或IBS患者(13UC、10CD和26IBS)与健康对照中,基于粪便和粘膜微生物群的16S rRNA 基因测序进一步证实了R.gnavus 作为区分疾病表型潜在生物标志物的作用。
3
结直肠癌
多项宏基因组学研究表明,结直肠癌(CRC)与肠粘膜相关微生物群的显著变化有关。
▸ 粘膜菌群失调与肿瘤形成存在关联
异常隐窝病灶(ACF)是CRC患者结肠中最早可识别的形态学病灶。对接受结肠镜筛查或监测个体的粘附细菌分析显示,与正常粘膜相比,ACF的细菌微生物组谱异质性显著更高;KRAS癌基因突变与R.gnavus呈正相关,提示特定结肠细菌与CRC相关突变之间可能存在联系。
这些结果表明,正常粘膜微生物群的扰动可能是早期肿瘤形成的危险因素,粘膜菌群失调可能影响ACF的组织微环境和行为,促进其向高级肿瘤发展。
此外,最近一项研究通过16S扩增子测序分析CRC患者治疗前后肠道微生物群,发现R.gnavus与脂肪细胞因子信号通路和过氧化物酶体通路相关。
4
过敏、免疫和炎症
▸ R.gnavus可能对特应性皮炎有一定保护作用
肠道微生物组失调与儿童过敏密切相关,R.gnavus 是儿童过敏的重要参与者。研究表明,患特应性皮炎(AD)的婴儿肠道微生物群与健康婴儿存在差异。通过对129名婴儿队列中随机选取的40名6个月大婴儿(20名对照组,20名AD患者)的肠道微生物组进行全宏基因组测序,发现与免疫发育相关的功能基因存在差异。AD组中A.muciniphila、R.gnavus和Lachnospiraceae bacterium 2_1_58FAA的定植减少,与免疫发育迟缓显著相关。临床前研究进一步支持了R.gnavus在特应性皮炎模型中的保护作用。
▸ 食物或呼吸道过敏儿童中R.gnavus升高
相比之下,在受食物或呼吸道过敏影响的儿童中观察到R.gnavus(和F.prausnitzii)的丰度更高。在一项前瞻性双胞胎队列的研究中,在过敏表现出现之前观察到粪便微生物群中R.gnavus的丰度增加,并且与呼吸道过敏或呼吸道过敏与特应性湿疹共存有关。
在小鼠模型中,添加R.gnavus ATCC 29149 导致气道高反应性和炎症(哮喘),表现为结肠和肺中辅助T细胞2的扩增,以及嗜酸性粒细胞和肥大细胞浸润结肠和肺实质。
▸ 一些炎症反应中R.gnavus增多
系统性红斑狼疮(SLE)患者中R.gnavus丰度显著增加,且与整体疾病活动呈正比,在狼疮性肾炎患者中尤为明显。狼疮性肾炎患者的粪便中sIgA包被的R.gnavus细菌更多,血清IgG水平升高,主要针对R.gnavus菌株特异性细胞壁脂聚糖抗原。
R.gnavus水平升高也与脊柱关节炎相关,这是一类炎症性风湿病,但其机制尚不明确。此外,COVID-19患者(未使用抗生素)及长期并发症患者的肠道微生物组中R.gnavus水平较高,可能与细菌的肠肺易位或免疫与炎症调节有关。
5
代谢综合征
▸ R.gnavus与体脂率、腰围、血清甘油三酯等指标相关
R.gnavus与代谢综合征的多个特征密切相关,包括体脂百分比增加。这一关联得到了以挪威20-94岁参与者为基础的大型发现队列(n=2875)及两个复制队列(n=999和n=1341)的分析支持。
编辑
在联合队列中,33.7%的参与者检测到R.gnavus,其存在与脂肪量、腰围、血清甘油三酯、C反应蛋白(CRP)、HbA1c增加及HDL降低相关。这些关联在调整混杂因素后依然显著,且在不同性别和年龄(以中位年龄 59.6 岁为界)分层分析中表现一致。
6
肥胖
▸ R.gnavus在肥胖者中更丰富
在一项横断面多种族肥胖表型研究(812 名男性,843名女性,60-77 岁)中,16S rRNA 基因测序显示 R.gnavus与能量调整饮食炎症指数(E-DII)和肥胖表型相关。
另一项研究发现,在41名BMI正常者中,R.gnavus 与内脏脂肪密切相关,并与代谢指标呈正相关。早期研究也表明,R.gnavus在肥胖者中明显更丰富,并在减重期间减少,且与高BMI呈正相关。此外,一项研究显示,R.gnavus在对减肥手术无反应的患者中更为丰富。
注:瘤胃球菌喜欢植物中的多糖。如果肠道中有过多的瘤胃球菌,可想而知细胞会吸收更多的糖,那就不可避免地导致体重增加。
▸ R.gnavus会影响脂质代谢及信号通路
最近的动物研究表明,R.gnavus影响宿主代谢物。在高脂肪饮食小鼠中,R.gnavus影响肝脏的信号通路和下游脂质代谢,特别是降低FGF21表达,增加肝脏甘油三酯水平、血清总胆固醇和低密度脂蛋白(LDL)水平,所有这些都会导致代谢紊乱。
7
冠状动脉和肝脏疾病
▸ 冠状动脉疾病晚期患者R.gnavus相对丰度增加
肠道微生物组的改变与心血管疾病相关。一项病例对照研究通过16S rRNA测序分析了53名晚期冠状动脉疾病(CAD)患者与53名年龄、性别、种族和BMI匹配的对照者的粪便微生物群,发现CAD患者的肠道微生物组丰富度和均匀度降低。R.gnavus是相对丰度增加超过数倍的五个分类群之一,并在调整糖尿病和血脂异常等风险因素后,与晚期CAD的存在显著相关。
▸ 在脂肪性肝病肝硬化中丰度显著增加
宏基因组测序显示,R.gnavus是脂肪性肝病(MASLD)肝硬化和脂肪性肝病-肝细胞癌(HCC)患者中最丰富的五种细菌之一,且在MASLD-HCC患者中丰度最高。
此外,R.gnavus与MASLD-HCC和MASLD肝硬化患者的细胞毒性CD8+ T细胞呈负相关,而在MASLD合并冠心病患者中,其丰度低于仅患冠心病的个体。然而,这些研究未包含MASLD对照组,限制了对MASLD肠道微生物组的理解。
已有研究表明,与健康对照和脂肪性肝病对照相比,脂肪性肝病肝硬化患者的R.gnavus丰度显著增加,暗示其可能与脂肪性肝病向肝硬化的进展有关。
▸ 驱动肝性脑病
高达50-70%的肝硬化患者会发展为肝性脑病(HE),这与肠道菌群失调密切相关,机制尚不清楚。通过构建肠脑模块评估宏基因组数据集中的细菌神经毒素,研究人员发现主要来自R.gnavus的苯丙氨酸脱羧酶(PDC)基因在肝硬化患者中增加了约10倍,在HE患者中更高。
用R.gnavus定植的肝硬化、不健康的小鼠表现出脑苯乙胺(PEA)积累,以及记忆障碍、对称性震颤和皮层特异性神经元丢失,通常见于肝性脑病患者。
8
2型糖尿病
▸ 2型糖尿病患者中R.gnavus较高,而抗炎细菌丰度较低
肠道菌群的变化和慢性低度炎症在2型糖尿病(T2D)发展中起关键作用。一项对T2D患者粪便样本的初步研究发现,R.gnavus、Lactobacillus ruminis、Bacteroides caccae、Butyricimonas 和 Collinsella aerofaciens丰度较高,而抗炎细菌F.prausnitzii和Butyrivibrio丰度较低。
在一项随访的人群队列研究中,R.gnavus被确定为与新发2型糖尿病(T2D)持续相关的四个物种之一。对134名糖尿病前期成年人的分析显示,梭菌目(Clostridiales)和阿克曼菌(A.muciniphila)丰度降低,而R.gnavus丰度增加。一项基于258名T2D患者的研究发现,富含R.gnavus的微生物簇与适中血糖、严重胰岛素抵抗、高胆固醇水平相关。
▸ 与妊娠晚期空腹血糖呈正相关
妊娠糖尿病(GDM)研究表明,R.gnavus与妊娠晚期空腹血糖呈正相关。此外,糖尿病周围神经病变(DPN)研究显示,甘氨酸熊去氧胆酸和牛磺熊去氧胆酸与R.gnavus和Phascolarctobacterium的丰度呈正相关。
9
感染与脓毒症
编辑
▸ R.gnavus可能导致外周感染及血液感染
R.gnavus感染病例包括血液恶性肿瘤和外周感染,如泌尿生殖系统感染。例如,一名患深部浸润性子宫内膜异位症和盆腔炎的女性在双侧输卵管卵巢脓肿中培养出R.gnavus。
R.gnavus血流感染还与憩室病、化脓性关节炎、胆囊穿孔、多发性骨髓瘤和乙状结肠癌化疗患者的肠穿孔以及小肠疝和穿孔引起的粪便腹膜炎相关。这些研究表明R.gnavus感染的致病性与胃肠道损伤密切相关。
10
神经系统疾病
新出现的证据表明,微生物失调可导致神经认知障碍的发生和发展,如精神分裂症、抑郁症、双相情感障碍、焦虑症和痴呆症。
有人认为,饮食、生活方式、遗传因素和外部压力源“合作”调节肠道微生物群组成,从而影响大脑的反应。越来越多的研究报告了患有神经系统疾病的患者R.gnavus水平的变化。
▸ 焦虑症、脑癫痫患者R.gnavus增加
尽管研究规模有限,但焦虑症患者的肠道微生物丰富度和多样性显著降低,同时R.gnavus丰度增加。一项为期8周的临床试验测试了益生菌对抑郁症的治疗效果,结果显示益生菌组和安慰剂组均有症状减轻,但肠道微生物群未发生显著变化。然而,重度抑郁患者的R.gnavus相对丰度显著增加,并与抑郁焦虑压力量表评分呈正相关。
另一项研究发现,R.gnavus与脑癫痫患者的癫痫发作显著正相关,这种神经系统疾病以癫痫发作易感性为特征,与健康对照组相比差异明显。
▸ 阿尔茨海默病和认知障碍患者中R.gnavus丰度增加
随着人口老龄化的加剧,微生物代谢物在神经退行性疾病如阿尔茨海默病(AD)和帕金森病(PD)进展中的作用受到越来越多关注。在AD患者中,主要特征是淀粉样蛋白β(Aβ)在记忆相关脑区的积累。一项基于AD小鼠模型的研究发现,Aβ蛋白的过表达显著影响肠道微生物群,其抗菌活性导致R.gnavus等物种的丰度变化。
另一项研究调查了PD患者的肠道微生物群,并根据疾病严重程度分组。结果显示,路易体痴呆患者中R.gnavus和粪杆菌的相对丰度更高。这与另一项研究的结果一致,该研究发现帕金森病(PD)患者肠道中R.gnavus的丰度显著高于健康对照组。
在易患神经认知障碍的老年人和患有心理症状的克罗恩病患者中观察到R.gnavus的富集。与健康对照相比,中风后认知障碍患者的R.gnavus丰度增加,且与认知测试结果呈负相关。对患偏头痛的老年妇女与健康对照(年龄和BMI匹配)的粪便样本进行宏基因组学分析显示,R.gnavus是偏头痛组中显著富集的物种之一。
综上所述,这些研究表明R.gnavus在神经系统疾病中的丰度增加,尽管因果关系尚未明确。文献倾向于将粘膜相关或粘液溶解细菌的存在与肠道屏障通透性增加或炎症相关联,导致细菌代谢物或分子泄漏,触发炎症并向大脑发出信号。例如R.gnavus ATCC 29149 能够将色氨酸脱羧形成色胺,提高了肠道和中枢神经系统互作的可能性。
然而,目前尚无证据表明R.gnavus能物理改变粘膜屏障。与多形拟杆菌(Bacteroides thetaiotaomicron)或A.muciniphila等物种因其广泛的粘蛋白-聚糖降解能力可分解完整的粘蛋白聚糖链不同,R.gnavus的粘蛋白聚糖降解能力具有菌株特异性,仅限于从上皮屏障外觅食聚糖表位。
R.gnavus与疾病关联的研究
编辑
Crost EH,et al.FEMS Microbiol Rev.2023
▸ 高糖高肉会增加R.gnavus
饮食是肠道微生物群的主要调节因素。在题为“满足欧洲老年人口健康老龄化特定需求的新饮食策略”(NU-AGE)的研究中,调查了饮食、肠道微生物群和认知之间的关联,结果表明R.gnavus和Collinsella spp.与富含动物产品的饮食有关,被称为“促炎物种”。
通过对多种族队列研究(5936名参与者)的粪便样本进行16S rRNA基因测序,确定了饮食质量与肠道微生物组的长期关联。结果显示,R.gnavus的存在与健康饮食指数呈负相关。
健康饮食指数(HEI)由13个组成部分组成,最高100分,包括9个充足性组成部分(总水果、全水果、总蔬菜、蔬菜和豆类、全谷物、乳制品、总蛋白质食品、海鲜和植物蛋白以及脂肪酸)以及四个适度成分(精制谷物、钠、添加糖和饱和脂肪)。大多数成分按每1000大卡摄入量的摄入量评分。2
以羊肉、猪肉等红肉为基础的饮食会增加活泼瘤胃球菌(Ruminococcus gnavus)的丰度。
此外,经常食用糖果、饮料、糕点等,也会导致Ruminococcus gnavus升高,并降低了肠道中某些有益菌。
▸ 富含多酚的食物有助于减少R.gnavus
针对R.gnavus的饮食干预研究较少。一项对23名健康个体的随机交叉试验发现,在高红肉饮食中添加高直链淀粉玉米可降低R.gnavus的比例;补充富含多酚的红树莓可减少糖尿病前期和胰岛素抵抗成人的R.gnavus。这表明针对活泼瘤胃球菌(R.gnavus)的饮食干预可作为促进健康的策略。
▸ 益生菌调节
唾液乳杆菌(Lactobacillus salivarius Ren)显著减少R.gnavus的数量。
Lactobacillus paracasei DG干预后,瘤胃球菌丰度下降55%(P = 0.016)
口服长双歧杆菌BB536 和鼠李糖乳杆菌HN001 1个月后,Ruminococcus gnavus丰度减少。
此外,我们推测多形拟杆菌(Bacteroides thetaiotaomicron)等能够降解碳水化合物的有益细菌可能会与R.gnavus竞争,从而抑制R.gnavus的丰度。
但在注射了乳杆菌的小鼠小肠微生物群中,瘤胃球菌过度生长。
以下的细菌也可能对R.gnavus具有抑制作用
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Bacteroidales
Bacteroides
Porphyromonadaceae
Odoribacter
Parabacteroides
Porphyromonas
Prevotella
Rikenellaceae
Alistipes
Turicibacter
Streptococcus
Clostridiales
Catabacteriaceae
Clostridium
Clostridiales incertae sedis
Peptoniphilus
Clostridiales Family XIII. Incertae Sedis
Lachnospiraceae
Blautia
Lachnospiraceae
Coprococcus
Dorea
Eubacterium
Lachnobacterium
Lachnospira
Roseburia
Lachnospiraceae
Peptococcaceae
Ruminococcaceae
Ruminiclostridium
Acetivibrio
Eubacterium
Faecalibacterium
Oscillospira
Ruminococcus
Acidaminococcus
Dialister
Phascolarctobacterium
Veillonella
Rubrivivax
Alcaligenaceae
Oxalobacter
Bilophila
Desulfovibrio
Campylobacteraceae
Enterobacteriaceae
Escherichia
Erysipelotrichaceae
Erysipelotrichaceae
Holdemania
Akkermansia
▸ 益生元调节
施用低聚半乳糖(GOS)后,R.gnavus丰度下降。
龙舌兰菊粉,3周,随机对照试验,交叉试验,R.gnavus减少。
玉米可溶性纤维21g/d, 3周,随机对照试验,交叉试验,R.gnavus减少。
尽管活泼瘤胃球菌(Ruminococcus gnavus)是人类肠道微生物群的重要组成部分,通常在健康个体的肠道中广泛存在,但研究表明,其丰度的异常升高可能与多种疾病的发生和发展密切相关。这些疾病不仅包括肠道相关疾病,如炎症性肠病(IBD)、肠易激综合征(IBS)和结直肠癌,还涉及非肠道相关疾病,如神经发育障碍、神经系统疾病、代谢性疾病以及免疫系统紊乱等。
例如,除了最近《Nature Medicine》揭示活泼瘤胃球菌可通过苯丙氨酸脱羧酶及其代谢产物苯乙胺驱动肝性脑病,为肝性脑病提供了潜在诊疗靶点。 今年江南大学王鸿超团队基于机器学习识别关键菌群,发现肥胖个体中肠道共生菌活泼瘤胃球菌的丰度增加,且与临床指标显著相关,且通过调节胆汁酸代谢(如促进次级胆汁酸的生成)对宿主代谢产生不利影响,间接阻碍了体重的下降;并可能导致肝脏损伤。
因此,监测和预防活泼瘤胃球菌丰度的异常升高对于维持肠道菌群平衡和降低疾病风险具有重要意义。然而,要实现这一目标,需要建立可靠的健康人群和疾病人群的肠道微生物数据库,以明确健康状态下该菌的正常丰度范围及其在疾病状态下的异常变化边界。这些数据库应包括不同年龄、性别、生活方式和地理区域的健康人群数据,同时结合疾病人群的微生物组特征,明确活泼瘤胃球菌的丰度变化与疾病的关联模式。通过这些数据的积累和分析,不仅可以更准确地识别活泼瘤胃球菌的异常丰度阈值,还能为个性化的肠道健康管理和疾病预防策略提供科学支持。
主要参考文献
Crost EH, Coletto E, Bell A, Juge N. Ruminococcus gnavus: friend or foe for human health. FEMS Microbiol Rev. 2023 Mar 10;47(2):fuad014.
Juge N. Microbe Profile: Ruminococcus gnavus: the yin and yang of human gut symbionts. Microbiology (Reading). 2023 Aug;169(8):001383.
Grahnemo L, Nethander M, Coward E, Gabrielsen ME, Sree S, Billod JM, Engstrand L, Abrahamsson S, Langhammer A, Hveem K, Ohlsson C. Cross-sectional associations between the gut microbe Ruminococcus gnavus and features of the metabolic syndrome. Lancet Diabetes Endocrinol. 2022 Jul;10(7):481-483.
Henke MT, Kenny DJ, Cassilly CD, Vlamakis H, Xavier RJ, Clardy J. Ruminococcus gnavus, a member of the human gut microbiome associated with Crohn’s disease, produces an inflammatory polysaccharide. Proc Natl Acad Sci U S A. 2019 Jun 25;116(26):12672-12677.
Titécat M, Wallet F, Vieillard MH, Courcol RJ, Loïez C. Ruminococcus gnavus: an unusual pathogen in septic arthritis. Anaerobe. 2014 Dec;30:159-60.
de la Fuente-Nunez C, Meneguetti BT, Franco OLet al. Neuromicrobiology: how microbes influence the brain. ACS Chem Neurosci. 2018;9:141–50.
Fan X, Chen Y, Liu Yet al. First case of bloodstream infection caused by Ruminococcus gnavus in an 85 year old man in China. Lab Med. 2022;53:e36–9.
Hall AB, Yassour M, Sauk Jet al. A novel Ruminococcus gnavus clade enriched in inflammatory bowel disease patients. Genome Med. 2017;9:103.

谷禾健康

霍尔德曼氏菌属(Holdemania)是一种棒状或杆状的革兰氏阳性细菌,属于厚壁菌门下的丹毒丝菌科。严格厌氧,不形成芽孢。
其表现出对糖类的代谢能力,能够发酵葡萄糖和其他糖类如阿拉伯糖、纤维二糖、赤藓糖醇等。并产生乙酸,乳酸和琥珀酸,有时还会产生少量甲酸。还发现Holdemania与色氨酸代谢呈正相关,这可能是其影响神经系统疾病的一个机制。
Holdemania通常被认为是人体肠道正常菌群的一部分,在谷禾健康人群检出率为29.33%,在维持肠道微生态平衡中起一定作用,大多数情况下,Holdemania属菌不会引起疾病,是人体共生的细菌。但研究发现其丰度过高与脂质代谢紊乱的严重程度相关。之前的报告还表明,肠道中高丰度的霍尔德曼氏菌会诱导炎症反应。
谷禾查找并整理了相关文献资料,发现霍尔德曼氏菌属(Holdemania)与脂质和葡萄糖代谢受损有关,其在II型糖尿病和肥胖等代谢性疾病中具有潜在危害作用。
此外研究发现在肝炎、抑郁症、肠易激综合征、肺动脉高压、心房颤动、痛风、过敏性哮喘和非酒精性脂肪肝等病症中,Holdemania的相对丰度明显增加。而在胰腺炎、肾结石中Holdemania的丰度减少。此外,一些研究表明霍尔德曼氏菌属可能对巴雷特食管和癌症治疗具有一定的积极作用。
鸭肉、羊肉、乳制品和藻类蔬菜等饮食因素以及利福昔明和伊匹单抗+纳武单抗等药物会增加Holdemanella属的相对丰度。锌过载时Holdemania的丰度也会增加。而使用二陈汤、夏桑菊、针刺疗法等有助于减少Holdemania的丰度。
关于霍尔德曼氏菌属(Holdemania)的研究资料相对有限,本文将根据该菌相关的研究结果以及检测实践数据来综合分享该菌的相关信息和健康特性及其干预措施。
1
细胞形态
霍尔德曼氏菌属(Holdemania)是一种棒状或杆状的革兰氏阳性细菌,最早于1997年被发现,大小约0.5-1.2μm×1.5-6μm,更长的细胞有中央到末端的肿胀。无鞭毛,成对或短链出现,不产生孢子。
该菌的细胞壁含有B组胞壁质类型(B1δ(L-Ala)-D-Glu-L-Asp-L-Lys),这种类型在任何其他细菌物种中均未观察到。
在琼脂上生长的菌落直径为1.0毫米。它们是圆形、完整的、半透明的,具有颗粒状外观。通过葡萄糖肉汤培养浑浊并含有白色沉淀物。
2
生长条件
该菌属通常在37°C下生长最佳,但也能在25°C至45°C的温度范围内生长。它们是专性厌氧菌,不能在有氧条件下生长。适宜生长的pH范围是6.5-7.5,最佳pH是7.0。人体大肠的环境非常适宜其生长。
3
代谢特征
Holdemania有严格的无氧代谢,通常表现出对糖类的代谢能力,而不是蛋白质分解。能够发酵葡萄糖和其他糖类。例如阿拉伯糖、纤维二糖、赤藓糖醇、甘露糖、麦芽糖、甘露糖、棉子糖、鼠李糖、核糖、山梨醇、淀粉、海藻糖或木糖等。
通过代谢葡萄糖的最终产物是乙酸,乳酸和琥珀酸,有时还会产生少量甲酸。不产生过氧化氢酶和吲哚。
此外还发现Holdemania与色氨酸代谢呈正相关,与异丁酸呈负相关。
4
抗生素敏感性
霍尔德曼氏菌属(Holdemania)对万古霉素具有耐药性,但对特定的抗生素敏感,如在一些研究中观察到的对青霉素类和大环内酯类抗生素的敏感性。
5
霍尔德曼氏菌属下的物种
Holdemania filiformis是该菌属的模式种,此外还可以对其他物种进行细分。
Holdemania filiformis
–Holdemania filiformis DSM 12042
Holdemania massiliensis
–Holdemania massiliensis AP2
未分类的 Holdemania
–Holdemania sp.
–Holdemania sp. 1001095H_141210_F2
–Holdemania sp. 1001302B_160321_E10
–Holdemania sp. cp07.24
–Holdemania sp. Marseille-P2844
–Holdemania sp. P15wH7
–Holdemania sp. P23wH1
具有致病性的物种:
Holdemania filiformis
Holdemania sp AP2
6
基因组结构
霍尔德曼氏菌属(Holdemania)的DNA G+C 含量(mol%):38
霍尔德曼氏菌属的模式菌种Holdemania filiformis有一条环状染色体,由3932923个碱基对组成,该基因组采用宏基因组测序法进行测序,已识别出4223个假定的蛋白质编码区。
7
人群中的分布特征
研究表明,霍尔德曼氏菌属(Holdemania)在不同人群中的分布特征存在差异。
儿童和老年人群中Holdemania的丰度较低,而成年人群中丰度较高。这可能与年龄相关的生理变化和免疫系统成熟度有关。性别方面,目前的数据并不充分,但初步研究指出Holdemania在女性中的丰度较高,而在男性中的丰度较低。
Holdemania属的分布特征与地理区域密切相关。不同地区的环境条件、饮食习惯及生活方式等因素都可能对其在人群中的存在产生影响。一项针对亚洲和西方国家的微生物群落研究显示,Holdemania属 在亚洲人群中更为常见。
8
与其他菌群的互作
Holdemania与其他微生物之间存在复杂的互作关系。这些互作可以是共生的、促进的或拮抗的,具体取决于环境条件和微生物群的组成。以下是一些可能的互作方式。
能够增强下列菌属的生长:
•Bacteroidales
•Bacteroides
•Odoribacter
•Peptococcaceae
能够抑制下列菌属的生长:
•Bifidobacterium
•Coriobacteriales
•Adlercreutzia
•Collinsella
•Porphyromonas
•Prevotella
•Clostridium
•Clostridiales incertae sedis
•Clostridiales Family XIII. Incertae Sedis
•Blautia
•Coprococcus
•Dorea
•Lachnospiraceae
•Ruminococcaceae
•Ruminococcus
•Dialister
•Campylobacteraceae
•Erysipelotrichaceae
谷禾查找并整理了相关文献资料,发现霍尔德曼氏菌属(Holdemania)的丰度变化与健康状态或一些疾病存在关联。
研究显示,在肝炎、抑郁症、肠易激综合征、肺动脉高压、心房颤动、痛风、过敏性哮喘和非酒精性脂肪肝等病症中,Holdemania的相对丰度明显增加。
Part 1
Holdemania高丰度相关
前列腺炎、肝炎

霍尔德曼氏菌属(Holdemania)属于丹毒丝菌科,是一个相对不典型的属。它存在于各种环境中,包括动物的胃肠道。一些观察性研究表明,在患有肝炎、肺炎和神经炎症等各种炎症性疾病的患者肠道中,Holdemania的丰度显著增加。
推测其丰度的变化可能影响肠道屏障的完整性,促进微生物产物易位到血液中,诱导IL-8的产生,这被认为是一种潜在的促炎机制,从而引发炎症反应。此外发现Holdemania数量增加还会带来前列腺炎风险,可能与前列腺炎风险呈正相关。
抑郁症

研究发现,抑郁症患者的肠道菌群发生改变,其中Butyricicoccus、Coprococcus、Faecalibacterium、Fusicatenibacter、Romboutsia的含量持续下降,而Eggerthella、Enterococcus、Flavonifractor、Holdemania 和 Streptococcus的含量增加。
这些肠道菌群可能通过影响色氨酸代谢来调节大脑功能。一些编码色氨酸合酶基因的细菌,如肠球菌、乳杆菌和Oscillibacter,被发现在研究中增加。Trp和5-HTP(5-HT的前体)可以通过血脑屏障(BBB),成为脑内5-HT的前体。
同时在患有沮丧的个体中观察到Holdemania的增多,这表明这种细菌与抑郁症状之间可能存在联系。

抑郁症性高血压(DEP-HTN)患者肠道细菌主要富集的菌落包括Eubacterium siraeum、Alistipes obesi、Holdemania filiformis、Lachnospiraceae bacterium 1.1.57FAA和Streptococcus salivariu,这5种细菌的丰度较高。
肠易激综合征

在属水平上,霍尔德曼氏菌属(Holdemania)在肠易激综合征(IBS)患者中显著高于对照组。IBS 粪便样本中有9个属显著丰富,包括Akkermansia、Blautia、Coprococcus、Granulicatella、Holdemania、Oribacterium、Oscillospira、Parabacteroides和Sutterella。
食物蛋白诱导的小肠结肠炎综合征(FPIES)患儿的粪便菌群失调,表现为:青春双歧杆菌显著减少,拟杆菌属(尤其是脆弱拟杆菌)、Holdemania、Lachnobacterium、鲁氏不动杆菌等菌增加,而双歧杆菌利用寡糖产生短链脂肪酸的代谢通路显著减少。
主观记忆障碍

来自大型前瞻性队列的老年女性的研究中,报告有2个或更多主观记忆障碍(SMC)的女性与报告仅有1个或没有的女性相比,霍尔德曼氏菌属(Holdemania)和脱硫弧菌科的相对丰度更高。
与主观记忆障碍(SMC)少于2个的女性相比,SMC 有2个以上女性的Holdemania和脱硫弧菌科的相对丰度分别高2.09倍和2.10倍。
肺动脉高压
肺动脉高压(PAH)患者可能导致丁酸球菌 (Butyricicoccus)和Holdemania的水平升高,同时降低无害梭菌(Clostridium innocuum)、Defluviitaleaceae UCG011、Eisenbergiella和Ruminiclostridium 5的水平 。
心房颤动
Holdemania与心房颤动(AF)风险相关,霍尔德曼氏菌属(Holdemania)与BMI显著相关,而霍尔德曼氏菌属通过BMI对心房颤动风险的中介作用比例为12.01%。
口腔溃疡

三种肠道微生物群与口腔溃疡呈正相关:Holdemania(比值比 [OR] = 1.005,95% 置信区间 [CI]:1.001-1.009,P = .019)、草酸杆菌(OR = 1.004,95% CI:1.000-1.007,P = .032)和瘤胃球菌科 UCG011(OR = 1.006,95% CI:1.001-1.011,P = .029)。
其他疾病
痛风
基于细菌 16sRNA 的测序结果表明,拟杆菌、Holdemania、Anaerotruncus 和其他几种细菌与痛风病呈正相关。
非酒精性脂肪肝
非酒精性脂肪肝(NAFLD)会导致Holdemania和瘤胃球菌丰度增加。
过敏性哮喘
霍尔德曼氏菌属(Holdemania)(P=0.046)与过敏性哮喘(AA)存在正相关关系。
慢性自发性荨麻疹
慢性自发性荨麻疹(CSU)和对照组肠道菌群Holdemania菌属相对丰度分别为0.04%、0.01%,两组间差异有统计学意义(P = 0.025)。
创伤性脊髓损伤
还分析了23名创伤性脊髓损伤(SCI)患者与23名健康对照,并报道了在创伤性脊髓损伤(SCI)患者中Parabacteroides、aliistipes、Phascolarctobacterium、Christensenella、Barnesiella、Holdemania、Eggerthella、nestiinimonas、Gordonibacter、Bilophila和Coprobacillus的丰度高于健康个体。
乙型肝炎肝硬化
研究发现,乙型肝炎肝硬化无腹水(HBLC-WOA)患者中:阿克曼菌属(Akkermansia)、另枝菌属(Alistipes)、肠杆菌属(Enterobacter)、霍尔德曼菌属(Holdemania)的丰度明显升高。
重症肌无力
此外,瘤胃球菌科UCG005属、 Holdemania、 Lachnoclostridium和真细菌属(反刍动物)与重症肌无力(MG)发生概率较大相关。
Part 2
Holdemania低丰度相关
霍尔德曼氏菌属(Holdemania)在一些疾病中的丰度较高,与此同时,某些疾病中霍尔德曼氏菌属(Holdemania)的丰度可能会降低。
胰腺炎

已确定七种微生物群与胰腺炎的发展显著相关。宿主基因驱动的拟杆菌目和拟杆菌纲与胰腺炎风险增加有关。粪球菌属和裂解真杆菌组(Eubacterium fissicatena)也对胰腺炎的发展表现出促进作用。同时,急性胰腺炎与变形菌门和毛螺菌属呈正相关,与Holdemania属呈负相关。
认知障碍

一项对西班牙裔为主的认知障碍(CI)和不认知障碍(NC)个体中口腔和肠道微生物群的测序研究发现:认知障碍(CI)个体表现出一些肠道菌属的丰度下降,包括Shuttleworthia、Holdemania和Subdoligranulum。
肾结石
肾结石患者中显著降低的菌群:霍氏真杆菌、多尔氏菌属、啮齿杆菌、厌氧棒菌属、Ruminiclostridium_5、霍尔德曼氏菌属(Holdemania)、Fusicatenibacter、罕见小球菌属(Subdoligranulum)、戴阿利斯特菌属、Parasutterella、嗜胆菌属。
Part 3
可能存在的益处
尽管霍尔德曼氏菌属(Holdemania)被发现在一些疾病中存在丰度的变化,但是也有一小部分研究发现霍尔德曼氏菌属(Holdemania)可能对一些疾病存在保护作用。
对巴雷特食管可能具有保护作用

研究发现,Alistipes、Lactobacillus、Prevotella 7和Ruminococcaceae UCG004是Barrett食管(BE)的危险因素,而Flavonifractor和Ruminococcaceae UCG004是食管腺癌(EAC)的危险因素。
另一方面,某些肠道微生物群似乎对BE和EAC都有保护作用。这些菌群包括Eubacterium、 Holdemania、Lactococcus和Actinomyces。
预防3-4期子宫内膜异位症

研究了肠道菌群与子宫内膜异位症不同阶段之间的因果关系。霍尔德曼氏菌属(Holdemania)和瘤胃球菌科UCG002可能在子宫内膜异位症的发展中起着至关重要的作用。
Holdemania和瘤胃球菌科UCG002参与肠道丁酸的产生。值得注意的是,瘤胃球菌科UCG002与调节性T细胞(Treg)呈正相关,其丰度与促炎细胞因子水平密切相关。
目前推测霍尔德曼氏菌属(Holdemania)是预防3-4期子宫内膜异位症的保护因素。相反,较高水平的瘤胃球菌科UCG002会增加1-2期子宫内膜异位症的风险。
在肿瘤治疗中的积极作用
霍尔德曼氏菌属(Holdemania)、多形拟杆菌和普鲁士尼茨菌在对肿瘤免疫治疗响应的患者中显著富集。
此外,肝细胞癌(HCC)恢复正常的群体有几个微生物属相对于延迟恢复(DR)患者显著富集,包括双歧杆菌、丹毒菌科、霍尔德曼氏菌属(Holdemania)。
某些食物和药物的摄入可能对Holdemania的丰度产生影响,导致其水平升高或降低。这种影响取决于食物的种类、药物的成分以及个体的具体健康状况。通过调整饮食和药物使用,可以间接调节Holdemania的丰度。
✦ 果胶
果胶的添加富集了厚壁菌门的微生物成员,包括梭菌纲下的Mogibacteriaceae科、Lachnospiraceae(毛螺菌科)以及产芽胞菌科。
其中,毛螺菌科的Butyrivibrio(丁酸弧菌属)、Coprococcus(粪球菌属)、Moryella、Holdemania(霍尔德曼氏菌属)和Bulleidia属对果胶表现出显著的特异性。
✦ 纳米硒
代谢组学和微生物组学分析结果表明,纳米硒SeNPs能够参与调节机体脂质代谢途径,提高霍尔德曼氏菌的丰度及其代谢产物短链脂肪酸(乙酸、丙酸)的含量。
✦ 利福昔明
利福昔明干预后丰度升高的菌属包括粪杆菌属(Faecalibacterium)、嗜胆菌属(Bilophila)、副萨特氏菌属(Parasutterella)、粪芽孢菌属(Coprobacillus)、霍尔德曼菌(Holdemania)、双歧杆菌属、真杆菌属(Eubacterium)。
✦ 伊匹单抗+纳武单抗
使用伊匹单抗结合纳武单抗治疗的患者肠道内厚壁菌门的Faecalibacterium prausnitzii和Holdemania filiformis菌以及拟杆菌门的Bacteroides thetaiotamicron增多。
✦ 针刺疗法
2型糖尿病患者,通过针刺疗法,在细菌属、种水平上,针刺组的埃希菌属(Escherichia)、肠球菌属(Enterococcus)、明串珠菌属(Leuconostoc)、霍尔德曼氏菌属(Holdemania)、罗氏菌属(Rothia)、普雷沃氏菌属(Prevotella)、罗斯氏菌属(Roseburia)、弯曲杆菌属(Campylobacter)、厌氧棍状菌属(Anaerotruncus)、厌氧消化链球菌(Peptostreptococcus anaerobius)和Shuttleworthia satelles的丰度下降。
✦ 低FODMAP黑麦面包
一项随机临床试验比较低FODMAP黑麦面包与普通黑麦面包对肠易激综合征患者破坏菌群的影响,结果显示食用低FODMAP黑麦面包减少了拟杆菌、Flavonifractor、Holdemania、Parasutterella 和克雷伯菌的丰度。
✦ 夏桑菊

夏桑菊是一种上市药物和膳食补充剂,用于治疗具有炎症的代谢疾病。夏桑菊可以引起肠道菌群组成的变化,颤杆菌丰度增加,胆菌属、Candidatus Stoquefichus、Holdemania、Parasutterella和Rothia减少。
✦ 二陈汤
二陈汤(ECD):使用二陈汤主要减少了Prevotella、Blautia和Holdemania菌属的含量,这些菌属及丙酸水平与宿主肥胖表型(特别是脂质代谢紊乱)存在正相关关系。
✦ 开菲尔
使用开菲尔干预后Holdemania属的显著减少可能通过炎症产生了积极的微生物群组成变化。
主要参考文献
Liu H, Li J, Guan C, Gao W, Li Y, Wang J, Yang Y, Du Y. Endometriosis is a disease of immune dysfunction, which could be linked to microbiota. Front Genet. 2024 Jun 21;15:1386411.
Gao M, Wang J, Liu P, Tu H, Zhang R, Zhang Y, Sun N, Zhang K. Gut microbiota composition in depressive disorder: a systematic review, meta-analysis, and meta-regression. Transl Psychiatry. 2023 Dec 8;13(1):379.
Wu F, Davey S, Clendenen TV, Koenig KL, Afanasyeva Y, Zhou B, Bedi S, Li H, Zeleniuch-Jacquotte A, Chen Y. Gut Microbiota and Subjective Memory Complaints in Older Women. J Alzheimers Dis. 2022;88(1):251-262.
Zhou F, Liu Y, Shi Y, Wu N, Xie Y, Zhou X. Association between gut microbiota and acute pancreatitis: a bidirectional Mendelian randomization study. J Gastroenterol Hepatol. 2024 Jun 18.
Wadop YN, Vasquez EL, Mathews JJ, Muhammad JAS, Mavarez RP, Satizabal C, Gonzales MM, Tanner J, Maestre G, Fonteh AN, Seshadri S, Kautz TF, Fongang B. Differential Patterns of Gut and Oral Microbiomes in Hispanic Individuals with Cognitive Impairment. bioRxiv [Preprint]. 2024 Jul 29:2024.07.27.605455.
Mishra AK, Lagier JC, Pfleiderer A, Nguyen TT, Caputo A, Raoult D, Fournier PE. Non-contiguous finished genome sequence and description of Holdemania massiliensis sp. nov. Stand Genomic Sci. 2013 Dec 15;9(2):395-409.
Zhang M, Fang J, Zheng C, Lin Q, Zhang J. Gut microbiota and autoimmune neurologic disorders: a two-sample bidirectional Mendelian randomization study. Front Microbiol. 2024 Apr 24;15:1337632.

谷禾健康

肠易激综合征 (IBS) 是一种普遍存在的、症状驱动的慢性疾病,其特征是腹部不适和排便不规律,估计影响全球 11.2% 的人口。这些患者中大约三分之一被诊断患有便秘型肠易激综合征(IBS-C),这是IBS 的一种亚型。
鉴于传统治疗的局限性,越来越多的证据强调分泌药物的有效性。这些靶向氯离子通道的新药具有明确的作用机制,一个例子是鸟苷酸环化酶C激动剂利那洛肽。利那洛肽不仅可以缓解便秘症状,还可以改善腹部不适、疼痛和腹胀等全身症状。该药物已获得美国食品和药物管理局 (FDA) 和美国胃肠病学会认可用于治疗成人慢性特发性便秘 (CIC) 和便秘型肠易激综合征。
然而,利那洛肽治疗的疗效已被证明表现出显著的个体差异。 2018 年中国的一项 III 期试验显示,约 40% 患者对利那洛肽治疗没有反应,这可能是由于IBS-C的多因素病因所致。
研究表明,肠道菌群不仅影响IBS-C的发病,也影响疾病治疗的有效性,包括结肠癌患者的化疗敏感性、二甲双胍对糖尿病的影响以及利法昔明治疗IBS-D的疗效。通过动物实验,一项日本研究确认利那洛肽能增强肾功能不全患者的肠道环境。然而,利那洛肽是否能改善肠道菌群失调,以及肠道菌群与利那洛肽治疗IBS-C患者症状缓解之间的关系尚待确定。
近日,来自重庆医科大学附属第一医院、第三军医大学第二附属医院、遂宁市中心医院等消化内科的研究人员,发现肠道菌群尤其是经黏液真杆菌属(Blautia属),对利那洛肽治疗效果具有潜在影响,该研究结果发表在《Journal of Translational Medicine》(转化医学杂志)上。

该研究通过多中心临床试验,评估利那洛肽的疗效和安全性,辨别利那洛肽治疗提供的缓解与肠道菌群变化之间的关系,治疗后Blautia的丰度可用于预测利那洛肽的疗效,这对IBS-C治疗具有重要意义。
本文我们来详细了解一下吧。
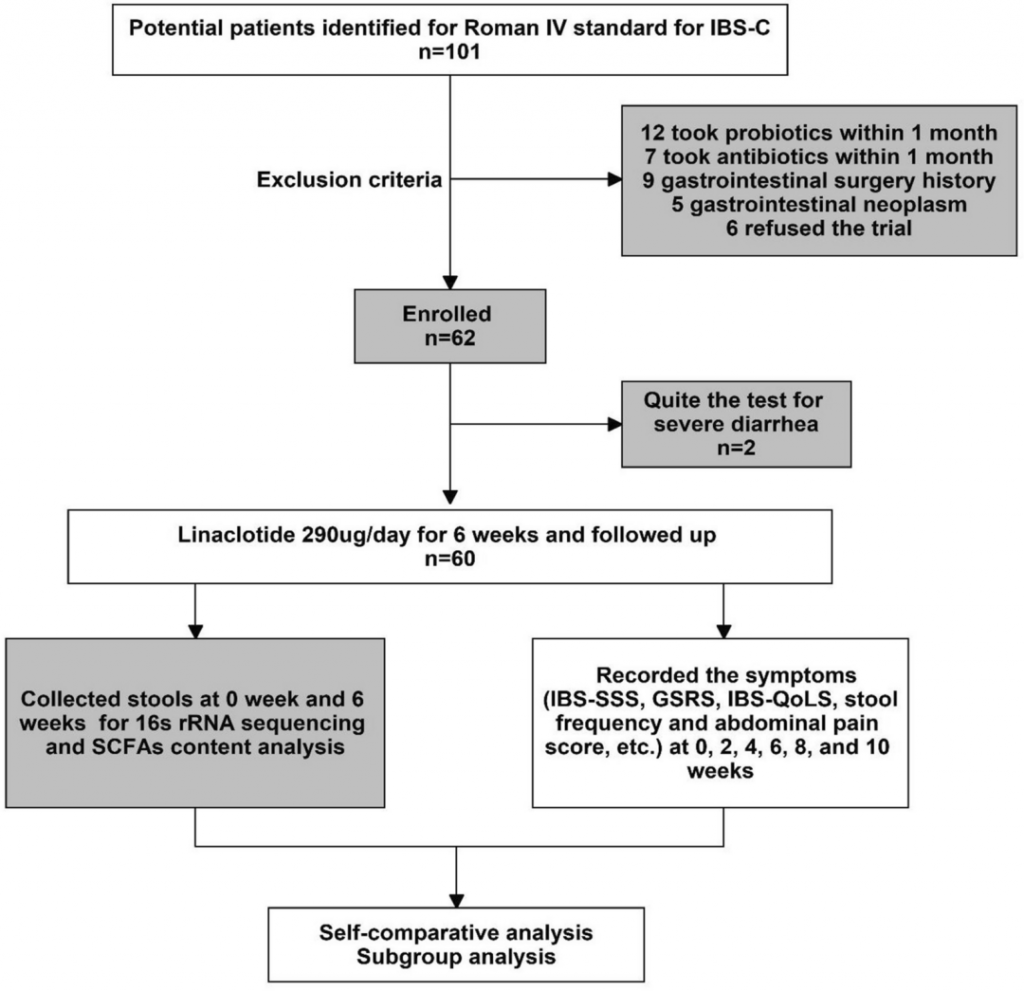
这项多中心、前后临床试验于2020年1月-2021年6月期间在六家医院进行,包括:
IBS-C患者
纳入标准如下:
排除标准如下:
健康志愿者
排除标准如下:
治疗及随访
所有患者均接受相同剂量的利纳洛肽治疗(每天一次,早餐前半小时口服290微克),治疗周期为6周。每周进行两次随访。治疗期间,患者不得服用任何其他与便秘相关的药物,包括益生菌和泻药。
样本、指标收集
在利纳洛肽治疗前后各收集一次粪便样本。每位患者收集三份粪便样本,进行16s rRNA测序。
每两周评估一次腹痛变化:
治疗期间每日根据饮食状况评估布里斯托粪便形态量表(BSFS)和自发性大便次数(SBMs)。
治疗后,将患者分为缓解组和无缓解组。根据FDA响应标准;
缓解组中的患者进一步分为响应者和非响应者。
IBS-C的FDA响应终点标准如下:
IBS-C的缓解标准是在至少50%的治疗期间腹痛或便秘得到缓解。
01
利那洛肽改变了IBS-C患者的肠道菌群
从60名患者中收集了初始(第0周)和最终(第6周)的粪便样本,并进行了16S rRNA的测序分析。通过广义线性模型使用各种方法评估了肠道菌群的alpha多样性,并且不同指数(ACE和Chao1)的一致结果显示,第6周组的alpha多样性显著高于第0周组(p < 0.0001)。
用Jaccard距离算法的主坐标分析(PCoA)评估了beta多样性。OTUs的清晰聚类分离表明,第0周组和第6周组之间存在着明显的群落结构差异。
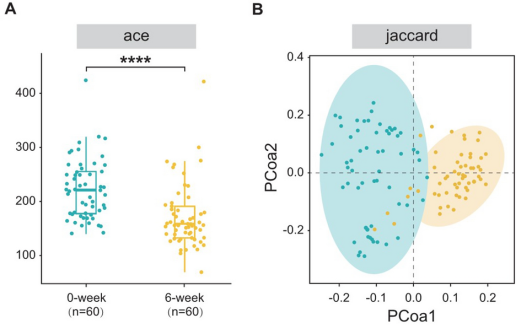
在门级别,厚壁菌门是最丰富的门,分别占0周组和6周组肠道微生物群的63.81%和77.93%(p < 0.0001)。
在属级别,两组之间观察到生物组成的明显差异。其中,Blautia属(分别为18.57%对7.77%,p < 0.001)和Fusicatenibacter属(分别为1.23%对1.69%,p < 0.001)在6周组中的丰度相对较高。
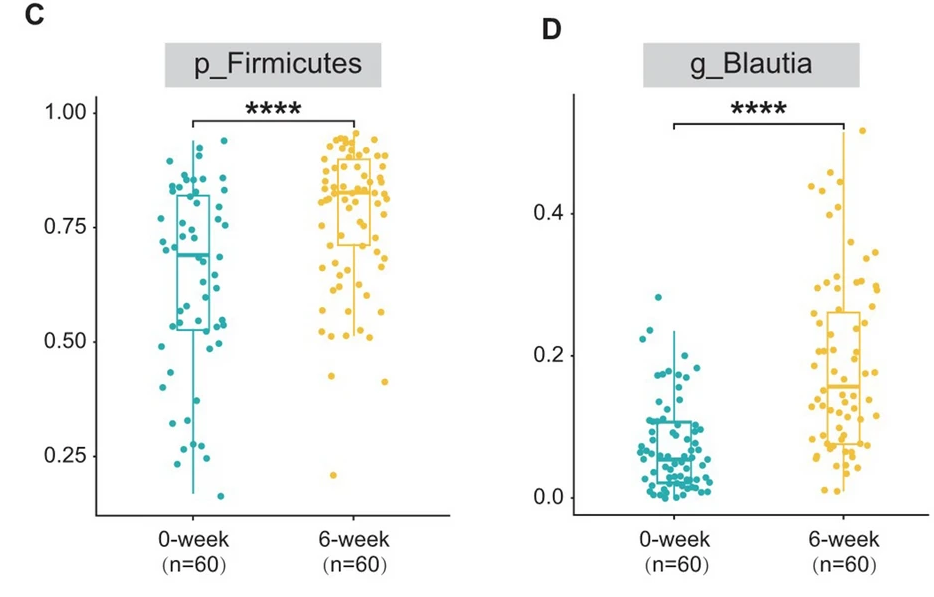
用LEfSe进行了高维比较,发现Blautia属(来自厚壁菌门和毛螺菌科)是导致6周组肠道微生物群失调的关键细菌类型。
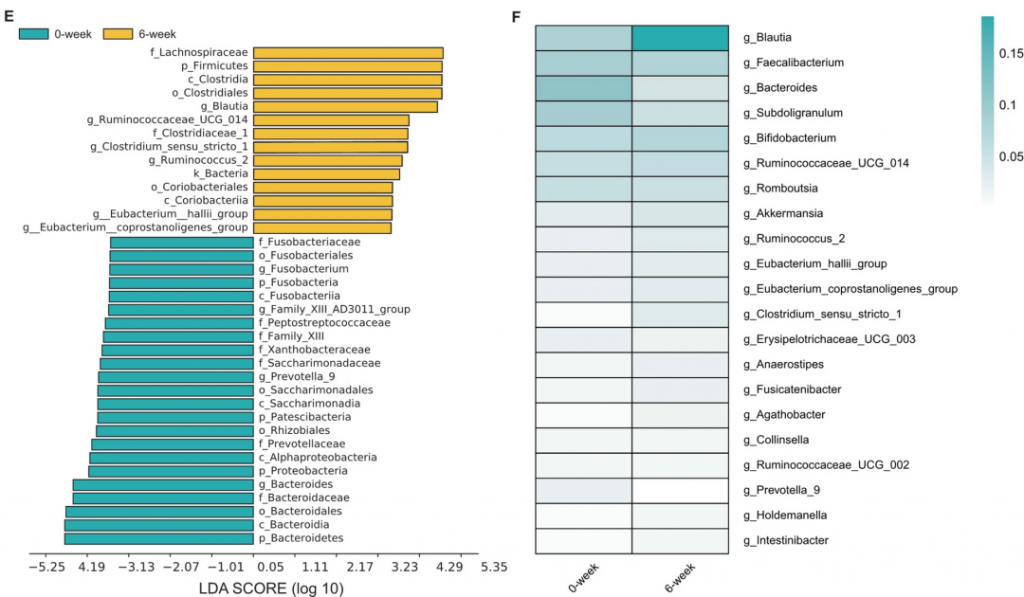
LEfSe结果表明,厚壁菌门在门级别和Blautia属在属级别在健康志愿者中占主导地位。IBS-C患者的Blautia属丰度低于健康志愿者,而利那洛肽治疗后的Blautia属丰度高于健康志愿者。
在连续观察中(利那洛肽撤药后4周),还发现Blautia属的丰度高于治疗前,但低于治疗期间。
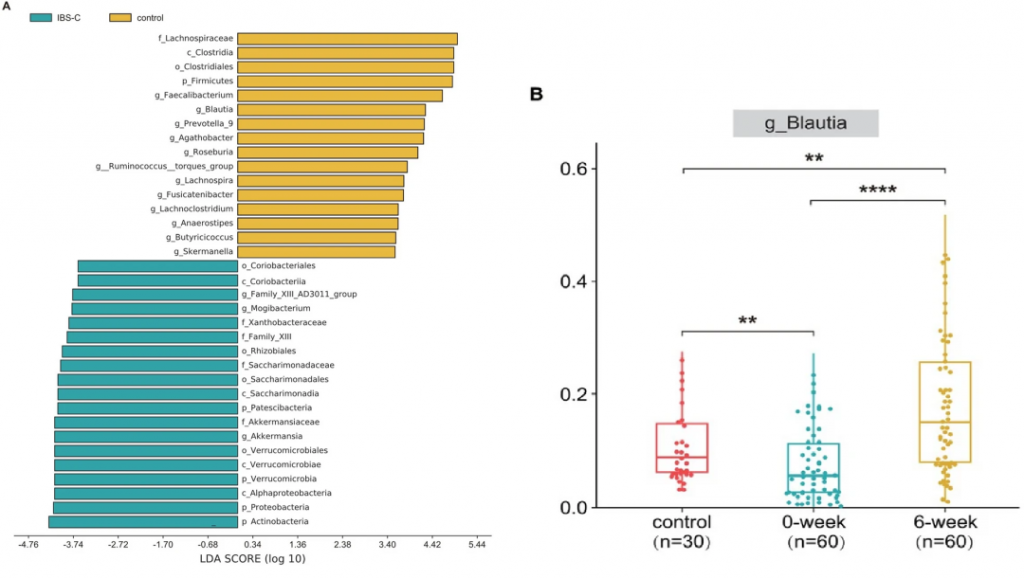
这些发现进一步支持了利纳洛肽可能通过调节肠道菌群发挥作用的观点。
02
Blautia属的丰度与利纳洛肽的疗效相关
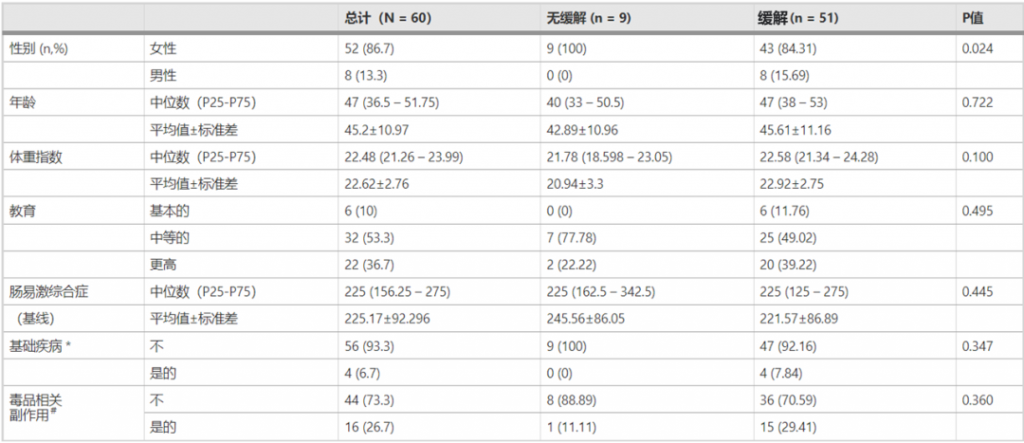
为了控制性别、年龄和BMI等混杂因素,使用了1:4的比例匹配了9位未缓解(NR)的患者和51名缓解的患者中的36名。还分析了0周和6周收集的粪便样本,结果显示缓解和未缓解患者之间的肠道菌群整体结构和α多样性没有差异。
有趣的是,如果治疗后Blautia属的丰度明显高于治疗前,观察到更明显的症状缓解(下图CD)。
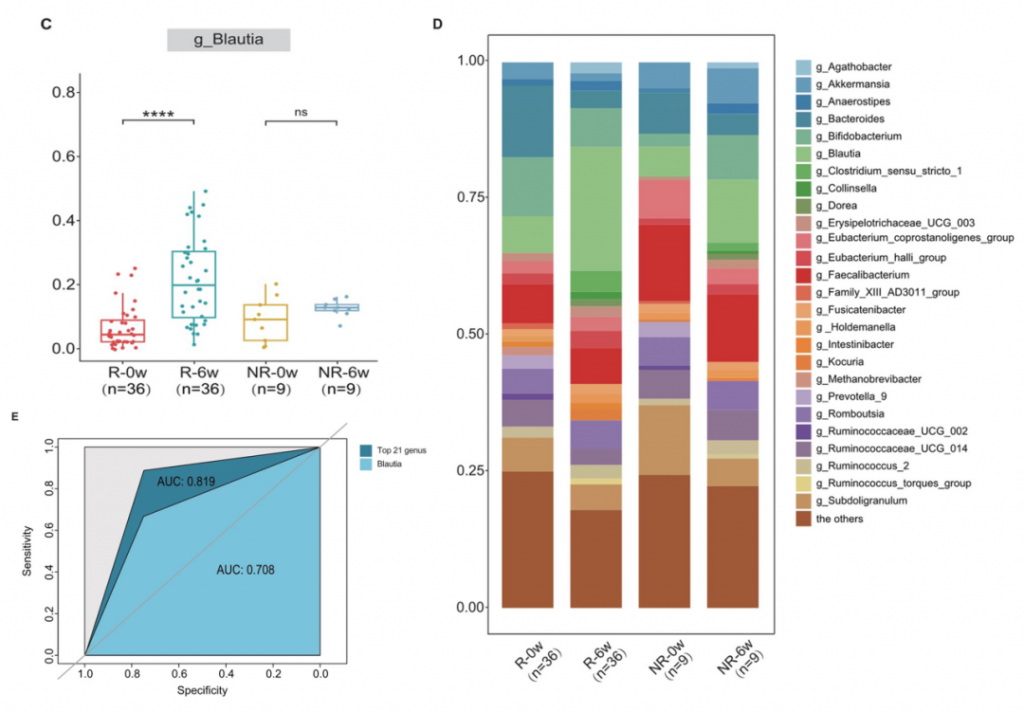
ROC分析,属级别的基线丰度可以用来预测IBS-C治疗的效果,AUC为0.819,而Blautia属AUC为0.708,位于前21个属之中(上图E)。
这些发现表明,某些特定肠道微生物如Blautia属这样的菌,在缓解的患者和未缓解的患者之间,对利纳洛肽效果的影响存在显著差异(p < 0.01)。
03
Blautia属和短链脂肪酸水平与临床症状的缓解呈正相关
根据相关研究,Blautia属是产生短链脂肪酸的细菌。对粪便样本的代谢组学分析显示,经过6周利纳洛肽治疗的IBS-C患者粪便中乙酸(p < 0.01)、丙酸(p < 0.05)、丁酸(p < 0.01)和异丁酸(p < 0.05)的浓度显著增加(下图A)。
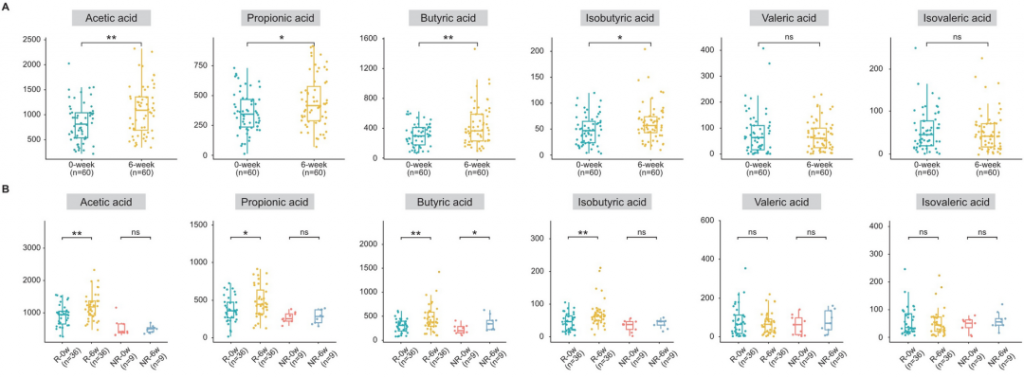
缓解组和未缓解组之间的比较显示,治疗后缓解组的乙酸(p < 0.0001)、丙酸(p < 0.0001)和异丁酸(p < 0.001)水平显著更高(上图B)。
随后进行了相关性分析,以探讨Blautia属的丰度、短链脂肪酸的含量和临床症状之间的关系。
Blautia属的丰度与乙酸、丙酸和丁酸的含量之间存在正相关关系。肠易激综合征生活质量量表分数的增加,肠易激综合征症状严重度评分,胃肠症状评分量表分数的减少与Blautia属的丰度呈正相关。
此外,肠易激综合征生活质量量表分数的增加,肠易激综合征症状严重度评分分数的减少与乙酸和丁酸的含量呈正相关(下图)。
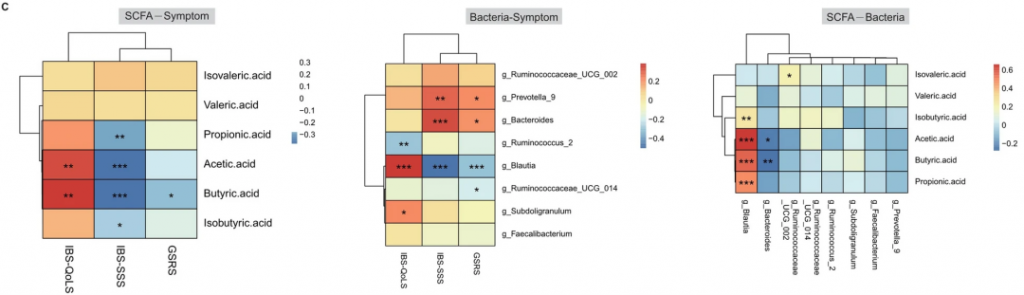
这些发现表明,Blautia属可能在利纳洛肽治疗的效果中扮演着关键角色。
利纳洛肽能够改善排便、缓解腹部症状,并在大多数IBS-C患者中改变排便习惯,而腹泻是一种常见的副作用。然而,结果显示治疗效果存在个体差异,这可能归因于病理生理学的多因素性质。肠道菌群失调已被认定为IBS-C患者中的一个重要致病因素。
越来越多的证据表明,IBS-C患者存在肠道微生态失衡。例如,IBS-C患者表现出更高的肠道微生物多样性,粪便产甲烷菌(主要是甲烷杆菌Methanobrevibacter )的相对丰度更高。
这种失衡可能涉及粪便在肠道中停留时间过长,这会改变肠道微生物和菌群代谢产物如短链脂肪酸、细菌的细胞成分(脂多糖)的数量和平衡,或影响细菌与宿主免疫系统之间的相互作用,所有这些都会影响各种肠道功能。
这里,研究人员对治疗前后6周收集的IBS-C患者粪便进行了16S测序。结果表明,利那洛肽会影响肠道菌群,即使在调整了年龄、饮食和其他因素后,IBS-C患者的Blautia和Fusicatenibacter的丰度也会增加。
最近的一项II期临床研究发现,MRx1234含有一种Blautia hydrogenotrophica菌株,可以改善IBS-C患者的腹痛评分,并显著改善其排便习惯。特别是,IBS-C患者的Blautia丰度低于健康志愿者,这表明Blautia有可能成为一种新的、安全的治疗选择。
作为厚壁菌门的一员,Blautia在缓解炎症和代谢疾病方面表现出了希望,因为它对特定微生物具有抗菌活性。Blautia在肠道中的组成和丰度受到各种因素的影响,包括饮食、年龄、健康、疾病状态、基因型、地理和生理条件。这些发现与本研究中获得的实验结果一致。
在我们前面的文章中,也强调了肠道微生物群和各种临床药物之间复杂的双向相互作用。肠道微生物组会受到药物的影响,反之亦然,肠道微生物组可以通过影响药物结构和改变其生物利用度、生物活性或毒性来影响药物的治疗效果(药物微生物学)。详见:
为什么药物对人效果不一?探索药物-微生物群相互作用对效果的影响
在这项研究中,研究人员还发现缓解组的Blautia丰度显著增加,而非缓解组的则没有,这表明利那洛肽可能会调节Blautia的丰度,作为其作用机制的一部分。
先前的研究已经阐明了Blautia作为一种共生厌氧细菌的作用,它有助于维持肠道环境平衡,预防炎症,增加肠道调节性T细胞,并产生短链脂肪酸。
关于Blautia属详见:
IBS-C患者的总短链脂肪酸浓度低于健康个体,主要是由于乙酸和丙酸水平降低。此外,短链脂肪酸的水平与IBS患者粪便的粘度有关。如果IBS-C患者(其主要临床表现为便秘)的粪便质地干燥,相应的短链脂肪酸含量也会降低。
在这项研究中,症状改善、Blautia丰度和短链脂肪酸浓度之间呈正相关,表明利那洛肽的治疗效果可能涉及通过调节肠道菌群,特别是通过增加Blautia的丰度来增加短链脂肪酸浓度。这些结果表明,肠道微生物群及其代谢产物可能有助于利那洛肽的治疗及其治疗效果。
这项研究有局限性,它不是一项随机、对照、双盲的临床研究,样本量也不够大。其次,明确报告了IBS的性别差异,大多数IBS-C患者为女性。尽管患者的性别分布显示了上述现象,并且研究人员进行了一项自我控制的前后研究以排除性别干扰因素,但无法获得利那洛肽治疗中性别差异的有效结果。
研究表明,肠道微生物群是必要的,而且足以在临床环境中介导利那洛肽的作用。利那洛肽的功效与Blautia丰度和短链脂肪酸浓度的调节有关。治疗后Blautia的丰度可用于预测利那洛肽的疗效。利那洛肽补充Blautia治疗可能是提高IBS-C临床治疗总体疗效的一种潜在方法。

谷禾健康

腹泻是常见的健康问题,相信绝大多数人在生活中都曾遭受过腹泻的困扰。
根据2016年柳叶刀期刊统计,慢性腹泻影响全世界 3%-20% 的成年人。全球每年有17亿儿童腹泻病例,腹泻是五岁以下儿童死亡的第五大原因,每年约有52.5万儿童死亡。儿童时期腹泻还可能与营养不良相关,甚至对健康带来终生影响(后面文中会提到)。

全球对所有腹泻原因中特定类型细菌性腹泻患病率的估计包括大肠杆菌10%-25%、志贺氏菌10%、沙门氏菌3%、弯曲杆菌3%-6%。
我国是15个腹泻高发国家之一。十年纵向监测研究显示,主要病毒病原体来自A型轮状病毒和诺如病毒,主要的细菌病原体来自腹泻性大肠杆菌、非伤寒沙门氏菌。
腹泻的种类多、原因复杂,有病原体感染引起的急性腹泻,也有胃肠道疾病、神经系统疾病、食物过敏等伴随的慢性腹泻。
在腹泻期间肠道环境的短暂氧化,专性厌氧肠道菌群急剧消失,肠道菌群可能出现短暂失调。实际上,每次腹泻对肠道引起的波动不容小觑,人体内的肠道菌群相当于“历了个劫”。
DOI: 10.1016/bs.pmbts.2022.08.002
针对腹泻问题的处理,一般人可能认为偶尔腹泻一两天就过去了没什么,甚至有人还觉得拉肚子有助于减肥…
实际上如果不引起重视没有及时干预,或者说身体免疫系统没有将病原体彻底清除,一些病原体残留在体内,可能引起多次腹泻,反复多次后可能逐渐形成慢性腹泻,甚至悄悄延伸到其他慢性疾病。
我们也有时候会看到这样的现象:
– 有些人在腹泻后疲倦了好一阵恢复不过来…
– 在几次腹泻的一段时间后,突然对某些食物开始过敏了…
– 甚至某一天不明所以地出现了自身免疫疾病…
– 也有人在腹泻后突然爆发了一些大面积的皮肤状况…
本文我们就来详细了解一下关于腹泻的病因,腹泻后的肠道菌群有哪些变化,这些变化会不会与其他疾病相关,在与腹泻相关的疾病中肠道微生物群发挥的作用,以及实际应用中的干预措施。

腹泻一般会出现以下症状:
可能还会伴随着:
腹泻可能引起脱水,如果不及时治疗,有可能危及生命。脱水对儿童、老年人和免疫系统功能低下者来说尤其危险。
成人脱水症状:
婴幼儿脱水症状:
★ 感染
感染可能是由于食用了被某种致病菌污染的食物,或饮用受污染的水,其中可能含有细菌、寄生虫等。
常见的感染有:细菌、病毒、真菌、寄生虫等。
★ 旅行者腹泻
旅行者腹泻是由食用被细菌、病毒或寄生虫污染的食物或饮用水引起的。旅行者腹泻最常见的是急性腹泻。然而,一些寄生虫会引起持续时间更长的腹泻。
部分地方可能很难将废水和污水与烹饪、饮用和洗澡的水分开,就比较容易出现腹泻。
★ 药物
许多药物都可能引起腹泻,包括抗生素、抗酸剂(含镁)、口服糖尿病药物、抗癌药物、降胆固醇药、秋水仙碱等。
★ 食物问题
食物过敏:对牛奶、大豆、谷物、鸡蛋、海鲜等食物过敏可能会导致慢性腹泻。
乳糖不耐受:很多人有这个问题。乳糖是存在于奶类和其他乳制品中的一种糖。有乳糖消化障碍的人在食用奶制品后会出现腹泻。
有些人小时候喝牛奶没事,长大后慢慢出现腹泻的情况了。由于人体内帮助消化代谢乳糖的酶会随着年龄的增长有所减少,乳糖不耐受症的情况也会随着年龄的增长而增多。
其他比如说果糖,天然存在于水果和蜂蜜中,有时,也作为甜味剂添加到一些饮料中。对于有果糖消化障碍的人来说,果糖可引起腹泻。
有些人可能吃含糖、辛辣、高脂肪或油炸食品,也会腹泻。食物中成分刺激胃黏膜和肠道,引起胃肠道炎症和蠕动加快,从而导致腹泻。
★ 慢性疾病
★ 手术
许多人在腹部手术后可能会出现腹泻。腹部手术包括对阑尾、胆囊、大肠、肝脏、胰腺、小肠、脾脏或胃的手术。消化道可能需要一段时间才能恢复从吃的食物中正常吸收营养。
关于围手术期相关知识详见我们之前的文章:
★ 营养不良
腹泻是五岁以下儿童营养不良的主要原因。每一次腹泻都会使他们的营养不良更加严重。
对于大多数感染来说,营养不良和腹泻之间的相互作用是双向的。也就是说,营养状态改变宿主对感染的反应,营养不良会导致对肠道病原体的抵抗力下降,增加腹泻的风险;而反复腹泻则会改变营养状态。当感染频繁时,尤其是复发性腹泻病,宿主营养状况也在相应变化且逐渐恶化,导致营养不良,免疫力下降,发育矮小。
关于儿童营养不良我们之前的文章写过,详见:全球队列显示儿童营养不良关键在肠道菌群
▸ 急性腹泻
持续一到两天的稀稀水样腹泻。这是最常见的类型,通常无需治疗,在几天内自行消失。
大多数急性腹泻病例都有感染性病因。
急性腹泻有没有可能发展为其他疾病?
急性感染性腹泻会导致原有的肠道微生态失调恶化,如果这种情况发生在儿童身上,从长远来看,粘膜免疫系统的发育和成熟以及肠道屏障的完整性可能会受到影响,使儿童更有可能因肠漏而患上自身免疫性疾病。(我们在后面会详细讲到)。
▸ 持续性腹泻
持续约两到四个星期的腹泻。
▸ 慢性腹泻
持续超过四个星期或在很长一段时间内有规律地发作和发作。
慢性腹泻通常是腹腔疾病、慢性胰腺炎、病理性胆汁吸收、慢性炎症性疾病的症状,或是药物、进食、肠道手术、放疗的副作用。慢性腹泻也可能继发于肠易激综合征,其特征是与腹痛相关的排便习惯改变(腹泻和/或便秘)。
功能性腹泻是一种特殊类型的慢性腹泻,根据Roma IV临床标准定义为腹泻性大便,发生时间超过25%,在诊断前3至6个月的时间范围内,肠壁没有任何结构异常。
全球每年有17亿儿童腹泻病例,腹泻是五岁以下儿童死亡的第二大原因,每年约有52.5万儿童死亡。
慢性腹泻影响全世界 3%-20% 的成年人。
全球对所有腹泻原因中特定类型细菌性腹泻患病率的估计包括大肠杆菌10%-25%、志贺氏菌10%、沙门氏菌3%、弯曲杆菌3%-6%。
美国细菌性腹泻约占所有腹泻的31%。 导致食源性腹泻的细菌病原体比例为:沙门氏菌15.4%,弯曲杆菌11.8%,志贺菌4.6%,产志贺毒素的大肠杆菌(STEC)约3%。
我国是15个腹泻高发国家之一。以下是一项对我国长达十年(2009-2018年)的纵向监测研究。

▸在患者中检测到的两种主要病毒病原体:
其次是腺病毒和星状病毒。
▸两种主要的细菌病原体:
其次是志贺氏菌和副溶血性弧菌。
▸年龄对病原体检测的影响:
以上我们了解了关于腹泻的一些基本信息,腹泻作为一种常见的消化系统症状,与肠道微生物群的平衡之间有什么关联呢?下一章节我们详细了解一下。
这里我们从两个方面来了解:
下面要介绍的菌群,如果在肠道菌群检测报告中发现超出正常范围,那么腹泻的发生与这些菌群密切相关,在食物卫生方面需要格外留意。
■气单胞菌属 (Aeromonas)
气单胞菌属细菌更常见于海鲜、肉类,有时也存在于蔬菜中。症状往往在食用受污染食品后不久出现,可以持续几天到2周。除了腹泻,一般没有腹痛,呕吐和发烧可能存在,也可能不存在。
■ 蜡样芽孢杆菌(Bacillus cereus)
“炒饭综合征”,即蜡样芽孢杆菌引起的食源性疾病,具有明显的季节性,多发生在6月到10月;蜡样芽孢杆菌污染的食品,外观一般无明显变化,看不到腐败变质现象。潜伏期在1至16小时之间,在这段时间之后,症状才会变得明显,总体短暂仅持续约1至2天。除了大量腹泻,还有呕吐和腹痛。发烧通常不会发生在由蜡样芽孢杆菌引起的细菌性肠胃炎中。
■ 弯曲菌属(Campylobacter)
弯曲菌常见于乳制品、不同肉类和家禽中。潜伏期为2至4天,之后出现症状。整个病程在5至7天之间。呕吐通常不会发生。不过,腹泻时伴有发热、腹痛。
■ 梭菌属(Clostridium)
通常与食源性感染相关的是艰难梭菌和产气荚膜梭菌。
艰难梭菌感染的潜伏期是可变的。艰难梭菌引起的腹泻症状通常在用抗生素后 5-10 天开始,但也可能在第一天或长达 2个月后出现;艰难梭菌的病程也有很大差异。
艰难梭菌轻中度感染症状:
严重感染时通常会脱水,需要住院治疗。
(关于艰难梭菌感染我们在后面还会详细讲)
产气荚膜梭菌感染的潜伏期通常不超过1天,可以短至几个小时,病程大概仅持续约1天。呕吐一般较轻,通常不发烧,但腹泻时确实会出现腹痛。
■大肠杆菌(E.coli)
虽然我们说大肠杆菌自然存在于人类的肠道中,但一些菌株可能会导致严重的疾病。
不同的腹泻大肠杆菌菌株表现出不同的流行病学,并分为肠致病性大肠杆菌(EPEC,婴儿腹泻的主要原因)、肠出血性大肠杆菌,根据病理类型、定植部位、毒力机制和临床症状,可分为肠毒素性大肠杆菌(ETEC,旅行者腹泻和婴儿腹泻的主要原因)和肠侵袭性大肠杆菌。
在食品中,它通常来源于碎牛肉,但也可能在蔬菜中找到,尤其是当灌溉水被人或动物粪便污染时。肠出血性大肠杆菌潜伏期为1至8天,通常持续约3至6天。
通常不呕吐,可能发烧,也可能不发烧,但腹痛伴有腹泻。产肠毒素大肠杆菌的潜伏期为1至3天,疾病持续约3至5天。低烧伴呕吐、腹痛、腹泻。
■ 李斯特菌属(Listeria)
李斯特菌属细菌常见于牛奶和乳制品中。潜伏期约1天,期间无症状。这种疾病往往会持续3天左右。有些人确实会呕吐,但通常并不常见。出现发烧,腹痛可能也可能不会与腹泻同时发生。
■ 邻单胞菌属(Plesiomonas)
邻单胞菌更常见于海鲜中,食用受污染的牡蛎后容易感染。这种疾病往往在食用受污染的食物后很短一段时间内开始,并可持续2周。除腹泻外,呕吐、发热和腹痛等其他症状可能存在,也可能不存在。
■沙门氏菌属(Salmonella)
沙门氏菌是一种革兰氏阴性兼性厌氧细菌,存在于许多不同的食品中,包括乳制品、鸡蛋、肉类、豆芽、黄瓜等。潜伏期可以是几小时到3天。这种被称为沙门氏菌病的疾病可以持续约2至7天。除了腹泻(水样腹泻),还有呕吐、发烧、腹痛、胃痉挛。粪便颜色可能出现绿色。
大多数沙门氏菌引起的腹泻患者可以完全康复。一些沙门氏菌感染者在感染结束后会出现关节疼痛,称为反应性关节炎。一些患有反应性关节炎的人在排尿时会出现眼睛刺激和疼痛。
■志贺氏菌属(Shigella)
志贺氏菌一般分四类:
志贺菌属引起志贺菌病,这是常见的细菌性痢疾类型之一。痢疾志贺氏菌产生志贺毒素,引起细菌性痢疾。宋内氏志贺氏菌毒性不如其他志贺氏菌,但容易暴发和流行。
如果由患病且不保持良好卫生的人处理,任何食品中都会发现这种病毒。用受污染的水烹制的生鲜食品或用受污水污染的水灌溉的蔬菜也可能是一个问题。
潜伏期最长可达2天。志贺菌病通常持续2至7天。表现为高烧、腹痛伴腹泻,即使肠子空了也感觉还需要排便。呕吐通常不会发生。5 岁以下的儿童最容易患志贺氏菌病,但所有年龄段的人都可能患上这种疾病。志贺氏菌感染中约有 5% 具有广泛耐药性。
志贺氏菌等感染后伴随发烧症状,可能是一些人群的肠道屏障薄弱,致病菌就容易进入到血液,引起发烧。大多数志贺氏菌感染是自限性的。
■葡萄球菌属(Staphylococcus)
食品中的葡萄球菌可能存在于乳制品和肉类中。它也可能出现在蛋黄酱等食品中。潜伏期很短,约2至6小时。这种疾病是短暂的,持续时间仅为1天左右。通常不会发烧。出现呕吐、腹痛和腹泻。
■ 弧菌属(Vibrio)
弧菌属细菌通常存在于牡蛎等海鲜中。较为知名的弧菌种类是霍乱弧菌,它是霍乱的病因。它通常通过受污染的水传播。弧菌感染的潜伏期非常短,最多1天左右。这种病最长可以持续5年。
■ 小肠结肠炎耶尔森菌(Yersinia enterocolitica)
小肠结肠炎耶尔森菌通过未充分煮熟的猪肉传播给人类。它也可能通过受污染的水传播。潜伏期可以持续数小时到6天不等。这种疾病最短可持续1天,最长可达45天。通常症状包括发烧、呕吐、腹痛伴腹泻。
如果在这种急性腹泻的时候进行肠道菌群检测,可以对应相关症状,辅助判别引起本次腹泻的病原菌。如果某些菌群超标,则与腹泻相关。
谷禾长期的肠道菌群检测实践发现,很多的健康人或者是说非腹泻人群的肠道菌群检测报告中,也可能会携带以上这些菌群,这是为什么呢?
有些致病菌可能是一过性的,最近旅行,或者吃的不干净的食物中把这些菌带进去了,但是它在健康的肠道中没有定植成功,又从粪便排出体外,因此肠道菌群检测就检出了这些菌。
致病菌也可能悄悄潜伏在身体内,正常情况下没有反应,但当有时候没睡好太累了免疫力低下的时候,或者其他病理炎症感染的时候,或者服用抗生素之后正常菌群一定程度存在失调,这些致病菌趁虚而入,定植成功,就到了它们发挥作用的时候,腹泻也就随之而来。
以上所提及的菌群与腹泻有直接联系,那么在腹泻期间,整体肠道菌群是否会受到影响呢?
一些菌群的变化是否与细菌性感染或病毒性感染相关呢?
我们接着看。
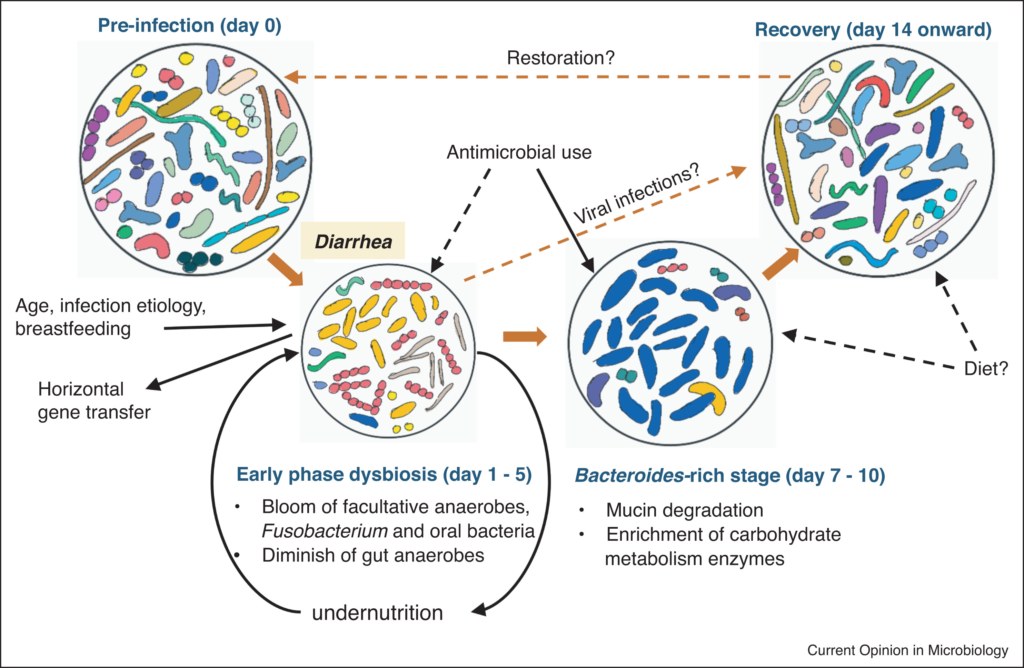
腹泻早期肠道菌群失调
这里将疾病的早期定义为腹泻症状没有消退的时期,通常是在疾病发作或出现在医院后的前三到五天内。
与年龄、位置匹配的健康个体相比,腹泻导致分类丰富度和多样性显著降低。重复冲洗可能会极大地侵蚀微生物群,腹泻粪便中较高的含水量(较低的排便时间)与较低的α多样性有关。
腹泻发作后,兼性厌氧菌的增殖
腹泻发作后,肠道微生物组发生了显著的分类变化,有利于快速生长的兼性厌氧菌的增殖。变形杆菌(主要是肠杆菌科/大肠杆菌)和链球菌(主要是唾液链球菌和Streptococcus gallolyticus)在早期阶段富集最为显著,在粪便微生物群中的相对丰度可能高达80%。
肠道短暂氧化,专性厌氧肠道共生菌的急剧消失
腹泻期间肠道环境的短暂氧化,促进了这些细菌的繁殖,编码低亲和力细胞色素氧化酶的基因相应升高证明了这一点。这种丰度的增加伴随着专性厌氧肠道共生菌的急剧消失(Blautia、Prevotella、Faecalibacterium、Lachnospiraceae、Ruminococceae等),导致相关代谢产物如短链脂肪酸耗竭。
然而,腹泻细菌通常是短暂的和/或低丰度的(第一天的霍乱弧菌除外)。
并不是在所有腹泻患者中都发生菌群失调
部分感染患者的粪便微生物群与健康对照组的粪便微生物组非常相似。特别是,腹泻儿童的肠道微生物组可以分为四种肠道类型,每种类型都以一个分类单元为主:双歧杆菌、拟杆菌、链球菌或大肠杆菌。
目前尚不清楚这些不同的初始配置如何影响临床结果和恢复,但链球菌的相对丰度较高与住院时间或腹泻持续时间呈正相关。
感染性腹泻下的肠道微生物组演替
doi: 10.1016/j.mib.2022.01.006
F. mortiferum过多可能是肠道失调的一般标志
除了埃希氏菌和链球菌,腹泻粪便微生物群中也发现了其他细菌过多,即使在整个肠道微生态没有失调的情况下也是如此。
在越南的研究强调,其中包括 Fusobacterium mortiferum,以及人类口腔微生物群的几个菌(Granulicatella、Gemella、放线菌、Rothia、具核梭杆菌等)。
厌氧F. mortiferum通常在中国人的胃肠道定植(虽然丰度较低),但在西方人群中没有定植,最近在大肠息肉患者中注意到其增殖。
这些结果表明,F. mortiferum过多可能是肠道失调的一般标志,尤其是在亚洲人群中。
口腔细菌与腹泻肠道微生物群的紧密联系
计算分析表明,根据分类群共丰度模式推断,口腔细菌可能在腹泻肠道微生物群中形成紧密的相关网络。这表明它们可能共存于多微生物生物膜中,与口腔中存在的类似,但它们在腹泻病中的意义目前尚未研究。
对健康个体来说,微生物在口腔-肠道轴上的移位是频繁发生的,而腹泻所产生的生态贫瘠环境可能是这些口腔菌群临时定居的理想条件。
不同腹泻病因的菌群存在一些细微的差异
虽然整体的生态失调模式与不同的腹泻病因无关,但存在一些细微的差异。
这可能表明,病毒感染导致厌氧肠道共生菌减少的程度较低,可能是因为大多数病毒(轮状病毒、诺如病毒)感染的是小肠内壁的细胞,而不是结肠。在小鼠模型中,轮状病毒感染仅在回肠微生物群中导致拟杆菌和阿克曼菌群(均具有粘蛋白降解能力)增加,但这两个分类群在人类轮状病毒感染中过度生长的证据尚不确定。
另一方面,贾第虫引起的腹泻,始终与γ变形菌减少和普雷沃氏菌属富集有关。
痢疾(粘液性/血性腹泻)是一种严重的感染性腹泻,肠道炎症加剧,需要抗菌治疗和更长的住院时间。痢疾腹泻中存在过多的兼性厌氧菌(大肠杆菌、链球菌、肠球菌等),同时具有免疫调节作用的细菌(Lactobacillus ruminis, Bifidobacterium pseudocatenulatum)减少。
这些发现表明,细菌感染和痢疾通常伴随着与健康状况进一步不同的失调状态,这可能是病原体引发的炎症和/或频繁使用抗菌药物的影响。
腹泻后恢复阶段
腹泻后恢复期患者的肠道菌群与疾病早期不同,并向健康人群的肠道菌群趋同。恢复阶段标志着肠道微生物群的分类丰富度和多样性逐渐增加,但微生物群落演替在感染个体中显示出较高的时间变异性。
中期:拟杆菌↑↑,晚期:普雷沃氏菌属,产短链脂肪酸菌↑↑
通过对感染了霍乱弧菌和产肠毒素大肠杆菌的孟加拉国患者的研究,研究人员提出了肠道菌群恢复的逐步(中晚期)演替模型。大肠杆菌/链球菌的扩张最终耗尽肠道环境中的氧气,导致其种群在恢复阶段下降。
中期的特征是拟杆菌数量相当丰富(最早出现在发病后的第7天),而晚期则含有更丰富、更多样的普雷沃氏菌属和产短链脂肪酸的厚壁菌。碳水化合物代谢基因(主要为拟杆菌属)在中期富集最显著,使这些细菌能够灵活地从饮食来源和宿主来源的碳水化合物(分别富含纤维和粘蛋白)中提取能量。
这种按时间顺序排列的微生物组合,类似于服用抗生素后肠道微生物组恢复的情况。大量研究指出,经过抗生素治疗后,拟杆菌大量增殖,而厚壁菌和放线菌则减少了。
拟杆菌成为结肠生态恢复的关键物种
类似地,等渗性腹泻诱发短暂的肠道扰动,冲洗后立即出现明显的拟杆菌繁殖。拟杆菌属,如单形拟杆菌(Bacteroides uniformis),多形拟杆菌(Bacteroides thetaiotaomicron),因其粘蛋白降解能力被确定为初级恢复相关类群。通过利用宿主衍生的营养物质,拟杆菌成为结肠生态恢复的关键物种。
这随后启动了一个复杂的交叉喂食网络,以加快其他厌氧菌和产短链脂肪酸的菌(双歧杆菌、玫瑰杆菌、粪便杆菌等)的重新繁殖,从而建立一个分类学和功能多样性的群落。
患者恢复的微生物群是否恢复到感染前状态?
由于缺乏腹泻队列研究,此类数据有限。一项弯曲杆菌人类挑战研究结果表明,在比较恢复期和感染前的微生物组,显著的成分差异仍然存在,恢复期拟杆菌的丰度归因于抗菌药物的使用。
相比之下,在病毒性肠胃炎的康复过程中,拟杆菌富集期的存在并不突出,这可能是由于其不太严重的失调状态和很少使用抗菌药物。
儿童腹泻带来的长期影响
虽然腹泻大多是急性的,但反复腹泻可能会对儿童健康产生终身影响。长期以来,研究表明,腹泻和营养不良相互影响,使儿童在成年后容易发育迟缓、认知障碍和葡萄糖不耐受。
腹泻→多样性↓↓,与发育迟缓相关
秘鲁儿童的纵向微生物组跟踪表明,腹泻频率的增加,大大降低了肠道微生物组的多样性和丰富度,而发育迟缓儿童的这种影响更为严重。发育迟缓还与微生物群恢复速度较慢有关,而长期的扰动反过来又降低了对随后肠道感染的适应能力,形成了腹泻和营养不良的恶性循环。
口腔菌群→肠道定植,可能引发炎症
非洲发育迟缓的儿童的小肠和结肠中口腔细菌过度生长,口腔细菌占优势,如唾液乳杆菌和链球菌。研究人员推测,反复腹泻增加了移位口腔细菌适应紊乱肠道环境的机会,口腔菌群稳定定植可能会引发炎症并改变微生物组的功能。
无症状携带的肠道病原体也会重塑肠道微生物组
感染弯曲杆菌、诺如病毒或肠聚集性大肠杆菌的儿童具有显著更高丰度的Ruminococcus gnavus,它与克罗恩病密切相关,并产生促炎多糖。与腹泻类似,弯曲杆菌的无症状感染与发育迟缓有关,突出了菌群失调在腹泻之外的重要性。
腹泻:耐药基因水平转移,促进新的耐药性表型
肠杆菌科在腹泻早期的扩张,大大增加了它与攻击性病原体的接触,从而增加了水平基因转移的可能性。实验模型已经证实,由于结肠炎诱导的肠杆菌科细菌增多,质粒很容易从沙门氏菌转移到大肠杆菌。
越南的研究发现,共生大肠杆菌和致病性Shigella sonnei中存在相同的多药耐药质粒,这两种质粒都是从一名腹泻儿童身上分离出来的。这表明,一旦病原体进入肠道感染发生率和抗菌药物使用率高的环境,肠道的肠杆菌科可以成为促进新的多药耐药性表型出现的有效宿主。
腹泻后的肠道微生态失调是短暂且可逆的,但其负面影响在脆弱人群中会被放大。
以上是关于感染性腹泻与肠道菌群之间的关联,实际上研究表明,肠道菌群的失调与慢性腹泻之间也存在密切的联系。接下来,我们从具体疾病中一一来看它们之间的关联机制。
腹泻可能是许多疾病的症状。这里我们介绍一些常见的与肠道菌群相关的包括腹泻症状的疾病,例如肠易激综合征、胆汁酸腹泻、乳糜泻、炎症性肠病、抗生素治疗腹泻、放射性腹泻、酮症腹泻等。
IBS的特征是慢性腹痛或不适以及排便习惯改变,其诊断是根据罗马 IV 标准在临床上确定的,该标准将 IBS 定义为过去三个月内平均每周至少一天发生的复发性腹痛,涉及以下两种或多种相关症状:排便、大便频率的变化或大便外观的变化。
IBS的亚类包括:
什么人群更易出现IBS?
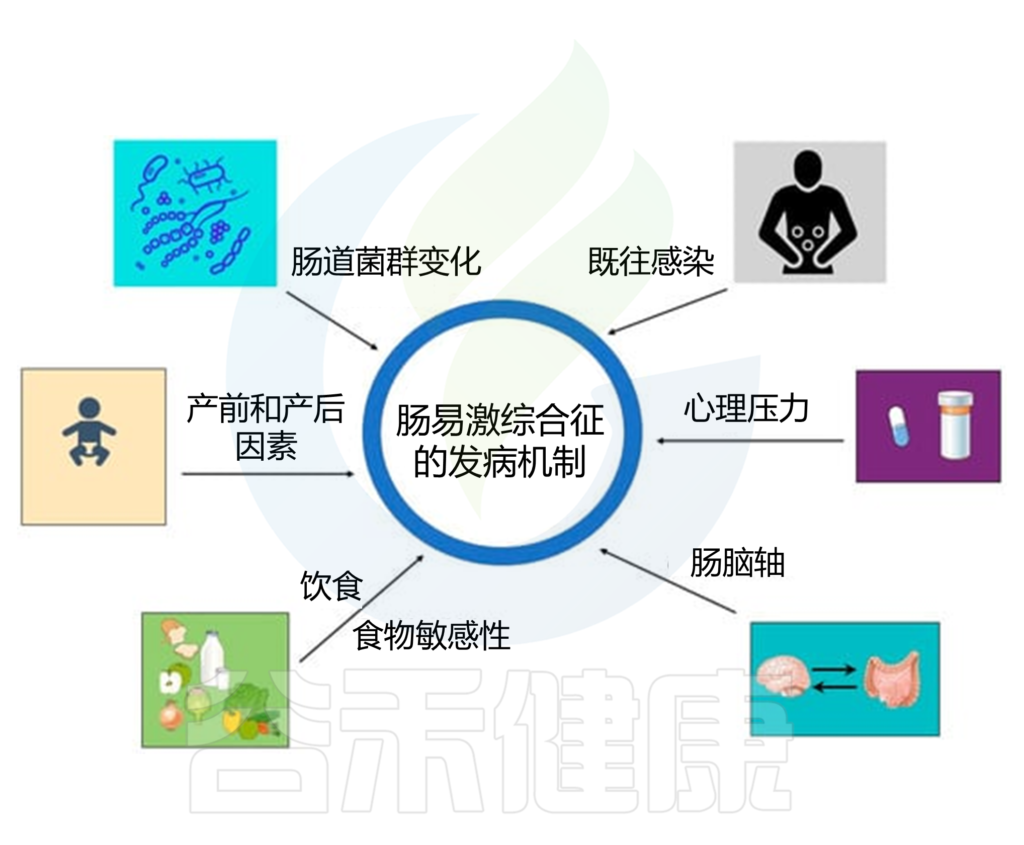
IBS的多种病理生理机制
如运动能力改变、屏障功能受损、免疫激活、内脏过敏和中枢神经系统异常,并可能与个人和环境风险因素有关,包括遗传易感性、压力、抗生素使用、肠道感染、心理困扰、饮食等。
doi.org/10.3390/jcm12072558
脑-肠轴的失调会改变胃肠道系统的运动、感觉、自主和分泌功能,进而改变肠道蠕动、肠道通透性、内脏敏感性和肠道微生物群组成,所有这些都与 IBS 的发病机制有关。
关于内脏敏感详见我们之前的文章:
腹胀、腹痛、肠胃不明原因疼痛?–可能是内脏高敏感,详细了解内脏高敏的原因后果
IBS 中常见的肠道蠕动变化是由血清素代谢改变介导的。肠神经系统的肠嗜铬细胞释放血清素,刺激肠道蠕动并调节分泌和血管舒张功能。肠神经系统失调可导致血清素分泌增加或减少,分别表现为腹泻或便秘。
IBS的肠道菌群变化
IBS-D 的特点是粪便微生物群的微生物多样性总体下降,厚壁菌门显著减少,拟杆菌门增加。

多种类型IBS的菌群变化:
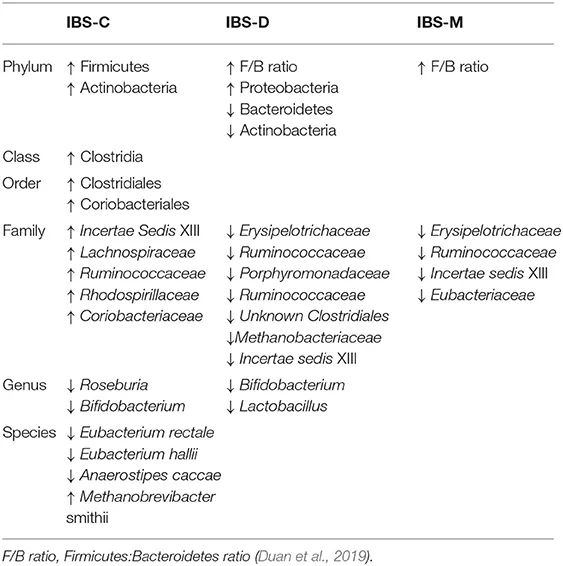
低度炎症和免疫功能障碍在 IBS 中发挥作用
研究发现 IBS 患者的促炎细胞因子水平升高,部分原因可能是压力所致。
10%的IBS病例是在最近患有胃肠道疾病的情况下感染后发生的,这通常会导致粘膜和全身炎症。
IBS症状与心理、生理和神经胃肠道因素有关
肠道微生物组的改变也会导致一些炎症和免疫学变化,这些变化可能会通过增加肠道通透性来损害胃肠粘膜屏障。这反过来可能会干扰胃肠道稳态,并使脑-肠伤害感受通路失调,导致内脏过敏或胃肠道疼痛感增强。
IBS相关干预措施
IBS患者饮食方面要注意,豆类、含乳糖食品和人工甜味剂中存在的可发酵低聚糖、单糖、二糖和多元醇 (FODMAP) 由于其发酵和渗透作用,可能会加剧部分患者的症状。
注:FODMAP 在小肠中吸收不良,导致大结肠中的水分吸收增加和发酵产生气体,这可能会导致与 IBS 相关的几种症状,包括腹痛和腹胀。摄入 FODMAP 的渗透效应也可能导致胃肠道系统扩张,并在肠道蠕动异常中发挥作用。
消除 FODMAP饮食 可以改善 IBS 整体症状,消除饮食涉及短时间(即几天到几周)而不是永久地禁食各种食物。
IBS基于病理生理学的分类和治疗建议

四分之一的 IBS-D 患者实际上患有特发性胆汁酸腹泻,接下来我们来看看胆汁酸腹泻。
胆汁酸腹泻
胆汁酸腹泻(BAD)是一种常见的疾病,其起因是原发性胆汁酸流失增加,并可导致微生物群变化,同时与腹泻型肠易激综合征(IBS-D)有重叠之处。
胆汁酸腹泻患者报告的最常见症状是爆发性腹泻、难闻的气味或水样腹泻(80%)、尿急 (85%) 以及腹胀或肿胀 (54%)。
实际上,25-33%的慢性腹泻患者患有原发性胆汁酸腹泻。继发性胆汁酸腹泻继发于终末期回肠切除或发生在克罗恩病或放射线后。
胆汁酸腹泻是怎么回事?
胆汁酸由肝脏产生并储存在胆囊中。吃脂肪食物时,胆汁酸会释放到小肠中分解脂肪,之后胆汁酸被重新吸收并送回肝脏重新利用。通常,只有很少的胆汁酸最终进入大肠。
胆汁酸的正常肝肠循环
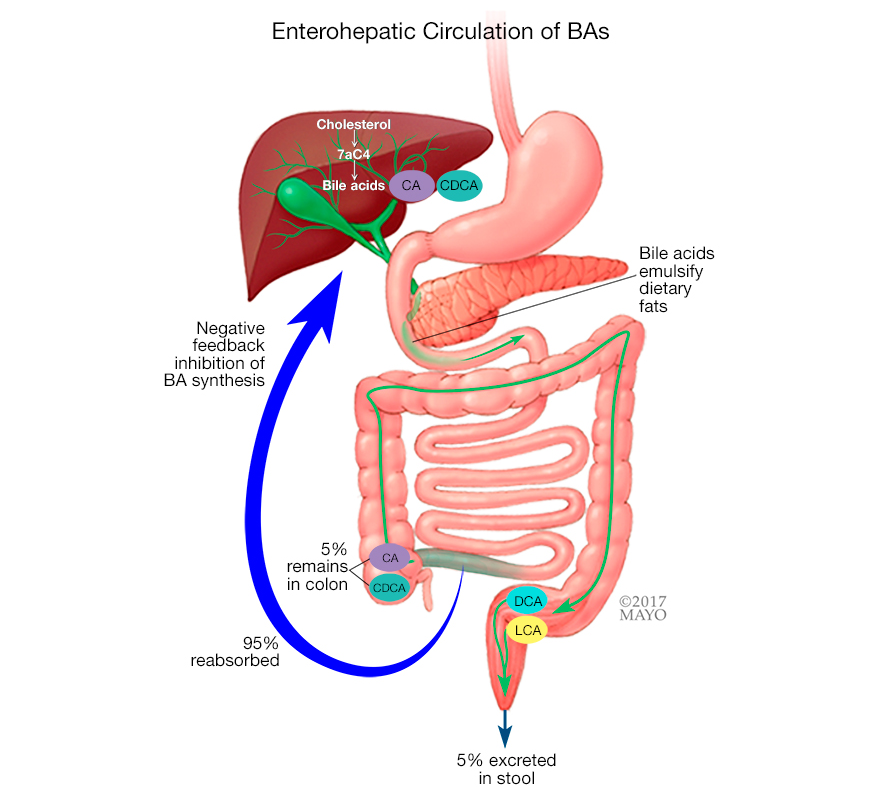
对于 BAD 患者,大量胆汁酸会被冲入大肠。这会导致肠道内液体增加。液体通过肠道的运动速度加快,结果是水样大便。
胆汁酸合成由与肠肝循环相关的负反馈回路调节,该负反馈回路依赖于法尼素X受体和成纤维细胞生长因子。这些反馈回路的中断会导致胆汁酸的过量产生,从而导致胆汁酸腹泻。
低脂饮食可能有助于改善与胆汁酸腹泻相关的症状。
与肠道菌群有什么关联?
由于电解质失衡,胆汁酸的吸收不良或过量产生会导致肠道菌群失调和腹泻。
肠道菌群负责初级胆汁酸的去结合、脱氢、7α脱氢和差向异构化,在胃肠腔产生次级胆汁酸,并介导胆汁酸合成的反馈控制。肠道菌群是胆汁酸的主要调节者,反过来又调节微生物群的组成和丰富度及其特征。
在一组胆汁酸排泄过多的IBS-D患者(BA+IBS-D)中,一种以胆汁酸转化梭菌物种富集为特征的特定肠道菌群能够增强胆汁酸总排泄量,这与粪便胆汁酸和血清7-羟-4-胆甾酮(C4)水平较高有关。
另一项最新研究显示,BAD患者粪便细菌多样性降低,其他菌群变化如下:
BAD患者的初级粪便胆汁酸比例也较高,可能是由于肠道微生物群中双歧杆菌和Leptum减少,大肠杆菌增加所致。这可能会改变胆汁酸对FXR和TGR5的亲和力,从而导致FXR活性降低,胆汁酸向结肠的输送增加。
另有研究表明,双歧杆菌丰度增加的同时,次级粪便胆汁酸减少,从而导致乙酸盐和丙酸盐水平升高。
乳糜泻 (CD) 是一种常见的全身性疾病,是由于人体免疫力对麸质摄入的异常反应而导致的。
注:麸质是一种存在于小麦、大麦、黑麦等谷物中的蛋白质,可溶于酒精。
乳糜泻的发病机制涉及遗传和环境因素的复杂相互作用。肠道微生物群在乳糜泻的发病机制中发挥着复杂的作用。
与乳糜泻相关的微生物群的变化
包括有益菌丰度降低,特别是以其抗炎和免疫调节特性而闻名的双歧杆菌。
还有乳杆菌通过多种机制,包括分泌抗炎细胞因子和改变Th1免疫反应。
某些细菌的过度生长与肠道通透性增加有关,这是乳糜泻的一个标志。具体来说:
肠道微生物群导致乳糜泻的可能发病机制
这里从环境因素的作用、微生物群本身的作用、遗传学因素、围产期因素等几个方面来说。
环境因素的作用:
一种假设是,一些肠道细菌表达模仿麦醇溶蛋白(麸质的一种成分)的表位,可以引发宿主免疫反应。这种反应导致免疫系统激活并产生攻击肠道内壁的抗体。
另一个假设与脂多糖有关,脂多糖是革兰氏阴性细菌外膜中发现的分子。脂多糖可以通过产生IL-15在先天性和适应性免疫系统中发挥相关作用,IL-15可以引发肠道炎症。
一些细菌,例如铜绿假单胞菌,与麸质结合可导致粘膜炎症加剧。这两个因素的结合可能会导致肠道内壁进一步受损,并加剧乳糜泻症状。
最后,病毒感染也可以触发先天免疫系统的激活。具体来说,TLR3是一种可以识别病毒感染并做出反应的受体,导致先天免疫系统激活和肠道炎症。
微生物群本身的作用:
– 通过产生特异性免疫原性或耐受性面筋肽
– 释放影响肠道通透性的连蛋白(zonulin)
– 通过促进上皮粘膜成熟,改变麸质的消化,从而促进乳糜泻发病
– 肠道菌群产生的促炎或抗炎肽和细胞因子也可能通过调节免疫系统发挥作用
微生物群代谢产物的作用:
肠道细菌还可以通过释放短链脂肪酸来调节,具体来说,短链脂肪酸通过促进紧密连接形成、抑制促炎细胞因子的产生以及促进调节性T细胞分化,参与维持肠上皮屏障的完整性。通过这种方式,肠道细菌及其产物的平衡可能会影响宿主对包括麸质在内的膳食抗原的耐受能力,可能导致乳糜泻的发生。
遗传学的作用:
– 乳糜泻家族风险婴儿的基因型(携带HLA-DQ2单倍型的),影响早期肠道菌群的组成
– 有乳糜泻遗传易感性的婴儿肠道菌群组成不同(即拟杆菌比例)
– 出生后前6个月微生物群变化增加了包括乳糜泻在内的自身免疫性疾病的发病风险
患有乳糜泻一级亲属的婴儿的大规模前瞻性出生队列研究,在引入食物(包括麸质)之前,4-6个月大的婴儿中几种链球菌和粪球菌的丰度减少与患乳糜泻的遗传风险有关。发生乳糜泻的标准遗传风险和高遗传风险与拟杆菌和肠球菌种类增加有关。出生后4-6个月时,下列菌群丰度下降:
围产期因素的作用:
剖腹产:由于粪肠球菌增加,拟杆菌属和副拟杆菌属数量减少,导致乳糜泻的风险更高。
喂食类型:婴儿配方奶粉喂养可能是发生乳糜泻的危险因素,但结果不一致。
任何的配方奶粉(无论是纯配方奶粉喂养还是与母乳混合喂养的儿童)都与短双歧杆菌数量减少相关。
抗生素使用:与乳糜泻之间存在关系,这可能是剂量依赖性的。
胃肠道感染:出生后 6-18 个月内的胃肠道感染会因肠道通透性增强而增加患乳糜泻的风险。
肠病毒、腺病毒12型、正呼肠病毒和白色念珠菌也与乳糜泻风险增加有关。
以上所有这些机制凸显了肠道微生物组、麸质和免疫系统在乳糜泻发展过程中复杂的相互作用。
炎症性肠病(IBD)常见症状是腹痛、腹泻和体重减轻。炎症性肠病主要包括:克罗恩病(CD)和溃疡性结肠炎(UC)。
IBD 类型通常通过炎症位置和胃肠道的组织病理学特征来区分。临床上:
这两种情况均源于遗传易感宿主对微生物和/或环境因素的不适当免疫反应。
炎症性肠病患者肠道菌群变化
炎症性肠病患者肠道菌群多样性较低,对大多数炎症性肠病患者的报告了厚壁菌门、拟杆菌门和变形菌门内特定细菌类群的丰度变化,具有攻击性的菌群的增多,如变形杆菌、梭杆菌属、瘤胃球菌,同时具有保护性的菌群的减少,例如Faecalibacterium、罗氏菌属 、毛螺菌科、双歧杆菌属。
当粘蛋白降解细菌(如瘤胃球菌)过度生长时,粘液层开始变薄,肠壁更容易受到肠道微生物的促炎信号的影响。
当这种情况变成慢性时,肠壁中的异常炎症反应似乎成为常态,导致我们在 IBD 中看到的肠壁损伤以及特征性的高粪便钙卫蛋白和FIT。慢性炎症会使肠道菌群失调和肠道屏障功能障碍长期存在,形成恶性循环。
肠道中高水平的具核梭杆菌(一种来自口腔的共生细菌),与炎症性肠病的进展有关。
其他例如普拉梭菌等一些产丁酸菌也减少,丁酸盐有助于肠壁修复和调节炎症。如果肠道丁酸生成量低,肠壁可能会变得渗透性过高,并由于这种微生物介导的愈合机制的丧失而出现慢性炎症。
关于IBD在我们之前的文章有详细阐述其机制,以及肠道微生物群与IBD之间的密切关联,详见:肠道菌群失调与炎症性肠病的关联
抗生素相关性腹泻(AAD)通常是指与服用抗生素相关且无法以其他方式解释的腹泻。腹泻可发生在抗生素治疗期间和治疗停止后长达8周。
发病率:
AAD的临床病程因是否涉及艰难梭菌而异,大多数非艰难梭菌发作。艰难梭菌AAD严重程度轻微,自限性强,仅持续几天。
一项对住院患者抗生素相关性腹泻相关细菌的荟萃分析显示,艰难梭菌、产气荚膜梭菌、产酸克雷伯菌(Klebsiella oxytoca)、金黄色葡萄球菌是全球AAD住院患者中最常见的细菌。
AAD组动物模型中变形菌门和放线菌门丰度较高。更重要的是,模型组乳杆菌的丰度明显低于对照组,而肠球菌的丰度明显高于对照组。
抗生素治疗还增加了柠檬酸杆菌(Citrobacter)、窄养单胞菌(Stenotrophomonas)和谷氨酸杆菌(Glutamicibacter)的丰度,而抗生素降低了支原体和幽门螺杆菌的丰度。
■ 艰难梭菌感染
艰难梭菌是一种革兰氏阳性厌氧芽孢杆菌,是一种重要的医院病原体。艰难梭菌是属于厚壁菌门的正常微生物群的一部分,正常在特定范围内。
近年来,由于抗生素过量使用,艰难梭菌相关性腹泻(CDAD)的发病率有所增加。
艰难梭菌相关性腹泻发展的关键风险因素:
艰难梭菌感染的临床表现各不相同,从无症状或非常轻微的腹泻到严重的伪膜性结肠炎。艰难梭菌感染的发病机制似乎与正常肠道微生物群的破坏有关,主要来自抗生素治疗,如阿莫西林、氟喹诺酮、氨苄青霉素、克林霉素和头孢菌素,这些药物可能导致肠道微生态失调。
注:健康微生物组的共生菌群通过定植抗性控制艰难梭菌等病原体的定植。在抗生素和抗肿瘤或免疫抑制药物对正常肠道菌群产生破坏性影响后,肠道易被艰难梭菌定殖,或者这种影响可能导致肠道环境中预先存在的微生物种群过度生长,从而导致CDAD。
病原体通过粪口途径和孢子传播,一旦摄入,可以在胃酸中存活并定植于结肠,释放肠毒素A和细胞毒素B,这在很大程度上是造成临床严重程度的原因。
与未发生艰难梭菌感染的患者相比,抗生素治疗后艰难梭菌感染患者的微生物群多样性较低。与对照艰难梭菌抗性小鼠相比,发现数量显著增加的初级胆汁酸和某些碳水化合物有利于艰难梭菌的生长。
对于复发性艰难梭菌感染,可以使用粪菌移植FMT治疗,目前临床上有较好的反馈,随着研究的深入和技术的成熟,成功率也越来越高,关于FMT我们在后面章节也会讲到。
有时候常常将食物过敏与食物不耐受混为一谈。虽然这两种情况可能会导致类似的症状,但它们是由不同的机制触发的。
食物过敏是由于免疫系统对特定食物物质的过度反应引起的。食物过敏的主要原因是蛋白质。
蛋白质存在于花生、坚果、鸡蛋、乳制品、鱼、小麦、大豆和虾等贝类中。
牛奶过敏是婴幼儿期常见的食物过敏,牛奶蛋白质分为两大类:酪蛋白和乳清蛋白,所有蛋白质都可能是潜在的过敏原,并且可以诱导IgE 和非 IgE 介导的免疫反应,从而导致广泛的临床表现和不同的表型。
非 IgE 介导的牛奶过敏涵盖多种疾病,包括食物蛋白诱发的过敏性直肠结肠炎、食物蛋白诱发的小肠结肠炎综合征和食物蛋白诱发的肠病。
当身体遇到少量的有害食物时,它都会释放组胺,肠道内布满了具有组胺受体的细胞。当组胺与这些受体结合时,会引起消化系统的肌肉收缩,导致腹部痉挛和腹泻。
患有慢性小肠结肠炎综合征的婴儿表现出更多的慢性症状,如呕吐、慢性腹泻和生长发育不良。
案
例
一名6个月的患者,基本情况:中度营养不良,牛奶蛋白过敏,每日腹泻较多。
肠道菌群检测报告如下:
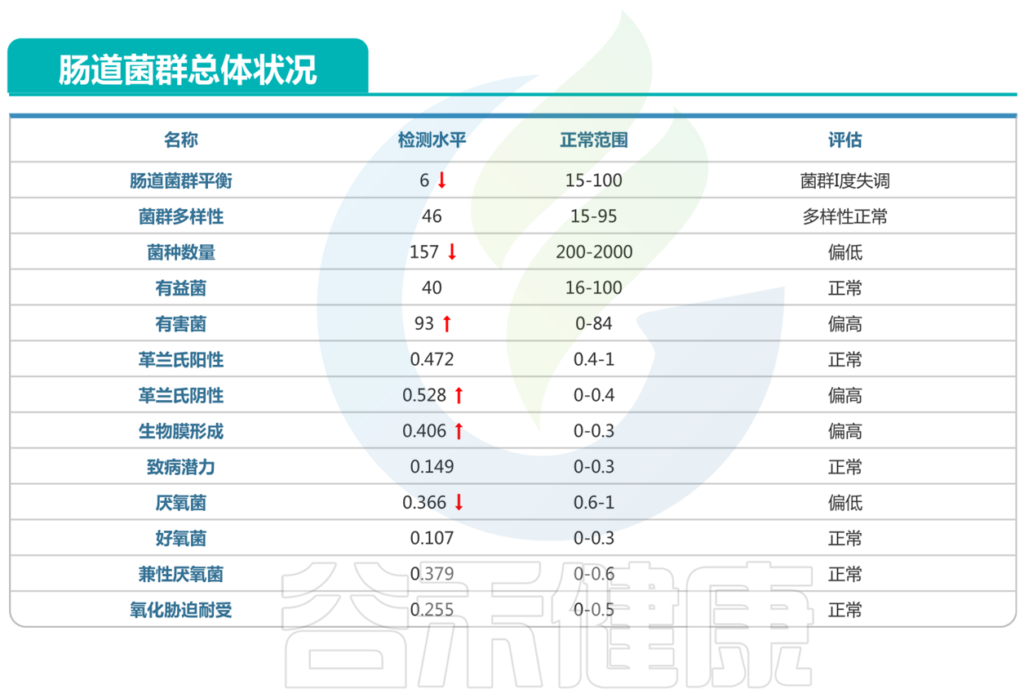
<来源:谷禾健康肠道菌群数据库>
以上我们可以看到:
病原菌中:
对应的菌属中:链球菌属,志贺氏菌属,梭菌属这几类有害菌较多的菌属属于人群中较高。
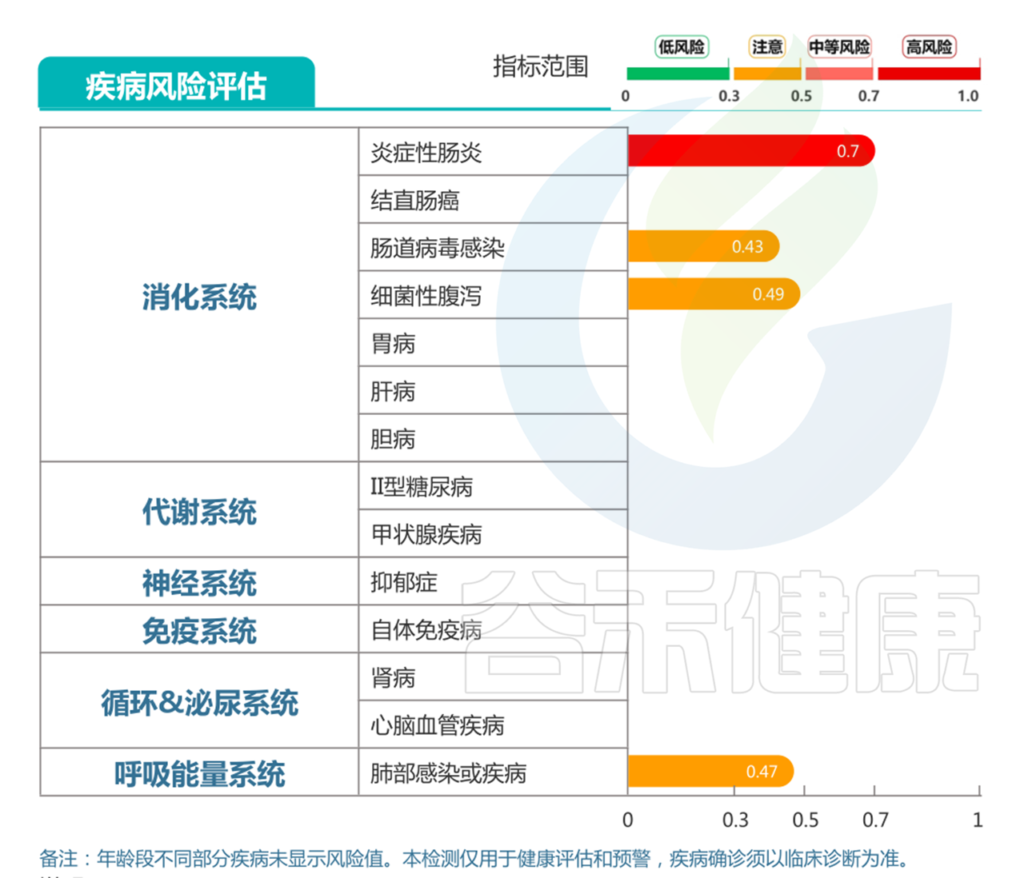
<来源:谷禾健康肠道菌群数据库>
针对牛奶蛋白过敏,以及出现中度营养不良和腹泻的情况,对应报告中:
消化道疾病部分的显示的,肠炎高风险,细菌性腹泻、病毒性腹泻和过敏性腹泻均提示注意。
结合前面病原菌的超标和每日腹泻症状,判断较大可能存在细菌性腹泻的可能。较大可能存在肠炎的情况,并引发肠道屏障损伤,导致乳蛋白过敏的情况。
干预建议:
牛奶过敏暂时可以使用深度水解的奶粉减少过敏。另外可以适当开始摄入米粉等辅食,补充碳水化合物。
基于肠道炎症的情况,可以考虑少量服用姜黄素,并补充益生菌。
扩展阅读:生命早期微生物接触和过敏风险:如何预防
放射性腹泻患者的肠道微生物群落变化比非放射性腹泻患者的肠道微生物群落变化更大,因此,肠道微生物群对于预防放射性腹泻至关重要。
腹泻患者的拟杆菌、Dialister、Veillonella和未分类细菌种类增加,梭菌XI和XVIII、Faecalibacterium、Oscillobacter、Prevotella、Parabacteroides减少。
一些证据还表明,接受放射治疗的患者艰难梭菌感染的发生率很高,这与高死亡率有关。研究表明,肠道微生物群组成可作为放射治疗引起的腹泻和疲劳发展的预测标志。
肠道微生物组对辐射诱导的胃肠道粘膜炎发病机制的影响,是通过调节氧化应激和炎症过程、肠道通透性、粘液层组成、上皮修复和抵抗有害刺激的能力,以及免疫效应分子在肠道中的表达和释放介导的。
肠道微生物组可以通过两种机制影响辐射诱导的胃肠道粘膜炎:易位和微生态失调。
辐射破坏肠道屏障和粘液层,导致细菌移位,从而激活炎症反应。生物失调,无论是由辐射还是其他因素引起,都会影响局部和全身免疫反应。
TLR 具有抗辐射保护作用的另一个潜在机制是激活 NF-κB 信号传导,这对于保护肠道免受辐射诱导的细胞凋亡至关重要。也就是说 TLR 可能通过 NF-κB 途径影响肠道对辐射诱导的上皮损伤的反应。
由于缺乏纤维,便秘往往是生酮饮食的最大问题,但事实上,生酮饮食也会导致腹泻。酮症腹泻可能只是比平时更多的水样大便和/或更频繁地排便。
酮症腹泻的原因可能如下:
脂肪很难消化
一般来说,身体消化脂肪需要更长的时间。在像酮这样的高脂肪饮食中,你会突然比平常吃更多的鳄梨、坚果、种子、肉类、橄榄油和其他脂肪,这会扰乱消化。当你改用这种高脂肪饮食时,可能会导致腹泻。
人工甜味剂和糖醇可能会对胃造成伤害
在生酮饮食中经常摄入更多的糖醇和其他人造甜味剂。这些甜味剂虽然碳水化合物含量低且通常是安全的,但过量食用可能会导致腹胀和腹泻。因此,如果有人食用大量糖醇含量高的酮类产品,他们可能会患酮类腹泻。
破坏肠道菌群
一些小型研究发现,在进行生酮饮食三个月后,肠道菌群发生了很大变化,这可能会导致一些人腹泻。与基线相比,3个月时,脱硫弧菌属统计显着增加(p = 0.025)。脱硫弧菌属与食用动物源性脂肪相关的肠道粘膜炎症状况恶化有关。还需要做更多的研究。
酮症腹泻持续多久?
酮症腹泻并不是一个永久性的问题。通常是暂时的,一般会发生在一开始改变饮食的时候,可能是在身体能够调整之前的第一到四周。
然而,如果高脂肪饮食对一个人的身体来说不容易消化,或者肠道微生物群确实发生了变化,腹泻可能是一个长期的副作用。
如果酮类腹泻持续存在,就值得重新考虑饮食计划。一种饮食计划不太可能适合所有人,其他可能考虑地中海饮食等饮食方式。
关于腹泻相关的干预,我们分三步走:
▼
1. 腹泻未发生 → 预防
预防腹泻相关措施
勤洗手:可以预防感染性腹泻的传播,比如准备食物前后,如厕、换尿布、打喷嚏、咳嗽、擦鼻涕等之后都要洗手。
正确储存食物:在正确的温度下储存食物,并烹饪所有食物直至达到建议的温度。不要冒险食用过期的食物或饮料。
预防旅行者腹泻:到卫生条件不完善的地区旅行时,需要注意食品安全。吃完全煮熟的热食,吃水果要吃可以去皮的,喝原包装的瓶装水,包括刷牙也用瓶装水。避开未经高温消毒的牛奶或果汁产品。合理摄入一些益生元,降低旅行者腹泻的风险。
保持肠道菌群平衡:当我们肠道菌群在一个良好的状态时,可以提高我们的免疫力,甚至能抵抗病原菌的定植,通过均衡饮食、保持良好的作息规律、适度运动、减少压力等各个方面,维持肠道菌群平衡。
当腹泻发生时,首先要判别感染源和感染原因。
如果是急性腹泻,很可能是因为病原体引起的,进行常规的病原物判别,医院可以进行相关检测,当然也可以结合肠道菌群检测,找出感染的原因,进行针对性治疗。
在处理优先级上,首先要解决感染问题
细菌性感染
如果是细菌性感染腹泻,就需要用到相关抗生素治疗。比如说大肠埃希氏菌、沙门氏菌、志贺氏菌等感染,可以考虑β-内酰胺类抗生素,如头孢曲松、拉氧头孢等。
不过需要注意的是,使用抗生素的时候尽量遵医嘱一次性吃到位,如果吃了一天感觉好了就不吃了,没有起到彻底杀菌的作用,则可能出现病情反复,那么这时候也会带来抗生素耐药性问题,即便吃了抗生素药也不一定很快好转。
因此关于抗生素用药需要谨慎,要么不用,要么用到位,尽量避免形成抗生素耐药性问题。如果有进行肠道菌群检测,也可以看到有没有抗生素耐药性问题,如果存在某种抗生素耐药,则可以避免该药物,改用其他抗生素代替。
病毒性感染
如果主要症状是腹泻+呕吐,也可能伴随出现一些腹痛、头痛、发烧、畏寒、肌肉酸痛等情况,则考虑可能是病毒性感染。一般病毒性感染具有自限性。
病毒性感染则需要避免使用抗生素。配合一些补液及益生菌,辅助治疗。
研究表明,鼠李糖乳杆菌GG可减少病毒性腹泻持续时间和每天排便次数。其他包括嗜酸乳杆菌NCFM,可有效增强轮状病毒疫苗效果。
其次,考虑其他功能性问题
肠道感染也是IBS的危险因素,如果是IBS患者,饮食因素可诱发或加重IBS症状。
短期使用利福昔明可以改善IBS的腹痛、腹泻、腹胀症状。洛哌丁胺的随机双盲安慰剂对照研究证实其可以显著降低IBS排便频率。
一些不确定病因的腹泻,比如说腹部绞痛、头痛、持续排出恶臭气体,进食后马上又腹泻,怀疑是否是因为胆汁酸吸收不良引起的腹泻,这时候可能需要配合进行SeHCAT测试、或血清7αC4检测、或粪便胆汁测试等进行相关诊断。一般来说,胆汁酸腹泻在克罗恩病和肠易激综合征患者中比较常见。
医生可能会开出胆汁酸螯合剂来减少胆汁的循环。通常为10-14天。
有些不明原因的腹痛、腹胀、腹泻、各种不适,在进行肠道菌群健康检测后,如果发现存在失调的情况,比如说肠道菌群多样性过低,有益菌缺乏,一些其他有害菌超标,那么需要结合相应的指标去综合判别,纠正可能的诱发因素。
案
例
我们来看一个案例:一名患者50岁,主诉腹泻。

<来源:谷禾健康肠道菌群数据库>
可以看到肠道菌群多样性明显缺乏,且埃希氏菌属明显超标。大肠埃希氏菌在正常情况下对人体无害,但某些菌株也可能引起感染和疾病,导致胃肠道症状,如腹泻、腹痛等。
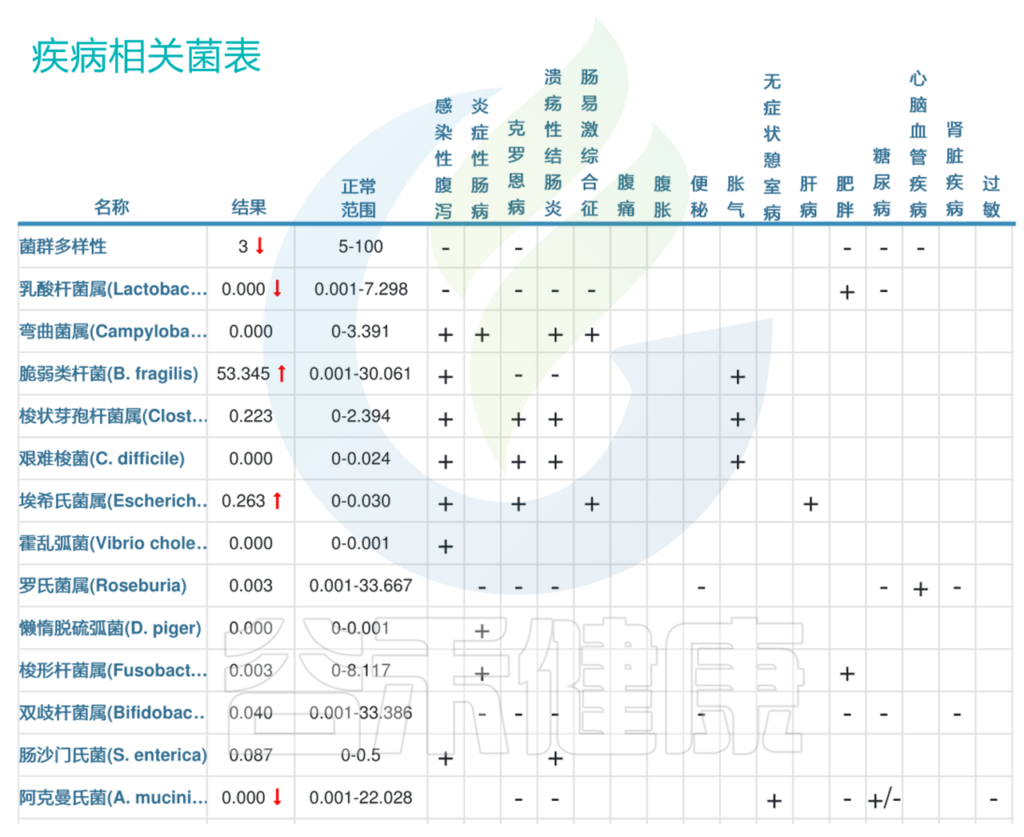
<来源:谷禾健康肠道菌群数据库>
以上我们可以看到最明显的,脆弱拟杆菌53.345,明显超标,脆弱拟杆菌这一行右边第一格显示“+”,说明脆弱拟杆菌丰度与“感染性腹泻”呈正相关,那么脆弱拟杆菌超标也就意味着该患者很有可能存在感染性腹泻。
其他菌群例如第二行乳酸杆菌属,结果0.000,也就是没有检出,低于正常范围。而乳酸杆菌属与“感染性腹泻”、“克罗恩病”、“溃疡性结肠炎”、“肠易激综合征”都呈负相关(都显示“–”)。患者刚好低于正常范围,也就是说乳酸杆菌属低,提示该患者很有可能存在以上这些肠道类疾病。
整体肠道菌群检测结果也与该患者“腹泻”的症状吻合,可以作为临床上的参考。
比如说过敏性腹泻,则应识别过敏源,在过敏源不明确的情况下,应该短期采用限制性食物疗法,排除蛋奶等可能引发过敏的食物,如果在这段时间内症状消失,则可定期有计划地引入单一食物,对于过敏食物进行回避。
在纠正诱发因素后,可以采取措施进行调理,提升免疫力,合理应用微生态制剂,也就到了接下来第三步。
一次腹泻,对于我们肠道来说,就好比打了一场仗,各大菌群忙着争夺领地、占据优势地位,肠道菌群的平衡却遭受了巨大的打击,有益菌可能被削弱,而有害菌则可能过度繁殖,甚至肠粘膜都受损。因此,腹泻后的肠道养护很重要。
我们从两个方面进行养护肠道,营养和菌群。
营 养
腹泻后可以吃什么?
土豆(不带皮),含有维生素B6、维生素C、烟酸和微量矿物质碘等营养成分。不要加黄油那些会刺激肠道的添加物,可以直接吃。
生吃蔬菜可能很难消化。可以通过剥皮、去除种子和彻底煮熟吃更好。
面食,提供膳食纤维和碳水化合物。
燕麦片,很容易消化,并且富含具有治疗作用的抗氧化剂。它还含有维生素 B1、硒和锰,也是可溶性纤维的良好来源。
香蕉,较温和,容易消化,是治疗腹泻的好选择。它们也是钾的良好来源,钾是一种可能因腹泻而流失的重要电解质。
苹果酱,比生苹果更好,因为水果的皮含有不溶性纤维。苹果酱还含有果胶,可以帮助粪便凝固。
腹泻后避免吃什么?
以上只是关于腹泻期间饮食的普适性建议,临床上病人腹泻情况复杂,可能需要根据不同类别的腹泻进行分层管理。
对于 IBS 患者来说,则需额外避免:
对于 胆汁酸腹泻患者来说,其他干预包括:
对于炎症性肠病患者来说,一些干预措施包括:
每个人的身体状况,肠道菌群特征各不相同,并不适用于所有人。比如说有些人吃香蕉后腹泻会更严重,这个就需要避免,根据自身情况而定。
扩展阅读:深度解析 | 炎症,肠道菌群以及抗炎饮食
菌 群
除了上述营养之外,也可以通过对肠道菌群的调理,促进有益菌生长,抑制有害菌过度生长,优化菌群组成;增强肠道屏障功能,加强抵抗病原体入侵后的定植;从根本上改善人体免疫力。
▼ 益生菌
普遍认为,益生菌的功能在于:
一项研究表明,益生菌大肠杆菌抑制其他大肠杆菌菌株,以及病原菌金黄色葡萄球菌和表皮葡萄球菌的生物膜形成。
小鼠研究表明,短双歧杆菌和Bifidobacterium pseudocantenulatum DSM20439 可以抑制肠出血性大肠杆菌产生的志贺毒素的表达。
益生菌的摄入也可以降低住院患者中艰难梭菌相关腹泻和抗生素诱导腹泻的发生率。含益生菌的嗜酸乳杆菌(L.acidophilus)和干酪乳杆菌(L.casei)菌株在预防艰难梭菌相关腹泻方面取得了良好的效果,没有严重的不良反应报告。布拉氏酵母菌也为治疗艰难梭菌相关腹泻提供了很好的前景。
罗伊氏乳杆菌DSM 17938 可能有助于调节肠道微生物群、消除感染以及减轻结肠炎、抗生素相关的胃肠道症状。无论是儿童还是成人,罗伊氏乳杆菌都能缩短急性感染性腹泻的持续时间,并改善结肠炎或炎症性肠病患者的腹痛。
益生菌似乎也能有效治疗痢疾;在接受乳杆菌和双歧杆菌菌株以及一种链球菌菌株组合治疗的患者中,腹泻的血液持续时间和住院时间都显著缩短。
益生菌也可以减轻与抗生素使用有关的肠道微生物群的改变,并可能抑制抗生素耐药性细菌的生长。
▼ 益生元
益生元也可以对腹泻患者产生积极影响。益生元的主要靶标是乳酸杆菌和双歧杆菌。益生元的摄入会增加短链脂肪酸的产生,这对维持肠道屏障的完整性很重要。由于丁酸盐在促进正常细胞增殖和分化方面的作用,它是被认为对肠道健康最有益的短链脂肪酸。
一些益生元,如低聚半乳糖、低聚果糖、菊粉、乳果糖和果胶低聚糖,可以拮抗病原体对上皮细胞的粘附,从而抑制定植并促进肠道病原体的清除。此前的研究表明,益生元可以缩短急性水样腹泻的持续时间,对腹泻有良好的治疗作用。
白术挥发油通过调节肠道菌群缓解急性溃疡性结肠炎。白术挥发油可以有效缓解溃疡性结肠炎小鼠的出血性腹泻、结肠组织损伤和结肠炎症。白术挥发油抑制了潜在的有害细菌(Turicibacter、Parasuterella、Erysipelatoclosstridium)的生长,富集了潜在有益菌(Enterorhabdus、Parvibacter、Akkermansia)。综上,白术挥发油可能作为一种新型益生元缓解溃疡性结肠炎。
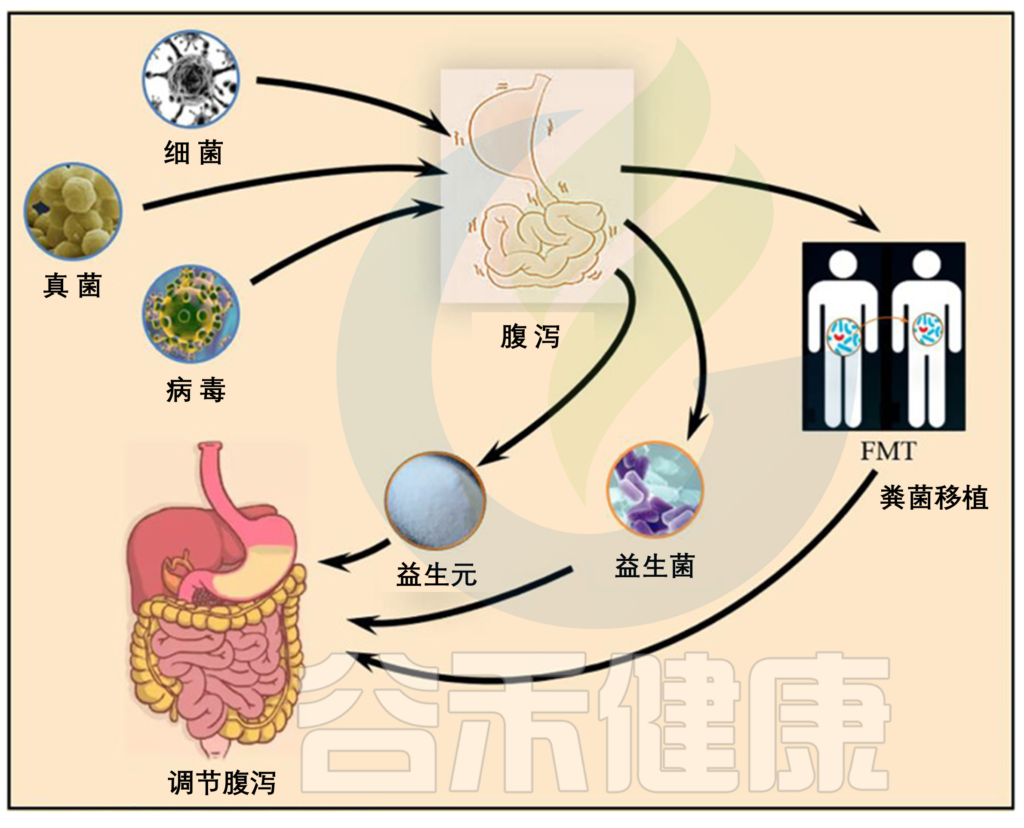
doi.org/10.3389/fcimb.2021.625210
▼ 粪菌移植(FMT)
我们知道一般腹泻用抗生素治疗可见明显好转,但也有些用了抗生素,病情没有好转,反而产生耐药性,形成慢性腹泻,反反复复,那这样的情况就可能需要用到FMT。
在腹泻患者中使用FMT的好处是基于这样一种观点,即通过FMT引入的健康微生物群可以战胜病原体,并将恢复健康肠道微生物组的组成。
在许多研究中,FMT已成功用于治疗难治性艰难梭菌诱导的腹泻。现有文献支持FMT的使用,并将其作为复发性艰难梭菌相关腹泻的安全有效的治疗方法。
此外,FMT在4 周后, IBS患者的生活质量方面显著优于安慰剂(平均差 [MD] = 7.47,95% 置信区间 [CI]:2.05-12.89,p = 0.04)
单臂分析显示,IBS 症状改善的发生率为 57.8%(45.6%-69.9%),IBS-SSS 减少(MD = -74,95% CI:-101.7 至 -46.3)。
一项临床研究表明,FMT可能安全有效地改善慢性放射性肠炎患者的肠道症状和粘膜损伤。此外,FMT 也是缓解急性放射综合症的有效疗法。
扩展阅读:粪菌移植——一种治疗人体疾病的新型疗法
▼ 中 药
越来越多的研究支持:中草药配方通过调节肠道菌群缓解腹泻症状。传统中药方剂,如“四君子汤、痛泻要方、补中益气汤、参苓白术汤”等,广泛用于治疗慢性腹泻。
升姜泻心汤通过改变肠道菌群和肠道代谢稳态来改善抗生素相关性腹泻。升姜泻心汤可以显著提高肠道菌群多样性,显著增加了拟杆菌属的相对丰度(p < 0.01),并降低了埃希氏杆菌属-志贺氏杆菌的相对丰度(p < 0.001)。
升姜泻心汤可以有效预防人类伊立替康引起的迟发性腹泻的发生。增强肠道屏障功能并减轻小鼠结肠炎。改善胆汁酸代谢和氨基酸代谢。
七味白术散(QWBZP)是一种治疗各种原因引起的腹泻的中药配方。七味白术散煎剂和七味白术散总苷,在抗生素相关性腹泻小鼠中,促进乳杆菌的增殖,抑制变形杆菌、梭状芽胞杆菌、真杆菌、Facklamia、埃希氏菌的生长。还增加了脱氧胆酸和 β-鼠胆酸的水平,并降低了牛磺胆酸、牛磺-α-鼠胆酸和牛磺-β-鼠胆酸的水平。乳杆菌是响应七味白术散总苷的关键细菌属。
清化止泻汤可调节肠道微生物群,减少5-羟色胺和血管活性肠多肽,改善腹泻症状。葛根芩连汤具有止泻作用和肠道微生物调节功能。香连丸可能通过恢复肠道菌群和减轻黏膜损伤来治疗抗生素相关性腹泻。经典中草药复方参苓白术可以通过调节结肠腔和粘膜微生物群,恢复肠道离子转运,缓解乳糖诱导的腹泻。
肠安Ⅰ号方治疗IBS-D临床能够明显降低IBS-SSS积分,提高AR应答率,疗效优于安慰剂,临床未发现明确不良反应。
在一项为期28天的双盲、随机、对照初步研究中,香沙六君子汤(XSLJZT)对IBS患者的腹泻(定义为频繁排便)有改善,但对稀便或急便没有改善。
除了中药配方,越来越多的证据表明,中国单一草药,如生姜、人参发酵物、苍术、小檗碱、黄柏提取物还具有止泻特性,恢复不平衡的肠道微生物群。
一项荟萃分析报告称,肠溶薄荷油可改善整体 IBS 症状。
中草药多糖是由单糖组成的天然聚合物,广泛存在于中草药中,是重要的活性成分,作为肠道微生物群的重要能量来源,具有止泻作用。
中草药多糖对慢性腹泻患者肠道微生物群的影响
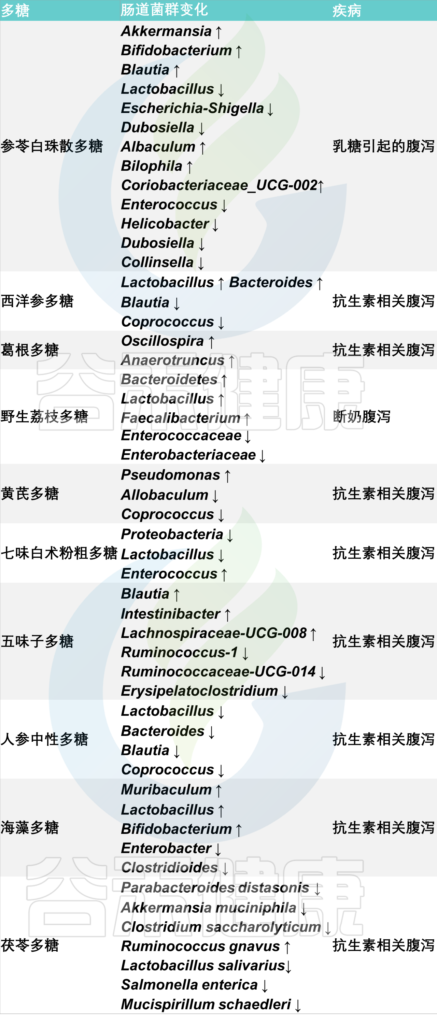
以上这些都是关于腹泻的相关干预措施。
一次看似偶然的腹泻,实际上可能是我们肠道菌群平衡打破的一声警钟。平衡的肠道菌群可以帮助我们抵抗腹泻病原菌的定植。
当腹泻发生后,我们首先应该去寻找腹泻的原因,传统的医学检查往往需要繁琐的流程和耗时的等待以及不确定的结果,而依托于高通量测序和人工智能等技术的肠道菌群检测,则极大地提高了效率和精确性,在医疗手段飞速发展的时代,“快检、便检”已经逐渐开始成为获得关键医学信息的刚需,便于临床医生能够快速判断疾病类型和严重程度,有针对性地制定治疗方案。
结合个体差异,深入分析肠道菌群变化和疾病发展的关联,更好地了解每个人的疾病风险和治疗响应,可以提升治疗效果,缩短治疗时间,提高生活质量,减轻医疗负担,从而有助于将个性化医学推向前沿。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
相关阅读:
关 于 谷 禾
杭州谷禾健康专注于利用高通量测序技术进行肠道菌群和精准健康检测,是国家高新技术企业。
公司于2012年成立于浙江大学校内,核心创始团队主要来自浙江大学。谷禾在高通量基因测序领域独立研发大量独有技术,已授权包括采样,提取和数据库相关国家发明专利6项,此外还有9项软件和作品著作权。并通过ISO19001认证,并建有II级病原微生物P2实验室,并正在申请更全面的资质。公司为150多家国内顶级医院和医疗以及健康相关机构提供科研和检测服务。
经过多年的积累,已完成检测并构建了超过70万例各类人群样本数据库。自主构建了肠道菌群参考注释数据库,同时建立了基于近7万人群的肠道菌群人群分布及正常范围。在Nature Communications,Gut,PNAS等国际顶级学术期刊发表多项研究论文。支持合作50多项目临床开放基金项目,已发表研究成果20多项。
谷禾更大的数据和人工智能平台意味着可以更可靠和准确地反应您当前的菌群和健康状况。
主要参考文献:
Li Y, Xia S, Jiang X, Feng C, Gong S, Ma J, Fang Z, Yin J, Yin Y. Gut Microbiota and Diarrhea: An Updated Review. Front Cell Infect Microbiol. 2021 Apr 15;11:625210.
GBD 2016 Diarrhoeal Disease Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of diarrhoea in 195 countries: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis. 2018 Nov;18(11):1211-1228.
Chung The H, Le SH. Dynamic of the human gut microbiome under infectious diarrhea. Curr Opin Microbiol. 2022 Apr;66:79-85.
Ramamurthy T, Kumari S, Ghosh A. Diarrheal disease and gut microbiome. Prog Mol Biol Transl Sci. 2022;192(1):149-177.
Moshiree B, Heidelbaugh JJ, Sayuk GS. A Narrative Review of Irritable Bowel Syndrome with Diarrhea: A Primer for Primary Care Providers. Adv Ther. 2022 Sep;39(9):4003-4020.
Xue H, Mei C F, Wang F Y, et al. Relationship among Chinese herb polysaccharide (CHP), gut microbiota, and chronic diarrhea and impact of CHP on chronic diarrhea[J]. Food Science & Nutrition, 2023, 11(10): 5837-5855.
抗菌药物临床应用指导原则修订工作组. 抗菌药物临床应用指导原则[M]. 2015: 21-39
Mada PK, Alam MU. Clostridioides difficile Infection. 2023 Jan 23. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 28613708.
Shaikh SD, Sun N, Canakis A, Park WY, Weber HC. Irritable Bowel Syndrome and the Gut Microbiome: A Comprehensive Review. J Clin Med. 2023 Mar 28;12(7):2558.
Holtmann G J, Ford A C, Talley N J. Pathophysiology of irritable bowel syndrome[J]. The lancet Gastroenterology & hepatology, 2016, 1(2): 133-146.
Farrugia A, Arasaradnam R. Bile acid diarrhoea: pathophysiology, diagnosis and management. Frontline Gastroenterol. 2020 Sep 22;12(6):500-507.
Piovezani Ramos G, Camilleri M. Current and Future Therapeutic Options for Irritable Bowel Syndrome with Diarrhea and Functional Diarrhea. Dig Dis Sci. 2023 May;68(5):1677-1690.
Jay P. Sanford. 桑德福抗微生物治疗指南[M]. 范洪伟译. 北北京: 中国协和医科大学出版社. 2013: 71-76
Camilleri M, Boeckxstaens G. Irritable bowel syndrome: treatment based on pathophysiology and biomarkers. Gut. 2023 Mar;72(3):590-599.
Cheng H, Zhang D, Wu J, Liu J, Tan Y, Feng W, Peng C. Atractylodes macrocephala Koidz. volatile oil relieves acute ulcerative colitis via regulating gut microbiota and gut microbiota metabolism. Front Immunol. 2023 May 2;14:1127785.
Wellens J, Vissers E, Matthys C, Vermeire S, Sabino J. Personalized Dietary Regimens for Inflammatory Bowel Disease: Current Knowledge and Future Perspectives. Pharmgenomics Pers Med. 2023 Jan 12;16:15-27.
何礼贤. 国家抗微生物治疗指南[M]. 北北京: 人民卫生出版社. 2012: 196-210
Elhusein AM, Fadlalmola HA. Efficacy of Fecal Microbiota Transplantation in Irritable Bowel Syndrome Patients: An Updated Systematic Review and Meta-Analysis. Gastroenterol Nurs. 2022 Jan-Feb 01;45(1):11-20.
Altomare A, Di Rosa C, Imperia E, Emerenziani S, Cicala M, Guarino MPL. Diarrhea Predominant-Irritable Bowel Syndrome (IBS-D): Effects of Different Nutritional Patterns on Intestinal Dysbiosis and Symptoms. Nutrients. 2021 Apr 29;13(5):1506.
Saviano A, Brigida M, Migneco A, Gunawardena G, Zanza C, Candelli M, Franceschi F, Ojetti V. Lactobacillus Reuteri DSM 17938 (Limosilactobacillus reuteri) in Diarrhea and Constipation: Two Sides of the Same Coin? Medicina (Kaunas). 2021 Jun 23;57(7):643.

谷禾健康
我们的身体中有很多不同的器官,组织,腺体等会产生许多信号分子来精确控制和影响身体的反应和活动,这些信号分子包括激素、神经递质、生长因子、细胞因子等。它们可以促进或抑制细胞的生长和分化,调节细胞间的相互作用和通讯,影响身体的代谢和能量平衡,参与免疫系统的细胞和分子相互作用,调节身体的内环境和外环境的适应性等。
其中,激素是一类重要的生物活性物质,也可以说是信号分子,一般由特定的内分泌细胞,腺体或器官所产生,包括性激素、脂质激素、蛋白质激素、胰岛素、甲状腺激素、肾上腺素和去甲肾上腺素等。
这其中性激素是一类重要的激素,主要由生殖腺(如卵巢、睾丸)和肾上腺产生,包括雌激素、孕激素和雄激素等。它们在生殖系统中发挥重要作用,对女性月经周期、妊娠、分娩、哺乳等过程起调节作用,对男性性发育、精液生成、性欲等方面也具有重要影响。此外,性激素还与骨密度、心血管健康、认知能力等方面有关。
临床上性激素六项是生殖内分泌门诊常用的检查。性激素六项检查主要用于评估男女生殖内分泌功能,对月经失调、性功能障碍、不孕不育、生殖系统肿瘤、性染色体病等的鉴别和诊断及内分泌治疗的效果检测都具有重要的临床意义和参考价值。
近年来,越来越多的科学证据表明,肠道菌群与性激素(宿主的内源激素或外源补充激素)存在直接或间接的相互作用。性激素对于塑造肠道微生物群组成具有一定影响,与此同时,肠道微生物群本身也会影响性激素水平。
目前的研究主要基于横断面研究,基于纵向的检测肠道菌群发育以及激素水平变化的研究队列还较少,目前无法区分是性激素变化在前还是菌群变化在前,但是肠道菌群的失调和性激素的异常水平都与多种疾病的发生和发展有关,如肥胖症、炎症性肠病、乳腺增生、甲状腺疾病,妇科疾病、自身免疫疾病等。因此,保持肠道菌群和激素水平的平衡,对于维持人体的健康十分重要。
本文旨在阐述激素与肠道微生物群的相互作用,主要着重讲述性激素影响下的人体一些疾病和菌群的差异。
这些发现可能会在未来用于开发治疗激素紊乱相关疾病或与性别和激素活动相关的自身免疫性疾病、甲状腺疾病、代谢疾病甚至是压力等情绪状态的新疗法。
目录/contents
Part1:肠道微生物与激素的关联
Part2:肠道微生物通过激素对宿主的影响
Part3:性别差异下的肠道微生物群
Part4:肠道菌群与性激素的相互作用
Part5:性激素影响下的相关疾病
Part6:结语
肠道微生物群以多种方式影响动物和人类的行为,甚至可能影响人类的情绪状态和疾病状态。最近揭示了菌群的一个关键作用:调节激素分泌。
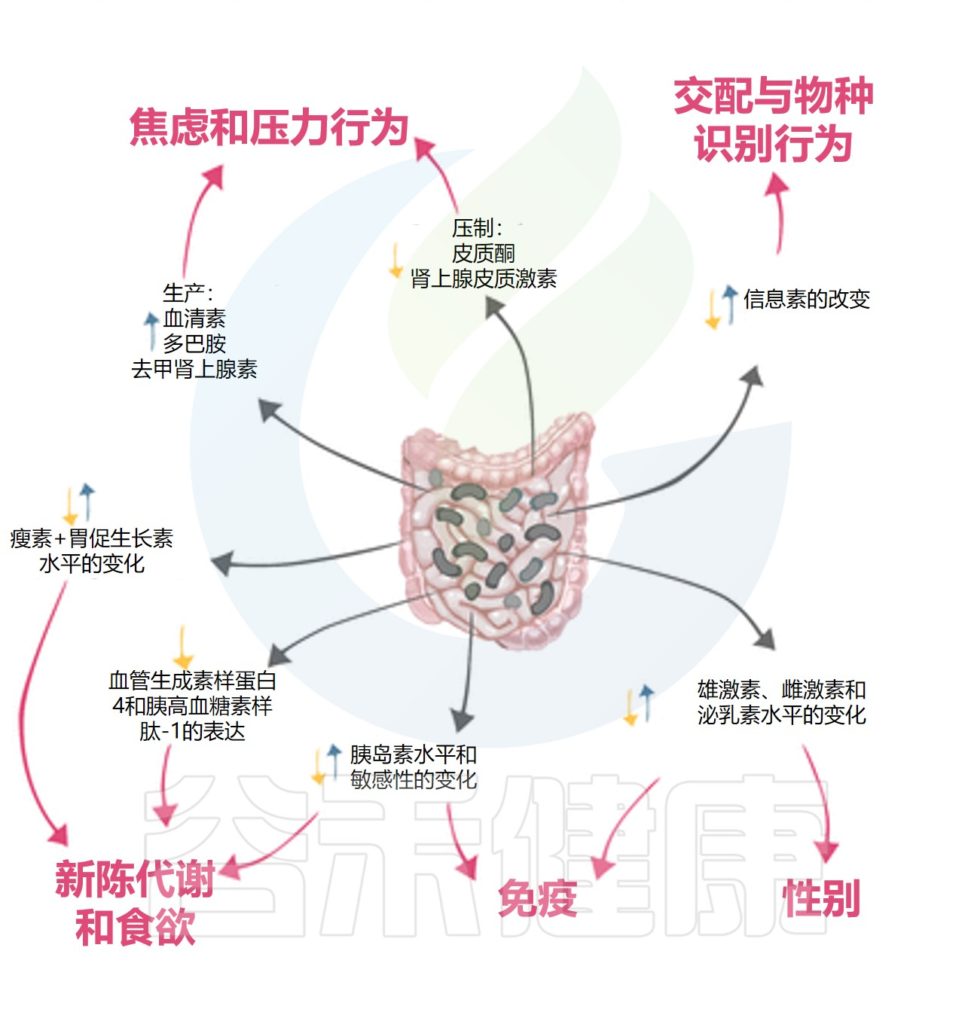
微生物和激素之间的相互作用会影响宿主的新陈代谢、免疫力和行为。这种相互作用是双向的,因为微生物群已被证明既受宿主激素影响又影响宿主激素。
肠道微生物群通过激素影响宿主情绪、免疫及代谢等
微生物群对宿主激素水平的影响可能是直接的,即微生物群产生激素,也可能是间接的,即微生物可能调节肾上腺皮质(控制焦虑和压力反应)的功能,或调节炎症和免疫反应。
Neuman H,et al.FEMS Microbiol Rev.2015
激素水平调节微生物群的生长、毒性
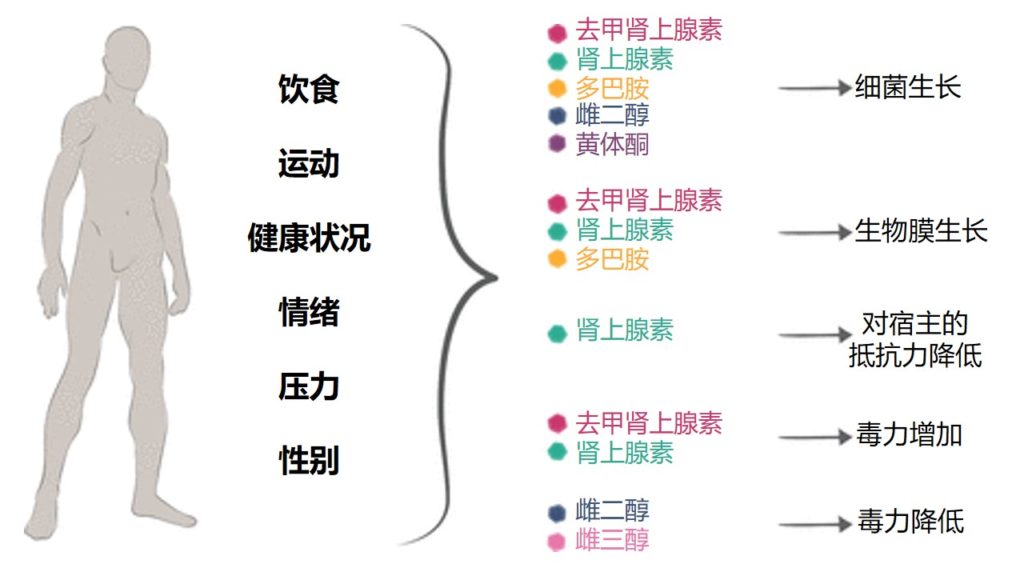
多种宿主因素(如饮食、运动、情绪、健康状况、压力和性别)会导致激素水平发生变化,进而对微生物群产生多种影响(包括生长、毒力和抵抗力)。
Neuman H,et al.FEMS Microbiol Rev.2015
文献中已记载激素和微生物群之间的相互作用




Neuman H,et al.FEMS Microbiol Rev.2015
▸ 菌群通过影响神经激素前体调节肠道运动、情绪、食欲等
神经内分泌细胞响应神经元输入而分泌神经激素。尽管它们被分泌到血液中以发挥全身作用,但它们也可以充当神经递质。微生物群对行为的调节(例如小鼠的焦虑)被认为是通过神经激素前体(例如血清素、多巴胺)发生的。
最近,肠道细菌被证明可以产生和响应神经激素,例如血清素、多巴胺和去甲肾上腺素。
这些机制对于研究病原体的研究人员来说很有趣,因为它们可能会影响病原体对宿主防御反应的敏感性。例如,为了响应宿主肾上腺素,沙门氏菌会下调其对宿主抗菌肽的抵抗力并诱导关键的金属转运系统,从而影响细胞中的氧化应激平衡。
// 血清素
血清素,也称为 5-羟色胺 (5-HT),是大脑中的主要神经递质之一。然而,超过90%的哺乳动物宿主血清素都存在于肠道中。
肠道血清素的分泌受饮食影响,调节肠道运动、情绪、食欲、睡眠和认知功能。这种双重作用表明血清素可能将肠道(包括其微生物群)与宿主行为联系起来。
血清素与肠易激综合征和克罗恩病有关
大脑血清素可以通过血清素转运蛋白穿过血脑屏障进入血液,这表明肠-脑轴中存在另一个联系。血清素与肠易激综合征和克罗恩病等胃肠道疾病有关,这些疾病也与微生物群的差异有关。
// 多巴胺
多巴胺由芽孢杆菌(Bacillus)和沙雷氏菌(Serratia)等细菌产生 。
无菌小鼠中的游离管腔多巴胺水平显著低于常规小鼠,并且在接种表达β-葡萄糖醛酸酶的细菌后再次升高。
多巴胺不足与帕金森病有关
这些结果表明,在以多巴胺形成不足为特征的帕金森病等疾病中,肠道细菌与多巴胺水平之间可能存在相关性。
//γ-氨基丁酸
γ-氨基丁酸 (GABA) 是哺乳动物中枢神经系统中的主要抑制性神经递质,它也由微生物群产生,并可能影响宿主行为。这很有趣,因为中枢γ-氨基丁酸受体表达的改变与焦虑和抑郁的发病机制有关。
γ-氨基丁酸影响焦虑和抑郁
已经研究了由乳杆菌产生的γ-氨基丁酸,以试图大规模发酵安全的γ-氨基丁酸。因此,向小鼠施用鼠李糖乳杆菌会改变不同中枢神经系统区域中γ-氨基丁酸受体的表达,从而减少与焦虑和抑郁相关的行为。
▸ 菌群通过调节应激激素降低宿主焦虑行为
微生物群可以通过改变应激激素水平来帮助我们保持冷静和平衡。无菌小鼠具有升高的应激激素皮质酮和促肾上腺皮质激素 (ACTH) 血浆水平以响应轻度压力,增加与焦虑和压力相关的行为。
促肾上腺皮质激素通过进一步产生皮质类固醇在下丘脑-垂体-肾上腺轴中发挥重要作用。因此,两种特定物种,瑞士乳杆菌(Lactobacillus helveticus)和长双歧杆菌,降低了大鼠和健康人类的应激激素皮质醇水平和焦虑样行为。
此外,与对照组相比,长期接受益生菌鼠李糖乳杆菌治疗的小鼠在强迫游泳测试中皮质酮水平较低,抑郁行为也较少。
▸ 肠道菌群影响甲状腺激素的转化影响代谢
肠道菌群产生的代谢物对甲状腺和内分泌功能也是必不可少的。它影响硒、铁、锌和碘的吸收,这些都是甲状腺激素产生所需的重要矿物质。它制造短链脂肪酸(SCFAs)与甲状腺激素协同工作,以改善肠道屏障功能和加强细胞间紧密连接。
肠道菌群失衡是影响甲状腺激素转化的主要障碍。事实上,20%的T4(甲状腺素)在肠道中转化为活性的T3(三碘甲状腺原氨酸)形式,肠道菌群不健康,肠道内存在过多的病原体,肠道中甲状腺激素的转化也会减少。
此外当肠道屏障功能减弱时,毒素和未完全消化的食物残渣等颗粒会逃逸,导致肠胃不适和全身炎症。炎症会在组织水平损害甲状腺激素的转化。受体受损,身体也不能将T4激素转化为活性的T3形式。
▸ 细菌通过信息素影响宿主行为
信息素是在性识别、吸引力和交配行为以及攻击行为和支配行为中发挥重要作用的激素。
信息素也称为外激素,一种分泌到一个人体外并影响他人行为的化学物质。
共生细菌和信息素之间的这种联系也发生在哺乳动物身上。两种鬣狗的气味腺中有不同的细菌群落,这与气味分泌物中不同的挥发性脂肪酸特征有关。作者推测,共生细菌产生的代谢产物提供了物种特有的气味。
这进一步支持了细菌可以产生影响宿主行为的气味特征的观点。细菌也可以在配偶选择中发挥作用:雌性小鼠不会被感染沙门氏菌的雄性小鼠的尿液所吸引。
化学信号和嗅觉刺激也在人类行为中发挥作用,未来的研究将帮助我们了解细菌产生的气味是否会影响我们自身的相互作用,甚至可能影响进化。
▸ 肠道菌群代谢性激素影响健康
肠道菌群也影响雌激素,它们通过特定的酶对雌激素进行循环利用并产生雌激素代谢物。当肠道菌群失衡或不健康时,这些过程就会被破坏,从而导致健康问题。
例如,Prevotella intermedius吸收雌二醇和黄体酮,从而促进其生长。雌激素受体ER-β表达的变化也会影响肠道微生物群的组成。
雌二醇在卵巢中合成,是雌激素中含量最高的,活性最强的激素,经肝脏代谢后,通过胆道排泄到胃肠道,部分雌二醇被胃肠道重新吸收进入血液。肠道菌群可以通过改变雌二醇的活性和非活性状态,影响血清中类固醇激素的水平。
武汉大学人民医院转化医学研究所的李艳教授团队在cell metabolism上发表研究论文,发现绝经期前抑郁症患者肠道细菌Klebsiella aerogenes(产气克雷伯氏菌)的3β-羟基类固醇脱氢酶(3β-HSD)通过降解雌二醇诱导绝经期前女性出现抑郁症。
肠道微生物群作为人体最大的菌群库,动物和人类研究发现,肠道微生物群存在性别相关差异。
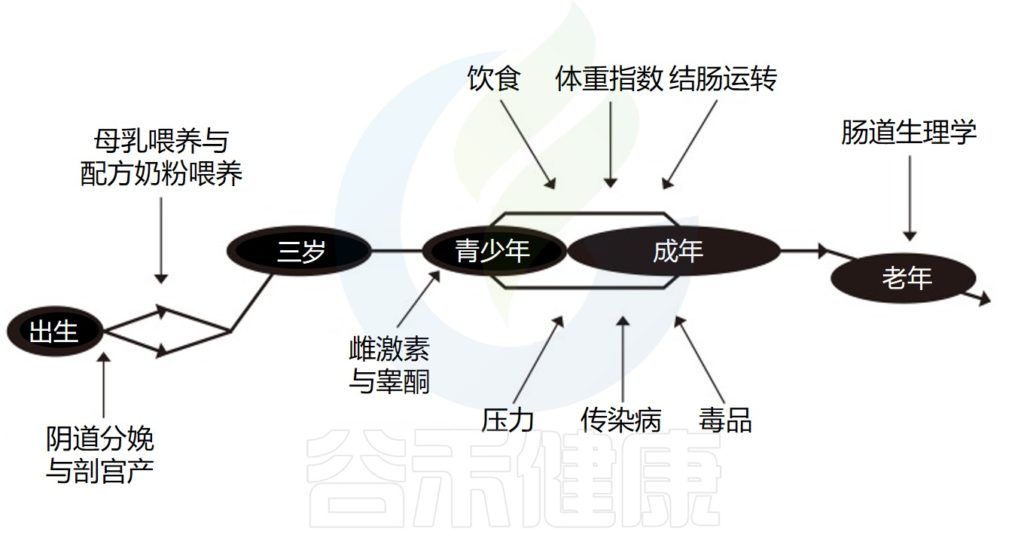
影响微生物群的重要因素(例如环境或激素)取决于不同的生命周期,并且在男性和女性中会有所不同。
Kim YS,et al.World J Mens Health.2020
需要注意的是,性激素对肠道微生物具有显著的影响,青春期、怀孕、更年期、多囊卵巢综合征和性腺切除术等各种因素会导致性激素水平(睾酮和雌二醇)发生变化,进而导致肠道菌群组成发生变化。
肠道微生物群与性激素之间的相互作用
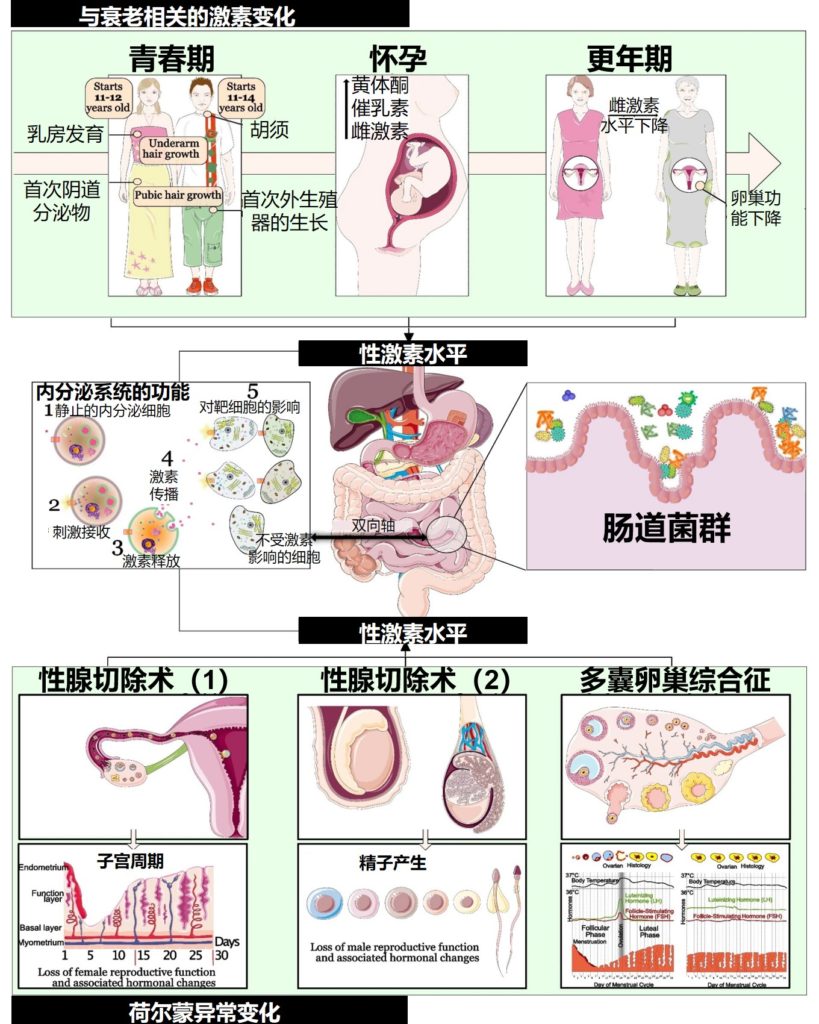
Santos-Marcos JA,et al.Biol Sex Differ.2023
▷婴儿时期肠道菌群组成与性别相关的差异
婴儿期的特点是参与人乳低聚糖代谢的细菌种类占主导地位(据估计,婴儿细菌微生物群的25-30%来自母乳)并且肠道微生物群多样性的差异减少。
特别是,这个年龄段的特点是被属于双歧杆菌(Bifidobacterium)和链球菌(Streptococcus)的几种物种定殖,例如长双歧杆菌和嗜热链球菌。
6个月至2岁之间的年龄段的特点是将固体食物引入婴儿的饮食中,并伴随着肠道微生物群结构和功能多样性的快速增加。这是婴儿生长的关键时期,肠道微生物群开始接近成人特征。
最近对人类婴儿进行的几项研究发现了他们出生后第一年不同时间点肠道微生物群落的潜在性别依赖差异。
男婴α多样性较低
例如,对出生后前30天新生儿粪便样本的分析显示,与女性相比,男婴的α多样性较低,梭状芽孢杆菌的丰度也较高,而肠杆菌的丰度较低。
男婴双歧杆菌更丰富
在新生儿肠道中最早和最丰富的细菌定植者中,已知双歧杆菌可为宿主肠道提供健康益处。改变在从出生后一天到六个月大,在男性和女性阴道分娩的婴儿中观察到双歧杆菌丰度。发现与女孩相比,男孩的双歧杆菌水平更高。
▷儿童时期肠道菌群组成与性别相关的差异
在出生后的前12个月,婴儿的肠道因饮食中引入固体食物而发生变化,随之而来的是微生物群落的变化。
特别是,在引入固体食物后,婴儿大肠中厌氧菌种群的初始定植在数量和组成上开始与成人相似。几项研究表明,在没有饮食变化或抗生素治疗等外部压力因素的情况下,与儿童相比,成年期的肠道微生物群更加稳定和有弹性。
这表明尽管出现了部分趋同,但仍存在差异,因此分析这一生命阶段与性别差异的关系很有价值。
男孩双歧杆菌与乳酸杆菌之间的正相关性比女孩更强
对来自哥伦比亚两个不同地点的277名1至5岁儿童(154名女孩和123名男孩)的评估(研究临床腹泻的存在)表明,粪便微生物群受到多种宿主因素的影响,包括年龄、健康状况、地点和性别。
有趣的是,与女孩相比,健康男孩的双歧杆菌和乳酸杆菌之间存在显著更强的正相关性,而在受腹泻影响的儿童中未观察到显着相关性。
▷青春期与性别相关的肠道菌群差异最明显!
青春期是发展的关键时期,性激素,如雌激素和睾酮,在这个年龄段人群的肠道微生物群中发挥重要作用。
在性激素的影响下异性间微生物群差距变大
一项针对青春期肠道微生物群组成的人类研究表明,与同性双胞胎相比,青少年(13-17岁)异性双胞胎的粪便微生物群差异更大。
最近的一项研究得出结论,与青春期受试者(5-15岁)相比,非青春期的α和β多样性没有差异。随着青春期的开始,梭状芽孢杆菌(Clostridium)的水平降低,而变形杆菌(Proteus)的丰度增加。
在青春期受试者中,发现Adlercreutzia、Ruminococcus、Dorea、Clostridium和Parabacteroides与睾酮水平有关。
考虑到人类这一生命阶段的可用数据有限——必须使用啮齿动物模型的研究作为替代。在小鼠身上进行的实验表明,肠道微生物群的性别差异出现在与性激素水平相关的青春期开始时。
动物实验中青春期的菌群性别差异
特别是,仅在10至13周龄的非肥胖糖尿病青春期后小鼠中检测到α多样性的差异,与雄性相比,雌性的水平显著更高。
此外,雄性小鼠表现出更高丰度的卟啉单胞菌科(porphyromonas)、韦荣球菌科、消化球菌科、乳杆菌科和肠杆菌科与女性相比。而当雄性小鼠被阉割后,这些差异就消失了。
▷成年后肠道菌群组成与性别相关的差异
肠道微生物组在生命的最初几年大部分时间都不稳定,但在成年期变得更加稳定,之后细菌丰富度和组成可能伴随着特定疾病会发生变化。
在整个生命周期中,随着免疫和神经系统的成熟,肠道微生物群的伴随发育是性别二态性的,导致成年男性和女性的不同微生物群落以及免疫和神经炎症通路。
注:年龄、环境(饮食和身体活动)和地理位置在内的多种因素似乎在这些性别依赖性肠道菌群差异中发挥了作用。
分析来自结肠癌研究对照组的82名受试者得出结论,性别与肠道微生物组的整体组成显著相关。然而,这项研究包括的参与者数量相对较少,年龄范围相当广泛(30-83 岁),这可能混淆了研究的结果。
年轻女性肠道微生物α多样性比同年龄男性更高
在包括美国、英国在内的四个地理区域以及来自哥伦比亚和中国的两个队列中评估了年龄在20至69岁之间的三个大型队列中年龄、性别和肠道微生物群α多样性之间的关系。
有趣的是,与同年龄段的男性相比,年轻的成年女性(20-45 岁)表现出更高的α多样性。此外,性别和α多样性之间的关联在年轻人中比在中年人中更为明显,而当参与者的平均年龄为60岁时,男女之间的α多样性没有差异。这可以解释为更年期女性的雌激素水平下降。而更年期之后男性与女性的激素水平差异变小,肠道微生物群的相似程度更接近。
总之,对来自不同国家的男性和女性进行的人口研究发现人体肠道微生物群组成存在性别相关差异。
这意味着,性激素的动态变化会影响肠道共生,而青春期时激素的变化最大,此时男性与女性的肠道微生物群之间的差异非常明显。
注:由于该研究所覆盖的样本量还较小,年龄之间的跨度比较大,仅作为研究参考,还不能用于诊断标准。
整个生命周期中男性和女性肠道微生物群组成的差异
Valeri F,et al.Front Neuroendocrinol.2021
不仅肠道微生物群受性激素的影响,而且肠道微生物群本身也会影响激素水平。
▷ 微生物代谢雌激素进而影响多个器官
生殖内分泌功能涉及由复杂反馈机制控制的多种激素。卵巢、肾上腺和脂肪组织会产生雌激素。体内产生的或作为食物摄入的雌激素可以被肠道微生物代谢。
产生的代谢物再次影响宿主。性激素通过类固醇受体(包括雌激素受体β)直接调节细菌的新陈代谢。
具有雌激素代谢能力的肠道微生物群基因库
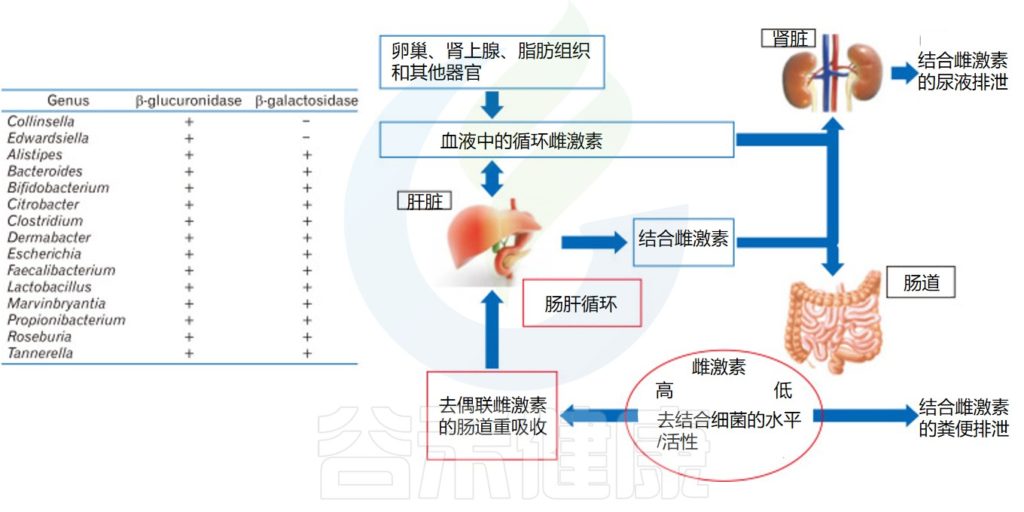
Yoon K,et al.J Neurogastroenterol Motil.2021
同时,具有β-葡萄糖醛酸酶活性的肠道微生物群解离胆汁中排出的结合循环雌激素。去结合使雌激素对系统的重吸收过程成为可能。去结合的雌激素通过雌激素受体循环并影响多个器官,不仅影响生殖器官,还影响骨骼系统、心血管系统和中枢神经系统。
雌激素循环途径
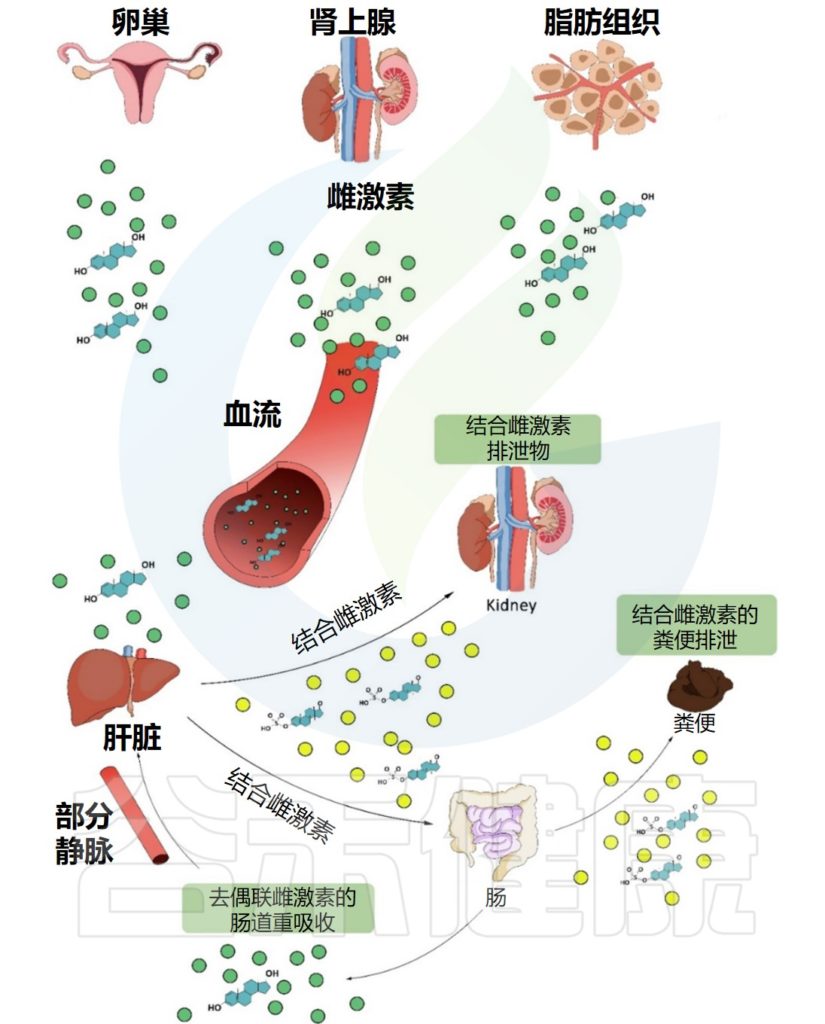
Valeri F,et al.Front Neuroendocrinol.2021
雌激素在几个组织中局部产生(主要是卵巢,但也有肾上腺和脂肪组织)。它们在血液中循环,到达多个靶器官,如肝脏和肾脏。一旦到达肝脏,它们就会通过葡萄糖醛酸化或磺化反应进行结合。
此外,结合雌激素被转化为水溶性分子,随后可以通过胆汁、尿液和粪便排出体外。某些部分的结合雌激素可以在肠道中被肠道微生物分解,并通过门静脉被重新吸收到肝脏中。
雌激素对发病机制具有影响
通常,雌激素与核受体结合,引起构象变化。通过肠道屏障通透性和免疫系统调节,中枢和外周改变与肠易激综合征 (IBS) 相关联。流行病学研究表明女性在肠易激综合征中比例更大,暗示性激素对其发病机制的影响。
雌激素受体作用的分子途径
Yoon K,et al.J Neurogastroenterol Motil.2021
▷ 微生物群影响雄激素的代谢
据报道,在雄激素代谢中,肠道微生物群是一个重要的调节因子。在小鼠的小肠内容物中,葡萄糖醛酸化睾酮和双氢睾酮含量很高。远端肠道具有高水平的游离双氢睾酮。
在年轻成年男性的粪便中观察到明显高水平的未结合双氢睾酮。在无菌小鼠中,葡萄糖醛酸化睾酮和双氢睾酮较高;然而,在远端肠道中发现游离水平非常低。这意味着肠道微生物群会影响双氢睾酮和睾酮的肠道代谢。
▷ 性激素高的人拥有更多样化的肠道微生物
血清睾酮升高的男性和雌二醇水平升高的女性分别拥有更多样化的肠道微生物群,许多细菌属与睾酮(Acinetobacter, Dorea, Ruminococcus和Megamonas)和雌二醇(Slackia和Butyricimonas)水平相关。
高雄激素的女性微生物群明显改变
在这方面,患有多囊卵巢综合征(高雄激素)的女性在妊娠早期到晚期的变化中,表现出明显的微生物群改变,变形菌(Proteobacteria)和放线菌(Actinobacteria)总体增加,丰富度降低。
肠道微生物群组成的性别差异在青春期增加,随着青春期的进展,女孩的肠道微生物群变得与成年人更相似。这些结果可能还表明肠道微生物群可能会影响青春期的时间,可能是通过调节宿主性激素水平。
雌激素水平与肠道微生物多样性密切相关
在男性和绝经后女性中,尿液中的雌激素水平与肠道微生物群丰富度和α多样性密切相关,而绝经前女性雌激素水平在月经周期中收集时变化很大,并未显示出这种关联。
▷ 微生物群可以预测粪菌移植后睾酮水平
最近报道,绝经后妇女的肠道菌群与男性比绝经前妇女更相似,绝经后妇女与同龄男性之间实际上没有显著差异。
这项研究还表明,性腺类固醇与微生物群差异之间存在关联,绝经前妇女的类固醇生物合成和降解途径丰富,并且与血浆睾酮水平显著相关。
此外,微生物群可以预测人类粪便转移后人类和(经抗生素处理的)雄性小鼠的循环睾酮水平。
综上所述,这些结果表明,肠道微生物群组成的差异与性别以及不同激素状态有关。
既然知道了肠道微生物群与性激素之间存在相互作用,那么它们具体是通过什么机制影响的呢?
性激素和肠道微生物组之间相互作用机制
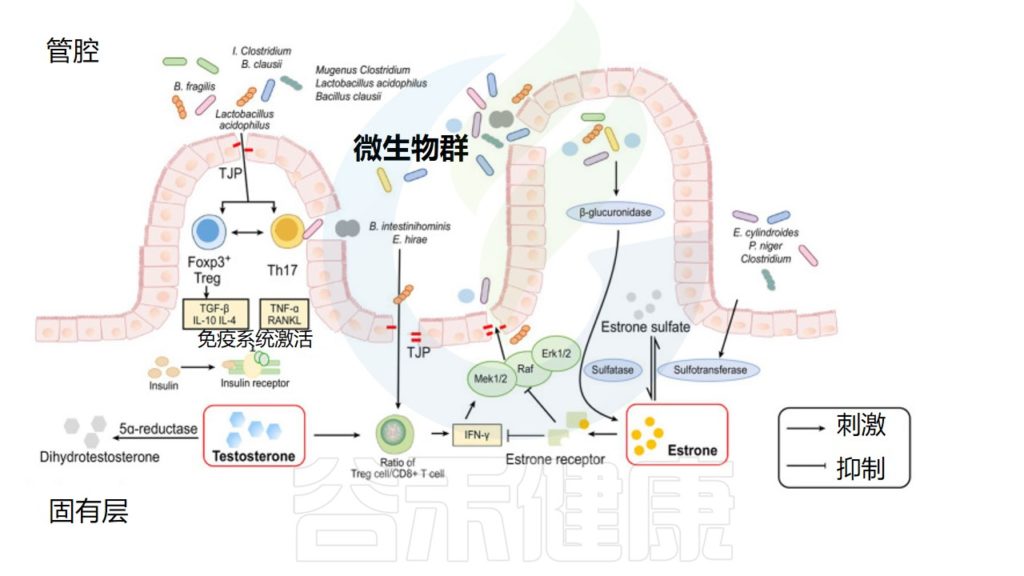
He S,et al.Front Microbiol.2021
1
微生物群通过改变胆汁酸影响性激素水平
最近有人提出,肠道微生物群的部分性别差异可能取决于胆汁酸,因为男性的胆汁酸库比女性大。在肝脏中由胆固醇合成后,它们被肠道微生物群代谢为次级胆汁酸,从而改变微生物群的结构并导致各种病理。
因此,肠道微生物群通过依赖于法尼醇X受体(FXR)的机制调节回肠中成纤维细胞生长因子15(FGF15)和肝脏中胆固醇7α-羟化酶(CYP7A1)的表达,从而调节胆汁酸的二次代谢,并抑制胆汁酸在肝脏中的合成。
FGF15抑制肝脏中CYP7A1的表达,CYP7A1是一种催化和调节胆汁酸合成第一步的酶。
胆汁酸同时也能影响微生物群的结构和丰度
已经观察到胆汁酸的减少导致细菌增殖,并且法尼醇X受体抑制细菌过度生长。
几项研究证实了胆汁酸、性激素和肠道菌群组成之间的关系。通过这种方式,给大鼠服用胆汁酸引起的微生物群变化类似于高脂肪饮食引起的变化,以牺牲拟杆菌属为代价增加厚壁菌门的水平。
此外,粪便微生物群(来自瘦供体)的移植产生了与瘦供体相似的肠道微生物群和胆汁酸库的变化,而小鼠的性腺切除术也改变了胆汁酸模式。
由于睾酮是由胆汁酸衍生的,并且如上所述,胆汁酸水平会被微生物群改变,因此微生物群可能间接影响睾酮水平的说法是成立的。
2
微生物群通过酶促激活性激素
共生微生物群落可以通过其酶的活性影响性激素水平。通过这种方式,术语“strobolome”被创造出来,定义为肠道微生物群中能够从其无活性葡萄糖醛酸苷中激活雌激素的一组基因,这主要归功于β-葡萄糖醛酸苷酶,它将雌激素解离为活性形式。这些活性雌激素进入血液并作用于雌激素受体α(ERα) 和雌激素受体β(ERβ)。
同样,最近的一项研究得出结论,肠道微生物群参与双氢睾酮 (DHT) 和睾酮的代谢和肠道去葡萄糖化,从而导致最高水平的雄激素。
肠道微生物群在性别差异中的另一种可能作用机制可以在羟基类固醇脱氢酶 (HSD) 中找到,这些酶参与类固醇激素的代谢并控制类固醇与其核受体的结合,使它们充当激活剂或抑制剂。
✦ 肠道微生物还通过植物雌激素影响代谢
除了三种主要形式的雌激素(胆固醇衍生的类固醇激素)、雌二醇(E2,在绝经前的非孕妇中占主导地位)、雌酮(E1,在绝经后占主导地位)和雌三醇(E3,在怀孕期间占主导地位),还有一种称为植物雌激素的植物化合物,其结构和功能与雌激素相似。
植物雌激素是天然存在于植物中的化合物,植物雌激素包括异黄酮,如染料木黄酮和黄豆苷原,它们主要存在于大豆中,并在被肠道微生物群代谢后被激活。从这个意义上说,肠道微生物群允许从黄豆苷元中获得O-Desmethylangolensin (ODMA) 和雌马酚,这两种物质都具有雌激素活性。
与雌激素类似,植物雌激素通过影响细胞信号传导引起生理效应,因为它们可以通过激活或抑制雌激素受体α或雌激素受体β来诱导或抑制雌激素作用,并且还可能引发表观遗传效应和细胞内信号级联反应。
植物雌激素可以调节内分泌系统改善病症
与此相关的是,几项人类研究表明,植物雌激素可以通过调节内分泌系统来改善各种病症,包括更年期症状,并且可以逆转代谢性内毒素血症的症状。
在这方面,植物雌激素代谢物雌马酚通过促进雌激素的尿液排泄和改变女性的血液水平,与降低女性激素相关疾病的风险有关,而不产生O-Desmethylangolensin与肥胖有关。
植物雌激素在饮食中被消耗,因为它们出现在水果、蔬菜、豆类和一些谷物中。事实上,饮食成分对肠道微生物群生态系统具有急性影响。通过促进更多样化和更稳定的微生物系统的发展,以植物为基础的饮食似乎对人类健康更有益。
!
药物和益生菌治疗的性别差异
已有一些关于药物治疗和微生物群性别差异的报道。
▷男女服用同一种抗炎药后微生物变化有差异
一项人体研究调查了23名健康男性和女性在非甾体抗炎药诱导的肠道屏障功能和微生物组方面的差异。使用 16S 核糖体 RNA 测序确定了十二指肠和粪便微生物群组成。健康女性的肠道通透性较低,十二指肠和粪便微生物多样性高于健康男性。
两性服用吲哚美辛后肠道通透性增加。然而,只有雌性在摄入吲哚美辛后粪便微生物多样性下降,包括普氏菌丰度增加。十二指肠微生物群组成没有表现出性别特异性变化。
▷益生菌给药存在性别差异
如今,益生菌因多种原因而流行,并且有人认为其效果可能因性别而异。
一项研究报告说,将5种乳杆菌菌株的益生菌混合物给予易患狼疮的小鼠可改善肾功能,并在雌性和阉割的雄性小鼠中显示出抗炎作用,但在性腺完整的雄性小鼠中则没有,这表明益生菌给药存在性别差异。
另一项研究报告了金枪鱼油和海藻油混合物对肠道微生物群的抗衰老作用存在性别差异。雄性小鼠在特定混合油比例下表现出比雌性小鼠更好的抗衰老效果。
肠道菌群失调引发的疾病在两性之间表现不同。研究最多的疾病主要是代谢性疾病。研究发现,性激素等多种因素影响这些疾病,它们密切相关,相互作用。
▸ 全球肥胖发病率越来越高
肥胖症的体重指数(BMI)为30kg/m2或更高,在全球各国成人和儿童中的流行率都在增加。这种病理学是复杂的遗传、社会经济和文化相互作用的结果,会导致严重的健康、经济和社会问题。
科学研究表明,一些代谢紊乱的发生与身体脂肪的分布有关,而且这种分布表现出性别二态性。脂肪倾向于堆积在男性的躯干和腹部周围,而女性的脂肪一般在臀部和大腿周围。
•腹部肥胖
腹部肥胖,尤其是内脏肥胖,会导致血糖和甘油三酯升高、高密度脂蛋白胆固醇降低和低密度脂蛋白 (LDL) 颗粒的增加,以及炎症标志物的增加 。
•臀部肥胖
相反,臀部脂肪与保护性脂质和葡萄糖水平以及降低代谢风险有关,似乎通过长期脂肪酸储存和有益的脂肪因子水平(与瘦素和脂联素水平呈正相关,与炎性细胞因子水平负相关)发挥其保护作用。
肥胖中的微生物多样性和性激素
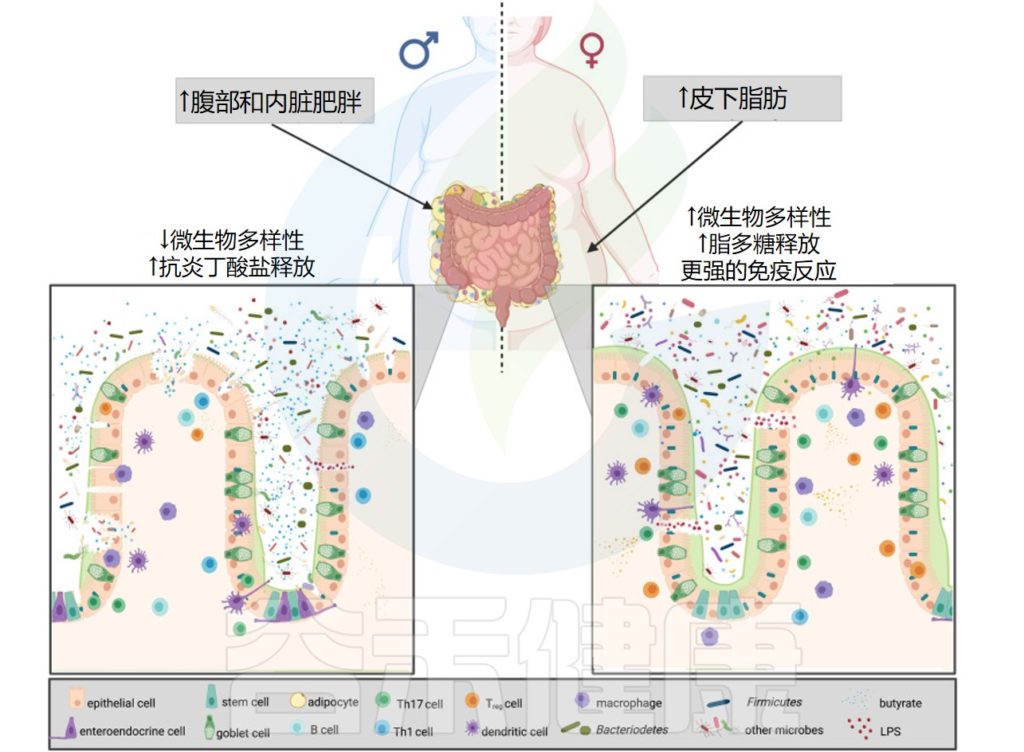
Brettle H,et al.Front Immunol.2022
在肥胖症中,拟杆菌门决定了疾病的严重程度。肥胖男性的物种丰富度较低,并且发现睾酮与厚壁菌门增加有关,因此会释放更多的抗炎丁酸盐。
另一方面,肥胖女性尽管微生物多样性更高,但雌二醇和拟杆菌增加,导致脂多糖释放更多,从而引发更强的免疫反应。
脂肪组织分布、性激素和肥胖的代谢紊乱
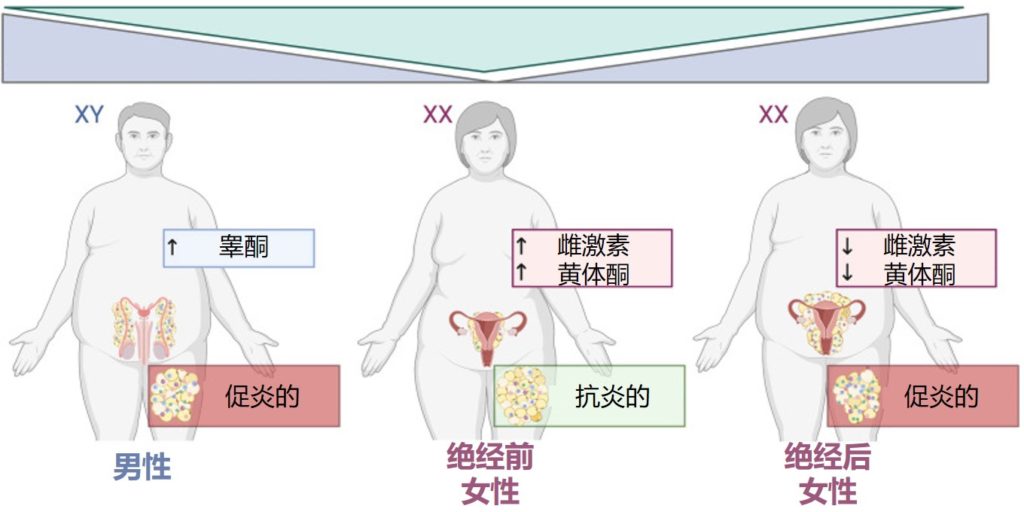
Brettle H,et al.Front Immunol.2022
与绝经前女性相比,男性和绝经后女性心血管风险增加,腹部/内脏肥胖和胰岛素皮下脂肪分布减少。男性和绝经后女性体内的脂肪组织比绝经前女性的脂肪组织更具促炎性。
√性激素调节身体脂肪分布
大量证据支持性类固醇调节身体脂肪分布的观点。在这方面,青春期激素的变化与不同性别之间的体重增加有关,这是由于男孩的瘦体重增加和女孩的脂肪量增加,以及男性和女性的脂肪分布。
此外,几项研究表明,一些基因参与了在体脂分布中观察到的性别二态性,以及性类固醇激素在这些基因调节中的潜在作用。
睾酮影响不同部位的脂肪堆积
在男性中,睾酮抑制腹内区域甘油三酯的摄取,并似乎促进它们在皮下区域的积累,同时导致儿茶酚胺刺激的皮下脂肪分解减少,而不是内脏脂肪分解。
这些过程似乎受到雄激素受体 (AR) 基因的影响,因为在雄激素受体敲除小鼠模型中,雄激素受体的缺失通过减少脂肪分解导致肥胖增加,尤其是晚期肥胖。
此外,caveolin-1蛋白(CAV1)似乎在脂肪堆积中起着重要作用,并且它受雌激素(雌二醇)和雄激素(双氢睾酮)的不同调节。
√性激素影响脂肪细胞功能
在细胞水平上,已经观察到性激素(雄激素和雌激素)对白色脂肪组织中脂肪细胞功能影响的差异,涉及脂肪细胞分化、脂肪分解、脂肪生成、胰岛素敏感性和脂肪因子产生/分泌等关键方面。
在这种情况下,睾酮和双氢睾酮调节小鼠间充质干细胞的分化,以雄激素依赖性方式分别促进和抑制它们向肌细胞和脂肪细胞的分化。
双氢睾酮增加脂肪分解
同样,在对人体细胞进行的体外研究中,双氢睾酮以雄激素受体依赖性方式抑制人间充质干细胞和人前脂肪细胞的脂肪形成分化,增加脂肪分解并减少脂质积累。
睾酮阻止脂肪细胞肥大和脂肪细胞生成
在阉割小鼠(雄性性腺功能减退症模型)中,脂肪量通过脂肪细胞肥大和脂肪生成增加,而当这些小鼠接受激素替代疗法时,睾酮阻止内脏和皮下脂肪量的扩张。
此外,致肥胖脂肪生成也通过抑制雄激素受体活性而升高。这项研究还显示了脂肪分布的不同调节,睾酮衍生的雌二醇和双氢睾酮分别阻止了内脏和皮下脂肪的增加。
√睾酮浓度较高利于减少内脏脂肪
睾酮浓度与向心性肥胖呈负相关,并且已发现睾酮治疗可减少具有雄激素缺乏症状和低血清睾酮水平的男性的内脏脂肪。
睾酮含量下降后脂肪更多的积累
此外,随着年龄的增长,睾丸激素的下降伴随着肥胖的增加,腹部脂肪的优先积累和内脏脂肪组织的更多积累。
还有报道称,内脏脂肪组织与生物可利用和游离睾酮呈负相关,皮下脂肪组织与性激素结合球蛋白 (SHBG) 呈负相关。
√雌二醇水平较低的女性易患向心性肥胖
在女性中,向心性肥胖与睾酮水平升高和雌二醇降低相关。更年期的荷尔蒙变化导致脂肪重新分布,与总脂肪和年龄无关,然而,一些研究表明,绝经后上半身脂肪的分布可能是由于衰老而不是绝经本身。
向心性肥胖——指患者体内脂肪沉积是以心脏、腹部为中心发展的一种肥胖类型。
最近发现,绝经前妇女的身体或躯干脂肪量与较低的总雌二醇和较高的游离雌二醇浓度有关,绝经前和绝经后妇女的总睾酮和计算游离睾酮浓度较高,性激素结合球蛋白和胰岛素样生长因子-I(IGF-I)浓度较低。
▼
代谢综合征是一种以腹部肥胖、胰岛素抵抗、高血压和高血脂为特征的病理状况,已遍布全球并导致2型糖尿病、冠心病和中风等疾病患病率上升。
性激素对肥胖、代谢综合征和2型糖尿病的影响

Santos-Marcos JA,et al.Biol Sex Differ.2023
√代谢综合征患者中男女的菌群差异
在代谢综合征患者中也观察到特定菌属的丰度差异。男性中韦荣氏球菌属(Veillonella)、Methanobrevibacter、Acidaminococcus、梭状芽孢杆菌(Clostridium)、罗氏菌属(Roseburia)和Faecalibacterium的丰度较高,而女性中嗜胆菌属(Bilophila)、瘤胃球菌属(Ruminococcus)和拟杆菌属(Bacteroides)的丰度更高。
√睾酮水平会影响代谢综合征
在睾酮对代谢综合征的影响中观察到的性别二态性似乎是雄激素受体依赖性的,并且已经提出了几种机制来解释睾酮水平与代谢综合征之间的关联。
男性中睾酮水平高不易患代谢综合征
在男性中,有证据表明睾酮与内脏肥胖、胰岛素抵抗和代谢综合症的发展呈负相关。沿着这些思路,在男性和啮齿动物中都报道了睾酮的雄激素受体介导的抗肥胖作用。
过量的睾酮可能导致女性胰岛素分泌受损
在女性中,据报道睾酮水平升高与胰岛素抵抗和葡萄糖耐受不良相关,因为它会降低全身葡萄糖的摄取。
关于睾酮对胰腺的作用,一项小鼠研究表明,雄激素受体调节男性胰岛β细胞生理,因此该受体的缺乏会降低葡萄糖刺激的胰岛素分泌并导致葡萄糖耐受不良。相反,有人提出,过量的睾酮可能通过雄激素受体依赖性机制导致女性胰岛β细胞功能障碍,胰岛素分泌受损。
√雌激素缺乏的女性代谢综合征患病率较高
雌激素水平似乎也影响代谢综合症的患病率。因此,大鼠卵巢切除术引起的雌激素耗竭导致大多数代谢综合征成分(脂质、葡萄糖、高密度脂蛋白和低密度脂蛋白)恶化,而在50岁以下的女性中,即经历更年期,其患病率增加。
卵巢切除的女性血糖和血压升高
此外,据报道,在接受过子宫切除术(通常伴随双侧卵巢切除术以预防后续卵巢癌)的女性中,血糖水平和高血压升高。
绝经导致性激素结合球蛋白水平下降,至少部分是由于雌激素减少,而睾酮水平在绝经期间没有改变 。从这个意义上说,绝经可以被认为是代谢综合征及其独立于年龄的所有独立组成部分的预测因素(风险因素)。
此外,已经描述了性激素结合球蛋白和代谢综合征之间的负相关,尤其是在绝经后妇女中。
▼
糖尿病包括一组疾病,根据其发展机制进行区分,这些疾病会降低调节血流中葡萄糖水平的能力,并导致长期高血糖症。
由于自身免疫和代谢过程,糖尿病有两种主要形式,即胰岛素依赖型糖尿病(1型糖尿病,T1D)和非胰岛素依赖型糖尿病(2型糖尿病,T2D)。
2型糖尿病的特征是胰岛B细胞产生的胰岛素不足和肝脏葡萄糖代谢受损,以及胰岛素抵抗,导致组织对胰岛素的反应性降低。
√糖尿病前期的症状表现出性别差异
空腹血糖受损 (IFG) 和葡萄糖耐量受损 (IGT) 作为2型糖尿病的前期阶段发生,表现出性别二态性,葡萄糖耐量受损在女性中更常见,而空腹血糖受损在男性中更常见。
有人提出,性激素可能是造成这种二态性的原因。事实上,更年期的雌激素治疗会降低空腹血糖并恶化葡萄糖耐量。
√男性的2型糖尿病发病率高于女性
此外,已证实男性的2型糖尿病发病率高于女性,这进一步支持了性激素参与这种病理学的发展。更年期2型糖尿病的风险增加,而更年期的激素治疗可能会延迟2型糖尿病的发作。
√睾酮水平影响男性2型糖尿病患病率
患有2型糖尿病的男性总睾酮和游离睾酮水平较低。与此相关的是,低水平的睾酮和性激素结合球蛋白与男性胰岛素抵抗和随后的2型糖尿病的发展有关。
低睾酮水平男性死亡率增加
此外,高水平性激素结合球蛋白和低水平睾酮的结合与2型糖尿病男性死亡率增加有关。其他研究表明,在患有2型糖尿病的男性中,低睾酮水平本身与死亡率增加相关,而睾酮替代疗法可能会提高这些男性的生存率。
同样,据报道,经过2年的睾酮治疗后,患有2型糖尿病的男性比例有所降低。此外,已发现前列腺癌的雄激素剥夺疗法会增加患糖尿病的风险。
患有2型糖尿病的男性睾酮水平往往较低
与上述一致,患有2型糖尿病的男性往往睾酮水平较低,而且他们中的大多数患有性腺功能减退症。事实上,许多研究已经证实,患有性腺功能减退症和低睾酮水平的肥胖2型糖尿病患者在接受睾酮替代疗法 (TRT) 后表现出改善的胰岛素抵抗和血糖控制。
√雌二醇水平高的男性患2型糖尿病的风险增加
关于女性荷尔蒙,雌二醇水平高的男性患2型糖尿病的风险增加,这种高雌二醇浓度与低性激素结合球蛋白浓度一起对男性患2型糖尿病的风险产生不利影响。
√女性睾酮水平较高可能易患2型糖尿病
与男性相反,女性的高睾酮水平与胰岛素抵抗和2型糖尿病相关。然而一项研究表明,中国女性性激素结合球蛋白值升高与患2型糖尿病的可能性降低相关,但雌二醇和睾酮水平与该族群中的2型糖尿病无关。
注:这些关于睾酮与2型糖尿病发病率之间关系的相互矛盾的结果可能是由于睾酮的测量,一些作者使用总睾酮而其他人使用游离睾酮,并且根据最近的一项研究,不同研究的分析方法可能不同。
此外,当性激素结合球蛋白浓度低于30nmol/L时,游离雄激素指数(FAI)不是游离睾酮的可靠指标,这将导致性激素结合球蛋白水平较低的女性可能出现研究错误。
因此,在女性中,总睾酮与2型糖尿病之间没有关联,尽管游离睾酮水平较高与2型糖尿病风险增加有关。
√雌二醇水平异常会增加2型糖尿病发病率
关于雌二醇,据报道患有2型糖尿病的绝经后女性的雌二醇水平高于健康女性。然而,基于早期初潮或绝经以及子宫切除术和卵巢切除术实践的大量证据表明,非生理性雌二醇水平(高于或低于正常值)可能是导致2型糖尿病发病率增加的原因。
月经初潮提前会增加2型糖尿病的风险
在这方面,月经初潮提前似乎会增加患2型糖尿病的风险。然而,一些研究表明,初潮早导致的2型糖尿病风险的部分原因可能是肥胖增加,因为早期月经初潮已被证明也与成年期体重指数的增加有关。
提前绝经和卵巢功能不全导致2型糖尿病风险增加
另一方面,提前绝经或卵巢功能不全会导致患2型糖尿病的风险增加。在接受双侧卵巢切除术的绝经后妇女中也观察到了类似的结果。
切除卵巢的女性2型糖尿病风险增加
最后,伴有双侧输卵管卵巢切除术(BSO)的子宫切除术显示2型糖尿病的风险高于子宫切除术本身。然而,其他研究表明子宫切除术与2型糖尿病风险增加有关,而双侧输卵管卵巢切除术本身或与子宫切除术一起并没有增加2型糖尿病的风险。
研究表明表明接受子宫切除术或卵巢切除术的女性患2型糖尿病的风险增加,但并未区分这两种情况是单独发生还是同时发生。
另一项研究表明,相对于完整女性,双侧卵巢切除的子宫切除女性的总睾酮和生物可利用睾酮水平较低,而保留卵巢的子宫切除女性的睾酮水平居中。
与此相关,绝经后妇女(子宫完整和子宫切除)的雌激素和孕激素激素疗法降低了糖尿病的发病率。
▼
肠易激综合征是一组持续或间歇发作,以腹痛、腹胀、排便习惯或大便性状改变为临床表现,胃肠道结构和生化异常的肠道功能紊乱性疾病。
√女性患肠易激综合征的比例更高
肠易激综合征 (IBS) 是一种具有性别差异的代表性疾病,通常在女性中的发生频率是男性的两倍。特别是,到三级中心就诊的患有严重症状的肠易激综合征患者的女性比例更高。
感染性结肠炎后肠易激综合征的风险增加,约10%的肠易激综合征患者在感染性结肠炎后开始出现症状。有趣的是,感染后肠易激综合征的发病率在女性中较高,这表明性别间肠道微生物群的差异可能在肠易激综合征的发病机制中发挥重要作用。
√肠易激综合征的症状存在性别差异
女性更有可能出现腹痛和便秘
肠易激综合征症状存在性别差异:具体而言,IBS-C在女性中占主导地位,而IBS-D在男性中占主导地位。
便秘型肠易激综合征(IBS-C)是肠易激综合征的一种亚型:至少25%的排便为硬粪或干球粪,且松散(糊状)粪或水样粪<25%。
腹泻型肠易激综合征(IBS-D):至少25%的排便为松散(糊状)粪或水样粪,且硬粪或干球粪<25%。
在对22项关于肠易激综合征症状性别差异的研究进行的系统回顾和荟萃分析中,发现女性比男性更可能出现腹痛和便秘相关症状。便秘型肠易激综合征在患有肠易激综合征的女性中的合并患病率为40%,而在患有肠易激综合征的男性中为21%。
男性出现腹泻症状更多
相比之下,患有肠易激综合征的男性比女性更有可能报告腹泻相关症状。腹泻型肠易激综合征(IBS-D)在患有肠易激综合征的女性中的合并患病率为 31%,而在男性中为50%。
√女性月经期间肠易激综合征症状加重
女性在月经期间报告更频繁和更严重的肠易激综合征症状,例如稀便、腹胀和腹痛加重,这些症状的增加可能与月经周期的变化有关。
在冰岛进行的一项基于人群的邮政研究表明,患有痛经的女性比没有痛经的女性更容易出现肠易激综合征症状。此外,更年期似乎与肠易激综合征症状的恶化有关。也就是说,女性在绝经后报告的腹痛比绝经前更严重。
此外,纤维肌痛、慢性疲劳综合征、慢性盆腔痛和偏头痛等经常与肠易激综合征重叠的慢性疼痛疾病的患病率在肠易激综合征女性中更高,这表明她们的症状与激素之间存在关联。
▼
甲状腺是重要的内分泌腺。甲状腺的主要功能是分泌含碘的甲状腺激素三碘甲状腺原氨酸(T3)和甲状腺素(T4)以及肽类激素降钙素,通过影响新陈代谢和组织发育来影响心血管和生殖疾病。
肠道微生物群在甲状腺疾病中起着至关重要的作用,包括桥本氏甲状腺炎 (HT) 和格雷夫斯氏病 (GD)。桥本氏甲状腺炎和格雷夫斯氏病分别是甲状腺功能减退症和甲状腺功能亢进症的主要原因。
√女性甲状腺疾病发病率高于男性
甲状腺疾病性别差异特别的显著,它的高发人群多为中年的女性,男性的患病率相对来说比较低,而之所以会这样是因为女性的内分泌活跃程度很高,没有一定的稳定性。
在平时压力大和情绪发生变化的情况下,会导致自身的免疫调节出现异常,致使甲状腺激素分泌过多,从而就会容易造成甲状腺疾病的发生。
√胆汁酸的组成可以反映甲状腺功能
胆汁酸是肠道微生物群的重要代谢产物,在甲状腺疾病中起着至关重要的作用。甲亢和甲减患者的血清胆汁酸谱不同,胆汁酸的组成可以反映甲状腺功能。甲状腺功能减退患者中最主要的胆汁酸是次级胆汁酸脱氧胆酸,而鹅去氧胆酸是甲状腺功能亢进患者中最主要的胆汁酸。
胆汁酸的组成和水平参与甲状腺激素的分泌,促甲状腺激素水平与亚临床甲减患者血清总胆汁酸呈负相关。
√短链脂肪酸与甲状腺激素相互作用影响女性情绪健康
短链脂肪酸是肠道菌群代谢的主要产物之一,短链脂肪酸与甲状腺激素三碘甲状腺原氨酸相互作用,并通过调节肠细胞基因转录来影响激素的分泌。例如,粪便短链脂肪酸酯可通过影响高脂血症和甲状腺疾病来影响女性的情绪健康。
▼
卵巢癌症的病因尚不清楚,可能与环境、生殖、行为和遗传因素有关。在这些因素中,雌激素水平的失调和雌激素的活性被认为是重要因素。
肠道微生物群可能通过影响雌激素水平参与卵巢的发育。发现17β-雌二醇治疗会改变卵巢癌小鼠模型的病理生理学,导致肿瘤提前发作、缩短总生存时间,并具有典型的乳头组织学特征。
√雌激素促进细胞粘附和迁移从而影响卵巢癌的病症
利用不同的卵巢癌症细胞系进行了一项体外研究,以确认雌激素受体在卵巢癌症病因中的需求。
他们的结果表明,雌激素治疗后,雌激素受体阳性细胞系的粘附和迁移能力增强,而雌激素受体阴性细胞系的粘附和移动能力没有显著变化。
这些结果表明,雌激素的作用与雌激素受体的表达直接相关,雌激素促进细胞粘附和迁移,从而影响卵巢癌症的转移和定植。
√微生物通过影响活性雌激素含量影响卵巢癌
如上所述,具有 β-葡萄糖醛酸酶活性的细菌可以介导雌激素的去结合,从而影响循环中活性雌激素的数量。结合雌激素水平和活性在卵巢癌病因学中所起的作用,我们可以推断肠道微生物组可能通过影响活性雌激素的量来促进雌激素驱动的疾病(如卵巢癌)的发展。
▼
绝经后骨质疏松症 (PMOP) 是一种由雌激素缺乏引起的骨质疏松症,会导致绝经后妇女骨折频率增加。
√雌激素缺乏易引起骨质疏松
目前的研究表明,肠道微生物群与骨重塑以及骨代谢疾病之间存在潜在的密切关系。
研究人员发现,在无菌小鼠中,性类固醇缺乏不能诱导破骨细胞因子表达增加、骨吸收激活,这表明肠道微生物组在性类固醇缺乏导致的骨质疏松中至关重要。
他们进一步证明,用益生菌鼠李糖乳杆菌或市售益生菌补充剂每周两次治疗性类固醇缺乏小鼠可以避免骨质疏松。这种情况的发生可能是由于肠道通透性的降低、肠道和骨髓炎症的抑制。
相比之下,补充非益生菌大肠杆菌菌株或突变鼠李糖乳杆菌并没有显示出对骨丢失的保护作用。
上述结果表明,肠道微生物群失调可能导致肠道通透性增加,并触发重要炎症通路的激活,从而导致性类固醇缺乏小鼠的骨质流失。
这些结果将雌激素缺乏引起的骨质疏松症与肠道微生物多样性、肠道通透性和炎症联系起来。
▼
√高雄激素可能导致多囊卵巢综合征
多囊卵巢综合征是育龄妇女常见的内分泌疾病,其病因可能与高雄激素血症、胰岛素抵抗和神经内分泌功能障碍有关。
一些研究关注多囊卵巢综合征患者的肠道微生物组,这些研究发现肠道微生物组与多囊卵巢综合征之间存在某种关联。然而,与多囊卵巢综合征相关的微生物的确切机制尚未确定。
√多囊卵巢综合征患者肠道微生物多样性较低
一些研究人员发现,患有多囊卵巢综合征的患者肠道微生物组的多样性明显低于健康对照组。在多囊卵巢综合征患者的肠道微生物组中,普通拟杆菌(Bacteroides vulgatus)显著升高,脱氧胆酸和熊去氧胆酸水平降低。
通过比较多囊卵巢综合征女性的粪便微生物组、肠上皮通透性和炎症状态,一些研究提出了一个假设,即肠上皮高通透性导致的毒血症与炎症、胰岛素抵抗和高雄激素血症有关。不过还需要更深入的研究来阐明内毒素血症的具体机制。
√调节肠道微生物有助于改善多囊卵巢综合征
菊粉和二甲双胍对多囊卵巢综合征的缓解作用与抗炎和肠道微生物群的调节有关,这可能有助于多囊卵巢综合症的潜在临床治疗。
环丙孕酮Diane-35(雌激素和孕激素)和益生菌可以帮助重建肠道微生物群的多样性,减少肠道菌群紊乱可以改善多囊卵巢综合征样大鼠的生殖功能。
还需要进一步的研究来确定改善肠道微生物组是否可以作为多囊卵巢综合征的有效治疗方法。
小结
根据性激素和肠道微生物组之间的相互作用,性激素相关疾病的可能治疗策略的显示在下图:
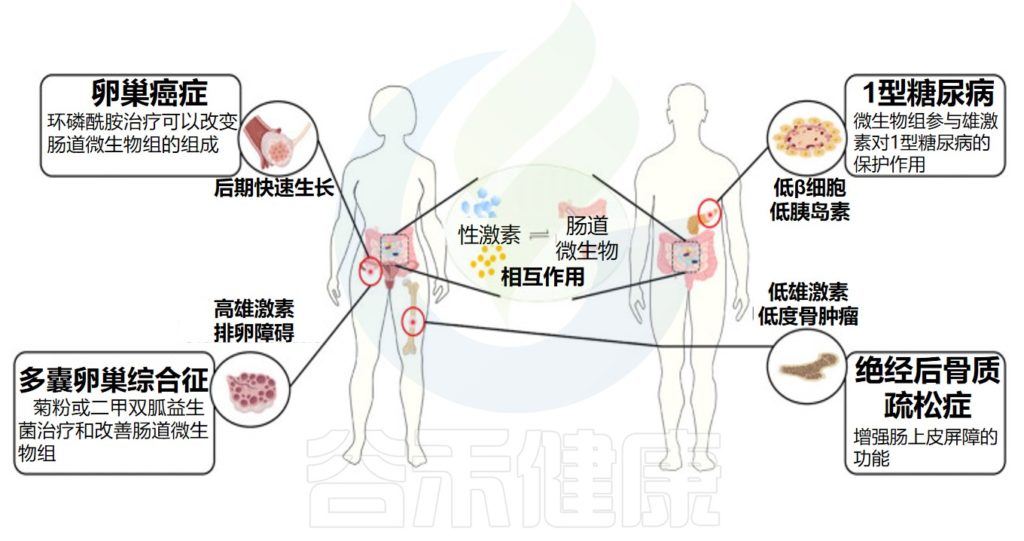
He S,et al.Front Microbiol.2021
在对性激素相关疾病治疗的过程中发现了肠道微生物群的变化,未来通过对肠道微生物的检测或许有助于判断性激素相关疾病的治疗效果。
性激素,特别是雌激素和睾酮,与肠道微生物群的结构和组成有关,性激素与肠道微生物群的相互作用对疾病的发展和性别差异具有重要影响。
肠道微生物群的特定变化可能有助于缓解激素紊乱相关的疾病,因此肠道微生物群被认为是一个重要治疗靶点。
在制定治疗策略时,确定导致疾病发病率中性别二态性的机制具有特殊的重要性,因为肠道微生物群的组成取决于与性激素的相互作用以及其他因素。治疗与这些疾病相关的肠道微生物群失调的疗法可能具有性别特异性效应。
总之,肠道微生物群与激素相互作用在疾病中的影响已经成为了一个备受关注的研究领域。肠道微生物群在激素变化及其带来的健康风险的重要作用及其检测的意义也被越来越多的人所认识。未来,随着相关研究的不断深入,肠道微生物群与激素相互作用的机制和应用价值也将会进一步得到探索和发展。
主要参考文献
Santos-Marcos JA, Mora-Ortiz M, Tena-Sempere M, Lopez-Miranda J, Camargo A. Interaction between gut microbiota and sex hormones and their relation to sexual dimorphism in metabolic diseases. Biol Sex Differ. 2023 Feb 7;14(1):4.
Li D, Sun T, Tong Y, Le J, Yao Q, Tao J, Liu H, Jiao W, Mei Y, Chen J, Liu Z, Wang G, Li Y. Gut-microbiome-expressed 3β-hydroxysteroid dehydrogenase degrades estradiol and is linked to depression in premenopausal females. Cell Metab. 2023 Apr 4;35(4):685-694.e5.
Brettle H, Tran V, Drummond GR, Franks AE, Petrovski S, Vinh A, Jelinic M. Sex hormones, intestinal inflammation, and the gut microbiome: Major influencers of the sexual dimorphisms in obesity. Front Immunol. 2022 Sep 27;13:971048.
Kautzky-Willer A, Harreiter J, Pacini G. Sex and Gender Differences in Risk, Pathophysiology and Complications of Type 2 Diabetes Mellitus. Endocr Rev. 2016 Jun;37(3):278-316.
Saklayen MG. The global epidemic of the metabolic syndrome. Curr Hypertens Rep. 2018;20(2):12.
Paschou SA, Papanas N. Type 2 diabetes mellitus and menopausal hormone therapy: an update. Diabetes Ther. 2019;10(6):2313–2320.
Valeri F, Endres K. How biological sex of the host shapes its gut microbiota. Front Neuroendocrinol. 2021 Apr;61:100912.
Kim YS, Unno T, Kim BY, Park MS. Sex Differences in Gut Microbiota. World J Mens Health. 2020 Jan;38(1):48-60.
Yoon K, Kim N. Roles of Sex Hormones and Gender in the Gut Microbiota. J Neurogastroenterol Motil. 2021 Jul 30;27(3):314-325.
He S, Li H, Yu Z, Zhang F, Liang S, Liu H, Chen H, Lü M. The Gut Microbiome and Sex Hormone-Related Diseases. Front Microbiol. 2021 Sep 28;12:711137.

谷禾健康

越来越多的证据表明,肠道菌群定植紊乱和微生物多样性减少与全球非传染性疾病 (NCD) 的增加有关。影响儿童和青少年的非传染性疾病包括肥胖及其相关合并症、自身免疫性疾病、过敏性疾病和哮喘。饮食变化也与非传染性疾病的发病机制有关,并且由于饮食是肠道微生物群组成和功能的主要驱动因素之一,因此人们开始关注通过饮食干预,来促进健康的肠道微生物群,最终促进健康。
一些生物活性营养素,如长链多不饱和脂肪酸 (LC-PUFA)、铁、维生素、蛋白质或碳水化合物,已被确定在婴儿出生后的前 1000 天对婴儿生长、神经发育发挥重要作用,以及肠道菌群的建立和成熟。LC-PUFA 是中枢神经系统 (CNS) 的结构成分,对视网膜发育或海马可塑性至关重要。最近,乳脂球膜 (MFG) 的成分被添加到婴儿配方奶粉中,因为它们在婴儿发育中起着关键作用。
大量摄入蛋白质会导致婴儿期体重增加更快,但这与后来的肥胖有关。可消化的碳水化合物提供葡萄糖,这对中枢神经系统的充分运作至关重要;不易消化的碳水化合物 [例如人乳低聚糖 (HMO)] 是肠道细菌的主要碳源。婴儿期缺铁性贫血与精神和精神运动发育的改变有关。与维生素 B6 和 B12 密切相关的叶酸代谢控制表观遗传变化。
从历史上看,重点一直放在早期营养对生长模式和儿童体脂成分的影响上。证据表明,生命早期摄入过多的能量和快速或缓慢的生长模式与不良的发育结果有关;事实上,婴儿期体重快速增加是晚年肥胖的重要预测指标。
肠道菌群与营养失调与多种儿科疾病有关,营养素的摄入和肠道微生物群的定植和成熟是相互关联的,因此通过饮食干预来促进健康的肠道微生物群是一种有前途的方法,可以改善儿童健康结果。

本文讨论和总结评估营养和肠道微生物群对儿童健康结果影响的临床研究的最新发现,并分享使用营养方法有利地改变肠道微生物群以改善儿童健康结果的研究成果。
脂肪酸是许多脂质的主要成分,必须通过婴儿饮食提供必需的脂肪酸,以实现健康成长、神经发育、免疫系统和胃肠功能。
婴儿的脂肪摄入量占比
在生命的头几个月,多不饱和脂肪酸 (PUFAs) 的需求增加,因为快速生长和神经发育。婴儿的脂肪摄入量在母乳喂养期间很高,从开始添加辅食后的第一年下半年逐渐减少。脂肪营养需求量占每日总能量摄入:
细分各类脂肪酸的摄入量
最近,不同的国家确定亚油酸的摄入量应占总能量的 4%,而 α 亚麻酸应占总能量的 0.5%。
长链多不饱和脂肪酸 (LC-PUFAs)、n-3 二十二碳六烯酸 (DHA, 22 : 6n-3) 和花生四烯酸 (ARA, 20 : 4n-6) 是中枢神经系统细胞膜的功能成分,在神经传递具有关键作用。
欧洲食品安全局 (EFSA) 委员会已确定:
0 ~ 24 个月的 DHA 摄入量为 100 毫克/天;
0 ~不到6个月的 ARA 摄入量为 140 毫克/天;
ARA 和 DHA 由母乳提供
婴儿的 DHA 状态是通过母乳提供的,它取决于母亲的 DHA 状态;尽管如此,母乳中的 ARA 浓度始终接近总脂肪酸的 0.5%,通常高于 DHA,与 DHA 相比更稳定。
与大脑发育相关的脂肪酸
大量的 n-3 和 n-6 LC-PUFA 在器官和组织的膜中迅速积累。在胎儿生命的最后三个月和生命的头两年,DHA 在脑组织中积累,特别是在与注意力、运动控制和感觉统合相关的灰质区域,而 ARA 负责海马可塑性。
已经表明,ARA 的延伸产物肾上腺酸 (ADA,22:4n-6) 是细胞膜中的重要成分。ADA构成了大脑中近一半的n-6 LC-PUFA,n-6 LC-PUFA的含量远远超过n-3 LC-PUFA。
均衡摄入DHA和ARA对大脑功能和发育至关重要
事实上,生命早期较高的 DHA/ARA 比率与更好的认知结果相关。已经表明,神经发育结果有利于 DHA 与 ARA 的比例为 1:1 或 1:2,而与1:1和1:2的比例相比,1.5∶1的比例会降低大脑发育过程中红细胞中ARA的浓度。
在脂肪酸摄入量和线性生长之间建立关系的研究得出了不同的结论。其中一些人认为必需脂肪酸对于婴儿期的最佳线性生长很重要,也有研究人员没有发现任何关联。
乳脂球膜蛋白的健康益处
另一方面,脂肪的研究工作表明,乳脂球膜 (MFGM) 蛋白代表母乳的生物活性部分,可提供一些健康益处。这种膜组分由不同的生物活性成分(磷脂酰胆碱、鞘磷脂、胆固醇和脑苷脂、神经节苷脂等)组成,它们对大脑发育和免疫功能有积极影响并保护新生儿胃肠道调节肠道菌群组成。
饮食中脂肪酸的分布与肠道菌群的关联
我们通常认为饮食中脂肪过多会造成肥胖,实际上,饮食中脂肪酸的分布也可能改变肠道微生物群的组成和肥胖状况。最近,表明人乳中的 sn-2 脂肪酸与婴儿肠道微生物群之间存在显着关联;ARA 和 DHA 与拟杆菌属(Bacteroides)、肠杆菌科(Enterobacteriaceae)、韦荣球菌属(Veillonella)、链球菌属(Streptococcus)和梭菌属(Clostridium)有关,参与短链脂肪酸(乙酸盐、丙酸盐和丁酸盐)生产的细菌,具有重要的免疫调节功能,在抵抗肠道病变的发展等方面发挥着关键作用,并且在母乳喂养后 13-15 天显着增加。
扩展阅读:脂肪毒性的新兴调节剂——肠道微生物组
蛋白质在生命的前 1000 天非常重要,因为它们在细胞结构中发挥着重要作用,并且是酶和神经递质的组成部分。
蛋白质推荐量
在出生后的头 6 个月内,每公斤体重/天的蛋白质推荐量为:
0 至 6 个月大时为 0.58 克;
6 至 36 个月大时为 0.66 克。
母乳中蛋白质种类多,有多种功能
母乳含有 400 多种蛋白质,多种功能如抗菌、免疫调节活性或刺激营养吸收等。蛋白质缺乏会导致生长发育不良以及运动和认知发育迟缓;然而,高蛋白质摄入会导致婴儿期体重增加更快,并与以后的肥胖相关。
使用婴儿配方奶粉喂养的婴儿在生命的前四个月内表现出正常的婴儿生长模式,婴儿的总蛋白质减少 1.0 g/dl(类似于母乳)。
辅食中蛋白质影响婴儿生长及肠道菌群组成
补充食品中的蛋白质来源和摄入量会显着影响婴儿生长并可能影响超重风险;以肉类和奶制品为基础的辅食会导致不同的生长模式,尤其是身高。
同时,补充喂养期间相关类型的富含蛋白质的食物,对配方奶喂养婴儿的肠道微生物组成和代谢物有影响;吃肉的儿童肠道群落富含厚壁菌门和粪杆菌属,同时变形杆菌门和双歧杆菌属减少。
扩展阅读:肠道菌群与蛋白质代谢
碳水化合物需求量
每日总能量摄入中的总碳水化合物需求量占比如下:
0 ~ 6 个月为 40-45%
6 至 12 个月以下为 45-55%
12 至 36 个月以下为 45-60%(接近成年人)
葡萄糖
葡萄糖对于中枢神经系统的充分运作起着关键作用,因为它是生长、神经冲动和突触的主要能量来源。葡萄糖由不同的碳水化合物提供给婴儿,例如乳糖,作为母乳中的主要糖分(范围为 6.7 至 7.8 g/dl),以及多种低聚糖,其含量约为 1 g/dl。
母乳低聚糖
母乳低聚糖 (HMO) 构成了婴儿无法消化的母乳碳水化合物的重要部分。母乳低聚糖具有益生元功能,可喂养胃肠道微生物群,并促进有益菌的生长;此外,它们还与多种生物学功能有关,例如对胃肠道发育和全身免疫的影响、双歧杆菌生成活性和抗感染、炎症调节、肠神经元激活和肠道运动,以及中枢神经系统功能的增强。
母乳低聚糖包括酸性低聚糖,主要是唾液酸化 [例如 6′-唾液酸乳糖 (6′-SL)、3′-唾液酸乳糖 (3′-SL)] 或中性低聚糖 [例如 2′-岩藻糖基乳糖 (2′-FL)]。
岩藻糖基聚糖是母乳中最丰富的母乳低聚糖形式 (80–90%) 。
聚糖
聚糖(glycans)是微生物的碳源,对宿主细胞和微生物之间的识别、信号传导和表观遗传调控至关重要,与广泛的免疫和代谢紊乱有关。双歧杆菌属和乳杆菌属与的生长之间存在显着相关性。在哺乳早期和晚期的婴儿肠道中。
几个临床前模型已经证明母乳低聚糖对认知功能的影响,但人类的临床数据尚未公布。
关于糖没有特定推荐量,2岁以下避免添加糖
关于糖,没有针对婴儿期糖的特定的每日参考摄入量。ESPGHAN 营养委员会建议,避免在 2 岁以下儿童的饮食中添加糖分。还建议避免饮用果汁或含糖饮料,因为过早摄入这些饮料会增加日后患 1 型糖尿病的风险。
为什么婴儿在 6 个月左右时需要添加辅食?与铁等营养素的需求有关
在婴儿出生前,胎儿会从母体中吸收铁元素,积累在肝脏中,以备出生后使用。然而,母乳中的铁含量相对较低,因此在婴儿 6 个月左右时,需要从饮食中摄取外源性铁以满足营养需求。
铁的需求量
0 ~ 6 个月为 0.3 毫克/天;
6 ~ 12 个月以下为 6-11 毫克/天;
12 ~ 36 个月以下的需求量为 3.9-9 毫克/天。
缺铁有哪些影响?
缺铁会影响大脑、神经和精神运动发育,因为铁是神经递质所需酶的组成部分。缺铁会导致携氧能力降低,从而导致生长发育所需的葡萄糖转化受限;这些限制可能导致生长迟缓、体重减轻和年龄增长,但与神经发育不同的是,它们可以通过补铁治疗来克服。
缺铁影响肠道菌群组成
母乳是短双歧杆菌的主要来源,它可以在二价金属通透酶和乳铁蛋白的帮助下获得管腔铁,促进这些有益细菌的生长,并从细菌病原体中隔离铁。缺铁导致肠道微生物群落失调,这反映在肠杆菌科(Enterobacteriaceae)和韦荣球菌科(Veillonellaceae)的相对丰度增加,以及与健康对照相比,红蝽菌科(Coriobacteriaceae)肠杆菌科和双歧杆菌科/肠杆菌科的丰度降低。
Coriobacteriaceae被确定为一个潜在的生物标志物,将运动与健康改善联系起来。
扩展阅读:人与菌对铁的竞争吸收 | 塑造并控制肠道潜在病原菌的生长
纯母乳喂养的婴儿摄入的维生素 D 低于最低推荐摄入量,远低于每日参考摄入量。
维生素D推荐摄入量
为避免因维生素D而可能出现的病症,例如骨矿化不足或软骨病,母亲每天补充 400 至 2000 IU 可以增加母乳中的维生素 D 水平;建议纯母乳喂养的婴儿接受阳光照射和补充维生素 D。
0 至 36 个月以下的婴儿维生素 D 营养需求为:
10 微克/天。
缺乏维生素D会引起什么?
维生素D诱导神经生长因子,促进神经突生长,抑制海马神经元凋亡。关键神经发育时期的缺陷会导致生命后期的行为、记忆和学习障碍。
低水平的维生素 D 会导致肠道通透性增加,产生慢性低度炎症状态。
维生素 D 与肠道菌群之间存在关联,在 3-6 个月大的不同种族婴儿的肠道微生物群组成中观察到一些差异,这些婴儿的母亲在怀孕期间补充了维生素 D 以预防其后代的哮喘和过敏症。
扩展阅读:维生素D与肠道菌群的互作
维生素 B12 的需求量
0 ~ 6 个月为 0.4 微克/天,
6 ~ 不到 12 个月为 0.5 至 0.8 微克/天,
12 ~ 36 个月以下为 0.6 至 1 微克/天。
叶酸的需求量
EFSA 推荐:
0 ~ 6 个月的叶酸营养需求为 65 微克/天,
6 ~ 12 个月婴儿的叶酸摄入量为 80 微克/天,
12 ~ 36 个月以下的需求量为100微克/天;
1-17 岁儿童的叶酸 (FA) 摄入量上限已确定为 200 – 800 微克/天。
叶酸和维生素B12的作用
叶酸和维生素 B12(钴胺素)作为参与广泛生物过程的辅助底物和辅助因子发挥着重要作用,例如核酸合成、糖酵解、糖异生和氨基酸代谢。
此外,叶酸和维生素 B12 以及单碳代谢循环所需的其他微量营养素辅助因子的状况可能会影响 DNA 甲基化,从而对健康产生长期影响。
叶酸——必须,但不要过量
众所周知,怀孕期间缺乏叶酸会导致后代出现神经管缺陷的风险更高。然而,高剂量的叶酸与更好的状态无关,与母亲或后代无关;事实上,怀孕期间摄入量高于 400 微克/天并没有明显的好处。母乳喂养期间补充叶酸可导致母乳总叶酸适度增加。
在儿童中,叶酸缺乏与认知发育受损以及腹泻和呼吸系统疾病增加相关;然而,补充叶酸对于减少这些病症并没有明显帮助。
过量摄入叶酸可能会产生潜在的不利影响,包括几种疾病(例如癌症、神经系统疾病、生长综合征、呼吸系统疾病和多发性硬化症)的发病率增加。
目前,由于食用补充剂或强化食品,很多欧洲儿童摄入大量叶酸;目前尚不清楚这些摄入量是否会造成伤害,尤其是在早期发育过程中,而许多组织中正在发生大量表观遗传变化。
缺乏维生素B12有什么影响?
当母亲的维生素B12状况不佳时,母乳中的含量会降低,会影响后代维生素B12的状态。维生素 B12 对中枢神经系统的代谢和维持至关重要,与叶酸一起在同型半胱氨酸代谢和髓磷脂的保护中起着关键作用。因此,维生素 B12 缺乏会导致覆盖颅神经、脊神经和周围神经的髓鞘受损,从而导致神经精神疾病的发展。
B族维生素缺乏影响肠道菌群
通过基因组重建和预测,针对几种B族维生素,预测整个微生物群落的代谢表型,发现微生物群落中有相当一部分是辅助营养物种(它们无法自己合成某些生命所需的化学物质,需要从外部环境中获取这些物质才能生存),它们的生存完全依赖于从饮食和/或原养型微生物中获取一种或多种B族维生素,通过特定的拯救途径(一种代谢途径,通过这种途径,微生物可以从外部环境或其他微生物的代谢产物中回收利用某些生命所需的化学物质,以满足自身生存所需)来实现。
膳食摄入影响:
母体甲基供体的摄入(胆碱、甜菜碱、叶酸、蛋氨酸)会改变其后代的DNA甲基化。观察到这种摄入量,特别是在围孕期,会影响婴儿口腔中与代谢、生长、食欲调节和维持 DNA 甲基化反应相关的基因的 DNA 甲基化。
细菌合成影响:
除了膳食摄入外,细菌叶酸生物合成也备受关注。细菌叶酸生物合成可以提供额外的叶酸来源,对健康结果和/或 DNA 甲基化具有重要意义。
在体外结肠模型中,研究发现补充甲钴胺和乳清可以提高厚壁菌门和拟杆菌属的比例,同时减少变形杆菌属的数量,其中包括一些病原体,如大肠杆菌(Escherichia)和志贺氏菌属(Shigella)等,以及假单胞菌属(Pseudomonas)。此外,研究还发现甲钴胺可以促进肠道细菌对脂质、萜类化合物和聚酮化合物的代谢,诱导外源性物质的降解,抑制转录因子和次级代谢产物(如维生素 B12)的合成。
扩展阅读:如何解读肠道菌群检测报告中的维生素指标?
新生儿肠道菌群的建立及发育
新生儿的肠道菌群既直接来自母亲,也来自分娩后的环境。微生物组在生命的头几个月经历动态演替和成熟,这一过程伴随着身体指标以及器官和神经认知发育的快速变化。
新研究结果强调母乳喂养和婴儿饮食会影响肠道微生物组成和功能。一项使用宏基因组鸟枪法测序的综合研究表明,停止母乳喂养(而不是引入固体食物),可以推动婴儿肠道微生物组的功能成熟,使其接近成人状态。
新生儿肠道菌群的影响因素
新生儿微生物组和免疫系统的不成熟似乎与肠道感染的易感性增加有关,特别是在 LMIC(中低收入国家) 环境中。虽然新生儿获得微生物群的时间各不相同,但多次接触,包括分娩方式、母婴饮食、药物、获得安全水和卫生设施以及多种宿主因素,是微生物群组成的主要决定因素。
母乳对婴儿的发育和成熟起着重要作用,微生物组在断奶时进入过渡阶段,此时微生物组会发生其他变化。
儿童营养不良和生长障碍是由膳食摄入不足和炎症之间复杂的相互作用驱动的,炎症通常是持续和/或反复感染和慢性疾病(包括镰状细胞病、艾滋病毒、先天性心脏病、心理障碍和内分泌或代谢疾病)的结果。
肠病是营养不良的一个重要驱动因素
肠病可能是肠病原体相关性腹泻病的结果,这在 LMIC 环境中的儿童中很常见,并且与死亡率、生长迟缓和认知发育不良的风险较高有关。
而这些环境中的许多儿童在存在或不存在已知肠病原体的情况下患有无症状肠病。这种肠病与非特异性持续粪口污染、反复肠道感染和小肠细菌过度生长 (SIBO) 有关。这种肠病与其他慢性肠道炎症有一些相似之处,包括克罗恩病和溃疡性结肠炎。它与发育迟缓密切相关,可能通过营养吸收不良和食欲抑制间接影响生长,并通过生长激素-胰岛素样生长因子 1 (IGF-1) 轴直接影响生长。
肠道通透性增加也会对发育产生负面影响
肠屏障功能障碍和肠道通透性增加可能导致微生物和/或微生物产物易位,从而激活先天免疫反应并促进全身炎症,从而对生长产生负面影响。
扩展阅读:什么是肠漏综合征,它如何影响健康?
肠道微生物群会影响多种宿主功能,包括代谢调节和信号传导,通过获取膳食营养素和微生物群衍生的代谢物、免疫耐受和对病原体的抵抗力、昼夜节律以及与儿童健康成长相关的其他途径。
肠道菌群失调可能影响儿童生长发育
由于疾病、环境或药物暴露或其他损害而破坏微生物组的正常多样性和组成,可能导致生态失调,这是一种以致病菌大量繁殖、共生体丧失和多样性丧失为特征的状态。在一些人群中,生态失调与肥胖、2 型糖尿病、肝脂肪变性和肠道疾病有关。在儿童和部分人群中,生态失调与生长和神经认知发育不良以及反复感染、免疫力改变和炎症增加有关。
与营养良好的儿童相比,营养不良的儿童拥有“不太成熟”的肠道菌群,其多样性较低。生态失调导致营养提取效率低下、吸收不良、易患肠杆菌科等侵袭性疾病和肠道炎症,从而影响生长。
肠道微生物群与发育迟缓之间存在密切关联,表明存在因果机制
谷禾健康与长沙妇幼儿童保健中心实验室合作发表的临床研究,揭示了肠道微生物群对患有严重急性营养不良 (SAM) 等严重儿科病理状况的儿童的重要性;临床诊断为生长发育迟缓 (FTT) 的受试者和正常生长正常的早产受试者 (NFTT-pre) 在不同年龄段表现出明显的肠道菌群发育轨迹中断,并且其α多样性的发展以及观察到的 OTU 和 Shannon 指数不足,尤其是在具有 FTT 的受试者中。
此外,与正常相比,FTT组中细菌如拟杆菌、双歧杆菌、链球菌和大多数年龄歧视性细菌分类群的顺序定殖和富集及其微生物功能紊乱。我们的研究结果表明,发育迟缓的婴儿肠道菌群发育不全,具有潜在的临床和实践意义。

肠道菌群失调还与共生微生物的易位和系统传播以及对病原体的易感性有关。此外,共生细菌抵抗肠道炎症的功能能力降低,如产生短链脂肪酸和色氨酸分解代谢配体(驱动芳烃受体激活),可导致肠道炎症。
恢复肠道菌群稳态,可促进儿童生长发育
共生菌还维持先天性淋巴样细胞,这是白细胞介素IL-22 的主要来源,IL-22 可刺激抗菌肽,帮助防止病原菌的微生物移位和入侵。恢复稳态微生物组和相关代谢物,有可能逆转与生态失调相关的表型,并促进儿童的生长发育。
确定肠道微生物群落结构和功能的变化(包括确定它们与疾病的因果关系)以制定有效的干预措施,对恢复肠道微生物群落结构并改善健康生长发育至关重要。
确定可以在怀孕、婴儿期和儿童期实施的干预措施,以预防或改善这些导致生长发育不良的驱动因素,对于改善短期和长期健康与发育至关重要。
扩展阅读:
怀孕期间母体肠道菌群的组成和功能似乎与出生结局密切相关,包括体重和胎龄。在健康的非妊娠成人中,肠道微生物群由相对稳定的种群组成,主要由拟杆菌门、厚壁菌门、放线菌门、变形菌门和疣微菌门组成。微生物组的组成和多样性在怀孕期间发生了变化。例如,在怀孕期间,肠道微生物群 α 多样性和产丁酸菌减少,而双歧杆菌、变形菌和产乳酸菌增加。
最近对来自刚果、印度、巴基斯坦和危地马拉的孕妇进行的一项纵向研究表明,怀孕期间肠道微生物群的个体属和 α 多样性(丰富度)有所减少。
妊娠期肠道菌群与新生儿生长关联
最近进行了一项研究,以了解津巴布韦农村地区妊娠期肠道微生物群分类群与代谢功能对胎龄、出生体重和新生儿生长的关联。
结果证明,抗性淀粉降解细菌,主要是瘤胃球菌科、毛螺菌科和真细菌科,是主要的肠道类群,并且是出生体重、新生儿生长和胎龄的重要预测因子。
此外,这项研究表明,与淀粉和能量代谢、信号和维生素 B 代谢相关的细菌功能,与出生体重增加有关。这些结果表明,非洲农村地区母亲食用富含淀粉的饮食的饮食模式,可能会推动选择影响婴儿健康和成长的物种。
扩展阅读:肠道核心菌属——毛螺菌属(Lachnospira)
肠道菌群变化分别与妊娠糖尿病和高脂血症有关
谷禾健康与江南大学食品科学与技术国家重点实验室合作的临床研究成果表明妊娠糖尿病 (GDM) 通常与高脂血症合并症有关。改变的人类肠道微生物群分别与妊娠糖尿病和高脂血症有关,但与合并症无关。发现链球菌(Streptococcus)、粪杆菌(Faecalibacterium)、韦荣球菌(Veillonella)、普雷沃氏菌(Prevotella)、嗜血杆菌(Haemophilus)和放线菌( Actinomyces )在糖尿病加高脂血症人群中显着更高。此外,几种细菌与患有妊娠糖尿病和高脂血症的参与者的空腹血糖和血脂水平相关。
扩展阅读:肠道重要基石菌属——普雷沃氏菌属 Prevotella
母体微生物群的干预:益生菌
针对母体微生物群的干预措施有可能显着影响婴儿健康,因为孕期生态失调和母体暴露会影响微生物群的建立、免疫发育和代谢健康。正在评估妊娠期膳食补充益生菌(对宿主健康有益的活微生物),以预防妊娠相关并发症和不良出生结果,包括早产和极低出生体重。
一些数据表明,益生菌对孕妇或哺乳期妇女在治疗妊娠糖尿病 (GDM)、B族链球菌定植和乳腺炎方面具有有益作用。
鉴于已知的安全性,益生菌作为妊娠干预措施特别有吸引力。然而,迄今为止的研究还没有定论。在新西兰、芬兰、丹麦、瑞典、澳大利亚、伊朗和我国的女性中,补充各种益生菌和混合物(包括乳酸杆菌、链球菌和双歧杆菌菌株)对出生人体测量没有影响。但有一些数据表明益生菌单独或联合使用可能与低收入国家早产儿死亡率、坏死性小肠结肠炎和/或新生儿败血症的降低有关。
新生儿和婴儿是考虑针对微生物组进行干预的关键人群,因为婴儿微生物组在出生后经历快速进化。此外,婴儿期是生长和神经认知发育的关键时期,也是发病率和死亡率最高的时期。
婴儿肠道菌群的定植
来自拟杆菌门和放线菌门的专性厌氧菌会迅速定植婴儿肠道,主要是双歧杆菌属、拟杆菌属和梭菌属,在生命的前 6 个月内,其特点是多样性低。
母体肠道微生物群似乎对婴儿肠道的定植有显着贡献,而阴道和皮肤来源的细菌似乎更短暂,并且不会在新生儿期后持续存在于婴儿肠道中。
婴儿肠道菌群->免疫系统->宿主
婴儿肠道微生物群为免疫系统的发育提供信息,而免疫系统又协调维持宿主-微生物共生的关键特征。因此,肠道微生物组成和代谢的异常可能会破坏正在发育的免疫系统。
母乳喂养->断奶,肠道菌群变化
婴儿期的母乳喂养还通过母乳中微生物种类的直接转移和其他主要成分的调节影响婴儿生长和塑造肠道微生物群,例如人乳低聚糖(HMO – 人类酶无法消化的复合糖),分泌IgA 和抗菌因子。
断奶,即逐渐将固体食物引入婴儿饮食,是婴儿发育的一个重要里程碑。断奶也是肠道菌群快速扩张的时期,包括双歧杆菌、乳杆菌、韦荣球菌(Veillonella)、柯林氏菌(Collinsella)、普雷沃氏菌、粪杆菌属和大肠杆菌属以及参与复杂多糖代谢的其他物种的多样化和扩张。
断奶期微生物群受干扰,可能导致肠道感染的易感性
断奶时微生物群的扩大还与强烈免疫反应的诱导有关,一种“断奶反应”,其特征是与生命后期的免疫成熟和耐受性相关的调节性 T 细胞的扩增。
在小鼠中,断奶期间限制微生物组的成熟会导致免疫发育受损并增加对肠道感染的易感性。此外,在母乳喂养率高且在长时间断奶期间也接受补充饮食的孟加拉国社区队列中,发现了一个独特的“过渡”长双歧杆菌进化枝,它携带利用母乳和食物底物的酶。这种过渡性长双歧杆菌在断奶期间引入固体食物后会扩大,并且在孟加拉国以外的婴儿队列中也得到证实,尽管患病率要低得多。 这些发现表明,底物和混合喂养的持续时间也会影响肠道微生物组的结构和功能。
断奶期过后,肠道菌群高度依赖于饮食习惯
农村地区的儿童表现出拟杆菌门的显着富集和厚壁菌门的枯竭,普雷沃氏菌属的细菌数量独特丰富,显示出利用富含多糖的营养素的能力。
然而,在工业化国家,这些普氏菌肠型不太常见,断奶后微生物组的特征是拟杆菌和瘤胃球菌肠型的存在。
在试图了解微生物群落是如何共同配置的,包括描述组成成员之间的相互作用以及这些群落随着年龄的增长而成熟时,需要较大的样本人群队列,这也是谷禾一直推进的事情。
微生物群是否有一个稳定的架构?
综合众多的研究结果确定了一个由几十个细菌分类群组成的核心“生态群”,这些分类群在孟加拉国、印度和秘鲁的出生队列的健康成员中,在 20 个月及以后表现出一致的协变。研究得出结论,生态群网络是微生物群组织的一个保守的一般特征,建议这样的生态群可以提供一个框架来描述营养不良儿童的生态失调。
我们建议这样的生态群可以用作定量指标,用于定义旨在重新配置肠道微生物群落的靶向干预措施的功效。
婴儿绞痛、反流和便秘常常引起父母的痛苦也是儿科就诊的主要原因。如前所述,母乳喂养婴儿的微生物群通常被认为富含双歧杆菌和乳杆菌等“有益”细菌,以及梭菌等产气细菌的生长减少。
益生菌:罗伊氏乳杆菌DSM 17938减少哭闹
在随机对照试验中,与安慰剂相比,使用罗伊氏乳杆菌(L. reuteri)DSM 17938 治疗绞痛婴儿可显着减少哭闹时间、反流和功能性便秘。
相比之下,报道了与L. reuteri DSM 17938 相比,安慰剂组在治疗 1 个月时的烦躁时间短暂减少和睡眠持续时间更长。这种烦躁增加仅发生在配方奶喂养的婴儿中,而不发生在母乳喂养的婴儿中。
另一项最近的研究评估了L. reuteri DSM 17938 在 1 个月和 3 个月大时通过显着减少哭闹时间来预防绞痛。一般来说,罗伊氏乳杆菌DSM 17938 似乎可以减少患有绞痛的母乳喂养婴儿的哭闹时间,但是,这种益生菌在绞痛配方奶喂养婴儿中的作用需要进一步研究。
同样对于绞痛的预防,使用L. reuteri DSM 17938 似乎是有效的,但这需要在其他研究环境中得到证实。
扩展阅读:认识罗伊氏乳杆菌(Lactobacillus reuteri)
为了促进“有益”细菌的生长,婴儿配方奶粉中添加了特定的益生元,并在临床试验中进行了评估。
益生元:低聚半乳糖降低绞痛和反流的风险
在最近的一项双盲随机对照试验中,摄入补充低聚半乳糖的配方奶显示出与母乳喂养参照组相似的双歧杆菌和乳杆菌发育趋势,并且与接受不含低聚半乳糖的配方奶粉的婴儿相比,降低了绞痛和反流的风险。
合生元:减少哭闹、减轻疾病发作
人们对合生元提供“有益”细菌及其底物的兴趣也越来越大。
与随机分配到安慰剂配方奶粉的对照组相比,给婴儿喂食七种益生菌菌株和低聚果糖的混合物后,婴儿在第 7 天和第 30 天的哭闹时间减少了 50% 以上。
在另一项前瞻性双盲随机对照试验中,评估了含有嗜热链球菌(Streptococcus thermophilus)、保加利亚乳杆菌(L. bulgaricus)和动物双歧杆菌( B. animalis ssp. lactis)的合生酸奶饮料的效果。
与安慰剂相比,乳糖和菊糖对疾病发作(腹泻、上呼吸道感染和发热性疾病)的影响减少了发烧天数。 干预组大便稀便的频率更高,需要照顾孩子的次数也更多,但差异无统计学意义。
注意:
作者强调益生菌的干预并不是适合所有有症状的婴儿,婴儿的肠道菌群变化较快,益生菌及其组合的干预需要充分评估肠道菌群及其功能,了解其肠道菌群网络结构下,选择对应症状的干预方式才能确保安全和发挥干预的效果。
总的来说,在得出任何确定的结论之前,需要更多的研究来评估益生元和合生元在这些在不同类型儿童及其整体肠道微生态条件下的作用。
扩展阅读:
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
人们还关注肠道菌群失调在过敏表型发生发展中的作用。
肠道菌群 & 过敏性疾病
肠杆菌科/拟杆菌比率↑ — 食物致敏的风险↑
据报道,在基于人群的加拿大健康婴儿纵向发育 (CHILD) 出生队列研究中,婴儿粪便中低肠道微生物群丰富度和升高的肠杆菌科/拟杆菌比率与随后食物致敏的风险增加有关。
瘤胃球菌科↓
–食物敏感 –特应性湿疹 –炎症性先天免疫反应过度
他们还发现食物敏感的婴儿在 1 岁时瘤胃球菌科的丰度下降。这可能与过敏性疾病高风险婴儿的病例对照研究结果一致,发现瘤胃球菌科的相对丰度较低与未出现任何过敏表现的婴儿相比,随后出现特应性湿疹的婴儿的粪便样本中。
值得注意的是,瘤胃球菌属的相对丰度较低也与炎症性先天免疫反应过度有关。
总的来说,这些发现进一步支持了这样一种假设,即缺乏潜在的免疫调节细菌可能会增加发生过敏表现的风险。由于瘤胃球菌能够降解纤维,并且是成人“核心”微生物组的一部分,未来的研究应该检验其重要性。
益生菌 & 肠道菌群
鼠李糖乳杆菌GG — 产丁酸菌↑
在最近的一项研究中,研究了益生菌对牛奶过敏婴儿肠道微生物组的影响。报道称,添加了鼠李糖乳杆菌GG (LGG) 的深度水解酪蛋白 (EHCF) 配方导致了与丁酸盐生产相关的特定细菌的富集。
丁酸盐是一种已知的结肠细胞底物,与增强肠道完整性有关。与单独使用 EHCF 相比,接受 EHCF + LGG 治疗的婴儿在治疗 6 个月后的丁酸产量呈双峰分布。
已知的丁酸盐生产者,Faecalibacterium,Blautia,Ruminococcus,Roseburia在高丁酸盐样本中富集,而拟杆菌显着减少。与牛奶不耐受的孩子相比,牛奶耐受的孩子Blautia和Roseburia富集。正如作者推测的那样,这些物种可能导致丁酸盐产量增加和肠道完整性增加。
扩展阅读:
肠道核心菌属——经黏液真杆菌属(Blautia),炎症肥胖相关的潜力菌
肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
母亲摄入益生菌降低孩子发病率
在该团队随后的2份研究中,其中在一项随机对照试验中,与无菌安慰剂牛奶相比,孕妇在围产期摄入含益生菌的低脂发酵牛奶可降低其孩子 2 岁和 6 岁时的湿疹发病率。然而,临床益处似乎与 3 个月或 2 岁时对肠道微生物多样性的影响无关。
由于益生菌仅给予母亲,另一种解释可能是通过影响母乳成分。在婴儿期益生菌随机对照试验的另一项后续研究中,对长期肠道微生物群的建立没有影响, 这与之前的报道一致。
注意:
虽然说荟萃分析报告,怀孕期间、母乳喂养期间和/或给婴儿服用益生菌可降低婴儿湿疹的风险,但证据仍然薄弱。因此,专家机构未能推出具体的指导方针。然而,在考虑所有关键结果时,世界过敏组织现在建议使用益生菌预防有过敏孩子高风险的孕妇和哺乳期母亲以及有高风险患过敏性疾病的婴儿(基于家族史)。
在他们的指南中,他们强调该建议是有条件的并且基于低质量的证据,并不能给出关于最有效的菌株、剂量或治疗的开始和持续时间的具体指导。因此,仍然需要更具体的指南和研究基础。
肠易激综合症
在一项评估肠易激综合征儿童低发酵底物饮食的初步研究中,该饮食与腹痛频率和严重程度的降低显著相关。与无反应者相比,对治疗有反应的儿童在基线和干预期间似乎具有不同的粪便微生物组。
在一项更大的、双盲、随机、交叉研究中,同一组使用 16S 测序研究了低发酵低聚糖、二糖、单糖和多元醇 (FODMAP) 饮食对肠易激综合症儿童的临床结果和肠道微生物组成的影响。
低 FODMAP 饮食减少了腹痛,并且对饮食有反应的儿童的微生物群具有更强的糖分解能力。作者建议,鉴定具有更强糖分解能力的微生物群可能作为预测对低 FODMAP 饮食反应的生物标志物。
克罗恩病
肠道微生物群环境的变化被认为是克罗恩病患者纯肠内营养治疗特性的中介。令人惊讶的是,与没有炎症性肠病家族史的健康对照相比,克罗恩病患儿在纯肠内营养过程中肠道微生物多样性、普拉梭菌和丁酸盐浓度有所降低。
当参与者恢复正常饮食时,这后来又恢复到治疗前的水平。伴随着这种假定的“不健康”微生物群,矛盾的是临床结果得到改善,结肠炎症标志物减少。然而,这些发现的相关性需要进一步阐明。
乳糜泻
在乳糜泻中,坚持严格的无麸质饮食 (GFD) 有时很困难,患者可能仍会出现临床症状和营养缺乏,随后持续发炎和肠道菌群失调。
由于特定的益生菌已被证明可以减轻炎症,因此在一项双盲探索性试验中,新诊断出患有乳糜泻的儿童被随机分配到摄入长双歧杆菌CECT 7347 或安慰剂组 3 个月。无论治疗如何,对 GFD 的依从性与生长参数呈正相关,与安慰剂组相比,益生菌组的身高有所增加。此外,益生菌处理减少了脆弱拟杆菌的数量组和分泌型 IgA。
在另一项评估两种益生菌短双歧杆菌菌株对 GFD 患儿影响的随机对照试验中,与安慰剂相比,干预减少了炎性细胞因子 TNFα 的产生。
总的来说,这些研究表明益生菌对患有乳糜泻的儿童可能有益,但需要在更大规模的试验中验证。
扩展阅读:双歧杆菌:长双歧杆菌
青年糖尿病环境决定因素 (TEDDY) 研究最近的一份报告中,该研究包括芬兰、瑞典、德国和美国患 1 型糖尿病的高风险儿童,肠道的组成和多样性都存在很大差异。即使在这个具有同源人类白细胞抗原 (HLA) II 类基因型并因此具有相似遗传风险的人群中,根据地理区域也存在显着差异。
这些差异的根本原因尚不清楚,因为即使在对早年生活和饮食变量进行调整后,差异仍然存在。
在同一项前瞻性队列研究中,还检查了早期接触益生菌和膳食可溶性纤维(可能影响肠道微生物群组成和形成免疫反应)与胰岛自身免疫的关系。与后期补充或无益生菌相比,益生菌暴露(≤27 天)与胰岛自身免疫风险降低相关。 相反,儿童早期膳食可溶性纤维的摄入与胰岛自身免疫或 I 型糖尿病无关。未来的研究需要检验这些发现的重要性。
人们一直对肠道菌群失调在影响儿科人群的大量疾病中的作用感兴趣。
儿童生长迟缓和认知发育不良的驱动因素是多方面的,包括饮食摄入量和多样性不足、暴露于反复感染、慢性疾病和肠道病理学,包括肠病和 SIBO。最近的研究表明,肠道菌群失调与发育迟缓之间存在密切关联,表明存在潜在的因果关系。这些研究强调需要确定肠道微生物群落的结构和功能改变,并恢复微生物组稳态和相关代谢物以促进低收入环境或国家儿童的生长发育。
儿童时期的肠道微生物组成高度依赖于饮食习惯。在营养不良的儿童中,与标准营养干预措施(如 RUSF)相比,含有当地可用成分的低热量密度 MDCF 可改善微生物组的成熟度和生长。未来我们需要努力探究不同地理环境和不同饮食习惯下中婴儿期微生物群的多样性,更深入地了解它们与免疫发育和生长的联系。
鉴定具有更高定植效率和临床有效性的适合当地的菌株可能提供巨大的潜力来优化可在怀孕、婴儿期和儿童期实施的干预措施,这可能会导致针对肠道微生物群的治疗和预防策略得到改进,并且也可能成为安全和具体指南的基础。
主要参考文献:
Njunge JM, Walson JL. Microbiota and growth among infants and children in low-income and middle-income settings. Curr Opin Clin Nutr Metab Care. 2023 Mar 6.
Videhult FK, West CE. Nutrition, gut microbiota and child health outcomes. Curr Opin Clin Nutr Metab Care. 2016 May;19(3):208-13.
Cerdó T, Diéguez E, Campoy C. Infant growth, neurodevelopment and gut microbiota during infancy: which nutrients are crucial? Curr Opin Clin Nutr Metab Care. 2019 Nov;22(6):434-441.
WHO. Levels and trends in child malnutrition: key findings of the 2021 edition of the joint child malnutrition estimates. United Nations Children’s Fund (UNICEF), World Health Organization, International Bank for Reconstruction and Development/The World Bank. 2021.
Gizaw Z, Yalew AW, Bitew BD, et al. Stunting among children aged 24-59 months and associations with sanitation, enteric infections, and environmental enteric dysfunction in rural northwest Ethiopia. Sci Rep 2022; 12:19293.
West CE, Renz H, Jenmalm MC, et al. The gut microbiota and inflammatory noncommunicable diseases: associations and potentials for gut microbiota therapies. J Allergy Clin Immunol 2015; 135:3–13.
Troesch B, Biesalski HK, Bos R, et al. Increased intake of foods with high nutrient density can help to break the intergenerational cycle of malnutrition and obesity. Nutrients 2015; 7:6016–6037.
Hiltunen H, Löyttyniemi E, Isolauri E, Rautava S. Early nutrition and growth until the corrected age of 2 years in extremely preterm infants. Neonatology 2018; 113:100–107.
Zheng M, Lamb KE, Grimes C, et al. Rapid weight gain during infancy and subsequent adiposity: a systematic review and meta-analysis of evidence. Obes Rev 2018; 19:321–332.