-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
人的脑部大约有860亿个神经元和数万亿个突触连接,由250-300亿的神经胶质细胞支持,消耗基础氧气中约20%的比例来维持ATP驱动的活动。
与其他器官相比,大脑及其神经组织由于其高代谢率和能量活动而产生大量的 ROS(活性氧)。与此同时,与其他组织相比,大脑的抗氧化防御系统较弱,因此容易出现氧化还原稳态紊乱。
氧化应激是指由于 ROS 水平高于抗氧化剂水平而导致细胞内氧化还原信号通路中断。这种不平衡状态会产生有害影响,是许多神经系统疾病的主要原因。当大脑缺氧时,每分钟有大约190万个神经元和1400万个突触会开始丧失。
人们最初认为神经退行性疾病 (NDD) 是由神经系统缺陷引起的,而忽略了肠道和大脑之间的通讯涉及神经、代谢、内分泌和免疫途径。
大量研究观察到,肠道微生物组在通过其自身代谢产物或产生次生代谢产物减轻氧化应激、炎症和能量代谢方面发挥了不可忽视的作用,而通过使用具有抗氧化和抗炎活性的益生菌来调节肠道微生物组种群已显示出有希望的神经恢复能力。据报道从德氏乳杆菌(Lactobacillus delbrueckii)亚种Lactobacillus delbrueckii ssp. bulgaricus B3和 Lactobacillus plantarum GD2中分离出的胞外多糖可保护 SH-SY5Y 细胞免受 Aβ(1–42) 诱导的细胞凋亡,这表明它们有望成为药物治疗阿尔茨海默病 (AD)的有前途的天然化学成分。
doi: 10.1016/j.jare.2021.09.005
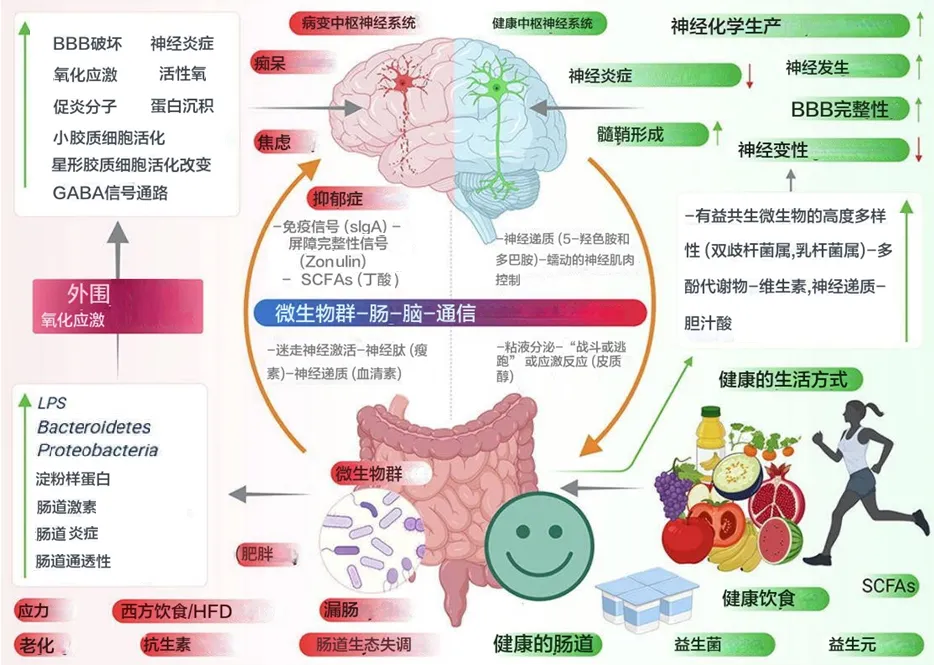
肠道微生物分子,如神经递质、氨基酸、短链脂肪酸 (SCFA)、淀粉样蛋白、脂多糖 (LPS) 和微生物相关分子模式 (MAMP),通过循环与宿主免疫系统相互作用,影响宿主的代谢和神经系统,并通过肠道神经系统直接激活迷走神经影响大脑。压力等情况会导致下丘脑神经元分泌促肾上腺皮质激素(CRH),触发肾上腺皮质激素释放激素(ACTH) 的释放,随后激活皮质醇的释放,影响肠道屏障完整性,进而影响肠道健康。
当肠道菌群失调时,抗炎分子(如SCFAs、H2)的含量减少,而促炎分子(LPS、淀粉样蛋白)的含量增加,同时有益菌种数目减少,致病菌增加。这导致肠道和血脑屏障通透性增加,随之增加外周免疫反应,进而在中枢神经系统(CNS)中增加氧化应激。在神经元的细胞器(如线粒体、内质网(ER)和过氧化物体)中观察到反应性氧化物种(ROS)的产生增加,同时伴随神经毒素的聚集,导致神经退行性变化。
近期的研究提出了肠道微生物群与大脑之间的两个最重要的联系:
所以本文想和大家一起深入了解相关方面研究成果和进展,重点关注涉及神经退化的肠道微生物群介导的氧化应激,以及显示肠道微生物群及其代谢物参与神经保护的研究。
神经退行性疾病(NDD)是一类涉及神经元退化和功能损害的疾病,通常会导致神经细胞的死亡或损伤,进而引起神经系统功能障碍。随着时间的推移逐渐恶化,影响患者的日常生活和活动能力,目前的发病人群越来越大。
阿尔茨海默病:一种进行性痴呆疾病,主要表现为记忆丧失、认知功能下降和行为变化。
帕金森病:一种影响运动控制的疾病,其中运动功能受损,如震颤、肌肉僵硬和运动迟缓。
亨廷顿病(Huntington’s Disease):一种遗传性疾病,表现为神经元的逐渐死亡,导致运动障碍、认知功能下降和精神障碍。
路易体痴呆症(Amyotrophic Lateral Sclerosis, ALS):一种肌萎缩性疾病,导致运动神经元受损,最终导致肌肉无力和萎缩。
多发性硬化:这是一种影响中枢神经系统的慢性疾病,导致神经纤维的髓鞘损伤,影响神经信号的传递。
中风与脑损伤:中风是一种急性神经退行性疾病,由于脑部血流中断导致脑组织损伤。脑损伤也可以是慢性的,随着时间的推移导致神经细胞的损伤。
肠道的“第二大脑”:肠神经系统 (ENS)
肠道不仅仅是消化食物的地方,它还有一个聪明的“大脑”——肠神经系统 (ENS)。它在胃肠道 (GI) 和中枢神经系统 (CNS) 之间架起了一座沟通的桥梁。
肠道神经元通过迷走神经、内分泌和免疫途径与中枢神经系统进行对话,确保我们的肠道健康有序。
肠道微生物群:调节通讯的关键
上面说的“肠神经系统”并不是独自工作的,它有一个重要的合作伙伴——肠道微生物群。这些微生物不仅数量庞大,其代谢能力甚至可以与我们的肝脏相媲美。它们是调节肠道与大脑之间通讯的幕后英雄。
肠道微生物群的多重角色
该领域的持续研究表明,肠道微生物群不仅参与免疫系统的建设和代谢调节,还在我们身体各种器官的发育中扮演着重要角色。
饮食、药物等各种环境因素以及年龄和遗传等宿主因素,不仅会改变肠道菌群的组成,还会造成它们的信号活性发生变化,进而影响我们的健康。
IgA:肠道菌群的守护者
免疫球蛋白A (IgA) 是粘膜表面分泌的最丰富的抗体,她不仅能够包裹病原体以防止其侵入,还能包裹肠道中的共生菌,从而共同抵抗病原菌,维持着肠道菌群的稳定。
连蛋白:肠道屏障的调控者
肠道菌群还会影响连蛋白(zonulin),而连蛋白是调节肠道和血管内皮 (血脑屏障) 紧密连接所必需的。肠道菌群的变化直接影响连蛋白通路,我们常听说的“肠漏”就与此相关。
肠道菌群与情绪
肠道菌群还能影响我们的肠道蠕动,甚至与我们的内分泌系统有关。例如,压力和抑郁可能与皮质醇水平的升高有关,而这种激素的变化又与肠道菌群的平衡有关。
简而言之,肠道菌群通过感知和调节大量化学信号,直接影响我们的身心健康。
肠道细菌与神经系统的联系:从被忽视到被认可
肠道细菌与神经系统疾病之间的关系首次在20世纪提出,现在已被众多研究人员认可。
最初,人们认为神经退行性疾病(NDDs)仅由神经系统内部的缺陷引起,但现代研究揭示了一个事实:肠道微生物能产生和改变各种免疫、代谢和神经化学因子,它们实际上在调控我们的大脑健康方面发挥着关键作用。
肠道菌群:参与神经退行性疾病的双重角色
——失调带来的破坏
神经退行性疾病主要由氧化损伤、活性氧 (ROS) 生成增加、神经炎症和能量代谢紊乱引起,这些病理过程不仅侵袭大脑,也影响肠道微生物群的平衡。
肠道微生物组成会随着身体新陈代谢从健康状态到患病状态的变化而改变。这表明肠道菌群与宿主和环境之间存在交集,且与各种神经和心理疾病存在关联。
肠道菌群失调和神经炎症是各种神经系统疾病病理生理学中一致的因素。在本文中,我们重点展示了肠道微生物群介导的氧化应激在神经退行性疾病中的作用,包括 ROS 产生机制的解释、大脑更容易受到氧化应激的原因以及肠道微生物代谢物如何影响氧化应激引起的大脑损伤,重点关注阿尔茨海默病、帕金森病、创伤性脑损伤。
——保护作用
虽然说肠道菌群在神经退行性疾病的病理学中发挥着作用,但肠道菌群也具有保护大脑免受损伤的潜力,一些细菌能够释放代谢物,这些代谢物转化自膳食纤维、多酚或宿主分子,如胆汁酸、类固醇激素等。此外,通过益生元调节肠道菌群的组成,可以增强神经恢复力。
益生菌的神经保护作用:实验室到临床的探索
肠道菌群的神经保护作用在最近的研究中已得到充分证实,从发酵食品中分离的 Lactobacillus buchneri KU200793菌株表现出较高的抗氧化活性,并且能够保护 SH-SY5Y 细胞免受有害物质 1-甲基-4-苯基吡啶 (MPP + ) 的侵害,表明其具有益生菌和神经保护作用。
同样,从德氏乳杆菌亚种Lactobacillus delbrueckii ssp. bulgaricusB3和 Lactobacillus plantarum GD2 中分离出的胞外多糖,展现出保护神经细胞免受阿尔茨海默相关毒性的能力。
热灭活的Rumnicoccus albus菌株在细胞和小鼠模型中显示出降低ROS水平和提高抗氧化酶(SOD和GSH)水平的能力。此外,植物乳杆菌MTCC1325在动物模型中显示出抗阿尔茨海默病的潜力,预防记忆缺陷。
总之,这些研究反映了肠道微生物群的良好作用、它们的抗氧化作用以及随后的神经保护作用。
氧化应激的微妙平衡
氧化应激是一种生物学现象,当细胞内的活性氧(ROS)水平超过抗氧化剂的防御能力时,就会发生。这种失衡可能会导致细胞内的氧化还原信号通路中断,进而引发一系列有害的生物效应,成为众多神经系统疾病的潜在推手。
ROS是怎么产生的?
有氧代谢中涉及的每个化学反应都会形成不稳定且短暂的反应性中间产物,即 ROS。
注:生物分子氧 (O2) 具有两个不成对电子,不能被完全还原,因此其不完全还原会形成高度亲电且短寿命的 ROS,如:H2O2、超氧化物阴离子、一氧化氮、过氧亚硝酸根阴离子、羟基、过氧化物自由基等。
ROS要么在正常细胞过程中通过ROS生成酶作为中间体产生,要么在药物、毒素和辐射等外源性因素存在下产生。
神经组织更容易产生ROS
与其他器官相比,神经组织因其高代谢率而更容易产生ROS。
线粒体,作为细胞的能量工厂,同时也是ROS生成的主要场所。在ATP生成的过程中,线粒体可能会产生超氧化物,这些超氧化物随后被转化为H2O2和O2。O2的量越多,超氧化物的形成越多,这进一步导致更多的 ROS,如 H2O2和羟基自由基等。
线粒体与神经元活动的紧密联系
线粒体 ROS 的产生与神经元活动密切相关。强烈的突触传递不仅能促进超氧化物的产生,而且这种产生还受到细胞内钙(Ca2+)水平的调节,线粒体 ROS 产生的增加也与线粒体膜电位的增加有关。
单胺氧化酶(MAO)与神经健康
线粒体外膜上有一种酶,叫单胺氧化酶(MAO),它在神经细胞的发育和功能中起着关键作用。MAO通过催化单胺的氧化脱氨,产生H2O2作为副产物,这在神经退行性疾病中可能起到重要作用。
注:MAO-A 主要存在于儿茶酚胺能神经元中,参与去甲肾上腺素和血清素的氧化,而 MAO-B 则特别表达于血清素能神经元和神经胶质细胞中,并氧化 β-苯乙胺。
一氧化氮合酶(NOS):神经信号与氧化应激的交汇点
一氧化氮合酶(NOS)是神经元中产生ROS的酶,也是脑内ROS的来源之一。它通过催化L-精氨酸的氧化,产生一氧化氮(NO),NO在调节突触传递和干扰氧化还原稳态中起着双重作用。
NADPH氧化酶(NOX):神经元活动的响应者
NADPH氧化酶(NOX)是另一种在神经组织中产生ROS的酶,也是脑内ROS的来源之一,在脑皮质和海马区域丰富。它在神经元活动中的作用表明,NOX可能参与了多种中枢神经系统疾病的进展,包括AD、PD、肌萎缩侧索硬化症 (ALS) 和亨廷顿氏病 (HD)等。
注:Ca2+是 NOX 的主要激活剂,导致酶复合物在神经元中定位于突触后,从而表明NOX 参与神经元活动。已报道 7 种 NOX 的同源物,即 NOX (1-5)、双氧化酶 DUOX (1 和 2),它们的大小和结构域不同,但主要参与 ROS 的生成。
先前的报道还揭示了线粒体 ROS 和 NOX-ROS 之间的协同关系,从而支持彼此的 ROS 生成。
因此,开发异构体选择性 NOX 抑制剂可能是治疗急性和慢性中枢神经系统疾病的一种有前途的治疗方法。
其他产ROS的酶
在细胞质中,非血红素铁酶(如脂氧合酶)在分子O2存在下催化花生四烯酸的过氧化,并产生超氧化物和羟基自由基。
细胞质中的许多其他酶,如黄嘌呤氧化酶、细胞色素 P450 单加氧酶、环氧酶、D-氨基氧化酶也是重要的ROS 产生者。
氧化应激通过介导脂质过氧化、蛋白质氧化和核酸损伤三种主要反应导致细胞损伤。
事实上,氧化应激是衰老过程中正常生理过程的一部分,但已知它与大脑慢性疾病有关,如阿尔茨海默病 (AD)、帕金森病 (PD)、HD、缺血性中风、抑郁症和硬化症。此外,它在生活方式相关的代谢紊乱中也起着重要作用,如 2 型糖尿病 (T2D)、非酒精性脂肪肝、非酒精性脂肪性肝炎、肥胖、心血管疾病和癌症。
Tips:生理状态下正常浓度ROS在脑中的作用
虽然高浓度的ROS是有害的,会导致生物分子损伤,从而引起多种细胞功能障碍,但在安全稳定的水平上,ROS其实是细胞生理功能中不可或缺的助手。
详情展开如下:
免疫反应的哨兵
在正常生理条件下,细胞外的ROS是先天免疫系统的得力助手,它们能够引发免疫反应,帮助身体抵御外来的感染。
细胞信号的激活者
细胞内产生的ROS也是信号通路的激活者,它们参与刺激细胞凋亡和增强细胞对氧化应激的防御能力。
NF-κB的触发器
ROS在激活核转录因子NF-κB方面扮演着重要角色,这一过程会引发炎症反应,进而可能引发氧化应激。
病原体的克星
次氯酸(HOCl)这样的自由基,由髓过氧化物酶在溶酶体中作用产生,是一种对抗病原体的强大氧化剂。
中枢神经系统的调控者
对于中枢神经系统,生理条件下许多反应产生的副产物ROS,不仅是细胞内信号转导途径的调节者,还参与调控细胞的增殖、分化和成熟。
促进神经发生
研究表明,ROS的产生和氧化还原平衡有助于前体神经元祖细胞向神经元的分化,以及轴突的形成,促进神经元在其微环境中的扩增。
影响信号级联
氧化还原信号,包括ROS,能够调节多种转录因子和信号分子的功能,影响神经发生的信号级联。
神经元兴奋性的调节者
ROS,如H2O2,能通过增强细胞内钙(Ca2+)信号来调节皮质神经元的兴奋性。
影响神经系统信号级联
氧化还原信号(ROS和氧化状态)还调节转录因子(如NF-κB)、活化T细胞的核因子和活化蛋白1(AP-1)以及酪氨酸磷酸化蛋白PKC的氧化还原状态的功能。
研究人员观察到 H2O2可增加皮质神经元和 PC12 细胞中 ERK 和 cAMP 反应元件结合蛋白 (CREB) 的磷酸化。
参与学习和记忆
ROS 在大脑的不同部位(如海马、大脑皮层、下丘脑、杏仁核和脊髓)充当第二信使,海马中的长期增强(LTP)被证实是必不可少的,而海马与哺乳动物的学习和记忆有关,因此表明 ROS 参与了突触增强。
参与疼痛调节
ROS还通过参与增加杏仁核中央核的兴奋性来影响疼痛相关行为,杏仁核是大脑中负责疼痛调节情绪方面的区域。同样,在脊髓中,与神经性疼痛和炎症疼痛相关的神经可塑性过程也受 ROS 作为信号分子的控制。
ROS在细胞生理中的作用是复杂而精细的。它们既是细胞健康的守护者,也是潜在的挑战者。了解ROS如何在不同生理条件下发挥作用,对于我们理解健康和疾病的机制至关重要。
(为何大脑更容易积累过量ROS,清除机制vs产生机制)
我们将从以下方面来阐述大脑易受氧化应激影响的因素:
Ca2+在神经细胞中的作用:在神经细胞中,动作电位引起的Ca2+瞬变对于维持神经元之间的连接强度(即双向突触可塑性)至关重要。
Ca2+稳态失调的影响:当细胞膜上的Ca2+通道功能受损,导致Ca2+流入过多时,细胞内的游离Ca2+浓度会异常增加。
激活有害酶类:这种高浓度的Ca2+会激活一些有害的酶,如神经一氧化氮合酶(NOS)、磷脂酶A2和钙蛋白,这些酶的活性增加可能导致细胞骨架的破坏。
NO的产生及其影响:NOS的激活会产生一氧化氮(NO),NO是一种信号分子,但高浓度时会对细胞产生负面影响。NO会与线粒体内的细胞色素C氧化酶结合,抑制线粒体的呼吸作用,影响能量产生。
形成有害物质:NO还可以与超氧阴离子(O2.– )反应生成过氧亚硝酸盐(ONOO–),这是一种强氧化剂,可以对细胞造成进一步的损害。
线粒体功能障碍:线粒体内的Ca2+超载会导致线粒体通透性转换孔(MPTP)开放,使得Ca2+和H2O2流出,这可能导致细胞坏死。
大脑易受氧化应激:由于上述过程,Ca2+的稳态失调会使大脑细胞更容易受到氧化应激的影响,氧化应激是指细胞内氧化剂和抗氧化剂之间的不平衡,可能导致细胞损伤。
谷氨酸的兴奋性作用:谷氨酸是一种主要的兴奋性神经递质,它在神经元之间的信号传递中起着关键作用。然而,当谷氨酸在细胞外环境中大量积累时,它可能导致神经细胞的损伤甚至死亡。
谷氨酸的毒性作用:谷氨酸的过量积累可以激活神经元上的谷氨酸受体,尤其是AMPA和NMDA受体。这些受体的激活会导致细胞内Ca2+和Na+的持续流入,引发所谓的“兴奋性毒性”。
注:AMPA和NMDA是两种类型的谷氨酸受体,它们在神经元之间的信号传递中起着关键作用。这些受体是离子通道受体,意味着它们不仅能够结合神经递质谷氨酸,还能够控制特定离子的流动,从而影响神经细胞的电活动。
AMPA受体:AMPA受体(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体)是快速兴奋性突触后电流的主要介质。当谷氨酸结合到AMPA受体时,受体通道打开,允许Na+和K+离子通过,导致突触后膜的去极化,这是神经信号传递的一个重要步骤。AMPA受体的激活通常与快速的、短暂的信号传递相关。
NMDA受体:NMDA受体(N-甲基-D-天冬氨酸受体)是另一种类型的谷氨酸受体,它们在学习和记忆中起着重要作用。NMDA受体通道的开放需要谷氨酸的结合以及突触后膜的去极化(通常由AMPA受体的激活引起)。NMDA受体通道开放时,允许Ca2+和Na+离子进入细胞,同时也允许K+离子流出。Ca2+的流入可以激活多种细胞内信号途径,包括那些涉及长期增强(LTP)和长期抑制(LTD)的途径,这些都是学习和记忆的关键机制。
这两种受体在神经传递中的协同作用对于正常的脑功能至关重要,包括感知、运动控制、学习和记忆。然而,当这些受体过度激活时,它们也可能参与神经退行性疾病和神经损伤的过程,如兴奋性毒性。
反应性物质的形成:细胞内Ca2+的增加可以激活NOS,产生一氧化氮(NO),NO与超氧阴离子(O2–)反应生成过氧亚硝酸盐(ONOO–)。ONOO–是一种强氧化剂,可以对细胞造成损害。
谷氨酸合成酶的抑制:ONOO–等反应性物质可以使谷氨酸合成酶失活,这种酶负责将谷氨酸转化为谷氨酰胺,从而抑制了谷氨酸的代谢。
谷氨酸与半胱氨酸的交换受阻:谷氨酸还可以通过Xc-载体抑制细胞内谷氨酸与半胱氨酸的交换。半胱氨酸是合成谷胱甘肽(GSH)的关键成分。
主编解读:在细胞内,氨基酸不仅是蛋白质的构建块,还参与多种生物化学反应。谷氨酸(Glutamate)和半胱氨酸(Cysteine)是两种重要的氨基酸,它们在细胞内的水平受到严格调控。
谷氨酸与半胱氨酸的交换通常通过特定的转运蛋白(载体)进行,这些转运蛋白位于细胞膜上,负责将氨基酸从细胞外环境转运到细胞内。这种交换是双向的,意味着谷氨酸可以从细胞内转运到细胞外,同时半胱氨酸可以从细胞外转运到细胞内。
半胱氨酸是合成谷胱甘肽(Glutathione, GSH)的关键前体。谷胱甘肽是一种重要的抗氧化剂,对于保护细胞免受氧化应激的损害至关重要。因此,半胱氨酸的供应对于维持细胞内GSH的水平和细胞的抗氧化能力非常重要。
当谷氨酸与半胱氨酸的交换受阻时,意味着这种双向转运过程受到了干扰。这可能是由于转运蛋白的功能障碍、细胞外谷氨酸水平的异常升高(如在兴奋性毒性情况下),或者其他因素导致的细胞膜通透性的改变。
这种交换受阻可能导致细胞内半胱氨酸的供应不足,进而影响GSH的合成。GSH的减少会使细胞更容易受到氧化应激的影响,可能导致细胞损伤或死亡。在某些情况下,这种交换受阻还可能与特定的疾病状态或病理过程相关。
谷胱甘肽的耗竭与铁死亡:由于谷氨酸与半胱氨酸的交换受阻,导致细胞内GSH的耗竭。GSH的减少会使细胞更容易受到氧化应激的影响,并可能导致一种称为“铁死亡”的细胞死亡形式,这是一种由铁依赖的脂质过氧化驱动的细胞死亡。
总结来说,谷氨酸的过量积累通过激活神经元上的受体,导致细胞内Ca2+和Na+的持续流入,进而引发一系列的生物化学反应,包括反应性物质的形成、谷氨酸代谢的抑制、GSH的耗竭,最终可能导致神经元的损伤和死亡。这些过程表明,谷氨酸的稳态对于维持神经细胞的健康至关重要。
扩展阅读:
过渡金属离子,如铁(Fe2+)和铜(Cu+),在大脑中扮演着多重角色。它们不仅是许多酶的辅因子,参与能量代谢、抗氧化防御和神经递质的合成等多种生物化学过程,而且还与神经退行性疾病和脑损伤有关。
酶的辅因子:Fe2+和Cu+等过渡金属离子是许多酶的必要组成部分,这些酶参与细胞内的各种代谢过程。例如,铁是细胞色素c氧化酶和铁硫蛋白的组成部分,而铜是细胞色素c氧化酶和超氧化物歧化酶的组成部分。
自由基反应的催化剂:在某些情况下,过渡金属离子可以催化自由基反应,这些反应可以产生有害的氧化剂,如羟自由基(·OH)。自由基是不稳定的分子,它们可以损害细胞结构,包括脂质、蛋白质和DNA。
铁的持久存在:大脑中的铁主要以Fe2+的形式存在,它在脑脊液中的结合能力较低,这意味着铁离子可以在脑脊液中相对自由地移动,并且可能积累在某些区域。铁的积累与氧化应激和神经退行性疾病(如阿尔茨海默病和帕金森病)有关。
脑损伤的应激因素:在脑损伤或疾病状态下,细胞可能会释放更多的过渡金属离子。这些离子在细胞外环境中可能催化自由基的产生,导致进一步的细胞损伤。
总结来说,过渡金属离子在大脑中的正常功能对于维持神经细胞的健康至关重要。然而,当这些离子在细胞外环境中过度积累或以不适当的形式存在时,它们可能成为氧化应激和细胞损伤的催化剂。因此,维持大脑中过渡金属离子的稳态对于预防神经退行性疾病和脑损伤具有重要意义。
神经递质的自动氧化:多巴胺、5-羟色胺和去甲肾上腺素等神经递质在有氧条件下可以发生自动氧化反应。这些反应涉及神经递质与氧气之间的化学反应,产生活性氧(ROS),如超氧阴离子(O2–)和羟自由基(·OH)。
多巴胺的自动氧化过程:多巴胺与氧气反应首先生成半醌(一种不稳定的中间产物)和超氧阴离子(O2–)。半醌可以进一步与氧气反应生成醌。醌是一种氧化产物,它可以被氧气重新氧化为醌醇和过氧化氢(H2O2)。
线粒体和溶酶体功能障碍:ROS的积累可以导致线粒体和溶酶体的功能障碍。线粒体是细胞的能量工厂,而溶酶体是细胞的“消化系统”,负责分解和回收细胞内的废物。这些细胞器的功能障碍可能导致细胞能量代谢的紊乱和细胞内废物的积累。
总结来说,神经递质的自动氧化是一个产生ROS的过程,这些ROS可以对细胞造成损害,特别是通过损害线粒体和溶酶体的功能。这种损害可能与多种神经退行性疾病有关,包括帕金森病和阿尔茨海默病。因此,控制神经递质的自动氧化和ROS的产生对于维持神经细胞的健康至关重要。
大脑对葡萄糖的依赖:大脑是身体中对葡萄糖依赖性最高的器官之一。葡萄糖不仅是大脑的主要能量来源,还参与多种代谢途径和信号传导过程。
糖醇磷酸途径:糖醇磷酸途径(Glycolysis)是葡萄糖分解代谢的第一步,产生能量和中间代谢产物。磷酸果糖激酶(Phosphofructokinase, PFK)是糖醇磷酸途径中的一个关键酶,它控制着糖酵解的速率。
神经元降解磷酸果糖激酶:在某些情况下,神经元可能会降解磷酸果糖激酶,这可能导致糖酵解速率的降低。糖酵解速率的降低意味着葡萄糖的利用效率下降。
蛋白质糖基化和AGE的形成:糖酵解速率的降低可能导致葡萄糖在细胞内的积累。过量的葡萄糖可以非酶促地与蛋白质发生反应,形成糖基化产物,最终生成高级糖基化终产物(Advanced Glycation End Products, AGE)。
AGE的损害作用:AGE可以与细胞内的AGE受体结合,引发炎症反应和氧化应激。这种氧化应激可以损害蛋白质和线粒体的功能。线粒体是细胞的能量工厂,其功能障碍可能导致细胞能量代谢的紊乱。
炎症性氧化应激:AGE诱导的炎症性氧化应激可能导致细胞内氧化剂和抗氧化剂之间的不平衡,进一步加剧细胞损伤。
Tips:以上总结就是葡萄糖诱导的氧化应激涉及糖酵解速率的降低、蛋白质糖基化和AGE的形成,以及由此引发的炎症性氧化应激。这些过程可能导致蛋白质和线粒体功能的损害,从而影响神经细胞的健康。因此,维持适当的糖酵解速率和控制AGE的形成对于预防神经退行性疾病和脑损伤具有重要意义。
大脑中的多不饱和脂肪酸:大脑富含多不饱和脂肪酸,特别是二十碳五烯酸(Docosahexaenoic Acid, DHA)。DHA是构成神经细胞膜的重要成分,对于维持神经细胞的结构和功能至关重要。
氧化应激的影响:多不饱和脂肪酸由于其化学结构中的多个双键,容易受到氧化应激的影响。氧化应激可以引发脂质过氧化反应,导致脂肪酸的氧化和损伤。
脂质过氧化和信号传导:脂质过氧化产物可以参与脑部的信号传导过程。然而,这些过氧化产物也可能对神经细胞产生负面影响,包括细胞膜的损伤和细胞功能的紊乱。
4-羟基壬酸醛的神经毒性:脂质过氧化产物之一,4-羟基壬酸醛(4-Hydroxynonenal, 4-HNE),可以通过提高细胞内Ca2+水平使谷氨酸转运体失活,从而具有神经毒性。谷氨酸转运体的失活可能导致谷氨酸的积累,引发兴奋性毒性。
α-酮戊二酸脱氢酶的失活:脂质过氧化物还可以使α-酮戊二酸脱氢酶(α-Ketoglutarate Dehydrogenase)失活,这是一种参与三羧酸循环(TCA循环)的酶。该酶的失活可能导致能量代谢的紊乱。
血管收缩作用和蛋白酶体的破坏:脂质过氧化物具有血管收缩作用,可能导致脑血流的减少。此外,它们还可以破坏蛋白酶体,这是一种负责蛋白质降解的细胞器,其功能障碍可能导致细胞内废物的积累。
脂质过氧化物在多种神经退行性疾病,如阿尔茨海默病中起着持续的作用。这些疾病的特点是神经细胞的进行性损伤和死亡。
大脑中多不饱和脂肪酸的易感性使得神经细胞更容易受到氧化应激的影响。脂质过氧化产物如4-HNE可以通过多种机制对神经细胞产生负面影响,包括神经毒性、能量代谢的紊乱、血管收缩和蛋白酶体的破坏。这些过程可能与神经退行性疾病的病理机制有关。
微胶质细胞的角色:微胶质细胞(Microglia)是大脑和脊髓中的常驻免疫细胞,它们在维持大脑的正常功能和发育中起着关键作用。微胶质细胞参与多种生理过程,包括神经保护、突触修剪、炎症反应和组织修复。
吞噬活动和反应性物质的产生:在正常的吞噬活动中,微胶质细胞可以清除死亡的细胞碎片和外来的病原体。在这个过程中,微胶质细胞产生超氧阴离子(O2–)和其他反应性物质,这些物质在清除病原体和受损细胞中起着重要作用。
NOX-2酶的作用:NOX-2(NADPH氧化酶2)是一种酶,它在微胶质细胞中产生O2–。NOX-2的激活可以增加O2–的产生,这是微胶质细胞应对损伤和感染的一种防御机制。
氧气生物可用性与微胶质细胞活性:微胶质细胞的活性取决于总的氧气生物可用性。在损伤或疾病状态下,微胶质细胞可能通过消耗更多的氧气来产生更多的O2–,这可能导致局部氧浓度的降低。
反应性物质与突触损伤:H2O2和NO等反应性物质在损伤部位吸引微胶质细胞,这些物质可以引发局部炎症反应。炎症反应可能导致突触的损伤,这是神经退行性疾病中的一个关键过程。
神经退行性的推动:微胶质细胞的过度激活和炎症反应可能推动神经退行性过程。在某些情况下,微胶质细胞的持续激活可能导致神经细胞的损伤和死亡,这是多种神经退行性疾病的共同特征。
一句话总结就是微胶质细胞在大脑中扮演着多重角色,包括免疫防御、吞噬活动和炎症反应。然而,微胶质细胞的过度激活和炎症反应可能导致神经细胞的损伤和神经退行性疾病的进展。因此,平衡微胶质细胞的活性对于维持大脑健康和预防神经退行性疾病至关重要。
大脑抗氧化防御系统的脆弱性:大脑是一个高代谢活跃的器官,对氧气的需求很高,因此容易受到氧化应激的影响。与其他组织相比,大脑的抗氧化防御系统相对较弱,这使得大脑更容易出现氧化还原稳态的紊乱。
过氧化氢酶的含量:过氧化氢酶(Catalase)是一种重要的抗氧化酶,它能够分解过氧化氢(H2O2)为水和氧气。神经元中的过氧化氢酶含量比肝细胞中的低得多,这可能是因为神经元对H2O2的处理能力较弱。
过氧化物酶体的限制:过氧化氢酶主要存在于过氧化物酶体中,这是一种细胞器,专门负责处理过氧化氢和其他有害物质。然而,过氧化物酶体的存在限制了过氧化氢酶的活性,使其无法作用于其他亚细胞区室(如线粒体和细胞质)产生的H2O2。
谷胱甘肽的含量:谷胱甘肽(Glutathione, GSH)是一种重要的细胞内抗氧化剂,它能够清除自由基并参与亲电子物质的代谢。神经元中的GSH含量非常低,这使得它们更容易受到氧化应激的影响,并且难以代谢亲电子物质。
铁死亡的风险:铁死亡是一种由铁依赖的脂质过氧化驱动的细胞死亡形式。神经元中GSH的低含量可能增加它们发生铁死亡的风险,这是一种与多种神经退行性疾病相关的细胞死亡机制。
总结来说,大脑的抗氧化防御系统相对脆弱,这使得神经元更容易受到氧化应激的影响。过氧化氢酶和谷胱甘肽的低含量限制了神经元处理氧化应激的能力,可能导致氧化还原稳态的紊乱和细胞损伤。
血红蛋白与H2O2的反应:血红蛋白(Hemoglobin)是红细胞中的一种蛋白质,负责携带氧气。当血红蛋白与过量的过氧化氢(H2O2)反应时,它可以释放出铁离子(Fe2+)和血红素(Heme)。这些产物可以参与进一步的化学反应,产生有害的过氧化物。
血红蛋白的氧化:在氧化应激条件下,血红蛋白可以被过氧化氢(H2O2)或其他氧化剂氧化。这种氧化过程可以破坏血红蛋白的结构,导致其携氧能力下降。
铁离子的释放:血红蛋白的氧化可以导致铁离子(Fe2+)从血红蛋白中释放出来。这些游离的铁离子可以参与Fenton反应,即铁离子与H2O2反应生成羟自由基(·OH)。羟自由基是一种强氧化剂,可以对细胞造成广泛损害。
血红素的释放:血红蛋白的氧化还可以导致血红素的释放。血红素是一种铁卟啉化合物,它是血红蛋白的活性部分。血红素可以催化脂质过氧化反应,导致细胞膜的损伤。
脂质过氧化:血红素可以催化不饱和脂肪酸的过氧化反应,生成脂质过氧化物。这些过氧化物可以进一步分解产生更多的自由基,加剧氧化应激。
血管收缩:血红素还可以与一氧化氮(NO)结合,形成复合物。这种复合物可能导致血管收缩,影响脑血流和氧气供应。
因此,控制血红蛋白与H2O2的反应对于预防神经毒性和维持大脑健康具有重要意义。
CYP2E1(Cytochrome P450 2E1)是一种属于细胞色素 P450 酶家族的酶。细胞色素 P450 酶是一组含有血红素(铁卟啉)的酶,它们在许多生物体内参与多种化合物的氧化代谢。CYP2E1 主要存在于肝脏中,但它也在其他组织中表达,包括大脑。
CYP2E1 的主要功能是催化小分子化合物的氧化反应,包括乙醇、某些药物、致癌物和其他外源性物质。这些反应通常涉及将分子中的氢原子移除,并添加一个氧原子,从而使化合物更容易被进一步代谢或排出体外。
CYP2E1 酶的角色:CYP2E1(Cytochrome P450 2E1)是一种存在于肝脏和其他组织中的酶,包括大脑。它参与多种代谢过程,包括小分子(如乙醇、某些药物和致癌物)的氧化代谢。
电子泄漏与氧化应激:CYP2E1 在催化反应时可能会发生电子泄漏,这意味着在代谢过程中,它可能会产生超氧阴离子(O2–)和其他活性氧(ROS)。这些 ROS 是高度反应性的分子,可以导致氧化应激,即细胞内氧化剂和抗氧化剂之间的不平衡。
大脑中的 CYP2E1:虽然大脑中含有低水平的细胞色素 P450 酶,但 CYP2E1 的存在使得大脑在代谢过程中容易受到氧化应激的影响。大脑中的 CYP2E1 活性可能导致神经细胞的损伤。
饮酒和吸烟的影响:研究表明,CYP2E1 的水平可能会因饮酒和吸烟而增加。这是因为乙醇和其他烟草中的化合物可以诱导 CYP2E1 的表达和活性。CYP2E1 的增加可能导致更多的 ROS 产生,从而加剧氧化应激。
总结来说,DNA 修复酶如 PARP-1 在修复 DNA 损伤中起着关键作用,但它们的过度激活可能导致 NAD+ 的消耗和能量产生的限制,以及可能通过 TRPM2 通道导致细胞内 Ca2+ 浓度的增加,从而导致神经元细胞死亡。
DNA 修复酶的角色:DNA 修复酶是一类酶,它们在细胞内负责修复 DNA 分子的损伤。这些损伤可能由多种因素引起,包括氧化应激、紫外线辐射、化学物质和复制错误。
PARP-1 的功能:聚 ADP 核糖聚合酶 (PARP-1) 是一种重要的 DNA 修复酶。当 DNA 发生单链断裂时,PARP-1 会被激活。它通过裂解烟酰胺腺嘌呤二核苷酸 (NAD+) 并将 ADP 核糖部分转移到核蛋白上,从而启动 DNA 修复过程。
PARP-1 的过度激活:在严重的 DNA 损伤或氧化应激条件下,PARP-1 可能会过度激活。这种过度激活会导致大量的 NAD+ 消耗,因为 NAD+ 是 PARP-1 活性所必需的底物。
因此,平衡 PARP-1 的活性对于维持细胞健康和预防神经退行性疾病具有重要意义。
RNA 的易感性:RNA 是单链分子,不像 DNA 那样有双螺旋结构和组蛋白的保护。因此,RNA 更容易受到氧化应激的影响。氧化应激可以导致 RNA 分子中的核糖和碱基发生氧化损伤。
氧化的 RNA 的影响:氧化的 RNA 可能会阻止核糖体合成蛋白质。核糖体是细胞内的蛋白质合成工厂,它们通过读取 RNA 分子上的遗传信息来合成蛋白质。如果 RNA 被氧化,其结构可能会改变,导致核糖体无法正确读取遗传信息,从而影响蛋白质的合成。
蛋白质合成异常:如果 RNA 的氧化损伤未得到修复,可能会导致合成的蛋白质未折叠或截短。未折叠或截短的蛋白质可能无法正常执行其功能,甚至可能形成有害的蛋白质聚集体,这在多种神经退行性疾病中是一个关键的病理特征。
氧化的 RNA 与氧化还原活性过渡金属(如铁和铜)一起可以催化 Fenton 反应。Fenton 反应是一种产生羟自由基(·OH)的化学反应,羟自由基是一种强氧化剂,可以对细胞造成广泛损害。
此外,超氧化物歧化酶(SOD)是一种重要的抗氧化酶,能够将超如果氧阴离子(O2–)转化为过氧化氢(H2O2)。铜锌超氧化物歧化酶(CuZn-SOD)的 mRNA 被氧化,可能是肌萎缩侧索硬化症(ALS)的临床前征兆。ALS 是一种神经退行性疾病,其特点是运动神经元的进行性退化和死亡。
注意,尽管神经退行性疾病中氧化的 RNA 在神经退行性疾病中的作用已经引起了关注,但其确切的作用机制和重要性仍需要进一步的研究。
胃肠道 (GI) 包含数万亿共生微生物和约 200-2000左右个物种,它们在维持膜屏障功能方面发挥着重要作用。这些微生物是肠道内的永久居民,参与宿主生物体内分子的不断流动,从而调节各种代谢功能。
人在出生后两年内,宿主胃肠道中的微生物群就会稳定下来,但它们的组成因个体而异,并且会根据年龄、健康、遗传和生活方式等外界因素而改变。胃肠道的腔侧暴露于饮食成分和肠道微生物群,此外,70% 的免疫细胞位于肠道组织,并由连接肠道和大脑的神经元支配,涉及肠道和大脑之间的持续沟通。
肠道微生物群与大脑之间的沟通主要涉及四条途径;
1、神经高速公路——迷走神经
第一种重要模式包括激活迷走神经,迷走神经连接胃肠道的肌肉层和粘膜层与脑干。最近研究显示,肠道病原体和益生菌通过激活迷走神经元改变大脑中的 γ-氨基丁酸 (GABA)、色氨酸、催产素和脑源性神经营养因子 (BDNF) 信号,从而调节宿主的焦虑、进食和抑郁等行为。
2、肠嗜铬细胞释放的血清素影响大脑
直接或间接影响大脑活动的通讯途径涉及通过肠道内壁的肠嗜铬细胞 (EC) 释放的血清素发出信号。一项研究表明,在用益生菌双歧杆菌治疗抑郁症小鼠模型时,其血清素和血清素前体水平会增加,从而改善其抑郁状态。同样,据报道,产芽孢细菌(梭菌属)的代谢物能够刺激 EC 产生血清素。
3、肠道菌群通过小胶质细胞介导对神经系统的调节
肠道菌群在小胶质细胞的发育、成熟和激活中起着至关重要的作用。在一项研究中,据报道,无菌 (GF) 小鼠携带的未成熟小胶质细胞数量比传统小鼠多,而且用双歧杆菌治疗时,可通过转录激活小胶质细胞。在行为和神经退行性疾病 (NDD) 中观察到小胶质细胞功能的变化,表明肠道微生物群通过小胶质细胞介导对 NDD 的影响。肠道微生物群还通过全身免疫系统(即细胞因子和趋化因子)影响神经系统。研究表明,与传统小鼠相比,GF 小鼠的血脑屏障 (BBB) 通透性更大,因此大脑更容易接触微生物产物,进而导致神经病理学状况。
4、肠道菌群传递化学信号
肠道微生物群通过直接向大脑传递化学信号进行交流。例如,肠道细菌发酵膳食纤维会产生短链脂肪酸 (SCFA),已被证明可以调节中枢神经系统的神经可塑性,还可以改善小鼠的抑郁行为。此外,肠道微生物群如拟杆菌、双歧杆菌、副拟杆菌、大肠杆菌属。能够产生神经递质 GABA,这表明肠道微生物群调节宿主生物体神经递质的浓度。
人体肠道内定植着四种主要的共生菌门,包括厚壁菌门、拟杆菌门、放线菌门、变形菌门。肠道中的共生菌和致病菌都能通过调节线粒体活性来改变细胞的 ROS。
共生菌产生甲酰化肽,这些肽与巨噬细胞和中性粒细胞上的 G 蛋白偶联受体 (GPCR) 结合,从而引发上皮细胞炎症。该过程导致 NOX-1 产生超氧化物,从而增加细胞的 ROS。
肠道乳酸杆菌和双歧杆菌具有将硝酸盐和亚硝酸盐转化为 NO 的能力,使肠道上皮成为 NO 的丰富来源。类似地,链球菌和杆菌利用 NOS 从 L-精氨酸产生 NO。
低浓度NO→保护;高浓度NO→有害
纳摩尔浓度的 NO 具有神经保护作用,是去甲肾上腺素能、非胆碱能肠道神经元的神经递质。而在较高浓度下,它会导致产生活性氧和氮物质 (RONS)(如超氧化物和 H2O2)而引起的有害影响,这进一步形成高活性羟基自由基,使其与神经炎症、轴突变性和神经退行性疾病相关。
肠道细菌产生的有益代谢物(如 SCFA)有助于通过影响线粒体活动来降低 ROS。这个后面章节详细讨论。
MAMPs维持微生物结构功能,影响大脑发育与炎症反应
膜相关分子模式 (MAMP) 维持着所有微生物类别的结构完整性和基本功能,甚至大脑也能检测到。这些是不同的化学基团,包括肽、核苷酸、碳水化合物和脂质。当宿主无法检测到此类分子模式时,它可能伴有急性到慢性炎症,并被发现会改变大脑的发育和功能。这些高度保守的结构基序与先天免疫系统细胞上的模式识别受体 (PRR) 结合,从而诱导线粒体 ROS 的产生和 NF-κB 通路的激活,导致炎症反应,引起神经元应激和细胞死亡。
在最近的一项研究中,据报道,细菌细胞壁成分肽聚糖易位到发育中的大脑,影响基因表达并导致社会行为的改变。同样,革兰氏阴性细菌细胞壁中的脂多糖被发现会损害小鼠的胎儿大脑发育、急性抑郁和认知障碍。此外,在 PD、自闭症谱系障碍 (ASD) 和突触核蛋白病模型中,急性和慢性暴露于 MAMP 是导致疾病症状的一个因素。
机会性病原体产生的细菌毒素,也对神经系统产生负面影响
发现梭菌属(Clostridium )产生的致命毒素,如毒素 B、肠毒素和ε 毒素,可降低神经元活力,并通过破坏的 BBB到达大脑,抑制神经递质的释放。
葡萄球菌属(Staphylococcus)和芽孢杆菌属(Bacillus)产生的肠毒素和麦芽孢杆菌素可通过刺激迷走神经引起呕吐和疾病行为。
沙门氏菌和大肠杆菌等致病菌能够降解含硫氨基酸,从而在肠道中产生硫化氢 (H2S) 。H2S水平的升高会引起各种代谢活动的变化,如乳酸增加和ATP生成减少、环氧合酶2 (COX-2)活性抑制、线粒体对O2的消耗减少、促炎细胞因子表达增加,并且已知会刺激高血压和神经炎症。
肠道菌群介导的氧化应激在神经退行性病变中的作用
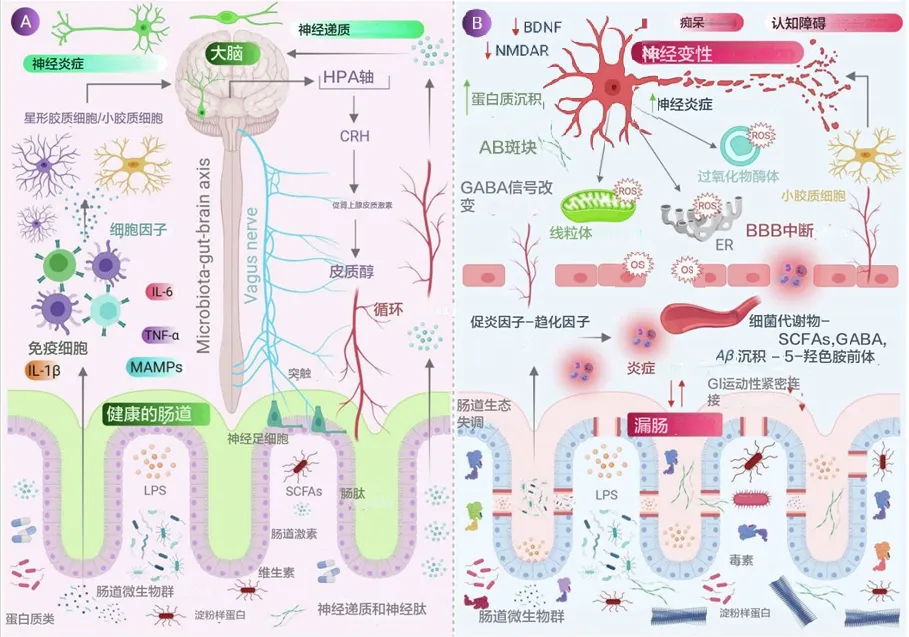
doi: 10.1016/j.jare.2021.09.005
神经退行性疾病(如阿尔茨海默病和帕金森病)的病因病理涉及神经细胞内蛋白质错误折叠及其聚集,氧化应激也被认为是其病理因素之一。发现帕金森患者的肠道中肌间神经丛(Auerbach丛)和粘膜下神经丛(Meissner丛)存在α-突触核蛋白的聚集,暗示了肠道菌群在启动肠道α-突触核蛋白聚集中的作用,然后通过跨突触途径向上影响中枢神经系统神经元导致神经退行性变化。
阿尔茨海默病:全球性的健康挑战
阿尔茨海默病 (AD) 是导致痴呆的主要原因,影响着全球超过 5000 万人口,其中老年人群的发病率更高,85 岁以上每 1000 人中约有 80 人患有该病。阿尔茨海默病的无症状病理学在记忆力减退和认知障碍等症状出现前约20年就开始了。
病理变化:蛋白质的异常积累
与阿尔茨海默相关的脑病理变化包括蛋白质淀粉样β蛋白 (Aβ-淀粉样斑块) 的细胞外积累和 tau 蛋白 (tau 缠结) 的细胞内积累。这种异常的蛋白质积累导致小胶质细胞被激活以清除 Aβ 和 tau 蛋白,但随着随后的衰老,会发生慢性炎症,引起神经元细胞死亡,从而导致萎缩。
氧化应激:阿尔茨海默的潜在危险因素
在可能的危险因素中,氧化应激和肠道微生物群的作用引起了科学界的关注,并被认为是神经退行性过程的直接可能后果。
许多研究表明,阿尔茨海默病患者大脑的抗氧化防御系统发生了变化,即超氧化物歧化酶和过氧化氢酶的活性和水平降低。同时,氧化应激生物标志物(如丙二醛、4-羟基壬烯醛和F2-异前列腺素、蛋白质羰基、3-硝基酪氨酸、8-羟基脱氧鸟苷)在血液和脑脊液中含量较高,这些物质的浓度与认知障碍和脑重量成正比。
阿尔茨海默症脑内ROS的产生还表现为细胞器功能障碍,如线粒体(细胞色素C氧化酶缺乏)、未折叠蛋白反应 (UPR) 引起的内质网、神经斑块中金属离子的积累以及小胶质细胞的过度活化和随后的NADPH氧化酶的过度表达。
Aβ沉积和氧化应激之间也存在相互关系
即Aβ聚集会诱导氧化应激(也存在于线粒体、内质网和高尔基体等细胞器中),而氧化应激会诱导Aβ积累。甚至,神经元中tau蛋白的聚集会导致NADH-泛醌还原酶活性降低,从而导致ROS生成增加和线粒体功能障碍。
肠道菌群失调→炎症→神经退行性病变
最近的事实和数据显示,阿尔茨海默不仅是局限性脑炎症的结果,也是外周炎症的结果。肠道菌群失调会导致炎症,而炎症会随着年龄的增长而增加,血脑屏障被破坏,免疫系统被激活,随后出现神经退行性病变,另一方面,健康均衡的肠道有助于减少 ROS 产生的有害影响。
共生菌减少,致病菌增加
已发现患有阿尔茨海默的个体体内共生菌如双歧杆菌和厚壁菌数量减少,大肠杆菌、志贺氏菌和拟杆菌数量增加,随后出现炎症和 Aβ 积累增加。
肠道菌群变化与阿尔茨海默病严重程度的关联
同样,在 APP/PS1 小鼠模型中,当用广谱抗生素联合治疗时,Aβ 斑块形成也减少。5xFAD 小鼠阿尔茨海默模型显示微生物群向促炎物种转变,同时氨基酸分解代谢也发生变化,相反,抗生素治疗可逆转这种影响,这表明疾病的严重程度和肠道菌群转化之间可能存在联系。
Toll样受体激活与肠道屏障紊乱
肠道中形成的微生物淀粉样蛋白激活 Toll 样受体 (TLR),分化簇 14 (CD14) 促进免疫反应,导致被忽视的错误折叠 Aβ 和 Aβ 清除受损,随后细胞因子产生增加,导致肠道和血脑屏障紊乱。此外,研究还表明,阿尔茨海默患者的肠道激素水平下降,相反,肠道微生物代谢物如 H2S 和三甲胺增加。
与年龄有关的肠道微生物多样性下降
研究表明,随着年龄的增长,双歧杆菌属减少,变形菌增加,痴呆症不是由于 SCFA 减少而是由于脂质代谢受到干扰。双歧杆菌在调节胆固醇水平方面发挥着重要作用,直接促进胆固醇通过粪便排出,间接通过增加血清瘦素水平,从而参与维持海马可塑性和记忆功能。
肠道菌群影响神经递质
肠道细菌如乳酸杆菌和双歧杆菌会代谢抑制性神经递质 GABA。一项研究发现,在 APPSwe/PSEN1DeltaE9 双基因 (人类早老素(DeltaE9)和人鼠淀粉样前蛋白(APPswe)融合体阿尔茨海默小鼠模型中,海马突触可塑性发生了改变,其中发现 GABA 生成减少,同时谷氨酸能神经传递增加。虽然有报道显示蓝藻门太高会产生导致认知障碍的神经毒素,但尚未观察到与阿尔茨海默的关系。
淀粉样蛋白的交叉播种机制
另一个可能的连接环节是脑淀粉样蛋白的积累和肠道微生物群,涉及微生物淀粉样蛋白的交叉播种机制,其方式类似于朊病毒的传播,因此形成的不同淀粉样蛋白构象体在其细胞靶标中诱导不同水平的毒性,推测存在阿尔茨海默表型。
口腔菌群与阿尔茨海默
除了肠道微生物群外,还研究了口腔共生菌与阿尔茨海默之间的联系。有趣的是,口腔卫生不良和牙齿脱落会增加阿尔茨海默早期发病的风险。
关于口腔菌群与神经系统疾病的关联,详见:
帕金森病 (PD) 的病理特征是多巴胺能神经元的进行性退化、磷酸化蛋白 α-突触核蛋白的聚集、过量 ROS 产生、线粒体功能障碍和小胶质细胞活化。其症状特征是患者无法控制自主运动(震颤、肌肉僵硬、行走困难和驼背姿势),这是由于大脑的黑质和纹状体区域受损所致。
它是第二常见的神经退行性疾病 (NDD),影响全球超过 1% 的老年人口。
关于肠道与帕金森病之间的关系的第一份报告出现在1817年詹姆斯·帕金森的一篇关于震颤麻痹的文章中。
注:詹姆斯·帕金森,我们所说的描述帕金森病的这位前辈,全名是“James William Keys Parkinson”。1817年,62岁的James Parkinson发表了论文“An Essay on the Shaking Palsy”,在文中,详细地描述了六例被其称为患有“震颤麻痹”的患者,在论文中他注意到了患者不适,像被无法逃脱的魔鬼所控制。他对这种疾病的描述,很多都被现在的医学观察所承认:不自主震颤的同时还有肌肉乏力,即使在被支撑时也不能缓解;身体前驱,不能刹车,越走越快甚至要小跑起来;感觉和智能几乎不受影响…..
肠道病理与帕金森病的联系
后来的研究支持了这一观点,表明了病理过程是从肠道开始,然后影响大脑。越来越多的证据显示,帕金森病患者常见的特征包括肠道炎症、磷酸化α-突触核的早期积累导致跨过迷走神经的腹背侧运动神经元、便秘问题和肠道通透性增加,这表明了肠道菌群与帕金森病发病机制之间的密切关系。
接受迷走神经切断手术的个体患帕金森病的风险降低,这进一步支持了肠道与PD之间的联系。
氧化应激与神经元损伤
较低水平的谷胱甘肽(GSH)和较高水平的铁和H2O2使黑质致密部 (SNc) 神经元易受氧化应激。而且,该区域的脂质过氧化和多巴胺氧化会导致神经元细胞死亡。研究还表明,线粒体呼吸链功能障碍会导致过量的 ROS 产生。
相关病理与细胞毒性
复合物 1 的抑制剂会对多巴胺神经元产生细胞毒性作用,这一事实也支持了这一观点,患有 α-突触核蛋白、磷酸酶和张力蛋白同源物 (PTEN) 诱导的假定激酶 1 (PINK1) 和 Parkin 病理的患者被检测到患有线粒体功能障碍和氧化应激增加。
异常蛋白聚集与肠道微生物群
与 AD 类似,异常蛋白质 α-突触核蛋白的聚集与氧化应激增加相关,反之亦然。谈到肠道微生物群的作用,一些致病菌会释放毒素,导致肠道和肠神经系统 (ENS)细胞的线粒体功能障碍,从而导致神经退行性。
肠道致病菌及其产物参与发病
帕金森病患者肠道中的致病菌增加及其微生物产物直接参与帕金森病的发病机制。为了支持这一事实,最近有报道称,大肠杆菌会产生一种名为 curli 的淀粉样蛋白,这种蛋白会促进 α-突触核蛋白在肠道和大脑中的聚集,会导致小鼠的运动障碍。
另一方面,当小鼠接受肠道限制性淀粉样蛋白抑制剂治疗时,小鼠的运动功能得到改善,便秘也得到改善,表明肠道与 PD 症状的病因有关。
克罗恩病与帕金森病共病风险高
肠道细菌引起的肠道炎症与 PD 中的进行性神经退行性病变直接相关。虽然 PD 患者的血清代谢谱和肠道成分发生了改变,但研究发现,在严重的 PD 情况下,肠道中的肠杆菌科细菌水平会增强,而抗炎细菌水平却非常低,这也表明它与克罗恩病的肠道炎症具有平行关联。这表明克罗恩病患者患 PD 的风险非常高。
同样,研究发现,在PINK1基因敲除小鼠模型中,柠檬酸杆菌(Citrobacter rodentium)感染会通过诱发肠道炎症加重 PD 症状。
肠道菌群代谢物影响PD药物疗效
除了诱发炎症之外,肠道菌群还会发挥代谢作用,例如,在 PD 患者中,其代谢物 β-葡萄糖醛酸、色氨酸和 SCFA 会发生改变。
肠道菌群的一个显著特性是,它能够通过降低抗 帕金森药物的生物利用度或增加药物失活来降低其疗效,就像在标准左旋多巴治疗中的那样。
H2饱和水对PD症状的改善
在这些研究中,还发现肠道细菌产生H2的减少是导致 PD 的因素之一。
当向患PD大鼠和 MPTP 小鼠模型提供 50% H2饱和水时,发现它能够成功减少黑质中的神经元丢失以及氧化应激标志物,当在人体中进行双盲随机试验时,PD患者的运动评分有所改善。
肠道菌群参与帕金森病的证据
此外,针对这一观点,最近对过表达人类 α-突触核蛋白基因的 GF 小鼠 PD 模型的研究表明,SCFA 水平降低,小胶质细胞活化减少,运动功能改善,这表明肠道菌群直接参与了增强 PD。
当将 PD 患者的肠道菌群移植到无菌α-突触核蛋白过表达的小鼠模型中时,运动症状恶化,表明肠道菌群功能失调在 PD 患者中起着作用。同样,用神经毒素治疗的小鼠模型显示肠道菌群组成发生改变,致病性肠杆菌科细菌水平升高。
一些特定的细菌物种,如奇异变形杆菌(Proteus mirabilis)发现能促进小鼠的神经退行性病变。综合起来,这些研究表明,肠道微生物群加剧了人类和动物帕金森病模型中的神经元功能障碍和神经炎症。
注:奇异变形杆菌(Proteus mirabilis, PM)是革兰阴性细菌,属于肠杆菌科。在自然界中广泛存在,具有特殊的群集运动能力,可促进结石形成,在导管、泌尿系上皮中形成结晶生物膜,是引起感染的重要病原。
创伤性脑损伤 (TBI) 是世界范围内最常见的损伤类型之一,是导致死亡和残疾的主要原因之一。
TBI的广泛影响
TBI 造成的残疾不仅包括脑的原发性机械损伤,还包括损伤后的继发性损伤,这种损伤发生在细胞和分子水平,可能导致代谢异常,如线粒体功能障碍、氧化应激、炎症、小胶质细胞活化、兴奋性毒性,从而造成暂时或终身的认知障碍。TBI 的严重程度不仅集中在大脑上,还可能造成多器官损伤,是一种异质性病理生物学状况。
TBI的治疗现状
由于脑损伤的异质性,针对 TBI 引起的神经病理学的治疗方法仍然缺乏,需要考虑新的治疗方案。针对这一问题,肠道益生疗法因其能够恢复肠道菌群失调和 TBI 之间的双面关系而受到广泛关注。
肠道微生物群与 TBI 损伤之间存在双向关系
TBI 的全身表现之一是肠道蠕动和通透性紊乱、粘膜损伤、肠绒毛组织病理学改变,这表明肠道微生物群组成受到干扰。
最近的报告显示,暴露于轻度反复性脑损伤 20 天的小鼠会逐渐出现白质损伤、认知能力下降和轻度、短暂性的肠道菌群失调。
肠道菌群失调也会影响创伤性中枢神经系统损伤的病理生理、血脑屏障通透性改变和小胶质细胞激活,导致严重后果。
研究发现,在脑损伤之前和之后,小鼠 TBI 模型中的肠道菌群耗尽会导致海马 CA1 区神经元密度增加、联想学习障碍减轻以及病变体积缩小。
TBI中肠道菌群的变化
最近的研究还表明,脊髓创伤后会出现肠道菌群失调,导致椎管内炎症和病变病理。
肠道菌群在TBI恢复中的作用
最近的一项研究指出,在 TBI 之前、期间和之后,广谱抗生素引起的肠道菌群失调会导致神经元丢失增加、神经发生受到抑制以及小胶质细胞和外周免疫反应发生改变,同时恐惧记忆反应也会发生调节。
因此,肠道菌群对 TBI 患者的影响具有至关重要的临床意义,因为 TBI 患者由于定期使用抗生素和长期住院,肠道菌群容易发生改变。此外,检测肠道菌群调节可能为识别 TBI 严重程度提供诊断工具,从而提供有针对性的治疗方法。
中枢神经系统与氧化应激
中枢神经系统极易受到氧化应激的影响,并导致神经系统疾病。由于高 O2需求和过氧化敏感脂质细胞的涌入,中枢神经系统运作期间会产生高水平的 ROS。这种氧化代谢产生活性物质,用于传递氧化还原信号以调节突触可塑性等关键功能。
抗氧化剂(无论是酶促还是非酶促、内源性还是外源性)通过阻止 ROS 的产生或清除自由基或使自由基产物失活来保护大脑免受氧化应激。
抗氧化防御机制
抗氧化酶的作用
抗氧化酶如:SOD通过催化超氧化物歧化为O2和H2O2来降低超氧化物阴离子的浓度;GPx还原H2O2和脂质过氧化物;硫醇特异性过氧化物酶如过氧化物酶减少羟基过氧化物的量,过氧化氢酶将H2O2转化为H2O和普通分子O2。
自由基激活参与抗氧化途径的基因转录,保护细胞免受不利影响。
谷胱甘肽不足可能会限制过氧化物酶的活性,从而使神经元更容易受到氧化应激的影响。
体内和体外研究表明:
重要途径与相关机制
Keap1-Nrf2-ARE 与神经退行性疾病相关的氧化应激防御机制有关,调节 SOD、硫氧还蛋白、过氧化物酶和 GPx 的活性。
NF-κB 是中枢神经系统 (CNS) 中的氧化还原传感器,可由 ROS 激活。
中枢神经系统抗氧化代谢的调节受到严格控制,而肠道微生物的作用是高度动态的。
肠道菌群之间、与宿主等相互作用产生代谢物
肠道菌与菌之间、菌与宿主之间的相互作用通过产生各种代谢物(如可吸收维生素、多酚、SCFA、BDNF、可扩散抗氧化剂和氧化剂气体等)来调节内源性和外源性 ROS 水平。
肠道菌群通过代谢物调节屏障、免疫系统、神经系统
肠道微生物还控制代谢物对血脑屏障的通透性、紧密连接完整性和肠道屏障,调节免疫系统,阻止病原体在肠道定植。副交感神经系统的迷走神经感知肠道代谢物,并将肠道信息传达给中枢神经系统,以产生特定的反应。
肠道菌群与神经系统疾病的关系
在应激条件下,迷走神经张力受到抑制,并由于菌群失调而表现出有害影响,如肠易激综合征 (IBS) 和炎症性肠病 (IBD)。参与 AD 发病机制的 Aβ 蛋白由肠道细菌(如ENS 中的大肠杆菌和肠道沙门氏菌)表达。
有益的肠道微生物还会产生多巴胺、血清素和 GABA。这些是调节 ENS 活性并可能相互关联的中枢神经递质。
肠道菌群管理小胶质细胞,失调引发神经炎症
一些研究表明,肠道微生物管理小胶质细胞的激活和成熟,而激活的小胶质细胞会释放大量诱导型一氧化氮合酶 (iNOS) 来调节 NO 的产生。菌群失调会引发炎症性 iNOS 并导致神经炎症。
我们已经看到肠道菌群的潜在作用以及氧化应激在介导神经元疾病中的重要作用,近年来,开发基于抗氧化剂的疗法来治疗氧化应激诱导的神经退行性疾病的需求日益增长,并且成为科学研究的重点。
抗氧化剂疗法与肠道微生物组的作用
抗氧化剂是能够抵消ROS/RNS诱导的氧化应激的化学或天然物质。尽管已经观察到抗氧化剂对糖尿病、关节炎、白内障和骨质疏松症等疾病的强大治疗作用,但用于中枢神经系统疾病的抗氧化疗法有限,仍然需要深入了解其机制。
肠道微生物组的双重作用
肠道微生物组的作用具有两面性,一方面它负责神经退行性(肠道菌群失调和神经炎症)的基本机制,另一方面,肠道微生物组及其代谢物调节许多相关通路,表明它们具有神经保护治疗作用。
蛋白质、维生素等微生物分子通过多步生物合成途径产生,可能对宿主系统产生有益或有害的影响。因此,通过包括益生元和益生菌在内的适当饮食来维持健康的肠道微生物群是维持神经元健康的先决条件。
肠道菌群代谢物的作用及其对肠道菌群的调节过程在神经退行性疾病(NDDs)中的作用
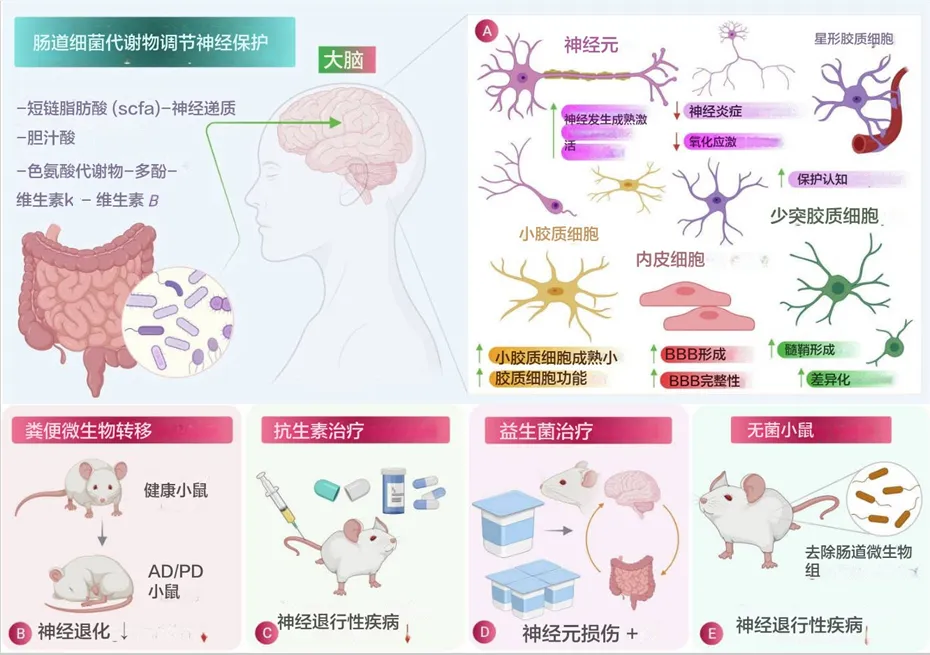
doi: 10.1016/j.jare.2021.09.005
肠道菌群在神经保护中的作用:
(A)肠道菌群释放的有益代谢物在减少炎症和氧化应激方面对脑细胞的特定影响示意图。
(B)粪菌移植 (FMT) 涉及将粪便细菌从健康个体转移到有病理状况的个体,被发现是一种有效的程序,可减少阿尔茨海默病、帕金森病、亨廷顿病和多发性硬化症等神经退行性疾病的病理生理。
(C)和(D)分别使用抗生素治疗和益生菌治疗,它们在减少神经退行性疾病的发病机制方面显示出相当大的效果。
(E)无菌小鼠(没有肠道微生物的小鼠)显示神经退行性疾病的减少,也用于研究肠道微生物对大脑生理的影响,从而显示肠道微生物参与神经退行性疾病。
肠道微生物群在神经保护中的作用

doi: 10.1016/j.jare.2021.09.005
肠道菌群与宿主分子的相互作用
胆汁酸的生成与功能
胆汁酸在肝脏中产生并在肠腔中释放,主要参与脂质和脂溶性维生素的溶解、能量代谢信号传导,并且在脑的生理学和病理生理学中发挥重要作用。
胆汁酸对神经系统的影响
胆汁酸通过直接结合穿过血脑屏障的脑内受体或通过与肠道受体结合间接诱导成纤维细胞生长因子 (FGF) 和胰高血糖素样肽 1 的释放,影响脑不同区域的神经元活动以及迷走神经活动。
胆汁酸的神经保护特性
胆汁酸如熊去氧胆酸 (UDCA) 和牛磺熊去氧胆酸 (TUDCA) 具有神经保护特性且无细胞毒性,这分别在其 III 期临床试验和动物研究中得到证实。最近的数据显示,TUDCA 有助于减弱慢性 PD 小鼠模型中的自噬、α-突触核蛋白聚集和蛋白质氧化。
此外,它还有助于通过Takeda G 蛋白偶联受体 5/sirtuin-3 (TGR5/SIRT-3) 通路防止蛛网膜下腔出血大鼠的神经元凋亡。同样,UDCA 在带电多泡体蛋白 2B (CHMP2B) 内含子 5 额颞叶痴呆模型中表现出神经保护作用。
肠道微生物对胆汁酸的影响
肠腔内的肠道微生物群在脱水酶的作用下将初级胆汁酸(胆酸和鹅去氧胆酸)转化为次级胆汁酸,包括氨基酸与胆汁盐水解酶和其他酶促过程的解离,从而改变它们的核受体结合、溶解度和循环。在人类和小鼠的 AD、PD、ASD多发性硬化症模型中发现了次级胆汁酸水平的变化。
此外,细菌修饰的胆汁酸对 ALS 和中风有神经保护作用。肠道微生物群落的调节可导致胆汁酸水平和性质的变化,这可能是神经退行性或神经保护性的。
胆汁酸在神经保护和疾病治疗中的潜在应用
肠道微生物介导的脱氧胆酸增加会诱导小鼠 EC 中神经递质血清素的释放。胆汁酸代谢物被发现可改善脱髓鞘和减少氧化应激,通过分别作用于少突胶质细胞和小胶质细胞增强其神经保护作用。然而,微生物操纵的胆汁酸的潜在作用和影响尚不清楚,仍有待明确定义。
类固醇激素在大脑发育和功能中的作用
类固醇激素发出的信号对大脑的发育和功能(记忆、决策和性行为)至关重要。类固醇激素在整个身体中循环时,会遇到肠腔内的微生物群。
肠道微生物对类固醇激素的修饰作用
肠道细菌在 β-葡萄糖醛酸酶和 β-葡萄糖苷酶介导的去结合反应中修饰类固醇激素,从而重新激活激素并阻止其排泄。因此,肠道微生物群通过降解和活化途径影响活性和非活性类固醇激素的水平。
肠道微生物与性激素代谢
研究发现,雄激素和雌激素受到肠道微生物群的影响。研究发现,大量肠道细菌能代谢雌激素,雌激素在粪便样本中也会发生氧化还原反应,这表明肠道微生物群发挥了作用。
研究发现,肠道微生物群还具有将睾酮和胆固醇转化为雄激素的能力。受微生物影响的雌激素具有神经保护作用,对小胶质细胞具有抗炎作用。
此外,肠道微生物群落改变会导致雌激素水平降低,从而导致慢性炎症和认知障碍。雌激素分子还会影响少突胶质细胞的分化和髓鞘形成。最近的报告还显示,即使在 MPTP 帕金森病小鼠模型中使用黄体酮治疗也显示出神经保护、抗炎和免疫调节作用,但神经保护作用是始于肠道还是大脑仍不清楚。
肠道菌群与饮食分子的相互作用
膳食氨基酸与肠道微生物代谢
膳食氨基酸也可以被肠道微生物代谢,它们对大脑的影响取决于膳食摄入的类型和频率。虽然肠道微生物编码的氨基酸在宿主体内循环,但影响中枢神经系统的氨基酸是由肠道细菌代谢的膳食氨基酸。
芳香族氨基酸
酪氨酸、色氨酸和苯丙氨酸等芳香族氨基酸被肠道细菌代谢为短链脂肪酸、吲哚衍生物、神经递质、有机酸、胺和氨。
酪氨酸
酪氨酸代谢的最终产物是由酪胺中间体形成两种儿茶酚胺、多巴胺和去甲肾上腺素。体外研究表明,大量肠道细菌可以产生毫摩尔范围内的去甲肾上腺素。最近的报告显示,非肾上腺素通过刺激 B-3 肾上腺素能受体增加星形胶质细胞的谷胱甘肽供应,从而保护神经元免受 H2O2诱导的神经元死亡。
研究发现,酪氨酸也被肠道微生物代谢为苯酚,如 4-乙基苯酚,随后在宿主体内被硫酸化为 4-乙基苯酚硫酸盐,在 ASD 小鼠模型中发现该物质升高,也是 ASD 儿童尿液的生物标志物。
色氨酸代谢产生的神经活性分子
色胺和犬尿氨酸等吲哚衍生物是肠道细菌代谢色氨酸的产物,是一种神经活性分子。吲哚丙酸是一种吲哚衍生物,可作为抗氧化剂减少神经炎症,并被观察到在减少 AD 病理方面具有潜在作用。
发现犬尿氨酸代谢物会影响焦虑、记忆和应激样行为。还观察到犬尿氨酸代谢途径的紊乱会促进炎症、兴奋毒性谷氨酸的产生和自由基攻击,表明平衡的犬尿氨酸具有神经保护作用,并在 AD、PD 和 HD 中具有抗炎作用。
色氨酸代谢物通过调节其芳烃受体有助于降低星形胶质细胞的炎症反应,同时也影响它们与小胶质细胞的相互作用。同样,还观察到吲哚酚-3-硫酸盐控制小胶质细胞的活化,随后控制其与星形胶质细胞的相互作用。
谷氨酸和精氨酸的神经保护
氨基酸谷氨酸也被肠道细菌谷氨酸脱羧酶转化为 GABA,一种抑制性神经递质,在小鼠模型中观察到它可以减轻抑郁和焦虑症状。
就氨基酸精氨酸而言,它被代谢成四种多胺,即胍丁胺、腐胺、亚精胺和精胺,它们的作用机理是谷氨酸受体并参与维持突触可塑性和记忆形成。
胍丁胺在作为脑中 α-2 肾上腺素能受体和咪唑受体的配体时,对中枢神经系统疾病有治疗作用。亚精胺也在 3-硝基丙酸 3-NP HD 模型中显示出神经保护作用。
此外,胍丁胺能刺激 Nrf-2 信号通路,改善脂多糖 (LPS) 诱导的 ROS 产生。体外和体内研究还表明,胍丁胺可保护星形胶质细胞和小胶质细胞免受氧化应激引起的损伤。这些研究表明肠道微生物内分泌学在神经科学中的潜在作用。
肠道菌群可以将膳食纤维代谢成短链脂肪酸
未消化的膳食纤维(如复合碳水化合物多糖)在肠道微生物酶糖苷水解酶和多糖裂解酶的作用下,通过厌氧发酵转化为短链脂肪酸(SCFA)。
丁酸、乙酸和丙酸组成短链脂肪酸,是结肠上皮细胞的能量来源。除此之外,它还进入体循环,随后直接或间接影响许多器官的生理功能,包括神经发育和功能。
短链脂肪酸在神经退行性疾病中的作用
有报道显示,当通过使用益生菌混合物或使用抗炎短链脂肪酸来调节 AD 小鼠模型的肠道菌群时,有助于抵消疾病的进展。同样,短链脂肪酸被发现能有效加剧 GF 小鼠 PD 模型中的运动症状。
SCFA对神经系统的直接影响
短链脂肪酸和乙酸穿过血脑屏障,激活神经元,调节神经递质和神经营养因子的水平。一项研究表明,丙酸和丁酸会影响神经元细胞内的钾水平。
丁酸是调节表观遗传基因活化(组蛋白去乙酰化酶)的酶的强效抑制剂,并被发现在 AD、PD、HD、中风和记忆障碍的小鼠模型中起到强效抗炎剂的作用。
有趣的是,SCFA 会干扰 Aβ 肽之间的相互作用,形成神经毒性低聚物,从而预防 AD 病理。据报道,将野生型小鼠的粪便微生物群移植到 PD 动物模型中,同时给予丁酸,可显著改善运动症状和多巴胺缺乏症。
SCFA对神经系统保护的多重机制
当我们观察细胞特异性反应时,丁酸已被证明可以在体外减少星形胶质细胞中的神经炎症和氧化,而乙酸盐被这些细胞用作能量来源。
一项研究发现,SCFA 通过与内皮细胞上的 SCFA 受体结合来增加紧密连接蛋白的表达,从而有助于降低 血脑屏障的通透性并预防 LPS 诱发的癫痫和中风。
SCFA 通过减少小胶质细胞活化来减少大脑中的氧化应激,从而对抗 AD 和 PD 中的神经炎症。总之,从膳食纤维中获得的 SCFA 有助于改善大脑健康,具体取决于个人的肠道健康状况。
多酚的分类及抗氧化特性
多酚是植物中存在的生物活性分子,在植物的生长、保护和繁殖中起着根本性的作用。多酚分为黄酮类化合物、酚酸类化合物和单宁类化合物。
多酚的分子结构,即羟基的位置和芳香环取代的性质,使其具有清除自由基的能力,并被广泛研究作为治疗NDD的抗氧化疗法。
多酚的代谢及其神经保护机制
未吸收的多酚在宿主体内通过水解和酯化作用,在肠道微生物群的作用下转化为生物可利用和生物活性的代谢物,随后在到达外周组织之前进行甲基化、硫酸化、羟基化等修饰。
研究表明,从葡萄和葡萄酒中提取的白藜芦醇、从绿茶中提取的姜黄素和表没食子儿茶素-3-没食子酸酯等不同多酚通过激活蛋白激酶通路(如 Keap1/Nrf-2/ARE)发挥神经保护作用,而这些通路是缓解内源性和外源性 ROS 的主要通路。
多酚代谢物在神经退行性疾病中的潜在作用
据报道,细菌多酚代谢物如 3-羟基苯甲酸和 3-(3′-羟基苯基)丙酸可抑制淀粉样蛋白聚集,从而有助于抑制 AD 的进展。
同样,据观察,黄酮类槲皮素可作为 BACE-1 抑制剂。此外,天然黄酮类原花青素可在体外 减轻鱼藤酮诱导的多巴胺能神经元的氧化应激。此外,肠道菌群产生的多酚(如阿魏酸)可促进神经发生,并在 AD和脑缺血的小鼠模型中显示出神经保护作用。
多酚与肠道菌群的相互作用及其对神经保护的影响
雌马酚和肠内酯也是肠道细菌通过代谢植物雌激素(多酚之一)产生的衍生物,可能对雌激素受体介导的经典神经保护途径产生影响。有趣的是,多酚还可以调节肠道菌群的组成,进一步将其转化为抗炎和神经保护代谢物。
扩展阅读:
肠道微生物与维生素合成
肠道微生物也是维生素的重要来源,特别是维生素B和K,它们不仅对肠道微生物代谢至关重要,而且还对宿主的生理途径产生影响。
维生素的吸收与生理作用
虽然膳食维生素通过小肠吸收,但微生物衍生的维生素的吸收发生在结肠中。为了预防新生儿出血性疾病,在肠道菌群建立之前,需要补充维生素K,这是血栓形成过程中必不可少的物质。
此外,维生素B和K对大脑发育和功能也很重要。就神经退行性疾病 (NDD)而言,许多研究表明维生素B和K在改善神经元健康方面发挥着有效作用。
维生素K在神经退行性疾病中的作用
研究发现,维生素K缺乏与AD的发病机制有关,增加膳食中维生素K的摄入有助于改善老年患者的记忆功能。
最近的报告显示,维生素K2(甲基萘醌-4)具有强大的抗氧化特性,能显著抑制鱼藤酮诱导的p38活化、ROS产生和caspase-1活性,进而恢复线粒体膜电位,显示出其在治疗神经炎症诱导的帕金森方面的潜力。
类似地,维生素 K2 可有效调节 PC12 小鼠神经母细胞瘤细胞中的 bax 和 caspase-3 活化,保护其免受 6-OHDA 诱导的细胞凋亡。
维生素缺乏与神经系统疾病的关系
最近的一份报告显示,帕金森病患者体内维生素 K2 水平低与炎症反应失调和凝血信号级联有关。
维生素 B 缺乏还与脚气病和多发性神经病等神经系统疾病有关。同样,叶酸缺乏与老年女性的认知障碍和进行性痴呆有关。而且,大量摄入 B6、B9 和 B12 可降低与 AD 认知能力下降有关的大脑区域萎缩的速度。此外,还需要更多建设性的研究来证明肠道微生物群产生的维生素在神经保护中的潜在联系。
扩展阅读:
自由基可能带来的危害
ROS 形式的自由基是细胞正常代谢过程的副产物。自由基有可能破坏遗传物质、使酶失活、使复合碳水化合物解聚以及使脂质过氧化。
抗氧化剂的保护机制
细胞内分子的这种破坏会导致细胞死亡。为了平衡自由基,身体具有特定的抗氧化剂,如谷胱甘肽。
一些产品也开始流入医药市场以应对氧化应激,如阿魏酸 (FA),因为它具有抗氧化和抗炎特性。它通过增强 BDNF 和神经生长因子 (NGF) 以及一些具有抗炎特性的神经肽的产生来帮助神经干细胞增殖。
益生菌在抗氧化应激中的作用
2017 年的研究,益生菌如植物乳杆菌 NCIMB 8826、发酵乳杆菌 NCIMB 5221和动物双歧杆菌也能通过细菌 FA 酯酶大量产生 FA。
由于其治疗效果,它在 AD 治疗中的应用越来越受到关注,用 FA 进行预处理已被证明可以减少 Aβ 原纤维并治疗 AD 小鼠的神经炎症。产生 FA 的益生菌通过清除 ROS 来抑制 β-淀粉样蛋白原纤维的形成和聚集。
SIRT1蛋白脱乙酰酶的抗氧化特性
其他益生菌蛋白,sirtuin-1 (SIRT1) 蛋白脱乙酰酶已被证明具有抗氧化特性。这种蛋白质调节宿主抗氧化途径的基因,并具有神经保护作用。
在接受治疗的转基因 3xTg-AD 小鼠中,观察到大脑中 SIRT1 蛋白的表达和活性恢复,Aβ 肽的形成减少。然而,在未经治疗的 AD 小鼠中,发现 SIRT1 的表达显著下降。
此外,SIRT1 活性增强可降低 p53 蛋白乙酰化,并通过抑制凋亡途径提高应激细胞的存活率。其他研究也表明,益生菌补充剂可激活 SIRT1 途径并激发抗氧化作用。
SLAB51益生菌配方的神经保护作用
最近的研究探究了一种名为 SLAB51(嗜热链球菌、嗜酸乳杆菌、植物乳酸杆菌、副干酪乳酸杆菌、德氏乳酸杆菌保加利亚亚种、短乳酸杆菌、长双歧杆菌、短双歧杆菌、婴儿双歧杆菌)的益生菌配方缓解氧化应激的能力,并发现了其作用的分子机制。
SLAB51 还能增强 GPx 和过氧化氢酶抗氧化酶的活性,从而减轻氧化应激引起的损伤。在人类中也观察到了类似的发现,AD 患者大脑中的 SIRT1 浓度显著降低,这与 AD 患者大脑皮层中淀粉样蛋白 β 和 tau 的积累密切相关。一项补充益生菌菌株干酪乳杆菌 01 的人体研究报告称,SIRT1 水平有所提高。
肠道菌群与免疫反应
肠道菌群与宿主免疫细胞之间的关系非常脆弱。免疫细胞专门区分宿主友好细菌和致病细菌。如果这种关系受到损害,则会导致不必要的免疫反应,引发慢性炎症。这种分化是由肠上皮细胞启动的,肠上皮细胞负责根据细菌细胞表面抗原(如 LPS、肽聚糖和鞭毛蛋白)产生受过训练的巨噬细胞表型。当上皮细胞变得容易受到致病攻击时,抗原会转移到脉管系统中,并产生促炎细胞因子,如 IL(白细胞介素)-1、IL-6 和肿瘤坏死因子-α (TNF-α),从而导致感染性休克以及肠道和脑部炎症。
肠道微生物与神经系统炎症的关联
一些细菌毒素也可以穿过血脑屏障。为了探究微生物在淀粉样变性中的作用,研究人员通过评估认知障碍患者几种肠道微生物的促炎(CXCL2、CXCL10、IL-1β、IL-6、IL-18、IL-8、炎症小体复合物 NLRP3、TNF-α)和抗炎(IL-4、IL-10、IL-13)细胞因子活性进行了研究,结果发现:
大肠杆菌/志贺氏菌的数量增加和直肠真杆菌的数量减少与认知障碍和淀粉样蛋白阳性患者的促炎和抗炎细胞因子浓度变化显著相关。同时,在 AD 患者中观察到 IL-6、CXCL2、NLRP3 和 IL-1β 水平升高,而 IL-10 水平降低。这项研究表明,肠道微生物群可能引发、加重或减轻神经系统疾病的外周炎症。
扩展阅读:
随着技术的进步,有关大脑的知识正在成倍增加。神经科学家从分子生物学、分子遗传学、脑成像和其他新技术中生成了大量数据,并且对共享神经科学数据以进行各种分析有着浓厚的兴趣。
神经成像在预测和检测神经退行性疾病和精神障碍方面也非常有帮助。为了收集和分析神经科学数据,正在开发各种生物信息学工具,以进一步开发基于大脑功能的设备。到目前为止,研究人员对因各种压力条件而导致神经退化的分子通路有了初步了解。
集成数据库将有助于从公开来源收集与神经退行性疾病相关的不同类型的数据。
当前与神经数据相关的活跃数据库
编辑
doi: 10.1016/j.jare.2021.09.005
随着高通量技术的加强,人们对微生物组的全面了解及其在人类健康中的重要性正在快速增长。
近期已证明肠道细菌可以改变中枢神经系统生理,而菌群失调可能是神经炎症的一个潜在因素。
微生物群影响左旋多巴治疗PD效果,数据库助力解析神经退行性疾病
据报道,在临床试验中,左旋多巴治疗 PD 的结果在招募受试者之间有所不同。这种差异是由于他们的微生物群造成的。L-多巴由不同肠道细菌物种(即粪肠球菌和Eggerthella lenta A2)的酪氨酸脱羧酶 (TDC) 和多巴胺脱羟酶 (Dadh) 代谢。
为了灭活细菌 L-多巴脱羧酶,人们发现了一种药物,即 (S)-α-氟甲基酪氨酸 (AFMT)。L-多巴和 AFMT 的组合被用于治疗帕金森病。与健康个体相比,AD 患者的肠道微生物群在分类学水平上发生了改变,例如拟杆菌、放线菌、瘤胃球菌、毛螺菌科。
宏基因组数据/16S RNA 测序数据支持菌群失调与 AD 之间存在明确关联。细菌产物(如 LPS 和 SCFA)与淀粉样蛋白病理有关。开发这些数据库的主要目的是将数据组织成一组结构化记录,这些记录有助于分析师检索信息进行不同的分析,从而为与神经退行性疾病相关的各种未解之谜提供解决方案。
肠道微生物群与大脑的相互联系已导致神经科学研究取得变革性进展。迄今为止,发现的大多数研究都与肠道细菌神经科学研究有关,但肠道微生物群非常庞大,需要科学家的关注,以确定和描述肠道微生物及其群落对肠脑信号传导途径的影响。
★ 为什么大脑容易发生氧化应激?
目前我们了解到大脑含有丰富的神经元,突触以及神经胶质细胞,相比于其他器官有更高的能量代谢活动和要求,大脑的抗氧化防御系统较弱,因此容易出现氧化还原稳态紊乱。
大脑Ca2+的稳态失调,神经元的兴奋性氨基酸在大量摄入导致谷胱甘肽(SH)的耗竭,从而引发神经元的铁死亡。
神经递质如多巴胺、5-羟色胺和去甲肾上腺素自动氧化生成ROS。大脑对由葡萄糖诱导的氧化应激敏感。大脑富含多不饱和脂肪酸,尤其是二十碳五烯酸(DHA),这使得其更容易受到氧化应激的影响,因为脂质过氧化和脑部利用过氧脂质进行信号传导。
脑部的微胶质细胞是大脑的常驻免疫细胞,对于大脑发育和功能至关重要。微胶质细胞活性取决于总的氧气生物可用性,并借此展示对突触的损伤,通过消耗更多氧气来产生O2–。H2O2和NO等反应性物质在损伤部位吸引微胶质细胞,引发局部炎症并推动神经退行性。
因此综合以上因素表面大脑容易发生氧化应激,这是很多神经退行疾病比如阿尔茨海默病,帕金森以及痴呆等的主要原因。
而大量的研究观察到肠道微生物组在通过其自身代谢产物或产生次生代谢产物减轻氧化应激、炎症和能量代谢方面发挥了不可忽视的作用。
★ 肠道菌群如何影响神经系统?
肠道微生物还控制代谢物对血脑屏障的通透性、紧密连接完整性和肠道屏障,调节免疫系统,阻止病原体在肠道定植。副交感神经系统的迷走神经感知肠道代谢物,并将肠道信息传达给中枢神经系统,以产生特定的反应。
在应激条件下,迷走神经张力受到抑制,并由于菌群失调而表现出有害影响,如肠易激综合征 (IBS) 和炎症性肠病 (IBD)。参与 AD 发病机制的 Aβ 蛋白由肠道细菌(如ENS 中的大肠杆菌和肠道沙门氏菌)表达。有益的肠道微生物还会产生多巴胺、血清素和 GABA。这些是调节 ENS 活性并可能相互关联的中枢神经递质。
肠道微生物管理小胶质细胞的激活和成熟,而激活的小胶质细胞会释放大量诱导型一氧化氮合酶 (iNOS) 调节 NO产生。菌群失调会引发炎症性 iNOS 并导致神经炎症。
★ 肠道菌群代谢物的作用
胆汁酸通过直接结合穿过血脑屏障的脑内受体或通过与肠道受体结合间接诱导成纤维细胞生长因子 (FGF) 和胰高血糖素样肽 1 的释放,影响脑不同区域的神经元活动以及迷走神经活动。
色胺和犬尿氨酸等吲哚衍生物是肠道细菌代谢色氨酸的产物,是一种神经活性分子。吲哚丙酸是一种吲哚衍生物,可作为抗氧化剂减少神经炎症,并被观察到在减少 AD 病理方面具有潜在作用。
短链脂肪酸和乙酸穿过血脑屏障,激活神经元,调节神经递质和神经营养因子的水平。一项研究表明,丙酸和丁酸会影响神经元细胞内的钾水平。
雌马酚和肠内酯也是肠道细菌通过代谢植物雌激素(多酚之一)产生的衍生物,可能对雌激素受体介导的经典神经保护途径产生影响。
而通过使用具有抗氧化和抗炎活性的益生菌来调节肠道微生物组已显示出有希望的神经恢复能力。
★ 益生菌帮助恢复神经系统
益生菌如植物乳杆菌 NCIMB 8826、发酵乳杆菌 NCIMB 5221和动物双歧杆菌也能通过细菌 FA 酯酶大量产生 FA。由于其治疗效果,它在 AD 治疗中的应用越来越受到关注,
最近的研究探究了一种名为 SLAB51(嗜热链球菌、嗜酸乳杆菌、植物乳酸杆菌、副干酪乳酸杆菌、德氏乳酸杆菌保加利亚亚种、短乳酸杆菌、长双歧杆菌、短双歧杆菌、婴儿双歧杆菌)的益生菌配方缓解氧化应激的能力,并发现了其作用的分子机制。
从德氏乳杆菌(Lactobacillus delbrueckii)亚种Lactobacillus delbrueckii ssp. bulgaricus B3 和 Lactobacillus plantarum GD2 中分离出的胞外多糖可保护 SH-SY5Y 细胞免受 Aβ(1–42) 诱导的细胞凋亡,这表明它们有望成为药物治疗阿尔茨海默病 (AD)的有前途的天然化学成分。
★ 饮食塑造肠道菌群缓解氧化应激助力大脑健康
氨基酸谷氨酸也被肠道细菌谷氨酸脱羧酶转化为 GABA,一种抑制性神经递质,在小鼠模型中观察到它可以减轻抑郁和焦虑症状。
就氨基酸精氨酸而言,它被代谢成四种多胺,即胍丁胺、腐胺、亚精胺和精胺,它们的作用机理是谷氨酸受体并参与维持突触可塑性和记忆形成。
从葡萄和葡萄酒中提取的白藜芦醇、从绿茶中提取的姜黄素和表没食子儿茶素-3-没食子酸酯等不同多酚通过激活蛋白激酶通路(如 Keap1/Nrf-2/ARE)发挥神经保护作用,而这些通路是缓解内源性和外源性 ROS 的主要通路。
主要参考文献
2020 Alzheimer’s disease facts and figures. Alzheimer’s Dement 2020;16:391–460.
Akasaka Naoki, Fujiwara Shinsuke. The therapeutic and nutraceutical potential of agmatine, and its enhanced production using Aspergillus oryzae. Amino Acids. 2020;52(2):181–197.
Barua Sumit, Kim Jong Youl, Kim Jae Young, Kim Jae Hwan, Lee Jong Eun. Therapeutic Effect of Agmatine on Neurological Disease: Focus on Ion Channels and Receptors. Neurochem Res. 2019;44(4):735–750.

谷禾健康
在这个充满压力、紧张和焦虑的快节奏世界中,人人都容易患上许多身心疾病。
根据世界卫生组织 (WHO) 的数据,世界上每 8 人中就有 1 人患有精神障碍,其中焦虑症和抑郁症最为常见。尤其经历疫情,仅2020年,全球重度抑郁症患者增加27.6%(95%不确定区间(UI):25.1-30.3),焦虑症患者增加25.6%(95%不确定区间:23.2-28.0).

情绪健康对身体健康有直接影响,反之亦然。这背后的原因离不开肠道和大脑之间的双向交流,这两者之间的对话主要是由肠道微生物群介导的。
也就是说,肠道微生物群在神经精神疾病的发病机制中起着至关重要的作用。
精神障碍,包括抑郁、焦虑、恐惧、双相情感障碍、精神分裂症和其他精神病、痴呆、以及自闭症和创伤后应激障碍等,都有一系列症状,比如:异常的思想、感知、情绪、行为和人际关系等。

哪些因素会引发精神疾病?
大多数精神疾病是由环境、心理和生物因素共同引起的。遗传、脑损伤、微生物感染、药物滥用、营养不良或暴露于环境污染物都可能在精神障碍的发展中发挥重要作用。
环境污染物影响精神疾病易感性
随着世界各地工业流程和技术的进步,现代文明产生的各种环境污染物已大大增加。人们在日常生活中会接触到各种各样的污染物,这些污染物会影响肠道微生物群并操纵肠道和大脑之间的双向交流,从而导致精神或神经系统疾病的易感性。
精神益生菌:有助大脑健康的下一代益生菌
精神益生菌是一种能够影响肠-脑轴的益生菌菌株,对改善微生物群以及缓解中枢神经系统疾病的某些症状具有积极作用。常见的精神益生菌包括:乳酸杆菌、链球菌、双歧杆菌、大肠杆菌、肠球菌等。
//
本文讨论了各种环境污染物(重金属、邻苯二甲酸盐、双酚 A 、颗粒物等)如何影响错综复杂的微生物群-肠-脑轴,从而影响神经和整体心理健康,总结了精神益生菌如何通过菌群有效缓解多种中枢神经系统疾病的症状及改善心理健康。
本文涉及的专业术语
CNS—中枢神经系统
ENS—肠神经系统
HPA—下丘脑-垂体-肾上腺
GBA—肠脑轴
MGBA—微生物-肠-脑轴
GABA—一种中枢神经系统抑制性神经递质
VN—迷走神经
BDNF—脑源性神经营养因子
在了解环境污染物如何引发精神疾病之前,我们先来了解一下:微生物群-肠-脑轴。
微生物群-肠-脑轴是如何运作的?
它负责协调肠神经系统(ENS)和中枢神经系统(CNS)之间的双向交流,将外周消化活动与大脑的情绪、行为和认知中心联系起来。
微生物群-肠-脑轴 (MGB) 的双向交流
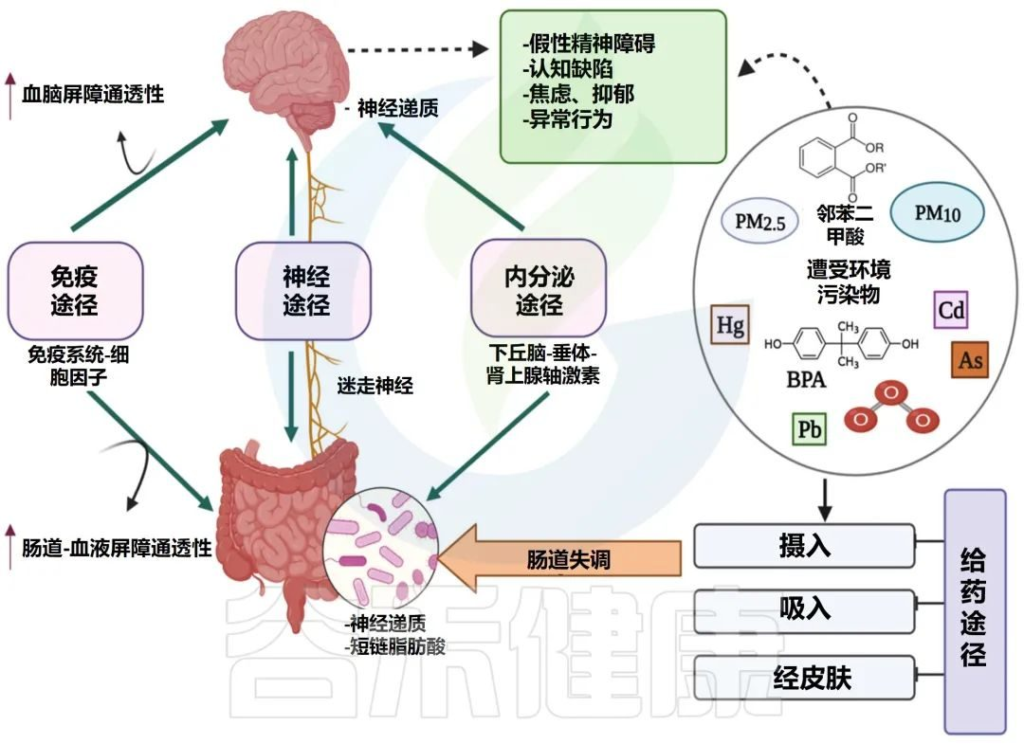
Singh S,et al., Microorganisms.2022
这种关联受皮质醇和下丘脑-垂体-肾上腺(HPA)激素、迷走神经(VN)系统和免疫反应等激素的调节。迷走神经是副交感神经系统的主要组成部分,可将肠道信号传递到中枢神经系统并刺激反应。
肠道菌群在肠-脑轴中如何发挥作用?
肠道菌群可以通过多种潜在机制改变大脑功能:
同时并产生具有神经活性特性的代谢物,例如短链脂肪酸、支链氨基酸、肽聚糖等。
这在我们之前的文章也有详细阐述过:
深度解读 | 肠道菌群和中枢神经系统的关系
微生物群-肠-脑轴如何影响压力、焦虑等?
肠-脑轴的作用已在几个生理过程中得到证实,例如饱腹感、食物摄入以及脂肪和骨代谢、葡萄糖调节和胰岛素分泌。
此外,宿主行为受肠神经系统和中枢神经系统与肠脑轴相关性的影响。这些系统活动的减少与压力或焦虑增加有关。
已经确定肠脑轴活性受降钙素基因相关肽(CGRP)的调节。当增加的病原微生物破坏肠道微生物群时,神经元可以产生CGRP并将其释放到肠道中。感染可诱导CGRP的分泌,进而激活宿主防御和降钙素受体的相应免疫反应。
微生物-肠-脑轴的存在表明,通过饮食、宿主衍生代谢物和不同环境污染物改变肠道微生物的组成和数量,可以影响中枢神经系统和肠神经系统,从而影响精神疾病的发生和发展。
菌群代谢产物——短链脂肪酸
有助于调节中枢神经系统
短链脂肪酸可以通过单羧酸盐转运蛋白穿过血脑屏障(BBB),通过过度表达紧密连接蛋白并保持血脑屏障的完整性。
短链脂肪酸可以调节神经营养因子 (BDNF) 的水平,促进神经发生,影响神经胶质细胞的形态和功能,有利于血清素形成并改善神经元稳态和功能,所有这些都有助于调节中枢神经系统中的神经炎症。
短链脂肪酸与这些肠-脑网络的结合可以直接或间接地改变认知、情绪和精神障碍的病理生理学。
通过调节途径(包括犬尿氨酸途径)改变神经递质活性,以及大脑中短链脂肪酸的可用性和影响的变化,都可能对脑源性神经营养因子(BDNF)功能产生影响,包括中枢神经系统中的神经元存活和分化。
如肽酪氨酸酪氨酸 (PYY)、胆囊收缩素(CCK)和胰高血糖素样肽-1(GLP-1)从表达游离脂肪酸受体(FF-R)的肠粘膜肠内分泌细胞中的释放。在啮齿动物中,血源性PYY和GLP-1会渗透到大脑中,并对神经递质和行为产生显著影响。
每天接触各种环境污染物会影响肠道微生物群,损害肠脑轴,它们是如何导致抑郁、焦虑等心理健康问题的?下一章节我们展开讨论。
我们知道,人体各类疾病(免疫性疾病、胃肠道疾病和神经行为疾病)可能是由于微生物群的变化而产生的,微生物群失调后致病菌增多,产生毒力因子,如脂多糖,从而引发一系列导致“肠漏”的过程。
所谓“肠漏”,即肠黏膜通透性增加,这可能使细菌、细菌毒素和其他小分子物质泄漏到血液中并引起全身炎症。
关于肠漏详见:什么是肠漏综合征,它如何影响健康?
细菌毒素因子和代谢物能够转移到远处的目标区域,例如大脑。激素合成、细菌产生的代谢物、模仿宿主产生的因子和表观遗传突变都是肠道菌群失调影响宿主的潜在机制。
✦ 环境污染物通过干扰菌群影响宿主
暴露于环境污染物会针对宿主和常驻肠道微生物群,其干扰可能会产生系统性影响,包括通过微生物群-肠-脑轴改变中枢神经系统的功能。
重金属、有机溶剂和空气污染物是研究最多的与人类精神疾病和心理功能有关的人造和天然毒物类型。
研究人员发现那些生活在土壤中重金属和重金属浓度较高的地区的人,患精神疾病的可能性更高。即使较低的水平也会导致肠道失调和对心理健康的负面影响。
重金属类型:
铅 (Pb)、镉 (Cd )、汞( Hg )等。
重金属可能以四种方式进入人体:
▸ 重金属如何对人类健康的不利影响?
在重金属到达大脑之前,初步的环境暴露预计会与肠道微生物群相互作用。
当重金属到达胃肠道系统时,重金属毒性可能由肠道微生物组通过代谢氧化或还原过程介导。另一方面,重金属会引起氧化应激,改变肠道屏障的通透性,扰乱人体健康的微生物群,导致菌群失调。肠道菌群失调提高了重金属和氧化应激的潜在破坏性影响,这与精神疾病有关。
肠道菌群对重金属的吸收和代谢的直接影响
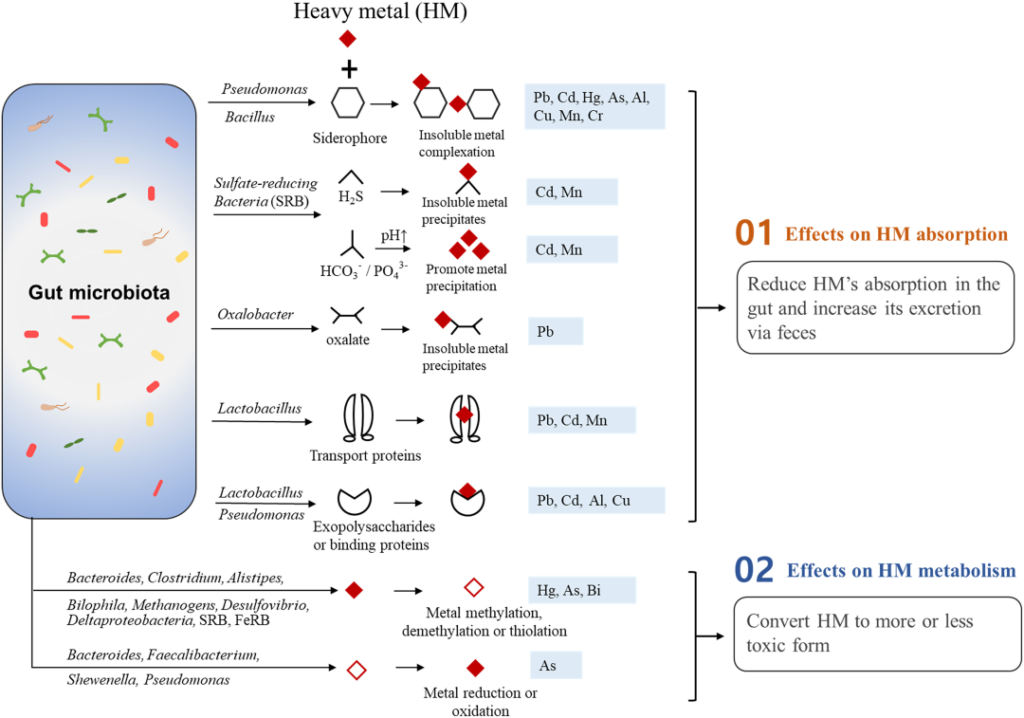
Duan H, et al., Sci Total Environ. 2020
【 铅 】
铅是一种众所周知的神经毒素,它对单胺信号传导 、下丘脑-垂体-肾上腺(HPA)轴和其他几个大脑系统的影响与情绪障碍有关。
几项动物研究表明,接触铅会导致HPA轴永久功能失调。
▸ 重金属导致线粒体功能障碍,与精神疾病有关
在某些精神疾病的病理生理学中,铅和镉等重金属可能导致线粒体生化级联反应发生故障。研究人员记录了 19 例线粒体疾病,这些疾病还伴有抑郁和焦虑等精神问题,确立了线粒体功能障碍和精神疾病之间的联系。
乳酸菌产生的支链氨基酸可以穿过血脑屏障,并通过增强线粒体生物合成来改变宿主生理,从而提高对活性氧的抗氧化作用。这就提供了重金属暴露、肠道微生物组和心理健康之间的重要联系。
根据肠道微环境因素,如 pH 值、氧化还原电位、氧气可用性、易感/耐药微生物的流行程度以及微生物群的总体多样性和代谢活动,推测肠道中有害金属的暴露会对常驻菌群产生不同的影响。
【 汞 】
汞中毒是第二大常见的重金属毒性。有几起因汞中毒引起的精神疾病的报告。汞的神经精神毒性主要涉及元素汞(Hg2+),它是通过甲基汞通过血脑屏障去甲基化而形成的。
▸ 汞积累可能引发脑损伤
由于大脑是汞的主要靶点,因此其产前暴露会导致人类和实验动物的大脑萎缩、大脑皮层和基底神经节损伤、细胞死亡、脑层紊乱和神经胶质增生。
由于Me-Hg中毒与年龄有关,因此汞中毒和汞沉积的症状因人在接触时的年龄而有很大差异。
▸ 过多接触汞的胎儿存在思维问题
在子宫内暴露于Me-Hg的儿童,可能在认知思维、记忆力、注意力、语言技能、肌肉控制和视觉空间技能方面存在问题。
急性Me-Hg暴露也改变了大鼠肠道微生物群的结构和功能,包括脱硫弧菌目、消化球菌科和幽门螺杆菌,所有这些都与特定的神经代谢物有关,如谷氨酸和γ-氨基丁酸 (GABA)。
在成熟的中枢神经系统中,谷氨酸和γ-氨基丁酸分别是主要的兴奋性和抑制性神经递质。它们的不平衡可能导致不同的精神和神经问题。
关于谷氨酸与肠道菌群详见:兴奋神经递质——谷氨酸与大脑健康
在鱼类中,Me-Hg处理增加了下列菌群:
Xanthomonadaceae,Pirellula,Cloacibacterium,
Comamonadaceae,Deltaproteobacteria FAC87
所有这些都参与了异生物质代谢和金属去除。有机和无机形式的汞通过胃肠道吸收并影响其他系统,包括中枢神经系统,引发心理问题。
【 砷 】
砷,也会导致认知功能障碍和易患情绪障碍,主要是通过破坏血清素和多巴胺代谢。
由于已知有几种肠道微生物有助于这些神经递质的生物合成,因此微生物群中的任何干扰都可能是导致肠脑串扰改变的可能原因。
▸ 砷处理小鼠:拟杆菌↑↑,厚壁菌↓↓,短链脂肪酸↓↓
在几项研究中,小鼠肠道微生物群中砷暴露的时间和剂量依赖性变化被确定为拟杆菌门的增加和厚壁菌门的减少。
研究还发现砷处理促进了与脂多糖产生、多重应激反应、DNA 修复和维生素生物合成有关的细菌基因转录,同时减少了短链脂肪酸生物合成有关的基因转录。
短链脂肪酸减少引起了:
慢性炎症、肠道通透性增加、条件致病菌增殖、金属摄入增加和血脑屏障功能障碍增加。
▸ 砷暴露的人类研究:致病菌↑↑ 共生菌↓↓
一项对尼泊尔人的研究发现,砷暴露通过富集挥发性细菌和致病菌,同时消耗肠道共生菌,从而改变了肠道微生物群组成。
此外,代谢组学分析显示了伴随的影响,几种肠道微生物群相关的代谢物在各种生物基质中被破坏。砷暴露不仅使肠道微生物群在丰度方面变化,还在代谢特征和功能方面也发生了变化 。
下列菌群因接触砷而发生显著变化,并可能与接触砷引起的疾病直接相关:
胃肠道上皮内的重金属离子相互作用或积累导致氧化应激、微生物群失调、细胞损伤和兼性厌氧菌丰度增加(包括变形杆菌和杆菌在内)。因此,上皮细胞可利用的氧气量增加,消耗产生短链脂肪酸的厌氧细菌,并降低抗炎和抗氧化代谢物的产生,这可能进一步破坏血脑屏障的完整性并减少神经发生,导致大脑功能紊乱。
重金属与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
小结
总体而言,重金属暴露会改变微生物组成,从而导致肠道微生物群的代谢改变,从而影响人体新陈代谢。
为了消除外源金属,需要一个稳定有效的肠道微生物群。预计膳食有毒金属缓解治疗可减轻有益肠道菌群的炎症负担,从而减轻精神疾病的发展。
一旦重金属进入人体,一些食物就会与它们螯合。水果和蔬菜提供了大量的抗氧化剂,能够减少重金属的损害。香菜、野生蓝莓、大蒜、柠檬水、小球藻、螺旋藻、咖喱、绿茶、大西洋海藻、大麦草、西红柿和益生菌是可以帮助逐渐去除体内金属的食物或补充剂。
重金属可能存在于:
– 处理过的木材中的防腐剂(砷和铜)
– 家用消毒剂(汞、铜和银)
– 厨具,如锅、锅、刀、汤匙和叉子(铝、铜和铅)
– 油漆(铅、汞、镉、锑)
– 杀虫剂、除草剂和杀菌剂(砷、锑和镉)
– 灭鼠药(铊)
– 鱼(汞)
– 大米(砷)
– 化妆品、染发剂(汞、铅)
– 纹身(汞)
– 地板蜡/抛光剂、织物柔软剂、汞合金填充物(汞)
– 巧克力、汽油、烟草烟雾(铅、镉)
– 罐头食品(铝、铅)
– 发酵粉、面粉、除臭剂、牙膏、胃抗酸剂、铝箔、泻药(铝)
– 自来水(铝, 镉)
– 含铅管道 (铅)
– 空气污染 (柴油机尾气、燃煤厂、钢铁和金属铸造厂、化肥公司)
邻苯二甲酸盐是存在于大量产品中的增塑剂,特别是润滑剂、地板材料和个人护理用品,如洗发水和肥皂。在产品使用和储存过程中,它们的浸出、迁移和氧化会污染各种水源、空气和土壤。
人类通过以下方式暴露于邻苯二甲酸盐:
对多个物种的研究表明,发育中的生物暴露于邻苯二甲酸盐会影响肠道微生物群,降低其多样性,特别是改变细菌代谢物的数量,这可能对健康产生严重影响。
✦ 邻苯二甲酸引起菌群失调:罗氏菌属和长双歧杆菌减少
新生儿的肠道微生物群受到早期药物治疗中接触邻苯二甲酸二酯 (DEHP) 的影响,这可能会影响他们以后的免疫反应。当婴儿静脉注射DEHP 时,会出现暂时的肠道微生物失调。DEHP暴露改变了细菌群落的组成和多样性,包括罗氏菌和长双歧杆菌的减少。
在小鼠中,DEHP暴露会导致肠道微生物群落结构以及粪便代谢物谱和雌性生殖毒性的改变。DEHP暴露引起的肠道菌群失调改变了微生物代谢物的水平,例如短链脂肪酸、支链氨基酸和单糖,它们是微生物群-肠-脑轴的重要组成部分。
对319 名在1999 年- 2006 年间在市中心分娩的不吸烟女性进行了研究,其中检测到了四种邻苯二甲酸酯代谢物:
其中三种邻苯二甲酸酯(DnBP、DiBP和BBzP)与一系列行为问题有关,包括焦虑、抑郁、躯体不适和退缩行为。
▸ 产前邻苯二甲酸酯暴露对儿童的神经发育产生负面影响
这些负面影响包括精神运动、认知和行为结果。通过干扰神经内分泌系统,这种污染物可能会损害神经元的分化和成熟,增加行为和认知缺陷的风险。
✦ 情绪问题通常与HPA轴有关
它会被邻苯二甲酸盐和双酚A等激素破坏。研究记录了青春期和成年小鼠在围产期暴露与DEHP时的焦虑和抑郁行为。在这些试验中,增加的焦虑相关行为与功能失调的HPA轴相关,表现为ACTH增加、皮质酮水平降低以及下丘脑GR水平升高。
▸ DEHP暴露后,小鼠菌群代谢物对甲酚上调
在年轻小鼠中,DEHP暴露通过增加合成代谢物前体的物种的丰度,来抑制丁酸盐合成并上调对甲酚的产生,对甲酚是一种与神经发育和行为问题相关的细菌代谢物。这证明了DEHP的神经毒性作用与肠道菌群失调之间的联系。
双酚A(BPA)是一种内分泌干扰化学品(EDC),用于生产聚碳酸酯塑料。饮食、空气、水和灰尘都是人类接触双酚A的可能来源。
由于双酚A的广泛使用,它的暴露正成为一个值得关注的问题。根据最近对暴露于双酚A的发育或成年动物调查,双酚可以改变一系列物种的肠道微生物群。
▸ 双酚A暴露减少了双歧杆菌,AKK菌,导致炎症,引发精神障碍
在一项研究中,肠道变化如下:
小鼠产前双酚A暴露减少了双歧杆菌,双歧杆菌已知具有抗炎特性,这可能导致全身炎症,从而导致各种健康问题,包括精神障碍。
▸ 产前母亲尿液双酚A浓度高的孩子,具有更高水平的焦虑和认知异常
各种实验和流行病学调查已将产前母亲尿液双酚A浓度的增加与儿童行为,空间学习和记忆结果联系起来。
更多的研究表明,通过过度激活HPA轴并破坏其基础和压力诱导,产前暴露于双酚A的动物具有更高水平的焦虑和认知异常,通过减少海马 GR 介导的反馈介导的HPA轴抑制,可能会增加在以后的生活中出现压力相关问题的风险。
数据表明,产前双酚A暴露和精神障碍持续增强通过重编程诱导的HPA轴激活联系起来。雌激素EDC已被证明以时间、性别和暴露依赖的方式影响大脑,尤其是下丘脑。
▸ 双酚A降低短链脂肪酸的水平,诱发炎症,损害认知
根据16SrRNA 扩增子测序分析,暴露于双酚A会导致β多样性的差异,而短链脂肪酸生产者的相对丰度显著下降。双酚A还降低了粪便短链脂肪酸的水平,同时增加了氧化应激 、全身脂多糖水平和肠道通透性,所有这些都是炎症引起的慢性疾病的早期迹象。
根据最近的一项调查,小鼠中双酚A暴露引起的神经毒性可能部分归因于MGBA的破坏。暴露于双酚A的雄性小鼠的结果表明,增加的神经炎症损害了它们的认知功能。神经递质血清素、其前体色氨酸及其代谢物5-羟基吲哚乙酸 (5-HIAA) 的脑、结肠和血清水平在暴露于双酚A后都会降低。
▸ 双酚A诱导的肠道菌群变化使粘蛋白、丁酸、血清素降低
随着肠道微生物群的改变,发现结肠中的粘蛋白水平和粘液分泌降低,丁酸水平也是如此。双酚A诱导的肠道菌群变化部分地调节了双酚A对心理和代谢健康的负面影响。
双酚A降低了粪便中短链脂肪酸和大脑中血清素水平,以及参与色氨酸代谢的不同类型的微生物,导致神经递质信号发生变化。双酚A改变了肠血屏障(GBB)和血脑屏障(BBB)的完整性,这可能与肠道和大脑的生态失调、认知能力下降和炎症增加有关。
内分泌干扰物与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
空气污染中最常见的化学物质包括一氧化碳、颗粒物、臭氧、二氧化氮和其他构成固体和液体成分(包括道路灰尘、车辆尾气和风吹土壤)。
▸ 空气污染物影响肠道菌群,诱发炎症,损害神经认知
空气污染已被证明会改变肠道微生物群的组成和功能,导致有害代谢物的产生,调节免疫反应,影响代谢途径,引发局部炎症,最后破坏肠血屏障,所有这些可能会进一步破坏血脑屏障并改变大脑功能。
空气污染会产生严重的神经认知后果,从行为改变到神经退行性疾病,这些后果可能会产生可怕的心理健康后果。
研究人员发现了长期和短期暴露于空气污染物(CO、PM10、PM2.5、NO2、SO2和O3)和精神障碍,如注意力缺陷多动障碍、抑郁症、自杀,焦虑和各种行为问题有关。
颗粒物与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
▸ 氧化应激升高和促炎细胞因子的产生
对PM、NO2和SO等空气污染物暴露的几项研究在各种动物模型中报告了氧化应激升高和促炎细胞因子的产生,以及脑组织中抗氧化活性降低导致精神障碍,这意味着空气污染暴露与心理健康问题之间存在关系。
▸ 通过血脑屏障或沿嗅觉神经易位到达大脑,引发促炎反应
根据人体尸检发现和动物实验研究,空气污染物,特别是细颗粒和超细颗粒,能够通过血脑屏障或沿嗅觉神经易位到达大脑。通过破坏血管调节过程,这些颗粒还可以在大脑中引发促炎反应。
通过改变肠道菌群的组成并通过活性氧产生和核因子NF-kB激活在体内引起持续的促炎倾向,空气污染物对肠道菌群产生有害影响。污染物通过破坏结肠上皮细胞中的紧密连接蛋白而导致肠道通透性增加。
▸ PM和臭氧:激活HPA轴
PM和臭氧是两种具有不同特性和反应性的常见污染物,已在实验中显示可激活HPA轴并释放糖皮质激素应激激素作为神经内分泌应激反应的一部分。这可能通过与肾上腺素能受体的作用相当的受体来调节肠道菌群的组成。
根据一项结合多组学和多指标技术进行的流行病学研究,PM2.5可能通过改变肠道菌群、色氨酸代谢、炎症因子和关键HPA轴激素来激活肠脑轴,从而导致神经和心理功能障碍。
▸ 空气污染导致的菌群及其代谢物变化
空气污染成分与增加和促炎细胞因子释放到肠道有关,以及拟杆菌门、厚壁菌门和疣微菌的相对数量发生显著变化,导致体内炎症水平升高,这与几种精神疾病的开始和发展有关。
短链脂肪酸的产生在接受治疗的小鼠中也发生了变化,盲肠中的支链脂肪酸(如异丁酸和异戊酸)丰度增加。它还导致丁酸盐耗竭,这与屏障功能的降低和对粘膜炎症的更易感性有关。
由于微生物代谢物从肠道迁移到体循环,空气污染物引起的肠道通透性增加,可能在增加全身炎症水平方面发挥重要作用,这将对中枢神经系统产生影响并促进精神疾病的发展。
考虑到微生物群-肠-脑轴在中枢神经系统功能中的重要性,调节微生物群-肠-脑轴的干预措施是改善心理健康的有希望的方法。
肠道微生物群已成为心理健康的重要渠道和前瞻性干预目标。益生菌、益生元、合生元和后生元都可以作为精神益生菌,其中一些是精神障碍的治疗干预措施。
“精神益生菌”:益生菌、益生元和所有微生物群靶向干预措施,它们可以操纵微生物群-肠-脑信号并对情绪、认知和焦虑等神经功能产生积极影响。
精神益生菌对心理的积极影响

Oroojzadeh P,et al.J Mol Neurosci.2022
➤ 益生菌
许多研究表明,以合适剂量服用益生菌可以减轻健康人群的压力、焦虑和抑郁。乳酸杆菌和双歧杆菌是用于精神心理研究最多的菌株。各种益生菌菌株的混合物也可用于产生协同效应或提高功效。
益生菌会影响血清素、脑源性神经营养因子、多巴胺和中枢神经系统抑制性神经递质的水平。迷走神经和肠神经系统在这方面起着至关重要的作用。益生菌还通过产生包括色氨酸和短链脂肪酸在内的代谢物间接改变中枢神经系统功能。
➤ 益生元
当宿主微生物有选择地利用益生元时,它会给宿主带来健康益处。具有双歧化特性的益生元,如低聚果糖、低聚半乳糖和短链低聚果糖,都已因其心理生物效应而受到研究。
除了这些多酚,Omega-3脂肪酸和母乳低聚糖,如具有益生元特性的 3’唾液酸乳糖 (3’SL) 或 6’唾液酸乳糖 (6’SL),在适量服用时显示出对心理健康的益处。
益生元可以通过增加双歧杆菌和减少致病菌来恢复肠道中的益生菌状态,从而潜在地缓解焦虑和抑郁等心理健康问题。
例如,短链脂肪酸对细胞系统的影响是通过免疫系统和内分泌途径以及神经和体液途径介导的。短链脂肪酸激活游离脂肪酸受体并与免疫和肠上皮细胞相互作用,从而影响肠黏膜的安全性和功能。
在环境方面,它还分别通过分泌白细胞介素和控制小胶质细胞的形态和功能来影响全身炎症和神经炎症。它还诱导肠道激素如胰高血糖素样肽1的分泌,这些激素通过迷走神经和全身通路将间接信号传递到大脑。所有这些途径最终都会影响学习、情绪和记忆。
➤ 合生元
合生元正在发展为通过调节肠道微生物群来改变情绪和行为的另一种方式。在多项研究中,合生元已被证明可以减轻特定人群的压力和焦虑样行为。
➤ 后生元
后生元,或故意灭活的全细胞或其成分,通过微生物群的变化、改善肠道屏障功能、调节代谢或免疫反应或神经系统信号传导来提供健康益处。
几项关于人类和动物模型的研究表明,后生元具有抗抑郁和抗焦虑作用。
对精神益生菌在人体的研究
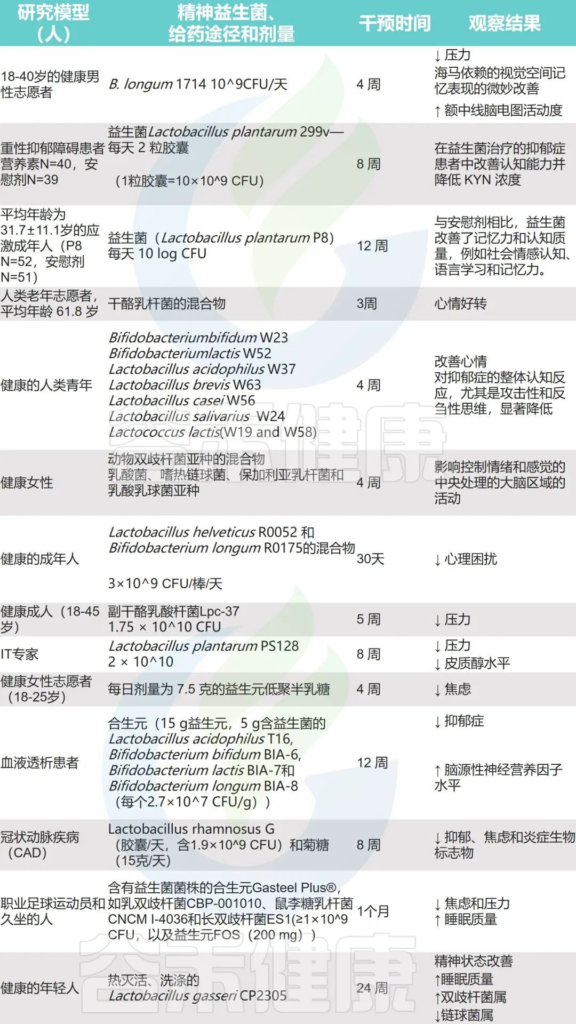
Singh S,et al.Microorganisms.2022
对精神益生菌的动物研究

Singh S,et al.Microorganisms.2022
精神益生菌的可能作用方式
HPA轴的调节、免疫反应和炎症的调节以及神经激素和神经递质的产生是精神益生菌发挥作用的主要机制。
精神益生菌通过恢复肠道中的益生菌状态和减轻精神障碍来影响细菌-肠道-大脑的关系。
✦ 精神益生菌调节神经递质,影响情绪
心理、智力、生理和神经元指数的变化是精神益生菌抗精神病作用的特征。精神益生菌可以调节神经递质和蛋白质,例如儿茶酚胺、乙酰胆碱、血清素和脑源性神经营养因子。它们影响情绪、认知表现、学习和记忆,以及维持大脑中的兴奋-抑制平衡。
当肠道中神经递质浓度升高时,血浆色氨酸水平下降,导致肠道细胞将化学物质释放到大脑中,从而缓解精神疾病。通过G-蛋白偶联受体产生主要作用的短链脂肪酸是精神益生菌对双向肠脑轴的另一个重要的拟议作用途径。短链脂肪酸可能通过加强血脑屏障、改变神经传递、改变神经营养因子水平和帮助记忆巩固来直接影响大脑功能。
精神益生菌的潜在作用模式
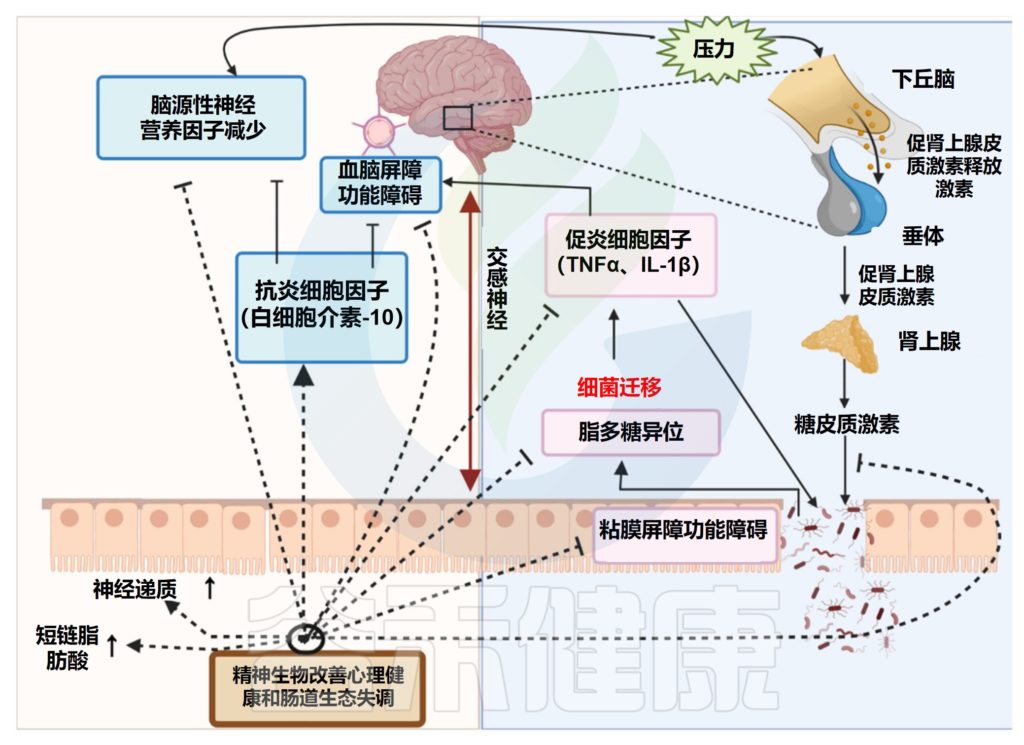
Singh S,et al.Microorganisms.2022
✦ 精神益生菌调节激素,改善认知
通过激素途径作用于大脑,影响身体的应激反应系统,即HPA轴,涉及肾上腺和大脑;当这种情况发生时,它会破坏压力荷尔蒙的产生和功能。这很可能是导致认知问题的主要因素。
精神益生菌可以通过调节HPA轴来降低糖皮质激素水平。糖皮质激素会破坏肠道屏障功能,降低上皮完整性,将细菌向外移动并引发炎症免疫反应。
✦ 精神益生菌调节免疫系统
精神益生菌可以通过直接减轻促炎细胞因子或通过增加抗炎细胞因子以迂回的方式减少炎症和恢复血脑屏障完整性来调节免疫系统的功能。管腔外的细菌迁移也可以通过增加促炎细胞成分的水平直接影响炎症。
✦ 调节肠脑轴中特定神经化学受体的表达,抗抑郁
一些可以产生中枢神经系统抑制性神经递质、去甲肾上腺素和血清素等神经递质的肠道微生物有:
嗜酸乳杆菌、干酪乳杆菌、婴儿双歧杆菌、长双歧杆菌、大肠杆菌、芽孢杆菌、酵母菌、念珠菌、链球菌、肠球菌。
这些可以通过调节肠脑轴中特定神经化学受体的表达来产生抗焦虑和抗抑郁作用。尽管对人类微生物组的研究仍处于初期阶段,但研究结果表明肠道微生物可能会影响人们的认知健康、行为和情绪。
一些能产生神经递质或神经激素的肠道微生物

Oroojzadeh P,et al.J Mol Neurosci.2022
生活方式、饮食、衰老和遗传等一系列因素促成了神经退行性疾病的发生和发展。益生菌对肠脑轴的影响可以通过影响中枢神经系统来实现。
肠道微生物群对神经系统疾病的影响
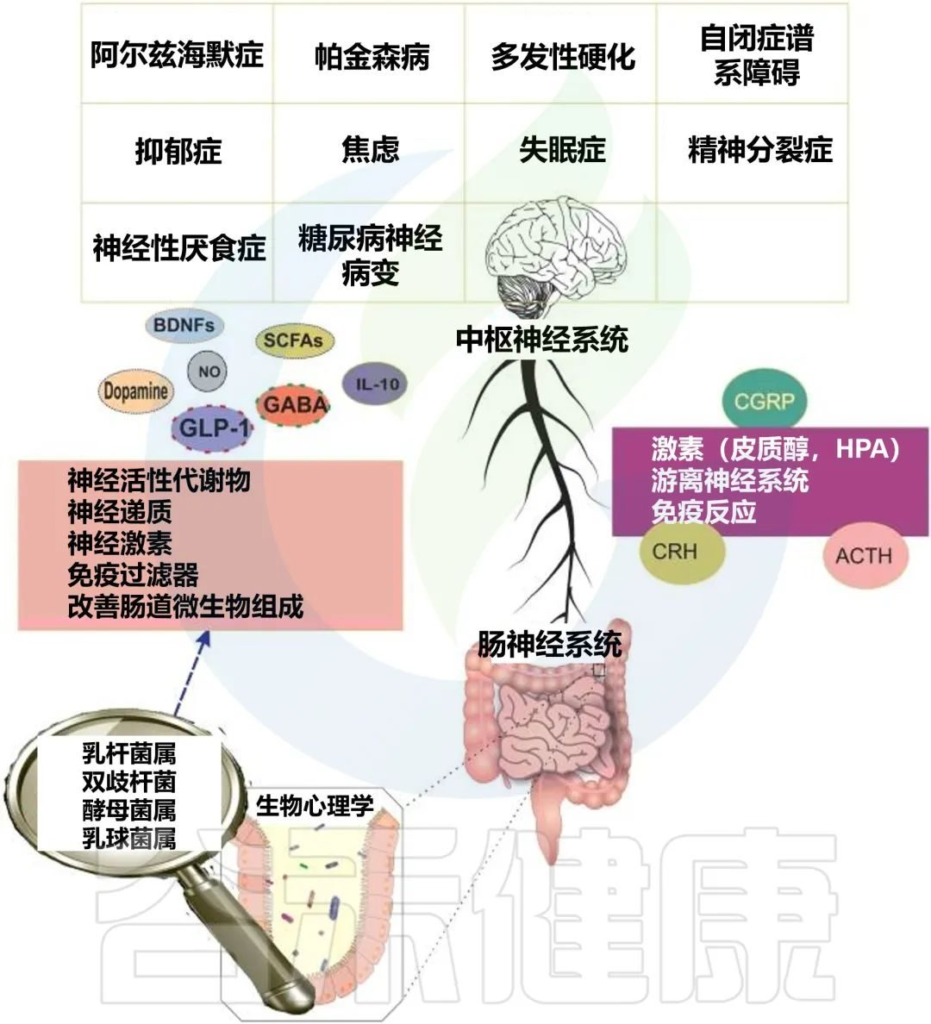
Oroojzadeh P,et al.J Mol Neurosci.2022
阿尔兹海默病是神经系统疾病中痴呆的主要原因。痴呆症通常发生在 60岁以上的人群中。这种疾病没有明确和有效的治疗方法。
研究表明,阿尔茨海默病的主要表现与细胞内Tau 神经原纤维缠结和细胞外淀粉样斑块的产生有关。
更好地了解这种疾病所涉及的生理机制可以帮助确定有效的治疗方法。
肠道微生物与阿尔茨海默症
鉴于肠道微生物群的损害可能与阿尔茨海默症等神经退行性疾病有关,因此调节肠道菌群是治疗阿尔茨海默症的一种可能方法。
炎症和氧化应激会破坏中枢神经系统中的神经细胞,从而导致阿尔茨海默症。
预防胆碱能神经元破坏以及大脑中乙酰胆碱水平的增加是成功治疗阿尔茨海默症所需要的。
已经证明,持续应用D-半乳糖可能会通过增加氧化应激和活性氧物质而导致认知异常和记忆障碍。
一些益生菌,包括植物乳杆菌,能够产生乙酰胆碱,并且可以保护由D-半乳糖消耗引起的记忆缺陷。
几种关于益生菌菌株补充的研究:
关于阿尔茨海默病与肠道菌群详见:阿尔茨海默病de饮食-微生物-脑轴
阿尔兹海默症与2型糖尿病
阿尔兹海默症的一个重要危险因素是2型糖尿病。胰高血糖素样肽-1(GLP-1)在肠道和中枢神经系统(尤其是脑干)中产生,并与神经保护以及认知功能和葡萄糖代谢有关。
GLP-1受体在不同组织(肾、肺、心脏、中枢神经系统等)中表达,可以上调参与脑细胞修复和分化的各种基因的表达。GLP-1还可以促进高血糖状态下的胰岛素分泌。
以前的研究表明,GLP-1在中枢神经系统中作为神经保护因子,可诱导神经细胞增殖/凋亡,改善学习和记忆,降低Aβ斑块沉积,保留多巴胺能神经元,刺激神经再生。
▸ GLP-1工程益生菌减少记忆障碍
研究人员研究了GLP-1工程益生菌(Lactococcus lactis MG1363)口服给药后对AD小鼠模型的影响。脂多糖和1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)分别诱导记忆障碍和运动功能障碍。
结果表明,工程菌株能够通过两种信号通路减少记忆障碍和运动功能障碍。此外,工程益生菌降低了病原体的丰度,并增加了Akkermansia muciniphila的丰度。
还观察到炎症反应下调、阻断NF-κB信号和 MAPKs/PI3K/AKT。已确定GLP-1和GIP(葡萄糖依赖性促胰岛素多肽)作为神经保护因子对2型糖尿病治疗的有效性。
探讨GLP-1/GIP/胰高血糖素三位一体治疗(30天)对AD小鼠认知行为的影响。结果表明,该治疗通过减少认知障碍和病理变化对阿尔茨海默病产生有益影响。
小结
总的来说,这些信息阐明了在阿尔兹海默症中用益生菌操纵肠道微生物群可以改善葡萄糖代谢受损、延缓阿尔兹海默症进展并减少神经炎症,从而有利于胰高血糖素样肽1的作用。
帕金森病是第二种常见且主要的神经退行性疾病。该疾病与突触核蛋白积累和多巴胺能神经元的进行性丧失有关,并以运动和非运动症状为特征。肠道功能异常的非运动症状主要是体重减轻、胃轻瘫、便秘和排便功能障碍。
目前,在治疗帕金森病时,服用精神生物药物备受关注。报告说,食用益生菌混合物对释放多巴胺的神经元提供有效保护,并随后减少小鼠的运动功能障碍恶化。
✦ 补充益生菌能改善帕金森病的相关症状
研究确定了益生菌副干酪乳杆菌对帕金森病大鼠运动障碍的影响,并且与对照组相比,有益生菌的大鼠运动障碍更少。
在一项临床研究中,评估了含有的L.casei Shirota发酵乳对帕金森病患者5周的效果,并报告了腹胀减少、便秘减少和腹痛减少。
每天一次服用含有多种益生菌菌株和益生元的发酵乳,持续4周,并报告改善了帕金森病患者的便秘。
每片使用60毫克两种益生菌:嗜酸乳杆菌和婴儿双歧杆菌,每天两次,持续3个月,40名帕金森病患者腹痛和腹胀缓解。
报告称,在接受8×10^9 CFU/天益生菌12周的帕金森病患者中,过敏反应降低,丙二醛水平降低,谷胱甘肽水平升高。
关于帕金森与肠道菌群详见:肠道微生物与帕金森以及相关影响因素
多发性硬化症是一种涉及中枢神经系统的自身免疫性疾病,其中髓鞘覆盖的轴突被破坏。
遗传和环境因素以及病毒感染被认为是多发性硬化症发展的主要风险因素。然而,这种疾病的确切原因尚不清楚。
✦益生菌可以改善多发性硬化症
越来越多的证据表明,益生菌可以通过改变肠道微生物组、抑制炎症通路和调节免疫系统来改善多发性硬化症患者的免疫系统。
评估了含有发酵乳杆菌、干酪乳杆菌、嗜酸乳杆菌和双歧杆菌的益生菌菌株的效果对接受益生菌混合物12周的多发性硬化症患者的心理健康、残疾和代谢状况的影响。
证明益生菌菌株增加了多发性硬化症小中抗炎细胞因子包括IL-4、IL-5、IL-10的表达,并减少了促炎 IFN-γ和IL-1β的分泌。
自闭症谱系障碍是社会交流、感觉运动行为和有限兴趣方面的一系列缺陷。
自闭症谱系障碍的表现始于儿童早期。自闭症患者表现出胃肠道症状。自闭症儿童的胃肠道功能障碍通常与攻击性行为、易怒和睡眠障碍有关。
✦益生菌对自闭症的有益影响
报告了益生菌对自闭症患者行为和胃肠道表现的有益影响。使用含有嗜酸乳杆菌、鼠李糖乳杆菌和长双歧杆菌的益生菌菌株治疗孤独症儿童3个月后,双歧杆菌和乳酸杆菌的数量增加,体重减轻,胃肠道症状改善。
此外,接受益生菌菌株1个月的自闭症儿童的自闭症核心症状有所改善,腹部症状有所减轻。
扩展阅读:自闭症,抑郁症等与维生素缺乏有关
抑郁症和焦虑症是常见的疾病之一。这两种疾病大多同时发生。抗抑郁药、抗焦虑药和催眠药通常用于治疗。临床上,抑郁与下丘脑-垂体-肾上腺失调之间存在关联。
研究表明,健康个体和重度抑郁症患者的肠道微生物群是不同的。重度抑郁患者双歧杆菌和乳杆菌减少,同时梭菌、链球菌、克雷伯菌、颤杆菌和Allistipes增加。
胃肠道细菌通过迷走神经通路激活压力回路。长期暴露于压力源会导致去甲肾上腺素的长期分泌,这会改变肠道微生物群并使肠道对细菌和毒素更具渗透性,然后是HPA轴的压力反应。
✦益生菌能降低压力改善焦虑
研究了益生菌菌株B. breve CCFM1025对粪便微生物组成和脑神经系统改变以及皮质酮、细胞因子和短链脂肪酸的血清水平的影响。总体而言,抑郁和焦虑样行为减少了。
研究指出,益生菌菌株B. longum 1714 能够降低压力水平并改善健康志愿者的记忆力。
评估了鼠李糖乳杆菌HN001对423名孕妇产后焦虑和抑郁表现的影响,并指出益生菌治疗组的抑郁状况显著降低。
益生菌菌株L. plantarum 299v可降低犬尿氨酸水平并增强重度抑郁症患者的认知功能。然而,其他调查并未报告接受益生菌的患者与对照组在焦虑和幸福感评分方面有任何显著差异。
有学者指出益生菌菌株长双歧杆菌NCC3001可以提高肠易激综合征患者的生活质量,并可以减少这些病例的抑郁症。
关于抑郁症与肠道菌群详见:抑郁症,恐惧,压力和肠道微生物群脱不开的关系
失眠
充足的睡眠是影响生活质量的关键因素。肠道菌群通过微生物-肠-脑轴影响宿主的精神状态和睡眠状态。
宿主的昼夜节律和睡眠质量取决于微生物组谱和代谢特性。益生菌被认为可以改善睡眠健康。GABA 是一种抑制性神经递质,能够通过减少焦虑来促进放松。
L.brevis DL1-11 是一种具有高GABA生产能力的益生菌菌株,其改善小鼠睡眠的潜力已得到证实。
关于睡眠与肠道菌群详见:肠道菌群与睡眠:双向调节
精神分裂症
精神分裂症是一种慢性衰弱性疾病。研究表明,肠道微生物群的破坏会增加全身炎症。因此,神经炎症会导致精神分裂症。
精神分裂症患者通常患有营养状况受损、压力反应高、炎症状态增加和乳糖不耐症。具有抗炎和免疫调节特性的益生菌可能有助于减轻精神分裂症患者。
✦ 益生菌减轻精神分裂症症状
报道了丁酸梭菌、粪链球菌和肠系膜芽孢杆菌的益生菌混合物可以减轻精神分裂症的症状。研究表明,益生菌菌株B. lactis Bb12 亚种的组合B. lactis Bb12 GG和鼠李糖乳杆菌菌株可以减少精神分裂症患者的肠道障碍。
研究了鼠李糖乳杆菌菌株GG和动物双歧杆菌乳亚种在慢性精神分裂症的可能免疫调节作用。报告称,血管性血友病因子浓度显著降低,同时脑源性神经营养因子、巨噬细胞炎性蛋白-1β、单核细胞趋化蛋白-1和RANTES(受激活、正常T细胞表达和分泌的调节)水平升高。因此,精神分裂症患者服用益生菌补充剂可能会改善胃肠道渗漏。
B. lactis Bb12有助于使男性患者的白色念珠菌抗体水平和白色念珠菌相关肠道不适正常化。
糖尿病性神经病变是一种与轴突萎缩、脱髓鞘疾病、再生能力下降、神经元炎症和周围神经病变有关的营养性神经退行性疾病。
糖尿病神经病变可通过神经元肠脑轴、门静脉(调节中枢神经系统中的能量代谢)和外周神经元传导丧失改变血糖调节以及肠道葡萄糖吸收不良。
2型糖尿病的特征是葡萄糖代谢失调,导致空腹和餐后高血糖。胰岛素和胰高血糖素分泌和功能受损是这种疾病的主要原因。
▸ 胰高血糖素样肽1(GLP-1)
GLP-1是肠细胞响应葡萄糖而分泌的一种肠促胰岛素激素,用于2型糖尿病治疗。它通过特定受体激活肠道神经元并调节肠道转运,增加胰岛β细胞的增殖,增强葡萄糖依赖性胰岛素分泌,减少胰岛α细胞的胰高血糖素分泌。
因此,它会降低2型糖尿病患者的血糖和食物摄入量。当 GLP-1被激活时,它会向迷走神经传递一个神经信息,该信息通过肠脑轴参与血糖调节。GLP-1 还具有神经保护和神经源性潜力,研究表明它在来自背根神经节的神经元的原代培养物中诱导轴突。因此,它可以有效地治疗糖尿病神经病变。
✦ 益生菌增强胰岛素分泌,改善肠神经系统
研究发现益生菌通过上调G蛋白偶联受体 、胰高血糖素原和转化酶原活性,通过葡萄糖触发的GLP-1 分泌来增强胰岛素分泌。
已经确定,当无菌小鼠被健康的肠道微生物群稳态定植时,肠神经系统和迷走神经的神经元活动得到恢复,但糖尿病小鼠的肠道微生物群却没有。
研究发现用罗伊氏乳杆菌喂养大鼠9天可以通过靶向肠道感觉神经中的钙依赖性钾通道来改善肠神经系统。
一些乳酸杆菌菌株(L. farciminis, plantarum, fermentum)可以产生一氧化氮作为神经递质,它能够影响神经元对GLP-1和葡萄糖代谢的反应。
✦ 益生菌降低胰岛素抵抗,增加抗氧化能力
研究了GLP-1在2型糖尿病大鼠体内,白藜芦醇和益生菌作用。给大鼠喂食各种益生菌,包括植物乳杆菌、保加利亚乳杆菌、干酪乳杆菌、婴儿双歧杆菌、嗜酸乳杆菌、长双歧杆菌、短双歧杆菌,剂量为 50 × 10^9 4周。发现与糖尿病组相比,这些益生菌和白藜芦醇可以降低葡萄糖和胰岛素抵抗(p < 0.001),并增加GLP-1以及总抗氧化能力(p < 0.001)。
发现两种菌株,L. kefiranofaciens M 和 L. kefiri K可以通过诱导GLP-1分泌,抑制细胞因子产生(促炎和炎症因子),增加IL-10的产生,改变肠道菌群向LAB和双歧杆菌的方向发展,减少产气荚膜梭菌和大肠菌群,从而降低小鼠模型中T1D的进展。
这些结果揭示了益生菌在增加GLP-1水平中的作用,这可以随后缓解高血糖症,并可能被认为是糖尿病治疗的潜在候选者。
关于2型糖尿病和肠道菌群详见:2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
神经性厌食症是另一种重要的精神障碍,与严重的体重减轻、精神合并症、对肥胖的恐惧和饮食限制有关。
根据对肠脑相互作用的深入了解以及益生菌对该轴的积极作用,可以为神经性厌食症治疗提供几种新的治疗策略。
✦ 益生菌改善神经性厌食症中的胃肠道不适
分析了益生菌对神经性厌食症患者的疗效,并通过分析血清和粪便样本测量了体重指数、心理/神经心理参数。他们报告了神经性厌食症中肠道微生物群落的正调节,以改善体重增加、胃肠道不适和炎症减少。
通过低聚果糖1.67g/天和益生菌(Saccharomyces boulardii 5×10^8 CFU)干预评估益生菌对神经性厌食症的影响。饮食限制后,与健康状态相比,总微生物群和代谢物减少,但补充低聚果糖和布拉式酵母通过改变以下菌群来恢复微生物群落。
研究显示了两种饮食(酸奶或牛奶)的积极作用,包括保加利亚乳杆菌和嗜热链球菌,它们能够诱导IFN-γ产生对抗儿童腹泻和神经性厌食症患者的感染。
值得注意的是,抗生素和25%的药物可能会影响微生物群,患者需要基于益生菌治疗来实现主要目标,如能量收集、体重增加、降低肠道通透性、炎症过程以及肠道微生物组群的改变等。
益生菌的作用主要是增强肠道健康。食用含有益生菌的健康食品在预防中枢神经系统疾病和通过调节肠道微生物群控制相关症状方面具有重要作用。这种效应通过微生物群-肠-脑轴发生,可以整合到临床试验中。
酸奶、开菲尔、豆豉和泡菜等发酵食品富含益生菌。一些益生菌产生活性神经元化合物或充当载体。一些双歧杆菌和乳酸杆菌菌株分泌γ-氨基丁酸 (GABA)。此外,对健康人的粪便样本进行分析,发现拟杆菌属、副拟杆菌属和埃希氏菌属物种能够调节产生GABA的途径。
GABA的功能障碍与抑郁和焦虑有关。GABA 是乳酸菌 (LAB) 的分泌代谢产物之一。它是哺乳动物中枢神经系统中抑制性传播的主要介质。食品工业通过生产含有能够产生 GABA 的益生菌物种的功能性食品,在减少抑郁和焦虑方面发挥着关键作用。
开菲尔颗粒含有Acetobacter aceti, L. fructivorans, Acetobacter sp., Enterococcus faecium, Leuconostoc spp., L. delbrueckii delbrueckii, L. fermentum, L. kefiranofaciens, Candida famata, Candida krusei.
益生菌菌株L. helveticus从发酵乳中分离得到,可以改善老年人和中年人的认知功能。
用短乳杆菌L. brevis BJ20浓缩发酵海带, 以确定其对老年人体质和短时工作记忆的影响。研究人员说,食用这种发酵食品可以为老年人的痴呆症提供保护机制。
由于包括牛奶、乳制品和豆制品在内的发酵产品的广泛使用,其他研究表明,含有干酪乳杆菌的发酵乳可以改善学生的情绪、增加粪便中的血清素并降低压力水平,瑞士乳杆菌影响认知功能。
含有发酵乳杆菌、干酪乳杆菌混合物的发酵牛奶降低了小鼠的亚硝化应激参数。含有B. lactis BB12和L. acidophilus LA5益生菌的酸奶可显著增强整体健康并减轻焦虑、抑郁和压力。
使用含有短乳杆菌L. brevis FPA 3709的发酵黑豆浆能够产生 GABA 在小鼠中显示出抗抑郁活性。
个体微生物组会受到宿主条件和环境的影响。肠道微生物群的紊乱会对宿主的生理反应和整体健康产生巨大影响。
大量证据表明,环境污染物与微生物群相互作用,而微生物群在肠脑轴中发挥着关键作用。长时间处于污染环境下,肠道生态失调,对宿主造成系统性和长期的影响。
精神益生菌在控制中枢神经系统疾病症状方面具有有效的特征,或将辅助治疗各类疾病。然而神经精神类疾病病情复杂,原因不一,有些益生菌也并不一定对所有患者有效,通过肠道菌群检测,可以了解个体肠道菌群,从而有针对性地采取相关干预措施。
主要参考文献
Singh, S.; Sharma, P.; Pal, N.; Kumawat, M.; Shubham, S.; Sarma, D.K.; Tiwari, R.R.; Kumar, M.; Nagpal, R. Impact of Environmental Pollutants on Gut Microbiome and Mental Health via the Gut–Brain Axis. Microorganisms 2022, 10, 1457. https://doi.org/10.3390/microorganisms10071457.
Oroojzadeh P, Bostanabad SY, Lotfi H. Psychobiotics: the Influence of Gut Microbiota on the Gut-Brain Axis in Neurological Disorders. J Mol Neurosci. 2022 Jul 18:1–13. doi: 10.1007/s12031-022-02053-3. Epub ahead of print. PMID: 35849305; PMCID: PMC9289355.
Liu, L.; Huh, J.R.; Shah, K. Microbiota and the gut-brain-axis: Implications for new therapeutic design in the CNS. eBioMedicine 2022, 77, 103908.
Long, D.; Liu, M.; Li, H.; Song, J.; Jiang, X.; Wang, G.; Yang, X. Dysbacteriosis induces abnormal neurogenesis via LPS in a pathway requiring NF-κB/IL-6. Pharmacol. Res. 2021, 167, 105543.
Duan H, Yu L, Tian F, Zhai Q, Fan L, Chen W. Gut microbiota: A target for heavy metal toxicity and a probiotic protective strategy. Sci Total Environ. 2020 Nov 10;742:140429. doi: 10.1016/j.scitotenv.2020.140429. Epub 2020 Jun 25. PMID: 32629250.
Briffa J, Sinagra E, Blundell R. Heavy metal pollution in the environment and their toxicological effects on humans. Heliyon. 2020 Sep 8;6(9):e04691. doi: 10.1016/j.heliyon.2020.e04691. PMID: 32964150; PMCID: PMC7490536.