-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

5月29日,是世界肠道健康日。肠道是人体最重要的消化系统之一,与人体健康紧密相关。而肠道菌群作为肠道重要组成部分,在肠道健康中发挥着重要的作用。
编辑
由于基因、环境、饮食、药物等因素的影响,每个人的肠道菌群都有所不同,因此我们常常说每个人的肠道菌群都是独一无二的。
然而在不同年龄段不同人群中,有一类菌群却普遍存在,它们在人体的健康和稳定性方面发挥着重要的作用,这就是“肠道核心菌属”。
在这个世界肠道健康日,我们一起来聊聊关于“肠道核心菌属”。结合肠道菌群检测报告的部分案例,我们可以更深入直观地了解肠道核心菌属,这对于我们保持肠道健康和整体健康有重要意义。
谷禾在多年的肠道菌群检测中,发现大批量的肠道菌群检测报告中有那么一些菌群在大多数人群中普通存在,这些菌群的存及其丰度构成在肠道健康中起着至关重要的作用。一些科研文献中也有关于肠道核心菌属的相关研究。
一项大规模研究,利用微生物扩增子变异体精确作图 (RExMap)对来自全球 16 个地区的 29,349 名个体的现有 16S 数据进行重新分析,RExMap 的重新分析来自 10 项人口规模研究的现有 16S 微生物组数据绘制了来自世界各地 29,349 名个体的 17,786 个 OSU。
在此荟萃分析中,平均 122 个 OSU 占单个人微生物组丰度的 99%,平均 2000 个 OSU 占一个地理区域内 95% 的微生物组丰度。揭示了不同人群和地理区域的肠道微生物物种的详细景观。表明人类确实存在共享肠道核心微生物组。
这些核心菌属在不同的人群中,核心微生物之间的相对比例高度保守,这可能表明存在稳定的生态或功能关系。
我们的数据和这篇大规模荟萃分析表明这些核心微生物群对于其它菌群的定植,营养代谢,体重指数以及整个微生态健康起非常关键的作用。
目前,对于核心菌属的定义还没有统一的标准,但一般认为,核心菌属应该具备以下特征:
1. 在不同人群中普遍存在:核心菌属应该在不同人群中都能够被检测到,而不是仅存在于某些特定人群中。
2. 数量相对较高:核心菌属应该在肠道菌群中占据较高的比例,而不是仅占据极小的比例。
3. 对人体健康具有重要作用:核心菌属应该对人体健康具有重要作用,如参与食物消化、维持肠道屏障功能、调节免疫系统等。
谷禾健康基于超过60万人肠道菌群检测样本数据,这些样本包括了来自全球各大洲不同人种、地区饮食习惯和所有年龄段人群,给出了人体肠道菌群核心菌属的标准:
在90%人群检出,人群平均丰度1%以上的菌属为核心菌属(双歧杆菌和乳杆菌作为益生菌相对丰度低于1%但是重要性很高)。
核心菌属及有益菌累加占总肠道菌群比例低于60%就可能出现肠道菌群紊乱,菌群是一种生态系统,健康的核心菌属占据菌群构成的绝大部分后,其他可能导致感染、免疫反应以及无法有效代谢食物的异常菌的比例就会被抑制。
核心菌属缺乏就给了病原菌或非肠道菌群生存空间,导致肠道健康问题。
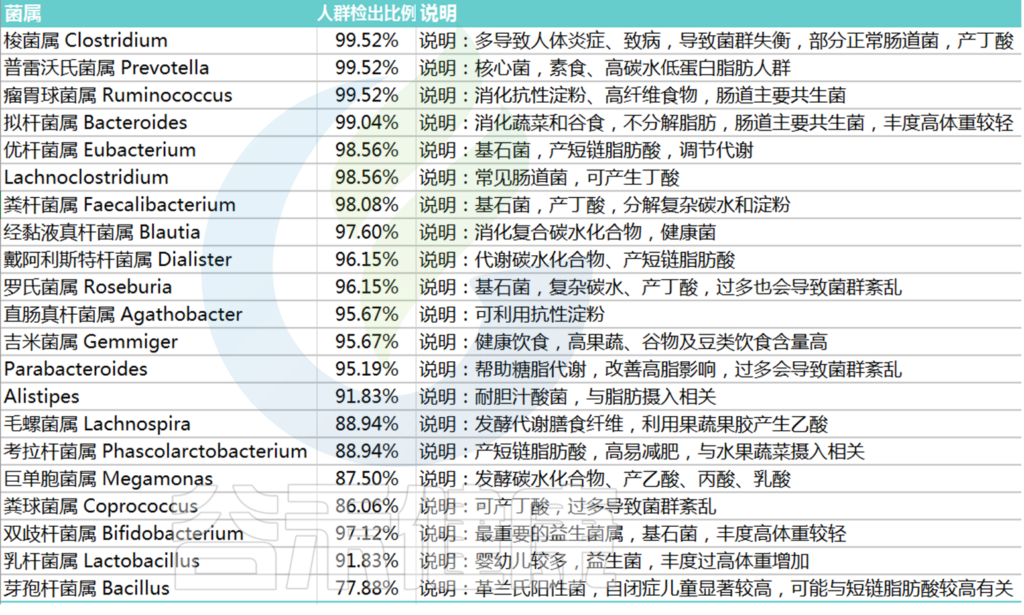
<来源:谷禾肠道菌群检测数据库>
上述这些核心菌属比如:
1. 拟杆菌 Bacteroides
Bacteroides是人体肠道中最常见的菌属之一,能够分解多糖类物质,产生短链脂肪酸,维持肠道屏障功能,调节免疫系统等。
2. 普雷沃氏菌属 Prevotella
Prevotella是一种厌氧菌,能够分解多糖类物质,产生短链脂肪酸,参与肠道免疫调节等。
3. 粪杆菌属 Faecalibacterium
Faecalibacterium是一种产生丰富的丁酸和丙酸的梭菌,能够维持肠道屏障功能,调节免疫系统等。
4.瘤胃球菌属Ruminococcus
Ruminococcus是一种产生丰富的丙酸和丁酸的菌属,能够参与食物消化、维持肠道屏障功能等。
虽然都属于核心菌属,且广泛存在于各类人群的肠道中,但每个人各个菌属的相对丰度却存在很大差异,不同的饮食习惯、母体传递以及生活地区都会导致这些核心菌属构成的偏好。
由于使用相对丰度来评估,其中一类菌丰度占比更高通常会导致其他菌属的相对丰度占比下降,因此早期肠道菌群研究中根据占据最主要丰度的菌属来将肠道菌群构成划分为多个肠型,常见的有拟杆菌、普氏菌、罗氏菌型三种。
不过肠型的划分相对比较粗放,也忽略了其他菌属的构成,那么:
这么多菌属怎么样的比例才是最健康的呢?
是不是都在范围内就都正常了,可是这些范围看着都好大,有的是从0.001~36%,都一样吗?
针对这些问题,我们给出了另一个指标:
该菌属丰度处于人群%水平
对于核心菌属我们评估较为:
因此评估菌群总体状况时较简单的方法,就是看过高和过低的核心菌属数量,超标越多菌群问题越大。当绝大部分菌属都处于正常范围之后我们就可以优化我们的核心菌属构成,使其尽量处于50~70%的水平。
下图其中第4列就给出了这个指标,意思是这个核心菌属现有丰度超过了人群中%的人。
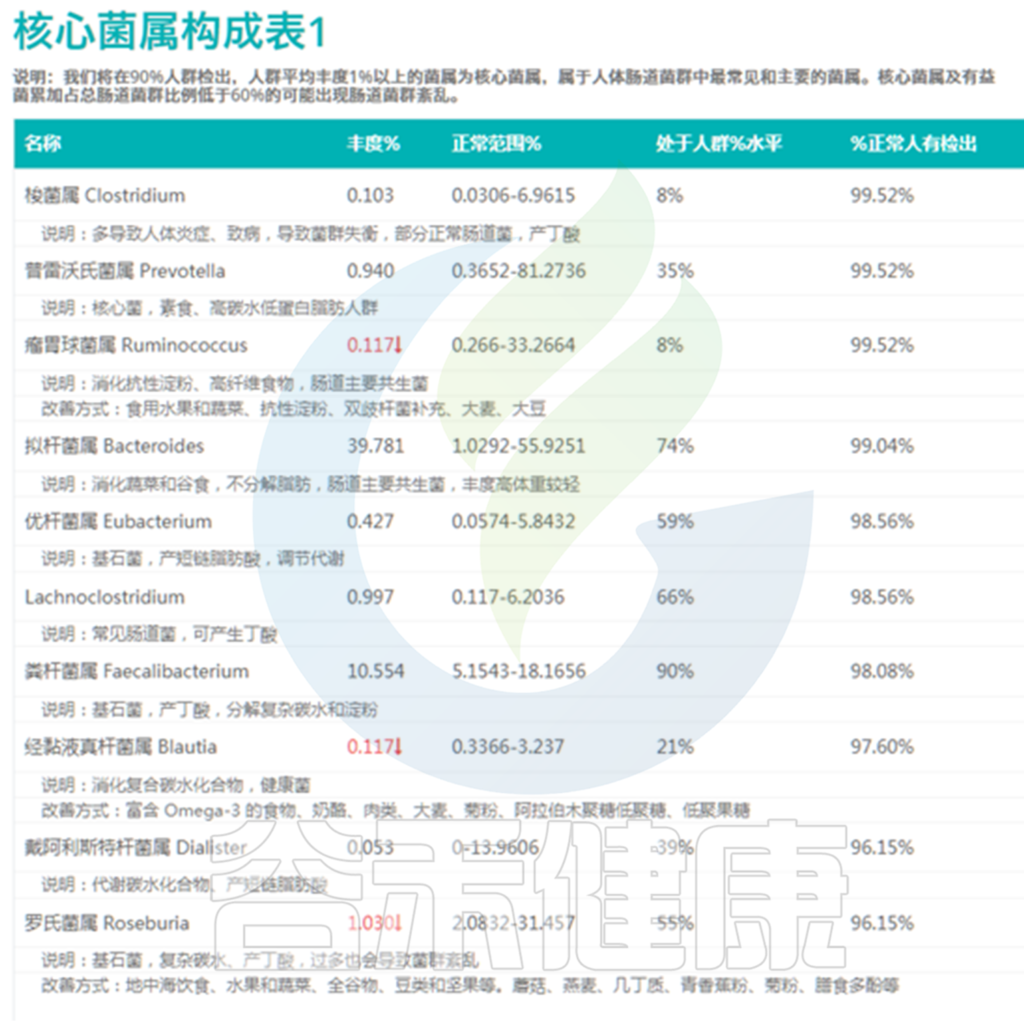
<来源:谷禾肠道菌群检测数据库>
其中瘤胃球菌属的丰度水平是0.117%,并给出了红色向下箭头,表明其丰度水平过低,超标了,对应的人群水平是8%,也就是这个丰度仅比8%的人要高。
除了箭头标示的过低菌属之外,其实像普雷沃氏菌属的35%人群水平也属于偏低,而粪杆菌属的90%人群水平就偏高了。
这样通过饮食和补剂定向干预可以使菌群中占比最主要的核心菌属达到更加稳定和合理的水平,整体肠道菌群的健康状况也会得到极大改善。
作为核心菌属,它们对于人体肠道菌群的作用主要包括:
1
参与食物消化
核心菌属能够分解多糖类物质,产生短链脂肪酸等,帮助人体消化食物
2
维持肠道屏障功能
核心菌属能够维持肠道黏膜屏障的完整性,防止有害物质进入血液循环。
3
调节免疫系统
核心菌属能够调节肠道免疫系统的功能,维持肠道微生物群落的稳定性。
4
构建稳定的肠道菌群生态
经过长期的共同进化和适应,核心菌属中的大部分能够有效代谢和利用人类饮食并消化进入结直肠部位的物质。这些菌属通过代谢途径的互补相互之间构建起一个菌群代谢网络,并维持稳定的菌群结构。
类似于我们常见的生态系统,一次抗生素的使用或某次感染后免疫系统的清理重建,相当于大草原或森林的一场大火,会摧毁大部分的生态成员,但一旦雨季来临生态又会重新开始建立。最底层的食物和能量来源就相当于雨水,最早能利用这些食物和能量来源的菌群构成了肠道菌群的基石。
研究发现上述核心菌属中的大部分都属于能代谢特定碳水化合物的降解和能量产生途径,包括拟杆菌(Bacteroides thetaiotaomicron)和青春双歧杆菌(Bifidobacterium adolescentis),以及Ruminococcus torques、Bacteroides coprocola、Faecalibacterium prausnitzii、Coprococcus catus、Parabacteroides johnsonii、Alistipes shahii等。
当上述这些核心菌属含量较高且构成合理时,肠道菌群的整体生态环境就会非常稳定,从最初代谢碳水化合物产生短链脂肪酸,进一步维持肠道内下游菌群的生长,同时调节肠道屏障,供给肠道黏膜细胞养分,维持免疫系统的均衡。
总之,核心菌属在人体肠道菌群中具有重要作用,对于人体健康具有重要意义。
谷禾肠道菌群检测数据库中显示,肠道核心菌属的异常与以下66种疾病相关:
以下是与每种核心菌属相关的疾病数量:
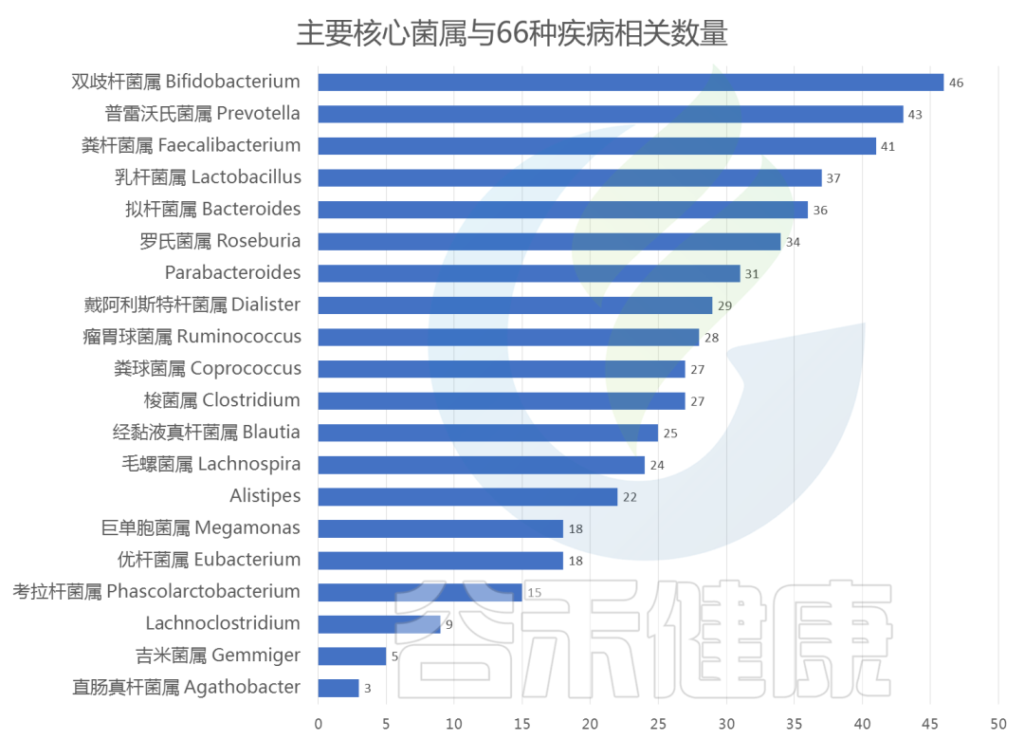
<来源:谷禾肠道菌群检测数据库>
★
结合谷禾肠道菌群检测报告案例,我们来看看一些慢性疾病患者的肠道核心菌属构成情况。
一般来说,他们的核心菌属异常分为两种情况:
这里我们来看关于慢性腹泻和便秘患者的两个案例。
➤➤ 慢性腹泻患者:
该慢性腹泻患者的肠道菌群检测报告中,许多核心菌属均处于低丰度的情况。
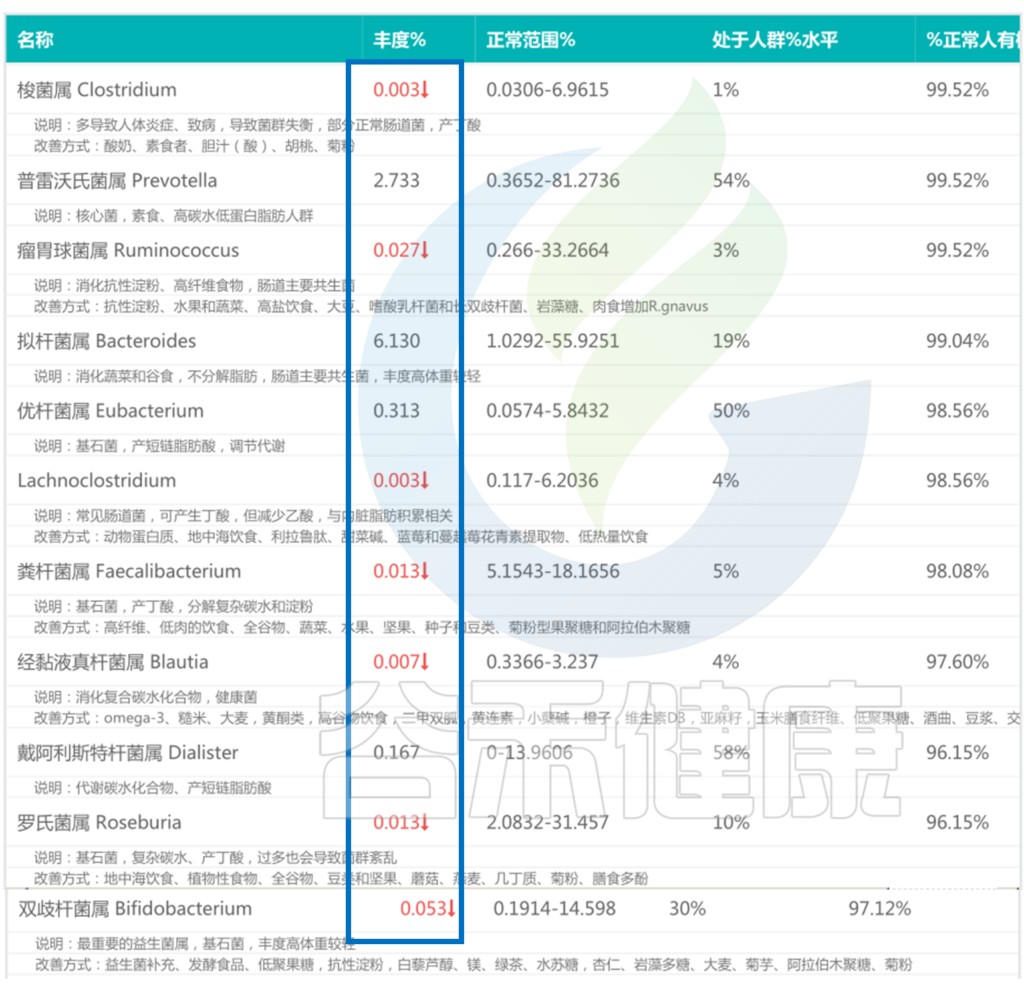
<来源:谷禾肠道菌群检测数据库>
当多数核心菌属丰度较低处于劣势的情况下,肠道有害菌逐渐开始占上风:
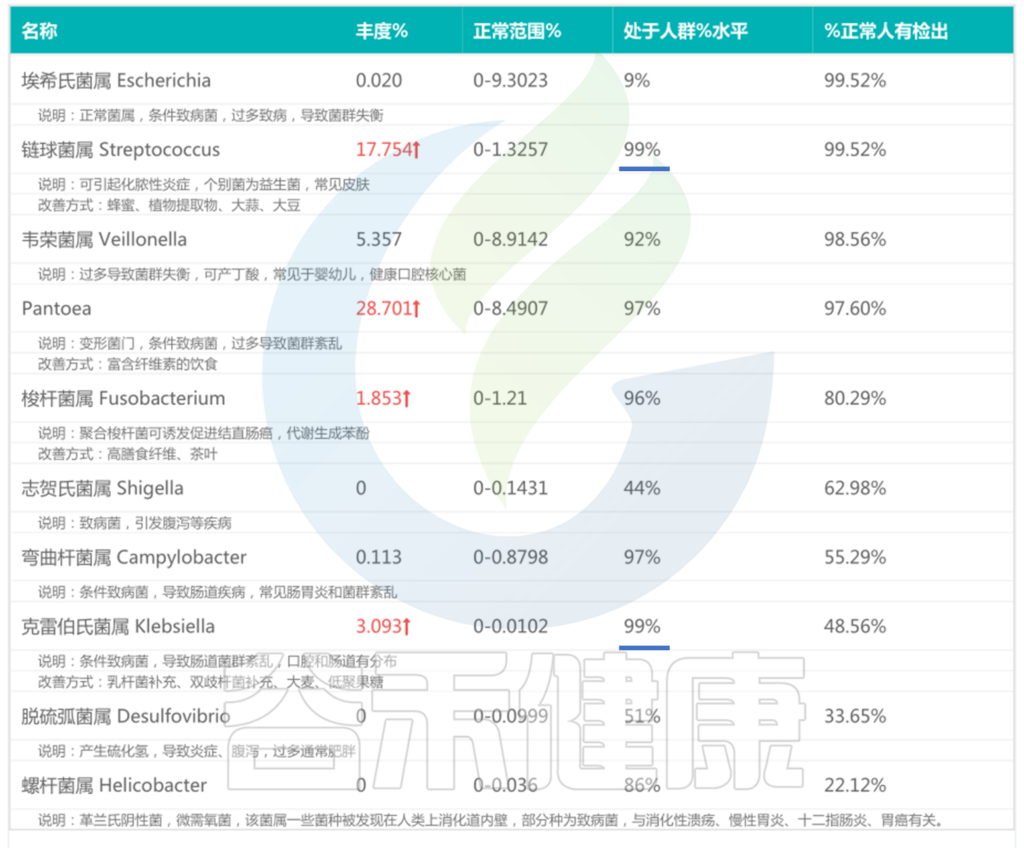
<来源:谷禾肠道菌群检测数据库>
可以看到,链球菌属、Pantoea、克雷伯氏菌属等有害菌远高于正常水平。
链球菌通常是存在于人体正常的口腔、鼻咽、肠道等部位的常见菌群,一些链球菌感染可以引起喉咙痛、扁桃体肿胀等症状。
肠道中检出的过量链球菌,可能是由呼吸道感染后通过体循环进入肠道,链球菌到了肠道可能会影响肠道的健康和功能,导致一些症状,包括腹泻、腹痛、消化不良等。
链球菌在自身免疫性疾病中也会富集,和免疫相关疾病中自身抗体的产生或Th17细胞的激活有关。
Pantoea是肠杆菌科内一个高度多样化和多变的人类机会性人类病原菌,一般由伤口或医院获得性感染引起,主要发生在免疫功能低下的个体中。在我们的肠道菌群检测实践中也发现许多健康状况不良的人群,尤其幼儿和老年患者中检出高丰度的Pantoea菌。
只有大约 20% 的病例能够在培养中分离出泛菌属物种。大多数关于Pantoea 物种可以通过适当的抗生素和支持性管理进行治疗。
克雷伯氏菌可以自然存在于健康个体的肠道和呼吸道中,具有健康免疫系统的人很少发生感染疾病。一旦克雷伯氏菌属进入体内并在免疫系统的防御中幸存下来,它们就会影响各种器官。疾病的症状通常取决于感染开始的位置。
当克雷伯氏菌属感染肠道后,由于克雷伯氏菌通过肠道分泌毒素,导致肠道蠕动加快,从而引起腹泻,同时患者可能出现腹部不适的症状。有时会伴随发热等全身反应,这可能是由于克雷伯氏菌在肠道内繁殖并释放炎症介质所致。具体症状和严重程度因人而异。
而拟杆菌的存在可以阻止肺炎克雷伯菌的肠道定殖。上述报告中拟杆菌丰度并不高,对克雷伯菌的抑制程度有限。
易感因素包括营养不良,接触程度,不卫生的环境、酒精、年龄(衰老)、遗传易感性、药物、慢性肝病、糖尿病、大型手术等。
以上我们可以看到仅这三种有害菌的丰度加起来已经占一半了,那么核心菌属自然就没有生长空间,肠道菌群整体趋于失调。
有害菌过多会影响肠道内环境,如pH值,含氧量,肠道内毒素等,可能会导致出现一些机会感染和机会致病菌入侵,进而诱发肠道炎症和相关疾病。

➤➤ 便秘患者:
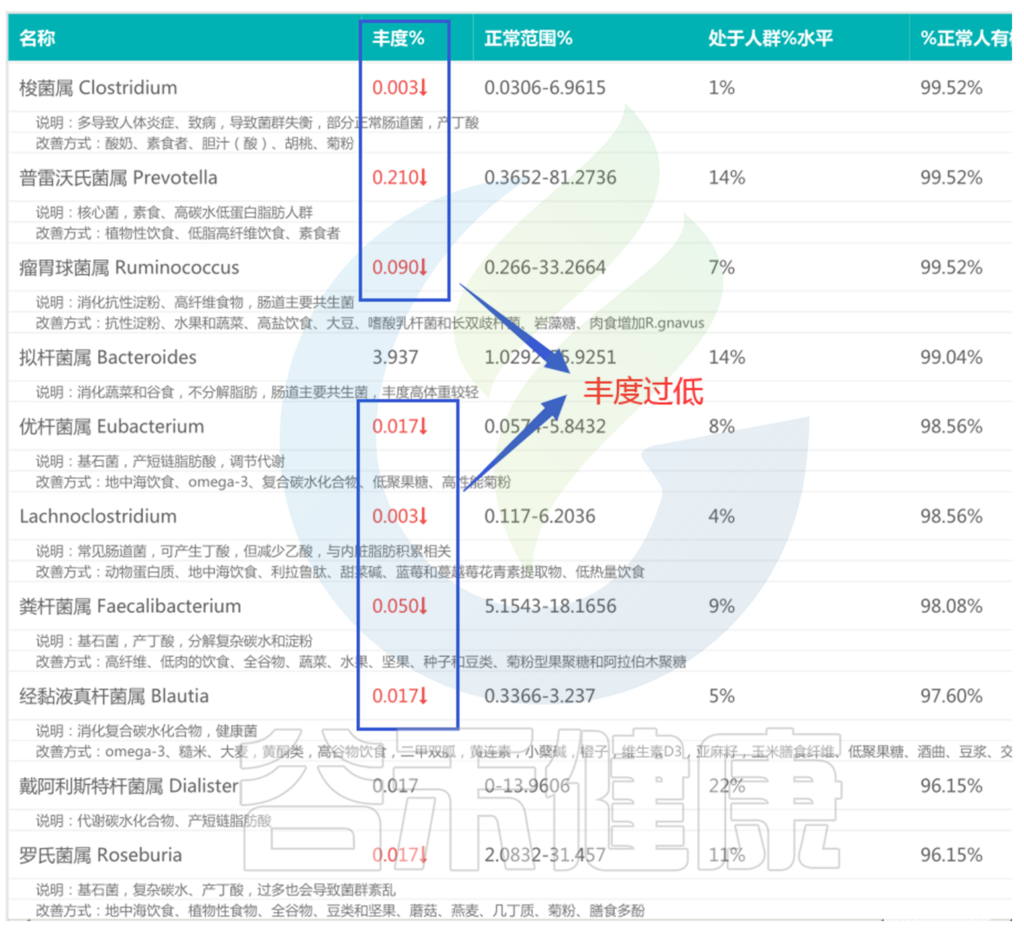
<来源:谷禾肠道菌群检测数据库>
同样,在便秘患者的肠道菌群检测报告中,部分核心菌属丰度是过低的。
上述报告中,与产丁酸相关的核心菌属丰度较低。有研究表明,便秘患者可能出现肠道菌群和丁酸代谢失调。
核心菌属丰度低,伴随着部分有害菌的丰度大幅上升,肠道菌群多样性下降。
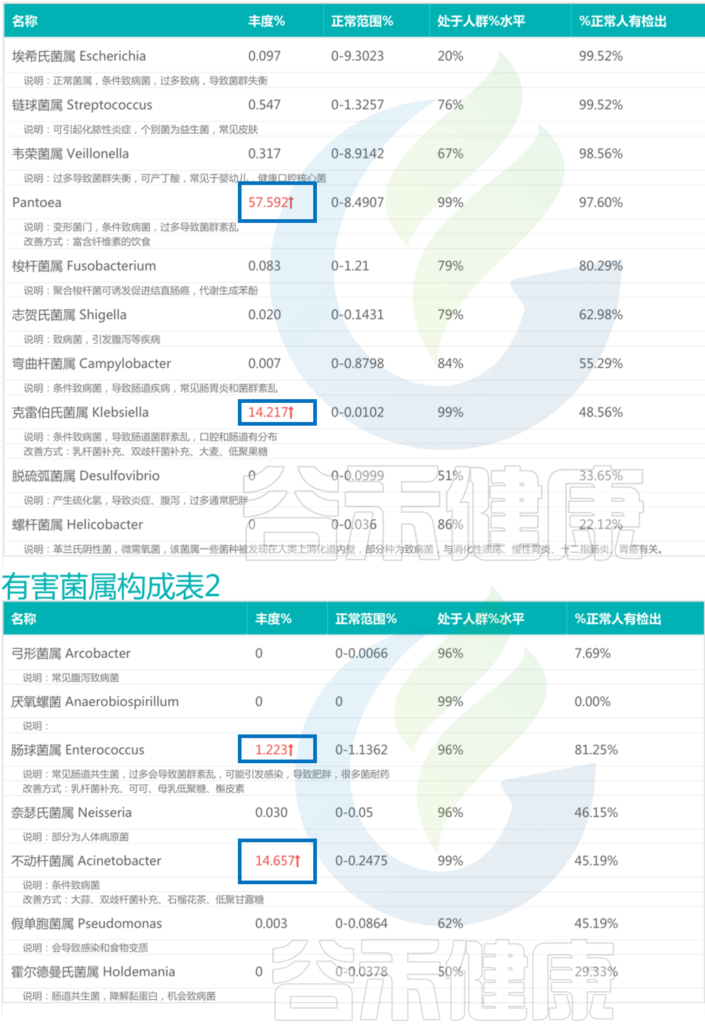
<来源:谷禾肠道菌群检测数据库>
不动杆菌属Acinetobacter是一类革兰氏阴性菌,该菌属于常见的医院感染病原体之一。不动杆菌属感染常见的病症包括呼吸道感染、泌尿道感染、创伤感染等,严重情况下还可能导致败血症。
不动杆菌属对常见抗生素经常会产生抗药性。这里不动杆菌属丰度较高可能与抗生素使用较多相关。
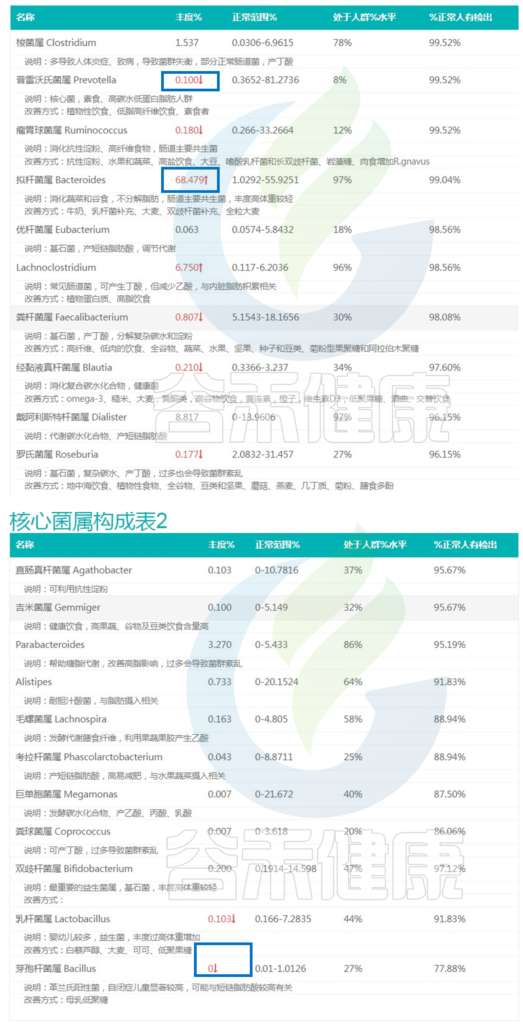
泛菌属Pantoea:57.592%
克雷伯氏菌属:14.217%
肠球菌属:1.223%
不动杆菌属:14.657%
以上四种有害菌加起来已经超过85%,核心菌属的生存空间受到严重影响,整体丰度很低,肠道多样性下降,这可能与便秘相关。
以上是核心菌属低,有害菌大量入侵的情况,那么如果核心菌属丰度整体很高,是不是意味着健康的肠道菌群?
不一定。也有可能出现核心菌属内部不平衡,个别核心菌属疯长的情况。
肠易激综合征、消化不良患者:
<来源:谷禾肠道菌群检测数据库>
可以看到虽然核心菌属整体占比较高,但是个别核心菌属丰度过高,例如:拟杆菌、Lachnoclostridium菌群丰度属于过高,那么其他核心菌属的生存空间就会受到影响,这就导致菌群单一化,多样性下降,肠道菌群稳定性较差。
多项研究表明拟杆菌、普拉梭菌、瘤胃球菌属和双歧杆菌与肠易激综合征相关。其中拟杆菌的过度生长可能与肠易激综合征的症状加重相关。
研究表明,肠易激综合征患者中短链脂肪酸水平降低,尤其是丁酸盐,上述报告中与产丁酸相关的核心菌属如粪杆菌属,罗氏菌属等都有所下降。
同时,与消化复合碳水化合物相关的经黏液真杆菌属丰度也较低,可能与患者的消化不良有关。
以上是核心菌属异常的情况,健康人的肠道菌群检测报告中核心菌属具体如何?
这里从谷禾肠道菌群检测数据库选取一例健康人的报告,健康总分在89分。
注:在谷禾肠道菌群检测报告评分机制中,超过80分已经算很健康的状态。

其核心菌属丰度如下:
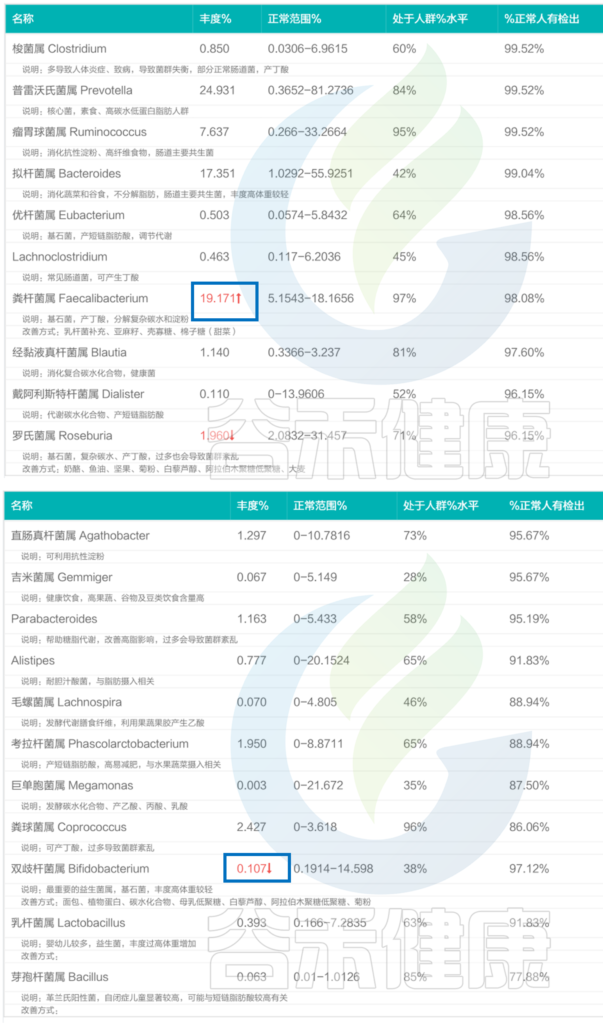
<来源:谷禾肠道菌群检测数据库>
可以看到,健康人的核心菌属绝大部分都在正常范围内,其肠道菌群结构非常稳定。
当然也有个别菌群超标。其中粪杆菌属丰度为19.171%,比正常范围的上限略高一点点,而粪杆菌属,可以帮助分解膳食纤维,产短链脂肪酸,有助于维持肠黏膜健康、增强免疫系统功能,维持肠道内长期的稳定状态。
其他像罗氏菌属的丰度在1.960%,双歧杆菌属丰度在0.107%,略微低于正常水平,对整体健康基本不构成威胁。
还有像芽孢杆菌属在一些亚健康人群中有很多未检出或者极低,而该报告中芽孢杆菌属能检测到且丰度属于正常水平,有助于提升其整体肠道菌群结构的稳定性。
我们需要关注肠道菌群中的核心菌属,因为这些菌属在整个人体肠道菌群中扮演着网络节点或基础菌群的角色。核心菌属及其重要菌属的紊乱会直接影响营养物质的吸收、代谢产物的合理构成以及维持肠道正常生理环境的稳定性等。
如何保持这些核心菌属的健康水平呢?
一方面要坚持通过健康的饮食和生活状态来实现。尽量选择多样化新鲜卫生的食物、富含含欧米伽-3的不饱和脂肪酸,平衡动物和植物蛋白,更多的十字花科蔬菜、富含多酚的水果、根茎类蔬菜以及合理的脂肪。
另外一方面,了解肠道健康和菌群状态,针对性的调整异常菌属和菌群结构,保持核心菌属的平衡和喂养,才能构筑一个强大的菌群网络结构,维护正常的免疫状态和身体健康。
世界肠道健康日,希望每个人都拥有更健康的肠道和更好的身体~

谷禾健康

Lachnoclostridium属是一类革兰氏阳性菌,专性厌氧、形成孢子、属于Clostridiales目、Lachnospiraceae科、Firmicutes门。该属最初被描述为Clostridium phytofermentans,后来被重新分类为Lachnoclostridium属。
Lachnoclostridium属包括来自Lachnospiraceae科和几个梭菌簇的生物,例如梭菌XIVa。已知梭菌簇 XIVa 构成了人类肠道微生物群落的重要组成部分;它可以发挥抗炎作用,并在体内平衡中发挥作用。此外,梭菌簇 XIVa 通过其成分和代谢物(尤其是丁酸盐)维持肠道健康。
Lachnoclostridium属的相对丰度在一些疾病中有所变化,如:
Lachnoclostridium属是一种新定义的属,该属在人类肠道菌群中越来越多地被发现,其代表种包括下列菌属:
其中,Lachnoclostridium phytofermentans是该属的模式菌株,能够在37℃下生长,pH值为6.0-9.0。
Lachnoclostridium edouardi则是一种与胆汁酸诱导基因簇相关的菌株,与肥胖和2型糖尿病等疾病有关。
部分菌种可以在中等“嗜温”温度和极高“嗜热”温度下生长。
这类细菌是肠道微生物群落中的重要成员,能够发酵多糖类物质产生短链脂肪酸,如丁酸和乙酸等。这些物质对肠道上皮细胞的生长和肠道屏障功能的增强具有积极作用,同时也具有抗炎作用。
Lachnoclostridium YL32则是一种在易感小鼠中存在的菌株,可能与肠道免疫系统的调节有关。这些代表种在肠道菌群中具有重要的代谢和免疫调节功能。Lachnoclostridium在人类肠道微生物中具有较高的丰度和普遍性。
代谢性疾病
Lachnoclostridium属与多种代谢性疾病的发生密切相关,包括肥胖、高血压、糖尿病等。其相对丰度与血糖水平呈负相关。
Lachnoclostridium是一种能够利用单糖和双糖产生乙酸的细菌。乙酸可以通过抗炎和免疫抑制作用有效地稳定肠道内环境。此外,乙酸还可以作为细菌的ATP产生的氧化产物。Lachnoclostridium的丰度与肠道内乙酸水平呈正相关。
也有一些研究表明,Lachnoclostridium的高丰度可能会降低循环中乙酸的水平,从而导致腹部脂肪增加,对肥胖和2型糖尿病产生负面影响。
在孕妇患有妊娠糖尿病时,Lachnoclostridium属的丰度显著增加。
肠道疾病
在不同疾病状态下,Lachnoclostridium属的相对丰度存在差异,如在溃疡性结肠炎和肠易激综合征患者的肠道菌群中,Lachnoclostridium属的含量较高。
肝脏疾病
在肝脏疾病中,Lachnoclostridium属的含量也存在变化。
心血管疾病
Lachnoclostridium属还能够将胆碱转化为三甲胺,进而转化为三甲胺氧化物,而三甲胺氧化物与肥胖、糖尿病和心血管疾病的进展有关。
Lachnoclostridium的丰度与动脉粥样硬化患者显著相关,而L. saccharolyticum WM1菌株可以在体外有效地将胆碱转化为TMA,同时提高血清TMAO水平并促进动脉粥样硬化的形成。因此,Lachnoclostridium与TMAO的关联机制可能会增加心脏代谢风险。
截瘫
ITSCI患者的肠道内Lachnoclostridium属丰度更高,截瘫患者的肠道内Acidaminococcaceae、Lachnoclostridium、Porphyromonadaceae、Blautia属丰度更高。而四肢麻痹患者的肠道内拟杆菌属丰度更高。
肿瘤的发生发展
Lachnoclostridium与肥胖、高胆固醇、炎症等因素相关,这些因素与肿瘤的发生有关。此外,Lachnoclostridium还可以通过调节肠道免疫系统和抗氧化系统来影响肿瘤的发生和发展。
研究发现,Lachnoclostridium可以促进CD8+ T细胞的招募和激活,从而增强抗肿瘤免疫力,Lachnoclostridium属的高丰度与肿瘤内CD8+ T细胞浸润、肿瘤内细菌和患者生存率有关。在肿瘤内,Lachnoclostridium属的高丰度与患者死亡风险降低有关。
肿瘤控制
在肿瘤组织中,高水平的Lachnoclostridium与CD8+ T细胞浸润和趋化因子CXCL9、CXCL10和CCL5表达呈正相关。此外,高水平的Lachnoclostridium也与患者的生存率有关。
研究还发现,Lachnoclostridium可以通过氧化和表皮化特定羟基的方式将胆酸转化为去氧胆酸,从而与去氧胆酸的水平相关。这些发现表明,肠道菌群可以影响肿瘤的免疫细胞浸润和患者的生存率。因此,Lachnoclostridium可能在肿瘤的预防和治疗中具有重要作用。
其他疾病
Lachnoclostridium能够通过代谢L-谷氨酸来产生乙酸等短链脂肪酸,这些短链脂肪酸对于肾脏保护具有重要作用,如抗炎、抗动脉粥样硬化和抗氧化等。
此外,Lachnoclostridium还与食物过敏、多囊卵巢综合征、骨质疏松、肺癌等疾病的发生发展有关。
COVID-19患者肠道内Lachnoclostridium属的丰度较高。
肌肉减少症患者 Lachnoclostridium显著减少,整体微生物多样性减少。
桥本甲状腺患者的Lachnoclostridium 属减少。
营养代谢
在一些研究中发现,Lachnoclostridium的丰度与营养消化率和营养吸收有关,可能与营养代谢和肠道健康有关。
在一些研究中,Lachnoclostridium的丰度降低与蛋白质处理和营养物质转运等功能通路的下调有关。此外,一些研究还发现,Lachnoclostridium的丰度降低与体重下降有关。
此外,Lachnoclostridium也被发现与肠道炎症、肠癌和阿尔茨海默病等疾病有关。
Lachnoclostridium与代谢相关疾病或结直肠癌的发生可能存在关联,并且可以通过饮食干预进行改善。这意味着,Lachnoclostridium的丰度可能是代谢相关疾病或结直肠癌的一个有用的预测因子。
不同的季节、饮食和营养等都会影响Lachnoclostridium属在肠道内的丰度。
药 物
治疗糖尿病药物利拉鲁肽治疗可增加Lachnoclostridium属的丰度。
重金属
镉(Cd)扰乱了大鼠肠道菌群组成,显着降低了普雷沃氏菌和Lachnoclostridium的丰度。青春期接触镉会导致肠道微生物群紊乱,肝、肾和卵巢功能障碍,这可能与镉诱导的炎症反应的激活有关。
季 节
Lachnoclostridium是一种常见的菌属,其丰度在不同季节存在差异:
此外,与脂肪酸生物合成和亚油酸代谢相关的KEGG功能在冬季的丰度增加。
益生菌
植物乳杆菌 ZY08 显着减轻了小鼠酒精相关的肝脂肪变性、肝损伤、肠屏障,并降低了血浆内毒素水平,并影响了与脂质代谢相关的肝脏基因。通过恢复菌群丰度有效恢复肠道菌群稳态,包括 Blautia、Oscillibacter、Lachnoclostridium、Intestimonas,从而提高肠道短链脂肪酸含量。
植物乳杆菌 FRT10 在减轻喂食高脂肪饮食的小鼠肥胖方面的功效:补充植物乳杆菌FRT10 可显著降低体重增加、脂肪重量以及肝脏三酰甘油 (TG) 和丙氨酸转氨酶 (ALT) 浓度 (P < 0.05)。植物乳杆菌FRT10 显著改善了高脂饮食引起的肠道菌群失调,增加Butyricicoccus,Butyricimonas,Alistipes, Intestinimonas,Odoribacter,降低脱硫弧菌科、Roseburia、Lachnoclostridium的丰度。
副干酪乳杆菌CCFM1223 预防脂多糖诱导的急性肝损伤 (ALI) 的有益作用:显着增加了Catabacter的相对丰度,但显着降低了 ASF356 , Lachnospiraceae NK4A136 group , Lachnoclostridium。
食物营养成分
素食者和杂食者在肠道清洁后,饮食中的植物蛋白和动物蛋白对Bilophila和Lachnoclostridium的丰度有相反的影响。
食用甜菜碱可以显著增加Lachnoclostridium的相对丰度,有助于减轻高脂饮食引起的肥胖。
蓝莓和蔓越莓花青素提取物的补充可以促进Lachnoclostridium的生长。
西藏茶多糖可以促进Lachnoclostridium、拟杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)等微生物的生长,同时促进短链脂肪酸的产生。
白藜芦醇喂养的小鼠微生物群组成发生显著变化,减少高脂肪饮食喂养小鼠的肥胖。
其特征是下列菌群富集:
拟杆菌、Lachnospiraceae_NK4A136_group、Blautia、Lachnoclostridium、Parabacteroides 、Ruminiclostridium_9
慢性肾病患者服用姜黄素补充剂(Meriva ®) 六个月,显著降低血浆促炎介质(CCL-2、IFN-γ 和 IL-4)和脂质过氧化作用, Escherichia-Shigella水平显著降低, Lachnoclostridium水平显著升高。
红曲米中红曲素(MP)干预明显改善了过量饮酒小鼠的脂质代谢和肝功能,Lachnoclostridium、Alistipes、Roseburia、Vagococcus等菌群比例显著升高。
红小豆补充剂显著降低了由高脂饮食引起的小鼠肥胖、脂质积累以及血清脂质和脂多糖水平,减轻了肝功能损伤和肝脂肪变性。通过增加胰岛素敏感性来改善葡萄糖稳态。
改善肠道菌群失调,Lachnoclostridium、双歧杆菌、Prevotellaceae、Turicibacter、Alloprevotella、Muribaculum等显著升高。
黄芩素是一种具有多种生物活性的天然黄酮类化合物。黄芩素可以重塑非酒精性脂肪肝模型小鼠肠道微生物群的整体结构,尤其是Lachnoclostridium、Mucispirillum、Anaerotruncus,在黄芩素治疗组中显着恢复到正常水平。黄芩素可以显著降低高脂饮食引起的肝脏重量增加,改善非酒精性脂肪肝小鼠脂质代谢紊乱。
吴茱萸碱可通过调节肠道菌群和抑制肝脏炎症反应来改善CCl4诱导的小鼠肝纤维化。吴茱萸碱可增加乳杆菌、阿克曼氏菌、拟杆菌的丰度,降低肠球菌和Lachnoclostridiun的丰度(P<0.05)。
核桃青壳多糖是一种低分子量酸性杂多糖,主要由葡萄糖醛酸、阿拉伯糖和半乳糖组。核桃青壳多糖显著改善了高脂饮食诱导的肥胖小鼠的糖代谢和脂质代谢,并降低了氧化应激。对肝脏脂肪变性和血管内皮功能障碍具有保护作用。增加了门水平的Deferribacteres的相对丰度,降低了Akkermansia,Lachnoclostridium等相对丰度。
铁皮石斛可以调节肠道微生物群、肠道通透性和肝脏炎症,从而减轻非酒精性脂肪性肝炎。铁皮石斛处理降低了Romboutsia、Turicibacter、Lachnoclostridium、Blautia、Ruminococcus_torques_group、Sutterella、Escherichia-Shigella等丰度。
人参皂苷 Rg1 治疗 4 周可显著降低血糖水平,人参皂苷 Rg1 通过改变肠道微生物群来治疗2型糖尿病,增加了 Lachnospiraceae_NK4A136_group 和 Lachnoclostridium 的比例,降低了 Lactobacillus 的比例。
全麦燕麦改善了高脂血症小鼠的血清脂质分布,降低了体重和脂质沉积,全麦燕麦中的黄酮类化合物对高脂血症小鼠胆汁酸代谢和肠道微生物群具有调节作用,显著减少Lachnoclostridium、Blautia、Desulfovibrio、Colidextribacter。
四物汤对肝纤维化小鼠表现出显著的治疗效果,通过增加拟杆菌和Lachnoclostridium的相对丰度,并降低 Alistipes 和 Rikenellaceae 的相对丰度,显著重组了纤维化小鼠的肠道微生物群。
饮食方式
增加孕妇水果和蔬菜的摄入量可以影响婴儿肠道内Lachnoclostridium属的丰度。
地中海饮食可以增加Lachnoclostridium属在肠道内的丰度。
高粗粮饮食可增加Lachnoclostridium属的丰度。
低热量饮食也可以选择性地促进Lachnoclostridium等抗炎菌群,从而改善胰岛素敏感性和血糖水平。
而高脂饮食则会降低Lachnoclostridium的相对丰度。
主要参考文献:
Kang L, Li P, Wang D, Wang T, Hao D, Qu X. Alterations in intestinal microbiota diversity, composition, and function in patients with sarcopenia. Sci Rep. 2021 Feb 25;11(1):4628. doi: 10.1038/s41598-021-84031-0. PMID: 33633246; PMCID: PMC7907362.
Zhao F, Feng J, Li J, Zhao L, Liu Y, Chen H, Jin Y, Zhu B, Wei Y. Alterations of the Gut Microbiota in Hashimoto’s Thyroiditis Patients. Thyroid. 2018 Feb;28(2):175-186. doi: 10.1089/thy.2017.0395. Epub 2018 Feb 1. PMID: 29320965.
Xue X, Wu J, Ding M, Gao F, Zhou F, Xu B, Lu M, Li J, Li X. Si-Wu-Tang ameliorates fibrotic liver injury via modulating intestinal microbiota and bile acid homeostasis. Chin Med. 2021 Nov 4;16(1):112. doi: 10.1186/s13020-021-00524-0. PMID: 34736501; PMCID: PMC8570021.
Wu L, Zhou K, Yang Z, Li J, Chen G, Wu Q, Lv X, Hu W, Rao P, Ai L, Ni L. Monascuspiloin from Monascus-Fermented Red Mold Rice Alleviates Alcoholic Liver Injury and Modulates Intestinal Microbiota. Foods. 2022 Sep 30;11(19):3048. doi: 10.3390/foods11193048. PMID: 36230124; PMCID: PMC9564352.
Zhao Q, Hou D, Fu Y, Xue Y, Guan X, Shen Q. Adzuki Bean Alleviates Obesity and Insulin Resistance Induced by a High-Fat Diet and Modulates Gut Microbiota in Mice. Nutrients. 2021 Sep 17;13(9):3240. doi: 10.3390/nu13093240. PMID: 34579118; PMCID: PMC8466346.
Duan R, Guan X, Huang K, Zhang Y, Li S, Xia J, Shen M. Flavonoids from Whole-Grain Oat Alleviated High-Fat Diet-Induced Hyperlipidemia via Regulating Bile Acid Metabolism and Gut Microbiota in Mice. J Agric Food Chem. 2021 Jul 14;69(27):7629-7640. doi: 10.1021/acs.jafc.1c01813. Epub 2021 Jul 2. PMID: 34213907.
Liang JQ, Li T, Nakatsu G, Chen YX, Yau TO, Chu E, Wong S, Szeto CH, Ng SC, Chan FKL, Fang JY, Sung JJY, Yu J. A novel faecal Lachnoclostridium marker for the non-invasive diagnosis of colorectal adenoma and cancer. Gut. 2020 Jul;69(7):1248-1257. doi: 10.1136/gutjnl-2019-318532. Epub 2019 Nov 27. PMID: 31776231; PMCID: PMC7306980.
Li P, Hu J, Zhao H, Feng J, Chai B. Multi-Omics Reveals Inhibitory Effect of Baicalein on Non-Alcoholic Fatty Liver Disease in Mice. Front Pharmacol. 2022 Jun 15;13:925349. doi: 10.3389/fphar.2022.925349. PMID: 35784718; PMCID: PMC9240231.
Dandachi I, Anani H, Hadjadj L, Brahimi S, Lagier JC, Daoud Z, Rolain JM. Genome analysis of Lachnoclostridium phocaeense isolated from a patient after kidney transplantation in Marseille. New Microbes New Infect. 2021 Mar 16;41:100863. doi: 10.1016/j.nmni.2021.100863. PMID: 33898042; PMCID: PMC8054182.
Guo W, Mao B, Tang X, Zhang Q, Zhao J, Cui S, Zhang H. Lactobacillus paracasei CCFM1223 Protects against Lipopolysaccharide-Induced Acute Liver Injury in Mice by Regulating the “Gut-Liver” Axis. Microorganisms. 2022 Jun 30;10(7):1321. doi: 10.3390/microorganisms10071321. PMID: 35889040; PMCID: PMC9319883.
Cai H, Wen Z, Li X, Meng K, Yang P. Lactobacillus plantarum FRT10 alleviated high-fat diet-induced obesity in mice through regulating the PPARα signal pathway and gut microbiota. Appl Microbiol Biotechnol. 2020 Jul;104(13):5959-5972. doi: 10.1007/s00253-020-10620-0. Epub 2020 May 14. PMID: 32409945.
Yang J, Chen W, Sun Y, Liu J, Zhang W. Effects of cadmium on organ function, gut microbiota and its metabolomics profile in adolescent rats. Ecotoxicol Environ Saf. 2021 Oct 1;222:112501. doi: 10.1016/j.ecoenv.2021.112501. Epub 2021 Jul 12. PMID: 34265528.
Ding Q, Cao F, Lai S, Zhuge H, Chang K, Valencak TG, Liu J, Li S, Ren D. Lactobacillus plantarum ZY08 relieves chronic alcohol-induced hepatic steatosis and liver injury in mice via restoring intestinal flora homeostasis. Food Res Int. 2022 Jul;157:111259. doi: 10.1016/j.foodres.2022.111259. Epub 2022 Apr 16. PMID: 35761571.
Tian G, Wang W, Xia E, Chen W, Zhang S. Dendrobium officinale alleviates high-fat diet-induced nonalcoholic steatohepatitis by modulating gut microbiota. Front Cell Infect Microbiol. 2023 Feb 13;13:1078447. doi: 10.3389/fcimb.2023.1078447. PMID: 36860985; PMCID: PMC9968977.
Miao J, Cui HT, Wang L, Guo LY, Wang J, Li P, Lei JY, Jia JW. [Effects of evodiamine on carbon tetrachloride-induced liver fibrosis mice based on modulating gut microbiota]. Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi. 2021 Jun 20;39(6):401-406. Chinese. doi: 10.3760/cma.j.cn121094-20201204-00666. PMID: 34218553.
Peng M, Wang L, Su H, Zhang L, Yang Y, Sun L, Wu Y, Ran L, Liu S, Yin M, Li S, Chunyu W. Ginsenoside Rg1 improved diabetes through regulating the intestinal microbiota in high-fat diet and streptozotocin-induced type 2 diabetes rats. J Food Biochem. 2022 Oct;46(10):e14321. doi: 10.1111/jfbc.14321. Epub 2022 Jul 19. PMID: 35851705.
Cai YY, Huang FQ, Lao X, Lu Y, Gao X, Alolga RN, Yin K, Zhou X, Wang Y, Liu B, Shang J, Qi LW, Li J. Integrated metagenomics identifies a crucial role for trimethylamine-producing Lachnoclostridium in promoting atherosclerosis. NPJ Biofilms Microbiomes. 2022 Mar 10;8(1):11. doi: 10.1038/s41522-022-00273-4. Erratum in: NPJ Biofilms Microbiomes. 2022 May 9;8(1):40. PMID: 35273169; PMCID: PMC8913745.
Wang G, Zhang Y, Zhang R, Pan J, Qi D, Wang J, Yang X. The protective effects of walnut green husk polysaccharide on liver injury, vascular endothelial dysfunction and disorder of gut microbiota in high fructose-induced mice. Int J Biol Macromol. 2020 Nov 1;162:92-106. doi: 10.1016/j.ijbiomac.2020.06.055. Epub 2020 Jun 10. PMID: 32531370.
谷禾健康
Eubacterium 通常翻译为真杆菌属或优杆菌属
Eubacterium,革兰氏阳性细菌,属于真杆菌科,厚壁菌门。
Eubacterium 是在健康人结肠中发现的一种重要的肠道细菌,它是人类肠道微生物群的核心菌属之一,并显示出在大部分人群肠道,口腔等部位的广泛定植,对机体有营养代谢和维持肠道平衡有重要的作用。但是少数菌种可与其它兼性厌氧菌造成混合感染,引起人心内膜炎,盆腔炎等疾病。
这个家族的成员很重要,因为许多菌种产生短链脂肪酸,尤其丁酸。短链脂肪酸普遍被认为对维持人体健康具有多种重要作用,例如充当肠道上皮特殊营养和能量组分、保护肠道黏膜屏障、降低人体炎症水平和增强胃肠道运动机能等等。
F.prausnitzii、Eubacterium rectale、Eubacterium hallii、Roseburia gutis和Ruminococcus bromii是人类肠道中产生丁酸的主要物种。真杆菌属的几个成员均产生丁酸盐,丁酸盐在能量稳态、结肠运动、免疫调节和肠道炎症抑制中起着关键作用。
同时真杆菌属成员还被证明在以下过程中发挥关键作用:
胆汁酸和胆固醇转化
参与草酸盐分解代谢
促进抗炎分子的产生
预防气道过敏性炎症
降低胰岛素分泌并增加“健康”脂肪的水平
与下腹部脂肪之间的关联
…
在越来越多的肠道菌群研究中发现,Eubacterium的减少或缺乏与很多疾病相关,比如抑郁和/或疲劳、肥胖、IBD、II型糖尿病、心脑血管、结直肠癌、自闭症、老年肌少症、肠道健康以及肿瘤预后良好和肠道稳态状态等。
该属的多个物种目前被认为是微生物治疗的有希望的目标。事实上,基于谷禾长期的菌群检测实践与肠道微生物科学研究等达成的“共识”表明,肠道真杆菌属(Eubacterium)、罗氏菌属(Roseburia)和粪杆菌属, (Faecalibacterium, 也称为普拉梭菌)等的特定产丁酸盐微生物菌株属于对人类健康有益的菌属,其作用方式与乳杆菌属和双歧杆菌属菌株可能相同。
但是,需要注意的是,Eubacterium属正如下面进一步讨论的一样,很难定义,因为最初分配给该属的几个物种随后被重新分配给现有的或新的属。即使是现在,该属在系统发育上仍然是多样化的,成员可以被分配到几个谱系。认识到这种分类学的变化,我们将包括一些最近重新分配给其他属的前真杆菌属物种。此外,本文也将在很大程度上讨论对真杆菌属的与肠道以及健康相关的信息。
真/优杆菌属(Eubacterium)是人类胃肠道含量较为丰富的菌属,是人和动物口腔与肠道正常菌群的成员。
该属由系统发生学上和表型上不同的物种组成,使真杆菌属成为分类学上独特且具有挑战性的属。该属的特征是包含多种表型多样化的物种,革兰氏阳性,杆状生物属,非孢子形成,这些细菌的特点是坚硬的细胞壁。它们可以是能动的或不能动的。如果能动,它们就有鞭毛。通常单独出现,成对出现,或短链。偶尔与腹部、骨盆或泌尿生殖道的混合感染有关。
该物种是厌氧的,这使得真杆菌属的表型鉴定非常耗时,这可能一定程度抑制了对从粪便中分离的属成员的详细研究。
真杆菌属
Eubacterium
化能有机营养,发酵代谢,有些种利用碳水化合物。发酵葡萄糖或蛋白胨的主要产物通常包括大量的丁酸、乙酸或甲酸并有可测得的H2的混合酸。接触酶阴性,通常吲哚阴性。可能还原硝酸盐,可能液化明胶。
1938年首次提出,常在哺乳动物的口腔和肠道中发现,包括在反刍动物的瘤胃以及在环境中。
该属构成人类肠道微生物群的核心属之一,并显示出在全世界人类肠道的广泛定植,包括亚洲、非洲、澳大利亚、欧洲、南美洲、北美洲等不同人群中,表明该菌属具有高度的特异性和适应性。真杆菌属DNA(G + C)含量约为30~57mol%,代表菌种为黏液真杆菌。
多数物种要求特殊的厌氧培养技术和营养丰富的培养基,菌落通常低凸或平坦。这个属里的有些种在自然界中可被糖乳酸化或可运动。
本属细菌从碳水化合物或蛋白胨中产生有机酸混合物,其可能包括大量的丁酸、乙酸和甲酸。
根据Bergey的《细菌和古菌系统学手册》以及NCBI分类学的最新版本,真细菌属属于厚壁菌门、梭状芽胞杆菌目和真细菌科。
由于该属的定义相当宽松,目前该属中的许多物种不属于严格意义上的属,很可能会及时移至新的或现有的属中。
2020年爱尔兰Cotter 团队提供了该树的更新,以显示该属某些成员与其他密切相关物种之间的系统发育关系(下图)。
真杆菌属的系统发育关系
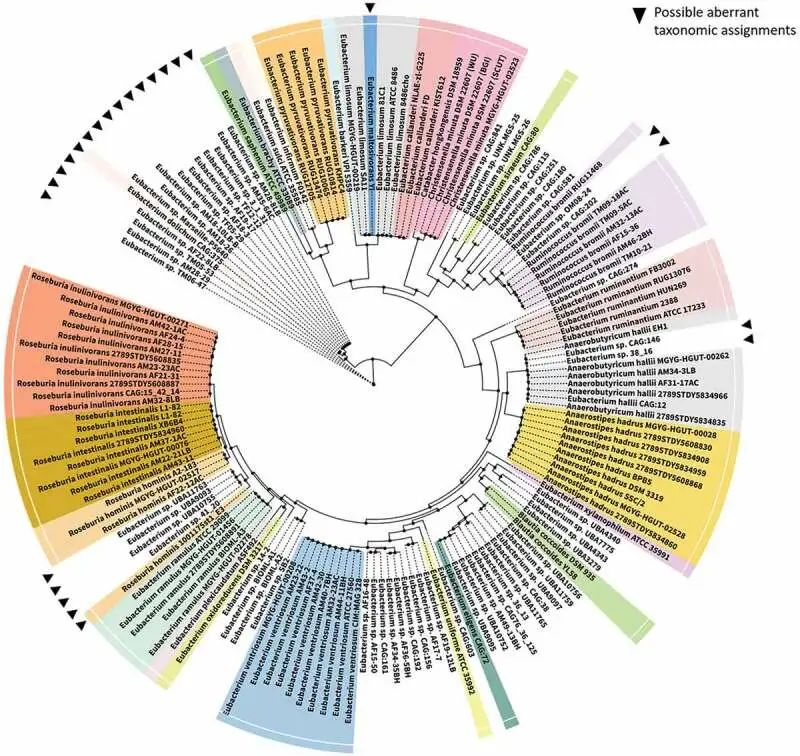
doi: 10.1080/19490976.2020.1802866
▸ 真杆菌属的重新分类
经过重新分类的真杆菌属的大多数成员被归入厚壁菌门,并广泛分布于其中。例如,E. formicgenerans和E. timidum,它们分别被重新分配到Dorea属和Mogibacterium属。
然而,其他几个成员已被重新分配到其他门;实例包括将真杆菌物种重新分配给Slackia 、Cryptobacterium和Eggerthela等属,所有这些属都属于放线菌门。
值得注意的是,某些E. cylindroides等真杆菌属物种可能同时表现出革兰氏阳性和革兰氏阴性特征,从而在分类学分配中经常实施的基本表型特征中产生歧义;这进一步导致了真杆菌属物种分类的相当大的混乱。
▸ 狭义的真杆菌属
有人提出,狭义真杆菌属的核心基因型仅限于该属的模式种Eubacterium limnosum,以及Eubacterium callanderi 、Eubacterium barkeri和Eubacterium aggregans,当有足够的基因组和系统发育证据支持时,其余物种可能被同化为/重新分类为现有或新属。
为实用起见,迄今为止,成员已根据系统发育特征分为子类别。提议的松散系统发育子类别之一包含E. rectale、E. oxidoreducens、E. ramulus、Roseburia cecicola和R. intestinalis,其中除E. oxidoreducens之外的所有物种都产生丁酸盐并且是糖分解的。
▸ 进一步分类的必要性
后来又有科学家提出了对其中一些物种进行重新分类的有力案例。E. eligens是一种重要的肠道真杆菌,已被发现与Lachnospira pectinoschiza具有相当大的系统发育和表型相似性,并且随着进一步证据的可用性而值得重新分类。
鉴于它们不同的表型和系统发育特征,某些对肠道健康很重要的真杆菌属物种已经或计划进行重新分类。例如,建议将E. hallii重新分类为Anaerobutyricum hallii Comb。
2020年11月,报道了一种类似的新型产丁酸盐和丙酸盐的物种Anaerobutyricum soehngenii。事实上,E. hallii与E. indolis、E. cellulosolvens、E. plexicaudatum、E. ruminantium、E. saburreum、E. xylanophilum、E. uniforme 和 E. ventriosum 一起构成了真杆菌属中有趣的种。
值得注意的是,这一群体的成员在系统发育上或表型上与该属中的其他物种没有亲缘关系,并表现出独特的特征,从而为每个物种创建一个新的属。
▸分类对人类微生物群研究影响大,重新分类需谨慎
此外,最近有人提议将最重要的肠道微生物之一直肠肠杆菌重新归类为直肠Agathobacter。然而,这种重新分类受到其他科学家等人的质疑。认为没有理由重新分类并指出其分类学或系统发育隶属关系的任何变化都将对人类微生物群研究产生重大影响。
可以理解的是,提出的分类学重新分配尚未被普遍接受,事实上,如前所述,在考虑真杆菌属任何成员的分类学分类和报告时必须小心。与属的分类有关的进一步努力应该主要关注基因型,并强调基因组特征。
真杆菌属目前的模式菌种为黏液真杆菌(Eubacterium limosum)。研究较多的是:
饮食是决定肠道菌群组成和多样性的最重要因素之一。就真杆菌属而言,它们在肠道中的存在在很大程度上与膳食纤维摄入量的增加有关,多项研究证真杆菌属对消化抗性复合碳水化合物的利用,并且已被证明随着饮食中蛋白质/脂肪百分比的增加而减少。
E. hallii和E. rectale被证明能够利用证明能够利用补充有抗性碳水化合物的培养基,即长链的果聚糖,如低聚果糖、高性能菊粉。
▸ 地中海饮食增加真杆菌属的数量
多项研究报告称,西方饮食中动物蛋白和脂肪的比例增加且纤维含量低,导致肠道细菌丰度显着下降,包括双歧杆菌和真杆菌属等理想的菌群。涉及地中海饮食的研究也表明,地中海饮食可以增加肠道中真杆菌属(Eubacterium)的数量。
研究显示45岁男性食用富含多不饱和 omega-3 脂肪酸的饮食时,肠道微生物群的变化,包括真杆菌在内的几种丁酸盐菌的丰度急剧增加,表明多不饱和脂肪酸对真杆菌的正向调节。
在衰老过程中,胃肠道会发生变化,包括粘膜屏障和肠神经系统的退化以及肠道运动的改变和胃肠道病变的增加。
▸老年菌群多样性↓,短链脂肪酸生成↓,肠道炎症↑
总的趋势是,老年人的微生物群多样性随着丁酸盐生产者的减少和潜在病原体数量的增加而减少。肠道中短链脂肪酸生成的减少可导致肠上皮细胞粘蛋白分泌受损,从而增加病原体进入肠粘膜的机会, 潜在的肠道炎症。
在老年人中,肠道相关淋巴组织 (GALT) 受损会加剧肠道炎症,导致无法有效控制常驻微生物群并导致肠细胞释放促炎细胞因子和趋化因子;后者驱动效应 TH1、TH2 和 TH17 细胞的分化。
与上面观察结果一致的是,在百岁老人中,在百岁老人中发现了E. hallii、E. rectale 和 E.ventriosum相对比例降低,而来自变形杆菌门的潜在致病细菌增加。
▸ 真杆菌:老年肠道微生物生态系统中的关键物种
后续的研究进行的一项广泛研究强调了真杆菌属的有益作用,其中调查了一大群老年人(n=612),以评估地中海饮食对其肠道微生物群的调节作用。作者报告称,真杆菌(Eubacterium)物种,如直肠真杆菌(E.rectale)和 E.eligens与一些较低虚弱、认知能力提高以及短/支链脂肪酸产量增加的标志物呈正相关。
真杆菌与炎症标志物如IL-2和C反应蛋白呈负相关。此外,网络分析显示,真杆菌属是老年肠道微生物生态系统中的关键物种。然而,与这些一般观察结果相反,其他研究推断出真杆菌属与年龄之间存在正相关。
短链脂肪酸有益于人类健康,它们由不同的结肠微生物群产生,包括来自真杆菌属的几种物种(上图)。
▸ E. rectale 是研究最广泛的真杆菌种之一
它首先从健康的日本-夏威夷男性的粪便中分离出来,被确定为主要的丁酸盐生产者,能够利用复杂的碳水化合物(如纤维二糖和淀粉)进行生长和增殖。
▸ 产丁酸的途径,与真杆菌相关
E. hallii也是人体肠道中的丁酸盐生产者。在肠道中,丁酸可以通过糖酵解从碳水化合物中产生,其中两分子乙酰辅酶A结合形成乙酰乙酰辅酶A,然后逐步还原生成丁酰辅酶 A。
目前已知丁酸CoA最终转化为丁酸的两种不同途径;这通过丁酸CoA:乙酸CoA转移酶途径或磷酸转丁酸酶和丁酸激酶途径进行。丁酰辅酶 A 转移酶途径与丁酸合成基因与直肠真杆菌和Roseburia等物种密切相关。
其他真杆菌种也采用相同的途径,例如E. hallii和E. biforme(现在重新归类为Holdemanella biformis)用于生产丁酸盐。
▸ 丁酸高产的真杆菌属——E. rectale 和 E. hallii
E. rectale和E. hallii随后被确定为肠道中的高产丁酸盐生产者。它们被发现是人类粪便微生物群中最丰富的 10 个成员之一,贡献了从 10 名健康志愿者的粪便样本中检索到的超过 44% 的丁酰辅酶 A:乙酸 CoA 转移酶序列。
瑞士最近的一项队列研究也表明,E. hallii 是婴儿肠道中丁酸的首批生产者之一。
▸ 转化为丙酸的1,2-丙二醇可被E. hallii 代谢
肠道微生物通过糖发酵的两种途径形成丙酸。虽然琥珀酸途径处理大多数戊糖和己糖产生丙酸,但丙二醇途径代谢脱氧糖如岩藻糖和鼠李糖。后者作为膳食(例如人乳低聚糖)或宿主衍生(粘蛋白)聚糖在肠道环境中很容易获得,并且在被各种肠道微生物利用后可以产生 1,2-丙二醇作为最终产物。虽然不能降解脱氧糖,但 1,2-丙二醇可被E. hallii代谢,已证明携带甘油/二醇脱水酶PduCDE,这是1,2-丙二醇转化为丙酸和丙醇并生成一个ATP的关键酶。
1,2-丙二醇转化为丙酸取决于维生素B12的有效性,并发生在称为多面体的小隔间内,以隔离有毒中间体丙醛。
虽然真杆菌属(Eubacterium)可以降解复合碳水化合物,但某些真杆菌属菌株可能缺乏降解特定复合碳水化合物的能力,并依赖于其他肠道微生物产生的代谢产物;然后,这些其他肠道微生物产生的发酵产物可以被真杆菌利用。
▸ 交叉喂养机制在真杆菌属生产短链脂肪酸中的重要性
已在多个实例中得到证明。在这些研究中,真杆菌与双歧杆菌在复合碳水化合物存在下共培养。这些双歧杆菌菌株能够降解阿拉伯木聚糖低聚糖和岩藻糖基乳糖等复合碳水化合物,可产生乙酸盐、乳酸和 1,2-丙二醇,所有这些物质又被真杆菌属吸收和利用,生成丁酸和丙酸。真杆菌属这种交叉喂养的证据。
这不仅强调了肠道微生物与抗性碳水化合物的产丁酸作用之间的协同相互作用,而且强调了肠道微生态整齐的生态互作,不是关注一个菌而是整体的菌群健康状况。同时也突出了真杆菌属在维持肠道健康中的生态作用。
研究已经证实丁酸盐构成了结肠细胞的主要能量来源,促进了它们的增殖、成熟,发育成健康的结肠。事实上,据报道,E. rectale (直肠真杆菌)优先定殖粘液层,从而增加丁酸盐对上皮结肠细胞的生物利用度。
▸ 短链脂肪酸促进肠道完整性
此外,短链脂肪酸已被证明在通过促进肠道完整性和调节免疫反应来调节肠道炎症方面发挥重要作用。短链脂肪酸可以通过上调紧密连接蛋白(例如 claudin-1 和 occludin)以及肠粘蛋白、粘蛋白 2 来改善肠上皮抵抗力。
▸ 短链脂肪酸激活GPCR,抑制HDAC
短链脂肪酸对免疫反应的调节,包括G 蛋白偶联受体 (GPCR) 的激活和组蛋白脱乙酰酶 (HDAC) 的抑制。 短链脂肪酸可以结合至少四种离散的 GPCR——FFAR2(游离脂肪酸受体)、FFAR3、GPR109a 和 Olfr78 作为配体,尽管具有不同的特异性。
▸ 短链脂肪酸抑制促炎细胞因子,上调抗炎细胞因子
一些研究表明,短链脂肪酸可以通过抑制促炎细胞因子(如 IFN-γ、IL-1β、IL-6、IL-8 和 TNF-α)发挥抗炎作用,同时上调抗炎细胞因子例如 FFAR2/FFAR3 依赖性方式的 IL-10 和 TGF-β。
GPR109a 激活结肠巨噬细胞和树突状细胞中的炎性体通路,从而诱导调节性 T 细胞和产生抗炎性 IL-10 的 T 细胞的分化。
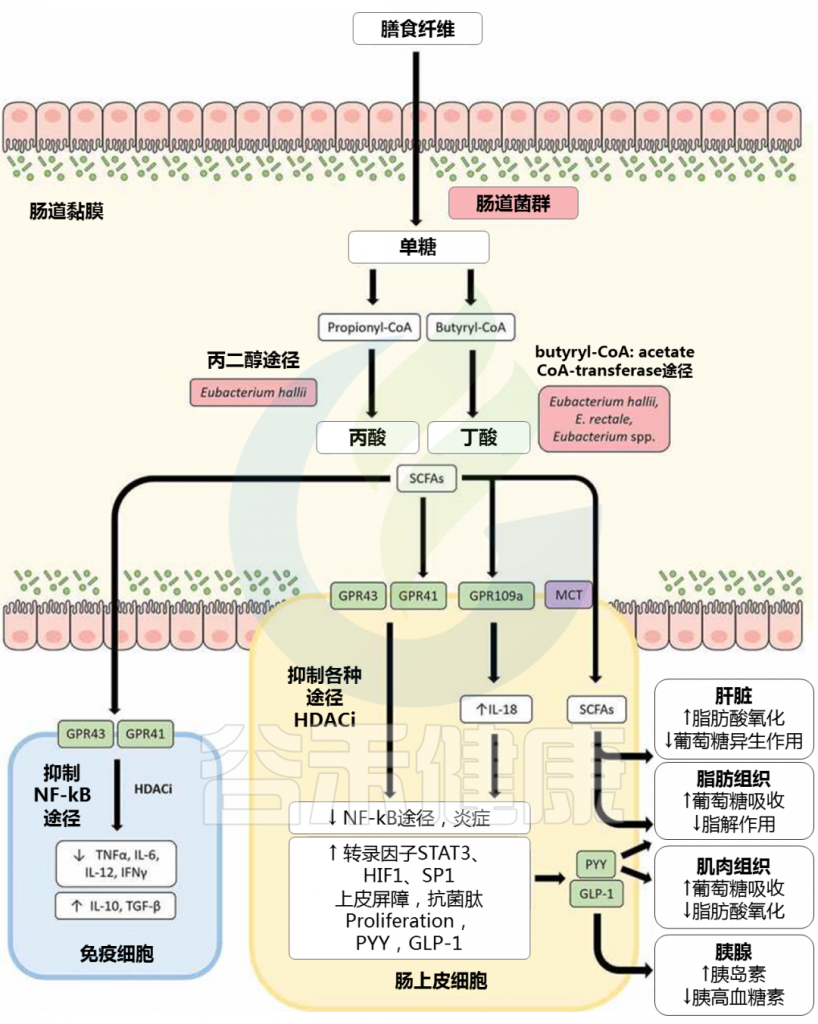

doi: 10.1080/19490976.2020.1802866
▸ 短链脂肪酸增加IL-18 的产生
短链脂肪酸在肠上皮细胞 (IECs) 中激活 GPR109a 也可以增加 IL-18 的产生,IL-18 是修复和维持肠上皮完整性的关键细胞因子。丙酸盐和丁酸盐对 HDAC 活性的抑制与 IEC 中促炎细胞因子和趋化因子(如 CXCL8 和 CCL20)的表达下调有关。
短链脂肪酸对 HDAC 的抑制也与 β-防御素和导管素(如 LL-37)的表达增加有关。鉴于如上所述,短链脂肪酸广泛参与调节肠道健康,尤其是丁酸盐,由于肠道中短链脂肪酸分布的改变,涉及短链脂肪酸生产者的肠道微生物群失调具有重大影响。
注:组蛋白去乙酰化酶(histone deacetylase,HDAC)是一类蛋白酶,对染色体的结构修饰和基因表达调控发挥着重要的作用。
炎症性肠病 (IBD) 是胃肠道的严重和慢性炎症,其特征在于两种主要的临床表型:克罗恩病 (CD) 和溃疡性结肠炎 (UC)。克罗恩病涉及上皮壁所有层的透壁炎症,而溃疡性结肠炎仅影响浅表粘膜层。
▸ IBD患者真杆菌属持续减少
一般来说,IBD 反复表现出肠道微生物群失调,其特征是微生物群的多样性和时间稳定性下降。虽然微生物干扰在 IBD 的发病机制或病因中的确切作用仍在阐明,但包括真杆菌属(Eubacterium)在内的丁酸盐生产者的比例在 IBD 受试者中肠道中的持续减少。
▸ IBD患者丁酸水平降低
事实上,与非 IBD、健康个体相比,IBD 患者中梭菌簇 IV 和 XIVa 的丰度减少以及伴随的致病变形杆菌增加构成了 IBD 微生物失调的特征,可以被视为生物标志物。因此,在患有 IBD 的患者中通常会观察到肠道丁酸水平降低,从而导致宿主免疫系统调节不当。IBD 和实验性结肠炎患者肠道中短链脂肪酸水平降低也与调节性 T 细胞功能降低和炎症增加相关。
▸ 真杆菌在IBD中提供了丁酸盐介导的保护作用
用溃疡性结肠炎和克罗恩病患者粪便微生物群的体外研究表明,丁酸盐产生者较少,定植能力和丁酸盐产生能力降低;用已知的丁酸盐产生菌(包括真细菌属)补充IBD微生物群可恢复丁酸盐的产生,并改善上皮屏障完整性和定植能力。
真杆菌的作用在接受抗 TNF-α 治疗的患有 IBD 的儿童中,进一步证明了肠道健康中的丁酸盐-抗炎轴;E. rectale基线丰度较高的患者对治疗更敏感,E. rectale(直肠真杆菌)的存在预示着炎症的成功减轻。
在体外和小鼠模型中已经证明了E. limosum(粘液真杆菌)及其产生的短链脂肪酸对肠道炎症的保护作用。当TNF-α处理刺激时,由E.limsum产生的短链脂肪酸诱导T84结肠细胞生长,并降低结肠细胞IL-6和TLR4的表达,其中丁酸盐是最显著的效应物。此外,与对照组相比,当提供5%的E. limosum时,小鼠在结肠炎诱导时显示出体重和结肠长度的显著保留。这些观察表明,真杆菌属对肠道健康具有丁酸盐介导的抗炎作用,并将其作为炎症性肠道疾病的一种有吸引力的生物治疗药物。
到目前为止,真杆菌属与肥胖的关系仍存在争议,有几份报告表明真杆菌属和肥胖呈正相关。BMI通常被认为是用来衡量肥胖的参数;一些基于BMI的研究也报告了肥胖受试者体内真杆菌的丰度更高。
▸ 为什么肥胖人群真杆菌的丰度更高?
有趣的是,据报道,在接受治疗的肥胖受试者中,粪便短链脂肪酸减少的肥胖个体中总丁酸水平较高,这表明碳水化合物和脂质的同化增强,这可能导致肥胖表型。这一观察结果可以解释肥胖个体中丁酸盐产生菌(包括真杆菌属)的丰度较高。
仔细观察饮食干预研究表明,肥胖受试者中真杆菌属和其他丁酸盐产生者的比例可能主要受饮食影响。在几项研究中,肥胖个体肠道微生物对复合碳水化合物的利用受到限制,一直有报道称真杆菌属的显著减少。
对印度肥胖和非肥胖儿童进行的一项研究没有发现各组间直肠大肠杆菌(Eubacterium rectale) 丰度的差异。
综合来看,目前的证据表明,当通过合理数量的复合碳水化合物的持续供应在肠道时,真杆菌属和其他丁酸盐产生菌在肥胖个体中的比例增加,从而促进肠道中的能量提取。肥胖个体的饮食而非改变的代谢参数也可能驱动丁酸盐产生菌(包括真杆菌属)的生长和增殖。
▸ 肠道微生物群调节肥胖的确切机制仍在阐明中
丁酸盐已被证明可以缓解饮食诱导的肥胖和改善葡萄糖稳态,这使得很难得出线性结论。在推断肠道菌群和肥胖之间的直接关联时必须谨慎,因为对于具有多因素影响的代谢综合征,任何的相关性结论可能会过于简单。我们在检测实践中也发现,菌群可能只能解释60%左右的肥胖,肥胖是一种多因素代谢综合征,还与菌群外的其他很多因素相关。
在几项研究中,真杆菌属和丁酸盐产生菌与胰岛素敏感性呈正相关。最近的独立研究比较了健康和2型糖尿病个体的宏基因组,明确表明肠道微生物群与2型糖尿病病理生理学之间的潜在相关性。
▸ 2型糖尿病患者真杆菌显著减少
一项在中国和欧洲人群中进行的研究均报告了2型糖尿病受试者中丁酸盐产生菌(包括真杆菌属)的显著减少。其他研究表明,在人和小鼠胰岛素抵抗模型中,丁酸盐生产商(包括从瘦个体移植的真杆菌属)具有恢复作用。
▸ 粪菌移植后真杆菌的增加,代谢改善
事实上,粪菌移植后真杆菌的增加与胰岛素抵抗个体的代谢改善相关。当向肥胖和胰岛素抵抗的db/db小鼠口服给药时,已表明E.hallii显著改善胰岛素敏感性和能量代谢。
▸ 2型糖尿病的代谢调节,与菌群代谢产物短链脂肪酸相关
短链脂肪酸对肠道激素的刺激和对食物摄入的抑制,是2型糖尿病个体肠道微生物群调节宿主代谢的可能机制。这种提出的机制与观察结果一致,即与FFAR2受体结合的丁酸盐和丙酸盐可以调节饱腹激素,例如生长素释放肽(促食欲肽)、胰高血糖素样肽-1(GLP-1)和PYY(促食欲肽) 。
短链脂肪酸对生长素释放肽和 GLP-1/PYY 的相反调节,其中 GLP_1/PYY 上调,生长素释放肽下调,确保减少食物摄入、饱腹感和减少肥胖。 Ghrelin,也与产生丁酸盐的E. rectale呈负相关。
注:Ghrelin,也被称为“饥饿激素”,刺激食欲,在饭前分泌,而 GLP-1 和 PYY 由肠内分泌 L 细胞合成和释放,刺激胰腺 β 细胞分泌胰岛素,减少食物摄入,使能量正常化摄入量和体重减轻。
▸ 直肠真杆菌高丰度与较低的餐后血糖反应呈正相关
一个大型队列(n=800)进行了一项基于机器学习的研究,以便使用从饮食习惯、肠道微生物群、人体测量、身体活动和血液参数中得出的综合特征数据集来预测个体的个性化餐后血糖反应,也支持真杆菌属在胰岛素敏感性中的肯定作用。在他们的研究中,肠道微生物组的72个特征被推断为具有预测性,其中直肠大肠杆菌(Eubacterium rectale)是最强大的特征之一,肠道中较高的细菌丰度与较低的餐后血糖反应呈正相关(n = 430)。
▸ 真杆菌产生的丁酸盐改善胰岛素敏感性和饱腹感
真杆菌产生的丁酸盐也可以通过HDAC(组蛋白去乙酰化酶)抑制介导的胰腺β细胞重编程来改善胰岛素敏感性和饱腹感,从而为2型糖尿病患者提供额外的益处。
▸ 真杆菌产生的短链脂肪酸有助于恢复炎症
据报道,2型糖尿病中存在低度炎症,其中炎症分子在胰岛素靶组织中上调,并导致胰岛素抵抗。例如,TLR4依赖性通过激活胰岛中的巨噬细胞和β细胞产生促炎细胞因子,导致β细胞的调节失调、功能受损和生存能力下降。由真杆菌产生的短链脂肪酸可通过上述机制有助于恢复生理炎症环境。2型糖尿病中其他肠道丁酸盐产生者的持续减少也加强了这种联系。因此,目前的观察结果一致表明,真杆菌属是缓解2型糖尿病的积极贡献者,应被视为一种潜在的治疗方法。
20世纪30年代首次报道了肠道细菌将胆固醇转化为粪甾醇(coprostanol),此后进行了几项研究,以确定能够将胆固醇转化成粪甾醇的细菌。许多已鉴定的微生物最终被归入真细菌属。
▸ 可降解胆固醇的真杆菌:
——Eubacterium coprostanoligenes HL
Eubacterium coprostanoligenes HL (ATCC 51222) 代表了一种这样的细菌,该菌是从生猪污水泻湖中分离出来的,并且由于其降低胆固醇的特性而受到相当大的关注。
尽管随后有报道称多氏拟杆菌 (Bacteroides dorei)、乳杆菌(Lactobacillus sp)和双歧杆菌(Bifidobacterium sp)具有胆固醇利用特性,但这些特性似乎是暂时性的,可能会丢失,从而使Eubacterium coprostanoligenes HL成为唯一可降解胆固醇的可培养肠道分离物。
▸ 肠道微生物群中E. coprostanoligenes 的存在与粪便粪甾醇密切相关
最近,在肠道宏基因组中发现了E. coprostanoligenes 的3β-羟基类固醇脱氢酶同系物,可将胆固醇转化为粪甾醇。
有趣的是,这些肠道甾醇代谢A基因(ismA)被归因于尚未培养的肠道微生物,它们与生命树中的真杆菌物种形成了一个连贯的分支,并可能代表了参与肠道胆固醇降低的新真细菌物种。
▸ Eubacterium coprostanoligenes的胆固醇代谢
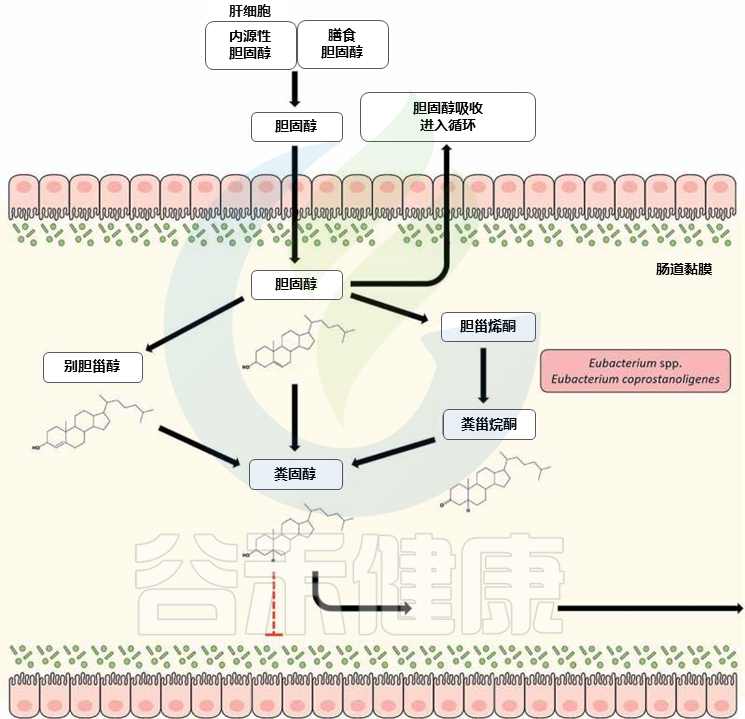
doi: 10.1080/19490976.2020.1802866
来自膳食和额外膳食来源的近1克胆固醇每天到达人体结肠,在那里由共生肠道细菌代谢为粪甾醇。与胆固醇不同,粪甾醇在肠道中吸收不良,并被认为对胆固醇代谢和血清胆固醇水平的调节有影响。
发现血浆胆固醇水平与粪便中胆固醇与粪甾醇的比例之间存在反比关系,这一观点得到了证实。因此,胆固醇向共甾醇的转化被认为是人类胆固醇稳态管理的新策略。作为一种延伸,研究了肠道内高度参与粪甾醇代谢的真杆菌属(Eubacterium spp)的降胆固醇作用。
▸ 动物实验发现E. coprostanoligenes降低胆固醇
据报道,喂食E. coprostanoligenes的高胆固醇血症兔子的血浆胆固醇水平降低,消化液中的粪甾醇/胆固醇比值增加。在这些兔子中观察到的效果进一步归因于E. coprostanoligenes降胆固醇,因为E. coprostanoligenes优先在空肠和回肠中定殖,这两个地方都是胆固醇吸收的场所。在无菌小鼠中也发现了类似的观察结果。
代谢组学和宏基因组学联合研究的其他结果已经确定了多种细菌门型,包括 Eubacterium eligens ATCC 27750 发光真杆菌ATCC 27750(p=1.477e-02)与高粪便粪便甾烷醇显着相关。
▸ 肠道菌群的变化与胆固醇转化速率直接相关,从而影响心血管疾病风险
动脉粥样硬化性心血管疾病 (CVD) 发展过程中的关键风险因素包括血液胆固醇水平失衡和血清低密度脂蛋白胆固醇浓度高。事实上,CVD 患者的肠道胆固醇吸收更高。值得注意的是,肠道微生物群的变化与胆固醇转化为粪前列醇的速率直接相关,而胆固醇转化为粪前列醇的效率高与 CVD 风险降低有关。
由于它们的降胆固醇作用,真杆菌属和其他降低胆固醇的微生物可以预防心血管疾病。
事实上,肠道真杆菌属在动脉粥样硬化受试者中,与已动脉粥样硬化标志物(如低密度脂蛋白、胆固醇和白细胞)呈显着负相关。当给小鼠喂食甲硫氨酸-胆碱饮食以诱发非酒精性脂肪性肝炎时,小鼠肠道中的Eubacterium coprostanoligenes 也减少了,其中对肝脏的损害会抑制内源性胆固醇的产生。
胆汁酸 (BA) 是宿主产生的代谢物,来源于肝脏周围肝细胞中的胆固醇。
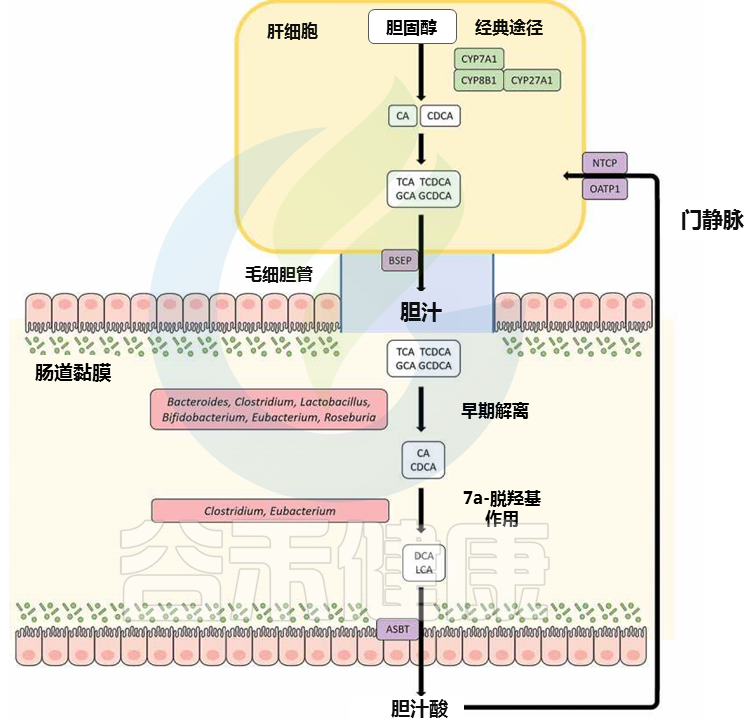
我们来了解一下肝肠循环。
胆酸 (CA) 和鹅去氧胆酸 (CDCA) 是肝脏中产生的主要 BA,然后与牛磺酸或甘氨酸结合,然后暂时储存在胆囊中;这些胆汁酸随后经过餐后分泌到达肠道。肠道中 95% 的总胆汁酸池被有效吸收并通过门静脉循环回肝脏,这个循环过程被称为肠肝循环。其余的作为肠道细菌代谢的底物,构成胆固醇从体内排泄的关键途径。
胆汁酸可以以多种形式出现,包括初级胆汁酸、次级胆汁酸、共轭或非共轭。肠道微生物群的各种成员都能够转化胆汁酸,从而影响局部胆汁酸库的组成以及宿主生理学的其他各个方面。
有胆汁盐水解酶(BSH)酶的肠道微生物(包括真杆菌属)能够水解共轭胆汁酸中的C-24 N-酰基酰胺键,以释放甘氨酸/牛磺酸部分。
真杆菌对胆汁酸的修饰与肠肝循环
doi: 10.1080/19490976.2020.1802866
▸ 真杆菌参与人体代谢,通过影响胆汁酸的溶解率,影响胆固醇水平
事实上,真杆菌属与其他属(如Roseburia和Clostridium)一起构成了肠道中胆汁盐水解酶的主要储存库。解偶联使BAs的pKa增加到约5,从而使其不易溶解,这反过来导致胆固醇从头合成所损失的胆汁酸的吸收和补充效率低下。
▸ 调节胆汁盐水解酶活性来调节宿主的体重增加和胆固醇水平
胆汁盐水解酶活性广泛分布于肠道微生物群中,因此可以通过调节胆汁盐水解酶活性来调节宿主的体重增加和胆固醇水平。解偶联还通过产生的游离胆汁酸重新捕获和输出共转运的质子,从而帮助胆汁解毒,从而抵消 pH 值。
▸ 肠道细菌转化胆汁酸的方式:生成异胆汁盐
肠道细菌转化胆汁酸的另一种方式是通过C3、C7和C12位羟基的氧化和差向异构化,从而生成异胆汁盐(β-羟基)。
聚合涉及从α构型到β构型的可逆立体化学变化,反之亦然,生成稳定的氧代胆汁酸中间体。这一过程由α-和β-羟基类固醇脱氢酶(HSDHs)催化,可以由含有两种酶的单个细菌物种进行,也可以通过两种物种之间的原合作进行,每个物种贡献一种酶。据报道,包括真杆菌在内的几个物种具有HSDH活性。
▸ 肠道中胆汁酸的细菌转化,真杆菌能够进行
肠道中的细菌 7α-脱羟基酶将初级胆汁酸、CA 和 CDCA 分别转化为脱氧胆酸 (DCA) 和石胆酸 。尽管从数量上讲,7α-羟基化代表了肠道中胆汁酸最重要的细菌转化,但据报道只有少数肠道微生物群的不同成员,如真杆菌和梭菌XIVa 簇能够进行这种反应。
▸ 真杆菌:催化初级胆汁酸7α-脱氢化,对肠道健康有重要影响
对真杆菌菌株 VPI 12708 的研究已经鉴定出由胆汁酸诱导型 ( bai ) 操纵子编码的酶,该操纵子催化初级胆汁酸7α-脱氢化的多步途径。
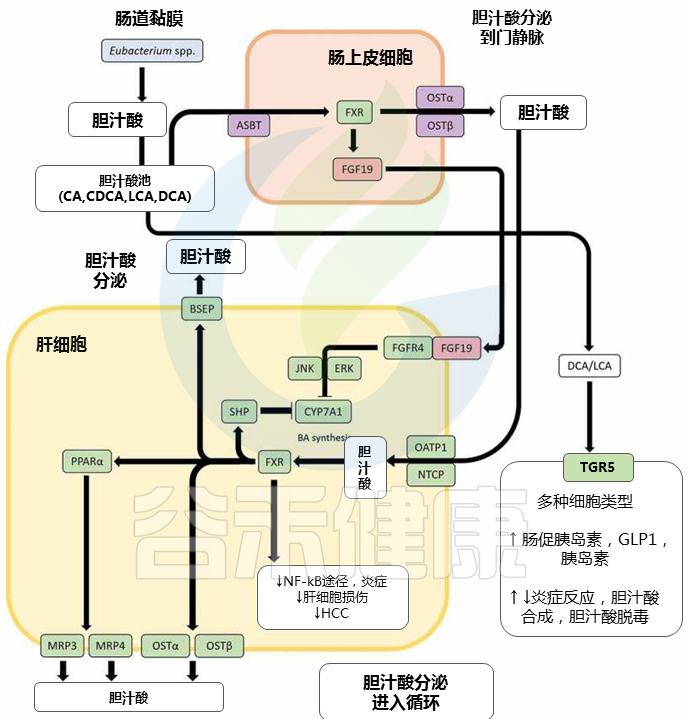
脱氧胆酸DCA 和 石胆酸LCA 通过真细菌对初级胆汁酸的 7α-脱氢化作用产生属 可对主要通过胆汁酸信号受体表现出来的肠道健康和体内平衡产生重大影响。DCA 和 LCA 都是核激素受体法尼醇 X 受体 (FXR) 的高亲和力配体;DCA 或 LCA 激活肠道 FXR 会上调成纤维细胞生长因子 19 (FGF19) 的表达,后者又与肝成纤维细胞生长因子受体 4 (FGFR4) 结合,随后下调肝细胞中胆汁酸的合成。
胆汁酸诱导的信号通路影响胆汁酸稳态和炎症
doi: 10.1080/19490976.2020.1802866
▸ FXR促进抗炎特性,有助于控制病原体
主要是通过抑制 NF-κB 通路和胆汁酸解毒,通过调节增殖物激活受体 α (PPARα)。据报道,FXR 激活可诱导抗菌肽的表达,从而有助于控制病原体。
▸ TGR5刺激GLP-1和胰岛素分泌,调节炎症反应
TGR5是一种在与胆汁酸相互作用后激活各种细胞内通路的 GPCR,它也以胆汁酸池中最高的亲和力结合 LCA 和 DCA。一旦被激活,TGR5 会刺激肠促胰岛素激素 GLP-1 和胰岛素的分泌,从而促进能量消耗。
此外,TGR5 可以调节炎症反应,这在本质上可以是促炎或抗炎的;BA-TGR5 信号在肠道促炎细胞因子和抗炎细胞因子的复杂平衡中起着关键作用。
LCA 和 DCA 还与孕烷 X 受体 (PXR)、维生素 D 3受体 (VDR) 和组成型雄激素受体 (CAR) 结合,以不同方式影响胆汁酸稳态和胆汁酸解毒。
生产LCA和DCA的真杆菌属是TGR5的高亲和力配体。
胆汁酸信号受体对微生物群诱导的次生胆汁酸的强亲和力,突出了包括真菌属在内的肠道菌群如何通过胆汁酸信号调节胆汁酸稳态、胆汁酸解毒、控制和维持肠道细菌生长、炎症和血糖反应。
▸ 高脂饮食过度刺激->次级胆汁酸的产生↑->促炎
受饮食和其他因素调节的肠道微生物群可导致特定的胆汁酸分布,进而产生重要后果。高脂肪饮食(HFD)(如西方饮食)过度刺激胆汁酸向肠道的排放,导致肠道微生物群失调,并增加次级胆汁酸的产生,特别是LCA和DCA。
DCA和LCA是胆汁酸池中最疏水的,升高的水平可能具有细胞毒性;DCA和LCA产生的有害影响可通过对DNA的氧化损伤、引发促炎反应和增加细胞增殖来破坏结肠上皮的结构和功能。
▸ LCA/DCA的增加间接与真杆菌相关
在喂食高脂肪饮食的小鼠中,LCA/DCA的增加与梭状芽孢杆菌(一种来自XI梭状芽胞杆菌簇的细菌)丰度的增加相关。令人惊讶的是,据报道,真杆菌属的梭状芽孢杆菌簇XIVa是次要的贡献者,尽管它们表现出7-α羟基化性质。
如上所述,这种观察结果与真细菌属一致,真细菌属受到高脂肪饮食(HFDs)的负调节。
高脂饮食引起的肠内继发胆汁酸的重吸收增加,随后转运至肝脏,导致肝脏炎症。由于炎症增加导致FXR信号减少,导致肝胆汁酸转运蛋白功能降低,这会导致持续的肝脏炎症,最终导致肝细胞癌。
肝脏疾病(如肝细胞癌、脂肪酸肝病(FLD)、纤维化和肝硬化)中的生物失调还表现为需氧、促炎、富含BSH的细菌(如肠杆菌和肠球菌)的增加,这也导致继发胆汁酸的产生增加。
▸ 肝病患者粪便真杆菌比例较低
事实上,在非酒精性脂肪肝(NAFLD)患者中,粪便中的初级和次级胆汁酸之间的比率以及血清中结合和非结合胆汁酸的水平更高,而真细菌在肝脏疾病中的比例始终较低。与健康个体相比,患有纤维化和肝硬化的受试者的肠道微生物组真细菌种类(如E. rectale, E. hallii 和 E. eligens )显著减少。
肠道微生物群产生的二级胆汁酸也可能在结直肠癌(CRC)的发展和建立中发挥关键作用。
▸ 结直肠癌患者中真杆菌属显著减少
如上所述,丁酸盐抑制结直肠癌的发生,并且在结直肠癌患者中通常观察到包括真杆菌在内的肠道中产丁酸盐菌的显著减少。几种丁酸盐生产者,包括属于梭状芽胞杆菌簇 XIVa 的真杆菌属,可以通过初级胆汁酸(BA) 的 7-α 羟基化额外产生次级 BA。
据报道,在患有肠道慢性炎症的 IBD 受试者中,二级 BA 水平显着降低,同时粪便结合 BA 增加,梭菌簇 XIVa 显着减少。
次级 BA 水平的降低导致次级 BA 对肠上皮细胞的抗炎作用丧失,从而加剧慢性炎症。尽管 IBD 中丁酸盐生产者和二级 BA 生产者的损失是分开进行的,但这两个群体有很大的重叠,并且都在肠道慢性炎症中被耗尽。
▸ 炎症性肠病患者中真杆菌属显著减少
事实上,最近对肠道宏基因组的生物信息学分析显示,IBD患者中丁酸盐产生者F.prausnitzii和E.rectale的数量显著减少。可以理解的是,这组丁酸和次级胆汁酸产生细菌(包括真杆菌属)的缺失促进了IBD的发展,并可能最终发展为结直肠癌,因为在那里观察到类似的肠道微生物群。
实际上,胆汁酸分布和/或肠道微生物群的调节正被作为肝癌和结直肠癌的新治疗方法。
▸真杆菌改善自闭症儿童症状和肠道问题
我国陆军军医大学的专家,去年在《Frontiers in Cellular and Infection Microbiology》上发表了研究报告,指出真杆菌是通过肠道菌群调整,改善自闭症患儿症状,及肠道问题的重要关键菌群。而且该研究验证了特定细菌,即真杆菌特别是其中的产粪甾醇真杆菌(Eubacterium coprostanoligenes)丰度变化,可以改善患自闭症患儿症状和多种肠道问题,也让调整肠道菌群成为治疗自闭症的新手段。
▸真杆菌可能避免患上痴呆症
来自日本东京工业大学的 Takuji Yamada 团队通过粪便 16S rRNA 基因测序比较了健康、轻度认知功能障碍(Mild cognitive impairment,MCI)和阿尔茨海默病组的肠道微生物组成,发现肠道关键菌株——普拉梭菌 Faecalibacterium prausnitzii(F. prausnitzii)具有保护人避免患上痴呆症的作用,此外,真杆菌属在两组之间也是存在显著差异,普拉梭菌和真杆菌都是产丁酸重要的肠道核心菌,可以推断真杆菌属可能也具有保护人避免患上痴呆症的作用。
▸重度抑郁症的真杆菌水平较低
来自中国和美国三个不同机构的的一组研究人员,最近在《Science Advances》上发表了一项研究,指出了人类肠道微生物组紊乱与重度抑郁症(MDD)之间的联系。研究人员从156名重度抑郁症患者和155名没有重度抑郁症的人中,收集了311份粪便样本进行基因分析,发现重度抑郁症患者的粪便样本中,出现了高水平的拟杆菌属 和较低水平的真杆菌和布氏杆菌(Blautia)。这意味着,重度抑郁症患者可能具有独特的肠道微生物特征,其中真杆菌是重要的菌群特征菌。
常驻微生物群对肠道中特定化合物的代谢转化对人类健康至关重要。人体无法解毒或分解的物质可能会进入肠道,从而导致毒性作用。
真杆菌属已被证明能够在肠道中进行重要的代谢转化,对人类健康产生积极影响,包括将有毒化合物解毒为更良性的形式。
▸E.hallii 将致癌物转化为不可用形式
最近报道了E.hallii的多种有益转化。E.hallii非常擅长将高度丰富的食物衍生杂环芳香胺致癌物2-氨基-1-甲基-6-苯基咪唑并(4,5-b)吡啶(PhIP)转化为生物学上不可用的形式7-羟基-5-甲基-3-苯基-6,7,8,9-四氢吡啶并[3′,2′:4,5]咪唑并[1,2-α]嘧啶-5-鎓氯化物(PhIP-M1)。
▸E.hallii 转化后的显示其作为保护剂的潜力
此外,在模拟的近端和远端结肠菌群存在的情况下,E.hallii的PhIP转化导致其丰度分别增加300倍和120倍,表明其作为保护剂的巨大潜力。
在同一项研究中,还观察到E.hallii能够将甘油代谢为3-羟基丙醛(3-HPA),其在水溶液中以罗伊氏菌素(Reuterin)的形式存在。有趣的是,罗伊氏菌素已被证明对革兰氏阳性和革兰氏阴性细菌、真菌和酵母具有抑制作用,可能通过调节细胞内谷胱甘肽增加氧化应激,从而使其成为治疗的一个有吸引力的靶点。
注:Reuterin是罗伊氏乳杆菌代谢甘油产生的一种特有广谱抗菌物质,它是一种复杂混合物,主成分为3-羟基丙醛,对多种病原微生物均有较强的抑制作用,在生物防腐方面极具潜力
除了生产短链脂肪酸,需要进一步的研究来真正开发真细菌属所能提供的所有潜在益处。
老年肌少症(Sarcopenia)是以肌肉量减少、肌力下降和肌肉功能减退为特征的增龄性疾病。研究表明肠道微生物可以通过参与宿主体内的多条代谢通路来影响宿主肌肉量与肌肉功能。
北京协和医院共招募87名受试者,包括11名肌少症患者、16名可能肌少症(Possible Sarcopenia)患者和60名健康对照受试者发现毛螺菌属(Lachnospira)、真杆菌属和瘤胃球菌属(Ruminococcus)与握力具有显著正相关性(P < 0.05),罗氏菌属(Roseburia)、真杆菌属(Eubacterium)和蓝绿藻菌属(Lachnoclostridium)与五次起坐时间具有显著负相关性(P< 0.01),结果提示这些菌属的降低与肌肉量的减少和功能的降低存在相关性。
Eubacterium
真杆菌属(Eubacterium)是一组系统发育多样的微生物,这一事实使得相关的分类学分配具有挑战性。
但是,该属的许多现任和前任成员都表现出与肠道健康密切相关,并且作为主要的丁酸盐生产者和核心肠道微生物群组成部分,非常重要。
真杆菌在调节炎症、调节免疫反应、维持肠道屏障完整性、调节血糖反应和胆固醇稳态等方面发挥重要作用。在几种临床条件下与有益效果的强相关性促使人们对该属产生了进一步的兴趣,多个物种被考虑作为下一代益生菌/生物治疗剂进行商业尝试。
最值得注意的是,目前国际上已正在创建含有E. hallii菌株的口服制剂作为生物治疗药物,以降低患有代谢综合征的个体的胰岛素抵抗并预防2型糖尿病的发展。
但是,应该警惕的是,我们对所有相关物种的肠道微生物群在多大程度上影响临床状况以及反之亦然的理解仍然有限。可能需要对严格控制的饮食方案进行纵向研究,在长时间内评估肠道微生物群和相关健康参数,谷禾也在积极推进这样的研究合作,以阐明此类因果关系。
关于真杆菌属的体外和体内表征,需要在基因组、代谢组以及最终在生态水平上进行研究。这将使我们能够更好地了解相对未被充分研究的真杆菌属与肠道微生物组的其他成员相互作用(这也是我们非常看重的),比如它们与其他潜在的下一代健康促进微生物(如Akkermansia muciniphila和F. prausnitzii)分离和组合,以确保其在循证肠道治疗中的有效实践(这也是我们非常看重的)。
主要参考文献
Mukherjee A, Lordan C, Ross RP, Cotter PD. Gut microbes from the phylogenetically diverse genus Eubacterium and their various contributions to gut health. Gut Microbes. 2020 Nov 9;12(1):1802866. doi: 10.1080/19490976.2020.1802866. PMID: 32835590; PMCID: PMC7524325.
Gomes AC, Hoffmann C, Mota JF. The human gut microbiota: Metabolism and perspective in obesity. Gut Microbes. 2018 Jul 4;9(4):308-325. doi: 10.1080/19490976.2018.1465157. Epub 2018 May 24. PMID: 29667480; PMCID: PMC6219651.
akansson A, Molin G. Gut microbiota and inflammation. Nutrients. 2011 Jun;3(6):637-82. doi: 10.3390/nu3060637. Epub 2011 Jun 3. PMID: 22254115; PMCID: PMC3257638.
Wing Sun Faith Chung, Marjolein Meijerink, Birgitte Zeuner, Jesper Holck, Petra Louis, Anne S. Meyer, Jerry M. Wells, Harry J. Flint, Sylvia H. Duncan, Prebiotic potential of pectin and pectic oligosaccharides to promote anti-inflammatory commensal bacteria in the human colon, FEMS Microbiology Ecology, Volume 93, Issue 11, November 2017, fix127,
Mukherjee A, Lordan C, Ross P & Paul D. Cotter. Gut microbes from the phylogenetically diverse genus Eubacterium and their various contributions to gut health, Gut Microbes, 12:1.
Chung W S F, Meijerink M, Zeuner B, Holck J, Louis P, Meyer A S, Wells J M, Flint H J, Duncan S H. Prebiotic potential of pectin and pectic oligosaccharides to promote anti-inflammatory commensal bacteria in the human colon, FEMS Microbiology Ecology, Volume 93, Issue 11, November 2017, fix127,
Chung WSF, Meijerink M, Zeuner B, Holck J, Louis P, Meyer AS, Wells JM, Flint HJ, Duncan SH. Prebiotic potential of pectin and pectic oligosaccharides to promote anti-inflammatory commensal bacteria in the human colon. FEMS Microbiol Ecol. 2017 Nov 1;93(11).
Peñaloza HF, Noguera LP, Riedel CA and Bueno SM. Expanding the Current Knowledge About the Role of Interleukin-10 to Major Concerning Bacteria. Front. Microbiol. 9:2047.
Iyer SS, Cheng G. Role of interleukin 10 transcriptional regulation in inflammation and autoimmune disease. Crit Rev Immunol. 2012;32(1):23-63.
Nauli A M and Matin S. Why Do Men Accumulate Abdominal Visceral Fat? Front. Physiol. 10:1486. December 2021.
Nie X, Chen J, Ma X, Ni Y, Shen Y, Yu H, Panagiotou G, Bao Y. A metagenome-wide association study of gut microbiome and visceral fat accumulation. Comput Struct Biotechnol J. 2020 Sep 20;18:2596-2609.

谷禾健康

巨单胞菌属(Megamonas)
巨单胞菌属(Megamonas),厚壁菌门,梭状芽孢杆菌目的革兰氏阴性菌,发酵各种碳水化合物,终产物是乙酸、丙酸和乳酸。分离于人、动物和家禽的肠道。
巨单胞菌作为肠道核心种,可能是亚洲人种的特征。与炎症性肠病、结直肠癌、强制性脊柱炎(AS)、自闭症谱系障碍(ASD)、肥胖等疾病密切相关。
巨单胞菌属(Megamonas)革兰氏阴性,专性厌氧,嗜中温,亲糖,不产芽孢,杆状,不产芽孢,不运动。分离于人、动物和家禽的肠道。

doi.org/10.1099/ijs.0.65456-0
基于比较16S rRNA基因测序的系统发育分析表明,该菌种与“氨基酸球菌科(Acidaminococcaceae)” 的菌种聚为一类,故有研究者认为巨单胞菌属应归入厚壁菌门( Firmicutes )、巨单胞菌属的谱系中。
化能有机营养,发酵各种碳水化合物,终产物是乙酸、丙酸和乳酸。
属内成员有三个种:
Megamonas hypermegas(趋巨巨单胞菌)
Megamonas funiformis(单形巨单胞菌)
Megamonas rupellensis
此属的模式种为趋巨巨单胞菌 ( Megamonas hypermegale )。
目前该类型菌株M. funiformis JCM 14723、M. funiformis菌株1CBH44的完整基因组已被报道,从健康日本男性的人类粪便中分离出来。
Megamonas rupellensis sp. nov,一种从鸭子的盲肠中分离出来的厌氧菌。
结直肠癌
宏基因组和代谢组学揭示早期结直肠癌患者的肠道微生物群特征,对616名参与者进行了粪便宏基因组和代谢组学研究。在代谢组学研究中,他们发现:
在19.2%的患者(616名中的118名)中,巨单胞菌属(Megamonas)数量非常丰富。但在以往欧美受试者的肠道微生物群研究中,巨单胞菌没有被报道为优势属,只在中国个体的研究中发现,这表明该属可能是亚洲人群的特征;但在另外一篇研究中表明,炎症性肠病患者巨单胞菌属度显著降低。
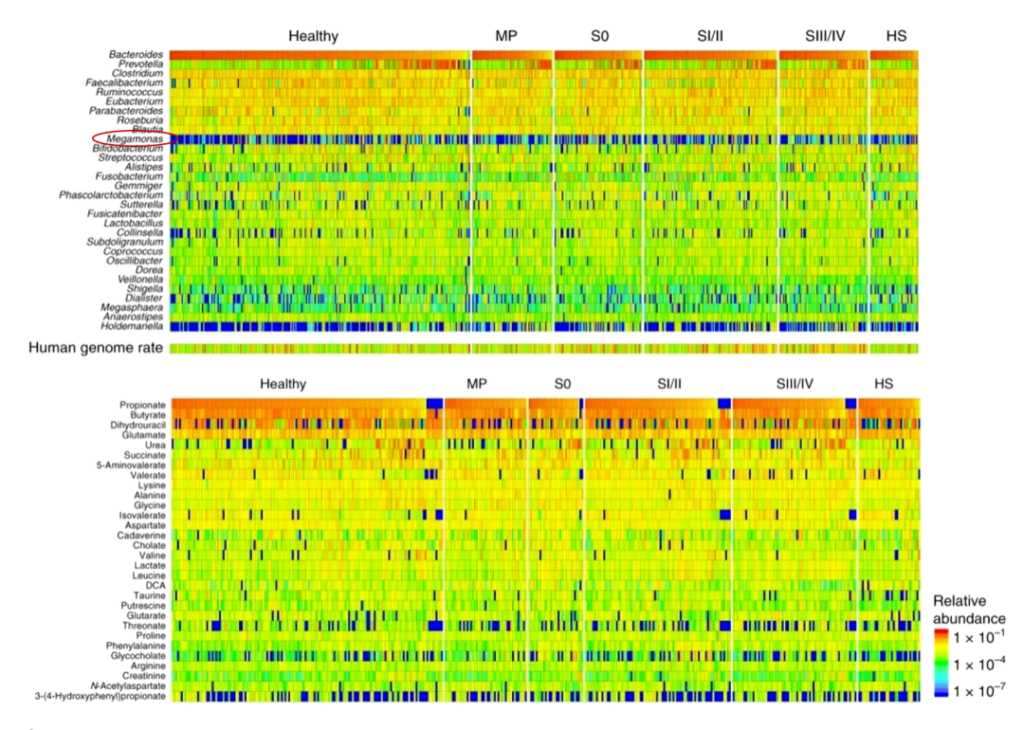
Yachida S, et al., Nat Med. 2019
Megamonas funiformis 可以作为区分胆囊切除术后病人与普通人的生物指标。其丰度与胆囊切除术后结直肠癌的发展有关。
没有癌前期病变或结直肠癌的胆囊切除术后病人比起有癌前期病变或结直肠癌的胆囊切除术后病人其Megamonas. funiformis丰度更高。
此外,研究发现巨单胞菌属(Megamonas)相对丰度与结直肠息肉发病风险增大呈负相关。
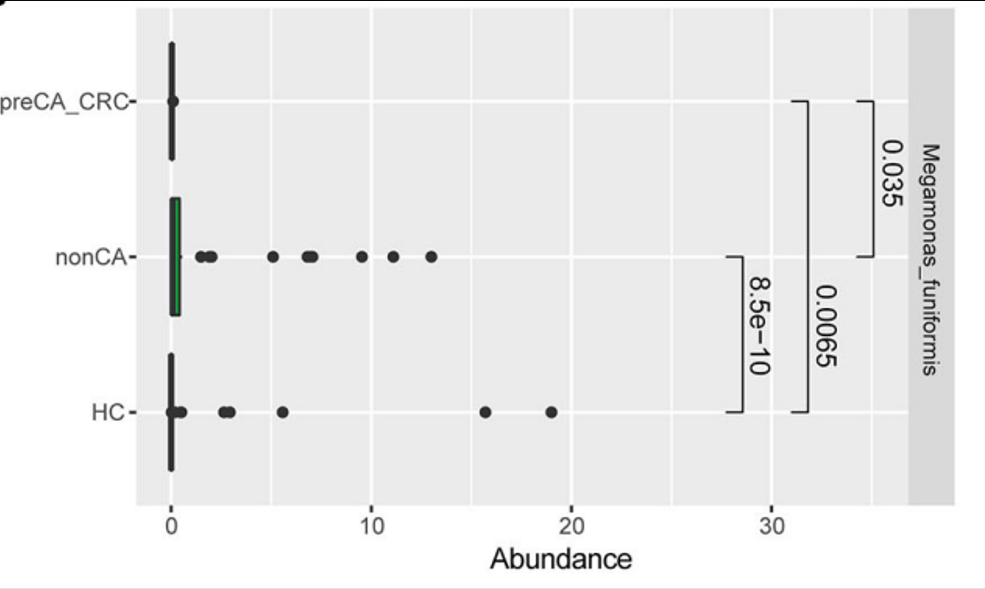
Ren, X et al., Frontiers in oncology. 2020
强制性脊柱炎(AS)
研究共纳入207名研究对象(包括103名AS患者和104名健康对照),结果显示巨单胞菌属(Megamonas)和链球菌属(Streptococcus)是强直性脊柱炎组中相对丰度增幅最大的2个属,通过聚类分析发现,巨单胞菌属的相对丰度在 AS、溃疡性结肠炎(ulcerative colitis,UC)、RA 及银屑病等病种组间的欧氏距离较近,而与Ⅱ型糖尿病及腺瘤较远。
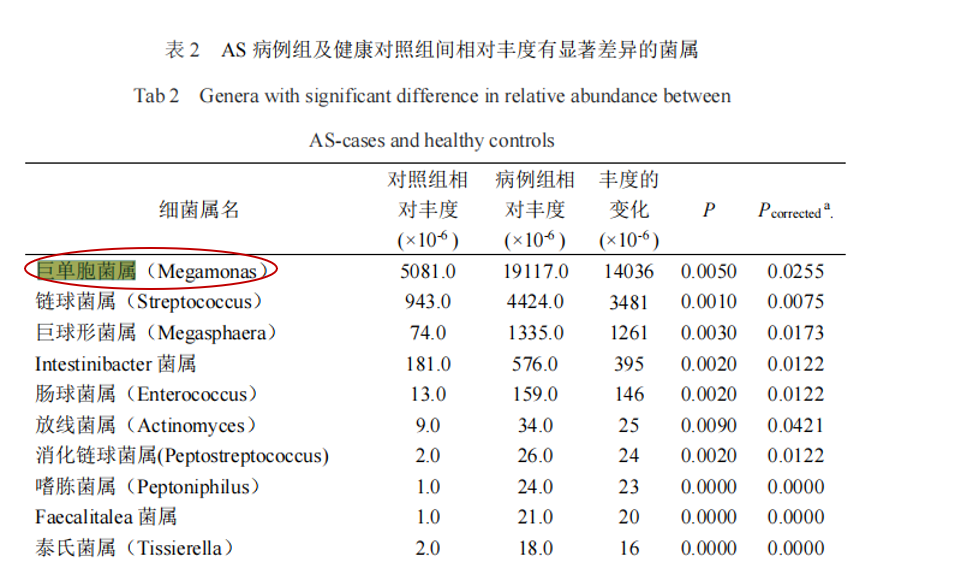
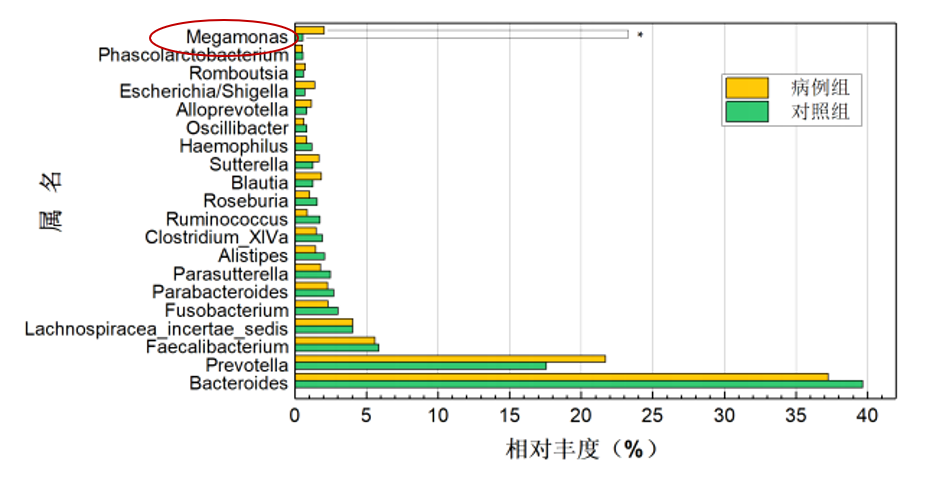
蒋光明,安徽医科大学,2021
自闭症谱系障碍(ASD)
肠道微生物群的改变可能会影响自闭症谱系障碍(ASD),患者中可能出现胃肠道(GI)生态失调。研究发现在自闭症儿童粪便中Megamonas丰度显著高于健康儿童。同时在矮身材儿童组的Megamonas丰度显著高于健康组,表明维持一定丰度在巨单胞菌属在儿童神经和体格生长发育方面的重要作用。

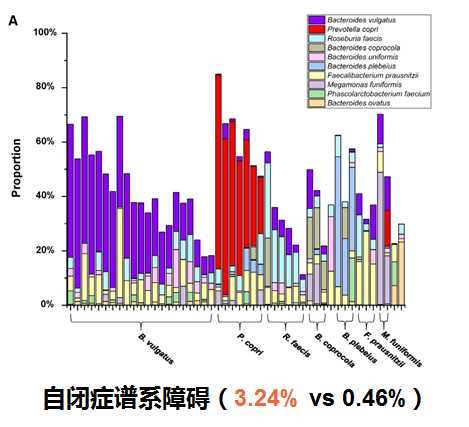
Zou R, et al., Autism Res. 2020
注意缺陷/多动障碍 (ADHD)
注意缺陷/多动障碍(ADHD)是一种神经发育障碍,其特征在于持续存在注意力不集中、多动和冲动的症状,导致个体生活两个或更多区域的功能(ADHD)组在属水平上显示出较高水平的Dialister和Megamonas以及较低的Anaerotaenia 和 Gracilibacter 丰度。
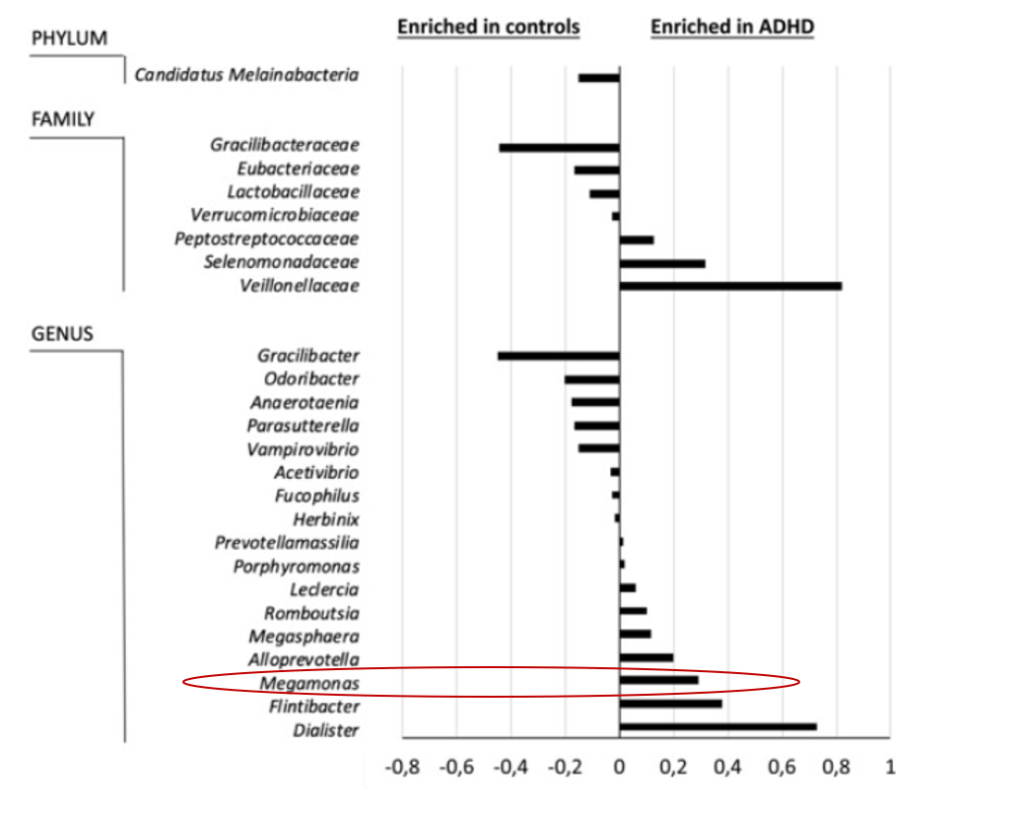
Richarte V, et al., Transl Psychiatry. 2021
注意缺陷多动障碍患者巨单胞菌丰度提高。同时作者还指出巨单胞菌可作为区分多动症患者与正常人的指标之一。
肥胖
研究发现在肥胖和对照受试者之间微生物群的显着差异。肥胖组的Prevotella、巨型单胞菌(Megamonas)、梭杆菌属和Blautia显著增加。
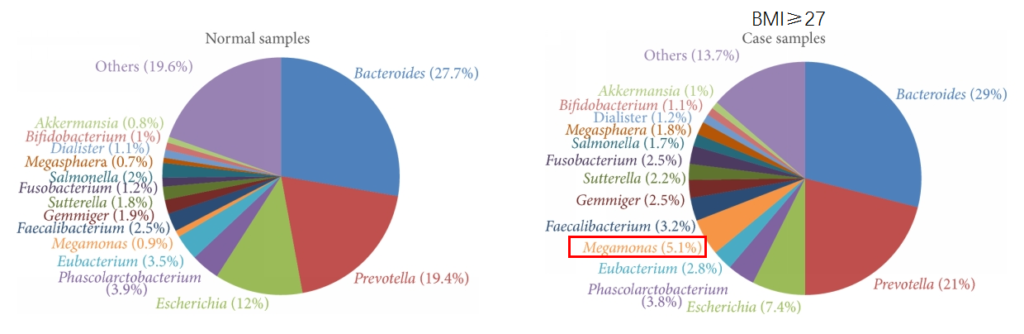
Chiu, C.M., et al., BioMed research international, 2014
另外一项研究表明体重降低或营养不良与巨单胞菌丰度减少有关联。巨单胞菌的丰度与体重减轻率呈负相关,Megamonas的丰度与肥胖犬减重的速度呈负相关。
急性缺血性脑卒中(AIS)
急性脑卒中(AIS)是一类脑部血液供应障碍引起局部组织缺血缺氧性坏死、相应神经功能出现缺损的不可逆性损害的临床综合征。同健康组比较,AIS组患者肠道中巨单胞菌属相对丰度上调,大肠杆菌属相对丰度下调。
通过将健康组和AIS患者肠道中巨单胞菌属和大肠杆菌属相对丰度进行分析,发现二者相对丰度及比值对潜在AIS具有一定诊断效能,可作为潜在的AIS诊断指标。
抑郁
部分研究报道巨单胞菌属的丰度在抑郁症患者中增加。脑卒中后抑郁患者巨单胞菌属水平上均显著高于对照组。巨单胞菌属与精神分裂症阳性和阴性症状量表(PANSS)总分呈正相关。
但也有个别文献检测到其丰度在抑郁症患者中下降。实际变化需要进一步研究。
其他
在最近的一项研究中,根据16S rRNA测序结果,发现Megamonas、放线杆菌属、Dorea和Ruminococcus与男性血清睾酮浓度呈正相关。
在另一项关于肠道微生物群性别差异的研究中,发现Megamonas、Prevotella、梭杆菌属和Megasphaera在男性中比在女性中更丰富。前列腺特异性抗原(PSA)水平高(G3)组的Megamonas丰度低于中等PSA水平(G2)组;此外,观察到PSA水平与先前报道的其他属之间没有关联。暗示Megamonas在雄激素代谢中具有潜在积极作用。
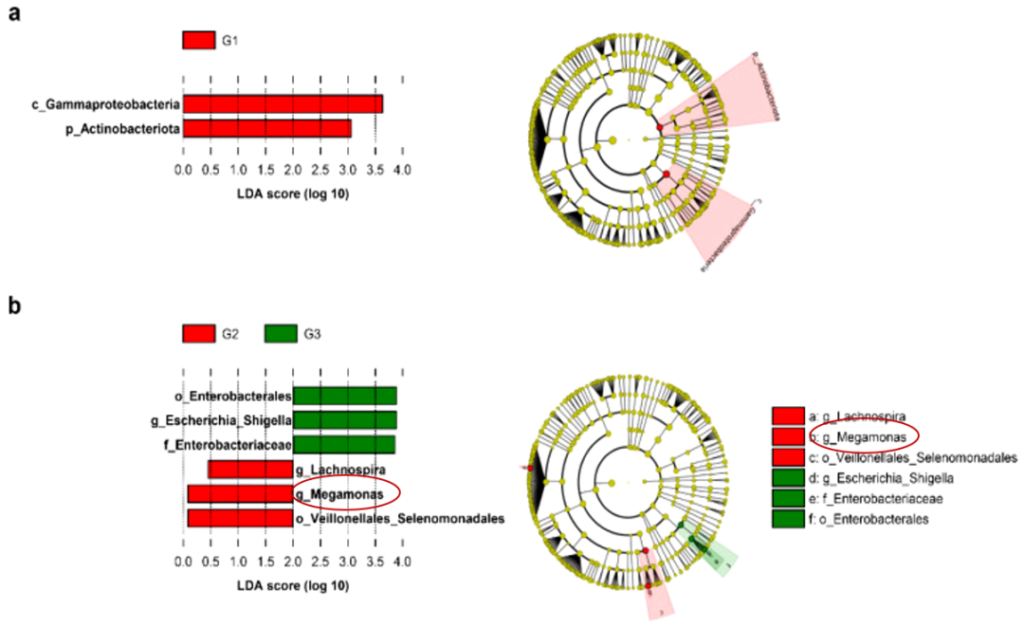
Kim HN, et al., J Pers Med. 2021
虚弱
虚弱是一种常见的老年综合征,主要根据症状进行诊断和分期。以确定这种综合征的微生物生物标志物收集了94名社区居住的老年人的血清和粪便样本,采用16SrRNA扩增子测序法测定粪便微生物群的粪便组成。
与对照组相比,来自虚弱组的粪便样本下列菌群具有较高的水平:
Akkermansia, Parabacteroides, Klebsiella
而共生属较低水平菌群如下:
Megamonas, Faecalibacterium, Prevotella, Roseburia, Blautia
推测其中Megamonas减少与老年人虚弱症状有关。
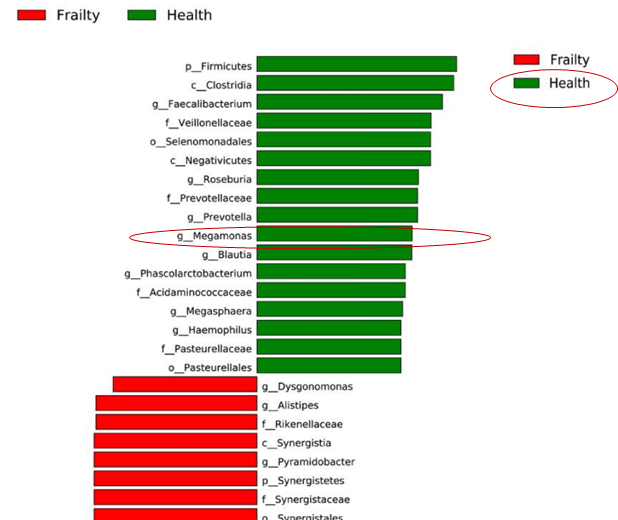
Xu Y, et al., Front Cell Infect Microbiol. 2021
炎症性肠病,白塞病,肝病等
IBD患者肠道中巨单胞菌属相对丰度显著降低。
与 正常个体相比,白塞病患者肠道中巨单胞菌物种的相对丰度显着降低。这可能与白塞病患者代谢物改变导致的 T 细胞畸变有关。
代偿期肝硬化患者巨单胞菌丰度下降。
老年血液透析(HD)患者巨单胞菌属减少。
血肌酐升高和血液透析可能影响肠道菌群的生存环境心力衰竭组与对照组相比,巨单胞菌属丰度降低。
▾ 该菌丰度较少相关:
动物脂肪摄入过多,肠道中产生短链脂肪酸(SCFAs) 的细菌(如Blautia、Megamonas)的丰度显着降低。
一项针对3500名加拿大儿童进行了从出生前直至青春期的持续追踪,其主要目标是为了发现过敏、哮喘、肥胖症及其它慢性疾病的根本原因。他们发现无论婴儿采用何种喂养方式(母乳喂养或配方奶喂养),直接补充维生素D滴剂的婴儿体内巨单胞菌属丰度都较低。
▴ 该菌丰度增加相关:
在体外发酵条件下,含牛肉蛋白和鸡肉蛋白组巨单胞菌属(Megamonas) 相对丰度显著增加,有益菌相对丰度增加。
饮食中豆类消费的高频率与Megamonas属呈正相关,但是目前该证据样本量太小,还需要进一步研究。
抗性淀粉(RS)在小肠中不能被酶解,大部分在结肠被肠道微生物发酵。研究显示玉米,马铃薯可以增加巨单胞菌属丰度。
岩藻糖基硫酸软骨素(fCS)是从海参中提取的一种独特的天然硫酸软骨素类似物,fCS-Sc显著增加了Megamonas(1.26倍)。
燕麦阿拉伯木聚糖 (AX) 刺激了鸭肠巨单胞菌和双歧杆菌的生长物种,其中巨单胞菌表现出最大的刺激。
在日粮中添加桑叶粉后,鸡肠道中的拟杆菌属、普氏菌和巨单胞菌属的相对丰度增加。
作为亚洲人肠道重要的菌属——巨单胞菌属,关于其与疾病的研究还处于开始阶段。部分数据能说明其与炎症性肠病、结直肠癌、强制性脊柱炎(AS)、肥胖、神经系统的相关性。但具体的因果关系与分子机制仍待研究,可能的研究方向有巨单胞菌的代谢产物短链脂肪酸在机体中的作用以及其与免疫反应互作反应。p.s. 本文感谢提供部分资料的各位同学。
主要参考文献:
Richarte V, Sánchez-Mora C, Corrales M, Fadeuilhe C, Vilar-Ribó L, Arribas L, Garcia E, Rosales-Ortiz SK, Arias-Vasquez A, Soler-Artigas M, Ribasés M, Ramos-Quiroga JA. Gut microbiota signature in treatment-naïve attention-deficit/hyperactivity disorder. Transl Psychiatry. 2021 Jul 8;11(1):382. doi: 10.1038/s41398-021-01504-6. PMID: 34238926; PMCID: PMC8266901.
Yachida S, Mizutani S, Shiroma H, Shiba S, Nakajima T, Sakamoto T, Watanabe H, Masuda K, Nishimoto Y, Kubo M, Hosoda F, Rokutan H, Matsumoto M, Takamaru H, Yamada M, Matsuda T, Iwasaki M, Yamaji T, Yachida T, Soga T, Kurokawa K, Toyoda A, Ogura Y, Hayashi T, Hatakeyama M, Nakagama H, Saito Y, Fukuda S, Shibata T, Yamada T. Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer. Nat Med. 2019 Jun;25(6):968-976. doi: 10.1038/s41591-019-0458-7. Epub 2019 Jun 6. PMID: 31171880.
Ren, X., Xu, J., Zhang, Y., Chen, G., Zhang, Y., Huang, Q., & Liu, Y. (2020). Bacterial Alterations in Post-Cholecystectomy Patients Are Associated With Colorectal Cancer. Frontiers in oncology, 10, 1418. https://doi.org/10.3389/fonc.2020.01418
Duan, M., Wang, Y., Zhang, Q., Zou, R., Guo, M., & Zheng, H. (2021). Characteristics of gut microbiota in people with obesity. PloS one, 16(8), e0255446.
Chiu, C. M., Huang, W. C., Weng, S. L., Tseng, H. C., Liang, C., Wang, W. C., Yang, T., Yang, T. L., Weng, C. T., Chang, T. H., & Huang, H. D. (2014). Systematic analysis of the association between gut flora and obesity through high-throughput sequencing and bioinformatics approaches. BioMed research international, 2014, 906168. https://doi.org/10.1155/2014/906168
Elizabeth P. Cato, Ella M. Barnes. Designation of the Neotype Strain of Bacteroides hypermegas Harrison and Hansen. https://doi.org/10.1099/00207713-26-4-494
Zou R, Xu F, Wang Y, Duan M, Guo M, Zhang Q, Zhao H, Zheng H. Changes in the Gut Microbiota of Children with Autism Spectrum Disorder. Autism Res. 2020 Sep;13(9):1614-1625. doi: 10.1002/aur.2358. Epub 2020 Aug 24. PMID: 32830918.
Morotomi M, Nagai F, Sakon H. Genus Megamonas should be placed in the lineage of Firmicutes; Clostridia; Clostridiales; ‘Acidaminococcaceae’; Megamonas. Int J Syst Evol Microbiol. 2007 Jul;57(Pt 7):1673-1674. doi: 10.1099/ijs.0.65150-0. PMID: 17625216.
Shimizu, J., Kubota, T., Takada, E., Takai, K., Fujiwara, N., Arimitsu, N., Ueda, Y., Wakisaka, S., Suzuki, T., & Suzuki, N. (2019). Relative abundance of Megamonas hypermegale and Butyrivibrio species decreased in the intestine and its possible association with the T cell aberration by metabolite alteration in patients with Behcet’s disease (210 characters). Clinical rheumatology, 38(5), 1437–1445. https://doi.org/10.1007/s10067-018-04419-8
Romain Chevrot, Arnaud Carlotti, Valérie Sopena, Pierre Marchand, Eric Rosenfeld. Megamonas rupellensis sp. nov., an anaerobe isolated from the caecum of a duck. https://doi.org/10.1099/ijs.0.2008/001297-0
Cheung, S. G., Goldenthal, A. R., Uhlemann, A. C., Mann, J. J., Miller, J. M., & Sublette, M. E. (2019). Systematic Review of Gut Microbiota and Major Depression. Frontiers in psychiatry, 10, 34. https://doi.org/10.3389/fpsyt.2019.00034
Kelly, J. R., Minuto, C., Cryan, J. F., Clarke, G., & Dinan, T. G. (2017). Cross Talk: The Microbiota and Neurodevelopmental Disorders. Frontiers in neuroscience, 11, 490.
Kim HN, Kim JH, Chang Y, Yang D, Kim HL, Ryu S. Gut Microbiota Composition across Normal Range Prostate-Specific Antigen Levels. J Pers Med. 2021 Dec 17;11(12):1381. doi: 10.3390/jpm11121381. PMID: 34945854; PMCID: PMC8703440.

谷禾健康

毛螺菌属(Lachnospira),属于厚壁菌门,毛螺菌科(Lachnospiraceae),该菌属存在于大多数健康人的肠道里,可能是一种潜在的有益菌,参与多种碳水化合物的代谢,尤其水果蔬菜中的果胶(一种复杂的膳食纤维和益生元)的能力很强,发酵导致乙酸和丁酸的产生为宿主提供能量的主要来源。
图片来源:microbiomology
毛螺菌科(Lachnospiraceae)目前在NCBI中被描述为包括 58 个属和几个未分类的菌。毛螺菌属(Lachnospira)是毛螺菌科的一个重要组成成员。
认识毛螺菌属之间先了解下毛螺菌科。
人类结肠微生物群可以处理多种底物,包括蛋白质、寡肽、膳食多糖、内源性粘蛋白和逃避宿主消化的糖蛋白 。肠道菌群对碳水化合物的代谢是向宿主提供营养和能量的关键过程。
在厚壁菌门中,毛螺菌科、乳杆菌科和瘤胃球菌科水解淀粉和其他糖以产生丁酸盐和其他短链脂肪酸。
毛螺菌科(Lachnospiraceae)的基因组分析揭示了其组内成员利用饮食衍生的多糖(包括淀粉、菊粉和阿拉伯木聚糖)的相当大的能力,但是在菌种和菌株之间存在很大差异。
毛螺菌科是一个系统发育和形态异质的分类群,属于厚壁菌门的梭菌簇 XIVa,毛螺菌科的所有成员都是厌氧的、发酵的和化学有机营养的,并且一些表现出强水解活性,例如通过果胶甲酯酶、果胶酸裂合酶、木聚糖酶、α-L-阿拉伯呋喃糖苷酶、β-木糖苷酶α-和β-半乳糖苷酶的活性、α-和β-葡萄糖苷酶、N-乙酰-β-氨基葡萄糖苷酶或α-淀粉酶。
毛螺菌科存在于早期婴儿中,甚至在胎粪中也有发现。然而,毛螺菌科丰度的增加与衰老有关。毛螺菌科的丰度在患有不同疾病的受试者的肠腔中也增加了,尽管该科的分类群一再显示出它们为宿主产生有益代谢物的能力。
★ 形态和代谢
Lachnospira细胞形态呈直的或略微弯曲的棒状细胞,有的可能呈螺旋状。单细胞尺寸为 0.35–0.6×2.0–4.0 µm,DNA G + C 含量( mol %):38–45。细胞成对出现,有时呈长链状。细胞具有革兰氏阳性超微结构,严格厌氧。
在 30–45 °C 下生长,在含有瘤胃液或酵母提取物、无机盐、果胶或聚半乳糖醛酸的厌氧培养基中生长。
化能有机营养,发酵代谢;发酵果胶、聚半乳糖醛酸、果糖和纤维二糖等。乙酸盐、甲酸盐、乙醇和 CO2是聚半乳糖醛酸和果胶发酵的主要最终产物。也可能产生少量的H2 。果胶发酵时也会产生甲醇,不产生琥珀酸盐、丁酸盐和丙酸盐。
不产生吲哚、过氧化氢酶或 H2S,不还原硝酸盐。不水解明胶或淀粉。主要存在于哺乳动物肠道,从牛瘤胃内容物和猪粪便和盲肠内容物中分离。
在肠道中,抗性淀粉和低聚半乳糖可以通过结合胆盐直接降低胆汁酸的浓度。Lachnospira等产生丁酸盐细菌的增加都间接导致胆汁盐浓度降低。
★ 分类和物种
Lachnospira(毛螺菌属)主要有以下结果物种:
Lachnospira rogosae
Lachnospira eligens
Lachnospira multipara
Lachnospira multiparis
Lachnospira pectinoschiza
模式种是多对毛螺菌(Lachnospira multiparus)。
以前的16S 的测试,可能会错误地将Lachnospira rogosae识别为乳酸杆菌。后来纠正这一错误并更新了数据库,重新正确重命名为Lachnospira rogosae。
Lachnospira pectinoschiza 是从猪的结肠内容物中分离的能分解果胶的菌。但是该菌物种无法从羊的瘤胃内容物中分离出来,即使这些动物被喂食高果胶饮食。实验中果胶、聚半乳糖醛酸和葡萄糖酸盐是支持该菌快速生长的唯一底物。
不同的是,Lachnospira multiparus 是瘤胃内主要的果胶分解菌。它的碳水化合物代谢在实验室发酵罐的生长实验中进行的研究。
★ 哪些因素影响毛螺菌属
增加
食用富含纤维的植物性饮食与Roseburia、Lachnospira和Prevotella属的丰度增加以及短链脂肪酸产量增加相关。
用全谷物代替六周的饮食习惯精制谷物增加了 Lachnospira和Roseburia,减少了肠杆菌科的成员,总体上产生了更有利的微生物景观。
全谷物:是指完整、碾碎、破碎或压片的谷物,其基本组成包括淀粉质胚乳、胚芽与皮层,各组成部分的相对比例与完整颖果一样。
全谷物不仅含有丰富的B族维生素、镁、铁和膳食纤维,还含有多酚、维生素E、单宁、类胡萝卜素、植酸、木质素和木脂素等常见抗氧化成分,而且还含有一些果蔬食品中少见但具有很高营养价值的抗氧化成分,如γ-谷维素、烷基间苯二酚、燕麦蒽酰胺等。比如:全燕麦,荞麦,黑米,小米,全麦等。
果胶是一种水果蔬菜中发现的复杂的膳食纤维和益生元。研究表明水果中纤维的消耗与健康成人肠道中大量的果胶分解细菌属Lachnospira 密切相关。果胶摄入增加梭菌属簇 XIV(Lachnospira、Dorea和Clostridium),其中Lachnospira的增幅最大。
最近的一项研究发现Lachnospira与 β-胡萝卜素、维生素 E 和植物脂肪的摄入量呈正相关,而与肉类、总蛋白和胆固醇的摄入量呈负相关 。
洋车前子是一种广泛用于治疗便秘的药物。它将水分困在肠道中,增加粪便中的水分,缓解排便并改变结肠环境。研究显示洋车前子处理可以增加Lachnospira,Roseburia 和 Faecalibacterium.
茶多糖维持了肠道微生物群的多样性,恢复了一些因糖尿病而减少的细菌属(毛螺菌属、罗斯氏菌和Fluviicola)的相对丰度。
茶多糖主要由葡萄糖、阿拉伯糖、木糖、岩藻糖、核糖、半乳糖等组成。
葡萄不仅含有各种植物化学物质,如儿茶素,原花青素,花青素,亮氨酸花青素,槲皮素,山奈酚,二苯乙烯,鞣花酸和羟基肉桂酸酯,而且也是膳食纤维的良好来源。与基线相比,4周的葡萄粉摄入量显着增加三个属Akkermansia,Flavonifractor和毛螺菌属的相对丰度。
减少
将117名超重成年人随机均分为食用4次/周炸肉组和不食用炸肉组,干预4周,发现食用炸肉组的菌群多样性降低,Lachnospira和Flavonifractor丰度降低,Dialister、Dorea、韦荣球菌属丰度增加。
越来越多的证据表明,众所周知的致癌驱动因素吸烟会影响肠道微生物组。一项研究针对 803 名成年人子集的吸烟和肠道微生物组使用16s测序进行了分析。
发现以前和现在吸烟者的粪便微生物组的整体组成与从不吸烟者有显着差异。相对于从不吸烟者而言, Lachnospira 和Tenericutes菌则被耗尽。这些变化在种族和族裔亚群中是一致的,表明吸烟会导致Lachnospira消失或减少。
★ 与其他菌的相互作用(仅供参考)
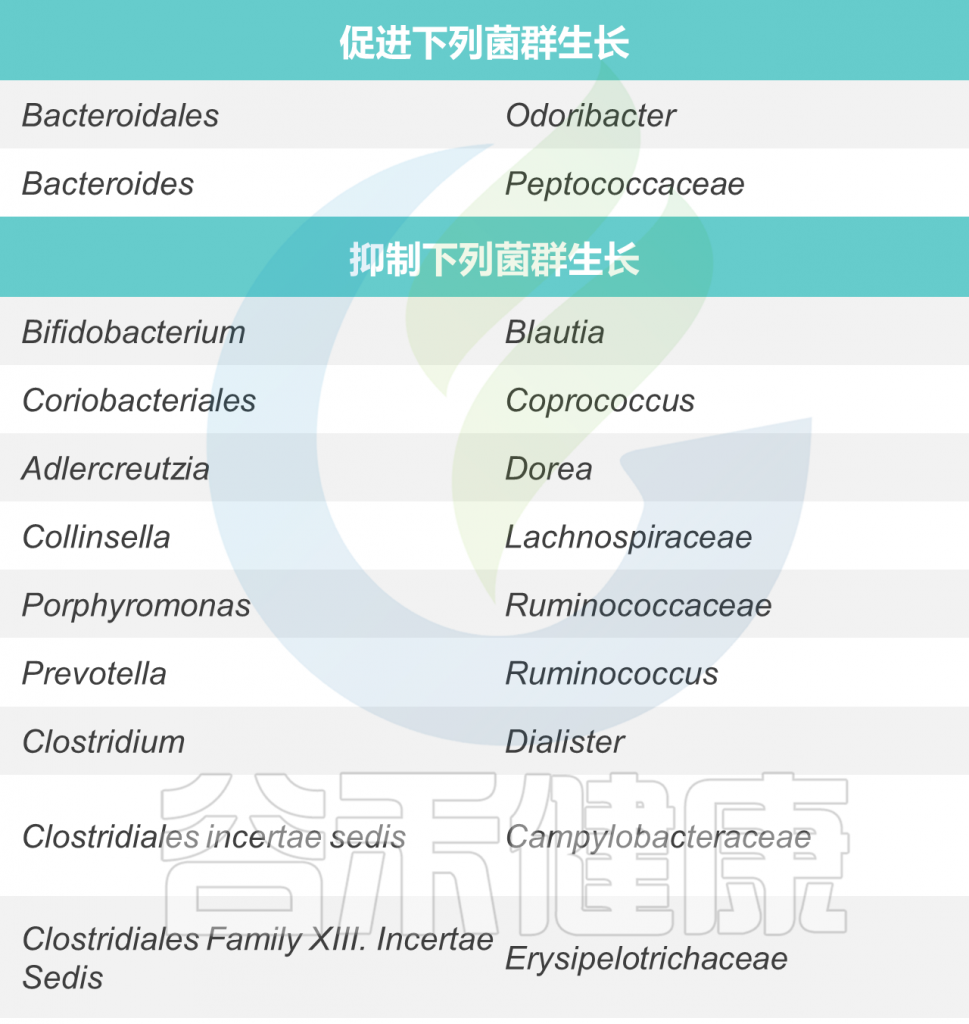


睡眠(夜猫子)
海法大学和以色列理工学院的合作研究项目发现,“早起的人”和“夜猫子”的肠道微生物组(寄居在消化道的细菌群)彼此不同。该研究将人们分为三种不同的‘时型’:
“云雀”——早起的晨型人,在早晨活力最好;
“猫头鹰”——晚睡的夜猫子,在早晨运作困难;
“中间群体”——大部分人属于这种。
研究结果指出了“云雀”和“猫头鹰”的微生物组之间的差异;在“云雀”中,细菌属Alistipes 的百分比更高,而在“猫头鹰”中,属于Lachnospira属的细菌更高,该细菌为产生丁酸盐的细菌,是一种短链脂肪酸,是睡眠和觉醒相关信号的来源。
其他研究也陆续发现包括毛螺菌属Lachnospira、棒状杆菌属Corynebacterium 和 布劳特氏菌属Blautia 在内的几种微生物与睡眠质量呈负相关。
调节肠道菌群是改善睡眠的可行路径之一,好好睡觉也可以帮助我们维护肠道微生态健康,好眠养好菌,好菌助好眠。
肝病
非酒精性肝脂肪变性疾病中毛螺菌属的丰度相对对照较高,同样在非酒精性脂肪肝中也发现毛螺菌属的富集。
哮喘
哮喘是一种气道慢性疾病,尤其对于儿童。生命早期的特定细菌属与 1 岁儿童的特应性和喘息有关。越来越多的证据表明,其中一个原因可能是儿童在生命早期获得的健康微生物受到破坏。
加拿大健康婴儿纵向发育 (CHILD) 研究中发现,在生命的前 3 个月内,毛螺菌相对丰度的的下降与学龄前哮喘有关,并且 Lachnospira/Clostridium 比率可作为预测哮喘发展的潜在生命早期生物标志物。
《Science Translational Medicine》上刊登了加拿大温哥华的不列颠哥伦比亚大学(UBC)Brett Finlay 等科学家的文章,他们采集了300多个婴儿在3个月和1岁时的便便和尿液样本,结果显示,粪便样品中缺乏四种细菌(Lachnospira,Veillonella,Faecalibacterium,Rothia)的3个月的婴儿,后来在1岁时都显示出了早期哮喘的症状(喘息和皮肤过敏)。
而那些在1岁时没有这些症状的孩子,无一例外在其3个月的粪便样本中含有大量的这四种微生物。检测这些肠道微生物即可预测这些孩子日后患哮喘的风险,通过控制这些肠道细菌的组成还有可能找到预防儿童哮喘的方法。
抑郁症
研究发现,Lachnospira、Roseburia和Faecalibacterium与抑郁症状的严重程度呈负相关。
自闭症
南医大刘星吟团队揭示在属水平上,Lachnospira 和Megamonas 在对照组内的2-3岁和7-11岁亚组中丰度较高,而自闭症组不存在此趋势。
阿尔兹海默症
与健康对照组相比,阿尔茨海默病 (AD) 患者的肠道微生物组发生了改变。然而,以前的研究经常评估一直在服用药物或其他疾病干预措施的 AD 患者。此外,在一项研究中同时测定轻度认知障碍 (MCI) 或 AD 患者的肠道微生物组是罕见的。
与健康对照组相比,阿尔茨海默病患者的拟杆菌属、毛螺菌属和瘤胃梭菌减少,普氏菌属水平增加。而轻度认知障碍患者中这些属的变化方向与AD患者相同。然而,Lachnospira是唯一一个在轻度认知障碍患者中的丰度在统计学上显着低于健康对照组的属,表明该菌属的关键作用。
慢性肾病
研究表明,与健康人群相比,慢性肾脏病人群的肠道菌群组成不同,Lachnospira 和Ruminocococus gnavus 是很好的微生物标志物。
食管鳞状细胞癌
口腔健康以及口腔微生物不佳与食管鳞状细胞癌(ESCC)的发生有很大的关系。中国淮安市第一人民医院的 23 名食管癌患者身上采集的粪便样本中含有丰富的厚壁菌门和放线菌门。根据这项研究, Lachnospira可用作食管鳞状细胞癌潜在的生物标志物。
系统性红斑狼疮
肠道微生物组与系统性红斑狼疮 (SLE) 之间相关性被越来越多的研究关注。研究表明Lachnospira与SLE风险呈负相关。
慢性自发性荨麻疹
慢性自发性荨麻疹(CSU)是一种肥大细胞驱动的疾病,在过去几年中其病因和发病机制取得了许多进展。CSU的主要治疗方法是口服第二代抗组胺药。
然而,只有平均 50% 的 CSU 患者对常规或四倍剂量的非镇静抗组胺药有充分反应。同时,肠道菌群会影响药物的疗效。研究发现毛螺菌科及其下属分类群被发现是响应者和非响应者之间肠道微生物群的主要差异。而且Lachnospira是预测抗组胺药对 CSU 患者疗效的标志物。
格雷夫斯病(GD)
格雷夫斯病(GD)是一种以甲状腺功能亢进为特征的全身性自身免疫性疾病。有证据表明,肠道菌群的改变可能与自身免疫性疾病的发展有关。研究发现GD患者中Lachnospira 相较于对照减少。
肠癌
根据已有报道发现,两个丁酸盐生产者Lachnospira multipara和Eubacterium eligens在结直肠癌中含量降低,生成硫化物的细菌Desulfovibrio vietnamensis、D.longreachensis和Bilophila wadsworthia 增加。
大肠癌是由大肠息肉(腺瘤)和粘膜内癌一步步演变而来的(多阶段癌变)。研究表明,双歧杆菌属(Bifidobacterium)的细菌群会在粘膜内癌阶段减少。另外,作为丁酸产生菌的多毛毛螺菌(Lachnospira multipara)和挑剔真杆菌(Eubacterium eligens)从粘膜内癌阶段到晚期大肠癌阶段一直持续减少。
胃癌
胃癌患者肠道菌群的特点是物种丰富度增加,丁酸产生菌减少,以及其他共生细菌的富集,尤其是乳酸杆菌、埃希氏菌和克雷伯氏菌。据报道乳杆菌属和毛螺菌属是胃癌相关细菌属网络中的关键物种。毛螺菌属、乳杆菌属、链球菌属、韦荣氏菌属的组合在区分胃癌患者和健康对照方面表现出良好的表现。
2 型糖尿病 (T2D)
肠道微生物组可能在与 2 型糖尿病 (T2D) 发展相关的炎症中发挥作用。横断面研究发现 2 型糖尿病患者中毛螺菌属和消化链球菌科较少。
与对照大鼠相比,糖尿病大鼠肠道菌群中厚壁菌属的比例增加而拟杆菌属的丰度降低,菊粉治疗可使糖尿病大鼠的肠道菌群组成恢复正常。
与未治疗的糖尿病大鼠相比,接受菊粉治疗的糖尿病大鼠的益生菌乳杆菌及可产生短链脂肪酸的细菌(如毛螺菌属、考拉杆菌属及拟杆菌属)丰度会明显增加,可产生脂多糖的脱硫弧菌属丰度会降低。进一步分析发现,毛螺菌属的丰度与葡萄糖负荷后的血糖反应呈负相关。
白塞病
在白塞病 (BD) 中,一种自身炎症性血管炎,不平衡的肠道微生物群可导致促炎反应。与对照相比,Barnesiellaceae和Lachnospira属的显着减少与 BD 患者有关。

尽管毛螺菌属是一个重要的肠道菌属,但是目前关于该菌的研究和证据还不是很多,还仅限于关联性研究,在机制方面研究较少,以上文中主要的健康相关性证据支持还不充足,需要更大队列来探讨。
总的来说,该菌是一个对健康有益的菌,更深入地了解其与宿主相互作用的机制将有利于我们干预肠道菌群,最终目标是将其用于预防和治疗肠内外疾病。
主要参考文献:
Carasso S, Fishman B, Lask LS, Shochat T, Geva-Zatorsky N, Tauber E. Metagenomic analysis reveals the signature of gut microbiota associated with human chronotypes. FASEB J. 2021 Nov;35(11):e22011. doi: 10.1096/fj.202100857RR. PMID: 34695305.
Liu R, Peng C, Jing D, Xiao Y, Zhu W, Zhao S, Zhang J, Chen X, Li J. Lachnospira is a signature of antihistamine efficacy in chronic spontaneous urticaria. Exp Dermatol. 2022 Feb;31(2):242-247. doi: 10.1111/exd.14460. Epub 2021 Sep 30. PMID: 34558729.
Xiang K, Wang P, Xu Z, Hu YQ, He YS, Chen Y, Feng YT, Yin KJ, Huang JX, Wang J, Wu ZD, Yang XK, Wang DG, Ye DQ, Pan HF. Causal Effects of Gut Microbiome on Systemic Lupus Erythematosus: A Two-Sample Mendelian Randomization Study. Front Immunol. 2021 Sep 7;12:667097. doi: 10.3389/fimmu.2021.667097. PMID: 34557183; PMCID: PMC8453215.
Saladrigas-García M, D’Angelo M, Ko HL, Nolis P, Ramayo-Caldas Y, Folch JM, Llonch P, Solà-Oriol D, Pérez JF, Martín-Orúe SM. Understanding host-microbiota interactions in the commercial piglet around weaning. Sci Rep. 2021 Dec 6;11(1):23488. doi: 10.1038/s41598-021-02754-6. PMID: 34873196; PMCID: PMC8648723.
Maskarinec G, Raquinio P, Kristal BS, Setiawan VW, Wilkens LR, Franke AA, Lim U, Le Marchand L, Randolph TW, Lampe JW, Hullar MAJ. The gut microbiome and type 2 diabetes status in the Multiethnic Cohort. PLoS One. 2021 Jun 23;16(6):e0250855. doi: 10.1371/journal.pone.0250855. PMID: 34161346; PMCID: PMC8221508.
Prakash A, Peters BA, Cobbs E, Beggs D, Choi H, Li H, Hayes RB, Ahn J. Tobacco Smoking and the Fecal Microbiome in a Large, Multi-ethnic Cohort. Cancer Epidemiol Biomarkers Prev. 2021 Jul;30(7):1328-1335. doi: 10.1158/1055-9965.EPI-20-1417. Epub 2021 May 21. PMID: 34020999; PMCID: PMC8254769.
Ye X, Wang D, Zhu H, Wang D, Li J, Tang Y, Wu J. Gut Microbiota Changes in Patients With Major Depressive Disorder Treated With Vortioxetine. Front Psychiatry. 2021 May 7;12:641491. doi: 10.3389/fpsyt.2021.641491. PMID: 34025474; PMCID: PMC8138160.
Chen W, Bi Z, Zhu Q, Gao H, Fan Y, Zhang C, Liu X, Ye M. An analysis of the characteristics of the intestinal flora in patients with Parkinson’s disease complicated with constipation. Am J Transl Res. 2021 Dec 15;13(12):13710-13722. PMID: 35035709; PMCID: PMC8748098.
谷禾健康
Phascolarctobacterium,考拉杆菌属,专性厌氧和革兰氏阴性细菌,可产生短链脂肪酸,包括乙酸盐和丙酸盐,并可能与宿主的代谢状态和情绪有关,在人体胃肠道大量定植。
每个人都有可能具有与其他人不同的个体特异性微生物遗传成分,并且可能从童年到成年持续存在。Phascolarctobacterium属物种在较长的时间内显示出相对较高的个体内稳定性。一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少)。
来自梅奥临床医学中心的研究人员研究发现比较容易减肥的人体肠道内考拉杆菌属水平较高。该菌除了减肥同时也是肠道菌群动态平衡的关键调节因素。
Phascolarctobacterium 多形棒状杆菌,0.5 × 2.0 µm 至 0.5 × 5 –20 µm。在琥珀酸的存在下,小棒会变成带有多个分支的细长和碎片状的棒。革兰氏染色阴性、不运动、不形成孢子的化学有机营养物。丙酸是琥珀酸发酵的主要终产物。富马酸盐抑制其生长。在 30–37°C 时生长最快。
系统发育上属于韦荣菌科,厚壁菌门。到目前为止, Succiniclasticum ruminis是最近的系统发育邻居。
DNA G + C 含量(mol %):41.4–42.3 ( Tm )
主要存在于人体肠道内,我们根据谷禾数据库认为其是基石核心菌。
目前报告的3个物种如下:
Phascolarctobacterium faecium
Phascolarctobacterium succinatutens
Phascolarctobacterium wakonense
其中,Phascolarctobacterium faecium (P. faecium)最早是从以有毒桉树叶为食的动物考拉中分离出来的,它可能与肠道菌群的解毒有关。因此,P. faecium可能在人体胃肠道中发挥有益作用。该菌种是一种专性厌氧和革兰氏阴性细菌,不形成孢子、不运动、分解酶,属于厚壁菌门。
它在普通琼脂上生长不良,但在培养基中添加琥珀酸盐可促进其生长。表明其利用生长需要琥珀酸。
虽然在人类胃肠道的样本中经常检测到与P. faecium密切相关的未培养菌落,但文献中尚未描述从人类胃肠道中分离出Phascolarctobacterium和扩大培养物,从而限制了Phascolarctobacterium faecium相关的功能研究和临床应用。
Phascolarctobacterium wakonense从普通狨猴 (Callithrixjacchus) 粪便中分离出,他们不仅利用了琥珀酸,还利用了丙酮酸。补充丙酮酸后,他们同时产生丙酸和乙酸,而琥珀酸仅产生丙酸。
肠道菌群的遗传特异性可用来做宿主的“微生物指纹”。
研究发现人体肠道菌群的遗传特征比其相对丰度更具有个体特异性。其中Phascolarctobacterium succinatutens 的鉴别准确率达到了88%。
饮食模式
一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少。作者指出这种现象可能与饮食习惯有关。
考拉杆菌属专注于利用其他细菌产生的琥珀酸盐,同时,琥珀酸的主要生产者拟杆菌属和副拟杆菌属的丰度因高脂饮食而增加,并且与体重呈正相关。
老年人和1岁以下个体消耗的脂肪相对较少,体重相对较低,这可能导致拟杆菌属和副拟杆菌属减少,可用于考拉杆菌属的琥珀酸盐减少。
已发现体重和脂肪量与Phascolarctobacterium丰度呈负相关,因此可以帮助预测肥胖风险。
与年轻人相比,老年人群的体育锻炼较少,这可能是Phascolarctobacterium减少的另一个原因。
高脂饮食组富含拟杆菌属和Phascolarctobacterium,在人体肠道微生物群中,拟杆菌属产生乙酸和琥珀酸作为主要代谢产物。琥珀酸在肠道中的过量积累会导致腹泻,而利用琥珀酸的细菌的存在可能对人类有益。因此,Phascolarctobacterium可能和拟杆菌,尤其Bacteroides thetaiotaomicron(常栖息在人类肠道中,能够消化多糖)等菌存在共生。
此外,除了Phascolarctobacterium,研究发现高脂肪饮食更有可能导致大量产生丙酸和乙酸的细菌物种,如奇异变形杆菌(Proteus mirabilis)和韦荣氏球菌 (Veillonellaceae)。
含淀粉类食物、谷物和奶制品,与较高的Phascolarctobacterium 相对丰度。
一些小样本证据显示:
菊粉、岩藻多糖、中等剂量木糖醇可以增加Phascolarctobacterium 的丰度,但是低聚果糖的补充会降低Phascolarctobacterium。
此外,小檗碱和二甲双胍可以显着增加这种菌,这反过来可能有助于这两种药物对宿主的有益作用。
与其他菌互作
人体肠道中存在多种微生物,其中一些被认为是相互作用的。大多数这些相互作用涉及细菌代谢物。考拉杆菌属Phascolarctobacterium几乎不用碳水化合物进行生长,而是使用琥珀酸盐作为底物。研究发现Bacteroides thetaiotaomicron产生的琥珀酸支持Phascolarctobacterium菌的生长和伴随的通过琥珀酸途径产生丙酸。
丙酸生产的三种不同生化途径包括琥珀酸、丙烯酸酯和丙二醇途径。拟杆菌属拥有琥珀酸途径,该途径也存在于Phascolarctobacterium。然而,由于缺乏延胡索酸还原酶,推测P. faecium JCM 30894 无法产生琥珀酸,这是琥珀酸途径的关键代谢物。因此,与产生琥珀酸的细菌(如拟杆菌属)共存对于考拉杆菌属是必不可少的。
此外,从琥珀酸到丙酸的转化反应之一涉及甲基丙二酰辅酶 A 变位酶,它需要维生素 B12 。Bacteroides thetaiotaomicron 一些菌株缺乏维生素 B族 所需的上游基因12生物合成。
此外,发现Phascolarctobacterium与颤螺菌属一般呈正相关。
在一项对 314 名中国健康青年样本的队列研究中,9 个核心属中的 8 个,包括Blautia、Clostridium、Ruminococcus、Faecalibacterium、Subdoligranulum、Roseburia、Coprococcus、Bacteroides,彼此之间呈显著正相关,而核心属Phascolarctobacterium与其他八个核心属呈负相关。综合谷禾数据库和相关研究结果:

环境条件
考拉杆菌属(Phascolarctobacterium),这些细菌与他们的种族/地理和生活方式有关。通过对来自9个省份与自治区、7个民族的20个健康年轻人群的314名居民粪便进行16SrRNA测序,发现厚壁菌门、拟杆菌门、变形杆菌门和放线菌门是4种最主要的细菌门,其中,来自厚壁菌门的考拉杆菌属在人群中丰度占比较高。
人体肠道微生物群是可塑的,与周围环境密切相关。医务人员在日常工作中不断与患者接触,并暴露于医院环境中,这种高风险的接触与暴露使很多病原微生物成为医务人员手部微生物群的一部分而被携带。
万献尧教授团队2021年发表在《Clin Microbiol Infect》上的研究评估了医务人员与非医疗人员肠道微生物组的变化。与非ICU工作人员相比,ICU工作人员肠道内Phascolarctobacterium丰度显著增加。
疾病状态
而与健康人相比,早期肝癌患者中,考拉杆菌属(Phascolarctobacterium)和瘤胃球菌属(Ruminococcus) 明显减少。
在重度抑郁、阿尔茨海默病(AD)、自闭症等疾病中发现Phascolarctobacterium高富集,尽管疾病组内异质性也较高,因此,有必要开展大人群队列和临床验证该菌对于神经类疾病的发生和发展贡献情况。
在参与一项小型研究的复发缓解型多发性硬化症(RRMS) 患者中确定了肉类消费与其如何影响肠道细菌、免疫细胞谱和新陈代谢之间的关系。发现许多与多发性硬化症和多发性硬化症患者残疾严重程度与肠道4种细菌产气柯林氏菌、Coprococcus come、Phascolarctobacterium succinatutens、Sutterella wadsworthensis呈正相关。
Phascolarctobacterium属的减少与结肠炎症的存在有关。
阻止艰难梭菌定植
宿主免疫在肠道微生物群介导的对艰难梭菌感染 (CDI) 的定植抗性中发挥重要作用。研究发现人类微生物群相关小鼠中的 IL-22 信号传导调节宿主糖基化,这使得消耗琥珀酸的细菌Phascolarctobacterium 能够生长。在肠道微生物群中,Phascolarctobacterium降低了琥珀酸的可用性,这是艰难梭菌生长的关键代谢物,因此阻止了艰难梭菌的生长。
Phascolarctobacterium有助于肺癌的免疫治疗
免疫检查点阻断(ICB),特别是PD1/PDL1轴的阻断,为非小细胞肺癌(NSCLC)的治疗开辟了新的标准。然而,尽管临床护理取得了重大进展,但许多患者仍然对这些疗法无效。PD-L1 表达和肿瘤突变负荷等生物标志物与 ICB 疗效相关。Phascolarctobacterium在具有临床益处的患者中富集,并与延长的无进展生存期相关,而Dialister在进展性疾病患者中的代表性更高,其较高的相对丰度与无进展生存期和总生存期降低相关,具有独立的预后价值多变量分析。
有助于减肥
研究发现,比较容易减肥的人体肠道内考拉杆菌属(Phascolarctobacterium)水平较高,因此该菌也用来预测肥胖指标。而难以减肥的人体内则小类杆菌属(Dialister)水平较高。此外,在代谢综合征女性中观察到的Phascolarctobacterium属的丰度高于代谢综合征男性。
无论健康的核心细菌是如何定义的,以及群体研究中的鉴定结果有多么不同,可以肯定的是,普遍和优势的核心细菌对于宿主肠道稳态和健康至关重要。因此,重要的是发现一个全面的核心微生物群概况,以定义健康的肠道微生物群并指导它们对宿主健康的干预。
考拉杆菌属作为我们东方人肠道的核心菌属 ,其丰度高低对于维持健康和情绪等非常重要,后续期待更多关于该菌的深入研究信息。
主要参考文献:
Wu F, Guo X, Zhang J, Zhang M, Ou Z, Peng Y. Phascolarctobacterium faecium abundant colonization in human gastrointestinal tract. Exp Ther Med. 2017;14(4):3122-3126. doi:10.3892/etm.2017.4878
Watanabe Y, Nagai F, Morotomi M. Characterization of Phascolarctobacterium succinatutens sp. nov., an asaccharolytic, succinate-utilizing bacterium isolated from human feces. Appl Environ Microbiol. 2012 Jan;78(2):511-8. doi: 10.1128/AEM.06035-11. Epub 2011 Nov 11. PMID: 22081579; PMCID: PMC3255759.
Ogata Y, Suda W, Ikeyama N, Hattori M, Ohkuma M, Sakamoto M. Complete Genome Sequence of Phascolarctobacterium faecium JCM 30894, a Succinate-Utilizing Bacterium Isolated from Human Feces. Microbiol Resour Announc. 2019;8(3):e01487-18. Published 2019 Jan 17. doi:10.1128/MRA.01487-18
Bhandarkar NS, Mouatt P, Majzoub ME, Thomas T, Brown L, Panchal SK. Coffee Pulp, a By-Product of Coffee Production, Modulates Gut Microbiota and Improves Metabolic Syndrome in High-Carbohydrate, High-Fat Diet-Fed Rats. Pathogens. 2021 Oct 22;10(11):1369. doi: 10.3390/pathogens10111369. PMID: 34832525; PMCID: PMC8624503.
Zheng YH, Xu Y, Ma HX, Liang CJ, Yang T. Effect of High-Fat Diet on the Intestinal Flora in Letrozole-Induced Polycystic Ovary Syndrome Rats. Evid Based Complement Alternat Med. 2021 Jun 25;2021:6674965. doi: 10.1155/2021/6674965. PMID: 34257691; PMCID: PMC8257354.

谷禾健康

Faecalibacterium prausnitzii(F. prausnitzii),普氏栖粪杆菌,又名:普拉梭菌,是人类肠道菌群中最重要的细菌之一,占健康人粪便样本中检测到的细菌总数的 5-15%,是丁酸的重要生产者之一,具有抗炎作用,维持细菌酶的活性,保护消化系统免受肠道病原体的侵害。
已经证实,患有慢性便秘、乳糜泻、肠易激综合征和炎症性肠病(包括克罗恩病和溃疡性结肠炎)的个体中这种微生物的数量减少。此外,在 2 型糖尿病、结直肠癌和银屑病患者中观察到较低水平的F. prausnitzii。
F. prausnitzii 数量的变化可能是人类肠道菌群失调的迹象,科学家们将其视为下一代益生菌的候选者。
Faecalibacterium prausnitzii,革兰氏阴性,对氧极度敏感,是柔嫩梭菌类群的优势菌,属于梭菌科,厚壁菌门。该物种属于Clostridium cluster IV分组的Clostridium leptum group柔嫩梭菌类群,是该类群的最优势菌种,占64%左右。一般中文翻译柔嫩梭菌指的就是这个类群,其代表物种就是普氏栖粪杆菌,又名普拉梭菌。
普拉梭菌的扫描电子显微镜图像
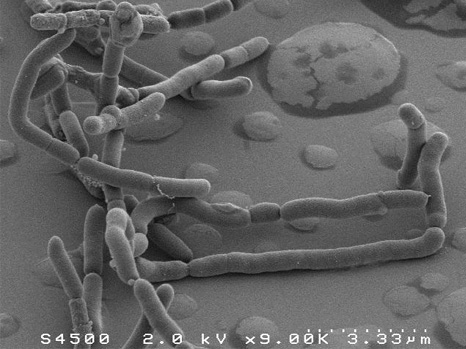
Plateforme MIMA 2, T. Meylheuc
直到 2000 年代中期,16S rRNA 文库的高通量测序和粪便 DNA 的宏基因组分析显示F. prausnitzii是人类肠道中最丰富的细菌之一,人们才完全意识到该物种对人类健康的重要性细菌总数的 5–15%。
在婴儿早期,Faecalibacterium prausnitzii 的数量非常低,并在原定殖细菌建立后增加。同时,在克罗恩病 (CD)和溃疡性结肠炎 (UC) 等各种炎症性肠病 (IBD) 以及结直肠癌 (CRC) 和 2 型糖尿病中观察到 F. prausnitzii 水平降低。
F. prausnitzii 生长繁殖肠道理化调节
F. prausnitzii 生长的最佳 pH 值范围在 5.7 和 6.7 之间,这是在结肠中发现的 pH 值范围。尽管在 5-5.7 的 pH 值范围内菌株之间的耐受性存在差异,但在 3.5 和 4.5 的 pH 值之间没有观察到生长。这表明 pH 值影响F. prausnitzii 沿肠道的分布。
该菌在健康受试者和肠道疾病患者的十二指肠(pH 范围 5.7-6.4)和回肠末端中也被检测到。据报道,溃疡性结肠炎和克罗恩病患者经常出现酸性大便,因此仍有待证明肠道局部 pH 值是否会调节F.prausnitzii 在肠道疾病(如 IBD)患者中的丰度和组成。
F. prausnitzii 对胆汁盐生理浓度的轻微增加也高度敏感,这为克罗恩病患者表现出的F. prausnitzii丰度减少提供了一个合理的解释,因为这些患者的胆红素浓度增加,尤其是那些有回肠疾病受累和接受过肠切除术的患者。
此外,据报道,分离株之间的耐受性存在差异,尤其是胆盐浓度为 0.1% (wt/vol) 时,表明胆汁盐浓度的变化可能决定F. prausnitzii亚型组成的变化。由于克罗恩病患者的胆盐成分也发生改变,需要进一步研究以确定F. prausnitzii是否对某些类型的胆盐成分具有更高的敏感性,并确定不同的胆汁盐谱是否会改变 F. prausnitzii 亚型组成。
F. prausnitzii对氧极为敏感,但它能够通过在黄素和半胱氨酸或谷胱甘肽存在的情况下使用细胞外电子转移来承受肠粘膜中发现的低水平氧气 。最近,已经证明,当与这些抗氧化剂和菊粉作为冷冻保护剂一起配制时,菌株 A2-165 可以在环境空气中保持活力 24 小时。因为氧气梯度在定义结肠中微生物的空间组织方面具有重要作用,确定F. prausnitzii亚型之间的氧耐受性是否存在差异,以及它是否与粘膜的发炎状态相关,将会很有趣。
F. prausnitzii的必需营养素的可用性和有效性可能会影响其在肠道中的分布。
F. prausnitzii的全局营养需求已经通过人工策划的代谢重建进行了调查,该重建确定了几种氨基酸和维生素作为生长因子。体外实验表明,F. prausnitzii可以通过代谢交叉喂养直接或间接地代谢纤维。乙酸盐消耗是F. prausnitzii生产丁酸盐的主要驱动力。当这两个物种在低聚果糖上一起生长时,青春双歧杆菌释放的醋酸盐的消耗已被证明会刺激F. prausnitzii。F. prausnitzii可以代谢来自宿主和饮食来源的底物,菌株之间存在一些差异。
F. prausnitzii分离株可以使用简单碳水化合物生长良好,但菌株之间在发酵更复杂碳水化合物的能力方面存在一些差异,例如那些来自宿主或饮食的碳水化合物,尽管大多数F. prausnitzii菌株都能够发酵菊粉,但研究结果表明,其中只有两种菌株可以在该基质上生长良好。这支持观察到该益生元在营养干预中对该物种的刺激,并表明只有F. prausnitzii种群的一些成员受到菊粉的选择性刺激。
该物种的菌株利用肠腔中发现的其他多糖的能力有限,例如阿拉伯半乳聚糖、木聚糖和可溶性淀粉。大多数分离株可以在苹果果胶上生长,并且能够使用一些果胶衍生物。体外研究表明,在生理条件下,F. prausnitzii可以在某些类型的果胶发酵中发挥关键作用,并且可以与其他肠道细菌成功竞争这种底物。
最近一项基于普拉梭菌 A2-165菌株功能代谢图的研究预测其无法合成氨基酸丙氨酸、半胱氨酸、蛋氨酸、丝氨酸和色氨酸。通过对其他F. prausnitzii菌株基因组的进一步分析,已经观察到维生素和辅助因子(例如:生物素、叶酸、烟酸、泛酸、吡哆醇和硫胺素)的营养缺陷型,并且菌株之间似乎存在与核黄素生产有关的一些差异,这可能是由于菌株间差异。
相比之下,该物种已被预测为钴胺素生产者。有证据表明,一些 IBD 患者易患钴胺素缺乏症,但尚未确定这种情况的原因。由于缺乏一致的临床数据表明 IBD 患者易患这种缺陷,因此确定它是否与肠道中钴胺素生产者的消耗有关会很有价值。
F. prausnitzii与肠道微生物群其他成员的关系
F. prausnitzii在肠道中与C. coccoides组和 Bacteroidetes 的几个成员共同发生。有人提出F. prausnitzii可能依赖其他物种(如拟杆菌)进行交叉饲养。在共培养实验中,观察到F. prausnitzii 的发酵活动过程中,多形拟杆菌(B. thetaiotaomicron)正在发酵果胶。表明后者产生的乙酸盐促进了F. prausnitzii 的生长。此外,B. thetaiotaomicron对果胶的初始发酵可以释放果胶衍生物,然后可以被F. prausnitzii使用。
最近对大鼠模型的研究表明,F.prausnitzii 需要预先存在后,B.thetaiotaomicron才能在肠道定植。已经反复观察到无法维持F. prausnitzii单相关动物模型 并且还描述了一种小鼠模型,其中F. prausnitzii植入胃肠道需要用大肠杆菌预先制备,表明F. prausnitzii和其他菌群存在密切关系。在 IBD 患者中发现了这两种物种之间的相关性,根据疾病位置观察到正相关或负相关。这表明一个种群对另一个种群的影响,尽管还不能排除宿主因素的影响。
F. prausnitzii 的分类学和系统发育
已经确定Faecalibacterium属与厚壁菌门、梭菌类和瘤胃球菌科中的梭菌群 IV的成员有关。目前,F. prausnitzii是唯一成功分离的粪杆菌属物种。
最近对分离株的系统发育表征确定该物种包括两个系统发育群,它们具有 97% 的 16S rRNA 基因序列相似性。其中分类群 I 的减少是肠道炎症的更敏感标志物。迄今为止,大部分可用的基因组和生理数据是使用分类群 II 菌株收集的。
F. prausnitzii基因组之间的平均核苷酸同一性水平非常低,而基因组的可塑性却很高。两个基因组可以根据功能基因互补的差异进行分离,尽管这种划分与基于保守基因系统发育的分离不完全一致,突出了水平基因转移在塑造F. prausnitzii 中的重要性基因组。两个基因组之间的差异主要在于与碳水化合物分解代谢相关的基因(例如分类群 I中预测的唾液酸酶基因)和氨基酸的互补,以及防御机制。
值得注意的是,最近对健康和患病肠道样本中物种多样性和丰度的研究表明,存在其他F. prausnitzii系统发育型,并且不能排除Faecalibacterium属内其他物种的存在。这些已经通过分析粪便样本中总体细菌群落的分子方法估计,代表大约 2% 的粪杆菌序列,并使用物种特异性引物。有趣的是,罕见的系统发育型主要是从患有肠道疾病的受试者身上发现的。
产生丁酸,维持肠道稳态
Faecalibacterium prausnitzii 一直被报道为肠道中发现的主要丁酸盐生产者之一。丁酸盐在肠道生理学和宿主健康中起着至关重要的作用。丁酸盐结肠细胞的主要能量来源之一,能够保持肠道内壁的完整性,防止病原体通过肠道进入人体。它刺激绒毛的生长 (肠道屏障上的微观挤压)并促进粘蛋白的产生,粘蛋白是一种覆盖肠道内壁的保护性凝胶。此外,丁酸盐通过增加紧密连接蛋白的合成和抗菌肽的产生来参与结肠屏障的增强。
肠道屏障依赖于 T 连接蛋白来防止肠道内容物泄漏到血液中。丁酸盐通过激活 AMP 活化蛋白激酶 (AMPK) 来促进紧密结合的 T 连接蛋白。
丁酸盐可以通过调节肠腔 pH 值来调节肠道微生物群,这对产生短链脂肪酸的细菌有益,丁酸盐可以保持上皮缺氧并限制硝酸盐呼吸依赖性细菌的过度生长以维持肠道稳态。
丁酸盐是由某些细菌在乳酸发酵过程中产生的。然而,乳酸也是硫酸盐还原菌的首选能源,硫酸盐还原菌会产生硫化物并抑制结肠细胞对丁酸的氧化。IBD 中产生丁酸盐的菌的消耗可能会削弱已经脆弱的肠上皮细胞,导致共生或低致病性细菌的入侵,随后激活免疫活性细胞。
产生丁酸,抗炎抗肿瘤
丁酸盐可以通过抑制 NF-κB 转录因子激活、上调 PPARγ和抑制干扰素γ来减轻肠黏膜炎症。
此外,F. prausnitzii已被证明可以产生许多具有抗炎特性的物质,包括一种 15 kDa 的蛋白质“微生物抗炎分子”(MAM),它能够抑制肠上皮中的 NF-κB 通路细胞和预防小鼠 IBD 模型中的结肠炎 。而且,丁酸盐可能通过抑制组蛋白脱乙酰酶活性来抑制炎症反应,导致组蛋白过度乙酰化和抑制 NF-κB 活性。
Faecalibacterium prausnitzii 上清液已被证明可以抑制促炎性 IL-8 免疫蛋白的产生。
F. prausnitzii 还通过激活产生 IL-10(一种抗炎蛋白)的 T 细胞来帮助对抗炎症。
F. prausnitzii 的抗炎机制
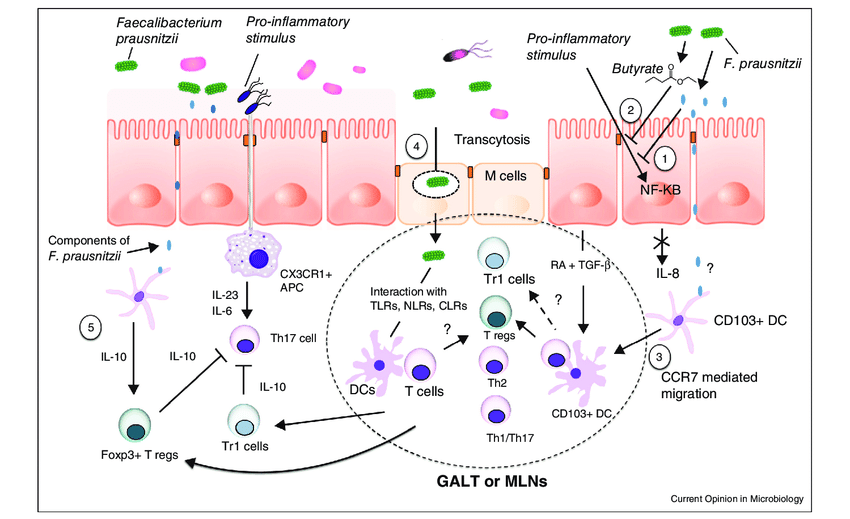
额外的抗炎特性归因于该菌还通过其诱导耐受性细胞因子谱的能力(促炎细胞因子如 IL-12 和 IFN-γ 的分泌非常低,而抗炎细胞因子 IL-10 的分泌增加)。这些抗炎作用部分与能够阻断 NF-κB 激活、IL-8 产生和调节性 T 细胞产生上调的分泌代谢物有关。
这些微生物可以产生莽草酸,一种常见于植物中的酸,能够防止脂多糖 (LPS) 引起的炎症。LPS 是一些细菌外膜上的毒素,可以激活免疫系统并引起炎症。F. prausnitzii 还可以制造水杨酸,这有助于防止细菌形成生物膜,这是一些引起感染的微生物的常见特征。
体外研究表明,丁酸盐还具有抗肿瘤作用,包括减少肠上皮细胞中肿瘤坏死因子 (TNF) 的分泌,并诱导肿瘤细胞的分化和凋亡,从而抑制肿瘤生长。
F. prausnitzii 及其代谢物对小鼠结肠炎发挥保护作用,改善了肠道菌群失调,增加了细菌多样性和产生短链脂肪酸菌的丰度,降低了血清 TNF-α 和Proteinbacteria,酸杆菌门和拟杆菌。这些发现将为F. prausnitzii 的抗炎抗肿瘤作用提供进一步的证据,其具有治疗 IBD 的潜力。

下一代益生菌特性
大多数商业益生菌不包括有益健康的优势肠道微生物菌株,这就是为什么这些益生菌菌株不会在人类肠道中定殖并且它们的作用仅在很短的时间内持续存在的原因。如今,人们对使用共生细菌作为潜在的益生菌剂越来越感兴趣。
使用厌氧细菌和 EOS(氧敏感) 细菌是成功分离可能影响肠道稳态的代表性菌株的先决条件。Faecalibacterium prausnitzii从健康志愿者分离株:F. prausnitzii作为新一代益生菌在使用中向前迈进了一步。
但是下一代共生益生菌必须满足与传统益生菌相同的标准。它们应该:
(i) 被隔离和充分表征
(ii) 达到安全要求,例如可接受的抗生素抗性或缺乏裂解和粘附能力
(iii) 作为益生菌考虑,在被隔离之前对宿主表现出有益的影响
关于F. prausnitzii,虽然对其安全性知之甚少,但该物种作为下一代益生菌具有明显的潜力。到目前为止,所有F. prausnitzii分离株具有一些特征,例如:
(i) 缺乏上皮细胞粘附、质粒、抗微生物和溶血活性
(ii) 存在 DNAse 活性。部分的F. prausnitzii菌株产生的 D-乳酸微弱,不会对宿主产生代谢有害影响,无法降解黏蛋白。
仅使用参考菌株F. prausnitzii A2-165在体外和体内分析了其有益的抗炎作用和生物膜形成菌株 HTF-F。由于益生菌特性通常是菌株特异性的,需要单独研究来评估其他F. prausnitzii分离菌株的抗炎特性。
人体微生物组中 F. prausnitzii 的丰度受其健康状况和结肠环境的影响。这一点尤其重要,因为在患有消化系统疾病的患者中发现了低于平均水平的F. prausnitzii。
克罗恩病和溃疡性结肠炎
肠道微生物群可能通过两种机制驱动致病性,即“促炎”菌群的扩张或微生物群保护性化合物的限制。
健康肠道和IBD患者中 F. prausnitzii
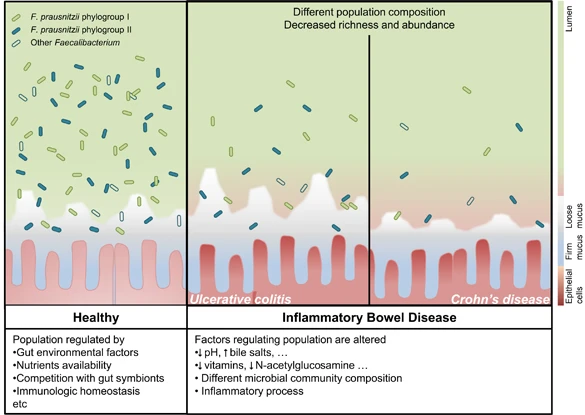
在IBD患者中,肠道环境的改变可能会影响F. prausnitzii 的种群组成和负荷。这些差异可以通过监测来鉴别IBD亚型。
在过去的十年的研究已发现,相当数量的降低的F. prausnitzii水平与某些形式的IBD相关。虽然F. prausnitzii水平与溃疡性结肠炎活动和隐窝炎之间的联系是有争议的,在克罗恩病中F. prausnitzii枯竭,尤其是在疾病发作和克罗恩病的回肠部位。
◥ 治疗后F. prausnitzii恢复
在粪便和活检样本中使用的各种证明方法表明,对克罗恩病患者有效的各种抗炎和抗菌治疗,包括大剂量皮质醇、英夫利昔单抗、干扰素-α2b 和利福昔明,都能够恢复正常水平的F. prausnitzii。
因此,有人提出F. prausnitzii的消耗不是克罗恩病的致病事件,而是产生过量活性氧 (ROS) 的粘膜炎症的结果。这导致粘膜相关和管腔 EOS 培养物显着减少,包括F. prausnitzii。
如何解释Faecalibacterium prausnitzii在溃疡性结肠炎和克罗恩病患者中减少?
◥ pH值
健康的肠道 pH 值 (5.7–6.7) 为 F. prausnitzii 的生长提供了最佳条件,而高酸性环境会抑制 Faecalibacterium prausnitzii 的生长。尤其是,溃疡性结肠炎和克罗恩病患者的大便呈酸性,这可能有助于解释为什么他们的微生物群中缺乏 F. prausnitzii .
◥ 胆汁
胆汁及其成分水平略微升高也会影响 F. prausnitzii 丰度。胆汁是肝脏分泌的一种物质,可在消化过程中分解脂肪。胆汁盐已被证明可以抑制 Faecalibacterium prausnitzii。
研究人员假设这种对胆汁的敏感性可以解释为什么这些微生物在克罗恩病患者中较少。患有这种炎症性疾病的人往往有较高水平的胆红素,胆红素是一种赋予胆汁颜色的色素,特别是如果他们已经切除了部分肠道。
溃疡性结肠炎中, F. prausnitzii有缺陷的肠道定植,这在缓解期短、既往有频繁复发史和结肠炎大范围扩展的患者中更为严重。此外,复发后,F. prausnitzii在维持缓解时逐渐恢复,1年后达到接近参考种群的值。
基于F. prausnitzii菌株特性的治疗探索
科学研究人员提出假设,即F. prausnitzii 的高定植可能会阻止溃疡性结肠炎中粘膜炎症过程的重新激活。这一假设应在未来的研究和增加肠道F. prausnitzii 的策略中得到证实需要在患有广泛疾病的患者中对人群进行验证。
F. prausnitzii菌株还可以利用N-乙酰氨基葡萄糖,一种在肠粘膜中发现的糖蛋白的成分。有趣的是,用这种化合物进行治疗可能会改善克罗恩病,因为它可以作为炎症、受损肠道软组织的愈合因子。因此,鉴于F. prausnitzii能够发酵这种碳水化合物,探索在接受这种治疗的克罗恩病患者中恢复这种有益肠道细菌的效果将是有意义的。
镇痛特性
慢性腹痛是肠易激综合征或炎症性肠病等肠道疾病患者的常见症状之一。研究人员表明,在炎症性肠病的患者中,肠道中的Faecalibacterium prausnitzii细菌的丰度降低。
这些研究人员已经证明,由于压力动物模型(产生绞痛起源的内脏超敏反应),F. prausnitzii丰度的减少与内脏超敏反应的出现有关。对于人类,这种超敏反应会导致肠道不适或腹痛。
科学家已经证明,通过给这些动物服用F. prausnitzii,它们恢复了正常的绞痛敏感性。
结直肠癌
丁酸盐的抗炎功能包括抗癌特性。这种短链脂肪酸是一种组蛋白脱乙酰酶 (HDAC) 抑制剂:它抑制癌细胞的活性和生命周期。这促使研究人员调查 Faecalibacterium prausnitzii 在结直肠癌中的作用。
结直肠癌患者产丁酸盐的细菌较少,包括Faecalibacterium prausnitzii。有人提出,由于丁酸盐产量较低,肠道内壁细胞可能更容易受到损伤,这可能会增加患癌症的风险。
扩展阅读:结直肠癌防治新策略——微生物群
乳腺癌
F.prausnitzii 通过抑制IL-6/STAT3通路抑制乳腺癌细胞的生长。菌群代谢物与菌群结合(如Faecalibacterium与磷胆碱结合)可能是乳腺癌的一种新的检测方法。
糖尿病
糖尿病是一种代谢性疾病,其中由于胰岛素功能受损,身体失去控制血糖的能力。升高的循环葡萄糖会损害血管并增加患心脏病的风险。
许多针对人类的研究已经确定了肠道微生物组的失衡(生态失调),这会削弱肠道内壁,并使不良分子进入体内,从而破坏其他器官。科学家们认为,生态失调先于并促进了糖尿病的发展。
糖尿病患者的厚壁菌门水平较低,包括 Faecalibacterium prausnitzii 和其他可强化肠道内壁的产丁酸盐细菌。
研究表明,脂多糖是在某些革兰氏阴性细菌上发现的促炎分子,当肠道屏障薄弱时,它会进入血液并损害胰腺中的B 细胞功能,产生胰岛素的细胞。
过敏反应
Faecalibacterium prausnitzii通过调节肠道微生物群和短链脂肪酸的产生来缓解屋尘螨引起的过敏性哮喘。
补充F. prausnitzii可阻断嗜酸性粒细胞、中性粒细胞、淋巴细胞和巨噬细胞的流入,减轻病理变化。此外,活的和死的F. prausnitzii给药都降低了白细胞介素 IL-4、IL-5、IL-13 和免疫球蛋白 G1 的水平,提高了调节性 T 细胞 (Treg) 的比例,改善了微生物生态失调并增强了短链脂肪酸生产。
Faecalibacterium prausnitzii部分通过肠道微生物群调节和短链脂肪酸产生发挥抗哮喘作用,表明其作为预防过敏性哮喘的益生菌剂的潜力。
肝病
研究人员研究了口服F. prausnitzii治疗对高脂肪喂养小鼠的影响。与高脂肪对照小鼠相比,F. prausnitzii处理的小鼠肝脏脂肪含量、天冬氨酸氨基转移酶和丙氨酸氨基转移酶较低,肝脏中脂肪酸氧化和脂联素信号传导增加。肝脏脂质组学分析显示,几种甘油三酯、磷脂和胆固醇酯的含量减少。内脏脂肪组织中的脂联素表达增加,皮下和内脏脂肪组织对胰岛素更敏感。
且F. prausnitzii治疗增加了肌肉质量,这可能与增强线粒体呼吸、改变肠道微生物群组成和改善肠道完整性有关。总的来说,F. prausnitzii治疗可改善肝脏健康,减少小鼠脂肪组织炎症,需要进一步研究以发现其治疗潜力。
其它
肠道菌群中F. prausnitzii的消耗与微生物失调有关,同时伴随着广泛的代谢和/或免疫介导的慢性疾病,包括银屑病、高血压、心脏和肾脏疾病。
在以下患者中已显示低水平的F. prausnitzii:
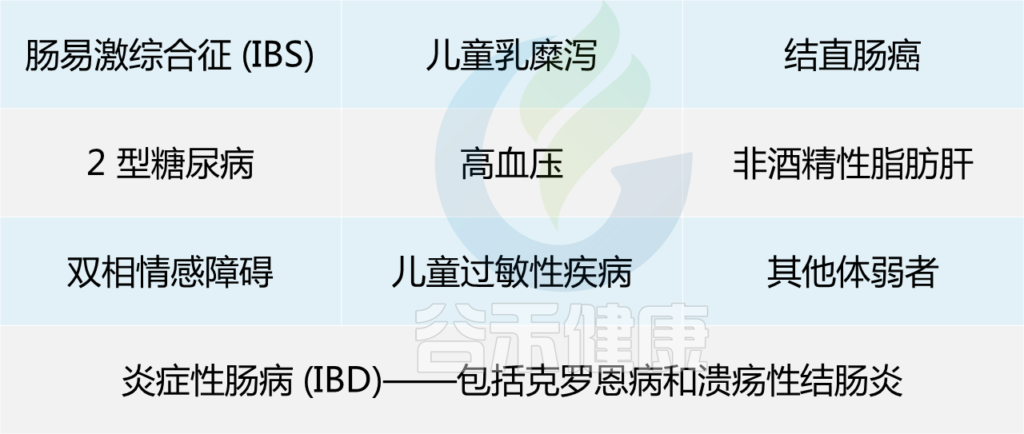
综上所述,F. prausnitzii 对人体肠道和健康非常重要,以至于它被称为肠道中的“关键物种”。现在问题来了:如何增加肠道中这种细菌的数量?
能否添加到酸奶中补充?
不能。
添加到酸奶中或作为补充剂的典型细菌在暴露于空气(氧气)时能够存活。然而,F. prausnitzii是“氧敏感的”,它们在暴露于空气后几分钟内就会死亡。研究人员将这种有益细菌视为“未来的益生菌”,目前正在进行研究以找出它可以轻松储存并暴露在空气中几个小时而不会死亡的方法。所以目前没有办法服用益生菌F. prausnitzii补充剂。
除此之外还能做什么呢?
饮食。
高动物肉、高动物脂肪、高糖、高度加工食品和低纤维饮食(典型的西化饮食)会降低F. prausnitzii 的数量,而高纤维、低肉的饮食会增加 F. prausnitzii 的数量。
——高纤维
我们可以做的第一个提高 F. prausnitzii 的数量的办法, 就是增加饮食中的纤维。增加膳食纤维会增加丁酸盐,丁酸盐与结肠健康有关,具有抗炎和抗癌作用。
高纤维是包括:全谷物、蔬菜、水果、坚果、种子和豆类。此外,还要主要吃多样化的植物性饮食,也就是说大量的植物性食物。多样性似乎很重要——不同类型的纤维喂养不同的细菌。
——益生元
菊粉型果聚糖和阿拉伯木聚糖等益生元可增加F. prausnitzii的数量。

一项研究表明,猕猴桃胶囊的摄入增加了功能性便秘患者的Faecalibacterium prausnitzii 丰度。
虽然F. prausnitzii可能是肠道中一种重要的有益细菌,但是它与其他有益细菌的关系,它们是交叉喂养的。研究表明青春双歧杆菌是利用菊粉主要物种并刺激Faecalibacterium prausnitzii的增加。
主要参考文献:
Heinken, A., Khan, M. T., Paglia, G., Rodionov, D. A., Harmsen, H. J. M., & Thiele, I. (2014). Functional Metabolic Map of Faecalibacterium prausnitzii, a Beneficial Human Gut Microbe. Journal of Bacteriology, 196(18), 3289–3302. doi:10.1128/jb.01780-14
Rivière, A., Selak, M., Lantin, D., Leroy, F., & De Vuyst, L. (2016). Bifidobacteria and Butyrate-Producing Colon Bacteria: Importance and Strategies for Their Stimulation in the Human Gut. Frontiers in Microbiology, 7. doi:10.3389/fmicb.2016.00979
Lopez-Siles, M., Duncan, S. H., Garcia-Gil, L. J., & Martinez-Medina, M. (2017). Faecalibacterium prausnitzii: from microbiology to diagnostics and prognostics. The ISME Journal, 11(4), 841–852. doi:10.1038/ismej.2016.176
Moreno-Indias, I., Sánchez-Alcoholado, L., Pérez-Martínez, P., Andrés-Lacueva, C., Cardona, F., Tinahones, F., & Queipo-Ortuño, M. I. (2016). Red wine polyphenols modulate fecal microbiota and reduce markers of the metabolic syndrome in obese patients. Food & Function, 7(4), 1775–1787. doi:10.1039/c5fo00886g
Richardson, D. P., Ansell, J., & Drummond, L. N. (2018). The nutritional and health attributes of kiwifruit: a review. European Journal of Nutrition. doi:10.1007/s00394-018-1627-z
Blatchford, P., Stoklosinski, H., Eady, S., Wallace, A., Butts, C., Gearry, R., … Ansell, J. (2017). Consumption of kiwifruit capsules increases Faecalibacterium prausnitzii abundance in functionally constipated individuals: a randomized controlled human trial. Journal of Nutritional Science, 6. doi:10.1017/jns.2017.52
Lopez-Siles M, Duncan SH, Garcia-Gil LJ, Martinez-Medina M. Faecalibacterium prausnitzii: from microbiology to diagnostics and prognostics. ISME J. 2017 Apr;11(4):841-852. doi: 10.1038/ismej.2016.176. Epub 2017 Jan 3. PMID: 28045459; PMCID: PMC5364359.
Ramirez-Farias C, Slezak K, Fuller Z, Duncan A, Holtrop G, Louis P. Effect of inulin on the human gut microbiota: stimulation of Bifidobacterium adolescentis and Faecalibacterium prausnitzii. Br J Nutr. 2009 Feb;101(4):541-50. doi: 10.1017/S0007114508019880. Epub 2008 Jul 1. PMID: 18590586.
Varela E, Manichanh C, Gallart M, Torrejón A, Borruel N, Casellas F, Guarner F, Antolin M. Colonisation by Faecalibacterium prausnitzii and maintenance of clinical remission in patients with ulcerative colitis. Aliment Pharmacol Ther. 2013 Jul;38(2):151-61. doi: 10.1111/apt.12365. Epub 2013 Jun 3. PMID: 23725320.
Munukka, E., Rintala, A., Toivonen, R. et al. Faecalibacterium prausnitzii treatment improves hepatic health and reduces adipose tissue inflammation in high-fat fed mice. ISME J 11, 1667–1679 (2017). doi.org/10.1038/ismej.2017.24