-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

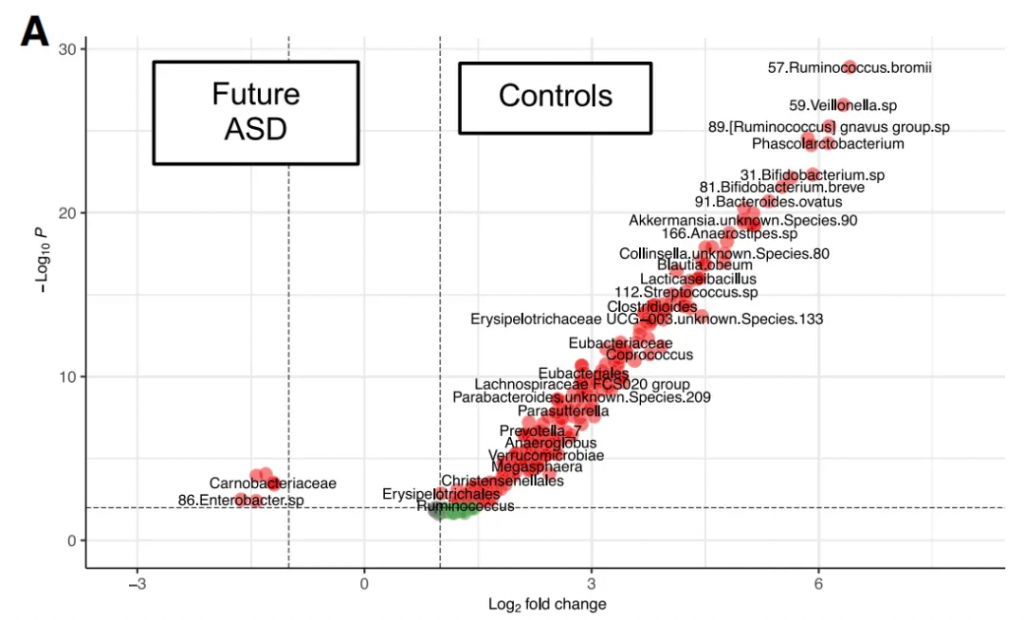
在谷禾的检测实践中发现很多自闭症和情绪障碍人群的对甲酚含量很高,并且结合现有文献,有充分的证据认为对甲酚与自闭症存在相关性。

<来源:谷禾健康自闭症儿童检测示例>
什么是对甲酚?对甲酚是人体中特定细菌(例如艰难梭菌、部分梭杆菌、肠杆菌)降解蛋白质中的l-酪氨酸产生的一种酚类化合物。
目前在自闭症谱系障碍(ASD)患者的血液、尿液和粪便中均已发现对甲酚及其人体代谢物对甲酚硫酸盐的水平明显升高,并发现ASD患者的重复刻板行为、交流与认知障碍症状的加重与尿液中对甲酚和对甲酚硫酸盐水平升高密切相关。
分析还发现,尿液中的对甲酚和对甲酚硫酸盐水平能够很好地区分开ASD儿童与健康儿童,有望作为自闭症谱系障碍的生物标志物和客观定量指标。
作为经过肠道代谢和吸收的物质,过量的对甲酚对肠道健康也存在一定的危害。高浓度对甲酚对结肠细胞具有毒性,会抑制细胞的增殖并增加线粒体耗氧量;还与肠道菌群失衡相互促进,促使耐受和产生对甲酚的细菌进一步增长,并损害肠道上皮细胞,导致屏障功能受损。
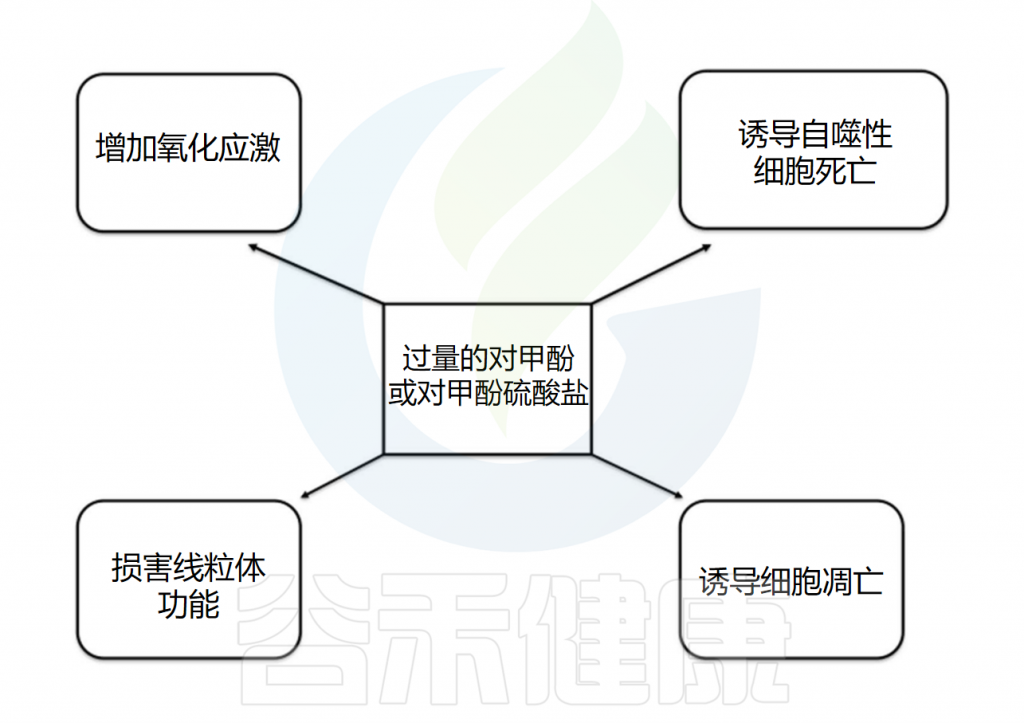
除了在自闭症中展现出的相关性及对肠道的危害外,过量的对甲酚还可作为一种尿毒症毒素。在慢性肾脏疾病(CKD)中,血浆中对甲酚和对甲酚硫酸盐的显著升高被检测到,在肾小管细胞中,对甲酚和对甲酚硫酸盐增加氧化应激,影响线粒体功能,并导致细胞死亡,加重慢性肾脏疾病进展。并且对甲酚硫酸盐被发现与肾纤维化有关。
对甲酚和对甲酚硫酸盐也被怀疑在CKD相关的不良心血管事件中发挥作用,因为它们影响内皮细胞的增殖和迁移,降低内皮伤口修复的能力,增加内皮细胞的衰老,并与心肌细胞功能障碍相关。
在这种背景下,本文详细讲述了对甲酚及其代谢产物对自闭症、肠道细胞及菌群和外周组织细胞(即肾小管细胞和血管内皮细胞)的影响。此外,我们将回顾最近的证据,探讨肠道微生物群和对甲酚的产生与自闭症之间的关联,以及该化合物在自闭症中可能发挥的机制。
如何检测自身对甲酚水平,并通过饮食或药理手段降低对甲酚或对甲酚循环浓度也是人们所关心的。在本文的最后一个部分,我们列举了当前主要的一些降低体内对甲酚水平或减轻其危害的措施,包括使用克里美净等药物;多食用富含原花青素的水果,减少红肉的摄入;保持平衡的肠道菌群状态;以及一些合生元疗法。降低对甲酚水平还可能有助于改善自闭症、慢性肾脏疾病和相关的心血管障碍。
对甲酚过高的危害
我们发现,当人体中对甲酚浓度过高时,会存在以下的危害:
•可能是介导自闭症的关键因子
•导致肠道菌群失衡
•对结肠细胞具有毒性
•诱导肠道屏障功能的改变
•会加重肾脏疾病
•与心血管功能障碍相关
作为栖息在我们肠道中的微生物群落,其就像一个个小型的加工厂,可以产生许多代谢产物。
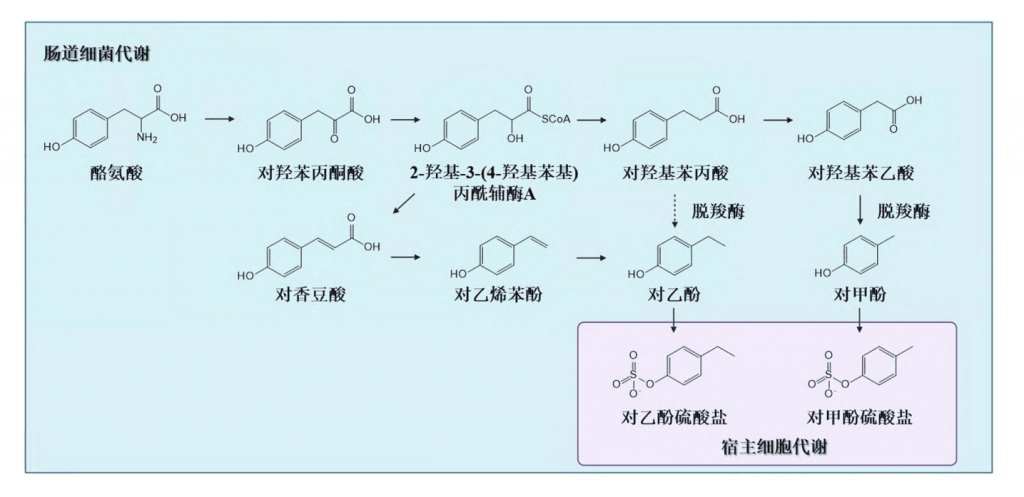
▸肠道菌群代谢酪氨酸产生对甲酚
人体内的对甲酚主要来源于肠道菌群的代谢。在微生物代谢可用的底物中,肠道微生物群降解未消化(或未完全消化的蛋白质)释放的芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸),产生酚类和吲哚类产物。在这些化合物中,酚类化合物对甲酚(4-甲基苯酚)由l-酪氨酸产生。
如下图所示,以梭菌属为代表的细菌可表达脱羧酶,该酶可将酪氨酸的中间代谢产物对羟基苯乙酸和对羟基苯丙酸脱去羧基形成对甲酚和对乙酚。
肠道细菌似乎使用几种酪氨酸衍生的代谢产物,如4-羟基苯丙酮酸、4-羟基苯乳酸、3-(对羟基苯基)丙酸和4-羟基苯乙酸作为对甲酚合成的中间体。
DOI︰10.20059/j.cnki.pps.2023.08.1011
▸艰难梭菌、乳杆菌科等可以产生对甲酚
分析表明,在人类肠道中存在的细菌中,特定的细菌家族,如梭杆菌科、肠杆菌科、梭菌科、拟杆菌科、乳杆菌科和红椿菌科(Coriobacteriaceae),是强对甲酚生产者,部分双歧杆菌科也可代谢产生对甲酚。
其中以艰难梭菌的对甲酚产量最高,可达其他细菌的10~1000倍。因此,感染艰难梭菌的患者体内可能会出现对甲酚含量升高的情况。

在另一项研究中,通过使用补充有酪氨酸及其代谢物的培养基鉴定产生对甲酚的肠道细菌。发现B.longumsubsp.infantis YIT 4018亚种、艰难梭菌 YIT 10084T、Cl. paraputrificum YIT 10074T和F.necrogenes YIT 10362T具有产生对甲酚的能力。
▸乳酸可以减少对甲酚的产生
艰难梭菌产生对甲酚的能力与其相对于其他肠道细菌的竞争优势有关,从艰难梭菌感染的小鼠模型中可以看出,过量生产对甲酚会影响肠道微生物群的生物多样性。
乳酸是另一种细菌代谢产物,已被证明可以在体外减少细菌对甲酚的产生。利用这一特点,我们推测提升产乳酸细菌的丰度有助于减少对甲酚的产生。
▸高蛋白摄入量会增加对甲酚浓度
在哺乳动物中,饮食中蛋白质摄入量的增加会提高粪便和尿液中的对甲酚浓度,这可能是由于来源于未消化蛋白质的底物l-酪氨酸在细菌代谢活动中的可用性增加。
相反,含有抗性淀粉和麦麸提取物的饮食会减少对甲酚的粪便含量。
人体细胞由于缺乏相关的酶,自身并不会产生对甲酚。
对甲酚除了可经肠道细菌代谢产生以外,石油、颜料、香水、化妆品等日用品中含有对甲酚,对甲酚也是部分食品用防腐剂的原料,因此人体内的对甲酚也可能来源于饮食直接摄入或气体挥发吸入。
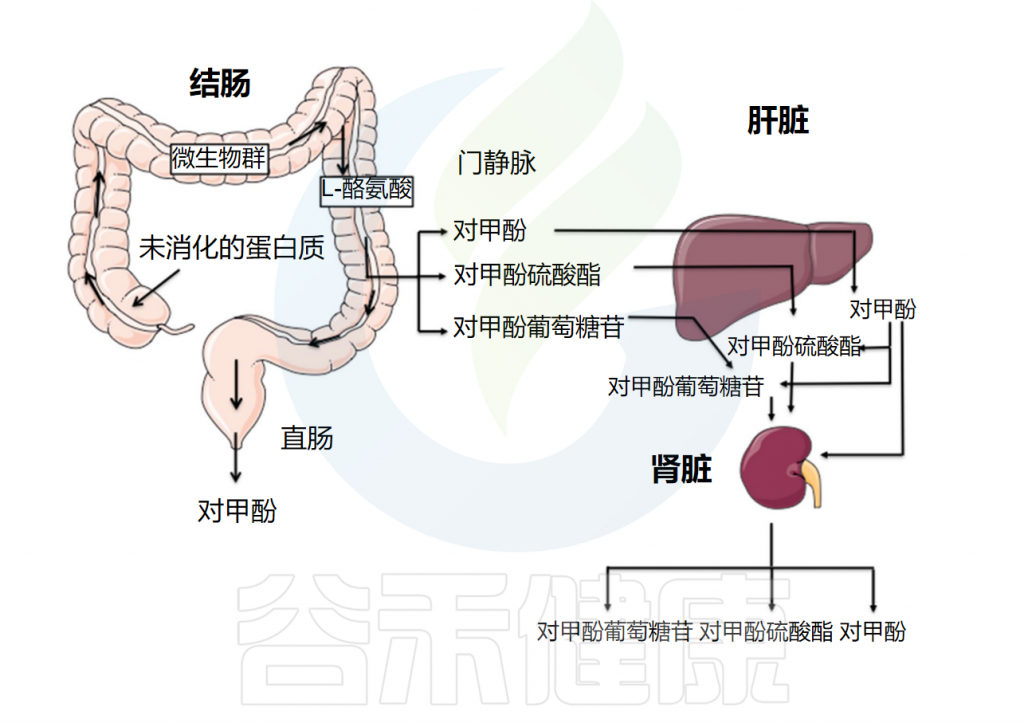
对甲酚虽然不是宿主合成的,但在吸收过程中及吸收后可在宿主组织中被修饰。肠上皮细胞吸收对甲酚,产生几种共代谢产物,最终这些产物会在尿液中排出。
▸结肠黏膜结合生成对甲酚硫酸盐
结肠黏膜与硫酸盐和葡萄糖苷酸结合酚类物质的能力已得到证实,分别允许产生对甲酚硫酸盐(p-CS)和对甲酚葡糖苷酸(p-CG)。
在一项研究中,比较了有结肠和没有结肠的血液透析患者血浆中的p-CS水平,表明结肠在p-CS的产生中起着重要作用。从肠道门静脉释放的未代谢的对甲酚由肝脏代谢,主要产生对甲酚硫酸盐,在较小程度上产生对甲酚葡糖苷酸以及其他次要代谢物。
肠道菌群和宿主组织对甲酚代谢的示意图
doi: 10.1007/s00726-021-03064-x.
▸与白蛋白结合保持血液中的含量平衡
对甲酚、p-CS和p-CG以可逆的方式与血浆白蛋白结合,导致血液中结合和游离部分之间的平衡。健康受试者血液中对甲酚的总浓度为9-13µM,而总p-CS的循环浓度为13-15µM。在血液中,游离形式的p-CS浓度平均仅为0.31µM,约占总量的2%。
最后,未与白蛋白结合的对甲酚、p-CS和p-CG会通过尿液排出。志愿者尿液中对甲酚的平均浓度为340µM,个体值之间存在显著差异。这些研究中未报告志愿者的饮食状况,加上个体肠道微生物群组成的差异,可能解释了这种差异。
▸素食者的对甲酚浓度会较低
值得注意的是,一项针对少数食用素食或无限制饮食的健康志愿者的研究表明,素食者的p-CS尿排泄量明显低于无限制饮食者,这可能是因为素食者的膳食纤维含量较高,蛋白质摄入量较低。
在一项针对志愿者的随机、平行、双盲试验中,研究表明,与等热量对照组(不补充蛋白质,摄入相似量的膳食纤维)观察到的微生物群组成相比,补充膳食蛋白质会导致细菌代谢向氨基酸降解转变。
与对照组相比,服用酪蛋白补充剂的组尿p-CS较高,而服用大豆蛋白补充剂的组则没有,这表明膳食蛋白质的来源可能对肠道微生物群对对甲酚的产生或宿主对这种细菌代谢物的代谢产生不同的影响。
▸对甲酚硫酸盐具有神经毒性,与自闭症相关
有临床研究表明对甲酚硫酸盐可能具有神经毒性,是部分神经系统疾病的潜在病因。
目前在自闭症谱系障碍(ASD)患者的血液、尿液和粪便中均已发现对甲酚和对甲酚硫酸盐的水平明显升高,并发现ASD患者的重复刻板行为、交流与认知障碍症状的加重与尿液中对甲酚和对甲酚硫酸盐水平升高密切相关。
我们将在后面的章节中详细讨论对甲酚在自闭症中的作用及其机制。
▸高浓度对甲酚对结肠细胞具有毒性
在体外实验中,浓度为1000µM及以上的对甲酚对人结肠细胞表现出剂量依赖性的遗传毒性。在不同底物的情况下,结合对人类结肠细胞发酵上清液的遗传毒性测试,发现对甲酚是这些上清液中对结肠细胞遗传毒性的最大预测因子。
▸过量的对甲酚减少增殖和线粒体耗氧量
浓度为800µM的对甲酚减缓了人结肠细胞HT-29 Glc−/+的增殖,伴随S期细胞的积聚和细胞分离的轻微增加。在这项研究中,800µM对甲酚的急性处理减少了集落细胞中的线粒体耗氧量。
此外,预处理细胞1天后,基础和最大耗氧量增加,可能抵消了对甲酚对细胞呼吸的不利影响。预处理的细胞中测量到阴离子超氧化物产量增加。在较高浓度(1600和3200µM)下,对甲酚预处理也显示出类似效果,但处理1天后,质子通过线粒体内膜的泄漏增加,降低了线粒体的生物能量代谢效率。
用浓度在800至3200µM之间的对甲酚预处理结肠细胞3天后,细胞内ATP浓度呈剂量依赖性降低。因此,在这个体外模型中,过量的对甲酚被确定为能量代谢的干扰物和对结肠细胞的遗传毒性物质。
对甲酚对结肠上皮的主要作用
doi: 10.1007/s00726-021-03064-x.
▸抑制革兰氏阴性细菌的生长繁殖,同时对对甲酚不敏感的菌群具有生存优势
进一步研究发现肠道中的对甲酚水平和肠道菌群失衡存在相互促进的关系。对甲酚可抑制脆弱拟杆菌等革兰氏阴性肠道细菌的生长繁殖,造成艰难梭菌等对对甲酚不敏感的革兰氏阳性肠道细菌具备生存优势,进而导致肠道菌群组成及多样性的改变;而艰难梭菌正是肠道中产生对甲酚最多的细菌,其相对丰度升高又会进一步造成肠道中对甲酚水平升高。
▸过量的对甲酚促使菌群失衡,失衡的菌群进一步升高对甲酚水平
即肠道中过量的对甲酚促使肠道菌群失衡,失衡的肠道菌群又可进一步升高肠道中的对甲酚水平并加剧菌群的失衡。
关于对甲酚及其代谢物对炎症性肠病病因的影响数据很少。一项研究发现,克罗恩病患者尿液中p-CS的含量低于健康对照组,这提出了炎症性肠病患者结肠细胞中对甲酚代谢/解毒可能受影响的假设。
▸损害肠道上皮细胞,屏障功能受损
研究发现,对甲酚可通过抑制结肠上皮细胞线粒体呼吸链造成ATP产量减少,并促使结肠上皮细胞产生超氧阴离子引发DNA损伤,导致结肠上皮细胞活性及增殖能力受损,造成结肠上皮细胞层完整性受损、细胞间透过性增加,说明对甲酚可通过损害肠道上皮细胞造成肠道屏障功能受损。
使用人Caco-2结肠细胞单层,1600-6000µM的对甲酚剂量依赖性地增加了细胞之间的旁运输,表明高浓度对甲酚可诱导肠屏障功能的改变。在后续研究中,水果提取物中的多酚混合物阻止了对甲酚诱导的旁运输变化,但植物提取物中化合物发挥作用的机制仍需进一步确定。
★ 对甲酚是肠道菌群参与自闭症发生的重要介质
过量的对甲酚被怀疑会对中枢神经系统产生有害影响,这种影响可能与自闭症谱系障碍(ASD)的病因有关。对甲酚、对甲酚硫酸盐在自闭症谱系障碍(ASD)患者体内水平升高且与异常行为的程度呈明显的正相关关联,说明对甲酚可能是肠道菌群参与ASD发生发展的重要中介物质。
有什么证据支持尿液和粪便中对甲酚含量升高可能作为ASD早期有价值的生物标志物,并可能在自闭症病因中发挥作用?接下来将介绍对甲酚在自闭症谱系障碍(ASD)中的潜在致病机制及其与ASD病因和生理变化的关系。
▸自闭症儿童粪便和尿液中对甲酚含量高于正常儿童
首先,与年龄和性别匹配的对照儿童相比,自闭症儿童晨尿中对甲酚浓度较高。这些浓度差异在7岁前都能明显检测到。在另一项研究中,8岁以下的自闭症幼儿尿中对甲酚及其共代谢物对甲酚硫酸盐(p-CS)和对甲酚葡糖苷酸(p-CG)含量高于同年龄、同性别的对照儿童,但在大一点的儿童中则没有。
尿中对甲酚和对甲酚硫酸盐的水平与刻板印象和强迫/重复行为有关。另外两项研究也对自闭症儿童和对照组儿童粪便中的对甲酚进行了测量,结果表明自闭症儿童粪便中对甲酚含量高于对照组儿童。
▸额外注射对甲酚会导致焦虑行为及大脑结构发生改变
在小鼠模型中,单次静脉注射1mg/kg的对甲酚可诱导焦虑和运动活动增加。在10mg/kg的较高剂量下,对甲酚加剧了小鼠自闭症的核心症状,并显著减少了小鼠之间的社会互动偏好。此外,研究中进行了脑区特异性神经化学分析,结果表明这些行为变化与大脑某些区域(如杏仁核、伏隔核和背尾状壳核)多巴胺周转量的剂量依赖性增加相关。
值得指出的是,自闭症不应该仅仅被视为一种“脑部疾病”,因为免疫系统和消化道的异常也存在于自闭症。
大鼠腹腔注射对甲酚(30mg/kg)可改变伏隔核和海马体中N-甲基-D-天冬氨酸谷氨酸受体(NMDARs)亚基的表达,表明对甲酚可能损害这些结构中NMDAR依赖的活性。NMDARs在学习、记忆和突触发育中发挥核心作用。
此外,对甲酚在体外抑制少突胶质细胞的分化,这些细胞是中枢神经系统的髓磷脂形成细胞,源自胶质祖细胞。
中脑边缘多巴胺奖赏环路的正常激活是形成社会动机和产生奖励行为的基础。奖赏环路的激活可产生愉悦感并促进相关奖赏行为的重复,同时促进社交意向等社会动机的形成;而其激活失常则可能导致重复刻板行为和社会交往障碍等ASD核心症状。
该环路由中脑腹侧被盖区(VTA)的多巴胺神经元通过释放多巴胺,向伏隔核、杏仁核和前额叶皮质等脑区的多巴胺敏感神经元发出投射,从而调节行为动机与奖赏反馈。
目前,临床神经影像学技术已观察到ASD患者中脑腹侧被盖区(VTA)与伏隔核之间的结构性和功能性损伤,并在多种ASD模型小鼠中检测到奖赏环路下游神经元兴奋性降低,提示多巴胺奖赏环路受损可能是ASD的重要潜在发病机制。
▸补充对甲酚后社交缺陷加重、多巴胺及其代谢产物水平升高
研究表明对甲酚可能是诱发自闭症谱系障碍(ASD)的重要机理。ASD模型小鼠在服用对甲酚后,其社交缺陷、刻板行为和焦虑样行为明显加重,且在伏隔核等脑区内多巴胺及多巴胺代谢终产物高香草酸的水平显著升高,提示对甲酚可提高多巴胺在奖赏环路中的蓄积与代谢水平;而健康小鼠在服用对甲酚后不仅既可呈现出社交缺陷和重复刻板行为等AS样表现,其VTA多巴胺神经元的兴奋性和兴奋传导能力也显著降低,表现为神经元动作电位的产生数量减少、自发性兴奋性突触后电流的频率和振幅降低,这一现象符合由血清皮质酮升高所引发的神经生理改变。
DOI︰10.20059/j.cnki.pps.2023.08.1011
▸奖赏环路功能受损、神经元兴奋性受抑制
此外,研究还发现升高血清对甲酚硫酸盐水平可显著提升小鼠的血清皮质酮水平,皮质酮是一种受下丘脑和垂体调控、由肾上腺皮质分泌的激素,通常在机体应激时分泌增加从而升高血糖并使精神紧张。提高血清皮质酮水平会提高应激反应,从而造成社交活动减少等ASD样症状。给予其口服式活性炭AST-120则可同时降低其血清对甲酚硫酸盐水平和血清皮质酮水平。
注释:AST-120是一种口服式活性炭,服用后可通过物理作用非特异性地吸附肠道中的酚类物质及其他芳香族化合物并随着肠道的蠕动排出体外,目前已在临床上应用于肾功能衰竭患者的治疗康复。
以上结果说明,对甲酚在体内被代谢为对甲酚硫酸盐后,可引发肾上腺糖皮质激素分泌增加,进而引发奖赏环路中多巴胺水平异常升高和多巴胺D2受体过度激活,造成奖赏环路功能受损、神经元兴奋性和兴奋传导受抑制,进而导致自闭症相关行为异常。
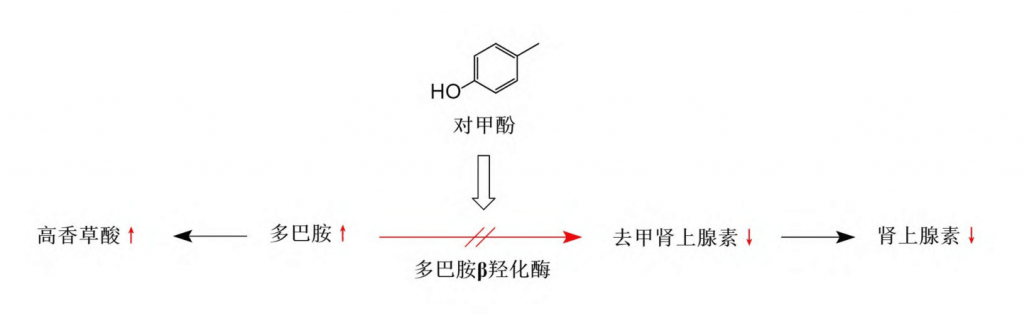
▸抑制多巴胺β羟化酶活性
此外,体外实验还发现对甲酚可使多巴胺β羟化酶不可逆地失去活性,而该酶是催化多巴胺向去甲肾上腺素转化的关键酶。
这一结果说明对甲酚除了可以通过升高血清肾上腺糖皮质激素提高VTA中的多巴胺水平以外,还可能通过抑制多巴胺向去甲肾上腺素的转化从而进一步导致神经系统及奖赏环路中多巴胺的蓄积以及多巴胺代谢水平升高,继而参与ASD的发病机制。
综上所述,对甲酚可能通过提高肾上腺糖皮质激素的分泌和抑制多巴胺β羟化酶的活性,导致多巴胺蓄积并引发中脑边缘多巴胺奖赏环路损伤,进而参与社交障碍等ASD症状的发生发展。
大脑前额叶皮质负责调控情绪、认知、决策等高级功能,参与威胁性刺激的解析评估、恐惧记忆的储存与消退并调节应激反应。临床研究显示ASD患者前额叶皮质的功能以及与其他脑区的连接性明显降低,小鼠实验表明社交障碍等ASD症状与前额叶皮质中多种神经元兴奋性异常有关,提示该脑区功能异常可能是诱发ASD的重要病因。
▸对甲酚硫酸盐诱发氧化应激和神经炎症
有研究发现对甲酚硫酸盐可在小鼠前额叶皮质中蓄积并诱发氧化应激与神经炎症,造成前额叶皮质神经元和神经干细胞受损凋亡。在服用AST-120后,该小鼠前额叶皮质中对甲酚硫酸盐的水平显著下降,同时前额叶皮质的氧化应激与神经炎症水平明显降低,神经元与神经干细胞的活性损伤得以修复,小鼠行为异常与ASD样症状随之得到改善,说明对甲酚硫酸盐可能通过影响前额叶皮质功能从而参与ASD的发病机制。
▸对甲酚硫酸盐可增加CD68的表达
研究还发现,对甲酚硫酸盐显著增加小鼠前额叶皮质中CD68分子的表达,而前额叶皮质中对甲酚硫酸盐水平的降低伴随CD68表达水平的下降。CD68可激活小胶质细胞,参与脑内免疫应答并介导炎症反应。
多项临床研究表明,ASD患者脑内小胶质细胞密度增加且过度激活,导致的神经系统炎症可能是引发ASD症状的重要因素。这提示对甲酚硫酸盐可能通过间接激活小胶质细胞,导致前额叶皮质的神经炎症与功能损伤,从而引发ASD症状。
▸自闭症患者存在线粒体功能障碍
线粒体是细胞中直接能源物质腺苷三磷酸(ATP)的产生场所,同时也参与细胞的应激反应与自噬凋亡。ASD患者常伴随线粒体功能障碍,临床上已借助脑磁共振波谱成像在ASD患者的多个脑区观察到线粒体功能障碍。
线粒体中的谷胱甘肽能起到解毒和抗氧化的作用,有助于维持线粒体内氧化还原反应平衡,保障线粒体产能功能的正常行使。肠道宏基因组测序显示,在ASD患者的肠道菌群中,谷胱甘肽合成酶及相关通路出现明显缺陷,说明肠道菌群的潜在线粒体保护功能受损;血液学检测显示ASD患者血浆中还原型谷胱甘肽与氧化型谷胱甘肽的比例明显降低,ASD患者有可能存在较为广泛的线粒体功能障碍。
▸耗竭细胞中的还原型谷胱甘肽
体外实验发现,对甲酚和对甲酚硫酸盐可耗竭细胞中的还原型谷胱甘肽,并显著提升胞内氧化型谷胱甘肽的水平。体内实验也发现对甲酚硫酸盐可显著降低小鼠前额叶皮质中的还原型谷胱甘肽水平,而通过服用AST-120降低小鼠体内的对甲酚硫酸盐能有效恢复前额叶皮质中的还原型谷胱甘肽水平。
谷胱甘肽的合成减少与解毒功能减弱是可能造成线粒体功能障碍并引发ASD症状的重要机制。
研究发现,对甲酚硫酸盐可增强细胞对葡萄糖和氧的摄取,提高线粒体的有氧呼吸,但显著降低ATP产量。这是因为对甲酚硫酸盐降低了与氮代谢和酸碱平衡相关的酶(如谷氨酰胺酶和谷氨酸脱氢酶)及抗氧化防御相关酶(如烟酰胺核苷酸转氢酶)的表达,同时激活NADPH氧化酶,导致线粒体能量消耗和氧化应激水平升高,从而引发线粒体ATP产量下降、分裂和凋亡。
上述证据反映了,对甲酚可能通过消耗细胞中的还原型谷胱甘肽、提高线粒体的氧化应激水平,造成线粒体功能障碍和能量代谢失衡,进而参与ASD的发病机制。
▸自闭症患者的肠道症状与菌群和行为异常有关
自闭症谱系障碍(ASD)患者常出现腹痛、胀气等肠道不适症状,严重者可长期伴随呕吐、便秘、腹泻等肠道功能紊乱表现,且患者的肠道症状与其行为异常之间存在程度上的显著关联。临床研究发现ASD患者肠道菌群组成失衡,提示肠道菌群失调可能是引发ASD相关行为异常的重要潜在诱因。
研究发现,将ASD患者的肠道菌群移植给无菌小鼠可导致小鼠脑中出现ASD相关基因的可变剪接,并表现出ASD样行为。特定的肠道细菌及其代谢产物能够调节小鼠行为并诱发ASD样表现,而移植健康人肠道菌群则不会引发这些变化。
▸过量的对甲酚导致肠道菌群紊乱及ASD症状
进一步研究发现,长期服用对甲酚的小鼠出现肠道菌群紊乱和社交障碍等ASD样症状。将这些小鼠的肠道菌群移植给健康小鼠后,后者也表现出ASD样症状和肠道中对甲酚水平上升。而将另一健康小鼠的肠道菌群移植给长期服用对甲酚的小鼠,则可降低其肠道中对甲酚水平,缓解VTA神经元兴奋性异常,并改善ASD样行为。
肠道中的对甲酚水平和肠道菌群失衡存在相互促进的关系。即肠道中过量的对甲酚促使肠道菌群失衡,失衡的肠道菌群又可进一步升高肠道中的对甲酚水平并加剧菌群的失衡,这可能是对甲酚参与 ASD发病机制的重要途径。
▸过量对甲酚损害肠道屏障功能
除了肠道菌群失调,肠道屏障功能受损也是ASD患者常见肠道症状的可能原因和潜在诱因。活检结果显示,75%的ASD患者小肠上皮细胞中维持肠道屏障完整性的紧密连接组分表达量减少,说明ASD患者普遍存在肠道通透性增加。这导致肠道中细菌、毒素及外源性蛋白质(包括细菌和食物来源)进入血液,成为引发ASD的潜在病因。
研究发现,对甲酚通过抑制结肠上皮细胞的线粒体呼吸链减少ATP产量,并促使细胞产生超氧阴离子引发DNA损伤,导致结肠上皮细胞活性和增殖能力受损,进而影响细胞层的完整性和增加细胞间透过性。这说明,对甲酚可能通过损害肠道上皮细胞来影响肠道屏障功能,这可能是其参与ASD发病的另一潜在机制。
编者小结
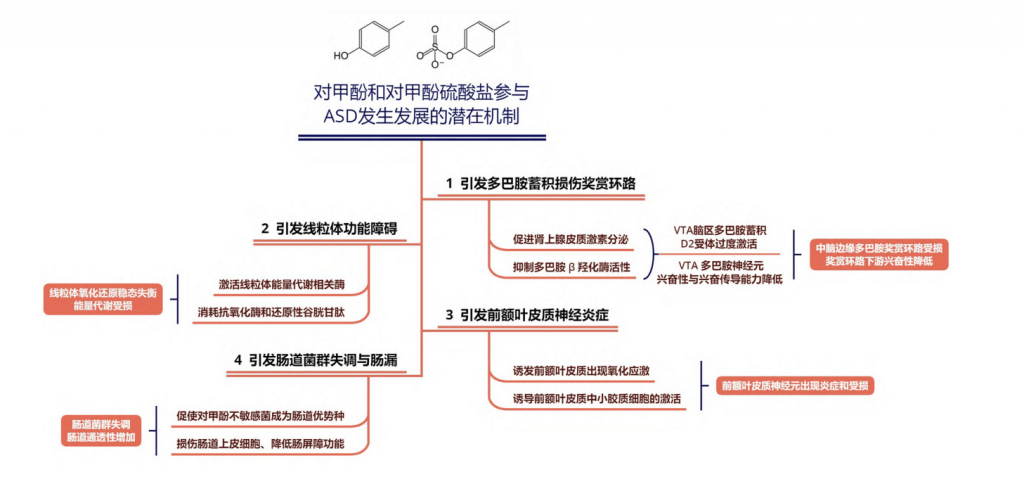
综上所述,对甲酚及其代谢产物对甲酚硫酸盐可能通过四种潜在途径参与ASD的发生发展:
①引发多巴胺蓄积和中脑边缘多巴胺奖赏环路受损;
②导致线粒体功能障碍;
③前额叶皮质神经炎症;
④以及肠道菌群失调和肠屏障功能受损。
DOI︰10.20059/j.cnki.pps.2023.08.1011
在慢性肾病(CKD)患者中,肾功能障碍的进展与血浆中蛋白结合和水溶性尿毒症溶质的积累有关。在这些尿毒症溶质中,对甲酚及其代谢物对甲酚硫酸盐(p-CS)在很大程度上被怀疑会加重CKD。因为它们与血清蛋白结合的能力很强,容易在血液中积累。
相比之下,血清中另一种对甲酚共代谢物对甲酚葡糖苷酸(p-CG)的蛋白结合程度远低于p-CS。
▸慢性肾病和透析患者血液中对甲酚浓度更高
慢性肾病和血液透析患者血液中的对甲酚和p-CS浓度远高于健康人。在血液透析患者中,总对甲酚的5-7%以游离形式存在,其余为共轭形式。CKD患者的p-CS血药浓度为50-120µM,血液透析患者为110-220µM,其中约7%以游离形式存在。相比健康人,CKD/血液透析患者的对甲酚和p-CS浓度分别高出4-19倍和4-16倍。
并且血液透析患者肾小管分泌对甲酚硫酸盐的清除率显著低于健康人,表明CKD患者的p-CS分泌受损。
对甲酚和p-CS作为尿毒症毒素参与CKD进程。一项针对CKD患者的研究显示,p-CS基线水平可预测CKD进展,而血液透析患者血清中对甲酚的游离浓度与死亡率相关。
▸对甲酚硫酸盐与肾纤维化有关
体外研究和部分肾切除小鼠经对甲酚硫酸盐(p-CS)治疗4周的体内数据表明,p-CS可能与肾纤维化相关。由于肾小管分泌是肾处理p-CS的主要途径,p-CS可能通过诱导氧化应激导致肾小管细胞损伤。
在体外,p-CS浓度为5-26µM时,会以与炎症反应相关的方式改变近端肾小管细胞的基因表达;浓度为5-260µM时,会损害线粒体功能和生物发生。此外,对甲酚在12-52µM时对肾小管细胞具有凋亡作用,而在144-577µM时可诱导细胞自噬死亡。
有趣的是,在接受维持性血液透析的终末期肾病患者中,摄入含有抗性淀粉的饮食8周能够降低血清中对甲酚浓度。此外,在透析患者中,在饮食中补充不可消化的碳水化合物可降低血浆中p-CS的浓度,从而表明这种饮食干预在减少结肠源性对甲酚的产生方面是有效的。
▸不可消化的碳水化合物有助于减轻对甲酚过量引起的症状
未消化的碳水化合物可能通过减少对甲酚在结肠的吸收间接降低其循环浓度。在慢性肾病中,尿素流入结肠后被脲酶活性细菌转化为铵,过量的铵会损伤结肠黏膜,增加通透性,并引起结肠黏液层和吸收性结肠细胞的形态学改变,同时减少短链脂肪酸氧化。
下图总结了对甲酚及其代谢物在过量时对肾细胞的有害影响。低蛋白饮食(0.6-0.8g/kg/天)通常被推荐用于延缓CKD进展和推迟透析治疗,这与高蛋白饮食显著增加肠道微生物群合成对甲酚所需l-酪氨酸正好相反。
doi: 10.1007/s00726-021-03064-x.
对甲酚及其次生代谢物作为尿毒症毒素受到广泛关注,其对心血管系统的有害影响主要来自肾病患者的观察性研究和内皮细胞的体外实验。
▸对甲酚浓度与心血管疾病风险相关
观察研究发现,血清游离对甲酚浓度是慢性肾病(CKD)患者心血管疾病的风险预测因子,而在血液透析患者中,血清游离和总对甲酚浓度与心血管事件相关。
尿中对甲酚硫酸盐(p-CS)的高排泄与CKD患者的心血管事件直接相关。血清游离对甲酚浓度与首次心血管事件的发生和心血管疾病相关,并可能预测老年人心血管疾病的死亡率。
▸不同浓度对甲酚对内皮细胞的影响
内皮功能障碍在心血管疾病发展中起重要作用,几项实验研究测试了对甲酚对内皮细胞生理的影响。
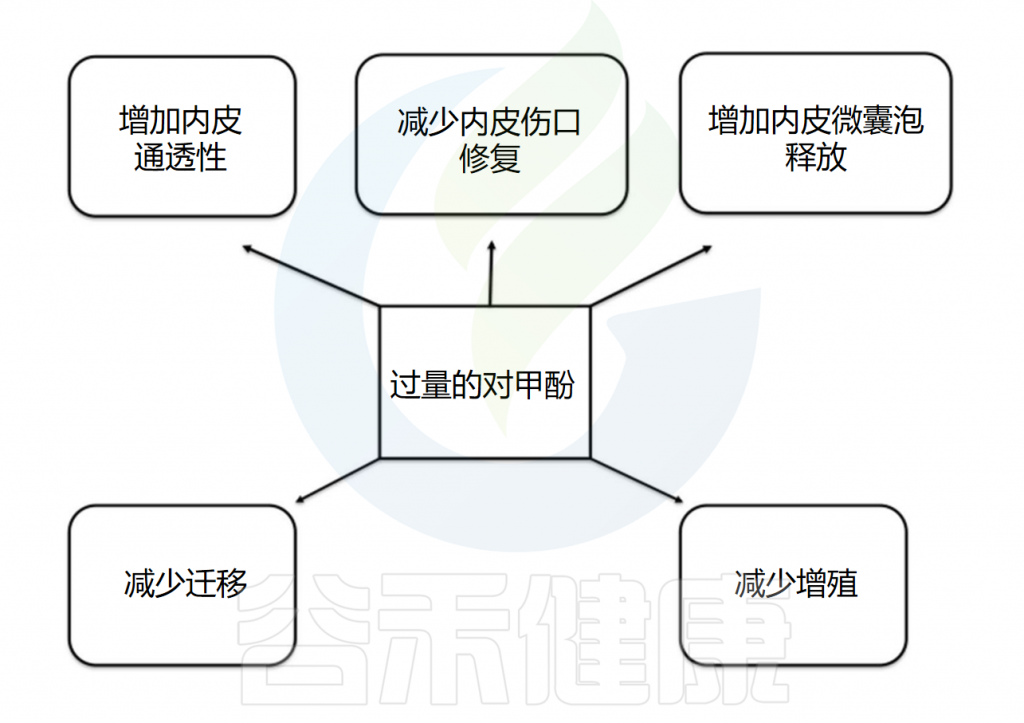
在白蛋白存在下,对甲酚浓度为100-500µM时,剂量依赖性地抑制内皮细胞增殖和伤口修复。浓度为185-739µM时,抑制作用部分源于细胞周期G0/G1期细胞的积累,伴随细胞周期抑制剂p21/WAF1/Cip1表达增强和cyclin D1表达抑制。此外,对甲酚显著增加内皮通透性,并在90-3000µM范围内导致细胞周期G2/M期积累,损害内皮祖细胞增殖和迁移。浓度为92-740µM时,其对内皮祖细胞增殖的抑制与p38和Erk1/2磷酸化的激活有关。
370µM浓度的对甲酚(自由形式或与白蛋白结合)会增加内皮细胞释放内皮微泡。内皮微泡是从活化或凋亡的内皮细胞和血细胞中释放的膜泡,大小为0.1-1.0µm,反映内皮细胞损伤程度。这些由细胞质膜起泡脱落形成的微泡被认为是调节血管生理的活跃细胞信使。内皮微泡释放的增加会降低内皮细胞迁移能力,促进成熟内皮细胞衰老,从而影响内皮修复。
▸影响内皮细胞的生物学和修复
在血液透析患者中,游离血清对甲酚浓度与循环内皮微泡的数量相关。最近有研究表明,对甲酚在230µM浓度下时,可增强内皮细胞中微囊泡的释放;当在92-920µM范围内时,可以激活内皮细胞中的整合素连接激酶。该激酶是整合素信号复合体的关键组成部分,参与血管完整性和血管生成。在体外获得的大量实验证据清楚地表明,对甲酚可能影响内皮细胞的生物学和修复。
下图概述了对甲酚对内皮细胞的影响:
doi: 10.1007/s00726-021-03064-x.
▸对甲酚过量与心肌细胞功能障碍相关
对甲酚在心肌细胞中的作用研究表明,在230-920µM范围内,对甲酚可逆地降低新生儿心肌细胞的自发收缩率,并引发间隙连接分解,说明其过量与心肌功能障碍的关联。
间隙连接在心肌细胞间的电偶联和脉冲传播中起关键作用。此外,相同浓度下,对甲酚还会破坏心肌细胞的粘附连接,可能进一步影响心肌细胞功能。
1
克里美净等药物降低对甲酚水平
▸克里美净降低对甲酚水平并改善自闭症症状
临床研究表明,给12-17岁的自闭症谱系障碍(ASD)儿童服用克里美净(AST-120),可明显降低受试儿童尿液中对甲酚硫酸盐的水平,同时显著改善了受治儿童的重复刻板行为和社会动机异常等ASD症状,并且未发现明显的不良副作用。
对于具有严重情绪障碍的ASD儿 童 还 可 显 著 降 低 其 焦 虑 和 易 怒 程度。克里美净(又名AB-2004、AST-120)是一种可食用的活性碳颗粒,可非选择性地吸附肠道内的酚类物质及其他芳香族化合物。由于AST-120本 身 并 不 参 与 体 内 生 化 反应,仅起到物理吸附作用,不会被人体所吸收,因此具有良好的安全性。这也从侧面表明临床上降低肠道中对甲酚水平具有改善孤独症症状的能力。
▸阿卡波糖减少对甲酚的生成和浓度
其他研究还发现,小肠α-葡萄糖苷酶抑制剂,如阿卡波糖(Glucobay®)可增加到达结肠的未消化碳水化合物的数量,并可降低蛋白质结合的尿毒症溶质对甲酚的生成和血清浓度。
注:本文不作为医疗建议,药物需在医生建议下服用
2
高纤维,低蛋白饮食调整
▸富含原花青素和多酚提取物的果蔬可预防对甲酚的有害作用

一项研究在暴露于对甲酚的结肠上皮细胞中评估了来自苹果、牛油果、蔓越莓、葡萄或其他含有原花青素和多酚提取物水果的保护作用。
对甲酚会显著增加乳酸脱氢酶(LDH)渗漏并降低 ATP 含量,而在Caco-2细胞中,它显著降低跨上皮电阻并增加葡聚糖的细胞旁转运。蔓越莓和牛油果中提取的原花青素类物质阻止了对甲酚诱导的细胞的改变。
原花青素细菌代谢物减少了LDH泄漏,改善了细胞活力,但未改善细胞内ATP。所有多酚提取物和原花青素细菌代谢物都阻止了对甲酚诱导的屏障功能改变。这些结果表明,含原花青素的多酚提取物和原花青素代谢物可能有助于保护结肠粘膜免受对甲酚的有害影响。
▸增加膳食纤维和抗性淀粉摄入,降低对甲酚水平
已经研究了补充纤维在降低透析前慢性肾脏病 (CKD)患者对甲酚的影响。在血液透析(HD)患者中,纤维补充已被证明可显著降低血浆对甲酚浓度。提供豌豆壳纤维和菊粉可使血清对甲酚减少24%,与低聚果糖和菊粉在HD患者中的效果相似,表明补充纤维对疾病早期患者有潜在益处。
3期和4期CKD患者在补充益生菌和6.6克/天菊粉后,15天和30天内对甲酚减少40%,需要注意的是,益生菌可能也在降低对甲酚方面发挥作用。
该研究支持这样一个结论,即提供高度可发酵的纤维,如菊粉,可能通过抑制蛋白水解和增强糖发酵来减少对甲酚的产生。豌豆壳纤维也可能通过缩短肠道运输时间来帮助减少蛋白水解发酵从而减少对甲酚的产生。
还有研究比较了食用抗性淀粉或表没食子儿茶素没食子酸酯(EGCG)对体内对甲酚含量的影响。研究表明,抗性淀粉可以在大鼠模型中有效降低结肠和尿液中的对甲酚水平。
表没食子儿茶素没食子酸酯(EGCG):这种茶多酚中最有效的活性成分,通过调节肠道微生物群,减少对甲酚生成细菌的含量,从而降低其血浆和尿液浓度。
▸高蛋白和酪氨酸摄入会增加体内对甲酚水平
我们知道,蛋白质中的酪氨酸是对甲酚产生的原料,因此饮食中蛋白质摄入量的增加会提高粪便和尿液中的对甲酚浓度,这可能是由于蛋白质的底物l-酪氨酸在细菌代谢活动中的可用性增加。
3
通过调整肠道菌群,减少对甲酚的产生
▸减少艰难梭菌等产对甲酚的细菌
在人类肠道中存在的细菌中,梭杆菌科、肠杆菌科、梭菌科、拟杆菌科、乳杆菌科和红椿菌科,是对甲酚生产者,部分双歧杆菌科也可产生对甲酚。
其中艰难梭菌的对甲酚产量最高,可达其他细菌的10~1000倍。因此,感染艰难梭菌的患者体内可能会出现对甲酚含量升高的情况。
并且肠道中的对甲酚水平和肠道菌群失衡存在相互促进的关系。对甲酚会抑制一些革兰氏阴性肠道细菌的生长繁殖,并造成艰难梭菌等对对甲酚不敏感的革兰氏阳性肠道细菌具备生存优势,导致肠道菌群组成及多样性的改变;而艰难梭菌正是肠道中产生对甲酚最多的细菌,其相对丰度升高又会进一步造成肠道中对甲酚水平升高。
因此,减少艰难梭菌等产对甲酚的细菌,相当于对“生产机器”进行了阻断,减少了体内对甲酚的产生。
▸产乳酸细菌有助于抑制对甲酚
乳酸是另一种细菌代谢产物,已被证明可以在体外减少细菌对甲酚的产生。利用这一特点,我们推测提升产乳酸细菌的丰度有助于减少对甲酚的产生。
嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei)、长双歧杆菌(Bifidobacterium longum)、婴儿双歧杆菌(Bifidobacterium infantis)和乳链球菌(Streptococcus lactis)是常见的产乳酸细菌,一些发酵乳制品及益生菌产品中常有其存在,通过提高其肠道占比可能有助于减少对甲酚的产生。
▸一些粪肠球菌菌株有助于对甲酚的解毒

还有研究发现,粪肠球菌(Enterococcus faecalis)的三个菌株(UTD-1、UTD-2和UTD-3),能够以很高的速率降低细胞外对甲酚浓度(30μg/ml),说明肠道分离株粪肠球菌可能是减轻对甲酚危害的潜在候选方法。
▸粪菌移植使肠道菌群正常化也降低了自闭症患者的对甲酚水平
此外,临床研究发现粪菌移植治疗可持续降低自闭症儿童肠道中过高的对甲酚水平,并且可以改善患者的肠道不适以及情绪和行为异常。
同时也进一步提示,菌群失调造成菌群代谢物紊乱继而引发肠道功能失调和菌肠脑轴失衡可能是自闭症的重要潜在病因,对甲酚等菌群代谢物具有作为 自闭症诊断和治疗靶标的潜力。
4
短期合生元治疗有助于降低对甲酚水平

一项初步研究调查了Probinul-neutro®(一种使肠道菌群正常化的合生元)是否可以降低血浆对甲酚浓度并减轻未透析慢性肾脏病(CKD)患者的胃肠道症状。
每包含有冻干细菌(5×109植物乳杆菌、2×109干酪乳杆菌亚种和2×109加氏乳杆菌、1×109婴儿双歧杆菌和1×109长双歧杆菌、1×109嗜酸乳杆菌、1×109唾液乳杆菌和1×109产孢乳杆菌和5×109嗜热链球菌)、益生元菊粉(2.2克;VB Beneo Synergy 1) 和1.3克木薯淀粉。
在两组中观察到对甲酚的相反变化:在接受安慰剂治疗的患者中,观察到但不显著的增加趋势,而在合生元组中显著降低。治疗开始后15天,血浆总对甲酚浓度比基线低约40%,然后一直保持在该水平直到研究结束。
这种影响可能源于共生诱导下肠道中产生对甲酚的细菌减少。益生菌和益生元成分均可调节肠道微生物组,合生元干预可显著降低3-4期慢性肾脏病患者的血浆总对甲酚浓度。
自闭症谱系障碍(ASD)患者的肠道菌群及体内对甲酚水平与健康人群相比呈现出显著差异,菌群多样性较低,产对甲酚细菌显著增多,并且对甲酚水平明显偏高。
对甲酚过量可能通过:①引发多巴胺蓄积和中脑边缘多巴胺奖赏环路受损;②导致线粒体功能障碍;③前额叶皮质神经炎症;④以及肠道菌群失调和肠屏障功能受损这几个方式促进自闭症的发展。
对甲酚水平过高还会导致肠道菌群失调和肠道屏障功能受损,菌群失调造成菌群代谢物紊乱继而引发肠道功能失调和肠脑轴失衡及一些代谢物通过“肠漏”进入血液可能是自闭症的重要潜在病因,对甲酚、对甲酚硫酸盐等菌群代谢物具有作为自闭症诊断和治疗靶标的潜力。
此外,对甲酚作为一种“尿毒症毒素”对肾脏和心血管的危害也不容小觑,在肾小管细胞中,对甲酚和对甲酚硫酸盐增加氧化应激,影响线粒体功能,并导致细胞死亡,加重慢性肾脏疾病进展。它还影响内皮细胞的增殖和迁移,降低内皮伤口修复的能力,增加内皮细胞的衰老,并与心肌细胞功能障碍相关。
《黄帝内经》中曾提到,“上医医未病,中医医欲病,下医医已病”。自闭症和慢性肾病一旦确诊,想要完全治愈极为困难,及时并准确地获取体内对甲酚水平和肠道菌群组成,可能是提前预测并预防自闭症和慢性肾脏疾病的一个方法。
谷禾的肠道菌群检测,能够以较为快速且精准的方式,获取人体肠道菌群的组成情况、菌群的多样性和占比以及包括对甲酚、吲哚等重要的菌群代谢物等关键信息。根据这些检测结果和数据,可以更有针对性地制定个性化的治疗方案或预防措施,做到对症下药。这不仅大大提高了治疗的效果,还能减少不必要的治疗手段和药物使用,为人们的健康提供更精准、有效的保障。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Blachier F, Andriamihaja M. Effects of the L-tyrosine-derived bacterial metabolite p-cresol on colonic and peripheral cells. Amino Acids. 2022 Mar;54(3):325-338.
Toft PB, Vanslette AM, Trošt K, Moritz T, Gillum MP, Bäckhed F, Arora T. Microbial metabolite p-cresol inhibits gut hormone expression and regulates small intestinal transit in mice. Front Endocrinol (Lausanne). 2023 Jul 18;14:1200391.
Stewart Campbell A, Needham BD, Meyer CR, Tan J, Conrad M, Preston GM, Bolognani F, Rao SG, Heussler H, Griffith R, Guastella AJ, Janes AC, Frederick B, Donabedian DH, Mazmanian SK. Safety and target engagement of an oral small-molecule sequestrant in adolescents with autism spectrum disorder: an open-label phase 1b/2a trial. (2022) Nature Medicine, Advance online publication.
Chen B, Morioka S, Nakagawa T, Hayakawa T. Resistant starch reduces colonic and urinary p-cresol in rats fed a tyrosine-supplemented diet, whereas konjac mannan does not. Biosci Biotechnol Biochem. 2016 Oct;80(10):1995-2000.
Meijers BK, Claes K, Bammens B, de Loor H, Viaene L, Verbeke K, Kuypers D, Vanrenterghem Y, Evenepoel P. p-Cresol and cardiovascular risk in mild-to-moderate kidney disease. Clin J Am Soc Nephrol. 2010 Jul;5(7):1182-9.
Salmean YA, Segal MS, Palii SP, Dahl WJ. Fiber supplementation lowers plasma p-cresol in chronic kidney disease patients. J Ren Nutr. 2015 May;25(3):316-20.
Vijayasarathy M, Kiran GK, Balaji S, Jabastin J, Bruntha Devi P, Brindha Priyadarisini V. In Vitro Detoxification Studies of p-Cresol by Intestinal Bacteria Isolated from Human Feces. Curr Microbiol. 2020 Oct;77(10):3000-3012.
Chang MC, Chang HH, Chan CP, Yeung SY, Hsien HC, Lin BR, Yeh CY, Tseng WY, Tseng SK, Jeng JH. p-Cresol affects reactive oxygen species generation, cell cycle arrest, cytotoxicity and inflammation/atherosclerosis-related modulators production in endothelial cells and mononuclear cells. PLoS One. 2014 Dec 17;9(12):e114446.
Wong X, Carrasco-Pozo C, Escobar E, Navarrete P, Blachier F, Andriamihaja M, Lan A, Tomé D, Cires MJ, Pastene E, Gotteland M. Deleterious Effect of p-Cresol on Human Colonic Epithelial Cells Prevented by Proanthocyanidin-Containing Polyphenol Extracts from Fruits and Proanthocyanidin Bacterial Metabolites. J Agric Food Chem. 2016 May 11;64(18):3574-83.

谷禾健康

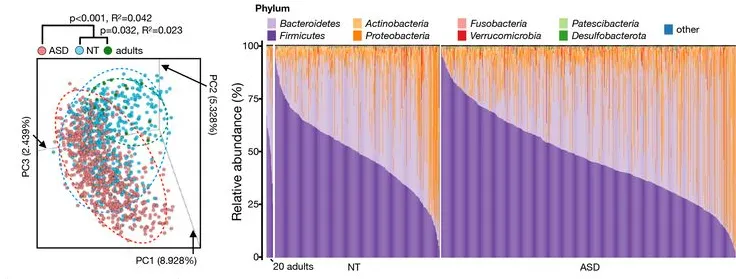
自闭症谱系障碍 (ASD) 是一组神经发育疾病,其特征是社交互动和沟通的质量障碍、兴趣受限以及重复和刻板行为。
环境因素在自闭症中发挥重要作用,多项研究以及谷禾队列研究文章表明肠道微生物对于自闭症的发生和发展以及存在明显的菌群和代谢物的生物标志物。
doi: 10.1136/gutjnl-2021-325115.
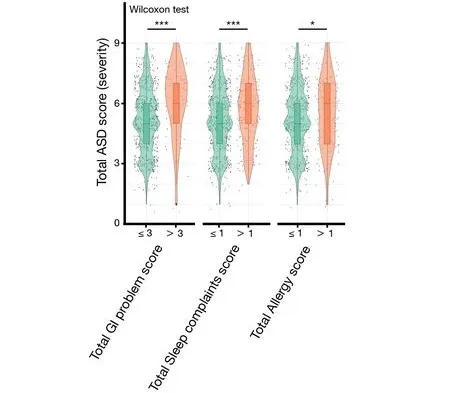
尽管环境因素在自闭症中发挥重要作用,但几乎没有确凿的证据将饮食与疾病的发生和进展联系起来。然而,最近关于饮食如何塑造肠道-大脑轴的研究可能会为环境对疾病机制的影响提供新的见解,并提出至少通过饮食改善某些自闭症谱系障碍症状的可能性。
此外,在谷禾检测实践过程中,也发现部分自闭症儿童的消化功能,以及饮食营养存在问题,主要集中表现为挑食,消化不良等。
doi: 10.1136/gutjnl-2021-325115.
本文参考以往相关研究性文章,详细讨论饮食和肠道微生物群-肠-脑轴如何影响自闭症,主要概述肠道微生物群对分子代谢(各类氨基酸、γ-氨基丁酸、不饱和脂肪酸、短链脂肪酸、胆固醇、丁酸盐、乙酸盐、N-乙酰天冬氨酸、多酚等)和与自闭症发病和进展相关的酶(二糖酶、己糖转运蛋白和单羧酸转运蛋白等)。还回顾了饮食模式、益生菌和肠道微生物群在大脑发育中的作用及与自闭症的关联,这些都为自闭症的干预策略提供了重要的理论支持。
自闭症谱系障碍 (ASD) 是一组神经发育疾病,一般在 3 岁之前发病,其特征是社交互动和沟通的质量障碍、兴趣受限以及重复和刻板行为。
直到几十年前,自闭症谱系障碍还被认为相当罕见,但自 20 世纪 80 年代以来,全世界自闭症谱系障碍快速增加,这给自闭症谱系障碍患者的家庭和整个社会带来了重大的后果。
目前在临床上自闭症谱系障碍的诊断仍然是根据行为来定义的,通过详细的发展史、父母对孩子日常行为的描述以及对孩子的社交互动方式以及沟通和智力功能的直接评估。
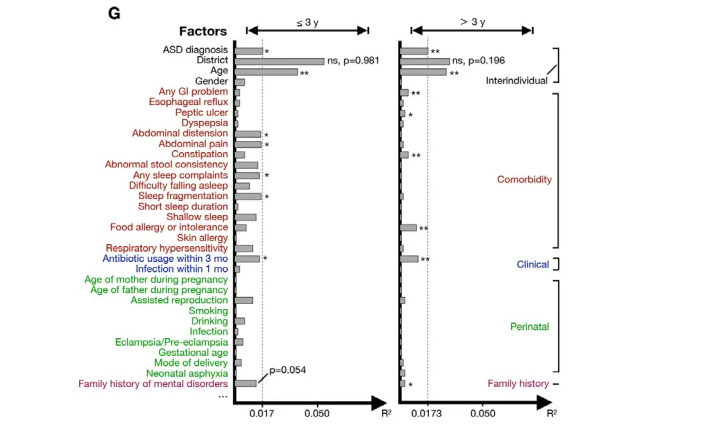
一个重要问题让人对自闭症表型发病机制的理解变得更加复杂,简而言之,自闭症谱系障碍的发病和表现远非同质:
此外,除了核心症状之外,这些儿童通常还表现出一系列其他相关特征,例如:
doi: 10.1136/gutjnl-2021-325115.
饮 食
人体必需氨基酸必须由食物供给,喂养可能代表环境因素和神经生物学因素之间的桥梁,因此可能在导致疾病表型的途径中发挥作用。从临床经验和文献中都知道,自闭症儿童往往与喂养和饮食态度有特殊的关系。
部分自闭症儿童可能有进食困难及胃肠道症状,对食物的味道和颜色非常挑剔。因此,自闭症儿童必需氨基酸 (赖氨酸、色氨酸、苯丙氨酸、组氨酸) 减少,可能部分是由于食物摄入不足或饮食习惯不良所致。
非常有限的饮食可能会使任何儿童面临营养缺乏和发育不良的风险,包括大脑发育。
遗 传
强有力的证据支持遗传因素对自闭症和相关疾病的疾病风险有影响。
然而,与自闭症风险有关的许多不同基因编码参与各种生理过程的各种不同蛋白质,包括大脑发育和功能、神经递质受体或转运蛋白、细胞粘附/屏障功能蛋白、免疫相关蛋白、参与胆固醇代谢或运输的蛋白质,以及影响线粒体功能的蛋白质。
近期,发表在《Cell》的一项研究对一个出生队列进行了 20多年的跟踪,详细的早期纵向问卷记录了感染和抗生素事件、压力、产前因素、家族史等饮食,在随访的 16,440 名瑞典儿童中,1,197 名患上神经发育障碍。下面一些有关自闭症风险的研究数据出自该文章:
家族病史
环 境
并非所有携带这些特定突变的个体都会患自闭症谱系障碍。最近的一项同卵双胞胎研究强调,环境因素可能解释了他们患自闭症谱系障碍相对风险的 55%,环境因素为自闭症谱系障碍型症状的出现提供了选择性压力,这些症状从各种不同的症状中出现。各种易诱发的遗传异常,结合起来会引起明显的疾病。
重大生活事件
化学物质暴露
早期感染和抗生素
儿童早期(出生至 5 岁)感染与自闭症风险增加显著相关,最显著的是第一年内中耳炎和反复湿疹。
微生物组
胃肠道症状长期以来表明,肠道和大脑之间存在着紧密联系,即”肠-脑轴”。
——胃肠道问题
在未来患有神经发育障碍的儿童中,早期胃肠道问题明显,情绪问题程度较轻。
——肠道菌群
肠道细菌可能在自闭症病理生理学中发挥一定作用。事实上,各种研究表明肠道微生物群在自闭症中发生了改变, 尽管文献中对于参与其中可能发挥作用的细菌几乎没有达成一致。
肠道细菌及其代谢产物不仅影响肠道功能和饱腹感,还可能与情绪、认知、行为、抑郁以及大脑发育等方面有关。
饮食在塑造哺乳动物代谢通量(包括神经化学物质的通量)以及塑造肠道微生物群及其活动方面具有重要作用。
例如,纤维和益生元尤其支持有益的糖分解肠道微生物群,其特征是双歧杆菌和乳酸菌的相对丰度增加以及短链脂肪酸 (SCFA) 的产生。来自水果、谷物和蔬菜等全植物食品的多酚也会影响肠道微生物群组成、免疫功能,充当抗氧化剂,防止大脑炎症并改善血脑屏障 (BBB) 功能。
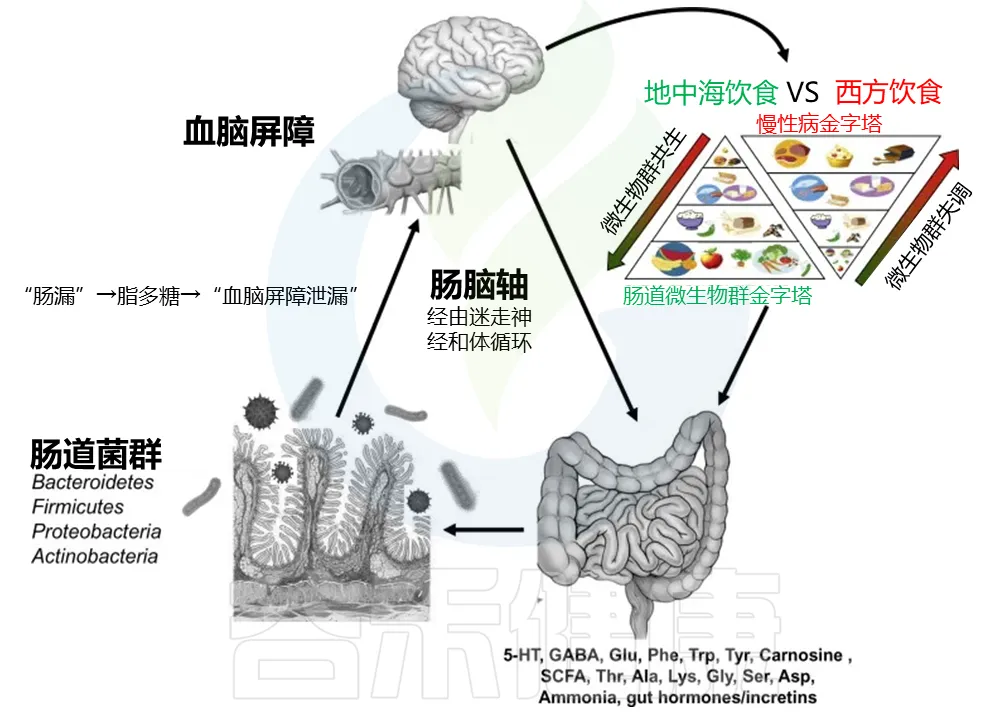
Kieran M. Tuohy, et al.,Diet and the Gut Microbiota,2015,225-245
接下来我们着重就微生物组这方面,详细探讨肠道微生物群如何在自闭症的发展中起作用,以及相关的最新研究进展。
肠-脑轴作为外部环境与人类大脑之间的沟通通路,在体内有重要的“内部”通道——人类肠道微生物群。许多营养物质和摄入的化学物质必须经过这些通道,转化为生物可利用和活跃的中间产物,然后通过肝门静脉被吸收并在全身分布。
许多对大脑重要的化学物质也由肠道微生物群在肠道中产生,包括色氨酸、多巴胺、血清素、GABA、β-羟基丁酸、胆碱、牛磺酸、乙酸盐、琥珀酸、乳酸、乙酰辅酶A、肌酐、甜菜碱、谷氨酸、谷氨酰胺、对甲酚、反式吲哚丙烯酸甘氨、脂肪酸和马尿酸。
一些其他化学物质可能由细菌(例如在消化和发酵过程中)调节,或者是细菌成分,如革兰氏阴性细菌细胞壁的组成部分脂多糖(LPS),它可剂量依赖性地减少人类肠道细胞对血清素的吸收,并在外周和大脑引发炎症,影响大脑功能。
神经递质:GABA、血清素
最近有研究表明,神经递质GABA在自闭症谱系障碍神经元发育中可能起作用,尤其是考虑到它在婴儿期从神经递质兴奋剂到抑制剂的转变。
另一种神经递质,血清素(5-羟色胺,5-HT),也被怀疑在自闭症中起作用。自闭症患者的血液中,血清素和 GABA 水平均发生了变化。有趣的是,这两种神经递质都是由氨基酸代谢产生的,分别是色氨酸和谷氨酸。
肠道代谢物是否直接影响大脑的神经发育?
取决于它们是否能够穿过血脑屏障(BBB)。
比如说,肠道细菌可以产生GABA,这个 GABA 可能会影响到肠道神经系统的工作,或者改变血液中 GABA 的含量。但是,在正常健康的情况下,肠道产生的 GABA 是不能直接穿过”血脑屏障”进入大脑的。
反之,乙酸盐作为肠道微生物群发酵碳水化合物的主要终产物和哺乳动物细胞胆固醇生物合成的底物,可以迅速通过血脑屏障。
然而,血脑屏障可能会因氧化或炎症压力等原因受到损伤,与胃肠道屏障类似出现“漏”,允许不需要的化学物质进入大脑。在自闭症患者中血脑屏障受到损伤。
为什么说肠道菌群可用于区分自闭症与非自闭症?
研究表明,肠道微生物群在影响自闭症谱系障碍(ASD)代谢产物谱和生理参数的过程中起着重要作用。
首先,自闭症患者的肠道微生物群与健康对照组或非自闭症的兄弟姐妹有显著差异,显示出异常的肠道微生物组成和活动是自闭症的一个特征。
研究报告显示,自闭症群体与非自闭症对照组之间在拟杆菌门、厚壁菌门、变形菌门和放线菌门的组成上存在差异。
前面提到的发表在《Cell》大队列的自闭症儿童研究,在 11.9 ± 2.9 个月时采集了 1,748 名婴儿的粪便样本,将所有可用的对照与未来的神经发育障碍进行比较,然后匹配风险因素和微生物组多样性混杂因素。
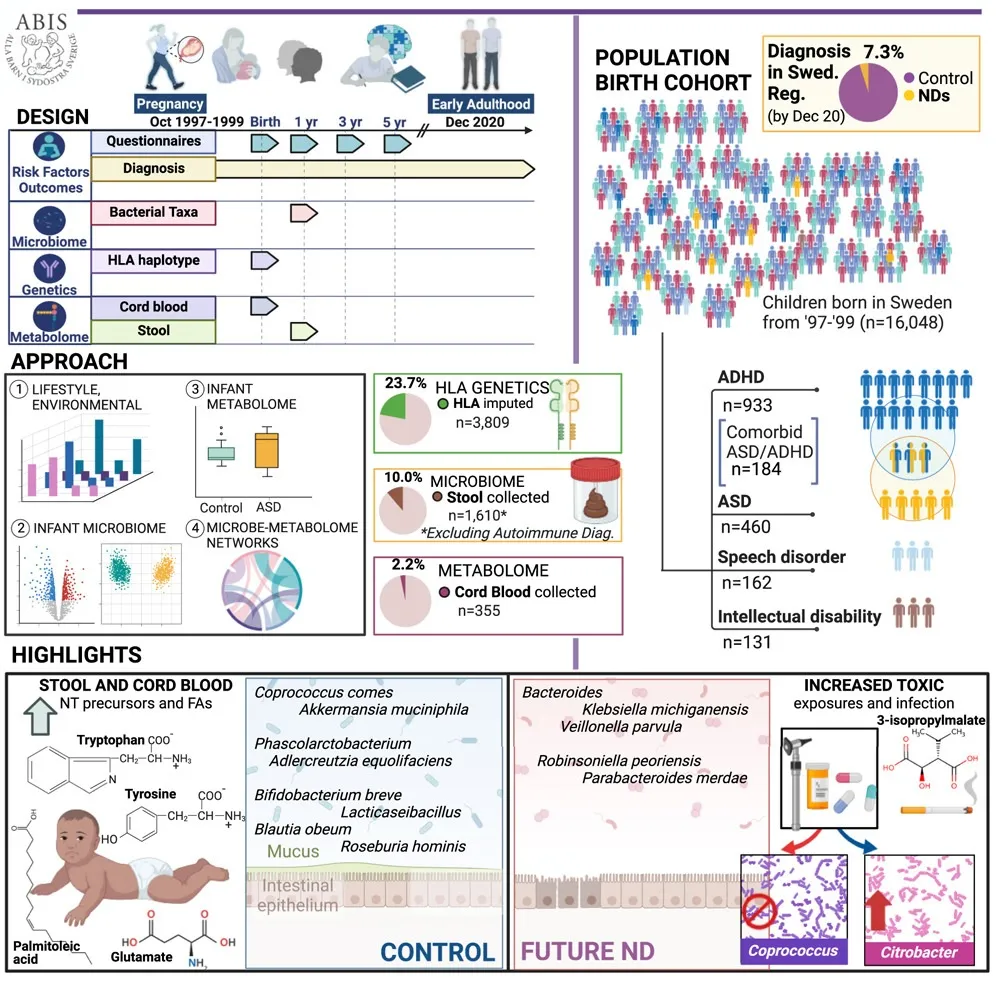
doi.org/10.1016/j.cell.2024.02.035
在未来的神经发育障碍中,下列菌群丰度较高:
在我们的GUT队列里,也发现自闭症儿童这个菌的Veillonella显著富集。
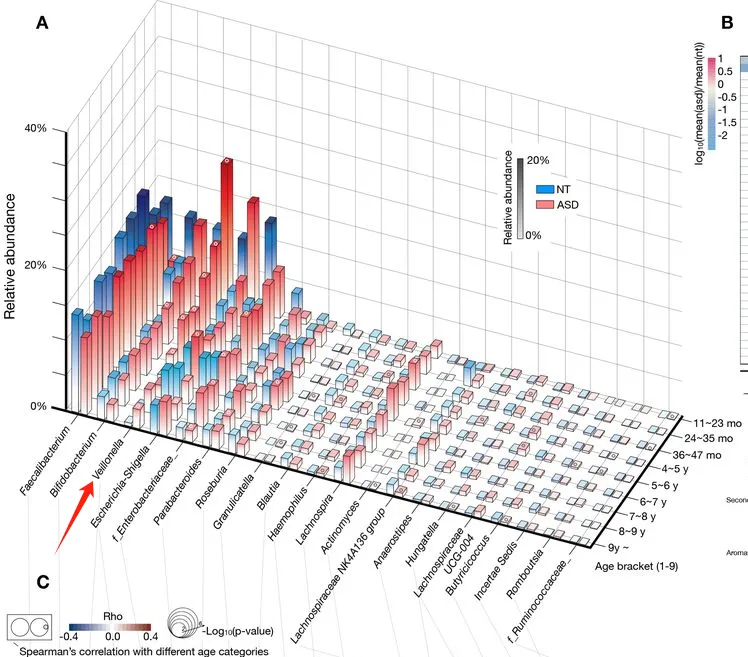
doi: 10.1136/gutjnl-2021-325115.
注:Veillonella是一种革兰氏阴性的厌氧球菌,正常情况下通常存在于人体口腔和胃肠道中。该菌以其乳酸发酵能力而闻名,能代谢乳酸产生丙酸、CO2和H2。
下列菌群始终较少富集:
这些菌属具有抗炎、维护肠道屏障、产生短链脂肪酸等有益作用,其减少可能导致肠道功能紊乱和免疫失调。
Akkermansia muciniphila在后来被诊断患有自闭症或自闭症-多动症合并的婴儿中不存在,并且与儿童早期的胃肠道和情绪症状呈负相关。
Akkermansia muciniphila促进粘蛋白并产生叶酸,丙酸和乙酸;以增强肠细胞单层完整性和强化受损的肠道屏障而闻名;并具有免疫调节特性。
doi.org/10.1016/j.cell.2024.02.035
特定菌群:
与对照组(21.7%)相比,两种Klebsiella michiganensis菌株(HCXXMCOL0180 和 HCXXMCOL0513)在自闭症儿童中更普遍(43.6%),携带这两种菌株的婴儿日后患自闭症的风险更高。
携带这两种菌株的对照组婴儿抗生素使用频率更高(27.1%),提示抗生素暴露可能促进了这些菌株的定植。
性别和诊断年龄影响:
菌群自闭症男童的肠道菌群组成可能因诊断年龄不同而异,如晚期诊断与Akkermansia muciniphila丰度增加相关,而这种模式在女童中并不明显,女童中一些Bacteroides菌株丰度升高。
而早期诊断男童,Enterobacteriaceae科一些菌属如Enterobacter、 Klebsiella丰度升高。
这提示自闭症的肠道菌群变化可能具有性别特异性,且随年龄和病程进展而动态变化。
代谢物异常与菌群相关:
粪便代谢组学分析显示,自闭症儿童的某些代谢物如酪氨酸、色氨酸(儿茶酚胺、血清素前体)、精氨酸、赖氨酸等氨基酸,亚油酸等脂肪酸以及维生素B6等水平异常。
注:关于氨基酸,脂肪酸等详细介绍与自闭症的关联详见后面章节。
精氨酸水平与Roseburia、Coprococcus、Akkermansia丰度呈正相关,提示菌群失调可能影响宿主氨基酸代谢。
色氨酸代谢产物:吲哚-3-乙酸盐(AhR激动剂)在自闭症组中升高,且与Ruminococcaceae和Lachnospiraceae科菌属丰度正相关。
其他的一些与自闭症相关菌群的研究结果:
多样性降低
一些菌群减少,包括:
一些菌群增多,包括:
下列菌群可作为3-6岁有胃肠道症状儿童自闭症的可靠生物标志物:
菌群代谢产物LPS→慢性炎症→血脑屏障损伤
研究表明,细菌脂多糖(LPS)会引发慢性低度系统性炎症或“代谢性内毒素血症”,在动物模型中,这被证明会损害包括血脑屏障(BBB)在内的屏障功能。实际上,出生期暴露于LPS引发的系统性炎症的小鼠表现出永久性的血脑屏障损伤和渗透性增加,且在青少年和成年期表现出行为改变。对自闭症患者而言,血脑屏障功能的永久性损害将只会加剧肠道微生物及异常代谢产物输出所带来的病理后果。
母亲妊娠期:LPS诱导的系统性炎症如何影响孩子神经发育,增加自闭症风险?
妊娠期由LPS诱导的系统性炎症可以改变后代的神经发育和脑功能。自闭症中的这种先天性或细胞介导的炎症反应,可能会因获得性免疫系统中明显的自身免疫成分而加剧。由系统性炎症或母体自身免疫疾病触发的自身抗体在妊娠期间产生,现在被怀疑在胎儿异常神经发育和受损的血脑屏障发展中起作用,并影响婴儿期的大脑功能,包括增加自闭症的风险。
肠道菌群失调诱导产生自身抗体,影响神经系统发育
在自闭症患者中,对叶酸、血清素和GABA受体的自身抗体水平,以及一些重要的免疫相关酶如转谷氨酰胺酶2的抗体水平也有所升高。尽管自身抗体生成的分子触发机制尚不完全了解,但有一个可能性是,对关键代谢物如神经递质受体的自身抗体可能是在血液中异常代谢物浓度、早期生活中的不当免疫教育或由肠道细菌模拟引导下由免疫系统产生的。
这样的“代谢组-炎症组”调控网络也在其他自身免疫性疾病中出现,包括1型糖尿病和炎症性肠病(IBD),并且似乎与肠道微生物群密切相关。
氨基酸代谢在神经传递相关代谢物的生物合成中扮演着重要角色,长期以来被怀疑在自闭症谱系障碍中发挥作用。
血液分析氨基酸变化
Glu:Gln比率升高
有许多研究报告称,自闭症患者的血液中谷氨酸与谷氨酰胺(Glu:Gln)的比率升高。
将谷氨酸转化为谷氨酰胺是大脑中处理氨废物的主要方式,这对于避免氨中毒和在突触中谷氨酸的过度积累以减少兴奋性毒性非常关键。因此,血液中Glu:Gln比率的升高可能表明自闭症患者大脑中的氨解毒和谷氨酸循环发自闭症生了变化,这会影响行为。
注:低纤维高蛋白饮食可能会使这种氨中毒恶化,因为这样的饮食会导致肠道中的蛋白水解微生物群发酵氨基酸,从而增加系统性氨贡献。饮食中氨基酸的微生物分解会影响哺乳动物体内氨基酸的可用性和循环,也可能产生生物活性化合物,如短链脂肪酸、支链脂肪酸和生物胺。
蛋氨酸
一项包括87项研究的自闭症氧化应激生物标志物的汇总荟萃分析发现,参与甲基化循环和硫酸盐转移途径的几种代谢物异常。
蛋氨酸在硫酸盐转移途径中利用半胱氨酸合成,该途径连接蛋氨酸和谷胱甘肽的生物合成,蛋氨酸显著降低(p < 0.001),异常甲基化会增加自闭症谱系症状的风险 。
瓜氨酸
有研究发现,自闭症儿童的瓜氨酸水平与刻板行为(ADOS-2 上的 RRB 评分)之间存在正相关,且具有统计学意义。瓜氨酸和氨的累积暴露是经典瓜氨酸血症(精氨琥珀酸合成酶缺乏症)患者认知功能较差的最可靠标志。
尿液代谢物分析氨基酸变化
色氨酸
色氨酸因与自闭症症状相关而闻名,它是血清素 (5-HT) 的前体,血清素是一种抑制性单胺类神经递质,一些研究报告色氨酸水平升高,而另一些研究报告色氨酸水平降低 。
关于色氨酸,详见我们之前的文章:
苏氨酸
有研究发现,自闭症组男孩的苏氨酸含量明显高于对照组男孩。5 岁以下自闭症儿童的尿液苏氨酸含量高于 5 岁以上儿童。苏氨酸属于天冬氨酸家族,是一种蛋白质氨基酸,其分解产生乙酰胆碱酯酶 A 和甘氨酸,促进各种生理过程和整体身体稳态 ,它也可以通过影响色氨酸进入大脑,间接影响5-羟色胺的合成。
脯氨酸
有研究发现,5 岁以下自闭症儿童的脯氨酸含量明显低于 5 岁以上儿童。
与 22q11.2 染色体缺失的 CMPT158 基因型相关的脯氨酸水平异常升高,会影响自闭症谱系症状的严重程度,尤其是影响面部情绪识别、行为和认知。
β-丙氨酸
β-丙氨酸,在肉类中常见的氨基酸,会抑制肠道细胞(如Caco-2细胞)对GABA的吸收。β-丙氨酸也可以在肠道内由白色念珠菌产生的丙酸和氨反应形成,尽管这些化合物也由肠道内的许多其他微生物产生。
HPHPA
有研究报告了一种稀有代谢物3-(3-羟基苯基)-3-羟基丙酸(HPHPA)的出现。HPHPA是梭菌属细菌特有的代谢产物,会耗尽大脑中的儿茶酚胺,导致自闭症症状。
HPHPA在患有艰难梭菌感染的个体中也有发现,并且在急性精神病发作的精神分裂症患者中甚至达到非常高的水平。
以上这些研究是基于血浆、尿液氨基酸变化,血液和尿液中的氨基酸(AA)水平受许多因素影响,包括从食物中吸收的氨基酸、氨基酸和蛋白质的降解、宿主蛋白质的分泌和在粪便中的排泄。这些氨基酸相对比例的改变也可能对它们参与的代谢途径的产物产生连锁反应,包括不同神经递质的生产或相对比例。
肠道菌群代谢分析氨基酸变化
大多数氨基酸来自饮食或由体内合成,但肠道微生物群也会影响饮食氨基酸的回收以及氨基酸的生产或分解。
目前,我们对参与氨基酸生物利用度和肠道微生物群体生物转化的微生物种类或代谢过程知之甚少,对于其对神经功能的可能影响了解更少,也不清楚不同食物和食物成分如何相互作用以调节肠道微生物群对氨基酸的摄取或代谢。
有早期体外研究显示,人类肠道微生物群对氨基酸的发酵受到低pH值和可发酵纤维/碳水化合物(抗性淀粉)存在的抑制。然而,目前不知道这种过程在体内如何转化,或在自闭症等疾病状态或抗生素治疗下如何变化。
谷禾肠道菌群健康检测数据库中有这样的案例,一起来看一下:
一名5岁自闭症男孩,检测结果,自闭症为中等风险,符合实际情况。
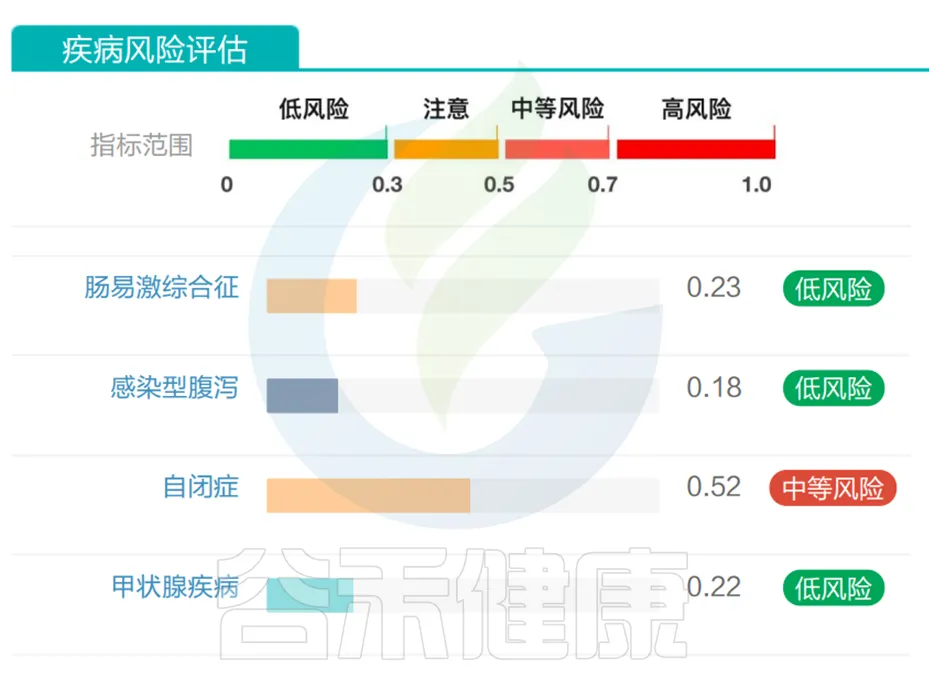
<来源:谷禾健康肠道菌群检测数据库>
这是谷禾利用几十万例的临床和人群样本数据(其中4895例自闭症患者),结合机器学习方法,使用肠道菌群数据进行疾病状态和风险的预测,并给出了的风险值。
<来源:谷禾健康肠道菌群检测数据库>
从该患者肠道菌群检测报告可以看到,蛋白质,脂肪水平都相对偏低。
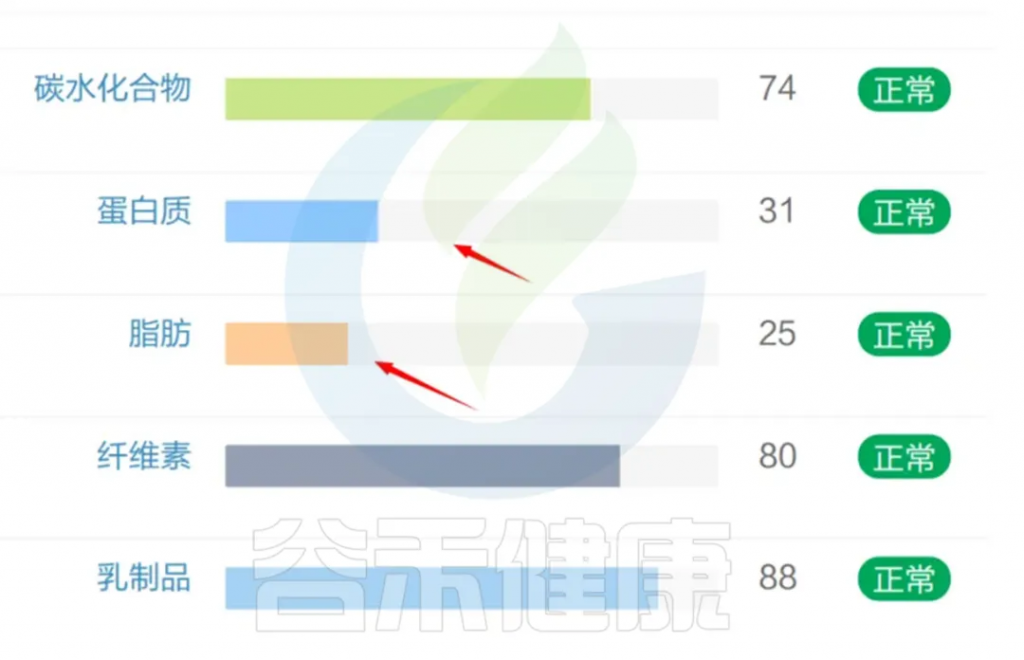
<来源:谷禾健康肠道菌群检测数据库>
我们再来看肠道菌群检测报告中的氨基酸水平,部分氨基酸严重缺乏,例如组氨酸;
其他氨基酸如酪氨酸、谷氨酸、甘氨酸、亮氨酸、赖氨酸、蛋氨酸也都相对偏低。
酪氨酸是一种与认知功能相关的儿茶酚胺前体。
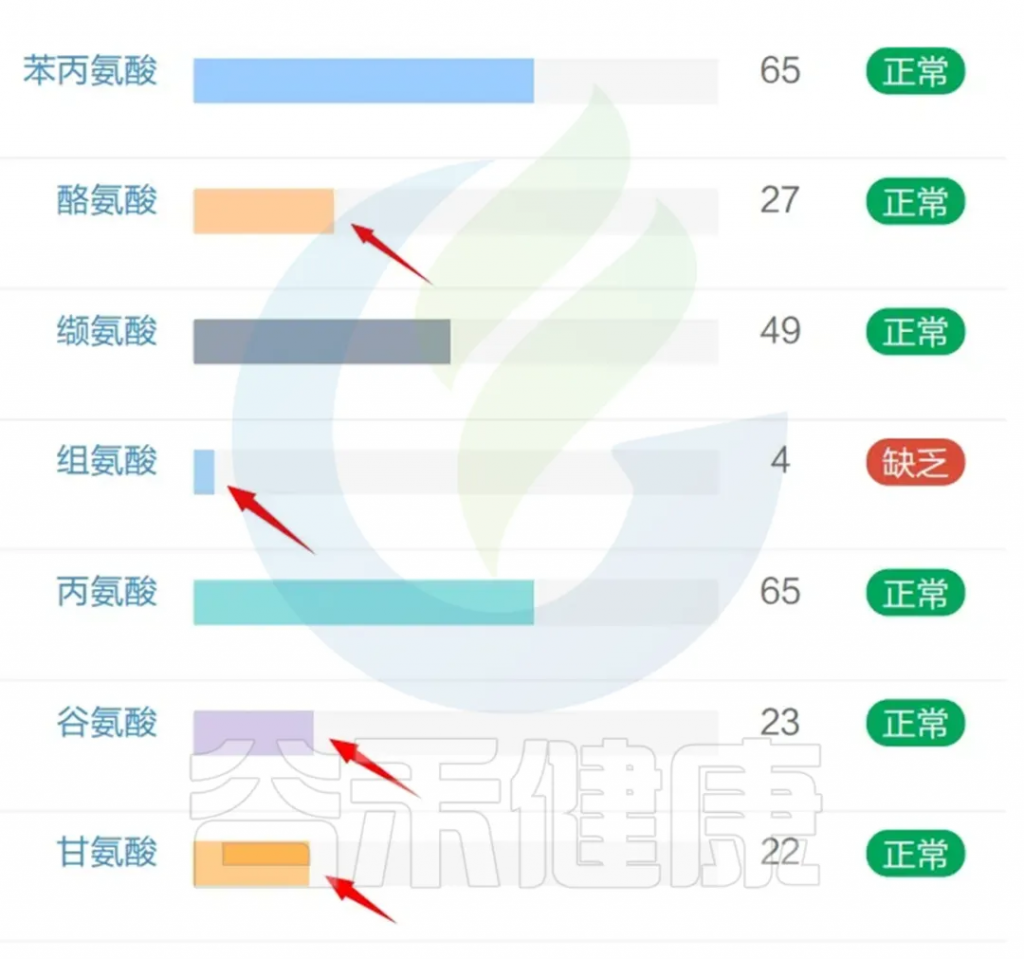
<来源:谷禾健康肠道菌群检测数据库>
组氨酸通过清除氧自由基发挥抗氧化作用,从而参与缓解氧化应激。组氨酸是肌肽的前体,肌肽是一种含有 β 丙氨酸和组氨酸的二肽,在人脑中起到缓冲剂和抗氧化剂的作用。肌肽可以调节与智力障碍相关的各种生物途径。
组氨酸是组胺的前体,而组胺是一种重要的神经递质和神经调节因子。关于组胺,详见之前的文章:
有小鼠研究显示,组氨酸缺乏的小鼠表现出一些类似自闭症的行为,如社交互动减少、刻板重复行为增多等。其他也有多项研究表明,组氨酸血症与自闭症和语言发育迟缓之间存在关联。
谷氨酸,可以调节记忆和学习等认知功能,而这些功能在自闭症患者中通常会受损,关于谷氨酸,详见谷禾之前的文章:
甘氨酸是一种具有抗炎、细胞保护和免疫调节特性的抑制性神经递质,甘氨酸以多种方式与线粒体代谢相关。
其他,赖氨酸,蛋氨酸,亮氨酸都属于人体必须氨基酸,是人体不能自行合成或以适合人体需要的速率合成的氨基酸,必须通过食物摄入来获取。
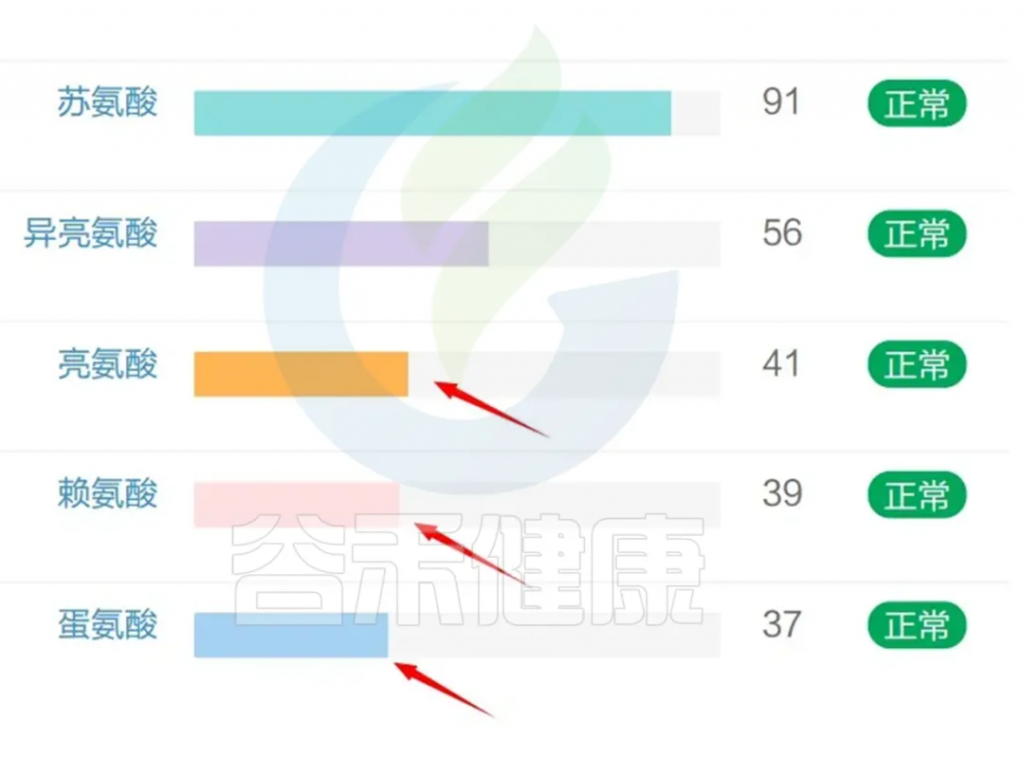
<来源:谷禾健康肠道菌群检测数据库>
亮氨酸,属于支链氨基酸,支链氨基酸生物合成与自闭症症状、甲基化潜力和细胞内 GSH 比率相关。支链氨基酸具有多种生理作用,包括调节葡萄糖和脂肪酸代谢以及调节重要的分子途径和促进蛋白质合成,它们通过琥珀酰辅酶 A 进入 CAC 与线粒体功能相连。大多数自闭症患者都会有线粒体功能障碍。
赖氨酸,是一种生酮氨基酸,通过合成谷氨酸作为其分解的副产物,参与肠道菌群-肠-脑轴。
经过几个月的干预,再次检测肠道菌群,该患者的自闭症风险有所下降,症状也有相应好转。

<来源:谷禾健康肠道菌群检测数据库>
未来患有自闭症的新生儿中关键脂质减少,如亚油酸、α-亚麻酸、胆汁酸、甘油三酯。
这些必需脂肪酸、它们的衍生物、相对比例和个体分子种类在许多哺乳动物的生理过程中起关键作用,包括磷脂生成、膜流动性和大脑发育。
亚油酸和α-亚麻酸
亚油酸和α-亚麻酸是哺乳动物不能自行合成的必需脂肪酸(EFA),必须通过饮食摄取。
注:亚油酸: LA,C18:2n-6,n-6脂肪酸的前体
α-亚麻酸: ALA,C18:3n-3,n-3脂肪酸的前体
它们对大脑具有抗炎作用,并调节自噬、神经传递和神经发生。它们通过抑制神经递质(例如GABA)的释放来调节内源性大麻素系统,从而影响突触功能和可塑性。
ARA、DHA、EPA
与其他身体组织相比,大脑中亚油酸和α-亚麻酸的浓度较低,而其衍生物,特别是ARA(花生四烯酸)和DHA(即二十二碳六烯酸)的浓度较高。
在妊娠晚期,胎儿大脑快速积累多不饱和脂肪酸,特别是DHA。
亚油酸和α-亚麻酸的衍生物可以进一步被宿主磷脂酶修饰,转化为主要来自ARA的二十碳烷类,如前列腺素、白三烯和血栓素。这些二十碳烷是促炎分子,作为局部激素来激活免疫细胞、启动血小板聚集和引发分娩。
相反,DHA和EPA可以进一步转化为抗炎的消退素(resolvins)和保护素(protectins)。
胆汁酸
关于胆汁酸,UDCA,熊去氧胆酸,一种天然存在的次级胆汁酸,在代谢性疾病、自身免疫性疾病、慢性炎症性疾病和神经病理学等疾病中显示出治疗前景。研究发现,UDCA在未来自闭症患者中较低。
ARA加DHA改善自闭症
一项双盲、安慰剂对照随机试验发现膳食补充ARA加DHA(ARA占优势)显著改善了自闭症患者(n=13)在异常行为检查表-社区量表测量的社交退缩和社交回应量表测量的沟通情况。虽然样本量较小,但这个研究证明了通过饮食调节大脑脂肪酸谱可能带来的好处,这种脂肪酸调节在动物研究中也可以通过益生菌达到。
n-3和n-6脂肪酸
一些小规模的n-3和n-6脂肪酸的膳食干预研究显示,自闭症患者的症状有所缓解,虽然并非所有研究都显示有改善。
自闭症患者可能与母乳喂养较少有关
自闭症和精神分裂症患者较少接受母乳喂养,而健康对照组则较多,这表明富含ARA、EPA和DHA的人类母乳对婴儿大脑发育的最佳饮食份额的重要性。相反,早期断奶与自闭症风险增加相关。这些观察结果不仅强调了早期产后饮食对大脑发育和自闭症风险的重要性,还暗示了肠脑轴和肠道微生物群在这一发育过程中的可能早期作用。
补充益生菌,改变脂肪酸
一些肠道微生物,最著名的是某些乳酸菌属和双歧杆菌属的菌种,具备进行脂肪酸生物氢化所需的酶,从而增加脂肪酸的不饱和度。
研究表明,饮食补充α-亚麻酸(ALA)会改变小鼠肝脏、脂肪组织和大脑中的脂肪酸谱,并且在联合补充α-亚麻酸与益生菌Bifidobacterium breve NCIMB 702258时,脂肪酸谱会进一步改变。
注:B. breve NCIMB 702258是高效生产共轭亚油酸(CLA)的菌。
相比于对照组喂养或单独补充α-亚麻酸的情况,食用n-3脂肪酸加益生菌的动物其大脑中的DHA水平升高,而ARA水平下降。
同一组作者随后表明,单独使用B. breve NCIMB 702258菌株,相比于另一种共轭亚油酸(CLA)产生的B. breve菌株和对照组,小鼠的大脑中DHA和ARA的水平也有所上升,证实了益生菌调节大脑脂肪酸谱的能力,并显示这种活动具有明显的菌株特异性。
LA和ALA不够,其他饱和脂肪酸来凑
尽管亚油酸(LA)和α-亚麻酸(ALA)是磷脂形成所必需的必需脂肪酸,但当饮食中这些脂肪酸含量偏低时,其他脂肪如饱和脂肪酸有时可作为替代品,从而对最终磷脂的结构和可能的功能产生影响。
磷脂代谢异常、脂肪酸缺乏或血脂异常已牵涉到多种神经和大脑发育或退行性疾病,包括精神分裂症、注意力缺陷多动障碍(ADHD)、抑郁症、广泛性发育障碍、发育性协调障碍、癫痫、双相情感障碍、阿尔茨海默病、帕金森病、尼曼-皮克病、亨廷顿舞蹈病、中风。
胆固醇代谢和磷脂代谢异常在自闭症中起作用
自闭症患者血液中磷脂酶A2水平较高,细胞膜中的ARA和DHA水平较低,并且可能具有更高的n-6脂肪酸与n-3脂肪酸的比例。
与健康对照组相比,自闭症儿童(n=16)的红细胞脂质谱被修改,表现为较低的胆固醇水平和细胞膜中单唾液四己糖神经节苷脂(GM1)的比例较高。研究人员认为这可能反映了更普遍的胆固醇合成缺陷,在大脑中,结合GM1表达的变化,可能会促成自闭症的病理生理机制。
BDNF对突触传递和神经元胆固醇合成的影响
自闭症与BDNF和益生菌的关联
然而,并非所有益生菌研究都显示BDNF与实验动物观察到的脑功能改善有关。
益生菌、益生元与改善脑功能
然而,需要在人类受试者和相关实验模型中进行基础研究,以验证这些假设的有效性并在机制上将肠道细菌与这些病情联系起来。
大脑占人体质量约2%,但却占胆固醇约20%。血脑屏障(BBB)对脂蛋白是不可通透的,这意味着大脑所需的胆固醇是内源性形成的。
其中星形胶质细胞和神经元分别是胆固醇的净生产者和使用者,体现了胆固醇生物合成机制的独特分区化。
神经元——胆固醇的使用者
神经元需要大量的胆固醇来维持其广泛的膜表面积并提供突触前囊泡的形成。它们还有稍微不同的酶途径,将鲨烯转化为胆固醇。出生后的胆固醇主要由星形胶质细胞提供,并优先来源于乙酸盐。
注:鲨烯(C30H50)是一种多不饱和烃类,也称为角鲨烯或三十碳六烯。 它是一种在人体胆固醇合成等代谢过程中产生的萜类化合物。鲨烯在自然界中广泛存在,尤其是在鲨鱼肝油中含量较高,同时也是橄榄油、米糠油等少数几种植物油中的成分。具有良好的生物活性,在食品、化妆品、保健品等领域广泛应用。
星形胶质细胞——胆固醇的净生产者
星形胶质细胞是包裹神经细胞的细胞,负责供应细胞外钾、谷氨酸、能量和抗氧化剂,并调节大脑中的活性依赖性血流,并可能影响突触活动。
星形胶质细胞在大脑胆固醇运输中的关键作用
ApoE缺乏的啮齿动物模型,表现出各种行为和神经系统症状,并在感觉系统中也有缺陷,这些缺陷与随年龄增长而丧失的突触和树突,突触膜胆固醇分布的改变有关。
CYP46,在维持大脑胆固醇稳态中的作用
短链脂肪酸——乙酸,对神经发育的作用
出生后乙酸在神经发育中重要,母乳喂养乙酸多
AceCS1的表达及其功能
乙酸是胆固醇的组成成分
乙酸的代谢去向
乙酸作为特殊代谢产物的重要性
NAA——乙酸的主要来源之一
N-乙酰天冬氨酸(NAA)在大脑中的作用
自闭症儿童大脑中NAA浓度降低
短链脂肪酸——丙酸,对大脑的负面影响
饮食如何影响大脑中短链脂肪酸的可用性?
自闭症中二糖酶和己糖转运蛋白减少
研究发现,在自闭症儿童中,二糖酶和己糖转运蛋白的表达显著减少,这些变化与肠道微生物群组成的变化相关。这些变化与厚壁菌门相对丰度较高,拟杆菌门较少,以及β-变形菌门升高有关。
注:至少是三种常见肠道二糖酶之一:蔗糖酶-异麦芽糖酶(SI)、麦芽糖酶-异麦芽糖酶(MGAM)、乳糖酶(LCT)
己糖转运蛋白:SGLT1、GLUT2
肠道二糖酶和糖转运蛋白的表达受到多种因素的调控,包括饮食、肠道微生物以及肠神经系统等。
丁酸:结肠健康的关键能量源与吸收机制
考虑到丁酸是结肠细胞的首选能量来源、黏膜更新和分化的介质,以及其生产率在早期肠道微生物群继发发育过程中发生变化,丁酸在肠黏膜成熟中的作用可能非常重要。
丁酸吸收机制:MCT1负责运输,GPR109A助攻
在了解了丁酸在肠黏膜中的重要性及其吸收机制之后,我们再探讨不同饮食和环境因素对MCT1表达的影响及其对丁酸和其他短链脂肪酸吸收的调节作用。
饮食影响短链脂肪酸(丁酸)吸收的机制
高纤维饮食和益生元→MCT1表达和短链脂肪酸吸收↑
高脂肪饮食→抑制短链脂肪酸在结肠中的吸收
肠道炎症和氧化应激→MCT1表达↓→丁酸吸收↓
以上我们知道,MCT1表达异常会影响丁酸吸收,不仅如此,MCT1表达异常还可能与肥胖相关的神经系统疾病有关。
在饮食诱导和遗传性肥胖动物中,MCT1-4 表达都增加,特别是在神经元和神经元胞体中,说明这种变化可能不全是饮食因素,也可能是由于肥胖引起的激素变化间接导致的。
前面我们知道,MCT与短链脂肪酸转运相关,那么MCT表达异常,短链脂肪酸也异常,可能会影响大脑的能量代谢,如果这些变化发生在生命早期,可能会影响神经系统的发育过程,并与个体成年后的肥胖易感性相关。
注:从母乳到固体食物的饮食结构转换可能会影响生理发育、代谢途径和营养转运蛋白(如MCT)的表达,从而对大脑功能产生重要影响。
谷禾发表在 GUT上的队列也表明,随着断奶或引入辅食,自闭症儿童的肠道菌群发育轨迹逐渐偏离健康儿童。如下:
doi: 10.1136/gutjnl-2021-325115.
不良饮食,尤其是在断奶后采用现代西式饮食,实际上可能通过将营养素转运蛋白关闭,重定向营养流向,从而下调了必需营养素(如氨基酸、脂肪和SCFA)的肠道流动。
对比现代西式饮食和古老传统的饮食,有助于重新定义营养不良的范式。营养不良不再仅限于某些必需营养素的缺乏,还包括营养过剩和异常的营养素比例和结构。

在人类“超级有机体”中,这种改变的营养环境的代谢后果,最明显地体现在肠道微生物群与宿主能量代谢和大脑功能的相互作用中。
生命早期:母乳喂养
前面我们了解到,早期断奶与自闭症风险增加相关。很多自闭症患者较少接受母乳喂养,这表明母乳中含有ARA、EPA和DHA,是婴儿大脑发育的最佳饮食。
随着年龄增长:其他饮食
多酚及其代谢物
现有的研究确认了流行病学数据,表明多酚及其代谢物可能有助于促进大脑健康。提出的作用机制包括抗氧化活动、改善血管功能和脑部血流、直接增强神经元信号传递、缓冲钙离子、增强神经保护性应激蛋白和减少应激信号。
线粒体功能障碍在自闭症谱系障碍、神经退行性疾病和一般脑老化的发病机制中得到了关注。线粒体常被认为是氧化应激的启动者和目标,植物多酚代谢物可能具有保护作用。
体外研究在生理相关剂量下测试了选定多酚代谢物对高级糖化终产物形成的抑制能力以及对人类神经元细胞中轻度氧化应激的对抗能力。例如:
药用植物的多酚提取物
少数研究探讨了来自药用植物的多酚提取物对自闭症动物模型的影响,发现:
注:尚需确定这些高剂量植物提取物的抗氧化活性仅与减轻丙戊酸引起的氧化损伤相关,还是在氧化损伤可能只是一个影响因素的神经病理情况下更具广泛相关性。
——黄酮类化合物
肠道菌群对黄酮类化合物的吸收转化
估计有95%的膳食植物多酚在上肠道内无法消化和吸收,并最终到达结肠中的肠道微生物群。一些黄酮类糖苷进入结肠,被肠道菌群分解为更简单的代谢物,比如:
黄酮类化合物对肠道菌群的调节
膳食类黄酮调节肠道菌群改善自闭症
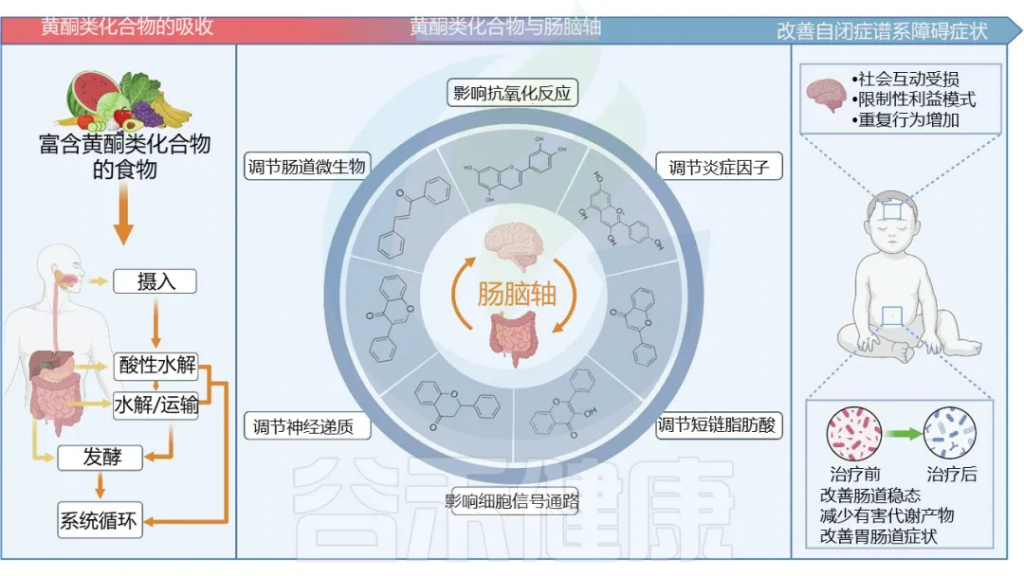
doi.org/10.1016/j.foodres.2024.114404
黄酮类化合物抗自闭症作用的实验研究


doi.org/10.1016/j.foodres.2024.114404
肥胖和不良饮食与抑郁症和自闭症谱系障碍发病率增加有关。同样,母亲的不良饮食(特别是高脂肪饮食),健康状况(特别是肥胖/代谢综合症),会影响胎儿和新生儿的大脑发育过程,从而增加焦虑、抑郁、注意力缺陷多动障碍(ADHD)和自闭症等神经系统疾病的风险。
神经内分泌系统,特别是下丘脑-垂体-肾上腺(HPA)轴,代表了肠道环境和中枢神经系统(CNS)之间的主要通信通道。
在动物模型中,使用各种益生菌微生物干预,既包括乳酸杆菌也包括双歧杆菌,已显示能够减轻标准动物应激挑战下的类似焦虑行为。
婴儿双歧杆菌
L. helveticus R0052 和 B. longum R0175
L. rhamnosus JB-1
脆弱拟杆菌NCTC 9343
注:脆弱拟杆菌是一个比较复杂的菌种,里面既有潜在的益生菌株,也有致病的病原菌株,具体可以查看我们以前文章:
益生元
最近的研究表明,饮食中补充益生元发酵纤维,可以选择性地刺激对人体有益的肠道细菌,如双歧杆菌,从而对大脑产生重要变化。
实验动物在摄入果寡糖(FOS)或半乳寡糖(GOS)后,海马中的BDNF和N-甲基-d-天冬氨酸受体(NMDARs)亚基NR1的表达增加,并且GOS似乎通过诱导肠道激素PYY来介导这一过程。FOS和GOS都能够上调肠道微生物群中短链脂肪酸的产生,特别是乙酸和丁酸,同时增加肠道双歧杆菌的相对丰度。
L-肌肽
胆固醇或DHA
从模拟人类婴儿营养的猪仔研究中,发现婴儿配方奶粉中的胆固醇补充会改变大脑中的氨基酸谱,降低谷氨酸、丝氨酸、谷氨酰胺、苏氨酸、β-丙氨酸、丙氨酸、蛋氨酸、异亮氨酸、亮氨酸和γ-氨基丁酸的浓度,同时增加甘氨酸和赖氨酸的浓度。
二十二碳六烯酸(DHA)也有类似的效果,但会降低牛磺酸水平,对异亮氨酸和赖氨酸没有影响。胆固醇或DHA膳食补充剂也会影响猪仔肝脏、肌肉和血浆中的氨基酸水平。DHA还会减少肌肉和大脑中的肌肽和氨的含量。
这些观察结果确实对食物选择或家庭饮食对营养可用性和代谢的影响有重要启示,进而影响早期儿童的大脑发育和功能,当然还需在人类队列中进一步研究其潜在机制。
药物
对自闭症儿童每周使用万古霉素治疗,可显著改善神经行为和胃肠道症状。
粪菌移植
一项开放标签研究对18名自闭症儿童进行了粪菌移植(每日口服8周),结果表明移植后其胃肠道症状和自闭症核心症状评分均有所改善。
移植后8周,受试者的肠道菌群多样性增加,厚壁菌门丰度下降,拟杆菌门和变形菌门丰度上升。
随访2年后,受试者的部分症状改善仍然维持。这提示通过重建肠道菌群可能成为干预自闭症的新策略。
关于粪菌移植,仍需更多深入研究。
自闭症谱系障碍 (ASD) 是一组神经发育疾病,一般在 3 岁之前发病,目前的发病率在全世界逐渐升高,与多种因素有关,其中饮食会影响和塑造肠道微生物群,孕期和幼儿期似乎是一个关键时期,尤其从哺乳/配方奶→断奶→成人“家庭”饮食的过渡过程中饮食和环境暴露影响较大。
人类微生物组对宿主代谢过程和膳食化合物加工的核心贡献,许多营养物质和摄入的化学物质必须经过肠道及肠道微生物,转化为生物可利用和活跃的中间产物,然后通过肝门静脉被吸收并在全身分布。
研究表明,大部分自闭症患者的肠道菌群异常,这可能与饮食习惯、抗生素使用等因素有关。同时,自闭症患者某些氨基酸水平也存在异常。
饮食作为塑造肠道微生物群的重要因素,可能在自闭症的发病中扮演重要角色。优化孕期和幼儿期的饮食结构,如母乳喂养、合理添加辅食、避免过多加工食品和添加剂等,有助于维持肠道菌群平衡,从而有助于大脑健康。
针对自闭症患者的饮食干预,如补充益生元、益生菌,调整膳食纤维和蛋白质比例等,可能对改善部分症状有一定帮助。但由于自闭症的高度异质性,饮食干预的效果可能因人而异,还需要更多的结合个体化健康信息及相应症状进行个性化指导和干预。
此外,幼儿早期尤其6-12个月能够更早判别出自闭症风险,对于神经发育的改善和行为的扭转非常重要,希望临床上与相关机构能够合作共同推进自闭症的研究和个性化干预。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Lou M, Cao A, Jin C, Mi K, Xiong X, Zeng Z, Pan X, Qie J, Qiu S, Niu Y, Liang H, Liu Y, Chen L, Liu Z, Zhao Q, Qiu X, Jin Y, Sheng X, Hu Z, Jin G, Liu J, Liu X, Wang Y. Deviated and early unsustainable stunted development of gut microbiota in children with autism spectrum disorder. Gut. 2022 Aug;71(8):1588-1599.
Ahrens A P, Hyötyläinen T, Petrone J R, et al. Infant microbes and metabolites point to childhood neurodevelopmental disorders[J]. Cell, 2024, 187(8): 1853-1873. e15.
Chen, WX., Chen, YR., Peng, MZ. et al. Plasma Amino Acid Profile in Children with Autism Spectrum Disorder in Southern China: Analysis of 110 Cases. J Autism Dev Disord 54, 1567–1581 (2024).
Chang, X., Zhang, Y., Chen, X. et al. Gut microbiome and serum amino acid metabolome alterations in autism spectrum disorder. Sci Rep 14, 4037 (2024).
Kieran M. Tuohy, Paola Venuti, Simone Cuva, et al, Chapter 15 – Diet and the Gut Microbiota – How the Gut: Brain Axis Impacts on Autism, 2015, Pages 225-245, American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders (4th ed.), American Psychiatric Association, Washington DC (1994)
Anastasescu, C.M.; Gheorman, V.; Popescu, F.; Stoicănescu, E.-C.; Gheorman, V.; Riza, A.-L.; Badea, O.; Streață, I.; Militaru, F.; Udriștoiu, I. Serum Amino Acid Profiling in Children with Autistic Spectrum Disorder: Insights from a Single-Center Study in Southern Romania. Healthcare 2023, 11, 2487
V. Hughes. Epidemiology: complex, disorder, Nature, 491 (2012), pp. S2-S3
S. Baron-Cohen, F.J. Scott, C. Allison, et al., Prevalence of autism-spectrum conditions: UK school-based population study. Br J Psychiatry, 194 (2009), pp. 500-509
T.S. Brugha, S. McManus, J. Bankart, et al., Epidemiology of autism spectrum disorders in adults in the community in England Arch Gen Psychiatry, 68 (2011), pp. 459-466
B.S. Abrahams, D.H. Geschwind., Advances in autism genetics: On the threshold of a new neurobiology, Nat Rev Genet, 9 (2008), pp. 341-355
Brister, D.; Rose, S.; Delhey, L.; Tippett, M.; **, Y.; Gu, H.; Frye, R.E. Metabolomic Signatures of Autism Spectrum Disorder. J. Pers. Med. 2022, 12, 1727.
S. Ozonoff, B.J. Williams, R. Landa, Parental report of the early development of children with regressive autism: The delays-plus-regression phenotype, Autism, 9 (2005), pp. 461-486
S. Ozonoff, G.S. Young, M.B. Steinfeld, et al., How early do parent concerns predict later autism diagnosis?
J Dev Behav Pediatr, 30 (2009), pp. 367-375
G. Esposito, P. Venuti, Symmetry in infancy: Analysis of motor development in autism spectrum., disorders, Symmetry, 1 (2009), pp. 215-225
Zhao Y, Wang Y, Meng F, Chen X, Chang T, Huang H, He F, Zheng Y. Altered Gut Microbiota as Potential Biomarkers for Autism Spectrum Disorder in Early Childhood. Neuroscience. 2023 Jul 15;523:118-131.
G. Esposito, P. Venuti, F. Apicella, F. Muratori, Analysis of unsupported gait in toddlers with autism, Brain and Development, 33 (2011), pp. 367-373
F. Happé, A. Ronald, R. Plomin, Time to give up on a single explanation for autism, Nat Neurosci, 9 (2006), pp. 1218-1220
T. Charman, C.R.G. Jones, A. Pickles, E. Simonoff, G. Baird, F. Happé, Defining the cognitive phenotype of autism, Brain Res, 1380 (2011), pp. 10-21
P. Krakowiak, C.K. Walker, A.A. Bremer, et al.,Maternal metabolic conditions and risk for autism and other neurodevelopmental disorders,Pediatrics, 129 (2012), pp. e1121-e1128
J.A. Hollway, M.G. Aman Pharmacological treatment of sleep disturbance in developmental disabilities: a review of the literature,Res Dev Disabil, 32 (2011), pp. 939-962
Shen L, Liu X, Zhang H, Lin J, Feng C, Iqbal J. Biomarkers in autism spectrum disorders: Current progress. Clin Chim Acta. 2020 Mar;502:41-54.
C.A. Molloy, P. Manning-Courtney,Prevalence of chronic gastrointestinal symptoms in children with autism and autistic spectrum disorders, Autism, 7 (2003), pp. 165-171
D.V. Keen , Childhood autism, feeding problems and failure to thrive in early infancy: Seven case studies, Eur Child Adolesc Psychiatr, 17 (2008), pp. 209-216
L.G. Bandini, S.E. Anderson, C. Curtin, et al., Food selectivity in children with autism spectrum disorders and typically developing children, J Pediatr, 157 (2010), pp. 259-264
S.A. Cermak, C. Curtin, L.G. Bandini, Food selectivity and sensory sensitivity in children with autism spectrum disorders, J Am Diet Assoc, 110 (2010), pp. 238-246
Y. Martins, R.L. Young, D.C. Robson, Feeding and eating behaviors in children with autism and typically developing children, J Autism Dev Disord, 38 (2008), pp. 1878-1887, View at publisher
E. Cornish, A balanced approach towards healthy eating in autism, J Hum Nutr Diet, 11 (1998), pp. 501-509
P. Whiteley, J. Rodgers, D. Savery, P. Shattock, A gluten-free diet as an intervention for autism and associated spectrum disorders: Preliminary findings, Autism, 3 (1999), pp. 45-65
K. Fitzgerald, M. Hyman, K. Swift, Autism spectrum disorders, Glob Adv Health Med, 1 (2012), pp. 62-74
E. Courchesne, K. Campbell, S. Solso, Brain growth across the life span in autism: age-specific changes in anatomical pathology, Brain Res, 1380 (2011), pp. 138-145
M. Rutter, Aetiology of autism: findings and questions, J Intell Disabil Res, 49 (2005), pp. 231-238, View at publisher
J.J. Michaelson, Y. Shi, M. Gujral, et al.
Whole-genome sequencing in autism identifies hot spots for de novo germline mutation, Cell, 151 (2012), pp. 1431-1442
B.N. Vardarajan, A. Eran, J.Y. Jung, L.M. Kunkel, D.P. Wall, Haplotype structure enables prioritization of common markers and candidate genes in autism spectrum disorder
Transl Psychiatry, 3 (2013), p. e262
Yu X, Qian-Qian L, Cong Y, Xiao-Bing Z, Hong-Zhu D. Reduction of essential amino acid levels and sex-specific alterations in serum amino acid concentration profiles in children with autism spectrum disorder. Psychiatry Res. 2021 Mar;297:113675.
J. Veenstra-Vanderweele, R.D. Blakely
Networking in autism: Leveraging genetic, biomarker and model system findings in the search for new treatments, Neuropsychopharmacol, 37 (2012), pp. 196-212
K.T.E. Kleijer, M.J. Schmeisser, D.D. Krueger, et al. Neurobiology of autism gene products: towards pathogenesis and drug targets, Psychopharmacology (Berl), 231 (6) (2014), pp. 1037-1062
Li H, Dang Y, Yan Y. Serum interleukin-17 A and homocysteine levels in children with autism. BMC Neurosci. 2024 Mar 12;25(1):17.

谷禾健康
不知道大家有没有这样的体验:紧张时会想上厕所,伤心时会食欲不振。任何情绪变化,好像都会反映在消化系统。
与此同时,你相不相信一个人的肠道微生物可以影响其认知、性格、气质、社交情况、甚至是责任心。
有大量证据表明神经系统与肠道微生物的组成和功能有关。目前,已经描述了各种肠-脑串扰途径,包括通过迷走神经途径的免疫、内分泌和神经回路。此外,中枢神经系统控制肠道菌群的失衡,构成双向通讯系统。
肠道菌群失衡,也许是导致精神问题的潜在原因。一些研究发现,肠道菌群改变(生态失调)与阿尔茨海默病、自闭症和帕金森病等神经精神疾病以及焦虑、抑郁和认知功能障碍等其他心理疾病有关。
肠道菌群可以分泌神经递质,例如乙酰胆碱、γ-氨基丁酸(GABA)和色氨酸;此外肠道中有数百万个神经元,可以通过神经递质向大脑发送信号。
肠脑轴功能障碍被认为是精神障碍的病理生理学;因此,恢复受干扰的微生物生态系统为管理或预防这些神经系统疾病提供了一种新颖且有前途的方法。
本文对人类肠道微生物群失调与几种精神和心理疾病之间联系进行了概述。此外,还展示了一些使用精神药物与调节肠道微生物相结合的方式以改善精神疾病或心理障碍的干预措施。肠道微生物群在未来可能成为缓解压力与治疗精神疾病的新工具。
人类肠道含有多样化的微生物群落,据估计,肠道中的微生物数量可以达到数万亿个。微生物群的密度在肠道不同部位也有所不同,结肠和直肠的微生物密度较高,而小肠的微生物密度较低。
肠道微生物由多种微生物类群组成,包括细菌、病毒、真菌、古细菌和原生动物,其中最主要的是细菌。
•古细菌
在健康的人类肠道中,古细菌的数量很少,其中史密斯产甲烷短杆菌(Methanobrevibactersmithii)是最常见的物种。
•真菌
肠道中最常检测到的真核微生物是真菌,例如念珠菌(Candida)和酵母菌(Saccharomyces)。这些真菌维持生态和免疫肠道微生物组的平衡。
•病毒
人体病毒组主要由噬菌体组成,它们在肠道中的作用是作为细菌组的调节剂。
•原生生物
一些原生动物,例如芽囊原虫属(Blastocystis),已在人类肠道微生物群中检测到,它们的存在通常与胃肠道疾病有关。
✦细菌是人类肠道中最常见的微生物
细菌是人体肠道中最常见的微生物,一般属于以下8个门:放线菌门 (Actinobacteria)、芽孢杆菌门 (Bacillota)(又名厚壁菌门)、拟杆菌门 (Bacteroidetes)、弯曲菌门 (Campylobacterota)、梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)、热脱硫杆菌门(Thermodesulfobacteriota)和疣微菌门(Verrucomicrobia)。
下图显示了健康人肠道微生物群中主要的门、科和属。
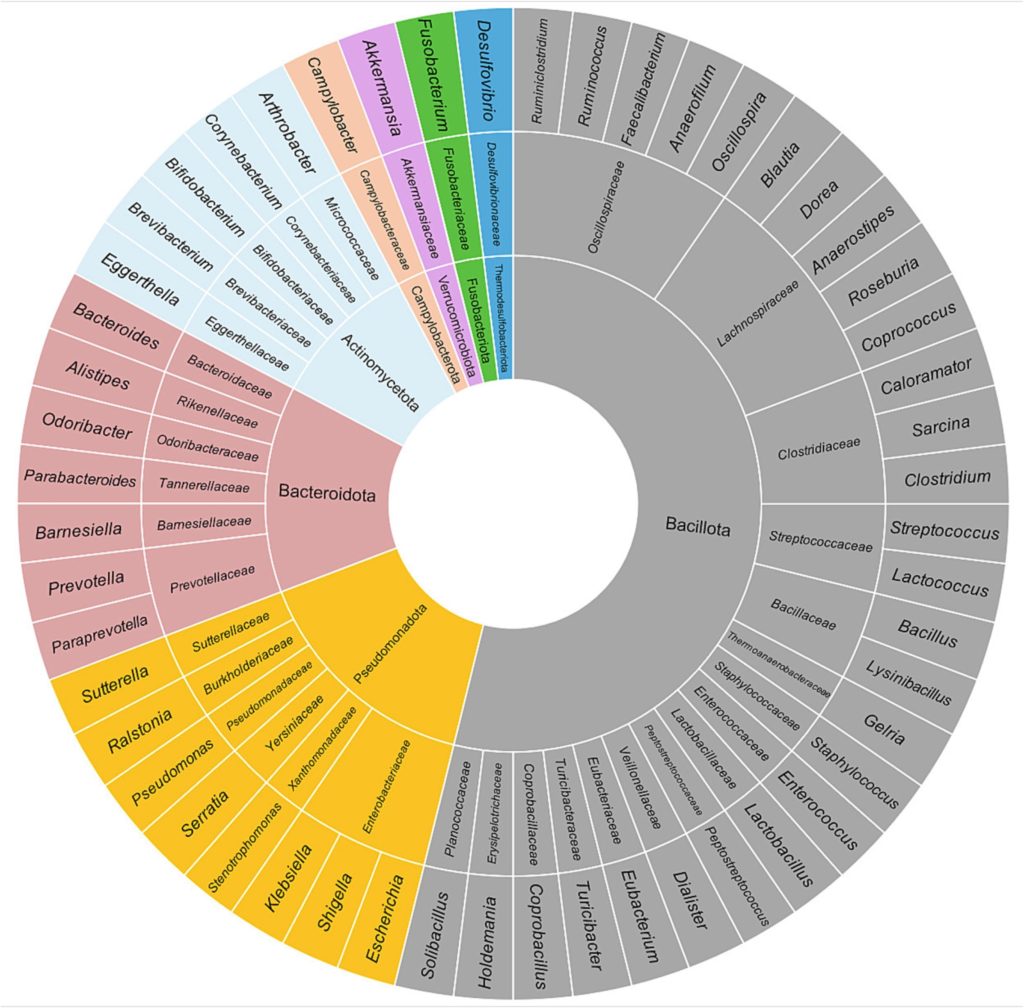
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
✦肠道不同部位的微生物群组成具有差异
肠道区室中的微生物有特定的空间分布。上消化道中最主要的是孪生球菌属(Gemella)、韦荣氏球菌属(Veillonella)、奈瑟菌属(Neisseria)、梭杆菌属(Fusobacterium)、链球菌属(Streptococcus)、普雷沃氏菌属(Prevotella)、假单胞菌属(Pseudomonas)和放线菌属(Actinomyces)。
而在下消化道中则有粪杆菌属(Faecalibacterium)、拟杆菌属(Bacteroides)和瘤胃球菌属(Ruminococcus)。
十二指肠
研究发现人类十二指肠粘膜富含芽孢杆菌(Bacillus)、Solibacillus、赖氨酸芽孢杆菌(Lysinibacillus)、微小杆菌属(Exiguobacterium)、海洋芽胞杆菌属(Oceanobacillus)和类芽孢杆菌(Paenibacillus)。
空肠
在空肠中,变形菌门和厚壁菌门是最常见的门,而埃希氏菌属、乳杆菌属和肠球菌属是空肠中最常见的属。
回肠
链球菌属(Streptococcus spp.)、大肠杆菌(Escherichia coli)和梭菌属(Clostridium spp.),是回肠中最常见的物种。
结肠
结肠是一个厌氧环境,以拟杆菌门、放线菌门和厚壁菌门以及毛螺菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)、普雷沃氏菌科(Prevotellaceae)、拟杆菌科(Bacteroidaceae)和理研菌科(Rikenellaceae)为主,以及已鉴定的主要细菌属乳杆菌属、双歧杆菌属和粪杆菌属。
研究了不同结肠区域的细菌属优势,他们发现乙状结肠中存在拟杆菌属、肠球菌属。近端结肠和远端结肠为粪杆菌和大肠杆菌。
阑尾中微生物多样性较高,以放线菌门、梭杆菌门、变形菌门、拟杆菌门和厚壁菌门为主;以及毛螺菌科、肠杆菌科、拟杆菌科、梭杆菌科和双歧杆菌科。
尽管人类肠道微生物群的组成因年龄、营养和抗生素使用等因素而在分类学和功能上存在差异,但人类肠道微生物群主要是由乳杆菌属、芽孢杆菌属、梭菌属、肠球菌属、瘤胃球菌属、粪杆菌属、罗氏菌属(Roseburia)、经黏液真杆菌属(Blautia)、Dorea属、拟杆菌属、普雷沃氏菌属、双歧杆菌属和埃希氏菌属。
✦肠道微生物对于消化非常重要
肠道微生物群为人类宿主提供了多种积极影响,包括免疫和代谢功能。肠道微生物是消化的关键调节者,通过营养物质的吸收以及多种代谢物的合成,包括脂质、氨基酸、维生素和短链脂肪酸。
✦肠道微生物有助于预防病原体感染
此外,肠道微生物群通过多种竞争过程在预防病原菌感染方面发挥着关键作用,并且还有助于维持肠上皮的完整性。
✦肠道微生物产生的化合物可作为信号分子
肠道微生物群从未消化的食物中产生多种分泌化合物。其中一些可以作为细菌间通讯的信号分子,影响细菌调节、稳态、生长、毒力和生物膜形成等。
色氨酸代谢物
细菌还可能分泌其他生物活性化合物,包括色氨酸分解代谢物、短链脂肪酸、多胺和组胺。色氨酸的代谢产物[5-羟色胺(血清素)、犬尿氨酸和吲哚]与生理和神经元活动有关。
吲哚
吲哚调节肠促胰岛素的分泌,调节肠道屏障通透性,并且可以作为微生物和宿主细胞之间细胞间通讯的信号分子。此外,吲哚及其衍生物被描述为神经炎症的抑制化合物。
短链脂肪酸
最重要的定量代谢物是由微生物降解不可消化的膳食纤维、蛋白质和糖蛋白产生的短链脂肪酸。如丁酸盐、乙酸盐和丙酸盐,可以作为信号分子,局部调节从十二指肠到结肠的肠道功能,并且通过肠内分泌细胞,它们还可以控制肝脏、肌肉和大脑的代谢,影响肠道功能及宿主能量稳态。
此外,短链脂肪酸通过诱导神经炎症反应呈现神经活性特性。短链脂肪酸是强大的表观遗传调节剂,控制DNA甲基化遗传物质的可及性并抑制组蛋白脱乙酰化。
该机制依赖于10-11易位 (TET) 蛋白,该蛋白催化胞嘧啶残基羟基化为5-羟甲基胞嘧啶,介导主动DNA去甲基化。确定丁酸盐诱导前额皮质中许多行为相关基因的变化,特别是影响涉及神经元兴奋或抑制的基因。几种兴奋性神经递质和神经元激活标记基因的减少,以及抑制性神经递质基因的增加表明丁酸盐促进抑制途径转录物的转录。
✦细菌代谢产物会影响神经发育
最近的研究表明,细菌代谢产物会影响神经发育。一些研究人员还报道了短链脂肪酸影响神经发生基因的表达。
使用无微生物的斑马鱼模型,观察到无微生物培养的胚胎中神经基因表达显著下降,并通过添加斑马鱼代谢物重新建立了该模型,识别出超过300个下调的基因。
基因分析表明,这些基因参与重要的神经发育途径,包括转录调控和Wnt信号传导。事实上,Wnt信号通路在发育和疾病中发挥着重要作用,可以推测其调控与多细胞真核生物的细菌定植共同进化。
下图展示了肠道微生物群合成的一些关键神经递质及其与心理和精神疾病的关联。这些神经活性化合物通过内在或外在传入神经通路将信息从肠腔传输到肠神经系统、肠神经胶质细胞和中枢神经系统。
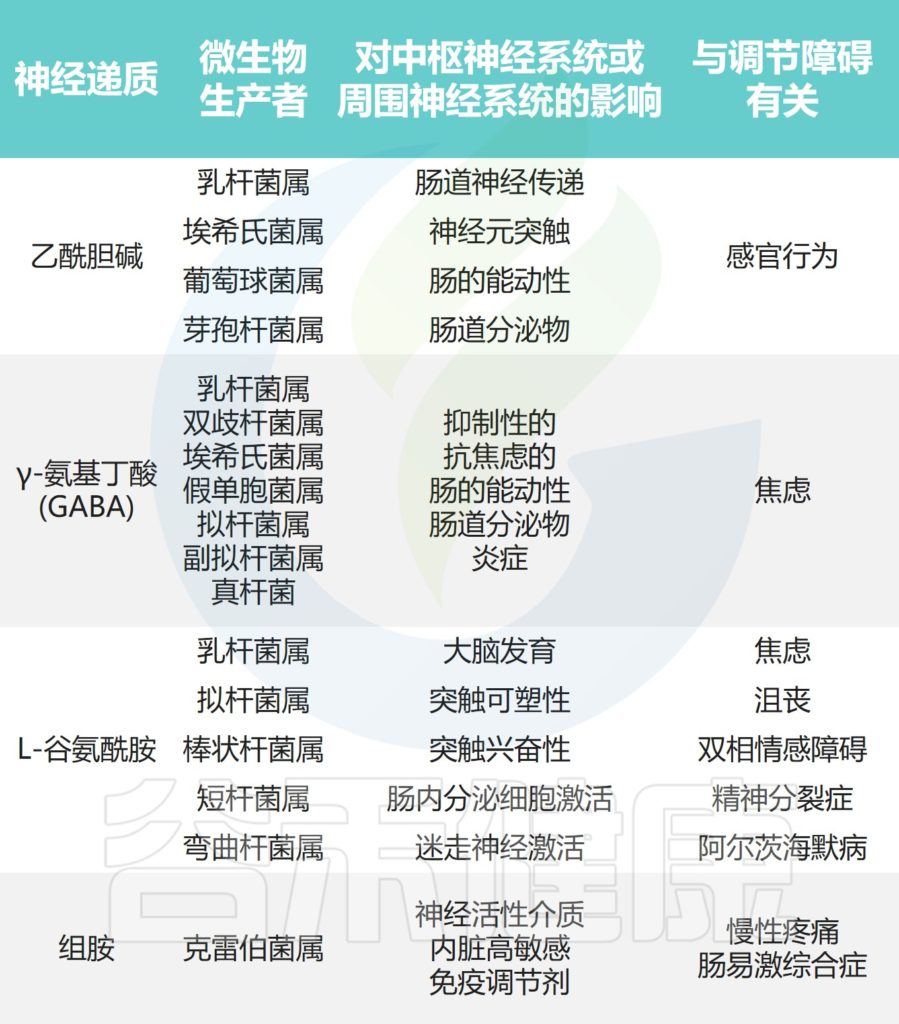

Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
阿尔茨海默病(AD)是一种慢性神经退行性疾病,其中记忆和执行功能进行性丧失,与突触损伤和神经损失有关,主要发生在海马体和大脑皮层。
多项研究已明确β-淀粉样肽(Aβ)在阿尔茨海默病中的作用。最近的研究表明,细菌来源的淀粉样蛋白,例如curli、Csg A、tau、TasA、FapC和酚溶性调节蛋白,在Aβ寡聚体的聚集和促进错误折叠中发挥作用。
细菌淀粉样蛋白通过与Toll样受体2相互作用激活宿主免疫系统,诱导促炎介质刺激大脑中神经元淀粉样蛋白的产生。
•肠道微生物失调与阿尔兹海默病存在关联
其他证据表明肠道微生物群失调与阿尔茨海默病的早期阶段有关,导致细胞因子分泌增强、免疫衰老、神经炎症和氧化应激。
此外,肠道微生物失调会诱导脂多糖的分泌,从而破坏胃肠道通透性和血脑屏障,调节炎症途径,促进神经炎症和认知能力下降,并导致阿尔茨海默病中的神经元死亡。
在大鼠中,腹膜脂多糖给药导致炎症因子(例如IL-1、IL-6和TNF-α)水平升高,表明微生物组在阿尔茨海默病先天免疫反应的启动中发挥作用。
•阿尔兹海默病中短链脂肪酸水平降低
研究表明,阿尔茨海默病小鼠的微生物群组成和多样性受到干扰,短链脂肪酸水平降低,这预示着30多种代谢途径的改变,这可能与淀粉样蛋白沉积有关。
肠道菌群失调可能会增加氧化三甲胺(TMAO)浓度,这与不同的功能有关,例如β-淀粉样蛋白的形成、外周免疫反应的激活和氧化应激。此外,还与肠粘膜屏障功能障碍、血脑屏障通透性以及胆汁酸和胆固醇进入大脑的通道增加有关。
•阿尔茨海默病患者体内促炎菌群比例增加
研究发现阿尔茨海默病患者中大肠杆菌/志贺氏菌等促炎菌群的比例增加,而直肠真杆菌(eubacterium rectale)、霍氏大肠杆菌(E.hallii)、普拉梭菌(F. prausnitzii)和脆弱拟杆菌等产生丁酸的细菌则减少。
这些细菌与外周炎症状态有关,这是轻度认知障碍(MCI)和脑淀粉样变性患者的典型症状。
注:淀粉样脑血管病主要是由淀粉样物质在软脑膜以及大脑皮质小动脉中层沉积所导致的疾病,多见于80岁以上的老年人,可能会导致血管壁受损。
•阿尔茨海默病患者肠道微生物多样性较低
据报道阿尔茨海默病患者肠道菌群的微生物多样性较低,厚壁菌门和双歧杆菌种类减少。
此外,发现门水平上拟杆菌门细菌成员增加,放线菌门减少,以及科水平上瘤胃球菌科、肠球菌科和乳杆菌科增加,毛螺菌科、拟杆菌科和韦荣氏菌减少。
促炎细菌类群增加,同时产生丁酸盐的细菌减少,例如丁酸弧菌(B.proteoclasticus和B.Hungatei)、梭菌属、真杆菌属(E.Hallii、E.rectal和E.eligens)、普拉梭菌和罗斯拜瑞氏菌 (R.hominis)。
几种精神障碍疾病中的肠道菌群失调
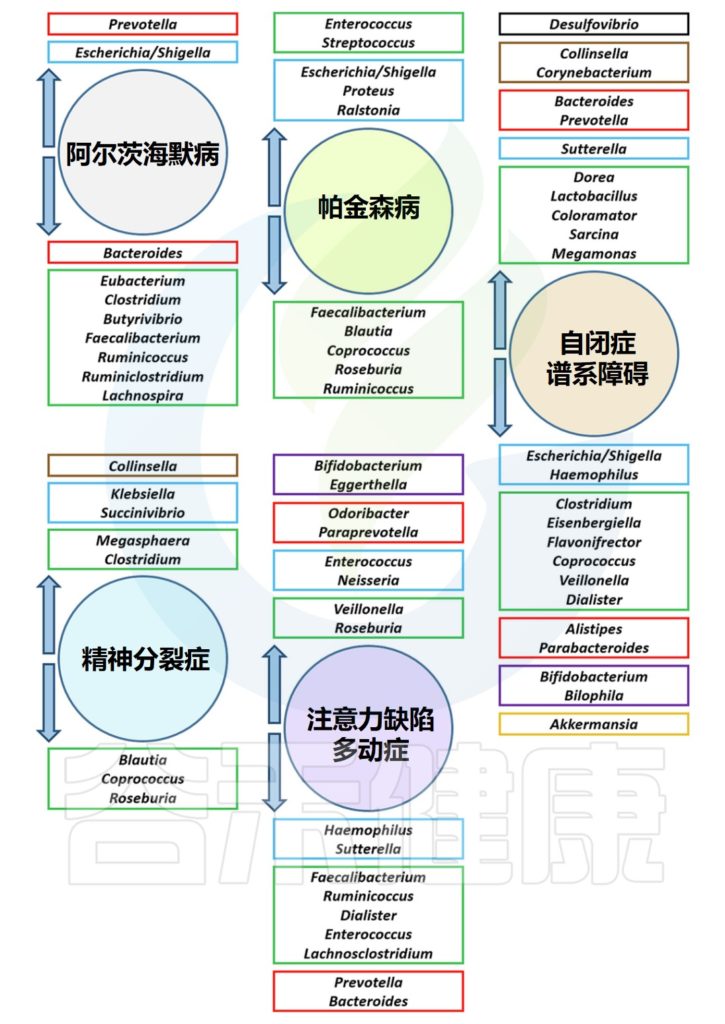
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
自闭症谱系障碍(ASD)是一种大脑发育障碍,其特征是刻板行为以及沟通和社交互动缺陷。
注:儿童自闭症是儿童精神类疾病当中最为严重的一种。
自闭症谱系障碍的确切病理学和病因很难确定,研究重点是调查遗传原因、免疫系统失调、环境毒物暴露以及肠道微生物群的改变。
•自闭症儿童的肠道微生物多样性较高
据报道自闭症儿童的肠道微生物多样性较高。自闭症谱系障碍样本中最常见的属如下:
拟杆菌属(Bacteroides),
脱硫弧菌属(Desulfovibrio),
柯林斯氏菌属(collinsella),
棒状杆菌属 (Corynebacterium),
乳杆菌属(Lactobacillus),
普雷沃氏菌属(Prevotella),
萨特氏菌属(Sutterella),
八叠球菌(Sarcina),
罗氏菌属(Roseburia),
粪杆菌属(Faecalibacterium),
巨单胞菌(Megamonas),
Caloramator,
Dorea;
此外以下属的存在减少:
双歧杆菌(Bifidobacterium) ↓↓↓
另枝菌属(Alistipes) ↓↓↓
嗜胆菌属(Bilophila) ↓↓↓
韦荣氏球菌属(Veillonella) ↓↓↓
阿克曼菌(Akkermansia) ↓↓↓
粪球菌属(Coprococcus) ↓↓↓
埃希氏杆菌属-志贺氏杆菌 ↓↓↓
梭菌属(Clostridium) ↓↓↓
艾森伯格氏菌(Eisenbergiella) ↓↓↓
嗜血杆菌属(Haemophilus)↓↓↓
Dialister ↓↓↓
Parabacteroides ↓↓↓
Flavonifractor ↓↓↓
这些发现强烈表明肠道微生物群失调与自闭症行为表现之间存在联系。
•有害菌会产生神经毒素影响自闭症
在自闭症行为表现患者中发现双歧杆菌丰度较低,而双歧杆菌是产生GABA神经递质的关键,双歧杆菌丰度过低会导致焦虑、认知缺陷和行为障碍。
产生神经毒素的艰难梭菌和溶组织梭菌的积累与自闭症谱系障碍症状相关。这些释放的有毒分子会影响血清素信号传导,可能导致自闭症谱系障碍行为模式,例如社交能力下降、对疼痛的反应减弱、语言异常以及自虐或重复行为。
受自闭症行为表现影响的个体表现出其他潜在有毒化合物水平的改变,例如抑制多巴胺-β-羟化酶的对甲酚和对甲酚硫酸盐。此外,在受自闭症谱系障碍影响的个体中检测到梭菌衍生的代谢物3-(3-羟基苯基)-3-羟基丙酸增加,这可能反映了儿茶酚胺代谢的改变。
•短链脂肪酸对自闭症的作用存在矛盾结果
短链脂肪酸在自闭症谱系障碍中的作用存在矛盾的结果。丙酸盐会诱导小胶质细胞激活、神经毒性细胞因子产生、基因表达改变、海马组织学异常和神经行为异常,例如重复动作和社交互动受损。
然而,丁酸盐对一种自闭症谱系障碍样小鼠模型的社交和重复行为具有有益影响。丁酸盐改善血脑屏障的不渗透性可能是丁酸盐可以恢复丙酸盐诱发的自闭症样疾病异常的另一种机制。
帕金森病(PD)是老年人中常见的一种痴呆症,其主要疾病症状包括神经炎症、中脑多巴胺能神经元丧失以及伴有非运动症状的异常运动。
•微生物失调引起的炎症可能导致帕金森病发展
一些研究人员认为,微生物群失调引起的炎症反应可能会导致帕金森病病理学的发展或恶化。这些反应可以促进脂多糖和α-突触核蛋白在肠道和大脑中的积累,并且由于促炎细菌活性导致氧化应激增加,从而促进α-突触核蛋白病理学通过迷走神经从头侧向尾侧区域扩散。
•帕金森病患者体内短链脂肪酸显著减少
另一方面,微生物短链脂肪酸可以防止肠粘膜通透性增加,从而减少细菌移位。帕金森病中短链脂肪酸显著减少。
短链脂肪酸在帕金森病病理学中的作用尚未完全阐明,报道短链脂肪酸的消耗导致肠神经系统中路易体的形成;相反,有研究表明短链脂肪酸能够降低血脑屏障的通透性。
注:路易体主要是以帕金森病为代表的脑门特征性标志物,患者常常会出现功能障碍。
考虑到短链脂肪酸缺乏与神经炎症和小胶质细胞激活以及便秘、肠漏和结肠炎症等胃肠道特征有关,这些研究结果支持了这样的假设:短链脂肪酸缺乏可能是帕金森病的病因。
•帕金森病患者有抗炎作用的菌群减少
帕金森病患者经常出现属于乳杆菌科、巴氏杆菌科和肠球菌科的某些细菌种类水平升高。
此外发现,帕金森病患者粪便和粘膜中产生抗炎丁酸的细菌水平显著降低(普雷沃氏菌、布氏菌、粪球菌属和罗氏菌属),以及粪杆菌属的水平显著降低。
此外,像罗尔斯通氏菌(Ralstonia)这样的促炎细菌在帕金森病患者的肠粘膜中更为丰富。
拓展
基于肠杆菌科细菌滴度与帕金森病症状严重程度之间的正相关性,这些作者认为肠道微生物群可能与帕金森病表型有关。
相关分析显示疾病严重程度和帕金森病持续时间与纤维素降解剂呈负相关,但与致病生物呈正相关,可能导致短链脂肪酸产生减少以及神经毒素和内毒素增加,可能与帕金森病病理学的发展有关。
此外,普雷沃菌科丰度的降低和乳杆菌科丰度的增加与胃饥饿素浓度的降低有关,胃饥饿素是一种与维持正常多巴胺功能有关的肠道激素,帕金森病患者的胃饥饿素分泌发生了改变。
精神分裂症是一种复杂的精神障碍,患者对现实的理解异常,经常出现焦虑和严重抑郁症状。
这种疾病的起源是有争议的,表明是遗传起源。然而,值得注意的是,通过表观遗传学机制,如神经传递基因甲基化、核苷酸修饰或非编码RNA的作用,一些环境因素可能在其易感性和疾病的发展中发挥作用。
•肠道菌群代谢物影响精神分裂症风险
短链脂肪酸、色氨酸分解代谢物和神经递质(GABA、谷氨酸)的差异被称为精神分裂症相关的肠脑模块。
微生物产生的多巴胺与精神分裂症有关,而与精神分裂症相关的胃肠道炎症增加强烈表明肠道微生物群可能在患精神分裂症或其表现的风险中发挥作用。
•精神分裂症患者肠道微生物群显著改变
研究表明抗生素治疗引起的肠道微生物群失调与精神分裂症的发病率之间存在直接关系。精神分裂症患者中巨球型菌属、琥珀酸弧菌属、梭菌属、柯林斯氏菌属、甲烷短杆菌属和克雷伯菌属的丰度显著增加,而与健康人相比,精神分裂症患者中经黏液真杆菌属、粪球菌属和罗氏菌属的滴度下降。
•抗精神病药物治疗后肠道微生物群发生改变
几项研究已经确定抗精神病药物治疗与肠道微生物群之间的联系。精神分裂症患者在接受抗精神病药物治疗后发现微生物群丰度发生了显著变化。
在其他研究中,接受抗精神病药物治疗的患者的厚壁菌门与拟杆菌门的比例逐渐增加,与体重指数的上升相关。此外,接受治疗的个体的肠道微生物群富含短链脂肪酸和血清素代谢的基因。
注意缺陷与多动障碍(ADHD)是一种神经发育障碍,其特征是高度多动冲动和注意力问题。尽管可能涉及环境和遗传因素,一些证据表明注意缺陷与多动障碍的发展或症状可能与饮食成分对肠道微生物组的调节有关。
•ADHD儿童体内有害菌丰度较高,有益菌较少
最近发现,食用加工饮食的注意缺陷与多动障碍儿童体内有害细菌(如肠杆菌、大肠杆菌和梭菌菌株)的丰度明显较高,而有益细菌(如双歧杆菌和瘤胃球菌菌株)的丰度明显较低。
食用加工食品的注意缺陷与多动障碍患者的肠道微生物群α多样性和短链脂肪酸水平显著低于对照组,研究人员认为不平衡的饮食会扰乱结肠微生物平衡,并可能成为多动症患病的潜在风险因素。
•患者肠道菌群失衡影响激素和神经递质水平
宿主-微生物组的相互作用对激素和神经递质水平产生影响,被认为与注意缺陷与多动障碍的病理生理学有关。肠道菌群失调加上持续接触微生物病原体引起的免疫功能障碍可能会导致受影响的多动症患者出现过度活跃的行为。
肠道菌群提供多巴胺和去甲肾上腺素的前体
注意缺陷与多动障碍与预测的多巴胺和去甲肾上腺素合成异常有关,其前体由肠道细菌(主要是双歧杆菌)提供。
压力被定义为由困难情况或环境压力源引起的非特定情绪或身体反应。这种反应与心理和生物因素有关,例如性激素、高情绪反应性、被动应对技巧、糖皮质激素抵抗以及中枢和外周免疫激活。
✦压力会影响肠道微生物组成与活动
不同类型的心理和社会压力源已被证明可以通过神经元、免疫细胞和结肠嗜铬细胞释放信号分子、激素或神经递质来调节肠道微生物群的组成和活动。
压力对肠道微生物群的影响可能直接通过宿主肠道微生物群信号传导介导,也可能间接通过肠道生态系统的变化介导,并涉及炎症反应、微生物栖息地的改变、肠道运动和粘蛋白分泌。
✦产生短链脂肪酸的细菌减少可能是导致焦虑的关键
暴露于压力会导致肠道微生物群组成的实质性变化,肠杆菌科细菌的增加,而乳杆菌属的细菌减少。拟杆菌属减少,梭菌属增加。以及大肠杆菌和假单胞菌属的增加。
某些微生物群可能参与应激性焦虑和一般性焦虑症,其特征是社交和职业功能下降。研究人员报道,在一般性焦虑症患者中,粪杆菌(Faecalibacterium)、直肠真杆菌(E.rectale)、毛螺菌属(Lachnospira)、丁酸球菌(Butyricicoccus)和萨特氏菌(Sutterella)较低。这些都是短链脂肪酸的重要生产者。
应激性焦虑是指在强烈的精神或躯体应激事件的刺激下,产生的过度焦虑、恐惧等情绪。患者可出现紧张、坐立不安、心慌、呼吸急促等症状,还可伴有睡眠障碍、食欲改变等表现。
大胆猜想
短链脂肪酸产生菌的减少是焦虑和抑郁单胺类假说的关键。
单胺假说——指科学家在抗抑郁药领域提出的假说,即抑郁患者神经突触间隙可有效利用的单胺类神经递质浓度明显下降,而升高突触间隙单胺递质浓度(主要是血清素)能发挥抗抑郁作用。
抑郁症是一种与压力相关的情绪障碍,涉及神经免疫-神经内分泌失调,与促炎细胞因子水平升高相关。
促炎细胞因子与高水平的皮质醇有关,通过抑制四氢生物蝶呤酶发挥重要作用,四氢生物蝶呤对于合成多巴胺、血清素和去甲肾上腺素至关重要。
多巴胺、血清素和去甲肾上腺素是人体内重要的神经递质,它们在神经系统中发挥着重要的作用。
✦肠道微生物的多样性与抑郁严重程度负相关
几项研究报告称,不同抑郁症患者的肠道微生物群组成差异较大,粪便微生物多样性的增加与抑郁症症状的严重程度呈负相关。
研究人员发现,Gelria、Turicibacter、Anaerofilum、Paraprevotella、Holdemania和Eggerthella属在抑郁症患者中普遍存在,而普雷沃氏菌(Prevotella)和戴阿利斯特杆菌(Dialiste)的存在减少。
抑郁症患者体内有益菌大量减少
后来的研究还发现,与对照组相比,抑郁症患者肠道微生物总体减少。肠道微生物群中的双歧杆菌和乳酸菌减少。Dorea、瘤胃球菌属和阿克曼氏菌属的显著减少,以及副拟杆菌属(Parabacteroides)、普雷沃氏菌属(Prevotella)和放线菌属(Actinobacteria)的增加与抑郁个体相关。
✦短链脂肪酸有助于释放神经递质和调节血脑屏障
几项研究表明,重度抑郁症患者的丁酸盐、乙酸盐和丙酸盐减少,表明短链脂肪酸可能通过直接刺激神经通路或通过神经内分泌和免疫激活的间接中枢效应改变行为。
短链脂肪酸也有助于结肠嗜铬细胞合成和释放外周神经递质(血清素和乙酰胆碱),并有助于交感神经元合成和释放去甲肾上腺素。
除了局部作用外,短链脂肪酸还可以直接作用于血脑屏障的中心受体。此外,体外研究表明,丙酸盐和丁酸盐,而不是乙酸盐,都可以调节血脑屏障的通透性,防止脂多糖引起的通透性增加。
强迫症是一种慢性且持久的疾病,会被迫出现侵入性、自我张力障碍的想法或冲动或重复行为。
尽管只有少数研究涉及肠道微生物群与强迫症的关系,但压力和抗生素治疗都会影响微生物群组成,已被认为是与强迫症症状同时发生的因素。
✦强迫症患者肠道微生物丰富度较低
据报道,患有强迫症的个体肠道微生物群的物种丰富度较低,产生丁酸盐的属(颤旋菌属、Odoribacter和Anaerostipes)的相对丰度较低。
最近还报道强迫症患者粪便样本显示文肯菌科(Rikenellaceae)(另枝菌属)丰度增加,而普雷沃氏菌和毛螺菌科(Lachnospiraceae)丰度降低。
几种心理障碍中的肠道菌群失调
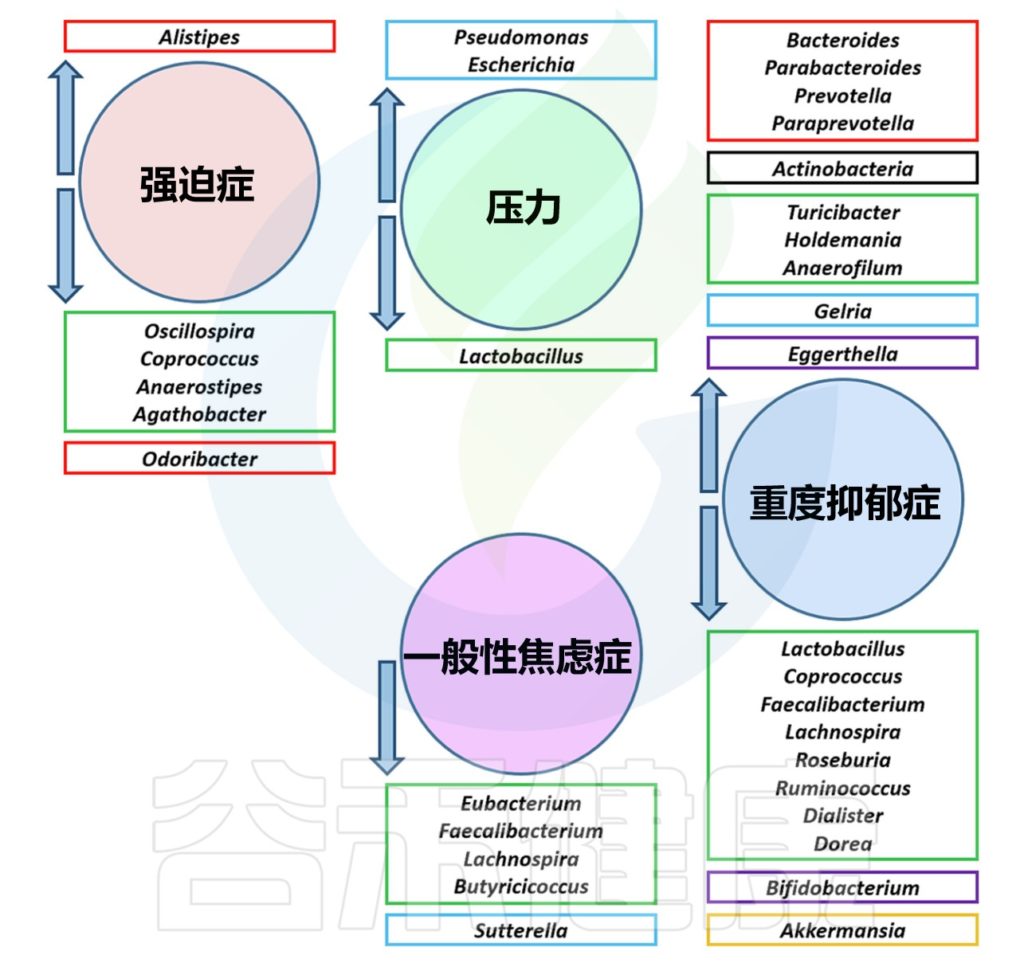
Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
杏仁核在与压力相关的情绪、行为反应和情绪调节中发挥着关键作用,它显著受到肠道微生物群的影响。
杏仁核,又名杏仁体,呈杏仁状,是边缘系统的一部分。
√肠道微生物的变化可以调节认知功能
在动物模型中,有一些证据支持肠道微生物群组成的变化可以影响调节认知功能,尽管只有少数研究关注人类认知。
拟杆菌水平较高的人群拥有较好的认知表现
最近,根据粪杆菌(Faecalibacterium)、拟杆菌(Bacteroides)和瘤胃球菌科(Ruminococcaceae)的丰度建立了三组受试者,并得出结论,较好的认知表现与较高水平的拟杆菌相对应。
使用抗生素会影响认知功能,故不可滥用
用抗生素治疗剥夺或破坏肠道微生物群也会影响认知功能,包括语言学习能力以及工作和空间记忆。
√肠道微生物会影响一个人的气质和性格
由于人格特征和行为模式以及生理和心理健康结果之间存在很强的关联,一些研究已经证明肠道微生物群与气质和性格之间存在关联,这些特征甚至可以通过粪菌移植在受试者之间传播。
研究了肠道微生物的组成与儿童气质之间的关系,发现更大的暴躁/外向和恐惧与系统发育多样性呈正相关,包括戴阿利斯特杆菌属 (Dialister)、文肯菌科(Rikenellaceae)、瘤胃球菌科(Ruminococcaceae)和约氏副拟杆菌(Parabacteroides)的丰度变化。
产丁酸细菌更丰富的人可能有更高的责任心
发现高度神经质和低外向性与γ-变形菌纲丰度增加有关。低责任性与变形菌丰度增加和毛螺菌科丰度减少有关,而开放程度高的人与更大的系统发育多样性和丰富度相关。
另一方面,高度的责任心与产生丁酸的细菌滴度的增加有关,这些细菌主要属于毛螺菌科。
√多样化的肠道微生物有助于社交和好心情
最近有研究表明,特定细菌属的丰度与人格特征显著相关。对肠道微生物组多样性的分析表明,具有较高社交网络的个体呈现出多样化的肠道微生物组,而焦虑和压力与肠道微生物组的组成改变和多样性降低有关。
研究还发现某些细菌属,包括阿克曼氏菌、脱硫弧菌、乳球菌、颤螺菌和萨特氏菌可能与行为密切相关。
已经使用了几种方法来确定肠道微生物群对中枢神经系统功能的作用,包括抗生素治疗、无菌动物模型和粪菌移植。
此外,精神抗生素和益生元已被用作精神和心理疾病的辅助治疗。精神抗生素的类别可以定义为“一种活的有机体,通过与共生肠道细菌相互作用,为患有精神疾病的患者带来心理健康益处”。这些药物通过调节和改善肠道微生物群发挥作用。
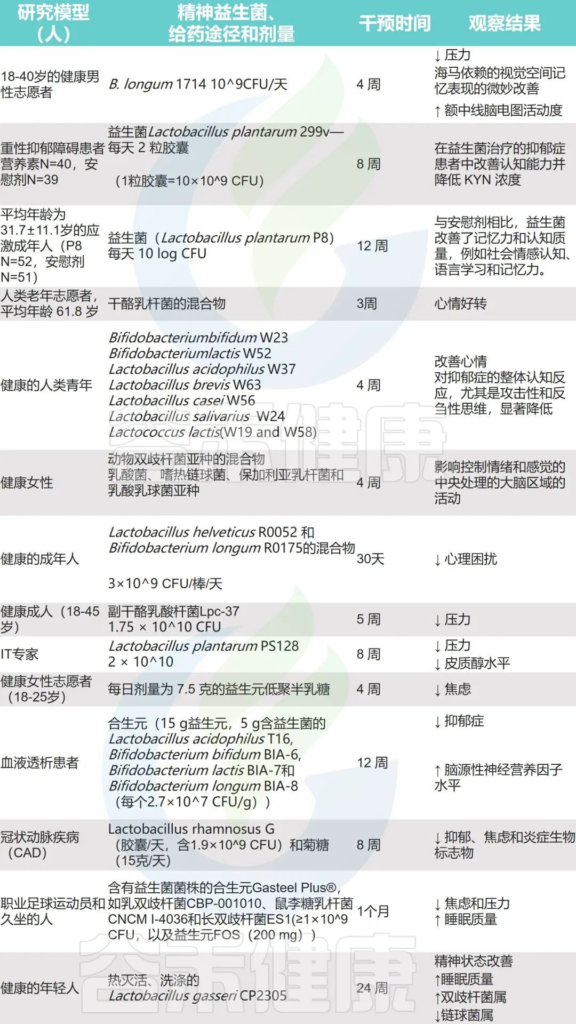
为了让大家有更清晰的认识,谷禾在下表整理了使用益生菌或益生元治疗对心理或精神疾病的影响。





Borrego-Ruiz A,et al.Prog Neuropsychopharmacol Biol Psychiatry.2023
•基因集富集分析展示下肠道菌群与精神疾病的关联
使用基因集富集分析 (GSEA) 能够检测肠道微生物群与精神疾病之间的以下显著关联:注意力缺陷与多动障碍常伴有脱硫弧菌和梭状芽孢杆菌富集;自闭症谱系障碍与拟杆菌属和脱硫弧菌有关;对于重度抑郁障碍,观察到脱硫弧菌、梭状芽孢杆菌目、钩端螺旋菌科和拟杆菌类的关联。
最近报道了普雷沃氏菌与自闭症谱系障碍以及放线菌属与精神分裂症之间的特定关联。还有一组研究人员提出了放线菌和假单胞菌与重度抑郁障碍之间的关系。
肠道微生物群和中枢神经系统通过两条途径进行交流:
(1)通过迷走神经途径的神经免疫和代谢回路;
(2)通过微生物群合成的代谢产物、肠道激素和内分泌肽。
先前的研究表明,肠道微生物群的失调是几种精神疾病的病理生理学。因此,恢复受干扰的微生物生态平衡可能为管理或预防神经系统疾病提供一种新的、有前景的方法。
另一方面,心理干预已证明在治疗功能性胃肠道疾病如肠易激综合征方面是有效的;然而还需要进一步的研究来确定心理干预对肠道微生物群变化的具体影响。
通过粪菌移植、健康的饮食和生活方式或使用心理生物药物等干预措施重建失调的肠道微生物群,可能在未来调节微生物群肠脑轴功能和促进心理精神健康方面具有重大潜力。
特别是,心理干预可能对某些神经系统疾病具有潜在的治疗作用。然而,这些干预措施的有效性并不相同,取决于给药方法、干预时间、使用的微生物菌株的数量和具体类型以及宿主的生理状况等因素。
在未来,单独或与抗精神病药物联合的个性化精神微生物干预可能成为临床患者的一种新的治疗策略。
主要参考文献
Borrego-Ruiz A, Borrego JJ. An updated overview on the relationship between human gut microbiome dysbiosis and psychiatric and psychological disorders. Prog Neuropsychopharmacol Biol Psychiatry. 2023 Sep 8:110861.
Abuaish S, Al-Otaibi NM, Abujamel TS, Alzahrani SA, Alotaibi SM, AlShawakir YA, Aabed K, El-Ansary A. Fecal Transplant and Bifidobacterium Treatments Modulate Gut Clostridium Bacteria and Rescue Social Impairment and Hippocampal BDNF Expression in a Rodent Model of Autism. Brain Sci. 2021 Aug 5;11(8):1038.
Bear T, Dalziel J, Coad J, Roy N, Butts C, Gopal P. The Microbiome-Gut-Brain Axis and Resilience to Developing Anxiety or Depression under Stress. Microorganisms. 2021 Mar 31;9(4):723.
Ansari F, Pourjafar H, Tabrizi A, Homayouni A. The Effects of Probiotics and Prebiotics on Mental Disorders: A Review on Depression, Anxiety, Alzheimer, and Autism Spectrum Disorders. Curr Pharm Biotechnol. 2020;21(7):555-565.
Bharwani A, Mian MF, Foster JA, Surette MG, Bienenstock J, Forsythe P. Structural & functional consequences of chronic psychosocial stress on the microbiome & host. Psychoneuroendocrinology. 2016 Jan;63:217-27.
Cerovic M, Forloni G, Balducci C. Neuroinflammation and the Gut Microbiota: Possible Alternative Therapeutic Targets to Counteract Alzheimer’s Disease? Front Aging Neurosci. 2019 Oct 18;11:284.
Cryan JF, O’Riordan KJ, Sandhu K, Peterson V, Dinan TG. The gut microbiome in neurological disorders. Lancet Neurol. 2020 Feb;19(2):179-194.

谷禾健康
在这个充满压力、紧张和焦虑的快节奏世界中,人人都容易患上许多身心疾病。
根据世界卫生组织 (WHO) 的数据,世界上每 8 人中就有 1 人患有精神障碍,其中焦虑症和抑郁症最为常见。尤其经历疫情,仅2020年,全球重度抑郁症患者增加27.6%(95%不确定区间(UI):25.1-30.3),焦虑症患者增加25.6%(95%不确定区间:23.2-28.0).

情绪健康对身体健康有直接影响,反之亦然。这背后的原因离不开肠道和大脑之间的双向交流,这两者之间的对话主要是由肠道微生物群介导的。
也就是说,肠道微生物群在神经精神疾病的发病机制中起着至关重要的作用。
精神障碍,包括抑郁、焦虑、恐惧、双相情感障碍、精神分裂症和其他精神病、痴呆、以及自闭症和创伤后应激障碍等,都有一系列症状,比如:异常的思想、感知、情绪、行为和人际关系等。

哪些因素会引发精神疾病?
大多数精神疾病是由环境、心理和生物因素共同引起的。遗传、脑损伤、微生物感染、药物滥用、营养不良或暴露于环境污染物都可能在精神障碍的发展中发挥重要作用。
环境污染物影响精神疾病易感性
随着世界各地工业流程和技术的进步,现代文明产生的各种环境污染物已大大增加。人们在日常生活中会接触到各种各样的污染物,这些污染物会影响肠道微生物群并操纵肠道和大脑之间的双向交流,从而导致精神或神经系统疾病的易感性。
精神益生菌:有助大脑健康的下一代益生菌
精神益生菌是一种能够影响肠-脑轴的益生菌菌株,对改善微生物群以及缓解中枢神经系统疾病的某些症状具有积极作用。常见的精神益生菌包括:乳酸杆菌、链球菌、双歧杆菌、大肠杆菌、肠球菌等。
//
本文讨论了各种环境污染物(重金属、邻苯二甲酸盐、双酚 A 、颗粒物等)如何影响错综复杂的微生物群-肠-脑轴,从而影响神经和整体心理健康,总结了精神益生菌如何通过菌群有效缓解多种中枢神经系统疾病的症状及改善心理健康。
本文涉及的专业术语
CNS—中枢神经系统
ENS—肠神经系统
HPA—下丘脑-垂体-肾上腺
GBA—肠脑轴
MGBA—微生物-肠-脑轴
GABA—一种中枢神经系统抑制性神经递质
VN—迷走神经
BDNF—脑源性神经营养因子
在了解环境污染物如何引发精神疾病之前,我们先来了解一下:微生物群-肠-脑轴。
微生物群-肠-脑轴是如何运作的?
它负责协调肠神经系统(ENS)和中枢神经系统(CNS)之间的双向交流,将外周消化活动与大脑的情绪、行为和认知中心联系起来。
微生物群-肠-脑轴 (MGB) 的双向交流
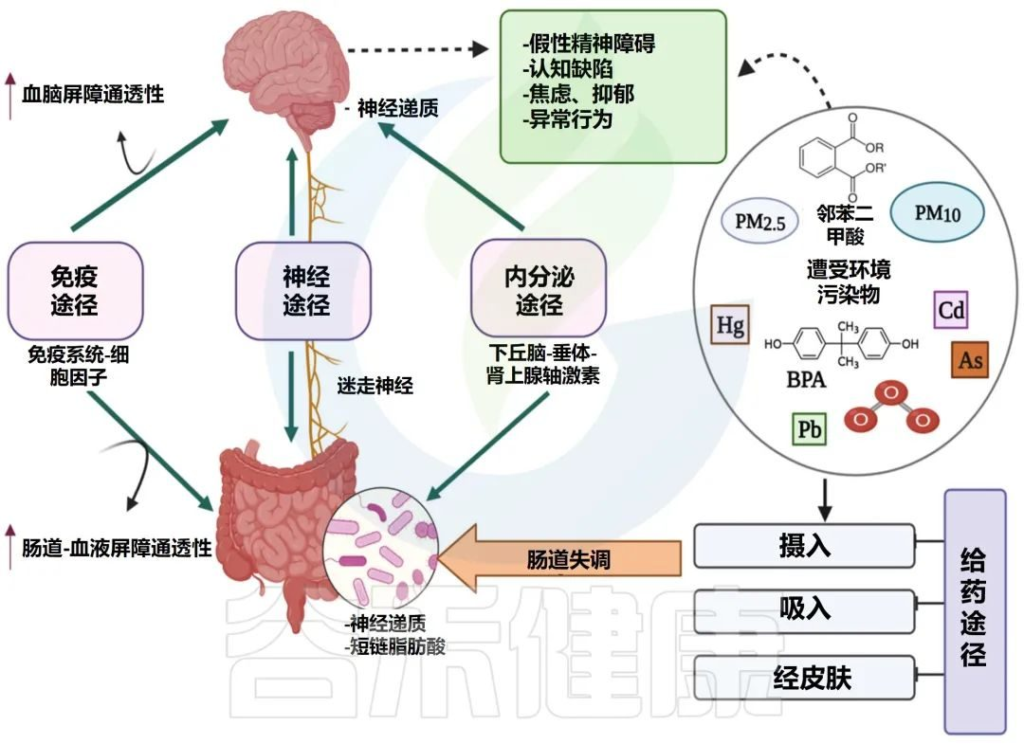
Singh S,et al., Microorganisms.2022
这种关联受皮质醇和下丘脑-垂体-肾上腺(HPA)激素、迷走神经(VN)系统和免疫反应等激素的调节。迷走神经是副交感神经系统的主要组成部分,可将肠道信号传递到中枢神经系统并刺激反应。
肠道菌群在肠-脑轴中如何发挥作用?
肠道菌群可以通过多种潜在机制改变大脑功能:
同时并产生具有神经活性特性的代谢物,例如短链脂肪酸、支链氨基酸、肽聚糖等。
这在我们之前的文章也有详细阐述过:
深度解读 | 肠道菌群和中枢神经系统的关系
微生物群-肠-脑轴如何影响压力、焦虑等?
肠-脑轴的作用已在几个生理过程中得到证实,例如饱腹感、食物摄入以及脂肪和骨代谢、葡萄糖调节和胰岛素分泌。
此外,宿主行为受肠神经系统和中枢神经系统与肠脑轴相关性的影响。这些系统活动的减少与压力或焦虑增加有关。
已经确定肠脑轴活性受降钙素基因相关肽(CGRP)的调节。当增加的病原微生物破坏肠道微生物群时,神经元可以产生CGRP并将其释放到肠道中。感染可诱导CGRP的分泌,进而激活宿主防御和降钙素受体的相应免疫反应。
微生物-肠-脑轴的存在表明,通过饮食、宿主衍生代谢物和不同环境污染物改变肠道微生物的组成和数量,可以影响中枢神经系统和肠神经系统,从而影响精神疾病的发生和发展。
菌群代谢产物——短链脂肪酸
有助于调节中枢神经系统
短链脂肪酸可以通过单羧酸盐转运蛋白穿过血脑屏障(BBB),通过过度表达紧密连接蛋白并保持血脑屏障的完整性。
短链脂肪酸可以调节神经营养因子 (BDNF) 的水平,促进神经发生,影响神经胶质细胞的形态和功能,有利于血清素形成并改善神经元稳态和功能,所有这些都有助于调节中枢神经系统中的神经炎症。
短链脂肪酸与这些肠-脑网络的结合可以直接或间接地改变认知、情绪和精神障碍的病理生理学。
通过调节途径(包括犬尿氨酸途径)改变神经递质活性,以及大脑中短链脂肪酸的可用性和影响的变化,都可能对脑源性神经营养因子(BDNF)功能产生影响,包括中枢神经系统中的神经元存活和分化。
如肽酪氨酸酪氨酸 (PYY)、胆囊收缩素(CCK)和胰高血糖素样肽-1(GLP-1)从表达游离脂肪酸受体(FF-R)的肠粘膜肠内分泌细胞中的释放。在啮齿动物中,血源性PYY和GLP-1会渗透到大脑中,并对神经递质和行为产生显著影响。
每天接触各种环境污染物会影响肠道微生物群,损害肠脑轴,它们是如何导致抑郁、焦虑等心理健康问题的?下一章节我们展开讨论。
我们知道,人体各类疾病(免疫性疾病、胃肠道疾病和神经行为疾病)可能是由于微生物群的变化而产生的,微生物群失调后致病菌增多,产生毒力因子,如脂多糖,从而引发一系列导致“肠漏”的过程。
所谓“肠漏”,即肠黏膜通透性增加,这可能使细菌、细菌毒素和其他小分子物质泄漏到血液中并引起全身炎症。
关于肠漏详见:什么是肠漏综合征,它如何影响健康?
细菌毒素因子和代谢物能够转移到远处的目标区域,例如大脑。激素合成、细菌产生的代谢物、模仿宿主产生的因子和表观遗传突变都是肠道菌群失调影响宿主的潜在机制。
✦ 环境污染物通过干扰菌群影响宿主
暴露于环境污染物会针对宿主和常驻肠道微生物群,其干扰可能会产生系统性影响,包括通过微生物群-肠-脑轴改变中枢神经系统的功能。
重金属、有机溶剂和空气污染物是研究最多的与人类精神疾病和心理功能有关的人造和天然毒物类型。
研究人员发现那些生活在土壤中重金属和重金属浓度较高的地区的人,患精神疾病的可能性更高。即使较低的水平也会导致肠道失调和对心理健康的负面影响。
重金属类型:
铅 (Pb)、镉 (Cd )、汞( Hg )等。
重金属可能以四种方式进入人体:
▸ 重金属如何对人类健康的不利影响?
在重金属到达大脑之前,初步的环境暴露预计会与肠道微生物群相互作用。
当重金属到达胃肠道系统时,重金属毒性可能由肠道微生物组通过代谢氧化或还原过程介导。另一方面,重金属会引起氧化应激,改变肠道屏障的通透性,扰乱人体健康的微生物群,导致菌群失调。肠道菌群失调提高了重金属和氧化应激的潜在破坏性影响,这与精神疾病有关。
肠道菌群对重金属的吸收和代谢的直接影响
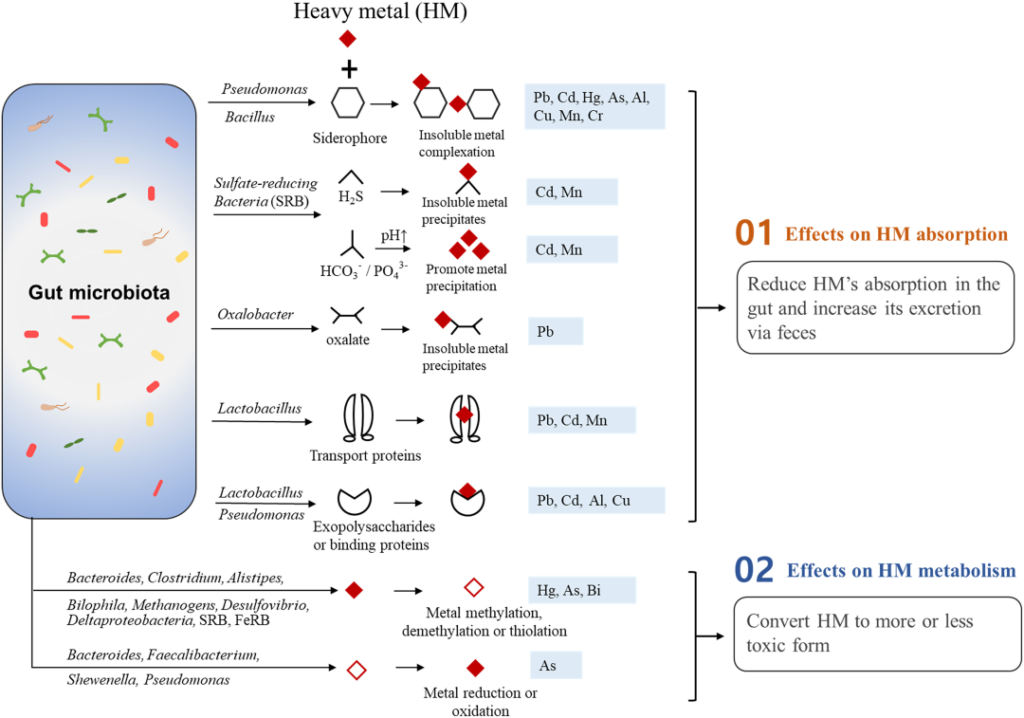
Duan H, et al., Sci Total Environ. 2020
【 铅 】
铅是一种众所周知的神经毒素,它对单胺信号传导 、下丘脑-垂体-肾上腺(HPA)轴和其他几个大脑系统的影响与情绪障碍有关。
几项动物研究表明,接触铅会导致HPA轴永久功能失调。
▸ 重金属导致线粒体功能障碍,与精神疾病有关
在某些精神疾病的病理生理学中,铅和镉等重金属可能导致线粒体生化级联反应发生故障。研究人员记录了 19 例线粒体疾病,这些疾病还伴有抑郁和焦虑等精神问题,确立了线粒体功能障碍和精神疾病之间的联系。
乳酸菌产生的支链氨基酸可以穿过血脑屏障,并通过增强线粒体生物合成来改变宿主生理,从而提高对活性氧的抗氧化作用。这就提供了重金属暴露、肠道微生物组和心理健康之间的重要联系。
根据肠道微环境因素,如 pH 值、氧化还原电位、氧气可用性、易感/耐药微生物的流行程度以及微生物群的总体多样性和代谢活动,推测肠道中有害金属的暴露会对常驻菌群产生不同的影响。
【 汞 】
汞中毒是第二大常见的重金属毒性。有几起因汞中毒引起的精神疾病的报告。汞的神经精神毒性主要涉及元素汞(Hg2+),它是通过甲基汞通过血脑屏障去甲基化而形成的。
▸ 汞积累可能引发脑损伤
由于大脑是汞的主要靶点,因此其产前暴露会导致人类和实验动物的大脑萎缩、大脑皮层和基底神经节损伤、细胞死亡、脑层紊乱和神经胶质增生。
由于Me-Hg中毒与年龄有关,因此汞中毒和汞沉积的症状因人在接触时的年龄而有很大差异。
▸ 过多接触汞的胎儿存在思维问题
在子宫内暴露于Me-Hg的儿童,可能在认知思维、记忆力、注意力、语言技能、肌肉控制和视觉空间技能方面存在问题。
急性Me-Hg暴露也改变了大鼠肠道微生物群的结构和功能,包括脱硫弧菌目、消化球菌科和幽门螺杆菌,所有这些都与特定的神经代谢物有关,如谷氨酸和γ-氨基丁酸 (GABA)。
在成熟的中枢神经系统中,谷氨酸和γ-氨基丁酸分别是主要的兴奋性和抑制性神经递质。它们的不平衡可能导致不同的精神和神经问题。
关于谷氨酸与肠道菌群详见:兴奋神经递质——谷氨酸与大脑健康
在鱼类中,Me-Hg处理增加了下列菌群:
Xanthomonadaceae,Pirellula,Cloacibacterium,
Comamonadaceae,Deltaproteobacteria FAC87
所有这些都参与了异生物质代谢和金属去除。有机和无机形式的汞通过胃肠道吸收并影响其他系统,包括中枢神经系统,引发心理问题。
【 砷 】
砷,也会导致认知功能障碍和易患情绪障碍,主要是通过破坏血清素和多巴胺代谢。
由于已知有几种肠道微生物有助于这些神经递质的生物合成,因此微生物群中的任何干扰都可能是导致肠脑串扰改变的可能原因。
▸ 砷处理小鼠:拟杆菌↑↑,厚壁菌↓↓,短链脂肪酸↓↓
在几项研究中,小鼠肠道微生物群中砷暴露的时间和剂量依赖性变化被确定为拟杆菌门的增加和厚壁菌门的减少。
研究还发现砷处理促进了与脂多糖产生、多重应激反应、DNA 修复和维生素生物合成有关的细菌基因转录,同时减少了短链脂肪酸生物合成有关的基因转录。
短链脂肪酸减少引起了:
慢性炎症、肠道通透性增加、条件致病菌增殖、金属摄入增加和血脑屏障功能障碍增加。
▸ 砷暴露的人类研究:致病菌↑↑ 共生菌↓↓
一项对尼泊尔人的研究发现,砷暴露通过富集挥发性细菌和致病菌,同时消耗肠道共生菌,从而改变了肠道微生物群组成。
此外,代谢组学分析显示了伴随的影响,几种肠道微生物群相关的代谢物在各种生物基质中被破坏。砷暴露不仅使肠道微生物群在丰度方面变化,还在代谢特征和功能方面也发生了变化 。
下列菌群因接触砷而发生显著变化,并可能与接触砷引起的疾病直接相关:
胃肠道上皮内的重金属离子相互作用或积累导致氧化应激、微生物群失调、细胞损伤和兼性厌氧菌丰度增加(包括变形杆菌和杆菌在内)。因此,上皮细胞可利用的氧气量增加,消耗产生短链脂肪酸的厌氧细菌,并降低抗炎和抗氧化代谢物的产生,这可能进一步破坏血脑屏障的完整性并减少神经发生,导致大脑功能紊乱。
重金属与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
小结
总体而言,重金属暴露会改变微生物组成,从而导致肠道微生物群的代谢改变,从而影响人体新陈代谢。
为了消除外源金属,需要一个稳定有效的肠道微生物群。预计膳食有毒金属缓解治疗可减轻有益肠道菌群的炎症负担,从而减轻精神疾病的发展。
一旦重金属进入人体,一些食物就会与它们螯合。水果和蔬菜提供了大量的抗氧化剂,能够减少重金属的损害。香菜、野生蓝莓、大蒜、柠檬水、小球藻、螺旋藻、咖喱、绿茶、大西洋海藻、大麦草、西红柿和益生菌是可以帮助逐渐去除体内金属的食物或补充剂。
重金属可能存在于:
– 处理过的木材中的防腐剂(砷和铜)
– 家用消毒剂(汞、铜和银)
– 厨具,如锅、锅、刀、汤匙和叉子(铝、铜和铅)
– 油漆(铅、汞、镉、锑)
– 杀虫剂、除草剂和杀菌剂(砷、锑和镉)
– 灭鼠药(铊)
– 鱼(汞)
– 大米(砷)
– 化妆品、染发剂(汞、铅)
– 纹身(汞)
– 地板蜡/抛光剂、织物柔软剂、汞合金填充物(汞)
– 巧克力、汽油、烟草烟雾(铅、镉)
– 罐头食品(铝、铅)
– 发酵粉、面粉、除臭剂、牙膏、胃抗酸剂、铝箔、泻药(铝)
– 自来水(铝, 镉)
– 含铅管道 (铅)
– 空气污染 (柴油机尾气、燃煤厂、钢铁和金属铸造厂、化肥公司)
邻苯二甲酸盐是存在于大量产品中的增塑剂,特别是润滑剂、地板材料和个人护理用品,如洗发水和肥皂。在产品使用和储存过程中,它们的浸出、迁移和氧化会污染各种水源、空气和土壤。
人类通过以下方式暴露于邻苯二甲酸盐:
对多个物种的研究表明,发育中的生物暴露于邻苯二甲酸盐会影响肠道微生物群,降低其多样性,特别是改变细菌代谢物的数量,这可能对健康产生严重影响。
✦ 邻苯二甲酸引起菌群失调:罗氏菌属和长双歧杆菌减少
新生儿的肠道微生物群受到早期药物治疗中接触邻苯二甲酸二酯 (DEHP) 的影响,这可能会影响他们以后的免疫反应。当婴儿静脉注射DEHP 时,会出现暂时的肠道微生物失调。DEHP暴露改变了细菌群落的组成和多样性,包括罗氏菌和长双歧杆菌的减少。
在小鼠中,DEHP暴露会导致肠道微生物群落结构以及粪便代谢物谱和雌性生殖毒性的改变。DEHP暴露引起的肠道菌群失调改变了微生物代谢物的水平,例如短链脂肪酸、支链氨基酸和单糖,它们是微生物群-肠-脑轴的重要组成部分。
对319 名在1999 年- 2006 年间在市中心分娩的不吸烟女性进行了研究,其中检测到了四种邻苯二甲酸酯代谢物:
其中三种邻苯二甲酸酯(DnBP、DiBP和BBzP)与一系列行为问题有关,包括焦虑、抑郁、躯体不适和退缩行为。
▸ 产前邻苯二甲酸酯暴露对儿童的神经发育产生负面影响
这些负面影响包括精神运动、认知和行为结果。通过干扰神经内分泌系统,这种污染物可能会损害神经元的分化和成熟,增加行为和认知缺陷的风险。
✦ 情绪问题通常与HPA轴有关
它会被邻苯二甲酸盐和双酚A等激素破坏。研究记录了青春期和成年小鼠在围产期暴露与DEHP时的焦虑和抑郁行为。在这些试验中,增加的焦虑相关行为与功能失调的HPA轴相关,表现为ACTH增加、皮质酮水平降低以及下丘脑GR水平升高。
▸ DEHP暴露后,小鼠菌群代谢物对甲酚上调
在年轻小鼠中,DEHP暴露通过增加合成代谢物前体的物种的丰度,来抑制丁酸盐合成并上调对甲酚的产生,对甲酚是一种与神经发育和行为问题相关的细菌代谢物。这证明了DEHP的神经毒性作用与肠道菌群失调之间的联系。
双酚A(BPA)是一种内分泌干扰化学品(EDC),用于生产聚碳酸酯塑料。饮食、空气、水和灰尘都是人类接触双酚A的可能来源。
由于双酚A的广泛使用,它的暴露正成为一个值得关注的问题。根据最近对暴露于双酚A的发育或成年动物调查,双酚可以改变一系列物种的肠道微生物群。
▸ 双酚A暴露减少了双歧杆菌,AKK菌,导致炎症,引发精神障碍
在一项研究中,肠道变化如下:
小鼠产前双酚A暴露减少了双歧杆菌,双歧杆菌已知具有抗炎特性,这可能导致全身炎症,从而导致各种健康问题,包括精神障碍。
▸ 产前母亲尿液双酚A浓度高的孩子,具有更高水平的焦虑和认知异常
各种实验和流行病学调查已将产前母亲尿液双酚A浓度的增加与儿童行为,空间学习和记忆结果联系起来。
更多的研究表明,通过过度激活HPA轴并破坏其基础和压力诱导,产前暴露于双酚A的动物具有更高水平的焦虑和认知异常,通过减少海马 GR 介导的反馈介导的HPA轴抑制,可能会增加在以后的生活中出现压力相关问题的风险。
数据表明,产前双酚A暴露和精神障碍持续增强通过重编程诱导的HPA轴激活联系起来。雌激素EDC已被证明以时间、性别和暴露依赖的方式影响大脑,尤其是下丘脑。
▸ 双酚A降低短链脂肪酸的水平,诱发炎症,损害认知
根据16SrRNA 扩增子测序分析,暴露于双酚A会导致β多样性的差异,而短链脂肪酸生产者的相对丰度显著下降。双酚A还降低了粪便短链脂肪酸的水平,同时增加了氧化应激 、全身脂多糖水平和肠道通透性,所有这些都是炎症引起的慢性疾病的早期迹象。
根据最近的一项调查,小鼠中双酚A暴露引起的神经毒性可能部分归因于MGBA的破坏。暴露于双酚A的雄性小鼠的结果表明,增加的神经炎症损害了它们的认知功能。神经递质血清素、其前体色氨酸及其代谢物5-羟基吲哚乙酸 (5-HIAA) 的脑、结肠和血清水平在暴露于双酚A后都会降低。
▸ 双酚A诱导的肠道菌群变化使粘蛋白、丁酸、血清素降低
随着肠道微生物群的改变,发现结肠中的粘蛋白水平和粘液分泌降低,丁酸水平也是如此。双酚A诱导的肠道菌群变化部分地调节了双酚A对心理和代谢健康的负面影响。
双酚A降低了粪便中短链脂肪酸和大脑中血清素水平,以及参与色氨酸代谢的不同类型的微生物,导致神经递质信号发生变化。双酚A改变了肠血屏障(GBB)和血脑屏障(BBB)的完整性,这可能与肠道和大脑的生态失调、认知能力下降和炎症增加有关。
内分泌干扰物与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
空气污染中最常见的化学物质包括一氧化碳、颗粒物、臭氧、二氧化氮和其他构成固体和液体成分(包括道路灰尘、车辆尾气和风吹土壤)。
▸ 空气污染物影响肠道菌群,诱发炎症,损害神经认知
空气污染已被证明会改变肠道微生物群的组成和功能,导致有害代谢物的产生,调节免疫反应,影响代谢途径,引发局部炎症,最后破坏肠血屏障,所有这些可能会进一步破坏血脑屏障并改变大脑功能。
空气污染会产生严重的神经认知后果,从行为改变到神经退行性疾病,这些后果可能会产生可怕的心理健康后果。
研究人员发现了长期和短期暴露于空气污染物(CO、PM10、PM2.5、NO2、SO2和O3)和精神障碍,如注意力缺陷多动障碍、抑郁症、自杀,焦虑和各种行为问题有关。
颗粒物与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
▸ 氧化应激升高和促炎细胞因子的产生
对PM、NO2和SO等空气污染物暴露的几项研究在各种动物模型中报告了氧化应激升高和促炎细胞因子的产生,以及脑组织中抗氧化活性降低导致精神障碍,这意味着空气污染暴露与心理健康问题之间存在关系。
▸ 通过血脑屏障或沿嗅觉神经易位到达大脑,引发促炎反应
根据人体尸检发现和动物实验研究,空气污染物,特别是细颗粒和超细颗粒,能够通过血脑屏障或沿嗅觉神经易位到达大脑。通过破坏血管调节过程,这些颗粒还可以在大脑中引发促炎反应。
通过改变肠道菌群的组成并通过活性氧产生和核因子NF-kB激活在体内引起持续的促炎倾向,空气污染物对肠道菌群产生有害影响。污染物通过破坏结肠上皮细胞中的紧密连接蛋白而导致肠道通透性增加。
▸ PM和臭氧:激活HPA轴
PM和臭氧是两种具有不同特性和反应性的常见污染物,已在实验中显示可激活HPA轴并释放糖皮质激素应激激素作为神经内分泌应激反应的一部分。这可能通过与肾上腺素能受体的作用相当的受体来调节肠道菌群的组成。
根据一项结合多组学和多指标技术进行的流行病学研究,PM2.5可能通过改变肠道菌群、色氨酸代谢、炎症因子和关键HPA轴激素来激活肠脑轴,从而导致神经和心理功能障碍。
▸ 空气污染导致的菌群及其代谢物变化
空气污染成分与增加和促炎细胞因子释放到肠道有关,以及拟杆菌门、厚壁菌门和疣微菌的相对数量发生显著变化,导致体内炎症水平升高,这与几种精神疾病的开始和发展有关。
短链脂肪酸的产生在接受治疗的小鼠中也发生了变化,盲肠中的支链脂肪酸(如异丁酸和异戊酸)丰度增加。它还导致丁酸盐耗竭,这与屏障功能的降低和对粘膜炎症的更易感性有关。
由于微生物代谢物从肠道迁移到体循环,空气污染物引起的肠道通透性增加,可能在增加全身炎症水平方面发挥重要作用,这将对中枢神经系统产生影响并促进精神疾病的发展。
考虑到微生物群-肠-脑轴在中枢神经系统功能中的重要性,调节微生物群-肠-脑轴的干预措施是改善心理健康的有希望的方法。
肠道微生物群已成为心理健康的重要渠道和前瞻性干预目标。益生菌、益生元、合生元和后生元都可以作为精神益生菌,其中一些是精神障碍的治疗干预措施。
“精神益生菌”:益生菌、益生元和所有微生物群靶向干预措施,它们可以操纵微生物群-肠-脑信号并对情绪、认知和焦虑等神经功能产生积极影响。
精神益生菌对心理的积极影响

Oroojzadeh P,et al.J Mol Neurosci.2022
➤ 益生菌
许多研究表明,以合适剂量服用益生菌可以减轻健康人群的压力、焦虑和抑郁。乳酸杆菌和双歧杆菌是用于精神心理研究最多的菌株。各种益生菌菌株的混合物也可用于产生协同效应或提高功效。
益生菌会影响血清素、脑源性神经营养因子、多巴胺和中枢神经系统抑制性神经递质的水平。迷走神经和肠神经系统在这方面起着至关重要的作用。益生菌还通过产生包括色氨酸和短链脂肪酸在内的代谢物间接改变中枢神经系统功能。
➤ 益生元
当宿主微生物有选择地利用益生元时,它会给宿主带来健康益处。具有双歧化特性的益生元,如低聚果糖、低聚半乳糖和短链低聚果糖,都已因其心理生物效应而受到研究。
除了这些多酚,Omega-3脂肪酸和母乳低聚糖,如具有益生元特性的 3’唾液酸乳糖 (3’SL) 或 6’唾液酸乳糖 (6’SL),在适量服用时显示出对心理健康的益处。
益生元可以通过增加双歧杆菌和减少致病菌来恢复肠道中的益生菌状态,从而潜在地缓解焦虑和抑郁等心理健康问题。
例如,短链脂肪酸对细胞系统的影响是通过免疫系统和内分泌途径以及神经和体液途径介导的。短链脂肪酸激活游离脂肪酸受体并与免疫和肠上皮细胞相互作用,从而影响肠黏膜的安全性和功能。
在环境方面,它还分别通过分泌白细胞介素和控制小胶质细胞的形态和功能来影响全身炎症和神经炎症。它还诱导肠道激素如胰高血糖素样肽1的分泌,这些激素通过迷走神经和全身通路将间接信号传递到大脑。所有这些途径最终都会影响学习、情绪和记忆。
➤ 合生元
合生元正在发展为通过调节肠道微生物群来改变情绪和行为的另一种方式。在多项研究中,合生元已被证明可以减轻特定人群的压力和焦虑样行为。
➤ 后生元
后生元,或故意灭活的全细胞或其成分,通过微生物群的变化、改善肠道屏障功能、调节代谢或免疫反应或神经系统信号传导来提供健康益处。
几项关于人类和动物模型的研究表明,后生元具有抗抑郁和抗焦虑作用。
对精神益生菌在人体的研究
Singh S,et al.Microorganisms.2022
对精神益生菌的动物研究

Singh S,et al.Microorganisms.2022
精神益生菌的可能作用方式
HPA轴的调节、免疫反应和炎症的调节以及神经激素和神经递质的产生是精神益生菌发挥作用的主要机制。
精神益生菌通过恢复肠道中的益生菌状态和减轻精神障碍来影响细菌-肠道-大脑的关系。
✦ 精神益生菌调节神经递质,影响情绪
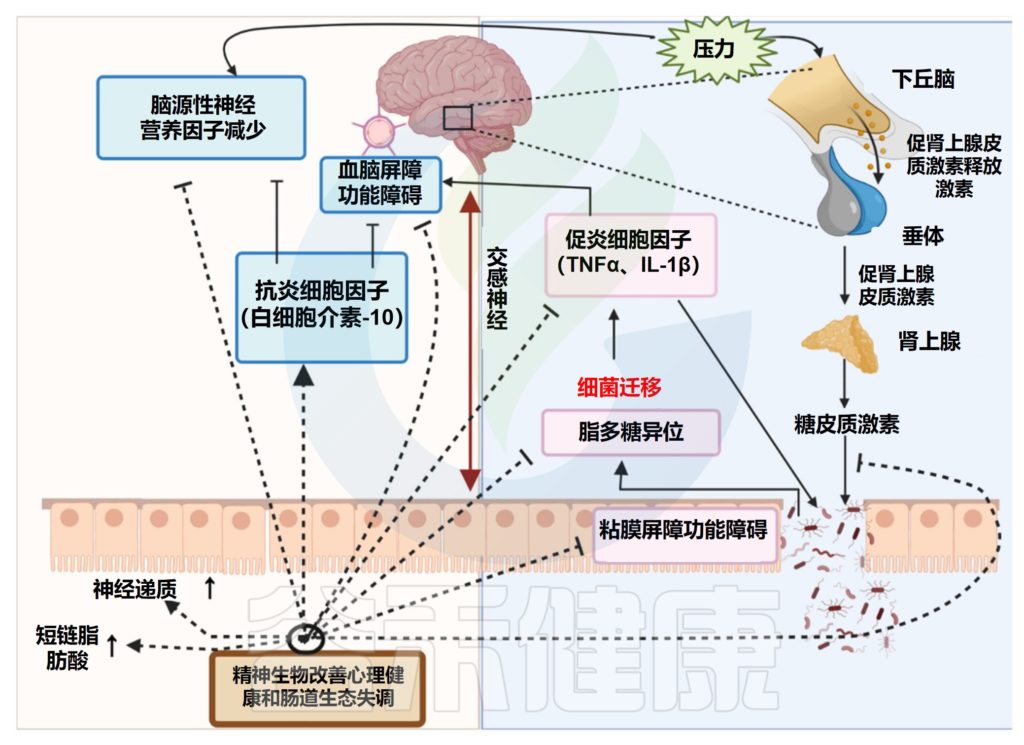
心理、智力、生理和神经元指数的变化是精神益生菌抗精神病作用的特征。精神益生菌可以调节神经递质和蛋白质,例如儿茶酚胺、乙酰胆碱、血清素和脑源性神经营养因子。它们影响情绪、认知表现、学习和记忆,以及维持大脑中的兴奋-抑制平衡。
当肠道中神经递质浓度升高时,血浆色氨酸水平下降,导致肠道细胞将化学物质释放到大脑中,从而缓解精神疾病。通过G-蛋白偶联受体产生主要作用的短链脂肪酸是精神益生菌对双向肠脑轴的另一个重要的拟议作用途径。短链脂肪酸可能通过加强血脑屏障、改变神经传递、改变神经营养因子水平和帮助记忆巩固来直接影响大脑功能。
精神益生菌的潜在作用模式
Singh S,et al.Microorganisms.2022
✦ 精神益生菌调节激素,改善认知
通过激素途径作用于大脑,影响身体的应激反应系统,即HPA轴,涉及肾上腺和大脑;当这种情况发生时,它会破坏压力荷尔蒙的产生和功能。这很可能是导致认知问题的主要因素。
精神益生菌可以通过调节HPA轴来降低糖皮质激素水平。糖皮质激素会破坏肠道屏障功能,降低上皮完整性,将细菌向外移动并引发炎症免疫反应。
✦ 精神益生菌调节免疫系统
精神益生菌可以通过直接减轻促炎细胞因子或通过增加抗炎细胞因子以迂回的方式减少炎症和恢复血脑屏障完整性来调节免疫系统的功能。管腔外的细菌迁移也可以通过增加促炎细胞成分的水平直接影响炎症。
✦ 调节肠脑轴中特定神经化学受体的表达,抗抑郁
一些可以产生中枢神经系统抑制性神经递质、去甲肾上腺素和血清素等神经递质的肠道微生物有:
嗜酸乳杆菌、干酪乳杆菌、婴儿双歧杆菌、长双歧杆菌、大肠杆菌、芽孢杆菌、酵母菌、念珠菌、链球菌、肠球菌。
这些可以通过调节肠脑轴中特定神经化学受体的表达来产生抗焦虑和抗抑郁作用。尽管对人类微生物组的研究仍处于初期阶段,但研究结果表明肠道微生物可能会影响人们的认知健康、行为和情绪。
一些能产生神经递质或神经激素的肠道微生物

Oroojzadeh P,et al.J Mol Neurosci.2022
生活方式、饮食、衰老和遗传等一系列因素促成了神经退行性疾病的发生和发展。益生菌对肠脑轴的影响可以通过影响中枢神经系统来实现。
肠道微生物群对神经系统疾病的影响
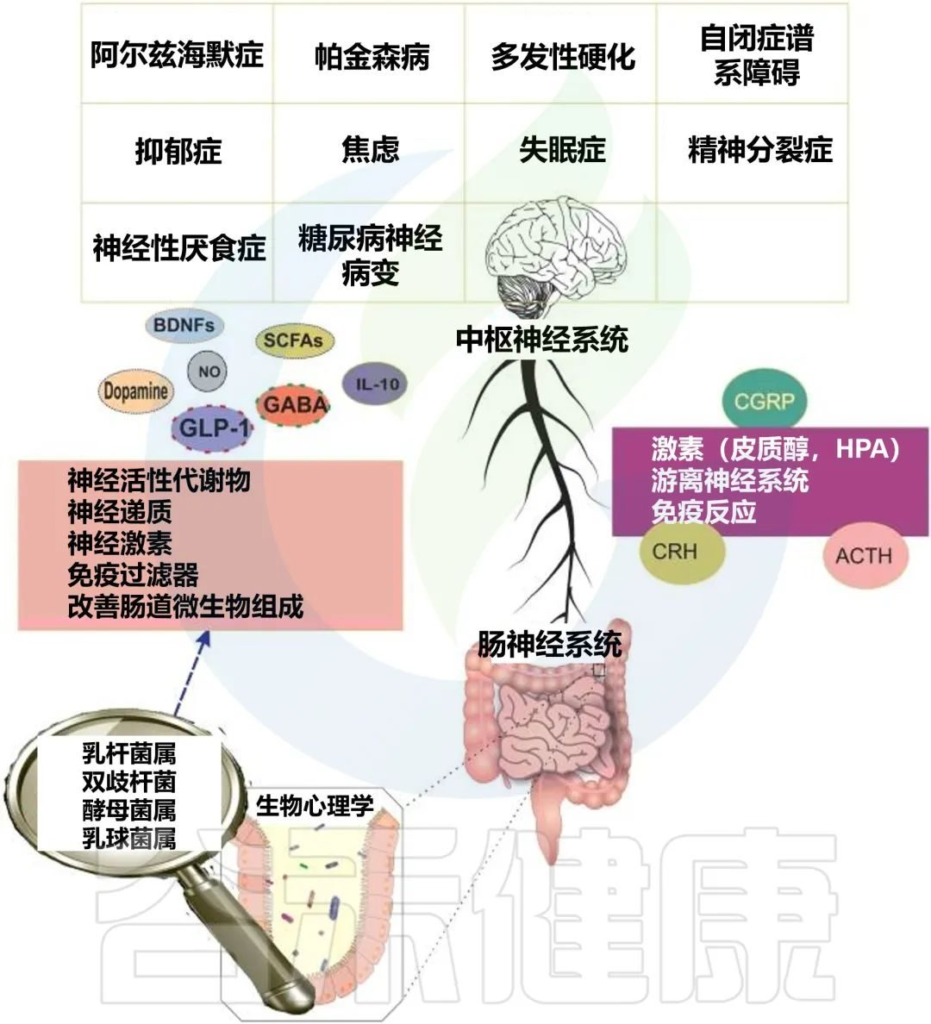
Oroojzadeh P,et al.J Mol Neurosci.2022
阿尔兹海默病是神经系统疾病中痴呆的主要原因。痴呆症通常发生在 60岁以上的人群中。这种疾病没有明确和有效的治疗方法。
研究表明,阿尔茨海默病的主要表现与细胞内Tau 神经原纤维缠结和细胞外淀粉样斑块的产生有关。
更好地了解这种疾病所涉及的生理机制可以帮助确定有效的治疗方法。
肠道微生物与阿尔茨海默症
鉴于肠道微生物群的损害可能与阿尔茨海默症等神经退行性疾病有关,因此调节肠道菌群是治疗阿尔茨海默症的一种可能方法。
炎症和氧化应激会破坏中枢神经系统中的神经细胞,从而导致阿尔茨海默症。
预防胆碱能神经元破坏以及大脑中乙酰胆碱水平的增加是成功治疗阿尔茨海默症所需要的。
已经证明,持续应用D-半乳糖可能会通过增加氧化应激和活性氧物质而导致认知异常和记忆障碍。
一些益生菌,包括植物乳杆菌,能够产生乙酰胆碱,并且可以保护由D-半乳糖消耗引起的记忆缺陷。
几种关于益生菌菌株补充的研究:
关于阿尔茨海默病与肠道菌群详见:阿尔茨海默病de饮食-微生物-脑轴
阿尔兹海默症与2型糖尿病
阿尔兹海默症的一个重要危险因素是2型糖尿病。胰高血糖素样肽-1(GLP-1)在肠道和中枢神经系统(尤其是脑干)中产生,并与神经保护以及认知功能和葡萄糖代谢有关。
GLP-1受体在不同组织(肾、肺、心脏、中枢神经系统等)中表达,可以上调参与脑细胞修复和分化的各种基因的表达。GLP-1还可以促进高血糖状态下的胰岛素分泌。
以前的研究表明,GLP-1在中枢神经系统中作为神经保护因子,可诱导神经细胞增殖/凋亡,改善学习和记忆,降低Aβ斑块沉积,保留多巴胺能神经元,刺激神经再生。
▸ GLP-1工程益生菌减少记忆障碍
研究人员研究了GLP-1工程益生菌(Lactococcus lactis MG1363)口服给药后对AD小鼠模型的影响。脂多糖和1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)分别诱导记忆障碍和运动功能障碍。
结果表明,工程菌株能够通过两种信号通路减少记忆障碍和运动功能障碍。此外,工程益生菌降低了病原体的丰度,并增加了Akkermansia muciniphila的丰度。
还观察到炎症反应下调、阻断NF-κB信号和 MAPKs/PI3K/AKT。已确定GLP-1和GIP(葡萄糖依赖性促胰岛素多肽)作为神经保护因子对2型糖尿病治疗的有效性。
探讨GLP-1/GIP/胰高血糖素三位一体治疗(30天)对AD小鼠认知行为的影响。结果表明,该治疗通过减少认知障碍和病理变化对阿尔茨海默病产生有益影响。
小结
总的来说,这些信息阐明了在阿尔兹海默症中用益生菌操纵肠道微生物群可以改善葡萄糖代谢受损、延缓阿尔兹海默症进展并减少神经炎症,从而有利于胰高血糖素样肽1的作用。
帕金森病是第二种常见且主要的神经退行性疾病。该疾病与突触核蛋白积累和多巴胺能神经元的进行性丧失有关,并以运动和非运动症状为特征。肠道功能异常的非运动症状主要是体重减轻、胃轻瘫、便秘和排便功能障碍。
目前,在治疗帕金森病时,服用精神生物药物备受关注。报告说,食用益生菌混合物对释放多巴胺的神经元提供有效保护,并随后减少小鼠的运动功能障碍恶化。
✦ 补充益生菌能改善帕金森病的相关症状
研究确定了益生菌副干酪乳杆菌对帕金森病大鼠运动障碍的影响,并且与对照组相比,有益生菌的大鼠运动障碍更少。
在一项临床研究中,评估了含有的L.casei Shirota发酵乳对帕金森病患者5周的效果,并报告了腹胀减少、便秘减少和腹痛减少。
每天一次服用含有多种益生菌菌株和益生元的发酵乳,持续4周,并报告改善了帕金森病患者的便秘。
每片使用60毫克两种益生菌:嗜酸乳杆菌和婴儿双歧杆菌,每天两次,持续3个月,40名帕金森病患者腹痛和腹胀缓解。
报告称,在接受8×10^9 CFU/天益生菌12周的帕金森病患者中,过敏反应降低,丙二醛水平降低,谷胱甘肽水平升高。
关于帕金森与肠道菌群详见:肠道微生物与帕金森以及相关影响因素
多发性硬化症是一种涉及中枢神经系统的自身免疫性疾病,其中髓鞘覆盖的轴突被破坏。
遗传和环境因素以及病毒感染被认为是多发性硬化症发展的主要风险因素。然而,这种疾病的确切原因尚不清楚。
✦益生菌可以改善多发性硬化症
越来越多的证据表明,益生菌可以通过改变肠道微生物组、抑制炎症通路和调节免疫系统来改善多发性硬化症患者的免疫系统。
评估了含有发酵乳杆菌、干酪乳杆菌、嗜酸乳杆菌和双歧杆菌的益生菌菌株的效果对接受益生菌混合物12周的多发性硬化症患者的心理健康、残疾和代谢状况的影响。
证明益生菌菌株增加了多发性硬化症小中抗炎细胞因子包括IL-4、IL-5、IL-10的表达,并减少了促炎 IFN-γ和IL-1β的分泌。
自闭症谱系障碍是社会交流、感觉运动行为和有限兴趣方面的一系列缺陷。
自闭症谱系障碍的表现始于儿童早期。自闭症患者表现出胃肠道症状。自闭症儿童的胃肠道功能障碍通常与攻击性行为、易怒和睡眠障碍有关。
✦益生菌对自闭症的有益影响
报告了益生菌对自闭症患者行为和胃肠道表现的有益影响。使用含有嗜酸乳杆菌、鼠李糖乳杆菌和长双歧杆菌的益生菌菌株治疗孤独症儿童3个月后,双歧杆菌和乳酸杆菌的数量增加,体重减轻,胃肠道症状改善。
此外,接受益生菌菌株1个月的自闭症儿童的自闭症核心症状有所改善,腹部症状有所减轻。
扩展阅读:自闭症,抑郁症等与维生素缺乏有关
抑郁症和焦虑症是常见的疾病之一。这两种疾病大多同时发生。抗抑郁药、抗焦虑药和催眠药通常用于治疗。临床上,抑郁与下丘脑-垂体-肾上腺失调之间存在关联。
研究表明,健康个体和重度抑郁症患者的肠道微生物群是不同的。重度抑郁患者双歧杆菌和乳杆菌减少,同时梭菌、链球菌、克雷伯菌、颤杆菌和Allistipes增加。
胃肠道细菌通过迷走神经通路激活压力回路。长期暴露于压力源会导致去甲肾上腺素的长期分泌,这会改变肠道微生物群并使肠道对细菌和毒素更具渗透性,然后是HPA轴的压力反应。
✦益生菌能降低压力改善焦虑
研究了益生菌菌株B. breve CCFM1025对粪便微生物组成和脑神经系统改变以及皮质酮、细胞因子和短链脂肪酸的血清水平的影响。总体而言,抑郁和焦虑样行为减少了。
研究指出,益生菌菌株B. longum 1714 能够降低压力水平并改善健康志愿者的记忆力。
评估了鼠李糖乳杆菌HN001对423名孕妇产后焦虑和抑郁表现的影响,并指出益生菌治疗组的抑郁状况显著降低。
益生菌菌株L. plantarum 299v可降低犬尿氨酸水平并增强重度抑郁症患者的认知功能。然而,其他调查并未报告接受益生菌的患者与对照组在焦虑和幸福感评分方面有任何显著差异。
有学者指出益生菌菌株长双歧杆菌NCC3001可以提高肠易激综合征患者的生活质量,并可以减少这些病例的抑郁症。
关于抑郁症与肠道菌群详见:抑郁症,恐惧,压力和肠道微生物群脱不开的关系
失眠
充足的睡眠是影响生活质量的关键因素。肠道菌群通过微生物-肠-脑轴影响宿主的精神状态和睡眠状态。
宿主的昼夜节律和睡眠质量取决于微生物组谱和代谢特性。益生菌被认为可以改善睡眠健康。GABA 是一种抑制性神经递质,能够通过减少焦虑来促进放松。
L.brevis DL1-11 是一种具有高GABA生产能力的益生菌菌株,其改善小鼠睡眠的潜力已得到证实。
关于睡眠与肠道菌群详见:肠道菌群与睡眠:双向调节
精神分裂症
精神分裂症是一种慢性衰弱性疾病。研究表明,肠道微生物群的破坏会增加全身炎症。因此,神经炎症会导致精神分裂症。
精神分裂症患者通常患有营养状况受损、压力反应高、炎症状态增加和乳糖不耐症。具有抗炎和免疫调节特性的益生菌可能有助于减轻精神分裂症患者。
✦ 益生菌减轻精神分裂症症状
报道了丁酸梭菌、粪链球菌和肠系膜芽孢杆菌的益生菌混合物可以减轻精神分裂症的症状。研究表明,益生菌菌株B. lactis Bb12 亚种的组合B. lactis Bb12 GG和鼠李糖乳杆菌菌株可以减少精神分裂症患者的肠道障碍。
研究了鼠李糖乳杆菌菌株GG和动物双歧杆菌乳亚种在慢性精神分裂症的可能免疫调节作用。报告称,血管性血友病因子浓度显著降低,同时脑源性神经营养因子、巨噬细胞炎性蛋白-1β、单核细胞趋化蛋白-1和RANTES(受激活、正常T细胞表达和分泌的调节)水平升高。因此,精神分裂症患者服用益生菌补充剂可能会改善胃肠道渗漏。
B. lactis Bb12有助于使男性患者的白色念珠菌抗体水平和白色念珠菌相关肠道不适正常化。
糖尿病性神经病变是一种与轴突萎缩、脱髓鞘疾病、再生能力下降、神经元炎症和周围神经病变有关的营养性神经退行性疾病。
糖尿病神经病变可通过神经元肠脑轴、门静脉(调节中枢神经系统中的能量代谢)和外周神经元传导丧失改变血糖调节以及肠道葡萄糖吸收不良。
2型糖尿病的特征是葡萄糖代谢失调,导致空腹和餐后高血糖。胰岛素和胰高血糖素分泌和功能受损是这种疾病的主要原因。
▸ 胰高血糖素样肽1(GLP-1)
GLP-1是肠细胞响应葡萄糖而分泌的一种肠促胰岛素激素,用于2型糖尿病治疗。它通过特定受体激活肠道神经元并调节肠道转运,增加胰岛β细胞的增殖,增强葡萄糖依赖性胰岛素分泌,减少胰岛α细胞的胰高血糖素分泌。
因此,它会降低2型糖尿病患者的血糖和食物摄入量。当 GLP-1被激活时,它会向迷走神经传递一个神经信息,该信息通过肠脑轴参与血糖调节。GLP-1 还具有神经保护和神经源性潜力,研究表明它在来自背根神经节的神经元的原代培养物中诱导轴突。因此,它可以有效地治疗糖尿病神经病变。
✦ 益生菌增强胰岛素分泌,改善肠神经系统
研究发现益生菌通过上调G蛋白偶联受体 、胰高血糖素原和转化酶原活性,通过葡萄糖触发的GLP-1 分泌来增强胰岛素分泌。
已经确定,当无菌小鼠被健康的肠道微生物群稳态定植时,肠神经系统和迷走神经的神经元活动得到恢复,但糖尿病小鼠的肠道微生物群却没有。
研究发现用罗伊氏乳杆菌喂养大鼠9天可以通过靶向肠道感觉神经中的钙依赖性钾通道来改善肠神经系统。
一些乳酸杆菌菌株(L. farciminis, plantarum, fermentum)可以产生一氧化氮作为神经递质,它能够影响神经元对GLP-1和葡萄糖代谢的反应。
✦ 益生菌降低胰岛素抵抗,增加抗氧化能力
研究了GLP-1在2型糖尿病大鼠体内,白藜芦醇和益生菌作用。给大鼠喂食各种益生菌,包括植物乳杆菌、保加利亚乳杆菌、干酪乳杆菌、婴儿双歧杆菌、嗜酸乳杆菌、长双歧杆菌、短双歧杆菌,剂量为 50 × 10^9 4周。发现与糖尿病组相比,这些益生菌和白藜芦醇可以降低葡萄糖和胰岛素抵抗(p < 0.001),并增加GLP-1以及总抗氧化能力(p < 0.001)。
发现两种菌株,L. kefiranofaciens M 和 L. kefiri K可以通过诱导GLP-1分泌,抑制细胞因子产生(促炎和炎症因子),增加IL-10的产生,改变肠道菌群向LAB和双歧杆菌的方向发展,减少产气荚膜梭菌和大肠菌群,从而降低小鼠模型中T1D的进展。
这些结果揭示了益生菌在增加GLP-1水平中的作用,这可以随后缓解高血糖症,并可能被认为是糖尿病治疗的潜在候选者。
关于2型糖尿病和肠道菌群详见:2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
神经性厌食症是另一种重要的精神障碍,与严重的体重减轻、精神合并症、对肥胖的恐惧和饮食限制有关。
根据对肠脑相互作用的深入了解以及益生菌对该轴的积极作用,可以为神经性厌食症治疗提供几种新的治疗策略。
✦ 益生菌改善神经性厌食症中的胃肠道不适
分析了益生菌对神经性厌食症患者的疗效,并通过分析血清和粪便样本测量了体重指数、心理/神经心理参数。他们报告了神经性厌食症中肠道微生物群落的正调节,以改善体重增加、胃肠道不适和炎症减少。
通过低聚果糖1.67g/天和益生菌(Saccharomyces boulardii 5×10^8 CFU)干预评估益生菌对神经性厌食症的影响。饮食限制后,与健康状态相比,总微生物群和代谢物减少,但补充低聚果糖和布拉式酵母通过改变以下菌群来恢复微生物群落。
研究显示了两种饮食(酸奶或牛奶)的积极作用,包括保加利亚乳杆菌和嗜热链球菌,它们能够诱导IFN-γ产生对抗儿童腹泻和神经性厌食症患者的感染。
值得注意的是,抗生素和25%的药物可能会影响微生物群,患者需要基于益生菌治疗来实现主要目标,如能量收集、体重增加、降低肠道通透性、炎症过程以及肠道微生物组群的改变等。
益生菌的作用主要是增强肠道健康。食用含有益生菌的健康食品在预防中枢神经系统疾病和通过调节肠道微生物群控制相关症状方面具有重要作用。这种效应通过微生物群-肠-脑轴发生,可以整合到临床试验中。
酸奶、开菲尔、豆豉和泡菜等发酵食品富含益生菌。一些益生菌产生活性神经元化合物或充当载体。一些双歧杆菌和乳酸杆菌菌株分泌γ-氨基丁酸 (GABA)。此外,对健康人的粪便样本进行分析,发现拟杆菌属、副拟杆菌属和埃希氏菌属物种能够调节产生GABA的途径。
GABA的功能障碍与抑郁和焦虑有关。GABA 是乳酸菌 (LAB) 的分泌代谢产物之一。它是哺乳动物中枢神经系统中抑制性传播的主要介质。食品工业通过生产含有能够产生 GABA 的益生菌物种的功能性食品,在减少抑郁和焦虑方面发挥着关键作用。
开菲尔颗粒含有Acetobacter aceti, L. fructivorans, Acetobacter sp., Enterococcus faecium, Leuconostoc spp., L. delbrueckii delbrueckii, L. fermentum, L. kefiranofaciens, Candida famata, Candida krusei.
益生菌菌株L. helveticus从发酵乳中分离得到,可以改善老年人和中年人的认知功能。
用短乳杆菌L. brevis BJ20浓缩发酵海带, 以确定其对老年人体质和短时工作记忆的影响。研究人员说,食用这种发酵食品可以为老年人的痴呆症提供保护机制。
由于包括牛奶、乳制品和豆制品在内的发酵产品的广泛使用,其他研究表明,含有干酪乳杆菌的发酵乳可以改善学生的情绪、增加粪便中的血清素并降低压力水平,瑞士乳杆菌影响认知功能。
含有发酵乳杆菌、干酪乳杆菌混合物的发酵牛奶降低了小鼠的亚硝化应激参数。含有B. lactis BB12和L. acidophilus LA5益生菌的酸奶可显著增强整体健康并减轻焦虑、抑郁和压力。
使用含有短乳杆菌L. brevis FPA 3709的发酵黑豆浆能够产生 GABA 在小鼠中显示出抗抑郁活性。
个体微生物组会受到宿主条件和环境的影响。肠道微生物群的紊乱会对宿主的生理反应和整体健康产生巨大影响。
大量证据表明,环境污染物与微生物群相互作用,而微生物群在肠脑轴中发挥着关键作用。长时间处于污染环境下,肠道生态失调,对宿主造成系统性和长期的影响。
精神益生菌在控制中枢神经系统疾病症状方面具有有效的特征,或将辅助治疗各类疾病。然而神经精神类疾病病情复杂,原因不一,有些益生菌也并不一定对所有患者有效,通过肠道菌群检测,可以了解个体肠道菌群,从而有针对性地采取相关干预措施。
主要参考文献
Singh, S.; Sharma, P.; Pal, N.; Kumawat, M.; Shubham, S.; Sarma, D.K.; Tiwari, R.R.; Kumar, M.; Nagpal, R. Impact of Environmental Pollutants on Gut Microbiome and Mental Health via the Gut–Brain Axis. Microorganisms 2022, 10, 1457. https://doi.org/10.3390/microorganisms10071457.
Oroojzadeh P, Bostanabad SY, Lotfi H. Psychobiotics: the Influence of Gut Microbiota on the Gut-Brain Axis in Neurological Disorders. J Mol Neurosci. 2022 Jul 18:1–13. doi: 10.1007/s12031-022-02053-3. Epub ahead of print. PMID: 35849305; PMCID: PMC9289355.
Liu, L.; Huh, J.R.; Shah, K. Microbiota and the gut-brain-axis: Implications for new therapeutic design in the CNS. eBioMedicine 2022, 77, 103908.
Long, D.; Liu, M.; Li, H.; Song, J.; Jiang, X.; Wang, G.; Yang, X. Dysbacteriosis induces abnormal neurogenesis via LPS in a pathway requiring NF-κB/IL-6. Pharmacol. Res. 2021, 167, 105543.
Duan H, Yu L, Tian F, Zhai Q, Fan L, Chen W. Gut microbiota: A target for heavy metal toxicity and a probiotic protective strategy. Sci Total Environ. 2020 Nov 10;742:140429. doi: 10.1016/j.scitotenv.2020.140429. Epub 2020 Jun 25. PMID: 32629250.
Briffa J, Sinagra E, Blundell R. Heavy metal pollution in the environment and their toxicological effects on humans. Heliyon. 2020 Sep 8;6(9):e04691. doi: 10.1016/j.heliyon.2020.e04691. PMID: 32964150; PMCID: PMC7490536.